This document is an excerpt from the EUR-Lex website
Document 32009D0365
2009/365/EC: Commission Decision of 28 April 2009 authorising the placing on the market of lycopene from Blakeslea trispora as a novel food ingredient under Regulation (EC) No 258/97 of the European Parliament and of the Council (notified under document number C(2009) 3039)
2009/365/CE: Decisione della Commissione, del 28 aprile 2009 , che autorizza la commercializzazione del licopene ottenuto da Blakeslea trispora in qualità di nuovo ingrediente alimentare ai sensi del regolamento (CE) n. 258/97 del Parlamento europeo e del Consiglio [notificata con il numero C(2009) 3039]
2009/365/CE: Decisione della Commissione, del 28 aprile 2009 , che autorizza la commercializzazione del licopene ottenuto da Blakeslea trispora in qualità di nuovo ingrediente alimentare ai sensi del regolamento (CE) n. 258/97 del Parlamento europeo e del Consiglio [notificata con il numero C(2009) 3039]
GU L 111 del 05/05/2009, p. 31–34
(BG, ES, CS, DA, DE, ET, EL, EN, FR, IT, LV, LT, HU, MT, NL, PL, PT, RO, SK, SL, FI, SV)
 In force
In force
|
5.5.2009 |
IT |
Gazzetta ufficiale dell'Unione europea |
L 111/31 |
DECISIONE DELLA COMMISSIONE
del 28 aprile 2009
che autorizza la commercializzazione del licopene ottenuto da Blakeslea trispora in qualità di nuovo ingrediente alimentare ai sensi del regolamento (CE) n. 258/97 del Parlamento europeo e del Consiglio
[notificata con il numero C(2009) 3039]
(Il testo in lingua spagnola è il solo facente fede)
(2009/365/CE)
LA COMMISSIONE DELLE COMUNITÀ EUROPEE,
visto il trattato che istituisce la Comunità europea,
visto il regolamento (CE) n. 258/97 del Parlamento europeo e del Consiglio, del 27 gennaio 1997, sui nuovi prodotti e i nuovi ingredienti alimentari (1), in particolare l’articolo 7,
considerando quanto segue:
|
(1) |
In data 30 agosto 2007 la società Vitatene ha chiesto alle competenti autorità del Regno Unito di poter commercializzare il licopene ottenuto da Blakeslea trispora come nuovo ingrediente alimentare. In data 17 ottobre 2007 l’ente del Regno Unito competente per la valutazione degli alimenti ha pubblicato una relazione di valutazione iniziale nella quale è giunto alla conclusione che, in considerazione del fatto che sono state presentate altre domande concernenti il licopene, è necessaria una valutazione supplementare per garantire che le autorizzazioni d’uso dei diversi tipi di licopene come nuovi ingredienti alimentari siano rilasciate alle stesse condizioni. |
|
(2) |
L’11 febbraio 2008 la Commissione ha trasmesso la relazione di valutazione iniziale a tutti gli Stati membri. |
|
(3) |
L’Autorità europea per la sicurezza alimentare (EFSA) è stata consultata e ha emesso il suo parere in data 4 dicembre 2008. |
|
(4) |
Nel suo parere l’EFSA è giunta alla conclusione che il licopene, essendo soggetto a modificazioni ossidative, deve essere formulato come sospensioni in oli commestibili, polveri direttamente compressibili o polveri disperdibili in acqua. Deve essere assicurata una sufficiente protezione antiossidativa. |
|
(5) |
Secondo il parere emesso dall’EFSA, per la maggior parte dei consumatori l’assunzione di licopene si manterrà al di sotto della dose giornaliera accettabile (DGA), ma per talune categorie di consumatori potrebbe risultare superiore alla DGA. È quindi opportuno raccogliere dati sull’assunzione di licopene per alcuni anni dopo l’autorizzazione, affinché quest’ultima possa essere riesaminata sulla base delle nuove informazioni raccolte circa la sicurezza del licopene e il suo consumo. Particolare attenzione merita la raccolta di dati riguardanti il tenore di licopene nei cereali per la prima colazione. Questa disposizione della presente decisione si applica però all’uso del licopene in quanto nuovo ingrediente alimentare e non all’uso in quanto colorante alimentare, che rientra nel campo d’applicazione della direttiva 89/107/CEE del Consiglio, del 21 dicembre 1988, per il ravvicinamento delle legislazioni degli Stati membri concernenti gli additivi autorizzati nei prodotti alimentari destinati al consumo umano (2). |
|
(6) |
Dalla valutazione scientifica risulta che il licopene ottenuto da Blakeslea trispora è conforme ai criteri di cui all’articolo 3, paragrafo 1, del regolamento (CE) n. 258/97. |
|
(7) |
La società Vitatene ha dato il suo assenso all’abrogazione della decisione 2006/721/CE della Commissione (3). |
|
(8) |
Le misure di cui alla presente decisione sono conformi al parere del comitato permanente per la catena alimentare e la salute degli animali, |
HA ADOTTATO LA PRESENTE DECISIONE:
Articolo 1
Il licopene ottenuto da Blakeslea trispora (di seguito «il prodotto») quale specificato nell’allegato I può essere commercializzato nella Comunità come nuovo ingrediente alimentare destinato a essere utilizzato nei prodotti alimentari elencati nell’allegato II.
Articolo 2
La denominazione del nuovo ingrediente alimentare autorizzato dalla presente decisione figurante sull’etichetta del prodotto alimentare che lo contiene è «licopene».
Articolo 3
La società Vitatene predispone un programma di monitoraggio che accompagna la commercializzazione del prodotto. Tale programma è destinato a raccogliere informazioni sui livelli d’uso del licopene nei prodotti alimentari, come specificato nell’allegato III.
I dati raccolti sono messi a disposizione della Commissione e degli Stati membri. Sulla base delle nuove informazioni e di una relazione dell’EFSA, l’uso del licopene è oggetto di un riesame entro il 2014.
Articolo 4
La decisione 2006/721/CE è abrogata.
Articolo 5
Vitatene S.A.U., Avda. Antibióticos 59-61, 24009 León, Spagna è destinataria della presente decisione.
Fatto a Bruxelles, il 28 aprile 2009.
Per la Commissione
Androulla VASSILIOU
Membro della Commissione
(1) GU L 43 del 14.2.1997, pag. 1.
(2) GU L 40 dell’11.2.1989, pag. 27.
(3) GU L 296 del 26.10.2006, pag. 13.
ALLEGATO I
Specifiche del licopene ottenuto da Blakeslea trispora
DESCRIZIONE
Il licopene purificato ottenuto da Blakeslea trispora è costituito per almeno il 95 % da licopene e per non più del 5 % da altri carotenoidi. Si presenta in forma di polvere in idonea matrice o di dispersione oleosa. È di colore rosso scuro o rosso violetto. Deve essere assicurata una protezione antiossidativa.
SPECIFICA
|
Nome chimico |
: |
Licopene |
|
Numero CAS |
: |
502-65-8 (tutti i licopene trans) |
|
Formula chimica |
: |
C40H56 |
|
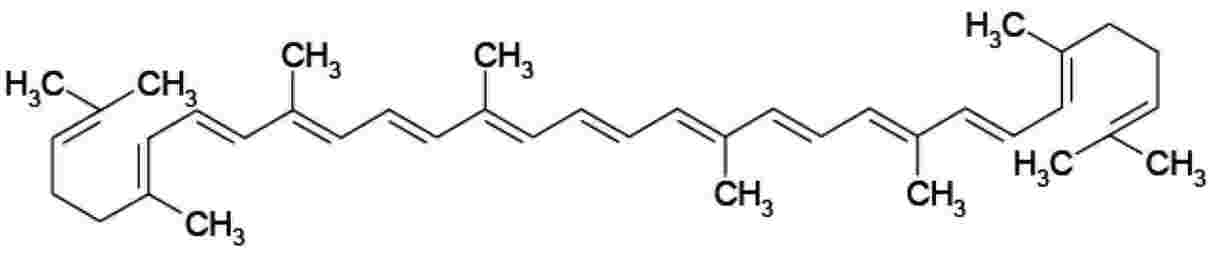
Formula strutturale |
: |
|
|
Peso formula |
: |
536,85 |
ALLEGATO II
Prodotti alimentari nei quali è autorizzata l’aggiunta del licopene ottenuto da Blakeslea trispora
|
Categoria di prodotti alimentari |
Tenore massimo di licopene |
|
Bevande a base di succhi di frutta o di ortaggi (compresi i concentrati) |
2,5 mg/100 g |
|
Bevande destinate a persone che compiono uno sforzo muscolare intenso, in particolare gli sportivi |
2,5 mg/100 g |
|
Alimenti destinati a diete ipocaloriche volte alla riduzione del peso |
8 mg per porzione sostituiva di un pasto |
|
Cereali per la prima colazione |
5 mg/100 g |
|
Grassi e salse |
10 mg/100 g |
|
Minestre (escluse quelle di pomodoro) |
1 mg/100 g |
|
Pane (anche del tipo croccante) |
3 mg/100 g |
|
Alimenti dietetici per scopi medici speciali |
Secondo le particolari esigenze nutrizionali |
|
Integratori alimentari |
15 mg per dose giornaliera raccomandata dal fabbricante |
ALLEGATO III
Monitoraggio del licopene ottenuto da Blakeslea trispora successivo alla sua commercializzazione
INFORMAZIONI DA RACCOGLIERE
Quantità di licopene ottenuto da Blakeslea trispora fornite dalla società Vitatene ai suoi clienti destinate alla produzione di prodotti alimentari finali commercializzati nell’Unione europea.
Risultati di ricerche in basi di dati sulla commercializzazione di prodotti alimentari addizionati di licopene ottenuto da Blakeslea trispora, compresi i livelli di fortificazione e la dimensione delle porzioni di ciascun alimento commercializzato negli Stati membri.
TRASMISSIONE DELLE INFORMAZIONI
Le informazioni di cui sopra sono trasmesse annualmente alla Commissione per gli anni dal 2009 al 2012, ad iniziare dal 31 ottobre 2010 per il periodo dal 1o luglio 2009 al 30 giugno 2010, poi nei due anni successivi per i corrispondenti periodi annuali.
ALTRE INFORMAZIONI
Se del caso e se la società Vitatene ne dispone, queste informazioni sono trasmesse anche per quanto riguarda l’assunzione di licopene utilizzato come colorante alimentare.
Se ne dispone, la società Vitatene fornisce nuove informazioni scientifiche che permettano di riesaminare i livelli massimi di assunzione di licopene da considerare sicuri.
VALUTAZIONE DEI LIVELLI DI ASSUNZIONE DI LICOPENE
Sulla base delle informazioni raccolte e trasmesse, la società Vitatene procede a una valutazione aggiornata dell’assunzione.
RIESAME
La Commissione consulta nel 2013 l’EFSA per esaminare le informazioni fornite dall’industria.