This document is an excerpt from the EUR-Lex website
Document 32009D0365
2009/365/EC: Commission Decision of 28 April 2009 authorising the placing on the market of lycopene from Blakeslea trispora as a novel food ingredient under Regulation (EC) No 258/97 of the European Parliament and of the Council (notified under document number C(2009) 3039)
2009/365/CE: Decisão da Comissão, de 28 de Abril de 2009 , que autoriza a colocação no mercado de licopeno de Blakeslea trispora como novo ingrediente alimentar, nos termos do Regulamento (CE) n. o 258/97 do Parlamento Europeu e do Conselho [notificada com o número C(2009) 3039]
2009/365/CE: Decisão da Comissão, de 28 de Abril de 2009 , que autoriza a colocação no mercado de licopeno de Blakeslea trispora como novo ingrediente alimentar, nos termos do Regulamento (CE) n. o 258/97 do Parlamento Europeu e do Conselho [notificada com o número C(2009) 3039]
JO L 111 de 5.5.2009, p. 31–34
(BG, ES, CS, DA, DE, ET, EL, EN, FR, IT, LV, LT, HU, MT, NL, PL, PT, RO, SK, SL, FI, SV)
 In force
In force
|
5.5.2009 |
PT |
Jornal Oficial da União Europeia |
L 111/31 |
DECISÃO DA COMISSÃO
de 28 de Abril de 2009
que autoriza a colocação no mercado de licopeno de Blakeslea trispora como novo ingrediente alimentar, nos termos do Regulamento (CE) n.o 258/97 do Parlamento Europeu e do Conselho
[notificada com o número C(2009) 3039]
(Apenas faz fé o texto em língua espanhola)
(2009/365/CE)
A COMISSÃO DAS COMUNIDADES EUROPEIAS,
Tendo em conta o Tratado que institui a Comunidade Europeia,
Tendo em conta o Regulamento (CE) n.o 258/97 do Parlamento Europeu e do Conselho, de 27 de Janeiro de 1997, relativo a novos alimentos e ingredientes alimentares (1), nomeadamente o artigo 7.o,
Considerando o seguinte:
|
(1) |
Em 30 de Agosto de 2007, a empresa Vitatene apresentou um pedido às autoridades competentes do Reino Unido para colocar no mercado licopeno de Blakeslea trispora como novo ingrediente alimentar; em 17 de Outubro de 2007, o organismo competente do Reino Unido para a avaliação de alimentos emitiu o seu relatório de avaliação preliminar. Nesse relatório, o referido organismo concluía que, tendo em conta outros pedidos pendentes relativos ao licopeno, era necessária uma avaliação adicional a fim de assegurar que a autorização da utilização dos vários licopenos como novos ingredientes alimentares seja concedida nos mesmos termos. |
|
(2) |
A Comissão transmitiu o relatório de avaliação preliminar a todos os Estados-Membros em 11 de Fevereiro de 2008. |
|
(3) |
A Autoridade Europeia para a Segurança dos Alimentos (AESA) foi consultada em 2008, tendo emitido o seu parecer em 4 de Dezembro de 2008. |
|
(4) |
No referido parecer, a AESA conclui que, visto que o licopeno pode sofrer alterações por oxidação, tem de ser formulado sob a forma de suspensões em óleos alimentares ou pós directamente compressíveis ou dispersáveis em água. Deve ser assegurada protecção antioxidante suficiente. |
|
(5) |
A AESA conclui igualmente que o consumo de licopeno pelo utilizador médio se situará abaixo da dose diária admissível (DDA), mas que alguns utilizadores de licopeno poderão exceder a DDA. Por conseguinte, é igualmente adequado recolher dados sobre a ingestão durante alguns anos após a autorização, a fim de a reexaminar à luz de quaisquer informações complementares sobre a segurança do licopeno e do respectivo consumo. Deve ser dada especial atenção à recolha de dados relativamente aos níveis de licopeno nos cereais de pequeno-almoço. Todavia, esta exigência, estabelecida pela presente decisão, é aplicável à utilização de licopeno como novo ingrediente alimentar, mas não à utilização de licopeno como corante alimentar, a qual é abrangida pelo âmbito de aplicação da Directiva 89/107/CEE do Conselho, de 21 de Dezembro de 1988, relativa à aproximação das legislações dos Estados-Membros respeitantes aos aditivos que podem ser utilizados nos géneros destinados à alimentação humana (2). |
|
(6) |
Com base na avaliação científica, ficou estabelecido que o licopeno de Blakeslea trispora cumpre os critérios enunciados no n.o 1 do artigo 3.o do Regulamento (CE) n.o 258/97. |
|
(7) |
A empresa Vitatene concordou com a revogação da Decisão 2006/721/CE da Comissão (3). |
|
(8) |
As medidas previstas na presente decisão estão em conformidade com o parecer do Comité Permanente da Cadeia Alimentar e da Saúde Animal, |
ADOPTOU A PRESENTE DECISÃO:
Artigo 1.o
O licopeno de Blakeslea trispora, tal como especificado no anexo I, a seguir denominado «o produto», pode ser colocado no mercado comunitário enquanto novo ingrediente alimentar para utilização nos alimentos enumerados no anexo II.
Artigo 2.o
A designação do novo ingrediente alimentar autorizado pela presente decisão a utilizar na rotulagem do género alimentício que o contenha será «licopeno».
Artigo 3.o
A Vitatene deve estabelecer um programa de vigilância para o acompanhamento da comercialização do produto. Este programa deve abranger informações sobre os níveis de utilização do licopeno nos alimentos, conforme especificado no anexo III.
Os dados recolhidos devem ser disponibilizados à Comissão e aos Estados-Membros. A utilização do licopeno como ingrediente alimentar deve ser revista o mais tardar em 2014, à luz das novas informações e de um relatório da AESA.
Artigo 4.o
É revogada a Decisão 2006/721/CE.
Artigo 5.o
A Vitatene S.A.U. Avda. Antibióticos 59-61, E-24009 León, Espanha, é a destinatária da presente decisão.
Feito em Bruxelas, em 28 de Abril de 2009.
Pela Comissão
Androulla VASSILIOU
Membro da Comissão
(1) JO L 43 de 14.2.1997, p. 1.
(2) JO L 40 de 11.2.1989, p. 27.
(3) JO L 296 de 26.10.2006, p. 13.
ANEXO I
Especificações do licopeno de Blakeslea trispora
DESCRIÇÃO
O licopeno de Blakeslea trispora purificado é composto por ≥ 95 % de licopeno e ≤ 5 % de outros carotenóides. É apresentado quer como pó numa matriz adequada, quer como dispersão em óleo. A sua cor é o vermelho escuro ou vermelho-violeta. Deve ser assegurada protecção antioxidante.
ESPECIFICAÇÃO
|
Denominação química |
: |
Licopeno |
|
Número CAS |
: |
502-65-8 (licopeno totalmente trans) |
|
Fórmula química |
: |
C40H56 |
|
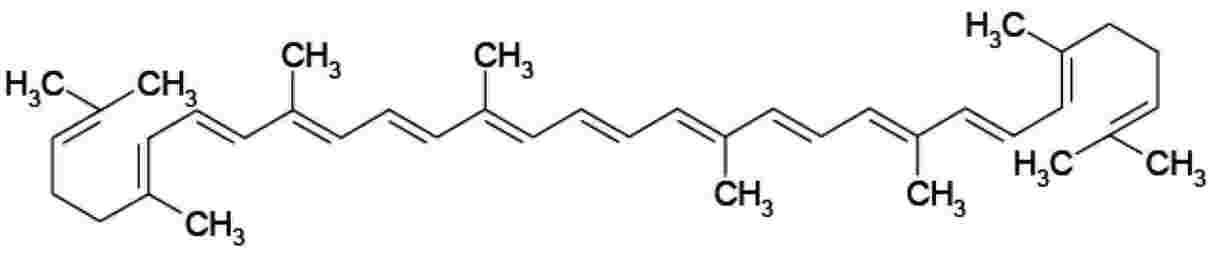
Fórmula estrutural |
: |
|
|
Massa molecular |
: |
536,85 |
ANEXO II
Lista de alimentos aos quais se pode adicionar licopeno de Blakeslea trispora
|
Categoria de alimentos |
Teor máximo de licopeno |
|
Bebidas à base de sumos de frutas/produtos hortícolas (incluindo concentrados) |
2,5 mg/100 g |
|
Bebidas adaptadas a um esforço muscular intenso, sobretudo para os desportistas |
2,5 mg/100 g |
|
Alimentos destinados a serem utilizados em dietas de restrição calórica para redução do peso |
8 mg/substituto de refeição |
|
Cereais de pequeno-almoço |
5 mg/100 g |
|
Gorduras e guarnições |
10 mg/100 g |
|
Sopas, excepto sopa de tomate |
1 mg/100 g |
|
Pão (incluindo tostas) |
3 mg/100 g |
|
Alimentos dietéticos para fins medicinais específicos |
De acordo com as necessidades nutricionais específicas |
|
Suplementos alimentares |
15 mg por dose diária, tal como recomendado pelo fabricante |
ANEXO III
Vigilância pós-comercialização do licopeno de Blakeslea trispora
INFORMAÇÕES A RECOLHER
Quantidades de licopeno de Blakeslea trispora fornecidas pela Vitatene aos seus clientes para o fabrico de produtos alimentares finais para colocação no mercado na União Europeia.
Resultados de pesquisas em bases de dados sobre a comercialização de alimentos com licopeno de Blakeslea trispora adicionado, por Estado-Membro, indicando os níveis de fortificação e o tamanho das doses por cada alimento.
COMUNICAÇÃO DAS INFORMAÇÕES
As informações acima referidas devem ser comunicadas à Comissão Europeia anualmente, de 2009 a 2012. O primeiro relatório, referente ao período de 1 de Julho de 2009 a 30 de Junho de 2010, deve ser transmitido até 31 de Outubro de 2010, aplicando-se períodos de referência idênticos no que se refere aos dois anos seguintes.
INFORMAÇÕES SUPLEMENTARES
Quando adequado, devem igualmente ser comunicados os mesmos dados no que respeita à ingestão de licopeno utilizado como corante alimentar, caso a Vitatene disponha de tais informações.
A Vitatene deve fornecer as novas informações científicas eventualmente disponíveis para o reexame dos níveis máximos de segurança aplicáveis à ingestão de licopeno.
AVALIAÇÃO DOS NÍVEIS DE INGESTÃO DE LICOPENO
Com base nas informações recolhidas e comunicadas, a Vitatene procederá a uma avaliação actualizada da ingestão.
REEXAME
A Comissão consultará a AESA em 2013 a fim de reexaminar as informações fornecidas pela indústria.