

This document is an excerpt from the EUR-Lex website
Document 32015L0566
Commission Directive (EU) 2015/566 of 8 April 2015 implementing Directive 2004/23/EC as regards the procedures for verifying the equivalent standards of quality and safety of imported tissues and cells Text with EEA relevance
Direktiva Komisije (EU) 2015/566 оd 8. travnja 2015. o provedbi Direktive 2004/23/EZ s obzirom na postupke provjere ekvivalentnosti standarda kvalitete i sigurnosti uvezenih tkiva i stanica Tekst značajan za EGP
Direktiva Komisije (EU) 2015/566 оd 8. travnja 2015. o provedbi Direktive 2004/23/EZ s obzirom na postupke provjere ekvivalentnosti standarda kvalitete i sigurnosti uvezenih tkiva i stanica Tekst značajan za EGP
SL L 93, 9.4.2015, p. 56–68
(BG, ES, CS, DA, DE, ET, EL, EN, FR, HR, IT, LV, LT, HU, MT, NL, PL, PT, RO, SK, SL, FI, SV)
 In force
In force
|
9.4.2015 |
HR |
Službeni list Europske unije |
L 93/56 |
DIREKTIVA KOMISIJE (EU) 2015/566
оd 8. travnja 2015.
o provedbi Direktive 2004/23/EZ s obzirom na postupke provjere ekvivalentnosti standarda kvalitete i sigurnosti uvezenih tkiva i stanica
(Tekst značajan za EGP)
EUROPSKA KOMISIJA
uzimajući u obzir Ugovor o funkcioniranju Europske unije,
uzimajući u obzir Direktivu 2004/23/EZ Europskog parlamenta i Vijeća od 31. ožujka 2004. o utvrđivanju standarda kvalitete i sigurnosti za postupke darivanja, prikupljanja, testiranja, obrade, čuvanja, skladištenja i distribucije ljudskih tkiva i stanica (1), a posebno njezin članak 9. stavak 4.,
budući da:
|
(1) |
Direktivom 2004/23/EZ utvrđuju se standardi kvalitete i sigurnosti za postupke darivanja, prikupljanja, testiranja, obrade, čuvanja, skladištenja i distribucije svih ljudskih tkiva i stanica namijenjenih za primjenu kod ljudi te darivanja, prikupljanja i testiranja ljudskih tkiva i stanica sadržanih u derivatima proizvoda namijenjenih za primjenu kod ljudi, ako su ti proizvodi obuhvaćeni drugim zakonodavstvom Unije, radi osiguranja visoke razine zaštite zdravlja ljudi u Uniji. |
|
(2) |
Razmjena tkiva i stanica sve se više odvija na svjetskoj razini i stoga se Direktivom 2004/23/EZ zahtijeva da se uvozom tkiva i stanica bave banke tkiva koje su u tu svrhu akreditirale, imenovale, odobrile ili licencirale države članice. Iznimke od tog zahtjeva utvrđene su člankom 9. stavkom 3. Direktive 2004/23/EZ kojim se nadležnim tijelima dopušta da izravno odobre uvoz posebnih tkiva i stanica pod uvjetima utvrđenima člankom 6. Direktive Komisije 2006/17/EZ (2) ili u hitnim slučajevima. Te se iznimke redovito upotrebljavaju za, ali nisu ograničene na, dopuštanje uvoza krvotvornih matičnih stanica iz koštane srži, periferne krvi ili krvi pupkovine koja se upotrebljava u liječenju niza stanja opasnih po život. |
|
(3) |
Nadalje, Direktivom 2004/23/EZ zahtijeva se od država članica i banaka tkiva uvoznica da osiguraju da je uvoz tkiva i stanica ujednačen sa standardima kvalitete i sigurnosti utvrđenima Direktivom 2004/23/EZ, i poziva se na uspostavljanje postupaka provjere ujednačenosti standarda kvalitete i sigurnosti uvoza tkiva i stanica. Ti postupci trebaju biti utvrđeni u ovoj Direktivi ne dovodeći u pitanje zakonodavstvo Unije o carini. |
|
(4) |
Osobito je prikladno uspostaviti programe odobravanja i inspekcije na način da ti programi odražavaju postojeći postupak provjere aktivnosti vezanih uz tkiva i stanice koje se provode unutar Unije. Jednako tako, prikladno je utvrditi postupke koje banke tkiva uvoznice trebaju slijediti u odnosima sa svojim dobavljačima iz trećih zemalja. |
|
(5) |
Uz iznimku uvoza koji su nadležna tijela izravno odobrila na temelju članka 9. stavka 3. Direktive 2004/23/EZ, sav uvoz tkiva i stanica iz trećih zemalja mogu obavljati samo banke tkiva uvoznici. Ako nadležna tijela izravno odobre uvoz na temelju članka 9. stavka 3. Direktive 2004/23/EZ, odgovornost osiguravanja da takav uvoz zadovoljava standarde kvalitete i sigurnosti jednake standardima utvrđenima u toj Direktivi pada na nadležna tijela. |
|
(6) |
Tkiva i stanice trebaju uvoziti banke tkiva ili bolničke jedinice koje su u svrhu svojih aktivnosti uvoza akreditirane, imenovane, odobrene ili licencirane kao banke tkiva uvoznici. Banke tkiva ili bolničke jedinice trebaju se smatrati bankama tkiva uvoznicama ako su strana u ugovornom sporazumu s dobavljačem iz trećih zemalja za uvoz tkiva i stanica. Ako je strana u ugovornom sporazumu s dobavljačem iz trećih zemalja za uvoz tkiva i stanica ustanova koja nudi usluge posredovanja kako bi se olakšao uvoz tkiva i stanica, ali ne i za sâm uvoz, ona se ne treba smatrati bankom tkiva uvoznicom. Države članice mogu odlučiti takve usluge regulirati izvan područja primjene ove Direktive. |
|
(7) |
Ako su strana u ugovornom sporazumu s dobavljačem iz trećih zemalja za uvoz tkiva i stanica druga tijela kao što su ustanove odgovorne za primjenu kod ljudi, proizvođači lijekova za naprednu terapiju, klinički liječnici ili pojedinci, trebaju se smatrati bankom tkiva uvoznicom. One moraju zadovoljiti zahtjeve iz ove Direktive, biti u skladu sa svim relevantnim odredbama Direktive 2004/23/EZ te ih u svrhu obavljanja svojih aktivnosti uvoza njihova relevantna nadležna tijela moraju akreditirati, imenovati, odobriti ili licencirati kao banke tkiva uvoznice. Ako se one, nakon uvoza, bave i testiranjem, obradom, čuvanjem, skladištenjem ili distribucijom uvezenih tkiva i stanica, moraju ih u svrhu navedenih aktivnosti akreditirati, imenovati, odobriti i licencirati njihova relevantna nadležna tijela te moraju zadovoljiti zahtjeve iz Direktive 2004/23/EZ. One mogu dobiti tkiva i stanice podrijetlom iz trećih zemalja i od banaka tkiva ili bolničkih jedinica smještenih unutar Unije, koje su akreditirane, imenovane, odobrene ili licencirane od svojih relevantnih nadležnih tijela kao banke tkiva uvoznice. |
|
(8) |
Ako su banke tkiva uvoznice akreditirane, imenovane, odobrene ili licencirane kao banke tkiva za aktivnosti koje obavljaju unutar Unije, države članice mogu uskladiti postupke odobrenja, inspekcije i izvješćivanja pod uvjetom da poštuju postupke utvrđene ovom Direktivom. |
|
(9) |
Kako bi se olakšala distribucija uvezenih tkiva i stanica unutar Unije, uključujući slučajeve kada je takva distribucija prekogranične prirode, nadležno tijelo ili tijela trebaju izdati potvrdu kojom se potvrđuje akreditacija, imenovanje, odobrenje ili dozvola banke tkiva uvoznice. |
|
(10) |
Inspekcijske mjere igraju važnu ulogu u provjeri ujednačenosti uvezenih tkiva i stanica sa standardima kvalitete i sigurnosti utvrđenima u Direktivi 2004/23/EZ. Državama članicama stoga se preporučuje, prema potrebi, da pregledaju i dobavljače iz trećih zemalja i surađuju s drugim državama članicama u kojima će se vjerojatno distribuirati uvezena tkiva i stanice. Države članice u kojima se nalaze banke tkiva uvoznice zadržavaju odgovornost za odlučivanje o najprimjerenijim mjerama koje treba poduzeti i za odluke o potrebi inspekcije na licu mjesta dobavljača iz trećih zemalja. |
|
(11) |
Operativni priručnik za nadležna tijela o inspekcijama ažuriran je kako bi se u obzir uzele inspekcije banaka tkiva uvoznica i njihovih dobavljača iz trećih zemalja, a državama članicama dostupan je kao vodič prilikom poduzimanja takvih mjera inspekcije. |
|
(12) |
Banke tkiva uvoznice trebale bi potvrditi da su standardi kvalitete i sigurnosti tkiva i stanica koje uvoze u Uniju ekvivalentni standardima kvalitete i sigurnosti utvrđenima u Direktivi 2004/23/EZ. Pisani sporazumi s dobavljačima iz trećih zemalja i dokumentacija koju treba osigurati i staviti na raspolaganje nadležnim tijelima ključni su elementi za osiguravanje provođenja takve provjere, a posebice za omogućavanje povratne sljedivosti do darivatelja i osiguravanja poštovanja načela dobrovoljnog i neplaćenog darivanja u skladu s Direktivom 2004/23/EZ. Bankama tkiva uvoznicama jednako se tako preporučuje da, kao dio ovog postupka provjere, provedu nadzor dobavljača iz trećih zemalja. |
|
(13) |
Banke tkiva uvoznice trebale bi osigurati primjenu Jedinstvenog europskog sustava označivanja na uvezena tkiva i stanice u skladu s Direktivom Komisije 2006/86/EZ (3), bilo da sami obavljaju taj zadatak ili ga prenesu na dobavljače iz trećih zemalja kao dio uvjeta iz njihovih pisanih sporazuma s tim dobavljačima. |
|
(14) |
Državama članicama potrebno je dopustiti da iz zahtjeva utvrđenih u ovoj Direktivi koji se tiču dokumentacije i pisanih sporazuma izuzmu jednokratne uvoze. Međutim, takve bi jednokratne uvoze trebale provoditi akreditirane, imenovane, ovlaštene ili licencirane banke tkiva uvoznice, a kao opće pravilo ne bi ih trebalo provoditi redovno ili učestalo od strane istog dobavljača iz trećih zemalja. Upotreba takvih izuzeća trebala bi se ograničiti na situacije u kojima jedna ili više osoba ima ili imaju tkiva i stanice pohranjene u trećoj zemlji za buduću upotrebu, posebno u slučajevima reproduktivnih stanica u postupcima homologne medicinski pomognute oplodnje, autolognog darivanja, ili darivanja usmjerenog na bližu rodbinu, a slijedom toga, na želje da se ta tkiva ili stanice uvezu u Uniju u njihovo ime. Takav uvoz bilo koje posebne vrste tkiva ili stanice obično se ne smije provesti više od jedanput za bilo kojeg primatelja i ne bi trebao uključivati tkiva ili stanice za treće strane. |
|
(15) |
Ovom Direktivom ne sprečavaju se države članice da zadrže ili uvedu strože mjere koje se odnose na uvoz tkiva i stanica, posebice kako bi se osiguralo poštovanje načela dobrovoljnog i neplaćenog darivanja, pod uvjetom da su ispunjene odredbe Ugovora. |
|
(16) |
Mjere predviđene u ovoj Direktivi u skladu su s mišljenjem Odbora za tkiva i stanice uspostavljenog člankom 29. stavkom 3. Direktive 2004/23/EZ, |
DONIJELA JE OVU DIREKTIVU:
POGLAVLJE I.
OPĆE ODREDBE
Članak 1.
Područje primjene
1. Ova se Direktiva primjenjuje na uvoz u Uniju:
|
(a) |
ljudskih tkiva i stanica namijenjenih za primjenu kod ljudi i |
|
(b) |
industrijskih proizvoda izrađenih od tkiva i stanica ljudskog podrijetla, namijenjenih za primjenu kod ljudi, ako ti proizvodi nisu obuhvaćeni drugim zakonodavstvom Unije. |
2. Ako su ljudska tkiva i stanice koji se uvoze namijenjeni isključivo za primjenu u industrijskim proizvodima obuhvaćenima drugim zakonodavstvom Unije, ova se Direktiva primjenjuje samo na darivanje, prikupljanje i testiranje koje se provodi izvan Unije te kako bi se pridonijelo osiguravanju sljedivosti od darivatelja do primatelja i obrnuto.
3. Ova Direktiva ne primjenjuje se na:
|
(a) |
uvoz tkiva i stanica iz članka 9. stavka 3. točke (a) Direktive 2004/23/EZ koji je izravno odobrilo nadležno tijelo ili tijela; |
|
(b) |
uvoz tkiva i stanica iz članka 9. stavka 3. točke (b) Direktive 2004/23/EZ koji je izravno odobren u hitnim slučajevima; |
|
(c) |
krv i krvne sastojke prema definiciji iz Direktive 2002/98/EZ; |
|
(d) |
organe ili dijelove organa prema definiciji iz Direktive 2004/23/EZ. |
Članak 2.
Definicije
Za potrebe ove Direktive primjenjuju se sljedeće definicije:
|
(a) |
„hitan slučaj” znači svaka nepredviđena situacija u kojoj ne postoji nijedna druga mogućnost osim hitnog uvoza tkiva i stanica iz treće zemlje u Uniju za neposrednu primjenu na poznatog primatelja ili poznate primatelje čije bi zdravlje bez takvog uvoza bilo ozbiljno ugroženo; |
|
(b) |
„banka tkiva uvoznica” znači banka tkiva ili bolnička jedinica ili drugo tijelo uspostavljeno unutar Unije koje je strana u ugovornom sporazumu s dobavljačem iz trećih zemalja za uvoz u Uniju tkiva i stanica koji dolaze iz treće zemlje i koji su namijenjeni za primjenu kod ljudi; |
|
(c) |
„jednokratni uvoz” znači uvoz bilo koje posebne vrste tkiva ili stanica namijenjene za osobnu upotrebu kod jednog ili više primatelja kojima su namijenjeni, a koji su poznati banci tkiva uvoznici i dobavljaču iz trećih zemalja prije obavljanja uvoza. Takav uvoz bilo koje posebne vrste tkiva ili stanica obično se ne provodi više od jedanput za jednog primatelja. Uvoz od istog dobavljača iz trećih zemalja koji se odvija redovito ili učestalo ne smatra se „jednokratnim uvozom”; |
|
(d) |
„dobavljač treće zemlje” znači banka tkiva ili drugo tijelo uspostavljeno u trećoj zemlji odgovorno za izvoz u Uniju tkiva i stanica kojima opskrbljuje banku tkiva uvoznicu. Dobavljač iz trećih zemalja jednako tako može obavljati jednu ili više aktivnosti, koje se provode izvan Unije, darivanja, prikupljanja, testiranja, obrade, čuvanja, skladištenja ili distribucije tkiva i stanica uvezenih u Uniju. |
POGLAVLJE II.
OBVEZE TIJELA DRŽAVA ČLANICA
Članak 3.
Akreditacija, imenovanje, odobravanje ili licenciranje za banke tkiva uvoznice
1. Ne dovodeći u pitanje članak 1. stavak 3., države članice osiguravaju da se svim uvozom tkiva i stanica iz trećih zemalja bave banke tkiva uvoznice koje je u svrhu tih djelatnosti akreditiralo, imenovalo, odobrilo ili licenciralo jedno ili više nadležnih tijela.
2. Nadležno tijelo ili tijela, nakon što dobiju podatke utvrđene Prilogom I. ovoj Direktivi i nakon što provjere da banka tkiva uvoznica zadovoljava zahtjeve iz ove Direktive, akreditiraju, imenuju, odobravaju ili izdaju dozvolu banci tkiva uvoznici za uvoz tkiva i stanica te upućuju na sve uvjete koji se primjenjuju, kao što su ograničenja koja se tiču vrsta tkiva i stanica koji se uvoze ili dobavljača iz trećih zemalja čijim se uslugama koristi. Nadležno tijelo ili tijela izdaju akreditiranim, imenovanim, ovlaštenim ili licenciranim bankama tkiva uvoznicama potvrdu iz Priloga II. ovoj Direktivi.
3. Banka tkiva uvoznica ne unosi bitne promjene u djelatnost uvoza bez prethodnog pisanog odobrenja jednog ili više nadležnih tijela. Bitnim promjenama posebno se smatraju sve promjene vezane uz vrste uvezenih tkiva i stanica, aktivnosti poduzetih u trećim zemljama koje bi mogle utjecati na kvalitetu i sigurnost uvezenih tkiva i stanica ili promjene dobavljača iz trećih zemalja. Ako banka tkiva uvoznica obavi jednokratan uvoz tkiva ili stanica od dobavljača iz trećih zemalja koji nije obuhvaćen postojećom akreditacijom, imenovanjem, odobrenjem ili dozvolom, takav se uvoz ne smatra bitnom promjenom ako je banci tkiva uvoznici odobren uvoz iste vrste tkiva ili stanica od jednog ili više drugih dobavljača iz trećih zemalja.
4. Nadležno tijelo ili tijela mogu, djelomično ili u potpunosti, suspendirati ili opozvati akreditaciju, imenovanje, odobrenje ili dozvolu banke tkiva uvoznice ako se ponajprije inspekcijama ili drugim mjerama kontrole dokaže da takva banka više ne ispunjava zahtjeve iz ove Direktive.
Članak 4.
Inspekcije i druge mjere kontrole
1. Države članice osiguravaju da nadležno tijelo ili tijela organiziraju inspekcije i druge mjere kontrole banaka tkiva uvoznica i, prema potrebi, njihovih dobavljača iz trećih zemalja te da banke tkiva uvoznice provode odgovarajuće kontrole kako bi se osigurala ujednačenost standarda kvalitete i sigurnosti tkiva i stanica koje se uvoze sa standardima utvrđenima u Direktivi 2004/23/EZ. Razdoblje između inspekcija bilo koje banke tkiva uvoznice nije duže od dvije godine.
2. Takve nadzore provode ovlašteni predstavnici jednog ili više nadležnih tijela koji:
|
(a) |
su ovlašteni pregledati banke tkiva uvoznice i, prema potrebi, aktivnosti bilo kojeg dobavljača iz trećih zemalja; |
|
(b) |
procjenjuju i provjeravaju postupke i aktivnosti koji se obavljaju u bankama tkiva uvoznicama i ustanovama dobavljača trećih zemalja te koji su bitni za osiguravanje ujednačenosti standarda kvalitete i sigurnosti tkiva i stanica koje se uvoze sa standardima utvrđenima u Direktivi 2004/23/EZ; |
|
(c) |
pregledavaju sve dokumente ili druge evidencije koje su bitne za ovu procjenu i provjeru. |
3. Na opravdani zahtjev druge države članice ili Komisije, države članice dostavljaju podatke o rezultatima inspekcija i drugih mjera kontrole koje se odnose na banke tkiva uvoznice i dobavljače iz trećih zemalja.
4. Države članice u koje se uvoze tkiva i stanice, na opravdani zahtjev iz druge države članice u koju se kasnije distribuiraju uvezena tkiva i stanice, razmatraju obavljanje inspekcija ili drugih mjera kontrole banaka tkiva uvoznica i aktivnosti dobavljača trećih zemalja. Države članice u kojima se nalazi banka tkiva uvoznica odlučuju o odgovarajućim mjerama koje je potrebno poduzeti nakon savjetovanja s državom članicom koja je podnijela takav zahtjev.
5. Ako se inspekcija na licu mjesta provodi slijedom takvog zahtjeva, nadležno tijelo ili tijela države članice u kojoj se nalazi banka tkiva uvoznica dogovaraju s nadležnim tijelom ili tijelima države članice koja je podnijela taj zahtjev hoće li i kako država članica koja je podnijela taj zahtjev sudjelovati u inspekciji. Konačna je odluka o tom sudjelovanju na državama članicama u kojima se nalazi banka tkiva uvoznica. Razlozi odluke o odbijanju takvog sudjelovanja objašnjavaju se državi članici koja je podnijela takav zahtjev.
POGLAVLJE III.
OBVEZE BANAKA TKIVA UVOZNICA
Članak 5.
Zahtjevi za akreditaciju, imenovanje, odobravanje ili licenciranje za banke tkiva uvoznice
1. Banke tkiva uvoznice, nakon što su poduzele mjere kojima se osigurava da uvoz tkiva i stanica zadovoljava standarde kvalitete i sigurnosti ujednačene standardima utvrđenima u Direktivi 2004/23/EZ i da se uvezena tkiva i stanice mogu pratiti od darivatelja do primatelja i obrnuto, podnose zahtjev za akreditaciju, imenovanje, odobrenje ili licenciranje kao banke tkiva uvoznice:
|
(a) |
dostavljanjem nadležnom tijelu ili tijelima potrebnih informacija i dokumentacije kako je navedeno u Prilogu I. ovoj Direktivi; |
|
(b) |
stavljanjem na raspolaganje i, kada to zatraži nadležno tijelo ili tijela, dostavljanjem dokumentacije navedene u Prilogu III. ovoj Direktivi. |
2. Države članice mogu odlučiti da neće primjenjivati zahtjeve za dokumentaciju iz Priloga I. Dijela F i Priloga III. ovoj Direktivi na jednokratne uvoze kako su definirani u članku 2. ove Direktive pod uvjetom da imaju uspostavljene odgovarajuće nacionalne mjere za reguliranje takvih uvoza. Tim se nacionalnim mjerama osigurava sljedeće:
|
(a) |
sljedivost od darivatelja do primatelja i obrnuto i |
|
(b) |
uvezena tkiva i stanice ne primjenjuju se ni na kome drugome osim na njihovim primateljima kojima su i namijenjeni. |
Članak 6.
Ažurirane informacije
1. Banke tkiva uvoznice traže prethodno pisano odobrenje jednog ili više nadležnih tijela za sve planirane bitne promjene u svojim djelatnostima uvoza, a posebno za one bitne promjene opisane u članku 3. stavku 3. te obavješćuju nadležno tijelo ili tijela o odluci da djelomično ili u potpunosti prestaju s djelatnostima uvoza.
2. Banke tkiva uvoznice odmah obavješćuju nadležno tijelo ili tijela o svim sumnjivim ili stvarnim ozbiljnim štetnim događajima ili reakcijama o kojima su ih izvijestili dobavljači iz trećih zemalja, a koji mogu utjecati na kvalitetu i sigurnost tkiva i stanica koje uvoze. Informacije navedene u Prilogu III. i IV. Direktivi 2006/86/EZ uključuju se u takve obavijesti.
3. Banka tkiva uvoznica odmah obavješćuje nadležno tijelo ili tijela o:
|
(a) |
svim opozivima ili suspenzijama, djelomičnim ili potpunim, odobrenja dobavljača iz trećih zemalja za izvoz tkiva i stanica i |
|
(b) |
svim drugim odlukama koje je zbog nesukladnosti donijelo nadležno tijelo ili tijela zemlje u kojoj se nalazi dobavljač iz trećih zemalja i koji mogu biti od važnosti za kvalitetu i sigurnost uvezenih tkiva i stanica. |
Članak 7.
Pisani sporazumi
1. Banke tkiva uvoznice imaju uspostavljene pisane sporazume s dobavljačima iz trećih zemalja ako se bilo koja od aktivnosti darivanja, prikupljanja, testiranja, obrade, čuvanja, skladištenja ili izvoza u Uniju tkiva i stanica koje se uvoze u Uniju provodi izvan Unije.
Države članice mogu odlučiti da neće primjenjivati ovaj zahtjev na jednokratne uvoze kako su definirani u članku 2. ove Direktive pod uvjetom da imaju uspostavljene odgovarajuće nacionalne mjere za reguliranje takvog uvoza. Tim se nacionalnim mjerama osigurava sljedeće:
|
(a) |
sljedivost od darivatelja do primatelja i obrnuto i |
|
(b) |
uvezena tkiva i stanice ne primjenjuju se ni na kome drugome osim na njihovim primateljima kojima su namijenjeni. |
2. Pisanim sporazumima između banaka tkiva uvoznica i dobavljača iz trećih zemalja utvrđuju se zahtjevi kvalitete i sigurnosti koje je potrebno zadovoljiti kako bi se osigurala ekvivalentnost standarda kvalitete i sigurnosti tkiva i stanica koji se uvoze sa standardima utvrđenima u Direktivi 2004/23/EZ. Pisani sporazum ponajprije uključuje barem sadržaje navedene u Prilogu IV. ovoj Direktivi.
3. Pisanim sporazumom utvrđuje se pravo jednog ili više nadležnih tijela da pregledaju aktivnosti, uključujući i objekte ustanove, svih dobavljača iz trećih zemalja tijekom trajanja pisanog sporazuma i u razdoblju od dvije godine nakon njegova prestanka.
4. Banke tkiva uvoznice osiguravaju primjerke pisanih sporazuma s dobavljačima trećih zemalja nadležnom tijelu ili tijelima kao dio njihova zahtjeva za akreditaciju, imenovanje, odobrenje ili licenciranje.
Članak 8.
Registar banaka tkiva uvoznica
1. Banke tkiva uvoznice vode evidenciju o aktivnostima, uključujući vrste i količine uvezenih tkiva i stanica, te o njihovu podrijetlu i odredištu. Ta evidencija sadržava iste informacije i za sve provedene jednokratne uvoze. Godišnje izvješće iz članka 10. stavka 1. Direktive 2004/23/EZ obuhvaća informacije o tim aktivnostima.
2. Nadležno tijelo ili tijela uvrštavaju banke tkiva uvoznice u javno dostupan registar banaka tkiva utvrđen člankom 10. stavkom 2. Direktive 2004/23/EZ.
3. Informacije o akreditacijama, imenovanjima, odobrenjima ili dozvolama banaka tkiva uvoznica jednako su tako dostupne putem mreže registara iz članka 10. stavka 3. Direktive 2004/23/EZ.
POGLAVLJE IV.
ZAVRŠNE ODREDBE
Članak 9.
Prenošenje
1. Države članice donose i objavljuju zakone i druge propise potrebne za usklađivanje s ovom Direktivom najkasnije do 29. listopada 2016. One Komisiji odmah dostavljaju tekst tih odredaba.
One te odredbe primjenjuju od 29. travnja 2017.
Kada države članice donose te odredbe, one prilikom službene objave sadržavaju i upućivanje na ovu Direktivu ili se uz njih navodi takvo upućivanje. Načine tog upućivanja određuju države članice.
2. Države članice Komisiji dostavljaju tekst glavnih odredaba nacionalnog prava koje donesu u području na koje se odnosi ova Direktiva.
Članak 10.
Stupanje na snagu
Ova Direktiva stupa na snagu dvadesetog dana od dana objave u Službenom listu Europske unije.
Članak 11.
Adresati
Ova je Direktiva upućena državama članicama.
Sastavljeno u Bruxellesu 8. travnja 2015.
Za Komisiju
Predsjednik
Jean-Claude JUNCKER
(1) SL L 102, 7.4.2004., str. 48.
(2) Direktiva Komisije 2006/17/EZ od 8. veljače 2006. o provedbi Direktive 2004/23/EZ Europskog parlamenta i Vijeća u pogledu određenih tehničkih zahtjeva za darivanje, prikupljanje i testiranje ljudskih tkiva i stanica (SL L 38, 9.2.2006., str. 40.).
(3) Direktiva Komisije 2006/86/EZ od 24. listopada 2006. o provedbi Direktive 2004/23/EZ Europskog parlamenta i Vijeća s obzirom na zahtjeve za sljedivost, prijavu ozbiljnih štetnih reakcija i događaja te određene tehničke zahtjeve za označivanje, obradu, čuvanje, skladištenje i distribuciju ljudskih tkiva i stanica za (SL L 294, 25.10.2006., str. 32.).
PRILOG I.
Minimalni zahtjevi koji se odnose na informacije i dokumentaciju koju dostavljaju banke tkiva uvoznice podnositeljice zahtjeva prilikom podnošenja zahtjeva za akreditiranje, imenovanje, odobrenje ili licenciranje u svrhu obavljanja uvoznih aktivnosti
Prilikom podnošenja zahtjeva za akreditiranje, imenovanje, odobrenje ili licenciranje u svrhu obavljanja uvoznih aktivnosti, banka tkiva uvoznica podnositeljica zahtjeva, ako već nije dostavila kao dio prethodnih zahtjeva za akreditiranje, imenovanje, odobrenje ili licenciranje kao banke tkiva ili banke tkiva uvoznice, dostavlja ažurirane informacije i, za dio F, dokumentaciju o sljedećem:
A. Opće informacije o banci tkiva uvoznici (BTU)
|
1. |
Naziv BTU-a (naziv banke tkiva/ustanove/organizacije). |
|
2. |
Adresa za posjetitelje BTU-a. |
|
3. |
Poštanska adresa BTU-a (ako je različita). |
|
4. |
Status podnositelja zahtjeva BTU-a: Potrebno je naznačiti je li riječ o prvom zahtjevu za akreditiranje, imenovanje, odobrenje ili licenciranje kao BTU-a ili, prema potrebi, o zahtjevu za obnovu. Ako je podnositelj zahtjeva već akreditiran, imenovan, odobren ili licenciran kao banka tkiva, potrebno je dostaviti EU-ov preglednik oznaka BT-a. |
|
5. |
Naziv jedinice koja podnosi zahtjev (ako je različit od naziva banke tkiva). |
|
6. |
Adresa za posjetitelje jedinice koja podnosi zahtjev. |
|
7. |
Poštanska adresa jedinice koja podnosi zahtjev (ako je različita). |
|
8. |
Naziv mjesta primitka uvoza (ako je različito od naziva banke tkiva i jedinice koja podnosi zahtjev). |
|
9. |
Adresa za posjetitelje mjesta primitka. |
|
10. |
Poštanska adresa mjesta primitka (ako je različita). |
B. Podaci za kontakt za zahtjev
|
1. |
Ime osobe za kontakt za zahtjev. |
|
2. |
Telefonski broj. |
|
3. |
Adresa elektroničke pošte. |
|
4. |
Ime odgovorne osobe (ako je različito od osobe za kontakt). |
|
5. |
Telefonski broj. |
|
6. |
Adresa elektroničke pošte. |
|
7. |
URL web-mjesta BTU-a (ako postoji). |
C. Pojedinosti o tkivima i stanicama koji se uvoze
|
1. |
Popis vrsta tkiva i stanica koji se uvoze, uključujući jednokratan uvoz posebnih vrsta tkiva ili stanica. |
|
2. |
Naziv proizvoda (prema potrebi, u skladu s popisom generičkih naziva EU-a) svih vrsta tkiva i stanica koji se uvoze. |
|
3. |
Izvorni naziv (ako je različit od naziva proizvoda) svih vrsta tkiva i stanica koji se uvoze. |
|
4. |
Naziv dobavljača iz treće zemlje za svaku vrstu tkiva i stanica koji se uvoze. |
D. Mjesto aktivnosti
|
1. |
Popis u kojem je navedeno koje aktivnosti darivanja, prikupljanja, testiranja, obrade, čuvanja ili skladištenja provodi dobavljač iz trećih zemalja prije uvoza prema vrsti tkiva ili stanica. |
|
2. |
Popis u kojem je navedeno koje aktivnosti darivanja, prikupljanja, testiranja, obrade, čuvanja ili skladištenja provodi podugovaratelj dobavljača iz trećih zemalja prije uvoza prema vrsti tkiva ili stanica. |
|
3. |
Popis svih aktivnosti koje provodi BTU nakon uvoza prema vrsti tkiva ili stanica. |
|
4. |
Nazivi trećih zemalja u kojima se provode aktivnosti prije uvoza prema vrsti tkiva ili stanica. |
E. Pojedinosti o dobavljačima iz trećih zemalja
|
1. |
Naziv(i) dobavljača iz trećih zemalja (naziv trgovačkog društva). |
|
2. |
Ime osobe za kontakt. |
|
3. |
Adresa za posjetitelje. |
|
4. |
Poštanska adresa (ako je različita). |
|
5. |
Telefonski broj, uključujući međunarodni pozivni broj. |
|
6. |
Broj za kontakt u hitnim slučajevima (ako je različit). |
|
7. |
Adresa elektroničke pošte. |
F. Dokumentacija koja se prilaže uz zahtjev
|
1. |
Preslika pisanog sporazuma s dobavljačem/dobavljačima iz trećih zemalja. |
|
2. |
Detaljan opis kretanja uvezenih tkiva i stanica od njihova prikupljanja do njihova primitka u banci tkiva uvoznici. |
|
3. |
Preslika potvrde o odobrenju izvoza dobavljača iz trećih zemalja ili, ako se ne izdaje posebna potvrda o odobrenju izvoza, potvrda od jednog ili više relevantnih nadležnih tijela iz trećih zemalja kojom se odobravaju djelatnosti dobavljača iz trećih zemalja u sektoru tkiva i stanica, uključujući izvoz. Ta dokumentacija uključuje i podatke za kontakt jednog ili više nadležnih tijela iz trećih zemalja. U trećim zemljama gdje takva dokumentacija nije dostupna dostavljaju se alternativni oblici dokumentacije kao što su izvješća o nadzoru dobavljača iz trećih zemalja. |
PRILOG II.
Potvrda o akreditaciji, imenovanju, odobrenju ili dozvoli koje izdaje jedno ili više nadležnih tijela bankama tkiva uvoznicama
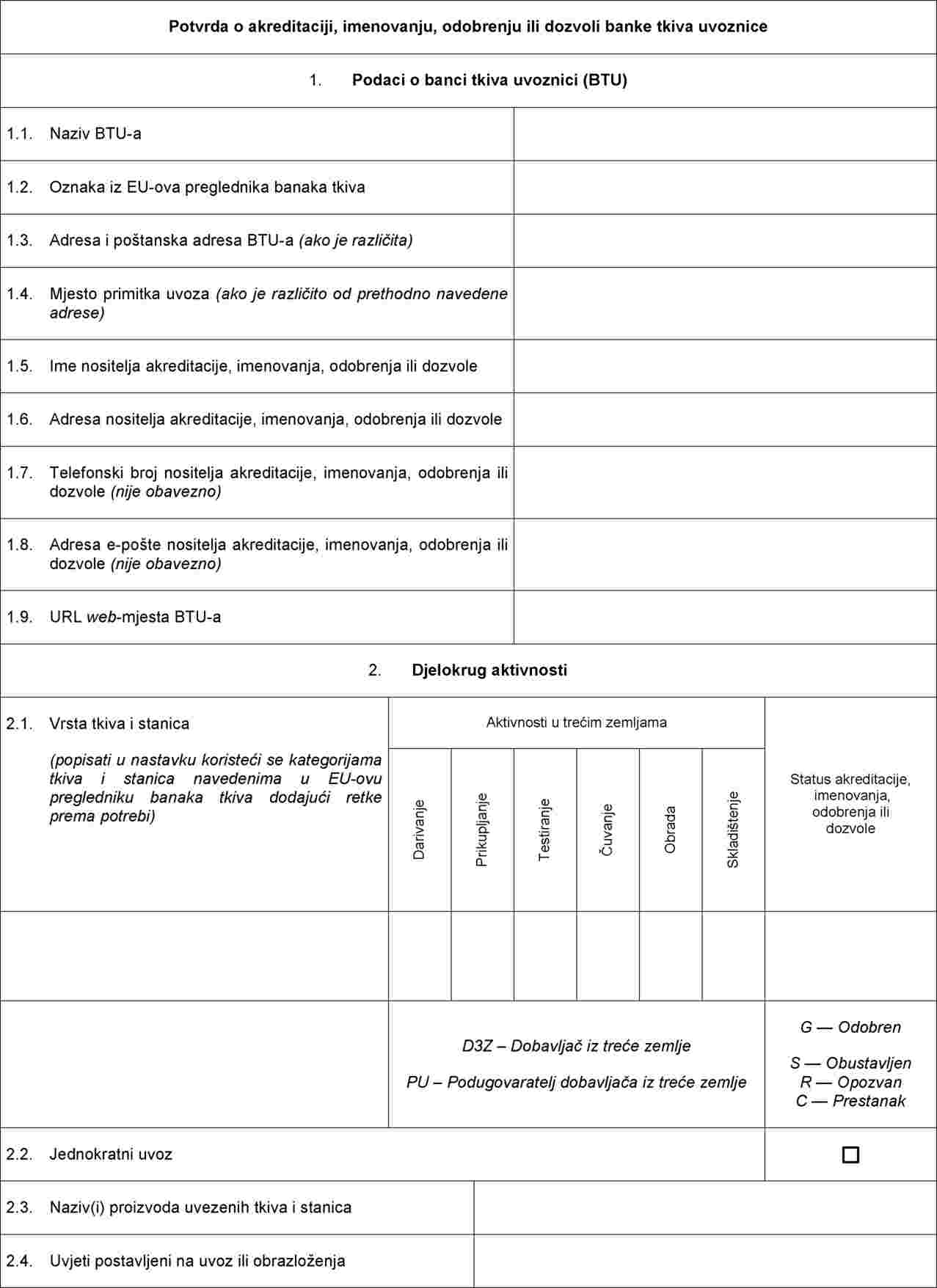

PRILOG III.
Minimalni zahtjevi koji se odnose na dokumentaciju koju banke tkiva koje namjeravaju uvesti tkiva i stanice iz trećih zemalja stavljaju na raspolaganje nadležnom tijelu ili tijelima
Uz iznimku jednokratnih uvoza kako su definirani u članku 2. ove Direktive koji su izuzeti iz ovih zahtjeva za dokumentaciju, banka tkiva uvoznica koja podnosi zahtjev stavlja na raspolaganje i, ako već nije dostavila kao dio prethodnih prijava za akreditaciju, imenovanje, odobrenje ili dozvolu kao banke tkiva uvoznice ili banke tkiva, osigurava na zahtjev jednog ili više nadležnih tijela ažurirane verzije sljedeće dokumentacije o podnositelju zahtjeva i njegovu/njegovim dobavljaču/dobavljačima iz trećih zemalja.
A. Dokumentacija koja se odnosi na banku tkiva uvoznicu (BTU)
|
1. |
Opis poslova odgovorne osobe i pojedinosti o njegovim/njezinim relevantnim kvalifikacijama i zapisnik s izobrazbi kako je utvrđeno u Direktivi 2004/23/EZ; |
|
2. |
Preslika prvotne oznake, oznake na prepakiranju, vanjskom pakiranju i kontejneru za prijevoz; |
|
3. |
Popis relevantnih i ažuriranih verzija standardnih operativnih postupaka (SOP-ovi) koji se odnose na djelatnosti uvoza banke, uključujući SOP-ove o primjeni Jedinstvenog europskog sustava označivanja, primitku i čuvanju uvezenih tkiva i stanica u banci tkiva uvoznici, upravljanju štetnim događajima i reakcijama, upravljanju vraćenim proizvodima i sljedivosti od davatelja do primatelja. |
B. Dokumentacija koja se odnosi na dobavljača ili dobavljače iz trećih zemalja
|
1. |
Detaljan opis kriterija korištenih za identifikaciju i procjenu darivatelja, informacije pružene darivatelju ili obitelji darivatelja, način na koji je dobiven pristanak darivatelja ili obitelji darivatelja i je li darivanje bilo dobrovoljno i neplaćeno ili nije; |
|
2. |
Detaljne informacije o centru/centrima za testiranje koje su upotrebljavali dobavljači iz trećih zemalja i ispitivanjima koja su provodili ti centri; |
|
3. |
Detaljne informacije o metodama korištenima tijekom obrade tkiva i stanica, uključujući pojedinosti o validaciji za kritične postupke obrade; |
|
4. |
Detaljan opis prostora i opreme, kritične opreme i materijala, kao i kriterija koji se upotrebljavaju za kontrolu kvalitete i kontrolu okoliša za svaku djelatnost koju obavlja dobavljač iz treće zemlje; |
|
5. |
Detaljne informacije o uvjetima za izdavanje tkiva i stanica dobavljača iz trećih zemalja; |
|
6. |
Pojedinosti o svim podugovarateljima koje su upotrebljavali dobavljači iz trećih zemalja, uključujući naziv, mjesto i poduzete aktivnosti; |
|
7. |
Sažetak najnovije inspekcije dobavljača iz treće zemlje koju je provelo nadležno tijelo ili tijela iz trećih zemalja, uključujući datum inspekcije, vrstu inspekcije i glavne zaključke; |
|
8. |
Sažetak zadnjeg nadzora dobavljača iz trećih zemalja koju je provela banka tkiva uvoznica ili koji se provodi u njezino ime; |
|
9. |
Sve relevantne nacionalne ili međunarodne akreditacije. |
PRILOG IV.
Minimalni zahtjevi koji se odnose na sadržaj pisanih sporazuma između banaka tkiva uvoznica i njihovih dobavljača iz trećih zemalja
Uz iznimku jednokratnih uvoza kako su definirani u članku 2. ove Direktive koji su izuzeti iz ovih zahtjeva, pisani sporazum između banke tkiva uvoznice i dobavljača iz trećih zemalja sadržava barem sljedeće odredbe.
|
1. |
Detaljne informacije o specifikacijama banke tkiva uvoznice kako bi se osiguralo ispunjavanje standarda kvalitete i sigurnosti utvrđenih u Direktivi 2004/23/EZ i zajednički dogovorenim ulogama i odgovornostima obiju strana u osiguravanju uvjeta u kojima će uvezena tkiva i stanice imati ekvivalentne standarde kvalitete i sigurnosti; |
|
2. |
Klauzulu kojom se osigurava da dobavljač iz treće zemlje dostavlja podatke iz Priloga III. B ovoj Direktivi banci tkiva uvoznici; |
|
3. |
Klauzulu kojom se osigurava da dobavljač iz treće zemlje obavješćuje banku tkiva uvoznicu o svim sumnjivim ili stvarnim ozbiljnim štetnim događajima ili reakcijama koji mogu utjecati na kvalitetu i sigurnost tkiva i stanica koje je banka tkiva uvoznica uvezla ili namjerava uvesti; |
|
4. |
Klauzulu kojom se osigurava da dobavljač iz treće zemlje obavješćuje banku tkiva uvoznicu o svim bitnim promjenama u svojim aktivnostima, uključujući opoziv ili suspenziju, djelomičnu ili potpunu, njegova odobrenja za izvoz tkiva i stanica ili druge takve odluke jednog ili više nadležnih tijela treće zemlje u slučajevima neusklađenosti, koje mogu utjecati na kvalitetu i sigurnost tkiva i stanica koje je banka tkiva uvoznica uvezla ili namjerava uvesti; |
|
5. |
Klauzulu kojom se nadležnom tijelu ili tijelima jamči pravo inspekcije aktivnosti dobavljača iz treće zemlje, uključujući inspekcije na licu mjesta, ako to želi učiniti kao dio inspekcije banke tkiva uvoznice. Klauzula bi jednako tako banci tkiva uvoznici trebala jamčiti pravo na redovit nadzor svojeg dobavljača iz treće zemlje; |
|
6. |
Dogovorene uvjete koje je potrebno zadovoljiti za prijevoz tkiva i stanica između dobavljača iz trećih zemalja i banke tkiva uvoznice; |
|
7. |
Klauzulu kojom se osigurava da dobavljač iz treće zemlje ili njegov podugovaratelj čuva evidenciju darivatelja u vezi s uvezenim tkivima i stanicama u skladu s pravilima EU-a o zaštiti podataka 30 godina nakon prikupljanja i da se izradi prikladna odredba o njezinu čuvanju u slučaju da dobavljač iz treće zemlje prestane poslovati; |
|
8. |
Odredbe o redovitoj reviziji i, ako je potrebno, reviziju pisanog sporazuma, kako bi se odrazile sve promjene u zahtjevima standarda kvalitete i sigurnosti EU-a utvrđenih u Direktivi 2004/23/EZ; |
|
9. |
Popis svih standardnih operativnih postupaka dobavljača iz trećih zemalja u odnosu na kvalitetu i sigurnost uvezenih tkiva i stanica te obvezu da ih se dostavi na zahtjev. |