

This document is an excerpt from the EUR-Lex website
Document 32011R0142
Commission Regulation (EU) No 142/2011 of 25 February 2011 implementing Regulation (EC) No 1069/2009 of the European Parliament and of the Council laying down health rules as regards animal by-products and derived products not intended for human consumption and implementing Council Directive 97/78/EC as regards certain samples and items exempt from veterinary checks at the border under that Directive Text with EEA relevance
Règlement (UE) n ° 142/2011 de la Commission du 25 février 2011 portant application du règlement (CE) n ° 1069/2009 du Parlement européen et du Conseil établissant des règles sanitaires applicables aux sous-produits animaux et produits dérivés non destinés à la consommation humaine et portant application de la directive 97/78/CE du Conseil en ce qui concerne certains échantillons et articles exemptés des contrôles vétérinaires effectués aux frontières en vertu de cette directive Texte présentant de l'intérêt pour l'EEE
Règlement (UE) n ° 142/2011 de la Commission du 25 février 2011 portant application du règlement (CE) n ° 1069/2009 du Parlement européen et du Conseil établissant des règles sanitaires applicables aux sous-produits animaux et produits dérivés non destinés à la consommation humaine et portant application de la directive 97/78/CE du Conseil en ce qui concerne certains échantillons et articles exemptés des contrôles vétérinaires effectués aux frontières en vertu de cette directive Texte présentant de l'intérêt pour l'EEE
JO L 54 du 26.2.2011, p. 1–254
(BG, ES, CS, DA, DE, ET, EL, EN, FR, IT, LV, LT, HU, MT, NL, PL, PT, RO, SK, SL, FI, SV) Ce document a été publié dans des éditions spéciales
(HR)
 In force: This act has been changed. Current consolidated version: 11/07/2024
In force: This act has been changed. Current consolidated version: 11/07/2024
|
26.2.2011 |
FR |
Journal officiel de l'Union européenne |
L 54/1 |
RÈGLEMENT (UE) No 142/2011 DE LA COMMISSION
du 25 février 2011
portant application du règlement (CE) no 1069/2009 du Parlement européen et du Conseil établissant des règles sanitaires applicables aux sous-produits animaux et produits dérivés non destinés à la consommation humaine et portant application de la directive 97/78/CE du Conseil en ce qui concerne certains échantillons et articles exemptés des contrôles vétérinaires effectués aux frontières en vertu de cette directive
(Texte présentant de l'intérêt pour l'EEE)
LA COMMISSION EUROPÉENNE,
vu le traité sur le fonctionnement de l’Union européenne,
vu le règlement (CE) no 1069/2009 du Parlement européen et du Conseil du 21 octobre 2009 établissant des règles sanitaires applicables aux sous-produits animaux et produits dérivés non destinés à la consommation humaine et abrogeant le règlement (CE) no 1774/2002 (règlement relatif aux sous-produits animaux) (1), et notamment son article 5, paragraphe 2, son article 6, paragraphe 1, premier alinéa, point b) ii), paragraphe 1, deuxième alinéa, et paragraphe 2, deuxième alinéa, son article 11, paragraphe 2, premier alinéa, points b) et c), et paragraphe 2, deuxième alinéa, son article 15, paragraphe 1, premier alinéa, points b), d), e), h) et i), et paragraphe 1, deuxième alinéa, son article 17, paragraphe 2, son article 18, paragraphe 3, son article 19, paragraphe 4, premier alinéa, points a), b) et c), et paragraphe 4, deuxième alinéa, son article 20, paragraphes 10 et 11, son article 21, paragraphes 5 et 6, son article 22, paragraphe 3, son article 23, paragraphe 3, son article 27, premier alinéa, points a), b), c) et e) à h), et deuxième alinéa, son article 31, paragraphe 2, son article 32, paragraphe 3, son article 40, son article 41, paragraphe 3, premier et troisième alinéas, son article 42, son article 43, paragraphe 3, son article 45, paragraphe 4, son article 47, paragraphe 2, et son article 48, paragraphe 2, paragraphe 7, premier alinéa, point a), paragraphe 8, premier alinéa, point a), et paragraphe 8, deuxième alinéa,
vu la directive 97/78/CE du Conseil du 18 décembre 1997 fixant les principes relatifs à l’organisation des contrôles vétérinaires pour les produits en provenance des pays tiers introduits dans la Communauté (2), et notamment son article 16, paragraphe 3,
considérant ce qui suit:
|
(1) |
Le règlement (CE) no 1069/2009 fixe les règles sanitaires visant la santé publique et animale applicables aux sous-produits animaux et aux produits qui en sont dérivés. Ce règlement détermine les conditions dans lesquelles il y a lieu d’éliminer les sous-produits animaux pour empêcher la propagation de risques pour la santé publique et animale. En outre, ce règlement énonce les conditions dans lesquelles les sous-produits animaux peuvent être utilisés dans l’alimentation animale et à diverses fins, notamment dans les cosmétiques, les médicaments et les applications techniques. Il impose également aux exploitants de manipuler les sous-produits animaux dans des usines et établissements soumis à des contrôles officiels. |
|
(2) |
Le règlement (CE) no 1069/2009 prévoit l’adoption de mesures d’application fixant les règles détaillées relatives à la manipulation des sous-produits animaux et des produits dérivés, telles que les critères de transformation, les conditions d’hygiène et la structure des documents justificatifs qui doivent accompagner les envois de sous-produits animaux et de produits dérivés aux fins de leur traçabilité. |
|
(3) |
Il convient que les règles détaillées régissant l’utilisation et l’élimination des sous-produits animaux, fixées dans le présent règlement, concourent à la réalisation des objectifs du règlement (CE) no 1069/2009, à savoir, notamment, assurer une utilisation durable des matières d’origine animale et maintenir un niveau élevé de protection de la santé publique et animale dans l’Union européenne. |
|
(4) |
Le règlement (CE) no 1069/2009 ne s’applique pas aux cadavres entiers ou aux parties d’animaux sauvages non suspectés d’être infectés ou affectés par une maladie transmissible aux êtres humains ou aux animaux, à l’exception des animaux aquatiques débarqués à des fins commerciales. Il ne s’applique pas non plus aux cadavres entiers ou aux parties de gibier sauvage qui ne sont pas collectés après la mise à mort sous réserve du respect des bonnes pratiques cynégétiques. Les sous-produits animaux provenant de la chasse doivent être éliminés dans des conditions empêchant la propagation des risques qui soient adaptées aux pratiques cynégétiques spécifiques et conformes aux bonnes pratiques décrites par le secteur de la chasse. |
|
(5) |
Le règlement (CE) no 1069/2009 s’applique aux sous-produits animaux destinés à la préparation de trophées de chasse. La préparation de tels trophées, ainsi que les préparations d’animaux et de parties d’animaux pour lesquelles d’autres méthodes, comme la plastination, sont utilisées, doivent se dérouler dans des conditions qui empêchent la propagation des risques pour la santé humaine ou animale. |
|
(6) |
Le règlement (CE) no 1069/2009 s’applique aux déchets de cuisine et de table lorsqu’ils proviennent de moyens de transport opérant au niveau international, telles les matières provenant de denrées alimentaires servies à bord d’un avion ou d’un navire arrivant dans l’Union européenne en provenance d’un pays tiers. Le règlement s’applique également aux déchets de cuisine et de table destinés à l’alimentation animale, destinés à être transformés au moyen de l’une des méthodes autorisées en vertu du présent règlement et destinés à être convertis en biogaz ou à être compostés. Le règlement (CE) no 1069/2009 interdit l’alimentation d’animaux d’élevage autres que des animaux à fourrure au moyen de déchets de cuisine et de table. Par conséquent, conformément au règlement (CE) no 1069/2009, les déchets de cuisine et de table peuvent être transformés puis utilisés, à condition que le produit dérivé ne soit pas utilisé dans l’alimentation des animaux d’élevage autres que des animaux à fourrure. |
|
(7) |
La cohérence de la législation de l’Union européenne commande que la définition des matières premières pour aliments des animaux contenue dans le règlement (CE) no 767/2009 du Parlement européen et du Conseil du 13 juillet 2009 concernant la mise sur le marché et l’utilisation des aliments pour animaux, modifiant le règlement (CE) no 1831/2003 du Parlement européen et du Conseil et abrogeant la directive 79/373/CEE du Conseil, la directive 80/511/CEE de la Commission, les directives 82/471/CEE, 83/228/CEE, 93/74/CEE, 93/113/CE et 96/25/CE du Conseil, ainsi que la décision 2004/217/CE de la Commission (3) serve de base à la définition des matières premières d’origine animale destinées aux aliments pour animaux, dans le présent règlement. |
|
(8) |
Le règlement (CE) no 1069/2009 interdit que les sous-produits animaux et produits dérivés provenant d’espèces sensibles fassent l’objet d’envois au départ d’exploitations, d’établissements, d’usines ou de zones soumis à des restrictions en raison de la présence d’une maladie transmissible grave. Il convient, pour assurer un niveau élevé de protection de la santé animale dans l’Union, que la liste des maladies contenue dans les codes sanitaires pour les animaux terrestres et aquatiques de l’Organisation mondiale de la santé animale (ci-après «l’OIE») soit mentionnée comme étant la liste des maladies transmissibles graves à utiliser pour déterminer la portée de cette interdiction. |
|
(9) |
Étant donné que la directive 2000/76/CE du Parlement européen et du Conseil du 4 décembre 2000 sur l’incinération des déchets (4) ne s’applique pas à l’incinération ou à la coïncinération de certains sous-produits animaux, il convient de fixer des règles adéquates de prévention des risques sanitaires découlant de ces opérations dans le présent règlement, en tenant compte des effets possibles sur l’environnement. Les résidus provenant de l’incinération ou de la coïncinération de sous-produits animaux ou de produits dérivés doivent être recyclés ou éliminés conformément à la législation environnementale de l’Union, étant donné, notamment, que cette législation autorise l’utilisation de la fraction phosphorée des cendres dans les engrais et la remise des cendres provenant de la crémation d’animaux familiers aux propriétaires. |
|
(10) |
Il convient que les produits d’origine animale ou denrées alimentaires contenant de tels produits ne soient mis en décharge, conformément à la directive 1999/31/CE du Conseil du 26 avril 1999 concernant la mise en décharge des déchets (5), que s’ils ont fait l’objet d’une transformation, au sens du règlement (CE) no 852/2004 du Parlement européen et du Conseil du 29 avril 2004 relatif à l’hygiène des denrées alimentaires (6), dans le but que soient réduits les risques potentiels pour la santé. |
|
(11) |
L’élimination des sous-produits animaux ou des produits dérivés dans le circuit des eaux usées doit être interdite, car ces effluents ne font pas l’objet de dispositions qui garantiraient une gestion correcte des risques pour la santé publique et animale. Il convient de prendre des mesures adéquates visant à écarter les risques inacceptables d’élimination accidentelle de sous-produits animaux liquides, notamment lors du nettoyage des sols et des équipements utilisés lors de la transformation. |
|
(12) |
La directive 2008/98/CE du Parlement européen et du Conseil du 19 novembre 2008 relative aux déchets et abrogeant certaines directives (7) prévoit certaines mesures de protection de l’environnement et de la santé humaine. L’article 2, paragraphe 2, point b), de cette directive prévoit que certaines matières, dont les sous-produits animaux régis par le règlement (CE) no 1774/2002 du Parlement européen et du Conseil du 3 octobre 2002 établissant des règles sanitaires applicables aux sous-produits animaux non destinés à la consommation humaine (8), à l’exception de ceux qui sont destinés à l’incinération, la mise en décharge ou l’utilisation dans une usine de production de biogaz ou de compostage, sont exclues du champ d’application de la directive, dans la mesure où elles sont déjà régies par d’autres dispositions de l’Union Le règlement précité a été abrogé et remplacé par le règlement (CE) no 1069/2009 à compter du 4 mars 2011. La cohérence de la législation de l’Union commande que les procédés de conversion en biogaz et de compostage des sous-produits animaux et produits dérivés soient conformes aux règles sanitaires établies dans le présent règlement ainsi qu’aux dispositions relatives à la protection de l’environnement de la directive 2008/98/CE. |
|
(13) |
L’autorité compétente d’un État membre doit pouvoir autoriser l’utilisation d’autres paramètres de conversion des sous-produits animaux en biogaz ou de compostage de ceux-ci sur la base d’une validation conforme à un modèle harmonisé. Lorsque cette possibilité est exploitée, il doit être possible de mettre les résidus de digestion et le compost sur le marché dans l’ensemble de l’Union européenne. En outre, l’autorité compétente d’un État membre doit pouvoir autoriser l’utilisation de certains paramètres pour des sous-produits animaux spécifiques, tels les déchets de cuisine et de table et les mélanges de déchets de cuisine et de table avec certaines autres matières, qui sont convertis en biogaz ou compostés. Étant donné que ces autorisations ne font pas l’objet d’une harmonisation, il convient que les résidus de digestion et le compost ne soient mis sur le marché que dans l’État membre dans lequel l’utilisation de ces paramètres a été autorisée. |
|
(14) |
Il convient, pour prévenir la contamination des denrées alimentaires par des agents pathogènes, que les établissements ou usines transformant des sous-produits animaux et les abattoirs ou autres établissements transformant des denrées alimentaires exercent leurs activités sur des sites séparés, conformément, en particulier, au règlement (CE) no 853/2004 du Parlement et du Conseil du 29 avril 2004 fixant des règles spécifiques d’hygiène applicables aux denrées alimentaires d’origine animale (9), sauf si la transformation des sous-produits animaux se déroule dans des conditions qui ont été approuvées par l’autorité compétente, visant à empêcher la propagation des risques pour la santé publique et animale dans les établissements de transformation des denrées alimentaires. |
|
(15) |
Le règlement (CE) no 999/2001 du Parlement européen et du Conseil du 22 mai 2001 fixant les règles pour la prévention, le contrôle et l’éradication de certaines encéphalopathies spongiformes transmissibles (10) impose aux États membres d’appliquer un programme annuel de surveillance des encéphalopathies spongiformes transmissibles (EST). Les cadavres d’animaux utilisés pour l’alimentation de certaines espèces dans le contexte d’actions visant à promouvoir la biodiversité devraient relever de ces programmes de surveillance de façon à garantir que lesdits programmes fournissent suffisamment d’informations au sujet de la prévalence des EST dans un État membre donné. |
|
(16) |
Le règlement (CE) no 1069/2009 autorise l’utilisation de certaines matières de catégorie 1 pour l’alimentation d’espèces d’oiseaux nécrophages menacées d’extinction ou protégées et d’autres espèces vivant dans leur habitat naturel, afin d’encourager la biodiversité. Il convient d’autoriser ce régime alimentaire pour certaines espèces carnivores visées dans la directive 92/43/CEE du Conseil du 21 mai 1992 concernant la conservation des habitats naturels ainsi que de la faune et de la flore sauvages (11) et pour certaines espèces d’oiseaux de proie visées dans la directive 2009/147/CE du Parlement européen et du Conseil du 30 novembre 2009 concernant la conservation des oiseaux sauvages (12), afin de tenir compte des habitudes alimentaires naturelles de ces espèces. |
|
(17) |
Le règlement (CE) no 1069/2009 a instauré une procédure d’autorisation d’autres méthodes d’utilisation ou d’élimination des sous-produits animaux ou produits dérivés. La Commission peut autoriser ces méthodes après s’être enquise de l’avis de l’Autorité européenne de sécurité des aliments (ci-après «l’EFSA»). Il convient, pour faciliter l’évaluation des demandes par l’EFSA, d’établir un modèle présentant aux demandeurs le type d’informations à fournir. Conformément aux traités, il doit être possible de soumettre des demandes d’autorisation d’autres méthodes dans les langues officielles de l’Union, mentionnées dans le règlement no 1 portant fixation du régime linguistique de la Communauté Économique Européenne (13). |
|
(18) |
Conformément au règlement (CE) no 183/2005 du Parlement européen et du Conseil du 12 janvier 2005 établissant des exigences en matière d’hygiène des aliments pour animaux (14), les exploitants du secteur de l’alimentation animale autres que les producteurs primaires doivent respecter certaines conditions d’hygiène en matière d’entreposage et de transport des aliments pour animaux. Étant donné que ces conditions prévoient une atténuation équivalente des risques potentiels, les aliments composés pour animaux dérivés de sous-produits animaux ne doivent pas être soumis aux obligations du présent règlement relatives à l’entreposage et au transport. |
|
(19) |
Afin de promouvoir la science et la recherche et de garantir une utilisation optimale des sous-produits animaux et des produits dérivés dans le contexte de l’établissement de diagnostics pour des maladies humaines ou animales, il convient que l’autorité compétente soit autorisée à fixer les conditions applicables aux échantillons de ces matières destinés à la recherche, à l’enseignement et à l’établissement d’un diagnostic. Il convient néanmoins de ne pas prévoir de telles conditions pour les échantillons d’agents pathogènes, auxquels s’appliquent des règles particulières fixées dans la directive 92/118/CEE du Conseil du 17 décembre 1992 définissant les conditions de police sanitaire ainsi que les conditions sanitaires régissant les échanges et les importations dans la Communauté de produits non soumis, en ce qui concerne lesdites conditions, aux réglementations communautaires spécifiques visées à l’annexe A, chapitre Ier, de la directive 89/662/CEE et, en ce qui concerne les pathogènes, de la directive 90/425/CEE (15). |
|
(20) |
La directive 97/78/CE dispense des contrôles vétérinaires effectués au poste d’inspection frontalier d’entrée dans l’Union les sous-produits animaux destinés à des expositions, sous réserve qu’ils ne soient pas destinés à être commercialisés, et les sous-produits animaux destinés à des analyses ou études particulières. Cette directive permet l’adoption de mesures portant application de ce régime de dispenses. Le présent règlement doit fixer des conditions d’importation adéquates pour les sous-produits animaux et les produits dérivés destinés à des expositions et à des analyses ou études particulières, pour exclure la propagation de risques inacceptables pour la santé publique ou animale lorsqu’ils sont introduits dans l’Union. La cohérence de la législation de l’Union et la nécessité de garantir la certitude juridique dans l’intérêt des exploitants commandent que ces conditions et les mesures portant application de la directive 97/78/CE soient établies par le présent règlement. |
|
(21) |
Après leur collecte, les sous-produits animaux doivent être manipulés dans des conditions propres à exclure la propagation de risques inacceptables pour la santé publique ou animale. Les usines ou établissements dans lesquels sont accomplies certaines opérations avant que des sous-produits fassent l’objet d’une transformation doivent être construits et exploités de manière à empêcher la propagation de tels risques. Cela doit être le cas des usines et établissements dans lesquels sont accomplies des opérations telles que la manipulation de sous-produits animaux conformément à la législation vétérinaire de l’Union, à l’exclusion de la manipulation de sous-produits animaux au cours des activités de soins réalisées par les vétérinaires privés. |
|
(22) |
Conformément au règlement (CE) no 1069/2009, les exploitants doivent assurer la traçabilité des sous-produits animaux et des produits dérivés à tous les stades de la chaîne de fabrication, d’utilisation et d’élimination, de manière à éviter toute perturbation inutile du marché intérieur en cas d’événements liés à des risques avérés ou potentiels pour la santé publique ou animale. La traçabilité doit dès lors être assurée non seulement par les exploitants produisant, collectant ou transportant des sous-produits animaux, mais par les exploitants éliminant des sous-produits animaux ou des produits dérivés par incinération, coïncinération ou mise en décharge. |
|
(23) |
Les conteneurs et moyens servant au transport de sous-produits animaux ou de produits dérivés doivent être maintenus dans un état de propreté qui empêche toute contamination. Lorsque ces conteneurs et moyens sont affectés au transport d’une matière particulière, tel un sous-produit animal liquide qui ne présente pas de risque sanitaire inacceptable, les exploitants peuvent adapter leurs mesures de prévention de la contamination au risque réel que présente cette matière. |
|
(24) |
Les États membres doivent être autorisés à obliger les exploitants à utiliser le système informatique vétérinaire intégré (Traces), mis en œuvre par la décision 2004/292/CE de la Commission du 30 mars 2004 relative à la mise en application du système TRACES et modifiant la décision 92/486/CEE (16) (ci-après «le système Traces»), pour fournir la preuve de l’arrivée au lieu de destination des envois de sous-produits animaux ou de produits dérivés. L’arrivée des envois doit également pouvoir être attestée au moyen d’un quatrième exemplaire du document commercial, à retourner au producteur. Ces deux solutions doivent être évaluées au terme de la première année d’application du présent règlement. |
|
(25) |
Le règlement (CE) no 853/2004 énonce certains paramètres relatifs au traitement des graisses fondues, des huiles de poisson et des ovoproduits qui permettent de maîtriser correctement les risques éventuels pour la santé lorsque ces produits sont utilisés à des fins autres que la consommation humaine. Ces paramètres doivent dès lors être autorisés en tant que solutions de remplacement des traitements des sous-produits animaux prévus au présent règlement. |
|
(26) |
Le colostrum et les produits à base de colostrum doivent provenir de troupeaux de bovins qui sont indemnes de certaines maladies visées dans la directive 64/432/CEE du Conseil du 26 juin 1964 relative à des problèmes de police sanitaire en matière d’échanges intracommunautaires d’animaux des espèces bovine et porcine (17). |
|
(27) |
Il convient de mettre à jour les références à la directive 76/768/CEE du Conseil du 27 juillet 1976 concernant le rapprochement des législations des États membres relatives aux produits cosmétiques (18), à la directive 96/22/CE du Conseil du 29 avril 1996 concernant l’interdiction d’utilisation de certaines substances à effet hormonal ou thyréostatique et des substances β-agonistes dans les spéculations animales (19) et à la directive 96/23/CE du Conseil du 29 avril 1996 relative aux mesures de contrôle à mettre en œuvre à l’égard de certaines substances et de leurs résidus dans les animaux vivants et leurs produits (20), de même que la référence à la directive 2009/158/CE du Conseil du 30 novembre 2009 relative aux conditions de police sanitaire régissant les échanges intracommunautaires et les importations en provenance des pays tiers de volailles et d’œufs à couver (21) dans les règles sanitaires régissant les échanges de lisier non transformé. |
|
(28) |
Certaines matières importées en vue de la production d’aliments pour animaux familiers doivent être manipulées et utilisées dans des conditions adaptées au risque qu’elles peuvent présenter. Il convient en particulier de veiller à la sécurité d’acheminement de ces matières vers les établissements ou usines de destination lorsque de telles matières, ainsi que des matières de catégorie 3, sont incorporées à des aliments pour animaux familiers. L’autorité compétente doit être autorisée à permettre aux établissements ou usines de destination d’entreposer les matières importées avec des matières de catégories 3 à condition que la traçabilité des premières soit assurée. |
|
(29) |
Le règlement (CE) no 1069/2009 mentionne certains produits dérivés qui peuvent être mis sur le marché conformément aux dispositions d’autres législations spécifiques de l’Union. Ces législations fixent également les conditions d’importation, de collecte et de circulation des sous-produits animaux et des produits dérivés destinés à la fabrication des produits dérivés en question. Le règlement (CE) no 1069/2009 s’applique dès lors que d’autres législations spécifiques de l’Union ne fixent pas de conditions en ce qui concerne les risques que ces matières premières peuvent présenter pour la santé publique et animale. Étant donné que de telles conditions n’ont pas été fixées pour les matières ayant subi certaines transformations préalables à leur mise en conformité avec les conditions de mise sur le marché, il convient que le présent règlement fixe ces conditions. Il convient en particulier de fixer les conditions d’importation et de manipulation de ces matières à l’intérieur de l’Union en prévoyant des dispositions strictes en matière de contrôle et de documentation, afin d’empêcher que ces matières puissent propager des risques pour la santé. |
|
(30) |
Il importe en particulier que le présent règlement fixe des conditions sanitaires appropriées pour les matières utilisées pour la fabrication de médicaments conformément à la directive 2001/83/CE du Parlement européen et du Conseil du 6 novembre 2001 instituant un code communautaire relatif aux médicaments à usage humain (22), de médicaments vétérinaires conformément à la directive 2001/82/CE du Parlement européen et du Conseil du 6 novembre 2001 instituant un code communautaire relatif aux médicaments vétérinaires (23), de dispositifs médicaux conformément à la directive 93/42/CEE du Conseil du 14 juin 1993 relative aux dispositifs médicaux (24), de dispositifs médicaux de diagnostic in vitro conformément à la directive 98/79/CE du Parlement européen et du Conseil du 27 octobre 1998 relative aux dispositifs médicaux de diagnostic in vitro (25), de dispositifs médicaux implantables actifs conformément à la directive 90/385/CE du Conseil du 20 juin 1990 concernant le rapprochement des législations des États membres relatives aux dispositifs médicaux implantables actifs (26) ou de réactifs de laboratoire (ci après «les produits finis»). Si les risques présentés par ces matières sont atténués par la purification ou la concentration des matières dans le produit ou par les conditions de manipulation et d’élimination de celles-ci, seules les dispositions du règlement (CE) no 1069/2009 et du présent règlement relatives à la traçabilité doivent s’appliquer. En pareil cas, il convient de ne pas appliquer les dispositions relatives à la séparation des sous-produits animaux de différentes catégories au sein de l’établissement ou de l’usine fabriquant les produits finis, car l’utilisation ultérieure des matières à d’autres fins, en particulier leur détournement vers les chaînes alimentaires humaine et animale, peut être exclue par l’application correcte des règles par l’exploitant sous la responsabilité de l’autorité compétente. Les envois de ces matières destinés à être importés dans l’Union doivent être soumis à des contrôles vétérinaires au poste d’inspection frontalier d’entrée, conformément à la directive 97/78/CE, de manière à ce qu’il soit vérifié que ces produits satisfont aux conditions de mise sur le marché dans l’Union. |
|
(31) |
Conformément à la directive 2009/156/CE du Conseil du 30 novembre 2009 relative aux conditions de police sanitaire régissant les mouvements d’équidés et les importations d’équidés en provenance des pays tiers (27), certaines maladies auxquelles les équidés sont sensibles sont des maladies à déclaration obligatoire. Il importe que les produits sanguins d’équidés destinés à des usages autres que l’alimentation animale, tels que les produits sanguins destinés à la fabrication de médicaments vétérinaires, ou pharmacie vétérinaire, proviennent d’équidés qui ne présentaient aucun signe clinique de ces maladies, de manière que le risque de transmission de ces maladies soit réduit. |
|
(32) |
Il doit être permis de mettre sur le marché des peaux et cuirs frais à des fins autres que la consommation humaine, pourvu qu’ils satisfassent aux conditions de police sanitaire applicables aux viandes fraîches, fixées conformément à la directive 2002/99/CE du Conseil du 16 décembre 2002 fixant les règles de police sanitaire régissant la production, la transformation, la distribution et l’introduction des produits d’origine animale destinés à la consommation humaine (28), étant donné que ces conditions garantissent une atténuation appropriée des risques potentiels. |
|
(33) |
Les dispositions sanitaires du présent règlement relatives à la fabrication et à la mise sur le marché de trophées de chasse et d’autres préparations provenant d’animaux qui éliminent les risques potentiels doivent s’appliquer sans préjudice des dispositions protégeant certaines espèces d’animaux sauvages du règlement (CE) no 338/97 du Conseil du 9 décembre 1996 relatif à la protection des espèces de faune et de flore sauvages par le contrôle de leur commerce (29), car l’objectif de ce règlement est différent. Les préparations anatomiques d’animaux ou de sous-produits animaux qui ont été soumises à un processus tel que la plastination, qui élimine également les risques potentiels, ne doivent pas faire l’objet de restrictions de police de sanitaire, de sorte que l’utilisation, en particulier dans l’enseignement, de ces préparations soit facilitée. |
|
(34) |
Les sous-produits apicoles destinés à être mis sur le marché doivent être indemnes de certaines maladies auxquelles les abeilles sont sensibles et qui sont mentionnées dans la directive 92/65/CEE du Conseil du 13 juillet 1992 définissant les conditions de police sanitaire régissant les échanges et les importations dans la Communauté d’animaux, de spermes, d’ovules et d’embryons non soumis, en ce qui concerne les conditions de police sanitaire, aux réglementations communautaires spécifiques visées à l’annexe A section I de la directive 90/425/CEE (30). |
|
(35) |
Le Parlement européen et le Conseil ont demandé à la Commission de déterminer le point final de la chaîne de fabrication des produits oléochimiques au-delà duquel ces produits ne sont plus soumis aux dispositions du règlement (CE) no 1069/2009. La décision relative au point final doit être prise dès qu’il aura été procédé à une évaluation de la capacité des procédés oléochimiques à atténuer les risques sanitaires que peuvent présenter les graisses animales provenant de matières de toute catégorie subissant une transformation. |
|
(36) |
Le présent règlement doit faire référence au règlement (UE) no 206/2010 de la Commission du 12 mars 2010 établissant des listes des pays tiers, territoires ou parties de pays tiers ou territoires en provenance desquels l’introduction dans l’Union européenne de certains animaux et viandes fraîches est autorisée, et définissant les exigences applicables en matière de certification vétérinaire (31), dans la mesure où ces pays tiers et autres territoires doivent faire l’objet d’une autorisation en vue de l’importation de certains sous-produits animaux ou produits dérivés, car les risques que présentent ces produits sont identiques à ceux que peuvent présenter les animaux vivants ou les viandes fraîches importés. |
|
(37) |
Il convient également de faire référence à d’autres listes des pays tiers en provenance desquels certaines matières d’origine animale peuvent être importées pour permettre que soient déterminés les pays tiers en provenance desquels des sous-produits animaux des différentes espèces peuvent être importés, et cela sur la base de considérations similaires concernant les risques sanitaires et dans le but d’assurer la cohérence de la législation de l’Union. Ces listes ont été établies par la décision 2004/211/CE de la Commission du 6 janvier 2004 établissant la liste des pays tiers et des parties de territoires de ces pays en provenance desquels les États membres autorisent les importations d’équidés vivants et de sperme, d’ovules et d’embryons de l’espèce équine, et modifiant les décisions 93/195/CEE et 94/63/CE (32), par le règlement (UE) no 605/2010 de la Commission du 2 juillet 2010 arrêtant les conditions sanitaires et de police sanitaire ainsi que les exigences en matière de certification vétérinaire pour l’introduction dans l’Union européenne de lait cru et de produits laitiers destinés à la consommation humaine (33), par la décision 2006/766/CE de la Commission du 6 novembre 2006 établissant les listes des pays tiers et territoires en provenance desquels l’importation de mollusques bivalves, d’échinodermes, de tuniciers, de gastéropodes marins et de produits de la pêche est autorisée (34), par le règlement (CE) no 798/2008 de la Commission du 8 août 2008 établissant une liste des pays tiers, territoires, zones ou compartiments en provenance desquels les volailles et les produits de volailles peuvent être importés dans la Communauté et transiter par celle-ci ainsi que les règles en matière de certification vétérinaire (35) et par le règlement (CE) no 119/2009 de la Commission du 9 février 2009 établissant une liste de pays tiers, ou de parties de pays tiers, pour l’importation dans la Communauté ou le transit par celle-ci de viandes de léporidés sauvages, de certains mammifères terrestres sauvages et de lapins d’élevage, ainsi que les exigences applicables à la certification vétérinaire (36). |
|
(38) |
Étant donné que les déchets de l’industrie photographique, qui utilise certains sous-produits animaux tels que les colonnes vertébrales de bovins, présentent des risques non seulement pour la santé publique et animale, mais pour l’environnement, ces déchets doivent être éliminés ou exportés vers le pays tiers d’origine des sous-produits animaux conformément au règlement (CE) no 1013/2006 du Parlement européen et du Conseil du 14 juin 2006 concernant les transferts de déchets (37). |
|
(39) |
Les règles applicables au transit de certains sous-produits animaux et produits dérivés par l’Union européenne entre des territoires de la Fédération de Russie doivent faire référence à la liste des postes d’inspection frontaliers figurant dans la décision 2009/821/CE de la Commission du 28 septembre 2009 établissant une liste de postes d’inspection frontaliers agréés, fixant certaines règles concernant les inspections réalisées par les experts vétérinaires de la Commission et définissant les unités vétérinaires du système TRACES (38). Le document vétérinaire commun d’entrée établi par le règlement (CE) no 136/2004 de la Commission du 22 janvier 2004 fixant les procédures des contrôles vétérinaires aux postes d’inspection frontaliers de la Communauté lors de l’importation des produits en provenance de pays tiers (39) doit être utilisé aux fins de ce transit. |
|
(40) |
Le présent règlement doit prévoir que les certificats sanitaires qui doivent accompagner les envois de sous-produits animaux ou de produits dérivés au point d’entrée dans l’Union, où les contrôles vétérinaires sont effectués, doivent être établis conformément à des principes de certification équivalents à ceux prévus dans la directive 96/93/CE du Conseil du 17 décembre 1996 concernant la certification des animaux et des produits animaux (40). |
|
(41) |
La cohérence de la législation de l’Union commande que les contrôles officiels effectués tout au long de la chaîne des opérations portant sur les sous-produits animaux et les produits dérivés doivent l’être conformément aux obligations générales concernant l’organisation des contrôles officiels fixées par le règlement (CE) no 882/2004 du Parlement européen et du Conseil du 29 avril 2004 relatif aux contrôles officiels effectués pour s’assurer de la conformité avec la législation sur les aliments pour animaux et les denrées alimentaires et avec les dispositions relatives à la santé animale et au bien-être des animaux (41). |
|
(42) |
Il est dès lors nécessaire que le présent règlement contienne des mesures d’application du règlement (CE) no 1069/2009. |
|
(43) |
Le règlement (CE) no 1069/2009 abroge le règlement (CE) no 1774/2002 avec effet au 4 mars 2011. |
|
(44) |
À la suite de l’adoption du règlement (CE) no 1774/2002, un certain nombre d’actes d’application ont été adoptés; il s’agit du règlement (CE) no 811/2003 de la Commission (42) relatif à l’interdiction de la réutilisation du poisson au sein de l’espèce, et à l’enfouissement et l’incinération de sous-produits animaux, de la décision 2003/322/CE de la Commission (43) relative à l’utilisation de matières de catégorie 1 pour l’alimentation de certains oiseaux nécrophages, de la décision 2003/324/CE de la Commission (44) relative à une dérogation à l’interdiction de la réutilisation des animaux à fourrure au sein de l’espèce, du règlement (CE) no 79/2005 de la Commission (45) relatif au lait et aux produits à base de lait, du règlement (CE) no 92/2005 de la Commission (46) relatif aux modes d’élimination ou à l’utilisation des sous-produits animaux, du règlement (CE) no 181/2006 de la Commission (47) relatif aux engrais organiques et aux amendements autres que le lisier, du règlement (CE) no 1192/2006 de la Commission (48) relatif aux listes d’établissements agréés et du règlement (CE) no 2007/2006 de la Commission (49) relatif à l’importation et au transit de certains produits intermédiaires dérivés de matières de catégorie 3. |
|
(45) |
En outre, certaines mesures transitoires ont été adoptées, notamment le règlement (CE) no 878/2004 de la Commission (50) relatif à l’importation et au traitement de certaines matières de catégorie 1 ou 2, la décision 2004/407/CE de la Commission (51) relative à l’importation de certaines matières en vue de la production de gélatine photographique et le règlement (CE) no 197/2006 de la Commission (52) relatif au traitement et à l’élimination des anciennes denrées alimentaires, pour que certaines utilisations spécifiques de sous-produits animaux soient soumises à des mesures proportionnées aux risques. |
|
(46) |
La Présidence du Conseil ayant demandé de poursuivre la simplification de la réglementation de l’Union relative aux sous-produits animaux lors de l’adoption du règlement (CE) no 1069/2009, ces mesures d’application et ces mesures transitoires ont été révisées. Elles doivent maintenant être abrogées et remplacées, dans la mesure où c’est nécessaire, par le présent règlement, qui constituera un cadre légal cohérent dans le domaine des sous-produits animaux et des produits dérivés. |
|
(47) |
Le règlement (CE) no 1069/2009 est applicable à partir du 4 mars 2011 et il convient donc que le présent règlement soit applicable à partir de la même date. Il est en outre nécessaire de prévoir une période transitoire pour permettre aux parties concernées de s’adapter aux nouvelles règles instaurées par le présent règlement et de mettre sur le marché certains produits qui ont été produits conformément aux règles sanitaires de l’Union applicables avant cette date, et pour permettre la poursuite des importations après la mise en application des dispositions du présent règlement. |
|
(48) |
La mise sur le marché et l’exportation de certains produits visés dans le règlement (CE) no 878/2004 doivent continuer à s’effectuer conformément aux mesures nationales, car les risques associés aux quantités limitées de matières concernées permettent actuellement qu’elles soient régies au niveau national, dans l’attente d’une éventuelle harmonisation. Dans l’attente de l’adoption de mesures relatives à la collecte et à l’élimination de certaines quantités limitées de produits d’origine animale provenant du commerce de détail sur la base de données supplémentaires, l’autorité compétente doit rester habilitée à autoriser la collecte et l’élimination de ces produits par d’autres moyens, à condition que la santé publique et animale jouisse d’une protection équivalente. |
|
(49) |
Conformément à la demande formulée par le Parlement européen lorsqu’il a approuvé le règlement (CE) no 1069/2009 en première lecture et eu égard aux suggestions plus spécifiques du Parlement au sujet de certaines questions techniques, un projet du présent règlement a été présenté le 27 septembre 2010 à sa commission de l’environnement, de la santé publique et de la sécurité alimentaire en prélude à un échange de vues. |
|
(50) |
Les mesures prévues au présent règlement sont conformes à l’avis du comité permanent de la chaîne alimentaire et de la santé animale, |
A ADOPTÉ LE PRÉSENT RÈGLEMENT:
CHAPITRE I
DISPOSITIONS GÉNÉRALES
Article premier
Objet et champ d’application
Le présent règlement établit des mesures d’application:
|
a) |
concernant les règles sanitaires pour la santé publique et animale relatives aux sous-produits animaux et aux produits qui en sont dérivés, établies par le règlement (CE) no 1069/2009; |
|
b) |
concernant certains échantillons et articles exemptés des contrôles vétérinaires aux postes d’inspection frontaliers conformément à l’article 16, paragraphe 1, points e) et f), de la directive 97/78/CE. |
Article 2
Définitions
Aux fins du présent règlement, les définitions figurant à l’annexe I sont applicables.
Article 3
Point final de la chaîne de fabrication de certains produits dérivés
Les produits dérivés suivants, autres que ceux importés, peuvent être mis sur le marché sans restrictions, conformément à l’article 5, paragraphe 2, du règlement (CE) no 1069/2009:
|
a) |
le biodiesel qui remplit les conditions d’élimination et d’utilisation des produits dérivés énoncées à l’annexe IV, chapitre IV, section 3, point 2 b), du présent règlement; |
|
b) |
les aliments transformés pour animaux familiers qui satisfont aux exigences spécifiques relatives aux aliments transformés pour animaux familiers énoncées à l’annexe XIII, chapitre II, point 7 a), du présent règlement; |
|
c) |
les articles à mastiquer qui satisfont aux exigences spécifiques relatives aux articles à mastiquer énoncées à l’annexe XIII, chapitre II, point 7 b), du présent règlement; |
|
d) |
les cuirs et les peaux d’ongulés qui satisfont aux exigences spécifiques relatives au point final de la chaîne de fabrication de ces produits, énoncées à l’annexe XIII, chapitre V, point C, du présent règlement; |
|
e) |
la laine et les poils qui satisfont aux exigences spécifiques relatives au point final de la chaîne de fabrication de ces produits, énoncées à l’annexe XIII, chapitre VII, point B, du présent règlement; |
|
f) |
les plumes et le duvet qui satisfont aux exigences spécifiques relatives au point final de la chaîne de fabrication de ces produits, énoncées à l’annexe XIII, chapitre VII, point C, du présent règlement; |
|
g) |
la fourrure qui satisfait aux exigences spécifiques de l’annexe XIII, chapitre VIII, du présent règlement. |
Article 4
Maladies transmissibles graves
Les maladies énumérées à l’article 1.2.3 du Code sanitaire pour les animaux terrestres 2010 et au chapitre 1.3 du Code sanitaire pour les animaux aquatiques 2010 de l’OIE sont considérées comme des maladies transmissibles graves aux fins des restrictions de police sanitaire générales prévues à l’article 6, paragraphe 1, point b) ii), du règlement (CE) no 1069/2009.
CHAPITRE II
ÉLIMINATION ET UTILISATION DE SOUS-PRODUITS ANIMAUX ET DE PRODUITS DÉRIVÉS
Article 5
Restrictions concernant l’utilisation de sous-produits animaux et de produits dérivés
1. Les exploitants des États membres visés à l’annexe II, chapitre I, satisfont aux conditions d’alimentation des animaux à fourrure au moyen de certaines matières dérivées de corps ou de parties d’animaux de la même espèce, énoncées au même chapitre.
2. Les exploitants satisfont aux restrictions concernant l’alimentation des animaux d’élevage au moyen de fourrages provenant de pâturages auxquels ont été appliqués certains engrais organiques ou amendements, énoncées à l’annexe II, chapitre II.
Article 6
Élimination par incinération et coïncinération
1. L’autorité compétente veille à ce que l’incinération et la coïncinération de sous-produits animaux et de produits dérivés soient réalisées uniquement:
|
a) |
dans des installations d’incinération et de coïncinération qui ont obtenu un permis conformément à la directive 2000/76/CE; ou |
|
b) |
pour les installations auxquelles cette directive n’impose pas d’avoir un permis, dans des installations d’incinération et de coïncinération qui ont été agréées par l’autorité compétente pour effectuer l’élimination par incinération, ou l’élimination ou la valorisation par coïncinération, en tant que déchets, de sous-produits animaux ou de produits dérivés, conformément à l’article 24, paragraphe 1, point b) ou c), du règlement (CE) no 1069/2009. |
2. L’autorité compétente n’agrée les installations d’incinération et les installations de coïncinération visées au paragraphe 1, point b), conformément à l’article 24, paragraphe 1, point b) ou c), du règlement (CE) no 1069/2009, que si elles satisfont aux exigences énoncées à l’annexe III du présent règlement.
3. Les exploitants d’installations d’incinération et d’installations de coïncinération satisfont aux exigences générales relatives à l’incinération et à la coïncinération énoncées à l’annexe III, chapitre I, du présent règlement.
4. Les exploitants d’installations d’incinération et de coïncinération de grande capacité satisfont aux exigences énoncées à l’annexe III, chapitre II, du présent règlement.
5. Les exploitants d’installations d’incinération et de coïncinération de faible capacité satisfont aux exigences énoncées à l’annexe III, chapitre III, du présent règlement.
Article 7
Mise en décharge de certaines matières des catégories 1 et 3
Par dérogation à l’article 12 et à l’article 14, point c), du règlement (CE) no 1069/2009, l’autorité compétente peut autoriser l’élimination des matières suivantes des catégories 1 et 3 dans une décharge autorisée:
|
a) |
les aliments pour animaux familiers importés ou produits à partir de matières importées, provenant de matières de catégorie 1 visées à l’article 8, point c), du règlement (CE) no 1069/2009; |
|
b) |
les matières de catégorie 3 visées à l’article 10, points f) et g), du règlement (CE) no 1069/2009, à condition:
|
Article 8
Exigences applicables aux usines de transformation et aux autres établissements
1. Les exploitants veillent à ce que les usines de transformation et les autres établissements se trouvant sous leur contrôle satisfassent aux conditions suivantes, détaillées à l’annexe IV, chapitre I:
|
a) |
les conditions générales de transformation énoncées à la section 1; |
|
b) |
les conditions de traitement des eaux usées énoncées à la section 2; |
|
c) |
les conditions spécifiques de transformation des matières de catégorie 1 et de catégorie 2, énoncées à la section 3; |
|
d) |
les conditions spécifiques de transformation des matières de catégorie 3, énoncées à la section 4. |
2. L’autorité compétente n’agrée les usines de transformation et les autres établissements que s’ils satisfont aux conditions fixées à l’annexe IV, chapitre I.
Article 9
Exigences en matière d’hygiène et de transformation applicables aux usines de transformation et autres établissements
Les exploitants veillent à ce que les établissements et les usines se trouvant sous leur contrôle satisfassent aux exigences suivantes, détaillées à l’annexe IV:
|
a) |
les exigences en matière d’hygiène et de transformation énoncées au chapitre II; |
|
b) |
les méthodes de transformation selon les normes décrites au chapitre III, à condition qu’elles soient employées au sein de l’établissement ou de l’usine; |
|
c) |
les autres méthodes de transformation décrites au chapitre IV, à condition qu’elles soient employées au sein de l’établissement ou de l’usine. |
Article 10
Exigences concernant la conversion de sous-produits animaux et de produits dérivés en biogaz et le compostage
1. Les exploitants veillent à ce que les établissements et usines sous leur contrôle satisfassent aux exigences suivantes concernant la conversion de sous-produits animaux et produits dérivés en biogaz et le compostage, détaillées à l’annexe V:
|
a) |
les exigences applicables aux usines de production de biogaz et de compostage, énoncées au chapitre I; |
|
b) |
les exigences en matière d’hygiène applicables aux usines de production de biogaz et de compostage, énoncées au chapitre II; |
|
c) |
les paramètres de conversion selon les normes énoncées au chapitre III, section 1; |
|
d) |
les normes relatives aux résidus de digestion et au compost énoncées au chapitre III, section 3. |
2. L’autorité compétente n’agrée les usines de production de biogaz et de compostage que si elles satisfont aux exigences énoncées à l’annexe V.
3. L’autorité compétente peut autoriser les usines de production de biogaz et de compostage à utiliser d’autres paramètres de conversion sous réserve des exigences énoncées à l’annexe V, chapitre III, section 2.
CHAPITRE III
DÉROGATIONS À CERTAINES DISPOSITIONS DU RÈGLEMENT (CE) No 1069/2009
Article 11
Règles particulières relatives aux échantillons de recherche et de diagnostic
1. L’autorité compétente peut autoriser le transport, l’utilisation et l’élimination des d’échantillons de recherche et de diagnostic dans des conditions qui garantissent la maîtrise des risques pour la santé publique et animale.
L’autorité compétente veille en particulier à ce que les exploitants satisfassent aux exigences de l’annexe VI, chapitre I.
2. Les exploitants se conforment aux règles particulières relatives aux échantillons de recherche et de diagnostic, énoncées à l’annexe VI, chapitre I.
3. Les exploitants peuvent expédier des échantillons de recherche et de diagnostic constitués des sous-produits animaux et des produits dérivés mentionnés ci-après vers un autre État membre sans en informer l’autorité compétente de l’État membre d’origine conformément à l’article 48, paragraphe 1, du règlement (CE) no 1069/2009 et sans que l’autorité compétente de l’État membre de destination en ait été informée au moyen du système Traces et ait décidé d’accepter l’envoi conformément à l’article 48, paragraphes 1 et 3, dudit règlement:
|
a) |
les matières des catégories 1 et 2 et les farines de viande et d’os ou les graisses animales dérivées de matières de ces catégories; |
|
b) |
les protéines animales transformées. |
Article 12
Règles particulières relatives aux échantillons commerciaux et aux articles d’exposition
1. L’autorité compétente peut autoriser le transport, l’utilisation et l’élimination des échantillons commerciaux et des articles d’exposition dans des conditions qui garantissent la maîtrise des risques pour la santé publique et animale.
L’autorité compétente veille en particulier à ce que les exploitants satisfassent aux exigences de l’annexe VI, chapitre I, section 1, points 2, 3 et 4.
2. Les exploitants se conforment aux règles particulières relatives aux échantillons commerciaux et aux articles d’exposition, énoncées à l’annexe VI, chapitre I, section 2.
3. Les exploitants peuvent expédier des échantillons commerciaux constitués des sous-produits animaux et des produits dérivés mentionnés ci-après vers un autre État membre sans en informer l’autorité compétente de l’État membre d’origine conformément à l’article 48, paragraphe 1, du règlement (CE) no 1069/2009 et sans que l’autorité compétente de l’État membre de destination en ait été informée au moyen du système Traces et ait décidé d’accepter l’envoi conformément à l’article 48, paragraphes 1 et 3, de ce règlement:
|
a) |
les matières des catégories 1 et 2 et les farines de viande et d’os ou les graisses animales dérivées de matières de ces catégories; |
|
b) |
les protéines animales transformées. |
Article 13
Règles particulières relatives à l’alimentation des animaux
1. Les exploitants peuvent utiliser les matières de catégorie 2, à condition qu’elles proviennent d’animaux qui n’ont pas été mis à mort et ne sont pas morts en raison de la présence ou de la présence suspectée d’une maladie transmissible aux humains ou aux animaux, sous réserve des exigences générales établies à l’annexe VI, chapitre II, section 1, et de toutes autres conditions que l’autorité compétente pourrait fixer, pour l’alimentation des animaux suivants:
|
a) |
les animaux de zoo; |
|
b) |
les animaux à fourrure; |
|
c) |
les chiens provenant d’élevages ou de meutes reconnus; |
|
d) |
les chiens et les chats des refuges; |
|
e) |
les asticots et les vers destinés à servir d’appâts de pêche. |
2. Les exploitants peuvent utiliser les matières de catégorie 3, sous réserve des exigences générales établies à l’annexe VI, chapitre II, section 1, et de toutes autres conditions que l’autorité compétente pourrait fixer, pour l’alimentation des animaux suivants:
|
a) |
les animaux de zoo; |
|
b) |
les animaux à fourrure; |
|
c) |
les chiens provenant d’élevages ou de meutes reconnus; |
|
d) |
les chiens et les chats des refuges; |
|
e) |
les asticots et les vers destinés à servir d’appâts de pêche. |
Article 14
Alimentation des animaux de certaines espèces à l’intérieur et à l’extérieur de placettes de nourrissage et à l’intérieur de zoos
1. L’autorité compétente peut autoriser l’utilisation des matières de catégorie 1 consistant en cadavres entiers ou parties d’animaux morts contenant des matériels à risque spécifiés pour:
|
a) |
l’alimentation, dans des placettes de nourrissage, d’espèces d’oiseaux nécrophages menacées d’extinction ou protégées et d’autres espèces vivant dans leur habitat naturel, afin d’encourager la biodiversité, sous réserve des conditions énoncées à l’annexe VI, chapitre II, section 2; |
|
b) |
l’alimentation, en dehors de placettes de nourrissage, s’il y a lieu en l’absence de collecte préalable des animaux morts, des animaux sauvages visés à l’annexe VI, chapitre II, section 2, point 1 a), sous réserve des conditions fixées à l’annexe VI, chapitre II, section 3. |
2. L’autorité compétente peut autoriser l’utilisation de matières de catégorie 1 consistant en cadavres entiers ou parties d’animaux morts contenant des matériels à risque spécifiés et l’utilisation de matières provenant d’animaux de zoo pour l’alimentation d’animaux de zoo, sous réserve des conditions fixées à l’annexe VI, chapitre II, section 4.
Article 15
Règles particulières relatives à la collecte et à l’élimination
Si l’autorité compétente autorise par voie de dérogation que les sous-produits animaux soient éliminés suivant l’une des méthodes prévues à l’article 19, paragraphe 1, point a), b), c) et e), du règlement (CE) no 1069/2009, l’élimination s’effectue dans le respect des règles particulières suivantes, détaillées à l’annexe VI, chapitre III, du présent règlement:
|
a) |
les règles particulières relatives à l’élimination des sous-produits animaux, énoncées à la section 1; |
|
b) |
les règles relatives à l’incinération et à l’enfouissement des sous-produits animaux dans les régions éloignées, énoncées à la section 2; |
|
c) |
les règles relatives à l’incinération et à l’enfouissement des abeilles et des sous-produits apicoles, énoncées à la section 3. |
CHAPITRE IV
AUTORISATIONS D’AUTRES MÉTHODES
Article 16
Formats requis pour les demandes d’autorisation d’autres méthodes
1. Les demandes d’autorisation d’autres méthodes d’utilisation ou d’élimination des sous-produits animaux ou des produits dérivés, visées à l’article 20, paragraphe 1, du règlement (CE) no 1069/2009, sont introduites par les États membres ou les parties intéressées, qui se conforment aux exigences de présentation des demandes d’autorisation d’autres méthodes figurant à l’annexe VII du présent règlement.
2. Les États membres désignent des points de contact nationaux chargés de communiquer des informations sur l’autorité compétente chargée de l’évaluation des demandes d’autorisation d’autres méthodes d’utilisation ou d’élimination des sous-produits animaux.
3. La Commission publie la liste des points de contact nationaux sur son site web.
CHAPITRE V
COLLECTE, TRANSPORT, IDENTIFICATION ET TRAÇABILITÉ
Article 17
Exigences relatives aux documents commerciaux et certificats sanitaires, à l’identification, à la collecte et au transport des sous-produits animaux et à la traçabilité
1. Les exploitants veillent à ce que les sous-produits animaux et les produits dérivés:
|
a) |
satisfassent aux exigences relatives à la collecte, au transport et à l’identification énoncées à l’annexe VIII, chapitres I et II; |
|
b) |
soient accompagnés durant le transport par des documents commerciaux ou des certificats sanitaires conformément aux exigences énoncées à l’annexe VIII, chapitre III. |
2. Les exploitants qui expédient, transportent ou reçoivent des sous-produits animaux ou des produits dérivés conservent des enregistrements concernant les envois et les documents commerciaux ou certificats sanitaires s’y rapportant conformément aux exigences énoncées à l’annexe VIII, chapitre IV.
3. Les exploitants se conforment aux exigences relatives au marquage de certains produits dérivés énoncées à l’annexe VIII, chapitre V.
CHAPITRE VI
ENREGISTREMENT ET AGRÉMENT DES ÉTABLISSEMENTS ET USINES
Article 18
Exigences relatives à l’agrément d’un ou de plusieurs établissements et usines manipulant des sous-produits animaux sur un même site
L’autorité compétente peut accorder l’agrément à plusieurs établissements ou usines manipulant des sous-produits animaux sur un même site, à condition que la propagation des risques pour la santé publique et animale entre les établissements ou usines soit exclue par leur aménagement et la manipulation des sous-produits animaux et produits dérivés au sein des établissements ou usines.
Article 19
Exigences concernant certains établissements et usines agréés manipulant des sous-produits animaux et des produits dérivés
Les exploitants veillent à ce que les établissements et usines sous leur contrôle qui ont été agréés par l’autorité compétente satisfassent aux exigences énoncées aux chapitres de l’annexe IX du présent règlement mentionnés ci-après lorsqu’ils exercent une ou plusieurs des activités suivantes visées à l’article 24, paragraphe 1, du règlement (CE) no 1069/2009:
|
a) |
le chapitre I, lorsqu’ils fabriquent des aliments pour animaux familiers, comme visé à l’article 24, paragraphe 1, point e), dudit règlement; |
|
b) |
le chapitre II, lorsqu’ils entreposent des sous-produits animaux, comme visé à l’article 24, paragraphe 1, point i), dudit règlement et lorsqu’ils manipulent des sous-produits animaux après leur collecte, sous la forme des opérations suivantes visées à l’article 24, paragraphe 1, point h), dudit règlement:
|
|
c) |
le chapitre III, lorsqu’ils entreposent des produits dérivés destinés à certains usages visés à l’article 24, paragraphe 1, point j), dudit règlement. |
Article 20
Exigences concernant certains établissements et usines enregistrés manipulant des sous-produits animaux et des produits dérivés
1. Les exploitants d’usines ou d’établissements enregistrés et les autres exploitants enregistrés manipulent les sous-produits animaux et les produits dérivés conformément aux conditions énoncées à l’annexe IX, chapitre IV.
2. Les exploitants enregistrés transportant des sous-produits animaux ou des produits dérivés entre des endroits autres que des locaux du même exploitant satisfont en particulier aux conditions énoncées à l’annexe IX, chapitre IV, point 2.
3. Les paragraphes 1 et 2 ne s’appliquent pas:
|
a) |
aux exploitants agréés qui font du transport des sous-produits animaux ou des produits dérivés une activité auxiliaire; |
|
b) |
aux exploitants qui ont été enregistrés pour des activités de transport conformément au règlement (CE) no 183/2005. |
4. L’autorité compétente peut exempter les exploitants mentionnés ci-après de l’obligation de communiquer des informations visée à l’article 23, paragraphe 1, point a), du règlement (CE) no 1069/2009:
|
a) |
les exploitants manipulant ou produisant des trophées de chasse ou d’autres préparations visés à l’annexe XIII, chapitre VI, du présent règlement à des fins privées ou non commerciales; |
|
b) |
les exploitants manipulant ou éliminant des échantillons de recherche et de diagnostic à des fins éducatives. |
CHAPITRE VII
MISE SUR LE MARCHÉ
Article 21
Transformation et mise sur le marché des sous-produits animaux et des produits dérivés destinés à l’alimentation des animaux d’élevage à l’exception des animaux à fourrure
1. Les exploitants satisfont aux exigences visées ci-après concernant la mise sur le marché, à l’exception de l’importation, des sous-produits animaux et des produits dérivés destinés à l’alimentation des animaux d’élevage à l’exception des animaux à fourrure, arrêtées conformément à l’article 31, paragraphe 2, du règlement (CE) no 1069/2009 et énoncées à l’annexe X du présent règlement:
|
a) |
les exigences générales relatives à la transformation et à la mise sur le marché énoncées au chapitre I; |
|
b) |
les exigences spécifiques relatives aux protéines animales transformées et aux autres produits dérivés, énoncées au chapitre II; |
|
c) |
les exigences relatives à certains aliments pour poissons et appâts de pêche énoncées au chapitre III. |
2. L’autorité compétente peut autoriser la mise sur le marché, à l’exception de l’importation, du lait, des produits à base de lait et des produits dérivés du lait qui sont classés dans les matières de catégorie 3 conformément à l’article 10, points e), f) et h), du règlement (CE) no 1069/2009 et qui n’ont pas été transformés conformément aux exigences générales énoncées à l’annexe X, chapitre II, section 4, partie I, du présent règlement, à condition que ces matières satisfassent aux conditions de dérogation relatives à la mise sur le marché de lait transformé conformément aux normes nationales énoncées à l’annexe X, chapitre II, section 4, partie II, du présent règlement.
Article 22
Mise sur le marché et utilisation d’engrais organiques et d’amendements
1. Les exploitants satisfont aux exigences relatives à la mise sur le marché, à l’exception de l’importation, d’engrais organiques et d’amendements et à l’utilisation de ces produits, en particulier leur application au sol, arrêtées conformément à l’article 15, paragraphe 1, point i), et à l’article 32, paragraphe 1, du règlement (CE) no 1069/2009 et énoncées à l’annexe XI du présent règlement.
2. La mise sur le marché, y compris l’importation, de guano d’oiseaux marins sauvages n’est soumise à aucune condition de police sanitaire.
3. L’autorité compétente de l’État membre dans lequel un engrais organique ou un amendement produit à partir de farines de viande et d’os dérivées de matières de catégorie 2 ou de protéines animales transformées doit être appliqué au sol, autorise un ou plusieurs constituants destinés à être mélangés avec ces matières conformément à l’article 32, paragraphe 1, point d), du règlement (CE) no 1069/2009, dans le respect des conditions énoncées à l’annexe XI, chapitre II, section I, point 3, du présent règlement.
4. Par dérogation à l’article 48, paragraphe 1, du règlement (CE) no 1069/2009, les autorités compétentes d’un État membre d’origine et d’un État membre de destination qui ont une frontière commune peuvent autoriser l’expédition de lisier entre des exploitations agricoles situées dans des régions frontalières de ces deux États membres sous réserve de conditions appropriées de maîtrise de tous les risques éventuels pour la santé publique ou animale, comme l’obligation faite aux exploitants concernés de conserver les informations appropriées, énoncées dans un accord bilatéral.
5. Comme prévu à l’article 30, paragraphe 1, du règlement (CE) no 1069/2009, les autorités compétentes des États membres encouragent, si nécessaire, l’élaboration, la diffusion et l’utilisation de guides nationaux de bonnes pratiques agricoles pour l’application au sol d’engrais organiques et d’amendements.
Article 23
Produits intermédiaires
1. Les produits intermédiaires importés dans l’Union ou transitant par celle-ci satisfont aux conditions de maîtrise des risques potentiels pour la santé publique et animale énoncées à l’annexe XII du présent règlement.
2. Les produits intermédiaires qui ont été transportés dans un établissement ou une usine visés à l’annexe XII, point 3, du présent règlement peuvent être manipulés sans autres restrictions au titre du règlement (CE) no 1069/2009 et du présent règlement, à condition:
|
a) |
que l’établissement ou l’usine dispose des équipements qui permettent de réceptionner les produits intermédiaires en empêchant la transmission de maladies transmissibles à l’homme ou aux animaux; |
|
b) |
que les produits intermédiaires ne présentent aucun risque de transmission de maladies transmissibles à l’homme ou aux animaux, en raison de leur purification ou des traitements auxquels les sous-produits animaux contenus dans les produits intermédiaires ont été soumis, en raison de la concentration de sous-produits animaux dans les produits intermédiaires ou en raison de l’application de mesures de biosécurité adéquates lors de la manipulation des produits intermédiaires; |
|
c) |
que l’établissement ou l’usine conserve des enregistrements sur lesquels figurent les quantités de matières reçues, leur catégorie, le cas échéant, et l’établissement, l’usine ou l’exploitant où les produits ont été livrés; et |
|
d) |
que les produits intermédiaires inutilisés ou les autres matières excédentaires de l’établissement ou de l’usine, tels les produits périmés, soient éliminés conformément au règlement (CE) no 1069/2009. |
3. L’exploitant ou le propriétaire de l’établissement ou usine de destination des produits intermédiaires ou son représentant utilise et/ou expédie les produits intermédiaires dans le seul but qu’ils soient mélangés, enrobés, assemblés, emballés ou étiquetés.
Article 24
Aliments pour animaux familiers et autres produits dérivés
1. Il est interdit d’utiliser des matières de catégorie 1 visées à l’article 8, points a), b), d) et e), du règlement (CE) no 1069/2009 pour la fabrication de produits dérivés destinés à être ingérés par des humains ou des animaux, ou destinés à leur être appliqués, autres que les produits dérivés visés aux articles 33 et 36 dudit règlement.
2. Lorsqu’un sous-produit animal ou un produit dérivé peut être utilisé pour l’alimentation des animaux d’élevage ou à d’autres fins visées à l’article 36, point a), du règlement (CE) no 1069/2009, il fait l’objet d’une mise sur le marché autre qu’une importation conformément aux exigences spécifiques relatives aux protéines animales transformées et aux autres produits dérivés énoncées à l’annexe X, chapitre II, du présent règlement, à condition que l’annexe XIII du présent règlement n’énonce pas d’exigences spécifiques pour ces produits.
3. Les exploitants satisfont aux exigences relatives à la mise sur le marché, autre que l’importation, d’aliments pour animaux familiers, visées à l’article 40 du règlement (CE) no 1069/2009 et énoncées à l’annexe XIII, chapitres I et II, du présent règlement.
4. Les exploitants satisfont aux exigences relatives à la mise sur le marché, autre que l’importation, de produits dérivés, visées à l’article 40 du règlement (CE) no 1069/2009 et énoncées à l’annexe XIII, chapitre I et chapitres III à XII, du présent règlement.
CHAPITRE VIII
IMPORTATION, TRANSIT ET EXPORTATION
Article 25
Importation, transit et exportation des sous-produits animaux et des produits dérivés
1. L’importation dans l’Union et le transit par celle-ci des sous-produits animaux suivants sont interdits:
|
a) |
le lisier non transformé; |
|
b) |
les plumes, les parties de plumes et le duvet non traités; |
|
c) |
la cire d’abeille sous la forme de rayon de miel. |
2. L’importation dans l’Union et le transit par celle-ci des produits suivants ne sont soumis à aucune condition de police sanitaire:
|
a) |
la laine et les poils qui ont été lavés en usine ou qui ont été traités selon une autre méthode garantissant l’élimination de tout risque inacceptable; |
|
b) |
les fourrures qui ont été séchées à une température ambiante de 18 °C pendant au moins deux jours à un taux d’humidité de 55 %. |
3. Les exploitants satisfont aux exigences spécifiques visées ci-après relatives à l’importation dans l’Union et au transit par celle-ci de certains sous-produits animaux et produits dérivés arrêtées conformément à l’article 41, paragraphe 3, et à l’article 42 du règlement (CE) no 1069/2009 et énoncées à l’annexe XIV du présent règlement:
|
a) |
les exigences spécifiques relatives à l’importation et au transit de matières de catégorie 3 et de produits dérivés destinés à être utilisés dans la chaîne alimentaire animale, en dehors des aliments pour animaux familiers ou pour animaux à fourrure, énoncées à l’annexe XIV, chapitre I; |
|
b) |
les exigences spécifiques relatives à l’importation et au transit de sous-produits animaux et de produits dérivés destinés à être utilisés en dehors de la chaîne alimentaire des animaux d’élevage, énoncées à l’annexe XIV, chapitre II. |
Article 26
Mise sur le marché, y compris l’importation, et exportation de certaines matières de catégorie 1
L’autorité compétente peut autoriser la mise sur le marché, y compris l’importation, et l’exportation de peaux et de cuirs provenant d’animaux qui ont fait l’objet d’un traitement illégal au sens de l’article 1er, paragraphe 2, point d), de la directive 96/22/CE ou de l’article 2, point b), de la directive 96/23/CE, d’intestins de ruminants (vidés ou non), d’os et de produits à base d’os contenant la colonne vertébrale et le crâne, sous réserve des exigences suivantes:
|
a) |
ces matières ne peuvent être des matières de catégorie 1 provenant des animaux suivants:
|
|
b) |
ces matières ne peuvent être destinées à aucun des usages suivants:
|
|
c) |
les matières doivent être importées munies d’une étiquette et doivent satisfaire aux exigences spécifiques applicables à certains mouvements de sous-produits animaux énoncées à l’annexe XIV, chapitre IV, section 1, du présent règlement; |
|
d) |
les matières doivent être importées conformément aux dispositions légales nationales relatives à la certification sanitaire. |
Article 27
Importation et transit d’échantillons de recherche et de diagnostic
1. L’autorité compétente peut autoriser l’importation et le transit d’échantillons de recherche et de diagnostic qui contiennent des produits dérivés ou des sous-produits animaux, y compris les sous-produits animaux visés à l’article 25, paragraphe 1, dans des conditions qui garantissent la maîtrise des risques pour la santé publique et animale.
Ces conditions prévoient au moins ce qui suit:
|
a) |
l’introduction de l’envoi doit avoir été préalablement autorisée par l’autorité compétente de l’État membre de destination; et |
|
b) |
l’envoi doit être expédié directement à l’utilisateur autorisé à partir du point d’entrée dans l’Union européenne. |
2. Les exploitants présentent les échantillons de recherche et de diagnostic qui sont destinés à être importés via un État membre autre que l’État membre de destination à un poste d’inspection frontalier agréé de l’Union mentionné sur la liste figurant à l’annexe I de la décision 2009/821/CE. Au poste d’inspection frontalier, ces échantillons de recherche et de diagnostic ne font pas l’objet des contrôles vétérinaires effectués conformément au chapitre I de la directive 97/78/CE. L’autorité compétente du poste d’inspection frontalier informe l’autorité compétente de l’État membre de destination de l’introduction des échantillons de recherche et de diagnostic au moyen du système Traces.
3. Les exploitants manipulant des échantillons de recherche et de diagnostic satisfont aux exigences particulières applicables à l’élimination des échantillons de recherche et de diagnostic, énoncées à l’annexe XIV, chapitre III, section I, du présent règlement.
Article 28
Importation et transit d’échantillons commerciaux et d’articles d’exposition
1. L’autorité compétente peut autoriser l’importation et le transit d’échantillons commerciaux conformément aux règles particulières énoncées à l’annexe XIV, chapitre III, section 2, point 1, du présent règlement.
2. Les exploitants manipulant des échantillons commerciaux satisfont aux règles particulières relatives à la manipulation et à l’élimination des échantillons commerciaux, énoncées à l’annexe XIV, chapitre III, section 2, points 2 et 3, du présent règlement.
3. L’autorité compétente peut autoriser l’importation et le transit d’articles d’exposition conformément aux règles particulières relatives aux articles d’exposition, énoncées à l’annexe XIV, chapitre III, section 3, du présent règlement.
4. Les exploitants manipulant des articles d’exposition satisfont aux conditions relatives à l’emballage, à la manipulation et à l’élimination des articles d’exposition, énoncées à l’annexe XIV, chapitre III, section 3, du présent règlement.
Article 29
Dispositions spécifiques concernant certains mouvements de sous-produits animaux entre des territoires de la Fédération de Russie
1. L’autorité compétente autorise les mouvements spécifiques d’envois de sous-produits animaux provenant de la Fédération de Russie et destinés à celle-ci, transportés directement ou via un autre pays tiers, par route ou par rail, sur le territoire de l’Union, entre des postes d’inspection frontaliers agréés de l’Union mentionnés à l’annexe I de la décision 2009/821/CE, pour autant que les conditions suivantes soient remplies:
|
a) |
l’envoi est scellé par les services vétérinaires de l’autorité compétente au poste d’inspection frontalier d’entrée dans l’Union au moyen d’un sceau portant un numéro d’ordre; |
|
b) |
les documents accompagnant l’envoi, visés à l’article 7 de la directive 97/78/CE, sont marqués sur chaque page, par le vétérinaire officiel de l’autorité compétente responsable du poste d’inspection frontalier, au moyen d’un cachet portant la mention «UNIQUEMENT POUR TRANSIT PAR L’UE À DESTINATION DE LA RUSSIE»; |
|
c) |
les exigences procédurales prévues à l’article 11 de la directive 97/78/CE sont respectées; |
|
d) |
le vétérinaire officiel du poste d’inspection frontalier d’introduction a certifié que l’envoi était acceptable pour le transit sur le document vétérinaire commun d’entrée prévu à l’annexe III du règlement (CE) no 136/2004. |
2. Le déchargement ou l’entreposage de tels envois sur le territoire d’un État membre, au sens de l’article 12, paragraphe 4, ou de l’article 13 de la directive 97/78/CE, ne sont pas autorisés.
3. L’autorité compétente effectue régulièrement des contrôles afin de vérifier que le nombre d’envois et les quantités de produits quittant le territoire de l’Union européenne correspondent au nombre et aux quantités qui y ont été introduites.
Article 30
Listes des établissements et usines dans les pays tiers
Les listes des établissements et des usines dans les pays tiers sont enregistrées dans le système Traces conformément aux spécifications techniques publiées sur le site web de la Commission.
Chaque liste est régulièrement mise à jour.
Article 31
Modèles de certificats sanitaires et de déclarations à utiliser pour l’importation et le transit
Les envois de sous-produits animaux et de produits dérivés destinés à être importés dans l’Union ou à transiter par celle-ci sont accompagnés de certificats sanitaires et de déclarations établis conformément aux modèles figurant à l’annexe XV du présent règlement, lorsqu’ils sont présentés au point d’entrée dans l’Union où les contrôles vétérinaires sont effectués, comme le prévoit la directive 97/78/CE.
CHAPITRE IX
CONTRÔLES OFFICIELS
Article 32
Contrôles officiels
1. L’autorité compétente prend les mesures nécessaires pour contrôler tous les stades de la collecte, du transport, de l’utilisation et de l’élimination des sous-produits animaux et des produits dérivés, visés l’article 4, paragraphe 2, du règlement (CE) no 1069/2009.
Ces mesures sont appliquées conformément aux principes relatifs aux contrôles officiels, énoncés à l’article 3 du règlement (CE) no 882/2004.
2. Les contrôles officiels visés au paragraphe 1 comprennent des vérifications concernant l’archivage des enregistrements et autres documents requis par les dispositions du présent règlement.
3. L’autorité compétente effectue les contrôles officiels mentionnés ci-dessous, visés à l’article 45, paragraphe 1, du règlement (CE) no 1069/2009, conformément aux exigences énoncées à l’annexe XVI du présent règlement:
|
a) |
les contrôles officiels dans les usines de transformation, décrits au chapitre I; |
|
b) |
les contrôles officiels concernant d’autres activités incluant la manipulation de sous-produits animaux et de produits dérivés, décrits au chapitre III, sections 1 à 9. |
4. L’autorité compétente contrôle les scellés apposés sur les envois de sous-produits animaux ou de produits dérivés.
Lorsque l’autorité compétente appose un scellé sur un tel envoi qui est transporté vers un lieu de destination, elle doit en informer l’autorité compétente du lieu de destination.
5. L’autorité compétente établit la liste des établissements, usines et exploitants visée à l’article 47, paragraphe 1, du règlement (CE) no 1069/2009, en respectant les modalités fixées à l’annexe XVI, chapitre II, du présent règlement.
6. L’autorité compétente de l’État membre de destination se prononce sur la demande d’un exploitant concernant l’acceptation ou le refus de certaines matières de catégorie 1 ou 2 et de farines de viande et d’os ou des graisses animales dérivées de matières de catégorie 1 ou 2 dans un délai de 20 jours civils à compter de la date de réception de la demande, à condition qu’elle ait été présentée dans l’une des langues officielles de cet État membre.
7. Les exploitants présentent leurs demandes d’autorisation visées au paragraphe 6 en respectant le modèle figurant à l’annexe XVI, chapitre III, section 10, du présent règlement.
Article 33
Nouvel agrément d’usines et d’établissements après l’octroi d’un agrément temporaire
1. Lorsqu’une usine ou un établissement agréé pour la transformation de matières de catégorie 3 est agréé temporairement pour la transformation de matières de catégorie 1 ou 2 conformément à l’article 24, paragraphe 2, point b) ii), du règlement (CE) no 1069/2009, cette usine ou cet établissement ne peut recommencer à transformer des matières de catégorie 3 qu’après avoir été préalablement agréé à cet effet par l’autorité compétente conformément à l’article 44 de ce règlement.
2. Lorsqu’une usine ou un établissement agréé pour la transformation de matières de catégorie 2 est agréé temporairement pour la transformation de matières de catégorie 1 conformément à l’article 24, paragraphe 2, point b) ii), du règlement (CE) no 1069/2009, cette usine ou cet établissement ne peut recommencer à transformer des matières de catégorie 2 qu’après avoir été préalablement agréé à cet effet par l’autorité compétente conformément à l’article 44 de ce règlement.
CHAPITRE X
DISPOSITIONS FINALES
Article 34
Restrictions concernant la mise sur le marché de certains sous-produits animaux et produits dérivés pour des raisons de santé publique ou animale
L’autorité compétente n’interdit pas et ne limite pas la mise sur le marché des sous-produits animaux et des produits dérivés mentionnés ci-après pour des raisons de santé publique ou de santé animale autres que celles prévues dans la législation de l’Union, en particulier dans le règlement (CE) no 1069/2009 et dans le présent règlement:
|
a) |
les protéines animales transformées et les autres produits dérivés visés à l’annexe X, chapitre II, du présent règlement; |
|
b) |
les aliments pour animaux familiers et certains autres produits dérivés visés à l’annexe XIII du présent règlement; |
|
c) |
les sous-produits animaux et les produits dérivés importés ou en transit dans l’Union visés à l’annexe XIV du présent règlement. |
Article 35
Abrogation
1. Les actes suivants sont abrogés:
|
a) |
le règlement (CE) no 811/2003; |
|
b) |
la décision 2003/322/CE; |
|
c) |
la décision 2003/324/CE; |
|
d) |
le règlement (CE) no 878/2004; |
|
e) |
la décision 2004/407/CE; |
|
f) |
le règlement (CE) no 79/2005; |
|
g) |
le règlement (CE) no 92/2005; |
|
h) |
le règlement (CE) no 181/2006; |
|
i) |
le règlement (CE) no 197/2006; |
|
j) |
le règlement (CE) no 1192/2006; |
|
k) |
le règlement (CE) no 2007/2006. |
2. Les références aux actes abrogés s’entendent comme faites au présent règlement.
Article 36
Mesures transitoires
1. Pendant une période transitoire expirant le 31 décembre 2011, les exploitants peuvent mettre sur le marché des engrais organiques et des amendements qui ont été produits avant le 4 mars 2011 conformément aux dispositions des règlements (CE) no 1774/2002 et (CE) no 181/2006:
|
a) |
à condition qu’ils aient été produits à partir:
|
|
b) |
même s’ils n’ont pas été mélangés à un constituant de façon à exclure l’utilisation ultérieure du mélange aux fins de l’alimentation des animaux. |
2. Pendant une période transitoire expirant le 31 janvier 2012, les envois de sous-produits animaux et de produits dérivés accompagnés par un certificat sanitaire, une déclaration ou un document commercial rempli et signé conforme au modèle approprié figurant à l’annexe X du règlement (CE) no 1774/2002 continuent d’être acceptés en vue de leur importation dans l’Union, à condition que ce certificat, cette déclaration ou ce document ait été rempli et signé avant le 30 novembre 2011.
3. Pendant une période transitoire expirant le 31 décembre 2012 et par dérogation à l’article 14 du règlement (CE) no 1069/2009, les États membres peuvent autoriser la collecte, le transport et l’élimination des matières de catégorie 3 comprenant des produits d’origine animale, ou des denrées alimentaires contenant des produits d’origine animale, qui ne sont plus destinées à la consommation humaine pour des raisons commerciales ou en raison de défauts de fabrication ou d’emballage ou d’autres défauts n’entraînant aucun risque pour la santé humaine ou animale, visées à l’article 10, point f), de ce règlement, par des moyens autres que l’incinération ou l’enfouissement sur place, visés à l’article 19, paragraphe 1, point d), de ce règlement, sous réserve des exigences relatives à l’élimination par d’autres moyens énoncées à l’annexe VI, chapitre IV, du présent règlement.
Article 37
Le présent règlement entre en vigueur le vingtième jour suivant celui de sa publication au Journal officiel de l’Union européenne.
Il est applicable à partir du 4 mars 2011.
Le présent règlement est obligatoire dans tous ses éléments et directement applicable dans tout État membre.
Fait à Bruxelles, le 25 février 2011.
Par la Commission
Le Président
José Manuel BARROSO
(1) JO L 300 du 14.11.2009, p. 1.
(2) JO L 24 du 30.1.1998, p. 9.
(3) JO L 229 du 1.9.2009, p. 1.
(4) JO L 332 du 28.12.2000, p. 91.
(5) JO L 182 du 16.7.1999, p. 1.
(6) JO L 139 du 30.4.2004, p. 1.
(7) JO L 312 du 22.11.2008, p. 3.
(8) JO L 273 du 10.10.2002, p. 1.
(9) JO L 139 du 30.4.2004, p. 55.
(10) JO L 147 du 31.5.2001, p. 1.
(11) JO L 206 du 22.7.1992, p. 7.
(12) JO L 20 du 26.1.2010, p. 7.
(13) JO 17 du 6.10.1958, p. 385/58.
(14) JO L 35 du 8.2.2005, p. 1.
(15) JO L 62 du 15.3.1993, p. 49.
(16) JO L 94 du 31.3.2004, p. 63.
(17) JO 121 du 29.7.1964, p. 1977/64.
(18) JO L 262 du 27.9.1976, p. 169.
(19) JO L 125 du 23.5.1996, p. 3.
(20) JO L 125 du 23.5.1996, p. 10.
(21) JO L 343 du 22.12.2009, p. 74.
(22) JO L 311 du 28.11.2001, p. 67.
(23) JO L 311 du 28.11.2001, p. 1.
(24) JO L 169 du 12.7.1993, p. 1.
(25) JO L 331 du 7.12.1998, p. 1.
(26) JO L 189 du 20.7.1990, p. 17.
(27) JO L 192 du 23.7.2010, p. 1.
(28) JO L 18 du 23.1.2003, p. 11.
(29) JO L 61 du 3.3.1997, p. 1.
(30) JO L 268 du 14.9.1992, p. 54.
(31) JO L 73 du 20.3.2010, p. 1.
(32) JO L 73 du 11.3.2004, p. 1.
(33) JO L 175 du 10.7.2010, p. 1.
(34) JO L 320 du 18.11.2006, p. 53.
(35) JO L 226 du 23.8.2008, p. 1.
(36) JO L 39 du 10.2.2009, p. 12.
(37) JO L 190 du 12.7.2006, p. 1.
(38) JO L 296 du 12.11.2009, p. 1.
(39) JO L 21 du 28.1.2004, p. 11.
(40) JO L 13 du 16.1.1997, p. 28.
(41) JO L 165 du 30.4.2004, p. 1.
(42) JO L 117 du 13.5.2003, p. 14.
(43) JO L 117 du 13.5.2003, p. 32.
(44) JO L 117 du 13.5.2003, p. 37.
(45) JO L 16 du 20.1.2005, p. 46.
(46) JO L 19 du 21.1.2005, p. 27.
(47) JO L 29 du 2.2.2006, p. 31.
(48) JO L 215 du 5.8.2006, p. 10.
(49) JO L 379 du 28.12.2006, p. 98.
(50) JO L 162 du 30.4.2004, p. 62.
(51) JO L 151 du 30.4.2004, p. 11.
(52) JO L 32 du 4.2.2006, p. 13.
ANNEXE I
DÉFINITIONS VISÉES À L’ARTICLE 2
Aux fins du présent règlement, on entend par:
|
1. |
«animaux à fourrure», les animaux qui sont détenus ou élevés pour la production de fourrure et qui ne sont pas utilisés pour la consommation humaine; |
|
2. |
«sang», le sang frais entier; |
|
3. |
«matières premières pour aliments des animaux», les matières premières pour aliments des animaux qui sont définies à l’article 3, paragraphe 2, point g), du règlement (CE) no 767/2009 et qui sont d’origine animale, y compris les protéines animales transformées, les produits sanguins, les graisses fondues, les ovoproduits, les huiles de poisson, les dérivés lipidiques, le collagène, la gélatine, les protéines hydrolysées, le phosphate dicalcique, le phosphate tricalcique, le lait, les produits à base de lait, les produits dérivés du lait, le colostrum, les produits à base de colostrum et les boues de centrifugeuses ou de séparateurs issues du traitement du lait; |
|
4. |
«produits sanguins», les produits dérivés du sang ou de composants du sang, à l’exclusion des farines de sang; il s’agit notamment du plasma sec/congelé/liquide, du sang entier sec, de globules rouges sous forme séchée/congelée/liquide ou de composants ou mélanges de ces produits; |
|
5. |
«protéines animales transformées», les protéines animales issues entièrement de matières de catégorie 3 traitées conformément à l’annexe X, chapitre II, section I, (y compris les farines de sang et les farines de poisson) de manière à pouvoir être utilisées directement en tant que matières premières pour aliments des animaux ou à toute autre fin dans les aliments pour animaux, y compris les aliments pour animaux familiers, ou à pouvoir être utilisées dans des engrais organiques ou des amendements; néanmoins, elles ne comprennent pas les produits sanguins, le lait, les produits à base de lait, les produits dérivés du lait, le colostrum, les produits à base de colostrum, les boues de centrifugeuses ou de séparateurs, la gélatine, les protéines hydrolysées et le phosphate dicalcique, les œufs et les ovoproduits, y compris les coquilles, le phosphate tricalcique et le collagène; |
|
6. |
«farines de sang», les protéines animales transformées provenant du traitement thermique du sang ou de composants du sang conformément à l’annexe X, chapitre II, section I; |
|
7. |
«farines de poisson», les protéines animales transformées dérivées d’animaux aquatiques autres que des mammifères marins; |
|
8. |
«graisses fondues», les matières grasses issues de la transformation:
|
|
9. |
«huiles de poisson», les huiles provenant de la transformation d’animaux aquatiques ou les huiles provenant de la transformation de poissons destinés à la consommation humaine, qu’un exploitant a destinées à des usages autres que la consommation humaine; |
|
10. |
«sous-produits apicoles», le miel, la cire, la gelée royale, la propolis ou le pollen qui ne sont pas destinés à la consommation humaine; |
|
11. |
«collagène», le produit à base de protéines dérivé des cuirs, des peaux, des os, des arêtes et des tendons des animaux; |
|
12. |
«gélatine», la protéine naturelle et soluble, gélifiée ou non, obtenue par hydrolyse partielle du collagène produit à partir des os, arêtes, peaux et cuirs, tendons, nerfs et ligaments des animaux; |
|
13. |
«cretons», les résidus protéiniques de la fonte, après séparation partielle des graisses et de l’eau; |
|
14. |
«protéines hydrolysées», les polypeptides, peptides et acides aminés ainsi que leurs mélanges, obtenus par hydrolyse de sous-produits animaux; |
|
15. |
«eau blanche», un mélange de lait, de produits à base de lait ou de produits dérivés du lait et d’eau provenant du rinçage du matériel de laiterie, y compris les récipients utilisés pour les produits laitiers, avant son nettoyage et sa désinfection; |
|
16. |
«aliments en conserve pour animaux familiers», les aliments pour animaux familiers ayant subi un traitement thermique et conditionnés en récipients hermétiquement clos; |
|
17. |
«articles à mastiquer», les produits destinés à être mâchés par les animaux familiers, fabriqués à partir de peaux et de cuirs non tannés d’ongulés ou d’autres matières d’origine animale; |
|
18. |
«viscère aromatique», un produit dérivé liquide ou déshydraté d’origine animale utilisé pour améliorer les valeurs de sapidité des aliments pour animaux familiers; |
|
19. |
«aliments pour animaux familiers», les aliments destinés aux animaux familiers et les articles à mastiquer qui:
|
|
20. |
«aliments transformés pour animaux familiers», les aliments pour animaux familiers, autres que les aliments crus pour animaux familiers, qui ont été transformés conformément à l’annexe XIII, chapitre II, point 3; |
|
21. |
«aliments crus pour animaux familiers», les aliments pour animaux familiers contenant certaines matières de catégorie 3, qui n’ont subi aucun processus de conservation, exception faite de la réfrigération ou de la congélation; |
|
22. |
«déchets de cuisine et de table», tous les déchets d’aliments y compris les huiles de cuisson usagées provenant de la restauration et des cuisines, y compris les cuisines centrales et les cuisines des ménages; |
|
23. |
«résidus de digestion» ou «digestat», les résidus résultant de la transformation de sous-produits animaux dans une usine de production de biogaz; |
|
24. |
«contenu de l’appareil digestif», le contenu de l’appareil digestif de mammifères et de ratites; |
|
25. |
«dérivés lipidiques», les produits dérivés de graisses fondues qui, dans le cas des graisses fondues de matières de catégorie 1 ou de catégorie 2, ont été transformées conformément à l’annexe XIII, chapitre XI; |
|
26. |
«guano», un produit naturel qui est constitué d’excréments de chauves-souris ou d’oiseaux marins sauvages et qui n’est pas minéralisé; |
|
27. |
«farines de viande et d’os», les protéines animales résultant de la transformation de matières de catégorie 1 ou de catégorie 2 conformément à l’une des méthodes de transformation décrites à l’annexe IV, chapitre III; |
|
28. |
«cuirs et peaux traités», les produits dérivés de cuirs et de peaux non traités autres que les articles à mastiquer, qui ont été:
|
|
29. |
«cuirs et peaux non traités», tous les tissus cutanés et sous-cutanés qui n’ont subi aucun traitement autre que la découpe, la réfrigération ou la congélation; |
|
30. |
«plumes et parties de plumes non traitées», les plumes et parties de plumes qui n’ont pas été traitées:
|
|
31. |
«laine non traitée», la laine qui:
|
|
32. |
«poils non traités», les poils qui:
|
|
33. |
«soies de porc non traitées», les soies de porc qui:
|
|
34. |
«articles d’exposition», les sous-produits animaux ou les produits dérivés destinés à des expositions ou des activités artistiques; |
|
35. |
«produit intermédiaire», un produit dérivé:
|
|
36. |
«réactif de laboratoire», un produit conditionné, prêt à l’emploi, contenant des sous-produits animaux ou des produits dérivés et destiné à être spécifiquement utilisé, seul ou en combinaison avec des substances d’origine non animale, en laboratoire comme réactif ou produit réactif, étalon ou matériau de contrôle pour la détection, la mesure, l’examen ou la fabrication d’autres substances; |
|
37. |
«produit pour diagnostic in vitro», un produit conditionné, prêt à l’emploi, contenant un produit sanguin ou un autre sous-produit animal et utilisé en tant que réactif, produit réactif, étalon, kit ou tout autre système destiné à être employé in vitro, seul ou combiné, pour des examens d’échantillons d’origine humaine ou animale, dans le but unique ou principal de diagnostiquer un état physiologique, un état de santé, une maladie ou une anomalie génétique, ou de déterminer leur innocuité et leur compatibilité avec des réactifs; il ne comprend pas les dons d’organes ou de sang; |
|
38. |
«échantillons de recherche et de diagnostic», les sous-produits animaux et les produits dérivés destinés aux usages suivants: l’examen dans le contexte d’activités liées à l’établissement de diagnostics ou l’analyse visant à faire progresser les sciences et les techniques, dans le contexte d’activités liées à l’éducation ou à la recherche; |
|
39. |
«échantillons commerciaux», les sous-produits animaux ou les produits dérivés destinés à des analyses ou des études particulières en vue de la réalisation d’un procédé de fabrication ou la mise au point de nouveaux aliments pour animaux ou autres produits dérivés, y compris des essais sur des machines, et destinés à un établissement ou à une usine qui:
|
|
40. |
«coïncinération», la valorisation ou l’élimination de sous-produits animaux ou de produits dérivés, s’il s’agit de déchets, dans une installation de coïncinération; |
|
41. |
«combustion», un processus d’oxydation de carburant permettant d’utiliser la valeur énergétique des sous-produits animaux ou des produits dérivés, s’il ne s’agit pas de déchets; |
|
42. |
«incinération», l’élimination de sous-produits animaux ou de produits dérivés, en tant que déchets, dans une installation d’incinération au sens de l’article 3, point 4, de la directive 2000/76/CE; |
|
43. |
«résidu d’incinération et de coïncinération», tout résidu au sens de l’article 3, point 13, de la directive 2000/76/CE qui est produit par une installation d’incinération ou de coïncinération traitant des sous-produits animaux ou des produits dérivés; |
|
44. |
«codage par couleur», l’emploi systématique de couleurs, conformément à l’annexe VIII, chapitre II, point 1 c), pour afficher les informations prévues dans le présent règlement sur la surface ou une partie de la surface de l’emballage, du conteneur ou du véhicule, ou sur une étiquette ou un symbole apposé sur ces supports; |
|
45. |
«opérations intermédiaires», les opérations autres que l’entreposage visées à l’article 19, point b); |
|
46. |
«tannage», le raffermissement des peaux à l’aide d’agents de tannage végétaux, de sels de chrome ou d’autres substances telles que les sels d’aluminium, les sels ferriques, les sels siliciques, les aldéhydes et les quinones, ou d’autres agents synthétiques; |
|
47. |
«taxidermie», l’art de préparer, d’empailler et de naturaliser les peaux d’animaux pour les conserver avec l’apparence de la vie, en excluant que des risques inacceptables pour la santé publique et animale puissent être propagés par les peaux naturalisées; |
|
48. |
«échanges», les échanges de marchandises entre les États membres, tels que visés à l’article 28 du traité sur le fonctionnement de l’Union européenne; |
|
49. |
«méthodes de transformation», les méthodes décrites à l’annexe IV, chapitres III et IV; |
|
50. |
«lot», une quantité de produit fabriquée dans une seule usine au moyen de paramètres de production uniformes, comme l’origine des matières, ou plusieurs de ces quantités lorsqu’elles sont produites successivement dans une seule usine et entreposées ensemble pour former une unité d’expédition; |
|
51. |
«récipient hermétiquement clos», un récipient conçu pour et destiné à empêcher la pénétration de micro-organismes; |
|
52. |
«usine de production de biogaz», une usine dans laquelle des sous-produits animaux ou des produits dérivés font au moins partie des matières soumises à une dégradation biologique en anaérobiose; |
|
53. |
«centres de collecte», les établissements autres que les usines de transformation dans lesquels sont collectés les sous-produits animaux visés à l’article 18, paragraphe 1, du règlement (CE) no 1069/2009 afin d’être utilisés comme aliments pour les animaux visés au même article; |
|
54. |
«usine de compostage», une usine dans laquelle des sous-produits animaux ou des produits dérivés font au moins partie des matières soumises à une dégradation biologique en aérobiose; |
|
55. |
«installation de coïncinération», toute installation fixe ou mobile dont la fonction essentielle consiste à produire de l’énergie ou des produits matériels, au sens de l’article 3, point 5), de la directive 2000/76/CE; |
|
56. |
«installation d’incinération», tout équipement ou unité technique fixe ou mobile destiné spécifiquement au traitement thermique de déchets, au sens de l’article 3, point 4, de la directive 2000/76/CE; |
|
57. |
«usine de production d’aliments pour animaux familiers», des locaux ou des installations servant à la production d’aliments pour animaux familiers ou de viscères aromatiques, comme le prévoit l’article 24, paragraphe 1, point e), du règlement (CE) no 1069/2009; |
|
58. |
«usine de transformation», des locaux ou des installations servant à la transformation de sous-produits animaux, telle que visée à l’article 24, paragraphe 1, point a), du règlement (CE) no 1069/2009, dans lesquels les sous-produits animaux sont transformés conformément à l’annexe IV et/ou à l’annexe X. |
ANNEXE II
RESTRICTIONS CONCERNANT L’UTILISATION DE SOUS-PRODUITS ANIMAUX
CHAPITRE I
Réutilisation intraspécifique des animaux à fourrure
|
1. |
En Estonie, en Lettonie et en Finlande, les animaux à fourrure suivants peuvent être nourris au moyen de farines de viande et d’os ou d’autres produits qui ont été transformés conformément à l’annexe IV, chapitre III, et qui sont issus de cadavres ou de parties de cadavres d’animaux de la même espèce:
|
|
2. |
En Estonie et en Lettonie, les animaux à fourrure appartenant à l’espèce du vison d’Amérique (Mustela vison) peuvent être nourris au moyen de farines de viande et d’os ou d’autres produits qui ont été transformés conformément aux méthodes de transformation décrites à l’annexe IV, chapitre III, et qui sont issus de cadavres ou de parties de cadavres d’animaux de la même espèce. |
|
3. |
Le nourrissage visé aux points 1 et 2 doit avoir lieu dans les conditions énoncées ci-après.
|
CHAPITRE II
Alimentation d’animaux d’élevage au moyen de fourrages
Les conditions énoncées ci-après s’appliquent à l’alimentation d’animaux d’élevage au moyen de fourrages provenant de pâturages auxquels les animaux ont directement accès ou constitués d’herbes coupées, lorsque les sols dont ils proviennent ont été fertilisés au moyen d’engrais organiques ou d’amendements:
|
a) |
la période d’attente d’au moins 21 jours visée à l’article 11, paragraphe 1, point c), du règlement (CE) no 1069/2009 doit avoir été respectée; |
|
b) |
seuls des engrais organiques ou des amendements satisfaisant aux dispositions de l’article 32, paragraphes 1 et 2, du règlement (CE) no 1069/2009 et de l’annexe XI, chapitre II, du présent règlement doivent avoir été utilisés. |
Néanmoins, ces conditions ne s’appliquent pas si les seuls engrais organiques ou amendements utilisés sont les suivants:
|
a) |
le lisier et le guano; |
|
b) |
le contenu de l’appareil digestif, le lait, les produits à base de lait, les produits dérivés du lait, le colostrum et les produits à base de colostrum dont les autorités compétentes estiment qu’ils ne présentent pas de risque de propagation de maladies animales graves. |
ANNEXE III
ÉLIMINATION ET VALORISATION
CHAPITRE I
EXIGENCES GÉNÉRALES RELATIVES À L’INCINÉRATION ET À LA COÏNCINÉRATION
Section 1
Conditions générales
|
1. |
Les exploitants d’installations d’incinération et de coïncinération visées à l’article 6, paragraphe 1, point b), du présent règlement doivent veiller à ce que les conditions d’hygiène énoncées ci-après soient remplies dans les installations se trouvant sous leur contrôle.
|
|
2. |
L’exploitant d’une installation d’incinération ou de coïncinération doit prendre toutes les précautions nécessaires concernant la réception des sous-produits animaux ou produits dérivés afin de prévenir ou de limiter, autant que faire se peut, les risques directs pour la santé humaine ou animale. |
|
3. |
Les animaux ne peuvent avoir accès ni aux installations, aux sous-produits animaux et produits dérivés qui attendent l’incinération ou la coïncinération, ni aux cendres résultant de l’incinération ou de la coïncinération de sous-produits animaux. |
|
4. |
Si l’installation d’incinération ou de coïncinération est située dans un élevage:
|
|
5. |
Les sous-produits animaux et produits dérivés qui doivent faire l’objet d’une incinération ou d’une coïncinération ainsi que les cendres doivent être entreposés dans des conteneurs couverts, correctement identifiés et, si nécessaire, étanches. |
|
6. |
Les sous-produits animaux ayant fait l’objet d’une incinération incomplète doivent être à nouveau incinérés ou éliminés par d’autres moyens, différents de l’élimination dans une décharge autorisée, conformément à l’article 12, 13 ou 14, selon le cas, du règlement (CE) no 1069/2009. |
Section 2
Conditions d’exploitation
Toute installation d’incinération ou de coïncinération doit être conçue, équipée, construite et exploitée de manière que les émanations gazeuses produites par l’incinération soient portées, d’une manière contrôlée et homogène, même dans les conditions les plus défavorables, à une température de 850 °C pendant au moins 2 secondes ou à une température de 1 100 °C pendant 0,2 seconde, la mesure étant prise à proximité de la paroi intérieure ou en tout autre point représentatif de la chambre d’incinération ou de coïncinération, conformément à ce qui est autorisé par l’autorité compétente.
Section 3
Résidus d’incinération et de coïncinération
|
1. |
La quantité et la nocivité des résidus d’incinération et de coïncinération doivent être réduites au maximum. Ces résidus doivent être valorisés, quand c’est possible, sur place dans l’installation ou à l’extérieur de celle-ci, conformément à la législation applicable de l’Union, ou être éliminés dans une décharge autorisée. |
|
2. |
Le transport et l’entreposage intermédiaire de résidus secs, y compris de poussières, doivent être effectués de manière à éviter la dispersion des résidus dans l’environnement, par exemple dans des conteneurs fermés. |
Section 4
Mesure de la température et d’autres paramètres
|
1. |
Des méthodes doivent être utilisées afin de surveiller les paramètres et les conditions applicables au processus d’incinération ou de coïncinération. |
|
2. |
L’agrément délivré par l’autorité compétente ou les conditions qui y sont assorties doivent fixer les exigences relatives aux mesures de la température. |
|
3. |
Le fonctionnement de tout équipement de surveillance automatisée doit faire l’objet de contrôles et d’un étalonnage annuel. |
|
4. |
Les résultats des opérations de mesure de la température doivent être enregistrés et présentés de manière à permettre à l’autorité compétente de s’assurer que l’installation d’incinération ou de coïncinération respecte les conditions d’exploitation autorisées, telles que fixées dans le présent règlement, conformément aux procédures établies par cette autorité. |
Section 5
Fonctionnement anormal
En cas de panne ou de conditions de fonctionnement anormales d’une installation d’incinération ou de coïncinération, l’exploitant doit ralentir ou arrêter, dès que possible, les opérations jusqu’à ce que le fonctionnement puisse reprendre dans des conditions normales.
CHAPITRE II
INSTALLATIONS D’INCINÉRATION ET DE COÏNCINÉRATION DE GRANDE CAPACITÉ
Section 1
Conditions d’exploitation spécifiques
Les installations d’incinération ou de coïncinération traitant exclusivement des sous-produits animaux et des produits dérivés, dont la capacité est supérieure à 50 kg par heure (installations de grande capacité) et auxquelles la directive 2000/76/CE n’impose pas d’avoir une autorisation d’exploitation, doivent satisfaire aux conditions énoncées ci-après.
|
a) |
Toutes les lignes d’incinération doivent être équipées d’au moins un brûleur auxiliaire. Celui-ci doit s’enclencher automatiquement lorsque la température des gaz de combustion descend en dessous de 850 °C ou de 1 100 °C, selon le cas, après la dernière injection d’air de combustion. Il doit également être mis en action lors des phases de démarrage et d’arrêt afin que la température de 850 °C ou de 1 100 °C, selon le cas, soit maintenue à tout instant pendant ces opérations et aussi longtemps que des matières non brûlées se trouvent dans la chambre d’incinération ou de coïncinération. |
|
b) |
Lorsque l’introduction des sous-produits animaux ou des produits dérivés dans la chambre d’incinération ou de coïncinération résulte d’un procédé continu, l’installation doit être munie d’un système automatique empêchant l’introduction de sous-produits animaux ou de produits dérivés pendant la phase de démarrage, avant que la température de 850 °C ou de 1 100 °C, selon le cas, ait été atteinte et chaque fois que cette température n’est plus atteinte. |
|
c) |
L’exploitant doit veiller à ce que l’installation d’incinération atteigne un niveau d’incinération tel que la teneur en carbone organique total (COT) des cendres et mâchefers soit inférieure à 3 % du poids sec de ces matières ou que leur perte au feu soit inférieure à 5 % de ce poids sec. Des techniques appropriées de prétraitement doivent être utilisées, si nécessaire. |
Section 2
Rejet des eaux
|
1. |
Les implantations des installations de grande capacité, y compris les aires annexes d’entreposage des sous-produits animaux, doivent être conçues de manière à empêcher le rejet non autorisé et accidentel de substances polluantes dans le sol, les eaux de surface et les eaux souterraines. |
|
2. |
Un bassin de rétention doit être prévu pour les eaux de pluie contaminées s’écoulant du site de l’installation ainsi que pour l’eau contaminée résultant de débordements ou d’opérations de lutte contre l’incendie. L’exploitant doit, si nécessaire, veiller à ce que ces eaux puissent êtres analysées et, au besoin, traitées avant d’être rejetées. |
CHAPITRE III
INSTALLATIONS D’INCINÉRATION ET DE COÏNCINÉRATION DE FAIBLE CAPACITÉ
Les installations d’incinération et de coïncinération traitant exclusivement des sous-produits animaux et des produits dérivés, dont la capacité maximale est inférieure à 50 kg de sous-produits animaux par heure ou par lot (installations de faible capacité) et auxquelles la directive 2000/76/CE n’impose pas d’avoir une autorisation d’exploitation, doivent:
|
a) |
être utilisées uniquement pour l’élimination:
|
|
b) |
être équipées d’un brûleur auxiliaire lorsque des matières de catégorie 1 visées à l’article 8, points b), du règlement (CE) no 1069/2009 y sont introduites; |
|
c) |
fonctionner de manière que les sous-produits animaux soient entièrement réduits en cendres. |
ANNEXE IV
TRANSFORMATION
CHAPITRE I
EXIGENCES APPLICABLES AUX USINES DE TRANSFORMATION ET À CERTAINS AUTRES ÉTABLISSEMENTS ET USINES
Section 1
Conditions générales
|
1. |
Les usines de transformation doivent satisfaire aux exigences ci-après pour la transformation réalisée par stérilisation sous pression ou conformément aux méthodes de transformation visées à l’article 15, paragraphe 1, point b), du règlement (CE) no 1069/2009.
|
|
2. |
L’usine de transformation doit disposer d’équipements adéquats pour le nettoyage et la désinfection des conteneurs ou récipients dans lesquels sont réceptionnés les sous-produits animaux ainsi que des moyens de transport – autres que les navires – dans lesquels ils sont transportés. |
|
3. |
Des équipements appropriés doivent être prévus pour la désinfection des roues et, s’il y a lieu, des autres parties des véhicules quittant le secteur souillé de l’usine de transformation. |
|
4. |
Toute usine de transformation doit disposer d’un système d’évacuation des eaux résiduaires satisfaisant aux exigences fixées par l’autorité compétente conformément à la législation de l’Union. |
|
5. |
L’usine de transformation doit avoir son propre laboratoire ou faire appel aux services d’un laboratoire externe. Le laboratoire doit être équipé pour effectuer les analyses nécessaires et être agréé par l’autorité compétente sur la base d’une évaluation de sa capacité à effectuer ces analyses, être accrédité selon des normes reconnues au niveau international ou être soumis par l’autorité compétente à des contrôles réguliers afin d' évaluer la capacité du laboratoire à effectuer ces analyses. |
|
6. |
Si, sur la base d’une évaluation des risques, le volume de produits traités requiert la présence régulière ou permanente de l’autorité compétente, l’usine de transformation doit mettre un local convenablement aménagé, fermant à clé, à la disposition exclusive du service d’inspection. |
Section 2
Traitement des eaux résiduaires
|
1. |
Les usines de transformation de matières de catégorie 1 et les autres locaux où sont enlevés des matériels à risque spécifiés, les abattoirs et les usines de transformation de matières de catégorie 2 doivent disposer d’un processus de prétraitement qui permet de retenir et de recueillir les matières d’origine animale, ce qui constitue la première étape du traitement des eaux résiduaires. L’équipement utilisé pour le prétraitement doit consister en puisards ou cribles situés en aval du processus et munis d’ouvertures dont les pores de filtration ou les mailles n’excèdent pas 6 mm ou de systèmes équivalents assurant que la taille des particules solides présentes dans les eaux résiduaires qui passent au travers de ces systèmes n’est pas supérieure à 6 mm. |
|
2. |
Toutes les eaux résiduaires provenant des locaux visés au point 1 doivent subir un prétraitement garantissant leur filtrage par ce processus avant leur évacuation des locaux. Tout broyage, toute macération, toute autre transformation ou toute application d’une pression pouvant faciliter le passage de matières animales solides au travers de ce stade du prétraitement est exclu. |
|
3. |
Toute matière animale recueillie lors du prétraitement dans les locaux visés au point 1 est collectée et transportée en tant que matière de catégorie 1 ou de catégorie 2, selon le cas, et éliminée conformément au règlement (CE) no 1069/2009. |
|
4. |
Les eaux résiduaires ayant subi le processus de prétraitement dans les locaux visé au point 1 et les eaux résiduaires provenant d’autres locaux où sont manipulés ou transformés des sous-produits animaux doivent être traitées conformément à la législation de l’Union et donc, sans restrictions conformément au présent règlement. |
|
5. |
Outre les exigences visées au point 4, l’autorité compétente peut obliger les exploitants à traiter les eaux résiduaires provenant du secteur souillé des usines de transformation et des usines ou établissements effectuant des opérations intermédiaires sur des matières de catégorie 1 ou de catégorie 2 ou entreposant des matières de catégorie 1 ou de catégorie 2 conformément à des conditions garantissant la limitation des risques dus aux agents pathogènes. |
|
6. |
Sans préjudice des points 1 à 5, l’élimination des sous-produits animaux, y compris le sang et le lait, ou des produits dérivés par le flux d’eaux usées est interdite. Néanmoins, les matières de catégorie 3 constituées de boues de centrifugeuses ou de séparateurs peuvent être éliminées par le flux d’eaux usées à condition d’avoir subi l’un des traitements prévus pour les boues de centrifugeuses ou de séparateurs qui sont décrits à l’annexe X, chapitre II, section 4, partie III, du présent règlement. |
Section 3
Exigences spécifiques relatives à la transformation des matières de catégorie 1 et de catégorie 2
L’aménagement des usines de transformation transformant des matières de catégorie 1 et de catégorie 2 doit garantir la séparation totale entre les matières de catégorie 1 et les matières de catégorie 2 de la réception des matières premières jusqu’à l’expédition des produits dérivés, sauf si un mélange de matières de catégorie 1 et de matières de catégorie 2 est transformé en matières de catégorie 1.
Section 4
Exigences spécifiques relatives à la transformation des matières de catégorie 3
Outre les conditions générales énoncées à la section 1, les exigences suivantes s’appliquent.
|
1. |
Les usines de transformation de matières de catégorie 3 ne peuvent se trouver sur le même site que des usines de transformation de matières de catégorie 1 ou 2, sauf si elles sont situées dans des bâtiments totalement séparés. |
|
2. |
Néanmoins, l’autorité compétente peut autoriser la transformation de matières de catégorie 3 sur un site où sont manipulées ou transformées des matières de catégorie 1 ou 2, si la contamination croisée est empêchée par:
|
|
3. |
Les usines de transformation de matières de catégorie 3 doivent être dotées d’une installation permettant de détecter la présence de corps étrangers, tels des matériaux d’emballage et des pièces métalliques, dans les sous-produits animaux ou les produits dérivés, si elles transforment des matières destinées à l’alimentation des animaux. Ces corps étrangers doivent être enlevés avant ou pendant la transformation. |
CHAPITRE II
EXIGENCES RELATIVES À L’HYGIÈNE ET À LA TRANSFORMATION
Section 1
Exigences générales en matière d’hygiène
Non seulement les usines de transformation doivent respecter les règles générales d’hygiène prévues à l’article 25 du règlement (CE) no 1069/2009, mais elles doivent disposer d’un programme détaillé de lutte contre les nuisibles afin d’assurer la mise en œuvre des dispositifs de protection contre les animaux nuisibles, tels que les insectes, les rongeurs et les oiseaux, visés à l’article 25, paragraphe 1, point c), de ce règlement.
Section 2
Exigences générales en matière de transformation
|
1. |
Des dispositifs de mesure et d’enregistrement correctement étalonnés doivent être utilisés pour surveiller en permanence les conditions de transformation. Les documents attestant les dates d’étalonnage des dispositifs de mesure et d’enregistrement doivent être conservés. |
|
2. |
Les matières qui n’ont pas subi le traitement thermique requis (chutes en début de processus ou fuites échappées du cuiseur, par exemple) doivent être réintroduites au début du circuit de traitement thermique ou collectées et soumises à une nouvelle transformation, ou encore éliminées conformément au règlement (CE) no 1069/2009. |
Section 3
Méthodes de transformation des matières de catégorie 1 et de catégorie 2
Sauf si l’autorité compétente requiert la stérilisation sous pression (méthode 1), les matières de catégorie 1 et de catégorie 2 doivent être transformées conformément à la méthode de transformation 2, 3, 4 ou 5 décrite au chapitre III.
Section 4
Transformation des matières de catégorie 3
|
1. |
Pour chacune des méthodes de transformation décrites au chapitre III, les points critiques pour la maîtrise (CCP) déterminant l’intensité des traitements thermiques appliqués lors de la transformation doivent comprendre:
|
|
2. |
Dans le cas de traitements chimiques ayant été autorisés par l’autorité compétente en tant que méthode de transformation 7, conformément chapitre III, point G, les points critiques pour la maîtrise (CCP) déterminant l’intensité des traitements chimiques appliqués doivent comprendre l’ajustement du pH réalisé. |
|
3. |
Les enregistrements attestant l’application des valeurs minimales de transformation pour chaque point critique pour la maîtrise (CCP) doivent être conservés pendant une période minimale de deux ans. |
|
4. |
Les matières de catégorie 3 doivent être transformées conformément à l’une des méthodes de transformation 1 à 5 ou à la méthode de transformation 7 ou, dans le cas de matières provenant d’animaux aquatiques, conformément à l’une des méthodes 1 à 7, décrites au chapitre III. |
CHAPITRE III
MÉTHODES DE TRANSFORMATION NORMALISÉES
A. Méthode de transformation 1 (stérilisation sous pression)
Réduction
|
1. |
Si la taille des particules des sous-produits animaux à transformer excède 50 millimètres, les sous-produits en question doivent être fragmentés à l’aide des équipements appropriés, de manière que la taille des particules soit réduite à 50 millimètres au maximum. Le bon fonctionnement des équipements doit faire l’objet d’une vérification et d’un enregistrement quotidiens. Si les contrôles révèlent la présence de particules excédant 50 millimètres, la transformation doit être arrêtée et des réparations doivent être effectuées avant sa reprise. |
Durée, température et pression
|
2. |
Les sous-produits animaux dont les particules ont une taille n’excédant pas 50 millimètres doivent être portés à une température à cœur supérieure à 133 °C pendant au moins 20 minutes, sans interruption et à une pression (absolue) d’au moins 3 bars. La pression doit être produite par l’évacuation de tout l’air présent dans la chambre de stérilisation et son remplacement par de la vapeur («vapeur saturée»); ce traitement thermique peut être appliqué en tant que transformation unique ou en tant que phase de stérilisation antérieure ou postérieure à une autre transformation. |
|
3. |
La transformation peut être effectuée dans un système par lot ou dans un système en continu. |
B. Méthode de transformation 2
Réduction
|
1. |
Si la taille des particules des sous-produits animaux à transformer excède 150 millimètres, les sous-produits en question doivent être fragmentés à l’aide des équipements appropriés, de manière que la taille des particules soit réduite à 150 millimètres au maximum. Le bon fonctionnement des équipements doit faire l’objet d’une vérification et d’un enregistrement quotidiens. Si les contrôles révèlent la présence de particules excédant 150 millimètres, la transformation doit être arrêtée et des réparations doivent être effectuées avant sa reprise. |
Durée, température et pression
|
2. |
Après réduction, les sous-produits animaux doivent être chauffés de manière que leur température à cœur soit maintenue à plus de 100 °C pendant au moins 125 minutes, à plus de 110 °C pendant au moins 120 minutes et à plus de 120 °C pendant au moins 50 minutes. Les températures à cœur peuvent être atteintes consécutivement ou par une combinaison concomitante des périodes mentionnées. |
|
3. |
La transformation doit être effectuée dans un système par lot. |
C. Méthode de transformation 3
Réduction
|
1. |
Si la taille des particules des sous-produits animaux à transformer excède 30 millimètres, les sous-produits en question doivent être fragmentés à l’aide des équipements appropriés, de manière que la taille des particules soit réduite à 30 millimètres au maximum. Le bon fonctionnement des équipements doit faire l’objet d’une vérification et d’un enregistrement quotidiens. Si les contrôles révèlent la présence de particules excédant 30 millimètres, la transformation doit être arrêtée et des réparations doivent être effectuées avant sa reprise. |
Durée, température et pression
|
2. |
Après réduction, les sous-produits animaux doivent être chauffés de manière que leur température à cœur soit maintenue à plus de 100 °C pendant au moins 95 minutes, à plus de 110 °C pendant au moins 55 minutes et à plus de 120 °C pendant au moins 13 minutes. Les températures à cœur peuvent être atteintes consécutivement ou par une combinaison concomitante des périodes mentionnées. |
|
3. |
La transformation peut être effectuée dans un système par lot ou dans un système en continu. |
D. Méthode de transformation 4
Réduction
|
1. |
Si la taille des particules des sous-produits animaux à transformer excède 30 millimètres, les sous-produits en question doivent être fragmentés à l’aide des équipements appropriés, de manière que la taille des particules soit réduite à 30 millimètres au maximum. Le bon fonctionnement des équipements doit faire l’objet d’une vérification et d’un enregistrement quotidiens. Si les contrôles révèlent la présence de particules excédant 30 millimètres, la transformation doit être arrêtée et des réparations doivent être effectuées avant sa reprise. |
Durée, température et pression
|
2. |
Après réduction, les sous-produits animaux doivent être placés dans une cuve à laquelle sont ajoutées des graisses et être chauffés de manière que leur température à cœur soit maintenue à plus de 100 °C pendant au moins 16 minutes, à plus de 110 °C pendant au moins 13 minutes, à plus de 120 °C pendant au moins 8 minutes et à plus de 130 °C pendant au moins 3 minutes. Les températures à cœur peuvent être atteintes consécutivement ou par une combinaison concomitante des périodes mentionnées. |
|
3. |
La transformation peut être effectuée dans un système par lot ou dans un système en continu. |
E. Méthode de transformation 5
Réduction
|
1. |
Si la taille des particules des sous-produits animaux à transformer excède 20 millimètres, les sous-produits en question doivent être fragmentés à l’aide des équipements appropriés, de manière que la taille des particules soit réduite à 20 millimètres au maximum. Le bon fonctionnement des équipements doit faire l’objet d’une vérification et d’un enregistrement quotidiens. Si les contrôles révèlent la présence de particules excédant 20 millimètres, la transformation doit être arrêtée et des réparations doivent être effectuées avant sa reprise. |
Durée, température et pression
|
2. |
Après réduction, les sous-produits animaux doivent être chauffés jusqu’à la coagulation, puis pressés de manière que l’eau et les graisses soient extraites des matières protéiniques. Celles-ci doivent ensuite être chauffées de manière que leur température à cœur soit maintenue à plus de 80 °C pendant au moins 120 minutes et à plus de 100 °C pendant au moins 60 minutes. Les températures à cœur peuvent être atteintes consécutivement ou par une combinaison concomitante des périodes mentionnées. |
|
3. |
La transformation peut être effectuée dans un système par lot ou dans un système en continu. |
F. Méthode de transformation 6 (uniquement pour les sous-produits animaux de catégorie 3 provenant d’animaux aquatiques ou d’invertébrés aquatiques)
Réduction
|
1. |
Les sous-produits animaux doivent être réduits en fragments de manière que la taille des particules n’excède pas:
Il faut ensuite les mélanger à de l’acide formique pour abaisser et maintenir leur pH à une valeur égale ou inférieure à 4,0. Il faut laisser reposer le mélange pendant au moins 24 heures avant d’entamer la phase de traitement suivante. |
Durée, température et pression
|
2. |
Après réduction, le mélange doit être porté:
Lorsqu’un système en continu est utilisé, la progression du produit dans le convertisseur thermique doit être contrôlée au moyen de commandes mécaniques qui en règlent le mouvement de manière à ce qu’en fin de traitement thermique, le produit ait subi un cycle suffisant en ce qui concerne la durée et la température. |
|
3. |
La transformation peut être effectuée dans un système par lot ou dans un système en continu. |
G. Méthode de transformation 7
|
1. |
Toute méthode de transformation autorisée par l’autorité compétente, à qui l’exploitant a démontré que les conditions suivantes étaient remplies:
|
|
2. |
Les données détaillées concernant les points critiques pour la maîtrise (CCP) permettant d’établir que chaque usine de transformation respecte les normes microbiologiques de manière satisfaisante doivent être enregistrées et conservées de manière que l’exploitant et l’autorité compétente puissent contrôler le fonctionnement de l’usine concernée. Parmi les informations à consigner et à contrôler doivent figurer la taille des particules et, selon le cas, la température critique, la durée absolue du traitement, la pression, le taux d’alimentation en matières premières et le taux de recyclage des graisses. |
|
3. |
Par dérogation au point 1, l’autorité compétente peut autoriser le recours à des méthodes de transformation qui ont été approuvées avant la mise en application du présent règlement conformément à l’annexe V, chapitre III, du règlement (CE) no 1774/2002. |
|
4. |
L’autorité compétente doit interdire ou suspendre l’application des méthodes de transformation visées aux points 1 et 3 si elle obtient la preuve que l’une des conditions énoncées au point 1 a) ou 1 b) a changé substantiellement. |
|
5. |
L’autorité compétente doit communiquer à l’autorité compétente d’un autre État membre qui le demande les informations relatives à une méthode de transformation autorisée qui lui ont été transmises en application des points 1 et 2. |
CHAPITRE IV
AUTRES MÉTHODES DE TRANSFORMATION
Section 1
Dispositions générales
|
1. |
Les matières résultant de la transformation de matières de catégorie 1 et de catégorie 2, à l’exception du biodiesel produit conformément à la section 2, point D, du présent chapitre, doivent être marquées de façon permanente conformément aux exigences relatives au marquage de certains produits dérivés énoncées à l’annexe VIII, chapitre V. |
|
2. |
L’autorité compétente d’un État membre doit communiquer à l’autorité compétente d’un autre État membre qui le demande les résultats des contrôles officiels disponibles lorsqu’une autre méthode est utilisée pour la première fois dans cet État membre, de manière à faciliter l’introduction de cette nouvelle méthode. |
Section 2
Normes de transformation
A. Procédé d’hydrolyse alcaline
1. Matières premières
Pour ce procédé, les sous-produits animaux de toutes les catégories peuvent être utilisés.
2. Méthode de transformation
L’hydrolyse alcaline doit être réalisée dans le respect des normes de transformation suivantes:
|
a) |
doit être utilisée une solution d’hydroxyde de sodium (NaOH) ou d’hydroxyde de potassium (KOH) (ou une combinaison des deux) en une quantité garantissant une équivalence molaire approximative par rapport au poids, au type et à la composition des sous-produits animaux devant être digérés. Si une teneur élevée en lipides des sous-produits animaux neutralise la base, la base ajoutée doit être adaptée de manière que l’équivalence molaire mentionnée soit atteinte; |
|
b) |
les sous-produits animaux doivent être placés dans un récipient en alliage d’acier. La quantité d’alcali mesurée doit être ajoutée soit sous forme solide, soit sous forme de solution, telle que décrite au point a); |
|
c) |
le récipient doit être fermé et les sous-produits animaux et le mélange alcalin doivent être portés à une température à cœur d’au moins 150 °C et à une pression (absolue) d’au minimum 4 bars pendant au moins:
|
|
d) |
la transformation doit être effectuée dans un système par lot et la matière dans la cuve doit être constamment mélangée, de manière à faciliter le processus de digestion jusqu’à la dissolution des tissus et l’amollissement des os, des arêtes et des dents; et |
|
e) |
le traitement des sous-produits animaux doit être organisé de manière qu’il soit satisfait simultanément aux exigences de durée, de température et de pression. |
B. Procédé d’hydrolyse à température élevée et à haute pression
1. Matières premières
Pour ce procédé, les matières de catégorie 2 et de catégorie 3 peuvent être utilisées.
2. Méthode de transformation
L’hydrolyse à température élevée et à haute pression doit être réalisée dans le respect des normes de transformation suivantes:
|
a) |
les sous-produits animaux doivent être portés à une température à cœur d’au moins 180 °C pendant au minimum 40 minutes sans interruption à une pression (absolue) d’au moins 12 bars, la montée en température étant produite par apport indirect de vapeur au réacteur biolytique; |
|
b) |
la transformation doit être effectuée dans un système par lot et la matière dans la cuve doit être constamment mélangée; et |
|
c) |
le traitement des sous-produits animaux doit être organisé de manière qu’il soit satisfait simultanément aux exigences de durée, de température et de pression. |
C. Procédé de production de biogaz par hydrolyse à haute pression
1. Matières premières
Pour ce procédé, les sous-produits animaux de toutes les catégories peuvent être utilisés.
2. Méthode de transformation
Le procédé de production de biogaz par hydrolyse à haute pression doit être réalisé dans le respect des normes de transformation suivantes:
|
a) |
les sous-produits animaux doivent d’abord être transformés au moyen de la méthode de transformation 1 (stérilisation sous pression) décrite au chapitre III dans une usine de transformation agréée; |
|
b) |
au terme du processus visé au point a), les matières dégraissées doivent être traitées à une température d’au moins 220 °C pendant au minimum 20 minutes à une pression (absolue) d’au moins 25 bars, la montée en température étant produite en deux temps, premièrement par injection directe de vapeur et, deuxièmement, de manière indirecte, via un échangeur de chaleur coaxial; |
|
c) |
la transformation doit être effectuée dans un système par lot ou dans un système en continu et la matière doit être constamment mélangée; |
|
d) |
le traitement des sous-produits animaux doit être organisé de manière qu’il soit satisfait simultanément aux exigences de durée, de température et de pression; |
|
e) |
la matière obtenue doit ensuite être mélangée avec de l’eau et soumise à un processus de fermentation anaérobie (conversion en biogaz) dans un réacteur; |
|
f) |
si les matières premières sont de catégorie 1, la totalité du procédé doit se dérouler sur le même site et en circuit fermé, et le biogaz produit durant la transformation doit être brûlé rapidement dans la même usine à au moins 900 °C, puis soumis à un refroidissement rapide (quenching). |
D. Procédé de production de biodiesel
1. Matières premières
Pour ce procédé, une fraction lipidique dérivée de sous-produits animaux de toutes catégories peut être utilisée.
2. Méthode de transformation
La production de biodiesel doit être réalisée dans le respect des normes de transformation suivantes:
|
a) |
sauf en cas d’utilisation d’huiles de poisson ou de graisses fondues produites conformément à l’annexe III, section VIII ou section XII (selon le cas), du règlement (CE) no 853/2004, la fraction lipidique dérivée de sous-produits animaux doit tout d’abord être soumise:
|
|
b) |
la transformation des graisses transformées doit se poursuivre au moyen de l’une des méthodes suivantes:
|
E. Procédé de gazéification Brookes
1. Matières premières
Pour ce procédé, les matières de catégorie 2 et de catégorie 3 peuvent être utilisées.
2. Méthode de transformation
Le procédé de gazéification Brookes doit être réalisé dans le respect des normes de transformation suivantes:
|
a) |
la chambre de postcombustion doit être chauffée au gaz naturel; |
|
b) |
les sous-produits animaux doivent être placés dans la chambre primaire du gazéificateur, puis la porte doit être fermée. La chambre primaire doit être dépourvue de brûleurs et doit être chauffée par la chaleur transférée par conduction depuis la chambre de postcombustion, qui doit être située en dessous de la chambre primaire. Trois valves d’admission montées sur la porte principale afin d’accroître l’efficacité du processus doivent constituer la seule entrée d’air dans la chambre primaire; |
|
c) |
les sous-produits animaux doivent être volatilisés en hydrocarbures complexes et les gaz obtenus doivent passer par une ouverture étroite située en haut de la paroi arrière de la chambre primaire vers les zones de mélange et de craquage où ils doivent être décomposés en leurs éléments constitutifs. Enfin, les gaz doivent être évacués dans la chambre de postcombustion où ils doivent être brûlés à la flamme d’un brûleur au gaz naturel en présence d’un excès d’air; |
|
d) |
chaque unité de transformation doit posséder deux brûleurs et deux ventilateurs secondaires de manière qu’il puisse être remédié à la défaillance d’un brûleur ou d’un ventilateur. La chambre secondaire doit être conçue pour un temps de séjour minimal de deux secondes à une température d’au moins 950 °C quelles que soient les conditions de combustion; |
|
e) |
à la sortie de la chambre secondaire, les gaz d’échappement doivent passer par un volet barométrique situé à la base de la cheminée, qui les refroidit et les dilue avec l’air ambiant, en maintenant une pression constante dans les chambres primaire et secondaire; |
|
f) |
le processus doit être réalisé au cours d’un cycle de 24 heures incluant le chargement, la transformation, le refroidissement et l’élimination des cendres. Au terme du cycle, les cendres résiduelles doivent être évacuées de la chambre primaire par un système d’extraction sous vide vers des sacs fermés qui sont ensuite scellés avant d’être transportés; |
|
g) |
la gazéification de matières autres que des sous-produits animaux ne peut pas être autorisée. |
F. Procédé de combustion des graisses animales dans une chaudière thermique
1. Matières premières
Pour ce procédé, une fraction lipidique dérivée de sous-produits animaux de toutes catégories peut être utilisée.
2. Méthode de transformation
La combustion de graisses animales dans une chaudière thermique doit être réalisée dans le respect des normes de transformation suivantes:
|
a) |
sauf en cas d’utilisation d’huiles de poisson ou de graisses fondues produites conformément à l’annexe III, section VIII ou section XII (selon le cas), du règlement (CE) no 853/2004, la fraction lipidique dérivée de sous-produits animaux doit tout d’abord être soumise:
|
|
b) |
la fraction lipidique doit être séparée des protéines et, lorsqu’il s’agit de graisses provenant de ruminants destinées à être brûlées dans une autre usine, les impuretés insolubles doivent être éliminées pour que leur niveau ne représente pas plus de 0,15 % du poids; |
|
c) |
après la transformation visée aux points a) et b), les graisses doivent être:
|
|
d) |
la combustion de matières d’origine animale autres que les graisses animales ne peut pas être autorisée; |
|
e) |
la combustion des graisses dérivées des matières de catégorie 1 et de catégorie 2 doit s’effectuer dans l’usine même où ces graisses sont fondues afin que l’énergie générée soit utilisée pour les processus de fonte. L’autorité compétente peut néanmoins autoriser que ces graisses soient transférées vers d’autres usines pour y être brûlées, à condition:
|
|
f) |
la combustion doit s’effectuer conformément à la législation de l’Union en matière de protection de l’environnement, notamment aux normes de cette législation relatives aux meilleures techniques disponibles dans le domaine de la maîtrise et du contrôle des émissions. |
G. Procédé de production thermomécanique de biocarburant
1. Matières premières
Pour ce procédé, le lisier et le contenu de l’appareil digestif ainsi que les matières de catégorie 3 peuvent être utilisés.
2. Méthode de transformation
La production thermomécanique de biocarburant doit être réalisée dans le respect des normes de transformation suivantes:
|
a) |
les sous-produits animaux doivent être déversés dans un convertisseur puis traités à une température de 80 °C durant 8 heures. Au cours de cette période, la taille des matières doit être constamment réduite, au moyen d’équipements d’abrasion mécanique appropriés; |
|
b) |
les matières doivent ensuite être traitées à une température de 100 °C durant au moins 2 heures; |
|
c) |
la taille des particules des matières qui en résultent ne peut dépasser 20 millimètres; |
|
d) |
les sous-produits animaux doivent être traités de façon telle qu’il est satisfait simultanément aux exigences de durée et de température énoncées aux points a) et b); |
|
e) |
au cours du traitement thermique des matières concernées, l’eau évaporée doit être constamment extraite de l’espace situé au-dessus du biocarburant et doit circuler à travers un condensateur en acier inoxydable. Le condensat doit être maintenu à une température d’au moins 70 °C pendant au moins une heure avant d’être évacué dans les eaux usées; |
|
f) |
au terme du traitement thermique des matières concernées, le biocarburant qui découle du convertisseur doit être déversé et transporté automatiquement, au moyen d’un système de transport totalement couvert et confiné, vers une installation d’incinération ou de coïncinération située sur le même site; |
|
g) |
le procédé doit s’effectuer par lot. |
Section 3
Élimination et utilisation des produits dérivés
|
1. |
Les produits dérivés de la transformation:
|
|
2. |
Les matières résultant d’une transformation réalisée conformément:
|
|
3. |
Tous déchets résultant de la transformation de sous-produits animaux conformément à la présente section, tels que les boues, contenus de filtres, cendres et résidus de digestion, doivent être éliminés conformément aux dispositions du règlement (CE) no 1069/2009 et du présent règlement. |
ANNEXE V
CONVERSION DE SOUS-PRODUITS ANIMAUX ET DE PRODUITS DÉRIVÉS EN BIOGAZ ET COMPOSTAGE
CHAPITRE I
EXIGENCES APPLICABLES AUX USINES
Section 1
Usines de production de biogaz
|
1. |
Une usine de production de biogaz doit être équipée d’une unité de pasteurisation/d’hygiénisation incontournable pour les sous-produits animaux ou produits dérivés dont la taille maximale des particules avant leur entrée dans l’unité est de 12 mm; cette unité doit être munie:
|
|
2. |
Par dérogation au point 1, l’unité de pasteurisation/d’hygiénisation n’est pas obligatoire dans les usines de production de biogaz convertissant uniquement:
|
|
3. |
Si l’usine de production de biogaz est située sur un site ou à côté d’un site où des animaux d’élevage sont détenus et que cette usine n’utilise pas uniquement le lisier, le lait ou le colostrum provenant de ces animaux, l’usine doit se trouver à une certaine distance de la zone de détention des animaux. Cette distance doit être déterminée de manière qu’elle exclue tout risque inacceptable de transmission d’une maladie transmissible à l’homme ou aux animaux à partir de l’usine de production de biogaz. Dans tous les cas, une séparation physique totale doit être assurée, si nécessaire au moyen de clôtures, entre l’usine de production de biogaz, d’une part, et les animaux, leurs aliments et leur litière, d’autre part. |
|
4. |
Toute usine de production de biogaz doit avoir son propre laboratoire ou faire appel à un laboratoire externe. Le laboratoire doit être équipé pour effectuer les analyses nécessaires et être agréé par l’autorité compétente, être accrédité selon des normes reconnues au niveau international ou être soumis à des contrôles réguliers par l’autorité compétente. |
Section 2
Usines de compostage
|
1. |
Une usine de compostage doit disposer d’un réacteur de compostage fermé ou d’une zone fermée qui soient incontournables pour les sous-produits animaux ou produits dérivés qui sont introduits dans l’usine; elle doit être munie:
|
|
2. |
Par dérogation au point 1, d’autres systèmes de compostage peuvent être autorisés à condition:
|
|
3. |
Si l’usine de compostage est située sur un site ou à côté d’un site où des animaux d’élevage sont détenus et que cette usine n’utilise pas uniquement le lisier, le lait ou le colostrum provenant de ces animaux, l’usine doit se trouver à une certaine distance de la zone de détention des animaux. Cette distance doit être déterminée de manière qu’elle exclue tout risque inacceptable de transmission d’une maladie transmissible à l’homme ou aux animaux à partir de l’usine de compostage. Dans tous les cas, une séparation physique totale doit être assurée, si nécessaire au moyen de clôtures, entre l’usine de compostage, d’une part, et les animaux, leurs aliments et leur litière, d’autre part. |
|
4. |
Toute usine de compostage doit avoir son propre laboratoire ou faire appel à un laboratoire externe. Le laboratoire doit être équipé pour effectuer les analyses nécessaires et il doit être agréé par l’autorité compétente, accrédité selon des normes reconnues au niveau international ou soumis à des contrôles réguliers par l’autorité compétente. |
CHAPITRE II
EXIGENCES EN MATIÈRE D’HYGIÈNE APPLICABLES AUX USINES DE PRODUCTION DE BIOGAZ ET AUX USINES DE COMPOSTAGE
|
1. |
Les sous-produits animaux doivent être convertis ou traités le plus rapidement possible après leur arrivée à l’usine de production de biogaz ou de compostage. Ils doivent être entreposés convenablement jusqu’à leur traitement. |
|
2. |
Les conteneurs, récipients et véhicules utilisés pour le transport des matières non traitées doivent être nettoyés et désinfectés dans un secteur réservé. La localisation ou l’aménagement de ce secteur doivent être pensés de manière à empêcher tout risque de contamination des produits traités. |
|
3. |
Des mesures de prévention doivent être prises systématiquement contre les oiseaux, les rongeurs, les insectes et autres nuisibles. Ces mesures doivent s’inscrire dans un programme détaillé de lutte contre les nuisibles. |
|
4. |
Des procédures de nettoyage doivent être établies et consignées pour toutes les parties des installations. Les équipements et produits d’entretien appropriés doivent être fournis aux fins du nettoyage. |
|
5. |
Le contrôle de l’hygiène doit comprendre des inspections régulières de l’environnement et des équipements. Le calendrier des inspections et leurs résultats doivent être consignés. |
|
6. |
Les installations et les équipements doivent être bien entretenus et les équipements de mesure étalonnés à intervalles réguliers. |
|
7. |
Les résidus de digestion et le compost doivent être manipulés et entreposés dans l’usine de production de biogaz ou de compostage de manière à prévenir toute recontamination. |
CHAPITRE III
PARAMÈTRES DE CONVERSION
Section 1
Paramètres de conversion normalisés
|
1. |
Les matières de catégorie 3 utilisées comme matières premières dans une usine de production de biogaz dotée d’une unité de pasteurisation/d’hygiénisation doivent être soumises aux exigences minimales suivantes:
Néanmoins, le lait, les produits à base de lait, les produits dérivés du lait, le colostrum et les produits à base de colostrum de catégorie 3 peuvent être utilisés comme matières premières dans une usine de production de biogaz sans pasteurisation/hygiénisation si l’autorité compétente estime qu’ils ne risquent pas de propager des maladies transmissibles graves à l’homme ou aux animaux. Les exigences minimales énoncées au premier alinéa, points b) et c), s’appliquent également aux matières de catégorie 2 qui sont introduites dans une usine de production de biogaz sans avoir subi de transformation préalable, conformément à l’article 13, point e) ii), du règlement (CE) no 1069/2009. |
|
2. |
Les matières de catégorie 3 utilisées comme matières premières dans une usine de compostage doivent être soumises aux exigences minimales suivantes:
Les exigences minimales énoncées au premier alinéa, points b) et c), s’appliquent également aux matières de catégorie 2 qui sont compostées sans avoir subi de transformation préalable, conformément à l’article 13, point e) ii), du règlement (CE) no 1069/2009. |
Section 2
Autres paramètres de conversion à respecter par les usines de production de biogaz et les usines de compostage
|
1. |
L’autorité compétente peut autoriser l’utilisation de paramètres autres que les paramètres énoncés au chapitre I, section 1, point 1, et autres que les paramètres de conversion normalisés, à condition que le demandeur apporte la preuve qu’ils garantissent une diminution adéquate des risques biologiques. Cette preuve doit comporter une validation, qui doit être effectuée conformément aux exigences suivantes:
|
|
2. |
Par dérogation au point 1, dans l’attente de l’adoption des règles visées à l’article 15, paragraphe 2, point a) ii), du règlement (CE) no 1069/2009, l’autorité compétente peut autoriser l’application d’exigences spécifiques autres que celles prévues au présent chapitre, à condition qu’elles garantissent un effet équivalent quant à la réduction des agents pathogènes, pour:
|
|
3. |
Lorsque les matières visées au point 2 b) ou les produits dérivés visés à l’article 10, point g), du règlement (CE) no 1069/2009 constituent les seules matières premières d’origine animale traitées dans une usine de production de biogaz ou une usine de compostage, l’autorité compétente peut autoriser l’application d’exigences spécifiques autres que celles prévues au présent chapitre, à condition qu’elle:
|
|
4. |
Les exploitants peuvent mettre sur le marché les résidus de digestion et le compost qui ont été produits conformément aux paramètres autorisés par l’autorité compétente:
|
Section 3
Normes relatives aux résidus de digestion et au compost
|
1. |
Où, dans le cas du point a) ou du point b):
|
|
2. |
Les résidus de digestion ou le compost non conformes aux exigences de la présente section sont soumis à une nouvelle conversion ou à un nouveau compostage et, dans le cas de salmonella, manipulés ou éliminés conformément aux instructions de l’autorité compétente. |
ANNEXE VI
RÈGLES PARTICULIÈRES RELATIVES À LA RECHERCHE, À L’ALIMENTATION DES ANIMAUX AINSI QU’À LA COLLECTE ET À L’ÉLIMINATION
CHAPITRE I
RÈGLES PARTICULIÈRES RELATIVES AUX ÉCHANTILLONS DESTINÉS À LA RECHERCHE ET À D’AUTRES USAGES
Section 1
Échantillons de recherche et de diagnostic
|
1. |
Les exploitants doivent veiller à ce que les envois d’échantillons de recherche et de diagnostic soient accompagnés d’un document commercial mentionnant les éléments suivants:
|
|
2. |
Les utilisateurs qui manipulent des échantillons de recherche et de diagnostic doivent prendre toutes les mesures nécessaires pour éviter la propagation de maladies transmissibles à l’homme ou aux animaux durant la manipulation des matières se trouvant sous leur contrôle; à cet effet, ils doivent notamment respecter les bonnes pratiques de laboratoire. |
|
3. |
Toute utilisation ultérieure d’échantillons de recherche et de diagnostic à des fins autres que celles visées au point 38 de l’annexe I est interdite. |
|
4. |
À moins qu’ils ne soient conservés à des fins de référence, les échantillons de recherche et de diagnostic ainsi que les produits dérivés de l’utilisation de ces échantillons doivent être éliminés:
|
|
5. |
Les utilisateurs qui manipulent des échantillons de recherche et de diagnostic doivent tenir un registre des envois de ces échantillons. Le registre doit contenir les informations visées au point 1 ainsi que la date et la méthode d’élimination des échantillons et de tout produit dérivé. |
|
6. |
Par dérogation aux points 1, 4 et 5, l’autorité compétente peut accepter la manipulation et l’élimination d’échantillons de recherche et de diagnostic à des fins éducatives dans d’autres conditions qui excluent l’apparition de tout risque inacceptable pour la santé publique ou animale. |
Section 2
Échantillons commerciaux et articles d’exposition
|
1. |
Les échantillons commerciaux et articles d’exposition doivent être transportés, utilisés et éliminés conformément à la section 1, points 1 à 4 et point 6. |
|
2. |
À moins qu’ils ne soient conservés à des fins de référence, les échantillons commerciaux doivent, après la réalisation des études ou analyses s’y rapportant, être:
|
|
3. |
Après l’exposition ou l’activité artistique, les articles d’exposition doivent être réexpédiés vers l’État membre d’origine, expédiés ou éliminés conformément au point 2. |
CHAPITRE II
RÈGLES PARTICULIÈRES RELATIVES À L’ALIMENTATION DES ANIMAUX
Section 1
Exigences générales
Les matières de catégorie 2 et de catégorie 3 visées à l’article 18, paragraphe 1, du règlement (CE) no 1069/2009 peuvent être utilisées pour l’alimentation des animaux visés au paragraphe 1, points a), d), f), g) et h) du même article, pourvu que soient respectées au moins les conditions ci-après, outre les conditions fixées par l’autorité compétente conformément à l’article 18, paragraphe 1, dudit règlement.
|
1. |
Les sous-produits animaux doivent être transportés jusque chez les utilisateurs ou jusqu’à des centres de collecte conformément à l’annexe VIII, chapitre I, sections 1 et 3. |
|
2. |
Les centres de collecte doivent être enregistrés par l’autorité compétente à condition:
|
|
3. |
Les États membres peuvent autoriser l’utilisation d’une usine de transformation de matières de catégorie 2 en tant que centre de collecte. |
|
4. |
Les exploitants des centres de collecte fournissant des matières autres que des sous-produits animaux provenant d’animaux aquatiques et d’invertébrés aquatiques aux utilisateurs finals doivent veiller à ce qu’elles subissent l’un des traitements suivants:
|
Section 2
Alimentation de certaines espèces dans des placettes de nourrissage
|
1. |
L’autorité compétente peut autoriser l’utilisation de matières de catégorie 1 visées à l’article 18, paragraphe 2, point b), du règlement (CE) no 1069/2009 pour l’alimentation, dans des placettes de nourrissage, des espèces menacées d’extinction et protégées mentionnées ci-après dans les conditions suivantes:
|
|
2. |
Lorsqu’un État membre demande à la Commission de l’inscrire sur la liste figurant au point 1 a), il doit fournir:
|
Section 3
Alimentation des animaux sauvages à l’extérieur de placettes de nourrissage
L’autorité compétente peut autoriser l’utilisation de matières de catégorie 1 consistant en cadavres entiers ou parties d’animaux morts contenant des matériels à risque spécifiés en dehors de placettes de nourrissage, s’il y a lieu en l’absence de collecte préalable des animaux morts, pour le nourrissage des animaux sauvages visés à la section 2, point 1 a), sous réserve des conditions suivantes:
|
1. |
l’autorité compétente doit avoir la conviction, sur la base d’une évaluation de la situation spécifique des espèces concernées et de leur habitat, que l’état de conservation des espèces s’améliorera; |
|
2. |
l’autorité compétente doit préciser, dans l’autorisation, les exploitations ou troupeaux se trouvant dans une zone de nourrissage géographiquement définie en respectant les conditions suivantes:
|
Section 4
Nourrissage des animaux de zoo avec des matières de catégorie 1
L’autorité compétente peut autoriser l’utilisation de matières de catégorie 1 consistant en cadavres entiers ou parties d’animaux morts contenant des matériels à risque spécifiés et l’utilisation de matières provenant d’animaux de zoo pour l’alimentation d’animaux de zoo, dans les conditions suivantes:
|
a) |
l’autorité compétente doit avoir accordé une autorisation à l’exploitant responsable du nourrissage. L’autorité compétente accorde cette autorisation à condition:
|
|
b) |
l’autorisation accordée par l’autorité compétente doit être suspendue sans délai en cas de:
|
|
c) |
l’exploitant responsable du nourrissage doit:
|
CHAPITRE III
RÈGLES PARTICULIÈRES RELATIVES À LA COLLECTE ET À L’ÉLIMINATION
Section 1
Règles particulières relatives à l’élimination des sous-produits animaux
|
1. |
Si l’autorité compétente autorise l’élimination de sous-produits animaux sur place conformément à l’article 19, paragraphe 1, points a), b), c) et e), du règlement (CE) no 1069/2009, cette élimination peut se faire:
|
|
2. |
L’incinération de sous-produits animaux sur les sites visés à l’article 19, paragraphe 1, points b), c) et e), du règlement (CE) no 1069/2009 doit se faire de manière à garantir que les sous-produits animaux sont incinérés:
|
|
3. |
L’enfouissement de sous-produits animaux sur les sites visés à l’article 19, paragraphe 1, points a), b), c) et e), du règlement (CE) no 1069/2009 doit se faire de manière à garantir que les sous-produits animaux sont enfouis:
|
|
4. |
Si l’élimination se fait conformément à l’article 19, paragraphe 1, points a), b), c) et e), du règlement (CE) no 1069/2009, les sous-produits animaux doivent être transportés du lieu d’origine au lieu d’élimination dans les conditions suivantes:
|
Section 2
Incinération et enfouissement de sous-produits animaux dans des régions éloignées
Le pourcentage maximal visé à l’article 19, paragraphe 2, du règlement (CE) no 1069/2009 est fixé à:
|
a) |
10 % de la population bovine de l’État membre concerné; |
|
b) |
25 % de la population ovine et caprine de l’État membre concerné; |
|
c) |
10 % de la population porcine de l’État membre concerné; et |
|
d) |
un pourcentage de la population des autres espèces qui est déterminé par l’autorité compétente sur la base d’une évaluation des risques pour la santé publique et animale pouvant découler de l’élimination d’animaux de ces espèces par incinération ou enfouissement sur place. |
Section 3
Incinération et enfouissement d’abeilles et de sous-produits apicoles
En ce qui concerne les abeilles et les sous-produits apicoles, l’autorité compétente peut autoriser l’élimination par incinération ou enfouissement sur place, visée à l’article 19, paragraphe 1, point f), du règlement (CE) no 1069/2009, à condition que toutes les mesures nécessaires soient prises pour garantir que l’incinération ou l’enfouissement ne menace ni la santé animale ou humaine ni l’environnement.
CHAPITRE IV
ÉLIMINATION PAR D’AUTRES MOYENS
Par dérogation à l’article 14 du règlement (CE) no 1069/2009, les États membres peuvent autoriser la collecte, le transport et l’élimination des matières de catégorie 3 visées à l’article 10, point f), de ce règlement, par des moyens autres que l’incinération ou l’enfouissement sur place à condition que:
|
a) |
le poids de matières collectées dans un établissement ou une usine n’excède pas 20 kg par semaine, quelle que soit l’espèce d’origine des matières; |
|
b) |
les matières soient collectées, transportées et éliminées par des moyens qui empêchent la propagation de risques inacceptables pour la santé publique et animale; |
|
c) |
l’autorité compétente effectue régulièrement des contrôles, y compris des contrôles des registres tenus par les exploitants, dans les établissements ou les usines où les matières sont collectées, afin de s’assurer du respect des dispositions de la présente section. |
Les États membres peuvent décider de porter le poids visé au point a) à 50 kg par semaine au maximum, à condition de fournir à la Commission et aux autres États membres, par l’intermédiaire du comité permanent de la chaîne alimentaire et de la santé animale visé à l’article 52, paragraphe 1, du règlement (CE) no 1069/2009, une justification détaillée précisant la nature des activités requérant une augmentation de cette quantité, l’espèce d’origine des sous-produits animaux concernée et les raisons pour lesquelles il est nécessaire d’augmenter cette quantité, eu égard au système adéquat de traitement et d’élimination des sous-produits animaux et des produits dérivés mis en place sur leur territoire conformément à l’article 4, paragraphe 4, de ce règlement.
(1) CEN TC/102 – Stérilisateurs à usage médical - EN 285:2006 + A2:2009 - Stérilisation — Stérilisateurs à la vapeur d’eau — Grands stérilisateurs, référence publiée au JO C 293 du 2.12.2009, p. 39.
ANNEXE VII
PRÉSENTATION DES DEMANDES D’AUTORISATION D’AUTRES MÉTHODES
CHAPITRE I
Régime linguistique
|
1. |
Les demandes d’autorisation d’une autre méthode d’utilisation ou d’élimination des sous-produits animaux ou des produits dérivés, visées à l’article 20 du règlement (CE) no 1069/2009, doivent être introduites dans l’une des langues officielles de l’Union européenne, mentionnées à l’article 1er du règlement no 1 de 1958. |
|
2. |
Les parties intéressées qui soumettent une telle demande dans une langue autre que l’anglais doivent valider la traduction officielle de leur demande, qui leur est fournie par l’EFSA, avant l’évaluation. Le délai prévu à l’article 20, paragraphe 5, du règlement (CE) no 1069/2009 ne court qu’à partir de la date de validation de la traduction officielle de la demande par la partie intéressée. |
CHAPITRE II
Contenu des demandes
|
1. |
Les demandes doivent contenir toutes les informations nécessaires concernant les points suivants, afin de permettre à l’EFSA d’évaluer la sûreté de l’autre méthode qui est proposée:
|
|
2. |
Les demandes doivent être accompagnées des documents probants dont, en particulier, un schéma technique détaillant le fonctionnement du procédé, les preuves mentionnées au point 1 c), ainsi que tout autre élément destiné à étayer les explications fournies en application du point 1. |
|
3. |
Les demandes doivent mentionner les coordonnées de la partie intéressée, à savoir le nom et l’adresse complète, les numéros de téléphone et/ou de télécopieur et/ou l’adresse électronique d’une personne de contact agissant en qualité de partie intéressée ou au nom de celle-ci. |
ANNEXE VIII
COLLECTE, TRANSPORT ET TRAÇABILITÉ
CHAPITRE I
COLLECTE ET TRANSPORT
Section 1
Véhicules et conteneurs
|
1. |
Dès le point de départ de la chaîne de fabrication visé à l’article 4, paragraphe 1, du règlement (CE) no 1069/2009, les sous-produits animaux et les produits dérivés doivent être collectés et transportés dans des emballages neufs scellés ou dans des conteneurs ou véhicules étanches et couverts. |
|
2. |
Les véhicules et les conteneurs réutilisables ainsi que tous les équipements ou appareils réutilisables qui entrent en contact avec des sous-produits animaux ou des produits dérivés autres que les produits dérivés qui sont mis sur le marché conformément au règlement (CE) no 767/2009 et qui sont entreposés et transportés conformément à l’annexe II du règlement (CE) no 183/2005, doivent être gardés propres. En particulier, s’ils ne sont pas affectés au transport de sous-produits animaux ou produits dérivés donnés d’une manière qui empêche toute contamination croisée, ils doivent:
|
|
3. |
Les conteneurs réutilisables doivent être affectés au transport d’un sous-produit animal ou d’un produit dérivé particulier dans la mesure nécessaire à empêcher toute contamination croisée. Néanmoins, les conteneurs réutilisables peuvent être utilisés, si l’autorité compétente l’autorise:
|
|
4. |
Les emballages doivent être éliminés par incinération ou par d’autres moyens, conformément à la législation de l’Union. |
Section 2
Conditions de température
|
1. |
Le transport de sous-produits animaux destinés à la production de matières premières pour aliments des animaux ou d’aliments crus pour animaux familiers doit se dérouler à une température appropriée, soit à une température maximale de 7 °C dans le cas de sous-produits animaux issus de viandes et de produits à base de viande qui ne sont pas destinés à la consommation humaine, sauf s’ils sont utilisés pour l’alimentation des animaux conformément à l’annexe II, chapitre I, pour que soit évité tout risque pour la santé animale ou publique. |
|
2. |
Les matières de catégorie 3 non transformées, destinées à la production de matières premières pour aliments des animaux ou d’aliments pour animaux familiers, doivent être entreposées et transportées réfrigérées, congelées ou ensilées, sauf:
|
|
3. |
Les véhicules servant au transport réfrigéré doivent être conçus de telle manière qu’une température adéquate puisse être maintenue pendant toute la durée du transport et que la température puisse être surveillée. |
Section 3
Dérogation concernant la collecte et le transport de matières de catégorie 3 composées de lait, de produits à base de lait et de produits dérivés du lait
La section 1 ne s’applique pas à la collecte et au transport de matières de catégorie 3 composées de lait, de produits à base de lait et de produits dérivés du lait effectués par des exploitants d’établissements de transformation du lait agréés conformément à l’article 4 du règlement (CE) no 853/2004, qui réceptionnent des produits qu’ils ont livrés précédemment, en particulier, à leurs clients et qui leur sont renvoyés par ceux-ci.
Section 4
Dérogation concernant la collecte et le transport de lisier
Par dérogation à la section 1, l’autorité compétente peut accepter que la collecte et le transport de lisier transporté entre deux points situés au sein d’une même exploitation ou entre des exploitants agricoles et des utilisateurs se trouvant dans le même État membre s’effectuent dans d’autres conditions qui assurent la prévention des risques inacceptables pour la santé publique et animale.
CHAPITRE II
IDENTIFICATION
|
1. |
Toutes les mesures nécessaires doivent être prises afin de garantir:
|
|
2. |
Pendant le transport et l’entreposage, une étiquette apposée sur l’emballage, le conteneur ou le véhicule doit:
|
|
3. |
Les États membres peuvent établir des systèmes ou définir des règles concernant le codage par couleur des emballages, conteneurs ou véhicules utilisés pour le transport de sous-produits animaux et de produits dérivés provenant de leur territoire et destinés à y rester, pourvu que ces systèmes ou règles n’interfèrent pas avec le système de codage par couleur prévu au point 1 c). |
|
4. |
Les États membres peuvent établir des systèmes ou définir des règles pour le marquage des sous-produits animaux provenant de leur territoire et destinés à y rester, pourvu que ces systèmes ou règles ne soient pas en contradiction avec les exigences relatives au marquage des produits dérivés énoncées au chapitre V de la présente annexe. |
|
5. |
Par dérogation aux points 3 et 4, les États membres peuvent utiliser les systèmes ou règles visés à ces points pour les sous-produits animaux provenant de leur territoire mais non destinés à y rester si l’État membre ou le pays tiers de destination a donné son accord. |
|
6. |
Néanmoins:
|
CHAPITRE III
DOCUMENTS COMMERCIAUX ET CERTIFICATS SANITAIRES
|
1. |
Pendant le transport, un document commercial établi conformément au modèle figurant au présent chapitre ou, lorsque le présent règlement le prévoit, un certificat sanitaire doit accompagner les sous-produits animaux et les produits dérivés. Néanmoins, ce document ou certificat n’est pas nécessaire si:
|
|
2. |
Le document commercial doit être fourni au moins en triple exemplaire (un original et deux copies). L’original doit accompagner l’envoi jusqu’à sa destination finale. Le destinataire doit le conserver. Le producteur et le transporteur doivent en garder chacun une copie. Les États membres peuvent exiger que l’arrivée des envois soit attestée au moyen du système Traces ou d’un quatrième exemplaire du document commercial, que le destinataire renvoie au producteur. |
|
3. |
Les certificats sanitaires doivent être délivrés et signés par l’autorité compétente. |
|
4. |
Un document commercial établi conformément au modèle figurant au point 6 doit accompagner les sous-produits animaux et les produits dérivés pendant leur transport dans l’Union, dès le point de départ de la chaîne de fabrication visé à l’article 4, paragraphe 1, du règlement (CE) no 1069/2009. Néanmoins, outre la communication d’informations par un autre moyen visée à l’article 21, paragraphe 3, deuxième alinéa, du règlement (CE) no 1069/2009, l’autorité compétente peut autoriser que les sous-produits animaux et les produits dérivés qui sont transportés sur son territoire soient accompagnés:
|
|
5. |
Les registres et les documents commerciaux ou certificats sanitaires y afférents doivent être conservés pendant une période d’au moins deux ans pour présentation à l’autorité compétente. |
|
6. |
Modèle de document commercial Notes
|
Document commercial
pour le transport, à l’intérieur de l’Union européenne, de sous-produits animaux et de produits dérivés non destinés à la consommation humaine, conformément au règlement (CE) no 1069/2009
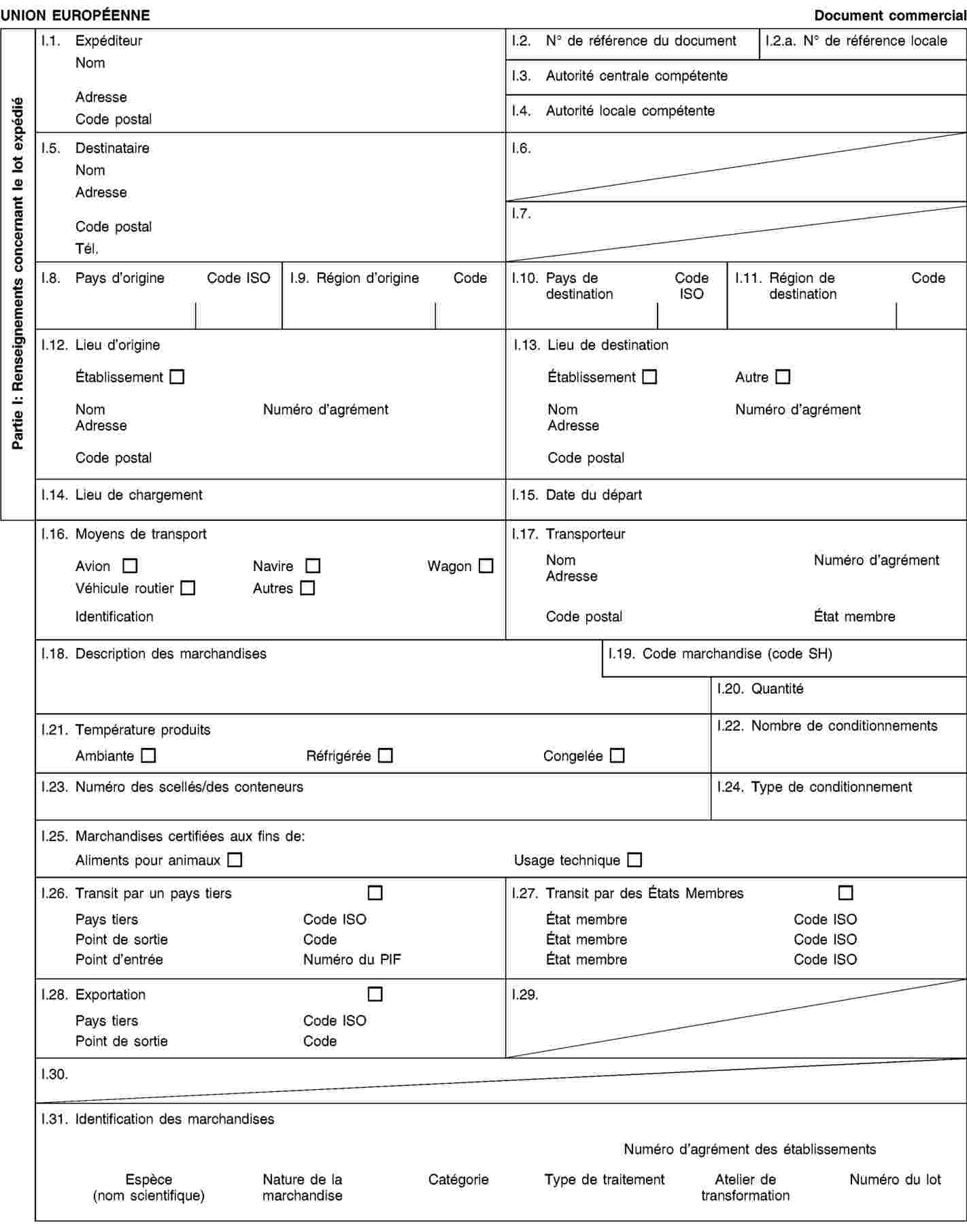

CHAPITRE IV
DONNÉES À CONSIGNER
Section 1
Dispositions générales
|
1. |
Les données consignées conformément à l’article 22, paragraphe 1, du règlement (CE) no 1069/2009 pour ce qui concerne les sous-produits animaux et produits dérivés, autres que les aliments composés pour animaux définis à l’article 3, paragraphe 2, point h), du règlement (CE) no 767/2009, qui ont été fabriqués à partir de sous-produits animaux ou de produits dérivés et qui sont mis sur le marché conformément à l’article 4 dudit règlement, doivent comporter:
|
|
2. |
Par dérogation au point 1 de la présente section, les exploitants ne doivent pas conserver les informations visées au point 1 a) et aux points 1 b) i), 1 c) i), 1 c) iii), 1 d) ii) et 1 d iii) séparément s’ils gardent une copie du document commercial figurant au chapitre III pour chaque envoi et tiennent à disposition ces informations avec les autres informations requises en vertu du point 1. |
|
3. |
Les exploitants d’installations d’incinération et d’installations de coïncinération doivent enregistrer les quantités et la catégorie des sous-produits animaux et des produits dérivés incinérés ou coïncinérés, selon le cas, ainsi que la date à laquelle ces opérations ont été effectuées. |
Section 2
Exigences supplémentaires relatives aux matières servant à l’alimentation de certains animaux dans des conditions spécifiques
Outre les données requises conformément à la section 1, les exploitants doivent consigner les données mentionnées ci-après au sujet des matières concernées si les sous-produits animaux servent à l’alimentation d’animaux dans les conditions spécifiques prévues à l’annexe VI, chapitre II:
|
1. |
en ce qui concerne les utilisateurs finaux, la quantité utilisée, les animaux auxquels elles sont censées servir de nourriture et la date d’utilisation; |
|
2. |
en ce qui concerne les centres de collecte:
|
Section 3
Exigences relatives à certains animaux à fourrure
L’exploitant de l’exploitation visé à l’annexe II, chapitre I, doit enregistrer au moins:
|
a) |
le nombre de fourrures et de carcasses provenant d’animaux nourris au moyen de matières provenant de leur espèce; et |
|
b) |
tout envoi afin d’assurer la traçabilité des matières. |
Section 4
Exigences relatives à l’application au sol de certains engrais organiques et amendements
Le responsable de pâturages auxquelles sont appliqués des engrais organiques et des amendements autres que ceux visés à l’annexe II, chapitre II, deuxième alinéa, et auxquelles des animaux d’élevage ont accès ou sur lesquelles des herbes sont coupées en vue de servir à l’alimentation d’animaux d’élevage, doit consigner les données mentionnées ci-après et les conserver pendant au moins deux ans:
|
1. |
les quantités d’engrais organiques et d’amendements appliqués; |
|
2. |
la date à laquelle les engrais organiques et les amendements ont été appliqués et les endroits où ils ont été appliqués; |
|
3. |
la date à laquelle le bétail a été autorisé à paître dans les pâturages après leur fertilisation au moyen des engrais organiques ou des amendements ou à laquelle l’herbe de ces pâturages a été coupée pour servir de fourrage. |
Section 5
Exigences relatives aux sous-produits animaux provenant d’animaux aquatiques et à l’alimentation des poissons
Les usines de transformation produisant des farines de poisson ou d’autres aliments pour animaux issus d’animaux aquatiques doivent consigner les données suivantes:
|
a) |
les quantités produites chaque jour; |
|
b) |
l’espèce d’origine, en précisant si les animaux aquatiques ont été capturés dans la nature ou s’ils proviennent de l’aquaculture; |
|
c) |
pour les farines de poissons d’élevage destinées à l’alimentation de poissons d’élevage d’une autre espèce, le nom scientifique de l’espèce d’origine. |
Section 6
Exigences relatives à l’incinération et à l’enfouissement de sous-produits animaux
Si des sous-produits animaux sont incinérés ou enfouis conformément à l’article 19, paragraphe 1, du règlement (CE) no 1069/2009, la personne responsable de l’incinération ou de l’enfouissement des sous-produits animaux doit consigner les données suivantes:
|
a) |
les quantités et les catégories de sous-produits animaux incinérés ou enfouis et les espèces dont ils proviennent; |
|
b) |
les date et lieu d’incinération ou d’enfouissement. |
Section 7
Exigences relatives à la gélatine photographique
Les exploitants des firmes photographiques agréées visées à l’annexe XIV, chapitre II, section 11, doivent consigner les données relatives aux achats et utilisations de gélatine photographique ainsi qu’à l’élimination des résidus et des matières excédentaires.
CHAPITRE V
MARQUAGE DE CERTAINS PRODUITS DÉRIVÉS
|
1. |
Dans les usines de transformation de matières de catégorie 1 ou de catégorie 2, les produits dérivés doivent être marqués de façon permanente au glycéroltriheptanoate (GTH) de telle manière que:
|
|
2. |
Les exploitants des usines de transformation visées au point 1 doivent disposer d’un système de surveillance et d’enregistrement des paramètres permettant de démontrer à l’autorité compétente que la concentration minimale homogène requise en GTH est atteinte. Ce système de surveillance et d’enregistrement doit permettre de déterminer, à partir d’échantillons prélevés à intervalles réguliers, la teneur en GTH intact comme triglycéride dans un extrait de GTH obtenu par une extraction à l’éther de pétrole 40-70. |
|
3. |
Le marquage au GTH n’est pas requis pour:
|
ANNEXE IX
EXIGENCES APPLICABLES À CERTAINS ÉTABLISSEMENTS ET USINES AGRÉÉS ET ENREGISTRÉS
CHAPITRE I
FABRICATION D’ALIMENTS POUR ANIMAUX FAMILIERS
Les établissements ou usines fabriquant des aliments pour animaux familiers, visés à l’article 24, paragraphe 1, point e), du règlement (CE) no 1069/2009 doivent disposer d’installations appropriées pour:
|
a) |
entreposer et traiter les matières entrantes en toute sécurité; et |
|
b) |
éliminer, conformément au présent règlement, les sous-produits animaux qui n’ont pas été utilisés pour la fabrication des produits, ou ces matières doivent être expédiées vers une installation d’incinération, une installation de coïncinération, une usine de transformation ou, s’il s’agit de matières de catégorie 3, une usine de production de biogaz ou une usine de compostage, conformément aux articles 12, 13 et 14 du règlement (CE) no 1069/2009 et aux dispositions du présent règlement. |
CHAPITRE II
MANIPULATION DES SOUS-PRODUITS ANIMAUX APRÈS LEUR COLLECTE
Les exigences du présent chapitre s’appliquent à l’entreposage de sous-produits animaux, visé à l’article 24, paragraphe 1, point i), du règlement (CE) no 1069/2009, et aux opérations mentionnées ci-après, qui concernent la manipulation des sous-produits animaux après leur collecte, visée à l’article 24, paragraphe 1, point h), de ce règlement:
|
a) |
le tri; |
|
b) |
la découpe; |
|
c) |
la réfrigération; |
|
d) |
la congélation; |
|
e) |
le salage ou la conservation par d’autres procédés; |
|
f) |
l’enlèvement des peaux et des cuirs; |
|
g) |
le retrait des matériels à risque spécifiés; |
|
h) |
les opérations comprenant la manipulation de sous-produits animaux qui sont accomplies en exécution d’obligations découlant de la législation vétérinaire de l’Union, tel l’examen post mortem ou le prélèvement d’échantillons; |
|
i) |
l’hygiénisation ou la pasteurisation de sous-produits animaux destinés à être convertis en biogaz ou compostés avant cette conversion ou ce compostage dans un autre établissement ou une autre usine conformément à l’annexe V du présent règlement; |
|
j) |
le tamisage. |
Section 1
Exigences générales
|
1. |
Les locaux et installations servant à l’accomplissement d’opérations intermédiaires doivent satisfaire au moins aux exigences suivantes:
|
|
2. |
L’usine doit disposer d’installations adéquates pour nettoyer et désinfecter les conteneurs ou récipients dans lesquels les sous-produits animaux sont réceptionnés ainsi que les véhicules, autres que les navires, dans lesquels ils sont transportés. Elle doit disposer des installations appropriées de désinfection des roues de véhicules. |
Section 2
Exigences en matière d’hygiène
|
1. |
Le tri des sous-produits animaux doit être effectué de manière à éviter tout risque de propagation de maladies animales. |
|
2. |
Tout au long de l’entreposage, les sous-produits animaux doivent être manipulés et entreposés séparément des autres marchandises et de manière que soit évitée toute propagation d’agents pathogènes. |
|
3. |
Les sous-produits animaux doivent être convenablement entreposés, notamment dans des conditions de température appropriées, jusqu’à leur réexpédition. |
Section 3
Normes de transformation applicables à l’hygiénisation ou à la pasteurisation
L’hygiénisation ou la pasteurisation visées à l’alinéa initial, point i), du présent chapitre, doit être effectuée conformément aux normes de transformation visées à l’annexe V, chapitre I, section 1, point 1, ou conformément aux autres paramètres de conversion autorisés conformément à l’annexe V, chapitre III, section 2, point 1.
CHAPITRE III
EXIGENCES APPLICABLES À L’ENTREPOSAGE DE PRODUITS DÉRIVÉS
Section 1
Exigences générales
Les locaux et les installations servant à l’entreposage de produits dérivés doivent satisfaire au moins aux exigences ci-après.
|
1. |
Les locaux et installations servant à l’entreposage de produits dérivés de matières de catégorie 3 ne peuvent pas se trouver sur le même site que les locaux servant à l’entreposage de produits dérivés de matières de catégorie 1 ou de catégorie 2, sauf si l’aménagement et la gestion des locaux (l’entreposage dans des bâtiments complètement séparés, par exemple) empêchent toute contamination croisée. |
|
2. |
L’usine doit:
|
|
3. |
L’usine doit disposer d’installations adéquates pour nettoyer et désinfecter les conteneurs ou récipients dans lesquels les produits dérivés sont réceptionnés ainsi que les véhicules, autres que les navires, dans lesquels ils sont transportés. |
|
4. |
Les produits dérivés doivent être convenablement entreposés jusqu’à leur réexpédition. |
Section 2
Exigences spécifiques relatives à l’entreposage de lait, produits à base de lait et produits dérivés du lait particuliers
|
1. |
Les produits visés à l’annexe X, chapitre II, section 4, partie II, doivent être entreposés à une température qui écarte tout risque pour la santé publique ou animale dans un établissement d’entreposage agréé ou enregistré et affecté à cet usage ou dans une aire de stockage séparée, affectée à cet usage et se trouvant dans un établissement d’entreposage agréé ou enregistré. |
|
2. |
Les échantillons de produits finaux prélevés pendant l’entreposage ou au terme de celui-ci doivent satisfaire au moins aux normes microbiologiques énoncées à l’annexe X, chapitre I. |
CHAPITRE IV
EXPLOITANTS ENREGISTRÉS
|
1. |
Les exploitants d’usines ou d’établissements enregistrés et les autres exploitants enregistrés doivent manipuler les sous-produits animaux et les produits dérivés conformément aux conditions suivantes:
|
|
2. |
Les exploitants doivent tenir un registre sur un support accessible à l’autorité compétente. |
|
3. |
Les exploitants enregistrés transportant des sous-produits animaux ou des produits dérivés entre des endroits autres que des locaux du même exploitant doivent en particulier:
|
ANNEXE X
MATIÈRES PREMIÈRES POUR ALIMENTS DES ANIMAUX
CHAPITRE I
EXIGENCES GÉNÉRALES RELATIVES À LA TRANSFORMATION ET À LA MISE SUR LE MARCHÉ
Normes microbiologiques applicables aux produits dérivés
Les normes microbiologiques énoncées ci-après s’appliquent aux produits dérivés.
Les échantillons de produits finaux prélevés pendant l’entreposage ou au terme de celui-ci dans l’usine de transformation doivent satisfaire aux normes suivantes:
|
|
Salmonella: absence dans 25 g: n = 5, c = 0, m = 0, M = 0 |
|
|
Enterobacteriaceae: n = 5, c = 2, m = 10, M = 300 dans 1 g |
où:
|
n |
= |
le nombre d’échantillons à tester; |
|
m |
= |
la valeur-seuil pour le nombre de bactéries. Le résultat est considéré comme satisfaisant si le nombre de bactéries dans la totalité des échantillons n’excède pas m; |
|
M |
= |
la valeur maximale du nombre de bactéries. Le résultat est considéré comme non satisfaisant si le nombre de bactéries dans un ou plusieurs échantillons est supérieur ou égal à M; et |
|
c |
= |
le nombre d’échantillons dans lesquels le nombre de bactéries peut se situer entre m et M, l’échantillon étant toujours considéré comme acceptable si le nombre de bactéries dans les autres échantillons est inférieur ou égal à m. |
Néanmoins, les normes microbiologiques énoncées dans le présent chapitre ne s’appliquent pas aux graisses fondues et aux huiles de poisson provenant de la transformation de sous-produits animaux, lorsque les protéines animales transformées, obtenues au cours de la même transformation, sont soumises à un échantillonnage visant à garantir le respect de ces normes.
CHAPITRE II
EXIGENCES SPÉCIFIQUES RELATIVES AUX PROTÉINES ANIMALES TRANSFORMÉES ET À D’AUTRES PRODUITS DÉRIVÉS
Section 1
Exigences spécifiques relatives aux protéines animales transformées
A. Matières premières
Seuls les sous-produits animaux qui sont des matières de catégorie 3, à l’exception des matières de catégorie 3 visées à l’article 10, points n), o) et p), du règlement (CE) no 1069/2009, ou les produits qui sont dérivés de ces sous-produits animaux peuvent servir à la production de protéines animales transformées.
B. Normes de transformation
|
1. |
Les protéines animales transformées issues de mammifères doivent avoir été soumises à la méthode de transformation 1 (stérilisation sous pression) décrite à l’annexe IV, chapitre III. Néanmoins,
|
|
2. |
Les protéines animales transformées ne provenant pas de mammifères, à l’exclusion des farines de poisson, doivent avoir été soumises à l’une des méthodes de transformation 1 à 5 ou à la méthode de transformation 7 décrites à l’annexe IV, chapitre III. |
|
3. |
Les farines de poisson doivent avoir été soumises:
|
C. Entreposage
|
1. |
Les protéines animales transformées doivent être emballées et entreposées dans des sacs neufs ou stérilisés, ou entreposées dans des silos convenablement aménagés ou dans des hangars. Des mesures suffisantes doivent être prises pour minimiser la condensation à l’intérieur des silos, des transporteurs et des élévateurs. |
|
2. |
Dans les transporteurs, les élévateurs et les silos, les produits doivent être protégés de toute contamination accidentelle. |
|
3. |
Les équipements servant à la manipulation des protéines animales transformées doivent être maintenus propres et secs; des points d’inspection appropriés doivent être définis pour permettre de vérifier l’état de propreté des équipements. Toutes les installations d’entreposage doivent être vidées et nettoyées régulièrement, dans la mesure nécessaire à prévenir toute contamination. |
|
4. |
Les protéines animales transformées doivent être protégées de l’humidité. Toute fuite d’eau ou condensation dans les zones d’entreposage doit en conséquence être évitée. |
Section 2
Exigences spécifiques relatives aux produits sanguins
A. Matières premières
Seul le sang visé à l’article 10, point a) et point b) i), du règlement (CE) no 1069/2009 peut être utilisé pour la production des produits sanguins.
B. Normes de transformation
Les produits sanguins doivent avoir été soumis:
|
a) |
à l’une des méthodes de transformation 1 à 5 ou à la méthode de transformation 7 décrites à l’annexe IV, chapitre III; ou |
|
b) |
à une autre méthode garantissant la conformité du produit sanguin avec les normes microbiologiques applicables aux produits dérivés, prévues au chapitre I de la présente annexe. |
Section 3
Exigences spécifiques relatives aux graisses fondues, aux huiles de poisson et aux dérivés lipidiques provenant de matières de catégorie 3
A. Matières premières
1. Graisses fondues
Seules les matières de catégorie 3 autres que celles visées à l’article 10, points i), j) n), o) et p), du règlement (CE) no 1069/2009 peuvent être utilisées pour la production de graisses fondues.
2. Huiles de poisson
Seules les matières de catégorie 3 visées à l’article 10, points i) et j), du règlement (CE) no 1069/2009 et les matières de catégorie 3 provenant d’animaux aquatiques visées à l’article 10, points e) et f), de ce règlement peuvent être utilisées pour la production d’huiles de poisson.
B. Normes de transformation
Si les huiles de poisson ou les graisses fondues n’ont pas été produites conformément à la section VIII ou à la section XII, selon le cas, de l’annexe III du règlement (CE) no 853/2004, les graisses fondues doivent être produites au moyen de l’une des méthodes de transformation 1 à 5 ou de la méthode de transformation 7, et les huiles de poisson peuvent être produites:
|
a) |
au moyen de l’une des méthodes de transformation 1 à 7 décrites à l’annexe IV, chapitre III; ou |
|
b) |
selon une autre méthode garantissant la conformité du produit avec les normes microbiologiques applicables aux produits dérivés, prévues au chapitre I de la présente annexe. |
Les graisses fondues issues de ruminants doivent être purifiées de manière que le niveau maximal des quantités totales d’impuretés non solubles restantes n’excède pas 0,15 % du poids.
Les dérivés lipidiques provenant de graisses fondues ou d’huiles de poisson de catégorie 3 doivent être produits selon l’une des méthodes de transformation décrites à l’annexe IV, chapitre III.
C. Exigences en matière d’hygiène
Lorsque les graisses fondues ou les huiles de poissons sont conditionnées, les récipients utilisés doivent être neufs ou avoir été nettoyés et désinfectés si nécessaire aux fins de la prévention de la contamination, et toutes les précautions nécessaires pour éviter leur recontamination doivent être prises.
Lorsqu’il est prévu de transporter les produits en vrac, les tuyaux, les pompes, les citernes et tout autre conteneur pour vrac ou camion-citerne utilisés pour transporter les produits de l’établissement de production soit directement vers le navire ou des citernes de stockage à terre, soit directement vers des usines, doivent être propres avant d’être utilisés.
Section 4
Exigences spécifiques relatives au lait, au colostrum et à certains autres produits dérivés du lait ou du colostrum
A. Matières premières
Seul le lait visé à l’article 10, point e), du règlement (CE) no 1069/2009, à l’exclusion des boues de centrifugeuses ou de séparateurs, et le lait visé à l’article 10, points f) et h), de ce règlement peuvent être utilisés pour la production de lait, de produits à base de lait et de produits dérivés du lait.
Le colostrum ne peut être utilisé que s’il provient d’animaux vivants qui ne présentaient aucun signe de maladie transmissible à l’homme ou aux animaux par l’intermédiaire du colostrum.
B. Normes de transformation
|
1. |
Le lait doit être soumis à l’un des traitements suivants:
|
|
2. |
Les produits à base de lait et les produits dérivés du lait doivent être soumis à au moins un des traitements prévus au point 1 ou être produits à partir de lait traité conformément au point 1. |
|
3. |
Le petit-lait destiné à l’alimentation d’animaux d’espèces sensibles à la fièvre aphteuse et provenant de lait traité conformément au point 1 doit:
|
|
4. |
Outre les exigences prévues aux points 1, 2 et 3, le lait, les produits à base de lait et les produits dérivés du lait doivent satisfaire aux exigences suivantes:
|
|
5. |
Les conditions de production du lait cru doivent offrir des garanties de police sanitaire satisfaisantes. |
|
6. |
Le colostrum et les produits à base de colostrum doivent:
|
|
1. |
Les exigences énoncées aux points 2 et 3 de la présente partie s’appliquent à la transformation, à l’utilisation et à l’entreposage du lait, des produits à base de lait et des produits dérivés du lait qui sont des matières de catégorie 3 visées à l’article 10, point e), du règlement (CE) no 1069/2009, à l’exclusion des boues de centrifugeuses ou de séparateurs, et du lait visé à l’article 10, points f) et h), de ce règlement, qui n’ont pas été transformés conformément à la partie I de la présente section. |
|
2. |
L’autorité compétente doit autoriser les établissements de transformation du lait agréés ou enregistrés conformément à l’article 4 du règlement (CE) no 853/2004 à fournir du lait, des produits à base de lait et des produits dérivés du lait pour les utilisations prévues au point 3 de la présente partie, à condition que les établissements concernés assurent la traçabilité des produits. |
|
3. |
Le lait, les produits à base de lait et les produits dérivés du lait peuvent être fournis et utilisés comme matières premières pour aliments des animaux:
|
|
4. |
L’autorité compétente peut autoriser la fourniture de colostrum qui ne satisfait pas aux conditions énoncées dans la partie I, point B 6, d’un exploitant agricole à un autre exploitant agricole se trouvant dans le même État membre aux fins de l’alimentation animale, dans des conditions qui empêchent la propagation des risques pour la santé. |
Les matières de catégorie 3 composées de boues de centrifugeuses ou de séparateurs doivent avoir subi un traitement thermique à une température d’au moins 70 °C pendant 60 minutes ou d’au moins 80 °C pendant 30 minutes avant de pouvoir être mises sur le marché aux fins de l’alimentation des animaux d’élevage.
Section 5
Exigences spécifiques relatives à la gélatine et aux protéines hydrolysées
A. Matières premières
Seuls les sous-produits animaux qui sont des matières de catégorie 3, à l’exception des matières visées à l’article 10, points m), n), o) et p), du règlement (CE) no 1069/2009, ou les produits qui sont dérivés de ces sous-produits animaux peuvent servir à la production de gélatine et de protéines hydrolysées.
B. Normes de transformation pour la gélatine
|
1. |
Si la gélatine n’a pas été produite conformément à l’annexe III, section XIV, du règlement (CE) no 853/2004, elle doit être produite selon un procédé garantissant que les matières de catégorie 3 sont soumises à un traitement acide ou alcalin suivi d’un ou de plusieurs rinçages. Le pH doit ensuite être rectifié. La gélatine doit être extraite par une ou plusieurs opérations de chauffage successives, suivies d’une purification par filtrage et d’une stérilisation. |
|
2. |
Au terme des opérations visées au point 1, la gélatine peut être soumise à un processus de dessiccation suivi, le cas échéant, d’un processus de pulvérisation ou de laminage. |
|
3. |
L’emploi d’agents de conservation autres que le dioxyde de soufre et le peroxyde d’hydrogène est interdit. |
C. Autres exigences concernant la gélatine
La gélatine doit être emballée, conditionnée, entreposée et transportée dans des conditions d’hygiène satisfaisantes.
En particulier:
|
a) |
un local ou un emplacement doit être prévu pour l’entreposage des matériaux d’emballage et de conditionnement; |
|
b) |
l’emballage et le conditionnement doivent avoir lieu dans un local ou un emplacement prévu à cet effet. |
D. Normes de transformation pour les protéines hydrolysées
Le procédé de production des protéines hydrolysées doit comprendre des mesures destinées à réduire au maximum les risques de contamination. Les protéines hydrolysées provenant de ruminants doivent avoir une masse moléculaire inférieure à 10 kilodaltons.
Outre les exigences énoncées au premier alinéa, les protéines hydrolysées issues, en partie ou en totalité, de cuirs et de peaux de ruminants doivent être produites dans une usine de transformation exclusivement réservée à la production de protéines hydrolysées suivant un procédé par lequel les matières premières de catégorie 3 sont préparées par un saumurage, un chaulage et un lavage intensif suivi de l’exposition des matières à:
|
a) |
un pH supérieur à 11 pendant plus de 3 heures à une température supérieure à 80 °C, suivie d’un traitement thermique à une température supérieure à 140 °C pendant 30 minutes à une pression supérieure à 3,6 bars; ou |
|
b) |
un pH de 1 à 2, puis un pH supérieur à 11, suivie d’un traitement thermique à 140 °C pendant 30 minutes à une pression de 3 bars. |
Section 6
Exigences spécifiques relatives au phosphate dicalcique
A. Matières premières
Seuls les sous-produits animaux qui sont des matières de catégorie 3, à l’exception des matières visées à l’article 10, points m), n), o) et p), du règlement (CE) no 1069/2009, ou les produits qui sont dérivés de ces sous-produits animaux peuvent servir à la production de phosphate dicalcique.
B. Normes de transformation
|
1. |
Le phosphate dicalcique doit être produit selon un procédé comprenant les trois étapes suivantes:
|
|
2. |
Le phosphate dicalcique dérivé d’os dégraissés doit provenir d’os visés à l’article 10, point a), du règlement (CE) no 1069/2009. |
Section 7
Exigences spécifiques relatives au phosphate tricalcique
A. Matières premières
Seuls les sous-produits animaux qui sont des matières de catégorie 3, à l’exception des matières visées à l’article 10, points m), n), o) et p), du règlement (CE) no 1069/2009, ou les produits qui sont dérivés de ces sous-produits animaux peuvent servir à la production de phosphate tricalcique.
B. Normes de transformation
Le phosphate tricalcique doit être produit selon un procédé garantissant:
|
a) |
que tous les os qui sont des matières de catégorie 3 sont finement broyés et dégraissés à contre-courant avec de l’eau chaude (éclats d’os de moins de 14 mm); |
|
b) |
une cuisson en continu à la vapeur à 145 °C pendant 30 minutes à 4 bars; |
|
c) |
la séparation de la solution protéique de l’hydroxyapatite (phosphate tricalcique) par centrifugation; |
|
d) |
la granulation du phosphate tricalcique après séchage sur lit fluidisé avec de l’air à 200 °C. |
Section 8
Exigences spécifiques relatives au collagène
A. Matières premières
Seuls les sous-produits animaux qui sont des matières de catégorie 3, à l’exception des matières visées à l’article 10, points m), n), o) et p), du règlement (CE) no 1069/2009, ou les produits qui sont dérivés de ces sous-produits animaux peuvent servir à la production de collagène.
B. Normes de transformation
|
1. |
Si le collagène n’a pas été produit conformément à l’annexe III, section XV, du règlement (CE) no 853/2004, il doit être produit selon un procédé garantissant que les matières de catégorie 3 non transformées sont soumises à un traitement comportant un lavage et une adaptation du pH au moyen d’un acide ou d’un alcali, suivis d’un ou de plusieurs rinçages, d’une filtration et d’une extrusion. Après ce traitement, le collagène peut être soumis à un procédé de dessiccation. |
|
2. |
L’utilisation d’agents de conservation autres que ceux autorisés par la législation de l’Union est interdite. |
C. Autres exigences
Le collagène doit être emballé, conditionné, entreposé et transporté dans des conditions d’hygiène satisfaisantes. En particulier:
|
a) |
un local ou un emplacement doit être prévu pour l’entreposage des matériaux d’emballage et de conditionnement; |
|
b) |
l’emballage et le conditionnement doivent avoir lieu dans un local ou un emplacement prévu à cet effet. |
Section 9
Exigences spécifiques relatives aux ovoproduits
A. Matières premières
Seuls les sous-produits animaux visés à l’article 10, points e) et f), et à l’article 10, point k) ii), du règlement (CE) no 1069/2009 peuvent être utilisés pour la production d’ovoproduits.
B. Normes de transformation
Les ovoproduits doivent avoir été:
|
a) |
soumis à l’une des méthodes de transformation 1 à 5 ou à la méthode de transformation 7 décrites à l’annexe IV, chapitre III; |
|
b) |
soumis à une autre méthode et à des paramètres garantissant la conformité des produits avec les normes microbiologiques applicables aux produits dérivés, énoncées au chapitre I; ou |
|
c) |
traités conformément aux exigences relatives aux œufs et aux ovoproduits énoncées à l’annexe III, section X, chapitres I, II et III, du règlement (CE) no 853/2004. |
Section 10
Exigences spécifiques relatives à certaines matières de catégorie 3
Les matières de catégorie 3 comprenant des produits d’origine animale, ou des denrées alimentaires contenant des produits d’origine animale, qui ne sont plus destinés à la consommation humaine pour des raisons commerciales ou en raison de défauts de fabrication ou d’emballage ou d’autres défauts n’entraînant aucun risque pour la santé humaine ou animale, visés à l’article 10, point f), du règlement (CE) no 1069/2009, peuvent être mises sur le marché aux fins de l’alimentation des animaux d’élevage, à condition que:
|
a) |
les matières ne soient pas composées de matières d’origine animale et n’aient pas été en contact avec des matières d’origine animale qui n’ont pas subi une transformation:
|
|
b) |
toutes les précautions nécessaires pour éviter la contamination des matières aient été prises. |
CHAPITRE III
EXIGENCES RELATIVES À CERTAINS ALIMENTS POUR POISSONS ET APPÂTS DE PÊCHE
|
1. |
Les sous-produits animaux provenant de poissons ou d’invertébrés aquatiques et les produits qui en sont dérivés destinés à être utilisés pour l’alimentation des poissons d’élevage ou d’autres espèces aquacoles, doivent:
|
|
2. |
L’autorité compétente peut fixer des conditions visant à écarter les risques inacceptables de transmission de maladies transmissibles à l’homme ou aux animaux et applicables à l’utilisation d’animaux aquatiques et d’invertébrés aquatiques et terrestres:
|
(1) F0 est l’effet létal calculé sur les spores bactériennes. Une valeur F0 de 3,00 signifie que le point le plus froid du produit a été suffisamment chauffé pour atteindre le même effet létal qu’une température de 121 °C (250 °F) en trois minutes avec chauffage et refroidissement instantanés.
(2) UHT= traitement à ultra-haute température, c’est-à-dire à 132 °C pendant au moins une seconde.
(3) HTST= pasteurisation ultrarapide à haute température, c’est-à-dire à 72 °C pendant au moins 15 secondes, ou effet de pasteurisation équivalent donnant une réaction négative au test de la phosphatase.
ANNEXE XI
ENGRAIS ORGANIQUES ET AMENDEMENTS
CHAPITRE I
EXIGENCES RELATIVES AU LISIER NON TRANSFORMÉ, AU LISIER TRANSFORMÉ ET AUX PRODUITS DÉRIVÉS DU LISIER TRANSFORMÉ
Section 1
Lisier non transformé
|
1. |
Les échanges de lisier non transformé d’espèces autres que la volaille ou les équidés entre les États membres doivent satisfaire aux conditions suivantes et faire l’objet d’une décision favorable de l’État membre de destination conformément à l’article 48, paragraphe 1, du règlement (CE) no 1069/2009:
|
|
2. |
Les échanges de lisier non transformé de volaille entre les États membres doivent satisfaire aux conditions suivantes et faire l’objet d’une décision favorable de l’État membre de destination conformément à l’article 48, paragraphe 1, du règlement (CE) no 1069/2009:
|
|
3. |
Modèle de l’attestation sanitaire à joindre au document commercial:
|
|
4. |
Le lisier non transformé d’équidés peut faire l’objet d’échanges entre les États membres à condition que l’État membre de destination ait marqué son accord sur les échanges par une décision favorable prise conformément à l’article 48, paragraphe 1, du règlement (CE) no 1069/2009 et à condition qu’il ne provienne pas d’une exploitation soumise à des restrictions de police sanitaire concernant la morve, la stomatite vésiculeuse, le charbon bactéridien ou la rage, conformément à l’article 4, paragraphe 5, de la directive 2009/156/CE. |
|
5. |
Conformément à l’article 48, paragraphe 1, point c) ii), du règlement (CE) no 1069/2009, l’autorité compétente de l’État membre de destination peut exiger des exploitants expédiant du lisier non transformé à partir d’un autre État membre:
|
|
6. |
L’autorité compétente peut autoriser l’expédition de lisier transporté entre deux points situés au sein d’une même exploitation sous réserve de conditions de maîtrise de tous les risques éventuels pour la santé, telle l’obligation faite aux exploitants concernés de conserver les informations appropriées. |
Section 2
Guano de chauve-souris, lisier transformé et produits dérivés du lisier transformé
La mise sur le marché de lisier transformé, de produits dérivés du lisier transformé et de guano de chauve-souris doit satisfaire aux conditions ci-après et faire l’objet d’une décision favorable de l’État membre de destination conformément à l’article 48, paragraphe 1, du règlement (CE) no 1069/2009.
|
a) |
Ils doivent provenir d’une usine de produits dérivés destinés à être utilisés en dehors de la chaîne alimentaire animale, d’une usine de production de biogaz, d’une usine de compostage ou d’une usine de production d’engrais organiques ou d’amendements. |
|
b) |
Ils doivent avoir été soumis à un traitement thermique à une température d’au moins 70 °C pendant au moins 60 minutes et à un traitement de réduction des bactéries sporulantes et de la toxigénèse, lorsqu’elles sont identifiées comme un danger à prendre en considération. |
|
c) |
L’autorité compétente peut néanmoins autoriser l’utilisation de paramètres de transformation normalisés autres que ceux visés au point b) à condition qu’un demandeur apporte la preuve qu’ils garantissent une réduction maximale des risques biologiques. Cette preuve doit comporter une validation, qui est effectuée comme suit:
Les données détaillées concernant les paramètres appropriés du procédé utilisés dans une usine ainsi que les autres points critiques pour la maîtrise (CCP) doivent être enregistrés et conservés de manière que le propriétaire, l’exploitant ou leur représentant et l’autorité compétente puissent contrôler le fonctionnement de l’usine. Les informations relatives à un procédé autorisé en application du présent point doivent être mises à la disposition de la Commission sur demande. |
|
d) |
Les échantillons représentatifs de lisier prélevés au cours de la transformation ou immédiatement après dans l’usine aux fins du contrôle du procédé doivent satisfaire aux normes suivantes:
où:
Le lisier transformé ou les produits transformés à base de lisier ne satisfaisant pas aux normes du présent point sont considérés comme non transformés. |
|
e) |
Ils doivent être conservés de manière à réduire au maximum, après transformation, toute contamination, infestation secondaire ou formation d’humidité. Ils doivent donc être conservés dans:
|
CHAPITRE II
EXIGENCES RELATIVES À CERTAINS ENGRAIS ORGANIQUES ET AMENDEMENTS
Section 1
Conditions de production
|
1. |
Les engrais organiques et amendements autres que le lisier, le contenu de l’appareil digestif, le compost, le lait, les produits à base de lait, les produits dérivés du lait, le colostrum, les produits à base de colostrum et les résidus de digestion provenant de la conversion de sous-produits animaux ou de produits dérivés en biogaz, doivent être produits:
|
|
2. |
Les engrais organiques et les amendements consistant en farines de viande et d’os dérivées de matières de catégorie 2 ou de protéines animales transformées ou produits à partir de ces matières doivent être mélangés, dans une usine ou un établissement enregistré, avec une proportion minimale suffisante d’un constituant autorisé par l’autorité compétente de l’État membre sur le territoire duquel le produit doit être utilisé, de façon à exclure l’utilisation ultérieure du mélange aux fins de l’alimentation des animaux. |
|
3. |
L’autorité compétente doit autoriser le constituant visé au point 2 s’il satisfait aux conditions suivantes:
L’autorité compétente doit mettre la liste des constituants autorisés à la disposition de la Commission et des autres États membres sur demande. |
|
4. |
Néanmoins, les exigences énoncées au point 2 ne s’appliquent pas:
|
|
5. |
Les fabricants d’engrais organiques et d’amendements doivent s’assurer que l’élimination des agents pathogènes est effectuée avant la mise sur le marché, conformément à:
|
Section 2
Entreposage et transport
Après transformation ou conversion, les engrais organiques et les amendements doivent être convenablement entreposés et transportés:
|
a) |
en vrac, dans des conditions appropriées prévenant la contamination; |
|
b) |
conditionnés ou dans de grands sacs (big bags), dans le cas d’engrais organiques et d’amendements destinés à être vendus aux utilisateurs finaux; ou |
|
c) |
dans un lieu d’entreposage adéquat auquel les animaux d’élevage n’ont pas accès, en cas d’entreposage dans une exploitation agricole. |
ANNEXE XII
PRODUITS INTERMÉDIAIRES
Conformément à l’article 34, paragraphe 2, du règlement (CE) no 1069/2009, les conditions ci-après s’appliquent à l’importation dans l’Union et au transit par celle-ci de produits intermédiaires.
|
1. |
L’importation et le transit de produits intermédiaires sont autorisés à condition:
|
|
2. |
Une usine ou un établissement peut être enregistré ou agréé par l’autorité compétente d’un pays tiers, comme le prévoit le point 1 e), à condition:
|
|
3. |
Les produits intermédiaires importés dans l’Union doivent être contrôlés au poste d’inspection frontalier conformément à l’article 4 de la directive 97/78/CE et transportés directement du poste d’inspection frontalier:
|
|
4. |
Les produits intermédiaires en transit dans l’Union doivent être transportés conformément à l’article 11 de la directive 97/78/CE. |
|
5. |
Le vétérinaire officiel du poste d’inspection frontalier concerné doit informer l’autorité responsable de l’usine ou de l’établissement du lieu de destination au sujet de l’envoi au moyen du système Traces. |
|
6. |
L’exploitant ou le propriétaire de l’usine ou de l’établissement de destination, ou son représentant, doit tenir un registre conformément à l’article 22 du règlement (CE) no 1069/2009 et, sur demande de l’autorité compétente, fournir à celle-ci les informations nécessaires concernant les achats, ventes, utilisations, stocks et destructions de surplus des produits intermédiaires aux fins de la vérification du respect du présent règlement. |
|
7. |
L’autorité compétente doit s’assurer, conformément à la directive 97/78/CE, que les envois de produits intermédiaires sont expédiés de l’État membre dans lequel se trouve le poste d’inspection frontalier devant effectuer l’inspection à l’usine de destination visée au point 3 ou, en cas de transit, au poste d’inspection frontalier de sortie. |
|
8. |
L’autorité compétente doit effectuer des contrôles documentaires à intervalles réguliers afin de vérifier la correspondance entre les quantités de produits intermédiaires importées, d’une part, et les quantités entreposées, utilisées, expédiées ou éliminées, d’autre part, de manière à vérifier le respect des dispositions du présent règlement. |
|
9. |
En ce qui concerne les envois de produits intermédiaires en transit, les autorités compétentes qui sont responsables, respectivement, du poste d’inspection frontalier d’entrée et du poste d’inspection frontalier de sortie doivent coopérer dans la mesure nécessaire pour garantir la réalisation de contrôles efficaces et la traçabilité de ces envois. |
ANNEXE XIII
ALIMENTS POUR ANIMAUX FAMILIERS ET CERTAINS AUTRES PRODUITS DÉRIVÉS
CHAPITRE I
Exigences générales
Les usines de production d’aliments pour animaux familiers et les établissements ou usines produisant des produits dérivés visés à la présente annexe doivent disposer des installations adéquates pour:
|
a) |
entreposer et traiter les matières entrantes dans des conditions qui écartent les risques pour la santé publique et animale; |
|
b) |
éliminer les sous-produits animaux et les produits dérivés qui n’ont pas été utilisés pour la production, sauf si les matières inutilisées sont expédiées vers un autre établissement ou une autre usine pour y être transformées ou éliminées, conformément au présent règlement. |
CHAPITRE II
Exigences spécifiques relatives aux aliments pour animaux familiers, y compris les articles à mastiquer
1. Aliments crus pour animaux familiers
Les exploitants ne peuvent fabriquer des aliments crus pour animaux familiers qu’à partir des matières de catégorie 3 visées à l’article 10, point a), point b) i) et point b) ii), du règlement (CE) no 1069/2009.
Les aliments crus pour animaux familiers doivent être conditionnés dans un emballage neuf étanche.
Des mesures efficaces doivent être prises pour garantir que le produit est protégé de toute contamination à chaque étape de la chaîne de production et jusqu’au point de vente.
2. Matières premières pour les aliments transformés pour animaux familiers et les articles à mastiquer
Les exploitants ne peuvent fabriquer des aliments transformés pour animaux familiers et des articles à mastiquer qu’à partir:
|
a) |
des matières de catégorie 3 autres que celles visées à l’article 10, points n), o) et p), du règlement (CE) no 1069/2009; et |
|
b) |
dans le cas d’aliments pour animaux familiers importés ou d’aliments pour animaux familiers produits à partir de matières importées, de matières de catégorie 1 composées de sous-produits animaux provenant d’animaux qui ont fait l’objet d’un traitement illégal au sens de l’article 1er, paragraphe 2, point d), de la directive 96/22/CE ou de l’article 2, point b), de la directive 96/23/CE. |
3. Aliments transformés pour animaux familiers
|
a) |
Les aliments en conserve pour animaux familiers doivent être soumis à un traitement thermique caractérisé par une valeur Fc d’au moins 3. |
|
b) |
Les aliments transformés pour animaux familiers autres que les aliments en conserve doivent:
Après la production, toutes les précautions doivent être prises pour que les aliments transformés pour animaux familiers ne soient pas exposés à une source de contamination. Les aliments transformés pour animaux familiers doivent être conditionnés dans des emballages neufs. |
4. Les articles à mastiquer doivent être soumis à un traitement suffisant pour détruire les organismes pathogènes, y compris les salmonelles.
Après ce traitement, toutes les précautions doivent être prises pour que ces articles à mastiquer ne soient pas exposés à une source de contamination.
Les articles à mastiquer doivent être conditionnés dans des emballages neufs.
5. Des échantillons doivent être prélevés de manière aléatoire sur les articles à mastiquer et les aliments transformés pour animaux familiers à l’exception des aliments en conserve et des aliments transformés pour animaux familiers traités conformément au point 3 b) v), en cours de production et/ou d’entreposage (avant expédition), en vue de la vérification de leur conformité aux normes suivantes:
|
|
Salmonella: absence dans 25 g: n = 5, c = 0, m = 0, M = 0 |
|
|
Enterobacteriaceae: n = 5, c = 2, m = 10, M = 300 dans 1 g |
Où:
|
n |
= |
le nombre d’échantillons à tester; |
|
m |
= |
la valeur-seuil pour le nombre de bactéries. Le résultat est considéré comme satisfaisant si le nombre de bactéries dans la totalité des échantillons n’excède pas m; |
|
M |
= |
la valeur maximale du nombre de bactéries. Le résultat est considéré comme non satisfaisant si le nombre de bactéries dans un ou plusieurs échantillons est supérieur ou égal à M; et |
|
c |
= |
le nombre d’échantillons dans lesquels le nombre de bactéries peut se situer entre m et M, l’échantillon étant toujours considéré comme acceptable si le nombre de bactéries dans les autres échantillons est inférieur ou égal à m. |
6. Des échantillons doivent être prélevés de manière aléatoire sur les aliments crus pour animaux familiers en cours de production et/ou d’entreposage (avant expédition) en vue de la vérification de leur conformité avec les normes suivantes:
|
|
Salmonella: absence dans 25 g: n = 5, c = 0, m = 0, M = 0 |
|
|
Enterobacteriaceae: n = 5, c = 2, m = 10, M = 5 000 dans 1 g |
Où:
|
n |
= |
le nombre d’échantillons à tester; |
|
m |
= |
la valeur-seuil pour le nombre de bactéries. Le résultat est considéré comme satisfaisant si le nombre de bactéries dans la totalité des échantillons n’excède pas m; |
|
M |
= |
la valeur maximale du nombre de bactéries. Le résultat est considéré comme non satisfaisant si le nombre de bactéries dans un ou plusieurs échantillons est supérieur ou égal à M; et |
|
c |
= |
le nombre d’échantillons dans lesquels le nombre de bactéries peut se situer entre m et M, l’échantillon étant toujours considéré comme acceptable si le nombre de bactéries dans les autres échantillons est inférieur ou égal à m. |
7. Point final de la chaîne de fabrication des aliments transformés pour animaux familiers et des articles à mastiquer
Peuvent être mis sur le marché sans restrictions conformément au présent règlement:
|
a) |
les aliments transformés pour animaux familiers:
|
|
b) |
les articles à mastiquer:
|
CHAPITRE III
Exigences spécifiques relatives aux viscères aromatiques utilisés pour la fabrication d’aliments pour animaux familiers
|
1. |
Les exploitants ne peuvent utiliser que des sous-produits animaux pouvant servir de matières premières pour les aliments transformés pour animaux familiers et les articles à mastiquer conformément au chapitre II, point 2, pour la production de produits dérivés liquides ou déshydratés utilisés pour améliorer les valeurs de sapidité des aliments pour animaux familiers. |
|
2. |
Les viscères aromatiques doivent avoir été soumis à une méthode de traitement et à des paramètres garantissant la conformité du produit avec les normes microbiologiques fixées au chapitre II, point 5, de la présente annexe. Après le traitement, toutes les précautions doivent être prises pour veiller à ce que le produit ne soit pas exposé à une source de contamination. |
|
3. |
Le produit final doit:
|
CHAPITRE IV
Exigences spécifiques relatives au sang et aux produits sanguins d’équidés
La mise sur le marché de sang et de produits sanguins d’équidés à des fins autres que l’alimentation animale, est soumise aux conditions ci-après.
|
1. |
Le sang peut être mis sur le marché à de telles fins à condition d’avoir été prélevé:
|
|
2. |
Les produits sanguins peuvent être mis sur le marché à ces fins à condition:
|
|
3. |
Le sang et les produits sanguins d’équidés doivent être conditionnés dans des récipients étanches scellés qui, dans le cas de sang d’équidés, portent le numéro d’agrément de l’abattoir ou de l’établissement de collecte visé au point 1 b). |
CHAPITRE V
Exigences spécifiques relatives aux cuirs et peaux d’ongulés et aux produits qui en sont dérivés
A. Établissements et usines
L’autorité compétente peut autoriser les usines manipulant des cuirs et des peaux, y compris des peaux chaulées, à fournir des chutes et des rognures de ces cuirs et de ces peaux en vue de la production de gélatine destinée à la consommation animale, d’engrais organiques ou d’amendements, à condition:
|
a) |
que l’usine dispose de locaux d’entreposage dotés de sols en dur et de murs lisses, faciles à nettoyer et à désinfecter et, s’il y a lieu, pourvus d’installations frigorifiques; |
|
b) |
que les locaux d’entreposage soient maintenus en bon état d’entretien et de propreté, de façon à ne pas risquer de contaminer les matières premières; |
|
c) |
que, si des matières premières ne satisfaisant pas aux exigences du présent chapitre sont entreposées et/ou transformées dans ces locaux, elles soient tenues à l’écart des matières premières répondant aux exigences du présent chapitre de la réception à l’expédition en passant par l’entreposage et la transformation; |
|
d) |
que, dans le cas de chutes et de rognures provenant de peaux chaulées, les chutes et rognures soient soumises à un traitement garantissant que tout risque pour la santé publique et animale est écarté avant d’être utilisées pour la production:
|
B. Mise sur le marché de sous-produits animaux et de produits dérivés
|
1. |
Les cuirs et peaux non traités peuvent être mis sur le marché sous réserve des conditions sanitaires applicables aux viandes fraîches en vertu de la directive 2002/99/CE. |
|
2. |
Les cuirs et peaux traités peuvent être mis sur le marché à condition:
|
C. Point final de la chaîne de fabrication des cuirs et peaux
|
1. |
Les cuirs et peaux d’ongulés qui, conformément à la décision d’un exploitant, sont destinés à des usages autres que la consommation humaine et qui satisfont aux exigences du règlement (CE) no 853/2004 relatives aux matières premières servant à la production de gélatine ou de collagène destinés à être utilisés dans l’alimentation humaine, peuvent être mis sur le marché sans restrictions au titre du présent règlement. |
|
2. |
Les cuirs et peaux traités énumérés ci-après peuvent être mis sur le marché sans restrictions conformément au présent règlement:
|
|
3. |
Par dérogation au point C 2, l’autorité compétente peut exiger que les envois de cuirs et peaux traités visés aux points 2 c) et 2 d) soient accompagnés d’un document commercial établi conformément au modèle figurant à l’annexe VIII, chapitre III, point 6, lorsqu’ils sont livrés à des établissements ou usines produisant des aliments pour animaux familiers, des engrais organiques ou des amendements, ou convertissant ces matières en biogaz. |
CHAPITRE VI
Exigences spécifiques relatives aux trophées de chasse et à d’autres préparations d’animaux
A. Les dispositions du présent chapitre s’appliquent sans préjudice des mesures de protection de la faune sauvage adoptées en application du règlement (CE) no 338/97.
B. Sûreté de l’approvisionnement
Les trophées de chasse et les autres préparations d’animaux peuvent être mis sur le marché lorsque, en vue de la préparation, les sous-produits animaux ont été soumis à un traitement ou sont présentés dans un état qui ne comporte aucun risque sanitaire, et à condition qu’ils proviennent:
|
a) |
d’espèces autres que les ongulés, les oiseaux et les animaux de la classe biologique Insecta ou Arachnida; et |
|
b) |
d’animaux originaires d’une région non soumise à des restrictions liées à la présence d’une maladie transmissible grave à laquelle les animaux de l’espèce concernée sont sensibles. |
C. Sûreté du traitement
|
1. |
Les trophées de chasse et les autres préparations d’animaux peuvent être mis sur le marché lorsque, en vue de la préparation, les sous-produits animaux ont été soumis à un traitement ou sont présentés dans un état qui ne comporte aucun risque sanitaire, et à condition:
|
|
2. |
Les trophées de chasse et les autres préparations autres que ceux visés au point B et au point C 1, qui proviennent d’animaux originaires d’une région soumise à des restrictions liées à la présence d’une maladie transmissible grave à laquelle les animaux de l’espèce concernée sont sensibles, peuvent être mis sur le marché à condition:
|
CHAPITRE VII
Exigences spécifiques relatives à la laine, aux poils, aux soies de porc, aux plumes, aux parties de plumes et au duvet
A. Matières premières
|
1. |
La laine non traitée, les poils non traités, les soies de porc non traitées et les plumes, les parties de plumes et le duvet non traités doivent être des matières de catégorie 3 visées à l’article 10, points b) iii), b) iv) et b) v), et à l’article 10, points h) et n), du règlement (CE) no 1069/2009. Ils doivent être conditionnés à l’état sec dans des emballages hermétiques. Néanmoins, en ce qui concerne les plumes, les parties de plumes et le duvet non traités expédiés directement de l’abattoir à l’usine de transformation, l’autorité compétente peut accorder une dérogation à l’exigence de séchage des matières transportées sur le territoire dont elle est responsable, à condition:
|
|
2. |
Les mouvements de soies de porc provenant de régions où la peste porcine africaine est endémique sont interdits, sauf en ce qui concerne les soies qui:
|
|
3. |
Les dispositions du point 1 ne s’appliquent pas aux plumes décoratives ni aux plumes:
|
B. Point final de la chaîne de fabrication de la laine et des poils
La laine et les poils qui ont été lavés en usine ou qui ont été traités selon une autre méthode garantissant l’élimination de tout risque inacceptable peuvent être mis sur le marché sans restrictions au titre du présent règlement.
Les États membres peuvent autoriser la mise sur le marché de laine et de poils non traités provenant d’exploitations agricoles ou d’établissements ou usines qui ont été enregistrés conformément à l’article 23 du règlement (CE) no 1069/2009 ou agréés conformément à l’article 24, paragraphe 1, point i), du même règlement sur leur territoire conformément au présent règlement, s’ils ont pu s’assurer que la laine et les poils ne présentaient aucun risque inacceptable pour la santé publique ou animale.
C. Point final de la chaîne de fabrication des plumes et du duvet
Les plumes, les parties de plumes et le duvet lavés en usine et traités avec de la vapeur chaude à 100 °C pendant au moins 30 minutes peuvent être mis sur le marché sans restrictions au titre du présent règlement.
CHAPITRE VIII
Exigences spécifiques relatives aux fourrures
Point final de la chaîne de fabrication
Les fourrures qui ont été séchées à une température ambiante de 18 °C pendant deux jours à un taux d’humidité de 55 % peuvent être mises sur le marché sans restrictions au titre du présent règlement.
CHAPITRE IX
Exigences spécifiques relatives aux sous-produits apicoles
Les sous-produits apicoles destinés à être utilisés exclusivement en apiculture:
|
1. |
ne peuvent provenir d’une zone faisant l’objet d’une interdiction liée à l’apparition:
|
|
2. |
doivent satisfaire aux exigences prévues à l’article 8, point a), de la directive 92/65/CEE. |
CHAPITRE X
Exigences spécifiques relatives aux graisses fondues obtenues à partir de matières de catégorie 1 ou de catégorie 2 et destinées à un usage oléochimique
|
1. |
Les graisses fondues dérivées de matières de catégorie 1 ou de catégorie 2 qui sont destinées à un usage oléochimique doivent être produites au moyen de l’une des méthodes de transformation 1 à 5 décrites à l’annexe IV, chapitre III. |
|
2. |
Les graisses fondues issues de ruminants doivent être purifiées de manière que le niveau maximal des quantités totales d’impuretés non solubles restantes n’excède pas 0,15 % du poids. |
CHAPITRE XI
Exigences spécifiques relatives aux dérivés lipidiques
|
1. |
Les procédés ci-après peuvent être utilisés pour produire des dérivés lipidiques provenant de graisses fondues obtenues à partir de matières de catégorie 1 et de catégorie 2:
|
|
2. |
Les dérivés lipidiques produits conformément au présent chapitre ne peuvent être mis sur le marché:
|
CHAPITRE XII
Exigences spécifiques relatives aux cornes et produits à base de corne (à l’exclusion de la farine de corne) ainsi qu’aux onglons et produits à base d’onglons (à l’exclusion de la farine d’onglons), destinés à la production d’engrais organiques ou d’amendements
La mise sur le marché de cornes et produits à base de corne (à l’exclusion de la farine de corne) ainsi que d’onglons et produits à base d’onglons (à l’exclusion de la farine d’onglons), destinés à la production d’engrais organiques ou d’amendements, est soumise aux conditions suivantes:
|
a) |
ils doivent provenir d’animaux:
|
|
b) |
ils doivent avoir subi un traitement thermique pendant 1 heure à une température à cœur d’au moins 80 °C; |
|
c) |
les cornes doivent être séparées du crâne par application d’une méthode laissant la cavité crânienne intacte; |
|
d) |
toute précaution doit avoir été prise, à tout stade de la transformation, de l’entreposage ou du transport, pour que soit évitée une contamination croisée; |
|
e) |
ils doivent être conditionnés dans un conditionnement ou des récipients neufs, ou transportés dans des véhicules ou dans des conteneurs pour vrac désinfectés avant le chargement à l’aide d’un produit approuvé par l’autorité compétente; |
|
f) |
le conditionnement ou les récipients doivent:
|
ANNEXE XIV
IMPORTATION, EXPORTATION ET TRANSIT
CHAPITRE I
EXIGENCES SPÉCIFIQUES APPLICABLES À L’IMPORTATION DANS L’UNION ET AU TRANSIT PAR CELLE-CI DES MATIÈRES DE CATÉGORIE 3 ET PRODUITS DÉRIVÉS DESTINÉS À ÊTRE UTILISÉS DANS LES ALIMENTS DES ANIMAUX AUTRES QUE LES ANIMAUX FAMILIERS ET LES ANIMAUX À FOURRURE
Section 1
Conformément à l’article 41, paragraphe 1, point a), et paragraphe 3, du règlement (CE) no 1069/2009, les exigences suivantes s’appliquent aux envois importés et en transit de matières de catégorie 3 et de produits qui en sont dérivés destinés à être utilisés dans les aliments pour animaux autres que les animaux familiers et les animaux à fourrure:
|
a) |
ces envois doivent être constitués de matières de catégorie 3 visées dans la colonne «Matières premières» du tableau 1 ou avoir été produits à partir de ces matières, selon le cas; |
|
b) |
ils doivent remplir les conditions d’importation et de transit spécifiées dans la colonne «Conditions d’importation et de transit» du tableau 1; |
|
c) |
ils doivent provenir d’un pays tiers ou d’une partie de pays tiers figurant dans la colonne «Listes de pays tiers» du tableau 1; et |
|
d) |
ils doivent être accompagnés, lors de leur transport jusqu’au point d’entrée dans l’Union où les contrôles vétérinaires sont effectués, du certificat sanitaire visé dans la colonne «Certificats/modèles de documents» du tableau 1; ou |
|
e) |
ils doivent être présentés au point d’entrée dans l’Union où les contrôles vétérinaires sont effectués accompagnés d’un document correspondant au modèle visé dans la colonne «Certificats/modèles de documents» du tableau 1. |
Tableau 1
|
No |
Produits |
Matières premières [référence aux dispositions du règlement (CE) no 1069/2009] |
Conditions d’importation et de transit |
Listes de pays tiers |
Certificats/modèles de documents |
||||||||||||||||
|
1 |
Protéines animales transformées |
Matières de catégorie 3 visées à l’article 10, points a), b), d), e), f), h), i), j), k), l) et m) |
|
|
Annexe XV, chapitre 1 |
||||||||||||||||
|
2 |
Produits sanguins destinés à être utilisés comme matières premières pour aliments des animaux |
Matières de catégorie 3 visées à l’article 10, point a) et point b) i) |
Les produits sanguins doivent avoir été produits conformément à l’annexe X, chapitre II, section 2. |
|
Annexe XV, chapitre 4 B |
||||||||||||||||
|
3 |
Graisses fondues et huiles de poisson |
|
|
|
|
||||||||||||||||
|
4 |
Lait, produits à base de lait et produits dérivés du lait, colostrum et produits à base de colostrum |
|
Le lait, les produits à base de lait, le colostrum et les produits à base de colostrum doivent satisfaire aux exigences de la section 4 du présent chapitre. |
|
|
||||||||||||||||
|
5 |
Gélatine et protéines hydrolysées |
Matières de catégorie 3 visées à l’article 10, points a), b), e), f), g), i) et j) et, dans le cas de protéines hydrolysées, matières de catégorie 3 visées à l’article 10, points d), h) et k). |
La gélatine et les protéines hydrolysées doivent avoir été produites conformément à l’annexe X, chapitre II, section 5. |
|
|
||||||||||||||||
|
6 |
Phosphate dicalcique |
Matières de catégorie 3 visées à l’article 10, points a), b), d), e), f), g), h), i), j) et k) |
Le phosphate dicalcique doit avoir été produit conformément à l’annexe X, chapitre II, section 6. |
Les pays tiers figurant sur la liste de l’annexe II, partie 1, du règlement (UE) no 206/2010 et les pays suivants:
|
Annexe XV, chapitre 12 |
||||||||||||||||
|
7 |
Phosphate tricalcique |
Matières de catégorie 3 visées à l’article 10, points a), b), d), e), f), g), h), i) et k) |
Le phosphate tricalcique doit avoir été produit conformément à l’annexe X, chapitre II, section 7. |
Les pays tiers figurant sur la liste de l’annexe II, partie 1, du règlement (UE) no 206/2010 et les pays suivants:
|
Annexe XV, chapitre 12 |
||||||||||||||||
|
8 |
Collagène |
Matières de catégorie 3 visées à l’article 10, points a), b), e), f), g), i) et j) |
Le collagène doit avoir été produit conformément à l’annexe X, chapitre II, section 8. |
Les pays tiers figurant sur la liste de l’annexe II, partie 1, du règlement (UE) no 206/2010 et les pays suivants:
|
Annexe XV, chapitre 11 |
||||||||||||||||
|
9 |
Ovoproduits |
Matières de catégorie 3 visées à l’article 10, points e) et f) et point k) ii) |
Les ovoproduits doivent avoir été produits conformément à l’annexe X, chapitre II, section 9. |
Les pays tiers figurant sur la liste de l’annexe II, partie 1, du règlement (UE) no 206/2010, et les pays tiers ou parties de pays tiers en provenance desquels les États membres autorisent l’importation de viandes fraîches de volaille, d’œufs et d’ovoproduits, figurant sur la liste de l’annexe I, partie 1, du règlement (CE) no 798/2008. |
Annexe XV, chapitre 15 |
Section 2
Importations de protéines animales transformées
Les exigences suivantes s’appliquent à l’importation de protéines animales transformées.
|
1. |
Avant la mise en libre pratique des envois sur le territoire de l’Union, l’autorité compétente doit échantillonner les protéines animales transformées des envois importés au poste d’inspection frontalier en vue de s’assurer du respect des exigences générales de l’annexe X, chapitre I. L’autorité compétente doit:
|
|
2. |
Par dérogation au point 1, lorsque 6 tests consécutifs portant sur des envois en vrac provenant d’un pays tiers donné se sont révélés négatifs, l’autorité compétente du poste d’inspection frontalier peut procéder à un échantillonnage aléatoire des envois en vrac suivants en provenance de ce pays tiers. Si l’un de ces échantillons aléatoires produit un résultat positif, l’autorité compétente effectuant l’échantillonnage doit en informer l’autorité compétente du pays tiers d’origine afin qu’elle puisse prendre les mesures appropriées pour remédier au problème. L’autorité compétente du pays tiers d’origine doit porter ces mesures à la connaissance de l’autorité compétente effectuant l’échantillonnage. En cas de nouveau résultat positif sur un envoi de la même provenance, l’autorité compétente du poste d’inspection frontalier doit échantillonner tous les envois de cette provenance jusqu’à ce que 6 tests consécutifs se révèlent de nouveau négatifs. |
|
3. |
Les autorités compétentes doivent conserver pendant au moins 3 ans un relevé des résultats des échantillonnages effectués sur tous les envois qui ont fait l’objet d’un échantillonnage. |
|
4. |
Lorsque le résultat des tests de recherche des salmonelles effectués sur un envoi importé dans l’Union est positif ou lorsque l’envoi ne respecte pas les normes microbiologiques relatives aux entérobactéries fixées à l’annexe X, chapitre I, celui-ci doit être:
|
Section 3
Importations de graisses fondues
Les exigences suivantes s’appliquent à l’importation de graisses fondues.
Les graisses fondues doivent:
|
a) |
être issues, en partie ou en totalité, de matières premières de porcins et provenir d’un pays tiers ou d’une partie du territoire d’un pays tiers indemne de fièvre aphteuse depuis 24 mois et indemne de peste porcine classique et de peste porcine africaine depuis 12 mois; |
|
b) |
être issues, en partie ou en totalité, de matières premières de volailles et provenir d’un pays tiers ou d’une partie du territoire d’un pays tiers indemne de maladie de Newcastle et d’influenza aviaire depuis 6 mois; |
|
c) |
être issues, en partie ou en totalité, de matières premières de ruminants et provenir d’un pays tiers ou d’une partie du territoire d’un pays tiers indemne de fièvre aphteuse depuis 24 mois et de peste bovine depuis 12 mois; ou |
|
d) |
lorsqu’un foyer de l’une des maladies visées aux points a), b) et c) est apparu au cours de la période de référence définie auxdits points, avoir été soumises à l’un des traitements thermiques suivants:
Les données détaillées concernant les points critiques doivent être consignées par les exploitants et conservées de manière à ce que le propriétaire, l’exploitant ou leur représentant et, au besoin, l’autorité compétente, puissent contrôler le fonctionnement de l’usine; parmi ces données doivent figurer la taille des particules, la température critique et, selon le cas, la durée absolue du traitement, la pression, le taux d’alimentation en matières premières et le taux de recyclage des graisses. |
Section 4
Importations de lait, de produits à base de lait, de produits dérivés du lait, de colostrum et de produits à base de colostrum
|
A. |
Les exigences suivantes s’appliquent à l’importation de lait, de produits à base de lait, de produits dérivés du lait, de colostrum et de produits à base de colostrum.
|
|
B. |
Les exigences suivantes s’appliquent à l’importation de colostrum et de produits à base de colostrum.
|
CHAPITRE II
EXIGENCES SPÉCIFIQUES APPLICABLES À L’IMPORTATION DANS L’UNION ET AU TRANSIT PAR CELLE-CI DES SOUS-PRODUITS ANIMAUX ET PRODUITS DÉRIVÉS DESTINÉS À ÊTRE UTILISÉS EN DEHORS DE LA CHAÎNE ALIMENTAIRE DES ANIMAUX D’ÉLEVAGE AUTRES QUE LES ANIMAUX À FOURRURE
Section 1
Exigences spécifiques
Conformément à l’article 41, paragraphe 1, point a), paragraphe 2, point c), et paragraphe 3, du règlement (CE) no 1069/2009, les exigences spécifiques suivantes s’appliquent aux envois importés et en transit de sous-produits animaux et de produits dérivés destinés à être utilisés en dehors de la chaîne alimentaire des animaux d’élevage autres que les animaux à fourrure:
|
a) |
ces envois doivent être constitués de sous-produits animaux visés dans la colonne «Matières premières» du tableau 2 ou avoir été produits à partir de ces sous-produits animaux; |
|
b) |
ils doivent remplir les conditions d’importation et de transit spécifiées dans la colonne «Conditions d’importation et de transit» du tableau 2; |
|
c) |
ils doivent provenir d’un pays tiers ou d’une partie de pays tiers figurant dans la colonne «Listes de pays tiers» du tableau 2; et |
|
d) |
ils doivent être accompagnés, lors de leur transport jusqu’au point d’entrée dans l’Union où les contrôles vétérinaires sont effectués, du certificat sanitaire ou de l’autre document, selon le cas, visés dans la colonne «Certificats/modèles de documents» du tableau 2; ou |
|
e) |
ils doivent être présentés au point d’entrée dans l’Union où les contrôles vétérinaires sont effectués accompagnés d’un document correspondant au modèle visé dans la colonne «Certificats/modèles de documents» du tableau 2. |
Tableau 2
|
No |
Produits |
Matières premières [référence aux dispositions du règlement (CE) no 1069/2009] |
Conditions d’importation et de transit |
Listes de pays tiers |
Certificats/modèles de documents |
||||||||||||||||||||||||||||||
|
1 |
Lisier transformé, produits dérivés du lisier transformé et guano de chauve-souris |
Matières de catégorie 2 visées à l’article 9, point a) |
Le lisier transformé, les produits dérivés du lisier transformé et le guano de chauve-souris doivent avoir été produits conformément à l’annexe XI, chapitre I, section 2. |
Les pays tiers figurant sur la liste:
|
Annexe XV, chapitre 17 |
||||||||||||||||||||||||||||||
|
2 |
Produits sanguins, à l’exclusion des produits sanguins d’équidés, devant servir à la fabrication de produits dérivés à utiliser en dehors de la chaîne alimentaire des animaux d’élevage |
Matières de catégorie 1 visées à l’article 8, points c) et d), et matières de catégorie 3 visées à l’article 10, points a), b), d) et h) |
Les produits sanguins doivent avoir été produits conformément à la section 2. |
Les pays tiers suivants:
|
|
||||||||||||||||||||||||||||||
|
3 |
Sang et produits sanguins d’équidés |
Matières de catégorie 3 visées à l’article 10, points a), b), d) et h) |
Le sang et les produits sanguins doivent satisfaire aux exigences de la section 3. |
Les pays tiers suivants:
|
Annexe XV, chapitre 4 A |
||||||||||||||||||||||||||||||
|
4 |
Cuirs et peaux frais ou réfrigérés d’ongulés |
Matières de catégorie 3 visées à l’article 10, point a) et point b) iii) |
Les cuirs et les peaux doivent satisfaire aux exigences de la section 4, points 1 et 4. |
Les cuirs et les peaux doivent provenir d’un pays tiers ou, en cas de régionalisation conformément à la législation de l’Union, d’une partie de pays tiers figurant sur la liste de l’annexe II, partie 1, du règlement (UE) no 206/2010, en provenance desquels les États membres autorisent l’importation de viandes fraîches de la même espèce. |
Annexe XV, chapitre 5 A |
||||||||||||||||||||||||||||||
|
5 |
Cuirs et peaux traités d’ongulés |
Matières de catégorie 3 visées à l’article 10, point a), point b) i), point b) iii) et point n) |
Les cuirs et les peaux doivent satisfaire aux exigences de la section 4, points 2, 3 et 4. |
|
|
||||||||||||||||||||||||||||||
|
6 |
Trophées de chasse et autres préparations d’animaux |
Matières de catégorie 2 visées à l’article 9, point f), issues d’animaux sauvages qui ne sont pas soupçonnés d’être infectés par une maladie transmissible à l’homme ou aux animaux, et matières de catégorie 3 visées à l’article 10, point a), point b) i), point b) iii), point b) v) et point n) |
Les trophées de chasse et les autres préparations doivent satisfaire aux exigences de la section 5. |
|
|
||||||||||||||||||||||||||||||
|
7 |
Soies de porc |
Matières de catégorie 3 visées à l’article 10, point b) iv) |
Les soies de porc doivent avoir été obtenues à partir d’animaux provenant du pays tiers d’origine et abattus dans un abattoir de ce pays. |
|
|
||||||||||||||||||||||||||||||
|
8 |
Laine et poils non traités |
Matières de catégorie 3 visées à l’article 10, points h) et n) |
La laine et les poils non traités doivent:
|
Tout pays tiers |
Aucun certificat sanitaire n’est requis pour l’importation de laine et de poils non traités. |
||||||||||||||||||||||||||||||
|
9 |
Plumes, parties de plumes et duvet traités |
Matières de catégorie 3 visées à l’article 10, point b) v) et points h) et n) |
Les plumes et les parties de plumes traitées doivent satisfaire aux exigences de la section 6. |
Tout pays tiers |
Aucun certificat sanitaire n’est requis pour l’importation de plumes, de parties de plumes et de duvet traités. |
||||||||||||||||||||||||||||||
|
10 |
Sous-produits apicoles |
Matières de catégorie 3 visées à l’article 10, point e) |
|
|
|
||||||||||||||||||||||||||||||
|
11 |
Os et produits à base d’os (à l’exclusion de la farine d’os), cornes et produits à base de corne (à l’exclusion de la farine de corne), onglons et produits à base d’onglons (à l’exclusion de la farine d’onglons), non destinés à servir de matières premières pour aliments des animaux, d’engrais organiques ou d’amendements |
Matières de catégorie 3 visées à l’article 10, point a), point b) i), point b) iii) et points e) et h) |
Les produits doivent satisfaire aux exigences de la section 7. |
Tout pays tiers |
Les produits doivent être accompagnés:
|
||||||||||||||||||||||||||||||
|
12 |
Aliments pour animaux familiers, y compris les articles à mastiquer |
|
Les aliments pour animaux familiers et les articles à mastiquer doivent avoir été produits conformément à l’annexe XIII, chapitre II. |
|
|
||||||||||||||||||||||||||||||
|
13 |
Viscères aromatiques devant servir à la fabrication d’aliments pour animaux familiers |
Matières visées à l’article 35, point a) |
Les viscères aromatiques doivent avoir été produits conformément à l’annexe XIII, chapitre III. |
Les pays tiers figurant sur la liste de l’annexe II, partie 1, du règlement (UE) no 206/2010, en provenance desquels les États membres autorisent l’importation de viandes fraîches de la même espèce et pour lesquels seules les viandes non désossées sont autorisées. En ce qui concerne les viscères aromatiques provenant de matières issues de poissons, les pays tiers figurant sur la liste de l’annexe II de la décision 2006/766/CE. |
Annexe XV, chapitre 3 E |
||||||||||||||||||||||||||||||
|
14 |
Sous-produits animaux devant servir à la fabrication d’aliments pour animaux familiers autres que les aliments crus et de produits dérivés à utiliser en dehors de la chaîne alimentaire animale |
|
Les produits doivent satisfaire aux exigences de la section 8. |
|
|
||||||||||||||||||||||||||||||
|
15 |
Sous-produits animaux destinés à être utilisés en tant qu’aliments crus pour animaux familiers |
Matières de catégorie 3 visées à l’article 10, point a), point b) i) et point b) ii) |
Les produits doivent satisfaire aux exigences de la section 8. |
Les pays tiers figurant sur la liste de l’annexe II, partie 1, du règlement (UE) no 206/2010, en provenance desquels les États membres autorisent l’importation de viandes fraîches de la même espèce et pour lesquels seules les viandes non désossées sont autorisées. En ce qui concerne les matières issues de poissons, les pays tiers figurant sur la liste de l’annexe II de la décision 2006/766/CE. |
Annexe XV, chapitre 3 D |
||||||||||||||||||||||||||||||
|
16 |
Sous-produits animaux destinés à l’alimentation des animaux à fourrure |
Matières de catégorie 3 visées à l’article 10, point a), point b) i) et point b) ii) |
Les produits doivent satisfaire aux exigences de la section 8. |
Les pays tiers figurant sur la liste de l’annexe II, partie 1, du règlement (UE) no 206/2010 de la Commission ou de l’annexe I du règlement (CE) no 798/2008, en provenance desquels les États membres autorisent l’importation de viandes fraîches de la même espèce et pour lesquels seules les viandes non désossées sont autorisées. En ce qui concerne les matières issues de poissons, les pays tiers figurant sur la liste de l’annexe II de la décision 2006/766/CE. |
Annexe XV, chapitre 3 D |
||||||||||||||||||||||||||||||
|
17 |
Graisses fondues destinées à certains usages en dehors de la chaîne alimentaire des animaux d’élevage |
|
Les graisses fondues doivent satisfaire aux exigences de la section 9. |
Les pays tiers figurant sur la liste de l’annexe II, partie 1, du règlement (UE) no 206/2010 de la Commission et, en ce qui concerne les matières issues de poissons, les pays tiers figurant sur la liste de l’annexe II de la décision 2006/766/CE. |
Annexe XV, chapitre 10 B |
||||||||||||||||||||||||||||||
|
18 |
Dérivés lipidiques |
|
Les dérivés lipidiques doivent satisfaire aux exigences de la section 10. |
Tout pays tiers |
|
||||||||||||||||||||||||||||||
|
19 |
Gélatine photographique |
Matières de catégorie 1 visées à l’article 8, point b), et matières de catégorie 3 visées à l’article 10. |
La gélatine photographique importée doit satisfaire aux exigences de la section 11. |
La gélatine photographique ne peut être importée qu’en provenance des établissements d’origine situés aux États-Unis et au Japon qui sont autorisés conformément à la section 11. |
Annexe XV, chapitre 19 |
||||||||||||||||||||||||||||||
|
20 |
Cornes et produits à base de corne (à l’exclusion de la farine de corne) et onglons et produits à base d’onglons (à l’exclusion de la farine d’onglons), destinés à la production d’engrais organiques ou d’amendements |
Matières de catégorie 3 visées à l’article 10, points a), b), h) et n) |
Les produits doivent satisfaire aux exigences de la section 12. |
Tout pays tiers |
Annexe XV, chapitre 18 |
Section 2
Importations de sang et de produits sanguins, à l’exclusion du sang et des produits sanguins d’équidés, devant servir à la fabrication de produits dérivés à utiliser en dehors de la chaîne alimentaire des animaux d’élevage
Les exigences suivantes s’appliquent à l’importation de sang et de produits sanguins, à l’exclusion du sang et des produits sanguins d’équidés, devant servir à la fabrication de produits dérivés à utiliser en dehors de la chaîne alimentaire des animaux d’élevage.
|
1. |
Les produits sanguins doivent provenir d’une usine de production de produits dérivés destinés à être utilisés en dehors de la chaîne alimentaire des animaux d’élevage satisfaisant aux conditions spécifiques fixées par le présent règlement ou de l’établissement de collecte. |
|
2. |
Le sang à partir duquel les produits sanguins devant servir à la fabrication de produits dérivés à utiliser en dehors de la chaîne alimentaire des animaux d’élevage sont produits doit:
|
|
3.1. |
Les produits sanguins devant servir à la fabrication de produits dérivés à utiliser en dehors de la chaîne alimentaire des animaux d’élevage, qui proviennent d’animaux appartenant aux taxons Artiodactyla, Perissodactyla et Proboscidea, y compris leurs hybrides, doivent satisfaire aux conditions fixées soit au point a), soit au point b):
|
|
3.2. |
Outre les conditions prévues au point 3.1 b) i) et au point 3.1 b) ii), l’une des conditions suivantes doit être remplie dans le cas d’animaux n’appartenant ni à la famille Suidae ni à la famille Tayassuidae:
|
|
3.3. |
Outre les conditions prévues au point 3.1 b) i) et au point 3.1 b) ii), dans le cas d’animaux appartenant à la famille Suidae ou Tayassuidae, aucun cas de maladie vésiculeuse du porc, de peste porcine classique et de peste porcine africaine ne doit avoir été constaté depuis au moins 12 mois et la vaccination contre ces maladies ne doit pas être pratiquée depuis au moins 12 mois dans la région ou le pays tiers d’origine, et l’une des conditions suivantes doit être remplie:
|
|
4. |
Les produits sanguins devant servir à la fabrication de produits dérivés à utiliser en dehors de la chaîne alimentaire des animaux d’élevage, qui proviennent de volailles et d’autres espèces aviaires, doivent satisfaire aux conditions fixées soit au point a), soit au point b):
|
Section 3
Importations de sang et de produits sanguins d’équidés
Les exigences suivantes s’appliquent à l’importation de sang et de produits sanguins d’équidés.
|
1. |
Le sang doit remplir les conditions fixées à l’annexe XIII, chapitre IV, point 1 a), et avoir été collecté sous contrôle vétérinaire:
|
|
2. |
Les produits sanguins doivent remplir les conditions fixées à l’annexe XIII, chapitre IV, point 2. En outre, les produits sanguins visés à l’annexe XIII, chapitre IV, point 2 b) i), doivent avoir été produits à partir de sang prélevé sur des équidés détenus, pendant au moins 3 mois avant la date du prélèvement – ou depuis la naissance s’ils avaient moins de 3 mois –, dans des exploitations placées sous contrôle vétérinaire dans le pays tiers de prélèvement, lequel, durant cette période et celle du prélèvement de sang, était indemne:
|
|
3. |
Les produits sanguins doivent provenir d’une usine ou d’un établissement agréé ou enregistré par l’autorité compétente du pays tiers. |
|
4. |
Le sang et les produits sanguins doivent être conditionnés et étiquetés conformément à l’annexe XIII, chapitre IV, point 3. |
Section 4
Importations de cuirs et de peaux d’ongulés
Les exigences suivantes s’appliquent à l’importation de cuirs et de peaux d’ongulés.
|
1. |
Les cuirs et les peaux frais ou réfrigérés peuvent être importés s’ils:
|
|
2. |
Les cuirs et les peaux traités visés à l’annexe XIII, chapitre V, point C 2, peuvent être importés sans restrictions. |
|
3. |
Les autres cuirs et peaux traités peuvent être importés s’ils:
|
|
4. |
L’importation des cuirs et des peaux frais, réfrigérés ou traités d’ongulés doit être effectuée dans des conteneurs, des véhicules routiers, des wagons de chemin de fer ou des balles scellés sous la responsabilité de l’autorité compétente du pays tiers expéditeur. |
Section 5
Importations de trophées de chasse et d’autres préparations d’animaux
Les exigences suivantes s’appliquent à l’importation de trophées de chasse et d’autres préparations d’animaux.
|
1. |
Les trophées de chasses et les autres préparations d’animaux remplissant les conditions énoncées à l’annexe XIII, chapitre VI, points B et C 1, peuvent être importés sans restrictions. |
|
2. |
Les trophées de chasse et les autres préparations traités d’oiseaux et d’ongulés constitués uniquement d’os, de cornes, d’onglons, de griffes, de bois, de dents, de cuirs ou de peaux, en provenance de pays tiers, peuvent être importés s’ils satisfont aux exigences de l’annexe XIII, chapitre VI, point C 1 a) et points C 2 a) i) à iii) et C 2 b) i) et ii). Toutefois, dans le cas des peaux salées à sec ou en saumure et transportées par navire, il n’est pas nécessaire de procéder à un salage de 14 jours avant l’expédition, sous réserve d’effectuer un salage de 14 jours avant l’importation. |
|
3. |
Les trophées de chasse et les autres préparations d’oiseaux et d’ongulés constitués de parties anatomiques entières n’ayant subi aucun traitement peuvent être importés s’ils:
|
Section 6
Importations de plumes, de parties de plumes et de duvet traités
Les plumes, les parties de plumes et le duvet traités peuvent être importés:
|
a) |
s’il s’agit de plumes d’ornement traitées, de plumes traitées transportées par des voyageurs pour leur usage personnel ou d’envois de plumes ou de duvet traités expédiés à des particuliers à des fins non industrielles; ou |
|
b) |
s’ils sont accompagnés d’un document commercial attestant que les plumes, les parties de plumes ou le duvet ont été traités par jet de vapeur ou toute autre méthode écartant tout risque inacceptable et sont conditionnés à l’état sec dans des emballages hermétiques; et |
|
c) |
à moins que le document commercial n’indique qu’ils ont été lavés en usine et traités avec de la vapeur chaude à 100 °C pendant au moins 30 minutes, ils sont envoyés dans une usine ou un établissement enregistré pour subir un tel traitement. |
Section 7
Importations d’os et de produits à base d’os (à l’exclusion de la farine d’os), de cornes et de produits à base de corne (à l’exclusion de la farine de corne) et d’onglons et de produits à base d’onglons (à l’exclusion de la farine d’onglons) non destinés à servir de matières premières pour aliments des animaux, d’engrais organiques ou d’amendements
|
1. |
Les os et les produits à base d’os (à l’exclusion de la farine d’os), les cornes et les produits à base de corne (à l’exclusion de la farine de corne) et les onglons et les produits à base d’onglons (à l’exclusion de la farine d’onglons) peuvent être importés pour produire des produits dérivés destinés à être utilisés en dehors de la chaîne alimentaire animale si:
|
|
2. |
Chaque envoi doit être accompagné d’un document commercial estampillé par l’autorité compétente surveillant l’établissement d’origine et comportant les informations suivantes:
|
|
3. |
Lors de l’expédition vers l’Union, les matières doivent être enfermées dans des conteneurs ou des véhicules scellés, ou chargées en vrac sur un navire. En cas de transport en conteneurs, les conteneurs et, dans tous les cas, les documents d’accompagnement, doivent porter le nom et l’adresse de l’usine ou de l’établissement enregistré de destination. |
|
4. |
À l’issue des contrôles vétérinaires prévus par la directive 97/78/CE, et dans le respect des dispositions de l’article 8, paragraphe 4, de cette directive, les matières doivent être transportées directement vers l’usine ou l’établissement enregistré de destination. |
Section 8
Importations de sous-produits animaux devant servir à la fabrication d’aliments pour animaux à fourrure, d’aliments pour animaux familiers autres que les aliments crus et de produits dérivés à utiliser en dehors de la chaîne alimentaire des animaux d’élevage
Les sous-produits animaux devant servir à la fabrication d’aliments pour animaux à fourrure, d’aliments pour animaux familiers autres que les aliments crus et de produits dérivés à utiliser en dehors de la chaîne alimentaire des animaux d’élevage peuvent être importés si les conditions suivantes sont remplies:
|
1. |
les sous-produits animaux ont été surgelés dans l’usine d’origine ou ont été conservés conformément à la législation de l’Union de manière à éviter leur altération entre l’expédition et la livraison à l’établissement ou l’usine de destination; |
|
2. |
les sous-produits animaux ont fait l’objet de toutes les précautions nécessaires en vue d’éviter une contamination par des agents pathogènes; |
|
3. |
les sous-produits animaux ont été conditionnés dans un emballage neuf hermétique ou dans un emballage qui a été nettoyé et désinfecté avant son utilisation; |
|
4. |
les sous-produits animaux sont transportés, à l’issue des contrôles vétérinaires prévus par la directive 97/78/CE et dans le respect des conditions fixées à l’article 8, paragraphe 4, de cette directive, directement vers:
|
|
5.1. |
dans le cas de matières premières destinées à la production d’aliments pour animaux familiers visées à l’article 35, point a) ii), du règlement (CE) no 1069/2009, les matières premières:
|
|
5.2. |
lorsqu’un envoi se compose de matières premières traitées comme indiqué au point 5.1 ci-dessus et d’autres matières premières non traitées, toutes les matières premières de l’envoi ont été marquées conformément aux points 5.1 a) et 5.1 b) ci-dessus; |
|
5.3. |
le marquage prévu aux points 5.1 a), 5.1 b) et 5.2 reste visible depuis l’expédition jusqu’à la livraison à l’usine de production d’aliments pour animaux familiers de destination; |
|
6. |
dans l’usine de production d’aliments pour animaux familiers de destination, les matières premières destinées à la production d’aliments pour animaux familiers visées à l’article 35, point a) ii), du règlement (CE) no 1069/2009 sont entreposées avant la production, utilisées et éliminées dans des conditions autorisées par l’autorité compétente, qui permettent la réalisation de contrôles officiels portant sur les quantités de matières reçues, utilisées pour la production et éliminées, le cas échéant. L’autorité compétente peut autoriser l’exploitant de l’usine de production d’aliments pour animaux familiers à entreposer ces matières avec des matières de catégorie 3. |
Section 9
Importations de graisses fondues destinées à certains usages en dehors de la chaîne alimentaire des animaux d’élevage
Les graisses fondues qui ne sont pas destinées à la production d’aliments pour animaux d’élevage ou à la fabrication de produits cosmétiques, de médicaments ou de dispositifs médicaux peuvent être importées si les conditions suivantes sont remplies:
|
a) |
elles sont issues:
|
|
b) |
elles ont été transformées par la méthode de transformation 1 (stérilisation sous pression) ou par une autre méthode de transformation visée à l’annexe IV, chapitre III; |
|
c) |
dans le cas de graisses issues de ruminants, les impuretés non solubles dépassant 0,15 % du poids ont été éliminées; |
|
d) |
elles ont été marquées avant leur expédition vers l’Union de telle manière que la concentration minimale en GTH visée à l’annexe VIII, chapitre V, point 1 b), est atteinte; |
|
e) |
à l’issue des contrôles vétérinaires prévus par la directive 97/78/CE, et dans le respect des dispositions de l’article 8, paragraphe 4, de cette directive, les graisses fondues sont transportées directement vers l’usine ou l’établissement enregistré de destination, dans des conditions empêchant toute contamination; et |
|
f) |
leur emballage ou leur récipient est muni d’étiquettes portant la mention «NON DESTINÉ À LA CONSOMMATION HUMAINE OU ANIMALE». |
Section 10
Importations de dérivés lipidiques
|
1. |
Les dérivés lipidiques peuvent être importés à condition que le certificat sanitaire qui accompagne l’envoi certifie:
|
|
2. |
Le certificat sanitaire visé au point 1 doit être présenté à l’autorité compétente au poste d’inspection frontalier du premier point d’entrée des marchandises sur le territoire de l’Union et une copie de celui-ci doit ensuite accompagner l’envoi jusqu’à son arrivée à l’usine de destination. |
|
3. |
À l’issue des contrôles vétérinaires prévus par la directive 97/78/CE, et dans le respect des dispositions de l’article 8, paragraphe 4, de cette directive, les dérivés lipidiques doivent être transportés directement vers l’usine ou l’établissement enregistré de destination. |
Section 11
Importations de gélatine photographique
|
1. |
La gélatine produite à partir de matières contenant des colonnes vertébrales de bovins composées de matières de catégorie 1 visées à l’article 8, point b), du règlement (CE) no 1069/2009 et destinée à l’industrie photographique («gélatine photographique») peut être importée si elle:
Tableau 3 Importation de gélatine photographique
|
|
2. |
Dès lors que la gélatine photographique a été introduite dans l’État membre de destination, elle ne peut plus être échangée entre États membres. Elle doit être utilisée dans la firme photographique agréée de l’État membre de destination et uniquement à des fins de production photographique. |
|
3. |
À l’issue des contrôles vétérinaires prévus par la directive 97/78/CE, et dans le respect des dispositions de l’article 8, paragraphe 4, de cette directive, la gélatine photographique doit être transportée directement vers la firme photographique agréée de destination. |
|
4. |
Le transport visé au point 3 doit s’effectuer dans des véhicules ou des conteneurs dans lesquels la gélatine photographique est isolée physiquement de tout produit destiné à l’alimentation humaine ou animale. |
|
5. |
Dans la firme photographique agréée de destination, l’exploitant doit s’assurer que tout surplus, résidu ou autre déchet de gélatine photographique est:
|
|
6. |
La gélatine photographique doit être produite conformément aux dispositions suivantes.
|
Section 12
Importations de cornes et de produits à base de corne (à l’exclusion de la farine de corne) et d’onglons et de produits à base d’onglons (à l’exclusion de la farine d’onglons) destinés à la production d’engrais organiques ou d’amendements
Les cornes et les produits à base de corne (à l’exclusion de la farine de corne) et les onglons et les produits à base d’onglons (à l’exclusion de la farine d’onglons) destinés à la production d’engrais organiques ou d’amendements peuvent être importés si les conditions suivantes sont remplies:
|
1. |
ils ont été produits conformément à l’annexe XIII, chapitre XII; et |
|
2. |
à l’issue des contrôles vétérinaires prévus par la directive 97/78/CE, et dans le respect des dispositions de l’article 8, paragraphe 4, de cette directive, ils sont transportés directement vers une usine ou un établissement agréé ou enregistré. |
CHAPITRE III
DISPOSITIONS PARTICULIÈRES APPLICABLES À CERTAINS ÉCHANTILLONS
Section 1
Échantillons de recherche et de diagnostic
À moins qu’ils ne soient conservés à des fins de référence ou réexpédiés vers le pays tiers d’origine, les échantillons de recherche et de diagnostic ainsi que les produits dérivés de l’utilisation de ces échantillons doivent être éliminés:
|
a) |
comme déchets, par incinération; |
|
b) |
par une stérilisation sous pression suivie d’une élimination ou d’une utilisation conformément aux articles 12 à 14 du règlement (CE) no 1069/2009; ou |
|
c) |
conformément à l’annexe VI, chapitre I, section 1, point 4 b), si:
|
Section 2
Échantillons commerciaux
|
1. |
L’autorité compétente peut autoriser l’importation et le transit d’échantillons commerciaux si les conditions suivantes sont remplies:
|
|
2. |
À moins qu’ils ne soient conservés à des fins de référence, les échantillons commerciaux doivent être:
|
|
3. |
Si les échantillons commerciaux sont utilisés pour tester des machines, les tests doivent être effectués:
Durant le transport jusqu’à l’usine ou l’établissement approuvé ou enregistré, les échantillons commerciaux doivent être emballés dans des conteneurs étanches. |
Section 3
Articles d’exposition
|
1. |
L’importation et le transit des articles d’exposition doivent avoir lieu dans les conditions suivantes:
|
|
2. |
Chaque envoi doit être emballé dans un emballage hermétique et accompagné d’un document commercial comportant:
|
|
3. |
À l’issue de l’exposition ou de l’activité artistique, les articles d’exposition doivent être:
|
CHAPITRE IV
EXIGENCES SPÉCIFIQUES APPLICABLES À CERTAINS MOUVEMENTS DE SOUS-PRODUITS ANIMAUX
Section 1
Importations de certaines matières de catégorie 1
Les conditions suivantes s’appliquent à l’importation des matières visées à l’article 26.
|
1. |
Lors de l’importation des matières, l’emballage, le conteneur ou le véhicule doit être muni d’une étiquette portant la mention «Interdit dans les denrées alimentaires, les aliments pour animaux, les engrais, les produits cosmétiques, les médicaments et les dispositifs médicaux». |
|
2. |
Les matières doivent être livrées directement dans une usine ou un établissement agréé ou enregistré pour la fabrication de produits dérivés autres que les produits visés au point 1. |
|
3. |
Les matières non utilisées ou excédentaires doivent être utilisées ou éliminées conformément à l’article 12 du règlement (CE) no 1069/2009. |
Section 2
Importations de certaines matières destinées à d’autres fins que l’alimentation des animaux terrestres d’élevage
|
1. |
L’autorité compétente peut autoriser l’importation des matières mentionnées ci-après à d’autres fins que l’alimentation des animaux terrestres d’élevage, à l’exception de l’alimentation des animaux à fourrure, à condition qu’elle ne présente aucun risque inacceptable de transmission de maladies transmissibles à l’homme ou aux animaux:
|
|
2. |
Les importations d’envois de matières visées au point 1 doivent avoir lieu dans le respect des dispositions nationales relatives à la certification sanitaire. |
ANNEXE XV
MODÈLES DE CERTIFICATS SANITAIRES
Les modèles de certificats sanitaires établis dans la présente annexe s’appliquent à l’importation de pays tiers et au transit par l’Union européenne des différents sous-produits animaux et produits dérivés auxquels ils renvoient.
Notes
|
a) |
Les certificats vétérinaires doivent être établis par le pays tiers exportateur sur la base des modèles figurant dans la présente annexe, conformément au modèle correspondant aux sous-produits animaux ou aux produits dérivés concernés. Ils doivent contenir, numérotées dans l’ordre indiqué sur le modèle, les attestations exigées pour tout pays tiers et, le cas échéant, les garanties supplémentaires requises pour le pays tiers exportateur ou pour une partie de ce dernier. |
|
b) |
Lorsqu’il est précisé dans le modèle de certificat qu’il convient de choisir, parmi une série de mentions, celle qui convient, les mentions inutiles peuvent être biffées par le certificateur, qui doit en outre y apposer son paraphe et son sceau, ou être entièrement supprimées du certificat. |
|
c) |
L’original de chaque certificat doit se composer d’une seule feuille, recto et verso, ou, si cela ne suffit pas, il doit se présenter sous une forme telle que toutes les feuilles nécessaires font partie d’un tout intégré et indivisible. |
|
d) |
Il doit être établi dans au moins une des langues officielles de l’État membre de l’UE dans lequel est réalisée l’inspection au poste frontalier et de l’État membre de l’UE de destination. Toutefois, ces États membres peuvent admettre que le certificat soit établi dans d’autres langues et accompagné, si nécessaire, d’une traduction officielle. |
|
e) |
Si des feuilles supplémentaires sont jointes au certificat pour des raisons d’identification des différents éléments de l’envoi, ces feuilles sont également considérées comme faisant partie du certificat original, la signature et le sceau du vétérinaire officiel chargé de la certification devant figurer sur chacune d’entre elles. |
|
f) |
Lorsque le certificat, y compris les feuilles supplémentaires visées au point e), comporte plus d’une page, chaque page doit être numérotée au bas de la page — (numéro de la page) de (nombre total de pages) —, et le numéro de code du certificat attribué par l’autorité compétente doit figurer en haut de la page. |
|
g) |
Le certificat original doit être rempli et signé par un vétérinaire officiel. Les autorités compétentes du pays exportateur garantissent ainsi l’application de principes de certification équivalents à ceux fixés dans la directive 96/93/CE. |
|
h) |
La couleur de la signature doit être différente de celle du texte imprimé. Cette règle s’applique également aux sceaux, à l’exclusion des reliefs et des filigranes. |
|
i) |
Le certificat original doit accompagner l’envoi jusqu’au poste d’inspection frontalier de l’UE. |
|
j) |
Si le certificat sanitaire accompagne un envoi en transit, la case I.5 («Destinataire») du certificat sanitaire en question doit contenir le nom et l’adresse du poste d’inspection frontalier par lequel l’envoi doit quitter l’Union européenne. |
CHAPITRE 1
Certificat sanitaire
pour les protéines animales transformées non destinées à la consommation humaine, y compris les mélanges et produits autres que les aliments pour animaux familiers contenant ces protéines, destinées à être expédiées vers l’Union européenne ou à transiter par celle-ci (2)
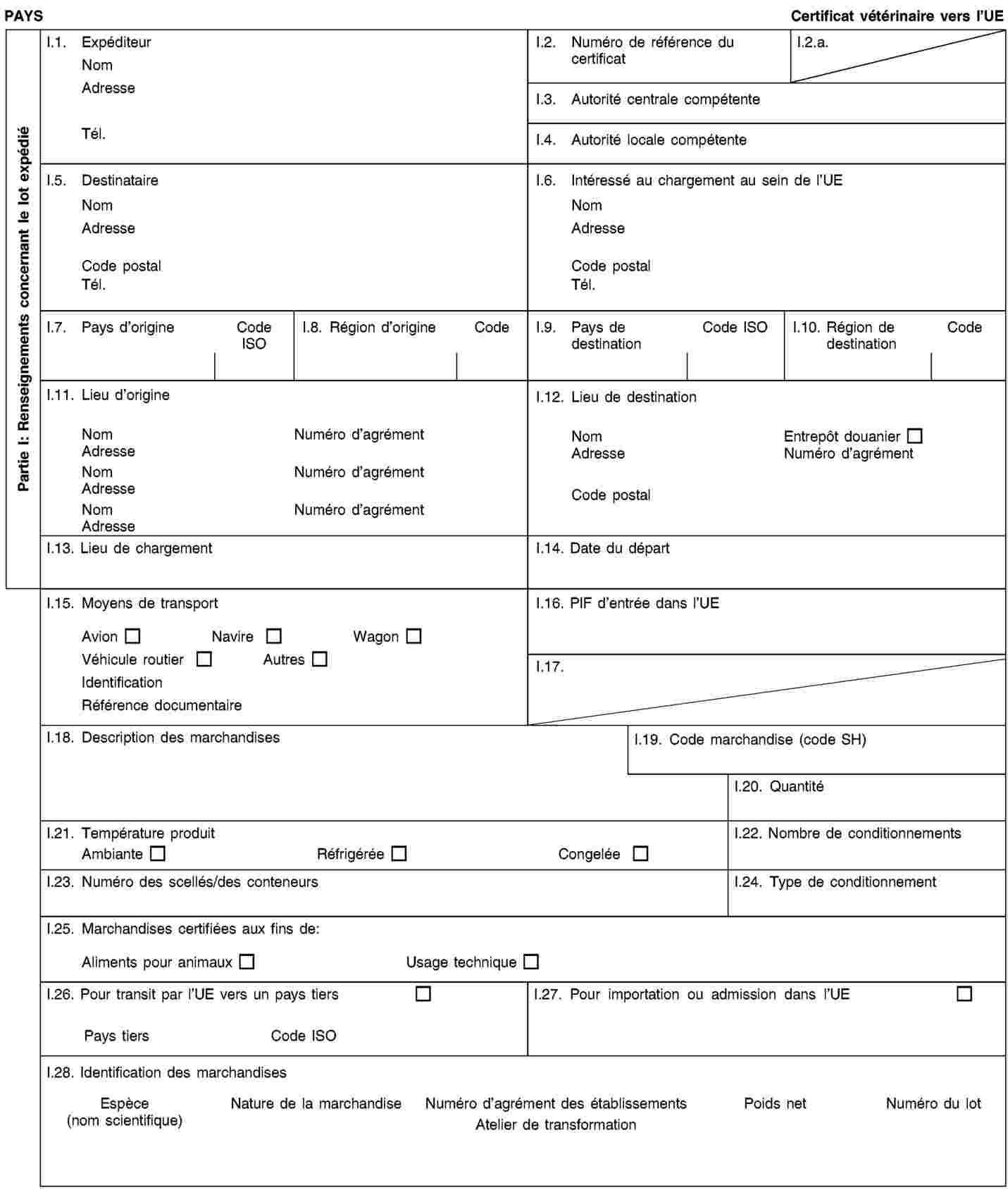



CHAPITRE 2 A
Certificat sanitaire
pour le lait, les produits à base de lait et les produits dérivés du lait non destinés à la consommation humaine et destinés à être expédiés vers l’Union européenne ou à transiter par celle-ci (2)




CHAPITRE 2 B
Certificat sanitaire
pour le colostrum bovin et les produits à base de colostrum bovin non destinés à la consommation humaine et destinés à être expédiés vers l’Union européenne ou à transiter par celle-ci (2)




CHAPITRE 3 A
Certificat sanitaire
pour les aliments en conserve pour animaux familiers destinés à être expédiés vers l’Union européenne ou à transiter par celle-ci (2)




CHAPITRE 3 B
Certificat sanitaire
pour les aliments transformés pour animaux familiers autres que les aliments en conserve, destinés à être expédiés vers l’Union européenne ou à transiter par celle-ci (2)






CHAPITRE 3 C
Certificat sanitaire
pour les articles à mastiquer destinés à être expédiés vers l’Union européenne ou à transiter par celle-ci (2)
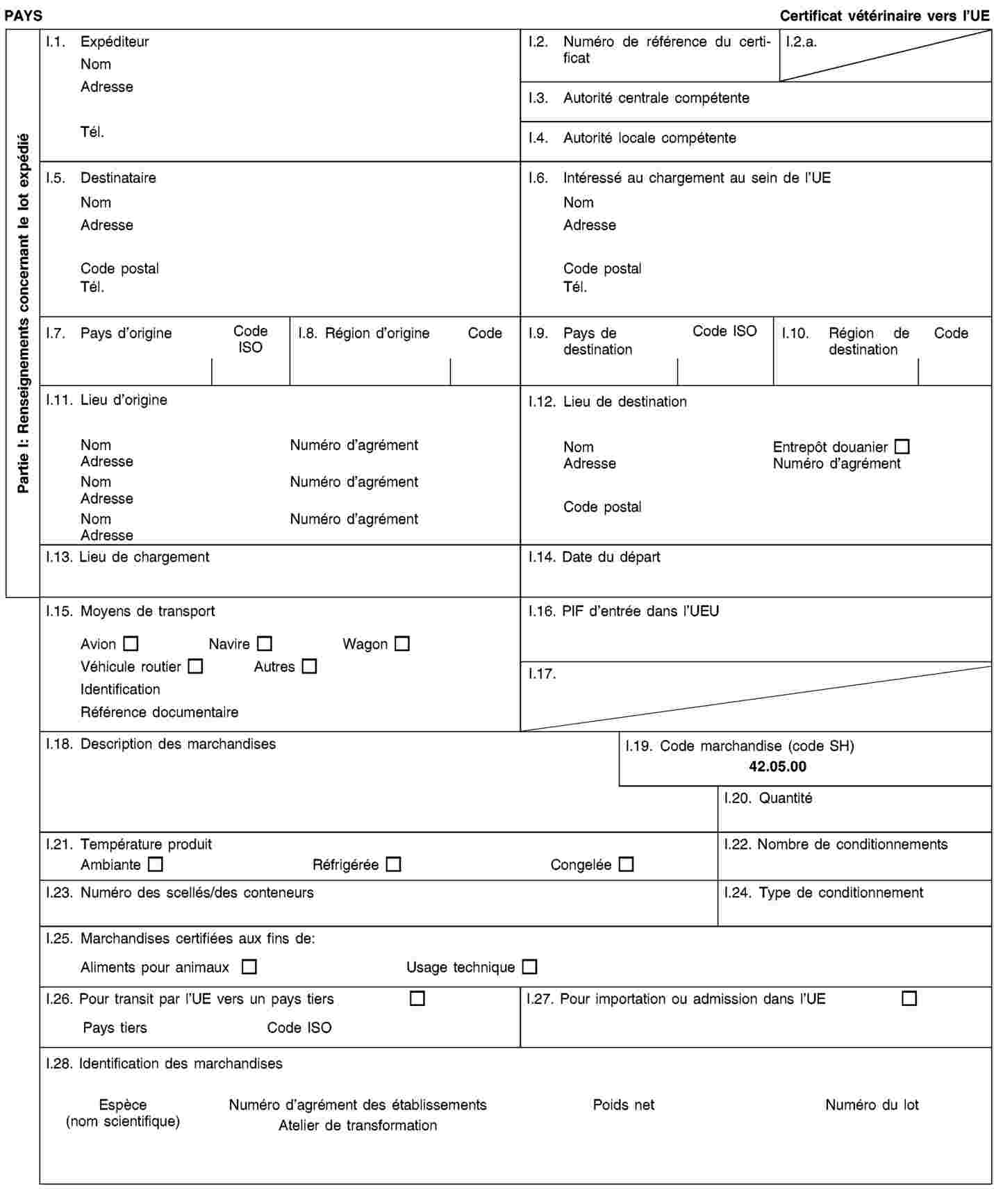



CHAPITRE 3 D
Certificat sanitaire
pour les aliments crus pour animaux familiers destinés à la vente directe ou pour les sous-produits animaux devant servir à l’alimentation des animaux à fourrure, destinés à être expédiés vers l’Union européenne ou à transiter par celle-ci (2)
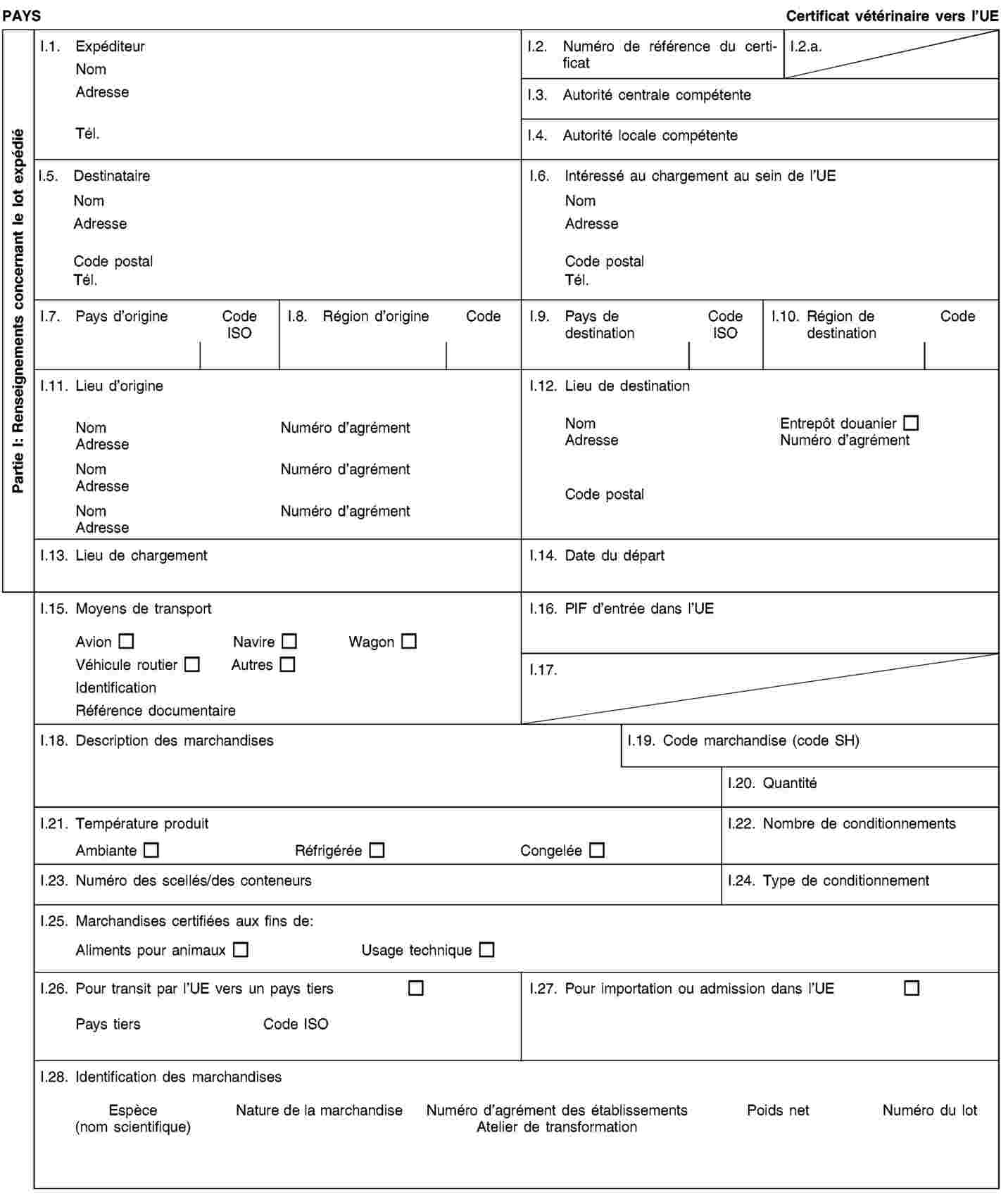



CHAPITRE 3 E
Certificat sanitaire
pour les viscères aromatiques devant servir à la fabrication d’aliments pour animaux familiers et destinés à être expédiés vers l’Union européenne ou à transiter par celle-ci (2)
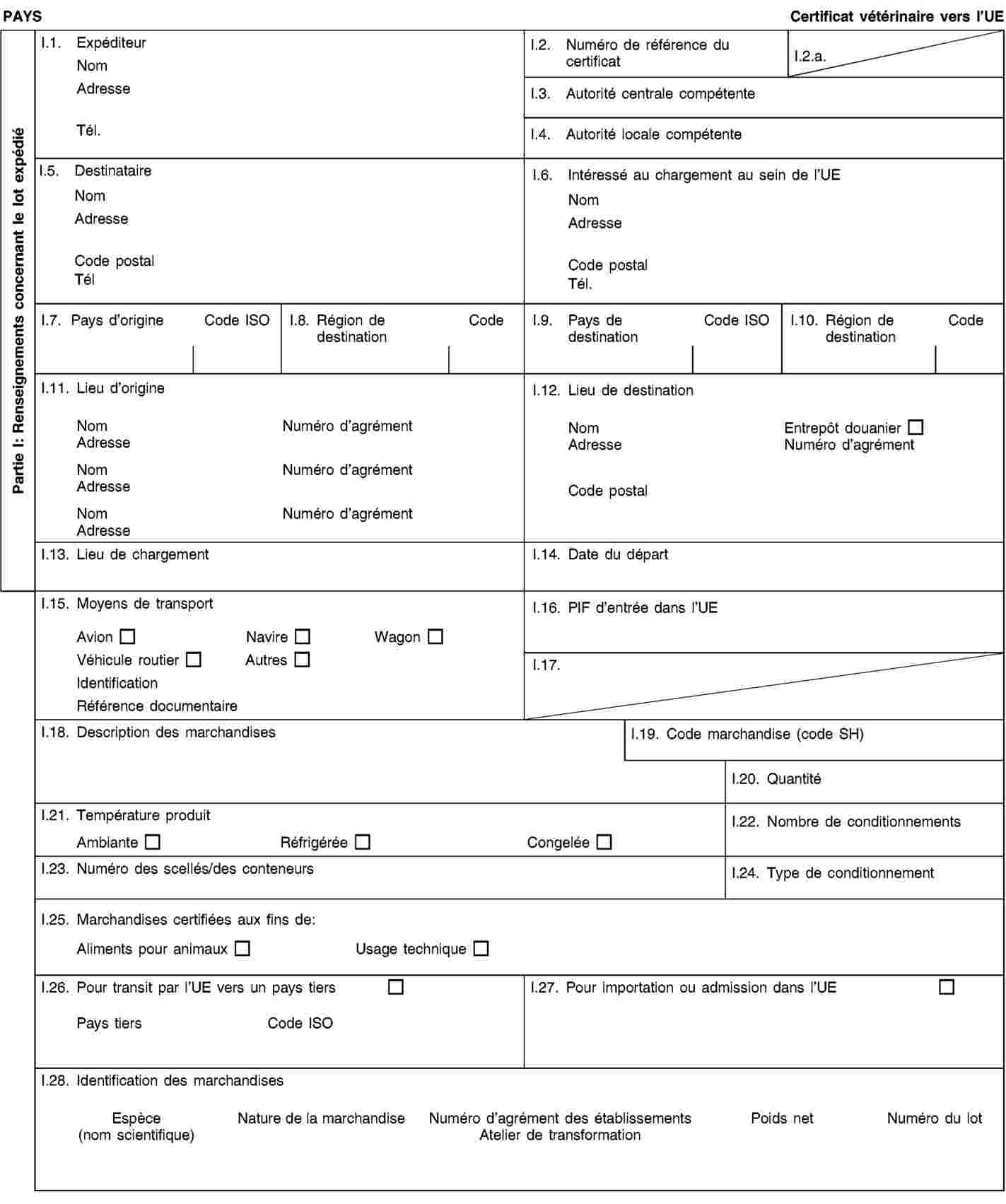




CHAPITRE 3 F
Certificat sanitaire
pour les sous-produits animaux (3) devant servir à la fabrication d’aliments pour animaux familiers et destinés à être expédiés vers l’Union européenne ou à transiter par celle-ci (2)
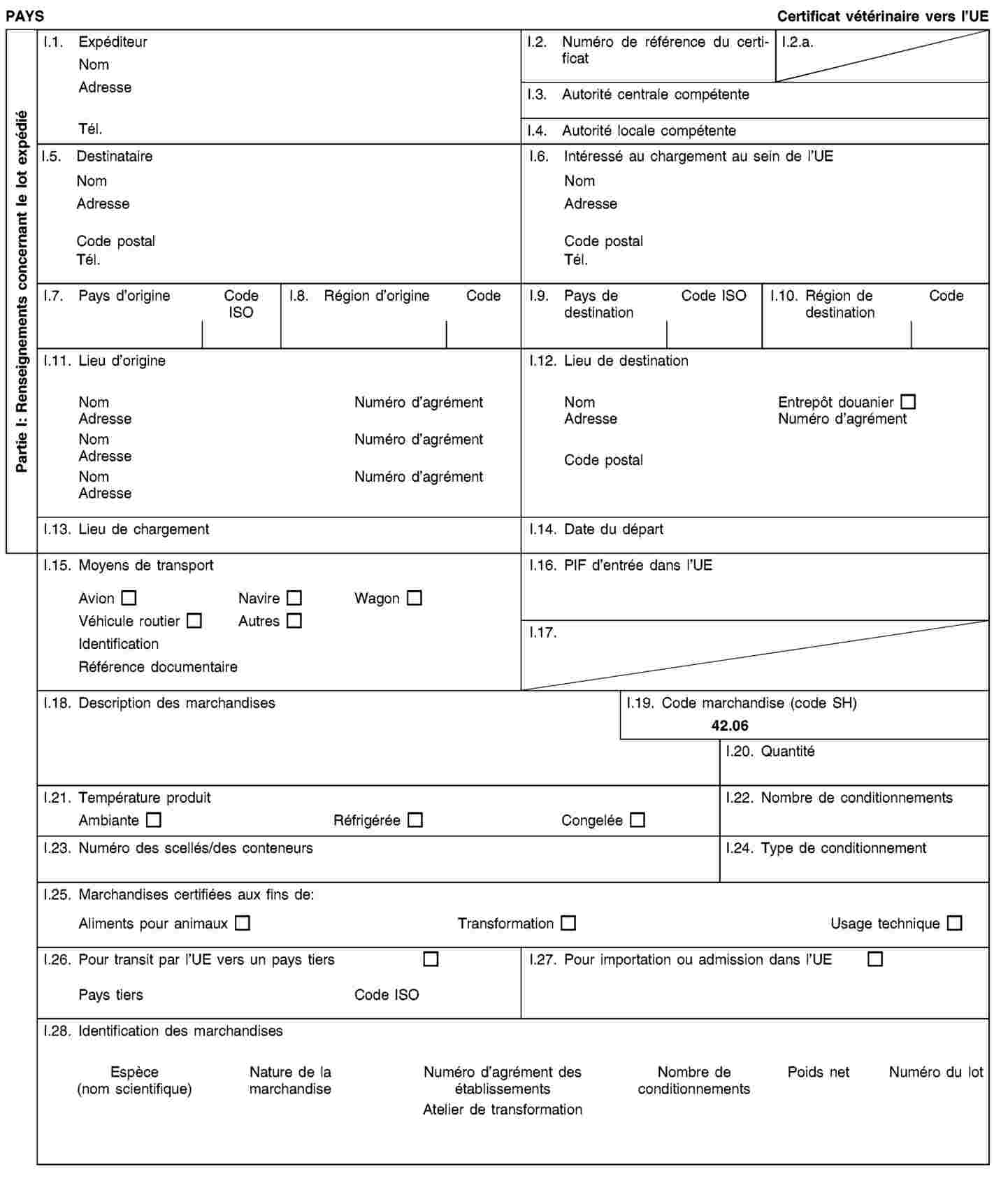





CHAPITRE 4 A
Certificat sanitaire
pour l’importation de sang et de produits sanguins d’équidés à utiliser en dehors de la chaîne alimentaire animale et destinés à être expédiés vers l’Union européenne ou à transiter par celle-ci (2)
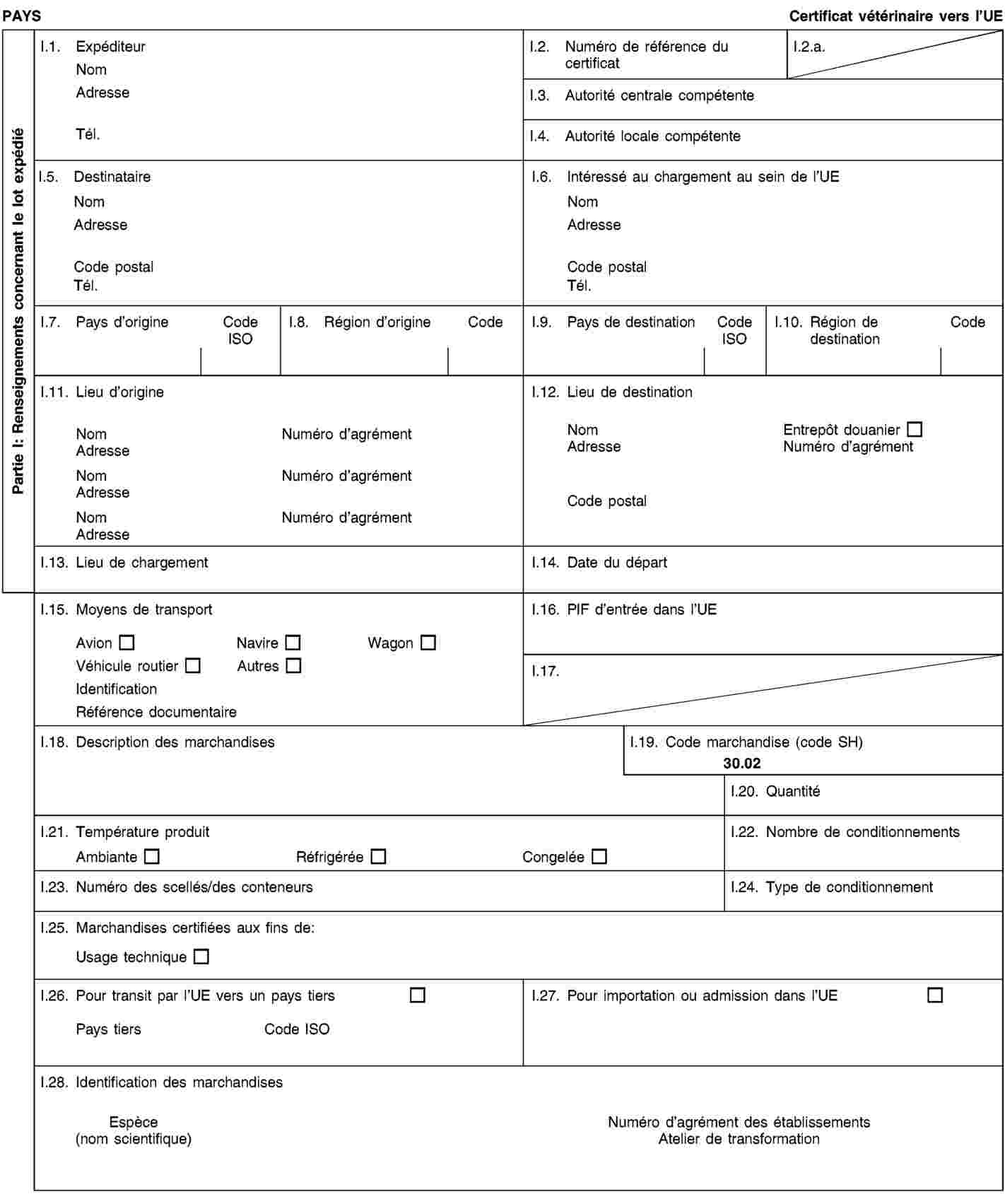



CHAPITRE 4 B
Certificat sanitaire
pour les produits sanguins non destinés à la consommation humaine, susceptibles d’être utilisés comme matières premières pour aliments des animaux et destinés à être expédiés vers l’Union européenne ou à transiter par celle-ci (2)



CHAPITRE 4 C
Certificat sanitaire
pour les produits sanguins non traités, à l’exclusion des produits sanguins d’équidés, devant servir à la fabrication de produits dérivés à utiliser en dehors de la chaîne alimentaire des animaux d’élevage, et destinés à être expédiés vers l’Union européenne ou à transiter par celle-ci (2)




CHAPITRE 4 D
Certificat sanitaire
pour les produits sanguins traités, à l’exclusion des produits sanguins d’équidés, devant servir à la fabrication de produits dérivés à utiliser en dehors de la chaîne alimentaire des animaux d’élevage, et destinés à être expédiés vers l’Union européenne ou à transiter par celle-ci (2)




CHAPITRE 5 A
Certificat sanitaire
pour les cuirs et peaux frais ou réfrigérés d’ongulés, destinés à être expédiés vers l’Union européenne ou à transiter par celle-ci (2)



CHAPITRE 5 B
Certificat sanitaire
pour les cuirs et peaux traités d’ongulés, destinés à être expédiés vers l’Union européenne ou à transiter par celle-ci (2)
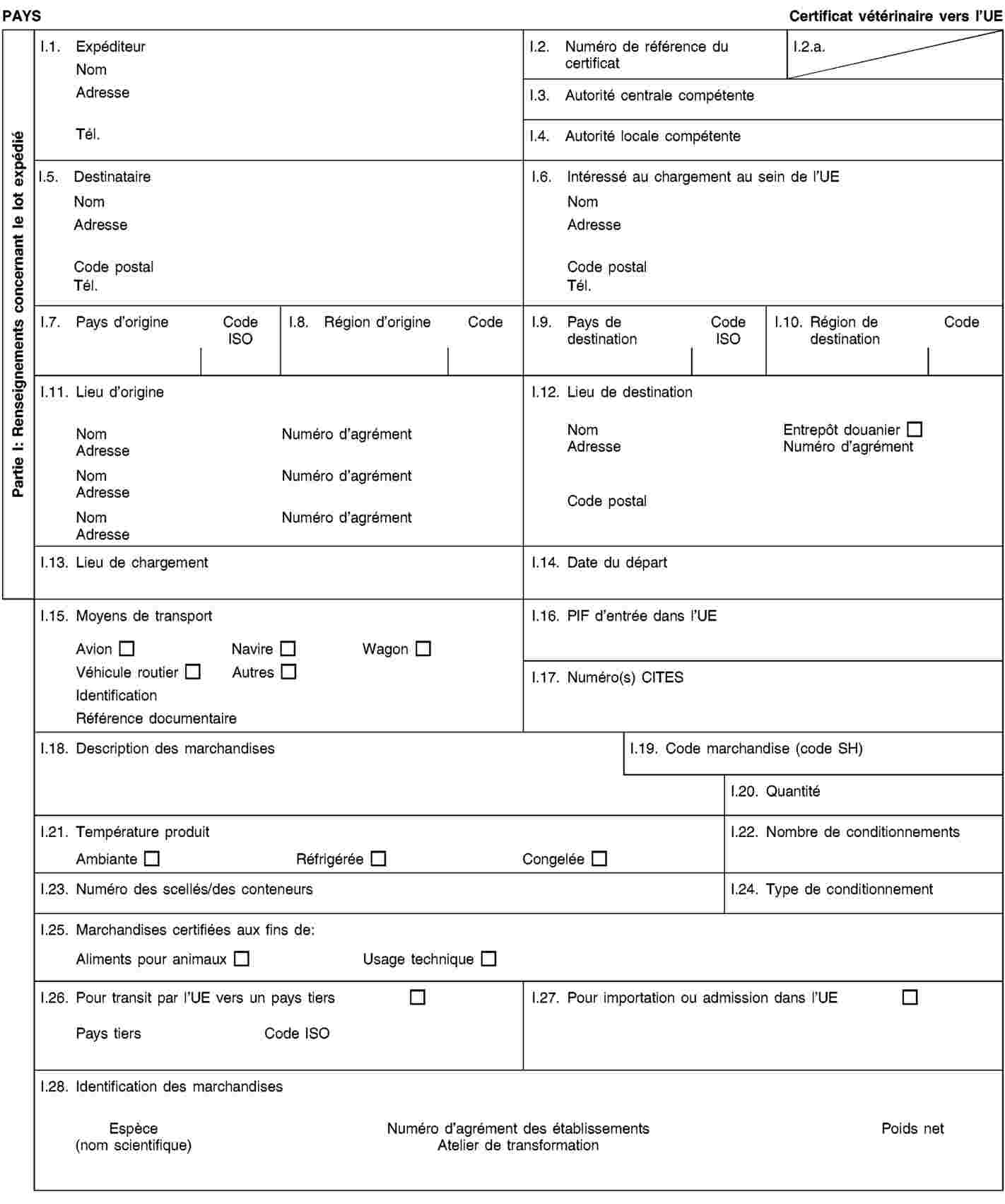


CHAPITRE 5 C
Déclaration officielle
pour les cuirs et peaux traités de ruminants et d’équidés, qui sont destinés à être expédiés vers l’Union européenne ou à transiter par celle-ci (1) et qui ont été isolés pendant 21 jours ou seront transportés pendant 21 jours sans interruption avant l’importation



CHAPITRE 6 A
Certificat sanitaire
pour les trophées de chasse et autres préparations traités d’oiseaux et d’ongulés constitués uniquement d’os, de cornes, d’onglons, de griffes, de bois, de dents, de cuirs ou de peaux et destinés à être expédiés vers l’Union européenne ou à transiter par celle-ci (2)



CHAPITRE 6 B
Certificat sanitaire
pour les trophées de chasse ou autres préparations d’oiseaux et d’ongulés constitués de parties entières n’ayant pas subi de traitement et destinés à être expédiés vers l’Union européenne ou à transiter par celle-ci (2)
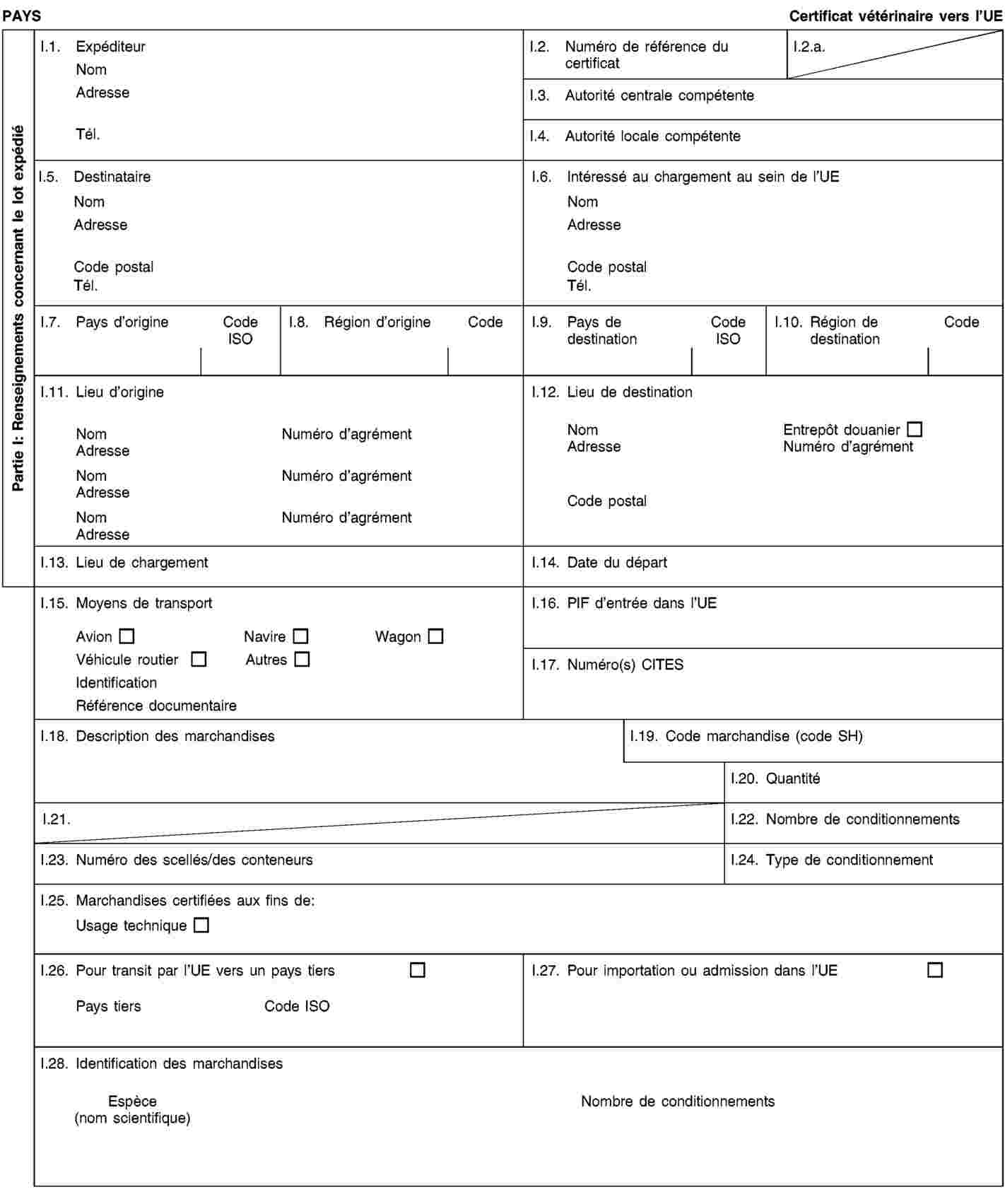


CHAPITRE 7 A
Certificat sanitaire
pour les soies de porc en provenance de pays tiers ou de régions de pays tiers qui sont indemnes de peste porcine africaine, destinées à être expédiées vers l’Union européenne ou à transiter par celle-ci (2)


CHAPITRE 7 B
Certificat sanitaire
pour les soies de porc en provenance de pays tiers ou de régions de pays tiers qui ne sont pas indemnes de peste porcine africaine, destinées à être expédiées vers l’Union européenne ou à transiter par celle-ci (2)



CHAPITRE 8
Certificat sanitaire
pour les sous-produits animaux à utiliser en dehors de la chaîne alimentaire animale ou comme échantillons commerciaux (2), destinés à être expédiés vers l’Union européenne ou à transiter par celle-ci (2)






CHAPITRE 9
Certificat sanitaire
pour les huiles de poisson non destinées à la consommation humaine, à utiliser comme matières premières pour aliments des animaux ou en dehors de la chaîne alimentaire animale et destinées à être expédiées vers l’Union européenne ou à transiter par celle-ci (2)



CHAPITRE 10 A
Certificat sanitaire
pour les graisses fondues non destinées à la consommation humaine, à utiliser comme matières premières pour aliments des animaux et destinées à être expédiées vers l’Union européenne ou à transiter par celle-ci (2)





CHAPITRE 10 B
Certificat sanitaire
pour les graisses fondues non destinées à la consommation humaine, à utiliser en dehors de la chaîne alimentaire animale et destinées à être expédiées vers l’Union européenne ou à transiter par celle-ci (2)




CHAPITRE 11
Certificat sanitaire
pour la gélatine et le collagène non destinés à la consommation humaine, à utiliser comme matières premières pour aliments des animaux ou en dehors de la chaîne alimentaire animale et destinés à être expédiés vers l’Union européenne ou à transiter par celle-ci (2)




CHAPITRE 12
Certificat sanitaire
pour les protéines hydrolysées, le phosphate dicalcique et le phosphate tricalcique non destinés à la consommation humaine, à utiliser comme matières premières pour aliments des animaux ou en dehors de la chaîne alimentaire animale et destinés à être expédiés vers l’Union européenne ou à transiter par celle-ci (2)





CHAPITRE 13
Certificat sanitaire
pour les sous-produits apicoles à utiliser exclusivement en apiculture, destinés à être expédiés vers l’Union européenne ou à transiter par celle-ci (2)


CHAPITRE 14 A
Certificat sanitaire
pour les dérivés lipidiques non destinés à la consommation humaine, à utiliser en dehors de la chaîne alimentaire animale et destinés à être expédiés vers l’Union européenne ou à transiter par celle-ci (2)




CHAPITRE 14 B
Certificat sanitaire
pour les dérivés lipidiques non destinés à la consommation humaine, à utiliser comme aliments pour animaux ou en dehors de la chaîne alimentaire animale et destinés à être expédiés vers l’Union européenne ou à transiter par celle-ci (2)



CHAPITRE 15
Certificat sanitaire
pour les ovoproduits non destinés à la consommation humaine, susceptibles d’être utilisés comme matières premières pour aliments des animaux et destinés à être expédiés vers l’Union européenne ou à transiter par celle-ci (2)



CHAPITRE 16
Modèle de déclaration

CHAPITRE 17
Certificat sanitaire
pour le lisier transformé, les produits dérivés du lisier transformé et le guano de chauve-souris destinés à être expédiés vers l’Union européenne ou à transiter par celle-ci (2)



CHAPITRE 18
Certificat sanitaire
pour les cornes et produits à base de corne (à l’exclusion de la farine de corne) ainsi que les onglons et produits à base d’onglons (à l’exclusion de la farine d’onglon) devant servir à la production d’engrais organiques ou d’amendements et destinés à être expédiés vers l’Union européenne ou à transiter par celle-ci (2)



CHAPITRE 19
Certificat sanitaire
pour la gélatine non destinée à la consommation humaine, à usage photographique, et destinée à être expédiée dans l’Union européenne



CHAPITRE 20
Modèle de déclaration
Déclaration pour les produits intermédiaires devant servir à la fabrication de médicaments, de médicaments vétérinaires, de dispositifs médicaux, de dispositifs médicaux de diagnostic in vitro et de réactifs de laboratoire, importés de pays tiers ou en transit dans l’Union européenne




ANNEXE XVI
CONTRÔLES OFFICIELS
CHAPITRE I
CONTRÔLES OFFICIELS DANS LES USINES DE TRANSFORMATION
Section 1
Surveillance de la production
|
1. |
L’autorité compétente doit exercer une surveillance sur les usines de transformation pour s’assurer du respect des exigences du règlement (CE) no 1069/2009 et du présent règlement. Elle doit en particulier:
|
|
2. |
Afin qu’elle puisse exercer ses responsabilités au titre du point 1, l’autorité compétente doit avoir libre accès, à tout moment, à toutes les parties de l’usine de transformation, ainsi qu’aux données consignées, documents commerciaux et certificats sanitaires. |
Section 2
Procédures de validation
|
1. |
Avant de délivrer un agrément à une usine de transformation en vertu de l’article 44, paragraphe 1, du règlement (CE) no 1069/2009, l’autorité compétente doit vérifier que l’exploitant a procédé à la validation de l’usine conformément aux procédures et indicateurs suivants:
|
|
2. |
Dans le cas d’un système par lot sous pression:
Au moins une fois par an, le thermocouple et le manomètre doivent être étalonnés. |
|
3. |
Dans le cas d’un système en continu sous pression:
|
|
4. |
L’autorité compétente doit répéter les contrôles portant sur les procédures de validation lorsqu’elle le juge nécessaire et, dans tous les cas, chaque fois que le procédé subit un changement important (par exemple, modification des machines ou changement de matières premières). |
CHAPITRE II
LISTES DES ÉTABLISSEMENTS, USINES ET EXPLOITANTS ENREGISTRÉS ET AGRÉÉS
|
1. |
Accès aux listes des établissements, usines et exploitants enregistrés et agréés Afin d’aider les États membres à mettre à la disposition des autres États membres et du public des listes actualisées des établissements, usines et exploitants enregistrés et agréés, la Commission doit mettre en place un site web comprenant les liens vers les sites nationaux mis en place par chaque État membre conformément au point 2 a). |
|
2. |
Structure des sites web nationaux
|
|
3. |
La présentation des index, y compris des informations et des codes pertinents, doit être conforme aux spécifications techniques publiées par la Commission sur son site web. |
CHAPITRE III
EXIGENCES SPÉCIFIQUES APPLICABLES AUX CONTRÔLES OFFICIELS
Section 1
Contrôles officiels relatifs au marquage des produits dérivés
L’autorité compétente doit contrôler le fonctionnement du système de surveillance et d’enregistrement visé à l’annexe VIII, chapitre V, point 2, du présent règlement afin de vérifier sa conformité avec le présent règlement et peut, au besoin, exiger l’analyse d’échantillons supplémentaires suivant la méthode visée au deuxième alinéa dudit point.
Section 2
Contrôles officiels dans les installations d’incinération de faible capacité
L’autorité compétente doit inspecter une installation d’incinération de faible capacité spécialisée dans l’incinération de matériels à risque spécifiés avant de l’agréer et au moins une fois par an afin de vérifier sa conformité avec le règlement (CE) no 1069/2009 et avec le présent règlement.
Section 3
Contrôles officiels dans les régions éloignées
En cas d’élimination de sous-produits animaux dans des régions éloignées conformément à l’article 19, paragraphe 1, point b), du règlement (CE) no 1069/2009, l’autorité compétente doit assurer une surveillance régulière des zones classées comme régions éloignées afin de garantir le contrôle adéquat de ces régions et des opérations d’élimination.
Section 4
Contrôles officiels dans les exploitations enregistrées pour l’alimentation des animaux à fourrure
|
1. |
L’autorité compétente doit prendre les mesures nécessaires pour contrôler:
|
|
2. |
Certains des échantillons visés au point 1 b) ii) doivent être prélevés sur des animaux présentant des symptômes neurologiques et sur des animaux reproducteurs plus âgés. |
Section 5
Contrôles officiels relatifs aux centres de collecte
|
1. |
L’autorité compétente doit:
|
|
2. |
L’autorité compétente doit réaliser des contrôles officiels dans les centres de collecte pour veiller au respect du présent règlement. |
Section 6
Contrôles officiels relatifs à l’utilisation de matières de catégorie 1 pour l’alimentation d’oiseaux nécrophages
L’autorité compétente doit surveiller l’état de santé des animaux d’élevage dans la région où des matières de catégorie 1 sont utilisées pour l’alimentation d’oiseaux nécrophages et procéder à une surveillance appropriée des EST au moyen d’échantillonnages et d’examens de laboratoire réguliers.
Certains de ces échantillons doivent être prélevés sur des animaux présentant des symptômes neurologiques et sur des animaux reproducteurs plus âgés.
Section 7
Contrôles officiels relatifs à l’utilisation de certains engrais organiques et amendements
L’autorité compétente doit réaliser des contrôles dans l’ensemble de la chaîne de production et d’utilisation des engrais organiques et des amendements, compte tenu des restrictions visées à l’annexe II, chapitre II.
Ces contrôles doivent porter entre autres sur le mélange avec un constituant visé à l’annexe XI, chapitre II, section 1, point 2, ainsi que sur les stocks de tels produits conservés dans les exploitations et les données consignées conformément au règlement (CE) no 1069/2009 et au présent règlement.
Section 8
Contrôles officiels concernant les firmes photographiques agréées
L’autorité compétente doit effectuer, dans les firmes photographiques agréées énumérées à l’annexe XIV, chapitre II, section 11, point 1, tableau 3, des contrôles documentaires concernant la chaîne d’acheminement depuis les postes d’inspection frontaliers de première entrée jusqu’aux firmes photographiques agréées, afin de vérifier la correspondance entre les quantités de produits importées, utilisées et éliminées.
Section 9
Contrôles officiels relatifs à certaines graisses fondues importées
L’autorité compétente doit effectuer, dans les usines ou établissements enregistrés qui reçoivent des graisses fondues importées conformément à l’annexe XIV, chapitre II, section 9, des contrôles documentaires concernant la chaîne d’acheminement depuis les postes d’inspection frontaliers de première entrée jusqu’aux usines ou établissements enregistrés, afin de vérifier la correspondance entre les quantités de produits importées, utilisées et éliminées.
Section 10
Modèle de demande relative à certaines autorisations d’échanges dans l’Union
Les exploitants doivent introduire leurs demandes d’autorisation d’expédier des sous-produits animaux visées à l’article 48, paragraphe 1, du règlement (CE) no 1069/2009 en respectant le modèle ci-après.



