

This document is an excerpt from the EUR-Lex website
Document 32005R2074
Commission Regulation (EC) No 2074/2005 of 5 December 2005 laying down implementing measures for certain products under Regulation (EC) No 853/2004 of the European Parliament and of the Council and for the organisation of official controls under Regulation (EC) No 854/2004 of the European Parliament and of the Council and Regulation (EC) No 882/2004 of the European Parliament and of the Council, derogating from Regulation (EC) No 852/2004 of the European Parliament and of the Council and amending Regulations (EC) No 853/2004 and (EC) No 854/2004 (Text with EEA relevance)
Verordnung (EG) Nr. 2074/2005 der Kommission vom 5. Dezember 2005 zur Festlegung von Durchführungsvorschriften für bestimmte unter die Verordnung (EG) Nr. 853/2004 des Europäischen Parlaments und des Rates fallende Erzeugnisse und für die in den Verordnungen (EG) Nr. 854/2004 des Europäischen Parlaments und des Rates und (EG) Nr. 882/2004 des Europäischen Parlaments und des Rates vorgesehenen amtlichen Kontrollen, zur Abweichung von der Verordnung (EG) Nr. 852/2004 des Europäischen Parlaments und des Rates und zur Änderung der Verordnungen (EG) Nr. 853/2004 und (EG) Nr. 854/2004 (Text von Bedeutung für den EWR)
Verordnung (EG) Nr. 2074/2005 der Kommission vom 5. Dezember 2005 zur Festlegung von Durchführungsvorschriften für bestimmte unter die Verordnung (EG) Nr. 853/2004 des Europäischen Parlaments und des Rates fallende Erzeugnisse und für die in den Verordnungen (EG) Nr. 854/2004 des Europäischen Parlaments und des Rates und (EG) Nr. 882/2004 des Europäischen Parlaments und des Rates vorgesehenen amtlichen Kontrollen, zur Abweichung von der Verordnung (EG) Nr. 852/2004 des Europäischen Parlaments und des Rates und zur Änderung der Verordnungen (EG) Nr. 853/2004 und (EG) Nr. 854/2004 (Text von Bedeutung für den EWR)
ABl. L 338 vom 22.12.2005, p. 27–59
(ES, CS, DA, DE, ET, EL, EN, FR, IT, LV, LT, HU, NL, PL, PT, SK, SL, FI, SV) Dieses Dokument wurde in einer Sonderausgabe veröffentlicht.
(BG, RO, HR)
ABl. L 306M vom 15.11.2008, p. 419–451
(MT)
 In force
In force
|
22.12.2005 |
DE |
Amtsblatt der Europäischen Union |
L 338/27 |
VERORDNUNG (EG) Nr. 2074/2005 DER KOMMISSION
vom 5. Dezember 2005
zur Festlegung von Durchführungsvorschriften für bestimmte unter die Verordnung (EG) Nr. 853/2004 des Europäischen Parlaments und des Rates fallende Erzeugnisse und für die in den Verordnungen (EG) Nr. 854/2004 des Europäischen Parlaments und des Rates und (EG) Nr. 882/2004 des Europäischen Parlaments und des Rates vorgesehenen amtlichen Kontrollen, zur Abweichung von der Verordnung (EG) Nr. 852/2004 des Europäischen Parlaments und des Rates und zur Änderung der Verordnungen (EG) Nr. 853/2004 und (EG) Nr. 854/2004
(Text von Bedeutung für den EWR)
DIE KOMMISSION DER EUROPÄISCHEN GEMEINSCHAFTEN —
gestützt auf den Vertrag zur Gründung der Europäischen Gemeinschaft,
gestützt auf die Verordnung (EG) Nr. 852/2004 des Europäischen Parlaments und des Rates vom 29. April 2004 über Lebensmittelhygiene (1), insbesondere auf Artikel 13 Absatz 2,
gestützt auf die Verordnung (EG) Nr. 853/2004 des Europäischen Parlaments und des Rates vom 29. April 2004 mit spezifischen Hygienevorschriften für Lebensmittel tierischen Ursprungs (2), insbesondere auf die Artikel 9, 10 und 11,
gestützt auf die Verordnung (EG) Nr. 854/2004 des Europäischen Parlaments und des Rates vom 29. April 2004 mit besonderen Verfahrensvorschriften für die amtliche Überwachung von zum menschlichen Verzehr bestimmten Erzeugnissen tierischen Ursprungs (3), insbesondere auf die Artikel 16, 17 und 18,
gestützt auf die Verordnung (EG) Nr. 882/2004 des Europäischen Parlaments und des Rates vom 29. April 2004 über amtliche Kontrollen zur Überprüfung der Einhaltung des Lebensmittel- und Futtermittelrechts sowie der Bestimmungen über Tiergesundheit und Tierschutz (4), insbesondere auf Artikel 63,
in Erwägung nachstehender Gründe:
|
(1) |
Die Verordnung (EG) Nr. 853/2004 enthält spezifische Hygienevorschriften für Lebensmittel tierischen Ursprungs. Es ist angezeigt, bestimmte Durchführungsvorschriften für Fleisch, lebende Muscheln, Fischereierzeugnisse, Milch, Eier, Froschschenkel und Schnecken sowie deren Verarbeitungserzeugnisse festzulegen. |
|
(2) |
Die Verordnung (EG) Nr. 854/2004 enthält besondere Verfahrensvorschriften für die amtliche Überwachung von zum menschlichen Verzehr bestimmten Erzeugnissen tierischen Ursprungs. Es ist angezeigt, bestimmte Vorschriften weiter zu entwickeln und andere Anforderungen zu präzisieren. |
|
(3) |
Mit der Verordnung (EG) Nr. 882/2004 wurden auf Gemeinschaftsebene harmonisierte allgemeine Rahmenvorschriften für amtliche Kontrollen festgelegt. Es ist angezeigt, bestimmte Vorschriften weiterzuentwickeln und andere Anforderungen zu präzisieren. |
|
(4) |
Mit der Entscheidung 20XX/../EG der Kommission (5) werden bestimmte Entscheidungen zur Durchführung von Maßnahmen aufgehoben, die in den mit der Richtlinie 2004/41/EG des Europäischen Parlaments und des Rates vom 21. April 2004 zur Aufhebung bestimmter Richtlinien über Lebensmittelhygiene und Hygienevorschriften für die Herstellung und das Inverkehrbringen von bestimmten, zum menschlichen Verzehr bestimmten Erzeugnissen tierischen Ursprungs sowie zur Änderung der Richtlinien 89/662/EWG und 92/118/EWG des Rates und der Entscheidung 95/408/EG des Rates (6) aufgehobenen Richtlinien vorgesehen waren. Bestimmte Teile der betreffenden Entscheidungen sollten daher in dieser Verordnung beibehalten werden. |
|
(5) |
Gemäß der Verordnung (EG) Nr. 852/2004 sind Lebensmittelunternehmer verpflichtet, Aufzeichnungen zu erstellen und aufzubewahren und relevante Informationen in diesen Aufzeichnungen der zuständigen Behörde und belieferten Lebensmittelunternehmern zur Verfügung zu stellen. |
|
(6) |
Gemäß der Verordnung (EG) Nr. 853/2004 sind auch Schlachthofbetreiber verpflichtet, in Bezug auf alle Tiere außer frei lebendem Wild, die an den Schlachthof transportiert wurden oder bei denen der Transport zum Schlachthof beabsichtigt ist, Informationen zur Lebensmittelkette einzuholen, entgegenzunehmen und zu prüfen sowie diesen Informationen entsprechend zu handeln. Schlachthofbetreiber sollten darüber hinaus sicherstellen, dass die Informationen zur Lebensmittelkette alle in der Verordnung (EG) Nr. 853/2004 vorgesehenen Einzelheiten enthalten. |
|
(7) |
Die Informationen zur Lebensmittelkette erleichtern Schlachthofbetreibern die Organisation des Schlachtablaufs und amtlichen Tierärzten die Entscheidung über die erforderlichen Kontrollen. Die Informationen sollten vom amtlichen Tierarzt evaluiert und als integrierender Bestandteil des Kontrollverfahrens genutzt werden. |
|
(8) |
Existierende Kommunikationssysteme sollten so weit wie möglich genutzt und angepasst werden, um den Vorschriften der Verordnung (EG) Nr. 854/2004 in Bezug auf die Informationen zur Lebensmittelkette gerecht zu werden. |
|
(9) |
Zur Verbesserung der Viehwirtschaft in Haltungsbetrieben und nach Maßgabe der Verordnung (EG) Nr. 854/2004 sollte der amtliche Tierarzt im Schlachthof festgestellte Erkrankungen und das Allgemeinbefinden einzelner Tiere oder der Herde/des Bestands, die die öffentliche Gesundheit oder die Tiergesundheit beeinträchtigen oder den Tierschutz gefährden könnten, aufzeichnen und seine Feststellungen erforderlichenfalls dem mit dem Herkunftsbetrieb assoziierten Lebensmittelunternehmer, den betreuenden Tierärzten und den zuständigen Behörden mitteilen. |
|
(10) |
Die Verordnungen (EG) Nr. 853/2004 und (EG) Nr. 854/2004 enthalten Vorschriften für Parasitenkontrollen, die beim Umgang mit Fischereierzeugnissen an Land oder an Bord von Fischereifahrzeugen durchzuführen sind. Es ist Sache des Lebensmittelunternehmers, auf allen Stufen der Herstellung von Fischereierzeugnissen Eigenkontrollen im Sinne von Anhang III Abschnitt VIII Kapitel V Punkt D der Verordnung (EG) Nr. 853/2004 durchzuführen, damit Fische, die sichtbar von Parasiten befallen sind, nicht zum menschlichen Verzehr in den Verkehr gebracht werden. Die Festlegung von Durchführungsvorschriften für Sichtkontrollen setzt die Definition der Begriffe des sichtbaren Parasiten und der Sichtkontrolle sowie die Bestimmung von Art und Häufigkeit der Kontrollen voraus. |
|
(11) |
Die Kontrollen gemäß der Verordnung (EG) Nr. 853/2004, mit denen verhindert werden soll, dass nicht zum menschlichen Verzehr geeignete Fischereierzeugnisse in den Verkehr gebracht werden, können bestimmte chemische Kontrollen, einschließlich Kontrollen auf flüchtige Basenstickstoffe (TVB-N), umfassen. Es ist angezeigt, TVB-N-Werte festzulegen, die bei bestimmten Artenkategorien nicht überschritten werden dürfen, und die anzuwendenden Analysemethoden vorzugeben. Analysemethoden, die für die TVB-N-Kontrolle derzeit wissenschaftlich anerkannt sind, sollten zwar weiterhin routinemäßig angewandt werden, doch sollte für den Fall zweifelhafter Ergebnisse oder für Streitfälle eine Referenzmethode festgelegt werden. |
|
(12) |
Die Grenzwerte für PSP-Toxine (Paralytic Shellfish Poison), ASP-Toxine (Amnesic Shellfish Poison) und lipophile Toxine sind in der Verordnung (EG) Nr. 853/2004 festgelegt. Bioassays sind die Referenzmethode zum Nachweis bestimmter Toxine und sollen verhindern, dass giftige Schalentiere geerntet werden. Höchstwerte und Analysemethoden sollten harmonisiert und zum Schutz der öffentlichen Gesundheit von den Mitgliedstaaten angewandt werden. Zusätzlich zu den biologischen Testmethoden sollten auch alternative Nachweisverfahren wie chemische Methoden und in-vitro-Versuche zulässig sein, sofern erwiesen ist, dass die gewählten Methoden nicht weniger leistungsfähig sind als die biologische Methode und ihre Anwendung einen gleichwertigen Gesundheitsschutz gewährleistet. Die vorgeschlagenen Grenzwerte für lipophile Toxine beruhen auf vorläufigen Daten und sollten erneut geprüft werden, sobald neue wissenschaftliche Erkenntnisse vorliegen. Das Fehlen von Referenzmaterial und die ausschließliche Anwendung nicht biologischer Verfahren bedeutet derzeit, dass das in Bezug auf die genannten Toxine gegebene Gesundheitsschutzniveau nicht dem Schutzniveau bei Einsatz biologischer Nachweisverfahren entspricht. Biologische Verfahren sollten daher so schnell wie möglich ersetzt werden. |
|
(13) |
Separatorenfleisch, das nach Verfahren gewonnen wird, die die Struktur der verwendeten Knochen nicht verändern, sollte anders bewertet werden als Separatorenfleisch, bei dessen Gewinnung die Knochenstruktur verändert wird. |
|
(14) |
Separatorenfleisch der ersteren Art, das unter vorgegebenen Bedingungen gewonnen wird und eine bestimmte Zusammensetzung aufweist, sollte in Fleischzubereitungen, die auf keinen Fall ohne vorherige Hitzebehandlung verzehrt werden dürfen, zulässig sein. Diese Bedingungen stehen insbesondere in Zusammenhang mit dem Kalziumgehalt von Separatorenfleisch, der gemäß Artikel 11 Nummer 2 der Verordnung (EG) Nr. 853/2004 festgelegt werden sollte. Der in der vorliegenden Verordnung festgesetzte Kalziumhöchstgehalt sollte angepasst werden, sobald ausführliche Informationen über Abweichungen infolge der Verwendung unterschiedlicher Arten von Rohmaterial vorliegen. |
|
(15) |
Gemäß Artikel 31 Absatz 2 Buchstabe f der Verordnung (EG) Nr. 882/2004 halten die Mitgliedstaaten Listen zugelassener Betriebe ständig auf dem neuesten Stand. Es sollte eine gemeinsame Rahmenregelung für die Weitergabe relevanter Informationen an andere Mitgliedstaaten und die Öffentlichkeit festgelegt werden. |
|
(16) |
Anhang III Abschnitt XI der Verordnung (EG) Nr. 853/2004 enthält Vorschriften für die Zubereitung von Froschschenkeln und Schnecken für den menschlichen Verzehr. Es sollten auch besondere Vorschriften, einschließlich Genusstauglichkeitsbescheinigungen, für die Einfuhr von zum Verzehr bestimmten Froschschenkeln und Schnecken aus Drittländern festgelegt werden. |
|
(17) |
In Anhang III Abschnitte XIV und XV der Verordnung (EG) Nr. 853/2004 sind Vorschriften für die Herstellung und das Inverkehrbringen von Speisegelatine und Kollagen für den menschlichen Verzehr festgelegt. Es sollten auch besondere Vorschriften, einschließlich Genusstauglichkeitsbescheinigungen, für die Einfuhr von Gelatine und Kollagen sowie von Rohmaterial für die Herstellung von Speisegelatine und Kollagen für den menschlichen Verzehr aus Drittländern festgelegt werden. |
|
(18) |
Flexibilität ist erforderlich, um auch weiterhin traditionelle Lebensmittel herstellen zu können. Die Mitgliedstaaten haben bereits im Rahmen der vor dem 1. Januar 2006 geltenden Gesetzgebung für eine breite Palette derartiger Lebensmittel Ausnahmen gewährt. Lebensmittelunternehmer sollten in der Lage sein, gängige Herstellungspraktiken ohne zeitliche Lücken auch nach dem genannten Termin anzuwenden. Ein Verfahren, das den Mitgliedstaaten Flexibilität einräumt, ist in den Verordnungen (EG) Nr. 852/2004, (EG) Nr. 853/2004 und (EG) Nr. 854/2004 bereits vorgesehen. In den meisten Fällen, in denen bereits Ausnahmen gewährt wurden, ging es jedoch hauptsächlich darum, mit bewährten Praktiken fortzufahren; daher würde ein umfassendes Mitteilungsverfahren mit vollständiger Gefahrenanalyse die Mitgliedstaaten nur unnötig und unverhältnismäßig belasten. Traditionelle Lebensmittel und allgemeine Vorschriften für diese Lebensmittel sollten daher unter gebührender Berücksichtigung der Ziele der Lebensmittelsicherheit abweichend von den strukturellen Anforderungen der Verordnung (EG) Nr. 852/2004 definiert bzw. festgelegt werden. |
|
(19) |
Da die Verordnungen (EG) Nr. 853/2004 und (EG) Nr. 854/2004 vor dem Beitrittsdatum des 1. Mai 2004 erlassen wurden, waren die neuen Mitgliedstaaten ausgeschlossen. Die ISO-Codes für diese Mitgliedstaaten und die Abkürzungen für die Europäische Gemeinschaft in den jeweiligen Landessprachen sollten daher in die betreffenden Vorschriften dieser Verordnungen aufgenommen werden. |
|
(20) |
Anhang III Abschnitt I der Verordnung (EG) Nr. 853/2004 enthält Vorschriften für die Gewinnung und das Inverkehrbringen von Fleisch von als Haustieren gehaltenen Huftieren. Kapitel IV Nummer 8 dieses Abschnitts regelt Ausnahmen von der Vorschrift des vollständigen Enthäutens von Schlachtkörpern und anderer zum Verzehr bestimmter Schlachtkörperteile. Diese Ausnahmen sollten auf Rinderfüße ausgedehnt werden, sofern sie dieselben Anforderungen erfüllen wie Kalbsfüße. |
|
(21) |
Bestimmte Praktiken können den Verbraucher, was die Zusammensetzung bestimmter Erzeugnisse anbelangt, irreführen. Insbesondere der Verkauf von mit Wasserbindern behandeltem Geflügelfleisch als frisches Fleisch sollte verboten werden, um Verbrauchererwartungen nicht zu enttäuschen. |
|
(22) |
Aus der Stellungnahme der Europäischen Behörde für Lebensmittelsicherheit vom 30. August 2004 geht hervor, dass Fischereierzeugnisse der Familie Gempylidae, insbesondere Ruvettus pretiosus und Lepidocybium flavobrunneum, beim Verzehr unter bestimmten Bedingungen Magen-Darm-Störungen hervorrufen können. Die Vermarktung von Fischereierzeugnissen dieser Familie sollten daher an bestimmte Vermarktungsbedingungen gebunden werden. |
|
(23) |
Anhang III Abschnitt IX der Verordnung (EG) Nr. 853/2004 enthält Hygienevorschriften für Rohmilch und Milcherzeugnisse. Gemäß Kapitel I Teil II Punkt B Nummer 1 Buchstabe e dürfen Zitzenbäder oder andere Reinigungsmittel für Euter nur verwendet werden, wenn sie von der zuständigen Behörde zugelassen wurden. Dieser Teil enthält jedoch keine ausführliche Zulassungsregelung. Daher ist es im Interesse eines harmonisierten Vorgehens der Mitgliedstaaten angezeigt, die Verfahren für die Erteilung von Zulassungen zu präzisieren. |
|
(24) |
Gemäß der Verordnung (EG) Nr. 853/2004 müssen Lebensmittelunternehmer sicherstellen, dass zur Verarbeitung von Rohmilch und Milcherzeugnissen angewandte Wärmebehandlungen einem international anerkannten Standard genügen. Aufgrund der Spezifität einiger der in diesem Sektor üblichen Wärmebehandlungen und ihrer Auswirkungen auf die Lebensmittelsicherheit und Tiergesundheit sollten Lebensmittelunternehmern diesbezüglich genauere Leitlinien an die Hand gegeben werden. |
|
(25) |
Mit der Verordnung (EG) Nr. 853/2004 wird eine neue Definition für Erzeugnisse aus Eiern eingeführt, die nach dem Entfernen der Schale noch nicht verarbeitet wurden. Daher müssen die Vorschriften für diese Erzeugnisse präzisiert und die Bestimmungen von Anhang III Abschnitt X Kapitel II der Verordnung (EG) Nr. 853/2004 entsprechend geändert werden. |
|
(26) |
Anhang III Abschnitt XIV der Verordnung (EG) Nr. 853/2004 enthält spezifische Hygienevorschriften für Gelatine. Diese Vorschriften beinhalten Anforderungen an die Art des zur Gelatineherstellung zulässigen Rohmaterials sowie die Beförderung und Lagerung dieses Materials. Sie umfassen auch Spezifikationen für die Gelatineherstellung. Es sollten jedoch auch Vorschriften für die Etikettierung von Gelatine festgelegt werden. |
|
(27) |
Aufgrund neuer wissenschaftlicher Erkenntnisse wurde als anerkannte Referenzmethode zum Nachweis von E. coli in Muscheln die ISO-Norm 16649-3 festgelegt. Gemäß der Verordnung (EG) Nr. 2073/2005 über mikrobiologische Kriterien für Lebensmittel (7) wurde diese Referenzmethode für lebende Muscheln aus Gebieten der Klasse A bereits vorgegeben. Daher sollte die ISO-Norm 16649-3 auch als MPN(Most Probable Number)-Referenzmethode zum Nachweis von E. coli in Muscheln aus Gebieten der Klassen B und C festgelegt werden. Die Anwendung alternativer Methoden sollte nur genehmigt werden, wenn sie der Referenzmethode gleichwertig sind. |
|
(28) |
Die Verordnungen (EG) Nr. 853/2004 und (EG) Nr. 854/2004 sollten entsprechend geändert werden. |
|
(29) |
Die in dieser Verordnung vorgesehenen Maßnahmen entsprechen der Stellungnahme des Ständigen Ausschusses für die Lebensmittelkette und Tiergesundheit — |
HAT FOLGENDE VERORDNUNG ERLASSEN:
Artikel 1
Anforderungen an die Informationen zur Lebensmittelkette im Sinne der Verordnungen (EG) Nr. 853/2004 und (EG) Nr. 854/2004
Die Anforderungen an die Informationen zur Lebensmittelkette im Sinne von Anhang II Abschnitt III der Verordnung (EG) Nr. 853/2004 sowie von Anhang I Abschnitt I Kapitel II Punkt A der Verordnung (EG) Nr. 854/2004 sind in Anhang I dieser Verordnung festgelegt.
Artikel 2
Anforderungen an Fischereierzeugnisse im Sinne der Verordnungen (EG) Nr. 853/2004 und (EG) Nr. 854/2004
Anforderungen an Fischereierzeugnisse im Sinne von Artikel 11 Absatz 9 der Verordnung (EG) Nr. 853/2004 und Artikel 18 Absätze 14 und 15 der Verordnung (EG) Nr. 854/2004 sind in Anhang II dieser Verordnung festgelegt.
Artikel 3
Anerkannte Testmethoden zum Nachweis mariner Biotoxine im Sinne der Verordnungen (EG) Nr. 853/2004 und Nr. 854/2004
Anerkannte Testmethoden zum Nachweis mariner Biotoxine im Sinne von Artikel 11 Absatz 4 der Verordnung (EG) Nr. 853/2004 und von Artikel 18 Absatz 13 Buchstabe a der Verordnung (EG) Nr. 854/2004 sind in Anhang III dieser Verordnung festgelegt.
Artikel 4
Kalziumgehalt von Separatorenfleisch im Sinne der Verordnung (EG) Nr. 853/2004
Der Kalziumgehalt von Separatorenfleisch im Sinne von Artikel 11 Absatz 2 der Verordnung (EG) Nr. 853/2004 ist in Anhang IV dieser Verordnung festgelegt.
Artikel 5
Betriebslisten im Sinne der Verordnung (EG) Nr. 882/2004
Anforderungen an die Betriebslisten im Sinne von Artikel 31 Absatz 2 Buchstabe f der Verordnung (EG) Nr. 882/2004 sind in Anhang V dieser Verordnung festgelegt.
Artikel 6
Muster von Genusstauglichkeitsbescheinigungen für Froschschenkel, Schnecken, Gelatine und Kollagen im Sinne der Verordnung (EG) Nr. 853/2004
Die Muster der Genusstauglichkeitsbescheinigungen für die Einfuhr von Froschschenkeln, Schnecken, Gelatine und Kollagen im Sinne von Artikel 6 Absatz 1 Buchstabe d der Verordnung (EG) Nr. 853/2004 und für Rohmaterial zur Herstellung von Gelatine und Kollagen sind in Anhang VI dieser Verordnung festgelegt.
Artikel 7
Abweichung von der Verordnung (EG) Nr. 852/2004 für traditionelle Lebensmittel
(1) Zum Zwecke dieser Verordnung sind „traditionelle Lebensmittel“ Lebensmittel, die in dem Mitgliedstaat, in dem sie traditionsgemäß hergestellt werden,
|
a) |
seit jeher als Erzeugnisse mit Tradition anerkannt sind oder |
|
b) |
nach verschlüsselten oder eingetragenen technischen Spezifikationen oder in Bezug auf die traditionelle Herstellung nach traditionellen Produktionsmethoden hergestellt werden oder |
|
c) |
nach gemeinschaftlichem, staatlichem, regionalem oder örtlichem Recht als traditionelle Lebensmittel geschützt sind. |
(2) Die Mitgliedstaaten können Unternehmen, die traditionelle Lebensmittel herstellen, einzelne oder allgemeine Ausnahmen von folgenden Anforderungen gewähren:
|
a) |
Anhang II Kapitel II Nummer 1 der Verordnung (EG) Nr. 852/2004 in Bezug auf Räume, in denen diese Erzeugnisse Umweltbedingungen ausgesetzt werden, die für die teilweise Entwicklung ihrer charakteristischen Eigenschaften erforderlich sind. Derartige Räume können insbesondere Wände, Decken und Türen aufweisen, die nicht aus glattem, Flüssigkeit abstoßendem, nicht absorbierendem oder korrosionsfestem Material bestehen, sowie natürliche Mauern, Decken und Böden; |
|
b) |
Anhang II Kapitel II Nummer 1 Buchstabe f und Kapitel V Nummer 1 der Verordnung (EG) Nr. 852/2004 in Bezug auf die Materialbeschaffenheit, aus der die Geräte und Ausrüstungen, die speziell für die Zubereitung, Verpackung und Umhüllung dieser Erzeugnisse verwendet werden, hergestellt sind. Um der spezifischen Umgebungsflora dieser Räumlichkeiten Rechnung zu tragen, werden Häufigkeit und Art der Reinigung und Desinfektion der Räume gemäß Buchstabe a an die jeweiligen Umstände angepasst. Die Arbeitsgeräte und Ausrüstungen gemäß Buchstabe b sind stets in hygienisch einwandfreiem Zustand zu halten sowie regelmäßig zu reinigen und zu desinfizieren. |
(3) Mitgliedstaaten, die Ausnahmen im Sinne von Absatz 2 gewähren, teilen dies der Kommission und den anderen Mitgliedstaaten spätestens zwölf Monate nach der Gewährung einzelner oder allgemeiner Ausnahmen mit. Jede Mitteilung umfasst
|
a) |
eine Kurzbeschreibung der angepassten Anforderungen, |
|
b) |
eine Beschreibung der betreffenden Lebensmittel und Unternehmen und |
|
c) |
etwaige andere maßgebliche Informationen. |
Artikel 8
Änderungen der Verordnung (EG) Nr. 853/2004
Die Anhänge II und III der Verordnung (EG) Nr. 853/2004 werden im Sinne von Anhang VII dieser Verordnung geändert.
Artikel 9
Änderung der Verordnung (EG) Nr. 854/2004
Die Anhänge I, II und III der Verordnung (EG) Nr. 854/2004 werden im Sinne von Anhang VIII dieser Verordnung geändert.
Artikel 10
Inkrafttreten und Anwendbarkeit
Diese Verordnung tritt am zwanzigsten Tag nach ihrer Veröffentlichung im Amtsblatt der Europäischen Union in Kraft.
Sie gilt ab dem 1. Januar 2006, ausgenommen die Kapitel II und III von Anhang V, die ab dem 1. Januar 2007 gelten.
Diese Verordnung ist in allen ihren Teilen verbindlich und gilt unmittelbar in jedem Mitgliedstaat.
Brüssel, den 5. Dezember 2005
Für die Kommission
Markos KYPRIANOU
Mitglied der Kommission
(1) ABl. L 139 vom 30.4.2004, S. 1. Berichtigung im ABl. L 226 vom 25.6.2004, S. 3.
(2) ABl. L 139 vom 30.4.2004, S. 55. Berichtigung im ABl. L 226 vom 25.6.2004, S. 22.
(3) ABl. L 139 vom 30.4.2004, S. 206. Berichtigung im ABl. L 226 vom 25.6.2004, S. 83.
(4) ABl. L 165 vom 30.4.2004, S. 1. Berichtigung im ABl. L 191 vom 28.5.2004, S. 1.
(5) Noch nicht im Amtsblatt veröffentlicht.
(6) ABl. L 157 vom 30.4.2004, S. 33. Berichtigung im ABl. L 195 vom 2.6.2004, S. 12.
(7) Siehe Seite 1 dieses Amtsblatts.
ANHANG I
INFORMATIONEN ZUR LEBENSMITTELKETTE
ABSCHNITT I
VERPFLICHTUNGEN VON LEBENSMITTELUNTERNEHMERN
Lebensmittelunternehmer, die Tiere aufziehen, die zur Versendung zur Schlachtung bestimmt sind, tragen dafür Sorge, dass die Informationen zur Lebensmittelkette im Sinne der Verordnung (EG) Nr. 853/2004 angemessen in den Dokumenten der Tiere vermerkt sind und so übermittelt werden, dass sie dem betreffenden Schlachthofbetreiber zugänglich sind.
ABSCHNITT II
VERPFLICHTUNGEN DER ZUSTÄNDIGEN BEHÖRDEN
KAPITEL I
MITTEILUNG VON INFORMATIONEN ZUR LEBENSMITTELKETTE
|
1. |
Die zuständige Behörde am Versandort teilt dem versendenden Lebensmittelunternehmer mit, welche Mindestangaben die Informationen zur Lebensmittelkette, die dem Schlachthof gemäß Anhang II Abschnitt III der Verordnung (EG) Nr. 853/2004 zu übermitteln sind, enthalten müssen. |
|
2. |
Die zuständige Behörde am Schlachtort überprüft, ob:
|
|
3. |
Soweit Tiere zur Schlachtung in einen anderen Mitgliedstaat versendet werden, arbeiten die zuständigen Behörden am Versand- und am Schlachtort zusammen, um zu gewährleisten, dass die vom versendenden Lebensmittelunternehmer übermittelten Informationen dem diese Informationen entgegennehmenden Schlachthofbetreiber leicht zugänglich sind. |
KAPITEL II
RÜCKFLUSS VON INFORMATIONEN ZUM HERKUNFTSBETRIEB
|
1. |
Zur Übermittlung relevanter Untersuchungsbefunde, die dem Betrieb, in dem die Tiere vor der Schlachtung im selben Mitgliedstaat aufgezogen wurden, gemäß Anhang I Abschnitt II Kapitel I der Verordnung (EG) Nr. 854/2004 mitzuteilen sind, kann der amtliche Tierarzt das Musterdokument in Anlage I verwenden. |
|
2. |
Die zuständige Behörde ist verantwortlich für die Übermittlung relevanter Untersuchungsbefunde in Fällen, in denen die Tiere von einem Betrieb in einem anderen Mitgliedstaat aufgezogen wurden; sie ist in diesem Falle verpflichtet, das Musterdokument in der Anlage sowohl in der Sprache des Versandlandes als auch der Sprache des Bestimmungslandes auszufüllen. |
Anlage zu Anhang I
MUSTERDOKUMENT
|
1. |
Angaben zur Identifizierung |
||
|
|
1.1. |
Herkunftsbetrieb (z. B. Eigentümer oder Betriebsleiter) |
|
|
|
|
Name/Nummer |
|
|
|
|
Vollständige Anschrift |
|
|
|
|
Telefonnummer |
|
|
|
1.2. |
Kennnummern (separat angeben) |
|
|
|
|
Gesamtzahl der Tiere (aufgeschlüsselt nach Arten) |
|
|
|
|
Kennzeichnungsprobleme (sofern gegeben) |
|
|
|
1.3. |
Herden-/Bestands-/Käfignummer (sofern vorhanden) |
|
|
|
1.4. |
Tierart |
|
|
|
1.5. |
Bezugsnummer der Gesundheitsbescheinigung |
|
|
2. |
Befunde der Schlachttieruntersuchung |
||
|
|
2.1. |
Allgemeinbefinden |
|
|
|
|
Zahl der betroffenen Tiere |
|
|
|
|
Art/Klasse/Alter |
|
|
|
|
Feststellungen (z. B. Schwanzbeißen) |
|
|
|
2.2. |
Anlieferung der Tiere in verschmutztem Zustand |
|
|
|
2.3. |
klinische Befunde (Krankheitsbefunde) |
|
|
|
|
Zahl der betroffenen Tiere |
|
|
|
|
Art/Klasse/Alter |
|
|
|
|
Feststellungen |
|
|
|
|
Untersuchungsdatum |
|
|
|
2.4. |
Laborbefunde (1) |
|
|
3. |
Befunde der Fleischuntersuchung |
||
|
|
3.1. |
(Makroskopische) Befunde |
|
|
|
|
Zahl der betroffenen Tiere |
|
|
|
|
Art/Klasse/Alter |
|
|
|
|
Organ bzw.Körperstelle des (der) betroffenen Tiere(s) |
|
|
|
|
Schlachtdatum |
|
|
|
3.2. |
Krankheit (evtl. mit Angabe von Codes (2) |
|
|
|
|
Zahl der betroffenen Tiere |
|
|
|
|
Art/Klasse/Alter |
|
|
|
|
Organ bzw. Körperstelle des (der) betroffenen Tiere(s) |
|
|
|
|
Vorläufig oder endgültig beschlagnahmter Schlachtkörper (mit Angabe von Gründen) |
|
|
|
|
Schlachtdatum |
|
|
|
3.3. |
Laborbefunde (3) |
|
|
|
3.4. |
Sonstige Befunde (z. B. Parasitenbefall, Fremdkörper usw.) |
|
|
|
3.5. |
Allgemeinbefinden (z. B. gebrochene Beine) |
|
|
4. |
Zusätzliche Informationen |
||
|
5. |
Kontaktadressen |
||
|
|
5.1. |
Schlachthof (Zulassungsnummer) |
|
|
|
|
Name |
|
|
|
|
Vollständige Anschrift |
|
|
|
|
Telefonnummer |
|
|
|
5.2. |
E-Mail (sofern vorhanden) |
|
|
6. |
Amtlicher Tierarzt (in Druckbuchstaben) |
||
|
|
|
Unterschrift und Stempel |
|
|
7. |
Datum |
||
|
8. |
Zahl der diesem Formular beigefügten Seiten: |
||
(1) Mikrobiologische, chemische, serologische usw. Befunde (inkl. beigefügter Untersuchungsergebnisse).
(2) Die zuständigen Behörden können folgende Codes einführen: Code A für Seuchen der OIE-Listen; Codes B100 und B200 für Tierschutzprobleme (Anhang I Abschnitt I Kapitel II Punkt C der Verordnung (EG) Nr. 854/2004) und Codes C100 bis C290 für Entscheidungen bezüglich Fleisch (Anhang I Abschnitt II Kapitel V Nummer 1 Buchstaben a bis u der Verordnung (EG) Nr. 854/2004). Die Codes können erforderlichenfalls weiter unterteilt werden (z. B. C141 für eine mild verlaufende Allgemeinerkrankung, C142 für eine schwerere Krankheit, usw.). Soweit sie verwendet werden, sollten die Codes, einschließlich einer angemessenen Erläuterung ihrer Bedeutung, für den Lebensmittelunternehmer leicht zugänglich sein.
(3) Mikrobiologische, chemische, serologische usw. Befunde (inkl. beigefügter Untersuchungsergebnisse).
ANHANG II
FISCHEREIERZEUGNISSE
ABSCHNITT I
VERPFLICHTUNGEN VON LEBENSMITTELUNTERNEHMERN
Dieser Abschnitt enthält Durchführungsvorschriften für Sichtkontrollen zum Nachweis von Parasiten in Fischereierzeugnissen.
KAPITEL I
DEFINITIONEN
|
1. |
„Sichtbarer Parasit“: ein Parasit oder eine Gruppe von Parasiten in einer Größe, von einer Farbe oder mit einer Textur, die sich vom Fischgewebe deutlich unterscheidet. |
|
2. |
„Sichtkontrolle“: die nicht destruktive Untersuchung von Fischen oder Fischereierzeugnissen mit oder ohne optische Vergrößerung bei für die Sehkraft des Menschen guten Lichtverhältnissen, erforderlichenfalls auch mittels Durchleuchtung. |
|
3. |
„Durchleuchtung“: das Untersuchen von Plattfischen oder Fischfilets auf Parasiten durch Betrachtung vor einer Lichtquelle in einem abgedunkelten Raum. |
KAPITEL II
SICHTKONTROLLE
|
1. |
Sichtkontrollen werden an einer repräsentativen Anzahl Proben vorgenommen. Die für Landbetriebe verantwortlichen Personen sowie qualifizierte Personen an Bord von Fabrikschiffen entscheiden je nach Art der Fischereierzeugnisse, ihrem geografischen Ursprung und ihrer Verwendung über Umfang und Häufigkeit der Kontrollen. Während der Produktion werden ausgenommene Fische (d. h. Bauchhöhle, Leber und zum Verzehr bestimmte Rogen) von qualifizierten Personen der Sichtkontrolle unterzogen. Die Sichtkontrolle wird in Abhängigkeit der Art des Ausnehmens
|
|
2. |
Bei Fischfilets oder Fisch in Scheiben wird die Sichtkontrolle von qualifizierten Personen während des Zurichtens und nach dem Filetieren oder Zerlegen in Scheiben vorgenommen. Kann eine einzelne Sichtkontrolle aufgrund der Größe der Filets oder des Filetierungsvorgangs nicht durchgeführt werden, so ist ein Stichprobenplan aufzustellen und der zuständigen Behörde gemäß Anhang III Abschnitt VIII Kapitel II Nummer 4 der Verordnung (EG) Nr. 853/2004 zur Verfügung zu stellen. Ist die Durchleuchtung von Filets technisch gesehen unumgänglich, so ist dies im Stichprobenplan anzugeben. |
ABSCHNITT II
VERPFLICHTUNGEN DER ZUSTÄNDIGEN BEHÖRDEN
KAPITEL I
GRENZWERTE FÜR FLÜCHTIGE BASENSTICKSTOFFE (TVB-N) FÜR BESTIMMTE KATEGORIEN VON FISCHEREIERZEUGNISSEN UND ANZUWENDENDE ANALYSEMETHODEN
|
1. |
Unverarbeitete Fischereierzeugnisse der in Kapitel II genannten Artenkategorien gelten als untauglich zum Genuss für Menschen, wenn die organoleptische Prüfung Zweifel an der Frische des Erzeugnisses aufkommen ließ und chemische Kontrollen ergeben, dass die folgenden TVB-N-Grenzwerte überschritten wurden:
Die zur Kontrolle der TVB-N-Grenzwerte anzuwendende Referenzmethode umfasst die Destillation eines mit Perchlorsäure denaturierten Extraktes in Sinne von Kapitel III. |
|
2. |
Die Destillation gemäß Nummer 1 ist mit einem Gerät durchzuführen, das dem Schaubild in Kapitel IV entspricht. |
|
3. |
Folgende Routinemethoden können zur Kontrolle der TVB-N-Grenzwerte angewendet werden:
|
|
4. |
Die Probe muss aus rund 100 g Fleisch bestehen, das an mindestens drei unterschiedlichen Stellen entnommen und durch Zerkleinern vermischt wird. Die Mitgliedstaaten empfehlen, dass amtliche Laboratorien die genannte Referenzmethode als Routineverfahren anwenden. In Zweifels- oder Streitfällen bezüglich der Ergebnisse eines Routineverfahrens darf zur Bestätigung der Ergebnisse nur die Referenzmethode eingesetzt werden. |
KAPITEL II
KATEGORIEN, FÜR DIE TVB-N-GRENZWERTE FESTGESETZT WERDEN
|
1. |
Sebastes spp., Helicolenus dactylopterus, Sebastichthys capensis |
|
2. |
Arten der Familie der Pleuronectidae (mit Ausnahme des Heilbutts: Hippoglossus spp.) |
|
3. |
Salmo salar, Arten der Familie der Merlucciidae und der Familie der Gadidae. |
KAPITEL III
BESTIMMUNG DER TVB-N-KONZENTRATION IN FISCH UND FISCHEREIERZEUGNISSEN
Referenzverfahren
1. Zweck und Anwendungsgebiet
Diese Methode beschreibt ein Referenzverfahren zur Bestimmung der Stickstoffkonzentration von TVB-N in Fisch und Fischereierzeugnissen. Das Verfahren ist bei TVB-N–Konzentrationen von 5 mg/100 g bis mindestens 100 mg/100 g anwendbar.
2. Definition
„TVB-N-Konzentration“: der Stickstoffgehalt flüchtiger stickstoffhaltiger Basen, bestimmt nach dem beschriebenen Verfahren.
Die Konzentration wird in mg/100 g ausgedrückt.
3. Kurzbeschreibung
Der flüchtige Basenstickstoff wird mit einer Lösung von 0,6 Mol Perchlorsäure aus einer Probe extrahiert. Nach Alkalisierung wird der Extrakt wasserdampfdestilliert und die flüchtigen Basenanteile werden in einer Säurevorlage absorbiert. Die TVB-N-Konzentration wird durch Titrierung der absorbierten Basen bestimmt.
4. Reagenzien
Sofern nicht anders angegeben, sind analysenreine Reagenzien zu verwenden. Das Wasser muss entweder destilliert oder demineralisiert sein und mindestens die gleiche Reinheit aufweisen. Sofern nichts anderes bestimmt ist, ist unter einer „Lösung“ eine wässrige Lösung wie folgt zu verstehen:
|
a) |
Perchlorsäurelösung = 6 g/100 ml; |
|
b) |
Natriumhydroxydlösung = 20 g/100 ml; |
|
c) |
Salzsäure-Standardlösung 0,05 mol/l (0,05 N).
|
|
d) |
Borsäurelösung = 3 g/100 ml; |
|
e) |
Silikon-Schaumverhüter; |
|
f) |
Phenolphtaleinlösung = 1 g/100 ml 95 % Ethanol; |
|
g) |
Indikatorlösung (Tashiro-Mischindikator) 2 g Methylrot und 1 g Methylenblau werden in 1 000 ml 95-prozentigem Ethanol gelöst. |
5. Geräte und Zubehör
|
a) |
Fleischhackmaschine zur Herstellung eines ausreichend homogenen Fischprobengemenges. |
|
b) |
Hochgeschwindigkeitsmischer mit Drehzahlen von 8 000 min-1 bis 45 000 min-1. |
|
c) |
Faltenfilter, 150 mm Durchmesser, Schnellfilterung. |
|
d) |
5-ml-Bürette, 0,01-ml-Graduierung. |
|
e) |
Gerät für die Wasserdampfdestillation: Das Gerät muss für die Regelung unterschiedlicher Dampfmengen ausgelegt sein und über eine bestimmte Zeit konstante Dampfmengen erzeugen können. Es muss gewährleistet sein, dass die bei Zugabe der alkalisierenden Substanzen freiwerdenden Basen nicht entweichen können. |
6. Durchführung
Warnung: Beim Arbeiten mit hochgradig korrosiver Perchlorsäure müssen erforderliche Vorsichtsmaßnahmen getroffen werden. Die Proben sollten, sofern möglich, so schnell wie möglich nach ihrem Eintreffen nach folgenden Anleitungen zubereitet werden:
|
a) |
Die zu untersuchende Probe wird in einer wie in Nr. 5 Buchstabe a beschriebenen Fleischhackmaschine sorgfältig zerkleinert. Es werden genau 10 g (± 0,1 g) der zerkleinerten Probe in einen geeigneten Behälter eingewogen, mit 90,0 ml der in Nr. 4 Buchstabe a beschriebenen Perchlorsäurelösung versetzt, zwei Minuten mit dem in Nr. 5 Buchstabe b beschriebenen Mischer homogenisiert und anschließend gefiltert. Der so gewonnene Extrakt kann mindestens sieben Tage lang bei Temperaturen zwischen annähernd + 2 oC und + 6 oC aufbewahrt werden. |
|
b) |
Es werden 50,0 ml des nach Buchstabe a gewonnenen Extrakts in das in Nr. 5 Buchstabe e beschriebene Dampfdestilliergerät gegeben. Damit später überprüft werden kann, ob der Extrakt ausreichend alkalisiert ist, werden einige Tropfen der in Nr. 4 Buchstabe f beschriebenen Phenolphtaleinlösung hinzugegeben. Nach Zugabe einiger Tropfen Silikon-Schaumverhüter wird der Extrakt mit 6,5 ml in Nr. 4 Buchstabe b beschriebenen Natriumhydroxydlösung versetzt und umgehend mit der Dampfdestillation begonnen. Die Dampfdestillation wird so eingestellt, dass innerhalb von 10 Minuten rund 100 ml Destillat entstehen. Das Ablassrohr wird in eine Vorlage mit 100 ml einer in Nr. 4 Buchstabe d beschriebenen Borsäurelösung eingetaucht, der drei bis fünf Tropfen der in Nr. 4 Buchstabe g beschriebenen Indikatorlösung zugesetzt wurden. Nach genau 10 Minuten ist die Destillation beendet. Das Ablassrohr wird aus der Vorlage entfernt und mit Wasser gespült. Die flüchtigen Basen in der Vorlagelösung werden durch Titrierung mit der in Nr. 4 Buchstabe c beschriebenen Salzsäure-Standardlösung bestimmt. Der ph-Wert des Endpunkts sollte bei 5,0 (± 0,1) liegen. |
|
c) |
Die Analysen sind zweimal durchzuführen. Die angewandte Methode wurde korrekt durchgeführt, wenn die Differenz zwischen beiden Analysen nicht mehr als 2 mg/100 g beträgt. |
|
d) |
Es wird ein Blindtest gemäß Buchstabe b durchgeführt. Anstelle des Extrakts werden 50,0 ml Perchlorsäurelösung (s. Nr. 4 Buchstabe a) verwendet. |
7. Berechnung des TVB-N-Gehalts
Nach Titrierung der Vorlagelösung mit Salzsäurelösung (s. Nr. 4 Buchstabe c) wird die TVB-N-Konzentration anhand folgender Gleichung berechnet:
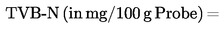
V1 = Volumen von 0,01 Mol Salzsäurelösung (in ml) für die Probe
V0 = Volumen von 0,01 Mol Salzsäurelösung (in ml) für die Blindprobe
M = Gewicht der Probe in Gramm.
Anmerkungen
|
1. |
Die Analysen sind zweimal durchzuführen. Die angewandte Methode ist korrekt, wenn die Differenz zwischen beiden Analysen nicht mehr als 2 mg/100 g beträgt. |
|
2. |
Die Geräte werden durch Destillieren einer NH4Cl-Lösungsmenge überprüft, die 50 mg TVB-N/100 g entsprechen. |
|
3. |
Standardabweichung der Wiederholbarkeit: Sr = 1,20 mg/100 g. Standardabweichung der Vergleichbarkeit: SR = 2,50 mg/100 g. |
KAPITEL IV
TVB-N-DAMPFDESTILLIERGERÄT

ANHANG III
ANERKANNTE TESTMETHODEN ZUM NACHWEIS MARINER BIOTOXINE
Die zuständigen Behörden und gegebenenfalls Lebensmittelunternehmer wenden zur Kontrolle der Einhaltung der Grenzwerte gemäß Anhang III Abschnitt VII Kapitel V Nummer 2 der Verordnung (EG) Nr. 853/2004 die folgenden Analysemethoden an.
Gemäß Artikel 7 Absätze 2 und 3 der Richtlinie 86/609/EWG des Rates (1) sind bei der Anwendung biologischer Methoden die Kriterien bezüglich der Ersetzung, Verfeinerung und Reduzierung von Tierversuchen zu berücksichtigen.
KAPITEL I
METHODE ZUM PSP-NACHWEIS (PARALYTIC SHELLFISH POISON)
|
1. |
Der PSP-Gehalt genießbarer Teile von Weichtieren (ganzer Körper oder genießbare Körperteile) wird nach der biologischen Testmethode oder einer anderen international anerkannten Methode nachgewiesen. Die biologische Testmethode kann erforderlichenfalls in Kombination mit einer anderen Methode zum Nachweis von Saxitoxin und ähnlichen Toxinen, für die Standards vorliegen, angewandt werden. |
|
2. |
Bei Anfechtung der Ergebnisse gilt die biologische Methode als Referenzmethode. |
KAPITEL II
METHODE ZUM ASP-NACHWEIS (AMNESIC SHELLFISH POISON)
Der Gesamtgehalt an ASP in genießbaren Teilen von Weichtieren (ganzer Körper oder genießbare Körperteile) wird durch Hochleistungs-Flüssigkeitschromatographie (HPLC-Methode) oder nach einer anderen anerkannten Methode nachgewiesen.
Bei Anfechtung der Ergebnisse gilt die HPLC-Methode als Referenzmethode.
KAPITEL III
METHODEN ZUM NACHWEIS LIPOPHILER TOXINE
A. Biologische Methoden
|
1. |
Zum Nachweis der in Anhang III Abschnitt VII Kapitel V Nummer 2 Buchstaben c, d und e der Verordnung (EG) Nr. 853/2004 genannten Toxine kann eine Reihe von Maus-Bioassays durchgeführt werden, die sich durch die Testmenge (Hepatopankreas oder Ganzkörper) und die zur Extraktion und Purifikation verwendeten Lösemittel unterscheiden. Sensitivität und Selektivität hängen von den für die Extraktion und Purifikation gewählten Lösemitteln ab. Dies ist bei der Wahl der Methode zu berücksichtigen, damit alle Toxine erfasst werden. |
|
2. |
Ein einziger Maus-Bioassay mit Azeton-Extraktion kann verwendet werden, um Okadainsäure, Dinophysistoxine, Pectenotoxine und Yessotoxine nachzuweisen. Dieser Assay ist gegebenenfalls durch Flüssig-Flüssig-Trennung mit Ethylacetat/Wasser oder Dichlormethan/Wasser zu ergänzen, um mögliche Interferenzen auszuschließen. Der Nachweis von Azaspirosäure innerhalb der regulativen Grenzwerte mit diesem Verfahren setzt die Ganzkörperuntersuchung voraus. |
|
3. |
Für jeden Test sollten drei Mäuse verwendet werden. Der Tod zweier von drei Mäusen binnen 24 Stunden nach der Beimpfung eines Extraktes von je 5 g Hepatopankreas oder 25 g Ganzkörper gilt als positiver Nachweis eines oder mehrerer der in Anhang III Abschnitt VII Kapitel V Nummer 2 Buchstaben c, d und e der Verordnung (EG) Nr. 853/2004 genannten Toxine in Mengen, die die festgesetzten Grenzwerte überschreiten. |
|
4. |
Ein Maus-Bioassay mit Azeton-Extraktion, gefolgt von einer Flüssig-Flüssig-Trennung mit Diethylether, kann durchgeführt werden, um Okadainsäure, Dinophysistoxine, Pectenotoxine und Azaspirosäuren nachzuweisen, nicht jedoch Yessotoxine, da diese Toxine während der Trennung verloren gehen können. Für jeden Test werden drei Mäuse verwendet. Der Tod zweier von drei Mäusen binnen 24 Stunden nach der Beimpfung eines Extraktes von je 5 g Hepatopankreas oder 25 g Ganzkörper gilt als positiver Nachweis des Vorhandenseins von Okadainsäure, Dinophysistoxine, Pectenotoxine und Azaspirosäuren in Mengen, die über die in Anhang III Abschnitt VII Kapitel V Nummer 2 Buchstaben c und e der Verordnung (EG) Nr. 853/2004 festgesetzten Grenzwerte hinausgehen. |
|
5. |
Mit einem Ratten-Bioassay können Okadainsäure, Dinophysistoxine und Azaspirosäuren nachgewiesen werden. Für jeden Test werden drei Ratten verwendet. Eine diarrhöische Reaktion bei einer der drei Ratten gilt als positiver Nachweis von Okadainsäure, Dinophysistoxinen und Azaspirosäuren in Mengen, die die in Anhang III Abschnitt VII Kapitel V Nummer 2 Buchstaben c und e der Verordnung (EG) Nr. 853/2004 festgesetzten Grenzwerte überschreiten. |
B. Alternative Nachweismethoden
|
1. |
Als Alternativen oder ergänzend zu den biologischen Nachweismethoden sind eine Reihe von Methoden wie z. B. die Hochleistungs-Flüssigkeitschromatographie (HPLC) mit fluorimetrischer Detektion, die Flüssigchromatographie (LC), die Massenspektrometrie (MS), Immunoassays und funktionale Assays wie der Phosphatase-Inhibitionsassay zu verwenden, sofern sie nicht weniger leistungsfähig sind als die biologische Methode, ihre Verwendung ein gleichwertiges Gesundheitsschutzniveau gewährleistet und mit ihnen, allein oder in Kombination, mindestens folgende Analoga nachweisbar sind:
|
|
2. |
Für den Fall, dass neue, für die öffentliche Gesundheit relevante Analoga entdeckt werden, sollten diese in die Analyse einbezogen werden. Bevor eine chemische Analyse möglich ist, müssen Standards vorliegen. Die Gesamttoxizität wird auf der Grundlage der für jedes Toxin vorliegenden Toxizitätsdaten anhand von Umrechnungsfaktoren errechnet. |
|
3. |
Die Leistungsmerkmale dieser Methoden werden nach einer Validierung auf der Grundlage eines international anerkannten Protokolls definiert. |
|
4. |
Biologische Methoden sind durch alternative Nachweismethoden zu ersetzen, sobald Referenzmaterialien für den Nachweis der in Anhang III Abschnitt VI Kapitel V der Verordnung (EG) Nr. 853/2004 genannten Toxine erhältlich sind, die Methoden validiert wurden und dieses Kapitel entsprechend geändert wurde. |
(1) ABl. L 358 vom 18.12.1986, S. 1.
ANHANG IV
KALZIUMGEHALT VON SEPARATORENFLEISCH
Der Kalziumgehalt von Separatorenfleisch gemäß der Verordnung (EG) Nr. 853/2004
|
1. |
darf 0,1 % (=100 mg/100 g oder 1 000 ppm) des frischen Erzeugnisses nicht überschreiten; |
|
2. |
ist nach einer standardisierten international anerkannten Methode festzusetzen. |
ANHANG V
LISTEN ZUGELASSENER LEBENSMITTELUNTERNEHMEN
KAPITEL I
ZUGANG ZU LISTEN ZUGELASSENER LEBENSMITTELUNTERNEHMEN
Um die Mitgliedstaaten bei der Erstellung aktueller Listen zugelassener Lebensmittelunternehmen, die auch anderen Mitgliedstaaten und der Öffentlichkeit zugänglich sind, zu unterstützen, erstellt die Kommission eine Internet-Website, auf der jeder Mitgliedstaat einen Link zu seiner nationalen Website angibt.
KAPITEL II
FORMAT NATIONALER WEBSITES
A. Standardliste
|
1. |
Jeder Mitgliedstaat übermittelt der Kommission einen Link zu einer einzigen nationalen Website, über die die Standardliste der für Erzeugnisse tierischen Ursprungs im Sinne von Anhang I Nummer 8.1 der Verordnung (EG) Nr. 853/2004 zugelassenen Lebensmittelunternehmen abgerufen werden kann. |
|
2. |
Die Standardliste gemäß Nummer 1 besteht aus einem einzigen Blatt und ist in einer oder mehreren Amtssprachen der Gemeinschaft abzufassen. |
B. Funktionsschema
|
1. |
Die Website mit der Standardliste wird von der zuständigen Behörde gegebenenfalls von einer der in Artikel 4 der Verordnung (EG) Nr. 882/2004 genannten zuständigen Behörden aufgestellt. |
|
2. |
Die Standardliste enthält auch Links zu
|
KAPITEL III
LAYOUT UND CODES FÜR LISTEN ZUGELASSENER LEBENSMITTELUNTERNEHMEN
Um die allgemeine Zugänglichkeit der Informationen über zugelassene Lebensmittelunternehmen zu gewährleisten und die Leserfreundlichkeit der Listen zu verbessern, werden Layouts, einschließlich Vorgaben für relevante Informationen und Codes, festgelegt.
KAPITEL IV
TECHNISCHE SPEZIFIKATIONEN
Die in den Kapiteln II und III genannten Aufgaben und Tätigkeiten werden nach den von der Kommission veröffentlichten technischen Spezifikationen durchgeführt.
ANHANG VI
MUSTER VON GENUSSTAUGLICHKEITSBESCHEINIGUNGEN FÜR DIE EINFUHR VON FROSCHSCHENKELN, SCHNECKEN, GELATINE UND KOLLAGEN
ABSCHNITT I
FROSCHSCHENKEL UND SCHNECKEN
Genusstauglichkeitsbescheinigungen für die Einfuhr von Froschschenkeln und Schnecken gemäß Artikel 6 Absatz 1 Buchstabe d der Verordnung (EG) Nr. 853/2004 werden nach dem jeweiligen Muster in Teil A bzw. Teil B von Anlage I zu diesem Anhang erstellt.
ABSCHNITT II
GELATINE
Unbeschadet anderer spezifischer Gemeinschaftsvorschriften, die Vorschriften für transmissible spongiforme Enzephalopathien und Hormone zumindest einschließen, jedoch nicht darauf begrenzt sind, werden die Genusstauglichkeitsbescheinigungen gemäß Artikel 6 Absatz 1 Buchstabe d der Verordnung (EG) Nr. 853/2004 für die Einfuhr von Gelatine und Rohmaterial zur Herstellung von Gelatine nach dem jeweiligen Muster in Teil A bzw. Teil B von Anlage II zu diesem Anhang erstellt.
ABSCHNITT III
KOLLAGEN
Unbeschadet anderer spezifischer Gemeinschaftsvorschriften, die Vorschriften für transmissible spongiforme Enzephalopathien und Hormone zumindest einschließen, jedoch nicht darauf begrenzt sind, werden die Genusstauglichkeitsbescheinigungen gemäß Artikel 6 Absatz 1 Buchstabe d der Verordnung (EG) Nr. 853/2004 für die Einfuhr von Kollagen und Rohmaterial zur Herstellung von Kollagen nach dem jeweiligen Muster in Teil A bzw. Teil B von Anlage III zu diesem Anhang erstellt.
Anlage I zu Anhang VI
Teil A
MUSTER — GENUSSTAUGLICHKEITSBESCHEINIGUNG FÜR DIE EINFUHR VON GEKÜHLTEN, GEFRORENEN ODER ZUBEREITETEN FROSCHSCHENKELN FÜR DEN MENSCHLICHEN VERZEHR


Teil B
MUSTER — GENUSSTAUGLICHKEITSBESCHEINIGUNG FÜR DIE EINFUHR VON GEGARTEN, ZUBEREITETEN ODER HALTBAR GEMACHTEN SCHNECKEN, AUCH OHNE GEHÄUSE, FÜR DEN MENSCHLICHEN VERZEHR


Anlage II zu Anhang VI
Teil A
MUSTER — GENUSSTAUGLICHKEITSBESCHEINIGUNG FÜR DIE EINFUHR VON SPEISEGELATINE


Teil B
MUSTER — GENUSSTAUGLICHKEITSBESCHEINIGUNG FÜR DIE EINFUHR VON ROHMATERIAL ZUR HERSTELLUNG VON SPEISEGELATINE


Anlage III zu Anhang VI
Teil A
MUSTER — GENUSSTAUGLICHKEITSBESCHEINIGUNG FÜR DIE EINFUHR VON KOLLAGEN FÜR DEN MENSCHLICHEN VERZEHR


Teil B
MUSTER — GENUSSTAUGLICHKEITSBESCHEINIGUNG FÜR DIE EINFUHR VON ROHMATERIAL ZUR HERSTELLUNG VON KOLLAGEN FÜR DEN MENSCHLICHEN VERZEHR


ANHANG VII
ÄNDERUNGEN DER VERORDNUNG (EG) NR. 853/2004
Die Anhänge II und III der Verordnung (EG) Nr. 853/2004 werden wie folgt geändert:
|
1. |
Anhang II Abschnitt I Punkt B wird wie folgt geändert:
|
|
2. |
Anhang III wird wie folgt geändert:
|
(1) ABl. L 123 vom 24.4.1998, S. 1.“
ANHANG VIII
ÄNDERUNGEN DER VERORDNUNG (EG) NR. 854/2004
Die Anhänge I, II und III der Verordnung (EG) Nr. 854/2004 werden wie folgt geändert:
|
1. |
Anhang I Abschnitt I Kapitel III Nummer 3 wird wie folgt geändert:
|
|
2. |
Anhang II Kapitel II Punkt A Nummern 4 und 5 erhalten folgende Fassung:
|
|
3. |
Anhang III Kapitel II Punkt G Nummer 1 erhält folgende Fassung:
|