

This document is an excerpt from the EUR-Lex website
Document 32017R0735
Commission Regulation (EU) 2017/735 of 14 February 2017 amending, for the purpose of its adaptation to technical progress, the Annex to Regulation (EC) No 440/2008 laying down test methods pursuant to Regulation (EC) No 1907/2006 of the European Parliament and of the Council on the Registration, Evaluation, Authorisation and Restriction of Chemicals (REACH) (Text with EEA relevance. )
2017 m. vasario 14 d. Komisijos reglamentas (ES) 2017/735, kuriuo, derinant prie technikos pažangos, iš dalies keičiamas Reglamento (EB) Nr. 440/2008, nustatančio bandymų metodus pagal Europos Parlamento ir Tarybos reglamentą (EB) Nr. 1907/2006 dėl cheminių medžiagų registracijos, įvertinimo, autorizacijos ir apribojimų (REACH), priedas (Tekstas svarbus EEE. )
2017 m. vasario 14 d. Komisijos reglamentas (ES) 2017/735, kuriuo, derinant prie technikos pažangos, iš dalies keičiamas Reglamento (EB) Nr. 440/2008, nustatančio bandymų metodus pagal Europos Parlamento ir Tarybos reglamentą (EB) Nr. 1907/2006 dėl cheminių medžiagų registracijos, įvertinimo, autorizacijos ir apribojimų (REACH), priedas (Tekstas svarbus EEE. )
C/2017/0773
OL L 112, 2017 4 28, p. 1–402
(BG, ES, CS, DA, DE, ET, EL, EN, FR, HR, IT, LV, LT, HU, MT, NL, PL, PT, RO, SK, SL, FI, SV)
 In force
In force
- Date of document:
- 14/02/2017; Priėmimo data
- Date of effect:
- 18/05/2017; įsigaliojimas paskelbimo data +20 žr. str. 2
- Date of end of validity:
- No end date
- Author:
- Europos Komisija, Aplinkos generalinis direktoratas
- Responsible body:
- ENV
- Form:
- Reglamentas
- Additional information:
- taikymas EEE
- Treaty:
- Sutartis dėl Europos Sąjungos veikimo
- Legal basis:
-
- 32006R1907 - A13P2
- Link
- Link
- Link
- Select all documents mentioning this document No data available in the table
- Modifies:
-
Relation Act Comment Subdivision concerned From To Modifies 32008R0440 Repeal priedas p. B skyrius B.15 18/05/2017 Modifies 32008R0440 Repeal priedas p. B skyrius B.16 18/05/2017 Modifies 32008R0440 Repeal priedas p. B skyrius B.18 18/05/2017 Modifies 32008R0440 Repeal priedas p. B skyrius B.19 18/05/2017 Modifies 32008R0440 Repeal priedas p. B skyrius B.20 18/05/2017 Modifies 32008R0440 Repeal priedas p. B skyrius B.24 18/05/2017 Modifies 32008R0440 papildymas priedas p. A skyrius A.25 18/05/2017 Modifies 32008R0440 papildymas priedas p. B skyrius B.59 18/05/2017 Modifies 32008R0440 papildymas priedas p. B skyrius B.60 18/05/2017 Modifies 32008R0440 papildymas priedas p. B skyrius B.61 18/05/2017 Modifies 32008R0440 papildymas priedas p. B skyrius B.62 18/05/2017 Modifies 32008R0440 papildymas priedas p. C skyrius C.47 18/05/2017 Modifies 32008R0440 papildymas priedas p. C skyrius C.48 18/05/2017 Modifies 32008R0440 papildymas priedas p. C skyrius C.49 18/05/2017 Modifies 32008R0440 papildymas priedas p. C skyrius C.50 18/05/2017 Modifies 32008R0440 papildymas priedas p. C skyrius C.51 18/05/2017 Modifies 32008R0440 pakeitimas priedas p. B skyrius B.10 18/05/2017 Modifies 32008R0440 pakeitimas priedas p. B skyrius B.11 18/05/2017 Modifies 32008R0440 pakeitimas priedas p. B skyrius B.12 18/05/2017 Modifies 32008R0440 pakeitimas priedas p. B skyrius B.47 18/05/2017 Modifies 32008R0440 pakeitimas priedas p. B skyrius B.48 18/05/2017 Modifies 32008R0440 pakeitimas priedas p. B skyrius B.49 18/05/2017 Modifies 32008R0440 pakeitimas priedas p. B skyrius B.5 18/05/2017 Modifies 32008R0440 pakeitimas priedas p. C skyrius C.13 18/05/2017 Modifies 32008R0440 pakeitimas priedas p. C skyrius C.20 18/05/2017 Modifies 32008R0440 pakeitimas priedas p. C skyrius C.29 P 66 18/05/2017
No data available in the table
- Modified by:
-
Relation Act Comment Subdivision concerned From To Corrected by 32017R0735R(01) (HU) - Instruments cited:
- Link
- EUROVOC descriptor:
- Subject matter:
- Directory code:
-
- 13.30.18.00 Pramonės politika ir vidaus rinka / Vidaus rinka: teisės aktų derinimas / Pavojingos medžiagos
- 15.10.20.50 Aplinkos, vartotojų ir sveikatos apsauga / Aplinka / Tarša ir trukdžiai / Cheminės medžiagos, pramoninė rizika ir biotechnologijos
- 15.30.00.00 Aplinkos, vartotojų ir sveikatos apsauga / Sveikatos apsauga
|
28.4.2017 |
LT |
Europos Sąjungos oficialusis leidinys |
L 112/1 |
KOMISIJOS REGLAMENTAS (ES) 2017/735
2017 m. vasario 14 d.
kuriuo, derinant prie technikos pažangos, iš dalies keičiamas Reglamento (EB) Nr. 440/2008, nustatančio bandymų metodus pagal Europos Parlamento ir Tarybos reglamentą (EB) Nr. 1907/2006 dėl cheminių medžiagų registracijos, įvertinimo, autorizacijos ir apribojimų (REACH), priedas
(Tekstas svarbus EEE)
EUROPOS KOMISIJA,
atsižvelgdama į Sutartį dėl Europos Sąjungos veikimo,
atsižvelgdama į 2006 m. gruodžio 18 d. Europos Parlamento ir Tarybos reglamentą (EB) Nr. 1907/2006 dėl cheminių medžiagų registracijos, įvertinimo, autorizacijos ir apribojimų (REACH), įsteigiantį Europos cheminių medžiagų agentūrą, iš dalies keičiantį Direktyvą 1999/45/EB bei panaikinantį Tarybos reglamentą (EEB) Nr. 793/93, Komisijos reglamentą (EB) Nr. 1488/94, Tarybos direktyvą 76/769/EEB ir Komisijos direktyvas 91/155/EEB, 93/67/EEB, 93/105/EB bei 2000/21/EB, (1) ypač į jo 13 straipsnio 2 dalį,
kadangi:
|
(1) |
Komisijos reglamente (EB) Nr. 440/2008 (2) pateikti bandymų metodai, skirti cheminių medžiagų fizikinėms ir cheminėms savybėms, toksiškumui ir ekotoksiškumui nustatyti ir taikytini pagal Reglamentą (EB) Nr. 1907/2006; |
|
(2) |
Reglamentą (EB) Nr. 440/2008 būtina atnaujinti, kad į jį būtų įtraukti Ekonominio bendradarbiavimo ir plėtros organizacijos (EBPO) neseniai patvirtinti nauji ir atnaujinti bandymų metodai, siekiant atsižvelgti į techninę pažangą ir sumažinti bandymams naudojamų gyvūnų skaičių pagal Europos Parlamento ir Tarybos direktyvą 2010/63/ES (3). Dėl šio projekto konsultuotasi su suinteresuotaisiais subjektais; |
|
(3) |
šį pritaikymą prie techninės pažangos sudaro dvidešimt bandymų metodų: vienas naujas fizikinių ir cheminių savybių nustatymo metodas, penki nauji ir vienas atnaujintas ekotoksiškumo vertinimo bandymo metodas, du atnaujinti išlikimo ir elgesio aplinkoje bandymo metodai bei keturi nauji ir septyni atnaujinti poveikio žmonių sveikatai nustatymo metodai; |
|
(4) |
EBPO reguliariai peržiūri savo bandymų gaires, siekdama nustatyti tas, kurios jau moksliškai atgyveno. Atliekant šį derinimą su technikos pažanga, pašalinami šeši bandymo metodai, kurių atitinkamos EBPO bandymų gairės yra panaikintos; |
|
(5) |
todėl Reglamentą (EB) Nr. 440/2008 reikėtų atitinkamai iš dalies pakeisti; |
|
(6) |
šiame reglamente numatytos priemonės atitinka pagal Reglamento (EB) Nr. 1907/2006 133 straipsnį įsteigto komiteto nuomonę, |
PRIĖMĖ ŠĮ REGLAMENTĄ:
1 straipsnis
Reglamento (EB) Nr. 440/2008 priedas iš dalies keičiamas pagal šio reglamento priedą.
2 straipsnis
Šis reglamentas įsigalioja dvidešimtą dieną po jo paskelbimo Europos Sąjungos oficialiajame leidinyje.
Šis reglamentas yra privalomas visas ir tiesiogiai taikomas visose valstybėse narėse.
Priimta Briuselyje 2017 m. vasario 14 d.
Komisijos vardu
Pirmininkas
Jean-Claude JUNCKER
(1) OL L 396, 2006 12 30, p. 1.
(2) 2008 m. gegužės 30 d. Komisijos reglamentas (EB) Nr. 440/2008, nustatantis bandymo metodus pagal Europos Parlamento ir Tarybos reglamentą (EB) Nr. 1907/2006 dėl cheminių medžiagų registracijos, įvertinimo, autorizacijos ir apribojimų (REACH) (OL L 142, 2008 5 31, p. 1).
(3) 2010 m. rugsėjo 22 d. Europos Parlamento ir Tarybos direktyva 2010/63/ES dėl mokslo tikslais naudojamų gyvūnų apsaugos (OL L 276, 2010 10 20, p. 33).
PRIEDAS
Reglamento (EB) Nr. 440/2008 priedas iš dalies keičiamas taip:
|
1) |
A dalis papildoma šiuo skyriumi: „A.25 DISOCIACIJOS VANDENYJE KONSTANTOS (TITRAVIMO METODAS. SPEKTROFOTOMETRINIS METODAS. KONDUKTOMETRINIS METODAS) ĮVADAS Šis bandymų metodas atitinka EBPO bandymų gaires (TG) 112 (1981 m.). Būtinos sąlygos
Nurodomoji informacija
Tikslinamieji pareiškimai
Tipiniai dokumentai Šis bandymo metodas pagrįstas metodais, pateiktais skirsnyje Literatūra išvardytose nuorodose ir EPA priešgamybinio pranešimo preliminariniame vadovo projekte, 1978 m. rugpjūčio 18 d. METODAS. BANDYMO ĮVADAS, TIKSLAS, TAIKYMO SRITIS, SVARBA, TAIKYMAS IR RIBOS Cheminės medžiagos disociacija vandenyje yra svarbi vertinant jos poveikį aplinkai. Ji daro įtaką medžiagos formai, kuri savo ruožtu lemia jos elgseną ir transportavimą. Ji gali veikti cheminės medžiagos adsorbciją dirvožemyje ir nuosėdose bei jos absorbciją į biologines ląsteles. Apibrėžtys ir vienetai Disociacija yra grįžtamasis skilimas į dvi ar daugiau cheminių dalelių, kurios gali būti joninės. Procesas paprastai žymimas taip: RX ⇌ R ++ X – reakciją apibūdinanti koncentracijos pusiausvyros konstanta yra:
pavyzdžiui, konkrečiu atveju, kai R yra vandenilis (medžiaga yra rūgštis), konstanta yra
arba
Etaloninės medžiagos Šias etalonines medžiagas nebūtina naudoti kiekvienu atveju, kai tiriama nauja cheminė medžiaga. Jos pirmiausia pateiktos tam, kad retkarčiais būtų galima atlikti metodo kalibravimą ir būtų galimybė palyginti rezultatus, jei taikomas kitas metodas.
Būtų naudinga turėti kelias pK vertes turinčią cheminę medžiagą, kaip toliau nurodyta skirsnyje Bandymo metodo principas. Tokia medžiaga galėtų būti:
Bandymo metodo principas Aprašytas cheminis procesas paprastai tik šiek tiek priklauso nuo temperatūros aplinkai būdingame temperatūros intervale. Reikia išmatuoti cheminės medžiagos disocijavusios ir nedisocijavusios formų koncentraciją, kad būtų galima nustatyti disociacijos konstantą. Žinant Apibrėžčių ir vienetų skyriuje nurodytos disociacijos reakcijos stechiometriją, galima nustatyti atitinkamą konstantą. Šiame bandymo metode aprašytu konkrečiu atveju cheminė medžiaga elgiasi kaip rūgštis ar bazė, todėl patogiausias nustatymo būdas – jonizuotos ir nejonizuotos formų santykinės koncentracijos ir tirpalo pH nustatymas. Santykis tarp šių pKa lygties narių pateiktas pirmiau Apibrėžčių ir vienetų skirsnyje. Kai kurios cheminės medžiagos turi daugiau kaip vieną disociacijos konstantą ir galima sukurti panašias lygtis. Kai kurie iš čia aprašytų metodų taip pat tinka vykstant nerūgštinei / bazinei disociacijai. Kokybės kriterijai Pakartojamumas Reikėtų atlikti kartotinį disociacijos konstantos nustatymą (ne mažiau kaip tris kartus) ± 0,1 log vienetų tikslumu. BANDYMO PROCEDŪRŲ APRAŠYMAS Yra du pagrindiniai pKa. nustatymo būdai. Taikant vieną, žinomas cheminės medžiagos kiekis titruojamas etaloniniu rūgšties arba bazės tirpalu; pagal kitą nustatoma jonizuotos ir nejonizuotos formų santykinė koncentracija ir jų priklausomybė nuo pH. Parengiamieji darbai Šiais principais pagrįsti metodai gali būti klasifikuojami kaip titravimo, spektrofotometrinės ir konduktometrinės procedūros. Bandymo tirpalai Taikant titravimo ir konduktometrinį metodą, cheminė medžiaga turėtų būti ištirpinta distiliuotame vandenyje. Taikant spektrofotometrinį ir kitus metodus, naudojami buferiniai tirpalai. Bandomosios cheminės medžiagos koncentracija neturėtų būti didesnė nei 0,01 mol/l arba viena antroji soties koncentracijos, jei ši mažesnė, o tirpalams ruošti turėtų būti naudojama gryniausia turima medžiagos forma. Jei medžiagos tirpumas vidutinis, ją galima ištirpinti mažame tūryje su vandeniu maišaus tirpiklio prieš padidinant iki pirmiau nurodytų koncentracijos verčių. Tirpalus reikėtų tikrinti dėl emulsijos susidarymo naudojant Tindalio šviesos pluoštą, ypač jei buvo naudojamas kitas tirpiklis tirpumui padidinti. Jei naudojami buferiniai tirpalai, jų koncentracija neturėtų būti didesnė kaip 0,05 mol/l. Bandymo sąlygos Temperatūra Temperatūra turėtų būti kontroliuojama bent ± 1°C tikslumu. Nustatymą pageidautina atlikti 20 °C temperatūroje. Jei yra įtarimų dėl reikšmingos priklausomybės nuo temperatūros, nustatymą reikėtų atlikti esant mažiausiai dar dviem temperatūros vertėms. Šiuo atveju temperatūros intervalai turėtų būti 10 °C, o temperatūra kontroliuojama ± 0,1 °C tikslumu. Analizės Dėl metodo bus sprendžiama atsižvelgiant į bandomosios cheminės medžiagos tipą. Jis turi būti pakankamai jautrus, kad būtų galima nustatyti skirtingas daleles esant kiekvienai bandymo tirpalo koncentracijai. Bandymo eiga Titravimo metodas Bandymo tirpalas matuojamas titruojant reikiamu etaloniniu bazės ar rūgšties tirpalu ir matuojant pH po kiekvieno titranto pridėjimo. Iki ekvivalentinio taško titrantą reikėtų įpilti ne mažiau kaip per 10 kartų. Jei pusiausvyra pasiekiama pakankamai greitai, galima naudoti savirašį potenciometrą. Taikant šį metodą nebūtina tiksliai žinoti suminį medžiagos kiekį ir jos koncentraciją. Turi būti imtasi priemonių anglies dioksidui pašalinti. Daugiau informacijos apie procedūrą, atsargumo priemones ir skaičiavimą pateikta tipinių bandymų aprašymuose, pvz., (1), (2), (3), (4) nuorodos. Spektrofotometrinis metodas Nustatomas bangos ilgis, kuriam esant cheminės medžiagos jonizuotos ir nejonizuotos formų ekstinkcijos koeficientai žymiai skiriasi. Gaunamas pastovios koncentracijos tirpalų UV/VIS absorbcijos spektras, esant pH vertei, kai medžiaga yra iš esmės nejonizuota ir visiškai jonizuota bei kelioms tarpinėms pH vertėms. Tai galima atlikti nedidelius koncentruotos rūgšties (bazės) kiekius dedant į palyginti didelį cheminės medžiagos daugiakomponenčio buferinio tirpalo tūrį, iš pradžių esant didelei (mažai) pH vertei (nuor. 5), arba pridedant vienodus cheminės medžiagos pradinio tirpalo, pvz., vandenyje, metanolyje, tūrius į pastovius tūrius įvairių buferinių tirpalų, apimančių reikiamą pH intervalą. Pagal pH ir optinio tankio vertes, esant pasirinktam bangos ilgiui, apskaičiuojamas pakankamas pKa verčių skaičius, naudojant duomenis, gautus bent penkioms pH vertėms, kai cheminė medžiaga yra ne mažiau kaip 10 procentų ir mažiau kaip 90 procentų jonizuota. Papildomi bandymų duomenys ir skaičiavimo metodas pateikti (1) nuorodoje. Konduktometrinis metodas Naudojant žinomos mažos konstantos celę, matuojamas maždaug 0,1 mol/l cheminės medžiagos tirpalo laidžiui matuoti skirtame vandenyje laidis. Taip pat matuojamos kelių šio tirpalo tiksliai praskiestų tirpalų laidžio vertės. Kiekvieną kartą koncentracija mažinama pusiau, o tirpalų serija turi aprėpti bent vieną koncentracijos dydžių eilę. Ribinis laidis esant begaliniam praskiedimui nustatomas atliekant panašų bandymą su Na druska ir ekstrapoliuojant. Taikant Onzagerio lygtį, pagal kiekvieno tirpalo laidį galima apskaičiuoti disociacijos laipsnį, taigi taikant Ostvaldo praskiedimo dėsnį galima apskaičiuoti disociacijos konstantą kaip K = α2C/(1 – α), kai C yra koncentracija moliais litre, o α – disociacijos laipsnis. Turi būti imtasi priemonių CO2 pašalinti. Daugiau informacijos apie bandymo duomenis ir skaičiavimą pateikta tipinių bandymų aprašymuose ir (1), (6) bei (7) nuorodose. DUOMENYS IR ATASKAITOS RENGIMAS Rezultatų apdorojimas Titravimo metodas pKa apskaičiuojamas 10 matavimo taškų titravimo kreivėje. Apskaičiuojamas tokių pKa verčių vidurkis ir standartinis nuokrypis. Reikėtų įtraukti pH priklausomybės nuo etaloninio bazės ar rūgšties tirpalo tūrio grafiką ir duomenis lentelių pavidalu. Spektrofotometriniai metodai Į lenteles įrašomos kiekvienam spektrui gautos optinio tankio ir pH vertės. Pagal tarpinius spektrinių duomenų taškus apskaičiuojamos ne mažiau kaip penkios pKa vertės, taip pat apskaičiuojamas šių rezultatų vidurkis ir standartinis nuokrypis. Konduktometrinis metodas Ekvivalentinis laidis Λ apskaičiuojamas kiekvienai rūgšties koncentracijai ir kiekvienai mišinio, sudaryto iš vieno ekvivalento rūgšties ir 0,98 ekvivalento karbonato neturinčio natrio hidroksido, koncentracijai. Rūgšties perteklius imamas tam, kad nebūtų OH– pertekliaus dėl hidrolizės. Gaunamas 1/Λ kaip √C funkcijos grafikas, o druskos Λo gali būti nustatytas atliekant ekstrapoliavimą į nulinę koncentraciją. Rūgšties Λo gali būti apskaičiuotas, naudojant literatūroje pateiktas H+ ir Na+ vertes. Kiekvienos koncentracijos pKa gali būti apskaičiuota pagal α = Λi /Λo ir Ka = α2C/(1 – α). Tikslesnės Ka vertės gali būti gautos darant judrumo ir aktyvumo pataisas. Reikėtų apskaičiuoti pKa verčių vidurkį ir standartinius nuokrypius. Bandymo ataskaita Reikėtų pateikti visus neapdorotus duomenis, apskaičiuotas pKa vertes kartu su skaičiavimo metodu (pageidautina lentelės pavidalu, koks siūlomas nuor. 1), taip pat pirmiau aprašytus statistinius parametrus. Jei taikomi titravimo metodai, reikėtų pateikti titrantų standartizavimo duomenis. Jei taikomas spektrofotometrinis metodas, reikėtų pateikti visus spektrus. Jei taikomas konduktometrinis metodas, ataskaitoje reikėtų pateikti celės konstantos nustatymo duomenis. Reikėtų pateikti informaciją apie naudojamą įrangą, analizės metodus ir visų naudotų buferinių tirpalų tipą. Reikėtų pateikti bandymo temperatūros vertę (-es). LITERATŪRA
|
|
2) |
B dalies B.5 skyrius pakeičiamas taip: „B.5 ŪMUS AKIŲ DIRGINIMAS IR (ARBA) ĖSDINIMAS ĮVADAS Šis bandymų metodas atitinka EBPO bandymų gaires (TG) 405 (2012). EBPO cheminėms medžiagoms bandyti skirtos bandymų gairės periodiškai peržiūrimos, siekiant, kad jose būtų atsižvelgta į geriausius turimus mokslinius duomenis. Anksčiau peržiūrint šias gaires, ypatingas dėmesys buvo kreipiamas į galimus pagerinimo būdus, įvertinant visą turimą informaciją apie bandomąją cheminę medžiagą, kad būtų išvengta nebūtinų bandymų su laboratoriniais gyvūnais ir taip būtų sprendžiamos jų gerovės problemos. Į TG 405 (priimtas 1981 m. ir atnaujintas 1987, 2002 ir 2012 m.) įtraukta rekomendacija, kad prieš atliekant aprašytą ūmaus akių dirginimo ar ėsdinimo in vivo bandymą, reikėtų atlikti esamų atitinkamų duomenų įrodomosios vertės analizę (1). Jei duomenų nepakanka, rekomenduojama jų gauti atliekant nuosekliuosius bandymus (2)(3). Bandymų strategiją, pateiktą kaip šio bandymų metodo priedėlis, sudaro patvirtinti ir priimti in vitro bandymai. Reglamento (EB) Nr. 1907/2006 dėl cheminių medžiagų registracijos, įvertinimo, autorizacijos ir apribojimų (REACH) (2) taikymo tikslu kompleksinių bandymų strategija taip pat įtraukta į atitinkamą ECHA rekomendaciją (21). Bandymus su gyvūnais reikėtų atlikti tik tais atvejais, kai nustatoma, kad jie yra būtini, išnagrinėjus turimus alternatyvius metodus, ir taikyti tik tuos metodus, kurie nustatyti kaip tinkami. Tuo metu, kai buvo rengiamas šio atnaujinto bandymo metodo projektas, pagal kai kurias reglamentavimo sistemas vis dar buvo būtina arba reikalaujama taikyti šį metodą. Vėliausiame atnaujinime daugiausia dėmesio skiriama analgetikų ir anestetikų naudojimui, nedarant įtakos pagrindinei bandymų gairių koncepcijai ir struktūrai. ICCVAM (3) ir tarptautinė mokslinė nepriklausomų ekspertų grupė peržiūrėjo vietinių anestetikų ir sisteminių analgetikų įprastinio naudojimo naudą bei apribojimus ir humaniško poveikio vertinamąsias baigtis, atliekant in vivo akių dirginimo saugos bandymus (12). Peržiūros išvada yra ta, kad, naudojant vietinius anestetikus ir sisteminius analgetikus, dažniausiai arba visiškai būtų galima išvengti skausmo ir kančių, nedarant įtakos bandymo rezultatui, ir rekomenduojama, kad šios medžiagos būtų visuomet naudojamos. Šiame bandymo metode atsižvelgta į šią peržiūrą. Atliekant ūmaus akių dirginimo ir ėsdinimo in vivo bandymus, įprastai reikėtų naudoti vietinius anestetikus, sisteminius analgetikus ir humaniško poveikio vertinamąsias baigtis. Jų naudojimo išimtys turėtų būti pagrįstos. Šiame metodo aprašyme nurodyti patobulinimai iš esmės sumažins gyvūnų skausmą ir kančias arba jų bus išvengta atliekant daugelį bandymų, kai vis dar yra būtinas in vivo akių saugos bandymas. Subalansuotą prevencinį skausmo valdymą turėtų sudaryti (i) įprastinis išankstinis apdorojimas vietiniu anestetiku (pvz., proparakainu ar tetrakainu) ir sisteminiu analgetiku (pvz., buprenorfinu), (ii) įprastinio paskesnio nuskausminimo sisteminiais analgetikais (pvz., buprenorfinu ir meloksikamu) planas, (iii) planinis gyvūnų stebėjimas, monitoringas ir registravimas dėl klinikinių skausmo ir (arba) kančių požymių ir (iv) planinis visų akių pažeidimo tipų, rimtumo ir eigos stebėjimas, monitoringas ir registravimas. Papildoma informacija pateikta toliau aprašytose atnaujintose procedūrose. Po veikimo bandomąja chemine medžiaga nereikėtų naudoti papildomų vietinių anestetikų ar analgetikų, kad būtų išvengta tyrimo trukdžių. Analgetikų su priešuždegiminiu veikimu (pvz., meloksikamo) nereikėtų naudoti kaip vietinių analgetikų, o sisteminio naudojimo dozės neturėtų trukdyti akių poveikiui. Apibrėžtys aprašytos bandymo metodo priedėlyje. PRADINIAI ASPEKTAI Siekiant užtikrinti duomenų mokslinį patikimumą ir gyvūnų gerovę, in vivo bandymai neturėtų būti numatomi tol, kol atliekant duomenų įrodomosios vertės analizę nebus įvertinti visi turimi duomenys, apibūdinantys galimą cheminės medžiagos ėsdinamąjį ar dirginamąjį poveikį akims. Tokius duomenis sudaro turimų tyrimų su žmonėmis ir (arba) laboratoriniais gyvūnais rezultatai, ėsdinimo ar dirginimo duomenys, gauti apie vieną arba kelias medžiagas, turinčias giminingą struktūrą, arba jų mišinius, duomenys, patvirtinantys cheminės medžiagos stiprias rūgštines arba šarmines savybes (4)(5), be to, patvirtintų ir priimtų in vitro arba ex vivo odos ėsdinimo ir dirginimo bandymų rezultatai (6) (13) (14) (15) (16) (17). Tyrimai gali būti daromi prieš duomenų įrodomosios vertės analizę arba kaip jos rezultatas. Tokia tam tikrų cheminių medžiagų analizė gali parodyti, kad reikia atlikti cheminės medžiagos akių ėsdinimo ar dirginimo gebos in vivo tyrimus. Visais šiais atvejais prieš svarstant in vivo akių bandymo atlikimą, pageidautina prieš tai atlikti cheminės medžiagos in vitro ir (arba) odos ėsdinimo in vivo padarinių tyrimą ir ją įvertinti taikant B.4 bandymų metodo (7) nuosekliųjų bandymų strategiją arba kompleksinių bandymų strategiją, aprašytą ECHA rekomendacijoje (21). Nuosekliųjų bandymų strategija, kurią sudaro patvirtintų in vitro ar ex vivo akių ėsdinimo ar dirginimo bandymų atlikimas, yra įtraukta į šį bandymo metodą kaip priedėlis ir, dėl REACH, į ECHA rekomendaciją (21). Prieš pradedant in vivo bandymus, rekomenduojama laikytis šios bandymų strategijos. Naujoms cheminėms medžiagoms rekomenduojamas nuosekliųjų bandymų metodas, siekiant gauti moksliškai pagrįstus cheminės medžiagos ėsdinimo ar dirginimo duomenis. Esamoms cheminėms medžiagoms, apie kurių odos ir akių ėsdinimo ar dirginimo savybes duomenų nepakanka, ši strategija gali būti taikoma trūkstamiems duomenims gauti. Kitokios bandymo strategijos arba procedūros taikymas arba sprendimas netaikyti nuosekliųjų bandymų metodo turėtų būti pagrįstas. IN VIVO BANDYMO METODO PRINCIPAS Po parengtinio apdorojimo sisteminiu analgetiku ir suleidus atitinkamo vietinio anestetiko, viena iš bandymo gyvūno akių veikiama vienkartine bandomosios cheminės medžiagos doze, neapdorota akis naudojama kaip kontrolinė. Akių dirginimo ir (arba) ėsdinimo geba nustatoma tam tikrais laiko tarpais balais įvertinant junginės, ragenos ir rainelės pažeidimus. Be to, siekiant išsamiai įvertinti poveikį, aprašomas bet koks kitas poveikis ir neigiamas sisteminis poveikis. Tyrimo trukmė turi būti pakankama, kad būtų galima įvertinti, ar poveikis yra grįžtamas ar negrįžtamas. Gyvūnai, kuriems bet kurioje bandymo stadijoje pasireiškia stiprus skausmas, kančios arba pažeidimai, atitinkantys šiame bandymų metode aprašytas humaniško poveikio vertinamąsias baigtis (žr. 26 pastraipą), turi būti humaniškai numarinami, o cheminė medžiaga atitinkamai įvertinta. Sprendimo dėl gaištančių ir stipriai kenčiančių gyvūnų humaniško numarinimo priėmimo kriterijai yra nagrinėjami EBPO rekomendaciniame dokumente (8). IN VIVO BANDYMO METODO PARENGIAMIEJI DARBAI Rūšių parinkimas Tinkamiausias laboratorinis gyvūnas – baltasis triušis; naudojami sveiki, jauni suaugę triušiai. Kitų rūšių ar veislių naudojimas turi būti pagrįstas. Gyvūnų paruošimas Abi kiekvieno bandymui numatyto gyvūno akys turėtų būti patikrintos per 24 h iki bandymo pradžios. Gyvūnai, kuriems nustatomas akių dirginimas, akių defektai arba prieš tai buvęs ragenos pažeidimas, neturėtų būti naudojami. Laikymo ir šėrimo sąlygos Gyvūnai turėtų būti laikomi atskirai. Patalpos, kurioje laikomi bandymo triušiai, temperatūra turėtų būti 20 °C (± 3 °C). Nors santykinė oro drėgmė turėtų būti mažiausiai 30 % ir pageidautina ne didesnė kaip 70 %, išskyrus patalpos plovimo laiką, reikėtų siekti, kad ji būtų 50–60 %. Apšvietimas turėtų būti dirbtinis, taikant 12 h šviesos ir 12 h tamsos seką. Reikėtų vengti per didelio šviesos stiprio. Gyvūnams šerti tinka įprastas laboratorijoje naudojamas pašaras, neribojant geriamojo vandens kiekio. BANDYMO PROCEDŪRA Vietinių anestetikų ir sisteminių analgetikų naudojimas Rekomenduojamos šios procedūros, kad atliekant saugos akims bandymo procedūras būtų išvengta skausmo ir kančių arba jos būtų kiek įmanoma mažesnės. Jas galima pakeisti alternatyviomis procedūromis, jei būtų nustatyta, kad jos vienodai arba labiau padeda išvengti skausmo ir kančių.
Bandomosios cheminės medžiagos įterpimas Bandomoji cheminė medžiaga dedama į kiekvieno gyvūno vienos akies junginės maišelį, švelniai atitraukiant apatinį voką nuo akies obuolio. Vokai švelniai suspaudžiami maždaug vienai sekundei, kad medžiaga neištekėtų. Kita neapdorota akis naudojama kontrolei. Drėkinimas Įdėjus bandomosios cheminės medžiagos, bandymo gyvūno akių nereikėtų plauti mažiausiai 24 h, išskyrus kietąsias medžiagas (žr. 18 pastraipą) ir jei iš karto pasireiškia ėsdinimo arba dirginimo poveikis. Po 24 h akis galima plauti, jei manoma, kad tai reikia daryti. Nerekomenduojama naudoti pagalbinės gyvūnų grupės plovimo įtakai tirti, išskyrus atvejus, kai tai yra moksliškai pagrįsta. Prireikus pagalbinės grupės, reikėtų naudoti du triušius. Plovimo sąlygos turėtų būti išsamiai dokumentuotos, pvz., plovimo laikas; plovimo tirpalo sudėtis ir temperatūra; plovimo trukmė, tirpalo tūris ir srautas. Dozės dydis (1) Skysčių bandymas Bandant skysčius, naudojama 0,1 ml dozė. Nereikėtų naudoti purškiklio cheminei medžiagai tiesiai į akį įlašinti. Prieš įlašinant 0,1 ml į akį, skystasis purškiklis išpurškiamas į indą ir surenkamas. (2) Kietųjų medžiagų bandymas Bandant kietąsias, pastos ir dalelių pavidalo chemines medžiagas, naudojamos medžiagos tūris turėtų būti 0,1 ml arba masė – ne didesnė kaip 100 mg. Bandomoji cheminė medžiaga turėtų būti sumalta į smulkias dulkes. Kietosios medžiagos tūrį reikėtų matuoti ją švelniai sutankinus, pvz., tapšnojant matavimo indą. Jei stebint pirmą kartą, praėjus 1 h po akies apdorojimo, kieta bandomoji cheminė medžiaga nepasišalino iš bandymo gyvūno akies veikiant fiziologiniams mechanizmams, akį galima praplauti fiziologiniu tirpalu arba distiliuotu vandeniu. (3) Aerozolių bandymas Prieš įlašinant į akį rekomenduojama visas purškiamąsias medžiagas ir aerozolius iš pradžių surinkti į indą. Viena išimtis taikoma slėginiuose aerozolių purkštuvuose esančioms cheminėms medžiagoms, kurių negalima surinkti dėl garavimo. Tokiais atvejais akis laikoma atverta ir bandomoji cheminė medžiaga maždaug vieną sekundę purškiama tiesiai į akį stačiu kampu iš 10 cm atstumo. Šis atstumas gali skirtis, atsižvelgiant į purkštuvo ir jo turinio slėgį. Reikia imtis atsargumo priemonių nepažeisti akies veikiant purškimo slėgiui. Atitinkamais atvejais gali tekti įvertinti mechaninio akies pažeidimo srauto jėga tikimybę. Aerozolio dozės įvertį būtų galima gauti modeliuojant bandymą taip: cheminė medžiaga purškiama ant sveriamojo popieriaus pro triušio akies dydžio angą, esančia tiesiai prieš popierių. Popieriaus masės padidėjimas naudojamas apytikriam į akį įpurkšto kiekio įvertinimui. Lakiųjų cheminių medžiagų dozė gali būti įvertinta pasveriant indą su chemine medžiaga prieš įpurškimą ir po jo. Pradinis bandymas (akies dirginimo ar ėsdinimo bandymas in vivo su vienu gyvūnu) Griežtai rekomenduojama atlikti in vivo bandymą iš pradžių su vienu gyvūnu (žr. šio bandymo priedėlį Nuosekliųjų bandymų strategija akių dirginimui ir ėsdinimui nustatyti). Stebėjimai turėtų padėti nustatyti rimtumą ir grįžtamumą prieš atliekant patvirtinamąjį bandymą su antruoju gyvūnu. Jei šio bandymo rezultatai rodo, kad taikant aprašytąją procedūrą cheminė medžiaga yra akis ėsdinanti arba stipriai jas dirginanti, kitų akies dirginimo bandymų nereikėtų atlikti. Patvirtinamasis bandymas (in vivo akies dirginimo bandymas su papildomais gyvūnais) Jei atliekant pradinį bandymą ėsdinantis poveikis nestebimas, dirginamąjį poveikį arba neigiamą atsaką reikėtų patvirtinti naudojant ne daugiau kaip du papildomus gyvūnus. Jei atliekant pradinį bandymą ėsdinantis poveikis stebimas, patvirtinamąjį bandymą rekomenduojama atlikti nuosekliuoju būdu su vienu gyvūnu, o ne veikiant abu papildomus gyvūnus vienu metu. Jei antrajam gyvūnui pasireiškia ėsdinamasis arba stiprus dirginamasis poveikis, bandymas nutraukiamas. Jei antrajam gyvūnui gautų rezultatų pakanka klasifikavimui nustatyti, kiti papildomi bandymai neatliekami. Stebėjimo periodas Stebėjimo laikotarpio trukmės turėtų pakakti stebimo poveikio dydžiui ir grįžtamumui visiškai įvertinti. Tačiau bandymą reikėtų baigti bet kuriuo momentu, kai tik gyvūnui pasireiškia stipraus skausmo arba kančios požymiai (8). Poveikio grįžtamumui nustatyti gyvūnai paprastai stebimi 21 parą po bandomosios cheminės medžiagos davimo. Jei grįžtamumas pastebimas anksčiau nei 21 parą, bandymas nutraukiamas tuo momentu. Klinikiniai stebėjimai ir akių reakcijos įvertinimas balais Reikėtų išsamiai įvertinti, ar akys pažeistos ar ne, praėjus vienai valandai po TCA, vėliau įvertinant ne rečiau kaip kasdien. Pirmąsias 3 paras gyvūnus reikėtų įvertinti kelis kartus per dieną, siekiant užtikrinti, kad sprendimai dėl nutraukimo būtų priimti laiku. Bandymo gyvūnai turėtų būti įprastiniu būdu įvertinami visą tyrimo trukmę skausmo ir (arba) kančių klinikiniams požymiams (pvz., kartotinio akies lietimo letena arba trynimo, per dažno mirkčiojimo, per didelio ašarojimo) (9) (10) (11) nustatyti ne rečiau kaip du kartus per dieną, esant ne mažesniam kaip 6 h intervalui tarp stebėjimų, arba dažniau, jei būtina. Tai yra būtina siekiant (i) tinkamai įvertinti gyvūnus dėl skausmo ir kančių požymių buvimo, kad būtų priimti pagrįsti sprendimai, ar reikia padidinti analgetikų dozes, ir (ii) įvertinti gyvūnus dėl nustatytų humaniško poveikio vertinamųjų baigčių buvimo, kad būtų galima priimti pagrįstus sprendimus, ar reikia humaniškai numarinti gyvūnus, ir užtikrinti, kad tokie sprendimai būtų priimti laiku. Paprastai reikėtų dažyti fluoresceinu ir naudoti biologinį mikroskopą su plyšine lempa, jei manoma, kad to reikia (pvz., žaizdos gyliui įvertinti, esant ragenos išopėjimui) kaip priemonės akių pažaidai aptikti bei išmatuoti ir įvertinti, ar pasiekti humaniško numarinimo vertinamųjų baigčių kriterijai. Galima kaupti stebimų pažeidimų skaitmenines nuotraukas, kurios būtų naudojamos palyginimui ir kaip nuolatinis akių pažaidų laipsnio registravimas. Gyvūnai turėtų būti bandomi ne ilgiau nei būtina galutinei informacijai gauti. Gyvūnai, kuriems pasireiškia stiprus skausmas arba kančia, turi būti iš karto humaniškai numarinti, o cheminė medžiaga atitinkamai įvertinta. Turėtų būti humaniškai numarinami gyvūnai, kuriems po įlašinimo atsiranda šie pažeidimai (žr. 1 lentelę dėl pažeidimo balų aprašymo): ragenos pradūrimas arba didelės ragenos opos, įskaitant stafilomą; kraujo atsiradimas priekinėje akies kameroje; 4 balų ragenos drumstumas; šviesos reflekso nebuvimas (2 balų rainelės atsakas) ilgiau kaip 72h; junginės membranos opos; junginės arba mirksimosios membranos nekrozė, arba nekrozinio audinio lupimasis. Numarinti reikia todėl, kad tokie pažeidimai paprastai yra negrįžtami. Be to, rekomenduojama toliau nurodytus akių pažeidimus naudoti kaip humaniško poveikio vertinamąsias baigtis tyrimui užbaigti anksčiau nei 21 paros stebėjimo laikotarpiu. Sunkių dirginimo ar ėsdinimo sužeidimų ir sužeidimų, kurie, kaip manoma, nebūtų visiškai grįžtami baigiantis 21 paros stebėjimo periodui, numatomaisiais pažeidimais laikomi šie: didelis žaizdos gylis (pvz., ragenos opa išplinta giliau nei paviršiniai ragenos medžiagos sluoksniai), ragenos krašto suirimas > 50 % (rodo junginės audinio blukimas), ir stipri akių infekcija (pūlių išsiskyrimas). Ragenos paviršiaus vaskuliarizacijos (t. y. panuso), nudažyto fluoresceinu ploto nemažėjimo per kasdieniniam vertinimui nustatytą trukmę ir (arba) reepitelizacijos nebuvimo, praėjus 5 paroms nuo cheminės medžiagos įterpimo, derinys taip pat galėtų būti laikomas potencialiai naudingu kriterijumi priimant klinikinį sprendimą dėl pirmalaikio tyrimo nutraukimo. Tačiau vien tik šių duomenų nepakanka pirmalaikiam tyrimo nutraukimui pagrįsti. Nustačius stiprų poveikį akims, reikėtų pasikonsultuoti su gydančiuoju arba kvalifikuotu laboratorijos veterinaru arba su klinikinius pažeidimus nustatyti apmokytu personalu, kad būtų galima nustatyti, ar šių poveikių derinys pateisina pirmalaikį tyrimo nutraukimą. Turėtų būti gauti akių (junginės, ragenos ir rainelės) pažeidimai balais ir užrašyti praėjus 1, 24, 48 ir 72 h po bandomosios cheminės medžiagos uždėjimo (1 lentelė). Jei gyvūnų akių pažeidimų neatsiranda, bandymas gali būti baigtas ne anksčiau kaip 3 paros po įlašinimo. Gyvūnus su nedideliais pažeidimais reikėtų stebėti tol, kol tie pažeidimai pranyksta, arba 21 parą, kai tyrimas baigiamas. Stebėjimai turi būti atliekami ir registruojami ne rečiau kaip po 1 h, 24 h, 48 h, 72 h, 7 parų, 14 parų ir 21 paros, kad būtų galima nustatyti pažeidimų būseną ir jų grįžtamumą ar negrįžtamumą. Prireikus stebima dažniau, kad būtų galima nustatyti, ar bandymų gyvūną reikėtų numarinti iš humaniškų paskatų ar pašalinti iš tyrimo dėl neigiamų rezultatų. Akių pažeidimų vertinimo balai (1 lentelė) turėtų būti užrašomi kiekvieno tikrinimo metu. Taip pat reikėtų pranešti apie visus kitus akių pažeidimus (pvz., panusą, dėmių atsiradimą, priekinės kameros pokyčius) arba neigiamą sisteminį poveikį. Reakcijos tikrinimą galima palengvinti naudojant binokulinę lupą, rankinę plyšinę lempą, biologinį mikroskopą arba kitokį tinkamą įtaisą. Užrašius 24 h stebėjimus, akys gali būti toliau tiriamos naudojant fluoresceiną. Akių reakcijos įvertinimas balais neišvengiamai yra subjektyvus. Siekiant labiau suderinti akių reakcijos įvertinimą balais ir padėti bandymo laboratorijoms ir visiems, kurie vykdo ir aiškina stebėjimus, juos vykdantis personalas turi būti atitinkamai išmokytas taikyti įvertinimo balais sistemą. DUOMENYS IR ATASKAITOS RENGIMAS Rezultatų įvertinimas Akių dirginimo balus reikėtų įvertinti atsižvelgiant į pažeidimų tipą ir rimtumą bei į poveikio grįžtamumą arba negrįžtamumą. Atskiri balai nėra cheminės medžiagos dirginamųjų savybių absoliutusis įvertis, kadangi dar įvertinamas kitas bandomosios cheminės medžiagos poveikis. Į šiuos atskirai gautus balus reikėtų žiūrėti kaip į palyginamąsias vertes, reikšmingas tik tais atvejais, kai jas patvirtina išsamus visų kitų stebėjimų aprašymas ir įvertinimas. Bandymo ataskaita Į bandymo ataskaitą turėtų būti įtraukta ši informacija:
Rezultatų aiškinimas Su laboratoriniais gyvūnais atliktų akių dirginimo tyrimų rezultatų ekstrapoliavimas žmonėms tinka tik tam tikru mastu. Daugeliu atvejų baltieji triušiai yra jautresni akis dirginančioms arba ėsdinančioms medžiagoms nei žmonės. Aiškinant rezultatus turi būti stengiamasi neįtraukti antrinės infekcijos sukelto dirginimo. LITERATŪRA
1 lentelė Akių pažeidimo vertinimo balais skalė
Priedėlis APIBRĖŽTYS Rūgšties ar šarmo atsarga – jei preparatai rūgštiniai, natrio hidroksido/100 g preparato kiekis (g), kurio reikia nurodytai pH vertei gauti. Jei preparatai šarminiai, natrio hidroksido kiekis (g), ekvivalentiškas sieros rūgšties/100 g preparato kiekiui (g), kurio reikia nurodytai pH vertei gauti (Young et al. 1988). Cheminė medžiaga – medžiaga arba mišinys. Nedirginančios cheminės medžiagos – medžiagos, kurios neklasifikuojamos kaip JAV aplinkos apsaugos agentūros (AAA) I, II ar III kategorijos; GHS 1, 2, 2A ar 2B kategorijos arba ES 1 ar 2 kategorijos akis dirginančios medžiagos (17) (18) (19). Akis ėsdinančios cheminės medžiagos – a) cheminės medžiagos, kurios sukelia negrįžtamąjį akies audinio pažeidimą; b) cheminės medžiagos, kurios klasifikuojamos kaip GHS 1 kategorijos, ar AAA I kategorijos akis dirginančios medžiagos arba ES 1 kategorijos (17) (18) (19). Akis dirginančios cheminės medžiagos – a) cheminės medžiagos, kurios sukelia grįžtamuosius akies pokyčius; b) cheminės medžiagos, kurios klasifikuojamos kaip AAA II ar III kategorijos; GHS 2, 2A ar 2B kategorijos arba ES 2 kategorijos akis dirginančios medžiagos (17) (18) (19). Akis stipriai dirginančios medžiagos – a) cheminės medžiagos, sukeliančios akies audinių pažeidimą, kuris neišnyksta per 21 parą nuo įterpimo, arba sukeliančios smarkų fizinį regėjimo pablogėjimą; b) cheminės medžiagos, kurios klasifikuojamos kaip GHS 1 kategorijos, AAA I kategorijos arba ES 1 kategorijos akis dirginančios medžiagos (17) (18) (19). Bandomoji cheminė medžiaga – taikant šį metodą bandoma medžiaga arba mišinys. Nuosekliųjų bandymų metodas – pakopomis atliekamų bandymų strategija, kai tam tikra eilės tvarka nagrinėjama visa turima informacija apie bandomąją cheminę medžiagą, kiekvienoje pakopoje taikant įrodomosios vertės analizės procesą, siekiant nustatyti, ar yra pakankamai duomenų sprendimui dėl pavojingumo kategorijos priimti, prieš pereinant prie kitos pakopos. Jei bandomajai cheminei medžiagai dirginamąją gebą galima priskirti atsižvelgiant į turimą informaciją, papildomų bandymų atlikti nereikia. Jei atsižvelgiant į turimą informaciją, bandomajai cheminei medžiagai dirginamosios gebos priskirti neįmanoma, taikoma nuosekliųjų bandymų su gyvūnais procedūra tol, kol galima gauti nedviprasmį klasifikavimą. Įrodomosios vertės analizė (procesas): Sukauptos informacijos privalumų ir trūkumų naudojimas, kad būtų galima pagrįsti išvadą, kuri, atsižvelgiant į pavienius duomenis, gali nebūti akivaizdi. B.5 BANDYMŲ METODO PRIEDĖLIS (4) NUOSEKLIŲJŲ BANDYMŲ STRATEGIJA AKIŲ DIRGINIMUI IR ĖSDINIMUI NUSTATYTI Bendrieji aspektai Siekiant gauti nuodugnių mokslinių rezultatų ir rūpinantis gyvūnų gerove, svarbu be reikalo nenaudoti gyvūnų ir kiek įmanoma mažinti visus bandymus, kurie gyvūnams gali sukelti stiprius atsakus. Visa informacija apie cheminę medžiagą dėl jos galimo ėsdinamojo ar dirginamojo poveikio odai turėtų būti įvertinta prieš sprendžiant dėl in vivo bandymų. Jei jau yra pakankamai duomenų galimam bandomosios cheminės medžiagos ėsdinamajam arba dirginamajam odos poveikiui klasifikuoti, su laboratoriniais gyvūnais bandymų atlikti nereikia. Taigi, taikant duomenų įrodomosios vertės analizę ir nuosekliųjų bandymų strategiją, iki minimumo sumažėja būtinybė atlikti in vivo bandymus, ypač jei tikėtina, kad cheminė medžiaga gali sukelti stiprias reakcijas. Turimai informacijai apie cheminių medžiagų dirginamąjį ir ėsdinamąjį poveikį akims įvertinti rekomenduojama taikyti duomenų įrodomosios vertės analizę, kuri leistų spręsti, ar tokio poveikio galimybei apibūdinti reikia atlikti papildomus tyrimus, išskyrus in vivo akių tyrimus. Jei reikia papildomų tyrimų, atitinkamiems eksperimentiniams duomenims gauti, rekomenduojama taikyti nuosekliųjų bandymų strategiją. Jei nėra medžiagų bandymo duomenų jų ėsdinamajam ar dirginamajam poveikiui odai įvertinti, reikėtų taikyti nuosekliųjų bandymų strategiją. Šiame priedėlyje aprašyta pradinių bandymų strategija sukurta EBPO praktiniame seminare (1). Vėliau ji buvo patvirtinta bei išplėsta kaip integruota darnioji pavojų dėl cheminių medžiagų poveikio žmonių sveikatai ir aplinkai klasifikavimo sistema, 1998 m. lapkričio mėn. priimta 28-ame jungtiniame cheminių medžiagų komiteto ir cheminių medžiagų darbo grupės posėdyje (2) ir 2011 m. atnaujinta EBPO ekspertų grupės. Nors ši bandymų strategija nėra sudėtinė B.5 bandymo metodo dalis, ji yra rekomenduojamas akių dirginimo ar ėsdinimo savybių nustatymo būdas. Šis būdas atitinka geriausią praktiką ir yra akių dirginimo ar ėsdinimo in vivo bandymų etikos etalonas. Bandymo metode pateikiamos in vivo bandymų rekomendacijos ir apibendrinami veiksniai, į kuriuos reikėtų atkreipti dėmesį prieš pradedant tokį bandymą. Nuosekliųjų bandymų strategijoje siūlomas duomenų įrodomosios vertės analizės būdas, kuris leistų įvertinti turimus duomenis apie bandomųjų cheminių medžiagų akių dirginimo ar ėsdinimo savybes, kad būtų galima nuosekliai gauti reikiamų duomenų apie chemines medžiagas, kurias reikia papildomai ištirti arba kurios nebuvo tirtos. Taikant strategiją iš pradžių atliekami patvirtinti ir priimti in vitro ar ex vivo bandymai ir tada TM B.4 tyrimai specifinėmis aplinkybėmis (3) (4). Nuosekliųjų bandymų strategijos aprašymas Siekiant nustatyti in vivo akių bandymų reikalingumą, prieš atliekant bandymus, kurie būtų nuosekliųjų bandymų strategijos dalis (schema), reikėtų įvertinti visą turimą informaciją. Nors reikšmingos informacijos galima būtų gauti vertinant atskirus parametrus (pvz., ribines pH vertes), turėtų būti nagrinėjama visa turima informacija. Priimant įrodomosios vertės analizės sprendimą, turėtų būti įvertinti visi atitinkami duomenys apie konkrečios cheminės medžiagos ir jos struktūrinių analogų poveikį, ir turėtų būti pateiktas sprendimo priėmimo pagrindimas. Didžiausias dėmesys turėtų būti kreipiamas į turimus duomenis apie cheminę medžiagą, gautus tiriant žmones ir gyvūnus, o vėliau tirti in vitro arba ex vivo bandymų rezultatus. Ėsdinančiųjų medžiagų in vivo tyrimų reikėtų kiek įmanoma vengti. Toliau pateikiami bandymų strategijos veiksniai.
AKIŲ DIRGINIMO AR ĖSDINIMO BANDYMO IR ĮVERTINIMO STRATEGIJA
LITERATŪRA
|
|
3) |
B dalies B.10 skyrius pakeičiamas taip: „B.10 Žinduolių chromosomų aberacijų in vitro bandymas ĮVADAS Šis bandymų metodas atitinka EBPO bandymų gaires (TG) 473 (2016). Jis yra genetinės toksikologijos metodų serijos dalis. Yra parengtas EBPO dokumentas, kuriame glaustai pateikiama informacijos apie genetinės toksikologijos bandymus ir naujausių šių gairių pakeitimų apžvalga (1). Chromosomų aberacijų tyrimo in vitro tikslas – identifikuoti chemines medžiagas, sukeliančias žinduolių ląstelių kultūros chromosomų aberacijas (2) (3) (4). Struktūrinės aberacijos gali būti 2 tipų: chromosominės ar chromatidinės. Atliekant chromosomų aberacijų tyrimus in vitro galėtų atsirasti poliploidija (įskaitant endoreduplikaciją). Nors aneugeninės cheminės medžiagos gali sukelti poliploidiją, pati poliploidija nerodo aneugeninio potencialo ir gali tiesiog rodyti ląstelių ciklo sutrikimą arba citotoksiškumą (5). Šis bandymas nenumatytas aneuploidijai matuoti. Aneuploidijai aptikti būtų galima rekomenduoti in vitro mikrobranduolių bandymą (6). Tiriant chromosomų aberacijas in vitro, galima naudoti gerai žinomų ląstelių linijų arba žmogaus ar graužikų kilmės pirminių ląstelių kultūras. Naudojamas ląsteles reikėtų pasirinkti pagal jų gebėjimą augti kultūroje, kariotipo stabilumą (įskaitant chromosomų skaičių) ir chromosomų aberacijų spontaninį dažnumą. Atsižvelgiant į šiuo metu turimus duomenis, neįmanoma pateikti patikimų rekomendacijų, bet svarbu patarti, kad, įvertinant cheminius pavojus, reikėtų atsižvelgti į bandymams pasirinktų ląstelių p53 būseną, genetinį (kariotipo) stabilumą, DNR atkūrimo gebą ir kilmę (graužikų, palyginti su žmogaus). Todėl šio bandymo metodo naudotojai raginami atsižvelgti į šių ir kitų ląstelių charakteristikų įtaką ląstelių linijos savybėms aptinkant chromosomų aberacijų atsiradimą, nes šios srities žinių visą laiką daugėja. Vartojamų terminų apibrėžtys pateiktos 1 priedėlyje. PRADINIAI ASPEKTAI IR APRIBOJIMAI Bandymus atliekant in vitro paprastai reikia naudoti egzogeninį metabolinio aktyvinimo šaltinį, išskyrus atvejus, kai ląstelės yra metaboliškai pajėgios bandomųjų cheminių medžiagų atžvilgiu. Egzogeninė metabolinio aktyvinimo sistema nevisiškai atkartoja in vivo sąlygas. Reikėtų stengtis išvengti sąlygų, kurioms esant būtų gauti dirbtinai teigiami rezultatai, t. y. chromosomos būtų pažeistos ne dėl tiesioginės sąveikos tarp bandomųjų cheminių medžiagų ir chromosomų; tokias sąlygas sudaro pH ar osmolialumo pokyčiai (8) (9) (10), sąveika su terpės komponentais (11) (12) ar per didelis citotoksiškumo lygis (13) (14) (15) (16). Šis bandymas naudojamas aptikti chromosomų aberacijas, kurios gali atsirasti dėl klastogeninio poveikio reiškinių. Chromosomų aberacijos atsiradimo analizė turėtų būti atliekama naudojant metafazės ląsteles. Todėl svarbu, kad įvyktų apdorotos ir neapdorotos kultūrų ląstelių mitozė. Pramoninėms nanomedžiagoms gali prireikti tam tikro šio bandymų metodo pakeitimų, kurie šiame bandymų metode neaprašyti. Prieš taikant bandymų metodą mišiniui, kad būtų gauti numatomo reglamentavimo tikslui skirti duomenys, reikėtų panagrinėti, ar metodu galima pasiekti tą tikslą atitinkančius rezultatus ir, jei taip, dėl kokios priežasties. Tokie svarstymai nereikalingi, kai yra reglamentavimo reikalavimas bandyti mišinį. BANDYMO PRINCIPAS Žmogaus arba kitų žinduolių kilmės ląstelių kultūros veikiamos bandomąja chemine medžiaga naudojant egzogeninį metabolinio aktyvinimo šaltinį ar jo nenaudojant, jei naudojamos reikiamą metabolinę gebą turinčios ląstelės (žr. 13 pastraipą). Tam tikrais iš anksto nustatytais tarpais nuo ląstelių kultūrų veikimo bandomąja chemine medžiaga pradžios ląstelės apdorojamos metafazę stabdančia chemine medžiaga (pvz., kolcemidu arba kolchicinu), surenkamos, dažomos, o metafazės ląstelės tiriamos mikroskopu, kad būtų nustatytos chromatidinės ir chromosominės aberacijos. METODO APRAŠYMAS Parengiamieji darbai Ląstelės Galima naudoti įvairias ląstelių linijas (pvz., kiniškojo žiurkėno kiaušidžių (CHO), kiniškojo žiurkėno plaučių V79, kiniškojo žiurkėno plaučių (CHL)/IU, TK6 ląsteles) arba pirmines ląstelių kultūras, įskaitant žmogaus ar kitų žinduolių periferinio kraujo limfocitus (7). Naudojamų ląstelių linijų pasirinkimą reikėtų moksliškai pagrįsti. Naudojant pirmines ląsteles, dėl gyvūnų gerovės priežasčių reikėtų atsižvelgti į galimybę naudoti, jei įmanoma, žmogiškos kilmės pirmines ląsteles, ir ėminius imti atsižvelgiant į žmonių etikos principus ir taisykles. Žmogaus periferinio kraujo limfocitus reikėtų gauti iš jaunų (maždaug 18–35 metų amžiaus), nerūkančių žmonių, kurie nesirgtų ar kurie nebūtų neseniai paveikti genotoksiniais agentais (pvz., cheminėmis medžiagomis, jonizuojančiąja spinduliuote) tokiu mastu, kad tai padidintų chromosomų aberacijų foninį dažnumą. Tai užtikrintų, kad chromosomų aberacijų foninis dažnumas būtų mažas ir pastovus. Chromosomų aberacijų dažnumo atskaitos vertė didėja senstant ir ši tendencija labiau pasireiškia moterims nei vyrams (17) (18). Jei naudojamos ląstelės paimamos daugiau kaip iš vieno donoro, turėtų būti nurodytas donorų skaičius. Būtina įrodyti, kad ląstelės dalijosi nuo ląstelių ėminio apdorojimo bandomąja chemine medžiaga pradžios. Ląstelių kultūros laikomos eksponentinio ląstelių augimo fazėje (ląstelių linijos) arba stimuliuojamos dalytis (pirminės limfocitų kultūros), kad ląstelės būtų veikiamos skirtingose ląstelės ciklo stadijose, nes ląstelių stadijų jautris bandomosioms cheminėms medžiagoms gali būti nežinomas. Pirminės ląstelės, kurias reikia stimuliuoti mitogeniniais agentais, kad jos pradėtų dalytis, paprastai daugiau nesinchronizuojamos jas veikiant bandomąja chemine medžiaga (pvz., žmogaus limfocitai po 48 h mitogeninio stimuliavimo). Naudoti sinchronizuotas ląsteles apdorojimo metu nerekomenduojama, bet gali būti priimtina, jei būtų pagrįsta. Terpės ir kultūros sąlygos Prižiūrimoms kultūroms reikėtų naudoti reikiamą kultūros terpę ir inkubavimo sąlygas (kultūros indus, drėkinamąją 5 % CO2 atmosferą, jei tinka, inkubavimo temperatūrą – 37 °C). Ląstelių linijos turėtų būti reguliariai tikrinamos, ar nesikeičia modalinis chromosomų skaičius ir nėra mikoplazmos užkrato (7) (19), o užkrėstos arba pakitusio modalinio chromosomų skaičiaus ląstelės neturėtų būti naudojamos. Turėtų būti nustatyta bandymo laboratorijoje naudojamų ląstelių linijų ar pirminių kultūrų normalaus ląstelių ciklo trukmė ir ji turėtų atitikti paskelbtas ląstelių charakteristikas (20). Kultūrų paruošimas Ląstelių linijos: ląstelės yra dauginamos iš kamieninių kultūrų, sėjamos kultūros terpėje tokiu tankiu, kad ląstelių suspensijos ar monosluoksniai visą laiką iki pat surinkimo momento augtų eksponentiškai (pvz., reikėtų vengti monosluoksniuose augančių ląstelių susiliejimo). Limfocitai: viso kraujo ėminys, apdorotas antikoaguliantu (pvz., heparinu), ar iš to kraujo atskirti limfocitai auginami (pvz., žmogaus limfocitai – 48 h) esant mitogeno (pvz., žmogaus limfocitams – fitohemagliutinino (PHA)), kad ląstelės pradėtų dalytis prieš jas paveikiant bandomąja chemine medžiaga. Metabolinis aktyvinimas Kai naudojamos nepakankamos endogeninės metabolinės gebos ląstelės, reikėtų naudoti egzogenines metabolizavimo sistemas. Jei nebūtų pagrįsta kita sistema, dažniausiai kaip numatytoji rekomenduojama sistema yra kofaktoriumi papildyta pomitochondrinė frakcija (S9), ruošiama iš graužikų (paprastai žiurkių) kepenų, apdorotų fermentų aktyvumą skatinančiais agentais, pvz,. Aroclor 1254 (21) (22) (23) ar fenobarbitalio ir β-naftoflavono derinys (24) (25) (26) (27) (28) (29). Pastarasis derinys neprieštarauja Stokholmo konvencijai dėl patvariųjų organinių teršalų (30) ir pasirodė esąs toks pat veiksmingas kaip Aroclor 1254 mišrių funkcijų oksidazėms skatinti (24) (25) (26) (28). S9 frakcija paprastai naudojama nuo 1 % iki 2 % (tūrio) koncentracijos, bet galutinio bandymo terpėje gali būti padidinta iki 10 % (tūrio). Apdorojant reikėtų vengti naudoti produktus, kurie mažina mitozinį indeksą, ypač su kalciu kompleksus sudarančius produktus (31). Naudojamos egzogeninės metabolinio aktyvinimo sistemos ar metabolizmo skatinimo priemonės tipo ir koncentracijos pasirinkimui įtakos gali turėti bandomų cheminių medžiagų klasė. Bandomosios cheminės medžiagos ruošimas Prieš apdorojant ląsteles, kietąsias chemines medžiagas reikėtų ištirpinti atitinkamuose tirpikliuose ir, jei reikia, praskiesti (žr. 23 pastraipą). Skystąsias chemines medžiagas galima dėti tiesiogiai į bandymo sistemą ir (arba) praskiesti prieš apdorojant bandymo sistemą. Dujos ar lakiosios bandomosios cheminės medžiagos turėtų būti bandomos atitinkamai pakeitus standartinius protokolus, pvz., apdorojimas sandariuose kultūros induose (32) (33) (34). Bandomųjų cheminių medžiagų preparatus reikėtų ruošti prieš pat apdorojimą, išskyrus atvejus, kai stabilumo duomenys rodo galimybę laikyti. Bandymo sąlygos Tirpikliai Tirpiklį reikėtų pasirinkti taip, kad būtų optimizuotas bandomosios cheminės medžiagos tirpumas, bet nebūtų daroma neigiama įtaka tyrimo eigai, pvz., kistų ląstelių augimas, būtų paveiktas bandomosios cheminės medžiagos vientisumas, vyktų reakcija su kultūros indais, būtų pakenkta metabolinio aktyvinimo sistemai. Jei įmanoma, rekomenduojama naudoti vandeninį tirpiklį (ar kultūros terpę). Gerai ištirti tirpikliai yra, pvz., vanduo ar dimetilsulfoksidas. Paprastai organinio tirpiklio koncentracija galutinio apdorojimo terpėje neturėtų būti didesnė kaip 1 % (tūrio), o vandeninių tirpiklių (natrio chlorido tirpalo ar vandens) – 10 % (tūrio). Jei naudojami tinkamai neištirti tirpikliai (pvz., etanolis ar acetonas), jų naudojimas turėtų būti pagrįstas duomenimis, rodančiais, kad tirpiklis yra suderinamas su bandomosiomis cheminėmis medžiagomis bei bandymo sistema ir kad naudojama koncentracija nesukelia genetinio toksiškumo. Jei tokių patvirtinančių duomenų nebūtų, svarbu įtraukti neapdorotus kontrolinius ėminius (žr. 1 priedėlį), kurie įrodytų, kad pasirinktas tirpiklis nesukelia žalingo arba klastogeninio poveikio. Ląstelių proliferacijos bei citotoksiškumo matavimas ir apdorojimo koncentracijos verčių parinkimas Nustatant didžiausią bandymui naudojamą bandomosios cheminės medžiagos koncentraciją reikėtų vengti koncentracijos, galinčios sukelti dirbtinį teigiamą atsaką, pvz., kuri sukeltų per didelį citotoksiškumą (žr. 22 pastraipą), nuosėdų kultūros terpėje (žr. 23 pastraipą) ar žymius pH arba osmolialumo pokyčius (žr. 5 pastraipą). Jei bandomosios cheminės medžiagos pridėjimo metu žymiai pakinta terpės pH vertė, ją būtų galima reguliuoti buferuojant galutinio apdorojimo terpę, kad būtų išvengta dirbtinių teigiamų rezultatų ir būtų užtikrintos tinkamos kultūros sąlygos. Ląstelių proliferacija matuojama siekiant įsitikinti, ar bandymo metu pakankamas apdorotų ląstelių skaičius pasiekė mitozę ir ar apdorojama esant reikiamam citotoksiškumo lygiui (žr. 18 ir 22 pastraipas). Citotoksiškumą reikėtų nustatyti pagrindinio bandymo metu pagal atitinkamus ląstelių žūties ir augimo rodiklius, esant ir nesant metaboliniam aktyvinimui. Nors citotoksiškumo įvertinimas atliekant pradinį bandymą gali būti naudingas pagrindinio bandymo koncentracijos vertėms geriau apibrėžti, pradinis bandymas nėra privalomas. Jei jis būtų atliekamas, jis neturėtų pakeisti citotoksiškumo matavimo atliekant pagrindinį bandymą. Santykinis populiacijos padvigubėjimas (RPD) ar santykinis ląstelių skaičiaus padidėjimas (RICC) yra tinkami metodai citotoksiškumui įvertinti atliekant citogenetinius bandymus (13) (15) (35) (36) (55) (formules žr. 2priedėlyje). Jei apdorojimas yra ilgalaikis, o ėminių ėmimo laikas nuo apdorojimo pradžios yra daugiau kaip 1,5 karto ilgesnis nei normalaus ląstelių ciklo trukmė (t. y. iš viso yra daugiau kaip 3 kartus ilgesnis nei ląstelių ciklo trukmė), citotoksiškumo įvertis taikant RPD galėtų būti per mažas (37). Šiomis aplinkybėmis geresnis matas galėtų būti RICC arba naudingas įvertis galėtų būti ir RPD, citotoksiškumą įvertinant praėjus laikui, kuris būtų 1,5 karto ilgesnis nei normalaus ląstelių ciklo trukmė. Jei kaip pirminė kultūra naudojami limfocitai, kurių citotoksinio ar citostatinio poveikio matas yra mitozinis indeksas (MI), jam įtaką daro matavimo laikas po apdorojimo, naudojamas mitogenas ir galimas ląstelių ciklo nutrūkimas. Tačiau MI yra priimtinas, nes kiti citotoksiškumo matavimai gali būti sudėtingi ir praktiškai neįmanomi bei gali netikti stimuliuojant PHA augančiai limfocitų tikslinei populiacijai. Nors rekomenduojami ląstelių linijų citotoksiškumo parametrai yra RICC ir RPD, o pirminės limfocitų kultūros – MI, kiti rodikliai (pvz., ląstelių vientisumas, apoptozė, nekrozė, ląstelių ciklas) galėtų suteikti naudingos papildomos informacijos. Reikėtų įvertinti ne mažiau kaip tris bandymo koncentracijos vertes (neįskaitant tirpiklio ir teigiamų kontrolinių ėminių), kurios atitinka priimtinumo kriterijus (reikiamas citotoksiškumas, ląstelių skaičius ir kt.). Neatsižvelgiant į ląstelių tipą (ląstelių linijos ar pirminės limfocitų kultūros), galima naudoti kiekvienos bandymo koncentracijos kartotines ar pavienes apdorotas kultūras. Nors patariama naudoti kartotines kultūras, pavienės kultūros taip pat priimtinos, jei vertinamas vienodas suminis pavienės ar kartotinės kultūros ląstelių skaičius. Naudoti pavienę kultūrą ypač tinka, kai vertinamos daugiau kaip 3 koncentracijos vertės (žr. 31 pastraipą). Nepriklausomoms kartotinėms kultūroms gauti tam tikros koncentracijos rezultatai gali būti sutelkti bendrai duomenų analizei (38). Jei bandomoji cheminė medžiaga rodo mažą citotoksiškumą arba jo visai nėra, paprastai tiktų maždaug nuo 2 iki 3 kartų besiskiriančios koncentracijos intervalai. Jei citotoksiškumas nustatomas, pasirinktos koncentracijos vertės turėtų aprėpti intervalą nuo koncentracijos, kuriai esant citotoksiškumas pasireiškia, kaip aprašyta 22 pastraipoje, įtraukiant koncentracijos vertes, kurioms esant gaunamas vidutinis citotoksiškumas ar jo visai nėra. Daugelio bandomųjų cheminių medžiagų koncentracijos atsako kreivės kyla staigiai, todėl norint gauti mažo arba vidutinio citotoksiškumo duomenis arba išsamiai ištirti dozės ir atsako santykį, būtina naudoti arčiau išdėstytas ir (arba) daugiau kaip tris koncentracijos vertes (pavienių ar kartotinių kultūrų), ypač tomis aplinkybėmis, kai reikia atlikti kartotinį bandymą (žr. 47 pastraipą). Jei maksimali koncentracija pagrįsta citotoksiškumu, didžiausiai koncentracijai reikėtų pasiekti 55 ± 5 % citotoksiškumą, taikant rekomenduotus citotoksiškumo parametrus (t. y. ląstelių linijų RICC bei RPD sumažėjimą ir pirminių limfocitų kultūrų MI sumažėjimą iki 45 ± 5 % vienalaikio neigiamo kontrolinio ėminio). Reikėtų atsargiai aiškinti teigiamus rezultatus, kurie būtų gauti tik viršutiniam šio 55 ± 5 % citotoksiškumo intervalo galui (13). Jei mažai tirpios bandomosios cheminės medžiagos nėra citotoksiškos, kai koncentracija yra mažesnė nei mažiausia netirpumo koncentracija, paveikimo bandomąja chemine medžiaga pabaigoje, esant didžiausiai analizuojamai koncentracijai, turėtų atsirasti drumstumas arba nuosėdos, matomos plika akimi arba per inversinį mikroskopą. Netgi jei citotoksiškumas pasireiškia, kai koncentracija yra didesnė nei mažiausia netirpumo koncentracija, patartina bandyti tik esant vienai drumstumą ar matomas nuosėdas sukeliančiai koncentracijai, nes nuosėdos gali daryti dirbtinį poveikį. Esant koncentracijai, kurioje susidaro nuosėdos, reikėtų imtis priemonių užtikrinti, kad nuosėdos netrukdytų atlikti bandymą (pvz., dažymą ar įvertinimą). Gali padėti tirpumo nustatymas kultūros terpėje prieš atliekant bandymą. Jei nuosėdų ar ribinio citotoksiškumo nestebima, didžiausia bandymo koncentracija turėtų atitikti 10 mmol/l, 2 mg/ml ar 2 μl/ml, pasirenkant mažiausią (39) (40) (41). Jei bandomoji cheminė medžiaga yra neapibrėžtos sudėties, pvz., nežinomos ar kintamos sudėties medžiaga, sudėtingųjų reakcijų produktai ar biologinė medžiaga (UVCB) (42), iš aplinkos ekstrahuojamas ėminys ir kt., nesant pakankamam citotoksiškumui, gali prireikti didesnės didžiausios koncentracijos (pvz., 5 mg/ml), kad būtų didesnė kiekvieno iš komponentų koncentracija. Reikėtų pažymėti, kad žmonėms skirtiems vaistiniams preparatams šie reikalavimai gali būti skirtingi (43). Kontroliniai ėminiai Kiekvieną kartą surenkant kultūrą, reikėtų įtraukti vienalaikius neigiamus kontrolinius ėminius (žr. 15 pastraipą), sudarytus vien tik iš tirpiklio apdorojimo terpėje ir apdorotus taip pat, kaip apdorojamos kultūros. Vienalaikiai teigiami kontroliniai ėminiai yra būtini siekiant įrodyti laboratorijos gebėjimą naudojamo bandymų protokolo sąlygomis identifikuoti klastogenus ir egzogeninės metabolinio aktyvinimo sistemos efektyvumą, jei tinka. Teigiamų kontrolinių ėminių pavyzdžiai pateikiami toliau 1 lentelėje. Galima naudoti alternatyvias teigiamas kontrolines chemines medžiagas, jei tai būtų pagrįsta. Kadangi žinduolių ląstelių genetinio toksiškumo in vitro bandymai yra pakankamai standartizuoti, teigiamų kontrolinių ėminių naudojimas gali apsiriboti klastogenais, kuriems būtinas metabolinis aktyvinimas. Jei jis atliekamas vienu metu su neaktyvinto ėminio bandymu naudojant vienodą apdorojimo trukmę, šis vienas teigiamos kontrolės atsakas įrodys metabolinio aktyvinimo sistemos aktyvumą ir bandymo sistemos jautrį. Tačiau ilgalaikiam apdorojimui (be S9) reikėtų turėti savo teigiamą kontrolinį ėminį, nes apdorojimo trukmė skirsis nuo metabolinį aktyvinimą naudojančio bandymo trukmės. Kiekvienas teigiamas kontrolinis ėminys turėtų būti naudojamas vienos arba kelių koncentracijos verčių, kurioms esant būtų galima tikėtis gauti atkuriamą ir aptinkamą didesnį nei fonas atsaką, kad būtų galima įrodyti bandymo sistemos jautrį (t. y. poveikis yra aiškus, bet tyrėjui ne iš karto atskleidžiama užkoduotų objektinių stiklelių tapatybė), ir atsako neturėtų sutrikdyti citotoksiškumas, kuris viršytų bandymo metodui nustatytas ribas. 1 lentelė. Etaloninės cheminės medžiagos, rekomenduojamos laboratorijos kvalifikacijai vertinti ir teigiamiems kontroliniams ėminiams pasirinkti.
PROCEDŪRA Paveikimas bandomąja chemine medžiaga Proliferuojančios ląstelės veikiamos bandomąja chemine medžiaga esant metabolinio aktyvinimo sistemai arba jos nesant. Kultūrų surinkimo laikas Siekiant atlikti išsamų įvertinimą, kurio prireiktų neigiamam rezultatui patvirtinti, visos šios trys Bandymo sąlygos turėtų būti įgyvendintos, taikant trumpalaikį apdorojimą su metaboliniu aktyvinimu ir be jo bei ilgalaikį apdorojimą be metabolinio aktyvinimo (žr. 43, 44 ir 45 pastraipas):
Jei esant kuriai nors vienai iš pirmiau nurodytų bandymo sąlygų gaunamas teigiamas atsakas, gali būti nebūtina tirti kurią nors kitą apdorojimo schemą. Chromosomų paruošimas Paprastai likus 1–3 h iki surinkimo ląstelių kultūros yra veikiamos kolcemidu ar kolchicinu. Kiekviena ląstelių kultūra surenkama ir atskirai apdorojama chromosomoms paruošti. Ruošiant chromosomas ląstelės apdorojamos hipotoniniu tirpalu, fiksuojamos ir dažomos. 3–6 h trukmės apdorojimo pabaigoje monosluoksniuose gali būti mitozinių ląstelių (atpažįstamų iš apvalios formos ir atsiskyrimo nuo paviršiaus). Kadangi šios mitozinės ląstelės lengvai atsiskiria, jos gali būti prarastos šalinant terpę su bandomąja chemine medžiaga. Jei yra įrodymų dėl esminio mitozinių ląstelių skaičiaus padidėjimo palyginti su kontroliniais ėminiais, rodančio galimą ląstelių sulaikymą mitozės etape, ląsteles reikėtų surinkti centrifugavimu ir grąžinti į kultūras, kad surinkimo metu nebūtų prarastos mitozės etapo ląstelės, kurioms kyla chromosomų aberacijos rizika. Analizė Prieš atliekant chromosomų aberacijų mikroskopinę analizę, visi objektiniai stikleliai turėtų būti nepriklausomai užkoduoti, įskaitant teigiamų ir neigiamų kontrolinių ėminių stiklelius. Kadangi fiksavimo metu dalis metafazės ląstelių praranda chromosomas, todėl suskaičiuotos ląstelės turės tam tikrą skaičių centromerų, lygų modaliniam skaičiui ± 2. Ne mažiau kaip 300 gerai matomų metafazių turėtų būti suskaičiuotos kiekvienai koncentracijai ir kontroliniam ėminiui, norint padaryti išvadą, kad bandomoji cheminė medžiaga yra aiškiai neigiama (žr. 45 pastraipą). 300 ląstelių turėtų būti vienodai paskirstytos tarp kartotinių ėminių, jei naudojami kartotiniai kultūrų ėminiai. Kai vienai koncentracijai naudojama pavienė kultūra (žr. 21 pastraipą), šioje pavienėje kultūroje turėtų būti suskaičiuota ne mažiau kaip 300 gerai matomų metafazių. 300 ląstelių skaičiaus pranašumas – padidėja bandymo statistinė galia, be to, retai būtų stebimos nulinės vertės (manoma, kad jos sudarytų tik 5 %) (44). Skaičiuojamų metafazių skaičių galima sumažinti, kai stebimas didelis ląstelių su chromosomų aberacijomis skaičius ir bandomoji cheminė medžiaga laikoma aiškiai teigiama. Reikėtų skaičiuoti ląsteles su chromosomų struktūrine (-ėmis) aberacija (-omis), įskaitant plyšius ir jų neįskaitant. Trūkiai ir plyšiai apibrėžti 1 priedėlyje pagal (45) (46). Chromatidinė ir chromosominė aberacijos turėtų būti registruojamos atskirai ir klasifikuojamos pagal potipius (trūkius, mainus). Laboratorijoje taikomos procedūros turėtų užtikrinti, kad chromosomų aberacijų analizę atlieka tinkamai apmokyti skaičiuotojai ir, jei reikia, ją peržiūrėtų ekspertai. Nors tyrimo tikslas yra nustatyti chromosomų struktūrines aberacijas, svarbu registruoti poliploidijos bei endoduplikacijos dažnumą, kai šie įvykiai yra matomi (žr. 2 pastraipą). Laboratorijos kvalifikacija Siekdama įgyti pakankamos bandymo atlikimo patirties prieš jį taikydama įprastiniams tyrimams, laboratorija turėtų būti atlikusi etaloninių teigiamų cheminių medžiagų bandymų seriją, joms veikiant pagal skirtingus mechanizmus ir su įvairiais neigiamais kontroliniais ėminiais (naudojant įvairius tirpiklius ir nešiklius). Šių teigiamų ir neigiamų kontrolinių ėminių atsakas turėtų atitikti literatūros duomenis. Tai netaikoma patirties turinčioms laboratorijoms, t. y. kurios turi istorinių duomenų bazę, prieinamą kaip apibrėžta 37 pastraipoje. Teigiamų kontrolinių cheminių medžiagų rinkinį (žr. 26 pastraipos 1 lentelę) reikėtų tirti atliekant trumpalaikį ir ilgalaikį apdorojimą be metabolinio aktyvinimo, taip pat trumpalaikį apdorojimą esant metaboliniam aktyvinimui, kad būtų galima įrodyti kvalifikaciją aptikti klastogenines chemines medžiagas ir nustatyti metabolinio aktyvinimo sistemos efektyvumą. Pasirinktų cheminių medžiagų koncentracijos verčių intervalas turėtų būti pasirinktas taip, kad, siekiant įrodyti bandymo sistemos jautrį ir dinaminį diapazoną, būtų gautas atkuriamas ir su koncentracija susijęs padidėjimas palyginti su fonu. Istorinių kontrolinių ėminių duomenys Laboratorija turėtų nustatyti:
Pirmą kartą gaunant duomenis, skirtus istorinių neigiamų kontrolinių ėminių pasiskirstymui, vienalaikiai neigiami kontroliniai ėminiai turėtų atitikti paskelbtus kontrolinius duomenis, jei jie yra. Kontrolinių ėminių pasiskirstymą papildant vis didesniu bandymų duomenų kiekiu, būtų gerai, kad vienalaikiai neigiami kontroliniai ėminiai patektų į to skirstinio 95 % kontrolines ribas (44) (47). Laboratorijos istorinių neigiamų kontrolinių ėminių duomenų bazę iš pradžių turėtų sudaryti ne mažiau kaip 10 bandymų, bet būtų geriau, jei tokių palyginamosiomis Bandymo sąlygomis atliktų bandymų skaičius būtų ne mažesnis kaip 20. Laboratorijos turėtų taikyti kokybės kontrolės metodus, tokius kaip kontrolinės diagramos (pvz., C tipo ar X juostinės diagramos (48)), kad galėtų nustatyti savo teigiamų ir neigiamų kontrolinių ėminių duomenų kintamumą ir įrodyti metodikos „valdomumą“ savo laboratorijoje (44). Papildomas rekomendacijas, kaip kurti ir naudoti istorinius duomenis (t. y. duomenų įtraukimo ir pašalinimo iš istorinių duomenų kriterijus ir tam tikro bandymo priimtinumo kriterijus) galima rasti literatūroje (47). Į visus bandymų protokolo pakeitimus reikėtų žiūrėti atsižvelgiant į jų suderinamumą su esamomis laboratorijos istorinių kontrolinių ėminių duomenų bazėmis. Esant didesnėms neatitiktims, turėtų būti kuriama nauja istorinių kontrolinių ėminių duomenų bazė. Neigiamų kontrolinių ėminių duomenis turėtų sudaryti pavienės kultūros ląstelių su chromosomų aberacijomis skaičius arba kartotinių kultūrų skaičių suma, kaip aprašyta 21 pastraipoje. Būtų gerai, kad vienalaikiai neigiami kontroliniai ėminiai patektų į laboratorijos istorinių neigiamų kontrolinių ėminių duomenų bazės skirstinio 95 % kontrolines ribas (44) (47). Jei vienalaikių neigiamų kontrolinių ėminių duomenys nepatenka į 95 % kontrolines ribas, jie gali būti tinkami įtraukti į istorinių kontrolinių ėminių skirstinį, jei nėra kraštiniai riktai ir yra įrodymų, kad bandymo sistema „valdoma“ (žr. 37 pastraipą) ir kad nėra techninių ar žmogaus klaidų. DUOMENYS IR ATASKAITOS RENGIMAS Rezultatų pateikimas Turėtų būti gautas ląstelių, turinčių struktūrines chromosomų aberacijas, įvertis procentais. Bandymo ir kontrolinių ėminių kultūrų chromatidinė ir chromosominė aberacijos, klasifikuojamos pagal potipius (trūkius, mainus), turėtų būti registruojamos atskirai, nurodant jų skaičių ir dažnumą. Plyšiai registruojami ir pateikiami ataskaitoje atskirai, bet neįtraukiami į suminį aberacijų buvimo dažnumą. Ataskaitoje pateikiama poliploidinių ir (arba) endoreduplikuotų ląstelių, kai matomos, procentinė dalis. Turėtų būti registruojami vienalaikiai visų apdorotų, neigiamų ir teigiamų kontrolinių ėminių citotoksiškumo duomenys, gauti atliekant pagrindinį (-ius) aberacijos bandymą (-us). Turėtų būti pateikti atskiri kiekvienos kultūros duomenys. Be to, visi duomenys turi būti suvesti į lenteles. Priimtinumo kriterijai Bandymo priimtinumas pagrįstas šiais kriterijais:
Rezultatų įvertinimas ir aiškinimas Jei įvykdomi visi priimtinumo kriterijai, bandomoji cheminė medžiaga laikoma aiškiai teigiama, jei, esant kuriai nors ištirtai bandymo sąlygai (žr. 28 pastraipą):
Atitinkant visus šiuos kriterijus, laikoma, kad bandomoji cheminė medžiaga gali sukelti šios bandymų sistemos žinduolių ląstelių kultūros chromosomų aberacijas. Rekomendacijų dėl tinkamiausių statistinių metodų galima rasti literatūroje (49) (50) (51). Jei įvykdomi visi priimtinumo kriterijai, bandomoji cheminė medžiaga laikoma aiškiai neigiama, jei visomis ištirtomis bandymo sąlygomis (žr. 28 pastraipą):
Tada laikoma, kad bandomoji cheminė medžiaga negali sukelti šios bandymų sistemos žinduolių ląstelių kultūros chromosomų aberacijų. Nėra reikalavimo patikrinti aiškų teigiamą ar neigiamą atsaką. Jei atsakas nėra aiškiai neigiamas ar aiškiai teigiamas, kaip apibūdinta pirmiau, arba, siekiant padėti nustatyti rezultato biologinę svarbą, duomenys turėtų būti įvertinti pateikiant ekspertų nuomonę ir (arba) atliekant papildomus tyrimus. Galėtų būti naudingas papildomų ląstelių skaičiavimas (jei tinka) arba kartotinis bandymas galbūt modifikuotomis bandymo sąlygomis (pvz., tarpai tarp koncentracijos verčių, kitos metabolinio aktyvinimo sąlygos (t. y. S9 koncentracija ar S9 kilmė)). Retais atvejais, kai netgi atlikus papildomus tyrimus, gautų duomenų rinkinio nepakaks padaryti išvadą, ar rezultatai yra teigiami ar neigiami, bus priimtas sprendimas, kad cheminės medžiagos atsakas yra dviprasmis. Poliploidinių ląstelių skaičiaus padidėjimas gali rodyti, kad bandomoji cheminė medžiaga gali slopinti mitozinius procesus ir sukelti kiekybines chromosomų aberacijas (52). Ląstelių su endoreduplikuotomis chromosomomis skaičiaus padidėjimas gali rodyti, kad bandomosios cheminės medžiagos gali slopinti ląstelių ciklo eigą (53) (54) (žr. 2 pastraipą). Todėl poliploidinių ląstelių ir ląstelių su endoreduplikuotomis chromosomomis dažnumas turėtų būti registruojamas atskirai. Bandymo ataskaita Į bandymo ataskaitą turėtų būti įtraukta ši informacija:
LITERATŪRA
1 priedėlis APIBRĖŽTYS Aneuploidija – vienos arba daugiau kaip vienos chromosomų, bet ne viso (-ų) jų rinkinio (-ų) (poliploidija) nukrypimas nuo normalaus diploidinio (arba haploidinio) chromosomų skaičiaus. Apoptozė – užprogramuota ląstelių žūtis, kuriai būdinga serija etapų, per kuriuos ląstelės suyra į membrana apsuptas daleles, kurios vėliau pašalinamos fagocitoze arba numetimo būdu. Ląstelių proliferacija – ląstelių skaičiaus didėjimas dėl mitozinio jų dalijimosi. Cheminė medžiaga – medžiaga arba mišinys. Chromatidžių trūkis – atskiros chromatidės nevientisumas, kai yra aiškus vienos iš chromatidžių nesutapimas. Chromatidinis plyšys – nedažoma (achromatinė) vienos chromatidės sritis, kurioje yra mažiausias skaičius klaidingai suporuotų bazių. Chromatidinė aberacija – struktūrinis chromosomos pažeidimas, pasireiškiantis kaip vienos iš chromatidžių trūkis arba kaip chromatidžių trūkis ir susijungimas. Chromosominė aberacija – struktūrinis chromosomos pažeidimas, pasireiškiantis kaip abiejų chromatidžių trūkis arba kaip trūkis ir susijungimas toje pačioje vietoje. Klastogenas – сheminė medžiaga, kuris sukelia ląstelių arba eukariotinių organizmų populiacijų struktūrines chromosomų aberacijas. Koncentracijos vertės – bandomosios cheminės medžiagos koncentracijos kultūros terpėje galutinės vertės. Citotoksiškumas – jei šio bandymo metodo tyrimams naudojamos ląstelių linijos, citotoksiškumas nustatomas kaip apdorotų ląstelių santykinio populiacijos padvigubėjimo (RPD) sumažėjimas ar santykinis ląstelių skaičiaus padidėjimas (RICC) palyginti su neigiamu kontroliniu ėminiu (žr. 17 pastraipą ir 2 priedėlį). Jei šio bandymo metodo tyrimams naudojamos pirminės limfocitų kultūros, citotoksiškumas nustatomas kaip apdorotų ląstelių mitozinio indekso (MI) sumažėjimas palyginti su neigiamu kontroliniu ėminiu (žr. 18 pastraipą ir 2 priedėlį). Endoreduplikacija – procesas, kurio metu pasibaigus DNR replikacijos S periodui, branduolys nepradeda dalytis mitozės būdu, bet prasideda naujas S periodas. Taip atsiranda chromosomos, turinčios 4, 8, 16 … chromatidžių. Genotoksinis – bendrasis terminas, kuriuo išreiškiamas visų tipų DNR arba chromosomų pažeidimas, įskaitant trūkius, delecijas, aduktus, nukleotidų modifikacijas ir ryšius, pergrupavimus, genų mutacijas, chromosomų aberacijas ir aneuploidiją. Ne visų tipų genotoksiniai poveikiai sukelia mutacijas ar pastovų chromosomų pažeidimą. Mitozinis indeksas (MI) – metafazės ląstelių skaičiaus ir ląstelių populiacijos stebimų ląstelių suminio skaičiaus dalmuo, kuris rodo tos ląstelių populiacijos proliferacijos laipsnį. Mitozė – ląstelės branduolio dalijimasis, paprastai į profazę, prometafazę, metafazę, anafazę ir telofazę. Mutageninis – sukeliantis paveldimą DNR bazinės poros sekos (-ų) pokytį genuose arba chromosomų struktūroje (chromosomų aberacijas). Kiekybinė aberacija – chromosomų skaičiaus pokytis palyginti su naudojamų ląstelių būdingu normaliu chromosomų skaičiumi. Poliploidija – kiekybinės chromosomų aberacijos ląstelėse arba organizmuose, apimančios visą (-us) chromosomų rinkinį (-us), skirtingai nei atskirą (-as) chromosomą (-as) (aneuploidija). p53 būsena – p53 baltymo dalyvavimas reguliuojant ląstelių ciklą, apoptozę ir DNR atkūrimą. Ląstelės, kurioms trūksta funkcinio p53 baltymo ir negali sustabdyti ląstelių ciklo arba pašalinti pažeistų ląstelių per apoptozę arba kitais mechanizmais (pvz., DNR atkūrimo skatinimą), susijusiais su p53 funkcijomis atsakant į DNR pažaidą, teoriškai turėtų būti labiau linkusios genų mutacijai ar chromosomų aberacijoms. Santykinis ląstelių skaičiaus padidėjimas (angl. RICC)– ląstelių skaičiaus padidėjimas chemine medžiaga veikiamose kultūrose, palyginti su padidėjimu neapdorotose kultūrose, santykį išreiškiant procentine dalimi. Santykinis populiacijos padvigubėjimas (angl. RPD)– populiacijos padvigubėjimų skaičiaus padidėjimas chemine medžiaga veikiamose kultūrose, palyginti su neapdorotomis kultūromis, santykį išreiškiant procentine dalimi. S9 kepenų frakcija – skystis virš kepenų homogenato, gautas po centrifugavimo esant 9 000 g, t. y. žalių kepenų ekstraktas. S9 mišinys – S9 kepenų frakcijos ir fermentų metaboliniam aktyvumui būtinų kofaktorių mišinys. Tirpiklio kontrolinis ėminys – bendras terminas, apibūdinantis kontrolines kultūras, į kurias dedama vien tik tirpiklio, naudoto bandomajai cheminei medžiagai ištirpinti. Struktūrinė aberacija – chromosomos struktūros pokytis, kurį galima nustatyti dalijimosi ciklo metafazės ląsteles tiriant mikroskopu; jis pasireiškia kaip delecijos ir fragmentai, pokyčiai grandinių viduje ar tarp grandinių. Bandomoji cheminė medžiaga – taikant šį metodą bandoma medžiaga arba mišinys. Neapdorotieji kontroliniai ėminiai – kultūros, kurios neapdorojamos (t. y. nededama bandomosios cheminės medžiagos ar tirpiklio), bet yra tiriamos vienu metu su kultūromis, į kurias dedama bandomoji cheminė medžiaga. 2 priedėlis CITOTOKSIŠKUMO VERTINIMO FORMULĖS Mitozinis indeksas (MI):
Rekomenduojama naudoti santykinį ląstelių skaičiaus padidėjimą (RICC) ar santykinį populiacijos padvigubėjimą (RPD), nes abiem atvejais atsižvelgiama į padalytų ląstelių populiacijos dalį.
čia: Populiacijos padvigubėjimas = [log (ląstelių skaičius po apdorojimo ÷ pradinis ląstelių skaičius)] ÷ log 2 Pvz., 53 % RICC ar RPD rodo 47 % citotoksiškumą ar citostazę, o 55 % citotoksiškumas ar citostazė matuojant MI reiškia, kad faktinis MI yra 45 % kontrolinio ėminio. Visais atvejais reikėtų išmatuoti ląstelių skaičių prieš apdorojimą ir apdorojamose bei neigiamų kontrolinių ėminių kultūrose jis turėtų būti vienodas. Nors praeityje kaip citotoksiškumo parametras buvo naudojamas RCC (t. y. apdorotų kultūrų ląstelių skaičius/ kontrolinių kultūrų ląstelių skaičius), jis daugiau nerekomenduojamas, nes gali būti gautas per mažas citotoksiškumo įvertis. Neigiamų kontrolinių kultūrų populiacijos padvigubėjimas turėtų būti suderinamas su reikalavimu imti ląstelių ėminius nuo apdorojimo praėjus laikui, kuris būtų maždaug 1,5 karto ilgesnis nei normalaus ląstelių ciklo trukmė, o mitozinis indeksas turėtų būti gana didelis, kad būtų gautas pakankamas mitozės etapo ląstelių skaičius ir būtų galima patikimai apskaičiuoti 50 % sumažėjimą. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
4) |
B dalies B.11 skyrius pakeičiamas taip: „B.11 Žinduolių kaulų čiulpų chromosomų aberacijų bandymas ĮVADAS Šis bandymų metodas atitinka EBPO bandymų gaires (TG) 475 (2014). Jis yra genetinės toksikologijos metodų serijos dalis. Yra parengtas EBPO dokumentas, kuriame glaustai pateikiama informacijos apie genetinės toksikologijos bandymus ir naujausių šių gairių pakeitimų apžvalga (1). Žinduolių kaulų čiulpų chromosomų aberacijų bandymas in vivo ypač tinka genotoksiškumui vertinti, nes, nors skirtingų gyvūnų rūšių chromosomos gali skirtis, in vivo metabolizmo veiksniai, farmakokinetika ir DNR atkūrimo procesai yra aktyvūs ir prisideda prie atsakų. Tyrimas in vivo taip pat naudingas toliau tiriant in vitro sistemoje nustatytą genotoksiškumą. Žinduolių chromosomų aberacijų tyrimas in vivo naudojamas nustatant struktūrines chromosomų aberacijas, kurias bandomoji cheminė medžiaga sukelia žinduolių, paprastai graužikų, kaulų čiulpų ląstelėse (2) (3) (4) (5). Struktūrinės chromosomų aberacijos gali būti dviejų tipų – chromosominės arba chromatidinės. Nors dauguma genotoksinių cheminių medžiagų sukeltų aberacijų yra chromatidinės, tačiau pasitaiko ir chromosominių aberacijų. Chromosomų pažeidimas ir su juo susiję reiškiniai yra daugumos genetiškai paveldimų žmonių ligų priežastis ir yra esminių įrodymų, kad, kai šie pažeidimai ir susiję reiškiniai sukelia onkogenų bei navikų supresorinių genų pokyčius, jie prisideda prie žmonių ir bandymų sistemų vėžio atsiradimo. Atliekant chromosomų aberacijų tyrimus in vivo galėtų atsirasti poliploidija (įskaitant endoreduplikaciją). Tačiau pati padidėjusi poliploidija nerodo aneugeninio potencialo ir ji tiesiog gali rodyti ląstelių ciklo sutrikimą ar citotoksiškumą. Šis bandymas nenumatytas aneuploidijai matuoti. Žinduolių eritrocitų mikrobranduolių bandymas in vivo (šio priedo B.12 skyrius) arba žinduolių ląstelių mikrobranduolių bandymas in vitro (šio priedo B.49 skyrius) būtų in vivo ir in vitro bandymai, rekomenduojami aneuploidijai aptikti. Vartojamų terminų apibrėžtys pateiktos 1 priedėlyje. PRADINIAI ASPEKTAI Šiam bandymui atlikti paprastai naudojami graužikai, bet kai kuriais atvejais gali tikti kitos rūšys, jei jų naudojimas būtų moksliškai pagrįstas. Šio bandymo tikslinis audinys yra kaulų čiulpai, kadangi jis yra gausiai vaskuliarizuotas audinys ir turi sparčiai besidauginančių ląstelių, kurias galima atskirti ir apdoroti, populiaciją. Kitų nei žiurkės ar pelės rūšių naudojimas turėtų būti moksliškai pagrįstas ataskaitoje. Jei naudojamos kitos nei graužikai rūšys, rekomenduojama kaulų čiulpų chromosomų aberacijos matavimą įtraukti į kitą tinkamą toksiškumo bandymą. Jei yra duomenų, kad bandomoji (-osios) cheminė (-ės) medžiaga (-os) ar jos arba jų metabolitas (-ai) nepasieks tikslinio audinio, jis gali būti netinkamas naudoti šiame bandyme. Prieš šiuo bandymų metodu bandant mišinį, siekiant gauti duomenų numatomo reglamentavimo tikslais, reikėtų apsvarstyti, ar metodu galima pasiekti tą tikslą atitinkančius rezultatus, ir, jei taip, dėl kokios priežasties. Tokie svarstymai nereikalingi, kai yra reglamentavimo reikalavimas bandyti mišinį. BANDYMŲ METODO PRINCIPAS Gyvūnai veikiami bandomąja chemine medžiaga tinkamu veikimo būdu ir reikiamu momentu po paveikimo humaniškai numarinami. Prieš numarinant gyvūnai paveikiami agentu, stabdančiu metafazę (pvz., kolchicinu ar kolcemidu). Tada iš kaulų čiulpų ląstelių ruošiami chromosomų preparatai, jie dažomi, ir metafazės ląstelės tiriamos mikroskopu chromosomų aberacijoms nustatyti. LABORATORIJOS KVALIFIKACIJOS TIKRINIMAS Kvalifikacijos tyrimai Siekdama įgyti pakankamos tyrimo atlikimo patirties prieš jį taikydama įprastiniams bandymams, laboratorija turėtų įrodyti gebėjimą atkurti paskelbtų duomenų (pvz., (6)) tikėtinus chromosomų aberacijų dažnumo rezultatus, naudodama ne mažiau kaip dvi teigiamas kontrolines chemines medžiagas (įskaitant mažos dozės teigiamų kontrolinių ėminių sukeltus silpnus atsakus), pvz., išvardytas 1 lentelėje, ir suderinamų tirpiklių ir (arba) nešiklių kontrolinius ėminius (žr. 22 pastraipą). Atliekant šiuos bandymus, reikėtų naudoti dozes, kurioms esant tiriamajame audinyje (kaulų čiulpuose) gaunami atkuriami ir su doze susiję padidėjimai, ir įrodyti bandymų sistemos jautrį ir dinaminį diapazoną, pasitelkiant laboratorijoje taikomą vertinimo metodą. Šis reikalavimas netaikomas patirties turinčioms laboratorijoms, t. y. toms, kurios turi istorinių duomenų bazę, prieinamą kaip apibrėžta 10–14 pastraipose. Istorinių kontrolinių ėminių duomenys Atlikdama kvalifikacijos tyrimus, laboratorija turėtų nustatyti:
Pirmą kartą gaunant duomenis, skirtus istorinių neigiamų kontrolinių ėminių pasiskirstymui, vienalaikiai neigiami kontroliniai ėminiai turėtų atitikti paskelbtus kontrolinius duomenis, jei jie yra. Istorinių kontrolinių ėminių pasiskirstymą papildant vis didesniu bandymų duomenų kiekiu, būtų gerai, kad vienalaikiai neigiami kontroliniai ėminiai patektų į to skirstinio 95 % kontrolines ribas. Laboratorijos istorinių neigiamų kontrolinių ėminių duomenų bazė turėtų būti statistiškai patikima, kad būtų užtikrintas laboratorijos gebėjimas vertinti savo neigiamų kontrolinių ėminių duomenų pasiskirstymą. Literatūroje daroma prielaida, kad gali prireikti ne mažiau kaip 10 bandymų, bet būtų geriau, jei palyginamosiomis Bandymo sąlygomis atliktų bandymų skaičius būtų ne mažesnis kaip 20. Laboratorijos turėtų taikyti kokybės kontrolės metodus, tokius kaip kontrolinės diagramos (pvz., C tipo ar X juostinės diagramos (7)), kad galėtų nustatyti savo duomenų kintamumą ir įrodyti metodikos „valdomumą“ savo laboratorijoje. Papildomas rekomendacijas, kaip kurti ir naudoti istorinius duomenis (t. y. duomenų įtraukimo ir pašalinimo iš istorinių duomenų kriterijus ir tam tikro bandymo priimtinumo kriterijus) galima rasti literatūroje (8). Jei, atliekant 9 skirsnyje aprašytus kvalifikacijos tyrimus, laboratorijai nepakanka bandymų skaičiaus statistiškai patikimam neigiamų kontrolių ėminių skirstiniui gauti (žr. 11 pastraipą), priimtina skirstinį papildyti atliekant pirmuosius įprastinius bandymus. Taikant šį būdą, reikėtų laikytis literatūroje nurodytų rekomendacijų (8), o atliekant šiuos bandymus gauti neigiamų kontrolinių ėminių rezultatai turėtų būti suderinami su paskelbtais neigiamų kontrolinių ėminių duomenimis. Į visus bandymų protokolo pakeitimus reikėtų žiūrėti atsižvelgiant į jų poveikį gaunamiems duomenims, kurie turi likti suderinami su esamomis laboratorijos istorinių kontrolinių ėminių duomenų bazėmis. Tik esant didesnėms neatitiktims turėtų būti kuriama nauja istorinių kontrolinių ėminių duomenų bazė, jei, atsižvelgiant į ekspertų nuomonę, nustatoma, kad ji skiriasi nuo ankstesnio skirstinio (žr. 11 pastraipą). Atkūrimo metu atliekamam bandymui gali neprireikti visos neigiamų kontrolinių ėminių duomenų bazės, jei laboratorija gali įrodyti, kad vienalaikių neigiamų kontrolinių ėminių vertės ir toliau yra suderinamos su ankstesne duomenų baze arba su atitinkamais paskelbtais duomenimis. Neigiamų kontrolinių ėminių duomenis turėtų sudaryti kiekvieno gyvūno struktūrinės chromosomų aberacijos dažnumas (išskyrus plyšius). Būtų gerai, kad vienalaikiai neigiami kontroliniai ėminiai patektų į laboratorijos istorinių neigiamų kontrolinių ėminių duomenų bazės skirstinio 95 % kontrolines ribas. Jei vienalaikių neigiamų kontrolinių ėminių duomenys nepatenka į 95 % kontrolines ribas, jie gali būti tinkami įtraukti į istorinių kontrolinių ėminių skirstinį, jei jie nėra kraštiniai riktai ir yra įrodymų, kad bandymo sistema yra „valdoma“ (žr. 11 pastraipą) ir kad nėra techninių ar žmogaus klaidų. METODO APRAŠYMAS Parengiamieji darbai Gyvūnų rūšies parinkimas Reikėtų tirti dažniausiai naudojamas sveikų jaunų suaugusių gyvūnų laboratorines veisles. Paprastai naudojamos žiurkės, nors taip pat gali tikti pelės. Galima naudoti kitas tinkamas žinduolių rūšis, jei ataskaitoje tai būtų moksliškai pagrįsta. Gyvūnų laikymo ir šėrimo sąlygos Temperatūra graužikų patalpoje turėtų būti 22 °C (± 3 °C). Nors geriausia būtų užtikrinti 50–60 % drėgmę, ji neturėtų būti mažesnė kaip 40 % ir būtų gerai, jei ji nebūtų didesnė kaip 70 %, išskyrus patalpos valymo laiką. Apšvietimas turėtų būti dirbtinis, taikant 12 h šviesos ir 12 h tamsos seką. Gyvūnams šerti tinka įprastas laboratorijose naudojamas pašaras, neribojant geriamojo vandens kiekio. Pašaro pasirinkimui gali turėti įtakos būtinybė užtikrinti tinkamą bandomosios cheminės medžiagos sumaišymą su pašaru, kai ji duodama tokiu būdu. Jei nesitikima agresyvaus elgesio, graužikus reikėtų laikyti nedidelėmis vienos lyties vienodai apdorojamomis grupėmis (ne daugiau kaip po penkis viename narvelyje), pageidautina narveliuose su kietomis grindimis ir esant atitinkamai pagerintai aplinkai. Tik moksliškai pagrįstais atvejais gyvūnus galima laikyti atskirai. Gyvūnų paruošimas Paprastai naudojami sveiki, jauni suaugę gyvūnai (geriausias graužikų amžius apdorojimo pradžioje yra 6–10 savaičių, nors leidžiama naudoti šiek tiek vyresnius gyvūnus), kurie atsitiktinai paskirstomi į kontrolines ir apdorojamas grupes. Kiekvienas gyvūnas humanišku minimaliai invaziniu būdu paženklinamas unikaliu ženklu (pvz., žieduojant, kabinant etiketę, naudojant mikrolustą ar biometrinį identifikavimą, bet ne ausų ar pėdų spaustukus) ir aklimatizuojami laboratorinėmis sąlygomis ne trumpiau kaip 5 paras. Narvelius reikėtų įrengti taip, kad jų išdėstymo poveikis būtų minimalus. Reikėtų vengti teigiamo kontrolinio ėminio ir bandomosios cheminės medžiagos kryžminės taršos. Tyrimo pradžioje gyvūnų masės skirtumas turėtų būti minimalus ir neviršyti ± 20 % kiekvienos lyties vidutinės gyvūno masės. Dozių ruošimas Kietąsias bandomąsias chemines medžiagas prieš dozuojant gyvūnams reikėtų ištirpinti atitinkamuose tirpikliuose ar nešikliuose, paruošti jų suspensiją arba įmaišyti į pašarą ar geriamąjį vandenį. Skystąsias bandomąsias chemines medžiagas galima dozuoti tiesiogiai arba prieš tai praskiesti. Jei bandomoji cheminė medžiaga patenka per kvėpavimo takus, ją, atsižvelgiant į jos fizikines ir chemines savybes, galima duoti dujų, garų arba kietojo ar skystojo aerozolio pavidalu. Reikėtų naudoti tik iš naujo paruoštus bandomosios cheminės medžiagos preparatus, nebent stabilumo duomenys rodo, kad laikymas priimtinas ir yra apibrėžtos tinkamos laikymo sąlygos. Tirpiklis ir (arba) nešiklis Neturėtų būti tirpiklio ar nešiklio toksinio poveikio, esant naudojamiems dozių dydžiams, ir neturėtų kilti įtarimų, kad galėtų vykti jų cheminė reakcija su bandomosiomis cheminėmis medžiagomis. Jei naudojami kiti nei gerai žinomi tirpikliai ar nešikliai, juos galima įtraukti tik pateikus suderinamumą rodančius etaloninius duomenis. Rekomenduojama visuomet iš pradžių atsižvelgti į galimybę naudoti vandeninį tirpiklį arba nešiklį. Dažniausiai naudojamų suderinamų tirpiklių ar nešiklių pavyzdžiai yra vanduo, fiziologinis tirpalas, metilceliuliozės tirpalas, karboksimetilceliuliozės natrio druskos tirpalas, alyvuogių ir kukurūzų aliejus. Jei nėra istorinių arba paskelbtų kontrolinių duomenų, kurie rodo, kad pasirinktas netipinis tirpiklis ar nešiklis nesukelia struktūrinių aberacijų ar kitokio žalingo poveikio, reikėtų atlikti pradinį tyrimą tirpiklio ar nešiklio kontrolinio ėminio priimtinumui nustatyti. Kontroliniai ėminiai Teigiami kontroliniai ėminiai Paprastai į kiekvieną bandymą reikėtų įtraukti grupę gyvūnų, apdorotų teigiama kontroline chemine medžiaga. To galima atsisakyti, jei bandymų laboratorija įrodė kvalifikaciją atlikti bandymą ir nustatė istorinių teigiamų kontrolinių ėminių intervalą. Jei vienalaikių teigiamų kontrolinių ėminių grupė neįtraukiama, į kiekvieną bandymą reikėtų įtraukti vertinimo kontrolinius ėminius (fiksuotus ir nedažytus objektinius stiklelius). Juos galima gauti į tyrimo vertinimą įtraukiant atitinkamus etaloninius ėminius, kurie būtų gauti bandymų laboratorijoje periodiškai (pvz., kas 6–18 mėnesių) atliekant atskirą teigiamo kontrolinio ėminio bandymą, pvz., kvalifikacijos tyrimo metu ir reguliariai vėliau, jei būtina, ir tuos ėminius laikyti. Teigiamos kontrolinės cheminės medžiagos turėtų patikimai sukelti ląstelių su struktūrinėmis chromosomų aberacijomis aiškų dažnumo padidėjimą, palyginti su savaiminiu lygiu. Reikėtų pasirinkti tokias teigiamų kontrolinių ėminių dozes, kad poveikis būtų ryškus, bet skaičiuotojui ne iškarto atsiskleistų užkoduotų ėminių tapatybė. Teigiamą kontrolinę cheminę medžiagą galima duoti kitu nei bandomoji cheminė medžiaga būdu, taikant skirtingą apdorojimo planą ir ėminius imant tik vienu laiko momentu. Be to, jei tinka, galima atsižvelgti į tos pačios cheminės klasės teigiamų kontrolinių cheminių medžiagų naudojimą. Teigiamų kontrolinių cheminių medžiagų pavyzdžiai pateikti 1 lentelėje. 1 lentelė Teigiamų kontrolinių cheminių medžiagų pavyzdžiai
Neigiami kontroliniai ėminiai Neigiamos kontrolinės grupės gyvūnus reikėtų įtraukti kiekvieną kartą imant ėminį ir su jais elgtis kaip su apdorojama grupe, išskyrus tai, kad gyvūnai nepaveikiami bandomąja chemine medžiaga. Jei bandomajai cheminei medžiagai duoti naudojamas tirpiklis ar nešiklis, kontrolinė grupė turėtų gauti šio tirpiklio ar nešiklio. Tačiau jei kiekvienam ėminių ėmimo laikui bandymų laboratorijos istorinių neigiamų kontrolinių ėminių duomenys rodo pastovų kintamumą tarp gyvūnų ir ląstelių su struktūrinėmis aberacijomis dažnumą, gali pakakti paimti tik vieną neigiamą kontrolinį ėminį. Jei imamas tik vienas neigiamas kontrolinis ėminys, jis turėtų būti imamas pirmą kartą imant atliekamo tyrimo ėminį. PROCEDŪRA Gyvūnų skaičius ir lytis Apskritai, vyriškos ir moteriškos lyties gyvūnų mikrobranduolių atsakas yra panašus (9) ir tikėtina, kad taip atsitiks tiriant struktūrines chromosomų aberacijas, todėl daugumą tyrimų būtų galima atlikti su bet kurios lyties gyvūnais. Jei duomenys rodytų esminius skirtumus tarp patinų ir patelių (pvz., sisteminio toksiškumo, metabolizmo, biologinio įsisavinamumo, toksiškumo kaulų čiulpams ir kt. skirtumus, įskaitant, pvz., intervalo nustatymo tyrimą), tai paskatintų naudoti abiejų lyčių gyvūnus. Šiuo atveju galbūt reikėtų atlikti tyrimą su abiejų lyčių gyvūnais, pvz., kaip kartotinės dozės toksiškumo tyrimo dalį. Jei naudojamos abi lytys, galbūt tiktų taikyti faktorinės analizės schemą. Išsami informacija, kaip analizuoti duomenis taikant šią schemą, pateikta 2 priedėlyje. Reikėtų nustatyti grupių dydį tyrimo pradžioje, turint tikslą vienai grupei gauti ne mažiau kaip 5 analizei tinkamus vienos lyties gyvūnus arba kiekvienos lyties gyvūnus, jei naudojami abiejų lyčių gyvūnai. Jei cheminių medžiagų poveikis žmonėms gali priklausyti nuo lyties, pvz., kai kurių vaistų atveju, bandymas turėtų būti atliekamas su atitinkamos lyties gyvūnais. Atliekant kaulų čiulpų tyrimą, kai trijų dozių grupių ir vienos vienalaikio neigiamo kontrolinio ėminio grupės ėminiai imami du kartus, ir dar yra teigiamo kontrolinio ėminio grupė (kiekvieną grupę sudaro penki vienos lyties gyvūnai), rekomenduojamas tipinis maksimalus gyvūnų poreikis būtų 45 gyvūnai. Dozių dydžiai Jei atliekamas parengiamasis intervalo nustatymo tyrimas, nes nėra tinkamų duomenų, kurie padėtų pasirinkti dozę, jį reikėtų atlikti toje pačioje laboratorijoje, naudojant pagrindiniam tyrimui naudoti numatytą rūšį, veislę, lytį ir apdorojimo schemą (10). Tyrimo tikslas – nustatyti didžiausią toleruojamą dozę (MTD), apibrėžiamą kaip didžiausia dozė, kuri būtų toleruojama nesant tyrimą ribojančio toksiškumo požymių, susijusių su tyrimo laikotarpio trukme (pvz., sukeliant kūno masės sumažėjimą arba hematopoetinės sistemos citotoksiškumą, bet ne žūtį ar skausmo, kančių ar išsekimo požymius, dėl kurių gyvūną reikėtų humaniškai numarinti (11)). Didžiausią dozę taip pat būtų galima apibrėžti kaip dozę, kuri būtų tam tikras toksiškumo kaulų čiulpams rodiklis. Cheminės medžiagos, kurios rodo toksikokinetinių savybių prisotinimą arba po ilgalaikio veikimo sukelia detoksifikavimo procesus, galinčius mažinti poveikį, gali būti dozės nustatymo kriterijų išimtys ir turėtų būti įvertinamos kiekvienu atveju atskirai. Siekiant gauti informacijos apie dozės ir atsako priklausomybę, į išsamų tyrimą reikėtų įtraukti neigiamo kontrolinio ėminio grupę ir ne mažiau kaip tris dozes, kurių dydžio skirtumo faktorius būtų 2, bet ne didesnis kaip 4. Jei cheminė medžiaga nerodo toksiškumo atliekant intervalo nustatymo tyrimą arba atsižvelgiant į turimus duomenis, didžiausia vienkartinio davimo dozė turėtų būti 2 000 mg/kg kūno masės. Tačiau jei bandomoji cheminė medžiaga yra toksiška, didžiausia duodama dozė turėtų būti MTD, o naudojami dozių dydžiai turėtų aprėpti intervalą nuo didžiausios dozės iki mažo toksiškumo arba visiškai jo nesukeliančios dozės. Kai toksiškumas tiksliniam audiniui (kaulų čiulpams) stebimas visiems bandomiems dozės dydžiams, patartina toliau tirti netoksines dozes. Tyrimams, kurių tikslas būtų išsamiau apibūdinti kiekybinę dozės ir atsako priklausomybės informaciją, gali prireikti papildomų dozių grupių. Tam tikrų tipų bandomųjų cheminių medžiagų (pvz., vaistų žmonėms), kurioms taikomi specifiniai reikalavimai, šios ribos gali skirtis. Ribinis bandymas Jei dozės intervalo nustatymo bandymai arba esami susijusių gyvūnų veislių duomenys rodo, kad apdorojimo režimu bent ribinė dozė (aprašyta toliau) nesukelia jokio toksinio poveikio (įskaitant tai, kad nėra kaulų čiulpų proliferacijos slopinimo ar kitų citotoksiškumo tiksliniam audiniui požymių) ir, jei atsižvelgiant in vitro genotoksiškumo tyrimus arba į giminingos struktūros cheminėms medžiagoms gautus duomenis, genotoksiškumo nereikėtų tikėtis, visas bandymas naudojant trijų dydžių dozes gali būti nebūtinas, jei būtų įrodyta, kad bandomoji (-osios) cheminė (-ės) medžiaga (-os) pasiekia tikslinį audinį (kaulų čiulpus). Tokiais atvejais gali pakakti vienos ribinio dydžio dozės. Jei davimo laikotarpis > 14 parų, ribinė dozė yra 1 000 mg/kg kūno masės per parą. Jei davimo laikotarpis – 14 parų arba trumpesnis, ribinė dozė yra 2 000 mg/kg kūno masės per parą. Dozių davimas Rengiant bandymo schemą, reikėtų atsižvelgti į numatomą poveikio žmogui būdą. Todėl galima pasirinkti pagrįstus veikimo būdus, pvz., duoti su pašaru, geriamuoju vandeniu, atlikti vietinę poodinę arba intraveninę injekciją, duoti per burną (per zondą), kvėpavimo takus, intubacinį vamzdelį ar implantuoti. Visais atvejais turėtų būti pasirinktas būdas, kuris užtikrintų reikiamą tikslinio (-ių) audinio (-ių) veikimą. Injekcija į pilvo ertmę paprastai nerekomenduojama, nes tai nėra numatytas poveikio žmogui būdas ir jį reikėtų naudoti, tik jei būtų specialiai moksliškai pagrįstas. Jei bandomoji cheminė medžiaga įmaišoma į pašarą ar į geriamąjį vandenį, ypač vienkartinio dozavimo atveju reikėtų imtis priemonių, kad laiko tarpas nuo maisto bei vandens vartojimo iki ėminių ėmimo būtų pakankamas poveikiui aptikti (žr. 33–34 pastraipas). Skysčio, kurį galima duoti per zondą arba įšvirkšti per vieną kartą, maksimalus tūris priklauso nuo bandymo gyvūno dydžio. Tūris neturėtų būti didesnis kaip 1 ml/100 g kūno masės, išskyrus vandeninius tirpalus, kurių galima duoti ne daugiau kaip po 2 ml/100 g kūno masės. Didesnio nei šis tūrio naudojimą reikėtų pagrįsti. Išskyrus dirginančias ar ėsdinančias bandomąsias chemines medžiagas, kurios, būdamos didesnės koncentracijos, paprastai sukeltų sunkesnį poveikį, bandymo tūrio kintamumas turėtų būti kuo mažesnis reguliuojant koncentraciją, kad būtų užtikrintas visų dydžių dozių tūrio pastovumas kūno masės atžvilgiu. Apdorojimo planas Paprastai bandomosios cheminės medžiagos duodamos per vieną kartą, bet, siekiant palengvinti didelių tūrių davimą, dozę galima padalyti (t. y. per vieną dieną apdoroti du arba daugiau kartų, tarp apdorojimų esant ne ilgesniam kaip 2–3 h tarpui). Šiomis aplinkybėmis arba tais atvejais, kai bandomoji cheminė medžiaga duodama ją įkvepiant, ėminių ėmimo tvarkaraštį reikėtų sudaryti atsižvelgiant į paskutinės dozės davimo arba veikimo pabaigos laiką. Turima mažai duomenų apie kartotinės dozės protokolo tinkamumą šiam bandymui. Tačiau jei šį bandymą norima sujungti su kartotinės dozės toksiškumo bandymu, reikėtų imtis priemonių išvengti mitozinių ląstelių su pažeistomis chromosomomis nuostolių, kurių gali būti esant toksinėms dozėms. Toks sujungimas yra priimtinas, kai didžiausia dozė yra lygi ribinei dozei arba didesnė (žr. 29 pastraipą) ir dozės grupei duodama ribinė dozė visą apdorojimo laikotarpio trukmę. Į mikrobranduolių bandymą (B.12 bandymų metodas) galima žiūrėti kaip į geriausią chromosomų aberacijų bandymą in vivo, kai siekiama jungti su kitais tyrimais. Kaulų čiulpų ėminiai turėtų būti imami atskirai du kartus po vienkartinio apdorojimo. Graužikų pirmasis ėminių ėmimo intervalas turėtų būti laikas, kuris yra būtinas, kad galėtų baigtis laikotarpis, 1,5 karto ilgesnis nei normalaus ląstelių ciklo trukmė (pastaroji paprastai yra 12–18 h po apdorojimo laikotarpio). Kadangi bandomosios (-ųjų) cheminės (-ių) medžiagos (-ų) sugertis ir metabolizmas, taip pat medžiagos (-ų) įtaka ląstelių ciklo kinetikai gali paveikti optimalų chromosomų aberacijos aptikimo laiką, rekomenduojama antrąjį ėminį paimti praėjus 24 h nuo pirmojo ėminio paėmimo. Imant ėminį pirmą kartą, visos dozių grupės turėtų būti apdorotos ir ėminiai paimti analizei, tačiau, imant ėminį kitą (-us) kartą (-us), duoti reikia tik didžiausią dozę. Jei moksliškai yra pagrįstos daugiau kaip vienos paros dozės davimo schemos, paprastai ėminius reikėtų imti vieną kartą, po galutinio apdorojimo praėjus laikui, maždaug 1,5 ilgesniam nei normalaus ląstelių ciklo trukmė. Po apdorojimo ir prieš ėminių surinkimą gyvūnams suleidžiama injekcija į pilvo ertmę su metafazę stabdančios medžiagos (pvz., kolchicino ar kolcemido) reikiama doze, ir ėminiai surenkami po reikiamo laiko tarpo. Pelėms šis laiko tarpas prieš surinkimą yra maždaug 3–5 h, žiurkėms – 2–5 h. Ląstelės surenkamos iš kaulų čiulpų, brinkinamos, fiksuojamos, dažomos ir analizuojamos chromosomų aberacijoms nustatyti (12). Stebėjimai Reikėtų atlikti bendruosius bandymo gyvūnų klinikinius stebėjimus ir bent kartą per dieną registruoti klinikinius požymius, pageidautina kartą ar kelis kartus kasdien tuo pačiu laiku, atsižvelgiant į didžiausio numatomo poveikio laiką po dozės davimo. Mažiausiai du kartus per dieną dozavimo laikotarpiu visus gyvūnus reikėtų apžiūrėti siekiant nustatyti liguistumo ir gaištamumo požymius. Visi gyvūnai turėtų būti sveriami tyrimo pradžioje, bent kartą per savaitę kartotinės dozės tyrimų metu ir numarinant. Jei tyrimai atliekami ne trumpiau kaip vieną savaitę, bent kartą per savaitę reikėtų matuoti pašaro suvartojimą. Jei bandomoji cheminė medžiaga duodama su geriamuoju vandeniu, suvartoto vandens kiekį reikėtų išmatuoti kaskart, kai vanduo keičiamas, ir bent kartą per savaitę. Gyvūnus, kuriems pasireiškia nemirtini pernelyg didelio toksiškumo požymiai, reikėtų humaniškai numarinti dar nesibaigus bandymo laikotarpiui (11). Tikslinio audinio veikimas Reikiamu laiku vieną ar kelis kartus reikėtų paimti kraujo ėminį bandomųjų cheminių medžiagų koncentracijai plazmoje nustatyti, siekiant įsitikinti, ar kaulų čiulpai buvo paveikti, jei reikalaujama ir jei nėra kitų poveikio duomenų (žr. 44 pastraipą). Kaulų čiulpų ir chromosomų preparatai Iš karto po humaniško numarinimo gaunamos kaulų čiulpų ląstelės iš gyvūnų šlaunikaulių ar blauzdikaulių, veikiamos hipotoniniu tirpalu ir fiksuojamos. Metafazės ląstelės paskleidžiamos ant objektinių stiklelių ir dažomos nustatytais būdais (žr. (3) (12)). Analizė Visi objektiniai stikleliai, įskaitant teigiamų ir neigiamų kontrolinių ėminių, prieš analizę turėtų būti atskirai koduojami ir randomizuojami, kad skaičiuotojas nežinotų apdorojimo sąlygų. Reikėtų nustatyti mitozinį indeksą kaip citotoksiškumo matą, įvertinant citotoksiškumą mažiausiai 1 000 ląstelių vienam gyvūnui, jį nustatant visiems apdorotiems gyvūnams (įskaitant teigiamus kontrolinius ėminius), neapdorotiems gyvūnams arba tirpiklio ar nešiklio neigiamų kontrolinių ėminių gyvūnams. Reikėtų ištirti ne mažiau kaip 200 metafazės kiekvieno gyvūno ląstelių, kad būtų nustatytos struktūrinės chromosomų aberacijos, įtraukiant ir neįtraukiant plyšių (6). Tačiau jei istorinių neigiamų kontrolinių ėminių duomenų bazė rodo, kad bandymo laboratorijos vidutinis foninis struktūrinių chromosomų aberacijų dažnumas yra < 1 %, reikėtų atsižvelgti į galimybę skaičiuoti papildomas ląsteles. Chromatidinė ir chromosominė aberacijos turėtų būti registruojamos atskirai ir klasifikuojamos pagal potipius (trūkius, mainus). Laboratorijoje taikomos procedūros turėtų užtikrinti, kad chromosomų aberacijų analizę atlieka tinkamai apmokyti skaičiuotojai ir, jei reikia, ją peržiūrėtų ekspertai. Atsižvelgiant į tai, kad objektinių stiklelių ruošimo procedūrų dažnas rezultatas dėl gautų chromosomų nuostolių pakeičia metafazės ląstelių dalį, skaičiuojamų ląstelių centromerų skaičius turėtų būti ne mažesnis kaip 2n ± 2, kai n yra tos rūšies haploidinis chromosomų skaičius. DUOMENYS IR ATASKAITOS RENGIMAS Rezultatų apdorojimas Kiekvieno gyvūno bandymų rezultatai turėtų būti pateikiami lentelėse. Reikėtų įvertinti kiekvieno gyvūno mitozinį indeksą, suskaičiuotų metafazės ląstelių skaičių, aberacijų vienai metafazės ląstelei skaičių ir ląstelių su strūktūrine (-ėmis) chromosomų aberacija (-omis) procentinę dalį. Turėtų būti išvardyti apdorotų ir kontrolinių grupių gyvūnų skirtingi struktūrinių chromosomų aberacijų tipai, nurodant jų skaičių bei dažnumą. Plyšiai, taip pat poliploidinės ląstelės ir ląstelės su endoreduplikuotomis chromosomomis yra registruojamos atskirai. Plyšių dažnumas pateikiamas ataskaitoje, bet paprastai neįtraukiamas į suminio struktūrinių aberacijų dažnumo analizę. Jei nėra atsako skirtumo dėl lyties įrodymų, atliekant statistinę analizę duomenis galima apjungti. Ataskaitoje taip pat reikėtų pateikti toksiškumo gyvūnams ir klinikinių požymių duomenis. Priimtinumo kriterijai Apie bandymo priimtinumą sprendžiama pagal šiuos kriterijus:
Rezultatų įvertinimas ir aiškinimas Jei įvykdomi visi priimtinumo kriterijai, bandomoji cheminė medžiaga laikoma aiškiai teigiama, jei:
Jei tam tikru ėminio ėmimo laiku tiriama tik didžiausia dozė, bandomoji cheminė medžiaga laikoma aiškiai teigiama, jei yra statistiškai reikšmingas padidėjimas, palyginti su vienalaikiu neigiamu kontroliniu ėminiu, o rezultatai yra už istorinių neigiamų kontrolinių ėminių duomenų skirstinio ribų (pvz., Puasono skirstinio 95 % kontrolinių ribų). Rekomendacijų dėl tinkamų statistinių metodų galima rasti literatūroje (13). Atliekant dozės ir atsako priklausomybės analizę, reikėtų analizuoti ne mažiau kaip tris dozę gavusias grupes. Taikant statistinius kriterijus, bandymo vienetu turėtų būti gyvūnas. Teigiami chromosomų aberacijų bandymo rezultatai rodo, kad bandomoji cheminė medžiaga sukelia bandomųjų rūšių kaulų čiulpų struktūrines chromosomų aberacijas. Jei įvykdomi visi priimtinumo kriterijai, bandomoji cheminė medžiaga laikoma aiškiai neigiama, jei visomis ištirtomis bandymo sąlygomis:
Rekomendacijų dėl tinkamiausių statistinių metodų galima rasti literatūroje (13). Kaulų čiulpų veikimo bandomąja chemine medžiaga įrodymu gali būti mitozinio indekso sumažėjimas arba bandomosios (-ųjų) cheminės (-ių) medžiagos (-ų) koncentracijos verčių plazmoje ar kraujyje matavimas. Jei cheminė medžiaga leidžiama į veną, įrodyti poveikio nebūtina. Siekiant įrodyti, kad kaulų čiulpai buvo paveikti, taip pat galima naudoti ADME (absorbcijos, pasiskirstymo, metabolizmo, šalinimo) duomenis, gautus atliekant nepriklausomą tyrimą, kuriame būtų naudojamas tas pats davimo būdas ir ta pati rūšis. Neigiami rezultatai rodo, kad tyrimo sąlygomis bandomoji cheminė medžiaga nesukelia chromosomų aberacijų bandytos gyvūnų rūšies kaulų čiulpuose. Nėra reikalavimo patikrinti aiškų teigiamą ar aiškų neigiamą atsaką. Tais atvejais, kai atsakas nėra aiškiai neigiamas ar teigiamas, ir siekiant padėti nustatyti rezultato biologinę svarbą (pvz., mažas ar tarpinis padidėjimas), duomenys turėtų būti įvertinti pateikiant ekspertų nuomonę ir (arba) papildomai tiriant esamus atliktus bandymus. Kai kuriais atvejais galėtų būti naudinga analizuoti didesnį ląstelių skaičių arba pakartoti bandymą šiek tiek pakeistomis bandymo sąlygomis. Retais atvejais, netgi atlikus papildomus tyrimus, nepakaks duomenų padaryti išvadą, ar gauti bandomosios cheminės medžiagos rezultatai yra teigiami ar neigiami, todėl bus priimtas sprendimas, kad tyrimas yra dviprasmis. Poliploidinių ir endoreduplikuotų metafazės ląstelių dažnumas turėtų būti registruojamas atskirai. Poliploidinių ar endoreduplikuotų ląstelių skaičiaus padidėjimas gali rodyti, kad bandomoji cheminė medžiaga gali slopinti mitozinius procesus ar ląstelių ciklo eigą (žr. 3 pastraipą). Bandymo ataskaita Į bandymo ataskaitą turėtų būti įtraukta ši informacija: Santrauka
LITERATŪRA
1 priedėlis APIBRĖŽTYS Aneuploidija – vienos arba daugiau kaip vienos chromosomų, bet ne viso (-ų) jų rinkinio (-ų) (žr. poliploploidija) nukrypimas nuo normalaus diploidinio (arba haploidinio) chromosomų skaičiaus. Centromera – chromosomos regionas, su kuriuo ląstelės dalijimosi metu asocijuojasi verpstės siūlai ir dėl to dukterinės chromosomos tvarkingai išsidėsto dukterinių ląstelių poliuose. Cheminė medžiaga – medžiaga arba mišinys. Chromatidinė aberacija – struktūrinis chromosomos pažeidimas, pasireiškiantis kaip vienos iš chromatidžių trūkis arba kaip chromatidžių trūkis ir susijungimas. Chromosominė aberacija – struktūrinis chromosomos pažeidimas, pasireiškiantis kaip abiejų chromatidžių trūkis arba kaip trūkis ir susijungimas toje pačioje vietoje. Endoreduplikacija – procesas, kurio metu pasibaigus DNR replikacijos S periodui, branduolys nepradeda dalytis mitozės būdu, bet prasideda naujas S periodas. Taip atsiranda chromosomos, turinčios 4, 8, 16 ... chromatidžių. Plyšys – achromatinė, mažesnė nei vienos chromatidės plotis, spraga, kurioje yra mažiausias skaičius klaidingai suporuotų bazių. Mitozinis indeksas – santykis tarp metafazėje esančių ląstelių skaičiaus ir visų populiacijos ląstelių skaičiaus, kuris yra tos ląstelių populiacijos proliferacijos būsenos matas. Chromosomų skaičiaus aberacija – naudojamų gyvūnų chromosomų skaičiaus pokytis palyginti su normaliu jų skaičiumi (aneuploidija). Poliploidija – chromosomų skaičiaus aberacija ląstelėse arba organizmuose, apimanti viso chromosomų rinkinio skaičiaus pokytį, bet ne chromosomų rinkinio dalies skaičiaus pokytį (žr. aneuploidija). Struktūrinė chromosomų aberacija – chromosomos struktūros pokytis, kurį galima nustatyti dalijimosi ciklo metafazės ląsteles tiriant mikroskopu; jis pasireiškia kaip delecijos ir fragmentai, pokyčiai grandinių viduje ar tarp grandinių. Bandomoji cheminė medžiaga – taikant šį metodą bandoma medžiaga arba mišinys. 2 priedėlis FAKTORINĖS ANALIZĖS SCHEMA LYČIŲ SKIRTUMAMS NUSTATYTI ATLIEKANT CHROMOSOMŲ ABERACIJŲ TYRIMĄ IN VIVO Faktorinės analizės schema ir jos taikymas Pagal šią schemą kiekvienai koncentracijos vertei bandomi ne mažiau kaip 5 patinai ir 5 patelės. Iš viso pagal schemą naudojama ne mažiau kaip 40 gyvūnų (20 patinų ir 20 patelių ir dar atitinkami teigiami kontroliniai ėminiai). Schema, kuri yra viena iš paprastesnių faktorinės analizės schemų, atitinka dvifaktorinės dispersinės analizės schemą, kurios pagrindiniai veiksniai yra lytis ir koncentracijos vertė. Duomenis galima analizuoti naudojant daug standartinių statistinės programinės įrangos rinkinių, pvz., SPSS, SAS, STATA, Genstat taip pat naudojant programavimo kalbą R. Atliekant analizę, duomenų rinkinio kintamumas perdalijamas į kintamumą tarp lyčių, tarp koncentracijos verčių ir į kintamumą, susijusį su sąveika tarp lyčių ir koncentracijos verčių. Kiekvienas iš narių tikrinamas tos pačios lyties kartotinių gyvūnų kintamumo grupių viduje įverčio atžvilgiu, esant vienodai koncentracijai. Išsami informacija apie bazinę metodiką pateikta daugelyje standartinių statistinių vadovėlių (žr. nuorodas) ir su statistiniais rinkiniais pateikiamose pagalbinėse priemonėse. Analizė tęsiama tikrinant ANOVA lentelės x lyties ir koncentracijos sąveikos narį (5). Nesant reikšmingo sąveikos nario, lytims ar koncentracijos vertėms gautos jungtinės vertės duoda patikimus statistinius kriterijus tarp koncentracijos verčių, pagrįstus grupės jungtiniu ANOVA kintamumo nariu. Atliekant analizę toliau, kintamumo tarp koncentracijos verčių įvertis dalijamas į kontrastus, taip gaunamas atsakų pagal koncentracijos vertes tiesinių ir kvadratinių kontrastų kriterijus. Kai yra reikšminga x lyties ir koncentracijos sąveika, šį narį taip pat galima padalyti į tiesinius x lyties ir kvadratinius x lyties sąveikos kontrastus. Šie nariai pateikia kriterijus, ar abiejų lyčių atsakas į koncentraciją yra lygiagretus, ar abiejų lyčių atsakas yra skirtuminis. Grupės jungtinio kintamumo įvertis gali būti naudojamas skirtumų tarp vidurkių poriniams kriterijams gauti. Galima lyginti abiejų lyčių vidurkius ir skirtingoms koncentracijos vertėms gautus vidurkius, pvz., palyginimui su neigiamų kontrolinių ėminių vidurkiais. Jei sąveika yra reikšminga, galima lyginti vienos lyties skirtingoms koncentracijos vertėms gautus vidurkius ir vienos koncentracijos lytims gautus vidurkius. Nuorodos Yra daug statistikos vadovėlių, kuriuose aptariama faktorinės analizės schemų, nuo paprasčiausios dvifaktorinės analizės iki bandymų planavimo metodikoje naudojamų sudėtingesnių formų, teorija, projektavimas, metodika, analizė ir aiškinimas. Toliau pateikiamas sąrašas nėra išsamus. Kai kuriose knygose pateikiami palyginamųjų schemų pavyzdžiai su skaičiavimais, kartais su kompiuterine programa analizei atlikti naudojant įvairius programinės įrangos rinkinius.
|
|
5) |
B dalies B.12 skyrius pakeičiamas taip: „B.12 Žinduolių eritrocitų mikrobranduolių bandymas ĮVADAS Šis bandymų metodas atitinka EBPO bandymų gaires (TG) 474 (2014). Jis yra genetinės toksikologijos metodų serijos dalis. Yra parengtas EBPO dokumentas, kuriame glaustai pateikiama informacijos apie genetinės toksikologijos bandymus ir naujausių šių gairių pakeitimų apžvalga (1). Žinduolių mikrobranduolių bandymas in vivo ypač tinka genotoksiškumui vertinti, nes, nors skirtingų gyvūnų rūšių mikrobranduoliai gali skirtis, metabolizmo in vivo veiksniai, farmakokinetika ir DNR atkūrimo procesai yra aktyvūs ir prisideda prie atsakų. Tyrimas in vivo taip pat yra naudingas toliau tiriant genotoksiškumą, aptiktą in vitro sistema. Žinduolių mikrobranduolių bandymas in vivo yra naudojamas aptikti pažaidoms, kurias bandomoji cheminė medžiaga sukelia chromosomoms ar eritroblastų mitoziniam aparatui. Atliekant bandymą įvertinamas mikrobranduolių susidarymas eritrocituose, imant gyvūnų, paprastai graužikų, kaulų čiulpų arba periferinio kraujo ląstelių ėminius. Mikrobranduolių bandymo tikslas – identifikuoti chemines medžiagas, sukeliančias citogenetinius pažeidimus, dėl kurių susiformuoja mažieji branduoliai, turintys atsilikusių chromosomų fragmentų ar ištisas chromosomas. Kai kaulų čiulpų eritroblastas virsta nesubrendusiu eritrocitu (kartais vadinamu polichrominiu eritrocitu ar retikulocitu), pagrindinis branduolys yra išstumiamas; susiformavęs mikrobranduolys gali likti citoplazmoje. Matyti ar aptikti mikrobranduolius šiose ląstelėse nėra sunku, nes jos neturi pagrindinio branduolio. Nesubrendusių eritrocitų su mikrobranduoliais dažnumo padidėjimas apdorotuose gyvūnuose rodo sukeltas struktūrines arba kiekybines chromosomų aberacijas. Naujai susidarę eritrocitai su mikrobranduoliais nustatomi ir kiekybiškai įvertinami juos dažant ir vizualiai skaičiuojant pro mikroskopą arba atliekant automatizuotą analizę. Nepakankamai subrendusių eritrocitų suaugusių gyvūnų periferiniame kraujyje ar kaulų čiulpuose suskaičiavimą labai palengvina automatizuota kompiuterinė skaičiavimo sistema. Tokios sistemos yra priimtinos vertinimo rankiniu būdu alternatyvos (2). Palyginamieji tyrimai parodė, kad, naudojant atitinkamus kalibravimo etalonus, tokiais metodais galima gauti geresnį laboratorinį ir tarplaboratorinį atkuriamumą ir jautrį, palyginti su skaičiavimu rankiniu būdu (3) (4). Automatizuotos sistemos, kurios gali matuoti eritrocitų su mikrobranduoliais dažnumą, yra tėkmės citometrai (5), vaizdo analizės sistemos (6) (7) ir lazeriniai skenuojantys citometrai (8), tačiau gali būti ir kitų sistemų. Nors paprastai tai neatliekama kaip bandymo dalis, chromosomų fragmentus galima atskirti nuo ištisų chromosomų pagal kelis kriterijus. Tai yra kinetochorų ar centromerinių DNR buvimo ar nebuvimo nustatymas, nes abu dalykai yra nepažeistų chromosomų charakteristika. Kai kinetochorų ar centromerinių DNR nėra, tai rodo, kad mikrobranduoliai turi tik chromosomų fragmentus, o kai jų yra – chromosomų praradimą. Taikomų terminų apibrėžtys pateiktos 1 priedėlyje. PRADINIAI ASPEKTAI Jaunų suaugusių graužikų kaulų čiulpai yra šio bandymo genetinių pažeidimų tikslinis audinys, nes eritrocitai gaminami šiame audinyje. Galima vertinti kitų rūšių žinduolių mikrobranduolius periferinio kraujo nesubrendusiuose eritrocituose, jei įrodyta (mikrobranduolių indukcijos nesubrendusiuose eritrocituose būdu), kad jie pakankamai jautrūs, kad būtų galima išsiaiškinti, ar cheminės medžiagos sukelia struktūrines chromosomų ar jų skaičiaus aberacijas tose ląstelėse, ir jei pateiktas mokslinis pagrindimas. Nesubrendusių eritrocitų su mikrobranduoliais dažnumas yra pagrindinė vertinamoji baigtis. Rūšims be stiprios ląstelių su mikrobranduoliais atrankos blužnyje ir gyvūnus nuolat apdorojant laikotarpiu, kurio trukmė yra didesnė nei naudojamos gyvūnų rūšies eritrocitų gyvavimo trukmė (pvz., pelių – 4 savaitės arba ilgiau) kaip vertinamoji baigtis taip pat gali būti naudojamas periferinio kraujo subrendusių eritrocitų, turinčių mažuosius branduolius, dažnumas. Jei yra duomenų, kad bandomoji (-osios) cheminė (-ės) medžiaga (-os) ar jos arba jų metabolitas (-ai) nepasieks tikslinio audinio, šis metodas gali būti netinkamas. Prieš taikant bandymų metodą mišiniui, kad būtų gauti duomenys numatomo reglamentavimo tikslu, reikėtų panagrinėti, ar metodu galima pasiekti tą tikslą atitinkančius rezultatus ir, jei taip, dėl kokios priežasties. Tokie svarstymai nereikalingi, kai yra reglamentavimo reikalavimas bandyti mišinį. BANDYMŲ METODO PRINCIPAS Gyvūnai veikiami bandomąja chemine medžiaga reikiamu būdu. Jei naudojami kaulų čiulpai, gyvūnai humaniškai numarinami reikiamu (-ais) momentu (-ais) po apdorojimo, kaulų čiulpai išimami ir ruošiami bei dažomi jų preparatai (9) (10) (11) (12) (13) (14) (15). Kai naudojamas periferinis kraujas, jis imamas reikiamu (-ais) momentu (-ais) po apdorojimo ir ruošiami bei dažomi jo preparatai (12) (16) (17) (18). Jei apdorojama ūmiu būdu, svarbu pasirinkti tokį kaulų čiulpų ar kraujo surinkimo laiką, kuriuo būtų galima aptikti su apdorojimu susijusią nesubrendusių eritrocitų su mikrobranduoliais indukciją. Imant periferinio kraujo ėminius taip pat turi praeiti pakankamai laiko, kad šie reiškiniai pasireikštų cirkuliuojančiame kraujyje. Preparatai analizuojami mikrobranduolių buvimui nustatyti vizualiai pro mikroskopą, naudojant vaizdo analizę, tėkmės citometriją ar lazerinę skenuojančią citometriją. LABORATORIJOS KVALIFIKACIJOS TIKRINIMAS Kvalifikacijos tyrimai Siekdama įgyti pakankamos tyrimo atlikimo patirties prieš jį taikydama įprastiniams bandymams, laboratorija turėtų įrodyti gebėjimą atkurti paskelbtų duomenų (17) (19) (20) (21) (22) tikėtinus mikrobranduolių dažnumo rezultatus, naudodama ne mažiau kaip dvi teigiamas kontrolines chemines medžiagas (įskaitant mažos dozės teigiamų kontrolinių ėminių sukeltus silpnus atsakus), pvz., išvardytas 1 lentelėje, ir suderinamų tirpiklių ir (arba) nešiklių kontrolinius ėminius (žr. 26 pastraipą). Atliekant šiuos bandymus, reikėtų naudoti dozes, kurioms esant tiriamajame audinyje (kaulų čiulpuose ar periferiniame kraujyje) gaunami atkuriami ir su doze susiję padidėjimai, bei įrodyti bandymo sistemos jautrį ir dinaminį diapazoną, pasitelkiant laboratorijoje taikomą vertinimo metodą. Šis reikalavimas netaikomas patirties turinčioms laboratorijoms, t. y. kurios turi istorinių duomenų bazę, prieinamą kaip apibrėžta 14–18 pastraipose. Istorinių kontrolinių ėminių duomenys Atlikdama kvalifikacijos tyrimus, laboratorija turėtų nustatyti:
Pirmą kartą gaunant istorinių neigiamų kontrolinių ėminių pasiskirstymo duomenis, vienalaikiai neigiami kontroliniai ėminiai turėtų atitikti paskelbtus kontrolinius duomenis, jei jie yra. Istorinių kontrolinių ėminių pasiskirstymą papildant vis didesniu bandymų duomenų kiekiu, būtų gerai, kad vienalaikiai neigiami kontroliniai ėminiai patektų į to skirstinio 95 % kontrolines ribas. Laboratorijos istorinių neigiamų kontrolinių ėminių duomenų bazė turėtų būti statistiškai patikima, kad būtų užtikrinta laboratorijos gebėjimas vertinti savo neigiamų kontrolinių ėminių duomenų pasiskirstymą. Literatūroje daroma prielaida, kad gali prireikti ne mažiau kaip 10 bandymų, bet būtų geriau, jei palyginamosiomis Bandymo sąlygomis atliktų bandymų skaičius būtų ne mažesnis kaip 20. Laboratorijos turėtų taikyti kokybės kontrolės metodus, tokius kaip kontrolinės diagramos (pvz., C tipo ar X juostinės diagramos (23)), kad galėtų nustatyti savo duomenų kintamumą ir įrodyti metodikos „valdomumą“ savo laboratorijoje. Papildomas rekomendacijas, kaip kurti ir naudoti istorinius duomenis (t. y. duomenų įtraukimo ir pašalinimo iš istorinių duomenų kriterijus ir tam tikro bandymo priimtinumo kriterijus) galima rasti literatūroje (24). Jei atliekant 13 skirsnyje aprašytus kvalifikacijos tyrimus laboratorijai nepakanka bandymų skaičiaus statistiškai patikimam neigiamų kontrolių ėminių skirstiniui gauti (žr. 15 pastraipą), priimtina skirstinį papildyti atliekant pirmuosius įprastinius bandymus. Taikant šį būdą, reikėtų laikytis literatūroje nurodytų rekomendacijų (24), o atliekant šiuos bandymus gauti neigiamų kontrolinių ėminių rezultatai turėtų būti suderinami su paskelbtais neigiamų kontrolinių ėminių duomenimis. Į visus bandymų protokolo pakeitimus reikėtų žiūrėti atsižvelgiant į jų poveikį gaunamiems duomenims, kurie turi likti suderinami su esamomis laboratorijos istorinių kontrolinių ėminių duomenų bazėmis. Tik esant didesnėms neatitiktims turėtų būti kuriama nauja istorinių kontrolinių ėminių duomenų bazė, jei atsižvelgiant į ekspertų nuomonę nustatoma, kad ji skiriasi nuo ankstesnio skirstinio (žr. 15 pastraipą). Atkūrimo metu atliekamam bandymui gali neprireikti visos neigiamų kontrolinių ėminių duomenų bazės, jei laboratorija gali įrodyti, kad vienalaikių neigiamų kontrolinių ėminių vertės ir toliau yra suderinamos su ankstesne duomenų baze arba su atitinkamais paskelbtais duomenimis. Neigiamų kontrolinių ėminių duomenis turėtų sudaryti kiekvieno gyvūno nesubrendusių, mažųjų branduolių turinčių eritrocitų dažnumas. Būtų gerai, kad vienalaikiai neigiami kontroliniai ėminiai patektų į laboratorijos istorinių neigiamų kontrolinių ėminių duomenų bazės skirstinio 95 % kontrolines ribas. Jei vienalaikių neigiamų kontrolinių ėminių duomenys nepatenka į 95 % kontrolines ribas, jie gali būti tinkami įtraukti į istorinių kontrolinių ėminių skirstinį, jei nėra kraštiniai riktai ir yra įrodymų, kad bandymo sistema „valdoma“ (žr. 15 pastraipą) ir kad nėra techninių ar žmogaus klaidų. METODO APRAŠYMAS Parengiamieji darbai Gyvūnų rūšies parinkimas Reikėtų tirti dažniausiai naudojamas sveikų jaunų suaugusių gyvūnų laboratorines veisles. Galima naudoti peles, žiurkes ar kitas tinkamas žinduolių rūšis. Kai naudojamas periferinis kraujas, turi būti nustatyta, ar indukuotų mikrobranduolių aptikimas netrikdomas, pasirinktos rūšies gyvūno blužniai iš apytakos šalinant ląsteles su mikrobranduoliais. Tai buvo aiškiai įrodyta pelių ir žiurkių periferiniam kraujui (2). Kitų nei žiurkės ar pelės rūšių naudojimas turėtų būti moksliškai pagrįstas ataskaitoje. Jei naudojamos kitos nei graužikai rūšys, rekomenduojama indukuotų mikrobranduolių matavimą įtraukti į kitą tinkamą toksiškumo bandymą. Gyvūnų laikymo ir šėrimo sąlygos Temperatūra graužikų patalpoje turėtų būti 22 °C (± 3 °C). Nors geriausia būtų užtikrinti 50–60 % drėgmę, ji neturėtų būti mažesnė kaip 40 % ir būtų gerai, jei ji nebūtų didesnė kaip 70 %, išskyrus patalpos valymo laiką. Apšvietimas turėtų būti dirbtinis, taikant 12 h šviesos ir 12 h tamsos seką. Gyvūnams šerti tinka įprastas laboratorijose naudojamas pašaras, neribojant geriamojo vandens kiekio. Pašaro pasirinkimui gali turėti įtakos būtinybė užtikrinti tinkamą bandomosios cheminės medžiagos sumaišymą su pašaru, kai ji duodama tokiu būdu. Jei nesitikima agresyvaus elgesio, graužikus reikėtų laikyti nedidelėmis vienos lyties vienodai apdorotomis grupėmis (ne daugiau kaip po penkis viename narvelyje), pageidautina narveliuose su kietomis grindimis ir esant atitinkamai pagerintai aplinkai. Tik moksliškai pagrįstais atvejais gyvūnus galima laikyti atskirai. Gyvūnų paruošimas Paprastai naudojami sveiki jauni suaugę gyvūnai (geriausias graužikų amžius apdorojimo pradžioje yra 6–10 savaičių, nors leidžiama naudoti šiek tiek vyresnius gyvūnus), kurie atsitiktinai paskirstomi į kontrolines ir apdorotas grupes. Atskiri gyvūnai unikaliai paženklinami humanišku minimaliai invaziniu būdu (pvz., žieduojant, kabinant etiketę, naudojant mikrolustą ar biometrinį identifikavimą, bet ne ausų ar pėdų spaustukus) ir aklimatizuojami laboratorinėmis sąlygomis ne trumpiau kaip 5 paras. Narvelius reikėtų įrengti taip, kad jų išdėstymo poveikis būtų minimalus. Reikėtų vengti teigiamo kontrolinio ėminio ir bandomosios cheminės medžiagos kryžminės taršos. Tyrimo pradžioje gyvūnų masės skirtumas turėtų būti kuo mažesnis ir neviršyti ± 20 % kiekvienos lyties gyvūno masės. Dozių ruošimas Kietąsias bandomąsias chemines medžiagas, prieš dozuojant gyvūnams, reikėtų ištirpinti atitinkamuose tirpikliuose ar nešikliuose, paruošti jų suspensiją arba įmaišyti į pašarą ar geriamąjį vandenį. Skystąsias bandomąsias chemines medžiagas galima dozuoti tiesiogiai arba prieš tai praskiesti. Jei bandomoji cheminė medžiaga patenka per kvėpavimo takus, ją galima duoti dujų, garų arba kietojo ar skystojo aerozolio pavidalu, atsižvelgiant į jos fizikines ir chemines savybės. Reikėtų naudoti tik iš naujo paruoštus bandomosios cheminės medžiagos preparatus, nebent stabilumo duomenys rodo, kad laikymas priimtinas ir šiuo atveju apibrėžiamos tinkamos laikymo sąlygos. Bandymo sąlygos Tirpiklis ir (arba) nešiklis Neturėtų būti tirpiklio ar nešiklio toksinio poveikio, esant naudojamiems dozių dydžiams, ir negalėtų vykti jų cheminė reakcija su bandomosiomis cheminėmis medžiagomis. Jei naudojami kiti nei gerai žinomi tirpikliai ar nešikliai, juos galima įtraukti, pateikus suderinamumą rodančius nuorodų duomenis. Rekomenduojama visuomet iš pradžių atsižvelgti į galimybę naudoti vandeninį tirpiklį arba nešiklį. Dažniausiai naudojamų suderinamų tirpiklių ar nešiklių pavyzdžiai yra vanduo, fiziologinis tirpalas, metilceliuliozės tirpalas, karboksimetilceliuliozės natrio druskos tirpalas, alyvuogių ir kukurūzų aliejus. Jei nėra istorinių arba paskelbtų kontrolinių duomenų, kurie rodo, kad pasirinktas netipinis tirpiklis ar nešiklis nesukelia mikrobranduolių atsiradimo ir kitokio žalingo poveikio, reikėtų atlikti pradinį tyrimą tirpiklio ar nešiklio kontrolinio ėminio priimtinumui nustatyti. Kontroliniai ėminiai Teigiami kontroliniai ėminiai Paprastai į kiekvieną bandymą reikėtų įtraukti grupę gyvūnų, apdorotų teigiama kontroline chemine medžiaga. To galima atsisakyti, jei bandymų laboratorija įrodė turinti kvalifikaciją atlikti bandymą ir nustatė istorinių teigiamų kontrolinių ėminių intervalą. Jei vienalaikių teigiamų kontrolinių ėminių grupė neįtraukiama, į kiekvieną bandymą reikėtų įtraukti vertinimo kontrolinius ėminius (fiksuotus ir nedažytus objektinius stiklelius arba ląstelių suspensijos ėminius, atsižvelgiant į vertinimo metodą). Juos galima gauti į tyrimo vertinimą įtraukiant atitinkamus etaloninius ėminius, kurie būtų gauti periodiškai (pvz., kas 6–18 mėnesių) atliekant atskirą teigiamo kontrolinio ėminio bandymą, pvz., kvalifikacijos tyrimo metu ir reguliariai vėliau, jei būtina, ir tuos ėminius laikyti. Teigiamos kontrolinės cheminės medžiagos turėtų patikimai sukelti aiškų mikrobranduolių dažnumo padidėjimą palyginti su savaiminiu lygiu. Kai skaičiuojama rankiniu būdu žiūrint pro mikroskopą, reikėtų pasirinkti tokias teigiamų kontrolinių ėminių dozes, kad poveikis būtų ryškus, bet skaičiuotojui ne iškarto atsiskleistų užkoduotų ėminių tapatybė. Teigiamą kontrolinę cheminę medžiagą galima duoti kitu nei bandomoji cheminė medžiaga būdu, taikant skirtingą apdorojimo planą ir ėminius imant tik vienu laiko momentu. Be to, jei tinka, galima atsižvelgti į tos pačios cheminės klasės teigiamų kontrolinių cheminių medžiagų naudojimą. Teigiamų kontrolinių cheminių medžiagų pavyzdžiai pateikti 1 lentelėje. 1 lentelė. Teigiamų kontrolinių cheminių medžiagų pavyzdžiai Cheminės medžiagos ir CAS Nr. Etilmetansulfonatas [CAS Nr. 62-50-0] Metilmetansulfonatas [CAS Nr. 66-27-3] Etilnitrozokarbamidas [CAS Nr. 759-73-9] Mitomicinas C [CAS Nr. 50-07-7] Ciklofosfamidas (monohidratas) [CAS Nr. 50-18-0 (CAS Nr. 6055-19-2)] Trietilenmelaminas [CAS Nr. 51-18-3] Kolchicinas [CAS Nr. 64-86-8] ar vinblastinas [CAS Nr. 865-21-4] – kaip aneugenai Neigiami kontroliniai ėminiai Neigiamos kontrolinės grupės gyvūnus reikėtų įtraukti kiekvieną kartą imant ėminį ir su jais elgtis kaip su apdorota grupe, išskyrus tai, kad gyvūnai nepaveikiami bandomąja chemine medžiaga. Jei bandomajai cheminei medžiagai duoti naudojamas tirpiklis ar nešiklis, kontrolinė grupė turėtų gauti šio tirpiklio ar nešiklio. Tačiau jei kiekvienam ėminių ėmimo laikui bandymų laboratorijos istorinių neigiamų kontrolinių ėminių duomenys rodo pastovų kintamumą tarp gyvūnų ir ląstelių su mikrobranduoliais dažnumą, gali pakakti paimti tik vieną neigiamą kontrolinį ėminį. Jei imamas tik vienas neigiamas kontrolinis ėminys, jis turėtų būti imamas pirmą kartą imant atliekamo tyrimo ėminį. Jei naudojamas periferinis kraujas, vietoj vienalaikio neigiamo kontrolinio ėminio atliekant trumpalaikius tyrimus galima naudoti parengtinio apdorojimo ėminį, kai gauti duomenys yra suderinami su bandymų laboratorijos istorinių kontrolinių ėminių duomenų baze. Naudojant žiurkes buvo įrodyta, kad mažo tūrio parengtinio ėminio ėmimas (pvz., mažesnio kaip 100 μl/parai) turi minimalų poveikį mikrobranduolių foniniam dažnumui (25). PROCEDŪRA Gyvūnų skaičius ir lytis Apskritai, vyriškos ir moteriškos lyties gyvūnų mikrobranduolių atsakas yra panašus, todėl daugumą tyrimų būtų galima atlikti su bet kurios lyties gyvūnais (26). Jei duomenys rodytų esminius skirtumus tarp patinų ir patelių (pvz., sisteminio toksiškumo, metabolizmo, biologinio įsisavinamumo, toksiškumo kaulų čiulpams ir kt. skirtumus, įskaitant, pvz., intervalo nustatymo tyrimą), tai paskatintų naudoti abiejų lyčių gyvūnus. Šiuo atveju galbūt reikėtų atlikti tyrimą su abiejų lyčių gyvūnais, pvz., kaip kartotinės dozės toksiškumo tyrimo dalį. Jei naudojamos abi lytys, galbūt tiktų taikyti faktorinės analizės schemą. Išsami informacija, kaip analizuoti duomenis taikant šią schemą, pateikta 2 priedėlyje. Reikėtų nustatyti grupių dydį tyrimo pradžioje, turint tikslą vienai grupei gauti ne mažiau kaip 5 analizei tinkamus vienos lyties gyvūnus arba kiekvienos lyties gyvūnus, jei naudojami abiejų lyčių gyvūnai. Jei cheminių medžiagų poveikis žmonėms gali priklausyti nuo lyties, pvz., kai kurių vaistų atveju, bandymas turėtų būti atliekamas su atitinkamos lyties gyvūnais. Atliekant kaulų čiulpų tyrimą pagal 37 pastraipoje nustatytus parametrus, kai yra trys dozių grupės ir vienalaikio neigiamo ir teigiamo kontrolinių ėminių grupės (kiekvieną grupę sudaro penki vienos lyties gyvūnai), rekomenduojamas tipinis maksimalus gyvūnų poreikis būtų nuo 25 iki 35 gyvūnų. Dozės dydžiai Jei atliekamas parengiamasis intervalo nustatymo tyrimas, nes nėra tinkamų duomenų, kurie padėtų pasirinkti dozę, jį reikėtų atlikti toje pačioje laboratorijoje, naudojant pagrindiniam tyrimui naudoti numatytą rūšį, veislę, lytį ir apdorojimo schemą (27). Tyrimo tikslas – nustatyti didžiausią toleruojamą dozę (MTD), apibrėžiamą kaip didžiausia dozė, kuri būtų toleruojama nesant tyrimą ribojančio toksiškumo požymių, susijusių su tyrimo laikotarpio trukme (pvz., sukeliant kūno masės sumažėjimą arba hematopoetinės sistemos citotoksiškumą, bet ne žūtį ar skausmo, kančių ar išsekimo požymius, dėl kurių reikėtų humaniškai numarinti (28)). Didžiausią dozę taip pat būtų galima apibrėžti kaip dozę, kuri sukeltų toksiškumą kaulų čiulpams (pvz., kaulų čiulpų arba periferinio kraujo nesubrendusių eritrocitų dalies sumažėjimas suminio eritrocitų skaičiaus atžvilgiu daugiau kaip 50 %, bet iki ne mažiau kaip 20 % kontrolinės vertės). Tačiau analizuojant periferinės kraujotakos CD71 teigiamas ląsteles (t. y. tėkmės citometrijos metodu), ši labai jauna nesubrendusių eritrocitų frakcija gali reaguoti į toksinius veiksnius labiau nei didesnė RNR teigiama nesubrendusių eritrocitų grupė. Todėl didesnis akivaizdus toksiškumas gali būti matomas naudojant ūmaus paveikimo schemas, kai tiriama CD71 teigiamų nesubrendusių eritrocitų frakcija, palyginti su schemomis, pagal kurias nustatomi nesubrendę eritrocitai pagal RNR kiekį. Todėl, kai bandant apdorojama penkias paras arba mažiau, didžiausia toksiškumą sukeliančių cheminių medžiagų dozė gali būti apibrėžta kaip dozė, kuri sukelia statistiškai reikšmingą CD71 teigiamų nesubrendusių eritrocitų sumažėjimą suminio eritrocitų skaičiaus atžvilgiu, bet ne mažesnį kaip 5 % kontrolinės vertės (29). Cheminės medžiagos, kurios rodo toksikokinetinių savybių prisotinimą arba po ilgalaikio davimo sukelia detoksifikavimo procesus, galinčius mažinti veikimą, gali būti dozės nustatymo kriterijų išimtys ir turėtų būti įvertinamos kiekvienu atveju atskirai. Siekiant gauti informacijos apie dozės ir atsako priklausomybę, į išsamų tyrimą reikėtų įtraukti neigiamo kontrolinio ėminio grupę ir ne mažiau kaip tris dozes, kurių dydžio skirtumo faktorius būtų 2, bet ne didesnis kaip 4. Jei cheminė medžiaga nėra toksiška atliekant intervalo nustatymo tyrimą arba atsižvelgiant į turimus duomenis, 14 parų ar ilgesnio laikotarpio didžiausia davimo dozė turėtų būti 1 000 mg/kg kūno masės per parą arba 2 000 mg/kg kūno masės per parą, jei laikotarpis trumpesnis kaip 14 parų. Tačiau, jei bandomoji cheminė medžiaga yra toksiška, didžiausia duodama dozė turėtų būti MTD, o naudojami dozių dydžiai turėtų aprėpti intervalą nuo didžiausios dozės iki mažo toksiškumo arba visiškai jo nesukeliančios dozės. Kai toksiškumas tiksliniam audiniui (kaulų čiulpams) stebimas naudojant visus bandomus dozės dydžius, patartina toliau tirti netoksines dozes. Tyrimams, kurių tikslas būtų išsamiau apibūdinti kiekybinę dozės ir atsako priklausomybės informaciją, gali prireikti papildomų dozių grupių. Tam tikrų tipų bandomųjų cheminių medžiagų (pvz., vaistų žmonėms), kurioms taikomi specifiniai reikalavimai, šios ribos gali skirtis. Ribinis bandymas Jei dozės intervalo nustatymo bandymai arba esami susijusių gyvūnų veislių duomenys rodo, kad apdorojimo režimu bent ribinė dozė (aprašyta toliau) nesukelia jokio toksinio poveikio (įskaitant tai, kad nėra kaulų čiulpų proliferacijos slopinimo ar kitų citotoksiškumo tiksliniam audiniui požymių) ir, jei atsižvelgiant į in vitro genotoksiškumo tyrimus arba į giminingos struktūros cheminėms medžiagoms gautus duomenis, genotoksiškumo nereikėtų tikėtis, visas bandymas naudojant trijų dydžių dozes gali būti nebūtinas, jei būtų įrodyta, kad bandomoji (-osios) cheminė (-ės) medžiaga (-os) pasiekia tikslinį audinį (kaulų čiulpus). Tokiais atvejais gali pakakti vienos ribinio dydžio dozės. Jei davimo laikotarpis – 14 parų arba ilgesnis, ribinė dozė yra 1 000 mg/kg kūno masės per parą. Jei davimo laikotarpis yra trumpesnis kaip 14 parų, ribinė dozė yra 2 000 mg/kg kūno masės per parą. Dozių davimas Rengiant bandymo schemą, reikėtų atsižvelgti į numatomą poveikio žmogui būdą. Todėl galima pasirinkti pagrįstus poveikio būdus, pvz., duoti su pašaru, geriamuoju vandeniu, atlikti vietinę poodinę arba intraveninę injekciją, duoti per burną (per zondą), kvėpavimo takus, intubacinį vamzdelį ar implantuoti. Visais atvejais turėtų būti pasirinktas būdas, kuris užtikrintų reikiamą tikslinio (-ių) audinio (-ių) veikimą. Injekcija į pilvo ertmę paprastai nerekomenduojama, nes tai nėra numatytas poveiko žmogui būdas ir jį reikėtų naudoti, tik, jei būtų specialiai moksliškai pagrįstas. Jei bandomoji cheminė medžiaga įmaišoma į pašarą ar į geriamąjį vandenį, ypač vienkartinio dozavimo atveju, reikėtų imtis priemonių, kad laiko tarpas nuo maisto bei vandens vartojimo iki ėminių ėmimo būtų pakankamas poveikiui aptikti (žr. 37 pastraipą). Skysčio, kurį galima duoti per zondą arba įšvirkšti per vieną kartą, maksimalus tūris priklauso nuo bandymo gyvūno dydžio. Tūris neturėtų būti didesnis kaip 1 ml/100 g kūno masės, išskyrus vandeninius tirpalus, kurių galima duoti ne daugiau kaip po 2 ml/100 g kūno masės. Didesnio nei šis tūrio naudojimą reikėtų pagrįsti. Išskyrus dirginančias ar ėsdinančias bandomąsias chemines medžiagas, kurios, būdamos didesnės koncentracijos, paprastai sukeltų sunkinantį poveikį, bandymo tūrio kintamumas turėtų būti kuo mažesnis reguliuojant koncentraciją, kad būtų užtikrintas visų didžių dozių tūrio pastovumas kūno masės atžvilgiu. Apdorojimo planas Pageidautina apdoroti 2 kartus arba daugiau, duodant kas 24 h, ypač kai šis bandymas įtraukiamas į kitus toksiškumo tyrimus. Arba galima apdoroti duodant vieną kartą, jei tai būtų moksliškai pagrįsta (pvz., žinoma, kad bandomosios cheminės medžiagos stabdo ląstelių ciklą). Bandomąsias chemines medžiagas galima duoti kaip padalytą dozę (t. y. siekiant palengvinti didelių tūrių davimą, per vieną dieną apdorojama du kartus arba daugiau, tarp apdorojimų esant ne ilgesniam kaip 2–3 h tarpui). Šiomis aplinkybėmis arba tais atvejais, kai bandomoji cheminė medžiaga duodama ją įkvepiant, ėminių ėmimo tvarkaraštį reikėtų sudaryti atsižvelgiant į paskutinės dozės davimo arba veikimo pabaigos laiką. Bandymą su pelėmis arba žiurkėmis galima atlikti vienu iš trijų būdų:
Galima naudoti kitas dozavimo ar ėminių ėmimo schemas, siekiant palengvinti sujungimą su kitais toksiškumo bandymais, jei jos būtų tinkamos ir moksliškai pagrįstos. Stebėjimai Reikėtų atlikti bendruosius bandymo gyvūnų klinikinius stebėjimus ir bent kartą per dieną registruoti klinikinius požymius, pageidautina kartą ar kelis kartus kasdien tuo pačiu laiku, atsižvelgiant į didžiausio numatomo poveikio laiką po dozės davimo. Mažiausiai du kartus per dieną, siekiant nustatyti liguistumo ir gaištamumo požymius, dozavimo laikotarpiu visus gyvūnus reikėtų apžiūrėti. Visi gyvūnai turėtų būti sveriami tyrimo pradžioje, bent kartą per savaitę kartotinės dozės tyrimų metu ir numarinant. Jei tyrimai atliekami ne trumpiau kaip vieną savaitę, bent kartą per savaitę reikėtų matuoti pašaro suvartojimą. Jei bandomoji cheminė medžiaga duodama su geriamuoju vandeniu, suvartoto vandens kiekį reikėtų išmatuoti kaskart, kai vanduo keičiamas, ir bent kartą per savaitę. Gyvūnus, kuriems pasireiškia nemirtini pernelyg didelio toksiškumo požymiai, reikėtų humaniškai numarinti iki bandymo laikotarpio pabaigos (28). Tam tikromis aplinkybėmis būtų galima kontroliuoti gyvūnų kūno temperatūrą, nes apdorojimo sukelta hipertermija ir hipotermija prisidėjo gaunant klaidingus rezultatus (32) (33) (34). Tikslinio audinio veikimas Reikiamu laiku vieną ar kelis kartus reikėtų paimti kraujo ėminį bandomųjų cheminių medžiagų koncentracijai plazmoje nustatyti, siekiant įsitikinti, ar kaulų čiulpai buvo paveikti, jei reikalaujama ir jei nėra kitų poveikio duomenų (žr. 48 pastraipą). Kaulų čiulpų ar kraujo paruošimas Kaulų čiulpų ląstelės gaunamos iš gyvūnų šlaunikaulių ar blauzdikaulių iš karto po humaniško numarinimo. Paprastai ląstelės yra išskiriamos, paruošiamos ir dažomos nustatytais būdais. Maži periferinio kraujo tūriai gali būti gauti pagal atitinkamus gyvūnų gerovės reikalavimus, taikant metodą, kuris užtikrintų bandymų gyvūno išgyvenamumą, pvz., imant kraują iš uodeginės venos ar kito tinkamo kraujo indo, atliekant širdies punkciją ar imant ėminį iš didelio kraujo indo gyvūną numarinus. Atsižvelgiant į analizės metodą, kaulų čiulpų ar iš periferinio kraujo gautų eritrocitų ląstelės gali būti nedelsiant supravitaliai dažomos (16) (17) (18), daromi tepinėliai ir tada dažomi mikroskopijai arba fiksuojami ir tinkamai dažomi tėkmės citometrinei analizei atlikti. Naudojant DNR specifinius dažus, pvz., akridino oranžinį (35) ar Hoechst 33258 ir pironiną Y (36), galima pašalinti kai kuriuos artefaktus, susijusius su DNR atžvilgiu nespecifinių dažų naudojimu. Šis privalumas netrukdo naudoti įprastinių dažų (pvz., Giemsa dažus mikroskopinei analizei atlikti). Taip pat galima naudoti papildomas sistemas (pvz., celiulioze užpildytas kolonėles, skirtas branduolius turinčioms ląstelėms pašalinti (37) (38)), jei būtų įrodyta, kad šios sistemos yra suderinamos su ėminių paruošimu laboratorijoje. Jei taikomi šie metodai, mikrobranduolių tipui identifikuoti (chromosomų ar chromosomų fragmentų), kad būtų galima nustatyti, ar mikrobranduolių indukcijos mechanizmas susijęs su klastogeniniu ir (arba) aneugeniniu aktyvumu, gali būti naudojami antikinetochoro antikūnai (39), FISH analizė ir pancentromeriniai DNR zondai (40) arba in situ ženklinimas pancentromerų specifiniais užpildais kartu su atitinkamu DNR priešpriešiniu dažymu (41). Gali būti taikomi kiti metodai klastogenams ir aneugenams atskirti, jei jie pasirodytų efektyvūs. Analizė (rankiniu būdu ir automatizuota) Prieš atliekant bet kurio tipo analizę visi objektiniai stikleliai ar ėminiai, įskaitant teigiamus ir neigiamus kontrolinius ėminius, turėtų būti nepriklausomai užkoduoti ir randomizuoti, kad skaičiuotojas rankiniu būdu nežinotų apdorojimo sąlygų; toks kodavimas nebūtinas, kai naudojamos automatizuotos skaičiavimo sistemos, kurios nepriklauso nuo vizualios apžiūros ir negali būti paveiktos veiklos vykdytojo šališkumo. Nustatomas kiekvieno gyvūno nesubrendusių eritrocitų kiekis kaip visų eritrocitų (subrendusių ir nesubrendusių) skaičiaus dalis, suskaičiuojant ne mažiau kaip 500 kaulų čiulpų eritrocitų ir 2 000 periferinio kraujo eritrocitų (42). Reikėtų suskaičiuoti ne mažiau kaip 4 000 nesubrendusių eritrocitų vienam gyvūnui, kad būtų galima nustatyti nesubrendusių eritrocitų su mikrobranduoliais dažnumą (43). Jei istorinių neigiamų kontrolinių ėminių duomenų bazė rodo, kad bandymo laboratorijos vidutinis foninis nesubrendusių eritrocitų su mikrobranduoliais dažnumas yra < 0,1 %, reikėtų atsižvelgti į galimybę skaičiuoti papildomas ląsteles. Analizuojant ėminius, apdorotų gyvūnų nesubrendusių eritrocitų dalis visų eritrocitų atžvilgiu neturėtų būti mažesnė kaip 20 % nešiklio ar tirpiklio kontrolinių ėminių dalies, kai skaičiuojama mikroskopu, ir ne mažesnė kaip maždaug 5 % nešiklio ar tirpiklio kontrolinių ėminių dalies, kai CD71+ nesubrendę eritrocitai skaičiuojami citometriniais metodais (žr. 31 pastraipą) (29). Pvz., jei atliekant kaulų čiulpų tyrimą mikroskopu, kontrolinio ėminio kaulų čiulpų nesubrendusių eritrocitų dalis yra 50 %, viršutinė toksiškumo riba būtų 10 % nesubrendusių eritrocitų. Kadangi žiurkių blužnis atskiria ir suardo eritrocitus su mikrobranduoliais, siekiant užtikrinti didelį tyrimo jautrį, kai analizuojamas žiurkių periferinis kraujas, atliekant nesubrendusių eritrocitų su mikrobranduoliais analizę pageidautina apsiriboti jauniausia frakcija. Kai taikomi automatizuotos analizės metodai, šiuos labiausiai nesubrendusius eritrocitus galima nustatyti pagal jų didelį RNR kiekį arba jų paviršiuje ekspresuotų transferino receptorių (CD71+) didelį lygį (31). Tačiau tiesioginis daugelio dažymo būdų palyginimas parodė, kad priimtinus rezultatus galima gauti taikant įvairius būdus, įskaitant įprastinį dažymą akridino oranžiniu (3) (4). DUOMENYS IR ATASKAITOS RENGIMAS Rezultatų apdorojimas Kiekvienam gyvūnui gauti rezultatai turėtų būti pateikiami lentelėse. Turėtų būti atskirai įrašytas kiekvieno tirto gyvūno suskaičiuotų nesubrendusių eritrocitų skaičius, nesubrendusių eritrocitų su mikrobranduoliais skaičius bei nesubrendusių ir subrendusių eritrocitų skaičiaus santykis. Kai pelės apdorojamos nuolat 4 savaites ar ilgiau, taip pat reikėtų pateikti subrendusių eritrocitų skaičiaus ir subrendusių eritrocitų su mikrobranduoliais dalies duomenis, jei renkami. Ataskaitoje taip pat reikėtų pateikti toksiškumo gyvūnams ir klinikinių požymių duomenis. Priimtinumo kriterijai Apie bandymo priimtinumą sprendžiama pagal šiuos kriterijus:
Rezultatų įvertinimas ir aiškinimas Jei įvykdomi visi priimtinumo kriterijai, bandomoji cheminė medžiaga laikoma aiškiai teigiama, jei:
Jei tam tikru ėminio ėmimo laiku tiriama tik didžiausia dozė, bandomoji cheminė medžiaga laikoma aiškiai teigiama, jei yra statistiškai reikšmingas padidėjimas palyginti su vienalaikiu neigiamu kontroliniu ėminiu, o rezultatai yra už istorinių neigiamų kontrolinių ėminių duomenų skirstinio ribų (pvz., Puasono skirstinio 95 % kontrolinių ribų). Rekomendacijų dėl tinkamiausių statistinių metodų galima rasti literatūroje (44) (45) (46) (47). Atliekant dozės ir atsako priklausomybės analizę, reikėtų analizuoti ne mažiau kaip tris dozę gavusias grupes. Statistiniai kriterijai turėtų naudoti gyvūną kaip bandymo vienetą. Atliekant mikrobranduolių bandymą gauti teigiami rezultatai rodo, kad bandomoji cheminė medžiaga sukelia mažųjų branduolių atsiradimą dėl bandymo rūšies gyvūnų chromosomų ar eritroblastų mitozinio aparato pažeidimų. Jei bandymas atliekamas centromeroms mikrobranduoliuose aptikti, bandomoji cheminė medžiaga, kuri gamina centromeras turinčius mikrobranduolius (centromeros DNR ar kinetochoras, kurie rodo ištisos chromosomos praradimą), akivaizdžiai yra aneugenas. Jei įvykdomi visi priimtinumo kriterijai, bandomoji cheminė medžiaga laikoma aiškiai neigiama, jei visomis ištirtomis bandymo sąlygomis:
Rekomendacijų dėl tinkamiausių statistinių metodų galima rasti literatūroje (44) (45) (46) (47). Kaulų čiulpų paveikimo bandomąja chemine medžiaga įrodymu gali būti nesubrendusių ir subrendusių eritrocitų santykio sumažėjimas arba bandomosios cheminės medžiagos koncentracijos verčių plazmoje ar kraujyje matavimas. Jei cheminė medžiaga leidžiama į veną, poveikio įrodyti nebūtina. Siekiant įrodyti, kad kaulų čiulpai buvo paveikti, taip pat galima naudoti ADME (absorbcijos, pasiskirstymo, metabolizmo, šalinimo) duomenis, gautus atliekant nepriklausomą tyrimą, kuriame būtų naudojamas tas pats davimo būdas ir ta pati rūšis. Neigiami rezultatai rodo, kad bandymo sąlygomis bandomoji cheminė medžiaga nesukelia mažųjų branduolių atsiradimo bandymo rūšies gyvūnų nesubrendusiuose eritrocituose. Nėra reikalavimo patikrinti aiškų teigiamą ar neigiamą atsaką. Tais atvejais, kai atsakas nėra aiškiai neigiamas ar teigiamas, ir siekiant padėti nustatyti rezultato biologinę svarbą (pvz., mažas ar fono padidėjimas), duomenys turėtų būti įvertinti pateikiant ekspertų nuomonę ir (arba) atliekant papildomus baigtų bandymų tyrimus. Kai kuriais atvejais galėtų būti naudinga analizuoti didesnį ląstelių skaičių arba pakartoti bandymą, naudojant modifikuotas bandymo sąlygas. Retais atvejais, netgi atlikus papildomus tyrimus, duomenų nepakaks padaryti išvadą, ar bandomajai cheminei medžiagai gauti rezultatai yra teigiami ar neigiami, todėl bus priimtas sprendimas, kad tyrimas yra dviprasmis. Bandymo ataskaita Į bandymo ataskaitą turėtų būti įtraukta ši informacija:
LITERATŪRA
1 priedėlis APIBRĖŽTYS Centromera – chromosomos regionas, su kuriuo ląstelės dalijimosi metu asocijuojasi verpstės siūlai ir dėl to dukterinės chromosomos tvarkingai išsidėsto dukterinių ląstelių poliuose. Cheminė medžiaga – medžiaga arba mišinys. Eritroblastas – ankstyvoji eritrocitų vystymosi stadija, prieš pat nesubrendusių eritrocitų stadiją, kai ląstelė dar turi branduolį. Kinetochoras – ant eukariotinių lastelių centromeros susidaranti baltyminė struktūra, kuri mitozės ir mejozės metu sujungia chromosomą su mitozinės verpstės mikrovamzdelių polimerais ir dalijantis ląstelėms veikia kaip dukterinių chromatidžių atstūmimo vieną nuo kitos priemonė. Mikrobranduoliai – nuo ląstelių pagrindinių branduolių atskirti papildomi maži branduoliai, susidarę mitozės (mejozės) telofazėje, kai chromosomų fragmentai ar ištisos chromosomos lėtai juda link ląstelės polių. Normochrominis ar subrendęs eritrocitas – visiškai subrendęs eritrocitas, pametęs po enukleacijos likusias RNR ir (arba) kitus trumpalaikius ląstelių žymeklius, kurie jiems būdingu būdu išnyksta po enukleacijos, vykstančios po galutinio eritroblasto dalijimosi. Polichrominis ar nesubrendęs eritrocitas – naujai susidaręs tarpinėje vystymosi stadijoje esantis eritrocitas, kuris nusidažo klasikinių kraujo dažų, pvz., Wright Giemsa, mėlynuoju ir raudonuoju komponentais dėl liekamųjų RNR buvimo naujai susidariusioje ląstelėje. Tokios naujai susidariusios ląstelės yra maždaug tas pats kaip retikulocitai, kurios vizualizuojamos naudojant vitalinį dažą, sukeliantį liekamųjų ląstelių RNR sulipimą į būdingą tinklą. Šiuo metu dažnai taikomi kiti naujai susidariusių raudonųjų kraujo ląstelių identifikavimo metodai, įskaitant RNR monochrominį dažymą fluorescenciniais dažais arba trumpalaikių paviršinių žymeklių, pvz., CD71, ženklinimą fluorescuojančiais antikūnais. Polichrominiai eritrocitai, retikulocitai ir CD71 teigiami eritrocitai yra nesubrendę eritrocitai, nors kiekvienas iš jų kažkiek skiriasi amžiaus pasiskirstymu. Retikulocitas – naujai susidaręs eritrocitas, dažytas vitaliniu dažu, kuris sukelia liekamųjų ląstelių RNR sulipimą į būdingą tinklą. Retikulocitų ir polichrominių eritrocitų ląstelių amžiaus pasiskirstymas yra panašus. Bandomoji cheminė medžiaga – taikant šį metodą bandoma medžiaga arba mišinys. 2 priedėlis FAKTORINĖS ANALIZĖS CHEMA LYČIŲ SKIRTUMAMS NUSTATYTI ATLIEKANT MIKROBRANDUOLIŲ TYRIMĄ IN VIVO Faktorinės analizės schema ir jos taikymas Pagal šią schemą kiekvienai koncentracijos vertei bandomi ne mažiau kaip 5 patinai ir 5 patelės, iš viso pagal schemą naudojant ne mažiau kaip 40 gyvūnų (20 patinų ir 20 patelių ir dar atitinkami teigiami kontroliniai ėminiai). Schema, kuri yra viena iš paprastesnių faktorinės analizės schemų, atitinka dvifaktorinės dispersinės analizės schemą, kurios pagrindiniai veiksniai yra lytis ir koncentracijos vertė. Duomenis galima analizuoti naudojant daug standartinių statistinės programinės įrangos rinkinių, pvz., SPSS, SAS, STATA, Genstat taip pat naudojant programavimo kalbą R. Atliekant analizę, duomenų rinkinio kintamumas perdalijamas į kintamumą tarp lyčių, tarp koncentracijos verčių ir į kintamumą, susijusį su sąveika tarp lyčių ir koncentracijos verčių. Kiekvienas iš narių tikrinamas tos pačios lyties kartotinių gyvūnų kintamumo grupių viduje įverčio atžvilgiu, esant vienodai koncentracijai. Išsami informacija apie bazinę metodiką pateikta daugelyje standartinių statistinių vadovėlių (žr. nuorodas) ir su statistiniai rinkiniais pateikiamose pagalbinėse priemonėse. Analizė tęsiama tikrinant ANOVA lentelės x lyties ir koncentracijos sąveikos narį (6). Nesant reikšmingo sąveikos nario, lytims ar koncentracijos vertėms gautos jungtinės vertės duoda patikimus statistinius kriterijus tarp koncentracijos verčių, pagrįstus grupės jungtiniu ANOVA kintamumo nariu. Atliekant analizę toliau, kintamumo tarp koncentracijos verčių įvertis dalijamas į kontrastus, taip gaunamas atsakų pagal koncentracijos vertes tiesinių ir kvadratinių kontrastų kriterijus. Kai yra reikšminga x lyties ir koncentracijos sąveika, šį narį taip pat galima padalyti į tiesinius x lyties ir kvadratinius x lyties sąveikos kontrastus. Šie nariai pateikia kriterijus, ar abiejų lyčių atsakas į koncentraciją yra lygiagretus, ar abiejų lyčių atsakas yra skirtuminis. Grupės jungtinio kintamumo įvertis gali būti naudojamas skirtumų tarp vidurkių poriniams kriterijams gauti. Galima lyginti abiejų lyčių vidurkius ir skirtingoms koncentracijos vertėms gautus vidurkius, pvz., palyginimui su neigiamų kontrolinių ėminių vidurkiais. Jei sąveika yra reikšminga, galima lyginti vienos lyties skirtingoms koncentracijos vertėms gautus vidurkius ir vienos koncentracijos lytims gautus vidurkius. Nuorodos Yra daug statistikos vadovėlių, kuriuose aptariama faktorinės analizės schemų teorija, projektavimas, metodika, analizė ir aiškinimas, kurios varijuoja nuo paprasčiausios dvifaktorinės analizės iki „bandymų planavimo“ metodikoje naudojamų sudėtingesnių formų. Toliau pateikiamas sąrašas nėra išsamus. Kai kuriose knygose pateikiami palyginamųjų schemų pavyzdžiai su skaičiavimais, kartais su kompiuterine programa analizei atlikti naudojant įvairius programinės įrangos rinkinius.
|
|
6) |
B dalies B.15 skyrius išbraukiamas. |
|
7) |
B dalies B.16 skyrius išbraukiamas. |
|
8) |
B dalies B.18 skyrius išbraukiamas. |
|
9) |
B dalies B.19 skyrius išbraukiamas. |
|
10) |
B dalies B.20 skyrius išbraukiamas. |
|
11) |
B dalies B.24 skyrius išbraukiamas. |
|
12) |
B dalies B.47 skyrius pakeičiamas taip: „B.47 Galvijų ragenos drumstumo ir pralaidumo bandymo metodas, skirtas identifikuoti i) chemines medžiagas, sukeliančias smarkų akių pažeidimą, ir ii) chemines medžiagas, kurių nereikia klasifikuoti kaip dirginančias akis ar sukeliančias smarkų akių pažeidimą ĮVADAS Šis bandymo metodas atitinka EBPO bandymo gaires (TG) 437 (2013). Galvijų ragenos drumstumo ir pralaidumo (angl. Bovine Corneal Opacity and Permeability, BCOP) bandymo metodą 2006 m. ir 2010 m. įvertino Alternatyvių metodų patvirtinimo tarpžinybinio koordinavimo komitetas (angl. Interagency Coordinating Committee on the Validation of Alternative Methods, ICCVAM) kartu su Europos alternatyvių metodų patvirtinimo centru (angl. European Centre for the Validation of Alternative Methods, ECVAM) ir Japonijos alternatyvių metodų patvirtinimo centru (angl. Japanese Centre for the Validation of Alternative Methods, JaCVAM) (1)(2). Atliekant pirmąjį įvertinimą, buvo tiriama, ar BCOP bandymo metodas tinka nustatant chemines medžiagas (medžiagas ir mišinius), kurios sukelia smarkų akių pažeidimą (1). Atliekant antrąjį įvertinimą, buvo tiriama, ar BCOP bandymų metodas tinka nustatant chemines medžiagas (medžiagas ir mišinius), kurios neklasifikuojamos kaip dirginančios akis ar sukeliančios smarkų akių pažeidimą (2). BCOP tinkamumo patvirtinimo duomenų bazę iš viso sudarė 113 medžiagų ir 100 mišinių (2)(3). Atsižvelgiant į šiuos įvertinimus ir jų ekspertizę buvo padaryta išvada, kad taikant bandymų metodą galima tinkamai identifikuoti chemines medžiagas (medžiagas ir mišinius), sukeliančias smarkų akių pažeidimą (1 kategorijos), taip pat medžiagas, kurių nereikia klasifikuoti kaip dirginančias akis ar sukeliančias smarkų akių pažeidimą, kaip apibrėžta Jungtinių Tautų (JT) visuotinai suderintoje cheminių medžiagų klasifikavimo ir ženklinimo sistemoje (GHS) (4) ir Reglamente (EB) Nr. 1272/2008 dėl cheminių medžiagų ir mišinių klasifikavimo, ženklinimo ir pakavimo (CLP) (7), todėl jis buvo patvirtintas kaip moksliškai tinkamas abiem tikslams. Smarkus akių pažeidimas – tai akies audinio pažeidimas arba smarkus fizinis regėjimo pablogėjimas, ant išorinio akies paviršiaus uždėjus bandomosios cheminės medžiagos, kuris ne visiškai praeina per 21 dieną nuo uždėjimo. Bandomosios cheminės medžiagos, kurios sukelia smarkų akių pažeidimą, pagal JT GHS klasifikuojamos kaip 1 kategorijos medžiagos. Cheminės medžiagos, neklasifikuojamos kaip dirginančios akis ar sukeliančios smarkų akių pažeidimą, apibrėžiamos kaip medžiagos, kurios neatitinka JT GHS 1 ar 2 kategorijos (2A ar 2B) klasifikavimo reikalavimų, t. y. jos nurodomos kaip JT GHS be kategorijos. Į šį bandymų metodą įtrauktas BCOP bandymų metodo rekomenduojamas taikymas ir apribojimai, pagrįsti jo įvertinimo darbais. Pagrindiniai skirtumai tarp EBPO bandymų gairių originalios 2009 m. versijos ir atnaujintos 2013 m. versijos yra susiję su šiais dalykais (tačiau ne tik): BCOP metodo taikymas nustatant chemines medžiagas, kurių nereikia klasifikuoti pagal JT GHS (2 ir 7 pastraipos); pateikti paaiškinimai dėl BCOP bandymo metodo taikomumo bandant alkoholius, ketonus ir kietąsias medžiagas (6 ir 7 pastraipos) bei medžiagas ir mišinius (8 pastraipa); paaiškinta, kaip reikėtų bandyti paviršinio aktyvumo medžiagas ir jų turinčius mišinius (28 pastraipa); atnaujintas ir paaiškintas teigiamų kontrolinių ėminių naudojimas (39 ir 40 pastraipos); atnaujinti BCOP bandymų metodo sprendimo priėmimo kriterijai (47 pastraipa); atnaujinti tyrimo priimtinumo kriterijai (48 pastraipa); atnaujinti bandymo ataskaitos elementai (49 pastraipa); atnaujintos 1 priedėlio apibrėžtys; papildytas 2 priedėlis dėl BCOP bandymų metodo tinkamumo prognozėms daryti pagal skirtingas klasifikavimo sistemas; atnaujintas 3 priedėlio kvalifikacijai tikrinti naudojamų cheminių medžiagų sąrašas ir atnaujintas 4 priedėlis dėl BCOP ragenos laikiklio (1 pastraipa) ir drumstumo matuoklio (2 ir 3 pastraipos). Šiuo metu visuotinai pripažįstama, kad artimiausioje ateityje joks vienas in vitro akių dirginimo bandymas negalės pakeisti Draize akių bandymo in vivo siekiant prognozuoti skirtingų cheminių klasių visą dirginimo gebos intervalą. Tačiau kelių alternatyvių bandymų metodų strateginiai deriniai taikant (nuosekliųjų) bandymų strategiją galėtų pakeisti Draize akių bandymą (5). Žemynkryptis metodas (5) skirtas taikyti tada, kai, atsižvelgiant į esamą informaciją, daroma prielaida apie didelę cheminės medžiagos dirginamojo poveikio gebą, o aukštynkryptis metodas (5) skirtas taikyti tada, kai, atsižvelgiant į esamą informaciją, daroma prielaida, kad cheminė medžiaga nepakankamai dirgina akis, kad ją reikėtų klasifikuoti. BCOP bandymų metodas – bandymų metodas in vitro, kuris su tam tikrais apribojimais ir tam tikromis aplinkybėmis gali būti taikomas klasifikuoti ir ženklinti cheminėms medžiagoms, keliančioms pavojų akims. Nors kaip atskiras metodas BCOP metodas nelaikomas tinkamu pakeisti triušių akių bandymą in vivo, jis rekomenduojamas kaip pirmas bandymų strategijos etapas, pvz., žemynkryptis metodas, pasiūlytas Scott et al. (5), be papildomų bandymų nustatant chemines medžiagas, sukeliančias smarkų akių pažeidimą, t. y. chemines medžiagas, kurias reikia klasifikuoti kaip JT GHS 1 kategorijos medžiagas (4). BCOP bandymų metodas taip pat rekomenduojamas, kai reikia identifikuoti chemines medžiagas, kurių nereikia klasifikuoti kaip dirginančias akis ar sukeliančias smarkų akių pažeidimą, kaip apibrėžta JT GHS (JT GHS be kategorijos) (4), taikant bandymų strategiją, pvz., aukštynkryptį metodą (5). Tačiau cheminė medžiaga, kuri pagal BCOP bandymų metodą nelaikoma galinčia sukelti smarkų akių pažeidimą arba neklasifikuojama dėl akių dirginimo ar smarkaus akių pažeidimo, turėtų būti bandoma papildomai (in vitro ir (arba) in vivo) galutinei klasifikavimo kategorijai nustatyti. Šio bandymo metodo tikslas – aprašyti procedūras, taikomas įvertinant bandomosios cheminės medžiagos keliamo pavojaus akims galimybę, matuojant jos gebą sukelti atskirai paimtos galvijo ragenos drumstumą ir padidėjusį pralaidumą. Toksinis poveikis ragenai vertinamas pagal: (i) sumažėjusį šviesos pralaidumą (drumstumą) ir ii) padidėjusią fluoresceino natrio druskos dažiklio skverbtį (pralaidumą). Bandomąja chemine medžiaga paveiktos ragenos drumstumo ir pralaidumo vertinimo rezultatai bendrinami, kad būtų gautas in vitro dirginimo balas (angl. In Vitro Irritancy Score, IVIS), kuris naudojamas bandomosios cheminės medžiagos dirginimo gebos lygiui klasifikuoti. Apibrėžtys pateiktos 1 priedėlyje. PRADINIAI ASPEKTAI IR APRIBOJIMAI Šis bandymų metodas pagrįstas ICCVAM BCOP bandymo metodo protokolu (6)(7), kuris iš pradžių buvo sukurtas pagal informaciją, gautą iš In vitro bandymų metodų instituto (angl. Institute for In Vitro Sciences, IIVS) protokolo ir iš INVITTOX protokolo Nr. 124 (8). Pastarasis atitinka protokolą (10), kuris buvo naudojamas 1997–1998 m. atliekant Europos bendrijos finansuotą preliminaraus patvirtinimo tyrimą. Abu šie protokolai buvo pagrįsti BCOP bandymų metodu, kurį pirmasis paskelbė Gautheron et al. (9). BCOP bandymų metodas gali būti taikomas nustatant chemines medžiagas, kurios sukelia smarkų akių pažeidimą, kaip apibrėžta JT GHS, t. y. chemines medžiagas, kurias reikia priskirti JT GHS 1 kategorijai (4). Kai taikomas šiuo tikslu, BCOP bandymų metodo visuminis tikslumas – 79 % (150/191), klaidingai teigiamų rezultatų dalis – 25 % (32/126), klaidingai neigiamų rezultatų dalis – 14 % (9/65), palyginti su triušio akies bandymo metodo in vivo duomenimis, klasifikuojamais pagal JT GHS klasifikavimo sistemą (3) (žr. 2 priedėlio 1 lentelę). Kai tam tikrų cheminių (t. y. alkoholių, ketonų) ar fizikinių (t. y. kietųjų medžiagų) klasių bandomosios cheminės medžiagos pašalinamos iš duomenų bazės, BCOP bandymo metodo bendras tikslumas pagal JT GHS klasifikavimo sistemą siekia 85 % (111/131), klaidingai teigiamų rezultatų dalis – 20 % (16/81), klaidingai neigiamų rezultatų dalis – 8 % (4/50) (3). Galimi BCOP bandymo metodo trūkumai, kai jis taikomas nustatant chemines medžiagas, kurios sukelia smarkų akių pažeidimą (JT GHS 1 kategorijos), susiję su didele klaidingai teigiamų rezultatų dalimi bandant alkoholius bei ketonus ir didele klaidingai neigiamų rezultatų dalimi bandant kietąsias medžiagas, kaip nurodyta tinkamumo patvirtinimo duomenų bazėje (1)(2)(3). Tačiau kadangi taikant BCOP bandymų metodą neteisingai įvertinami ne visi alkoholiai ar ketonai, o kai kurie tiksliai nustatomi kaip JT GHS 1 kategorijos, šios dvi organinės funkcinės grupės nelaikomos nepatenkančiomis į bandymo metodo taikymo sritį. Šio bandymo metodo naudotojas turi nuspręsti, ar galimas alkoholio arba ketono pervertinimas yra priimtinas ar reikia atlikti papildomus bandymus taikant įrodomosios duomenų galios metodą. Kalbant apie klaidingai neigiamų rezultatų dalį, reikėtų pažymėti, kad atliekant kietųjų medžiagų Draize akių dirginimo bandymą in vivo, gali susidaryti kintamos ir ribinės veikimo sąlygos, todėl gali būti gautos netinkamos jų tikrosios dirginamosios gebos prognozės (10). Taip pat reikėtų pažymėti, kad, identifikuojant chemines medžiagas, sukeliančias smarkų akių pažeidimą (JT GHS 1 kategorijos), nė vienai ICCVAM tinkamumo įvertinimo duomenų bazėje (2)(3) nurodytai klaidingai neigiamai cheminei medžiagai nebuvo gauta IVIS ≤ 3 vertė, kuri naudojama kaip kriterijus cheminę medžiagą identifikuojant kaip JT GHS be kategorijos. Be to, BCOP klaidingai neigiamas rezultatas šiame kontekste esmės nekeičia, nes, priklausomai nuo reglamentavimo reikalavimų, visos bandomosios cheminės medžiagos, kurioms gaunama 3 < IVIS ≤ 55 vertė, vėliau būtų bandomos atliekant tinkamai patvirtintus bandymus in vitro arba, blogiausiu atveju, atliekant bandymą su triušiais pagal įrodomosios duomenų galios metodą taikant nuosekliųjų bandymų strategiją. Kadangi taikant BCOP bandymų metodą kai kurios kietosios medžiagos yra tiksliai nustatomos kaip JT GHS 1 kategorijos medžiagos, ši agregatinė būsena taip pat nelaikoma nepatenkančia į bandymo metodo taikymo sritį. Tyrėjai galėtų spręsti, ar taikyti šį bandymų metodą visų tipų cheminėms medžiagoms, o IVIS > 55 turėtų būti priimta kaip smarkų akių pažeidimą sukeliančio atsako rodiklis ir cheminę medžiagą reikėtų klasifikuoti kaip JT GHS 1 kategorijos be papildomų bandymų. Tačiau, kaip buvo nurodyta pirmiau, alkoholiams ar ketonams gautus teigiamus rezultatus dėl galimo pervertinimo reikėtų aiškinti atsargiai. BCOP bandymo metodą taip pat galima taikyti nustatant chemines medžiagas, kurių nereikia klasifikuoti kaip dirginančių akis arba sukeliančių smarkų akių pažeidimą pagal JT GHS klasifikavimo sistemą (4). Kai taikomas šiuo tikslu, BCOP bandymų metodo bendras tikslumas – 69 % (135/196), klaidingai teigiamų rezultatų dalis – 69 % (61/89), klaidingai neigiamų rezultatų dalis – 0 % (0/107) palyginti su triušio akies bandymo metodo in vivo duomenimis, klasifikuojamais pagal JT GHS klasifikavimo sistemą (3) (žr. 2 priedėlio 2 lentelę). Gauta klaidingai teigiamų rezultatų dalis (in vivo JT GHS be kategorijos cheminės medžiagos, kurių IVIS > 3, žr. 47 pastraipą) yra labai didelė, bet šiame kontekste ji esmės nekeičia, nes, priklausomai nuo reglamentavimo reikalavimų, visos bandomosios cheminės medžiagos, kurioms gaunama 3 < IVIS ≤ 55 vertė, vėliau būtų bandomos atliekant tinkamai patvirtintus bandymus in vitro arba, blogiausiu atveju, atliekant bandymą su triušiais, pagal įrodomosios duomenų galios metodą taikant nuosekliųjų bandymų strategiją. BCOP bandymų metodas neturi specifinių trūkumų bandant alkoholius, ketonus ir kietąsias medžiagas, kai tikslas yra identifikuoti chemines medžiagas, kurių nereikia klasifikuoti kaip dirginančių akis arba sukeliančių smarkų akių pažeidimą (JT GHS be kategorijos) (3). Tyrėjai galėtų pamąstyti apie šio bandymo metodo taikymą visų tipų cheminėms medžiagoms, o neigiamas rezultatas (IVIS ≤ 3) turėtų būti laikomas kaip rodiklis, kad nereikia klasifikuoti (JT GHS be kategorijos). Kadangi BCOP bandymų metodu galima tiksliai identifikuoti tik 31 % cheminių medžiagų, kurių nereikia klasifikuoti kaip dirginančių akis arba sukeliančių smarkų akių pažeidimą, šis bandymų metodas neturėtų būti pirmoji pasirinktis pradedant taikyti aukštynkryptį metodą (5), jei yra kitų patvirtintų ir priimtų panašaus didelio jautrumo ir dar didesnio specifiškumo in vitro metodų. BCOP tinkamumo patvirtinimo duomenų bazę iš viso sudarė 113 medžiagų ir 100 mišinių (2)(3). Todėl BCOP bandymų metodas laikomas tinkamu bandyti medžiagas ir mišinius. BCOP bandymų metodas nerekomenduojamas, kai reikia identifikuoti bandomąsias chemines medžiagas, kurias reikėtų klasifikuoti kaip akis dirginančias (JT GHS 2 kategorija ar 2A kategorija), arba bandomąsias chemines medžiagas, kurias reikėtų klasifikuoti kaip akis nestipriai dirginančias (JT GHS 2B kategorija), dėl gana didelio skaičiaus JT GHS 1 kategorijos cheminių medžiagų, klaidingai priskiriamų JT GHS 2, 2A ar 2B kategorijai, ir JT GHS be kategorijos cheminių medžiagų, klaidingai priskiriamų JT GHS 2, 2A ar 2B kategorijai (2)(3). Šiuo tikslu gali prireikti papildomų bandymų taikant kitą tinkamą metodą. Visos procedūros su galvijų akimis ir galvijų ragenomis turėtų būti atliekamos pagal bandymų laboratorijos taisykles ir procedūras, taikytinas gyvūninės kilmės medžiagoms, įskaitant audinius ir audinių skysčius, bet neapsiribojant tik jais. Rekomenduojama laikytis bendrųjų laboratorijose taikytinų atsargumo priemonių (11). Nors taikant šį BCOP bandymų metodą neatsižvelgiama į akies junginės ir rainelės pažeidimus, tiriamas poveikis ragenai, kuris yra pagrindinis rodiklis, klasifikuojant in vivo pagal JT GHS klasifikavimą. Taikant BCOP bandymų metodą, ragenos pažeidimų grįžtamumas negali būti tiesiogiai įvertintas. Atsižvelgiant į triušio akies tyrimus, buvo pasiūlyta ragenos žaizdos pradinį gylį naudoti kaip galimą būdą kai kuriems negrįžtamo poveikio tipams nustatyti (12). Tačiau reikia turėti papildomų mokslinių duomenų, kad būtų galima suprasti, kaip atsiranda negrįžtamas poveikis, kuris nėra susijęs su dideliu pradinio pažeidimo lygiu. Galiausiai, taikant BCOP bandymų metodą, negalima įvertinti su poveikiu akims susijusio sisteminio toksiškumo galimybės. Šis bandymų metodas bus periodiškai atnaujinamas, kai tik bus išnagrinėta nauja informacija ir duomenys. Pvz., histopatologija gali būti naudinga, kai reikia išsamiau apibūdinti ragenos pažeidimus. Kaip aprašyta EBPO rekomendaciniame dokumente Nr. 160 (13), naudotojai skatinami konservuoti ragenas ir ruošti histopatologinius bandinius, kuriuos galima naudoti kuriant duomenų bazę ir sprendimo priėmimo kriterijus, galinčius pagerinti šio bandymų metodo tikslumą. Kiekviena laboratorija, kuri pradėtų taikyti šį bandymo metodą, turėtų naudoti 3 priedėlyje nurodytas kvalifikacijai tikrinti skirtas chemines medžiagas. Laboratorija gali naudoti šias chemines medžiagas, norėdama įrodyti savo techninę kompetenciją taikyti BCOP bandymų metodą, prieš pateikdama BCOP bandymo duomenis teisės aktuose numatytais pavojų klasifikavimo tikslais. BANDYMO PRINCIPAS BCOP bandymo metodas yra tipinis konkretaus organo tyrimo modelis, pagal kurį galima išsaugoti normalų trumpalaikį fiziologinį ir biocheminį galvijų ragenos funkcionavimą in vitro. Pagal šį bandymo metodą bandomosios cheminės medžiagos sukeltas pažeidimas nustatomas kiekybiškai įvertinant ragenos drumstumo ir pralaidumo pokyčius drumstumo matuokliu ir regimosios šviesos spektrofotometru. Abu matavimai naudojami siekiant apskaičiuoti IVIS, kuri naudojama in vitro dirginimo pavojaus klasifikavimo kategorijai nustatyti, kad būtų galima prognozuoti bandomosios cheminės medžiagos gebą dirginti akis in vivo (žr. 48 pastraipą Sprendimo priėmimo kriterijai). Pagal BCOP bandymo metodą naudojamos atskirtos ragenos, paimtos iš ką tik paskerstų galvijų akių. Ragenos drumstumas kiekybiškai įvertinamas matuojant ragenos praleidžiamos šviesos kiekį. Ragenos pralaidumas kiekybiškai įvertinamas kaip per visą ragenos storį prasiskverbusio fluoresceino natrio druskos dažiklio kiekis, nustatytas užpakalinės kameros terpėje. Bandomosios cheminės medžiagos uždedamos ant ragenos epitelio paviršiaus jų įdedant į ragenos laikiklio priekinę kamerą. 4 priedėlyje pateiktas ragenos laikiklio, naudojamo taikant BCOP bandymo metodą, aprašymas ir schema. Ragenų laikiklių galima įsigyti iš įvairių šaltinių arba pasidaryti. Galvijų akių šaltinis bei amžius ir gyvūnų rūšies pasirinkimas Į skerdyklas atvežti galvijai paprastai skerdžiami žmonių maistui arba kitais komerciniais tikslais. BCOP bandymo metodui skirtų ragenų šaltinis gali būti tik sveiki gyvūnai, kurie laikomi tinkamais naudoti žmonių maisto grandinėje. Kadangi galvijų masės intervalas gana didelis ir priklauso nuo veislės, amžiaus bei lyties, nėra nustatyta rekomenduojama skerdžiamo gyvūno masė. Ragenų matmenys gali skirtis dėl gyvūnų amžiaus skirtumo. Ragenos, kurių horizontalus skersmuo > 30,5 mm ir ragenos storio per vidurį vertės ≥ 1 100 μm, paprastai gaunamos iš senesnių kaip aštuonerių metų galvijų, o ragenos, kurių horizontalus skersmuo < 28,5 mm ir ragenos storis per vidurį < 900 μm, paprastai gaunamos iš jaunesnių kaip penkerių metų galvijų (14). Dėl šios priežasties senesnių kaip 60 mėnesių galvijų akys paprastai nenaudojamos. Jaunesnių kaip 12 mėnesių galvijų akys paprastai nenaudojamos, nes jos vis dar vystosi, o jų ragenos storis ir skersmuo yra gerokai mažesni nei suaugusių galvijų. Tačiau jaunų gyvūnų (t. y. 6–12 mėnesių) ragenas naudoti leidžiama, nes jų naudojimas turi tam tikrų pranašumų, pvz., jų lengviau gauti, amžiaus intervalas yra nedidelis ir yra mažiau pavojų, susijusių su galimu galvijų spongiforminės encefalopatijos poveikiu darbuotojams (15). Kadangi būtų naudinga papildomai įvertinti ragenos matmenų arba storio įtaką atsako į ėsdinančias ir dirginančias chemines medžiagas jautriui, naudotojai prašomi pateikti duomenis apie gyvūnų, iš kurių gautos per tyrimą naudotos ragenos, apytikrį amžių ir (arba) masę. Akių paėmimas ir transportavimas į laboratoriją Akis surenka skerdyklų darbuotojai. Siekiant, kad mechaninis ir kitoks akių pažeidimas būtų kuo mažesnis, jas iš paskersto gyvulio reikėtų išimti kiek įmanoma greičiau, nedelsiant atšaldyti ir atšaldytas vežti. Skerdyklų darbuotojai neturėtų naudoti valiklių gyvulio galvai nuplauti, kad į akis nepatektų galinčių dirginti cheminių medžiagų. Akis reikėtų visiškai panardinti į atvėsintą Hankso subalansuotą druskos tirpalą (angl. Hanks' Balanced Salt Solution, HBSS), supiltą į tinkamo dydžio talpyklą, ir į laboratoriją jos turėtų būti vežamos taip, kad būtų kuo mažiau pažeistos ir (arba) užkrėstos bakterijomis. Kadangi akys imamos skerdžiant, jos gali būti išteptos krauju ir kitomis biologinėmis medžiagomis, įskaitant bakterijas ir kitus mikroorganizmus. Todėl svarbu užtikrinti kuo mažesnį užkrėtimo pavojų (pvz., surenkant ir vežant indą su akimis laikyti ant drėgno ledo ir į joms vežti naudojamą HBSS tirpalą įdėti antibiotikų, pvz., 100 IU/ml penicilino ir 100 μg/ml streptomicino). Laiko tarpas nuo akių surinkimo iki ragenų panaudojimo taikant BCOP bandymų metodą turėtų būti kuo trumpesnis (paprastai jos surenkamos ir naudojamos tą pačią dieną) ir reikėtų įrodyti, kad dėl to neigiamos įtakos tyrimo rezultatams nepadaryta. Šie rezultatai yra pagrįsti akių atrankos kriterijais ir teigiamų bei neigiamų kontrolinių ėminių atsaku. Visos tyrimui naudojamos akys turėtų būti iš tos pačios tam tikrą dieną surinktų akių grupės. Taikant BCOP bandymo metodą naudojamų akių atrankos kriterijai Į laboratoriją atvežtos akys atidžiai apžiūrimos, ar jos neturi defektų, įskaitant padidėjusį drumstumą, įbrėžimus ir neovaskuliarizaciją. Turėtų būti naudojamos tik tokių defektų neturinčių akių ragenos. Be to, kiekvienos ragenos kokybė įvertinama vėlesniais tyrimo etapais. Ragenos, kurių drumstumas po pradinio vienos valandos trukmės pusiausvirinimo laikotarpio yra didesnis kaip septyni drumstumo vienetai arba lygiavertis, naudojant kitą drumstumo matuoklį ir ragenos laikiklį, atmetamos (PASTABA. Drumstumo matuoklis turėtų būti kalibruotas pagal drumstumo etalonus, naudojamus drumstumo vienetams nustatyti, žr. 4 priedėlį). Kiekvieną apdorojimo grupę (bandomosios cheminės medžiagos, vienalaikių neigiamų ir teigiamų kontrolinių ėminių) sudaro ne mažiau kaip trys akys. Taikant BCOP bandymų metodą, neigiamam kontroliniam ėminiui reikėtų naudoti tris ragenas. Kadangi visos ragenos yra išpjaunamos iš viso akies obuolio ir įdedamos į ragenų kameras, dėl tvarkymo veiksmų gali būti ragenų drumstumo ir pralaidumo verčių artefaktų (įskaitant neigiamą kontrolinį ėminį). Be to, drumstumo ir pralaidumo vertės, gautos neigiamų kontrolinių ėminių ragenoms, yra naudojamos bandomąja chemine medžiaga apdorotų ir teigiamų kontrolinių ėminių ragenų drumstumo ir pralaidumo vertėms koreguoti, atliekant IVIS skaičiavimus. PROCEDŪRA Akių paruošimas Stengiantis nepažeisti ragenos epitelio ir endotelio, defektų neturinčios ragenos išpjaunamos kartu su 2–3 mm pločio odenos žiedu, kuris paliekamas tam, kad vėliau būtų patogiau tvarkyti rageną. Atskirtos ragenos įdedamos į specialios konstrukcijos ragenų laikiklius, sudarytus iš priekinės ir užpakalinės kamerų, kurios liečiasi su ragenos epitelio ir endotelio pusėmis. Abi kameros iki viršaus pripildomos pašildyta Eagle'o minimalia pagrindine terpe (angl. Eagle's Minimum Essential Medium, EMEM) be fenolio raudonojo (pirmiau užpakalinė kamera) taip, kad nesusidarytų burbulų. Tada ne trumpiau kaip vieną valandą įtaisas pusiausvirinamas 32 ± 1 °C temperatūroje, kad susilygintų ragenų bei terpės temperatūra ir būtų gautas kiek įmanoma normalus metabolinis aktyvumas (apytikrė ragenos paviršiaus temperatūra in vivo yra 32 °C). Pasibaigus pusiausvirinimo laikotarpiui, abi kameros pripildomos naujos pašildytos EMEM be fenolio raudonojo, ir registruojami kiekvienos ragenos pradinio drumstumo rodmenys. Visos ragenos, turinčios makroskopinių audinio pažeidimų (pvz., įbrėžimų, pigmentinių dėmių, neovaskuliarizacijos požymių) arba kurių drumstumas yra didesnis kaip septyni drumstumo vienetai arba lygiavertis, naudojant kitą drumstumo matuoklį ir ragenos laikiklį, atmetamos. Ne mažiau kaip trys ragenos pasirenkamos kaip neigiamo (arba tirpiklio) kontrolinio ėminio ragenos. Likusios ragenos padalijamos į paveikimo bandomąja chemine medžiaga grupę ir teigiamo kontrolinio ėminio grupę. Kadangi vandens šiluminė talpa didesnė už oro, vanduo užtikrina stabilesnes inkubavimo temperatūros sąlygas. Todėl ragenos laikiklį ir jo turinį rekomenduojama laikyti vandens vonioje, kurioje būtų palaikoma 32 ± 1 °C temperatūra. Tačiau gali būti naudojami ir oro inkubatoriai, jei būtų imtasi priemonių temperatūros stabilumui užtikrinti (pvz., iš anksto pašildant laikiklius ir terpę). Bandomosios cheminės medžiagos įterpimas Taikomi du skirtingi apdorojimo protokolai: vienas – skysčiams ir paviršinio aktyvumo medžiagoms (kietosioms medžiagoms arba skysčiams), kitas – kietosioms ne paviršinio aktyvumo medžiagoms. Skysčiai bandomi neskiesti. Pusiau kietosios medžiagos, tepalai ir vaškai paprastai bandomi kaip skysčiai. Grynos paviršinio aktyvumo medžiagos bandomos naudojant 10 % m/V koncentracijos tirpalą 0,9 % natrio chlorido tirpale, distiliuotame vandenyje arba kitame tirpiklyje, kuris, kaip buvo įrodyta, neturi neigiamo poveikio bandymo sistemai. Reikėtų tinkamai pagrįsti kitas praskiestų tirpalų koncentracijos vertes. Paviršinio aktyvumo medžiagų turinčius mišinius galima bandyti neskiestus arba praskiestus iki reikiamos koncentracijos, atsižvelgiant į atitinkamą veikimo scenarijų in vivo. Bandyme naudojamą koncentraciją reikėtų tinkamai pagrįsti. Ragenos veikiamos skysčiais ir paviršinio aktyvumo medžiagomis 10 min. Jei taikoma kitokia veikimo trukmė, ją reikėtų tinkamu būdu moksliškai pagrįsti. Žr. 1 priedėlį, kuriame pateiktos paviršinio aktyvumo medžiagų ir paviršinio aktyvumo medžiagų turinčio mišinio apibrėžtys. Ne paviršinio aktyvumo kietosios medžiagos paprastai bandomos kaip 20 % m/V koncentracijos tirpalai ar suspensijos 0,9 % natrio chlorido tirpale, distiliuotame vandenyje arba kitame tirpiklyje, kuris, kaip įrodyta, neturi neigiamo poveikio bandymo sistemai. Tam tikromis aplinkybėmis ir pateikus reikiamą mokslinį pagrindimą, kietąsias medžiagas taip pat būtų galima bandyti grynas, jas tiesiogiai uždedant ant ragenos paviršiaus taikant atvirosios kameros metodą (žr. 32 skirsnį). Ragenos veikiamos kietosiomis medžiagomis keturias valandas, tačiau skysčiams ir paviršinio aktyvumo medžiagoms gali būti taikoma kitokia veikimo trukmė, pateikus reikiamą mokslinį pagrindimą. Atsižvelgiant į bandomosios cheminės medžiagos fizikinę būseną ir chemines savybes (pvz., kietoji medžiaga, skystis, klampus arba neklampus skystis), galima taikyti įvairius apdorojimo būdus. Pagrindinis veiksnys – užtikrinti, kad bandomoji cheminė medžiaga tinkamai padengtų epitelio paviršių ir būtų gerai pašalinta atliekant plovimo veiksmus. Neklampios ir nedidelės klampos bandomosios cheminės medžiagos paprastai bandomos uždarosios kameros metodu, o pusiau klampios ir klampios skystosios bandomosios cheminės medžiagos bei grynos kietosios medžiagos – atvirosios kameros metodu. Taikant uždarosios kameros metodą, bandomosios cheminės medžiagos kiekis, kurio pakanka ragenos epitelio paviršiui padengti (750 μl), įterpiamas į priekinę kamerą per jos viršutiniame paviršiuje esančią dozavimo angą, veikimo metu užkemšama kamščiu. Svarbu užtikrinti, kad reikiamą laiko tarpą kiekvieną rageną veiktų bandomoji cheminė medžiaga. Taikant atvirosios kameros metodą, prieš apdorojimą iš priekinės kameros išimamas lango fiksavimo žiedas ir stiklinis langas. Kontrolinė arba bandomoji cheminė medžiaga (750 μl arba toks bandomosios cheminės medžiagos kiekis, kurio pakaktų visai ragenai padengti) tiesiogiai užlašinama ant ragenos epitelio paviršiaus mikropipete. Jei bandomąją cheminę medžiagą sunku įlašinti pipete, dozavimui palengvinti bandomoji cheminė medžiaga gali būti įšvirkšta į stūmoklinę pipetę. Stūmoklinės pipetės antgalis įstatomas į švirkšto dozavimo galą taip, kad medžiagą būti galima įšvirkšti į stūmoklinės pipetės galą. Švirkšto stūmoklis stumiamas, tuo pat metu pipetės stūmoklis traukiamas į viršų. Jei antgalyje atsiranda oro burbuliukų, bandomoji cheminė medžiaga pašalinama (išstumiama), ir procedūra kartojama tol, kol antgalis užpildomas be oro burbuliukų. Prireikus gali būti naudojamas paprastas švirkštas (be adatos), kadangi jį naudojant galima tiksliai išmatuoti bandomosios cheminės medžiagos kiekį ir lengviau padengti ragenos epitelio paviršių. Baigus dozuoti, stiklinis langas įdedamas atgal į priekinę kamerą, taip vėl atkuriant uždarąją sistemą. Inkubavimas po paveikimo Pasibaigus veikimo laikotarpiui, bandomoji cheminė medžiaga, neigiama kontrolinė medžiaga arba teigiama kontrolinė cheminė medžiaga pašalinama iš priekinės kameros, epitelis plaunamas ne mažiau kaip tris kartus (arba kol nelieka matomų bandomosios cheminės medžiagos žymių) naudojant EMEM (kurios sudėtyje yra fenolio raudonojo). Plovimui naudojama terpė su fenolio raudonuoju, nes galima stebėti fenolio raudonojo spalvos kitimą, kad būtų galima nustatyti rūgštinių ar šarminių bandomųjų cheminių medžiagų nuplovimo efektyvumą. Jei fenolio raudonasis vis dar keičia spalvą (į geltoną ar į raudonai violetinę) arba jei bandomoji cheminė medžiaga vis dar yra matoma, ragenos plaunamos daugiau kaip tris kartus. Iš terpės pašalinus bandomąją cheminę medžiagą, ragenos paskutinį kartą plaunamos EMEM (be fenolio raudonojo). Paskutinį kartą plaunama EMEM (be fenolio raudonojo) tam, kad prieš drumstumo matavimą fenolio raudonasis būtų visiškai pašalintas iš priekinės kameros. Tada priekinė kamera iš naujo pripildoma nauja EMEM be fenolio raudonojo. Jei bandomi skysčiai arba paviršinio aktyvumo medžiagos, nuplautos ragenos dar dvi valandas laikomos 32 ± 1 °C temperatūroje. Tam tikromis aplinkybėmis gali būti naudinga ilgesnė laikymo po paveikimo trukmė ir dėl jos būtų galima spręsti kiekvienu konkrečiu atveju. Pasibaigus keturių valandų veikimo laikotarpiui, kietosiomis medžiagomis apdorotos ragenos kruopščiai nuplaunamos, bet papildomai inkubuoti jų nereikia. Pasibaigus skysčių ir paviršinio aktyvumo medžiagų inkubaciniam laikotarpiui po veikimo ir keturių valandų trukmės ne paviršinio aktyvumo kietųjų medžiagų veikimo laikotarpiui, matuojamas kiekvienos ragenos drumstumas ir pralaidumas. Be to, kiekviena ragena apžiūrima ir registruojamos susijusios pastabos (pvz., audinio lupimasis, bandomosios cheminės medžiagos likučiai, nevienodo drumstumo vaizdai). Šios pastabos galėtų būti svarbios, nes jos gali paaiškinti drumstumo matuoklio rodmenų svyravimus. Kontrolinės cheminės medžiagos Atliekant kiekvieną bandymą, naudojami vienalaikiai neigiami kontroliniai ėminiai arba tirpiklis ar nešiklis ir teigiami kontroliniai ėminiai. Kai pagal BCOP bandymo metodą bandoma 100 % grynumo skystoji cheminė medžiaga, naudojamas vienalaikis neigiamas kontrolinis ėminys (pvz., 0,9 % natrio chlorido tirpalas arba distiliuotas vanduo), kad bandymo sistemoje būtų galima aptikti netipinius pokyčius ir gauti bandymo vertinamųjų baigčių atskaitos vertę. Taip pat užtikrinama, kad tyrimo sąlygos nesukeltų netinkamo dirginamojo atsako. Kai bandomas atskiestas skystis, paviršinio aktyvumo arba kietoji cheminė medžiaga, taikant BCOP bandymo metodą, įtraukiama vienalaikių tirpiklio ar nešiklio kontrolinių ėminių grupė, kad būtų galima aptikti nebūdingus bandymo sistemos pokyčius ir gauti bandymo vertinamųjų baigčių atskaitos vertę. Galima naudoti tik tokį tirpiklį ar nešiklį, kurie, kaip buvo įrodyta, neturi neigiamos įtakos bandymo sistemai. Cheminė medžiaga, kuri žinoma kaip sukelianti teigiamą atsaką, yra įtraukiama į kiekvieną bandymą kaip vienalaikis teigiamas kontrolinis ėminys, kad būtų patikrintas bandymo sistemos vientisumas ir jos tinkamas veikimas. Tačiau siekiant užtikrinti galimybę užtikrinti teigiamo kontrolinio ėminio atsako kintamumą per tam tikrą laiką, atsakas į dirginimą neturėtų būti per stiprus. Skystųjų bandomųjų cheminių medžiagų teigiamų kontrolinių ėminių pavyzdžiai yra 100 % etanolis ar 100 % dimetilformamidas. Kietųjų bandomųjų cheminių medžiagų teigiamo kontrolinio ėminio pavyzdys yra 20 % m/V imidazolo tirpalas 0,9 % natrio chlorido tirpale. Palyginamosios cheminės medžiagos yra naudingos, kai reikia įvertinti tam tikros cheminių medžiagų ar produktų klasės nežinomų cheminių medžiagų gebą dirginti akis arba akis dirginančios medžiagos santykinę dirginamąją gebą tam tikrame atsako į dirginimą intervale. Matuojamos vertinamosios baigtys Drumstumas nustatomas pagal ragenos praleidžiamą šviesos kiekį. Ragenos drumstumas kiekybiškai matuojamas drumstumo matuokliu, kuriuo gaunamos drumstumo vertės tolydžioje skalėje. Pralaidumas nustatomas pagal fluoresceino natrio druskos dažiklio kiekį, prasiskverbusį per visus ragenos ląstelių sluoksnius (t. y. nuo išorinio ragenos paviršiaus epitelio per vidinio ragenos paviršiaus endotelį). Į priekinę ragenos laikiklio kamerą, kuri liečiasi su ragenos epitelio paviršiumi, įpilamas 1 ml fluoresceino natrio druskos tirpalo (4 arba 5 mg/ml, kai bandomos skystosios, paviršinio aktyvumo medžiagos arba ne paviršinio aktyvumo medžiagos), o į užpakalinę kamerą, kuri liečiasi su ragenos endotelio paviršiumi, pripilama naujos EMEM. Laikiklis laikomas 90 ± 5 min horizontalioje padėtyje 32 ± 1 °C temperatūroje. UV/VIS spektrofotometrijos metodu matuojamas į užpakalinę kamerą patekusios fluoresceino natrio druskos kiekis. Spektrofotometrinio matavimo duomenys registruojami kaip optinio tankio esant 490 nm bangos ilgiui (OD490) arba sugerties vertės, išmatuotos tolydžioje skalėje. Fluoresceino pralaidumo vertės nustatomos naudojant OD490 vertes, išmatuotas regimosios šviesos spektrofotometru, taikant standartinį 1 cm storio sluoksnį. Taip pat galima naudoti 96 duobučių mikrotitravimo plokštelės skaitytuvą, jei: i) gali būti nustatytas plokštelės skaitytuvo, naudojamo fluoresceino OD490 vertėms nustatyti, tiesinis intervalas ir ii) į 96 duobučių plokštelės duobutes įpilamas reikiamas tūris, kad būtų gautos OD490 vertės, atitinkančios standartinį 1 cm storio sluoksnį (gali prireikti visiškai pripildyti duobutę (įprastas kiekis – 360 μl)). DUOMENYS IR ATASKAITOS RENGIMAS Duomenų įvertinimas Drumstumo ir vidutinio pralaidumo (OD490) vertes pakoregavus pagal foninio drumstumo ir neigiamo kontrolinio ėminio pralaidumo OD490 vertes, kiekvienos paveiktos bandomąja chemine mežiaga grupės vidutinės drumstumo ir pralaidumo OD490 vertes reikėtų įrašyti į empiriniu būdu gautą formulę, skirtą kiekvienos apdorotų ėminių grupės in vitro dirginimo skaitinei vertei (IVIS) apskaičiuoti: IVIS = vidutinė drumstumo vertė + (15 × vidutinė pralaidumo OD490 vertė). Sina et al. (16) paskelbė, kad ši formulė buvo gauta atliekant laboratorinius ir tarplaboratorinius tyrimus. Buvo atlikta duomenų, gautų atlikus 36 junginių serijos tarplaboratorinį tyrimą, daugiafaktorinė analizė, kad būtų gauta geriausiai in vivo ir in vitro duomenis atitinkanti lygtis. Šią analizę atliko dviejų atskirų bendrovių mokslininkai, kurie gavo beveik vienodas lygtis. Drumstumo ir pralaidumo vertės taip pat turėtų būti įvertintos atskirai, siekiant nustatyti, ar bandomoji cheminė medžiaga sukėlė ėsdinimą arba stiprų dirginimą tik pagal vieną iš dviejų vertinamųjų baigčių (žr. Sprendimo priėmimo kriterijai). Sprendimo priėmimo kriterijai IVIS ribinės vertės, pagal kurias bandomosios cheminės medžiagos identifikuojamos kaip sukeliančios smarkų akių pažeidimą (JT GHS 1 kategorija) ir bandomosios cheminės medžiagos, kurių nereikia klasifikuoti dėl akių dirginimo ar smarkaus akių pažeidimo (JT GHS be kategorijos), pateiktos toliau:
Tyrimo priimtinumo kriterijai Bandymas laikomas priimtinu, jei teigiamam kontroliniam ėminiui gaunama IVIS, kuri patenka į dabartinio istorinio vidurkio dviejų standartinių nuokrypių intervalą, vidurkį atnaujinant ne rečiau kaip kartą per tris mėnesius arba kiekvieną kartą laboratorijose atliekant priimtiną bandymą, kai bandymai atliekami nedažnai (t. y. rečiau kaip kartą per mėnesį). Vertinant atsaką į neigiamą kontrolinę medžiagą arba tirpiklį ar nešiklį, gautos drumstumo ir pralaidumo vertės neturėtų viršyti foninio drumstumo ir pralaidumo verčių viršutinių ribų, nustatytų galvijų ragenoms, apdorotoms atitinkama neigiama kontroline medžiaga arba tirpikliu ar nešikliu. Jei klasifikavimas nedviprasmis, bandomajai cheminei medžiagai turėtų pakakti vieno bandymo, bandant ne mažiau kaip tris ragenas. Tačiau jei atliekant pirmąjį bandymą gaunami tarpiniai rezultatai, reikėtų spręsti klausimą dėl antrojo bandymo (bet jo nebūtinai reikia), taip pat, esant prieštaringiems pirmų dviejų bandymų IVIS vidutiniams rezultatams, – dėl trečiojo bandymo. Šiuo atveju pirmojo bandymo rezultatas laikomas tarpine verte, jei bandymų su 3 ragenomis gautos prognozės nesutapo taip, kad:
Bandymo ataskaita Į bandymo ataskaitą turėtų būti įtraukta ši informacija, jei ji yra svarbi atliekant tyrimą:
LITERATŪRA
1 priedėlis APIBRĖŽTYS Tikslumas – bandymo metodo rezultatų ir patvirtintų pamatinių verčių sutapimo artumas. Tikslumas yra bandymo metodo taikymo charakteristikų matas ir vienas iš „tinkamumo“ aspektų. Terminas dažnai vartojamas kaip lygiavertis terminui „atitiktis“ tinkamų bandymo metodo rezultatų daliai išreikšti. Palyginamoji cheminė medžiaga – cheminė medžiaga, naudojama kaip etalonas lyginant su bandomąja chemine medžiaga. Palyginamoji cheminė medžiaga turėtų turėti šias savybes: i) pastovų (-ius) ir patikimą (-us) šaltinį (-ius); ii) struktūrinį ir funkcinį panašumą su bandomųjų cheminių medžiagų klase; iii) žinomas fizikines ir (arba) chemines charakteristikas; iv) žinomą poveikį patvirtinančius duomenis ir v) žinomą veikimo gebą reikiamo atsako intervale. Aukštynkryptis metodas – pakopinis metodas, taikomas cheminei medžiagai, apie kurią daroma prielaida, kad jos nereikia klasifikuoti dėl akių dirginimo arba smarkaus akių pažeidimo, kurio pradžioje cheminės medžiagos, kurių nereikia klasifikuoti (duodančios neigiamą rezultatą), atskiriamos nuo nuo kitų cheminių medžiagų (duodančių teigiamą rezultatą). Cheminė medžiaga – medžiaga arba mišinys. Ragena – permatoma priekinė akies obuolio dalis, dengianti rainelę bei vyzdį ir praleidžianti šviesą į vidų. Ragenos drumstumas – ragenos, paveiktos bandomąja chemine medžiaga, neskaidrumo laipsnio matas. Padidėjęs ragenos drumstumas rodo ragenos pažeidimą. Drumstumą galima įvertinti subjektyviai, kaip tai daroma atliekant Draize triušio akies bandymą, arba objektyviai, naudojant prietaisą, pvz., drumstumo matuoklį. Ragenos pralaidumas – kiekybinis ragenos epitelio pažeidimo matas, gautas nustatant fluoresceino natrio druskos dažiklio kiekį, kuris prasiskverbia per visus ragenos ląstelių sluoksnius. Akių dirginimas – akių pokyčių sukėlimas, uždėjus bandomosios cheminės medžiagos ant priekinio akies paviršiaus, kai pokyčiai visiškai išnyksta per 21 parą nuo uždėjimo. Atitinka klasifikaciją Grįžtamasis poveikis akims ir JT GHS 2 kategorija (4). Klaidingai neigiamų rezultatų dalis – visų teigiamų cheminių medžiagų, kurios taikant bandymų metodą klaidingai identifikuotos kaip neigiamos, dalis. Tai yra vienas iš bandymo metodo taikymo charakteristikų rodiklių. Klaidingai teigiamų rezultatų dalis – visų neigiamų cheminių medžiagų, kurios taikant bandymų metodą klaidingai identifikuotos kaip teigiamos, dalis. Tai yra vienas iš bandymo metodo taikymo charakteristikų rodiklių. Pavojus – būdingoji medžiagos savybė arba situacija, galinti sukelti neigiamų padarinių, kai organizmą, sistemą ar populiaciją (arba jos dalį) veikia ta medžiaga. In vitro dirginimo skaitinė vertė (IVIS) – vertė, apskaičiuojama pagal empiriniu būdu gautą formulę, naudojamą taikant BCOP bandymų metodą, kai kiekvienos apdorotos grupės vidutinės drumstumo ir vidutinio pralaidumo vertės bendrinamos į vieną kiekvienos apdorotos grupės in vitro skaitinę vertę. IVIS = vidutinė drumstumo vertė + (15 × vidutinė pralaidumo vertė). Negrįžtamasis poveikis akims – žr. Smarkus akių pažeidimas. Mišinys – dviejų arba daugiau medžiagų mišinys arba tirpalas, kuriame jos nereaguoja (4) Neigiamas kontrolinis ėminys – neapdorotas kartotinis ėminys, turintis visus bandymo sistemos komponentus. Šis ėminys tiriamas kartu su bandomąja chemine medžiaga paveiktais ėminiais ir kitais kontroliniais ėminiais, siekiant nustatyti, ar vyksta tirpiklio sąveika su bandymo sistema. Neklasifikuojamos – cheminės medžiagos, kurios neklasifikuojamos dėl akių dirginimo (JT GHS 2, 2A ar 2B kategorija) ar dėl smarkaus akių pažeidimo (JT GHS 1 kategorija). Atitinka klasifikaciją JT GHS be kategorijos. Drumstumo matuoklis – prietaisas, naudojamas ragenos drumstumui matuoti, kiekybiškai įvertinant šviesos praleidimą per rageną. Paprastai šis prietaisas yra sudarytas iš dviejų skyrių, iš kurių kiekvienas turi savo šviesos šaltinį ir fotoelementą. Vienas skyrius skirtas apdorotai ragenai, kitas – prietaisui kalibruoti ir nuliui nustatyti. Halogeninės lempos šviesa perduodama per valdymo skyrių (tuščią kamerą be langų ar skysčio) į fotoelementą ir lyginama su šviesa, į fotoelementą perduota per bandymo skyrių, kuriame yra kamera su ragena. Fotoelementų praleistos šviesos skirtumas palyginamas ir skaitmeniniame ekrane rodoma skaitinė drumstumo vertė. Teigiamas kontrolinis ėminys – kartotinis ėminys, turintis visus bandymo sistemos komponentus ir paveiktas chemine medžiaga, kuri yra žinoma kaip sukelianti teigiamą atsaką. Siekiant užtikrinti galimybę vertinti teigiamo kontrolinio ėminio atsako kintamumą per tam tikrą laiką, teigiamas atsakas neturėtų būti per stiprus. Grįžtamasis poveikis akims – žr. Akių dirginimas. Patikimumas – pagal tą patį protokolą atliekamo bandymo metodo, tam tikrą laiką taikomo laboratorijose ir tarp laboratorijų, atkuriamumo laipsnio matas. Jis įvertinamas apskaičiuojant atkuriamumą laboratorijoje ir tarp laboratorijų ir pakartojamumą laboratorijoje. Smarkus akių pažeidimas – tai akies audinio pažeidimas arba smarkus fizinis regėjimo pablogėjimas, ant išorinio akies paviršiaus uždėjus bandomosios cheminės medžiagos, kuris ne visiškai praeina per 21 dieną nuo uždėjimo. Atitinka klasifikaciją Negrįžtamasis poveikis akims ir su JT GHS 1 kategorija (4). Tirpiklio ar nešiklio kontrolinis ėminys – visus bandymo sistemos komponentus, įskaitant tirpiklį ar nešiklį, turintis neapdorotas ėminys, kuris tiriamas kartu su bandomąja chemine medžiaga apdorotais ėminiais ir kitais kontroliniais ėminiais, siekiant nustatyti atskaitos vertę ėminiams, paveiktiems bandomąja chemine medžiaga, ištirpinta tame pačiame tirpiklyje ar nešiklyje. Kai bandomas kartu su vienalaikiu neigiamu kontroliniu ėminiu, šis ėminys taip pat parodo, ar vyksta tirpiklio arba nešiklio sąveika su bandymo sistema. Medžiaga – gamtoje randami arba gamybos procese gaunami cheminiai elementai ir jų junginiai, įskaitant visus priedus, kurių reikia produkto stabilumui užtikrinti, ir visas priemaišas, patenkančias į produktą taikomo proceso metu, tačiau neįskaitant tirpiklio, kurį galima atskirti, nepaveikiant medžiagos stabilumo ar nekeičiant jos sudėties (4). Paviršinio aktyvumo medžiaga – dar vadinama paviršinio aktyvumo agentu, tai yra medžiaga, pvz., ploviklis, kuri gali sumažinti skysčio paviršiaus įtemptį, kad jis galėtų putoti ar prasiskverbti į kietąsias medžiagas; be to, ji žinoma kaip drėkiklis. Paviršinio aktyvumo medžiagų turintis mišinys – šio bandymų metodo kontekste tai yra mišinys, turintis vieną arba daugiau paviršinio aktyvumo medžiagų, kurių galutinė koncentracija > 5 %. Žemynkryptis metodas – pakopinis metodas, taikomas cheminei medžiagai, apie kurią daroma prielaida, kad ji sukelia smarkų akių pažeidimą, pagal kurį cheminės medžiagos, kurios sukelia smarkų akių pažeidimą (duodančios teigiamą rezultatą), atskiriamos nuo kitų cheminių medžiagų (duodančių neigiamą rezultatą). Bandomoji cheminė medžiaga – taikant šį metodą bandoma medžiaga arba mišinys. Nuosekliųjų bandymų strategija – pakopomis atliekamų bandymų strategija, kai tam tikra eilės tvarka nagrinėjama visa turima informacija apie bandomąją cheminę medžiagą, kiekvienoje pakopoje taikant įrodomosios vertės analizės procesą, siekiant nustatyti, ar yra pakankamai duomenų sprendimui dėl pavojingumo kategorijos priimti, prieš pereinant prie kitos pakopos. Jei bandomosios cheminės medžiagos dirginamąją gebą galima nustatyti atsižvelgiant į turimą informaciją, papildomų bandymų atlikti nereikia. Jei atsižvelgiant į turimą informaciją, bandomajai cheminei medžiagai dirginamosios gebos priskirti neįmanoma, taikoma nuosekliųjų bandymų su gyvūnais procedūra tol, kol galima gauti nedviprasmį klasifikavimą. Jungtinių Tautų visuotinai suderinta cheminių medžiagų klasifikavimo ir ženklinimo sistema (JT GHS) – sistema, kurioje pateikiamas cheminių medžiagų (medžiagų ir mišinių) klasifikavimas pagal standartizuotus fizikinių pavojų, pavojų sveikatai bei aplinkai tipus ir nagrinėjami atitinkami informaciniai elementai, pvz., piktogramos, signaliniai žodžiai, pavojingumo frazės, atsargumo frazės ir saugos duomenų lapai, kad būtų galima informuoti apie cheminių medžiagų neigiamą poveikį, siekiant apsaugoti žmones (įskaitant darbuotojus, darbininkus, vežėjus, vartotojus ir avarijų likvidatorius) ir aplinką (4). JT GHS 1 kategorija – žr. Smarkus akių pažeidimas. JT GHS 2 kategorija – žr. Akių dirginimas. JT GHS be kategorijos – cheminės medžiagos, kurios neatitinka JT GHS 1 arba 2 (2A ar 2B) kategorijos klasifikavimo reikalavimų. Atitinka Neklasifikuojamos. Patvirtinto tinkamumo bandymų metodas – bandymų metodas, kurio patvirtinimo tyrimai atlikti, kad būtų nustatytas jo tinkamumas tam tikram tikslui pasiekti (įskaitant tikslumą) ir patikimumas. Svarbu pažymėti, kad patvirtinto tinkamumo bandymo metodo tikslumo ir patikimumo charakteristikos gali būti nepakankamos, kad jį būtų galima laikyti priimtinu siūlomam tikslui pasiekti. Įrodomoji duomenų galia – įvairių informacijos dalių privalumų ir trūkumų nagrinėjimo procesas priimant ir patvirtinant sprendimą dėl cheminės medžiagos pavojingumo. 2 priedėlis BCOP BANDYMŲ METODO PROGNOZAVIMO GEBA 1 lentelė BCOP prognozavimo geba nustatant chemines medžiagas, sukeliančias smarkius akių pažeidimus (JT GHS ar ES CLP 1 kategorijos palyginti su ne 1 kategorijos (2 kategorijos ir be kategorijos); JAV AAA I kategorijos palyginti su ne I kategorijos (II kategorijos + III kategorijos + IV kategorijos)
2 lentelė BCOP prognozavimo geba nustatant chemines medžiagas, kurių nereikia klasifikuoti dėl akių dirginimo arba smarkaus akių pažeidimo (nedirginančias) (JT GHS/ES CLP be kategorijos palyginti su ne be kategorijos (1 kategorijos + 2 kategorijos); JAV AAA IV kategorijos palyginti su ne IV kategorijos (I kategorijos + II kategorijos + III kategorijos))
3 priedėlis KVALIFIKACIJAI TIKRINTI SKIRTOS CHEMINĖS MEDŽIAGOS TAIKANT BCOP BANDYMŲ METODĄ Prieš pradėdamos įprastiniu būdu taikyti šį bandymų metodą, laboratorijos turėtų įrodyti savo techninę kvalifikaciją, tinkamai klasifikuodamos 1 lentelėje rekomenduojamų 13 cheminių medžiagų keliamą pavojų akims. Šios cheminės medžiagos buvo parinktos taip, kad atitiktų pavojų akims atsakų intervalą (t. y. 1, 2A, 2B kategorijas arba be kategorijos), atsižvelgiant į in vivo triušio akių bandymo (TG 405) (17) rezultatus ir į JT GHS klasifikavimo sistemą (4). Kiti atrankos kriterijai buvo cheminių medžiagų komercinis prieinamumas ir tai, ar galima gauti aukštos kokybės in vivo etaloninius duomenis bei aukštos kokybės in vitro BCOP bandymų metodo duomenis. Etaloniniai duomenys pateikti supaprastintame suvestiniame dokumente (3) ir BCOP bandymų metodo ICCVAM istorinės apžvalgos dokumente (2)(18). 1 lentelė Cheminės medžiagos, rekomenduojamos techninei kvalifikacijai tikrinti taikant BCOP bandymų metodą
4 priedėlis BCOP BANDYMUI NAUDOJAMAS RAGENOS LAIKIKLIS BCOP ragenų laikikliai gaminami iš inertinės medžiagos (pvz., polipropileno). Laikikliai yra sudaryti iš dviejų dalių (priekinės ir užpakalinės kamerų) ir turi dvi panašias cilindro pavidalo vidines kameras. Kiekvienos kameros projektinė talpa yra maždaug 5 ml, jų galuose yra stikliniai langai, per kuriuos registruojamos drumstumo matavimų vertės. Kiekviena vidinė kamera yra 1,7 cm skersmens ir 2,2 cm gylio (11). Į užpakalinę kamerą yra įdėtas žiedinis tarpiklis, kad būtų išvengta nuotėkio. Ragenos endotelio puse dedamos ant užpakalinių kamerų žiedinio tarpiklio, o priekinės kameros dedamos ant ragenų epitelio. Kameros tvirtinamos trimis nerūdijančiojo plieno varžtais, esančiais išoriniuose kameros kraštuose. Kiekvienos kameros gale yra stiklinis langas, kurį galima išimti, kad būtų patogiau pasiekti rageną. Žiedinis tarpiklis taip pat yra įdėtas tarp stiklinio lango ir kameros, kad būtų išvengta nuotėkio. Kiekvienos kameros viršuje yra dvi angos, per kurias įpilama bei pašalinama terpė ir bandomosios cheminės medžiagos. Apdorojimo ir inkubavimo laikotarpiais jos uždaromos guminiais kamšteliais. Šviesos praleidimas per ragenos laikiklius gali kisti, nes susidėvėjimo reiškiniai arba tam tikrų cheminių medžiagų likučių kaupimasis ant vidinių kamerų angų arba ant stiklinių langų gali turėti įtakos šviesos sklaidai arba atspindžio gebai. Dėl to galėtų padidėti ar sumažėti šviesos praleidimo per ragenos laikiklius atskaitos vertės (drumstumo rodmenų atskaitos vertės pasikeistų priešingai), ir galėtų atrodyti kaip žymūs atskirų kamerų pradinio drumstumo matavimų tikėtinos atskaitos vertės pokyčiai (t. y. tam tikrų atskirų ragenų laikiklių pradinės ragenų drumstumo vertės gali įprastai skirtis daugiau kaip 2 ar 3 drumstumo vienetais, palyginti su numatomomis atskaitos vertėmis). Kiekviena laboratorija turėtų atsižvelgti į galimybę sukurti programą, kurią taikant būtų įvertinti šviesos praleidimo per ragenų laikiklius pokyčiai, atsižvelgiant į bandomųjų cheminių medžiagų tipą ir kamerų naudojimo dažnumą. Siekiant gauti atskaitos vertes, ragenų laikiklius galima patikrinti prieš įprastinį naudojimą, išmatuojant drumstumo (ar šviesos praleidimo) atskaitos vertes, į kameras be ragenų įpylus visos sudėties terpės. Tada būtų galima periodiškai tikrinti ragenų laikiklių šviesos praleidimo pokyčius naudojimo laikotarpiu. Kiekviena laboratorija, atsižvelgdama į tai, kokios cheminės medžiagos bandomos, į naudojimo dažnumą ir pastebėtus ragenų drumstumo atskaitos verčių pokyčius, galėtų nustatyti ragenų laikiklių tikrinimo dažnumą. Jei būtų pastebėti žymūs šviesos praleidimo per ragenų laikiklius pokyčiai, reikėtų spręsti ragenų laikiklių vidinių paviršių tinkamų valymo ir (arba) poliravimo procedūrų ar laikiklių pakeitimo klausimą. Ragenos laikiklio surinkimo schema. 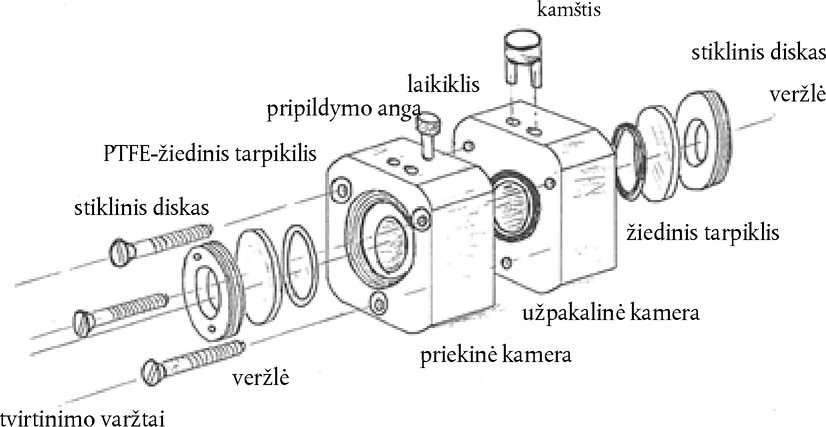
5 priedėlis DRUMSTUMO MATUOKLIS Drumstumo matuoklis yra šviesos praleidimo matavimo prietaisas. Pvz., jei BCOP bandymo metodo tinkamumui patvirtinti naudojama OP-KIT įranga iš Electro Design (Riomas, Prancūzija), halogeninės lempos šviesa perduodama per valdymo skyrių (tuščią kamerą be langų ar skysčio) į fotoelementą ir lyginama su šviesa, į fotoelementą perduodama per bandymo skyrių, kuriame yra kamera su ragena. Fotoelementų praleistos šviesos skirtumas palyginamas ir skaitmeniniame ekrane rodoma skaitinė drumstumo vertė. Drumstumo vienetai yra nustatyti. Galima naudoti kitokios konstrukcijos drumstumo matuoklius (pvz., kuriems nereikia atlikti lygiagrečių valdymo ir bandymo skyrių matavimų), jei būtų įrodyta, kad jais gaunami rezultatai yra panašūs į gautus patvirtinta įranga. Drumstumo matuokliu gautas atsakas turėtų būti tiesinis tam tikrame drumstumo rodmenų intervale, kuris aprėptų ribas, atitinkančias įvairius klasifikavimo būdus, aprašytus pagal prognozavimo modelį (t. y. iki ribos, susijusios su ėsdinimu ir (arba) stipriu dirginimu). Siekiant užtikrinti tiesinius ir tikslius rodmenis iki 75–80 drumstumo vienetų, drumstumo matuoklį būtina kalibruoti naudojant įvairius kalibravimo etalonus. Kalibravimo etalonai dedami į kalibravimo kamerą (ragenos kamerą, skirtą kalibravimo etalonams laikyti) ir registruojami drumstumo matuoklio rodmenys. Kalibravimo kamera suprojektuota kalibravimo etalonams laikyti tarp šviesos šaltinio ir fotoelemento maždaug tokiu atstumu, kokiu įdedamos ragenos matuojant jų drumstumą. Etaloninės vertės ir pradinis nuostatis priklauso nuo naudojamos įrangos tipo. Drumstumo matavimų tiesiškumą turėtų užtikrinti reikiamos (prietaisui nustatytos) procedūros. Pvz., jei naudojama OP-KIT įranga iš Electro Design (Riomas, Prancūzija), drumstumo matuoklis iš pradžių kalibruojamas drumstumo vienetų nulinei vertei gauti, naudojant kalibravimo kamerą be kalibravimo etalono. Tada vienas po kito į kalibravimo kamerą dedami trys kalibravimo etalonai ir matuojamas drumstumas. Naudojant 1, 2 ir 3 kalibravimo etalonus, reikėtų gauti jų nuostačių vertes atitinkančius drumstumo rodmenis – 75, 150 ir 225 drumstumo vienetų ± 5 %. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
13) |
B dalies B.48 skyrius pakeičiamas taip: „B.48 Atskirtų viščiukų akių bandymo metodas, skirtas identifikuoti i) chemines medžiagas, sukeliančias smarkius akių pažeidimus, ir ii) chemines medžiagas, kurių nereikia klasifikuoti dėl akių dirginimo ar smarkaus akių pažeidimo ĮVADAS Šis bandymų metodas atitinka EBPO bandymų gaires (TG) 438 (2013). Atskirtų viščiukų akių (ICE) bandymo metodą 2006 ir 2010 m. įvertino Alternatyvių metodų patvirtinimo tarpžinybinio koordinavimo komitetas (angl. Interagency Coordinating Committee on the Validation of Alternative Methods, ICCVAM) kartu su Europos alternatyvių metodų patvirtinimo centru (angl. European Centre for the Validation of Alternative Methods, ECVAM) ir Japonijos alternatyvių metodų patvirtinimo centru (angl. Japanese Centre for the Validation of Alternative Methods, JaCVAM) (1) (2) (3). Atliekant pirmąjį įvertinimą, ICE buvo patvirtintas kaip moksliškai pagrįstas bandymų metodas, tinkamas kaip atrankos bandymas nustatant chemines medžiagas (medžiagas ir mišinius), kurios sukelia smarkius akių pažeidimus (1 kategorijos), kaip apibrėžta Jungtinių Tautų (JT) visuotinai suderintoje cheminių medžiagų klasifikavimo ir ženklinimo sistemoje (GHS) (4) ir Reglamente (EB) Nr. 1272/2008 dėl cheminių medžiagų ir mišinių klasifikavimo, ženklinimo ir pakavimo (CLP) (12). Atliekant antrąjį įvertinimą, buvo tiriama, ar ICE bandymų metodas tinka kaip atrankos bandymas nustatant chemines medžiagas, kurios pagal JT GHS neklasifikuojamos dėl akių dirginimo ar smarkių akių pažeidimų (3) (4). Remiantis tinkamumo patvirtinimo tyrimo rezultatais ir ekspertų grupės rekomendacijomis, palikta galioti pirminė rekomendacija, kad ICE galima naudoti klasifikuojant chemines medžiagas, kurios sukelia smarkius akių pažeidimus (JT GHS 1 kategorijos), nes turima duomenų bazė nepasikeitė nuo pradinio ICCVAM tinkamumo patvirtinimo. Tame etape nebuvo pasiūlyta jokių papildomų rekomendacijų dėl ICE taikymo srities išplėtimo, kad būtų įtrauktos kitos kategorijos. Buvo iš naujo įvertintas in vitro ir in vivo duomenų rinkinys, naudotas atliekant tinkamumo patvirtinimo tyrimą, siekiant visų pirma įvertinti ICE naudingumą nustatant chemines medžiagas, kurių nereikia klasifikuoti dėl akių dirginimo ar smarkaus akių pažeidimo (5). Atlikus pakartotinį įvertinimą, buvo prieita prie išvados, kad ICE bandymų metodas taip pat gali būti taikomas, kai reikia nustatyti chemines medžiagas, kurių nereikia klasifikuoti dėl akių dirginimo ar smarkaus akių pažeidimo pagal JT GHS (4) (5). Atsižvelgiant į šiuos įvertinimus, į šį bandymų metodą įtrauktos rekomenduojamos ICE bandymų metodo taikymo sritys ir apribojimai. Pagrindiniai skirtumai tarp EBPO bandymų gairių originalios 2009 m. versijos ir atnaujintos 2013 m. versijos yra, be kita ko, susiję su šiais dalykais: ICE metodo taikymas nustatant chemines medžiagas, kurių nereikia klasifikuoti pagal JT GHS klasifikavimo sistemą, atnaujinti bandymo ataskaitos elementai, atnaujintos 1 priedėlio apibrėžtys ir atnaujintas 2 priedėlio kvalifikacijai tikrinti naudojamų cheminių medžiagų sąrašas. Šiuo metu visuotinai pripažįstama, kad artimiausioje ateityje joks atskiras in vitro akių dirginimo bandymas negalės pakeisti Draize akių bandymo in vivo, kad būtų galima prognozuoti skirtingų cheminių klasių visą dirginimo intervalą. Tačiau kelių alternatyvių bandymų metodų strateginiai deriniai taikant (nuosekliųjų) bandymų strategiją galėtų pakeisti Draize akių bandymą (6). Žemynkryptis metodas (7) skirtas taikyti tada, kai, atsižvelgiant į esamą informaciją, daroma prielaida apie didelę cheminės medžiagos dirginamojo poveikio gebą, o aukštynkryptis metodas (7) skirtas taikyti tada, kai, atsižvelgiant į esamą informaciją, daroma prielaida, kad cheminė medžiaga nepakankamai dirgina akis, kad ją reikėtų klasifikuoti. ICE bandymų metodas – bandymų metodas in vitro, kuris tam tikromis aplinkybėmis ir su tam tikrais apribojimais, kaip aprašyta 8–10 pastraipose, gali būti taikomas akims keliamam pavojui klasifikuoti ir cheminėms medžiagoms ženklinti. Nors kaip atskiras metodas ICE metodas nelaikomas tinkamu pakeisti triušių akių bandymą in vivo, jis rekomenduojamas kaip pirmas bandymų strategijos etapas, pvz., žemynkryptis metodas, pasiūlytas Scott et al. (7), be papildomų bandymų nustatant chemines medžiagas, sukeliančias smarkius akių pažeidimus, t. y. chemines medžiagas, kurias reikia klasifikuoti kaip JT GHS 1 kategorijos medžiagas (4). ICE bandymų metodas taip pat rekomenduojamas, kai reikia identifikuoti chemines medžiagas, kurių nereikia klasifikuoti dėl akių dirginimo ar smarkaus akių pažeidimo, kaip apibrėžta JT GHS (JT GHS be kategorijos) (4), ir todėl gali būti taikomas kaip pradinis aukštynkrypčio metodo bandymo strategijos etapas (7). Tačiau cheminė medžiaga, kuri pagal ICE bandymų metodą nelaikoma galinčia sukelti smarkų akių pažeidimą arba neklasifikuojama dėl akių dirginimo ar smarkaus akių pažeidimo, turėtų būti bandoma papildomai (in vitro ir (arba) in vivo) galutinei kategorijai nustatyti. Be to, prieš pradedant taikyti ICE kaip aukštinkryptį metodą pagal kitas nei JT GHS klasifikavimo schemas, reikėtų pasitarti su atitinkamomis priežiūros institucijomis. Šio bandymo metodo tikslas – aprašyti procedūras, taikomas įvertinant bandomosios cheminės medžiagos keliamo pavojaus akims galimybę, matuojant jos gebą sukelti toksiškumą iš kūno paimtai viščiuko akiai. Toksinis poveikis ragenai matuojamas šiais būdais: i) kokybiškai vertinamas drumstumas, ii) kokybiškai vertinami epitelio pažeidimai ant akies uždėjus fluoresceino (fluoresceino sulaikymas), iii) kiekybiškai matuojamas storio padidėjimas (pabrinkimas) ir iv) kokybiškai įvertinami makroskopiniai morfologiniai paviršiaus pažeidimai. Ragenos drumstumas, pabrinkimas ir pažeidimai, paveikus bandomąja chemine medžiaga, vertinami atskirai ir kartu, kad būtų nustatyta akies dirginimo kategorija. Apibrėžtys pateiktos 1 priedėlyje. PRADINIAI ASPEKTAI IR APRIBOJIMAI Šis bandymo metodas pagrįstas EBPO rekomendaciniame dokumente 160 pasiūlytu protokolu (8), kuris buvo parengtas ICCVAM atlikus tarptautinį tinkamumo patvirtinimo tyrimą (1) (3) (9), padedant Europos alternatyvių metodų patvirtinimo centrui, Japonijos alternatyvių metodų patvirtinimo centrui ir TNO Gyvenimo kokybės – Toksikologijos ir taikomosios farmakologijos departamentui (Nyderlandai). Protokolas pagrįstas informacija, gauta iš paskelbtų protokolų ir iš TNO dabar taikomo protokolo (10) (11) (12) (13) (14). Atliekant šio bandymų metodo tinkamumo patvirtinimą, buvo išbandyta didelė cheminių medžiagų grupė, o tinkamumo patvirtinimo tyrimo empirinę duomenų bazę sudarė 152 cheminės medžiagos, įskaitant 72 medžiagas ir 80 mišinių (5). Bandymų metodas tinka kietosioms medžiagoms, skysčiams, emulsijoms ir geliams. Skysčiai gali būti vandeniniai arba nevandeniniai; kietosios medžiagos gali būti tirpios arba netirpios vandenyje. Atliekant tinkamumo patvirtinimo tyrimą, dujos ir aerozoliai nebuvo vertinami (24). ICE bandymų metodas gali būti taikomas nustatant chemines medžiagas, kurios sukelia smarkius akių pažeidimus, t. y. chemines medžiagas, kurias reikia klasifikuoti kaip JT GHS 1 kategorijos medžiagas (4). Kai ICE metodas taikomas šiuo tikslu, nustatyti jo apribojimai – didelė alkoholiams gautų teigiamų rezultatų dalis ir didelė kietosioms medžiagoms bei paviršinio aktyvumo medžiagoms gautų klaidingai neigiamų rezultatų dalis (1) (3) (9). Tačiau klaidingai neigiamų rezultatų dalis šiame kontekste (JT GHS 1 kategorijos identifikuota kaip ne JT GHS 1 kategorijos) esmės nekeičia, nes, priklausomai nuo reglamentavimo reikalavimų, visos bandomosios cheminės medžiagos, kurioms gaunamas neigiamas rezultatas, vėliau bandomos atliekant tinkamai patvirtintą (-us) bandymą (-us) in vitro arba, blogiausiu atveju, bandymą su triušiais pagal nuosekliųjų bandymų strategiją, taikant įrodomosios duomenų galios metodą. Reikėtų pažymėti, kad atliekant kietųjų medžiagų Draize akių dirginimo bandymą in vivo gali būti kintamos ir ribinės veikimo sąlygos, dėl kurių gali būti gautos netinkamos jų tikrosios dirginamosios gebos prognozės (15). Tyrėjai galėtų spręsti, ar taikyti šį bandymų metodą visų tipų cheminėms medžiagoms, kai teigiamas rezultatas turėtų būti priimtas kaip smarkų akių pažeidimą sukeliančio atsako rodiklis ir cheminę medžiagą reikėtų klasifikuoti kaip JT GHS 1 kategorijos be papildomų bandymų. Tačiau teigiamus rezultatus, gautus bandant alkoholius, reikėtų aiškinti atsargiai, vengiant nepagrįstų prognozių. Kai ICE bandymų metodas taikomas siekiant nustatyti chemines medžiagas, sukeliančias smarkius akių pažeidimus (JT GHS 1 kategorijos), jo visuminis tikslumas – 86 % (120/140), klaidingai teigiamų rezultatų dalis – 6 % (7/113), klaidingai neigiamų rezultatų dalis – 48 % (13/27), palyginti su triušio akių bandymų metodo in vivo duomenimis, klasifikuojamais pagal JT GHS klasifikavimo sistemą (4) (5). ICE bandymų metodą taip pat galima taikyti nustatant chemines medžiagas, kurių nereikia klasifikuoti dėl akių dirginimo arba smarkaus akių pažeidimo pagal JT GHS klasifikavimo sistemą (4). Prieš pradedant taikyti ICE kaip aukštinkryptį metodą pagal kitas klasifikavimo schemas, reikėtų pasitarti su atitinkamomis reguliavimo institucijomis. Šį bandymų metodą galima taikyti visų tipų cheminėms medžiagoms, kurioms gautą neigiamą rezultatą būtų galima priimti kaip įrodymą, kad cheminės medžiagos nereikia klasifikuoti dėl akių dirginimo ir smarkaus akių pažeidimo. Tačiau, atsižvelgiant į vieną rezultatą iš tinkamumo įvertinimo duomenų bazės, organinių tirpiklių turintiems nuo apnašų apsaugantiems dažams galėtų būti gautas klaidingai neigiamas rezultatas (5). Kai ICE bandymų metodas taikomas nustatant chemines medžiagas, kurių nereikia klasifikuoti dėl akių dirginimo ir smarkaus akių pažeidimo, jo visuminis tikslumas – 82 % (125/152), klaidingai teigiamų rezultatų dalis – 33 % (26/79), klaidingai neigiamų rezultatų dalis – 1 % (1/73), palyginti su triušio akių bandymų metodo in vivo duomenimis, klasifikuojamais pagal JT GHS (4) (5). Kai tam tikrų klasių bandomosios cheminės medžiagos (t. y. organinių tirpiklių turintys nuo apnašų apsaugantys dažai) pašalinamos iš duomenų bazės, ICE bandymų metodo tikslumas taikant JT GHS klasifikavimo sistemą yra 83 % (123/149), klaidingai teigiamų rezultatų dalis – 33 % (26/78), klaidingai neigiamų rezultatų dalis – 0 % (0/71) (4) (5). ICE bandymų metodas nerekomenduojamas, kai reikia nustatyti bandomąsias chemines medžiagas, kurias reikėtų klasifikuoti kaip akis dirginančias (t. y. JT GHS 2 kategorijos ar 2A kategorijos), arba bandomąsias chemines medžiagas, kurias reikėtų klasifikuoti kaip akis nestipriai dirginančias (JT GHS 2B kategorijos), dėl gana didelio skaičiaus JT GHS 1 kategorijos cheminių medžiagų, klaidingai priskiriamų JT GHS 2, 2A ar 2B kategorijai, ir JT GHS be kategorijos cheminių medžiagų, klaidingai priskiriamų JT GHS 2, 2A ar 2B kategorijai. Šiuo tikslu gali prireikti papildomų bandymų taikant kitą tinkamą metodą. Visos procedūros su viščiukų akimis turėtų būti atliekamos pagal bandymų laboratorijos taikytinas žmogaus arba gyvūninės kilmės medžiagų, įskaitant audinius ir audinių skysčius, bet neapsiribojant tik jais, tvarkymo taisykles ir procedūras. Rekomenduojama laikytis bendrųjų laboratorijose taikytinų atsargumo priemonių (16). Nors ICE bandymų metode neatsižvelgiama į akies junginės ir rainelės pažeidimus, kurie yra įvertinami taikant triušio akių dirginimo bandymų metodą, tiriamas poveikis ragenai, kuris yra pagrindinis rodiklis, klasifikuojant in vivo pagal JT GHS klasifikavimą. Be to, nors pagal ICE bandymų metodą ragenos pažeidimų grįžtamumas negali būti įvertintas tiesiogiai, atsižvelgiant į triušio akių tyrimus, buvo pasiūlyta naudoti ragenos žaizdos pradinį gylį, kaip galimą būdą kai kuriems negrįžtamo poveikio tipams nustatyti (17). Visų pirma reikia turėti papildomų mokslinių duomenų, kad būtų galima suprasti, kaip atsiranda negrįžtamas poveikis, nesusijęs su dideliu pradinio pažeidimo lygiu. Galiausiai taikant ICE bandymų metodą negalima įvertinti su poveikiu akims susijusio sisteminio toksiškumo galimybės. Šis bandymų metodas bus periodiškai atnaujinamas, kai tik bus išnagrinėta nauja informacija ir duomenys. Pvz., gali būti naudinga histopatologija, kai reikia išsamiau apibūdinti ragenos pažeidimus. Siekiant įvertinti šią galimybę, naudotojai skatinami konservuoti ragenas ir ruošti histopatologinius bandinius, kuriuos galima naudoti kuriant duomenų bazę ir sprendimo priėmimo kriterijus, galinčius pagerinti šio bandymų metodo tikslumą. EBPO parengė toksiškumo akims bandymų in vitro metodų rekomendacinį dokumentą, kurį sudaro išsamiai aprašytos histopatologinių bandinių ėmimo procedūros ir informacija apie tai, kur pateikti bandinius ir (arba) histopatologinius duomenis (8). Kiekviena laboratorija, kuri pradėtų taikyti šį bandymo metodą, turėtų naudoti kvalifikacijai tikrinti skirtas chemines medžiagas, nurodytas 2 priedėlyje. Laboratorija gali naudoti šias chemines medžiagas, norėdama įrodyti savo techninę kompetenciją taikyti ICE bandymo metodą, prieš pateikdama ICE bandymų duomenis teisės aktuose numatytais pavojų klasifikavimo tikslais. BANDYMO PRINCIPAS ICE bandymo metodas yra organotipinių audinių tyrimo modelis, pagal kurį galima išsaugoti trumpalaikį viščiuko akies funkcionavimą in vitro. Pagal šį bandymų metodą bandomosios cheminės medžiagos padarytas pažeidimas nustatomas įvertinant ragenos pabrinkimą, drumstumą ir fluoresceino sulaikymą. Pastarieji du parametrai vertinami kokybiškai, o ragenos pabrinkimo analizė yra kiekybinis įvertinimas. Kiekvienas matavimas perskaičiuojamas į kiekybinį balą, naudojamą visuminiam dirginimo indeksui apskaičiuoti, arba priskiriama kokybinė kategorija, kuri naudojama pavojui akims in vitro klasifikuoti kaip JT GHS 1 kategorijos arba kaip JT GHS be kategorijos. Bet kuris iš šių rezultatų po to gali būti naudojamas bandomosios cheminės medžiagos sukeliamam smarkiam akių pažeidimui in vivo prognozuoti arba nustatyti, kad bendomosios cheminės medžiagos pavojaus akims klasifikuoti nereikia (žr. Sprendimo priėmimo kriterijai). Tačiau ICE bandymų metodu neįmanoma suklasifikuoti cheminių medžiagų, kurios nenustatytos kaip sukeliančios smarkius akių pažeidimus arba kurios neklasifikuojamos (žr.11 pastraipą). Viščiukų akių šaltinis ir amžius Paprastai šiam tyrimui naudojamos žmonėms skirtų vartoti viščiukų akys, paimtos skerdykloje, kurioje viščiukai skerdžiami, kad nereikėtų naudoti laboratorinių gyvūnų. Naudojamos tik sveikų gyvūnų, kurie laikomi tinkamais patekti į žmonių maisto grandinę, akys. Nors kontrolinis tyrimas tinkamiausiam viščiukų amžiui įvertinti nebuvo atliktas, anksčiau taikant šį bandymų metodą buvo naudojami viščiukai, kurių amžius ir masė atitinka paukščių skerdykloje pavasarį skerdžiamų mėsinių viščiukų amžių ir masę (t. y. maždaug 7 savaičių amžiaus, 1,5–2,5 kg masės). Akių paėmimas ir transportavimas į laboratoriją Galvos turėtų būti nupjautos iš karto po to, kai viščiukai numarinami, paprastai elektros šoku, ir įpjaunamas kaklas, kad nubėgtų kraujas. Reikėtų rasti netoli laboratorijos esantį vietinį viščiukų šaltinį, kad galvas būtų galima nuvežti iš skerdyklos į laboratoriją pakankamai greitai ir būtų kuo mažesnė jų pažeidimo ir (arba) užteršimo bakterijomis tikimybė. Laikotarpis nuo viščiukų galvų surinkimo iki išpjautų akių pernešimo į perfuzijos aparato kamerą turėtų būti kuo mažesnis (paprastai trumpesnis kaip dvi valandos), kad būtų užtikrinta atitiktis tyrimo priimtinumo kriterijams. Visos bandymui atlikti naudojamos akys turėtų būti iš tos pačios tam tikrą dieną surinktos akių grupės. Kadangi akys išpjaunamos laboratorijoje, iš skerdyklos vežamos galvos su akimis laikomos plastikinėse dėžėse aplinkos temperatūroje (paprastai nuo 18 °C iki 25 °C) ir drėkinamos servetėlėmis, įmirkytomis izotoniniu druskos tirpalu. ICE bandymui skirtų akių atrankos kriterijai ir skaičius Išimtos akys atmetamos, jei jų dažymo fluoresceinu atskaitos vertės (t. y. > 0,5) arba ragenos drumstumo atskaitos vertės (t. y. > 0,5) yra didelės. Kiekvieną apdorotų ėminių ir vienalaikių kontrolinių ėminių grupę sudaro ne mažiau kaip trys akys. Neigiamo kontrolinio ėminio arba tirpiklio ar nešiklio kontrolinio ėminio (jei naudojamas kitas nei druskos tirpalas tirpiklis) grupę sudaro bent viena akis. Jei kietosioms medžiagoms gaunamas GHS be kategorijos rezultatas, rekomenduojama atlikti antrąjį bandymą su trimis akimis, kad būtų patvirtintas arba paneigtas neigiamas rezultatas. PROCEDŪRA Akių paruošimas Atsargiai, nepažeidžiant ragenos, išpjaunami akių vokai. Ragenos vientisumas greitai įvertinamas ant ragenos paviršiaus kelioms sekundėms užlašinus 2 % (m/V) fluoresceino natrio druskos tirpalo lašą ir jį nuplovus izotoniniu druskos tirpalu. Fluoresceinu apdorotos akys apžiūrimos per mikroskopą su plyšine lempa, siekiant įsitikinti, ar ragena yra nepažeista (t. y. ar fluoresceino sulaikymo ir ragenos drumstumo vertės yra ≤ 0,5). Jei ragena nepažeista, akis išpjaunama iš kaukolės, nepažeidžiant ragenos. Akies obuolys ištraukiamas iš akiduobės tvirtai suimant mirksimąją membraną chirurginėmis žnyplėmis, tada lenktomis, bukais galais žirklėmis nupjaunami akies raumenys. Svarbu nepažeisti ragenos (t. y. nepalikti spaudimo žymių) per daug ją spaudžiant. Akį išėmus iš akiduobės, matoma regos nervo dalis turėtų būti palikta. Iš akiduobės išimta akis padedama ant sugeriamojo padėklo, tada nupjaunama mirksimoji membrana ir kiti jungiamieji audiniai. Išimta akis tvirtinama nerūdijančiojo plieno laikiklyje taip, kad ragenos padėtis būtų vertikali. Laikiklis perkeliamas į perfuzijos aparato kamerą (18). Laikiklius perfuzijos aparate reikėtų įtaisyti taip, kad izotoninis druskos tirpalas lašėtų ant visos ragenos (3–4 lašai per minutę ar 0,1–0,15 ml/min). Kontroliuojama perfuzijos aparato kamerų temperatūra turėtų būti 32 ± 1,5 °C. 3 priedėlyje pateikta perfuzijos aparato ir akių laikiklių, kuriuos galima nusipirkti arba pasigaminti, schema. Aparato konstrukciją galima keisti, atsižvelgiant į kiekvienos laboratorijos poreikius (pvz., norint įdėti kitokį akių skaičių). Įdėjus akis į perfuzijos aparatą, jos dar kartą apžiūrimos per mikroskopą su plyšine lempa, siekiant įsitikinti, ar jos nebuvo pažeistos per išpjovimo procedūrą. Kartu taip pat turėtų būti išmatuotas ragenos storis jos viršūnėje, naudojant gylio matavimo prietaisą, įrengtą mikroskope su plyšine lempa. Akis, kurių i) fluoresceino sulaikymo vertė > 0,5, ii) ragenos drumstumas > 0,5 arba iii) yra papildomų pažeidimo požymių, reikėtų pakeisti. Jei akys nebuvo atmestos pagal kurį nors iš šių kriterijų, reikėtų atmesti atskiras akis, kurių ragenos storio nuokrypis nuo visų akių vidurkio didesnis kaip 10 %. Naudotojai turėtų žinoti, kad matuojant mikroskopu su plyšine lempa gautas ragenų storis gali skirtis, pasirinkus nevienodus plyšio pločio nuostačius. Reikėtų nustatyti 0,095 mm pločio plyšį. Apžiūrėjus akis ir patvirtinus jų tinkamumą, jos maždaug 45–60 min inkubuojamos, kad prieš dozavimą būtų pasiekta pusiausvyra su bandymo sistema. Pasibaigus pusiausvirinimo laikotarpiui, registruojamos ragenos nulinės storio ir drumstumo vertės, kurios būtų naudojamos kaip atskaitos vertės (t. y. laikas = 0). Išpjovimo metu gauta fluoresceino skaitinė vertė naudojama kaip šios vertinamosios baigties atskaitos vertė. Bandomosios cheminės medžiagos įterpimas Iš karto po nulinio laiko atskaitos verčių matavimo, akis (su laikikliu) išimama iš perfuzijos aparato, padedama horizontaliai ir ant ragenos uždedama bandomosios cheminės medžiagos. Skystos bandomosios cheminės medžiagos paprastai bandomos grynos, tačiau prireikus (pvz., jei tai yra tyrimo schemos dalis) jas galima atskiesti. Tinkamiausias bandomųjų cheminių medžiagų tirpiklis yra fiziologinis tirpalas. Kontroliuojamomis sąlygomis galima naudoti kitus tirpiklius, tačiau būtina įrodyti tirpiklių, kurie nėra fiziologinis tirpalas, tinkamumą. Skystos bandomosios cheminės medžiagos užlašinamos ant ragenos taip, kad visas ragenos paviršius būtų tolygiai padengtas bandomąja chemine medžiaga, kurios tipinis tūris – 0,03 ml. Jei įmanoma, kietąsias bandomąsias chemines medžiagas reikėtų kuo smulkiau sumalti grūstuve arba panašia malimo priemone. Milteliai ant ragenos beriami taip, kad jos paviršius būtų tolygiai padengtas bandomąja chemine medžiaga, kurios tipinis kiekis – 0,03 g. Bandomoji cheminė medžiaga (skysta arba kieta) laikoma uždėta 10 sekundžių ir nuplaunama nuo akies aplinkos temperatūros izotoniniu druskos tirpalu (maždaug 20 ml). Tada akis (su laikikliu) vėl įdedama į perfuzijos aparatą, į pradinę vertikaliąją padėtį. Prireikus po 10 sekundžių laikymo ir vėlesniais laiko momentais (pvz., ant ragenos radus bandomosios cheminės medžiagos likučių) galima plauti papildomai. Apskritai papildomam plovimui naudojamas druskos tirpalo tūris neturi didelės reikšmės, bet svarbu pastebėti, ar ant ragenos yra prilipusios cheminės medžiagos. Kontrolinės cheminės medžiagos Atliekant kiekvieną bandymą turėtų būti įtraukti vienalaikiai neigiami arba tirpiklio ar nešiklio kontroliniai ėminiai ir teigiami kontroliniai ėminiai. Kai pagal ICE bandymo metodą bandomi gryni skysčiai arba kietosios medžiagos, kaip vienalaikis neigiamas kontrolinis ėminys naudojamas fiziologinis tirpalas, kad būtų galima aptikti netipinius bandymo sistemos pokyčius ir kad tyrimo sąlygos nesukeltų netinkamo dirginamojo atsako. Kai taikant bandymo metodą bandomi atskiesti skysčiai, įtraukiama vienalaikė tirpiklio ar nešiklio kontrolinė grupė, kad būtų galima aptikti netipinius bandymo sistemos pokyčius ir kad tyrimo sąlygos nesukeltų netinkamo dirginamojo atsako. Kaip nurodyta 31 skirsnyje, galima naudoti tik tokį tirpiklį ar nešiklį, kuris, kaip įrodyta, neturi neigiamo poveikio bandymo sistemai. Siekiant patikrinti, ar sukeliamas reikiamas atsakas, atliekant kiekvieną bandymą kaip teigiama kontrolinė medžiaga įtraukiama žinoma akis dirginanti medžiaga. Kadangi pagal šį bandymo metodą ICE bandymas atliekamas ėsdinančioms arba smarkiai dirginančioms medžiagoms nustatyti, šio bandymų metodo teigiama kontrolinė medžiaga turėtų būti etaloninė cheminė medžiaga, kuri sukelia stiprų atsaką. Tačiau, siekiant užtikrinti galimybę vertinti teigiamo kontrolinio ėminio atsako kintamumą per tam tikrą laiką, teigiamas atsakas neturėtų būti per stiprus. Turėtų būti gauta pakankamai in vitro duomenų apie teigiamą kontrolinę medžiagą, kad būtų galima apskaičiuoti statistiškai apibrėžtą priimtiną teigiamos kontrolinės medžiagos intervalą. Jei tinkamų istorinių ICE bandymo metodo duomenų apie tam tikrą teigiamą kontrolinę medžiagą nėra, gali tekti atlikti tyrimus šiai informacijai gauti. Tinkamų teigiamų kontrolinių medžiagų pavyzdžiai bandant skystas chemines medžiagas yra 10 % acto rūgštis arba 5 % benzalkonio chloridas, o bandant kietąsias chemines medžiagas – natrio hidroksidas arba imidazolas. Palyginamosios cheminės medžiagos yra naudingos, kai reikia įvertinti tam tikros cheminių medžiagų ar produktų klasės nežinomų cheminių medžiagų gebą dirginti akis arba akis dirginančios medžiagos santykinę dirginamąją gebą tam tikrame atsako į dirginimą intervale. Matuojamos vertinamosios baigtys Apdorotos ragenos įvertinamos prieš apdorojimą ir 30, 75, 120, 180 bei 240 min (± 5 min) po apdorotų ragenų nuplovimo. Matuojant tokiais laiko momentais užtikrinamas tinkamas matavimų skaičius keturių valandų apdorojimo laikotarpiu, tarp matavimų paliekant pakankamai laiko reikiamai visų akių apžiūrai. Nustatytos vertinamosios baigtys – ragenos drumstumas, pabrinkimas, fluoresceino sulaikymas ir morfologiniai padariniai (pvz., epitelio išopėjimas arba atsiskyrimas). Visos vertinamosios baigtys, išskyrus fluoresceino sulaikymą (kuris nustatomas tik prieš apdorojimą ir praėjus 30 min nuo paveikimo bandomąja chemine medžiaga), vertinamos kiekvienu pirmiau nurodytu laiko momentu. Patariama padaryti nuotraukas, kad būtų gauti ragenos drumstumo, fluoresceino sulaikymo, morfologinių padarinių ir histopatologinių tyrimų, jei atliekami, dokumentai. Baigus keturių valandų tyrimą, naudotojams siūloma konservuoti akis tinkamame fiksavimo tirpale (pvz., neutraliame buferuotame formalino tirpale), kad būtų galima atlikti histopatologinį tyrimą (išsamesnės informacijos pateikta 14 pastraipoje ir (8) nuorodoje). Ragenų pabrinkimas nustatomas ragenos storį matuojant optiniu pachimetru, įrengtu mikroskope su plyšine lempa. Jis išreiškiamas procentais ir taikant ragenos storio matavimo duomenis apskaičiuojamas pagal šią formulę:
Apskaičiuojamas visų bandytų akių vidutinis ragenos pabrinkimas procentais kiekvienu stebėjimo laiko momentu. Pagal didžiausią vidutinį ragenos pabrinkimo balą, nustatytą kuriuo nors laiko momentu, kiekvienai bandomajai cheminei medžiagai priskiriamas visuminis kategorijos balas (žr. 51 pastraipą). Ragenos drumstumas įvertinamas tame ragenos plote, kuris labiausiai nepraleidžia šviesos, kad būtų gautas drumstumo balas, pateiktas 1 lentelėje. Apskaičiuojama visų bandytų akių vidutinė ragenos drumstumo vertė kiekvienu stebėjimo laiko momentu. Pagal didžiausią vidutinį ragenos drumstumo balą, nustatytą kuriuo nors laiko momentu, kiekvienai bandomajai cheminei medžiagai priskiriamas bendras kategorijos balas (žr. 51 pastraipą). 1 lentelė Ragenos drumstumo balai
Fluoresceino sulaikymas įvertinamas tik 30 min atitinkančiu stebėjimo momentu, kaip pateikta 2 lentelėje. Visų bandytų akių vidutinė fluoresceino sulaikymo vertė apskaičiuojama tik 30 min atitinkančiam stebėjimo momentui ir ji naudojama kiekvienos bandomosios cheminės medžiagos visuminiam kategorijos balui gauti (žr. 51 pastraipą). 2 lentelė Fluoresceino sulaikymo balai
Morfologiniai padariniai aprėpia ragenos epitelio ląstelių opėjimą, epitelio atsiskyrimą, ragenos paviršiaus šiurkštėjimą ir bandomosios cheminės medžiagos sulipimą su ragena. Šių požymių stiprumas gali būti įvairus ir jie gali pasireikšti kartu. Šių požymių klasifikavimas yra subjektyvus, priklauso nuo tyrėjo aiškinimų. DUOMENYS IR ATASKAITOS RENGIMAS Duomenų įvertinimas Ragenos drumstumo, pabrinkimo ir fluoresceino sulaikymas turėtų būti įvertinti atskirai, kad būtų gauta kiekvienos vertinamosios baigties ICE klasė. Tada kiekvienos vertinamosios baigties ICE klasės apibendrinamos, kad būtų gautas kiekvienos bandomosios cheminės medžiagos akių dirginimo klasifikavimas. Sprendimo priėmimo kriterijai Nustačius kiekvieną vertinamąją baigtį, ICE klasės gali būti priskirtos atsižvelgiant į iš anksto nustatytą intervalą. Ragenos pabrinkimo (3 lentelė), drumstumo (4 lentelė) ir fluoresceino sulaikymo (5 lentelė) rezultatų aiškinimas, taikant keturias ICE klases, atliekamas pagal toliau pateiktas skales. Svarbu atkreipti dėmesį į tai, kad 3 lentelėje pateikti ragenos pabrinkimo balai taikomi tik tada, jei storis matuojamas mikroskopu su plyšine lempa (pvz., Haag-Streit BP900), gylio matavimo įtaisu Nr.1 ir plyšio pločio nuostačiu 9 3 lentelė ICE klasifikavimo kriterijai atsižvelgiant į ragenos pabrinkimą
4 lentelė ICE klasifikavimo kriterijai atsižvelgiant į drumstumą
.5 lentelė ICE klasifikavimo kriterijai atsižvelgiant į vidutinį fluoresceino sulaikymą
Bandomosios cheminės medžiagos in vitro klasifikavimas vertinamas gaunant GHS klasifikavimą, kuris atitinka gautų ragenų pabrinkimo, ragenų drumstumo ir fluoresceino sulaikymo kategorijų derinį, kaip aprašyta 6 lentelėje. 6 lentelė Visuminis in vitro klasifikavimas
Tyrimo priimtinumo kriterijai Bandymas laikomas priimtinu, jei vienalaikiai neigiami arba nešiklio ar tirpiklio kontroliniai ėminiai ir vienalaikiai teigiami kontroliniai ėminiai nustatomi kaip GHS neklasifikuojami ar GHS 1 kategorijos ėminiai. Bandymo ataskaita Į bandymo ataskaitą turėtų būti įtraukta ši informacija, jei ji yra svarbi atliekant tyrimą:
LITERATŪRA
1 priedėlis APIBRĖŽTYS Tikslumas – bandymo metodo rezultatų ir patvirtintų pamatinių verčių sutapimo artumas. Tikslumas yra bandymo metodo taikymo charakteristikų matas ir vienas iš „tinkamumo“ aspektų. Terminas dažnai vartojamas kaip lygiavertis terminui „atitiktis“ tinkamų bandymo metodo rezultatų daliai išreikšti. Palyginamoji cheminė medžiaga – cheminė medžiaga, naudojama kaip etalonas lyginant su bandomąja chemine medžiaga. Palyginamoji cheminė medžiaga turėtų turėti šias savybes: i) pastovų (-ius) ir patikimą (-us) šaltinį (-ius); ii) struktūrinį ir funkcinį panašumą su bandomųjų cheminių medžiagų klase; iii) žinomas fizikines ir (arba) chemines charakteristikas; iv) žinomą poveikį patvirtinančius duomenis ir v) žinomą veikimo gebą reikiamo atsako intervale. Aukštynkryptis metodas – pakopinis metodas, taikomas cheminei medžiagai, apie kurią daroma prielaida, kad jos nereikia klasifikuoti dėl akių dirginimo arba smarkaus akių pažeidimo, kai cheminės medžiagos, kurių nereikia klasifikuoti (duoda neigiamą rezultatą), nustatomos atskiriant jas nuo kitų cheminių medžiagų (duoda teigiamą rezultatą). Cheminė medžiaga – medžiaga arba mišinys. Ragena – permatoma priekinė akies obuolio dalis, dengianti rainelę bei vyzdį ir praleidžianti šviesą į vidų. Ragenos drumstumas – ragenos, paveiktos bandomąja chemine medžiaga, neskaidrumo laipsnio matas. Padidėjęs ragenos drumstumas rodo ragenos pažeidimą. Ragenos pabrinkimas – objektyvus atliekant ICE bandymą nustatomas ragenos išsipūtimo lygio, baigus veikti bandomąja chemine medžiaga, matas. Išreiškiamas procentais ir apskaičiuojamas pagal ragenos storio atskaitos vertę (nustatytą prieš veikiant doze) ir ragenos storį, užregistruotą vienodais laiko tarpais, baigus veikti bandomąja chemine medžiaga atliekant ICE bandymą. Ragenos pabrinkimo lygis rodo ragenos pažeidimą. Akių dirginimas – akių pokyčių sukėlimas, uždėjus bandomosios cheminės medžiagos ant priekinio akies paviršiaus, kai pokyčiai visiškai išnyksta per 21 parą nuo uždėjimo. Sukeičiama su Grįžtamasis poveikis akims ir su JT GHS 2 kategorija (4). Klaidingai neigiamų rezultatų dalis – visų teigiamų cheminių medžiagų, kurios taikant bandymų metodą klaidingai nustatytos kaip neigiamos, dalis. Tai yra vienas iš bandymo metodo taikymo charakteristikų rodiklių. Klaidingai teigiamų rezultatų dalis – visų neigiamų cheminių medžiagų, kurios taikant bandymų metodą klaidingai identifikuotos kaip teigiamos, dalis. Tai yra vienas iš bandymo metodo taikymo charakteristikų rodiklių. Fluoresceino sulaikymas – per ICE bandymą subjektyviai nustatomas fluoresceino natrio druskos kiekis, išlikęs ragenos epitelio ląstelėse, rageną baigus veikti bandomąja chemine medžiaga. Fluoresceino sulaikymo laipsnis rodo ragenos epitelio pažeidimą. Pavojus – būdingoji agento savybė arba situacija, galinti sukelti neigiamų padarinių, kai organizmą, sistemą ar populiaciją (arba jos dalį) veikia tas agentas. Negrįžtamasis poveikis akims – žr. smarkus akių pažeidimas ir JT GHS 1 kategorija. Mišinys – dviejų arba daugiau medžiagų mišinys arba tirpalas, kuriuose jos nereaguoja (4) Neigiamas kontrolinis ėminys – neapdorotas kartotinis ėminys, turintis visus bandymo sistemos komponentus. Šis ėminys tiriamas kartu su bandomąja chemine medžiaga apdorotais ėminiais ir kitais kontroliniais ėminiais, siekiant nustatyti, ar vyksta tirpiklio sąveika su bandymo sistema. Neklasifikuojamos – cheminės medžiagos, kurios neklasifikuojamos dėl akių dirginimo (JT GHS 2 kategorija) ar dėl smarkaus akių pažeidimo (JT GHS 1 kategorija). Sukeičiama su JT GHS be kategorijos. Teigiamas kontrolinis ėminys – kartotinis ėminys, turintis visus bandymo sistemos komponentus ir paveiktas chemine medžiaga, kuri yra žinoma kaip sukelianti teigiamą atsaką. Siekiant užtikrinti galimybę vertinti teigiamo kontrolinio ėminio atsako kintamumą per tam tikrą laiką, teigiamas atsakas neturėtų būti per stiprus. Patikimumas – pagal tą patį protokolą atliekamo bandymų metodo, tam tikrą laiką taikomo laboratorijose ir tarp laboratorijų, atkuriamumo laipsnio matai. Jis įvertinamas apskaičiuojant atkuriamumą laboratorijoje ir tarp laboratorijų ir pakartojamumą laboratorijoje. Grįžtamasis poveikis akims – žr. akių dirginimas ir JT GHS 2 kategorija. Smarkus akių pažeidimas – tai akies audinio pažeidimas arba smarkus fizinis regėjimo pablogėjimas, ant išorinio akies paviršiaus uždėjus bandomosios cheminės medžiagos, kuris ne visiškai išnyksta praėjus 21 parai nuo uždėjimo. Sukeičiama su Nerįžtamasis poveikis akims ir su JT GHS 1 kategorija (4). Mikroskopas su plyšine lempa – prietaisas, naudojamas tiesiogiai ištirti akį, jos vaizdą padidinant binokuliniu mikroskopu ir sukuriant tiesioginį stereoskopinį vaizdą. Taikant ICE bandymo metodą, šis prietaisas naudojamas viščiukų akių priekinėms struktūroms apžiūrėti ir ragenos storiui objektyviai išmatuoti pritaisytu gylio matavimo prietaisu. Tirpiklio ar nešiklio kontrolinis ėminys – visus bandymo sistemos komponentus, įskaitant tirpiklį ar nešiklį, turintis neapdorotas ėminys, kuris tiriamas kartu su bandomąja chemine medžiaga apdorotais ėminiais ir kitais kontroliniais ėminiais, siekiant nustatyti atskaitos vertę ėminiams, paveiktiems bandomąja chemine medžiaga, ištirpinta tame pačiame tirpiklyje ar nešiklyje. Kai bandomas kartu su vienalaikiu neigiamu kontroliniu ėminiu, šis ėminys taip pat parodo, ar vyksta tirpiklio arba nešiklio sąveika su bandymo sistema. Medžiaga – natūralios būsenos arba gamybos procese gaunami cheminiai elementai ir jų junginiai, įskaitant visus priedus, kurie reikalingi produkto stabilumui užtikrinti, ir visas priemaišas, patenkančias į produktą jo gamybos proceso metu, tačiau neįskaitant tirpiklio, kurį galima atskirti, nepaveikiant medžiagos stabilumo ar nekeičiant jos sudėties; Paviršinio aktyvumo medžiaga – dar vadinama paviršinio aktyvumo agentu, tai yra medžiaga, pvz., ploviklis, kuri gali sumažinti skysčio paviršiaus įtemptį, kad skystis galėtų putoti ar prasiskverbti į kietąsias medžiagas; be to, ji žinoma drėkiklio pavadinimu. Žemynkryptis metodas – pakopinis metodas, taikomas cheminei medžiagai, apie kurią daroma prielaida, kad ji sukelia smarkų akių pažeidimą, kai cheminės medžiagos, kurios sukelia smarkų akių pažeidimą (duoda teigiamą rezultatą), nustatomos atskiriant jas nuo kitų cheminių medžiagų (duoda neigiamą rezultatą). Bandomoji cheminė medžiaga – taikant šį metodą bandoma medžiaga arba mišinys. Nuosekliųjų bandymų strategija – pakopomis atliekamų bandymų strategija, kai tam tikra eilės tvarka nagrinėjama visa turima informacija apie bandomąją cheminę medžiagą, kiekvienoje pakopoje taikant įrodomosios vertės analizės procesą, siekiant nustatyti, ar yra pakankamai duomenų sprendimui dėl pavojingumo kategorijos priimti, prieš pereinant prie kitos pakopos. Jei bandomosios cheminės medžiagos dirginamąją gebą galima nustatyti atsižvelgiant į turimą informaciją, papildomų bandymų atlikti nereikia. Jei atsižvelgiant į turimą informaciją, bandomajai cheminei medžiagai dirginamosios gebos priskirti neįmanoma, taikoma nuosekliųjų bandymų su gyvūnais procedūra tol, kol būtų galima gauti nedviprasmį klasifikavimą. Jungtinių Tautų visuotinai suderinta cheminių medžiagų klasifikavimo ir ženklinimo sistema (JT GHS) – sistema, kurioje pateikiamas cheminių medžiagų (medžiagų ir mišinių) klasifikavimas pagal standartizuotus fizikinių pavojų, pavojų sveikatai bei aplinkai tipus ir nagrinėjami atitinkami informaciniai elementai, pvz., piktogramos, signaliniai žodžiai, pavojingumo frazės, atsargumo frazės ir saugos duomenų lapai, kad būtų galima informuoti apie medžiagų neigiamą poveikį, siekiant apsaugoti žmones (įskaitant darbuotojus, darbininkus, vežėjus, vartotojus ir avarijų likvidatorius) ir aplinką (4). JT GHS 1 kategorija – žr. Smarkus akių pažeidimas ir (arba) Negrįžtamasis poveikis akims. JT GHS 2 kategorija – žr. Akių dirginimas ir (arba) Grįžtamasis poveikis akims. JT GHS be kategorijos – cheminės medžiagos, kurios neatitinka JT GHS 1 arba 2 (2A ar 2B) kategorijos klasifikavimo reikalavimų. Sukeičiama su Neklasifikuojamos. Patvirtinto tinkamumo bandymų metodas – bandymų metodas, kurio patvirtinimo tyrimai atlikti, kad būtų nustatytas jo tinkamumas tam tikram tikslui pasiekti (įskaitant tikslumą) ir patikimumas. Svarbu pažymėti, kad patvirtinto tinkamumo bandymo metodo tikslumo ir patikimumo charakteristikos gali būti nepakankamos, kad jį būtų galima laikyti priimtinu siūlomam tikslui pasiekti. Įrodomoji duomenų galia – įvairių informacijos dalių privalumų ir trūkumų nagrinėjimo procesas priimant ir patvirtinant sprendimą dėl cheminės medžiagos pavojingumo. 2 priedėlis CHEMINĖS MEDŽIAGOS, SKIRTOS KVALIFIKACIJAI TIKRINTI TAIKANT ICE BANDYMŲ METODĄ Prieš pradėdamos įprastiniu būdu atlikti bandymus, susijusius su šiuo bandymo metodu, laboratorijos turėtų įrodyti savo techninę kvalifikaciją, tinkamai klasifikuodamos 1 lentelėje rekomenduojamų 13 cheminių medžiagų keliamą pavojų akims. Šios cheminės medžiagos buvo parinktos taip, kad atitiktų pavojų akims atsakų intervalą, atsižvelgiant į in vivo triušio akių bandymo (TG 405) rezultatus ir į JT GHS klasifikavimo sistemą (t. y. JT GHS 1, 2A, 2B kategorijas ar į GHS be kategorijos) (4)(6). Kiti atrankos kriterijai buvo galimybė pirkti chemines medžiagas ir tai, ar galima gauti aukštos kokybės in vivo etaloninius duomenis bei aukštos kokybės in vitro ICE bandymų metodo duomenis. Etaloniniai duomenys pateikti supaprastintame suvestiniame dokumente (5) ir ICE bandymų metodo ICCVAM istorinės apžvalgos dokumente (9). 1 lentelė Cheminės medžiagos, rekomenduojamos techninei kvalifikacijai tikrinti taikant ICE bandymų metodą
3 priedėlis ICE PERFUZIJOS APARATO IR AKIŲ LAIKIKLIŲ SCHEMOS (Perfuzijos aparato ir akies laikiklio išsamesnis bendrasis aprašymas pateiktas Burton et al. (18)) 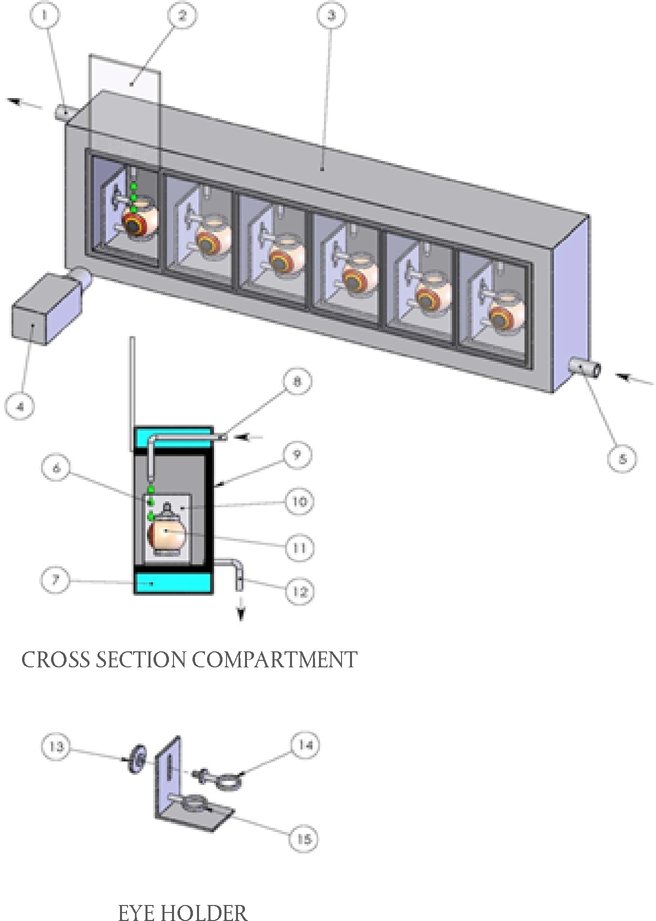
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
14) |
B dalies B.49 skyrius pakeičiamas taip: „B.49 In vitro žinduolių ląstelių mikrobranduolių bandymas ĮVADAS Šis bandymų metodas atitinka EBPO bandymų gaires (TG) 487 (2014). Jis yra genetinės toksikologijos metodų serijos dalis. Yra parengtas EBPO dokumentas, kuriame glaustai pateikiama informacijos apie genetinės toksikologijos bandymus ir naujausių šių gairių pakeitimų apžvalga (1). In vitro mikrobranduolių (MNvit) tyrimas yra genotoksiškumo bandymas, skirtas tarpfazinių ląstelių citoplazmos mikrobranduoliams (angl. micronuclei, MN) aptikti. Mikrobranduoliai gali susidaryti iš chromosomų acentrinių fragmentų (t. y. neturinčių centromeros) arba iš visų chromosomų, kurios ląstelių dalijimosi anafazės stadijoje negali migruoti link polių. Todėl MNvit bandymas yra in vitro metodas, kuris užtikrina patikimą pagrindą tiriant in vitro chromosomų pažeidimo gebą, nes galima aptikti aneugenus ir klastogenus (2) (3) ląstelėse, kurioms įvyko ląstelių dalijimasis veikiant chemine medžiaga arba pasibaigus veikimui (daugiau informacijos pateikta 13 pastraipoje). Mikrobranduoliai rodo pažeidimą, kuris buvo perduotas dukterinėms ląstelėms, o metafazės ląstelėse užfiksuotos chromosomų aberacijos gali būti neperduotos. Bet kuriuo atveju pokyčiai gali būti nesuderinami su ląstelės išgyvenamumu. Pagal šį bandymo metodą galima naudoti protokolus su aktino polimerizacijos inhibitoriumi citochalazinu B (citoB) arba be jo. Pridėjus citoB prieš mitozę gaunamos dvibranduolės ląstelės, todėl yra galimybė atpažinti ir analizuoti mikrobranduolius tik tose ląstelėse, kuriose įvyko viena mitozė (4) (5). Pagal šį bandymo metodą taip pat galima naudoti protokolus be citokinezės blokavimo, jei yra įrodymų, kad analizuojamoje ląstelių populiacijoje įvyko mitozė. Be MNvit tyrimo taikymo nustatant chemines medžiagas, kurios indukuoja mikrobranduolius, imunocheminio kinetochorų ženklinimo arba hibridizacijos su centromeriniais ar telomeriniais zondais (fluorescencinė in situ hibridizacija (FISH)) naudojimas taip pat gali suteikti papildomos informacijos apie chromosomų pažeidimo ir mikrobranduolių susidarymo mechanizmus (6) (7) (8) (9) (10) (11) (12) (13) (14) (15) (16) (17). Šias ženklinimo ir hibridizacijos procedūras galima taikyti, kai yra padidėjęs mikrobranduolių susidarymas ir tyrėjas nori nustatyti, ar tą padidėjimą sukėlė klastogeniniai ir (arba) aneugeniniai reiškiniai. Kadangi tarpfazinių ląstelių mikrobranduoliai gali būti įvertinti palyginti objektyviai, laboratorijos personalui tereikia nustatyti ląstelių su dviem branduoliais skaičių, kai naudojamas citoB, ir ląstelių su mikrobranduoliais dažnumą visais atvejais. Todėl objektinių stiklelių tyrimas yra palyginti spartus ir analizė gali būti automatizuota. Dėl to įmanoma įvertinti ne šimtus, o tūkstančius vieno apdorojimo ląstelių, todėl kriterijaus galia padidėja. Galiausiai, kadangi mikrobranduoliai gali susidaryti iš atsiliekančių chromosomų, yra galimybė aptikti aneuploidiją sukeliančias medžiagas, kurias sunku tirti įprastais chromosomų aberacijos bandymais, pvz., šio priedo B.10 (18). Tačiau taikant šiame bandymo metode aptašytą MNvit bandymą, negalima atskirti cheminių medžiagų, sukeliančių chromosomų skaičiaus pokyčius ir (arba) ploidiją, nuo klastogeniškumą sukeliančių medžiagų, jei netaikomi specialieji metodai, pvz., 4 pastraipoje nurodytas FISH metodas. MNvit tyrimas yra patikimas ir gali būti atliekamas su įvairių tipų ląstelėmis, esant citoB arba jo nesant. Yra daug duomenų, kurie patvirtina MNvit bandymo tinkamumą, naudojant įvairių tipų ląsteles (ląstelių linijų kultūras ar pirminių ląstelių kultūras) (19) (20) (21) (22) (23) (24) (25) (26) (27) (28) (29) (30) (31) (32) (33) (34) (35) (36). Pirmiausia tai yra tarptautiniai tinkamumo patvirtinimo tyrimai, kuriuos koordinavo Société Française de Toxicologie Génétique (SFTG) (19) (20) (21) (22) (23), ir tarptautinio genotoksiškumo bandymų seminaro ataskaitos (5) (17). Turimi duomenys buvo pakartotinai įvertinti atliekant retrospektyvųjį tinkamumo patvirtinimo tyrimą įrodomosios vertės analizės metodu, kurį atliko Europos Komisijos Europos alternatyvių metodų tinkamumo patvirtinimo centras (ECVAM), o ECVAM mokslinis patariamasis komitetas (ESAC) patvirtino tyrimo metodą kaip moksliškai patikimą (37) (38) (39). Atliekant žinduolių ląstelių MNvit bandymą, galima naudoti gerai žinomų ląstelių linijų arba žmogaus ar graužikų kilmės pirminių ląstelių kultūras. Kadangi foninis mikrobranduolių dažnumas turės poveikį bandymo jautriui, rekomenduojama naudoti ląstelių tipus, kurių mikrobranduolių susidarymo foninis dažnumas yra mažas ir stabilus. Naudojamos ląstelės pasirenkamos pagal jų sugebėjimą gerai augti kultūroje, kariotipų stabilumą (įskaitant chromosomų skaičių) ir spontaninį mikrobranduolų dažnumą. Atsižvelgiant į šiuo metu turimus duomenis, neįmanoma pateikti tvirtų rekomendacijų, bet svarbu nurodyti, kad, įvertinant cheminius pavojus, reikėtų atsižvelgti į bandymams pasirinktų ląstelių p53 būseną, genetinį (kariotipo) stabilumą, DNR atkūrimo gebą ir kilmę (graužikų palyginti su žmogaus). Todėl šio bandymo metodo naudotojai raginami atsižvelgti į šių ir kitų ląstelių charakteristikų įtaką ląstelių linijos savybėms aptinkant mikrobranduolių indukciją, nes šios srities žinių visą laiką daugėja. Vartojamos apibrėžtys pateiktos 1 priedėlyje. PRADINIAI ASPEKTAI IR APRIBOJIMAI Bandymus atliekant in vitro paprastai reikia naudoti egzogeninį metabolinio aktyvinimo šaltinį, išskyrus atvejus, kai ląstelės yra metaboliškai pajėgios bandomųjų cheminių medžiagų atžvilgiu. Egzogeninė metabolinio aktyvinimo sistema nevisiškai atkartoja in vivo sąlygas. Reikėtų imtis priemonių, kad būtų išvengta sąlygų, kurioms esant būtų gauti dirbtinai teigiami rezultatai, nerodantys bandomųjų cheminių medžiagų genotoksiškumo. Tokios sąlygos gali atsirasti dėl tokių veiksnių kaip pH pH (41) (42) (43) ar osmolialumo pokyčiai, sąveika su ląstelių kultūros terpe (44) (45) ar per didelis citotoksiškumas (žr. 29 pastraipą). Mikrobranduolių indukcijai analizuoti svarbiausia, kad apdorotose ir neapdorotose kultūrose būtų įvykusi mitozė. Informatyviausias mikrobranduolių vertinimo etapas vyksta ląstelėse, kuriose veikiant bandomąja chemine medžiaga arba po to įvyko viena mitozė. Pramoninėms nanomedžiagoms gali prireikti tam tikro šio bandymų metodo pakeitimų, kurie šiame bandymų metode neaprašyti. Prieš taikant bandymų metodą mišiniui, kad būtų gauti numatomo reglamentavimo tikslui skirti duomenys, reikėtų panagrinėti, ar metodu galima pasiekti tą tikslą atitinkančius rezultatus ir, jei taip, tai dėl kokios priežasties. Tokie svarstymai nereikalingi, kai yra reglamentavimo reikalavimas bandyti mišinį. BANDYMO PRINCIPAS Žmogaus ar kitų žinduolių kilmės ląstelių kultūros veikiamos bandomąja chemine medžiaga naudojant egzogeninį metabolinio aktyvinimo šaltinį arba jo nenaudojant, jei naudojamos reikiamą metabolinę gebą turinčios ląstelės (žr. 19 pastraipą). Ląstelės auginamos pakankamą laikotarpį veikimo bandomąja chemine medžiaga metu arba po jo, kad įvyktų chromosomų pažeidimas arba kiti ląstelių ciklo ar ląstelių dalijimosi reiškiniai, dėl kurių interfazinėse ląstelėse imtų formuotis mikrobranduoliai. Aneuploidijai indukuoti bandomoji cheminė medžiaga paprastai turėtų būti mitozės metu. Surinktos ir nudažytos interfazinės ląstelės analizuojamos ieškant mikrobranduolių. Geriausiai būtų skaičiuoti mikrobranduolius tik tose ląstelėse, kuriose mitozė pasibaigia veikimo bandomąja chemine medžiaga metu arba jam pasibaigus, jei toks taikomas. Citokinezės blokatoriumi apdorotose kultūrose tai lengvai pasiekiama skaičiuojant tik dvibranduoles ląsteles. Jei nėra citokinezės blokatoriaus, svarbu įrodyti, kad analizuojamų ląstelių dalijimasis galimai įvyko atsižvelgiant į ląstelių populiacijos didėjimą veikimo bandomąja chemine medžiaga metu arba po jo. Pagal visus protokolus svarbu įrodyti, kad ląstelių proliferacija įvyko kontrolinėje ir apdorotoje kultūrose, o bandomosios cheminės medžiagos sukelto citotoksiškumo arba citostazės laipsnį reikėtų įvertinti visose kultūrose, kuriose skaičiuojami mikrobranduoliai. METODO APRAŠYMAS Ląstelės Galima naudoti pirminių žmogaus arba kitų žinduolių periferinio kraujo limfocitų kultūras (7) (20) (46) (47) ir įvairias graužikų ląstelių linijas, pvz., CHO, V79, CHL/IU ir L5178Y ląsteles, arba žmogaus ląstelių linijas, pvz., TK6, (19) (20) (21) (22) (23) (26) (27) (28) (29) (31) (33) (34) (35) (36) (žr. 6 pastraipą). Atliekant mikrobranduolių bandymus, buvo naudotos kitos ląstelių linijos, pvz., HT29 (48), Caco-2 (49), HepaRG (50) (51), HepG2 ląstelės (52) (53), A549 ir pirminės Sirijos žiurkėno embrioninės ląstelės (54), bet jų tinkamumas šiuo metu nėra plačiai patvirtintas. Todėl šių ląstelių linijų ir tipų naudojimą reikėtų pagrįsti, atsižvelgiant į jų įrodytas bandymo charakteristikas, kaip aprašyta Priimtinumo kriterijų skyriuje. Buvo paskelbta, kad CitoB gali daryti įtaką L5178Y ląstelių augimui, todėl jis nerekomenduojamas naudoti su šia ląstelių linija (23). Naudojant pirmines ląsteles, dėl gyvūnų gerovės priežasčių reikėtų atsižvelgti į galimybę naudoti, jei įmanoma, žmogiškos kilmės pirmines ląsteles, ir ėminius imti atsižvelgiant į žmonių etikos principus ir reglamentus. Žmogaus periferinio kraujo limfocitus reikėtų gauti iš jaunų (maždaug 18–35 metų amžiaus), nerūkančių žmonių, kurie nesirgtų ar nebūtų neseniai paveikti genotoksiniais agentais (pvz., cheminėmis medžiagomis, jonizuojančiąja spinduliuote), esant tokiems jų lygiams, kurie padidintų ląstelių su mikrobranduoliais foninį dažnumą. Tai užtikrintų, kad ląstelių su mikrobranduoliais foninis dažnumas būtų mažas ir pastovus. Ląstelių su mikrobranduoliais dažnumo atskaitos vertė didėja senstant ir ši tendencija labiau pasireiškia moterims nei vyrams (55). Jei naudojamos ląstelės paimamos daugiau kaip iš vieno donoro, turėtų būti nurodytas donorų skaičius. Būtina įrodyti, kad ląstelės dalijosi nuo ląstelių ėminio veikimo bandomąja chemine medžiaga pradžios. Ląstelių kultūros laikomos eksponentinio augimo fazėje (ląstelių linijos) arba stimuliuojamos dalytis (pirminės limfocitų kultūros), kad ląstelės būtų veikiamos skirtingose ląstelės ciklo stadijose, nes ląstelių stadijų jautris bandomosioms cheminėms medžiagoms gali būti nežinomas. Pirminės ląstelės, kurias reikia stimuliuoti mitogeniniais agentais, kad jos pradėtų dalytis, paprastai daugiau nesinchronizuojamos jas veikiant bandomąja chemine medžiaga (pvz., žmogaus limfocitai po 48 h mitogeninio stimuliavimo). Naudoti sinchronizuotas ląsteles veikimo bandomąja chemine medžiaga metu nerekomenduojama, bet gali būti priimtina, jei būtų pagrįsta. Terpės ir kultūros sąlygos Prižiūrimoms kultūroms reikėtų naudoti reikiamą kultūros terpę ir inkubavimo sąlygas (kultūros indus, drėkinamąją 5 % CO2 atmosferą, jei tinka, temperatūrą – 37 °C). Ląstelių linijos turėtų būti reguliariai tikrinamos, ar nesikeičia modalinis chromosomų skaičius ir nėra mikoplazmos užkrato, o užkrėstos arba pakitusio modalinio chromosomų skaičiaus ląstelės neturėtų būti naudojamos. Turėtų būti nustatyta bandymo laboratorijoje naudojamų ląstelių linijų ar pirminių kultūrų normalaus ląstelių ciklo trukmė ir ji turėtų atitikti paskelbtas ląstelių charakteristikas. Kultūrų paruošimas Ląstelių linijos: ląstelės yra dauginamos iš kamieninių kultūrų, sėjamos kultūros terpėje tokiu tankiu, kad ląstelės suspensijose ar monosluoksniuose visą laiką iki pat surinkimo laiko augtų eksponentiškai (pvz., reikėtų vengti monosluoksniuose augančių ląstelių susiliejimo). Limfocitai: viso kraujo ėminys, apdorotas antikoaguliantu (pvz., heparinu), ar iš to kraujo atskirti limfocitai auginami (pvz., žmogaus limfocitai – 48 h) esant mitogeno (pvz., žmogaus limfocitams – fitohemagliutinino (PHA)), kad ląstelės pradėtų dalytis prieš jas paveikiant bandomąja chemine medžiaga ir citoB. Metabolinis aktyvinimas Kai naudojamos nepakankamos endogeninės metabolinės gebos ląstelės, reikėtų naudoti egzogenines metabolinimo sistemas. Jei nebūtų pagrįsta kita sistema, dažniausiai kaip numatytoji rekomenduojama sistema yra kofaktoriumi papildyta pomitochondrinė frakcija (S9), ruošiama iš graužikų (paprastai žiurkių) kepenų, paveiktų fermentų aktyvumą skatinančiais agentais, pvz,. Aroclor 1254 (56) (57) ar fenobarbitalio ir b-naftoflavono deriniu (58) (59) (60). Pastarasis derinys neprieštarauja Stokholmo konvencijai dėl patvariųjų organinių teršalų (61) ir pasirodė esąs toks pat veiksmingas kaip Aroclor 1254 mišrių funkcijų oksidazėms skatinti (58) (59) (60) (28). S9 frakcija paprastai naudojama nuo 1 % iki 2 % (tūrio) koncentracijos, bet galutinio bandymo terpėje gali būti padidinta iki 10 % (tūrio). Paveikiant bandomąja chemine medžiaga reikėtų vengti naudoti produktus, kurie mažina mitozinį indeksą, ypač su kalciu kompleksus sudarančius produktus (62). Naudojamos egzogeninės metabolinio aktyvinimo sistemos ar metabolizmo skatinimo priemonės tipo ir koncentracijos pasirinkimui įtakos gali turėti naudojamų cheminių medžiagų klasė. Bandomosios cheminės medžiagos ruošimas Prieš apdorojant ląsteles, kietąsias chemines medžiagas reikėtų ištirpinti atitinkamuose tirpikliuose ir, jei reikia, praskiesti. Skystąsias chemines medžiagas galima dėti tiesiogiai į bandymo sistemą ir (arba) praskiesti prieš apdorojant bandymo sistemą. Dujos ar lakiosios bandomosios cheminės medžiagos turėtų būti bandomos atitinkamai pakeitus standartinius protokolus, pvz., apdorojimas sandariuose kultūros induose (63) (64) (65). Bandomųjų cheminių medžiagų preparatus reikėtų ruošti prieš pat apdorojimą, išskyrus atvejus, kai stabilumo duomenys rodo, kad juos galima laikyti. Bandymo sąlygos Tirpikliai Tirpiklį reikėtų pasirinkti taip, kad būtų optimizuotas bandomosios cheminės medžiagos tirpumas, bet nebūtų daroma neigiama įtaka tyrimo eigai, pvz., kistų ląstelių augimas, būtų paveiktas bandomosios cheminės medžiagos vientisumas, vyktų reakcija su kultūros indais, būtų pakenkta metabolinio aktyvinimo sistemai. Jei įmanoma, rekomenduojama naudoti vandeninį tirpiklį (ar kultūros terpę). Gerai ištirti tirpikliai yra vanduo ar dimetilsulfoksidas (DMSO). Paprastai organinių tirpiklių kiekis neturėtų būti didesnis kaip 1 % (tūrio). Jei citoB tirpinamas DMSO, cheminei medžiagai ir citoB tirpinti naudojamas organinio tirpiklio suminis kiekis neturėtų būti didesnis kaip 1 % (tūrio); priešingu atveju reikėtų naudoti neapdorotus kontrolinius ėminius, kad būtų galima įsitikinti, ar organinio tirpiklio procentinis kiekis nedaro neigiamo poveikio. Vandeninių tirpiklių (natrio chlorido tirpalo ar vandens) koncentracija galutinėje apdorojimo terpėje neturėtų būti didesnė kaip 10 % (tūrio). Jei naudojami tinkamai neištirti tirpikliai (pvz., etanolis ar acetonas), jų naudojimas turėtų būti pagrįstas duomenimis, kurie rodytų tirpiklio suderinamumą su bandomąja chemine medžiaga bei bandymo sistema ir genetinio toksiškumo nebuvimą, esant naudojamai koncentracijai. Jei tokių patvirtinančių duomenų nėra, svarbu įtraukti neapdorotus kontrolinius ėminius (žr. 1 priedėlį), taip pat tirpiklio kontrolinius ėminius, siekiant įrodyti, kad pasirinktas tirpiklis nėra žalingas ir nesukelia žalingo poveikio chromosomoms (pvz., aneuploidijos ar klastogeniškumo). CitoB kaip citokinezės blokatoriaus naudojimas Vienas iš svarbiausių aspektų atliekant MNvit bandymą – užtikrinti, kad skaičiuojamų ląstelių mitozė būtų baigta apdorojimo metu ar po jo. Todėl mikrobranduolių skaičiavimas turėtų apsiriboti ląstelėmis, kuriose mitozė įvyko apdorojimo metu ar po jo. CitoB yra medžiaga, kuri plačiausiai naudojama citokinezei blokuoti, nes slopina aktino susijungimą ir taip neleidžia dukterinėms ląstelėms atsiskirti po mitozės, dėl ko ima formuotis dvibranduolės ląstelės (6) (66) (67). Kai naudojamas citoB, kartu galima matuoti bandomosios cheminės medžiagos įtaką ląstelių proliferacijos kinetikai. CitoB reikėtų naudoti kaip citokinezės blokatorių, kai naudojami žmogaus limfocitai, nes ląstelių ciklo trukmė tarp donorų skirsis ir ne visi limfocitai reaguos į stimuliavimą PHA. CitoB nėra privalomas kitų tipų ląstelėms, jei būtų galima nustatyti, kad jos pasidalijo, kaip aprašyta 27 pastraipoje. Be to, citoB paprastai nenaudojamas, kai ėminių mikrobranduoliai įvertinami taikant tėkmės citometrinius metodus. Laboratorija turėtų nustatyti reikiamą citoB koncentraciją kiekvieno tipo ląstelėms, kad būtų gautas optimalus dvibranduolių ląstelių dažnumas tirpiklio kontrolinėse kultūrose ir būtų įrodyta, kad gaunama skaičiavimui tinkama dvibranduolių ląstelių išeiga. Tinkama citoB koncentracija paprastai yra 3–6 μg/ml. Ląstelių proliferacijos bei citotoksiškumo matavimas ir apdorojimo koncentracijos verčių parinkimas Nustatant didžiausią bandymui naudojamą bandomosios cheminės medžiagos koncentraciją reikėtų vengti koncentracijos, galinčios sukelti dirbtinį teigiamą atsaką, pvz., kuri sukeltų per didelį citotoksiškumą (žr. 29 pastraipą), nuosėdų kultūros terpėje (žr. 30 pastraipą) ar žymius pH arba osmolialumo pokyčius (žr. 9 pastraipą). Jei bandomosios cheminės medžiagos pridėjimo metu žymiai pakinta terpės pH vertė, ją būtų galima reguliuoti buferuojant galutinio apdorojimo terpę, kad būtų išvengta dirbtinių teigiamų rezultatų ir būtų užtikrintos tinkamos kultūros sąlygos. Ląstelių proliferacija matuojama siekiant įsitikinti, ar bandymo metu pakankamas paveiktų ląstelių skaičius pasiekė mitozę ir ar apdorojama esant reikiamam citotoksiškumo lygiui (žr. 29 pastraipą). Citotoksiškumą reikėtų nustatyti pagrindinio bandymo metu pagal atitinkamus ląstelių žūties ir augimo rodiklius, esant ir nesant metaboliniam aktyvinimui (žr. 26 ir 27 pastraipas). Nors citotoksiškumo įvertinimas atliekant pradinį parengiamąjį bandymą gali būti naudingas pagrindinio bandymo koncentracijos vertėms geriau apibrėžti, pradinis bandymas nėra privalomas. Jei jis būtų atliekamas, jis neturėtų pakeisti citotoksiškumo matavimo atliekant pagrindinį bandymą. Ląstelių apdorojimas citoB ir santykinio vienbranduolių, dvibranduolių ir daugiabranduolių ląstelių dažnumo kultūroje matavimas yra tikslus metodas kiekybiškai įvertinant poveikį ląstelių proliferacijai ir apdorojimo citotoksinį ar citostatinį aktyvumą (6) ir juo užtikrinama, kad per mikroskopą būtų skaičiuojamos tik apdorojimo metu ar po jo pasidalijusios ląstelės. Apdorojimo citotoksiniam ar citostatiniam aktyvumui įvertinti, lyginant apdorotų ir kontrolinių kultūrų vertes, rekomenduojamas citokinezės blokavimo proliferacijos indeksas (angl. cytokinesis-block proliferation index, CBPI)(6) (27) (68) arba replikacijos indeksas (angl. Replication Index, RI), imant ne mažiau kaip 500 ląstelių vienai kultūrai (dėl formulių žr. 2priedėlį). Kitų citotoksiškumo rodiklių (pvz., ląstelių vientisumo, apoptozės, nekrozės, metafazės ląstelių skaičiaus, ląstelės ciklo) vertinimas galėtų suteikti naudingos informacijos, bet jų nereikėtų naudoti vietoj CBPI ar RI. Atliekant tyrimus be citoB, būtina įrodyti, kad kultūros ląstelės dalijosi taip, kad didžioji skaičiuojamų ląstelių dalis pasidalijo veikimo bandomąja cheminė medžiaga metu arba po jo. Apdorojimo citotoksiniam ar citostatiniam aktyvumui įvertinti rekomenduojamas santykinio populiacijos padvigubėjimo (RPD) ar santykinio ląstelių skaičiaus padidėjimo (RICC) matavimas (17) (68) (69) (70) (71) (dėl formulių žr. 2priedėlį). Jei atliekamas ilgalaikis apdorojimas (t. y. 1,5–2,0 karto ilgesnis nei normalaus ląstelių ciklo trukmė, o surenkama praėjus laikui, dar 1,5–2,0 karto ilgesniam nei normalaus ląstelių ciklo trukmė, iš viso gaunant ėminių ėmimo trukmę 3–4 kartus ilgesnę nei normalaus ląstelių ciklo trukmė, kaip aprašyta 38 ir 39 pastraipose), taikant RPD gali būti gautas per mažas citotoksiškumo įvertis (71). Šiomis aplinkybėmis geresnis matas galėtų būti RICC arba naudingas įvertis galėtų būti ir RPD, citotoksiškumą įvertinant praėjus laikui, kuris būtų 1,5–2 karto ilgesnis nei normalaus ląstelių ciklo trukmė. Kitų citotoksiškumo ar citostazės rodiklių (pvz., ląstelių vientisumo, apoptozės, nekrozės, metafazės ląstelių skaičiaus, proliferacijos indekso (PI), ląstelės ciklo, nukleoplazmos tiltelių ar branduolų užuomazgų) vertinimas galėtų suteikti naudingos informacijos, bet jų nereikėtų naudoti vietoj RPD ar RICC. Reikėtų įvertinti ne mažiau kaip tris bandymo koncentracijos vertes (neįskaitant tirpiklio ir teigiamus kontrolinius ėminius), kurios atitinka priimtinumo kriterijus (reikiamas citotoksiškumas, ląstelių skaičius ir kt.). Neatsižvelgiant į ląstelių tipą (ląstelių linijos ar pirminės limfocitų kultūros), galima naudoti kiekvienos bandymo koncentracijos kartotines ar pavienes apdorotas kultūras. Nors patariama naudoti kartotines kultūras, pavienės kultūros taip pat priimtinos, jei vertinamas vienodas suminis pavienės ar kartotinės kultūros ląstelių skaičius. Naudoti pavienę kultūrą ypač tinka, kai vertinamos daugiau kaip 3 koncentracijos vertės (žr. 44–45 pastraipas). Nepriklausomoms kartotinėms kultūroms gauti tam tikros koncentracijos rezultatai gali būti subendrinti duomenų analizei (38). Jei bandomoji cheminė medžiaga rodo mažą citotoksiškumą arba jo visai nėra, paprastai tiktų maždaug nuo 2 iki 3 kartų besiskiriančios koncentracijos intervalai. Jei citotoksiškumas nustatomas, pasirinktos koncentracijos vertės turėtų aprėpti intervalą nuo koncentracijos, kuriai citotoksiškumas pasireiškia, kaip aprašyta 29 pastraipoje, įtraukiant koncentracijos vertes, kurioms gaunamas vidutinis citotoksiškumas ar jo visai nėra. Daugelio bandomųjų cheminių medžiagų koncentracijos atsako kreivės kyla staigiai, todėl norint gauti mažo arba vidutinio citotoksiškumo duomenis arba išsamiai ištirti dozės ir atsako santykį, būtina naudoti arčiau išdėstytas ir (arba) daugiau kaip tris koncentracijos vertes (pavienių ar kartotinių kultūrų), ypač tomis aplinkybėmis, kai reikia atlikti kartotinį bandymą (žr. 60 pastraipą). Jei maksimali koncentracija pagrįsta citotoksiškumu, didžiausiai koncentracijai reikėtų pasiekti 55 ± 5 % citotoksiškumą, taikant rekomenduotus citotoksiškumo parametrus (t. y. ląstelių linijų RICC bei RPD sumažėjimą, kai citoB nenaudojamas, ir CBPI ar RI sumažėjimą iki 45 ± 5 % vienalaikio neigiamo kontrolinio ėminio, kai citoB yra naudojamas) (72). Reikėtų atsargiai aiškinti teigiamus rezultatus, kurie būtų gauti tik viršutiniam šio 55 ± 5 % citotoksiškumo intervalo galui (71). Jei mažai tirpios bandomosios cheminės medžiagos nėra citotoksiškos, kai koncentracija yra mažesnė nei mažiausia netirpumo koncentracija, veikimo bandomąja chemine medžiaga pabaigoje, esant didžiausiai analizuojamai koncentracijai, turėtų atsirasti drumstumas arba nuosėdos, matomos plika akimi arba per inversinį mikroskopą. Netgi jei citotoksiškumas pasireiškia, kai koncentracija yra didesnė nei mažiausia netirpumo koncentracija, patartina bandyti tik esant vienai drumstumą ar matomas nuosėdas sukeliančiai koncentracijai, nes nuosėdos gali daryti dirbtinį poveikį. Esant koncentracijai, kurioje susidaro nuosėdos, reikėtų imtis priemonių užtikrinti, kad nuosėdos netrukdytų atlikti bandymą (pvz., dažymą ar įvertinimą). Gali padėti tirpumo nustatymas kultūros terpėje prieš atliekant bandymą. Jei nuosėdų ar ribinio citotoksiškumo nestebima, didžiausia bandymo koncentracija turėtų atitikti 10 mmol/l, 2 mg/ml ar 2 μl/ml, pasirenkant mažiausią (73) (74) (75). Jei bandomoji cheminė medžiaga yra neapibrėžtos sudėties, pvz., nežinomos ar kintamos sudėties medžiaga, sudėtingųjų reakcijų produktai ar biologinės medžiagos (UVCB) (76), iš aplinkos ekstrahuojamas ėminys ir kt., nesant pakankamam citotoksiškumui, gali prireikti didesnės didžiausios koncentracijos (pvz., 5 mg/ml), kad būtų didesnė kiekvieno iš komponentų koncentracija. Reikėtų pažymėti, kad žmonėms skirtiems vaistiniams preparatams šie reikalavimai gali skirtis (93). Kontroliniai ėminiai Kiekvieną kartą surenkant kultūrą, reikėtų įtraukti vienalaikius neigiamus kontrolinius ėminius (žr. 21 pastraipą), sudarytus vien tik iš tirpiklio apdorojimo terpėje ir apdorotus taip pat, kaip apdorojamos kultūros. Vienalaikiai teigiami kontroliniai ėminiai yra būtini siekiant įrodyti laboratorijos gebėjimą naudojamo bandymų protokolo sąlygomis identifikuoti klastogenus bei aneugenus ir egzogeninės metabolinio aktyvinimo sistemos efektyvumą (jei taikoma). Teigiamų kontrolinių ėminių pavyzdžiai pateikiami toliau 1 lentelėje. Galima naudoti alternatyvias teigiamas kontrolines chemines medžiagas, jei tai būtų pagrįsta. Šiuo metu nežinoma jokių aneugenų, kurių genotoksiniam aktyvumui būtinas metabolinis aktyvinimas (17). Kadangi genetinio toksiškumo žinduolių ląstelėms bandymai in vitro yra pakankamai standartizuoti, esant trumplaikiam apdorojimui, atliekamam vienu metu su metaboliniu aktyvinimu ar be jo, naudojant vienodą apdorojimo trukmę, teigiamų kontrolinių ėminių naudojimas gali apsiriboti klastogenu, kuriam būtinas metabolinis aktyvinimas. Šiuo atveju vieno klastogeninio teigiamo kontrolinio ėminio atsakas įrodys metabolinio aktyvinimo sistemos aktyvumą ir bandymo sistemos jautrį. Tačiau ilgalaikiam apdorojimui (be S9) reikėtų turėti savo teigiamą kontrolinį ėminį, nes apdorojimo trukmė skirsis nuo metabolinį aktyvinimą naudojančio bandymo trukmės. Jei atliekant trumpalaikį apdorojimą su metaboliniu aktyvinimu ar be jo, kaip vienas teigiamas kontrolinis ėminys pasirenkamas klastogenas, tai atliekant ilgalaikį apdorojimą be metabolinio aktyvinimo reikėtų pasirinkti aneugeną. Reikėtų naudoti teigiamus kontrolinius ėminius su klastogenu ir aneugenu, jei ląstelės yra metaboliškai pajėgios ir joms nereikia S9. Kiekvienas teigiamas kontrolinis ėminys turėtų būti naudojamas vienos arba kelių koncentracijos verčių, kurioms esant būtų galima tikėtis gauti atkuriamą ir aptinkamą didesnį nei fonas atsaką, kad būtų galima įrodyti bandymo sistemos jautrį (t. y. poveikis yra aiškus, bet tyrėjui ne iš karto atskleidžiama užkoduotų objektinių stiklelių tapatybė), ir atsako neturėtų sutrikdyti citotoksiškumas, kuris viršytų šiam bandymo metodui nustatytas ribas. 1 lentelė Etaloninės cheminės medžiagos, rekomenduojamos laboratorijos kvalifikacijai vertinti ir teigiamiems kontroliniams ėminiams pasirinkti
PROCEDŪRA Apdorojimo planas Siekiant padidinti tikimybę aptikti aneugeną ar klastogeną, veikiantį tam tikroje ląstelės ciklo stadijoje, svarbu, kad bandomąja chemine medžiaga būtų apdorotas pakankamas skaičius ląstelių, reprezentuojančių visas įvairias ląstelių ciklo stadijas. Kiekvienas apdorojimas turėtų prasidėti ir baigtis ląstelėms augant eksponentiškai ir ląstelės turėtų augti iki ėminio ėmimo pradžios. Todėl ląstelių linijų ir pirminių ląstelių kultūrų apdorojimo planas gali kažkiek skirtis nuo taikomo limfocitams, kurių ląstelių ciklui pradėti būtinas mitogeninis stimuliavimas (17). Jei tai limfocitai, veiksmingiausias metodas yra pradėti veikti bandomąja chemine medžiaga praėjus 44–48 h nuo stimuliavimo PHA, kai ląstelės toliau dalysis nesinchroniškai (6). Paskelbti duomenys (19) rodo, kad dauguma aneugenų ir klastogenų bus aptikti per trumpą 3–6 h apdorojimo laikotarpį esant ir nesant S9, vėliau bandomoji cheminė medžiaga pašalinama ir ėminiai imami nuo apdorojimo pradžios praėjus laikui, kuris būtų maždaug 1,5–2,0 kartus ilgesnis nei normalaus ląstelių ciklo trukmė (7). Tačiau siekiant atlikti išsamų įvertinimą, kurio prireiktų neigiamam rezultatui patvirtinti, visos šios trys Bandymo sąlygos turėtų būti įgyvendintos, taikant trumpalaikį apdorojimą su metaboliniu aktyvinimu ir be jo bei ilgalaikį apdorojimą be metabolinio aktyvinimo (žr. 56, 57 ir 58 pastraipas):
Jei esant kuriai nors vienai iš pirmiau nurodytų bandymo sąlygų gaunamas teigiamas atsakas, gali būti nebūtina tirti kurią nors kitą apdorojimo schemą. Jei žinoma ar yra įtarimų, kad bandomoji cheminė medžiaga daro įtaką ląstelių ciklo trukmei (pvz., kai bandomi nukleozidų analogai), ypač p53 kompetentinėms ląstelėms (35) (36) (77), papildomas ėminių ėmimo arba regeneravimo laikas galėtų būti dar 1,5–2,0 kartus ilgesnis nei normalaus ląstelių ciklo trukmė (t. y. laikas nuo trumpalaikio ir ilgalaikio apdorojimo pradžios iš viso būtų 3,0–4,0 kartus ilgesnis nei ląstelių ciklo trukmė). Šios pasirinktys skirtos situacijoms, kai gali kilti susirūpinimas dėl galimos bandomosios cheminės medžiagos ir citoB sąveikos. Jei taikoma ilgesnė ėminių ėmimo trukmė (t. y. laikas iš viso būtų 3,0–4,0 kartus ilgesnis nei kultūros ląstelių ciklo trukmė), reikėtų imtis priemonių užtikrinti, kad vis dar vyktų aktyvus ląstelių dalijimasis. Pvz., limfocitų eksponentinis augimas gali pradėti mažėti praėjus 96 h nuo stimuliavimo ir vienasluoksnės ląstelių kultūros gali susilieti. Siūlomi ląstelių apdorojimo planai pateikti 2 lentelėje. Šie bendrieji apdorojimo planai gali būti keičiami (ir turėtų būti pagrįsti), atsižvelgiant į bandomosios cheminės medžiagos stabilumą ar reaktyvumą ar tam tikras naudojamų ląstelių augimo charakteristikas. 2 lentelė MNvit tyrimo ląstelių apdorojimo ir surinkimo trukmė
Vienasluoksnių kultūrų 3–6 h trukmės apdorojimo pabaigoje gali būti mitozinių ląstelių (atpažįstamų iš apvalios formos ir atsiskyrimo nuo paviršiaus). Kadangi šios mitozinės ląstelės lengvai atsiskiria, jos gali būti prarastos šalinant terpę su bandomąja chemine medžiaga. Jei yra įrodymų dėl esminio mitozinių ląstelių skaičiaus padidėjimo palyginti su kontroliniais ėminiais, rodančio galimą ląstelių susilaikymą mitozės metu, jas reikėtų surinkti centrifugavimu ir surinkimo metu grąžinti į kultūrą, kad nebūtų prarastos mitozės ląstelės, kurioms kyla mikrobranduolių susidarymo ar chromosomų aberacijos rizika. Ląstelių surinkimas ir preparatų ant objektinių stiklelių paruošimas Kiekviena kultūra turėtų būti surenkama ir apdorojama atskirai. Ruošiamos ląstelės gali būti apdorojamos hipotoniniu tirpalu, tačiau šis veiksmas nebūtinas, jei ląsteles galima tinkamai paskleisti kitu būdu. Objektinius stiklelius galima paruošti įvairiais būdais, jei skaičiavimui gaunami aukštos kokybės ląstelių preparatai. Ląstelės su nepaliesta ląstelių membrana ir citoplazma turėtų būti išsaugotos, kad būtų galima aptikti mikrobranduolius ir citokinezės blokavimo metodu patikimai nustatyti dvibranduoles ląsteles. Preparatai ant objektinio stiklelio gali būti dažomi įvairiais metodais, pvz., Giemsa arba DNR specifiniais dažikliais. Naudojant tinkamus fluorescencinius dažus (pvz., akridino oranžinį (78) ar Hoechst 33258 ir pironiną Y (79)), galima pašalinti kai kuriuos artefaktus, susijusius su DNR nespecifinių dažų naudojimu. Mikrobranduolių turiniui nustatyti gali būti naudojami antikinetochoro antikūnai FISH analizė ir pancentromeriniai DNR zondai arba in situ ženklinimas pancentromerų specifiniais užpildais kartu su atitinkamu DNR priešpriešiniu dažymu (nusidažo sveika chromosoma, bet ne acentriniai chromosomų fragmentai), jei domina informacija apie mikrobranduolių susidarymo mechanizmą (16) (17). Gali būti taikomi kiti metodai klastogenams ir aneugenams atskirti, jei jie pasirodytų efektyvūs ir būtų patvirtintas jų tinkamumas. Pvz., tam tikrų ląstelių linijų hipodiploidinių ląstelių branduolių kaip hipodiploidinių reiškinių matavimas taikant, pvz., vaizdo analizės, lazerinės skenuojančios citometrijos ar tėkmės citometrijos metodus, taip pat galėtų suteikti naudingos informacijos (80) (81) (82). Morfologiniai branduolių stebėjimai taip pat galėtų rodyti galimą aneuploidiją. Be to, metafazės chromosomų aberacijų bandymas, pageidautina to paties ląstelių tipo ir taikant palyginamojo jautrio protokolą, taip pat galėtų būti patogus būdas nustatyti, ar mikrobranduoliai susidaro dėl chromosomų trūkimo (žinant, kad chromosomų praradimas nebūtų aptiktas atliekant chromosomų aberacijų bandymą). Analizė Prieš atliekant mikrobranduolių dažnumo mikroskopinę analizę, visi objektiniai stikleliai turėtų būti nepriklausomai užkoduoti, įskaitant tirpiklio, neapdorotų ėminių (jei naudojami) ir teigiamų kontrolinių ėminių stiklelius. Reikėtų taikyti atitinkamus metodus, kad būtų galima kontroliuoti sistemingąsias paklaidas ar poslinkį, kai naudojamos automatizuotos skaičiavimo sistemos, pvz., tėkmės citometrijos, lazerinės skenuojančios citometrijos ar vaizdo analizės sistemos. Neatsižvelgiant į mikrobranduoliams skaičiuoti naudojamą automatizuotą sistemą, tuo pačiu metu reikėtų įvertinti CBPI, RI, RPD ar RICC. CitoB apdorotose kultūrose mikrobranduolių dažnumą reikėtų analizuoti bent 2 000 dvibranduolių ląstelių kiekvienai koncentracijai ir kontroliniam ėminiui (83), vienodai padalytų tarp kartotinių ėminių, jei jie naudojami Jei dozei naudojama po vieną kultūrą (žr. 28 pastraipą), reikėtų suskaičiuoti ne mažiau kaip 2 000 dvibranduolių šios pavienės kultūros ląstelių (83). Jei vienai (kartotinių kultūrų) kultūrai būtų suskaičiuota gerokai mažiau kaip po 1 000 dvibranduolių ląstelių arba mažiau kaip 2 000 ląstelių (pavienei kultūrai), o reikšmingo mikrobranduolių skaičiaus padidėjimo nebūtų aptikta, bandymą reikėtų pakartoti naudojant daugiau ląstelių arba mažiau citotoksinę koncentraciją, jei tai būtų tinkamiau. Reikia imtis atsargumo priemonių, kad nebūtų skaičiuojamos netaisyklingos formos arba labai nevienodo dydžio branduolių dvibranduolės ląstelės. Be to, dvibranduolių ląstelių nereikia painioti su blogai pasklidusiomis daugiabranduolėmis ląstelėmis. Ląstelės, kuriose yra daugiau kaip du pagrindiniai branduoliai, neturi būti analizuojamos dėl mikrobranduolių, nes šių ląstelių mikrobranduolių dažnumo atskaitos vertė gali būti didesnė (84). Skaičiuoti vienbranduoles ląsteles galima, jei yra įrodyta, kad bandomoji cheminė medžiaga veikia citoB aktyvumą. Tokiais atvejais galėtų būti naudingas kartotinis bandymas be citoB. Be dvibranduolių ląstelių skaičiaus naudingos informacijos galėtų suteikti vienbranduolių ląstelių skaičius (85) (86), bet jis nėra privalomas. CitoB neapdorotų ląstelių linijų mikrobranduolių dažnumą reikėtų analizuoti bent 2 000 ląstelių kiekvienai koncentracijai ir kontroliniam ėminiui (83), vienodai padalytų tarp kartotinių ėminių, jei jie naudojami. Jei koncentracijai naudojama po vieną kultūrą (žr. 28 pastraipą), reikėtų suskaičiuoti ne mažiau kaip 2 000 šios pavienės kultūros ląstelių (83). Jei kiekvienos koncentracijos vienai (kartotinių kultūrų) kultūrai būtų suskaičiuota gerokai mažiau kaip po 1 000 ląstelių arba mažiau kaip 2 000 ląstelių (pavienei kultūrai), o reikšmingo mikrobranduolių skaičiaus padidėjimo nebūtų aptikta, bandymą reikėtų pakartoti naudojant daugiau ląstelių arba mažiau citotoksinę koncentraciją, jei tai būtų tinkamiau. Kai naudojamas citoB, reikėtų nustatyti CBPI arba RI ląstelių proliferacijai įvertinti (žr. 2 priedėlį), naudojant ne mažiau kaip 500 ląstelių vienai kultūrai. Jei apdorojama nesant citoB, svarbu pateikti įrodymą, kad kultūros ląstelės dalijosi, kaip aptarta 24–28 skirsniuose. Laboratorijos kvalifikacija Siekdama įgyti pakankamos bandymo atlikimo patirties prieš jį taikydama įprastiniams tyrimams, laboratorija turėtų būti atlikusi etaloninių teigiamų cheminių medžiagų bandymų seriją, joms veikiant pagal skirtingus mechanizmus (bent vieną su metaboliniu aktyvinimu, vieną – be jo ir vieną, kuri veiktų pagal aneugeninį mechanizmą, medžiagas pasirenkant iš 1 lentelės sąrašo) su įvairiais neigiamais kontroliniais ėminiais (įskaitant neapdorotas kultūras ir įvairius tirpiklius ar nešiklį). Šių teigiamų ir neigiamų kontrolinių ėminių atsakas turėtų atitikti literatūros duomenis. Tai netaikoma patirties turinčioms laboratorijoms, t. y. kurios turi istorinių duomenų bazę, prieinamą kaip apibrėžta 49–52 pastraipose. Teigiamų kontrolinių cheminių medžiagų rinkinį (žr. 1 lentelę) reikėtų tirti atliekant trumpalaikį ir ilgalaikį apdorojimą be metabolinio aktyvinimo, taip pat trumpalaikį apdorojimą esant metaboliniam aktyvinimui, kad būtų galima įrodyti kvalifikaciją aptikti klastogenines ir aneugenines chemines medžiagas, nustatyti metabolinio aktyvinimo sistemos efektyvumą ir įrodyti skaičiavimo procedūrų (vizualios mikroskopinės analizės, tėkmės citometrijos, lazerinės skenuojančios citometrijos ar vaizdo analizės) tinkamumą. Pasirinktų cheminių medžiagų koncentracijos verčių intervalas turėtų būti pasirinktas taip, kad, siekiant įrodyti bandymo sistemos jautrį ir dinaminį diapazoną, būtų gautas atkuriamas ir su koncentracija susijęs padidėjimas palyginti su fonu. Istorinių kontrolinių ėminių duomenys Laboratorija turėtų nustatyti:
Pirmą kartą gaunant duomenis, skirtus istorinių neigiamų kontrolinių ėminių pasiskirstymui, vienalaikiai neigiami kontroliniai ėminiai turėtų atitikti paskelbtus kontrolinius duomenis, jei jie yra. Kontrolinių ėminių pasiskirstymą papildant vis didesniu bandymų duomenų kiekiu, būtų gerai, kad vienalaikiai neigiami kontroliniai ėminiai patektų į to skirstinio 95 % kontrolines ribas (87) (88). Laboratorijos istorinių neigiamų kontrolinių ėminių duomenų bazę iš pradžių turėtų sudaryti ne mažiau kaip 10 bandymų, bet būtų geriau, jei tokių palyginamosiomis Bandymo sąlygomis atliktų bandymų skaičius būtų ne mažesnis kaip 20. Laboratorijos turėtų taikyti kokybės kontrolės metodus, tokius kaip kontrolinės diagramos (pvz., C tipo ar X juostinės diagramos (88)), kad galėtų nustatyti savo teigiamų ir neigiamų kontrolinių ėminių duomenų kintamumą ir įrodyti metodikos „valdomumą“ savo laboratorijoje (83). Papildomas rekomendacijas, kaip kurti ir naudoti istorinius duomenis (t. y. duomenų įtraukimo ir pašalinimo iš istorinių duomenų kriterijus ir tam tikro bandymo priimtinumo kriterijus) galima rasti literatūroje (87). Į visus bandymų protokolo pakeitimus reikėtų žiūrėti atsižvelgiant į duomenų suderinamumą su esamomis laboratorijos istorinių kontrolinių ėminių duomenų bazėmis. Esant didesnėms neatitiktims turėtų būti kuriama nauja istorinių kontrolinių ėminių duomenų bazė. Neigiamų kontrolinių ėminių duomenis turėtų sudaryti pavienės kultūros ląstelių mikrobranduolių dažnumo skaičius arba kartotinių kultūrų skaičių suma, kaip aprašyta 28 pastraipoje. Būtų gerai, kad vienalaikiai neigiami kontroliniai ėminiai patektų į laboratorijos istorinių neigiamų kontrolinių ėminių duomenų bazės skirstinio 95 % kontrolines ribas (87) (88). Jei vienalaikių neigiamų kontrolinių ėminių duomenys nepatenka į 95 % kontrolines ribas, jie gali būti tinkami įtraukti į istorinių kontrolinių ėminių skirstinį, jei nėra kraštiniai riktai ir yra įrodymų, kad bandymo sistema „valdoma“ (žr. 50 pastraipą) ir kad nėra techninių ar žmogaus klaidų. DUOMENYS IR ATASKAITOS RENGIMAS Rezultatų pateikimas Jei taikomas citokinezės blokavimo metodas, vertinant mikrobranduolių indukciją naudojamas tik dvibranduolių ląstelių su mikrobranduoliais (nepriklausomai nuo mikrobranduolių skaičiaus ląstelėje) dažnumas. Naudingos informacijos galėtų suteikti ląstelių su vienu, dviem ar keliais mikrobranduoliais skaičiai ir jų pateikimas atskirai ataskaitoje, bet tai neprivaloma. Turėtų būti nustatyti visų apdorotų, neigiamų ir teigiamų kontrolinių ėminių citotoksiškumo ir (arba) citostazės vienalaikių matavimų duomenys (16). Visų apdorotų ir kontrolinių kultūrų CBPI arba RI turi būti apskaičiuoti kaip ląstelių ciklo delsos matavimų duomenys, kai taikomas citokinezės blokavimo metodas. Jei apdorojama be citoB, reikėtų taikyti RPD arba RICC ar PI (žr. 2 priedėlį). Turėtų būti pateikti atskiri kiekvienos kultūros duomenys. Be to, visi duomenys turi būti suvesti į lenteles. Priimtinumo kriterijai Bandymo priimtinumas pagrįstas šiais kriterijais:
Rezultatų įvertinimas ir aiškinimas Kai įvykdyti visi priimtinumo kriterijai, bandomoji cheminė medžiaga laikoma aiškiai teigiama, jei esant kuriai nors ištirtai bandymo sąlygai (žr. 36–39 pastraipas):
Kai įvykdyti visi šie kriterijai, laikoma, kad bandomoji cheminė medžiaga gali sukelti šios bandymų sistemos chromosomų trūkius ir (arba) skaičiaus padidėjimą ar sumažėjimą. Rekomendacijų dėl tinkamiausių statistinių metodų taip pat galima rasti literatūroje (90) (91) (92). Kai įvykdyti visi priimtinumo kriterijai, bandomoji cheminė medžiaga laikoma aiškiai neigiama, jei visomis ištirtomis bandymo sąlygomis (žr. 36–39 pastraipas):
Laikoma, kad ši bandomoji cheminė medžiaga negali sukelti šios bandymų sistemos chromosomų trūkių ir (arba) skaičiaus padidėjimo ar sumažėjimo. Rekomendacijų dėl tinkamiausių statistinių metodų taip pat galima rasti literatūroje (90) (91) (92). Nėra reikalavimo patikrinti aiškų teigiamą ar neigiamą atsaką. Jei atsakas nėra aiškiai neigiamas ar aiškiai teigiamas, kaip apibūdinta pirmiau, ir (arba) siekiant padėti nustatyti rezultato biologinę svarbą, duomenys turėtų būti įvertinti pateikiant ekspertų nuomonę ir (arba) atliekant papildomus tyrimus. Galėtų būti naudingas papildomų ląstelių skaičiavimas (jei tinka) arba kartotinis bandymas galbūt modifikuotomis bandymo sąlygomis (pvz., tarpai tarp koncentracijos verčių, kitos metabolinio aktyvinimo sąlygos (t. y. S9 koncentracija ar S9 kilmė)). Retais atvejais, netgi atlikus papildomus tyrimus, gautų duomenų rinkinio nepakaks padaryti išvadą, ar rezultatai teigiami ar neigiami, todėl bus priimtas sprendimas, kad atsakas yra dviprasmis. Bandomosios cheminės medžiagos, kurios atliekant MNvit bandymą indukuoja mikrobranduolius, tai gali daryti todėl, kad sukelia chromosomų trūkimą, netekimą arba abiejų veiksnių derinį. Siekiant nustatyti, ar mikrobranduolių indukcijos mechanizmas yra klastogeninio ir (arba) aneugeninio aktyvumo rezultatas, gali būti atliekama papildoma analizė naudojant antikinetochoro antikūnus, centromeroms skirtus in situ zondus ar taikant kitus metodus. Bandymo ataskaita Į bandymo ataskaitą turėtų būti įtraukta ši informacija:
LITERATŪRA
1 priedėlis APIBRĖŽTYS Aneugenas – cheminė medžiaga ar procesas, kuris dėl sąveikos su mitozinio ir mejozinio ląstelių dalijimosi ciklo komponentais sukelia aneuploidiją ląstelėse ar organizmuose. Aneuploidija – vienos arba daugiau kaip vienos chromosomų, bet ne viso (-ų) jų rinkinio (-ų) (poliploidija) nukrypimas nuo normalaus diploidinio (arba haploidinio) chromosomų skaičiaus. Apoptozė – užprogramuota ląstelių žūtis, kuriai būdinga serija etapų, per kuriuos ląstelės suyra į membrana apsuptas daleles, kurios vėliau pašalinamos fagocitoze arba numetimo būdu. Ląstelių proliferacija – ląstelių skaičiaus didėjimas dėl mitozinio jų dalijimosi. Centromera – chromosomos regionas, su kuriuo ląstelės dalijimosi metu asocijuojasi verpstės siūlai ir dėl to dukterinės chromosomos tvarkingai išsidėsto dukterinių ląstelių poliuose. Cheminė medžiaga – medžiaga arba mišinys. Koncentracijos vertės – taikoma bandomosios cheminės medžiagos koncentracijos kultūros terpėje galutinėms vertėms. Klastogenas – сheminė medžiaga, kuri sukelia ląstelių arba eukariotinių organizmų populiacijų struktūrines chromosomų aberacijas. Citokinezė – ląstelių dalijimosi procesas iškart po mitozės, kai susidaro dvi dukterinės ląstelės, turinčios po vieną branduolį. Citokinezės blokavimo proliferacijos indeksas (CBPI) – apdorotos populiacijos ląstelių po antrojo pasidalijimo dalis palyginti su neapdorotu kontroliniu ėminiu (formulė pateikta 2 priedėlyje). Citostazė – ląstelių augimo slopinimas (formulė pateikta 2 priedėlyje). Citotoksiškumas – jei šio bandymo metodo tyrimai atliekami esant citochalazinui B, citotoksiškumas nustatomas kaip apdorotų ląstelių citokinezės blokavimo proliferacijos indekso (CBPI) ar replikacijos indekso (RI) sumažėjimas palyginti su neigiamu kontroliniu ėminiu (žr. 26 pastraipą ir 2 priedėlį). Jei šio bandymo metodo tyrimai atliekami be citochalazino B, citotoksiškumas nustatomas kaip apdorotų ląstelių santykinio populiacijos padvigubėjimo (RPD) sumažėjimas ar santykinis ląstelių skaičiaus padidėjimas (RICC) palyginti su neigiamu kontroliniu ėminiu (žr. 27 pastraipą ir 2 priedėlį). Genotoksinis – bendrasis terminas, kuriuo išreiškiamas visų tipų DNR arba chromosomų pažeidimas, įskaitant trūkius, delecijas, aduktus, nukleotidų modifikacijas ir ryšius, pergrupavimus, genų mutacijas, chromosomų aberacijas ir aneuploidiją. Ne visų tipų genotoksiniai poveikiai sukelia mutacijas ar pastovų chromosomų pažeidimą. Interfazinės ląstelės – ląstelės, kurios nėra mitozės stadijoje. Kinetochoras – baltyminė struktūra, susidaranti chromosomos centromeroje, prie kurios dalijantis ląstelėms jungiasi verpstės siūlai ir dėl to dukterinės chromosomos tvarkingai išsidėsto dukterinių ląstelių poliuose. Mikrobranduoliai – nuo ląstelių pagrindinių branduolių atskirti papildomi maži branduoliai, susidarę mitozės ar mejozės telofazėje, kai chromosomų fragmentai ar ištisos chromosomos lėtai juda ląstelės polių link. Mitozė – ląstelės branduolio dalijimasis, paprastai į profazę, prometafazę, metafazę, anafazę ir telofazę. Mitozinis indeksas – metafazės ląstelių skaičiaus ir ląstelių populiacijos stebimų ląstelių suminio skaičiaus dalmuo, kuris rodo tos ląstelių populiacijos proliferacijos laipsnį. Mutageninis – sukeliantis paveldimą DNR bazinės poros sekos (-ų) pokytį genuose arba chromosomų struktūroje (chromosomų aberacijas). Neatsijungimas – porinių chromatidžių nesugebėjimas atsijungti ir tinkamai atsiskirti į besivystančias dukterines ląsteles, todėl pastarosiose susidaro nenormalus chromosomų skaičius. p53 būsena – p53 baltymo dalyvavimas reguliuojant ląstelių ciklą, apoptozę ir DNR atkūrimą. Ląstelės, kurioms trūksta funkcinio p53 baltymo ir negali sustabdyti ląstelių ciklo arba pašalinti pažeistas ląsteles per apoptozę arba kitais mechanizmais (pvz., DNR atkūrimo skatinimą), susijusiais su p53 funkcijomis atsakant į DNR pažaidą, teoriškai turėtų būti labiau linkusios genų mutacijai ar chromosomų aberacijoms. Poliploidija – chromosomų skaičiaus aberacijos ląstelėse arba organizmuose, apimančios visą (-us) chromosomų rinkinį (-us), skirtingai nei atskiros chromosomos ar chromosomų (aneuploidija). Proliferacijos indeksas (PI) – citotoksiškumo matavimo metodas, kai citoB nenaudojamas (formulė pateikta 2 priedėlyje). Santykinis ląstelių skaičiaus padidėjimas (RICC) – citotoksiškumo matavimo metodas, kai citoB nenaudojamas (formulė pateikta 2 priedėlyje). Santykinis populiacijos padvigubėjimas (RPD) – citotoksiškumo matavimo metodas, kai citoB nenaudojamas (formulė pateikta 2 priedėlyje). Replikacijos indeksas (RI) – apdorotos kultūros ląstelių pasibaigusių dalijimosi ciklų skaičiaus santykis su neapdorotos kontrolinės kultūros ląstelių skaičiumi veikimo ir regeneravimo laikotarpiu (formulė pateikta 2 priedėlyje). S9 kepenų frakcija – skystis virš kepenų homogenato, gautas po centrifugavimo esant 9 000 g, t. y. žalių kepenų ekstraktas. S9 mišinys – S9 kepenų frakcijos ir fermentų metaboliniam aktyvumui būtinų kofaktorių mišinys. Tirpiklio kontrolinis ėminys – bendrasis terminas, apibūdinantis kontrolines kultūras, į kurias dedama vien tik tirpiklio, naudoto bandomajai cheminei medžiagai ištirpinti. Bandomoji cheminė medžiaga – taikant šį metodą bandoma medžiaga arba mišinys. Neapdorotas kontrolinis ėminys – kultūros, kurios neapdorojamos (t. y. nededama bandomosios cheminės medžiagos ar tirpiklio), bet yra tiriamos vienu metu su kultūromis, į kurias dedama bandomoji cheminė medžiaga. 2 priedėlis CITOTOKSIŠKUMO VERTINIMO FORMULĖS Kai naudojamas citoB , citotoksiškumo įvertinimas turėtų būti pagrįstas citokinezės blokavimo proliferacijos indeksu (CBPI) ar replikacijos indeksu (RI) (17) (69). CBPI rodo vidutinį ląstelės branduolių skaičių ir gali būti naudojamas ląstelių proliferacijai skaičiuoti. RI rodo apdorotų kultūrų santykinį ląstelių ciklų skaičių vienai ląstelei citoB veikimo laikotarpiu palyginti su kontrolinėmis kultūromis ir gali būti naudojamas citostazės % skaičiuoti: % citostazės = 100 – 100{(CBPIT – 1) ÷ (CBPIC – 1)}, kai:
čia:
Taigi, CBPI lygus 1 (visos ląstelės yra vienbranduolės) atitinka 100 % citostazę. Citostazė = 100 – RI,
Taigi, RI = 53 % reiškia, kad, palyginti su kontrolinės kultūros ląstelių, kurios pasidalijo sudarydamos dvibranduoles ir daugiabranduoles ląsteles, skaičiumi, apdorotos kultūros pasidalijusių ląstelių skaičius yra tik 53 %, t. y. 47 % citostazė. Kai citoB nenaudojamas , rekomenduojamas citotoksiškumo įvertinimas, pagrįstas santykiniu ląstelių skaičiaus padidėjimu (RICC) arba santykiniu populiacijos padvigubėjimu (RPD) (69), nes abiem atvejais atsižvelgiama į pasidalijusią ląstelių populiacijos dalį.
čia: Populiacijos padvigubėjimas = [log (ląstelių skaičius po apdorojimo ÷ pradinis ląstelių skaičius)] ÷ log 2 Taigi 53 % RICC ar RPD rodo 47 % citotoksiškumą ar citostazę. Naudojant proliferacijos indeksą (PI), citotoksiškumą galima įvertinti skaičiuojant skaičių klonų, sudarytų iš 1 ląstelės (cl1), 2 ląstelių (cl2), 3–4 ląstelių (cl4) ir 5–8 ląstelių (cl8).
PI vartojamas kaip vertingas ir patikimas citotoksiškumo parametras be citoB auginamoms in vitro ląstelių linijoms (35) (36) (37) (38) ir į jį galima žiūrėti kaip į naudingą papildomą parametrą. Visais atvejais apdorotų ir neigiamų kontrolinių ėminių kultūrų ląstelių skaičius prieš apdorojimą turėtų būti vienodas. Nors praeityje kaip citotoksiškumo parametras buvo naudojamas RCC (t. y. apdorotų kultūrų ląstelių skaičius/kontrolinių kultūrų ląstelių skaičius), jis daugiau nerekomenduojamas, nes gali būti gautas per mažas citotoksiškumo įvertis. Kai naudojamos automatizuotos skaičiavimo sistemos, pvz., tėkmės citometrija, lazerinė skenuojanti citometrija ar vaizdo analizė, ląstelių skaičių formulėje galima pakeisti branduolių skaičiumi. Neigiamų kontrolinių kultūrų populiacijos padvigubėjimas ar replikacijos indeksas turėtų būti suderinamas su reikalavimų imti ląstelių ėminius nuo apdorojimo praėjus laikui, kuris būtų maždaug 1,5–2,0 kartus ilgesnis nei normalaus ląstelių ciklo trukmė. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
15) |
B dalis papildoma šiais skyriais: „B.59 Odos jautrinimas in chemico. Tiesioginio peptidų reaktyvumo bandymas ĮVADAS Šis bandymų metodas atitinka EBPO bandymų gaires (TG) 442C (2015). Odą jautrinančia medžiaga vadinama medžiaga, kuri susilietusi su oda sukelia alerginį atsaką, kaip apibrėžta Jungtinių Tautų (JT) visuotinai suderintoje cheminių medžiagų klasifikavimo ir ženklinimo sistemoje (GHS) (1) ir Europos Sąjungos Reglamente (EB) Nr. 1272/2008 dėl cheminių medžiagų ir mišinių klasifikavimo, ženklinimo ir pakavimo (CLP) (18). Šiame bandymų metode pateikta in chemico procedūra (tiesioginio peptidų reaktyvumo bandymas) (angl. Direct Peptide Reactivity Assay, DPRA) kuri turi būti taikoma siekiant patvirtinti skirtumą tarp odą jautrinančių medžiagų ir odos nejautrinančių medžiagų pagal JT GHS ir CLP. Yra bendrasis susitarimas dėl pagrindinių biologinių reiškinių, kurie pagrįstų odos jautrinimą. Turimos žinios apie cheminius ir biologinius mechanizmus, susijusius su odos jautrinimu, buvo apibendrintos kaip nepalankios baigties kelias (angl. Adverse Outcome Pathway, AOP) (2) nuo molekulinio inicijavimo įvykio per tarpinius įvykius iki neigiamo poveikio, būtent, iki žmonių alerginio kontaktinio dermatito arba graužikų kontaktinio hiperjautrumo. Kalbant apie odos jautrinimo AOP, molekulinio inicijavimo įvykis yra kovalentinio ryšio atsiradimas tarp elektrofilinių medžiagų ir odos baltymų nukleofilinių centrų. Odos jautrinimas paprastai yra įvertinamas naudojant laboratorinius gyvūnus. Klasikiniai metodai, atliekant bandymus su jūrų kiaulytėmis, yra Magnussono Kligmano jūrų kiaulyčių maksimizavimo bandymas (GMPT) ir Buehlerio bandymas (TM B.6 (3)), kuriuos taikant tiriamos odos jautrinimo indukcijos ir atsako sukėlimo tarpsniai. Bandymas su pelėmis, vietinių limfmazgių bandymas (LLNA, TM B.42 (4)) ir jo dvi modifikacijos nenaudojant radioaktyviųjų medžiagų, LLNA: DA (TM B.50 (5)) ir LLNA: BrdU-IFA (TM B.51 (6)), kurie visi vertina tik atsaką į indukciją, taip pat buvo priimti, nes jų privalumas palyginti su bandymais naudojant kiaulytes – gyvūnų gerovė ir odos jautrinimo indukcijos tarpsnio objektyvus matavimas. Vėliau in chemico ir in vitro mechanizmų tyrimais pagrįsti bandymų metodai buvo patvirtinti kaip moksliniu požiūriu tinkami metodai cheminių medžiagų keliamam odos jautrinimo pavojui vertinti. Tačiau bandymų nenaudojant gyvūnų metodų deriniai (in silico, in chemico, in vitro), kaip integruotųjų bandymo ir vertinimo metodų (IATA) dalis, turės visiškai pakeisti šiuo metu atliekamus bandymus su gyvūnais, atsižvelgiant į kiekvieno iš dabar turimų bandymų be gyvūnų metodų apribojimus, susijusius su AOP mechanizmų aprėptimi (2) (7). DPRA yra siūlomas, kad būtų galima ištirti odos jautrinimo AOP molekulinio inicijavimo įvykį, būtent, baltymų reaktyvumą, kiekybiškai įvertinant bandomųjų cheminių medžiagų aktyvumą lizino ar cisteino turinčių modelinių sintetinių peptidų atžvilgiu (8). Paskui cisteino ir lizino peptidų procentinio kiekio sumažėjimo vertės naudojamos medžiagos kategorijai nustatyti pagal vieną iš keturių reaktyvumo klasių, kad būtų galima patvirtinti skirtumą tarp odą jautrinančių medžiagų ir odos nejautrinančių medžiagų (9). DPRA buvo įvertintas, Europos Sąjungos bandymų su gyvūnais alternatyvų etaloninei laboratorijai (angl. European Union Reference Laboratory for Alternatives to Animal Testing, EURL ECVAM) atlikus tinkamumo patvirtinimo tyrimą ir vėliau EURL ECVAM patariamajam moksliniam komitetui (angl. EURL ECVAM Scientific Advisory Committee, ESAC) – nepriklausomą ekspertizę, ir buvo patvirtintas kaip moksliškai pagrįstas metodas (10), kuris gali būti taikomas kaip IATA dalis, kad būtų galima patvirtinti skirtumą tarp odą jautrinančių medžiagų ir odos nejautrinančių medžiagų pavojams klasifikuoti ir ženklinti. DPRA taikymo duomenys kartu su kita informacija yra pateikti literatūroje (11) (12) (13) (14). Apibrėžtys pateiktos I priedėlyje. PRADINIAI ASPEKTAI, TAIKOMUMAS IR APRIBOJIMAI Baltymų reaktyvumo koreliacija su odos jautrinimo geba yra aiškiai nustatyta (15) (16) (17). Vis dėlto, kadangi baltymų surišimas yra tik vienas svarbus įvykis, nors tai būtų odos jautrinimo AOP molekulinio inicijavimo įvykis, vien tik baltymų reaktyvumo informacijos, gautos bandymų ir ne bandymų metodais, gali nepakakti gauti išvadą apie cheminių medžiagų jautrinimo gebos nebuvimą. Todėl į duomenis, gautus taikant šį bandymų metodą, reikėtų žiūrėti kaip į integruotųjų metodų, pvz., IATA, dalį, juos derinant su kita papildančia informacija, pvz., gauta atliekant in vitro bandymus, kurie nagrinėja kitus svarbius odos jautrinimo AOP įvykius, taip pat taikant ne bandymų metodus, įskaitant kryžmines nuorodas į cheminius analogus. Šis bandymų metodas gali būti taikomas kaip IATA dalis kartu su kita papildančia informacija, kad būtų galima patvirtinti skirtumą tarp odą jautrinančių medžiagų (t. y. JT GHS ar CLP 1 kategorijos) ir odos nejautrinančių medžiagų. Šis bandymų metodas negali būti taikomas atskirai odą jautrinančioms medžiagoms priskirti 1A ir 1B subkategorijoms, kaip apibrėžta JT GHS ar CLP, arba prognozuoti jų jautrinimo gebą priimant saugos vertinimo sprendimus. Tačiau teigiamas rezultatas, gautas taikant DPRA, priklausomai nuo reglamentavimo sistemos gali būti naudojamas atskirai, kad cheminė medžiaga galėtų būti priskirta JT GHS ar CLP 1 kategorijai. Buvo patvirtinta, kad DPRA bandymo metodą galima pritaikyti laboratorijose, kurios turi analizės efektyviosios skysčių chromatografijos (HPLC) metodu patirties. Prognozių atkuriamumo lygis, kurio būtų galima tikėtis taikant bandymų metodą, yra maždaug 85 % laboratorijų viduje ir 80 % tarp laboratorijų (10). Rezultatų, gautų atliekant tinkamumo patvirtinimo tyrimą (18), ir paskelbtų tyrimų rezultatų (19) visuma rodo, kad, palyginti su LLNA rezultatais, DPRA tikslumas atskiriant jautrinančias medžiagas (t. y. JT GHS ar CLP 1 kategorijos) nuo nejautrinančių medžiagų yra 80 % (N=157), esant 80 % (88/109) jautriui ir 77 % (37/48) specifiškumui. Labiau tikėtina, kad DPRA sumažintų prognozę dėl cheminių medžiagų, kurios rodo mažą ar vidutinę odos jautrinimo gebą (t. y. JT GHS ar CLP 1B subkategorijos), nei cheminės medžiagos, kurios rodo didelę odos jautrinimo gebą (t. y. JT GHS ar CLP 1A kategorijos) (18) (19). Tačiau čia pateiktos DPRA, kaip atskirai taikomo bandymų metodo, tikslumo vertės yra tik orientacinės, kadangi bandymų metodo duomenis reikėtų nagrinėti kartu su kitais informacijos šaltiniais kaip IATA dalimis ir atsižvelgiant į 9 pastraipos nuostatas. Be to, įvertinant odos jautrinimo metodus, kurie nenaudoja gyvūnų, reikėtų turėti omenyje, kad LLNA bandymas, kaip ir kiti bandymai su gyvūnais, gali ne visiškai atitikti situaciją, susijusią su tiriamąja rūšimi, t. y. žmonėmis. Atsižvelgiant į turimų duomenų visumą, buvo įrodyta, kad DPRA tinka bandomosioms cheminėms medžiagoms, kurios aprėpia įvairias organines funkcines grupes, reakcijų mechanizmus, odos jautrinimo gebą (kaip nustatyta atliekant in vivo tyrimus) ir fizikines chemines medžiagų savybes (8) (9) (10) (19). Kartu paimta ši informacija rodo DPRA naudą prisidedant prie odos jautrinimo pavojaus identifikavimo. Šiame bandymų metode vartojamas terminas bandomoji cheminė medžiaga reiškia tai, kas yra bandoma, ir nėra susijęs su DPRA tinkamumu bandyti chemines medžiagas ir (arba) mišinius. Šis bandymų metodas netinka metalų junginiams, nes, kaip žinoma, jie su baltymais reaguoja pagal kitus nei kovalentinio ryšio mechanizmus. Bandomoji cheminė medžiaga turėtų būti tirpi atitinkamame tirpiklyje, kai jos galutinė koncentracija būtų 100 mmol/l (žr. 18 pastraipą). Tačiau bandomąsias chemines medžiagas, kurios netirpsta tiek, kad būtų gauta ši koncentracija, vis vien galima bandyti esant mažesnei tirpumo koncentracijai. Tokiu atveju teigiamas rezultatas vis tiek galėtų būti taikomas bandomajai cheminei medžiagai patvirtinti kaip odą jautrinančiai medžiagai, bet pagal neigiamą rezultatą negalima daryti tvirtos išvados dėl reaktyvumo nebuvimo. Šiuo metu turima nedaug informacijos apie DPRA tinkamumą žinomos sudėties mišiniams (18) (19). DPRA vis dėlto laikomas techniškai tinkamu bandyti daugiakomponentes medžiagas ir žinomos sudėties mišinius (žr. 18 pastraipą). Prieš taikant bandymų metodą mišiniui, kad būtų gauti numatomo reglamentavimo tikslui skirti duomenys, reikėtų panagrinėti, ar šiuo metodu galima pasiekti tą tikslą atitinkančius rezultatus ir, jei taip, tai dėl kokios priežasties. Tokie svarstymai nereikalingi, kai yra reglamentavimo reikalavimas bandyti mišinį. Dabartinis prognozavimo modelis negali būti taikomas nežinomos sudėties sudėtingiems mišiniams arba nežinomos ar kintamos sudėties medžiagoms, sudėtingųjų reakcijų produktams ar biologinėms medžiagoms (t. y. UVCB medžiagoms) dėl tam tikro bandomosios cheminės medžiagos ir peptido molinio santykio. Šiam tikslui reikės sukurti gravimetriniu metodu pagrįstą naują prognozavimo modelį. Tais atvejais, kai galima pateikti įrodymų dėl bandymų metodo netinkamumo kitų specifinių kategorijų cheminėms medžiagoms, bandymų metodo nereikėtų taikyti toms specifinių kategorijų cheminėms medžiagoms. Šis bandymų metodas yra in chemico metodas, kuris neaprėpia metabolinės sistemos. Cheminės medžiagos, kurioms būtinas biologinis aktyvinimas fermentais, kad galėtų pasireikšti jų odos jautrinimo geba (t. y. prohaptenai) negali būti aptiktos šiuo bandymų metodu. Yra pranešimų, kad cheminės medžiagos, kurios tampa odą jautrinančiomis po abiotinio virsmo (t. y. prehaptenai) kartais tiksliai aptinkamos šiuo bandymų metodu (18). Atsižvelgiant į tai, kas buvo pasakyta pirmiau, taikant bandymų metodą gauti neigiami rezultatai turėtų būti aiškinami, atsižvelgiant į nurodytus apribojimus ir kartu su kitais IATA sistemos informacijos šaltiniais. Dėl bandomųjų cheminių medžiagų, kurios kovalentiškai nesijungia su peptidu, bet skatina jo oksidaciją (t. y. cisteino dimerizaciją) galėtų būti pervertintas peptidų kiekio sumažėjimas, dėl ko galbūt būtų gautos klaidingai teigiamos prognozės ir (arba) medžiagos būtų priskirtos didesnio reaktyvumo klasei (žr. 29 ir 30 pastraipas). Kaip aprašyta, DPRA padeda patvirtinti skirtumą tarp odą jautrinančių medžiagų ir odos nejautrinančių medžiagų. Tačiau jis taip pat gali prisidėti prie jautrinimo gebos vertinimo (11), kai taikomas kaip integruotųjų metodų, pvz IATA, dalis. Tačiau būtinas tolesnis darbas, pageidautina pagrįstas gautais duomenimis apie žmones, kad būtų galima nustatyti, kaip DPRA rezultatai gali prisidėti prie veikimo gebos vertinimo. BANDYMO PRINCIPAS DPRA yra in chemico metodas, kuriuo kiekybiškai nustatoma cisteino ar lizino turinčio peptido liekamoji koncentracija po 24 h trukmės inkubavimo su bandomąja chemine medžiaga 25 ± 2,5 °C temperatūroje. Aptikimui palengvinti sintetiniai peptidai turi fenilalanino. Santykinė peptidų koncentracija matuojama efektyviosios skysčių chromatografijos (HPLC) metodu, taikant gradientinį eliuavimą ir UV aptikimą esant 220 nm. Apskaičiuojamos cisteino ir lizino peptido kiekio sumažėjimo procentinės vertės, ir jos naudojamos kuriant prognozavimo modelį (žr. 29 pastraipą), pagal kurį bandomąją cheminę medžiagą galima priskirti vienai iš keturių reaktyvumo klasių, naudojamų patvirtinti skirtumą tarp odą jautrinančių medžiagų ir odos nejautrinančių medžiagų. Prieš pradėdamos taikyti bandymų metode aprašytą procedūrą įprastiniu būdu, laboratorijos turėtų įrodyti savo techninę kvalifikaciją, naudodamos dešimt kvalifikacijai tikrinti skirtų cheminių medžiagų, išvardytų 2 priedėlyje. PROCEDŪRA Šis bandymų metodas yra pagrįstas DPRA DB-ALM protokolu Nr. 154 (20), kuris atitinka protokolą, taikytą atliekant EURL ECVAM koordinuotą tinkamumo patvirtinimo tyrimą. Rekomenduojama šį protokolą taikyti tada, kai metodas įdiegiamas ir taikomas laboratorijoje. Toliau pateiktas pagrindinių DPRA komponentų ir procedūrų aprašymas. Jei naudojama alternatyvioji HPLC schema, reikėtų įrodyti jos atitiktį patvirtintai schemai, aprašytai DB-ALM protokole (pvz., bandant 2 priedėlyje nurodytas kvalifikacijai tikrinti skirtas chemines medžiagas). Cisteino ar lizino turinčių peptidų paruošimas Sintetinių peptidų, turinčių cisteino (Ac-RFAACAA-COOH) ir lizino (Ac-RFAAKAA-COOH), pradiniai tirpalai, kurių grynumas yra didesnis kaip 85 % ir pageidautina 90–95 % intervale, turėtų būti iš naujo paruošti visiškai prieš jų inkubavimą su bandomąja chemine medžiaga. Galutinė cisteino peptido koncentracija turėtų būti 0,667 mmol/l fosfatinio buferinio tirpalo, kurio pH 7,5, o lizino peptido – 0,667 mmol/l amonio acetato buferinio tirpalo, kurio pH 10,2. HPLC eigos seka turėtų būti sudaryta taip, kad HPLC analizės trukmė būtų trumpesnė kaip 30 h. Jei tai HPLC įrenginys, naudotas atliekant tinkamumo patvirtinimo tyrimą ir aprašytas šiame bandymų metode, atliekant vieną HPLC bandymų seriją galima įdėti iki 26 analizės ėminių (kuriuos sudaro bandomosios cheminės medžiagos ėminiai, teigiami kontroliniai ėminiai ir reikiamas skaičius tirpiklio kontrolinių ėminių, pagrįstas atskirų bandyme naudojamų tirpiklių skaičiumi, kiekvieną ėminį bandant kaip trijų kartotinių ėminių rinkinį). Visus vienos serijos analizuojamus kartotinius ėminius reikėtų ruošti iš identiškų cisteino ir lizino peptidų pradinių tirpalų. Prieš naudojant, rekomenduojama patikrinti atskiras peptidų partijas, ar jie pakankamai gerai tirpsta. Bandomosios cheminės medžiagos paruošimas Prieš atliekant bandymą, reikėtų įvertinti bandomosios cheminės medžiagos tirpumą tinkamame tirpiklyje pagal soliubilizavimo procedūrą, aprašytą DPRA DB-ALM protokole (20). Tinkamas tirpiklis – tai tirpiklis, kuriame bandomoji cheminė medžiaga visiškai ištirpsta. Kadangi taikant DPRA bandomoji cheminė medžiaga inkubuojama esant dideliam jos pertekliui palyginti su cisteino ar lizino peptidais, pakankamu įrodymu, kad bandomoji cheminė medžiaga (ir visi jos komponentai, jei bandoma daugiakomponentė medžiaga ar mišinys) yra ištirpusi, yra skaidraus tirpalo susidarymas. Tinkami tirpikliai yra acetonitrilas, vanduo, vandens ir acetonitrilo 1:1 mišinys, izopropanolis, acetonas arba acetono ir acetonitrilo 1:1 mišinys. Galima naudoti kitus tirpiklius, jei jie neturi įtakos peptidų stabilumui, kuriam kontroliuoti naudojami etaloniniai kontroliniai ėminiai C (t. y. ėminiai, kuriuos sudaro vien tik peptidas, ištirpintas tinkamame tirpiklyje; žr. 3 priedėlį). Jei bandomoji cheminė medžiaga netirpsta nei viename iš šių tirpiklių, blogiausiu atveju reikėtų mėginti ją soliubilizuoti 300 μl DMSO ir gautą tirpalą atskiesti 2 700 μl acetonitrilo, o jei bandomoji cheminė medžiaga netirpsta šiame mišinyje, reikėtų mėginti tą patį bandomosios cheminės medžiagos kiekį soliubilizuoti 1 500 μl DMSO ir gautą tirpalą atskiesti 1 500 μl acetonitrilo. Bandomąją cheminę medžiagą reikėtų iš anksto pasverti į stiklinius buteliukus ir nedelsiant ištirpinti prieš pat bandymą tinkamame tirpiklyje, paruošiant 100 mmol/l tirpalą. Jei tiriami žinomos sudėties mišiniai ir daugiakomponentės medžiagos, reikėtų nustatyti vieną grynumą, kaip jų sudedamųjų dalių (išskyrus vandenį) sumą, ir vieną vidutinę molekulinę masę – atsižvelgiant į kiekvieno atskiro mišinio komponento (išskyrus vandenį) molekulinę masę ir kiekvieno iš jų dalį. Gautas grynumo ir vidutinės molekulinės masės vertes reikėtų naudoti apskaičiuojant bandomosios cheminės medžiagos masę, kurios reikia 100 mmol/l tirpalui paruošti. Kadangi negalima nustatyti polimerų pagrindinės molekulinės masės, galima imti monomero molekulinę masę (ar polimerą sudarančių monomerų vidutinę molekulinę masę) 100 mmol/l tirpalui paruošti. Tačiau, bandant žinomos sudėties mišinius, daugiakomponentes medžiagas ar polimerus, reikėtų numatyti galimybę bandyti grynąją cheminę medžiagą. Skystąsias grynas chemines medžiagas reikėtų bandyti kaip tokias ir iš anksto neskiestas, inkubuojant atitinkamai 1:10 ir 1:50 moliniu santykiu su cisteino ir lizino peptidais. Kietąsias bandomąsias chemines medžiagas reikėtų ištirpinti gaunant maksimalią tirpumo koncentraciją tame pačiame tirpiklyje, kuris naudojamas 100 mmol/l efektyviosios koncentracijos tirpalui ruošti. Jas reikėtų bandyti kaip tokias ir papildomai neskiesti, inkubuojant atitinkamai 1:10 ir 1:50 moliniu santykiu su cisteino ir lizino peptidais. Jei efektyviosios koncentracijos 100 mmol/l tirpalui ir grynai cheminei medžiagai gauti rezultatai (reaktyvumo ar nereaktyvumo) sutaptų, būtų galima padaryti tvirtą išvadą dėl rezultato. Teigiamų kontrolinių ėminių, etaloninių kontrolinių ėminių ir koeliuavimo kontrolinių ėminių paruošimas Kaip teigiamą kontrolinę cheminę medžiagą (PC) reikėtų naudoti cinamono aldehidą (CAS 104-55-2; ≥95 % maistinio grynumo), ruošiant 100 mmol/l koncentracijos tirpalą acetonitrile. Galima naudoti kitas tinkamas teigiamas kontrolines chemines medžiagas, kurioms būtų gautos vidutinės kiekio sumažėjimo vertės, jei yra istorinių duomenų, kad būtų galima gauti palyginamuosius bandymo eigos priimtinumo kriterijus. Be to, į HPLC bandymų seką reikėtų įtraukti etaloninius kontrolinius ėminius (t. y. ėminius, kuriuos sudaro vien tik peptidas, ištirpintas tinkamame tirpiklyje), kurie naudojami HPLC sistemos tinkamumui tikrinti prieš analizę (etaloninius kontrolinius ėminius A), etaloninių kontrolinių ėminių laikiniam stabilumui tikrinti (etaloninius kontrolinius ėminius B), ir ėminius, kurie patikrintų, ar bandomajai cheminei medžiagai ištirpinti naudojamas tirpiklis nedaro įtakos procentiniam peptidų kiekio sumažėjimui (etaloninius kontrolinius ėminius C) (žr. 3 priedėlį). Kiekvienai cheminei medžiagai naudojamas reikiamas kontrolinis ėminys tos cheminės medžiagos procentiniam peptidų kiekio sumažėjimui apskaičiuoti (žr. 26 pastraipą). Be to, kiekvienai analizuojamai bandomajai cheminei medžiagai į bandymų seką reikėtų įtraukti koeliuavimo kontrolinį ėminį, kurį sudarytų vien tik bandomoji cheminė medžiaga, kad būtų galima aptikti galimą bandomosios cheminės medžiagos koeliuavimą su lizino ar cisteino peptidu. Bandomosios cheminės medžiagos inkubavimas su cisteino ir lizino peptidų tirpalais Cisteino ir lizino peptidų tirpalus reikėtų inkubuoti su bandomąja chemine medžiaga stikliniuose automatinio ėminių ėmiklio buteliukuose atitinkamai 1:10 ir 1:50 santykiu. Jei iš karto po bandomosios cheminės medžiagos tirpalo įpylimo į peptidų tirpalą atsiranda nuosėdų dėl jos mažo tirpumo vandenyje, šiuo atveju nėra aišku, koks bandomosios cheminės medžiagos kiekis liko tirpale reakcijai su peptidu. Todėl tokiu atveju teigiamą rezultatą vis tiek būtų galima panaudoti, bet neigiamas rezultatas yra neapibrėžtas ir jį reikėtų aiškinti gana atsargiai (taip pat žr. 11 pastraipos nuostatas dėl cheminių medžiagų, kurių tirpumo nepakanka 100 mmol/l koncentracijai gauti, bandymo). Prieš atliekant HPLC analizę, reakcijos tirpalą reikėtų laikyti 24 ± 2 h tamsoje ir 25 ± 2,5 °C temperatūroje. Kiekviena bandomoji cheminė medžiaga turėtų būti analizuojama tris kartus su abiem peptidais. Prieš HPLC analizę ėminiai turi būti vizualiai patikrinti. Jei stebimos nuosėdos arba fazių atsiskyrimas, atsargumo dėlei ėminius galima centrifuguoti mažu greičiu (100–400 × g), kad nuosėdos nusėstų ant buteliuko dugno, nes dėl didelio nuosėdų kiekio gali užsikimšti HPLC vamzdeliai ar kolonėlės. Jei, pasibaigus inkubavimo laikotarpiui, stebimos nuosėdos arba fazių atsiskyrimas, peptidų kiekio sumažėjimo įvertis gali būti per mažas ir neigiamo rezultato atveju negalima padaryti pakankamai patikimos išvados dėl reaktyvumo nebuvimo. HPLC etaloninės kalibravimo kreivės sudarymas Reikėtų sudaryti abiejų peptidų, cisteino ir lizino, etaloninę kalibravimo kreivę. Peptidų etalonus reikėtų ruošti 20 % ar 25 % acetonitrilo ir buferinio tirpalo mišinio tirpale, naudojant fosfatinį buferinį tirpalą (pH 7,5) cisteino peptidui ir amonio acetato buferinį tirpalą (pH 10,2) lizino peptidui. Naudojant peptidų pradinio tirpalo (0,667 mmol/l) praskiestų etaloninių tirpalų seriją, reikėtų paruošti 6 kalibravimo tirpalus, kurie apimtų 0,534–0,0167 mmol/l intervalą. Į etaloninę kalibravimo kreivę taip pat reikėtų įtraukti buferinio tirpalo tuščiąjį ėminį. Tinkamos kalibravimo kreivės turėtų turėti r2>0,99. Pasiruošimas HPLC ir analizė Prieš atliekant analizę reikėtų patikrinti HPLC sistemos tinkamumą. Peptidų kiekio sumažėjimas stebimas HPLC sistema, sujungta su UV detektoriumi (fotodiodinės matricos detektoriumi ar fiksuoto bangos ilgio sugerties detektoriumi, matuojant 220 nm signalą). HPLC sistemoje įrengiama reikiama kolonėlė. HPLC įrenginio struktūra yra aprašyta patvirtintame protokole, kuriame kaip tinkamiausia kolonėlė naudojama Zorbax SB-C-18 2,1 mm × 100 mm × 3,5 mikronų kolonėlė. Naudojant šią atvirkštinių fazių HPLC kolonėlę 2 h iki bandymo pradžios visoje sistemoje turi būti nustatyta pusiausvyra 30 °C su 50 % A fazės (0,1 % (tūrio) trifluoracto rūgšties tirpalas vandenyje) ir 50 % B fazės (0,085 % (tūrio) trifluoracto rūgšties tirpalas acetonitrile) tirpalu.. HPLC analizė turėtų būti atliekama esant 0,35 ml/min srautui ir tiesiniam gradientui nuo 10 % iki 25 % acetonitrilo per 10 min, tada staigiai padidinama iki 90 % acetonitrilo kitoms medžiagoms pašalinti. Reikėtų įpurkšti vienodą kiekvieno etalono, ėminio ir kontrolinio ėminio tūrį. Tarp įpurškimų pradinėmis sąlygomis kolonėlėje 7 min turėtų būti nustatoma pusiausvyra. Jei naudojama kitokia atvirkštinių fazių HPLC kolonėlė, pirmiau aprašytus nustatomuosius parametrus reikėtų reguliuoti, kad būtų užtikrintas reikiamas eliuavimas ir cisteino bei lizino peptidų smailių integravimas, įskaitant įpurškiamą tūrį, kuris gali skirtis atsižvelgiant į naudojamą sistemą (paprastai 3–10 μl). Svarbu pažymėti, kad naudojant alternatyviąją HPLC schemą, reikėtų įrodyti jos atitiktį pirmiau aprašytai patvirtintai schemai (pvz., bandant 2 priedėlyje nurodytas kvalifikacijai tikrinti skirtas chemines medžiagas). Sugerties koeficientas matuojamas esant 220 nm. Jei naudojamas fotodiodinės matricos detektorius, reikėtų registruoti sugerties koeficientą esant 258 nm. Reikėtų pažymėti, kad kai kurių tiekėjų acetonitrilas gali daryti neigiamą įtaką peptidų stabilumui ir tai reikėtų įvertinti, kai naudojama nauja acetonitrilo partija. Kaip koeliuavimo rodiklį galima naudoti 220 smailės ploto ir 258 smailės ploto santykį. Jei kiekvieno ėminio santykio intervalas atitinka 90 % < kontrolinių ėminių santykio vidurkis (19) <100 %, tai būtų tinkamas įrodymas, kad koeliuavimo nebuvo. Gali būti bandomųjų cheminių medžiagų, kurios galėtų skatinti cisteino peptido oksidaciją. Cisteino peptido dimero smailę galima stebėti vizualiai. Jei pasirodytų, kad vyko dimerizacija, ji būtų stebima kaip galimas per didelis procentinio peptidų kiekio sumažėjimo įvertis, dėl ko būtų gaunamos klaidingai teigiamos prognozės ir (arba) medžiaga priskirta aukštesnei reaktyvumo klasei (žr. 29 ir 30 pastraipas). Cisteino ir lizino peptidų HPLC analizę galima atlikti vienu metu (jei yra dvi HPLC sistemos) ar skirtingomis dienomis. Jei analizė atliekama skirtingomis dienomis, visi bandomosios cheminės medžiagos tirpalai turėtų būti iš naujo ruošiami abiem bandymams kiekvieną dieną. Analizės trukmę reikėtų matuoti, siekiant užtikrinti, kad pirmasis ėminys būtų įpurškiamas praėjus 22–26 h nuo bandomosios cheminės medžiagos sumaišymo su peptidų tirpalu. HPLC eigos seka turėtų būti sudaryta taip, kad HPLC analizės trukmė būtų trumpesnė kaip 30 h. Jei tai HPLC įrenginys, naudotas atliekant tinkamumo patvirtinimo tyrimą ir aprašytas šiame bandymų metode, atliekant vieną HPLC bandymų seriją galima įdėti iki 26 analizės ėminių (taip pat žr. 17 pastraipą). HPLC analizės sekos pavyzdys pateiktas 3 priedėlyje. DUOMENYS IR ATASKAITOS RENGIMAS Duomenų įvertinimas Kiekvieno ėminio cisteino ar lizino peptidų koncentracija nustatoma fotometriškai, matuojant 220 nm bangos ilgį atitinkančių reikiamų smailių plotą (plotą po kreive) ir peptidų koncentraciją apskaičiuojant pagal etalonams gautą tiesinio kalibravimo kreivę. Kiekvieno ėminio procentinis peptidų kiekio sumažėjimas nustatomas, matuojant smailės plotą, kuris dalijamas iš atitinkamų etaloninių kontrolinių ėminių C vidutinio smailės ploto (žr. 3 priedėlį) pagal toliau pateiktą formulę.
Priimtinumo kriterijai Bandymų seka būtų laikoma tinkama, jei ji atitiktų šiuos kriterijus:
Jei nėra atitikties vienam arba daugiau kriterijų, bandymą reikėtų pakartoti. Bandomajai cheminei medžiagai gauti rezultatai būtų laikomi tinkamais, jei jie atitiktų šiuos kriterijus:
Prognozavimo modelis Apskaičiuojamas kiekvienai bandomajai cheminei medžiagai gautas cisteino ir lizino vidutinis kiekio sumažėjimas procentais. Skaičiuojant vidurkį, neigiamas sumažėjimas prilyginamas nuliui. Naudojant cisteino 1:10 ir lizino 1:50 prognozavimo modelį, pateiktą 1 lentelėje, peptidų kiekio sumažėjimo vidurkio 6,38 % riba turėtų būti naudojama kaip odą jautrinančių medžiagų ir odos nejautrinančių medžiagų skiriamoji riba IATA sistemoje. Prognozavimo modelio taikymas, bandomąją cheminę medžiagą priskiriant reaktyvumo klasei (t. y. mažo, vidutinio ir didelio reaktyvumo), gali būti naudingas jautrinimo gebos vertinimo informacijai gauti IATA sistemoje. 1 lentelė Cisteino 1:10 ir lizino 1:50 prognozavimo modelis (20)
Gali pasitaikyti atvejų, kai bandomoji cheminė medžiaga (medžiaga ar vienas arba keli daugiakomponentės medžiagos ar mišinio komponentai) reikšmingai sugeria esant 220 nm bangos ilgiui ir sulaikymo trukmė yra lygi peptido sulaikymo trukmei (koeliuavimas). Koeliuavimo problemą galima išspręsti šiek tiek suderinant HPLC įrenginį, kad labiau atsiskirtų bandomosios cheminės medžiagos ir peptido sulaikymo trukmė. Jei sprendžiant atskyrimo problemą naudojamas alternatyvus HPLC įrenginys, turėtų būti įrodyta jo atitiktis patvirtintai procedūrai (pvz., bandant 2 priedėlyje nurodytas kvalifikacijai tikrinti skirtas chemines medžiagas). Jei vyksta koeliuavimas, peptido smailė negali būti integruojama ir neįmanoma apskaičiuoti procentinio peptidų kiekio sumažėjimo. Kai tokios bandomosios cheminės medžiagos koeliuavimas vyksta su abiem, cisteino ir lizino, peptidais, analizė turėtų būti pateikta ataskaitoje kaip „nedavusi rezultato“. Jei koeliuavimas vyksta tik su lizino peptidu, galima naudoti cisteino 1:10 prognozavimo modelį, pateiktą 2 lentelėje. 2 lentelė Cisteino 1:10 prognozavimo modelis (22)
Gali būti kitų atvejų, kai bandomosios cheminės medžiagos ir kurio nors iš peptidų sulaikymo trukmės persidengimas yra nepakankamas. Tokiais atvejais procentinį peptidų kiekio sumažėjimą galima įvertinti apytikriai ir naudoti kaip cisteino 1:10 ar lizino 1:50 prognozavimo modelį, tačiau bandomosios cheminės medžiagos negalima tiksliai priskirti reaktyvumo klasei. Vienos cisteino ir lizino peptidų HPLC analizės turėtų pakakti bandomajai cheminei medžiagai, kai rezultatas yra aiškus. Tačiau kai rezultatai yra arti naudojamos teigiamo ir neigiamo rezultatų atskyrimo ribos (t. y. tarpiniai rezultatai), gali prireikti papildomo bandymo. Jei pagal cisteino 1:10 ar lizino 1:50 prognozavimo modelį procentinio peptidų kiekio sumažėjimo vidurkis yra 3 %–10 % intervale, o pagal cisteino 1:10 prognozavimo modelį cisteino procentinio kiekio sumažėjimo vidurkis yra 9 %–17 % intervale, reikėtų spręsti klausimą dėl antrojo bandymo, taip pat dėl trečiojo, jei per pirmuosius du būtų gauti prieštaraujantys rezultatai. Bandymo ataskaita Į bandymo ataskaitą turėtų būti įtraukta ši informacija:
LITERATŪRA
1 priedėlis APIBRĖŽTYS Tikslumas – bandymo metodo rezultatų ir patvirtintų pamatinių verčių sutapimo artumas. Tikslumas yra bandymo metodo taikymo charakteristikų matas ir vienas iš „tinkamumo“ aspektų. Terminas dažnai vartojamas kaip lygiavertis terminui „atitiktis“ tinkamų bandymo metodo rezultatų daliai išreikšti (21). Nepalankios baigties kelias (angl. Adverse Outcome Pathway, AOP) – įvykių seka nuo tikslinės cheminės medžiagos ar panašių cheminių medžiagų grupių cheminės sandaros per molekulinio inicijavimo įvykį iki in vivo tiriamo rezultato (2). Kalibravimo kreivė – bandant žinomą cheminę medžiagą gauto atsako vertės priklausomybė nuo analizinės koncentracijos (tai pat vadinama etalonine kalibravimo kreive). Cheminė medžiaga – medžiaga arba mišinys. Variacijos koeficientas – kintamumo matas, apskaičiuojamas kartotinių ėminių duomenų grupei kaip standartinio nuokrypio ir vidurkio dalmuo. Jį galima padauginti iš 100, kad būtų išreikštas procentais. Pavojus – būdingoji agento savybė arba situacija, galinti sukelti neigiamų padarinių, kai organizmą, sistemą ar populiaciją (arba jos dalį) veikia tas agentas. Integruotasis bandymo ir vertinimo metodas (angl. Integrated Approach to Testing and Assessment, IATA) – struktūrinis metodas, taikomas cheminės medžiagos ar cheminių medžiagų grupės (galimam) pavojui identifikuoti, pavojui (veikimo gebai) apibūdinti ir (arba) saugai vertinti (galimo pavojaus ir (arba) veikimo gebos ir paveikimo), kurį taikant strategiškai apjungiami į vieną visumą ir įvertinami visi susiję duomenys, kad būtų galima pateikti informaciją reglamentavimo sprendimui priimti dėl galimo pavojaus ir (arba) rizikos, ir (arba) dėl būtinumo atlikti papildomą tikslinį, taigi minimalų bandymą. Molekulinio inicijavimo įvykis – cheminės medžiagos sukelta biologinės sistemos triktis molekuliniu lygiu, kuri identifikuojama kaip nepalankios baigties kelio pradinis įvykis. Mišinys – iš dviejų arba daugiau medžiagų sudarytas mišinys arba tirpalas, kuriame jos nereaguoja (1) Vienkomponentė medžiaga – medžiaga, kurią apibrėžia jos kiekybinė sudėtis, kai vienas pagrindinis komponentas sudaro ne mažiau kaip 80 % (masės). Daugiakomponentė medžiaga – medžiaga, kurią apibrėžia jos kiekybinė sudėtis, kai daugiau kaip vieno pagrindinio komponento koncentracija ≥ 10 % (masės) ir < 80 % (masės). Daugiakomponentė medžiaga yra gamybos proceso rezultatas. Skirtumas tarp mišinio ir daugiakomponentės medžiagos yra tas, kad mišinys gaunamas sumaišant dvi medžiagas arba daugiau nevykstant cheminei reakcijai. Daugiakomponentė medžiaga yra cheminės reakcijos rezultatas. Teigiamas kontrolinis ėminys – kartotinis ėminys, turintis visus bandymo sistemos komponentus ir apdorotas chemine medžiaga, kuri yra žinoma kaip sukelianti teigiamą atsaką. Siekiant užtikrinti galimybę vertinti teigiamo kontrolinio ėminio atsako kintamumą per tam tikrą laiką, teigiamas atsakas neturėtų būti per stiprus. Pamatinis kontrolinis ėminys – visus bandymo sistemos komponentus, įskaitant tirpiklį ar nešiklį, turintis neapdorotas ėminys, kuris tiriamas kartu su bandomąja chemine medžiaga, apdorotais ėminiais ir kitais kontroliniais ėminiais, siekiant nustatyti atskaitos vertę ėminiams, apdorotiems bandomąja chemine medžiaga, ištirpinta tame pačiame tirpiklyje ar nešiklyje. Kai bandomas kartu su vienalaikiu neigiamu kontroliniu ėminiu, šis ėminys taip pat parodo, ar vyksta tirpiklio arba nešiklio sąveika su bandymo sistema. Tinkamumas – santykio tarp bandymo ir tiriamo poveikio bei bandymo reikšmingumo bei naudingumo siekiant tam tikro tikslo apibūdinimas. Tai yra atliekant bandymą tiriamo biologinio poveikio matavimo ar prognozavimo tikslumo laipsnis. Tinkamumas aprėpia bandymų metodo tikslumo (atitikties) aspektą (21). Patikimumas – pagal tą patį protokolą atliekamo bandymų metodo, tam tikrą laiką taikomo laboratorijose ir tarp laboratorijų, atkuriamumo laipsnio matas. Jis įvertinamas apskaičiuojant atkuriamumą laboratorijoje ir tarp laboratorijų ir pakartojamumą laboratorijoje (21). Atkuriamumas – rezultatų, gautų pagal vienodą bandymų protokolą bandant tą pačią cheminę medžiagą, sutapimas (žr. patikimumas) (21). Jautris – visų teigiamų ar veikliųjų cheminių medžiagų, kurios buvo tiksliai klasifikuotos atliekant bandymą, dalis. Jis yra bandymų metodo, kuriuo gaunami kategorijos nustatymo rezultatai, tikslumo matas ir svarbus aspektas vertinant bandymų metodo tinkamumą (21). Specifiškumas – visų neigiamų ar neveikliųjų cheminių medžiagų, kurios buvo tiksliai klasifikuotos atliekant bandymą, dalis. Jis yra bandymų metodo, kuriuo gaunami kategorijos nustatymo rezultatai, tikslumo matas ir svarbus aspektas vertinant bandymų metodo tinkamumą (21). Medžiaga – gamtoje randami arba gamybos procese gaunami cheminiai elementai ir jų junginiai, įskaitant visus priedus, kurių reikia produkto stabilumui užtikrinti, ir visas priemaišas, patenkančias į produktą taikomo proceso metu, tačiau neįskaitant tirpiklio, kurį galima atskirti, nepaveikiant medžiagos stabilumo ar nekeičiant jos sudėties (1). Sistemos tinkamumas – prietaiso eksploatacinių charakteristikų (pvz., jautrio) nustatymas analizuojant pamatinį etaloną prieš atliekant ėminių partijos analizę (22). Bandomoji cheminė medžiaga – terminas bandomoji cheminė medžiaga vartojamas bandomam dalykui nurodyti. Jungtinių Tautų visuotinai suderinta cheminių medžiagų klasifikavimo ir ženklinimo sistema (JT GHS) – sistema, kurioje pateikiamas cheminių medžiagų (medžiagų ir mišinių) klasifikavimas pagal standartizuotus fizikinių pavojų, pavojų sveikatai bei aplinkai tipus ir nagrinėjami atitinkami informaciniai elementai, pvz., piktogramos, signaliniai žodžiai, pavojingumo frazės, atsargumo frazės ir saugos duomenų lapai, kad būtų galima informuoti apie medžiagų neigiamą poveikį, siekiant apsaugoti žmones (įskaitant darbuotojus, darbininkus, vežėjus, vartotojus ir avarijų likvidatorius) ir aplinką (1). UVCB – nežinomos ar kintamos sudėties medžiagos, sudėtingųjų reakcijų produktai ar biologinės medžiagos. Patvirtinto tinkamumo bandymų metodas – bandymų metodas, kurio tinkamumo ir patikimumo pakanka tam tikram tikslui pasiekti ir kuriam taikomi moksliškai pagrįsti principai. Bandymų metodas niekuomet nėra visiškai tinkamas absoliučiąja prasme, bet tik tam tikro tikslo atžvilgiu (21). 2 priedėlis KVALIFIKACIJAI TIKRINTI SKIRTOS CHEMINĖS MEDŽIAGOS Odos jautrinimas in chemico. Tiesioginio peptidų reaktyvumo tyrimas Prieš pradėdamos įprastiniu būdu taikyti šį bandymų metodą, laboratorijos turėtų įrodyti savo techninę kvalifikaciją, pateikdamos tikslią DPRA prognozę, tam naudodamos 10 cheminių medžiagų, kurios rekomenduojamos 1 lentelėje, siekiant nustatyti kiekvienam peptidui cisteino ir lizino kiekio sumažėjimo vertes, kurios patektų į atitinkamą 8 iš 10 kvalifikacijos tikrinimui panaudotų etaloninių medžiagų nurodytą intervalą. Šios kvalifikacijai tikrinti skirtos etaloninės medžiagos buvo pasirinktos taip, kad atitiktų odos jautrinimo pavojaus intervalą. Kiti atrankos kriterijai buvo galimybė pirkti chemines medžiagas ir tai, ar yra aukštos kokybės in vivo etaloniniai duomenys bei aukštos kokybės in vitro DPRA bandymų metodo duomenys ir ar jie buvo naudojami atliekant EURL ECVAM koordinuotą tinkamumo patvirtinimo tyrimą, siekiant įrodyti sėkmingą bandymų metodo įdiegimą tyrime dalyvaujančiose laboratorijose. 1 lentelė Rekomenduojamos kvalifikacijai tikrinti skirtos cheminės medžiagos laboratorijos techninei kvalifikacijai įrodyti atliekant tiesioginio peptidų reaktyvumo tyrimą
3 priedėlis ANALIZĖS SEKOS PAVYZDŽIAI
B.60 Odos jautrinimas in vitro. ARE-Nrf2 liuciferazės bandymų metodas ĮVADAS Šis bandymų metodas atitinka EBPO bandymų gaires (TG) 442D (2015). Odą jautrinančia medžiaga vadinama medžiaga, kuri susilietusi su oda sukelia alerginį atsaką, kaip apibrėžta Jungtinių Tautų (JT) visuotinai suderintoje cheminių medžiagų klasifikavimo ir ženklinimo sistemoje (GHS) (1) ir Europos Sąjungos Reglamente (EB) Nr. 1272/2008 dėl cheminių medžiagų ir mišinių klasifikavimo, ženklinimo ir pakavimo (CLP) (27). Šiame bandymų metode pateikiama procedūra in vitro (ARE-Nrf2 liuciferazės bandymas), kuri turi būti taikoma, kad būtų galima nustatyti skirtumą tarp odą jautrinančių medžiagų ir odos nejautrinančių medžiagų pagal JT GHS (1) ir CLP. Yra bendrasis susitarimas dėl pagrindinių biologinių reiškinių, kurie pagrįstų odos jautrinimą. Turimos žinios apie cheminius ir biologinius mechanizmus, susijusius su odos jautrinimu, buvo apibendrintos kaip nepalankios baigties kelias (angl. Adverse Outcome Pathway, AOP) (2) nuo molekulinio inicijavimo įvykio per tarpinius įvykius iki neigiamo poveikio sveikatai, t. y. žmonių alerginio kontaktinio dermatito arba graužikų kontaktinio hiperjautrumo (2) (3). Molekulinio inicijavimo įvykis yra kovalentinio ryšio atsiradimas tarp elektrofilinių medžiagų ir odos baltymų nukleofilinių centrų. Antrasis pagrindinis šio AOP įvykis vyksta keratinocituose ir aprėpia uždegiminius atsakus, taip pat genų ekspresiją, susijusią su specifiniais ląstelių signalizacijos keliais, pvz., nuo antioksidacinio ar elektrofilinio atsako elemento (ARE) priklausomais keliais. Trečiasis pagrindinis įvykis – dendritinių ląstelių aktyvinimas, paprastai įvertinamas kaip specifinių ląstelių paviršinių žymeklių, chemokinų ir citokinų, ekspresija. Ketvirtasis pagrindinis įvykis – yra T ląstelių proliferacija, kuri netiesiogiai vertinama atliekant pelių vietinių limfmazgių bandymą (4). Odos jautrinimas paprastai buvo įvertinamas naudojant laboratorinius gyvūnus. Klasikiniai metodai, atliekant bandymus su jūrų kiaulytėmis, yra Magnussono Kligmano jūrų kiaulyčių maksimizavimo bandymas (GMPT) ir Buehlerio bandymas (TM B.6 (5)), kurie tiria odos jautrinimo indukcijos ir atsako sukėlimo tarpsnius. Bandymas su pelėmis, vietinių limfmazgių bandymas (LLNA, TM B.42 (4)) ir jo dvi modifikacijos nenaudojant radioaktyviųjų medžiagų, LLNA: DA (TM B.50 (6)) ir LLNA: BrdU-IFA (TM B.51 (7)), kurie visi vertina tik atsaką į indukciją, taip pat buvo priimti, nes jų privalumai palyginti su bandymais naudojant kiaulytes – gyvūnų gerovė ir odos jautrinimo indukcijos tarpsnio objektyvus matavimas. Vėliau in chemico ir in vitro mechanizmų tyrimais pagrįsti bandymų metodai buvo patvirtinti kaip moksliniu požiūriu tinkami metodai cheminių medžiagų keliamam odos jautrinimo pavojui vertinti. Tačiau bandymų nenaudojant gyvūnų metodų deriniai (in silico, in chemico, in vitro), kaip integruotųjų bandymo ir vertinimo metodų (IATA) dalis, turės visiškai pakeisti šiuo metu atliekamus bandymus su gyvūnais, atsižvelgiant į kiekvieno iš dabar turimų bandymų be gyvūnų metodų apribojimus, susijusius su AOP mechanizmų aprėptimi (2) (3). Šis bandymų metodas (ARE-Nrf2 liuciferazės bandymas) siūlomas antrajam įvykiui tirti, kaip paaiškinta 2 pastraipoje. Buvo pranešimų, kad odą jautrinančios medžiagos indukuoja genus, kuriuos reguliuoja antioksidacinis atsako elementas (ARE) (8) (9). Mažos molekulinės masės elektrofilinės medžiagos, pvz., odą jautrinančios medžiagos gali veikti receptorinį baltymą Keap1 (angl. Kelch-like ECH-associated protein 1), pvz., kovalentiškai modifikuodamos jo cisteino liekaną, dėl ko jis atsiskiria nuo transkripcijos faktoriaus Nrf2 (angl. nuclear factor-erythroid 2-related factor 2). Atsiskyręs Nrf2 gali aktyvinti nuo ARE priklausomus genus, pvz., kurie koduoja II fazės detoksikuojančius fermentus (8) (10) (11). Šiuo metu pagal šį bandymų metodą atliekamas in vitro ARE-Nrf2 liuciferazės bandymas yra tik KeratinoSensTM bandymas, kurio tinkamumo patvirtinimo tyrimai buvo baigti (9) (12) (13) ir jo nepriklausomą ekspertizę atliko Europos Sąjungos bandymų su gyvūnais alternatyvų etaloninė laboratorija (angl. European Union Reference Laboratory for Alternatives to Animal Testing, EURL ECVAM) (14). KeratinoSensTM bandymas buvo laikomas moksliškai pagrįstu, kad galėtų būti naudojamas kaip IATA dalis, kad būtų galima patvirtinti skirtumą tarp odą jautrinančių medžiagų ir odos nejautrinančių medžiagų pavojams klasifikuoti ir ženklinti (14). Laboratorijos, kurios norėtų įdiegti bandymų metodą, gali gauti rekombinantinių ląstelių liniją, naudojamą atliekant KeratinoSensTM bandymą, sudarydamos licencinę sutartį su bandymų metodo kūrėju (15). Apibrėžtys pateiktos 1 priedėlyje. PRADINIAI ASPEKTAI, TAIKOMUMAS IR APRIBOJIMAI Kadangi Keap1-Nrf2-ARE kelio aktyvinimu tiriamas tik antrasis odos jautrinimo AOP atvejis, neatrodo, kad vien šios informacijos, gautos taikant šio kelio aktyvinimu pagrįstus bandymų metodus pakaktų ją naudojant išvadai apie cheminės medžiagos odos jautrinimo gebą gauti. Todėl į duomenis, gautus taikant šį bandymų metodą, reikėtų žiūrėti kaip į integruotųjų metodų, pvz., IATA, dalį, juos derinant su kita papildančia informacija, pvz., gauta atliekant in vitro bandymus, kurie nagrinėja kitus svarbius odos jautrinimo AOP įvykius, taip pat taikant ne bandymų metodus, įskaitant kryžmines nuorodas į cheminius analogus. ARE-Nrf2 liuciferazės bandymų metodo taikymo kartu su kita informacija pavyzdžiai pateikti literatūroje (13) (16) (17) (18) (19). Šis bandymų metodas gali būti taikomas kaip IATA dalis, kad būtų galima patvirtinti skirtumą tarp odą jautrinančių medžiagų (t. y. JT GHS ar CLP 1 kategorijos) ir odos nejautrinančių medžiagų. Šis bandymų metodas negali būti taikomas atskirai odą jautrinančioms medžiagoms priskirti 1A ir 1B subkategorijoms, kaip apibrėžta JT GHS ar CLP, arba prognozuoti jų jautrinimo gebą priimant saugos vertinimo sprendimus. Tačiau teigiamas rezultatas priklausomai nuo reglamentavimo sistemos gali būti naudojamas atskirai, kad cheminė medžiaga galėtų būti priskirta JT GHS ar CLP 1 kategorijai. Atsižvelgiant į tinkamumo patvirtinimo tyrime gautą duomenų rinkinį ir į duomenis, gautus atliekant vidinę bandymo metodo nepriklausomą ekspertizę, buvo patvirtinta, kad KeratinoSensTM bandymų metodą galima pritaikyti laboratorijose, kurios turi darbo su ląstelių kultūromis patirties. Taikant metodą tikėtinas prognozių laboratorinio ir tarplaboratorinio atkuriamumo lygis yra 85 % eilės (14). Su LLNA palyginti KeratinoSensTM bandymo tikslumo (77 % – 155/201), jautrio (78 % – 71/91) ir specifiškumo (76 % – 84/110) rezultatai, atskiriant odą jautrinančias medžiagas (t. y. JT GHS ar CLP 1 kategorijos) ir nejautrinančias medžiagas, buvo apskaičiuoti atsižvelgiant į visus duomenis, pateiktus EURL ECVAM bandymo metodui įvertinti ir ekspertizei atlikti (14). Šie skaičiai yra panašūs į neseniai paskelbtus skaičius, pagrįstus maždaug 145 medžiagų bandymais laboratorijos viduje (tikslumas – 77 %, jautris – 79 %, specifiškumas – 72 %) (13). Labiau tikėtina, kad KeratinoSens TM sumažintų prognozę dėl cheminių medžiagų, kurios rodo mažą ar vidutinę odos jautrinimo gebą (t. y. JT GHS ar CLP 1B subkategorijos), nei dėl cheminių medžiagų, kurios rodo didelę odos jautrinimo gebą (t. y. JT GHS ar CLP 1A subkategorijos) (13) (14). Kartu paimta ši informacija rodo KeratinoSens TM bandymo naudą prisidedant prie odos jautrinimo pavojaus identifikavimo. Tačiau čia pateiktos KeratinoSens TM, kaip atskirai taikomo bandymų metodo, tikslumo vertės yra tik orientacinės, kadangi bandymų metodo duomenis reikėtų nagrinėti kartu su kitais informacijos šaltiniais kaip IATA dalimis ir atsižvelgiant į 9 pastraipos nuostatas. Be to, įvertinant odos jautrinimo metodus, kurie nenaudoja gyvūnų, reikėtų turėti omenyje, kad LLNA bandymas, kaip ir kiti bandymai su gyvūnais, gali nevisiškai atitikti situaciją, susijusią su tiriamąja rūšimi, t. y. žmonėmis. Šiame bandymų metode vartojamas terminas bandomoji cheminė medžiaga reiškia tai, kas yra bandoma, ir nėra susijęs su ARE-Nrf2 liuciferazės bandymo metodo tinkamumu bandyti chemines medžiagas ir (arba) mišinius. Atsižvelgiant į šiuo metu turimų duomenų visumą, buvo įrodyta, kad KeratinoSens TM bandymas tinka bandomosioms cheminėms medžiagoms, kurios aprėpia įvairias organines funkcines grupes, reakcijų mechanizmus, odos jautrinimo gebą (nustatyta atliekant in vivo tyrimus) ir fizikines chemines medžiagų savybes (9) (12) (13) (14). Daugiausia buvo bandomos vienkomponentės medžiagos, nors yra šiek tiek duomenų apie mišinių bandymus (20). Badymų metodas vis dėlto laikomas techniškai tinkamu bandyti daugiakomponentes medžiagas ir žinomos sudėties mišinius. Tačiau, prieš taikant bandymų metodą mišiniui, kad būtų gauti numatomo reglamentavimo tikslui skirti duomenys, reikėtų panagrinėti, ar metodu galima pasiekti tą tikslą atitinkančius rezultatus ir, jei taip, tai dėl kokios priežasties. Tokie svarstymai nereikalingi, kai yra reglamentavimo reikalavimas bandyti mišinį. Be to, bandant daugiakomponentes medžiagas ar mišinius, reikėtų atsižvelgti į citotoksinių sudedamųjų dalių galimus trikdžius, keliamus stebimiems atsakams. Bandymų metodas taikomas tirpioms bandomosioms cheminėms medžiagoms arba jų stabilioms dispersijoms (t. y. koloidams ar suspensijoms, iš kurių bandomoji cheminė medžiaga neiškrenta į nuosėdas ar nesudaro su tirpikliu skirtingų fazių) vandenyje arba DMSO (įskaitant visus bandomosios cheminės medžiagos komponentus, jei bandoma daugiakomponentė medžiaga ar mišinys). Bandomosios cheminės medžiagos, kurios neatitinka šių sąlygų, būdamos reikiamos didžiausios galutinės koncentracijos 2 000 μmol/l (žr. 22 pastraipą), vis tiek gali būti bandomos mažesnės koncentracijos. Tokiu atveju rezultatai, kurie atitinka teigiamo atsako kriterijus, aprašytus 39 pastraipoje, vis tiek galėtų būti naudojami bandomosios cheminės medžiagos, kaip odą jautrinančios medžiagos, identifikavimui patvirtinti, bet neigiamą rezultatą, gautą esant < 1 000 μmol/l koncentracijai, reikėtų laikyti negalutiniu (žr. 39 pastraipoje pateiktą prognozavimo modelį). Paprastai tų medžiagų, kurių logP yra ne didesnis kaip 5, bandymas buvo sėkmingas, o ypač hidrofobinės medžiagos, kurių logP didesnis kaip 7, nepatenka į žinomą metodo taikymo sritį (14). Apie medžiagas, kurių logP yra nuo 5 iki 7, turima tik ribota informacija. Neigiamus rezultatus reikėtų aiškinti atsargiai, nes, taikant bandymų metodą, kaip neigiamos gali būti aptiktos medžiagos, kurios rodo ypač didelį reaktyvumą lizino liekanų atžvilgiu. Be to, dėl ribotos naudojamos ląstelių linijos metabolinės gebos (21) ir dėl bandymo sąlygų prohaptenai (t. y. cheminės medžiagos, kurias būtina aktyvinti fermentais, pvz., P450 fermentais) ir prehaptenai (t. y. cheminės medžiagos, kurios aktyvinamos autooksidacija), ypač esant mažam oksidacijos greičiui, taip pat gali duoti neigiamus rezultatus. Kita vertus, klaidingai teigiami rezultatai gali būti gauti bandomosioms cheminėms medžiagoms, kurios neveikia kaip jautrinančios, bet yra stresą sukeliantys cheminiai veiksniai (14). Be to, neįmanoma visuomet patikimai įvertinti ypač didelio citotoksiškumo bandomąsias chemines medžiagas. Pagaliau, bandomosios cheminės medžiagos, kurios kelia trukdžius liuciferazės fermentui, gali iškreipti jos aktyvumą atliekant bandymus su ląstelėmis, sukeldamos akivaizdų slopinimą arba padidėjusią liuminescenciją (22). Pavyzdžiui, buvo pranešta, kad fitoestrogenai, būdami didesnės kaip 1 μmol/l koncentracijos, trikdo liuminescencijos signalus, kai atliekami kiti liuciferazės reporterinių genų bandymai dėl per didelio liuciferazės reporterinio geno aktyvinimo (23). Dėl to liuciferazės ekspresiją reikia tirti atidžiai, kai ji gaunama esant didelei koncentracijai fitoestrogenų ar panašių cheminių medžiagų, kurios, kaip manoma, sukelia fitoestrogenams būdingą per didelį liuciferazės reporterinio geno aktyvinimą (23). Tais atvejais, kai galima pateikti įrodymų dėl bandymų metodo netinkamumo kitų specifinių kategorijų cheminėms medžiagoms, toms specifinių kategorijų cheminėms medžiagoms bandymų metodo nereikėtų taikyti. Be to, kad patvirtinamas skirtumas tarp odą jautrinančių medžiagų ir nejautrinančių medžiagų, atliekant KeratinoSens TM bandymą, taip pat gaunama informacijos apie koncentracijos ir atsako priklausomybę, ir ši informacija galėtų papildyti jautrinimo gebos vertinimą, kai bandymas naudojamas kaip integruotųjų metodų, pvz., IATA, dalis (19). Tačiau būtinas papildomas darbas, pageidautina pagrįstas gautais patikimais duomenimis apie žmones, kad būtų galima nustatyti, kaip KeratinoSens TM bandymo rezultatai gali prisidėti prie veikimo gebos vertinimo (24) ir jautrinančių medžiagų skirstymo į subkategorijas pagal JT GHS ar CLP. BANDYMO PRINCIPAS ARE-Nrf2 liuciferazės bandymų metode naudojama imortalizuotų adhezinių ląstelių linija, gauta iš HaCaT žmogaus keratinocitų, stabiliu būdu atlikus transfekciją pasirinkta plazmide. Ląstelių linija turi liuciferazės geną, kurio transkripcinę kontrolę atlieka konstitutyvinis promotorius, sujungtas su geno ARE elementu, apie kurį yra žinoma, kad jo aktyvumą gali skatinti odą jautrinančios medžiagos (25) (26). Liuciferazės signalas rodo nuo Nrf2 priklausančių endogeninių genų aktyvinimą odą jautrinančiomis medžiagomis, ir ši rekombinantinių ląstelių linijos liuciferazės signalo priklausomybė nuo Nrf2 buvo įrodyta (27). Todėl, naudojant gerai ištirtus liuminescenciją sukeliančius liuciferazės substratus, galima kiekybiškai matuoti (aptikti liuminescenciją) elektrofilinėmis medžiagomis apdorotų ląstelių liuciferazės geno indukciją, kaip Nrf2 transkripcijos faktoriaus aktyvumo rodiklį. Atliekant KeratinoSens™ bandymą, laikoma, kad bandomųjų cheminių medžiagų atsakas yra teigiamas, jei jos sukelia statistiškai reikšmingą liuciferazės aktyvumo indukciją, kuri būtų didesnė už tam tikrą ribinę vertę (t. y. padidėtų > 1,5 karto arba 50 %), esant koncentracijai, kuri būtų mažesnė nei tam tikra koncentracija, kuri nedaro reikšmingos įtakos ląstelių gyvybingumui (t. y. mažesnei kaip 1 000 μmol/l ir kuriai esant ląstelių gyvybingumas būtų didesnis kaip 70 % (9) (12)). Šiuo tikslu nustatomas maksimalus liuciferazės aktyvumo indukcijos padidėjimas kartais (Imax) palyginti su tirpiklio (neigiamu) kontroliniu ėminiu. Be to, kadangi ląstelės apdorojamos bandomosiomis cheminėmis medžiagomis, imant koncentracijos verčių seriją, koncentraciją, kuri sukeltų didesnę nei ribinė (t. y. EC1,5 vertės) statistiškai reikšmingą liuciferazės aktyvumo indukciją, reikėtų interpoliuoti pagal dozės ir atsako priklausomybės kreivę (skaičiavimai pateikti 32 pastraipoje). Galiausiai reikėtų atlikti vienalaikius citotoksiškumo matavimus, siekiant įvertinti, ar liuciferazės aktyvumo indukcija vyksta esant mažesnėms nei citotoksinės koncentracijos vertėms. Prieš pradėdamos taikyti ARE-Nrf2 liuciferazės bandymų metodą nuolatiniam naudojimui, laboratorijos turėtų įrodyti savo techninę kvalifikaciją, naudodamos dešimt kvalifikacijai tikrinti skirtų cheminių medžiagų, išvardytų 2 priedėlyje. Galima gauti naudojimo charakteristikų standartus (28), kurie padėtų patvirtinti naujus arba modifikuotus į KeratinoSens™ bandymą panašius in vitro ARE-Nrf2 liuciferazės bandymų metodus, kad būtų galima laiku iš dalies pakeisti šį bandymų metodą ir juos įtraukti į bandymų gaires. Savitarpis duomenų pripažinimas (angl. Mutual Acceptance of Data, MAD) pagal EBPO susitarimą bus užtikrintas tik bandymų metodams, kurių tinkamumas būtų patvirtintas atsižvelgiant į naudojimo charakteristikų standartus, jei būtų atlikta šių bandymų metodų ekspertizė ir EBPO juos įtrauktų į atitinkamas bandymų gaires. PROCEDŪRA Šiuo metu į šį bandymų metodą yra įtrauktas tik vienas moksliškai pagrįstas KeratinoSensTM bandymas (9) (12) (13) (14). Galima gauti keratinoSensTM bandymo standartines veiklos procedūras (angl. Standard Operating Procedures, SOP), kurias reikėtų naudoti, įdiegiant ir taikant šį bandymų metodą laboratorijoje (15). Laboratorijos, kurios norėtų įdiegti bandymų metodą, gali gauti rekombinantinių ląstelių liniją, naudojamą atliekant KeratinoSensTM bandymą, sudarydamos licencinę sutartį su bandymų metodo kūrėju. Tolesnėse pastraipose pateikiamas ARE-Nrf2 liuciferazės bandymų metodo pagrindinių komponentų ir procedūrų aprašymas. Keratinocitų kultūrų paruošimas Reikėtų naudoti transgeninių ląstelių liniją, turinčią stabilų liuciferazės reporterinio geno intarpą, kontroliuojamą ARE elemento (pvz., KeratinoSens™ ląstelių linija). Gautos ląstelės dauginamos (pvz., nuo 2 iki 4 sėjimų) ir laikomos užšaldytos kaip vienalytė pradinė kultūra. Šios pradinės kultūros ląstelės gali būti dauginamos iki maksimalaus sėjimų skaičiaus (t. y. 25 sėjimų KeratinoSens TM atveju) ir naudojamos nuolatiniams bandymams, jas imant iš reikiamos maitinimo terpės (KeratinoSens TM atveju tai yra DMEM, turinti serumo ir geneticino). Bandomos ląstelės turėtų būti 80–90 % susiliejusios ir reikėtų imtis priemonių užtikrinti, kad ląstelės niekuomet neaugtų iki visiško susiliejimo. Vieną dieną prieš bandymą ląstelės yra surenkamos ir paskirstomos į 96 duobučių plokšteles (10 000 ląstelių vienai duobutei KeratinoSens TM atveju). Reikėtų žiūrėti, kad sėjant nebūtų ląstelių nusėdimo, ir taip užtikrinti tolygų ląstelių skaičiaus pasiskirstymą tarp duobučių. Jei taip nėra, dėl šio veiksmo gali atsirasti didelis kintamumas tarp duobučių. Kiekvienam kartotiniam liuciferazės aktyvumo matavimų veiksmui naudojami trys kartotiniai ėminiai ir vienas analogiškas ląstelių gyvybingumo bandymo ėminys. Bandomosios cheminės medžiagos ir kontrolinių cheminių medžiagų paruošimas Bandomoji cheminė medžiaga ir kontrolinės cheminės medžiagos ruošiamos bandymo dieną. Atliekant KeratinoSens TM bandymą, bandomosios cheminės medžiagos ištirpinamos dimetilsulfokside (DMSO) galutinei reikiamai koncentracijai gauti (pvz., 200 mmol/l). Galima laikyti, kad DMSO tirpalai yra sterilūs savaime, todėl sterilus filtravimas nebūtinas. DMSO netirpios bandomosios cheminės medžiagos ištirpinamos steriliame vandenyje ar kultūros terpėje ir tirpalai sterilizuojami, pvz., filtruojant. Jei bandomoji cheminė medžiaga neturi nustatytos molekulinės masės, KeratinoSens TM bandymui atlikti ruošiamas numatytosios koncentracijos pradinis tirpalas (40 mg/ml arba 4 % (m/V)). Jei vietoj DMSO, vandens ar kultūros terpės naudojami kiti tirpikliai, tai reikėtų tinkamai moksliškai pagrįsti. Iš pradinių bandomosios cheminės medžiagos tirpalų ruošiama praskiestų tirpalų serija, tirpikliu naudojant DMSO, kad būtų gauta 12 pagrindinių bandomų cheminės medžiagos koncentracijos verčių (nuo 0,098 iki 200 mmol/l KeratinoSens TM bandyme). Jei bandomoji cheminė medžiaga netirpsta DMSO, praskiesti tirpalai pagrindinėms koncentracijos vertėms gauti ruošiami naudojant sterilų vandenį ar sterilią kultūros terpę. Neatsižvelgiant į naudojamą tirpiklį, pagrindinių koncentracijos verčių tirpalai papildomai skiedžiami 25 kartus serumo turinčia kultūros terpe ir galiausiai dar kartą praskiesti 4 kartus naudojami apdorojimui, taigi KeratinoSens TM bandymo bandomosios cheminės medžiagos galutinių koncentracijos verčių intervalas yra nuo 0,98 iki 2 000 μmol/l. Galima naudoti alternatyvias koncentracijos vertes, jei jos būtų pagrįstos (pvz., dėl citotoksiškumo ar blogo tirpumo). Neigiamas (tirpiklio) kontrolinis ėminys, naudojamas KeratinoSens TM bandyme, yra DMSO (CAS Nr. 67-68-5, ≥ 99 % grynumo), kiekvienoje plokštelėje paruošiant šešias jo duobutes. Jis skiedžiamas vienodai su pagrindinių koncentracijos verčių tirpalais, kaip aprašyta 22 pastraipoje, todėl neigiamo (tirpiklio) kontrolinio ėminio galutinė DMSO koncentracija yra 1 %, nes, kaip žinoma, tokios koncentracijos DMSO nedaro įtakos ląstelių gyvybingumui, ir ji atitinka bandomosios cheminės medžiagos ir teigiamo kontrolinio ėminio DMSO koncentraciją. Jei bandomoji cheminė medžiaga netirpsta DMSO ir buvo skiedžiama vandeniu, DMSO koncentracija visose duobutėse su galutiniu bandymo tirpalu turi būti nustatyta lygi 1 %, kaip kitų bandomųjų cheminių medžiagų ir kontrolinių cheminių medžiagų. Teigiama kontrolinė medžiaga, naudojama atliekant KeratinoSens TM bandymą, yra cinamono aldehidas (CAS Nr. 14371-10-9, ≥ 98 % grynumo), iš kurio, skiedžiant DMSO, ruošiama 5 pagrindinių koncentracijos verčių nuo 0,4 iki 6,4 mmol/l tirpalų serija (iš 6,4 mmol/l pradinio tirpalo) ir tirpalai toliau skiedžiami, kaip aprašyta 22 pastraipoje dėl pagrindinių koncentracijos verčių, taigi galutinė teigiamo kontrolinio ėminio koncentracija yra nuo 4 iki 64 μmol/l. Galima naudoti kitas teigiamas kontrolines medžiagas, pageidautina tas, kurioms EC1,5 vertė būtų gaunama per intervalo vidurį, jei yra istorinių duomenų palyginamiems bandymų priėmimo kriterijams gauti. Bandomosios cheminės medžiagos ir kontrolinių cheminių medžiagų įterpimas Reikia atlikti vieną kiekvienos bandomosios cheminės medžiagos ir teigiamos kontrolinės cheminės medžiagos bandymą, kurį sudarytų ne mažiau kaip du nepriklausomi kartotiniai trijų kartotinių ėminių bandymai (t. y. n = 6) kad būtų gauta prognozė (teigiama ar neigiama). Jei nepriklausomų kartotinių bandymų rezultatai būtų prieštaraujantys, reikėtų atlikti trečiąjį kartotinį bandymą naudojant tris kartotinius ėminius (t. y. n = 9). Kiekvienas nepriklausomas kartotinis bandymas atliekamas ne tą pačią dieną, naudojant naują bandomosios cheminės medžiagos pradinį tirpalą ir nepriklausomai surinktas ląsteles. Tačiau ląstelės gali būti to paties sėjimo. Pasėtos, kaip aprašyta 20 pastraipoje, ląstelės 24 h auginamos 96 duobučių mikrotitravimo plokštelėse. Tada terpė pašalinama ir pakeičiama nauja kultūros terpe (150 μl kultūros terpės, turinčios serumo, bet be geneticino KeratinoSens TM atveju), į kurią įlašinama 50 μl 25 kartus praskiestos bandomosios cheminės medžiagos ir kontrolinių cheminių medžiagų. Bent vieną plokštelės duobutę reikėtų palikti tuščią (be ląstelių ir be apdorojimo), kad būtų įvertintos foninės vertės. Atliekant KeratinoSens TM bandymą, apdorotos plokštelės inkubuojamos maždaug 48 h 37 ± 1 °C temperatūroje, esant 5 % CO2. Reikėtų imtis priemonių lakiųjų bandomųjų cheminių medžiagų nuostoliams ir kryžminei bandomųjų cheminių medžiagų taršai tarp duobučių išvengti, pvz., uždengiant plokšteles folija prieš inkubavimą su bandomąja chemine medžiaga. Liuciferazės aktyvumo matavimai Trys veiksniai yra labai svarbūs, kad būtų galima užtikrinti reikiamus liuminescencijos rodmenis:
Prieš bandymą reikėtų atlikti kontrolinį bandymą pagal 3 priedėlyje aprašytą procedūrą, kad būtų galima įsitikinti, ar šie trys reikalavimai yra įvykdyti. Po 48 h trukmės apdorojimo bandomąja chemine medžiaga ir kontrolinėmis cheminėmis medžiagomis, atliekant KeratinoSens TM bandymą, ląstelės plaunamos fiziologiniu tirpalu fosfatiniame buferiniame tirpale ir atitinkamu lizės buferiniu tirpalu, įlašinamu į kiekvieną duobutę 20 min kambario temperatūroje, liuminescencijos rodmenims gauti. Plokštelės su ląstelių lizatu dedamos į liuminometrą rodmenims gauti, kuris atliekant KeratinoSens TM bandymą yra suprogramuotas: i) įlašinti liuciferazės substrato į kiekvieną duobutę (t. y. 50 μl), ii) palaukti 1 s ir iii) integratuoti liuciferazės aktyvumą 2 s laikotarpiu. Jei naudojami alternatyvūs nuostačiai, pvz., atsižvelgiant į naudojamo liuminometro modelį, juos reikėtų pagrįsti. Be to, galima naudoti švytinti substratą, jei sėkmingai atliekamas 3 priedėlyje aprašytas kokybės kontrolės bandymas. Citotoksiškumo vertinimas Kad būtų galima atlikti KeratinoSensTM ląstelių gyvybingumo bandymą, veikimo terpė po 48 h trukmės pakeičiama nauja terpe, turinčia MTT (3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazolinio bromido, tiazolilo mėlynojo tetrazolinio bromido, CAS Nr. 298–93–1)] ir ląstelės inkubuojamos 4 h 37 °C temperatūroje esant 5 % CO2. MTT terpė pašalinama ir per naktį atliekama ląstelių lizė (pvz., į kiekvieną duobutę įpilant 10 % natrio dodecilsulfato tirpalo). Sumaišius tirpalą, fotometru matuojama absorbcija, esant 600 nm bangos ilgiui. DUOMENYS IR ATASKAITOS RENGIMAS Duomenų įvertinimas Atliekant KeratinoSensTM tyrimą, apskaičiuojami šie parametrai:
1 lygtis:
čia
EC1,5 apskaičiuojama tiesinės interpoliacijos metodu pagal 2 lygtį, o visuminė EC1,5 apskaičiuojama kaip atskirų kartotinių ėminių geometrinis vidurkis. 2 lygtis:
čia:
Gyvybingumas apskaičiuojamas pagal 3 lygtį: 3 lygtis:
čia:
IC 50 ir IC 30 apskaičiuojamos tiesinės interpoliacijos metodu pagal 4 lygtį, o visuminės IC 50 ir IC 30 yra apskaičiuojamos kaip atskirų kartotinių ėminių geometrinis vidurkis 4 lygtis:
čia:
Kiekvienai koncentracijos vertei, kuriai gaunama > 1,5 karto didesnė liuciferazės aktyvumo indukcija, apskaičiuojamas statistinio reikšmingumo lygmuo (pvz., taikant dvipusį Stjudento t kriterijų), lyginant trijų kartotinių ėminių liuminescencijos vertes su liuminescencijos vertėmis tirpiklio (neigiamo) kontrolinio ėminio duobutėse, kad būtų nustatyta, ar liuciferazės aktyvumo indukcija yra statistiškai reikšminga (p < 0,05). Mažiausia koncentracija, kuriai esant gaunama > 1,5 karto didesnė liuciferazės aktyvumo indukcija, yra vertė, pagal kurią nustatoma EC 1,5 vertė. Kiekvieną kartą tikrinama, ar ši vertė yra mažesnė nei IC 30 vertė, ir tai rodytų, kad esant EC 1,5 apsprendžiančiai koncentracijai ląstelių gyvybingumo sumažėjimas yra mažesnis kaip 30 %. Rekomenduojama duomenis tikrinti vizualiai pagal grafikus. Jei nėra aiškios dozės ir atsako kreivės arba gauta dozės ir atsako kreivė yra dvifazė (t. y. 1,5 karto atitinkančią ribą kerta du kartus), bandymą reikėtų pakartoti, kad būtų galima patikrinti, ar tai yra susiję su bandomąja chemine medžiaga ar dėl bandymo artefakto. Jei, atliekant nepriklausomą bandymą, dvifazis atsakas pasikartoja, ataskaitoje reikėtų nurodyti mažesnę EC1,5 vertę (koncentracija, kuriai esant 1,5 karto atitinkanti riba kertama pirmą kartą). Retais atvejais, kai stebima statistiškai nereikšminga daugiau kaip 1,5 karto didesnė indukcija, po kurios didesnei koncentracijai gaunama statistiškai reikšminga indukcija, šio kartotinio bandymo rezultatai laikomi tinkamais ir teigiamais, jei didesnė kaip ribinė 1,5 karto statistiškai reikšminga indukcija buvo gauta esant citotoksiškumo nesukeliančiai koncentracijai. Galiausiai, jei 1,5 karto ar dar didesnę indukciją bandomosios cheminės medžiagos sukelia esant mažiausiai bandymo koncentracijai 0,98 μmol/l, nustatoma EC 1,5 < 0,98 vertė pagal vizualiai ištirtą dozės ir atsako kreivę. Priimtinumo kriterijai Atliekant KeratinoSens TM bandymą, reikėtų atitikti šiuos priimtinumo kriterijus. Pirma, teigiamai kontrolinei cheminei medžiagai, cinamono aldehidui, gauta liuciferazės aktyvumo indukcija turėtų būti statistiškai reikšmingai didesnė nei 1,5 karto ribinė vertė (pvz., taikant t kriterijų) bent vienai bandymo koncentracijai (nuo 4 iki 64 μmol/l). Antra, EC1,5 vertė turėtų patekti bandymo laboratorijos istorinio vidurkio dviejų standartinių nuokrypių intervalą (pvz., nuo 7 μmol/l iki 30 μmol/l, pagal tinkamumo patvirtinimo duomenų rinkinį), vidurkį reguliariai atnaujinant. Be to, 64 μmol/l koncentracijos cinamono aldehido trijų kartotinių ėminių vidutinė indukcija turėtų būti nuo 2 iki 8. Jei pastarasis kriterijus nevykdomas, cinamono aldehidą reikėtų kruopščiai patikrinti ir bandymai gali būti priimti tik tuo atveju, jei yra aiški dozės ir atsako priklausomybė, kai, didėjant teigiamos kontrolinės cheminės medžiagos koncentracijai, liuciferazės aktyvumo indukcija didėja. Galiausiai, atliekant kiekvieną kartotinį bandymą, kurį sudaro trijų kartotinių ėminių 6 duobutės, neigiamo (tirpiklio) DMSO kontrolinio ėminio liuminescencijos rodmens vidutinis variacijos koeficientas turėtų būti mažesnis kaip 20 %. Jei kintamumas didesnis, rezultatus reikėtų atmesti. Rezultatų aiškinimas ir prognozavimo modelis KeratinoSens TM prognozė laikoma teigiama, jei visos šios 4 sąlygos įvykdomos 2 iš 2 ar 2 iš 3 kartotinių bandymų, kitaip KeratinoSens TM prognozė laikoma neigiama (1 paveikslas):
Jei atliekant tam tikrą kartotinį bandymą, įvykdomos visos trys pirmosios sąlygos, bet negalima matyti aiškios liuciferazės indukcijos dozės ir atsako priklausomybės, to kartotinio bandymo rezultatą reikėtų laikyti negalutiniu ir gali prireikti papildomų bandymų (1 paveikslas). Be to, negalutiniu reikėtų laikyti neigiamą rezultatą, gautą < 1 000 μmol/l (ar < 200 μg/ml, jei tai nenustatytos molekulinės masės bandomoji cheminė medžiaga) koncentracijai (žr. 11 pastraipą). 1 paveikslas. Prognozavimo modelis, naudojamas atliekant KeratinoSensTM bandymą. Į KeratinoSensTM prognozę reikėtų žiūrėti kaip į IATA sistemos dalį ir atsižvelgti į 9 ir 11 pastraipų nuostatas.
Retais atvejais bandomosios cheminės medžiagos, sukeliančios liuciferazės aktyvumo indukciją, kai jų koncentracija yra labai arti citotoksiškumo koncentracijos, atliekant vienus kartotinius bandymus gali būti teigiamos, kai jų koncentracija mažesnė nei citotoksiškumo koncentracija (t. y. EC 1,5 apsprendžianti koncentracija mažesnė nei (<) IC 30), o atliekant kitus kartotinius bandymus, gali būti teigiamos tik esant citotoksiškumo koncentracijai (t. y. EC 1,5 apsprendžiančiai koncentracijai didesnei kaip (>) IC 30). Tokias bandomąsias chemines medžiagas reikėtų bandyti pakartotinai, dozės ir atsako analizę atliekant siauresniame intervale ir naudojant mažesnį skiedimo faktorių (pvz., praskiedimas tarp duobučių skiriasi 1,33 ar Ö2 (= 1,41) karto), kad būtų nustatyta, ar esant citotoksiškumo koncentracijai indukcija vyko ar nevyko (9). Bandymo ataskaita Į bandymo ataskaitą turėtų būti įtraukta ši informacija:
LITERATŪRA
1 priedėlis APIBRĖŽTYS Tikslumas – bandymo metodo rezultatų ir patvirtintų pamatinių verčių sutapimo artumas. Tikslumas yra bandymo metodo taikymo charakteristikų matas ir vienas iš „tinkamumo“ aspektų. Terminas dažnai vartojamas kaip lygiavertis terminui „atitiktis“ tinkamų bandymo metodo rezultatų daliai išreikšti (29). Nepalankios baigties kelias (angl. Adverse Outcome Pathway, AOP) – įvykių seka nuo tikslinės cheminės medžiagos ar panašių cheminių medžiagų grupių cheminės sandaros per molekulinio inicijavimo įvykį iki in vivo tiriamo rezultato (2). ARE – antioksidacinis atsako elementas (angl. Antioxidant response element) (taip pat vadinamas EpRE, elektrofilinis atsako elementas) yra atsako elementas, randamas daugelio citoprotektorių genų ir II fazės genų priekinėje promotorinėje srityje. Aktyvinamas Nfr2, jis tarpininkauja šių genų transkripcinei indukcijai. Cheminė medžiaga – medžiaga arba mišinys. Variacijos koeficientas – kintamumo matas, apskaičiuojamas kartotinių ėminių duomenų grupei kaip standartinio nuokrypio ir vidurkio dalmuo. Jį galima padauginti iš 100, kad būtų išreikštas procentais. EC 1,5 – koncentracija gauta interpoliacijos būdu, kai liuciferazės indukcijos vertė yra didesnė 1,5 karto. IC 30 – koncentracija, kuriai esant ląstelių gyvybingumas sumažėja 30 %. IC 50 – koncentracija, kuriai esant ląstelių gyvybingumas sumažėja 50 %. Pavojus – būdingoji agento savybė arba situacija, galinti sukelti neigiamų padarinių, kai organizmą, sistemą ar populiaciją (arba jos dalį) veikia tas agentas. Integruotasis bandymo ir vertinimo metodas (angl. Integrated Approach to Testing and Assessment, IATA) – struktūrinis metodas, taikomas cheminės medžiagos ar cheminių medžiagų grupės (galimam) pavojui identifikuoti, pavojui (veikimo gebai) apibūdinti ir (arba) saugai vertinti (galimo pavojaus ir (arba) veikimo gebos ir veikimo), kurį taikant strategiškai apjungiami į vieną visumą ir įvertinami visi susiję duomenys, kad būtų galima pateikti informaciją reglamentavimo sprendimui priimti dėl galimo pavojaus ir (arba) rizikos, ir (arba) dėl būtinumo atlikti papildomą tikslinį, taigi minimalų bandymą. I max – maksimalus liuciferazės aktyvumo indukcijos padidėjimo palyginti su tirpiklio (neigiamu) kontroliniu ėminiu rodiklis, išmatuotas esant kuriai nors bandomosios cheminės medžiagos koncentracijai. Keap1 – Keap1 (angl. Kelch-like ECH-associated protein 1) yra receptorinis baltymas, kuris gali reguliuoti Nrf2 aktyvumą. Indukavimo nebuvimo sąlygomis Keap1 receptorinis baltymas pasirenka Nrf2 transkripcijos faktorių kaip ubikvitinilinimo ir proteolitinio skaidymo proteasomoje taikinį. Dėl reaktyviųjų Keap1 cisteino liekanų modifikavimo, susidarant jų kovalentiniam ryšiui su mažomis molekulėmis, Nrf2 gali atsiskirti nuo Keap1 (8) (10) (11)8) (10) (11). Mišinys – iš dviejų arba daugiau medžiagų sudarytas mišinys arba tirpalas, kuriame jos nereaguoja (1) Vienkomponentė medžiaga – medžiaga, kurią apibrėžia jos kiekybinė sudėtis, kai vienas pagrindinis komponentas sudaro ne mažiau kaip 80 % (masės). Daugiakomponentė medžiaga – medžiaga, kurią apibrėžia jos kiekybinė sudėtis, kai daugiau kaip vieno pagrindinio komponento koncentracija ≥ 10 % (masės) ir < 80 % (masės). Daugiakomponentė medžiaga yra gamybos proceso rezultatas. Skirtumas tarp mišinio ir daugiakomponentės medžiagos yra tas, kad mišinys gaunamas sumaišant dvi medžiagas arba daugiau nevykstant cheminei reakcijai. Daugiakomponentė medžiaga yra cheminės reakcijos rezultatas. Nrf2 – Nrf2, branduolinis faktorius (angl. nuclear factor (erythroid-derived 2)-like 2 factor), yra transkripcijos faktorius, kuris dalyvauja antioksidacinio atsako kelyje. Kai Nrf2 nėra ubikvitinilintas, jis gaminasi citoplazmoje ir perkeliamas į branduolius, kur jis jungiasi prie ARE daugelio citoprotekcinių genų priekinėje promotorinėje srityje, inicijuodamas jų transkripciją (8) (10) (11). Teigiamas kontrolinis ėminys – kartotinis ėminys, turintis visus bandymo sistemos komponentus ir apdorotas chemine medžiaga, kuri yra žinoma kaip sukelianti teigiamą atsaką. Siekiant užtikrinti galimybę vertinti teigiamo kontrolinio ėminio atsako kintamumą per tam tikrą laiką, teigiamas atsakas neturėtų būti per stiprus. Tinkamumas – santykio tarp bandymo ir tiriamo poveikio bei bandymo reikšmingumo bei naudingumo siekiant tam tikro tikslo apibūdinimas. Tai yra atliekant bandymą tiriamo biologinio poveikio matavimo ar prognozavimo tikslumo laipsnis. Tinkamumas aprėpia bandymų metodo tikslumo (atitikties) aspektą (29). Patikimumas – pagal tą patį protokolą atliekamo bandymų metodo, tam tikrą laiką taikomo laboratorijose ir tarp laboratorijų, atkuriamumo laipsnio matas. Jis įvertinamas apskaičiuojant atkuriamumą laboratorijoje ir tarp laboratorijų ir pakartojamumą laboratorijoje (29). Atkuriamumas – rezultatų, gautų pagal vienodą bandymų protokolą bandant tą pačią cheminę medžiagą, sutapimas (žr. patikimumas) (29). Jautris – visų teigiamų ar veikliųjų cheminių medžiagų, kurios buvo tiksliai klasifikuotos atliekant bandymą, dalis. Jis yra bandymų metodo, kuriuo gaunami kategorijos nustatymo rezultatai, tikslumo matas ir svarbus aspektas vertinant bandymų metodo tinkamumą (29). Tirpiklio ar nešiklio kontrolinis ėminys – visus bandymo sistemos komponentus, įskaitant tirpiklį ar nešiklį, turintis kartotinis ėminys. Jis naudojamas tam, kad būtų nustatyta atskaitos vertė ėminiams, apdorotiems bandomąja chemine medžiaga, ištirpinta tame pačiame tirpiklyje. Specifiškumas – visų neigiamų ar neveikliųjų cheminių medžiagų, kurios buvo tiksliai klasifikuotos atliekant bandymą, dalis. Jis yra bandymų metodo, kuriuo gaunami kategorijos nustatymo rezultatai, tikslumo matas ir svarbus aspektas vertinant bandymų metodo tinkamumą (29). Medžiaga – gamtoje randami arba gamybos procese gaunami cheminiai elementai ir jų junginiai, įskaitant visus priedus, kurių reikia produkto stabilumui užtikrinti, ir visas priemaišas, patenkančias į produktą taikomo proceso metu, tačiau neįskaitant tirpiklio, kurį galima atskirti, nepaveikiant medžiagos stabilumo ar nekeičiant jos sudėties (1). Bandomoji cheminė medžiaga – terminas bandomoji cheminė medžiaga vartojamas bandomam dalykui nurodyti. Jungtinių Tautų visuotinai suderinta cheminių medžiagų klasifikavimo ir ženklinimo sistema (JT GHS) – sistema, kurioje pateikiamas cheminių medžiagų (medžiagų ir mišinių) klasifikavimas pagal standartizuotus fizikinių pavojų, pavojų sveikatai bei aplinkai tipus ir nagrinėjami atitinkami informaciniai elementai, pvz., piktogramos, signaliniai žodžiai, pavojingumo frazės, atsargumo frazės ir saugos duomenų lapai, kad būtų galima informuoti apie medžiagų neigiamą poveikį, siekiant apsaugoti žmones (įskaitant darbuotojus, darbininkus, vežėjus, vartotojus ir avarijų likvidatorius) ir aplinką (1). UVCB – nežinomos ar kintamos sudėties medžiagos, sudėtingųjų reakcijų produktai ar biologinės medžiagos. Patvirtinto tinkamumo bandymų metodas – bandymų metodas, kurio tinkamumo ir patikimumo pakanka tam tikram tikslui pasiekti ir kuriam taikomi moksliškai pagrįsti principai. Bandymų metodas niekuomet nėra visiškai tinkamas absoliučiąja prasme, bet tik tam tikro tikslo atžvilgiu (29). 2 priedėlis KVALIFIKACIJAI TIKRINTI SKIRTOS CHEMINĖS MEDŽIAGOS Odos jautrinimas in vitro. ARE-Nrf2 liuciferazės bandymų metodas Prieš pradėdamos įprastiniu būdu taikyti šį bandymų metodą, laboratorijos turėtų įrodyti savo techninę kvalifikaciją, gaudamos tinkamą KeratinoSens™ prognozę dėl 10 kvalifikacijai tikrinti skirtų cheminių medžiagų, rekomenduotų 1 lentelėje, ir gaudamos EC1,5 bei IC50 vertes, kurios patenka į atitinkamus etaloninius intervalus, ne mažiau kaip 8 iš 10 kvalifikacijai tikrinti skirtų cheminių medžiagų. Kvalifikacijai tikrinti skirtos cheminės medžiagos buvo pasirinktos taip, kad atitiktų odos jautrinimo pavojų intervalą. Kiti atrankos kriterijai buvo galimybė pirkti chemines medžiagas ir tai, ar galima gauti aukštos kokybės in vivo etalonus ir aukštos kokybės KeratinoSens TM bandymo in vitro duomenis. 1 lentelė Cheminės medžiagos, rekomenduojamos techninei kvalifikacijai tikrinti taikant KeratinoSensTM bandymą
3 priedėlis LIUMINESCENCIJOS MATAVIMO KOKYBĖS KONTROLĖ Pagrindinis bandymas atliekant KeratinoSensTM tyrimą, kad būtų užtikrinti optimalūs liuminescencijos matavimai Šie trys parametrai yra ypač svarbūs, kad liuminometru būtų gauti patikimi rezultatai:
Prieš bandymus rekomenduojama užtikrinti tinkamus liuminescencijos matavimus, bandant kontrolinės plokštelės rinkinį, kaip aprašyta toliau (trijų kartotinių ėminių analizė). Pirmojo mokomojo bandymo plokštelės rinkinys
EGDMA– etilenglikolio dimetakrilatas (CAS Nr. 97-90-5), stipriai indukuojanti cheminė medžiaga, CA– cinamono aldehidas, teigiama etaloninė cheminė medžiaga (CAS Nr. 104-55-2). Kokybės kontrolės analizė turėtų rodyti:
B.61 Fluoresceino nuotėkio bandymų metodas akis ėsdinančioms ir stipriai dirginančioms medžiagoms identifikuoti ĮVADAS Šis bandymų metodas atitinka EBPO bandymų gaires (TG) 460 (2012). Fluoresceino nuotėkio (angl. Fluorescein Leakage, FL) bandymų metodas yra bandymų metodas in vitro, kuris tam tikromis aplinkybėmis ir esant tam tikriems apribojimams gali būti taikomas cheminėms medžiagoms (medžiagoms ir mišiniams) klasifikuoti kaip akis ėsdinančias ir stipriai dirginančias medžiagas, kaip apibrėžta Jungtinių Tautų (JT) visuotinai suderintoje cheminių medžiagų klasifikavimo ir ženklinimo sistemoje (GHS) (1 kategorijos), Reglamente (EB) Nr. 1272/2008 dėl cheminių medžiagų ir mišinių klasifikavimo, ženklinimo ir pakavimo (CLP) (31) (1 kategorijos) ir JAV Aplinkos apsaugos agentūros (AAA) (angl. Environmental Protection Agency, EPA) (I kategorijos) (1)(2). Šiame bandymų metode kaip stipriai dirginančios cheminės medžiagos yra apibrėžiamos cheminės medžiagos, kurios sukelia akies audinių pažeidimą, neišnykstantį per 21 parą nuo įterpimo, arba sukelia smarkų fizinį regėjimo pablogėjimą, o akis ėsdinančios cheminės medžiagos yra cheminės medžiagos, kurios sukelia negrįžtamąjį akies audinio pažeidimą. Šios cheminės medžiagos yra klasifikuojamos kaip JT GHS 1 kategorijos, ES CLP 1 kategorijos arba JAV AAA I kategorijos. Nors FL bandymų metodas nelaikomas tinkamu visiškai pakeisti triušių akių bandymą in vivo, FL rekomenduojamas kaip klasifikavimo ir ženklinimo reguliavimo tikslais taikomų nuosekliųjų bandymų strategijos dalis. Todėl FL rekomenduojamas kaip pirmas žemynkrypčio metodo etapas akis ėsdinančioms ar stipriai dirginančioms cheminėms medžiagoms identifikuoti, specialiai skirtas tik tam tikro tipo cheminėms medžiagoms (t. y. vandenyje tirpioms medžiagoms ir mišinimas) (3)(4). Šiuo metu visuotinai pripažįstama, kad artimiausioje ateityje joks atskiras in vitro akių dirginimo bandymas negalės pakeisti in vivo akių bandymo (TM B.5 (5)), kad būtų galima prognozuoti skirtingų cheminių klasių visą dirginimo būdų intervalą. Tačiau kelių alternatyvių bandymų metodų strateginiai deriniai taikant (nuosekliųjų) bandymų strategiją galėtų pakeisti in vivo akių bandymą (4). Žemynkryptis metodas (4) skirtas taikyti tada, kai, atsižvelgiant į esamą informaciją, daroma prielaida apie didelę cheminės medžiagos dirginamojo poveikio gebą. Taikant prognozavimo modelį, išsamiai aprašytą 35 pastraipoje, FL bandymų metodu be jokio papildomo bandymo galima identifikuoti chemines medžiagas kaip akis ėsdinančias ar stipriai dirginančias (JT GHS 1 kategorijos; ES CLP 1 kategorijos; JAV AAA I kategorijos), esant ribotai metodo taikymo sričiai. Tokia pati prielaida daroma dėl mišinių, nors atliekant tinkamumo patvirtinimą, mišiniai nebuvo naudojami. Todėl FL bandymų metodas gali būti taikomas cheminių medžiagų akių dirginimo ar ėsdinimo gebai nustatyti, laikantis TM B.5 nuosekliųjų bandymų strategijos (5). Tačiau cheminę medžiagą, kuriai taikant FL bandymų metodą nebuvo gauta akių ėsdinimo ar stipraus dirginimo prognozės, reikėtų bandyti vienu ar keliais papildomais bandymų metodais (in vitro ir (arba) in vivo), kad būtų galima tiksliai identifikuoti i) chemines medžiagas, kurios pagal FL yra in vitro klaidingai neigiamos akis ėsdinančios ar stipriai dirginančios (JT GHS 1 kategorijos, ES CLP 1 kategorijos, JAV AAA I kategorijos); ii) chemines medžiagas, kurios neklasifikuojamos dėl akių ėsdinimo ar dirginimo (JT GHS be kategorijos, ES CLP be kategorijos, U.S. EPA IV kategorijos) ir (arba) iii) chemines medžiagas, kurios yra vidutiniškai ar nestipriai akis dirginančios (JT GHS 2A ir 2B kategorijos, ES CLP 2 kategorijos, JAV AAA II ir III kategorijos). Šio bandymo metodo tikslas – aprašyti procedūras, taikomas įvertinant akių ėsdinimo ar stipraus dirginimo bandomąja chemine medžiaga galimybę, matuojant jos gebą pažeisti sandarų susiliejusių epitelio ląstelių monosluoksnį. Epitelio pralaidumo vientisumas yra pagrindinė epitelio funkcija, kurią atlieka junginės ir ragenos epitelis. Epitelio pralaidumą reguliuoja įvairios sandarios jungtys. Buvo įrodyta, kad epitelio pralaidumo padidėjimas in vivo yra susijęs su uždegimo lygiu ir paviršiaus pažeidimu, stebimu stiprėjant akių dirginimui. Taikant FL bandymų metodą, toksinis bandomosios cheminės medžiagos poveikis po trumpalaikio veikimo matuojamas kaip fluoresceino natrio druskos pralaidumo per epitelio monosluoksnį, kurį sudaro ant pralaidžių įdėklų auginamos Madin Darby šunų inkstų (angl. Madin-Darby Canine Kidney, MDCK) ląstelės, padidėjimas. Vykstančio fluoresceino nuotėkio vertė yra proporcinga cheminės medžiagos sukeltam sandarių jungčių, desmosominių jungčių ir ląstelių membranų pažeidimui ir gali būti naudojama kaip bandomosios cheminės medžiagos toksiškumo akims stiprumo įvertis. 1 priedėlyje pateikta FL bandymų metodui skirtų MDCK ląstelių auginimo ant įdėklo membranos schema. Apibrėžtys pateiktos 2 priedėlyje. PRADINIAI ASPEKTAI IR APRIBOJIMAI Šis bandymų metodas yra pagrįstas INVITTOX protokolu Nr. 71 (6), kuris buvo įvertintas tarptautiniame tinkamumo patvirtinimo tyrime, kurį atliko Europos alternatyvių metodų patvirtinimo centras (ECVAM), bendradarbiaudamas su JAV alternatyvių metodų patvirtinimo tarpžinybiniu koordinavimo komitetu (ICCVAM) ir Japonijos alternatyvių metodų patvirtinimo centru (JaCVAM). FL bandymų metodas nerekomenduojamas, kai reikia identifikuoti chemines medžiagas, kurias reikėtų klasifikuoti kaip akis vidutiniškai ar nestipriai dirginančias, arba chemines medžiagas (medžiagas ir mišinius), kurių nereikėtų klasifikuoti dėl akių dirginimo (t. y. JT GHS 2A ar 2B kategorijos, be kategorijos, ES CLP 2 kategorijos, be kategorijos, JAV AAA II, III ir IV kategorijos), kaip buvo įrodyta atliekant patvirtinimo tyrimą (3) (7). Bandymų metodas taikomas tik vandenyje tirpioms cheminėms medžiagoms (medžiagoms ir mišiniams). Taikant FL bandymų metodą, paprastai galima tiksliai prognozuoti vandenyje tirpių cheminių medžiagų stiprų akių dirginimą ir (arba) chemines medžiagas, kurių toksiniam poveikiui įtakos nedaro praskiedimas (7). Cheminė medžiaga turėtų būti tirpi steriliame kalcio jonų turinčiame (1,0-1,8 mmol/l koncentracijos) Hankso subalansuotame druskos tirpale (HBSS) be fenolio raudonojo, esant koncentracijai ≥ 250 mg/ml (didesnei nei 100 mg/ml ribinei dozei), kad ją būtų galima klasifikuoti kaip bandymo sąlygomis vandenyje tirpią cheminę medžiagą. Tačiau jei bandomosios cheminės medžiagos tirpumas yra mažesnis kaip 100 mg/ml, bet toje koncentracijoje ji sukelia 20 % FL (t. y. FL20 < 100 mg/ml), ją vis dar galima klasifikuoti kaip GHS 1 kategorijos ar AAA I kategorijos. Dėl nustatytų šio bandymų metodo apribojimų į jo taikymo sritį neįtraukiamos stiprios rūgštys ir bazės, ląstelių fiksavimo priemonės ir labai lakios cheminės medžiagos. Šių cheminių medžiagų veikimo mechanizmo negalima nustatyti FL bandymų metodu, pvz., didelio laipsnio koaguliacija, muilinimas ar specifinės cheminės reakcijos. Kiti nustatyti šio metodo apribojimai yra pagrįsti prognozavimo dėl spalvotųjų ir klampių bandomųjų cheminių medžiagų gebos rezultatais (7). Daroma prielaida, kad abiejų tipų chemines medžiagas sunku pašalinti nuo monosluoksnio po trumpalaikio veikimo ir kad bandymų metodo prognozavimo gebą būtų galima pagerinti atliekant didesnį plovimo veiksmų skaičių. Kietųjų cheminių medžiagų suspensijos turi polinkį iškristi į nuosėdas ir gali būti sunku nustatyti jų galutinę koncentraciją prie ląstelių. Iš duomenų bazės pašalinus šių cheminių ir fizikinių klasių chemines medžiagas, FL bandymų metodo tikslumas pagal ES, EPA ir GHS klasifikavimo sistemas iš esmės pagerėjo (7). Tačiau, atsižvelgiant į šio bandymų metodo tikslą (t. y. identifikuoti tik akis ėsdinančias ar stipriai dirginančias chemines medžiagas), klaidingai neigiamų rezultatų dalis (žr. 13 pastraipą) esmės nekeičia, nes priklausomai nuo reglamentavimo reikalavimų tokios cheminės medžiagos vėliau būtų bandomos atliekant tinkamai patvirtintus bandymus in vitro arba bandymą su triušiais įrodomosios duomenų galios metodui (5) taikant nuosekliųjų bandymų strategiją (taip pat žr. 3 ir 4 pastraipas). Kiti nustatyti FL bandymų metodo apribojimai yra pagrįsti klaidingai neigiamų rezultatų ir klaidingai teigiamų rezultatų dalimi. Kai taikomas kaip pradinis žemynkrypčio metodo etapas, kad būtų identifikuotos akis ėsdinančios ar stipriai dirginančios vandenyje tirpios cheminės medžiagos ir mišiniai (JT GHS 1 kategorijos, ES CLP 1 kategorijos, JAV AAA I kategorijos), su in vivo rezultatais palygintų FL bandymų metodo klaidingai teigiamų rezultatų dalis buvo nuo 7 % (7/103, JT GHS ir ES CLP) iki 9 % (9/99, JAV AAA), o klaidingai neigiamų rezultatų dalis buvo nuo 54 % (15/28, JAV AAA) iki 56 % (27/48, JT GHS ir ES CLP). Cheminės grupės, kurioms taikant FL bandymų metodą gaunami klaidingai teigiami ir (arba) klaidingai neigiami rezultatai, šame dokumente neapibrėžtos. Tam tikri techniniai apribojimai yra susiję su MDCK ląstelių kultūra. Didėjant sėjimų skaičiui, blogėja sandarių jungčių, kurios trukdo fluoresceino natrio druskos dažikliui prasiskverbti per monosluoksnį, kokybė. Dėl nevisiško sandarių jungčių susidarymo padidėja neapdorotiems kontroliniams ėminiams gautas FL. Todėl svarbu nustatyti tam tikrą leidžiamą maksimalų nuotėkį, kuris būtų gautas neapdorotiems kontroliniams ėminiams (žr. 38 pastraipą, nuotėkis 0 %). Kaip visų kitų bandymų in vitro atveju, ląstelės bėgant laikui turi galimybę pasikeisti, todėl svarbu nurodyti bandant atliekamų ląstelių sėjimų skaičiaus intervalus. Dabartinę taikomumo sritį kai kuriais atvejais galima išplėsti, bet tik atlikus tirtų bandomųjų cheminių medžiagų išplėsto duomenų rinkinio, pageidautina gauto bandymų keliu, analizę (3). Šis bandymų metodas bus atnaujinamas, kai tik bus išnagrinėta nauja informacija ir duomenys. Kiekviena laboratorija, kuri pradėtų taikyti šį bandymo metodą, turėtų naudoti kvalifikacijai tikrinti skirtas chemines medžiagas, nurodytas 3 priedėlyje. Laboratorijos gali naudoti šias chemines medžiagas, norėdamos įrodyti savo techninę kompetenciją taikyti FL bandymų metodą, prieš pateikdama FL bandymų duomenis teisės aktuose numatytais pavojų klasifikavimo tikslais. BANDYMO PRINCIPAS FL bandymų metodas yra citotoksiškumu ir ląstelių funkcija pagrįstas bandymas in vitro, atliekamas su susiliejusiu monosluoksniu, kurį sudaro MDCK CB997 kanalėlių epitelio ląstelės, auginamos ant pusiau pralaidžių įdėklų, ir kuris modeliuoja ragenos epitelio in vivo nesidalijančių ląstelių būseną. MDCK ląstelių linija yra gerai ištirta ir sudaro sandarias jungtis bei desmosomines jungtis, panašias į tas, kurios yra junginės ir ragenos epitelio priekinėje pusėje. Sandarios ir desmosominės jungtys in vivo neleidžia tirpalams ir pašalinėms medžiagoms prasiskverbti per ragenos epitelį. Epitelio sandarumo praradimas dėl sandarių jungčių ir desmosominių jungčių pažeidimo yra vienas iš ankstesnių įvykių, kuriuos sukelia dirginimas chemine medžiaga. Bandomoji cheminė medžiaga įterpiama ant susiliejusio sluoksnio, sudaryto iš įdėklo viršutinėje pusėje auginamų ląstelių. Paprastai taikomas trumpalaikis 1 min veikimas, kad būtų galima aptikti įprastinio pralaidumo padidėjimą, kai veikiami žmonės. Trumpalaikio veikimo privalumas yra tas, kad vandenyje ištirpintas medžiagas ir mišinius galima bandyti grynus, jei juos galima nesunkiai pašalinti pasibaigus veikimo laikotarpiui. Tai yra labiau tiesioginis būdas palyginti su cheminio poveikio žmonėms rezultatais. Bandomoji cheminė medžiaga pašalinama ir viršutinė monosluoksnio pusė 30 min veikiama netoksiniu fluoresceino natrio druskos stipriai fluosescuojančiu dažikliu. Bandomąja chemine medžiaga sukeltas sandarių jungčių pažeidimas nustatomas pagal fluoresceino kiekį, kuris per tam tikrą laikotarpį prasiskverbia per ląstelių sluoksnį. Fluoresceino natrio druskos dažiklio kiekis, kuris praeina per monosluoksnį ir įdėklo membraną į duobutėje esančio tirpalo nustatytą tūrį (į kurį skverbiasi fluoresceino natrio druskos dažiklis), nustatomas spektrofluorimetriniu metodu matuojant fluoresceino koncentraciją duobutėje. Fluoresceino nuotėkio (FL) vertė apskaičiuojama pagal dviejų kontrolinių ėminių fluoresencijos intensyvumo (FI) rodmenis: tuščiojo kontrolinio ėminio ir maksimalaus nuotėkio kontrolinį ėminį. Kiekvienai bandomosios cheminės medžiagos koncentracijos vertei gauta nuotėkio procentinė vertė, taigi ir sandarių jungčių pažeidimo dydis, yra išreiškiama šių kontrolinių ėminių atžvilgiu. Tada apskaičiuojama FL20 (t. y. koncentracijos, kuri sukelia 20 % FL palyginti su verte, gauta neapdorotam susiliejusiam monosluosniui ir įdėklams be ląstelių) vertė. FL20 (mg/ml) vertė yra naudojama akis ėsdinančioms ir stipriai dirginančioms cheminėms medžiagoms identifikuoti pagal prognozavimo modelį (žr. 35 pastraipą). Regeneravimasis yra svarbi bandomosios cheminės medžiagos toksiškumo profilio dalis, kuri taip pat įvertinama atliekant akių dirginimo bandymą in vivo. Parengiamoji analizė parodė, kad regeneravimosi duomenys (iki 72 h po paveikimo chemine medžiaga) galėtų padidinti prognozavimo taikant INVITTOX 71 protokolą gebą, bet būtinas papildomas įvertinimas ir būtų naudingi papildomi duomenys, pageidautina, gauti atliekant papildomus bandymus (6). Šis bandymų metodas bus atnaujinamas, kai tik bus išnagrinėta nauja informacija ir duomenys. PROCEDŪRA Ląstelių monosluoksnio paruošimas MDCK CB997 ląstelių monosluoksnis ruošiamas naudojant dar nesusiliejusias ląsteles, auginamas ląstelių kultūros kolbose su DMEM ir maistinių medžiagų mišiniu F12 (1× koncentratas su L-glutaminu, 15 mmol/l HEPES buferiniu tirpalu, kalciu (koncentracija – 1,0–1,8 mmol/l) ir 10 % šildant inaktyvuoto fetalinio veršiukų serumo (FCS) ar fetalinio jaučių serumo (FBS)). Svarbu, kad visą FL bandymą naudojamos terpės ar tirpalai turėtų kalcio jonų, kurių koncentracija būtų nuo 1,8 mmol/l (200 mg/l) iki 1,0 mmol/l (111 mg/l), kad būtų užtikrintas sandarių jungčių susidarymas ir vientisumas. Reikėtų kontroliuoti ląstelių sėjimų skaičiaus intervalą, kad būtų galima užtikrinti tolygų ir atkuriamą sandarių jungčių susidarymą. Pageidautina, kad atitirpintų ląstelių sėjimų skaičius būtų 3–30, nes tokio sėjimų skaičiaus ląstelės turi panašias funkcines savybes, todėl gaunamas geresnis bandymų rezultatų atkuriamumas. Prieš atliekant bandymus pagal FL metodą, ląstelės paimamos iš kolbos apdorojant tripsinu, centrifuguojamos ir reikiamas jų skaičius sėjamas į įdėklus, įdėtus į 24 duobučių plokšteles (žr. 1 priedėlį). Ląsteles reikėtų sėti į 12 mm skersmens įdėklus su mišriųjų celiuliozės esterių membrana, kurios storis būtų 80–150 μm ir akučių dydis – 0,45 μm. Atliekant tinkamumo patvirtinimo tyrimą buvo naudojami Millicell-HA 12 mm įdėklai. Įdėklo ir membranos savybės yra svarbios, nes jos gali daryti įtaką ląstelių augimui ir cheminiam ryšiui. Gali atsirasti ryšys tarp tam tikrų tipų cheminių medžiagų ir Millicell-HA įdėklo membranos, kuris gali daryti įtką rezultatų aiškinimui. Reikėtų naudoti kvalifikaciniam bandymui skirtą cheminę medžiagą (žr. 3 priedėlį), kad būtų galima įrodyti lygiavertiškumą, jei naudojamos kito tipo membranos. Cheminis ryšys su įdėklo membrana daugiau būdingas katijoninėms cheminėms medžiagoms, pvz., benzalkonio chloridui, kurį traukia krūvį turinti membrana (7). Cheminis ryšys su įdėklo membrana gali padidinti cheminės medžiagos poveikio trukmę, todėl būtų gautas per didelis cheminės medžiagos toksinio poveikio įvertis, taip pat gali fiziškai sumažėti fluoresceino nuotėkis per įdėklą dėl dažiklio ryšio su katijonine chemine medžiaga, susijungusia su įdėklo membrana, todėl būtų gautas per mažas cheminės medžiagos toksinio poveikio įvertis. Tai galima lengvai kontroliuoti veikiant tik membraną didžiausios koncentracijos bandomąja chemine medžiaga, įpilant įprastinės koncentracijos fluoresceino natrio druskos dažiklio ir laikant nustatytą laiką (be ląstelių kontrolinio ėminio). Jei yra ryšys su fluoresceino natrio druskos dažikliu, įdėklo membrana, nuplovus bandomąją cheminę medžiagą, lieka nudažyta geltonai. Todėl svarbu žinoti bandomosios cheminės medžiagos rišamąsias savybes, kad būtų galima paaiškinti cheminės medžiagos poveikį ląstelėms. Į įdėklą sėjamos ląstelės, prieš pradedant veikti chemine medžiaga, turėtų sudaryti susiliejusį monosluoksnį. Į kiekvieną įdėklą reikėtų įdėti 1,6 × 105 ląstelių (400 μl ląstelių suspensijos, kurios tankis 4 × 105 ląstelių/ml). Šiomis sąlygomis susiliejęs monosluoksnis gaunamas po 96 h auginimo kultūroje. Įdėklus reikėtų apžiūrėti prieš sėjimą, siekiant įsitikinti, kad visi pažeidimai, užregistruoti 30 pastraipoje aprašytos apžiūros metu, atsirado dėl apdorojimo veiksmų. MDCK ląstelių kultūras reikėtų laikyti inkubatoriuose, drėgnoje atmosferoje, turinčioje 5 % ± 1 % CO2, ir 37 ± 1 °C temperatūroje. Ląstelės neturėtų būti užkrėstos bakterijomis, virusais, mikoplazma ar grybeliais. Bandomųjų ir kontrolinių cheminių medžiagų įterpimas Kiekvienam bandymui reikėtų paruošti naują bandomosios cheminės medžiagos pradinį tirpalą ir jį panaudoti ne vėliau kaip per 30 min nuo paruošimo. Bandomąsias chemines medžiagas reikėtų ruošti kalcio jonų turinčiame (1,0–1,8 mmol/l koncentracijos) Hankso subalansuotame druskos tirpale (HBSS) be fenolio raudonojo, kad būtų išvengta serumo baltymų surišimo. Prieš bandymus reikėtų įvertinti, ar cheminės medžiagos tirpumas HBSS yra 250 mg/ml. Jei būdama tokios koncentracijos cheminė medžiaga sudaro stabilią suspensiją ar emulsiją (t. y. užtikrina vienalytiškumą ir neiškrenta į nuosėdas ar nesudaro daugiau kaip vienos fazės) ilgiau kaip 30 min, HBSS vis dar gali būti naudojamas kaip tirpiklis. Tačiau jei nustatoma, kad cheminė medžiaga neištirpsta HBSS tokiai koncentracijai gauti, reikėtų pagalvoti apie tai, ar nereikėtų taikyti kitus nei FL metodus. Į galimybę naudoti lengvąją mineralinę alyvą kaip tirpiklį, jei nustatoma, kad cheminė medžiaga netirpsta HBSS, reikėtų žiūrėti atsargiai, nes nėra pakankamai duomenų išvadai apie FL bandymo charakteristikas tokiomis sąlygomis padaryti. Visos cheminės medžiagos, kurias reikia bandyti, ruošiamos pradinį tirpalą skiedžiant steriliu kalcio jonų turinčiu (1,0–1,8 mmol/l koncentracijos) HBSS be fenolio raudonojo, kad būtų gauti penki pastovių verčių masės tūrinės koncentracijos tirpalai: 1, 25, 100, 250 mg/ml, gryna medžiaga arba sotus tirpalas. Bandant kietąją cheminę medžiagą, reikėtų įtraukti labai didelę 750 mg/ml koncentraciją. Tokios koncentracijos cheminę medžiagą gali tekti lašinti ant ląstelių stūmokline pipete. Jei nustatoma, kad toksiškumas pasireiškia nuo 25 iki 100 mg/ml, šias papildomas koncentracijos vertes reikėtų bandyti du kartus: 1, 25, 50, 75, 100 mg/ml. FL20 vertė turėtų būti gauta pagal šias koncentracijos vertes, jei yra įvykdyti priimtinumo kriterijai. Prieš susiliejusius ląstelių monosluoksnius apdorojant bandomąja chemine medžiaga, pašalinama ląstelių kultūros terpė ir sluoksniai plaunami du kartus steriliu, šiltu (37 °C), kalcio jonų turinčiu (1,0–1,8 mmol/l koncentracijos) HBSS be fenolio raudonojo. Prieš tai filtrai vizualiai patikrinami, ar nėra pažeidimų, kurie galėtų būti klaidingai priskirti galimiems nesuderinamumams su bandomąja chemine medžiaga. Atliekant kiekvieną bandymą, reikėtų naudoti ne mažiau kaip tris kartotinius kiekvienos bandomosios cheminės medžiagos koncentracijos ir kontrolinius ėminius. Po 1 min veikimo kambario temperatūroje bandomoji cheminė medžiaga atsargiai pašalinama nusiurbiant, monosluoksnis plaunamas du kartus steriliu, šiltu (37 °C), kalcio jonų turinčiu (1,0–1,8 mmol/l koncentracijos) HBSS be fenolio raudonojo, ir nedelsiant matuojamas nuotėkis. Atliekant kiekvieną bandymą, reikėtų naudoti vienalaikius neigiamus (NC) ir teigiamus (PC) kontrolinius ėminius, siekiant įrodyti, kad monosluoksnio vientisumas (NC) ir ląstelių jautris (PC) atitinka apibrėžtą istorinį priimtinumo intervalą. Siūloma PC cheminė medžiaga yra 100 mg/ml koncentracijos Brij 35 (CAS Nr. 9002-92-0). Esant šiai koncentracijai, turėtų būti gautas maždaug 30 % fluoresceino nuotėkis (priimtinas intervalas – 20–40 % fluoresceino nuotėkis, t. y. ląstelių sluoksnio pažeidimas). Siūloma NC cheminė medžiaga yra kalcio jonų turintis (1,0–1,8 mmol/l koncentracijos) HBSS be fenolio raudonojo (neapdorotas, tuščiasis kontrolinis ėminys). Taip pat į kiekvieną bandymą reikėtų įtraukti maksimalaus nuotėkio kontrolinį ėminį, kad būtų galima apskaičiuoti FL20 vertes. Maksimalus nuotėkis nustatomas naudojant kontrolinį įdėklą be ląstelių. Fluoresceino pralaidumo nustatymas Pašalinus bandomąją ir kontrolines chemines medžiagas, į įdėklus (pvz., Millicell-HA) iškart įpilama 400 μl 0,1 mg/ml fluoresceino natrio druskos tirpalo (0,01 % (m/V) kalcio jonų turinčiame (1,0–1,8 mmol/l koncentracijos) HBSS be fenolio raudonojo. Kultūros laikomos 30 min kambario temperatūroje. Pasibaigus inkubavimui su fluoresceinu, įdėklai atsargiai išimami iš kiekvienos duobutės. Kiekvienas filtras vizualiai patikrinamas ir registruojami visi pažeidimai, kurie galėjo atsirasti atliekant apdorojimo veiksmus. Kiekybiškai įvertinamas per monosluoksnį ir įdėklą prasiskverbusio fluoresceino kiekis tirpale, kuris liko duobutėse iš jų išėmus įdėklus. Matuojama spektrofluorimetru esant 485 nm sužadinimo ir 530 nm emisijos bangų ilgiams. Turėtų būti nustatytas toks spektrofluorimetro jautris, kad būtų didžiausias skaitmeninis skirtumas tarp maksimalaus FL (įdėklo be ląstelių) ir minimalaus FL (įdėklo su susiliejusiu monosluoksniu, apdorotu NC). Dėl skirtumų tarp naudojamų spektrofluorimetrų patariama naudoti tokį jautrį, kad maksimalaus fluoresceino nuotėkio ėminiui fluorescencijos intensyvumas būtų > 4 000. Maksimali FL vertė neturėtų būti didesnė kaip 9 999. Maksimalaus fluoresceino nuotėkio ėminio fluorescencijos intensyvumas turėtų atitikti naudojamo spektrofluorimetro tiesinį intervalą. Rezultatų aiškinimas ir prognozavimo modelis FL kiekis yra proporcingas sandarių jungčių pažeidimui, kurį sukelia cheminė medžiaga. Cheminės medžiagos kiekvienos bandymo koncentracijos procentinė FL vertė apskaičiuojama pagal bandomajai cheminei medžiagai gautas FL vertes, palygintas su FL vertėmis, gautomis NC (rodmuo, gautas susiliejusio monosluoksnio ląstelėms, apdorotoms NC) ir maksimalaus nuotėkio kontroliniam ėminiui (rodmuo, gautas FL nuotėkiui per įdėklą be ląstelių). Maksimalaus nuotėkio fluorescencijos intensyvumas = x, 0 % nuotėkio vidutinis fluorescencijos intensyvumas (NC) = y. Vidutinis 100 % nuotėkis gaunamas atimant vidutinį 0 % nuotėkį iš vidutinio maksimalaus nuotėkio, t. y. x – y = z. Kiekvienos tam tikros dozės procentinė nuotėkio vertė gaunama 0 % nuotėkio vertę atimant iš trijų kartotinių fluorescencijos intensyvumo rodmenų vidurkio (m), ir šią vertę dalijant iš 100 % nuotėkio vertės, t. y. % FL = [(m – y)/z] × 100 %, čia:
Cheminės medžiagos koncentraciją, kuriai esant sukeliamas 20 % FL, reikėtų apskaičiuoti pagal šią lygtį: FLD = [(A–B) / (C–B)] × (MC –MB) + MB, čia:
FL20 ribinė vertė prognozuojant akis ėsdinančias ar stipriai dirginančias chemines medžiagas pateikta toliau:
FL bandymų metodas yra rekomenduojamas tik vandenyje tirpioms akis ėsdinančioms ir stipriai dirginančioms cheminėms medžiagoms identifikuoti (JT GHS 1 kategorijos, ES CLP 1 kategorijos, JAV AAA I kategorijos) (žr. 1 ir 10 pastraipas). Vandenyje tirpioms bandomosioms cheminėms medžiagoms (medžiagoms ir mišiniams) reikėtų gauti FL20 vertę ≤ 100 mg/ml, kad jas būtų galima identifikuoti kaip „sukeliančias smarkius akių pažeidimus“ (JT GHS ar ES CLP 1 kategorijos) ar kaip „akis ėsdinančias ar stipriai dirginančias“ (JAV AAA I kategorijos) (3) (6) (7). Rezultatų priimtinumas Vidutinė maksimali fluoresceino nuotėkio vertė (x) turėtų būti didesnė kaip 4 000 (žr. 31 pastraipą), vidutinė 0 % nuotėkio vertė (y) turėtų būti lygi 300 arba mažesnė, o vidutinė 100 % nuotėkio vertė (z) turėtų būti nuo 3 700 iki 6 000. Bandymas laikomas priimtinu, jei teigiamam kontroliniam ėminiui buvo gautas 20 %–40 % ląstelių sluoksnio pažeidimas (išmatuotas kaip fluoresceino nuotėkis, %). DUOMENYS IR ATASKAITOS RENGIMAS Duomenys Ataskaitoje lentelės forma reikėtų pateikti kiekvieno bandymo kiekvieno kartotinio ėminio duobutei gautus duomenis (pvz., kiekvienos bandomosios cheminės medžiagos fluorescencijos intensyvumo vertes ir apskaičiuotas FL duomenų procentines vertes, įskaitant klasifikavimą). Be to, reikėtų pateikti kiekvieno bandymo atskirų kartotinių matavimų vidurkius ± standartinį nuokrypį. Bandymo ataskaita Į bandymo ataskaitą turėtų būti įtraukta ši informacija:
LITERATŪRA
1 priedėlis FL BANDYMŲ METODUI SKIRTŲ MDCK LĄSTELIŲ AUGINIMO ANT ĮDĖKLO MEMBRANOS SCHEMA Susiliejantis MDCK ląstelių sluoksnis auginamas ant pusiau pralaidžios įdėklo membranos. Įdėklai dedami į 24 duobučių plokštelių duobutes. 
Paveikslas paimtas iš: Wilkinson, P.J. (2006), Development of an in vitro model to investigate repeat ocular exposure, Ph.D. Thesis, University of Nottingham, UK. 2 priedėlis APIBRĖŽTYS Tikslumas – bandymo metodo rezultatų ir patvirtintų pamatinių verčių sutapimo artumas. Tikslumas yra bandymo metodo taikymo charakteristikų matas ir vienas iš „tinkamumo“ aspektų. Terminas dažnai vartojamas kaip lygiavertis terminui „atitiktis“ tinkamų bandymo metodo rezultatų daliai išreikšti. Cheminė medžiaga – medžiaga arba mišinys. AAA (angl. Environmental Protection Agency, EPA) I kategorijos – cheminės medžiagos, kurios sukelia ėsdinamąjį pažeidimą (negrįžtamą akies audinio suardymą) arba ragenos pažeidimą ar dirginimą, kuris trunka ilgiau kaip 21 parą (2). ES CLP (Reglamentas (EB) Nr. 1272/2008 dėl cheminių medžiagų ir mišinių klasifikavimo, ženklinimo ir pakavimo) – įgyvendina JT GHS cheminių medžiagų (medžiagų ir mišinių) klasifikavimo sistemą Europos Sąjungoje (ES). Klaidingai neigiamų rezultatų dalis – visų teigiamų cheminių medžiagų, kurios taikant bandymų metodą klaidingai identifikuotos kaip neigiamos, dalis. Tai yra vienas iš bandymo metodo taikymo charakteristikų rodiklių. Klaidingai teigiamų rezultatų dalis – visų neigiamų cheminių medžiagų, kurios taikant bandymų metodą klaidingai identifikuotos kaip teigiamos, dalis. Tai yra vienas iš bandymo metodo taikymo charakteristikų rodiklių. FL20 – bandomosios cheminės medžiagos koncentracijos, kuriai esant sukeliamas 20 % fluoresceino nuotėkis per ląstelių sluoksnį, įvertis. Fluoresceino nuotėkis – per ląstelių sluoksnį prasiskverbusio fluoresceino kiekis, išmatuotas spektrofluorimetriniu metodu. GHS (Jungtinių Tautų (JT) visuotinai suderinta cheminių medžiagų klasifikavimo ir ženklinimo sistema) – sistema, kurioje pateikiamas cheminių medžiagų (medžiagų ir mišinių) klasifikavimas pagal standartizuotus fizikinių pavojų, pavojų sveikatai bei aplinkai tipus ir nagrinėjami atitinkami informaciniai elementai, pvz., piktogramos, signaliniai žodžiai, pavojingumo frazės, atsargumo frazės ir saugos duomenų lapai, kad būtų galima informuoti apie medžiagų neigiamą poveikį, siekiant apsaugoti žmones (įskaitant darbuotojus, darbininkus, vežėjus, vartotojus ir avarijų likvidatorius) ir aplinką (1). JT GHS 1 kategorija – akies audinio pažeidimo arba smarkaus fizinio regėjimo pablogėjimo, ant išorinio akies paviršiaus uždėjus bandomosios cheminės medžiagos, iki galo nepraeinančio per 21 dieną nuo uždėjimo, kategorija. Pavojus – būdingoji agento savybė arba situacija, galinti sukelti neigiamų padarinių, kai organizmą, sistemą ar populiaciją (arba jos dalį) veikia tas agentas. Mišinys – JT GHS kontekste tai yra iš dviejų arba daugiau medžiagų sudarytas mišinys arba tirpalas, kuriame jos nereaguoja. Neigiamas kontrolinis ėminys – neapdorotas kartotinis ėminys, turintis visus bandymo sistemos komponentus. Šis ėminys tiriamas kartu su bandomąja chemine medžiaga apdorotais ėminiais ir kitais kontroliniais ėminiais, siekiant nustatyti, ar vyksta tirpiklio sąveika su bandymo sistema. Neklasifikuojamos – cheminės medžiagos, kurios neklasifikuojamos kaip JT GHS 1, 2A ar 2B kategorijos; ES CLP 1 ar 2 kategorijos arba JAV AAA I, II ar III kategorijos akis dirginančios medžiagos. Akis ėsdinanti cheminė medžiaga – a) cheminė medžiaga, kuri sukelia negrįžtamąjį akies audinio pažeidimą; b) cheminės medžiagos, kurios klasifikuojamos kaip JT GHS 1 kategorijos, ES CLP 1 kategorijos ar JAV AAA I kategorijos akis dirginančios medžiagos. Akis dirginanti cheminė medžiaga – a) cheminė medžiaga, kuri sukelia grįžtamuosius akies pokyčius jos uždėjus ant priekinio akies paviršiaus; b) cheminės medžiagos, kurios klasifikuojamos kaip JT GHS 2A ar 2B kategorijos, ES CLP 2 kategorijos ar JAV AAA II ar III kategorijos akis dirginančios medžiagos. Akis stipriai dirginančios medžiagos – a) cheminės medžiagos, kurios sukelia akies audinių pažeidimą, neišnykstantį per 21 parą nuo įterpimo, arba sukelia smarkų fizinį regėjimo pablogėjimą; b) cheminės medžiagos, kurios klasifikuojamos kaip JT GHS 1 kategorijos, ES CLP 1 kategorijos arba JAV AAA I kategorijos akis dirginančios medžiagos. Teigiamas kontrolinis ėminys – kartotinis ėminys, turintis visus bandymo sistemos komponentus ir apdorotas chemine medžiaga, kuri yra žinoma kaip sukelianti teigiamą atsaką. Siekiant užtikrinti galimybę vertinti teigiamo kontrolinio ėminio atsako kintamumą per tam tikrą laiką, teigiamas atsakas neturėtų būti per stiprus. Kvalifikacijai tikrinti skirtos cheminės medžiagos – cheminių medžiagų grupė, pasirinkta iš sąrašo etaloninių cheminių medžiagų, kurias patirties neturinti laboratorija, taikydama patvirtinto tinkamumo bandymų metodą, gali naudoti savo kvalifikacijai įrodyti. Tinkamumas – santykio tarp bandymo ir tiriamo poveikio bei bandymo reikšmingumo bei naudingumo siekiant tam tikro tikslo apibūdinimas. Tai yra atliekant bandymą tiriamo biologinio poveikio matavimo ar prognozavimo tikslumo laipsnis. Tinkamumas aprėpia bandymų metodo tikslumo (atitikties) aspektą (8). Patikimumas – pagal tą patį protokolą atliekamo bandymų metodo, tam tikrą laiką taikomo laboratorijose ir tarp laboratorijų, atkuriamumo laipsnio matas. Jis įvertinamas apskaičiuojant atkuriamumą laboratorijoje ir tarp laboratorijų ir pakartojamumą laboratorijoje. Pakaitinis bandymas – bandymas, kuris skirtas pakeisti bandymą, įprastiniu būdu naudojamą ir pripažintą tinkamu pavojui identifikuoti ir (arba) rizikai įvertinti, ir kuris nustatytas kaip bandymas, užtikrinantis lygiavertę ar geresnę, palyginti su patvirtintu bandymu, žmonių ar gyvūnų sveikatos arba aplinkos apsaugą, jei tinka, esant visoms galimoms bandymo aplinkybėms ir bandomosioms cheminėms medžiagoms. Jautris – visų teigiamų ar veikliųjų cheminių medžiagų, kurios buvo tiksliai klasifikuotos atliekant bandymą, dalis. Jis yra bandymų metodo, kuriuo gaunami kategorijos nustatymo rezultatai, tikslumo matas ir svarbus aspektas vertinant bandymų metodo tinkamumą (8). Smarkus akių pažeidimas – tai akies audinio pažeidimas arba smarkus fizinis regėjimo pablogėjimas, ant išorinio akies paviršiaus uždėjus bandomosios cheminės medžiagos, kurie nevisiškai išnyksta praėjus 21 parai nuo uždėjimo. Tirpiklio ar nešiklio kontrolinis ėminys – visus bandymo sistemos komponentus, įskaitant tirpiklį ar nešiklį, turintis neapdorotas ėminys, kuris tiriamas kartu su bandomąja chemine medžiaga apdorotais ėminiais ir kitais kontroliniais ėminiais, siekiant nustatyti atskaitos vertę ėminiams, apdorotiems bandomąja chemine medžiaga, ištirpinta tame pačiame tirpiklyje ar nešiklyje. Kai bandomas kartu su vienalaikiu neigiamu kontroliniu ėminiu, šis ėminys taip pat parodo, ar vyksta tirpiklio arba nešiklio sąveika su bandymo sistema. Specifiškumas – visų neigiamų ar neveikliųjų cheminių medžiagų, kurios buvo tiksliai klasifikuotos atliekant bandymą, dalis. Jis yra bandymų metodo, kuriuo gaunami kategorijos nustatymo rezultatai, tikslumo matas ir svarbus aspektas vertinant bandymų metodo tinkamumą. Medžiaga – gamtoje randami arba gamybos procese gaunami cheminiai elementai ir jų junginiai, naudojami JT GHS kontekste, įskaitant visus priedus, kurių reikia produkto stabilumui užtikrinti, ir visas priemaišas, patenkančias į produktą taikomo proceso metu, tačiau neįskaitant tirpiklio, kurį galima atskirti, nepaveikiant medžiagos stabilumo ar nekeičiant jos sudėties. Bandomoji cheminė medžiaga – taikant šį metodą bandoma medžiaga arba mišinys. Nuosekliųjų bandymų strategija – pakopomis atliekamų bandymų strategija, kai tam tikra eilės tvarka nagrinėjama visa turima informacija apie bandomąją cheminę medžiagą, kiekvienoje pakopoje taikant įrodomosios vertės analizės procesą, siekiant nustatyti, ar yra pakankamai duomenų sprendimui dėl pavojingumo kategorijos priimti, prieš pereinant prie kitos pakopos. Jei bandomajai cheminei medžiagai dirginamąją gebą galima priskirti atsižvelgiant į turimą informaciją, papildomų bandymų atlikti nereikia. Jei, atsižvelgiant į turimą informaciją, bandomajai cheminei medžiagai dirginamosios gebos priskirti neįmanoma, taikoma nuosekliųjų bandymų su gyvūnais procedūra tol, kol būtų galima gauti nedviprasmį klasifikavimą. Patvirtinto tinkamumo bandymų metodas – bandymų metodas, kurio tinkamumo tam tikram tikslui pasiekti patvirtinimo tyrimai buvo atlikti, nustatant tinkamumą (įskaitant tikslumą) ir patikimumą. Svarbu pažymėti, kad patvirtinto tinkamumo bandymo metodo tikslumo ir patikimumo charakteristikos gali būti nepakankamos, kad jį būtų galima laikyti priimtinu siūlomam tikslui pasiekti (8). Įrodomoji duomenų galia – įvairių informacijos dalių pranašumų ir trūkumų nagrinėjimo procesas priimant ir patvirtinant sprendimą dėl cheminės medžiagos pavojingumo. 3 priedėlis CHEMINĖS MEDŽIAGOS, SKIRTOS KVALIFIKACIJAI TIKRINTI TAIKANT FL BANDYMŲ METODĄ Prieš pradėdamos įprastiniu būdu taikyti šį bandymų metodą, laboratorijos turėtų įrodyti savo techninę kvalifikaciją, tinkamai nustatydamos 1 lentelėje rekomenduojamų 8 cheminių medžiagų akių ėsdinimo klasifikavimą. Šios cheminės medžiagos buvo parinktos taip, kad atitiktų atsako į vietinį akių dirginimą ir (arba) ėsdinimą intervalą, atsižvelgiant į triušio akių bandymų in vivo (TG 405, TM B.5 (5)) rezultatus (t. y. 1, 2A, 2B kategorijos arba neklasifikuojamas pagal JT GHS ir ES CLP. Tačiau, atsižvelgiant į patvirtintą FL bandymo naudingumą (t. y. identifikuoti tik ėsdinančias ir stipriai dirginančias chemines medžiagas), yra tik du klasifikavimui tinkami bandymų rezultatai (ėsdinančios ir (arba) stipriai dirginančios arba neėsdinančios ir (arba) stipriai nedirginančios), kad būtų galima įrodyti kvalifikaciją. Kiti atrankos kriterijai buvo galimybė pirkti chemines medžiagas ir tai, ar galima gauti aukštos kokybės duomenis in vivo bei aukštos kokybės FL bandymų metodo duomenis. Dėl šios priežasties kvalifikacijai tikrinti skirtos cheminės medžiagos buvo parinktos iš Fluorescein Leakage Assay Background Review Document as an Alternative Method for Eye Irritation Testing (8) dokumento, kuris buvo naudojamas FL bandymų metodo retrospektyviam tinkamumo patvirtinimui. 1 lentelė Cheminės medžiagos, rekomenduojamos techninei kvalifikacijai tikrinti taikant FL
B.62 Žinduolių ląstelių bandymas in vivo kometų metodu šarminėmis sąlygomis ĮVADAS Šis bandymų metodas atitinka EBPO bandymų gaires (TG) 489 (2016). Kometų bandymas in vivo šarminėmis sąlygomis (pavienių ląstelių gelio elektroforezė) (toliau tiesiog vadinamas kometų bandymu) naudojamas DNR gijų trūkiams aptikti ląstelėse ar branduoliuose, išskirtuose iš daugelio gyvūnų, dažniausiai graužikų, audinių, kurie buvo veikiami galimai genotoksine (-ėmis) medžiaga (-omis). Kometų bandymą peržiūrėjo ir rekomendacijas paskelbė įvairių ekspertų grupės (1) (2) (3) (4) (5) (6) (7) (8) (9) (10). Šis bandymų metodas yra genetinės toksikologijos metodų serijos dalis. Yra parengtas EBPO dokumentas, kuriame glaustai pateikiama informacijos apie genetinės toksikologijos bandymus ir naujausių šių gairių pakeitimų apžvalga (11). Šio kometų bandymo tikslas – identifikuoti chemines medžiagas, kurios sukelia DNR pažaidas. Atliekant kometų bandymą šarminėmis sąlygomis (> pH 13), galima aptikti vienos ir dviejų gijų trūkius dėl, pvz., tiesioginės sąveikos su DNR, šarmams jautrių vietų arba pereinamuosius DNR trūkius, susijusius su DNR ekscizine reparacija. Šie gijų trūkiai gali būti pataisyti, bet poveikis būtų ne nuolatinis, todėl tai gali būti mirtina ląstelei arba likti kaip mutacija, kuri vyktų kaip nuolatinis gyvybingas kitimas. Dėl jų taip pat gali atsirasti chromosomų pažeidimas, kuris taip pat yra susijęs su daugeliu žmonių ligų, įskaitant vėžį. Graužikų kometų bandymo in vivo oficialus tinkamumo patvirtinimo tyrimas buvo atliekamas 2006–2012 m., jį koordinavo Japonijos alternatyvių metodų patvirtinimo centras (angl. Japanese Centre for the Validation of Alternative Methods, JaCVAM) kartu su Europos alternatyvių metodų patvirtinimo centru (angl. European Centre for the Validation of Alternative Methods, Alternatyvių metodų patvirtinimo tarpžinybinio koordinavimo komitetu (angl. Interagency Coordinating Committee on the Validation of Alternative Methods, ICCVAM) ir Nacionalinės toksikologijos programos alternatyvių toksikologinių metodų patvirtinimo tarpžinybinio koordinavimo komitetu (angl. NTP Interagency Center for the Evaluation of Alternative Toxicological Methods (NICEATM) (12). Į šį bandymų metodą įtrauktas kometų bandymo rekomenduojamas taikymas ir apribojimai, jis yra pagrįstas galutiniu protokolu (12), naudotu atliekant tinkamumo patvirtinimo tyrimą, ir susijusiais papildomais paskelbtais bei nepaskelbtais (laboratorijų nuosavybės teisėmis turimais) duomenimis. Pagrindinių terminų apibrėžtys pateiktos 1 priedėlyje. Reikia pažymėti, kad šiam bandymui atlikti galima naudoti daug skirtingų sistemų (mikroskopo objektiniai stikleliai, gelio dėmės, 96 duobučių plokštelės ir kt.) Patogumo dėlei toliau šiame dokumente vartojamas terminas objektinis stiklelis, bet jis taip pat aprėpia visas kitas sistemas. PRADINIAI ASPEKTAI IR APRIBOJIMAI Kometų bandymas yra eukariotinių ląstelių DNR gijų trūkių matavimo metodas. Atliekama ant objektinio stiklelio į agarozę įlietų pavienių ląstelių ar branduolių lizė plovikliu ir didelės koncentracijos druska. Šiame lizės etape suyra ląstelių ir branduolių membranos ir galima išskirti DNR spiralių kilpas, kurios paprastai vadinamos nukleotidais ir DNR fragmentais. Atliekant elektroforezę esant didelei pH vertei, susidaro į kometas panašios struktūros, kurias galima stebėti fluorescencinės mikroskopijos metodu naudojant atitinkamus fluorescencinius dažus; DNR fragmentai, priklausomai nuo jų dydžio, migruoja nuo „galvos“ link „uodegos“, o kometos uodegos fluorescencijos intensyvumas palyginti su suminiu intensyvumu (galvos ir uodegos) rodo DNR trūkio dydį (13) (14) (15). Kometų bandymas in vivo šarminėmis sąlygomis ypač tinka įvertinant genotoksinį pavojų, kai bandymo atsakai priklauso nuo absorbcijos, pasiskirstymo, metabolizmo ir šalinimo (angl. absorption, distribution, metabolism, excretion, ADME) in vivo, taip pat nuo DNR reparacijos procesų. Šie dalykai gali skirtis tarp rūšių, tarp audinių ir tarp DNR pažaidų tipų. Siekiant atitikti gyvūnų gerovės reikalavimus, ypač dėl jų naudojimo mažinimo (laikantis 3R principo – pakeitimas, mažinimas, tobulinimas (angl. Replacement, Reduction, Refinement)), šį bandymą taip pat galima integruoti su kitais toksikologiniais tyrimais, pvz., kartotinės dozės toksiškumo tyrimais (10) (16) (17), arba vertinamąją baigtį galima derinti su kitomis genotoksiškumo vertinamosiomis baigtimis, pvz., žinduolių eritrocitų mikrobranduolių bandymo in vivo baigtimis (18) (19) (20). Kometų bandymas dažniausiai atliekamas su graužikais, tačiau jis buvo taikomas kitoms žinduolių ir ne žinduolių rūšims. Kitų nei graužikai rūšių naudojimas kiekvienu atskiru atveju turėtų būti pagrįstas moksliniu ir etiniu požiūriu; kometų bandymą su kitomis nei graužikai rūšimis primygtinai rekomenduojama atlikti tik kaip kito toksiškumo tyrimo dalį, o ne kaip atskirą bandymą. Veikimo būdą ir tiriamą (-us) audinį (-ius) reikėtų pasirinkti atsižvelgiant į visas turimas ar esamas žinias apie bandomąją cheminę medžiagą, pvz., numatomą ar tikėtiną žmonių veikimo būdą, metabolizmą ir pasiskirstymą, poveikio sąlyčio vietoje galimybę, struktūrinius toksiškumo požymius, kitus genotoksiškumo ar toksiškumo duomenis ir tyrimo tikslą. Todėl tam tikrais atvejais bandomosios cheminės medžiagos genotoksinis potencialas gali būti tikrinamas tiriant kancerogeninį ir (arba) kitą toksinį poveikį tiksliniame (-iuose) audinyje (-iuose). Bandymas taip pat yra naudingas toliau tiriant genotoksiškumą, aptiktą in vitro sistema. Tiriamo audinio kometų bandymą in vivo reikia atlikti tada, kai galima pagrįstai tikėtis, kad tiriamas audinys bus veikiamas tinkamu būdu. Bandymo tinkamumas buvo išsamiai patvirtintas atliekant tarplaboratorinius žiurkių patinų somatinių audinių tyrimus, pvz., JaCVAM (12) ir Rothfuss et al., 2010 (10) tyrimus. Atliekant JaCVAM tarptautinį tinkamumo patvirtinimo tyrimą buvo naudojamos kepenys ir skrandis. Kepenys buvo pasirinktos todėl, kad jos yra aktyviausias cheminių medžiagų metabolizme dalyvaujantis organas, taip pat dažnai yra kancerogeniškumo tikslinis audinys. Skrandis pasirinktas todėl, kad jis yra pirmoji sąlyčio su chemine medžiaga vieta, kai ji patenka per burną, nors į kitas virškinimo trakto zonas, pvz., dvylikapirštę žarną ir tuščiąją žarną, taip pat reikėtų žiūrėti kaip į sąlyčio vietos audinius ir jos gali būti laikomos svabesnėmis žmonėms nei graužikų liaukinis skrandis. Reikėtų imtis priemonių užtikrinti, kad tokie audiniai nebūtų veikiami ypač didelės koncentracijos bandomąja chemine medžiaga (21). Metodas iš esmės tinka visiems audiniams, iš kurių galima gauti analizei tinkamas pavienių ląstelių ar branduolių suspensijas. Kelių laboratorijų nuosavybės teise turimi duomenys rodo jo sėkmingą taikymą daugeliui skirtingų audinių ir yra daug leidinių, kuriuose pateikta įrodymų, kad metodas tinka kitiems nei kepenys ar skrandis organams ir audiniams, pvz., tuščiajai žarnai (22), inkstams (23) (24), odai (25) (26), šlapimo pūslei (27) (28), plaučių ir bronchų bei alveolių išplovų ląstelėms (tinka įkvėptų cheminių medžiagų tyrimams) (29) (30), be to, bandymai buvo atlikti du daugeliu kitų organų (31) (32). Nors gali būti įdomu tirti genotoksinį poveikį embrioninėms ląstelėms, reikėtų pažymėti, kad šiame bandymų metode aprašytas standartinis kometų bandymas šarminėje terpėje nelaikomas tinkamu subrendusių embrioninių ląstelių DNR gijų trūkiams matuoti. Kadangi literatūros apžvalgoje dėl kometų bandymo naudojimo tiriant embrioninių ląstelių genotoksiškumą buvo pranešta apie didelius ir kintamus DNR pažaidų lygius (33), manoma, kad prieš įtraukiant subrendusių embrioninių ląstelių (pvz., spermos) kometų bandymą į bandymų metodą, būtina protokolą modifikuoti ir atlikti patobulintus standartizavimo ir tinkamumo patvirtinimo tyrimus. Be to, šiame bandymų metode aprašyta rekomenduojama veikimo schema nėra optimali ir galbūt būtų būtina ilgesnė veikimo ar ėminių ėmimo trukmė, kad būtų galima atlikti subrendusių spermatozoidų DNR gijų trūkių reikšmingą analizę. Literatūroje yra aprašytas genotoksinis poveikis, išmatuotas skirtingais diferenciacijos etapais atliekant sėklidžių ląstelių kometų bandymą (34) (35). Tačiau reikėtų pažymėti, kad lytinės liaukos turi somatinių ir embrioninių ląstelių mišinį. Dėl šios priežasties visai lytinei liaukai (sėklidei) gauti teigiami rezultatai nebūtinai rodo embrioninių ląstelių pažeidimą; visgi jie rodo, kad bandomoji (-osios) cheminė medžiaga (-os) ir (arba) jos ar jų metabolitai pasiekė lytinę liauką. Taikant kometų bandymo standartines Bandymo sąlygas, skersinių jungčių negalima patikimai aptikti. Tam tikromis pakeistomis Bandymo sąlygomis būtų galima aptikti DNR-DNR ir DNR-baltymo skersines jungtis ir kitas bazių modifikacijas, pvz., oksiduotas bazes (23) (36) (37) (38) (39). Vis dėlto reikėtų atlikti papildomus darbus, kad būtų galima tinkamai apibūdinti būtinus protokolo pakeitimus. Todėl skersines jungtis sudarančių agentų aptikimas nėra pagrindinis čia aprašyto bandymo tikslas. Bandymas netinka, netgi su pakeitimais, aneugenams aptikti. Atsižvelgiant į šiuo metu turimas žinias, keli papildomi apribojimai (žr. 3 priedėlį) yra susiję su kometų bandymu in vivo. Tikimasi ateityje bandymų metodą peržiūrėti ir, atsižvelgiant į įgytą patirtį, prireikus pataisyti. Prieš taikant bandymų metodą mišiniui, kad būtų gauti numatomo reglamentavimo tikslui skirti duomenys, reikėtų panagrinėti, ar metodu galima pasiekti tą tikslą atitinkančius rezultatus ir, jei taip, tai dėl kokios priežasties. Tokie svarstymai nereikalingi, kai yra reglamentavimo reikalavimas bandyti mišinį. METODO PRINCIPAS Gyvūnai veikiami bandomąja chemine medžiaga reikiamu būdu. Išsamus dozavimo ir ėminių ėmimo aprašymas pateiktas 36–40 pastraipose. Pasirinktu (-ais) ėminių ėmimo momentu (-ais) tiriami audiniai išpjaunami ir ruošiamos pavienių ląstelių ar branduolių suspensijos (galima atlikti perfuziją in situ, jei manoma, kad tai būtų naudinga, pvz., kepenų) ir įliejamos į minkštąjį agarą, kad jas būtų galima fiksuoti ant objektinių stiklelių. Ląstelės ar branduoliai apdorojamos lizės buferiniu tirpalu, kad būtų pašalintos ląstelių ir (arba) branduolių membranos, ir veikiama stipriais šarmais, pvz., pH ≥ 13, kad būtų galima išvyti DNR spiralę ir išlaisvinti išvytų DNR kilpas ir fragmentus. Tada atliekama branduolio DNR elektroforezė. Į fragmentus nesuskilusios normalios DNR molekulės lieka toje vietoje, kurioje agare buvo branduolio DNR, o visos fragmentuotos DNR ir išlaisvintos DNR kilpos migruotų anodo link. Po elektoforezės DNR vizualizuojama naudojant reikiamą fluorescencinį dažą. Preparatus reikėtų analizuoti naudojant mikroskopą ir visiškai ar pusiau automatizuotas vaizdo analizės sistemas. Elektroforezės metu migravusios DNR kiekis ir migracijos atstumas rodo DNR fragmentų kiekį ir dydį. Yra kelios kometų bandymo vertinamosios baigtys. DNR pažaidoms vertinti buvo rekomenduojamas DNR kiekis uodegoje (uodegos procentinė DNR dalis ar uodegos intensyvumo procentinė dalis) (12) (40) (41) (42). Atlikus pakankamo branduolių skaičiaus analizę, duomenys analizuojami tinkamais metodais, kad būtų galima spręsti apie bandymo rezultatus. Reikėtų pažymėti, kad buvo tiriami įvairūs kintami metodikos aspektai, įskaitant ėminių paruošimą, elektroforezės sąlygas, vizualios analizės parametrus (pvz., dažo intensyvumą, mikroskopo lempos šviesos stiprį, mikroskopo filtrų naudojimą ir dinaminius filmavimo kameros parametrus) ir aplinkos sąlygas (pvz., foninį apšvietimą), ir jie gali daryti įtaką DNR migracijai (43) (44) (45) (46). LABORATORIJOS KVALIFIKACIJOS TIKRINIMAS Kiekviena laboratorija turėtų nustatyti savo kompetenciją atliekant kometų bandymą, įrodydama sugebėjimą gauti kiekvienos naudotos rūšies kiekvieno tikslinio audinio pakankamos kokybės pavienių ląstelių ar branduolių suspensijas. Preparatų kokybė bus įvertinta visų pirma pagal nešikliu apdorotiems gyvūnams gautą uodegos DNR procentinę dalį, kurios vertė patektų į atkuriamą mažų verčių intervalą. Šiuo metu turimi duomenys rodo, kad būtų gerai, jei žiurkių kepenims gautos uodegos DNR procentinės dalies grupės vidurkis (pagal medianų vidurkį, žr. 57 pastraipą, kurioje šie terminai išsamiai paaiškinti), būtų ne didesnis kaip 6 %, kuris sutaptų su vertėmis, gautomis atliekant JaCVAM tinkamumo patvirtinimo tyrimą (12) ir su kitais paskelbtais ir nuosavybės teise turimais duomenimis. Šiuo metu nėra pakankamai duomenų, kad būtų galima pateikti rekomendacijas apie kitiems audiniams gautus optimalius arba priimtinus intervalus. Tai netrukdo naudoti kitus audinius, jei būtų pagrįsta. Bandymo ataskaitoje turi būti pateikta tinkama kometų bandymo naudojant šiuos audinius charakteristikų apžvalga, atsižvelgiant į mokslinėje literatūroje paskelbtus arba nuosavybės teise turimus duomenis. Pirma, pageidautina, kad kontroliniams ėminiams gautą uodegos DNR procentinė dalis būtų maža, nes tai užtikrintų pakankamą dinaminį intervalą teigiamam poveikiui aptikti. Antra, kiekviena laboratorija turėtų gebėti atkurti tikėtinus atsakus į tiesioginius mutagenus ir promutagenus, esant skirtingiems veikimo būdams, kurie pateikti 1 lentelėje (29 pastraipa). Teigiamas medžiagas galima pasirinkti, pvz., iš naudotų atliekant JaCVAM tinkamumo patvirtinimo tyrimą (12) arba iš kitų paskelbtų duomenų (žr. 9 pastraipą), jei tinka, jas pagrįsti ir parodyti tiriamų audinių aiškius teigiamus atsakus. Reikėtų parodyti gebėjimą nustatyti silpną žinomų mutagenų poveikį, pvz., etilmetansulfonato (EMS) mažomis dozėmis, pvz., nustatant dozės ir atsako priklausomybes, esant reikiamam dozių skaičiui ir tarpams tarp jų. Iš pradžių reikėtų sutelkti dėmesį į kvalifikacijos nustatymą imant dažniausiai naudojamus audinius, pvz,. graužikų kepenis, nes laukiamus rezultatus galima palyginti su esamais duomenimis (12). Kitiems audiniams, pvz., skrandžiui, dvylikapirštei, tuščiajai žarnai ar kraujui gauti duomenys galėtų būti renkami tuo pačiu metu. Laboratorija turi įrodyti kvalifikaciją atlikdama bandymus su kiekvienu numatytu tirti kiekvienos rūšies atskiru audiniu, jai taip pat reikės įrodyti, kad su žinomu mutagenu (pvz., EMS) gali gauti priimtiną teigiamą to audinio atsaką. Turėtų būti renkami nešiklio ar neigiamų kontrolinių ėminių duomenys, siekiant įrodyti neigiamų duomenų atsakų atkuriamumą ir užtikrinti tinkamą techninių bandymo aspektų kontrolę arba pasiūlyti, kad būtina iš naujo sukurti istorinių kontrolinių ėminių duomenų intervalus (žr. 22 pastraipą). Reikėtų pažymėti, kad, nors atliekant skrodimą galima paimti daugelį audinių ir apdoroti juos kometų analizei atlikti, laboratorija turi turėti patirties daugelį šių audinių paimti iš vieno gyvūno ir taip užtikrinti, kad bus atsižvelgta į visas galimas DNR pažaidas ir kad kometų analizė nebus sugadinta. Laiko tarpas nuo numarinimo iki apdoroti skirtų audinių pašalinimo gali būti labai svarbus (žr. 44 pastraipą). Tobulinant šio bandymo atlikimo kvalifikaciją, būtina atsižvelgti į gyvūnų gerovę, todėl galima naudoti kituose bandymuose naudotų gyvūnų audinius, kai reikia įgyti patirties įvairiais bandymo aspektais. Be to, vykdant naujo bandymų metodo įdiegimo laboratorijoje etapus, viso tyrimo atlikti nebūtina, tobulinant būtinus įgūdžius, galima naudoti mažiau gyvūnų ar bandymo koncentracijos verčių. Istorinių kontrolinių ėminių duomenys Atlikdama su kvalifikacijos tikrinimu susijusius tyrimus, laboratorija turėtų sukurti istorinių duomenų bazę, kad atitinkamiems audiniams ir rūšims būtų galima nustatyti teigiamų ir neigiamų kontrolinių ėminių intervalus ir skirstinius. Rekomendacijas, kaip kurti ir naudoti istorinius duomenis (t. y. duomenų įtraukimo ir pašalinimo iš istorinių duomenų kriterijus ir tam tikro bandymo priimtinumo kriterijus) galima rasti literatūroje (47). Skirtingiems audiniams ir skirtingoms rūšims, taip pat skirtingiems nešikliams ir dozės davimo būdams gali būti gautos skirtingos neigiamų kontrolinių ėminių uodegos DNR procentinės dalies vertės. Todėl svarbu nustatyti neigiamų kontrolinių ėminių intervalus kiekvienam audiniui ir rūšiai. Laboratorijos turėtų taikyti kokybės kontrolės metodus, tokius kaip kontrolinės diagramos (pvz., C tipo ar X juostinės diagramos (48)), kad galėtų nustatyti savo duomenų kintamumą ir įrodyti metodikos „valdomumą“ savo laboratorijoje. Taip pat gali tekti optimizuoti reikiamų teigiamų kontrolinių cheminių medžiagų, dozių intervalų ir Bandymo sąlygų (pvz., elektroforezės sąlygų) pasirinkimą, kad būtų galima aptikti silpną poveikį (žr. 17pastraipą). Į visus bandymų protokolo pakeitimus reikėtų žiūrėti atsižvelgiant į jų suderinamumą su esamomis laboratorijos istorinių kontrolinių ėminių duomenų bazėmis. Esant didesnėms neatitiktims turėtų būti kuriama nauja istorinių kontrolinių ėminių duomenų bazė. METODO APRAŠYMAS Parengiamieji darbai Gyvūnų rūšies parinkimas Paprastai naudojamos sveikų jaunų suaugusių graužikų laboratorinės veislės (6–10 savaičių amžiaus nuo apdorojimo pradžios, nors leidžiama naudoti šiek tiek vyresnius gyvūnus). Pasirenkant graužikų rūšį, reikėtų atsižvelgti į i) rūšis, naudotas atliekant toksiškumo tyrimus (kad būtų galima susieti duomenis ir atlikti integruotuosius tyrimus), ii) rūšis, kurioms susidarė augliai tiriant kancerogeniškumą (kancerogenezės mechanizmą) arba iii) rūšis, kurių metabolizmas daugiausiai panašus į žmonių, jei jis žinomas. Atliekant šį bandymą dažniausiai naudojamos žiurkės. Tačiau galima naudoti kitas rūšis, jei jų naudojimas būtų etiškai ir moksliškai pagrįstas. Gyvūnų laikymo ir šėrimo sąlygos Jei naudojami graužikai, temperatūra bandymo gyvūnų patalpoje turėtų būti 22 °C (± 3 °C). Nors geriausia būtų užtikrinti 50–60 % santykinę drėgmę, ji neturėtų būti mažesnė kaip 30 % ir būtų gerai, jei ji nebūtų didesnė kaip 70 %, išskyrus patalpos valymo laiką. Apšvietimas turėtų būti dirbtinis, taikant 12 h šviesos ir 12 h tamsos seką. Gyvūnams šerti tinka įprastas laboratorijose naudojamas pašaras, neribojant geriamojo vandens kiekio. Pašaro pasirinkimui gali turėti įtakos būtinybė užtikrinti tinkamą bandomosios cheminės medžiagos sumaišymą su pašaru, kai ji duodama tokiu būdu. Graužikai turėtų būti laikomi mažomis grupėmis (paprastai ne daugiau kaip po penkis) tos pačios lyties gyvūnus, jei nėra agresyvaus elgesio pavojaus. Tik moksliškai pagrįstais atvejais gyvūnus galima laikyti atskirai. Jei yra galimybė, reikėtų naudoti narvelius su kietomis grindimis, nes tinklinės grindys gali būti sunkių sužeidimų priežastimi (49). Turi būti užtikrinta reikiama pagerinta aplinka. Gyvūnų paruošimas Gyvūnai yra atsitiktinai suskirstomi į kontrolines ir apdorojimo grupes. Gyvūnai unikaliai paženklinami ir aklimatizuojami laboratorinėmis sąlygomis ne trumpiau kaip 5 paras iki apdorojimo pradžios. Gyvūnai turi būti paženklinami minimaliai invaziniu būdu. Tinkamiausi būdai būtų žiedavimas, etiketės kabinimas, mikrolusto naudojimas ir biometrinis identifikavimas. Pėdų ar ausų spaustukai nėra moksliškai pagrįsti atliekant šiuos bandymus. Narvelius reikėtų įrengti taip, kad jų išdėstymo poveikis būtų minimalus. Tyrimo pradžioje gyvūnų masės skirtumas turėtų būti minimalus ir neviršyti ± 20 %. Dozių ruošimas Kietąsias bandomąsias chemines medžiagas prieš duodant gyvūnams reikėtų ištirpinti atitinkamuose nešikliuose, paruošti jų suspensiją arba įmaišyti į pašarą ar geriamąjį vandenį. Skystąsias bandomąsias chemines medžiagas galima dozuoti tiesiogiai arba prieš tai praskiesti. Jei bandomoji cheminė medžiaga patenka per kvėpavimo takus, ją, atsižvelgiant į jos fizikines ir chemines savybes (50) (51), galima duoti dujų, garų arba kietojo ar skystojo aerozolio pavidalu. Reikėtų naudoti tik iš naujo paruoštus bandomosios cheminės medžiagos preparatus, nebent stabilumo duomenys rodo, kad laikymas priimtinas ir šiuo atveju apibrėžiamos tinkamos laikymo sąlygos. Bandymo sąlygos Nešiklis Neturėtų būti nešiklio toksinio poveikio, esant naudojamai dozei, ir neturėtų kilti įtarimų, kad galėtų vykti jų cheminė reakcija su bandomosiomis cheminėmis medžiagomis. Jei naudojami kiti nei gerai žinomi tirpikliai ar nešikliai, juos galima įtraukti, pateikus etaloninius duomenis, kurie rodytų suderinamumą su bandymo gyvūnais, davimo būdu ir vertinamąja baigtimi. Rekomenduojama visuomet iš pradžių atsižvelgti į galimybę naudoti vandeninį tirpiklį arba nešiklį. Reikėtų pažymėti, kad kai kurie nešikliai (ypač klampūs nešikliai) gali sukelti uždegimą ir padidinti DNR gijų trūkių sąlyčio vietoje foninį lygį, ypač medžiagą duodant daug kartų. Kontroliniai ėminiai Teigiami kontroliniai ėminiai Šiuo metu atliekant kiekvieną bandymą paprastai reikėtų imti gyvūnų grupę, kurią sudarytų ne mažiau kaip 3 vienos lyties ar kiekvienos lyties, jei naudojami abiejų lyčių gyvūnai (žr. 32 pastraipą), apdoroti teigiama kontroline chemine medžiaga. Ateityje galbūt laboratorija galės įrodyti, kad jos kvalifikacijos pakanka teigiamų kontrolinių ėminių skaičiui sumažinti. Jei ėminiai imami kelis kartus (pvz., pagal vieno dozės davimo protokolą), teigiamus kontrolinius ėminius būtina įtraukti tik į vieną ėminių ėmimą, bet reikėtų užtikrinti subalansuotą schemą (žr. 48 pastraipą). Vienalaikio teigiamo kontrolinio ėminio chemines medžiagas nebūtina duoti tokiu pačiu būdu, kaip bandomąją cheminę medžiagą, nors svarbu, kad būtų naudojamas vienodas būdas matuojant poveikį sąlyčio vietoje. Turėtų būti įrodyta, kad teigiamos kontrolinės medžiagos sukelia DNR gijų trūkius visuose audiniuose, kurie naudojami bandomajai cheminei medžiagai tirti, ir atrodo, kad kaip teigiamą kontrolinę medžiagą reikėtų pasirinkti EMS, nes jis sukelia visų tirtų audinių DNR gijų trūkius. Teigiamų kontrolinių cheminių medžiagų dozes reikėtų parinkti taip, kad būtų sukeltas vidutinis poveikis, pagal kurį galima kritiškai įvertinti bandymo charakteristikas ir jautrumą, o jas būtų galima pagrįsti dozės ir atsako kreivėmis, gautomis atliekant kvalifikacijos tikrinimą. Vienalaikių teigiamų kontrolinių ėminių gyvūnams gauta uodegos DNR procentinė dalis turėtų atitikti iš anksto tos rūšies audiniui nustatytą laboratorijos intervalą ir ėminių ėmimo laiką (žr. 16 pastraipą). Teigiamų kontrolinių cheminių medžiagų pavyzdžiai ir kai kurie jų tiksliniai audiniai (graužikų) yra įtraukti į 1 lentelę. Galima pasirinkti kitas chemines medžiagas, nei nurodytos 1 lentelėje, jei moksliškai būtų pagrįsta. 1 lentelė. Teigiamų kontrolinių cheminių medžiagų pavyzdžiai ir kai kurie jų tiksliniai audiniai Medžiagos ir CAS Nr. Etilmetansulfonatas (CAS Nr. 62-50-0), visi audiniai Etilnitrozokarbamidas (CAS Nr. 759-73-9), kepenys ir skrandis, dvylikapirštė ar tuščioji žarna Metilmetansulfonatas (CAS Nr. 66-27-3) kepenys, skrandis, dvylikapirštė ar tuščioji žarna, plaučių ir bronchų bei alveolių išplovų (BAL) ląstelės, inkstai, šlapimo pūslė, plaučiai, sėklidės ir kaulų čiulpai ar kraujas N-metil-N'-nitro-N-nitrozoguanidinas (CAS Nr.: 70-25-7) skrandis, dvylikapirštė ar tuščioji žarna 1,2-dimetilhidrazinas 2HCl (CAS Nr. 306-37-6), kepenys ir žarnynas N-metil-N-nitrozokarbamidas (CAS Nr. 684-93-5), kepenys, kaulų čiulpai, kraujas, inkstai, skrandis, tuščioji žarna ir smegenys. Neigiami kontroliniai ėminiai Neigiamos kontrolinės grupės gyvūnus, apdorotus vien tik nešikliu, reikėtų įtraukti į kiekvieną bandymą kiekvienam ėminių ėmimo laikui ir audiniui, ir su jais elgtis kaip su apdorotomis grupėmis. Neigiamų kontrolinių ėminių gyvūnams gauta uodegos DNR procentinė dalis turėtų atitikti iš anksto kiekvienam audiniui nustatytą laboratorijos foninį intervalą ir ėminių ėmimo laiką (žr. 16 pastraipą). Jei nėra istorinių arba paskelbtų kontrolinių duomenų, kurie rodo, kad pasirinktas nešiklis nesukelia jokio žalingo arba genotoksinio poveikio dėl davimų skaičiaus arba davimo būdo, prieš atliekant visą tyrimą reikėtų atlikti pradinį tyrimą nešiklio kontrolinio ėminio priimtinumui nustatyti. PROCEDŪRA Gyvūnų skaičius ir lytis Nors patelėms gautų duomenų yra per mažai, kad atliekant kometų bandymą būtų galima palyginti lytis, kiti patinams ir patelėms gauti genotoksiškumo in vivo atsakai iš esmės yra panašūs, todėl daugumą tyrimų galima atlikti su bet kurios lyties gyvūnais. Jei duomenys rodytų esminius skirtumus tarp patinų ir patelių (pvz., sisteminio toksiškumo, metabolizmo, biologinio įsisavinamumo ir kt. skirtumus, įskaitant, pvz., intervalo nustatymo tyrimą), tai paskatintų naudoti abiejų lyčių gyvūnus. Šiuo atveju galbūt reikėtų atlikti tyrimą su abiejų lyčių gyvūnais, pvz., kaip kartotinės dozės toksiškumo tyrimo dalį. Jei naudojamos abi lytys, galbūt tiktų taikyti faktorinės analizės schemą. Išsami informacija, kaip analizuoti duomenis taikant šią schemą, pateikta 2 priedėlyje. Tyrimo pradžioje ir nustatant kvalifikaciją reikėtų nustatyti grupių dydį turint tikslą vienai grupei gauti ne mažiau kaip 5 analizei tinkamus vienos lyties gyvūnus arba kiekvienos lyties gyvūnus, jei naudojami abiejų lyčių gyvūnai (vienalaikių teigiamų kontrolinių ėminių grupei reikia mažiau gyvūnų, žr. 29 pastraipą). Jei cheminių medžiagų poveikis žmonėms gali priklausyti nuo lyties, pvz., kai kurių vaistų atveju, bandymas turėtų būti atliekamas su atitinkamos lyties gyvūnais. Atliekant tyrimą pagal 33 pastraipoje nustatytus parametrus, kai yra trys dozių grupės ir vienalaikio neigiamo ir teigiamo kontrolinių ėminių grupės (kiekvieną grupę sudaro penki vienos lyties gyvūnai), rekomenduojamas tipinis maksimalus gyvūnų poreikis būtų nuo 25 iki 35 gyvūnų. APDOROJIMO PLANAS Gyvūnai turėtų būti apdorojami kasdien 2 paras ar ilgiau (t. y. apdorojama du kartus ar daugiau maždaug kas 24 h), ir ėminiai surenkami vieną kartą, nuo paskutinio apdorojimo praėjus 2–6 h (arba Tmax) (12). Priimtini išplėstinių dozių davimo schemų (pvz., 28 parų kasdienio dozavimo) ėminiai. Buvo parodyta, kad galima sėkmingai derinti kometų ir eritrocitų mikrobranduolių bandymus (10) (19). Tačiau reikėtų kruopščiai ištirti kometų analizei paimtų ėminių tiekimo klausimus, atsižvelgiant į reikalavimus, susijusius su kitiems toksikologinių įvertinimų tipams skirtų audinių ėminių ėmimu. Surinkimas praėjus 24 h nuo paskutinės dozės davimo, kuris yra tipinis laikas atliekant bendrojo toksiškumo tyrimą, daugumoje atveju netinka (žr. 40 pastraipą apie ėminių ėmimo laiką). Kitokių apdorojimo ir ėminių ėmimo tvarkaraščių naudojimą reikėtų pagrįsti (žr. 3 priedėlį). Pvz., būtų galima imti daugkartinius ėminius po vienkartinio apdorojimo, tačiau reikėtų pažymėti, kad tyrimui su vienkartiniu davimu atlikti prireiks daugiau gyvūnų, nes ėminius reikės imti daug kartų, bet kartais tai gali tikti labiau, pvz., kai bandomoji cheminė medžiaga sukelia per didelį toksiškumą po pakartotinio dozių davimo. Nepriklausomai nuo bandymo atlikimo būdo, jis yra priimtinas, jei bandomajai cheminei medžiagai gaunamas teigiamas atsakas arba, kai atsakas yra neigiamas, ar yra tikslinio (-ų) audinio (-ų) paveikimą patvirtinančių tiesioginių ar netiesioginių įrodymų ir ar pasiekta ribinė dozė (žr. 36 pastraipą). Bandomąsias chemines medžiagas galima duoti kaip padalytą dozę, t. y. siekiant palengvinti didelių tūrių davimą, per vieną dieną apdorojama du kartus arba daugiau, tarp apdorojimų esant ne ilgesniam kaip 2–3 h tarpui. Šiomis aplinkybėmis ėminių ėmimo tvarkaraštį reikėtų sudaryti atsižvelgiant į paskutinės dozės davimo laiką (žr. 40 pastraipą). Dozių dydžiai Jei atliekamas parengiamasis intervalo nustatymo tyrimas, nes nėra kitų susijusių tyrimų tinkamų duomenų, kurie padėtų pasirinkti dozę, jį reikėtų atlikti toje pačioje laboratorijoje, naudojant pagrindiniam tyrimui naudoti numatytą rūšį, veislę, lytį ir apdorojimo schemą pagal dabartinius intervalo nustatymo tyrimų atlikimo metodus. Tyrimo tikslas – nustatyti didžiausią toleruojamą dozę (MTD), apibrėžiamą kaip dozė, kuri sukeltų nestiprų toksinį poveikį, susijusį su tyrimo laikotarpio trukme (pvz., būtų aiškūs klinikiniai požymiai, pvz., nenormalus elgesys ar reakcija, nedidelis kūno masės sumažėjimas arba tikslinio audinio citotoksiškumas), bet ne žūtį ar skausmo, kančių ar išsekimo požymius, dėl kurių gyvūną reikėtų numarinti. Jei bandomoji cheminė medžiaga nėra toksiška, 14 parų ar ilgesnio laikotarpio didžiausia (ribinė) davimo dozė turėtų būti 1 000 mg/kg kūno masės per parą. Jei davimo laikotarpis yra trumpesnis kaip 14 parų, maksimali (ribinė) dozė yra 2 000 mg/kg kūno masės per parą. Tam tikrų tipų bandomųjų cheminių medžiagų (pvz., vaistų žmonėms), kurioms taikomi specifiniai reglamentai, šios ribos gali skirtis. Cheminės medžiagos, kurios rodo toksikokinetinių savybių prisotinimą arba po ilgalaikio davimo sukelia detoksifikavimo procesus, galinčius mažinti poveikį, gali būti dozės nustatymo kriterijų išimtys ir turėtų būti įvertinamos kiekvienu atveju atskirai. Atliekant ūmaus ir poūmio poveikio kometų bandymą, be didžiausios dozės (MTD, didžiausios leidžiamos dozės, didžiausios poveikio ar ribinės dozės) kiekvienam ėminio ėmimo laikui reikėtų pasirinkti ne mažiau kaip dvi papildomas mažėjančios sekos ir reikiamo skirtumo (pageidautina, kad skirtumas būtų mažesnis kaip 10 kartų) dozes, kad būtų įrodyti su doze susiję atsakai. Tačiau būtų gerai, jei naudojami dozių dydžiai aprėptų intervalą nuo didžiausios dozės iki mažo toksiškumo arba visiškai jo nesukeliančios dozės. Kai toksiškumas tiksliniam audiniui stebimas visiems bandomiems dozės dydžiams, patartina toliau tirti netoksines dozes (žr. 54–55 pastraipas). Tyrimams, kurių tikslas būtų išsamiau ištirti dozės ir atsako priklausomybės kreivės formą, gali prireikti papildomos (-ų) dozių grupės (-ių). Dozių davimas Rengiant bandymo schemą, reikėtų atsižvelgti į numatomą poveikio žmogui būdą. Todėl galima pasirinkti pagrįstus veikimo būdus, pvz., duoti su pašaru, geriamuoju vandeniu, dėti ant odos, atlikti vietinę poodinę arba intraveninę injekciją, duoti per burną (per zondą), kvėpavimo takus, intubacinį vamzdelį ar implantuoti. Visais atvejais turėtų būti pasirinktas būdas, kuris užtikrintų reikiamą tikslinio (-ių) audinio (-ių) veikimą. Injekcija į pilvo ertmę paprastai nerekomenduojama, nes tai nėra numatytas poveikio žmogui būdas ir jį reikėtų naudoti, tik, jei jis būtų specialiai moksliškai pagrįstas (pvz., kai kurios teigiamos kontrolinės cheminės medžiagos, tyrimo tikslai ar kai kurie vaistai, kurie duodami darant injekciją į pilvo ertmę). Skysčio, kurį galima duoti per zondą arba įšvirkšti per vieną kartą, maksimalus tūris priklauso nuo bandymo gyvūno dydžio. Tūris neturėtų būti didesnis kaip 1 ml/100 g kūno masės, išskyrus vandeninius tirpalus, kurių galima duoti po 2 ml/100g kūno masės. Didesnio nei šis tūrio naudojimą (jei leidžiama pagal gyvūnų gerovės teisės aktus) reikėtų pagrįsti. Visais įmanomais atvejais skirtingo dydžio dozes reikėtų gauti atitinkamai reguliuojant dozuojamo preparato koncentraciją, kad būtų užtikrintas visų dydžių dozių tūrio pastovumas kūno masės atžvilgiu. Ėminių ėmimo laikas Ėminių ėmimo laikas yra kritinis kintamasis, nes jį lemia laikotarpis, per kurį bandomosios cheminės medžiagos pasieka maksimalią koncentraciją tiksliniame audinyje ir yra gauti DNR gijų trūkiai, bet jie dar nėra pašalinti ir pataisyti ar dar nežuvo ląstelės. Kai kurių pažaidų, kurios sukeltų kometų bandymu aptinkamus DNR gijų trūkius, buvimo trukmė gali būti labai trumpa, bent kai kurioms in vitro bandomoms cheminėms medžiagoms (52) (53). Todėl įtariant tokias laikinas DNR pažaidas, reikėtų imtis priemonių jų praradimui sumažinti, užtikrinant pakankamai ankstyvą audinių ėminių ėmimą, galbūt imant anksčiau nei toliau nurodytos numatomosios vertės. Optimalus (-ūs) ėminių ėmimo laikas (-ai) gali būti susijęs (-ę) su chemine medžiaga ar davimo būdu, dėl kurio, pvz., audinys būtų paveikiamas būtų greita, suleidus į veną ar įkvėpus. Todėl, jei įmanoma, ėminių ėmimo laikus reikėtų nustatyti pagal kinetinius duomenis (pvz., pagal laiką (Tmax), kuriuo pasiekiama didžiausia koncentracija (Cmax) plazmoje ar audinyje, arba pasiekus nuostoviąją būseną, taikant daugkartinį dozės davimą). Neturint kinetinių duomenų, tinkamas genotoksiškumo matavimo kompromisas būtų ėminių ėmimas, praėjus 2–6 h nuo paskutinio apdorojimo, jei apdorojama du kartus ar daugiau, arba praėjus 2–6 ir 16–26 h po vienkartinio davimo, bet reikėtų imtis priemonių atlikti vienalaikį visų gyvūnų skrodimą po paskutinės (ar vienintelės) dozės. Informacija apie tikslinių audinių toksinio poveikio vaizdą (jei yra) taip pat gali būti naudojama reikiamiems ėminių ėmimo laikams pasirinkti. Stebėjimai Bandymo gyvūnų sveikatos bendruosius klinikinius stebėjimus reikėtų atlikti ir registruoti bent kartą per dieną, ir pageidautina tai daryti kartą ar kelis kartus kasdien tuo pačiu laiku, atsižvelgiant į didžiausio numatomo poveikio laiką po dozės davimo (54). Mažiausiai du kartus per dieną, siekiant nustatyti liguistumo ir gaištamumo požymius, visus gyvūnus reikėtų apžiūrėti. Jei tyrimų trukmė ilgesnė, visus gyvūnus reikėtų sverti bent kartą per savaitę ir pasibaigus bandymo laikotarpiui. Pašaro suvartojimą reikėtų matuoti jį keičiant ir bent kas savaitę. Jei bandomoji cheminė medžiaga duodama su geriamuoju vandeniu, suvartoto vandens kiekį reikėtų išmatuoti kaskart, kai vanduo keičiamas, ir bent kartą per savaitę. Gyvūnus, kuriems pasireiškia nemirtini per didelio toksiškumo požymiai, reikėtų humaniškai numarinti iki bandymo laikotarpio pabaigos, ir jie paprastai nenaudojami kometų analizei. Audinių surinkimas Kadangi iš esmės įmanoma tirti kiekvieno audinio DNR gijų trūkių indukciją (kometas), renkamo audinio (-ų) pasirinkimo principą reikėtų aiškiai apibrėžti ir pagrįsti atsižvelgiant į tyrimo atlikimo priežastį ir į turimus tiriamų bandomųjų cheminių medžiagų ADME, genotoksiškumo, kancerogeniškumo ar kitus toksiškumo duomenis. Svarbūs nagrinėjami veiksniai turėtų aprėpti davimo būdą (pagrįstą galimu (-ais) poveikio žmonėms būdu (-ais)), prognozuojamą pasiskirstymą ir absorbciją audiniuose, metabolizmo vaidmenį ir galimą bandomųjų cheminių medžiagų veikimo mechanizmą. Dažniausiai tiriamas audinys yra kepenys, apie kurias sukaupta daugiausiai duomenų. Todėl, jei nėra bendrosios informacijos ir neidentifikuoti specifiniai audiniai, kuriuos reikėtų tirti, pagrįstai būtų galima imti kepenų ėminius, nes jos yra pagrindinė ksenobiotinio metabolizmo vieta, dažnai labai veikiama pačios -ų) pradinės (-ių) medžiagos (-ų) ir metabolito (-ų). Kartais labiausiai tiktų tirti tiesioginio sąlyčio vietą (pvz., liaukinį skrandį arba dvylikapirštę ar tuščiąją žarną, chemines medžiagas duodant per burną, arba plaučius, jei tiriamos įkvepiamos cheminės medžiagos). Atsižvelgiant į specifines bandymo atlikimo priežastis, reikėtų pasirinkti papildomus ar alternatyvius audinius, tačiau būtų naudinga ištirti kelis tų pačių gyvūnų audinius, jei laboratorija įrodė turinti kvalifikaciją visus tuos audinius ištirti ir geba juos apdoroti vienu metu. Bandinių paruošimas Kalbant apie procesus, aprašytus kitose pastraipose (44–49), yra svarbu tai, kad visi tirpalai ar stabilios suspensijos būtų panaudotos iki galiojimo pabaigos datos, arba prireikus būtų paruoštos iš naujo. Be to, toliau pateiktose pastraipose kritiniais kintamaisiais laikomas i) kiekvieno audinio pašalinimo po skrodimo, ii) kiekvieno audinio apdorojimo gaunant ląstelių ar branduolių suspensiją ir iii) suspensijos apdorojimo ir objektinių stiklelių paruošimo laikas (žr. 1 priedėlį Apibrėžtys), o priimtina kiekvieno šių etapų trukmė turėjo būti nustatyta kuriant metodą ir atliekant kvalifikacijos įrodymą. Laikantis galiojančių gyvūnų gerovės teisės aktų ir trijų R principų ir praėjus reikiamam (-iems) laikui (-ams) po paskutinio apdorojimo bandomąja chemine medžiaga, gyvūnai numarinami. Pasirinktas (-i) audinys (-ai) yra pašalinamas (-i), preparuojamas (-i), ir jo ar jų dalis yra surenkama kometų bandymui atlikti, o kartu reikėtų paimti tos pačios audinio dalies išpjovą ir ją įdėti į formaldehido tirpalą ar reikiamą fiksavimo priemonę galimai histopatologinei analizei (žr. 55 pastraipą) pagal standartinius metodus (12) atlikti. Kometų bandymo audinys dedamas į malimo buferinį tirpalą, gerai išplaunamas šaltu malimo buferiniu tirpalu liekamajam kraujui pašalinti ir laikomas lediniame malimo buferiniame tirpale iki apdorojimo pradžios. Taip pat galima atlikti perfuziją in situ, pvz., kepenų, inkstų. Yra daug paskelbtų metodų ląstelėms ar branduoliams atskirti. Juos sudaro audinių, pvz., kepenų ir inkstų, malimas, virškinimo trakto gleivėtų paviršių grandymas, homogenizavimas ir fermentinis skaidymas. Atliekant JaCVAM tinkamumo patvirtinimo tyrimą, buvo tiriamos tik atskiros ląstelės, todėl, kad būtų galima kurti metodą ir naudoti JaCVAM tyrimų duomenis kvalifikacijai įrodyti, pageidautina naudoti atskiras ląsteles. Tačiau buvo įrodyta, kad skirtumas tarp bandymo rezultatų nelabai priklausė nuo to, ar buvo naudojamos atskiros ląstelės, ar branduoliai (8). Palyginami rezultatai taip pat gaunami, taikant skirtingus metodus ląstelėms ar branduoliams atskirti (pvz., homogenizavimą, malimą, fermentinį skaidymą ir filtravimą per tinklelį (55). Todėl galima naudoti atskiras ląsteles arba atskirus branduolius. Laboratorija turėtų kruopščiai įvertinti audiniams būdingus atskirų ląstelių ar branduolių gavimo metodus ir patvirtinti jų tinkamumą. Kaip aptarta 40 pastraipoje, kai kurios pažaidos, pagal kurias kometų metodu aptinkami DNR gijų trūkiai, gali būti labai trumpą laiką (52) (53). Todėl, neatsižvelgiant į metodą, taikomą atskirų ląstelių ar branduolių suspensijoms gauti, yra svarbu, kad numarinus gyvūnus audiniai būtų apdoroti kuo greičiau ir būtų laikomi sąlygomis, kurios mažintų pažaidų išnykimą (pvz., audinius laikyti žemoje temperatūroje). Ląstelių suspensijas iki naudojimo pradžios reikėtų laikyti ledo temperatūroje taip, kad galima būtų įrodyti minimalius pokyčius tarp ėminių ir reikiamus teigiamų bei neigiamų kontrolinių ėminių atsakus. OBJEKTINIŲ STIKLELIŲ PARUOŠIMAS Objektiniai stikleliai turėtų būti ruošiami kuo greičiau (geriausia per vieną valandą) po atskirų ląstelių ar branduolių paruošimo, bet temperatūra ir laiko tarpas tarp gyvūnų numarinimo ir objektinių stiklelių paruošimo turėtų būti griežtai kontroliuojami ir patvirtinti laboratorijos sąlygomis. Ląstelių suspensijos tūris, įdėtas į žemos lydymosi temperatūros agarozę (paprastai 0,5–1,0 %) objektiniams stikleliams paruošti, neturėtų sumažinti žemos lydymosi temperatūros agarozės procentinės dalies iki mažesnės kaip 0,45 %. Optimalus ląstelių tankis bus nustatytas vaizdo analizės sistema, naudojama kometoms skaičiuoti. Lizė Lizės sąlygos taip pat yra kritinis kintamasis ir gali trukdyti gijų trūkiams, gautiems specifinių DNR modifikacijų tipams (tam tikroms alkilintoms DNR ir baziniams aduktams). Todėl rekomenduojama užtikrinti kiek įmanoma pastovesnes lizės sąlygas visiems vieno bandymo objektiniams stikleliams. Paruoštus objektinius stiklelius reikėtų panardinti į atšaldytą iki maždaug 2–8 °C lizės tirpalą ne trumpiau kaip vienai valandai (arba per naktį) prislopinto apšvietimo, pvz., geltonos šviesos (arba šviesos nepatekimo) sąlygomis, kad būtų išvengta UV komponentų galinčio turėti baltos šviesos poveikio. Pasibaigus inkubavimo laikotarpiui ir prieš pradedant išvijimo šarminėje terpėje etapą, objektinius stiklelius reikėtų nuplauti, kad būtų pašalintas ploviklis ir druskos. Tai galima daryti naudojant dejonizuotą vandenį, neutralizavimo buferinį tirpalą ar fosfatinį buferinį tirpalą. Taip pat galima naudoti elektroforezės buferinį tirpalą. Taip būtų užtikrintos šarminės sąlygos elektroforezės kameroje. Gijų išvijimas ir elektroforezė Objektiniai stikleliai turėtų būti atsitiktinai sudėti ant panardinamo tipo elektroforezės bloko, turinčio pakankamai elektroforezės tirpalo objektinių stiklelių paviršiams visiškai padengti, platformos (padengimo gylis taip pat turėtų būti vienodas tarp atskirų bandymų). Naudojant kito tipo kometų bandymo elektroforezės blokus, t. y. aktyviojo aušinimo su aušalo cirkuliacija ir su didelės galios maitinimo šaltiniu, bus gauta didesnė elektros srovė esant storesniam tirpalo sluoksniui, bet įtampa bus pastovi. Reikėtų naudoti subalansuotą objektinių stiklelių dėjimo į elektroforezės indą schemą, kad būtų sušvelnintas visų nukrypimų poveikis ar kraštinis efektas indo viduje ir sumažintas kintamumas tarp partijų, t. y. atliekant kiekvieną elektroforezės bandymą, turėtų būti tas pats kiekvieno tyrime naudoto gyvūno objektinių stiklelių skaičius ir būtų įtraukti skirtingo dozavimo grupių ėminiai, neigiami ir teigiami kontroliniai ėminiai. Objektiniai stikleliai paliekami bent 20 min, kad DNR galėtų išsivyti, ir atliekama elektroforezė kontroliuojamomis sąlygomis, kurios kiek įmanoma padidintų bandymo jautrį ir dinaminį diapazoną (t. y. būtų gauta priimtina neigiamų ir teigiamų kontrolinių ėminių uodegos DNR procentinė dalis, kuri užtikrintų didžiausią jautrį). Yra tiesinė priklausomybė tarp DNR migracijos atstumo ir elektroforezės trukmės bei jos potencialo (V/cm). Atsižvelgiant į JaCVAM tyrimą, potencialas turėtų būti 0,7 V/cm, o trukmė – bent 20 min. Elektroforezės trukmė yra laikoma kritiniu kintamuoju ir ji turėtų būti nustatoma dinaminiam diapazonui optimizuoti. Dėl ilgesnės elektroforezės trukmės (pvz., 30 ar 40 min, didžiausiam jautriui gauti) paprastai gaunamas stipresnis žinomų mutagenų teigiamas atsakas. Tačiau dėl ilgesnės elektroforezės trukmės gali būti gauta per didelė kontroliniams ėminiams migracija. Kiekvieno bandymo metu reikėtų užtikrinti pastovią įtampą, o kitų parametrų kintamumas turėtų atitikti siauras ir nustatytas ribas, pvz., atliekant JaCVAM tyrimą 0,7 V/cm įtampai buvo gauta 300 mA pradinė srovė. Buferinio tirpalo gylį reikėtų reguliuoti, kad reikiamos sąlygos būtų pasiektos ir užtikrintos per visą bandymą. Srovė turėtų būti registruojama elektroforezės laikotarpio pradžioje ir pabaigoje. Todėl kiekvieno tirto audinio optimalios sąlygos turėtų būti nustatytos laboratorijoje atliekant pradinį kvalifikacijos įrodymą. Elektroforezės tirpalo temperatūra išvijimo ir elektroforezės laikotarpiu turėtų būti žema, paprastai 2–10 °C (10). Reikėtų registruoti elektroforezės tirpalo temperatūrą išvijimo pradžioje, elektroforezės pradžioje ir elektroforezės pabaigoje. Baigus elektroforezę, objektinius stiklelius reikėtų įmerkti į neutralizavimo buferinį tirpalą ar juo plauti ne trumpiau kaip 5 min. Galima dažyti tik ką gautus gelius ir vertinti (pvz., po 1–2 dienų) ar juos galima dehidratuoti, kad būtų galima vertinti vėliau (pvz., po 1–2 savaičių nuo dažymo) (56). Tačiau sąlygos turėtų būti patvirtintos atliekant kvalifikacijos įrodymo bandymus, o istoriniai duomenys turėtų būti gauti ir saugomi atskirai kiekvienai iš šių sąlygų. Tuo atveju, kai vertinama vėliau, objektinius stiklelius reikėtų dehidratuoti, panardinant į absoliutųjį etanolį ne trumpiau kaip 5 min, palikti džiūti ir laikyti kambario temperatūroje arba sudėti į talpyklą ir laikyti šaldytuve iki vertinimo pradžios. Matavimo metodai Kometas reikėtų vertinti kiekybiškai, naudojant automatizuotą ar pusiau automatizuotą vaizdo analizės sistemą. Objektiniai stikleliai dažomi tinkamu fluorescenciniu dažu, pvz., SYBR Gold, Green I, propidiumo jodidu ar etidiumo bromidu ir stebimi esant tinkamam didinimui (pvz., 200×) per epifluorescencinį mikroskopą, turintį reikiamus detektorius ar skaitmeninį (pvz., CCD) fotoaparatą. Ląsteles galima suskirstyti į tris kategorijas, kaip aprašyta kometų vaizdų atlase (57), t. y. skaičiuojamas, neskaičiuojamas ir „ląsteles vaiduoklius“ (aptarimas pateiktas 56 pastraipoje). Siekiant išvengti artefaktų, vertinamos tik skaičiuojamos ląstelės (su aiškiai apibrėžta galva bei uodega ir be kaimyninių ląstelių trukdžių) uodegos DNR procentinei daliai nustatyti. Ataskaitoje nebūtina nurodyti neskaičiuojamų ląstelių dažnumą. Ląstelių vaiduoklių dažnumas turėtų būti nustatytas pagal vizualų 150 ląstelių vienam ėminiui vertinimą (nes aiškiai apibrėžtos galvos nebuvimas reikštų, kad jas būtų nelengva aptikti vaizdo analizės metodu) (aptarimas pateiktas 56 pastraipoje) ir dokumentuotas atskirai. Visi objektiniai stikleliai, įskaitant teigiamų ir neigiamų kontrolinių ėminių, turėtų būti atskirai koduojami ir vertinami „aklai“, kad skaičiuotojas nežinotų apdorojimo sąlygų. Reikėtų analizuoti ne mažiau kaip kiekvieno ėminio (vienam audiniui ir vienam gyvūnui) 150 ląstelių (išskyrus ląsteles vaiduoklius, žr. 56 pastraipa). Vertinant ne mažiau kaip 5 gyvūnus (vienalaikio teigiamo kontrolinio ėminio gyvūnų yra mažiau, žr. 29 pastraipą) vienai dozei ir 150 ląstelių vienam gyvūnui, gaunama pakankama statistinė galia pagal Smith et al., 2008 analizę (5). Jei naudojami objektiniai stikleliai, vienam ėminiui galėtų būti vertinami 2–3 stikleliai, kai kiekvieną grupę sudaro penki gyvūnai. Reikėtų apžiūrėti kelias objektinio stiklelio zonas, kuriose yra toks tankis, kuris užtikrina, kad nebūtų uodegų sanklotos. Reikėtų vengti ląsteles vertinti objektinių stiklelių kraštuose. Atliekant kometų bandymą, DNR gijų trūkius galima matuoti pagal nepriklausomas vertinamąsias baigtis, pvz., uodegos DNR procentinę dalį, uodegos ilgį ir uodegos momentą. Galima matuoti visus tris parametrus, jei naudojama tinkama vaizdo analizės sistemos programinė įranga. Tačiau rekomenduojama naudoti uodegos DNR procentinę dalį (taip pat vadinamą uodegos intensyvumo %) rezultatams įvertinti ir aiškinti (12) (40) (41) (42), ir ji nustatoma pagal DNR fragmento intensyvumą uodegoje, išreikštą kaip viso ląstelės intensyvumo procentinė dalis (13). Audinių pažeidimas ir citotoksiškumas Teigiami kometų bandymo rezultatai gali būti gauti ne vien tik dėl genotoksiškumo, nes DNR migracija gali padidėti ir dėl toksiškumo tiksliniam audiniui (12) (41). Ir atvirkščiai, žinomoms genotoksinėms medžiagoms dažnai stebimas mažas arba vidutinis citotoksiškumas (12), ir tai rodo, kad vien tik pagal kometų bandymą neįmanoma atskirti genotoksiškumo ir citotoksiškumo sukeltos DNR migracijos. Tačiau jei stebimas DNR migracijos padidėjimas, rekomenduojama ištirti vieną ar kelis citotoksiškumo rodiklius, nes tai palengvintų aiškinti rezultatus. DNR migracijos padidėjimą esant aiškiems citotoksiškumo požymiams reikėtų aiškinti atsargiai. Pasiūlyta daug citotoksiškumo matavimo kriterijų ir iš jų, kaip tinkamas citotoksiškumo audiniams kriterijus, buvo pasiūlyti histopatologiniai pokyčiai. Stebėjimų rezultatai, pvz., uždegimas, ląstelių infiltracija, apoptoziniai ar nekroziniai pokyčiai, buvo susiję su padidėjusia DNR migracija, tačiau, kaip matyti iš JaCVAM tinkamumo patvirtinimo tyrimo (12), negalima pateikti galutinio histopatologinių pokyčių, kurie yra visada susiję su padidėjusia DNR migracija, sąrašo. Naudingos informacijos apie audinių pažeidimą galima gauti iš klinikinės biochemijos tyrimų (pvz., AST, ALT), ir galima taip pat atsižvelgti į papildomus rodiklius, pvz., kaspazių aktyvinimą, apoptozės aptikimą TUNEL metodu, Annexin V dažymu ir kt. Tačiau yra paskelbta mažai duomenų apie tai, kad pastarieji metodai buvo taikomi atliekant tyrimus in vivo, o kai kurie gali būti mažiau patikimi nei kiti. Ląstelės vaiduokliai (arba debesys) yra ląstelės, kurių mikroskopinį vaizdą sudaro maža galva ar jos apskritai nėra ir didelės pasklidosios uodegos, ir kurios laikomos stipriai pažeistomis ląstelėmis, nors ląstelių vaiduoklių etiologija nėra aiški (žr. 3 priedėlį). Uodegos DNR procentinės dalies matavimai vaizdo analizės metodu yra nepatikimi dėl ląstelių vaiduoklių išvaizdos, todėl ląstelės vaiduokliai turėtų būti įvertintos atskirai. Ląstelių vaiduoklių buvimas turėtų būti pažymėtas ir pateiktas ataskaitoje, o kiekvienas reikšmingas jų kiekio padidėjimas, kurį būtų galima susieti su bandomąja chemine medžiaga, turėtų būti ištirtas ir išsamiai paaiškintas. Žinios apie bandomųjų cheminių medžiagų galimą veikimo būdą gali padėti tiriant šiuos aspektus. DUOMENYS IR ATASKAITOS RENGIMAS Rezultatų apdorojimas Gyvūnas yra bandymo vienetas, todėl atskirų gyvūnų duomenys ir apibendrinti rezultatai turėtų būti pateikti lentelių pavidalu. Dėl hierarchinės duomenų prigimties rekomenduojama, kad kiekvienam objektiniam stikleliui būtų nustatyta uodegos DNR procentinės dalies mediana ir kiekvienam gyvūnui būtų apskaičiuotas medianinių verčių vidurkis (12). Nustatomi atskiriems gyvūnams gauti vidurkiai, kad būtų gautas grupės vidurkis. Visos šios vertės turėtų būti įtrauktos į ataskaitą. Galima taikyti alternatyvius metodus (žr. 53 pastraipą), jei jie būtų pagrįsti moksliniu ir statistiniu požiūriu. Statistinę analizę galima atlikti taikant įvairius metodus (58) (59) (60) (61). Kaip aptarta pirmiau pateiktose nuorodose, renkantis taikomus statistinius metodus, reikėtų atsižvelgti į duomenų transformacijos poreikį (pvz., logaritminės arba kvadratinės šaknies) ir (arba) į poreikį pridėti mažą skaičių (pvz., 0,001) prie visų (net ne nulio) verčių, kad būtų sušvelnintas ląstelių nulinių verčių poveikis. Išsami informacija apie apdorojimo ir lyčių sąveiką, kai naudojami abiejų lyčių gyvūnai, ir apie vėliau atliekamą duomenų analizę, nustačius skirtumus ar jų nenustačius, pateikta 2 priedėlyje. Ataskaitoje taip pat reikėtų pateikti toksiškumo ir klinikinių požymių duomenis. Priimtinumo kriterijai Bandymo priimtinumas pagrįstas šiais kriterijais:
Rezultatų įvertinimas ir aiškinimas Kai įvykdyti visi priimtinumo kriterijai, bandomoji cheminė medžiaga laikoma aiškiai teigiama, jei:
Atitinkant visus šiuos kriterijus, laikoma, kad bandomoji cheminė medžiaga gali sukelti šioje bandymų sistemoje tirtų audinių DNR gijų trūkius. Jei yra tik vieno ar dviejų kriterijų atitiktis, žr. 62 pastraipą. Kai įvykdyti visi priimtinumo kriterijai, bandomoji cheminė medžiaga laikoma aiškiai neigiama, jei:
Laikoma, kad ši bandomoji cheminė medžiaga negali sukelti šioje bandymų sistemoje tirtų audinių DNR gijų trūkių. Nėra reikalavimo patikrinti aiškų teigiamą ar neigiamą atsaką. Jei atsakas nėra aiškiai neigiamas ar aiškiai teigiamas (t. y. atitinka ne visus 59 ar 60 pastraipoje išvardytus kriterijus), ir siekiant padėti nustatyti rezultato biologinę svarbą, duomenys turėtų būti įvertinti pateikiant ekspertų nuomonę ir (arba) atliekant papildomus tyrimus, jei jie būtų moksliškai pagrįsti. Galėtų būti naudingas papildomų ląstelių skaičiavimas (jei tinka) arba kartotinis bandymas galbūt optimizuotomis bandymo sąlygomis (pvz., kiti tarpai tarp dozės verčių, kiti davimo būdai, kitas ėminių ėmimo laikas arba kiti audiniai). Retais atvejais, netgi atlikus papildomus tyrimus, gautų duomenų rinkinio nepakaks padaryti išvadą, ar rezultatai teigiami ar neigiami, todėl bus priimtas sprendimas, kad atsakas yra dviprasmis. Siekiant įvertinti teigiamo ar dviprasmio rezultato biologinę svarbą, reikia turėti informacijos apie citotoksiškumą tiksliniam audiniui (žr. 54–55 pastraipas). Jei teigiami ar dviprasmiai rezultatai stebimi tik esant aiškiems citotoksiškumo įrodymams, būtų daroma išvada, kad tyrimas dviprasmis dėl genotoksiškumo, nebent būtų informacijos, kurios pakaktų galutinei išvadai patvirtinti. Jei neigiamas tyrimo rezultatas gautas tokiomis aplinkybėmis, kai visoms bandytoms dozėms yra toksiškumo požymių, gal būtų naudinga atlikti papildomą tyrimą esant netoksinėms dozėms. Bandymo ataskaita Į bandymo ataskaitą turėtų būti įtraukta ši informacija:
LITERATŪRA
1 priedėlis TERMINŲ APIBRĖŽTYS Pavienių ląstelių gelio elektroforezė šarminėmis sąlygomis – jautrus metodas pirminėms DNR pažaidoms aptikti atskirų ląstelių ar branduolių lygiu. Cheminė medžiaga – medžiaga arba mišinys. Kometa – forma, kurią įgauna elektroforezės lauko veikiamas nukleotidas, pavadinta dėl savo panašumo į kometas: galva yra branduolys, o uodegą sudaro DNR, migruojanti iš branduolio elektriniame lauke. Kritinis kintamasis ar parametras – protokolo kintamasis, kurio mažas pokytis gali daryti didelę įtaką bandymo išvadai. Kritiniai kintamieji gali būti audiniui būdingi kintamieji. Kritinių kintamųjų nereikėtų keisti, ypač vieno bandymo metu, neatsižvelgus į tai, kaip pakeitimas paveiks bandymo atsaką, pvz., kaip rodo teigiamų ir neigiamų kontrolinių ėminių atsako dydis ir kintamumas. Bandymo ataskaitoje turėtų būti išvardyti kritinių kintamųjų pakeitimai, padaryti bandymo metu, arba palyginti su standartiniu laboratorijos protokolu, ir pateiktas kiekvieno pakeitimo pagrindimas. Uodegos intensyvumas arba uodegos procentinė DNR dalis – atitinka kometos uodegos fluorescencijos intensyvumą palyginti su suminiu intensyvumu (galvos ir uodegos). Šis parametras rodo DNR trūkių mastą, išreikštą procentais. Bandomoji cheminė medžiaga – taikant šį metodą bandoma medžiaga arba mišinys. UVCB – nežinomos ar kintamos sudėties medžiagos, sudėtingųjų reakcijų produktai ar biologinės medžiagos. 2 priedėlis FAKTORINĖS ANALIZĖS SCHEMA LYČIŲ SKIRTUMAMS NUSTATYTI ATLIEKANT KOMETŲ BANDYMĄ IN VIVO Faktorinės analizės schema ir jos taikymas Pagal šią schemą kiekvienai koncentracijos vertei bandomi ne mažiau kaip 5 patinai ir 5 patelės, iš viso pagal schemą naudojant ne mažiau kaip 40 gyvūnų (20 patinų ir 20 patelių ir dar atitinkami teigiami kontroliniai ėminiai). Schema, kuri yra viena iš paprastesnių faktorinės analizės schemų, atitinka dvifaktorinės dispersinės analizės schemą, kurios pagrindiniai veiksniai yra lytis ir koncentracijos vertė. Duomenis galima analizuoti naudojant daug standartinių statistinės programinės įrangos rinkinių, pvz., SPSS, SAS, STATA, Genstat taip pat naudojant programavimo kalbą R. Atliekant analizę, duomenų rinkinio kintamumas perdalijamas į kintamumą tarp lyčių, tarp koncentracijos verčių ir į kintamumą, susijusį su sąveika tarp lyčių ir koncentracijos verčių. Kiekvienas iš narių tikrinamas tos pačios lyties kartotinių gyvūnų kintamumo grupių viduje įverčio atžvilgiu, esant vienodai koncentracijai. Išsami informacija apie bazinę metodiką pateikta daugelyje standartinių statistinių vadovėlių (žr. nuorodas) ir su statistiniais rinkiniais pateikiamose pagalbinėse priemonėse. Analizė tęsiama tikrinant ANOVA lentelės x lyties ir koncentracijos sąveikos narį (35). Nesant reikšmingo sąveikos nario, lytims ar koncentracijos vertėms gautos jungtinės vertės duoda patikimus statistinius kriterijus tarp koncentracijos verčių, pagrįstus grupės jungtiniu ANOVA kintamumo nariu. Atliekant analizę toliau, kintamumo tarp koncentracijos verčių įvertis dalijamas į kontrastus, taip gaunamas atsakų pagal koncentracijos vertes tiesinių ir kvadratinių kontrastų kriterijus. Kai yra reikšminga x lyties ir koncentracijos sąveika, šį narį taip pat galima padalyti į tiesinius x lyties ir kvadratinius x lyties sąveikos kontrastus. Šie nariai pateikia kriterijus, ar abiejų lyčių atsakas į koncentraciją yra lygiagretus, ar abiejų lyčių atsakas yra skirtuminis. Grupės jungtinio kintamumo įvertis gali būti naudojamas skirtumų tarp vidurkių poriniams kriterijams gauti. Galima lyginti abiejų lyčių vidurkius ir skirtingoms koncentracijos vertėms gautus vidurkius, pvz., palyginimui su neigiamų kontrolinių ėminių vidurkiais. Jei sąveika yra reikšminga, galima lyginti vienos lyties skirtingoms koncentracijos vertėms gautus vidurkius ir vienos koncentracijos lytims gautus vidurkius. Nuorodos Yra daug statistikos vadovėlių, kuriuose aptariama faktorinės analizės schemų, nuo paprasčiausios dvifaktorinės analizės iki bandymų planavimo metodikoje naudojamų sudėtingesnių formų, teorija, projektavimas, metodika, analizė ir aiškinimas. Toliau pateikiamas sąrašas nėra išsamus. Kai kuriose knygose pateikiami palyginamųjų schemų pavyzdžiai su skaičiavimais, kartais su kompiuterine programa analizei atlikti naudojant įvairius programinės įrangos rinkinius.
3 priedėlis DABARTINIAI BANDYMO APRIBOJIMAI Atsižvelgiant į šiuo metu turimas žinias, keli apribojimai yra susiję su kometų bandymu in vivo. Tikimasi, kad šie apribojimai bus sumažinti arba tiksliau apibrėžti, kai bus daugiau bandymo taikymo patirties, kad būtų išspręstos su reglamentavimu susijusios saugos problemos.
Nuorodos
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
16) |
C dalies C.13 skyrius pakeičiamas taip: „C.13 Biologinis kaupimasis žuvyse. Veikimo per vandeninę terpę metodas ir mitybos bandymas ĮVADAS Šis bandymų metodas atitinka EBPO bandymų gaires (TG) 305 (2012). Šios bandymų metodo peržiūros pagrindinis tikslas yra dvejopas. Pirma, numatyta įtraukti biologinio kaupimosi per maistą (36) bandymą, kuris tiktų labai mažai tirpių vandenyje medžiagų biologinio kaupimosi gebai nustatyti. Antra, numatyta sukurti bandymų metodą, kuriame dėl gyvūnų gerovės priežasčių būtų naudojama mažiau žuvų, jei tinka, ir kuris būtų ekonomiškai efektyvesnis. Per metus, praėjusius nuo konsoliduoto bandymų metodo C.13 (1) priėmimo, buvo išbandyta daug medžiagų ir laboratorijos bei priežiūros institucijos įgijo nemažą patirtį. Tai padėjo įsitikinti, kad bandymo sudėtingumą galima sumažinti, jei būtų įvykdyti specifiniai kriterijai (žr. 88 pastraipą), ir kad galimas nuosekliųjų bandymų metodas. Patirtis taip pat parodė, kad biologiniai veiksniai, pvz., augimas bei žuvų lipidų kiekis, gali daryti didelę įtaką rezultatams ir į juos gali tekti atsižvelgti. Be to, buvo pripažinta, kad vandenyje labai mažai tirpių medžiagų bandymus gali būti techniškai neįmanoma atlikti. Be to, jei medžiagos labai mažai tirpsta vandeninėje terpėje, veikimo per vandeninę terpę metodas gali būti ne toks svarbus, palyginti su mitybos bandymu. Taip buvo sukurtas bandymų metodas, kurį atliekant žuvys paveikiamos per jų maistą (žr. 7–14 pastraipas ir nuo 97 pastraipos). Mitybos tinkamumo patvirtinimo bandymas (tarplaboratorinis bandymas) buvo atliktas 2010 m. (51). Pagrindinius pakeitimus sudaro:
Prieš atliekant bet kurį iš biologinio kaupimosi bandymų, reikėtų turėti šią informaciją apie bandomąją cheminę medžiagą:
Nepriklausomai nuo pasirinkto veikimo būdo ar ėminių ėmimo schemos, šiame bandymų metode aprašyta procedūra cheminių medžiagų biologinio kaupimosi žuvyse gebai nustatyti. Nors visiška pirmenybė teikiama dinaminių bandymų režimams, leidžiami pusiau statiniai režimai, jei jie atitinka tinkamumo kriterijus (žr. 24 ir 113 pastraipas). Taikant mitybos metodą, dinaminė sistema nėra būtina, kad būtų išlaikyta bandomosios cheminės medžiagos koncentracija vandenyje, tačiau ji padės užtikrinti reikiamą ištirpusio deguonies koncentraciją bei vandens grynumą ir pašalinti įtaką darančius veiksnius, pvz., organizmo išskiriamus produktus. Nepriklausomai nuo pasirinkto bandymų metodo, pateikta pakankamai daug duomenų šiam bandymui atlikti, bet paliekant reikiamą laisvę bandymo schemai priderinti prie konkrečių laboratorijų sąlygų ir prie įvairių bandomųjų cheminių medžiagų charakteristikų. Veikimo per vandeninę terpę bandymas labiausiai tinka stabilioms organinėms medžiagoms, kurių log K OW vertės yra nuo 1,5 iki 6,0 (13), bet vis dar gali būti taikoma stipriai hidrofobinėms medžiagoms (kurių log K OW > 6,0), jei galima įrodyti visiškai vandenyje ištirpusios bandomosios cheminės medžiagos koncentracijos stabilumą. Jei vandenyje ištirpintos bandomosios cheminės medžiagos koncentracijos stabilumo negalima įrodyti, veikimo per vandeninę terpę tyrimas netiktų, todėl medžiagą žuvyse reikėtų nustatyti mitybos metodu (nors mitybos bandymo rezultatų aiškinimas ir naudojimas gali priklausyti nuo reglamentavimo sistemos). Organinių medžiagų, kurių log K OW vertės yra ne didesnės kaip maždaug 9,0, biologinio kaupimosi faktoriaus (BCF, kartais žymimo K B) pradinius įverčius galima gauti taikant Bintein et al. lygtį (14). Tokių stipriai hidrofobinių medžiagų biologinio kaupimosi faktoriaus pradinis įvertis gali būti didesnis nei nuostoviosios būsenos biologinio kaupimosi faktoriaus (BCFSS) vertė, kurią būtų tikimasi gauti atliekant laboratorinius bandymus, ypač, kai pradiniam įverčiui gauti naudojamas paprastas tiesinis modelis. Parametrai, kurie apibūdina biologinio kaupimosi gebą, yra sugerties greičio konstanta (k 1), šalinimo greičio konstantos, įskaitant apsivalymo greičio konstantą (k 2), nuostoviosios būsenos biologinio koncentravimo faktorius (BCFSS), kinetinis biologinio koncentravimo faktorius (BCFK) ir mitybos biomagnifikacijos faktorius (BMF) (38). Žymėtosios bandomosios cheminės medžiagos gali palengvinti vandens, maisto ir žuvų ėminių analizę, ir gali būti naudojamos tam, kad būtų nustatyta, ar reikės atlikti metabolitų identifikavimą ir kiekybinį nustatymą. Jei matuojamas vien tik suminis radioaktyviųjų likučių kiekis (pvz., sudeginant arba soliubilizuojant audinį), BCF ar BMF yra pagrįsti pradinės cheminės medžiagos, visų išlikusių metabolitų, taip pat asimiliuotos anglies suminiu kiekiu. Todėl BCF ar BMF vertės, pagrįstos suminiu radioaktyviųjų likučių kiekiu, negali būti tiesiogiai lyginamos su BCF ar BMF, gautų atliekant vien tik pradinės cheminės medžiagos specifinę analizę. Atliekant žymėtųjų medžiagų tyrimus, prieš analizę galima taikyti atskyrimo procedūras, pvz., plonasluoksnė chromatografija TLC, HPLC ar GC (39), kad BCF ar BMF būtų nustatyti pagal pradinę cheminę medžiagą. Taikant atskyrimo metodus, reikėtų atlikti pradinės cheminės medžiagos ir atitinkamų metabolitų identifikavimą ir kiekybinį nustatymą (40) (žr. 65 pastraipą), jei BCF ar BMF reikia gauti pagal pradinės cheminės medžiagos koncentraciją žuvyje, o ne pagal žymėtųjų likučių suminį kiekį. Taip pat galima sujungti žuvų metabolizmo ar in vivo pasiskirstymo tyrimą su biologinio kaupimosi tyrimu dėl likučių audiniuose analizės ir identifikavimo. Metabolizmo tikimybę galima prognozuoti tinkamomis priemonėmis (pvz., naudojant EBPO QSAR instrumentines priemones (15) ir nuosavybės teise turimas QSAR programas). Sprendimas dėl veikimo per vandeninę terpę ar mitybos bandymo atlikimo ir dėl jo schemos turėtų būti pagrįstas 3 pastraipos veiksniais, kurie būtų nagrinėjami kartu su atitinkama reglamentavimo sistema. Pvz., jei cheminės medžiagos turi didelį log K OW, bet jų tirpumas vandenyje vis dar yra pakankamas atsižvelgiant į turimų analizės metodų jautrį, pirmenybę reikėtų teikti veikimo per vandeninę terpę bandymui. Tačiau gali būti, kad nėra galutinės informacijos apie šių hidrofobinių medžiagų tirpumą vandenyje, todėl, prieš priimant sprendimą dėl taikomo bandymų metodo, reikėtų ištirti galimybę gauti stabilias ir matuojamas vandenyje ištirpusios medžiagos koncentracijos vertes (stabilios emulsijos neleidžiamos), tinkamas veikimo per vandeninę terpę metodui (16). Neįmanoma pateikti tikslių nurodymų dėl metodo, kurį reikia taikyti atsižvelgiant į tirpumo vandenyje ir pasiskirstymo tarp oktanolio ir vandens koeficiento „ribinius“ kriterijus, nes dėl pirmiau nurodytų priežasčių metodo taikomumui gali turėti reikšmingą įtaką kiti veiksniai (analizės metodai, skaidumas, adsorbcija ir kt.). Tačiau didesnis kaip 5 K OW ir mažesnis kaip ~0,01 – 0,1 mg/l tirpumas vandenyje žymi grupę medžiagų, kurių veikimo per vandeninę terpę bandymas gali būti vis sunkesnis. Reikėtų atsižvelgti į kitus veiksnius, kurie gali turėti įtakos bandymo pasirinkimui, įskaitant cheminės medžiagos adsorbcijos ant bandymo indų ir aparatūros gebą, jos stabilumą vandeniniame tirpale palyginti su jos stabilumu žuvų maiste (17) (18) ir kt. Informacijos apie tokius praktinius aspektus galima gauti iš kitų baigtų vandeninės terpės tyrimų. Papildomos informacijos apie tai, kaip įvertinti aspektus, susijusius su biologinio kaupimosi tyrimų charakteristikomis, galima rasti literatūroje (pvz., (19)). Jei medžiagų tirpumas arba vandeninio tirpalo koncentracijos užtikrinimas, taip pat šių koncentracijos verčių analizė niekaip netrukdo taikyti veikimo per vandeninę terpę metodo, šiam metodui yra teikiama pirmenybė, kai reikia nustatyti medžiagos biologinio koncentravimo gebą. Bet kuriuo atveju reikėtų patikrinti, ar naudoti numatyta (-os) veikimo per vandeninę terpę koncentracijos vertė (-ės) atitinka tirpumo bandymo terpėje vertes. Galima taikyti įvairius metodus ištirpintos bandomosios cheminės medžiagos stabiliai koncentracijai užtikrinti, pvz., naudoti pradinius tirpalus ar pasyvaus dozavimo sistemas (pvz., kolonėlės eliuavimo metodą), jei galima įrodyti, kad galima užtikrinti stabilias koncentracijos vertes ir kad bandymo terpės nepakito palyginti su rekomenduotomis 27 pastraipoje. Stipriai hidrofobinių medžiagų (kurių log K OW > 5, o tirpumas mažesnis kaip ~ 0,01–0,1 mg/l) veikimo per vandeninę terpę bandymas gali būti vis sunkesnis. Apribojimų priežastimi gali būti nesugebėjimas užtikrinti vandeninės terpės koncentracijos, kurią būtų galima laikyti pakankamai pastovia (pvz., dėl sorbcijos ant veikimo indų stiklo ar dėl to, kad žuvys ją greitai sugeria), arba naudojamos koncentracijos vandeninėje terpėje vertės yra tokios mažos, kad jos atitinka analizės kiekybinio nustatymo ribą arba yra dar mažesnės (41). Šioms stipriai hidrofobinėms medžiagoms rekomenduojamas mitybos bandymas, jei bandymas yra suderinamas su atitinkama reglamentavimo sistema ir rizikos vertinimo poreikiais. Tiriant paviršinio aktyvumo medžiagas reikėtų spręsti, ar, atsižvelgiant į cheminės medžiagos savybes, biologinio koncentravimo bandymą vandeninėje terpėje įmanoma atlikti, kitu atveju turbūt labiau tiktų mitybos tyrimas. Paviršinio aktyvumo medžiagos yra paviršiuje veikiantys agentai, kurie mažina sąlyčio tarp dviejų skysčių paviršiaus įtemptį. Dėl savo amfifilinės prigimties (t. y. jos turi hidrofilinę ir hidrofobinę dalį) jos kaupiasi sąlyčio paviršiuje, pvz., vandens ir oro sąlyčio paviršiuje, vandens ir maisto bei stiklinių sienų sąlyčio paviršiuje, ir tai trukdo nustatyti jų koncentraciją vandenyje. Atliekant mitybos bandymą, galima apeiti kai kuriuos veikimo aspektus, kai tiriami sudėtingi mišiniai, kurių komponentų tirpumo vandenyje ribos skiriasi, nes tolygesnis veikimas įvairiems mišinio komponentams yra labiau tikėtinas palyginti su veikimo per vandeninę terpę metodu (žr. (20)). Reikėtų pažymėti, kad taikant mitybos metodą gaunamas mitybos biomagnifikacijos faktorius (BMF), o ne biologinio koncentravimo faktorius (BCF) (42). Yra metodų, kuriuos taikant galima įvertinti kinetinį biologinio koncentravimo faktorių (BCFK) pagal duomenis, gautus tiriant mitybą (kaip aptarta 8 priedėlyje), tačiau šie metodai turėtų būti taikomi atsargiai. Apskritai, taikant šiuos metodus daroma prielaida dėl pirmojo laipsnio kinetikos ir jie yra taikomi tik tam tikrų grupių junginiams. Mažai tikėtina, kad šiuos metodus galima taikyti paviršinio aktyvumo medžiagoms (žr. 12 pastraipą). Veikimo per vandeninę terpę supaprastinto bandymo schemą, imant mažiau ėminių ėmimo taškų gyvūnų skaičiui ir (arba) ištekliams sumažinti (žr. 83 pastraipą), reikėtų taikyti tik toms cheminėms medžiagoms, iš kurių galima pagrįstai tikėtis, kad sugertis ir apsivalymas vyks maždaug pagal pirmojo laipsnio kinetiką (t. y. apskritai nejoninėms organinėms medžiagoms, žr. 88 pastraipą). C.13 – I. Biologinio kaupimosi žuvyse bandymas veikiant per vandeninę terpę BANDYMO PRINCIPAS Bandymą sudaro du tarpsniai – veikimo (sugerties) tarpsnis ir (apsivalymo) tarpsnis po veikimo. Sugerties tarpsniu vienos rūšies žuvų grupė veikiama vienos ar kelių koncentracijos verčių bandomąja chemine medžiaga, priklausomai nuo bandomosios cheminės medžiagos savybių (žr. 49 pastraipą). Vėliau apsivalymo tarpsniui jos pernešamos į terpę be bandomosios cheminės medžiagos. Apsivalymo tarpsnis yra būtinas visada, išskyrus atvejus, kai sugerties tarpsniu cheminės medžiagos sugertis buvo nereikšminga. Bandomosios cheminės medžiagos koncentracija žuvyje ir (arba) jos paviršiuje (ar tam tikrame jos audinyje) stebima abiem bandymo tarpsniais. Be apdorotos grupės yra kontrolinė žuvų grupė, kuri laikoma tokiomis pačiomis sąlygomis, bet be bandomosios cheminės medžiagos, kad, atliekant biologinio koncentravimo bandymą, pastebėtą galimą neigiamą poveikį būtų galima palyginti su vienodos sudėties kontroline grupe ir gauti bandomosios cheminės medžiagos fonines koncentracijos vertes (43). Atliekant veikimo per vandeninę terpę bandymą, sugerties tarpsnis paprastai trunka 28 paras. Prireikus galima bandyti ilgiau (žr. 18 pastraipą) arba trumpiau, jei įrodoma, kad nuostovioji būsena pasiekiama anksčiau (žr. 1 priedėlį, Apibrėžtys ir vienetai). Sugerties tarpsnio trukmę ir laiką nuostoviajai būsenai pasiekti galima prognozuoti pagal 5 priedėlio lygtis. Apsivalymo tarpsnis prasideda tada, kai žuvys nebeveikiamos bandomąja chemine medžiaga, žuvis pernešant į švarų indą su ta pačia terpe, bet be bandomosios cheminės medžiagos. Jei įmanoma, apskaičiuojamas biologinio koncentravimo faktorius, pageidautina kaip koncentracijos žuvyje (C f) ir vandenyje santykis (C w), esant nuostoviajai būsenai (BCFSS; apibrėžtis pateikta 1 priedėlyje), ir kaip kinetinis biologinio koncentravimo faktorius (BCFK; žr. 1 priedėlį, Apibrėžtys ir vienetai), kuris įvertinamas kaip sugerties (k 1) ir apsivalymo (k 2) greičio konstantų santykis, darant prielaidą dėl pirmojo laipsnio kinetikos (44). Jei nuostovioji būsena nepasiekiama per 28 paras, BCF apskaičiuojamas taikant kinetinį metodą (žr. 38 pastraipą) arba galima prailginti sugerties tarpsnį. Jei dėl to sugerties tarpsnis nuostoviajai būsenai pasiekti būtų per ilgas (žr. 37 ir 38 pastraipas, 5 priedėlį), pirmenybė teikiama kinetiniam metodui. Arba reikėtų atsižvelgti į galimybę atlikti stipriai hidrofobinių cheminių medžiagų mitybos tyrimą (45), jei mitybos bandymas suderinamas su atitinkama reglamentavimo sistema. Sugerties greičio konstanta, apsivalymo (netekimo) greičio konstanta (ar konstantos, jei naudojami sudėtingesni modeliai), biologinio koncentravimo faktorius (nuostovioji būsena ir (arba) kinetika) ir, jei įmanoma, kiekvieno šių parametrų pasikliovimo ribos apskaičiuojami pagal modelį, kuris geriausiai aprašo žuvyse ir vandenyje išmatuotas bandomosios cheminės medžiagos koncentracijos vertes (žr. 5 priedėlį). Dėl žuvies masės padidėjimo bandymo metu mažės bandomosios cheminės medžiagos koncentracija augančioje žuvyje (vadinamas praskiedimas dėl augimo), todėl kinetinio BCF įvertis būtų per mažas, jei nebūtų daroma pataisos dėl augimo (žr. 72 ir 73 pastraipas). BCF yra pagrįstas sumine koncentracija žuvyje (t. y. suminės žuvies šlapios kūno masės atžvilgiu). Tačiau specialiems tikslams, jei žuvis yra pakankamai didelė, gali būti naudojami tam tikri audiniai ar organai (pvz., raumuo, kepenys) arba žuvis gali būti padalyta į valgomąją (filė) ir nevalgomą (viduriai) dalis. Kalbant apie daugelį organinių cheminių medžiagų yra aiški priklausomybė tarp jų biologinio koncentravimo gebos ir hidrofobiškumo, bet taip pat yra atitinkama priklausomybė tarp lipidų kiekio bandymo žuvyse ir stebimo tokių cheminių medžiagų biologinio koncentravimo. Todėl, siekiant sumažinti šį medžiagų su dideliu lipofiliškumu (t. y. kurių log K OW > 3) bandymų rezultatų kintamumo šaltinį, biologinį koncentravimą, gautą tiesiogiai atliekant tyrimą, papildomai reikėtų išreikšti kaip normalizuotą 5 % lipidų (viso šlapios kūno masės atžvilgiu) turinčiai žuviai. Tai yra būtina siekiant turėti galimybę tarpusavyje palyginti skirtingoms cheminėms medžiagoms ir (arba) bandymų rūšims gautus rezultatus. Skaičius – 5 % lipidų kiekiui buvo plačiai taikomas, nes jis atitinka bandymo metode dažniausiai naudojamų žuvų vidutinį lipidų kiekį (21). INFORMACIJA APIE BANDOMAJĄ CHEMINĘ MEDŽIAGĄ Be įvade (3 pastraipa) pateiktų bandomosios cheminės medžiagos savybių, kita reikiama informacija yra toksiškumas žuvų rūšims, kurios turi būti naudojamos atliekant bandymus, pageidautina asimptotinė LC50 (t. y. nuo laiko nepriklausanti), ir (arba) toksiškumas, įvertintas atliekant ilgalaikius žuvų bandymus (pvz., C.47 (22), C.15 (23), C.14 (24) bandymų metodai). Reikėtų turėti tinkamą žinomo tikslumo, preciziškumo ir jautrio analizės metodą cheminei medžiagai kiekybiškai nustatyti bandymo tirpaluose ir biologinėje medžiagoje, kartu su ėminių ruošimo ir laikymo duomenimis. Taip pat reikėtų žinoti bandomosios cheminės medžiagos kiekybinio analizinio nustatymo vandenyje ir žuvų audiniuose ribą. Jei naudojama žymėtoji bandomoji cheminė medžiaga, ji turėtų būti kuo grynesnė (pvz., pageidautina > 98 %) ir turėtų būti žinoma su priemaišomis susijusio radioaktyvumo procentinė dalis. BANDYMO TINKAMUMAS Taikomos šios bandymo tinkamumo sąlygos:
ETALONINĖS CHEMINĖS MEDŽIAGOS Būtų naudinga naudoti žinomos biologinio koncentravimo gebos ir mažo metabolizmo etalonines chemines medžiagas tikrinant bandymo procedūrą, kai reikia (pvz., kai laboratorija neturi ankstesnės bandymų patirties ar pakito Bandymo sąlygos). METODO APRAŠYMAS Aparatūra Reikia užtikrinti, kad visoms įrangos dalims gaminti nebūtų naudojamos medžiagos, kurios gali tirpti, sugerti arba išsiplauti ir turėti neigiamą poveikį žuvims. Galima naudoti stačiakampio arba ritinio formos standartines talpyklas, kurios būtų pagamintos iš chemiškai inertiškų medžiagų ir kurių tūris atitiktų įkrovos dydį (žr. 43 pastraipą). Minkšti plastikiniai vamzdžiai turi būti kuo mažiau naudojami. Reikėtų naudoti politetrafluoretileno, nerūdijančiojo plieno ir (arba) stiklinius vamzdžius. Patirtis parodė, kad bandant chemines medžiagas su dideliu sugerties koeficientu, pvz., sintetinius piretroidus, gali prireikti silanizuoto stiklo. Šiomis sąlygomis įrangą po naudojimo reikėtų išmesti. Prieš dedant bandymų organizmus, bandymų sistemas pageidautina veikti tokių koncentracijos verčių bandomąja chemine medžiaga, kurias numatoma naudoti atliekant tyrimą, ir taip ilgai, kad būtų galima įrodyti veikimo koncentracijos verčių stabilumą. Vanduo Bandymuose dažniausiai naudojamas gamtinis vanduo, jis turi būti imamas iš neužteršto ir vienodos kokybės šaltinio. Vis dėlto, atkurtasis vanduo (t. y. demineralizuotas vanduo su žinomu tam tikrų mitybinių medžiagų kiekiu) galbūt tiktų labiau, siekiant laikui bėgant užtikrinti vienodą kokybę. Skiedimo vanduo, t. y. vanduo, su kuriuo bandomojo cheminė medžiaga maišoma prieš ją dedant į bandymo indą (žr. 30 pastraipą), turėtų būti tokios kokybės, kuri užtikrintų pasirinktų žuvų rūšių išgyvenamumą aklimatizavimo ir bandymo laikotarpiais, nepasireiškiant jokiems neįprastiems jų išvaizdos ar elgesio pokyčiams. Būtų gerai įrodyti, kad bandomosios rūšys skiedimo vandenyje gali išlikti, augti ir daugintis (pvz., laboratorinėje kultūroje arba atliekant gyvavimo ciklo trukmės toksiškumo bandymą). Skiedimo vandenį reikėtų apibūdinti nurodant bent pH vertę, kietumą, suminį kietųjų dalelių kiekį, suminį organinės anglies kiekį (TOC (47)), taip pat būtų gerai nurodyti amonio bei nitrito jonų kiekį bei šarmingumą, o jūros žuvų rūšims – druskingumą. Parametrai, kurie būtų svarbūs žuvų optimaliai gerovei, nėra visiškai žinomi, tačiau 1 priedėlyje pateiktos kelių gėlo ir jūros vandens komponentų rekomenduojamos didžiausios koncentracijos vertės. Skiedimo vanduo turėtų būti pastovios kokybės visą bandymo laikotarpį. pH vertė turėtų būti 6,0–8,5 intervale, tačiau atliekant tam tikrą bandymą, ji galėtų kisti ne daugiau kaip ± 0,5 pH vieneto. Siekiant užtikrinti, kad skiedimo vanduo per daug neturėtų įtakos bandymo rezultatui (pvz., sudarydamas kompleksinius junginius su bandomąja chemine medžiaga) arba neigiamai veiktų žuvų būrio elgesį, ėminius reikėtų imti analizei per tam tikrus laiko tarpus, bent jau bandymo pradžioje ir pabaigoje. Pagrindinių sunkiųjų metalų anijonų ir katijonų (pvz., Ca2+, Mg2+, Na+, K+, Cl– ir SO4 2-), pesticidų (pvz., fosforo organinių ir chloro organinių pesticidų suminio kiekio), suminio organinės anglies kiekio ir suspenduotų kietųjų dalelių analizė turėtų būti atliekama, pvz., kas tris mėnesius, jei žinoma, kad skiedimo vandens kokybė yra gana pastovi. Jei buvo įrodyta, kad skiedimo vandens kokybė buvo pastovi bent metus, analizė gali būti daroma ne taip dažnai, o tarpai padidinti (pvz., kas šešis mėnesius). Natūralus kietųjų dalelių kiekis, taip pat suminės organinės anglies (TOC) kiekis skiedimo vandenyje turėtų būti kuo mažesnis, kad būtų išvengta bandomosios cheminės medžiagos adsorbcijos ant organinės medžiagos, dėl ko gali sumažėti bandomosios cheminės medžiagos biologinis įsisavinamumas, todėl būtų gautas per mažas BCF įvertis. Didžiausias leidžiamas kietųjų dalelių kiekis yra 5 mg/l (sausos medžiagos, sulaikomos 0,45 μm filtru), o suminės organinės anglies kiekis – 2 mg/l (žr. 2 priedėlį). Jei reikia, prieš naudojant skiedimo vandenį reikėtų filtruoti. Bandymų žuvų (ekskrementų) ir maisto likučių bandymo vandenyje indėlis į organinės anglies kiekį turėtų būti kuo mažesnis (žr. 46 pastraipą). Bandymų tirpalai Ruošiamas reikiamos koncentracijos bandomosios cheminės medžiagos pradinis tirpalas. Pradinį tirpalą geriausiai būtų ruošti bandomąją cheminę medžiagą tiesiog maišant arba plakant skiedimo vandenyje. Kaip tinkama alternatyva kartais galėtų būti naudojama kietosios fazės desorbcijos dozavimo sistema. Naudoti tirpiklius arba dispergentus (soliubilizavimo agentus) paprastai nerekomenduojama (žr. (25)); tačiau juos leidžiama naudoti tinkamos koncentracijos pradiniam tirpalui gauti, bet reikėtų dėti visas pastangas tokių medžiagų naudojimui sumažinti, o jų ribinė micelių koncentracija neturėtų būti viršyta (jei tinka). Tirpikliai, kuriuos būtų galima naudoti, yra acetonas, etanolis, metanolis, dimetilformamidas ir trietilenglikolis; naudoti dispergentai yra Tween 80, metilceliuliozės 0,01 % tirpalas ir HCO-40. Tirpiklio koncentracija visų apdorotų ėminių galutinėje bandymų terpėje turėtų būti vienoda (t. y. neatsižvelgiant į bandomosios cheminės medžiagos koncentraciją) ir neturėtų būti didesnė nei atitinkamos toksiškumo ribinės vertės, nustatytos tirpikliui Bandymo sąlygomis. Maksimali koncentracija – 100 mg/l (arba 0,1 ml/l). Maža tikimybė, kad 100 mg/l koncentracijos tirpiklis reikšmingai pakeistų ištirpusios bandomosios cheminės medžiagos maksimalią koncentraciją, kurią būtų galima pasiekti terpėje (25). Reikėtų žinoti, kokią viso organinės anglies kiekio bandymų vandenyje dalį sudaro tirpiklis (kartu su bandomąja chemine medžiaga). Suminės organinės anglies koncentracija bandymų induose visą bandymo laiką neturėtų viršyti bandomosios cheminės medžiagos ir tirpiklio ar soliubilizavimo agento (48), jei naudojamas, anglies koncentracijos daugiau kaip 10 mg/l (± 20 %) Organinės medžiagos koncentracija gali daryti reikšmingą įtaką laisvai ištirpintos bandomosios cheminės medžiagos kiekiui atliekant dinaminius žuvų bandymus, ypač – labai lipofilinių medžiagų. Mikroekstrahavimas kietąja faze (žr. 60 pastraipą) gali suteikti svarbios informacijos apie santykį tarp sujungtų ir laisvai ištirpintų junginių, iš kurių pastarieji, kaip manoma, ir yra biologiškai įsisavinama frakcija. Bandomosios cheminės medžiagos koncentracija turėtų būti mažesnė nei jos tirpumo bandymų terpėje ribinė koncentracija, neatsižvelgiant į tirpiklio ar soliubilizavimo agento naudojimą. Naudojant lengvai biologiškai skaidžius tirpiklius, reikėtų imtis priemonių, kad neatsirastų problemų dėl bakterijų augimo atliekant dinaminius bandymus. Jei pradinio tirpalo neįmanoma paruošti nenaudojant soliubilizavimo agento, reikėtų atsižvelgti į tai, ar nebūtų tikslinga vietoj veikimo per vandeninę terpę tyrimo atlikti mitybos bandymo. Atliekant dinaminius bandymus reikia turėti sistemą, kuri nuolat dozuoja ir skiedžia bandomosios cheminės medžiagos (pvz., dozavimo siurblį, proporcinį skiestuvą, sotintuvo sistemą), arba kietosios fazės desorbcijos dozavimo sistemą reikiamoms bandymo koncentracijos vertėms bandymų kamerose gauti. Pageidautina, kad bandymo kamerų tūris pasikeistų per parą ne mažiau kaip penkis kartus. Pirmenybė teikiama dinaminiam režimui, tačiau jei jis neįmanomas (pvz., kai tai kenkia bandymo organizmams), galima taikyti pusiau statinį metodą, jei jis atitinka tinkamumo kriterijus (žr. 24 pastraipą). Pradinio tirpalo ir skiedimo vandens srautas turi būti tikrinamas 48 h prieš bandymą ir vėliau bent kasdien visą bandymo laiką. Tikrinant nustatomas srautas per kiekvieną kamerą ir užtikrinama, kad kameroje arba tarp kamerų srautas nesiskirtų daugiau kaip 20 %. Rūšių parinkimas Pasirenkant rūšis svarbu yra tai, ar jas lengva gauti, ar jas galima gauti tinkamų matmenų ir ar galima tinkamai prižiūrėti laboratorijoje. Kitus žuvų rūšių atrankos kriterijus sudaro rekreacinė, komercinė, ekologinė svarba, taip pat palyginamas jautris, sėkmingas naudojimas praeityje ir kt. Rekomenduojamos žuvų rūšys nurodytos 3 priedėlyje. Galima naudoti kitas rūšis, tačiau tinkamoms bandymo sąlygoms užtikrinti gali tekti keisti bandymų procedūrą. Šiuo atveju ataskaitoje reikėtų pagrįsti rūšies pasirinkimą ir bandymo metodą. Apskritai, naudojant mažesnių žuvų rūšis trumpėja laikas, per kurį pasiekiama nuostovioji būsena, bet gali prireikti daugiau žuvų (ėminių), kad būtų galima tinkamai atlikti lipidų kiekio analizę ir cheminės medžiagos koncentraciją žuvyje. Be to, yra tikimybė, kad kvėpavimo spartos ir metabolizmo skirtumai tarp jaunų ir vyresnio amžiaus žuvų gali trukdyti palyginti skirtingų bandymų ir skirtingoms rūšims gautus rezultatus. Reikėtų pažymėti, kad bandant žuvų rūšis jų spartaus augimo (jauniklių) laikotarpiu, gali būti sunkiau aiškinti duomenis. Žuvų laikymas (atsižvelgiant į veikimą per vandeninę terpę ir mitybą) Pradinė populiacija bent dvi savaites aklimatizuojama vandenyje (žr. 28 pastraipą) bandymų temperatūroje ir visą laiką pakankamai maitinama (žr. 45 pastraipą). Vanduo ir maistas turėtų atitikti naudojamus atliekant bandymą. Po 48 h stabilizacijos laikotarpio, registruojamas gaištamumas ir taikomi tokie kriterijai:
Bandymams atlikti naudojamos žuvys neturėtų turėti pastebimų ligų ir išsigimimų. Visas ligotas žuvis reikėtų atmesti. Dvi savaites prieš bandymą ir visą bandymo laiką žuvys neturėtų būti gydomos vaistais. BANDYMO EIGA Parengiamasis bandymas Gali būti naudinga atlikti parengiamąjį bandymą, kad būtų galima optimizuoti galutinio bandymo sąlygas, pvz., pasirinkti bandomosios cheminės medžiagos koncentracijos vertę (-es) ir sugerties bei apsivalymo tarpsnių trukmę, arba nustatyti, ar reikia atlikti viso masto bandymą. Parengiamojo bandymo schema turėtų būti tokia, kad būtų galima gauti reikiamą informaciją. Būtų galima aptarti, ar BCF gauti pakaktų supaprastinto bandymo ar reikia atlikti viso masto tyrimą (žr. 83–95 pastraipas apie supaprastintą bandymą). Veikimo sąlygos Sugerties tarpsnio trukmė Sugerties tarpsnio trukmę galima prognozuoti atsižvelgiant į praktinę patirtį (pvz., iš ankstesnio panašios struktūros cheminės medžiagos sugerties tyrimo) arba pagal tam tikras empirines priklausomybes, naudojant bandomosios cheminės medžiagos tirpumo vandenyje arba pasiskirstymo tarp oktanolio ir vandens koeficiento duomenis (jei sugertis vyksta pagal pirmojo laipsnio kinetiką, žr. 5 priedėlį). Sugerties tarpsnis turėtų trukti 28 paras, nebent galima įrodyti, kad nuostovioji būsena pasiekiama anksčiau (žr. 1 priedėlį, Apibrėžtys ir vienetai). Nuostovioji būsena pasiekiama, kai bandomosios cheminės medžiagos koncentracijos žuvyje (C f) ir laiko priklausomybės kreivė tampa lygiagreti su laiko ašimi, kai bent kas dvi paras paimtų ėminių trijų nuoseklių C f analizės rezultatai skiriasi ne daugiau kaip ± 20 % ir nėra reikšmingo C f padidėjimo tarp pirmosios ir paskutinės nuoseklios analizės. Kai analizuojami jungtiniai ėminiai, reikia atlikti ne mažiau kaip keturias nuoseklias analizes. Jei bandomųjų cheminių medžiagų sugertis vyksta lėtai, labiau tiktų septynių parų intervalai. Jei nuostovioji būsena nebuvo pasiekta per 28 paras, BCF apskaičiuojamas taikant tik kinetinį metodą, kuris nėra pagrįstas pasiekiama nuostoviąja būsena, arba sugerties tarpsnį galima pratęsti atliekant papildomus matavimus tol, kol pasiekiama nuostovioji būsena, arba iki 60 parų, jei tai trumpiau. Be to, bandomosios cheminės medžiagos koncentracija žuvyje sugerties tarpsnio pabaigoje turi būti pakankamai didelė, kad būtų galima užtikrinti patikimą apsivalymo tarpsnio k 2 įvertį. Jei po 28 parų reikšmingos sugerties nėra, bandymą galima nutraukti. Apsivalymo tarpsnio trukmė Jei cheminių medžiagų apsivalymas vyksta pagal pirmojo laipsnio kinetiką, pusės sugerties tarpsnio trukmės paprastai pakanka, kad kūno sugertos cheminės medžiagos kiekis sumažėtų iki atitinkamos vertės (pvz., 95 %) (žr. 5 priedėlį dėl šio įverčio aiškinimo). Jei laikas 95 % netekčiai gauti yra praktiškai per ilgas ir, pvz., yra dvigubai ilgesnis nei įprastinė sugerties tarpsnio trukmė (t. y. ilgiau kaip 56 paros), galima naudoti trumpesnį laikotarpį (pvz., kai bandomosios cheminės medžiagos koncentracija yra mažesnė nei 10 % nuostoviosios būsenos koncentracijos). Tačiau ilgesnių apsivalymo tarpsnių gali prireikti cheminėms medžiagoms, turinčioms sudėtingesnį modelį, nei žuvims taikomas vienos aplinkos terpės sugerties ir apsivalymo modelis, kuris atitinka pirmojo laipsnio kinetiką. Jei yra stebimi ir (arba) numanomi tokie sudėtingi modeliai, reikėtų klausti biologinės statistikos ir (arba) farmakologinės kinetikos specialisto patarimo tinkamai bandymo schemai užtikrinti. Jei apsivalymo tarpsnis pratęsiamas, ribojančiu veiksniu gali tapti ėminiams imamų žuvų skaičius, o įtaką rezultatams gali daryti žuvų augimo skirtumai. Tačiau tarpsnio trukmę taip pat lems laikotarpis, kurį bandomosios cheminės medžiagos koncentracija žuvyse yra didesnė nei analizės kiekybinio nustatymo riba. Bandymo žuvų skaičius Vienai bandymo koncentracijai imamas toks žuvų skaičius, kad kiekvienam ėminiui tektų ne mažiau kaip keturios žuvys. Žuvis galima sujungti į vieną grupę tik tada, jei pavienių žuvų analizė neįmanoma. Jei numatoma gauti geresnį kreivių priderinimo (ir išvestų parametrų) tikslumą arba reikia atlikti metabolizmo tyrimus (pvz., atskirti metabolitus ir pradinę cheminę medžiagą, kai naudojamos žymėtosios bandomosios cheminės medžiagos), vienam ėminiui prireiks daugiau žuvų. Lipidų kiekį reikėtų nustatyti toje pačioje biologinėje medžiagoje, kurioje nustatoma bandomosios cheminės medžiagos koncentracija. Jei tai būtų neįmanoma, gali prireikti papildomų žuvų (žr. 56 ir 57 pastraipas). Jei naudojamos suaugusios (t. y. lytiškai subrendusios) žuvys, prieš bandymą ar bandymo metu jos neturėtų būti neršto būsenos ar neseniai išleidusios ikrus (t. y. jau po neršto). Taip pat ataskaitoje reikėtų pateikti duomenis, ar atliekant bandymą buvo naudojami vyriškos ar moteriškos lyties ar abiejų lyčių žuvys. Jei naudojamos abiejų lyčių žuvys, reikėtų pateikti dokumentus, kurie rodytų nereikšmingus augimo ir lipidų kiekio skirtumus veikimo pradžioje, ypač jei numatoma, kad prireiks sujungti vyriškos ir moteriškos lyties žuvis aptinkamai cheminės medžiagos koncentracijai ir (arba) lipidų kiekiui užtikrinti. Kiekvienam atskiram bandymui parenkamos panašios masės žuvys, kad mažiausių žuvų masė būtų ne mažesnė kaip du trečdaliai didžiausios žuvies masės. Visos žuvys turėtų būti tų pačių metų ir iš to paties šaltinio. Kadangi masė ir amžius gali daryti reikšmingą įtaką BCF vertėms (12), šie duomenys turėtų būti tiksliai registruojami. Prieš pat bandymų pradžią rekomenduojama pasverti žuvų būrio poėminį, kad būtų gauta vidutinė masė (žr. 61 pastraipą). Įkrova Reikėtų naudoti didelius vandens ir žuvų kiekio santykius, kad dėl žuvų pridėjimo bandymo pradžioje kuo mažiau sumažėtų bandomosios cheminės medžiagos koncentracija, taip pat būtų išvengta ištirpusio deguonies koncentracijos mažėjimo. Svarbu, kad įkrovos dydis atitiktų naudojamą bandymų rūšį. Bet kuriuo atveju paprastai rekomenduojamas įkrovos dydis yra 0,1–1,0 g žuvies (šlapios kūno masės) litrui vandens per parą. Galima naudoti didesnio žuvų ir vandens santykio įkrovas, jei žinoma, kad reikiamą bandomosios cheminės medžiagos koncentraciją įmanoma užtikrinti ± 20 % tikslumu ir kad ištirpusio deguonies koncentracija nesumažėja daugiau kaip iki 60 % soties koncentracijos (žr. 24 pastraipą). Pasirenkant tinkamus įkrovos režimus, atsižvelgiama į žuvų rūšies įprastosios gyvenimo aplinkos sąlygas. Pvz., dugne gyvenančioms žuvims tam pačiam vandens tūriui gali būti reikalingas didesnis akvariumo dugno plotas nei jūros žuvų rūšims. Maitinimas Aklimatizavimo ir bandymo laikotarpiu žuvys maitinamos tinkamu maistu, kurio lipidų ir baltymų suminis kiekis yra žinomas ir kurio pakanka, kad žuvys būtų sveikos ir būtų palaikoma jų kūno masė (galimas nedidelis augimas). Maitinama kasdien visą aklimatizavimo ir bandymo laikotarpį duodant nustatytą kiekį priklausomai nuo naudojamos rūšies, Bandymo sąlygų ir maisto energinės vertės (pvz., vaivorykštiniam upėtakiui per parą duodama nuo 1 iki 2 % kūno masės). Maisto norma turėtų būti parinkta taip, kad būtų išvengta greito augimo ir didelio lipidų kiekio padidėjimo. Siekiant užtikrinti tą pačią maisto normą, jo kiekis turėtų būti iš naujo apskaičiuojamas, jei reikia, pvz., vieną kartą per savaitę. Šiam apskaičiavimui atlikti žuvų masę kiekvienoje kameroje galima įvertinti pagal neseniai iš šios kameros ėminiams paimtų žuvų masę. Nereikia sverti kameroje likusių žuvų. Nesuėstą maistą ir išmatas reikėtų išsiurbti iš kameros kasdien, netrukus po maitinimo (nuo 30 min iki vienos valandos). Kameros visą bandymų trukmę turėtų būti kiek įmanoma švarios, kad organinių medžiagų koncentracija būtų kuo mažesnė (žr. 29 pastraipą), nes organinės anglies buvimas gali riboti bandomosios cheminės medžiagos biologinį įsisavinamumą (12). Kadangi dauguma maisto gaunama iš žuvų miltų, reikėtų užtikrinti, kad maistas neturėtų įtakos bandymų rezultatams arba nebūtų jokių nepageidaujamų reiškinių, pvz., dėl pesticidų, sunkiųjų metalų ir (arba) pačios bandomosios cheminės medžiagos ( pėdsakų) buvimo. Šviesa ir temperatūra Rekomenduojama 12–16 h šviesiojo laikotarpio trukmė, o temperatūra (± 2 °C) turėtų atitikti bandymo rūšį (žr. 3 priedėlį). Reikėtų žinoti apšvietimo tipą ir jo charakteristikas. Reikėtų atkreipti dėmesį į galimą bandomosios cheminės medžiagos fotocheminį virsmą tyrimo metu naudoto apšvietimo sąlygomis. Reikėtų naudoti tinkamą apšvietimą ir vengti žuvis veikti negamtiniais fotocheminio virsmo produktais. Kai kuriais atvejais galbūt tiktų filtras, kuris nepraleistų trumpesnio nei 290 nm bangos ilgio UV spinduliuotę. Bandymų koncentracijos vertės Bandymas iš pradžių buvo sumanytas nepolinėms organinėms medžiagoms. Manoma, kad šio tipo cheminėms medžiagos pakaktų žuvų paveikimo vienos vertės koncentracija, nes nesitikima jos poveikio, nors, atsižvelgiant į atitinkamą reglamentavimo sistemą, gali prireikti dviejų koncentracijos verčių. Jei bandomos kitokio tipo cheminės medžiagos arba yra duomenų apie galimą priklausomybę nuo koncentracijos, bandymą reikėtų atlikti naudojant dvi koncentracijos vertes arba daugiau. Jei bandoma tik viena koncentracija, reikėtų pagrįsti tokios koncentracijos pasirinkimą (žr. 79 pastraipą). Be to, bandoma koncentracija turėtų būti praktiškai ar techniškai kuo mažesnė (t. y. toliau nuo tirpumo ribinės koncentracijos). Kai kuriais atvejais galima numanyti, kad cheminės medžiagos biologinis koncentravimas priklauso nuo koncentracijos vandenyje (pvz., metalų, kurių sugertis žuvimis gali būti bent iš dalies reguliuojama). Tokiu atveju būtina bandyti bent dvi, bet geriau daugiau koncentracijos verčių (žr. 49 pastraipą), kurios atitinka aplinkos sąlygas. Be to, jei dėl praktinių priežasčių cheminės medžiagos bandomos koncentracijos vertės yra arti tirpumo ribinės koncentracijos, rekomenduojama bandyti esant bent dviem koncentracijos vertėms, nes taip būtų galima susidaryti vaizdą apie veikimo koncentracijos verčių patikimumą. Reikėtų pasirinkti bandymo koncentracijos vertes, kurios aprėptų faktines aplinkos sąlygas atitinkančias vertes, taip pat koncentraciją, kuri atitiktų specifinio vertinimo tikslą. Pasirinkta (-os) bandomosios cheminės medžiagos koncentracijos vertė (-ės) turėtų būti mažesnė (-ės) nei lėtinio poveikio koncentracija arba lygi 1 % ūmaus poveikio asimptotinės LC50, atitikti su aplinka susijusį intervalą ir būti bent viena eile didesnė nei taikomo analizės metodo kiekybinio nustatymo vandenyje riba. Didžiausią leidžiamą koncentraciją taip pat galima nustatyti, ūmaus poveikio 96 h LC50 padalijus iš atitinkamo ūmaus ir lėtinio poveikio koncentracijos santykio (pvz., kai kurių cheminių medžiagų reikiamas santykis yra didesnis kaip trys, bet keli yra didesni kaip 100). Jei naudojama antroji koncentracija, ji turėtų dešimt kartų skirtis nuo pirmosios. Jei tai neįmanoma atsižvelgiant į toksiškumo kriterijų (kuris riboja viršutinę bandymo koncentraciją) ir analizinio nustatymo ribą (ji nustato apatinę bandymo koncentraciją), galima naudoti mažesnį nei dešimt daugiklį ir reikėtų atsižvelgti į galimybę naudoti žymėtąją bandomąją cheminę medžiagą (didžiausio grynumo, pvz., pageidautina > 98 %). Reikėtų užtikrinti, kad nei viena naudota koncentracija nebūtų didesnė nei bandomosios cheminės medžiagos tirpumo bandymo terpėje ribinė koncentracija. Kontroliniai ėminiai Be bandomosios cheminės medžiagos serijos reikėtų bandyti vieną vandens kontrolinį ėminį arba, jei tinka (žr. 30 ir 31 pastraipas), vieną tirpiklio turintį kontrolinį ėminį. Vandens kokybės matavimo dažnumas Bandymo metu bandymo ir kontroliniuose induose reikėtų matuoti ištirpusį deguonį, TOC, pH ir temperatūrą. Reikėtų išmatuoti kontrolinio (-ių) ėminio (-ių) suminį kietumą ir druskingumą (jei tinka) ir tai daryti viename inde. Jei bandomos dvi koncentracijos vertės arba daugiau, šie parametrai matuojami didesnei (arba didžiausiai) koncentracijai. Reikėtų matuoti bent jau ištirpusį deguonį ir druskingumą (jei tinka), ir sugerties tarpsniu tai daryti tris kartus – pradžioje, maždaug per vidurį ir pabaigoje, o apsivalymo tarpsniu – kartą per savaitę. TOC reikėtų matuoti bandymo pradžioje (24 h ir 48 h iki bandymo sugerties tarpsnio pradžios) prieš dedant žuvis ir bent kartą per savaitę sugerties ir apsivalymo tarpsnių metu. Temperatūrą reikėtų matuoti ir registruoti kasdien, pH – kiekvieno tarpsnio pradžioje ir pabaigoje, o kietumą – kartą bandymo metu. Temperatūrą bent viename inde reikėtų kontroliuoti nuolat. Žuvų bei vandens ėminių ėmimas ir analizė Žuvų ir vandens ėminių ėmimo tvarkaraštis Vandens ėminius iš bandymo kamerų bandomosios cheminės medžiagos koncentracijai nustatyti reikėtų imti prieš dedant žuvis ir sugerties bei apsivalymo tarpsnių metu. Vandens ėminius reikėtų imti prieš maitinimą, tuo pačiu metu, kai imami žuvų ėminiai. Gali būti naudinga ėminius imti dažniau, kad būtų užtikrintos stabilios koncentracijos vertės įdėjus žuvis. Sugerties tarpsnio metu reikėtų matuoti bandomosios cheminės medžiagos koncentraciją, kad būtų galima patikrinti atitikti tinkamumo kriterijams (24 pastrapa). Jei, atliekant vandens ėminių analizę apsivalymo tarpsnio pradžioje nepavyksta aptikti bandomosios cheminės medžiagos, tai galima būtų naudoti kaip įrodymą, kad visą likusį apsivalymo tarpsnio laiką nereikia analizuoti bandymo ir kontrolinių ėminių vandens bandomajai cheminei medžiagai nustatyti. Žuvų ėminius bandomajai cheminei medžiagai nustatyti reikėtų imti bent penkis kartus sugerties tarpsniu ir ne mažiau kaip keturis kartus apsivalymo tarpsniu. Kadangi turint tokį ėminių skaičių kartais bus sunku gauti pakankamai tikslų BCF vertės įvertį (ypač kai yra požymių, kad sugerties ir apsivalymo kinetika nėra vien tik paprasto pirmojo laipsnio), būtų patartina ėminius imti dažniau abiem tarpsniais (žr. 4 priedėlį). Lipidų kiekį reikėtų nustatyti bent jau sugerties tarpsnio pradžioje ir pabaigoje ir apsivalymo tarpsnio pabaigoje, jį nustatant toje pačioje biologinėje medžiagoje, kuri naudojama bandomosios cheminės medžiagos koncentracijai nustatyti. Jei tai būtų neįmanoma, reikėtų atskirai paimti bent tris žuvis lipidų kiekiui nustatyti kiekvienu nurodytu laiko momentu. Žuvų skaičius vienam indui bandymo pradžioje turėtų būti atitinkamai pakoreguotas (49). Arba, jei kontrolinio ėminio žuvyje (t. y. pradinės populiacijos žuvyje) nebuvo aptikta reikšmingų bandomosios cheminės medžiagos kiekių, bandymo kontrolinio ėminio žuvis gali būti analizuojama tik lipidų kiekiui nustatyti, o bandomosios cheminės medžiagos koncentracijos bandymų grupės (-ių) žuvyse (ir susijusių sugerties greičio konstantos, apsivalymo greičio konstantos ir BCF verčių) pataisa gali būti daroma, atsižvelgiant į kontrolinės grupės lipidų kiekio pokyčius bandymo metu (50). Negyvos ar ligotos žuvys neturėtų būti analizuojamos bandomosios cheminės medžiagos ar lipidų koncentracijai nustatyti. Tinkamo ėminių ėmimo tvarkaraščio pavyzdys pateiktas 4 priedėlyje. Kitus tvarkaraščius būtų galima nesunkiai apskaičiuoti, naudojant kitas numatytas K OW vertes skaičiuojant veikimo trukmę, atitinkančią 95 % sugertį (skaičiavimai pateikti 5 priedėlyje). Ėminius reikėtų imti sugerties tarpsnio metu tol, kol pasiekiama nuostovioji būsena (žr. 1 priedėlį, Apibrėžtys ir vienetai) arba baigiasi sugerties tarpsnis (po 28 ar 60 parų, žr. 37 ir 38 pastraipas). Prieš pradedant apsivalymo tarpsnį žuvis reikėtų pernešti į švarius indus. Ėminių ėmimas ir ėminių ruošimas Vandens ėminius analizei reikėtų imti, pvz., siurbiant juos vamzdžiais iš inertinės medžiagos, įstatytais į bandymo kameros vidurį. Filtravimu ar centrifugavimu ne visada pasiseka atskirti biologiškai neįsisavinamas ir įsisavinamas bandomosios cheminės medžiagos frakcijas. Jei taikomas atskyrimo metodas, bandymo ataskaitoje, atsižvelgiant į biologinio įsisavinamumo sunkumus (25), reikėtų visada pagrįsti arba patvirtinti atskyrimo metodo tinkamumą. Visų pirma stipriai hidrofobinių cheminių medžiagų (t. y. cheminių medžiagų, kurių log K OW > 5) (12) (26), galinčių adsorbuotis ant filtro matricos ar ant centrifugavimo indų, ėminiai neturėtų būti apdorojami tokiais būdais. Vietoj to reikėtų imtis priemonių, kad indai būtų kuo švaresni (žr. 46 pastraipą), o suminės organinės anglies kiekį reikėtų kontroliuoti sugerties ir apsivalymo tarpsnio metu (žr. 53 pastraipą). Siekiant išvengti galimų mažesnio biologinio įsisavinamumo problemų, mažai tirpių ir stipriai hidrofobinių cheminių medžiagų ėminius galima imti mikroekstrahavimo kietąja faze metodais. Paimtos ėminiams žuvys turėtų būti numarinamos akimirksniu, naudojant tinkamiausią ir humanišką būdą (atliekant su visu žuvies kūnu susijusius matavimus, nereikėtų daryti jokių papildomų veiksmų, išskyrus plovimą vandeniu (žr. 28 pastraipą) ir paviršiaus džiovinimą). Žuvys sveriamos ir matuojamas jų visas ilgis (51) Kiekvienos žuvies atskirai išmatuotą masę ir ilgį reikėtų susieti su analizuojamos cheminės medžiagos koncentracija (ir lipidų kiekiu, jei taikoma), pvz., kiekvienai ėminio žuviai naudojant unikalų identifikavimo kodą. Žuvis ir vandenį geriausiai analizuoti iškart po ėminio paėmimo, kad būtų išvengta irimo arba kitų nuostolių, ir apskaičiuoti apytikres sugerties bei apsivalymo greičio konstantas bandymo eigoje. Be to, atliekant analizę iškart, laiku nustatoma, kai pasiekiama gulsčioji sritis (nuostovioji būsena). Jei analizė iš karto neįmanoma, ėminius reikėtų laikyti taikant reikiamus metodus. Prieš pradedant tyrimą, reikėtų gauti informaciją apie tinkamą konkrečios bandomosios cheminės medžiagos laikymo metodą, pvz., užšaldymą, laikymą 4 °C temperatūroje, ekstrahavimą ir kt. Laikymo trukmę reikėtų parinkti taip, kad būtų užtikrintas laikomos cheminės medžiagos patvarumas. Analizės metodo kokybė Kadangi visa bandymo procedūra iš esmės priklauso nuo bandomajai cheminei medžiagai nustatyti taikomo analizės metodo tikslumo, preciziškumo ir jautrio, bandymų keliu patikrinama, ar cheminės medžiagos analizės tikslumas ir atkuriamumas, taip pat bandomosios cheminės medžiagos atgavimo iš vandens ir žuvies laipsnis yra patenkinami taikant tam tikrą metodą. Tai turėtų būti parengiamųjų bandymų dalis. Taip pat patikrinama, ar bandomoji cheminė medžiaga neaptinkama naudojamame skiedimo vandenyje. Jei būtina, bandomosios cheminės medžiagos koncentracijos vandenyje ir žuvyse vertės, gautos atliekant bandymą, taisomos atsižvelgiant į atgavimo laipsnius ir kontrolinių ėminių fonines vertes. Žuvų ir vandens ėminius reikėtų visą laiką apdoroti taip, kad tarša ir nuostoliai (pvz., dėl adsorbcijos ėminių ėmimo įtaisu) būtų kuo mažesni. Žuvų ėminių analizė Jei bandant naudojamos žymėtosios medžiagos, galima nustatyti jų suminį kiekį (t. y. pradinę medžiagą ir metabolitus) arba ėminiai gali būti gryninami, kad pradinę medžiagą galima būtų analizuoti atskirai. Jei BCF reikia skaičiuoti pagal pradinę cheminę medžiagą, pagrindinius metabolitus reikėtų apibūdinti bent jau sugerties tarpsnio pabaigoje (žr. 6 pastraipą). Pagrindiniai metabolitai yra tie junginiai, kurie sudaro ≥ 10 % likučių žuvies audiniuose suminio kiekio, kurie sudaro ≥ 5 % dviejose gretimose ėminių ėmimo vietose, kurių kiekiai didėja sugerties tarpsnio metu ir kurių žinomas toksiškumas kelia susirūpinimą. Jei visos žuvies BCF pagal suminį žymėtųjų likučių kiekį yra ≥ 500, būtų galima patarti, o dėl tam tikrų kategorijų cheminių medžiagų, pvz., pesticidų, primygtinai rekomenduoti identifikuoti ir kiekybiškai nustatyti svarbiausius metabolitus. Tokių metabolitų kiekybinio nustatymo gali reikalauti kai kurios priežiūros institucijos. Jei žuvų audiniuose identifikuoti ir kiekybiškai nustatyti irimo produktai sudaro ≥ 10 % suminio žymėtųjų likučių kiekio, juos taip pat rekomenduojama identifikuoti ir kiekybiškai nustatyti bandymo vandenyje. Jei nustatymas būtų neįmanomas, tai reikėtų paaiškinti bandymo ataskaitoje. Bandomosios cheminės medžiagos koncentraciją paprastai reikėtų nustatyti kiekvienoje atskirai pasvertoje žuvyje. Jei tai neįmanoma, kiekvienu atskiro ėmimo atveju paimti ėminiai gali būti sujungti, bet sujungimas riboja statistines procedūras, kurias būtų galima taikyti duomenims, todėl bandymui reikėtų paimti reikiamą žuvų skaičių, kad būtų galima užtikrinti norimą sujungimą, statistinę procedūrą ir galią. Kaip įvadą į atitinkamas sujungimo procedūras galima naudoti (27) ir (28) nuorodas. Be vertės, gautos tiesiogiai atliekant tyrimą (žr. 21 pastraipą), BCF reikėtų išreikšti kaip normalizuotą žuviai, turinčiai 5 % lipidų (pagal šlapią kūno masę), nebent būtų galima įrodyti, kad ne lipidai sukaupia didžiausią bandomosios cheminės medžiagos kiekį. Jei įmanoma, žuvies lipidų kiekį reikėtų nustatyti kiekvienu ėminių ėmimo atveju ir pageidautina tame pačiame ekstrakte, kuris buvo gautas bandomajai cheminei medžiagai analizuoti, nes, prieš atliekant jo chromatografinę analizę, lipidus iš ekstrakto dažnai tenka pašalinti. Tačiau bandomųjų cheminių medžiagų analizei dažnai yra būtinos specifinės ekstrahavimo procedūros, kurios galėtų neatitikti lipidams nustatyti taikomų bandymo metodų. Šiuo atveju (iki bus sukurti tinkami neardomieji instrumentiniai metodai), rekomenduojama taikyti kitą žuvų lipidų kiekio nustatymo strategiją (žr. 56 pastraipą). Reikėtų taikyti tinkamus lipidų kiekio nustatymo metodus (20). Kaip standartinį metodą galima rekomenduoti (30) ekstrahavimo chloroformu ir metanoliu metodą (29), bet kaip alternatyvus metodas rekomenduojamas Smedes metodas (31). Pastarasis metodas pasižymi palyginamu ekstrahavimo efektyvumu, dideliu tikslumu, mažesnio toksiškumo organinių tirpiklių naudojimu ir atlikimo patogumu. Būtų galima taikyti kitus tinkamai pagrįstus metodus, kurių tikslumas palankiai skiriasi nuo rekomenduojamų metodų tikslumo. Svarbu pateikti taikomo metodo duomenis. Žuvų augimo matavimas Bandymo pradžioje atskirai pasveriama nuo penkių iki dešimties pradinės populiacijos žuvų ir išmatuojamas jų visas ilgis. Tai gali būti tos pačios žuvys, kurios būtų naudojamos lipidų analizei (žr. 56 pastraipą). Prieš atliekant cheminės medžiagos ar lipidų analizę, kiekvienu atskiro ėminių ėmimo atveju reikėti išmatuoti bandymo ir kontrolinių grupių žuvų masę ir ilgį. Šių ėminiams paimtų žuvų matavimai taip pat gali būti naudojami bandymo ir kontroliniuose induose likusių žuvų masei ir ilgiui įvertinti (žr. 45 pastraipą). DUOMENYS IR ATASKAITOS RENGIMAS Rezultatų apdorojimas Bandomosios cheminės medžiagos sugerties kreivę aritmetinėje skalėje reikėtų gauti bandymu nustatytą koncentraciją žuvyje arba jos paviršiuje (arba tam tikruose audiniuose) pateikiant kaip laiko funkciją. Jei kreivė pasiekė gulsčiąją sritį, t. y. tapo maždaug asimptotinė laiko ašiai, nuostoviosios būsenos BCF (BCFSS) reikėtų apskaičiuoti taip:
C f kitimui įtakos gali turėti žuvų augimas (žr. 72 ir 73 pastraipas). Vidutinei veikimo koncentracijai (Cw ) įtaką daro jos kitimas laikui bėgant. Galima tikėtis, kad laikinė svertinė vidutinė koncentracija yra tinkamesnė ir tikslesnė vertė atliekant biologinio kaupimosi tyrimus, net jei kitimas atitinka reikiamą tinkamumo intervalą (žr. 24 pastraipą). Koncentracijos vandenyje laikinis svertinis vidurkis (LSV) gali būti apskaičiuotas pagal 5 priedėlio 1 skirsnį. Kinetinį biologinio koncentravimo faktorių (BCFK) reikėtų nustatyti kaip dviejų pirmojo laipsnio kinetikos greičio konstantų k 1/k 2 santykį. Greičio konstantas k 1 ir k 2 bei BCFK galima išvesti atliekant vienalaikį sugerties ir apsivalymo tarpsnių vertinimą. Arba k 1 ir k 2 gali būti nustatytos nuosekliai (žr. 5 priedėlį, kuriame šie metodai aprašyti ir palyginti). Apsivalymo greičio konstantai (k 2) gali tekti daryti praskiedimo dėl augimo pataisą (žr. 72 ir 73 pastraipas). Jei apsivalymo kreivė akivaizdžiai yra ne pirmojo laipsnio, reikėtų taikyti sudėtingesnius modelius (žr. 5 priedėlio nuorodas, taip pat klausti biologinės statistikos ir (arba) farmakologinės kinetikos specialisto patarimo). Žuvų masės ir ilgio duomenys Atskirų žuvų šlapios kūno masės ir viso ilgio duomenys, gauti kiekvieną kartą imant ėminius sugerties tarpsniu (įskaitant pradinę populiaciją sugerties tarpsnio pradžioje) ir apsivalymo tarpsniu, įtraukiami į lenteles atskirai bandymo ir kontrolinių ėminių grupei. Kiekvienos žuvies atskirai išmatuotą masę ir ilgį reikėtų susieti su cheminės medžiagos koncentracija, pvz., naudojant unikalų identifikavimo kodą kiekvienai ėminio žuviai. Masei kaip augimo matui teikiama pirmenybė, kai reikia daryti kinetinio BCF verčių praskiedimo dėl augimo pataisą (žr. 73 pastraipą ir 5 priedėlį dėl metodo, taikomo darant praskiedimo dėl augimo pataisą). Praskiedimo dėl augimo pataisa ir normalizavimas pagal lipidus Dėl žuvų augimo apsivalymo tarpsniu gali būti gautos mažesnės išmatuotos cheminės medžiagos koncentracijos vertės, todėl visuminė apsivalymo greičio konstanta (k 2) yra didesnė nei būtų gauta vien tik pagal pašalinimo procesus (pvz., kvėpavimą, metabolizmą, šalinimą iš organizmo). Reikėtų daryti kinetinių biologinio koncentravimo faktorių praskiedimo dėl augimo pataisą. BCFSS taip pat darys įtaką augimas, bet nėra sutartos procedūros BCFSS pataisai dėl augimo daryti. Jei augimas reikšmingas, taip pat reikėtų apskaičiuoti BCFK, pataisytą dėl augimo (BCFKg), nes jis gali būti tinkamesnis biologinio koncentravimo faktoriaus matas. Lipidų kiekis bandymo žuvyse (kuris yra labai susijęs su hidrofobinių cheminių medžiagų biologiniu kaupimusi) praktiškai gali gerokai keistis, todėl jį būtina normalizuoti pagal nustatytą žuvų lipidų kiekį (5 % masės), siekiant kinetinį ir nuostoviosios būsenos biologinio koncentravimo faktorius pateikti prasmingu būdu, nebent būtų galima įrodyti, kad ne lipidai sukaupia didžiausią bandomosios cheminės medžiagos kiekį (pvz., kai kurios perfluorintos cheminės medžiagos gali jungtis su baltymais). Šių skaičiavimų lygtys ir pavyzdžiai pateikti 5 priedėlyje. Siekiant padaryti kinetinio BCF praskiedimo dėl augimo pataisą, reikėtų daryti apsivalymo greičio konstantos pataisą dėl augimo. Ši dėl augimo pataisyta apsivalymo greičio konstanta(k 2g) apskaičiuojama iš visuminės apsivalymo greičio konstantos (k 2) atimant augimo greičio konstantą (k g, gautą iš išmatuotos masės duomenų). Paskui apskaičiuojamas dėl augimo pataisytas kinetinis biologinio koncentravimo faktorius sugerties greičio konstantą (k 1) dalijant iš dėl augimo pataisytos apsivalymo greičio konstantos (k 2g) (žr. 5 priedėlį). Kai kuriais atvejais šis metodas turi trūkumų. Pvz., jei labai lėtai pasišalinančios cheminės medžiagos bandomos greitai augančiose žuvyse, apskaičiuota k 2g gali būti labai maža, todėl labai svarbia tampa jai gauti naudojamų dviejų greičio konstantų paklaida ir kai kuriais atvejais k g įverčiai gali būti didesni nei k 2. Alternatyvus metodas, kurį taikant nereikia daryti praskiedimo dėl augimo pataisos, kai apsivalymo duomenys gaunami naudojant bandomosios cheminės medžiagos masę vienoje žuvyje (pagal visos žuvies masę), o ne įprastiniai (koncentravimo) duomenys, gaunami kaip bandomosios cheminės medžiagos masė žuvies masės vienetui. Šiuos duomenis galima nesunkiai gauti, nes bandymai pagal šį bandymų metodą turėtų susieti audiniui registruotas koncentracijos vertes su atskirų žuvų mase. Paprasta šių veiksmų atlikimo procedūra apibūdinta 5 priedėlyje. Reikia pažymėti, kad k 2 vis tiek reikėtų pateikti ataskaitoje, jei taikomas šis alternatyvus metodas. Kinetinį ir nuostoviosios būsenos biologinio koncentravimo faktorius taip pat reikėtų pateikti ataskaitoje numatytojo 5 % (masės) žuvų lipidų kiekio atžvilgiu, nebent būtų galima įrodyti, kad ne lipidai sukaupia didžiausią bandomosios cheminės medžiagos kiekį. Koncentravimo žuvyse duomenys arba BCF normalizuojami pagal santykį tarp 5 % ir faktinį (atskirą) vidutinį lipidų kiekį ( % šlapios kūno masės) (žr. 5 priedėlį). Jei cheminės medžiagos ir lipidų analizės buvo atliekamos su ta pačia žuvimi, atskirų žuvų pagal lipidus normalizuotus duomenis reikėtų naudoti pagal lipidus normalizuotam BCF apskaičiuoti. Arba, jei augimas kontroliniuose ir apdorotų žuvų ėminiuose yra panašus, pataisai dėl lipidų galima naudoti tik kontrolinių ėminių žuvų lipidų kiekį (žr. 56 pastraipą). Pagal lipidus normalizuoto BCF skaičiavimo metodas aprašytas 5 priedėlyje. Rezultatų aiškinimas Rezultatus reikėtų aiškinti atsargiai, jei išmatuotos bandymo tirpalų koncentracijos vertės yra arti analizės metodo aptikimo ribos. Bandymo ir kontrolinių grupių vidutiniai augimo duomenys iš esmės neturėtų reikšmingai skirtis, kad būtų pašalintas toksinis poveikis. Abiejų grupių augimo greičio konstantas arba augimo kreives reikėtų lyginti taikant tinkamą procedūrą (52)). Aiškiai apibrėžtos sugerties ir apsivalymo kreivės yra biologinio koncentravimo duomenų geros kokybės ženklas. Greičio konstantoms gautas χ2 suderinamumo kriterijaus rezultatas turėtų rodyti gerą suderinamumą su biologinio kaupimosi modeliu (t. y. mažą matavimo paklaidos procentinę dalį (32)), kad greičio konstantas būtų galima laikyti patikimomis (žr. 5 priedėlį). Jei naudojama daugiau kaip viena bandymo koncentracija, sugerties ir apsivalymo konstantų kitimas kintant bandymo koncentracijai turėtų būti mažesnis kaip 20 % (53). Jei taip nėra, reikėtų pažymėti priklausomybę nuo koncentracijos. Reikėtų registruoti stebimus didelius sugerties ir apsivalymo greičio konstantų skirtumus, kintant naudojamoms bandymo koncentracijos vertėms, ir pateikti galimus paaiškinimus. Jei tyrimo schema sukurta tinkamai, BCF 95 % pasikliovimo riba yra ± 20 % gauto BCF. Jei bandomos dvi koncentracijos vertės arba jų yra daugiau, abiejų ar visų koncentracijos verčių rezultatai yra naudojami jų nuoseklumui patikrinti ir įrodyti, ar yra priklausomybė nuo koncentracijos. Jei bandoma tik viena koncentracija, siekiant sumažinti gyvūnų ir (arba) išteklių naudojimą, vienos koncentracijos naudojimą reikėtų pagrįsti. Gautas BCFSS kelia abejonių, jei BCFK yra reikšmingai didesnis nei BCFSS, nes tai gali rodyti, kad nebuvo pasiekta nuostovioji būsena arba nebuvo atsižvelgta į praskiedimo dėl augimo ir netekimo procesus. Tais atvejais, kai BCFSS yra ypač daug didesnis nei BCFK, reikėtų patikrinti sugerties ir apsivalymo greičių konstantų skaičiavimą dėl paklaidų ir jas įvertinti iš naujo. BCFK galėtų pagerinti kitokia priderinimo procedūra (žr. 5 priedėlį). Bandymo ataskaita Be 3 pastraipoje nurodytos informacijos apie bandomąją cheminę medžiagą, bandymo ataskaitą sudaro ši informacija:
C.13 -II. II. Žuvų veikimo per vandeninę terpę supaprastintas bandymas ĮVADAS Vis didesnė laboratorijų ir reglamentavimo institucijų patirtis, įgyta atliekant viso masto bandymą ir aiškinant jo rezultatus, rodo, kad, esant kai kurioms išimtims, galioja pirmojo laipsnio kinetika skaičiuojant sugerties ir apsivalymo greičio konstantas. Todėl įvertinti sugerties ir apsivalymo greičio konstantas ir apskaičiuoti kinetinį BCF galima pagal minimalų ėminių ėmimo taškų skaičių. Pradinis tikslas tiriant alternatyvias BCF tyrimų schemas buvo sukurti nedidelio masto bandymą, kuris būtų naudojamas kaip tarpinis bandymo etapas pagal K OW ir QSAR gautiems BCF įverčiams atmesti arba patvirtinti ir taip atsisakyti daugelio cheminių medžiagų viso masto tyrimo ir sumažinti sąnaudas bei naudojamų gyvūnų skaičių, imant mažiau ėminių ir atliekant mažiau analizės procedūrų. Laikantis pagrindinės pirmiau taikyto bandymų metodo schemos, kad bandymo rezultatus būtų galima apjungti su esamais BCF duomenimis ir palengvinti bandymų atlikimą ir duomenų aiškinimą, buvo siekiama gauti reikiamo tikslumo ir preciziškumo BCF įverčius rizikos vertinimo sprendimams priimti. Galioja dauguma viso masto bandymo aspektų, pvz., tinkamumo patvirtinimo kriterijai (žr. 24 pastraipą) ir bandymo nutraukimas, jei sugerties tarpsnio pabaigoje stebima nereikšminga sugertis (žr. 16 ir 38 pastraipas). Cheminės medžiagos, kurioms būtų galima pasirinkti supaprastinto bandymo schemą, turėtų priklausyti bendrajai grupei, kuriai jis buvo sukurtas, t. y. nepolinėms organinėms medžiagoms (žr. 49 pastraipą). Jei yra kokių nors požymių, kad cheminė medžiaga, kurią reikia bandyti, gali elgtis kitaip (pvz., aiškiai nukrypsta nuo pirmojo laipsnio kinetikos), viso masto bandymas turėtų būti atliekamas reglamentavimo tikslais. Paprastai, supaprastinto bandymo trukmė nėra mažesnė nei standartinio BCF bandymo, bet jį atliekant imama mažiau žuvų ėminių (žr. pagrindimą 6 priedėlyje). Tačiau sparčiai pasišalinančių cheminių medžiagų apsivalymo laikotarpį galima sutrumpinti, kad prieš bandymo pabaigą būtų išvengta koncentracijos žuvyse verčių, mažesnių nei aptikimo ar kiekybinio nustatymo riba. Galima naudoti supaprastintą žuvų veikimo vienos vertės koncentracija bandymą, jei reikia nustatyti, ar būtinas viso masto bandymas, ir, jei gauti duomenys, naudojami greičio konstantoms ir BCF apskaičiuoti, yra patikimi (žr. 93 pastraipą), viso masto bandymo galima atsisakyti, jei gauta BCF vertė yra labai nutolusi nuo susirūpinimą keliančių reglamentavimo verčių. Kai kuriais atvejais kaip parengiamąjį bandymą gali būti naudinga atlikti supaprastintą bandymą pagal schemą su daugiau kaip viena bandymo koncentracija, siekiant nustatyti, ar cheminei medžiagai gauti BCF įverčiai priklauso nuo koncentracijos. Jei BCF įverčiai, gauti atliekant supaprastintą bandymą, rodo priklausomybę nuo koncentracijos, būtina atlikti viso masto bandymą. Jei pagal tokio supaprastinto bandymo rezultatus BCF įverčiai nepriklauso nuo koncentracijos, bet rezultatai nėra laikomi galutiniais, galima atlikti vienos koncentracijos viso masto bandymą, taip sumažinant naudojamų gyvūnų skaičių palyginti su dviejų (ar daugiau) koncentracijos verčių viso masto bandymu. Cheminės medžiagos, kurias būtų galima pasirinkti supaprastintam bandymui, turėtų:
ĖMINIŲ ĖMIMO PROGRAMA ATLIEKANT TYRIMUS PAGAL SUPAPRASTINTĄ SCHEMĄ Žuvų ėminių ėmimas Žuvų ėminių ėmimo kartų skaičius sumažintas iki keturių:
Vandens ėminių ėmimas Taikant supaprastintą schemą, vandens ėminiai imami kaip atliekant viso masto tyrimą (žr. 54 pastraipą) arba bent penkis kartus vienodais tarpais sugerties tarpsniu ir kas savaitę apsivalymo tarpsniu. Schemos pakeitimai Atsižvelgiant į bandomosios cheminės medžiagos savybes, pagrįstas QSAR prognozes ir specifinį tyrimo tikslą, galima nuspręsti dėl kai kurių schemos pakeitimų:
Skaičiavimai Šio metodo pagrindinis argumentas yra tas, kad atliekant viso mato bandymą biologinio koncentravimo faktorius gali būti nustatytas kaip nuostoviosios būsenos biologinio koncentravimo faktorius (BCFSS), skaičiuojant bandomosios cheminės medžiagos koncentracijos žuvies audinyje ir bandomosios cheminės medžiagos koncentracijos vandenyje santykį, arba skaičiuojant kinetinį biologinio koncentravimo faktorių (BCFK) kaip sugerties greičio konstantos k 1 ir apsivalymo greičio konstantos k 2 santykį. BCFK yra tikras netgi nepasiekus cheminės medžiagos nuostoviosios būsenos koncentracijos sugerties tarpsniu, jei sugertis ir apsivalymas vyksta maždaug kaip pirmojo laipsnio kinetikos procesai. Sugerties ir apsivalymo greičio konstantoms įvertinti būtinai reikia turėtų ne mažiau kaip du taškus, kurių vienas būtų sugerties tarpsnio pabaigoje (t. y. apsivalymo tarpsnio pradžioje), o kitas – apsivalymo tarpsnio pabaigoje (arba praėjus reikšmingai jo daliai). Rekomenduojamas tarpinis ėminių ėmimo taškas sugerties ir apvalymo tarpsnių kinetikai patikrinti (57). Dėl skaičiavimų žr. 5 ir 6 priedėlį. Rezultatų aiškinimas Siekiant įvertinti bandymo tinkamumą ir informacinę vertę, reikia patikrinti, ar apsivalymo laikotarpis yra ilgesnis nei viena pusėjimo trukmė. Be to, BCFKm (kinetinį BCF, gautą atliekant supaprastintą bandymą) reikėtų palyginti su supaprastinto bandymo BCFSS verte (kuri yra lygi BCFSS, apskaičiuotam sugerties tarpsnio pabaigoje, darant prielaidą, kad nuostovioji būsena buvo pasiekta. Galima daryti tik prielaidą, nes ėminių ėmimo taškų yra per mažai, kad tai būtų galima įrodyti). Jei BCFKm < supaprastinto bandymo BCFSS, supaprastinto bandymo BCFSS reikėtų teikti pirmenybę. Jei BCFKm yra mažesnis nei 70 % supaprastinto bandymo BCFSS, rezultatai netinka ir reikėtų atlikti viso masto bandymą. Jei atliekant supaprastintą bandymą gautas BCFKm atitinka kurios nors susirūpinimą keliančios reglamentavimo vertės sritį, reikėtų atlikti viso masto bandymą. Jei rezultatas visiškai neatitinka kurios nors susirūpinimą keliančios reglamentavimo vertės (gerokai didesnis arba mažesnis), viso masto bandymas gali būti nebūtinas, arba galima atlikti vienos koncentracijos viso masto bandymą, jei to reikalauja atitinkama reglamentavimo sistema. Jei, atlikus vienos koncentracijos supaprastintą bandymą, nustatoma, kad būtinas viso masto bandymas, jį galima atlikti naudojant kitą koncentraciją. Jei rezultatai yra suderinami, tolesnio viso masto bandymo naudojant skirtingas koncentracijos vertes galima atsisakyti, nes nesitikima, kad cheminės medžiagos biologinis koncentravimas priklausytų nuo koncentracijos. Jei supaprastintas bandymas buvo atliktas naudojant dvi koncentracijos vertes ir rezultatai nerodo priklausomybės nuo koncentracijos, viso masto bandymą galima atlikti naudojant tik vieną koncentraciją (žr. 87 pastraipą). Bandymo ataskaita Į supaprastinto bandymo ataskaitą reikėtų įtraukti viso masto bandymui reikiamą informaciją (žr. 81 pastraipą), išskyrus tą informaciją, kurios neįmanoma gauti (t. y. kreivę, rodančią nuostoviosios būsenos pasiekimo trukmę, ir nuostoviosios būsenos biologinio koncentravimo faktorių; vietoj pastarojo reikėtų pateikti supaprastinto bandymo BCFss). Be to, į ją turėtų būti įtrauktas supaprastinto bandymo naudojimo priežasčių aptarimas ir gautas BCFKm. C.13 – III. Biologinio kaupimosi žuvyse bandymas veikiant per mitybą ĮVADAS Šiame skyriuje aprašytą metodą reikėtų taikyti cheminėms medžiagoms, kurioms neįmanoma taikyti veikimo per vandeninę terpę metodo (pvz., kai neįmanoma užtikrinti stabilios išmatuojamos koncentracijos vandenyje arba per 60 veikimo parų neįmanoma pasiekti reikiamo kūno sugerto kiekio; žr. ankstesnius veikimo per vandeninę terpę metodo skirsnius). Visgi reikėtų aiškiai suvokti, kad šio bandymo vertinamoji baigtis bus mitybos biomagnifikacijos faktorius (BMF), o ne biologinio koncentravimo faktorius (BCF) (58). 2001 m. gegužę Madride vykusioje Aplinkos toksikologijos ir chemijos draugijos (angl. Society of Environmental Toxicology and Chemistry) Europos skyriaus konferencijoje buvo pristatytas naujas vandenyje mažai tirpių organinių cheminių medžiagų biologinio kaupimosi bandymo metodas (36). Šis darbas pagrįstas įvairiais literatūroje pateiktais biologinio kaupimosi tyrimais, kuriuos atliekant taikomas dozavimo metodas naudojant sodrintą maistą (pvz. (37)). 2004 m. pradžioje ES PBT darbo grupei buvo pateiktas mažai vandenyje tirpių organinių cheminių medžiagų, kurioms neįmanoma taikyti etaloninio veikimo per vandeninę terpę metodo, biologinio kaupimosi gebos matavimo protokolo projektas (38) ir jį patvirtinančių nuorodų dokumentas (39). Papildomai metodui pagrįsti buvo nurodyta, kad galimas aplinkos poveikis esant tokioms mažai vandenyje tirpioms cheminėms medžiagoms (t. y. log K OW > 5) daugiausia gali vykti per maistą (žr. (40) (41) (42) (43) (44)). Dėl šios priežasties mitybos bandymai buvo nurodyti kai kuriuose paskelbtuose cheminių medžiagų reglamentuose (59). Tačiau reikėtų suvokti, kad šiame skyriuje aprašytame bandymų metode griežtai vengiama veikti per vandeninę terpę, todėl šio bandymų metodo BMF vertė negali būti tiesiogiai lyginama su BMF verte, gauta atliekant tyrimą lauko sąlygomis (kai galima sujungti veikimą per vandeninę terpę ir mitybą). Šis bandymų metodo skyrius atitinka šį protokolą (38) ir yra naujas metodas, kurio nėra ankstesnėje C.13 bandymų metodo versijoje. Taikant šį alternatyvų bandymą, galima tiesiogiai tirti mitybos kelią kontroliuojamomis laboratorinėmis sąlygomis. Galimi tyrėjai turėtų remtis šio bandymų metodo 1–14 pastraipomis dėl informacijos apie tai, kada mitybos bandymui gali būti teikiama pirmenybė palyginti su veikimo per vandeninę terpę bandymu. Pateikta informacija apie įvairius cheminių medžiagų aspektus ir į juos reikėtų atsižvelgti prieš atliekant bandymą. Galima atsižvelgti į galimybę naudoti žymėtąsias bandomąsias chemines medžiagas dėl panašių priežasčių, kurios buvo naudojamos taikant veikimo per vandeninę terpę metodą (žr. 6 ir 65 pastraipas). Mitybos metodas gali būti taikomas daugiau kaip vienai cheminei medžiagai patikrinti atliekant vieną bandymą, jei jos atitinka tam tikrus kriterijus; jie nagrinėjami 112 pastraipoje. Procedūroms supaprastinti čia aprašomas bandymas, kurį atliekant tiriama tik viena cheminė medžiaga. Mitybos bandymas daugeliu aspektų yra panašus į veikimo per vandeninę terpę bandymą, išskyrus, aišku, veikimo būdą. Taigi daugelis čia aprašyto metodo aspektų sutampa su veikimo per vandeninę terpę metodu, aprašytu pirmiau pateiktame skyriuje. Kiek įmanoma, pateikiamos kryžminės nuorodos į atitinkamas to skyriaus pastraipas, bet dėl skaitomumo ir supratimo priežasčių tam tikri pasikartojimai yra neišvengiami. BANDYMO PRINCIPAS Galima naudoti dinamines arba pusiau statines sąlygas (žr. 4 pastraipą); dinaminės sąlygos rekomenduojamos, kad būtų ribojamas galimas veikimas per vandenį bandomąja chemine medžiaga dėl desorbcijos nuo sodrinto maisto ar išmatų. Bandymą sudaro du tarpsniai – sugerties (bandomąja chemine medžiaga sodrintas maistas) ir apsivalymo (švarus, neapdorotas maistas) (žr. 16 pastraipą). Sugerties tarpsniu žuvų bandymo grupė kasdien šeriama nustatytos žinomos sudėties komerciniu žuvų maistu, sodrintu bandomąja chemine medžiaga. Būtų gerai, jei žuvys suėstų visą duodamą maistą (žr. 141 pastraipą). Apsivalymo etapu žuvys šeriamos grynu, neapdorotu komerciniu žuvų maistu. Esant poreikiui, galima naudoti daugiau negu vieną tyrimo grupę su skirtingomis tiriamomis cheminių medžiagų koncentracijomis, kaip veikimo per vandeninę terpę metode, tačiau daugumai stipraus hidrofobiškumo organinių cheminių medžiagų tyrimui vienos tyrimo grupės užtenka (žr. 49 ir 107 pastraipas). Jei naudojamos pusiau statinės sąlygos, sugerties tarpsnio pabaigoje žuvis reikėtų perkelti į naują terpę ir (arba) į naują bandymų kamerą (tuo atveju, kai naudojama įsisavinimo etape terpė ir / arba aparatūra buvo užteršta tiriamąja chemine medžiaga). Bandomosios cheminės medžiagos koncentracijos žuvyse vertės matuojamos abiem bandymo tarpsniais. Be sodrintu maistu šeriamos žuvų grupės (bandymo grupės) yra kontrolinė žuvų grupė, laikoma vienodomis sąlygomis ir vienodai šeriama, išskyrus tai, kad komercinis žuvų maistas nesodrinamas bandomąja chemine medžiaga. Galima kiekybiškai įvertinti bandomosios cheminės medžiagos foninę koncentraciją tokios kontrolinės grupės neapdorotose žuvyse ir tą grupę naudoti palyginimui su nepageidaujamais reiškiniais, stebimais bandymo grupėje (-ėse) dėl apdorojimo (60). Taip pat galima lyginti augimo greičio konstantas tarp grupių, kaip būdą patikrinti, ar buvo suvartoti panašūs duodamo maisto kiekiai (aiškinant skirtingas augimo greičio konstantas, reikia atsižvelgti į galimus maisto skonio skirtumus; žr. 138 pastraipą). Svarbu, kad sugerties ir apsivalymo tarpsniais bandymo ir kontrolinės grupės būtų maitinamos vienodos mitybinės vertės maistu. Atsižvelgiant į metodo kūrėjų patirtį, sugerties tarpsnis turėtų trukti 7–14 parų (38) (39). Toks laikotarpis turėtų kiek įmanoma sumažinti bandymo atlikimo kainą, bet kartu užtikrinti pakankamą daugelio tiriamų cheminių medžiagų poveikį. Tačiau kai kuriais atvejais sugerties tarpsnis gali būti pratęstas (žr. 127 pastraipą). Per sugerties tarpsnį cheminės medžiagos koncentracija žuvyse gali nepasiekti nuostoviosios būsenos, todėl duomenų apdorojimas ir šiuo metodu gauti rezultatai paprastai yra pagrįsti likučių audiniuose kinetikos analize. (Pastaba. Šiuo atveju kaip ir veikimo per vandeninę terpę metodui galima naudoti nuostoviosios būsenos pasiekimo trukmės nustatymo lygtis, žr. 5 priedėlį). Apsivalymo tarpsnis prasideda žuvims pirmą kartą davus nesodrinto maisto ir jis paprastai trunka iki 28 parų arba trumpiau, kai bandomosios cheminės medžiagos nebegalima kiekybiškai nustatyti visoje žuvyje. Apsivalymo tarpsnį galima sutrumpinti ar tęsti ilgiau kaip 28 paras, priklausomai nuo cheminės medžiagos koncentracijos ir žuvų dydžio pokyčių laikui einant. Šiuo metodu galima nustatyti cheminės medžiagos būdingą pusėjimo trukmę žuvyse (t 1/2, pagal apsivalymo greičio konstantą k 2), bandomosios cheminės medžiagos žuvyje įsisavinimo efektyvumą (absorbciją per virškinimo traktą a), kinetinį mitybos biomagnifikacijos faktorių (BMFK), kinetinį mitybos biomagnifikacijos faktorių su pataisa dėl augimo (BMFKg), kinetinį mitybos biomagnifikacijos faktorių su pataisa dėl lipidų (61) (BMFKL) (ir (arba) kinetinį mitybos biomagnifikacijos faktorių su pataisa dėl augimo ir lipidų BMFKgL). Kaip ir veikimo per vandeninę terpę metodo atveju, dėl žuvies masės padidėjimo bandymo metu vyksta bandomosios cheminės medžiagos praskiedimas dėl žuvies augimo, todėl (kinetinio) BMF reikšmė bus per maža, jei nebūtų daroma pataisa dėl augimo (žr. 162 ir 163 pastraipas). Be to, jei įvertinama, kad sugerties tarpsniu buvo pasiekta nuostovioji būsena, galima apskaičiuoti būdingąjį nuostoviosios būsenos BMF. Naudojant šiuos metodus galima apskaičiuoti kinetinį biologinio koncentravimo faktorių (BKFK) iš mitybos tyrimo duomenų (pvz., (44) (45) (46) (47) (48). 8 priedėlyje yra aptariami šių metodų privalumai ir trūkumai. Bandymas buvo pirmiausia skirtas mažai tirpioms nepolinėms organinėms cheminėms medžiagoms, kurių sugerties ir apsivalymo kinetika žuvyse yra maždaug pirmojo laipsnio. Jei bandoma cheminė medžiaga, kurios sugerties ir apsivalymo kinetika nėra maždaug pirmojo laipsnio, reikėtų taikyti sudėtingesnius modelius (žr. 5 priedėlio nuorodas), taip pat klausti biologinės statistikos ir (arba) farmakologinės kinetikos specialisto patarimo. BMF paprastai yra nustatomas atliekant bandomosios cheminės medžiagos kiekio analizę visoje žuvyje (šlapios kūno masės atžvilgiu). Tačiau jei tai atitinka tyrimo tikslus, gali būti imami tam tikrų audinių (pvz., raumenų, kepenų) ėminiai, jei žuvis padalyta į valgomąją ir nevalgomą dalis (žr. 21 pastraipą). Be to, galima pašalinti virškinimo traktą ir jį analizuoti atskirai, kad būtų nustatytas jo indėlis į visos žuvies koncentracijos vertę, imant ėminius sugerties tarpsnio pabaigoje ir prieš apsivalymo tarpsnio pradžią, arba šį būdą galima naudoti kaip masių balanso metodo dalį. Reikėtų išmatuoti visos žuvies ėminio lipidų kiekį, kad būtų galima daryti koncentracijos pataisą dėl lipidų, atsižvelgiant į jų kiekį maiste ir žuvyje (žr. 56 bei 57 pastraipas ir 7 priedėlį). Reikėtų matuoti ir registruoti ėminiams paimtų atskirų žuvų masę, kuri būtų susieta su analizuojamos cheminės medžiagos koncentracija toje žuvyje (pvz., naudojant unikalų identifikavimo kodą kiekvienai ėminio žuviai), kad būtų galima apskaičiuoti galimą augimą bandymo metu. Jei įmanoma, reikėtų išmatuoti visą žuvies ilgį (62). Masės duomenys taip pat yra būtini vertinant BKF pagal mitybos bandymo apsivalymo duomenis. INFORMACIJA APIE BANDOMAJĄ CHEMINĘ MEDŽIAGĄ Reikėtų turėti informaciją apie bandomąją cheminę medžiagą, kaip aprašyta 3 ir 22 pastraipose. Analizės metodas bandomosios cheminės medžiagos koncentracijos vandenyje analizės metodas paprastai nėra būtinas; reikia turėti tinkamo jautrio metodus koncentracijai žuvų maiste ir žuvų audiniuose matuoti. Atliekant vieną bandymą, gali būti taikomas metodas daugiau kaip vienai cheminei medžiagai nustatyti. Tačiau bandomosios cheminės medžiagos turėtų būti suderinamos, kad negalėtų vykti jų sąveika ir nepakistų jų cheminė sudėtis sodrinant jomis žuvų maistą. Siekiama, kad išmatuoti kiekvienos cheminės medžiagos rezultatai neturėtų labai skirtis nuo rezultatų, gautų kiekvieną cheminę medžiagą bandant atskirai. Atliekant parengiamuosius analizės darbus, reikėtų nustatyti, ar kiekvieną cheminę medžiagą galima atgauti iš daugeliu cheminių medžiagų sodrinto maisto ir žuvies audinių ėminio, esant i) dideliam atgavimo laipsniui (pvz., > 85 % nominalaus kiekio) ir ii) bandymui atlikti reikiamam jautriui. Suminė kartu bandytų cheminių medžiagų dozė turėtų būti mažesnė nei jungtinė koncentracija, kuri galėtų sukelti toksinį poveikį (žr. 51 pastraipą). Be to, kuriant bandymų schemą, reikėtų atsižvelgti į galimus nepageidaujamus reiškinius žuvyse ir į interaktyvių poveikių potencialą (pvz., metabolizmo reiškinių), susijusius su daugelio cheminių medžiagų bandymu, vienu metu. Reikėtų vengti kartu bandyti jonizuojančias chemines medžiagas. Kalbant apie veikimą, metodas taip pat tinka kompleksiniams mišiniams (žr. 51 pastraipą), nors galioja tie patys analizės apribojimai, kaip ir taikant bet kurį kitą metodą. BANDYMO TINKAMUMAS Taikomos šios bandymo tinkamumo sąlygos (žr. 24 pastraipą):
ETALONINĖS CHEMINĖS MEDŽIAGOS Jei laboratorija anksčiau nė karto nebuvo atlikusi tokio tyrimo arba buvo padaryti reikšmingi pakeitimai (pvz., pakeista žuvų veislė ar tiekėjas, kita žuvų rūšis, reikšmingi žuvų dydžio pasikeitimai, maisto ar sodrinimo metodo pakeitimai ir kt.), patartina atlikti techninės kvalifikacijos tyrimą, naudojant etaloninę cheminę medžiagą. Pagrindinis etaloninės medžiagos naudojimo tikslas – nustatyti, ar tinka taikomas maisto sodrinimo metodas, kad būtų užtikrintas maksimalus bandomųjų cheminių medžiagų homogeniškumas ir biologinis įsisavinamumas. Vienas iš naudojamų nepolinių hidrofobinių medžiagų pavyzdžių yra heksachlorbenzenas (HCB), bet dėl jo pavojingų savybių būtų galima pagalvoti apie kitas chemines medžiagas, jei yra patikimų duomenų apie sugertį ir biologinį koncentravimą per maistą (63). Jei naudojama etaloninė cheminė medžiaga, bandymo ataskaitoje apie ją reikėtų pateikti pagrindinę informaciją kaip ir apie bandomąsias chemines medžiagas, įskaitant pavadinimą, grynumą, CAS numerį, struktūrą, toksiškumo duomenis (jei yra) (žr. 3 ir 22 pastraipas). METODO APRAŠYMAS Aparatūra Medžiagos ir aparatūra turi būti naudojamos kaip nurodyta veikimo per vandeninę terpę metodo aprašyme (žr. 26 pastraipą). Reikėtų naudoti dinaminio ar statinio atnaujinimo sistemą, kuri užtikrina pakankamą į bandymo indus tiekiamo skiedimo vandens tūrį. Reikėtų registruoti srautą. Vanduo Vanduo turi būti naudojamos kaip nurodyta veikimo per vandeninę terpę metodo aprašyme (žr. 27–29 pastraipas). Bandymo terpė turėtų būti apibūdinta, kaip aprašyta, ir jos kokybė turėtų būti pastovi visą bandymo trukmę. Natūralus kietųjų dalelių kiekis ir suminės organinės anglies (TOC) kiekis prieš bandymo pradžią turėtų būti kuo mažesnis (≤ 5 mg/l kietųjų dalelių; ≤ 2 mg/l suminės organinės anglies). TOC, kaip vieną iš vandens charakteristikų, reikia matuoti tik prieš bandymą (žr. 53 pastraipą). Maistas Rekomenduojama naudoti pirktinį žuvų maistą (plūduriuojančias ir (arba) lėtai skęstančias maisto granules), kuris yra apibūdinamas, nurodant bent baltymų ir riebalų kiekį. Maisto granulės turėtų būti vienodo dydžio, kad būtų didesnis mitybos poveikio efektyvumas, t. y. žuvys suėstų daugiau maisto, nei ėsdamos tik didesnius gabalus ir nematydamos mažesnių. Granulių matmenys turėtų atitikti žuvų dydį bandymo pradžioje (pvz., galima naudoti granules, kurių skersmuo yra maždaug 0,6–0,85 mm, kai visas žuvų ilgis yra 3–7 cm, ir 0,85–1,2 mm, kai visas ilgis yra 6–12 cm). Granulių dydį, atsižvelgiant į žuvų augimą, apsivalymo tarpsnio pradžioje galima keisti. Tinkamos pirktinio maisto sudėties pavyzdys yra pateiktas 7 priedėlyje. Kuriant šį bandymų metodą, paprastai buvo naudojamas maistas, kurio suminis lipidų kiekis buvo 15–20 % (w/w)). Kai kuriuose regionuose gali nebūti maisto su tokia didele lipidų koncentracija. Tokiais atvejais tyrimai turėtų būti atliekami esant mažesnei tiekiamo maisto lipidų koncentracijai, bet prireikus reikėtų tinkamai reguliuoti maitinimo dažnumą, kad būtų užtikrinta gera žuvų sveikata (atsižvelgiant į parengiamuosius bandymus). Suminį lipidų kiekį bandymo grupės ir kontrolinės grupės maiste reikia matuoti ir registruoti prieš bandymo pradžią ir sugerties tarpsnio pabaigoje. Tyrimo ataskaitoje reikėtų pateikti maistinių medžiagų, drėgmės, ląstelienos, pelenų ir, jei įmanoma, mineralų bei pesticidų likučių (pvz., tipinių ypač pavojingų teršalų) analizės duomenis, kuriuos pateikia pirktinio maisto tiekėjas. Sodrinant maistą bandomąja chemine medžiaga, reikia imtis visų priemonių maisto homogeniškumui užtikrinti viso bandymo metu. Bandomosios cheminės medžiagos koncentracija bandymo grupės maiste turėtų būti pasirinkta atsižvelgiant į analizės metodo jautrį, bandomosios cheminės medžiagos toksiškumą (NOEC, jei žinoma) ir atitinkamus fizikinius ir cheminius duomenis. Naudojant etaloninę cheminę medžiagą, ją reikėtų įterpti esant koncentracijai, kuri būtų maždaug 10 % bandomosios cheminės medžiagos koncentracijos (arba kiek įmanoma mažesnė), atsižvelgiant į analizės jautrį (pvz., buvo nustatyta, kad priimtina heksachlorbenzeno koncentracija maiste yra 1–100 μg/g; daugiau informacijos apie HCB įsisavinimo efektyvumą pateikta (47). Žuvų maistą galima sodrinti bandomąja chemine medžiaga keliais būdais, atsižvelgiant į fizikines charakteristikas ir tirpumą (daugiau duomenų apie sodrinimo metodus pateikta 7 priedėlyje):
Kai kuriais atvejais, pvz., kadangi mažiau hidrofobinių bandomųjų cheminių medžiagų desorbcija iš maisto yra labai tikėtina, paruoštas maisto granules reikėtų padengti plonu kukurūzų aliejaus ar žuvų taukų sluoksniu (žr. 142 pastraipą). Tokiais atvejais, kontrolinių ėminių maistas turėtų būti apdorojamas panašiai ir galutinai paruoštas maistas naudojamas lipidų kiekiui nustatyti. Jei naudojamos etaloninės medžiagos, jų rezultatai turėtų būti palyginami su literatūroje pateiktais panašiomis sąlygomis atliktų tyrimų, naudojant palyginamą maisto normą, duomenimis (žr. 45 pastraipą), o etaloninei cheminei medžiagai būdingi parametrai turėtų atitikti taikytinus 113 pastraipos (3, 4 ir 5 punktų) kriterijus. Jei kaip bandomosios cheminės medžiagos nešiklis naudojamas aliejus arba tirpiklis, to paties nešiklio (be bandomosios cheminės medžiagos) lygiavertį kiekį reikėtų sumaišyti su kontrolinio ėminio maistu, kad būtų užtikrintas lygiavertiškumas su sodrintu maistu. Svarbu, kad sugerties ir apsivalymo tarpsniais bandymo ir kontrolinės grupės būtų maitinamos vienodos mitybinės vertės maistu. Sodrintą maistą reikėtų laikyti sąlygomis, kurios užtikrina bandomosios cheminės medžiagos stabilumą maisto mišinyje (pvz., laikyti šaldytuve), ir šias sąlygas pateikti ataskaitoje. Žuvų rūšių parinkimas Galima naudoti žuvų rūšis, nurodytas atliekant veikimo per vandeninę terpę metodą (žr. 32 pastraipą ir 3 priedėlį). Atliekant organinių cheminių medžiagų biologinio kaupimosi per maistą tyrimus prieš šio bandymų metodo paskelbimą, dažniausiai naudojamos rūšys buvo vaivorykštinis upėtakis (Oncorhynchus mykiss), karpis (Cyprinus carpio) ir juodoji drūtagalvė rainė (Pimephales promelas). Bandymo žuvų rūšys turėtų kuo sparčiau suėsti duodamą maisto normą, siekiant užtikrinti, kad visi veiksniai, kurie daro įtaką bandomosios cheminės medžiagos koncentracijai maiste (pvz., išplovimas į vandenį ir veikimo per vandeninę terpę galimybė) pasireikštų kuo mažiau. Reikėtų naudoti žuvis, kurios atitiktų rekomenduojamą dydžio ir masės intervalą (žr. 3 priedėlį). Žuvys neturėtų būti per mažos, kad nebūtų apsunkinta atskirų žuvų analizė. Gyvavimo ciklo metu sparčiai augančios bandymų žuvų rūšys gali apsunkinti duomenų aiškinimą, o didelis augimo greitis gali daryti įtaką įsisavinimo efektyvumo skaičiavimui (64). Žuvų laikymas Priimtinumo kriterijai, susiję su aklimatizavimu, gaištamumu ir susirgimais, atitinka veikimo per vandeninę terpę metodo kriterijus, išmatavus laidumą prieš tyrimą (žr. 33–35 pastraipas). BANDYMŲ EIGA Pasirengimo tyrimui darbai ir intervalo nustatymo bandymas Pasirengimo tyrimui analizės darbai yra būtini, kad būtų galima įrodyti cheminės medžiagos atgavimą iš prisodrinto maisto ar prisodrinto žuvų audinio. Intervalo nustatymo bandymas tinkamai koncentracijai maiste pasirinkti ne visada būtinas. Būtų galima atlikti parengiamuosius maisto davimo bandymus, turint tikslą įrodyti neigiamo poveikio nebuvimą, įvertinti sodrinto maisto skonines savybes ir žuvų audinių bei maisto analizės metodo jautrį ir pasirinkti tinkamą maisto normą bei ėminių ėmimo intervalus apsivalymo tarpsnio metu ir kt., tačiau jie nėra privalomi. Parengiamasis tyrimas gali būti naudingas įvertinant apsivalymo tarpsniu imamų ėminių žuvų skaičių. Taip būtų galima žymiai sumažinti naudojamų žuvų skaičių, ypač jautrioms metabolizmui tiriamosioms cheminėms medžiagoms. Veikimo sąlygos Sugerties tarpsnio trukmė Paprastai pakanka 7–14 parų trukmės sugerties tarpsnio, kurio metu viena žuvų grupė maitinama kontroliniu maistu, o kita žuvų grupė kasdien maitinama bandymo maistu esant nustatytam daviniui, kuris priklauso nuo žuvų bandymų rūšies ir bandymo sąlygų, pvz., vaivorykštiniam upėtakiui – nuo 1 iki 2 % kūno masės (šlapios kūno masės). Maisto norma turėtų būti parinkta taip, kad būtų išvengta greito augimo ir didelio lipidų kiekio padidėjimo. Jei reikia, atsižvelgiant į praktinę ankstesnių tyrimų patirtį ar turint bandomosios cheminės medžiagos (arba jos analogų) sugerties ir (arba) apsivalymo žuvyse duomenų, sugerties tarpsnis gali būti pratęstas. Bandymo pradžia nustatoma kaip laikas, kai žuviai pirmą kartą duodama sodrinto maisto. Bandymo para trunka nuo maisto davimo iki truputį anksčiau (pvz., viena valanda) nei kitas maisto davimo momentas. Taigi pirmoji bandymo sugerties tarpsnio para prasideda nuo pirmo sodrinto maisto davimo momento ir baigiasi beveik prieš pat sodrinto maisto davimą antrą kartą. Praktiškai sugerties tarpsnis baigiasi beveik prieš pat (pvz., viena valanda) pirmą kartą duodant bandomąja chemine medžiaga nesodrinto maisto, nes žuvis ir toliau virškina sodrintą maistą ir sugeria bandomąją cheminę medžiaga per tarpines 24 h. Svarbu užtikrinti, kad, atsižvelgiant į analizės metodą, sugertų pakankamai didelį (netoksinį) bandomosios cheminės medžiagos kiekį, kad apsivalymo metu būtų galima matuoti bent vienos eilės dydžio sumažėjimą. Specialiais atvejais sugerties tarpsnį galima pratęsti (iki 28 parų), imant papildomus ėminius, kad būtų galima įsigilinti į sugerties kinetiką. Per sugerties tarpsnį cheminės medžiagos koncentracija žuvyse gali nepasiekti nuostoviosios būsenos. Siekiant įvertinti nuostoviosios būsenos pasiekimo trukmę, kaip reikšmingos koncentracijos žuvyje gavimo tikėtinos trukmės rodiklį, galima taikyti veikimo per vandeninę terpę metodo skirtas lygtis (žr. 5 priedėlį). Kartais gali būti žinoma, kad, dėl per mažo analizės jautrio ar įsisavinimo efektyvumo, per 7–14 parų žuvies sugertas cheminės medžiagos kiekis, esant naudojamai koncentracijai maiste, gali būti per mažas gauti koncentraciją, kuri leistų išmatuoti bent vienos eilės jos mažėjimą apsivalymo. Tokiais atvejais gali būti naudinga pratęsti pradinį maitinimo tarpsnį ilgiau nei 14 parų arba reikėtų atsižvelgti į galimybę padidinti koncentraciją maiste, ypač tų cheminių medžiagų, kurios yra labai jautrios metabolizmui. Tačiau reikėtų imtis priemonių užtikrinti, kad sugerties tarpsniu kūno sugertos medžiagos kiekis būtų mažesnis nei (įvertinta) lėtinio poveikio nebuvimo koncentracija (NOEC) žuvies audinyje (žr. 138 pastraipą). Apsivalymo tarpsnio trukmė Apsivalymas paprastai trunka ne ilgiau kaip 28 paras ir prasideda, kai bandymo grupės žuvys po sugerties tarpsnio gauna gryno, neapdoroto maisto. Apsivalymas prasideda ne iš karto po paskutinio sodrinto maisto davimo, bet pirmą kartą davus nesodrinto maisto, nes žuvis toliau virškins maistą ir įsisavins bandomąją cheminę medžiagą per tarpines 24 h, kaip nurodyta 126 pastraipoje. Todėl pirmasis apsivalymo tarpsnio ėminys imamas beveik prieš pat antrąjį maitinimą nesodrintu maistu. Per šį apsivalymo laikotarpį numatoma aptikti medžiagas, kurių galima pusėjimo trukmė yra iki 14 parų, nes ji atitinka biologiškai kauptis galinčių cheminių medžiagų savybes, todėl (65) 28 paros sudaro dvi tokių cheminių medžiagų pusėjimo trukmes. Jei cheminių medžiagų biologinio kaupimosi geba yra labai didelė, gali būti naudinga pratęsti apsivalymo tarpsnį (jei tai rodo preliminarūs parengiamieji bandymai). Jei cheminė medžiaga pasišalina labai lėtai, pvz., kai apsivalymo tarpsniu neįmanoma nustatyti tikslios pusėjimo trukmės, informacijos vis dar gali pakakti vertinimo tikslams, kad būtų pažymėta didelė biologinio kaupimosi geba. Ir atvirkščiai, jei cheminė medžiaga pasišalina taip greitai, kad patikima nulinio laiko koncentracija (koncentracija sugerties tarpsnio pabaigoje ar apsivalymo tarpsnio pradžioje C 0,d) ir k 2 negali būti apskaičiuotos, galima gauti sumažintą k 2 įvertį (žr. 7 priedėlį). Jei žuvų analizė ankstesniais laikotarpiais (pvz., 7 arba 14 parą) rodo, kad cheminė medžiaga pasišalino ir jos kiekis sumažėjo iki mažesnės nei kiekybinio nustatymo koncentracija greičiau nei per 28 paras, ėminių galima nebeimti ir bandymą nutraukti. Kartais gali būti taip, kad sugerties tarpsnio pabaigoje (ar antrame apsivalymo tarpsnio ėminyje) nenustatoma matuoti tinkama bandomosios cheminės medžiagos sugertis. Jei galima įrodyti, kad: i) yra atitiktis 113 pastraipoje nurodytiems tinkamumo kriterijams ir ii) sugerties nebuvimas nėra susijęs su kai kuriais kitais bandymo atlikimo trūkumais (pvz., nepakankama sugerties trukmė, dėl netinkamo maisto sodrinimo metodo yra per mažas biologinis įsisavinamumas, nepakankamas analizės metodo jautris, žuvys nevartoja maisto ir kt.), tyrimą galima nutraukti ir nekartoti taikant ilgesnę sugerties trukmę. Jei atliekant parengiamąjį darbą buvo įrodyta, kad tai yra būtent toks atvejis, būtų galima patarti atlikti, jei įmanoma, išmatų analizę, kaip masių balanso metodo dalį, neįsisavintai bandomajai cheminei medžiagai nustatyti. Bandomųjų žuvų skaičius Kaip ir atliekant veikimo per vandeninę terpę metodą, reikėtų pasirinkti panašios masės ir ilgio žuvis, kad mažiausios žuvies masė būtų ne mažesnė nei dvi trečiosios didžiausios žuvies masės (žr. 40–42 pastraipas). Suminis tyrimo žuvų skaičius turėtų būti pasirinktas pagal ėminių ėmimo tvarkaraštį (ne mažiau kaip po vieną ėminį sugerties tarpsnio pabaigoje ir nuo keturių iki šešių ėminių apsivalymo tarpsnio metu, bet priklausomai nuo tarpsnių trukmės), atsižvelgiant į analizės metodo jautrį, koncentraciją, kuri galėtų būti sugerties tarpsnio pabaigoje (pagal ankstesnius duomenis) ir apsivalymo tarpsnio trukmę (jei galima įvertinti turint ankstesnių duomenų). Kiekvienu ėminio ėmimo atveju reikėtų ištirti nuo penkių iki dešimties žuvų, kurių augimo parametrai (masė ir visas ilgis) būtų išmatuoti prieš cheminės medžiagos ar lipidų analizę. Dėl žuvų dydžio, augimo greičio bei fiziologijos ir galbūt dėl duodamo maisto kiekio, kurį suvartoja kiekviena žuvis, būdingo kintamumo, kiekvieną kartą reikėtų imti ne mažiau kaip penkių žuvų bandymo grupės ėminį ir penkių žuvų kontrolinės grupės ėminį, kad būtų tinkamai nustatyta vidutinė koncentracija ir jos kintamumas. Naudojamų žuvų parametrų kintamumas gali turėti daugiau įtakos visuminiam nekontroliuojamam bandymo kintamumui, nei taikomoms analizės metodikoms būdingas kintamumas, todėl kartais pasiteisina iki dešimties žuvų ėminys vienam ėminių ėmimo kartui. Tačiau, jei apsivalymo tarpsnio pradžioje neįmanoma išmatuoti kontrolinių žuvų foninės bandomosios cheminės medžiagos koncentracijos, gali pakakti tik dviejų ar trijų žuvų cheminės analizės galutiniu ėminių ėmimo laikotarpiu, jei likusių kontrolinių žuvų ėminiai būtų imami visuose taškuose masei ir visam ilgiui nustatyti (taigi augimui nustatyti imamas vienodas bandymo ir kontrolinių grupių žuvų skaičius). Žuvis reikėtų sukaupti, atskirai pasverti (netgi jei būtų taip, kad ėminio rezultatus reikėtų vėliau sujungti) bei išmatuoti jų visą ilgį. Atliekant tipinį bandymą, pvz., esant 28 parų apsivalymo trukmei ir apsivalymo tarpsnio metu imant penkis ėminius, reikėtų 59–120 žuvų bandymo grupei ir 50–110 žuvų kontrolinei grupei, darant prielaidą, kad cheminės medžiagos analizės metodas duoda galimybę nustatyti lipidų kiekį toje pačioje žuvyje. Jei lipidų analizei negalima panaudoti cheminės medžiagos analizei paimtos žuvies ir taip pat yra neįmanoma kontrolines žuvis naudoti vien tik lipidų analizei (žr. 56 pastraipą), reikėtų paimti papildomai dar 15 žuvų (tris iš pradinės populiacijos bandymo pradžioje, po tris iš kontrolinės ir bandymo grupės apsivalymo tarpsnio pradžioje ir po tris iš kontrolinės ir bandymo grupės bandymo pabaigoje). Žuvų ėmimo tvarkaraščio ir žuvų skaičiaus pavyzdys pateiktas 4 priedėlyje. Įkrova Panašiai kaip taikant veikimo per vandeninę terpę metodą (žr. 43 ir 44 pastraipas), reikėtų naudoti didelius vandens ir žuvų santykius. Nors atliekant šį bandymą žuvų įkrovos dydis neturi įtakos veikimo koncentracijai, rekomenduojamas įkrovos dydis yra 0,1–1,0 g žuvies (šlapios kūno masės) litrui vandens per parą, kad būtų galima užtikrinti reikiamą ištirpusio deguonies koncentraciją ir sumažinti bandymo organizmams keliamą stresą. Bandymų maistas ir maitinimas Aklimatizavimo laikotarpiu žuvis reikėtų maitinti tinkamu maistu, kaip aprašytą pirmiau (117 pastraipa). Jei bandymas atliekamas dinaminėmis sąlygomis, srautą reikėtų stabdyti žuvų maitinimo metu. Bandymo grupės maistas atliekant bandymą turėtų atitikti pirmiau aprašytą (116–121 pastraipa). Pasirenkant tikslinę sodrinimo koncentraciją, reikėtų atsižvelgti ne tik į cheminei medžiagai būdingus veiksnius, analizės jautrį, tikėtiną koncentraciją maiste aplinkos sąlygomis ir lėtinio toksiškumo koncentracijos vertes ar kūno sugertą kiekį, bet ir į maisto skonines savybes (kad žuvis nenustotų jo ėsti). Ataskaitoje reikėtų pateikti bandomosios cheminės medžiagos nominalią sodrinimo koncentraciją. Atsižvelgiant į patirtį, sodrinimo koncentracija 1–1 000 μg/g yra praktinis darbinis intervalas, taikomas bandomosioms cheminėms medžiagoms, kurios nerodo specifinio toksiškumo mechanizmo. Jei cheminė medžiaga veikia ne pagal specifinį mechanizmą, likučių audiniuose koncentracija neturėtų būti didesnė kaip 5 μmol/g lipidų, nes dėl didesnio nei šis likučių kiekio gali pasireikšti lėtinis poveikis (19) (48) (50) (66). Dėl kitų cheminių medžiagų reikėtų imtis priemonių, kad dėl kaupiamojo poveikio nebūtų jokių neigiamų reiškinių (žr. 127 pastraipą). Tai ypač galioja tam atvejui, kai vienu metu bandoma daugiau kaip viena cheminė medžiaga (žr. 112 pastraipą). Reikiamu bandomosios cheminės medžiagos kiekiu galima sodrinti žuvų maistą vienu iš trijų būdų, kaip aprašyta 119 pastraipoje ir 7 priedėlyje. Maisto sodrinimo metodus ir procedūras reikėtų aprašyti ataskaitoje. Kontrolinėms žuvims duodamas neapdorotas maistas, turintis lygiavertį nesodrinto aliejaus nešiklio kiekį, jei sugerties tarpsniu aliejus buvo naudojamas sodrintam maistui, arba apdorotas grynu tirpikliu, jei bandymo grupių maistui ruošti kaip nešiklis buvo naudojamas tirpiklis. Bandomosios cheminės medžiagos koncentraciją apdorotame ir neapdorotame maiste reikėtų nustatyti sugerties tarpsnio pradžioje ir pabaigoje, atliekant ne mažiau kaip trijų kartotinių ėminių analizę. Nustojus žuvis veikti apdorotu maistu (sugerties tarpsniui), žuvys (abi grupės) maitinamos neapdorotu maistu (apsivalymo tarpsniu). Žuvys maitinamos duodant nustatytą kiekį (kuris priklauso nuo rūšies; pvz., vaivorykštiniam upėtakiui – nuo 1 iki 2 % šlapios kūno masės per parą). Maisto norma turėtų būti parinkta taip, kad būtų išvengta greito augimo ir didelio lipidų kiekio padidėjimo. Reikėtų registruoti tikslią bandymui nustatytą maisto normą. Pradinė maisto norma turėtų būti pagrįsta reguliariu pradinės populiacijos masės matavimu prieš pat bandymo pradžią. Maisto kiekį reikėtų koreguoti, atsižvelgiant į ėminių žuvų šlapią kūno masę kiekvieną kartą imant ėminius bandymo metu. Bandymo ir kontrolinių indų žuvų masę ir ilgį galima įvertinti pagal žuvų, paimtų kiekvieną kartą imant ėminį, masę ir ilgį; bandymo ir kontroliniame inde likusių žuvų masė ir ilgis nematuojami. Svarbu visą bandymą užtikrinti vienodą nustatytą maisto normą. Maitinimo procesą reikėtų stebėti, siekiant įsitikinti, ar žuvys akivaizdžiai suvartoja visą duotą maistą, nes tai užtikrintų, kad atliekant skaičiavimus bus naudojamos reikiamos suvartojimo normos. Reikėtų atsižvelgti į parengiamuosius maitinimo bandymus ar į ankstesnę patirtį, renkantis maisto normą, kuri užtikrintų, kad suvartojamas visas vienos paros maistas. Tuo atveju, kai maistas nuolat lieka nesuėstas, galbūt reikėtų paskirstyti dozę ilgesniam maitinimo laikotarpiui kiekvieną bandymo dieną (pvz., vietoj vienkartinio maitinimo duoti pusę kiekio du kartus per parą). Jei būtina maitinti antrą kartą, tai reikėtų daryti nustatytu laiku ir tokiu momentu, kad iki žuvų ėminių ėmimo būtų maksimalus laiko tarpas (pvz., antrąjį kartą maitinti bandymo paros pirmoje pusėje). Nors paprastai žuvys suėda maistą greitai, svarbu užtikrinti, kad cheminė medžiaga liktų adsorbuota ant maisto Reikėtų imtis priemonių bandomosios cheminės medžiagos išsiskyrimui iš maisto į vandenį išvengti, nes tada, be veikimo per maistą, žuvis veiktų tam tikros koncentracijos bandomoji cheminė medžiaga vandenyje. Tai galima pasiekti pašalinant visus nesuėsto maisto likučius (ir išmatas) iš bandymo ir kontrolinių indų ne vėliau kaip per valandą, bet geriau, per 30 min nuo maitinimo. Be to, galima naudoti nuolatinio vandens valymo per aktyvintųjų anglių filtrą sistemą, kad būtų absorbuoti visi „ištirpę“ teršalai. Naudojant dinaminio bandymo sistemas, būtų lengviau greitai nuplauti maisto daleles ir ištirpusias chemines medžiagas (67). Kai kuriais atvejais problemą galėtų sumažinti šiek tiek pakeistas sodrinto maisto paruošimo metodas (žr. 119 pastraipą). Šviesa ir temperatūra Kaip ir taikant veikimo per vandeninę terpę metodą (žr. 48 pastraipą), rekomenduojama 12–16 h šviesiojo laikotarpio trukmė ir naudojamoms bandymų rūšims tinkama temperatūra (± 2 °C) (žr. 3 priedėlį). Reikėtų žinoti ir dokumentuoti apšvietimo tipą bei jo charakteristikas. Kontroliniai ėminiai Reikėtų naudoti vieną kontrolinę grupę, kurios žuvys maitinamos tuo pačiu maisto kiekiu kaip bandomosios grupės žuvys, bet be bandomosios cheminės medžiagos maiste. Jei kaip nešiklis bandymo grupės maistui sodrinti naudojamas aliejus ar tirpiklis, kontrolinės grupės maistas turėtų būti apdorotas visiškai vienodai, bet be bandomosios cheminės medžiagos, taigi bandymo grupės ir kontrolinės grupės maistas yra lygiavertis (žr. 121 ir 139 pastraipas). Vandens kokybės matavimo dažnumas Čia taip pat taikomos sąlygos, aprašytos veikimo per vandeninę terpę metodui, išskyrus tai, kad TOC reikia matuoti tik prieš bandymą, kaip bandymo vandens charakteristikų dalį (žr. 53 pastraipą). Žuvų bei vandens ėminių ėmimas ir analizė Žuvų maisto ėminių analizė Reikėtų analizuoti bent tris kartotinius bandymo ir kontrolinio maisto ėminius bent sugerties tarpsnio pradžioje ir pabaigoje. Analizės metodai ir procedūros maisto homogeniškumui užtikrinti turėtų būti įtrauktos į ataskaitą. Bandomoji cheminė medžiaga turėtų būti analizuojama taikant nustatytą ir patvirtintą metodą. Reikėtų atlikti pasirengimo tyrimui darbus, kad būtų nustatyta kiekybinio nustatymo riba, atgavimo laipsnis procentais, trukdžiai ir numatomo ėminio matricos analizinis kintamumas. Jei bandoma žymėtoji medžiaga, reikėtų atsižvelgti į panašius aspektus kaip ir taikant veikimo per vandeninę terpę metodą, vandens analizę pakeičiant maisto analize (žr. 65 pastraipą). Žuvų analizė Kiekvieną kartą imant žuvų ėminį reikia imti po 5–10 žuvų iš poveikio ir kontrolinio apdorojimo indų (kai kuriais atvejais kontrolinio ėminio žuvų skaičių galima sumažinti; žr. 134 pastraipą). Ėminius reikėtų imti kiekvieną bandymų dieną tuo pačiu metu (maitinimo laiko atžvilgiu), ir tokiu laiku, kad būtų kuo mažesnė tikimybė maistui likti virškinimo trakte sugerties tarpsnio metu ir pačioje apsivalymo tarpsnio pradžioje, siekiant išvengti klaidingo suminės bandomosios cheminės medžiagos koncentracijos padidėjimo (t. y. žuvų ėminius reikėtų imti bandymų paros pabaigoje, turint omenyje, kad bandymų para prasideda maitinimo momentu ir baigiasi kito maitinimo momentu, maždaug po 24 h. Apsivalymo tarpsnis prasideda pirmą kartą davus nesodrinto maisto; žr. 128 pastraipą). Pirmasis apsivalymo tarpsnio ėminys (paimtas prieš pat antrąjį maitinimą nesodrintu maistu) yra svarbus, nes ekstrapoliavimas vieną parą atgal nuo šio matavimo naudojamas nulinio laiko koncentracijai įvertinti (C 0,d, koncentracija žuvyje sugerties tarpsnio pabaigoje ar apsivalymo tarpsnio pradžioje). Arba galima pašalinti virškinimo traktą ir jį analizuoti atskirai sugerties tarpsnio pabaigoje bei 1 ir 3 apsivalymo tarpsnio parą. Kiekvieną kartą imant ėminį, žuvis reikėtų paimti iš abiejų bandymo indų ir apdoroti veikimo per vandeninę terpę metode taikytu būdu (žr. 61–63 pastraipas). Kontrolinių ir bandymo grupių ėminių bandomosios cheminės medžiagos koncentracija visoje žuvyje (šlapios kūno masės atžvilgiu) matuojama bent sugerties tarpsnio pabaigoje ir visą apsivalymo etapą. Apsivalymo etapu rekomenduojama matuoti nuo keturių iki šešių kartų (pvz., 1, 3, 7, 14 ir 28 parą). Pasirinktinai galima imti papildomai dar vieną kartą 1–3 sugerties tarpsnio parą, kad būtų galima įvertinti įsisavinimo žuvimis efektyvumą tiesiniu sugerties tarpsniu,, kai dar esama beveik poveikio laikotarpio pradžioje. Yra du pagrindiniai nukrypimai nuo tvarkaraščio: i) jei sugerties kinetikai tirti sugerties tarpsnis pratęsiamas, bus papildomi ėminių ėmimo taškai sugerties tarpsnio metu, todėl reikės turėti papildomų žuvų (žr. 126 pastraipą); ii) jei tyrimas buvo nutrauktas sugerties tarpsnio pabaigoje dėl neišmatuojamos sugerties (žr. 131 pastraipą). Ėminiams imamas žuvis reikėtų atskirai pasverti (ir išmatuoti visą ilgį), kad būtų galima nustatyti augimo greičio konstantas. Cheminės medžiagos koncentraciją tam tikruose žuvų audiniuose (valgomų ir nevalgomų dalių) taip pat galima išmatuoti sugerties tarpsnio pabaigoje ir pasirinktais apsivalymo etapo tarpsnio momentais. Jei bandoma žymėtoji medžiaga, reikėtų atsižvelgti į panašius aspektus kaip ir taikant veikimo per vandeninę terpę metodą, vandens analizę pakeičiant maisto analize (žr. 65 pastraipą). Jei periodiškai naudojama etaloninė cheminė medžiaga (žr. 25 pastraipą), pageidautina, kad koncentracija bandymo grupės žuvyse būtų matuojama sugerties tarpsnio pabaigoje ir visus bandomajai cheminei medžiagai nurodytus kartus apsivalymo tarpsniu (visos žuvies); koncentraciją kontrolinės grupės žuvyse reikėtų nustatyti sugerties tarpsnio pabaigoje (visos žuvies). Tam tikromis aplinkybėmis (pvz., jei nesutampa bandomosios cheminės medžiagos ir etaloninės cheminės medžiagos analizės metodai ir dėl to reikės papildomų žuvų, kad būtų galima atitikti ėminių ėmimo tvarkaraštį) galima taikyti kitą toliau nurodytą metodą, siekiant kiek įmanoma sumažinti papildomų žuvų skaičių. Etaloninės cheminės medžiagos koncentracijos vertės yra matuojamos tik 1 ir 3 apsivalymo tarpsnio parą ir dar du kartus, laiką pasirenkant taip, kad būtų gauti patikimi etaloninės cheminės medžiagos nulinio laiko koncentracijos (C 0,d) ir k 2 įverčiai. Jei įmanoma, atskirų žuvų lipidų kiekį reikėtų nustatyti kiekvienu ėminių ėmimo atveju arba bent sugerties tarpsnio pradžioje bei pabaigoje ir apsivalymo tarpsnio pabaigoje (žr. 56 ir 67 pastraipas). Priklausomai nuo analizės metodo (žr. 67 pastraipą ir 4 priedėlį), galima naudoti tą pačią žuvį lipidų kiekiui ir bandomosios cheminės medžiagos koncentracijai nustatyti. Tokiems metodams teikiama pirmenybė dėl galimybės sumažinti žuvų skaičių. Tačiau, jei tai būtų neįmanoma, galima taikyti metodą, kuris aprašytas veikimo per vandeninę terpę bandymui (žr. 56 pastraipą dėl šių alternatyvių lipidų matavimo būdų). Bandymo ataskaitoje reikėtų pateikti lipidų kiekybinio nustatymo metodą. Analizės metodo kokybė Bandymų keliu reikėtų patikrinti, ar užtikrinamas cheminei medžiagai būdingo analizės metodo specifiškumas, tikslumas, preciziškumas ir atkuriamumas, taip pat bandomosios cheminės medžiagos atgavimo iš maisto ir žuvies laipsnis. Žuvų augimo matavimas Bandymo pradžioje reikia pasverti nuo penkių iki dešimties pradinės populiacijos žuvų ėminį ir išmatuoti jų visą ilgį. Šios žuvys turėtų būti imamos prieš pat pirmą sodrinto maisto davimą (pvz., likus vienai valandai) ir ėmimą priskirti 0 bandymų parai. Šio ėminio žuvų skaičius turėtų būti bent jau toks pat, kaip atliekant bandymą imamų ėminių. Kai kurios iš šių žuvų gali būti tos pačios žuvys, kurios buvo naudojamos lipidų analizei prieš sugerties tarpsnio pradžią (žr. 153 pastraipą). Kiekvieną kartą imant ėminius, žuvys sveriamos ir matuojamas jų ilgis. Kiekvienos žuvies atskirai išmatuotą masę ir ilgį reikėtų susieti su analizuojamos cheminės medžiagos koncentracija (ir lipidų kiekiu, jei taikoma), pvz., naudojant unikalų identifikavimo kodą kiekvienai ėminio žuviai. Šių ėminiams paimtų žuvų matavimai taip pat gali būti naudojami bandymo ir kontroliniuose induose likusių žuvų masei ir ilgiui įvertinti. Įvertinimas atliekant bandymus Gaištamumą reikėtų stebėti ir registruoti kasdien. Reikėtų papildomai stebėti neigiamus reiškinius, pvz., nenormalų elgesį ar pigmentines dėmes, ir duomenis registruoti. Žuvis laikoma negyva, jei negalima aptikti kvėpavimo judesių ir reakcijos į nestiprius mechaninius dirgiklius. Visas negyvas arba aiškiai gaištančias žuvis reikėtų pašalinti. DUOMENYS IR ATASKAITOS RENGIMAS Rezultatų apdorojimas Bandymų rezultatai naudojami apsivalymo greičio konstantai (k 2) kaip žuvies visos šlapios kūno masės funkcijai gauti. Prireikus apskaičiuojama augimo greičio konstanta, k g, pagrįsta žuvies masės vidutiniu padidėjimu, ir ji naudojama apsivalymo greičio konstantai su pataisa dėl augimo k 2g gauti. Be to, reikėtų pateikti įsisavinimo efektyvumą (a; absorbciją iš virškinimo trakto), kinetinį biomagnifikacijos faktorių (BMFK) (jei būtina, su pataisa dėl augimo BMFKg), jo vertę su pataisa dėl lipidų (BMFKL arba BMFKgL, jei daroma praskiedimo dėl augimo pataisa) ir maisto normą. Taip pat, jei galima gauti nuostoviosios būsenos pasiekimo sugerties tarpsniu trukmės įvertį (pvz., 95 % nuostoviosios būsenos arba t 95 = 3,0/k 2), galima įtraukti nuostoviosios būsenos BMF (BMFSS) (žr. 105 bei 106 pastraipas ir 5 priedėlį), jei t 95 vertė rodo, kad galėjo būti pasiektos nuostoviosios būsenos sąlygos. Šiam BMFSS reikėtų taikyti tą pačią pataisą dėl lipidų, kaip ir kinetiniu metodu gautam BMF (BMFK), kad būtų gauta vertė su pataisa dėl lipidų BMFSSL (reikia pažymėti, kad nėra sutartos procedūros kaip gauti nuostoviosios būsenos BMF praskiedimo dėl augimo pataisą). Formulės ir skaičiavimo pavyzdžiai pateikti 7 priedėlyje. Yra metodų, kuriuos taikant įmanoma įvertinti kinetinį biologinio koncentravimo faktorių (BCFK) pagal veikimo per maistą tyrimo duomenis. Tai aptariama 8 priedėlyje. Žuvų masės ir ilgio duomenys Atskirų žuvų šlapios kūnomasės ir viso ilgio duomenys, gauti kiekvieną kartą imant ėminius sugerties tarpsniu (pradinės populiacijos – sugerties tarpsnio pradžioje, kontrolinės grupės ir bandymo grupės – sugerties tarpsnio pabaigoje ir, jei atliekama, sugerties tarpsnio pačioje pradžioje, pvz., sugerties tarpsnio 1–3 parą) ir apsivalymo tarpsniu (kontrolinės ir bandymo grupės – pvz., 1, 2, 4, 7, 14, 28 parą) įtraukiami į lenteles atskirai bandymo ir kontrolinių ėminių grupei. Masei kaip augimo matui teikiama pirmenybė darant praskiedimo dėl augimo pataisą. Metodai, taikomi darant duomenų praskiedimo dėl augimo pataisą, pateikti toliau (162 ir 163 pastraipos) ir 5 priedėlis. Bandomosios cheminės medžiagos koncentracijos žuvyje duomenys Bandomosios cheminės medžiagos likučių atskiroje žuvyje (arba jungtinių žuvų ėminių, jei atskirų žuvų matavimas neįmanomas) kiekiai, gauti kiekvieną kartą imant ėminius ir išreikšti koncentracija (w/w ) šlapios kūno masės atžvilgiu, įtraukiami į lenteles atskirai bandymo ir kontrolinių ėminių grupei. Jei buvo atlikta kiekvienos ėminio žuvies lipidų analizė, galima gauti ir įtraukti į lenteles atskiras koncentracijos vertes su pataisa dėl lipidų, išreikštas lipidų koncentracija (w/w lipidų).
Apsivalymo greitis ir biomagnifikacijos faktorius Turint duomenis biomagnifikacijos faktoriui apskaičiuoti, iš pradžių reikėtų gauti įsisavinimo efektyvumo vertę (bandomosios cheminės medžiagos absorbciją per virškinimo traktą, α). Šią vertę reikėtų gauti pagal 7 priedėlio A7.1 lygtį, pagal kurią reikia žinoti apskaičiuotą apsivalymo tarpsnio nulinio laiko koncentraciją žuvyje (C 0,d), (visuminę) apsivalymo greičio konstantą (k 2), koncentraciją maiste (C maisto), maisto suvartojimo normą (I) ir sugerties tarpsnio trukmę (t). Gautas tiesinės priklausomybės tarp ln(koncentracijos) ir apsivalymo trukmės krypties koeficientas ir atkarpa ataskaitoje pateikiami kaip visuminė apsivalymo greičio konstanta (k 2 = krypties koeficientui) ir nulinio laiko koncentracija (C 0,d = eatkarpa), kaip minėta pirmiau. Apskaičiuotas vertes reikėtų tikrinti dėl biologinio patikimumo (pvz., ar įsisavinimo efektyvumas kaip trupmena nėra didesnis už 1). (I) skaičiuojamas maisto masę dalijant iš kasdien maitinamos žuvies masės (jei dozė – 2 % kūno masės, (I) bus 0,02). Tačiau skaičiavimams naudojamai maisto normai gali prireikti pataisos dėl žuvies augimo (tai galima daryti, naudojant žinomą augimo greičio konstantą žuvies masės įverčiui gauti kiekviename sugerties tarpsnio laiko taške; žr. 7 priedėlį). Tais atvejais, kai k 2 ir C 0,d negali būti apskaičiuotos, pvz., dėl to, kad antrojo apsivalymo tarpsnio ėminio koncentracija yra mažesnė nei kiekybinio nustatymo riba, galima gauti mažesnį k 2 įvertį ir BMFk„viršutinę ribą“ (žr. 7 priedėlį). Gavus įsisavinimo efektyvumo vertę (α), galima apskaičiuoti biomagnifikacijos faktorių, dauginant α iš suvartojimo normos (I) ir dalijant iš (visuminės) apsivalymo greičio konstantos (k 2). Biomagnifikacijos faktorius su pataisa dėl augimo yra apskaičiuojamas tokiu pat būdu, bet naudojant apsivalymo greičio konstantą su pataisa dėl augimo (k 2g; žr. 162 ir 163 pastraipas. Galima gauti alternatyvų įsisavinimo efektyvumo įvertį, jei žuvų audinių analizė buvo atliekama sugerties tarpsnio ankstyvuoju tiesiniu tarpsniu; žr. 151 pastraipą ir 7 priedėlį. Ši vertė atitinka nepriklausomą įsisavinimo efektyvumo įvertį, gauta iš esmės tada, kai organizmas dar nebuvo paveiktas (t. y. žuvis yra pačioje sugerties tarpsnio pradžioje). Įsisavinimo efektyvumo įvertis, gautas pagal apsivalymo duomenis, paprastai naudojamas BMF skaičiuoti. Pataisa dėl lipidų ir praskiedimo dėl augimo pataisa Dėl žuvų augimo apsivalymo tarpsniu išmatuota cheminės medžiagos koncentracija žuvyje gali būti mažesnė, dėl to visuminė apsivalymo greičio konstanta k2 yra didesnė nei jį būtų vien dėl pašalinimo procesų (pvz., metabolizmo, šalinimo iš organizmo) (žr. 72 pastraipą). Bandymo žuvų lipidų kiekis (kuris yra labai susijęs su hidrofobinių cheminių medžiagų biologiniu kaupimusi) ir maisto lipidų kiekis praktiškai gali gerokai skirtis, todėl būtina jų kiekio pataisa biomagnifikacijos faktoriams pateikti prasmingu būdu. Reikėtų daryti biomagnifikacijos faktoriaus dėl augimo praskiedimo pataisą (kuri daroma kinetiniam BCF, taikant veikimo per vandeninę terpę metodą) ir pataisą dėl maisto lipidų kiekio palyginti su žuvies lipidų kiekiu (pataisos dėl lipidų faktorius). Šių skaičiavimų lygtys ir pavyzdžiai pateikti 5 ir 7 priedėliuose. Reikėtų apskaičiuoti apsivalymo greičio konstantą su pataisa dėl augimo (k 2g), kad būtų galima daryti praskiedimo dėl augimo pataisą (lygtys pateiktos 5 priedėlyje). Vėliau ši apsivalymo greičio konstanta su pataisa dėl augimo (k 2g) naudojama biomagnifikacijos faktoriui su pataisa dėl augimo skaičiuoti kaip 73 pastraipoje. Kai kuriais atvejais šis metodas netinka. Alternatyvus metodas, kurį taikant nereikia daryti praskiedimo dėl augimo pataisos, kai apsivalymo duomenys gaunami naudojant bandomosios cheminės medžiagos masę vienoje žuvyje (pagal visos žuvies masę), o ne įprastiniai (koncentravimo) duomenys, gaunami kaip bandomosios cheminės medžiagos masė žuvies masės vienetui. Šiuos duomenis galima nesunkiai gauti, nes bandymai pagal šį metodą turėtų susieti audiniui registruotas koncentracijos vertes su atskirų žuvų mase. Paprasta šių veiksmų atlikimo procedūra apibūdinta 5 priedėlyje. Reikia pažymėti, kad, netgi taikant šį alternatyvų metodą, k 2 vis tiek reikėtų įvertinti ir pateikti ataskaitoje. Jei reikia daryti pataisą dėl žuvų ir maisto lipidų kiekio, kai buvo atliekama ne visų ėminiams paimtų žuvų lipidų analizė, gaunamos vidutinės žuvų ir maisto lipidų dalys (masės w/w) (68). Paskui, žuvų lipidų dalies vidurkį dalijant iš maisto lipidų dalies vidurkio, apskaičiuojamas pataisos dėl lipidų faktorius (Lc ). Biomagnifikacijos faktorius, su pataisa dėl augimo arba be jos, jei taikoma, dalijamas iš pataisos dėl lipidų faktoriaus biomagnifikacijos faktoriui su pataisa dėl lipidų gauti. Jei cheminės medžiagos ir lipidų analizė buvo atliekama su ta pačia žuvimi kiekviename ėminių ėmimo taške, atskirų žuvų pagal lipidus pataisytus duomenis galima naudoti pagal lipidus pataisytam BMF tiesiogiai apskaičiuoti (žr. (37)). Pagal koncentracijos su pataisa dėl lipidų duomenis gaunama C 0,d ir k 2. Matematinę analizę galima tęsti naudojant tas pačias 7 priedėlio lygtis, bet įsisavinimo efektyvumas (a) apskaičiuojamas imant pagal lipidus normalizuotą maisto suvartojimo normą (I lipidai) ir koncentraciją maiste pagal lipidus (C maistas-lipidai). Tada parametrai su pataisa dėl lipidų panašiu būdu naudojami BMF apskaičiuoti (reikia pažymėti, kad augimo greičio konstantos pataisa turėtų būti taikoma pagal lipidų dalį, o ne pagal žuvies šlapią kūno masę, kad būtų apskaičiuotas BMFKgL su pataisa dėl lipidų ir dėl augimo). Rezultatų aiškinimas Bandymo ir kontrolinių grupių vidutiniai augimo duomenys iš esmės neturėtų reikšmingai skirtis, kad būtų pašalintas toksinis poveikis. Abiejų grupių augimo greičio konstantas arba augimo kreives reikėtų lyginti taikant tinkamą procedūrą (69) Bandymo ataskaita Baigus tyrimą, rengiama galutinė ataskaita, kurioje pateikiama informacija apie bandomąją cheminę medžiagą, bandymų rūšis ir Bandymo sąlygas, kaip išvardyta 81 pastraipoje (taikant veikimo per vandeninę terpę metodą). Be to, būtina ši informacija:
LITERATŪRA
1 priedėlis APIBRĖŽTYS IR VIENETAI
LITERATŪRA
2 priedėlis KAI KURIOS TINKAMO SKIEDIMO VANDENS CHEMINĖS CHARAKTERISTIKOS
3 priedėlis BANDYMAMS REKOMENDUOJAMOS ŽUVŲ RŪŠYS
Ne taip plačiai naudojamos įvairios upių žiočių ir jūros žuvų rūšys, pvz:
(Lentelėje nurodytas gėlųjų vandenų žuvis lengva auginti ir (arba) jų visur galima gauti ištisus metus, o jūros ir upių žiočių žuvų iš dalies galima gauti tik atitinkamose šalyse. Žuvis galima auginti ir veisti žuvų fermose arba laboratorijoje, ligų ir parazitų kontrolės sąlygomis, kad bandymo gyvūnai būtų sveiki ir būtų žinoma jų kilmė. Šių žuvų yra daugelyje pasaulio kraštų. LITERATŪRA
4 priedėlis ĖMINIŲ ĖMIMO TVARKARAŠČIAI ATLIEKANT VEIKIMO PER VANDENINĘ TERPĘ IR MITYBOS BANDYMUS 1. Ėminių ėmimo tvarkaraščio, atliekant cheminės medžiagos, kurios log KOW = 4, visą veikimo per vandeninę terpę biologinio koncentravimo bandymą, teorinis pavyzdys
2. Ėminių ėmimo tvarkaraščio, atliekant cheminės medžiagos biologinio kaupimosi per maistą bandymą esant 10 parų sugerties ir 42 parų apsivalymo tarpsniui, teorinis pavyzdys
Pastaba dėl tarpsnio trukmės ir ėminių ėmimo laiko nustatymo. Sugerties tarpsnis prasideda pirmą kartą davus sodrinto maisto. Bandymų para trunka nuo vieno maisto davimo iki šiek tiek anksčiau nei kito maitinimo po 24 h. Pirmą kartą ėminiai imami (lentelėje pažymėta 1) prieš pat pirmą maitinimą (pvz., likus vienai valandai). Būtų gerai, jei atliekant tyrimą ėminiai būtų imami prieš pat kitos paros maitinimo laiką (t. y. maždaug 23 h po maitinimo ėminių ėmimo dieną). Sugerties tarpsnis baigiasi prieš pat pirmą maitinimą nesodrintu maistu, kai prasideda apsivalymo tarpsnis (tikėtina, kad bandymo grupės žuvys vis dar virškina sodrintą maistą per tas tarpines 24 h po paskutinio sodrinto maisto davimo). Tai reiškia, kad sugerties tarpsnio pabaigos ėminį reikėtų imti prieš pat pirmą maitinimą nesodrintu maistu, o pirmąjį apsivalymo tarpsnio ėminį reikėtų imti maždaug 23 h po pirmo maitinimo nesodrintu maistu. 5 priedėlis BENDRIEJI SKAIČIAVIMAI
1. ĮVADAS Bendrasis biologinio kaupimosi žuvyse veikimo per vandeninę terpę modelis gali būti aprašytas kaip sugerties ir netekimo procesai, neatsižvelgiant į sugertį per maistą. Diferencialinė lygtis (dC f/dt), kuria aprašomas koncentracijos žuvyje kitimo greitis (mg·kg– 1·day– 1) atrodo taip (1):
Čia
Jei cheminės medžiagos biologiškai kaupiasi, galima tikėtis, kad laikinis svertinis vidurkis (LSV) yra tinkamiausia veikimo per vandeninę terpę koncentracija (Cw ), atsižvelgiant į leidžiamą svyravimų intervalą (žr. 24 pastraipą). Koncentracijos vandenyje LSV rekomenduojama skaičiuoti pagal C.20 bandymų metodo 6 priedėlio procedūrą (2). Reikėtų pažymėti, kad yra patogu transformuoti koncentraciją vandenyje į natūralųjį logaritmą, jei laukiama eksponentinio skaidymo tarp atnaujinimo laikotarpių, pvz., taikant pusiau statinio bandymo schemą. Jei naudojama dinaminė sistema, veikimo koncentracijos verčių transformavimas į natūralųjį logaritmą gali būti nebūtinas. Jei gaunami koncentracijos vandenyje LSV, juos reikėtų pateikti ataskaitoje ir naudoti vėlesniems skaičiavimams. Taikant tipinį žuvų BCF bandymą, sugertį ir apsivalymą galima aprašyti kaip du pirmojo laipsnio kinetinius procesus.
Darant prielaidą, kad augimas ir metabolizmas yra nykstamai maži (t. y. k g ir k m vertės yra arti nulio), esant nuostoviajai būsenai sugerties greitis yra lygus apsivalymo greičiui, todėl jungiant A5.2 ir A5.3 lygtis gaunama tokia priklausomybė:
Čia
Santykis k 1/k 2 yra žinomas kaip kinetinis BCF (BCFK) ir turėtų būti lygus nuostoviosios būsenos BCF (BCFSS) yra gaunamas kaip nuostoviosios būsenos koncentracijos žuvyje ir vandenyje santykis, bet gali būti nukrypimų, jei nuostovioji būsena buvo neapibrėžta arba jei kinetiniam BCF buvo taikomos pataisos dėl augimo. Tačiau, kadangi k 1 ir k 2 yra konstantos, nuostoviosios būsenos pasiekti nebūtina, kad būtų gautas BCFK. Į šį 5 priedėlį įtraukti bendrieji skaičiavimai pagal šias pirmojo laipsnio kinetikos lygtis, kurie yra būtini taikant veikimo per vandeninę terpę mitybos biologinio kaupimosi metodus. Tačiau 5, 6 ir 8 skirsniai tinka tik veikimo per vandeninę terpę metodui, bet jie įtraukti į šį priedėlį, nes yra „bendrosios“ procedūros. Taikant nuosekliuosius (4 ir 5 skirsniai) ir vienalaikius (6 skirsnis) metodus, galima apskaičiuoti sugerties ir apsivalymo konstantas, kurios naudojamos kinetiniams BCF gauti. Nuoseklusis k 2 nustatymo metodas (4 skirsnis) yra svarbus mitybos metodui ir yra būtinas, kai reikia apskaičiuoti įsisavinimo efektyvumą ir BMF. 7 priedėlyje išsamiai aprašyti mitybos metodui būdingi skaičiavimai. 2. SUGERTIES TARPSNIO TRUKMĖS PROGNOZAVIMAS Taikant empirines priklausomybes tarp k 2 ir pasiskirstymo tarp n-oktanolio ir vandens koeficiento (K OW) arba tarp k 1 ir BCF, dar prieš bandymo pradžią galima gauti k 2 įvertį, taigi ir laiką, kuris būtinas tam tikrai nuostoviosios būsenos procentinei daliai pasiekti. Tačiau reikėtų suvokti, kad šio skyriaus lygtys galioja tik tada, kai sugertis ir apsivalymas atitinka pirmojo laipsnio kinetiką. Jei tai nėra visiškai aišku, patariama konsultuotis su biologinės statistikos ir (arba) farmakologinės kinetikos specialistu, jei norima gauti prognozes dėl sugerties tarpsnio. k 2 (paros– 1) įvertis gali būti gautas keliais metodais. Pvz., pirmuoju atveju galima naudoti tokią empirinę priklausomybę (87):
arba
W – vidutinė paveiktos tiriamąja chemine medžiaga žuvies masė (šlapia kūno masė gramais) sugerties tarpsnio pabaigoje ar apsivalymo tarpsnio pradžioje (88) Kitos priklausomybės pateiktos (6). Gali būti naudinga taikyti sudėtingesnius k2 įvertinimo modelius, pvz., jei yra tikimybė, kad gali atsirasti reikšmingas metabolizmas (7) (8). Tačiau, didėjant modelio sudėtingumui, reikėtų atsargiau aiškinti prognozes. Pvz., nitrogrupių buvimas galėtų reikšti greitą metabolizmą, bet tai ne visuomet pasitvirtina. Todėl, kurdamas tyrimo schemą, naudotojas turėtų įvertinti prognozavimo metodu gautus rezultatus, atsižvelgdamas į cheminę sandarą ir kitą susijusią informaciją (pvz., parengiamųjų tyrimų). Laikas, per kurį pasiekiama tam tikra nuostoviosios būsenos procentinė dalis, gali būti gautas taikant k 2- įvertį, nustatytą pagal sugertį ir apsivalymą aprašančią bendrąją kinetinę lygtį (pirmojo laipsnio kinetika), ir darant prielaidą apie nežymų augimą ir metabolizmą. Jei tyrimo metu augimas yra reikšmingas, toliau aprašyti įverčiai nebus patikimi. Tokiais atvejais geriau taikyti k 2g su pataisa dėl augimo, kaip aprašyta toliau (žr. šio priedėlio 7 skirsnį):
arba, jei C w yra pastovi:
Artėjant prie nuostoviosios būsenos (t → ∞), A5.10 lygtį galima supaprastinti (žr. (9) (10)) iki:
arba
Tada BCF × C w yra koncentracijos žuvyje nuostoviosios būsenos sąlygomis artinys (C f-SS). (Pastaba. Tas pats metodas tinka nuostoviosios būsenos BMF įverčiui gauti, atliekant mitybos bandymą. Šiuo atveju pirmiau pateiktose lygtyse BCF yra keičiamas BMF, o C w – C food, koncentracija maiste). A.5.10 lygtis gali būti pertvarkyta į
arba į
Taikant A5.14 lygtį, galima prognozuoti laiką, per kurį pasiekiama nuostoviosios būsenos tam tikra procentinė dalis, kai prieš tai gaunamas k 2 įvertis pagal A5.5 arba A5.6 lygtį. Maždaug statistiškai optimalia sugerties tarpsnio trukme statistiškai priimtiniems duomenims (BCFK) gauti yra laikomas laikas, per kurį bandomosios cheminės medžiagos koncentracijos žuvyje logaritmo, kaip laiko tiesinėje skalėje funkcijos, kreivė pasiekia ne mažiau kaip 50 % nuostoviosios būsenos (t. y. 0,69/k 2), bet ne daugiau kaip 95 % nuostoviosios būsenos (t. y. 3,0/k 2) (11). Jei sugertis didesnė kaip 95 % nuostoviosios būsenos, galima skaičiuoti BCFSS. Laikas 80 % nuostoviosios būsenos pasiekti yra lygus (pagal A5.14 lygtį):
arba
Panašiai laikas 95 % nuostoviosios būsenos pasiekti yra lygus:
Pvz., bandomosios cheminės medžiagos, kurios log K OW = 4, sugerties tarpsnio trukmė (t. y. laikas, per kurį pasiekiama nuostoviosios būsenos tam tikra procentinė dalis, pvz., t 80 arba t 95) būtų (pagal A5.5, A5.16 ir A5.17 lygtis): logk 2 = 1,47 – 0,414 · 4 k 2 = 0,652 paros-1
arba Kaip alternatyva, lygtis:
gali būti naudojama apskaičiuojant laiką, per kurį pasiekiama faktinė nuostovioji būsena (t eSS ) (12). Jei bandomosios cheminės medžiagos log K OW = 4, gaunama: teSS = 6,54 · 10 – 3 · 104 + 55,31 = 121 h 3. APSIVALYMO TARPSNIO TRUKMĖS PROGNOZAVIMAS Taikant bendrąją lygtį, kuri aprašo sugertį ir apsivalymą (darant prielaidą dėl pirmojo laipsnio kinetikos), žr. A5.9 lygtį (1) (13), galima prognozuoti laiką, per kurį organizmo sugertos cheminės medžiagos kiekis sumažėja iki pradinės koncentracijos tam tikros procentinės dalies. Daroma prielaida, kad apsivalymo tarpsnio C w (arba C maisto atliekant mitybos bandymą) yra lygi nuliui. Tada lygtį galima supaprastinti taip:
arba
čia: C f,0 – koncentracija apsivalymo tarpsnio pradžioje. 50 % apsivalymas bus pasiektas laiko momentu (t 50):
arba
Panašiai 95 % apsivalymo trukmė yra lygi:
Jei pirmajam laikotarpiui taikoma 80 % sugerties trukmė (1,6/k 2), o apsivalymo tarpsnio trukmė atitinka 95 % netekimą (3,0/k 2), apsivalymo tarpsnio trukmė maždaug du kartus ilgesnė nei sugerties tarpsnio trukmė. Reikia pažymėti, kad įverčiai pagrįsti prielaida dėl sugerties ir apsivalymo vyksmo pagal pirmojo laipsnio kinetiką. Jei procesai akivaizdžiai vyksta ne pagal pirmojo laipsnio kinetiką, šie įverčiai netinka. 4. NUOSEKLUSIS METODAS. APSIVALYMO (NETEKIMO) GREIČIO KONSTANTOS K 2 NUSTATYMAS Buvo padaryta prielaida, kad biologinio koncentravimo duomenis gana tiksliai aprašo paprastas dviejų aplinkos terpių ir dviejų parametrų modelis, kurį rodo ištiesinta kreivė, einanti maždaug per koncentracijos žuvyje apsivalymo tarpsniu taškus (natūraliojo logaritmo skalėje).
Reikia pažymėti, kad nukrypimai nuo tiesės gali rodyti sudėtingesnę nei pirmojo laipsnio kinetikos apsivalymo schemą. Galima taikyti grafinį metodą, kad būtų nustatytas pirmojo laipsnio kinetikos neatitinkantis apsivalymo tipas. Atliekama tiesinė ln(koncentracijos) kaip laiko funkcijos regresija, kad k 2 būtų apskaičiuota pagal kelis laiko (ėminių ėmimo) taškus. Regresijos tiesės krypties koeficientas yra apsivalymo greičio konstantos k 2 įvertis (89). Pagal atkarpos dydį galima nesunkiai apskaičiuoti vidutinę koncentraciją žuvyje apsivalymo tarpsnio pradžioje (C 0,d, kuri yra lygi vidutinei koncentracijai žuvyje sugerties tarpsnio pabaigoje) (įskaitant leidžiamąsias paklaidas) (89):
Jei k 2 reikia apskaičiuoti tik pagal du turimus laiko (ėminių ėmimo) taškus (kaip pagal supaprastintą schemą), dvi vidutinės koncentracijos vertės įrašomos į šią lygtį:
Šioje lygtyje ln(C f1) ir ln(C f2) yra koncentracijos verčių laiko momentais t 1 ir t 2 natūralieji logaritmai, o t 2 ir t 1 – dviejų ėminių ėmimo laikas nuo apsivalymo tarpsnio pradžios (90). 5. NUOSEKLUSIS METODAS. SUGERTIES GREIČIO KONSTANTOS K 1 NUSTATYMAS (TIK VEIKIMO PER VANDENINĘ TERPĘ METODAS) k1 vertę galima rasti sugerties tarpsnio koncentracijos ir laiko sekos duomenims taikant kompiuterinę programą šiam modeliui pritaikyti:
Čia k 2 pateikta atliekant ankstesnį skaičiavimą, C f(t) ir C w(t) – koncentracija žuvyje ir vandenyje momentu t. Jei k 1 reikia apskaičiuoti tik pagal du turimus laiko (ėminių ėmimo) taškus (kaip pagal supaprastintą schemą), naudojama tokia formulė:
Čia k 2 pateikta atliekant ankstesnį skaičiavimą, C f – koncentracija žuvyje apsivalymo tarpsnio pradžioje ir C w – vidutinė koncentracija vandenyje sugerties tarpsnio metu (91). Apžiūra tikrinant k 1 ir k 2 krypties koeficientus, gautus grafike pagal ėminių ėmimo taškuose išmatuotus duomenis, gali būti naudojama suderintumui įvertinti. Jei pasirodo, kad nuosekliuoju metodu gautas netinkamas k 1 įvertis, reikėtų taikyti vienalaikį metodą k 1 ir k 2 apskaičiuoti (žr. kitą 6 skirsnį). Vėlgi, gautus krypties koeficientus reikėtų palyginti su išmatuotų duomenų grafiku, kad apžiūrint būtų įvertintas suderintumas. Jei suderintumas yra blogas, tai gali rodyti, kad pirmojo laipsnio kinetika netinka ir reikėtų taikyti sudėtingesnius modelius. 6. VIENALAIKIS METODAS SUGERTIES IR APSIVALYMO (NETEKIMO) GREIČIO KONSTANTOMS APSKAIČIUOTI (TIK VEIKIMO PER VANDENINĘ TERPĘ METODAS) Galima naudoti kompiuterines programas k 1 ir k 2 vertėms nustatyti pagal koncentracijos ir laiko sekos duomenis ir modelį:
čia
Šiuo metodu tiesiogiai gaunamos k 1 ir k 2 įverčių standartinės paklaidos. Kai k 1/k 2 A5.25 lygtyje ir A5.26 lygtyje pakeičiamos BCF (žr. A5.4 lygtį), taip pat galima įvertinti BCF standartinę paklaidą ir 95 % PI. Tai ypač naudinga lyginant skirtingus įverčius, gautus transformuojant duomenis. Priklausomasis kintamasis (koncentracija žuvyje) gali būti priderintas atliekant transformavimą į natūralųjį logaritmą arba be jo, o gauto BCF neapibrėžtis gali būti įvertinta. Kadangi tarp vienu metu įvertinamų dviejų parametrų k 1 ir k 2 yra stipri koreliacija, galbūt būtų geriau iš pradžių apskaičiuoti k 2 tik pagal apsivalymo duomenis (žr. pirmiau); k 2 dažniausiai galima įvertinti pagal apsivalymo kreivę, esant palyginti geram tikslumui. Vėliau pagal sugerties duomenis galima apskaičiuoti k 1, taikant netiesinę regresiją (92). Priderinant nuosekliai, patartina naudoti tokį patį duomenų transformavimą. Apžiūra tikrinant krypties koeficientus, gautus grafike pagal ėminių ėmimo taškuose išmatuotus duomenis, gali būti naudojama suderintumui įvertinti. Jei pasirodo, kad šiuo metodu gautas netinkamas k1 įvertis, reikėtų taikyti vienalaikį metodą k 1 ir k 2 apskaičiuoti. Vėlgi, priderintą modelį reikėtų palyginti su išmatuotų duomenų grafiku, kad apžiūrint būtų įvertintas suderintumas, ir gautus k 1, k 2 parametrų įverčius, pagal juos gautą BCF, jų standartines paklaidas ir (arba) pasikliovimo intervalus reikėtų palyginti atsižvelgiant į skirtingus priderinimo tipus. Jei suderintumas yra blogas, tai gali rodyti, kad pirmojo laipsnio kinetika netinka ir reikėtų taikyti sudėtingesnius modelius. Vienas iš dažniausiai pasitaikančių trukdžių yra žuvų augimas bandymo metu. 7. KINETINIO BCF IR BMF PATAISA ATSIŽVELGIANT Į PRASKIEDIMĄ DĖL AUGIMO Šiame skirsnyje aprašytas standartinis metodas pataisai dėl žuvų augimo bandymų metu gauti (vadinamasis „praskiedimas dėl augimo“), kuris tinka tik tada, kai galioja pirmojo laipsnio kinetika. Jei yra požymių, kad pirmojo laipsnio kinetika negalioja, siūloma klausti biologinės statistikos specialisto patarimo, kaip tinkamai įvertinti praskiedimo dėl augimo pataisą, arba taikyti toliau aprašytą mase pagrįstą metodą. Kartais šiam praskiedimo dėl augimo pataisos metodui trūksta tikslumo arba jis kartais visiškai netinka (pvz., jei labai lėtai pasišalinančios cheminės medžiagos bandomos greitai augančiose žuvyse, apskaičiuota apsivalymo greičio konstanta su praskiedimo dėl augimo pataisa k 2g gali būti labai maža, todėl labai svarbia tampa jai gauti naudojamų dviejų greičio konstantų paklaida ir kai kuriais atvejais k g įverčiai gali būti didesni nei k 2). Tokiais atvejais gali būti taikomas alternatyvus metodas (t. y. masių metodas), kuris taip pat tinka tada, kai augimo kinetika nėra pirmojo laipsnio ir kurį taikant nereikia daryti pataisos. Šis metodas aprašytas skirsnio gale. Augimo greičio konstantos atėmimas darant pataisą dėl augimo Taikant standartinį metodą, atskirai chemine medžiaga paveiktų ir kontrolinių grupių visi atskiri masės ir ilgio duomenys perskaičiuojami į natūraliuosius logaritmus ir gaunami ln(masės) ar ln(1/masės) kaip laiko (paros) funkcijos grafikai. Tas pats procesas kartojamas atskirai sugerties ir apsivalymo tarpsnių duomenims. Darant praskiedimo dėl augimo pataisą, paprastai geriau imti viso tyrimo masės duomenis augimo greičio konstantai (k g) gauti, bet statistiškai reikšmingi skirtumai tarp gautų sugerties ir apsivalymo tarpsnių greičio konstantų, gali reikšti, kad reikėtų naudoti apsivalymo tarpsnio greičio konstantą. Visuminiai augimo greičiai, gauti atliekant veikimo per vandeninę terpę metodo tyrimus, gali būti naudojami visiems su chemine medžiaga paveiktomis žuvimis susijusiems reiškiniams patikrinti. Taikant standartines statistines procedūras, mažiausiųjų kvadratų metodu apskaičiuojama viso tyrimo, sugerties ir apsivalymo tarpsnių kiekvienos grupės (bandymo (-ų) ir kontrolinės grupės, atskirų duomenų, ne paros vidutinių verčių) ln(žuvų masės) kaip laiko (paros) funkcijos (ir ln(1/masės) kaip laiko (paros) funkcijos) tiesinė koreliacija. Apskaičiuojama tiesių krypties koeficientų dispersijos, kurios naudojamos krypties koeficientų (augimo greičio konstantų) skirtumo statistiniam reikšmingumui įvertinti (p = 0,05), taikant Stjudento t kriterijų (arba ANOVA, jei bandoma daugiau kaip viena koncentracija). Darant pataisą dėl augimo, pirmenybė dažniausiai teikiama masės duomenims. Tokiu pačiu būdu apdoroti ilgio duomenys gali būti naudingi kontrolinėms ir bandymų grupėms palyginti dėl su apdorojimu susijusių reiškinių. Jei yra statistiškai reikšmingi masės duomenų analizės skirtumai, bandymų ir kontroliniai duomenys gali būti sujungti ir tyrimo visuminė žuvų augimo greičio konstanta (k g) apskaičiuojama kaip tiesinės koreliacijos visuminis krypties koeficientas. Jei stebimi statistiškai reikšmingi skirtumai, kiekvienos žuvų grupės ir (arba) tyrimo tarpsnio augimo greičio konstantos ataskaitoje pateikiamos atskirai. Tada kiekvienos apdorotos grupės greičio konstantą reikėtų naudoti tos grupės praskiedimo dėl augimo pataisai daryti. Jei buvo pastebėti statistiniai skirtumai tarp sugerties ir apsivalymo tarpsnių greičio konstantų, reikėtų naudoti apsivalymo tarpsniui gautas greičio konstantas. Apskaičiuotą augimo greičio konstantą (k g, išreikštą paros– 1) galima atimti iš visuminės apsivalymo greičio konstantos (k 2) apsivalymo greičio konstantai k 2g gauti.
Sugerties greičio konstanta dalijama iš dėl augimo pataisytos apsivalymo greičio konstantos, kad būtų gautas kinetinis BCF su pataisa dėl augimo, žymimas BCFKg (arba BMFKg).
Mitybos tyrimui gauta augimo greičio konstanta naudojama A7.5 lygtyje BMFKg su pataisa dėl augimo apskaičiuoti (žr. 7 priedėlį). Mase pagrįstas metodas, taikomas vietoj pataisos dėl augimo Pirmiau nurodytą augimo greičio konstantos atėmimo metodą galima pakeisti kitu metodu, kurį taikant nereikia daryti pataisos dėl augimo. Jo principą sudaro tai, kad naudojami apsivalymo tarpsnio duomenys, gauti pagal visą žuvies masę, o ne pagal koncentraciją. Apsivalymo tarpsnio audinių koncentracijos vertės (bandomosios cheminės medžiagos masė/žuvies masės vienetas) perskaičiuojamos į bandomosios cheminės medžiagos masę/žuviai: koncentracija ir atskiros žuvies masė pateikiamos greta lentelės pavidalu (pvz., naudojant kompiuterinę elektroninę lentelę) ir kiekviena to matavimo koncentracijos vertė padauginama iš visos žuvies masės, kad būtų gautas visų apsivalymo tarpsnio ėminių bandomosios cheminės medžiagos masės/žuviai duomenų rinkinys. Gaunamas apskaičiuotų cheminės medžiagos masės duomenų natūraliojo logaritmo kaip bandymo (apsivalymo tarpsnio) laiko funkcijos grafikas, kaip tai paprastai būtų daroma. Taikant veikimo per vandeninę terpę metodą, įprastiniu būdu gaunama sugerties greičio konstanta (žr. 4 ir 6 skirsnius); (reikia pažymėti, kad k 1 kreivių priderinimo lygtyse reikia naudoti „įprastinę“k 2) ir pagal pirmiau nurodytus duomenis apskaičiuojamą apsivalymo greičio konstantą. Kadangi gauta apsivalymo greičio konstantos vertė nepriklauso nuo augimo, nes ji buvo gauta pagal visos žuvies masę, ją reikėtų žymėti k 2g, bet ne k 2. 8. LIPIDŲ NORMALIZAVIMAS PAGAL 5 % LIPIDŲ KIEKĮ (TIK VEIKIMO PER VANDENINĘ TERPĘ METODAS) BCF (kinetinio ir nuostoviosios būsenos) rezultatai, gauti atliekant veikimo per vandeninę terpę bandymus, taip pat turėtų būti pateikti ataskaitoje numatytojo 5 % šlapios kūno masės žuvų lipidų kiekio atžvilgiu, nebent būtų galima įrodyti, kad ne lipidai sukaupia didžiausią bandomosios cheminės medžiagos kiekį (pvz., kai kurios perfluorintos cheminės medžiagos gali jungtis su baltymais). Koncentravimo žuvyse duomenis arba BCF reikia perskaičiuoti lipidų kiekiui, kuris sudaro 5 % šlapios kūno masės. Jei ta pati žuvis buvo naudojama visų ėminių ėmimo taškų cheminės medžiagos koncentracijai ir lipidų kiekiui matuoti, kiekvienai atskirai išmatuotai koncentracijai žuvyje turi būti daroma pataisa pagal tos žuvies lipidų kiekį.
čia:
Jei buvo atliekama ne visų ėminio žuvų lipidų analizė, BCF normalizuojamas pagal vidutinę lipidų vertę. Jei kalbama apie nuostoviosios būsenos BCF, reikėtų naudoti paveiktos chemine medžiaga grupės sugerties tarpsnio gale gautą vertę. Jei reikia normalizuoti kinetinį BCF, kartais pasiteisina kitas metodas, pvz., jei lipidų kiekis reikšmingai pakito sugerties ar apsivalymo tarpsniu. Tačiau paprastai reikėtų naudoti maisto normą, kuri kiek įmanoma sumažina staigius lipidų kiekio pokyčius.
čia:
LITERATŪRA
6 priedėlis VEIKIMO PER VANDENINĘ TERPĘ BANDYMO LYGČIŲ SKYRIUS. SUPAPRASTINTO BANDYMO SCHEMA Šio metodo pagrindinis argumentas yra tai, kad atliekant viso mato bandymą biologinio koncentravimo faktorius gali būti nustatytas kaip nuostoviosios būsenos biologinio koncentravimo faktorius (BCFSS), skaičiuojant bandomosios cheminės medžiagos koncentracijos žuvies audinyje ir bandomosios cheminės medžiagos koncentracijos vandenyje santykį, arba skaičiuojant kinetinį biologinio koncentravimo faktorių (BCFK) kaip sugerties greičio konstantos k 1 ir apsivalymo greičio konstantos k 2 santykį. BCFK yra tinkamas sugerties tarpsniu netgi nepasiekus cheminės medžiagos nuostoviosios būsenos koncentracijos, jei sugertis ir apsivalymas vyksta maždaug kaip pirmojo laipsnio kinetikos procesai. Jei cheminės medžiagos koncentracija audiniuose (C f1) matuojama veikimo pabaigos momentu (t 1) ir dar kartą matuojama laiko momentu (t 2) kaip koncentracija audiniuose (C f2), apsivalymo greičio konstanta (k 2) gali būti įvertinta, naudojant 5 priedėlio A5.22 lygtį. Tada, naudojant 5 priedėlio A5.23 lygtį, algebriniu metodu galima nustatyti sugerties greičio konstantą k 1 (kai C f yra lygi C f1, o t lygus t 1) (1). Taigi pagal supaprastintą schemą gautas kinetinis biologinio koncentravimo faktorius (žymimas BCFKm, kad būtų galima atskirti nuo kinetinių biologinio koncentravimo faktorių, nustatytų pagal kitus metodus) yra lygus:
Reikėtų daryti koncentracijos verčių arba rezultatų praskiedimo dėl augimo pataisą ir normalizuoti pagal 5 % lipidų kiekį, kaip aprašyta 5 priedėlyje. Pagal supaprastintą schemą gautas BCFSS yra BCF, apskaičiuotas sugerties tarpsnio pabaigoje, darant prielaidą, kad nuostovioji būsena buvo pasiekta. Galima daryti tik prielaidą, nes ėminių ėmimo taškų yra per mažai, kad tai būtų galima įrodyti.
Čia: C f-minSS koncentracija žuvyje, darant prielaidą dėl nuostoviosios būsenos sugerties tarpsnio pabaigoje (mg kg– 1 šlapios kūno masės); C w-minSS koncentracija vandenyje, darant prielaidą dėl nuostoviosios būsenos sugerties tarpsnio pabaigoje (mg l– 1). LITERATŪRA
7 priedėlis MITYBOS BANDYMO LYGČIŲ SKYRIUS
1. PIRKTINIO ŽUVŲ MAISTO SUDEDAMŲJŲ DALIŲ KIEKIO PAVYZDŽIAI
2. MAISTO SODRINIMO BŪDŲ PAVYZDŽIAI Bendrosios nuostatos Kontrolinių ėminių maistą reikėtų ruošti visiškai tokiu pačiu būdu, kaip ir sodrintą maistą, bet be bandomosios cheminės medžiagos. Norint patikrinti koncentraciją apdorotame maiste, tinkamu ekstrahavimo metodu reikėtų ekstrahuoti tris kartotinius maisto su medžiagos doze ėminius ir ekstraktuose išmatuoti bandomosios cheminės medžiagos koncentraciją ar radioaktyvumą. Reikėtų įrodyti didelį atgavimo laipsnį (> 85 %) ir mažą skirtumą tarp ėminių rezultatų (bandymo pradžioje paimtų trijų ėminių cheminės medžiagos koncentracijos vertės neturėtų skirtis daugiau kaip ± 15 % nuo vidurkio). Atliekant mitybos bandymą, reikėtų paimti po tris maisto ėminius 0 parą ir sugerties tarpsnio pabaigoje bandomajai cheminei medžiagai maiste nustatyti. Žuvų maisto su skysta bandomąja chemine medžiaga (gryna) paruošimas Nustatoma tikslinė nominali bandymo koncentracija apdorotame žuvų maiste, pvz., 500 μg bandomosios cheminės medžiagos/g maisto. Reikiamas grynos bandomosios cheminės medžiagos kiekis (pagal molinę masę ar savitąjį aktyvumą) įdedamas į stiklinį indą arba sukamojo garintuvo apvaliadugnę kolbą. Žuvų maisto masės turėtų pakakti visai sugerties tarpsnio trukmei (atsižvelgiant į būtinumą didinti kiekį kiekvieną kartą maitinant dėl žuvų augimo). Žuvų maistas ir bandomoji cheminė medžiaga turėtų būti maišomi per naktį lėtai vartant ( pvz., naudojant būgninį maišytuvą arba sukant, jei naudojama sukamojo garintuvo apvaliadugnė kolba). Sodrintą maistą reikėtų laikyti tokiomis sąlygomis, kurios užtikrina bandomosios cheminės medžiagos stabilumą maisto mišinyje iki jis bus panaudotas (pvz., šaldytuve). Žuvų maisto paruošimas, kaip nešiklį naudojant kukurūzų aliejų ar žuvų taukus Kietąsias bandomąsias chemines medžiagas reikėtų sumalti grūstuvėje į smulkius miltelius. Skystąsias bandomąsias chemines medžiagas galima dėti tiesiogiai į kukurūzų aliejų ar žuvų taukus. Bandomoji cheminė medžiaga ištirpinama žinomame kukurūzų aliejaus ar žuvų taukų tūryje (pvz., 5–15 ml). Sudozuotas aliejus yra kiekybiškai supilamas į tinkamo tūrio sukamojo garintuvo apvaliadugnę kolbą. Kolbą, naudojamą dozei aliejuje ruošti, reikėtų praplauti dviem nedideliais alikvotiniais aliejaus tūriais ir šį aliejų supilti į apvaliadugnę kolbą, siekiant užtikrinti, kad būtų supilta visa ištirpinta bandomoji cheminė medžiaga. Siekiant užtikrinti visišką ištirpimą ar dispergavimą aliejuje (arba jei tiriama daugiau nei viena bandomoji cheminė medžiaga), įdedama mikromaišyklė, kolba užkemšama ir mišinys greitai maišomas per naktį. Į apvaliadugnę kolbą įdedamas bandymui reikiamas žuvų maisto kiekis (paprastai granulių pavidalu), kolbos turinys tolygiai maišomas, nepertraukiamai sukant kolbą ne trumpiau kaip 30 min, bet pageidautina per naktį. Sodrintą maistą reikia tinkamai laikyti (pvz., šaldytuve), kad būtų užtikrintas bandomosios cheminės medžiagos stabilumas maiste iki jis bus naudojamas. Žuvų maisto paruošimas naudojant organinį tirpiklį Tikslinei dozei gauti reikiamas bandomosios cheminės medžiagos kiekis (pagal molinę masę ar savitąjį aktyvumą) ištirpinamas tinkamame organiniame tirpiklyje (pvz., cikloheksane arba acetone; 10–40 ml ar didesniame tūryje, jei reikia, atsižvelgiant į sodrinamo maisto kiekį). Šio tirpalo alikvotinė dalis arba visas (dalimis įpilamas) tirpalas sumaišomas su bandymui atlikti pakankama žuvų maisto mase, kad būtų gautas reikiamas nominalus dozės dydis. Maistą ir bandomąją cheminę medžiagą galima sumaišyti nerūdijančiojo plieno maišymo dubenėlyje ir naujai paruoštas žuvų maistas su doze dviem dienom paliekamas laboratorijos traukos spintoje tame pačiame inde (ir kartais maišomas), kad galėtų išgaruoti tirpiklio perteklius, arba maišomas sukamojo garintuvo apvaliadugnėje kolboje, ją nuolat sukant. Prireikus tirpiklio perteklių galima „išpūsti“ oro ar azoto srove. Reikėtų imtis priemonių užtikrinti, kad bandomoji cheminė medžiaga neišsikristalizuotų, kai pašalinamas tirpiklis. Sodrintą maistą reikėtų laikyti tokiomis sąlygomis (pvz., šaldytuve), kurios užtikrintų bandomosios cheminės medžiagos stabilumą maiste iki jis bus naudojamas. 3. ĮSISAVINIMO EFEKTYVUMO IR BIOMAGNIFIKACIJOS FAKTORIAUS SKAIČIAVIMAS Įsisavinimo efektyvumas apskaičiuojamas, turint visuminės apsivalymo greičio konstantos įvertį pagal 5 priedėlio 4 skirsnį (taikant nuoseklųjį metodą, t. y. standartinę tiesinę regresiją), naudojant apsivalymo tarpsnio ėminių vidutines koncentracijos vertes. Maisto norma I ir sugerties trukmė t yra žinomi tyrimo parametrai. C maisto, vidutinė išmatuota bandomosios cheminės medžiagos koncentracija maiste, yra matuojamas tyrimo kintamasis. C 0,d, bandomosios cheminės medžiagos koncentracija žuvyje sugerties tarpsnio pabaigoje, paprastai apskaičiuojama pagal ln(koncentracijos) kaip apsivalymo trukmės funkcijos grafiko atkarpą. Cheminės medžiagos įsisavinimo efektyvumas (a, bandomosios cheminės medžiagos absorbcija per virškinimo traktą) apskaičiuojamas taip:
čia: C 0,d apskaičiuota koncentracija žuvyje apsivalymo tarpsnio nuliniu laiku (mg kg– 1); k 2 visuminė (be pataisos dėl augimo) apsivalymo greičio konstanta (paros– 1), apskaičiuota pagal 5 priedėlio 3 skirsnį; I maisto suvartojimo norma (g maisto g– 1 žuvies paros– 1); C food koncentracija maiste (mg kg-1 maisto); t maitinimo laikotarpio trukmė (paros). Tačiau gali tekti daryti skaičiuojant naudojamos maisto normos I pataisą dėl žuvų augimo, kad būtų gautas tikslus įsisavinimo efektyvumas a. Jei atliekant bandymą žuvų augimas sugerties tarpsniu (kurio eigoje maisto kiekis nekeičiamas nustatytai maisto normai užtikrinti) yra reikšmingas, efektyvioji maisto norma sugerties tarpsnio eigoje bus mažesnė nei nustatyta, todėl „faktinis“ įsisavinimo efektyvumas bus didesnis. (Reikia pažymėti, kad tai nėra svarbu atliekant bendruosius BMF skaičiavimus, nes A7.1 lygties ir A7.4 lygties I nariai faktiškai pasinaikina). Vidutinė maisto norma su praskiedimo dėl augimo pataisa I g gali būti gauta keliais būdais, bet paprasčiausias ir tikslus būdas yra žinomos augimo greičio konstantos (k g) naudojimas žuvų masei sugerties tarpsnio momentais įvertinti, t. y.:
čia W f(t)– vidutinė žuvies masė sugerties tarpsnio parą t; W f,0 – vidutinė žuvies masė bandymo pradžioje. Šiuo būdu galima įvertinti (bent jau) vidutinę žuvies masę paskutinę veikimo parą (W f, sugerties pabaiga). Kadangi maisto norma buvo nustatyta pagal W f,0, kiekvienos paros efektyvioji maisto norma gali būti apskaičiuota naudojant šias dvi masės vertes. Tada maisto norma su pataisa dėl augimo I g (g maisto g– 1 žuvies paros-1), kuri būtų naudojama vietoj I žuvims greitai augant sugerties tarpsniu, gali būti apskaičiuota taip:
Gavus įsisavinimo efektyvumo vertę, BMF galima apskaičiuoti ją dauginant iš maisto normos I (arba I g, jei naudota α apskaičiuoti) ir sandaugą dalijant iš visuminės apsivalymo greičio konstantos k 2:
Taip pat reikėtų tokiu pačiu būdu apskaičiuoti biomagnifikacijos faktorių su pataisa dėl augimo, naudojant apsivalymo greičio konstantą su pataisa dėl augimo (gauta pagal 5 priedėlio 7 skirsnį). Vėlgi, jei α apskaičiuoti buvo naudojama I g, ją taip pat reikėtų naudoti šioje lygtyje vietoj I:. Vėlgi, jei α apskaičiuoti buvo naudojama I g, ją taip pat reikėtų naudoti šioje lygtyje vietoj I:
čia: α įsisavinimo efektyvumas (bandomosios cheminės medžiagos absorbcija per virškinimo traktą); k 2 visuminė (be pataisos dėl augimo) apsivalymo greičio konstanta (paros– 1), apskaičiuota pagal 5 priedėlio 3 skyriaus lygtis k 2g (apsivalymo greičio konstanta su pataisa dėl augimo, paros– 1); I maisto suvartojimo norma (g maisto g– 1 žuvies paros– 1); Pusėjimo trukmė su pataisa dėl augimo (t 1/2) apskaičiuojama taip:
Cheminės medžiagos įsisavinimo iš maisto efektyvumą taip pat galima įvertinti, jei likučiai žuvų audiniuose nustatomi sugerties tarpsnio ankstyvuoju tiesiniu tarpsniu (nuo 1 iki 3 paros). Šiuo atveju cheminės medžiagos įsisavinimo efektyvumas (α) gali būti nustatytas taip:
Čia: C žuvyje (t) bandomosios cheminės medžiagos koncentracija žuvyje momentu t (mg kg– 1 šlapios kūno masės). 4. PATAISA DĖL LIPIDŲ Jei visais ėminių ėmimo momentais lipidų kiekis buvo matuojamas cheminės medžiagos analizei paimtoje žuvyje, reikėtų daryti atskirų koncentracijos verčių pataisą dėl lipidų ir gauti ln(koncentracijos, su pataisa dėl lipidų) kaip sugerties tarpsnio trukmės (paros) funkcijos grafiką C 0,d ir k 2 apskaičiuoti. Tada galima apskaičiuoti įsisavinimo efektyvumą (A7.1 lygtis) su pataisa dėl lipidų, naudojant C maisto su pataisa dėl lipidų (t. y. C maisto dauginama iš vidutinės maisto lipidų dalies). Toliau skaičiuojant pagal A7.4 lygtį ir A7.5 lygtį, bus tiesiogiai gautas BMF su pataisa dėl lipidų (ir praskiedimo dėl augimo pataisa). Kitu atveju apskaičiuojama apdorotos ir kontrolinės grupių vidutinė žuvies ir maisto lipidų dalis (masės) (maisto ir kontrolinės grupės žuvų lipidų dalis apskaičiuojama pagal veikimo pradžioje ir pabaigoje gautus duomenis, chemine medžiaga paveiktos grupės žuvų – paprastai tik pagal veikimo pabaigoje gautus duomenis). Atliekant kai kuriuos tyrimus, gali gerokai padidėti žuvų lipidų kiekis; tokiais atvejais labiau tinka naudoti vidutinę bandymų žuvų lipidų koncentraciją, apskaičiuotą pagal veikimo pabaigoje ir apsivalymo pradžioje išmatuotas vertes. Apskritai, apdorojimo grupės duomenis reikėtų naudoti tik abiem lipidų dalims apskaičiuoti. Pataisos dėl lipidų faktorius (Lc ) apskaičiuojamas taip:
čia: L žuvies ird L maisto – vidutinė žuvies ir maisto lipidų dalis. Pataisos dėl lipidų faktorius yra naudojamas biomagnifikacijos faktoriui su pataisa dėl lipidų (BMFL) apskaičiuoti:
5. SKIRTUMŲ TARP IŠMATUOTOS NULINIO LAIKO KONCENTRACIJOS (C 0,M) IR APSKAIČIUOTOS NULINIO LAIKO KONCENTRACIJOS (C 0,D)ĮVERTINIMAS Reikėtų palyginti išmatuotą nulinio laiko koncentraciją (C 0,m) ir apskaičiuotą nulinio laiko koncentraciją (C 0,d). Jei jos labai panašios, tai tik patvirtintų pirmojo laipsnio modelį, taikomą apsivalymo parametrams gauti. Atliekant kai kuriuos tyrimus, gali būti gautas gana didelis skirtumas tarp apskaičiuotos nulinio laiko koncentracijos vertės C 0,d ir vidutinės išmatuotos nulinio laiko koncentracijos C 0,m (žr. šio bandymų metodo 159 pastraipos paskutinę įtrauką). Jei C 0,d yra gerokai mažesnė nei C 0,m (C 0,d << C 0,m), skirtumas gali reikšti nesuvirškinto sodrinto maisto buvimą virškinimo trakte. Tai galima patikrinti bandymo keliu, atliekant išpjauto virškinimo trakto analizę, jei sugerties tarpsnio pabaigoje buvo paimti ir laikomi papildomi (visos žuvies) ėminiai. Arba, jei apsivalymo tarpsnio duomenų tiesinei regresijai taikant statistiškai pagrįstą riktų kriterijų pasirodo, kad pirmajam apsivalymo ėminių ėmimo taškui gaunama klaidingai didelė vertė, galbūt, atliekant tiesinę regresiją k 2 gauti, reikėtų atmesti pirmojo apsivalymo tarpsnio taško koncentracijos vertę. Jei tokiais atvejais gerokai sumažėja tiesinės regresijos neapibrėžtis ir yra aišku, kad apsivalymo kinetika buvo maždaug pirmojo laipsnio, galbūt reikėtų naudoti gautas C 0,d ir k 2 vertes įsisavinimo efektyvumui skaičiuoti. Tai reikėtų išsamiai pagrįsti ataskaitoje. Gali būti, kad apsivalymo tarpsniui galiojo ne pirmojo laipsnio kinetika. Jei taip galėtų būti (t. y. vietoj tiesinės regresijos tiesės į natūralųjį logaritmą transformuoti duomenys duotų kreivę), maža tikimybė, kad k 2 ir C 0,d skaičiavimai yra pagrįsti, todėl reikėtų konsultuotis su biologinės statistikos specialistu. Jei C 0,d yra ypač daug didesnis nei išmatuota vertė (C 0,d >> C 0,m), tai gali rodyti, kad cheminė medžiaga pasišalina labai greitai (t. y. koncentracija ėminių ėmimo taškuose jau pačioje apsivalymo tarpsnio pradžioje buvo arti analizės metodo kiekybinio nustatymo ribos, žr. 6 skirsnį), kad buvo nukrypimas nuo pirmojo laipsnio apsivalymo kinetikos, kad tiesinė regresija k 2 ir C 0,d apskaičiuoti turi trūkumų arba kad buvo problemų matuojant koncentracijos vertes kai kuriuose tyrimo ėminių ėmimo laiko taškuose. Tokiais atvejais reikėtų labai kruopščiai ištirti tiesinės regresijos grafiką dėl ėminių, kurių koncentracija atitinka kiekybinio nustatymo ribą ar yra arti jo, dėl riktų ir dėl akivaizdaus kreivumo (kuris leistų daryti prielaidą apie ne pirmojo laipsnio kinetiką), ir pažymėti ataskaitoje. Visi paskesni pakartotinai atlikti tiesinės regresijos skaičiavimai įverčiams pagerinti turėtų būti aprašyti ir pagrįsti. Jei stebimas aiškus nukrypimas nuo pirmojo laipsnio kinetikos, maža tikimybė, kad k 2 ir C 0,d skaičiavimai yra pagrįsti, todėl reikėtų pasitarti su biologinės statistikos specialistu. 6. NURODYMAI DĖL LABAI SPARČIAI PASIŠALINANČIŲ BANDOMŲJŲ CHEMINIŲ MEDŽIAGŲ Kaip aptarta bandymų metodo 129 pastraipoje, kai kurios cheminės medžiagos gali pasišalinti taip greitai, kad patikima nulinio laiko koncentracija C 0,d ir k 2 negali būti apskaičiuotos, nes cheminės medžiagos koncentracijos faktiškai nebeįmanoma išmatuoti jau pačioje apsivalymo tarpsnio pradžioje (t. y. nuo apsivalymo tarpsnio antrojo ėminio ir vėliau) (ataskaitoje koncentracijos vertės pateikiamos kaip kiekybinio nustatymo ribos koncentracija). Ši situacija buvo stebima atliekant tarplaboratorinį tyrimą su benz[a]pirenu šiam bandymų metodui patvirtinti ir buvo pateikta metodo tinkamumo patvirtinimo ataskaitos dokumentuose. Tokiais atvejais neįmanoma patikimai atlikti tiesinė regresijos ir yra tikimybė gauti neįtikėtinai didelį C 0,d įvertį, todėl gautas tariamasis įsisavinimo efektyvumas yra daug didesnis už 1. Taip galima apskaičiuoti mažesnį k 2 įvertį ir BMFk„viršutinę ribą“. Naudojant tuos apsivalymo tarpsnio taškus, kuriuose koncentracija buvo matuojama iki pirmos „neaptiktos“ koncentracijos vertės imtinai (kiekybinio nustatymo ribos koncentracijos), (į natūralųjį logaritmą transformuotos koncentracijos ir laiko priklausomybės) tiesinės regresijos metodu gaunamas k 2 įvertis. Esant tokiems atvejams greičiausiai būtų galima įtraukti tik du duomenų taškus (pvz., apsivalymo tarpsnio 1 ir 2 paros ėminių ėmimo taškus) ir pagal 5 priedėlio A5.22 lygtį gali būti gautas k 2 įvertis. Šis k2 įvertis gali būti naudojamas įsisavinimo efektyvumui įvertinti pagal A7.1 lygtį, C0,d vertę joje pakeičiant išmatuota nulinio laiko koncentracija (C0,m) tais atvejais, kai būtų aiškiai įvertinta, kad C0,d yra daug didesnė, nei būtų gauta atliekant bandymą. Jei C0,m buvo neišmatuojama, reikėtų naudoti aptikimo žuvies audinyje ribą. Jei kai kuriais atvejais gaunama α > 1 vertė, daroma prielaida, kad „blogiausiojo atvejo“ įsisavinimo efektyvumas yra lygus 1. Tada pagal A7.4 lygtį galima gauti maksimalų BMFK įvertį, ir reikėtų nurodyti, kad tai yra „gerokai mažesnė“ (<<) vertė. Pvz., jei tyrimas atliekamas, kai maisto norma yra 3 %, apsivalymo pusėjimo trukmė yra trumpesnė kaip 3 paros, o „blogiausiojo atvejo“ α yra lygus 1, BMFK tikėtinai yra mažesnis nei maždaug 0,13. Atsižvelgiant į šio įvertinimo tikslą ir tą faktą, kad vertės iš esmės bus su atsarga, nebūtina daryti praskiedimo dėl augimo arba dėl žuvų ir maisto lipidų kiekio pataisą. 8 priedėlis METODAI LAIKINIESIEMS BCF ĮVERČIAMS GAUTI PAGAL DUOMENIS, SUKAUPTUS ATLIEKANT MITYBOS TYRIMĄ Į šį bandymų metodą įtrauktas veikimo per mitybą metodas, skirtas bandyti chemines medžiagas, kurių praktiškai neįmanoma bandyti taikant veikimo per vandeninę terpę metodą. Bandant veikimo per vandeninę terpę metodu, gaunamas biologinio koncentravimo faktorius, o mitybos metodu tiesiogiai gaunama informacija apie maitinimo biomagnifikacijos gebą. Daugumai cheminės medžiagos saugos sistemų reikia turėti informacijos apie veikimo per vandeninę terpę biologinį koncentravimą (pvz., vertinant riziką ir taikant visuotinai suderintą cheminių medžiagų klasifikavimo sistemą). Todėl reikia naudoti mitybos tyrimo duomenis, kad būtų galima gauti biologinio koncentravimo faktoriaus įvertį, kuris būtų palyginamas su gautu taikant veikimo per vandeninę terpę metodą (94). Šiame skyriuje nagrinėjami metodai, kuriuos taikant tai būtų galima padaryti, kartu pripažįstant šiems įverčiams būdingus trūkumus. Atliekant mitybos tyrimą, matuojamas apsivalymas jo greičio konstantai k 2 gauti. Jei sugerties greičio konstantos įvertį galima gauti turint duomenis tai situacijai, kurioje žuvys buvo veikiamos bandomąja chemine medžiaga per vandenį, galima būtų įvertinti kinetinį BCF. Sugerties greičio konstantos vertinimas, kai bandomąja chemine medžiaga veikiama per vandenį, yra pagrįstas daugeliu prielaidų, kurių kiekviena prisidės prie įverčio neapibrėžties. Be to, taikant šį BCF įverčio gavimo metodą daroma prielaida, kad visuminis apsivalymo greitis (įskaitant prisidedančius veiksnius, pvz., pasiskirstymą kūne ir atskirus apsivalymo procesus) nepriklauso nuo veikimo būdo, kuriuo buvo gautas kūno sugertas bandomosios cheminės medžiagos kiekis. Įvertinimo metodui būdingas prielaidas galima apibendrinti taip: apsivalymas nuo tam tikros cheminės medžiagos po mitybos tyrimo vyksta taip pat, kaip ir po veikimo per vandeninę terpę metodo; sugertis iš vandens vyks pagal pirmojo laipsnio kinetiką; atsižvelgiant į sugerčiai įvertinti taikytą metodą:
duomenų bazė („mokomasis rinkinys“), naudota sugerties įvertinimo metodui sukurti, reprezentuoja tiriamą cheminę medžiagą. Keliuose atvirai paskelbtuose darbuose yra pateiktos lygtys, kurios sugertį per žuvų žiaunas susieja su pasiskirstymo tarp oktanolio ir vandens koeficientu, žuvies mase (1) (2) (3) (4), tūriu ir (arba) lipidų kiekiu, sugertimi ar difuzija per membraną (5) (6), žuvų ventiliacijos tūriu (7) ir kurioms taikomas lakumo ir masių balanso metodas (8) (9) (10). Išsamus tokių metodų įvertinimas šiame kontekste yra pateiktas Crookes & Brooke (11). Barber (12) publikacija, kurioje dėmesys sutelktas į biologinio kaupimosi dėl mitybos modeliavimą, taip pat yra naudinga šiomis aplinkybėmis, nes į ją įtraukti sugerties per žiaunas indėlio į kinetiką modeliai. 2004 m. mitybos protokolo patvirtinančių nuorodų dokumentas (13) taip pat buvo skirtas šiam aspektui. Atrodo, kad dauguma šių modelių buvo gauti turint ribotas duomenų bazes. Jei yra informacijos apie modeliams sukurti naudojamų duomenų bazes, pasirodo, kad naudojamos cheminės medžiagos dažnai yra panašios struktūros arba klasės (funkcinių grupių požiūriu, pvz., chloro organiniai junginiai). Tokį modelį taikant kito tipo cheminės medžiagos sugerties greičio konstantai prognozuoti, neapibrėžtis didėja ne tik dėl bandymui būdingų aspektų, pvz., rūšies, temperatūros ir kt., bet ir dėl modelio. Turimų metodų apžvalga (11) parodė, kad nei vienas iš metodų nėra „tikslesnis“ nei kiti. Todėl kiekvieną naudotą modelį reikėtų aiškiai pagrįsti. Jei yra keli metodai, kurių taikymą būtų galima pagrįsti, galbūt būtų tikslinga pateikti kelis k 1 (tuo pačiu BCF) įverčius arba k 1 (ir BCF) verčių intervalą pagal kelis sugerties įvertinimo metodus. Tačiau, atsižvelgiant į modelių tipų ir jiems kurti naudojamų duomenų rinkinių skirtumus, netiktų naudoti skirtingais būdais gautų įverčių vidutinę vertę. Kai kurie tyrėjai teigė, kad, siekiant atsižvelgti į cheminės medžiagos adsorbciją ant ištirpusios organinės anglies (DOC) veikimo per vandeninę terpę sąlygomis, būtina daryti šios rūšies BCF įverčio pataisą dėl biologinio įsisavinamumo, kad įvertis atitiktų veikimo per vandeninę terpę tyrimų rezultatus (pvz., (13) (14)). Tačiau ši pataisa gali netikti, atsižvelgiant į tai, kad, atliekant veikimo per vandeninę terpę tyrimą, reikia mažos DOC koncentracijos (t. y. biologiškai įsisavinamos ir tirpale išmatuotos cheminės medžiagos santykio) „blogiausiojo atvejo“ įverčiui gauti. Stipriai hidrofobinių cheminių medžiagų sugertį per žiaunas gali riboti pasyvios difuzijos šalia žiaunų paviršiaus greitis; šiuo atveju gali būti taip, kad darant pataisą būtų įvertintas ne tas reiškinys, dėl kurio ji buvo numatyta. Patartina atkreipti didesnį dėmesį į metodus, kuriems reikia nesunkiai gaunamų įvesties duomenų apie chemines medžiagas, bandomas pagal čia aprašytą mitybos tyrimą (t. y. log K OW, žuvų masė). Gali būti taikomi kiti metodai, kuriems galima naudoti sudėtingesnius įvesties duomenis, tačiau bandant gali prireikti papildomų matavimų arba ne visiems prieinamų išsamių žinių apie bandomąją cheminę medžiagą ar žuvų rūšį. Be to, modelio pasirinkimui gali turėti įtakos tinkamumo lygis ir taikymo sritis (įvairių metodų peržiūra ir palyginimas pateiktas (11)). Reikėtų turėti omenyje, kad gautas k 1 įvertis ir apskaičiuotas BCF yra neapibrėžti ir jiems gali tekti taikyti įrodomosios duomenų galios metodą kartu su gautu BMF ir cheminės medžiagos parametrais (pvz., molekulių dydžiu), kad būtų gautas visas cheminės medžiagos biologinio kaupimosi gebos vaizdas. Šių parametrų aiškinimas ir naudojimas gali priklausyti nuo reglamentavimo sistemos. LITERATŪRA
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
17) |
C dalies C.20 skyrius pakeičiamas taip: „C.20 Daphnia magna reprodukcijos bandymas ĮVADAS Šis bandymų metodas atitinka EBPO bandymų gaires (TG) 211 (2012). EBPO bandymų gairės, atsižvelgiant į mokslo pažangą, yra periodiškai peržiūrimos ir atnaujinamos. Reprodukcijos bandymo gairės 211 kilo iš bandymų gairių 202, II dalies, Daphnia sp. reprodukcijos bandymas (1984). Bendrai visų buvo pripažinta, kad duomenys, gauti taikant testą, atitinkantį TG 202, gali būti kintami. Todėl įdėta daug pastangų norint nustatyti šių duomenų kintamumo priežastis, siekiant sukurti geresnį bandymų metodą. Bandymų gairės 211 pagristos šių įvairių tyrimo darbų, tarplaboratorinių tyrimų ir tinkamumo patvirtinimo tyrimų, atliktų 1992 m. (1), 1994 m. (2) ir 2008 m. (3), rezultatais. Pagrindiniai skirtumai tarp reprodukcijos bandymo gairių pirmosios versijos (TG 202, 1984 m.) ir antrosios versijos (TG 211, 1998 m.) yra:
Taikomų sąvokų apibrėžtys pateiktos 1 priedėlyje. BANDYMO PRINCIPAS Pagrindinis šio bandymo tikslas – įvertinti cheminių medžiagų poveikį Daphnia magna reprodukcijos našumui. Šiuo tikslu jaunos moteriškos lyties dafnijos (motininiai gyvūnai), kurių amžius bandymo pradžioje jaunesnis kaip 24 h, yra veikiamos kelių koncentracijos verčių vandenyje ištirpinta bandomąja chemine medžiaga. Bandymo trukmė – 21 para. Baigus bandymą vertinamas suminis gautų gyvų palikuonių skaičius. Motininių gyvūnų reprodukcijos našumą galima išreikšti kitais būdais (pvz., gyvų palikuonių, gautų iš vieno gyvūno per parą nuo pirmos palikuonių pastebėjimo dienos, skaičiumi), tačiau šie skaičiai turėtų būti pateikti ataskaitoje papildomai prie gyvų palikuonių, gautų iki bandymo pabaigos, suminio skaičiaus. Dėl ypatingos pusiau statinio bandymo schemos, palyginti su kitais bestuburių reprodukcijos bandymų metodais, taip pat galima suskaičiuoti iš kiekvieno atskiro motininio gyvūno gautus gyvus palikuonis. Kitaip nei taikant kitus bestuburių reprodukcijos bandymų metodus, į vertinimo duomenis galima neįtraukti bandymo laikotarpiu atsitiktinai ir (arba) netyčia žuvusių motininių gyvūnų palikuonių skaičiaus. Todėl, jei motininių gyvūnų gaištamumas pasitaiko apdorotų kartotinių ėminių induose, reikėtų ištirti, ar gaištamumas atitinka koncentracijos ir atsako priklausomybės kreivę ar jos neatitinka, pvz., ar yra reikšminga atsako regresija su teigiamu krypties koeficientu bandomosios cheminės medžiagos koncentracijos atžvilgiu (čia gali būti naudingas statistinis kriterijus, pvz., Cochran-Armitage tendencijos kriterijus). Jei gaištamumas neatkartoja koncentracijos ir atsako priklausomybės kreivės, šie kartotiniai ėminiai su žuvusiais motininiais gyvūnais neturėtų būti įtraukti į rezultatų analizę. Jei gaištamumas atkartoja koncentracijos ir atsako priklausomybės kreivę, motininių gyvūnų gaištamumą reikėtų priskirti prie bandomosios cheminės medžiagos poveikio ir kartotiniai ėminiai neturėtų būti pašalinti iš analizės. Jei motininis gyvūnas žūsta bandymo metu atsitiktinai dėl netinkamų veiksmų ar nelaimingo atsitikimo, arba netyčia dėl nepaaiškinamo incidento, nesusijusio su bandomosios cheminės medžiagos poveikiu, arba jei paaiškėja, kad gyvūnas yra vyriškos lyties, kartotinis ėminys pašalinamas iš analizės (daugiau pateikta 51 pastraipoje). Bandomosios cheminės medžiagos toksinis poveikis reprodukcijos našumui yra išreiškiamas kaip ECx, duomenis derinant netiesinės regresijos metodu prie atitinkamo modelio, kad būtų įvertinta koncentracija, kuriai esant reprodukcijos našumas sumažėtų x %, arba kaip NOEC ar LOEC vertė (4). Pageidautina, kad bandymų koncentracijos vertės aprėptų mažiausią iš naudotų poveikio koncentracijos verčių (pvz., EC10), nes tai reikštų, kad ši vertė apskaičiuojama interpoliavimo, o ne ekstrapoliavimo būdu. Ataskaitoje taip pat turėtų būti pateikta išgyvenusių motininių gyvūnų dalis ir pirmosios vados atsiradimo laikas. Taip pat galima tirti kitokį su chemine medžiaga susijusį poveikį parametrams, pvz., augimui (ilgiui), ir galimam populiacijos prieaugio greičiui (žr. 44 pastraipą). INFORMACIJA APIE BANDOMĄJĄ CHEMINĘ MEDŽIAGĄ Renkantis reprodukcijos bandymo reikiamą koncentracijos verčių intervalą, gali būti naudingi su Daphnia magna atliekamo ūmaus toksiškumo bandymo rezultatai (žr. šio priedo C.2 skyrių Daphnia sp. ūmaus judrumo slopinimo bandymas). Turėtų būti žinomas bandomosios cheminės medžiagos tirpumas vandenyje ir garų slėgis, be to, reikėtų turėti patikimą analizės metodą medžiagos kiekiui bandymo tirpaluose nustatyti, kurio atgavimo laipsnis ir nustatymo riba būtų žinomi. Informaciją apie bandomąją cheminę medžiagą, kuri gali būti naudinga bandymo sąlygoms nustatyti, sudaro struktūrinė formulė, cheminės medžiagos grynumas, atsparumas šviesai, stabilumas bandymo sąlygomis, pKa, Pow ir lengvo biologinio skaidymo bandymo rezultatai (žr. šio priedo C.4 (Lengvo biodegradavimo nustatymas) ir C.29 (Lengvas biodegradavimas. CO2 sandariuose induose) skyrius). BANDYMO TINKAMUMAS Bandymas laikomas tinkamu, jei kontroliniai ėminiai atitinka nurodytus charakteristikų kriterijus:
Pastaba. Tas pats tinkamumo kriterijus (20 %) gali būti taikomas atsitiktiniam ir netyčiniam kontrolinių ėminių, taip pat kiekvienos bandymo koncentracijos ėminių motininių gyvūnų gaištamumui. METODO APRAŠYMAS Aparatūra Bandymo indai ir kita aparatūra, kuri liečiasi su bandymo tirpalais, turėtų būti pagaminta vien tik iš stiklo arba kitos chemiškai inertinės medžiagos. Bandymo indai paprastai yra laboratorinės stiklinės. Papildomai reikalinga visa ar tam tikra įranga:
Bandymo organizmai Bandymui reikėtų naudoti Daphnia magna Straus (95). Kloną geriau būtų identifikuoti pagal genotipą. Tyrimas (1) parodė, kad A klono (jo kilmė – IRCHA (Institut de Recherche en Chimie Appliquee), Prancūzija) (5) reprodukcijos našumas visą laiką atitinka tinkamumo kriterijų, pagal kurį auginant šiame metode aprašytomis sąlygomis vieno gyvo likusio motininio gyvūno vidutinis palikuonių skaičius ≥ 60. Tačiau priimtini ir kiti klonai, jei parodoma, kad dafnijų kultūra atitinka bandymo tinkamumo kriterijus. Bandymo pradžioje gyvūnai turėtų būti jaunesnio kaip 24 h amžiaus ir tai neturėtų būti pirmoji palikuonių karta. Jos turėtų būti gautos iš sveikos pradinės kultūros (t. y. neturi būti streso požymių, tokių kaip, didelis gaištamumas, vyriškos lyties atstovai ir efipijų buvimas, pirmosios vados vėlavimas, gyvūnų spalvos pasikeitimas ir kt.). Pradinės kultūros gyvūnus reikėtų laikyti tokiomis sąlygomis (šviesos, temperatūros, terpės, maitinimo ir gyvūnų skaičiaus tūrio vienetui), kurios būtų panašios į bandymo sąlygas. Jei bandant naudota kultūros terpė skiriasi nuo įprastinės dafnijų kultūros, motininių gyvūnų stresui išvengti pagal gerąją praktiką reikalaujama leisti dafnijoms aklimatizuotis maždaug tris savaites (t. y. vienos kartos laikotarpiu). Bandymo terpė Rekomenduojama šiems bandymams naudoti visiškai apibrėžtą terpę. Taip galima išvengti sunkiai apibūdinamų priedų naudojimo (pvz., jūros dumblių, dirvožemio ekstrakto), taigi pagerėja tarplaboratorinio standartizavimo galimybės. Buvo nustatyta, kad labiausiai tinka Elendt M4 (6) ir M7 terpės (žr. 2 priedėlį). Tačiau yra priimtinos ir kitos terpės (pvz., (7) (8)), jei jose išauginta dafnijų kultūra atitinka bandymui nustatytus tinkamumo kriterijus. Jei naudojamos terpės su neapibrėžtais priedais, šie priedai turėtų būti aiškiai apibūdinti ir bandymo ataskaitoje turėtų būti informacija apie jų sudėtį, ypač apie organinės anglies kiekį, nes ji gali būti tiekiamo maisto dalis. Rekomenduojama nustatyti organinio priedo pradinio tirpalo suminę organinę anglį (TOC) ir (arba) cheminį deguonies suvartojimą (COD) ir įvertinti jų indėlį į paruoštos terpės TOC ar COD. Papildomai rekomenduojama, kad terpės (t. y. prieš pridedant dumblių) TOC koncentracija būtų mažesnė kaip 2 mg/l (9). Bandant metalų turinčias chemines medžiagas, svarbu suvokti, kad bandomosios terpės savybės (pvz., kietumas, chelatinimo geba) gali turėti įtakos bandomosios cheminės medžiagos toksiškumui. Dėl šios priežasties pageidautina turėti visiškai apibrėžtą terpę. Tačiau vienintelės visiškai apibrėžtos terpės, kurios, kiek šiandien žinoma, tiktų ilgą laiką auginti Daphnia magna, yra Elendt M4 ir M7. Abiejose terpėse esama chelanto EDTA. Šis darbas (2) parodė, kad, reprodukcijos bandymą atliekant M4 ir M7 terpėje, kadmio „tariamasis toksiškumas“ paprastai yra mažesnis palyginti su EDTA neturinčia terpe. Todėl M4 ir M7 nerekomenduojama naudoti bandant metalų turinčias chemines medžiagas, taip pat reikėtų vengti naudoti terpes, turinčias žinomus chelantus. Jei cheminės medžiagos turi metalų, galima patarti naudoti alternatyviąją terpę, pvz., ASTM atkurtojo kieto gėlo vandens terpę (9), kuri neturi EDTA. Šis ASTM atkurtojo kieto gėlo vandens ir jūros dumblių ekstrakto derinys (10) tinka ilgą laiką auginti Daphnia magna (2). Ištirpusio deguonies koncentracija bandymo pradžioje ir visą bandymų laikotarpį turėtų būti didesnė kaip 3 mg/l. pH turėtų būti 6–9 intervale ir kurio nors bandymo metu paprastai neturėtų kisti daugiau kaip 1,5 vieneto. Rekomenduojamas didesnis kaip 140 mg/l kietumas (išreikštas CaCO3). Bandymai, atlikti esant šiai arba didesnei koncentracijai, parodė, kad reprodukcijos našumas atitinka tinkamumo kriterijus (11) (12). Bandymų tirpalai Pasirinktų koncentracijos verčių bandymo tirpalai paprastai ruošiami skiedžiant pradinį tirpalą. Pradinius tirpalus reikėtų ruošti nenaudojant jokių tirpiklių ar dispergentų, jei įmanoma, maišant arba purtant bandomąją cheminę medžiagą bandymo terpėje mechaninėmis priemonėmis, pvz., naudojant maišyklę, purtyklę, ultragarsinę vonelę, ar taikant kitus tinkamus metodus. Prieš dedant bandymų organizmus, pageidautina veikti bandymų sistemas bandomąja chemine medžiaga tokios koncentracijos, kurią numatoma naudoti atliekant tyrimą, ir taip ilgai, kad būtų galima įrodyti veikimo koncentracijos verčių stabilumą. Jei bandomoji cheminė medžiaga sunkiai tirpsta vandenyje, reikėtų taikyti procedūras, aprašytas EBPO rekomendaciniame dokumente apie sunkiai apdorojamas chemines medžiagas (13). Reikėtų vengti naudoti tirpiklius ar dispergentus, bet kartais jie gali būti būtini, kad būtų galima gauti dozavimui tinkamos koncentracijos pradinį tirpalą. Be bandymo koncentracijos ėminių reikėtų bandyti reikiamą skaičių skiedimo vandens kartotinių kontrolinių ėminių ir, jei tinka, reikiamą skaičių tirpiklio kartotinių kontrolinių ėminių. Atliekant bandymą, reikėtų naudoti tik tuos tirpiklius ar dispergentus, kuriuos tiriant įrodyta, kad jie nedaro jokio reikšmingo poveikio atsako kintamiesiems ar šis poveikis yra labai mažas. Tinkami tirpikliai (pvz., acetonas, etanolis, metanolis, dimetilformamidas ir trietilenglikolis) ir dispergentai (pvz., Cremophor RH40, 0,01 % metilceliuliozė ir HCO-40) kaip pavyzdžiai yra pateikti (13). Jei naudojamas tirpiklis, jo galutinė koncentracija neturėtų būti didesnė kaip 0,1 ml/l (13) ir ji turėtų būti vienoda visose bandymo induose, išskyrus skiedimo vandens kontrolinių ėminių indus. Tačiau reikėtų imtis visų priemonių, kad tirpiklio koncentracija būtų kuo mažesnė. PROCEDŪRA Veikimo sąlygos Trukmė Bandymo trukmė – 21 para. Įkrova Jei bandymams atlikti nebūtina dinaminių bandymų schema, motininiai gyvūnai laikomi atskirai po vieną inde, paprastai su 50–100 ml terpės kiekviename inde (Daphnia magna atveju, bet galimas mažesnis tūris, ypač jei dafnijos mažesnės, pvz., Ceriodaphnia dubia). Atsižvelgiant į analizės procedūros bandomosios cheminės medžiagos koncentracijai nustatytus reikalavimus, kartais gali prireikti didesnio tūrio, nors taip pat leidžiama sujungti kartotinius ėminius cheminei analizei atlikti. Jei naudojamas didesnis kaip 100 ml tūris, gali tekti padidinti dafnijų maisto davinį, kad turimo maisto pakaktų ir būtų užtikrinta tinkamumo kriterijų atitiktis. Bandymo gyvūnai Pusiau statiniams bandymams kiekvienai koncentracijai imama bent 10 atskirai laikomų gyvūnų ir bent 10 atskirai laikomų kontrolinių ėminių serijos gyvūnų. Buvo parodyta, kad dinaminiams bandymams kiekvienai koncentracijai tinka naudoti 40 gyvūnų, padalytų į keturias grupes po 10 gyvūnų (1). Galima naudoti mažiau bandymo organizmų, bet kiekvienai koncentracijai rekomenduojama naudoti ne mažiau kaip po 20 gyvūnų, padalytų dviem ėminiams ar daugiau su vienodu gyvūnų skaičiumi (pvz., keturiems ėminiams su 5 dafnijomis kiekvienam ėminiui). Reikia pažymėti, kad atliekant bandymus, kai gyvūnai laikomi grupėmis, iš statistinės analizės nebus įmanoma pašalinti nei vieno palikuonio, jei reprodukcijos pradžioje atsitiktinai ar netyčia nugaišta motininiai gyvūnai, todėl šiais atvejais reprodukcijos našumą reikėtų išreikšti gautų gyvų palikuonių skaičiumi vienam bandymo pradžioje buvusiam motininiam gyvūnui. Apdorojimo dozės turėtų būti priskirtos bandymų indams, o toliau visi bandymų indai turėtų būti tvarkomi atsitiktiniu būdu. Taip nedarant, gali atsirasti sistemingoji paklaida, kuri galėtų būti aiškinama koncentracijos poveikiu. Ypač jei bandymo vienetai tvarkomi tokia seka, kokia jie buvo apdoroti, arba pagal koncentraciją, todėl kai kurie su laiku susiję veiksniai, pvz., operatoriaus nuovargis ar kita klaida esant didesnėms koncentracijos vertėms galėtų turėti didesnį poveikį. Be to, jei bandymo rezultatai galimai yra susiję su bandymo pradinėmis ar aplinkos sąlygomis, pvz., padėtimi laboratorijoje, reikėtų svarstyti galimybę stabdyti bandymą. Maitinimas Atliekant pusiau statinius bandymus geriau maitinti kasdien, tačiau ne mažiau kaip tris kartus per savaitę (t. y. kartu su terpės pakeitimu). Reikėtų atsižvelgti į galimą veikimo koncentracijos verčių sumažėjimą dėl praskiedimo dedant maistą ir to kiek įmanoma vengti imant didelės koncentracijos dumblių suspensiją. Nukrypimai nuo šių sąlygų (pvz., dinaminių bandymų) nurodomi ataskaitoje. Atliekant bandymą motininių gyvūnų maistą turėtų sudaryti šių gyvų dumblių ląstelės: Chlorella sp., Pseudokirchneriella subcapitata (seniau Selenastrum capricornutum) ir Desmodesmus subspicatus (seniau Scenedesmus subspicatus). Tiekiamas maistas turėtų būti apskaičiuotas pagal organinės anglies (C) kiekį, duodamą kiekvienam motininiam gyvūnui. Tyrimas (14) parodė, kad Daphnia magna pakanka duoti 0,1–0,2 mg C/dafnijai/parai, kad būtų gautas reikiamas gyvų palikuonių skaičius, kuris atitiktų bandymo tinkamumo kriterijus. Maistą galima duoti vienodu kiekiu visą bandymo trukmę, ar, jei norima, mažiau bandymo pradžioje ir daugiau bandymo eigoje, atsižvelgiant į motininių gyvūnų augimą. Šiuo atveju davinys turi visą laiką atitikti rekomenduotą 0,1–0,2 mg C/dafnijai/parai intervalą. Jei maisto kiekiui nustatyti reikia naudoti pakaitinius parametrus, pvz., dumblių ląstelių skaičių ar šviesos absorbciją (t. y., kad būtų patogiau, nes anglies kiekiui nustatyti reikia daug laiko), kiekviena laboratorija turėtų daryti savo nomogramą, kuri pakaitinį parametrą susietų su anglies kiekiu dumbliuose (žr. 3 priedėlį dėl patarimo, kaip gauti nomogramą). Nomogramas reikėtų tikrinti bent kartą per metus ar dažniau, jei kinta dumblių auginimo sąlygos. Buvo nustatyta, kad šviesos absorbcija yra geresnis anglies kiekio pakaitinis parametras nei ląstelių skaičius (15). Dafnijas reikėtų maitinti koncentruota dumblių suspensija, kad į bandymų indus įpiltos kultūros terpės tūris būtų kuo mažesnis. Dumblius galima koncentruoti centrifugavimu ir ruošti naują suspensiją dafnijų kultūros terpėje. Apšvietimas 16 h trukmės apšvietimas, kurio intensyvumas, išmatuotas indo vandens paviršiuje, būtų ne didesnis kaip 15–20 μE·m– 2·s– 1. Jei apšvietimo matavimo prietaisai kalibruoti liuksais, šaltos baltos šviesos 1 000–1 500 liuksų apšvieta beveik atitinka rekomenduotą 15–20 μE·m– 2·s– 1 šviesos stiprį. Temperatūra Bandymų terpės temperatūra turėtų būti 18–22 °C. Tačiau, atliekant kurį nors bandymą, temperatūra neturėtų kisti daugiau kaip 2 °C, jei įmanoma, esant šioms dienos intervalo riboms (pvz., 18–20, 19–21 ar 20–22 °C). Temperatūrai kontroliuoti gali būti naudingas papildomas bandymų indas. Aeravimas Atliekant bandymą bandymo indai neturėtų būti aeruojami. Bandymų schema Intervalo nustatymo bandymas Prireikus atliekamas intervalo nustatymo bandymas, pvz., imant penkių koncentracijos verčių bandomąją cheminę medžiagą ir du kartotinius kiekvienos koncentracijos ir kontrolinius ėminius. Sprendžiant dėl intervalo nustatymo bandymo koncentracijos verčių, gali būti naudinga papildoma informacija, gauta atliekant panašių cheminių medžiagų bandymus, ar žinios iš literatūros šaltinių apie ūmų toksiškumą dafnijoms ir (arba) kitiems vandens organizmams. Intervalo nustatymo bandymo trukmė – 21 para arba tokia trukmė, kurios pakaktų patikimai prognozuoti poveikio lygius. Baigus bandymą, vertinama dafnijų reprodukcija. Reikėtų registruoti motininių gyvūnų skaičių ir palikuonių buvimą. Galutinis bandymas Paprastai reikėtų naudoti ne mažiau kaip penkias bandymų koncentracijos vertes, kurios aprėptų efektyviąją koncentraciją (pvz., ECx), ir būtų išdėstytos geometrine progresija, kurios vardiklis turėtų būti ne didesnis kaip 3,2. Kiekvienai koncentracijai reikėtų naudoti reikiamą kartotinių ėminių skaičių (žr. 24–25 pastraipas). Reikėtų pagrįsti mažesnio nei penkių koncentracijos verčių skaičiaus naudojimą. Cheminės medžiagos neturėtų būti bandomos didesnės koncentracijos, nei jų tirpumo bandymų terpėje ribinė koncentracija. Prieš atliekant bandymą, patartina atsižvelgti į bandymų schemos statistinę galią ir taikyti reikiamus statistinius metodus (4). Nustatant koncentracijos verčių intervalą reikėtų turėti omenyje, kad:
Jei atliekant intervalo nustatymo bandymą, nestebima jokio poveikio, esant didžiausiai koncentracijai (pvz., 10 mg/l), arba kai yra labai didelė tikimybė, kad, atsižvelgiant į bandomosios cheminės medžiagos toksiškumą kitiems organizmams, jos toksiškumas yra mažas arba jo nėra ir (arba) sugertis yra maža arba jos nėra, reprodukcijos bandymas gali būti atliekamas kaip ribinis bandymas, naudojant bandymo koncentraciją, pvz., 10 mg/l, ir kontrolinį ėminį. Apdorojimo ir kontrolinei grupei reikėtų naudoti dešimt kartotinių ėminių. Jei ribinį bandymą tektų atlikti dinaminio bandymo sistemoje, pakaktų mažiau kartotinių ėminių. Ribinis bandymas suteiks galimybę įrodyti, kad, esant ribinei koncentracijai, nėra statistiškai reikšmingo poveikio, bet jei poveikis registruojamas, paprastai reikėtų atlikti visą bandymą. Kontroliniai ėminiai Be bandomosios cheminės medžiagos ėminių serijos, bandoma viena bandymų terpės kontrolinių ėminių serija ir, jei tinka, viena tirpiklio ar dispergento kontrolinių ėminių serija. Naudojamo tirpiklio ar dispergento koncentracija turėtų atitikti koncentraciją induose su bandomąja chemine medžiaga. Reikėtų naudoti reikiamą kartotinių ėminių skaičių (žr. 23–24 pastraipas). Paprastai tinkamai atliekant bandymą, kontrolinio (-ių) ėminio (-ių) variacijos koeficientas turėtų būti ≥ 25 %, skaičiuojant vidutiniam iš vieno motininio gyvūno gautų palikuonių skaičiui, ir jis turėtų būti pateiktas bandymo schemų su atskirai laikomais gyvūnais ataskaitose. Bandymų terpės atnaujinimas Bandymų terpės atnaujinimo dažnumas priklauso nuo bandomosios cheminės medžiagos, tačiau terpė turėtų būti atnaujinama bent tris kartus per savaitę. Jei pagal išankstinius stabilumo bandymus (žr. 7 pastraipą) bandomosios cheminės medžiagos koncentracija ilgiausiu (t. y. trijų parų) atnaujinimo laikotarpiu nėra pastovi (t. y. neatitinka 80–120 % nominalios koncentracijos ribų ar sumažėja iki mažesnės kaip 80 % išmatuotos pradinės koncentracijos), reikėtų numatyti dažnesnį terpės atnaujinimą arba atlikti dinaminį bandymą. Kai atnaujinama pusiau statinių bandymų terpė, paruošiama antra bandymų indų serija, ir į juos pernešami motininiai gyvūnai, pvz., tinkamo skersmens stikline pipete. Su dafnijomis pernešamos terpės tūris turėtų būti kuo mažesnis. Stebėjimai Stebėjimų rezultatai, gauti atliekant bandymą, registruojami duomenų lentelėse (pavyzdžiai pateikti 4 ir 5 priedėlyje). Jei reikia atlikti kitus matavimus (žr. 44 pastraipą), gali prireikti papildomų stebėjimų. Palikuonys Iš kiekvieno motininio gyvūno gautus palikuonis geriau atskirti ir skaičiuoti kasdien nuo pirmosios vados atsiradimo, kad jie nevartotų motininiams gyvūnams skirto maisto. Pagal šį bandymų metodą reikia skaičiuoti tik gyvus palikuonis, tačiau reikėtų registruoti neapvaisintų kiaušinių ar negyvų palikuonių skaičių. Gaištamumas Motininių gyvūnų gaištamumą pageidautina registruoti kasdien arba bent jau taip dažnai, kaip skaičiuojami palikuonys. Kiti parametrai Nors pagrindinis šio metodo tikslas – poveikio reprodukcijos našumui vertinimas, įmanoma gana kiekybiškai įvertinti kitus poveikio būdus, kad būtų įmanoma jų statistinė analizė. Galima registruoti reprodukcijos našumą vienam išgyvenusiam motininiam gyvūnui, t. y. gyvų palikuonių skaičių, gautą bandymo metu iš vieno išgyvenusio motininio gyvūno. Jį galima palyginti su pagrindiniu atsako kintamuoju (reprodukcijos našumu vienam motininiam gyvūnui bandymo pradžioje, kuris netyčia ar atsitiktinai nežuvo atliekant bandymą). Jei motininių gyvūnų gaištamumas pasitaiko apdorotų kartotinių ėminių induose, reikėtų ištirti, ar gaištamumas atitinka koncentracijos ir atsako priklausomybės kreivę ar jos neatitinka, pvz., ar yra reikšminga atsako regresija su teigiamu krypties koeficientu bandomosios cheminės medžiagos koncentracijos atžvilgiu (čia gali būti naudingas statistinis kriterijus, pvz., Cochran-Armitage tendencijos kriterijus). Jei gaištamumas neatkartoja koncentracijos ir atsako priklausomybės kreivės, šie kartotiniai ėminiai su žuvusiais motininiai gyvūnais neturėtų būti įtraukti į rezultatų analizę. Jei gaištamumas atkartoja koncentracijos ir atsako priklausomybės kreivę, motininių gyvūnų gaištamumą reikėtų priskirti prie bandomosios cheminės medžiagos poveikio ir kartotiniai ėminiai neturėtų būti pašalinti iš rezultato analizės. Labai pageidautina, kad būtų atliekami augimo matavimai, nes jie suteikia duomenų apie galimą subletalų poveikį, kurie gali būti naudingi reprodukcijos rezultatams papildyti; baigiant bandymą rekomenduojama išmatuoti motininių gyvūnų ilgį (t. y. kūno ilgį, išskyrus analinį dyglį). Kiti parametrai, kuriuos galima išmatuoti ar apskaičiuoti, yra pirmosios vados (ir vėlesnių vadų) atsiradimo laikas, vieno gyvūno vadų skaičius ir dydis, neapvaisintų kiaušinių skaičius, vyriškos lyties atstovų (EBPO, 2008 m.) ar efipijų buvimas ir būdingasis populiacijos prieaugio greitis (žr. 1 priedėlį dėl apibrėžčių ir 7 priedėlį dėl naujagimių lyties nustatymo). Analizinių nustatymų ir matavimų dažnumas Deguonies koncentracija, temperatūra, kietumas ir pH vertės turėtų būti matuojamos bent kartą per savaitę prieš ir po terpės atnaujinimo kontroliniame (-iuose) ėminyje (-iuose) ir induose su didžiausia bandomosios cheminės medžiagos koncentracija. Atliekant bandymą bandomosios cheminės medžiagos koncentracijos vertės nustatomos reguliariais laiko tarpais. Jei atliekami pusiau statiniai bandymai, dėl kurių daroma prielaida, kad bandomosios medžiagos koncentracija yra nominalios koncentracijos ± 20 % (t. y. 80–120 % intervale, žr. 6, 7 ir 39 pastraipas), rekomenduojama nustatyti bent didžiausią ir mažiausią bandymo koncentraciją iš karto po tirpalo paruošimo ir prieš pat jo atnaujinimą pirmąją bandymo savaitę (t. y. turi būti atliekama to paties tirpalo ėminių analizė iš karto po tirpalo paruošimo ir jį atnaujinant). Vėliau šis nustatymas turėtų būti kartojamas bent kas savaitę. Jei atliekant bandymus nesitikima, kad bandomosios cheminės medžiagos koncentracija galėtų likti nominalios vertės ± 20 %, būtina analizuoti visų koncentracijos verčių bandymo tirpalus iš karto po jų paruošimo ir prieš pat atnaujinimą. Tačiau jei atliekant bandymus išmatuota pradinė bandomosios cheminės medžiagos koncentracija nėra nominalios vertės ± 20 %, bet galima gauti pakankamai įrodymų, kad pradinės koncentracijos vertės yra pakartojamos ir stabilios (t. y. 80–120 % pradinių koncentracijos verčių intervale), bandymo antros ir trečios savaitės cheminių analizių skaičių galima sumažinti ir apsiriboti didžiausios ir mažiausios bandymo koncentracijos nustatymu. Visais atvejais prieš atnaujinimą bandomosios cheminės medžiagos koncentracija turi būti nustatoma tik viename kiekvienos bandymo koncentracijos kartotinio ėminio inde. Jei atliekamas dinaminis bandymas, ėminius galima imti pusiau statinių bandymų ėminių ėmimo režimu (bet „senų“ tirpalų analizė šiuo atveju netinka). Tačiau, siekiant įsitikinti, ar bandymo koncentracijos vertės yra stabilios, patartina pirmąją savaitę ėminius imti dažniau (pvz., trys matavimų serijos). Atliekant šio tipo bandymus, skiediklio srautas ir bandomoji cheminė medžiaga turėtų būti tikrinami kasdien. Jei yra įrodymų, kad bandomosios cheminės medžiagos koncentracija visą bandymo trukmę gali būti nominalios koncentracijos ar išmatuotos pradinės koncentracijos vertės ± 20 %, rezultatai gali būti pagrįsti nominaliomis ar išmatuotomis pradinėmis vertėmis. Jei nuokrypis nuo nominalios ar išmatuotos pradinės koncentracijos yra didesnis kaip ± 20 %, rezultatus reikėtų išreikšti kaip laikinį svertinį vidurkį (skaičiavimo rekomendacijos pateiktos 6 priedėlyje). DUOMENYS IR ATASKAITOS RENGIMAS Rezultatų apdorojimas Šio bandymo tikslas – nustatyti bandomosios cheminės medžiagos poveikį reprodukcijos našumui. Reikėtų apskaičiuoti suminį vieno motininio gyvūno palikuonių skaičių kiekvienam bandymų indui (t. y. kartotiniam ėminiui). Be to, galima apskaičiuoti reprodukciją, pagrįstą išgyvenusiam motininiam organizmui gautų gyvų palikuonių skaičiumi. Tačiau ekologiniu požiūriu tinkamiausias atsako kintamasis yra suminis gyvų palikuonių skaičius, gautas vienam motininiam gyvūnui, kuris atsitiktinai (96) ar netyčia (97) nežuvo atliekant bandymą. Jei motininis gyvūnas atsitiktinai ar netyčia žūsta bandymo metu arba jei paaiškėja, kad gyvūnas yra vyriškos lyties, kartotinis ėminys pašalinamas iš analizės. Tuomet analizė bus pagrįsta mažesniu kartotinių ėminių skaičiumi. Jei motininių gyvūnų gaištamumas pasitaiko apdorotų kartotinių ėminių induose, reikėtų ištirti, ar gaištamumas atitinka koncentracijos ir atsako priklausomybės kreivę ar jos neatitinka, pvz., ar yra reikšminga atsako regresija su teigiamu krypties koeficientu bandomosios cheminės medžiagos koncentracijos atžvilgiu (čia gali būti naudingas statistinis kriterijus, pvz., Cochran-Armitage tendencijos kriterijus). Jei gaištamumas neatkartoja koncentracijos ir atsako priklausomybės kreivės, šie kartotiniai ėminiai su žuvusiais motininiai gyvūnais neturėtų būti įtraukti į rezultatų analizę. Jei gaištamumas atkartoja koncentracijos ir atsako priklausomybės kreivę, motininių gyvūnų gaištamumą reikėtų priskirti prie bandomosios cheminės medžiagos poveikio ir kartotiniai ėminiai neturėtų būti pašalinti iš rezultato analizės. Apibendrinant, kai poveikiui išreikšti naudojamos LOEC ir NOEC ar ECx vertės, poveikį reprodukcijai rekomenduojama skaičiuoti naudojant abu pirmiau nurodytus atsako kintamuosius, t. y.
ir tada kaip galutinį rezultatą naudoti mažiausią NOEC ir LOEC ar ECx vertę, apskaičiuotą naudojant kurį nors vieną iš šių dviejų atsako kintamųjų. Prieš pradedant taikyti statistinės analizės, pvz., ANOVA, procedūras, apdorotų ėminių lyginimą su kontroliniais ėminiais, taikant Stjudento t kriterijų, Dunnetto kriterijų, Williamso kriterijų ar Jonckheere-Terpstra kriterijų mažėjimo tvarka, rekomenduojama patikrinti, ar reikia duomenis transformuoti, kad jie atitiktų tam tikro statistinio kriterijaus reikalavimus. Kaip neparametrines alternatyvas būtų galima taikyti Dunn ar Mann-Whitney kriterijus. Atskiriems gautiems apdorojimo dozių vidurkiams apskaičiuojami 95 % pasikliovimo intervalai. Neapdorotuose kontroliniuose ėminiuose išgyvenusių motininių gyvūnų skaičius yra tinkamumo kriterijus ir jį reikėtų dokumentuoti bei pateikti ataskaitoje. Galutinėje ataskaitoje taip pat reikėtų pateikti visus kitus kenksmingo poveikio požymius, pvz., nenormalų elgesį ir reikšmingus toksikologinius rezultatus. ECx ECx vertės, įskaitant su jomis susijusias apatinę ir viršutinę pasikliovimo ribas, skaičiuojamos taikant tinkamus statistinius metodus (pvz., logistinę ar Weibull funkciją, supaprastintą Spearman-Karber metodą arba paprastą interpoliaciją). Norint apskaičiuoti EC10, EC50 ar kitą ECx, reikėtų atlikti viso duomenų rinkinio regresinę analizę. NOEC ir (arba) LOEC Jei numatoma atlikti statistinę analizę NOEC ir (arba) LOEC nustatyti, reikėtų taikyti tinkamus statistinius metodus pagal EBPO 54 dokumentą Current Approaches in the Statistical Analysis of Ecotoxicity Data: a Guidance to Application (4). Apskritai, neigiami cheminės medžiagos poveikiai palyginti su kontroliniu ėminiu tiriami taikant vienpusį hipotezės tikrinimą, kai p ≤ 0,05. Normalusis pasiskirstymas ir dispersijos vienalytiškumas gali būti tikrinamas taikant tinkamą statistinį kriterijų, pvz., Shapiro-Wilk kriterijų ir Levene kriterijų (p ≤ 0,05). Galima atlikti vienfaktorinę ANOVA ir vėliau taikyti daugybinio lyginimo kriterijų. Galima taikyti daugybinio lyginimo kriterijus (pvz., Dunnett kriterijų) arba tendencijos kriterijus mažėjimo tvarka (pvz., Williams kriterijų arba ar Jonckheere-Terpstra kriterijų mažėjimo tvarka), kad būtų apskaičiuota, ar yra reikšmingi skirtumai (p ≤ 0,05) tarp kontrolinių ėminių ir įvairios koncentracijos cheminės medžiagos ėminių (rekomenduojamas kriterijus pasirenkamas pagal EBPO rekomendacinį dokumentą 54 (4)). Kitais atvejais NOEC ir LOEC galima būtų nustatyti taikant neparametrinius metodus (pvz., Bonferroni U kriterijų pagal Holm ar Jonckheere-Terpstra tendencijos kriterijų). Ribinis bandymas Jei buvo atliekamas ribinis bandymas (lyginamas tik kontrolinis ir tik vienos apdorojimo dozės ėminys) ir yra vykdomi parametrinių kriterijų procedūrų reikalavimai (normalumas, vienalytiškumas), metrinius atsakus galima įvertinti taikant Student kriterijų (t kriterijų). Jei šie reikalavimai nevykdomi, galima taikyti nelygių dispersijų t kriterijų (pvz., Welch kriterijų) arba neparametrinį kriterijų, pvz., Mann-Whitney U kriterijų. Jei norima nustatyti reikšmingus skirtumus tarp kontrolinių ėminių (kontrolinių ir tirpiklio ar dispergento kontrolinių ėminių), kiekvieno kontrolinio ėminio kartotinius ėminius galima bandyti, kaip aprašyta atliekant ribinį bandymą. Jei šiais bandymais reikšmingų skirtumų neaptinkama, visi kontroliniai ir tirpiklio kontroliniai ėminiai gali būti sujungti. Priešingu atveju visus apdorojimo dozių ėminius reikėtų lyginti su tirpiklio kontroliniais ėminiais. Bandymo ataskaita Į bandymo ataskaitą įtraukiama:
LITERATŪRA
1 priedėlis APIBRĖŽTYS Šiame bandymo metode taikomos šios apibrėžtys: Atsitiktinis gaištamumas – su chemine medžiaga nesusijęs gaištamumas, sukeltas atsitiktinio įvykio (t. y. žinoma priežastis). Cheminė medžiaga – medžiaga arba mišinys. Ecx – vandenyje ištirpintos cheminės medžiagos koncentracija, kuriai esant dafnijų reprodukcija per nurodytą veikimo laikotarpį sumažėja x %. Netyčinis gaištamumas – su chemine medžiaga nesusijęs gaištamumas dėl nežinomos priežasties. Būdingasis populiacijos prieaugio greitis – populiacijos augimo matas, kuris aprėpia reprodukcijos našumą ir su amžiumi susijusį gaištamumą (1) (2) (3). Stacionarios būsenos populiacijų jis lygus nuliui. Augančių populiacijų greitis yra teigiamas, o nykstančių populiacijų – neigiamas. Aišku, kad pastarosios yra neilgaamžės ir galiausiai išnyksta. Aptikimo riba – mažiausia koncentracija, kuriai esant medžiagą galima aptikti, bet negalima nustatyti kiekybiškai. Nustatymo riba – mažiausia kiekybiškai nustatoma koncentracija. Mažiausia stebimo poveikio koncentracija (LOEC) – mažiausia bandymo koncentracija, kuriai esant stebimas statistiškai reikšmingas cheminės medžiagos poveikis reprodukcijai ir motininių gyvūnų gaištamumui nurodytu veikimo laikotarpiu palyginti su kontroliniu ėminiu (kai p < 0,05). Tačiau esant visoms didesnėms nei LOEC bandymo koncentracijos vertėms, kenksmingas poveikis turėtų būti lygus arba didesnis nei poveikis, kuris būtų esant LOEC. Kai negalima įvykdyti šių dviejų sąlygų, turėtų būti pateiktas išsamus paaiškinimas, kaip buvo pasirinkta LOEC (taigi ir NOEC) vertė. Gaištamumas – gyvūnas registruojamas kaip nugaišęs, kai jis nejuda, t. y. kai negali plaukti arba kai nestipriai pakračius bandymų indą per 15 s negalima pastebėti galūnių ar pilvelio judėjimo. (Jei taikoma kita apibrėžtis, ji turėtų būti pateikta kartu su jos nuoroda.). Nestebimo poveikio koncentracija (NOEC) – vos mažesnė nei LOEC bandymo koncentracija, kuri per nurodytą veikimo laikotarpį nedaro statistiškai reikšmingo poveikio (p < 0,05) palyginti su kontroliniu ėminiu. Palikuonys – jaunos dafnijos, atsiradusios atliekant bandymą. Motininiai gyvūnai – bandymo pradžioje esančios moteriškos lyties dafnijos, kurių reprodukcijos našumas yra tyrimo objektas. Reprodukcijos našumas – iš motininių gyvūnų bandymo metu gautų palikuonių skaičius. Bandomoji cheminė medžiaga – taikant šį metodą bandoma medžiaga arba mišinys. LITERATŪRA
2 priedėlis VISIŠKAI APIBRĖŽTŲ ELENDT M7 IR M4 TERPIŲ RUOŠIMAS Aklimatizavimas Elendt M7 ir M4 terpėje Kai kurios laboratorijos turėjo sunkumų norėdamos dafnijas pernešti tiesiai į M4 (1) ir M7 terpes. Tačiau, aklimatizuojant laipsniškai, t. y. perkeliant dafnijas iš jų terpės į 30 % Elendt, paskui į 60 % Elendt ir pagaliau į 100 % Elendt, pasiekta geresnių rezultatų. Aklimatizavimas gali trukti visą mėnesį. Pasirengimas Mikroelementai Atskirų mikroelementų pradiniai tirpalai (I) iš pradžių ruošiami naudojant tinkamo grynumo vandenį, pvz., dejonizuotą, distiliuotą arba grįžtamojo osmoso būdu gautą vandenį. Iš šių skirtingų pradinių tirpalų (I) ruošiamas antras atskiras pradinis tirpalas (II), turintis visus mikroelementus (sudėtinis tirpalas), t. y.:
M4 ir M7 terpės M4 ir M7 terpės naudojant II pradinį tirpalą, makroelementus ir vitaminus yra ruošiamos taip:
Vitaminų mišinio pradinis tirpalas laikomas užšaldytas mažomis alikvotinėmis dalimis. Į terpę vitaminai dedami prieš pat naudojimą.
3 priedėlis SUMINĖS ORGANINĖS ANGLIES (TOC) ANALIZĖ IR DUMBLIŲ MAISTO TOC KIEKIO NOMOGRAMŲ GAVIMAS Pripažįstama, kad dumblių maisto anglies kiekis tiesioginiu metodu paprastai nematuojamas, bet taikoma jo koreliacija (t. y. nomogramos) su pakaitiniais parametrais, pvz., dumblių ląstelių skaičiumi ar šviesos absorbcija. TOC reikėtų matuoti taikant oksidavimo aukštos temperatūros sąlygomis metodą, bet ne UV ar persulfatinį metodą. (Patarimo žr.: The Instrumental Determination of Total Organic Carbon, Total Oxygen Demand and Related Determinands 1979, HMSO 1980; 49 High Holborn, London WC1V 6HB). Nomogramai gauti dumbliai ir auginimo terpė atskiriami centrifuguojant ir dumbliai vėl suspenduojami distiliuotame vandenyje. Kiekvieno ėminio pakaitinis parametras ir TOC koncentracija matuojami tris kartus. Analizuojami distiliuoto vandens tuštieji ėminiai ir jų TOC koncentracija atimama iš dumblių ėminio TOC koncentracijos. Nustatyto anglies koncentracijos verčių intervalo nomograma turėtų būti tiesinė. Pavyzdžiai pateikti toliau.

Chlorella vulgaris, var. viridis (CCAP 211/12). Sausosios masės mg/l ir mg C/l regresija. Koncentruotų suspensijų, gautų iš pusiau nepertraukiamu būdu auginamų ląstelių partijų ir pakartotinai suspenduotų distiliuotame vandenyje, duomenys. x ašis: koncentruoto dumblių maisto mg C/l y ašis: koncentruoto dumblių maisto sausosios masės mg/l Koreliacijos koeficientas -0,980 
Chlorella vulgaris, var. viridis (CCAP 211/12) Ląstelių skaičiaus ir mg C/l regresija. Koncentruotų suspensijų, gautų iš pusiau nepertraukiamu būdu auginamų ląstelių partijų ir pakartotinai suspenduotų distiliuotame vandenyje, duomenys. x ašis: koncentruoto dumblių maisto mg C/l y ašis: ląstelių skaičius/1 koncentruoto dumblių maisto Koreliacijos koeficientas -0,926 
Chlorella vulgaris, var. viridis (CCAP 211/12) Optinio tankio ir mg C/l regresija (1 cm optinis kelias). Koncentruotų suspensijų, gautų iš pusiau nepertraukiamu būdu auginamų ląstelių partijų ir pakartotinai suspenduotų distiliuotame vandenyje, duomenys. x ašis: koncentruoto dumblių maisto mg C/l y ašis: 1/10 praskiesto koncentruoto dumblių maisto optinis tankis, esant 440 mm bangos ilgiui Koreliacijos koeficientas -0,998 4 priedėlis TERPĖS ATNAUJINIMO, FIZIKINIO AR CHEMINIO MONITORINGO DUOMENŲ, MAITINIMO, DAFNIJŲ REPRODUKCIJOS IR MOTININIŲ GYVŪNŲ GAIŠTAMUMO DUOMENŲ REGISTRAVIMO LENTELĖS PAVYZDYS
5 priedėlis CHEMINĖS ANALIZĖS REZULTATŲ REGISTRAVIMO LENTELĖS PAVYZDYS a) Išmatuotos koncentracijos vertės
b) Išmatuotos koncentracijos vertės, išreikštos kaip nominalios koncentracijos procentinė dalis
6 priedėlis LAIKINIO SVERTINIO VIDURKIO APSKAIČIAVIMAS Laikinis svertinis vidurkis Darant prielaidą, kad bandomosios cheminės medžiagos koncentracija laikotarpiu tarp terpės atnaujinimų gali mažėti, būtina nuspręsti, kurią koncentracijos vertę reikėtų pasirinkti kaip motinines dafnijas veikiančios medžiagos koncentracijos verčių intervalo reprezentatyviąją vertę. Pasirinkimas turėtų būti pagrįstas biologiniais ir statistiniais aspektais. Pvz., jei manoma, kad reprodukciją labiausiai veikia didžiausia koncentracija, reikia naudoti maksimalios koncentracijos vertę. Tačiau jei svarbesniu laikomas kaupiamasis ar ilgalaikis toksiškos cheminės medžiagos poveikis, labiau tinka vidutinė koncentracija. Šiuo atveju tinkamas naudoti vidurkis yra laikinė svertinė vidutinė koncentracija, nes ją nustatant atsižvelgiama į momentinį koncentracijos kitimą laike. 1 paveikslas. Laikinio svertinio vidurkio pavyzdys 
1 paveiksle pateiktas septynių parų trukmės (supaprastinto) bandymo pavyzdys, terpę atnaujinant 0, 2 ir 4 parą.
Laikinis svertinis vidurkis apskaičiuojamas taip, kad plotas po laikinio svertinio vidurkio kreive yra lygus plotui po koncentracijos kreive. Pirmiau pateikto pavyzdžio apskaičiavimas pateiktas 1 lentelėje. 1 lentelė Laikinio svertinio vidurkio apskaičiavimas
Paros – atnaujinimo laikotarpio parų skaičius; Konc. 0 – kiekvieno atnaujinimo laikotarpio pradžioje išmatuota koncentracija; Konc. 1 – kiekvieno atnaujinimo laikotarpio pabaigoje išmatuota koncentracija; ln(konc. 0)– konc. 0 natūralusis logaritmas; ln(konc. 1)– konc. 1 natūralusis logaritmas. Plotas – kiekvieno atnaujinimo laikotarpio plotas po eksponentine kreive. Jis apskaičiuojamas:
Laikinis svertinis vidurkis (LS vidurkis) yra suminio ploto ir suminio parų skaičiaus dalmuo. Savaime aišku, kad atliekant dafnijų reprodukcijos bandymą, lentelė turėtų būti pratęsta iki 21 paros. Aišku, kad matuojant tik kiekvieno atnaujinimo laikotarpio pradžioje ir pabaigoje, neįmanoma patvirtinti, kad irimo procesas iš tikrųjų vyksta eksponentiškai. Kitokiai kreivei būtų gautas kitas ploto apskaičiavimo rezultatas. Tačiau irimo pagal eksponentinę kreivę procesas nėra neįmanomas ir, kai nėra kitos informacijos, tai turbūt labiausiai naudoti tinkama kreivė. Tačiau reikia būti atsargiems, jei atliekant cheminę analizę atnaujinimo laikotarpio pabaigoje nerandama jokios cheminės medžiagos. Jei negalima įvertinti, kaip greitai cheminė medžiaga išnyko iš tirpalo, neįmanoma gauti tikrojo ploto po kreive, taigi neįmanoma gauti pagrįsto laikinio svertinio vidurkio. 7 priedėlis NAUJAGIMIŲ LYTIES NUSTATYMO REKOMENDACIJOS Vyriškos lyties naujagimiai gali atsirasti kintamomis aplinkos sąlygomis, pvz., mažėjanti šviesiojo laikotarpio trukmė, temperatūra, mažėjanti maisto koncentracija ir didėjantis populiacijos tankis (Hobaek and Larson, 1990; Kleiven et al., 1992). Yra žinoma, kad patinėlių atsiradimui įtakos turi tam tikros kovos su vabzdžiais priemonės (Oda et al., 2005). Tomis sąlygomis, kai dėl cheminių streso veiksnių sumažėja partenogeninių patelių naujagimių, reikėtų laukti patinėlių padaugėjimo (EBPO, 2008). Atsižvelgiant į turimą informaciją, neįmanoma nuspėti, ar jautresnis būtų lyčių santykis, ar reprodukcija kaip vertinamoji baigtis, tačiau yra požymių (nuoroda Tinkamumo patvirtinimo ataskaita, 1 dalis), kad šis patinėlių skaičiaus padidėjimas galėtų būti ne toks jautrus palyginti su naujagimių skaičiaus sumažėjimu. Kadangi pagrindinis bandymų metodo tikslas – įvertinti gautų palikuonių skaičių, atsiradusių patinėlių kiekis yra neprivalomas stebėjimas. Jei atliekant tyrimą įvertinama ši neprivaloma vertinamoji baigtis, tada, kaip papildomą bandymo tinkamumo kriterijų, reikėtų naudoti ne didesnį kaip 5 % patinėlių kiekį kontroliniuose ėminiuose. Praktiškiausias ir patogiausias būdas nustatyti dafnijų lytį – naudoti jų fenotipines charakteristikas, nes patinai ir patelės yra genetiškai identiški ir jų lytis nustatoma pagal išorę. Skiriasi patinėlių ir patelių pirmojo čiuptuvėlio ilgis ir morfologija, patinėlių čiuptuvėlis yra ilgesnis (1 paveikslas). Šį skirtumą galima atpažinti iš karto po gimimo, nors jiems augant vystosi kiti antriniai lytiniai požymiai (pvz., žr. 2 paveikslą, pateiktą Olmstead and LeBlanc, 2000). Norint stebėti morfologinę lytį, kiekvieno bandymo gyvūno naujagimius reikėtų paimti pipete ir pernešti į petri lėkštelę su bandymo terpe. Terpės reikia imti kuo mažiau, kad gyvūnų judesiai būtų suvaržyti. Pirmąjį čiuptuvėlį galima stebėti per stereomikroskopą (× 10–60). 1 paveikslas D. magna 24 h amžiaus patinai (kairėje) ir patelės (dešinėje). Patinėlius nuo patelių galima atskirti pagal pirmojo čiuptuvėlio ilgį ir morfologiją, kaip pavaizduota apskritimuose (Tatarazako et al., 2004). 
NUORODOS Hobaek A and Larson P. 1990. Sex determination in Daphnia magna. Ecology 71: 2255-2268. Kleiven O.T., Larsson P., Hobaek A. 1992. Sexual reproduction in Daphnia magna requires three stimuli. Oikos 65, 197-206. Oda S., Tatarazako N, Watanabe H., Morita M., and Iguchi T. 2005. Production of male neonates in Daphnia magna (Cladocera, Crustacea) exposed to juvenile hormones and their analogs. Chemosphere 61:1168-1174. OECD, 2008. Validation report for an enhancement of OECD TG 211 Daphnia magna reproduction test. OECD Series on Testing and Assessment, Number 88. Organisation for Economic Co-operation and Development, Paris. Olmstead, A.W., LeBlanc, G.A., 2000. Effects of endocrine-active chemicals on the development characteristics of Daphnia magna. Environmental Toxicology and Chemistry 19:2107-2113. Tatarazako, N., Oda, S., Abe, R., Morita M. and Iguchi T., 2004. Development of a screening method for endocrine disruptors in crustaceans using Daphnia magna (Cladocera, Crustacea). Environmental Science 17, 439-449. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
18) |
C dalies C.29 skyriaus 66 pastraipa pakeičiama taip:
|
|
19) |
C dalis papildoma šiais skyriais: „C.47 Toksiškumo ankstyvųjų gyvenimo stadijų žuvims bandymas ĮVADAS
BANDYMO PRINCIPAS
INFORMACIJA APIE BANDOMĄJĄ CHEMINĘ MEDŽIAGĄ
BANDYMO TINKAMUMAS
METODO APRAŠYMAS Bandymų kameros
Rūšių parinkimas
Veislinių žuvų laikymas
Apvaisintų ikrų, embrionų ir lervų veikimas bandomąją medžiaga
Vanduo
Bandymo tirpalai
PROCEDŪRA Veikimo sąlygos Trukmė
Įkrova
Šviesa ir temperatūra
Maitinimas
Bandymo koncentracijos vertės
Kontroliniai ėminiai
Analizinių nustatymų ir matavimų dažnumas
Stebėjimai 26. Embrioninio vystymosi stadija : prieš veikimo bandomąja chemine medžiaga pradžią reikėtų kuo tiksliau patikrinti embrioninio vystymosi stadiją. Tai galima padaryti naudojant tinkamai konservuotų ir nuvalytų ikrų reprezentatyvų ėminį. 27. Išsiritimas ir išgyvenamumas : išsiritimą ir išgyvenamumą reikėtų stebėti bent kartą kasdien, o gautus skaičius registruoti. Jei ankstyvoje embriono vystymosi stadijoje (pvz., pirmąją ar antrąją bandymo parą) ant ikrų pastebimas grybelis, tuos ikrus reikėtų suskaičiuoti ir pašalinti. Negyvus embrionus, lervas ir mailių reikėtų pašalinti iš karto, kai tik pastebimi, nes jie greitai suyra ir gali būti sudraskyti kitų žuvų. Negyvus individus reikėtų šalinti ypač atsargiai, kad nebūtų fiziškai sužaloti šalia esantys ikrai ir (arba) lervos. Žūties požymiai skiriasi atsižvelgiant į rūšį ir gyvenimo stadiją. Pavyzdžiui:
28. Nenormali išvaizda : kūno formos anomalijų turinčių lervų arba mailiaus skaičių reikėtų registruoti atitinkamais laiko tarpais, atsižvelgiant į bandymo trukmę, ir aprašyti anomalijų požymius. Reikėtų pažymėti, kad nenormalios lervos ir mailius pasitaiko natūraliai ir kai kurių rūšių gali būti kelių kontrolinio (-ių) ėminio (-ių) procentų eilės. Jei laikoma, kad išsigimimo požymiai ir susijęs nenormalus elgesys yra toks ryškus, kad organizmas patiria dideles kančias ir nėra galimybės atsigauti, jis gali būti pašalintas iš bandymo. Tokius gyvūnus reikėtų numarinti ir vėliau atliekant duomenų analizę priskirti prie nugaišusių. Daugumos šiam bandymų metodui rekomenduotų rūšių normalus embrioninis vystymasis yra aprašytas (9) (10) (11) (12). 29. Nenormalus elgesys : anomalijas, pvz., hiperventiliaciją, nekoordinuotą plaukimą, netipišką nejudrumą ir elgesį maitinant reikėtų registruoti atitinkamais laiko tarpais, atsižvelgiant į bandymo trukmę (pvz., šiltųjų vandenų žuvų – kartą per parą). Nors šie reiškiniai yra sunkiai kiekybiškai įvertinami, kartą pastebėti jie gali padėti aiškinti gaištamumo duomenis. 30. Masė : pasibaigus bandymui, reikėtų pasverti visas išgyvenusias žuvis bent kartotinio ėminio (ataskaitoje pateikiant kartotinio ėminio gyvūnų skaičių ir vieno gyvūno vidutinę masę); pageidautina nurodyti drėgno kūno (nušluostyto filtravimo popieriumi) masę, tačiau ataskaitoje galima pateikti sauso kūno masės duomenis (13). 31. Ilgis : pasibaigus bandymui matuojamas atskirų žuvų ilgis. Rekomenduojama matuoti visą ilgį, tačiau jei supuvo uodegos pelekas ar jis yra išėstas, galima matuoti standartinį ilgį. Visas vieno bandymo žuvis reikėtų matuoti tuo pačiu būdu. Atskirų žuvų ilgį galima matuoti, pvz., slankmačiu, skaitmeniniu fotoaparatu arba kalibruotu okuliaro mikrometru. Tipinis mažiausias ilgis nurodytas 2 priedėlyje. DUOMENYS IR ATASKAITOS RENGIMAS Rezultatų apdorojimas
Bandymo ataskaita
LITERATŪRA
1 priedėlis APIBRĖŽTYS Ilgis iki šakutės (FL)– ilgis nuo snukio galo iki uodeginio peleko vidurinių spindulių galo ir naudojamas toms žuvims, kurioms sunku nustatyti stuburo pabaigą (www.fishbase.org). Standartinis ilgis (SL) – žuvies ilgis, išmatuotas nuo snukio galo iki paskutiniojo slankstelio užpakalinio galo arba iki stuburo plokštės mediolateralinės dalies užpakalinio galo. Kitaip tariant, į šį matmenį neįtrauktas uodeginio peleko ilgis. (www.fishbase.org). Visas ilgis (TL) – ilgis nuo snukio galo iki uodeginio peleko ilgesnės mentės galo, paprastai matuojamas mentes prispaudus išilgai vidurio linijos. Tai yra tiesinis matmuo, o ne matuojamas pagal kūno išlinkimą (www.fishbase.org). 1 paveikslas Įvairių naudojamų ilgių apibūdinimas Standartinis ilgis Ilgis iki šakutės Visas ilgis Cheminė medžiaga – medžiaga arba mišinys. ECx – (x % poveikio koncentracija) – koncentracija, kuriai esant daromas poveikis x % bandymo organizmų, palyginti su kontroliniu ėminiu per tam tikrą veikimo laikotarpį. Pvz., EC50 yra įvertinta koncentracija, kuri daro poveikį 50 % veikiamos populiacijos bandymo vertinamajai baigčiai per tam tikrą veikimo laikotarpį. Mažiausia stebimo poveikio koncentracija (LOEC) – mažiausia bandymo koncentracija, kuriai esant stebimas cheminės medžiagos poveikis yra statistiškai reikšmingas, palyginti su kontroliniu ėminiu (p < 0,05). Tačiau esant visoms didesnėms nei LOEC bandymo koncentracijos vertėms, kenksmingas poveikis turėtų būti lygus arba didesnis nei poveikis, kuris būtų esant LOEC. Kai negalima įvykdyti šių dviejų sąlygų, turėtų būti pateiktas išsamus paaiškinimas, kaip buvo pasirinkta LOEC (taigi ir NOEC) vertė. Nurodymai pateikti 5 ir 6 priedėliuose. Nestebimo poveikio koncentracija (NOEC) – vos mažesnė nei LOEC bandymo koncentracija, kuri per nurodytą veikimo laikotarpį nedaro statistiškai reikšmingo poveikio (p < 0,05), palyginti su kontroliniu ėminiu. UVCB – nežinomos ar kintamos sudėties medžiagos, sudėtingųjų reakcijų produktai ar biologinės medžiagos. IUPAC – Tarptautinė teorinės ir taikomosios chemijos sąjunga. SMILES – supaprastinto molekulių pateikimo linijine forma specifikacija. 2 priedėlis REKOMENDUOJAMŲ RŪŠIŲ BANDYMŲ SĄLYGOS, TRUKMĖ IR IŠGYVENAMUMO KRITERIJAI
3 priedėlis REKOMENDUOJAMŲ RŪŠIŲ NERŠIANČIŲ IR BANDYMŲ GYVŪNŲ MAITINIMO BEI PRIEŽIŪROS REKOMENDACIJOS
4 priedėlis KAI KURIOS TINKAMO SKIEDIMO VANDENS CHEMINĖS CHARAKTERISTIKOS
5 priedėlis NOEC NUSTATYMO STATISTINĖS ANALIZĖS REKOMENDACIJOS Bendrosios nuostatos Analizės vienetas yra kartotinio ėminio indas. Todėl, atliekant nuolatinius matavimus, pvz., dydžio, reikėtų apskaičiuoti kartotinio ėminio vidurkį arba medianą ir šios kartotinio ėminio vertės yra analizės duomenys. Reikėtų įrodyti taikomų kriterijų galią, pageidautina pagrįstą atitinkama kiekvienos laboratorijos istorinių duomenų baze. Kiekvienai vertinamajai baigčiai reikėtų gauti poveikio dydį, kuris, taikant statistinius kriterijus, gali būti aptiktas esant 75–80 % galiai. Šio bandymų metodo kūrimo metu turimos duomenų bazės nustato galią, kuri yra įmanoma taikant rekomenduojamas statistines procedūras. Atskira laboratorija turėtų įrodyti savo sugebėjimą atitikti šį galios reikalavimą, atlikdama savo galios analizę arba įrodydama, kad kiekvieno atsako variacijos koeficientas (VK) nėra didesnis nei rengiant šias bandymo gaires naudoto VK 90-oji procentilė. Šios VK vertės pateiktos 1 lentelėje. Jei yra tik kartotinių ėminių vidurkiai ar medianos, į kartotinių ėminių VK galima neatsižvelgti. 1 lentelė 90-osios procentilės VK vertės, gautos pasirinktoms gėlavandenėms rūšims
Beveik visi statistiniai kriterijai, taikyti įvertinant laboratorijos toksikologinius tyrimus, yra skirti apdorotos grupės ir kontrolinių ėminių tiriamiems palyginimams. Dėl šios priežasties negalima reikalauti tikrinti pagal reikšmingą ANOVA F kriterijų prieš taikant Dunnett ar Williams kriterijų arba pagal reikšmingą Kruskal-Wallis kriterijų prieš taikant Jonckheere-Terpstra, Mann-Whitney ar Dunn kriterijų (Hochberg and Tamhane 1987, Hsu 1996, Dunnett 1955, 1964, Williams 1971, 1972, 1975, 1977, Robertson et al. 1988, Jonckheere 1954, Dunn 1964). Taikant Dunnett kriterijų, galima atlikti daugybines korekcijas, todėl jo klaidingi teigiami ir klaidingi neigiami rodikliai yra netinkami F kriterijaus reikšmingumui nustayti. Panašiai, mažėjimo tvarka taikomi Williams ir Jonckheere-Terpstra kriterijai, naudojant 0,05 reikšmingumo lygį, kiekvienoje pakopoje užtikrina visuminę 5 % klaidingai teigiamų rodiklių dalį, ir ši dalis bei kriterijų galia yra netinkami nustatant pagal F ar Kruskal-Wallis kriterijų reikšmingumą. Todėl reikia daryti Mann-Whitney ir Dunn kriterijų pataisą dėl daugybinių korekcijų ir tam rekomenduojama Bonferroni-Holm pataisa. Daugumą rekomendacijų dėl hipotezių tikrinimo ir šiems kriterijams pagrįsti naudojamų prielaidų tikrinimo išsamiai aptariama EBPO (2006 m.) dokumente, kuriame taip pat pateikiama daug bibliografijos šaltinių. Kontrolinių ėminių apdorojimas, kai naudojamas tirpiklis Jei naudojamas tirpiklis, reikėtų įtraukti skiedimo vandens kontrolinį ėminį ir tirpiklio kontrolinį ėminį. Jei tarp kontrolinių ėminių nenustatoma reikšmingo skirtumo, abu kontrolinius ėminius reikėtų palyginti dėl kiekvieno atsako ir sujungti atliekant statistinę analizę. Priešingu atveju tirpiklio kontrolinį ėminį reikėtų naudoti nustatant NOEC ar įvertinant ECx, o vandens kontrolinio ėminio nenaudoti. Žr. tinkamumo kriterijų apribojimus (7 pastraipa) Ilgiui, masei, išsiritusių ikrų arba nugaišusių ar nenormalių lervų daliai ir pirmajai ar paskutinei išsiritimo parai ar plaukimo pradžiai reikėtų taikyti T kriterijų arba Mann-Whitney kriterijų skiedimo vandens ir tirpiklio kontroliniams ėminiams palyginti esant 0,05 reikšmingumo lygiui, nekreipiant dėmesio į apdorotas grupes. Tikrinimo pagal šiuos kriterijus rezultatai turėtų būti pateikti ataskaitoje. Dydžio matavimai (ilgio ir masės) Atskirų žuvų ilgio ir masės verčių pasiskirstymas gali būti normalusis ar lognormalusis. Bet kuriuo atveju kartotinių ėminių vidutinės vertės linkusios į normalųjį pasiskirstymą, atsižvelgiant į centrinę ribinę teoremą, ir tai patvirtina daugiau kaip šimtas trijų gėlavandenių žuvų rūšių ankstyvųjų gyvenimo stadijų toksiškumo tyrimų. Be to, jei duomenys ar istorinės duomenų bazės rodo atskirų žuvų dydžio verčių lognormalųjį pasiskirstymą, galima apskaičiuoti atskirų žuvų verčių kartotinio ėminio vidurkio logaritmą ir tada analizės duomenys gali būti šių kartotinių ėminių vidurkių logaritmų antilogaritmai. Duomenis reikėtų patikrinti dėl atitikties normaliajam pasiskirstymui ir dispersijos vienalytiškumui. Šiam tikslu reikėtų naudoti ANOVA modelio liekanas ir koncentraciją kaip vienintelį nepriklausomą kintamąjį. Galima naudoti vizualinį nustatymą pagal sklaidos diagramas ir histogramas arba kamieninę-lapinę diagramą. Arba galima taikyti formalųjį kriterijų, pvz., Shapiro-Wilk ar Anderson-Darling. Atitiktis dispersijos vienalytiškumui gali būti įvertinta vizualiai tiriant tą pačią sklaidos diagramą arba formaliai pagal Levene kriterijų. Įvertinamas tik parametrinių kriterijų (pvz., Williams, Dunnett) normalumas ar dispersijos vienalytiškumas. Reikėtų atkreipti dėmesį į galimus riktus ir jų įtaką analizei. Galima taikyti Tukey riktų kriterijų ir vizualiai patikrinti pirmiau aprašytus liekanų grafikus. Reikėtų priminti, kad stebėjimo vienetas yra visas kartotinis ėminys, todėl riktus iš analizės reikėtų šalinti tik po kruopštaus tyrimo. Statistiniai kriterijai, kurie yra naudojami bandymų schemų ir biologinės tikimybės charakteristikoms yra tendencijos mažėjimo kriterijai, tokie kaip pvz., Williams ir Jonckheere-Terpstra. Tokiems kriterijams taikoma prielaida dėl koncentracijos ir atsako priklausomybės monotoniškumo, todėl duomenys turėtų būti vertinami siekiant nuoseklaus atitikimo tokiai prielaidai. Tai galima atlikti vizualiai, pagal kartotinių ėminių vidurkių sklaidos diagramą palyginant su bandymo koncentracijom. Būtų naudinga perdengti sklaidos diagramą tiesinio grafiko dalimis, kurios sujungtų koncentracijos vidurkius kaip kartotinio ėminio imties dydžio svertinius vidurkius. Didelis tokio tiesinio grafiko dalių nukrypimas nuo monotoniškumo rodytų, kad galbūt reikėtų naudoti ne tendencijos mažėjimo kriterijus. Arba galima taikyti formalius kriterijus. Paprastas formalus kriterijus yra apskaičiuoti koncentracijos vidurkių tiesinius ir kvadratinius kontrastus. Jei kvadratinis kontrastas yra reikšmingas, o tiesinis – ne, tai rodo, kad gali būti monotoniškumo problema, kurią reikėtų įvertinti pagal grafikus. Jei problema – normalumas ar dispersijos vienalytiškumas, šiuos kontrastus galima gauti pagal rangų transformacijos duomenis. Galima taikyti alternatyvias procedūras, pvz., Bartholomew monotoniškumo kriterijų, bet ši procedūra sudėtingesnė. 2 paveikslas Struktūrinė diagrama NOEC gauti pagal dydžio (ilgio ir masės) matavimus 
Tais atvejais, kai duomenys neatitinka šių kriterijų reikalavimų, NOEC nustatoma mažėjimo tvarka taikant Williams ar Jonckheere-Terpstra kriterijus. Šios procedūros pateiktos EBPO (2006 m.). Jei duomenys neatitinka mažėjimo tvarka taikomo tendencijos kriterijaus, galima taikyti Dunnett kriterijų ar Tamhane-Dunnett (T3) kriterijų, kurie abu turi pataisas dėl daugybinių korekcijų. Taikant šiuos kriterijus daroma prielaida dėl normalumo, o Dunnett kriterijaus atveju – dėl dispersijos vienalytiškumo. Jei duomenys šių sąlygų neatitinka, galima taikyti Dunn neparametrinį kriterijų. Išsami informacija apie šiuos kriterijus pateikta EBPO (2006 m.). 2 paveiksle pateikta tinkamų kriterijų pasirinkimo apžvalga. Išsiritimas iš ikrų ir lervų išgyvenamumas Duomenys yra išsiritimo iš ikrų ar išgyvenusių lervų dalis atskirame kartotiniame ėminyje. Šias dalis reikėtų įvertinti dėl didesnės nei binominio skirstinio dispersijos, kuri yra įprastinė, bet ne visuotinė tokių matavimų dispersija. 3 paveiksle pateiktoje struktūrinėje diagramoje pateiktos rekomendacijos dėl tinkamo kriterijaus pasirinkimo; išsamus aprašymas pateiktas tekste. Dažniausiai taikomi du kriterijai. Tai yra Tarone C(α) kriterijus (Tarone, 1979 m.) ir chi kvadratu kriterijus, kurių kiekvienas taikomas atskirai kiekvienai bandymo koncentracijai. Jei didesnė nei binominio skirstinio dispersija nustatoma nors vienai bandymo koncentracijai, reikėtų taikyti metodus, kurie su tokia sąlyga būtų suderinami. 1 formulė. Tarone C (α) kriterijus (Tarone 1979 m.)
čia: ̂ – vidutinė dalis esant tam tikrai koncentracijai, m – kartotinių ėminių indų skaičius, nj – subjektų skaičius kartotiniame ėminyje j, ir xj – reaguojančių subjektų tame kartotiniame ėminyje skaičius, pvz., neišsiritusių ar žuvusių. Šis kriterijus taikomas kiekvienai koncentracija atskirai. Į šį kriterijų galima žiūrėti kaip į pataisytą chi kvadratu kriterijų, bet Tarone atliktas ribotos galios modeliavimas parodė, kad jis yra didesnės galios nei chi kvadratu kriterijus. 3 paveikslas. Struktūrinė diagrama NOEC gauti pagal išsiritimą iš ikrų ir lervų gaištamumą 
Jei nėra reikšmingų didesnės nei binominio skirstinio dispersijos įrodymų, galima taikyti Cochran-Armitage kriterijų mažėjimo tvarka. Šis kriterijus neatsižvelgia į kartotinius ėminius, todėl, jei yra tokių įrodymų, reikėtų taikyti Cochran-Armitage kriterijų su Rao-Scott pataisa (RSCA), kuri atsižvelgia į kartotinius ėminius, kartotinių ėminių dydį ir į didesnę nei binominio skirstinio dispersiją, todėl ir yra rekomenduojama. Alternatyvūs kriterijai yra Williams ir Jonckheere-Terpstra kriterijai mažėjimo tvarka ir Dunnett kriterijus, aprašyti dydžio matavimams. Šie kriterijai taikomi, kai yra didesnė nei binominio skirstinio dispersija ar kai jos nėra, bet jų galia yra kažkiek mažesnė (Agresti 2002, Morgan 1992, Rao and Scott 1992, 1999, Fung et al. 1994, 1996). Pirmoji arba paskutinė išsiritimo arba plaukimo para Atsakas yra sveikas skaičius, rodantis bandymo dieną, kurią yra stebimas nurodytas parametras tam tikrame kartotinio ėminio inde. Verčių intervalas paprastai yra labai ribotas ir dažnai esama didelės susijusių verčių dalies, pvz., ta pati pirmoji išsiritimo para stebima visuose kontroliniuose kartotiniuose ėminiuose ir galbūt vienos ar dviejų mažos koncentracijos verčių ėminiuose. Tokiems duomenims netinka parametriniai kriterijai, pvz., Williams ir Dunnett kriterijai. Jei nėra didelio nemonotoniškumo įrodymų, Jonckheere-Terpstra kriterijus mažėjimo tvarka turi didelę galią bandomosios cheminės medžiagos poveikiui aptikti. Priešingu atveju galima taikyti Dunn kriterijų. Lervų anomalijos Atsakas yra kokių nors anomalijų turinčių lervų skaičius. Šis atsakas labai dažnai yra mažo dažnumo ir turi kai kurių panašių pirmosios išsiritimo dienos problemų, taip pat kartais pastebima nepastovi koncentracijos ir atsako priklausomybė. Jei duomenys bent apytikriai atitinka monotonišką priklausomybės nuo koncentracijos formą, Jonckheere-Terpstra kriterijus mažėjimo tvarka turi didelę galią poveikiui aptikti. Priešingu atveju galima taikyti Dunn kriterijų. NUORODOS Agresti, A. (2002); Categorical Data Analysis, second edition, Wiley, Hoboken. Dunnett C. W. (1955); A multiple comparison procedure for comparing several treatments with a control, J. American Statistical Association 50, 1096-1121. Dunn O. J. (1964 ); Multiple Comparisons Using Rank Sums, Technometrics 6, 241-252. Dunnett C. W. (1964); New tables for multiple comparisons with a control, Biometrics 20, 482-491. Fung, K.Y., D. Krewski, J.N.K. Rao, A.J. Scott (1994); Tests for Trend in Developmental Toxicity Experiments with Correlated Binary Data, Risk Analysis 14, 639-648. Fung, K.Y, D. Krewski, R.T. Smythe (1996); A comparison of tests for trend with historical controls in carcinogen bioassay, Canadian Journal of Statistics 24, 431-454. Hochberg, Y. and A. C. Tamhane (1987); Multiple Comparison Procedures, Wiley, New York. Hsu, J.C. (1996); Multiple Comparisons: Theory and Methods; Chapman and Hall/CRC Press, Boca Raton. Jonckheere A. R. (1954); A distribution-free k-sample test against ordered alternatives, Biometrika 41, 133. Morgan, B.J.T. (1992); Analysis of Quantal Response Data, Chapman and Hall, London. OECD (2006). Current approaches in the statistical analysis of ecotoxicity data: A guidance to application. Series on Testing and Assessment, No. 54. Organisation for Economic Co-operation and Development, OECD, Paris.. Rao J.N.K. and Scott A.J. (1992) – A simple method for the analysis of clustered binary data, Biometrics 48, 577-585. Rao J.N.K. and Scott A.J. (1999) – A simple method for analyzing overdispersion in clustered Poisson data, Statistics in Medicine 18, 1373-1385. Robertson, T., Wright F.T. and Dykstra R.L. (1988); Order restricted statistical inference, Wiley. Tarone, R.E. (1979); Testing the goodness of fit of the Binomial distribution, Biometrika 66, 585-590. Williams D.A. (1971); A test for differences between treatment means when several dose levels are compared with a zero dose control, Biometrics 27, 103-117. Williams D.A. (1972); The comparison of several dose levels with a zero dose control, Biometrics 28, 519-531. Williams D. A. (1975); The Analysis of Binary Responses from Toxicological Experiments Involving Reproduction and Teratotlogy, Biometrics 31, 949-952. Williams D.A. (1977); Some inference procedures for monotonically ordered normal means, Biometrika 64, 9-14. 6 priedėlis STATISTINĖS ANALIZĖS REKOMENDACIJOS ĮVERČIAMS GAUTI REGRESIJOS METODU Bendrosios nuostatos Modeliui priderinti naudoti stebėjimų duomenys yra kartotinių ėminių vidurkiai (ilgio ir masės) arba kartotinių ėminių dalys (išsiritimo iš ikrų ir lervų gaištamumo) (EBPO, 2006 m.). Paprastai patariama svertinė regresija pagal kartotinio ėminio imties dydį. Galima taikyti kitas svertinio įvertinimo schemas, pvz., svertinį įvertinimą pagal prognozuojamą vidutinį atsaką arba jo ir kartotinio ėminio imties dydžio derinį. Svertinis įvertinimas pagal vienos koncentracijos ėminių atvirkštinę dispersiją nerekomenduojamas (Bunke et al. 1999, Seber and Wild, 2003, Motulsky and Christopoulos 2004, Huet et al. 2003). Transformuojant atsakus prieš analizę, reikėtų išsaugoti stebėjimo duomenų nepriklausomybę, ir ECx, o jos pasikliovimo ribos turėtų būti išreikštos pradiniais matavimo vienetais, o ne transformuotais vienetais. Pvz., ilgio logaritmo 20 % pokytis nėra lygiavertis ilgio 20 % pokyčiui (Lyles et.al 2008, Draper and Smith 1999). 4 paveiksle pateikta struktūrinė diagrama ECx įverčiams gauti. Išsamesnis paaiškinimas pateiktas tolesniame tekste. 4 paveikslas ECx įvertinimo pagal kartotinių ėminių vidutinį ilgį, masę arba išsiritimo iš ikrų ar lervų gaištamumo dalį struktūrinė diagrama, išsamesnis paaiškinimas pateiktas tekste 
Išsiritimo iš ikrų ir lervų gaištamumo aspektai Jei imamas išsiritimas iš ikrų ir lervų gaištamumas, paprastai būtų geriau priderinti mažėjimo modelį, nebent būtų priderinamas probit regresijos modelis, kaip aprašyta toliau. T. y reikėtų modeliuoti pagal neišsiritusių ikrų ar žuvusių lervų dalį. To priežastis – ECx atitinka koncentraciją, kuriai esant pokytis yra lygus x % kontrolinio ėminio vidutinio atsako. Jei neišsirita 5 % kontrolinio ėminio ikrų ir modeliuojama pagal neišsiritusių ikrų skaičių, EC20 rodytų koncentraciją, kuriai esant yra 20 % pokytis, palyginti su 5 % kontrolinio ėminio neišsiritusių ikrų, t. y. pokytis yra 0,2 × 0,05 = 0,01 arba 1 procentinis punktas ir iš viso neišsirito 6 %. Toks nedidelis pokytis negali būti kaip nors prasmingai įvertintas pagal turimus duomenis ir nėra biologiškai svarbus. Tačiau, jei modeliuojama pagal išsiritusių ikrų kiekį, kontrolinio ėminio dalis šiame pavyzdyje būtų 95 %, o 20 % sumažėjimas, palyginti su kontrolinio ėminio vidurkiu, sudarytų pokytį 0,95 × 0,2 = 0,18, taigi nuo 95 % iki 77 % (= 95 – 18) išsiritusių ikrų procentinės dalies, todėl poveikio koncentracija gali būti įvertinta ir ji turbūt daug svarbesnė. Taip nėra matuojant dydį, nors neigiamas poveikis dydžiui paprastai reiškia dydžio sumažėjimą. Dydžio (ilgio arba masės) ir išsiritimo iš ikrų ar lervų išgyvenamumo dalies modeliai Išskyrus Brain-Cousens hormezės modelį, visi šie modeliai yra aprašyti ir rekomenduojami EBPO (2006 m.). Tai, kas vadinama EBPO 2-5, taip pat yra aptarta dėl ekotoksiškumo bandymų, Slob (2002). Aišku, kad yra daug kitų modelių, kurie galėtų būti naudingi. Bunke et al. (1999) išvardyta daug į šį dokumentą neįtrauktų modelių ir yra labai daug nuorodų į kitus modelius. Toliau išvardyti metodai yra siūlomi kaip ypač tinkami ekotoksiškumo bandymams ir yra plačiai taikomi. Penkios bandymo koncentracijos vertės ir kontrolinis ėminys:
Daugiau kaip šešios bandymo koncentracijos vertės ir kontrolinis ėminys:
Jei yra vizualūs hormezės įrodymai (maža jos tikimybė išsiritimo iš ikrų ar lervų išgyvenamumo daliai, bet kartais stebima dydžio duomenims):
Alternatyvūs išsiritimo iš ikrų ar lervų išgyvenamumo dalies modeliai
Atskiro modelio suderintumas
Modelių palyginimas
ECx įverčio kokybė ECx pasikliovimo intervalas (PI) neturėtų būti labai platus. Statistiškai reikėtų pagrįsti sprendimą dėl pasikliovimo intervalo pločio ir dėl vis dar tinkamo ECx naudingumo. Išsiritimo iš ikrų ir dydžių duomenų regresijos modelių priderinimo tikrinimas rodo, kad maždaug 75 % ECx (x = 10, 20 ar 30) pasikliovimo intervalų aprėpia ne daugiau kaip dvi koncentracijos vertes. Taip gaunamos bendrosios priimtinumo rekomendacijos ir praktinės pasiekiamumo rekomendacijos. Daug autorių teigia, kad ataskaitoje reikia pateikti visų modelio parametrų pasikliovimo intervalus, o platus modelio parametrų pasikliovimo intervalas rodo nepriimtiną modelį (Ott and Longnecker 2008, Alvord and Rossio 1993, Motulsky and Christopoulos 2004, Lyles et al. 2008, Seber and Wild 2003, Bunke et al. 1999, Environment Canada 2005). ECx pasikliovimo intervale (ar kitame modelio parametre) neturėtų būti nulio (Motulsky and Christopoulos 2004). Tai yra tas pat, kaip regresijai būtų minimalus reikšmingas skirtumas, kuris dažnai nurodomas taikant hipotezių tikrinimo metodus (pvz., Wang et al 2000). Tai taip pat atitinka LOEC atsakų vidurkių pasikliovimo intervalą, į kurį nepatenka kontrolinio ėminio vidurkis. Reikėtų įsitikinti, kad parametrų įverčiai yra moksliškai patikimi. Pvz., jei y0 pasikliovimo intervalas yra ± 20 %, joks EC10 įvertis nėra patikimas. Jei koncentracijai C pagal modelį prognozuojamas 20 % poveikis, o didžiausias stebimas poveikis esant C ir mažesnei koncentracijai yra 10 %, EC20 nėra patikima (Motulsky and Christopoulos 2004, Wang et al. 2000, Environment Canada 2005). ECx neturėtų prireikti ekstrapoliacijos toliau nei teigiamų koncentracijos verčių intervalas (Draper and Smith 1999, EBPO 2006). Pvz., bendroji rekomendacija galėtų būti tokia, kad ECx turi būti ne daugiau kaip 25 % mažesnė nei mažiausia bandyta koncentracija ir ne daugiau kaip 25 % didesnė nei didžiausia bandyta koncentracija. NUORODOS Alvord, W.G., Rossio, J.L. (1993); Determining confidence limits for drug potency in immunoassay, Journal of Immunological Methods 157, 155-163. Brain P. and Cousens R. (1989); An equation to describe dose responses where there is stimulation of growth at low doses. Weed res. 29: 93-96. Bunke, O., Droge, B. and Polzehl, J. (1999). Model selection, transformations and variance estimation in nonlinear regression. Statistics 33, 197-240. Collett, D. (2002); Modelling Binary Data, second edition, Chapman and Hall, London. Collett, D. (2003); Modelling Survival Data in Medical Research, second edition, Chapman and Hall, London. Draper, N.R. and Smith, H. (1999); Applied Regression Analysis, third edition. New York: John Wiley & Sons. Environment Canada (2005); Guidance Document on Statistical Methods for Environmental Toxicity Tests, Report EPS 1/RM/46 Huet, S., A. Bouvier, M.-A. Poursat, E. Jolivet (2003); Statistical Tools for Nonlinear Regression: A Practical Guide with S-PLUS and R Examples, Springer Series in Statistics, New York. Lyles, R. H., C. Poindexter, A. Evans, M. Brown, and C.R. Cooper (2008); Nonlinear Model-Based Estimates of IC50 for Studies Involving Continuous Therapeutic Dose-Response Data, Contemp Clin Trials. 2008 November; 29(6): 878–886. Morgan, B.J.T. (1992); Analysis of Quantal Response Data, Chapman and Hall, London. Motulsky, H., A. Christopoulos (2004); Fitting Models to Biological Data Using Linear and Nonlinear Regression: A Practical Guide to Curve Fitting, Oxford University Press, USA. O'Hara Hines, R. J. and J. F. Lawless (1993); Modelling Overdispersion in Toxicological Mortality Data Grouped over Time, Biometrics Vol. 49, pp. 107-121 OECD (2006); Current approaches in the statistical analysis of ecotoxicity data: A guidance to application. Series Testing and Assessment, No. 54, Organisation for Economic Co-operation and Development, OECD, Paris. Ott, R.L., M.T. Longnecker, An Introduction to Statistical Methods and Data Analysis, sixth edition, 2008, Brooks-Cole, Belmont, CA Ratkowsky, D.A. (1993); Principles of nonlinear regression, Journal of Industrial Microbiology 12, 195-199. Seber, G.A.F., C.J. Wild, Nonlinear Regression, Wiley, 2003 Slob W. (2002); Dose-response modelling of continuous endpoints. Toxicol. Sci., 66, 298-312 Wang, Q., D.L. Denton, and R. Shukla (2000); Applications and Statistical Properties Of Minimum Significant Difference-Based Criterion Testing In a Toxicity Testing Program, Environmental Toxicology and Chemistry, Vol. 19, pp. 113–117, 2000. C.48 Trumpalaikis žuvų reprodukcijos tyrimas ĮVADAS
PRADINIAI ASPEKTAI IR APRIBOJIMAI
BANDYMO PRINCIPAS
BANDYMO PRIIMTINUMO KRITERIJAI
METODO APRAŠYMAS Aparatūra
Vanduo
Bandymų tirpalai
Žuvų laikymas
Parengiamasis laikotarpis ir žuvų atranka
BANDYMO SCHEMA
Bandymų koncentracijos verčių parinkimas
PROCEDŪRA Bandymų žuvų atranka ir svėrimas
Veikimo sąlygos Trukmė
Maitinimas
Šviesa ir temperatūra
Analizinių nustatymų ir matavimų dažnumas
Stebėjimai
Išgyvenamumas
Elgesys ir išvaizda
Vislumas
Humaniškas žuvų numarinimas
Antrinių lytinių požymių stebėjimas
Vitelogeninas (VTG)
Lytinių liaukų histopatologijos įvertinimas
DUOMENYS IR ATASKAITOS RENGIMAS Biologinių žymenų atsako vertinimas taikant dispersinės analizės (ANOVA) metodą
Rezultatų ataskaita
BANDYMŲ REZULTATŲ AIŠKINIMO IR PRIĖMIMO REKOMENDACIJOS
LITERATŪRA
1 priedėlis SANTRUMPOS IR APIBRĖŽTYS Cheminė medžiaga – medžiaga arba mišinys. VK – variacijos koeficientas. IFA – imunofermentinė analizė. PHL ašis – pagumburio, hipofizės ir lytinių liaukų ašis. Įkrova – drėgnų žuvų masė vandens tūrio vienete. DTK – didžiausia toleruojama koncentracija, atitinkanti maždaug 10 % LC50. Žuvų tankis – žuvų skaičius, tenkantis vandens tūrio vienetui. Bandomoji cheminė medžiaga – taikant šį metodą bandoma medžiaga arba mišinys. VTG – vitelogeninas yra fosfolipoglikoproteininis kiaušinio trynio baltymų pirmtakas, kurio paprastai yra visų kiaušinius dedančių gyvūnų rūšių lytiškai aktyvių patelių organizme. 2 priedėlis BANDYMO SĄLYGOS ATLIEKANT POVEIKIO ŽUVŲ ENDOKRININEI SISTEMAI ATRANKOS TYRIMĄ
3 priedėlis KAI KURIOS TINKAMO SKIEDIMO VANDENS CHEMINĖS SAVYBĖS
4A priedėlis NERŠTO SUBSTRATAS ZEBRINEI DANIJAI Neršto padėklas – vien tik iš stiklo pagamintas instrumentinis indas, pvz., 22 × 15 × 5,5 cm (ilgis × plotis × gylis), uždengtas nuimamomis nerūdijančiojo plieno grotelėmis (su 2 mm pločio akutėmis). Grotelės turėtų uždengti instrumentinio indo angą žemiau jo krašto. 
Ant grotelių turėtų būti pritvirtintas neršto substratas. Jis turėtų sudaryti struktūrą, į kurią žuvys galėtų įplaukti. Pvz., jai gauti tinka dirbtiniai akvariumo augalai, pagaminti iš žalios spalvos plastiko (reikia pažymėti, kad reikėtų atsižvelgti į galimą bandomosios cheminės medžiagos adsorbciją ant plastiko). Medžiagas iš plastiko reikėtų gana ilgai mirkyti pakankamame šilto vandens tūryje, siekiant užtikrinti, kad jokios cheminės medžiagos nepatektų į bandymo vandenį. Naudojant stiklines medžiagas, reikėtų užtikrinti, kad žuvys negalėtų susižeisti ir nebūtų varžomi jų staigūs judesiai. Siekiant užtikrinti, kad nebūtų neršiama už padėklo ribų, atstumas tarp jo ir stiklinių sienelių turėtų būti bent 3 cm. Ant padėklo padėti ikrai iškrenta pro groteles ir jų ėminius galima paimti praėjus 45–60 min nuo apšvietimo pradžios. Skaidrūs ikrai nelimpa ir juos galima lengvai suskaičiuoti naudojant šoninę šviesą. Viename inde laikant penkias pateles, mažiau kaip 20 per parą padėtų ikrų skaičius gali būti laikomas mažu, iki 100 ikrų – vidutiniu ir daugiau kaip 100 ikrų – dideliu. Neršto padėklą reikėtų išimti, ikrus surinkti ir padėklą įdėti atgal į bandymų indą kuo vėliau vakare arba labai anksti ryte. Padėklas turėtų būti grąžintas į bandymo indą ne vėliau kaip per valandą, nes kitaip neršto substratas kaip dirgiklis gali sukelti individualų poravimąsi ir nerštą neįprastu laiku. Jei atsižvelgiant į situaciją padėklą nerštui reikia įdėti vėliau, tai reikėtų padaryti ne vėliau kaip per devynias valandas nuo apšvietimo pradžios. Tokiu vėlyvu paros metu nerštas nebevyksta. 4B priedėlis NERŠTO SUBSTRATAS JUODAJAI DRŪTAGALVEI RAINEI Į kiekvieną bandymų kamerą įdedama po dvi ar tris sujungtas neršto slėptuves ir padėklus, pagamintus iš plastiko, keramikos, stiklo derinio arba nerūdijančiojo plieno (pvz., 80 mm ilgio pilką pusapvalį lataką, padėtą ant 130 mm ilgio padėklo su užlenktais kraštais) (žr. paveikslą). Įrodyta, kad tinkamai pagamintos polivinilchlorido ar keraminės slėptuvės yra tinkamos naudoti kaip neršto substratas (Thorpe ir kiti, 2007). Rekomenduojama slėptuves šlifuoti, kad pagerėtų sukibimas. Padėklą taip pat reikėtų ekranuoti, kad žuvys negalėtų pasiekti nukritusių ikrų, nebent būtų įrodyta, kad ikrai efektyviai prilimpa prie naudojamo neršto substrato. 
Padėklo pagrindas skirtas visiems prie slėptuvės paviršiaus neprilipusiems, taigi į indo dugną nukritusiems ikrams (arba ikrams, padėtiems tiesiai ant plokščio plastikinio pagrindo) sulaikyti. Prieš naudojant, visi neršto substratai bent 12 h turėtų būti mirkomi skiedimo vandenyje. Thorpe KL, Benstead R, Hutchinson TH, Tyler CR, 2007. An optimised experimental test procedure for measuring chemical effects on reproduction in the fathead minnow, Pimephales promelas. Aquatic Toxicology, 81, 90–98. 5A priedėlis JUODOSIOS DRŪTAGALVĖS RAINĖS ANTRINIŲ LYTINIŲ POŽYMIŲ VERTINIMAS TAM TIKROMS ENDOKRININĘ SISTEMĄ VEIKIANČIOMS CHEMINĖMS MEDŽIAGOMS APTIKTI Apžvalga Suaugusios juodosios drūtagalvės rainės fizinės išvaizdos ypatybės, kurios gali būti svarbios atliekant endokrininę sistemą ardančių medžiagų bandymą, yra kūno spalva (t. y. šviesi ar tamsi), spalvų raštas (t. y. vertikalių dryžių buvimas arba nebuvimas), kūno forma (t. y. galvos ir krūtinės srities forma, pilvo išsipūtimas) ir rūšims būdingi antriniai lytiniai požymiai (t. y. poravimosi gumburėlių skaičius ir dydis, sprando pagalvėlės dydis ir kiaušdėtis). Poravimosi gumburėliai yra ant aktyvaus reprodukcinio amžiaus juodosios drūtagalvės rainės patino galvos (sprando pagalvėlės) ir paprastai yra simetriškai išsidėstę iš abiejų pusių (Jensen et al. 2001). Kontrolinės patelės ir abiejų lyčių žuvų jaunikliai gumburėlių neturi (Jensen et al. 2001). Aplink patinų akis ir tarp jų šnervių gali būti iki aštuonių atskirų gumburėlių. Daugiausia (ir didžiausių) gumburėlių yra išsidėstę dviem lygiagrečiomis linijomis iš karto po šnervėmis ir virš burnos. Daugelis žuvų turi gumburėlių grupes po apatiniu žandu; arčiausiai burnos paprastai yra pavienės poros, o arčiau pilvo esančią grupę gali sudaryti iki keturių gumburėlių. Faktinis gumburėlių skaičius retai viršija 30 (18–28 intervalas; Jensen et al. 2001). Pagrindiniai gumburėliai (kalbant apie jų skaičių) yra atskira, palyginti apvali, struktūra, kurios aukštis apytiksliai atitinka spindulį. Dauguma aktyvaus reprodukcinio amžiaus patinų taip pat turi bent kelis gumburėlius, kurie yra padidėję ir išaugę taip, kad jų neįmanoma įžiūrėti kaip atskirų struktūrų. Veikiant kai kurių rūšių endokrininę sistemą ardančioms cheminėms medžiagoms, priešingos lyties gyvūnams gali pasireikšti anomalūs antriniai lytiniai požymiai; pvz., dėl androgenų receptorių agonistų, tokių kaip 17α-metiltestosteronas ar 17β-trenbolonas, juodosios drūtagalvės rainės patelėms gali išsivystyti poravimosi gumburėliai (Smith 1974; Ankley et al. 2001; 2003), o dėl estrogenų receptorių agonistų gali sumažėti patinų poravimosi gumburėlių skaičius arba dydis (Miles-Richardson et al. 1999; Harries et al. 2000). Toliau pateiktas juodosios drūtagalvės rainės poravimosi gumburėlių apibūdinimas, pagrįstas procedūromis, taikytomis JAV Aplinkos apsaugos agentūros Duluto (Minesota) laboratorijoje. Tam tikrus produktus ir (arba) įrangą galima pakeisti panašiomis turimomis medžiagomis. Tyrimą geriausia atlikti naudojant padidinimo stiklą su apšvietimu arba 3× dviejų okuliarų mikroskopą su apšvietimu. Žuvis tiriama iš nugaros pusės, priešakine dalimi į priekį (galva nukreipta į tyrėjo pusę).
Gumburėlių skaičiavimas ir įvertinimas balais Nustatytos šešios specifinės juodosios drūtagalvės rainės kūno zonos, kuriose reikia įvertinti gumburėlių buvimą ir vystymąsi. Esamų gumburėlių vietai ir kiekiui sužymėti parengta lentelė (žr. šio priedėlio gale). Gumburėlių skaičius registruojamas, o jų dydis kiekviename organizme gali būti kiekybiškai įvertintas balais taip: 0 – nėra, 1 – yra, 2 – padidėjęs ir 3 – aiškiai išreikštas (1 paveikslas). Įvertis 0 – gumburėlių nėra. Įvertis 1 – gumburėlių yra; įvertis taikomas, jei bent vieno gumburėlio aukštis yra beveik lygus jo spinduliui. Įvertis 2 – padidėję gumburėliai; nustatomi pagal tai, kad jų audiniai primena žvaigždutę, paprastai didelio apskrito pagrindo, su einančiais iš centro grioveliais ir kanalėliais. Gumburėlių viršus dažnai yra nelygus, bet kartais gali būti kiek suapvalintas. Įvertis 3 – gumburėliai aiškiai išreikšti, paprastai gana dideli ir suapvalinti, turi mažiau apibrėžtą struktūrą. Kartais šie gumburėliai susilieja ir sudaro vientisą masę vienoje arba keliose srityse (B, C ir D, kaip apibūdinta toliau). Spalva ir forma panašios į 2 balais įvertintų gumburėlių, bet kartais gali būti gana silpnai išreikštos. Naudojant šią vertinimo balais sistemą, normaliam kontroliniam patinui, kuris turi 18–20 gumburėlių, paprastai gaunama balų suma < 50 (Jensen et al. 2001). 1 paveikslas 
Faktiškai kai kurios žuvys gali turėti daugiau gumburėlių nei lentelėje yra konkrečiai vertinamai sričiai skirtų langelių. Jei taip atsitinka, papildomi įverčiai gali būti įrašomi į langelį arba jo dešinėje ar kairėje. Todėl lentelė nebūtinai turi būti simetriška. Galima būtų sukurti papildomą būdą suporuotiems arba vertikaliai palei horizontaliąją burnos liniją sujungtiems gumburėliams žymėti, dviejų gumburėlių įverčius įrašant į vieną langelį. Žymėjimo sritys:
NUORODOS
5B priedėlis MEDAKOS ANTRINIŲ LYTINIŲ POŽYMIŲ VERTINIMAS TAM TIKROMS ENDOKRININĘ SISTEMĄ VEIKIANČIOMS CHEMINĖMS MEDŽIAGOMS APTIKTI Aprašytas spenelinių ataugų (*10), kurios yra medakos (Oryzias latipes) antriniai lytiniai požymiai, matavimas.
Matavimas
1 paveikslas Schemoje parodyti analinio peleko formos ir dydžio skirtumai pagal lytį. A – patino, B – patelės. Oka, T. B., 1931. On the processes on the fin rays of the male of Oryzias latipes and other sex characters of this fish. J. Fac. Sci., Tokyo Univ., IV, 2: 209-218. 
2 paveikslas A – ataugos ant sujungtų analinio peleko spindulio plokštelių. J.P. – sujungta plokštelė; A.S. – ašinis atstumas; P – atauga. B – distalinis analinio peleko galas. Aktinotrichijos (Act.) yra ant galiuko. Oka, T. B., 1931. On the processes on the fin rays of the male of Oryzias latipes and other sex characters of this fish. J. Fac. Sci., Tokyo Univ., IV, 2: 209-218. 
3 paveikslas Nuotraukoje parodyta žuvies kūno pjūvio vieta, kai lytinė liauka fiksuojama kitame fiksavimo tirpale nei 10 % formalino tirpalas neutraliame buferiniame tirpale. Tokiu atveju likusi kūno dalis bus nupjauta preparavimo peiliu (raudona linija) darant pjūvį tarp priekinės analinio peleko dalies ir išangės, žuvies kūno dalis arčiau galvos bus įdėta į lytinės liaukos fiksavimo tirpalą, o uodeginė dalis – į 10 % formalino tirpalą neutraliame buferiniame tirpale. 
6 priedėlis REKOMENDUOJAMOS ĖMINIŲ ĖMIMO VITELOGENINO ANALIZEI ATLIKTI PROCEDŪROS Reikėtų stengtis išvengti kryžminio patinų ir patelių VTG ėminių užteršimo. 1A procedūra. Juodoji drūtagalvė rainė, kraujo paėmimas iš uodegos venos arba arterijos Po anestezijos uodegos kotelis dalinai įpjaunamas skalpeliu ir iš uodegos venos arba arterijos heparinizuotu mikrohematokrito kapiliariniu vamzdeliu paimamas kraujas. Paėmus kraujo, plazma greitai atskiriama, esant 15 000 g centrifuguojant 3 min (arba esant 15 000 g – 10 min 4 oC temperatūroje). Jei reikia, po centrifūgavimo galima nustatyti hematokrito procentinę dalį. Plazmos frakcija paimama iš mikrohematokrito vamzdelio ir iki vitelogenino analizės laikoma centrifugavimo mėgintuvėlyje su 0,13 vienetų aprotinino (proteazės inhibitoriaus) –80 oC temperatūroje. Atsižvelgiant į juodosios drūtagalvės rainės dydį (kuris priklauso nuo lyties), iš vienos žuvies paprastai surenkama 5–60 mikrolitrų plazmos (Jensen et al. 2001). 1B procedūra. Juodoji drūtagalvė rainė, kraujo paėmimas iš širdies Kraują taip pat galima paimti atliekant širdies punkciją heparinizuotu švirkštu (1 000 vienetų heparino viename ml). Kraujas supilamas į Eppendorfo mėgintuvėlius (laikomus ant ledo) ir centrifuguojamas (5 min, 7 000 g, kambario temperatūroje). Iki analizės plazmą reikėtų perpilti į švarius Eppendorfo mėgintuvėlius (padalijus į alikvotines dalis, jei plazmos tūris yra pakankamas) ir greitai užšaldyti – 80 oC temperatūroje (Panter et al., 1998). 2A procedūra. Japoninė medaka, medakos kepenų pašalinimas Bandymų žuvies paėmimas iš bandymų kameros
Kepenų pašalinimas
Pašalinus kepenis, žuvies skerdeną galima naudoti antriniams lytiniams požymiams įvertinti. Bandinys Jei iš bandymų žuvų paimtų kepenų bandinių parengiamasis apdorojimas atliekamas ne iš karto, jie laikomi ≤ – 70oC temperatūroje. 1 paveikslas Vieta priešais krūtinės pelekus įkerpama žirklėmis. 
2 paveikslas Pilvas prakerpamas žirklėmis išilgai vidurinės pilvo linijos iki vietos, esančios maždaug 2 mm iki išangės nuo galvos pusės. 
3 paveikslas Pilvo sienelės praskečiamos chirurginėmis žnyplėmis, kad būtų galima išimti kepenis ir kitus vidaus organus. (Taip pat pilvo sieneles galima prispausti iš šonų). Rodykle nurodytos kepenys. 
4 paveikslas Kepenys išpjaunamos ir išimamos chirurginėmis žnyplėmis. 
5 paveikslas Žarnynas atsargiai atitraukiamas chirurginėmis žnyplėmis. 
6 paveikslas Abu žarnyno galai ir prisitvirtinusi žarnaplėvė atskiriami žirklėmis. 
7 paveikslas (patelė) Tokia pati procedūra atliekama su patele. 
8 paveikslas Procedūra baigta. 
2B procedūra. Japoninė medaka (Oryzias latipes), kepenų parengiamasis apdorojimas vitelogenino analizei Iš IFA rinkinio paimamas homogenizavimo buferio buteliukas ir atvėsinamas smulkintu ledu (tirpalo temperatūra: ≤ 4oC). Jei naudojamas homogenizavimo buferis iš EnBio IFA rinkinio, tirpalas paliekamas atitirpti kambario temperatūroje, o tada butelis atvėsinamas smulkintu ledu. Apskaičiuojamas reikiamas homogenizavimo buferinio tirpalo tūris pagal kepenų masę (vienam kepenų mg imama 50 μl homogenizavimo buferinio tirpalo). Pvz., jei kepenys sveria 4,5 mg, reikia 225 μl homogenizavimo buferinio tirpalo. Ruošiamas visoms kepenims reikiamo homogenizavimo buferinio tirpalo tūrių sąrašas. Kepenų paruošimas parengiamajam apdorojimui
Parengiamojo apdorojimo procedūra 1) Homogenizavimo buferinio tirpalo įpylimas Pagal sąrašą patikrinamas kiekvieno konkretaus ėminio homogenizavimo buferinio tirpalo tūris ir reikiamam tūriui nustatoma mikropipetė (tūrio intervalas: 100–1 000 μl). Ant mikropipetės užmaunamas švarus antgalis. Paimama homogenizavimo buferinio tirpalo iš reagento butelio ir įpilama į 1,5 ml mikromėgintuvėlį su kepenimis. Homogenizavimo buferinio tirpalo įpilama į visus 1,5 ml mikromėgintuvėlius su kepenimis pagal pirmiau aprašytą procedūrą. Mikropipetės antgalio nauju pakeisti nereikia. Tačiau, jeigu antgalis užterštas arba įtariama, kad jis gali būti užterštas, antgalį reikėtų pakeisti. 2) Kepenų homogenizavimas
3) Kepenų homogenato suspensijos centrifugavimas
4) Skysčio virš nuosėdų surinkimas
Bandinio laikymas 0,5 ml mikromėgintuvėliai su kepenų homogenato skysčiu virš nuosėdų laikomi ≤ –70 oC iki jie bus panaudoti atliekant IFA. 3A procedūra Zebrinė danija, kraujo paėmimas iš uodegos venos arba arterijos Iš karto po anestezijos uodegos kotelis skersai įpjaunamas ir iš uodegos venos arba arterijos heparinizuotu mikrohematokrito kapiliariniu vamzdeliu paimamas kraujas. Imama 5–15 mikrolitrų kraujo, atsižvelgiant į žuvies dydį. Toks pat aprotinino buferinio tirpalo (6 mikrogramai/ml fosfatinio buferinio druskos tirpalo) tūris įtraukiamas į mikrokapiliarinį vamzdelį ir plazma nuo kraujo atskiriama centrifuguojant (5 min esant 600 g). Plazma surenkama į mėgintuvėlius ir iki vitelogenino ar kitų tiriamų baltymų analizės laikoma –20 oC temperatūroje. 3B procedūra. Zebrinė danija, kraujo paėmimas atliekant širdies punkciją Siekiant išvengti kraujo koaguliacijos ir baltymų irimo, ėminiai imami į fosfatinį buferinį druskos tirpalą (PBS), kuriame yra heparino (1 000 vienetų/ml) ir proteazės inhibitoriaus aprotinino (2 TIU/ml). Buferiniam tirpalui paruošti kaip sudedamąsias dalis rekomenduojama naudoti hepariną, amonio druską ir liofilizuotą aprotininą. Kraujo ėminiui paimti rekomenduojama naudoti švirkštą (1 ml) su fiksuota plona adata (pvz., Braun Omnikan-F). Švirkštą reikia iš anksto pripildyti buferinio tirpalo (maždaug 100 mikrolitrų), kad iš kiekvienos žuvies būtų visiškai išplautas nedidelis kraujo tūris. Kraujo ėminiai paimami atliekant širdies punkciją. Iš pradžių žuvį reikėtų anestezuoti MS-222 (100 mg/l). Tinkamai pritaikęs anesteziją, tyrėjas gali atskirti zebrinės danijos širdies plakimą. Atliekant širdies punkciją, švirkšto stūmoklis nestipriai įtempiamas. Paimamas kraujo tūris yra 20–40 mikrolitrų. Atlikus širdies punkciją, kraujo ir buferinio tirpalo mišinį reikėtų supilti į mėgintuvėlį. Plazma nuo kraujo atskiriama centrifuguojant (20 min, 5000 g) ir iki analizės turėtų būti laikoma – 80 oC temperatūroje. 3C procedūra. Standartinė veiklos procedūra (SVP). Zebrinė danija, galvos ir uodegos homogenizavimas
7 priedėlis VITELOGENINU SODRINTI ĖMINIAI IR TYRIMŲ SERIJOS PAMATINIS ETALONAS Kiekvieną dieną atliekant vitelogenino tyrimus analizuojamas sodrintas ėminys, paruoštas naudojant tyrimų serijos pamatinį etaloną. Pamatiniam tyrimų serijos etalonui paruošti naudojamas vitelogeninas imamas iš kitos partijos nei ta, kuri naudojama atliekamo tyrimo kalibravimo etalonams paruošti. Sodrintas ėminys ruošiamas į kontrolinio patino plazmą pridedant žinomą tyrimų serijos etalono kiekį. Ėminys sodrinamas turint tikslą gauti vitelogenino koncentraciją, kuri būtų 10–100 kartų didesnę nei numatoma kontrolinio patino vitelogenino koncentracija. Sodrinamą kontrolinio patino plazmos ėminį galima paimti iš vienos žuvies arba jis gali būti kelių žuvų sudėtinis ėminys. Nesodrintas kontrolinio patino plazmos poėminis analizuojamas bent dviejose kartotinėse duobutėse. Sodrintas ėminys taip pat analizuojamas bent dviejose kartotinėse duobutėse. Numatomai koncentracijai apskaičiuoti vidutinis dviejų kontrolinių patinų plazmos nesodrintų ėminių vitelogenino kiekis įdedamas į apskaičiuotą vitelogenino kiekį, įdėtą į sodrintus ėminius. Šios numatomos ir išmatuotos koncentracijos verčių santykis pateikiamas ataskaitoje kartu su kiekvienos tą dieną atliktų tyrimų serijos rezultatais. 8 priedėlis SPRENDIMUI PRIIMTI SKIRTA STATISTINĖS ANALIZĖS STRUKTŪRINĖ DIAGRAMA 
C.49 Ūmaus toksiškumo žuvų embrionams (FET) bandymas ĮVADAS
BANDYMO PRINCIPAS
PRADINIAI ASPEKTAI
BANDYMO TINKAMUMAS
METODO APRAŠYMAS
Aparatūra
Bandymo kameros
Vanduo ir bandymo sąlygos
Bandymo tirpalai
Veislinių žuvų priežiūra
Kvalifikacijos tikrinimas
Ikrų gamyba
Ikrų atskyrimas
PROCEDŪRA Veikimo sąlygos
Bandymo koncentracijos vertės
Kontroliniai ėminiai
Veikimo pradžia ir bandymo trukmė
Ikrų paskirstymas 24 duobučių plokštelėse
Stebėjimai
Analiziniai matavimai
RIBINIS BANDYMAS
DUOMENYS IR ATASKAITOS RENGIMAS Rezultatų apdorojimas
Bandymo ataskaita
LITERATŪRA
1 priedėlis APIBRĖŽTYS Apikalinė vertinamoji baigtis – sukelianti poveikį populiacijos lygiu. Blastulė – ląstelių darinys apie animalinį polių, kuris dengia tam tikrą trynio dalį. Cheminė medžiaga – medžiaga arba mišinys. Epibolija – didžiulė daugiausia epidermio ląstelių proliferacija embriono gastruliacijos tarpsniu ir ląstelių judėjimas iš nugaros į pilvo pusę, dėl ko endoderminiai ląstelių sluoksniai tampa vidiniai į invaginaciją panašaus proceso metu ir trynys atsiduria embriono viduje. Dinaminis bandymas – bandymas, kai per bandymo sistemą teka nuolatinis bandymo tirpalų srautas visą veikimo trukmę. Vidinis plokštelės kontrolinis ėminys – vidinis kontrolinis ėminys, kurį sudaro skiedimo vandens pripildytos 4 duobutės 24 duobučių plokštelėje, kad būtų galima nustatyti galimą gamintojo arba tyrėjo sukeltą plokštelių užteršimą procedūros metu ir visus su plokštele susijusius veiksnius, galbūt darančius įtaką bandymo rezultatui (pvz., temperatūros gradientą). IUPAC – Tarptautinė teorinės ir taikomosios chemijos sąjunga. Gyvūnams laikyti skirtas vanduo – vanduo, kuriame laikomos suaugusios akvariumų žuvys. Medianinė mirtina koncentracija (LC50) – bandomosios cheminės medžiagos koncentracija, kuriai esant bandymo metu žūsta 50 % bandymo organizmų. Pusiau statinis atnaujinimo bandymas – bandymas, kurį atliekant bandymo tirpalai reguliariai atnaujinami po tam tikro laikotarpio (pvz., kas 24 h). SMILES – supaprastinto molekulių pateikimo linijine forma specifikacija. Somitas – besivystančio stuburinių embriono somitai yra į šonus nuo nervinio vamzdelio pasiskirsčiusi mezoderminė masė, iš kurios vėliau susidaro derma (dermatomas), skeleto raumuo (miotomas) ir slanksteliai (sklerotomas). Statinis bandymas – bandymas, kurį atliekant bandymo tirpalai nekeičiami visą bandymo trukmę. Bandomoji cheminė medžiaga – taikant šį metodą bandoma medžiaga arba mišinys. UVCB – nežinomos ar kintamos sudėties medžiagos, sudėtingųjų reakcijų produktai ar biologinės medžiagos. 2 priedėlis PRIEŽIŪRA, VEISIMAS IR TIPINĖS SĄLYGOS ATLIEKANT ŪMAUS TOKSIŠKUMO ZEBRINĖS DANIJOS EMBRIONUI BANDYMUS
3 priedėlis NORMALUS ZEBRINĖS DANIJOS VYSTYMASIS 26 °C TEMPERATŪROJE 


4 Priedėlis 1 paveikslas 24 duobučių plokštelės išdėstymo schema 
2 paveikslas. Ūmaus toksiškumo zebrinės danijos embrionui bandymo procedūros schema (iš kairės į dešinę): ikrų gamyba, ikrų surinkimas, laikymas stikliniuose induose prieš veikimą iš karto po apvaisinimo, apvaisintų ikrų atranka per inversinį ar dviejų okuliarų mikroskopą ir apvaisintų ikrų paskirstymas į 24 duobučių plokšteles su atitinkamos koncentracijos chemine medžiaga ir kontroliniais ėminiais, n – ikrų skaičius vienai bandymo koncentracijai ar kontroliniam ėminiui (šiame bandyme – 20), hpf – valandoms po apvaisinimo. 
5 priedėlis ŪMAUS TOKSIŠKUMO ZEBRINĖS DANIJOS EMBRIONUI BANDYMO ŽŪSTAMUMO VERTINAMŲJŲ BAIGČIŲ ATLASAS Šios apikalinės vertinamosios baigtys rodo ūmų toksiškumą, taigi ir embrionų žūtį: Embriono koaguliacija, uodegos neatsiskyrimas, somitų nesusidarymas ir širdies plakimo nebuvimas. Šios mikrofotografijos buvo parinktos kaip šių vertinamųjų baigčių vaizdinė medžiaga. 1 paveikslas Embriono koaguliacija 
Šviesiojo lauko apšvietimo sąlygomis koaguliavusiuose zebrinės danijos embrionuose matomi įvairūs neskaidrūs intarpai. 2 paveikslas Somitų nesusidarymas 
Nors vystymasis vėluoja maždaug 10 h, 24 h amžiaus zebrinės danijos embrionui a) matomi gerai išsivystę somitai (→), o embrionui b) nesimato jokių somitų susidarymo požymių (→). Nors gerai matoma trynio maišelio edema (*), 48 h amžiaus zebrinės danijos embrionui c) ryškiai matomi susidarę somitai (→), o d) pavaizduotas 96 h amžiaus zebrinės danijos embrionas neturi jokių somitų susidarymo požymių (→). Atkreipiamas dėmesys į tai, kad d) pavaizduotas embrionas turi išlinkusį stuburą (skoliozė) ir perikardo edemą (*). 3 paveikslas Uodegos pumpuro neatsiskyrimo 
4 paveikslas Širdies plakimo nebuvimas 
Atsižvelgiant į apibrėžtį aišku, kad tai būtų sunku pavaizduoti mikrofotografijoje. Širdies plakimo nebuvimą rodo širdies nesusitraukimas (dviguba rodyklė). Kraujo ląstelių nejudrumas, pvz., pilvo aortos (→įklijoje) nėra širdies plakimo nebuvimo rodiklis. Taip pat reikia atkreipti dėmesį į tai, kad nesusidaro šio embriono somitai (*, raumenų audiniai labiau vientisi, o ne segmentuoti). Stebėjimo trukmė širdies plakimo nebuvimui registruoti turėtų būti ne mažesnė kaip viena minutė, esant ne mažesniam kaip 80× didinimui. C.50 Toksiškumo Myriophyllum spicatum bandymas sistemoje be nuosėdų ĮVADAS
BANDYMO PRINCIPAS
INFORMACIJA APIE BANDOMĄJĄ CHEMINĘ MEDŽIAGĄ
BANDYMO TINKAMUMAS
ETALONINĖ CHEMINĖ MEDŽIAGA
METODO APRAŠYMAS Aparatūra
Bandymo organizmas
Auginimas
Bandymo terpė
Bandymo tirpalai
Bandymo ir kontrolinių ėminių grupės
Veikimas bandomąja medžiaga
Bandymo sąlygos
Trukmė
Matavimai ir analiziniai nustatymai
Matavimų ir analizinių nustatymų dažnumas
Ribinis bandymas
DUOMENYS IR ATASKAITOS RENGIMAS Atsako kintamieji
Vidutinis savitasis augimo greitis
Išeiga
Dvigubėjimo trukmė
Koncentracijos ir atsako priklausomybės kreivių gavimas
ECx įvertinimas
Statistinės procedūros
Ataskaitos teikimas
LITERATŪRA
1 priedėlis APIBRĖŽTYS Biomasė – populiacijos gyvosios medžiagos masė, išreiškiama kaip žaliosios ir (arba) sausos medžiagos masė. Šiame bandyme biomasė yra pagrindinio ūglio, visų šoninių šakų ir visų šaknų masė. Cheminė medžiaga – medžiaga arba mišinys. Chlorozė – bandymo organizmo, ypač žiedų vainikų, spalvos pasikeitimas iš žalios į gelsvą. ECx – bandymo terpėje ištirpusios bandomosios cheminės medžiagos koncentracija, kuriai esant Myriophyllum spicatum augimo greitis per nustatytą veikimo laikotarpį (jo trukmę būtina tiksliai nurodyti, jei skiriasi nuo visos ar įprastinės bandymo trukmės) sumažėja x % (pvz., 50 %). EC vertei, gautai pagal augimo greitį arba pagal išeigą, vienareikšmiškai žymėti vartojami simboliai „ErC“ augimo greičiui ir „EyC“ išeigai, toliau nurodant naudotą matuojamą kintamąjį, pvz., ErC (pagrindinio ūglio ilgis). Augimas – matuojamo kintamojo didėjimas, pvz., pagrindinio ūglio ilgio, bendro šoninių šakų ilgio, bendro ūglių ilgio, bendro šaknų ilgio, žaliosios medžiagos masės, sausos medžiagos masės arba žiedų vainikų skaičiaus, bandymo laikotarpiu. Augimo greitis (vidutinis savitasis augimo greitis)– matuojamo kintamojo logaritminis padidėjimas veikimo laikotarpiu. Pastaba. Su augimo greičiu susiję atsako kintamieji nepriklauso nuo bandymo trukmės, jei neveikiamų kontrolinių organizmų augimo schema yra eksponentinė. Mažiausia stebimo poveikio koncentracija (LOEC)– mažiausia bandomosios medžiagos koncentracija, kuriai esant medžiagos poveikis augimo mažėjimui per nustatytą veikimo laikotarpį yra statistiškai reikšmingas palyginti su kontroliniais ėminiais (kai p < 0,05). Tačiau esant visoms didesnėms nei LOEC bandymo koncentracijos vertėms, kenksmingas poveikis turėtų būti lygus arba didesnis nei poveikis, kuris būtų esant LOEC. Kai negalima įvykdyti šių dviejų sąlygų, turėtų būti pateiktas išsamus paaiškinimas, kaip buvo pasirinkta LOEC (taigi ir NOEC) vertė. Matuojami kintamieji – visų tipų kintamieji, kurie yra matuojami bandymo vertinamajai baigčiai išreikšti, naudojant vieną arba daugiau skirtingų atsako kintamųjų. Šiame bandymų metode matuojami kintamieji yra pagrindinio ūglio ilgis, bendras šoninių šakų ilgis, visas ūglių ilgis, bendras šaknies ilgis, žaliosios medžiagos masė, sausos medžiagos masė ir žiedų vainikų skaičius. Monokultūra – vienos rūšies augalų kultūra. Nekrozė – bandymo organizmo žuvęs audinys (t. y. baltas arba tamsiai rudas). Nestebimo poveikio koncentracija (NOEC) – vos mažesnė nei LOEC bandymo koncentracija. Atsako kintamasis – toksiškumui įvertinti naudojamas kintamasis, gautas pagal bet kurį nors iš matuojamų kintamųjų, skirtingais apskaičiavimo metodais apibūdinančių biomasę. Šiame bandymų metode augimo greitis ir išeiga yra atsako kintamieji, gauti pagal matuojamus kintamuosius, pvz., pagrindinio ūglio ilgį, bendrą ūglių ilgį, žaliosios medžiagos masę, sausos medžiagos masę ar žiedų vainikų skaičių. Pusiau statinis (atnaujinimo) bandymas – bandymas, kurį atliekant bandymo tirpalas periodiškai keičiamas po tam tikro laiko tarpo. Statinis bandymas – bandymų metodas, kai bandymo tirpalas neatnaujinamas atliekant bandymą. Bandomoji cheminė medžiaga – medžiaga arba mišinys, bandyti pagal šį bandymų metodą. Bandymo vertinamoji baigtis – bendrasis veiksnys, kurio pokytis veikiant bandomąja chemine medžiaga palyginti su kontroliniu ėminiu yra bandymo tikslas. Šiame bandymų metode vertinamoji baigtis yra augimo slopinimas, kuris gali būti išreikštas skirtingais atsako kintamaisiais, pagrįstais vienu arba daugiau matuojamų kintamųjų. Bandymo terpė – visiškai paruošta sintetinė kultūros terpė, kurioje auga bandymo augalai, kai jie veikiami bandomąja chemine medžiaga. Bandomoji cheminė medžiaga paprastai yra ištirpinta bandymo terpėje. UVCB – nežinomos ar kintamos sudėties medžiagos, sudėtingųjų reakcijų produktai ar biologinės medžiagos. Išeiga – matuojamo kintamojo, naudojamo biomasės kiekiui išreikšti, vertės veikimo pabaigoje ir jo vertės veikimo pradžioje skirtumas. Pastaba. Kai neveikiamų organizmų augimo schema yra eksponentinė, išeiga pagrįsti atsako kintamieji bandymo eigoje mažės. 2 priedėlis MODIFIKUOTA ANDREWS TERPĖ, SKIRTA PRADINEI KULTŪRAI IR IŠ ANKSTO PARUOŠTAI KULTŪRAI Iš penkių atskirai paruoštų pradinių mitybinių tirpalų, pridedant 3 % sacharozės, ruošiama modifikuota Andrews terpė, skirta pradinei kultūrai ir iš anksto paruoštai kultūrai. 1 lentelė Andrews mitybinio tirpalo sudėtis (ASTM žymuo E 1913-04)
Pradinius tirpalus galima laikyti šaldytuve 6 mėnesius (5–10 °C). Tik pradinio tirpalo Nr. 5 laikymo trukmė yra trumpesnė (du mėnesiai). 2 lentelė Pradinis tirpalas 3.1, iš kurio ruošiamas pradinis tirpalas 3
Paruoštas pradinis tirpalas 3.1 (2 lentelė) užšaldomas maždaug 11 ml alikvotinėmis dalimis (ne aukštesnėje kaip – 18 °C temperatūroje). Padalytą užšaldytą tirpalą galima laikyti penkerius metus. Pradinis tirpalas 3 gaminamas iš atitirpinto tirpalo 3.1, kurio 10 ml įpilama į 1 l matavimo kolbą ir skiedžiama iki žymės ypač švariu vandeniu. Andrews modifikuotai terpei gauti į 5 l matavimo kolbą įpilama maždaug 2 500 ml ypač švaraus vandens. Įpilama po 50 ml kiekvieno pradinio tirpalo, skiedžiama ypač švariu vandeniu iki 90 % matavimo kolbos tūrio ir nustatoma pH vertė 5,8. Įpilama 150 g ištirpintos sacharozės (3 % nuo 5 l tūrio) ir matavimo kolbos turinys skiedžiamas iki žymės ypač švariu vandeniu. Mitybinis tirpalas išpilstomas į 1 l Schott kolbas, kurios 20 min apdorojamos autoklave 121 °C temperatūroje. Taip gautą mitybinį tirpalą galima laikyti steriliai šaldytuve (5–10 °C) tris mėnesius. Modifikuota Andrews terpė, skirta toksiškumo bandymui sistemoje be nuosėdų Iš 1 ir 2 lentelėse nurodytų penkių pradinių mitybinių tirpalų, pridedant 30 % sacharozės, ruošiama dešimteriopos koncentracijos modifikuota Andrews terpė, kurios reikia bandymo tirpalams gauti. Terpei gauti į 1 l matavimo kolbą įpilama maždaug 100 ml ypač švaraus vandens. Įpilus po 100 ml kiekvieno pradinio tirpalo, nustatoma pH vertė 5,8. Paskui įpilama 30 % sacharozės tirpalo (300 g/1 000 ml) ir matavimo kolbos turinys skiedžiamas iki žymės ypač švariu vandeniu. Mitybinis tirpalas išpilstomas į 0,5 l Schott kolbas, kurios 20 min apdorojamos autoklave 121 °C temperatūroje. Taip gautą dešimteriopos koncentracijos modifikuotą mitybinį tirpalą galima laikyti steriliai šaldytuve (5–10 °C) tris mėnesius. 3 priedėlis PRADINĖS KULTŪROS PRIEŽIŪRA Šiame 3 priedėlyje aprašyta pradinė kultūra Myriophyllum spicatum L (103) po vandeniu augantis plunksnalapių šeimos dviskiltis augalas. Neryškios rožinės spalvos gėlės pasirodo virš vandens paviršiaus nuo birželio iki rugpjūčio mėnesio. Augalai turi į gruntą įleidžiamą tvirtą šakniastiebių sistemą, jų galima rasti viso šiaurės pusrutulio eutrofiniuose, bet ne užterštuose ir daugiau kalkėtuose stovinčio vandens telkiniuose su dumblo substratu. Myriophyllum spicatum labiau patinka gėlas vanduo, bet augalų randama ir sūrokame vandenyje. Reikia naudoti sterilius augalus pradinei kultūrai be nuosėdų auginti laboratorinėmis sąlygomis. Sterilių augalų turi Vokietijos federalinės aplinkos agentūros ekotoksikologijos laboratorija. Arba bandymo organizmus galima paruošti iš nesterilių augalų pagal ASTM E 1913-04 standartą. Lauko sąlygomis surinktos Myriophyllum sibiricum kultūros auginimo procedūra aprašyta šioje ASTM standarto ištraukoje: „Jei pradedama nuo iš lauko sąlygomis surinktų nesterilių augalų, rudenį reikia rinkti M. sibiricum lapaūglius. Lapaūgliai dedami į 20 l akvariumą, turintį 5 cm storio sterilių nuosėdų sluoksnį, padengtą kvarciniu smėliu arba, pvz., Turface®, ir 18 l distiliuoto vandens. Akvariumas aeruojamas 15 oC temperatūroje esant 200 iki 300 μmol m– 2 s– 1 apšvietai 16 h per parą. Augalų kultūra akvariume gali būti prižiūrima kaip atsarginis augalų šaltinis tam atvejui, kai sterilios augalų kultūros sunaikinamos dėl mechaninės trikties auginimo kameroje, užteršimo arba dėl kitos priežasties. Akvariume auginami augalai nėra sterilūs ir kultūrų sterilumo negalima užtikrinti naudojant kultūros auginimo partijomis sistemą. Kultūrai sterilizuoti augalai paimami iš akvariumo ir apie 0,5 h plaunami tekančiu dejonizuotu vandeniu.Steriliomis laminarinio bokso sąlygomis augalai yra dezinfekuojami trumpiau nei 20 min (kol didžioji dalis augalų audinių išbalinama ir žalia lieka tik auganti viršūnė) 3 % (m/V) natrio hipochlorito tirpale, kuriame yra 0,01 % tinkamos paviršinio aktyvumo medžiagos. Dezinfekantas ir augalinė medžiaga maišomi. Segmentai su keliais bambliais pernešami į sterilius kultūros mėgintuvėlius su 45 ml sterilizuotos modifikuotos Andrews terpės ir mėgintuvėliai uždengiami paprastais kultūros mėgintuvėlio dangčiais. Į kiekvieną bandymo kamerą dedamas tik vienas augalo segmentas. Dangčiui pritvirtinti prie kultūros indo naudojama laboratorinė lipnioji plėvelė. Gavus sterilią kultūrą, augalų segmentus su keliais bambliais kas dešimt ar dvylika parų reikėtų pernešti į naujas bandymų kameras su nauja skystąja mitybine terpe. Auginant agaro lėkštelėse buvo įrodyta, kad augalai turi būti sterilūs ir lieka sterilūs aštuonias savaites prieš pradedant bandymus.“ Kadangi modifikuota Andrews terpė turi sacharozės (kuri skatina grybelių ir bakterijų augimą), visos medžiagos, bandymo tirpalai ir kultūros turi būti ruošiamos sterilumo sąlygomis. Visus skysčius ir visą įrangą reikia sterilizuoti prieš naudojant. Sterilizuojama 4 h apdorojant karštu oru (210 oC) arba 20 min autoklave 121 oC temperatūroje.Be to, visos kolbos, lėkštės, dubenys ir kita įranga prieš pat naudojimą apdorojami liepsna ant sterilaus darbastalio. Pradines kultūras galima laikyti ilgesnį laiką žemesnėje temperatūroje (50 μE m– 2 s– 1, 20 ± 2 oC) ir nereikia rekultivuoti. Myriophyllum auginimo terpė turėtų būti tokia pat, kaip ir bandymo terpė, bet pradinėms kultūroms galima naudoti kitų mitybinių medžiagų turinčias terpes. Augalų segmentai sterilumo sąlygomis paskirstomi į kelias 500 ml kūgines arba (ir) 2 000 ml Fernbacho kolbas, kurių kiekvienoje yra 450 arba 1 000 ml modifikuotos Andrews terpės. Kolbos sterilumo sąlygomis užkemšamos celiuliozės pluošto kamščiais. Be to, prieš pat pradedant naudoti įrangą, ji būtinai turi būti kruopščiai apdorota liepsna ant sterilaus darbastalio. Atsižvelgiant į augalų skaičių ir dydį, jie turi būti pernešami į naują mitybinį tirpalą maždaug kas tris savaites. Šiai atnaujintai kultūrai galima naudoti viršūnes, taip pat stiebo vidurinės dalies segmentus. Perneštų augalų (ar augalų segmentų) skaičius ir dydis priklauso nuo reikiamo augalų skaičiaus. Pvz., į vieną Fernbach kolbą galima pernešti penkis ūglių segmentus, o į vieną kūginę kolbą – tris ūglius, kurių kiekvienas yra 5 cm ilgio. Reikia atmesti visus įsišaknijusias, žydinčias, nuvytusias ar kitaip išsiskiriančias dalis. 1 paveikslas. Augalų pjaustymas pradinei ir iš anksto paruoštai kultūrai gauti po trijų savaičių auginimo 
Augalų kultūras reikia auginti 500 ml kūginėse kolbose ir 2 000 ml Fernbacho kolbose, laikomose aušinimo inkubatoriuje 20 ± 2 oC temperatūroje ir nuolat apšviestose maždaug 100–150 μE m– 2 s– 1 arba 6 000–9 000 liuksų šviesa (kameros apšvietimas, kurio spalvos temperatūra atitinka „šiltą baltą šviesą“). 2 paveikslas. Augalų kultūrų auginimas aušinimo inkubatoriuje su kameros apšvietimu. 
Kultūroms auginti turėtų būti naudojami chemiškai švarūs (rūgštimi išplauti) ir sterilūs stikliniai indai, ir taikomi sterilaus apdorojimo metodai. Jei pradinė kultūra užteršiama, pvz., dumbliais, grybeliais ir (arba) bakterijomis, reikėtų paruošti naują kultūrą arba reikėtų naudoti pradinę kultūrą iš kitos laboratorijos kultūrai atnaujinti. 4 priedėlis IŠ ANKSTO PARUOŠTOS KULTŪROS PRIEŽIŪRA IR BANDYMO ORGANIZMO PARUOŠIMAS BANDYMAMS Norint gauti iš anksto paruoštą kultūrą, pradinės kultūros ūgliai supjaustomi į segmentus su dviem žiedų vainikais, segmentai sudedami į Fernbacho kolbas, pripildytas modifikuota Andrews terpe (turinčia 3 % masės sacharozės). Kiekvienoje kolboje gali būti 50 ūglių segmentų. Tačiau reikėtų užtikrinti, kad segmentai būtų gajūs ir neturėtų jokių šaknų ir šoninių šakų ar jų pumpurų (žr. 3 priedėlio 1 paveikslą). Iš anksto paruoštos kultūros organizmai auginami steriliomis sąlygomis klimatinėje kameroje 14– 21 parą, esant 16 h šviesos ir 8 h tamsos tarpsniams. Pasirenkamas šviesos intensyvumas yra 100–150 μE m– 2 s– 1. Temperatūra bandymo induose turėtų būti 23 ± 2 oC. Kadangi modifikuota Andrews terpė turi sacharozės (kuri skatina dumblių, grybelių ir bakterijų augimą), bandomosios cheminės medžiagos tirpalus reikėtų ruošti ir kultūras auginti sterilumo sąlygomis. Visus skysčius ir visą įrangą reikia sterilizuoti prieš naudojant. Sterilizuojama 4 h apdorojant karštu oru (210 oC) arba 20 min autoklave 121 oC temperatūroje. Be to, visos kolbos, lėkštės, dubenys ir kita įranga prieš pat naudojimą apdorojami liepsna ant sterilaus darbastalio. Ūgliai išimami iš kolbų su iš anksto paruošta kultūra sterilumo sąlygomis, pasirenkant kuo vienalytiškesnę medžiagą. Kiekvienam bandymui reikia turėti ne mažiau kaip 60 bandymo organizmų (bandoma aštuonių koncentracijos verčių cheminė medžiaga). Bandymams imamos iš anksto paruoštos kultūros žaliosios šoninės šakos, kurios sutrumpinamos iki 2,5 cm nuo pagrindo (matuojant liniuote) ir pernešamos į stiklinę su sterilia modifikuota Andrews terpe. Šios šoninės šakos gali būti naudojamos atliekant toksiškumo Myriophyllum spicatum bandymą sistemoje be nuosėdų. 2 paveikslas. Iš anksto paruoštos kultūros augalų pjaustymas, atliekant toksiškumo Myriophyllum spicatum bandymą sistemoje be nuosėdų. 
C.51 Toksiškumo Myriophyllum spicatum bandymas vandens ir nuosėdų sistemoje ĮVADAS
BANDYMO PRINCIPAS
INFORMACIJA APIE BANDOMĄJĄ CHEMINĘ MEDŽIAGĄ
BANDYMO TINKAMUMAS
ETALONINĖ CHEMINĖ MEDŽIAGA
METODO APRAŠYMAS Bandymų aparatūra
Bandymo organizmas
Bandymo organizmo auginimas
Nuosėdos
Bandymo terpė
Bandymo schema
Bandomosios cheminės medžiagos koncentracija ir kontrolinės grupės
Ribinis bandymas
Bandymo tirpalai
BANDYMO PROCEDŪRA
Prigijimo tarpsnis
Vienodos augalinės medžiagos parinkimas
Veikimas per vandeninę fazę
Veikimas per nuosėdas
Vandens lygio užtikrinimas visą bandymo trukmę
Bandymo sąlygos
Bandymo trukmė
Matavimai ir analiziniai nustatymai
Matavimų ir analizinių nustatymų dažnumas
Bandomosios cheminės medžiagos analiziniai matavimai
DUOMENŲ ĮVERTINIMAS
Atsako kintamieji
Vidutinis savitasis augimo greitis
Išeiga
Koncentracijos ir atsako priklausomybės kreivių gavimas
ECx įvertinimas
Statistinės procedūros
ATASKAITOS RENGIMAS
LITERATŪRA
1 priedėlis SMART IR BARKO TERPĖS SUDĖTIS
2 priedėlis APIBRĖŽTYS Biomasė – populiacijos gyvosios medžiagos masė, išreiškiama kaip žaliosios ir (arba) sausos medžiagos masė. Šiame bandyme biomasė yra pagrindinio ūglio, visų šoninių šakų ir visų šaknų masė. Cheminė medžiaga – medžiaga arba mišinys. Chlorozė – bandymo organizmo, ypač žiedų vainikų, spalvos pasikeitimas iš žalios į gelsvą. ECx – bandymo terpėje ištirpusios bandomosios cheminės medžiagos koncentracija, kuriai esant Myriophyllum spicatum augimo greitis per nustatytą veikimo laikotarpį (jo trukmę būtina tiksliai nurodyti, jei skiriasi nuo visos ar įprastinės bandymo trukmės) sumažėja x % (pvz., 50 %). EC vertei, gautai pagal augimo greitį arba pagal išeigą, vienareikšmiškai žymėti vartojami simboliai „ErC“ augimo greičiui ir „EyC“ išeigai, toliau nurodant naudotą matuojamą kintamąjį, pvz., ErC (pagrindinio ūglio ilgis). Augimas – matuojamo kintamojo didėjimas, pvz., pagrindinio ūglio ilgio, bendro šoninių šakų ilgio, bendro ūglių ilgio, bendro šaknų ilgio, žaliosios medžiagos masės, sausos medžiagos masės arba žiedų vainikų skaičiaus, bandymo laikotarpiu. Augimo greitis (vidutinis savitasis augimo greitis)– matuojamo kintamojo logaritminis padidėjimas veikimo laikotarpiu. Pastaba. Su augimo greičiu susiję atsako kintamieji nepriklauso nuo bandymo trukmės, jei neveikiamų kontrolinių organizmų augimo schema yra eksponentinė. Mažiausia stebimo poveikio koncentracija (LOEC)– mažiausia bandomosios medžiagos koncentracija, kuriai esant medžiagos poveikis augimo mažėjimui per nustatytą veikimo laikotarpį yra statistiškai reikšmingas palyginti su kontroliniais ėminiais (kai p < 0,05). Tačiau esant visoms didesnėms nei LOEC bandymo koncentracijos vertėms, kenksmingas poveikis turėtų būti lygus arba didesnis nei poveikis, kuris būtų esant LOEC. Kai negalima įvykdyti šių dviejų sąlygų, turėtų būti pateiktas išsamus paaiškinimas, kaip buvo pasirinkta LOEC (taigi ir NOEC) vertė. Matuojami kintamieji – visų tipų kintamieji, kurie yra matuojami bandymo vertinamajai baigčiai išreikšti, naudojant vieną arba daugiau skirtingų atsako kintamųjų. Šiame bandymų metode matuojami kintamieji yra pagrindinio ūglio ilgis, bendras šoninių šakų ilgis, visas ūglių ilgis, bendras šaknies ilgis, žaliosios medžiagos masė, sausos medžiagos masė ir žiedų vainikų skaičius. Monokultūra – vienos rūšies augalų kultūra. Nekrozė – bandymo organizmo žuvęs audinys (t. y. baltas arba tamsiai rudas). Nestebimo poveikio koncentracija NOEC– vos mažesnė nei LOEC bandymo koncentracija. Atsako kintamasis – toksiškumui įvertinti naudojamas kintamasis, gautas pagal bet kurį nors iš matuojamų kintamųjų, skirtingais apskaičiavimo metodais apibūdinančių biomasę. Šiame bandymų metode augimo greitis ir išeiga yra atsako kintamieji, gauti pagal matuojamus kintamuosius, pvz., pagrindinio ūglio ilgį, bendrą ūglių ilgį, žaliosios medžiagos masę, sausos medžiagos masę ar žiedų vainikų skaičių. Pusiau statinis (atnaujinimo) bandymas – bandymas, kurį atliekant bandymo tirpalas periodiškai keičiamas po tam tikro laiko tarpo. Statinis bandymas – bandymų metodas, kai bandymo tirpalas neatnaujinamas atliekant bandymą. Bandomoji cheminė medžiaga – medžiaga arba mišinys, bandyti pagal šį bandymų metodą. Bandymo vertinamoji baigtis – bendrasis veiksnys, kurio pokytis veikiant bandomąja chemine medžiaga palyginti su kontroliniu ėminiu yra bandymo tikslas. Šiame bandymų metode vertinamoji baigtis yra augimo slopinimas, kuris gali būti išreikštas skirtingais atsako kintamaisiais, pagrįstais vienu arba daugiau matuojamų kintamųjų. Bandymo terpė – visiškai paruošta sintetinė kultūros terpė, kurioje auga bandymo augalai, kai jie veikiami bandomąja chemine medžiaga. Bandomoji cheminė medžiaga paprastai yra ištirpinta bandymo terpėje. UVCB – nežinomos ar kintamos sudėties medžiagos, sudėtingųjų reakcijų produktai ar biologinės medžiagos. Išeiga – matuojamo kintamojo, naudojamo biomasės kiekiui išreikšti, vertės veikimo pabaigoje ir jo vertės veikimo pradžioje skirtumas. Pastaba. Kai neveikiamų organizmų augimo schema yra eksponentinė, išeiga pagrįsti atsako kintamieji bandymo eigoje mažės. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(1) Nėra vertės, nustatytos esant 20 °C, bet galima daryti prielaidą, kad matavimo rezultatų kintamumas yra didesnis palyginti su tikėtina priklausomybe nuo temperatūros.
(2) 2006 m. gruodžio 18 d. Europos Parlamento ir Tarybos reglamentas (EB) Nr. 1907/2006 dėl cheminių medžiagų registracijos, įvertinimo, autorizacijos ir apribojimų (REACH), įsteigiantis Europos cheminių medžiagų agentūrą, iš dalies keičiantis Direktyvą 1999/45/EB bei panaikinantis Tarybos reglamentą (EEB) Nr. 793/93, Komisijos reglamentą (EB) Nr. 1488/94, Tarybos direktyvą 76/769/EEB ir Komisijos direktyvas 91/155/EEB, 93/67/EEB, 93/105/EB ir 2000/21/EB. OL L 304, 2007 11 22, p. 1.
(3) JAV Alternatyvių metodų patvirtinimo tarpžinybinis koordinavimo komitetas.
(*1) Turėtų būti nurodytas ragenos drumstumo srities plotas.
(4) Jei norima taikyti akių dirginimo kompleksinių bandymų strategiją pagal REACH, žr. taip pat ECHA Guidance on information requirements and chemical safety assessment, Chapter R.7a: Endpoint specific guidance http://echa.europa.eu/documents/10162/13632/information_requirements_r7a_en.pdf
(5) Statistikai, kurie taiko modeliavimo metodą, pvz., apibendrintuosius tiesinius modelius (GLM), gali atlikti analizę skirtingu, bet palyginamuoju būdu ir nebūtinai sudaryti tradicinę ANOVA lentelę, bet modeliai grąžina atgal prie algoritminių statistinių duomenų skaičiavimo metodų, sukurtų tada, kai nebuvo kompiuterių.
(6) Statistikai, kurie taiko modeliavimo metodą, pvz., apibendrintuosius tiesinius modelius (GLM), gali atlikti analizę skirtingu, bet palyginamuoju būdu ir nebūtinai sudaryti tradicinę ANOVA lentelę, bet modeliai grąžina atgal prie algoritminių statistinių duomenų skaičiavimo metodų, sukurtų tada, kai nebuvo kompiuterių.
(7) 2008 m. gruodžio 16 d. Europos Parlamento ir Tarybos reglamentas (EB) Nr. 1272/2008 dėl cheminių medžiagų ir mišinių klasifikavimo, ženklinimo ir pakavimo, iš dalies keičiantis ir panaikinantis direktyvas 67/548/EEB bei 1999/45/EB ir iš dalies keičiantis Reglamentą (EB) Nr. 1907/2006, OL L 353, 2008 12 31.
(8) Kiekviena bandomoji cheminė medžiaga priskirta cheminių junginių klasei, taikant standartinę klasifikavimo sistemą, pagrįstą Vaistų medicininių dalykinių antraščių (MeSH) nacionalinės bibliotekos klasifikavimo sistema (available at http//www.nlm.nih.gov/mesh).
(9) Atsižvelgiant į rezultatus, gautus atlikus triušio akies in vivo bandymą (EBPO TG 405) (17) ir taikant JT GHS (4).
(10) Klasifikavimas kaip 2A ar 2B priklauso nuo JT GHS kriterijaus šioms dviems kategorijoms atskirti aiškinimo, t. y. poveikis 7 parą 1 iš 3 gyvūnų palyginti su 2 iš 3 gyvūnų, kuris yra būtinas norint klasifikuoti kaip 2A kategorijos. In vivo tyrime buvo naudojami 3 gyvūnai. Visos vertinamosios baigtys, išskyrus vieno gyvūno junginės paraudimą, grįžo prie nulinių verčių 7 parą arba anksčiau. Vieno gyvūno, kurio junginės paraudimas ne visiškai išnyko iki 7 paros, paraudimo balas buvo 1 (7 parą), šis paraudimas visiškai išnyko 10 parą.
(11) Pateikti matmenys atitinka ragenos laikiklį, naudojamą tiriant 12–60 mėnesių karvių ragenas. Jei naudojami 6–12 mėnesių gyvuliai, reikėtų pagaminti laikiklį, kurio kiekvienos kameros talpa būtų 4 ml, o kiekvienos vidinės kameros skersmuo – 1,5 cm, gylis – 2,2 cm. Projektuojant visus naujus ragenų laikiklius, labai svarbu užtikrinti, kad veikiamo ragenos paviršiaus ploto ir užpakalinės kameros talpos santykis būtų lygus įprastinio ragenų laikiklio santykiui. Tai yra būtina, siekiant užtikrinti, kad būtų tinkamai nustatytos pralaidumo vertės, naudojamos IVIS skaičiuoti pagal pasiūlytą formulę.
(12) 2008 m. gruodžio 16 d. Europos Parlamento ir Tarybos reglamentas (EB) Nr. 1272/2008 dėl cheminių medžiagų ir mišinių klasifikavimo, ženklinimo ir pakavimo, iš dalies keičiantis ir panaikinantis direktyvas 67/548/EEB bei 1999/45/EB ir iš dalies keičiantis Reglamentą (EB) Nr. 1907/2006, OL L 353, 2008 12 31.
(*2) Didžiausias stebimas balas bet kuriuo laiko momentu.
(*3) Maksimalus vidutinis balas, stebimas bet kuriuo momentu (pagrįstas drumstumo balais, kaip apibrėžta 1 lentelėje).
(*4) Pagrįstas drumstumo balais, kaip apibrėžta 2 lentelėje.
(*5) Retai pasitaikantys deriniai.
(13) Kiekviena bandomoji cheminė medžiaga priskirta cheminių junginių klasei taikant standartinę klasifikavimo sistemą, pagrįstą Vaistų medicininių dalykinių antraščių (MeSH) nacionalinės bibliotekos klasifikavimo sistema (available at http//www.nlm.nih.gov/mesh).
(14) Atsižvelgiant į rezultatus, gautus atlikus triušio akies in vivo bandymą (EBPO TG 405), ir taikant JT GHS (4)(6).
(15) Atsižvelgiant į ICE rezultatus, kaip aprašyta 6 lentelėje.
(16) Kitų nei 6 lentelėje aprašytų GHS be kategorijos ir GHS 1 kategorijos ICE balų derinys (žr. 6 lentelę).
(17) Klasifikavimas kaip 2A ar 2B priklauso nuo JT GHS kriterijaus šioms dviems kategorijoms atskirti aiškinimo, t. y. poveikis 7 parą 1 iš 3 gyvūnų palyginti su 2 iš 3 gyvūnų, kuris yra būtinas norint klasifikuoti kaip 2A kategorijos. Į in vivo tyrime buvo naudojami 3 gyvūnai. Visos vertinamosios baigtys, išskyrus vieno gyvūno junginės paraudimą, grįžo prie nulinių verčių 7 parą arba anksčiau. Vieno gyvūno, kurio junginės paraudimas ne visiškai išnyko iki 7 paros, paraudimo balas buvo 1 (7 parą), šis paraudimas visiškai išnyko 10 parą.
(18) 2008 m. gruodžio 16 d. Europos Parlamento ir Tarybos reglamentas (EB) Nr. 1272/2008 dėl cheminių medžiagų ir mišinių klasifikavimo, ženklinimo ir pakavimo, iš dalies keičiantis ir panaikinantis direktyvas 67/548/EEB bei 1999/45/EB ir iš dalies keičiantis Reglamentą (EB) Nr. 1907/2006, OL L 353, 2008 12 31.
(19) Visame dokumente vidurkis reiškia aritmetinį vidurkį.
(20) Skaičiai rodo statistiškai gautas ribines vertes ir nėra susiję su matavimo tikslumu.
(21) Į DPRA prognozę reikėtų žiūrėti kaip IATA sistemos dalį ir atsižvelgti į 9 ir 12 pastraipų nuostatas.
(22) Skaičiai rodo statistiškai gautas ribines vertes ir nėra susiję su matavimo tikslumu.
(23) Į DPRA prognozę reikėtų žiūrėti kaip IATA sistemos dalį ir atsižvelgti į 9 bei 12 pastraipų nuostatas.
(24) Pavojaus (ir veikimo gebos) prognozės in vivo yra pagrįstos LLNA duomenimis (19). Veikimo geba in vivo gauta taikant ECETOC pasiūlytus kriterijus (23).
(25) Į DPRA prognozę reikėtų žiūrėti kaip į IATA sistemos dalį ir atsižvelgti į 9 bei 11 pastraipų nuostatas.
(26) Intervalai nustatyti pagal ne mažiau kaip 10 kiekio sumažėjimo verčių, gautų 6 nepriklausomose laboratorijose.
(27) 2008 m. gruodžio 16 d. Europos Parlamento ir Tarybos reglamentas (EB) Nr. 1272/2008 dėl cheminių medžiagų ir mišinių klasifikavimo, ženklinimo ir pakavimo, iš dalies keičiantis ir panaikinantis direktyvas 67/548/EEB bei 1999/45/EB ir iš dalies keičiantis Reglamentą (EB) Nr. 1907/2006, OL L 353, 2008 12 31.
(28) Pavojaus (ir veikimo gebos) prognozės in vivo yra pagrįstos LLNA duomenimis (13). Veikimo geba in vivo gauta taikant ECETOC pasiūlytus kriterijus (24).
(29) Į KeratinoSensTM prognozę reikėtų žiūrėti kaip į IATA sistemos dalį ir atsižvelgti į šio bandymų metodo 9 ir 11 pastraipų nuostatas.
(30) Pagrįstas stebimais istoriniais duomenimis (12).
(31) 2008 m. gruodžio 16 d. Europos Parlamento ir Tarybos reglamentas (EB) Nr. 1272/2008 dėl cheminių medžiagų ir mišinių klasifikavimo, ženklinimo ir pakavimo, iš dalies keičiantis ir panaikinantis direktyvas 67/548/EEB bei 1999/45/EB ir iš dalies keičiantis Reglamentą (EB) Nr. 1907/2006, OL L 353, 2008 12 31.
(32) Kiekviena bandomoji cheminė medžiaga priskirta cheminių junginių klasei taikant standartinę klasifikavimo sistemą, pagrįstą Vaistų medicininių dalykinių antraščių (MeSH) nacionalinės bibliotekos klasifikavimo sistema (available at http//www.nlm.nih.gov/mesh).
(33) Atsižvelgiant į rezultatus, gautus atlikus triušio akies in vivo bandymą (EBPO TG 405, TM B.5) ir taikant JT GHS bei ES CLP.
(34) Atsižvelgiant į rezultatus, gautus taikant FL (INVITTOX protokolas Nr. 71(6)).
(35) Statistikai, kurie taiko modeliavimo metodą, pvz., apibendrintuosius tiesinius modelius (GLM), gali atlikti analizę skirtingu, bet palyginamuoju būdu ir nebūtinai sudaryti tradicinę ANOVA lentelę, bet modeliai grąžina atgal prie algoritminių statistinių duomenų skaičiavimo metodų, sukurtų tada, kai nebuvo kompiuterių.
(36) Apibrėžtys ir vienetai pateikti 1 priedėlyje.
(37) Kartais žymimas P OW; nustatomas kratomos kolbos metodu pagal TM A.8 (4), HPLC metodu pagal TM A.24 (5) ir lėto maišymo metodu pagal TM A.23 (6). Kartais naudojamos tirpalo generavimo kolonėlės metodas log KOW nustatyti. Yra nedaug tyrimų, kuriuose būtų taikomas šis metodas, pirmiausiai polichlorintiesiems bifenilams ir dibenzdioksinams (pvz., Li and Doucette, 1993) (3). Jei medžiagos gali jonizuotis, log K OW būtų naudojamas nejonizuotai formai.
(38) Apibrėžtys ir vienetai pateikti 1 priedėlyje.
(39) TLC – plonasluoksnė chromatografija; HPLC –efektyvioji skysčių chromatografija; GC – dujų chromatografija.
(40) Taikant kai kurias reglamentavimo sistemas, gali būti privaloma metabolitų analizė, kai įvykdomos tam tikros sąlygos (žr. 65 pastraipą).
(41) Apskritai, vandeninio tirpalo koncentracijos vertės, išmatuotos sugerties tarpsnio metu, turėtų būti bent viena eile didesnės nei kiekybinio nustatymo riba, kad tyrimo apsivalymo tarpsniu būtų galima matuoti kūno sugertą kiekį ilgiau nei viena pusėjimo trukmė.
(42) Apibrėžtys ir vienetai pateikti 1 priedėlyje.
(43) Būtų gerai, jei daugumos bandomųjų cheminių medžiagų nebūtų įmanoma aptikti kontrolinių ėminių vandenyje. Foninė koncentracija turėtų būti susijusi tik su natūraliai paplitusiomis medžiagomis (pvz., kai kuriais metalais) ir medžiagomis, kurių yra visur aplinkoje.
(44) Jei pirmojo laipsnio kinetika aiškiai netinka, reikėtų taikyti sudėtingesnius modelius (žr. 5 priedėlio nuorodas) ir klausti biologinės statistikos specialisto patarimo.
(45) Atliekant biologinio koncentravimo bandymą, sugertį gali riboti maža veikimo koncentracija dėl mažo tirpumo vandenyje, o taikant mitybos bandymą, galima pasiekti gerokai didesnes koncentracijos vertes.
(46) Jei bandomos daugiakomponentės medžiagos, UVCB ir mišiniai, galbūt reikėtų nustatyti kiekvieno susijusio komponento tirpumą vandenyje, kad būtų nustatytos reikiamos veikimo koncentracijos vertės.
(47) TOC sudaro dalelių organinė anglis ir ištirpusi organinė anglis, t. y. TOC = POC + DOC.
(48) Nors tai paprastai nerekomenduojama, jei yra naudojamas tirpiklis ar soliubilizavimo agentas, iš šio agento gautą organinės anglies kiekį reikėtų sudėti su bandomosios cheminės medžiagos organinės anglies kiekiu, kad būtų įvertinta organinės anglies koncentracija bandymų induose.
(49) Jei lipidų kiekis nustatomas ne toje pačioje žuvyje kaip bandomoji cheminė medžiaga, žuvis turėtų būti bent jau tokios pačios masės ir (jei tinka) tos pačios lyties.
(50) Ši alternatyva galioja tik jei visų bandomųjų grupių žuvys laikomos panašaus dydžio grupėse, jos ėminiams imamos pagal tą pačią schemą ir maitinamos tuo pačiu būdu. Tai užtikrina, kad visų grupių žuvys auga panašiai, jei bandoma koncentracija yra mažesnė nei toksinio intervalo koncentracija. Manoma, kad, jei žuvys auga panašiai, lipidų kiekis turėtų būti panašus. Kitoks augimas kontroliniame ėminyje rodytų cheminės medžiagos poveikį ir tyrimo rezultatai būtų netinkami.
(51) Be masės reikėtų registruoti visą ilgį, nes ilgio padidėjimo palyginimas bandymo metu yra geras neigiamo poveikio buvimo rodiklis.
(52) Augimo greičio konstantas galima įvertinti taikant Stjudento t kriterijų, kad būtų galima patikrinti, ar yra skirtumas tarp kontrolinių ir bandymo grupių, arbaF kriterijų, jei atliekama dispersinė analizė. Jei reikia, galima taikyti F kriterijų arba tikėtinumo santykio kriterijų, kad būtų lengviau pasirinkti tinkamą augimo modelį (EBPO monografija 54, (32)).
(53) Šios procentinės vertės gautos darant prielaidą, kad analizės metodai yra patikimi ir pusėjimo trukmė yra < 14 parų. Jei analizės metodai yra ne tokie patikimi arba pusėjimo trukmė yra (gerokai) didesnė, šie skaičiai bus didesni.
1PI– pasikliovimo intervalas (jei įmanoma įvertinti);
SN– standartinis nuokrypis (jei įmanoma įvertinti).
(56) Supaprastintas bandymas faktiškai gali būti naudojamas greitam metabolizmui įrodyti, kai žinoma, kad yra greito metabolizmo tikimybė.
(57) Kai yra tik du duomenų taškai, BCFKm pasikliovimo ribų įverčius galima gauti taikant savirankos metodus. Kai taip pat yra tarpiniai duomenų taškai, BCFKm pasikliovimo ribų įverčius galima gauti taip, kaip jie gaunami atliekant viso masto bandymą.
(58) Apibrėžtys ir vienetai pateikti 1 priedėlyje.
(59) Atsižvelgiant į Reglamentą (EB) Nr. 1907/2006 dėl cheminių medžiagų registracijos, įvertinimo, autorizacijos ir apribojimų (REACH) OL L 396, 2006 12 30, p. 1), šis klausimas nagrinėjamas Guidance on Information Requirements and Chemical Safety Assessment, R.7c, R.7.10.3.1 skyriuje; R.7.10.4.1 ir R7.10-2 paveiksle.
(60) Būtų labai gerai, jei daugumos bandomųjų cheminių medžiagų nebūtų aptinkama kontroliniuose vandens ėminiuose. Foninė koncentracija turėtų būti susijusi tik su natūraliai paplitusioms medžiagoms (pvz., kai kuriais metalais) ir medžiagomis, kurios aplinkoje yra labai paplitusios.
(61) Kadangi BMF yra apibrėžiamas kaip cheminės medžiagos koncentracijos organizme ir jos koncentracijos maiste santykis, esant nuostoviajai būsenai, į lipidų kiekį yra atsižvelgiama darant pataisą dėl jų kiekio organizme ir maiste, todėl vartojamas tikslesnis terminas „pataisa“. Šis metodas skiriasi nuo „normalizavimo“ pagal nustatytą organizmo lipidų kiekį, kaip tai daroma atliekant veikimo per vandeninę terpę biologinio koncentravimo bandymą.
(62) Visą ilgį taip pat reikėtų matuoti ir registruoti bandymo metu, nes jis yra geras rodiklis, ar nebuvo nepageidaujamo poveikio.
(63) HCB yra įtrauktas į Stokholmo konvencijos A ir C priedus ir į Reglamento (EB) Nr. 850/2004 dėl patvariųjų organinių teršalų I ir III priedus (OL L 158, 2004 4 30, p. 7).
(64) Dėl spartaus augimo sugerties tarpsnio metu tikroji maisto norma bus mažesnė nei nustatyta veikimo pradžioje.
(65) Atliekant veikimo per vandeninę terpę, 14 parų pusėjimo trukmė atitiktų maždaug 10 000 l/kg BCF, jei naudojamos 1 g žuvys ir atitinkamas sugerties greitis yra 500 l/kg/parai (pagal Sijm et al (46) lygtį).
(66) Kadangi faktinę vidinę koncentraciją galima nustatyti tik atlikus bandymą, būtinas tikėtinos vidinės koncentracijos įvertis (pvz., pagrįstas tikėtinu BMF ir koncentracija maiste; žr. 5 priedėlio A5.8 5 lygtį).
(67) Neįmanoma visiškai išvengti bandomosios cheminės medžiagos buvimo bandymo terpėje dėl žuvų išmatų ar dėl išplovimo iš maisto. Todėl viena iš galimybių būtų cheminės medžiagos koncentracijos vandenyje matavimas sugerties tarpsnio pabaigoje, ypač jei naudojama pusiau statinio bandymo schema, kad būtų galima nustatyti, ar paveikta per vandeninę terpę.
(68) Šis metodas taikomas tik mitybos tyrimui, kuris skiriasi nuo veikimo per vandeninę terpę metodo, todėl, siekiant nesupainioti, taikomas žodis „pataisa“, o ne „normalizavimas“, taip pat žr. išnašą 106 pastraipoje.
(69) Augimo greičio konstantas galima įvertinti taikant Stjudento t kriterijų, kad būtų galima patikrinti, ar yra skirtumas tarp kontrolinių ir bandymo grupių, arba F kriterijų, jei atliekama dispersinė analizė. Jei reikia, galima taikyti F kriterijų arba tikėtinumo santykio kriterijų, kad būtų lengviau pasirinkti tinkamą augimo modelį (EBPO monografija 54 (32)).
(70) Maisto analizės metodas baltymų, lipidų, ląstelienos ir pelenų kiekiui nustatyti; šią informaciją paprastai galima gauti iš maisto tiekėjo.
PI– pasikliovimo intervalas (jei įmanoma įvertinti);
SN– standartinis nuokrypis (jei įmanoma įvertinti).
(73) Meyer et al. (1)
(74) Reikėtų pažymėti, kad atliekant patį bandymą, masei teikiama pirmenybė kaip dydžio matui ir augimo greičio konstantai išvesti. Tačiau pripažįstama, kad ilgis yra praktiškesnis matas, jei žuvį reikia pasirinkti vizualiai bandymo pradžioje (t. y. iš pradinės populiacijos).
(75) Šis ilgio intervalas yra nurodytas Naujų cheminių medžiagų bandymo metodai ir kt., pagrįstas Japonijos cheminių medžiagų kontrolės įstatymu (CSCL).
(76) Vertės skliausteliuose yra ėminių (vandens, žuvų), kuriuos reikia paimti, skaičius, jei imami papildomi ėminiai.
(77) Prieš bandymą gautas k 2 įvertis, kai log K OW yra lygus 4,0, yra 0,652 paros– 1. Nustatyta suminė bandymo trukmė yra 3 × t SS = 3 × 4,6 paros, t. y. 14 parų. Dėl t SS įvertinimo žr. 5 priedėlį.
(78) Vandens ėminys imamas po to, kai kameros vandens tūris buvo pakeistas mažiausiai tris kartus.
(79) Šios žuvys yra imamos iš pradinės populiacijos.
(80) Jei būtinas didesnis tikslumas ar metabolizmo tyrimai, kuriems atlikti reikia daugiau žuvų, jas reikėtų imti visų pirma sugerties ir apsivalymo tarpsnių pabaigoje (žr. 40 pastraipą).
(81) Lipidų kiekiui analizuoti gali prireikti ne mažiau kaip 3 papildomų žuvų, jei neįmanoma naudoti žuvų, kurios buvo paimtos cheminės medžiagos koncentracijos vertėms nustatyti bandymo pradžioje, sugerties tarpsnio pabaigoje ir apsivalymo tarpsnio pabaigoje. Reikėtų pažymėti, kad daugumoje atvejų galima naudoti tik tris kontrolines žuvis (žr. 56 pastraipą).
(82) Analizuojami 3 maisto ėminiai, paimti iš kontrolinių grupių ir bandymo grupių, bandomosios cheminės medžiagos koncentracijai ir lipidų kiekiui nustatyti.
(83) Žuvys imamos iš pradinės populiacijos kuo arčiau tyrimo pradžios; bandymo pradžioje paimamos bent 3 žuvys iš pradinės populiacijos lipidų kiekiui nustatyti.
(84) Imant (neprivalomai) ėminius sugerties tarpsniu, gaunami duomenys bandomosios medžiagos įsisavinimui su maistu apskaičiuoti, kad jį būtų galima palyginti su įsisavinimo efektyvumu, apskaičiuotu pagal apsivalymo tarpsnio duomenis.
(85) Galima paimti papildomai 5 žuvis audinių specifinei analizei atlikti.
(86) Lipidų kiekiui analizuoti gali prireikti ne mažiau kaip 3 papildomų žuvų, jei neįmanoma naudoti žuvų, kurios buvo paimtos cheminės medžiagos koncentracijos vertėms nustatyti bandymo pradžioje, sugerties tarpsnio pabaigoje ir apsivalymo tarpsnio pabaigoje. Reikėtų pažymėti, kad daugumoje atvejų galima naudoti tik tris kontrolines žuvis (žr. 56 ir 153 pastraipas).
(87) Kaip ir kiekvienos empirinės priklausomybės atveju, reikėtų patikrinti, ar bandomoji cheminė medžiaga patenka į priklausomybės taikymo sritį
(88) Žuvų masė sugerties tarpsnio pabaigoje gali būti įvertinta pagal ankstesnių tyrimų duomenis arba pagal turimas žinias apie bandymo rūšių galimą masės padidėjimą nuo tipinės masės bandymo pradžioje per tipinę sugerties tarpsnio trukmę, pvz., 28 paras).
(89) Dauguma programų tiesinei regresijai skaičiuoti turi galimybę gauti įverčių standartinį nuokrypį ir pasikliovimo intervalą (PI), pvz., Microsoft Excel naudojant duomenų analizės rinkinį.
(90) Priešingai nei taikant tiesinės regresijos metodą, naudojant šią formulę nebus gauta standartinė k2 paklaida.
(91) Priešingai nei taikant tiesės priderinimo procedūrą, šiuo metodu nebus gauta k1 įverčio standartinė paklaida ar pasikliovimo intervalas.
(92) Reikėtų suvokti, kad k 2 įverčio neapibrėžtis nėra tinkamai naudojama, taikant biologinio kaupimosi modelį, į ją iš esmės žiūrint kaip į konstantą, kai1 priderinama pagal nuosekliojo priderinimo metodą. Todėl nuosekliuoju ir vienalaikiu priderinimo metodu gauto BCF neapibrėžtis bus skirtinga.
(93) Kai kuriuose regionuose gali būti įmanoma gauti tik tokį žuvų maistą, kuriame lipidų koncentracija būtų gerokai mažesnė nei ši viršutinė riba. Tokiais atvejais tyrimai turėtų būti atliekami esant mažesnei tiekiamo maisto lipidų koncentracijai, bet reikėtų tinkamai reguliuoti maisto normą, kad būtų užtikrinta žuvų sveikata. Maisto lipidų kiekį nereikėtų dirbtinai didinti pridedant daugiau aliejaus.
(94) Gamtoje tikėtina, kad stipriai hidrofobinių cheminių medžiagų nurijimas daro didesnį poveikį nei veikimo per vandeninę terpę bandymas, todėl BCF įvertis nėra tokios cheminės medžiagos biologinio kaupimosi gebos tikslus rodiklis.
(95) Galima naudoti kitas dafnijų rūšis, jei jos atitinka reikiamus tinkamumo kriterijus (su kontrolinių ėminių reprodukcijos našumu susijęs tinkamumo kriterijus turėtų būti taikomas visoms rūšims). Jei naudojamos kitų rūšių dafnijos, jas reikėtų aiškiai identifikuoti ir jų naudojimą pagrįsti.
(96) Atsitiktinis gaištamumas – su chemine medžiaga nesusijęs gaištamumas, sukeltas atsitiktinio įvykio (t. y. žinoma priežastis).
(97) Netyčinis gaištamumas – su chemine medžiaga nesusijęs gaištamumas dėl nežinomos priežasties.
(*6) Nurodomas bandymui naudotas indas.
(*7) Registruojami neapvaisinti kiaušinėliai, atitinkamame langelyje įrašant „AB“
(*8) Registruojamas visų motininių gyvūnų giaštamumas, atitinkamame langelyje įrašant „M“
(98) Tipinis mažiausias visas vidutinis ilgis nėra tinkamumo kriterijus, bet didesnius nei nurodyti skaičiai nukrypimus reikėtų atidžiai ištirti atsižvelgiant į bandymo jautrį. Mažiausias visas vidutinis ilgis yra gautas pagal šiuo metu turimus atrinktus duomenis.
(99) Tam tikras bandomų vaivorykštinių upėtakių veisles gali tekti laikyti kitoje temperatūroje. Neršiančios žuvys turi būti laikomos toje pačioje temperatūroje, kurioje buvo laikomi ikrai. Gavus ikrus iš komercinio veisėjo, po atvykimo yra būtinas trumpas (pvz., 1–2 h) aklimatizavimas bandymo temperatūroje.
(100) Lervos vieną savaitę po išsiritimo laikomos tamsoje, išskyrus apžiūros metą, vėliau – prislopintoje šviesoje visą bandymo trukmę (12–16 h šviesiojo laikotarpio trukmė) (4).
(101) Esant tam tikroms bandymų sąlygoms, apšvietimo režimas turėtų būti pastovus.
(102) Atliekant visus bandymus tai turi būti nustatyta ± 20/00 tikslumu.
(*9) Reikėtų maitinti iki soties. Jei būtina, maisto perteklių ir išmatas reikėtų pašalinti, kad nesikauptų atliekos.
|
FBS |
– |
šaldytos sūriavandenės krevetės; suaugusios Artemia sp; |
|
BSN |
– |
sūriavandenių krevečių nauplijai; tik ką išsiritę; |
|
BSN48 |
– |
sūriavandenių krevečių nauplijai; 48 h amžiaus; |
(1) lervų su trynio maišeliu maitinti nereikia;
(2) filtruoti iš kultūros mišinio;
(3) fermentavimo proceso granulės.
(*10) Spenelinės ataugos paprastai atsiranda tik pas suaugusius patinus ir būna tarp antrojo ir septintojo arba aštuntojo analinio peleko spindulio, skaičiuojant nuo analinio peleko užpakalinio galo (1 ir 2 paveikslai). Tačiau ataugos retai atsiranda ant pirmojo peleko spindulio nuo analinio peleko užpakalinio galo. Pagal šią standartinę veiklos procedūrą (SVP) galima matuoti ant pirmojo peleko spindulio esančias ataugas (pagal šią SVP peleko spinduliai skaičiuojami nuo analinio peleko užpakalinio galo).
(*11) Homogenizavimo buferinis tirpalas:
|
— |
(50 mmol/l Tris-HCl, pH 7,4; 1 % proteazės inhibitoriaus mišinio (Sigma)): 12 ml Tris-HCl pH 7,4 + 120 μl proteazės inhibitoriaus mišinio. |
|
— |
TRIS: TRIS-ULTRA PURE (ICN), pvz., Bie & Berntsen gamybos, Danija. |
|
— |
Proteazės inhibitoriaus mišinys: Sigma gamybos (žinduolių audiniams). Produkto numeris P 8340. |
PASTABA. Homogenizavimo buferis turėtų būti naudojamas gamybos dieną. Naudojant dedamas ant ledo.
(103) Carl von Linné (gimė 1707 m. gegužės 23 d. Elmhulte; mirė 1778 m.sausio 10 dieną Upsaloje).
(*12) demineralizuotas (t. y. distiliuotas ar dejonizuotas) vanduo.



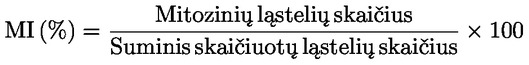
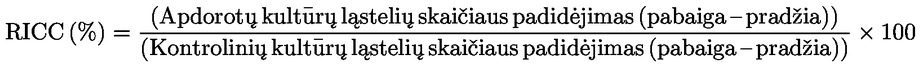


 , kuris yra lygus 0,095 mm. Naudotojai turėtų žinoti, kad matuojant mikroskopu su plyšine lempa ragenos storio matmenys gali skirtis, jei skirtingas plyšio pločio nuostatis.
, kuris yra lygus 0,095 mm. Naudotojai turėtų žinoti, kad matuojant mikroskopu su plyšine lempa ragenos storio matmenys gali skirtis, jei skirtingas plyšio pločio nuostatis.

































































