

This document is an excerpt from the EUR-Lex website
Document 02001L0018-20031107
Directive 2001/18/EC of the European Parliament and of the Council of 12 March 2001 on the deliberate release into the environment of genetically modified organisms and repealing Council Directive 90/220/EEC
Consolidated text: Directive 2001/18/EC of the European Parliament and of the Council of 12 March 2001 on the deliberate release into the environment of genetically modified organisms and repealing Council Directive 90/220/EEC
Directive 2001/18/EC of the European Parliament and of the Council of 12 March 2001 on the deliberate release into the environment of genetically modified organisms and repealing Council Directive 90/220/EEC
2001L0018 — CS — 07.11.2003 — 002.001
Tento dokument je třeba brát jako dokumentační nástroj a instituce nenesou jakoukoli odpovědnost za jeho obsah
|
SMĚRNICE EVROPSKÉHO PARLAMENTU A RADY 2001/18/ES ze dne 12. března 2001 (Úř. věst. L 106, 17.4.2001, p.1) |
Ve znění:
|
|
|
Úřední věstník |
||
|
No |
page |
date |
||
|
L 200 |
22 |
30.7.2002 |
||
|
NAŘÍZENÍ EVROPSKÉHO PARLAMENTU A RADY (ES) č. 1829/2003 ze dne 22. září 2003 |
L 268 |
1 |
18.10.2003 |
|
|
NAŘÍZENÍ EVROPSKÉHO PARLAMENTU A RADY (ES) č. 1830/2003 ze dne 22. září 2003 |
L 268 |
24 |
18.10.2003 |
|
SMĚRNICE EVROPSKÉHO PARLAMENTU A RADY 2001/18/ES
ze dne 12. března 2001
o záměrném uvolňování geneticky modifikovaných organismů do životního prostředí a o zrušení směrnice Rady 90/220/EHS
EVROPSKÝ PARLAMENT A RADA EVROPSKÉ UNIE,
s ohledem na Smlouvu o založení Evropského společenství, a zejména na článek 95 této smlouvy,
s ohledem na návrh Komise ( 1 ),
s ohledem na stanovisko Hospodářského a sociálního výboru ( 2 ),
v souladu s postupem stanoveným v článku 251 Smlouvy, s ohledem na společný návrh schválený dohodovacím výborem dne 20. prosince 2000 ( 3 ),
vzhledem k těmto důvodům:|
(1) |
Zpráva Komise o přezkoumání směrnice Rady 90/220/EHS ze dne 23. dubna 1990 o záměrném uvolňování geneticky modifikovaných organismů do životního prostředí ( 4 ), přijatá dne 10. prosince 1996, vymezila řadu oblastí, které vyžadují zlepšení. |
|
(2) |
Je potřeba jasně stanovit oblast působnosti směrnice 90/220/EHS a definic v ní obsažených. |
|
(3) |
Směrnice 90/220/EHS již byla pozměněna. Touto směrnicí jsou prováděny další změny, a tudíž je z důvodu jasnosti a přehlednosti žádoucí, aby byla příslušná ustanovení přeformulována. |
|
(4) |
Živé organismy, které jsou ve velkých nebo malých množstvích uvolňovány do životního prostředí pro vědecké účely nebo jako produkty obchodního charakteru, se mohou v tomto prostředí rozmnožovat a překračovat hranice států. Tím může docházet k jejich působení v dalších členských státech a účinky tohoto působení mohou být nevratné. |
|
(5) |
Ochrana lidského zdraví a životního prostředí vyžaduje, aby byla věnována dostatečná pozornost kontrole rizik spojených se záměrným uvolňováním geneticky modifikovaných organismů do životního prostředí. |
|
(6) |
Činnost Společenství týkající se životního prostředí by podle Smlouvy měla být založena na zásadě přijímání preventivních opatření. |
|
(7) |
Je nezbytné sbližovat právní předpisy členských států vztahující se k záměrnému uvolňování geneticky modifikovaných organismů do životního prostředí a zajistit bezpečný vývoj průmyslových produktů, které geneticky modifikované organismy využívají. |
|
(8) |
Při vypracování této směrnice byla vzata v úvahu zásada předběžné opatrnosti. Je třeba zajistit, aby tato zásada byla uplatněna i při provádění této směrnice. |
|
(9) |
Je zvláště důležité, aby byly respektovány etické zásady každého jednotlivého členského státu. Členské státy mohou k těmto etickým zásadám přihlížet při záměrném uvolňování geneticky modifikovaných organismů do životního prostředí nebo při uvádění na trh geneticky modifikovaných organismů nebo produktů, které geneticky modifikované organismy obsahují. |
|
(10) |
Má-li být právní rámec dostatečný a průhledný, je nezbytné zajistit, aby Komise nebo členské státy během přípravy příslušných opatření konzultovaly veřejnost a aby byla veřejnost informována o opatřeních přijatých během provádění této směrnice. |
|
(11) |
Uvádění na trh zahrnuje též dovoz. Produkty, které obsahují geneticky modifikované organismy nebo se z geneticky modifikovaných organismů skládají a na něž se vztahuje tato směrnice, nemohou být do Společenství dovezeny, nevyhovují-li ustanovením směrnice. |
|
(12) |
Na schválení dovozu geneticky modifikovaných organismů nebo nakládání s geneticky modifikovanými organismy ve velkých množstvích, např. jedná-li se o zemědělské komodity, je nutno pohlížet jako na proces uvádění na trh ve smyslu této směrnice. |
|
(13) |
Tato směrnice bere náležitě v úvahu mezinárodní zkušenosti na tomto poli a pravidla mezinárodního obchodu a měla by respektovat požadavky Cartagenského protokolu o biologické bezpečnosti k Úmluvě o biologické rozmanitosti. Komise by měla co nejdříve, nejpozději však do července 2001, předložit současně s ratifikací protokolu vhodné návrhy na jeho provádění. |
|
(14) |
Regulativní výbor by měl připravit prováděcí pokyny k ustanovením směrnice týkajícím se definice uvádění na trh. |
|
(15) |
Definice „geneticky modifikovaného organismu“ pro účely této směrnice by se neměla vztahovat na lidské bytosti. |
|
(16) |
Aniž jsou dotčeny vnitrostátní právní předpisy v oblasti odpovědnosti za životní prostředí, potřebují právní předpisy Společenství doplnit o pravidla týkající se odpovědnosti za různé druhy škod na životním prostředí ve všech oblastech Evropské unie. Za tímto účelem se Komise zavázala předložit legislativní návrh předpisu o odpovědnosti za životní prostředí, který by měl být vypracován do konce roku 2001 a bude se týkat i škod souvisejících s geneticky modifikovanými organismy. |
|
(17) |
Tato směrnice by neměla být uplatňována na organismy získané určitými technikami genetické modifikace, které jsou již dlouho běžně používány a u kterých je dlouhodobě dokumentována bezpečnost. |
|
(18) |
Je nutno stanovit harmonizované postupy a kritéria, které by případ od případu umožnily hodnotit možná rizika spojená se záměrným uvolňováním geneticky modifikovaných organismů do životního prostředí. |
|
(19) |
Hodnocení rizik pro životní prostředí případ od případu by mělo být prováděno před každým uvolněním. V úvahu by též měly být vzaty možné dlouhodobě působící účinky kumulativního charakteru vyplývající z interakce s dalšími geneticky modifikovanými organismy a se životním prostředím. |
|
(20) |
Je nutno ustanovit společnou metodiku postupu hodnocení rizik pro životní prostředí založenou na nezávislém vědeckém doporučení. Dále je nezbytné stanovit společné cíle monitorování geneticky modifikovaných organismů po jejich záměrném uvolnění do životního prostředí nebo jejich uvedení na trh jako produktů nebo jako součástí produktů. Povinnou částí plánu monitorování by mělo být monitorování možných dlouhodobě působících účinků kumulativního charakteru. |
|
(21) |
Členské státy a Komise by měly zajistit systematický a nezávislý výzkum možných rizik spojených se záměrným uvolňováním geneticky modifikovaných organismů nebo s jejich uváděním na trh. Zdroje potřebné pro takový výzkum by měly být zajištěny členskými státy a Komisí v souladu s jejich rozpočtovými pravidly a nezávislým výzkumníkům by měl být umožněn přístup ke všem souvisejícím materiálům, při respektování práv duševního vlastnictví. |
|
(22) |
Při hodnocení rizik geneticky modifikovaných organismů obsahujících geny pro rezistenci k antibiotikům by měla být těmto genům věnována zvláštní pozornost. |
|
(23) |
Záměrné uvolnění geneticky modifikovaných organismů ve stadiu výzkumu je ve většině případů nezbytným krokem při vývoji nových produktů na bázi geneticky modifikovaných organismů nebo produktů s jejich obsahem. |
|
(24) |
Zavádění geneticky modifikovaných organismů do životního prostředí by mělo být prováděno v souladu se zásadou postupu „krok za krokem“. To znamená, že uzavření by mělo být omezováno postupně a měřítko uvolnění postupně zvětšováno, a to pouze tehdy, jestliže vyhodnocení předcházejících kroků z hlediska ochrany lidského zdraví a životního prostředí další kroky dovoluje. |
|
(25) |
Žádné geneticky modifikované organismy a produkty s jejich obsahem, které jsou určeny k záměrnému uvolnění, nesmějí být uvedeny na trh, aniž by byly ve výzkumném i vývojovém stadiu podrobeny dostatečným polním zkouškám v takových ekosystémech, které by mohly být jejich použitím ovlivněny. |
|
(26) |
Provádění této směrnice by mělo probíhat v úzké souvislosti s prováděním dalších příslušných nástrojů, jako je např. směrnice Rady 91/414/EHS ze dne 15. července 1991 o uvádění přípravků na ochranu rostlin na trh ( 5 ). Orgány, které jsou odpovědné za provádění této směrnice a zmíněných nástrojů v rámci Komise a na vnitrostátní úrovni, by měly v tomto kontextu koordinovat svou činnost v nejvyšší možné míře. |
|
(27) |
Pokud se týká hodnocení rizika pro životní prostředí pro část C, řízení rizik, označování, monitorování, informování veřejnosti a ochranné doložky, měla by tato směrnice poskytovat referenční údaje pro geneticky modifikované organismy a pro produkty s jejich obsahem, které jsou autorizovány jinými právními předpisy Společenství a vyžadují specifické hodnocení rizik pro životní prostředí, které má být provedeno v souladu se zásadami uvedenými v příloze II a na základě informací podrobně specifikovaných v příloze III, aniž jsou dotčeny dodatečné požadavky právních předpisů Společenství zmíněných výše a požadavky týkající se řízení rizik, označování, popřípadě monitorování, informování veřejnosti a ochranné doložky, přinejmenším v míře, která odpovídá požadavkům této směrnice. Pro dosažení tohoto cíle je za účelem provádění této směrnice nezbytná spolupráce mezi orgány Společenství a členských států, které jsou v této směrnici uvedeny. |
|
(28) |
Pro uvádění na trh geneticky modifikovaných organismů nebo produktů s jejich obsahem, u nichž se při jejich používání předpokládá záměrné uvolnění organismu nebo organismů do životního prostředí, je nezbytné stanovit autorizační postup Společenství. |
|
(29) |
Komise byla vyzvána k provedení studie, která by měla vyhodnotit různé způsoby dalšího zlepšení provázanosti a účinnosti tohoto rámcového předpisu, především z hlediska společného autorizačního postupu pro uvádění geneticky modifikovaných organismů na trh Společenství. |
|
(30) |
Požadavky odvětvových předpisů na monitorování určitého produktu bude možná nutno pozměnit. |
|
(31) |
Část C této směrnice se netýká produktů, které jsou předmětem nařízení Rady (EHS) č. 2309/93 ze dne 22. července 1993, kterým se stanoví postupy Společenství pro registraci a dozor nad humánními a veterinárními léčivými přípravky a kterým se zakládá Evropská agentura pro hodnocení léčivých přípravků ( 6 ), za předpokladu, že hodnocení rizik pro životní prostředí je prováděno způsobem odpovídajícím požadavkům této směrnice. |
|
(32) |
Zahrnuje-li zamýšlené využití produktu záměrné uvolnění geneticky modifikovaného organismu do životního prostředí, musí kterákoli osoba před uskutečněním záměrného uvolnění geneticky modifikovaného organismu do životního prostředí nebo před uvedením na trh geneticky modifikovaných organismů nebo produktů s jejich obsahem předložit oznámení příslušnému vnitrostátnímu orgánu. |
|
(33) |
Toto oznámení by mělo obsahovat technickou dokumentaci obsahující úplné hodnocení rizik pro životní prostředí, přiměřenou reakci na požadavky bezpečnosti a mimořádných situací, u produktů i přesný návod a podmínky jejich použití a návrh označování a balení. |
|
(34) |
Po oznámení by jakékoli záměrné uvolnění mělo být provedeno až po obdržení souhlasu příslušných orgánů. |
|
(35) |
Oznamovatel by měl mít možnost stáhnout svou dokumentaci v kterémkoli stadiu správního postupu podle této směrnice. Stažením dokumentace by měl být správní postup ukončen. |
|
(36) |
Zamítnutím oznámení o uvedení geneticky modifikovaného organismu nebo produktů geneticky modifikované organismy obsahujících na trh příslušným orgánem by nemělo být dotčeno předložení oznámení téhož geneticky modifikovaného organismu jinému příslušnému orgánu. |
|
(37) |
Na konci doby určené ke zprostředkování by po odstranění všech výhrad mělo být dosaženo dohody. |
|
(38) |
Zamítnutím oznámení v důsledku potvrzené nepříznivé hodnotící zprávy by neměla být dotčena budoucí rozhodnutí založená na oznámení téhož geneticky modifikovaného organismu předloženém jinému příslušnému orgánu. |
|
(39) |
V zájmu hladkého fungování této směrnice by členské státy předtím, než využijí ochrannou doložku této směrnice, měly použít různá ustanovení o výměně informací a zkušeností. |
|
(40) |
Aby bylo zajištěno, že přítomnost geneticky modifikovaných organismů v produktech, které tyto organismy obsahují nebo z nichž sestávají, je dostatečně identifikována, měla by být slova „Tento produkt obsahuje geneticky modifikované organismy“ uvedena jasně buď na štítku produktu, nebo v průvodním dokumentu. |
|
(41) |
Příslušným postupem výboru by se zřetelem k náležitému vývoji na mezinárodním fóru měl být vytvořen systém jednoznačných identifikátorů geneticky modifikovaných organismů. |
|
(42) |
U geneticky modifikovaných organismů nebo produktů s jejich obsahem, které jsou autorizovány podle části C této směrnice, musí být zajištěna jejich sledovatelnost ve všech stadiích procesu uvádění na trh. |
|
(43) |
Do této směrnice je nutno zavést povinnost provádění plánu monitorování, aby mohly být sledovány a identifikovány všechny přímé i nepřímé, okamžité, opožděné i nepředvídatelné účinky geneticky modifikovaných organismů a produktů s jejich obsahem na lidské zdraví nebo životní prostředí v období po uvedení na trh. |
|
(44) |
Členské státy by měly být v souladu se Smlouvou schopny přijmout další opatření pro monitorování a inspekci geneticky modifikovaných organismů a produktů s jejich obsahem, např. prostřednictvím úředních orgánů. |
|
(45) |
Měly by být zváženy prostředky umožňující kontrolu geneticky modifikovaných organismů a nápravná opatření v případě vážného rizika. |
|
(46) |
Při přípravě opatření předkládaných regulativnímu výboru by měly být vzaty v úvahu připomínky veřejnosti. |
|
(47) |
Příslušný orgán by měl udělit souhlas pouze tehdy, jestliže je přesvědčen o bezpečnosti uvolnění pro lidské zdraví a životní prostředí. |
|
(48) |
Správní postup pro udělování souhlasu s uvedením na trh geneticky modifikovaných organismů a produktů s jejich obsahem by měl být účinnější a průhlednější a doba poprvé uděleného souhlasu by měla být pevně stanovena. |
|
(49) |
Pro produkty, u nichž byl vydán souhlas s pevně stanovenou dobou platnosti, by v případě obnovování souhlasu měl být využíván zjednodušený postup. |
|
(50) |
Existující souhlasy udělené podle směrnice 90/220/EHS musí být obnoveny, aby nedocházelo k nesrovnalostem mezi souhlasy udělenými podle zmíněné směrnice a této směrnice a aby byly splněny veškeré podmínky, které souhlas podle této směrnice vyžaduje. |
|
(51) |
Takové obnovení vyžaduje přechodné období, během kterého zůstávají souhlasy udělené podle směrnice 90/220/EHS v platnosti. |
|
(52) |
Při obnovování souhlasu by mělo být umožněno přezkoumání všech podmínek původního souhlasu, včetně těch, které se týkají monitorování a časových omezení tohoto souhlasu. |
|
(53) |
Mělo by být přijato ustanovení umožňující konzultace s vědeckým výborem nebo výbory, zřízenými rozhodnutím Komise 97/579/ES ( 7 ), k problémům, které mohou mít dopad na lidské zdraví nebo životní prostředí. |
|
(54) |
Systém výměny informací uvedených v oznámeních, který zavedla směrnice 90/220/EHS, prokázal svou užitečnost a měl by být zachován. |
|
(55) |
Je velice důležité pozorně sledovat vývoj a využívání geneticky modifikovaných organismů. |
|
(56) |
Je-li produkt sestávající z geneticky modifikovaných organismů nebo s jejich obsahem uveden na trh a je-li tento produkt příslušně autorizován podle této směrnice, pak členský stát nesmí zakázat nebo omezit uvedení na trh geneticky modifikovaných organismů nebo produktů s jejich obsahem, které splňují požadavky této směrnice, ani jim bránit. V případě rizika pro lidské zdraví nebo životní prostředí by měl být využit ochranný postup. |
|
(57) |
Měl by být zjišťován názor Evropské skupiny pro etiku ve vědě a v nových technologiích, zřízené Komisí, na etická hlediska podstaty záměrného uvolňování nebo uvádění na trh geneticky modifikovaných organismů. Tyto konzultace by neměly omezit pravomoci členských států v oblasti etiky. |
|
(58) |
Členské státy by měly mít možnost zjišťovat názor kteréhokoli z jimi zřízených výborů na otázky etických důsledků biotechnologií. |
|
(59) |
Opatření nezbytná k provádění této směrnice musí být přijata v souladu s rozhodnutím Rady 1999/468/ES ze dne 28. června 1999, které stanoví postupy pro výkon prováděcích pravomocí Komise ( 8 ). |
|
(60) |
Výměna informací podle této směrnice by se měla týkat též zkušeností v oblasti etických hledisek. |
|
(61) |
Z důvodu vyšší účinnosti při provádění ustanovení přijatých podle této směrnice je vhodné požadovat od členských států využívání pokut, a to včetně případů uvolnění nebo uvedení na trh, které nesplňují ustanovení této směrnice, zvláště je-li to výsledkem nedbalosti. |
|
(62) |
Zpráva, kterou Komise každé tři roky vydá a v níž shrne informace poskytnuté členskými státy, by měla obsahovat samostatnou kapitolu o sociálních a ekonomických výhodách a nevýhodách každé jednotlivé kategorie geneticky modifikovaných organismů autorizovaných pro uvedení na trh, zaměřenou na zájmy zemědělců a spotřebitelů. |
|
(63) |
Regulativní rámec pro biotechnologie by měl být přezkoumán, aby byly identifikovány možnosti pro zlepšení jeho provázanosti a účinnosti. Některé postupy bude z hlediska optimalizace účinnosti možná zapotřebí změnit a měly by být zváženy všechny cesty, které mohou vést k tomuto cíli, |
PŘIJALA TUTO SMĚRNICI:
ČÁST A
OBECNÁ USTANOVENÍ
Článek 1
Cíl
Cílem této směrnice je, v souladu se zásadou předběžné opatrnosti, sblížit právní a správní předpisy členských států a chránit lidské zdraví a životní prostředí pro případy:
— záměrného uvolňování geneticky modifikovaných organismů do životního prostředí z důvodů jiných, než je uvádění na trh Společenství,
— uvádění geneticky modifikovaných organismů nebo produktů s jejich obsahem na trh Společenství.
Článek 2
Definice
Pro účely této směrnice se rozumí:
|
1. |
„organismem“biologická entita schopná rozmnožování nebo přenosu genetického materiálu; |
|
2. |
„geneticky modifikovaným organismem“ organismus, s výjimkou lidských bytostí, jehož genetický materiál byl změněn způsobem, jehož se přirozenou cestou nedosáhne pářením ani přirozenou rekombinací; v rámci této definice: a) genetická modifikace se uskuteční přinejmenším při použití technik uvedených v příloze I A části 1; b) techniky uvedené v příloze I A části 2 nejsou považovány za techniky vedoucí ke genetické modifikaci; |
|
3. |
„záměrným uvolněním“úmyslné zavedení geneticky modifikovaného organismu nebo kombinace geneticky modifikovaných organismů do životního prostředí, při němž nejsou použita žádná zvláštní uzavírací opatření k omezení kontaktu a poskytnutí vysoké úrovně bezpečnosti pro veškerou populaci a životní prostředí; |
|
4. |
„uvedením na trh“ poskytnutí třetím stranám, za úplatu nebo bezplatně. Následující operace nesmějí být považovány za uvedení na trh: — poskytnutí geneticky modifikovaných organismů pro činnosti spadající do působnosti směrnice Rady 90/219/EHS ze dne 23. dubna 1990 o uzavřeném nakládání s geneticky modifikovanými mikroorganismy ( 9 ), včetně sbírek kultur, — poskytnutí geneticky modifikovaných organismů odlišných od mikroorganismů uvedených v první odrážce, které mají sloužit výlučně pro činnosti, při nichž jsou použita vhodná přísná uzavírací opatření k omezení kontaktu a poskytnutí vysoké úrovně bezpečnosti pro veškerou populaci a životní prostředí, přičemž tato opatření by měla vycházet ze stejných zásad uzavření, jako jsou zásady uvedené ve směrnici 90/219/EHS, — poskytnutí geneticky modifikovaných organismů, které mají být výlučně použity pro záměrné uvolnění v souladu s požadavky uvedenými v části B této směrnice; |
|
5. |
„oznámením“předložení informací vyžadovaných touto směrnicí příslušnému orgánu členského státu; |
|
6. |
„oznamovatelem“osoba, která oznámení předkládá; |
|
7. |
„produktem“přípravek, který se skládá z geneticky modifikovaného organismu nebo z kombinace geneticky modifikovaných organismů nebo je obsahuje a který je uváděn na trh; |
|
8. |
„hodnocením rizika pro životní prostředí“hodnocení rizik pro lidské zdraví a životní prostředí, přímých i nepřímých, okamžitých i časově opožděných, která mohou nastat v důsledku záměrného uvolnění geneticky modifikovaných organismů nebo uvedení geneticky modifikovaných organismů na trh, provedené podle přílohy II. |
Článek 3
Výjimky
1. Tato směrnice se nevztahuje na organismy získané technikami genetické modifikace uvedenými v příloze I B.
2. Tato směrnice se nevztahuje na přepravu geneticky modifikovaných organismů po železnici, po silnicích, po vnitrozemských vodních cestách, po moři nebo vzduchem.
Článek 4
Obecné povinnosti
1. Členské státy v souladu se zásadou předběžné opatrnosti zajistí přijetí veškerých vhodných opatření k odvrácení nepříznivých účinků na lidské zdraví a životní prostředí, které mohou nastat v důsledku záměrného uvolnění geneticky modifikovaných organismů nebo jejich uvedení na trh. Geneticky modifikované organismy mohou být záměrně uvolněny nebo uvedeny na trh pouze postupem uvedeným v části B nebo C.
2. Kterákoli osoba musí před podáním oznámení podle části B nebo C provést hodnocení rizika pro životní prostředí. Informace nezbytné pro hodnocení rizika pro životní prostředí jsou uvedeny v příloze III. Členské státy a Komise zajistí, aby geneticky modifikovaným organismům obsahujícím geny s rezistencí vůči antibiotikům používaným k lékařským nebo veterinárním účelům byla při hodnocení rizik pro životní prostředí věnována zvláštní pozornost, aby mohlo být identifikováno a vyloučeno využívání znaků antibiotické rezistence v geneticky modifikovaných organismech, které mohou mít nepříznivý účinek na lidské zdraví a životní prostředí. Toto vyloučení musí být provedeno do 31. prosince 2004 v případě geneticky modifikovaných organismů uvedených na trh podle části C a do 31. prosince 2008 v případě geneticky modifikovaných organismů autorizovaných podle části B.
3. Členské státy a popřípadě Komise zajistí, aby možné nepříznivé účinky na lidské zdraví a životní prostředí, které se mohou přímo nebo nepřímo vyskytnout v důsledku přenosu genů z geneticky modifikovaných organismů do jiných organismů, byly pečlivě případ od případu vyhodnoceny. Hodnocení bude provedeno v souladu s přílohou II, přičemž dopady na životní prostředí budou zváženy podle charakteru zaváděného organismu i podle přijímajícího prostředí.
4. Členské státy určí příslušný orgán nebo orgány odpovědné za soulad s požadavky této směrnice. Příslušný orgán musí přezkoumat oznámení podle části B a části C z hlediska souladu s požadavky této směrnice a z hlediska náležitosti hodnocení vyžadovaného podle odstavce 2.
5. Členské státy zajistí, aby příslušný orgán organizoval inspekce a další vhodná kontrolní opatření k zajištění souladu s touto směrnicí. Dojde-li k uvolnění nebo k uvedení na trh geneticky modifikovaného organismu či organismů nebo produktů obsahujících geneticky modifikované organismy, kterým nebyla udělena autorizace, zajistí členský stát, aby byla přijata opatření nezbytná k ukončení uvolňování nebo uvádění na trh, k započetí nápravných činností a k uvědomění veřejnosti, Komise a dalších členských států.
▼M3 —————
ČÁST B
ZÁMĚRNÉ UVOLŇOVÁNÍ GENETICKY MODIFIKOVANÝCH ORGANISMŮ PRO JINÉ ÚČELY, NEŽ JE UVEDENÍ NA TRH
Článek 5
1. Články 6 až 11 nesmějí být využity na lékové substance a léčiva pro lidskou potřebu, které sestávají z geneticky modifikovaných organismů nebo z kombinace geneticky modifikovaných organismů nebo tyto organismy nebo jejich kombinace obsahují, za předpokladu, že jejich záměrné uvolnění pro účely jiné než uvedení na trh je autorizováno právními předpisy Společenství, které vyžadují:
a) specifické hodnocení rizika pro životní prostředí v souladu s přílohou II a na základě informací uvedených v příloze III, aniž jsou dotčeny další požadavky výše zmíněných právních předpisů;
b) jednoznačné udělení souhlasu před uvolněním;
c) plán monitorování vypracovaný v souladu s příslušnými částmi přílohy III, s ohledem na detekci účinků geneticky modifikovaného organismu nebo organismů na lidské zdraví a životní prostředí;
d) vhodným způsobem formulované požadavky týkající se nakládání s novými informacemi, informacemi pro veřejnost, informacemi o výsledcích uvolnění a výměny informací přinejmenším v objemu rovnocenném objemu informací obsažených v této směrnici a v opatřeních, která z této směrnice vyplývají.
2. Hodnocení rizik pro životní prostředí, která zmíněné substance a léčiva představují, se provádí v součinnosti vnitrostátních orgánů a orgánů Společenství uvedených v této směrnici.
3. Postupy zajišťující shodu s požadovaným specifickým hodnocením rizika pro životní prostředí a rovnocennost s ustanoveními této směrnice musí být vyžadovány výše zmíněnými právními předpisy, v kterých musí být uveden odkaz na tuto směrnici.
Článek 6
Standardní autorizační postup
1. Aniž je dotčen článek 5, musí jakákoli osoba, dříve než přikročí k záměrnému uvolnění geneticky modifikovaného organismu nebo kombinace genetických organismů, předložit oznámení příslušnému orgánu členského státu, na jehož území má k uvolnění dojít.
2. Oznámení podle odstavce 1 musí obsahovat:
a) technickou dokumentaci s informacemi uvedenými v příloze III, které jsou nezbytné pro vyhodnocení rizik pro životní prostředí v souvislosti se záměrným uvolněním geneticky modifikovaného organismu nebo kombinace geneticky modifikovaných organismů, především:
i) všeobecné informace, včetně informací o pracovnících a jejich školení;
ii) informace o geneticky modifikovaném organismu nebo organismech;
iii) informace o podmínkách uvolnění a o možném přijímajícím prostředí;
iv) informace o interakcích mezi geneticky modifikovaným organismem nebo organismy a prostředím;
v) plán monitorování v souladu s příslušnými částmi přílohy III, aby bylo možné identifikovat účinky geneticky modifikovaného organismu nebo organismů na lidské zdraví a životní prostředí;
vi) informace o kontrolách, nápravných metodách, nakládání s odpady a plánech pro řešení mimořádných situací;
vii) shrnutí obsahu dokumentace;
b) hodnocení rizik na životní prostředí a závěry vyžadované v příloze II oddílu D, spolu s bibliografickými odkazy a označením použitých metod.
3. Oznamovatel může využít odkazu na údaje nebo výsledky předchozích oznámení předložených jinými oznamovateli, jestliže tyto informace, údaje a výsledky nejsou důvěrné nebo jestliže dotčení oznamovatelé dali již písemné svolení, nebo může poskytnout odpovídající doplňující informace.
4. Příslušný orgán může souhlasit s tím, aby uvolnění stejných geneticky modifikovaných organismů nebo kombinace geneticky modifikovaných organismů na stejném místě nebo na různých místech pro stejný účel a v určitém stanoveném období byla oznámena jediným oznámením.
5. Příslušný orgán zaznamená datum obdržení oznámení a po obdržení a případném zvážení výhrad ostatních členských států, učiněných v souladu s článkem 11, odpoví oznamovateli písemně do 90 dnů od obdržení oznámení buď:
a) sdělením, že oznámení je v souladu s touto směrnicí, a uvolnění tudíž může být provedeno, nebo
b) sdělením, že uvolnění nesplňuje podmínky této směrnice, a oznámení se tudíž zamítá.
6. Pro účely výpočtu devadesátidenní lhůty podle odstavce 5 se neberou v úvahu doby, během nichž příslušný orgán
a) čeká na další informace, které si může od oznamovatele vyžádat, nebo
b) pořádá veřejné dotazování nebo konzultaci v souladu s článkem 9; toto veřejné dotazování nebo konzultace však nesmí prodloužit devadesátidenní lhůtu podle odstavce 5 o více než 30 dnů.
7. Jestliže si příslušný orgán vyžádá další informace, musí zároveň uvést důvody své žádosti.
8. Oznamovatel může uvolnění provést pouze tehdy, obdrží-li písemný souhlas od příslušného orgánu a pouze v souladu se všemi podmínkami, které tento souhlas obsahuje.
9. Členské státy zajistí, aby žádný materiál odvozený od geneticky modifikovaných organismů záměrně uvolněných v souladu s částí B nebyl uveden na trh, pokud to není v souladu s částí C.
Článek 7
Odlišné postupy
1. Jestliže již byla získána dostatečná zkušenost s uvolňováním určitých geneticky modifikovaných organismů do určitého ekosystému a tyto geneticky modifikované organismy splňují kritéria uvedená v příloze V, může příslušný orgán předložit Komisi odůvodněný návrh na uplatnění odlišného postupu pro tento typ geneticky modifikovaného organismu.
2. Komise z vlastního podnětu anebo nejpozději do 30 dnů od obdržení návrhu od příslušného orgánu:
a) předá dále návrh příslušným orgánům, které mohou do 60 dnů předložit námitky, a zároveň
b) zpřístupní návrh veřejnosti, která může do 60 dnů připojit připomínky, a
c) obrátí se na odpovídající vědecký výbor nebo výbory, kterou mohou své stanovisko předložit do 60 dnů.
3. O každém návrhu musí být rozhodnuto postupem podle čl. 30 odst. 2. Toto rozhodnutí stanoví v souladu s přílohou III minimum technických informací, které jsou nezbytné pro vyhodnocení všech předvídatelných rizik spojených s uvolněním, především:
a) informace o geneticky modifikovaném organismu nebo organismech;
b) informace o podmínkách uvolnění a o možném přijímajícím prostředí;
c) informace o interakcích mezi geneticky modifikovaným organismem nebo organismy a prostředím;
d) hodnocení rizik pro životní prostředí.
4. Toto rozhodnutí musí být přijato do 90 dnů ode dne návrhu Komise nebo od obdržení návrhu od příslušných orgánů. Tato devadesátidenní lhůta nezahrnuje dobu, během níž Komise čeká na námitky příslušných orgánů, připomínky veřejnosti nebo stanovisko vědeckých výborů, jak je uvedeno v odstavci 2.
5. Podle rozhodnutí učiněného ve smyslu odstavců 3 a 4 může oznamovatel provést uvolnění pouze tehdy, jestliže obdržel písemný souhlas příslušného orgánu. Oznamovatel musí uvolnění provést v souladu se všemi podmínkami, které jsou v tomto souhlasu uvedeny.
Podle rozhodnutí učiněného ve smyslu odstavců 3 a 4 mohou být uvolnění geneticky modifikovaného organismu nebo kombinace geneticky modifikovaných organismů na stejném místě nebo na různých místech pro stejný účel a v určitém stanoveném období oznámeny jediným oznámením.
6. Aniž jsou dotčeny odstavce 1 až 5, zůstává v platnosti rozhodnutí Komise 94/730/ES ze dne 4. listopadu 1994, kterým se zavádějí zjednodušené postupy pro záměrné uvolňování geneticky modifikovaných rostlin do životního prostředí podle čl. 6 odst. 5 směrnice Rady 90/220/EHS ( 10 ).
7. Jestliže členský stát na svém území rozhodne o využití nebo nevyužití postupu pro uvolňování geneticky modifikovaných organismů zavedeného rozhodnutím podle odstavců 3 a 4, uvědomí o tom Komisi.
Článek 8
Modifikace a nové informace
1. V případě jakékoli modifikace nebo dojde-li k neúmyslné změně záměrného uvolňování geneticky modifikovaného organismu nebo kombinace geneticky modifikovaných organismů, která by mohla mít následky z hlediska rizik pro lidské zdraví a životní prostředí, musí oznamovatel již po vydání písemného souhlasu příslušnými orgány nebo jestliže se objeví nové informace o takovém riziku v době, kdy je oznámení posuzováno příslušnými orgány členského státu, nebo již po udělení písemného souhlasu, neprodleně:
a) přijmout opatření nezbytná k ochraně lidského zdraví a životního prostředí;
b) uvědomit příslušný orgán předem o jakékoli modifikaci nebo ihned, jakmile se zjistí neúmyslná změna nebo získá nová informace;
c) zrevidovat opatření uvedená v oznámení.
2. Pokud je příslušný orgán podle odstavce 1 seznámen s informacemi, které by mohly mít významné následky vzhledem k rizikům pro lidské zdraví a životní prostředí nebo za podmínek popsaných v odstavci 1, vyhodnotí tento orgán tyto informace a zpřístupní je veřejnosti. Příslušný orgán může oznamovateli nařídit úpravu podmínek záměrného uvolnění nebo pozastavení nebo zrušení uvolnění; o svých krocích uvědomí veřejnost.
Článek 9
Konzultace s veřejností a informování veřejnosti
1. Aniž jsou dotčena ustanovení článků 7 a 25, musí členské státy konzultovat navrhované záměrné uvolnění s veřejností a popřípadě se zájmovými skupinami. Pro tyto konzultace stanoví členské státy vhodný rámec, včetně určení rozumné časové lhůty, s cílem dát veřejnosti a zájmovým skupinám možnost vyjádřit stanovisko.
2. Aniž jsou dotčena ustanovení článku 25:
— členské státy zpřístupní veřejnosti informace o všech uvolněních geneticky modifikovaných organismů podle části B uskutečněných na jejich území,
— Komise zpřístupní veřejnosti informace obsažené v systému výměny informací podle článku 11.
Článek 10
Zpráva oznamovatele o provedených uvolněních
Po skončení uvolnění a dále v intervalech uvedených v souhlasu na základě výsledků hodnocení rizik pro životní prostředí zašle oznamovatel příslušnému orgánu výsledek uvolnění z hlediska rizik pro lidské zdraví a životní prostředí, popřípadě se zvláštním odkazem na jakýkoli druh produktu, který zamýšlí oznámit později. Formát, v němž má být výsledek předložen, bude stanoven postupem podle čl. 30 odst. 2.
Článek 11
Výměna informací mezi příslušnými orgány a Komisí
1. Komise stanoví systém výměny informací obsažených v oznámeních. Příslušné orgány zašlou Komisi do 30 dnů od přijetí shrnutí obsahu každé oznámení obdržené podle článku 6. Formát tohoto shrnutí bude stanoven nebo podle potřeby upraven postupem podle čl. 30 odst. 2.
2. Komise nejpozději do 30 dnů předá tato shrnutí ostatním členským státům, které mohou do 30 dnů předložit své námitky buď prostřednictvím Komise, nebo přímo. Pokud o to požádá, musí členský stát obdržet od příslušného orgánu dotčeného členského státu kopii plného znění oznámení.
3. Příslušné orgány uvědomí Komisi o konečných rozhodnutích podle čl. 6 odst. 5, popřípadě o důvodech zamítnutí oznámení, a o výsledcích uvolnění obdržených v souladu s článkem 10.
4. V případech uvolnění podle článku 7 zašlou členské státy jednou ročně Komisi seznam geneticky modifikovaných organismů, které na jejich území již byly uvolněny, a seznam oznámení, která byla zamítnuta. Komise tyto informace předá příslušným orgánům ostatních členských států.
ČÁST C
UVÁDĚNÍ NA TRH GENETICKY MODIFIKOVANÝCH ORGANISMŮ A PRODUKTŮ S JEJICH OBSAHEM
Článek 12
Odvětvové právní předpisy
1. Články 13 až 24 nesmějí být použity na žádné geneticky modifikované organismy a produkty s jejich obsahem, které byly autorizovány právními předpisy Společenství, jež vyžadují specifické hodnocení vlivu na životní prostředí provedené v souladu se zásadami uvedenými v příloze II a na základě informací specifikovaných v příloze III, aniž jsou dotčeny další požadavky těchto právních předpisů, a jež kladou požadavky na řízení rizik, označování a monitorování, informování veřejnosti a ochrannou doložku v míře přinejmenším rovnocenné této směrnici.
2. Pokud se týká nařízení Rady (EHS) č. 2309/93, nesmějí být články 13 až 24 této směrnice uplatněny na žádné geneticky modifikované organismy a produkty s jejich obsahem, které byly autorizovány podle zmíněného nařízení, za předpokladu, že bylo provedeno hodnocení rizik v souladu se zásadami uvedenými v příloze II této směrnice a na základě informací uvedených v příloze III této směrnice, aniž jsou dotčeny další příslušné požadavky na hodnocení rizik, řízení rizik, označování, monitorování, informování veřejnosti a ochrannou doložku, obsažené v právních předpisech Společenství pro humánní a veterinární léčivé přípravky.
3. Postupy, které zajistí, aby hodnocení rizik, požadavky na řízení rizik, označování, popřípadě monitorování, informování veřejnosti a ochrannou doložku vyhovovaly obsahu této směrnice, jsou stanoveny nařízením Evropského parlamentu a Rady. Budoucí odvětvové právní předpisy, založené na ustanoveních zmíněného nařízení, musí obsahovat odkaz na tuto směrnici. Do doby vstupu tohoto nařízení v platnost mohou být veškeré geneticky modifikované organismy a produkty s jejich obsahem, autorizované jinými právními předpisy Společenství, uvedeny na trh jedině tehdy, bude-li jejich uvedení na trh povoleno v souladu s touto směrnicí.
4. V průběhu vyhodnocování žádostí o uvedení na trh geneticky modifikovaných organismů podle odstavce 1 jsou požádány o názor orgány zřízené Společenstvím a členskými státy podle této směrnice za účelem jejího provádění.
Článek 12a
Přechodná opatření týkající se náhodné nebo technicky nevyhnutelné přítomnosti geneticky modifikovaných organismů s příznivým hodnocením rizika
1. Na uvádění stop GMO nebo kombinací GMO na trh v produktech určených pro přímé použití jako potravina nebo krmivo nebo určených ke zpracování se nevztahují články 13 až 21, pokud tyto produkty splňují podmínky uvedené v článku 47 nařízení Evropského parlamentu a Rady (ES) č. 1829/2003 ze dne 22. září 2003 o geneticky modifikovaných potravinách a krmivech ( 11 ).
2. Tento článek je použitelný po dobu tří let ode dne použitelnosti nařízení (ES) č. 1829/2003.
Článek 13
Postup oznámení
1. Předtím, než dojde k uvedení na trh geneticky modifikovaného organismu, kombinace geneticky modifikovaných organismů nebo produktu takové organismy obsahujícího musí být předloženo oznámení příslušnému orgánu toho členského státu, v němž má dojít k prvnímu uvedení na trh. Příslušný orgán potvrdí datum obdržení oznámení a bezprostředně poté předá shrnutí obsahu předložených dokumentů podle odst. 2 písm. h) příslušným orgánům dalších členských států a Komisi.
Příslušný orgán bez prodlení ověří, zda je oznámení v souladu s odstavcem 2 a je-li to nezbytné, vyžádá si od oznamovatele doplňující informace.
Je-li oznámení v souladu s odstavcem 2 a nejpozději tehdy, když zasílá hodnotící zprávu v souladu s čl. 14 odst. 2, zašle příslušný orgán kopii oznámení Komisi, která ji do 30 dnů od obdržení předá příslušným orgánům ostatních členských států.
2. Oznámení musí obsahovat:
a) informace požadované v příloze III a IV. Tyto informace musí vzít v úvahu různorodost míst využití geneticky modifikovaného organismu nebo produktu s jeho obsahem a musí obsahovat informace o údajích a výsledcích, které byly získány z uvolnění uskutečněných ve stadiích výzkumu a vývoje, především z hlediska dopadu těchto uvolnění na lidské zdraví a životní prostředí;
b) hodnocení rizik pro životní prostředí a závěry vyžadované v příloze II oddílu D;
c) podmínky pro uvedení produktu na trh, včetně specifických podmínek užívání a nakládání s produktem;
d) s odkazem na čl. 15 odst. 4 též navrhovanou dobu platnosti souhlasu, která nesmí být delší než deset let;
e) plán monitorování v souladu s přílohou VII, včetně návrhu doby monitorování; doba monitorování se může od navrhované doby platnosti souhlasu lišit;
f) návrh označení, který musí odpovídat požadavkům přílohy IV. Z označení musí být jasně zřejmá přítomnost geneticky modifikovaného organismu. Slova „Tento produkt obsahuje geneticky modifikované organismy“ se musí objevit buď na štítku produktu, nebo v průvodním dokumentu;
g) návrh obalu, který splňuje požadavky přílohy IV;
h) souhrn obsahu technické dokumentace. Formulář souhrnu se stanoví postupem podle čl. 30 odst. 2.
Jestliže na základě jakéhokoli uvolnění oznámeného podle části B nebo na jiném podstatném vědecky podloženém základě oznamovatel usoudí, že uvedení na trh a využití dotčeného geneticky modifikovaného organismu nebo produktu nepředstavuje žádné riziko pro lidské zdraví a životní prostředí, může příslušnému orgánu navrhnout, aby informace podle přílohy IV oddílu B neposkytoval vůbec nebo je poskytl jen částečně.
3. Oznamovatel musí v oznámení uvést informaci o údajích a výsledcích uvolnění téhož geneticky modifikovaného organismu nebo týchž kombinací geneticky modifikovaných organismů dříve nebo současně oznámených nebo uskutečněných stejným oznamovatelem na území Společenství i mimo ně.
4. Oznamovatel se také může odvolat na údaje nebo výsledky oznámení předložených dříve jinými oznamovateli nebo může předložit doplňkové informace, které považuje za vhodné, za předpokladu, že se nejedná o údaje a výsledky utajované nebo jestliže má k dispozici písemné svolení dotčených oznamovatelů.
5. Pro využití geneticky modifikovaného organismu nebo kombinace geneticky modifikovaných organismů k jinému účelu, než jaký je v oznámení uveden, musí být podáno samostatné oznámení.
6. Objeví-li se nové informace týkající se rizik geneticky modifikovaného organismu pro lidské zdraví nebo pro životní prostředí ještě předtím, než je udělen písemný souhlas, musí oznamovatel bezodkladně přijmout nezbytná opatření k ochraně lidského zdraví a životního prostředí a příslušné orgány o tom uvědomit. Oznamovatel dále musí upravit obsah oznámení a podmínky v něm specifikované.
Článek 14
Hodnotící zpráva
1. Po obdržení a potvrzení oznámení v souladu s čl. 13 odst. 2 zjistí příslušný orgán, zda obsah oznámení odpovídá této směrnici.
2. Do 90 dnů od obdržení oznámení příslušný orgán musí:
— připravit hodnotící zprávu a zaslat ji oznamovateli. Následným stažením ze strany oznamovatele nesmí být dotčeno žádné další předložení oznámení jiným příslušným orgánům,
— v případě zmíněném v odst. 3 písm. a) zaslat svou zprávu spolu s informacemi podle odstavce 4 a s jakýmikoli dalšími informacemi, ze kterých zpráva vychází, Komisi, která ji do 30 dnů od obdržení předá příslušným orgánům ostatních členských států.
V případě zmíněném v odst. 3 písm. b) zašle příslušný orgán svou zprávu spolu s informacemi podle odstavce 4 a s dalšími informacemi, z nichž tato zpráva vychází, Komisi, ne však dříve než 15 dnů po zaslání zprávy oznamovateli a ne později než 105 dnů po obdržení oznámení. Komise do 30 dnů po obdržení předá zprávu dále příslušným orgánům ostatních členských států.
3. V hodnotící zprávě musí být uvedeno, zda:
a) dotčený geneticky modifikovaný organismus nebo organismy mají být uvedeny na trh a za jakých podmínek, nebo
b) dotčený geneticky modifikovaný organismus nebo organismy by neměly být uvedeny na trh.
Hodnotící zprávy musí být zpracovány v souladu s pokyny uvedenými v příloze VI.
4. Při výpočtu lhůty 90 dnů podle odstavce 2 se nezapočítává doba, v níž příslušný orgán očekává další informace, které si od oznamovatele může vyžádat. Příslušný orgán musí uvést důvody své žádosti o další informace.
Článek 15
Standardní postup
1. V případech podle čl. 14 odst. 3 si může příslušný orgán nebo Komise ve lhůtě 60 dnů od rozeslání hodnotící zprávy vyžádat další informace, vznést připomínky nebo předložit odůvodněné výhrady k uvedení dotčeného geneticky modifikovaného organismu nebo organismů na trh.
Připomínky nebo odůvodněné výhrady a námitky musí být předány Komisi, která je bezodkladně poskytne všem příslušným orgánům.
Příslušné orgány a Komise mohou s cílem dosažení dohody projednat všechny sporné body do 105 dnů od rozeslání hodnotící zprávy.
Doba, během níž se čeká na další informace od oznamovatele, se nezapočítává do konečné doby 45 dnů pro dosažení dohody. V každé žádosti o další informace musí být uvedeny důvody této žádosti.
2. Jestliže v případě podle čl. 14 odst. 3 písm. b) příslušný orgán, který připravil hodnotící zprávu, rozhodne, že geneticky modifikovaný organismus nebo organismy by neměly být uvedeny na trh, musí být oznámení zamítnuto. Rozhodnutí musí obsahovat důvody zamítnutí.
3. Rozhodne-li příslušný orgán, který připravil hodnotící zprávu, že produkt může být uveden na trh, pak jestliže nejsou oznámeny žádné odůvodněné námitky ze strany členských států nebo ze strany Komise do 60 dnů ode dne, kdy byla hodnotící zpráva rozeslána, nebo jestliže byly sporné body odstraněny do 105 dnů podle odstavce 1, udělí příslušný orgán, který připravil hodnotící zprávu, písemný souhlas s uvedením produktu na trh, tento souhlas předá oznamovateli a do 30 dnů o tom uvědomí ostatní členské státy a Komisi.
4. Souhlas může být vydán na dobu nejdéle deseti let počínaje dnem vydání souhlasu.
Pro účely schválení geneticky modifikovaného organismu nebo jeho potomstva, u něhož se předpokládá obchodování pouze s jeho osivem podle příslušných ustanovení Společenství, končí doba prvního uděleného souhlasu nejpozději deset let po dni prvního vkladu první rostlinné odrůdy obsahující geneticky modifikovaný organismus do úředního vnitrostátního katalogu rostlinných odrůd v souladu se směrnicemi Rady 70/457/EHS ( 12 ) a 70/458/EHS ( 13 ).
V případě reprodukčního materiálu lesních dřevin končí doba prvního uděleného souhlasu nejpozději deset let po dni vkladu základního materiálu obsahujícího geneticky modifikovaný organismus do úředního vnitrostátního registru základních materiálů v souladu se směrnicí Rady 1999/105/ES ( 14 ).
Článek 16
Kritéria a informace pro určené geneticky modifikované organismy
1. Příslušný orgán nebo Komise ze svého vlastního podnětu mohou odchylně od článku 13 připravit návrh kritérií a požadavků na informace, které musí být splněny pro oznámení určitých druhů geneticky modifikovaných organismů nebo produktů s jejich obsahem.
2. Tato kritéria a požadavky na informace a jakékoli požadavky týkající se souhrnu obsahu oznámení mohou být přijaty po projednání s příslušným vědeckým výborem nebo výbory postupem podle čl. 30 odst. 2. Tato kritéria a požadavky na informace musí zajistit vysokou úroveň bezpečnosti pro lidské zdraví a životní prostředí a musí vycházet z dostupných vědeckých důkazů týkajících se této bezpečnosti a ze zkušenosti získané během uvolňování srovnatelných geneticky modifikovaných organismů.
Požadavky uvedené v čl. 13 odst. 2 musí být nahrazeny požadavky přijatými podle předchozího odstavce a musí být uplatněny postupy uvedené v čl. 13 odst. 4, 5 a 6 a v článcích 14 a 15.
3. Dříve, než je pro rozhodnutí o kritériích a požadavcích na informace podle odstavce 1 zahájen postup podle čl. 30 odst. 2, musí Komise návrh zpřístupnit veřejnosti. Veřejnost může do 60 dnů sdělit Komisi své připomínky. Komise musí veškeré obdržené připomínky spolu s jejich analýzou předat vědeckému výboru zřízenému podle článku 30.
Článek 17
Obnovení souhlasu
1. Odchylně od článků 13, 14 a 15 se uplatní postupy uvedené v odstavcích 2 až 9 pro obnovení:
a) souhlasů udělených podle části C a
b) před 17. říjnem 2006 souhlasů pro uvedení na trh geneticky modifikovaných organismů nebo produktů s jejich obsahem udělených podle směrnice 90/220/EHS před 17. říjnem 2002.
2. Nejpozději devět měsíců před skončením platnosti souhlasu v případě souhlasů podle odst. 1 písm. a) a před 17. říjnem 2006 v případě souhlasů podle odst. 1 písm. b) musí oznamovatel podle tohoto článku předložit příslušnému orgánu, který obdržel původní oznámení, oznámení obsahující:
a) kopii souhlasu k uvedení geneticky modifikovaných organismů na trh;
b) zprávu o výsledcích monitorování prováděného v souladu s článkem 20. V případě souhlasů podle odst. 1 písm. b) bude tato zpráva předložena tehdy, jestliže bylo monitorování prováděno;
c) veškeré nové informace o rizicích vyplývajících z produktu pro lidské zdraví nebo životní prostředí a
d) popřípadě návrh změn nebo doplnění podmínek původního souhlasu, mezi jiným i podmínek týkajících se budoucího monitorování a časového omezení souhlasu.
Příslušný orgán musí potvrdit datum obdržení oznámení a je-li oznámení v souladu s tímto odstavcem, musí neprodleně předat kopii oznámení a hodnotící zprávy Komisi, která je do 30 dnů od obdržení musí předat dále příslušným orgánům ostatních členských států. Hodnotící zprávu zašle příslušný orgán také oznamovateli.
3. V hodnotící zprávě musí být uvedeno, zda:
a) geneticky modifikovaný organismus nebo organismy by měly zůstat na trhu a za jakých podmínek, nebo
b) geneticky modifikovaný organismus nebo organismy by neměly zůstat na trhu.
4. Ostatní příslušné orgány nebo Komise si mohou vyžádat další informace, připojit připomínky nebo vznést odůvodněné námitky ve lhůtě 60 dnů ode dne rozeslání hodnotící zprávy.
5. Veškeré připomínky, odůvodněné výhrady a námitky musí být postoupeny Komisi, která je okamžitě rozešle všem příslušným orgánům.
6. V případě situace podle odst. 3 písm. a) a pokud nejsou ze strany členských států nebo Komise vzneseny žádné odůvodněné námitky do 60 dnů ode dne rozeslání hodnotící zprávy, musí příslušný orgán, který hodnotící zprávu připravil, zaslat oznamovateli konečné rozhodnutí v písemné formě a musí o tom do 30 dnů uvědomit ostatní členské státy a Komisi. Platnost souhlasu by obecně neměla přesáhnout deset let a může být omezena nebo rozšířena na základě specifických důvodů.
7. Příslušné orgány a Komise mohou s cílem nalezení dohody projednat sporné body během 75 dnů ode dne rozeslání hodnotící zprávy.
8. Jsou-li sporné body vyřešeny ve lhůtě 75 dnů podle odstavce 7, pak příslušný orgán, který zprávu připravil, zašle oznamovateli své konečné rozhodnutí v písemné formě a do 30 dnů o tom uvědomí ostatní členské státy a Komisi. Platnost souhlasu může být příslušně omezena.
9. Po podání oznámení k obnovení souhlasu v souladu s odstavcem 2 může oznamovatel dále pokračovat v uvádění geneticky modifikovaných organismů na trh za podmínek uvedených v předchozím souhlasu až do té doby, než je přijato konečné rozhodnutí o novém oznámení.
Článek 18
Postup Společenství v případě námitek
1. Jestliže příslušný orgán nebo Komise předloží námitky a naloží s nimi postupem podle článků 15, 17 a 20, musí být do 120 dnů přijato a zveřejněno rozhodnutí postupem podle čl. 30 odst. 2. Toto rozhodnutí musí obsahovat informace uvedené v čl. 19 odst. 3.
Při výpočtu uvedených 120 dnů se nezapočítá doba, během níž Komise očekává další informace, které si může vyžádat od oznamovatele, nebo očekává stanovisko vědeckého výboru, který požádala o projednání v souladu s článkem 28. Komise uvede důvody jakékoli žádosti o další informace a uvědomí příslušné orgány o vznesení svých požadavků na oznamovatele. Doba, během níž Komise čeká na stanovisko vědeckého výboru, nesmí být delší než 90 dnů.
Doba, během níž jedná Rada postupem podle čl. 30 odst. 2, se do výše zmíněné lhůty nezapočítává.
2. Je-li přijato kladné rozhodnutí, vydá příslušný orgán, který vypracoval zprávu, písemný souhlas s uvedením na trh geneticky modifikovaného organismu nebo produktu s jeho obsahem, zašle ho oznamovateli a uvědomí o tom ostatní členské státy a Komisi do 30 dnů po zveřejnění nebo oznámení tohoto rozhodnutí.
Článek 19
Souhlas
1. Aniž jsou dotčeny požadavky dalších právních předpisů Společenství a jedině tehdy, jestliže byl již vydán písemný souhlas pro uvedení na trh geneticky modifikovaných organismů nebo produktů s jejich obsahem, může být bez dalšího oznámení produkt používán ve Společenství, jsou-li splněny specifické podmínky pro jeho používání a jsou-li prostředí nebo zeměpisná území vymezená v těchto podmínkách přesně dodržena.
2. Oznamovatel může přikročit k uvedení na trh pouze tehdy, jestliže obdržel písemný souhlas příslušného orgánu v souladu s články 15, 17 a 18, a musí tak učinit za dodržení všech podmínek, které tento souhlas obsahuje.
3. V písemném souhlasu podle článků 15, 17 a 18 musí vždy být zřetelně uvedeno toto:
a) oblast, které se souhlas týká, včetně identity všech geneticky modifikovaných organismů, které mají být uvedeny na trh samostatně nebo v produktech, a jejich jednoznačných identifikátorů;
b) doba platnosti souhlasu;
c) podmínky pro uvedení produktu na trh, včetně veškerých specifických podmínek použití a balení geneticky modifikovaných organismů nebo produktů s jejich obsahem a nakládání s nimi, a podmínky pro ochranu určitých ekosystémů/prostředí nebo zeměpisných oblastí;
d) že aniž je dotčen článek 25, musí oznamovatel na vyžádání poskytnout kontrolní vzorky příslušnému orgánu;
e) požadavky týkající se označování, v souladu s těmi, které jsou uvedeny v příloze IV. Z označení musí být jasně patrná přítomnost geneticky modifikovaného organismu. Slova „Tento produkt obsahuje geneticky modifikované organismy“ musí být uvedena buď na štítku produktu, nebo v průvodním dokumentu tohoto produktu nebo jiných produktů, které obsahují geneticky modifikovaný organismus nebo organismy;
f) požadavky na monitorování v souladu s přílohou VII, včetně povinností podávat zprávy Komisi a příslušným orgánům, časový plán monitorování a popřípadě povinnosti osoby, která produkt prodává, nebo povinnosti uživatele, mezi jiným u pěstovaných geneticky modifikovaných organismů též i požadavky na vhodnou informaci o jejich umístění.
4. Členské státy přijmou veškerá nezbytná opatření ke zpřístupnění písemného souhlasu a popřípadě rozhodnutí podle článku 18 veřejnosti a k dodržování podmínek specifikovaných v tomto písemném souhlasu a popřípadě v uvedeném rozhodnutí.
Článek 20
Monitorování a nakládání s novými informacemi
1. Po uvedení geneticky modifikovaného organismu nebo produktu s jeho obsahem na trh oznamovatel zajistí, aby monitorování a podávání zpráv o monitorování probíhaly v souladu s podmínkami specifikovanými v souhlasu. Zprávy o monitorování se předkládají Komisi a příslušným orgánům členských států. Na základě těchto zpráv, v souladu se souhlasem a v rámci plánu monitorování specifikovaného v souhlasu může příslušný orgán, který obdržel původní oznámení, plán monitorování po prvním monitorovacím období přizpůsobit.
2. Získá-li oznamovatel od uživatelů nebo z jiných zdrojů nové informace o rizicích geneticky modifikovaného organismu nebo organismů pro lidské zdraví nebo životní prostředí již po udělení písemného souhlasu, neprodleně přijme opatření nezbytná k ochraně lidského zdraví a životního prostředí a uvědomí o nich příslušný orgán.
Dále oznamovatel upraví informace a podmínky uvedené v oznámení.
3. Získá-li příslušný orgán informace, které by mohly mít důsledky pro rizika geneticky modifikovaného organismu nebo organismů pro lidské zdraví nebo životní prostředí, nebo za okolností popsaných v odstavci 2, neprodleně předá tyto informace Komisi a příslušným orgánům ostatních členských států, a pokud ještě neudělil písemný souhlas, může případně využít možností čl. 15 odst. 1 nebo čl. 17 odst. 7.
Pokud je taková informace získána až po udělení souhlasu, musí příslušný orgán do 60 dnů od obdržení této nové informace předat Komisi svou hodnotící zprávu, v níž se stanoví, zda a jak musí být pozměněny podmínky souhlasu nebo zda by měl být souhlas odebrán; Komise do 30 dnů od obdržení předá tuto zprávu příslušným orgánům ostatních členských států.
Připomínky nebo odůvodněné námitky proti dalšímu uvedení dotčeného geneticky modifikovaného organismu na trh nebo návrhy na pozměnění podmínek souhlasu musí být do 60 dnů od rozeslání hodnotící zprávy předány Komisi, která je neprodleně předá všem příslušným orgánům.
Příslušné orgány a Komise mohou projednat sporné body s cílem dosažení dohody do 75 dnů ode dne data rozeslání hodnotící zprávy.
Jestliže členské státy ani Komise nepředloží do 60 dnů od rozeslání nové informace žádné odůvodněné námitky nebo jestliže jsou sporné body do 75 dnů projednány, příslušný orgán, který zprávu připravil, doplní souhlas podle návrhu, předá doplněný souhlas oznamovateli a uvědomí o tom do 30 dnů ostatní členské státy a Komisi.
4. Pro zajištění průhlednosti monitorování musí být výsledky monitorování prováděného podle části C veřejně přístupné.
Článek 21
Označování
1. Členské státy přijmou veškerá nezbytná opatření, která zajistí, že označování a balení geneticky modifikovaných organismů nebo produktů s jejich obsahem bude ve všech stadiích procesu uvádění na trh vyhovovat příslušným požadavkům specifikovaným v písemném souhlasu podle čl. 15 odst. 3, čl. 17 odst. 5 a 8, čl. 18 odst. 2 a čl. 19 odst. 3.
2. Pro produkty, v nichž nelze vyloučit náhodné nebo z technického hlediska nevyhnutelné stopy autorizovaných geneticky modifikovaných organismů, může být stanoven práh minimálního výskytu; jestliže jsou hodnoty v produktu nižší, nemusí být tento produkt již označen podle ustanovení odstavce 1. Prahová hodnota se pro jednotlivé produkty stanoví postupem podle čl. 30 odst. 2.
3. U produktů určených k přímému zpracování se odstavec 1 nevztahuje na stopy povolených GMO v poměru nepřesahujícím 0,9 % nebo nižší prahové hodnoty stanovené podle čl. 30 odst. 2, pokud jsou tyto stopy náhodné nebo technicky nevyhnutelné.
Článek 22
Volný oběh
Aniž je dotčen článek 23, nesmějí členské státy zakázat či omezit uvádění na trh geneticky modifikovaných organismů nebo produktů s jejich obsahem, které vyhovují požadavkům této směrnice, ani tomu nijak bránit.
Článek 23
Ochranná doložka
1. Jestliže členský stát získá na základě nových nebo dodatečných informací, které mohou ovlivnit hodnocení rizik pro životní prostředí, nebo na základě přehodnocení stávajících informací v souvislosti s novými nebo dodatečnými vědeckými poznatky dostatečný podklad pro názor, že geneticky modifikovaný organismus nebo produkt s jeho obsahem, který byl řádně oznámen a kterému již byl udělen písemný souhlas, představuje riziko pro lidské zdraví nebo životní prostředí, může tento členský stát používání nebo prodej tohoto geneticky modifikovaného organismu nebo produktu na svém území dočasně omezit nebo zakázat.
Členský stát zajistí, aby byla v případě vážného rizika použita opatření pro mimořádné situace, jako je odklad nebo ukončení uvádění na trh, a aby byla informována veřejnost.
Členský stát neprodleně uvědomí Komisi a ostatní členské státy o činnostech, které podniknul podle tohoto článku, udá důvody svého rozhodnutí, předloží přezkum hodnocení rizik pro životní prostředí a uvede, zda a jak je zapotřebí pozměnit podmínky souhlasu nebo zda má být souhlas odebrán, popřípadě uvede i nové nebo dodatečné informace, na nichž je jeho rozhodnutí založeno.
2. Rozhodnutí o této věci je třeba přijmout do 60 dnů postupem podle čl. 30 odst. 2. Při výpočtu těchto 60 dnů se nezapočítává doba, po kterou Komise čeká na další informace, jež si může od oznamovatele vyžádat, nebo po kterou očekává stanovisko vědeckého výboru nebo výborů. Doba, během níž Komise očekává stanovisko vědeckého výboru nebo výborů, nesmí překročit 60 dnů.
Do výše uvedených lhůt se nezapočítává doba, po kterou jedná Rada postupem podle čl. 30 odst. 2.
Článek 24
Informování veřejnosti
1. Aniž je dotčen článek 25, zpřístupní Komise veřejnosti neprodleně po obdržení oznámení, v souladu s čl. 13 odst. 1, souhrn podle čl. 13 odst. 2 písm. h). V případě uvedeném v čl. 14 odst. 3 písm. a) zpřístupní Komise veřejnosti také hodnotící zprávy. Veřejnost může své připomínky předložit Komisi do 30 dnů. Komise tyto připomínky neprodleně předá příslušným orgánům.
2. Aniž je dotčen článek 25, musí být veškeré hodnotící zprávy týkající se geneticky modifikovaných organismů nebo produktů s jejich obsahem, pro které byl již vydán písemný souhlas k uvedení na trh nebo pro které byl ve smyslu této směrnice písemný souhlas k uvedení na trh zamítnut, a stanovisko či stanoviska vědeckých výborů, jejichž názor na tuto věc byl vyžádán, zpřístupněny veřejnosti. U každého produktu musí být jasně specifikován v něm obsažený geneticky modifikovaný organismus nebo organismy a způsob nebo způsoby využití tohoto produktu.
ČÁST D
ZÁVĚREČNÁ USTANOVENÍ
Článek 25
Důvěrnost
1. Komise a příslušné orgány neprozradí třetím stranám žádné důvěrné informace, které byly oznámeny nebo vyměněny v rámci působnosti této směrnice, a chrání práva duševního vlastnictví vztahující se k obdrženým údajům.
2. Oznamovatel může v oznámení předkládaném podle této směrnice označit informace, jejichž zveřejnění by mohlo poškodit jeho pozici v rámci hospodářské soutěže, a které by proto měly být považovány za důvěrné. V takových případech musí být uvedeno ověřitelné odůvodnění.
3. Příslušný orgán po projednání s oznamovatelem rozhodne, která informace bude považována za důvěrnou, a uvědomí o svém rozhodnutí oznamovatele.
4. V žádném případě však nemohou být za důvěrné považovány následující informace, které byly poskytnuty podle článků 6, 7, 8, 13, 17, 20 a 23:
— obecný popis geneticky modifikovaného organismu nebo organismů, jméno a adresa oznamovatele, účel uvolnění, místo uvolnění a zamýšlené využití,
— metody a plány monitorování geneticky modifikovaného organismu nebo organismů a plány řešení mimořádných situací,
— hodnocení rizik pro životní prostředí.
5. Jestliže oznamovatel z jakéhokoli důvodu oznámení stáhne, musí příslušné orgány a Komise nadále zachovávat důvěrnost předložených informací.
Článek 26
Označování geneticky modifikovaných organismů podle čl. 2 odst. 4 druhého pododstavce
1. Z toho důvodu, aby mohly být geneticky modifikované organismy předmětem operací podle čl. 2 odst. 4 druhého pododstavce, musí splnit náležité požadavky na označování v souladu s odpovídajícími oddíly přílohy IV, jejichž smyslem je uvést na štítku nebo v průvodním dokumentu jasné informace o přítomnosti geneticky modifikovaných organismů. Za tímto účelem musí být buď na štítku, nebo v průvodním dokumentu uvedena slova „Tento produkt obsahuje geneticky modifikované organismy“.
2. Podmínky pro provádění odstavce 1 musí být postupem podle čl. 30 odst. 2 stanoveny v souladu se stávajícími ustanoveními pro označování podle právních předpisů Společenství, aniž by docházelo ke zdvojování nebo nesrovnalostem. Popřípadě musí být vzata v úvahu i ustanovení týkající se označování, která v souladu s právními předpisy Společenství přijaly členské státy.
Článek 26a
Opatření k předcházení nezáměrné přítomnosti GMO
1. Členské státy mohou přijmout vhodná opatření k předcházení nezáměrné přítomnosti GMO v jiných produktech.
2. Komise shromažďuje informace založené na studiích na úrovni Společenství i na národní úrovni a zajišťuje jejich koordinaci, sleduje vývoj, pokud jde o koexistenci v členských státech, a na základě těchto informací a pozorování vypracovává pokyny pro koexistenci geneticky modifikovaných, konvenčních a ekologických plodin.
Článek 27
Přizpůsobování příloh technickému pokroku
Oddíly C a D přílohy II, přílohy III a IV a oddíl C přílohy VII budou přizpůsobovány technickému pokroku postupem podle čl. 30 odst. 2.
Článek 28
Konzultace s vědeckým výborem nebo výbory
1. Vyskytne-li se ze strany příslušného orgánu nebo Komise námitka v souvislosti s riziky geneticky modifikovaných organismů pro lidské zdraví nebo životní prostředí a je-li s touto námitkou naloženo v souladu s čl. 15 odst. 1, čl. 17 odst. 4, čl. 20 odst. 3 nebo s článkem 23, nebo stanoví-li hodnotící zpráva uvedená v článku 14, že by geneticky modifikovaný organismus neměl být uveden na trh, musí Komise buď z vlastního podnětu, nebo na žádost členského státu projednat tuto námitku s příslušným vědeckým výborem nebo výbory.
2. V rámci této směrnice Komise též může požádat, buď z vlastního podnětu, nebo na žádost členského státu, příslušný vědecký výbor nebo výbory o konzultaci k jakékoli záležitosti, která by mohla mít nepříznivý účinek na lidské zdraví nebo životní prostředí.
3. Odstavec 2 se nevztahuje na správní postupy uvedené v této směrnici.
Článek 29
Konzultace s etickým výborem nebo výbory
1. Aniž jsou dotčeny pravomoci členských států týkající se etických otázek, Komise buď z vlastního podnětu, nebo na žádost Evropského parlamentu nebo Rady požádá o konzultaci kterýkoli z ustavených výborů, např. Evropskou skupinu pro etiku ve vědě a nových technologiích, aby získala jeho názor na etické důsledky biotechnologií z hlediska obecných otázek etiky.
Tato konzultace může být též uskutečněna na žádost členského státu.
2. Tato konzultace se řídí jasnými pravidly otevřenosti, průhlednosti a veřejné dostupnosti. Její výsledky musí být veřejnosti přístupné.
3. Odstavec 1 se nevztahuje na správní postupy vyžadované touto směrnicí.
Článek 30
Postup výboru
1. Komisi je nápomocen výbor.
2. Odkazuje-li se na tento odstavec, použijí se články 5 a 7 rozhodnutí 1999/468/ES s ohledem na článek 8 zmíněného rozhodnutí.
Doba uvedená v čl. 5 odst. 6 rozhodnutí 1999/468/ES je tři měsíce.
3. Výbor přijme svůj jednací řád.
Článek 31
Výměna informací a podávání zpráv
1. Členské státy a Komise si na pravidelných setkáních vyměňují informace o zkušenostech získaných při předcházení rizikům spojených s uvolňováním a uváděním na trh geneticky modifikovaných organismů. Výměna informací se týká i zkušeností získaných při provádění čl. 2 odst. 4 druhého pododstavce, při hodnocení rizik pro životní prostředí, monitorování, konzultacích s veřejností a při informování veřejnosti.
Kde je to nezbytné, vydá výbor zřízený podle čl. 30 odst. 1 pokyny k provádění článku 2 odst. 4 druhého pododstavce.
2. Komise zřídí jeden nebo více registrů, do nichž se ukládají informace o genetických modifikacích geneticky modifikovaných organismů uvedených v bodu A č. 7 přílohy IV. Aniž je dotčen článek 25, tento registr nebo registry obsahují tu část informací, která je přístupná veřejnosti. Podrobnosti provozování registru nebo registrů se stanoví postupem podle čl. 30 odst. 2.
3. Aniž je dotčen odstavec 2 a bod A č. 7 přílohy IV:
a) členské státy zřídí veřejné registry, ve kterých budou zaznamenána místa uvolnění geneticky modifikovaných organismů podle části B;
b) členské státy zřídí též registry pro záznam míst geneticky modifikovaných organismů pěstovaných podle části C, mezi jiným tak, aby možné účinky takových geneticky modifikovaných organismů na životní prostředí mohly být monitorovány v souladu s čl. 19 odst. 3 písm. f) a čl. 20 odst. 1. Aniž jsou dotčena ustanovení článků 19 a 20, zmíněná místa musí:
— být oznámena příslušným orgánům a
— oznámena veřejnosti
způsobem, který příslušné orgány považují za vhodný a který je v souladu s vnitrostátními ustanoveními.
4. Každé tři roky zašlou členské státy Komisi zprávu o opatřeních přijatých k provádění ustanovení této směrnice. Zpráva musí obsahovat krátké faktické shrnutí zkušenosti s uváděním na trh geneticky modifikovaných organismů nebo produktů s jejich obsahem.
5. Každé tři roky zveřejní Komise souhrn zpráv podle odstavce 4.
6. Poprvé v roce 2003 a potom každé tři roky zašle Komise Evropskému parlamentu a Radě zprávu o zkušenostech, které členské státy získaly v rámci této směrnice s uváděním geneticky modifikovaných organismů na trh.
7. Zároveň s touto zprávou předloží Komise v roce 2003 zvláštní zprávu týkající se činností podle části B a části C, včetně hodnocení:
a) veškerých důsledků, především z hlediska různosti evropských ekosystémů a potřeby doplnění regulativního rámce pro tuto oblast;
b) možností různých cest ke zlepšení celistvosti a účinnosti tohoto rámce, včetně jednotného autorizačního postupu Společenství a úprav postupu Komise při jejím konečném rozhodování;
c) toho, zda byla již získána dostatečná zkušenost z provádění odlišných postupů části B, aby bylo odůvodněno ustanovení těchto postupů o poskytování implicitního souhlasu, a dostatečná zkušenost z provádění části C, aby bylo odůvodněno využívání těchto odlišných postupů, a
d) sociálních a ekonomických důsledků záměrného uvolňování geneticky modifikovaných organismů a uvádění těchto organismů na trh.
8. Každoročně zašle Komise Evropskému parlamentu a Radě zprávu o etických otázkách podle čl. 29 odst. 1; tato zpráva může být popřípadě doplněna návrhem na změny této směrnice.
Článek 32
Provádění Cartagenského protokolu o biologické bezpečnosti
1. Komise byla vyzvána, aby podle možností co nejdříve a nejpozději do července 2001 vypracovala legislativní návrh týkající se podrobností provádění Cartagenského protokolu o biologické bezpečnosti. Návrh musí doplňovat, a je-li to nezbytné, pozměňovat ustanovení této směrnice.
2. Tento návrh musí obsahovat především vhodná opatření k provádění postupů uvedených v Cartagenském protokolu a v souladu se zmíněným protokolem požadovat od vývozců ze Společenství, aby zajistili splnění všech požadavků postupu pro dosažení dohody na základě postupu předchozího souhlasu, jak stanoví články 7 až 10, 12 a 14 Cartagenského protokolu.
Článek 33
Sankce
Členské státy stanoví sankce za porušení vnitrostátních ustanovení přijatých podle této směrnice. Tyto sankce musí být účinné, přiměřené a odrazující.
Článek 34
Provedení
1. Členské státy uvedou v účinnost právní a správní předpisy nezbytné pro dosažení souladu s touto směrnicí nejpozději do 17. října 2002. Neprodleně o tom uvědomí Komisi.
2. Přijatá opatření musí obsahovat odkaz na tuto směrnici nebo musí být takový odkaz učiněn při jejich úředním vyhlášení. Způsob odkazu si stanoví členské státy.
3. Členské státy sdělí Komisi znění hlavních ustanovení vnitrostátních právních předpisů, které přijaly v oblasti působnosti této směrnice.
Článek 35
Nevyřízené oznámení
1. Oznámení týkající se uvedení na trh geneticky modifikovaných organismů nebo produktů s jejich obsahem obdržené ve smyslu směrnice 90/220/EHS se v případě, že postupy podle uvedené směrnice nejsou ukončeny do 17. října 2002, posuzují podle této směrnice.
2. Do 17. ledna 2003 musí oznamovatelé doplnit oznámení v souladu s touto směrnicí.
Článek 36
Zrušení
1. Směrnice 90/220/EHS se dnem 17. října 2002 zrušuje.
2. Odkazy na zrušenou směrnici se považují za odkazy na tuto směrnici v souladu se srovnávací tabulkou uvedenou v příloze VIII.
Článek 37
Tato směrnice vstupuje v platnost dnem vyhlášení v Úředním věstníku Evropských společenství.
Článek 38
Tato směrnice je určena členským státům.
PŘÍLOHA 1 A
TECHNIKY PODLE ČL. 2 ODST. 2
ČÁST 1
Techniky genetické modifikace podle čl. 2 odst. 2 písm. a) jsou mezi jiným:
1. techniky rekombinace nukleové kyseliny spočívající ve vytváření nových kombinací genetického materiálu vkládáním molekul nukleové kyseliny připravené různými způsoby vně organismu do virů, bakteriálních plasmidů nebo jiných vektorových systémů a jejich zabudování do hostitelského organismu, ve kterém se přirozeně nevyskytují, ale jsou v něm schopny pokračujícího množení;
2. techniky, které spočívají v přímém zavedení genetického materiálu připraveného vně organismu do organismu a zahrnují mikroinjekci, makroinjekci a mikroenkapsulaci;
3. buněčná fúze (včetně fúze protoplastů) nebo hybridizační techniky, při nichž jsou fúzí dvou nebo více buněk vytvářeny živé buňky s novými kombinacemi dědičného genetického materiálu cestami, které se v přírodních podmínkách nevyskytují.
ČÁST 2
Techniky podle čl. 2 odst. 2 písm. b), u nichž se předpokládá, že nevedou ke genetické modifikaci, pokud nezahrnují použití rekombinantních molekul nukleové kyseliny nebo geneticky modifikované organismy získané technikami nebo postupy odlišnými od těch, které příloha I B vylučuje:
1. oplodnění in vitro;
2. konjugace, transdukce, transformace nebo jiné obdobné přirozené procesy;
3. indukce polyploidie.
PŘÍLOHA I B
TECHNIKY PODLE ČLÁNKU 3
Techniky/metody genetické modifikace, jejichž výsledkem jsou organismy, na které se tato směrnice nevztahuje, za podmínky, že nezahrnují použití rekombinantních molekul nukleové kyseliny nebo geneticky modifikovaných organismů jiných než takových, které jsou produktem jedné nebo více technik/metod uvedených níže:
1. mutageneze;
2. buněčná fúze (včetně fúze protoplastů) rostlinných buněk organismů, u nichž může být výměny genetického materiálu dosaženo tradičními šlechtitelskými metodami.
PŘÍLOHA II
ZÁSADY HODNOCENÍ RIZIKA PRO ŽIVOTNÍ PROSTŘEDÍ
Tato příloha popisuje v obecných rysech cíle, jichž má být dosaženo, prvky, které mají být vzaty v úvahu, metodiku a obecné zásady, jimiž je třeba se řídit při provádění hodnocení rizika pro životní prostředí podle článků 4 a 13. Bude doplněna prováděcími pokyny, které budou vypracovány postupem podle čl. 30 odst. 2. Tyto prováděcí pokyny se dokončí do 17. října 2002.
Z toho důvodu, aby byly při provádění této přílohy stejně chápány termíny „přímý, nepřímý, okamžitý, opožděný“, aniž jsou dotčeny další pokyny týkající se tohoto tématu, především pak pro správné pochopení šíře působení nepřímých účinků, jsou tyto termíny definovány takto:
— „přímými účinky“ se rozumějí prvotní účinky na lidské zdraví nebo na životní prostředí, které jsou výsledkem působení geneticky modifikovaného organismu a neprojevují se příčinným řetězcem dalších událostí,
— „nepřímými účinky“ se rozumějí účinky na lidské zdraví nebo životní prostředí, které se projeví příčinným řetězcem dalších událostí, jako např. interakcí s dalšími organismy, přenosem genetického materiálu nebo změnami v používání nebo nakládání.
— Pozorování nepřímých účinků může být časově opožděno;
— „okamžitými účinky“ se rozumějí účinky na lidské zdraví nebo životní prostředí, které lze pozorovat během uvolňování geneticky modifikovaného organismu. Okamžité účinky mohou být přímé i nepřímé,
— „opožděnými účinky“ se rozumějí účinky na lidské zdraví nebo životní prostředí, které nemusí být pozorovány během uvolňování geneticky modifikovaných organismů, ale projeví se přímo nebo nepřímo buď v pozdějších stadiích uvolňování, nebo po jeho skončení.
Obecnou zásadou hodnocení rizika pro životní prostředí také je, že musí být provedena analýza kumulativních dlouhodobě působících účinků souvisejících s uvolněním nebo uvedením na trh. „Kumulativními dlouhodobými účinky“ se rozumějí souhrnné povolené účinky na lidské zdraví a životní prostředí, mezi jiným na rostliny a živočichy, na úrodnost půdy, na rozklad organického materiálu v půdě, na potravinový řetězec člověka a zvířat, na biologickou různorodost, na zdraví zvířat a na rezistenci vůči antibiotikům.
A. Cíl
Cílem hodnocení rizik pro životní prostředí pro každý jednotlivý případ uvolnění nebo uvedení na trh geneticky modifikovaných organismů je určit a vyhodnotit možné nepříznivé účinky na lidské zdraví nebo životní prostředí, přímé či nepřímé, okamžité či opožděné. Hodnocení rizik pro životní prostředí by mělo být prováděno s ohledem na zjištění potřeby řízení rizik a jeho součástí by měl být návrh nejvhodnějších metod tohoto řízení.
B. Obecné zásady
V souladu se zásadou předběžné opatrnosti by se při hodnocení rizika pro životní prostředí mělo vždy postupovat podle těchto zásad:
— zjištěné charakteristiky geneticky modifikovaného organismu a jeho používání, které by mohly mít nepříznivé účinky na životní prostředí, by měly být porovnány s obdobnými charakteristikami původního organismu vystaveného stejným podmínkám,
— hodnocení by mělo být provedeno vědecky podloženým a průhledným způsobem, s využitím veškerých dostupných vědeckých poznatků a technických údajů,
— hodnocení by mělo být provedeno pro každý případ zvlášť, neboť požadované informace mohou být závislé na druhu geneticky modifikovaných organismů, na způsobu jejich plánovaného využití i na přijímajícím prostředí, přičemž je nutno vzít v úvahu i geneticky modifikované organismy, které se již v prostředí nalézají,
— vyskytnou-li se nové informace o geneticky modifikovaném organismu a jeho účincích na lidské zdraví nebo životní prostředí, může být zapotřebí hodnocení rizika přepracovat, aby se zjistilo:
—— zda došlo ke změně rizika,
— zda musí být změněna metoda řízení rizik.
C. Metodika
C.1 Charakteristiky geneticky modifikovaných organismů a charakteristiky uvolnění
Pro každý jednotlivý případ je při hodnocení rizika pro životní prostředí nutno vzít v úvahu podrobnosti technického a vědeckého charakteru týkající se charakteristik:
— přijímajícího nebo rodičovského organismu nebo organismů,
— genetické modifikace nebo modifikací, ať se jedná o vložení nebo odstranění genetického materiálu, a odpovídající informace o vektoru a dárci,
— geneticky modifikovaného organismu,
— zamýšleného uvolnění nebo využití, včetně jeho měřítka,
— možného přijímajícího prostředí a
— interakcí mezi geneticky modifikovaným organismem a prostředím.
Informace o uvolněních obdobných organismů a organismů s obdobnými vlastnostmi a o jejich interakcích s obdobným prostředím mohou být při hodnocení využity jako pomocné.
C.2 Jednotlivé kroky hodnocení rizika pro životní prostředí
Závěry hodnocení rizika pro životní prostředí podle článků 4, 6, 7 a 13 by se měly zaměřit na tyto body:
1. Identifikace charakteristik, které mohou působit nepříznivé účinky
Musí být identifikovány jakékoli charakteristiky spojené s genetickou modifikací, které mohou vyústit v nepříznivé účinky pro lidské zdraví nebo životní prostředí. Porovnání těchto charakteristik geneticky modifikovaného organismu nebo organismů s charakteristikami nemodifikovaného organismu za odpovídajících podmínek uvolnění nebo využití může pomoci při identifikaci určitých nepříznivých účinků, které mohou být důsledkem genetické modifikace. Důležité je, aby nebyl podceněn žádný z možných nepříznivých účinků jen proto, že je jeho výskyt nepravděpodobný.
Možné nepříznivé účinky geneticky modifikovaných organismů se budou případ od případu měnit a mohou zahrnovat:
— nemoci lidské populace včetně alergenních a toxických projevů (viz např. položky II.A.11 a II.C.2 písm. i) v příloze III A a B.7 v příloze III B),
— nemoci zvířat a rostlin včetně toxických a popřípadě alergenních projevů (viz např. položky II.A.11 a II.C.2 písm. i) v příloze III A a D.8 v příloze III B),
— účinky na dynamiku populace druhů v přijímajícím prostředí a na genetickou různorodost každé z těchto populací (viz např. položky IV.B.8, 9 a 12 v příloze III A),
— změněná vnímavost k patogenům umožňující šíření infekčních nemocí nebo vytváření nových zásobníků nebo vektorů,
— omezená účinnost profylaktických nebo terapeutických lékařských a zvěrolékařských zásahů nebo zásahů k ochraně rostlin, např. přenos genů způsobující rezistenci vůči antibiotikům používaným v lékařství a zvěrolékařství (viz např. položky II.A.11 písm. e) a II.C.2 písm. i) bod iv) v příloze III A),
— účinky biogeochemického charakteru (biogeochemické cykly), především oběh uhlíku a dusíku, projevující se změnami procesu půdního rozkladu organických materiálů (viz např. položky II.A.11 písm. f) a IV.B.15 v příloze III A a D.11 v příloze III B).
Nepříznivé účinky se mohou projevit přímo nebo nepřímo prostřednictvím mechanismů, které mohou zahrnovat:
— rozšíření geneticky modifikovaného organismu nebo organismů do životního prostředí,
— přenos vloženého genetického materiálu do jiných organismů nebo do téhož organismu, modifikovaného, či nikoli,
— fenotypovou a genetickou instabilitu,
— interakci s dalšími organismy,
— změny nakládání včetně, je-li to možné, změn zemědělských postupů.
2. Vyhodnocení možných následků každého nepříznivého účinku, dojde-li k němu
Měl by být vyhodnocen dosah následků každého identifikovaného možného nepříznivého účinku.
Toto hodnocení by mělo vycházet z toho, že k nepříznivému účinku dojde. Dosah následků pravděpodobně bude ovlivněn prostředím, do kterého je uvolnění organismu nebo organismů plánováno, a zamýšleným způsobem uvolnění.
3. Hodnocení možnosti výskytu každého identifikovaného možného nepříznivého účinku
Hlavním faktorem při hodnocení možnosti nebo pravděpodobnosti výskytu nepříznivého účinku je charakteristika prostředí, do kterého je uvolnění organismu nebo organismů plánováno, a zamýšlený způsob uvolnění.
4. Odhad rizika spojeného s každou identifikovanou charakteristikou geneticky modifikovaného organismu nebo organismů
Odhad rizika pro lidské zdraví nebo životní prostředí plynoucího z každé identifikované charakteristiky geneticky modifikovaného organismu, která může mít za následek nepříznivý účinek, by měl být proveden co nejlépe, s využitím všech dostupných znalostí a na základě společného vyhodnocení možnosti výskytu a dosahu možných následků.
5. Využití strategií řízení rizik při záměrném uvolňování geneticky modifikovaného organismu nebo organismů nebo při jeho uvádění na trh
Hodnocení rizik může identifikovat rizika, která vyžadují řízení a nalezení nejlepšího způsobu řízení rizik. Pak by měla být stanovena strategie řízení rizik.
6. Vyhodnocení celkového rizika geneticky modifikovaného organismu nebo organismů
Vyhodnocení celkového rizika spojeného s geneticky modifikovaným organismem nebo organismy by mělo být provedeno s ohledem na všechny navržené strategie řízení rizik.
D. Závěry o možných dopadech na životní prostředí v důsledku uvolnění geneticky modifikovaných organismů nebo uvedením těchto organismů na trh
Oznámení by měla obsahovat náležité informace k bodům uvedeným v oddílu D.1 popřípadě v oddílu D.2. Tyto informace, které mají vyplynout z hodnocení rizik pro životní prostředí s využitím metodiky a podle zásad uvedených v oddílech B a C a které mohou pomoci při vypracování závěrů o možných dopadech na životní prostředí v důsledku uvolnění nebo uvedení geneticky modifikovaných organismů na trh, jsou tyto:
D.1 V případě geneticky modifikovaných organismů jiných než vyšší rostliny
1. Pravděpodobnost, že se geneticky modifikované organismy za podmínek navrhovaného jednoho nebo více uvolnění stanou perzistentními a invazivními na přírodním stanovišti.
2. Jakékoli selektivní výhody nebo nevýhody spojené s geneticky modifikovaným organismem a pravděpodobnost jejich projevení za podmínek navrhovaných uvolnění.
3. Možnosti genového přenosu do jiných druhů za podmínek navrhovaného uvolnění geneticky modifikovaného organismu a jakékoli selektivní výhody nebo nevýhody spojené s těmito druhy.
4. Možnost okamžitého nebo opožděného dopadu na životní prostředí plynoucího z přímých a nepřímých interakcí mezi geneticky modifikovaným organismem a cílovými organismy (jsou-li tyto interakce možné).
5. Možnost okamžitého nebo opožděného dopadu na životní prostředí plynoucího z přímých a nepřímých interakcí mezi geneticky modifikovaným organismem a necílovými organismy, včetně dopadu na populační úrovně konkurentů, kořistí, hostitelů, symbiontů, predátorů, parazitů a patogenů.
6. Možné okamžité nebo opožděné účinky na lidské zdraví, které vyplývají z možných přímých nebo nepřímých interakcí mezi geneticky modifikovaným organismem a osobami, které s ním pracují, přicházejí s ním do styku nebo jsou v blízkosti jeho uvolnění.
7. Možné okamžité nebo opožděné účinky na zdraví zvířat a důsledky pro lidské/zvířecí potravní řetězce, které vyplývají z konzumace geneticky modifikovaného organismu nebo produktů z něho vytvořených, je-li určen jako krmivo.
8. Možné okamžité nebo opožděné účinky na biogeochemické procesy, které vyplývají z možných přímých nebo nepřímých interakcí geneticky modifikovaného organismu s cílovými a dalšími organismy, které se nacházejí v blízkosti jeho uvolnění.
9. Možné okamžité nebo opožděné, přímé nebo nepřímé dopady na životní prostředí, které vyplývají z použití specifických technik pro nakládání s geneticky modifikovanými organismy, odlišných od těch, které se používají pro nakládání s nemodifikovanými organismy.
D.2 V případě geneticky modifikovaných vyšších rostlin
1. Pravděpodobnost, že se geneticky modifikované vyšší rostliny stanou perzistentnějšími než přijímající nebo rodičovské rostliny v zemědělských stanovištích nebo invazivnějšími na přírodních stanovištích.
2. Jakékoli selektivní výhody nebo nevýhody spojené s geneticky modifikovanými vyššími rostlinami.
3. Možnosti genového přenosu na stejný nebo jiný sexuálně kompatibilní rostlinný druh za podmínek pěstování geneticky modifikovaných vyšších rostlin a jakékoli selektivní výhody nebo nevýhody spojené s těmito rostlinnými druhy.
4. Možný okamžitý nebo opožděný dopad na životní prostředí, který vyplývá z přímých nebo nepřímých interakcí mezi geneticky modifikovanými vyššími rostlinami a cílovými organismy, jimiž mohou být např. predátoři, parazitoidy a patogeny (pokud existují).
5. Možný okamžitý nebo opožděný dopad na životní prostředí, který vyplývá z přímých nebo nepřímých interakcí mezi geneticky modifikovanými vyššími rostlinami a necílovými organismy (též s ohledem na organismy, které interagují s cílovými organismy), včetně dopadů na populační úrovně konkurentů, býložravců, symbiontů (pokud existují), parazitů a patogenů.
6. Možné okamžité nebo opožděné účinky na lidské zdraví, které vyplývají z možných přímých nebo nepřímých interakcí mezi geneticky modifikovanými vyššími rostlinami a osobami v které s těmito rostlinami pracují, přicházejí s nimi do styku nebo jsou v blízkosti jejich uvolnění.
7. Možné okamžité nebo opožděné účinky na zdraví zvířat a důsledky pro potravní řetězce, které vyplývají z konzumace geneticky modifikovaných organismů a produktů z nich odvozených, jsou-li tyto produkty určeny jako krmivo.
8. Možné okamžité nebo opožděné účinky na biogeochemické procesy, které vyplývají z možných přímých nebo nepřímých interakcí mezi geneticky modifikovanými organismy a cílovými a necílovými organismy v blízkosti uvolnění geneticky modifikovaných organismů.
9. Možné okamžité nebo opožděné přímé nebo nepřímé dopady na životní prostředí, které vyplývají z použití specifických technik kultivace a sklizně geneticky modifikovaných vyšších rostlin a nakládání s nimi v případech, kdy se tyto techniky odlišují od technik používaných pro nemodifikované vyšší rostliny.
PROVÁDĚCÍ POKYNY TÝKAJÍCÍ SE CÍLE, PRVKŮ, OBECNÝCH ZÁSAD A METODIKY POSUZOVÁNÍ RIZIK PRO ŽIVOTNÍ PROSTŘEDÍ UVEDENÝCH V PŘÍLOZE II SMĚRNICE 2001/18/ES
1. ÚVOD
Posouzení rizik pro životní prostředí je definováno v čl. 2 odst. 8 směrnice 2001/18/ES jako „hodnocení rizik pro lidské zdraví a životního prostředí, přímých i nepřímých, okamžitých i opožděných, která mohou nastat v důsledku záměrného uvolnění geneticky modifikovaných organismů nebo jejich uvedení na trh“. Jako jednu ze obecných povinností stanovených touto směrnicí požaduje čl. 4 odst. 3, aby členské státy a případně Komise zajistily, aby se potenciální nepříznivé účinky na lidské zdraví a životní prostředí, které mohou nastat zejména přímo nebo nepřímo, případ od případu správně posoudily s přihlédnutím k dopadu na životní prostředí podle povahy zaváděného organismu a přijímajícího prostředí. Posouzení rizik pro životní prostředí se provádí v souladu s přílohou II směrnice a je uvedeno také v částech B a C uvedené směrnice. Příloha II obecně popisuje cíl, kterého se má dosáhnout, prvky, které je třeba vzít v úvahu, a obecné zásady a metodiku, podle nichž se musí při posuzování rizik pro životní prostředí postupovat, přičemž se vezme v úvahu dopad na lidské zdraví a životní prostředí podle povahy zaváděných organismů a přijímacího prostředí.
Oznamovatelé jsou povinni v případě záměrného uvolňování předložit oznámení obsahující posouzení rizik pro životní prostředí na základě čl. 6 odst. 2 nebo v případě uvedení na trh na základě čl. 13 odst. 2.
Tyto prováděcí pokyny doplňují přílohu II směrnice 2001/18/ES a vytyčují cíle, zásady a metodiku určené pro posuzování rizik pro životní prostředí a jejich cílem je poskytnout pomoc oznamovatelům, usnadnit úplné a správné vypracování posouzení rizik pro životní prostředí příslušnými orgány podle směrnice 2001/18/ES a zabezpečit průhlednost procesu posouzení rizik pro životní prostředí pro širokou veřejnost.
V kapitole 4.2 je stanoveno šest kroků posouzení rizik pro životní prostředí.
2. CÍL
Vsouladu s přílohou II směrnice 2001/18/ES je cílem posouzení rizik pro životní prostředí pro každý jednotlivý případ určit a vyhodnotit potenciální nepříznivé účinky GMO, ať přímé či nepřímé, okamžité či opožděné, na lidské zdraví a životní prostředí, které může mít záměrné uvolnění geneticky modifikovaných organismů nebo jejich uvedení na trh mít. Posouzení rizik pro životní prostředí by mělo být prováděno proto, aby se určilo, zda je nezbytné řízení rizik, a pokud ano, aby se určily nejvhodnější metody ( 15 ).
Posuzování rizik pro životní prostředí se tudíž zabývá záměrným uvolňováním (část B) a uváděním na trh (část C), jak je uvedeno ve směrnici 2001/18/ES. Součástí uvedení na trh je velice často, nikoli však nevyhnutelně, záměrné uvolňování do životního prostředí, ale jedná se vždy o záměrné zavedení na trh (například zemědělské produkty obsahující GMO nebo s jejich obsahem pouze pro použití jako potraviny, krmivo a ke zpracování). Také v těchto případech se posouzení rizik pro životní prostředí musí zahrnout do oznamovacího procesu. Obecně může existovat rozdíl mezi posouzením rizik pro životní prostředí v případě záměrného uvolňování a v případě uvádění na trh, a to například vzhledem k rozdílům ve stávajících údajích, časovém měřítku a oblasti.
Kromě toho se tyto prováděcí pokyny týkají všech GMO, včetně mikroorganismů, rostlin a živočichů. Ačkoli většinu GMO záměrně uvolněných nebo uvedených na trh dosud tvoří vyšší rostliny, může se situace v budoucnu změnit.
Posouzení rizik pro životní prostředí bude sloužit jako základ pro určení nezbytnosti řízení rizik a v případě, že tomu tak bude, pro určení nejvhodnějších metod, které se mají použít, a pro cílené monitorování (viz kapitola 3).
Celkové posouzení jednotlivých případů zahrnuje příslušný geneticky modifikovaný organismus nebo organismy (posuzování jednotlivých GMO) a jedno či více prostředí, do kterého se má GMO uvolnit (například posuzování jednotlivých lokalit a popřípadě jednotlivých regionů).
Další rozvoj v oblasti genetických modifikací může vyvolat nutnost přizpůsobit přílohu II a tyto prováděcí pokyny technickému pokroku. Je možné, že jakmile budou ve Společenství existovat dostatečné zkušenosti s oznamováním uvolňování konkrétních geneticky modifikovaných organismů (příloha III čtvrtý pododstavec a kapitola 6), dojde k další diferenciaci požadavků na informace o různých typech GMO, jako jsou jednobuněčné organismy, ryby nebo hmyz, nebo o konkrétním použití GMO, jako je vývoj očkovacích látek.
Velmi specifickou problematiku představuje posuzování rizik při využívání selekčních genů rezistence vůči antibiotikům a mohou být doporučeny další pokyny.
Různé „kategorie účinků“ geneticky modifikovaných organismů na lidské zdraví nebo životní prostředí popisuje příloha II směrnice 2001/18/ES. V zájmu společné interpretace jsou definice následujících výrazů uvedené ve směrnici vysvětleny takto:
— „přímými účinky“ se rozumějí prvotní účinky na lidské zdraví nebo životní prostředí, které jsou výsledkem působení geneticky modifikovaného organismu a neprojevují se příčinným řetězcem dalších událostí (například přímý účinek Bt toxinu na cílové organismy nebo patogenní účinek geneticky modifikovaného mikroorganismu na lidské zdraví),
— „nepřímými účinky“ se rozumějí účinky na lidské zdraví nebo životní prostředí, které se projeví příčinným řetězcem dalších událostí, jako např. interakcí s dalšími organismy, přenosem genetického materiálu nebo změnami v používání nebo nakládání; pozorování nepřímých účinků může být časově opožděno (např. případy, kdy redukování cílové populace hmyzu ovlivní populaci jiného druhu hmyzu, nebo případy, kdy vývoj několikanásobné rezistence nebo systémových účinků bude vyžadovat posouzení dlouhodobé interakce; určité nepřímé účinky, jako například snížené používání pesticidů, by však mohly být bezprostřední),
— „okamžitými účinky“ se rozumějí účinky na lidské zdraví nebo životní prostředí, které lze pozorovat během uvolňování geneticky modifikovaného organismu. Okamžité účinky mohou být přímé i nepřímé (například úhyn hmyzu živícího se transgenními rostlinami, jejichž charakteristickým rysem je rezistence vůči škůdcům, nebo vznik alergií u náchylných osob v souvislosti s vystavením konkrétnímu GMO),
— „opožděnými účinky“ se rozumějí účinky na lidské zdraví nebo životní prostředí, které nemusí být pozorovány během uvolňování geneticky modifikovaných organismů, ale projeví se přímo nebo nepřímo buď v pozdějších stadiích uvolňování, nebo po jeho skončení (například usídlení nebo invazívní chování GMO až za několik generací po úmyslném uvolnění, což je velice důležité v případě, kdy geneticky upravený organismus žije po dlouhou dobu, například geneticky upravené druhy stromů; nebo hybridy blízce příbuzných druhů transgenní plodiny, které se stanou invazívními v přirozených ekosystémech).
Opožděné účinky může být obzvlášť obtížné určit zvláště tehdy, pokud se projeví pouze v dlouhodobém horizontu. Při zjišťování těchto účinků mohou napomoci vhodná opatření, jako je například monitorování (viz níže).
3. OBECNÉ ZÁSADY
Při uplatnění zásady předběžné opatrnosti musí posuzování rizik pro životní prostředí vycházet z těchto obecných zásad:
— Zjištěné charakteristiky geneticky modifikovaného organismu a jeho používání, které by mohly mít nepříznivé účinky na životní prostředí, by měly být porovnány s obdobnými charakteristikami původního organismu a jeho použitím za stejných podmínek.
— Ještě předtím, než se mohou určit jakékoli (škodlivé) vlastnosti GMO, musí se stanovit výchozí stav přijímajícího prostředí včetně jeho organismů a jejich vzájemných interakcí a jejich známých obměn. Výchozí stav slouží jako východisko, s nímž lze porovnávat budoucí změny. Například v případě vegetativně množených plodin musí srovnávací analýza uvádět rodičovské druhy, které byly použity pro vytvoření transgenních linií.
— V případě plodin, které se rozmnožují pohlavně, by osoby provádějící porovnání měly vzít v úvahu příslušné izogenní linie. Pokud jsou plodiny vyšlechtěny pomocí zpětného křížení, je v těchto případech důležité, aby testování podstatné shody používalo co nejvhodnější způsoby kontroly a nespoléhalo se na pouhé porovnávání původního rodičovského materiálu.
— Pokud nejsou stávající údaje dostatečné, musí se výchozí stav definovat na základě jiných referencí umožňujících porovnání. Výchozí stav bude záviset do značné míry na přijímajícím prostředí včetně biotických a abiotických faktorů (například přírodní chráněná stanoviště biotopy, zemědělská půda nebo kontaminovaná půda) nebo na kombinaci různých prostředí.
— Posouzení rizik pro životní prostředí by mělo být prováděno vědecky podloženým a průhledným způsobem, s využitím veškerých dostupných vědeckých poznatků a technických údajů.
— Hodnocení potenciálních nepříznivých účinků by mělo vycházet z vědeckých a technických údajů a z obecné metodiky určování, shromažďování a interpretace příslušných údajů. Údaje, měření a testy musí být srozumitelně popsány. Kromě toho by použití vědecky správných modelovacích postupů mohlo poskytnout chybějící údaje potřebné z hlediska posouzení rizik pro životní prostředí.
— Posouzení rizik pro životní prostředí musí na různých úrovních vzít v úvahu faktor nejistoty. Vědecká nejistota vyplývá většinou z pěti vlastností vědecké metody: zvolená proměnná, provedená měření, odebrané vzorky, použité modely a příčinné vztahy. Vědecká nejistota může také pramenit z rozpornosti stávajících údajů nebo z nedostatku určitých významných údajů. Nejistota se může vztahovat ke kvalitativním nebo kvantitativním prvkům analýzy. Úroveň znalostí nebo údajů týkajících se výchozího stavu se odráží v úrovni nejistoty, kterou musí oznamovatel poskytnout (posouzení nejistoty, včetně chybějících údajů, mezer ve znalostech, standardní odchylky, složitostí atd.) ve srovnání s vědeckou nejistotou v běžné praxi.
— Posouzení rizik pro životní prostředí nemusí vždy poskytnout definitivní odpovědi na veškeré posuzované otázky, protože nemusí mít vždy dostatek údajů. Zejména v případě potenciálních dlouhodobých účinků může být dostupnost údajů velice nízká. V těchto případech se musí zvážit zejména vhodné řízení rizik (ochranná opatření) v souladu se zásadou předběžné opatrnosti, aby se zamezilo nepříznivým účinkům na lidské zdraví a životní prostředí.
— Obecnou zásadou je, že posouzení rizik pro životní prostředí musí obsahovat výsledky odpovídajícího výzkumu potenciálních rizik spojených se záměrným uvolňováním GMO nebo s jejich uvedením na trh, společně se všemi jasně zdokumentovanými srovnatelnými zkušenostmi.
— Jako užitečné se jeví použití metody postupných kroků (například všechny kroky počínaje pokusy v uzavřeném systému přes záměrné uvolňování až po uvedení na trh). V průběhu procesu se musí co nejdříve shromáždit údaje získané z jednotlivých kroků. Simulované environmentální podmínky v uzavřeném systému by mohly poskytnout důležité výsledky pro záměrné uvolňování (například chování mikroorganismů je možno simulovat v mikrokosmech nebo chování rostlin je možné do jisté míry simulovat ve skleníku).
— V případě geneticky modifikovaných organismů, které mají být uvedeny na trh, se musí poskytnout příslušné a dostupné údaje ze záměrného uvolňování z takových typů prostředí, ve kterých se bude GMO využívat.
— Posouzení by mělo být provedeno pro každý případ zvlášť, neboť požadované informace mohou být závislé na typu geneticky modifikovaných organismů, na způsobu jejich plánovaného využití i na přijímajícím prostředí, přičemž je nutno vzít v úvahu i geneticky modifikované organismy, které se již v prostředí nalézají.
— Posouzení rizik pro životní prostředí se musí provádět pro každý případ zvlášť vzhledem k široké škále individuálních vlastností různých organismů (jednotlivé GMO) a vzhledem k různým prostředím (jednotlivé lokality či regiony).
— Obrovská rozmanitost účinků na životní prostředí může existovat v případě geneticky modifikovaných mikroorganismů (vzhledem k jejich malé velikosti a k jejich často neznámému vzájemnému působení), rostlin (například vyšších rostlin používaných jako potraviny a krmivo nebo stromů vzhledem k jejich potenciální dlouhověkosti) a zvířat (například hmyzu pro jeho malou velikost a vysokou schopnost překonávat překážky; nebo mořských ryb vzhledem k jejich vysoké schopnosti rozšíření).
— Kromě toho může existovat široká škála environmentálních charakteristik (specifických pro danou lokalitu nebo pro region), která je třeba vzít v úvahu. Pro podporu posouzení jednotlivých případů může být užitečné provést klasifikaci regionálních údajů podle oblasti stanoviště, odrážející aspekty přijímajícího prostředí, které jsou důležité z hlediska geneticky modifikovaných organismů (například botanické údaje o výskytu planě rostoucích rostlin příbuzných s GMO v různých zemědělských nebo přírodních stanovištích Evropy).
— Oznamovatel musí zároveň vzít v úvahu potenciálně škodlivé interakce GMO s jinými relevantními geneticky modifikovanými organismy, které mohly být úmyslně uvolněny nebo uvedeny na trh v minulosti, a také opakovaná uvolnění stejných GMO, jako je například použití prostředků na ochranu rostlin. Opakovaná uvolnění ve srovnání s příležitostnými uvolněními by mohla časem způsobit, že by se vysoká úroveň pozadí GMO v prostředí stala permanentní.
— Vyskytnou-li se nové informace o geneticky modifikovaném organismu a jeho účincích na lidské zdraví nebo životní prostředí, může být zapotřebí znovu posouzení rizik přepracovat, aby se zjistilo:
—— zda došlo ke změně rizika,
— zda je nezbytné řízení rizik odpovídajícím způsobem změnit.
— V případě nových informací, nezávisle na tom, zda je nutné přijmout bezprostřední opatření, může být zapotřebí vypracovat nové posouzení rizik pro životní prostředí, aby se posoudilo, zda je nutné změnit podmínky povolení k uvolnění GMO nebo k jeho uvedení na trh nebo přizpůsobit opatření pro řízení rizik (viz také kapitola 6). Nové informace mohou vyplynout z výzkumu nebo z plánů monitorování nebo z příslušné praxe.
— Posouzení rizik pro životní prostředí a monitorování spolu úzce souvisejí. Posouzení rizik pro životní prostředí poskytuje základ pro plány monitorování, které se zaměřují na nepříznivé účinky na lidské zdraví a životní prostředí. Požadavky kladené na plány monitorování záměrného uvolňování geneticky modifikovaných organismů (část B v souladu s příslušnými částmi přílohy III) a uvedení GMO na trh (část C v souladu s přílohou VII) se liší. Monitorování uvedené v části C, včetně obecného dohledu, může také sehrát důležitou roli při zajišťování údajů pro dlouhodobé, potenciálně nepříznivé účinky geneticky modifikovaných organismů. Výsledky monitorování mohou potvrdit posouzení rizik pro životní prostředí nebo mohou vést k jeho přehodnocení.
— Obecnou zásadou posuzování rizik pro životní prostředí také je, že musí být provedena analýza „kumulativních dlouhodobých účinků účinků“, které jsou důležité z hlediska uvolnění a uvedením na trh. „Kumulativními dlouhodobými účinky“ se rozumějí souhrnné účinky povolení na lidské zdraví a životní prostředí, mezi jiným na rostliny a živočichy, na úrodnost půdy, na rozklad organického materiálu v půdě, na potravinový řetězec člověka a zvířat, na biologickou rozmanitost, na zdraví zvířat a na rezistenci vůči antibiotikům.
— Při zvažování kumulativních dlouhodobých účinků musí brát posouzení rizik pro životní prostředí v úvahu takové otázky jako například:
—— dlouhodobé interakce GMO a přijímajícího prostředí,
— vlastnosti GMO, které se stanou významnými z dlouhodobého hlediska,
— opakovaná záměrná uvolňování nebo uvádění na trh po dlouhou dobu,
— geneticky modifikované organismy záměrně uvolněné nebo uvedené natrh v minulosti.
— Zejména se mohou vyžadovat další informace o dlouhodobých účincích (například několikanásobné rezistence vůči herbicidům) a musí existovat přiměřený výzkum, částečně v rámci plánů monitorování, který může poskytnout důležité údaje pro posouzení kumulativních dlouhodobých účinků. V souvislosti s touto otázkou mohou být doporučeny další pokyny.
4. METODIKA
4.1 Charakteristiky geneticky modifikovaných organismů a charakteristiky uvolňování
Posouzení rizik pro životní prostředí musí vzít v úvahu příslušné technické a vědecké podrobnosti týkající se charakteristik:
— organismu příjemce nebo rodičovského organismu nebo organismů,
— genetické modifikace nebo modifikací, ať se jedná o vložení nebo odstranění genetického materiálu, a odpovídající informace o vektoru a dárci,
— geneticky modifikovaného organismu,
— zamýšleného uvolnění nebo využití včetně jejich rozsahu,
— potenciálního přijímajícího prostředí a
— interakcí mezi geneticky modifikovaným organismem a prostředím.
Při posuzování rizik pro životní prostředí mohou napomoci informace o uvolňování obdobných organismů nebo organismů s obdobnými vlastnostmi a jejich interakcích s obdobným prostředím.
Před záměrným uvolněním geneticky modifikovaného organismu nebo kombinace geneticky modifikovaných organismů podle části B nebo před uvedením na trh podle části C směrnice se musí příslušnému orgánu členského státu, kde se má poprvé uskutečnit uvolnění nebo uvedení na trh, předložit oznámení obsahující informace uvedené v přílohách IIIA a IIIB směrnice (informace o GMO, dárci, příjemci, vektoru, podmínkách uvolnění a prostředí, o interakci mezi GMO a životním prostředím a o monitorování GMO).
Tato oznámení musí obsahovat technickou dokumentaci informací včetně úplného posouzení rizik pro životní prostředí v souladu s čl. 6 odst. 2 a čl. 13 odst. 2 směrnice, množství podrobností, které jsou zapotřebí pro odůvodnění jednotlivých bodů v závislosti na jeho významu v rámci posouzení rizik pro životní prostředí. Oznamovatelé poskytnou bibliografické odkazy a uvedou použité metody.
Informace o příjemci, dárci, vektoru, genetické modifikaci a GMO na základě informací požadovaných v příloze IIIA a IIIB směrnice nezávisejí na prostředí, ve kterém se má GMO experimentálně uvolnit nebo uvést na trh, ani na podmínkách, podle nichž se bude experimentálně uvolňovat nebo prodávat. Tyto informace tvoří základ pro určení všech potenciálně škodlivých vlastností (potenciálních nebezpečí) geneticky modifikovaných organismů. Znalosti a zkušenosti získané při uvolňování stejných nebo podobných GMO mohou být zdrojem důležitých informací o potenciálních nebezpečích zmíněného uvolnění.
Informace o zamýšleném uvolnění, přijímajícím prostředí a jejich vzájemném působení, jak se vyžadují v přílohách IIIA a IIIB směrnice, se týkají konkrétního prostředí, do kterého se bude GMO uvolňovat, a podmínek, včetně rozsahu tohoto uvolnění. Tyto informace vymezí rozsah všech potenciálně škodlivých vlastností GMO.
4.2 Jednotlivé kroky analýzy posouzení rizik pro životní prostředí
Při formulování závěrů posouzení rizik pro životní prostředí podle článků 4, 6, 7 a 13 směrnice 2001/18/ES by měly být zahrnuty tyto body jako hlavní kroky v procesu posuzování rizik:
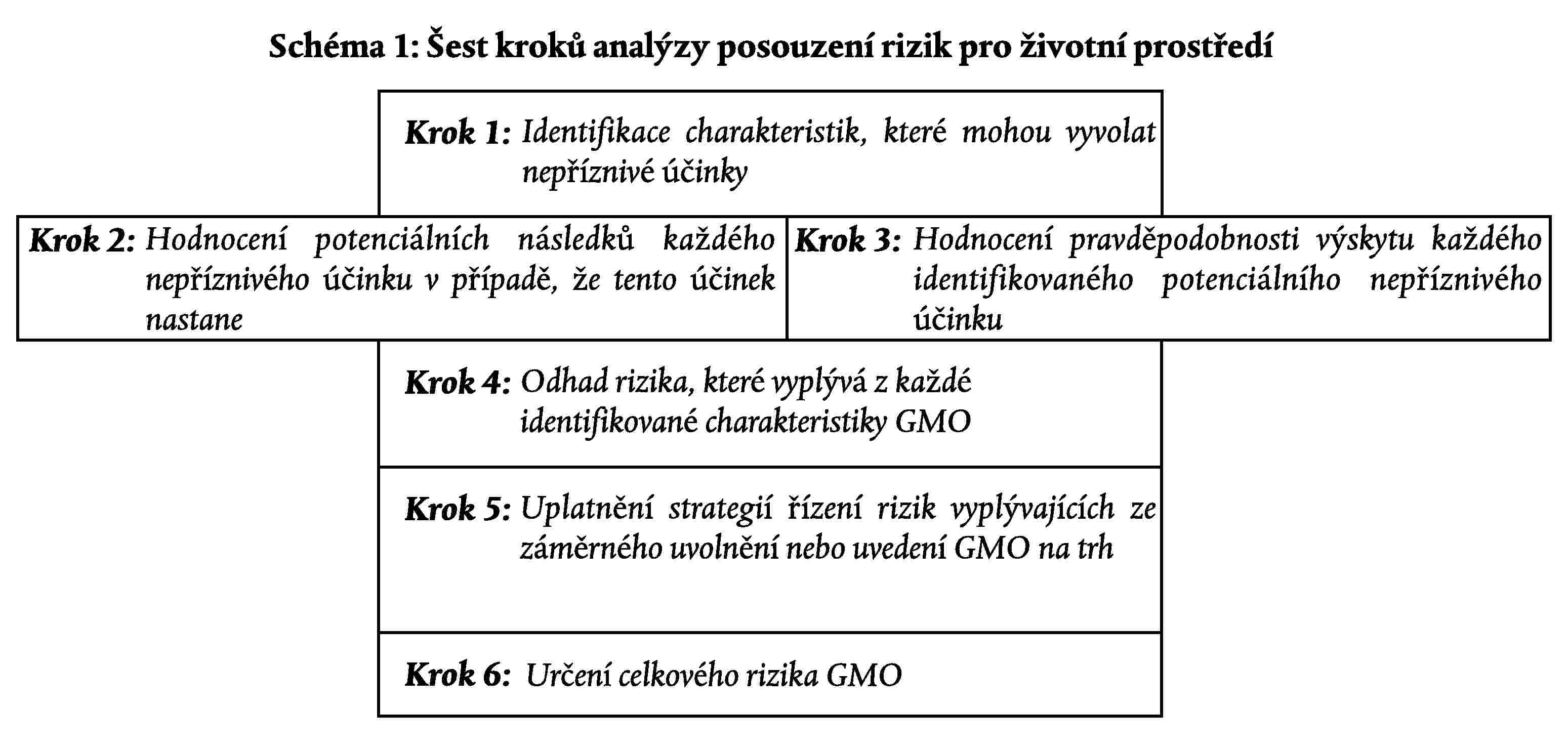
„Nebezpečím“ (škodlivou charakteristikou) se rozumí schopnost organismu způsobit poškození nebo nepříznivé účinky na lidské zdraví nebo životní prostředí.
„Rizikem“ se rozumí kombinace rozsahu následků nebezpečí, pokud nastane, a pravděpodobnosti, že tyto následky nastanou.
4.2.1 Krok 1: Identifikace charakteristik, které mohou způsobit nepříznivé účinky
Musí být identifikovány jakékoli charakteristiky spojené s genetickou modifikací, které mohou vyústit v nepříznivé účinky pro lidské zdraví nebo životní prostředí. Porovnání těchto charakteristik geneticky modifikovaného organismu nebo organismů s charakteristikami nemodifikovaného organismu za odpovídajících podmínek uvolnění nebo využití může pomoci při identifikaci určitých nepříznivých účinků, které mohou být důsledkem genetické modifikace. Důležité je, aby nebyl podceněn žádný z potenciálních nepříznivých účinků jen proto, že je jeho výskyt nepravděpodobný.
Potenciální nepříznivé účinky geneticky modifikovaných organismů se budou případ od případu lišit a mohou zahrnovat:
— nemoci lidí včetně alergenních nebo toxických účinků,
— nemoci zvířat a rostlin, včetně toxických, popřípadě alergenních projevů,
— účinky na dynamiku populace druhů v přijímajícím prostředí a na genetickou rozmanitost těchto jednotlivých populací,
— změněnou vnímavost k patogenům usnadňující šíření infekčních nemocí nebo vytváření nových zásobníků nebo vektorů,
— omezenou účinnost profylaktické nebo terapeutické lékařské, veterinární léčby nebo ošetření rostlin, například přenosem genů rezistence vůči antibiotikům používaným v lékařství nebo veterinárním lékařství,
— účinky biogeochemického charakteru (biogeochemické cykly), především na oběh uhlíku a dusíku, projevující se změnami procesu půdního rozkladu organických materiálů.
Příklady výše uvedených potenciálních nepříznivých účinků jsou uvedeny v přílohách IIIA a IIIB směrnice 2001/18//ES.
Většina identifikovatelných nebezpečí (škodlivých charakteristik), která mohou vyvolat nepříznivé účinky, se bude týkat příslušného genu nebo genů záměrně vnesených do GMO a odpovídajícího proteinu nebo proteinů exprimovaných podle těchto genů. Další nepříznivé účinky, například pleiotropní účinky, by mohly být vyvolány jako důsledek metody používané pro vytváření transgenů a v důsledku umístění konstruktu v genomu GMO, kam byly transgeny vneseny. V případech, kdy je do příjemce vnesen více než jeden transgen nebo kdy je transgen vnesen do GMO, se musí vzít v úvahu potenciální interakce různých transgenů, zejména v souvislosti s potenciálními epigenetickými nebo regulačními účinky.
Vzhledem k tomu, že je důležité nebezpečí co nepřesněji definovat, bude v mnoha případech účelné zvažovat nebezpečí podle záhlaví uvedených v následujícím textu a potom specifikovat jednotlivé druhy nebezpečí identifikované pro účely posouzení rizik pro životní prostředí (například, pokud v konkrétním případě byly identifikovány jako potenciální nepříznivé účinky na lidské zdraví vyvolání alergické reakce a toxicita, musí se tyto účinky při posuzování rizik pro životní prostředí zvažovat samostatně).
Pokud se v určitém GMO vyskytuje nebezpečí, vyskytuje se vždy a lze je považovat za základní charakteristiky tohoto GMO. Ohrožení může způsobit – na základě dané pravděpodobnosti (krok 3) – negativní následky a tyto následky naopak mohou mít různé pořadí podle velikosti (krok 2). Nakonec se jednotlivá nebezpečí pro GMO musí shrnout.
V této etapě posuzování rizik pro životní prostředí je však nezbytné pouze zvážit nebezpečí v důsledku genetické modifikace, která mohou vyvolat nepříznivé účinky. Krok 1 poskytuje vědecký základ pro následné kroky v rámci posuzování rizik pro životní prostředí. I v této etapě je rozhodující určit pro každé potenciální nebezpečí konkrétní úroveň vědecké nejistoty, aby se mohla vzít v úvahu v pozdější etapě.
Nepříznivé účinky se mohou projevit přímo nebo nepřímo prostřednictvím mechanismů, kam lze zařadit:
Cesty rozšíření ukazují potenciální směry rozšíření GMO nebo potenciálního ohrožení do prostředí a v jeho rámci (například toxicita pro lidi; inhalace toxických mikroorganismů nebo toxických proteinů).
Schopnost GMO rozšířit se do daného prostředí bude například záviset na:
— jeho biologické způsobilosti (GMO určené k lepšímu fungování v daném prostředí na základě vlastností vedoucích ke zvýšené konkurenceschopnosti v přirozených prostředích nebo kvalitativní a kvantitativní změna jednotlivých složek nebo GMO rezistentní vůči tlaku přirozeného výběru, jako jsou například choroby nebo abiotický stres, například teplo, chlad, sůl nebo vytváření antimikrobiálních látek v mikroorganismech),
— podmínkách záměrného uvolňování nebo uvedení na trh (zejména oblast uvolnění a rozsah, to znamená počet uvolněných GMO),
— pravděpodobnosti záměrného uvolnění nebo uvedení na trh nebo neúmyslných uvolnění do životního prostředí (například GMO určené ke zpracování),
— cestách šíření životaschopného materiálu (například semena, spóry atd.) větrem, vodou, živočichy atd.,
— konkrétních environmentálních hlediscích (specifické pro danou lokalitu nebo region): umožnit posouzení podle lokality nebo regionu může být účelné z hlediska klasifikace údajů podle oblasti stanoviště, zachycující aspekty přijímajícího prostředí s významem pro GMO (například botanické údaje o výskytu planě rostoucích příbuzných druhů GMO, s nimiž je možné křížení, v různých zemědělských nebo přírodních stanovištích Evropy).
Zároveň je důležité odhadnout délku časového období, po které je obecně pravděpodobné přežití jednotlivého GMO nebo konkrétního počtu GMO určitého druhu, a pohotovost, se kterou se může rozšířit a usadit se v různých biotopech. Je nezbytné vzít v úvahu reprodukční formy, formy přežívání a dormantní formy, kam patří například:
— u rostlin: životaschopnost pylu, semen a vegetativních struktur,
— u mikroorganismů: životaschopnost spór jako formy přežívání nebo schopnost mikroorganismů vstoupit do životaschopného, avšak nekultivovatelného stavu.
Celková schopnost rozšíření se může podstatně lišit v závislost na druhu, genetické modifikaci a na přijímajícím prostředí, například pěstování rostlin v poušti nebo chov ryb v moři.
Nebezpečí by mohlo vést k nepříznivým účinkům na základě přenosu genu v rámci stejného druhu nebo při přenosu do jiného druhu (vertikální a horizontální přenos genu). Rychlost a rozsah přenosu genu do jiných druhů (v případě vyšších organismů většinou sexuálně kompatibilních) závisí například na:
— rozmnožovacích vlastnostech samotného GMO, včetně modifikovaných sekvencí,
— podmínkách uvolnění a zejména na environmentálních hlediscích, jako je podnebí (například vítr),
— rozdílech v biologii rozmnožování,
— zemědělských postupech,
— dostupnosti potenciálních partnerů pro křížení,
— přenosu a opylujících vektorech (například hmyz nebo ptáci, obecně živočichové),
— dostupnosti hostitelů pro parazity.
Výskyt konkrétních nepříznivých účinků při přenosu genů může být spojen s množstvím uvolněných GMO. Rozsáhlá pole transgenních rostlin mohou mít naprosto jiný potenciál pro přenos genů než malá políčka, a to i proporcionálně. Kromě toho jsou velice důležité kvalitativní a kvantitativní informace o existenci potenciálních partnerů pro křížení nebo příjemců (pro rostliny v rámci příslušných vzdáleností).
U vyšších rostlin a živočichů se musí dále rozlišit možný genový přenos do stejného, blízce příbuzného, vzdáleně příbuzného a nepříbuzného druhu.
V případě mikroorganismů hraje horizontální přenos genů důležitější roli. Určitý genetický materiál lze snadno přenášet mezi příbuznějšími organismy, například prostřednictvím plazmidů nebo fágů. Schopnost rychlého růstu mikroorganismů umožňuje ve srovnání s vyššími organismy relativně vyšší úroveň přenosu genů.
Přenos transgenů může časem vést ke smíšené populaci GMO nebo k rozdílné kombinaci genů a rostlin, což může potom vést ke složitým modelům především u dlouhodobých nepříznivých účinků. Ty se stávají složitějšími, protože se do populace převádí stále více transgenního materiálu (například ukládání genů).
V některých případech může metoda genetických modifikací změnit schopnost přenosu genů, jako například v případě neintegrujících plazmidů nebo virových vektorů. Metoda genetické modifikace může také snížit schopnost přenosu genů, například transformace chloroplastů.
Přenos genů může vyústit v přetrvávání vneseného genetického materiálu v přírodních populacích. Pokud má GMO potenciál pro přenos genů, nepředstavuje to nutně vnitřní riziko nebo změnu schopnosti přežít, etablovat se nebo vyvolat nepříznivé účinky. To bude záviset na vloženém genetickém materiálu, na druhu a na přijímajícím prostředí, včetně potenciálních příjemců.
Je nutné zvážit rozsah, ve kterém by genetická (ne)stabilita mohla vést k fenotypové (ne)stabilitě a vyvolat nebezpečí. Nestabilita genetické modifikace může v určitých případech vyústit v reverzi do fenotypu planě rostoucího typu. Dále se musí vzít v úvahu další případy:
— jestliže v transgenní rostlinné linii, která obsahuje více než jeden transgen, vyústí následný segregační proces v to, že se tyto transgeny rozdělí do potomstva, mohly by existovat rostliny s menším počtem transgenů, avšak s novými fenotypy,
— jestliže se oslabení mutanti mohou v důsledku nestability (z důvodu stavby specifické mutace) navrátit k virulenci,
— jestliže duplikace transgenů vede k utlumení (potlačení) genů,
— jestliže jsou počty kopií velmi vysoké,
— jestliže opětovné vnesení přenosných prvků způsobí vznik nových fenotypů z důvodu deaktivace transgenu vložením mobilních genetických prvků,
— jestliže je úroveň exprese transgenu (například velmi nízká exprese toxické látky) významná, může mít genetická nestabilita regulátorového prvku (regulátorových prvků) za následek vyšší expresi transgenu.
Fenotypová nestabilita by mohla vyplynout z interakce s prostředím, ke které došlo během kultivace (pěstování), takže v posouzení rizik pro životní prostředí se musí zvážit účinky environmentálních a zemědělských faktorů na expresi transgenů.
Pokud se exprese transgenů omezí v GMO na určitý úsek (jako například určitá pletiva rostliny), mohla by nestabilita regulace vyvolat expresi transgenu v celém organismu. V této souvislosti hrají důležitou roli regulátorové signály (jako například promotory) a je zapotřebí je vzít v úvahu.
Zároveň se musí vzít v úvahu exprese transgenu v určitém čase během životního cyklu organismu nebo za konkrétních podmínek životního prostředí.
Do GMO je možné vnést konkrétní transgeny neplodnosti, aby způsobily neplodnost (například aby se zabránilo přenosu a rozšíření určitých transgenů). Nestabilita transgenů neplodnosti by mohla mít za následek reaktivaci plodnosti rostliny umožňující rozšíření transgenů, což by mohlo mít nepříznivé důsledky.
Stabilita různých transgenů nejen v primárním GMO, ale také v jeho potomstvu, je důležitá zejména z hlediska dlouhodobých účinků.
Je třeba pečlivě posoudit případné interakce s ostatními organismy, včetně ostatních GMO, přičemž se musí vzít v úvahu složitost multitrofických interakcí. Mezi přímo ohrožující interakce, které by mohly způsobit nepříznivé účinky, by mohly patřit:
— expozice lidí (jako například zemědělci, spotřebitelé),
— expozice zvířat,
— konkurence při získávání přírodních zdrojů, jako je půda, území, voda, světlo,
— vytěsnění přirozených populací jiných organismů,
— dodávání toxických látek,
— rozdílné modely růstu.
Obecně platí, že pokud je biologická způsobilost posílena genetickou modifikací, může GMO proniknout do nových prostředí a nahradit stávající druhy. Výskyt konkrétních nepříznivých účinků často proporcionálně souvisí s rozsahem uvolňování.
Jako nevyhnutelný důsledek záměrného uvolnění GMO se musí na základě stávajících postupů určit důležitost změn v řídících postupech. Změny v řízení farem se například týkají:
— setí, výsadby, růstu, sklizně nebo přepravy plodin (například výsadby na malých nebo rozsáhlých polích), načasování,
— střídání plodin (například pěstování stejného rostlinného druhu každý rok nebo každý čtvrtý rok),
— opatření proti chorobám a škůdcům (například typ a dávkování insekticidů pro rostliny nebo antibiotik pro zvířata, či alternativní opatření),
— řízení rezistence (například typ a dávkování herbicidu pro rostliny, které snášejí herbicidy nebo změna využívání biologické ochrany prostřednictvím Bt proteinů nebo účinku virů),
— izolace v krajinných a vodních zemědělských systémech (například izolační vzdálenosti při pěstování rostlin nebo kvalita izolace na rybích farmách),
— zemědělská praxe (hospodářství využívající GMO a hospodářství nevyužívající transgenních plodin, včetně ekologického hospodářství),
— řízení v nezemědělských systémech (například izolační vzdálenosti přirozených biotopů od oblastí výsadby GMO).
4.2.2 Krok 2: Hodnocení potenciálních následků každého nepříznivého účinku, pokud tento účinek nastane
Měla by být vyhodnocena velikost následků každého potenciálního nepříznivého účinku.
Nezávisle na pravděpodobnosti, že se projeví potenciální škodlivé charakteristiky (viz kapitola 4.2.3, krok 3), představuje hodnocení velikosti následků důležitou součást posouzení rizik. Velikostí rozumíme rozsah, ve kterém se projeví důsledky každého potenciálního ohrožení, které vyplývá z geneticky modifikovaných organismů, jež se mají záměrně uvolnit nebo uvést na trh.
Na velikost se musí pohlížet v souvislosti s výchozím stavem a bude pravděpodobně ovlivněna:
— genetickou stavbou,
— každým identifikovaným nepříznivým účinkem,
— počtem uvolněných GMO (rozsah),
— životním prostředím, do kterého se má geneticky modifikovaný organismus nebo organismy uvolnit,
— podmínkami uvolnění, včetně kontrolních opatření,
— kombinacemi výše uvedených faktorů.
U každého identifikovaného nepříznivého účinku se musí vyhodnotit důsledky pro ostatní organismy, populace, druhy nebo ekosystémy, které budou vystaveny působení GMO. To vyžaduje detailní znalost prostředí, do kterého se má GMO uvolnit (lokalita, region), a metod uvolňování. Důsledky se budou pohybovat od hodnoty „zanedbatelné“ nebo nepodstatné a s vlastním omezením na hodnotu „vysoké“ nebo závažné, přičemž mají buď bezprostřední a závažný nepříznivý dopad, nebo mohou případně vést k dlouhodobým, stálým nepříznivým účinkům.
Pomocí kvantitativních výrazů by se velikost měla vyjádřit, pokud to je možné, jako „vysoká“, „střední“, „nízká“ nebo „zanedbatelná“. V některých případech není možné v konkrétním prostředí určit nepříznivý účinek. Zde by se riziko spojené s tímto specifickým nepříznivým účinkem mohlo označit jako „zanedbatelné“ nebo nevýznamné.
Následující příklady mají sloužit jako ilustrační a kvalitativní příklady ve velice širokém smyslu. Nemají sloužit jako definitivní nebo výlučné, ale jejich cílem je naznačit hlediska, která by se měla vzít v úvahu při zvažování následků:
— „důsledky vysoké úrovně“ by mohly být závažné změny v počtech jednoho druhu či více druhů jiných organismů, včetně ohrožených a užitečných druhů v krátkodobém nebo dlouhodobém časovém horizontu. Mezi tyto změny by mohlo patřit snížení nebo úplné vyhubení druhů s negativním účinkem na fungování ekosystému nebo jiných souvisejících ekosystémů. Tyto změny by pravděpodobně nebyly rychle vratné a každá realizovaná obnova ekosystému by pravděpodobně byla pomalá,
— „důsledky střední úrovně“ by mohly být významné změny v hustotě populace jiných organismů, nejednalo by se však o změnu, která by mohla vyústit v úplné vyhubení druhu nebo v jiný závažný účinek ve vztahu k ohroženým nebo užitečným druhům. Mohly by sem být zařazeny přechodné a závažné změny v populacích, pokud by existovala pravděpodobnost, že jsou vratné. Mohly by zde být i dlouhodobé účinky za předpokladu, že neexistují žádné závažné negativní účinky na fungování ekosystému,
— „důsledky nízké úrovně“ by mohly být nevýznamné změny v hustotě populace jiných organismů, které nezpůsobí úplné vyhubení žádné populace nebo druhu jiných organismů a nemají žádné negativní účinky na fungování ekosystému. Jedinými ovlivněnými organismy by mohly být druhy, které nejsou ohroženy a nepřinášejí užitek, a to z krátkodobého nebo dlouhodobého hlediska,
— „zanedbatelné důsledky“ by nepředstavovaly žádné závažné změny způsobené v populacích daného prostředí ani v žádných ekosystémech.
Výše uvedené příklady zachycují potenciální nepříznivé účinky geneticky modifikovaných organismů na populace, ačkoli v některých případech je možná vhodnější zvažovat pravděpodobné účinky na jednotlivé organismy. Jedno samostatné ohrožení by mohlo vyvolat více než jeden nepříznivý důsledek a ve skutečnosti by velikosti jednotlivých nepříznivých účinků mohly být rozdílné. Nepříznivé účinky jednoho ohrožení na lidské zdraví a zemědělské a přírodní biotopy by se mohly lišit.
Potenciální důsledky by se mohly shrnout tak, aby pokrývaly všechny ekologické entity, kterých by se mohly týkat (jako například druhy, populace, trofické úrovně, ekosystémy) včetně potenciálního účinku a úrovně nejistoty.
4.2.3 Krok 3: Hodnocení pravděpodobnosti výskytu každého identifikovaného potenciálního nepříznivého účinku
Hlavním faktorem při hodnocení možnosti nebo pravděpodobnosti výskytu nepříznivého účinku je charakteristika prostředí, do kterého je uvolnění organismu nebo organismů plánováno, a zamýšlený způsob uvolnění.
Kromě velikosti důsledků ohrožení (viz kapitola 4.2.2, krok 2) představuje hodnocení pravděpodobnosti výskytu nepříznivých důsledků další důležitou část při posuzování rizik. Účelem tohoto kroku je odhadnout, jaká je pravděpodobnost, že nepříznivé důsledky skutečně nastanou. V některých případech se musí určit jak pravděpodobnost, tak i frekvence. Stejně jako v kroku 2 (hodnocení potenciálních důsledků každého nepříznivého účinku v případě, že tento účinek nastane) jsou pro definování pravděpodobnosti důležité kromě samotného ohrožení také počet GMO, přijímající prostředí a podmínky uvolnění. Důležité zřetele představují například klimatické, zeměpisné, půdní a demografické podmínky a typy rostlin a živočichů v potenciálním přijímajícím prostředí.
Pro schopnost přežití je tudíž vhodné stanovit poměr GMO, které pravděpodobně přežijí, mimo plánovaná opatření pro řízení rizik, která jsou navrhovaná pro záměrné uvolnění nebo uvedení na trh. V případech, kde je pravděpodobný přenos genu, se musí vzít v úvahu pravděpodobný počet těchto skutečností nebo rozsah, ve kterém se přenos uskuteční. Pokud má GMO patogenní nebo toxické charakteristiky, musí se odhadnout poměr cílových organismů v daném prostředí, u nichž existuje pravděpodobnost, že budou zasaženy.
Kromě toho bude pravděpodobnost výskytu účinku záviset na konkrétních opatřeních pro řízení rizik, která mohou zabránit tomu, aby se tato rizika vyskytla (například pokud není možný rozptyl pylu z důvodu zničení květenství).
U každého identifikovaného nepříznivého účinku nelze pravděpodobně kvantitativně určit relativní pravděpodobnost důsledku, avšak lze ji vyjádřit pomocí výrazů „vysoká“, „střední“, mírná „,“ nízká „nebo“ zanedbatelná.
Výše uvedené příklady zachycují potenciální nepříznivé účinky GMO na populace, ačkoli v některých případech je možná vhodnější zvažovat pravděpodobné účinky na jednotlivé organismy. Jedno samostatné ohrožení by mohlo vyvolat více než jeden nepříznivý důsledek a ve skutečnosti by velikosti jednotlivých nepříznivých účinků mohly být rozdílné. Nepříznivé účinky jednoho ohrožení na lidské zdraví a zemědělské a přírodní stanoviště by se mohly lišit.
Pravděpodobnost by se mohla shrnout tak, aby pokrývala všechny ekologické entity, kterých by se mohla týkat (jako například druhy, populace, trofické úrovně, ekosystémy), včetně opatření týkajících se potenciálního účinku a úrovně nejistoty.
4.2.4 Krok 4: Odhad rizika spojeného s každou identifikovanou charakteristikou geneticky modifikovaného organismu nebo organismů
Odhad rizika pro lidské zdraví nebo životní prostředí plynoucího z každé identifikované charakteristiky geneticky GMO, která může mít za následek nepříznivý účinek, by měl být proveden co nejlépe, s využitím všech dostupných znalostí a na základě společného vyhodnocení pravděpodobnosti výskytu nepříznivého účinku a dosahu možných následků, pokud tento nepříznivý účinek nastane.
Na základě závěrů, ke kterým se dospělo v krocích 2 a 3, se odhad rizika nepříznivých důsledků musí provést u každého nebezpečí uvedeného v kroku 1. Opět je pravděpodobně nemožné provést kvantitativní hodnocení. Hodnocení musí u každého ohrožení brát v úvahu:
— velikost důsledků („vysoká“, „střední“, „nízká“ nebo „zanedbatelná“),
— pravděpodobnost nepříznivého účinku („vysoká“, „střední“, „nízká“ nebo „zanedbatelná“),
— zda má ohrožení více než jeden nepříznivý účinek, velikost a pravděpodobnost každého jednotlivého nepříznivého účinku.
Každý GMO se musí posuzovat případ od případu. Jakýkoli obecný pokus kvantitativně vyjádřit skutečnosti popsané v předcházejícím textu se musí provádět velice opatrně. Například v jednom případě může být vysoká úroveň velikosti důsledků nepříznivého účinku kombinovaná se zanedbatelnou pravděpodobností jeho výskytu, což v konečném důsledku znamená, že se riziko pohybuje po celé škále rizika od vysokého až po zanedbatelné. Výsledek bude záviset na okolnostech případu a na zvážení určitých faktorů ze strany oznamovatele, přičemž vše se musí objasnit a odůvodnit v záznamech o posouzení rizik pro životní prostředí.
Celková nejistota u každého identifikovaného rizika se musí popsat, včetně případné dokumentace týkající se:
— předpokladů a extrapolací vypracovaných na různých úrovních v rámci posouzení rizik pro životní prostředí,
— různých odborných posouzení a stanovisek,
— nejistot,
— známých limitů opatření pro zmírnění účinků,
— závěrů, které lze odvodit na základě údajů.
Ačkoli by posouzení rizik pro životní prostředí mělo být založeno na kvantifikovatelných výsledcích, je pravděpodobné, že mnoho výsledků tohoto posouzení bude muset být kvalitativních. Je však nezbytné ve všech možných případech získat takové výsledky posouzení rizik pro životní prostředí, které mají relativní charakter (například v porovnání se srovnatelnými nemodifikovanými organismy), a to i přesto, že jsou kvalitativní.
4.2.5 Krok 5: Uplatnění strategií řízení rizik ze záměrného uvolňování geneticky modifikovaného organismu nebo organismů nebo z jeho uvádění na trh
Posouzení rizik pro životní prostředí může identifikovat rizika, která si vyžádají opatření určená k jejich řízení, je třeba stanovit strategii řízení.
Před uplatněním řízení rizik se musí z hlediska prevence zvážit možnost úpravy podmínek uvolnění, pokud možno tak, aby riziko bylo zanedbatelné. Například v procesu výstavby genů je nutné vyhnout se genetickým prvkům, které mohou vyvolat nepříznivé účinky nebo nejsou definovány. Pokud to není možné, musí být tyto genetické prvky odstraněny z GMO v pozdějším stádiu, ještě před jeho záměrným uvolněním nebo uvedením na trh.
Toto se musí vzít v úvahu v krocích 1 až 4. Řízení rizik musí kontrolovat identifikované riziko a obsáhnout nejistoty. Bezpečnostní opatření musí být přiměřená úrovni rizika a úrovni nejistoty. Jakmile jsou v pozdějším stádiu k dispozici náležité údaje, musí se řízení rizik těmto novým údajům přizpůsobit.
Aby se řízením snížila rizika, musí opatření dosáhnout konkrétně tohoto cíle. Například existuje-li riziko, že se gen, který je pro hmyz toxický a který je vložen do plodiny, přenese na příbuzné druhy této rostliny, měla by příslušná kontrolní opatření zahrnovat prostorovou nebo časovou izolaci od těchto příbuzných druhů nebo případně změnu lokality uvolnění na oblast, kde neexistuje vystavení konkrétnímu riziku (například druhy rostliny).
Součástí strategií řízení mohou být izolační opatření v každé odpovídající etapě manipulace a využívání geneticky modifikovaných organismů. Zároveň mohou obsahovat širokou škálu opatření včetně různých prostředků zajišťujících izolaci při rozmnožování, fyzických či biologických bariér a používání strojů na čištění nebo kontejnerů v kontaktu s geneticky modifikovanými organismy atd.
Podrobné postupy řízení rizik budou záviset na:
— použití GMO (typ a rozsah záměrného uvolnění nebo uvedení na trh),
— typu GMO (například geneticky modifikované mikroorganismy, vyšší jednoleté rostliny, vyšší rostliny s delší životností nebo živočichové, GMO s jednoduchou nebo několikanásobnou modifikací, jeden druh nebo různé druhy GMO),
— obecném typu stanoviště (například biogeochemický status, podnebí, dostupnost partnerů pro vzájemné a mezidruhové křížení, centra původu, propojení různých stanovišť),
— typu zemědělského stanoviště (například zemědělství, lesnictví, vodní kultura, venkovské oblasti, velikost lokalit, počet různých GMO),
— typu přirozeného stanoviště (například statut chráněných oblastí).
Je třeba jasně formulovat aspekty řízení rizik ve smyslu nezbytných přizpůsobení se experimentům, podmínek pro uvedení na trh atd., a následné snížení rizika, kterého se má pravděpodobně dosáhnout.
4.2.6 Krok 6: Stanovení celkového rizika geneticky modifikovaného organismu nebo organismů
Hodnocení celkového rizika spojeného s geneticky modifikovaným organismem nebo organismy by mělo být provedeno s ohledem na všechny navržené strategie řízení rizik.
Na základě kroku 4 a případně kroku 5 je zapotřebí vypracovat konečné hodnocení celkového rizika, včetně velikosti a pravděpodobnosti nepříznivých důsledků způsobených GMO, které je založeno na kombinaci rizik spojených s každým jednotlivým nepříznivým účinkem, včetně kumulativních účinků vyvolaných jinými GMO. Toto závěrečné hodnocení by mělo mít podobu souhrnu celkových rizik ze záměrného uvolňování nebo uvádění na trh a měly by zde být uvedeny i celkové nejistoty.
5. ZÁVĚRY O POTENCIÁNÍCH DOPADECH NA ŽIVOTNÍ PROSTŘEDÍ V DŮSLEDKU UVOLNĚNÍ GENETICKY MODIFIKOVANÝCH ORGANISMŮ NEBO UVEDENÍ TĚCHTO ORGANISMŮ NA TRH
Na základě posouzení rizik pro životní prostředí, provedeného podle obecných zásad a metodiky uvedené v oddílech 3 a 4, by měly být do oznámení zařazeny informace o bodech uvedených v oddílech D1 nebo D2 přílohy II směrnice 2001/18/ES s cílem pomoci při vypracování závěrů o potenciálních dopadech na životní prostředí způsobených uvolněním nebo uvedením geneticky modifikovaných organismů na trh.
Další rozvoj, zejména v jiné oblasti, než je oblast rostlin, může poskytnout další pokyny ohledně informací, které se mají uvést do oznámení.
6. PŘEZKOUMÁNÍ A ÚPRAVA
6.1 Přezkoumání a úprava posuzování rizik pro životní prostředí
Na posuzování rizik pro životní prostředí není možné pohlížet jako na neměnnou záležitost. Je nutné jej pravidelně přezkoumávat a aktualizovat a případně měnit, aby se vzaly v úvahu důležité nové údaje (v souladu s články 8 nebo 20 směrnice 2001/18/ES). Všechny revize musí vzít v úvahu účinnost, výkonnost a přesnost posuzování rizik pro životní prostředí a řízení rizik, dále údaje pocházející z výzkumu, jiných záměrných uvolnění a údaje získané při monitorování. To bude také záviset na úrovni nejistoty stanovené na základě posouzení rizik pro životní prostředí.
Na základě těchto přezkoumání se musí posuzování rizik pro životní prostředí a řízení rizik podle potřeby upravit nebo aktualizovat.
6.2 Přezkoumání a úprava pokynů pro posuzování rizik pro životní prostředí
Další rozvoj v oblasti genetických modifikací může vyvolat nutnost přizpůsobit přílohu II a tyto pokyny technickému pokroku. Je možné, že jakmile budou ve Společenství existovat dostatečné zkušenosti s oznamováním uvolňování konkrétních geneticky modifikovaných organismů (příloha III čtvrtý odstavec), dojde k další diferenciaci požadavků na informace o různých typech GMO, jako jsou jednobuněčné organismy, ryby nebo hmyz, nebo o konkrétním použití GMO, jako je vývoj očkovacích látek.
Přezkoumání a úprava pokynů pro posouzení rizik pro životní prostředí zároveň musí vzít v případech potřeby v úvahu nezbytnost jejich přizpůsobení technickému pokroku a nezbytnost vypracovat další pokyny vycházející ze zkušeností – v případech, kdy jsou tyto zkušenosti dostatečné – s uvolňováním určitých geneticky modifikovaných organismů do určitých ekosystémů, v souladu s kritérii uvedenými v příloze V (čl. 7 odst. 1) směrnice a dále ze zkušeností a vědeckých důkazů spojených s ochranou lidského zdraví a životního prostředí při uvedení určitých GMO na trh (čl. 16 odst. 2).
PŘÍLOHA III
INFORMACE VYŽADOVANÉ V OZNÁMENÍ
Oznámení podle části B nebo části C této směrnice musí obsahovat náležité informace, které jsou stanovené v následujících dílčích přílohách.
Ne všechny uvedené body budou v každém případě využity. Očekává se, že se jednotlivá oznámení zaměří jen na určitou podmnožinu hledisek, která bude odpovídat dané situaci.
Podrobnost odpovědí, kterou vyžadují jednotlivé podmnožiny hledisek, se bude pravděpodobně také lišit podle charakteru a měřítka navrhovaného uvolnění.
Budoucí vývoj v oblasti genetických modifikací si možná vyžádá přizpůsobení této přílohy technickému pokroku nebo vypracování prováděcích pokynů k této příloze. K dalšímu rozlišení požadavků na informace o různých druzích geneticky modifikovaných organismů, např. jednobuněčných organismů, ryb nebo hmyzu, nebo zvláštních způsobů využití geneticky modifikovaných organismů, např. při vývoji očkovacích látek, může dojít tehdy, až bude ve Společenství získána dostatečná zkušenost s oznámeními uvolnění určitých geneticky modifikovaných organismů.
Technická dokumentace musí též obsahovat popis použitých metod nebo odkaz na standardní nebo mezinárodně uznané metody, spolu se jménem subjektu nebo subjektů odpovědných za zpracování podkladů.
Příloha III A se vztahuje na uvolňování všech druhů geneticky modifikovaných organismů s výjimkou vyšších rostlin. Příloha III B se vztahuje na geneticky modifikované vyšší rostliny.
Termínem „vyšší rostliny“ se rozumějí rostliny, které náležejí do taxonomické skupiny Spermatophytae (Gymnospermae a Angiospermae).
PŘÍLOHA III A
INFORMACE VYŽADOVANÉ V OZNÁMENÍCH TÝKAJÍCÍCH SE UVOLNĚNÍ GENETICKY MODIFIKOVANÝCH ORGANISMŮ JINÝCH NEŽ VYŠŠÍ ROSTLINY
I. OBECNÉ INFORMACE
A. Název a adresa oznamovatele (společnosti nebo instituce)
B. Jméno, kvalifikace a zkušenost odpovědného vědce nebo vědců
C. Název projektu
II. INFORMACE O GENETICKY MODIFIKOVANÉM ORGANISMU
A. Charakteristiky a) dárce, b) příjemce nebo c) (popřípadě) rodičovského organismu nebo organismů:
1. vědecký název;
2. taxonomie;
3. další názvy (obvyklý název, název kmene atd.);
4. fenotypové a genetické znaky;
5. stupeň příbuznosti mezi dárcem a příjemcem nebo mezi rodičovskými organismy;
6. popis identifikačních a detekčních technik;
7. citlivost, spolehlivost (kvantitativní údaje) a specifické vlastnosti identifikačních a detekčních technik;
8. popis zeměpisného rozložení a přírodního stanoviště organismu, včetně informace o jeho přirozených predátorech, kořistech, parazitech a konkurentech, symbiontech a hostitelích;
9. známé organismy, se kterými probíhá v přírodních podmínkách výměna genetického materiálu;
10. ověření genetické stability organismů a faktory, které tuto stabilitu ovlivňují;
11. patologické, ekologické a fyziologické charakteristiky:
a) klasifikace nebezpečnosti provedená podle stávajících pravidel Společenství týkajících se ochrany lidského zdraví nebo životního prostředí;
b) doba generace v přírodních ekosystémech, pohlavní a nepohlavní reprodukční cyklus;
c) informace týkající se přežívání, včetně závislosti na roční době a schopnosti vytvářet přežívající struktury;
d) patogenicita: infekčnost, toxigenicita, virulence, alergenicita, nosič (vektor) patogenu, možné vektory, oblast hostitelů včetně necílového organismu. Možnost aktivace latentních virů (provirů). Schopnost kolonizace dalších organismů;
e) rezistence vůči antibiotikům a možnost využít tato antibiotika pro profylaktické a terapeutické účely u lidí a domestikovaných organismů;
f) účast v procesech environmentálního charakteru, jako je primární produkce, koloběh živin, rozklad organické hmoty, respirace atd.
12. Charakter původních vektorů:
a) sekvence;
b) četnost mobilizace;
c) specifičnost;
d) přítomnost genů, které způsobují rezistenci.
13. Přehled předchozích genetických modifikací.
B. Charakteristiky vektoru
1. charakter a zdroj vektoru;
2. sekvence transpozonů, vektorů a jiných nekódujících genetických segmentů používaných ke konstrukci geneticky modifikovaného organismu a k zabezpečení funkce zavedeného vektoru a inzertu v geneticky modifikovaném organismu;
3. četnost mobilizace vloženého vektoru nebo schopnosti genového přenosu a metody jejich stanovení;
4. informace o tom, do jaké míry je vektor omezen na DNA potřebnou k uskutečnění plánované funkce.
C. Charakteristiky modifikovaného organismu
1. Informace týkající se genetické modifikace:
a) metody použité k modifikaci;
b) metody použité ke konstrukci a zavedení inzertu (inzertů) do příjemce anebo k odstranění sekvence;
c) popis konstrukce inzertu nebo vektoru;
d) čistota inzertu s ohledem na neznámé sekvence a informace o tom, do jaké míry je vložená sekvence omezena na DNA potřebnou k uskutečnění požadované funkce;
e) metody a kritéria použitá k výběru;
f) sekvence, funkční identita a umístění pozměněných/vložených/odstraněných segmentů nukleové kyseliny, zejména údaje o všech známých škodlivých sekvencích.
2. Informace o výsledném geneticky modifikovaném organismu:
a) popis genetických znaků a fenotypových charakteristik, zejména všech nových znaků a charakteristik, které se mohou projevit nebo se již projevit nemohou;
b) struktura a množství nukleové kyseliny vektoru nebo dárce, která zůstala ve výsledné konstrukci geneticky modifikovaného organismu;
c) stabilita organismu z hlediska genetických znaků;
d) podíl nového genetického materiálu a úroveň exprese. Metoda a citlivost měření;
e) aktivita exprimované bílkoviny nebo bílkovin;
f) popis identifikačních a detekčních technik, včetně technik identifikace a detekce vložených sekvencí a vektorů;
g) citlivost, spolehlivost (kvantifikované údaje) a specifičnost detekčních a identifikačních technik;
h) historie předchozích uvolnění nebo využití geneticky modifikovaného organismu;
i) ochrana zdraví osob, zvířat a rostlin:
i) toxické nebo alergenní účinky geneticky modifikovaných organismů nebo jejich metabolických produktů;
ii) porovnání modifikovaného organismu s dárcem, příjemcem nebo popřípadě s rodičovským organismem z hlediska patogenity;
iii) schopnost kolonizace;
iv) je-li organismus patogenní pro imunokompetentní osoby:
— způsobené choroby a mechanismus patogenity, včetně invazivity a virulence,
— nakažlivost,
— infekční dávka,
— oblast hostitelů, možnost adaptací,
— možnost přežití mimo lidského hostitele,
— přítomnost vektorů nebo prostředků šíření,
— biologická stabilita,
— charakteristiky rezistence vůči antibiotikům,
— alergenicita,
— dostupnost vhodných terapií;
v) další nebezpečí vyplývající z produktu.
III. INFORMACE O PODMÍNKÁCH UVOLNĚNÍ A O PŘIJÍMAJÍCÍM PROSTŘEDÍ
A. Informace o uvolnění
1. popis navrhovaného záměrného uvolnění, včetně jeho účelu nebo účelů a předpokládaných produktů;
2. předpokládaná data a časový rozvrh experimentu, včetně četnosti a doby trvání uvolnění;
3. příprava místa předcházející uvolnění;
4. velikost místa;
5. metody uvolnění, které mají být použity;
6. množství geneticky modifikovaného organismu, které má být uvolněno;
7. rušivé vlivy v místě (druh a způsob kultivace, těžba, závlahy nebo jiné činnosti);
8. opatření přijatá k ochraně pracovníků během uvolňování;
9. ošetření místa po uvolnění;
10. předpokládané techniky odstranění nebo inaktivace geneticky modifikovaných organismů na konci experimentu;
11. informace o předešlých uvolněních geneticky modifikovaných organismů a o výsledcích těchto uvolnění, především z hlediska různých rozsahů uvolnění a uvolnění do různých ekosystémů.
B. Informace o životním prostředí (v místě uvolnění i v širším okolí)
1. zeměpisná poloha a souřadnice místa nebo míst (v případě oznámení podle části C budou místem nebo místy uvolnění předpokládané oblasti využití produktu);
2. fyzická nebo biologická blízkost k člověku nebo k jiným významným biotům;
3. blízkost k významným stanovištím, chráněným územím nebo nádržím na dodávku pitné vody;
4. klimatické charakteristiky regionu nebo regionů, které by mohly být uvolněním zasaženy;
5. zeměpisné, geologické a pedologické charakteristiky;
6. rostliny a živočichové, včetně užitkových rostlin a užitkových zvířat a stěhovavých druhů;
7. popis cílových a necílových ekosystémů, které mohou být uvolněním zasaženy;
8. porovnání přirozeného stanoviště přijímajícího organismu s navrhovaným místem nebo místy uvolnění;
9. všechny známé plánované rozvojové akce nebo změny ve využití území v regionu, které mohou ovlivnit dopad uvolnění na životní prostředí.
IV. INFORMACE O INTERAKCÍCH MEZI GENETICKY MODIFIKOVANÝMI ORGANISMY A ŽIVOTNÍM PROSTŘEDÍM
A. Charakteristiky, které ovlivňují přežití, reprodukci a rozšiřování
1. biologické faktory, které ovlivňují přežití, reprodukci a rozšiřování;
2. známé nebo předpovídané podmínky životního prostředí, které mohou ovlivnit přežití, reprodukci nebo rozšiřování (vítr, voda, půda, teplota, pH atd.);
3. citlivost vůči specifickým činidlům.
B. Interakce s prostředím
1. předpovídané stanoviště geneticky modifikovaných organismů;
2. studie chování a charakteristik geneticky modifikovaných organismů a dopadu těchto organismů na životní prostředí, provedené v simulovaném přírodním prostředí, např. v mikrokosmech, kultivátorech, ve sklenících;
3. schopnost genetického přenosu po uvolnění:
a) přenos genetického materiálu z geneticky modifikovaných organismů do organismů v zasaženém ekosystému;
b) přenos genetického materiálu z původních organismů do geneticky modifikovaných organismů;
4. pravděpodobnost, že po uvolnění dojde k selekci, v jejímž důsledku se projeví neočekávané nebo nežádoucí genetické znaky geneticky modifikovaného organismu;
5. popis genetických znaků, které mohou bránit rozptylu genetického materiálu nebo ho minimalizovat. Metody zajištění a verifikace genetické stability;
6. dráhy biologického šíření, známé nebo možné způsoby interakce s přenašeči, včetně vdechnutí, požití, povrchového kontaktu, zavrtání do pokožky atd.;
7. popis ekosystémů, do kterých se mohou geneticky modifikované organismy rozšířit;
8. možnost nadměrného růstu populace v daném prostředí;
9. konkurenční výhody geneticky modifikovaných organismů v porovnání s nemodifikovaným přijímajícími nebo rodičovskými organismy;
10. identifikace a popis cílových organismů v případě jejich existence;
11. předpokládané mechanismy a výsledek interakce mezi geneticky modifikovanými organismy a cílovým organismem, pokud existuje;
12. identifikace a popis necílových organismů, které mohou být nepříznivě ovlivněny uvolněním geneticky modifikovaných organismů, a předpokládané mechanismy veškerých identifikovaných nepříznivých interakcí;
13. pravděpodobnost posunu v biologických interakcích nebo v oblasti hostitelů v době po uvolnění;
14. známé nebo předpovídané interakce s necílovými organismy v prostředí, včetně konkurentů, kořistí, hostitelů, symbiontů, predátorů, parazitů a patogenů;
15. známé nebo předpovídané začlenění do biogeochemických procesů;
16. další možné interakce s prostředím.
V. INFORMACE TÝKAJÍCÍ SE MONITOROVÁNÍ, KONTROL, NAKLÁDÁNÍ S ODPADEM A PLÁNŮ PRO ŘEŠENÍ MIMOŘÁDNÝCH SITUACÍ
A. Techniky monitorování
1. metody sledování geneticky modifikovaných organismů a metody monitorování účinků geneticky modifikovaných organismů;
2. specifičnost (slouží k identifikaci geneticky modifikovaných organismů a k jejich odlišení od dárce, příjemce, popřípadě od rodičovského organismu), citlivost a spolehlivost monitorovacích technik;
3. techniky k detekci přenosu darovaného genetického materiálu do jiných organismů;
4. trvání a četnost monitorování.
B. Kontrola uvolnění
1. metody a postupy předcházení nebo minimalizace rozšíření geneticky modifikovaných organismů za rámec místa uvolnění nebo oblasti určené pro využití;
2. metody a postupy k ochraně místa před vniknutím neoprávněných jedinců;
3. metody a postupy, pomocí nichž je možno zabránit vniknutí jiných organismů do místa uvolnění.
C. Nakládání s odpady
1. druh vznikajícího odpadu;
2. očekávané množství odpadu;
3. popis předpokládaného nakládání s odpady.
D. Plány pro řešení mimořádných situací
1. metody a postupy získání dostatečné kontroly nad geneticky modifikovanými organismy v případě jejich neočekávaného rozšíření;
2. metody dekontaminace zasažených oblastí, např. vyhubení geneticky modifikovaných organismů;
3. metody odstranění nebo asanace rostlin, zvířat, půdy atd., které byly vystaveny nepříznivým účinkům během neočekávaného úniku nebo po něm;
4. metody izolace oblasti zasažené během neočekávaného úniku;
5. plány na ochranu lidského zdraví a životního prostředí pro případ vzniku nežádoucího účinku.
PŘÍLOHA III B
INFORMACE VYŽADOVANÉ V OZNÁMENÍCH TÝKAJÍCÍCH SE UVOLNĚNÍ GENETICKY MODIFIKOVANÝCH VYŠŠÍCH ROSTLIN (GYMNOSPERMAE A ANGIOSPERMAE)
A. OBECNÉ INFORMACE
1. Název a adresa oznamovatele (společnosti nebo instituce).
2. Jméno, kvalifikace a zkušenost odpovědného vědce nebo vědce vědců.
3. Název projektu.
B. INFORMACE TÝKAJÍCÍ SE A) PŘÍJEMCE NEBO (POPŘÍPADĚ) B) RODIČOVSKÝCH ROSTLIN
1. Úplný název:
a) čeleď;
b) rod;
c) druh;
d) poddruh;
e) kultivar/šlechtitelská linie;
f) obecné jméno.
a) Informace týkající se reprodukce:
i) způsob nebo způsoby reprodukce;
ii) specifické faktory ovlivňující reprodukci, pokud existují;
iii) generační doba.
b) Pohlavní kompatibilita s dalšími pěstovanými nebo volně žijícími druhy rostlin, včetně rozšíření kompatibilních druhů na území Evropy.
3. Schopnost přežití:
a) schopnost vytvářet struktury pro přežití nebo dormanci;
b) specifické faktory ovlivňující schopnost přežití, pokud existují.
4. Šíření:
a) způsoby šíření a rozsah rozšíření (např. odhad, jak se vzdáleností klesá životaschopnost pylu a semen);
b) specifické faktory ovlivňující šíření, pokud existují.
5. Geografické rozšíření rostliny.
6. V případě rostlinného druhu, který není v členském státě nebo státech běžně pěstován, popis přirozeného stanoviště rostliny, včetně informace o přirozených predátorech, parazitech, konkurentech a symbiontech.
7. Další možné interakce rostliny související s její genetickou modifikací, s organismy v ekosystému, v němž je obvykle pěstována, nebo jinde, včetně informací o toxických účincích na lidi, zvířata a ostatní organismy.
C. INFORMACE O GENETICKÉ MODIFIKACI
1. Popis metod použitých pro genetickou modifikaci.
2. Charakter a zdroj použitého vektoru.
3. Velikost, zdroj (název) dárcovského organismu nebo organismů a plánovaná funkce každé jednotlivé části úseku, do něhož má být vnesení provedeno.
D. INFORMACE O GENETICKY MODIFIKOVANÉ ROSTLINĚ
1. Popis znaku nebo znaků a charakteristik, které byly zavedeny nebo modifikovány.
2. Informace o aktuálně vložených/odstraněných sekvencích:
a) velikost a struktura inzertu a metody použité pro jeho charakterizaci, včetně informací o všech částech vektoru zavedeného do geneticky modifikované vyšší rostliny nebo o jakémkoli nosiči nebo cizí DNA zbývajících v geneticky modifikované vyšší rostlině;
b) v případě odstranění velikost a funkce odstraněného úseku nebo úseků;
c) počet kopií inzertu;
d) umístění inzertu nebo inzertů v rostlinných buňkách (integrován do chromozomů, chloroplastů, mitochondrií nebo v neintegrované podobě) a metody jejich určení.
3. Informace o projevu inzertu:
a) informace o vývoji exprese inzertu během životního cyklu rostliny a metody použité pro charakterizaci vývoje;
b) části rostlin, v nichž dochází k expresi inzertu (např. kořeny, stonek, pyl atd.).
4. Informace o rozdílech mezi geneticky modifikovanou a přijímající rostlinou:
a) ve způsobu či způsobech nebo rychlosti reprodukce;
b) v rozšiřování;
c) ve schopnosti přežití.
5. Genetická stabilita inzertu a fenotypová stabilita geneticky modifikované vyšší rostliny.
6. Jakákoli změna ve schopnosti geneticky modifikované vyšší rostliny přenášet genetický materiál do jiných organismů.
7. Informace o jakémkoli toxickém, alergenním nebo jiném škodlivém účinku na lidské zdraví vyplývajícím z genetické modifikace.
8. Informace týkající se bezpečnosti geneticky modifikované vyšší rostliny pro zdraví zvířat, především pokud jde o jakékoli toxické, alergenní nebo jiné škodlivé účinky vyplývající z genetické modifikace, je-li geneticky modifikovaná vyšší rostlina určena jako krmivo.
9. Mechanismus interakce mezi geneticky modifikovanou rostlinou a cílovým organismem (je-li taková interakce možná).
10. Možné změny v interakcích mezi geneticky modifikovanými vyššími rostlinami a necílovým organismem, které vyplývají z genetické modifikace.
11. Možné interakce s abiotickým prostředím.
12. Popis detekčních a identifikačních technik používaných pro geneticky modifikovanou rostlinu.
13. Informace o předchozích uvolněních geneticky modifikované rostliny v případě, že k takovým uvolněním došlo.
E. INFORMACE O MÍSTĚ UVOLNĚNÍ (POUZE PRO OZNÁMENÍ PŘEDKLÁDANÉ PODLE ČLÁNKŮ 6 A 7)
1. Umístění a velikost místa nebo míst uvolnění.
2. Popis ekosystému v místě uvolnění, včetně klimatu, rostlin a živočichů.
3. Přítomnost pohlavně kompatibilních volně žijících příbuzných nebo pěstovaných rostlinných druhů.
4. Blízkost úředně uznaných stanovišť nebo chráněných oblastí, které by mohly být zasaženy.
F. INFORMACE O UVOLNĚNÍ (JEN PRO OZNÁMENÍ PŘEDKLÁDANÉ PODLE ČLÁNKŮ 6 A 7)
1. Účel uvolnění.
2. Předpokládané datum či data a trvání uvolnění.
3. Metoda, pomocí níž budou geneticky modifikované rostliny uvolněny.
4. Metoda pro přípravu místa uvolnění a nakládání s ním před uvolněním, v průběhu uvolnění a po uvolnění, včetně metod pěstování a sklizně.
5. Přibližný počet rostlin (nebo počet rostlin na m2 ).
G. INFORMACE O PLÁNECH KONTROLY, MONITOROVÁNÍ, NÁSLEDNÉ PÉČE PO UVOLNĚNÍ A NAKLÁDÁNÍ S ODPADY (JEN PRO OZNÁMENÍ PŘEDKLÁDANÉ PODLE ČLÁNKŮ 6 A 7)
1. Uplatněná opatření předběžné opatrnosti:
a) vzdálenost nebo vzdálenosti od pohlavně kompatibilních rostlinných druhů, jak volně žijících, tak užitkových;
b) všechna opatření k minimalizaci/předcházení rozšíření jakéhokoli reprodukčního orgánu geneticky modifikované vyšší rostliny (např. pylu, semen, hlíz).
2. Popis metod pro ošetření místa po uvolnění.
3. Popis metod pro nakládání s geneticky modifikovaným rostlinným materiálem po skončení uvolnění, včetně nakládání s odpady.
4. Popis plánů monitorování a monitorovacích technik.
5. Popis všech plánů pro řešení mimořádných situací.
6. Metody a postupy k ochraně místa uvolnění.
PŘÍLOHA IV
DOPLŇKOVÉ INFORMACE
V této příloze jsou obecně popsány doplňkové informace, které musí být poskytnuty v případě oznámení o uvádění geneticky modifikovaných organismů nebo produktů s jejich obsahem na trh, a informace, které jsou vyžadovány pro označování geneticky modifikovaných organismů nebo produktů s jejich obsahem při jejich uvádění na trh, a též pro označování geneticky modifikovaných organismů, jimž je udělena výjimka podle čl. 2 odst. 4 druhého pododstavce. Příloha bude doplněna prováděcími pokyny, které budou vypracovány postupem podle čl. 30 odst. 2 a budou se kromě jiného týkat způsobu popisu zamýšleného využití produktu. Označení vyjmutých organismů musí podle článku 26 obsahovat příslušné doporučení nebo omezení užívání.
A. Následující informace musí být současně s informacemi podle přílohy III uvedeny v oznámení týkajícím se uvedení geneticky modifikovaných organismů nebo produktů s jejich obsahem na trh:
1. navrhované obchodní názvy produktů a názvy geneticky modifikovaných organismů v nich obsažených a jakákoli specifická identifikace, jméno nebo kód, který oznamovatel užívá k identifikaci geneticky modifikovaného organismu. Po udělení souhlasu by jakékoli nové obchodní jméno mělo být poskytnuto příslušnému orgánu;
2. jméno a úplná adresa osoby usazené ve Společenství (výrobce, dovozce nebo distributora), která je odpovědná za uvedení na trh;
3. jméno a úplná adresa dodavatele nebo dodavatelů kontrolních vzorků;
4. popis zamýšleného využití produktu, geneticky modifikovaného organismu nebo geneticky modifikovaného organismu obsaženého v produktu. Měly by být zdůrazněny rozdíly ve využití geneticky modifikovaných organismů nebo nakládání s nimi ve srovnání s obdobnými geneticky nemodifikovanými produkty;
5. popis zeměpisné oblasti nebo oblastí a typů prostředí, ve kterých má v rámci Společenství dojít k zamýšlenému využití produktu, popřípadě včetně odhadu míry využití v každé z oblastí;
6. plánované kategorie uživatelů produktu, např. průmysl, zemědělství a specializovaný prodej, spotřebitelské využití veřejností ve velkém;
7. informace o genetické modifikaci, které je možno využít pro účely jejich vložení do jednoho nebo více registrů modifikací v organismech a které mohou sloužit k detekci a identifikaci určitých produktů geneticky modifikovaných organismů při kontrole a inspekci po uvedení na trh. Tyto informace by se ve vhodných případech měly týkat i uložení vzorků geneticky modifikovaného organismu nebo jeho genetického materiálu u příslušného orgánu a podrobností o sekvencích nukleotidů nebo jiné skutečnosti, která je nezbytná pro identifikaci produktu geneticky modifikovaného organismu a jeho potomstva, např. metody detekce a identifikace produktu geneticky modifikovaného organismu, včetně experimentálních údajů charakteristických pro použitou metodiku. Informace, která je důvěrná a již nelze z tohoto důvodu umístit do veřejně přístupné části registru, by měla být jako taková identifikována;
8. navrhované označení na štítku nebo v průvodním dokumentu. Zde musí být uvedeny, alespoň v souhrnné formě, obchodní název produktu, prohlášení, že „Tento produkt obsahuje geneticky modifikované organismy“, název geneticky modifikovaného organismu a informace podle bodu 2; z označení by též mělo být zřejmé, jak se lze dostat k informacím, které jsou uloženy ve veřejně přístupné části registru.
B. V oznámení by podle náležitosti měly být vedle informací podle bodu A uvedeny v souladu s článkem 13 této směrnice ještě tyto informace:
1. opatření, která je nutno přijmout v případě neúmyslného uvolnění nebo nesprávného použití;
2. specifické instrukce nebo doporučení pro skladování a nakládání;
3. specifické instrukce pro provádění monitorování a podávání zpráv oznamovateli a pokud to vyžaduje, i příslušnému orgánu, aby příslušné orgány mohly být v případě nepříznivého účinku účinně informovány. Tyto instrukce by měly být v souladu s částí C přílohy VII;
4. návrh omezení schváleného užívání geneticky modifikovaného organismu, např. údaj o tom, kde může být produkt použit a k jakým účelům;
5. návrh obalu;
6. odhad objemu produkce nebo dovozů do Společenství;
7. návrh doplňkového označení. To může obsahovat, alespoň v souhrnné podobě, informace uvedené v bodech A.4, A.5, B.1, B.2, B.3 a B.4.
PŘÍLOHA V
KRITÉRIA PRO UPLATNĚNÍ ODLIŠNÝCH POSTUPŮ (ČLÁNEK 7)
Kritéria podle čl. 7. odst. 1 jsou uvedena níže.
1. Musí být velmi dobře známo taxonomické zařazení a biologické charakteristiky (např. způsob reprodukce a opylování, schopnost křížení s příbuznými druhy, patogenicita) nemodifikovaného (přijímajícího) organismu.
2. Musí být známý dostatek údajů o bezpečnosti organismu příjemce a popřípadě rodičovského organismu pro lidské zdraví a životní prostředí v tom prostředí, do kterého má být geneticky modifikovaný organismus uvolněn.
3. Především z hlediska hodnocení rizik pro životní prostředí musí být dostupné veškeré informace o interakcích mezi příjemcem a popřípadě rodičovským organismem a dalšími organismy, které byly získány během uvolnění do experimentálního ekosystému.
4. Musí být dostupné informace, z nichž lze usoudit, že charakterizace vloženého materiálu je dostatečná. Musí být dostupné informace o konstrukci všech vektorových systémů a sekvencí genetického materiálu, který byl s nosičem DNA použit. Jestliže genetická modifikace zahrnuje odstranění genetického materiálu, musí být znám rozsah odstranění. Genetická modifikace musí být dostatečně popsána, aby bylo možné během uvolnění zjistit totožnost geneticky modifikovaného organismu a jeho potomstva.
5. Geneticky modifikovaný organismus nesmí za podmínek experimentálního uvolnění vykázat dodatečná nebo vyšší rizika pro lidské zdraví a životní prostředí, než vykazuje odpovídající organismus příjemce, popřípadě rodičovský organismus. Schopnost rozšíření geneticky modifikovaného organismu do prostředí nebo průniku do dalších ekosystémů a schopnost přenosu genetického materiálu do jiných organismů v prostředí experimentálního uvolnění nesmí vyústit v nepříznivé účinky.
PŘÍLOHA VI
POKYNY PRO VYPRACOVÁNÍ HODNOTÍCÍ ZPRÁVY
Hodnotící zpráva podle článků 13, 17, 19 A 20 by měla obsahovat především tyto body:
1. Identifikaci charakteristik přijímajícího organismu, které jsou pro hodnocení daného geneticky modifikovaného organismu nebo organismů podstatné. Identifikaci jakýchkoli známých rizik pro lidské zdraví a životní prostředí vyplývajících z uvolnění do prostředí přijímajícího nemodifikovaného organismu.
2. Popis výsledku genetické modifikace v modifikovaném organismu.
3. Hodnocení toho, zda genetická modifikace je pro účely vyhodnocení rizika pro lidské zdraví a životní prostředí charakterizována dostatečně.
4. Identifikaci jakýchkoli nových rizik pro lidské zdraví a životní prostředí, jež mohou vyplynout z uvolnění daného geneticky modifikovaného organismu nebo organismů ve srovnání s uvolněním odpovídajícího nemodifikovaného organismu nebo organismů, která je založena na hodnocení rizik pro životní prostředí provedeného v souladu s přílohou II.
5. Závěr o tom, zda daný geneticky modifikovaný organismus či organismy nebo produkt či produkty mohou být uvedeny na trh a za jakých podmínek, zda dané geneticky modifikované organismy nesmějí být uvedeny na trh nebo zda jsou zapotřebí posudky dalších příslušných orgánů a Komise k určitým specifickým bodům hodnocení rizik pro životní prostředí. Příslušná hlediska je nutno specifikovat. Závěr by měl obsahovat jasné vyjádření k navrhovanému využití, k řízení rizik a k navrhovanému plánu monitorování. V případě, že dané geneticky modifikované organismy nesmějí být uvedeny na trh, musí závěr obsahovat důvody příslušných orgánů pro toto rozhodnutí.
PŘÍLOHA VII
PLÁN MONITOROVÁNÍ
V této příloze je obecně popsán cíl, jehož má být dosaženo, a obecné zásady, kterých je nutno se přidržet při zpracování plánu monitorování podle čl. 13 odst. 2, čl. 19 odst. 3 a článku 20. Příloha bude doplněna prováděcími pokyny postupem podle čl. 30 odst. 2.
Zmíněné prováděcí pokyny se dokončí do 17. října 2002.
A. Cíl
Cílem plánu monitorování je:
— potvrdit, že předpoklady týkající se výskytu a dopadu možných nepříznivých účinků geneticky modifikovaného organismu nebo jeho využití uvedené v hodnocení rizik pro životní prostředí jsou správné, a
— identifikovat nepříznivé účinky geneticky modifikovaného organismu a jeho použití na lidské zdraví a životní prostředí, které nebyly hodnocením rizik pro životní prostředí předvídány.
B. Obecné zásady
Monitorování podle článků 13, 19 a 20 začíná po udělení souhlasu k uvedení geneticky modifikovaného organismu na trh.
Interpretace údajů, které jsou v rámci monitorování shromážděny, by měla být prováděna s ohledem na další činnosti a podmínky prostředí. Jsou-li pozorovány změny prostředí, mělo by proběhnout další hodnocení, které stanoví, zda jsou tyto změny důsledkem geneticky modifikovaného organismu nebo jeho používání, neboť takové změny mohou být výsledkem působení jiných environmentálních faktorů, nikoli uvedení geneticky modifikovaného organismu na trh.
Zkušenosti a údaje shromážděné prostřednictvím monitorování experimentálních uvolnění geneticky modifikovaných organismů mohou pomoci při přípravě režimu monitorování po uvedení na trh, který je při uvádění geneticky modifikovaných organismů a produktů s jejich obsahem na trh vyžadován.
C. Plán monitorování
Plán monitorování by měl:
1. být dostatečně podrobný, s možností reagovat na zvláštnosti jednotlivých případů a vycházet z hodnocení rizik pro životní prostředí;
2. brát v úvahu charakteristiky geneticky modifikovaného organismu, charakteristiky a měřítko jeho plánovaného využití a soubor příslušných charakteristik prostředí, do něhož má být geneticky modifikovaný organismus uvolněn;
3. v obecných rysech zahrnout i nepředvídané nepříznivé účinky a je-li to nutné, umožnit (případ od případu) specifické monitorování zaměřené na nepříznivé účinky, které hodnocení rizik pro životní prostředí identifikovalo:
3.1 proto by mělo být specifické, danému případu odpovídající monitorování prováděno po dostatečně dlouhou dobu, aby mohly být zjištěny nejen okamžité a přímé, ale popřípadě i opožděné a nepřímé účinky, které hodnocení rizik pro životní prostředí identifikovalo;
3.2 proto by k monitorování měly být popřípadě využity stávající rutinní postupy, např. postupy monitorování zemědělských odrůd, ochrany rostlin nebo produktů užívaných v lékařství či zvěrolékařství. Mělo by být připojeno vysvětlení, jakým způsobem z těchto rutinních postupů získá držitel souhlasu odpovídající informace;
4. umožnit systematická pozorování uvolňování geneticky modifikovaného organismu do přijímajícího prostředí a interpretaci těchto pozorování z hlediska bezpečnosti pro lidské zdraví a životní prostředí;
5. určit, kdo (oznamovatel, uživatel) bude provádět různé úkoly, které plán monitorování vyžaduje, kdo bude odpovědný za zavedení plánu a za jeho správné provádění a kdo zajistí, že příslušné orgány a držitel souhlasu obdrží informaci o jakémkoli nepříznivém účinku na lidské zdraví a životní prostředí. (je nutno též stanovit doby pozorování a intervaly, v nichž budou sestavovány zprávy o výsledcích monitorování);
6. věnovat pozornost mechanismům umožňujícím identifikaci a potvrzení všech pozorovaných nepříznivých účinků na lidské zdraví a životní prostředí a umožnit držiteli souhlasu a popřípadě příslušnému orgánu přijmout opatření nezbytná k ochraně lidského zdraví a životního prostředí.
PŘÍLOHA VIII
SROVNÁVACÍ TABULKA
|
Směrnice 90/220/EHS |
Tato směrnice |
||
|
Čl. 1 odst. 1 |
Článek 1 |
||
|
Čl. 1 odst. 2 |
Čl. 3 odst. 2 |
||
|
Článek 2 |
Článek 2 |
||
|
Článek 3 |
Čl. 3 odst. 1 |
||
|
Článek 4 |
Článek 4 |
||
|
— |
Článek 5 |
||
|
Článek 5 |
|
||
|
Čl. 6 odst. 1 až 4 |
|||
|
Čl. 6 odst. 5 |
Článek 7 |
||
|
Čl. 6 odst. 6 |
Článek 8 |
||
|
Článek 7 |
Článek 9 |
||
|
Článek 8 |
Článek 10 |
||
|
Článek 9 |
Článek 11 |
||
|
Čl. 10 odst. 2 |
Článek 12 |
||
|
Článek 11 |
Článek 13 |
||
|
Čl. 12 odst. 1 až 3 a 5 |
Článek 14 |
||
|
Čl. 13 odst. 2 |
Čl. 15 odst. 3 |
||
|
— |
Čl. 15 odst. 1, 2 a 4 |
||
|
— |
Článek 16 |
||
|
— |
Článek 17 |
||
|
Čl. 13 odst. 3 až 4 |
Článek 18 |
||
|
Čl. 13 odst. 5 a 6 |
Čl. 19 odst. 1 a 4 |
||
|
Čl. 12 odst. 4 |
Čl. 20 odst. 3 |
||
|
Článek 14 |
Článek 21 |
||
|
Článek 15 |
Článek 22 |
||
|
Článek 16 |
Článek 23 |
||
|
— |
Čl. 24 odst. 1 |
||
|
Článek 17 |
Čl. 24 odst. 2 |
||
|
Článek 19 |
Článek 25 |
||
|
— |
Článek 26 |
||
|
Článek 20 |
Článek 27 |
||
|
— |
Článek 28 |
||
|
— |
Článek 29 |
||
|
Článek 21 |
Článek 30 |
||
|
Článek 22 |
Čl. 31 odst. 1, 4 a 5 |
||
|
Čl. 18 odst. 2 |
Čl. 31 odst. 6 |
||
|
Čl. 18 odst. 3 |
Čl. 31 odst. 7 |
||
|
— |
Článek 32 |
||
|
— |
Článek 33 |
||
|
Článek 23 |
Článek 34 |
||
|
— |
Článek 35 |
||
|
— |
Článek 36 |
||
|
— |
Článek 37 |
||
|
Článek 24 |
Článek 38 |
||
|
Příloha I A |
Příloha I A |
||
|
Příloha I B |
Příloha I B |
||
|
— |
Příloha II |
||
|
Příloha II |
Příloha III |
||
|
Příloha II A |
Příloha III A |
||
|
Příloha II B |
Příloha III B |
||
|
Příloha III |
Příloha IV |
||
|
— |
Příloha V |
||
|
— |
Příloha VI |
||
|
— |
Příloha VII |
( 1 ) Úř. věst. C 139, 4.5.1998, s. 1.
( 2 ) Úř. věst. C 407, 28.12.1998, s. 1.
( 3 ) Stanovisko Evropského parlamentu ze dne 11. února 1999 (Úř. věst. C 150, 28.5.1999, s. 363), Společný postoj Rady ze dne 9. prosince 1999 (Úř. věst. C 64, 6.3.2000, s. 1) a rozhodnutí Evropského parlamentu ze dne 12. dubna 2000 (Úř. věst. C 40, 7.2.2001, s. 123), rozhodnutí Evropského parlamentu ze dne 14. února 2001 a rozhodnutí Rady ze dne 15. února 2001.
( 4 ) Úř. věst. L 117, 8.5.1990, s 15. Směrnice naposledy pozměněná směrnicí Komise 97/35/ES (Úř. věst. L 169, 27.6.1997, s. 72).
( 5 ) Úř. věst L 230, 19.8.1991, s. 1. Směrnice naposledy změněná směrnicí Komise 1999/80/ES (Úř. věst. L 210, 10.8.1999, s. 13).
( 6 ) Úř. věst. L 214, 24.8.1993, s. 1. Nařízení pozměněné nařízením Komise (ES) č. 649/98 (Úř. věst. 88, 24.3.1998, s. 7).
( 7 ) Úř. věst. L 237, 28.8.1997, s. 18.
( 8 ) Úř. věst. L 184, 17.7.1999, s. 23.
( 9 ) Úř. věst. L 117, 8.5.1990, s. 1. Směrnice naposledy pozměněná směrnicí 98/81/ES (Úř. věst. L 330, 5.12.1998, s. 13).
( 10 ) Úř. věst. L 292, 12.11.1994, s. 31.
( 11 ) Úř. věst. L 268, 18.10.2003, s. 1.
( 12 ) Směrnice Rady 70/457/EHS ze dne 29. září 1970 o Společném katalogu odrůd druhů zemědělských rostlin (Úř. věst. L 225, 12.10.1970, s. 1). Směrnice naposledy pozměněná směrnicí 98/96/ES (Úř. věst. L 25, 1.2.1999, s. 27).
( 13 ) Směrnice Rady 70/458/EHS ze dne 29. září 1970 o uvádění osiva zeleniny na trh (Úř. věst. L 225, 12.10.1970, s. 7). Směrnice naposledy pozměněná směrnicí 98/96/ES.
( 14 ) Směrnice Rady 1999/105/ES ze dne 22. prosince 1999 o uvádění reprodukčního materiálu lesních dřevin na trh (Úř. věst. L 11, 15.1.2000, s. 17).
( 15 ) Text psaný kurzívou je převzat přímo ze směrnice 2001/18/ES.
