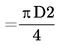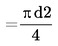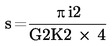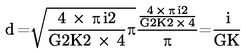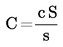EUR-Lex Access to European Union law

This document is an excerpt from the EUR-Lex website
Document 31998L0057
Council Directive 98/57/EC of 20 July 1998 on the control of Ralstonia solanacearum (Smith) Yabuuchi et al.
Directiva 98/57/CE a Consiliului din 20 iulie 1998 privind controlul Ralstonia solanacearum (Smith) Yabuuchi et al.
Directiva 98/57/CE a Consiliului din 20 iulie 1998 privind controlul Ralstonia solanacearum (Smith) Yabuuchi et al.
OJ L 235, 21.8.1998, p. 1–39
(ES, DA, DE, EL, EN, FR, IT, NL, PT, FI, SV)
Special edition in Czech: Chapter 03 Volume 023 P. 375 - 413
Special edition in Estonian: Chapter 03 Volume 023 P. 375 - 413
Special edition in Latvian: Chapter 03 Volume 023 P. 375 - 413
Special edition in Lithuanian: Chapter 03 Volume 023 P. 375 - 413
Special edition in Hungarian Chapter 03 Volume 023 P. 375 - 413
Special edition in Maltese: Chapter 03 Volume 023 P. 375 - 413
Special edition in Polish: Chapter 03 Volume 023 P. 375 - 413
Special edition in Slovak: Chapter 03 Volume 023 P. 375 - 413
Special edition in Slovene: Chapter 03 Volume 023 P. 375 - 413
Special edition in Bulgarian: Chapter 03 Volume 025 P. 119 - 157
Special edition in Romanian: Chapter 03 Volume 025 P. 119 - 157
Special edition in Croatian: Chapter 03 Volume 002 P. 84 - 122
 No longer in force, Date of end of validity: 31/12/2021; abrogat prin 32016R2031
No longer in force, Date of end of validity: 31/12/2021; abrogat prin 32016R2031
- Date of document:
- 20/07/1998
- Date of effect:
- 21/08/1998; intrare în vigoare data publicării a se vedea articolul 13
- Date of transposition:
- 21/08/1999; a se vedea articolul 12
- Date of end of validity:
- 31/12/2021; abrogat prin 32016R2031
- Author:
- Consiliul Uniunii Europene
- Responsible body:
- Directorate-General for Agriculture and Rural Development, Directorate-General for Health and Food Safety, DG06/B/03
- Form:
- Directivă
- Addressee:
- Cele cincisprezece state membre: Belgia, Danemarca, Germania, Irlanda, Grecia, Spania, Franţa, Italia, Luxemburg, Ţările de Jos, Austria, Portugalia, Finlanda, Suedia, Regatul Unit
- Additional information:
- CNS 92025
- Authentic language:
- spaniolă, daneză, germană, greacă, engleză, franceză, italiană, neerlandeză, portugheză, finlandeză, suedeză
- Procedure number:
- Link
- European Parliament - Legislative observatory
- Treaty:
- Tratatul de instituire a Comunităţii Europene
- Legal basis:
- Proposal:
- Link
- Select all documents based on this document
- Link
- Link
- Select all documents mentioning this document No data available in the table
- Modified by:
-
Relation Act Comment Subdivision concerned From To Corrected by 31998L0057R(01) Modified by 32006L0063 înlocuire anexă 5 30/07/2006 Modified by 32006L0063 înlocuire anexă 3 30/07/2006 Modified by 32006L0063 înlocuire anexă 4 30/07/2006 Modified by 32006L0063 înlocuire anexă 2 30/07/2006 Modified by 32006L0063 înlocuire anexă 7 30/07/2006 Modified by 32006L0063 înlocuire anexă 6 30/07/2006 Repealed by 32016R2031 01/01/2022 - Subsequent related instruments:
-
- Amendment proposed by 52013PC0267 abrogare
- Instruments cited:
- Link
- EUROVOC descriptor:
- Subject matter:
- Directory code:
|
03/Volumul 25 |
RO |
Jurnalul Ofícial al Uniunii Europene |
119 |
31998L0057
|
L 235/1 |
JURNALUL OFÍCIAL AL UNIUNII EUROPENE |
DIRECTIVA 98/57/CE A CONSILIULUI
din 20 iulie 1998
privind controlul Ralstonia solanacearum (Smith) Yabuuchi et al.
CONSILIUL UNIUNII EUROPENE,
având în vedere Tratatul de instituire a Comunității Europene, în special articolul 43,
având în vedere propunerea Comisiei (1),
având în vedere avizul Parlamentului European (2),
având în vedere avizul Comitetului Economic și Social (3),
întrucât organismul dăunător Ralstonia solanacearum (Smith) Yabuuchi et al. a fost cunoscut până acum sub denumirea de Pseudomonas solanacearum (Smith) Smith; întrucât este posibil ca Ralstonia solanacearum (Smith) Yabuuchi et al. să devină denumirea general acceptată pentru organism; întrucât prezenta directivă ar trebui să ia în calcul această evoluție științifică;
întrucât producția de cartofi și tomate ocupă un loc important în agricultura Comunității; întrucât randamentul cartofilor și tomatelor este amenințat constant de organisme dăunătoare;
întrucât prin protejarea culturilor de cartofi și tomate împotriva acestor organisme dăunătoare nu numai că s-ar menține capacitatea productivă, dar ar crește și productivitatea agricolă;
întrucât măsurile de protecție împotriva introducerii de organisme dăunătoare pe teritoriul unui stat membru ar avea doar un efect limitat dacă aceste organisme nu ar fi controlate simultan și metodic în toată Comunitatea și nu ar fi împiedicate să se răspândească;
întrucât unul dintre organismele dăunătoare pentru cartofi și tomate este Ralstonia solanacearum (Smith) Yabuuchi et al., agentul patogen al putregaiului brun al cartofului și al ofilirii bacteriene la cartofi și tomate; întrucât în unele părți ale Comunității au avut loc izbucniri ale maladiei cauzate de acest agent patogen și că mai există unele surse limitate de infecție;
întrucât există un risc considerabil pentru culturile de cartofi și tomate din Comunitate dacă nu sunt luate măsuri eficiente, în cazul acestor culturi, de localizare a acestui organism și de determinare a distribuției sale, pentru a preveni apariția și răspândirea sa și, dacă este găsit, pentru a preveni răspândirea sa și pentru a-l controla în scopul eradicării;
întrucât, pentru a asigura aceasta, trebuie luate anumite măsuri în cadrul Comunității; întrucât statele membre trebuie, în plus, să poată lua măsuri suplimentare sau mai stricte dacă este necesar, cu condiția să nu existe bariere la circulația cartofilor și tomatelor în cadrul Comunității, cu excepția celor stabilite în Directiva 77/93/CEE a Consiliului din 21 decembrie 1976 privind măsurile de protecție împotriva introducerii în Comunitate a organismelor dăunătoare plantelor sau produselor din plante și împotriva răspândirii lor în Comunitate (4); întrucât aceste măsuri trebuie notificate celorlalte state membre și Comisiei;
întrucât măsurile trebuie să țină cont de faptul că sunt necesare anchete oficiale sistematice pentru localizarea agentului patogen; întrucât aceste studii ar trebui să includă proceduri de inspecție și, dacă este cazul, proceduri de prelevare de probe și de testare, dat fiind faptul că în anumite condiții de mediu maladia poate rămâne în stare latentă și neobservată, atât în culturile în creștere de cartofi, cât și în tuberculii de cartofi depozitați; întrucât răspândirea agentului patogen într-o cultură în creștere nu este factorul cel mai important, ci faptul că agentul patogen se poate răspândi prin apa de suprafață și anumite plante sălbatice solanacee și, în consecință, irigarea culturilor de cartofi și de tomate cu apă contaminată pare să pună un risc de infectare a acestor culturi; întrucât agentul patogen poate exista de asemenea pe perioada iernii în plantele de cartofi sau tomate autoînsămânțate și acestea pot constitui o sursă de infecție dintr-un sezon în următorul; întrucât patogenul este răspândit de asemenea prin contaminarea cartofilor prin contactul cu cartofi infectați și prin contact cu echipamentul de plantare, recoltare și manipulare sau cu containerele de transport sau depozitare care au fost contaminate cu organismul printr-un contact anterior cu cartofi infectați;
întrucât răspândirea agentului patogen poate fi redusă sau împiedicată prin decontaminarea acestor obiecte; întrucât orice asemenea contaminare a cartofilor de sămânță pune un risc major de răspândire a agentului patogen; în mod similar, infectarea latentă a cartofilor de sămânță pune un risc major de răspândire a agentului patogen și poate fi împiedicată prin utilizarea cartofilor de sămânță produși într-un program aprobat oficial prin care cartofii au fost testați și găsiți indemni de infecție;
întrucât cunoștințele actuale cu privire la biologia și epidemiologia Ralstonia solanacearum (Smith) Yabuuchi et al. în condiții europene sunt incomplete și se anticipează necesitatea revizuirii după câteva sezoane a măsurilor propuse; în mod similar, ținând cont de cercetările viitoare, se anticipează îmbunătățiri ale procedurilor de testare în special în privința sensibilității și specificității metodelor de testare, în scopul selectării și standardizării metodelor de testare disponibile optime;
întrucât, pentru determinarea detaliilor acestor măsuri generale, precum și a măsurilor suplimentare sau mai stricte luate de către statele membre pentru împiedicarea introducerii agentului patogen pe teritoriul lor, este de dorit ca statele membre să coopereze îndeaproape cu Comisia în cadrul Comitetului fitosanitar permanent (în continuare denumit „comitet”),
ADOPTĂ PREZENTA DIRECTIVĂ:
Articolul 1
Prezenta directivă se referă la măsurile care urmează să fie luate de statele membre împotriva Ralstonia solanacearum (Smith) Yabuuchi et al., cunoscut anterior sub denumirea de Pseudomonas solanacearum (Smith) Smith, (în continuare denumit „organism”), cu privire la plantele gazdă ale organismului enumerate în anexa I, secțiunea 1 (în continuare denumite „material vegetal enumerat”), în scopul de:
|
(a) |
a-l localiza și a-i determina distribuția; |
|
(b) |
a-i preveni apariția și răspândirea și |
|
(c) |
a-i împiedica răspândirea și a-l controla în scopul eradicării, dacă este găsit. |
Articolul 2
(1) Statele membre desfășoară anchete oficiale sistematice anuale pentru organism asupra materialului vegetal enumerat originar din teritoriul lor. În scopul identificării altor posibile surse de contaminare care amenință producția materialului vegetal enumerat, statele membre efectuează o evaluare a riscului și, cu excepția cazului în care în timpul evaluării nu se identifică un risc de răspândire a organismului, desfășoară, în zonele de producție ale materialului vegetal enumerat, anchete oficiale orientate pentru detectarea organismului asupra altor plante decât materialul vegetal enumerat, inclusiv asupra plantelor gazdă solanacee sălbatice, ca și asupra apei de suprafață utilizate pentru irigarea sau stropirea materialului vegetal enumerat și asupra deșeurilor lichide deversate de instalațiile de prelucrare sau ambalare industrială care manipulează materialul vegetal enumerat și utilizate pentru irigarea sau stropirea materialului vegetal enumerat. Amploarea acestor anchete orientate se determină în conformitate cu riscul identificat. Statele membre pot de asemenea să desfășoare anchete oficiale pentru detectarea organismului asupra materialelor, cum ar fi mediul de cultură, solul și deșeurile solide din instalațiile de prelucrare industrială sau de ambalare.
(2) Anchetele oficiale prevăzute la alineatul (1) sunt efectuate:
|
(a) |
asupra materialului vegetal enumerat, în conformitate cu detaliile stabilite în anexa II, secțiunea II, punctul 1; |
|
(b) |
asupra plantelor gazdă, altele decât materialul vegetal enumerat, și asupra apei, inclusiv deșeurile lichide, în conformitate cu metodele corespunzătoare și, dacă este cazul, sunt prelevate mostre și sunt supuse testărilor de laborator oficiale sau avizate oficial; |
|
(c) |
acolo unde este cazul, asupra altor materiale, în conformitate cu metodele corespunzătoare. |
Pentru aceste anchete, detaliile suplimentare cu privire la procedurile de inspecție și numărul, originea, stratificarea și momentul colectării mostrelor sunt decise de către organismele oficiale în sensul Directivei 77/93/CEE în baza unor principii științifice și statistice sănătoase și pe biologia organismului și luând în considerare în statul membru în cauză sistemele specifice de producție ale materialului vegetal enumerat și, dacă este cazul, ale altor plante gazdă ale organismului.
(3) Detaliile și rezultatele anchetelor oficiale prevăzute la alineatul (1) sunt notificate anual celorlalte state membre și Comisiei, în conformitate cu dispozițiile anexei I, secțiunea II, punctul 2. Aceste notificări sunt prezentate până la 1 iunie cu excepția cartofilor utilizați ca sămânță obținuți pe propria exploatație pentru care notificarea este prezentată până la 1 septembrie. Detaliile și rezultatele pentru recolte se referă la producția anului precedent. Detaliile acestor prezentări pot fi prezentate comitetului.
(4) Se adoptă următoarea dispoziție în conformitate cu procedura stabilită la articolul 16a din Directiva 77/93/CEE:
|
— |
metodele corespunzătoare pentru anchete și pentru testările de laborator prevăzute la alineatul (2), primul paragraf, litera (b). |
(5) Următoarele dispoziții pot fi adoptate în conformitate cu procedura stabilită la articolul 16a din Directiva 77/93/CEE:
|
— |
metodele corespunzătoare pentru anchetele prevăzute la alineatul (2), primul paragraf, litera (c); |
|
— |
detalii ulterioare ale anchetelor prevăzute la alineatul (2), al doilea paragraf în vederea asigurării unor niveluri comparabile de asigurare între statele membre. |
Articolul 3
Statele membre se asigură că apariția suspectată sau prezența confirmată a organismului pe teritoriul lor este raportată către propriile organisme oficiale responsabile.
Articolul 4
(1) În fiecare caz de apariție suspectată, organismele oficiale responsabile ale statului membru sau statelor membre în cauză asigură efectuarea testării de laborator oficiale sau avizate oficial utilizând pentru materialul vegetal enumerat metoda relevantă stabilită în anexa II și în conformitate cu condițiile specificate în anexa III punctul 1 sau, în toate celelalte cazuri, orice altă metodă aprobată oficial în scopul confirmării sau infirmării apariției suspectate. În cazul confirmării se aplică cerințele stabilite în anexa III, punctul 2.
(2) În așteptarea confirmării sau infirmării unei apariții suspectate în conformitate cu alineatul (1), în fiecare caz de apariție suspectată în care:
|
(i) |
au fost văzute simptomele de diagnostic ale maladiei cauzate de organism și s-a obținut un rezultat pozitiv în testul(ele) de triere rapidă specificat(e) în anexa II, secțiunea I, punctul 1 și secțiunea II sau |
|
(ii) |
s-a obținut un rezultat pozitiv în testul(ele) de triere specificat(e) în anexa II, secțiunea I, punctul 2 și secțiunea III, |
organismele responsabile din statele membre, în funcție de producția proprie:
|
(a) |
interzic circulația plantelor și tuberculilor din toate recoltele, loturile sau transporturile din care provin eșantioanele, cu excepția celor controlate de acestea și cu condiția să se fi stabilit că nu există vreun risc identificabil de răspândire a organismului; |
|
(b) |
iau măsuri de depistare a originii apariției suspectate; |
|
(c) |
introduc măsuri de precauție suplimentare corespunzătoare bazate pe nivelul de risc estimat, în special în legătură cu producția materialului vegetal enumerat și cu circulația loturilor de cartofi de sămânță, altele decât cele prevăzute la litera (a), produse la locul de producție de unde s-au luat eșantioanele prevăzute la litera (a), în scopul prevenirii oricărei răspândiri a organismului. |
(3) În acele cazuri de apariție suspectată în care există riscul contaminării materialului vegetal enumerat sau a apei de suprafață dintr-un sau într-un alt stat membru, statul membru în care a fost raportată apariția suspectă notifică imediat, în conformitate cu riscul identificat, detaliile respectivei apariții suspecte celuilalt sau celorlalte state membre în cauză și există o cooperare corespunzătoare între respectivele state membre. Statul sau statele membre astfel notificate introduc măsuri de precauție în conformitate cu alineatul (2) litera (c) și iau orice măsuri ulterioare corespunzătoare, în conformitate cu alineatele (1) și (2).
(4) Următoarea dispoziție poate fi adoptată în conformitate cu procedura stabilită la articolul 16a din Directiva 77/93/CEE:
|
— |
măsurile prevăzute la alineatul (2) litera (c). |
Articolul 5
(1) În cazul în care testarea de laborator oficială sau avizată oficial care utilizează, pentru materialul vegetal enumerat, metoda relevantă stabilită în anexa II sau, în toate celelalte cazuri, orice altă metodă aprobată oficial confirmă prezența organismului într-o probă prelevată în conformitate cu prezenta directivă, organismele oficiale responsabile ale unui stat membru, având în vedere principii științifice sănătoase, biologia organismului și producția specifică, comercializarea și sistemele de prelucrare ale plantelor gazdă ale organismului în acest stat membru:
|
(a) |
pentru materialul vegetal enumerat:
|
|
(b) |
pentru culturile de plante gazdă, altele decât cele menționate la litera (a), unde producția de material vegetal enumerat este identificată ca fiind supusă riscului:
|
|
(c) |
pentru apa de suprafață (inclusiv deșeurile lichide deversate de instalațiile de prelucrare industrială sau de ambalare care manipulează materialul vegetal enumerat) și plantele gazdă solanacee sălbatice, acolo unde producția materialului vegetal enumerat este identificată ca fiind supusă riscului prin irigație, stropire sau inundare cu apa de suprafață:
|
(2) Statele membre notifică imediat celorlalte state membre și Comisiei, în conformitate cu dispozițiile din anexa V punctul 3 cu privire la orice contaminare desemnată în conformitate cu alineatul (1) litera (a) punctul (ii) și alineatul (1) litera (c) punctul (ii) și cu privire la detaliile demarcării zonei în conformitate cu alineatul (1) litera (a) punctul (iv) și, dacă este cazul, în conformitate cu alineatul (1) litera (c) punctul (iii). Detaliile notificării în conformitate cu prezentul alineat pot fi prezentate comitetului.
Statele membre prezintă în același timp comitetului notificarea suplimentară stabilită în anexa V punctul 4. Detaliile notificării în conformitate cu prezentul paragraf sunt prezentate imediat membrilor comitetului.
(3) În urma informării în conformitate cu alineatul (2) și a elementelor menționate în acesta, celelalte state membre vizate în notificare deschid o investigație în conformitate cu alineatul (1), litera (a) punctul (i) și, dacă este cazul, alineatul (1) litera (c) punctul (i) și iau acțiuni ulterioare, după caz, în conformitate cu alineatele (1) și (2).
Articolul 6
(1) Statele membre prescriu faptul că materialul vegetal enumerat desemnat ca fiind contaminat în conformitate cu articolul 5 alineatul (1) litera (a) punctul (ii) nu poate fi plantat și că în baza controlului și aprobării organismelor lor responsabile oficiale este supus uneia dintre dispozițiile din anexa VI punctul 1, astfel încât să fie garantată inexistența vreunui risc identificabil de răspândire a organismului.
(2) Statele membre prescriu faptul că materialul vegetal enumerat desemnat ca fiind probabil contaminat în conformitate cu articolul 5 alineatul (1) litera (a) punctul (iii) și litera (c) punctul (iii), inclusiv materialul vegetal enumerat pentru care a fost identificat un risc, produs în locuri de producție determinate ca probabil contaminate în conformitate cu articolul 5 alineatul (1) litera (a) punctul (iii) nu poate fi plantat și, sub controlul organismelor oficiale responsabile ale acestora, este utilizat sau eliminat corespunzător, după cum se specifică în anexa VI punctul 2, astfel încât să se stabilească faptul că nu există nici un risc identificabil de răspândire a organismului.
(3) Statele membre prescriu faptul că orice utilaj, vehicul, vas, depozit sau unități ale acestora și orice alte obiecte, inclusiv material de ambalare desemnat ca fiind contaminat în conformitate cu articolul 5 alineatul (1) litera (a) punctul (ii) sau determinat ca fiind probabil contaminat în conformitate cu articolul 5 alineatul (1) litera (a) punctul (iii) și litera (c) punctul (iii), este distrus sau decontaminat utilizând metodele corespunzătoare specificate în anexa VI punctul 3. După decontaminare nici un astfel de obiect nu mai este considerat ca fiind contaminat.
(4) Fără să aducă atingere măsurilor puse în aplicare în conformitate cu alineatele (1), (2) și (3), statele membre prescriu faptul că sunt puse în aplicare o serie de măsuri specificate la punctele 4.1 și 4.2 din anexa VI în zona demarcată în conformitate cu articolul 5 alineatul (1) litera (a) punctul (iv) și litera (c) punctul (iii). Detalii cu privire la aceste măsuri sunt notificate anual celorlalte state membre și Comisiei. Detaliile cu privire la această notificare pot fi prezentate comitetului.
Articolul 7
(1) Statele membre prescriu faptul că respectivii cartofi de sămânță îndeplinesc cerințele Directivei 77/93/CEE și derivă în linie directă din material de cartofi obținut în cadrul unui program aprobat oficial care a fost declarat ca fiind indemn cu organismul într-o testare oficială sau avizată oficial, utilizând metoda relevantă stabilită în anexa II.
Testarea menționată anterior este efectuată de către un stat membru:
|
(a) |
în cazurile în care a fost confirmată depistarea organismului în producția proprie de cartofi de sămânță:
|
|
(b) |
în alte cazuri, pe fiecare plantă a selecției clonale inițiale sau pe eșantioane reprezentative de cartofi de sămânță de bază sau înmulțiri anterioare. |
(2) Următoarele dispoziții pot fi adoptate în conformitate cu procedura stabilită la articolul 16a din Directiva 77/93/CEE:
|
— |
normele de aplicare a alineatului (1), al doilea paragraf, litera (a); |
|
— |
regulile privind eșantioanele reprezentative prevăzute la alineatul (1), al doilea paragraf, litera (b). |
Articolul 8
Statele membre interzic deținerea și manipularea organismului.
Articolul 9
Fără să aducă atingere dispozițiilor Directivei 77/93/CEE, statele membre pot autoriza derogări de la măsurile prevăzute în articolele 6 și 8 din prezenta directivă, în conformitate cu dispozițiile Directivei 95/44/CE (5) privind scopurile experimentale sau științifice și munca de selecție a soiurilor.
Articolul 10
Statele membre pot adopta în privința propriei producții măsuri suplimentare sau mai stricte cerute pentru combaterea organismului sau pentru a-i preveni răspândirea, în măsura în care sunt în conformitate cu dispozițiile Directivei 77/93/CEE.
Detaliile acestor măsuri sunt notificate celorlalte state membre și Comisiei. Detaliile acestei notificări pot fi prezentate comitetului.
Articolul 11
Modificările la anexele la prezenta directivă ce urmează să fie făcute ținând cont de evoluția cunoștințelor științifice sau tehnice sunt adoptate în conformitate cu procedura stabilită la articolul 16a din Directiva 77/93/CEE. În cazul metodelor stabilite în anexa II și a măsurilor din alineatele (4.1) și (4.2) din anexa VI la prezenta directivă, Comisia pregătește un raport de examinare a acestor metode și măsuri ținând cont de experiența câștigată, iar raportul este prezentat comitetului înainte de 1 ianuarie 2002.
Articolul 12
(1) Statele membre pun în aplicare actele cu putere de lege și actele administrative necesare pentru a se conforma prezentei directive cu efect de la 21 august 1999. Statele membre informează de îndată Comisia cu privire la aceasta.
Atunci când statele membre adoptă aceste acte, ele conțin o trimitere la prezenta directivă sau sunt însoțite de o asemenea trimitere la data publicării lor oficiale. Statele membre stabilesc modalitatea de efectuare a acestei trimiteri.
(2) Comisiei îi sunt comunicate de către statele membre textele dispozițiilor de drept intern pe care le adoptă în domeniul reglementat de prezenta directivă. Comisia informează celelalte state membre cu privire la aceasta.
Articolul 13
Prezenta directivă intră în vigoare la data publicării în Jurnalul Oficial al Comunităților Europene.
Articolul 14
Prezenta directivă se adresează statelor membre.
Adoptată la Bruxelles, 20 iulie 1998.
Pentru Consiliu
Președintele
W. MOLTERER
(1) JO C 124, 21.4.1997, p. 12 și
(2) JO C 14, 19.1.1998, p. 34.
(3) JO C 206, 7.7.1997, p. 57.
(4) JO L 26, 31.1.1977, p. 20. Directivă astfel cum a fost modificată ultima dată de Directiva 98/2/CE a Comisiei (JO L 15, 21.1.1998, p. 34).
(5) JO L 184, 3.8.1995, p. 34. Directivă astfel cum a fost modificată ultima dată de Directiva 97/46/CE a Comisiei (JO L 204, 31.7.1997, p. 43).
ANEXA I
SECȚIUNEA I
Lista plantelor gazdă ale Ralstonia solanacearum (Smith) Yabuuchi et al. prevăzute în articolul 1
|
Plante (inclusiv tuberculi), altele decât semințe propriu-zise de Sonanum tuberosum L. |
Cartof |
|
Plante, altele decât fructe și semințe de Lycopersicon lycopersicum (L.) Karsten ex Farw. |
Tomate |
SECȚIUNEA II
Anchete
1. Anchetele oficiale prevăzute la articolul 2, alineatul (2), litera (a) se bazează pe biologia organismului și pe sistemele de producție specifice din statul membru în cauză și cuprind:
|
(i) |
în cazul cartofului:
|
|
(ii) |
în cazul tomatelor:
|
2. Notificarea anchetelor oficiale prevăzute în articolul 2 alineatul (3) include:
|
(i) |
în cazul anchetelor asupra cartofilor:
|
|
(ii) |
în cazul anchetelor cel puțin asupra culturii în creștere de plante de tomate destinate replantării în scop profesional:
|
|
(iii) |
în cazul anchetelor asupra plantelor gazdă, altele decât cartofi și tomate, inclusiv plante gazdă solanacee sălbatice:
|
|
(iv) |
în cazul anchetelor asupra apei și deșeurilor lichide deversate din instalațiile de prelucrare industrială sau de ambalare:
|
ANEXA II
PROTOCOL DE TESTARE PENTRU DIAGNOSTICAREA, DETECTAREA ȘI IDENTIFICAREA RALSTONIA SOLANACEARUM (SMITH) YABUUCHI ET AL.
DOMENIUL DE APLICARE AL PROTOCOLULUI DE TESTARE
Protocolul prezentat descrie diversele proceduri implicate în:
|
(i) |
diagnosticarea putregaiului brun din tuberculii de cartof și a ofilirii bacteriene la plantele de cartof și tomate; |
|
(ii) |
detectarea Ralstonia solanacearum în eșantioanele de tuberculi de cartof; |
|
(iii) |
identificarea Ralstonia solanacearum. |
În apendice se oferă detalii cu privire la prepararea materialelor de testare, adică mediul de cultură, tampoanele, soluțiile, reactivii.
CUPRINS:
|
SECȚIUNEA I: |
Aplicarea protocolului de testare … |
127 |
|
1. Diagnosticarea putregaiului brun din tuberculii de cartof și a ofilirii bacteriene la plantele de cartof și tomată … |
127 |
|
|
2. Detectarea și identificarea Ralstonia solanacearum în eșantioanele de tuberculi de cartof … |
129 |
|
|
SECȚIUNEA II: |
Diagnosticarea putregaiului brun din tuberculii de cartof și a ofilirii bacteriene la plantele de cartof și tomată … |
131 |
|
1. Simptome … |
131 |
|
|
2. Test(e) de triere rapidă … |
131 |
|
|
3. Procedură de izolare … |
132 |
|
|
4. Test(e) de confirmare … |
132 |
|
|
SECȚIUNEA III: |
Detectarea și identificarea Ralstonia solanacearum în eșantioanele de tuberculi de cartof … |
135 |
|
1. Pregătirea eșantionului pentru testare … |
135 |
|
|
2. Test de imunofluorescență (IF) … |
136 |
|
|
3. Test de imunoadsorbție cu anticorpi marcați enzimatic (ELISA) … |
138 |
|
|
4. Testul de reacție de polimerizare în lanț (PCR™) … |
138 |
|
|
5. Testul de placare selectivă … |
140 |
|
|
6. Testul de probă biologică … |
141 |
|
|
7. Teste de îmbogățire … |
141 |
|
|
8. Testul de patogenicitate … |
141 |
|
|
Apendicele 1 |
Medii nutritive pentru izolarea și cultura Ralstonia solanacearum … |
142 |
|
Apendicele 2 |
Materiale pentru pregătirea eșantionului … |
143 |
|
Apendicele 3 |
Materiale pentru testul IF … |
144 |
|
Apendicele 4 |
Determinarea nivelului de contaminare în testul IF … |
145 |
|
Apendicele 5 |
Materiale pentru testul ELISA … |
146 |
|
Apendicele 6 |
Materiale pentru testul PCR … |
147 |
|
Apendicele 7 |
Materiale pentru test(ele) de placare selectivă și de îmbogățire … |
147 |
|
Bibliografie … |
148 |
|
SECȚIUNEA I
APLICAREA PROTOCOLULUI DE TESTARE
1. Diagnosticarea putregaiului brun din tuberculii de cartof și a ofilirii bacteriene la plantele de cartof și tomată
Protocolul de testare este destinat tuberculilor de cartof cu simptome tipice sau suspecți de putregai brun și în cazul plantelor de cartof și tomate cu simptome tipice sau suspecte de ofilire bacteriană. Presupune un test de triere rapidă, izolarea agentului patogen din țesutul vascular infectat pe mediile de diagnosticare și, în cazul unui rezultat pozitiv, identificarea culturii ca fiind Ralstonia solanacearum.
Prezentarea diagramei
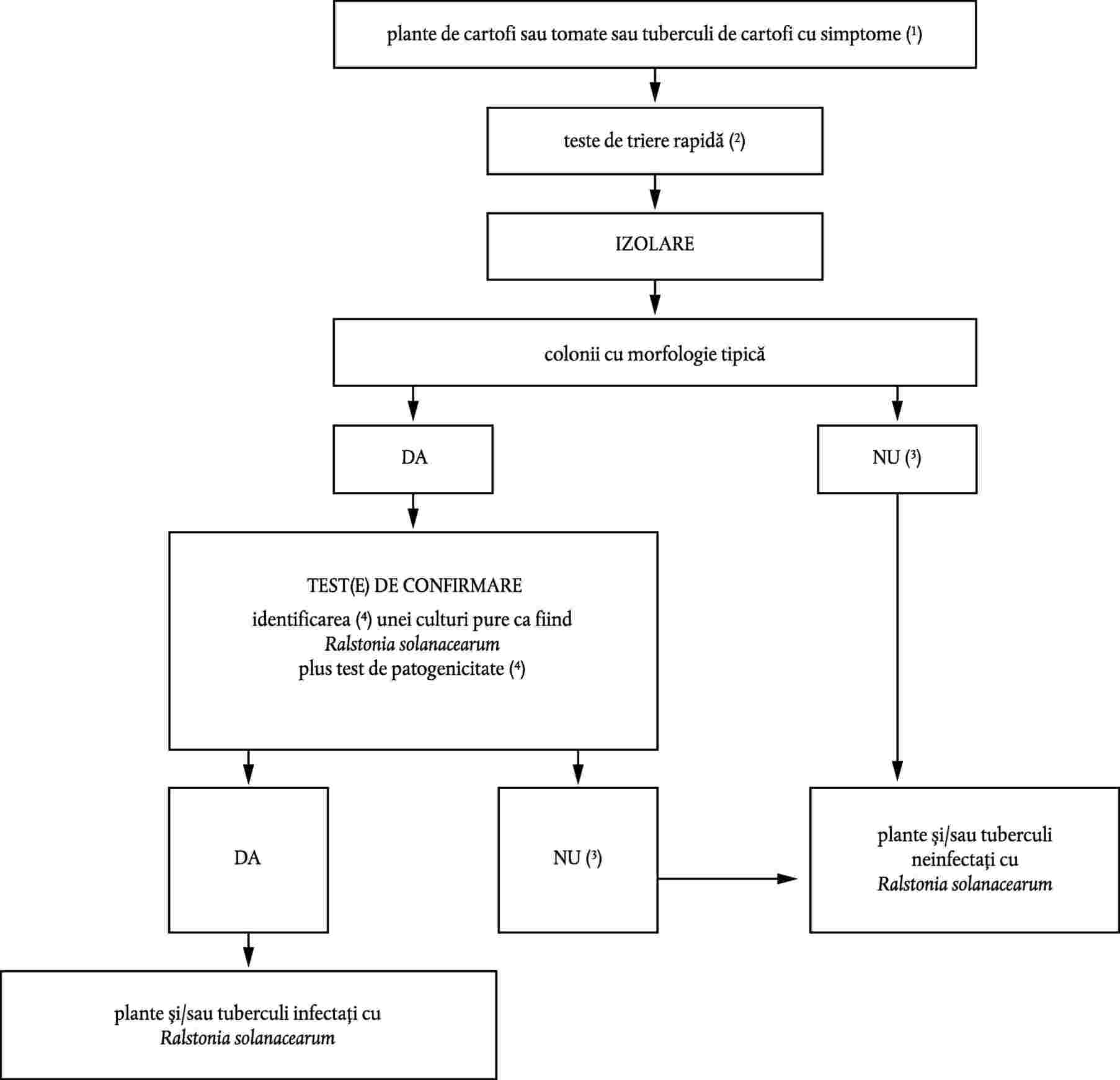
Referințe la diagramă:
|
(1) |
Descrierea simptomelor este oferită în secțiunea II.1. |
|
(2) |
Testele de triere rapidă ușurează diagnosticul prezumtiv. Testele corespunzătoare sunt:
|
|
(3) |
Cu toate că izolarea agentului patogen din materialul vegetal cu simptome tipice prin diluare galvano-plastică este directă, punerea în cultură poate eșua datorită stadiului avansat al infectării. Bacteriile saprofite care cresc în țesuturile bolnave se pot dezvolta mult mai repede decât agentul patogen sau îl pot inhiba în mediul de izolare. Dacă testul de izolare este negativ, dar simptomele bolii sunt tipice, izolarea trebuie repetată, de preferință printr-un test de placare selectivă. |
|
(4) |
Identificarea certă a unei culturi pure de Ralstonia solanacearum este obținută prin cel puțin unul dintre testele enumerate în secțiunea II.4.1, în combinație cu un test de patogenicitate (secțiunea II.4.3). Caracterizarea sușei este opțională, dar recomandată pentru fiecare caz nou. |
2. Detectarea și identificarea Ralstonia solanacearum din eșantioanele de tuberculi de cartof
Protocolul este destinat detectării infecțiilor latente în tuberculii de cartof printr-unul sau, de preferință, mai multe teste de triere care, dacă sunt pozitive, sunt suplimentate prin izolarea agentului patogen; urmat de identificarea unei culturi pure ca fiind Ralstonia solanacearum, în cazul izolării unor colonii tipice.
Prezentarea diagramei
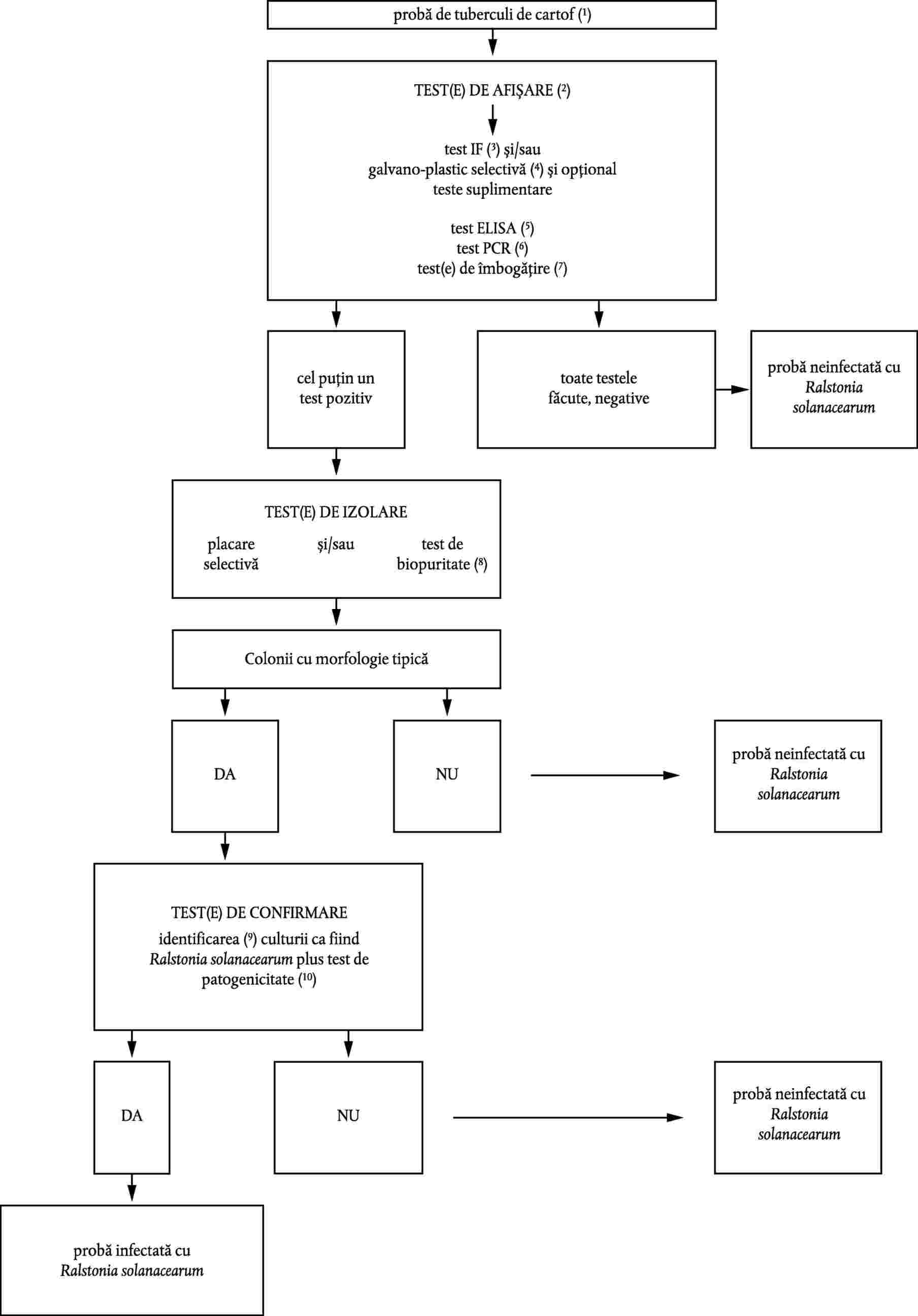
Referințe la diagramă:
|
(1) |
Mărimea eșantionului Mărimea standard este de 200 tuberculi. Cu toate acestea, protocolul poate fi aplicat în mod convenabil eșantioanelor cu mai puțin de 200 de tuberculi. |
|
(2) |
Test(e) de triere Un singur test poate să fie insuficient de sensibil sau de sigur pentru detectarea Ralstonia solanacearum dintr-un eșantion. Din acest motiv se recomandă mai mult de un test, iar aceste teste ar fi de preferat să se bazeze pe principii biologice diferite. |
|
(3) |
Test de imunofluorescență (IF) Testul IF este un test de triere bine cunoscut. Acesta reprezintă un avantaj față de alte teste care nu sunt încă complet dezvoltate sau validate. Testul este folosit pentru multe alte bacterii de carantină, de exemplu Clavibacter michiganensis subsp. sepedonicus. Datorită parametrilor de citire specificați în această metodă, este un test sensibil (pragul de sensibilitate de 10(3-104 celule pe ml de extract final de cartof). Factorul critic pentru siguranța rezultatelor testului este calitatea antiserului. Doar antiserul cu un titru superior (minim 2 000 pentru antiserul brut) este acceptabil și toate testele trebuie efectuate la titrul antiserului sau o diluție sub titru. Este preferată metoda indirectă. Metoda directă se poate aplica dacă testul are un nivel de sensibilitate și specificitate echivalente metodei indirecte. Testul IF are avantajul interpretării subiective a morfologiei colorației celulare și intensității fluorescenței care oferă informații asupra specificității reacției. Reacțiile încrucișate cu bacterii apropiate din punct de vedere serologic din sol sau asociate cu țesuturi de cartof cu morfologia celulară a Ralstonia solanacearum sunt obișnuite. Testul IF poate fi utilizat ca test unic de triere, deși în cazurile în care sunt bănuite reacții încrucișate ar trebui făcut un test de triere suplimentar bazat pe un principiu biologic diferit. În asemenea cazuri cel mai recomandat test este placarea selectivă. |
|
(4) |
Placarea selectivă Împreună cu mediul SMSA modificat și metodologia de testare specificată în această metodă, acesta este un test sensibil și selectiv pentru Ralstonia solanacearum. Rezultatul este disponibil la 3-6 zile după prepararea eșantionului. Agentul patogen este obținut direct în cultură și poate fi identificat imediat. Pentru exploatarea completă a potențialului său, testul cere o pregătire atentă a taloanelor pentru a se evita bacteriile secundare asociate tuberculului de cartof care sunt organisme concurente ale Ralstonia solanacearum în mediu și pot afecta dezvoltarea agentului patogen. Unele sușe se pot dezvolta insuficient, deoarece componentele mediului pot afecta organismul țintă. Se cere de asemenea atenție la diferențierea Ralstonia solanacearum de celelalte bacterii care se pot dezvolta în mediu. Placarea selectivă poate fi utilizată ca test unic de triere cu condiția ca în cazurile în care se bănuiește inhibiția Ralstonia solanacearum de alte bacterii de pe plăci și se obține un rezultat negativ al testului, eșantionul este testat din nou utilizând un test diferit pentru confirmarea sau infirmarea diagnosticului. În asemenea cazuri cel mai recomandat test este testul IF. |
|
(5) |
Testul ELISA Testul ELISA este în general mai puțin sensibil decât testul IF (prag de sensibilitate 104-105 celule pe extract final de cartof). Testul este ieftin și rapid, dar în general mai vulnerabil la false rezultate pozitive (reacții încrucișate) și negative (inhibare de către moleculele fenolice din extractul de cartof). Cerințele de specificitate a antiserului sunt extrem de mari. Testul ELISA nu poate fi folosit ca test de triere unic. |
|
(6) |
Testul PCR PCR are potențialul unei detectări foarte sensibile, deși testul este ușor inhibat de componente de plantă sau de extract de cartof ducând la un rezultat negativ fals. Unii cultivari de cartof conțin mai mulți inhibitori decât alții. De aceea este necesară îndepărtarea acestor inhibitori. Inhibiția se poate reduce prin diluare, dar se diluează și populația de Ralstonia solanacearum. Trebuie acordată multă atenție în toate etapele pregătirii eșantionului și testului pentru a împiedica contaminarea care ar duce la teste pozitive false. Testele pozitive false pot să apară de asemenea din omologie de secvențe cu alte organisme. Din aceste motive, testul direct PCR nu poate fi folosit ca test unic de triere. |
|
(7) |
Testul de îmbogățire Eșantioanele de extract final de cartof incubat în mediu nutritiv semi-selectiv, cum este mediul nutritiv modificat SMSA, permite multiplicarea Ralstonia solanacearum. Poate mult mai important este faptul că, de asemenea, diluează potențialii inhibitori ai testelor ELISA sau PCR. Astfel, Ralstonia solanacearum în mediu nutritiv îmbogățit poate fi detectată prin testele IF, ELISA și PCR. Nu recomandăm ca placarea directă să fie făcută din mediile nutritive îmbogățite. Aceste metode de îmbogățire nu au fost verificate și testate complet. Ele sunt incluse aici fiindcă au un potențial bun. Cu toate acestea, datorită relativei lipse de experiență în lucrul cu ele, nu pot fi utilizate ca metode unice de detectare. |
|
(8) |
Testul de probă biologică Testul de probă biologică este folosit pentru izolarea Ralstonia solanacearum din extractele finale de cartof prin îmbogățire selectivă într-o plantă gazdă și nu poate fi făcut pe plante de tomate sau vinete. Testul solicită condiții optime de incubare specificate în prezenta metodă. Bacteriile inhibitoare ale Ralstonia solanacearum în mediul SMSA probabil că nu vor interfera cu acest test. |
|
(9) |
Test(e) de confirmare Identificarea sigură a unei culturi pure de Ralstonia solanacearum se obține prin cel puțin unul dintre testele enumerate în secțiunea II.4.1., în combinație cu un test al patogenicității (secțiunea II.4.3.). Caracterizarea sușelor este opțională, dar recomandată pentru fiecare caz nou. |
SECȚIUNEA II
DIAGNOSTICAREA PUTREGAIULUI BRUN DIN TUBERCULII DE CARTOF ȘI A OFILIRII BACTERIENE LA PLANTELE DE CARTOF ȘI TOMATĂ
1. Simptome
1.1 Simptome la cartof
Planta de cartof. Stadiul incipient al infecției este reprezentat de ofilirea frunzelor înspre vârful plantei în timpul temperaturilor diurne ridicate și de revenirea în timpul nopții. Ofilirea devine repede ireversibilă și duce la moartea plantei. Țesutul vascular în secțiune transversală prin tulpina plantelor ofilite poate deveni brun și o scurgere lăptoasă iese de la suprafața tăieturii sau poate fi stoarsă ușor prin presare. Dacă se pune o tulpină tăiată în poziție verticală în apă, se preling fire vâscoase din canalele vasculare.
Tuberculul de cartof. Tuberculul de cartof trebuie tăiat transversal aproape de talon (= stolon). Stadiul incipient al infecției este o decolorare sticloasă galben spre brun deschis a inelului vascular din care iese o scurgere crem pal în mod spontan după câteva minute sau dacă se aplică o ușoară apăsare cu degetele pe coaja de lângă suprafața tăiată. Mai târziu, decolorarea vasculară devine de un brun mai distinct iar necroza se poate extinde la țesutul parenchimatos. În stadii avansate, infecția izbucnește în exterior de la talon și de la ochi și poate duce la leziuni de culoare brun-roșcat ușor adâncite ale cojii din care se pot scurge bacteriile determinând aderarea particulelor de sol.
1.2 Simptome la tomate
Planta de tomată. Primul simptom vizibil este aspectul slăbit al frunzelor tinere. În condiții favorabile de mediu pentru agentul patogen (temperatura solului circa 25 °C, umiditate saturată) epinastia și ofilirea unei părți sau a întregii plante se produce în câteva zile și duce la colapsul total al plantei. În condiții mai puțin favorabile (temperatura solului sub 21 °C) se pot dezvolta un număr mare de rădăcini adventive. Este posibilă observarea unui cordon gras de-a lungul tulpinii care este dovada necrozei sistemului vascular. Dacă tulpina este tăiată transversal, țesuturile vasculare brune decolorate ale tulpinii elimină picături dintr-o scurgere bacteriană albă sau gălbuie.
2. Teste de triere rapidă
Testele de triere rapidă ușurează diagnosticul prezumtiv. Folosiți unul sau mai multe dintre următoarele teste:
Testul de exsudație a tulpinii
Prezența Ralstonia solanacearum în tulpini ofilite de cartof sau tomate poate fi evaluată prin următorul test prezumtiv simplu:
Se taie tulpina chiar deasupra nivelului solului. Se pune suprafața tăiată într-un pahar cu apă. Imediat după aceea, fire de exudat bacterian curg spontan din fasciculele vasculare. Nici o altă bacterie care produce infecții vasculare la cartofi sau tomate nu va prezenta acest fenomen.
Detectarea granulelor de poli-β-hidroxibutirat (PHB)
Granulele de PHB din celulele de Ralstonia solanacearum sunt vizualizate prin colorarea cu albastru de Nil A sau cu negru de Sudan B.
Se prepară un frotiu din scurgere sau din țesutul în suspensie pe o lamelă de microscop sau se prepară un frotiu dintr-o cultură de 48 de ore pe bază de YPGA sau SPA (apendicele 1). Se prepară frotiuri de control pozitiv din sușa biovar 2/rasa 3 și, dacă se consideră necesar, un frotiu de control negativ dintr-o sușă eterogenă. Se lasă la uscat. Se trece rapid partea inferioară a lamelei de câteva ori prin flacără până la fixarea frotiului.
Testul cu albastru de Nil
|
1. |
Frotiul fixat se scufundă într-o soluție apoasă 1 % de albastru de Nil A. Se incubează 10 minute la 55 °C. |
|
2. |
Se usucă soluția colorantă. Se spală rapid cu apă de la robinet. Excesul de apă se îndepărtează cu hârtie de mătase. |
|
3. |
Frotiul se scufundă într-o soluție apoasă 8 % de acid acetic. Se incubează un minut la temperatura camerei. |
|
4. |
Se spală ușor cu apă de la robinet. Se usucă cu hârtie de mătase. |
|
5. |
Se umezește cu o picătură de apă. Se aplică o lamelă de acoperire. |
|
6. |
Se examinează frotiul colorat la un microscop cu epifluorescență la 450 nm sub imersiune în ulei la o mărire de 1 000. |
Se observă fluorescența portocalie strălucitoare a granulelor PHB. De asemenea, se observă la lumină normală pentru a avea certitudinea că granulele sunt intracelulare și că morfologia celulei este tipică pentru Ralstonia solanacearum.
Testul cu negru de Sudan
|
1. |
Frotiul fixat se scufundă într-o soluție de 0,3 % negru de Sudan B în 70 % etanol. Se incubează 10 minute la temperatura camerei. |
|
2. |
Se uscă soluția colorantă. Se spală rapid cu apă de la robinet. Se îndepărtează excesul de apă. Se îndepărtează excesul de apă cu hârtie de mătase. |
|
3. |
Frotiul se înmoaie puțin în xilen. Se usucă cu hârtie de mătase. Atenție! Xilenul este un produs dăunător. Lucrați într-o cameră cu abur. |
|
4. |
Se scufundă frotiul în soluție apoasă 0,5 % (w/v) de safranin și se lasă 10 secunde la temperatura camerei. Atenție! Safraninul este un produs dăunător. Lucrați într-o cameră cu abur. |
|
5. |
Se spală ușor cu apă de la robinet. Se uscă cu un șervețel de hârtie. Se aplică o lamelă de acoperire. |
|
6. |
Se examinează frotiul colorat la un microscop optic utilizând lumina transmisă sub imersie în ulei la o mărire de 1 000. Granulele de PHB din celulele de Ralstonia solanacearum se colorează în albastru- negru. Membrana celulară se colorează în roz. |
Alte teste
Alte teste de triere corespunzătoare sunt testul IF (secțiunea III.2), testul ELISA (secțiunea III.3) și testul PCR (secțiunea III.4).
3. Procedura de izolare
3.1. Se îndepărtează scurgerea sau secțiunile de țesut decolorat din inelul vascular al tuberculului de cartof sau din căile vasculare ale tulpinii plantei de cartof sau tomată. Se pune în suspensie într-un volum mic de apă distilată sterilă sau un tampon fosfat de 50 mM. Se lasă 5-10 minute pe masă.
3.2. Se prepară o serie de diluții zecimale ale suspensiei, de exemplu 1/10 și 1/100 sau mai multe dacă se consideră necesar.
3.3. Se transferă un volum standard de suspensie și de diluții într-un mediu nutritiv comun (NA, YPGA și SPA, apendicele 1) și/sau în mediul de tetrazoliu Kelman (apendicele 1) și/sau în mediul selectiv SMSA (apendicele 7). Se întinde sau se prepară în linii cu o tehnică de diluare galvano-plastică corespunzătoare. Dacă se consideră util se prepară plăci separate din fiecare mediu utilizat cu o cultură de celule în suspensie diluată din sușa virulentă biovar 2/rasa 3 de Ralstonia solanacearum drept control pozitiv.
3.4. Se incubează plăcile timp de trei zile la 28 °C. Incubarea poate fi prelungită la șase zile dacă este o creștere lentă, dar coloniile din plăcile SMSA devin deseori atipice și mor.
În mediile nutritive generale, izolările virulente de Ralstonia solanacearum dezvoltă colonii de culoare alb permanent, plate, neregulate și fluide, deseori cu spirale caracteristice.
În mediul tetrazolic Kelman coloniile tipice de izolări virulente de Ralstonia solanacearum sunt de culoare crem, plate, neregulate și fluide cu spirale roșii-sângerii în centru. Formele avirulente de Ralstonia solanacearum dezvoltă colonii butonoase, de culoare roșie intensă.
În mediul SMSA, coloniile tipice de izolări virulente de Ralstonia solanacearum sunt de culoare alb-lăptoasă, plate, neregulate și fluide cu colorație roșie-sângerie în centru.
Formele avirulente de Ralstonia solanacearum dezvoltă colonii mai puțin fluide care sunt în întregime de culoare roz până la roșu în mediul SMSA.
3.5. Se purifică coloniile cu morfologie caracteristică prin subcultură într-un mediu nutritiv general. Se evită subcultivarea regulată care poate duce la pierderea virulenței.
4. Test(e) de confirmare
4.1. Identificarea Ralstonia solanacearum
Culturile pure de Ralstonia solanacearum se identifică prin cel puțin una dintre procedurile următoare:
Teste enzimatice și de nutriție
Notă: În fiecare test folosit se includ sușele de control corespunzătoare.
Următoarele proprietăți fenotipice ale Ralstonia solanacearum sunt universal prezente sau absente:
|
Pigment fluorescent |
– |
|
Incluziuni PHB |
+ |
|
Test de oxidare/fermentare (O/F) |
O+/F– |
|
Catalază |
+ |
|
Oxidază Kovacs |
+ |
|
Reducerea nitraților |
+ |
|
Utilizarea citratului |
+ |
|
Creștere la 40 °C |
– |
|
Creștere în 1 % NaCl |
+ |
|
Creștere în 2 % NaCl |
– |
|
Dihidrolaza argininei |
– |
|
Lichefierea gelatinei |
– |
|
Hidroliza amidonului |
– |
|
Hidroliza esculinei |
– |
|
Producție de levan |
– |
Mediile și metodele se găsesc în Lelliott & Stead (1987)
Testul IF
Se prepară o suspensie de 106 celule pe ml din cultură și din sușa sau sușele de control. Se prepară o serie de diluții duble de antiser. Se aplică procedura IF (secțiunea III.2). Valoarea IF a culturii trebuie să fie echivalentă celei a controlului pozitiv.
Testul ELISA
Se prepară o suspensie de > 106 celule pe ml din cultură și din sușa sau sușele de control. Se aplică procedura ELISA (secțiunea III.3). Valoarea ELISA a culturii trebuie să fie echivalentă celei a controlului pozitiv.
Testul PCR
Se prepară o suspensie de 106 celule pe ml din cultură și din sușa sau sușele de control. Se aplică procedura PCR (secțiunea III.4). Produsul PCR al culturii trebuie să aibă aceeași dimensiune și același profil al analizei enzimatice restrictive (REA) ca și cel a controlului pozitiv.
Hibridizare fluorescentă in-situ (FISH)
Se prepară o suspensie de 106 celule pe ml din cultură și din sușa sau sușele de control. Se aplică procedura FISH (van Beuningen et al, 1995) cu amorsă OLI-1 PCR (Seal et al, 1993). Cultura trebuie să prezinte aceeași reacție ca și controlul pozitiv.
Profil proteic
Proteinele celulelor întregi denaturate se separă prin electroforeza gelului de poliacrilamidă – PAGE (Stead, 1992a).
Profilarea acizilor grași (FAP)
Se crește cultura și o sușă de control pozitiv timp de 48 de ore la 28 °C în mediu tripticaz-soia-agar și se aplică procedura FAP (Janse, 1991; Stead, 1992a; Stead, 1992b). Profilul culturii trebuie să fie identic cu cel al controlului pozitiv. În condițiile specificatee, acizii grași caracteristici sunt 14:0 3OH, 16:0 2OH, 16:1 2OH și 18:1 2OH.
4.2. Caracterizarea sușei
Caracterizarea sușei este opțională, dar este recomandată pentru fiecare caz nou folosind cel puțin una dintre următoarele:
Determinarea biovarului
Ralstonia solanacearum se separă pe biovari în baza capacității de a produce acid din trei hexoze alcoolice și trei zaharuri (Hayward, 1964 & 1994):
|
|
Biovar |
||||
|
1 |
2 |
3 |
4 |
5 |
|
|
Utilizarea: |
|
|
|
|
|
|
— maltozei |
– |
+ |
+ |
– |
+ |
|
— lactozei |
– |
+ |
+ |
– |
+ |
|
— celobiozei |
– |
+ |
+ |
– |
+ |
|
— manitolului |
– |
– |
+ |
+ |
+ |
|
— sorbitei |
– |
– |
+ |
+ |
– |
|
— dulcitolului |
– |
– |
+ |
+ |
– |
Teste suplimentare diferențiază biovarul 2 în subfenotipuri (Hayward, 1994):
|
|
Biovar 2 |
Biovar 2-A |
Biovar 2- T |
|
Utilizarea trehalozei |
– |
+ |
+ |
|
Utilizarea inozitei |
+ |
– |
+ |
|
Utilizarea D-ribozei |
– |
– |
+ |
|
Activitate pectolitică |
scăzută |
scăzută |
ridicată |
Determinarea rasei
Rasa se poate determina (Buddenhagen et al., 1962) în baza testelor de patogenicitate la plantele de tomate sau la vinete și la plantele de tutun și printr-un test de reacție de hipersensibilitate (HR) la frunzele de tutun (Lozano și Sequeira, 1970):
|
|
Rasă (1) |
||
|
1 |
2 |
3 |
|
|
Reacția la: |
|
|
|
|
— plante de tomate/vinete |
ofilire |
nici o reacție |
ofilire |
|
— plante de tutun |
ofilire |
nici o reacție |
nici o reacție |
|
— frunze de tutun |
necroză (48 de ore) și ofilire (7-8 zile) |
HR (12-24 ore) |
Cloroză (2-8 zile) |
Caracterizarea raselor prin testul de patogenicitate sau prin testul de hipersensibilitate al tutunului poate să nu fie foarte sigure și, în schimb, pot fi deduse din biovar și gazda naturală de origine.
Cultura poate fi caracterizată în continuare prin:
|
|
|
Diferențierea moleculară a sușelor din complexul Ralstonia solanacearum se poate face prin:
|
|
Analiza RFLP (Cook et al, 1989) |
|
|
PCR pe secvențe repetitive [REP-, ERIC- & BOX-PCR (Louws et al, 1995; Smith et al, 1995)] |
4.3 Testul de patogenicitate
Acesta este un test pentru confirmarea diagnosticului de Ralstonia solanacearumși pentru evaluarea virulenței culturilor identificate ca fiind Ralstonia solanacearum.
Se prepară un inocul de 106 celule pe ml din cultură și dintr-o sușă de control pozitiv. Se inoculează 5-10 plante de tomată sau vinete, preferabil la nivelul celei de-a treia frunze adevărate sau mai bătrâne (secțiunea III.6.). Se incubează până la două săptămâni la 22-28 °C și umiditate relativă mare, udând zilnic. Se observă ofilirea și/sau epinastia, cloroza, piticirea.
Se izolează din plantele simptomatice după cum urmează:
|
— |
se îndepărtează o secțiune de țesut din tulpină la 2 cm deasupra punctului inoculării; |
|
— |
se mărunțește și se suspendă într-un volum mic de apă distilată sterilă sau cu un tampon fosfat de 50 mM. Se pune pe placă, se incubează și se verifică existența coloniilor tipice de Ralstonia solanacearum. |
SECȚIUNEA III
DETECTAREA ȘI IDENTIFICAREA RALSTONIA SOLANACEARUM ÎN EȘANTIOANELE DE TUBERCULI DE CARTOF
Notă: Mărimea standard a eșantionului este de 200 de tuberculi. Cu toate acestea procedura se poate aplica în mod convenabil eșantioanelor cu mai puțin de 200 de tuberculi.
1. Pregătirea eșantionului pentru testare
Notă: Extractul final de cartof obținut în această procedură poate fi utilizat de asemenea pentru detectarea Clavibacter michiganensis subsp. sepedonicus.
Opțiuni de pre-testare, dacă sunt considerate utile:
|
(i) |
se incubează eșantionul la 25-30 °C până la două săptămâni pentru a încuraja multiplicarea populațiilor mici de Ralstonia solanacearum; |
|
(ii) |
se spală tuberculii sub jet de apă cu dezinfectanți și detergenți corespunzători. Tuberculii se usucă la aer. |
1.1. Cu un scalpel sau un cuțit pentru plante curat și dezinfectat se îndepărtează coaja de la talonul tuberculului, astfel încât să fie vizibile țesuturile vasculare. Se taie cu atenție un miez conic mic (3-5 mm diametru) de țesut vascular de la talon. Cantitatea de țesut nevascular trebuie redusă la minim. Se prelucrează fiecare dintre tuberculii din eșantion.
Notă: În această etapă se poate efectua examinarea vizuală a tuberculilor (secțiunea II.1). Se separă orice tubercul cu simptome sau putrefacție severă și se testează separat (secțiunea II).
1.2. Se colectează taloanele într-un container închis. Este preferabil ca acestea să fie prelucrate imediat. Dacă nu este posibil, se depozitează pentru cel mult 24 de ore sau, la 4 °C, pentru nu mai mult de 72 de ore.
1.3. Se prelucrează taloanele printr-una dintre următoarele proceduri:
|
(i) |
Se transferă taloanele într-un recipient corespunzător. Se adaugă un volum suficient de tampon de macerare pentru a acoperi taloanele (apendicele 2). Taloanele se mărunțesc într-un malaxor de tip Waring Blender sau Ultra Thurrax până se atinge omogenizarea completă. Se evită omogenizarea excesivă. Se permite maceratului să absoarbă apă timp de 15-30 de minute. |
|
(ii) |
Se transferă taloanele într-un recipient corespunzător. Se adaugă un volum suficient de tampon de macerare pentru a acoperi taloanele. Se pune recipientul pe un agitator rotativ. Se incubează la 50-100 rpm timp de 4 ore la 20-22 °C sau timp de 16-24 de ore la 4 °C. |
|
(iii) |
Se transferă taloanele într-un sac de macerare rezistent de unică folosință (de exemplu, sacul Stomacher cu dimensiuni 105 mm × 150 mm, sterilizat prin radiații). Taloanele se zdrobesc cu atenție cu o unealtă corespunzătoare, de exemplu un ciocan, până la atingerea omogenizării complete. Se adaugă un volum suficient de tampon de macerare pentru a acoperi taloanele. Se permite maceratului să se așeze timp de 15-30 de minute. |
1.4. Bacteriile se extrag din taloane printr-una din următoarele proceduri:
|
(i) |
Maceratul se decantează încet într-un tub de centrifugare lăsând resturile în recipient sau în sac. Dacă maceratul decantat este tulbure, se centrifughează timp de 10 minute la cel mult 180 g la o temperatură sub 10 °C. Se centrifughează maceratul decantat sau supranatantul din prima etapă de centrifugare la 7 000 g timp de 15 minute sau la 10 000 g timp de 10 minute la o temperatură sub 10 °C. Se îndepărtează supranatantul fără a deranja extractul concentrat. |
|
(ii) |
Se filtrează maceratul printr-un sistem de filtrare cu mărimea porilor de 40-100 μm. Se accelerează filtrarea utilizând o pompă de vid. Se colectează filtratul într-un tub de centrifugare. Se spală filtrul cu tamponul de macerare. Se centrifughează filtratul la 7 000 g timp de 15 minute sau la 10 000 g timp de 10 minute la o temperatură sub 10 °C. Se îndepărtează supranatantul fără a deranja extractul concentrat. |
1.5 Se face o nouă suspensie a extractului concentrat în 1 ml de tampon de concentrare (apendicele 2).
Se împarte în două părți egale și se transferă fiecare parte într-o microfiolă.
Una dintre microfiole se folosește pentru testare. Restul extractului se conservă pe perioada testelor la temperatura de 4 °C.
Se adaugă 10-25 % (v/v) glicerol steril în cealaltă microfiolă. Se centrifughează. Se depozitează la – 18 °C (săptămâni) sau la – 70 °C (luni).
2. Testul IF
Se folosește antiserul pentru Ralstonia solanacearum, preferabil rasa 3/biovar 2. Se determină titrul unei suspensii de 106 celule pe ml din sușa omologă de Ralstonia solanacearum cu o diluție corespunzătoare de antiser conjugat cu izotiocianat de fluoresceină (FITC), în conformitate cu recomandările producătorului. Antiserul brut ar trebui să aibă o valoare IF de minim 1:2 000.
Se utilizează lame microscopice cu mai multe puțuri, de preferință cu 10 ferestre de minim 6 mm diametru.
Pe fiecare lamă de test se include un control FITC conjugat. Testul ar trebui repetat cu includerea unui control PBS, dacă este observată o celulă pozitivă la controlul FITC.
Se prepară lame de control pozitiv separate cu o suspensie de 106 celule pe ml dintr-o sușă corespunzătoare de rasă/biovar de Ralstonia solanacearum. Se utilizează o lamă la fiecare set de teste.
2.1. Lamele de test se prepară printr-una dintre următoarele proceduri:
|
(i) |
pentru extracte concentrate cu relativ puțin amidon:
|
|
(ii) |
pentru alte extracte concentrate:
|
2.2. Se lasă picăturile să se usuce. Celulele bacteriene se fixează pe lamă prin încălzire, trecere prin flacără sau cu 95 % etanol.
Procedura IF
|
(i) |
În conformitate cu pregătirea lamei de test de la 2.1, punctul (i):
|
|
(ii) |
În conformitate cu pregătirea lamei de test de la 2.1 punctul (ii):
|
||||||||||||||||||||||||||||||||||||||||||||||||||
2.3.1. Se aranjează lamele pe hârtie absorbantă.
Se acoperă ferestrele de test cu diluția sau diluțiile antiserului. În ferestrele FITC se aplică PBS. Volumul antiserului aplicat în ferestre trebuie să fie echivalent cu volumul extractului aplicat.
2.3.2. Se incubează acoperit timp de 30 de minute la temperatura camerei.
2.3.3. Se scutură picăturile de antiser de pe lamă și se clătesc lamele cu atenție cu un tampon IF. Se spală timp de cinci minute în soluție tampon IF-Tween și apoi cinci minute în tampon IF (apendicele 3). Excesul de umezeală se îndepărtează cu grijă.
2.3.4. Se aranjează lamele pe hârtie absorbantă. Se acoperă ferestrele de test și fereastra FITC cu diluția conjugatului FITC utilizat pentru determinarea titrului. Volumul conjugatului aplicat în ferestre trebuie să fie echivalent cu volumul antiserului aplicat.
2.3.5. Se incubează acoperit timp de 30 de minute la temperatura camerei.
2.3.6. Se scutură picăturile de conjugat de pe lamelă. Se clătesc și se spală ca mai sus (2.3.3). Se îndepărtează cu grijă excesul de umezeală.
2.3.7. Se pipetează 5-10 μl glicerol tamponat fosfatic 0,1 M (apendicele 3) sau un suport similar în fiecare fereastră și se acoperă.
2.4. Citirea testului IF
Se examinează lamele de test la un microscop cu epifluorescență cu filtre compatibile excitării FITC sub imersiune în ulei la o mărire de 500-1 000. Se examinează ferestrele de pe două diametre în unghi drept și de-a lungul perimetrului.
Se verifică mai întâi lama de control pozitiv. Celulele trebuie să fie intens fluorescente și colorate complet.
Notă: Testul trebuie repetat dacă apare o colorație anormală.
Se citesc lamele de test. Se observă mai întâi absența celulelor fluorescente în ferestrele de control FITC. Celulele fluorescente din controlul FITC indică legături nespecifice ale conjugatului, autofluorescență sau contaminare.
Notă: Dacă se observă acestea, testul trebuie repetat
Se observă celulele intens fluorescente cu morfologia caracteristică a Ralstonia solanacearum în ferestrele de test. Intensitatea fluorescenței trebuie să fie echivalentă cu cea a sușei de control pozitiv la aceeași diluție a antiserului. Celulele cu colorație incompletă sau cu fluorescență slabă nu trebuie luate în considerare, dacă nu sunt în număr mare (vezi interpretarea rezultatului testului IF).
Interpretarea rezultatului testului IF:
|
(i) |
Dacă nu sunt descoperite celule intens fluorescente cu morfologie caracteristică, atunci testul IF este negativ. |
|
(ii) |
Dacă sunt descoperite celule intens fluorescente cu morfologie caracteristică, se determină numărul mediu de celule pe câmp microscopic și se calculează numărul de celule (N) pe ml de extract concentrat resuspendat (apendicele 4). O populație de aproximativ 103 celule pe ml de extract concentrat resuspendat este considerată a fi limita de sensibilitate pentru testul IF,
|
|
(iii) |
dacă se observă un număr mare (> 105 celule pe ml) de celule incomplet sau slab fluorescente în titrul antiserului, trebuie efectuat un al doilea test:
|
3. Testul ELISA
În baza Robinson-Smith et al., 1995
Se folosește antiser pentru Ralstonia solanacearum, preferabil rasa 3/biovar 2. Se determină titrul suspensiei de 106 celule pe ml din sușa omologă de Ralstonia solanacearum.
Se recomandă folosirea plăcilor de microtitrare NUNC-Polysorb.
Se include un extract de cartof de control negativ și un control salin tamponat fosfatic (PBS).
Se folosește o suspensie de >106 celule pe ml dintr-o sușă corespunzătoare de rasă/biovar de Ralstonia solanacearum drept control pozitiv. Se testează în mod identic cu eșantionul sau eșantioanele, dar separat de eșantioanele de pe placa de microtitru.
3.1. Se pipetează 100-200 μl din extractul concentrat resuspendat într-o microfiolă.
Se încălzește timp de 4 minute la 100 °C. Se pune microfiola la gheață.
3.2. Se adaugă un volum egal de tampon de acoperire din carbonat dublu concentrat (apendicele 5). Se centrifughează.
3.3. Se aplică 100 μl alicote fiecăreia dintre minim ultimele două puțuri ale plăcii de microtitrare. Se incubează o oră la 37 °C sau peste noapte la 4 °C.
3.4. Se scot extractele din puțuri. Se spală puțurile de trei ori cu PBS-Tween (apendicele 5), lăsând ultima soluție de spălare cel puțin cinci minute în puțuri.
3.5. Se prepară diluția corespunzătoare a antiserului de Ralstonia solanacearum în tampon de blocare (apendicele 5). Se aplică 100 μl de diluție de antiser în puțuri.
Se incubează o oră la 37 °C.
3.6. Se scoate antiserul din puțuri. Se spală ca mai înainte (3.4).
3.7. Se prepară diluția corespunzătoare de conjugat de fosfatază alcalină în tampon de blocare. Se aplică 100 μl de diluție conjugată în puțuri.
Se incubează o oră la 37 °C.
3.8. Se scoate conjugatul din puțuri. Puțurile se spală ca mai înainte (3.4 și 3.6).
3.9. Se prepară soluția de substrat de fosfatază alcalină (apendicele 5). Se aplică 100 μl în puțuri. Se incubează timp de 30 de minute până la o oră în întuneric la temperatura camerei.
3.10. Se citește absorbanța la 409 nm.
Interpretarea testului ELISA:
Testul ELISA este negativ dacă densitatea optică (DO) a eșantionului este < 2 × DO a controlului negativ.
Testul ELISA este pozitiv dacă densitatea optică (DO) a eșantionului este > 2 × DO a controlului negativ.
4. Testul PCR
În baza Seal et al., 1993
Notă: În timpul tuturor etapelor de pregătire a eșantioanelor și a altor manipulări care implică PCR trebuie folosite conuri de pipetă cu filtru.
Se prepară o suspensie de 106 celule pe ml dintr-o sușă din rasa 3/biovar 2 de Ralstonia solanacearum drept control pozitiv. Se testează într-un mod identic cu eșantionul sau eșantioanele.
4.1. Se pipetează 100 μl din extractul concentrat resuspendat într-o microfiolă.
În mod alternativ, se tranferă 90 μl din extractul concentrat resuspendat într-o microfiolă conținând 10 μl de 0,5M de NaOH. Se amestecă întorcând în mod repetat microfiola.
4.2. Se încălzește timp de 4 minute la 100 °C. Se pune imediat microfiola la gheață.
4.3. Se prepară cel puțin două soluții decimale, de exemplu 1/10 și 1/100 sau mai multe dacă se consideră util, în apă distilată sterilă sau ultrapură (AUP).
4.4. Se prepară amestecul de reacție PCR (apendicele 6) într-o fiolă sterilă, prin adăugarea următoarelor componente în ordinea următoare:
Pentru un volum de reacție de 50 μl:
|
Component |
Cantitate |
Concentrație finală |
|
Apă distilată sterilă sau AUP |
30,8 μl – 33,8 μl |
|
|
Tampon PCR × 10 |
5,0 μl |
1× |
|
d-ATP |
1,0 μl |
0,2 mM |
|
d-CTP |
1,0 μl |
0,2 mM |
|
d-GTP |
1,0 μl |
0,2 mM |
|
d-TTP |
1,0 μl |
0,2 mM |
|
Amorsă OLI-1 (20 μΜ) |
2,5 μl |
1 μΜ |
|
Amorsă Y-2 (20 μΜ) |
2,5 μl |
1 μΜ |
|
Polimerizare taq (5U/μl) |
0,2 μl |
1,0 U |
|
Volum total |
45-48 μl |
|
Pentru mai multe reacții:
Se calculează cantitatea din fiecare component pentru numărul cerut de reacții.
Se amestecă aceste componente și se transferă 45 μl – 48 μl din amestec în fiole PCR sterile.
Fiolele cu amestecul de reacție PCR se păstrează la gheață.
Pentru volume de reacție de 25 μl:
Se diminuează corespunzător componenții.
4.5. Amplificarea PCR
4.5.1. Opțional: se centrifughează pulsatoriu fiolele cu eșantionul fiert și cu controlul pozitiv.
Se adaugă în fiolele cu amestecul de reacție PCR, în ordinea specificată, 2-5 μl din eșantion sau eșantioane, apă și controlul pozitiv. Se pun fiolele în blocul de încălzire al ciclorului termic de ADN.
4.5.2. Se rulează următorul program:
1 ciclu de:
(i) 2 minute la 96 °C: denaturarea modelului
50 cicluri de:
(ii) 20 de secunde la 94 °C: denaturare
(iii) 20 de secunde la 68 °C: hibridarea amorselor
(iv) 30 de secunde la 72 °C: extinderea copiei
1 ciclu de:
(v) 10 minute la 72 °C: extindere finală
1 ciclu de:
|
(vi) |
menținere la 4 °C |
Notă: Acești parametri sunt pentru Perkin Elmer 9600. Alte cicluri termice pot necesita un strat de ulei mineral în fiolele de reacție PCR și/sau modificarea duratei etapelor (ii), (iii) și (iv) din profilul de amplificare.
4.5.3. Se scot fiolele din ciclorul termic. Se analizează produsul PCR. Dacă nu se efectuează imediat, fiolele se păstrează la 4 °C, dacă se folosesc în aceeași zi, și la –18 °C pentru o durată mai mare.
Analiza produsului PCR
Fragmentele PCR se detectează prin electroforeză în gel de agar și colorare cu bromură de etidiu.
4.6.1. Se prepară un mediu agarizat corespunzător aducând încet la fierbere agaroza în tampon de electroforeză tri-acetată (ETA).
4.6.2 Se răcește agaroza topită la 50-60 °C, se toarnă în cuva electroforezei și se introduce pieptenul. Soluția se lasă să se solidifice.
4.6.3 Se îndepărtează pieptenul. Gelul se introduce în ETA astfel încât să fie acoperit 2-3 mm de tampon.
4.6.4 Se pun 3 μl de picături de tampon de încărcare pe parafilm. Se adaugă 12 μl din produsul PCR din eșantion, din controlul pozitiv sau din controlul de apă și de amestecă prin aspirarea ușoară în conul pipetei înainte de încărcare. Volumele date pot fi modificate pentru a corespunde capacității puțurilor din mediul agarizat.
4.6.5 Puțurile se încarcă atent cu gel. Pentru referință, se include un marcator de ADN corespunzător în cel puțin unul dintre puțuri.
4.6.6 Se conectează firele de alimentare și cele ale echipamentului pentru electroforeză. Gelul este pus sub tensiune la 5-8 V/cm până când partea din față a indicatorului de urmărire este la 1 cm de capătul gelului.
4.6.7 Se oprește alimentarea. Se deconectează firele unității de electroforeză.
Gelul se îndepărtează cu atenție. Se înmoaie în soluție de bromură de etidiu timp de 30-45 minute.
Notă: Se poartă mănuși de unică folosire pe toată perioada manipulării bromurii de etidiu care este un mutagen puternic!
4.6.8 Se decolorează în apă distilată timp de 10-15 minute.
4.6.9 Fragmentul sau fragmentele de ADN amplificate se vizualizează prin iluminare ultravioletă. Produsul PCR de Ralstonia solanacearum cu setul de amorse OLI-1 și Y-2 are lungimea de 288 bp. Se compară cu marcatorul de ADN și cu controlul pozitiv.
Notă: Controlul de apă trebuie să fie negativ în toate cazurile. Dacă este pozitiv, testul se repetă.
4.6.10. Dacă este necesară o înregistrare permanentă, se fotografiază gelul.
4.6.11. Autenticitatea fragmentului amplificat este confirmată prin analiza enzimatică restrictivă (REA).
Analiza enzimatică restrictivă (REA)
4.7.1. Se transferă 8,5 μl din produsul PCR (4.5.3) într-o altă microfiolă. Se adaugă 1 μl din tamponul enzimatic ×10 și 0,5 μl din enzima de restricție Ava II.
4.7.2 Se amestecă prin aspirarea ușoară în conul pipetei. Dacă rămân picături pe pereții fiolei, se rotește pulsator într-o microcentrifugă. Se incubează o oră la 37 °C.
4.7.3 Fragmentul PCR digerat se analizează prin electroforeza în gel de agar ca mai înainte (4.6).
Interpretarea rezultatelor testului PCR:
Testul PCR este negativ dacă nu este detectat fragmentul caracteristic de 288 bp, iar fragmentul este detectat pentru sușa de control pozitiv de Ralstonia solanacearum.
Testul PCR este pozitiv dacă este detectat fragmentul caracteristic de 288 bp, iar fragmentul amplificat este identic cu sușa de control pozitiv de Ralstonia solanacearum.
5. Testul de placare selectivă
În baza Elphinstone et al., 1996
5.1 Testul se efectuează printr-o tehnică corespunzătoare de diluare galvano-plastică, cum ar fi:
|
(i) |
Se prepară cel puțin două diluții zecimale, 1/10 și 1/100 sau mai multe, dacă se consideră util, din extractul concentrat resuspendat în tamponul de concentrare. Se pipetează un volum standard măsurat (50-100 μl) din extractul concentrat resuspendat și fiecare diluție într-un mediu selectiv SMSA modificat (apendicele 7) și se împrăștie cu o baghetă de sticlă pe toată suprafața mediului. Dacă se consideră util, se face o striere a diluției de 10 μl din extractul concentrat resuspendat. Bucla se trece prin flacără între striații. |
|
(ii) |
Se transferă un volum standard măsurat (50-100 μl) din extractul concentrat resuspendat în mediul selectiv SMSA modificat și se împrăștie cu o baghetă de sticlă pe toată suprafața mediului. Bagheta se întinde pe cel puțin alte două plăci cu mediu SMSA modificat fără a se trece prin flacără. |
5.2 Prin aceeași tehnică de diluție, se aplică o suspensie de 106 celule pe ml dintr-o sușă virulentă din rasa 3/biovar 2 de Ralstonia solanacearum drept control pozitiv pe un set de plăci separate cu mediu SMSA modificat.
5.3 Plăcile se incubează la 28 °C. Citirea plăcilor se face după trei zile. Dacă este negativă, se mai incubează până la șase zile. Coloniile de izolate virulente de Ralstonia solanacearum sunt de culoare alb-lăptos, plate, neregulate și fluide cu o colorație roșie-sângerie în centru și prezentând spirale sau dungi interne.
5.4 Coloniile cu morfologie caracteristică se purifică prin subcultivare într-un mediu nutritiv comun (apendicele 1).
5.5 Identificarea culturilor pure (secțiunea II, 4.1) și confirmarea culturilor de Ralstonia solanacearum se face printr-un test de patogenicitate (secțiunea II, 4.3).
Interpretarea rezultatului testului de placare selectivă:
Testul de placare selectivă este negativ dacă după șase zile nu sunt izolate colonii bacteriene sau dacă nu sunt izolate colonii caracteristice Ralstonia solanacearum, cu condiția să nu fie bănuită o inhibiție din cauza coloniilor unei alte bacterii și ca coloniile caracteristice de Ralstonia solanacearum să fie găsite în controalele pozitive.
Testul de placare selectivă este pozitiv dacă sunt izolate colonii caracteristice de Ralstonia solanacearum.
6. Testul de probă biologică
În baza Janse, 1988.
6.1 Se utilizează până la 10 plante test de răsad de tomată sau de vinete în stadiul celei de-a treia frunze adevărate pentru fiecare eșantion. Plantele de test nu se udă cu 24 de ore înaintea inoculării.
6.2 Se distribuie 100 μl de extract concentrat resuspendat între plantele de test. Se inoculează în tulpină între cotiledoane și în unul sau mai multe alte locuri.
6.3 Prin aceeași tehnică se inoculează 10 răsaduri cu o suspensie de 106 celule pe ml dintr-o sușă virulentă din biovar 2/rasa 3 de Ralstonia solanacearum drept control pozitiv și cu tampon de concentrare drept control negativ. Se separă plantele de control pozitiv de celelalte plante pentru a evita contaminarea încrucișată.
6.4 Plantele se cresc în continuare până la patru săptămâni la 22-28 °C și umiditate relativă mare, udându-le zilnic. Se observă ofilirea, epinastia, cloroza și/sau piticirea.
6.5 Se izolează de plantele infectate (secțiunea II). Se identifică culturile pure cu morfologie caracteristică (secțiunea II.4.1) și se confirmă culturile de Ralstonia solanacearum printr-un test de patogenicitate (secțiunea II.4.3).
6.6 Dacă se consideră util, se verifică absența infecției în loturile de plante de test care nu prezintă semne de infecție. Din fiecare plantă de test se îndepărtează o secțiune de 1 cm de tulpină 2 cm deasupra punctului de inoculare. Se omogenizează țesuturile într-un tampon de macerare. Se efectuează o diluare galvano-plastică (secțiunea III.5.1) Dacă este pozitivă, se identifică culturile pure cu morfologie caracteristică (secțiunea II.4.1) și se confirmă culturile de Ralstonia solanacearum printr-un test de patogenicitate (secțiunea II.4.3).
Interpretarea rezultatelor testului de probă biologică:
Testul de probă biologică este negativ dacă plantele de test nu sunt infectate cu Ralstonia solanacearumși cu condiția ca Ralstonia solanacearum să fie detectată în controalele pozitive.
Testul de probă biologică este pozitiv dacă plantele de test sunt infectate cu Ralstonia solanacearum.
7. Teste de îmbogățire
În baza Elphinstone et al., 1996
7.1 Se transferă 100 μl de extract concentrat resuspendat în 3 ml de mediu nutritiv SMSA modificat (apendicele 7).
7.2 Se incubează timp de 48 de ore și în nici un caz mai mult de 72 de ore la temperatura de 28 °C, fără a închide ermetic dopul tubului, pentru a permite aerisirea.
7.3 Se fixează dopul și se centrifughează. Se utilizează alicote pentru testul IF (prezenta secțiune, 2.), testul ELISA (prezenta secțiune, 3.) și/sau testul PCR (prezenta secțiune, 4.).
8. Testul de patogenicitate
A se vedea secțiunea II, 4.3.
Apendicele 1
Medii nutritive pentru izolarea și cultura de Ralstonia solanacearum
|
|
Se prepară volume de ½ litri de mediu în flacoane de 1 litru. Se dizolvă ingredientele. Se sterilizează prin autoclavizare la 121 °C timp de 15 minute. Se răcește la 50 °C. Se toarnă pe plăci. |
|
|
Se prepară volume de ½ litri de mediu în flacoane de 1 litru. Se dizolvă ingredientele. Se sterilizează prin autoclavizare la 121 °C timp de 15 minute. Se răcește la 50 °C. Se toarnă pe plăci. |
|
|
Se prepară volume de ½ litri de mediu în flacoane de 1 litru. Se dizolvă ingredientele. Se ajustează la pH 7,2-7,4, dacă este necesar. Se sterilizează prin autoclavizare la 121 °C timp de 15 minute. Se răcește la 50 °C. Se toarnă pe plăci. |
|
|
Se prepară volume de ½ litri de mediu în flacoane de 1 litru. Se dizolvă ingredientele. Se sterilizează prin autoclavizare la 121 °C timp de 15 minute. Se răcește la 50 °C. Se adaugă o soluție apoasă sterilizată prin filtrare de clorură de trifeniltetrazoliu (Sigma) pentru obținerea concentrației finale de 50 mg la litru. Se toarnă pe plăci. |
Apendicele 2
Materiale pentru pregătirea eșantioanelor
|
|
Acest tampon este utilizat la macerarea țesuturilor.
Se dizolvă ingredientele și se verifică pH-ul. Se divizează în părți alicote după cum se consideră necesar. Se sterilizează prin autoclavizare la 121 °C timp de 15 minute. Este recomandată adăugarea de 5 % polivinilpirolidonă-40000 MWT (PVP-40) la efectuarea testului PCR direct, pentru a reduce incidența inhibiției amplificării datorate moleculelor aromatice din extract. Este recomandată adăugarea unui peptizant, a unui agent antispumant sau a unui antioxidant la folosirea procedurii de omogenizare cu ajutorul malaxorului de tip Waring Blender sau Ultra Turrax pentru macerarea miezului de țesut de cartof.
Se autoclavizează separat. Se adaugă până la concentrația dorită. |
|
|
Acest tampon este utilizat pentru resuspendarea și diluția talonului și extractelor concentrate de cartof.
Se dizolvă ingredientele și se verifică pH-ul. Se divizează în părți alicote după cum se consideră necesar. Se sterilizează prin autoclavizare la 121 °C timp de 15 minute. |
Apendicele 3
Materiale pentru testul IF
|
|
Acest tampon este utilizat pentru diluarea antiserurilor.
Se dizolvă ingredientele și se verifică pH-ul. Se divizează în părți alicote după cum se consideră necesar. Se sterilizează prin autoclavizare la 121 °C timp de 15 minute. |
|
|
Tampon IF-Tween Acest tampon este utilizat pentru spălarea lamelor. Se adaugă 0,1 % Tween 20 la tamponul IF. |
|
|
0,1 M glicerol tamponat fosfatic pH 7,6 Acest tampon este utilizat ca fluid de suport la ferestrele lamei IF pentru mărirea fluorescenței.
|
Apendicele 4
Determinarea nivelului de contaminare în testul IF
|
Suprafața (S) a ferestrei lamei multipuț
unde D este diametrul ferestrei |
(1) |
|||||||||
|
Suprafața (s) a câmpului obiectivului
Unde d este diametrul câmpului |
(2) |
|||||||||
|
Se calculează d fie prin măsurare directă sau din următoarele formule:
unde
|
(3) |
|||||||||
|
din (2)
|
(4) |
|||||||||
|
din (3)
Se calculează numărul de celule fluorescente tipice pe câmp (c). Se calculează numărul de celule fluorescente tipice pe fereastră (C).
Se calculează numărul de celule fluorescente tipice pe ml de extract concentrat (N).
unde
|
|
Apendicele 5
Materiale pentru testul ELISA
|
|
Se dizolvă ingredientele și se verifică pH-ul. Se divizează în părți alicote după cum se consideră necesar. Se sterilizează prin autoclavizare la 121 °C timp de 15 minute. Poate fi adăugat sulfit de sodiu la o concentrație finală de 0,2 % ca antioxidant dacă extractul conține un procent ridicat de molecule aromatice. |
|
|
Se dizolvă ingredientele și se verifică pH-ul. Se divizează în părți alicote după cum se consideră necesar. Se sterilizează prin autoclavizare la 121 °C timp de 15 minute. |
|
|
|
|
|
|
|
|
Se amestecă și se ajustează la pH 9,8 cu HCl concentrat. Se adaugă apă distilată până la 1 litru. Se adaugă 0,2 g MgCl2. Se dizolvă două tablete de 5 mg de substrat de fosfatază (Sigma) la 15 ml de soluție. |
Apendicele 6
Materiale pentru testul PCR
|
|
Pentru materiale a se vedea Seal et al (1993). |
Apendicele 7
Materiale pentru testele de placare selectivă și de îmbogățire
|
|
(Engelbrecht, 1994 modificat de Elphinstone et al, 1996) dar se elomină geloza și sărurile de tetrazoliu.
Se prepară volume de ½ litri de mediu în flacoane de 1 litru. Se dizolvă ingredientele și se verifică pH-ul. Se ajustează pH-ul, dacă este necesar, la 6,5 înainte de autoclavizare. Ralstonia solanacearum nu se dezvoltă bine într-un mediu cu pH > 7,0. Se sterilizează prin autoclavizare la 121 °C timp de 15 minute. Se răcește la 50 °C. Se adaugă următoarele ingrediente (toate de Sigma) pentru a obține concentrațiile finale specificate:
Se dizolvă ingredientele în 70 % etanol la concentrațiile date pentru volumul de mediu preparat. Unele ingrediente ca polimixina B și cloramfenicolul necesită o ușoară încălzire și agitare. (Elphinstone et al., 1996) Se prepară ca și pentru mediul selectiv SMSA, dar se elimină geloza. Se împarte în alicote de 3 ml în tuburi de unică folosință Universal de 30 ml. |
Bibliografie
Buddenhagen, I.W.; Sequeira, L. and Kelman, A., 1962. Description of races in Pseudomonas solanacearum. Phytopathology 52, 726.
Cook, D.; Elizabeth B. and Sequeira L., 1989. Genetic diversity of Pseudomonas solanacearum: detection of restriction fragment length polymorphism with DNA probes that specify virulence and hypersensitive respons. Molecular Plant-Microbe Interactions 2, 113—121.
Dinesen I.G. and DeBoer, S.H., 1995. Extraction of Clavibacter michiganensis subsp. sepedonicus from composite samples of potato tubers. American Potato Journal 72, 133—142.
Elphinstone, J.G.; Hennessy, J.; Wilson, J. and Stead, D.E., 1996. Sensitivity of different methods for the detection of Pseudomonas solanacearum (Smith) Smith in potato tuber extracts. EPPO Bulletin 26.
Engelbrecht, M.C., 1994. Modification of a semi-selective medium for the isolation and quantification of Pseudomonas solanacearum. ACIAR Bacterial Wilt Newsletter 10, 3—5.
Hayward, A.C., 1964. Characteristics of Pseudomonas solanacearum. Journal of Applied Bacteriology 27, 265—277.
Hayward, A.C., 1994. Systematic and phylogeny of Pseudomonas solanacearum and related bacteria. In: Bacterial Wilt: the disease and its causative agent, Pseudomonas solanacearum (eds. A.C. Hayward and G.L. Hartman) CAB International Oxford, 127—135.
Janse, J.D., 1988. A detection method for Pseudomonas solanacearum in symptomless potato tubers and some data on its sensitivity and specificity. EPPO Bulletin 18, 343—351.
Janse, J.D., 1991. Infra- and intraspecific classification of Pseudomonas solanacearum strains using whole cell fatty acid analysis. Systematic and Applied Microbiology 14, 335—345.
Kelman, A., 1954. The relationship of pathogenicity in Pseudomonas solanacearum to colony appearance on a tetrazolium medium. Phytopathology 64, 293—695.
Lelliot, R.A. and Stead, D.E., 1987. Methods for the diagnosis of bacterial diseases of plants. (T.F. Preece ed.) Blackwell Scientific Publications, Oxford. 216 pp.
Louws, F.J.; Fulbright, D.W.; Stephens, C.T. and De Bruijn, F.J., 1995. Differentiation of genomic structure by rep-PCR fingerprinting to rapidly classify Xanthomonas campestris pv. vesicatoria. Phytopathology 85, 528—536.
Lozano, J.C. and Sequeira, L., 1970. Differentiation of races of Pseudomonas solanacearum by a leaf infiltration technique. Phytopathology 60, 838.
Mirza, M.S.; Rademaker, J.W.L.; Janse, J.D. and Akkermans, A.D.L., 1993. Specific 16S ribosomal RNA targeted oligonucleotide probe against Clavibacter michiganensis subsp. sepedonicus. Canadian Journal of Microbiology 39, 1029—1034.
Robinson-Smith, A.; Jones, P.; Elphinstone, J.G. and Forde, S.M.D., 1995. Production of antibodies to Pseudomonas solanacearum, the causative agent of bacterial wilt. Food and Agricultural Immunology 7, 67—79.
Seal, S.E.; Jackson, L.A.; Young, J.P.W. and Daniels, M.J., 1993. Differentiation of Pseudomonas solanacearum, P. syzygii, P. picketti and the blood disease bacterium by partial 16S rRNA sequencing: construction of oligonucleotide primers for sensitive detection by polymerase chain reaction. Journal of General Microbiology 139, 1587—1594.
Smith, J.J.; Offord, L.C.; Holderness, M. and Saddler, G.S., 1995. Genetic diversity of Burkholderia solanacearum (synonym Pseudomonas solanacearum) race 3 in Kenya. Applied and Environmental Microbiology 61, 4262—4268.
Stead, D.E., 1992a. Techniques for detecting and identifying plant pathogenic bacteria. In: Techniques for rapid detection of plant pathogens (eds. J.M. Duncan and L. Torrance). Blackwell Scientific Publications, Oxford, 76—111.
Stead, D.E., 1992b. Grouping of plant pathogenic and some other Pseudomonas spp. using cellular fatty acid profiles. International Journal of Systematic Bacteriology 42, 281—295.
Van Beuningen, A.; Derks, H. and Janse J.D., 1995. Detection and identification of Clavibacter michiganensis subsp. sepedonicus with special attention to fluorescent in-situ hybridisation (FISH) using a 16S rRNA targeted oligonucleotide probe. Züchtungsforschung 2, 266—269.
(1) rasa 4 (patogenă pentru ghimbir și alte câteva plante gazdă) și rasa 5 (patogenă doar pentru dud) nu sunt incluse.
(2) Dacă se consideră necesar, mărirea concentrației de bacitracin la 300 ppm poate reduce contaminarea cu bacterii saprofite fără a reduce recuperarea de Ralstonia solanacearum.
ANEXA III
1. Pentru fiecare apariție suspectată pentru care a fost identificat un rezultat pozitiv în testul sau testele de triere în conformitate cu metoda relevantă stabilite în anexa II pentru materialul vegetal enumerat sau, în toate celelalte cazuri, orice altă metodă aprobată oficial, și pentru care este așteptată confirmarea sau infirmarea prin finalizarea respectivei metode, ar trebui să se păstreze și să conserve în mod corespunzător:
|
— |
lotul sau o parte din acesta (din care au fost luate eșantioanele) în ambalajul original etichetat, de câte ori este posibil; |
|
— |
partea rămasă din eșantioane, de câte ori este posibil; |
|
— |
orice rest de extras și material preparat suplimentar pentru testul sau testele de triere, de exemplu lamele de imunofluorescență și |
|
— |
toată documentația relevantă, |
până la finalizarea respectivei metode.
2. În cazul confirmării organismului, ar trebui să se păstreze și să se conserve în condiții corespunzătoare:
|
— |
materialul prevăzut la alineatul (1); |
|
— |
un eșantion din tomata sau vânăta infectată inoculată cu extractul de plantă sau tubercul, dacă este cazul și |
|
— |
cultura izolată a organismului, |
până cel puțin o lună după procedura de notificare prevăzută în articolul 5 alineatul (2).
ANEXA IV
Elementele din investigația prevăzută în articolul 5 alineatul (1), litera (a), punctul (i) includ, când sunt relevante:
|
(i) |
locurile de producție
|
|
(ii) |
apa de suprafață utilizată la irigarea sau stropirea sau care a inundat unul sau mai multe câmpuri sau locuri de producție confirmate ca fiind infectate cu organismul. |
ANEXA V
1. Elementele care determină amploarea contaminării probabile în conformitate cu articolul 5 alineatul (1), litera (a), punctul (iii) și litera (c), punctul (iii) includ, când este relevant:
|
— |
materialul vegetal enumerat cultivat într-un loc de producție desemnat ca fiind contaminat în conformitate cu articolul 5, alineatul (1), litera (a), punctul (ii); |
|
— |
locurile de producție cu o legătură de producție către materialului vegetal enumerat desemnat ca fiind contaminat în conformitate cu articolul 5 alineatul (1) litera (a) punctul (ii), inclusiv cele care partajează echipamente de producție și facilități în mod direct sau printr-un contractant comun; |
|
— |
materialul vegetal enumerat produs în locul sau locurile de producție prevăzute în liniuța precedentă sau prezent în acest loc sau aceste locuri de producție în timpul perioadei în care materialul vegetal enumerat desemnat ca fiind contaminat în conformitate cu articolul 5 alineatul (1), litera (a), punctul (ii) a fost prezent la locul de producție prevăzut la prima liniuță; |
|
— |
depozitele care manipulează materialul vegetal enumerat provenit din locurile de producție de mai sus; |
|
— |
orice utilaj, vehicul, vas, depozit sau unități ale acestora și orice alte obiecte inclusiv, materialul de ambalare, care ar fi putut intra în contact cu materialul vegetal enumerat desemnat ca fiind contaminat în conformitate cu articolul 5, alineatul (1), litera (a), punctul (ii); |
|
— |
oricare material vegetal enumerat depozitat sau în contact cu oricare dintre structurile sau obiectele enumerate la liniuța precedentă, înainte de curățarea și dezinfectarea acestor structuri sau obiecte; |
|
— |
ca rezultat al investigației și testării în conformitate cu articolul 5, alineatul (1), litera (a) punctul (ii), în cazul cartofilor, acei tuberculi sau plante cu o relație de rudenie clonală colaterală sau ascendentă, și în cazul tomatelor, acele plante cu aceeași sursă ca materialul vegetal enumerat desemnat ca fiind contaminat în conformitate cu articolul 5, alineatul (1), litera (a), punctul (ii) și pentru care apare ca probabilă contaminarea printr-o legătură clonală, deși rezultatele testării pot să fi fost negative pentru organism; |
|
— |
locul sau locurile de producție ale materialului vegetal enumerat prevăzute la liniuța precedentă; |
|
— |
locul sau locurile de producție ale materialului vegetal enumerat care utilizează apă pentru irigare sau stropire care a fost desemnată ca fiind contaminată în conformitate cu articolul 5, alineatul (1), litera (c), punctul (ii); |
|
— |
materialul vegetal enumerat produs în câmpurile inundate cu apă de suprafață confirmată ca fiind infectată cu organismul. |
2. Determinarea unei posibili răspândiri în conformitate cu articolul 5, alineatul (1), litera (a), punctul (iv) și 5, alineatul (1), litera (c), punctul (iii) include:
|
(i) |
în cazurile prevăzute la articolul 5, alineatul (1), litera (a), punctul (iv), o luare în considerare a următoarelor elemente:
|
|
(ii) |
în cazurile în care apa de suprafață a fost desemnată ca fiind contaminată în conformitate cu articolul 5, alineatul (1), litera (c), punctul (ii):
|
3. Detaliile notificării prevăzute la articolul 5, alineatul (2), primul paragraf includ:
|
— |
data raportării apariției suspectate în conformitate cu articolul 4 și datele de eșantionare și confirmare a prezenței organismului în conformitate cu articolul 5, după caz; |
|
— |
o descriere a elementelor contaminării desemnate și a demarcării zonei. |
4. Detaliile notificării suplimentare prevăzute în articolul 5, alineatul (2), al doilea paragraf includ:
|
— |
pentru orice transport sau lot de cartofi desemnat ca fiind contaminat, certificatele prescrise în articolele 7 și 8 din Directiva 77/93/CEE, numărul pașaportului sau numărul de înregistrare al producătorilor de cartofi, depozitele colective și centrele de expediere, după caz; |
|
— |
pentru orice transport sau lot de plante de tomate desemnat ca fiind contaminat, certificatele prescrise în articolele 7 și 8 din Directiva 77/93/CEE și numărul pașaportului, în conformitate cu lista din Directiva 77/93/CEE, anexa V, partea A, secțiunea 1.2.2; |
|
— |
denumirea soiului și a categoriei pentru stocurile de cartofi de sămânță și, dacă este posibil, în toate celelalte cazuri; |
|
— |
alte asemenea informații legate de izbucnirea confirmată, pe care ar putea să le ceară Comisia. |
ANEXA VI
1. Cu trimitere la articolul 6, alineatul (1), prevederile sunt:
|
— |
incinerarea; |
|
— |
utilizarea ca furaje pentru animale după tratament termic, astfel încât să nu existe riscul supraviețuirii organismului; |
|
— |
îngroparea profundă într-un loc de eliminare unde nu există riscul infiltrării în terenul agricol sau al contactului cu surse de apă care ar putea fi utilizate pentru irigarea terenului agricol; |
|
— |
prelucrare industrială prin livrare directă și imediată către o uzină de prelucrare cu facilități de eliminare a deșeurilor aprobate oficial care se conformează dispozițiilor prevăzute în anexa VII la prezenta directivă sau |
|
— |
alte măsuri, cu condiția să se fi stabilit că nu există nici un risc identificabil de răspândire a organismului; aceste măsuri sunt notificate imediat Comisiei și celorlalte state membre. |
2. Utilizarea sau eliminarea corespunzătoare a materialului vegetal enumerat prevăzut în articolul 6 alineatul (2), sub controlul organismelor oficiale responsabile ale statului membru sau ale statelor membre în cauză, cu o comunicare corespunzătoare între organismele oficiale responsabile de asigurarea acestui control în orice moment și aprobarea de către organismul oficial responsabil ale statului membru în care cartofii urmează să fie ambalați sau prelucrați în legătură cu facilitățile de eliminare a deșeurilor prevăzute în prima și a doua liniuță, sunt:
|
(i) |
pentru tuberculi de cartofi:
|
|
(ii) |
pentru alte părți de plantă, inclusiv resturi de tulpină sau frunziș,
|
3. Metodele corespunzătoare de decontaminare a obiectelor prevăzute în articolul 6 alineatul (3) sunt curățarea și, dacă este cazul, dezinfectarea, astfel încât să nu existe nici un risc identificabil de răspândire a organismului și sunt aplicate sub supravegherea organismelor oficiale responsabile ale statelor membre.
4. Seria de măsuri care urmează să fie puse în aplicare de statele membre în cadrul zonei sau zonelor demarcate stabilite în conformitate cu articolul 5 alineatul (1) litera (a) punctul (iv) și litera (c) punctul (iii) și prevăzute în articolul 6 alineatul (4) includ:
4.1 În cazurile în care locurile de producție au fost desemnate ca fiind contaminate în conformitate cu articolul 5 alineatul (1) litera (a) punctul (ii):
|
(a) |
într-un câmp sau o unitate de producție de cultură protejată desemnată ca fiind contaminată în conformitate cu articolul 5 alineatul (1) litera (a) punctul (ii)
|
|
(b) |
pe alte câmpuri:
|
|
(c) |
imediat după desemnarea contaminării în conformitate cu articolul 5 alineatul (1) litera (a) punctul (ii) și în fiecare dintre anii de cultivare următori până la inclusiv primul sezon permis pentru recoltarea cartofilor și tomatelor pe câmpul sau câmpurile desemnate ca fiind contaminate, după cum se detaliază la litera (a):
|
|
(d) |
într-o unitate de producție de cultură protejată desemnată ca fiind contaminată în conformitate cu articolul 5 alineatul (1) litera (a) punctul (ii) unde este posibilă înlocuirea completă a mediului de cultivare,
|
4.2 În cadrul zonei demarcate, fără să aducă atingere măsurilor detaliate la 4.1, statele membre:
|
(a) |
imediat după contaminarea desemnată și pentru cel puțin 3 ani de cultivare:
|
|
(b) |
instituie un program, dacă este cazul, de înlocuire a tuturor stocurilor de cartofi de sămânță într-o perioadă corespunzătoare de timp. |
ANEXA VII
Facilitățile de eliminare a deșeurilor aprobate oficial prevăzute la anexa VI alineatul (1) a patra liniuță sunt conforme cu următoarele dispoziții, astfel încât să se prevină riscul de răspândire a organismului:
|
(i) |
deșeurile din prelucrarea cartofilor și tomatelor (inclusiv cartofii, cojile de cartofi și tomatele aruncate) și orice alte deșeuri solide asociate cu cartofii și tomatele sunt eliminate prin:
|
|
(ii) |
deșeuri de prelucrare lichide: înaintea eliminării, deșeurile lichide care conțin solide în suspensie sunt supuse filtrării sau decantării pentru îndepărtarea acestor solide. Aceste solide sunt eliminate în conformitate cu cele stabilite la punctul (i) de mai sus. Deșeurile lichide:
|