ISSN 1977-0693
Journal officiel
de l'Union européenne
L 110

Édition de langue française
Législation
61e année
30 avril 2018
|
ISSN 1977-0693 |
||
|
Journal officiel de l'Union européenne |
L 110 |
|

|
||
|
Édition de langue française |
Législation |
61e année |
|
|
|
|
|
(1) Texte présentant de l'intérêt pour l'EEE. |
|
FR |
Les actes dont les titres sont imprimés en caractères maigres sont des actes de gestion courante pris dans le cadre de la politique agricole et ayant généralement une durée de validité limitée. Les actes dont les titres sont imprimés en caractères gras et précédés d'un astérisque sont tous les autres actes. |
II Actes non législatifs
RÈGLEMENTS
|
30.4.2018 |
FR |
Journal officiel de l'Union européenne |
L 110/1 |
RÈGLEMENT D'EXÉCUTION (UE) 2018/659 DE LA COMMISSION
du 12 avril 2018
relatif aux conditions d'entrée dans l'Union d'équidés vivants et de sperme, d'ovules et d'embryons d'équidés
(Texte présentant de l'intérêt pour l'EEE)
LA COMMISSION EUROPÉENNE,
vu le traité sur le fonctionnement de l'Union européenne,
vu la directive 91/496/CEE du Conseil du 15 juillet 1991 fixant les principes relatifs à l'organisation des contrôles vétérinaires pour les animaux en provenance des pays tiers introduits dans la Communauté et modifiant les directives 89/662/CEE, 90/425/CEE et 90/675/CEE (1), et notamment son article 3, paragraphe 2, et son article 9, paragraphe 1, point c),
vu la directive 92/65/CEE du Conseil du 13 juillet 1992 définissant les conditions de police sanitaire régissant les échanges et les importations dans la Communauté d'animaux, de spermes, d'ovules et d'embryons non soumis, en ce qui concerne les conditions de police sanitaire, aux réglementations communautaires spécifiques visées à l'annexe A section I de la directive 90/425/CEE (2), et notamment son article 17, paragraphe 3,
vu la directive 2009/156/CE du Conseil du 30 novembre 2009 relative aux conditions de police sanitaire régissant les mouvements d'équidés et les importations d'équidés en provenance des pays tiers (3), et notamment son article 2, point i), son article 12, paragraphes 1, 4 et 5, son article 13, paragraphe 2, et ses articles 15, 16, 17 et 19,
considérant ce qui suit:
|
(1) |
La directive 2009/156/CE fixe les conditions de police sanitaire régissant les importations d'équidés dans l'Union. Elle prévoit que seuls des équidés provenant d'un pays tiers ou d'une partie d'un pays tiers figurant sur une liste de pays tiers établie conformément à ses dispositions et accompagnés d'un certificat sanitaire correspondant à un modèle également établi conformément à ses dispositions, peuvent être importés dans l'Union. Le certificat sanitaire doit attester que les équidés satisfont aux conditions sanitaires fixées conformément à cette directive dans le certificat sanitaire correspondant. |
|
(2) |
La liste des pays tiers en provenance desquels les États membres autorisent les importations d'équidés vivants et de sperme, d'ovules et d'embryons de l'espèce équine et la régionalisation de certains de ces pays tiers devraient être établies sur la base du statut zoosanitaire de ces pays tiers et être basées sur la liste des pays tiers et des parties de territoires de pays tiers établie par la décision 2004/211/CE de la Commission (4). |
|
(3) |
Conformément à l'article 12, paragraphe 2, point a), de la directive 2009/156/CE, il convient que les conditions de police sanitaire énoncées dans le présent règlement soient fondées sur une évaluation des risques. Le principe du regroupement des pays en zones sanitaires, tel que prévu à l'article 12, paragraphe 4, de la directive 2009/156/CE, en fonction de risques communs s'est révélé efficace. Néanmoins, étant donné que le terme «zone» implique la contiguïté et que certains risques de même nature peuvent exister dans des régions éloignées les unes des autres, il conviendrait de classer les pays dans des «groupes sanitaires» distincts. |
|
(4) |
La directive 92/65/CEE établit les exigences de police sanitaire régissant les importations dans l'Union de spermes, d'ovules et d'embryons de l'espèce équine. Elle prévoit que seules les marchandises provenant d'un pays tiers ou d'une partie d'un pays tiers figurant sur une liste de pays tiers établie conformément à ses dispositions et accompagnées d'un certificat sanitaire correspondant à un modèle également établi conformément à ses dispositions peuvent être importées dans l'Union. Le certificat sanitaire doit attester que les marchandises proviennent de stations ou centres de collecte et de stockage agréés ou d'équipes de collecte et de production agréées offrant des garanties au moins équivalentes à celles prévues à l'annexe D, chapitre I, de ladite directive. |
|
(5) |
La directive 92/65/CEE, telle qu'elle a été modifiée par la directive 2008/73/CE du Conseil (5), a instauré une procédure simplifiée d'établissement des listes des stations et centres de collecte et de stockage de spermes et des équipes de collecte et de production d'embryons dans les pays tiers agréés aux fins de l'importation des marchandises dans l'Union. Les listes peuvent être consultées sur le site web de la Commission (6). |
|
(6) |
L'annexe D de la directive 92/65/CEE fixe certaines exigences applicables aux sperme, ovules et embryons d'équidés ainsi que les règles applicables à l'agrément, à la surveillance et à l'exploitation des centres et stations de collecte et de stockage de sperme et des équipes de collecte et de production d'embryons ainsi que les conditions détaillées relatives au statut sanitaire des animaux donneurs. En conséquence, il est nécessaire d'établir les modèles de certificat sanitaire à utiliser pour les importations dans l'Union de sperme, d'ovules et d'embryons d'équidés. |
|
(7) |
Il convient en outre de régler la question de l'importation dans l'Union des stocks existants de marchandises qui satisfont aux dispositions de la directive 92/65/CEE établies avant l'entrée en vigueur des modifications introduites par le règlement (UE) no 176/2010 de la Commission (7). En conséquence, il est nécessaire d'établir des modèles de certificat sanitaire distincts pour les importations de lots de sperme, d'ovules et d'embryons d'équidés collectés ou produits, traités et stockés conformément à l'annexe D de la directive 92/65/CEE avant le 1er septembre 2010. |
|
(8) |
Étant donné que ces marchandises peuvent être stockées longtemps, il est impossible de déterminer la date à laquelle les stocks existants seront épuisés. Il n'est donc pas possible de fixer la date à laquelle doit cesser l'utilisation des modèles de certificat sanitaire établis pour les stocks existants. |
|
(9) |
Afin de garantir la traçabilité intégrale des marchandises, il convient que le présent règlement établisse les modèles de certificat sanitaire à utiliser pour les importations dans l'Union de sperme d'équidés collecté dans des stations ou centres de collecte de sperme agréés et expédié à partir d'un centre de stockage de sperme agréé faisant ou non partie d'une station ou d'un centre de collecte de sperme agréé sous un numéro différent. |
|
(10) |
Il convient en outre que les lots de marchandises importés de Suisse dans l'Union soient accompagnés des certificats sanitaires conformes aux modèles utilisés pour les échanges de sperme, d'ovules et d'embryons d'équidés dans l'Union, établis par la décision 2010/470/UE de la Commission (8), moyennant leur adaptation conformément à l'annexe 11, appendice 2, chapitre IX B, points 8 et 9, de l'accord entre la Communauté européenne et la Confédération suisse relatif aux échanges de produits agricoles, approuvé par la décision 2002/309/CE, Euratom du Conseil et de la Commission (9). |
|
(11) |
Les sperme, ovules et embryons d'équidés expédiés en lots du Canada vers l'Union peuvent être accompagnés de certificats sanitaires établis conformément à l'accord entre la Communauté européenne et le gouvernement du Canada relatif aux mesures sanitaires de protection de la santé publique et animale applicables au commerce d'animaux vivants et de produits animaux (10), approuvé par la décision 1999/201/CE du Conseil (11). |
|
(12) |
Les sperme, ovules et embryons équins expédiés en lots de Nouvelle-Zélande vers l'Union peuvent être accompagnés de certificats sanitaires établis conformément à l'accord entre la Communauté européenne et la Nouvelle-Zélande relatif aux mesures sanitaires applicables au commerce d'animaux vivants et de produits animaux (12), approuvé par la décision 97/132/CE du Conseil (13). |
|
(13) |
Il convient, pour simplifier la législation de l'Union, de fondre dans un seul règlement les conditions de police sanitaire et de certification applicables à l'entrée dans l'Union de lots d'équidés et de sperme, ovules et embryons d'équidés, ainsi que la liste des pays tiers et des parties du territoire de pays tiers en provenance desquels les États membres doivent autoriser l'introduction de ces lots dans l'Union. |
|
(14) |
Il convient, pour préserver le statut sanitaire certifié des équidés durant leur déplacement entre le pays tiers d'exportation et l'Union, de fixer les conditions de police sanitaire applicables au transport d'équidés. |
|
(15) |
Il convient de prendre des dispositions en matière de qualité des tests sanitaires et d'enregistrement des vaccinations ainsi qu'en ce qui concerne la confirmation des résultats d'analyse par le laboratoire de référence de l'Union européenne pour les maladies équines autres que la peste équine, désigné conformément au règlement (CE) no 180/2008 de la Commission (14), dans le cas où l'échantillonnage des équidés, fondé sur le risque, effectué conformément à la décision 97/794/CE de la Commission (15), donne des résultats différents de ceux qui sont certifiés par le pays tiers d'expédition. |
|
(16) |
Les épreuves servant au diagnostic de l'artérite virale équine et les catégories d'équidés mâles auxquelles les exigences de recherche de l'artérite virale équine sont applicables devraient être définies sur la base des recommandations du comité vétérinaire scientifique (16) qui figurent dans la décision 95/329/CE de la Commission (17) et des dernières recommandations de l'Organisation mondiale de la santé animale (OIE), qui figurent au chapitre 12.9 du Code sanitaire pour les animaux terrestres, édition 2016 (18). |
|
(17) |
Il convient d'établir un modèle spécifique de certificat sanitaire pour le transit par l'Union d'équidés vivants provenant d'un pays tiers ou d'une partie du territoire d'un pays tiers et destinés à un autre pays tiers ou à une autre partie du territoire du même pays tiers. |
|
(18) |
Il est nécessaire, aux fins des contrôles servant à garantir une mise en œuvre uniforme, par les États membres, des dispositions relatives à l'admission temporaire de chevaux enregistrés, à la réintroduction de chevaux enregistrés après une exportation temporaire, au transit d'équidés et à la conversion de l'admission temporaire de chevaux enregistrés en admission définitive, d'établir des dispositions particulières et supplémentaires concernant l'utilisation du système informatique vétérinaire intégré «Traces» prévu dans les décisions de la Commission 2003/24/CE (19) et 2004/292/CE (20) depuis le poste d'inspection vétérinaire frontalier d'entrée, agréé conformément à la décision 2009/821/CE de la Commission (21), jusqu'au point de sortie de l'Union. |
|
(19) |
Il convient, dans un souci de cohérence et de simplification de la législation de l'Union, d'établir le format des modèles de certificat sanitaire à utiliser pour l'introduction dans l'Union d'équidés et de sperme, ovules et embryons d'équidés sur la base des modèles uniques de certificat vétérinaire figurant à l'annexe I de la décision 2007/240/CE de la Commission (22). |
|
(20) |
Il convient de prévoir des dispositions déterminant, conformément à l'article 19, point c), de la directive 2009/156/CE, les conditions de conversion d'une admission temporaire en admission définitive, ainsi que des dispositions relatives aux informations requises dans le système Traces et à l'échange du document vétérinaire commun d'entrée (DVCE) dont le modèle figure à l'annexe I du règlement (CE) no 282/2004 de la Commission (23). |
|
(21) |
Il convient d'établir des conditions spécifiques de police sanitaire applicables à la réintroduction de chevaux enregistrés après leur exportation temporaire vers des pays tiers pour participer à des courses, à des compétitions et à des manifestations culturelles, et il convient d'établir les modèles de certificat y afférents dans une annexe du présent règlement. |
|
(22) |
La décision 93/444/CEE de la Commission (24) définit le «point de sortie» et prévoit, entre autres, que les animaux destinés à être exportés vers un pays tiers doivent être accompagnés jusqu'au point de sortie d'un certificat sanitaire applicable au moins aux échanges d'animaux de boucherie de l'espèce concernée. Elle impose également à l'autorité compétente du lieu d'expédition de notifier le mouvement prévu au point de sortie. Il est nécessaire de préciser que, pour assurer la traçabilité, le «point de sortie» doit être un poste d'inspection frontalier et que le certificat sanitaire visé à l'article 2, paragraphe 1, de la décision 93/444/CEE doit également correspondre au modèle établi à l'annexe III de la directive 2009/156/CE dans le cas de chevaux enregistrés destinés à une exportation temporaire. |
|
(23) |
Pour des raisons de sécurité juridique, il convient d'abroger les décisions de la Commission 92/260/CEE (25), 93/195/CEE (26), 93/196/CEE (27), 93/197/CEE (28), 94/699/CE (29), 95/329/CE, 2003/13/CE (30), 2004/177/CE (31), 2004/211/CE, 2010/57/UE (32) et 2010/471/UE (33). |
|
(24) |
Afin de permettre aux opérateurs économiques de s'adapter aux nouvelles règles établies dans le présent règlement, il est opportun de prévoir une période transitoire au cours de laquelle les États membres doivent autoriser l'entrée dans l'Union d'équidés et de sperme, ovules et embryons d'équidés qui satisfont aux conditions fixées dans les modèles de certificat sanitaire applicables avant la mise en application du présent règlement. |
|
(25) |
Les mesures prévues au présent règlement sont conformes à l'avis du comité permanent des végétaux, des animaux, des denrées alimentaires et des aliments pour animaux, |
A ADOPTÉ LE PRÉSENT RÈGLEMENT:
SECTION 1
Objet, champ d'application et définitions
Article premier
Objet et champ d'application
Le présent règlement établit la liste des pays tiers et des parties du territoire de pays tiers en provenance desquels l'entrée dans l'Union de lots d'équidés et de sperme, ovules et embryons d'équidés est autorisée.
Il énonce également les conditions de police sanitaire et de certification vétérinaire applicables à ces lots.
Article 2
Définitions
Aux fins du présent règlement, on entend par:
|
la reconnaissance officielle d'une partie du territoire d'un pays tiers délimitée précisément sur le plan géographique qui comporte une sous-population d'équidés caractérisée par un statut sanitaire distinct au regard d'une ou de plusieurs maladies spécifiques et fait l'objet de mesures adéquates de surveillance, de lutte contre la ou les maladies et de sécurité biologique; |
||||||||||
|
tout document qui peut être utilisé pour prouver l'identité d'un équidé et qui comprend au moins les informations suivantes:
|
||||||||||
|
tout animal de l'espèce Equus caballus enregistré au sens de la directive 90/427/CEE du Conseil (35), identifié au moyen d'un document d'identification délivré par:
|
||||||||||
|
l'action consistant à faire entrer des équidés ou des sperme, ovules ou embryons d'équidés dans l'un des territoires énumérés à l'annexe I de la directive 97/78/CE du Conseil (36); |
||||||||||
|
l'admission temporaire, la réintroduction après exportation temporaire, l'importation ou le transit; |
||||||||||
|
le statut d'un cheval enregistré originaire d'un pays tiers qui est introduit sur le territoire de l'Union pour une période inférieure à 90 jours; |
||||||||||
|
le déplacement d'un cheval enregistré en dehors de l'Union pour une période inférieure à 90 jours; |
||||||||||
|
le retour d'un cheval enregistré dans l'Union après son exportation temporaire dans un pays tiers; |
||||||||||
|
l'introduction d'un lot d'équidés ou de sperme, ovules ou embryons d'équidés dans l'Union pour une période indéterminée; |
||||||||||
|
la circulation par voie routière, ferroviaire ou navigable sur le territoire de l'Union d'un lot d'équidés provenant d'un pays tiers et destiné à un autre pays tiers ou provenant d'une partie du territoire d'un pays tiers et destiné à une autre partie du territoire du même pays tiers; |
||||||||||
|
tout poste d'inspection au sens de l'article 2, paragraphe 2, point f), de la directive 91/496/CEE et de l'article 2, paragraphe 2, point g), de la directive 97/78/CE qui est agréé pour la marchandise concernée conformément à la décision 2009/821/CE; |
||||||||||
|
les équidés enregistrés, équidés de boucherie ou équidés d'élevage et de rente au sens de l'article 2 de la directive 2009/156/CE, ou les chevaux enregistrés; |
||||||||||
|
les stades haploïdes de la méiose II comprenant les ovocytes II et les ovules; |
||||||||||
|
toute personne physique ou morale soumise à une ou plusieurs des règles prévues au présent règlement qui a des équidés ou leurs produits germinaux sous sa responsabilité; |
||||||||||
|
la séparation, pendant une période déterminée, d'équidés d'autres animaux pour prévenir la transmission par contact direct ou indirect d'un ou de plusieurs agents pathogènes spécifiés, tandis que les équidés sont en observation et sont, s'il y a lieu, soumis à un dépistage et à un traitement sous la supervision de l'autorité vétérinaire; |
||||||||||
|
l'isolement des équidés dans des locaux exploités conformément à des règles de biosécurité spécifiques sous le contrôle de l'autorité vétérinaire; |
||||||||||
|
la mise en quarantaine d'équidés:
|
||||||||||
|
la mise en quarantaine d'équidés dans un bâtiment fermé hermétiquement:
|
||||||||||
|
le système informatique vétérinaire intégré prévu dans les décisions 2003/24/CE et 2004/292/CE. |
SECTION 2
Liste des pays tiers et parties de pays tiers pour l'entrée dans l'Union d'équidés et de sperme, ovules et embryons d'équidés
Article 3
Liste des pays tiers et parties du territoire de pays tiers en provenance desquels l'entrée d'équidés dans l'Union est autorisée
1. Les États membres autorisent l'entrée dans l'Union de lots d'équidés en provenance des pays tiers ou, lorsque l'Union applique une régionalisation, des parties du territoire de pays tiers mentionnés dans les colonnes 2 et 4 du tableau figurant à l'annexe I, conformément aux indications figurant dans cette annexe, comme suit:
|
a) |
l'admission temporaire, lorsqu'elle est prévue dans la colonne 6 du tableau de l'annexe I, de chevaux enregistrés accompagnés d'un certificat sanitaire individuel établi conformément au modèle de certificat sanitaire figurant à l'annexe II, partie 1, section A; |
|
b) |
le transit, lorsqu'il est prévu dans la colonne 15 du tableau de l'annexe I, d'équidés accompagnés d'un certificat sanitaire individuel établi conformément au modèle de certificat sanitaire figurant à l'annexe II, partie 1, section B; |
|
c) |
la réintroduction, lorsqu'elle est prévue dans la colonne 7 du tableau de l'annexe I, de chevaux enregistrés en vue des courses, de la compétition et de manifestations culturelles après une exportation temporaire et accompagnés d'un certificat sanitaire individuel établi conformément au modèle de certificat sanitaire approprié figurant à l'annexe II, partie 2, section A ou B; |
|
d) |
l'importation, lorsqu'elle est prévue dans la colonne 8 du tableau de l'annexe I, de chevaux enregistrés accompagnés d'un certificat sanitaire individuel établi conformément au modèle de certificat sanitaire figurant à l'annexe II, partie 3, section A; |
|
e) |
l'importation, lorsqu'elle est prévue dans la colonne 9 du tableau de l'annexe I, d'un lot d'équidés de boucherie accompagné d'un certificat sanitaire établi conformément au modèle de certificat sanitaire figurant à l'annexe II, partie 3, section B; |
|
f) |
l'importation, lorsqu'elle est prévue dans la colonne 10 du tableau de l'annexe I, d'équidés enregistrés et d'équidés d'élevage et de rente accompagnés d'un certificat sanitaire individuel établi conformément au modèle de certificat sanitaire figurant à l'annexe II, partie 3, section A. |
2. L'autorité compétente du pays tiers d'expédition applique les mesures nécessaires en vue de se conformer aux conditions particulières ou limites temporelles indiquées, pour ledit pays, dans la colonne 16 du tableau de l'annexe I.
Article 4
Pays tiers et parties du territoire de pays tiers en provenance desquels l'entrée de sperme d'équidés dans l'Union est autorisée
Les États membres autorisent l'entrée dans l'Union de lots de sperme d'équidés en provenance des pays tiers ou, lorsque l'Union applique une régionalisation, des parties du territoire de pays tiers mentionnés dans les colonnes 2 et 4 du tableau de l'annexe I, conformément aux indications figurant dans les colonnes 11, 12 et 13 de ce tableau, à condition que le lot respecte les conditions suivantes:
|
a) |
le lot a été expédié d'un centre de collecte ou de stockage de sperme mentionné sur une liste établie conformément à l'article 17, paragraphe 3, point b), de la directive 92/65/CEE; |
|
b) |
le lot est accompagné d'un certificat sanitaire établi conformément au modèle de certificat sanitaire approprié figurant à l'annexe III, partie 1. |
Article 5
Pays tiers et parties du territoire de pays tiers en provenance desquels l'entrée d'ovules et d'embryons d'équidés dans l'Union est autorisée
Les États membres autorisent l'entrée dans l'Union de lots d'ovules et d'embryons d'équidés en provenance des pays tiers ou, lorsque l'Union applique une régionalisation, des parties du territoire de pays tiers mentionnés dans les colonnes 2 et 4 du tableau de l'annexe I, conformément aux indications figurant dans la colonne 14 de ce tableau, à condition que le lot respecte les conditions suivantes:
|
a) |
le lot a été expédié par une équipe de collecte ou de production d'embryons mentionnée sur une liste établie conformément à l'article 17, paragraphe 3, point b), de la directive 92/65/CEE; |
|
b) |
le lot est accompagné d'un certificat sanitaire établi conformément au modèle de certificat sanitaire approprié figurant à l'annexe III, partie 2. |
SECTION 3
Conditions générales applicables à l'entrée dans l'Union de lots d'équidés et de sperme, ovules et embryons d'équidés
Article 6
Certification
1. Les certificats sanitaires prévus aux articles 3, 4 et 5 sont établis et délivrés conformément:
|
a) |
aux garanties ou conditions supplémentaires applicables précisées dans la colonne 16 de l'annexe I; |
|
b) |
aux notes explicatives figurant à l'annexe II, partie 4, ou à l'annexe III, partie 3, selon le cas. |
2. Les dispositions du paragraphe 1 n'empêchent pas le recours à la certification électronique ou à d'autres systèmes convenus lorsque des procédures harmonisées à l'échelon de l'Union ont été établies.
Article 7
Période de validité des certificats sanitaires
1. L'opérateur responsable d'un lot d'équidés ou de sperme, ovules ou embryons d'équidés destinés à être introduits dans l'Union veille à ce que le lot soit présenté à un poste d'inspection frontalier agréé autorisé pour le lot concerné au plus tard 10 jours après la date de la certification du lot dans le pays tiers d'expédition.
2. Lorsque des équidés sont transportés par voie maritime, la période de 10 jours prévue au paragraphe 1 est prolongée de la durée du voyage maritime.
SECTION 4
Exigences en matière de transport applicables à l'entrée d'équidés dans l'Union
Article 8
Conditions générales de police sanitaire
1. L'opérateur responsable d'un lot d'équidés destinés à être introduits dans l'Union veille à ce que ces équidés soient transportés conformément aux dispositions suivantes:
|
a) |
ils sont transportés dans un moyen de transport contenant uniquement des équidés dont l'Union est la destination, ou ils sont accompagnés d'un certificat sanitaire requis pour le transit; |
|
b) |
ils sont transportés dans un moyen de transport ne contenant pas d'équidés qui ont un autre statut sanitaire certifié, sauf dans les cas où les conditions particulières de police sanitaire fixées à l'annexe II, partie 1, sections A et B, et partie 3, section A, l'autorisent; |
|
c) |
ils sont transportés par voie routière ou ferroviaire ou déplacés à pied uniquement dans un pays tiers ou une partie du territoire d'un pays tiers en provenance desquels au moins un type d'entrée d'au moins une catégorie d'équidés est autorisé. |
2. L'opérateur responsable d'un lot d'équidés destinés à être introduits dans l'Union veille au respect des dispositions suivantes:
|
a) |
les caisses de transport, conteneurs ou stalles et le moyen de transport ou le compartiment de transport du moyen de transport dans lesquels les équidés seront transportés sont nettoyés et désinfectés avant le chargement des animaux avec un désinfectant officiellement reconnu dans le pays d'expédition; |
|
b) |
les moyens de transport utilisés pour le transport routier ou ferroviaire sont conçus, construits et exploités de manière à empêcher les fuites de fèces, d'urine et de fourrage au cours du voyage prévu; |
|
c) |
des mesures de protection des animaux contre les attaques des insectes vecteurs sont appliquées en cas d'apparition d'une des maladies suivantes:
Dans le cas des maladies visées au point i), la protection contre les vecteurs comprend des mesures telles que le placement d'une moustiquaire autour des caisses de transport, conteneurs ou stalles, la ventilation mécanique et la fermeture continue du compartiment de transport sauf pendant le chargement et le déchargement des animaux ou lorsque des soins leur sont donnés. |
3. L'opérateur responsable d'un lot d'équidés destinés à être introduits dans l'Union veille à ce que, pendant le voyage, les équidés soient déchargés uniquement dans un pays tiers ou une partie du territoire d'un pays tiers en provenance desquels des équidés sont autorisés à entrer dans l'Union conformément aux dispositions de l'annexe I.
Article 9
Conditions particulières de police sanitaire applicables au transport aérien
1. L'opérateur responsable d'un lot d'équidés destinés à être introduits dans l'Union par voie aérienne veille au respect des dispositions suivantes:
|
a) |
les caisses de transport, conteneurs ou stalles et l'espace ambiant du compartiment de transport sont pulvérisés avec un insectifuge approprié, combiné à un insecticide, immédiatement après la fermeture des portes de l'avion; |
|
b) |
le commandant de bord remplit et signe la déclaration figurant à l'annexe V, partie 1. |
2. Par dérogation à l'article 8, paragraphe 3, les États membres peuvent, à la demande de l'opérateur du lot, autoriser le transbordement direct d'un avion à un autre dans un pays non mentionné à l'annexe I, pour autant que les conditions suivantes soient remplies:
|
a) |
le transbordement est effectué dans le même aéroport, dans le périmètre du même bureau de douane et sous la supervision directe d'un vétérinaire officiel ou du douanier responsable; |
|
b) |
pendant le transbordement, les équidés sont protégés des attaques des insectes vecteurs de maladies transmissibles aux équidés; |
|
c) |
les équidés n'entrent pas en contact avec des équidés d'un statut sanitaire différent; |
|
d) |
les mesures prévues au paragraphe 1, points a) et b), sont appliquées à l'avion utilisé pour la suite du voyage; |
|
e) |
l'observation des conditions énoncées au paragraphe 1, point a), et aux points a), b) et c) du présent paragraphe est attestée par le vétérinaire officiel ou par le douanier responsable dans le manifeste de transbordement établi conformément au modèle figurant à l'annexe V, partie 3. |
Article 10
Conditions particulières de police sanitaire applicables au transport par voie maritime
1. L'opérateur responsable d'un lot d'équidés destiné à être introduit dans l'Union par voie maritime veille au respect des dispositions suivantes:
|
a) |
le navire doit accoster directement dans un port de l'Union sans faire escale dans un port situé dans un pays tiers ou une partie du territoire d'un pays tiers non mentionnés à l'annexe I; |
|
b) |
les caisses de transport, conteneurs ou stalles et l'espace ambiant du compartiment de transport sont pulvérisés avec un insectifuge approprié, combiné à un insecticide, immédiatement après la fermeture du compartiment; |
|
c) |
le capitaine du navire remplit et signe la déclaration figurant à l'annexe V, partie 2. |
2. Par dérogation au paragraphe 1, point a), les États membres peuvent autoriser le transbordement direct d'un navire à un autre dans un pays non mentionné à l'annexe I, à condition que:
|
a) |
le transbordement soit effectué dans le même port, dans le périmètre du même bureau de douane et sous la supervision directe d'un vétérinaire officiel ou du douanier responsable; |
|
b) |
pendant le transbordement, les équidés soient protégés des attaques des insectes vecteurs de maladies transmissibles aux équidés; |
|
c) |
les équidés n'entrent pas en contact avec des équidés d'un statut sanitaire différent; |
|
d) |
l'observation des conditions énoncées au paragraphe 1, point b), et aux points a), b) et c) du présent paragraphe est attestée par le vétérinaire officiel ou par le douanier responsable dans le manifeste de transbordement établi conformément au modèle figurant à l'annexe V, partie 3. |
SECTION 5
Exigences générales applicables à la recherche de maladies chez des équidés destinés à être introduits dans l'Union et chez des équidés donneurs dont les sperme, ovules ou embryons sont destinés à être introduits dans l'Union, ainsi qu'à leur vaccination
Article 11
Exigences générales applicables aux épreuves de laboratoire en vue de la certification de lots d'équidés ou de sperme, ovules ou embryons d'équidés destinés à être introduits dans l'Union
1. L'autorité compétente du pays tiers à partir duquel sont expédiés des équidés ou des sperme, ovules ou embryons d'équidés destinés à être introduits dans l'Union veille à ce que les épreuves de laboratoire prévues dans les certificats sanitaires figurant aux annexes II et III pour la morve, la dourine, l'anémie infectieuse des équidés, l'encéphalomyélite équine vénézuélienne, l'encéphalomyélite équine de l'Ouest et de l'Est, l'encéphalite japonaise, la fièvre de West Nile, la stomatite vésiculeuse, l'artérite virale équine et la métrite contagieuse équine remplissent au moins les exigences de sensibilité et de spécificité établies pour la maladie concernée au chapitre y afférent de la section 2.5 du Manuel des tests de diagnostic et des vaccins pour les animaux terrestres (dernière édition) de l'OIE.
2. L'autorité compétente du pays tiers à partir duquel sont expédiés des équidés destinés à l'Union veille à ce que les épreuves de laboratoire prévues dans les certificats sanitaires figurant à l'annexe II du présent règlement pour la peste équine soient effectuées conformément à l'annexe IV de la directive 2009/156/CE.
3. L'autorité compétente du pays tiers à partir duquel sont expédiés des équidés ou des sperme, ovules ou embryons d'équidés destinés à l'Union veille au respect des dispositions suivantes:
|
a) |
les épreuves visées aux paragraphes 1 et 2 sont effectuées dans un laboratoire reconnu par l'autorité compétente du pays tiers d'expédition; |
|
b) |
les données de l'échantillonnage et les résultats des épreuves sont indiqués, conformément aux exigences énoncées dans le certificat sanitaire établi pour le lot concerné suivant le modèle figurant à l'annexe II ou à l'annexe III, sur la base du rapport de laboratoire mis à la disposition du vétérinaire officiel chargé de la certification. |
Article 12
Recherche de maladies à l'arrivée dans l'Union
1. Lorsqu'une épreuve effectuée, dans ou pour l'État membre d'entrée, sur un échantillon prélevé conformément à l'article 4 de la décision 97/794/CE ne confirme pas le résultat d'une épreuve de laboratoire attesté dans le certificat sanitaire accompagnant les équidés ou les sperme, ovules ou embryons d'équidés arrivant dans l'Union, établi suivant le modèle figurant à l'annexe II ou à l'annexe III du présent règlement, l'autorité compétente dudit État membre d'entrée veille à ce que l'épreuve soit répétée dans le laboratoire national de référence désigné pour la maladie concernée conformément à l'article 4, paragraphe 1, du règlement (CE) no 882/2004 du Parlement européen et du Conseil (38).
2. Lorsque les mesures prévues au paragraphe 1 ne permettent pas de parvenir à un résultat probant lors des contrôles de conformité effectués conformément à l'article 4 de la décision 97/794/CE, l'autorité compétente visée au paragraphe 1 veille à ce que l'échantillon visé audit paragraphe soit soumis à des épreuves décisives de recherche:
|
a) |
de la peste équine, dans le laboratoire de référence de l'Union européenne pour la peste équine désigné conformément à la directive 92/35/CEE du Conseil (39); |
|
b) |
des maladies visées à l'article 11, paragraphe 1, dans le laboratoire de référence de l'Union européenne pour les maladies équines autres que la peste équine désigné conformément au règlement (CE) no 180/2008. |
Article 13
Administration de vaccins et enregistrement de la vaccination
1. L'autorité compétente du pays tiers à partir duquel sont expédiés des équidés ou des sperme, ovules ou embryons d'équidés destinés à l'Union veille à ce que la vaccination attestée dans l'un des certificats dont les modèles figurent à l'annexe II ou à l'annexe III soit effectuée conformément aux dispositions suivantes:
|
a) |
la vaccination est effectuée conformément aux instructions des fabricants ou à la législation nationale si celle-ci est plus stricte; |
|
b) |
la vaccination est effectuée au moyen d'un vaccin autorisé remplissant au moins les exigences en matière de sécurité, de stérilité et d'efficacité définies pour le vaccin concerné dans le Manuel des tests de diagnostic et des vaccins pour les animaux terrestres (dernière édition) de l'OIE. |
2. Lorsque l'autorité compétente d'un pays tiers atteste que le résultat positif d'une épreuve sérologique de recherche en laboratoire de la peste équine est lié à une vaccination précédente, la vaccination est documentée dans le document d'identification accompagnant l'équidé si un tel document est disponible.
Article 14
Exigences relatives à l'artérite virale équine
1. Les équidés mâles non castrés destinés à être introduits dans l'Union, à l'exception de ceux qui sont énumérés à l'annexe IV, point 1, sont soumis à des épreuves de recherche de l'artérite virale équine pour déterminer si leur sperme est indemne du virus de l'artérite virale équine.
2. La vaccination contre l'artérite virale équine ainsi que les épreuves requises conformément à l'annexe IV, point 1 a), sont effectuées sous supervision vétérinaire officielle.
3. Une vaccination contre l'artérite virale équine est valable lorsque l'équidé est accompagné d'un document prouvant un historique ininterrompu constitué d'une primovaccination, effectuée conformément à un des protocoles de vaccination prévus à l'annexe IV, point 1 a), et d'une revaccination régulière, suivant les recommandations des fabricants et, en tout état de cause, à des intervalles ne dépassant pas 12 mois.
SECTION 6
Identification des équidés destinés à être introduits dans l'Union
Article 15
Identification des équidés destinés à être introduits dans l'Union
1. Les équidés destinés à être introduits dans l'Union sont identifiés individuellement de façon à garantir une correspondance non équivoque entre l'animal et son statut sanitaire certifié.
Cette identification:
|
a) |
satisfait aux conditions énoncées à l'article 14 du règlement d'exécution (UE) 2015/262 ou |
|
b) |
contient au moins les informations visées à l'annexe I, partie 1, section 1, partie A, points 1, 2, 3 et 6 à 10, et partie B, points 12 à 18, dudit règlement. |
2. Les équidés de boucherie destinés à l'importation dans l'Union sont marqués individuellement au moyen d'un transpondeur électronique ou d'une marque auriculaire, dont le numéro est inscrit dans le certificat sanitaire accompagnant les animaux pendant le transport.
3. Les équidés de boucherie destinés à l'importation dans l'Union sont marqués au feu, sur le sabot antérieur gauche, d'un «S» apparent et indélébile dont la taille n'est pas inférieure à la moitié de la longueur de la paroi du sabot, dans les cas suivants:
|
a) |
ils sont marqués individuellement, par dérogation au paragraphe 2, au moyen d'une autre méthode mentionnée dans le certificat sanitaire, auquel cas les animaux doivent être expédiés à l'abattoir de destination conformément à l'article 21, point a); |
|
b) |
ils sont destinés à être expédiés à l'abattoir de destination conformément à l'article 21, point b). |
SECTION 7
Conditions particulières de police sanitaire et de certification applicables à l'entrée de lots d'équidés dans l'Union
Article 16
Mesures à prendre par les autorités compétentes pour garantir la traçabilité d'un cheval enregistré admis temporairement
1. S'il a été établi que les conditions d'entrée sont remplies, l'autorité compétente du poste d'inspection frontalier d'entrée:
|
a) |
conserve une copie du certificat sanitaire visé à l'article 3, paragraphe 1, point a); |
|
b) |
notifie, au moyen du système Traces, l'entrée d'un cheval enregistré admis temporairement, selon le cas, à l'autorité compétente ou au poste d'inspection frontalier de sortie concernés, à savoir:
|
|
c) |
délivre au moins une copie du DVCE à l'opérateur identifié comme «opérateur responsable du lot» dans la case I.7 du DVCE visé au paragraphe 1, point b). |
2. Lorsqu'un cheval enregistré doit être déplacé d'un État membre à un autre État membre pendant son admission temporaire, l'autorité compétente du lieu d'expédition:
|
a) |
délivre, si les conditions de police sanitaire fixées aux articles 4 et 5 de la directive 2009/156/CE sont remplies, un certificat sanitaire conforme au modèle figurant à l'annexe III de ladite directive, soit pour un seul cheval enregistré, soit pour un lot de chevaux enregistrés ayant la même origine et la même destination, et fait référence, dans la case I.6 de ce certificat, au certificat sanitaire visé à l'article 3, paragraphe 1, point a), de chacun des chevaux enregistrés admis temporairement constituant le lot, ainsi qu'au DVCE visé au paragraphe 1, point b) i); |
|
b) |
informe, au moyen du système Traces, l'autorité compétente du lieu de destination du mouvement d'un cheval enregistré vers l'État membre de cette autorité et lui demande de vérifier l'arrivée en remplissant une nouvelle partie III du DVCE visé au paragraphe 1, point b) i); |
|
c) |
délivre à l'opérateur identifié dans la case I.7 du DVCE visé au paragraphe 1, point b) i), un nouvel exemplaire imprimé du DVCE sur lequel figure la nouvelle partie III remplie conformément au point b) du présent paragraphe; |
|
d) |
invalide ou retire tout exemplaire imprimé du DVCE délivré à l'opérateur conformément au paragraphe 1, point c), ou, s'il y avait eu un mouvement antérieur à destination d'un autre État membre, conformément au point c) du présent paragraphe. |
3. L'autorité compétente du lieu de destination visée au paragraphe 1, point b) i), et au paragraphe 2, point b), signale, au moyen du système Traces, l'arrivée du cheval enregistré et décrit les contrôles effectués en remplissant la partie III du DVCE.
4. À la fin de l'admission temporaire, l'autorité compétente visée au paragraphe 1, point b) i), ou point b) iii), qui établit le certificat du cheval enregistré admis temporairement à l'intention du pays tiers d'origine ou d'un autre pays tiers:
|
a) |
informe, au moyen du système Traces, le poste d'inspection frontalier de sortie du départ de l'Union du cheval enregistré admis temporairement en remplissant une nouvelle partie III du DVCE visé au paragraphe 1, point b) i); |
|
b) |
délivre à l'opérateur identifié dans la case I.7 du DVCE visé au paragraphe 1, point b) i), un nouvel exemplaire imprimé du DVCE sur lequel figure la nouvelle partie III remplie conformément au point a) du présent paragraphe; |
|
c) |
lorsque le poste d'inspection frontalier de sortie est situé dans un autre État membre:
|
5. Le poste d'inspection frontalier de sortie visé au paragraphe 4, point a), consigne la fin de l'admission temporaire du cheval enregistré en remplissant la partie III du DVCE en conséquence.
6. Lorsqu'il n'a pas été mis fin à l'admission temporaire d'un cheval enregistré conformément au paragraphe 5 dans un délai inférieur à 90 jours à compter de la date de délivrance du DVCE visé au paragraphe 1, point b) i), une alerte est envoyée automatiquement au moyen du système Traces au poste d'inspection frontalier d'entrée et aux autorités compétentes visées dans le présent article jusqu'à ce que ces autorités compétentes aient déterminé le statut du cheval enregistré.
Article 17
Responsabilités de l'opérateur en ce qui concerne des chevaux enregistrés admis temporairement
1. L'opérateur responsable d'un cheval enregistré admis temporairement dans l'Union, identifié dans la case I.7 du DVCE visé à l'article 16, paragraphe 1, point b) i), veille à ce que les conditions suivantes soient remplies:
|
a) |
le cheval enregistré est accompagné en permanence pendant son admission temporaire de l'original de son certificat sanitaire visé à l'article 3, paragraphe 1, point a), et du DVCE délivré par le poste d'inspection frontalier d'entrée dans l'Union; |
|
b) |
le cheval enregistré reste dans l'État membre et dans les locaux indiqués dans la déclaration accompagnant le certificat sanitaire visé à l'article 3, paragraphe 1, point a); |
|
c) |
si le cheval enregistré doit être déplacé dans un autre État membre, il est accompagné d'un certificat sanitaire conforme au modèle figurant à l'annexe III de la directive 2009/156/CE et du DVCE modifié délivré par l'autorité compétente conformément à l'article 16, paragraphe 2; |
|
d) |
tout exemplaire imprimé antérieur du DVCE est remis à l'autorité compétente en vue de son invalidation ou de son retrait; |
|
e) |
le cheval enregistré quitte l'Union par un poste d'inspection frontalier mentionné dans le certificat sanitaire visé à l'article 3, paragraphe 1, point a), au plus tard 89 jours après la date d'entrée dans l'Union indiquée dans le DVCE correspondant. |
2. L'opérateur visé au paragraphe 1 reste responsable de la circulation du cheval enregistré pendant son admission temporaire dans l'Union et il informe en particulier:
|
a) |
l'autorité compétente visée à l'article 16, paragraphe 1, point b) i), et point b) iii), de toute modification à apporter aux déplacements indiqués dans la déclaration accompagnant le certificat sanitaire visé à l'article 3, paragraphe 1, point a); |
|
b) |
le poste d'inspection frontalier de sortie, de la date à laquelle le cheval enregistré admis temporairement doit quitter l'Union; |
|
c) |
l'autorité compétente visée à l'article 16, paragraphe 1, point b) i), et point b) iii), responsable de l'exploitation, de la mort ou de la perte du cheval enregistré ou de toute urgence, telle qu'un problème de santé, nécessitant des soins vétérinaires au-delà des 89 jours d'admission temporaire. |
Article 18
Réintroduction, après une exportation temporaire, de chevaux enregistrés admis temporairement dans l'Union
1. La réintroduction de chevaux enregistrés admis temporairement dans l'Union peut être autorisée après une exportation temporaire dans un pays tiers ou une partie du territoire d'un pays tiers en provenance desquels la réintroduction de chevaux enregistrés est autorisée pour participer à des courses, compétitions ou manifestations culturelles spécifiques pour lesquelles des modèles de certificat sanitaire pour la réintroduction dans l'Union sont établis conformément à l'article 20, paragraphe 3, à condition que la réintroduction dans l'Union européenne ait lieu dans un délai inférieur à 90 jours à compter de la date de délivrance du DVCE visé à l'article 16, paragraphe 1, point b) i).
2. Afin d'autoriser la réintroduction d'un cheval enregistré visé au paragraphe 1, l'autorité compétente visée à l'article 16, paragraphe 1, point b) i), et point b) iii), qui délivre le certificat pour l'exportation temporaire:
|
a) |
applique les mesures prévues à l'article 16, paragraphe 4, points a), b) et, le cas échéant, c); |
|
b) |
informe, au moyen du système Traces, le poste d'inspection frontalier où la réintroduction doit avoir lieu en remplissant la partie III du DVCE; |
|
c) |
délivre à l'opérateur identifié dans la case I.7 du DVCE visé à l'article 16, paragraphe 1, point b) i), un nouvel exemplaire imprimé du DVCE sur lequel figure la nouvelle partie III remplie conformément au point b) du présent paragraphe; |
|
d) |
invalide ou retire tout exemplaire imprimé du DVCE délivré conformément à l'article 16, paragraphe 1, point c), ou, s'il y avait eu un mouvement antérieur à destination d'un autre État membre, conformément à l'article 16, paragraphe 2, point c). |
3. Le poste d'inspection frontalier de réintroduction:
|
a) |
conserve l'original du certificat sanitaire visé à l'article 3, paragraphe 1, point c); |
|
b) |
notifie, au moyen du système Traces, la réintroduction du cheval enregistré:
|
|
c) |
demande à l'autorité compétente du lieu de destination de vérifier et, s'il y a lieu, de confirmer l'arrivée du cheval enregistré en remplissant la case I.6 du DVCE visé au point d), |
|
d) |
délivre à l'opérateur un exemplaire imprimé d'un nouveau DVCE dans lequel la case II.1 contient une référence au numéro du DVCE délivré antérieurement conformément à l'article 16, paragraphe 1, point c), ou, s'il y avait eu un mouvement antérieur à destination d'un autre État membre, conformément à l'article 16, paragraphe 2, point c), et dans lequel la case II.14 est remplie avant la date ultime de sortie de l'Union indiquée dans le DVCE visé à l'article 16, paragraphe 1, point b) i); |
|
e) |
invalide ou retire tout exemplaire imprimé du DVCE délivré conformément à l'article 16, paragraphe 1, point c), ou, s'il y avait eu un mouvement antérieur à destination d'un autre État membre, conformément à l'article 16, paragraphe 2, point c). |
4. Après la réintroduction, consécutive à une exportation temporaire, d'un cheval enregistré admis temporairement conformément au paragraphe 1, les dispositions de l'article 16 s'appliquent pendant le reste du délai de moins de 90 jours suivant la date de délivrance du DVCE visé à l'article 16, paragraphe 1, point b) i).
Article 19
Conversion de l'admission temporaire en admission définitive et mort ou perte d'un cheval enregistré
1. Lorsque l'opérateur identifié dans la case I.7 du DVCE visé à l'article 16, paragraphe 1, point b) i), soumet à l'autorité compétente visée à l'article 16, paragraphe 1, point b) i), ou point b) iii), ou à l'article 16, paragraphe 2, point b), une demande de conversion de l'admission temporaire d'un cheval enregistré en admission définitive, un État membre peut autoriser ladite conversion à condition que les conditions suivantes soient remplies:
|
a) |
conformément à l'annexe I, les importations de chevaux enregistrés sont autorisées en provenance du pays tiers ou de la partie du territoire du pays tiers concerné; |
|
b) |
l'autorité compétente responsable du lieu de résidence temporaire a satisfait aux conditions suivantes:
|
2. L'autorité compétente visée au paragraphe 1 ou un poste d'inspection frontalier désigné à cet effet par l'État membre:
|
a) |
met fin à l'admission temporaire dans le système Traces en choisissant l'option «Conversion en admission définitive» dans la partie III du DVCE délivré à l'opérateur conformément à l'article 16, paragraphe 1, point c), ou, s'il y avait eu un mouvement antérieur à destination d'un autre État membre, conformément à l'article 16, paragraphe 2, point c), ou, s'il y avait eu une réintroduction antérieure après une exportation temporaire, conformément à l'article 18, paragraphe 3, point c); |
|
b) |
délivre à l'opérateur identifié dans la case I.7 du DVCE visé à l'article 16, paragraphe 1, point b) i), un nouvel exemplaire imprimé du DVCE visé au point a) ou un nouveau DVCE dans lequel l'option «Pour le marché intérieur» est cochée (dans la case I.21); |
|
c) |
invalide ou retire tout exemplaire imprimé du DVCE délivré conformément à l'article 16, paragraphe 1, point c), ou, s'il y avait eu un mouvement antérieur à destination d'un autre État membre, conformément à l'article 16, paragraphe 2, point c), ou, s'il y avait eu une réintroduction antérieure après une exportation temporaire, conformément à l'article 18, paragraphe 3, point c); |
|
d) |
invalide ou retire l'original du certificat sanitaire visé à l'article 3, paragraphe 1, point a). |
3. Pendant la période de conversion, l'opérateur identifié dans la case I.7 du DVCE délivré conformément à l'article 16, paragraphe 1, point b) i), ou à l'article 18, paragraphe 3, point b), du cheval enregistré prend les mesures suivantes:
|
a) |
il prend des dispositions pour qu'un vétérinaire effectue régulièrement des visites, dont ce dernier garde la trace, au cheval enregistré afin de rechercher des signes cliniques de maladies infectieuses éventuelles; |
|
b) |
il tient un registre du déplacement du cheval enregistré et des mouvements d'équidés se trouvant par intermittence dans l'exploitation où il est détenu; |
|
c) |
il accomplit les procédures douanières visées à l'article 15 du règlement d'exécution (UE) 2015/262; |
|
d) |
il introduit une demande de délivrance d'un document d'identification ou d'adaptation d'un document d'identification existant conformément à l'article 15, paragraphe 1, du règlement d'exécution (UE) 2015/262. |
4. En cas de mort ou de perte d'un cheval enregistré admis temporairement dans l'Union, l'autorité compétente du lieu de la mort ou de la perte, en étroite collaboration avec un poste d'inspection frontalier si l'État membre concerné l'exige:
|
a) |
met fin à l'admission temporaire dans le système Traces en choisissant l'option «Mort/Perte» dans la partie III du DVCE visé à l'article 16, paragraphe 1, point b) i), ou à l'article 18, paragraphe 3, point b); |
|
b) |
invalide ou retire tout exemplaire imprimé du DVCE délivré conformément à l'article 16, paragraphe 1, point c), ou, s'il y avait eu un mouvement antérieur à destination d'un autre État membre, conformément à l'article 16, paragraphe 2, point c), ou, s'il y avait eu une réintroduction antérieure après une exportation temporaire, conformément à l'article 18, paragraphe 3, point c). |
Article 20
Conditions particulières de police sanitaire applicables à la réintroduction de chevaux enregistrés après leur exportation temporaire pour des courses, des compétitions et des manifestations culturelles
1. Les États membres autorisent la réintroduction de chevaux enregistrés sous réserve des conditions suivantes:
|
a) |
le cheval enregistré est resté en dehors de l'Union pendant une période n'excédant pas 30 jours, sauf dans le cas spécifiquement prévu au paragraphe 3; |
|
b) |
le cheval enregistré n'a pas séjourné dans — ni transité sur terre par — un pays tiers ou une partie du territoire d'un pays tiers qui ne relève pas du même groupe sanitaire que le pays tiers ou la partie du territoire du pays tiers dans lequel le certificat sanitaire établi conformément au modèle figurant à l'annexe II, partie 2, section A, a été signé par le vétérinaire officiel; |
|
c) |
le certificat sanitaire pour l'exportation temporaire signé par le vétérinaire officiel dans l'État membre d'origine, ou une copie authentifiée de celui-ci, est présenté à la demande du poste d'inspection frontalier de réintroduction dans l'Union. |
2. L'autorité compétente qui établit le certificat d'un cheval enregistré en vue d'une exportation temporaire dans un pays tiers veille à ce que, conformément à l'article 2, paragraphe 1, de la décision 93/444/CEE, le cheval enregistré soit accompagné jusqu'au point de sortie dans un autre État membre d'un certificat sanitaire établi conformément au modèle figurant à l'annexe III de la directive 2009/156/CE.
3. La réintroduction, après une exportation temporaire d'une durée supérieure à 30 jours, de chevaux enregistrés participant à des courses, compétitions ou manifestations culturelles spécifiques est subordonnée à l'observation des conditions particulières de police sanitaire énoncées dans le modèle de certificat sanitaire se rapportant à l'événement organisé figurant à l'annexe II, partie 2, section B.
4. L'opérateur, identifié dans la case I.7 du DVCE, responsable du lot veille à ce que, pendant l'exportation temporaire, le cheval enregistré n'ait pas séjourné dans — ni transité sur terre par — un pays tiers ou une partie du territoire d'un pays tiers qui n'appartient pas au même groupe sanitaire que le pays tiers ou la partie du territoire du pays tiers dans lequel le certificat sanitaire établi conformément au modèle figurant à l'annexe II, partie 2, section A, a été signé par le vétérinaire officiel.
Article 21
Conditions particulières de police sanitaire applicables à l'importation d'équidés de boucherie
L'opérateur identifié dans la case I.7 du DVCE visé à l'article 16, paragraphe 1, point b) i), d'un lot d'équidés de boucherie veille à ce que, après l'exécution des contrôles au poste d'inspection frontalier d'entrée dans l'Union, les animaux:
|
a) |
soient acheminés directement, sans délai et sans entrer en contact avec des équidés présentant un statut sanitaire différent, à l'abattoir de destination, où ils sont abattus dans les 72 heures suivant leur arrivée à l'abattoir, ou |
|
b) |
passent par un seul centre de rassemblement agréé, tel que visé à l'article 7, paragraphe 1, de la directive 2009/156/CE et tel qu'indiqué dans le certificat sanitaire visé à l'article 3, paragraphe 1, point e), du présent règlement, dont ils sont retirés à la fin du marché pour lequel ils ont été rassemblés dans le respect des règles nationales garantissant la traçabilité pour être directement acheminés dans un abattoir pour y être abattus dans les plus brefs délais et au plus tard 5 jours ouvrables après leur arrivée dans l'Union, sans entrer en contact avec des équidés d'un statut sanitaire différent. |
SECTION 8
Dispositions transitoires et finales
Article 22
Dispositions transitoires
Pendant une période transitoire expirant le 31 décembre 2018, les États membres autorisent l'entrée dans l'Union de lots d'équidés et de lots de sperme, ovules et embryons d'équidés accompagnés de certificats sanitaires établis conformément aux modèles de certificat sanitaire applicables avant la mise en application du présent règlement à la date précisée à l'article 24, deuxième alinéa.
Article 23
Abrogation
Les décisions 92/260/CEE, 93/195/CEE, 93/196/CEE, 93/197/CEE, 94/699/CE, 95/329/CE, 2003/13/CE, 2004/177/CE, 2004/211/CE, 2010/57/UE et 2010/471/UE sont abrogées.
Toute référence faite à ces décisions s'entend comme faite au présent règlement.
Article 24
Entrée en vigueur et mise en application
Le présent règlement entre en vigueur le vingtième jour suivant celui de sa publication au Journal officiel de l'Union européenne.
Il est applicable à partir du 1er octobre 2018.
Toutefois, l'article 16, paragraphe 1, point b) iii), paragraphe 2, points b), c) et d), paragraphe 3, paragraphe 4, points a) et b), et paragraphe 5, et l'article 17, paragraphe 1, point d), sont applicables à partir du 14 décembre 2019.
Le présent règlement est obligatoire dans tous ses éléments et directement applicable dans tout État membre.
Fait à Bruxelles, le 12 avril 2018.
Par la Commission
Le président
Jean-Claude JUNCKER
(1) JO L 268 du 24.9.1991, p. 56.
(2) JO L 268 du 14.9.1992, p. 54.
(3) JO L 192 du 23.7.2010, p. 1.
(4) Décision 2004/211/CE de la Commission du 6 janvier 2004 établissant la liste des pays tiers et des parties de territoires de ces pays en provenance desquels les États membres autorisent les importations d'équidés vivants et de sperme, d'ovules et d'embryons de l'espèce équine, et modifiant les décisions 93/195/CEE et 94/63/CE (JO L 73 du 11.3.2004, p. 1).
(5) Directive 2008/73/CE du Conseil du 15 juillet 2008 simplifiant les procédures d'établissement des listes et de publication de l'information dans les domaines vétérinaire et zootechnique, et modifiant les directives 64/432/CEE, 77/504/CEE, 88/407/CEE, 88/661/CEE, 89/361/CEE, 89/556/CEE, 90/426/CEE, 90/427/CEE, 90/428/CEE, 90/429/CEE, 90/539/CEE, 91/68/CEE, 91/496/CEE, 92/35/CEE, 92/65/CEE, 92/66/CEE, 92/119/CEE, 94/28/CE, 2000/75/CE, la décision 2000/258/CE et les directives 2001/89/CE, 2002/60/CE et 2005/94/CE (JO L 219 du 14.8.2008, p. 40).
(6) http://ec.europa.eu/food/animals/semen/equine_en
(7) Règlement (UE) no 176/2010 de la Commission du 2 mars 2010 modifiant l'annexe D de la directive 92/65/CEE du Conseil en ce qui concerne les centres de collecte et de stockage de sperme, les équipes de collecte et de production d'embryons et les conditions applicables aux animaux donneurs des espèces équine, ovine et caprine et au maniement des spermes, ovules et embryons de ces espèces (JO L 52 du 3.3.2010, p. 14).
(8) Décision 2010/470/UE de la Commission du 26 août 2010 établissant les modèles de certificats sanitaires applicables aux échanges dans l'Union de sperme, d'ovules et d'embryons d'équidés, d'ovins et de caprins ainsi que d'ovules et d'embryons de porcins (JO L 228 du 31.8.2010, p. 15).
(9) Décision 2002/309/CE, Euratom du Conseil et de la Commission concernant l'accord de coopération scientifique et technologique du 4 avril 2002 relative à la conclusion de sept accords avec la Confédération suisse (JO L 114 du 30.4.2002, p. 1).
(10) JO L 71 du 18.3.1999, p. 3.
(11) Décision 1999/201/CE du Conseil du 14 décembre 1998 relative à la conclusion de l'accord entre la Communauté européenne et le gouvernement du Canada relatif aux mesures sanitaires de protection de la santé publique et animale applicables au commerce d'animaux vivants et de produits animaux (JO L 71 du 18.3.1999, p. 1).
(12) JO L 57 du 26.2.1997, p. 5.
(13) Décision 97/132/CE du Conseil du 17 décembre 1996 concernant la conclusion de l'accord entre la Communauté européenne et la Nouvelle-Zélande relatif aux mesures sanitaires applicables au commerce d'animaux vivants et de produits animaux (JO L 57 du 26.2.1997, p. 4).
(14) Règlement (CE) no 180/2008 de la Commission du 28 février 2008 concernant le laboratoire communautaire de référence pour les maladies équines autres que la peste équine et modifiant l'annexe VII du règlement (CE) no 882/2004 du Parlement européen et du Conseil (JO L 56 du 29.2.2008, p. 4).
(15) Décision 97/794/CE de la Commission du 12 novembre 1997 fixant certaines modalités d'application de la directive 91/496/CEE du Conseil en ce qui concerne les contrôles vétérinaires des animaux sur pied en provenance des pays tiers (JO L 323 du 26.11.1997, p. 31).
(16) Rapport du comité vétérinaire scientifique sur l'artérite virale équine, 12 décembre 1994, VI/4994/94 — Rév. 4.
(17) Décision 95/329/CE de la Commission du 25 juillet 1995 fixant les catégories d'équidés mâles auxquels l'exigence pour l'artérite virale prévue à l'article 15 point b) ii) de la directive 90/426/CEE du Conseil est applicable (JO L 191 du 12.8.1995, p. 36).
(18) http://www.oie.int/fr/normes-internationales/code-terrestre/acces-en-ligne/?htmfile=chapitre_eav.htm
(19) Décision 2003/24/CE de la Commission du 30 décembre 2002 concernant le développement d'un système informatique vétérinaire intégré (JO L 8 du 14.1.2003, p. 44).
(20) Décision 2004/292/CE de la Commission du 30 mars 2004 relative à la mise en application du système TRACES et modifiant la décision 92/486/CEE (JO L 94 du 31.3.2004, p. 63).
(21) Décision 2009/821/CE de la Commission du 28 septembre 2009 établissant une liste de postes d'inspection frontaliers agréés, fixant certaines règles concernant les inspections réalisées par les experts vétérinaires de la Commission et définissant les unités vétérinaires du système TRACES (JO L 296 du 12.11.2009, p. 1).
(22) Décision 2007/240/CE de la Commission du 16 avril 2007 établissant de nouveaux certificats vétérinaires d'introduction des animaux vivants, de la semence, des embryons, des ovules et des produits d'origine animale dans la Communauté dans le cadre des décisions 79/542/CEE, 92/260/CEE, 93/195/CEE, 93/196/CEE, 93/197/CEE, 95/328/CE, 96/333/CE, 96/539/CE, 96/540/CE, 2000/572/CE, 2000/585/CE, 2000/666/CE, 2002/613/CE, 2003/56/CE, 2003/779/CE, 2003/804/CE, 2003/858/CE, 2003/863/CE, 2003/881/CE, 2004/407/CE, 2004/438/CE, 2004/595/CE, 2004/639/CE et 2006/168/CE (JO L 104 du 21.4.2007, p. 37).
(23) Règlement (CE) no 282/2004 de la Commission du 18 février 2004 relatif à l'établissement d'un document pour la déclaration et le contrôle vétérinaire des animaux en provenance des pays tiers et introduits dans la Communauté (JO L 49 du 19.2.2004, p. 11).
(24) Décision 93/444/CEE de la Commission du 2 juillet 1993 relative aux modalités régissant les échanges intracommunautaires de certains animaux vivants et produits destinés à être exportés vers les pays tiers (JO L 208 du 19.8.1993, p. 34).
(25) Décision 92/260/CEE de la Commission du 10 avril 1992 relative aux conditions sanitaires et à la certification sanitaire requises pour l'admission temporaire de chevaux enregistrés (JO L 130 du 15.5.1992, p. 67).
(26) Décision 93/195/CEE de la Commission du 2 février 1993 relative aux conditions sanitaires et à la certification sanitaire requises pour la réadmission de chevaux enregistrés en vue des courses, de la compétition et de manifestations culturelles après exportation temporaire (JO L 86 du 6.4.1993, p. 1).
(27) Décision 93/196/CEE de la Commission du 5 février 1993 relative aux conditions sanitaires et à la certification sanitaire requises pour les importations d'équidés de boucherie (JO L 86 du 6.4.1993, p. 7).
(28) Décision 93/197/CEE de la Commission du 5 février 1993 relative aux conditions sanitaires et à la certification sanitaire requises pour les importations d'équidés enregistrés ainsi que d'équidés d'élevage et de rente (JO L 86 du 6.4.1993, p. 16).
(29) Décision 94/699/CE de la Commission du 19 octobre 1994 prévoyant une fréquence réduite de contrôle d'identité et de contrôle physique lors de l'admission temporaire de certains équidés en provenance de Suède, de Norvège et de Finlande et abrogeant la décision 93/321/CEE (JO L 280 du 29.10.1994, p. 88).
(30) Décision 2003/13/CE de la Commission du 10 janvier 2003 relative à l'admission temporaire de chevaux participant aux épreuves préolympiques en Grèce en 2003 (JO L 7 du 11.1.2003, p. 86).
(31) Décision 2004/177/CE de la Commission du 20 février 2004 relative à l'introduction temporaire de chevaux enregistrés participant aux jeux Olympiques ou paralympiques en Grèce en 2004 (JO L 55 du 24.2.2004, p. 64).
(32) Décision 2010/57/UE de la Commission du 3 février 2010 établissant des garanties sanitaires pour le transit des équidés transportés à travers les territoires mentionnés à l'annexe I de la directive 97/78/CE du Conseil (JO L 32 du 4.2.2010, p. 9).
(33) Décision 2010/471/UE de la Commission du 26 août 2010 relative aux importations de sperme, d'ovules et d'embryons d'équidés dans l'Union en ce qui concerne les listes des stations et des centres de collecte et de stockage de sperme et des équipes de collecte et de production d'embryons ainsi que les conditions de certification (JO L 228 du 31.8.2010, p. 52).
(34) Règlement d'exécution (UE) 2015/262 de la Commission du 17 février 2015 établissant des règles conformément aux directives du Conseil 90/427/CEE et 2009/156/CE en ce qui concerne les méthodes d'identification des équidés (règlement sur le passeport équin) (JO L 59 du 3.3.2015, p. 1).
(35) Directive 90/427/CEE du Conseil du 26 juin 1990 relative aux conditions zootechniques et généalogiques régissant les échanges intracommunautaires d'équidés (JO L 224 du 18.8.1990, p. 55).
(36) Directive 97/78/CE du Conseil du 18 décembre 1997 fixant les principes relatifs à l'organisation des contrôles vétérinaires pour les produits en provenance des pays tiers introduits dans la Communauté (JO L 24 du 30.1.1998, p. 9).
(37) https://ec.europa.eu/food/sites/food/files/animals/docs/ad_control-measures_bt_guidance_vpe_7068_2012.pdf
(38) Règlement (CE) no 882/2004 du Parlement européen et du Conseil du 29 avril 2004 relatif aux contrôles officiels effectués pour s'assurer de la conformité avec la législation sur les aliments pour animaux et les denrées alimentaires et avec les dispositions relatives à la santé animale et au bien-être des animaux (JO L 165 du 30.4.2004, p. 1).
(39) Directive 92/35/CEE du Conseil du 29 avril 1992 établissant les règles de contrôle et les mesures de lutte contre la peste équine (JO L 157 du 10.6.1992, p. 19).
ANNEXE I
LISTE DES PAYS TIERS (1) ET DES PARTIES DU TERRITOIRE DE PAYS TIERS (2) EN PROVENANCE DESQUELS L'ENTRÉE DANS L'UNION DE LOTS D'ÉQUIDÉS ET DE SPERME, D'OVULES ET D'EMBRYONS D'ÉQUIDÉS EST AUTORISÉE
|
Code ISO |
Pays tiers |
Code de la partie du territoire du pays tiers |
Description de la partie du territoire du pays tiers |
GS |
AT |
Réintroduction |
Importation |
Importation |
Transit |
Conditions particulières |
|||||
|
CE |
CE |
CE |
EB |
E enr. + EER |
Sperme |
O/E |
Équidés |
|
|||||||
|
CE |
E enr. |
EER |
|
|
|
||||||||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
16 |
|
AE |
Émirats arabes unis |
AE-0 |
L'ensemble du pays |
E |
X |
X |
X |
— |
— |
X |
— |
— |
X |
X |
|
|
AR |
Argentine |
AR-0 |
L'ensemble du pays |
D |
X |
X |
X |
X |
X |
X |
X |
X |
X |
X |
|
|
AU |
Australie |
AU-0 |
L'ensemble du pays |
A |
X |
X |
X |
X |
X |
X |
X |
X |
X |
X |
|
|
BB |
Barbade |
BB-0 |
L'ensemble du pays |
D |
X |
X |
X |
— |
— |
X |
— |
— |
— |
X |
|
|
BH |
Bahreïn |
BH-0 |
L'ensemble du pays |
E |
X |
X |
X |
— |
— |
— |
— |
— |
— |
X |
|
|
BM |
Bermudes |
BM-0 |
L'ensemble du pays |
D |
X |
X |
X |
— |
— |
X |
— |
— |
— |
X |
|
|
BO |
Bolivie |
BO-0 |
L'ensemble du pays |
D |
X |
X |
X |
— |
— |
X |
— |
— |
— |
X |
|
|
BR |
Brésil |
BR-0 |
L'ensemble du pays |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
|
|
|
BR-1 |
Les États suivants: Rio Grande do Sul, Santa Catarina, Mato Grosso do Sul, Distrito Federal et Rio de Janeiro |
D |
X |
X |
X |
— |
— |
X |
— |
— |
— |
X |
|
||
|
BY |
Biélorussie |
BY-0 |
L'ensemble du pays |
B |
X |
X |
X |
X |
X |
|
|
|
|
X |
|
|
CA |
Canada |
CA-0 |
L'ensemble du pays |
C |
X |
X |
X |
X |
X |
X |
X |
X |
X |
X |
|
|
CH |
Suisse (1) |
CH-0 |
L'ensemble du pays |
A |
X |
X |
X |
X |
X |
X |
X |
X |
X |
X |
|
|
CL |
Chili |
CL-0 |
L'ensemble du pays |
D |
X |
X |
X |
X |
X |
— |
— |
— |
— |
X |
|
|
CN |
Chine |
CN-0 |
L'ensemble du pays |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
|
|
|
CN-1 |
La zone indemne de maladies des équidés située dans la ville de Conghua (municipalité de Guangzhou, province de Guangdong), y compris le couloir routier de biosécurité depuis et vers l'aéroport de Guangzhou et Hong Kong (voir l'ENCADRÉ 1 pour plus de précisions). |
G |
X |
X |
X |
— |
— |
— |
— |
— |
— |
X |
|
||
|
CN-2 |
Le site du Global Champions Tour dans le parc de stationnement no 15 de l'Expo 2010 et le couloir routier vers l'aéroport international de Shanghaï Pudong situé dans la partie septentrionale de la zone nouvelle de Pudong et dans la partie orientale du district de Minhang, dans la municipalité de Shanghaï (voir l'ENCADRÉ 1 pour plus de précisions). |
G |
— |
X |
— |
— |
— |
— |
— |
— |
— |
|
Uniquement moyennant une certification conformément à l'annexe II, partie 2, section B, chapitre 1 |
||
|
CR |
Costa Rica |
CR-0 |
L'ensemble du pays |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
|
|
|
CR-1 |
L'aire métropolitaine de San José |
D |
— |
X |
— |
— |
— |
— |
— |
— |
— |
|
|
||
|
CU |
Cuba |
CU-0 |
L'ensemble du pays |
D |
X |
X |
X |
— |
— |
|
— |
— |
— |
X |
|
|
DZ |
Algérie |
DZ-0 |
L'ensemble du pays |
E |
X |
X |
X |
X |
X |
|
|
|
|
X |
|
|
EG |
Égypte |
EG-0 |
L'ensemble du pays |
|
— |
— |
— |
— |
— |
— |
— |
— |
— |
|
|
|
EG-1 |
La zone indemne de maladies des équidés établie autour de l'hôpital vétérinaire des forces armées égyptiennes, route El Nasr, face au Al Ahly Club (Le Caire), et le couloir autoroutier menant à l'aéroport international du Caire (voir l'ENCADRÉ 2 pour plus de précisions) |
E |
X |
— |
X |
— |
— |
— |
— |
— |
— |
X |
|
||
|
FK |
Îles Falkland |
FK-0 |
L'ensemble du pays |
A |
X |
X |
X |
— |
X |
|
|
|
|
X |
|
|
GL |
Groenland |
GL-0 |
L'ensemble du pays |
A |
X |
X |
X |
X |
X |
|
|
|
|
X |
|
|
HK |
Hong Kong |
HK-0 |
L'ensemble du pays |
G |
X |
X |
X |
— |
— |
|
— |
— |
— |
X |
|
|
IL |
Israël (3) |
IL-0 |
L'ensemble du pays |
E |
X |
X |
X |
X |
X |
X |
X |
|
|
X |
|
|
IS |
Islande (5) |
IS-0 |
L'ensemble du pays |
A |
X |
X |
X |
X |
X |
X |
X |
X |
|
X |
|
|
JM |
Jamaïque |
JM-0 |
L'ensemble du pays |
D |
X |
X |
X |
— |
— |
|
— |
— |
— |
X |
|
|
JO |
Jordanie |
JO-0 |
L'ensemble du pays |
E |
X |
X |
X |
— |
— |
|
— |
— |
— |
X |
|
|
JP |
Japon |
JP-0 |
L'ensemble du pays |
G |
X |
X |
X |
— |
— |
|
— |
— |
— |
X |
|
|
KG |
Kirghizstan |
KG-0 |
L'ensemble du pays |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
|
|
|
KG-1 |
La région d'Issyk-Koul |
B |
— |
— |
X |
— |
— |
|
— |
— |
— |
X |
|
||
|
KR |
République de Corée |
KR-0 |
L'ensemble du pays |
G |
X |
X |
X |
— |
— |
|
— |
— |
— |
X |
|
|
KW |
Koweït |
KW-0 |
L'ensemble du pays |
E |
X |
X |
X |
— |
— |
— |
— |
— |
— |
X |
|
|
LB |
Liban |
LB-0 |
L'ensemble du pays |
E |
X |
X |
X |
— |
— |
— |
— |
— |
— |
X |
|
|
MA |
Maroc |
MA-0 |
L'ensemble du pays |
E |
X |
X |
X |
X |
X |
X |
X |
X |
|
X |
|
|
ME |
Monténégro |
ME-0 |
L'ensemble du pays |
B |
X |
X |
X |
X |
X |
|
|
|
|
X |
|
|
MK |
Ancienne République yougoslave de Macédoine (4) |
MK-0 |
L'ensemble du pays |
B |
X |
X |
X |
X |
X |
|
|
|
|
X |
|
|
MO |
Macao |
MO-0 |
L'ensemble du pays |
G |
X |
X |
X |
— |
— |
|
— |
— |
— |
X |
|
|
MY |
Malaisie |
MY-0 |
L'ensemble du pays |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
|
|
|
MY-1 |
La péninsule |
G |
X |
X |
X |
— |
— |
|
— |
— |
— |
X |
|
||
|
MU |
Maurice |
MU-0 |
L'ensemble du pays |
E |
— |
— |
X |
— |
— |
— |
— |
— |
— |
X |
|
|
MX |
Mexique |
MX-0 |
L'ensemble du pays |
C |
— |
— |
— |
— |
— |
— |
— |
— |
— |
|
|
|
|
|
MX-1 |
L'aire métropolitaine de Mexico |
C |
|
X |
|
|
|
|
|
|
|
|
Uniquement moyennant une certification conformément à l'annexe II, partie 2, section B, chapitre 1 |
|
NO |
Norvège (5) |
NO-1 |
L'ensemble du pays |
A |
X |
X |
X |
X |
X |
X |
X |
X |
X |
X |
|
|
NZ |
Nouvelle-Zélande |
NZ-0 |
L'ensemble du pays |
A |
X |
X |
X |
X |
X |
|
|
|
|
X |
|
|
OM |
Oman |
OM-0 |
L'ensemble du pays |
E |
X |
X |
X |
— |
— |
|
— |
— |
— |
X |
|
|
PE |
Pérou |
PE-0 |
L'ensemble du pays |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
|
|
|
PE-1 |
La région de Lima |
D |
X |
X |
X |
— |
— |
|
— |
— |
— |
X |
|
||
|
PM |
Saint-Pierre-et-Miquelon |
PM-0 |
L'ensemble du pays |
A |
— |
— |
X |
— |
X |
|
|
|
|
X |
|
|
PY |
Paraguay |
PY-0 |
L'ensemble du pays |
D |
X |
X |
X |
X |
X |
|
|
|
|
X |
|
|
QA |
Qatar |
QA-0 |
L'ensemble du pays |
E |
X |
X |
X |
— |
— |
|
— |
— |
— |
X |
|
|
RS |
Serbie (6) |
RS-0 |
L'ensemble du pays |
B |
X |
X |
X |
X |
X |
|
|
|
|
X |
|
|
RU |
Russie |
RU-0 |
L'ensemble du pays |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
|
|
|
RU-1 |
Les provinces suivantes: Kaliningrad, Arkhangelsk, Vologda, Murmansk, Leningrad, Novgorod, Pskov, Briansk, Vladimir, Ivanovo, Tver, Kaluga, Kostroma, Moskva, Orjol, Riasan, Smolensk, Tula, Jaroslavl, Nijninovgorod, Kirov, Belgorod, Voronesh, Kursk, Lipezk, Tambov, Astrahan, Volgograd, Penza, Saratov, Uljanovsk, Rostov, Orenburg, Perm et Kurgan |
B |
X |
X |
X |
X |
X |
|
|
|
|
X |
|
||
|
RU-2 |
Les régions de Stavropol et de Krasnodar |
B |
X |
X |
X |
X |
X |
|
|
|
|
X |
|
||
|
RU-3 |
Les républiques suivantes: Karelia, Marij-El, Mordovia, Chuvachia, Kalmykia, Tatarstan, Dagestan, Kabardino-Balkaria, Severnaya Osetia, Ingushetia et Karachaevo-Cherkesia |
B |
X |
X |
X |
X |
X |
|
|
|
|
X |
|
||
|
SA |
Arabie saoudite |
SA-0 |
L'ensemble du pays |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
|
|
|
SA-1 |
L'ensemble du pays, à l'exception de la partie du territoire SA-2 |
E |
X |
X |
X |
— |
— |
X |
— |
— |
— |
X |
|
||
|
SA-2 |
Les zones de protection et de surveillance des provinces de Jizan, d'Asir et de Najran décrites dans l'ENCADRÉ 3 |
— |
— |
— |
— |
|
|
— |
|
|
|
|
|
||
|
SG |
Singapour |
SG-0 |
L'ensemble du pays |
G |
X |
X |
X |
— |
— |
|
— |
— |
— |
X |
|
|
TH |
Thaïlande |
TH-0 |
L'ensemble du pays |
G |
X |
X |
X |
— |
— |
|
— |
— |
— |
X |
|
|
TN |
Tunisie |
TN-0 |
L'ensemble du pays |
E |
X |
X |
X |
X |
X |
|
|
|
|
X |
|
|
TR |
Turquie |
TR-0 |
L'ensemble du pays |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
|
|
|
TR-1 |
Les provinces suivantes: Ankara, Edirne, Istanbul, Izmir, Kirklareli et Tekirdag |
E |
— |
— |
— |
— |
— |
|
— |
— |
— |
— |
|
||
|
UA |
Ukraine |
UA-0 |
L'ensemble du pays |
B |
X |
X |
X |
X |
X |
X |
X |
X |
|
X |
|
|
US |
États-Unis d'Amérique |
US-0 |
L'ensemble du pays |
C |
X |
X |
X |
X |
X |
X |
X |
X |
X |
X |
|
|
UY |
Uruguay |
UY-0 |
L'ensemble du pays |
D |
X |
X |
X |
X |
X |
X |
X |
X |
|
X |
|
|
ZA |
Afrique du Sud |
ZA-0 |
L'ensemble du pays |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
|
|
|
ZA-1 |
L'aire métropolitaine du Cap (voir l'ENCADRÉ 4 pour plus de précisions) |
F |
— |
— |
— |
— |
— |
— |
— |
— |
— |
|
Décision 2008/698/CE de la Commission |
||
LÉGENDE DE L'ANNEXE I
|
Animal/Produit: |
Catégories/Conditions |
|
CE |
Chevaux enregistrés au sens de l'article 2, point c), du présent règlement. |
|
EB |
Équidés de boucherie au sens de l'article 2, point d), de la directive 2009/156/CE. |
|
E enr. |
Équidés enregistrés au sens de l'article 2, point c), de la directive 2009/156/CE. |
|
EER |
Équidés d'élevage et de rente au sens de l'article 2, point e), de la directive 2009/156/CE. |
|
Sperme |
Sperme d'animaux de l'espèce équine collecté conformément à l'article 17, paragraphe 2, point b) ii), de la directive 92/65/CEE. |
|
O/E |
Ovules et embryons d'animaux de l'espèce équine collectés conformément à l'article 17, paragraphe 2, point b) ii), de la directive 92/65/CEE. |
|
Colonnes |
Informations/Description des marchandises |
Certificat sanitaire requis |
|
1-4 |
Description territoriale |
s.o. |
|
5 |
Groupe sanitaire |
s.o. |
|
6 |
Admission temporaire de chevaux enregistrés |
ANNEXE II, partie 1, section A |
|
7 |
Réintroduction de chevaux enregistrés après une exportation temporaire en vue des courses, de la compétition et de manifestations culturelles |
ANNEXE II, partie 2, section A ANNEXE II, partie 2, section B, chapitre 1 ANNEXE II, partie 2, section B, chapitre 2 |
|
8 |
Importations de chevaux enregistrés |
ANNEXE II, partie 3, section A |
|
9 |
Importations d'équidés de boucherie |
ANNEXE II, partie 3, section B |
|
10 |
Importations d'équidés enregistrés et d'équidés d'élevage et de rente |
ANNEXE II, partie 3, section A |
|
11 |
Importations de sperme collecté sur des chevaux enregistrés |
ANNEXE III, partie 1, section A ANNEXE III, partie 1, section B ANNEXE III, partie 1, section C ANNEXE III, partie 1, section D |
|
12 |
Importations de sperme collecté sur des équidés enregistrés |
ANNEXE III, partie 1, section A ANNEXE III, partie 1, section B ANNEXE III, partie 1, section C ANNEXE III, partie 1, section D |
|
13 |
Importations de sperme collecté sur des équidés d'élevage et de rente |
ANNEXE III, partie 1, section A ANNEXE III, partie 1, section B ANNEXE III, partie 1, section C ANNEXE III, partie 1, section D |
|
14 |
Importations d'ovules et d'embryons de l'espèce équine |
ANNEXE III, partie 2, section A ANNEXE III, partie 2, section B |
|
15 |
Équidés en transit |
ANNEXE II, partie 1, section B |
|
16 |
Référence aux conditions particulières/aux garanties supplémentaires |
s.o. |
Cases
|
X |
Entrée autorisée |
|
— |
Entrée non autorisée |
Groupes sanitaires
|
Groupe sanitaire |
Garanties de police sanitaire limitées exigées pour l'entrée d'équidés dans l'Union |
|
A |
Anémie infectieuse des équidés, artérite virale équine |
|
B |
Anémie infectieuse des équidés, artérite virale équine, morve, dourine |
|
C |
Anémie infectieuse des équidés, artérite virale équine, encéphalomyélite équine de l'Est ou de l'Ouest, stomatite vésiculeuse |
|
D |
Anémie infectieuse des équidés, artérite virale équine, morve, dourine, encéphalomyélite équine de l'Est ou de l'Ouest, encéphalomyélite équine vénézuélienne, stomatite vésiculeuse |
|
E |
Anémie infectieuse des équidés, artérite virale équine, morve, dourine, peste équine |
|
F |
Anémie infectieuse des équidés, dourine, peste équine |
|
G |
Anémie infectieuse des équidés, artérite virale équine, morve, dourine, encéphalite japonaise |
|
ENCADRÉ 1 |
||||||||||||||||||||||||||||||||||||
|
CN |
Chine |
CN-1 |
La zone indemne de maladies des équidés (EDFZ) spécifique située dans la province de Guangdong, dont la délimitation est la suivante:
|
|||||||||||||||||||||||||||||||||
|
CN |
Chine |
CN-2 |
Délimitation de la zone dans la municipalité de Shanghaï:
|
|||||||||||||||||||||||||||||||||
|
ENCADRÉ 2 |
|||||||
|
EG |
Égypte |
EG-1 |
La zone indemne de maladies des équidés (EDFZ), d'une superficie d'environ 0,1 km2, établie autour de l'hôpital vétérinaire des forces armées égyptiennes, route El-Nasr, face au Al Ahly Club, dans la banlieue est du Caire (coordonnées 30°04′19,6″ N, 31°21′16,5″ E), ainsi que le couloir routier de 10 km sur la route El-Nasr et la route de l'aéroport menant à l'aéroport international du Caire.
|
||||
|
ENCADRÉ 3 |
|||||||||||||||||||||
|
SA |
Arabie saoudite |
SA-1 |
Stations de quarantaine agréées:
|
||||||||||||||||||
|
|
|
SA-2 |
Délimitation des zones de protection et de surveillance établie conformément à l'article 5, paragraphe 2, deuxième alinéa, points a) et b), de la directive 2009/156/CE:
|
||||||||||||||||||
|
ENCADRÉ 4 |
|||||||||||||||||
|
ZA |
Afrique du Sud |
ZA-1 |
Stations de quarantaine agréées:
|
||||||||||||||
(1) Sans préjudice des exigences spécifiques de certification prévues dans la décision 2002/309/CE, Euratom du Conseil et de la Commission.
(2) Lorsqu'une régionalisation officielle s'applique conformément à l'article 13, paragraphe 2, point a), de la directive 2009/156/CE.
(3) Ci-après entendu comme l'État d'Israël, à l'exclusion des territoires sous administration israélienne depuis juin 1967, à savoir le plateau du Golan, la bande de Gaza, Jérusalem-Est et le reste de la Cisjordanie.
(4) La nomenclature définitive pour ce pays sera adoptée à l'issue des négociations en cours à cet égard aux Nations unies.
(5) Sans préjudice des exigences spécifiques de certification prévues à l'article 17 de l'accord sur l'Espace économique européen (JO L 1 du 3.1.1994, p. 3).
(6) À l'exclusion du Kosovo tel qu'il est défini par la résolution no 1244 du Conseil de sécurité de l'Organisation des Nations unies du 10 juin 1999.
ANNEXE II
MODÈLES DE CERTIFICAT SANITAIRE ET MODÈLES DE DÉCLARATION POUR L'ENTRÉE D'ÉQUIDÉS VIVANTS DANS L'UNION
PARTIE 1
Admission temporaire et transit
Section A
Modèle de certificat sanitaire et modèle de déclaration pour l'admission temporaire (pendant une période inférieure à 90 jours) dans l'Union de chevaux enregistrés
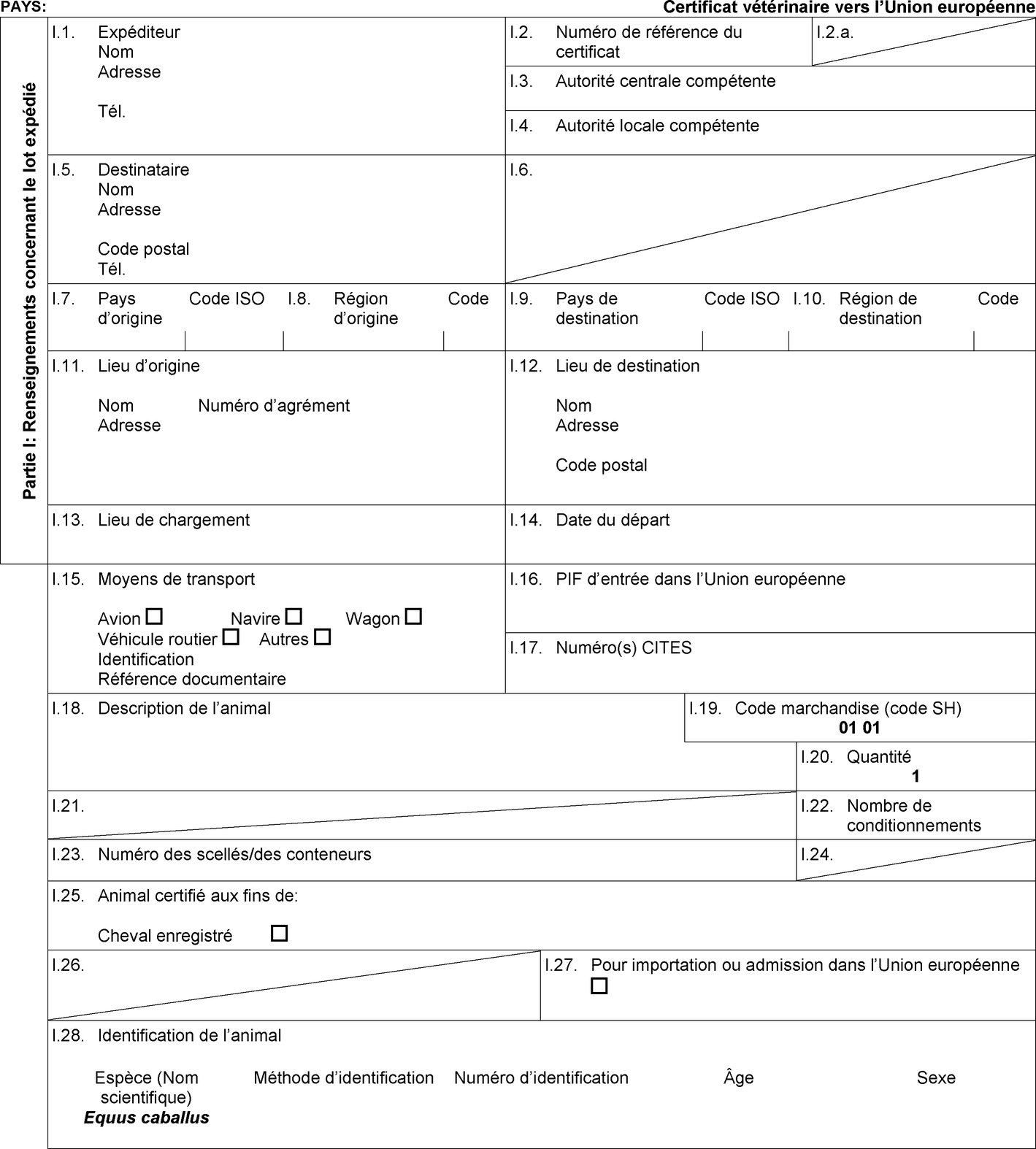 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
Section B
Modèle de certificat sanitaire et modèle de déclaration pour le transit par l'Union d'équidés vivants expédiés d'un pays tiers ou d'une partie du territoire d'un pays tiers à destination d'un autre pays tiers ou d'une autre partie du territoire du même pays tiers
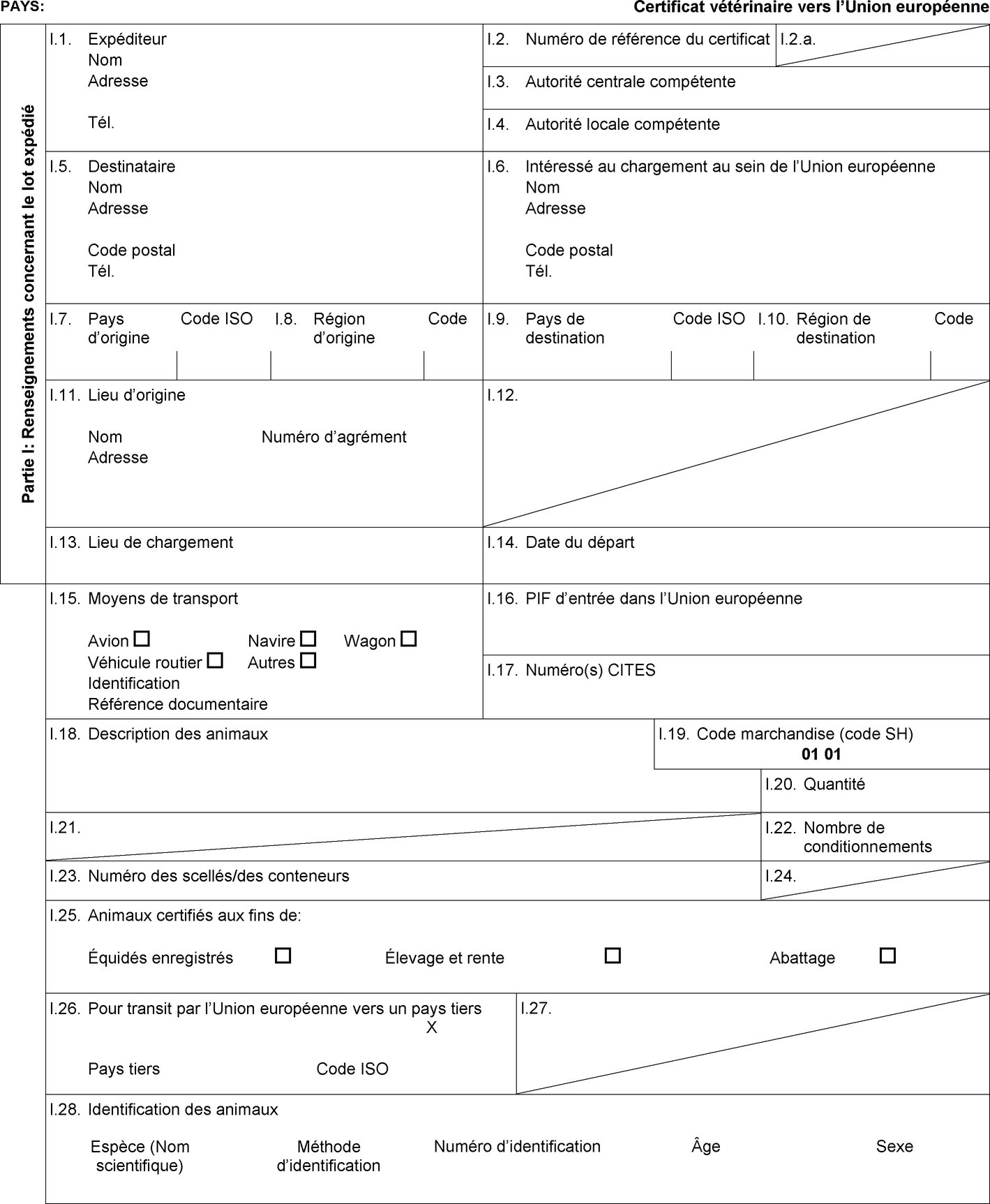 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
PARTIE 2
Réintroduction après une exportation temporaire
Section A
Modèle de certificat sanitaire et modèle de déclaration pour la réintroduction dans l'Union de chevaux enregistrés en vue des courses, de la compétition et de manifestations culturelles après une exportation temporaire d'une durée de moins de 30 jours
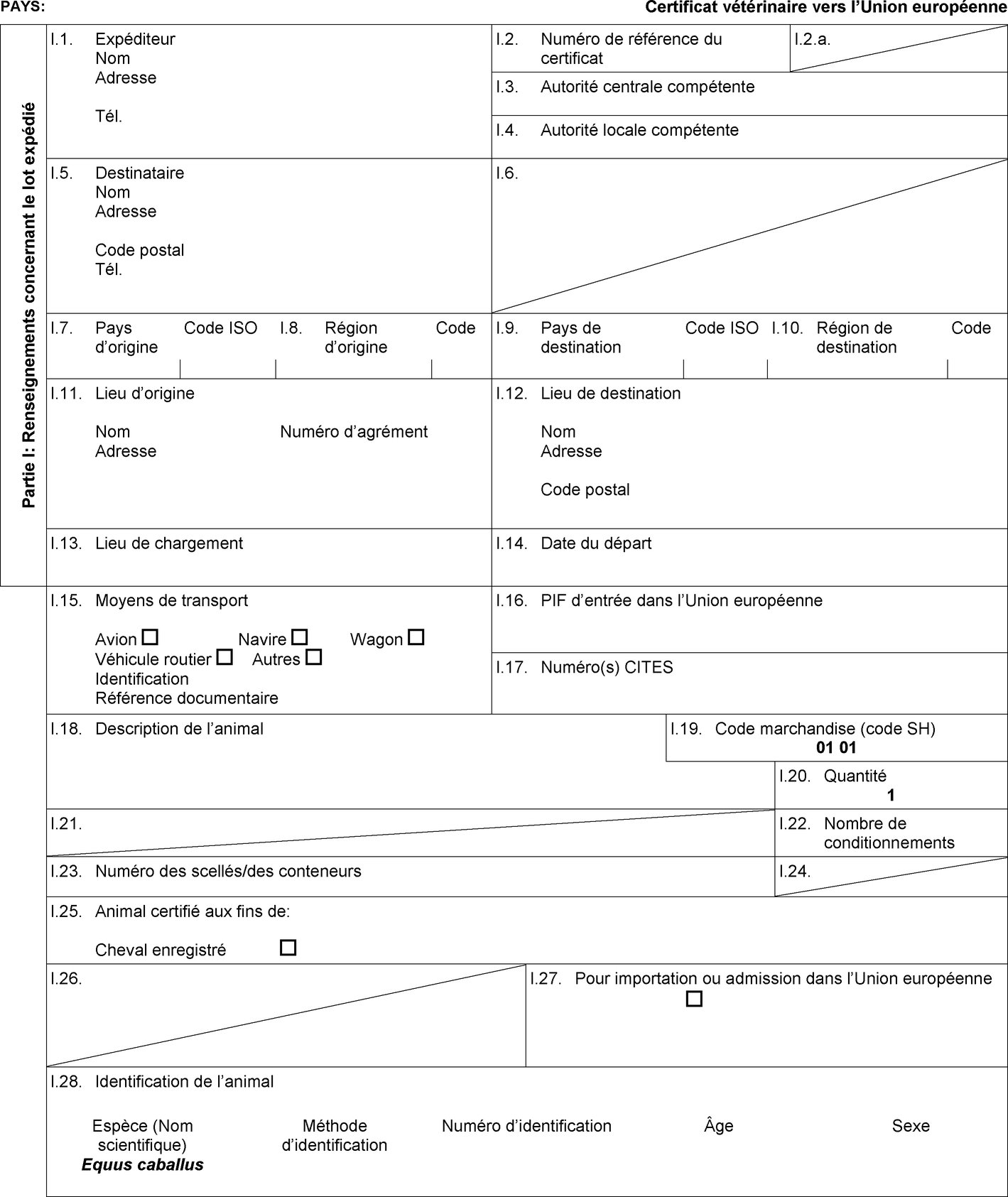 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
Section B
Modèles de certificat sanitaire et modèles de déclaration applicables en cas de réintroduction dans l'Union de chevaux enregistrés exportés temporairement en vue de courses ou compétitions spécifiques
Modèle de certificat sanitaire et modèle de déclaration applicables à la réintroduction dans l'Union de chevaux enregistrés en vue de la compétition après une exportation temporaire de moins de 90 jours pour participer à des manifestations équestres organisées sous les auspices de la Fédération équestre internationale (FEI)
(épreuve préparatoire des jeux Olympiques, jeux Olympiques ou paralympiques, Jeux équestres mondiaux, Jeux équestres asiatiques ou américains, Coupe du monde d'endurance aux Émirats arabes unis)
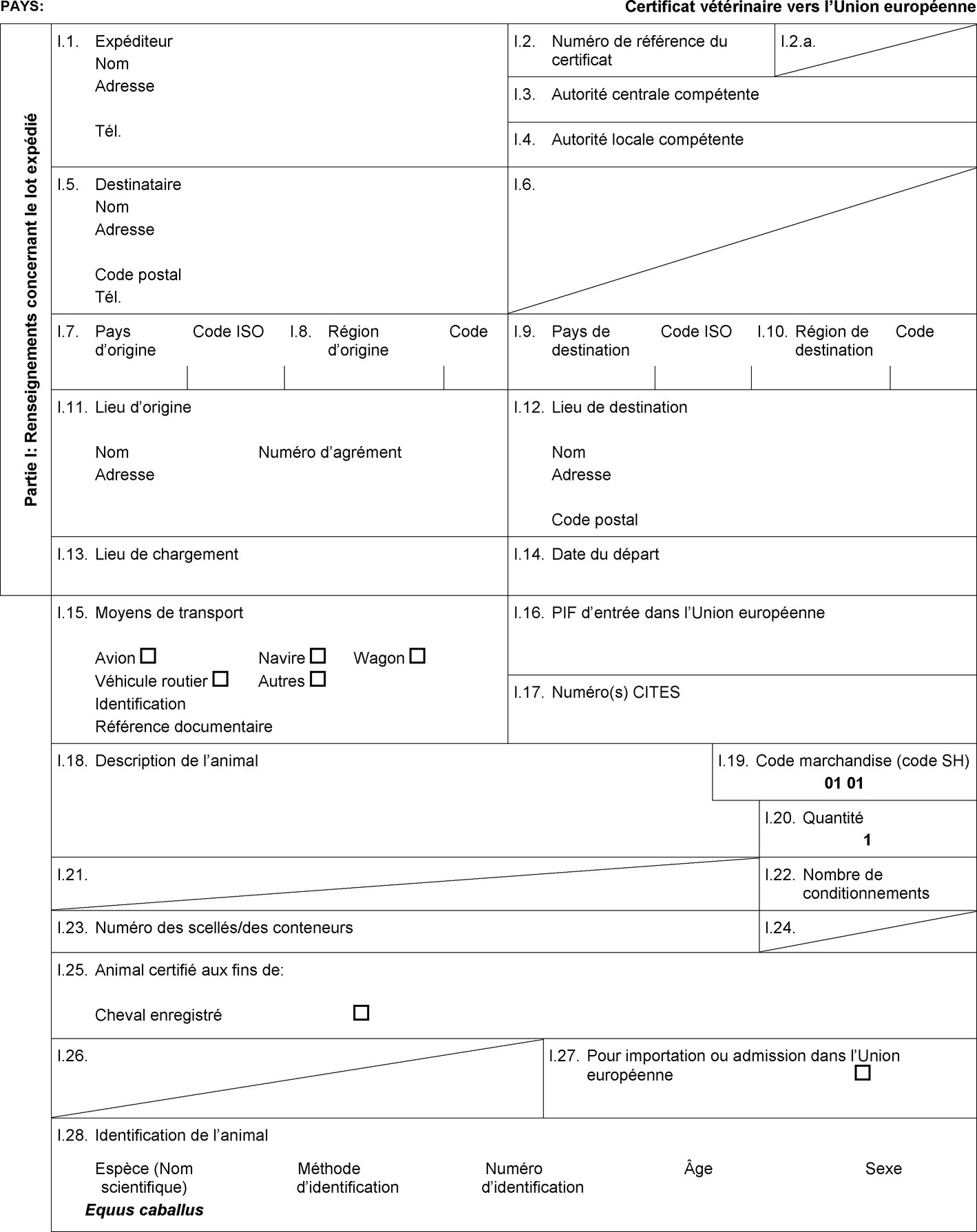 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
Modèle de certificat sanitaire et modèle de déclaration applicables à la réintroduction dans l'Union de chevaux enregistrés en vue des courses après une exportation temporaire de moins de 90 jours pour participer à des épreuves de course spécifiques en Australie, au Canada, aux Émirats arabes unis, aux États-Unis d'Amérique, à Hong Kong, au Japon, au Qatar ou à Singapour
(réunions internationales par groupes ou catégories, Japan Cup, Melbourne Cup, Dubai Racing World Cup ou Hong Kong International Races)
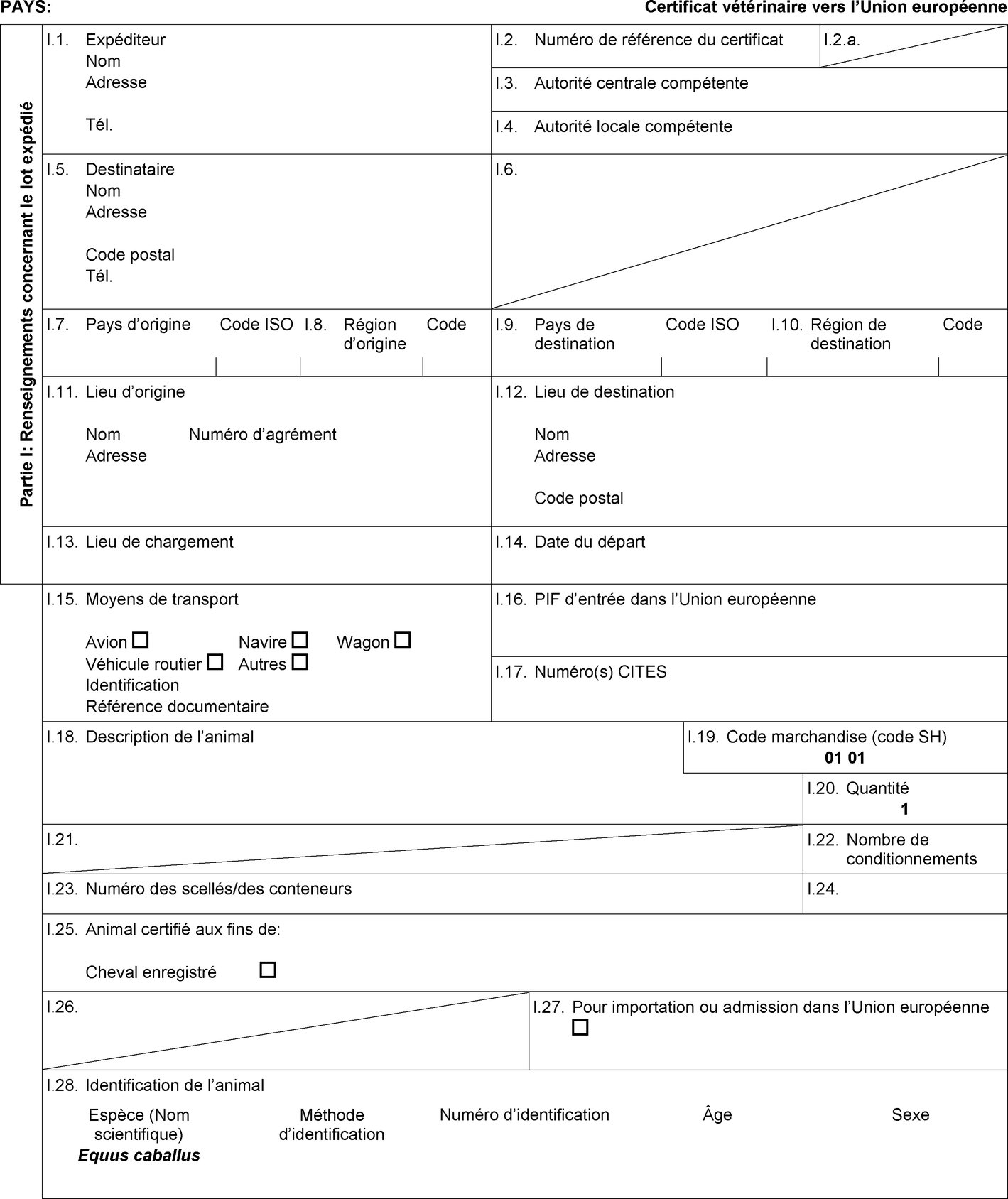 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
PARTIE 3
Importation
Section A
Modèle de certificat sanitaire et modèle de déclaration pour l'importation dans l'Union d'un cheval enregistré, d'un équidé enregistré ou d'un équidé d'élevage ou de rente
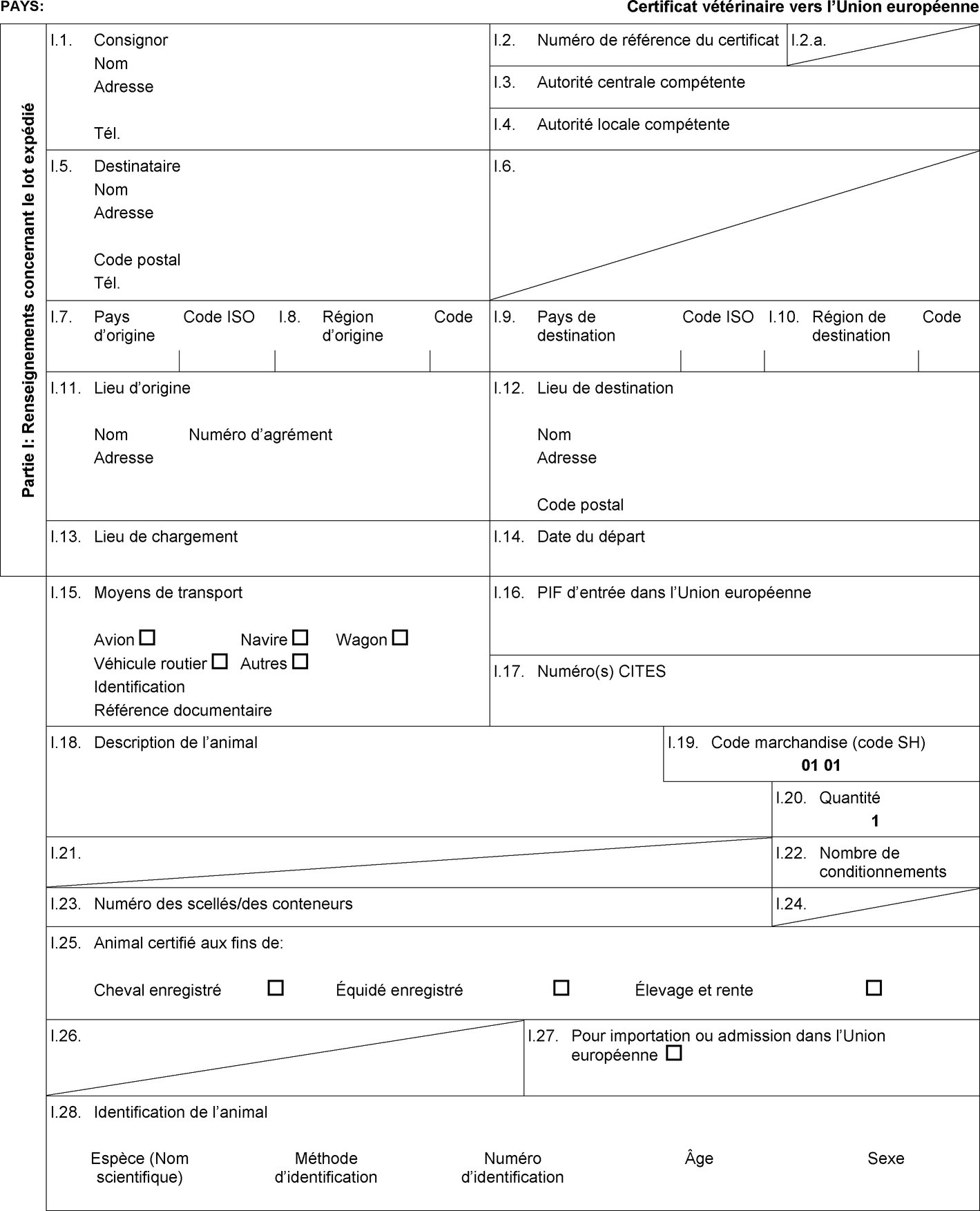 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
Section B
Modèle de certificat sanitaire et modèle de déclaration pour l'importation dans l'Union de lots d'équidés domestiques de boucherie
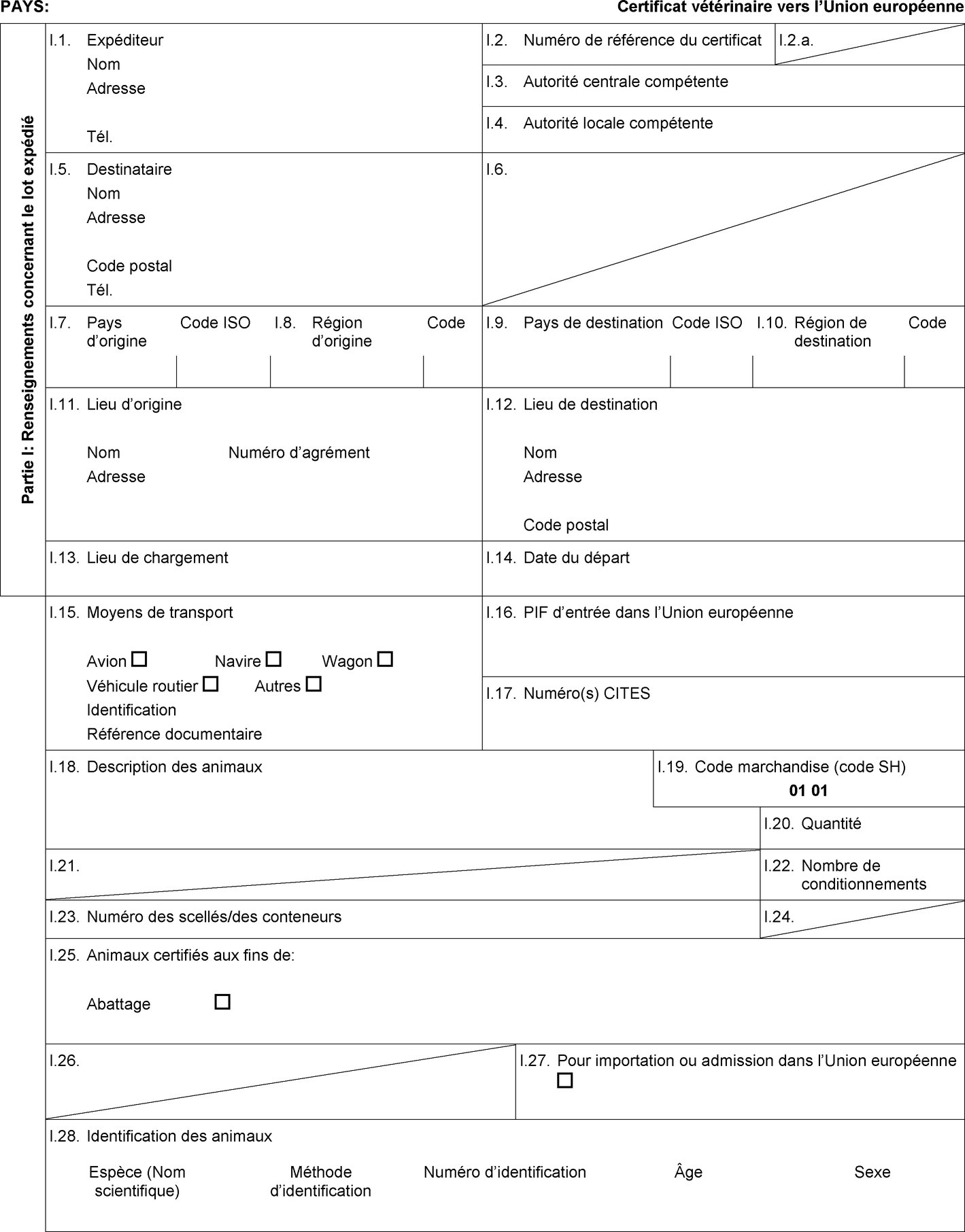 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
PARTIE 4
Notes explicatives concernant la certification
 Texte de l'image
Texte de l'image
ANNEXE III
MODÈLES DE CERTIFICATS SANITAIRES POUR L'ENTRÉE DANS L'UNION DE SPERME, D'OVULES ET D'EMBRYONS D'ÉQUIDÉS
PARTIE 1
Modèle de certificat sanitaire pour les importations de sperme
Section A
MODÈLE 1 — Modèle de certificat sanitaire pour les importations de lots de sperme d'équidés collecté conformément à la directive 92/65/CEE après le 30 septembre 2014 et expédié d'une station ou d'un centre de collecte de sperme agréé qui est le lieu d'origine du sperme
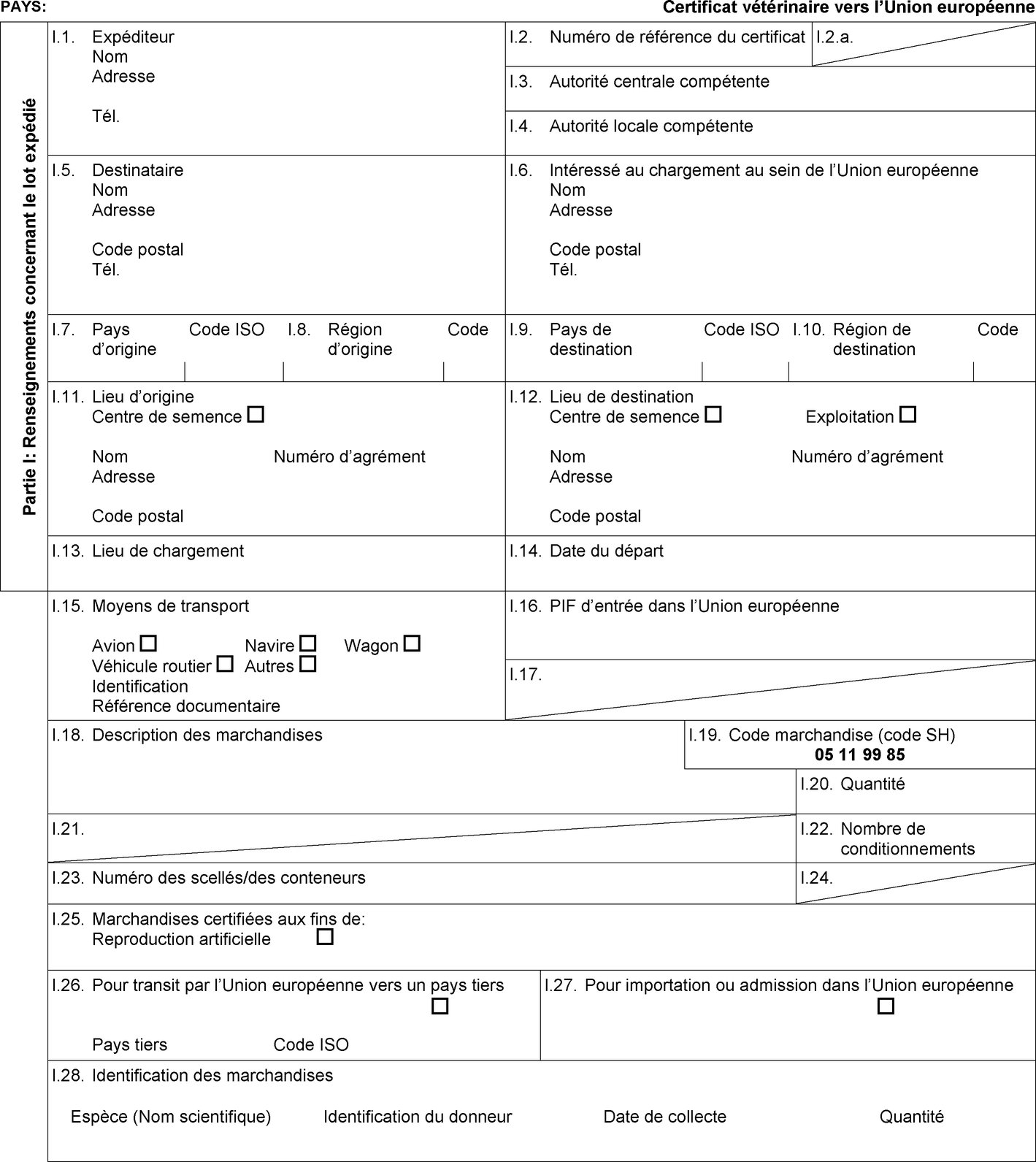 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
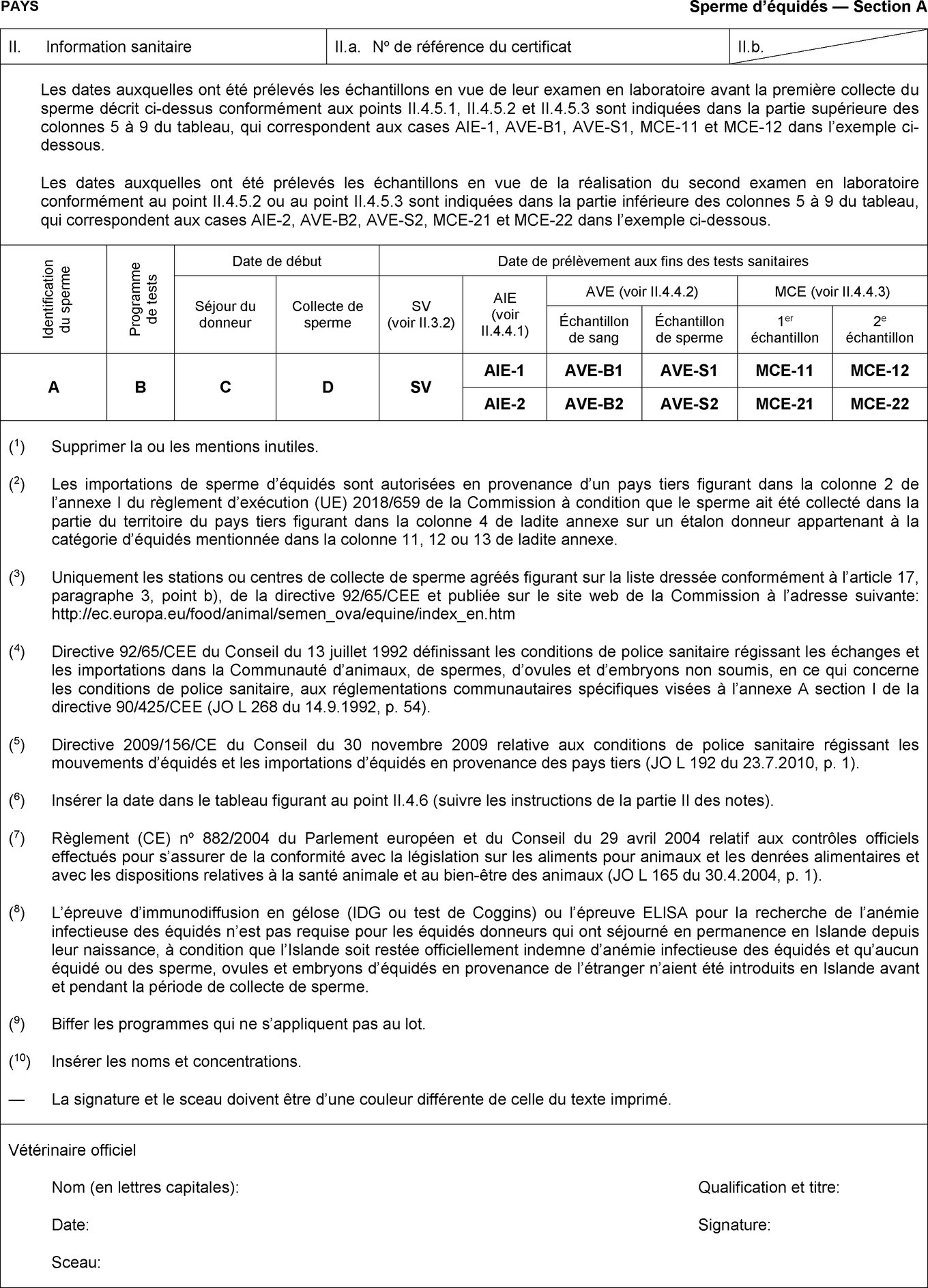 Texte de l'image
Texte de l'image
Section B
MODÈLE 2 — Modèle de certificat sanitaire pour les importations de lots de sperme d'équidés collecté, traité et stocké conformément à la directive 92/65/CEE après le 31 août 2010 et avant le 1er octobre 2014 et expédié après le 31 août 2010 d'une station ou d'un centre de collecte de sperme agréé qui est le lieu d'origine du sperme
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
Section C
MODÈLE 3 — Modèle de certificat sanitaire pour les importations de lots de sperme d'équidés collecté, traité et stocké conformément à la directive 92/65/CEE avant le 1er septembre 2010 et expédié après le 31 août 2010 d'une station ou d'un centre de collecte de sperme agréé qui est le lieu d'origine du sperme
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
Section D
MODÈLE 4 — Modèle de certificat sanitaire pour les importations de lots de sperme d'équidés collecté, traité et stocké conformément à la directive 92/65/CEE après le 30 septembre 2014 et de lots de sperme d'équidés collecté, traité et stocké conformément à la directive 92/65/CEE après le 31 août 2010 et avant le 1er octobre 2014 ou avant le 1er septembre 2010 et expédié après le 31 août 2010 d'un centre de stockage de sperme agréé
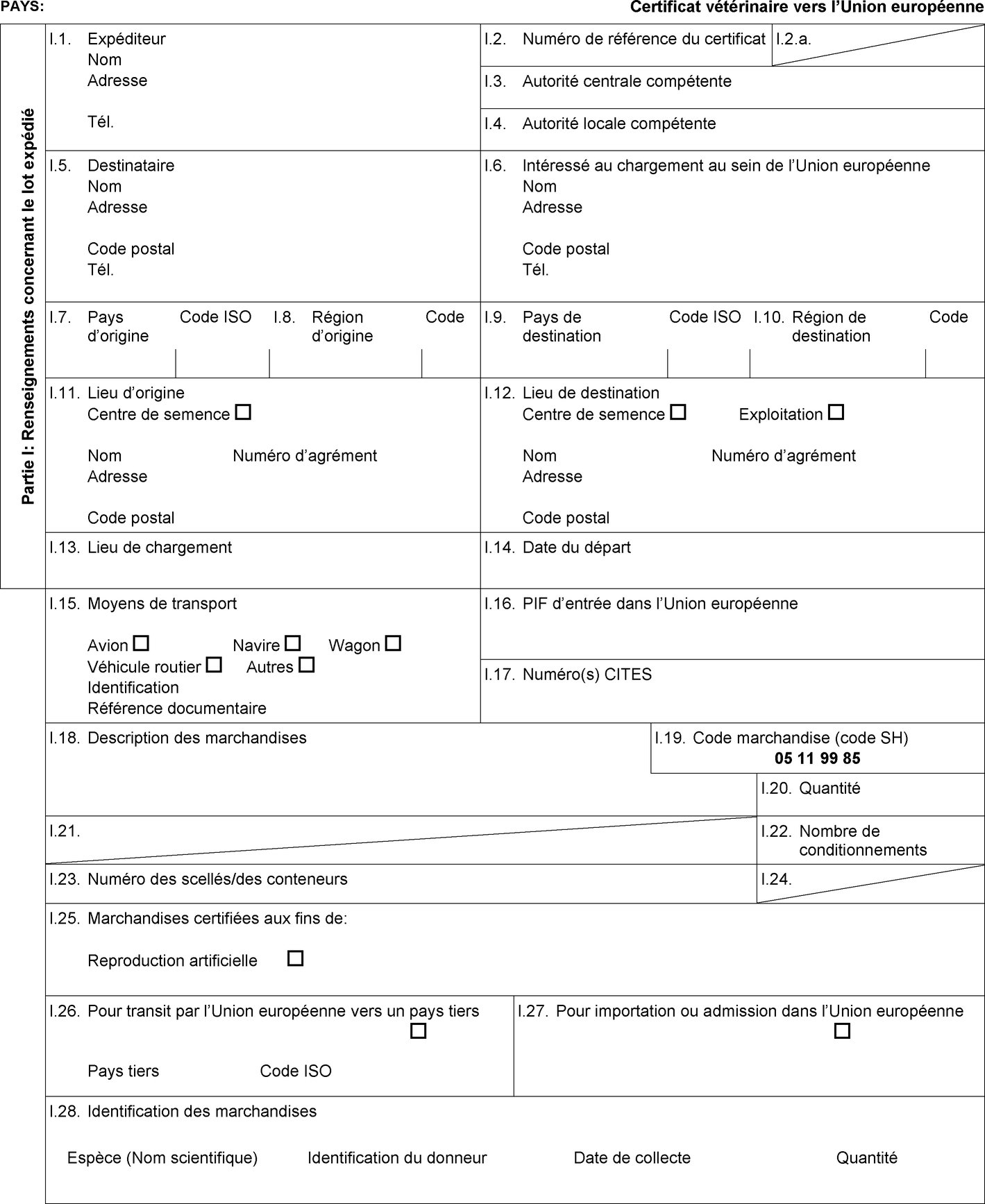 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
PARTIE 2
Modèle de certificat sanitaire pour les importations d'ovules et d'embryons
Section A
MODÈLE 1 — Modèle de certificat sanitaire pour les importations de lots d'ovules et d'embryons d'équidés collectés ou produits conformément à la directive 92/65/CEE après le 30 septembre 2014 et expédiés par une équipe de collecte ou de production d'embryons agréée qui est l'équipe d'origine des ovules ou des embryons
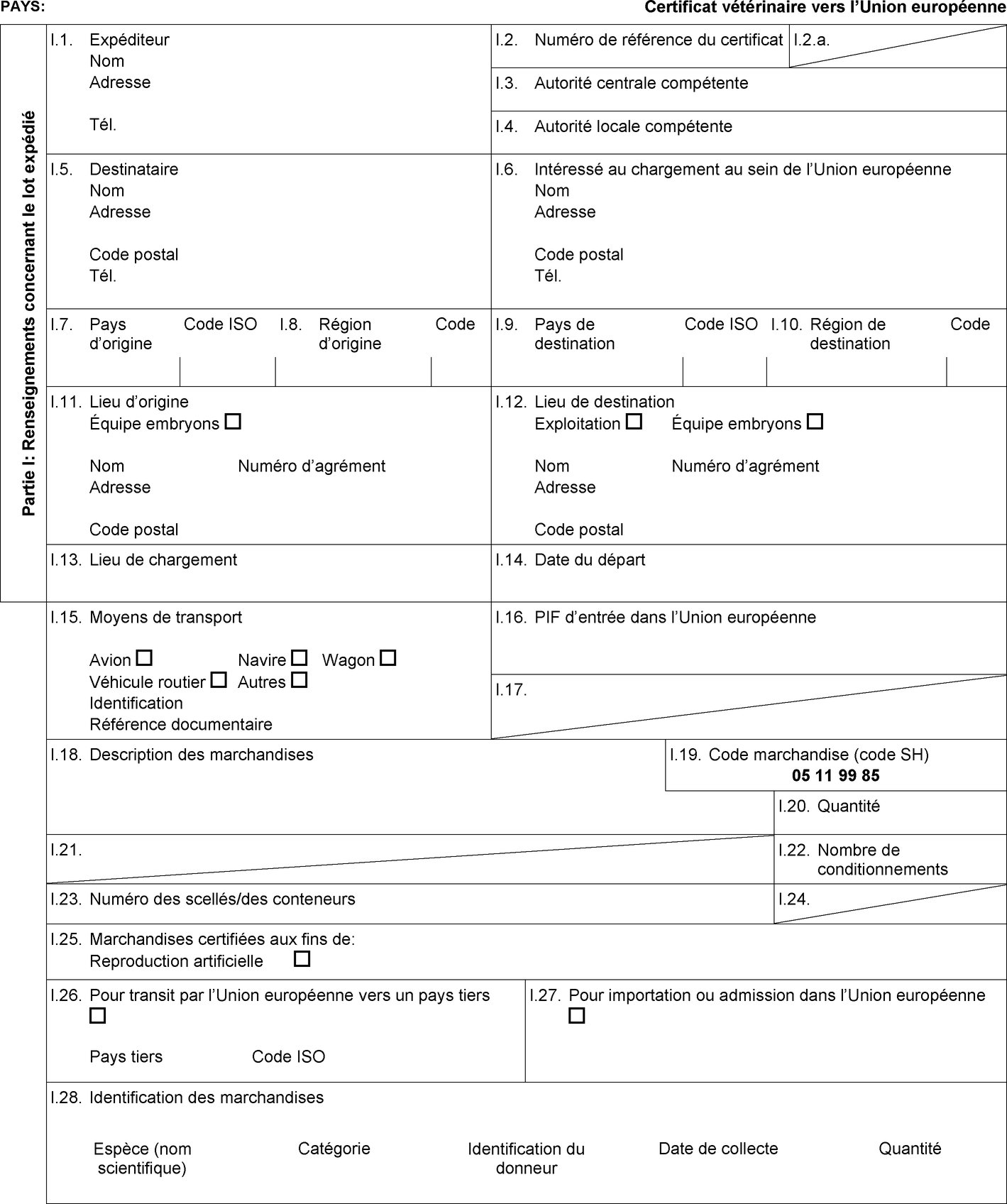 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
Section B
MODÈLE 2 — Modèle de certificat sanitaire pour les importations de lots d'ovules et d'embryons d'équidés collectés, traités et stockés conformément à la directive 92/65/CEE après le 31 août 2010 et avant le 1er octobre 2014 et expédiés après le 31 août 2010 par une équipe de collecte ou de production d'embryons agréée qui est l'équipe d'origine des ovules ou des embryons
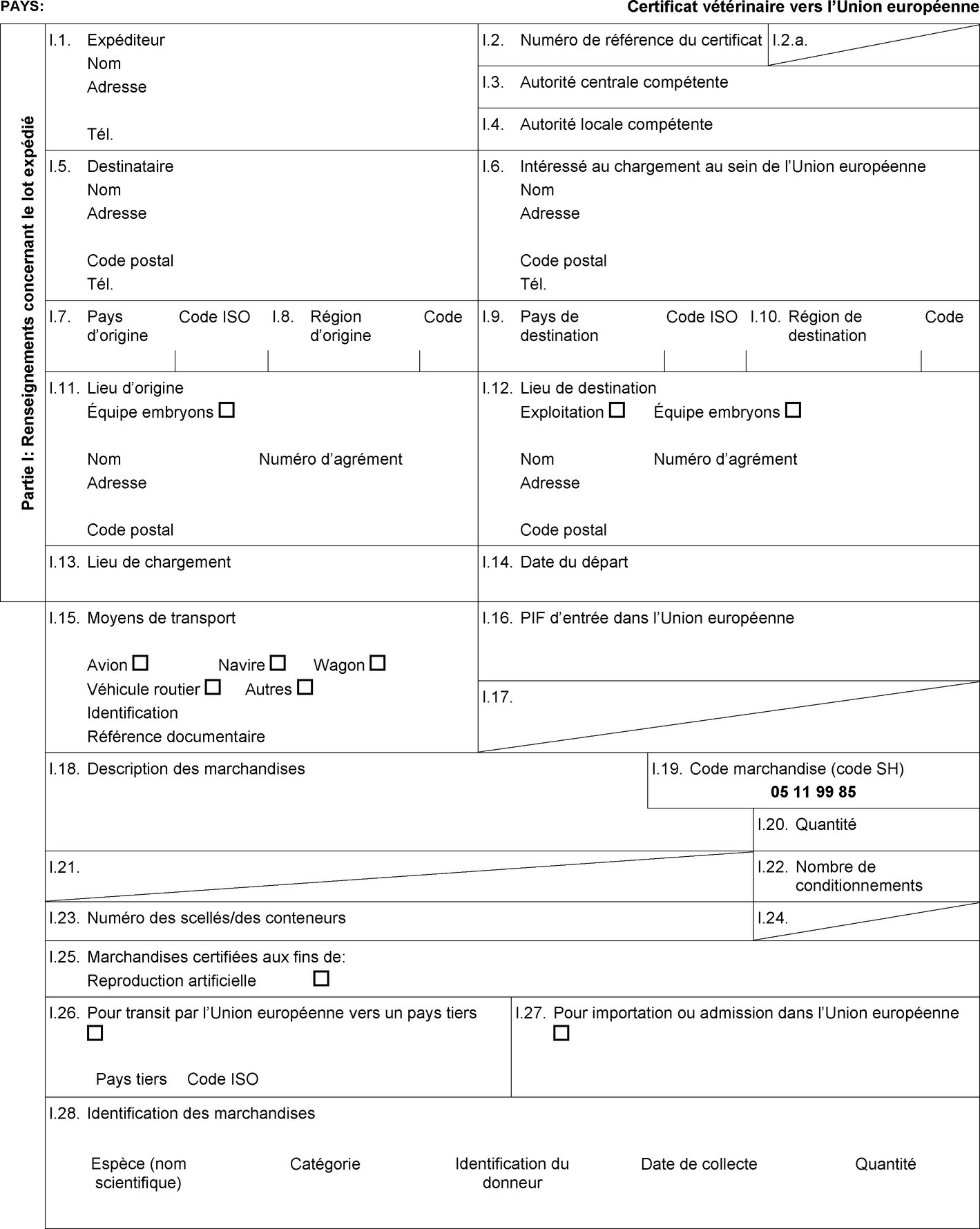 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
 Texte de l'image
Texte de l'image
PARTIE 3
Notes explicatives concernant la certification
 Texte de l'image
Texte de l'image
ANNEXE IV
CATÉGORIES D'ÉQUIDÉS MÂLES AUXQUELS LES CONDITIONS RELATIVES À L'ARTÉRITE VIRALE ÉQUINE SONT APPLICABLES CONFORMÉMENT AUX DISPOSITIONS DE L'ARTICLE 15, POINT b) ii), DE LA DIRECTIVE 2009/156/CE
|
1. |
L'exigence relative à l'artérite virale équine prévue à l'article 15, point b) ii), de la directive 2009/156/CE est applicable aux équidés mâles non castrés à l'exception:
|
|
2. |
L'épreuve est pratiquée et certifiée sous supervision vétérinaire officielle; les résultats et la vaccination sont certifiés sous supervision vétérinaire officielle. La vaccination est répétée à intervalle régulier selon les instructions du fabricant. Les numéros de lot du vaccin approuvé, les détails de la vaccination et de la revaccination et les résultats des épreuves sérologiques ou d'identification de l'agent pathogène sont documentés, dans le document d'identification (passeport) lorsqu'il en existe un, et mis à disposition à des fins de certification. |
|
3. |
L'accouplement de testage décrit à l'article 12.9.2, point 4 a), du Code sanitaire pour les animaux terrestres de l'Organisation mondiale de la santé animale (OIE) est réputé équivalent à l'épreuve d'isolement du virus visée au point 1 a) i) aux fins d'établir l'absence du virus de l'artérite équine dans le sperme. |
ANNEXE V
MODÈLES DE DÉCLARATION
PARTIE 1
Déclaration du commandant de bord
 Texte de l'image
Texte de l'image
PARTIE 2
Déclaration du capitaine du navire
 Texte de l'image
Texte de l'image
PARTIE 3
Modèle de manifeste de transbordement
 Texte de l'image
Texte de l'image
|
30.4.2018 |
FR |
Journal officiel de l'Union européenne |
L 110/122 |
RÈGLEMENT D'EXÉCUTION (UE) 2018/660 DE LA COMMISSION
du 26 avril 2018
renouvelant l'approbation de la substance active «bentazone» conformément au règlement (CE) no 1107/2009 du Parlement européen et du Conseil concernant la mise sur le marché des produits phytopharmaceutiques, et modifiant l'annexe du règlement d'exécution (UE) no 540/2011 de la Commission
(Texte présentant de l'intérêt pour l'EEE)
LA COMMISSION EUROPÉENNE,
vu le traité sur le fonctionnement de l'Union européenne,
vu le règlement (CE) no 1107/2009 du Parlement européen et du Conseil du 21 octobre 2009 concernant la mise sur le marché des produits phytopharmaceutiques et abrogeant les directives 79/117/CEE et 91/414/CEE du Conseil (1), et notamment son article 20, paragraphe 1,
considérant ce qui suit:
|
(1) |
Par sa directive 2000/68/CE (2), la Commission a inscrit le bentazone en tant que substance active à l'annexe I de la directive 91/414/CEE du Conseil (3). |
|
(2) |
Les substances actives figurant à l'annexe I de la directive 91/414/CEE sont réputées approuvées en vertu du règlement (CE) no 1107/2009 et sont répertoriées à l'annexe, partie A, du règlement d'exécution (UE) no 540/2011 de la Commission (4). |
|
(3) |
L'approbation de la substance active «bentazone», telle que mentionnée à l'annexe, partie A, du règlement d'exécution (UE) no 540/2011 de la Commission, arrive à expiration le 30 juin 2018. |
|
(4) |
Une demande de renouvellement de l'inscription de la substance «bentazone» à l'annexe I de la directive 91/414/CEE du Conseil a été introduite conformément à l'article 4 du règlement (UE) no 1141/2010 de la Commission (5), dans le délai prévu par cet article. |
|
(5) |
Les demandeurs ont présenté les dossiers complémentaires requis conformément à l'article 9 du règlement (UE) no 1141/2010. La demande a été jugée complète par l'État membre rapporteur. |
|
(6) |
L'État membre rapporteur, en concertation avec l'État membre corapporteur, a établi un rapport d'évaluation du renouvellement et l'a transmis à l'Autorité européenne de sécurité des aliments (ci-après l'«Autorité») et à la Commission le 8 janvier 2014. |
|
(7) |
L'Autorité a communiqué le rapport d'évaluation du renouvellement aux demandeurs et aux États membres afin de recueillir leurs observations et a transmis les observations reçues à la Commission. Elle a également mis le dossier récapitulatif complémentaire à la disposition du public. |
|
(8) |
Le 20 avril 2015, l'Autorité a communiqué à la Commission ses conclusions (6) sur la question de savoir si le bentazone est susceptible de satisfaire aux critères d'approbation énoncés à l'article 4 du règlement (CE) no 1107/2009. La Commission a présenté le projet de rapport de réexamen concernant le bentazone au comité permanent des végétaux, des animaux, des denrées alimentaires et des aliments pour animaux le 8 octobre 2015. |
|
(9) |
Les demandeurs ont eu la possibilité de présenter des observations sur le projet de rapport de réexamen. |
|
(10) |
Il a été établi, pour ce qui concerne une ou plusieurs utilisations représentatives d'au moins un produit phytopharmaceutique contenant du bentazone, que les critères d'approbation énoncés à l'article 4 du règlement (CE) no 1107/2009 étaient remplis. Il convient par conséquent de renouveler l'approbation du bentazone. |
|
(11) |
Néanmoins, plusieurs États membres ont détecté la présence de bentazone dans les eaux souterraines via leurs programmes de surveillance des eaux souterraines et l'EFSA a indiqué que pour certaines utilisations et dans certaines conditions sensibles du sol, la contamination des eaux souterraines ne pouvait pas être exclue. |
|
(12) |
Par conséquent, à la lumière des résultats des programmes nationaux de surveillance des eaux souterraines, et compte tenu de la nécessité de garantir un niveau de sécurité et de protection conforme au niveau élevé de protection recherché dans l'Union, il y a lieu de prévoir un renouvellement de l'approbation du bentazone pour une période de sept années qui garantit que le bentazone sera réévalué en priorité par rapport à d'autres substances actives, ce qui permettra de prendre en considération les résultats récents des programmes nationaux de surveillance des eaux souterraines. |
|
(13) |
L'évaluation des risques pour le renouvellement de l'approbation du bentazone repose sur un nombre limité d'utilisations représentatives, qui toutefois ne restreignent pas les utilisations pour lesquelles les produits phytopharmaceutiques contenant du bentazone peuvent être autorisés. Il convient donc de supprimer la restriction relative à une utilisation en tant qu'herbicide uniquement. |
|
(14) |
Conformément à l'article 14, paragraphe 1, du règlement (CE) no 1107/2009, lu en liaison avec l'article 6 dudit règlement, et à la lumière des connaissances scientifiques et techniques actuelles, il est cependant nécessaire de prévoir certaines conditions et restrictions. Il convient, en particulier, de demander des informations confirmatives supplémentaires. |
|
(15) |
Il convient, dès lors, de modifier l'annexe du règlement d'exécution (UE) no 540/2011 en conséquence. |
|
(16) |
Le règlement d'exécution (UE) 2017/841 de la Commission (7) a prolongé la période d'approbation de la substance active «bentazone» jusqu'au 30 juin 2018 afin que la procédure de renouvellement puisse être achevée avant l'expiration de l'approbation de cette substance. Cependant, étant donné qu'une décision de renouvellement a déjà été adoptée avant cette date, le présent règlement devrait s'appliquer à partir du 1er juin 2018. |
|
(17) |
Les mesures prévues par le présent règlement sont conformes à l'avis du comité permanent des végétaux, des animaux, des denrées alimentaires et des aliments pour animaux, |
A ADOPTÉ LE PRÉSENT RÈGLEMENT:
Article premier
Renouvellement de l'approbation de la substance active
L'approbation de la substance active «bentazone» est renouvelée comme indiqué à l'annexe I.
Article 2
Modification du règlement d'exécution (UE) no 540/2011
L'annexe du règlement d'exécution (UE) no 540/2011 est modifiée conformément à l'annexe II du présent règlement.
Article 3
Entrée en vigueur et date d'application
Le présent règlement entre en vigueur le vingtième jour suivant celui de sa publication au Journal officiel de l'Union européenne.
Il s'applique à compter du 1er juin 2018.
Le présent règlement est obligatoire dans tous ses éléments et directement applicable dans tout État membre.
Fait à Bruxelles, le 26 avril 2018.
Par la Commission
Le président
Jean-Claude JUNCKER
(1) JO L 309 du 24.11.2009, p. 1.
(2) Directive 2000/68/CE de la Commission du 23 octobre 2000 inscrivant une substance active (le bentazone) à l'annexe I de la directive 91/414/CEE du Conseil concernant la mise sur le marché des produits phytopharmaceutiques (JO L 276 du 28.10.2000, p. 41).
(3) Directive 91/414/CEE du Conseil du 15 juillet 1991 concernant la mise sur le marché des produits phytopharmaceutiques (JO L 230 du 19.8.1991, p. 1).
(4) Règlement d'exécution (UE) no 540/2011 de la Commission du 25 mai 2011 portant application du règlement (CE) no 1107/2009 du Parlement européen et du Conseil, en ce qui concerne la liste des substances actives approuvées (JO L 153 du 11.6.2011, p. 1).
(5) Règlement (UE) no 1141/2010 de la Commission du 7 décembre 2010 relatif à l'établissement de la procédure de renouvellement de l'inscription d'un deuxième groupe de substances actives à l'annexe I de la directive 91/414/CEE du Conseil et à l'établissement de la liste de ces substances (JO L 322 du 8.12.2010, p. 10).
(6) EFSA Journal 2015;13(4):4077, 153 pp. doi:10.2903/j.efsa.2015.4077.
(7) Règlement d'exécution (UE) 2017/841 de la Commission du 17 mai 2017 modifiant le règlement d'exécution (UE) no 540/2011 en ce qui concerne la prolongation de la période d'approbation des substances actives «alpha-cyperméthrine», «Ampelomyces quisqualis — souche AQ 10», «bénalaxyl», «bentazone», «bifénazate», «bromoxynil», «carfentrazone éthyl», «chlorprophame», «cyazofamide», «desmédiphame», «diquat», «DPX KE 459 (flupyrsulfuron-méthyle)», «étoxazole», «famoxadone», «fénamidone», «flumioxazine», «foramsulfuron», «Gliocladium catenulatum» — souche J1446, «imazamox», «imazosulfuron», «isoxaflutole», «laminarine», «métalaxyl-M», «méthoxyfénozide», «milbémectine», «oxasulfuron», «pendiméthaline», «phenmédiphame», «pymétrozine», «S-métolachlore» et «trifloxystrobine» (JO L 125 du 18.5.2017, p. 12).
ANNEXE I
|
Nom commun, numéros d'identification |
Dénomination de l'UICPA |
Pureté (1) |
Date d'approbation |
Expiration de l'approbation |
Dispositions particulières |
||||||||
|
Bentazone No CAS 25057-89-0 No CIMAP 366 |
3-isopropyl-1H-2,1,3-benzothiadiazin-4(3H)-one 2,2-dioxide |
≥ 960 g/kg 1,2-dichloroéthane < 3 mg/kg |
1er juin 2018 |
31 mai 2025 |
Pour la mise en œuvre des principes uniformes visés à l'article 29, paragraphe 6, du règlement (CE) no 1107/2009, il est tenu compte des conclusions du rapport de réexamen sur le bentazone, et notamment de ses annexes I et II. Lors de leur évaluation générale, les États membres accordent une attention particulière:
Les conditions d'utilisation comprennent, s'il y a lieu, des mesures d'atténuation des risques. Le demandeur doit présenter, au plus tard le 1er février 2019, à la Commission, aux États membres et à l'Autorité, des informations confirmatives concernant les tests de niveau 2/3 actuellement indiqués dans le cadre conceptuel de l'OCDE en vue d'étudier les possibilités d'effets à médiation endocrinienne du bentazone. |
(1) Des détails supplémentaires concernant l'identité et la spécification de la substance active sont fournis dans le rapport de réexamen.
ANNEXE II
L'annexe du règlement d'exécution (UE) no 540/2011 est modifiée comme suit:
|
1) |
dans la partie A, l'entrée 11 relative au bentazone est supprimée; |
|
2) |
dans la partie B, l'entrée suivante est ajoutée:
|
(1) Des détails supplémentaires concernant l'identité et la spécification de la substance active sont fournis dans le rapport de réexamen.
DÉCISIONS
|
30.4.2018 |
FR |
Journal officiel de l'Union européenne |
L 110/127 |
DÉCISION D'EXÉCUTION (UE) 2018/661 DE LA COMMISSION
du 26 avril 2018
modifiant la décision d'exécution (UE) 2015/750 sur l'harmonisation de la bande de fréquences 1 452-1 492 MHz pour les systèmes terrestres permettant de fournir des services de communications électroniques dans l'Union, en ce qui concerne son extension dans les bandes de fréquences harmonisées 1 427-1 452 MHz et 1 492-1 517 MHz
[notifiée sous le numéro C(2018) 2286]
(Texte présentant de l'intérêt pour l'EEE)
LA COMMISSION EUROPÉENNE,
vu le traité sur le fonctionnement de l'Union européenne,
vu la décision no 676/2002/CE du Parlement européen et du Conseil du 7 mars 2002 relative à un cadre réglementaire pour la politique en matière de spectre radioélectrique dans la Communauté européenne (décision «spectre radioélectrique») (1), et notamment son article 4, paragraphe 3,
considérant ce qui suit:
|
(1) |
La décision no 243/2012/UE du Parlement européen et du Conseil (2) établit un programme pluriannuel en matière de politique du spectre radioélectrique (PPSR) qui vise à recenser, sur la base de l'inventaire du spectre, au moins 1 200 MHz de fréquences appropriées au haut débit sans fil dans l'Union d'ici à 2015, y compris les radiofréquences déjà affectées à cet usage. |
|
(2) |
Dans son avis sur les défis stratégiques auxquels l'Europe est confrontée afin de répondre à la demande croissante de radiofréquences pour le haut débit sans fil (3), en date du 20 février 2013, le groupe pour la politique en matière de spectre radioélectrique (GPSR) avait recommandé d'évaluer la bande de fréquences 1 427-1 452 MHz, en vue de son utilisation pour le haut débit sans fil après 2015, comme une extension de la bande 1 452-1 492 MHz. Dans son avis, le GPSR avait également mis en évidence certains problèmes concernant l'éventuelle désignation des bandes de fréquences 1 427-1 452 MHz et 1 492-1 518 MHz pour le haut débit sans fil, dus à leur utilisation actuelle à des fins militaires et de services de Terre fixes sans fil. Le GPSR avait proposé de reconsidérer l'utilisation de la bande de fréquences 1 492-1 518 MHz en fonction des résultats de la Conférence mondiale des radiocommunications de 2015 (CMR-15). |
|
(3) |
La CMR-15 a sélectionné les bandes de fréquences 1 427-1 452 MHz et 1 492-1 518 MHz pour les télécommunications mobiles internationales dans le monde. Dans la région 1 de l'Union internationale des télécommunications, qui comprend l'Union européenne, ces bandes de fréquences, ou des parties de celles-ci respectivement, sont attribuées au service mobile (service mobile aéronautique excepté), au service fixe et au service d'exploitation spatiale Terre-espace à titre co-primaire. En outre, certains États membres ont désigné la bande de fréquences 1 452-1 518 MHz pour la réalisation de programmes et d'événements spéciaux. |
|
(4) |
Le 15 mars 2017, conformément à l'article 4, paragraphe 2, de la décision «spectre radioélectrique», la Commission a confié à la Conférence européenne des administrations des postes et des télécommunications (CEPT) le mandat d'élaborer des conditions techniques harmonisées dans des bandes de fréquences supplémentaires de la gamme de fréquences de 1,5 GHz, à savoir les bandes 1 427-1 452 MHz et 1 492-1 518 MHz, afin de promouvoir leur utilisation pour les services de communications électroniques de Terre à haut débit sans fil dans l'Union. |
|
(5) |
Le 16 novembre 2017, en réponse à ce mandat, la CEPT a publié son rapport 65 (4) dans lequel elle propose des conditions techniques harmonisées pour les services de communications électroniques à haut débit sans fil en liaison exclusivement descendante dans les bandes de fréquences 1 427-1 452 MHz et 1 492-1 517 MHz, en tenant compte de la désignation, à l'échelle de l'Union, de la bande de fréquences 1 452-1 492 MHz, selon des conditions techniques harmonisées, pour les systèmes de Terre permettant de fournir des services de communications électroniques, conformément à la décision d'exécution (UE) 2015/750 de la Commission (5). |
|
(6) |
La désignation, à l'échelle de l'Union, des bandes de fréquences 1 427-1 452 MHz et 1 492-1 517 MHz pour les services de communications électroniques à haut débit sans fil en liaison exclusivement descendante devrait contribuer, par l'ajout de 50 MHz de fréquences, à la réalisation de l'objectif du PPSR en matière de radiofréquences affectées au haut débit sans fil. L'utilisation en liaison exclusivement descendante est importante pour répondre aux problèmes d'asymétrie du trafic de données car elle renforce la capacité en liaison descendante des systèmes à haut débit sans fil, y compris pour la fourniture de services 5G. |
|
(7) |
Conformément aux recommandations du rapport 65 de la CEPT, les États membres devraient avoir une certaine latitude, au niveau national, dans l'utilisation de parties des bandes de fréquences 1 427-1 452 MHz et 1 492-1 517 MHz afin de respecter des accords militaires internationaux (6) ou de répondre — de façon ponctuelle — à des besoins nationaux spécifiques pour maintenir l'exploitation de services de Terre fixes sans fil. À cet égard, le rapport souligne que l'exploitation en co-canal de services mobiles et fixes n'est pas possible. En conséquence, la réaffectation de ces bandes de fréquences au niveau national afin de les mettre à disposition, en réponse à la demande, pour des services de communications électroniques à haut débit sans fil en liaison exclusivement descendante, constitue un processus complexe nécessitant un calendrier adéquat. |
|
(8) |
Bénéficiant d'une certaine latitude au niveau national, les États membres devraient privilégier la mise à disposition de radiofréquences contiguës pour les services de communications électroniques à haut débit sans fil en liaison exclusivement descendante, y compris dans la bande de fréquences 1 452-1 492 MHz, de façon à permettre des canalisations plus larges des services 5G, des économies d'échelle pour les équipements, la coexistence avec des services dans les bandes adjacentes ainsi que la coordination des fréquences. |
|
(9) |
Sans préjudice du droit des États membres d'organiser leur utilisation du spectre à des fins d'ordre public, de sécurité publique et de défense en vertu de l'article 1er, paragraphe 4, de la décision «spectre radioélectrique», les États membres devraient désigner, autant que possible, les bandes de fréquences 1 427-1 452 MHz et 1 492-1 517 MHz pour les services de communications électroniques à haut débit sans fil en liaison exclusivement descendante. |
|
(10) |
La fourniture de services de communications électroniques à haut débit sans fil en liaison exclusivement descendante dans l'intégralité de la bande de fréquences 1 427-1 517 MHz devrait se fonder sur des canalisations harmonisées et cohérentes et des conditions techniques minimales, c'est-à-dire le moins restrictives, pour promouvoir le marché unique, atténuer les brouillages préjudiciables et faciliter la coordination des fréquences. |
|
(11) |
Les conditions techniques et dispositions établies dans le rapport 65 de la CEPT permettent aussi la coexistence entre les services à haut débit sans fil et les services dans les bandes adjacentes. |
|
(12) |
En particulier, les conditions techniques et dispositions, comme les limites de puissance des émissions non désirées, permettent d'utiliser le haut débit sans fil dans la bande de fréquences 1 427-1 517 MHz en assurant une protection appropriée des services de radioastronomie et des services passifs d'exploration de la Terre par satellite dans la bande de fréquences 1 400-1 427 MHz, et des services mobiles par satellite dans la bande de fréquences 1 518-1 559 MHz. Il pourra s'avérer nécessaire de prendre d'autres mesures au niveau national pour faciliter la coexistence avec des services dans les bandes de fréquences 1 400-1 427 MHz et 1 518-1 559 MHz adjacentes, par exemple autour des aéroports, des ports maritimes et des stations au sol utilisées pour recevoir des signaux de recherche et de sauvetage relayés par satellite. En outre, il est nécessaire d'améliorer la performance des récepteurs des stations terriennes mobiles conformément aux objectifs et aux exigences de la directive 2014/53/UE du Parlement européen et du Conseil (7). |
|
(13) |
Étant donné que des parties de la bande de fréquences 1 452-1 492 MHz ne sont pas utilisées pour les systèmes de radiodiffusion de Terre, il convient de supprimer les contraintes réglementaires actuelles concernant la coexistence avec de tels services dans cette bande de fréquences afin de permettre le déploiement de services de communications électroniques à haut débit sans fil en liaison exclusivement descendante. |
|
(14) |
Des accords transfrontières de coordination des fréquences entre administrations pourront s'avérer nécessaires pour garantir l'application des paramètres fixés par la présente décision afin de renforcer les services de communications électroniques à haut débit sans fil en liaison exclusivement descendante dans les bandes de fréquences 1 427-1 452 MHz et 1 492-1 517 MHz de façon à éviter les brouillages préjudiciables et à accroître l'efficacité d'utilisation du spectre. Les accords transfrontières de coordination des fréquences en ce qui concerne les services de télémétrie aéronautique devraient être traités entre les administrations de la CEPT concernées sur une base bilatérale ou multilatérale. |
|
(15) |
Les mesures prévues dans la présente décision devraient être appliquées par les États membres avec le but ultime d'assurer l'utilisation de toute la bande de fréquences 1 427-1 517 MHz ou, faute de demande nationale, d'une partie de celle-ci, pour les services de communications électroniques à haut débit sans fil en liaison exclusivement descendante afin de contribuer, autant que possible, à la réalisation de l'objectif du PPSR en matière de spectre. |
|
(16) |
Les États membres devraient remettre à la Commission un rapport sur l'application de la décision et l'utilisation de la bande de fréquences afin de faciliter l'évaluation de ses effets au niveau de l'Union et sa révision en temps utile, le cas échéant. En particulier, les éléments justifiant une certaine latitude au niveau national quant à la mise à disposition de radiofréquences dans la bande de fréquences 1 427-1 452 MHz ou 1 492-1 517 MHz devraient être contrôlés tous les deux ans. De plus, les États membres devraient rendre compte, tous les deux ans, des mesures nationales facilitant la coexistence avec les services de radioastronomie et les services passifs d'exploration de la Terre par satellite dans la bande de fréquences 1 400-1 427 MHz, et les services mobiles par satellite dans la bande de fréquences 1 518-1 559 MHz. |
|
(17) |
Les mesures prévues par la présente décision sont conformes à l'avis du comité du spectre radioélectrique, |
A ADOPTÉ LA PRÉSENTE DÉCISION:
Article premier
La décision d'exécution (UE) 2015/750 de la Commission est modifiée comme suit:
|
1) |
le titre est remplacé par le texte suivant: «Décision d'exécution (UE) 2015/750 de la Commission du 8 mai 2015 sur l'harmonisation de la bande de fréquences 1 427-1 517 MHz pour les systèmes de Terre permettant de fournir des services de communications électroniques dans l'Union»; |
|
2) |
L'article 1er est remplacé par le texte suivant: «Article premier La présente décision vise à harmoniser les conditions de mise à disposition et d'utilisation efficace de la bande de fréquences 1 427-1 517 MHz pour les systèmes de Terre permettant de fournir des services de communications électroniques dans l'Union.»; |
|
3) |
à l'article 2, le paragraphe 2 est remplacé par le texte suivant: «2. Le 1er octobre 2018 au plus tard, les États membres désignent et mettent à disposition, sur une base non exclusive, les bandes de fréquences 1 427-1 452 MHz et 1 492-1 517 MHz, ou une partie de celles-ci, pour les systèmes de Terre permettant de fournir des services de communications électroniques à haut débit sans fil, conformément aux paramètres définis en annexe.»; |
|
4) |
à l'article 2, le paragraphe 3 est remplacé par le texte suivant: «3. S'ils désignent et mettent à disposition uniquement une partie de la bande de fréquences 1 427-1 452 MHz ou 1 492-1 517 MHz conformément au paragraphe 2, les États membres:
|
|
5) |
à l'article 2, le paragraphe 4 suivant est ajouté: «4. Les États membres veillent à ce que les systèmes de Terre visés au présent article offrent une protection appropriée aux systèmes dans les bandes de fréquences adjacentes.»; |
|
6) |
à l'article 2, le paragraphe 5 suivant est ajouté: «5. Les États membres favorisent les accords de coordination transfrontière afin de permettre l'exploitation des systèmes visés aux paragraphes 1, 2 et 3 en tenant compte des procédures réglementaires et des droits existants, ainsi que des accords internationaux applicables.»; |
|
7) |
l'article 2 bis suivant est ajouté: «Article 2 bis Les États membres réexaminent l'application de l'article 2 tous les deux ans afin de garantir la disponibilité maximale de la bande de fréquences 1 427-1 517 MHz pour les services de communications électroniques à haut débit sans fil.»; |
|
8) |
l'article 4 est remplacé par le texte suivant: «Article 4 Les États membres contrôlent l'utilisation de la bande de fréquences 1 427-1 517 MHz et transmettent leurs conclusions à la Commission, à la demande de celle-ci ou de leur propre initiative, afin de permettre une révision de la présente décision en temps utile, le cas échéant.»; |
|
9) |
l'article 4 bis suivant est ajouté: «Article 4 bis Les États membres remettent à la Commission un rapport sur l'application de la présente décision, y compris sur le degré de disponibilité des bandes de fréquences 1 427-1 452 MHz et 1 492-1 517 MHz, au plus tard le 1er novembre 2018.»; |
|
10) |
l'annexe de la décision d'exécution (UE) 2015/750 est remplacée par le texte figurant à l'annexe de la présente décision. |
Article 2
Les États membres sont destinataires de la présente décision.
Fait à Bruxelles, le 26 avril 2018.
Par la Commission
Mariya GABRIEL
Membre de la Commission
(1) JO L 108 du 24.4.2002, p. 1.
(2) Décision no 243/2012/UE du Parlement européen et du Conseil du 14 mars 2012 établissant un programme pluriannuel en matière de politique du spectre radioélectrique (JO L 81 du 21.3.2012, p. 7).
(3) Document RSPG 13-521 rev1.
(4) Rapport 65 de la CEPT, approuvé le 17 novembre 2017, corrigé le 2 mars 2018.
(5) Décision d'exécution (UE) 2015/750 de la Commission du 8 mai 2015 sur l'harmonisation de la bande de fréquences 1 452-1 492 MHz pour les systèmes terrestres permettant de fournir des services de communications électroniques dans l'Union (JO L 119 du 12.5.2015, p. 27).
(6) Les bandes de fréquences 1 427-1 452 MHz et 1 492-1 518 MHz sont utilisées pour des systèmes militaires terrestres et maritimes conformément à l'accord mixte OTAN sur les fréquences (NJFA) de 2014. Conformément au point 14 de l'accord, «[…] Lorsque l'utilisation de bandes de fréquences radio a été harmonisée par l'OTAN et des nations membres de l'OTAN à des fins militaires, cela n'exclut pas l'utilisation pour des applications civiles».
(7) Directive 2014/53/UE du Parlement européen et du Conseil du 16 avril 2014 relative à l'harmonisation des législations des États membres concernant la mise à disposition sur le marché d'équipements radioélectriques et abrogeant la directive 1999/5/CE (JO L 153 du 22.5.2014, p. 62).
ANNEXE
ANNEXE
PARAMÈTRES VISÉS À L'ARTICLE 2, PARAGRAPHES 1 ET 2
A. PARAMÈTRES GÉNÉRAUX
|
1. |
Le mode d'exploitation dans la bande de fréquences 1 427-1 517 MHz est limité à la transmission (en liaison exclusivement descendante) à partir de la station de base. |
|
2. |
La largeur des blocs assignés dans la bande de fréquences 1 427-1 517 MHz est un multiple de 5 MHz. La limite de fréquence inférieure d'un bloc assigné est alignée sur l'extrémité inférieure de la bande (1 427 MHz) ou espacée de celle-ci d'un multiple de 5 MHz. |
|
3. |
La transmission à partir d'une station de base respecte les conditions techniques (masques BEM) définies dans la présente annexe. |
B. CONDITIONS TECHNIQUES APPLICABLES AUX STATIONS DE BASE — MASQUE BEM
Les paramètres techniques suivants, applicables aux stations de base et appelés masque BEM (Block Edge Mask), servent à assurer la coexistence entre réseaux voisins en l'absence d'accords bilatéraux ou multilatéraux entre opérateurs de ces réseaux. Il est possible d'utiliser des paramètres techniques moins contraignants si les opérateurs ou les administrations concernés en conviennent, dès lors que ces paramètres satisfont aux conditions techniques applicables à la protection des autres services ou applications, notamment dans les bandes adjacentes, ou sous réserve des obligations transfrontalières.
Un BEM est un masque d'émission qui est défini, en fonction de la fréquence, par rapport à l'extrémité d'un bloc de fréquences pour lequel des droits d'utilisation sont accordés à un opérateur. Il consiste en des limites de puissance intrabloc et hors bloc. La limite de puissance intrabloc s'applique au bloc détenu par l'opérateur. Les limites de puissance hors bloc s'appliquent aux fréquences utilisées pour les services de communications électroniques à haut débit sans fil (SCE HDSF) dans la bande 1 427-1 517 MHz, qui sont situées en dehors du bloc attribué à l'opérateur. Ces limites figurent dans le tableau 2. Les limites de puissance hors bande s'appliquent aux fréquences situées en dehors de la partie de la bande 1 427-1 517 MHz, qui sont utilisées pour les SCE HDSF au niveau national.
En outre, des limites de puissance de coexistence sont définies pour les SCE HDSF dans la bande de fréquences 1 427-1 517 MHz de façon à garantir la compatibilité entre ces services et d'autres applications ou services radio, y compris lorsqu'une partie des bandes 1 427-1 452 MHz et 1 492-1 517 MHz n'est pas désignée pour les SCE HDSF. Les limites de puissance de coexistence concernant les services ou les applications dans les bandes adjacentes (c.-à-d. en dehors des fréquences utilisées pour les SCE HDSF) figurent dans les tableaux 3, 4 et 5 et permettent aussi une certaine latitude, au niveau national, dans l'assignation des radiofréquences aux SCE HDSF dans la bande de fréquences 1 427-1 517 MHz conformément à la présente décision.
Des mesures techniques ou procédurales supplémentaires (1) peuvent être prises au niveau national pour assurer la coexistence avec les services et les applications dans les bandes adjacentes.
Exigences intrabloc
Une limite de puissance isotrope rayonnée équivalente (PIRE) intrabloc pour les stations de base n'est pas obligatoire, sauf concernant le bloc de fréquences 1 512-1 517 MHz pour lequel une telle limite est indiquée dans le tableau 1. Pour les blocs de fréquences autres que 1 512-1 517 MHz, les États membres peuvent fixer une limite de PIRE n'excédant pas 68 dBm/5 MHz, qui peut être relevée pour des applications particulières, par exemple pour l'utilisation agrégée du spectre dans la bande de fréquences 1 427-1 512 MHz et dans les bandes de fréquences inférieures.
Tableau 1
PIRE intrabloc maximale, par cellule (2) , pour les stations de base SCE HDSF fonctionnant dans la bande de fréquences 1 512 -1 517 MHz
|
Bloc de fréquences |
PIRE intrabloc maximale |
Largeur de bande à mesurer |
|
1 512 -1 517 MHz |
58 dBm |
5 MHz |
Note explicative du tableau 1
Ces exigences visent à assurer la compatibilité entre les SCE HDSF fonctionnant dans le bloc de fréquences 1 512-1 517 MHz et les services mobiles par satellite fonctionnant dans la bande de fréquences 1 518-1 525 MHz.
Exigences hors bloc
Tableau 2
Limites de PIRE hors bloc du masque BEM de la station de base, par antenne, dans la bande de fréquences 1 427 -1 517 MHz
|
Bande de fréquences des émissions hors bloc |
PIRE hors bloc moyenne maximale |
Largeur de bande à mesurer |
|
– 10 à – 5 MHz par rapport à l'extrémité inférieure du bloc |
11 dBm |
5 MHz |
|
– 5 à 0 MHz par rapport à l'extrémité inférieure du bloc |
16,3 dBm |
5 MHz |
|
0 à + 5 MHz par rapport à l'extrémité supérieure du bloc |
16,3 dBm |
5 MHz |
|
+ 5 à + 10 MHz par rapport à l'extrémité supérieure du bloc |
11 dBm |
5 MHz |
|
Fréquences dans la bande 1 427 -1 517 MHz dont l'espacement par rapport à l'extrémité inférieure ou supérieure du bloc est supérieur à 10 MHz |
9 dBm |
5 MHz |
Exigences de coexistence avec les bandes de fréquences adjacentes
Tableau 3
Limites de puissance des émissions non désirées dans la bande de fréquences 1 400 -1 427 MHz pour les stations de base fonctionnant dans la bande de fréquences 1 427 -1 452 MHz
|
Bande de fréquences des émissions hors bande |
Niveau de puissance maximal des émissions non désirées (3) |
Largeur de bande à mesurer |
|
1 400 -1 427 MHz |
– 72 dBW |
27 MHz |
Note explicative du tableau 3
Cette exigence vise à protéger les services de radioastronomie et les services passifs d'exploration de la Terre par satellite dans la bande de fréquences passive 1 400-1 427 MHz des SCE HDSF fonctionnant dans la bande de fréquences 1 427-1 452 MHz, y compris lorsqu'une partie seulement de cette bande de fréquences est assignée aux SCE HDSF. D'autres mesures nationales peuvent s'avérer nécessaires pour mieux protéger les observations de radioastronomie dans la bande de fréquences passive 1 400-1 427 MHz des SCE HDSF.
Tableau 4
Limites de PIRE hors bande, par cellule (4) , dans la bande de fréquences 1 518 -1 559 MHz pour les stations de base fonctionnant dans la bande de fréquences 1 492 -1 517 MHz
|
Bande de fréquences des émissions hors bande |
PIRE hors bande maximale |
Largeur de bande à mesurer |
|
1 518 -1 520 MHz |
– 0,8 dBm |
1 MHz |
|
1 520 -1 559 MHz |
– 30 dBm |
1 MHz |
Note explicative du tableau 4
Ces exigences visent à protéger correctement les services mobiles par satellite fonctionnant dans la bande de fréquences 1 518-1 559 MHz, en particulier autour des ports maritimes, des aéroports et des stations au sol du service mobile par satellite pour la recherche et le sauvetage, des SCE HDSF fonctionnant dans la bande de fréquences 1 492-1 517 MHz, y compris lorsqu'une partie seulement de cette bande de fréquences est assignée aux SCE HDSF. D'autres mesures nationales peuvent s'avérer nécessaires pour mieux protéger les services mobiles par satellite dans la bande de fréquences 1 518-1 559 MHz.
Tableau 5
Limites de PIRE hors bande, par cellule, en dessous de 1 452 MHz et au-dessus de 1 492 MHz pour les stations de base fonctionnant dans la bande de fréquences 1 452 -1 492 MHz
|
Bande de fréquences des émissions hors bande |
PIRE hors bande moyenne maximale |
Largeur de bande à mesurer |
|
En dessous de 1 449 MHz |
– 20 dBm |
1 MHz |
|
1 449 -1 452 MHz |
14 dBm |
3 MHz |
|
1 492 -1 495 MHz |
14 dBm |
3 MHz |
|
Au-dessus de 1 495 MHz |
– 20 dBm |
1 MHz |
Note explicative du tableau 5
Ces exigences s'appliquent lorsqu'aucun SCE HDSF n'est déployé en dessous de 1 452 MHz ni/ou au-dessus de 1 492 MHz. Elles visent à assurer la compatibilité des SCE HDSF, dans la bande de fréquences 1 452-1 492 MHz, avec les liaisons fixes coordonnées, les services mobiles et les services de télémétrie aéronautique limités aux stations au sol, déployés dans les bandes de fréquences adjacentes en dessous de 1 452 MHz ou au-dessus de 1 492 MHz.
Lorsque des SCE HDSF sont déployés dans les blocs immédiatement en dessous de 1 452 MHz, les limites indiquées dans le tableau 5 pour les fréquences en dessous de 1 452 MHz ne s'appliquent pas. Lorsque des SCE HDSF sont déployés dans les blocs immédiatement au-dessus de 1 492 MHz, les limites indiquées dans le tableau 5 pour les fréquences au-dessus de 1 492 MHz ne s'appliquent pas. Cela est sans préjudice des exigences hors bande établies dans les tableaux 3 et 4 et des exigences hors bloc établies dans le tableau 2.
(1) Il peut s'agir, par exemple, d'une ou de plusieurs des mesures suivantes: coordination de la planification des fréquences, coordination des sites, limites de puissance intrabande et de puissance isotrope rayonnée équivalente hors bande pour les stations de base plus contraignantes que celles indiquées au tableau 5.
(2) Sur un site multisecteur, la valeur “par cellule” correspond à la valeur pour un des secteurs.
(3) Le niveau de puissance des émissions non désirées doit s'entendre comme le niveau mesuré au port d'antenne.
(4) Sur un site multisecteur, la valeur “par cellule” correspond à la valeur pour un des secteurs.
|
30.4.2018 |
FR |
Journal officiel de l'Union européenne |
L 110/134 |
DÉCISION D'EXÉCUTION (UE) 2018/662 DE LA COMMISSION
du 27 avril 2018
désignant le laboratoire de référence de l'Union européenne pour l'influenza aviaire et la maladie de Newcastle et modifiant l'annexe VII de la directive 2005/94/CE du Conseil
[notifiée sous le numéro C(2018) 2459]
(Texte présentant de l'intérêt pour l'EEE)
LA COMMISSION EUROPÉENNE,
vu le traité sur le fonctionnement de l'Union européenne,
vu la directive 92/66/CEE du Conseil du 14 juillet 1992 établissant des mesures communautaires de lutte contre la maladie de Newcastle (1), et notamment son article 15, paragraphe 1,
vu la directive 2005/94/CE du Conseil du 20 décembre 2005 concernant des mesures communautaires de lutte contre l'influenza aviaire et abrogeant la directive 92/40/CEE (2), et notamment son article 63, paragraphe 2,
considérant ce qui suit:
|
(1) |
La directive 92/66/CEE (*1) établit les mesures de lutte minimales à appliquer en cas d'apparition de la maladie de Newcastle chez les volailles, les pigeons voyageurs et d'autres oiseaux maintenus en captivité. L'article 15 de ladite directive prévoit la désignation d'un laboratoire de référence de l'Union européenne pour la maladie de Newcastle pour l'accomplissement des fonctions et missions prévues audit article. |
|
(2) |
La directive 2005/94/CE prévoit certaines mesures préventives relatives à la surveillance et à la détection précoce de l'influenza aviaire ainsi que des mesures minimales de lutte à appliquer en cas d'apparition d'un foyer de cette maladie chez des volailles ou d'autres oiseaux captifs. L'article 51, paragraphe 1, de ladite directive prévoit que le laboratoire désigné à l'annexe VII, point 1, est le laboratoire de référence de l'Union européenne pour l'influenza aviaire et qu'il accomplit les fonctions et les missions énumérées à l'annexe VII, point 2. |
|
(3) |
En raison de la notification faite par le Royaume-Uni au titre de l'article 50 du Traité sur l'Union européenne, les laboratoires de référence de l'Union européenne pour l'influenza aviaire et la maladie de Newcastle, actuellement désignés conformément aux directives 92/66/CEE et 2005/94/CE, devront cesser leurs fonctions et missions en tant que laboratoires de référence de l'Union européenne pour ces deux maladies. |
|
(4) |
En raison de la similarité des manifestations de l'influenza aviaire et de la maladie de Newcastle et de la similarité des techniques de diagnostic, ainsi que de l'expertise et de l'équipement requis, il convient de désigner un seul laboratoire de référence de l'Union européenne pour ces deux maladies. |
|
(5) |
Afin d'éviter toute perturbation des activités du laboratoire de référence de l'Union européenne pour l'influenza aviaire et la maladie de Newcastle et de laisser au laboratoire de référence de l'Union européenne nouvellement désigné suffisamment de temps pour être pleinement opérationnel dans ses nouvelles fonctions et missions, il convient que les mesures prévues par la présente décision soient applicables à compter du 1er janvier 2019. |
|
(6) |
La Commission, en étroite collaboration avec les États membres, a lancé un appel en vue de la sélection et de la désignation du laboratoire de référence de l'Union européenne pour l'influenza aviaire et la maladie de Newcastle, compte tenu des critères de compétence technique et scientifique du laboratoire ainsi que de l'expertise du personnel. |
|
(7) |
Au terme de la procédure de sélection, il convient de désigner le laboratoire retenu, l'Istituto Zooprofilattico Sperimentale delle Venezie (IZSVe), Legnaro (Italie), comme laboratoire de référence de l'Union européenne pour l'influenza aviaire et la maladie de Newcastle pour une période indéterminée débutant le 1er janvier 2019. |
|
(8) |
Les mesures prévues par la présente décision d'exécution sont conformes à l'avis du comité permanent des végétaux, des animaux, des denrées alimentaires et des aliments pour animaux, |
A ADOPTÉ LA PRÉSENTE DÉCISION:
Article premier
L'Istituto Zooprofilattico Sperimentale delle Venezie (IZSVe), Legnaro (Italie), est désigné comme laboratoire de référence de l'Union européenne pour l'influenza aviaire et la maladie de Newcastle.
Article 2
À l'annexe VII de la directive 2005/94/CE, le point 1 est remplacé par le texte suivant:
|
«1. |
Le laboratoire de référence de l'Union européenne pour l'influenza aviaire est: l'Istituto Zooprofilattico Sperimentale delle Venezie (IZSVe), Legnaro (Italie).» |
Article 3
La présente décision s'applique à compter du 1er janvier 2019.
Article 4
Les États membres sont destinataires de la présente décision.
Fait à Bruxelles, le 27 avril 2018.
Par la Commission
Vytenis ANDRIUKAITIS
Membre de la Commission
(1) JO L 260 du 5.9.1992, p. 1.
(2) JO L 10 du 14.1.2006, p. 16.
(*1) La directive 92/66/CEE du Conseil est en cours d'alignement sur le TFUE et sur le règlement (UE) 2017/625 du Parlement européen et du Conseil (JO L 95 du 7.4.2017, p. 1) relatif aux contrôles officiels.
|
30.4.2018 |
FR |
Journal officiel de l'Union européenne |
L 110/136 |
DÉCISION D'EXÉCUTION (UE) 2018/663 DE LA COMMISSION
du 27 avril 2018
concernant certaines mesures provisoires de protection contre la peste porcine africaine en Hongrie
[notifée sous le numéro C(2018) 2690]
(Le texte en langue hongroise est le seul faisant foi.)
(Texte présentant de l'intérêt pour l'EEE)
LA COMMISSION EUROPÉENNE,
vu le traité sur le fonctionnement de l'Union européenne,
vu la directive 89/662/CEE du Conseil du 11 décembre 1989 relative aux contrôles vétérinaires applicables dans les échanges intracommunautaires dans la perspective de la réalisation du marché intérieur (1), et notamment son article 9, paragraphe 3,
vu la directive 90/425/CEE du Conseil du 26 juin 1990 relative aux contrôles vétérinaires et zootechniques applicables dans les échanges intracommunautaires de certains animaux vivants et produits dans la perspective de la réalisation du marché intérieur (2), et notamment son article 10, paragraphe 3,
considérant ce qui suit:
|
(1) |
La peste porcine africaine, maladie virale infectieuse qui touche les populations de porcs domestiques et sauvages, peut avoir une incidence grave sur la rentabilité des élevages de porcs et, partant, perturber les échanges au sein de l'Union et les exportations vers les pays tiers. |
|
(2) |
Lorsqu'un cas de peste porcine africaine apparaît chez les porcs sauvages, le risque existe que l'agent pathogène se propage à d'autres populations de porcs sauvages et aux exploitations porcines. La maladie peut ainsi se propager d'un État membre à l'autre ou à des pays tiers, à la faveur des échanges commerciaux de porcs vivants ou de leurs produits. |
|
(3) |
La directive 2002/60/CE du Conseil (3) établit les mesures minimales de lutte contre la peste porcine africaine à appliquer dans l'Union. En particulier, l'article 15 de la directive 2002/60/CE prévoit l'obligation de prendre certaines mesures lorsqu'un ou plusieurs cas de peste porcine africaine ont été confirmés dans les populations de porcs sauvages. |
|
(4) |
La Hongrie a informé la Commission de la situation actuelle au regard de la peste porcine africaine sur son territoire et, conformément à l'article 15 de la directive 2002/60/CE, a pris plusieurs mesures, notamment la délimitation d'une zone infectée dans laquelle les mesures visées à l'article 15 de ladite directive sont appliquées, afin d'empêcher la propagation de cette maladie. |
|
(5) |
Pour prévenir toute perturbation inutile des échanges commerciaux au sein de l'Union et éviter que des pays tiers n'imposent des entraves au commerce injustifiées, il est nécessaire de décrire, à l'échelon de l'Union, la zone infectée par la peste porcine africaine en Hongrie, en collaboration avec cet État membre. |
|
(6) |
En conséquence, dans l'attente de la réunion du comité permanent des végétaux, des animaux, des denrées alimentaires et des aliments pour animaux, il convient que l'annexe de la présente décision définisse la zone infectée en Hongrie et fixe la durée de validité de cette zone. |
|
(7) |
La présente décision sera réexaminée lors de la prochaine réunion du comité permanent des végétaux, des animaux, des denrées alimentaires et des aliments pour animaux, |
A ADOPTÉ LA PRÉSENTE DÉCISION:
Article premier
La Hongrie veille à ce que la zone infectée délimitée, dans laquelle les mesures prévues à l'article 15 de la directive 2002/60/CE s'appliquent, comprenne au moins les zones énumérées à l'annexe de la présente décision.
Article 2
La présente décision s'applique jusqu'au 30 juin 2018.
Article 3
La Hongrie est destinataire de la présente décision.
Fait à Bruxelles, le 27 avril 2018.
Par la Commission
Vytenis ANDRIUKAITIS
Membre de la Commission
(1) JO L 395 du 30.12.1989, p. 13.
(2) JO L 224 du 18.8.1990, p. 29.
(3) Directive 2002/60/CE du Conseil du 27 juin 2002 établissant des dispositions spécifiques pour la lutte contre la peste porcine africaine et modifiant la directive 92/119/CEE, en ce qui concerne la maladie de Teschen et la peste porcine africaine (JO L 192 du 20.7.2002, p. 27).
ANNEXE
|
Zones composant la zone infectée définie en Hongrie et visées à l'article 1er |
Applicable jusqu'au |
|
Territory of the county of Heves located north of the motorway E 71 |
30 juin 2018 |
|
30.4.2018 |
FR |
Journal officiel de l'Union européenne |
L 110/139 |
DÉCISION (UE) 2018/664 DE LA SESSION PLÉNIÈRE DU CONSEIL DE RÉSOLUTION UNIQUE
du 23 mars 2017
sur la décharge sur l'exécution du budget et sur la clôture des comptes du Conseil de résolution unique pour l'exercice 2015 (SRB/PS/2017/02)
LE CONSEIL DE RÉSOLUTION UNIQUE RÉUNI EN SESSION PLÉNIÈRE,
vu l'article 50, paragraphe 1, point b), et l'article 63, paragraphe 8, du règlement (UE) no 806/2014 du Parlement européen et du Conseil du 15 juillet 2014 établissant des règles et une procédure uniformes pour la résolution des établissements de crédit et de certaines entreprises d'investissement dans le cadre d'un mécanisme de résolution unique et d'un Fonds de résolution bancaire unique, et modifiant le règlement (UE) no 1093/2010 (1),
vu les articles 103, 104 et 105 du règlement financier du Conseil de résolution unique tel qu'adopté par la décision de la session plénière du 25 mars 2015 (SRB/PS/2015/05) et tel que modifié par la décision de la session plénière du 16 mars 2016 (SRB/PS/2016/13),
vu la décision de la session plénière du 6 janvier 2017 établissant la procédure visant à ce que la session plénière donne décharge de l'exécution du budget au président du Conseil de résolution unique (SRB/PS/2017/01),
vu les comptes annuels définitifs du Conseil de résolution unique pour l'exercice 2015, tels qu'approuvés lors de sa réunion du 28 juin 2016,
vu le rapport annuel d'activité du Conseil de résolution unique pour l'exercice 2015, tel qu'adopté lors de sa réunion du 28 juin 2016,
vu le rapport annuel de la Cour des comptes couvrant la déclaration d'assurance concernant la fiabilité des comptes et la légalité et la régularité des opérations sous-jacentes ainsi que la bonne gestion financière pour l'exercice 2015, accompagné des réponses du Conseil de résolution unique,
vu le rapport de la Cour des comptes au titre de l'article 92, paragraphe 4, du règlement (UE) no 806/2014 sur tout engagement éventuel (du Conseil de résolution unique, du Conseil, de la Commission ou d'un autre organe) découlant de l'exécution par le Conseil de résolution unique, le Conseil et la Commission des tâches qui leur incombent en vertu dudit règlement, ainsi que les réponses du Conseil de résolution unique, du Conseil et de la Commission,
DÉCIDE:
|
1. |
d'octroyer la décharge de l'exécution du budget du Conseil de résolution unique pour l'exercice 2015 à la présidente du CRU; |
|
2. |
d'approuver la clôture des comptes du Conseil de résolution unique pour l'exercice 2015; |
|
3. |
d'exposer ses observations dans la proposition ci-dessous; |
|
4. |
d'inviter la présidente du Conseil de résolution unique à notifier la présente décision au Conseil, à la Commission et à la Cour des comptes en vue de sa publication au Journal officiel de l'Union européenne, ainsi que sur le site internet du CRU. |
Fait à Bruxelles, le 23 mars 2017.
Pour la session plénière du Conseil
Membre de la session plénière du CRU
Frank ELDERSON
(1) JO L 225 du 30.7.2014, p. 1.
|
30.4.2018 |
FR |
Journal officiel de l'Union européenne |
L 110/140 |
DÉCISION (UE) 2018/665 DE LA SESSION PLÉNIÈRE DU CONSEIL DE RÉSOLUTION UNIQUE
du 15 mars 2018
sur la décharge sur l'exécution du budget et sur la clôture des comptes du Conseil de résolution unique pour l'exercice 2016 (SRB/PS/2018/02)
LE CONSEIL DE RÉSOLUTION UNIQUE RÉUNI EN SESSION PLÉNIÈRE,
vu l'article 50, paragraphe 1, point b), et l'article 63, paragraphe 8, du règlement (UE) no 806/2014 du Parlement européen et du Conseil du 15 juillet 2014 établissant des règles et une procédure uniformes pour la résolution des établissements de crédit et de certaines entreprises d'investissement dans le cadre d'un mécanisme de résolution unique et d'un Fonds de résolution bancaire unique, et modifiant le règlement (UE) no 1093/2010 (1),
vu les articles 103, 104 et 105 du règlement financier du Conseil de résolution unique (ci-après le «CRU»),
vu les comptes annuels définitifs du CRU pour l'exercice 2016, tels qu'approuvés lors de sa réunion du 22 juin 2017,
vu le rapport annuel d'activité du CRU pour l'exercice 2016, tel qu'adopté lors de sa réunion du 22 juin 2017,
vu le rapport annuel de la Cour des comptes couvrant la déclaration d'assurance concernant la fiabilité des comptes et la légalité et la régularité des opérations sous-jacentes ainsi que la bonne gestion financière pour l'exercice 2016, accompagné des réponses du CRU,
vu le rapport de la Cour des comptes au titre de l'article 92, paragraphe 4, du règlement (UE) no 806/2014 sur tout engagement éventuel (du Conseil de résolution unique, du Conseil, de la Commission ou d'un autre organe) découlant de l'exécution par le Conseil de résolution unique, le Conseil et la Commission des tâches qui leur incombent en vertu dudit règlement pour l'exercice 2016, ainsi que les réponses du CRU, du Conseil et de la Commission,
DÉCIDE:
|
1. |
d'octroyer la décharge de l'exécution du budget du CRU pour l'exercice 2016 à la présidente du CRU; |
|
2. |
d'approuver la clôture des comptes du CRU pour l'exercice 2016; |
|
3. |
d'exposer ses observations dans la proposition ci-dessous; |
|
4. |
d'inviter la présidente du Conseil de résolution unique à notifier la présente décision au Conseil, à la Commission et à la Cour des comptes en vue de sa publication au Journal officiel de l'Union européenne, ainsi que sur le site internet du CRU. |
Fait à Bruxelles, le 15 mars 2018.
Pour la session plénière du Conseil
Membre de la session plénière du CRU
Tuija TAOS
(1) JO L 225 du 30.7.2014, p. 1.