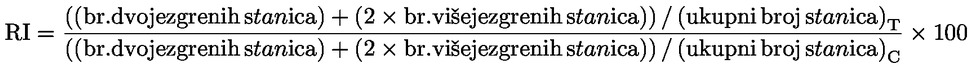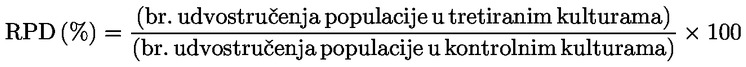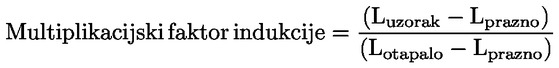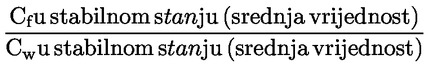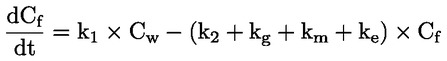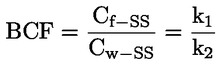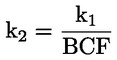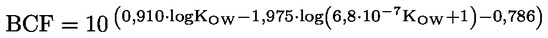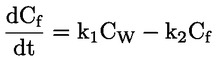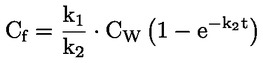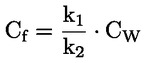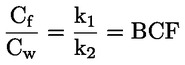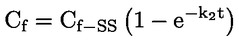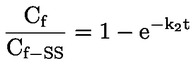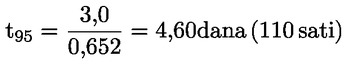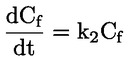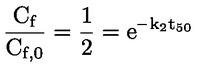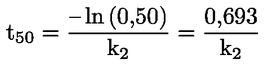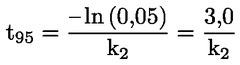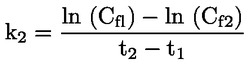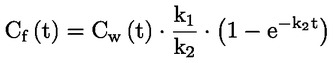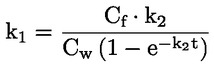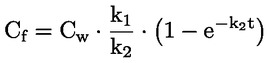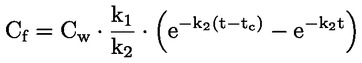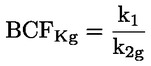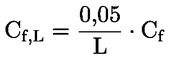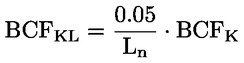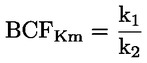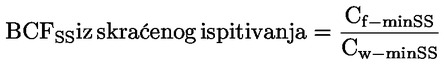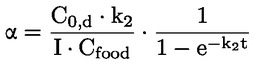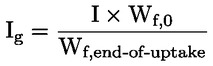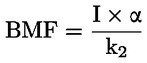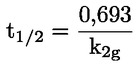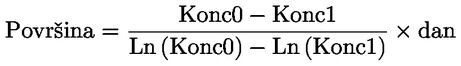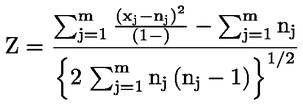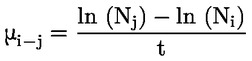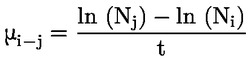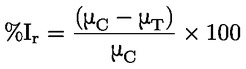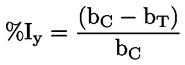EUR-Lex Access to European Union law

This document is an excerpt from the EUR-Lex website
Document 32017R0735
Commission Regulation (EU) 2017/735 of 14 February 2017 amending, for the purpose of its adaptation to technical progress, the Annex to Regulation (EC) No 440/2008 laying down test methods pursuant to Regulation (EC) No 1907/2006 of the European Parliament and of the Council on the Registration, Evaluation, Authorisation and Restriction of Chemicals (REACH) (Text with EEA relevance. )
Uredba Komisije (EU) 2017/735 оd 14. veljače 2017. o izmjeni Priloga Uredbi (EZ) br. 440/2008 o utvrđivanju ispitnih metoda u skladu s Uredbom (EZ) br. 1907/2006 Europskog parlamenta i Vijeća o registraciji, evaluaciji, autorizaciji i ograničavanju kemikalija (REACH) radi prilagodbe tehničkom napretku (Tekst značajan za EGP. )
Uredba Komisije (EU) 2017/735 оd 14. veljače 2017. o izmjeni Priloga Uredbi (EZ) br. 440/2008 o utvrđivanju ispitnih metoda u skladu s Uredbom (EZ) br. 1907/2006 Europskog parlamenta i Vijeća o registraciji, evaluaciji, autorizaciji i ograničavanju kemikalija (REACH) radi prilagodbe tehničkom napretku (Tekst značajan za EGP. )
C/2017/0773
SL L 112, 28.4.2017, p. 1–402
(BG, ES, CS, DA, DE, ET, EL, EN, FR, HR, IT, LV, LT, HU, MT, NL, PL, PT, RO, SK, SL, FI, SV)
 In force
In force
|
28.4.2017 |
HR |
Službeni list Europske unije |
L 112/1 |
UREDBA KOMISIJE (EU) 2017/735
оd 14. veljače 2017.
o izmjeni Priloga Uredbi (EZ) br. 440/2008 o utvrđivanju ispitnih metoda u skladu s Uredbom (EZ) br. 1907/2006 Europskog parlamenta i Vijeća o registraciji, evaluaciji, autorizaciji i ograničavanju kemikalija (REACH) radi prilagodbe tehničkom napretku
(Tekst značajan za EGP)
EUROPSKA KOMISIJA,
uzimajući u obzir Ugovor o funkcioniranju Europske unije,
uzimajući u obzir Uredbu (EZ) br. 1907/2006 Europskog parlamenta i Vijeća od 18. prosinca 2006. o registraciji, evaluaciji, autorizaciji i ograničavanju kemikalija (REACH) i osnivanju Europske agencije za kemikalije te o izmjeni Direktive 1999/45/EZ i stavljanju izvan snage Uredbe Vijeća (EEZ) br. 793/93 i Uredbe Komisije (EZ) br. 1488/94 kao i Direktive Vijeća 76/769/EEZ i direktiva Komisije 91/155/EEZ, 93/67/EEZ, 93/105/EZ i 2000/21/EZ (1), a posebno njezin članak 13. stavak 2.,
budući da:
|
(1) |
Uredba Komisije (EZ) br. 440/2008 (2) sadržava ispitne metode za potrebe određivanja fizikalno-kemijskih svojstava, toksičnosti i ekotoksičnosti kemikalija koje treba primijeniti za potrebe Uredbe (EZ) br. 1907/2006. |
|
(2) |
Uredbu (EZ) br. 440/2008 potrebno je ažurirati kako bi obuhvatila nove i ažurirane ispitne metode koje je nedavno donijela Organizacija za gospodarsku suradnju i razvoj (OECD), odnosno kako bi se u obzir uzeo tehnički napredak te osiguralo smanjenje broja životinja koje se upotrebljavaju za provođenje pokusa, u skladu s Direktivom 2010/63/EU Europskog parlamenta i Vijeća (3). S dionicima je provedeno savjetovanje o nacrtu. |
|
(3) |
Prilagodba tehničkom napretku sastoji se od dvadeset ispitnih metoda: jedne nove metode za određivanje fizikalno-kemijskog svojstva, pet novih i jedne ažurirane ispitne metode za procjenu ekotoksičnosti, dviju ažuriranih ispitnih metoda za procjenu sudbine i ponašanja tvari u okolišu te četiriju novih i sedam ažuriranih ispitnih metoda za određivanje učinaka na zdravlje ljudi. |
|
(4) |
OECD redovito revidira svoje smjernice za ispitivanje kako bi utvrdio koje su od njih znanstveno zastarjele. Ovom prilagodbom tehničkom napretku briše se šest ispitnih metoda za koje su poništene odgovarajuće smjernice OECD-a za ispitivanje. |
|
(5) |
Uredbu (EZ) br. 440/2008 trebalo bi stoga na odgovarajući način izmijeniti. |
|
(6) |
Mjere predviđene ovom Uredbom u skladu su s mišljenjem Odbora osnovanog na temelju članka 133. Uredbe (EZ) br. 1907/2006, |
DONIJELA JE OVU UREDBU:
Članak 1.
Prilog Uredbi (EZ) br. 440/2008 mijenja se u skladu s Prilogom ovoj Uredbi.
Članak 2.
Ova Uredba stupa na snagu dvadesetog dana od dana objave u Službenom listu Europske unije.
Ova je Uredba u cijelosti obvezujuća i izravno se primjenjuje u svim državama članicama.
Sastavljeno u Bruxellesu 14. veljače 2017.
Za Komisiju
Predsjednik
Jean-Claude JUNCKER
(1) SL L 396, 30.12.2006., str. 1.
(2) Uredba Komisije (EZ) br. 440/2008 od 30. svibnja 2008. o utvrđivanju ispitnih metoda u skladu s Uredbom (EZ) br. 1907/2006 Europskog parlamenta i Vijeća o registraciji, evaluaciji, autorizaciji i ograničavanju kemikalija (REACH) (SL L 142, 31.5.2008., str. 1.)
(3) Direktiva 2010/63/EU Europskog parlamenta i Vijeća od 22. rujna 2010. o zaštiti životinja koje se koriste u znanstvene svrhe (SL L 276, 20.10.2010., str. 33.)
PRILOG
Prilog Uredbi (EZ) br. 440/2008 mijenja se kako slijedi:
|
(1) |
U dijelu A dodaje se sljedeće poglavlje: „A.25. KONSTANTE DISOCIJACIJE U VODI (TITRACIJSKA METODA – SPEKTROFOTOMETRIJSKA METODA – KONDUKTOMETRIJSKA METODA) UVOD Ova ispitna metoda odgovara Smjernici OECD-a za ispitivanje 112 (1981.). Preduvjeti
Opće informacije
Posebni uvjeti
Referentni dokumenti Ova se ispitna metoda temelji na metodama koje su navedene u literaturi čiji se popis nalazi u odjeljku ‚Literatura’ te na EPA-inom ‚Preliminarnom nacrtu smjernica za obavješćivanje prije proizvodnje’ (engl. Preliminary Draft Guidance for Premanufacture Notification, EPA) od 18. kolovoza 1978. METODA – UVOD, SVRHA, PODRUČJE PRIMJENE, RELEVANTNOST, PRIMJENA I GRANICE ISPITIVANJA Disocijacija određene tvari u vodi važna je za procjenu utjecaja te tvari na okoliš. Njome se određuje oblik tvari, o kojemu zatim ovisi njezino ponašanje i prijenos. Može utjecati na adsorpciju kemikalije na tla i sedimente te na apsorpciju u biološke stanice. Definicije i jedinice Disocijacija je reverzibilno razdvajanje na dvije ili više kemijskih vrsta koje mogu biti ionske. Proces se uobičajeno prikazuje jednadžbom RX ⇌ R ++ X – a koncentracijska konstanta ravnoteže za tu je reakciju
Na primjer, u konkretnom slučaju u kojemu je R vodik (tvar je kiselina), konstanta je
ili
Referentne tvari Kod ispitivanja novih tvari nije uvijek potrebno upotrijebiti sljedeće referentne tvari. One se prije svega navode radi povremene kalibracije metode te kako bi se omogućila usporedba rezultata kod primjene neke druge metode.
Bilo bi korisno imati dostupnu tvar koja ima više vrijednosti pK, kako je navedeno u nastavku u odjeljku ‚Načelo metode’. Takva bi tvar mogla biti:
Načelo ispitne metode Opisani kemijski proces općenito tek u maloj mjeri ovisi o temperaturi u rasponu temperatura koji nalazimo u okolišu. Za određivanje konstante disocijacije potrebno je znati koncentraciju disociranih i nedisociranih oblika kemijske tvari. Na temelju spoznaja o stehiometriji reakcije disocijacije navedene u odjeljku ‚Definicije i jedinice’ može se odrediti odgovarajuća konstanta. U konkretnom slučaju opisanom u ispitnoj metodi tvar se ponaša kao kiselina ili baza pa je određivanje najprikladnije provesti mjerenjem relativnih koncentracija ioniziranog i neioniziranog oblika tvari te pH-vrijednosti otopine. Odnos između tih članova prikazan je jednadžbom za pKa, koja je navedena u odjeljku ‚Definicije i jedinice’. Neke tvari imaju više od jedne konstante disocijacije te se mogu izvesti slične jednadžbe. Neke od ovdje opisanih metoda prikladne su i za ne-acidobaznu disocijaciju. Kriteriji kvalitete Ponovljivost Određivanje konstante disocijacije potrebno je ponoviti (najmanje tri određivanja), a dobivene se vrijednosti moraju kretati unutar područja od ± 0,1 log jedinica. OPIS ISPITNIH POSTUPAKA Vrijednost pKa. može se odrediti na dva osnovna načina. Jedan uključuje titraciju poznate količine tvari standardnom kiselinom ili bazom, ovisno o slučaju; drugi uključuje određivanje relativne koncentracije ioniziranih i neioniziranih oblika te njihove ovisnosti o pH-vrijednosti. Preparati Metode koje se temelje na navedenim načelima mogu se svrstati u titracijske, spektrofotometrijske i konduktometrijske metode. Ispitne otopine Za titracijsku i konduktometrijsku metodu kemijsku tvar potrebno je otopiti u destiliranoj vodi. Za spektrofotometrijsku i ostale metode upotrebljavaju se puferske otopine. Koncentracija ispitivane tvari ne smije premašiti 0,01 M ili polovinu koncentracije zasićenja, ovisno o tome koja je od tih vrijednosti manja. Za pripremu otopine potrebno je upotrijebiti najčišći raspoloživi oblik tvari. Ako je tvar slabo topljiva, može se otopiti u maloj količini otapala mješljivog s vodom prije nego što se razrijedi do prethodno navedenih koncentracija. Potrebno je provjeriti jesu li u otopinama prisutne emulzije, i to tako da se provjeri javlja li se Tyndallov efekt, posebno ako je za poboljšanje topljivosti upotrijebljeno suotapalo. Ako se upotrebljavaju puferske otopine, koncentracija pufera ne smije premašiti 0,05 M. Ispitni uvjeti Temperatura Temperaturu treba održavati tako da odstupanje iznosi najviše± 1 °C. Određivanje je poželjno provoditi na temperaturi od 20 °C. Ako se smatra da će rezultati znatno varirati ovisno o temperaturi, određivanje je potrebno provesti na još barem dvije druge temperature. U tom slučaju temperaturni intervali trebaju iznositi 10 °C, a temperaturu treba održavati tako da odstupanje iznosi najviše ± 0,1 °C. Analize Izbor metode ovisi o vrsti tvari koja se ispituje. Metoda mora biti dovoljno osjetljiva da se njome omogući određivanje različitih vrsta pri svakoj koncentraciji ispitne otopine. Provođenje ispitivanja Titracijska metoda Ispitna otopina određuje se titracijom standardnom otopinom baze ili kiseline, ovisno o slučaju, pri čemu se nakon svakog dodavanja titranta mjeri pH. Potrebno je izvršiti najmanje deset dodavanja prije točke ekvivalencije. Ako se ravnoteža postigne dovoljno brzo, može se upotrijebiti potenciometar za bilježenje mjerenja. Za ovu je metodu potrebno točno znati količinu tvari i njezinu koncentraciju. Moraju se poduzeti mjere opreza kako bi se isključio ugljikov dioksid. Detaljne pojedinosti o postupku, mjerama opreza i izračunu navedene su u standardnim ispitivanjima, npr. u literaturi 1., 2., 3., 4. Spektrofotometrijska metoda Valna duljina pronalazi se tamo gdje ionizirani i neionizirani oblici tvari imaju znatno drukčije koeficijente ekstinkcije. Spektar apsorpcije UV/vidljivog zračenja bilježi se kod otopina stalne koncentracije u onim uvjetima pH-vrijednosti u kojima je tvar uglavnom neionizirana i u cijelosti ionizirana te pri nekoliko srednjih pH-vrijednosti. To se može postići dodavanjem koncentrirane kiseline (baze) u relativno velik volumen otopine tvari u višekomponentnom puferu, počevši pri visokoj (niskoj) pH-vrijednosti (literatura 5.), ili dodavanjem jednakih količina matične otopine tvari, npr. u vodi ili metanolu, u stalne volumene različitih puferskih otopina kojima je obuhvaćen željeni raspon pH-vrijednosti. Iz pH-vrijednosti i vrijednosti apsorbancije na izabranoj valnoj duljini izračunava se dovoljan broj vrijednosti za pKa, pri čemu se upotrebljavaju podaci dobiveni za najmanje pet pH-vrijednosti pri kojima stupanj ionizacije tvari iznosi najmanje 10 %, a manje od 90 %. Dodatni eksperimentalni podaci i metoda izračuna navedeni su u literaturi 1. Konduktometrijska metoda S pomoću ćelije čija je konstanta mala i poznata mjeri se vodljivost oko 0,1 M otopine tvari u elektrovodljivoj vodi. Mjeri se i vodljivost određenog broja otopina dobivenih preciznim razrjeđivanjem navedene otopine. Koncentracija se svaki put smanjuje za polovinu, a nizom treba obuhvatiti barem red veličine koncentracije. Granična vrijednost vodljivosti pri beskonačnom razrjeđenju utvrđuje se sličnim pokusom sa solju Na te ekstrapolacijom. Potom se iz podataka za vodljivost svake otopine može izračunati stupanj disocijacije s pomoću Onsagerove jednadžbe te se iz toga, primjenom Ostwaldovog zakona razrjeđenja, može izračunati konstanta disocijacije s pomoću formule K = α2C/(1 – α) pri čemu je C koncentracija u molovima po litri, a α je disocirana frakcija. Moraju se poduzeti mjere opreza kako bi se isključio CO2. Dodatni eksperimentalni podaci i metoda izračuna navedeni su u referentnim tekstovima i literaturi pod brojevima 1., 6. i 7. PODACI I IZVJEŠĆIVANJE Obrada rezultata Titracijska metoda Vrijednost pKa izračunava se za deset izmjerenih točaka na titracijskoj krivulji. Za te se vrijednosti pKa izračunavaju srednja vrijednost i standardna devijacija. Grafičkom prikazu potrebno je priložiti i grafički prikaz pH-vrijednosti u ovisnosti o volumenu standardne baze ili kiseline. Spektrofotometrijska metoda Za svaki se spektar tablično prikazuju podaci o apsorbanciji i pH-vrijednosti. Iz točaka podataka za prijelazne spektre izračunava se najmanje pet vrijednosti za pKa te srednja vrijednost i standardna devijacija tih rezultata. Konduktometrijska metoda Ekvivalentna vodljivost Λ izračunava se za svaku koncentraciju kiseline i za svaku koncentraciju smjese sastavljene od jednog ekvivalenta kiseline plus 0,98 ekvivalenta natrijeva hidroksida bez karbonata. Kiseline je više kako bi se spriječio višak OH– koji nastaje zbog hidrolize. Grafički se prikazuje 1/Λ u ovisnosti o √C, a Λo soli može se utvrditi ekstrapolacijom na nultu koncentraciju. Vrijednost Λo kiseline može se izračunati upotrebom vrijednosti koje su za H+ i Na+ navedene u literaturi. Za svaku se koncentraciju vrijednost pKa može izračunati s pomoću formula α = Λi /Λo i Ka = α2C/(1 – α). Bolje vrijednosti za Ka mogu se dobiti tako da se izvrše korekcije s obzirom na pokretljivost i aktivnost. Potrebno je izračunati srednje vrijednosti i standardne devijacije vrijednosti pKa. Izvješće o ispitivanju Potrebno je dostaviti sve sirove podatke i izračunane vrijednosti pKa te metodu izračuna (po mogućnosti u obliku tablice kako se predlaže u literaturi 1.), kao i prethodno opisane statističke parametre. Za titracijske metode potrebno je navesti podatke o standardizaciji titranta. Za spektrofotometrijsku metodu potrebno je dostaviti sve spektre. Za konduktometrijsku metodu potrebno je navesti podatke o određivanju konstante ćelije. Potrebno je navesti informacije o upotrijebljenim tehnikama, analitičkim metodama i vrsti svih upotrijebljenih pufera. Potrebno je izvijestiti o ispitnoj temperaturi (ispitnim temperaturama). LITERATURA
|
|
(2) |
U dijelu B poglavlje B.5. zamjenjuje se sljedećim: „B.5. AKUTNO NADRAŽIVANJE/NAGRIZANJE OKA UVOD Ova ispitna metoda odgovara Smjernici OECD-a za ispitivanje 405 (2012.). Smjernice OECD-a za ispitivanje kemijskih tvari periodički se preispituju kako bi se osiguralo da odražavaju najbolje dostupne znanstvene spoznaje. U prethodnim preispitivanjima ovih smjernica za ispitivanje posebna je pozornost posvećena mogućim poboljšanjima u smislu procjenjivanja svih postojećih informacija o ispitivanoj kemikaliji kako bi se izbjeglo nepotrebno ispitivanje na laboratorijskim životinjama i time pridonijelo njihovoj dobrobiti. Smjernica za ispitivanje 405 (donesena 1981. te ažurirana 1987., 2002. i 2012.) sadržava preporuku da se prije provođenja opisanog in vivo ispitivanja akutnog nagrizajućeg/nadražujućeg djelovanja tvari na oko provede analiza snage dokaza (1.) na temelju postojećih relevantnih podataka. Ako nema dovoljno raspoloživih podataka, preporučuje se njihovo prikupljanje primjenom sekvencijskog ispitivanja (2., 3.). Strategija ispitivanja uključuje provođenje validiranih i prihvaćenih ispitivanja in vitro, a opisana je u Dodatku ovoj ispitnoj metodi. Za potrebe Uredbe (EZ) br. 1907/2006 o registraciji, evaluaciji, autorizaciji i ograničavanju kemikalija (REACH) (2), integrirana strategija ispitivanja navedena je i u odgovarajućoj smjernici ECHA-e (21.). Ispitivanje na životinjama trebalo bi provoditi samo ako se utvrdi da je ono potrebno nakon razmatranja dostupnih alternativnih metoda i primjene onih za koje se utvrdi da su primjerene. U vrijeme izrade ove ažurirane ispitne metode još uvijek postoje slučajevi u kojima je primjena ove ispitne metode potrebna ili je propisana određenim regulatornim okvirima. Zadnje se ažuriranje uglavnom odnosilo na upotrebu analgetika i anestetika te se njime nije mijenjala osnovna zamisao i struktura smjernice za ispitivanje. ICCVAM (3) i međunarodni nezavisni odbor za stručnu reviziju preispitali su korisnost i ograničenja rutinske primjene lokalnih anestetika, sustavnih analgetika te humanih krajnjih točaka tijekom in vivo ispitivanja nadražujućeg djelovanja tvari na oko (12.). Zaključili su da bi se primjenom lokalnih anestetika i sustavnih analgetika moglo većim dijelom ili u cijelosti izbjeći bol i patnju bez utjecaja na ishod ispitivanja te su preporučili da bi te tvari trebalo uvijek primjenjivati. U ovoj se ispitnoj metodi uzimaju u obzir zaključci tog preispitivanja. Lokalne anestetike, sustavne analgetike i humane krajnje točke trebalo bi rutinski primjenjivati tijekom in vivo ispitivanja akutnog nagrizanja/nadraživanja oka. Iznimke u pogledu njihove primjene trebaju biti opravdane. Poboljšanjima opisanima u ovoj metodi značajno će se smanjiti ili izbjeći bol i patnja životinja u većini ispitnih okolnosti u kojima je još uvijek potrebno in vivo ispitivanje sigurnosti za oči. U uravnoteženu preventivnu kontrolu boli trebalo bi uključiti: i. rutinsko davanje lokalnog anestetika (npr. proparakaina ili tetrakaina) i sustavnog analgetika (npr. buprenorfina) prije tretiranja, ii. rutinski program tretiranja sustavnim analgetikom (npr. buprenorfinom i meloksikamom) nakon tretiranja, iii. program promatranja, praćenja i bilježenja kliničkih znakova boli i/ili patnje kod životinja te iv. program promatranja, praćenja i bilježenja vrste, težine i napredovanja svih ozljeda očiju. Dodatne su pojedinosti navedene u ažuriranim postupcima opisanima u nastavku. Nakon primjene ispitivane kemikalije ne bi se smjeli davati nikakvi dodatni lokalni anestetici ili analgetici kako ne bi utjecali na ispitivanje. Analgetike s protuupalnim djelovanjem (npr. meloksikam) ne bi trebalo primjenjivati lokalno, a doze koje se primjenjuju sustavno ne bi smjele utjecati na učinke na oči. Definicije su navedene u Dodatku ovoj ispitnoj metodi. POČETNA RAZMATRANJA Kako bi se osigurala pouzdanost znanstvenih rezultata i dobrobit životinja, in vivo ispitivanja ne bi smjela doći u obzir sve dok se analizom snage dokaza ne ocijene svi raspoloživi podaci koji su relevantni za moguće nagrizajuće/nadražujuće djelovanje predmetne kemikalije na oko. Takvi podaci obuhvaćaju dokaze koji proizlaze iz postojećih studija provedenih na ljudima i/ili laboratorijskim životinjama, dokaze o nagrizajućim/nadražujućim svojstvima jedne ili više strukturno srodnih tvari ili smjesa tih tvari, podatke koji ukazuju na jaku kiselost ili lužnatost kemikalije (4., 5.) i rezultate validiranih i prihvaćenih in vitro ili ex vivo ispitivanja nagrizanja kože i nagrizanja/nadraživanja oka (6., 13., 14., 15., 16., 17.). Te su studije mogle biti provedene prije analize snage dokaza ili na temelju te analize. Kod nekih kemikalija takva analiza može upućivati na potrebu za in vivo ispitivanjem potencijala kemikalije za nagrizanje/nadraživanje oka. U svim je takvim slučajevima poželjno da se prije razmatranja primjene in vivo ispitivanja na oku ispita nagrizajuće djelovanje kemikalije na kožu in vitro i/ili in vivo te da se dobiveni rezultati ocijene u skladu sa strategijom sekvencijskog ispitivanja iz ispitne metode B.4. (7.) ili integriranom strategijom ispitivanja koja je opisana u smjernici ECHA-e (21.). Strategija sekvencijskog ispitivanja, koja uključuje provođenje validiranih in vitro ili ex vivo ispitivanja nagrizanja/nadraživanja oka, navedena je u Dodatku ovoj ispitnoj metodi te, za potrebe Uredbe REACH, u smjernicama ECHA-e (21). Preporučuje se slijediti tu strategiju ispitivanja prije provođenja ispitivanja in vivo. Ako je riječ o novim kemikalijama, preporučuje se stupnjevito ispitivanje kako bi se dobili znanstveno pouzdani podaci o nagrizajućim/nadražujućim svojstvima kemikalije. Ako je riječ o postojećim kemikalijama o čijem nagrizanju/nadraživanju kože i oka nema dovoljno podataka, strategija se može primijeniti kako bi se popunile praznine u podacima. Primjenu drukčije strategije ili postupka ispitivanja ili odluku da se ne primijeni metoda stupnjevitog ispitivanja potrebno je opravdati. NAČELO IN VIVO ISPITIVANJA Nakon davanja sustavnog analgetika te odgovarajuće lokalne anestezije jedna doza ispitivane kemikalije nanese se na jedno oko pokusne životinje; netretirano oko služi za kontrolu. Stupanj nadraživanja/nagrizanja oka ocjenjuje se na temelju zabilježenih lezija očne spojnice (sluznice), rožnice i šarenice u određenim intervalima. Opisuju se i ostale promjene na oku, kao i neželjene sustavne promjene, kako bi se osigurala kompletna procjena djelovanja tvari. Ispitivanje treba trajati dovoljno dugo da se ocijeni reverzibilnost ili ireverzibilnost učinaka. Životinje koje pokazuju znakove jake patnje i/ili boli u bilo kojoj fazi ispitivanja ili lezije koje odgovaraju humanim krajnjim točkama opisanima u ovoj ispitnoj metodi (vidjeti stavak 26.) treba humano usmrtiti, a ispitivanu tvar ocijeniti u skladu s tim. Kriteriji za donošenje odluke o humanom usmrćivanju životinja koje su na umoru i koje jako pate navedeni su u smjernici OECD-a (8.). PRIPREME ZA IN VIVO ISPITIVANJE Odabir vrste Kao pokusne životinje preporučuje se upotrijebiti albino kuniće, i to zdrave mlade odrasle primjerke. Ako se upotrebljavaju neke druge subpopulacije ili vrste životinja, potrebno je navesti razloge za to. Priprema životinja Oba oka svake pokusne životinje odabrane za ispitivanje treba pregledati unutar 24 sata prije početka ispitivanja. Životinje kod kojih se utvrdi nadraženost oka, očni defekti ili već postojeća ozljeda rožnice ne smiju se upotrijebiti. Uvjeti smještaja i hranjenja Životinje treba smjestiti pojedinačno. Ako je riječ o kunićima, temperatura prostorije u kojoj se drže pokusne životinje treba biti 20 °C (± 3 °C). Iako relativna vlažnost zraka treba iznositi najmanje 30 % i po mogućnosti ne više od 70 %, osim za vrijeme čišćenja prostorije, treba je nastojati održavati na 50 – 60 %. Rasvjeta bi trebala biti umjetna uz izmjenu 12 sati svjetla i 12 sati mraka. Potrebno je izbjegavati prejako osvjetljenje. Što se tiče hranjenja, može se primjenjivati standardna hrana za laboratorijske životinje uz neograničene količine pitke vode. ISPITNI POSTUPAK Upotreba lokalnih anestetika i sustavnih analgetika Preporučuju se sljedeći postupci za sprječavanje ili smanjenje boli i patnje pri ispitivanju sigurnosti za oči. Mogu se primijeniti i zamjenski postupci za koje je dokazano da su isto toliko djelotvorni ili djelotvorniji u sprječavanju ili smanjenju boli i patnje životinja.
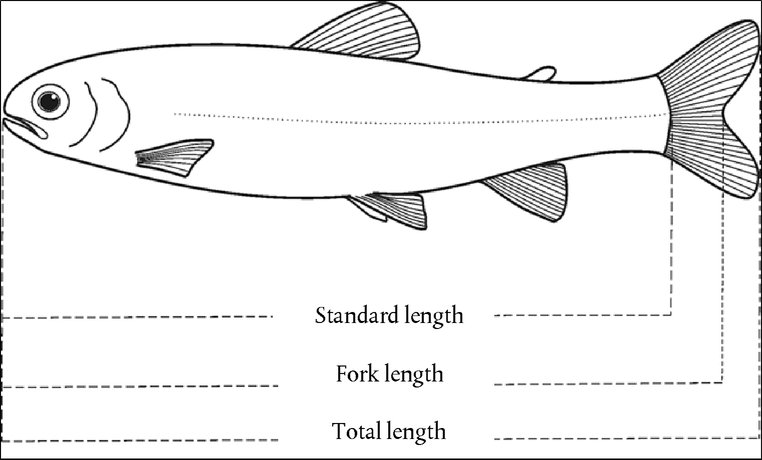
Primjena ispitivane kemikalije Ispitivanu kemikaliju treba staviti u konjunktivalnu vrećicu jednog oka svake životinje, pri čemu donji kapak treba lagano odmaknuti od očne jabučice. Kapke zatim treba lagano držati spojenima oko jedne sekunde da bi se spriječilo istjecanje materijala. Drugo oko koje se ne tretira služi za kontrolu. Ispiranje Oči pokusnih životinja ne smiju se ispirati najmanje 24 sata od primjene ispitivane kemikalije, osim ako je riječ o krutim tvarima (vidjeti stavak 18.) te u slučaju da odmah dođe do nagrizajućeg ili nadražujućeg djelovanja. Nakon 24 sata oči se mogu isprati, ako se to smatra potrebnim. Upotreba satelitske skupine životinja za istraživanje utjecaja ispiranja ne preporučuje se ako za to ne postoji znanstveno opravdanje. Ako je satelitska skupina potrebna, treba upotrijebiti dva kunića. Uvjete ispiranja treba detaljno dokumentirati, npr. vrijeme ispiranja; sastav i temperatura otopine za ispiranje; trajanje, volumen i brzina primjene otopine. Visina doze 1. Ispitivanje tekućina Za ispitivanje tekućina primjenjuje se doza od 0,1 ml. Sprejevi na pumpicu ne smiju se upotrebljavati za primjenu kemikalija izravno na oko. Ako je tekućina u spreju, najprije je treba istisnuti u posudu, iz nje uzeti 0,1 ml i nakapati u oko. 2. Ispitivanje krutih tvari Kad se ispituju krute tvari, paste i kemikalije u obliku čestica, volumen upotrijebljene doze treba iznositi 0,1 ml, odnosno njezina masa ne smije biti veća od 100 mg. Ispitivanu kemikaliju potrebno je usitniti u fini prah. Volumen krutog materijala treba izmjeriti nakon što se lagano natisne, npr. lupkanjem po mjernoj posudi. Ako se pri prvom opažanju jedan sat nakon tretiranja utvrdi da kruta ispitna kemikalija nije uklonjena iz oka pokusne životinje djelovanjem fizioloških mehanizama, oko se može isprati fiziološkom otopinom ili destiliranom vodom. 3. Ispitivanje aerosola U slučaju sprejeva na pumpicu i aerosola, prije kapanja u oko preporučuje se tekućinu staviti u posudu. Jedini izuzetak čine kemikalije u obliku aerosola pod tlakom koje se u posudu ne mogu staviti zbog hlapljenja. U takvim slučajevima oko treba držati otvorenim i ispitivanu kemikaliju nanijeti na oko jednostavnim prskanjem u trajanju od oko jedne sekunde, s udaljenosti od 10 cm ravno ispred oka. Ova razdaljina može varirati ovisno o tlaku i sadržaju spreja. Mora se paziti da ne dođe do oštećenja oka koje može izazvati tlak spreja. U nekim slučajevima može biti potrebno procijeniti mogućnost ‚mehaničkih’ ozljeda oka koje bi mogao izazvati jaki mlaz iz spreja. Procjena doze iz aerosola može se napraviti simuliranjem testa na sljedeći način: kemikalija se naspreja na papir za vaganje kroz otvor veličine oka kunića postavljen ravno ispred papira. Povećanje težine papira približno odgovara količini tekućine koja se naspreja u oko. Kod hlapljivih kemikalija doza se može procijeniti vaganjem posude u koju se naspreja ispitivana kemikalija prije i nakon pražnjenja posude. Inicijalni test (ispitivanje nadraživanja/nagrizanja oka in vivo na jednoj životinji) Čvrsto se preporučuje da se in vivo ispitivanje prvo provede samo na jednoj životinji (vidjeti dodatak ovoj ispitnoj metodi: Strategija sekvencijskog ispitivanja nadraživanja i nagrizanja oka). Zapažanja iz tog ispitivanja trebala bi omogućiti određivanje težine i reverzibilnosti lezija prije provođenja potvrdnog testa na dodatnoj životinji. Ako rezultati tog testa pokažu da uz primjenu opisanog postupka kemikalija djeluje na oko nagrizajuće ili jako nadražujuće, daljnja ispitivanja nadraživanja oka ne smiju se provoditi. Potvrdni test (ispitivanje nadraživanja/nagrizanja oka in vivo na dodatnim životinjama) Ako se tijekom inicijalnog testa ne opazi nagrizajuće ili jako nadražujuće djelovanje, nadražujuću ili negativnu reakciju potrebno je potvrditi upotrebljavajući do dvije dodatne životinje. Ako se tijekom inicijalnog testa opazi nadražujući učinak, preporučuje se da se potvrdni test izvede sekvencijski na jednoj po jednoj životinji, a ne da se istodobno izlože dvije dodatne životinje. Ako se na drugoj životinji otkrije nagrizajuće ili jako nadražujuće djelovanje, ispitivanje se ne nastavlja. Ako su rezultati testa na dodatnoj životinji dovoljni da omoguće svrstavanje tvari u kategoriju opasnosti, ne provode se daljnja ispitivanja. Razdoblje promatranja Promatranje treba trajati dovoljno dugo da se u potpunosti može utvrditi jačina i reverzibilnost opaženih učinaka. Međutim, pokus treba prekinuti čim životinja počne pokazivati znakove jake boli ili patnje (8.). Da bi se utvrdila reverzibilnost učinaka, životinje obično treba promatrati 21 dan od primjene ispitivane kemikalije. Ako se reverzibilnost uoči prije isteka 21 dana, pokus odmah treba prekinuti. Klinička opažanja i stupnjevanje reakcija oka Sat vremena nakon primjene ispitivane kemikalije oči treba sveobuhvatno pregledati kako bi se utvrdila moguća prisutnost očnih lezija, a potom preglede treba ponavljati najmanje jednom dnevno. Tijekom prva tri dana životinje treba pregledavati nekoliko puta dnevno kako bi se osiguralo pravovremeno donošenje odluke o prekidu pokusa. Tijekom cjelokupnog trajanja ispitivanja pokusne životinje treba rutinski pregledavati kako bi se provjerilo pokazuju li kliničke znakove boli i/ili patnje (npr. ponavljajuće grebanje šapom ili trljanje oka, pretjerano treptanje, pretjerano suzenje) (9., 10., 11.), i to najmanje dva puta dnevno u razmacima od najmanje šest sati ili češće ako je potrebno. Ta su pregledavanja potrebna kako bi se i. pravilno procijenilo pokazuju li životinje znakove boli i patnje te na temelju činjeničnog stanja donijela odluka o tome treba li povećati doziranje analgetika te ii. ocijenilo jesu li kod životinja dosegnute humane krajnje točke te na temelju činjeničnog stanja donijela odluka je li primjereno humano eutanazirati životinje, osiguravajući pritom da ta odluka bude donesena pravodobno. Kako bi se oštećenja očiju mogla lakše otkriti i izmjeriti te kako bi se ocijenilo jesu li dosegnute utvrđene krajnje točke za humanu eutanaziju, potrebno je rutinski primjenjivati bojenje fluoresceinom te upotrebljavati biomikroskop s procjepnom svjetiljkom kada se to smatra potrebnim (npr. za procjenu dubine lezije u slučaju ulceracije rožnice). Mogu se prikupiti digitalne fotografije uočenih lezija koje će služiti u referentne svrhe te biti trajan zapis o opsegu oštećenja očiju. Životinje ne treba držati u uvjetima ispitivanja duže nego što je potrebno za dobivanje konačnih rezultata. Životinje koje pokazuju znakove jake boli ili patnje treba bez odlaganja humano usmrtiti, a kemikaliju ocijeniti u skladu s tim. Životinje kod kojih se nakon primjene tvari uoče sljedeće lezije oka treba humano usmrtiti (u tablici 1. nalazi se opis stupnjeva lezija): perforacija ili znatna ulceracija rožnice, uključujući stafilom; krv u prednjoj očnoj komori; zamućenje rožnice 4. stupnja; nedostatak svjetlosnog refleksa (reakcija šarenice 2. stupnja) u trajanju od 72 sata; ulceracija konjunktivalne membrane; nekroza očne spojnice (konjunktive) ili trećeg kapka (membrana nictitans); ili ljuštenje. To se poduzima zato jer takve lezije uglavnom nisu reverzibilne. Nadalje se preporučuje da se sljedeće lezije očiju upotrebljavaju kao humane krajnje točke za prekid ispitivanja prije isteka planiranog razdoblja promatranja od 21 dana. Te se lezije smatra pretkazateljima teških oštećenja nastalih zbog nadražujućeg ili nagrizajućeg učinka tvari te oštećenja za koje se ne očekuje da će se u cijelosti povući do kraja razdoblja promatranja od 21 dana: vrlo duboke lezije (npr. ulceracija rožnice koja prodire dublje od površinskih slojeva strome), oštećenje limbusa > 50 % (koje dokazuje bljedilo konjunktivalnog tkiva) te teška infekcija oka (gnojni iscjedak). Istodobna pojava vaskularizacije površine rožnice (tj. panusa) te površine obojene fluoresceinom za koju je dnevnim pregledima utvrđeno da se ne smanjuje tijekom vremena i/ili izostanka ponovne epitelizacije pet dana nakon primjene ispitivane kemikalije mogu isto tako, u kombinaciji, biti korisni kriteriji za donošenje kliničke odluke o prijevremenom prekidu ispitivanja. Međutim, navedeni nalazi promatrani zasebno nisu dovoljni da opravdaju prijevremeni prekid ispitivanja. Nakon što se utvrde teški učinci na oči, potrebno je obratiti se veterinaru koji vodi brigu o pokusnim životinjama ili je specijalist za pokusne životinje ili osoblju koje je osposobljeno za prepoznavanje kliničkih lezija kako bi izvršili klinički pregled i utvrdili zahtijeva li kombinacija tih učinaka prijevremeni prekid ispitivanja. Nakon jednog, 24, 48 i 72 sata od primjene ispitivane kemikalije potrebno je odrediti i zabilježiti stupnjeve reakcija oka (očne spojnice, rožnice i šarenice) (tablica 1.). Životinje kod kojih se ne pojave očne lezije mogu se usmrtiti najranije tri dana nakon primjene ispitivane kemikalije. Životinje kod kojih očne lezije nisu teške treba promatrati dok lezije ne nestanu ili 21 dan, nakon čega se ispitivanje prekida. Promatranja treba izvršiti i zabilježiti najmanje nakon jednog, 24, 48 i 72 sata te sedmog, 14. i 21. dana kako bi se utvrdilo stanje lezija i njihova reverzibilnost ili ireverzibilnost. Ako je potrebno, promatranja treba provoditi češće kako bi se utvrdilo treba li pokusne životinje eutanazirati iz humanih razloga ili ih ukloniti iz ispitivanja zbog negativnih rezultata. Stupnjeve reakcija oka (tablica 1.) treba zabilježiti pri svakom pregledu. Isto tako treba zabilježiti sve druge lezije oka (npr. panus, obojenje, promjene prednje komore), kao i sustavne štetne učinke. Pregled reakcija može se olakšati upotrebom binokularne lupe, ručne procjepne svjetiljke, biomikroskopa i drugih prikladnih pomagala. Nakon bilježenja opažanja nakon 24 sata, oči se mogu dodatno pregledati s pomoću fluoroesceina. Stupnjevanje očnih reakcija po svojoj je prirodi subjektivno. Da bi se poboljšala usklađenost u stupnjevanju očnih reakcija te da bi se u tom smislu pomoglo ispitnim laboratorijima i svima koji sudjeluju u promatranjima i tumačenju rezultata, osoblje koje provodi promatranja treba proći odgovarajuću obuku o sustavu ocjenjivanja koji se primjenjuje. PODACI I IZVJEŠĆIVANJE Ocjena rezultata Vrijednosti za nadraženost očiju treba ocijeniti ovisno o vrsti i stupnju lezija te o njihovoj reverzibilnosti ili ireverzibilnosti. Pojedinačne vrijednosti ne predstavljaju apsolutni standard za nadražujuća svojstva kemikalije jer se ocjenjuju i drugi učinci ispitivane kemikalije. Umjesto toga, na pojedinačne vrijednosti treba gledati kao na referentne vrijednosti koje imaju značenje samo ako su potkrijepljene potpunim opisom i ocjenom svih opažanja. Izvješće o ispitivanju Izvješće o ispitivanju trebalo bi sadržavati sljedeće informacije:
Tumačenje rezultata Ekstrapolacija rezultata ispitivanja nadraživanja oka kod laboratorijskih životinja na ljude valjana je samo do određene granice. U mnogim su slučajevima albino kunići osjetljiviji od ljudi na tvari koje nadražuju ili nagrizaju oči. Pri tumačenju podataka treba paziti da se isključi nadraženost uzrokovana sekundarnom infekcijom. LITERATURA
Tablica 1. Stupnjevanje očnih lezija
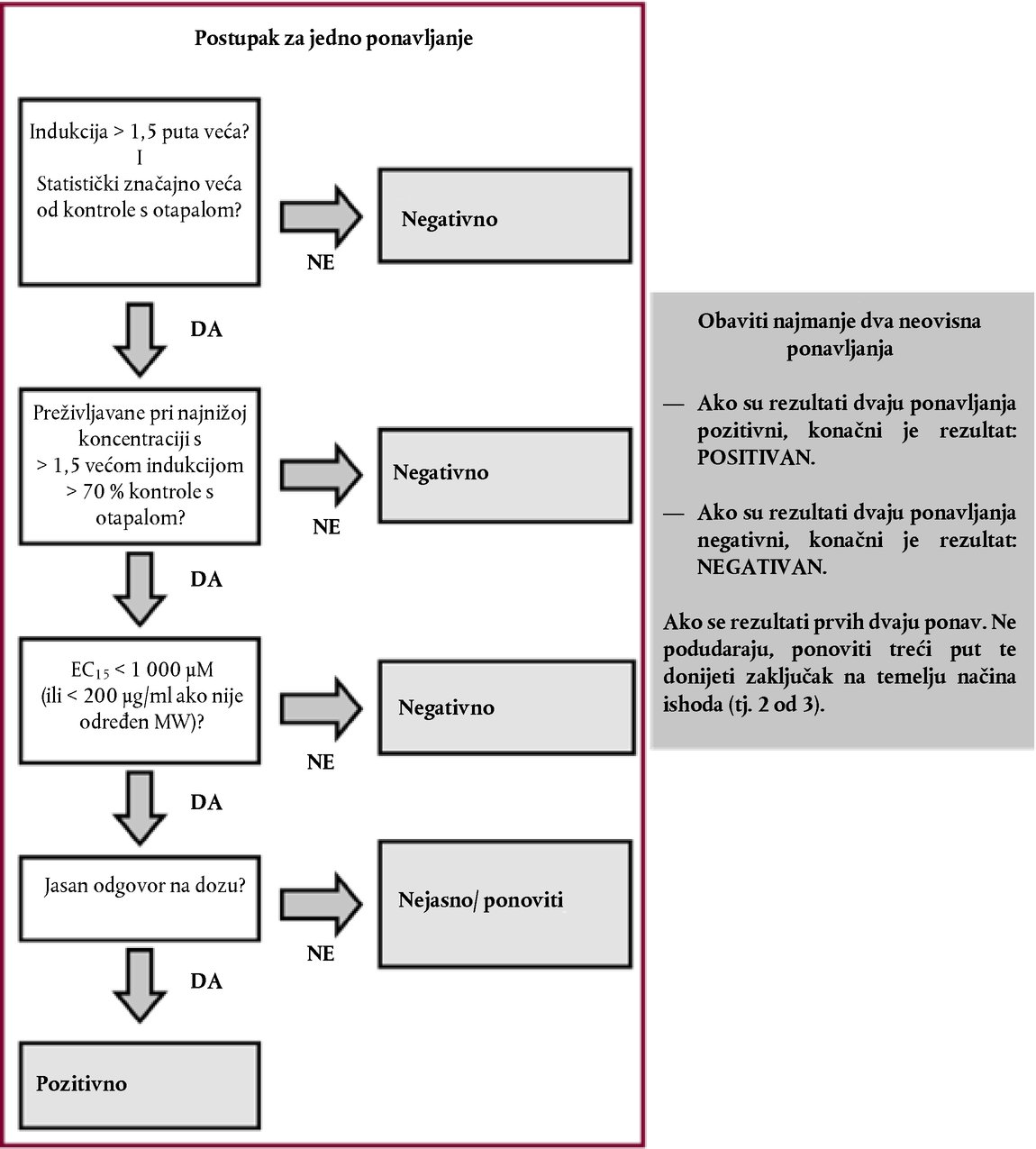
Dodatak DEFINICIJE Kisela/alkalna rezerva : Za pripravke na osnovi kiseline, to je količina (g) natrijeva hidroksida/100 g pripravka potrebna da se dobije određena pH-vrijednost. Za alkalne pripravke, to je količina (g) natrijeva hidroksida koja odgovara količini (g) sumporne kiseline/100 g pripravka potrebnoj da se dobije određena pH-vrijednost (Young et al. 1988.). Kemikalija : tvar ili smjesa. Nenadražujuće tvari : Tvari koje nisu razvrstane kao tvari nadražujuće za oko I., II. ili III. kategorije EPA-e; ili kao tvari nadražujuće za oči 1., 2., 2.A ili 2.B kategorije GHS-a; ili 1.ili 2. kategorije EU-a (17., 18., 19.). Tvar nagrizajuća za oči : (a) Kemikalija koja uzrokuje ireverzibilno oštećenje očnog tkiva; (b) Kemikalije koje su razvrstane kao tvari nadražujuće za oči 1. kategorije GHS-a ili I. kategorije EPA-e ili 1. kategorije EU-a (17., 18., 19.). Tvar nadražujuća za oči : (a) Kemikalija koja dovodi do reverzibilne promjene u oku; (b) Kemikalije koje su razvrstane kao tvari nadražujuće za oči II. ili III. kategorije EPA-e; ili kao tvari nadražujuće za oči 2., 2.A ili 2.B kategorije GHS-a; ili 2. kategorije EU-a (17., 18., 19.). Tvar jako nadražujuća za oči : (a) Kemikalija koja uzrokuje oštećenje očnog tkiva koje nije reverzibilno unutar 21 dana od primjene ili uzrokuje ozbiljno fizičko pogoršanje vida; (b) Kemikalije koje su razvrstane kao tvari nadražujuće za oči 1. kategorije GHS-a ili I. kategorije EPA-e ili 1. kategorije EU-a (17., 18., 19.). Ispitivana kemikalija : Sve tvari ili smjese koje se ispituju ovom ispitnom metodom. Višerazinski pristup : strategija stupnjevitog ispitivanja u kojoj se sve postojeće informacije o ispitivanoj kemikaliji preispituju točno utvrđenim redoslijedom, pri čemu se prije prelaska na sljedeću razinu na svakoj razini primjenjuje postupak ocjenjivanja snage dokaza kako bi se odredilo je li na raspolaganju dovoljno informacija za donošenje odluke o razvrstavanju tvari s obzirom na opasnost. Ako se na temelju postojećih podataka ispitivanoj kemikaliji može pripisati potencijal nadražujućeg djelovanja, daljnje ispitivanje nije potrebno. Ako se na temelju postojećih informacija ispitivanoj kemikaliji ne može pripisati potencijal za nadražujuće djelovanje, provodi se postupak stupnjevitog sekvencijskog ispitivanja na životinjama sve dok se nedvosmisleno ne utvrdi razvrstavanje. Ocjenjivanje snage dokaza (postupak) : Prednosti i mane skupa informacija upotrebljavaju se kao osnova za donošenje zaključka koji možda nije očit iz pojedinačnih podataka. DODATAK ISPITNOJ METODI B.5. (4) STRATEGIJA SEKVENCIJSKOG ISPITIVANJA NADRAŽIVANJA I NAGRIZANJA OKA Opća razmatranja Kako bi se osigurala pouzdanost znanstvenih rezultata i dobrobit životinja, važno je izbjegavati nepotrebnu upotrebu životinja te svesti na najmanju mjeru ispitivanja koja bi mogla uzrokovati teške reakcije kod životinja. Prije donošenja odluke o in vivo ispitivanju potrebno je procijeniti sve informacije o kemikaliji koje se odnose na njezino moguće nadraživanje/nagrizanje oka. Možda već postoji dovoljno dokaza na temelju kojih se ispitivana kemikalija može razvrstati s obzirom na njezin potencijal nagrizanja ili nadraživanja oka, bez potrebe za provođenjem ispitivanja na laboratorijskim životinjama. Prema tome, primjenom analize snage dokaza i strategije sekvencijskog ispitivanja potreba za in vivo ispitivanjima svodi se na minimum, posebno ako postoji vjerojatnost da će kemikalija izazvati teške reakcije. Preporučuje se primijeniti analizu snage dokaza kako bi se ocijenile postojeće informacije o nadražujućem i nagrizajućem djelovanju kemikalija na oko te utvrdilo je li potrebno provesti dodatna istraživanja koja ne uključuju in vivo ispitivanja na oku, a koja bi pomogla u karakterizaciji takvog potencijala. Ako su potrebna dodatna istraživanja, preporučuje se primijeniti strategiju sekvencijskog ispitivanja za dobivanje relevantnih eksperimentalnih podataka. Ako je riječ o tvarima koje nikada nisu bile podvrgnute ispitivanjima, strategiju sekvencijskog ispitivanja trebalo bi primijeniti za dobivanje podataka potrebnih za ocjenjivanje njihova nagrizanja/nadraživanja oka. Prva verzija strategije ispitivanja opisane u ovom Dodatku razvijena je u okviru OECD-ove radionice (1.). Kasnije je potvrđena i proširena u sklopu Usklađenog integriranog sustava za klasifikaciju opasnosti od štetnog djelovanja kemijskih tvari na ljudsko zdravlje i okoliš, koji je odobren na 28. zajedničkom sastanku Odbora za kemikalije i radne skupine za kemikalije, održanom u studenome 1998. (2.), a u 2011. ažurirala ju je radna skupina OECD-a. Iako ova strategija ispitivanja nije sastavni dio ispitne metode B.5., ona odražava preporučeni pristup utvrđivanju nadražujućeg/nagrizajućeg djelovanja tvari na oči. Taj pristup predstavlja najbolju praksu i etičko mjerilo za in vivo ispitivanja nadraživanja/nagrizanja oka. Ova ispitna metoda sadržava smjernice za izvođenje in vivo ispitivanja te sažeti prikaz čimbenika koje je potrebno razmotriti prije započinjanja takvog ispitivanja. Kod strategije sekvencijskog ispitivanja postojeći podaci o nadražujućem/nagrizajućem djelovanju kemikalija na oko ocjenjuju se na temelju analize snage dokaza, a za dobivanje relevantnih podataka o kemikalijama za koje su potrebna dodatna istraživanja ili za koje istraživanja još nisu provedena primjenjuje se višerazinski pristup. Prema toj strategiji prvo se provode validirana i prihvaćena in vitro ili ex vivo ispitivanja, a potom istraživanja prema ispitnoj metodi B.4. u posebnim okolnostima (3., 4.). Opis strategije stupnjevitog ispitivanja Prije provođenja ispitivanja u okviru strategije sekvencijskog ispitivanja (Slika) potrebno je ocijeniti sve raspoložive informacije kako bi se utvrdilo je li in vivo ispitivanje na oku uopće potrebno. Iako se ocjenjivanjem pojedinačnih parametara mogu dobiti važne informacije (npr. ekstremni pH), postojeće je informacije potrebno procijeniti u cijelosti. Kod donošenja odluke na temelju ocjenjivanja snage dokaza treba ocijeniti sve relevantne podatke o djelovanju predmetne kemikalije i njezinih strukturnih analoga te navesti na čemu se odluka temelji. Naglasak prije svega treba staviti na postojeće podatke o djelovanju kemikalije na ljude i životinje, a potom na rezultate in vitro ili ex vivo ispitivanja. Kad god je to moguće, treba izbjegavati in vivo istraživanja nagrizajućih kemikalija. U strategiji ispitivanja razmatraju se sljedeći čimbenici:
STRATEGIJA ISPITIVANJA I OCJENJIVANJA NADRAŽUJUĆEG/NAGRIZAJUĆEG DJELOVANJA NA OČI
LITERATURA
|
|
(3) |
U dijelu B poglavlje B.10. zamjenjuje se sljedećim: „B.10. In vitro ispitivanje kromosomskih aberacija kod sisavaca UVOD Ova ispitna metoda odgovara Smjernici OECD-a za ispitivanje 473 (2016.). Dio je serije metoda za ispitivanje genetske toksikologije. Razvijen je i dokument OECD-a u kojemu se daju sažete informacije o ispitivanju u području genetske toksikologije te pregled novijih promjena tih smjernica za ispitivanje (1). Svrha in vitro ispitivanja kromosomskih aberacija jest utvrđivanje kemikalija koje uzrokuju strukturne kromosomske aberacije u uzgojenim stanicama sisavaca (2., 3. i 4.). Razlikujemo dva tipa strukturnih kromosomskih aberacija, kromosomski i kromatidni. Tijekom in vitro analiza kromosomskih aberacija može doći do pojave poliploidije (uključujući endoreduplikaciju). Iako aneugeni mogu izazvati poliploidiju, sama poliploidija nije pokazatelj aneugenog potencijala, već može jednostavno biti pokazatelj poremećaja staničnog ciklusa ili citotoksičnosti (5.). Ovo ispitivanje nije namijenjeno mjerenju aneuploidije. In vitro mikronukleus-test (6.) preporučuje se za otkrivanje aneuploidije. U in vitro ispitivanju kromosomskih aberacija mogu se upotrebljavati kulture uspostavljenih staničnih linija ili primarne stanične kulture ljudskog podrijetla ili dobivene od glodavaca. Stanice za uporabu trebalo bi odabrati na temelju sposobnosti rasta u kulturi, stabilnosti kariotipa (uključujući broj kromosoma) i spontane učestalosti kromosomskih aberacija (7.). Podacima koji su dostupni u ovom trenutku ne omogućuje se davanje čvrstih preporuka, ali oni upućuju na to da je pri ocjenjivanju kemijskih opasnosti važno uzeti u obzir status proteina p53, genetsku (kariotipsku) stabilnost, sposobnost popravka DNK i podrijetlo stanica odabranih za ispitivanje (potječu li od sisavaca ili od ljudi). Stoga se korisnike ove ispitne metode potiče na to da u obzir uzmu utjecaj tih i drugih svojstava stanica na rezultate stanične linije u otkrivanju nastanka kromosomskih aberacija s razvojem znanja u tom području. Upotrijebljene definicije navedene su u Dodatku 1. POČETNA RAZMATRANJA I OGRANIČENJA Ispitivanja koja se obavljaju in vitro općenito zahtijevaju uporabu egzogenih izvora metaboličke aktivacije osim ako stanice imaju metaboličko djelovanje u odnosu na ispitivane kemikalije. Egzogenim sustavom metaboličke aktivacije ne oponašaju se u cijelosti in vivo uvjeti. Trebalo bi voditi računa o tome da se izbjegnu uvjeti koji bi mogli dovesti do lažnih pozitivnih rezultata, odnosno do oštećenja kromosoma koje nije uzrokovano izravnom interakcijom između ispitivanih kemikalija i kromosoma; takvi uvjeti uključuju promjene pH vrijednosti ili osmolalnosti (8., 9. i 10.), interakciju s komponentama podloge (11. i 12.) ili prekomjerne razine citotoksičnosti (13., 14., 15. i 16.). Ovo ispitivanje primjenjuje se za otkrivanje kromosomskih aberacija koje mogu nastati kao posljedica klastogenih događaja. Analizu nastanka kromosomskih aberacija trebalo bi provesti koristeći se stanicama u metafazi. Stoga je bitno da stanice dosegnu mitozu u tretiranim i netretiranim kulturama. U slučaju proizvedenih nanomaterijala mogu biti potrebne posebne prilagodbe ove ispitne metode, ali one nisu opisane u ovoj ispitnoj metodi. Prije nego što se ova ispitna metoda primijeni na smjesi radi dobivanja podataka za predviđenu regulatornu svrhu, potrebno je razmotriti mogu li se njome dobiti primjereni rezultati za tu svrhu te ako mogu, zašto. Takva razmatranja nisu potrebna ako postoji regulatorni zahtjev za ispitivanje smjese. NAČELO ISPITIVANJA Stanične kulture ljudskog podrijetla ili dobivene od drugih sisavaca izlažu se ispitivanoj kemikaliji s egzogenim izvorom metaboličke aktivacije i bez njega, osim ako se upotrebljavaju stanice s odgovarajućim metaboličkim djelovanjem (vidjeti stavak 13.). U prikladnim, unaprijed određenim intervalima nakon početka izlaganja staničnih kultura ispitivanoj kemikaliji stanične kulture tretiraju se kemikalijom za zaustavljanje metafaze (npr. kolcemidom ili kolhicinom), izdvajaju se stanice, boje se te se mikroskopskom analizom metafaznih stanica utvrđuje prisutnost aberacija kromatidnog i kromosomskog tipa. OPIS METODE Preparati Stanice Mogu se primjenjivati različite stanične linije (npr. jajnik kineskog hrčka(CHO), pluća kineskog hrčka V79, pluća kineskog hrčka (CHL)/IU, TK6) ili primarne stanične kulture, uključujući limfocite periferne krvi čovjeka ili drugih sisavaca (7.). Odabir upotrijebljenih staničnih linija trebalo bi znanstveno opravdati. Kada se primjenjuju primarne stanice, radi dobrobiti životinja trebalo bi, ako je to izvedivo, razmotriti uporabu primarnih stanica ljudskog podrijetla, a uzorke bi trebalo uzeti u skladu s ljudskim etičkim načelima i propisima. Ljudske limfocite periferne krvi trebalo bi uzeti od mladih (približna dob od 18 do 35 godina) nepušača koji prema raspoloživim informacijama ne boluju ni od kakvih bolesti i nisu nedavno bili izloženi genotoksičnim agensima (npr. kemikalijama, ionizirajućem zračenju) pri razinama koje uzrokuju povećanje osnovne pojavnosti kromosomskih aberacija. Time bi se osigurala niska i dosljedna osnovna pojavnost kromosomskih aberacija. Osnovna pojavnost kromosomskih aberacija povećava se s dobi, pri čemu je taj trend izraženiji kod ženki nego kod mužjaka (17. i 18.). Ako su za uporabu objedinjene stanice više od jednog donora, trebalo bi navesti broj donora. Potrebno je dokazati da je u razdoblju od početka tretiranja ispitivanom kemikalijom do uzorkovanja stanica došlo do diobe stanica. Stanične kulture održavaju se u fazi eksponencijalnog rasta stanica (stanične linije) ili se stimuliraju na diobu (primarne kulture limfocita) kako bi se osigurala izloženost stanica u različitim stadijima staničnog ciklusa jer možda nije poznata osjetljivost stadija stanice na ispitivanu kemikaliju. Primarne stanice koje je potrebno mitogenima potaknuti na diobu obično nisu više sinkronizirane tijekom izloženosti ispitivanoj kemikaliji (npr. ljudski limfociti nakon mitogenske stimulacije u trajanju od 48 sati). Uporaba sinkroniziranih stanica tijekom tretiranja nije preporučljiva, ali može biti prihvatljiva, ako je opravdana. Uvjeti koje moraju zadovoljavati podloge i kulture Za održavanje kultura trebalo bi primjenjivati prikladne uvjete za hranjive podloge za uzgoj kultura i uvjete inkubacije (posude za kulture, prema potrebi vlažne atmosferske uvjete od 5 % CO2, temperaturu inkubacije od 37 °C). Rutinski bi trebalo provjeravati stabilnost modalnog broj kromosoma staničnih linija te odsutnost mikoplazmatske kontaminacije (7. i 19.), a stanice ne bi trebalo upotrebljavati ako su kontaminirane ili ako je promijenjen modalni broj kromosoma. Trebalo bi utvrditi uobičajeno trajanje staničnog ciklusa staničnih linija ili primarnih kultura upotrijebljenih u ispitnom laboratoriju i ono bi trebalo biti usklađeno s objavljenim svojstvima stanica (20). Priprema kultura Stanične linije: stanice se razmnožavaju iz matičnih kultura te se nasađuju na hranjivu podlogu za uzgoj kulture takvom gustoćom da stanice u suspenziji ili jednoslojnoj kulturi nastave eksponencijalno rasti do trenutka izdvajanja (npr. treba izbjegavati konfluenciju kod stanica koje rastu kao jednoslojna kultura). Limfociti: cjelokupna krv tretirana antikoagulansom (npr. heparinom) ili izdvojeni limfociti uzgajaju se (npr. 48 sati za ljudske limfocite) u prisutnosti mitogena (npr. fitohemaglutinina (PHA) za ljudske limfocite) kako bi se izazvala dioba stanica prije izlaganja ispitivanoj kemikaliji. Metabolička aktivacija Kod uporabe stanica s neodgovarajućom endogenom sposobnošću metabolizma trebalo bi upotrebljavati egzogene sustave metaboličkog djelovanja. Sustav koji se najčešće upotrebljava i automatski preporučuje, osim ako je drukčije opravdano, jest postmitohondrijska frakcija s dodanim kofaktorom (S9), pripravljena iz jetra glodavaca (općenito štakora), koja je bila tretirana sredstvima za enzimsku indukciju, kao što je Aroclor 1254 (21., 22. i 23.), ili mješavinom fenobarbitona i β-naftoflavona (24., 25., 26., 27., 28. i 29.). Potonja smjesa nije u suprotnosti sa Stockholmskom konvencijom o postojanim organskim onečišćujućim tvarima (30.) i dokazano je da je za nastanak oksidaza s miješanom funkcijom jednako učinkovita kao Aroclor 1254 (24., 25., 26. i 28.). Frakcija S9 obično se upotrebljava u koncentracijama u rasponu od 1 do 2 % (v/v), ali može se povećati na 10 % (v/v) u konačnom ispitnom mediju. Tijekom tretiranja trebalo bi izbjegavati uporabu proizvoda kojima se smanjuje mitotski indeks, posebno proizvoda s kompleksom kalcija (31.). Na odabir vrste i koncentracije upotrijebljenog egzogenog sustava metaboličke aktivacije ili metaboličkog pokretača može utjecati kategorija kemikalija koje se ispituju. Priprema ispitivane kemikalije Prije tretiranja stanica krute ispitivane kemikalije trebalo bi pripremiti u prikladnim otapalima i prema potrebi razrijediti (vidjeti stavak 23.). Tekuće ispitivane kemikalije mogu se dodati izravno u ispitni sustav i/ili razrijediti prije tretiranja ispitnog sustava. Plinovite ili hlapive ispitivane kemikalije trebalo bi ispitivati nakon što se prikladno izmijene standardni protokoli, kao što je tretiranje u hermetički zatvorenim posudama za kulture (32., 33. i 34.). Ispitivanu kemikaliju potrebno je pripremiti neposredno prije tretiranja, osim ako je prema podacima o stabilnosti prihvatljivo skladištenje. Ispitni uvjeti Otapala Otapalo bi trebalo odabrati tako da se optimizira topljivost ispitivanih kemikalija bez negativnih učinaka na provedbu testa, kao što su npr. promjena rasta stanica, učinak na integritet ispitivane kemikalije, reagiranje s posudama za kulture ili oštećenje sustava metaboličke aktivacije. Preporučuje se da se, kada god je to moguće, prvo uzme u obzir upotreba vodenog otapala (ili hranjive podloge za uzgoj kulture). Dobro provjerena su otapala, na primjer, voda ili dimetil sulfoksid. Općenito, organska otapala ne bi trebala prelaziti 1 % (v/v), dok vodena otapala (fiziološka otopina ili voda) ne bi trebala prelaziti 10 % (v/v) u konačnom mediju za tretiranje. Ako se upotrebljavaju otapala koja nisu dobro provjerena (npr. etanol ili aceton), njihovu uporabu trebalo bi poduprijeti podacima u kojima su navedeni njihova kompatibilnost s ispitivanim kemikalijama, sustav ispitivanja i izostanak genetske toksičnosti u koncentraciji koja se upotrebljava. Ako ne postoje takvi popratni podaci, važno je uključiti netretirane kulture (vidjeti Dodatak 1.) kako bi se dokazalo da odabrano otapalo nema štetne ili klastogene učinke. Mjerenje proliferacije stanica i citotoksičnosti te odabir ispitnih koncentracija Pri utvrđivanju najviše koncentracije ispitivane kemikalije trebalo bi izbjegavati koncentracije koje imaju sposobnost izazivanja lažnih pozitivnih odgovora, kao što su koncentracije koje izazivaju prekomjernu citotoksičnost (vidjeti stavak 22.), taloženje u hranjivoj podlozi za uzgoj kulture (vidjeti stavak 23.) i značajne promjene pH vrijednosti ili osmolalnosti (vidjeti stavak 5.). Ako ispitivana kemikalija u trenutku dodavanja uzrokuje značajnu promjenu pH-vrijednosti hranjive podloge, pH-vrijednost može se prilagoditi puferiranjem konačnog medija za tretiranje kako bi se izbjegli lažno pozitivni rezultati te održali primjereni uvjeti uzgoja kulture. Proliferacija stanica mjeri se kako bi se osiguralo da je u dovoljnom broju tretiranih stanica tijekom ispitivanja došlo do mitoze i da se stanice tretiraju pri prikladnim razinama citotoksičnosti (vidjeti stavke 18. i 22.). Citotoksičnost bi trebalo utvrditi s metaboličkom aktivacijom i bez nje u glavnom pokusu uz uporabu prikladnih pokazatelja smrti i rasta stanica. Iako ocjena citotoksičnosti u početnom ispitivanju može biti korisna za bolje određivanje koncentracija koje će se upotrebljavati u glavnom pokusu, početno ispitivanje nije obvezno. Ako se provede, njime se ne bi trebalo zamijeniti mjerenje citotoksičnosti u glavnom pokusu. Relativno udvostručenje populacije (RPD) ili relativno povećanje broja stanica (RICC) prikladne su metode za ocjenu citotoksičnosti u citogenetskim ispitivanjima (13., 15., 35., 36. i 55.) (formule vidjeti u Dodatku 2.). U slučaju dugotrajnih tretiranja i vremena uzorkovanja koja od početka tretiranja traju dulje od 1,5 uobičajenog staničnog ciklusa (npr. dulje od tri stanična ciklusa ukupno), u okviru RPD-a citotoksičnost može biti podcijenjena (37.). U tim okolnostima RICC može biti bolja mjera ili bi ocjena citotoksičnosti nakon 1,5 uobičajenog staničnog ciklusa bila korisna procjena uz primjenu RPD-a. Iako je za limfocite u primarnim kulturama mitotski indeks mjerilo citotoksičnih/citostatskih učinaka, na njega utječu vrijeme u koje je izmjeren nakon tretiranja, upotrijebljeni mitogen i mogući poremećaj staničnog ciklusa. Međutim, mitotski je indeks prihvatljiv jer druga mjerenja citotoksičnosti mogu biti komplicirana i nepraktična i ne mogu se primjenjivati na ciljanu populaciju limfocita koji rastu kao odgovor na stimulaciju fitohemaglutininom (PHA). Iako su RICC i RPD za stanične linije i mitotski indeks za primarne kulture limfocita preporučeni parametri citotoksičnosti, drugim pokazateljima (kao što su npr. integritet stanica, apoptoza, nekroza, stanični ciklus) mogu se pružiti korisne dodatne informacije. Potrebno je ocijeniti najmanje tri ispitne koncentracije (ne uključujući kontrolu s otapalom i pozitivnu kontrolu) koje ispunjuju kriterije prihvatljivosti (odgovarajuća citotoksičnost, broj stanica itd.). Neovisno o vrsti stanica (stanične linije ili primarne kulture limfocita), za svaku se ispitivanu koncentraciju može upotrijebiti samo jedna tretirana kultura ili više njezinih ponovljenih uzoraka. Iako se preporučuje upotreba dviju identičnih kultura, prihvatljiva je i upotreba jedne kulture pod uvjetom da se pregleda jednak ukupni broj stanica neovisno o tome je li riječ o jednoj kulturi ili dvjema identičnim kulturama. Uporaba jedne kulture posebno je relevantna ako se ocjenjuje više od tri koncentracije (vidjeti stavak 31.). Rezultati dobiveni iz više neovisnih ponovljenih kultura pri određenoj koncentraciji mogu se objediniti radi analize podataka (38.). Za ispitivane kemikalije za koje je dokazana mala citotoksičnost ili nepostojanje citotoksičnosti uobičajeno će biti prikladne koncentracije u dva do tri intervala. U slučaju pojave citotoksičnosti, odabranim ispitnim koncentracijama trebao bi biti obuhvaćen raspon od koncentracije pri kojoj se pojavljuje citotoksičnost kako je opisano u stavku 22. do koncentracija pri kojima je citotoksičnost umjerena, niska ili nepostojeća. Mnoge ispitivane kemikalije imaju oštre krivulje odgovora na koncentraciju te će za dobivanje podataka pri niskoj ili umjerenoj citotoksičnosti ili za detaljno istraživanje odnosa između doze i odgovora biti potrebno upotrijebiti bliže raspoređene koncentracije i/ili više od tri koncentracije (za jednu ili ponovljene kulture), posebno u situacijama u kojima je potrebno ponavljanje pokusa (vidjeti stavak 47.). Ako se maksimalna koncentracija temelji na citotoksičnosti, najvišom koncentracijom trebalo bi nastojati ostvariti citotoksičnost od 55 ± 5 % uz primjenu preporučenih parametara citotoksičnosti (odnosno smanjenja RICC-a i RPD-a za stanične linije i smanjenja mitotskog indeksa za primarne kulture limfocita na 45 ± 5 % istodobne negativne kontrole). Trebalo bi voditi računa o tumačenju pozitivnih rezultata koji se mogu utvrditi samo u gornjem dijelu tog raspona citotoksičnosti od 55 ± 5 % (13.). Za slabo topljive ispitivane kemikalije koje nisu citotoksične pri koncentracijama nižima od najniže koncentracije pri kojoj kemikalija nije topljiva, najviša bi analizirana koncentracija trebala dovesti do zamućenja ili taloga vidljivog golim okom ili inverznim mikroskopom na kraju tretiranja ispitivanom kemikalijom. Čak i ako se citotoksičnost pojavi iznad najniže netopljive koncentracije, preporučuje se ispitivanje pri samo jednoj koncentraciji koja dovodi do zamućenja ili s vidljivim talogom jer lažni učinci mogu biti posljedica taloga. Pri koncentraciji zbog koje nastaje talog potrebno je osigurati da taj talog ne utječe na izvođenje testa (npr. bojenje ili brojenje). Može biti korisno odrediti topljivost u hranjivoj podlozi za uzgoj kulture prije izvođenja pokusa. Ako nisu zapaženi talog ili ograničavajuća citotoksičnost, najviša ispitna koncentracija trebala bi odgovarati najnižoj od sljedećih vrijednosti: 10 mM, 2 mg/ml ili 2 μl/ml (39., 40. i 41.). Ako nije utvrđen sastav ispitivane kemikalije, npr. ako je ona tvar nepoznatog ili promjenjivog sastava, složeni reakcijski proizvod ili biološki materijal (UVCB) (42.), uzorak iz okoliša itd., najviša koncentracija možda će morati biti viša (npr. 5 mg/ml) u slučaju izostanka dostatne citotoksičnosti kako bi se povećala koncentracija svake komponente. Međutim, trebalo bi napomenuti da ti zahtjevi mogu biti drukčiji za farmaceutske proizvode namijenjene ljudima (43.). Kontrole Kod svakog izdvajanja stanica trebalo bi uključiti istodobne negativne kontrole (vidjeti stavak 15.) koje se sastoje samo od otapala u hranjivoj podlozi i koje su tretirane jednako kao i kulture. Istodobne pozitivne kontrole potrebne su za dokazivanje sposobnosti laboratorija za određivanje klastogena u uvjetima upotrijebljenog protokola ispitivanja i učinkovitosti egzogenog sustava metaboličke aktivacije ako je to primjenjivo. Primjeri pozitivnih kontrola navedeni su u tablici 1. u nastavku. Ako je to opravdano, mogu se upotrebljavati alternativne kemikalije pozitivne kontrole. Budući da su in vitro ispitivanja stanica sisavaca na genetsku toksičnost u dovoljnoj mjeri standardizirana, uporaba pozitivnih kontrola može biti ograničena na klastogen koji zahtijeva metaboličku aktivaciju. Pod uvjetom da se provodi paralelno s neaktiviranim ispitivanjem uz primjenu jednakog trajanja tretiranja, jednim odgovorom pozitivne kontrole dokazat će se aktivnost sustava metaboličke aktivacije i osjetljivost sustava ispitivanja. Međutim, dugotrajno tretiranje (bez S9) trebalo bi imati svoju pozitivnu kontrolu jer će se trajanje tretiranja razlikovati od ispitivanja u kojem se primjenjuje metabolička aktivacija. Svaku pozitivnu kontrolu trebalo bi primijeniti pri jednoj ili više koncentracija za koje se očekuje da će dovesti do ponovljivih i zamjetnih povećanja u odnosu na pozadinu kako bi se dokazala osjetljivost ispitnog sustava (tj. učinci su jasni, ali identitet kodiranih predmetnih stakalaca nije odmah očit osobi koja očitava rezultate), a odgovor ne bi trebalo dovesti u pitanje citotoksičnošću koja prelazi granične vrijednosti utvrđene u ispitnoj metodi. Tablica 1. Referentne kemikalije preporučene za ocjenu osposobljenosti laboratorija i za odabir pozitivnih kontrola.
POSTUPAK Tretiranje ispitivanom kemikalijom Stanice koje se razmnožavaju tretiraju se ispitivanom kemikalijom uz prisutnost i odsutnost sustava metaboličke aktivacije. Vrijeme izdvajanja stanica iz kulture Za temeljito ocjenjivanje, koje će biti potrebno za donošenje zaključka o negativnom ishodu, trebalo bi provesti sva tri sljedeća pokusna uvjeta uz primjenu kratkotrajnog tretiranja s metaboličkom aktivacijom i bez nje i dugotrajnog tretiranja bez metaboličke aktivacije (vidjeti stavke 43., 44. i 45.).
Ako bilo koji od gore navedenih pokusnih uvjeta dovede to pozitivnog odgovora, možda neće biti potrebno istražiti ni jedan drugi postupak tretiranja. Priprema kromosoma Stanične kulture tretiraju se kolcemidom ili kolhicinom obično jedan sat do tri sata prije izdvajanja stanica. Stanice za pripremu kromosoma izdvajaju se i obrađuju iz svake stanične kulture zasebno. Priprema kromosoma uključuje hipotoničko tretiranje stanica, fiksiranje i bojenje. U slučaju jednog sloja, na kraju tretiranja u trajanju od tri sata do šest sati mogu biti prisutne mitotske stanice (prepoznatljive kao okrugle stanice koje se odvajaju od površine). Budući da se te mitotske stanice lako odvajaju, mogu se izgubiti pri odstranjivanju podloge s ispitivanom kemikalijom. Ako postoji dokaz o znatnom povećanju broja mitotskih stanica u odnosu na kontrole, čime se ukazuje na vjerojatno zaustavljanje mitoze, te stanice trebalo bi prikupiti centrifugiranjem i ponovno dodati kulturama kako bi se u trenutku izdvajanja stanica izbjegao gubitak stanica koje se nalaze u fazi mitoze i koje su u opasnosti od kromosomskih aberacija. Analiza Sva predmetna stakalca, uključujući i stakalca pozitivnih i negativnih kontrola, trebalo bi prije mikroskopske analize radi utvrđivanja kromosomskih aberacija nezavisno kodirati. Budući da postupak fiksiranja često za posljedicu ima određeni udio metafaznih stanica koje su izgubile kromosome, stanice koje se pregledavaju trebale bi stoga sadržavati broj centromera jednak modalnom broju +/– 2. Za svaku koncentraciju i kontrolu trebalo bi pregledati najmanje 300 dobro vidljivih metafaza kako bi se zaključilo da je ispitivana kemikalija jasno negativna (vidjeti stavak 45.). Ako se upotrebljavaju ponovljene kulture, 300 stanica trebalo bi jednakomjerno raspodijeliti među ponovljenim kulturama. Ako se upotrebljava jedna kultura po koncentraciji (vidjeti stavak 21.), trebalo bi pregledati najmanje 300 dobro vidljivih metafaza u toj jednoj kulturi. Prednost vrednovanja 300 stanica jest povećanje statističke snage ispitivanja; osim toga, rijetko se zapažaju nulte vrijednosti (očekuje se da će iznositi samo 5 %) (44.). Broj metafaza koje se pregledavaju može se smanjiti ako se opazi veliki broj stanica s kromosomskim aberacijama i ako se ispitivana kemikalija smatra jasno pozitivnom. Trebalo bi pregledati stanice sa strukturnim kromosomskim aberacijama uključujući i isključujući kromosomske prekide. Lomovi i prekidi definirani su u Dodatku 1. u skladu s (45. i 46.). Aberacije kromatidnog i kromosomskog tipa trebalo bi bilježiti odvojeno i klasificirati prema podtipovima (lomovi, zamjene). U postupcima koji se primjenjuju u laboratoriju trebalo bi osigurati da analizu kromosomskih aberacija provode dobro osposobljeni analitičari te da je, prema potrebi, pregledaju stručnjaci. Iako je svrha ovog ispitivanja otkrivanje strukturnih kromosomskih aberacija, važno je zabilježiti učestalost poliploidije i endoreduplikacije u slučaju da se opaze te pojave. (Vidjeti stavak 2.) Osposobljenost laboratorija Kako bi se utvrdilo dostatno iskustvo u ispitivanju prije njegove uporabe za rutinsko ispitivanje, laboratorij bi trebao provesti niz pokusa s referentnim pozitivnim kemikalijama uz primjenu različitih mehanizama i različitih negativnih kontrola (uključujući uporabu različitih otapala/nosača). Odgovori pozitivnih i negativnih kontrola trebali bi biti u skladu s literaturom. To se ne odnosi na laboratorije s iskustvom, odnosno laboratorije s bazom prijašnjih podataka koja je stavljena na raspolaganje u skladu s definicijom iz stavka 37. Odabir kemikalija pozitivnih kontrola (vidjeti tablicu 1. iz stavka 26.) trebalo bi istražiti primjenom kratkotrajnih i dugotrajnih tretiranja bez metaboličke aktivacije, kao i primjenom kratkotrajnog tretiranja s metaboličkom aktivacijom kako bi se dokazala osposobljenost za otkrivanje klastogenih kemikalija i utvrdila učinkovitost sustava metaboličke aktivacije. Potrebno je izabrati raspon koncentracija odabranih kemikalija pri kojima će doći do ponovljivih povećanja u odnosu na pozadinske vrijednosti, koja su povezana s koncentracijom, kako bi se dokazala osjetljivost i dinamički raspon ispitnog sustava. Podaci o prijašnjim kontrolama Laboratorij bi trebao utvrditi:
Pri prvom prikupljanju podataka za distribuciju prijašnjih negativnih kontrola istodobne negativne kontrole trebale bi biti u skladu s objavljenim podacima o kontrolama, ako oni postoje. Nakon što se distribuciji kontrola doda još podataka o pokusima, istodobne negativne kontrole trebale bi u idealnim okolnostima biti unutar kontrolnih granica od 95 % te distribucije (44. i 47.). Baza podataka o prijašnjim negativnim kontrolama laboratorija trebala bi u početku obuhvaćati najmanje deset pokusa, međutim bilo bi poželjno da se sastoji od najmanje 20 pokusa provedenih u usporedivim pokusnim uvjetima. Laboratoriji bi trebali primjenjivati metode za kontrolu kvalitete, kao što su kontrolni dijagrami (npr. C-dijagrami ili X-stupčasti dijagrami 48.), kako bi utvrdili koliko su promjenjivi njihovi podaci o pozitivnim i negativnim kontrolama i dokazali da je u njihovom laboratoriju metodologija ‚pod kontrolom’ (44.). Daljnje preporuke o tome kako uspostaviti i upotrebljavati ranije podatke (npr. kriterije za uključivanje podataka u ranije podatke i za isključivanje iz njih i kriterije prihvatljivosti za određeni pokus) nalaze se u literaturi (47.). Svaku izmjenu pokusnog protokola trebalo bi razmotriti s obzirom na to je li u skladu s postojećim bazama podataka laboratorija o prijašnjim kontrolama. Svaka veća nesukladnost trebala bi dovesti do uspostave nove baze podataka o prijašnjim kontrolama. Podaci o negativnim kontrolama trebali bi se sastojati od podataka o pojavnosti stanica s kromosomskim aberacijama iz jedne kulture ili zbroja ponovljenih kultura kako je opisano u stavku 21. Istodobne negativne kontrole trebale bi u idealnim okolnostima biti unutar kontrolnih granica od 95 % za distribuciju baze podataka laboratorija o prijašnjim negativnim kontrolama (44. i 47.). Ako su podaci o istodobnim negativnim kontrolama izvan kontrolnih granica od 95 %, njihovo je uključivanje u distribuciju prijašnjih kontrola prihvatljivo sve dok ti podaci nisu ekstremne netipične vrijednosti i ako postoje dokazi o tome da je sustav ispitivanja ‚pod kontrolom’ (vidjeti stavak 37.) i dokazi o nepostojanju tehničke ili ljudske pogreške. PODACI I IZVJEŠĆIVANJE Predstavljanje rezultata Trebalo bi ocijeniti postotak stanica sa strukturnim kromosomskim aberacijama. Aberacije kromatidnog i kromosomskog tipa, klasificirane prema podtipovima (lomovi, zamjene), trebalo bi navesti odvojeno s njihovim brojem i učestalošću za pokusne i kontrolne kulture. Kromosomski prekidi bilježe se i navode u izvješću odvojeno, ali se ne uključuju u ukupnu učestalost aberacija. Postotak poliploidnih i/ili endoredupliciranih stanica bilježi se ako su zapažene takve stanice. Trebalo bi zabilježiti i rezultate istodobnog mjerenja citotoksičnosti za sve tretirane, negativne i pozitivne kontrolne kulture u glavnim pokusima za dokazivanje aberacija. Potrebno je navesti podatke o pojedinačnim kulturama. Osim toga, sve je podatke potrebno sažeto prikazati u obliku tablice. Kriteriji prihvatljivosti Prihvatljivost ispitivanja temelji se na sljedećim kriterijima:
Ocjenjivanje i tumačenje rezultata Pod uvjetom da su ispunjeni svi kriteriji prihvatljivosti, ispitivana kemikalija smatra se jasno pozitivnom ako je u bilo kojem od ispitanih pokusnih uvjeta (vidjeti stavak 28.):
Kada su ispunjeni svi ti uvjeti, smatra se da ispitivana kemikalija može izazvati kromosomske aberacije u uzgojenim stanicama sisavaca u tom sustavu ispitivanja. Preporuke za najprikladnije statističke metode nalaze se u literaturi (49., 50. i 51.). Pod uvjetom da su ispunjeni svi kriteriji prihvatljivosti, ispitivana kemikalija smatra se jasno negativnom ako u svim ispitanim pokusnim uvjetima (vidjeti stavak 28.):
Tada se smatra da ispitivana kemikalija ne može izazvati kromosomske aberacije u uzgojenim stanicama sisavaca u tom sustavu ispitivanja. Jasan pozitivan ili negativan odgovor nije potrebno provjeravati. Ako odgovor nije ni jasno pozitivan ni jasno negativan kako je opisano gore ili kako bi se pridonijelo utvrđivanju biološke relevantnosti rezultata, podatke bi trebalo ocjenjivati na temelju stručne prosudbe i/ili daljnjih istraživanja. Vrednovanje dodatnih stanica (ako je to prikladno) ili ponavljanje pokusa uz moguću primjenu izmijenjenih pokusnih uvjeta (npr. rasporeda koncentracija, ostalih uvjeta metaboličke aktivacije (npr. S9 koncentracije ili S9 podrijetla)) mogu biti korisni. U rijetkim slučajevima, čak i nakon daljnjih istraživanja, neće biti moguće na temelju dobivenih podataka donijeti zaključak o pozitivnim ili negativnim rezultatima, te će se stoga zaključiti da je odgovor na ispitivanu kemikaliju dvosmislen. Povećanje broja poliploidnih stanica može značiti da ispitivana kemikalija može inhibirati mitotske procese i izazvati numeričke kromosomske aberacije (52.). Povećanje broja stanica s endoredupliciranim kromosomima može značiti da ispitivana kemikalije može inhibirati progresiju staničnog ciklusa (53. i 54.) (vidjeti stavak 2.). Stoga bi pojavnost poliploidnih stanica i stanica s endoredupliciranim kromosomima trebalo bilježiti odvojeno. Izvješće o ispitivanju Izvješće o ispitivanju trebalo bi sadržavati sljedeće informacije:
LITERATURA
Dodatak 1. DEFINICIJE Aneuploidija : svako odstupanje od uobičajenog diploidnog (ili haploidnog) broja kromosoma za jedan kromosom ili više njih, ali ne u cijeloj skupini ili skupinama kromosoma (poliploidija). Apoptoza : programirana smrt stanice koju obilježava niz koraka koji vode do razgradnje stanica u čestice vezane na membranu koje se potom eliminiraju fagocitozom ili rasipanjem. Proliferacija stanica : povećanje broja stanica kao posljedica mitotske diobe stanice. Kemikalija : tvar ili smjesa. Kromatidni lom : prestanak pojedinačne kromatide u kojoj postoji jasan otklon jedne od kromatida. Kromatidni prekid : neobojeno područje (akromatska lezija) jedne kromatide u kojoj postoji minimalan otklon kromatide. Aberacija kromatidnog tipa : strukturno oštećenje kromosoma izraženo kao lom pojedinačnih kromatida ili lom i ponovno spajanje kromatida. Aberacija kromosomskog tipa : strukturno oštećenje kromosoma izraženo kao lom ili lom i ponovno spajanje obiju kromatida na istom mjestu. Klastogen : svaka kemikalija koja uzrokuje strukturne kromosomske aberacije u populacijama stanica ili eukariotskih organizama. Koncentracije : odnosi se na konačne koncentracije ispitivane kemikalije u hranjivoj podlozi za uzgoj kultura. Citotoksičnost : za testove obuhvaćene ovom ispitnom metodom u kojima se upotrebljavaju stanične linije citotoksičnost je utvrđena kao smanjenje relativnog udvostručenja populacije (RPD) ili relativnog povećanja broja stanica (RICC) tretiranih stanica u odnosu na negativnu kontrolu (vidjeti stavak 17. i Dodatak 2.). Za testove obuhvaćene ovom ispitnom metodom u kojima se upotrebljavaju primarne kulture limfocita citotoksičnost je utvrđena kao smanjenje mitotskog indeksa tretiranih stanica u odnosu na negativnu kontrolu (vidjeti stavak 18. i Dodatak 2.). Endoreduplikacija : proces kod kojeg nakon S-faze replikacije DNK ne slijedi mitoza jezgre, nego započinje druga S-faza. Rezultat su kromosomi s 4, 8, 16... kromatida. Genotoksičnost : opći izraz kojim su obuhvaćene sve vrste oštećenja DNK ili kromosoma uključujući lomove, brisanja, adukte, modifikacije i povezivanje nukleotida, premještanja, genske mutacije, aberacije kromosoma i aneuploidiju. Ne dovode sve vrste genotoksičnih učinaka do mutacija ili trajnog oštećenja kromosoma. Mitotski indeks : omjer stanica u metafazi podijeljen s ukupnim brojem stanica zapaženih u populaciji stanica; pokazatelj stupnja proliferacije te populacije. Mitoza : dioba stanične jezgre koja je obično podijeljena na profazu, prometafazu, metafazu, anafazu i telofazu. Mutagen : uzrokuje nasljednu promjenu slijeda (slijedova) parova baza DNK u genima ili strukture kromosoma (kromosomske aberacije). Numerička aberacija : promjena broja kromosoma u odnosu na uobičajeni broj svojstven upotrijebljenim stanicama. Poliploidija : numeričke aberacije kromosoma u stanicama ili organizmima koje zahvaćaju cijeli skup kromosoma, a ne jedan ili više pojedinačnih kromosoma (aneuploidija). Status proteina p53 : protein p53 sudjeluje u regulaciji staničnog ciklusa, apoptozi i popravku DNK. Stanice kojima nedostaje funkcionalan protein p53, koje nisu u mogućnosti zaustaviti stanični ciklus ili ukloniti oštećene stanice putem apoptoze ili drugih mehanizama (npr. indukcijom popravka DNK) povezanih s funkcijama proteina p53 kao odgovorima na oštećenje DNK, teoretski bi trebale biti podložnije genskim mutacijama ili kromosomskim aberacijama. Relativno povećanje broja stanica (RICC) : povećanje broja stanica u kulturama izloženima kemikaliji u odnosu na povećanje u netretiranim kulturama, omjer izražen kao postotak. Relativno udvostručenje populacije (RPD) : povećanje broja udvostručenja populacije u kulturama izloženima kemikaliji u odnosu na povećanje u netretiranim kulturama, omjer izražen kao postotak. Frakcija jetre S9 : supernatant homogenata jetre centrifugiran na 9 000 g, tj. sirovi ekstrakt jetre. Mješavina S9 : smjesa frakcije jetre S9 i kofaktora potrebnih za djelovanje metaboličkih enzima. Kontrola s otapalom : opći izraz za označivanje kontrolnih kultura kojima je dodano jedino otapalo koje je upotrijebljeno za otapanje ispitne kemikalije. Strukturna aberacija : promjena u strukturi kromosoma koja se može otkriti mikroskopskim pregledom diobe stanica u metafazi, zapažena kao brisanja ili fragmenti, intrakromosomske promjene ili interkromosomske promjene. Ispitivana kemikalija : sve tvari ili smjese koje se ispituju ovom ispitnom metodom. Netretirane kulture : kulture koje nisu ničim tretirane (tj. ni ispitivanom kemikalijom ni otapalom), ali se obrađuju istodobno i na isti način kao i kulture tretirane ispitivanom kemikalijom. Dodatak 2. FORMULE ZA OCJENJIVANJE CITOTOKSIČNOSTI Mitotski indeks:
Preporučuju se relativno povećanje broja stanica (RICC) ili relativno udvostručenje populacije (RPD) budući da se u obje metode u obzir uzima udio populacije stanica koje su se podijelile.
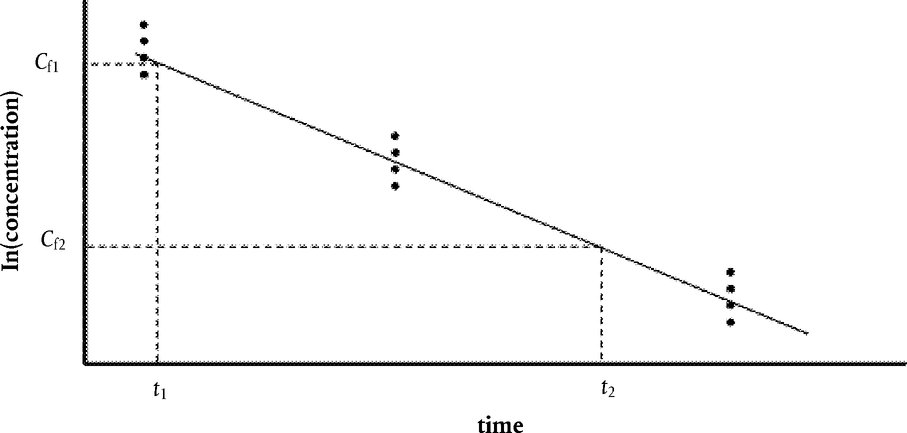
pri čemu je: udvostručenje populacije = [log (broj stanica nakon tretiranja ÷ početni broj stanica)] ÷ log 2 Na primjer, RICC ili RPD od 53 % ukazuje na citotoksičnost/citostazu od 47 %, dok citotoksičnost/citostaza od 55 %, mjerena mitotskim indeksom, znači da je stvarni mitotski indeks 45 % kontrole. U svakom slučaju, trebalo bi mjeriti broj stanica prije tretiranja jednako za tretirane i negativne kontrolne kulture. Iako se RCC (odnosno broj stranica u tretiranim kulturama / broj stanica u kontrolnim kulturama) u prošlosti upotrebljavao kao parametar citotoksičnosti, on se više ne preporučuje jer kod te metode citotoksičnost može biti podcijenjena. U negativnim kontrolnim kulturama udvostručenje populacije trebalo bi biti u skladu sa zahtjevom uzrokovanja stanica poslije tretiranja po isteku vremena koje odgovara trajanju približno 1,5 uobičajenog staničnog ciklusa i mitotski bi indeks trebao biti dovoljno visok za dobivanje dostatnog broja stanica u mitozi i pouzdano izračunavanje smanjenja od 50 %. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
(4) |
U dijelu B poglavlje B.11. zamjenjuje se sljedećim: „B.11. Ispitivanje kromosomskih aberacija u koštanoj srži sisavaca UVOD Ova ispitna metoda odgovara Smjernici OECD-a za ispitivanje 475 (2016.). Dio je serije metoda za ispitivanje genetske toksikologije. Razvijen je i dokument OECD-a u kojemu se daju sažete informacije o ispitivanju u području genetske toksikologije te pregled novijih promjena tih ispitnih smjernica (1). In vivo ispitivanje kromosomskih aberacija u koštanoj srži sisavaca posebno je relevantno za ocjenu genotoksičnosti jer, iako se mogu razlikovati među vrstama, faktori metabolizma, farmakokinetike i procesa popravka DNK in vivoaktivni su i pridonose odgovorima. In vivo test koristan je i za daljnje istraživanje genotoksičnosti otkrivene nekim in vitro sustavom. In vivo ispitivanje kromosomskih aberacija sisavaca primjenjuje se za otkrivanje strukturnih kromosomskih aberacija u stanicama koštane srži životinja, obično glodavaca, uzrokovanih ispitivanim kemikalijama (2., 3., 4. i 5.). Razlikujemo dva tipa strukturnih kromosomskih aberacija: kromosomski i kromatidni. Iako je većina aberacija izazvanih genotoksičnim kemikalijama kromatidnog tipa, pojavljuju se i aberacije kromosomskog tipa. Oštećenja kromosoma i srodne pojave uzrok su mnogih genetskih oboljenja ljudi i postoje dostatni dokazi da su te lezije i srodne pojave koje uzrokuju promjene u onkogenima i genima supresorima tumora povezane s pojavom raka kod ljudi i u pokusnim sustavima. Tijekom in vivo testova kromosomskih aberacija može doći do pojave poliploidije (uključujući endoreduplikaciju). Međutim, povećanje poliploidije samo po sebi nije pokazatelj aneugenog potencijala, već može jednostavno biti pokazatelj poremećaja staničnog ciklusa ili citotoksičnosti. Ovo ispitivanje nije namijenjeno mjerenju aneuploidije. In vivo mikronukleus-test na eritrocitima sisavaca (poglavlje B.12. ovog Priloga) ili in vitro mikronukleus-test na stanicama sisavaca (poglavlje B.49. ovog Priloga) bila bi in vivo i in vitro ispitivanja preporučena za otkrivanje aneuploidije. Upotrijebljene definicije terminologije navedene su u Dodatku 1. POČETNA RAZMATRANJA U tom ispitivanju uobičajeno se upotrebljavaju glodavci, ali i druge vrste mogu biti prikladne u određenim slučajevima, ako je to znanstveno opravdano. Ciljno tkivo u tom ispitivanju jest koštana srž jer je jako prokrvljena i sadržava populaciju stanica čiji se ciklus odvija brzo i koje se mogu lako izolirati i obrađivati. U izvješću bi trebalo navesti znanstveno opravdanje za uporabu drugih vrsta osim štakora i miševa. Ako se upotrebljavaju druge vrste osim glodavaca, preporučuje se uvrštavanje mjerenja kromosomske aberacije u koštanoj srži u drugo prikladno ispitivanje toksičnosti. Ako postoje dokazi da ispitivana kemikalija ili njezin metabolit neće dospjeti do ciljnog tkiva, ovaj oblik ispitivanja možda nije prikladan. Prije nego što se ta ispitna metoda primijeni na smjesi radi dobivanja podataka za predviđenu regulatornu svrhu, potrebno je razmotriti mogu li se njome dobiti primjereni rezultati za tu svrhu te ako mogu, zašto. Takva razmatranja nisu potrebna ako postoji regulatorni zahtjev za ispitivanje smjese. NAČELO ISPITNE METODE Životinje se izlažu ispitivanoj kemikaliji prikladnim načinom izlaganja i humano eutanaziraju u prikladnom trenutku nakon tretiranja. Prije eutanazije životinje se tretiraju agensom za zaustavljanje metafaze (npr. kolhicinom ili kolcemidom). Nakon toga se pripremaju i boje kromosomski preparati stanica koštane srži te se analizom utvrđuju kromosomske aberacije metafaznih stanica. PROVJERA OSPOSOBLJENOSTI LABORATORIJA Istraživanja osposobljenosti Kako bi se utvrdilo dostatno iskustvo u provedbi testa prije njegove uporabe za rutinsko ispitivanje, laboratorij bi trebao dokazati sposobnost dobivanja očekivanih rezultata na temelju objavljenih podataka (npr. 6.) za učestalost kromosomskih aberacija s najmanje dvije kemikalije pozitivnih kontrola (uključujući slabe odgovore izazvane niskom dozom pozitivnih kontrola), kao što su one navedene u tablici 1., i s kompatibilnim kontrolama s nosačem/otapalom (vidjeti stavak 22.). U tim pokusima trebalo bi upotrebljavati doze na temelju kojih se dobivaju ponovljiva povećanja koja se odnose na dozu i dokazuju osjetljivost i dinamički raspon ispitnog sustava u pogledu ciljnog tkiva (koštane srži) uz uporabu metode vrednovanja koja će se upotrebljavati u laboratoriju. Taj se zahtjev ne odnosi na laboratorije s iskustvom, odnosno laboratorije s bazom ranijih podataka koja je stavljena na raspolaganje u skladu s definicijom iz stavaka od 10. do 14. Podaci o prijašnjim kontrolama Tijekom istraživanja osposobljenosti laboratorij bi treba utvrditi:
Pri prvom prikupljanju podataka za distribuciju prijašnjih negativnih kontrola istodobne negativne kontrole trebale bi biti u skladu s objavljenim podacima o kontrolama, ako oni postoje. Nakon što se distribuciji prijašnjih kontrola doda još podataka o pokusima, istodobne negativne kontrole trebale bi u idealnim okolnostima biti unutar kontrolnih granica te distribucije od 95 %. Baza podataka laboratorija o prijašnjim negativnim kontrolama trebala bi biti statistički čvrsta kako bi se osigurala sposobnost laboratorija za ocjenjivanje distribucije podataka o negativnim kontrolama. U literaturi je navedeno da može biti potrebno najmanje deset pokusa, ali bilo bi poželjno da podaci obuhvaćaju najmanje 20 pokusa provedenih u usporedivim pokusnim uvjetima. Laboratoriji bi trebali primjenjivati metode za kontrolu kvalitete, kao što su kontrolni dijagrami (npr. C-dijagrami ili X-stupčasti dijagrami (7.)), kako bi utvrdili koliko su promjenjivi njihovi podaci i dokazali da je u njihovom laboratoriju metodologija ‚pod kontrolom’. Daljnje preporuke o tome kako uspostaviti i upotrebljavati ranije podatke (npr. kriterije za uključivanje podataka u ranije podatke i za isključivanje iz njih i kriterije prihvatljivosti za određeni pokus) nalaze se u literaturi (8.). Ako laboratorij ne provede dovoljan broj pokusa za utvrđivanje statistički čvrste distribucije negativnih kontrola (vidjeti stavak 11.) tijekom istraživanja osposobljenosti (kako je opisano u stavku 9.), prihvatljiva je uspostava distribucije tijekom prvih rutinskih ispitivanja. Taj pristup trebao bi biti u skladu s preporukama iz literature (8.), a rezultati dobiveni negativnim kontrolama u tim pokusima trebali bi biti u skladu s objavljenim podacima o negativnim kontrolama. Sve izmjene protokola pokusa trebalo bi razmotriti s obzirom na to je li njihov učinak na dobivene podatke ostao u skladu s postojećom bazom podataka laboratorija o prijašnjim kontrolama. Samo veće neusklađenosti trebale bi za posljedicu imati uspostavljanje nove baze podataka o prijašnjim kontrolama, pri čemu se na temelju stručne prosudbe utvrđuje da je riječ o razlici u odnosu na prijašnju distribuciju (vidjeti stavak 11.). Tijekom ponovnog uspostavljanja možda neće biti potrebna potpuna baza podataka o negativnim kontrolama za provedbu stvarnog ispitivanja pod uvjetom da laboratorij može dokazati da su vrijednosti istodobnih negativnih kontrola ostale u skladu s prijašnjom bazom podataka ili s odgovarajućim objavljenim podacima. Podaci o negativnim kontrolama trebali bi uključivati pojavnost strukturnih kromosomskih aberacija (isključujući prekide) kod svake životinje. Istodobne negativne kontrole trebale bi u idealnim okolnostima biti unutar kontrolnih granica od 95 % za distribuciju baze podataka laboratorija o prijašnjim negativnim kontrolama. Ako su podaci o istodobnim negativnim kontrolama izvan kontrolnih granica od 95 %, njihovo je uključivanje u distribuciju prijašnjih kontrola prihvatljivo sve dok ti podaci nisu ekstremne netipične vrijednosti i ako postoje dokazi o tome da je ispitni sustav ‚pod kontrolom’ (vidjeti stavak 11.) i ako nema dokaza o tehničkoj ili ljudskoj pogrešci. OPIS METODE Preparati Odabir životinjske vrste Trebalo bi upotrebljavati zdrave mlade odrasle životinje sojeva koji se obično upotrebljavaju u laboratorijskim istraživanjima. Uobičajeno se upotrebljavaju štakori, iako i miševi mogu biti prikladan odabir. Moguća je uporaba bilo koje druge prikladne vrste sisavaca ako je to znanstveno opravdano u izvješću. Uvjeti smještaja i hranjenja životinja U slučaju glodavaca, temperatura prostorije u kojoj se drže životinje trebala bi biti 22 °C (±3 °C). Iako bi u idealnim okolnostima relativna vlažnost trebala biti 50 – 60 %, ona bi trebala biti najmanje 40 %, a poželjno je da ne prelazi 70 %, osim tijekom čišćenja prostorije. Rasvjeta bi trebala biti umjetna uz izmjenu 12 sati svjetla i 12 sati mraka. Za hranjenje se može upotrebljavati konvencionalna laboratorijska hrana uz neograničenu količinu vode za piće. Kad se ispitivana tvar primjenjuje ovom metodom, na izbor prehrane može utjecati potreba da se osigura odgovarajuća primjesa ispitivane kemikalije. Glodavci bi trebali biti smješteni u malim skupinama (ne više od pet po kavezu) istog spola i skupine za tretiranje ako se ne očekuje agresivno ponašanje, po mogućnosti u kavezima s čvrstim podom i uz prikladno obogaćivanje okoliša. Životinje se mogu držati u zasebnim nastambama samo ako je to znanstveno opravdano. Priprema životinja Uobičajeno se upotrebljavaju zdrave mlade odrasle životinje (u slučaju glodavaca, u idealnim okolnostima životinje u dobi od šest do deset tjedana na početku tretiranja, iako su prihvatljive i nešto starije životinje) koje se nasumično određuju za kontrolne skupine i skupine za tretiranje. Pojedinačne životinje identificiraju se jedinstvenom humanom, najmanje invazivnom metodom (npr. prstenovanjem, stavljanjem oznaka, mikročipiranjem ili biometrijskom identifikacijom, ali ne rezanjem uha ili prsta) i prilagođavaju laboratorijskim uvjetima najmanje pet dana. Kaveze bi trebalo rasporediti tako da se učinci do kojih bi moglo doći zbog položaja kaveza svedu na minimum. Trebalo bi izbjegavati unakrsnu kontaminaciju pozitivnom kontrolom i ispitivanom kemikalijom. Na početku studije variranje tjelesne mase životinja trebalo bi biti što manje i ne bi trebalo prelaziti ±20 % odgovarajuće srednje vrijednosti mase svakog spola. Priprema doza Prije no što se doza da životinjama, krute ispitivane kemikalije trebalo bi otopiti ili suspendirati u prikladnim otapalima ili nosačima ili dodati hrani ili vodi za piće. Tekuće ispitivane kemikalije mogu se dozirati izravno ili razrijediti prije doziranja. Ako se unose inhaliranjem, ispitivane kemikalije mogu se primijeniti u obliku plina, pare ili krutog/tekućeg aerosola, ovisno o njihovim fizikalno-kemijskim svojstvima. Ako prema podacima o stabilnosti skladištenje nije prihvatljivo i ako nisu utvrđeni prikladni uvjeti skladištenja, preparate ispitivane kemikalije trebalo bi upotrebljavati svježe. Otapalo/nosač Pri visinama doza koje se primjenjuju otapalo/nosač ne bi trebali imati toksične učinke i ne bi trebala postojati sumnja da bi mogli kemijski reagirati s ispitivanim kemikalijama. Ako se upotrebljavaju otapala/nosači koji nisu dobro poznati, njihovo uključivanje u ispitivanje trebalo bi potkrijepiti referentnim podacima kojima se dokazuje njihova usklađenost. Kad god je to moguće preporučuje se najprije razmotriti mogućnost primjene vodenog otapala/nosača. Primjeri uobičajeno korištenih usklađenih otapala/nosača uključuju vodu, fiziološku otopinu, otopinu metil-celuloze, otopinu soli natrijeve karboksimetilne celuloze, maslinovo ulje i kukuruzno ulje. Ako ne postoje raniji ili objavljeni podaci o kontrolama kojima se dokazuje da odabranim atipičnim otapalom/nosačem nisu izazvane strukturne aberacije ili drugi štetni učinci, trebalo bi provesti početno istraživanje kako bi se utvrdila prihvatljivost kontrole s otapalom/nosačem. Kontrole Pozitivne kontrole U svako ispitivanje trebalo bi uobičajeno uključiti skupinu životinja tretiranih kemikalijom pozitivne kontrole. Od toga se može odstupiti ako je ispitni laboratorij dokazao osposobljenost za provedbu ispitivanja i uspostavio raspon prijašnjih pozitivnih kontrola. Ako nije uključena istodobna pozitivna kontrolna skupina, u svaki pokus trebalo bi uključiti kontrole vrednovanja (fiksirana i nebojena predmetna stakalca). Njih se može dobiti uključivanjem prikladnih referentnih uzoraka u vrednovanje istraživanja koji su dobiveni i pohranjeni iz zasebnog pokusa s pozitivnom kontrolom koji se provodi periodično (npr. svakih šest do 18 mjeseci) u laboratoriju u kojem se provodi ispitivanje, na primjer, tijekom ispitivanja osposobljenosti laboratorija i redovito nakon toga, ako je to potrebno. Kemikalije pozitivnih kontrola trebale bi pouzdano izazvati zamjetno povećanje učestalosti stanica sa strukturnim kromosomskim aberacijama iznad spontane razine. Doze pozitivnih kontrola trebalo bi odabrati tako da učinci budu jasni, ali da analitičar ne može odmah vidjeti identitet kodiranih uzoraka. Prihvatljiva je drukčija primjena pozitivnih kontrola u odnosu na primjenu ispitivane kemikalije, uz uporabu drukčijeg rasporeda tretiranja, te provedba uzorkovanja u samo jednom trenutku. Osim toga, može se razmotriti uporaba kemikalija pozitivne kontrole koje pripadaju istoj kategoriji opasnosti kao i ispitivana kemikalija ako je to prikladno. Primjeri kemikalija pozitivne kontrole navedeni su u tablici 1. Tablica 1. Primjeri kemikalija pozitivne kontrole
Negativne kontrole Životinje iz negativnih kontrolnih skupina trebalo bi uključiti kod svakog uzorkovanja te bi s njima trebalo postupati jednako kao i sa skupinama za tretiranje, uz izostanak tretiranja ispitivanom kemikalijom. Ako se pri primjeni ispitivane kemikalije upotrebljava nosač/otapalo, kontrolna skupina trebala bi dobiti taj nosač / to otapalo. Međutim, ako se podacima o prijašnjim negativnim kontrolama dokažu dosljedna varijabilnost među životinjama i učestalost stanica sa strukturnim aberacijama za svako vrijeme uzorkovanja za ispitni laboratorij, za negativnu kontrolu može biti potrebno samo jedno uzorkovanje. Ako se za negativne kontrole upotrebljava samo jedno uzorkovanje, to bi trebalo biti vrijeme prvog uzorkovanja u istraživanju. POSTUPAK Broj i spol životinja Općenito, odgovor mikronukleusa sličan je kod mužjaka i ženki (9.) te se očekuje da će to vrijediti i za strukturne kromosomske aberacije; stoga se većina istraživanja može provesti na bilo kojem spolu. Podacima kojima se dokazuju relevantne razlike između mužjaka i ženki (npr. razlike u sustavnoj toksičnosti, metabolizmu, bioraspoloživosti, toksičnosti za koštanu srž itd., uključujući npr. istraživanje o utvrđivanju raspona) potaknula bi se uporaba obaju spolova. U tom slučaju može biti prikladno provesti istraživanje na oba spola, npr. kao dio istraživanja toksičnosti nakon ponovljene doze. Ako se upotrebljavaju oba spola, bilo bi primjereno primijeniti faktorski model. U Dodatku 2. navedeni su detalji o načinu analize podataka primjenom tog plana. Na početku istraživanja trebalo bi utvrditi veličine skupina kako bi se po skupini osiguralo minimalno pet životinja istog spola, ili svakog spola ako se upotrebljavaju oba spola, prikladnih za analizu. U slučajevima kad izloženost ljudi nekoj kemikaliji može biti vezana uz spol, kao što je slučaj s nekim farmaceutskim sredstvima, test bi trebalo obaviti na životinjama odgovarajućeg spola. Kao smjernica za maksimalne uobičajene zahtjeve u pogledu životinja, za istraživanje koštane srži s dva vremena uzorkovanja, tri skupine koje primaju dozu i istodobnom negativnom kontrolnom skupinom plus pozitivnom kontrolnom skupinom (pri čemu se svaka skupina sastoji od pet životinja istog spola) bilo bi potrebno 45 životinja. Visine doza Ako se provodi preliminarno istraživanje o utvrđivanju raspona jer nisu već na raspolaganju prikladni podaci kao pomoć u odabiru doza, ono bi se trebalo provesti u istom laboratoriju uz uporabu iste vrste, soja, spola i postupaka tretiranja kao i u glavnom istraživanju (10.). Cilj istraživanja trebalo bi biti utvrđivanje maksimalne doze tolerancije (MTD), koja je definirana kao najviša doza koja će se tolerirati bez dokaza o toksičnosti, povezane s ograničavanjem trajanja istraživanja (na primjer izazivanjem smanjenja tjelesne mase ili hematopoetske sustavne citotoksičnosti), isključujući smrt ili dokaze o boli, patnji ili stresu zbog kojih se zahtijeva humana eutanazija (11.). Najviša doza može biti definirana i kao doza koja izaziva određenu toksičnost za koštanu srž. Kemikalije koje pokazuju zasićenost toksikokinetičkih svojstava ili koje izazivaju postupke detoksifikacije koji mogu dovesti do smanjene izloženosti nakon dugotrajnog tretiranja mogu se izuzeti iz kriterija u pogledu određivanja doza i trebalo bi ih ocijeniti od slučaja do slučaja. Kako bi se dobile informacije o odgovoru na dozu, potpuno istraživanje trebalo bi uključivati negativnu kontrolnu skupinu i minimalno tri visine doze pri čemu je svaka uglavnom dvostruko veća od prethodne, ali najviše četverostruko. Ako ispitivana kemikalija u istraživanju o utvrđivanju raspona ili na temelju postojećih podataka ne izaziva toksičnost, najviša doza za jednu primjenu trebala bi biti 2 000 mg/kg tjelesne mase. Međutim, ako ispitivana kemikalija uzrokuje toksičnost, MTD bi trebao biti najviša primijenjena doza i poželjno je da se primijenjenim visinama doze obuhvati raspon od maksimalne doze do doze koja izaziva malu toksičnost ili ne izaziva toksičnost. Ako je toksičnost ciljnog tkiva (koštane srži) zapažena pri svim ispitanim razinama doza, preporučuje se daljnje istraživanje pri netoksičnim dozama. Za istraživanja čiji je cilj potpunije opisati kvantitativne informacije o odgovoru na dozu mogu biti potrebne dodatne skupine koje primaju dozu. Za određene vrste ispitivanih kemikalija (npr. za farmaceutske proizvode namijenjene ljudima) obuhvaćene posebnim zahtjevima ta se ograničenja mogu razlikovati. Granično ispitivanje Ako se pokusima o utvrđivanju raspona doze ili postojećim podacima o srodnim sojevima životinja dokaže da se načinom tretiranja koji uključuje najmanje graničnu dozu (opisanu u nastavku) ne uzrokuju vidljivi toksični učinci (uključujući izostanak smanjenja proliferacije koštane srži ili druge dokaze o citotoksičnosti za ciljno tkivo) i ako se genotoksičnost ne očekuje na temelju in vitro istraživanja genotoksičnosti ili podataka o strukturno srodnim kemikalijama, potpuno istraživanje uz primjenu tri razine doza ne smatra se potrebnim, pod uvjetom da je dokazano da su ispitivane kemikalije dospjele do ciljnog tkiva (koštane srži). U takvim slučajevima može biti dovoljna jedna razina doze pri graničnoj dozi. Za razdoblje primjene > 14 dana granična je doza 1 000 mg/kg tjelesne mase dnevno. Za razdoblje primjene od 14 dana ili manje granična je doza 2 000 mg/kg tjelesne mase dnevno. Primjena doza Pri planiranju testa u obzir bi trebalo uzeti očekivani način ljudske izloženosti. Stoga se, ako su opravdani, mogu izabrati putovi primjene poput unosa hranom, vodom za piće, lokalnom primjenom, potkožno, intravenozno, oralno (intubacijom), udisanjem, intratrahealno ili implantacijom. U svakom slučaju, način izlaganja trebalo bi odabrati tako da se osigura prikladno izlaganje ciljnog tkiva. Intraperitonealna injekcija općenito se ne preporučuje jer nije način izlaganja namijenjen ljudima i trebalo bi je upotrebljavati samo uz posebno znanstveno opravdanje. Ako se ispitivana kemikalija dodaje hrani ili vodi za piće, posebno u slučaju primjene jedne doze, trebalo bi voditi računa o tome da se osigura dostatno vrijeme od unosa hrane i vode do uzorkovanja kako bi se omogućilo otkrivanje učinaka (vidjeti stavke 33. i 34.). Maksimalni volumen tekućine koji se odjednom može primijeniti sondom ili injekcijom ovisi o veličini ispitne životinje. Taj volumen uobičajeno ne bi trebao biti veći od 1 ml/100 g tjelesne mase, osim u slučaju vodenih otopina gdje je dopušteno upotrijebiti maksimalno 2 ml/100 g tjelesne mase. Opravdanost primjene većih volumena od navedenog trebalo bi dokazati. Osim kod nadražujućih ili nagrizajućih ispitivanih kemikalija, za koje je uobičajeno da u većim koncentracijama izazivaju intenzivnije učinke, variranje ispitnih volumena trebalo bi podešavanjem koncentracije svesti na minimum kako bi se kod primjene svih visina doze osigurao stalni volumen u odnosu na tjelesnu masu. Plan tretiranja Ispitivane kemikalije uobičajeno se primjenjuju jednokratno, ali se mogu primjenjivati i u podijeljenoj dozi (odnosno kao dva ili više doziranja u istom danu u razmaku od najviše dva do tri sata) kako bi se olakšalo davanje velikog volumena. U tim okolnostima ili pri primjeni ispitivane kemikalije inhalacijom, vrijeme uzorkovanja trebalo bi planirati na temelju vremena posljednje doze ili završetka izlaganja. Malo je podataka dostupno o prikladnosti protokola o primjeni ponovljenih doza za ovo ispitivanje. Međutim, u okolnostima u kojima je poželjno ovo ispitivanje uključiti u ispitivanje toksičnosti s ponovljenim dozama trebalo bi voditi računa o tome da se izbjegne gubitak mitotskih stanica s oštećenim kromosomima koje mogu nastati pri toksičnim dozama. Takvo je uključivanje prihvatljivo ako je najviša doza veća od granične doze ili jednaka graničnoj dozi (vidjeti stavak 29.) i ako se na skupinu koja prima dozu primijeni granična doza tijekom razdoblja tretiranja. Mikronukleus-test (ispitnu metodu B.12.) trebalo bi smatrati preferiranim in vivo ispitivanjem kromosomskih aberacija ako je poželjna integracija s drugim istraživanjima. Uzorci koštane srži trebali bi se uzimati odvojeno u dva navrata nakon pojedinačnih tretiranja. Ako je riječ o glodavcima, prvi interval uzorkovanja trebalo bi biti vrijeme potrebno za završetak 1,5 uobičajenog staničnog ciklusa (pri čemu potonji uobičajeno traje 12 – 18 sati nakon razdoblja tretiranja). Budući da vrijeme potrebno za unos i metabolizam ispitivane kemikalije i za njezino djelovanje na kinetiku staničnog ciklusa može utjecati na optimalno vrijeme za otkrivanje kromosomskih aberacija, preporuča se još jedno uzimanje uzorka 24 sata nakon vremena prvog uzorkovanja. U vrijeme prvog uzorkovanja trebalo bi tretirati sve skupine koje primaju dozu i prikupiti uzorke za analizu; međutim, u vrijeme kasnijeg uzorkovanja potrebno je primijeniti samo najvišu dozu. Ako se primjenjuju postupci primjene doze u trajanju duljem od jednog dana gdje je to znanstveno opravdano, općenito bi trebalo primijeniti samo jedno vrijeme uzorkovanja po isteku vremena od približno 1,5 uobičajenog staničnog ciklusa nakon posljednjeg tretiranja. Nakon tretiranja i prije uzimanja uzoraka životinjama se intraperitonealnom injekcijom daje prikladna doza agensa za zaustavljanje metafaze (npr. kolcemida ili kolhicina) te se nakon toga u prikladnom intervalu uzimaju uzorci. Za miševe je taj interval približno tri sata do pet sati prije uzimanja uzorka, a za štakore dva sata do pet sati. Stanice se izdvajaju iz koštane srži, bubre, fiksiraju i boje te zatim analiziraju kako bi se utvrdile kromosomske aberacije (12.). Zapažanja Opća klinička zapažanja o pokusnim životinjama i kliničke znakove trebalo bi bilježiti najmanje jednom dnevno, po mogućnosti svaki dan u isto vrijeme, vodeći računa o razdoblju najvećeg intenziteta očekivanih učinaka nakon primjene doze. Najmanje dva puta dnevno tijekom razdoblja primjene doze trebalo bi provjeriti ima li slučajeva morbiditeta ili mortaliteta životinja. Sve životinje trebalo bi izvagati na početku istraživanja, najmanje jednom tjedno tijekom istraživanja s ponovljenim dozama i pri eutanaziji. U istraživanjima koja traju najmanje tjedan dana trebalo bi najmanje jednom tjedno mjeriti unos hrane. Ako se ispitivana kemikalija daje s vodom za piće, trebalo bi mjeriti i unos vode pri svakoj promjeni vode i najmanje jednom tjedno. Životinje u kojih su vidljivi nesmrtonosni pokazatelji prekomjerne toksičnosti trebalo bi humano eutanazirati prije završetka ispitnog razdoblja (11.). Izlaganje ciljnog tkiva Uzorak krvi trebalo bi uzeti u prikladnom trenutku / prikladnim trenucima kako bi se omogućilo istraživanje razina plazme ispitivane kemikalije u cilju dokazivanja da je došlo do izlaganja koštane srži, ako je to opravdano i ako ne postoje drugi podaci o izlaganju (vidjeti stavak 44.). Preparati koštane srži i kromosomski preparati Stanice koštane srži uzimaju se iz femura ili tibije životinja odmah nakon humane eutanazije, izlažu hipotoničkoj otopini i fiksiraju. Metafazne stanice zatim se nanose na predmetna stakalca i boje primjenom utvrđenih metoda (vidjeti 3. i 12.). Analiza Sva predmetna stakalca, uključujući i ona za pozitivne i negativne kontrole, trebalo bi prije analize neovisno kodirati i pregledati nasumično tako da analitičar ne zna za uvjete tretiranja. Kao mjerilo toksičnosti trebalo bi odrediti mitotski indeks u najmanje 1 000 stanica po životinji za sve tretirane životinje (uključujući pozitivne kontrole), netretirane životinje iz negativnih kontrola ili životinje iz negativnih kontrola s nosačem/otapalom. Za svaku životinju trebalo bi analizirati najmanje 200 metafaza radi utvrđivanja strukturnih kromosomskih aberacija, uključujući i isključujući kromosomske prekide (6.). Međutim, ako je u bazi podataka o prijašnjim negativnim kontrolama navedeno da je prosječna učestalost osnovne pojavnosti strukturnih kromosomskih aberacija < 1 % u ispitnom laboratoriju, trebalo bi razmotriti vrednovanje dodatnih stanica. Aberacije kromatidnog i kromosomskog tipa trebalo bi bilježiti odvojeno i klasificirani prema podtipovima (lomovi, zamjene). U postupcima koji se primjenjuju u laboratoriju trebalo bi osigurati da analizu kromosomskih aberacija provode dobro osposobljeni analitičari te da je, prema potrebi, pregledaju stručnjaci. Uzimajući u obzir da postupci pripreme predmetnih stakalaca često za posljedicu imaju lom jednog dijela metafaza uz posljedični gubitak kromosoma, stanice koje se pregledavaju trebale bi stoga sadržavati broj centromera koji nije manji od 2n ± 2, pri čemu je n haploidan broj kromosoma za tu vrstu. PODACI I IZVJEŠĆIVANJE Obrada rezultata Podatke o pojedinačnim životinjama trebalo bi prikazati u tabličnom obliku. Za svaku životinju trebalo bi ocijeniti mitotski indeks, broj pregledanih metafaznih stanica, broj aberacija po metafaznoj stanici i postotak stanica sa strukturnim kromosomskim aberacijama. Trebalo bi navesti različite tipove strukturnih kromosomskih aberacija zajedno s njihovim brojem i učestalošću za tretirane i kontrolne skupine. Kromosomski prekidi, poliploidne stanice i stanice s endoredupliciranim kromosomima bilježe se odvojeno. Iako se bilježi učestalost kromosomskih prekida, ona se općenito ne uključuje u analizu ukupne učestalosti strukturnih aberacija. Ako nema dokaza o razlikama u odgovoru između spolova, za statističku analizu mogu se kombinirati podaci. Trebalo bi bilježiti i podatke o toksičnosti za životinje i o kliničkim znakovima. Kriteriji prihvatljivosti Na temelju sljedećih kriterija utvrđuje se prihvatljivost ispitivanja:
Ocjenjivanje i tumačenje rezultata Pod uvjetom da su ispunjeni svi kriteriji prihvatljivosti, ispitivana kemikalija smatra se jasno pozitivnom:
Ako se u određeno vrijeme uzorkovanja ispituje samo najviša doza, ispitivana kemikalija smatra se jasno pozitivnom ako postoji statistički značajno povećanje u odnosu na istodobnu negativnu kontrolu i ako rezultati nisu uključeni u distribuciju povijesnih podataka o negativnim kontrolama (npr. kontrolne granice od 95 % prema Poissonovoj distribuciji). Preporuke za prikladne statističke metode nalaze se u literaturi (13.). Pri analizi odgovora na dozu trebalo bi analizirati najmanje tri skupine tretirane dozom. U statističkim testovima trebalo bi upotrebljavati životinju kao pokusnu jedinicu. Pozitivnim rezultatima ispitivanja kromosomskih aberacija dokazuje se da ispitivana kemikalija izaziva strukturne kromosomske aberacije u koštanoj srži ispitne vrste. Pod uvjetom da su ispunjeni svi kriteriji prihvatljivosti, ispitivana kemikalija smatra se jasno negativnom ako u svim ispitanim pokusnim uvjetima:
Preporuke za najprikladnije statističke metode nalaze se u literaturi (13.). Dokaz o izlaganju koštane srži ispitivanoj kemikaliji može uključivati smanjenje mitotskog indeksa ili mjerenje razina plazme ili krvi ispitivane kemikalije. U slučaju intravenozne primjene nije potreban dokaz o izlaganju. Kao druga mogućnosti, podaci o apsorpciji, distribuciji, metabolizmu i eliminaciji (ADME), dobiveni u okviru neovisnog istraživanja u kojem su se upotrebljavali jednaki način izlaganja i jednaka vrsta, mogu se upotrijebiti za dokazivanje izlaganja koštane srži. Negativnim rezultatima dokazuju se da u ispitnim uvjetima ispitivana kemikalija ne izaziva strukturne kromosomske aberacije koštane srži ispitnih vrsta. Jasan pozitivan ili negativan odgovor nije potrebno provjeriti. Ako odgovor nije jasno negativan ili pozitivan i kako bi se pridonijelo utvrđivanju biološke relevantnosti rezultata (npr. blago ili granično povećanje), podatke bi trebalo ocjenjivati na temelju stručne prosudbe i/ili daljnjih istraživanja postojećih završenih pokusa. U nekim slučajevima može biti korisno analizirati više stanica ili provesti ponovljeni pokus uz primjenu izmijenjenih pokusnih uvjeta. U rijetkim slučajevima, čak i nakon daljnjih istraživanja, na temelju dobivenih podataka neće biti moguće donijeti zaključak da ispitivana kemikalija uzrokuje pozitivne ili negativne rezultate, te će se stoga zaključiti da je istraživanje dvosmisleno. Učestalost poliploidnih i endoredupliciranih metafaza među ukupnim metafazama trebalo bi zabilježiti odvojeno. Povećanje broja poliploidnih/endoredupliciranih stanica može značiti da ispitivana kemikalija može inhibirati mitotske procese ili progresiju staničnog ciklusa (vidjeti stavak 3.). Izvješće o ispitivanju Izvješće o ispitivanju trebalo bi sadržavati sljedeće informacije: Sažetak
LITERATURA
Dodatak 1. DEFINICIJE Aneuploidija : svako odstupanje od uobičajenog diploidnog (ili haploidnog) broja kromosoma za jedan kromosom ili više njih, ali ne za više kromosoma u cijelom skupu ili skupovima kromosoma (usp. poliploidija). Centromera : područje ili područja kromosoma s kojima su tijekom stanične diobe povezane niti diobenog vretena, čime se omogućuje uredno kretanje kromosoma kćeri prema polovima stanica kćeri. Kemikalija : tvar ili smjesa. Aberacija kromatidnog tipa : strukturno oštećenje kromosoma izraženo kao lom pojedinačnih kromatida ili lom i ponovno spajanje kromatida. Aberacija kromosomskog tipa : strukturno oštećenje kromosoma izraženo kao lom ili lom i ponovno spajanje obiju kromatida na istom mjestu. Endoreduplikacija : proces kod kojeg nakon S-faze replikacije DNK ne slijedi mitoza jezgre, nego započinje druga S-faza. Rezultat su kromosomi s 4, 8, 16… kromatida. Prekid : akromatska lezija manja od širine jedne kromatide i s minimalnim otklonom kromatida. Mitotski indeks : omjer broja stanica u mitozi i ukupnog broja stanica u populaciji, koji je mjerilo statusa proliferacije te populacije stanica. Numerička aberacija : promjena broja kromosoma u odnosu na uobičajeni broj svojstven upotrijebljenim životinjama (aneuploidija). Poliploidija : numerička aberacija kromosoma koja uključuje promjenu broja cjelokupnog skupa kromosoma za razliku od numeričke promjene dijela skupa kromosoma (vidjeti aneuploidiju). Strukturna kromosomska aberacija : promjena u strukturi kromosoma koja se može otkriti mikroskopskim pregledom diobe stanica u metafazi, zapažena kao brisanja i fragmenti, intrakromosomske promjene ili interkromosomske promjene. Ispitivana kemikalija : sve tvari ili smjese koje se ispituju ovom ispitnom metodom. Dodatak 2. FAKTORSKI MODEL ZA UTVRĐIVANJE RAZLIKA MEĐU SPOLOVIMA U IN VIVO ANALIZI KROMOSOMSKIH ABERACIJA Faktorski model i njegova analiza U okviru faktorskog modela ispituje se minimalno pet mužjaka i pet ženki pri svakoj razini koncentracije, a posljedica je model s minimalno 40 životinja (20 mužjaka i 20 ženki plus relevantne pozitivne kontrole). Model, koji je jedan od jednostavnijih faktorskih modela, istovjetan je dvosmjernoj analizi varijance (ANOVA) sa spolom i razinom koncentracije kao glavnim učincima. Podaci se mogu analizirati primjenom mnogih standardnih statističkih softverskih paketa kao što su SPSS, SAS, STATA i Genstat, kao i primjenom R. Analizom se varijabilnost skupa podataka razdjeljuje na varijabilnost između spolova, varijabilnost među koncentracijama i varijabilnost koja je povezana s interakcijom između spolova i koncentracija. Svaka od vrijednosti ispituje se u odnosu na procijenjenu varijabilnost među životinjama iz skupina životinja istog spola kojima je dana jednaka koncentracija. Potpuni podaci o osnovnoj metodologiji dostupni su u brojnim standardnim statističkim priručnicima (vidjeti literaturu) i sadržajima za pomoć osiguranima u okviru statističkih paketa. U analizi se nakon toga ispituje vrijednost interakcije spol x koncentracija u ANOVA tablici (5). U slučaju izostanka značajne vrijednosti interakcije, kombiniranim vrijednostima za spolove ili razine koncentracije osiguravaju se valjanja statistička ispitivanja među razinama na temelju vrijednosti varijabilnosti ANOVA-e objedinjena unutar skupine. Analiza se nastavlja razdjeljivanjem procijenjene varijabilnosti među koncentracijama na kontraste kojima se osigurava ispitivanje linearnih i kvadratnih kontrasta odgovora unutar razina koncentracije. Ako je prisutna značajna interakcija spol x koncentracija, ta se vrijednost jednako tako može razdijeliti na linearne kontraste interakcije x spol i kvadratne kontraste interakcije x spol. Na temelju tih vrijednosti provode se ispitivanja kojima se utvrđuje jesu li odgovori na koncentraciju paralelni za oba spola odnosno postoji li razlika u odgovoru između dvaju spolova. Procijenjena varijabilnost, koja je objedinjena unutar skupine, može se upotrijebiti za provedbu ispitivanja parova za utvrđivanje razlike između srednjih izmjerenih vrijednosti. Usporedbe se mogu napraviti između srednjih izmjerenih vrijednosti za oba spola i među srednjim izmjerenim vrijednostima za različite razine koncentracije, kao, na primjer, za usporedbe s negativnim kontrolnim razinama. U slučajevima značajne interakcije može se napraviti usporedba među srednjim izmjerenim vrijednostima za različite koncentracije unutar spola ili između srednjih izmjerenih vrijednosti za spolove pri jednakoj koncentraciji. Literatura Mnogo je statističkih priručnika u kojima se raspravlja o teoriji, planiranju, metodologiji, analizi i tumačenju faktorskih modela, od najjednostavnijih analiza s dva čimbenika do složenijih oblika koji se primjenjuju u metodologiji planiranja pokusa. U nastavku se nalazi nepotpuni popis. U nekima od priručnika navedeni su razrađeni primjeri usporedivih modela, u određenim slučajevima s kodom za provedbu analiza uz primjenu različitih softverskih paketa.
|
|
(5) |
U dijelu B poglavlje B.12. zamjenjuje se sljedećim: „B.12. Mikronukleus-test na eritrocitima sisavaca UVOD Ova ispitna metoda odgovara Smjernici OECD-a za ispitivanje 474 (2016.). Dio je serije metoda za ispitivanje genetske toksikologije. Razvijen je i dokument OECD-a u kojemu se daju sažete informacije o ispitivanju u području genetske toksikologije te pregled novijih promjena tih ispitnih smjernica (1). In vivo mikronukleus-test na sisavcima posebno je relevantan za ocjenu genotoksičnosti jer, iako se mogu razlikovati među vrstama, faktori metabolizma, farmakokinetika i procesi popravka DNK in vivo aktivni su i pridonose odgovorima. In vivo test koristan je i za daljnje istraživanje genotoksičnosti otkrivene nekim in vitro sustavom. In vivo mikronukleus-test na sisavcima primjenjuje se za otkrivanje oštećenja kromosoma ili oštećenja mitotskog aparata eritroblasta izazvanih ispitivanom kemikalijom. Ispitivanjem se ocjenjuje nastajanje mikronukleusa u eritrocitima uzorkovanih iz stanica koštane srži ili periferne krvi životinja, uobičajeno glodavaca. Svrha mikronukleus-testa jest utvrđivanje kemikalija koje izazivaju citogenetska oštećenja zbog kojih dolazi do nastajanja mikronukleusa koji sadržavaju zaostale fragmente kromosoma ili čitave kromosome. Kada se eritroblast koštane srži razvije u nezreli eritrocit (koji se ponekad naziva i polikromatski eritrocit ili retikulocit), dolazi do istiskivanja glavnog nukleusa; bilo koji nastali mikronukleus može zaostati u citoplazmi. Vidljivost ili otkrivanje mikronukleusa u tim je stanicama olakšano jer im nedostaje glavni nukleus. Povećanje učestalosti nezrelih eritrocita s mikronukleusima kod tretiranih životinja pokazatelj je izazvanih strukturnih ili numeričkih kromosomskih aberacija. Novonastali eritrociti s mikronukleusima utvrđuju se i kvantificiraju bojenjem, nakon čega slijedi vizualno očitavanje mikroskopom ili automatska analiza. Prebrojavanje dovoljnog broja nezrelih eritrocita u perifernoj krvi ili koštanoj srži odraslih životinja u velikoj je mjeri olakšano uporabom platforme za automatsko očitavanje. Takve su platforme prihvatljiva alternativa ručnom prebrojavanju (2.). Usporednim istraživanjima dokazano je da se takvim metodama, u kojima se primjenjuju prikladni standardi kalibracije, mogu osigurati bolja međulaboratorijska i unutarlaboratorijska obnovljivost i osjetljivost nego ručnim mikroskopskim očitavanjem (3. i 4.). Automatski sustavi kojima se može mjeriti učestalost eritrocita s mikronukleusima uključuju, među ostalim, protočne citometre (5.), platforme za analizu slike (6. i 7.) i citometre s laserskim skeniranjem (8.). Iako se to uobičajeno ne radi u okviru ispitivanja, fragmenti kromosoma mogu se razlikovati od čitavih kromosoma na temelju niza kriterija. Oni uključuju utvrđivanje prisutnosti ili odsutnosti kinetohore ili centromernog DNK, koji su oboje svojstveni netaknutim kromosomima. Odsutnost kinetohore ili centromernog DNK znači da mikronukleus sadržava samo fragmente kromosoma, dok njihova prisutnost znači gubitak kromosoma. Upotrijebljene definicije terminologije navedene su u Dodatku 1. POČETNA RAZMATRANJA Ciljno je tkivo za genetska oštećenja u ovom ispitivanju koštana srž mladih odraslih glodavaca jer u tom tkivu nastaju eritrociti. Mjerenje mikronukleusa u nezrelim eritrocitima u perifernoj krvi prihvatljivo je kod drugih vrsta sisavaca za koje je dokazana odgovarajuća osjetljivost na otkrivanje kemikalija koje uzrokuju strukturne ili numeričke kromosomske aberacije u tim stanicama (nastankom mikronukleusa u nezrelim eritrocitima) i za koje je navedeno znanstveno opravdanje. Učestalost nezrelih eritrocita s mikronukleusima glavna je krajnja točka. Učestalost zrelih eritrocita s mikronukleusima u perifernoj krvi jednako se tako može primijeniti kao krajnja točka kod vrsta bez snažne selekcije stanica s mikronukleusima u slezeni i u slučajevima kada se životinje neprekidno tretiraju tijekom razdoblja duljeg od životnog vijeka eritrocita kod upotrijebljene vrste (npr. četiri tjedna ili dulje kod miševa). Ako postoje dokazi da ispitivana kemikalija ili njezin metabolit neće dospjeti do ciljnog tkiva, ovaj oblik ispitivanja možda nije prikladan. Prije nego što se ova ispitna metoda primijeni na smjesi radi dobivanja podataka za predviđenu regulatornu svrhu, potrebno je razmotriti mogu li se njome dobiti primjereni rezultati za tu svrhu te ako mogu, zašto. Takva razmatranja nisu potrebna ako postoji regulatorni zahtjev za ispitivanje smjese. NAČELO ISPITNE METODE Životinje se na odgovarajući način izlažu ispitivanoj kemikaliji. Ako se upotrebljava koštana srž, životinje se humano eutanaziraju u prikladnom trenutku nakon tretiranja, uzima se koštana srž te se pripremaju mikroskopski preparati koji se zatim boje (9., 10., 11., 12., 13., 14. i 15.). Kada se upotrebljava periferna krv, u prikladnom trenutku nakon tretiranja uzima se krv te se pripremaju mikroskopski preparati koji se zatim boje (12., 16., 17. i 18.). Ako se tretiranje provodi akutno, važno je odabrati vrijeme uzimanja koštane srži i krvi u koje se može otkriti nastanak nezrelih eritrocita s mikronukleusima koji je povezan s tretiranjem. U slučaju uzorkovanja periferne krvi, mora proći dovoljno vremena kako bi došlo do pojave tih događaja u cirkulirajućoj krvi. Prisutnost mikronukleusa u preparatima analizira se vizualizacijom uz uporabu mikroskopa, analizom slike, protočnom citometrijom ili citometrijom s laserskim skeniranjem. PROVJERA OSPOSOBLJENOSTI LABORATORIJA Istraživanja osposobljenosti Kako bi se utvrdilo dostatno iskustvo u provedbi testa prije njegove uporabe za rutinsko ispitivanje, laboratorij bi trebao dokazati sposobnost stvaranja očekivanih rezultata na temelju objavljenih podataka (17., 19., 20., 21. i 22.) za učestalosti mikronukleusa s najmanje dvije kemikalije pozitivnih kontrola (uključujući slabe odgovore izazvane niskom dozom pozitivnih kontrola), kao što su one navedene u tablici 1., i s kompatibilnim kontrolama s nosačem/otapalom (vidjeti stavak 26.). U tim bi se pokusima trebale upotrebljavati doze na temelju kojih se dobivaju ponovljiva povećanja povezana s dozom i dokazuju osjetljivost i dinamički raspon ispitnog sustava u pogledu ciljnog tkiva (koštane srži ili periferne krvi) uz uporabu metode vrednovanja koja će se upotrebljavati u laboratoriju. Taj se zahtjev ne odnosi na laboratorije s iskustvom, odnosno laboratorije s bazom ranijih podataka koja je stavljena na raspolaganje u skladu s definicijom iz stavaka od 14. do 18. Podaci o prijašnjim kontrolama Tijekom istraživanja osposobljenosti laboratorij bi trebao utvrditi:
Pri prvom prikupljanju podataka za distribuciju prijašnjih negativnih kontrola istodobne negativne kontrole trebale bi biti u skladu s objavljenim podacima o kontrolama, ako oni postoje. Nakon što se distribuciji prijašnjih kontrola doda još podataka o pokusima, paralelne negativne kontrole trebale bi u idealnim okolnostima biti unutar kontrolnih granica od 95 % te distribucije. Baza podataka o prijašnjim negativnim kontrolama laboratorija trebala bi biti statistički čvrsta kako bi se osigurala sposobnost laboratorija za ocjenjivanje distribucije podataka o negativnim kontrolama. U literaturi je navedeno da može biti potrebno najmanje deset pokusa, ali bilo bi poželjno da podaci obuhvaćaju najmanje 20 pokusa provedenih u usporedivim pokusnim uvjetima. Laboratoriji bi trebali primjenjivati metode za kontrolu kvalitete, kao što su kontrolni dijagrami (npr. C-dijagrami ili X-stupčasti dijagrami (23.)), kako bi utvrdili koliko su promjenjivi njihovi podaci i dokazali da je u njihovom laboratoriju metodologija ‚pod kontrolom’. Daljnje preporuke o tome kako uspostaviti i upotrebljavati ranije podatke (npr. kriterije za uključivanje podataka u ranije podatke i za isključivanje iz njih i kriterije prihvatljivosti za određeni pokus) mogu se pronaći se u literaturi (24.). Ako laboratorij ne provede dovoljan broj pokusa za utvrđivanje statistički čvrste distribucije negativnih kontrola (vidjeti stavak 15.) tijekom istraživanja osposobljenosti (kako je opisano u stavku 13.), prihvatljiva je uspostava distribucije tijekom prvih rutinskih ispitivanja. Taj bi pristup trebao biti u skladu s preporukama iz literature (24.), a rezultati dobiveni negativnim kontrolama u tim pokusima trebali bi biti u skladu s objavljenim podacima o negativnim kontrolama. Sve izmjene protokola pokusa trebalo bi razmotriti s obzirom na to je li njihov učinak na dobivene podatke ostao u skladu s postojećom bazom podataka laboratorija o prijašnjim kontrolama. Samo veće neusklađenosti trebale bi za posljedicu imati uspostavljanje nove baze podataka o prijašnjim kontrolama, pri čemu se na temelju stručne prosudbe utvrđuje da je riječ o razlici u odnosu na prijašnju distribuciju (vidjeti stavak 15.). Tijekom ponovnog uspostavljanja možda neće biti potrebna potpuna baza podataka o negativnim kontrolama za provedbu stvarnog ispitivanja pod uvjetom da laboratorij može dokazati da su vrijednosti paralelnih negativnih kontrola ostale u skladu s prijašnjom bazom podataka ili s odgovarajućim objavljenim podacima. Podaci o negativnim kontrolama trebali bi uključivati pojavnost nezrelih eritrocita s mikronukleusima kod svake životinje. Istodobne negativne kontrole trebale bi u idealnim okolnostima biti unutar kontrolnih granica od 95 % za distribuciju baze podataka laboratorija o prijašnjim negativnim kontrolama. Ako su podaci o paralelnim negativnim kontrolama izvan kontrolnih granica od 95 %, njihovo je uključivanje u distribuciju prijašnjih kontrola prihvatljivo sve dok ti podaci nisu ekstremne netipične vrijednosti i ako postoje dokazi o tome da je ispitni sustav ‚pod kontrolom’ (vidjeti stavak 15.) i ako nema dokaza o tehničkoj ili ljudskoj pogrešci. OPIS METODE Preparati Odabir životinjske vrste Trebalo bi upotrebljavati zdrave mlade odrasle životinje sojeva koji se uobičajeno upotrebljavaju u laboratorijskim istraživanjima. Mogu se upotrebljavati miševi, štakori ili bilo koja druga prikladna vrsta sisavaca. Ako se upotrebljava periferna krv, mora se utvrditi da se uklanjanjem stanica s mikronukleusima iz krvotoka u slezeni ne ugrožava otkrivanje nastalih mikronukleusa kod odabranih vrsta. To je jasno dokazano za perifernu krv miševa i štakora (2.). U izvješću bi trebalo navesti znanstveno opravdanje za uporabu drugih vrsta osim štakora i miševa. Ako se upotrebljavaju druge vrste osim glodavaca, preporučuje se uvrštavanje mjerenja nastalih mikronukleusa u drugo prikladno ispitivanje toksičnosti. Uvjeti smještaja i hranjenja životinja U slučaju glodavaca, temperatura prostorije u kojoj se drže životinje trebala bi biti 22 °C (±3 °C). Iako bi u idealnim okolnostima relativna vlažnost trebala biti 50 – 60 %, ona bi trebala biti najmanje 40 %, a poželjno je da ne prelazi 70 %, osim tijekom čišćenja prostorije. Rasvjeta bi trebala biti umjetna uz izmjenu 12 sati svjetla i 12 sati mraka. Za hranjenje se može upotrebljavati konvencionalna laboratorijska hrana uz neograničenu količinu vode za piće. Na izbor prehrane može utjecati potreba da se na odgovarajući način umiješa ispitivana kemikalija, ako se ona daje u hrani. Glodavci bi trebali biti smješteni u malim skupinama (ne više od pet po kavezu) istog spola i skupine za tretiranje ako se ne očekuje agresivno ponašanje, po mogućnosti u kavezima s čvrstim podom i uz prikladno obogaćivanje okoliša. Životinje se mogu držati u zasebnim nastambama samo ako je to znanstveno opravdano. Priprema životinja Uobičajeno se upotrebljavaju zdrave mlade odrasle životinje (u slučaju glodavaca, u idealnim okolnostima životinje u dobi od šest do deset tjedana na početku tretiranja, iako su prihvatljive i nešto starije životinje) koje se nasumično određuju za kontrolne i skupine i skupine za tretiranje. Pojedinačne životinje identificiraju se jedinstvenom humanom, najmanje invazivnom metodom (npr. prstenovanjem, stavljanjem oznaka, mikročipiranjem ili biometrijskom identifikacijom, ali ne rezanjem uha ili prsta) i prilagođavaju laboratorijskim uvjetima najmanje pet dana. Kaveze bi trebalo rasporediti tako da se učinci do kojih bi moglo doći zbog položaja kaveza svedu na minimum. Trebalo bi izbjegavati unakrsnu kontaminaciju pozitivnom kontrolom i ispitivanom kemikalijom. Na početku studije variranje tjelesne mase životinja trebalo bi biti što manje i ne bi trebalo prelaziti ±20 % odgovarajuće srednje vrijednosti mase svakog spola. Priprema doza Prije no što se doza da životinjama, krute ispitivane kemikalije trebalo bi otopiti ili suspendirati u prikladnim otapalima ili nosačima ili dodati hrani ili vodi za piće. Tekuće ispitivane kemikalije mogu se dozirati izravno ili razrijediti prije doziranja. Ako se unose inhaliranjem, ispitivane kemikalije mogu se primijeniti u obliku plina, pare ili krutog/tekućeg aerosola, ovisno o njihovim fizikalno-kemijskim svojstvima. Ako prema podacima o stabilnosti skladištenje nije prihvatljivo i ako nisu utvrđeni prikladni uvjeti skladištenja, preparate ispitivane kemikalije trebalo bi upotrebljavati svježe. Ispitni uvjeti Otapalo/nosač Pri visinama doza koje se primjenjuju otapalo/nosač ne bi trebali imati toksične učinke i ne bi trebala postojati sumnja da bi mogli kemijski reagirati s ispitivanim kemikalijama. Ako se upotrebljavaju otapala/nosači koji nisu dobro poznati, njihovo uključivanje u ispitivanje trebalo bi potkrijepiti referentnim podacima kojima se dokazuje njihova usklađenost. Kad god je to moguće preporučuje se najprije razmotriti mogućnost primjene vodenog otapala/nosača. Primjeri uobičajeno korištenih usklađenih otapala/nosača uključuju vodu, fiziološku otopinu, otopinu metil-celuloze, otopinu soli natrijeve karboksimetilne celuloze, maslinovo ulje i kukuruzno ulje. Ako ne postoje raniji ili objavljeni podaci o kontrolama kojima se dokazuje da odabranim atipičnim otapalom/nosačem nije izazvana pojava mikronukleusa ili drugi štetni učinci, trebalo bi provesti početno istraživanje kako bi se utvrdila prihvatljivost kontrole s otapalom/nosačem. Kontrole Pozitivne kontrole U svako ispitivanje trebalo bi uobičajeno uključiti skupinu životinja tretiranih kemikalijom pozitivne kontrole. Od toga se može odstupiti ako je ispitni laboratorij dokazao osposobljenost za provedbu ispitivanja i uspostavio raspon prijašnjih pozitivnih kontrola. Ako nije uključena istodobna pozitivna kontrolna skupina, u svaki bi pokus trebalo uključiti kontrole vrednovanja (fiksirana i nebojena predmetna stakalca ili uzorke suspenzije stanica, ovisno o tome što je prikladno za metodu vrednovanja). Njih se može dobiti uključivanjem u vrednovanje istraživanja prikladnih referentnih uzoraka koji su dobiveni i pohranjeni iz zasebnog pozitivnog kontrolnog pokusa koji se provodi periodično (npr. svakih šest do 18 mjeseci); na primjer, tijekom ispitivanja osposobljenosti laboratorija i redovito nakon toga, ako je to potrebno. Kemikalije pozitivne kontrole trebale bi pouzdano izazvati zamjetno povećanje učestalosti mikronukleusa iznad spontane razine. Kada se primjenjuje ručna analiza mikroskopom, doze pozitivnih kontrola trebalo bi odabrati tako da učinci budu jasni, ali da analitičar ne može odmah vidjeti identitet kodiranih uzoraka. Prihvatljiva je drukčija primjena pozitivnih kontrola u odnosu na primjenu ispitivane kemikalije, uz uporabu drukčijeg rasporeda tretiranja, te provedba uzorkovanja u samo jednom trenutku. Osim toga, može se razmotriti uporaba kemikalija pozitivne kontrole koje pripadaju istoj kategoriji opasnosti kao i ispitivana kemikalija, ako je to prikladno. Primjeri kemikalija pozitivne kontrole navedeni su u tablici 1. Tablica 1. Primjeri kemikalija pozitivne kontrole. Kemikalije i CAS br. Etil metansulfonat [CAS br. 62-50-0] Metil metansulfonat [CAS br. 66-27-3] Etil-nitrozourea [CAS br. 759-73-9] Mitomicin C [CAS br. 50-07-7] Ciklofosfamid (monohidrat) [CAS br. 50-18-0 (CAS br. 6055-19-2)] Trietilenmelamin [CAS br. 51-18-3] Kolhicin [CAS br. 64-86-8] ili vinblastin [CAS br. 865-21-4] – kao aneugeni Negativne kontrole Životinje iz negativnih kontrolnih skupina trebalo bi uključiti kod svakog uzorkovanja te bi s njima trebalo postupati jednako kao i sa skupinama za tretiranje, uz izostanak tretiranja ispitivanom kemikalijom. Ako se pri primjeni ispitivane kemikalije upotrebljava nosač/otapalo, kontrolna skupina trebala bi dobiti taj nosač / to otapalo. Međutim, ako se podacima o prijašnjim negativnim kontrolama dokažu dosljedna varijabilnost među životinjama i učestalost stanica s mikronukleusima za svako vrijeme uzorkovanja za ispitni laboratorij, za negativnu kontrolu može biti potrebno samo jedno uzorkovanje. Ako se za negativne kontrole upotrebljava samo jedno uzorkovanje, to bi trebalo biti vrijeme prvog uzorkovanje u istraživanju. Ako se upotrebljava periferna krv, za kratkotrajna istraživanja prihvatljiv je uzorak uzet prije tretiranja umjesto istodobne negativne kontrole ako su dobiveni podaci u skladu s bazom podataka o prijašnjim kontrolama za ispitni laboratorij. Za štakore je dokazano da uzorkovanje malih volumena prije tretiranja (npr. manje od 100 μl/dan) ima minimalan učinak na osnovnu učestalost mikronukleusa (25.). POSTUPAK Broj i spol životinja Općenito, odgovor mikronukleusa sličan je kod mužjaka i ženki i stoga se većina istraživanja može provesti na bilo kojem spolu (26.). Podacima kojima se dokazuju relevantne razlike između mužjaka i ženki (npr. razlike u sustavnoj toksičnosti, metabolizmu, bioraspoloživosti, toksičnosti za koštanu srž itd., uključujući npr. istraživanje o utvrđivanju raspona) potaknula bi se uporaba obaju spolova. U tom slučaju može biti prikladno provesti istraživanje na oba spola, npr. kao dio istraživanja toksičnosti nakon ponovljene doze. Ako se upotrebljavaju oba spola, bilo bi primjereno primijeniti faktorski model. U Dodatku 2. navedeni su detalji o načinu analize podataka primjenom tog modela. Na početku istraživanja trebalo bi utvrditi veličine skupina kako bi se po skupini osiguralo minimalno pet životinja istog spola, ili svakog spola ako se upotrebljavaju oba spola, prikladnih za analizu. U slučajevima kad izloženost ljudi nekoj kemikaliji može biti povezana sa spolom, kao što je slučaj s nekim farmaceutskim sredstvima, ispitivanje bi trebalo obaviti na životinjama odgovarajućeg spola. Kao smjernica za maksimalne uobičajene zahtjeve u pogledu životinja, za istraživanje koštane srži koje se provodi u skladu s parametrima utvrđenima u stavku 37. s tri skupine koje primaju dozu i paralelnim negativnim i pozitivnim kontrolnim skupinama (pri čemu se svaka skupina sastoji od pet životinja istog spola) bilo bi potrebno od 25 do 35 životinja. Visine doza Ako se provodi preliminarno istraživanje o utvrđivanju raspona jer nisu već na raspolaganju prikladni podaci kao pomoć u odabiru doza, ono bi se trebalo provesti u istom laboratoriju uz uporabu iste vrste, soja, spola i postupaka tretiranja kao i u glavnom istraživanju (27.). Cilj istraživanja trebao bi biti utvrđivanje maksimalne doze tolerancije (MTD), koja je definirana kao najviša doza koja će se tolerirati bez dokaza o toksičnosti, povezane s ograničavanjem istraživanja (na primjer izazivanjem smanjenja tjelesne mase ili hematopoetske sustavne citotoksičnosti, isključujući smrt ili dokaze o boli, patnji ili stresu zbog kojih se zahtijeva humana eutanazija (28.). Najviša doza može biti definirana i kao doza koja izaziva toksičnost za koštanu srž (npr. smanjenje udjela nezrelih eritrocita u ukupnom broju eritrocita u koštanoj srži ili perifernoj krvi za više od 50 %, ali ne manje od 20 % kontrolne vrijednosti). Međutim, pri analizi stanica pozitivnih na CD71 u perifernoj krvi (npr. u protočnoj citometriji), taj vrlo mladi dio nezrelih eritrocita odgovara na toksične izazove brže od veće kohorte nezrelih eritrocita pozitivnih na RNK. Stoga viša prividna toksičnost može biti vidljiva kod modela akutnog izlaganja u okviru kojih se ispituje dio nezrelih eritrocita pozitivnih na CD71 u usporedbi s modelima u kojima se utvrđuju nezreli eritrociti na temelju sadržaja RNK. Zbog toga se u slučaju pokusa u kojima tretiranje traje pet ili manje dana najviša doza za ispitivane kemikalije koje uzrokuju toksičnost može definirati kao doza koja uzrokuje statistički značajno smanjenje udjela nezrelih eritrocita pozitivnih na CD71 u ukupnom broju eritrocita, ali koja nije manja od 5 % kontrolne vrijednosti (29.). Kemikalije koje pokazuju zasićenost toksikokinetičkih svojstava ili koje izazivaju postupke detoksifikacije koji mogu dovesti do smanjene izloženosti nakon dugotrajne primjene mogu se izuzeti iz kriterija u pogledu određivanja doza i trebalo bi ih ocijeniti od slučaja do slučaja. Kako bi se dobile informacije o odgovoru na dozu, potpuno istraživanje trebalo bi uključivati negativnu kontrolnu skupinu i minimalno tri visine doze pri čemu je svaka uglavnom dvostruko veća od prethodne, ali najviše četverostruko. Ako ispitivana kemikalija ne izaziva toksičnost u okviru istraživanja o utvrđivanju raspona ili na temelju postojećih podataka, najviša doza u razdoblju primjene od 14 dana ili više trebala bi biti 1 000 mg/kg tjelesne mase dnevno, a ako je razdoblje primjene kraće od 14 dana, 2 000 mg/kg/ tjelesne mase dnevno. Međutim, ako ispitivana kemikalija uzrokuje toksičnost, MTD bi trebao biti najviša primijenjena doza i poželjno je da se visinama doze obuhvati raspon od maksimalne doze do doze koja izaziva malu toksičnost ili ne izaziva toksičnost. Ako je toksičnost ciljnog tkiva (koštane srži) zapažena pri svim ispitanim razinama doza, preporučuje se daljnje istraživanje pri netoksičnim dozama. Za istraživanja čiji je cilj potpunije opisati kvantitativne informacije o odgovoru na dozu mogu biti potrebne dodatne skupine koje primaju dozu. Za određene vrste ispitivanih kemikalija (npr. za farmaceutske proizvode namijenjene ljudima) obuhvaćene posebnim zahtjevima ta se ograničenja mogu razlikovati. Granično ispitivanje Ako se pokusima o utvrđivanju raspona ili postojećim podacima o srodnim sojevima životinja dokaže da se postupkom tretiranja koji uključuje najmanje graničnu dozu (opisanu u nastavku) ne uzrokuju vidljivi toksični učinci (uključujući izostanak smanjenja proliferacije koštane srži ili druge dokaze o citotoksičnosti za ciljno tkivo) i ako se genotoksičnost ne očekuje na temelju in vitro istraživanja genotoksičnosti ili podataka o strukturno srodnim kemikalijama, potpuno istraživanje uz primjenu tri razine doza ne smatra se potrebnim, pod uvjetom da je dokazano da su ispitivane kemikalije dospjele do ciljnog tkiva (koštane srži). U takvim slučajevima može biti dovoljna jedna razina doze pri graničnoj dozi. Za razdoblje primjene od 14 dana ili više granična je doza 1 000 mg/kg tjelesne mase dnevno. Za razdoblje primjene od 14 dana ili manje granična je doza 2 000 mg/kg tjelesne mase dnevno. Primjena doza Pri planiranju testa u obzir bi trebalo uzeti očekivani način ljudske izloženosti. Stoga se, ako je to opravdano, mogu odabrati načini izlaganja kao što su unos hrane, unos vode za piće, lokalno potkožno, intravenozno, oralno (sondom), inhalacija, primjena u dušnik ili implantacija. U svakom slučaju, način izlaganja trebalo bi odabrati tako da se osigura prikladno izlaganje ciljnog tkiva. Intraperitonealna injekcija općenito se ne preporučuje jer nije način izlaganja namijenjen ljudima i trebalo bi je upotrebljavati samo uz posebno znanstveno opravdanje. Ako se ispitivana kemikalija dodaje hrani ili vodi za piće, posebno u slučaju primjene jedne doze, trebalo bi voditi računa o tome da se osigura dostatno vrijeme od unosa hrane i vode do uzorkovanja kako bi se omogućilo otkrivanje učinaka (vidjeti stavak 37.). Maksimalni volumen tekućine koji se odjednom može primijeniti sondom ili injekcijom ovisi o veličini ispitne životinje. Taj volumen uobičajeno ne bi trebao biti veći od 1 ml/100 g tjelesne mase, osim u slučaju vodenih otopina gdje je dopušteno upotrijebiti maksimalno 2 ml/100 g tjelesne mase. Opravdanost primjene većih volumena od navedenog trebalo bi dokazati. Osim kod nadražujućih ili nagrizajućih ispitivanih kemikalija, za koje je uobičajeno da u većim koncentracijama izazivaju intenzivnije učinke, variranje ispitnih volumena trebalo bi podešavanjem koncentracije svesti na minimum kako bi se kod primjene svih visina doze osigurao stalni volumen u odnosu na tjelesnu masu. Plan tretiranja Poželjna je primjena dvaju ili više tretmana u intervalima od 24 sata, posebno ako je ovo ispitivanje sastavni dio drugih ispitivanja toksičnosti. Druga je mogućnost primjena jednog tretmana ako je to znanstveno opravdano (npr. ako je poznato da ispitivane kemikalije blokiraju stanični ciklus). Ispitivane kemikalije mogu se primjenjivati i u podijeljenoj dozi, odnosno kao dva ili više tretmana u istom danu u razmaku od najviše dva do tri sata, kako bi se olakšalo davanje velikog volumena. U tim okolnostima ili pri primjeni ispitivane kemikalije inhalacijom, vrijeme uzorkovanja trebalo bi planirati na temelju vremena posljednje doze ili završetka izlaganja. Ispitivanje se može provoditi na miševima ili štakorima na jedan od sljedeća tri načina.
Ako je to relevantno i znanstveno opravdano te u cilju lakšeg uključivanja u druga ispitivanja toksičnosti, mogu se upotrebljavati drugi postupci primjene doza ili uzimanja uzoraka. Zapažanja Opća klinička zapažanja o ispitnim životinjama i kliničke znakove trebalo bi bilježiti najmanje jednom dnevno, po mogućnosti svaki dan u isto vrijeme, vodeći računa o razdoblju najvećeg intenziteta očekivanih učinaka nakon primjene doze. Najmanje dva puta dnevno tijekom razdoblja primjene doze trebalo bi provjeriti ima li slučajeva morbiditeta ili mortaliteta životinja. Sve bi životinje trebalo izvagati na početku istraživanja, najmanje jednom tjedno tijekom istraživanja s ponovljenim dozama i pri eutanaziji. U istraživanjima koja traju najmanje tjedan dana trebalo bi najmanje jednom tjedno mjeriti unos hrane. Ako se ispitivana kemikalija daje s vodom za piće, pri svakoj promjeni vode i najmanje jednom tjedno trebalo bi mjeriti i unos vode. Životinje u kojih su vidljivi nesmrtonosni pokazatelji prekomjerne toksičnosti trebalo bi humano eutanazirati prije završetka ispitnog razdoblja (28.). U određenim okolnostima mogla bi se pratiti tjelesna temperatura životinja jer se navodi da su hipertermija i hipotermija izazvane tretiranjem dovele do netočnih rezultata (32., 33. i 34.). Izlaganje ciljnog tkiva Uzorak krvi trebalo bi uzeti u prikladnom trenutku / prikladnim trenucima kako bi se omogućilo istraživanje razina plazme ispitivane kemikalije u cilju dokazivanja da je došlo do izlaganja koštane srži, ako je to opravdano i ako ne postoje drugi podaci o izlaganju (vidjeti stavak 48.). Preparati koštane srži / krvi Stanice koštane srži uobičajeno se uzimaju iz femura ili tibije životinja odmah nakon humane eutanazije. Stance se uobičajeno uklanjaju, pripremaju i boje primjenom utvrđenih metoda. Male količine periferne krvi mogu se uzeti, u skladu s odgovarajućim standardima dobrobiti životinja, primjenom metode kojom se omogućuje preživljavanje ispitne životinje, kao što je krvarenje iz repne vene ili druge prikladne krvne žile, ili punkcijom srca ili uzorkovanjem iz velike žile pri eutanaziji životinje. Ovisno o metodi analize, za eritrocite dobivene iz koštane srži ili periferne krvi, stanice se mogu odmah supravitalno obojiti (16., 17. i 18.), nakon čega se preparati razmaza pripremaju i boje za mikroskopiju ili se fiksiraju i boje na prikladan način za analizu protočnom citometrijom. Uporabom boja specifičnih za DNK [kao što su npr. akridin oranž (35.) ili Hoechst 33258 i pironin-Y (36.)] mogu se ukloniti neki od artefakta povezanih s uporabom boja koje nisu specifične za DNK. Ta prednost ne isključuje uporabu konvencionalnih boja (kao što je npr. Giemsa za mikroskopsku analizu). Mogu se upotrebljavati i dodatni sustavi [npr. celulozne kolone za uklanjanje stanica s nukleusom (37. i 38.)], pod uvjetom da je dokazano da su ti sustavi usklađeni s pripremom uzoraka u laboratoriju. Ako su te metode primjenjive, za utvrđivanje naravi mikronukleusa (kromosoma / fragmenata kromosoma) mogu se upotrebljavati antikinetohorna antitijela (39.), fluorescentna in situ hibridizacija (FISH) pancentromernim sondama DNK (40.) ili primarno in situ označavanje početnicama specifičnima za pancentromere, zajedno s prikladnim protubojenjem DNK (41.), kako bi se utvrdilo je li mehanizam nastajanja mikronukleusa posljedica klastogenog i/ili aneugenog djelovanja. Za razlikovanje između klastogena i aneugena mogu se primjenjivati i druge metode ako su dokazano učinkovite. Analiza (ručna i automatska) Sva predmetna stakalca ili uzorke za analizu, uključujući i one za pozitivne i negativne kontrole, trebalo bi prije bilo kakve vrste analize neovisno kodirati i pregledati nasumično tako da analitičar ne zna za uvjete tretiranja; kodiranje nije nužno ako se primjenjuju sustavi za automatsko očitavanje koji se ne temelje na vizualnom pregledu i na koje ne može utjecati pristranost ispitivača. Za svaku se životinju utvrđuje udio nezrelih eritrocita u ukupnom broju (nezrelih + zrelih) eritrocita tako da se ukupno prebroji najmanje 500 eritrocita kada je u pitanju koštana srž i 2 000 eritrocita kada je u pitanju periferna krv (42.). Za utvrđivanje pojavnosti nezrelih eritrocita s mikronukleusima za svaku bi životinju trebalo pregledati najmanje 4 000 nezrelih eritrocita (43.). Ako je u bazi podataka o prijašnjim negativnim kontrolama navedeno da je prosječna učestalost osnovne pojavnosti nezrelih eritrocita s mikronukleusima < 0,1 % u ispitnom laboratoriju, trebalo bi razmotriti vrednovanje dodatnih stanica. Prilikom analize uzoraka, udio nezrelih eritrocita u ukupnom broju eritrocita tretiranih životinja ne bi trebao biti manji od 20 % udjela u kontroli s nosačem/otapalom pri očitavanju mikroskopijom i ne bi trebao biti manji od približno 5 % udjela u kontroli s nosačem/otapalom pri očitavanju nezrelih eritrocita pozitivnih na CD71 citometrijskim metodama (vidjeti stavak 31.) (29.). Na primjer, kod testa koštane srži u kojem se za analizu primjenjuje mikroskop, ako je kontrolni udio nezrelih eritrocita u koštanoj srži 50 %, gornja granična vrijednost toksičnosti bila bi 10 % nezrelih eritrocita. Budući da se kod štakora eritrociti s mikronukleusima odvajaju i uništavaju u slezeni, za održavanje visoke razine osjetljivosti pri testu periferne krvi štakora poželjno je ograničiti analizu nezrelih eritrocita s mikronukleusima na najmlađi dio. Kada se primjenjuju metode automatske analize, najnezreliji eritrociti mogu se utvrditi na temelju njihova visokog sadržaja RNK ili visoke razine transferinskih receptora (CD71+) izraženih na njihovoj površini (31.). Međutim, izravnom usporedbom različitih metoda bojenja pokazalo se da se zadovoljavajući rezultati mogu dobiti različitim metodama, uključujući konvencionalno bojenje akridin oranžom (3. i 4.). PODACI I IZVJEŠĆIVANJE Obrada rezultata Podatke o pojedinačnim životinjama trebalo bi prikazati u tabličnom obliku. Za svaku bi analiziranu životinju trebalo posebno navesti broj pregledanih nezrelih eritrocita, broj nezrelih eritrocita s mikronukleusima i udio nezrelih eritrocita u ukupnom broju eritrocita. Ako se miševi neprekidno tretiraju četiri tjedna ili dulje, trebalo bi navesti i podatke o broju i udjelu zrelih eritrocita s mikronukleusima ako su prikupljeni. Trebalo bi bilježiti i podatke o toksičnosti za životinje i o kliničkim znakovima. Kriteriji prihvatljivosti Na temelju sljedećih kriterija utvrđuje se prihvatljivost ispitivanja:
Ocjenjivanje i tumačenje rezultata Pod uvjetom da su ispunjeni svi kriteriji prihvatljivosti, ispitivana kemikalija smatra se jasno pozitivnom:
Ako se u određeno vrijeme uzorkovanja ispituje samo najviša doza, ispitivana kemikalija smatra se jasno pozitivnom ako postoji statistički značajno povećanje u odnosu na istodobnu negativnu kontrolu i ako rezultati nisu uključeni u distribuciju povijesnih podataka o negativnim kontrolama (npr. kontrolne granice od 95 % prema Poissonovoj distribuciji). Preporuke za najprikladnije statističke metode nalaze se u literaturi (44., 45., 46. i 47.). Pri analizi odgovora na dozu trebalo bi analizirati najmanje tri skupine tretirane dozom. U statističkim ispitivanjima trebalo bi upotrebljavati životinju kao pokusnu jedinicu. Pozitivni rezultati u mikronukleus-testu znače da ispitivana kemikalija uzrokuje nastanak mikronukleusa, koji su posljedica oštećenja kromosoma ili oštećenja mitotskog aparata eritroblasta ispitne vrste. Ako je ispitivanje provedeno radi otkrivanja centromera unutar mikronukleusa, ispitivana kemikalija koja uzrokuje nastanak mikronukleusa s centromerima (centromernim DNK ili kinetohorom koji ukazuju na gubitak čitavog kromosoma) dokaz je da je ispitivana kemikalija aneugen. Pod uvjetom da su ispunjeni svi kriteriji prihvatljivosti, ispitivana kemikalija smatra se jasno negativnom ako u svim ispitanim pokusnim uvjetima:
Preporuke za najprikladnije statističke metode nalaze se u literaturi (44., 45., 46. i 47.). Dokaz o izlaganju koštane srži ispitivanoj kemikaliji može uključivati smanjenje omjera nezrelih i zrelih eritrocita ili mjerenje razina plazme ili krvi ispitivane kemikalije. U slučaju intravenozne primjene, nije potreban dokaz o izlaganju. Kao druga mogućnosti, podaci o apsorpciji, distribuciji, metabolizmu i eliminaciji (ADME), dobiveni u okviru neovisnog istraživanja u kojem su se upotrebljavali jednaki način izlaganja i jednaka vrsta, mogu se upotrijebiti za dokazivanje izlaganja koštane srži. Negativni rezultati znače da ispitivana kemikalija u ispitnim uvjetima ne uzrokuje nastanak mikronukleusa u nezrelim eritrocitima ispitne vrste. Jasan pozitivan ili negativan odgovor nije potrebno provjeriti. Ako odgovor nije jasno negativan ili pozitivan i kako bi se pridonijelo utvrđivanju biološke relevantnosti rezultata (npr. blago ili granično povećanje), podatke bi trebalo ocjenjivati na temelju stručne prosudbe i/ili daljnjih istraživanja postojećih završenih pokusa. U nekim slučajevima može biti korisno analizirati više stanica ili provesti ponovljeni pokus uz primjenu izmijenjenih pokusnih uvjeta. U rijetkim slučajevima, čak i nakon daljnjih istraživanja, neće biti moguće na temelju dobivenih podataka donijeti zaključak da ispitivana kemikalija uzrokuje pozitivne ili negativne rezultate, te će se stoga zaključiti da je istraživanje dvosmisleno. Izvješće o ispitivanju Izvješće o ispitivanju trebalo bi sadržavati sljedeće informacije:
LITERATURA
Dodatak 1. DEFINICIJE Centromera : područje ili područja kromosoma s kojima su tijekom stanične diobe povezane niti diobenog vretena, čime se omogućuje uredno kretanje kromosoma kćeri prema polovima stanica kćeri. Kemikalija : tvar ili smjesa. Eritroblast : rani stadij razvoja eritrocita, koji neposredno prethodi stadiju nezrelog eritrocita, gdje stanica još uvijek sadržava nukleus. Kinetohor : proteinska struktura koja nastaje na centromeri eukariotskih stanica s pomoću koje se kromosom povezuje s mikrotubulnim polimerima iz mitotskog diobenog vretena tijekom mitoze i mejoze i koja tijekom diobe stanica razdvaja sestrinske kromatide. Mikronukleusi : maleni nukleusi (jezgre), koji se nalaze uz glavne stanične jezgre i od njih su odvojeni, koje tijekom telofaze mitoze ili mejoze proizvode zaostali fragmenti kromosoma ili čitavi kromosomi. Normokromatski ili zreli eritrocit : potpuno sazreli eritrocit koji je izgubio rezidualni RNK zaostao nakon enukleacije i/ili koji je izgubio druge stanične markere kratkog vijeka kojima je svojstveno da nestanu nakon enukleacije poslije konačne diobe eritroblasta. Polikromatski ili nezreli eritrocit : novonastali eritrocit u prijelaznom razvojnom stadiju koji se zbog prisutnosti rezidualnog RNK u novonastaloj stanici može obojiti plavim i crvenim komponentama klasičnih bojila krvi kao što je Wrightova Giemsa. Takve novonastale stanice približno su jednake retikulocitima, koji postaju vidljivi primjenom vitalne boje zbog koje iz rezidualnog RNK grudanjem nastaje retikulum. Druge metode, uključujući monokromatsko bojenje RNK fluorescentnim bojama ili označavanje površinskih markera kratkog vijeka, kao što je CD71, fluorescentnim antitijelima, danas se često primjenjuju za utvrđivanje novonastalih crvenih krvnih stanica. Polikromatski eritrociti, retikulociti i eritrociti pozitivni na CD71 nezreli su eritrociti, iako svaka od skupina ima donekle drukčiju dobnu raspodjelu. Retikulocit : Novonastali eritrocit obojen vitalnom bojom zbog koje iz rezidualnog staničnog RNK grudanjem nastaje svojstveni retikulum. Retikulociti i polikromatski eritrociti imaju sličnu staničnu dobnu raspodjelu. Ispitivana kemikalija : sve tvari ili smjese koje se ispituju ovom ispitnom metodom. Dodatak 2. FAKTORSKI MODEL ZA UTVRĐIVANJE RAZLIKA MEĐU SPOLOVIMA U IN VIVO MIKRONUKLEUS-TESTU Faktorski model i njegova analiza U okviru faktorskog modela ispituje se minimalno pet mužjaka i pet ženki pri svakoj razini koncentracije, a posljedica je model s minimalno 40 životinja (20 mužjaka i 20 ženki plus relevantne pozitivne kontrole). Model, koji je jedan od jednostavnijih faktorskih modela, istovjetan je dvosmjernoj analizi varijance (ANOVA) sa spolom i razinom koncentracije kao glavnim učincima. Podaci se mogu analizirati primjenom mnogih standardnih statističkih softverskih paketa kao što su SPSS, SAS, STATA i Genstat, kao i primjenom R. Analizom se varijabilnost skupa podataka razdjeljuje na varijabilnost između spolova, varijabilnost među koncentracijama i varijabilnost koja je povezana s interakcijom između spolova i koncentracija. Svaka od vrijednosti ispituje se u odnosu na procijenjenu varijabilnost među životinja iz skupina životinja istog spola kojima je dana jednaka koncentracija. Potpuni podaci o osnovnoj metodologiji dostupni su u brojnim standardnim statističkim priručnicima (vidjeti literaturu) i sadržajima za pomoć osiguranima u okviru statističkih paketa. U analizi se nakon toga ispituje vrijednost interakcije spol x koncentracija u ANOVA tablici (6). U slučaju izostanka značajne vrijednosti interakcije, kombiniranim vrijednostima za spolove ili razine koncentracije osiguravaju se valjanja statistička ispitivanja među razinama na temelju vrijednosti varijabilnosti ANOVA-e objedinjena unutar skupine. Analiza se nastavlja razdjeljivanjem procijenjene varijabilnosti među koncentracijama na kontraste kojima se osigurava ispitivanje linearnih i kvadratnih kontrasta odgovora unutar razina koncentracije. Ako je prisutna značajna interakcija spol x koncentracija, ta se vrijednost jednako tako može razdijeliti na linearne kontraste interakcije x spol i kvadratne kontraste interakcije x spol. Na temelju tih vrijednosti provode se ispitivanja kojima se utvrđuje jesu li odgovori na koncentraciju paralelni za oba spola odnosno postoji li razlika u odgovoru između dvaju spolova. Procijenjena varijabilnost, koja je objedinjena unutar skupine, može se upotrijebiti za provedbu ispitivanja parova za utvrđivanje razlike između srednjih izmjerenih vrijednosti. Usporedbe se mogu napraviti između srednjih izmjerenih vrijednosti za oba spola i među srednjim izmjerenim vrijednostima za različite razine koncentracije, kao, na primjer, za usporedbe s negativnim kontrolnim razinama. U slučajevima značajne interakcije može se napraviti usporedba među srednjim izmjerenim vrijednostima za različite koncentracije unutar spola ili između srednjih izmjerenih vrijednosti za spolove pri jednakoj koncentraciji. Literatura Mnogo je statističkih priručnika u kojima se raspravlja o teoriji, planiranju, metodologiji, analizi i tumačenju faktorskih modela, od najjednostavnijih analiza s dva čimbenika do složenijih oblika koji se primjenjuju u metodologiji ‚planiranja pokusa’. U nastavku se nalazi nepotpuni popis. U nekima od priručnika navedeni su razrađeni primjeri usporedivih modela, u određenim slučajevima s kodom za provedbu analiza uz primjenu različitih softverskih paketa.
|
|
(6) |
U dijelu B briše se poglavlje B.15. |
|
(7) |
U dijelu B briše se poglavlje B.16. |
|
(8) |
U dijelu B briše se poglavlje B.18. |
|
(9) |
U dijelu B briše se poglavlje B.19. |
|
(10) |
U dijelu B briše se poglavlje B.20. |
|
(11) |
U dijelu B briše se poglavlje B.24. |
|
(12) |
U dijelu B poglavlje B.47. zamjenjuje se sljedećim: „B.47. Metoda ispitivanja zamućenja i propusnosti goveđe rožnice za utvrđivanje i. kemikalija koje izazivaju tešku ozljedu oka i ii. kemikalija koje nije potrebno razvrstati s obzirom na nadraživanje oka ili tešku ozljedu oka UVOD Ova ispitna metoda odgovara Smjernici OECD-a za ispitivanje 437 (2013.). Metodu ispitivanja zamućenja i propusnosti goveđe rožnice (BCOP) ocijenio je Međuagencijski koordinacijski odbor za validaciju alternativnih metoda (ICCVAM) u suradnji s Europskim centrom za validaciju alternativnih metoda (ECVAM) i Japanskim centrom za validaciju alternativnih metoda (JaCVAM) 2006. i 2010. (1. i 2.). Tijekom prvog ocjenjivanja BCOP ispitne metode ocjenjivala se njezina korisnost pri utvrđivanju kemikalija (tvari i smjesa) koje izazivaju tešku ozljedu oka (1.). Tijekom drugog ocjenjivanja BCOP ispitne metode ocjenjivala se njezina korisnost pri utvrđivanju kemikalija (tvari i smjesa) koje su nerazvrstane s obzirom na nadraživanje oka ili tešku ozljedu oka (2.) Validacijska baza podataka za validaciju sadržavala je ukupno 113 tvari i 100 smjesa (2. i 3.). Na temelju tih ocjenjivanja i njihova stručnog preispitivanja zaključeno je da se ispitnom metodom mogu točno utvrditi kemikalije (tvari i smjese) koje izazivaju tešku ozljedu oka (kategorija 1.) i one koje nije potrebno razvrstati s obzirom na nadraživanje oka ili tešku ozljedu oka, kako je utvrđeno Globalno usklađenim sustavom razvrstavanja i označivanja kemikalija (GHS) Ujedinjenih naroda (UN) (4.) i Uredbom (EZ) br. 1272/2008 o razvrstavanju, označivanju i pakiranju tvari i smjesa (CLP) (7), te je ona stoga odobrena kao znanstveno valjana u obje svrhe. Teška ozljeda oka znači oštećenje očnog tkiva ili ozbiljno fizičko pogoršanje vida nakon primjene ispitivane kemikalije na prednju površinu oka koji nisu potpuno reverzibilni u roku od 21 dana nakon primjene. Ispitivane kemikalije koje izazivaju tešku ozljedu oka razvrstane su u kategoriju 1. sustava UN GHS. Kemikalije koje su nerazvrstane s obzirom na nadraživanje oka ili tešku ozljedu oka definirane su kao one koje ne ispunjavaju zahtjeve za razvrstavanje u kategoriju 1. ili 2. (2.A ili 2.B) sustava UN GHS, odnosno one se navode kao kemikalije bez kategorije prema sustavu UN GHS. Ova ispitna metoda uključuje preporučenu uporabu i ograničenja BCOP ispitne metode na temelju njezinih ocjenjivanja. Glavne razlike između izvorne verzije Smjernice OECD-a za ispitivanje iz 2009. i ažurirane verzije iz 2013. odnose se, među ostalim, na: uporabu BCOP ispitne metode za utvrđivanje kemikalija koje nije potrebno razvrstati u skladu sa sustavom UN GHS (stavci 2. i 7.), pojašnjenja primjene BCOP ispitne metode na ispitivanje alkohola, ketona i krutih tvari (stavci 6. i 7.) te tvari i smjesa (stavak 8.), pojašnjenja kako bi trebalo ispitivati površinski aktivne tvari i smjese koje sadržavaju površinski aktivne tvari (stavak 28.), ažuriranja i pojašnjenja povezana s pozitivnim kontrolama (stavci 39. i 40), ažuriranje kriterija za donošenje odluke o BCOP ispitnoj metodi (stavak 47.), ažuriranje kriterija prihvatljivosti istraživanja (stavak 48.), ažuriranje elemenata izvješća o ispitivanju (stavak 49.), ažuriranje Dodatka 1. o definicijama, dodavanje Dodatka 2. o prediktivnoj sposobnosti BCOP ispitne metode u okviru različitih sustava razvrstavanja, ažuriranje Dodatka 3. o popisu kemikalija za ispitivanje osposobljenosti i ažuriranje Dodatka 4. o držaču rožnice za ispitivanje BCOP-a (stavak 1.) i o opacimetru (stavci 2. i 3.). Trenutačno je opće prihvaćena činjenica da se u doglednoj budućnosti in vivo Draizeovo ispitivanje na oku neće moći zamijeniti nijednim pojedinačnim in vitro ispitivanjem nadraživanja oka za predviđanje punog raspona nadraživanja za različite kemijske razrede. Međutim, kao zamjena za Draizeovo ispitivanje na oku mogu se primjenjivati strateške kombinacije nekoliko alternativnih ispitnih metoda u okviru strategije (višerazinskog) ispitivanja (5.). Pristup odozgo prema dolje (5.) trebalo bi primijeniti kada se na temelju postojećih informacija očekuje da će kemikalija imati veliki potencijal za nadražujuće djelovanje, dok bi se pristup odozdo prema gore (5.) trebao primijeniti kada se na temelju postojećih informacija očekuje da će nadraživanje oka koje prouzroči kemikalija biti takvo da će kemikaliju biti potrebno razvrstati. BCOP ispitna metoda je in vitro ispitna metoda koja se u određenim okolnostima i uz posebna ograničenja može primjenjivati za razvrstavanje i označivanje kemikalija prema opasnosti. Iako se ne smatra valjanom kao samostalna zamjena za in vivo ispitivanje na oku kunića, BCOP ispitna metoda preporučuje se kao početni korak u okviru ispitne strategije kao što je pristup odozgo prema dolje koji predlažu Scott et al. (5.) za utvrđivanje kemikalija koje izazivaju tešku ozljedu oka, odnosno kemikalija koje treba razvrstati u kategoriju 1. sustava UN GHS bez daljnjeg ispitivanja (4.). BCOP ispitna metoda preporučuje se i za utvrđivanje kemikalija koje nije potrebno razvrstati s obzirom na nadraživanje oka ili tešku ozljedu oka, kako je utvrđeno sustavom UN GHS (bez kategorije prema sustavu UN GHS (4.) u okviru ispitne strategije kao što je pristup odozdo prema gore (5.) Međutim, za kemikaliju za koju nije predviđeno da će uzrokovati tešku ozljedu oka ili da će biti nerazvrstana s obzirom na nadraživanje oka / tešku ozljedu oka na temelju BCOP ispitne metode bit će potrebno dodatno ispitivanje (in vitro i/ili in vivo) za utvrđivanje konačnog razvrstavanja. Svrha je ove ispitne metode opisati postupke koji se primjenjuju za ocjenjivanje potencijala opasnosti ispitivane kemikalije za oko mjerenog njezinom sposobnošću izazivanja zamućenja i povećane propusnosti izolirane goveđe rožnice. Toksični učinci na rožnicu mjere se: i. smanjenim prijenosom svjetlosti (zamućenjem) i ii. povećanim prolazom boje natrijevog fluoresceina (propusnošću). Ocjene zamućenja i propusnosti rožnice nakon izlaganja ispitivanoj kemikaliji kombiniraju se kako bi se dobila in vitro vrijednost nadražujućeg djelovanja (IVIS), koja se upotrebljava za razvrstavanje ispitivane kemikalije prema razini nadražujućeg djelovanja. Definicije su navedene u Dodatku 1. POČETNA RAZMATRANJA I OGRANIČENJA Ova se ispitna metoda temelji na protokolu ICCVAM-a za BCOP ispitnu metodu (6. i 7.), koji je izvorno razvijen na temelju informacija dobivenih iz protokola Instituta za in vitro znanosti (IIVS) i protokola INVITTOX 124. (8.). Potonji protokol primjenjivao se u predvalidacijskom istraživanju koje je naručila Europska zajednica i koje je provedeno 1997. i 1998. Oba su se protokola temeljila na BCOP ispitnoj metodi o kojoj su prvi izvijestili Gautheron et al. (9.). BCOP ispitna metoda može se primjenjivati za utvrđivanje kemikalija koje izazivaju tešku ozljedu oka kako je utvrđeno sustavom UN GHS, odnosno kemikalija koje treba razvrstati u kategoriju 1. sustava UN GHS (4.). Kada se primjenjuje u tu svrhu, BCOP ispitna metoda ima sveukupnu točnost od 79 % (150/191), stopu lažno pozitivnih rezultata od 25 % (32/126) i stopu lažno negativnih rezultata od 14 % (9/65) u odnosu na podatke dobivene metodom in vivo ispitivanja na oku kunića razvrstane u skladu sa sustavom razvrstavanja UN GHS (3.) (vidjeti tablicu 1. u Dodatku 2.). Ako se iz baze podataka isključe ispitivane kemikalije iz određenih kemijskih (tj. alkoholi, ketoni) ili fizikalnih (tj. krute tvari) kategorija, BCOP ispitna metoda ima sveukupnu točnost od 85 % (111/131), stopu lažno pozitivnih rezultata od 20 % (16/81) i stopu lažno negativnih rezultata od 8 % (4/50) u sustavu razvrstavanja UN GHS (3.). Mogući nedostaci BCOP ispitne metode kada se primjenjuje za utvrđivanje kemikalija koje izazivaju tešku ozljedu oka (kategorija 1. sustava UN GHS) temelje se na visokim stopama lažno pozitivnih rezultata za alkohole i ketone i visokoj stopi lažno negativnih rezultata za krute tvari zapaženih u validacijskoj bazi podataka (1., 2. i 3.). Međutim, budući da BCOP ispitnom metodom nisu precijenjeni rezultati za sve alkohole i ketone i budući da je za određene alkohole i ketone točno predviđena kategorija 1. sustava UN GHS, ne smatra se da su te dvije organske funkcionalne skupine izvan područja primjene ispitne metode. Na korisniku je ove ispitne metode da odluči o tome mogu li se prihvatiti mogući precijenjeni rezultati u pogledu određenog alkohola ili ketona ili bi trebalo provesti dodatno ispitivanje uz primjenu pristupa koji se temelji na ocjenjivanju snage dokaza. U pogledu stopa lažno negativnih rezultata za krute tvari, trebalo bi napomenuti da krute tvari mogu dovesti do promjenjivih i ekstremnih uvjeta izlaganja u in vivo Draizeovom ispitivanju nadraživanja oka, što za posljedicu može imati nevažna predviđanja u pogledu njihova stvarnog potencijala za nadražujuće djelovanje (10.). Jednako bi tako trebalo napomenuti da, u kontekstu utvrđivanja kemikalija koje izazivaju tešku ozljedu oka (kategorija 1. sustava UN GHS), nijedan lažno negativan rezultat utvrđen u validacijskoj bazi podataka ICCVAM-a (2. i 3.) nije za posljedicu imao IVIS ≤ 3, što je kriterij koji se primjenjuje kako bi se utvrdilo da je ispitivana kemikalija bez kategorije prema sustavu UN GHS. Nadalje, lažno negativni rezultati prema BCOP-u u tom kontekstu nisu kritični jer će se sve ispitivane kemikalije s rezultatom 3 < IVIS ≤ 55 naknadno ispitati drugim in vitro ispitivanjima potvrđenima na odgovarajući način ili, kao krajnja opcija, na kunićima, ovisno o regulatornim zahtjevima, uz primjenu strategije naknadnog ispitivanja i pristupa koji se temelji na ocjenjivanju snage dokaza. S obzirom na činjenicu da je BCOP ispitnom metodom točno predviđeno da određene krute kemikalije pripadaju kategoriji 1. sustava UN GHS, jednako se tako ne smatra da je to agregatno stanje izvan područja primjene ispitne metode. Istraživači bi mogli razmotriti primjenu ove ispitne metode za sve vrste kemikalija, pri čemu bi IVIS > 55 trebalo prihvatiti kao pokazatelj odgovora da kemikalija izaziva tešku ozljedu oka i da bi je bez daljnjeg ispitivanja trebalo razvrstati u kategoriju 1. sustava UN GHS. Međutim, kako je već navedeno, pozitivne rezultate dobivene s alkoholima ili ketonima trebalo bi oprezno tumačiti zbog potencijalno precijenjenih rezultata. BCOP ispitna metoda može se primjenjivati i za utvrđivanje kemikalija za koje nije potrebno razvrstavanje s obzirom na nadraživanje oka ili tešku ozljedu oka u skladu sa sustavom razvrstavanja UN GHS (4.). Kada se primjenjuje u tu svrhu, BCOP ispitna metoda ima sveukupnu točnost od 69 % (135/196), stopu lažno pozitivnih rezultata od 69 % (61/89) i stopu lažno negativnih rezultata od 0 % (0/107) u odnosu na podatke dobivene metodom in vivo ispitivanja na oku kunića razvrstane u skladu sa sustavom razvrstavanja UN GHS (3.) (vidjeti tablicu 2. u Dodatku 2.). Dobivena stopa lažno pozitivnih rezultata (in vivo kemikalije bez kategorije prema sustavu UN GHS koje imaju IVIS > 3, vidjeti stavak 47.) prilično je visoka, ali nije kritična u tom kontekstu jer će se sve ispitivane kemikalije s rezultatom 3 < IVIS ≤ 55 naknadno ispitati drugim in vitro ispitivanjima potvrđenima na odgovarajući način ili, kao krajnja opcija, na kunićima, ovisno o regulatornim zahtjevima, uz primjenu strategije sekvencijskog ispitivanja u okviru pristupa koji se temelji na ocjenjivanju snage dokaza. U BCOP ispitnoj metodi nisu zapaženi posebni nedostaci u pogledu ispitivanja alkohola, ketona i krutih tvari kada je cilj utvrđivanje kemikalija za koje nije potrebno razvrstavanje s obzirom na nadraživanje oka ili tešku ozljedu oka (bez kategorije prema sustavu UN GHS) (3.). Istraživači bi mogli razmotriti primjenu ove ispitne metode za sve vrste kemikalija, pri čemu bi negativan rezultat (IVIS ≤ 3) trebalo prihvatiti kao pokazatelj da nije potrebno razvrstavanje (bez kategorije prema sustavu UN GHS). Budući da se BCOP ispitnom metodom može točno utvrditi samo 31 % kemikalija za koje nije potrebno razvrstavanje s obzirom na nadraživanje oka ili tešku ozljedu oka, ova ispitna metoda ne bi trebala biti prvi izbor za pokretanje pristupa odozdo prema gore (5.) ako su na raspolaganju druge potvrđene i prihvaćene in vitro metode sa sličnom osjetljivošću, ali većom specifičnošću. Validacijska baza podataka za validaciju sadržavala je ukupno 113 tvari i 100 smjesa (2. i 3.). Stoga se smatra da je BCOP ispitna metoda primjenjiva za ispitivanje i tvari i smjesa. BCOP ispitna metoda ne preporučuje se za utvrđivanje ispitivanih kemikalija koje bi trebalo razvrstati kao kemikalije koje nadražuju oči (kategorija 2. ili kategorija 2.A sustava UN GHS) ili ispitivanih kemikalija koje bi trebalo razvrstati kao kemikalije koje blago nadražuju oči (kategorija 2.B sustava UN GHS) zbog znatnog broja kemikalija iz kategorije 1. sustava UN GHS koje su razvrstane u nedovoljno visoke kategorije 2., 2.A ili 2.B sustava UN GHS te zbog kemikalija bez kategorije prema sustavu UN GHS koje su razvrstane u previsoke kategorije 2., 2.A ili 2.B sustava UN GHS (2. i 3.). U tu svrhu može biti potrebno daljnje ispitivanje drugom prikladnom metodom. Svi postupci s goveđim očima i goveđim rožnicama trebali bi biti u skladu s primjenjivim propisima ustanove koja provodi ispitivanje i postupcima za rukovanje materijalom dobivenim od životinja, koji među ostalim uključuje tkiva i tkivne tekućine. Preporučuju se općenite mjere opreza za laboratorije (11.). Iako se u okviru BCOP ispitne metode ne razmatraju ozljede konjunktive i šarenice, razmatraju se učinci na rožnicu, koji su glavni pokretač in vivo razvrstavanja kad je riječ o razvrstavanju u skladu sa sustavom UN GHS. Reverzibilnost lezija rožnice ne može se sama po sebi ocijeniti BCOP ispitnom metodom. Na temelju istraživanja na oku kunića predloženo je da se za utvrđivanje određenih vrsta ireverzibilnih učinaka može primjenjivati ocjena početne dubine ozljede rožnice (12.). Međutim, potrebne su daljnje znanstvene spoznaje kako bi se razumjelo kako nastaju ireverzibilni učinci koji nisu povezani s početnom ozljedom visoke razine. Naposljetku, BCOP ispitnom metodom ne omogućuje se ocjena potencijala za sustavnu toksičnost povezanu s izlaganjem oka. Ovu će se ispitnu metodu povremeno ažurirati uzimajući u obzir nove informacije i podatke. Na primjer, histopatologija može biti korisna ako je potreban potpuniji opis oštećenja rožnice. Kako je istaknuto u Smjernici OECD-a br. 160 (13.), korisnike se potiče da konzerviraju rožnice i pripreme histopatološke uzorke koji se mogu upotrijebiti za izradu baze podataka i kriterija za donošenje odluka kojima se može dodatno poboljšati točnost ove ispitne metode. Svaki laboratorij koji je započeo s uspostavljanjem ove ispitne metode trebao bi upotrebljavati kemikalije za ispitivanje osposobljenosti navedene u Dodatku 3. Laboratorij može upotrebljavati te kemikalije kako bi dokazao svoju tehničku osposobljenost za provedbu BCOP ispitne metode prije dostave podataka o BCOP ispitnoj metodi u svrhu regulatornog razvrstavanja prema opasnosti. NAČELO ISPITIVANJA BCOP ispitna metoda organotipski je model kojim se osigurava kratkotrajno održavanje normalne fiziološke i biokemijske funkcije goveđe rožnice in vitro. U ovoj ispitnoj metodi oštećenje uzrokovano ispitivanom kemikalijom ocjenjuje se kvantitativnim mjerenjima promjena zamućenja i propusnosti rožnice opacimetrom odnosno spektrofotometrom vidljive svjetlosti. Oba mjerenja primjenjuju se za izračun IVIS-a, koji se upotrebljava kako bi se in vitro utvrđena kategorija razvrstavanja prema opasnosti nadraživanja mogla iskoristiti za in vivo procjenu potencijala neke ispitivane kemikalije da nadraži oko (vidjeti kriterije za donošenje odluke u stavku 48.). U BCOP ispitnoj metodi upotrebljavaju se izolirane rožnice iz očiju svježe zaklane stoke. Zamućenje rožnice mjeri se kvantitativno kao količina prijenosa svjetlosti kroz rožnicu. Propusnost se mjeri kvantitativno kao količina boje natrijeva fluoresceina koja prolazi punom debljinom rožnice, kako je detektirana u mediju u stražnjoj komori. Ispitivane kemikalije nanose se na epitelnu površinu rožnice dodavanjem u prednju komoru držača rožnice. Dodatak 4. sadržava opis i dijagram držača rožnice koji se upotrebljava u BCOP ispitnoj metodi. Držači rožnice mogu se komercijalno nabaviti iz različitih izvora ili se mogu izraditi. Izvor i starost goveđih očiju i odabir životinjskih vrsta Stoka koja se šalje u klaonicu obično se kolje za ljudsku potrošnju ili za druge komercijalne namjene. Samo zdrave životinje koje se smatraju prikladnima za uvrštavanje u lanac ljudske prehrane upotrebljavaju se kao izvor rožnica za uporabu u BCOP ispitnoj metodi. Budući da tjelesna masa stoke u velikoj mjeri varira ovisno o pasmini, dobi i spolu, ne postoji preporučena tjelesna masa životinje u vrijeme klanja. Kada se upotrebljavaju oči životinja različite dobi, može doći do varijacija u dimenzijama rožnica. Rožnice horizontalnog promjera > 30,5 mm i vrijednosti debljine srednjeg dijela rožnice (CCT) ≥ 1 100 μm obično se dobivaju od stoke starije od osam godina, dok se rožnice horizontalnog promjera < 28,5 mm i CCT-a < 900 μm obično dobivaju od stoke mlađe od pet godina (14.). Zbog toga se obično ne upotrebljavaju oči stoke starije od 60 mjeseci. Oči stoke mlađe od 12 mjeseci uglavnom se ne upotrebljavaju jer su one još u razvoju pa su debljina i promjer rožnice znatno manji nego kod očiju odrasle stoke. Međutim, uporaba rožnice mladih životinja (tj. životinja u dobi do šest do 12 mjeseci) dopuštena je jer ima određenih prednosti, kao što su veća dostupnost, uži dobni raspon i smanjena opasnost povezana s potencijalnim izlaganjem radnika goveđoj spongiformnoj encefalopatiji (15.). Budući da bi dodatno ocjenjivanje učinka veličine i debljine rožnice na osjetljivost na nagrizajuće i nadražujuće kemikalije bilo korisno, korisnike se potiče da za životinje od kojih se uzima rožnica koja se upotrebljava u istraživanju zabilježe procijenjenu dob i/ili tjelesnu masu. Prikupljanje i prijevoz očiju u laboratorij Oči prikupljaju radnici u klaonici. Kako bi se mehanička i druga oštećenja očiju svela na najmanju moguću mjeru, oči bi trebalo enukleirati što je to moguće prije nakon smrti životinje i odmah staviti na hlađenje nakon enukleacije i tijekom prijevoza. Kako bi se izbjeglo izlaganje očiju potencijalno nadražujućim kemikalijama, pri ispiranju glave životinje radnici u klaonici ne bi se trebali služiti deterdžentima. Oči bi trebalo potpuno uroniti u Hankovu izbalansiranu slanu otopinu (HBSS) u spremniku prikladne veličine i prevesti do laboratorija tako da se propadanje i/ili bakteriološka kontaminacija svedu na najmanju moguću mjeru. Budući da se prikupljaju tijekom postupka klanja, oči mogu biti izložene krvi i drugim biološkim materijalima, uključujući bakterije i druge mikroorganizme. Stoga je važno osigurati da se rizik kontaminacije svede na najmanju moguću mjeru (npr. spremnik s očima treba držati na mokrom ledu tijekom prikupljanja i prijevoza, a HBSS-u u kojem su oči pohranjene tijekom prijevoza treba dodati antibiotike [npr. 100 IU/ml penicilina i 100 μg/ml streptomicina]). Vremenski interval između prikupljanja očiju i uporabe rožnica u BCOP ispitnoj metodi trebao bi biti što kraći (oči se uobičajeno prikupljaju i upotrebljavaju istog dana) i trebalo bi dokazati da se njime ne dovode u pitanje rezultati analize. Ti se rezultati temelje na kriterijima za odabir očiju, kao i odgovorima pozitivnih i negativnih kontrola. Sve oči koje se upotrebljavaju u analizi trebale bi biti iz iste skupine očiju prikupljenih određenog dana. Kriteriji za odabir očiju koje se upotrebljavaju u BCOP ispitnoj metodi Kada stignu u laboratorij, oči se pažljivo pregledavaju kako bi se utvrdila oštećenja, uključujući povećano zamućenje, ogrebotine i neovaskularizaciju. Treba upotrebljavati samo rožnice očiju koja nemaju takvih oštećenja. Kvaliteta svake rožnice ocjenjuje se i u kasnijim fazama analize. Rožnice koje imaju zamućenje veće od sedam jedinica zamućenja ili istovjetnu vrijednost za upotrijebljeni opacimetar ili držače rožnice nakon početnog jednosatnog ujednačavanja treba odbaciti (NAPOMENA: opacimetar bi trebalo kalibrirati u skladu sa standardima zamućenja koji se primjenjuju za utvrđivanje jedinica zamućenja, vidjeti Dodatak 4.). Svaka skupina za tretiranje (ispitivana kemikalija, istodobne negativne i pozitivne kontrole) sadržava najmanje tri oka. Za negativnu kontrolu u BCOP ispitnoj metodi trebalo bi upotrijebiti tri rožnice. Budući da su sve rožnice odvojene od čitavih očnih jabučica i zatim stavljene u komore držača rožnice, postoji mogućnost pojave artefakata kao posljedice rukovanja pri pojedinim vrijednostima zamućenja i propusnosti rožnice (uključujući negativne kontrole). Nadalje, vrijednosti zamućenja i propusnosti rožnica iz negativnih kontrola primjenjuju se za korekciju vrijednosti zamućenja i propusnosti rožnica tretiranih ispitivanom kemikalijom i tretiranih u pozitivnim kontrolama u izračunima IVIS-a. POSTUPAK Priprema očiju Pri disekciji neoštećenih rožnica ostavlja se rub od 2 do 3 mm sklere kako bi se olakšalo naknadno rukovanje, pri čemu treba paziti da se ne oštete epitel i endotel rožnice. Izolirane rožnice postavljaju se na posebno konstruirane držače rožnice tako da je prednji odjeljak u kontaktu s epitelnom stranom rožnice, a stražnji s endotelnom stranom rožnice. Obje se komore do ruba pune prethodno zagrijanim Eagleovim minimalnim esencijalnim medijem (EMEM) bez fenolne crvene (prvo stražnja komora), vodeći računa o tome da se ne stvaraju mjehurići zraka. Uređaj se tada uravnotežuje na 32 ± 1 °C najmanje jedan sat kako bi se omogućilo uravnoteženje rožnica s medijem i, u mjeri u kojoj je to moguće, postigla normalna metabolička aktivnost (približna temperatura površine rožnice in vivo iznosi 32 °C). Nakon razdoblja uravnoteženja u obje komore dodaje se svježi, prethodno zagrijani EMEM bez fenolne crvene i za svaku rožnicu očitava se polazna vrijednost zamućenja. Odbacuju se sve rožnice kod kojih je zapaženo makroskopsko oštećenje tkiva (npr. ogrebotine, pigmentacija, neovaskularizacija) ili zamućenje veće od sedam jedinica zamućenja odnosno zamućenje istovjetne vrijednosti za upotrijebljeni opacimetar ili držače rožnice. Kao rožnice za negativnu kontrolu (ili kontrolu s otapalom) odabiru se minimalno tri rožnice. Preostale rožnice zatim se razdjeljuju u skupine za tretiranje i pozitivne kontrolne skupine. Budući da je toplinski kapacitet vode veći od toplinskog kapaciteta zraka, vodom se osiguravaju stabilniji temperaturni uvjeti za inkubaciju. Stoga se za održavanje držača rožnice i njegova sadržaja pri temperaturi od 32 ± 1 °C preporučuje uporaba vodene kupelji. Međutim, mogu se upotrebljavati i zračni inkubatori uz mjere opreza kako bi se održala stabilnost temperature (npr. prethodnim zagrijavanjem držača i medija). Primjena ispitivane kemikalije Za tretiranje se primjenjuju dva različita protokola, jedan za tekućine i površinski aktivne tvari (krute tvari ili tekućine) i jedan za površinski neaktivne krute tvari. Tekućine se ispituju nerazrijeđene. Polukrute tvari, paste i voskovi obično se ispituju kao tekućine. Čiste površinski aktivne tvari ispituju se pri koncentraciji od 10 % w/v u otopini natrijevog klorida od 0,9 %, destiliranoj vodi ili drugom otapalu za koje je dokazano da nema negativnih učinaka na ispitni sustav. Za alternativne koncentracije razrjeđivanja trebalo bi navesti prikladno opravdanje. Smjese koje sadržavaju površinski aktivne tvari mogu se ispitivati nerazrijeđene ili razrijeđene na prikladnu koncentraciju ovisno o relevantnom scenariju izlaganja in vivo. Za ispitane koncentracije trebalo bi navesti prikladno opravdanje. Rožnice se izlažu tekućinama i površinski aktivnim tvarima deset minuta. Uporaba drugih vremena izlaganja trebala bi biti popraćena prikladnim znanstvenim opravdanjem. Definicije površinski aktivne tvari i smjese koja sadržava površinski aktivne tvari navedene su u Dodatku 1. Površinski neaktivne krute tvari obično se ispituju kao otopine ili suspenzije pri koncentraciji od 20 % w/v u otopini natrijeva klorida od 0,9 %, destiliranoj vodi ili drugom otapalu za koje je dokazano da nema negativnih učinaka na ispitni sustav. U određenim okolnostima i uz primjereno znanstveno opravdanje krute tvari mogu se ispitivati i čiste izravnim nanošenjem na površinu rožnice metodom otvorene komore (vidjeti stavak 32.). Rožnice se izlažu krutim tvarima tijekom četiri sata, ali, kao i kod tekućina i površinski aktivnih tvari, moguća su alternativna vremena izlaganja uz prikladno znanstveno opravdanje. Mogu se primjenjivati različite metode tretiranja ovisno o fizikalnoj naravi i kemijskim svojstvima ispitivane kemikalije (npr. krute tvari, tekućine, viskozne ili neviskozne tekućine). Ključno je osigurati da je epitelna površina prikladno pokrivena ispitivanom kemikalijom i da se u fazama ispiranja ispitivana kemikalija pravilno ukloni. Za neviskozne do slabo viskozne tekuće ispitivane kemikalije uobičajeno se primjenjuje metoda zatvorene komore, dok se metoda otvorene komore obično primjenjuje za poluviskozne i viskozne tekuće ispitivane kemikalije i čiste krute tvari. Kod metode zatvorene komore, količina ispitivane kemikalije (750 μl) dovoljna za prekrivanje epitelne strane rožnice uvodi se u prednju komoru kroz otvore za doziranje na gornjoj površini komore, koji se nakon toga hermetički zatvaraju čepovima i ostaju zatvoreni tijekom izlaganja. Važno je osigurati da svaka rožnica bude izložena ispitivanoj kemikaliji u odgovarajućem vremenu. Kod metode otvorene komore, prije tretiranja s prednje se komore uklanja stakleni prozorčić i njegov prstenasti osigurač. Kontrolna ili ispitivana kemikalija (750 μl ili količina ispitivane kemikalije dovoljna za potpuno prekrivanje rožnice) mikropipetom se izravno nanosi na epitelnu površinu rožnice. Ako je ispitivanu kemikaliju teško pipetirati, radi lakšeg doziranja, ispitivana kemikalija može se pod tlakom napuniti u volumetrijsku pipetu. Vrh volumetrijske pipete umeće se u vrh šprice za doziranje tako da se materijal može pod tlakom napuniti u vrh volumetrijske pipete. Klip šprice potiskuje se istodobno s povlačenjem klipa pipete prema gore. Ako se u vrhu pipete pojave mjehurići zraka, ispitivana se kemikalija uklanja (izbacuje) i postupak se ponavlja dok vrh nije napunjen bez mjehurića zraka. Prema potrebi se može upotrijebiti obična šprica (bez igle) jer se njome omogućuje točno mjerenje volumena ispitivane kemikalije i lakše nanošenje na epitelnu površinu rožnice. Nakon doziranja stakleni prozorčić vraća se na prednju komoru čime se ponovno uspostavlja zatvoreni sustav. Inkubacija nakon izlaganja Nakon razdoblja izlaganja ispitivana kemikalija, kemikalija negativne kontrole ili kemikalija pozitivne kontrole uklanjaju se iz prednje komore i epitel se ispire najmanje tri puta (ili sve dok se više ne mogu zapaziti vidljivi dokazi ispitivane kemikalije) EMEM-om (koji sadržava fenolnu crvenu). Za ispiranje se upotrebljava medij koji sadržava fenolnu crvenu jer se u fenolnoj crvenoj može pratiti promjena boje kako bi se utvrdila učinkovitost ispiranja kiselih ili lužnatih ispitivanih kemikalija. Rožnice se ispiru više od tri puta ako fenolna crvena još nije obojena (ako je žuta ili ljubičasta) ili ako je još uvijek vidljiva ispitivana kemikalija. Nakon uklanjanja ispitivane kemikalije iz medija rožnice se završno ispiru EMEM-om (bez fenolne crvene). EMEM (bez fenolne crvene) se primjenjuje kao sredstvo za konačno ispiranje kako bi se osiguralo uklanjanje fenolne crvene iz prednje komore prije mjerenja zamućenja. Prednja komora zatim se ponovno puni svježim EMEM-om bez fenolne crvene. Za tekućine i površinski aktivne tvari, rožnice se nakon ispiranja inkubiraju dodatna dva sata pri temperaturi od 32 ± 1 °C. U određenim okolnostima može biti korisno produljiti vrijeme nakon izlaganja, što se može razmotriti u svakom pojedinačnom slučaju. Rožnice tretirane krutim tvarima temeljito se ispiru po isteku četverosatnog razdoblja izlaganja, ali daljnja inkubacija nije potrebna. Na kraju razdoblja inkubacije nakon izlaganja za tekućine i površinski aktivne tvari i na kraju četverosatnog razdoblja izlaganja za površinski neaktivne krute tvari bilježe se zamućenje i propusnost svake rožnice. Jednako tako, svaku se rožnicu vizualno promatra i bilježe se relevantna zapažanja (npr. ljuštenje tkiva, rezidualna ispitivana kemikalija, nejednolični obrasci zamućenja). Ta bi zapažanja mogla biti važna jer se mogu odraziti kao varijacije u očitavanjima opacimetra. Kontrolne kemikalije Svaki pokus uključuje istodobne negativne kontrole ili kontrole s otapalom/nosačem i pozitivne kontrole. Kada se ispituje nerazrijeđena tekuća tvar, u BCOP ispitnu metodu uvodi se istodobna negativna kontrola (npr. otopina natrijeva klorida od 0,9 % ili destilirana voda) kako bi se mogle otkriti nespecifične promjene u ispitnom sustavu i kako bi se dobila polazna vrijednost za krajnje točke testa. Njome se osigurava i da se uvjetima provedbe testa ne izazove neprikladan odgovor na nadražujuću tvar. Kada se ispituje razrijeđena tekućina, površinski aktivna tvar ili kruta tvar, u BCOP ispitnu metodu uvodi se istodobna kontrolna skupina s otapalom/nosačem kako bi se mogle otkriti nespecifične promjene u sustavu ispitivanja i kako bi se dobila polazna vrijednost za krajnje točke testa. Mogu se upotrebljavati samo otapala/nosači za koje je dokazano da nemaju negativne učinke na ispitni sustav. Kemikalija za koju se zna da izaziva pozitivan odgovor uvodi se u svaki pokus kao istodobna pozitivna kontrola kako bi se provjerili integritet ispitnog sustava i pravilna provedba pokusa. Međutim, kako bi se osigurala mogućnost procjene varijabilnosti odgovora u pozitivnoj kontroli tijekom vremena, jačina odgovora na nadražujuću tvar ne bi trebala biti prekomjerna. Primjeri pozitivnih kontrola za tekuće ispitivane kemikalije su 100 %-tni etanol ili 100 %-tni dimetilformamid. Primjer pozitivne kontrole za krute ispitivane kemikalije je 20 % w/v imidazola u otopini natrijeva klorida od 0,9 %. Referentne kemikalije korisne su za ocjenjivanje potencijala za nadražujuće djelovanje na oči nepoznatih kemikalija iz specifičnog kemijskog razreda ili razreda proizvoda ili za ocjenjivanje relativnog potencijala za nadražujuće djelovanje tvari koja nadražuje oči unutar specifičnog raspona odgovora na nadražujuću tvar. Mjerenje krajnjih točaka Zamućenje se utvrđuje na temelju količine prijenosa svjetlosti kroz rožnicu. Zamućenje rožnice mjeri se kvantitativno opacimetrom te se tako dobivaju vrijednosti zamućenja mjerene na kontinuiranoj ljestvici. Propusnost se utvrđuje na temelju količine boje natrijeva fluoresceina koja prodire u sve slojeve stanice rožnice (tj. od epitela na vanjskoj površini rožnice do endotela na unutarnjoj površini rožnice). Dodaje se 1 ml otopine natrijeva fluoresceina (4 ili 5 mg/ml kada se ispituju tekućine i površinski aktivne tvari odnosno površinski neaktivne krute tvari) u prednju komoru držača rožnice, koji je u kontaktu s epitelnom stranom rožnice, dok se stražnja komora, koja je u kontaktu s endotelnom stranom rožnice, puni svježim EMEM-om. Držač se zatim inkubira u horizontalnom položaju 90 ± 5 min pri temperaturi od 32 ± 1 °C. Količina natrijeva fluoresceina koja prijeđe u stražnju komoru kvantitativno se mjeri UV/VIS spektrofotometrijom. Spektrofotometrijska mjerenja koja se ocjenjuju pri 490 nm bilježe se kao vrijednosti optičke gustoće (OD490) ili vrijednosti apsorbancije, koje se mjere na kontinuiranoj ljestvici. Vrijednosti propusnosti fluoresceina utvrđuju se primjenom vrijednosti OD490 na temelju spektrofotometra vidljive svjetlosti standardne duljine puta od 1 cm. Kao druga mogućnost, može se upotrijebiti čitač pločica za mikrotitraciju s 96 bunarića pod uvjetom: i. da se za određivanje vrijednosti OD490 fluoresceina može utvrditi linearni raspon čitača pločica i ii. da se na pločici s 96 bunarića upotrebljavaju uzorci fluoresceina točnog volumena kako bi se dobile vrijednosti OD490 istovjetne standardnoj duljini puta od 1 cm (za što bi moglo biti potrebno potpuno napuniti bunarić [obično 360 μl]). PODACI I IZVJEŠĆIVANJE Procjena podataka Nakon korekcije vrijednosti (OD490) zamućenja i srednje izmjerene vrijednosti propusnosti s obzirom na osnovno zamućenje i na vrijednosti OD490 propusnosti negativne kontrole, srednje izmjerene vrijednosti OD490 zamućenja i propusnosti za svaku ispitnu skupinu trebalo bi kombinirati u empirijski izvedenoj formuli za izračun in vitro vrijednosti nadražujućeg djelovanja (IVIS) za svaku tretiranu skupinu kako slijedi: IVIS = srednja izmjerena vrijednost zamućenja + (15 × srednja izmjerena vrijednost OD490 propusnosti). Sina et al. (16.) izvijestili su da je ta formula izvedena tijekom unutarlaboratorijskih i međulaboratorijskih istraživanja. Podaci prikupljeni za niz od 36 spojeva u multilaboratorijskom istraživanju podvrgnuti su multivarijacijskoj analizi radi utvrđivanja najprikladnije jednadžbe između in vivo i in vitro podataka. Znanstvenici u dvama odvojenim poduzećima proveli su tu analizu i izveli gotovo identične jednadžbe. Vrijednosti zamućenja i propusnosti trebalo bi neovisno ocjenjivati i kako bi se na temelju samo jedne od dviju krajnjih točaka utvrdilo je li ispitivana kemikalija izazvala nagrizanje ili jako nadraživanje (vidjeti Kriterije za donošenje odluke). Kriteriji za donošenje odluke Granične vrijednosti IVIS-a za utvrđivanje ispitivanih kemikalija koje izazivaju tešku ozljedu oka (kategorija 1. sustava UN GHS) i ispitivanih kemikalija koje nije potrebno razvrstati s obzirom na nadraživanje oka ili tešku ozljedu oka (bez kategorije prema sustavu UN GHS) navedene su nastavku.
Kriteriji prihvatljivosti istraživanja Ispitivanje se smatra prihvatljivim ako se u pozitivnoj kontroli dobije IVIS između dvaju standardnih odstupanja postojeće povijesne srednje izmjerene vrijednosti, koja se ažurira najmanje svaka tri mjeseca ili svaki put kada se u laboratorijima u kojima se ispitivanja ne provode često (tj. manje nego jednom mjesečno) provede prihvatljivo ispitivanje. Odgovorima u negativnoj kontroli ili kontroli s nosačem/otapalom trebale bi se dobiti vrijednosti zamućenja i propusnosti koje su manje od utvrđenih gornjih granica za osnovne vrijednosti zamućenja i propusnosti za goveđe rožnice tretirane odgovarajućom negativnom kontrolom ili kontrolom s otapalom/nosačem. Jedan ciklus ispitivanja koji obuhvaća najmanje tri rožnice trebao bi biti dovoljan za ispitivanu kemikaliju ako je dobiveno razvrstavanje nedvosmisleno. Međutim, u slučajevima graničnih rezultata u prvom ciklusu ispitivanja, trebalo bi razmotriti mogućnost provođenja drugog ciklusa (koji, međutim, nije nužno potreban), a potom i trećeg u slučaju neusklađenih rezultata srednjeg izmjerenog IVIS-a između prvog i drugog ciklusa ispitivanja. U tom se kontekstu rezultat iz prvog ciklusa ispitivanja smatra graničnim ako predviđanja na temelju tri rožnice nisu bila usklađena tako da:
Izvješće o ispitivanju U izvješće o ispitivanju trebalo bi uključivati sljedeće informacije ako su one relevantne za provedbu istraživanja:
LITERATURA
Dodatak 1. DEFINICIJE Točnost : stupanj podudarnosti između rezultata ispitne metode i prihvaćenih referentnih vrijednosti. To je mjerilo učinkovitosti ispitne metode i jedan od aspekata ‚relevantnosti’. Pojam je često međusobno zamjenjiv s pojmom ‚podudarnost’ u smislu udjela točnih ishoda ispitne metode. Referentna kemikalija : kemikalija koja se primjenjuje kao standard za usporedbu s ispitivanom kemikalijom. Referentna kemikalija trebala bi imati sljedeća svojstva: i. podrijetlo iz dosljednih i pouzdanih izvora; ii. strukturnu i funkcionalnu sličnost s razredom kemikalija koje se ispituju; iii. poznata fizikalna/kemijska svojstva; iv. podatke kojima se dokazuju poznati učinci i v. poznatu snagu u rasponu željenog odgovora. Pristup odozdo prema gore : stupnjeviti pristup koji se primjenjuje za kemikaliju u pogledu koje postoji sumnja da joj nije potrebno razvrstavanje s obzirom na nadraživanje oka ili tešku ozljedu oka, a koji počinje utvrđivanjem kemikalija za koje nije potrebno razvrstavanje (negativan ishod) u odnosu na druge kemikalije (pozitivan ishod). Kemikalija : tvar ili smjesa. Rožnica : transparentni dio prednje strane očne jabučice kojim su prekrivene šarenica i zjenica i koji propušta svjetlost u unutrašnjost oka. Zamućenje rožnice : izmjereni stupanj zamućenja rožnice nakon izlaganja ispitivanoj kemikaliji. Povećano zamućenje rožnice pokazatelj je oštećenja rožnice. Zamućenje se može ocjenjivati subjektivno kao u Draizeovom ispitivanju na oku kunića ili objektivno instrumentom kao što je ‚opacimetar’. Propusnost rožnice : kvantitativno izmjereno oštećenje epitela rožnice utvrđivanjem količine boje natrijeva fluoresceina koja prolazi kroz sve slojeve stanice rožnice. Nadraživanje oka : promjene na oku nastale kao rezultat primjene ispitivane kemikalije na prednju površinu oka, koje su potpuno reverzibilne u roku od 21 dana nakon primjene. Pojam je međusobno zamjenjiv s pojmovima ‚reverzibilni učinci na oko’ i ‚kategorija 2. sustava UN GHS’ (4.). Stopa lažno negativnih rezultata : udio svih pozitivnih kemikalija koje su ispitnom metodom pogrešno identificirane kao negativne. Jedan je od pokazatelja uspješnosti ispitne metode. Stopa lažno pozitivnih rezultata : udio svih negativnih kemikalija koje su ispitnom metodom pogrešno identificirane kao pozitivne. Jedan je od pokazatelja uspješnosti ispitne metode. Opasnost : intrinzično svojstvo nekog agensa ili stanje koji imaju potencijal uzrokovanja štetnih učinaka kada su organizam, sustav ili (sub)populacija izloženi tom agensu. In vitro vrijednost nadražujućeg djelovanja (IVIS) : empirijski izvedena formula koja se primjenjuje u BCOP ispitnoj metodi i u kojoj se srednje izmjerene vrijednosti zamućenja i propusnosti za svaku tretiranu skupinu kombiniraju u jednu in vitro vrijednost za svaku tretiranu skupinu. IVIS = srednja izmjerena vrijednost zamućenja + (15 × srednja izmjerena vrijednost propusnosti). Ireverzibilni učinci na oko : vidjeti ‚tešku ozljedu oka’. Smjesa : smjesa ili otopina koja se sastoji od dviju ili više tvari u kojoj one ne reagiraju (4.). Negativna kontrola : netretiran ponovljeni uzorak koji sadržava sve komponente ispitnog sustava. Taj se uzorak obrađuje s uzorcima tretiranima ispitivanom kemikalijom i drugim kontrolnim uzorcima kako bi se utvrdilo je li otapalo u interakciji s ispitnim sustavom. Nerazvrstano : kemikalije koje su nerazvrstane s obzirom na nadraživanje oka (kategorija 2., 2.A ili 2.B sustava UN GHS) ili tešku ozljedu oka (kategorija 1. sustava UN GHS). Pojam je međusobno zamjenjiv s pojmom ‚bez kategorije prema sustavu UN GHS’. Opacimetar : instrument koji se upotrebljava za mjerenje ‚zamućenja rožnice’ kvantitativnim ocjenjivanjem prijenosa svjetlosti kroz rožnicu. Tipični instrument ima dva odjeljka, svaki s vlastitim izvorom svjetlosti i fotoćelijom. Jedan odjeljak upotrebljava se za tretiranu rožnicu, a drugi za kalibraciju instrumenta i podešavanje na nulu. Svjetlost iz halogene svjetiljke šalje se kroz kontrolni odjeljak (praznu komoru bez prozorčića ili tekućine) na fotoćeliju i uspoređuje sa svjetlošću koja se šalje na fotoćeliju kroz pokusni odjeljak u kojem je smještena komora s rožnicom. Uspoređuje se razlika u prijenosu svjetlosti s fotoćelija, a numerička vrijednost zamućenja prikazuje se na digitalnom zaslonu. Pozitivna kontrola : ponovljeni uzorak koji sadržava sve komponente ispitnog sustava i tretiran je kemikalijom za koju je poznato da izaziva pozitivan odgovor. Kako bi se osigurala mogućnost procjene varijabilnosti odgovora pozitivne kontrole tijekom vremena, odgovor ne bi smio biti presnažan. Reverzibilni učinci na oko : vidjeti ‚nadraživanje oka’. Pouzdanost : pokazuje u kojoj se mjeri ispitna metoda može obnovljivo primijeniti unutar jednog laboratorija i između više laboratorija tijekom vremena uz primjenu istog protokola. Ocjenjuje se izračunavanjem obnovljivosti unutar jednog laboratorija i između više njih te ponovljivosti unutar jednog laboratorija. Teška ozljeda oka : oštećenje očnog tkiva ili ozbiljno fizičko pogoršanje vida izazvano primjenom ispitivane kemikalije na prednju površinu oka, koje nije u potpunosti reverzibilno unutar 21 dana od primjene. Pojam je međusobno zamjenjiv s pojmovima ‚ireverzibilni učinci na oko’ i ‚kategorija 1. sustava UN GHS’ (4.). Kontrola s otapalom/nosačem : netretirani uzorak koji uključuje sve komponente ispitnog sustava, uključujući otapalo ili nosač, koji se obrađuje s uzorcima tretiranima ispitivanom kemikalijom i drugim kontrolnim uzorcima kako bi se utvrdio polazni odgovor za uzorke tretirane ispitivanom kemikalijom otopljenom u istom otapalu ili nosaču. Kada se ispituje s istodobnom negativnom kontrolom, tim se uzorkom dokazuje i jesu li otapalo ili nosač u interakciji s ispitnim sustavom. Tvar : kemijski elementi i njihovi spojevi u prirodnom stanju ili dobiveni bilo kojim proizvodnim procesom, uključujući sve dodatke koji su nužni za održavanje stabilnosti proizvoda te sve nečistoće proizišle iz primijenjenog procesa, ali isključujući sva otapala koja se mogu odvojiti bez utjecaja na stabilnost tvari ili promjene njezina sastava (4.). Površinski aktivna tvar : tvar, kao npr. deterdžent, koju se naziva i površinski aktivnim agensom, a kojom se može smanjiti površinska napetost tekućine i time omogućiti pjenjenje i prodiranje u krute tvari; poznata je i kao sredstvo za vlaženje. Smjesa koja sadržava površinski aktivne tvari : u kontekstu ove ispitne metode, to je smjesa koja sadržava jednu ili više površinski aktivnih tvari pri konačnoj koncentraciji > 5 %. Pristup odozgo prema dolje : stupnjeviti pristup koji se primjenjuje za kemikaliju u pogledu koje postoji sumnja da uzrokuje tešku ozljedu oka, a koji počinje utvrđivanjem kemikalija koje izazivaju tešku ozljedu oka (pozitivan ishod) u odnosu na druge kemikalije (negativan ishod). Ispitivana kemikalija : sve tvari ili smjese koje se ispituju ovom ispitnom metodom. Strategija višerazinskog ispitivanja : strategija stupnjevitog ispitivanja u kojoj se sve postojeće informacije o ispitivanoj kemikaliji preispituju točno utvrđenim redoslijedom, pri čemu se prije prelaska na sljedeću razinu na svakoj razini primjenjuje postupak ocjenjivanja snage dokaza kako bi se odredilo je li na raspolaganju dovoljno informacija za donošenje odluke o razvrstavanju tvari s obzirom na opasnost. Ako se na temelju postojećih podataka ispitivanoj kemikaliji može pripisati potencijal nadražujućeg djelovanja, daljnje ispitivanje nije potrebno. Ako se na temelju postojećih informacija ispitivanoj kemikaliji ne može pripisati potencijal za nadražujuće djelovanje, provodi se postupak stupnjevitog sekvencijskog ispitivanja na životinjama sve dok se nedvosmisleno ne utvrdi razvrstavanje. Globalno usklađeni sustav Ujedinjenih naroda za razvrstavanje i označivanje kemikalija (UN GHS) : sustav za razvrstavanje kemikalija (tvari i smjesa) prema standardiziranim vrstama i stupnjevima fizičkih opasnosti i opasnosti za zdravlje i okoliš kojim su obuhvaćena odgovarajuća komunikacijska sredstva, kao što su piktogrami, oznake opasnosti, oznake upozorenja, oznake obavijesti i sigurnosno-tehnički listovi, kojima se prenose informacije o njihovim štetnim učincima s ciljem zaštite ljudi (uključujući poslodavce, radnike, prijevoznike, potrošače i interventno osoblje) i okoliša (4.). Kategorija 1. sustava UN GHS : vidjeti ‚tešku ozljedu oka’. Kategorija 2. sustava UN GHS : vidjeti ‚nadraživanje oka’. Bez kategorije prema sustavu UN GHS : kemikalije koje ne ispunjavaju zahtjeve za razvrstavanje u kategoriju 1. ili 2. (2.A ili 2.B) sustava UN GHS. Pojam je međusobno zamjenjiv s pojmom ‚nerazvrstano’. Validirana ispitna metoda : ispitna metoda za koju su provedena validacijska istraživanja za utvrđivanje relevantnosti (uključujući točnost) i pouzdanosti za specifičnu namjenu. Važno je napomenuti da validirana ispitna metoda možda neće biti u dovoljnoj mjeri uspješna s obzirom na točnost i pouzdanost da bi je se moglo smatrati prihvatljivom za predloženu namjenu. Ocjenjivanje snage dokaza : proces razmatranja prednosti i slabosti različitih informacija u donošenju i dokazivanju zaključka o potencijalu opasnosti ispitivane kemikalije. Dodatak 2. PREDIKTIVNA SPOSOBNOST BCOP ISPITNE METODE Tablica 1. Prediktivna sposobnost BCOP ispitne metode za utvrđivanje kemikalija koje izazivaju tešku ozljedu oka [kategorija 1. sustava UN GHS / prema Uredbi EU-a o CLP-u u odnosu na kategorije koje nisu kategorija 1. (kategorija 2. + izvan kategorije); kategorija I. Agencije za zaštitu okoliša SAD-a (US EPA) u odnosu na kategorije koje nisu kategorija I. (kategorija II. + kategorija III. + kategorija IV.)]
Tablica 2. Prediktivna sposobnost BCOP ispitne metode za utvrđivanje kemikalija za koje nije potrebno razvrstavanje s obzirom na nadraživanje oka ili tešku ozljedu oka (‚tvari koje nemaju nadražujuće djelovanje’) [izvan kategorije prema sustavu UN GHS / Uredbi EU-a o CLP-u u odnosu na kemikalije koje nisu izvan kategorije (kategorija 1. + kategorija 2.); kategorija IV. US EPA-e u odnosu na kategorije koje nisu kategorija IV. (kategorija I. + kategorija II. + kategorija III.)]
Dodatak 3. KEMIKALIJE ZA ISPITIVANJE OSPOSOBLJENOSTI ZA BCOP ISPITNU METODU Prije rutinske primjene ove ispitne metode laboratoriji bi trebali dokazati svoju tehničku osposobljenost točnim utvrđivanjem kategorije opasnosti za oko za 13 kemikalija preporučenih u tablici 1. Odabrane kemikalije čine raspon odgovora u pogledu opasnosti za oko na temelju rezultata in vivo ispitivanja na oku kunića (TG 405) (17.) i sustava razvrstavanja UN GHS (tj. kategorija 1., 2.A, 2.B ili nerazvrstano) (4.). Ostali kriteriji odabira bili su komercijalna dostupnost kemikalija, dostupnost visokokvalitetnih referentnih in vivo podataka i dostupnost visokokvalitetnih in vitro podataka iz BCOP ispitne metode. Referentni podaci dostupni su u Jednostavnom sažetku (Streamlined Summary Document) (3.) i Osnovnom dokumentu za preispitivanje (Background Review Document) ICCVAM-a za BCOP ispitnu metodu (2. i 18.). Tablica 1. Kemikalije preporučene za dokazivanje tehničke osposobljenosti za BCOP ispitnu metodu
Dodatak 4. DRŽAČ ROŽNICE ZA BCOP ISPITNU METODU Držači rožnice za BCOP ispitnu metodu izrađeni su od inertnog materijala (npr. polipropilena). Držači se sastoje od dvije polovine (prednje i stražnje komore) i imaju dvije slične cilindrične unutarnje komore. Svaka komora ima zapreminu od približno 5 ml i završava staklenim prozorčićem kroz koji se bilježe izmjerena zamućenja. Svaka od unutarnjih komora ima promjer od 1,7 cm i duboka je 2,2 cm (11). O-prsten smješten na stražnjoj komori služi za sprečavanje istjecanja. Rožnice se postavljaju endotelnom stranom prema dolje na o-prsten stražnjih komora, dok se prednje komore postavljaju na epitelnu stranu rožnica. Komore su učvršćene trima vijcima od nehrđajućeg čelika smještenima na vanjskim rubovima komore. Na kraju svake komore nalazi se stakleni prozorčić koji se može ukloniti radi lakšeg pristupa rožnici. Radi sprečavanja istjecanja, jedan o-prsten smješten je i između staklenog prozorčića i komore. Dvama otvorima s gornje strane svake komore omogućuje se uvođenje i uklanjanje medija i ispitivanih kemikalija. Tijekom tretiranja i inkubacije zatvaraju se gumenim čepovima. Zbog trošenja ili nakupljanja ostataka određenih kemikalija u utorima unutarnje komore ili na staklenim prozorčićima može doći do promjene u prijenosu svjetlosti kroz držače rožnice, što može utjecati na raspršenje ili refleksiju svjetlosti. Moguće su posljedice povećanja ili smanjenja polazne vrijednosti prijenosa svjetlosti (kao i polazne vrijednosti očitanja zamućenja) kroz držače rožnice, koje su vidljive kao zamjetne promjene u očekivanim početnim mjerenjima polaznih vrijednosti zamućenja rožnice u pojedinačnim komorama (tj. početne vrijednosti zamućenja rožnice u posebnim pojedinačnim držačima rožnice mogu se rutinski razlikovati za dvije do tri jedinice zamućenja od očekivanih polaznih vrijednosti). Svaki laboratorij trebao bi razmotriti uspostavljanje programa za ocjenjivanje promjena u prijenosu svjetlosti kroz držače rožnice, ovisno o naravi ispitivanih kemija i učestalosti uporabe komora. Radi utvrđivanja polaznih vrijednosti, prije rutinske uporabe držači rožnice mogu se provjeriti mjerenjem polaznih vrijednosti zamućenja (ili prijenosa svjetlosti) za komore koje su napunjene potpunim medijem, ali bez rožnica. Nakon toga se držači rožnice periodički provjeravaju kako bi se utvrdile promjene u prijenosu svjetlosti tijekom uporabe. Svaki laboratorij može utvrditi učestalost provjera držača rožnice na temelju ispitivanih kemikalija, učestalosti uporabe i zapažanja promjena u polaznim vrijednostima zamućenja rožnice. Ako su zapažene vidljive promjene u prijenosu svjetlosti kroz držače rožnice, moraju se razmotriti prikladni postupci čišćenja i/ili poliranja unutarnje površine držača rožnice ili zamjena. Držač rožnice: dijagram uređaja u rastavljenom stanju 
Dodatak 5. OPACIMETAR Opacimetar je uređaj za mjerenje prijenosa svjetlosti. Na primjer, za opremu OP-KIT poduzeća Electro Desing (Riom, Francuska) koja se upotrebljava za validaciju BCOP ispitne metode, svjetlost iz halogene svjetiljke šalje se kroz kontrolni odjeljak (praznu komoru bez prozorčića ili tekućine) na fotoćeliju i uspoređuje sa svjetlošću koja se šalje na fotoćeliju kroz pokusni odjeljak u kojem je smještena komora s rožnicom. Uspoređuje se razlika u prijenosu svjetlosti s fotoćelija, a numerička vrijednost zamućenja prikazuje se na digitalnom zaslonu. Utvrđuju se jedinice zamućenja. Mogu se primjenjivati druge vrste opacimetara s drukčijim postavkama (npr. opacimetri kod kojih se ne zahtijevaju paralelna mjerenja kontrolnih i pokusnih odjeljaka) ako se dokaže da se njima dobivaju slični rezultati kao i potvrđenom opremom. Opacimetrom bi se trebao dobiti linearan odgovor u obliku niza očitanja zamućenja kojima su obuhvaćene granične vrijednosti za različita razvrstavanja opisana modelom predviđanja (tj. do granične vrijednosti kojom se utvrđuje nagrizajuće djelovanje/jako nadražujuće djelovanje). Kako bi se osigurala linearna i točna očitanja do 75 – 80 jedinica zamućenja, opacimetar treba kalibrirati serijom kalibratora. Kalibratori se postavljaju u komoru za kalibraciju (komoru držača rožnice koja je konstruirana tako da se u nju mogu smjestiti kalibratori) i očitavaju se vrijednosti na opacimetru. Kalibracijska komora konstruirana je tako da su kalibratori postavljeni na približno jednakoj udaljenosti između svjetlosti i fotoćelije na koju bi se kod mjerenja zamućenja postavile rožnice. Referentne vrijednosti i početna podešena vrijednost ovise o vrsti upotrijebljene opreme. Linearnost mjerenja zamućenja trebalo bi osigurati prikladnim postupcima (specifičnima za instrument). Na primjer, ako se primjenjuje oprema OP-KIT poduzeća Electro Design (Riom, Francuska), opacimetar se prvo kalibrira na 0 jedinica zamućenja upotrebom kalibracijske komore bez kalibratora. Zatim se u kalibracijsku komoru postavljaju tri različita kalibratora jedan po jedan i mjere se zamućenja. Kalibratorima 1., 2. i 3. trebala bi se dobiti očitanja zamućenja jednaka njihovim podešenim vrijednostima od 75, 150 odnosno 225 jedinica zamućenja ±5 %. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
(13) |
U dijelu B poglavlje B.48. zamjenjuje se sljedećim: „B.48. Metoda ispitivanja na izoliranom pilećem oku za utvrđivanje i. kemikalija koje izazivaju tešku ozljedu oka i ii. kemikalija koje nije potrebno razvrstati s obzirom na nadraživanje oka ili tešku ozljedu oka UVOD Ova ispitna metoda odgovara Smjernici OECD-a za ispitivanje 438 (2013.). Metodu ispitivanja na izoliranom pilećem oku (ICE) ocijenio je Međuagencijski koordinacijski odbor za validaciju alternativnih metoda (ICCVAM) u suradnji s Europskim centrom za validaciju alternativnih metoda (ECVAM) i Japanskim centrom za validaciju alternativnih metoda (JaCVAM) 2006. i 2010. (1., 2. i 3.). Tijekom prvog ocjenjivanja ICE ispitna metoda odobrena je kao znanstveno valjana ispitna metoda za primjenu u obliku testa probira za utvrđivanje kemikalija (tvari i smjesa) koje izazivaju tešku ozljedu oka (kategorija 1.), kako je utvrđeno Globalno usklađenim sustavom razvrstavanja i označivanja kemikalija (GHS) Ujedinjenih naroda (UN) (1., 2. i 4.) i Uredbom (EZ) br. 1272/2008 o razvrstavanju, označivanju i pakiranju tvari i smjesa (CLP) (12). Tijekom drugog ocjenjivanja ICE ispitne metode ocjenjivala se njezina primjena u obliku testa probira za utvrđivanje kemikalija koje su nerazvrstane s obzirom na nadraživanje oka ili tešku ozljedu oka kako je utvrđeno sustavom UN GHS (3. i 4.). Rezultatima validacijskog istraživanja i preporukama odbora za stručnu reviziju potvrđene su izvorne preporuke za primjenu ICE ispitne metode za razvrstavanje kemikalija koje izazivaju tešku ozljedu oka (kategorija 1. sustava UN GHS) jer je raspoloživa baza podataka ostala neizmijenjena od izvorne validacije ICCVAM-a. U toj fazi nisu dane daljnje preporuke za proširenje područja primjene ICE ispitne metode kako bi se uključile i druge kategorije. In vitro i in vivo skup podataka upotrijebljen u validacijskom istraživanju ponovno je ocijenjen s naglaskom na ocjenjivanje korisnosti ICE ispitne metode za utvrđivanje kemikalija koje nije potrebno razvrstati s obzirom na nadraživanje oka ili tešku ozljedu oka (5.). U ponovnom je ocjenjivanju zaključeno da se ICE ispitna metoda može primjenjivati i za utvrđivanje kemikalija koje nije potrebno razvrstati s obzirom na nadraživanje oka ili tešku ozljedu oka, kako je utvrđeno sustavom UN GHS (4. i 5.). U ovu su ispitnu metodu uključene preporučene primjene i ograničenja ICE ispitne metode na temelju tih ocjenjivanja. Glavne razlike između izvorne verzije Smjernice za ispitivanje OECD-a iz 2009. i ažurirane verzije iz 2013. uključuju, među ostalim, primjenu ICE ispitne metode za utvrđivanje kemikalija koje nije potrebno razvrstati u skladu sa sustavom razvrstavanja UN GHS, ažuriranje elemenata izvješća o ispitivanju, ažuriranje Dodatka 1. o definicijama i ažuriranje Dodatka 2. o kemikalijama za ispitivanje osposobljenosti. Trenutačno je opće prihvaćena činjenica da se u doglednoj budućnosti in vivo Draizeovo ispitivanje na oku neće moći zamijeniti nijednim pojedinačnim in vitro ispitivanjem nadraživanja oka za predviđanje različitih kemijskih razreda u punom rasponu nadraživanja. Međutim, kao zamjena za Draizeovo ispitivanje na oku mogu se primjenjivati strateške kombinacije nekoliko alternativnih ispitnih metoda u okviru strategije (višerazinskog) ispitivanja (6.). Pristup odozgo prema dolje (7.) trebalo bi primijeniti kada se na temelju postojećih informacija očekuje da će kemikalija imati veliki potencijal za nadražujuće djelovanje, dok bi se pristup odozdo prema gore (7.) trebao primijeniti kada se na temelju postojećih informacija očekuje da će nadraživanje oka koje prouzroči kemikalija biti takvo da će kemikaliju biti potrebno razvrstati. ICE ispitna metoda jest in vitro ispitna metoda koja se u određenim okolnostima i uz posebna ograničenja opisana u stavcima 8. i 10. može primjenjivati za razvrstavanje i označivanje kemikalija s obzirom na opasnosti za oko. Iako se ne smatra valjanom kao samostalna zamjena za in vivo ispitivanje na oku kunića, ICE ispitna metoda preporučuje se kao početni korak u okviru strategije ispitivanja kao što je pristup odozgo prema dolje koji predlažu Scott et al. (7.) za utvrđivanje kemikalija koje izazivaju tešku ozljedu oka odnosno kemikalija koje bez daljnjeg ispitivanja treba razvrstati u kategoriju 1. sustava UN GHS (4.). ICE ispitna metoda preporučuje se i za utvrđivanje kemikalija koje nije potrebno razvrstati s obzirom na nadraživanje oka ili tešku ozljedu oka, kako je utvrđeno sustavom UN GHS (bez kategorije) (4.) i stoga se može primjenjivati kao početni korak u okviru strategije ispitivanja kao što je pristup odozdo prema gore (7.). Međutim, za kemikaliju za koju nije predviđeno da će uzrokovati tešku ozljedu oka ili da će biti nerazvrstana s obzirom na nadraživanje oka / tešku ozljedu oka na temelju ICE ispitne metode bit će potrebno dodatno ispitivanje (in vitro i/ili in vivo) za utvrđivanje konačnog razvrstavanja. Nadalje, prije primjene ICE ispitne metode u okviru pristupa odozdo prema gore u skladu s drugim shemama razvrstavanja osim sustava UN GHS trebalo bi se savjetovati s odgovarajućim regulatornim tijelima. Svrha je ove ispitne metode opisati postupke koji se primjenjuju za ocjenjivanje potencijala opasnosti ispitivane kemikalije za oko mjerenog njezinom sposobnošću izazivanja ili neizazivanja toksičnosti u enukleiranom pilećem oku. Toksični učinci na rožnicu mjere se i. kvalitativnom ocjenom zamućenja, ii. kvalitativnom ocjenom oštećenja epitela zbog primjene fluoresceina na oko (zadržavanje fluoresceina), iii. kvantitativnim mjerenjem povećane debljine (oticanja) i iv. kvalitativnim ocjenjivanjem makroskopskog morfološkog oštećenja površine. Zamućenje, oticanje i oštećenje rožnice nakon izlaganja ispitivanoj kemikaliji ocjenjuju se pojedinačno, a zatim se ocjene kombiniraju kako bi se utvrdilo razvrstavanje s obzirom na nadražujuće djelovanje na oko. Definicije su navedene u Dodatku 1. POČETNA RAZMATRANJA I OGRANIČENJA Ova se ispitna metoda temelji na protokolu predloženom u Smjernici OECD-a 160 (8.), koja je izrađena nakon međunarodnog validacijskog istraživanja ICCVAM-a (1., 3. i 9.), uz doprinose iz Europskog centra za validaciju alternativnih metoda, Japanskog centra za validaciju alternativnih metoda i Odjela za toksikologiju i primijenjenu farmakologiju organizacije TNO Quality of Life (Nizozemska). Protokol se temelji na informacijama dobivenima iz objavljenih protokola, kao i protokola koji organizacija TNO trenutačno primjenjuje (10., 11., 12., 13. i 14.). Tijekom validacijskog istraživanja na kojem se temelji ova ispitna metoda ispitan je širok raspon kemikalija, a empirijskom bazom podataka validacijskog istraživanja bile su obuhvaćene 152 kemikalije, uključujući 72 tvari i 80 smjesa (5.). Ispitna metoda primjenjiva je na krute tvari, tekućine, emulzije i gelove. Tekućine mogu biti vodene i bezvodne; krute tvari mogu biti topljive ili netopljive u vodi. Plinovi i aerosoli još nisu ocijenjeni u validacijskom istraživanju. ICE ispitna metoda može se primjenjivati za utvrđivanje kemikalija koje izazivaju tešku ozljedu oka odnosno kemikalija koje treba razvrstati u kategoriju 1. sustava UN GHS (4.). Kada se primjenjuje u tu svrhu, utvrđena se ograničenja ICE ispitne metode temelje na visokim stopama lažno pozitivnih rezultata za alkohole i visokim stopama lažno negativnih rezultata za krute tvari i površinski aktivne tvari (1., 3. i 9.). Međutim, stope lažno negativnih rezultata (kategorija 1. sustava UN GHS za koju je utvrđeno da nije kategorija 1. sustava UN GHS) nisu kritične u tom kontekstu jer će se sve ispitivane kemikalije s negativnim rezultatom naknadno ispitati drugim in vitro ispitivanjima potvrđenima na odgovarajući način ili, kao krajnja opcija, na zečevima, ovisno o regulatornim zahtjevima, uz primjenu strategije sekvencijskog ispitivanja u okviru pristupa koji se temelji na ocjenjivanju snage dokaza. Trebalo bi napomenuti da krute tvari mogu dovesti do promjenjivih i ekstremnih uvjeta izlaganja u in vivo Draizeovom ispitivanju nadraživanja oka, što za posljedicu može imati nevažna predviđanja u pogledu njihova stvarnog potencijala za nadražujuće djelovanje (15.). Istraživači bi mogli razmotriti primjenu ove ispitne metode za sve vrste kemikalija, pri čemu bi pozitivan rezultat trebalo prihvatiti kao pokazatelj teške ozljede oka, odnosno razvrstavanja u kategoriju 1. sustava UN GHS bez daljnjeg ispitivanja. Međutim, pozitivne rezultate dobivene s alkoholima trebalo bi oprezno tumačiti zbog rizika od precijenjenih rezultata. Kada se primjenjuje za utvrđivanje kemikalija koje izazivaju tešku ozljedu oka (kategorija 1. sustava UN GHS), ICE ispitna metoda ima sveukupnu točnost od 86 % (120/140), stopu lažno pozitivnih rezultata od 6 % (7/113) i stopu lažno negativnih rezultata od 48 % (13/27) u odnosu na podatke dobivene metodom in vivo ispitivanja na oku kunića razvrstane u skladu sa sustavom razvrstavanja UN GHS (4. i 5.). ICE ispitna metoda može se primjenjivati i za utvrđivanje kemikalija koje nije potrebno razvrstati s obzirom na nadraživanje oka ili tešku ozljedu oka u skladu sa sustavom razvrstavanja UN GHS (4.). Prije primjene ICE ispitne metode u okviru pristupa odozdo prema gore u skladu s drugim shemama razvrstavanja trebalo bi se savjetovati s odgovarajućim regulatornim tijelima. Ova se ispitna metoda može primjenjivati za sve vrste kemikalija, pri čemu negativni rezultat može biti prihvatljiv za nerazvrstavanje kemikalije s obzirom na nadraživanje oka i tešku ozljedu oka. Međutim, na temelju jednog rezultata iz validacijske baze podataka moguće je podcijenjeno predviđanje u pogledu boja protiv obrastanja koje sadržavaju organsko otapalo (5.). Kada se primjenjuje za utvrđivanje kemikalija koje nije potrebno razvrstati s obzirom na nadraživanje oka ili tešku ozljedu oka, ICE ispitna metoda ima sveukupnu točnost od 82 % (125/152), stopu lažno pozitivnih rezultata od 33 % (26/79) i stopu lažno negativnih rezultata od 1 % (1/73) u odnosu na podatke dobivene metodom in vivo ispitivanja na oku kunića razvrstane u skladu sa sustavom UN GHS (4. i 5.). Ako se iz baze podataka isključe ispitivane kemikalije iz određenih razreda (tj. boje protiv obrastanja koje sadržavaju organsko otapalo), ICE ispitna metoda ima točnost od 83 % (123/149), stopu lažno pozitivnih rezultata od 33 % (26/78) i stopu lažno negativnih rezultata od 0 % (0/71) prema sustavu razvrstavanja UN GHS (4. i 5.). ICE ispitna metoda ne preporučuje se za utvrđivanje ispitivanih kemikalija koje bi trebalo razvrstati kao kemikalije koje nadražuju oči (tj. u kategoriju 2. ili kategoriju 2.A sustava UN GHS) ili ispitivanih kemikalija koje bi trebalo razvrstati kao kemikalije koje blago nadražuju oči (kategorija 2.B sustava UN GHS) zbog znatnog broja kemikalija iz kategorije 1. sustava UN GHS koje su razvrstane u nedovoljno visoke kategorije 2., 2.A ili 2.B sustava UN GHS te zbog kemikalija bez kategorije prema sustavu UN GHS koje su razvrstane u previsoke kategorije 2., 2.A ili 2.B sustava UN GHS. U tu svrhu može biti potrebno daljnje ispitivanje drugom prikladnom metodom. Svi postupci s pilećim očima trebali bi biti u skladu s primjenjivim propisima ustanove koja provodi ispitivanje i postupcima za rukovanje materijalom dobivenim od ljudi ili životinja, koji među ostalim uključuje tkiva i tkivne tekućine. Preporučuju se općenite mjere opreza za laboratorije (16.). Iako se u okviru ICE ispitne metode ne razmatraju ozljede konjunktive i šarenice koje se ocjenjuju metodom ispitivanja nadražujućeg djelovanja na zečje oko, razmatraju se učinci na rožnicu, koji su glavni pokretač in vivo razvrstavanja uzimajući u obzir razvrstavanje u skladu sa sustavom UN GHS. Nadalje, iako se reverzibilnost lezija rožnice ne može sama po sebi ocijeniti ICE ispitnom metodom, na temelju istraživanja na zečjem oku predloženo je da se za utvrđivanje određenih vrsta ireverzibilnih učinaka može primjenjivati ocjena početne dubine ozljede rožnice (17.). Potrebne su daljnje znanstvene spoznaje kako bi se razumjelo kako nastaju ireverzibilni učinci koji nisu povezani s početnom ozljedom visoke razine. Naposljetku, ICE ispitnom metodom ne omogućuje se procjena potencijala za sustavnu toksičnost povezanu s izlaganjem oka. Ovu će se ispitnu metodu povremeno ažurirati uzimajući u obzir nove informacije i podatke. Na primjer, histopatologija može biti korisna ako je potreban potpuniji opis oštećenja rožnice. Kako bi se ocijenila ta mogućnost, korisnike se potiče da konzerviraju oči i pripreme histopatološke uzorke koji se mogu upotrijebiti za izradu baze podataka i kriterija za donošenje odluka kojima se može dodatno poboljšati točnost ove ispitne metode. OECD je izradio Smjernicu za primjenu metoda in vitro ispitivanja toksičnosti za oko koja uključuje detaljne postupke za uzimanje histopatoloških uzoraka i informacije o tome kamo treba dostaviti uzorke i/ili histopatološke podatke (8.). Svi laboratoriji koji su započeli s uspostavljanjem ove analize trebali bi upotrebljavati kemikalije za ispitivanje osposobljenosti navedene u Dodatku 2. Laboratorij može upotrebljavati te kemikalije kako bi dokazao svoju tehničku osposobljenost za provedbu ICE ispitne metode prije dostave podataka o ICE ispitnoj metodi u svrhu regulatornog razvrstavanja s obzirom na opasnost. NAČELO ISPITIVANJA ICE ispitna metoda organotipski je model kojim se osigurava kratkotrajno održavanje pilećeg oka in vitro. U ovoj ispitnoj metodi, oštećenje uzrokovano ispitivanom kemikalijom procjenjuje se utvrđivanjem oticanja i zamućenja rožnice te zadržavanja fluoresceina. Zadnja dva parametra podrazumijevaju kvalitativnu ocjenu, a analizom oticanja rožnice dobiva se kvantitativna ocjena. Svako se mjerenje pretvara u kvantitativnu vrijednost za izračun sveukupnog indeksa nadraživanja ili mu se dodjeljuje kvalitativna kategorizacija za razvrstavanje kemikalije kao in vitro opasne za oko, bilo u kategoriju 1. sustava UN GHS ili kao nerazvrstanu prema UN GHS. Bilo koji od tih dvaju ishoda može se zatim upotrijebiti za predviđanje moguće in vivo teške ozljede oka ili nepostojanja potrebe za razvrstavanje ispitivane kemikalije prema opasnosti za oko (vidjeti kriterije za donošenje odluke). Ipak, nije moguće razvrstati kemikalije za koje nije predviđeno da uzrokuju tešku ozljedu oka ili da su nerazvrstane na temelju ICE ispitne metode (vidjeti stavak 11.). Izvor i starost pilećih očiju U testu se inače upotrebljavaju oči prikupljene od pilića iz klaonice gdje su usmrćeni za ljudsku potrošnju, čime se uklanja potreba za laboratorijskim životinjama. Upotrebljavaju se oči samo zdravih životinja koje se smatraju prikladnima za uvrštavanje u lanac ljudske prehrane. Iako nije provedeno kontrolirano istraživanje za ocjenu optimalne starosti pilića, starost i tjelesna masa pilića koji su se ranije upotrebljavali u ovoj ispitnoj metodi jesu starost i tjelesna masa mladih pilića koji se tradicionalno prerađuju u klaonici peradi (tj. pilići približne starosti od sedam tjedana i tjelesne mase od 1,5 do 2,5 kg). Prikupljanje i prijevoz očiju u laboratorij Glave bi trebalo ukloniti odmah nakon sedacije pilića, uobičajeno električnim šokom i rezanjem vrata radi otjecanja krvi. Trebalo bi pronaći lokalnog dobavljača pilića u blizini laboratorija kako bi se pileće glave mogle brzo prevesti iz klaonice u laboratorij i time na najmanju moguću mjeru sveli propadanje i/ili bakteriološka kontaminacija. Vrijeme od prikupljanja pilećih glava do stavljanja očiju u komoru za superfuziju nakon enukleacije trebalo bi biti što je kraće moguće (uobičajeno najviše dva sata) kako bi se osiguralo ispunjavanje kriterija prihvatljivosti analize. Sve oči koje se upotrebljavaju u analizi trebale bi biti iz iste skupine očiju prikupljenih određenog dana. Budući da se disekcija očiju obavlja u laboratoriju, netaknute glave prevoze se iz klaonice pri temperaturi okoline (obično između 18 °C i 25 °C) u plastičnim kutijama ovlaženima ručnicima natopljenima izotoničnom fiziološkom otopinom. Kriteriji za odabir očiju i broj očiju koje se upotrebljava u ICE ispitnoj metodi Odbacuju se oči koje imaju visoku polaznu vrijednost obojenosti fluoresceinom (tj. > 0,5) ili visoku polaznu vrijednost zamućenja rožnice (tj. > 0,5) nakon enukleacije. Sve skupine za tretiranje i istodobne pozitivne kontrole uključuju najmanje tri oka. Negativna kontrolna skupina ili kontrola s otapalom (ako se kao otapalo ne upotrebljava fiziološka otopina) uključuje najmanje jedno oko. U slučaju krutih materijala za koje je rezultat izvan kategorije prema sustavu GHS, preporučuje se drugi ciklus s tri oka kako bi se potvrdio ili odbacio negativan ishod. POSTUPAK Priprema očiju Očni kapci oprezno se izrezuju, pazeći pritom da se ne ošteti rožnica. Integritet rožnice brzo se ocjenjuje kapljicom 2 %-tnog (w/v) natrijeva fluoresceina koji se nanosi na površinu rožnice, ostavlja tamo nekoliko sekundi i zatim ispire izotoničnom fiziološkom otopinom. Oči tretirane fluoresceinom zatim se pregledava mikroskopom s procjepnom svjetiljkom kako bi se provjerilo je li rožnica neoštećena (tj. jesu li vrijednosti zadržavanja fluoresceina i zamućenja rožnice ≤ 0,5). Ako je neoštećeno, oko se zatim dalje secira iz lubanje, pazeći pritom da se ne ošteti rožnica. Očna jabučica izvlači se iz orbite tako da se treći očni kapak čvrsto uhvati kirurškom pincetom i očni mišići prerežu zakrivljenim škarama s tupim vrhom. Važno je da se prejakim pritiskom (tj. artefaktima tlačenja) ne ošteti rožnica. Nakon što je uklonjeno iz orbite, na oku bi trebao ostati vidljiv dio očnog živca. Oko se odmah nakon uklanjanja iz orbite stavlja na upijajući podložak te se izrezuju treći kapak i ostalo vezivno tkivo. Enukleirano oko postavlja se u stezaljku od nehrđajućeg čelika s rožnicom postavljenom vertikalno. Stezaljka se zatim prenosi u komoru uređaja za superfuziju (18.). Stezaljku bi trebalo postaviti u uređaj za superfuziju tako da se osigura nakapavanje čitave rožnice izotoničnom fiziološkom otopinom (tri do četiri kapi u minuti ili od 0,1 do 0,15 ml/min). U komorama uređaja za superfuziju temperaturu bi trebalo kontrolirati na 32 ± 1,5 °C. U Dodatku 3. nalazi se dijagram tipskog uređaja za superfuziju i stezaljke za oko, koji se mogu komercijalno nabaviti ili izraditi. Uređaj se može prilagoditi kako bi se zadovoljile potrebe pojedinih laboratorija (npr. tako da se u njega može postaviti drukčiji broj očiju). Oči se nakon postavljanja u uređaj za superfuziju ponovno pregledavaju mikroskopom s procjepnom svjetiljkom kako bi se osiguralo da nisu oštećene u postupku disekcije. Za to bi vrijeme na apeksu rožnice trebalo izmjeriti i debljinu rožnice uređajem za mjerenje dubine na mikroskopu s procjepnom svjetiljkom. Oči s: i. vrijednošću zadržavanja fluoresceina > 0,5; ii. zamućenjem rožnice > 0,5 ili iii. bilo kojim drugim znakovima oštećenja trebalo bi zamijeniti. Kada je riječ o očima koje nisu odbačene na temelju bilo kojeg od tih kriterija, treba odbaciti svako oko s debljinom rožnica koja za više od 10 % odstupa od srednje vrijednosti za sve oči Korisnici bi trebali znati da se mikroskopima s procjepnom svjetiljkom s različito podešenom širinom procjepa svjetiljke mikroskopa mogu dobiti različita mjerenja debljine rožnice. Širina procjepa trebala bi biti podešena na 0,095 mm. Nakon njihova pregleda i odobrenja, sve se oči inkubira približno 45 do 60 minuta kako bi se uravnotežile sa sustavom ispitivanja prije primjene doze. Nakon razdoblja ujednačavanja za debljinu i zamućenje rožnice kao referentno mjerenje bilježi se nula (tj. vrijeme = 0) koja služi kao polazna vrijednost. Vrijednost fluoresceina utvrđena tijekom seciranja primjenjuje se kao polazna mjera za tu krajnju točku. Primjena ispitivane kemikalije Odmah nakon nultih referentnih mjerenja oko se (u držaču) uklanja iz uređaja za superfuziju, postavlja u horizontalni položaj i ispitivana se kemikalija nanosi na rožnicu. Tekuće ispitivane kemikalije uobičajeno se ispituju nerazrijeđene, ali ih se može razrijediti ako se to smatra potrebnim (npr. kao dio plana istraživanja). Poželjno je otapalo za razrijeđene ispitivane kemikalije fiziološka otopina. Međutim, u kontroliranim se uvjetima mogu primjenjivati i alternativna otapala, ali prikladnost drugih otapala osim fiziološke otopine treba dokazati. Tekuće ispitivane kemikalije nanose se na rožnicu tako da se čitava površina rožnice jednakomjerno prekrije ispitivanom kemikalijom; standardni volumen iznosi 0,03 ml. Ako je to moguće, krute ispitivane kemikalije trebalo bi što finije usitniti mužarom i tučkom ili sličnim alatom za usitnjavanje. Prah se nanosi na rožnicu tako da se površina rožnice jednakomjerno prekrije ispitivanom kemikalijom; standardna količina iznosi 0,03 g. Nanesena ispitivana (tekuća ili kruta) kemikalija djeluje 10 sekundi i zatim se ispire iz oka izotoničnom fiziološkom otopinom (približno 20 ml) pri temperaturi okoline. Oko se (u svojem držaču) zatim vraća u uređaj za superfuziju u prvobitnom uspravnom položaju. Po potrebi se nakon primjene u trajanju od 10 sekundi i u kasnijim vremenskim točkama (npr. nakon otkrivanja ostataka ispitivane kemikalije na rožnici) može primijeniti dodatno ispiranje. Općenito, količina fiziološke otopine dodatno upotrijebljene za ispiranje nije kritična, ali važno je standarde pri primjeni kemikalije na rožnicu. Kontrolne kemikalije Svaki bi pokus trebao uključivati istodobne negativne kontrole ili kontrole s otapalom/nosačem i pozitivne kontrole. Kada se ispituju nerazrijeđene tekućine ili krute tvari, kao istodobna negativna kontrola u ICE ispitnoj metodi primjenjuje se fiziološka otopina kako bi se otkrile nespecifične promjene u ispitnom sustavu i kako bi se osiguralo da uvjeti provedbe testa ne dovedu do neprimjerenog odgovora na nadražujuću tvar. Kada se ispituju razrijeđene tekućine, u ispitnu se metodu uključuje istodobna kontrolna skupina s otapalom/nosačem kako bi se otkrile nespecifične promjene u ispitnom sustavu i kako bi se osiguralo da uvjeti provedbe testa ne dovedu do neprimjerenog odgovora na nadražujuću tvar. Kako je navedeno u stavku 31., mogu se upotrebljavati samo otapala/nosači za koje je dokazano da nemaju negativne učinke na ispitni sustav. Tvar za koju se zna da nadražuje oči uvodi se u svaki pokus kao istodobna pozitivna kontrola kako bi se potvrdio nastanak prikladnog odgovora. Budući da se u ovoj ispitnoj metodi za utvrđivanje nagrizajućih ili jako nadražujućih tvari primjenjuje ICE test, pozitivna kontrola trebala bi biti referentna kemikalija koja u toj ispitnoj metodi izaziva snažan odgovor. Međutim, kako bi se osigurala mogućnost procjene varijabilnosti odgovora pozitivne kontrole tijekom vremena, odgovor ne bi smio biti presnažan. Trebalo bi generirati dovoljno in vitro podataka o pozitivnoj kontroli kako bi se za pozitivnu kontrolu mogao izračunati statistički utvrđen prihvatljivi raspon. Ako za određenu pozitivnu kontrolu nisu dostupni odgovarajući raniji podaci o ICE ispitnoj metodi, možda će biti potrebno provesti istraživanja kako bi se došlo do tih podataka. Primjeri pozitivnih kontrola za tekuće ispitivane kemikalije su 10 %-tna octena kiselina ili 5 %-tni benzalkonijev klorid, dok su primjeri pozitivnih kontrolna za krute ispitivane kemikalije natrijev hidroksid ili imidazol. Referentne kemikalije korisne su za ocjenjivanje potencijala za nadražujuće djelovanje na oči nepoznatih kemikalija iz specifičnog kemijskog razreda ili razreda proizvoda ili za ocjenjivanje relativnog potencijala za nadražujuće djelovanje tvari koja nadražuje oči unutar specifičnog raspona odgovora na nadražujuću tvar. Mjerenje krajnjih točaka Tretirane rožnice ocjenjuju se prije tretiranja u 30., 75., 120., 180. i 240. minuti (±5 minuta) nakon ispiranja poslije tretiranja. Tim se vremenskim točkama osigurava prikladan broj mjerenja tijekom četverosatnog tretiranja, ostavljajući dovoljno vremena između mjerenja za potrebna zapažanja za sve oči. Krajnje točke koje se ocjenjuju jesu zamućenje i oticanje rožnice, zadržavanje fluoresceina i morfološki učinci (tj. pojava rupica ili slabljenje epitela). Sve krajnje točke, osim zadržavanja fluoresceina (koje se utvrđuje samo prije tretiranja i 30 minuta nakon izlaganja ispitivanoj kemikaliji), utvrđuju se u svakoj od prethodno navedenih vremenskih točaka. Preporučuje se fotografijama dokumentirati zamućenje rožnice, zadržavanje fluoresceina, morfološke učinke i histopatologiju, ako je provedena. Nakon posljednjeg pregleda po isteku četiri sata korisnike se potiče da oči konzerviraju u prikladnom fiksativu (npr. u neutralnom puferiranom formalinu) za eventualnu histopatološku pretragu (za pojedinosti vidjeti stavak 14. i literaturu pod 8.). Oticanje rožnice utvrđuje se mjerenjima debljine rožnice optičkim pahimetrom na mikroskopu s procjepnom svjetiljkom. Izražava se kao postotak, a izračunava iz mjerenja debljine rožnice prema sljedećoj formuli:
Srednji se postotak oticanja rožnice za sve ispitivane oči izračunava za sve vremenske točke zapažanja. Na temelju najveće srednje vrijednosti oticanja rožnice, bez obzira na to u kojoj je vremenskoj točki zapažena, dobiva se opća vrijednost za kategoriju za svaku ispitivanu kemikaliju (vidjeti stavak 51.). Za ocjenjivanje zamućenja rožnice uzima se najjače zamućena površina rožnice pri utvrđivanju vrijednosti iz tablice 1. Srednja izmjerena vrijednost zamućenja rožnice za sve ispitivane oči izračunava se za sve vremenske točke zapažanja. Na temelju najveće srednje vrijednosti zamućenja rožnice, bez obzira na to u kojoj je vremenskoj točki zapažena, dobiva se opća vrijednost za kategoriju za svaku ispitivanu kemikaliju (vidjeti stavak 51.). Tablica 1. Vrijednosti zamućenja rožnice.
Zadržavanje fluoresceina ocjenjuje se samo u 30-minutnom intervalu zapažanja kako je prikazano u tablici 2. Srednja vrijednost zadržavanja fluoresceina za sve ispitivane oči zatim se izračunava za 30-minutni interval zapažanja i upotrebljava za opću vrijednost za kategoriju za svaku ispitivanu kemikaliju (vidjeti stavak 51.). Tablica 2. Vrijednost zadržavanja fluoresceina.
Morfološki učinci uključuju ‚rupice’ na epitelnim stanicama rožnice, ‚slabljenje’ epitela, ‚grublju’ površinu rožnice i ‚lijepljenje’ ispitivane kemikalije za rožnicu. Ti nalazi mogu varirati s obzirom na jačinu i mogu se javiti istodobno. Razvrstavanje tih nalaza subjektivno je i temelji se na tumačenju istraživača. PODACI I IZVJEŠĆIVANJE Procjena podataka Rezultate zamućenja i oticanja rožnice te zadržavanja fluoresceina trebalo bi ocjenjivati odvojeno kako bi se dobio ICE razred za svaku krajnju točku. ICE razredi za svaku krajnju točku zatim se kombiniraju kako bi se svaku ispitivanu kemikaliju razvrstalo s obzirom na nadražujuće djelovanje. Kriteriji za donošenje odluke Nakon ocjenjivanja svih krajnjih točaka mogu se odrediti ICE razredi na temelju unaprijed utvrđenog raspona. Oticanje rožnice (tablica 3.), zamućenje rožnice (tablica 4.) i zadržavanje fluoresceina (tablica 5.) tumače se primjenom četiriju ICE razreda u skladu s ljestvicama navedenima u nastavku. Važno je napomenuti da su vrijednosti oticanja rožnice prikazane u tablici 3. primjenjive samo ako se debljinu mjeri mikroskopom (npr. procjepnom svjetiljkom Haag-Streit BP900) s uređajem za mjerenje dubine br. 1. i širinom procjepa podešenom na 9 Tablica 3. Kriteriji razvrstavanja za oticanje rožnice prema ICE-u.
Tablica 4. Kriteriji razvrstavanja za zamućenje prema ICE-u.
Tablica 5. Kriteriji razvrstavanja za srednju izmjerenu vrijednost zadržavanja fluoresceina prema ICE-u.
In vitro razvrstavanje ispitivane kemikalije ocjenjuje se tumačenjem razvrstavanja prema sustavu GHS koje odgovara kombinaciji kategorija dobivenih za oticanje rožnice, zamućenje rožnice i zadržavanje fluoresceina kako je opisano u tablici 6. Tablica 6. Opća in vitro razvrstavanja.
Kriteriji prihvatljivosti istraživanja Ispitivanje se smatra prihvatljivim ako se istodobnim negativnim kontrolama ili kontrolama s nosačem/otapalom i istodobnim pozitivnim kontrolama kemikalije ne mogu razvrstati prema GHS-u odnosno razvrstaju se u kategoriju 1. sustava GHS. Izvješće o ispitivanju U izvješće o ispitivanju trebalo bi uključiti sljedeće informacije ako su relevantne za provedbu istraživanja:
LITERATURA
Appendix 1 DEFINICIJE Točnost : stupanj podudarnosti između rezultata ispitne metode i prihvaćenih referentnih vrijednosti. To je mjerilo učinkovitosti ispitne metode i jedan od aspekata ‚relevantnosti’. Pojam je često međusobno zamjenjiv s pojmom ‚podudarnost’ u smislu udjela točnih ishoda ispitne metode. Referentna kemikalija : kemikalija koja se primjenjuje kao standard za usporedbu s ispitivanom kemikalijom. Referentna kemikalija trebala bi imati sljedeća svojstva: i. podrijetlo iz dosljednih i pouzdanih izvora; ii. strukturnu i funkcionalnu sličnost s razredom kemikalija koje se ispituju; iii. poznata fizikalna/kemijska svojstva; iv. podatke kojima se dokazuju poznati učinci i v. poznatu jakost u rasponu željenog odgovora. Pristup odozdo prema gore : stupnjevit pristup koji se primjenjuje za kemikaliju u pogledu koje postoji sumnja da joj nije potrebno razvrstavanje s obzirom na nadraživanje oka ili tešku ozljedu oka, a koji počinje utvrđivanjem kemikalija za koje nije potrebno razvrstavanje (negativan ishod) u odnosu na druge kemikalije (pozitivan ishod). Kemikalija : tvar ili smjesa. Rožnica : transparentni dio prednje strane očne jabučice kojim su prekrivene šarenica i zjenica i koji propušta svjetlost u unutrašnjost oka. Zamućenje rožnice : izmjereni stupanj zamućenja rožnice nakon izlaganja ispitivanoj kemikaliji. Povećano zamućenje rožnice pokazatelj je oštećenja rožnice. Oticanje rožnice : objektivno mjerenje u okviru ICE ispitne metode stupnja izduženosti rožnice nakon izlaganja ispitivanoj kemikaliji. Izražava se postotkom, a izračunava se iz polaznih mjerenja (prije primjene doze) debljine rožnice i debljine koja se bilježi u redovitim intervalima nakon izlaganja ispitivanoj kemikaliji u ICE ispitnoj metodi. Stupanj oticanja rožnice pokazatelj je oštećenja rožnice. Nadraživanje oka : promjene na oku nastale kao rezultat primjene ispitivane kemikalije na prednju površinu oka, koje su potpuno reverzibilne u roku od 21 dana nakon primjene. Pojam je međusobno zamjenjiv s pojmovima ‚reverzibilni učinci na oko’ i ‚kategorija 2. sustava UN GHS’ (4.). Stopa lažno negativnih rezultata : udio svih pozitivnih kemikalija koje su ispitnom metodom pogrešno identificirane kao negativne. Jedan je od pokazatelja uspješnosti ispitne metode. Stopa lažno pozitivnih rezultata : udio svih negativnih kemikalija koje su ispitnom metodom pogrešno identificirane kao pozitivne. Jedan je od pokazatelja uspješnosti ispitne metode. Zadržavanje fluoresceina : subjektivno mjerenje u okviru ICE ispitne metode stupnja zadržavanja fluorescein natrija u epitelnim stanicama rožnice nakon izlaganja ispitivanoj tvari. Stupanj zadržavanja fluoresceina pokazatelj je oštećenja epitela rožnice. Opasnost : intrinzično svojstvo nekog agensa ili stanje koji imaju potencijal da uzrokuju štetne učinke kada su organizam, sustav ili (sub)populacija izloženi tom agensu. Ireverzibilni učinci na oko : vidjeti ‚teška ozljeda oka’ i ‚kategorija 1. sustava UN GHS’. Smjesa : smjesa ili otopina koja se sastoji od dviju ili više tvari u kojoj one ne reagiraju (4.). Negativna kontrola : netretirani ponovljeni uzorak koji sadržava sve komponente ispitnog sustava. Taj se uzorak obrađuje s uzorcima tretiranima ispitivanom kemikalijom i drugim kontrolnim uzorcima kako bi se utvrdilo je li otapalo u interakciji s ispitnim sustavom. Izvan sustava razvrstavanja : kemikalije koje nisu razvrstane s obzirom na nadraživanje oka (kategorija 2. sustava UN GHS) ili tešku ozljedu oka (kategorija 1. sustava UN GHS). Pojam je međusobno zamjenjiv s pojmom ‚izvan kategorije prema sustavu UN GHS’. Pozitivna kontrola : ponovljeni uzorak koji sadržava sve komponente ispitnog sustava i tretiran je kemikalijom za koju je poznato da izaziva pozitivan odgovor. Kako bi se osigurala mogućnost procjene varijabilnosti odgovora pozitivne kontrole tijekom vremena, odgovor ne bi smio biti presnažan. Pouzdanost : pokazuje u kojoj se mjeri ispitna metoda može obnovljivo primijeniti unutar jednog laboratorija i između više laboratorija tijekom vremena uz primjenu istog protokola. Ocjenjuje se izračunavanjem obnovljivosti unutar jednog laboratorija i između više njih te ponovljivosti unutar jednog laboratorija. Reverzibilni učinci na oko : vidjeti ‚nadraživanje oka’ i ‚kategorija 2. sustava UN GHS’. Teška ozljeda oka : oštećenje očnog tkiva ili ozbiljno fizičko pogoršanje vida izazvano primjenom ispitivane kemikalije na prednju površinu oka, koje nije u potpunosti reverzibilno unutar 21 dana od primjene. Pojam je međusobno zamjenjiv s pojmovima ‚ireverzibilni učinci na oko’ i ‚kategorija 1. sustava UN GHS’ (4.). Biomikroskop : instrument koji se upotrebljava za izravan pregled oka pod povećalom binokularnog mikroskopa stvaranjem uspravne stereoskopske slike. U ICE ispitnoj metodi taj se instrument upotrebljava za promatranje prednjih struktura pilećeg oka, kao i za objektivno mjerenje debljine rožnice prigrađenim uređajem za mjerenje dubine. Kontrola s otapalom/nosačem : netretirani uzorak koji uključuje sve komponente ispitnog sustava, uključujući otapalo ili nosač koji se obrađuje s uzorcima tretiranima ispitivanom kemikalijom i drugim kontrolnim uzorcima kako bi se utvrdio polazni odgovor za uzorke tretirane ispitivanom kemikalijom otopljenom u istom otapalu ili nosaču. Kada se ispituje s istodobnom negativnom kontrolom, tim se uzorkom dokazuje i jesu li otapalo ili nosač u interakciji s ispitnim sustavom. Tvar : kemijski elementi i njihovi spojevi u prirodnom stanju ili dobiveni bilo kojim proizvodnim procesom, uključujući sve dodatke koji su nužni za održavanje stabilnosti proizvoda te sve nečistoće proizišle iz primijenjenog procesa, ali isključujući sva otapala koja se mogu odvojiti bez utjecaja na stabilnost tvari ili promjene njezina sastava (4.). Površinski aktivna tvar : tvar, kao npr. deterdžent, koju se naziva i površinski aktivnim agensom, a kojom se može smanjiti površinska napetost tekućine i time omogućiti pjenjenje i prodiranje u krute tvari; poznata je i kao sredstvo za vlaženje. Pristup odozgo prema dolje : stupnjevit pristup koji se primjenjuje za kemikaliju u pogledu koje postoji sumnja da uzrokuje tešku ozljedu oka, a koji počinje utvrđivanjem kemikalija koje izazivaju tešku ozljedu oka (pozitivan ishod) u odnosu na druge kemikalije (negativan ishod). Ispitivana kemikalija : sve tvari ili smjese koje se ispituju ovom ispitnom metodom. Strategija višerazinskog ispitivanja : strategija stupnjevitog ispitivanja u kojoj se sve postojeće informacije o ispitivanoj kemikaliji preispituju točno utvrđenim redoslijedom, pri čemu se prije prelaska na sljedeću razinu na svakoj razini primjenjuje postupak ocjenjivanja snage dokaza kako bi se odredilo je li na raspolaganju dovoljno informacija za donošenje odluke o razvrstavanju tvari s obzirom na opasnost. Ako se na temelju postojećih podataka ispitivanoj kemikaliji može pripisati potencijal nadražujućeg djelovanja, daljnje ispitivanje nije potrebno. Ako se na temelju postojećih informacija ne može pripisati potencijal nadražujućeg djelovanja, provodi se postupak stupnjevitog sekvencijskog ispitivanja na životinjama sve dok se nedvosmisleno ne utvrdi razvrstavanje. Globalno usklađeni sustav Ujedinjenih naroda za razvrstavanje i označivanje kemikalija (UN GHS) : sustav za razvrstavanje kemikalija (tvari i smjesa) prema standardiziranim vrstama i stupnjevima fizičkih opasnosti i opasnosti za zdravlje i okoliš kojim su obuhvaćena odgovarajuća komunikacijska sredstva, kao što su piktogrami, oznake opasnosti, oznake upozorenja, oznake obavijesti i sigurnosno-tehnički listovi, kojima se prenose informacije o njihovim štetnim učincima s ciljem zaštite ljudi (uključujući poslodavce, radnike, prijevoznike, potrošače i interventno osoblje) i okoliša (4.). Kategorija 1. sustava UN GHS : vidjeti ‚teška ozljeda oka’ i/ili ‚ireverzibilni učinci na oko’. Kategorija 2. sustava UN GHS : vidjeti ‚nadraživanje oka’ i/ili ‚reverzibilni učinci na oko’. Izvan kategorije prema sustavu UN GHS : tvari koje ne ispunjuju zahtjeve za razvrstavanje u kategoriju 1. ili 2. (2.A ili 2.B) sustava UN GHS. Pojam je međusobno zamjenjiv s pojmom ‚izvan sustava razvrstavanja’. Validirana ispitna metoda : ispitna metoda za koju su provedena validacijska istraživanja za utvrđivanje relevantnosti (uključujući točnost) i pouzdanosti za specifičnu namjenu. Važno je napomenuti da validirana ispitna metoda možda neće biti u dovoljnoj mjeri uspješna s obzirom na točnost i pouzdanost da bi je se moglo smatrati prihvatljivom za predloženu namjenu. Ocjenjivanje snage dokaza : proces razmatranja prednosti i nedostataka različitih informacija u donošenju i dokazivanju zaključka o potencijalu opasnosti kemikalije. Dodatak 2. KEMIKALIJE ZA ISPITIVANJE OSPOSOBLJENOSTI ZA ICE ISPITNU METODU Prije rutinske primjene ispitne metode koja je u skladu s ovom ispitnom metodom laboratoriji bi trebali dokazati tehničku osposobljenost točnim utvrđivanjem kategorije opasnosti za oči za 13 kemikalija preporučenih u tablici 1. Odabrane kemikalije čine raspon odgovora u pogledu opasnosti za oči na temelju rezultata in vivo ispitivanja na oku kunića (TG 405) i sustava razvrstavanja UN GHS (tj. kategorija 1., 2.A i 2.B sustava UN GHS ili izvan kategorije) (4. i 6.). Ostali kriteriji odabira bili su komercijalna dostupnost kemikalija, dostupnost visokokvalitetnih referentnih in vivo podataka i postojanje visokokvalitetnih podataka iz ICE in vitro ispitne metode. Referentni podaci dostupni su u Jednostavnom sažetku (engl. Streamlined Summary Document, SSD) (5.) i ICCVAM-ovom Osnovnom dokumentu za preispitivanje (engl. Background Review Document) za ICE ispitnu metodu (9.). Tablica 1. Kemikalije preporučene za dokazivanje tehničke osposobljenosti za ICE ispitnu metodu
Dodatak 3. DIJAGRAMI UREĐAJA ZA SUPERFUZIJU I STEZALJKE ZA OKO U ICE ISPITNOJ METODI (Vidjeti Burton et al. (18.) za dodatne generičke opise uređaja za superfuziju i stezaljke za oko) 
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
(14) |
U dijelu B poglavlje B.49. zamjenjuje se sljedećim: „B.49. In vitro mikronukleus-test na stanicama sisavaca UVOD Ova ispitna metoda odgovara smjernici OECD-a za ispitivanje 487 (2016.). Dio je niza metoda za ispitivanje u području genetske toksikologije. Sastavljen je dokument OECD-a u kojem se daju sažete informacije o ispitivanju u području genetske toksikologije te pregled novijih promjena tih smjernica za ispitivanje (1). Mikronukleus-test in vitro (MNvit) je test genotoksičnosti za otkrivanje mikronukleusa (MN) u citoplazmi interfaznih stanica. Mikronukleusi mogu nastati iz acentričnih kromosomskih fragmenata (tj. onih bez centromere) ili cijelih kromosoma koji tijekom anafaze diobe stanice nisu sposobni putovati na polove. Stoga je mikronukleus-test in vitro metoda in vitro koja pruža sveobuhvatnu osnovu za istraživanje potencijala za kromosomsko oštećenje in vitro jer omogućuje otkrivanje aneugenih i klastogenih agensa (2. i 3.) u stanicama u kojima je tijekom ili nakon izloženosti ispitivanoj kemikaliji došlo do diobe (više je detalja navedeno u stavku 13.). Mikronukleusi predstavljaju oštećenje koje je preneseno na stanice kćeri, dok se kromosomske aberacije u metafaznim stanicama ne moraju nužno prenijeti. U oba slučaja promjene mogu biti nepogodne za preživljavanje stanica. Ova ispitna metoda dopušta upotrebu protokola s citohalazinom B (citoB), inhibitorom polimerizacije aktina, ili bez njega. Dodavanje citohalazina B prije mitoze dovodi do dvojezgrenih stanica te stoga omogućuje identifikaciju i analizu mikronukleusa samo u onim stanicama koje su dovršile jednu mitozu (4. i 5.). U ovoj je ispitnoj metodi dopuštena upotreba protokola bez blokirane citokineze pod uvjetom da postoje dokazi da je u analiziranoj staničnoj populaciji mitoza već dovršena. Osim primjene mikronukleus-testa in vitro za određivanje kemikalija koje uzrokuju nastajanje mikronukleusa, upotrebom imunokemijskog označivanja kinetohora ili hibridizacije centromernim/telomernim sondama (fluorescentna in situ hibridizacija (FISH)) mogu se isto tako dobiti dodatni podaci o mehanizmima oštećenja kromosoma i nastajanja mikronukleusa (6., 7., 8., 9., 10., 11., 12., 13., 14., 15., 16. i 17.). Postupci označivanja i hibridizacije mogu se primijeniti u slučaju povećanog nastajanja mikronukleusa kada istraživač želi utvrditi je li povećanje posljedica klastogenih i/ili aneugenih djelovanja. Budući da se mikronukleusi u interfaznim stanicama mogu ocijeniti relativno objektivno, laboratorijsko osoblje treba utvrditi samo broj dvojezgrenih stanica ako je upotrijebljen citohalazin B te pojavnost stanica s mikronukleusima u svim slučajevima. Predmetna se stakalca stoga mogu pregledati relativno brzo i analiza može biti automatizirana. Time se u praksi omogućuje da se pri svakom tretiranju ocijeni na tisuće umjesto na stotine stanica, čime se povećava snaga tog testa. Naposljetku, s obzirom na to da mikronukleusi mogu nastati iz zaostalih kromosoma, postoji mogućnost otkrivanja tvari koje uzrokuju aneuploidiju i koje se teško proučavaju u uobičajenim ispitivanjima kromosomskih aberacija, npr. poput onih opisanih u poglavlju B.10. ovog Priloga (18.). Međutim, mikronukleus-testom in vitro opisanim u ovoj ispitnoj metodi ne omogućuje se razlikovanje kemikalija koje uzrokuju promjene u broju kromosoma i/ili ploidiju od onih koje uzrokuju klastogenost bez primjene posebnih tehnika, poput metode FISH navedene u stavku 4. Mikronukleus-test in vitro je robustan i može se provesti na različitim vrstama stanica u prisutnosti ili odsutnosti citohalazina B. Postoje opširni podaci kojima se podupire valjanost mikronukleus-testa in vitro kod različitih vrsta stanica (kultura staničnih linija ili primarnih staničnih kultura) (19., 20., 21., 22., 23., 24., 25., 26., 27., 28., 29., 30., 31., 32., 33., 34., 35., 36.). To su u prvom redu međunarodne validacijske studije kojima koordinira Société Française de Toxicologie Génétique (SFTG) (19., 20., 21., 22., 23.) te izvješća Međunarodne radionice o ispitivanju genotoksičnosti (engl. International Workshop on Genotoxicity Testing) (5., 17.). Dostupni podaci bili su isto tako ponovno ocijenjeni u retrospektivnoj validacijskoj studiji s obzirom na snag dokaza, koju je proveo Europski centar za validaciju alternativnih metoda (ECVAM) Europske komisije, dok je Znanstveni savjetodavni odbor ECVAM-a (ESAC) ispitnu metodu potvrdio kao znanstveno valjanu (37., 38., 39.). U mikronukleus-testu in vitro na stanicama sisavaca mogu se upotrijebiti kulture staničnih linija ili primarne stanične kulture podrijetlom od ljudi ili glodavaca. Budući da osnovna učestalost mikronukleusa utječe na osjetljivost testa, preporučuje se upotreba staničnih vrsta sa stabilnom i utvrđenom osnovnom učestalošću nastajanja mikronukleusa. Stanice koje se upotrebljavaju odabiru se na temelju sposobnosti da dobro rastu u kulturi, stabilnosti kariotipa (uključujući broj kromosoma) te spontane učestalosti mikronukleusa (40.). Podacima koji su dostupni u ovom trenutku ne omogućuje se davanje čvrstih preporuka, ali oni upućuju na to da je pri ocjenjivanju kemijskih opasnosti važno uzeti u obzir status proteina p53, genetsku (kariotipsku) stabilnost, sposobnost popravka DNK i podrijetlo stanica odabranih za ispitivanje (potječu li od sisavaca ili od ljudi). Korisnike ove ispitne metode potiče se da razmotre utjecaj tih i drugih značajki stanica na uspješnost stanične linije u otkrivanju indukcije mikronukleusa, s obzirom na razvoj novih spoznaja u tom području. Upotrijebljene definicije navedene su u Dodatku 1. POČETNA RAZMATRANJA I OGRANIČENJA Ispitivanja koja se obavljaju in vitro općenito zahtijevaju uporabu egzogenih izvora metaboličke aktivacije osim ako stanice imaju metaboličko djelovanje u odnosu na ispitivane kemikalije. Egzogenim sustavom metaboličke aktivacije ne oponašaju se u cijelosti in vivo uvjeti. Potrebno je osigurati da se izbjegava stvaranje uvjeta koji bi mogli dovesti do lažno pozitivnih rezultata koji ne odražavaju genotoksičnost ispitivanih kemikalija. Ti uvjeti mogu biti promjene pH-vrijednosti (41., 42., 43.) ili osmolalnosti, interakciju s hranjivom podlogom za uzgoj stanica (44., 45.) ili previsoke razine citotoksičnosti (vidjeti stavak 29.). Da bi se mogla analizirati indukcija mikronukleusa, ključno je da dođe do mitoze u tretiranim i netretiranim kulturama. Najviše se podataka za brojenje mikronukleusa dobiva u stanicama koje su dovršile jednu mitozu tijekom ili nakon tretiranja ispitivanom kemikalijom. Za proizvedene nanomaterijale ovu je ispitnu metodu potrebno posebno prilagoditi, ali te prilagodbe nisu opisane u ovoj ispitnoj metodi. Prije nego što se ova ispitna metoda primijeni na smjesi radi dobivanja podataka za predviđenu regulatornu svrhu, potrebno je razmotriti mogu li se njome dobiti primjereni rezultati za tu svrhu te ako mogu, zašto. Takva razmatranja nisu potrebna ako postoji regulatorni zahtjev za ispitivanje smjese. NAČELO ISPITIVANJA Stanične kulture ljudskog podrijetla ili stanične kulture sisavaca izlažu se ispitivanoj kemikaliji s egzogenim izvorom metaboličke aktivacije i bez njega, osim ako se upotrebljavaju stanice s odgovarajućim metaboličkim djelovanjem (vidjeti stavak 19.). Tijekom ili nakon izlaganja ispitivanoj kemikaliji stanice se uzgajaju onoliko koliko je potrebno da oštećenje kromosoma ili drugi učinci na stanični ciklus / diobu stanica dovedu do nastajanja mikronukleusa u interfaznim stanicama. Za nastanak aneuploidije ispitivana kemikalija obično mora biti prisutna tijekom mitoze. Izdvojene i obojene interfazne stanice analiziraju se na prisutnost mikronukleusa. U idealnom bi slučaju mikronukleuse trebalo pregledati isključivo u stanicama koje su dovršile mitozu tijekom izloženosti ispitivanoj kemikaliji ili u razdoblju nakon izloženosti, ako je takvo razdoblje predviđeno testom. U kulturama koje su tretirane blokatorom citokineze to se lako postiže pregledavanjem isključivo dvojezgrenih stanica. U nedostatku blokatora citokineze važno je na temelju povećanja populacije stanica dokazati da je u analiziranim stanicama vjerojatno došlo do diobe stanica tijekom ili nakon izlaganja ispitivanoj kemikaliji. Za sve je protokole važno dokazati da je došlo do proliferacije stanica i u kontrolnim i u tretiranim kulturama, a opseg citotoksičnosti ili citostaze uzrokovane ispitivanom kemikalijom potrebno je ispitati u svim kulturama u kojima se pregledavaju mikronukleusi. OPIS METODE Stanice Mogu se upotrijebiti primarne kulture limfocita iz periferne krvi čovjeka ili drugih sisavaca (7., 20., 46., 47.) i određeni broj staničnih linija glodavaca kao što su CHO, V79, CHL/IU te stanice L5178Y ili ljudske stanične linije poput TK6 (19., 20., 21., 22., 23., 26., 27., 28., 29., 31., 33., 34., 35., 36.) (vidjeti stavak 6.). Za ispitivanje mikronukleusa upotrebljavane su i druge stanične linije poput HT29 (48.), Caco-2 (49.), HepaRG (50., 51.), HepG2 (52., 53.), A549 te primarnih embrionalnih stanica sirijskog hrčka (54,) ali one još uvijek nisu opsežno validirane. Stoga je upotrebu tih staničnih linija i vrsta potrebno opravdati na temelju njihove dokazane učinkovitosti u ispitivanju, kako je opisano u odjeljku o kriterijima prihvatljivosti. Zabilježeno je da citohalazin B može utjecati na rast stanica L5178Y pa ga se stoga ne preporučuje upotrebljavati s tom staničnom linijom (23.). Kada se upotrebljavaju primarne stanice, trebalo bi radi dobrobiti životinja razmotriti upotrebu stanica ljudskog podrijetla, ako je to izvedivo, te takve stanice uzorkovati u skladu s etičkim načelima i propisima. Ljudski limfociti iz periferne krvi trebali bi se dobivati od mladih osoba (otprilike u dobi od 18 do 35 godina) koje su nepušači, ne boluju ni od jedne poznate bolesti i nisu nedavno bile izložene genotoksičnim agensima (npr. kemikalije, ionizirajuće zračenje) u razinama zbog kojih bi moglo doći do povećanja osnovne učestalosti stanica s mikronukleusima. Time bi se osigurala niska i stalna osnovna učestalost stanica s mikronukleusima. Učestalost stanica s mikronukleusima povećava se s dobi te je taj trend izraženiji kod žena nego kod muškaraca (55.). Ako su za uporabu objedinjene stanice više od jednog darivatelja, trebalo bi navesti broj darivatelja. Potrebno je dokazati da je u razdoblju od početka tretiranja ispitivanom kemikalijom do uzorkovanja stanica došlo do diobe stanica. Stanične kulture održavaju se u fazi eksponencijalnog rasta (stanične linije) ili ih se stimulira na diobu (primarne kulture limfocita) kako bi se izložile stanice u različitim fazama staničnog ciklusa jer možda nije poznato koliko su pojedine stanične faze osjetljive na ispitivane kemikalije. Primarne stanice koje treba stimulirati mitogenim agensima kako bi došlo do diobe obično više nisu sinkronizirane tijekom izlaganja ispitivanoj kemikaliji (npr. ljudski limfociti nakon mitogenske stimulacije u trajanju od 48 sati). Ne preporučuje se upotreba sinkroniziranih stanica tijekom tretiranja ispitivanom kemikalijom, ali ona može biti prihvatljiva u opravdanim slučajevima. Uvjeti koje moraju zadovoljavati podloge i kulture Za održavanje kultura trebalo bi upotrebljavati odgovarajuće hranjive podloge za uzgoj kulture i uvjete inkubacije (posude za kulture, prema potrebi vlažni atmosferski uvjeti s 5 % CO2, temperatura od 37 °C). Rutinski bi trebalo provjeravati stabilnost modalnog broja kromosoma staničnih linija te odsutnost kontaminacije mikoplazmom, a stanice ne bi trebalo upotrebljavati ako su kontaminirane ili ako je došlo promjene u modalnom broju kromosoma. Treba utvrditi uobičajeno trajanje staničnog ciklusa staničnih linija ili primarnih kultura koje se upotrebljavaju u ispitnom laboratoriju i ono treba biti u skladu s objavljenim značajkama stanica. Priprema kultura Stanične linije: stanice se razmnožavaju iz matičnih kultura te se nasađuju na hranjivu podlogu za uzgoj kulture takvom gustoćom da stanice u suspenziji ili jednoslojnoj kulturi nastave eksponencijalno rasti do izdvajanja (npr. treba izbjegavati konfluenciju kod stanica koje rastu kao jednoslojna kultura). Limfociti: puna krv tretirana antikoagulansom (npr. heparinom) ili izolirani limfociti uzgajaju se (npr. tijekom 48 sati ako je riječ o ljudskim limfocitima) u prisutnosti mitogena (npr. fitohemaglutinina (PHA) ako je riječ o ljudskim limfocitima) kako bi se izazvala dioba stanica prije izlaganja ispitivanoj kemikaliji i citohalazinu B. Metabolička aktivacija Kada se upotrebljavaju stanice s neodgovarajućom endogenom metaboličkom sposobnošću, potrebno je upotrijebiti egzogene sustave metaboliziranja. Postmitohondrijska frakcija s dodanim kofaktorom (S9) pripravljena iz jetre glodavaca (obično štakora), koja je bila tretirana sredstvima za enzimsku indukciju, kao što je Aroclor 1254 (56., 57.), ili smjesom fenobarbitala i b-naftoflavona (58., 59., 60.) najčešće je upotrebljavani sustav koji se u pravilu i preporučuje, osim ako je opravdana primjena nekog drugog sustava. Upotreba navedene smjese nije u suprotnosti sa Stockholmskom konvencijom o postojanim organskim onečišćujućim tvarima (61.) i dokazano je da je za nastanak oksidaza s miješanom funkcijom jednako učinkovita kao Aroclor 1254 (58., 59., 60.). Frakcija S9 obično se upotrebljava u koncentracijama u rasponu od 1 do 2 % (v/v), ali može se povećati na 10 % (v/v) u konačnom ispitnom mediju. Tijekom tretiranja trebalo bi izbjegavati proizvode koji smanjuju mitotski indeks, posebno proizvode koji kompleksiraju kalcij (62.). Na odabir vrste i koncentracije upotrijebljenog egzogenog sustava metaboličke aktivacije ili metaboličkog pokretača može utjecati kategorija kemikalija koje se ispituju. Priprema ispitivane kemikalije Prije tretiranja stanica krute ispitivane kemikalije trebalo bi pripremiti u odgovarajućim otapalima i prema potrebi razrijediti. Tekuće ispitivane kemikalije mogu se dodati izravno u ispitni sustav i/ili razrijediti prije tretiranja ispitnog sustava. Plinovite ili hlapljive kemikalije ispituju se nakon što se prikladno izmijene standardni protokoli, kao što je tretiranje u hermetički zatvorenim posudama (63., 64., 65.). Ispitivanu kemikaliju potrebno je pripremiti neposredno prije tretiranja, osim ako je prema podacima o stabilnosti prihvatljivo skladištenje. Uvjeti ispitivanja Otapala Otapalo bi trebalo odabrati tako da se optimizira topljivost ispitivanih kemikalija, a da ono pri tom nema negativnih učinaka na izvođenje pokusa, tj. ne mijenja rast stanica, ne utječe na cjelovitost ispitivane kemikalije, ne reagira s posudama za uzgoj kultura, ne ugrožava sustav metaboličke aktivacije. Preporučuje se da se, kada god je to moguće, prvo uzme u obzir upotreba vodenog otapala (ili hranjive podloge za uzgoj kulture). Uobičajena su otapala voda ili dimetil sulfoksid (DMSO). Organska otapala općenito ne bi smjela premašiti 1 % (v/v). Ako se citohalazin B otapa u DMSO-u, ukupna količina organskog otapala upotrijebljenog za ispitivanu kemikaliju i za citohalazin B ne bi smjela premašiti 1 % (v/v); u protivnom je potrebno upotrijebiti netretirane kontrole kako bi se osiguralo da postotak organskog otapala nema štetnih učinaka. Vodena otapala (fiziološka otopina ili voda) ne bi smjela premašiti 10 % (v/v) u konačnom mediju za tretiranje. Upotrebu neuobičajenih otapala (npr. etanola ili acetona) potrebno je opravdati podacima koji govore da su ta otapala kompatibilna s ispitivanom kemikalijom i ispitnim sustavom te da ne djeluju genotoksično pri upotrijebljenoj koncentraciji. U nedostatku takvih podataka važno je uključiti netretirane kontrole (vidjeti Dodatak 1.) te kontrole s otapalom kako bi se dokazalo da odabrano otapalo ne proizvodi nikakve štetne ili kromosomske učinke (npr. aneuploidiju ili klastogenost). Upotreba citohalazina B kao blokatora citokineze Za učinkovitost analize mikronukleusa in vitro vrlo je važno osigurati da u stanicama na kojima se izvodi test mitoza bude dovršena tijekom tretiranja ili u razdoblju inkubacije nakon tretiranja, ako je takvo razdoblje predviđeno testom. Brojenje mikronukleusa trebalo bi stoga ograničiti na stanice u kojima je došlo do mitoze tijekom tretiranja ili nakon njega. Citohalazin B je agens koji se najčešće upotrebljava za blokadu citokineze jer sprječava sastavljanje aktina i time onemogućuje odvajanje stanica kćeri nakon mitoze, zbog čega nastaju stanice s dvjema jezgrama (6., 66., 67.). Kada se upotrebljava citohalazin B, istodobno se može mjeriti i učinak ispitivane kemikalije na kinetiku proliferacije stanica. Citohalazin B potrebno je upotrijebiti kao blokatora citokineze kada se upotrebljavaju ljudski limfociti jer se trajanje staničnih ciklusa razlikuje od darivatelja do darivatelja i svi limfociti neće reagirati na stimulaciju fitohemaglutininom. Citohalazin B nije obvezan za druge vrste stanica ako se može utvrditi da je u tim stanicama došlo do diobe kako je opisano u stavku 27. Osim toga, citohalazin B općenito se ne upotrebljava ako se stvaranje mikronukleusa u uzorcima ocjenjuje metodama protočne citometrije. Laboratorij bi trebao za svaku vrstu stanica odrediti prikladnu koncentraciju citohalazina B za postizanje optimalne učestalosti dvojezgrenih stanica u kontrolnim kulturama s otapalom te dokazati da se njome omogućuje stvaranje dovoljnog broja dvojezgrenih stanica za analizu. Prikladna koncentracija citohalazina B obično je od 3 do 6 μg/ml (19.). Mjerenje proliferacije stanica i citotoksičnosti te odabir ispitnih koncentracija Kod određivanja najviše koncentracije ispitivane kemikalije potrebno je izbjegavati koncentracije koje imaju sposobnost izazivanja lažno pozitivnih odgovora, kao što su koncentracije koje izazivaju pretjeranu citotoksičnost (vidjeti stavak 29.), precipitaciju u hranjivoj podlozi za uzgoj kulture (vidjeti stavak 30.) ili znatne promjene pH-vrijednosti ili osmolalnosti (vidjeti stavak 9.). Ako ispitivana kemikalija u trenutku dodavanja uzrokuje znatnu promjenu pH-vrijednosti hranjive podloge, pH-vrijednost može se prilagoditi puferiranjem konačnog medija za tretiranje kako bi se izbjegli lažno pozitivni rezultati te održali primjereni uvjeti za uzgoj kulture. Proliferacija stanica mjeri se kako bi se osiguralo da je u dovoljnom broju tretiranih stanica došlo do mitoze tijekom ispitivanja te da se stanice tretiraju na odgovarajućim razinama citotoksičnosti (vidjeti stavak 29.). Citotoksičnost bi trebalo utvrditi s metaboličkom aktivacijom i bez nje u glavnom pokusu uz uporabu prikladnih pokazatelja smrti i rasta stanica (vidjeti stavke 26. i 27.). Iako preliminarno ocjenjivanje citotoksičnosti može biti korisno za bolje određivanje koncentracija koje će se upotrijebiti u glavnom pokusu, takvo ispitivanje nije obvezno. Ako se provede, njime se ne bi trebalo zamijeniti mjerenje citotoksičnosti u glavnom pokusu. Tretiranje kultura citohalazinom B i mjerenje relativne učestalosti stanica s jednom, dvije ili više jezgri u kulturi precizna je metoda kvantificiranja učinka na proliferaciju stanica i citotoksično ili citostatično djelovanje tretiranja (6.) te se njime osigurava da se mikroskopski pregledaju samo one stanice u kojima je došlo do diobe tijekom ili nakon tretiranja. Preporučuje se izmjeriti indeks proliferacije stanica s blokiranom citokinezom (cytokinesis-block proliferation index, CBPI) (6., 27., 68.) ili indeks ponavljanja (Replication Index, RI) na temelju najmanje 500 stanica po kulturi (vidjeti Dodatak 2. za formule) kako bi se usporedbom vrijednosti dobivenih za tretirane i kontrolne kulture procijenilo citotoksično i citostatično djelovanje tretiranja. Ocjenjivanjem drugih pokazatelja citotoksičnosti (kao što su cjelovitost stanica, apoptoza, nekroza, brojanje stanica u metafazi, stanični ciklus) mogli bi se dobiti korisni podaci, ali to se ocjenjivanje ne smije upotrijebiti kao zamjena za CBPI ili RI. U istraživanjima u kojima se ne primjenjuje citohalazin B potrebno je dokazati da je u stanicama u kulturi došlo do diobe, tako da je tijekom ili nakon tretiranja ispitivanom kemikalijom kod znatnog udjela stanica koje se pregledavaju došlo do stanične diobe jer se u suprotnome mogu dobiti lažno negativni rezultati. Za procjenu citotoksičnog i citostatičnog djelovanja tretiranja preporučuje se izmjeriti relativno udvostručenje populacije (Relative Population Doubling, RPD) ili relativno povećanje broja stanica (engl. Relative Increase in Cell Count, RICC) (17., 68., 69., 70., 71.) (vidjeti Dodatak 2. za formule). Kada se primjenjuju produljena vremena uzorkovanja (npr. ako razdoblje tretiranja odgovara duljini od 1,5 do 2 normalna stanična ciklusa, a izdvajanje se provodi po isteku dodatnog razdoblja koje odgovara duljini od 1,5 do 2 normalna stanična ciklusa, što dovodi do uzorkovanja s vremenskim odmakom duljim od 3 do 4 normalna stanična ciklusa kako je opisano u stavcima 38. i 39.) može se dogoditi da se RPD-om podcijeni citotoksičnost (71.). U tim bi okolnostima RICC mogao biti bolja mjera, ali bi i ocjena citotoksičnosti nakon 1,5 do 2 normalna stanična ciklusa bila korisna procjena. Ocjenjivanjem drugih pokazatelja citotoksičnosti ili citostaze (kao što su cjelovitost stanica, apoptoza, nekroza, brojanje stanica u metafazi, indeks proliferacije (PI), stanični ciklus, nukleoplazmatski mostovi ili nuklearni pupovi) mogli bi se dobiti korisni dodatni podaci, ali to se ocjenjivanje ne smije upotrijebiti kao zamjena za RPD ili RICC. Potrebno je ocijeniti najmanje tri ispitne koncentracije (ne uključujući otapalo i pozitivne kontrole) koje ispunjuju kriterije prihvatljivosti (odgovarajuća citotoksičnost, broj stanica itd.). Neovisno o vrsti stanica (stanične linije ili primarne kulture limfocita) za svaku se ispitivanu koncentraciju može upotrijebiti samo jedna tretirana kultura ili više njezinih ponovljenih uzoraka. Iako se preporučuje upotreba dviju usporednih kultura, prihvatljiva je i upotreba jedne kulture pod uvjetom da se pregleda jednak ukupni broj stanica neovisno o tome je li riječ o jednoj kulturi ili dvjema usporednim kulturama. Upotreba jedne kulture posebno je relevantna kada se ocjenjuje više od tri koncentracije (vidjeti stavke 44. – 45.). Rezultati dobiveni iz neovisnih ponovljenih kultura pri određenoj koncentraciji mogu se objediniti radi analize podataka. Za ispitivane kemikalije za koje je dokazana mala citotoksičnost ili nepostojanje citotoksičnosti uobičajeno će biti prikladne koncentracije u dva do tri intervala. Ako se pojavi citotoksičnost, odabranim bi ispitnim koncentracijama trebalo obuhvatiti raspon od one koja uzrokuje citotoksičnost kako je opisano u stavku 29. te uključiti koncentracije pri kojima se javlja umjerena citotoksičnost i one pri kojima je citotoksičnost mala ili je nema. Mnoge ispitivane kemikalije imaju oštre krivulje odgovora na koncentraciju te će za dobivanje podataka pri niskoj ili umjerenoj citotoksičnosti ili za detaljno istraživanje odnosa između doze i odgovora biti potrebno upotrijebiti bliže raspoređene koncentracije i/ili više od tri koncentracije (za jednu ili ponovljene kulture), posebno u situacijama u kojima je potrebno ponavljanje pokusa (vidjeti stavak 60.). Ako se najviša koncentracija temelji na citotoksičnosti, najjača bi koncentracija trebala proizvesti 55 ± 5 % citotoksičnosti prema preporučenim parametrima citotoksičnosti (tj. smanjenje RICC-a i RPD-a za stanične linije kada se ne upotrebljava citohalazin B te smanjenje CBPI-ja ili RI-ja kada se upotrebljava citohalazin B na 45 ± 5 % istodobne negativne kontrole) (72.). Trebalo bi s oprezom tumačiti pozitivne rezultate koji se nalaze samo u gornjem dijelu navedenog raspona citoksičnosti od 55 ± 5 % (71.). Za slabo topljive ispitivane kemikalije koje nisu citotoksične pri koncentracijama nižima od najniže koncentracije pri kojoj kemikalija nije topljiva najviša bi analizirana koncentracija trebala dovesti do zamućenosti ili taloga vidljivog golim okom ili inverznim mikroskopom na kraju tretiranja ispitivanom kemikalijom. Čak i ako se citotoksičnost javlja pri koncentracijama koje su više od najniže koncentracije pri kojoj tvar nije topljiva, preporučuje se provesti ispitivanje pri samo jednoj koncentraciji koja izaziva zamućenost ili vidljivi talog jer se mogu pojaviti lažni rezultati kao posljedica taloga. Pri koncentraciji zbog koje nastaje talog potrebno je osigurati da taj talog ne utječe na izvođenje ispitivanja (npr. bojenje ili brojenje). Može biti korisno odrediti topljivost u hranjivoj podlozi za uzgoj kulture prije izvođenja pokusa. Ako se ne opazi talog ili ograničavajuća citotoksičnost, najviša ispitna koncentracija trebala bi iznositi 10 mM, 2 mg/ml ili 2 μl/ml, ovisno o tome što je manje (73., 74., 75.). Ako sastav ispitivane kemikalije nije definiran, npr. ako je riječ o tvarima nepoznatog ili promjenjivog sastava, složenim reakcijskim proizvodima ili biološkim materijalima (UVCB) (76.), proizvodima ekstrahiranima iz okoliša itd., može biti potrebno povećati najvišu koncentraciju (npr. na 5 mg/ml), u nedostatku dovoljne citotoksičnosti, kako bi se povećala koncentracija svakog od sastojaka. Međutim, potrebno je naglasiti da navedeni zahtjevi mogu biti drukčiji za lijekove za ljudsku uporabu (93.). Kontrole Kod svakog izdvajanja stanica potrebno je uključiti i istodobne negativne kontrole (vidjeti stavak 21.) koje se sastoje samo od otapala u hranjivoj podlozi za tretiranje i tretirane su na jednak način kao i kulture. Istodobne pozitivne kontrole potrebne su za dokazivanje sposobnosti laboratorija da identificira klastogene i aneugene tvari u uvjetima ispitnog protokola te za dokazivanje učinkovitosti egzogenog sustava metaboličke aktivacije (kada je primjenjivo). Primjeri pozitivnih kontrola navedeni su u tablici 1. u nastavku. Ako je to opravdano, mogu se koristiti alternativne kemikalije koje se upotrebljavaju kao pozitivna kontrola. Trenutačno nisu poznati aneugeni koji za svoje genotoksično djelovanje zahtijevaju aktivaciju metabolizma (17.). S obzirom na to da je in vitro ispitivanje genotoksičnosti na stanicama sisavaca u dostatnoj mjeri standardizirano za kratkotrajna tretiranja koja se istodobno provode s metaboličkom aktivacijom i bez nje uz isto trajanje tretiranja, upotreba pozitivnih kontrola može se ograničiti na klastogene tvari koje zahtijevaju metaboličku aktivaciju. U tom će slučaju jedan klastogeni odgovor u pozitivnoj kontroli dokazati djelovanje sustava metaboličke aktivacije i osjetljivost ispitnog sustava. Međutim, dugotrajno tretiranje (bez S9) trebalo bi imati vlastitu pozitivnu kontrolu s obzirom na to da je trajanje tretiranja drukčije nego kod ispitivanja u kojemu se upotrebljava metabolička aktivacija. Ako se odabere klastogen kao jedina pozitivna kontrola za kratkotrajno tretiranje s metaboličkom aktivacijom i bez nje, za dugotrajno tretiranje s metaboličkom aktivacijom trebalo bi odabrati aneugen. Pozitivne kontrole i za klastogenost i za aneugenost trebalo bi upotrebljavati za metabolički kompetentne stanice koje ne zahtijevaju S9. Svaku pozitivnu kontrolu trebalo bi primijeniti pri jednoj ili više koncentracija za koje se očekuje da će dovesti do ponovljivih i zamjetnih povećanja u odnosu na pozadinu kako bi se dokazala osjetljivost ispitnog sustava (tj. učinci su jasni, ali identitet kodiranih predmetnih stakalaca nije odmah očit osobi koja ih očitava), a odgovor ne bi trebalo dovesti u pitanje citotoksičnošću koja prelazi granične vrijednosti utvrđene u ispitnoj metodi. Tablica 1. Preporučene referentne kemikalije za procjenu osposobljenosti laboratorija i odabir pozitivnih kontrola
POSTUPAK Plan tretiranja Kako bi vjerojatnost otkrivanja aneugenih ili klastogenih tvari koje djeluju u određenoj fazi staničnog ciklusa bila što veća, važno je da u svim fazama njihovih staničnih ciklusa dovoljan broj stanica bude tretiran ispitivanom kemikalijom. Sva bi tretiranja trebala započeti i završiti tijekom eksponencijalnog rasta stanica, koje bi trebale nastaviti rasti sve do uzorkovanja. Raspored tretiranja staničnih linija i primarnih staničnih kultura stoga se do određene mjere može razlikovati od onoga za limfocite koji zahtijevaju mitogensku stimulaciju za započinjanje staničnog ciklusa (17.). Najučinkovitiji pristup za limfocite je započeti s izlaganjem ispitivanoj tvari 44 do 48 sati nakon stimulacije PHA-om, kada su diobe stanica asinkrone (6.). Objavljeni podaci (19.) pokazuju da se većina aneugena i klastogena otkriva kratkotrajnim tretiranjem u trajanju od tri do šest sati u prisutnosti i odsutnosti S9 nakon čega se ispitivana kemikalija uklanja te se uzorkovanje provodi po isteku razdoblja koje otprilike odgovara trajanju od 1,5 do 2,0 normalna stanična ciklusa nakon početka tretiranja (7.). Međutim, za temeljitu procjenu, koja će biti potrebna za donošenje zaključka o negativnom ishodu, potrebno je primijeniti sva tri sljedeća pokusna uvjeta primjenom kratkotrajnog tretiranja s metaboličkom aktivacijom i bez nje te dugotrajnog tretiranja bez metaboličke aktivacije (vidjeti stavke 56., 57. i 58.):
Ako bilo koji od gore navedenih pokusnih uvjeta dovede to pozitivnog odgovora, možda neće biti potrebno istražiti ni jedan drugi postupak tretiranja. Ako je poznato da ispitivana kemikalija utječe na duljinu staničnog ciklusa ili se na to sumnja (npr. pri ispitivanju analognih nukleozida), posebno za stanice kompetentne u pogledu p53 (35., 36., 77.), uzorkovanje ili obnavljanje može se produljiti za dodatno razdoblje koje odgovara trajanju od 1,5 do 2,0 normalna stanična ciklusa (tj. ukupno od 3,0 do 4,0 stanična ciklusa nakon početka kratkotrajnih i dugotrajnih tretiranja). Navedene se mogućnosti odnose na situacije koje mogu biti zabrinjavajuće zbog mogućih interakcija između ispitivane kemikalije i citohalazina B. Kada se primjenjuju produljena vremena uzorkovanja (tj. uzgoj kulture u trajanju od 3,0 do 4,0 stanična ciklusa), potrebno je voditi računa o tome da se u stanicama i dalje aktivno odvija dioba. Primjerice, kod limfocita eksponencijalni rast može početi opadati 96 sati nakon stimulacije te jednoslojne kulture stanica mogu postati konfluentne. Predloženi rasporedi tretiranja stanica sažeto su navedeni u tablici 2. Ti se opći rasporedi tretiranja mogu izmijeniti (pri čemu izmjena mora biti opravdana) ovisno o stabilnosti ili reaktivnosti ispitivane kemikalije ili posebnim značajkama rasta upotrijebljenih stanica. Tablica 2. Razdoblja tretiranja i izdvajanja stanica za in vitro mikronukleus-test
Na kraju tretiranja u trajanju od tri do šest sati u jednoslojnim kulturama mogu biti prisutne mitotičke stanice (prepoznatljive po tome što su okrugle i odvajaju se od površine). Budući da se te mitotičke stanice lako odvajaju, mogu se izgubiti pri odstranjivanju podloge s ispitivanom kemikalijom. Ako postoji dokaz o znatnom povećanju broja mitotičkih stanica u odnosu na kontrole, čime se ukazuje na vjerojatno zaustavljanje mitoze, te stanice trebalo bi prikupiti centrifugiranjem i ponovno dodati kulturama kako bi se u trenutku izdvajanja stanica izbjegao gubitak stanica koje se nalaze u fazi mitoze i kojima prijeti opasnost od mikronukleusa / kromosomskih aberacija. Izdvajanje stanica i priprema predmetnih stakalaca Svaka se kultura izdvaja i obrađuje zasebno. Priprema stanica može uključiti hipotonično tretiranje, iako taj korak nije potreban ako se na drugi način može ostvariti primjereno širenje stanica. Za pripremu stakalca mogu se upotrijebiti različite tehnike, pod uvjetom da se za pregled dobiju visokokvalitetni preparati sa stanicama. Potrebno je zadržati stanice koje imaju netaknutu staničnu membranu i netaknutu citoplazmu kako bi se omogućilo otkrivanje mikronukleusa i (u metodi blokirane citokineze) pouzdana identifikacija dvojezgrenih stanica. Stakalca se mogu obojiti različitim metodama, kao što su metoda po Giemsi ili s pomoću fluorescentnih bojila specifičnih za DNK. Upotrebom odgovarajućih fluorescentnih bojila (npr. akridin oranž (78.) ili Hoechst 33258 plus pironin-Y (79.)) može se spriječiti stvaranje nekih od artefakta koji se povezuju s upotrebom bojila koja nisu specifična za DNK. Antikinetohorna protutijela, fluorescentna in situ hibridizacija (FISH) pancentromernim sondama DNK ili primarno označivanje in situ početnicama specifičnima za centromere zajedno s odgovarajućim kontrastnim bojenjem DNK mogu se primijeniti za određivanje sadržaja mikronukleusa (čitavi kromosomi bit će obojeni, a acentrični kromosomski fragmenti neće) ako se žele dobiti mehanističke informacije o njihovu nastajanju (16., 17.). Za razlikovanje klastogenih i aneugenih tvari mogu se primijeniti i druge metode, ako su dokazano učinkovite i validirane. Primjerice, za određene se stanične linije korisne informacije mogu dobiti mjerenjem jezgri sub-2N kao hipodiploidnih događaja primjenom tehnika poput analize slike, laserske skenirajuće citometrije ili protočne citometrije (80., 81., 82.). Morfološka zapažanja na jezgrama mogla bi isto tako upućivati na moguću aneuploidiju. Osim toga, ispitivanje aberacija metafaznih kromosoma, provedeno po mogućnosti na istoj vrsti stanice i u skladu s protokolom usporedive osjetljivosti, moglo bi isto tako biti koristan način određivanja nastaju li mikronukleusi zbog loma kromosoma (znajući da gubitak kromosoma ne bi bio otkriven testom kromosomske aberacije). Analiza Sva predmetna stakalca, uključujući ona s otapalom te netretiranim (ako su upotrijebljene) i pozitivnim kontrolama, potrebno je pojedinačno kodirati prije mikroskopske analize učestalosti mikronukleusa. Kad se primjenjuju automatski sustavi za brojenje, na primjer protočna citometrija, laserska skenirajuća citometrija ili slikovna analiza, trebalo bi primijeniti odgovarajuće tehnike za kontrolu mogućeg utjecaja ili pomaka. Bez obzira na to koja se automatska platforma upotrebljava za brojenje mikronukleusa, potrebno je istodobno procijeniti CBPI, RI, RPD i RICC. Kod kultura tretiranih citohalazinom B učestalost mikronukleusa potrebno je analizirati na najmanje 2 000 dvojezgrenih stanica po koncentraciji i kontroli (83.), jednakomjerno raspodijeljenih na ponovljenim uzorcima, ako se oni upotrebljavaju. Ako se za svaku koncentraciju upotrebljava samo jedna kultura (vidjeti stavak 28.), potrebno je pregledati najmanje 2 000 dvojezgrenih stanica po kulturi (83.). Ako je za pregled pri svakoj koncentraciji dostupno znatno manje od 1 000 dvojezgrenih stanica po kulturi (u slučaju dviju usporednih kultura) ili 2 000 dvojezgrenih stanica (ako se upotrebljava jedna kultura) te ako nije utvrđeno značajno povećanje mikronukleusa, test je potrebno ponoviti na većem broju stanica ili pri manje citotoksičnim koncentracijama, ovisno o tome što je primjerenije. Potrebno je paziti da se ne ocjenjuju dvojezgrene stanice nepravilnog oblika ili kod kojih postoji velika razlika u veličini dviju jezgri. Osim toga, dvojezgrene stanice ne smiju se zamijeniti sa slabo raširenim višejezgrenim stanicama. Stanice koje imaju više od dviju glavnih jezgri ne analiziraju se na mikronukleuse jer osnovna učestalost mikronukleusa u tim stanicama može biti veća (84.). Pregledavanje jednojezgrenih stanica prihvatljivo je ako se pokazalo da ispitivana kemikalija utječe na djelovanje citohalazina B. U takvim bi slučajevima moglo biti korisno ponoviti test bez citohalazina B. Pregledavanjem i jednojezgrenih stanica uz dvojezgrene mogle bi se dobiti korisne informacije (85., 86.), ali ono nije obvezno. Kod staničnih linija koje se ispituju bez tretiranja citohalazinom B mikronukleuse bi trebalo brojiti u najmanje 2 000 stanica po ispitnoj koncentraciji i kontroli (83.), jednakomjerno raspodijeljenih na ponovljenim uzorcima, ako se oni upotrebljavaju. Ako se za svaku koncentraciju upotrebljava samo jedna kultura (vidjeti stavak 28.), potrebno je pregledati najmanje 2 000 stanica po kulturi. Ako je za pregled pri svakoj koncentraciji dostupno znatno manje od 1 000 stanica po kulturi (u slučaju dviju usporednih kultura) ili 2 000 stanica (ako se upotrebljava jedna kultura) te ako nije utvrđeno znatno povećanje mikronukleusa, test je potrebno ponoviti na većem broju stanica ili pri manje citotoksičnim koncentracijama, ovisno o tome što je primjerenije. Ako se upotrebljava citohalazin B, potrebno je utvrditi CBPI ili RI kako bi se procijenila proliferacija stanica (vidjeti Dodatak 2.), upotrebljavajući pri tom najmanje 500 stanica po kulturi. Ako se tretiranje izvodi bez dodanog citohalazina B, ključno je dostaviti dokaz da je došlo do diobe stanica u kulturi, kako je objašnjeno u stavcima od 24. do 28. Osposobljenost laboratorija Kako bi stekao dovoljno iskustva u izvođenju testa prije njegove rutinske primjene, laboratorij treba izvesti niz pokusa s referentnim pozitivnim kemikalijama koje djeluju putem različitih mehanizama (najmanje jedna s metaboličkom aktivacijom i jedna bez metaboličke aktivacije te jedna putem aneugenog mehanizma, izabrane s popisa kemikalija iz tablice 1.) te s različitim negativnim kontrolama (uključujući netretirane kulture i različita otapala/nosače). Odgovori pozitivnih i negativnih kontrola trebali bi biti u skladu s literaturom. To se ne primjenjuje na laboratorije koji već imaju iskustva, tj. one koji imaju bazu podataka o prijašnjim ispitivanjima kako je utvrđeno u stavcima od 49. do 52. Odabrane kemikalije koje se upotrebljavaju kao pozitivna kontrola (vidjeti tablicu 1.) potrebno je ispitati u okviru kratkotrajnih i dugotrajnih tretiranja u odsutnosti metaboličke aktivacije te u okviru kratkotrajnog tretiranja u prisutnosti metaboličke aktivacije kako bi se pokazala osposobljenost za otkrivanje klastogenih i aneugenih kemikalija, dokazala djelotvornost sustava metaboličke aktivacije te primjerenost postupaka pregledavanja (vizualna mikroskopska analiza, protočna citometrija, laserska skenirajuća citometrija ili analiza slike). Potrebno je izabrati raspon koncentracija odabranih kemikalija pri kojima će doći do ponovljivih povećanja u odnosu na pozadinske vrijednosti, koja su povezana s koncentracijom, kako bi se dokazala osjetljivost i dinamički raspon ispitnog sustava. Podaci o prijašnjim kontrolama Laboratorij bi trebao uspostaviti:
Pri prvom bi dobivanju podataka radi uspostave baze podataka o raspodjeli prijašnjih negativnih kontrola istodobne negativne kontrole trebale biti u skladu s objavljenim podacima o negativnim kontrolama, ako postoje. Kako se budu dodavali novi podaci o raspodjeli kontrola, istodobne negativne kontrole trebale bi u idealnom slučaju biti unutar kontrolnih granica od 95 % te raspodjele (87., 88.). Laboratorij bi svoju bazu podataka o prijašnjim negativnim kontrolama prvo trebao uspostaviti na temelju najmanje deset pokusa, iako se preporučuje da se ona temelji na najmanje 20 pokusa provedenih u usporedivim pokusnim uvjetima. Laboratoriji bi trebali primjenjivati metode kontrole kvalitete, kao što su kontrolni dijagrami (npr. C-dijagrami (C-charts) ili X-stupčasti dijagrami (X-bar charts) (88.)), kako bi utvrdili varijabilnost svojih podataka o pozitivnim i negativnim kontrolama te pokazali da je u njihovu laboratoriju metodologija ‚pod kontrolom’ (83.). Dodatne preporuke o tome kako uspostaviti i upotrebljavati prijašnje podatke (tj. kriteriji prema kojima se podaci uključuju u bazu o prijašnjim podacima te isključuju iz nje, kao i kriteriji prihvatljivosti za određeni pokus) dostupne su u literaturi (87.). Svaku izmjenu pokusnog protokola trebalo bi razmotriti s obzirom na to jesu li podaci u skladu s postojećim bazama podataka laboratorija o prijašnjim kontrolama. Svaka veća nesukladnost trebala bi dovesti do uspostave nove baze podataka o prijašnjim kontrolama. Podaci o negativnim kontrolama trebali bi se sastojati od podataka o učestalosti stanica s mikronukleusima u jednoj kulturi ili u skupu ponovljenih kultura kako je opisano u stavku 28. Istodobne negativne kontrole u idealnom bi slučaju trebale biti unutar kontrolnih granica od 95 % raspodjele prijašnjih podataka o negativnim kontrolama koji se nalaze u bazi podataka laboratorija (87., 88.). Ako se podaci o istodobnim negativnim kontrolama nalaze izvan kontrolnih granica od 95 %, mogu biti prihvatljivi za uključenje u bazu povijesnih podataka o raspodjeli pod uvjetom da ti podaci nisu ekstremne netipične vrijednosti te da postoje dokazi o tome da je ispitni sustav ‚pod kontrolom’ (vidjeti stavak 50.) i da nema tehničke ili ljudske pogreške. PODACI I IZVJEŠĆIVANJE PREDSTAVLJANJE REZULTATA Ako se primjenjuje tehnika blokiranja citokineze, za ocjenjivanje indukcije mikronukleusa uzima se u obzir isključivo učestalost dvojezgrenih stanica s mikronukleusima (bez obzira na broj mikronukleusa po stanici). O pregledavanju stanica s jednim, dvama ili više mikronukleusa može se odvojeno izvijestiti te iako se tako mogu dobiti korisne informacije, to nije obvezno. Potrebno je izvršiti istodobna mjerenja citotoksičnosti i/ili citostaze za sve tretirane kulture te pozitivne i negativne kontrole (16.). Za sve tretirane i kontrolne kulture potrebno je izračunati CBPI ili RI kako bi se izmjerilo kašnjenje staničnog ciklusa ako se primjenjuje metoda blokirane citokineze. U odsutnosti citohalazina B mjeri se RPD ili RICC (vidjeti Dodatak 2.). Potrebno je navesti podatke o pojedinačnim kulturama. Osim toga, sve je podatke potrebno sažeto prikazati u obliku tablice. Kriteriji prihvatljivosti Prihvatljivost ispitivanja temelji se na sljedećim kriterijima:
Ocjenjivanje i tumačenje rezultata Pod uvjetom da su svi kriteriji prihvatljivosti ispunjeni, ispitivana kemikalija smatra se jasno pozitivnom ako u bilo kojem ispitanom pokusnom uvjetu (vidjeti stavke 36. – 39.):
Ako su svi navedeni kriteriji ispunjeni, smatra se da ispitivana kemikalija može uzrokovati lomove i/ili povećanje ili gubitak kromosoma u tom ispitnom sustavu. Preporuke o najprikladnijim statističkim metodama dostupne su i u literaturi (90., 91., 92.). Pod uvjetom da su svi kriteriji prihvatljivosti ispunjeni, ispitivana kemikalija smatra se jasno negativnom ako u svim ispitanim pokusnim uvjetima (vidjeti stavke 36. – 39.):
Tada se smatra da ispitivana kemikalija ne može uzrokovati lomove i/ili povećanje ili gubitak kromosoma u tom ispitnom sustavu. Preporuke o najprikladnijim statističkim metodama dostupne su i u literaturi (90., 91., 92.). Jasno pozitivan ili negativan odgovor nije potrebno provjeravati. U slučaju kada reakcija nije ni jasno negativna niti jasno pozitivna kako je prethodno opisano i/ili kako bi se utvrdila biološka relevantnost rezultata, podatke bi trebalo ocijeniti stručnom prosudbom i/ili dodatnim istraživanjima. Moglo bi biti korisno pregledati dodatne stanice (prema potrebi) ili ponoviti pokus u eventualno izmijenjenim pokusnim uvjetima (npr. razmak između koncentracija, drugi uvjeti metaboličke aktivacije (tj. koncentracija S9 ili podrijetlo S9)). U rijetkim slučajevima, čak i nakon dodatnih istraživanja, skupom podataka neće se omogućiti donošenje zaključka o tome je li rezultat pozitivan ili negativan te će se stoga zaključiti da je dvosmislen. U in vitro mikronukleus-testu ispitivane kemikalije mogu inducirati mikronukleuse zato što uzrokuju lom kromosoma, gubitak kromosoma ili kombinaciju tih dviju pojava. Kako bi se odredilo je li mehanizam indukcije mikronukleusa posljedica klastogenog i/ili aneugenog djelovanja, mogu se provesti dodatne analize primjenom antikinetohornih protutijela, in situ sondi specifičnih za centromere ili drugih metoda. Izvješće o ispitivanju Izvješće o ispitivanju trebalo bi sadržavati sljedeće informacije:
LITERATURA
Dodatak 1. DEFINICIJE Aneugen : svaka kemikalija ili postupak koji u interakciji s elementima mitotičkog i mejotičkog ciklusa diobe stanice uzrokuje aneuploidiju u stanicama ili organizmima. Aneuploidija : svako odstupanje od uobičajenog diploidnog (ili haploidnog) broja kromosoma za jedan kromosom ili više njih, ali ne u cijeloj skupini ili skupinama kromosoma (poliploidija). Apoptoza : programirana smrt stanice koju obilježava niz koraka koji vode do razgradnje stanica u čestice vezane na membranu koje se potom eliminiraju fagocitozom ili rasipanjem. Proliferacija stanica : povećanje broja stanica kao posljedica mitotičke diobe stanice. Centromera : DNK sekvenca kromosoma gdje su spojene obje kromatide i na kojoj su na obje strane pričvršćena oba kinetohora. Kemikalija : tvar ili smjesa. Koncentracije : odnosi se na konačne koncentracije ispitivane kemikalije u hranjivoj podlozi za uzgoj kulture. Klastogen : svaka kemikalija ili događaj koji uzrokuje strukturne kromosomske aberacije u populacijama stanica ili eukariotskim organizmima. Citokineza : proces diobe stanice koji slijedi neposredno nakon mitoze i kojim nastaju dvije stanice kćeri od kojih svaka sadržava jednu jezgru. Indeks proliferacije s blokiranom citokinezom (CBPI) : udio stanica u fazi druge diobe u tretiranoj populaciji u odnosu na netretiranu kontrolu (vidjeti Dodatak 2. za formulu). Citostaza : sprječavanje rasta stanica (vidjeti Dodatak 2. za formulu). Citotoksičnost : za analize obuhvaćene ovom ispitnom metodom koje se provode u prisutnosti citohalazina B citotoksičnost se definira kao smanjenje indeksa proliferacije stanica s blokiranom citokinezom (CBPI) ili indeksa ponavljanja (RI) tretiranih stanica u odnosu na negativnu kontrolu (vidjeti stavak 26. i Dodatak 2.). Za ispitivanja obuhvaćena ovom ispitnom metodom koja se provode u odsutnosti citohalazina B citotoksičnost se definira kao smanjenje relativnog udvostručenja populacije (RPD) ili relativnog povećanja broja stanica (RICC) kod tretiranih stanica u usporedbi s negativnom kontrolom (vidjeti stavak 27. i Dodatak 2.). Genotoksičnost : opći izraz kojim su obuhvaćene sve vrste oštećenja DNK ili kromosoma uključujući lomove, delecije, adukte, modifikacije i povezivanje nukleotida, premještanja, genske mutacije, aberacije kromosoma i aneuploidiju. Ne dovode sve vrste genotoksičnih učinaka do mutacija ili trajnog oštećenja kromosoma. Interfazne stanice : stanice koje nisu u fazi mitoze. Kinetohor : proteinska struktura koja nastaje na centromeri kromosoma na koju se tijekom diobe stanice prihvaćaju niti diobenog vretena, čime se omogućuje pravilno kretanje kromosoma kćeri prema polovima stanica kćeri. Mikronukleusi : maleni nukleusi koji se nalaze uz glavne stanične jezgre i od njih su odvojeni i koji nastaju tijekom telofaze mitoze ili mejoze iz zaostalih fragmenata kromosoma ili čitavih kromosoma. Mitoza : dioba stanične jezgre koja je obično podijeljena na profazu, prometafazu, metafazu, anafazu i telofazu. Mitotski indeks : omjer stanica u metafazi podijeljen s ukupnim brojem stanica zapaženih u populaciji stanica; pokazatelj stupnja proliferacije stanica te populacije. Mutagen : uzrokuje nasljednu promjenu slijeda (slijedova) parova baza DNK u genima ili strukture kromosoma (kromosomske aberacije). Nerazdvajanje : nemogućnost para kromatida da se razdvoji i pravilno odvoji u razvijajuće stanice kćeri, zbog čega nastaju stanice kćeri s neuobičajenim brojem kromosoma. Status proteina p53 : protein p53 sudjeluje u regulaciji staničnog ciklusa, apoptozi i popravku DNK. Stanice kojima nedostaje funkcionalan protein p53, koje nisu u mogućnosti zaustaviti stanični ciklus ili ukloniti oštećene stanice putem apoptoze ili drugih mehanizama (npr. indukcijom popravka DNK) povezanih s funkcijama proteina p53 kao odgovorima na oštećenje DNK, teoretski bi trebale biti podložnije genskim mutacijama ili kromosomskim aberacijama. Poliploidija : brojčane kromosomske aberacije u stanicama ili organizmima koje zahvaćaju cijeli skup (skupove) kromosoma, a ne jedan ili više pojedinačnih kromosoma (aneuploidija). Indeks proliferacije (PI) : metoda mjerenja citotoksičnosti kada se ne upotrebljava citohalazin B (formula je navedena u Dodatku 2.). Relativno povećanje broja stanica (RICC) : metoda mjerenja citotoksičnosti kada se ne upotrebljava citohalazin B (formula je navedena u Dodatku 2.). Relativno udvostručenje populacije (RPD) : metoda mjerenja citotoksičnosti kada se ne upotrebljava citohalazin B (formula je navedena u Dodatku 2.). Indeks ponavljanja (RI) : udio dovršenih ciklusa stanične diobe u tretiranoj kulturi u odnosu na netretiranu kulturu, tijekom razdoblja izloženosti i obnavljanja (formula je navedena u Dodatku 2.). Frakcija jetre S9 : supernatant homogenata jetre centrifugiran na 9 000 g, tj. sirovi ekstrakt jetre. Mješavina S9 : mješavina frakcije jetre S9 i kofaktora potrebnih za djelovanje metaboličkih enzima. Kontrola s otapalom : opći izraz za označivanje kontrolnih kultura kojima je dodano jedino otapalo koje je upotrijebljeno za otapanje ispitivane kemikalije. Ispitivana kemikalija : sve tvari ili smjese koje se ispituju ovom ispitnom metodom. Netretirana kontrola : kulture koje nisu ničim tretirane (tj. ni ispitivanom kemikalijom ni otapalom), ali se obrađuju istodobno i na isti način kao i kulture tretirane ispitivanom kemikalijom. Dodatak 2. FORMULE ZA OCJENJIVANJE CITOTOKSIČNOSTI Kada se upotrebljava citohalazin B , ocjenu citotoksičnosti trebalo bi temeljiti na indeksu proliferacije s blokiranom citokinezom (CBPI) ili indeksu ponavljanja (RI) (17., 69.). CBPI pokazuje prosječan broj jezgri po stanici te se može upotrijebiti za izračunavanje proliferacije stanica. RI pokazuje relativan broj staničnih ciklusa po stanici tijekom razdoblja izloženosti citohalazinu B u tretiranim kulturama u usporedbi s kontrolnim kulturama te se može upotrijebiti za izračunavanje postotka citostaze: % citostaze = 100 – 100{(CBPIT – 1) ÷ (CBPIC – 1)} i:
pri čemu je:
Stoga, CBPI koji iznosi 1 (sve su stanice jednojezgrene) odgovara citostazi od 100 %. Citostaza = 100 – RI
Stoga, RI od 53 % znači da se, u usporedbi s brojem stanica koje su se podijelile u dvojezgrene i višejezgrene stanice u kontrolnoj kulturi, samo 53 % od tog broja podijelilo u tretiranoj kulturi, tj. postoji citostaza od 47 %. Kada se ne upotrebljava citohalazin B , preporučuje se ocjenjivanje citotoksičnosti na temelju relativnog povećanja broja stanica (RICC) ili na temelju relativnog udvostručenja populacije (RPD) (69.) jer se kod obiju vrijednosti uzima u obzir udio populacije stanica u kojima je došlo do diobe.
Pri čemu je: udvostručenje populacije = [log (broj stanica nakon tretiranja ÷ početni broj stanica)] ÷ log 2 Stoga, RICC ili RPD od 53 % pokazuje citotoksičnost/citostazu od 47 %. Primjenom indeksa proliferacije (PI) citotoksičnost se može procijeniti brojenjem klonova koji se sastoje od jedne stanice (cl1), dvije stanice (cl2), tri do četiri stanice (cl4) te pet do osam stanica (cl8).
Indeks proliferacije upotrebljava se kao koristan i pouzdan parametar citotoksičnosti i za stanične linije uzgojene in vitro bez citohalazina B (35., 36., 37., 38.) te može poslužiti kao koristan dodatni parametar. U svakom slučaju, u tretiranim kulturama i u negativnim kontrolnim kulturama broj stanica prije tretiranja mora biti identičan. Iako se RCC (tj. broj stanica u tretiranim kulturama / broj stanica u kontrolnim kulturama) u prošlosti upotrebljavao kao parametar citotoksičnosti, više se ne preporučuje jer može podcijeniti citotoksičnost. Kada se upotrebljavaju automatski sustavi za brojenje, na primjer protočna citometrija, laserska skenirajuća citometrija ili analiza slike, u formuli se broj stanica može zamijeniti brojem jezgri. U negativnim bi kontrolnim kulturama udvostručenje populacije ili indeks ponavljanja trebali biti u skladu sa zahtjevom da se stanice uzorkuju nakon tretiranja po isteku razdoblja koje otprilike odgovara trajanju 1,5 do 2,0 normalna stanična ciklusa. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
(15) |
U dijelu B dodaju se sljedeća poglavlja: „B.59. Izazivanje preosjetljivosti kože in chemico: Test izravne reaktivnosti peptida (Direct Peptide Reactivity Assay – DPRA) UVOD Ova ispitna metoda odgovara smjernici OECD-a za ispitivanje (TG) 442C (2015.). Tvar koja izaziva preosjetljivost kože tvar je koja dovodi do alergijske reakcije nakon dodira s kožom, kako je definirana u Globalno usklađenom sustavu Ujedinjenih naroda za razvrstavanje i označivanje kemikalija (UN GHS) (1.) te u Uredbi Europske unije (EZ) 1272/2008 o razvrstavanju, označivanju i pakiranju tvari i smjesa (Uredba o CLP-u) (18). U ovoj se ispitnoj metodi opisuje postupak in chemico (test izravne reaktivnosti peptida – DPRA) koji treba primijeniti kao pomoć u razlikovanju tvari koje izazivaju preosjetljivost kože od tvari koje ne izazivaju preosjetljivost kože u skladu sa sustavom UN GHS i Uredbom o CLP-u. Postoji opća suglasnost o ključnim biološkim događajima koji izazivaju preosjetljivost kože. Postojeće spoznaje o kemijskim i biološkim mehanizmima koji su povezani s izazivanjem preosjetljivosti kože sažeto su prikazane u obliku puta nastanka štetnog ishoda (engl. Adverse Outcome Pathway – AOP) (2.), koji se kreće od početnog molekularnog događaja preko međudogađaja do štetnog učinka, tj. alergijskog kontaktnog dermatitisa u ljudi ili kontaktne preosjetljivosti u glodavaca. U AOP-u koji se odnosi na izazivanje preosjetljivosti kože početni je molekularni događaj stvaranje kovalentne veze između elektrofilnih tvari i nukleofilnih središta u bjelančevinama kože. U procjenama preosjetljivosti kože tradicionalno se upotrebljavaju laboratorijske životinje. Klasičnim metodama u kojima se upotrebljavaju zamorci, a to su Magnusson–Kligmanov maksimizacijski test sa zamorcima (GMPT) i Buehlerov test (ispitna metoda B.6. (3.)), ispituje se i faza indukcije i faza elicitacije preosjetljivosti kože. Ispitivanja na miševima, tj. analiza lokalnih limfnih čvorova (LLNA, ispitna metoda B.42. (4.)) i njezine dvije inačice u kojima se ne upotrebljavaju radioaktivni izotopi, LLNA: DA (ispitna metoda B.50. (5.)) te LLNA: BrdU-ELISA (ispitna metoda B.51. (6.)), pri čemu se svima trima ispituje isključivo odgovor u fazi indukcije, isto tako su prihvaćena jer predstavljaju prednost u odnosu na ispitivanja na zamorcima u smislu dobrobiti životinja i objektivnog mjerenja faze indukcije preosjetljivosti kože. U novije se vrijeme in chemico te in vitro ispitne metode koje se temelje na mehanističkom pristupu smatraju znanstveno valjanima za ocjenjivanje opasnosti od izazivanja preosjetljivosti kože povezanih s kemikalijama. Međutim, potrebne su kombinacije metoda koje ne uključuju ispitivanja na životinjama (in silico, in chemico, in vitro), u okviru integriranih pristupa ispitivanju i procjeni (engl. Integrated Approaches to Testing and Assessment – IATA), kako bi se mogla u cijelosti zamijeniti ispitivanja na životinjama koja su trenutačno u upotrebi, s obzirom na ograničenu mehanističku domenu AOP-a svake od trenutačno dostupnih ispitnih metoda koje ne uključuju ispitivanja na životinjama (2., 7.). Metoda DPRA predlaže se za ispitivanje početnog molekularnog događaja u AOP-u preosjetljivosti kože, posebice reaktivnosti bjelančevina, kvantificiranjem reaktivnosti ispitivanih kemikalija u odnosu na modelne sintetičke peptide koji sadržavaju lizin ili cistein (8.). Na temelju postotaka potrošnje peptida koji sadržavaju cistein i peptida koji sadržavaju lizin tvari se potom razvrstavaju u jedan od četiriju razreda reaktivnosti, koji služe kao pomoć u razlikovanju tvari koje izazivaju preosjetljivost kože od tvari koje ne izazivaju preosjetljivost kože (9.). Metoda DPRA ocijenjena je validacijskom studijom koju je proveo Referentni laboratorij Europske unije za alternative ispitivanju na životinjama (EURL ECVAM) i potom neovisnim stručnim pregledom koji je izvršio EURL ECVAM-ov Znanstveni savjetodavni odbor (ESAC) te je utvrđeno da je znanstveno valjana (10.) za primjenu u okviru IATA-e kao pomoć u razlikovanju tvari koje izazivaju preosjetljivost kože od tvari koje ne izazivaju preosjetljivost kože, u svrhu razvrstavanja i označivanja prema opasnosti. U literaturi su navedeni primjeri upotrebe podataka dobivenih metodom DPRA u kombinaciji s ostalim informacijama (11., 12., 13., 14.). Definicije su navedene u Dodatku 1. POČETNA RAZMATRANJA, PRIMJENJIVOST I OGRANIČENJA Jasno je utvrđena korelacija između reaktivnosti bjelančevina i potencijala izazivanja preosjetljivosti kože (15., 16., 17.). Međutim, iako je vezanje na bjelančevine početni molekularni događaj u AOP-u preosjetljivosti kože, to je samo jedan od ključnih događaja pa informacije o reaktivnosti bjelančevina dobivene ispitnim metodama i metodama koje ne uključuju ispitivanje možda same po sebi neće biti dovoljne za donošenje zaključka o odsutnosti potencijala kemikalija da izazovu preosjetljivost kože. Stoga bi podatke dobivene ovom ispitnom metodom trebalo razmatrati u kontekstu integriranih pristupa poput IATA-e te ih kombinirati s ostalim dodatnim informacijama, npr. onima dobivenima in vitro pokusima kojima se ispituju drugi ključni događaji AOP-a preosjetljivosti kože te metodama koje ne uključuju ispitivanje, kao i primjenom analogije s kemijski analognim tvarima. Ova se ispitna metoda može upotrijebiti, u kombinaciji s drugim dodatnim informacijama, kao pomoć u razlikovanju tvari koje izazivaju preosjetljivost kože (tj. onih koje su razvrstane u kategoriju 1. prema sustavu UN GHS / Uredbi o CLP-u) od tvari koje ne izazivaju preosjetljivost kože, u kontekstu IATA-e. Ova se ispitna metoda ne može upotrijebiti kao jedina metoda za razvrstavanje tvari koje izazivaju preosjetljivost kože u potkategorije 1.A i 1.B kako su definirane u sustavu UN GHS / Uredbi o CLP-u ni za predviđanje njihove jakosti pri donošenju odluka o ocjeni sigurnosti. Međutim, ovisno o regulatornom okviru pozitivan rezultat dobiven metodom DPRA može se samostalno upotrijebiti za razvrstavanje kemikalije u kategoriju 1. prema sustavu UN GHS / Uredbi o CLP-u. Dokazano je da se ispitna metoda DPRA može prenijeti u laboratorije koji imaju iskustva u izvođenju analiza s pomoću tekućinske kromatografije visoke djelotvornosti (HPLC). Može se očekivati da će za predviđanja do kojih se dođe s pomoću ove ispitne metode stupanj obnovljivosti biti reda veličine 85 % unutar laboratorija i 80 % između laboratorija (10.). Rezultati dobiveni u validacijskoj studiji (18.) i objavljenim studijama (19.) općenito pokazuju da točnost metode DPRA u razlikovanju tvari koje izazivaju preosjetljivost (tj. onih iz kategorije 1. prema sustavu UN GHS / Uredbi o CLP-u) od tvari koje ne izazivaju preosjetljivost iznosi 80 % (N = 157) uz osjetljivost od 80 % (88/109) i specifičnost od 77 % (37/48) u usporedbi s rezultatima dobivenima metodom LLNA. Veća je vjerojatnost da će se metodom DPRA podcijeniti kemikalije koje pokazuju nisku do umjerenu jakost u izazivanju preosjetljivosti kože (tj. potkategorija 1.B sustava UN GHS / prema Uredbi o CLP-u) nego što će se podcijeniti kemikalije koje pokazuju veliki potencijal izazivanja preosjetljivosti kože (tj. potkategorija 1.A sustava UN GHS / prema Uredbi o CLP-u) (18., 19.). Međutim, navedene vrijednosti koje se odnose na točnost metode DPRA kao samostalne ispitne metode samo su okvirne jer je tu metodu potrebno kombinirati s drugim izvorima informacija u kontekstu IATA-e te u skladu s odredbama prethodno navedenog stavka 9. Nadalje, pri ocjenjivanju metoda ispitivanja preosjetljivosti kože koje ne uključuju pokuse na životinjama potrebno je imati na umu da metoda LLNA i druga ispitivanja na životinjama možda neće u potpunosti odražavati situaciju kod vrste za koju se žele dobiti rezultati, tj. ljudi. Trenutačno dostupni podaci pokazuju da se metoda DPRA može primijeniti za ispitivanje kemikalija koje obuhvaćaju različite organske funkcionalne skupine, mehanizme reakcije, jakosti u izazivanju preosjetljivosti kože (kako su utvrđene istraživanjima in vivo) te fizikalno-kemijska svojstva (8., 9., 10., 19.). Prethodno navedene informacije upućuju na korisnost metode DPRA kao elementa koji pridonosi identifikaciji opasnosti od izazivanja preosjetljivosti kože. U ovoj se ispitnoj metodi izraz ‚ispitivana kemikalija’ upotrebljava za označivanje onoga što se ispituje te se ne odnosi na primjenjivost metode DPRA za ispitivanje tvari i/ili smjesa. Ova ispitna metoda nije primjenjiva za ispitivanje spojeva metala jer je poznato da oni reagiraju s bjelančevinama drugim mehanizmima, a ne stvaranjem kovalentnih veza. Ispitivana kemikalija trebala bi biti topljiva u odgovarajućem otapalu pri konačnoj koncentraciji od 100 mM (vidjeti stavak 18.). Međutim, ispitivane kemikalije koje nisu topljive pri toj koncentraciji mogu se ispitati pri nižim koncentracijama pri kojima jesu topljive. U tom se slučaju pozitivan rezultat može upotrijebiti kao potpora identifikaciji ispitivane kemikalije kao tvari koja izaziva preosjetljivost kože, ali se na temelju negativnog rezultata ne bi smio izvući čvrsti zaključak o nepostojanju reaktivnosti. Trenutačno su dostupne ograničene informacije o primjenjivosti metode DPRA na smjese poznatog sastava (18., 19.). Unatoč tomu, smatra se da je metoda DPRA tehnički primjenjiva za ispitivanje višekomponentnih tvari i smjesa poznatog sastava (vidjeti stavak 18.). Prije nego što se ova ispitna metoda primijeni na smjesi radi dobivanja podataka za predviđenu regulatornu svrhu, potrebno je razmotriti mogu li se njome dobiti primjereni rezultati za tu svrhu te ako mogu, zašto. Ta razmatranja nisu potrebna ako postoji regulatorni zahtjev za ispitivanje smjese. Trenutačni model predviđanja ne može se upotrijebiti za složene smjese nepoznatog sastava ili za tvari nepoznatog ili promjenjivog sastava, složene reakcijske proizvode ili biološke materijale (tj. UVCB tvari) zbog utvrđenog molarnog omjera između ispitivane kemikalije i peptida. U tu je svrhu potrebno razviti novi model predviđanja koji se temelji na gravimetrijskom pristupu. U slučajevima u kojima se može dokazati da se ispitna metoda ne može primijeniti za ispitivanje drugih specifičnih kategorija kemikalija, tu ispitnu metodu ne bi trebalo upotrebljavati za te specifične kategorije kemikalija. Ova je ispitna metoda in chemico metoda koja ne uključuje metabolički sustav. Ovom se ispitnom metodom ne mogu otkriti kemikalije koje zahtijevaju enzimsku bioaktivaciju da bi mogle pokazati svoj potencijal izazivanja preosjetljivosti kože (tj. prohapteni). U nekim su slučajevima ovom ispitnom metodom ispravno otkrivene kemikalije koje nakon abiotičke transformacije postaju tvari koje izazivaju preosjetljivost (tj. prehapteni) (18.). S obzirom na navedeno, negativne rezultate dobivene ispitnom metodom trebalo bi tumačiti u kontekstu navedenih ograničenja te u povezanosti s drugim izvorima informacija u okviru IATA-e. Ispitivane kemikalije koje se ne vežu kovalentnom vezom na peptid, ali potiču njegovu oksidaciju (tj. dimerizaciju cisteina), mogle bi dovesti do mogućeg precjenjivanja potrošnje peptida, što bi za posljedicu moglo imati moguća lažno pozitivna predviđanja i/ili razvrstavanje kemikalije u viši razred reaktivnosti (vidjeti stavke 29. i 30.). Kao što je opisano, metoda DPRA pomaže u razlikovanju tvari koje izazivaju preosjetljivost kože od tvari koje ne izazivaju preosjetljivost kože. Međutim, ako se upotrebljava u okviru integriranih pristupa poput IATA-e, mogla bi pridonijeti i procjeni jačine izazivanja preosjetljivosti (11.). Ipak, kako bi se moglo utvrditi na koji bi način rezultati dobiveni metodom DPRA mogli pomoći u toj procjeni, potreban je dodatan rad, koji će se po mogućnosti temeljiti na podacima dobivenima na ljudima. NAČELO ISPITIVANJA DPRA je in chemico metoda kojom se količinski određuje preostala koncentracija peptida koji sadržava cistein ili lizin nakon 24 sata inkubacije s ispitivanom kemikalijom pri temperaturi od 25 ± 2,5 °C. Sintetički peptidi sadržavaju fenilalanin radi lakšeg otkrivanja. Relativna koncentracija peptida mjeri se tekućinskom kromatografijom visoke djelotvornosti (HPLC) s gradijentnim eluiranjem i UV detekcijom na 220 nm. Potom se izračunavaju postotci potrošnje peptida koji sadržavaju cistein i peptida koji sadržavaju lizin te se te vrijednosti upotrebljavaju u modelu predviđanja (vidjeti stavak 29.) kojim se omogućuje razvrstavanje ispitivane kemikalije u jedan od četiriju razreda reaktivnosti, koji se potom upotrebljavaju kao pomoć u razlikovanju tvari koje izazivaju preosjetljivost od tvari koje ne izazivaju preosjetljivost. Prije rutinske primjene ove ispitne metode laboratoriji bi trebali dokazati svoju tehničku osposobljenost izvodeći metodu na deset tvari navedenih u Dodatku 2. koje služe za dokazivanje osposobljenosti. POSTUPAK Ova se ispitna metoda temelji na protokolu DPRA DB-ALM br. 154 (20.), koji je upotrijebljen u validacijskoj studiji kojom je koordinirao EURL ECVAM. Preporučuje se primijeniti taj protokol pri provedbi i primjeni metode u laboratoriju. U nastavku su opisane glavne komponente i postupci za DPRA. Ako se upotrebljava alternativni sustav HPLC, trebalo bi dokazati da je on u skladu s validiranim sustavom opisanim u protokolu DB-ALM (npr. ispitivanjem tvari za dokazivanje osposobljenosti iz Dodatka 2.). Pripremanje peptida koji sadržavaju cistein ili lizin Radne otopine sintetičkih peptida koji sadržavaju cistein (Ac-RFAACAA-COOH) i lizin (Ac-RFAAKAA-COOH), čistoće veće od 85 %, po mogućnosti u rasponu od 90 do 95 %, trebalo bi pripremiti svježe neposredno prije inkubacije s ispitivanom kemikalijom. Konačna bi koncentracija peptida koji sadržava cistein trebala iznositi 0,667 mM u fosfatnom puferu pH-vrijednosti 7,5, dok bi konačna koncentracija peptida koji sadržava lizin trebala iznositi 0,667 mM u amonijevom acetatnom puferu pH-vrijednosti 10,2. Analitički ciklus u HPLC-u trebalo bi programirati tako da trajanje analize s pomoću HPLC-a bude kraće od 30 sati. U okviru sustava HPLC koji je upotrijebljen u validacijskoj studiji i opisan u ovoj ispitnoj metodi, u jednom se ciklusu HPLC-a može analizirati do 26 uzoraka (koji uključuju ispitivanu kemikaliju, pozitivnu kontrolu i odgovarajući broj kontrola s otapalom koji ovisi o broju pojedinačnih otapala upotrijebljenih u testu, od kojih se svaki ispituje kao triplikat). U svim bi ponovljenim uzorcima koji se analiziraju u istoj analitičkoj seriji trebalo upotrijebiti identične radne otopine peptida koji sadržavaju cistein odnosno lizin. Preporučuje se dokazati ispravnu topljivost pojedinačnih šarži peptida prije njihove upotrebe. Priprema ispitivane kemikalije Prije izvođenja pokusa trebalo bi ocijeniti topljivost ispitivane kemikalije u odgovarajućem otapalu u skladu s postupkom solubilizacije opisanim u protokolu DPRA DB-ALM (20.). Odgovarajuće otapalo je ono koje u cijelosti otopi ispitivanu kemikaliju. S obzirom na to da se kod metode DPRA ispitivana kemikalija inkubira u velikom omjeru s peptidima koji sadržavaju cistein ili lizin, smatra se da je vizualna provjera stvaranja bistre otopine dovoljna kako bi se utvrdilo je li se ispitivana kemikalija (i sve njezine komponente ako je riječ o višekomponentnoj tvari ili smjesi) dobro otopila. Prikladna su otapala acetonitril, voda, smjesa vode i acetonitrila u omjeru 1:1, izopropanol, aceton ili smjesa acetona i acetonitrila u omjeru 1:1. Mogu se upotrijebiti i druga otapala pod uvjetom da ne utječu na stabilnost peptida, što se provjerava s pomoću referentnih kontrola C (tj. uzoraka koji se sastoje samo od peptida otopljenog u odgovarajućem otapalu; vidjeti Dodatak 3.). Ako ispitivana kemikalija nije topljiva ni u jednom od navedenih otapala, trebalo bi je, kao zadnju mogućnost, pokušati otopiti u 300 μL DMSO-a te nastalu otopinu razrijediti s 2 700 μL acetonitrila; ako ispitivana kemikalija nije topljiva u toj smjesi, istu količinu ispitivane kemikalije trebalo bi pokušati otopiti u 1 500 μL DMSO-a te nastalu otopinu razrijediti s 1 500 μL acetonitrila. Ispitivanu kemikaliju trebalo bi prethodno odvagati u staklene bočice te neposredno prije ispitivanja otopiti u odgovarajućem otapalu kako bi se pripremila otopina koncentracije 100 mM. Za smjese i višekomponentne tvari poznatog sastava trebalo bi odrediti jedan stupanj čistoće, koji se utvrđuje na temelju zbroja udjela njihovih sastojaka (isključujući vodu), te jednu prividnu molekularnu masu, koja se utvrđuje uzimajući u obzir molekularnu masu svake komponente smjese (isključujući vodu) i njihove pojedinačne udjele. Tako dobiveni stupanj čistoće i prividna molekularna masa potom se upotrebljavaju za izračunavanje mase ispitivane kemikalije koja je potrebna za pripremu otopine koncentracije 100 mM. U slučaju polimera za koje se ne može odrediti dominantna molekularna masa, za pripremu otopine koncentracije 100 mM može se uzeti u obzir molekularna masa monomera (ili prividna molekularna masa različitih monomera od kojih se polimer sastoji). Međutim, pri ispitivanju smjesa, višekomponentnih tvari ili polimera poznatog sastava trebalo bi predvidjeti ispitivanje i čiste kemikalije. U slučaju tekućina čistu bi kemikaliju trebalo ispitati kao takvu, bez prethodnog razrjeđivanja, inkubiranjem u molarnom omjeru 1:10 i 1:50 s peptidima koji sadržavaju cistein odnosno peptidima koji sadržavaju lizin. U slučaju krutih tvari ispitivanu bi kemikaliju trebalo otopiti do najviše topljive koncentracije, u istom otapalu koje se upotrebljava za pripremu otopine koncentracije 100 mM. Potom bi je trebalo ispitati kao takvu, bez dodatnog razrjeđivanja, inkubiranjem u omjeru 1:10 i 1:50 s peptidima koji sadržavaju cistein odnosno peptidima koji sadržavaju lizin. Ako se ispitivanjem otopine prividne koncentracije od 100 mM i čiste kemikalije dobiju sukladni rezultati (reaktivni i nereaktivni), trebalo bi biti moguće donošenje čvrstog zaključka o rezultatu. Priprema pozitivne kontrole, referentnih kontrola i kontrola koelucije Cimetni aldehid (CAS 104-55-2; prehrambene čistoće ≥95 %) trebalo bi upotrijebiti kao pozitivnu kontrolu (PK) u koncentraciji od 100 mM u acetonitrilu. Mogu se upotrijebiti druge prikladne pozitivne kontrole koje po mogućnosti daju srednje vrijednosti potrošnje, pod uvjetom da su dostupni prijašnji podaci na temelju kojih se mogu odrediti usporedivi kriteriji prihvatljivosti za analitičku seriju. Osim toga, u analitički ciklus HPLC-a trebalo bi uključiti i referentne kontrole (tj. uzorke koji sadržavaju samo peptid otopljen u odgovarajućem otapalu), koje se upotrebljavaju kako bi se prije analize provjerila prikladnost sustava HPLC (referentne kontrole A), stabilnost referentnih kontrola tijekom vremena (referentne kontrole B) te da otapalo koje je upotrijebljeno za otapanje ispitivane kemikalije ne utječe na postotak potrošnje peptida (referentne kontrole C) (vidjeti Dodatak 3.). Za svaku se kemikaliju upotrebljava odgovarajuća referentna kontrola kako bi se izračunao postotak potrošnje peptida za tu kemikaliju (vidjeti stavak 26.). Osim toga, za svaku od kemikalija koje se analiziraju trebalo bi uključiti u analitičku seriju i kontrolu koelucije, koja se sastoji samo od ispitivane kemikalije i služi za otkrivanje moguće koelucije ispitivane kemikalije s peptidom koji sadržava lizin ili cistein. Inkubiranje ispitivane kemikalije s otopinom peptida koji sadržava cistein i peptida koji sadržava lizin Otopinu peptida koji sadržava cistein i otopinu peptida koji sadržava lizin trebalo bi inkubirati s ispitivanom kemikalijom u omjeru 1:10 odnosno 1:50 u staklenim bočicama za automatski dodavač uzoraka. Ako se odmah nakon dodavanja otopine ispitivane kemikalije u otopinu peptida opazi precipitacija do koje dolazi zbog toga što je ispitivana kemikalija slabo topljiva u vodi, neće se moći sa sigurnošću utvrditi koliko je ispitivane kemikalije ostalo u otopini da reagira s peptidom. U tom se slučaju stoga pozitivan rezultat ipak može upotrijebiti, ali negativan rezultat nije siguran i trebalo bi ga pažljivo tumačiti (vidjeti i odredbe stavka 11. za ispitivanje kemikalija koje nisu topljive do koncentracije od 100 mM). Reakcijsku otopinu trebalo bi držati u mraku na temperaturi od 25 ± 2,5 °C tijekom 24 ± 2 sata prije izvođenja analize s pomoću HPLC-a. Svaku bi ispitivanu kemikaliju trebalo analizirati kao triplikat za oba peptida. Uzorke bi trebalo vizualno pregledati prije izvođenja analize s pomoću HPLC-a. Ako se primijeti precipitacija ili razdvajanje faza, kao mjera opreza uzorci se mogu centrifugirati pri maloj brzini (100 – 400 xg) kako bi se talog slegnuo na dno bočice jer bi velike količine taloga mogle začepiti kromatografske cijevi ili kolone. Ako se precipitacija ili razdvajanje faza primijeti nakon inkubacijskog razdoblja, potrošnja peptida mogla bi biti podcijenjena te se u slučaju negativnog rezultata ne može izvući dovoljno pouzdan zaključak o nepostojanju reaktivnosti. Priprema kalibracijske krivulje standarda za HPLC Potrebno je izraditi kalibracijsku krivulju standarda za peptide koji sadržavaju cistein i za peptide koji sadržavaju lizin. Standarde peptida trebalo bi pripremiti u otopini s 20 % ili 25 % acetonitrila: puferirati fosfatnim puferom (pH 7,5) za peptid koji sadržava cistein i amonijevim acetatnim puferom (pH 10,2) za peptid koji sadržava lizin. Koristeći se standardima dobivenima serijskim razrjeđenjem radne otopine peptida (0,667 mM), trebalo bi pripremiti šest kalibracijskih otopina koje obuhvaćaju raspon od 0,534 do 0,0167 mM. U kalibracijsku krivulju standarda trebalo bi uključiti i slijepu probu koja sadržava pufer za razrjeđivanje. Prikladna kalibracijska krivulja mora imati koeficijent r2 > 0,99. Priprema i izvođenje analize s pomoću HPLC-a Prije izvođenja analize trebalo bi provjeriti prikladnost sustava HPLC. Potrošnja peptida prati se HPLC-om u kombinaciji s UV detektorom (detektorom s nizom fotodioda ili detektorom apsorbancije na fiksnoj valnoj duljini od 220 nm). Odgovarajuća se kolona postavlja u sustav HPLC. U sustavu HPLC postavljenom kako je opisano u validiranom protokolu kao preporučena se kolona upotrebljava Zorbax SB-C-18 2,1 mm x 100 mm x 3,5 mikrona. S tom HPLC-ovom kolonom obrnutih faza cijeli bi sustav prije početka analize trebalo uravnoteživati najmanje dva sata na 30°C s 50 % faze A (0,1 % (v/v) trifluoroctene kiseline u vodi) i 50 % faze B (0,085 % (v/v) trifluoroctene kiseline u acetonitrilu). Analizu HPLC-om trebalo bi izvesti primjenom brzine protoka od 0,35 ml/min i linearnog gradijenta od 10 % do 25 % acetonitrila tijekom deset minuta nakon čega slijedi brzo povećanje acetonitrila na 90 % kako bi se uklonili ostali materijali. Trebalo bi ubrizgati jednake volumene svakog standarda, uzorka i kontrole. Između ubrizgavanja kolonu bi trebalo sedam minuta uravnoteživati na početne uvjete. Ako se upotrebljava drukčija HPLC-ova kolona obrnutih faza, može biti potrebno prilagoditi prethodno opisane parametre kako bi se jamčila odgovarajuća eluacija i integracija peptida koji sadržavaju cistein odnosno lizin, uključujući i ubrizgani volumen, koji može varirati ovisno o upotrijebljenom sustavu (obično u rasponu od 3 do 10 μl). Ako se upotrebljava alternativni sustav HPLC, važno je dokazati njegovu sukladnost s prethodno opisanim validiranim sustavom (npr. ispitivanjem tvari za dokazivanje osposobljenosti iz Dodatka 2.). Apsorbancija se očitava na valnoj duljini od 220 nm. Ako se upotrebljava detektor s nizom fotodioda, trebalo bi zabilježiti i apsorbanciju na 258 nm. Potrebno je naglasiti da bi u nekim slučajevima nabavljeni acetonitril mogao negativno utjecati na stabilnost peptida te bi tu mogućnost trebalo ocijeniti pri upotrebi nove šarže acetonitrila. Omjer između površine pikova na 220 nm i površine pikova na 258 nm može poslužiti kao pokazatelj koelucije. Za svaki uzorak omjer u rasponu od 90 % < do < 100 % srednje vrijednosti (19) omjera dobivenih za kontrolne uzorke dobar je pokazatelj da nije došlo do koelucije. Neke ispitivane kemikalije mogu potaknuti oksidaciju peptida koji sadržava cistein. Pik dimeriziranog peptida koji sadržava cistein može se vizualno promatrati. Ako se čini da je došlo do dimerizacije, trebalo bi je zabilježiti jer se postotak potrošnje peptida može precijeniti, što dovodi do lažnih pozitivnih predviđanja i/ili razvrstavanja u viši razred reaktivnosti (vidjeti stavke 29. i 30.). Analiza HPLC-om za peptide koji sadržavaju cistein i za peptide koji sadržavaju lizin može se provesti istodobno (ako su dostupna dva sustava HPLC) ili u različitim danima. Ako se analize ne provode istog dana, sve bi otopine ispitivane kemikalije trebalo pripremiti svježe za svako ispitivanje. Vrijeme izvođenja analize trebalo bi odrediti tako da se osigura da ubrizgavanje prvog uzorka započne 22 do 26 sati nakon miješanja ispitivane kemikalije s otopinom peptida. Analitički ciklus u HPLC-u trebalo bi programirati tako da trajanje analize s pomoću HPLC-a bude kraće od 30 sati. U okviru sustava HPLC koji je upotrijebljen u validacijskoj studiji i opisan u ovoj ispitnoj metodi u jednom se ciklusu HPLC-a može analizirati do 26 uzoraka (vidjeti i stavak 17.). U Dodatku 3. naveden je primjer analitičkog ciklusa HPLC-a. PODACI I IZVJEŠĆIVANJE Procjena podataka Koncentracija peptida koji sadržava cistein ili lizin određuje se fotometrijski u svakom uzorku na valnoj duljini od 220 nm i to tako da se za odgovarajuće pikove izmjeri površina pika (površina ispod krivulje, PIK) te izračuna koncentracija peptida primjenom linearne kalibracijske krivulje utvrđene na temelju standarda. Postotak potrošnje peptida određuje se u svakom uzorku tako da se izmjeri površina pika te podijeli sa srednjom vrijednošću površine pikova odgovarajućih referentnih kontrola C (vidjeti Dodatak 3.) u skladu s formulom navedenom u nastavku.
Kriteriji prihvatljivosti Kako bi se ispitivanje smatralo valjanim, trebali bi biti ispunjeni sljedeći kriteriji:
Ako nije ispunjen jedan od tih kriterija ili više njih, ispitivanje bi trebalo ponoviti. Da bi se rezultate dobivene za ispitivanu kemikaliju smatralo valjanima, trebali bi biti ispunjeni sljedeći kriteriji:
Model predviđanja Za svaku se ispitivanu kemikaliju izračunava srednja vrijednost postotka potrošnje cisteina i postotka potrošnje lizina. Pri izračunavanju srednje vrijednost za negativnu potrošnju uzima se vrijednost ‚0’. Ako se primjenjuje model predviđanja s cisteinom u omjeru 1:10 / lizinom u omjeru 1:50, koji je prikazan u tablici 1., trebalo bi primjenjivati prag od 6,38 % prosječne potrošnje peptida kao jedan od kriterija za razlikovanje tvari koje izazivaju preosjetljivost kože od tvari koje ne izazivaju preosjetljivost kože u okviru IATA-e. Primjena modela predviđanja za razvrstavanje ispitivane kemikalije u određeni razred reaktivnosti (tj. niska, umjerena ili visoka reaktivnost) može se pokazati korisnom i za dobivanje informacija potrebnih za procjenu jakosti tvari u okviru IATA-e. Tablica 1. Model predviđanja s cisteinom 1:10 / lizinom 1:50 (20)
Može se dogoditi da ispitivana kemikalija (tvar ili jedan ili više sastojaka višekomponentne tvari ili smjese) značajno apsorbira na 220 nm te ima isto vrijeme zadržavanja kao i peptid (koelucija). Koelucija se može riješiti tako da se postavke sustava HPLC neznatno prilagode kako bi se još više odvojila vremena eluiranja ispitivane kemikalije i peptida. Ako se za rješavanje problema koelucije upotrebljava alternativni sustav HPLC, trebalo bi dokazati da je on u skladu s validiranim sustavom (npr. ispitivanjem tvari za dokazivanje osposobljenosti iz Dodatka 2.). U slučaju pojavljivanja koelucije pik peptida ne može se integrirati te nije moguće izračunati postotak potrošnje peptida. Ako takve ispitne kemikalije koeluiraju i s peptidima koji sadržavaju cistein i s peptidima koji sadržavaju lizin, trebalo bi smatrati da je analiza ‚bez jasnih rezultata’. Ako se koelucija pojavljuje samo s peptidima koji sadržavaju lizin, može se upotrijebiti model predviđanja s cisteinom 1:10, koji je naveden u tablici 2. Tablica 2. Model predviđanja s cisteinom 1:10 (22)
Mogu isto tako postojati slučajevi u kojima se vrijeme zadržavanja ispitivane kemikalije i vrijeme zadržavanja jednog od peptida ne preklapaju u cijelosti. U takvim se slučajevima postotci potrošnje peptida mogu procijeniti i upotrijebiti u modelu predviđanja s cisteinom 1:10 / lizinom 1:50, ali ispitivanu kemikaliju nije moguće precizno razvrstati u razred reaktivnosti. Za ispitivanu kemikaliju trebala bi biti dovoljna jedna analiza HPLC-om za peptid koji sadržava cistein i peptid koji sadržava lizin ako se njome dobije jasan rezultat. Međutim, u slučajevima rezultata koji su blizu praga koji se upotrebljava za razlikovanje pozitivnih i negativnih rezultata (tj. graničnih rezultata) mogu biti potrebna dodatna ispitivanja. Ako je srednja vrijednost postotka potrošnje u rasponu od 3 % do 10 % za model predviđanja s cisteinom 1:10 / lizinom 1:50 ili ako je postotak potrošnje cisteina u rasponu od 9 % do 17 % za model predviđanja s cisteinom 1:10, trebalo bi razmotriti provođenje još jedne analize, a potom i treće ako se prvim dvjema analizama dobiju nesukladni rezultati. Izvješće o ispitivanju Izvješće o ispitivanju trebalo bi sadržavati sljedeće informacije:
LITERATURA
Dodatak 1. DEFINICIJE Točnost : stupanj podudarnosti između rezultata ispitne metode i prihvaćenih referentnih vrijednosti. To je mjerilo učinkovitosti ispitne metode i jedan od aspekata ‚relevantnosti’. Pojam je često međusobno zamjenjiv s pojmom ‚podudarnost’ u smislu udjela točnih ishoda ispitne metode (21.). AOP (engl. Adverse Outcome Pathway – put nastanka štetnog ishoda) : slijed događaja od kemijske strukture ciljne kemikalije ili skupine sličnih kemikalija preko početnog molekularnog događaja do in vivo štetnog ishoda (2.). Kalibracijska krivulja : odnos između vrijednosti odgovora dobivenog u pokusu i analitičke koncentracije (naziva se i standardna krivulja) poznate tvari. Kemikalija : tvar ili smjesa. Koeficijent varijacije : mjera varijabilnosti koja se za skupinu podataka dobivenih od ponovljenih uzoraka izračunava dijeljenjem standardnog odstupanja sa srednjom vrijednošću. Može se pomnožiti sa 100 da bi se izrazila u obliku postotka. Opasnost : intrinzično svojstvo nekog agensa ili stanje koji imaju potencijal da uzrokuju štetne učinke kada su organizam, sustav ili (sub)populacija izloženi tom agensu. IATA (engl. Integrated Approach to Testing and Assessment – integrirani pristup ispitivanju i procjeni ) : strukturiran pristup koji se primjenjuje za identifikaciju opasnosti (potencijal), karakterizaciju opasnosti (jakost) i/ili procjenu sigurnosti (potencijal/jakost i izloženost) kemikalije ili skupine kemikalija, kojim se na strateški način objedinjuju i ponderiraju svi relevantni podaci koji će služiti kao podloga za donošenje regulatornih odluka u vezi s potencijalnom opasnošću i/ili rizikom i/ili potrebom za daljnjim ciljnim, a time i minimalnim ispitivanjem. Početni molekularni događaj : poremećaj biološkog sustava na razini molekule koji je izazvala kemikalija, a koji je identificiran kao početni događaj u nastanku štetnog ishoda. Smjesa : smjesa ili otopina koja se sastoji od dviju ili više tvari koje u njoj ne reagiraju (1.). Jednokomponentna tvar : tvar, definirana količinskim sastavom, u kojoj je jedan glavni sastojak prisutan u koncentraciji od najmanje 80 % (w/w). Višekomponentna tvar : tvar, definirana količinskim sastavom, u kojoj je više od jednog glavnog sastojka prisutno u koncentraciji od 10 % (w/w) ili većoj, ali ne većoj od 80 % (w/w). Višekomponentna tvar rezultat je procesa proizvodnje. Smjesa i višekomponentna tvar razlikuju se po tome što se smjesa dobiva miješanjem dviju ili više tvari bez kemijske reakcije. Višekomponentna tvar rezultat je kemijske reakcije. Pozitivna kontrola : ponovljeni uzorak koji sadržava sve komponente ispitnog sustava i tretiran je s tvari za koju je poznato da izaziva pozitivan odgovor. Kako bi se osigurala mogućnost procjene varijabilnosti odgovora pozitivne kontrole tijekom vremena, odgovor ne bi smio biti presnažan. Referentna kontrola : netretirani uzorak koji sadržava sve komponente ispitnog sustava, uključujući otapalo ili nosač koji se obrađuje s uzorcima tretiranima ispitivanom kemikalijom i drugim kontrolnim uzorcima kako bi se utvrdila polazna reakcija za uzorke koji se tretiraju ispitivanom kemikalijom otopljenom u istom otapalu ili nosaču. Kada se ispituje s istodobnom negativnom kontrolom, taj uzorak pokazuje i jesu li otapalo ili nosač u interakciji s ispitnim sustavom. Relevantnost : opis odnosa između ispitivanja i istraživanog učinka te je li ispitivanje prikladno i korisno za određenu svrhu. Pokazuje u kojoj se mjeri ispitivanjem točno mjeri ili predviđa istraživani biološki učinak. Relevantnost uključuje i razmatranje o točnosti (sukladnosti) ispitne metode (21). Pouzdanost : pokazuje u kojoj se mjeri ispitna metoda može obnovljivo primijeniti unutar jednog laboratorija i između više laboratorija tijekom vremena uz primjenu istog protokola. Ocjenjuje se izračunavanjem obnovljivosti unutar jednog laboratorija i između više njih te ponovljivosti unutar jednog laboratorija (21). Obnovljivost : podudarnost rezultata dobivenih ispitivanjem iste kemikalije uz primjenu istog ispitnog protokola (vidjeti ‚pouzdanost’) (21.). Osjetljivost : udio svih pozitivnih/aktivnih kemikalija koje su pravilno razvrstane primjenom ispitne metode. To je mjera točnosti ispitne metode koja daje kategorijske rezultate i važan je čimbenik za ocjenu relevantnosti ispitne metode (21.). Specifičnost : udio svih negativnih/neaktivnih kemikalija koje su pravilno razvrstane primjenom ispitne metode. To je mjera točnosti ispitne metode koja daje kategorijske rezultate i važan je čimbenik za ocjenu relevantnosti ispitne metode (21.). Tvar : kemijski elementi i njihovi spojevi u prirodnom stanju ili dobiveni proizvodnim postupkom, uključujući i dodatke (aditive) koji su nužni za održavanje stabilnosti proizvoda te nečistoće koje proizlaze iz primijenjenog postupka, ali isključujući otapala koja se mogu izdvojiti bez utjecaja na stabilnost tvari ili promjene njezina sastava (1.). Prikladnost sustava : određivanje radnih značajki uređaja (npr. osjetljivosti) analiziranjem referentnog standarda prije izvođenja testa na analitičkoj šarži (22.). Ispitivana kemikalija : izraz ‚ispitivana kemikalija’ upotrebljava se za označivanje onoga što se ispituje. Globalno usklađeni sustav Ujedinjenih naroda za razvrstavanje i označivanje kemikalija (UN GHS) : sustav za razvrstavanje kemikalija (tvari i smjesa) prema standardiziranim vrstama i stupnjevima fizičkih opasnosti i opasnosti za zdravlje i okoliš, kojim su obuhvaćena odgovarajuća komunikacijska sredstva kao što su piktogrami, oznake opasnosti, oznake upozorenja, oznake obavijesti i sigurnosno-tehnički listovi, kojima se prenose informacije o njihovim štetnim učincima u cilju zaštite ljudi (uključujući poslodavce, radnike, prijevoznike, potrošače i interventno osoblje) i okoliša (1.). UVCB : tvari nepoznatog ili promjenjivog sastava, složeni reakcijski proizvodi ili biološki materijali. Valjana ispitna metoda : ispitna metoda za koju se smatra da je dovoljno relevantna i pouzdana za određenu svrhu te koja se temelji na znanstveno utemeljenim načelima. Ispitna metoda nije nikada valjana u apsolutnom smislu nego samo u odnosu na određenu svrhu (21.). Dodatak 2. TVARI ZA DOKAZIVANJE TEHNIČKE OSPOSOBLJENOSTI Izazivanje preosjetljivosti kože in chemico: test izravne reaktivnosti peptida Prije rutinske primjene ove ispitne metode laboratoriji bi trebali dokazati svoju tehničku osposobljenost tako što će za deset tvari koje su u tablici 1. preporučene za dokazivanje osposobljenosti dobiti očekivano predviđanje na temelju metode DPRA te za osam od deset tvari preporučenih za dokazivanje osposobljenosti za svaki peptid dobiti vrijednosti potrošnje cisteina i lizina koje su unutar odgovarajućeg referentnog raspona. Tvari za dokazivanje tehničke osposobljenosti izabrane su tako da predstavljaju niz odgovora povezanih s opasnostima od izazivanja preosjetljivosti kože. Drugi kriteriji za odabir bili su da tvari budu komercijalno dostupne, da su dostupni visokokvalitetni referentni podaci dobiveni in vivo i visokokvalitetni in vitro podaci dobiveni metodom DPRA te da su tvari upotrijebljene u validacijskoj studiji kojom je koordinirao EURL ECVAM za dokazivanje uspješne primjene ispitne metode u laboratorijima koji su sudjelovali u studiji. Tablica 1. Preporučene tvari za dokazivanje tehničke osposobljenosti za izvođenje testa izravne reaktivnosti peptida
Dodatak 3. PRIMJERI ANALITIČKOG CIKLUSA
B.60. Izazivanje preosjetljivosti kože in vitro: test luciferaze ARE-Nrf2 UVOD Ova ispitna metoda odgovara smjernici OECD-a za ispitivanje (TG) 442D (2015.). Tvar koja izaziva preosjetljivost kože tvar je koja dovodi do alergijske reakcije nakon dodira s kožom, kako je definirana u Globalno usklađenom sustavu Ujedinjenih naroda za razvrstavanje i označivanje kemikalija (UN GHS) (1.) te u Uredbi Europske unije (EZ) 1272/2008 o razvrstavanju, označivanju i pakiranju tvari i smjesa (Uredba o CLP-u) (27). U ovoj se ispitnoj metodi opisuje postupak in vitro (test luciferaze ARE-Nrf2) koji treba primijeniti kao pomoć u razlikovanju tvari koje izazivaju preosjetljivost kože od tvari koje ne izazivaju preosjetljivost kože u skladu sa sustavom UN GHS (1.) i Uredbom o CLP-u. Postoji opća suglasnost o ključnim biološkim događajima koji izazivaju preosjetljivost kože. Postojeće spoznaje o kemijskim i biološkim mehanizmima koji su povezani s izazivanjem preosjetljivosti kože sažeto su prikazane u obliku puta nastanka štetnog ishoda (AOP) (2.), koji se kreće od početnog molekularnog događaja preko međudogađaja do štetnog učinka na zdravlje, tj. alergijskog kontaktnog dermatitisa u ljudi ili kontaktne preosjetljivosti u glodavaca (2., 3.). Početni molekularni događaj jest stvaranje kovalentne veze između elektrofilnih tvari i nukleofilnih središta u bjelančevinama kože. Drugi se ključni događaj u tom AOP-u odvija u keratinocitima i uključuje upalne odgovore te gensku ekspresiju povezanu sa specifičnim staničnim signalnim putovima poput putova koji ovise o elementu antioksidacijskog/elektrofilnog odgovora (engl. antioxidant/electrophile response element, ARE). Treći je ključni događaj aktiviranje dendritičnih stanica, koje se obično ocjenjuje prema ekspresiji specifičnih staničnih površinskih biljega, kemokina i citokina. Četvrti je ključni događaj proliferacija T-stanica, koja se neizravno ocjenjuje analizom lokalnih limfnih čvorova na miševima (4.). U procjenama preosjetljivosti kože tradicionalno se upotrebljavaju laboratorijske životinje. Klasičnim metodama u kojima se upotrebljavaju zamorci, a to su Magnusson–Kligmanov maksimizacijski test sa zamorcima (GMPT) i Buehlerov test (ispitna metoda B.6. (5.)), ispituje se i faza indukcije i faza elicitacije preosjetljivosti kože. Ispitivanja na miševima, tj. analiza lokalnih limfnih čvorova (LLNA) (ispitna metoda B.42. (4.)) i njezine dvije inačice u kojima se ne upotrebljavaju radioaktivni izotopi, LLNA: DA (ispitna metoda B.50. (6.)) te LLNA: BrdU-ELISA (ispitna metoda B.51. (7.)), pri čemu se svima trima ispituje isključivo odgovor u fazi indukcije, isto tako su prihvaćena jer predstavljaju prednost u odnosu na ispitivanja na zamorcima u smislu dobrobiti životinja i objektivnog mjerenja faze indukcije preosjetljivosti kože. U novije se vrijeme in chemico i in vitro ispitne metode koje se temelje na mehanističkom pristupu smatraju znanstveno valjanima za ocjenjivanje opasnosti od izazivanja preosjetljivosti kože povezanih s kemikalijama. Međutim, potrebne su kombinacije metoda koje ne uključuju ispitivanja na životinjama (in silico, in chemico, in vitro), u okviru integriranih pristupa ispitivanju i procjeni (IATA), kako bi se mogla u cijelosti zamijeniti ispitivanja na životinjama koja su trenutačno u upotrebi, s obzirom na ograničenu mehanističku domenu AOP-a svake od trenutačno dostupnih ispitnih metoda koje ne uključuju ispitivanja na životinjama (2., 3.). Ova se ispitna metoda (test luciferaze ARE-Nrf2) predlaže za ispitivanje drugog ključnog događaja kako je objašnjeno u stavku 2. Postoje izvješća o tome da tvari koje izazivaju preosjetljivost kože induciraju gene koje regulira element antioksidacijskog odgovora (ARE) (8., 9.). Male elektrofilne tvari poput tvari koje izazivaju preosjetljivost kože mogu djelovati na senzorski protein Keap1 (Kelch-like ECH-associated protein 1), npr. kovalentnom modifikacijom njegovog cisteinskog ostatka, uzrokujući time njegovu disocijaciju od transkripcijskog faktora Nrf2 (nuclear factor-erythroid 2-related factor 2). Disocirani Nrf2 može potom aktivirati gene koji ovise o ARE-u, kao što su geni koji kodiraju detoksificirajuće enzime faze II. (8., 10., 11.). Ovom je ispitnom metodom trenutačno obuhvaćena samo jedna in vitro metoda ispitivanja luciferaze ARE-Nrf2, a to je test KeratinoSensTM za koji su provedene validacijske studije (9., 12., 13.) te potom neovisan stručni pregled koji je izvršio Referentni laboratorij Europske unije za alternative ispitivanju na životinjama (EURL ECVAM) (14.). Ocijenjeno je da je test KeratinoSensTM znanstveno valjan za primjenu u okviru IATA-e kao pomoć u razlikovanju tvari koje izazivaju preosjetljivost kože od tvari koje ne izazivaju preosjetljivost kože, a u svrhu razvrstavanja i označivanja prema opasnosti (14.). Laboratoriji koji žele primijeniti ispitnu metodu mogu dobiti rekombinantnu staničnu liniju koja se upotrebljava u testu KeratinoSensTM sklapanjem sporazuma o licenciji sa subjektom koji je razvio ispitnu metodu (15.). Definicije su navedene u Dodatku 1. POČETNA RAZMATRANJA, PRIMJENJIVOST I OGRANIČENJA S obzirom na to da se aktivacija puta Keap1-Nrf2-ARE odnosi isključivo na drugi ključni događaj u AOP-u preosjetljivosti kože, informacije dobivene ispitnim metodama koje se temelje na aktivaciji tog puta možda same po sebi neće biti dovoljne za donošenje zaključka o potencijalu kemikalija da izazovu preosjetljivost kože. Stoga bi podatke dobivene ovom ispitnom metodom trebalo razmatrati u kontekstu integriranih pristupa poput IATA-e te ih kombinirati s ostalim dodatnim informacijama, npr. onima dobivenima in vitro pokusima kojima se ispituju drugi ključni događaji AOP-a preosjetljivosti kože te metodama koje ne uključuju ispitivanje, kao i primjenom analogije s kemijski analognim tvarima. U literaturi su navedeni primjeri upotrebe testa luciferaze ARE-Nrf2 u kombinaciji s ostalim informacijama (13., 16., 17., 18., 19.). Ova se ispitna metoda može upotrijebiti kao pomoć u razlikovanju tvari koje izazivaju preosjetljivost kože (tj. onih koje su razvrstane u kategoriju 1. prema sustavu UN GHS / Uredbi o CLP-u) od tvari koje ne izazivaju preosjetljivost kože, u kontekstu IATA-e. Ova se ispitna metoda ne može upotrijebiti kao jedina metoda za razvrstavanje tvari koje izazivaju preosjetljivost kože u potkategorije 1.A i 1.B kako su definirane u sustavu UN GHS / Uredbi o CLP-u ni za predviđanje njihove jakosti pri donošenju odluka o ocjeni sigurnosti. Međutim, ovisno o regulatornom okviru pozitivan se rezultat može samostalno upotrijebiti za razvrstavanje kemikalije u kategoriju 1. prema sustavu UN GHS / Uredbi o CLP-u. Skup podataka iz validacijske studije i podataka dobivenih internim ispitivanjem provedenim za potrebe neovisnog stručnog pregleda ispitne metode dokazuje da se test KeratinoSensTM može prenijeti u laboratorije koji imaju iskustva u uzgoju stanica. Može se očekivati da će za predviđanja donesena s pomoću ove ispitne metode unutarlaboratorijska i međulaboratorijska obnovljivost biti reda veličine 85 % (14.). Točnost (77 % – 155/201), osjetljivost (78 % – 71/91) i specifičnost (76 % – 84/110) testa KeratinoSensTM za razlikovanje tvari koje izazivaju preosjetljivost kože (tj. onih koje su razvrstane u kategoriju 1. prema sustavu UN GHS / Uredbi o CLP-u) od tvari koje ne izazivaju preosjetljivost kože, u usporedbi s rezultatima dobivenima metodom LLNA, izračunati su uzimajući u obzir sve podatke koji su dostavljeni EURL ECVAM-u za potrebe ocjenjivanja i stručnog pregleda ispitne metode (14.). Te su brojke slične onima koje su nedavno objavljene na temelju internog ispitivanja oko 145 tvari (točnost od 77 %, osjetljivost od 79 %, specifičnost od 72 %) (13.). Veća je vjerojatnost da će se testom KeratinoSensTM podcijeniti kemikalije koje pokazuju nisku do umjerenu jakost u izazivanju preosjetljivosti kože (tj. potkategorija 1.B sustava UN GHS / prema Uredbi o CLP-u) nego što će se podcijeniti kemikalije koje pokazuju visoku jakost u izazivanju preosjetljivosti kože (tj. potkategorija 1.A sustava UN GHS / prema Uredbi o CLP-u) (13., 14.). Prethodno navedene informacije upućuju na to da se testom KeratinoSensTM može korisno pridonijeti identifikaciji opasnosti od izazivanja preosjetljivosti kože. Međutim, navedene vrijednosti koje se odnose na točnost testa KeratinoSensTM kao samostalne ispitne metode samo su okvirne jer je tu metodu potrebno kombinirati s drugim izvorima informacija u kontekstu IATA-e te u skladu s odredbama prethodnog stavka 9. Nadalje, pri ocjenjivanju metoda ispitivanja preosjetljivosti kože koje ne uključuju pokuse na životinjama potrebno je imati na umu da metoda LLNA i druga ispitivanja na životinjama možda neće u potpunosti odražavati situaciju kod vrste za koju se žele dobiti rezultati, tj. ljudi. U ovoj se ispitnoj metodi izraz ‚ispitivana kemikalija’ upotrebljava za označivanje onoga što se ispituje te se ne odnosi na primjenjivost testa luciferaze ARE-Nrf2 za ispitivanje tvari i/ili smjesa. Trenutačno dostupni podaci pokazuju da se test KeratinoSensTM može primijeniti za ispitivanje kemikalija koje obuhvaćaju različite organske funkcionalne skupine, mehanizme reakcije, jakosti u izazivanju preosjetljivosti kože (kako su utvrđene istraživanjima in vivo) te fizikalno-kemijska svojstva (9., 12., 13., 14.). Uglavnom su ispitane jednokomponentne tvari, iako postoji ograničena količina podataka i o ispitivanju smjesa (20.). Unatoč tomu, ova je ispitna metoda tehnički primjenjiva i za ispitivanje višekomponentnih tvari i smjesa. Međutim, prije nego što se ova ispitna metoda primijeni na smjesi radi dobivanja podataka za predviđenu regulatornu svrhu, potrebno je razmotriti mogu li se njome dobiti primjereni rezultati za tu svrhu te ako mogu, zašto. Takva razmatranja nisu potrebna ako postoji regulatorni zahtjev za ispitivanje smjese. Osim toga, kada se ispituju višekomponentne tvari ili smjese, trebalo bi razmotriti moguću interferenciju citotoksične komponente sa zapaženim odgovorima. Ova se ispitna metoda primjenjuje za ispitivanje kemikalija koje su topljive ili tvore stabilnu disperziju (tj. koloid ili suspenziju u kojoj se ispitivana kemikalija ne taloži ili ne odvaja od otapala stvarajući različite faze) u vodi ili DMSO-u (ovo vrijedi za sve komponente ispitivane kemikalije u slučaju ispitivanja višekomponentne tvari ili smjese). Ispitivane kemikalije koje ne ispunjuju te uvjete pri najvišoj potrebnoj konačnoj koncentraciji od 2 000 μM (vidjeti stavak 22.) mogu se ispitati i pri nižim koncentracijama. U tom se slučaju rezultati koji ispunjuju kriterije pozitivnosti opisane u stavku 39. mogu ipak upotrijebiti kao potpora identifikaciji ispitivane kemikalije kao tvari koja izaziva preosjetljivost kože, dok bi negativan rezultat dobiven s koncentracijama manjima od 1 000 μM trebalo smatrati nejasnim (vidjeti model predviđanja u stavku 39.). Općenito, uspješno su ispitane tvari kod kojih vrijednost LogP iznosi 5 ili manje, dok se krajnje hidrofobne tvari čija je vrijednost LogP veća od 7 nalaze izvan poznatih granica primjenjivosti ispitne metode (14). Za tvari kod kojih je vrijednost LogP između 5 i 7 dostupne su samo ograničene informacije. Negativne rezultate trebalo bi tumačiti s oprezom jer se tvari koje su reaktivne isključivo na lizinski ostatak mogu ovom metodom identificirati kao negativne. Nadalje, zbog ograničene metaboličke sposobnosti upotrijebljene stanične linije (21.) i uvjeta pokusa prohapteni (tj. kemikalije koje zahtijevaju enzimsku aktivaciju, na primjer preko enzima P450) i prehapteni (tj. kemikalije koje se aktiviraju autooksidacijom), posebno oni sa sporom oksidacijom, mogu isto tako dati negativne rezultate. S druge strane, ispitivane kemikalije koje ne izazivaju preosjetljivost, ali ipak uzrokuju kemijski stres, mogu dati lažno pozitivne rezultate (14). Nadalje, ispitivane kemikalije koje su vrlo citotoksične ne mogu se uvijek pouzdano ocijeniti. Konačno, ispitivane kemikalije koje utječu na enzim luciferazu mogu remetiti aktivnost luciferaze u staničnim analizama uzrokujući prividnu inhibiciju ili povećanu luminiscenciju (22.). Na primjer, postoje izvješća o tome da su koncentracije fitoestrogena veće od 1 μM u drugim luciferaznim testovima utjecale na signale luminiscencije zbog pretjerane aktivacije reporterskog gena za luciferazu (23.). Stoga je potrebno pažljivo ispitati ekspresiju luciferaze dobivenu pri visokim koncentracijama fitoestrogena ili sličnih kemikalija za koje se pretpostavlja da poput fitoestrogena dovode do pretjerane aktivacije reporterskog gena za luciferazu (23.). U slučajevima u kojima se može dokazati da se ispitna metoda ne može primijeniti za ispitivanje drugih specifičnih kategorija kemikalija, tu ispitnu metodu ne bi trebalo upotrebljavati za te specifične kategorije kemikalija. Osim što pomaže u razlikovanju tvari koje izazivaju preosjetljivost kože od tvari koje ne izazivaju preosjetljivost kože, testom KeratinoSensTM isto se tako dobivaju informacije o odnosu koncentracije i odgovora koje bi mogle pridonijeti procjeni jakosti izazivanja preosjetljivosti u okviru integriranih pristupa poput IATA-e (19.). Međutim, da bi se moglo utvrditi na koji način rezultati dobiveni testom KeratinoSensTM mogu pridonijeti procjeni jakosti (24.) te razvrstavanju tvari koje izazivaju preosjetljivost u potkategorije prema sustavu UN GHS / Uredbi o CLP-u, potreban je dodatan rad koji će se po mogućnosti temeljiti na pouzdanim podacima dobivenim na ljudima. NAČELO ISPITIVANJA U testu luciferaze ARE-Nrf2 upotrebljava se imortalizirana adherentna stanična linija dobivena iz ljudskih keratinocita HaCaT stabilno transficiranih selektibilnim plazmidom. Stanična linija sadržava gen luciferaze pod transkripcijskom kontrolom konstitutivnog promotora vezanog na element ARE gena za koji je poznato da mu se ekspresija pojačava pod utjecajem kontaktnih senzibilizatora (25., 26.). Signal luciferaze odražava aktivaciju endogenih gena ovisnih o faktoru Nrf2 koju izazivaju senzibilizatori, a dokazano je da signal luciferaze u rekombinantnoj staničnoj liniji ovisi o faktoru Nrf2 (27.). To omogućuje kvantitativno mjerenje (otkrivanjem luminiscencije) indukcije gena luciferaze, uporabom supstrata luciferaze za koje je poznato da stvaraju svjetlost, kao pokazatelja aktivnosti transkripcijskog faktora Nrf2 u stanicama nakon izlaganja elektrofilnim tvarima. U testu KeratinoSens™ ispitivane se kemikalije smatraju pozitivnima ako izazivaju statistički značajnu indukciju aktivnosti luciferaze iznad utvrđenog praga (tj. > pomnoženo s 1,5 ili povećanje od 50 %), ispod određene koncentracije koja ne utječe znatno na sposobnost preživljavanja stanica (tj. ispod 1 000 μM te pri koncentraciji pri kojoj je preživljavanje stanica veće od 70 % (9., 12.)). U tu se svrhu utvrđuje maksimalan multiplikacijski faktor (Imax) za indukciju aktivnosti luciferaze u odnosu na (negativnu) kontrolu s otapalom. Nadalje, s obzirom na to da se stanice izlaže nizu koncentracija ispitivanih kemikalija, koncentraciju potrebnu za statistički značajnu indukciju aktivnosti luciferaze iznad praga (tj. vrijednost EC1,5) trebalo bi interpolirati iz krivulje doza – odgovor (za izračune vidjeti stavak 32.). Konačno, trebalo bi provesti paralelna mjerenja citotoksičnosti kako bi se procijenilo dolazi li do indukcije aktivnosti luciferaze pri subcitotoksičnim koncentracijama. Prije rutinske primjene testa luciferaze ARE-Nrf2 koji je u skladu s ovom ispitnom metodom laboratoriji bi trebali dokazati tehničku osposobljenost izvodeći test na deset tvari navedenih u Dodatku 2. koje služe za dokazivanje tehničke osposobljenosti. Utvrđene su norme za djelovanje (28.) kako bi olakšale validaciju novih ili modificiranih in vitro testova luciferaze ARE-Nrf2 koji su slični testu KeratinoSens™ te omogućile pravodobnu izmjenu ove ispitne metode radi njihova uključenja u nju. Uzajamno prihvaćanje podataka na temelju sporazuma OECD-a jamči se samo za ispitne metode koje su validirane u skladu sa standardima djelovanja ako je OECD pregledao te ispitne metode i uključio ih u odgovarajuću smjernicu OECD-a za ispitivanje. POSTUPAK Ovom je ispitnom metodom trenutačno obuhvaćen samo znanstveno valjani test KeratinoSensTM (9., 12., 13., 14). Dostupni su standardni operativni postupci (SOP) za test KeratinoSensTM te bi ih trebalo primjenjivati pri provedbi i primjeni ispitne metode u laboratoriju (15.). Laboratoriji koji žele primijeniti ispitnu metodu mogu dobiti rekombinantnu staničnu liniju koja se upotrebljava u testu KeratinoSensTM sklapanjem sporazuma o licenciji sa subjektom koji je razvio ispitnu metodu. U sljedećim se stavcima navodi opis glavnih komponenata i postupaka testa luciferaze ARE-Nrf2. Priprema kultura keratinocita Trebalo bi upotrijebiti transgeničnu staničnu liniju koja ima stabilnu inserciju reporterskog gena za luciferazu pod kontrolom elementa ARE (npr. staničnu liniju KeratinoSens™ ). Nakon primitka stanice se razmnožavaju (npr. 2 do 4 pasaža) te čuvaju zamrznute kao homogena zaliha. Stanice iz izvorne zalihe mogu se razmnožiti do maksimalnog broja pasaža (npr. 25 u slučaju testa KeratinoSensTM) te se upotrebljavaju za rutinsko ispitivanje koristeći se pritom odgovarajućim medijem za održavanje (u slučaju testa KeratinoSensTM to je DMEM koji sadržava serum i geneticin). Za ispitivanje, stanice bi trebale biti 80 – 90 % konfluentne te bi trebalo paziti da nikada ne dosegnu punu konfluenciju. Dan prije ispitivanja stanice se izdvajaju i raspoređuju na pločice s 96 jažica (10 000 stanica po jažici u slučaju testa KeratinoSensTM). Potrebno je paziti da se izbjegne taloženje stanica tijekom nasađivanja kako bi se osigurala homogena distribucija broja stanica među jažicama. Ako to nije slučaj, ova faza može izazvati veliku varijabilnost među jažicama. Za svako ponavljanje upotrebljavaju se tri ponovljena uzorka za mjerenje aktivnosti luciferaze te jedan paralelni ponovljeni uzorak za ispitivanje sposobnosti preživljavanja stanica. Priprema ispitivane kemikalije i tvari koje služe kao kontrola Ispitivana kemikalija i tvari koje služe kao kontrola pripremaju se na dan ispitivanja. Za test KeratinoSensTM ispitivane kemikalije otapaju se u dimetil sulfoksidu (DMSO) do konačne željene koncentracije (npr. 200 mM). Otopine DMSO-a mogu se smatrati samosterilizirajućima te nije potrebna sterilna filtracija. Ispitivana kemikalija koja nije topljiva u DMSO-u otapa se u sterilnoj vodi ili hranjivoj podlozi za uzgoj kulture i otopine se steriliziraju, npr. filtriranjem. Za ispitivanu kemikaliju koja nema utvrđenu molekularnu masu (MM) priprema se radna otopina do zadane koncentracije (40 mg/mL ili 4 % (w/v)) u testu KeratinoSensTM. Ako se upotrebljavaju druga otapala, a ne DMSO, voda ili hranjiva podloga za uzgoj kulture, potrebno je navesti dovoljno znanstveno obrazloženje. Od radnih otopina ispitivane kemikalije u DMSO-u pripremaju se serijska razrjeđenja s pomoću DMSO-a kako bi se dobilo 12 glavnih koncentracija kemikalije koje će se ispitivati (od 0,098 do 200 mM u testu KeratinoSensTM). Za ispitivanu kemikaliju koja nije topljiva u DMSO-u razrjeđenja za dobivanje glavnih koncentracija pripremaju se s pomoću sterilne vode ili sterilne hranjive podloge za uzgoj kulture. Neovisno o upotrijebljenom otapalu glavne se koncentracije potom razrjeđuju dvadesetpeterostruko u hranjivoj podlozi za uzgoj kulture koja sadržava serum te se na kraju upotrebljavaju za tretiranje nakon još jednog četverostrukog razrjeđivanja tako da konačne koncentracije ispitivane kemikalije budu u rasponu od 0,98 do 2 000 μM u testu KeratinoSensTM. U opravdanim je slučajevima moguće upotrijebiti druge koncentracije (npr. u slučaju citotoksičnosti ili slabe topljivosti). U testu KeratinoSensTM kao negativna kontrola (s otapalom) upotrebljava se DMSO (CAS br. 67-68-5, čistoće ≥ 99 %), za koju se priprema šest jažica po pločici. Razrjeđuje se na isti način kako je opisano za glavne koncentracije u stavku 22., tako da konačna koncentracija negativne kontrole (s otapalom) bude 1 %, za koju je poznato da ne utječe na preživljavanje stanica te odgovara istoj koncentraciji DMSO-a u ispitanoj kemikaliji i pozitivnoj kontroli. Za ispitivanu kemikaliju koja nije topljiva u DMSO-u i za koju su razrjeđenja pripremljena u vodi, koncentracija DMSO-a u svim jažicama konačne ispitne otopine mora se prilagoditi tako da iznosi 1 % kao i kod drugih ispitivanih kemikalija i tvari koje služe kao kontrola. U testu KeratinoSensTM kao pozitivna kontrola upotrebljava se cimetni aldehid (CAS br. 14371-10-9, čistoće ≥ 98 %) te se za nju priprema serija od pet glavnih koncentracija u rasponu od 0,4 do 6,4 mM u DMSO-u (od radne otopine od 6,4 mM), koje se razrjeđuju kako je opisano za glavne koncentracije u stavku 22. tako da konačna koncentracija pozitivne kontrole bude u rasponu od 4 do 64 μM. Mogu se upotrijebiti i druge prikladne pozitivne kontrole koje po mogućnosti daju srednje vrijednosti EC1,5, pod uvjetom da su dostupni prijašnji podaci na temelju kojih se mogu odrediti usporedivi kriteriji prihvatljivosti za analitičku seriju. Primjena ispitivane kemikalije i tvari koje služe kao kontrola Za svaku ispitivanu kemikaliju i tvar koja se upotrebljava za pozitivnu kontrolu potreban je jedan pokus za izvođenje predviđanja (pozitivnog ili negativnog), koji se sastoji od najmanje dva neovisna ponavljanja od kojih svako sadržava tri ponovljena uzorka (tj. n = 6). Ako se dvama neovisnim ponavljanjima dobiju nesukladni rezultati, trebalo bi provesti treće ponavljanje s tri ponovljena uzorka (tj. n = 9). Neovisna se ponavljanja provode u različite dane svaki put sa svježom radnom otopinom ispitivanih kemikalija i neovisno izdvojenim stanicama. Međutim, stanice mogu biti iz iste pasaže. Nakon što se nasade kako je opisano u stavku 20., stanice se uzgajaju 24 sata na mikrotitracijskim pločicama s 96 jažica. Medij se potom uklanja i zamjenjuje svježom hranjivom podlogom za uzgoj kulture (150 μl hranjive podloge za uzgoj kulture koja sadržava serum, ali bez geneticina u slučaju testa KeratinoSensTM) u koju se dodaje 50 μl dvadesetpeterostruko razrijeđene ispitivane kemikalije i tvari koje služe za kontrolu. Najmanje jednu jažicu po pločici trebalo bi ostaviti praznu (bez stanica i tretiranja) radi određivanja osnovnih vrijednosti. Tretirane se pločice potom inkubiraju oko 48 sati na 37 ± 1 °C u prisutnosti 5 % CO2 u testu KeratinoSensTM. Potrebno je paziti da ne dođe do isparavanja hlapljivih ispitivanih kemikalija te unakrsne kontaminacije jažica ispitivanim kemikalijama, npr. pokrivanjem pločica metalnom folijom prije inkubacije s ispitivanim kemikalijama. Mjerenja aktivnosti luciferaze Tri su faktora ključna za osiguranje pravilnih očitavanja luminiscencije:
Prije ispitivanja trebalo bi provesti kontrolni pokus kako je opisano u Dodatku 3. kako bi se osiguralo ispunjavanje tih triju zahtjeva. Nakon 48 sati izlaganja ispitivanoj kemikaliji i tvarima koje služe za kontrolu u testu KeratinoSensTM stanice se ispiru fiziološkom otopinom puferiranom fosfatnim puferom te se u svaku jažicu doda odgovarajući lizni pufer za očitavanje luminiscencije i ostavi 20 minuta na sobnoj temperaturi. Potom se pločice koje sadržavaju stanični lizat radi očitavanja stavljaju u luminometar koji je u testu KeratinoSensTM programiran tako da: i. u svaku jažicu dodaje supstrat luciferaze (tj. 50 μl), ii. čeka jednu sekundu te iii. integrira aktivnost luciferaze dvije sekunde. Ako se upotrebljavaju drukčiji parametri, npr. ovisno o modelu luminometra, potrebno ih je obrazložiti. Nadalje, može se upotrijebiti i tinjavi supstrat pod uvjetom da je pokus za kontrolu kvalitete iz Dodatka 3. uspješno izveden. Procjena citotoksičnosti Za test preživljavanja stanica KeratinoSensTM medij se nakon 48 sati izlaganja zamjenjuje svježim medijem koji sadržava MTT (3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazolijev bromid, tiazolil plavi tetrazolijev bromid; CAS br. 298-93-1) te se stanice inkubiraju četiri sata na 37 oC u prisutnosti 5 % CO2. Potom se medij MTT uklanja i stanice se tijekom noći liziraju (npr. dodavanjem 10 %-tne otopine SDS-a u svaku jažicu). Nakon protresanja fotometrom se mjeri apsorpcija na 600 nm. PODACI I IZVJEŠĆIVANJE Procjena podataka U testu KeratinoSensTM izračunavaju se sljedeći parametri:
Jednadžba 1.:
pri čemu je:
EC1,5 se izračunava linearnom interpolacijom s pomoću jednadžbe 2., a ukupan EC1,5 izračunava se kao geometrijska sredina pojedinačnih ponavljanja. Jednadžba 2.:
pri čemu je:
Preživljavanje se izračunava s pomoću jednadžbe 3.: jednadžba 3.:
pri čemu je:
IC50 i IC30 izračunavaju se linearnom interpolacijom s pomoću jednadžbe 4., a ukupni IC50 i IC30 izračunavaju se kao geometrijska sredina pojedinačnih ponavljanja. Jednadžba 4.:
pri čemu je:
Za svaku se koncentraciju koja pokazuje povećanje indukcije aktivnosti luciferaze > 1,5 puta izračunava statistička značajnost (npr. dvosmjernim Studentovim t-testom) uspoređivanjem vrijednosti luminiscencije za tri ponovljena uzorka s vrijednostima luminiscencije u jažicama koje sadržavaju (negativnu) kontrolu s otapalom kako bi se utvrdilo je li indukcija aktivnosti luciferaze statistički značajna (p < 0,05). Najniža koncentracija pri kojoj je povećanje indukcije aktivnosti luciferaze > 1,5 puta vrijednost je koja određuje EC1,5. U svakom se slučaju provjerava je li ta vrijednost niža od vrijednosti IC30, dakle je li pri koncentraciji koja određuje vrijednost EC1,5 smanjenje preživljavanja stanica manje od 30 %. Preporučuje se da se podaci vizualno provjeravaju s pomoću grafikona. Ako se ne uočava jasna krivulja doza – odgovor ili ako dobivena krivulja doza – odgovor ima dvofazičan izgled (tj. dva puta presijeca prag od 1,5), pokus bi trebalo ponoviti kako bi se provjerilo je li taj rezultat specifičan za ispitivanu kemikaliju ili je riječ o analitičkom artefaktu. U slučaju da je dvofazični odgovor obnovljiv u neovisnom pokusu, u izvješću bi trebalo navesti nižu vrijednost EC1,5 (koncentraciju pri kojoj krivulja prvi put presijeca prag od 1,5). U rijetkim se slučajevima u kojima se iznad praga od 1,5 puta uočava indukcija koja nije statistički značajna, a nakon koje slijedi statistički značajna indukcija pri višoj koncentraciji, rezultati tog ponavljanja smatraju valjanima i pozitivnima jedino ako je statistički značajna indukcija iznad praga od 1,5 dobivena za koncentraciju koja nije citotoksična. Konačno, za ispitivane kemikalije kod kojih se već i pri najnižoj ispitnoj koncentraciji od 0,98 μM javlja 1,5 puta ili veća indukcija, vrijednost EC1,5 < 0,98 utvrđuje se na temelju vizualnog pregleda krivulje doza – odgovor. Kriteriji prihvatljivosti Sljedeći bi kriteriji prihvatljivosti trebali biti ispunjeni kada se primjenjuje test KeratinoSensTM. Prvo, indukcija aktivnosti luciferaze dobivena s pozitivnom kontrolom, cimetnim aldehidom, trebala bi biti statistički značajna iznad praga od 1,5 (npr. na temelju T-testa) za najmanje jednu od ispitanih koncentracija (od 4 do 64 μM). Drugo, vrijednost EC1,5 trebala bi biti unutar dvaju standardnih odstupanja prijašnje srednje vrijednosti ispitnog laboratorija (npr. između 7 μM i 30 μM na temelju podataka upotrijebljenih za validaciju), koju bi trebalo redovito ažurirati. Osim toga, prosječna indukcija u tri ponovljena uzorka za cimetni aldehid pri 64 μM trebala bi iznositi između 2 i 8. Ako nije ispunjen potonji kriterij, odnos doza – odgovor za cimetni aldehid trebalo bi pažljivo provjeriti, a testovi mogu biti prihvaćeni jedino ako postoji jasan odnos između doze i odgovora u kojemu se indukcija aktivnosti luciferaze povećava s povećanjem koncentracija za pozitivnu kontrolu. Konačno, prosječan koeficijent varijacije očitanih vrijednosti luminiscencije za negativnu kontrolu (s otapalom) s DMSO-om trebao bi biti ispod 20 % u svakom ponavljanju koje obuhvaća šest jažica ispitanih kao triplikat. Ako je varijabilnost veća, rezultati se odbacuju. Tumačenje rezultata i model predviđanja Predviđanje na temelju testa KeratinoSensTM smatra se pozitivnim ako su ispunjena sva četiri sljedeća uvjeta u dva od dva ponavljanja ili u ta ista dva od tri ponavljanja; u protivnom se predviđanje na temelju testa KeratinoSensTM smatra negativnim (slika 1.):
Ako su u određenom ponavljanju ispunjena sva tri prva uvjeta, ali se ne može uočiti jasan odnos između doze i odgovora za indukciju luciferaze, tada bi se trebalo smatrati da je rezultat tog ponavljanja nejasan te mogu biti potrebna dodatna ispitivanja (slika 1.). Osim toga, i negativan rezultat dobiven s koncentracijama < 1 000 μM (ili < 200 μg/ml za ispitivane kemikalije čija molekularna masa nije utvrđena) isto bi tako trebalo smatrati nejasnim (vidjeti stavak 11.). Slika 1. Model predviđanja koji se upotrebljava u testu KeratinoSensTM. Predviđanje na temelju testa KeratinoSensTM trebalo bi razmatrati u okviru IATA-e te u skladu s odredbama stavaka 9. i 11.
U rijetkim slučajevima, ispitivane kemikalije koje induciraju aktivnost luciferaze vrlo blizu citotoksičnih razina mogu u nekim ponavljanjima biti pozitivne pri razinama koje nisu citotoksične (tj. koncentracija koja određuje EC1,5 niža je od (<) vrijednosti IC30), a u drugim ponavljanjima samo pri razinama koje su citotoksične (tj. koncentracija koja određuje EC1,5 veća je od (>) vrijednosti IC30). Takve bi ispitivane kemikalije trebalo ponovno ispitati užom analizom odnosa između doze i odgovora primjenjujući niži faktor razrjeđenja (npr. 1,33 ili Ö2 (= 1,41) puta između jažica) kako bi se utvrdilo je li do indukcije došlo na citotoksičnim razinama ili nije (9.). Izvješće o ispitivanju Izvješće o ispitivanju trebalo bi sadržavati sljedeće informacije:
LITERATURA
Dodatak 1. DEFINICIJE Točnost : stupanj podudarnosti između rezultata ispitne metode i prihvaćenih referentnih vrijednosti. To je mjerilo učinkovitosti ispitne metode i jedan od aspekata ‚relevantnosti’. Pojam je često međusobno zamjenjiv s pojmom ‚podudarnost’ u smislu udjela točnih ishoda ispitne metode (29.). AOP (engl. Adverse Outcome Pathway – put nastanka štetnog ishoda) : slijed događaja od kemijske strukture ciljne kemikalije ili skupine sličnih kemikalija preko početnog molekularnog događaja do in vivo štetnog ishoda (2.). ARE : element antioksidacijskog odgovora (naziva se i EpRE, element odgovora na elektrofile) je element odgovora smješten u uzvodnoj promotorskoj regiji mnogih citoprotektivnih gena i gena faze II. Ako ga aktivira Nfr2, posreduje u transkripcijskoj indukciji tih gena. Kemikalija : tvar ili smjesa. Koeficijent varijacije : mjera varijabilnosti koja se za skupinu podataka dobivenih od ponovljenih uzoraka izračunava dijeljenjem standardnog odstupanja sa srednjom vrijednošću. Može se pomnožiti sa 100 da bi se izrazila u obliku postotka. EC1,5 : interpolirana koncentracija za indukciju luciferaze pomnoženu s 1,5. IC30 : koncentracija pri kojoj je preživljavanje stanica smanjeno za 30 %. IC50 : koncentracija pri kojoj je preživljavanje stanica smanjeno za 50 %. Opasnost : intrinzično svojstvo nekog agensa ili stanje koji imaju potencijal da uzrokuju štetne učinke kada su organizam, sustav ili (sub)populacija izloženi tom agensu. IATA (engl. Integrated Approach to Testing and Assessment – integrirani pristup ispitivanju i procjeni) : strukturiran pristup koji se primjenjuje za identifikaciju opasnosti (potencijal), karakterizaciju opasnosti (jakost) i/ili procjenu sigurnosti (potencijal/jakost i izloženost) kemikalije ili skupine kemikalija, kojim se na strateški način objedinjuju i ponderiraju svi relevantni podaci koji će služiti kao podloga za donošenje regulatornih odluka u vezi s potencijalnom opasnošću i/ili rizikom i/ili potrebom za daljnjim ciljnim, a time i minimalnim ispitivanjem. Imax : maksimalni faktor indukcije luciferaze u usporedbi s (negativnom) kontrolom s otapalom izmjeren pri bilo kojoj koncentraciji ispitivane kemikalije. Keap1 ( Kelch-like ECH-associated protein 1 ): senzorski protein koji može regulirati aktivnost faktora Nrf2. U neinduciranim uvjetima senzorski protein Keap1 ciljano djeluje na transkripcijski faktor Nrf2 radi njegove ubikvitinacije i proteolitičke razgradnje u proteasomu. Kovalentna modifikacija reaktivnih cisteinskih ostataka proteina Keap 1 s malim molekulama može dovesti do disocijacije faktora Nrf2 od proteina Keap1 (8) (10) (11). Smjesa : smjesa ili otopina koja se sastoji od dviju ili više tvari koje u njoj ne reagiraju (1.). Jednokomponentna tvar : tvar, definirana količinskim sastavom, u kojoj je jedan glavni sastojak prisutan u koncentraciji od najmanje 80 % (w/w). Višekomponentna tvar : tvar, definirana količinskim sastavom, u kojoj je više od jednog glavnog sastojka prisutno u koncentraciji od 10 % (w/w) ili većoj, ali ne većoj od 80 % (w/w). Višekomponentna tvar rezultat je procesa proizvodnje. Smjesa i višekomponentna tvar razlikuju se po tome što se smjesa dobiva miješanjem dviju ili više tvari bez kemijske reakcije. Višekomponentna tvar rezultat je kemijske reakcije. Nrf2 (nuclear factor (erythroid-derived 2)-like 2) : transkripcijski faktor koji je uključen u put antioksidacijskog odgovora. Kada Nrf2 nije ubikvitiniran, razvija se u citoplazmi i translocira u jezgru, gdje se veže s ARE-om u uzvodnoj promotorskoj regiji mnogih citoprotektivnih gena pokrećući njihovu transkripciju (8., 10., 11). Pozitivna kontrola : ponovljeni uzorak koji sadržava sve komponente ispitnog sustava i tretiran je s tvari za koju je poznato da izaziva pozitivan odgovor. Kako bi se osigurala mogućnost procjene varijabilnosti odgovora pozitivne kontrole tijekom vremena, odgovor ne bi smio biti presnažan. Relevantnost : opis odnosa između ispitivanja i istraživanog učinka te je li ispitivanje prikladno i korisno za određenu svrhu. Pokazuje u kojoj se mjeri ispitivanjem točno mjeri ili predviđa istraživani biološki učinak. Relevantnost uključuje i razmatranje o točnosti (sukladnosti) ispitne metode (29.). Pouzdanost : pokazuje u kojoj se mjeri ispitna metoda može obnovljivo primijeniti unutar jednog laboratorija i između više laboratorija tijekom vremena uz primjenu istog protokola. Ocjenjuje se izračunavanjem obnovljivosti unutar jednog laboratorija i između više njih te ponovljivosti unutar jednog laboratorija (29.). Obnovljivost : podudarnost rezultata dobivenih ispitivanjem iste kemikalije uz primjenu istog ispitnog protokola (vidjeti ‚pouzdanost’) (29.). Osjetljivost : udio svih pozitivnih/aktivnih kemikalija koje su pravilno razvrstane primjenom ispitne metode. To je mjera točnosti ispitne metode koja daje kategorijske rezultate i važan je čimbenik za ocjenu relevantnosti ispitne metode (29.). Kontrola s otapalom/nosačem : ponovljeni uzorak koji ne sadržava ispitivanu kemikaliju, ali sadržava sve ostale komponente ispitnog sustava te otapalo koje se upotrebljava u ispitivanju. Upotrebljava se za utvrđivanje polazne reakcije za uzorke koji se tretiraju ispitivanom kemikalijom otopljenom u istom otapalu. Specifičnost : udio svih negativnih/neaktivnih kemikalija koje su pravilno razvrstane primjenom ispitne metode. To je mjera točnosti ispitne metode koja daje kategorijske rezultate i važan je čimbenik za ocjenu relevantnosti ispitne metode (29.). Tvar : kemijski elementi i njihovi spojevi u prirodnom stanju ili dobiveni proizvodnim postupkom, uključujući i dodatke (aditive) koji su nužni za održavanje stabilnosti proizvoda te nečistoće koje proizlaze iz primijenjenog postupka, ali isključujući otapala koja se mogu izdvojiti bez utjecaja na stabilnost tvari ili promjene njezina sastava (1.). Ispitivana kemikalija : izraz ‚ispitivana kemikalija’ upotrebljava se za označivanje onoga što se ispituje. Globalno usklađeni sustav Ujedinjenih naroda za razvrstavanje i označivanje kemikalija (UN GHS) : sustav za razvrstavanje kemikalija (tvari i smjesa) prema standardiziranim vrstama i stupnjevima fizičkih opasnosti i opasnosti za zdravlje i okoliš, kojim su obuhvaćena odgovarajuća komunikacijska sredstva kao što su piktogrami, oznake opasnosti, oznake upozorenja, oznake obavijesti i sigurnosno-tehnički listovi, kojima se prenose informacije o njihovim štetnim učincima u cilju zaštite ljudi (uključujući poslodavce, radnike, prijevoznike, potrošače i interventno osoblje) i okoliša (1.). UVCB : tvari nepoznatog ili promjenjivog sastava, složeni reakcijski proizvodi ili biološki materijali. Valjana ispitna metoda : ispitna metoda za koju se smatra da je dovoljno relevantna i pouzdana za određenu svrhu te koja se temelji na znanstveno utemeljenim načelima. Ispitna metoda nije nikada valjana u apsolutnom smislu nego samo u odnosu na određenu svrhu (29.). Dodatak 2. TVARI ZA DOKAZIVANJE TEHNIČKE OSPOSOBLJENOSTI Preosjetljivost kože in vitro: Test luciferaze ARE-Nrf2 Prije rutinske primjene ove ispitne metode laboratoriji bi trebali dokazati svoju tehničku osposobljenost tako što će za deset tvari koje su u tablici 1. preporučene za dokazivanje osposobljenosti dobiti očekivano predviđanje na temelju testa KeratinoSens™ te za najmanje osam od deset tvari za dokazivanje osposobljenosti dobiti vrijednosti EC1,5 i IC50 koje su unutar odgovarajućeg referentnog raspona. Tvari za dokazivanje tehničke osposobljenosti izabrane su tako da predstavljaju niz odgovora povezanih s opasnostima od izazivanja preosjetljivosti kože. Drugi kriteriji za odabir bili su komercijalna dostupnost tvari, dostupnost visokokvalitetnih referentnih podataka dobivenih in vivo te dostupnost visokokvalitetnih in vitro podataka dobivenih s pomoću testa KeratinoSensTM. Tablica 1. Preporučene tvari za dokazivanje tehničke osposobljenosti za izvođenje testa KeratinoSensTM
Dodatak 3. KONTROLA KVALITETE MJERENJA LUMINISCENCIJE Osnovni pokus za osiguravanje optimalnog mjerenja luminiscencije u testu KeratinoSensTM Da bi se osiguralo dobivanje pouzdanih rezultata s pomoću luminometra, ključna su sljedeća tri parametra:
Kako bi se osiguralo primjereno mjerenje luminiscencije, preporučuje se da se prije provođenja testa ispita kontrolna pločica postavljena kako je opisano u nastavku (analiza triplikata). Raspored jažica na pločici za prvi preliminarni pokus
EGDMA= etilen glikol dimetakrilat (CAS br.: 97-90-5), kemikalija koja izaziva jaku indukciju CA= cimetni aldehid, pozitivna kontrola (CAS br.: 104-55-2) Analiza kontrole kvalitete trebala bi pokazati sljedeće:
B.61. Metoda ispitivanja propuštanja fluoresceina za identifikaciju tvari nagrizajućih i jako nadražujućih za oči UVOD Ova ispitna metoda odgovara smjernici OECD-a za ispitivanje (TG) 460 (2012.). Metoda ispitivanja propuštanja fluoresceina (engl. Fluorescein Leakage – FL) je in vitro ispitna metoda koja se u određenim okolnostima i uz specifična ograničenja može upotrijebiti za razvrstavanje kemikalija (tvari i smjesa) kao tvari nagrizajućih i jako nadražujućih za oči, kako su definirane u Globalno usklađenom sustavu Ujedinjenih naroda za razvrstavanje i označivanje kemikalija (UN GHS) (kategorija 1.) i Uredbi (EZ) br. 1272/2008 o razvrstavanju, označivanju i pakiranju tvari i smjesa (Uredba o CLP-u) (31) (kategorija 1.) te kako ih definira Agencija SAD-a za zaštitu okoliša (US EPA) (kategorija I.) (1., 2.). Za potrebe ove ispitne metode tvari jako nadražujuće za oči definiraju se kao kemikalije koje nakon primjene ispitivane kemikalije uzrokuju oštećenje očnog tkiva koje nije reverzibilno unutar 21 dana ili uzrokuje teško fizičko pogoršanje vida, a tvari nagrizajuće za oči su kemikalije koje uzrokuju ireverzibilno oštećenje očnog tkiva. Te se kemikalije razvrstavaju u kategoriju 1. sustava UN GHS, kategoriju 1. prema Uredbi EU-a o CLP-u ili kategoriju I. EPA-e. Iako se ne smatra da vrijedi kao potpuna zamjena za in vivo ispitivanje na oku kunića, metoda FL preporučuje se za primjenu kao dio strategije višerazinskog ispitivanja za regulatorno razvrstavanje i označivanje. Prema tome, metoda FL preporučuje se kao prvi korak u pristupu ‚odozgo prema dolje’ u svrhu identifikacije tvari nagrizajućih / jako nadražujućih za oči, posebno za određene vrste kemikalija (tj. tvari i smjese topljive u vodi) (3., 4.). Danas je općenito prihvaćeno da se u doglednoj budućnosti ispitivanje na očima in vivo (ispitna metoda B.5. (5.)) neće moći zamijeniti nekom jedinstvenom in vitro metodom ispitivanja nadražujućeg djelovanja na oči koja bi pokrivala čitav spektar nadražujućih učinaka različitih kategorija kemikalija. Međutim, strateške kombinacije nekoliko alternativnih ispitnih metoda u okviru strategije (višerazinskog) ispitivanja mogle bi zamijeniti in vivo ispitivanja na očima (4.). Pristup odozgo prema dolje (4.) namijenjen je za primjenu u slučajevima kada se na temelju postojećih informacija očekuje da kemikalija ima visok potencijal nadražujućeg djelovanja. Prema modelu predviđanja koji je detaljnije opisan u stavku 35., ispitnom metodom FL mogu se u okviru ograničenog područja primjenjivosti identificirati kemikalije kao tvari koje su nagrizajuće / jako nadražujuće za oči (kategorija 1. sustava UN GHS; kategorija 1. prema Uredbi EU-a o CLP-u; kategorija I. US EPA-e) bez dodatnih ispitivanja. Isto se pretpostavlja i za smjese, iako smjese nisu upotrijebljene u validaciji. Stoga se ispitna metoda FL može upotrijebiti za određivanje nadražujućeg/nagrizajućeg djelovanja kemikalija na oči u skladu sa strategijom sekvencijskog ispitivanja iz ispitne metode B.5. (5.). Međutim, kemikaliju za koju se na temelju ispitne metode FL ne predviđa da ima nagrizajuće ili jako nadražujuće djelovanje na oči potrebno je ispitati s pomoću još jedne ili više dodatnih metoda ispitivanja (in vitro i/ili in vivo) kojima se mogu točno identificirati i. kemikalije koje su u testu FL in vitro dale lažno negativne rezultate u pogledu nagrizajućeg/jako nadražujućeg djelovanja na oči (kategorija 1. sustava UN GHS; kategorija 1. prema Uredbi EU-a o CLP-u; kategorija I. US EPA-e); ii. kemikalije koje nisu razvrstane s obzirom na nagrizajuće/nadražujuće djelovanje na oči (izvan kategorije prema sustavu UN GHS; izvan kategorije prema Uredbi EU-a o CLP-u; kategorija IV. US EPA-e); i/ili iii. kemikalije koje su umjereno/blago nadražujuće za oči (kategorije 2.A i 2.B sustava UN GHS; kategorija 2. prema Uredbi EU-a o CLP-u; kategorije II. i III. US EPA-e). Svrha je ove ispitne metode opisati postupke koji se primjenjuju za ocjenjivanje potencijalno nagrizajućeg ili jako nadražujućeg djelovanja ispitivane kemikalije na oči s obzirom na njezinu sposobnost da uzrokuje oštećenje nepropusnog konfluentnog epitelnog monosloja. Integritet transepitelne propusnosti glavna je funkcija epitela poput onog koji se nalazi u konjunktivi i rožnici. Transepitelnu propusnost kontroliraju razni čvrsti međustanični spojevi. Pokazalo se da je povećanje propusnosti epitela rožnice in vivo u korelaciji sa stupnjem upale i površinskog oštećenja opaženog pri pojavi nadražujućeg djelovanja na oko. U ispitnoj metodi FL toksični učinci nakon kratkog izlaganja ispitivanoj kemikaliji mjere se na temelju povećanog propuštanja natrijeva fluoresceina kroz epitelni monosloj psećih bubrežnih stanica Madin Darby (MDCK) uzgojenih na propusnim umetcima. Količina propuštenog fluoresceina razmjerna je kemijski uzrokovanom oštećenju međustaničnih spojeva, dezmosoma i staničnih membrana te se na temelju nje može procijeniti potencijalna okularna toksičnost ispitivane kemikalije. U Dodatku 1. prikazan je dijagram uzgoja stanica MDCK na membrani umetka za ispitnu metodu FL. Definicije su navedene u Dodatku 2. POČETNA RAZMATRANJA I OGRANIČENJA Ova se ispitna metoda temelji na protokolu INVITTOX br. 71 (6.) koji je ocijenjen u okviru međunarodne validacijske studije koju je proveo Europski centar za validaciju alternativnih metoda (ECVAM) u suradnji s Međuagencijskim koordinacijskim odborom SAD-a za validaciju alternativnih metoda (ICCVAM) i Japanskim centrom za validaciju alternativnih metoda (JaCVAM). Ispitna metoda FL ne preporučuje se za identificiranje kemikalija koje bi trebalo razvrstati kao umjereno/blago nadražujuće za oči ili kemikalija koje ne bi trebalo razvrstati s obzirom na nadražujuće djelovanje na oči (tvari i smjese) (tj. kat. 2.A/2.B sustava GHS ili izvan kategorije; kat. 2. ili izvan kategorije prema Uredbi EU-a o CLP-u; kat. II./III./IV. US EPA-e), kako je pokazano validacijskom studijom (3., 7.). Ova se ispitna metoda primjenjuje samo na kemikalije (tvari i smjese) koje su topljive u vodi. Metodom FL općenito se može točno procijeniti potencijal za jako nadražujuće djelovanje na oči kod kemikalija koje su topljive u vodi i/ili na čije toksične učinke ne utječe razrjeđenje (7.). Da bi se neka kemikalija smatrala topljivom u vodi u eksperimentalnim uvjetima, trebala bi biti topljiva u sterilnoj ujednačenoj Hanksovoj otopini soli bez fenolnog crvenila koja sadržava kalcij (u koncentraciji od 1,0 do 1,8 mM) (HBSS), pri koncentraciji ≥ 250 mg/ml (jedna doza iznad granične vrijednosti od 100 mg/ml). Međutim, ako je ispitivana kemikalija topljiva pri koncentraciji manjoj od 100 mg/ml, ali izaziva propuštanje fluoresceina (FL) od 20 % već pri toj koncentraciji (dakle ako je FL20 < 100 mg/ml), ipak se može razvrstati u kat. 1. sustava GHS ili kat. I. EPA-e. S obzirom na utvrđena ograničenja ove ispitne metode iz njezinog su područja primjenjivosti isključene jake kiseline i baze, fiksativi za stanice te jako hlapljive kemikalije. Te kemikalije imaju mehanizme koji se ne mjere ispitnom metodom FL, kao što su ekstenzivna koagulacija, saponifikacija ili specifične kemijske reakcije. Ostala utvrđena ograničenja ove ispitne metode temelje se na rezultatima u pogledu prediktivnosti za obojene i viskozne ispitivane kemikalije (7.). S obzirom na to da je obje vrste kemikalija teško ukloniti iz monosloja nakon kratkog razdoblja izlaganja, sugerira se da bi se prediktivnost ispitne metode mogla poboljšati kad bi se primijenio veći broj faza ispiranja. Krute kemikalije suspendirane u tekućini sklone su taloženju te može biti teško odrediti konačnu koncentraciju kojoj su izložene stanice. Ako se kemikalije koje spadaju u navedene kemijske i fizikalne kategorije isključe iz baze podataka, točnost metode FL u sustavima za razvrstavanje EU-a, EPA-e i GHS bitno se poboljšava (7.). Imajući u vidu svrhu ove ispitne metode (a to je identifikacija samo onih tvari koje su nagrizajuće / jako nadražujuće za oči), stopa lažno negativnih rezultata (vidjeti stavak 13.) nije od presudne važnosti jer će se takve kemikalije naknadno ispitati drugim odgovarajućim validiranim in vitro testovima ili na kunićima, ovisno o regulatornim zahtjevima, primjenom strategije sekvencijskog ispitivanja koja se temelji na ocjenjivanju snage dokaza (5.) (vidjeti i stavke 3. i 4.). Ostala utvrđena ograničenja ispitne metode FL temelje se na stopama lažno negativnih i lažno pozitivnih rezultata. Kada se ispitna metoda FL primjenjuje kao početni korak u pristupu odozgo prema dolje radi identifikacije tvari i smjesa topljivih u vodi koje nagrizaju / jako nadražuju oči (kategorija 1. sustava UN GHS; kategorija 1. prema Uredbi EU-a o CLP-u; kategorija I. US EPA-e), stopa lažno pozitivnih rezultata kreće se u rasponu od 7 % (7/103; UN GHS i Uredba EU-a o CLP-u) do 9 % (9/99; US EPA), a stopa lažno negativnih rezultata kreće se u rasponu od 54 % (15/28; US EPA) do 56 % (27/48; UN GHS i Uredba EU-a o CLP-u) u usporedbi s rezultatima in vivo. Ovdje se ne definiraju kemijske skupine koje pokazuju lažno pozitivne i/ili lažno negativne rezultate u ispitnoj metodi FL. Određena tehnička ograničenja specifična su za staničnu kulturu MDCK. Što je veći broj pasaža stanica, to je slabija kvaliteta čvrstih međustaničnih spojeva koji blokiraju prolaz boje natrijevog fluoresceina kroz monosloj. Nepotpuno formiranje čvrstih međustaničnih spojeva dovodi do povećanog propuštanja fluoresceina u netretiranoj kontroli. Stoga je važno utvrditi najveći dopušteni stupanj propuštanja u netretiranim kontrolama (vidjeti stavak 38.: propuštanje od 0 %). Kao i kod svih pokusa in vitro, postoji mogućnost da tijekom vremena dođe do transformacije stanica, pa je stoga od ključne važnosti odrediti raspon broja pasaža u pokusima. Trenutačno područje primjene u nekim bi se slučajevima moglo proširiti, ali tek nakon što se analizira prošireni skup podataka o istraživanim kemikalijama, koji je po mogućnosti dobiven ispitivanjima (3.). Ova će se ispitna metoda ažurirati na odgovarajući način nakon što se razmotre nove informacije i podaci. Svaki laboratorij koji prvi put počinje primjenjivati ovaj test trebao bi upotrijebiti kemikalije iz Dodatka 3. koje služe za dokazivanje tehničke osposobljenosti. Laboratoriji mogu upotrijebiti te kemikalije kako bi dokazali svoju tehničku osposobljenost za provođenje ispitne metode FL prije nego što podatke iz testa FL dostave za razvrstavanje prema stupnju opasnosti u regulatorne svrhe. NAČELO ISPITIVANJA Ispitna metoda FL je in vitro test koji se temelji na parametrima citotoksičnosti i staničnih funkcija te se provodi na konfluentnom monosloju tubularnih epitelnih stanica MDCK CB997 koje su uzgojene na nepropusnim umetcima i model su neproliferirajućeg stanja epitela rožnice in vivo. Stanična linija MDCK dobro je poznata i stvara čvrste međustanične spojeve i dezmosome slične onima koji se nalaze na apikalnoj strani epitela konjunktive i rožnice. Čvrsti međustanični spojevi i dezmosomi in vivo sprečavaju da otopljene i strane tvari prodru kroz epitel rožnice. Gubitak transepitelne nepropusnosti zbog oštećenja čvrstih međustaničnih spojeva i dezmosoma jedan je od prvih događaja koji se javlja kod kemijski izazvanog nadraživanja oka. Ispitivana se kemikalija nanosi na konfluentni sloj stanica uzgajanih na apikalnoj strani umetka. U pravilu se primjenjuje kratko jednominutno vrijeme izlaganja kako bi se odrazio uobičajeni klirens kod izloženosti ljudi. Prednost kratkog vremena izlaganja u tome je da se tvari i smjese na osnovi vode mogu ispitati čiste ako se mogu lako ukloniti po isteku razdoblja izlaganja. To omogućuje izravnije usporedbe rezultata s kemijskim učincima kod ljudi. Ispitivana se kemikalija potom uklanja te se na apikalnu stranu monosloja 30 minuta dodaje netoksična, visoko fluorescentna boja natrijevog fluoresceina. Oštećenje koje je ispitivana kemikalija uzrokovala na čvrstim međustaničnim spojevima određuje se količinom fluoresceina koja u određenom razdoblju prođe kroz sloj stanica. Količina boje natrijevog fluoresceina koja prođe kroz monosloj i membranu umetka u određeni volumen otopine u jažici (u koju curi boja natrijevog fluoresceina) određuje se spektrofluorometrijskim mjerenjem koncentracije fluoresceina u jažici. Količina propuštanja fluoresceina (FL) izračunava se u odnosu na intenzitet fluorescencije (FI) izmjeren u dvjema kontrolama: slijepoj probi i kontroli s maksimalnim propuštanjem. Postotak propuštanja, a time i stupanj oštećenja čvrstih međustaničnih spojeva, izražava se, u odnosu na te kontrole, za svaku od zadanih koncentracija ispitivane kemikalije. Potom se izračunava FL20 (tj. koncentracija koja uzrokuje propuštanje fluoresceina u vrijednosti od 20 % u odnosu na vrijednost zabilježenu za netretirani konfluentni monosloj i umetke bez stanica). Vrijednost FL20 (mg/ml) upotrebljava se u modelu predviđanja za identifikaciju tvari koje nagrizaju i jako nadražuju oči (vidjeti stavak 35.). Iskorištenje je važan dio profila toksičnosti ispitivane kemikalije te se isto tako ispituje in vivo ispitivanjem nadraživanja oka. Preliminarne su analize pokazale da bi podaci o iskorištenju (do 72 sata nakon izlaganja kemikaliji) mogli povećati prediktivnu sposobnost protokola INVITTOX 71, ali potrebna su dodatna ocjenjivanja za koja bi bilo korisno imati dodatne podatke koji su po mogućnosti dobiveni dodatnim ispitivanjima (6.). Ova će se ispitna metoda ažurirati na odgovarajući način nakon što se razmotre nove informacije i podaci. POSTUPAK Priprema staničnog monosloja Monosloj stanica MDCK CB997 priprema se upotrebom subkonfluentnih stanica uzgajanih u bocama za uzgoj staničnih kultura u Dulbeccovom modificiranom Eagleovu mediju (DMEM) i hranjivoj mješavini F12 (1x koncentrat s L-glutaminom, 15 mM HEPES-a, kalcijem (u koncentraciji od 1,0 do 1,8 mM) i 10 % fetalnog telećeg/goveđeg seruma (FCS/FBS) inaktiviranog toplinom). Važno je da svi mediji/otopine upotrijebljeni tijekom testa FL sadržavaju kalcij u koncentraciji između 1,0 mM (111 mg/l) i 1,8 mM (200 mg/l) kako bi se osiguralo stvaranje i integritet čvrstih međustaničnih spojeva. Trebalo bi kontrolirati raspon broja pasaža stanica kako bi se osiguralo ujednačeno i obnovljivo stvaranje čvrstih međustaničnih spojeva. Broj pasaža stanica trebao bi se po mogućnosti kretati u rasponu od tri do 30 nakon odmrzavanja jer stanice u tom rasponu imaju sličnu funkcionalnost, što pridonosi obnovljivosti rezultata testa. Prije provođenja ispitne metode FL stanice se odvajaju od bočice tripsinizacijom te se centrifugiraju i odgovarajuća se količina stanica nasađuje na umetke postavljene na pločice s 24 jažice (vidjeti Dodatak 1.). Za nasađivanje stanica trebalo bi upotrijebiti umetke promjera dvanaest milimetara s membranom od mješovitih celuloznih estera, debljine od 80 do 150 μm i s porama veličine 0,45 μm. U validacijskoj su studiji upotrijebljeni umetci Millicell-HA 12 mm. Značajke umetka i vrsta membrane važni su jer mogu utjecati na rast stanica i stvaranje kemijskih veza. Neke se vrste kemikalija mogu vezati na membranu umetka Millicell-HA, što bi moglo utjecati na tumačenje rezultata. Ako se upotrebljavaju druge membrane, njihovu bi jednakovrijednost trebalo dokazati s pomoću kemikalija za dokazivanje tehničke osposobljenosti (vidjeti Dodatak 3.). Stvaranje kemijske veze s membranom umetka češće se javlja kod kationskih kemikalija kao što je benzalkonijev klorid, koje privlači nabijena membrana (7.). Stvaranje kemijske veze s membranom umetka može dovesti do produljenja razdoblja izlaganja, a time i do precjenjivanja toksičkog potencijala kemikalije, ali isto tako može dovesti i do fizičkog smanjenja propuštanja fluoresceina kroz umetak zbog vezanja boje na kationsku kemikaliju koja je vezana na membranu umetka, a time i do podcjenjivanja toksičkog potencijala kemikalije. Navedena se pojava može izravno ocijeniti izlaganjem same membrane najvišoj koncentraciji ispitane kemikalije te potom dodavanjem boje natrijevog fluoresceina u uobičajenoj koncentraciji tijekom standardnog vremena izlaganja (bez kontrole sa stanicama). Ako dođe do vezanja boje natrijevog fluoresceina, membrana umetka požutjet će nakon ispiranja ispitnog materijala. Stoga je ključno poznavati vezivna svojstva ispitivane kemikalije da bi se mogao protumačiti njezin učinak na stanice. Nasađivanjem stanica na umetke trebao bi se dobiti konfluentan monosloj u trenutku izlaganja kemikaliji. Trebalo bi dodati 1,6 × 105 stanica po umetku (400 μl suspenzije stanica gustoće 4 × 105 stanica / ml). U tim se uvjetima konfluentan monosloj obično dobije nakon 96 sati uzgoja. Umetke bi trebalo vizualno pregledati prije nasađivanja kako bi se osiguralo da sva eventualna oštećenja zabilježena vizualnim pregledom opisanim u stavku 30. proizlaze iz rukovanja. Stanične kulture MDCK trebalo bi držati u inkubatorima u vlažnoj atmosferi pri 5 % ± 1 % CO2 i 37 ± 1 °C. Stanice ne smiju biti kontaminirane bakterijama, virusima, mikoplazmom i gljivicama. Primjena ispitivanih i kontrolnih kemikalija Za svaki analitički ciklus potrebno je pripremiti svježu radnu otopinu te je upotrijebiti u roku od 30 minuta od pripreme. Ispitivane kemikalije trebalo bi pripremiti u HBSS-u s kalcijem (u koncentraciji od 1,0 do 1,8 mM) bez fenolnog crvenila kako bi se spriječilo vezanje s proteinima seruma. Prije ispitivanja trebalo bi procijeniti topljivost kemikalije pri koncentraciji od 250 mg/ml u HBSS-u. Ako pri toj koncentraciji kemikalija stvori stabilnu suspenziju ili emulziju (tj. ostane ujednačena i ne nataloži se niti razdvoji na više faza) tijekom 30 minuta, HBSS se može upotrijebiti kao otapalo. Međutim, ako se pokaže da je pri toj koncentraciji kemikalija netopljiva u HBSS-u, trebalo bi razmisliti o primjeni drugih ispitnih metoda umjesto metode FL. Upotrebu mineralnog ulja niske viskoznosti kao otapala u slučajevima kada se pokaže da kemikalija nije topljiva u HBSS-u trebalo bi uzeti u obzir s oprezom jer dostupni podaci nisu dostatni za donošenje zaključka o uspješnosti testa FL u tim uvjetima. Sve kemikalije koje treba ispitati pripremaju se iz radne otopine, u sterilnom HBSS-u s kalcijem (u koncentraciji od 1,0 do 1,8 mM) bez fenolnog crvenila, u pet razrjeđenja s fiksnim masenim koncentracijama: 1, 25, 100, 250 mg/ml te jedna čista ili zasićena otopina. Kada se ispituje kruta kemikalija, trebalo bi uključiti vrlo visoku koncentraciju od 750 mg/ml. Tu bi koncentraciju kemikalije trebalo nanijeti na stanice s pomoću pipete koja radi na načelu pozitivnog istisnog volumena. Ako se pokaže da se toksični učinci javljaju između 25 i 100 mg/ml, trebalo bi dva puta ispitati sljedeće dodate koncentracije: 1, 25, 50, 75, 100 mg/ml. Iz tih se koncentracija izvodi vrijednost FL20 pod uvjetom da su ispunjeni kriteriji prihvatljivosti. Ispitivane se kemikalije nanose na konfluentne monoslojeve stanica nakon što se hranjiva podloga za uzgoj stanica ukloni te monoslojevi isperu dva puta sterilnim, toplim (37 °C) HBSS-om s kalcijem (u koncentraciji od 1,0 do 1,8 mM) bez fenolnog crvenila. Filteri su prije toga bili vizualno pregledani kako bi se provjerilo postoje li otprije prisutna oštećenja koja bi se mogla pogrešno pripisati potencijalnoj inkompatibilnosti s ispitivanim kemikalijama. Za svaku koncentraciju ispitivane kemikalije te za kontrole trebalo bi upotrijebiti najmanje tri ponovljena uzorka u svakom analitičkom ciklusu. Nakon jedne minute izlaganja na sobnoj temperaturi ispitivanu kemikaliju trebalo bi pažljivo ukloniti aspiracijom, monosloj bi trebalo dva puta isprati sterilnim, toplim (37 °C) HBSS-om s kalcijem (u koncentraciji od 1,0 do 1,8 mM) bez fenolnog crvenila te bi trebalo odmah izmjeriti propuštanje fluoresceina. U svakom bi analitičkom ciklusu trebalo upotrijebiti istodobne negativne (NK) i pozitivne kontrole (PK) kako bi se dokazalo da su integritet monosloja (NK) i osjetljivost stanica (PK) unutar prihvatljivog raspona utvrđenog na temelju rezultata prijašnjih ispitivanja. Za PK se preporučuje upotrijebiti kemikaliju brij 35 (CAS br. 9002-92-0) u koncentraciji od 100 mg/ml. Pri toj bi koncentraciji propuštanje fluoresceina trebalo iznositi oko 30 % (prihvatljivi raspon propuštanja fluoresceina tj. oštećenja sloja stanica: od 20 do 40 % ). Za NK se preporučuje upotrijebiti HBSS s kalcijem (u koncentraciji od 1,0 do 1,8 mM) bez fenolnog crvenila (netretirana slijepa proba). U svaki bi ciklus trebalo uključiti i kontrolu s maksimalnim propuštanjem kako bi se mogle izračunati vrijednosti FL20. Maksimalno se propuštanje određuje s pomoću kontrolnog umetka bez stanica. Određivanje propuštanja fluoresceina Odmah nakon uklanjanja ispitivanih i kontrolnih kemikalija dodaje se u umetke (npr. Millicell-HA) 400 μl otopine natrijevog fluoresceina u koncentraciji od 0,1 mg/ml (0,01 % (w/v) u HBSS-u s kalcijem [u koncentraciji od 1,0 do 1,8 mM] bez fenolnog crvenila. Kulture se drže 30 minuta na sobnoj temperaturi. Na kraju inkubacije s fluoresceinom umetci se pažljivo vade iz jažica. Svaki se filter vizualno pregledava te se bilježi svako eventualno oštećenje nastalo tijekom rukovanja. Količina fluoresceina propuštenog kroz monosloj i umetak mjeri se u otopini koja preostane u jažicama nakon uklanjanja umetaka. Mjerenja se provode spektrofluorimetrom na valnim duljinama ekscitacije i emisije od 485 nm odnosno 530 nm. Osjetljivost spektrofluorimetra trebalo bi podesiti tako da se dobije najveća numerička razlika između maksimalnog propuštanja fluoresceina (umetak bez stanica) i minimalnog propuštanja fluoresceina (umetak s konfluentnim monoslojem tretiranim NK-om). Zbog razlika u upotrebljavanim spektrofluorimetrima predlaže se da osjetljivost bude takva da se u kontroli s maksimalnim propuštanjem fluoresceina dobije intenzitet fluorescencije > 4 000. Vrijednost maksimalnog propuštanja fluoresceina ne bi smjela biti veća od 9 999. Intenzitet fluorescencije koji odgovara maksimalnom propuštanju fluoresceina trebao bi biti unutar linearnog mjernog područja upotrijebljenog spektrofluorimetra. Tumačenje rezultata i model predviđanja Količina propuštenog fluoresceina razmjerna je kemijski uzrokovanom oštećenju čvrstih međustaničnih spojeva. Postotak propuštanja fluoresceina za svaku ispitanu koncentraciju kemikalije izračunava se iz vrijednosti propuštanja fluoresceina dobivenih za ispitivanu kemikaliju u odnosu na vrijednosti propuštanja fluoresceina u NK-u (očitani rezultat za konfluentni monosloj stanica tretiran NK-om) i kontrolu s maksimalnim propuštanjem fluoresceina (očitana količina fluoresceina propuštenog kroz umetak bez stanica). Srednja vrijednost intenziteta fluorescencije pri maksimalnom propuštanju = x Srednja vrijednost intenziteta fluorescencije pri propuštanju od 0 % (NK) = y Srednja vrijednost propuštanja od 100 % dobije se tako da se od srednje vrijednosti pri maksimalnom propuštanju oduzme srednja vrijednost pri propuštanju od 0 %, tj. x – y = z Za svaku fiksnu dozu postotak propuštanja izračunava se tako da se propuštanje od 0 % oduzme od srednje vrijednosti intenziteta fluorescencije očitanih za tri ponovljena uzorka (m) te tako dobivena vrijednost podijeli s vrijednošću propuštanja od 100 %, tj. % FL = [(m-y) / z] x 100 %, pri čemu je:
Trebalo bi primijeniti sljedeću jednadžbu za izračun kemijske koncentracije koja uzrokuje propuštanje fluoresceina od 20 %: FLD = [(A-B) / (C-B)] x (MC –MB) + MB pri čemu je:
U nastavku je navedena granična vrijednost za FL20 na temelju koje se predviđa da su kemikalije nagrizajuće / jako nadražujuće za oči:
Ispitna metoda FL preporučuje se jedino za identifikaciju tvari nagrizajućih i jako nadražujućih za oči koje su topljive u vodi (kategorija 1. sustava UN GHS, kategorija 1. prema Uredbi EU-a o CLP-u, kategorija I. US EPA-e) (vidjeti stavke 1. i 10.). Da bi se kemikalija koja je topljiva u vodi (tvar ili smjesa) (3., 6., 7.) mogla identificirati kao tvar koja ‚izaziva tešku ozljedu oka’ (kategorija 1. sustava UN GHS / prema Uredbi EU-a o CLP-u) ili kao tvar koja ‚nadražuje ili jako nagriza oči’ (kategorija I. US EPA-e), ispitivana kemikalija trebala bi dovesti do vrijednosti FL20 ≤ 100 mg/ml. Prihvaćanje rezultata Srednja vrijednost maksimalnog propuštanja fluoresceina (x) trebala bi biti veća od 4 000 (vidjeti stavak 31.), srednja vrijednost propuštanja od 0 % (y) trebala bi iznositi 300 ili manje, a srednja vrijednost propuštanja od 100 % (z) trebala bi biti između 3 700 i 6 000. Ispitivanje se smatra prihvatljivim ako je pozitivna kontrola izazvala oštećenje 20 % do 40 % sloja stanica (određeno kao postotak propuštanja fluoresceina). PODACI I IZVJEŠĆIVANJE Podaci Za svaki analitički ciklus, podatke o jažicama koje odgovaraju pojedinačnim ponovljenim uzorcima (npr. vrijednosti intenziteta fluorescencije te podaci o izračunatom postotku propuštanja fluoresceina za svaku ispitivanu kemikaliju, uključujući njezino razvrstavanje) trebalo bi predstaviti u obliku tablice. Osim toga, trebalo bi prijaviti i srednje vrijednosti ± standardno odstupanje za mjerenja koja odgovaraju pojedinačnim ponovljenim uzorcima u svakom ciklusu. Izvješće o ispitivanju Izvješće o ispitivanju trebalo bi sadržavati sljedeće informacije:
LITERATURA
Dodatak 1. PRIKAZ UZGOJA STANICA MDCK NA MEMBRANI UMETKA ZA ISPITNU METODU FL Konfluentni sloj stanica MDCK uzgaja se na polupropusnoj membrani umetka. Umetci se postavljaju u jažice na pločicama s 24 jažice. 
Slika je uzeta iz: Wilkinson, P.J. (2006), Development of an in vitro model to investigate repeat ocular exposure, Ph.D. Thesis, University of Nottingham, UK. Dodatak 2. DEFINICIJE Točnost : stupanj podudarnosti između rezultata ispitne metode i prihvaćenih referentnih vrijednosti. To je mjerilo učinkovitosti ispitne metode i jedan od aspekata ‚relevantnosti’. Pojam je često međusobno zamjenjiv s pojmom ‚podudarnost’ u smislu udjela točnih ishoda ispitne metode. Kemikalija : tvar ili smjesa. Kategorija I. EPA-e : kemikalije koje izazivaju nagrizanje (ireverzibilna oštećenja očnog tkiva) ili komplikacije rožnice ili nadraženost koji traju dulje od 21 dana (2.). Uredba EU-a o CLP-u (Uredba (EZ) br. 1272/2008 o razvrstavanju, označivanju i pakiranju tvari i smjesa): njome se u Europskoj uniji (EU) provodi sustav UN GHS za razvrstavanje kemikalija (tvari i smjesa). Stopa lažno negativnih rezultata : udio svih pozitivnih kemikalija koje su ispitnom metodom pogrešno identificirane kao negativne. Jedan je od pokazatelja uspješnosti ispitne metode. Stopa lažno pozitivnih rezultata : udio svih negativnih kemikalija koje su ispitnom metodom pogrešno identificirane kao pozitivne. Jedan je od pokazatelja uspješnosti ispitne metode. FL20 : može se procijeniti određivanjem koncentracije pri kojoj ispitana kemikalija uzrokuje da se 20 % fluoresceina propusti kroz sloj stanica. Propuštanje fluoresceina : količina fluoresceina koja prođe kroz sloj stanica, izmjerena spektrofluorometrijski. GHS (Globalno usklađeni sustav Ujedinjenih naroda (UN) za razvrstavanje i označivanje kemikalija) : sustav za razvrstavanje kemikalija (tvari i smjesa) prema standardiziranim vrstama i stupnjevima fizičkih opasnosti i opasnosti za zdravlje i okoliš, kojim su obuhvaćena odgovarajuća komunikacijska sredstva kao što su piktogrami, oznake opasnosti, oznake upozorenja, oznake obavijesti i sigurnosno-tehnički listovi, kojima se prenose informacije o njihovim štetnim učincima u cilju zaštite ljudi (uključujući poslodavce, radnike, prijevoznike, potrošače i interventno osoblje) i okoliša. Kategorija 1. sustava GHS : oštećenje očnog tkiva ili ozbiljno fizičko pogoršanje vida izazvano primjenom ispitivane kemikalije na prednju površinu oka, koje nije u potpunosti reverzibilno unutar 21 dana od primjene. Opasnost : intrinzično svojstvo nekog agensa ili stanje koji imaju potencijal da uzrokuju štetne učinke kada su organizam, sustav ili (sub)populacija izloženi tom agensu. Smjesa : u kontekstu sustava UN GHS smjesa ili otopina koja se sastoji od dviju ili više tvari koje u njoj ne reagiraju. Negativna kontrola : netretiran ponovljeni uzorak koji sadržava sve komponente ispitnog sustava. Taj se uzorak obrađuje s uzorcima tretiranima ispitivanom kemikalijom i drugim kontrolnim uzorcima kako bi se utvrdilo je li otapalo u interakciji s ispitnim sustavom. Nerazvrstana : kemikalija koja nije razvrstana kao tvar nagrizajuća za oči u kategoriju 1., 2.A ili 2.B sustava UN GHS, kategoriju 1. ili 2. prema Uredbi EU-a o CLP-u ili kategoriju I., II. ili III. US EPA-e. Tvar nagrizajuća za oči : (a) kemikalija koja uzrokuje ireverzibilno oštećenje očnog tkiva; (b) kemikalija koja je razvrstana kao tvar nadražujuća za oči u kategoriju 1. sustava UN GHS, kategoriju 1. prema Uredbi EU-a o CLP-u ili kategoriju I. US EPA-e. Tvar nadražujuća za oči : (a) kemikalija koja nakon primjene na prednjoj površini oka dovodi do reverzibilne promjene u oku; (b) kemikalija koja je razvrstana kao tvar nadražujuća za oči u kategoriju 2.A ili 2.B sustava UN GHS, kategoriju 2. prema Uredbi EU-a o CLP-u ili kategoriju II. ili III. US EPA-e. Tvar jako nadražujuća za oči : (a) kemikalija koja nakon primjene na prednjoj površini oka uzrokuje oštećenje očnog tkiva koje nije reverzibilno unutar 21 dana od primjene ili uzrokuje ozbiljno fizičko pogoršanje vida; (b) kemikalija koja je razvrstana kao tvar nadražujuća za oči u kategoriju 1. sustava UN GHS, kategoriju 1. prema Uredbi EU-a o CLP-u ili kategoriju I. US EPA-e. Pozitivna kontrola : ponovljeni uzorak koji sadržava sve komponente ispitnog sustava i tretiran je kemikalijom za koju je poznato da izaziva pozitivan odgovor. Kako bi se osigurala mogućnost procjene varijabilnosti odgovora pozitivne kontrole tijekom vremena, odgovor ne bi smio biti presnažan. Kemikalije za dokazivanje tehničke osposobljenosti : skupina kemikalija koje se nalaze na popisu referentnih kemikalija i koje laboratorij koji još nikada nije primijenio validiranu referentnu metodu može upotrijebiti kako bi dokazao tehničku osposobljenost za provođenje te metode. Relevantnost : opis odnosa između ispitivanja i istraživanog učinka te je li ispitivanje prikladno i korisno za određenu svrhu. Pokazuje u kojoj se mjeri ispitivanjem točno mjeri ili predviđa istraživani biološki učinak. Relevantnost uključuje i razmatranje o točnosti (sukladnosti) ispitne metode (8.). Pouzdanost : pokazuje u kojoj se mjeri ispitna metoda može obnovljivo primijeniti unutar jednog laboratorija i između više laboratorija tijekom vremena uz primjenu istog protokola. Ocjenjuje se izračunavanjem obnovljivosti unutar jednog laboratorija i između više njih te ponovljivosti unutar jednog laboratorija. Zamjenski test : test koji zamjenjuje rutinsko i prihvaćeno ispitivanje za određivanje opasnosti i/ili procjenu rizika, za koji je utvrđeno da osigurava istovjetnu ili bolju zaštitu zdravlja ljudi, zdravlja životinja ili okoliša u odnosu na prihvaćeno ispitivanje u svim mogućim okolnostima ispitivanja i za sve kemikalije. Osjetljivost : udio svih pozitivnih/aktivnih kemikalija koje su pravilno razvrstane primjenom ispitivanja. To je mjera točnosti ispitne metode koja daje kategorijske rezultate i važan je čimbenik za ocjenu relevantnosti ispitne metode (8.). Teška ozljeda oka : oštećenje očnog tkiva ili ozbiljno fizičko pogoršanje vida izazvano primjenom ispitivane kemikalije na prednju površinu oka, koje nije u potpunosti reverzibilno unutar 21 dana od primjene. Kontrola s otapalom/nosačem : netretirani uzorak koji sadržava sve komponente ispitnog sustava, uključujući otapalo ili nosač koji se obrađuje s uzorcima tretiranima ispitivanom kemikalijom i drugim kontrolnim uzorcima kako bi se utvrdila polazna reakcija za uzorke koji se tretiraju ispitivanom kemikalijom otopljenom u istom otapalu ili nosaču. Kada se ispituje s istodobnom negativnom kontrolom, taj uzorak isto tako pokazuje jesu li otapalo ili nosač u interakciji s ispitnim sustavom. Specifičnost : udio svih negativnih/neaktivnih kemikalija koje su pravilno razvrstane primjenom testa. To je mjera točnosti ispitne metode koja daje kategorijske rezultate i važan je čimbenik za ocjenu relevantnosti ispitne metode. Tvar : u kontekstu sustava UN GHS znači kemijski element i njegovi spojevi u prirodnom stanju ili dobiveni proizvodnim postupkom, uključujući i dodatke (aditive) koji su nužni za održavanje stabilnosti proizvoda te nečistoće koje proizlaze iz primijenjenog postupka, ali isključujući otapala koja se mogu izdvojiti bez utjecaja na stabilnost tvari ili promjene njezina sastava. Ispitivana kemikalija : sve tvari ili smjese koje se ispituju ovom ispitnom metodom. Strategija višerazinskog ispitivanja : strategija stupnjevitog ispitivanja u kojoj se sve postojeće informacije o ispitivanoj kemikaliji preispituju točno utvrđenim redoslijedom, pri čemu se prije prelaska na sljedeću razinu na svakoj razini primjenjuje postupak ocjenjivanja snage dokaza kako bi se odredilo je li na raspolaganju dovoljno informacija za donošenje odluke o razvrstavanju tvari s obzirom na opasnost. Ako se na temelju postojećih podataka ispitivanoj kemikaliji može pripisati potencijal nadražujućeg djelovanja, daljnje ispitivanje nije potrebno. Ako se na temelju postojećih informacija ne može odrediti potencijal ispitivane kemikalije za nadražujuće djelovanje, provodi se postupak stupnjevitog sekvencijskog ispitivanja na životinjama sve dok se nedvosmisleno ne utvrdi razvrstavanje. Validirana ispitna metoda : ispitna metoda za koju su provedena validacijska istraživanja za utvrđivanje relevantnosti (uključujući točnost) i pouzdanosti za specifičnu namjenu. Važno je napomenuti da validirana ispitna metoda možda neće biti u dovoljnoj mjeri uspješna s obzirom na točnost i pouzdanost da bi je se moglo smatrati prihvatljivom za predloženu namjenu (8.). Ocjenjivanje snage dokaza : proces razmatranja prednosti i nedostataka različitih informacija u donošenju i dokazivanju zaključka o potencijalu opasnosti kemikalije. Dodatak 3. KEMIKALIJE ZA DOKAZIVANJE TEHNIČKE OSPOSOBLJENOSTI ZA ISPITNU METODU FL Prije rutinske primjene ove ispitne metode laboratoriji bi trebali dokazati svoju tehničku osposobljenost tako da za osam kemikalija preporučenih u tablici 1. točno identificiraju kategoriju nagrizajućeg djelovanja na oči. Te su kemikalije izabrane tako da predstavljaju niz reakcija na lokalno nadraživanje/nagrizanje očiju koje se temelje na rezultatima in vivo ispitivanja na oku kunića (TG 405, ispitna metoda B.5. (5.)) (tj. kategorije 1., 2.A, 2.B ili nisu razvrstane prema sustavu UN GHS). Međutim, uzimajući u obzir validiranu korisnost testa FL (samo za identifikaciju tvari s nagrizajućim / jako nadražujućim djelovanjem na oči), samo dva rezultata testa dobivena u svrhu razvrstavanja tvari (nagrizajuća / jako nadražujuća ili nije nagrizajuća / nije jako nadražujuća) omogućuju dokazivanje tehničke osposobljenosti. Drugi kriteriji za odabir bili su da kemikalije budu komercijalno dostupne, da su dostupni visokokvalitetni referentni podaci dobiveni in vivo te da postoje visokokvalitetni podaci dobiveni s pomoću ispitne metode FL. Zbog toga su kemikalije za dokazivanje tehničke osposobljenosti izabrane s popisa navedenog u dokumentu ‚Fluorescein Leakage Assay Background Review Document as an Alternative Method for Eye Irritation Testing’ (8.), koji je upotrijebljen za retrospektivnu validaciju ispitne metode FL. Tablica 1. Preporučene kemikalije za dokazivanje tehničke osposobljenosti za izvođenje testa FL
B.62. In vivo alkalni komet-test na stanicama sisavaca UVOD Ova ispitna metoda odgovara smjernici OECD-a za ispitivanje (TG) 489 (2016.). Alkalni komet-test in vivo (single cell gel electrophoresis – elektroforeza pojedinačnih stanica u agaroznom gelu; dalje u tekstu: komet-test) upotrebljava se za otkrivanje lomova lanaca DNK u stanicama ili jezgrama izoliranima iz različitih tkiva životinja, obično glodavaca, koji su bili izloženi potencijalno genotoksičnom materijalu (materijalima). Različite stručne skupine pregledale su komet-test te objavile svoje preporuke (1., 2., 3., 4., 5., 6., 7., 8., 9., 10.). Ova je ispitna metoda dio niza ispitnih metoda u području genetske toksikologije. Sastavljen je dokument OECD-a u kojem se daju sažete informacije o ispitivanju u području genetske toksikologije te pregled novijih promjena tih smjernica za ispitivanje (1). Namjena je komet-testa identificiranje kemikalija koje uzrokuju oštećenje DNK. U alkalnim uvjetima (pH > 13) komet-testom mogu se otkriti jednolančani i dvolančani lomovi nastali, primjerice, zbog izravnih interakcija s DNK, zbog alkalno labilnih mjesta ili prolaznih lomova lanaca DNK nastalih tijekom ekscizijskog popravka. Ti se lomovi lanca mogu popraviti tako da nemaju trajnog učinka, mogu biti smrtonosni za stanicu ili se mogu fiksirati u mutaciju dovodeći do trajne održive promjene. Mogu isto tako dovesti i do kromosomskih oštećenja koja su također povezana s mnogim bolestima u ljudi, uključujući rakom. Formalno validacijsko ispitivanje komet-testa in vivo na glodavcima provedeno je u razdoblju od 2006. do 2012. i njime je koordinirao Japanski centar za validaciju alternativnih metoda (JaCVAM) u suradnji s Europskim centrom za validaciju alternativnih metoda (ECVAM), Međuagencijskim koordinacijskim odborom za validaciju alternativnih metoda (ICCVAM) te NTP-ovim Međuagencijskim centrom za evaluaciju alternativnih toksikoloških metoda (NICEATM) (12.). Ovom su ispitnom metodom obuhvaćeni preporučena primjena i ograničenja komet-testa i ona se temelji na konačnom protokolu (12.) upotrijebljenom u validacijskom ispitivanju te na dodatnim relevantnim objavljenim i neobjavljenim podacima (vlasnički podaci laboratorija). Definicije ključnih pojmova nalaze se u Dodatku 1. Napominje se da se za ovaj test može upotrijebiti niz različitih platformi (mikroskopska predmetna stakalca, stakalca za gel, pločice s 96 jažica itd.). Zbog praktičnih razloga u nastavku ovog dokumenta upotrebljava se izraz ‚predmetno stakalce’, ali on obuhvaća i sve ostale platforme. POČETNA RAZMATRANJA I OGRANIČENJA Komet-test je metoda mjerenja lomova lanaca DNK u eukariotskim stanicama. Pojedinačne stanice/jezgre uklopljene u agarozu na predmetnom stakalcu liziraju se s pomoću deterdženta i visoke koncentracije soli. Liziranje dovodi do pucanja stanične i jezgrine membrane te omogućuje otpuštanje petlji zavijene DNK koje se obično nazivaju nukleoidi i fragmenti DNK. Elektroforeza pri visokoj pH-vrijednosti dovodi do nastanka struktura sličnih kometima, koje se nakon bojenja odgovarajućim fluorescentnim bojama mogu promatrati s pomoću fluorescentnog mikroskopa; fragmeni DNK migriraju iz ‚glave’ kometa u njegov ‚rep’, ovisno o njihovoj veličini, a intenzitet repa kometa u odnosu na ukupni intenzitet (glava plus rep) odražava količinu lomova DNK (13., 14., 15.). Alkalni komet-test in vivo posebno je prikladan za ocjenjivanje genotoksične opasnosti jer reakcije u testu ovise o svojstvima ADME (apsorpcija, distribucija, metabolizam i izlučivanje) in vivo kao i o procesima popravka DNK. Ona se mogu razlikovati među vrstama, tkivima i vrstama oštećenja DNK. Kako bi se ispunili zahtjevi u pogledu dobrobiti životinja, posebno oni koji se odnose na smanjenje upotrebe životinja (načelo 3R – replacement, reduction, refinement – to jest zamjena, smanjenje broja, poboljšanje pokusa), ovaj se test može uklopiti i u druga toksikološka istraživanja, npr. istraživanja toksičnosti uz primjenu ponovljenih doza (10., 16., 17.), ili se krajnje točke mogu kombinirati s drugim krajnjim točkama genotoksičnosti, kao što je in vivo mikronukleus-test na eritrocitima sisavaca (18., 19., 20.). Komet-test najčešće se provodi na glodavcima, iako je bio primijenjen i na drugim sisavcima i vrstama koje nisu sisavci. Upotrebu vrsta koje nisu glodavci trebalo bi znanstveno i etički opravdati u svakom pojedinačnom slučaju te se snažno preporučuje da se komet-test na vrstama koje nisu glodavci provodi samo u okviru nekog drugog istraživanja toksičnosti, a ne kao samostalan test. Način izlaganja i tkivo (tkiva) koji će se ispitivati trebalo bi izabrati na temelju svih dostupnih/postojećih spoznaja o ispitivanim kemikalijama, npr. planiranog/očekivanog načina izlaganja ljudi, metabolizma i distribucije, potencijalnih učinaka na mjestu kontakta, rizičnih strukturnih elemenata i drugih podataka o genotoksičnosti ili toksičnosti, te na temelju svrhe ispitivanja. Tako se, prema potrebi, genotoksični potencijal ispitivanih kemikalija može istražiti u ciljnom tkivu (tkivima) za karcinogene i/ili druge toksične učinke. Smatra se da je ovaj test koristan i za daljnja istraživanja genotoksičnosti otkrivene s pomoću sustava in vitro. Primjereno je provesti komet-test in vivo na određenom tkivu ako se može opravdano očekivati da će to tkivo biti izloženo na odgovarajući način. Test je najopsežnije validiran na somatskim tkivima mužjaka štakora u okviru međulaboratorijskih ispitivanja poput onog koji je proveo JaCVAM (12.) i u Rothfuss et al., 2010. (10.). U međunarodnom validacijskom ispitivanju koje je proveo JaCVAM upotrijebljeni su jetra i želudac. Jetra zbog toga jer je najaktivniji organ u metabolizmu kemikalija i jer je često ciljni organ za karcinogenost. Želudac zato jer je obično prvo mjesto kontakta s kemikalijama nakon unosa oralnim putem, iako bi i druge dijelove gastrointestinalnog trakta, poput duodenuma i jejunuma, trebalo isto tako smatrati mjestima kontakta koja su, kad je riječ o ljudima, možda bitnija od žljezdanog želuca štakora. Potrebno je pobrinuti se da takva tkiva ne budu izložena previsokim koncentracijama ispitivane kemikalije (21.). Ova se tehnika može u načelu primijeniti na svako tkivo iz kojeg se mogu dobiti suspenzije pojedinačnih stanica/jezgri koje je moguće analizirati. Vlasnički podaci nekoliko laboratorija pokazuju da se ona može uspješno primijeniti na nizu različitih tkiva te postoje brojne publikacije koje potvrđuju da se može primijeniti ne samo na jetru i želudac nego i na druge organe i tkiva, npr. jejunum (22.), bubrege (23., 24.), kožu (25., 26.), ili stanice iz mokraćnog mjehura (27., 28.), pluća i bronhoalveolarnog lavata (u slučaju ispitivanja kemikalija unesenih disanjem) (29., 30.); testovi su isto tako provedeni i na više organa istodobno (31., 32.). Iako će se možda željeti istražiti genotoksični učinci na zametne stanice, treba napomenuti da se standardni alkalni komet-test koji je opisan u ovoj ispitnoj metodi ne smatra primjerenim za mjerenje lomova lanaca DNK u zrelim zametnim stanicama. S obzirom na to da su u pregledu literature o primjeni komet-testa u istraživanju genotoksičnosti na zametnim stanicama zabilježene visoke i promjenjive pozadinske razine kod oštećenja DNK (33.), smatra se potrebnim izmijeniti protokol te provesti poboljšane standardizacijske i validacijske studije prije nego što se u ispitnu metodu uključi komet-test na zrelim zametnim stanicama (npr. spermijima). Osim toga, preporučeni režim izlaganja koji je opisan u ovoj ispitnoj metodi nije optimalan pa bi stoga za smislenu analizu lomova lanaca DNK u zrelim spermijima bila potrebna dulja vremena izlaganja ili uzorkovanja. U literaturi su opisani genotoksični učinci izmjereni komet-testom u testikularnim stanicama u različitim fazama diferencijacije (34., 35.). Međutim, potrebno je napomenuti da spolne žlijezde sadržavaju mješavinu somatskih i zametnih stanica. Zbog toga pozitivni rezultati dobiveni za spolnu žlijezdu kao cjelinu (sjemenik) ne moraju nužno upućivati na oštećenje zametnih stanica; međutim, pokazuju da su ispitana kemikalija (ispitane kemikalije) i/ili njezini (njihovi) metaboliti došli u spolnu žlijezdu. U standardnim pokusnim uvjetima komet-testa ne mogu se pouzdano otkriti unakrsne veze. U određenim modificiranim pokusnim uvjetima mogla bi se otkriti unakrsna povezivanja DNK-DNK i DNK-protein te druge modifikacije baza poput oksidiranih baza (23., 36., 37., 38., 39.). Međutim, da bi se mogle na odgovarajući način utvrditi potrebne izmjene protokola, potreban je daljnji rad. Stoga, otkrivanje agensa odgovornih za stvaranje unakrsnih veza nije primarna svrha testa koji se ovdje opisuje. Ovaj test nije primjeren, čak ni uz izmjene, za otkrivanje aneugena. S obzirom na trenutačne spoznaje, još je nekoliko ograničenja (vidjeti Dodatak 3.) povezano s komet-testom in vivo. Očekuje se da će u budućnosti ova ispitna metoda biti preispitana i ako bude potrebno, izmijenjena na temelju stečenog iskustva. Prije nego što se ova ispitna metoda primijeni na smjesi radi dobivanja podataka za predviđenu regulatornu svrhu, potrebno je razmotriti mogu li se njome dobiti primjereni rezultati za tu svrhu te ako mogu, zašto. Takva razmatranja nisu potrebna ako postoji regulatorni zahtjev za ispitivanje smjese. NAČELO METODE Životinje se na odgovarajući način izlažu ispitivanoj kemikaliji. Detaljan opis doziranja i uzorkovanja naveden je u stavcima od 36. do 40. U izabrano vrijeme (vremena) uzorkovanja tkiva koja se želi analizirati diseciraju se te se pripremaju suspenzije pojedinačnih stanica/jezgri (može se izvesti in situ perfuzija ako se smatra korisnom, npr. za jetru), koje se potom uklapaju u agarozni gel kako bi se imobilizirale na predmetnom stakalcu. Stanice/jezgre obrađuju se puferom za lizu kako bi se uklonila stanična i/ili jezgrina membrana te se izlažu jakoj lužini, npr. pH ≥ 13 kako bi se omogućilo odmotavanje DNK i otpuštanje odmotanih petlji i fragmenata DNK. Potom se nuklearni DNK u agaru podvrgava elektroforezi. Normalne nefragmentirane molekule DNK ostaju na mjestu na kojemu se nuklearni DNK nalazio u agaru, a svi fragmenti DNK i odmotane petlje DNK kreću se prema anodi. Nakon elektroforeze DNK se vizualizira s pomoću odgovarajuće fluorescentne boje. Preparate bi trebalo analizirati s pomoću mikroskopa i automatskih ili poluautomatskih sustava za analizu slike. Stupanj migracije DNK tijekom elektroforeze i udaljenost migracije odražavaju količinu i veličinu fragmenata DNK. U komet-testu postoji nekoliko krajnjih točaka. Udio DNK u repu ( % DNK u repu ili % intenziteta repa) preporučeni je parametar za procjenu oštećenja DNK (12., 40., 41., 42.). Nakon što se analizira dostatan broj jezgri, dobiveni se podaci analiziraju odgovarajućim metodama kako bi se protumačili rezultati testa. Potrebno je napomenuti da provedena istraživanja upućuju na to da promjena pojedinih aspekata metodologije, uključujući pripremu uzoraka, uvjete elektroforeze, parametre vizualne analize (npr. intenzitet boje, intenzitet svjetlosti mikroskopske žarulje, upotreba filtera za mikroskop i dinamika kamere) te okolne uvjete (npr. pozadinsko osvjetljenje), može utjecati na migraciju DNK (43., 44., 45., 46.). PROVJERA OSPOSOBLJENOSTI LABORATORIJA Svaki bi laboratorij trebao utvrditi osposobljenost za izvođenje komet-testa dokazivanjem sposobnosti dobivanja dovoljno kvalitetnih suspenzija pojedinačnih stanica ili jezgri za svako ciljno tkivo ili tkiva svake upotrijebljene vrste. Kvaliteta preparata prvo se ocjenjuje prema postotku DNK u repu kometa za životinje tretirane nosačem, čije su vrijednosti unutar ponovljivog niskog raspona. Trenutačni podaci upućuju na to da skupinski srednji postotak DNK u repu kometa (na temelju srednje vrijednosti medijana – vidjeti stavak 57. za pojedinosti o ovim izrazima) u jetri štakora po mogućnosti ne bi trebao premašiti 6 %, što bi bilo u skladu s vrijednostima validacijskog ispitivanja koje je proveo JaCVAM (12.) te s drugim objavljenim i vlasničkim podacima. U ovom trenutku nema dovoljno podataka da bi se mogle dati preporuke o optimalnim ili prihvatljivim rasponima za druga tkiva. Time se ne isključuje mogućnost upotrebe drugih tkiva ako je takva upotreba opravdana. U izvješću o ispitivanju trebalo bi na odgovarajući način izvijestiti o provođenju komet-testa na tim tkivima pozivajući se na objavljenu literaturu ili vlasničke podatke. Prvo, da bi se dobio dovoljan dinamički raspon za otkrivanje pozitivnog učinka, poželjan je nizak raspon postotaka DNK u repu kometa u kontrolama. Drugo, svaki bi laboratorij trebao biti sposoban reproducirati očekivane odgovore za izravne mutagene i promutagene, s različitim načinima djelovanja kako su predloženi u tablici 1. (stavak 29.). Pozitivne tvari mogu se izabrati primjerice iz validacijskog ispitivanja koje je proveo JaCVAM (12.) ili drugih objavljenih podataka (vidjeti stavak 9.), prema potrebi, uz obrazloženje te dokazujući jasne pozitivne odgovore u tkivima od interesa. Trebalo bi dokazati i sposobnost otkrivanja slabih učinaka poznatih mutagena, npr. EMS-a u malim dozama, na primjer utvrđivanjem odnosa između doze i odgovora na temelju odgovarajućeg broja doza i razmaka među dozama. Početna nastojanja trebala bi biti usredotočena na utvrđivanje osposobljenosti s najčešće upotrebljavanim tkivima, npr. jetrom glodavaca, za koja je moguće izvršiti usporedbu s postojećim podacima i očekivanim rezultatima (12.). Istodobno bi se mogli prikupiti i podaci za druga tkiva, npr. želudac/duodenum/jejunum, krv itd. Laboratorij treba dokazati osposobljenost na svakom tkivu svake vrste koju planira ispitivati te treba dokazati da se u tom tkivu može dobiti prihvatljiv pozitivni odgovor s poznatim mutagenom (npr. EMS-om). Trebalo bi prikupiti podatke o kontroli s nosačem / negativnoj kontroli kako bi se dokazala obnovljivost negativnih odgovora te osiguralo da su tehnički aspekti testa ispravno kontrolirani ili ukazalo na potrebu za ponovnim utvrđivanjem raspona prijašnjih kontrola (vidjeti stavak 22.). Potrebno je napomenuti da iako se više tkiva može prikupiti pri obdukciji te obraditi za analizu kometa, laboratorij mora biti osposobljen za izdvajanje različitih tkiva od jedne životinje, čime se osigurava da ni jedna eventualna lezija DNK neće biti zanemarena te da analiza kometa neće biti ugrožena. Duljina vremenskog intervala između eutanazije i uzimanja tkiva za obradu može biti od ključne važnosti (vidjeti stavak 44.). Kod osposobljavanja za ovaj test mora se voditi računa o dobrobiti životinja te se stoga pri razvoju sposobnosti za različite aspekte testa mogu upotrijebiti tkiva životinja upotrijebljenih u drugim ispitivanjima. Nadalje, možda neće biti potrebno provesti cjelokupnu studiju tijekom faza uvođenja nove ispitne metode u laboratorij te se pri razvoju potrebnih vještina može upotrijebiti manji broj životinja ili ispitnih koncentracija. Podaci o prijašnjim kontrolama Tijekom istraživanja u svrhu dokazivanja tehničke osposobljenosti laboratorij bi trebao uspostaviti bazu s prijašnjim podacima kako bi mogao utvrditi raspone i distribucije vrijednosti pozitivnih i negativnih kontrola za odgovarajuća tkiva i vrste. Preporuke o tome kako uspostaviti i upotrebljavati prijašnje podatke (tj. kriteriji prema kojima se podaci uključuju u bazu s prijašnjim podacima te isključuju iz nje, kao i kriteriji prihvatljivosti za određeni pokus) mogu se pronaći u literaturi (47.). Različita tkiva i različite vrste, kao i različiti nosači i putovi primjene, mogu u negativnim kontrolama dati različite vrijednosti postotaka DNK u repu. Stoga je važno utvrditi raspone vrijednosti negativnih kontrola za svako tkivo i vrstu. Laboratoriji bi trebali primjenjivati metode kontrole kvalitete, kao što su kontrolni dijagrami (npr. C-dijagrami (C-charts) ili X-stupčasti dijagrami (X-bar charts) (48.)), kako bi utvrdili varijabilnost svojih podataka te pokazali da je u njihovu laboratoriju metodologija ‚pod kontrolom’. Za otkrivanje slabih učinaka (vidjeti stavak 17.) možda će isto tako biti potrebno optimizirati odabir odgovarajućih tvari koje se upotrebljavaju za pozitivnu kontrolu, raspone doza i uvjete pokusa (npr. uvjete elektroforeze). Svaku izmjenu pokusnog protokola trebalo bi razmotriti s obzirom na to je li u skladu s postojećim bazama podataka laboratorija o prijašnjim kontrolama. Svaka veća nesukladnost trebala bi dovesti do uspostave nove baze podataka o prijašnjim kontrolama. OPIS METODE Preparati Odabir životinjske vrste Obično se upotrebljavaju laboratorijske subpopulacije zdravih, mladih odraslih glodavaca (starih od 6 do 10 tjedana na početku tretiranja, iako su prihvatljive i nešto starije životinje). Odabir vrste glodavca trebao bi se temeljiti na: i. vrstama upotrijebljenima u drugim studijama toksičnosti (kako bi se podaci mogli povezivati i kako bi se omogućile integrirane studije), ii. vrstama kod kojih su se razvili tumori u studiji karcinogenosti (kada se istražuje mehanizam karcinogeneze) ili iii. vrstama čiji je metabolizam najbliži metabolizmu ljudi, ako su poznate. Za ovaj se test obično koriste štakori. Međutim, mogu se upotrijebiti i druge vrste ako je to etički i znanstveno opravdano. Uvjeti smještaja i hranjenja životinja Ako je riječ o glodavcima, temperatura u prostoriji u kojoj se drže pokusne životinje u idealnom bi slučaju trebala biti 22 °C (± 3 °C). Relativna vlaga trebala bi u idealnom slučaju iznosi od 50 do 60 %., pri čemu bi trebala biti najmanje 30 %, a poželjno je da ne prijeđe 70 % osim tijekom čišćenja prostorije. Rasvjeta bi trebala biti umjetna uz izmjenu 12 sati svjetla i 12 sati mraka. Za hranjenje se može upotrebljavati konvencionalna laboratorijska hrana uz neograničenu količinu vode za piće. Na odabir hrane može utjecati to što se mora osigurati da se ispitivana kemikalija u hranu dobro umiješa kada se daje tim putem. Glodavce bi trebalo držati u manjim skupinama (obično ne više od pet jedinki) istog spola ako se ne očekuje agresivno ponašanje. Životinje se mogu držati u zasebnim kavezima samo ako je to znanstveno opravdano. Kad god je moguće, trebalo bi upotrijebiti pune podove jer rešetkasti podovi mogu uzrokovati teške ozljede (49.). Mora se osigurati odgovarajuće obogaćivanje okoliša. Priprema životinja Životinje se nasumično raspoređuju u kontrolne skupine i skupine koje će se tretirati. Životinje se pojedinačno označuju jedinstvenim oznakama te se prilagođavaju laboratorijskim uvjetima najmanje pet dana prije početka tretiranja. Za pojedinačno označivanje životinja mora se primijeniti metoda koja je najmanje invazivna. Primjerene su metode prstenovanje, stavljanje privjesnica, mikročipiranje i biometrijska identifikacija. Obrezivanje prstiju ili ušiju nije znanstveno opravdano u ovim testovima. Kaveze treba rasporediti na način da se učinci do kojih bi moglo doći zbog položaja kaveza svedu na minimum. Na početku studije variranje tjelesne mase životinja treba biti što manje i ne smije prelaziti ± 20 %. Priprema doza Prije no što se doza daje životinjama, krute ispitivane kemikalije trebalo bi otopiti ili suspendirati u odgovarajućim nosačima ili umiješati u hranu ili vodu za piće. Tekuće ispitivane kemikalije mogu se dozirati izravno ili razrijediti prije doziranja. U slučaju izloženosti udisanjem ispitivane kemikalije mogu se primijeniti u obliku plina, pare ili krutog/tekućeg aerosola, ovisno o njihovim fizikalno-kemijskim svojstvima (50., 51.). Ako prema podacima o stabilnosti skladištenje nije prihvatljivo i ako nisu utvrđeni prikladni uvjeti skladištenja, preparate ispitivane kemikalije trebalo bi upotrebljavati svježe. Uvjeti ispitivanja Nosač Pri visinama doza koje se upotrebljavaju nosač ne smije imati toksične učinke i ne smije postojati sumnja da bi mogao kemijski reagirati s ispitivanim kemikalijama. Ako se upotrebljavaju nosači koji nisu dobro poznati, njihovo uključivanje u ispitivanje trebalo bi potkrijepiti referentnim podacima koji pokazuju njihovu kompatibilnost s pokusnim životinjama, putom primjene i krajnjom točkom koja se mjeri. Kad god je to moguće, preporučuje se najprije razmotriti mogućnost primjene vodenog otapala/nosača. Treba napomenuti da neki nosači (posebno viskozni nosači) mogu izazvati upalu i povećati pozadinske razine lomova lanaca DNK na mjestu kontakta, posebno u slučaju višekratne primjene. Kontrole Pozitivne kontrole Za sada bi u svako ispitivanje trebalo uključiti skupinu od najmanje tri životinje jednog spola koje je moguće analizirati, ili svakog spola ako se oba spola koriste (vidjeti stavak 32.), koje se tretiraju s tvari koja se upotrebljava za pozitivnu kontrolu. U budućnosti će možda biti moguće dokazati da je tehnička osposobljenost takva da omogućuje smanjenje broja pozitivnih kontrola. Ako se primjenjuje višekratno uzorkovanje (npr. u slučaju protokola koji obuhvaća jednokratnu primjenu), pozitivne je kontrole potrebno uključiti samo za jedno od tih uzorkovanja, pri čemu bi to trebalo izvesti prema uravnoteženom planu (vidjeti stavak 48.). Tvari koje se upotrebljavaju za istodobne pozitivne kontrole nije neophodno primjenjivati istim putem kao i ispitivanu kemikaliju, iako je važno upotrijebiti isti put primjene kada se mjere učinci na mjestu kontakta. Trebalo bi dokazati da tvari koje se upotrebljavaju za pozitivnu kontrolu izazivaju lomove lanaca DNK u svim tkivima na koje se odnosi ispitivana kemikalija te će EMS vjerojatno biti izabrana pozitivna kontrola jer je izazvao lomove lanaca DNK u svim tkivima koja su istraživana. Doze tvari koje se upotrebljavaju za pozitivnu kontrolu trebalo bi odabrati tako da proizvode umjerene učinke kojima se kritički procjenjuju rezultati i osjetljivost analize te bi se mogle temeljiti na krivulji doza – odgovor koju je laboratorij utvrdio tijekom dokazivanja tehničke osposobljenosti. Postotak DNK u repu kometa kod životinja u istodobnim pozitivnim kontrolama trebao bi biti u skladu s rasponom koji je laboratorij prethodno utvrdio za svako pojedino tkivo i vrijeme uzorkovanja za predmetnu vrstu (vidjeti stavak 16.). Primjeri tvari koje se upotrebljavaju za pozitivnu kontrolu i nekih njihovih ciljnih tkiva (u glodavaca) navedeni su u tablici 1. Mogu se odabrati i tvari koje nisu navedene u tablici 1. ako je to znanstveno opravdano. Tablica 1.: Primjeri tvari koje se upotrebljavaju za pozitivnu kontrolu i nekih njihovih ciljnih tkiva Tvari i CAS br. Etil metansulfonat (CAS br. 62-50-0) za sva tkiva Etil nitrozoureja (CAS br. 759-73-9) za jetru i želudac, duodenum ili jejunum Metil metansulfonat (CAS br. 66-27-3) za jetru, želudac, duodenum ili jejunum, stanice plućnog i bronhoalveolarnog lavata, bubrege, mjehur, pluća, sjemenike i koštanu srž/krv N-metil-N′-nitro-N-nitrozogvanidin(CAS br. 70-25-7) za želudac, duodenum ili jejunum 1,2-dimetilhidrazin 2HCl (CAS br. 306-37-6) za jetru i crijeva N-metil-N-nitrozoureja (CAS br. 684-93-5) za jetru, koštanu srž, krv, bubrege, želudac, jejunum i mozak. Negativne kontrole U svaki bi test za svako vrijeme uzorkovanja i svako tkivo trebalo uključiti skupinu životinja za negativnu kontrolu, kojima se daje samo nosač, a inače se tretiraju na jednak način kao i skupine koje se izlažu ispitivanoj kemikaliji. Postotak DNK u repu kometa kod životinja u negativnim kontrolama trebao bi biti unutar referentnog raspona koji je laboratorij prethodno utvrdio za svako pojedino tkivo i vrijeme uzorkovanja za predmetnu vrstu (vidjeti stavak 16.). U nedostatku prijašnjih ili objavljenih podataka o kontrolama kojima se dokazuje da odabrani nosač, broj primjena ili put primjene ne izazivaju štetne i genotoksične učinke trebalo bi prije izvođenja potpune studije provesti preliminarna istraživanja kako bi se utvrdila prihvatljivost kontrole s nosačem. POSTUPAK Broj i spol životinja Iako postoji malo podataka o ženkama na temelju kojih bi se mogle izvršiti usporedbe među spolovima u vezi s komet-testom, u drugim ispitivanjima genotoksičnosti in vivo dobiveni su općenito slični odgovori kod mužjaka i ženki te bi se stoga većina ispitivanja mogla provesti na životinjama bilo kojeg spola. Podaci koji ukazuju na značajne razlike između mužjaka i ženki (npr. razlike u sustavnoj toksičnosti, metabolizmu, bioraspoloživosti itd., uključujući podatke iz studija za određivanje raspona) potiču upotrebu obaju spolova. U tom slučaju može biti primjereno provesti istraživanje na oba spola, npr. u okviru istraživanja toksičnosti uz primjenu ponovljenih doza. Ako se upotrebljavaju oba spola, bilo bi primjereno primijeniti faktorski model. U Dodatku 2. navedeni su detalji o načinu analize podataka primjenom tog modela. Na početku istraživanja (i tijekom utvrđivanja tehničke osposobljenosti) skupine bi trebale biti takve da u svakoj od njih ima najmanje pet životinja jednog spola koje je moguće analizirati ili svakog spola ako se oba spola upotrebljavaju (manji broj u skupini koja služi za paralelnu pozitivnu kontrolu – vidjeti stavak 29.). U slučajevima kad izloženost ljudi nekoj kemikaliji može biti vezana uz spol, kao što je slučaj s nekim farmaceutskim sredstvima, ispitivanje bi trebalo obaviti na životinjama odgovarajućeg spola. Što se tiče maksimalnog broja potrebnih životinja, u pravilu bi za studiju koja se provodi u skladu s parametrima utvrđenima u stavku 33. s tri skupine koje se tretiraju te istodobnim negativnim i pozitivnim kontrolama (svaka skupina sastavljena od pet životinja istog spola) trebalo od 25 do 35 životinja. PLAN TRETIRANJA Životinje bi trebale dobiti dnevne doze u razdoblju od dva ili više dana (tj. dvije ili više doza u vremenskim razmacima od oko 24 sata), a uzorke bi trebalo prikupiti jednom od 2 do 6 sati (ili u Tmax) nakon posljednjeg tretiranja (12.). Prihvatljivi su uzorci uzeti nakon primjene produženog režima doziranja (npr. dnevne doze tijekom 28 dana). Dokazano je da se komet-test može uspješno kombinirati s mikronukleus-testom na eritrocitima (10., 19.). Međutim, potrebno je pomno razmotriti logistiku potrebnu za uzorkovanje tkiva za komet-test poštujući istodobno i zahtjeve u pogledu uzorkovanja tkiva za druge vrste toksikoloških procjena. Izdvajanje 24 sata nakon posljednje doze, koje je tipično za opće studije toksičnosti, u većini slučajeva nije primjereno (vidjeti stavak 40. o vremenu uzorkovanja). Opravdanost primjene drugih rasporeda tretiranja i uzorkovanja treba dokazati (vidjeti Dodatak 3.). Moglo bi se, na primjer, primijeniti jednokratno tretiranje s višekratnim uzorkovanjem, ali trebalo bi napomenuti da istraživanje s jednokratnom primjenom zahtijeva veći broj životinja jer je potreban veći broj uzimanja uzoraka; ovo rješenje ponekad može biti poželjno, npr. kada ispitivana kemikalija izaziva pretjeranu toksičnost nakon ponovljenih primjena. Bez obzira na način na koji se ispitivanje provodi, prihvatljivo je ako ispitivana kemikalija daje pozitivan odgovor ili u slučaju negativnih rezultata ako je dokazano postojanje izravnih ili neizravnih dokaza o izloženosti ciljnog tkiva (ciljnih tkiva) ili toksičnosti za to tkivo (ta tkiva) ili ako je dosegnuta granična doza (vidjeti stavak 36.). Isto se tako ispitivane kemikalije mogu primijeniti kao podijeljena doza, odnosno doza koja se primjenjuje u dva puta tijekom istog dana u razmaku od najviše dva do tri sata, kako bi se olakšala primjena velike količine materijala. U tim bi okolnostima vrijeme uzorkovanja trebalo odrediti na temelju vremena davanja posljednje doze (vidjeti stavak 40.). Visine doza Ako se provodi preliminarno istraživanje za određivanje raspona doza jer nisu dostupni prikladni podaci iz drugih relevantnih istraživanja koji bi pomogli u odabiru doza, trebalo bi ga provesti u istom laboratoriju primjenom iste vrste, subpopulacije, spola i režima tretiranja koji će se primijeniti u glavnom istraživanju u skladu s važećim načelima provođenja istraživanja za određivanje raspona doza. Tim bi se istraživanjem trebala odrediti najviša prihvatljiva doza (MTD – maximum tolerated dose), koja se definira kao doza koja izaziva blage toksične učinke povezane s trajanjem istraživanja (na primjer, jasne kliničke znakove poput neuobičajenog ponašanja ili reakcija, manji gubitak tjelesne mase ili citotoksičnosti u ciljnom tkivu), ali ne izaziva smrt ili znakove boli, patnje ili stresa zbog kojih bi životinju trebalo eutanazirati. Za netoksičnu ispitivanu kemikaliju koja se daje u razdoblju od 14 ili više dana najviša (granična) doza je 1 000 mg/kg tjelesne mase/dan. Za razdoblja primjene kraća od 14 dana najviša (granična) doza je 2 000 mg/kg tjelesne mase/dan. Za neke vrste ispitivanih kemikalija (npr. lijekove za ljude) koje su obuhvaćene posebnim propisima te granične vrijednosti mogu biti drukčije. Kemikalije koje pokazuju zasićenost toksikokinetičkih svojstava ili induciraju detoksifikacijske procese koji mogu dovesti do smanjene izloženosti nakon dugotrajne primjene mogu se izuzeti iz kriterija u pogledu određivanja doza i trebale bi se procjenjivati od slučaja do slučaja. Za akutne i subakutne verzije komet-testa, osim najviše doze (MTD, najveća moguća doza, maksimalna izloženost ili granična doza) za svako vrijeme uzorkovanja trebalo bi odabrati i dodatan niz sve nižih doza, najmanje dvije, s odgovarajućim razmakom između njihovih visina (koji će po mogućnosti biti manji od 10) kako bi se pokazali odgovori povezani s dozom. Međutim, upotrijebljene visine doza trebale bi po mogućnosti obuhvatiti i raspon od maksimalne do male ili nikakve toksičnosti. Ako se pri svim ispitanim visinama doza opaze toksični učinci na ciljnom tkivu, savjetuje se provesti dodatno istraživanje s netoksičnim dozama (vidjeti stavke 54. do 55.). Studije čija je svrha cjelovitije istražiti oblik krivulje doza – odgovor mogu zahtijevati jednu ili više dodatnih skupina doza. Primjena doza Pri planiranju analize u obzir bi trebalo uzeti očekivani način ljudske izloženosti. Stoga se, ako su opravdani, mogu izabrati putovi primjene poput unosa hranom, vodom za piće, lokalnom primjenom, potkožno, intravenozno, oralno (sondom), udisanjem, intratrahealno ili implantacijom. U svakom bi slučaju odabrani put trebao biti takav da se osigura odgovarajuća izloženost ciljnog tkiva (ciljnih tkiva). Intraperitonealno ubrizgavanje u pravilu se ne preporučuje jer nije tipičan relevantni put izloženosti ljudi te bi ga trebalo upotrebljavati jedino ako za to postoji posebno opravdanje (npr. za neke tvari koje se upotrebljavaju za pozitivnu kontrolu, u istraživačke svrhe ili za neke lijekove koji se daju intraperitonealno). Maksimalni volumen tekućine koji se odjednom može primijeniti sondom ili injekcijom ovisi o veličini pokusne životinje. Taj volumen ne smije biti veći od 1 ml/100 g tjelesne mase, osim kad se radi o vodenim otopinama koje dopuštaju primjenu volumena od 2 ml/100 g tjelesne mase. Opravdanost primjene većih volumena od navedenog (ako je dopuštena zakonodavstvom o dobrobiti životinja) treba dokazati. Kad god je moguće, različite visine doza trebalo bi postići prilagođavanjem koncentracije formulacije za doziranje kako bi se kod svih visina doze osigurao stalni volumen u odnosu na tjelesnu masu. Vrijeme uzorkovanja Vrijeme uzorkovanja kritična je varijabla jer ovisi o vremenu koje je potrebno da ispitivane kemikalije postignu maksimalnu koncentraciju u ciljnom tkivu te da dođe do indukcije lomova lanaca DNK, a mora se dogoditi prije nego što se ti lomovi uklone, poprave ili izazovu smrt stanice. Neke lezije koje dovode do lomova lanaca DNK koji se otkrivaju komet-testom mogu trajati vrlo kratko, barem za neke kemikalije ispitane in vitro (52., 53.). Stoga, ako se sumnja na takve prolazne lezije DNK, trebalo bi poduzeti mjere kako bi se ograničio njihov gubitak tako što se osigurava da se tkiva uzorkuju dovoljno rano, po mogućnosti prije zadanih rokova navedenih u nastavku. Optimalno vrijeme uzorkovanja može ovisiti o kemikaliji ili putu primjene, što za posljedicu ima, na primjer, brzo izlaganje tkiva intravenoznom primjenom ili inhalacijom. Shodno tome, vremena uzorkovanja trebalo bi odrediti na temelju kinetičkih podataka, ako su dostupni, (npr. vrijeme (Tmax) pri kojem se postiže vršna koncentracija u plazmi ili tkivu (Cmax) ili pri stabilnom stanju u slučaju višekratne primjene). U nedostatku kinetičkih podataka, odgovarajući kompromis za mjerenje genotoksičnosti jest uzorkovati od 2 do 6 sati nakon posljednjeg tretiranja u slučaju dvaju ili više tretiranja, ili od 2 do 6 i od 16 do 26 sati nakon jednokratne primjene, iako bi trebalo paziti da sve životinje budu obducirane u isto vrijeme nakon posljednje (ili jedine) doze. Odgovarajuće vrijeme uzorkovanja može se odabrati i na temelju informacija o izgledu toksičnih učinaka u ciljnim organima (ako su dostupne). Zapažanja Opća klinička opažanja zdravlja životinja trebalo bi provoditi i evidentirati najmanje jednom dnevno, po mogućnosti svaki dan u isto vrijeme, vodeći računa o razdoblju najvećeg intenziteta očekivanih učinaka nakon primjene doze (54.) Najmanje dva puta dnevno treba provjeravati ima li slučajeva pobolijevanja ili smrti životinja. Kod istraživanja duljeg trajanja sve bi životinje trebalo vagati barem jednom tjedno te na kraju razdoblja ispitivanja. Unos hrane trebalo bi mjeriti pri svakom obnavljanju hrane i najmanje jednom tjedno. Ako se ispitivana kemikalija daje s vodom za piće, pri svakoj promjeni vode i najmanje jednom tjedno trebalo bi mjeriti i unos vode. Životinje koje pokazuju nesmrtonosne pokazatelje prekomjerne toksičnosti trebale bi se eutanazirati prije dovršetka ispitnog razdoblja i u pravilu se ne upotrebljavaju za komet-test. Prikupljanje tkiva Budući da je indukciju lomova lanaca DNK (kometa) moguće proučavati u gotovo bilo kojem tkivu, razlozi za odabir tkiva koje je potrebno prikupiti trebali bi biti jasno definirani i temeljiti se na razlogu za provođenje istraživanja i svim postojećim podacima o ADME-u, genotoksičnosti, karcinogenosti ili drugim podacima o toksičnosti za kemikalije koje se istražuju. Važni čimbenici koje treba uzeti u obzir trebali bi uključivati put primjene (na temelju vjerojatnog puta (putova) izloženosti ljudi), predviđenu tkivnu distribuciju i apsorpciju, ulogu metabolizma i moguće mehanizme djelovanja ispitivanih kemikalija. Jetra je najčešće proučavano tkivo i za nju postoji najviše podataka. Stoga, u nedostatku osnovnih informacija te ako ne postoje razlozi za odabir nekog točno određenog tkiva, opravdano je uzorkovati jetru jer je ona primarno mjesto ksenobiotičkog metabolizma i često je u velikoj mjeri izložena kako izvornoj tvari (tvarima) tako i njezinu metabolitu (metabolitima). U nekim slučajevima može biti najrelevantnije ispitati mjesto izravnog dodira (na primjer, žljezdani želudac ili duodenum/jejunum ako je riječ o kemikalijama koje se daju oralnim putem, ili pluća ako je riječ o inhaliranim kemikalijama). Dodatna ili alternativna tkiva trebalo bi odabrati uzimajući u obzir konkretne razloge zbog kojih se ispitivanje provodi, ali može biti korisno ispitati više tkiva iste životinje pod uvjetom da je laboratorij dokazao da je osposobljen za rad s tim tkivima te da je u stanju obrađivati više tkiva u isto vrijeme. Priprema uzoraka Za postupke opisane u sljedećim stavcima (44. do 49.) važno je da sve otopine ili stabilne suspenzije budu upotrijebljene prije isteka njihove valjanosti ili da budu svježe pripremljene ako je potrebno. U sljedećim stavcima, isto tako, vremena potrebna za i. uzimanje svakog tkiva nakon obdukcije, ii. obradu svakog tkiva da bi se dobile suspenzije stanica/jezgri te iii. obradu suspenzije i pripremu predmetnih stakalaca smatraju se kritičnim varijablama (vidjeti definicije, Dodatak 1.) te bi prihvatljivo trajanje svake od tih etapa trebalo odrediti tijekom uspostavljanja metode i dokazivanja tehničke osposobljenosti. Životinje se eutanaziraju, u skladu s važećim zakonodavstvom o dobrobiti životinja i načelima 3R, u odgovarajućem trenutku (trenucima) nakon zadnje primjene ispitivane kemikalije. Odabrano se tkivo uklanja (odabrana se tkiva uklanjaju), disecira (diseciraju) te se dio uzima za komet-test, pri čemu bi se istodobno trebao uzeti isječak iz istog dijela tkiva te staviti u otopinu formaldehida ili odgovarajući fiksativ za eventualnu histopatološku analizu (vidjeti stavak 55.) u skladu sa standardnim metodama (12.). Tkivo za komet-test stavlja se u pufer za usitnjavanje, pomno se ispere hladnim puferom za usitnjavanje kako bi se uklonila rezidualna krv te se do obrade čuva u izrazito ledenom puferu za usitnjavanje. Može se isto tako izvesti in situ perfuzija, npr. za jetru, bubrege. Objavljen je veliki broj metoda izoliranja stanica/jezgri. One uključuju usitnjavanje tkiva poput jetre i bubrega, struganje mukozne površine u slučaju gastrointestinalnog trakta, homogenizaciju i enzimsku digestiju. U validacijskom ispitivanju koje je proveo JaCVAM proučavane su samo izolirane stanice pa je stoga u smislu uspostavljanja metode i upućivanja na podatke iz ispitivanja koje je proveo JaCVAM tijekom dokazivanja tehničke osposobljenosti poželjno upotrijebiti izolirane stanice. Međutim, pokazalo se da se rezultat testa ne razlikuje bitno bez obzira na to jesu li upotrijebljene izolirane stanice ili jezgre (8.). Isto tako, različite metode izoliranja stanica/jezgri (npr. homogenizacija, usitnjavanje, enzimska digestija i filtriranje kroz mrežicu) dale su usporedive rezultate (55.). Stoga se mogu upotrijebiti izolirane stanice ili izolirane jezgre. Laboratorij bi trebao temeljito ocijeniti i validirati metode izoliranja pojedinačnih stanica/jezgri koje su specifične za pojedino tkivo. Kao što je navedeno u stavku 40., neke lezije koje dovode do lomova lanaca DNK koji se otkrivaju komet-testom mogu trajati vrlo kratko (52., 53.). Stoga, neovisno o tome koja se metoda upotrebljava za pripremu suspenzija pojedinačnih stanica/jezgri, važno je tkiva obraditi što je prije moguće nakon eutanazije životinja te ih smjestiti u uvjete kojima se smanjuje nestanak lezija (npr. držati tkiva na niskoj temperaturi). Sve dok ne budu spremne za upotrebu, suspenzije stanica trebalo bi držati na vrlo niskoj temperaturi kako bi se mogle dokazati minimalne varijacije među uzorcima i odgovarajući odgovori kod pozitivnih i negativnih kontrola. PRIPREMA PREDMETNIH STAKALACA Predmetna stakalca trebalo bi pripremiti što je prije moguće (idealno bi bilo u roku od jednog sata) nakon pripreme pojedinačnih stanica/jezgri, ali bi temperaturu i vrijeme između smrti životinje i pripreme predmetnih stakalaca trebalo strogo kontrolirati i validirati u uvjetima laboratorija. Volumen stanične suspenzije koji se dodaje agarozi niskog tališta (obično od 0,5 do 1,0 %) kako bi se pripremila predmetna stakalca ne bi smio sniziti postotak agaroze niskog tališta na manje od 0,45 %. Optimalna gustoća stanica određuje se sustavom za analizu slike koji se upotrebljava za brojanje kometa. Liza Uvjeti liziranja isto su tako kritična varijabla i mogu utjecati na lomove lanaca koji nastaju zbog specifičnih vrsta modifikacije DNK (alkilacije i stvaranja adukata na bazama DNK). Stoga se preporučuje održavati uvjete liziranja konstantnima koliko je god moguće za sva predmetna stakalca unutar pokusa. Nakon pripreme predmetna stakalca trebalo bi namakati u rashlađenoj otopini za lizu najmanje jedan sat (ili preko noći) na oko 2 do 8 °C pod prigušenim svjetlom, npr. žutim svjetlom (ili u svjetlonepropusnim uvjetima) kako bi se izbjeglo izlaganje bijelom svjetlu koje može sadržavati UV komponente. Nakon tog razdoblja inkubacije predmetna stakalca trebalo bi isprati kako bi se uklonili ostaci deterdženta i soli prije faze alkalnog odmatanja. To se može učiniti s pomoću pročišćene vode, pufera za neutralizaciju ili fosfatnog pufera. Može se upotrijebiti i pufer za elektroforezu. Time će se održavati alkalni uvjeti u komori za elektroforezu. Odmatanje i elektroforeza Predmetna stakalca trebalo bi nasumice postaviti na platformu uređaja za elektroforezu na uronjenom gelu (engl. submarine-type electrophoresis) koji sadržava dovoljno otopine za elektroforezu da u cijelosti prekrije površinu predmetnih stakalaca (visina pokrivajućeg sloja trebala bi stalno biti ista u svim analitičkim ciklusima). Kod drugih vrsta uređaja za elektroforezu koji se upotrebljavaju u komet-testu, npr. s aktivnim hlađenjem, cirkulacijom i visokonaponskim izvorom napajanja, jačina električne struje bit će veća što je pokrivajući sloj otopine viši, dok će napon ostati isti. Predmetna stakalca trebalo bi postaviti u kadicu za elektroforezu na uravnotežen način kako bi se ublažili učinci eventualnih tendencija ili efekt ruba unutar kadice te smanjila varijabilnost među šaržama, tj. u svakom ciklusu elektroforeze trebao bi biti jednak broj predmetnih stakalaca s materijalom od svake životinje koja se upotrebljava u istraživanju te bi trebalo uključiti i uzorke različitih skupina doza te negativne i pozitivne kontrole. Predmetna stakalca trebalo bi držati u kadici najmanje 20 minuta kako bi se odmotao DNK te ih potom podvrgnuti elektroforezi u kontroliranim uvjetima kojima se maksimiziraju osjetljivost i dinamički raspon testa (tj. koji dovode do prihvatljivih postotaka DNK u repu kometa, kod pozitivnih i negativnih kontrola, kojima se osigurava maksimalna osjetljivost). Stupanj migracije DNK linearno je povezan s trajanjem elektroforeze, kao i s potencijalom (V/cm). Prema ispitivanju koje je proveo JaCVAM, to bi moglo biti 0,7 V/cm tijekom najmanje 20 minuta. Trajanje elektroforeze smatra se kritičnom varijablom te bi vrijeme elektroforeze trebalo odrediti tako da se osigura optimalan dinamički raspon. Dulje trajanje elektroforeze (npr. 30 ili 40 minuta radi maksimiziranja osjetljivosti) obično dovodi do jačih pozitivnih reakcija s poznatim mutagenima. Međutim, dulje trajanje elektroforeze može dovesti i do pretjerane migracije u kontrolnim uzorcima. U svakom bi pokusu trebalo održavati stalan napon, a varijabilnost ostalih parametara trebala bi biti unutar uskog i specificiranog raspona, na primjer u ispitivanju koje je proveo JaCVAM uz 0,7 V/cm postignuta je početna struja od 300 mA. Dubinu pufera trebalo bi prilagoditi tako da se postignu željeni uvjeti i trebalo bi je održavati tijekom cijelog pokusa. Trebalo bi zabilježiti intenzitet struje na početku i na kraju razdoblja elektroforeze. Optimalne bi uvjete stoga trebalo odrediti tijekom početnog dokazivanja tehničke osposobljenosti predmetnog laboratorija za svako tkivo koje se ispituje. Temperaturu otopine za elektroforezu tijekom odmotavanja i elektroforeze trebalo bi održavati na niskoj razini, obično na 2 do 10 °C (10.). Trebalo bi zabilježiti temperaturu otopine za elektroforezu na početku odmotavanja, na početku elektroforeze i na kraju elektroforeze. Po završetku elektroforeze predmetna stakalca trebalo bi namakati/ispirati u puferu za neutralizaciju najmanje pet minuta. Gelovi se mogu obojiti i pregledati u ‚svježem’ stanju (npr. unutar jednog do dva dana) ili ih se može dehidrirati za kasnije pregledavanje (npr. unutar jednog do dva tjedna nakon bojenja) (56.). Međutim, navedene bi uvjete trebalo validirati tijekom dokazivanja tehničke osposobljenosti te bi trebalo prikupiti prijašnje podatke i odvojeno ih čuvati za svaki od tih uvjeta. U tom drugom slučaju, predmetna stakalca trebalo bi dehidrirati namakanjem u apsolutnom etanolu najmanje pet minuta, ostaviti da se osuše na zraku te do pregledavanja čuvati na sobnoj temperaturi ili u spremniku pohranjenom u hladnjaku. Metode mjerenja Kvantitativnu analizu kometa trebalo bi izvršiti s pomoću automatskog ili poluautomatskog sustava za analizu slike. Predmetna stakalca boje se odgovarajućom fluorescentnom bojom, npr. bojom SYBR Gold, Green I, propidijevim jodidom ili etidijevim bromidom te se mjere pod prikladnim povećanjem (npr. 200×) s pomoću epifluorescentnog mikroskopa opremljenog odgovarajućim detektorima ili digitalnom kamerom (npr. CCD). Stanice se mogu razvrstati u tri kategorije opisane u atlasu slika kometa (57.), i to u kategoriju mjerljivih, nemjerljivih i ‚fantomskih’ stanica (hedgehog) (za detalje vidjeti stavak 56.). Kako bi se izbjegli artefakti, postotak DNK u repu trebalo bi mjeriti samo u mjerljivim stanicama (koje imaju jasno definiranu glavu i rep bez ikakve interferencije sa susjednim stanicama). Nije potrebno izvijestiti o učestalosti nemjerljivih stanica. Učestalost fantomskih stanica trebalo bi odrediti i odvojeno dokumentirati na temelju vizualnog pregleda (jer nedostatak jasno definirane glave znači da se stanice ne mogu dobro otkriti s pomoću sustava za analizu slike) najmanje 150 stanica po uzorku (za detalje vidjeti stavak 56.). Sva predmetna stakalca za analizu, uključujući i one za pozitivne i negativne kontrole, trebalo bi neovisno kodirati i pregledati ‚na slijepo’ tako da analitičar ne zna uvjete tretiranja. Za svaki bi uzorak (po tkivu po životinji) trebalo analizirati barem 150 stanica (isključujući fantomske stanice – vidjeti stavak 56.). Pregledavanjem 150 stanica po životinji kod najmanje pet životinja po dozi (ali manje od pet u skupini koja služi kao istodobna pozitivna kontrola – vidjeti stavak 29.) osigurava se odgovarajuća statistička snaga prema analizi koju su proveli Smith et al., 2008. (5.). Ako se upotrebljavaju predmetna stakalca, to bi značilo pregledavanje dvaju ili triju predmetnih stakalaca po uzorku ako se upotrebljava pet životinja po skupini. Trebalo bi pregledati nekoliko površina predmetnog stakalca pri gustoći koja osigurava da nema preklapanja repova kometa. Trebalo bi izbjegavati pregledavanje na rubovima predmetnih stakalaca. Lomovi lanaca DNK u komet-testu mogu se izmjeriti prema neovisnim parametrima kao što su postotak DNK u repu, duljina repa i repni moment. Ako se upotrebljava odgovarajući računalni program za analizu slike, mogu se izvršiti sva tri mjerenja. Međutim, za ocjenjivanje i tumačenje rezultata preporučuje se postotak DNK u repu (poznat i kao intenzitet repa) (12., 40., 41., 42.), koji je određen intenzitetom fragmenata DNK u repu izraženom kao postotak ukupnog intenziteta stanice (13). Oštećenje tkiva i citotoksičnost Pozitivni nalazi u komet-testu ne moraju biti isključivo posljedica genotoksičnosti jer i toksičnost za ciljna tkiva može isto tako dovesti do povećanja migracije DNK (12., 41.). Nasuprot tome, u slučaju poznatih genotoksičnih tvari često se uočava niska ili umjerena citotoksičnost (12.), što pokazuje da komet-test sam po sebi ne omogućuje razlikovanje migracije DNK koju je inducirala genotoksičnost od one koju je inducirala citotoksičnost. Međutim, uoči li se povećanje migracije DNK, preporučuje se ispitati jedan ili više pokazatelja citotoksičnosti jer to može pomoći u tumačenju nalaza. Povećanje migracije DNK u prisutnosti jasnih dokaza o citotoksičnosti potrebno je tumačiti s oprezom. Predložena su mnoga mjerila citotoksičnosti, od kojih se histopatološke promjene smatraju relevantnim mjerilom tkivne toksičnosti. Zapažanja poput upale, infiltracije stanica, apoptotskih ili nekrotskih promjena povezana su s povećanom migracijom DNK; međutim, kako je pokazalo validacijsko ispitivanje što ga je proveo JaCVAM (12.), ne postoji konačan popis histopatoloških promjena koje su uvijek povezane s povećanom migracijom DNK. Promjene u parametrima kliničke kemije (npr. AST, ALT) mogu isto tako pružiti korisne informacije o oštećenju tkiva te se mogu razmotriti i dodatni pokazatelji poput aktivacije kaspaze, obilježavanja apoptotičkih stanica metodom TUNEL, obojenosti aneksinom V itd. Međutim, objavljeni podaci o upotrebi tih pokazatelja u istraživanjima in vivo ograničeni su i nisu svi jednako pouzdani. Fantomske stanice (hedgehogs, clouds, ghost cells) jesu stanice na čijoj se mikroskopskoj slici vidi mala glava, ili glava ne postoji, i veliki difuzni rep te se smatraju teško oštećenim stanicama, iako nije moguće sa sigurnošću odrediti njihovu etiologiju (vidjeti Dodatak 3.). Zbog izgleda fantomskih stanica mjerenje postotka DNK u repu s pomoću analize slike nije pouzdano te bi stoga takve stanice trebalo ocijeniti odvojeno. Pojavu fantomskih stanica trebalo bi zabilježiti i navesti u izvješću, a svako relevantno povećanje za koje se smatra da je uzrokovano ispitivanom kemikalijom trebalo bi istražiti i tumačiti s oprezom. Poznavanje potencijalnog načina djelovanja ispitivanih kemikalija može pomoći pri tim razmatranjima. PODACI I IZVJEŠĆIVANJE Obrada rezultata S obzirom na to da je životinja pokusna jedinica, trebalo bi navesti podatke za pojedinačne životinje i sažetak rezultata u obliku tablice. Zbog hijerarhijske prirode podataka preporučuje se odrediti medijan postotka DNK u repu za svako predmetno stakalce te izračunati srednju vrijednost medijana za svaku životinju (12.). Potom se određuje srednja vrijednost pojedinačnih srednjih vrijednosti dobivenih za životinje kako bi se dobila srednja vrijednost za skupinu. Sve te vrijednosti trebalo bi navesti u izvješću. Mogu se primijeniti i alternativni pristupi (vidjeti stavak 53.) ako su znanstveno i statistički opravdani. Za statističku analizu mogu se primijeniti različiti pristupi (58., 59., 60., 61.). Pri odabiru statističkih metoda trebalo bi uzeti u obzir potrebu za eventualnim pretvaranjem podataka (npr. u logaritme ili kvadratne korijene) i/ili dodavanjem malog broja (npr. 0,001) svim vrijednostima (čak i nultima) kako bi se ublažili učinci nultih staničnih vrijednosti, kako je objašnjeno u literaturi na koju se upućuje prethodno u tekstu. U Dodatku 2. navedeni su detalji o analizi interakcija između tretiranja i spolova u slučaju kada se upotrebljavaju oba spola te o naknadnoj analizi podataka ovisno o tome jesu li ili nisu utvrđene razlike. Treba izvijestiti o podacima o toksičnosti i kliničkim znakovima. Kriteriji prihvatljivosti Prihvatljivost ispitivanja temelji se na sljedećim kriterijima:
Ocjenjivanje i tumačenje rezultata Pod uvjetom da su svi kriteriji prihvatljivosti ispunjeni, ispitivana kemikalija smatra se jasno pozitivnom ako:
Ako su svi navedeni kriteriji ispunjeni, smatra se da je ispitivana kemikalija sposobna uzrokovati lomove lanaca DNK u tkivima koja se proučavaju u tom ispitnom sustavu. Ako su ispunjeni samo jedan ili dva navedena kriterija, vidjeti stavak 62. Pod uvjetom da su svi kriteriji prihvatljivosti ispunjeni, ispitivana kemikalija smatra se jasno negativnom ako:
Tada se smatra da ispitivana kemikalija nije sposobna uzrokovati lomove lanaca DNK u tkivima koja se proučavaju u tom ispitnom sustavu. Jasno pozitivan ili negativan odgovor nije potrebno provjeravati. U slučaju kada odgovor nije ni jasno negativan niti jasno pozitivan (tj. nisu ispunjeni svi kriteriji koji su navedeni u stavku 59. ili 60.) te kako bi se utvrdila biološka relevantnost rezultata, podatke bi trebalo ocijeniti stručnom prosudbom i/ili bi trebalo provesti dodatna istraživanja ako je to znanstveno opravdano. Moglo bi biti korisno pregledati dodatne stanice (prema potrebi) ili ponoviti pokus s eventualno optimiziranim pokusnim uvjetima (npr. razmak između doza, drugi putovi primjene, druga vremena uzorkovanja ili druga tkiva). U rijetkim slučajevima, čak i nakon dodatnih istraživanja, skup podataka neće omogućiti donošenje zaključka o tome je li rezultat pozitivan ili negativan te će se stoga zaključiti da je dvosmislen. Da bi se procijenila biološka relevantnost pozitivnog ili dvosmislenog rezultata, potrebne su informacije o citotoksičnosti za ciljno tkivo (vidjeti stavke od 54. do 55.). Ako se pozitivni ili dvosmisleni rezultati uoče jedino u prisutnosti jasnih znakova citotoksičnosti, zaključuje se da je istraživanje dvosmisleno u pogledu genotoksičnosti, osim ako postoji dovoljno informacija koje omogućuju donošenje konačnog zaključka. Ako je negativan rezultat istraživanja popraćen znakovima toksičnosti pri svim ispitanim dozama, može biti preporučljivo provesti dodatno istraživanje s netoksičnim dozama. Izvješće o ispitivanju Izvješće o ispitivanju trebalo bi sadržavati sljedeće informacije:
LITERATURA
Dodatak 1. DEFINICIJE Elektroforeza pojedinačnih stanica u agaroznom gelu u alkalnim uvjetima : osjetljiva tehnika za otkrivanje primarnih oštećenja DNK na razini pojedinačnih stanica/jezgri. Kemikalija : tvar ili smjesa. Komet : oblik koji poprimaju nukleoidi pod utjecajem jednog od elektroforetskih polja, nazvan tako zbog sličnosti s kometima: glava je jezgra, a rep čini DNK koji migrira od jezgre u električnom polju. Kritična varijabla/parametar : to je varijabla protokola čija mala promjena može u velikoj mjeri utjecati na zaključak testa. Kritične varijable mogu biti specifične za određeno tkivo. Kritične varijable ne bi trebalo izmijeniti, posebno ne tijekom ispitivanja, a da se ne razmotri kako će ta izmjena utjecati na testnu reakciju, što može biti vidljivo, na primjer, po opsegu i varijabilnosti reakcije u pozitivnim i negativnim kontrolama. U izvješću o ispitivanju trebalo bi navesti izmjene kritičnih varijabli izvršenih tijekom ispitivanja ili u usporedbi sa standardnim protokolom laboratorija te obrazložiti svaku izmjenu. Intenzitet repa ili postotak DNK u repu : odgovara intenzitetu repa kometa u odnosu na ukupan intenzitet (glava plus rep). Odražava količinu lomova DNK izraženu u obliku postotka. Ispitivana kemikalija : sve tvari ili smjese koje se ispituju ovom ispitnom metodom. UVCB : tvari nepoznatog ili promjenjivog sastava, složeni reakcijski proizvodi ili biološki materijali. Dodatak 2. FAKTORSKI MODEL ZA UTVRĐIVANJE RAZLIKA MEĐU SPOLOVIMA U IN VIVO KOMET-TESTU Faktorski model i njegova analiza Prema ovom modelu svakoj se koncentraciji izlaže najmanje pet mužjaka i pet ženki, što znači da se upotrebljava najmanje 40 životinja (20 mužjaka i 20 ženki, plus odgovarajuće pozitivne kontrole). Model, koji je jedan od jednostavnijih faktorskih modela, istovjetan je dvosmjernoj analizi varijance (ANOVA) sa spolom i razinom koncentracije kao glavnim učincima. Podaci se mogu analizirati primjenom mnogih standardnih statističkih softverskih paketa kao što su SPSS, SAS, STATA i Genstat, kao i primjenom softvera R. Varijabilnost u skupu podataka analizom se dijeli na varijabilnost među spolovima, varijabilnost među koncentracijama i varijabilnost povezanu s interakcijom između spolova i koncentracija. Svaka od vrijednosti ispituje se u odnosu na procijenjenu varijabilnost među životinjama iz skupina životinja istog spola kojima je dana jednaka koncentracija. Potpuni podaci o osnovnoj metodologiji dostupni su u brojnim standardnim statističkim priručnicima (vidjeti literaturu) i sadržajima za pomoć osiguranima u okviru statističkih paketa. U analizi se nakon toga ispituje vrijednost interakcije spol x koncentracija u tablici ANOVA (35). U slučaju izostanka značajne vrijednosti interakcije kombiniranim vrijednostima za spolove ili razine koncentracije osiguravaju se valjana statistička ispitivanja među razinama na temelju vrijednosti varijabilnosti analize varijance objedinjene unutar skupine. Analiza se nastavlja razdjeljivanjem procijenjene varijabilnosti među koncentracijama na kontraste kojima se osigurava ispitivanje linearnih i kvadratnih kontrasta odgovora unutar razina koncentracije. Ako je prisutna značajna interakcija spol x koncentracija, ta se vrijednost jednako tako može razdijeliti na linearne kontraste interakcije x spol i kvadratne kontraste interakcije x spol. Na temelju tih vrijednosti provode se ispitivanja kojima se utvrđuje jesu li odgovori na koncentraciju paralelni za oba spola odnosno postoji li razlika u odgovoru između dvaju spolova. Procijenjena varijabilnost, koja je objedinjena unutar skupine, može se upotrijebiti za provedbu testova parova za utvrđivanje razlike između srednjih izmjerenih vrijednosti. Usporedbe se mogu napraviti između srednjih izmjerenih vrijednosti za oba spola i među srednjim izmjerenim vrijednostima za različite razine koncentracije, na primjer za usporedbe s razinama negativnih kontrola. U slučajevima značajne interakcije može se napraviti usporedba među srednjim izmjerenim vrijednostima za različite koncentracije unutar spola ili između srednjih izmjerenih vrijednosti za spolove pri jednakoj koncentraciji. Literatura Mnogo je statističkih priručnika u kojima se raspravlja o teoriji, planiranju, metodologiji, analizi i tumačenju faktorskih modela, od najjednostavnijih analiza s dva čimbenika do složenijih oblika koji se primjenjuju u metodologiji planiranja pokusa. U nastavku se nalazi nepotpuni popis. U nekim priručnicima navedeni su razrađeni primjeri usporedivih modela, u određenim slučajevima s kodom za provedbu analiza uz primjenu različitih softverskih paketa.
Dodatak 3. TRENUTAČNA OGRANIČENJA TESTA S obzirom na trenutačne spoznaje nekoliko je ograničenja povezano s in vivo komet-testom. Očekuje se da će se ta ograničenja smanjiti ili preciznije definirati u mjeri u kojoj će iskustvo stečeno u primjeni testa omogućiti odgovore na pitanja sigurnosti u regulatornom kontekstu.
Literatura
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
(16) |
U dijelu C poglavlje C.13. zamjenjuje se sljedećim: „C.13. Bioakumulacija u ribama: vodeno izlaganje ili izlaganje kroz hranu UVOD Ova ispitna metoda (IM) odgovara Smjernici OECD-a za ispitivanje (TG) 305 (2012.). Ova revizija ispitne metode ima dva ključna cilja. Kao prvo, namjerava se uključiti ispitivanje bioakumulacije kroz hranu (36) radi otkrivanja potencijala bioakumulacije tvari vrlo niske topljivosti u vodi. Kao drugo, namjerava se osmisliti ispitnu metodu pri kojoj se, prema potrebi, upotrebljava manje riba radi dobrobiti životinja i veće isplativosti. U godinama nakon donošenja konsolidirane ispitne metode C.13. (1.) ispitane su brojne tvari te su laboratoriji i regulatorna tijela stekli znatno iskustvo. To je dovelo do uvjerenja da je moguće smanjiti složenost ispitivanja ako su ispunjeni određeni kriteriji (vidjeti stavak 88.) i da je moguć slojevit pristup. Iz iskustva je vidljivo i da biološki čimbenici poput rasta i sadržaja lipida u ribi mogu u velikoj mjeri utjecati na rezultate i možda ih treba uzeti u obzir. Nadalje, prihvaćena je činjenica da ispitivanje tvari vrlo niske topljivosti u vodi možda nije tehnički izvedivo. Usto, kod tvari vrlo niske topljivosti u vodnom okruženju vodeno izlaganje može biti manje važno u usporedbi s izlaganjem kroz hranu. To je dovelo do razvoja ispitne metode u kojoj se upotrebljava izlaganje riba putem hrane (vidjeti stavke od 7. do 14. i 97. nadalje). Validacija (međulaboratorijski (ring) test) ispitivanja izlaganjem kroz hranu provedena je 2010. (51.). Neke su od glavnih promjena sljedeće:
Prije ispitivanja bioakumulacije moraju biti poznate sljedeće informacije o ispitivanoj tvari:
Neovisno o odabranoj metodi izlaganja ili programu uzorkovanja, ova se ispitna metoda odnosi na postupak određivanja potencijala bioakumulacije tvari u ribama. Iako se prednost daje režimima protočnog ispitivanja, dopušteni su i polustatički režimi, uz uvjet da su ispunjeni kriteriji valjanosti (vidjeti stavke 24. i 113.). Kod načina izlaganja kroz hranu sustav protočnog ispitivanja nije potreban za održavanje koncentracija ispitivane tvari u vodi, ali pomoći će pri održavanju prikladnih koncentracija otopljenog kisika i osiguranju čistoće vode te uklanjanju utjecaja, na primjer, proizvoda izlučivanja. Neovisno o odabranoj ispitnoj metodi, u ovoj se ispitnoj metodi pružaju dostatne pojedinosti za provođenje ispitivanja, istovremeno omogućujući odgovarajuću slobodu za prilagodbu plana izvođenja pokusa uvjetima u određenim laboratorijima i različitim obilježjima ispitivanih tvari. Ispitivanje vodenim izlaganjem najbolje se primjenjuje na stabilne organske tvari čije su vrijednosti log K OW između 1,5 i 6,0 (13.), ali može ga se primijeniti i na izrazito hidrofobne tvari (čija je vrijednost log K OW viša od 6,0) ako se može dokazati stabilna i potpuno otopljena koncentracija ispitivane tvari u vodi. Ako nije moguće dokazati stabilnu koncentraciju ispitivane tvari u vodi, ispitivanje vodenim izlaganjem nije odgovarajuće te bi za ispitivanje tvari u ribama trebalo primijeniti pristup kroz hranu (iako tumačenje i upotreba rezultata ispitivanja kroz hranu može ovisiti o regulatornom okviru). Prethodne procjene faktora biokoncentracije (BCF, ponekad ga se označuje s K B) za organske tvari čije vrijednosti log K OW iznose do otprilike 9,0 moguće je dobiti upotrebom jednadžbe iz Bintein et al. (14.). Prethodna procjena faktora biokoncentracije za takve izrazito hidrofobne tvari može biti viša od vrijednosti faktora biokoncentracije u stabilnom stanju (BCFSS) koja se očekuje dobiti iz laboratorijskih pokusa, posebno kad se za prethodne procjene upotrebljava jednostavni linearni model. U parametre značajne za potencijal bioakumulacije uključeni su konstanta brzine apsorpcije (k 1), konstanta brzine gubitka uključujući konstantu brzine izlučivanja (k 2), faktor biokoncentracije u stabilnom stanju (BCFSS), kinetički faktor biokoncentracije (BCFK) i faktor biomagnifikacije kroz hranu (BMF) (38). Radioaktivno obilježene ispitivane tvari mogu olakšati analizu uzoraka vode, hrane i riba te se mogu upotrijebiti pri utvrđivanju potrebe za identifikacijom i kvantifikacijom metabolita. Ako se ukupni radioaktivni ostatci mjere zasebno (npr. izgaranjem ili otapanjem tkiva), vrijednost BCF ili BMF temelji se na ukupnoj polaznoj tvari, zadržanim metabolitima i asimiliranom ugljiku. Vrijednosti BCF ili BMF koje se temelje na ukupnim radioaktivnim ostatcima stoga ne moraju biti izravno usporedive s vrijednostima BCF ili BMF dobivenima posebnom analizom samo polazne tvari. Postupci odvajanja kao što su TLC, HPLC ili GC (39) mogu se primijeniti prije analize u radioaktivno obilježenim ispitivanjima radi utvrđivanja vrijednosti BCF ili BMF na temelju polazne tvari. Kad se primjenjuju tehnike odvajanja potrebno je identificirati i kvantificirati polaznu tvar i relevantne metabolite (40) (vidjeti stavak 65.) ako se vrijednost BCF ili BMF temelji na koncentraciji polazne tvari u ribama, a ne na ukupnim radioaktivno obilježenim ostatcima. Moguće je i kombinirati ispitivanja ribljeg metabolizma ili in vivo distribucije s ispitivanjem bioakumulacije analizom i identificiranjem ostataka u tkivima. Mogućnosti metabolizma moguće je predvidjeti s pomoću odgovarajućih alata (npr. OECD-ov alat QSAR (15.) i vlastiti QSAR programi). Odluku o tome hoće li se i kako ispitivanje provesti vodenim izlaganjem ili izlaganjem kroz hranu trebalo bi temeljiti na čimbenicima iz stavka 3. razmotrenima zajedno s relevantnim regulatornim okvirom. Na primjer, za tvari čija je vrijednost log K OW visoka, ali ipak pokazuju znatnu topljivost u vodi u odnosu na osjetljivost dostupnih analitičkih tehnika trebalo bi u prvom redu razmotriti ispitivanje vodenim izlaganjem. Međutim, moguće je da informacije u pogledu topljivosti u vodi tih hidrofobnih vrsta tvari nisu konačne pa je mogućnost pripremanja stabilnih, mjerljivih otopljenih vodenih koncentracija (stabilne emulzije nisu dopuštene) odgovarajućih za ispitivanje vodenim izlaganjem potrebno istražiti prije donošenja odluke o ispitnoj metodi koju će se upotrijebiti (16.). Nije moguće pružiti točne obvezujuće smjernice o metodi koju treba upotrijebiti na temelju graničnih kriterija topljivosti u vodi i podjelnog koeficijenta oktanol-voda jer drugi čimbenici (analitičke tehnike, razgradnja, adsorpcija itd.) mogu znatno utjecati na primjenjivost metode iz prethodno navedenih razloga. Međutim, vrijednost log K OW iznad 5 i topljivost u vodi ispod ~ 0,01 – 0,1 mg/l označuju raspon tvari kod kojih ispitivanje vodenim izlaganjem može postati znatno otežano. Trebalo bi razmotriti druge čimbenike koji mogu utjecati na odabir ispitivanja, uključujući potencijal tvari za adsorpciju u ispitne posude i opremu, njezinu stabilnost u vodenim otopinama u odnosu na njezinu stabilnost u hrani za ribe (17., 18.) itd. Informacije o tim praktičnim aspektima možda se nalaze u drugim završenim ispitivanjima vodenim izlaganjem. Dodatne informacije o procjeni aspekata u pogledu provođenja ispitivanja bioakumulacije dostupne su u literaturi (npr. 19.). Za tvari kod kojih topljivost ili održavanje vodenih koncentracija te analiza tih koncentracija ne predstavljaju ograničenja za provedbu metode vodenog izlaganja, toj se metodi daje prednost u pogledu utvrđivanja potencijala biokoncentracije tvari. U svakom slučaju treba potvrditi da se koncentracije pri vodenom izlaganju u ispitnom mediju koje će se primijeniti nalaze unutar raspona topljivosti u vodi. Mogu se upotrijebiti različite metode za održavanje stabilnih koncentracija otopljene ispitivane tvari, poput upotrebe matičnih otopina ili sustava za pasivno doziranje (npr. metoda eluiranja kolone), pod uvjetom da se može dokazati da je moguće održati stabilne koncentracije i da se ispitni mediji ne mijenjaju u odnosu na one preporučene u stavku 27. Za izrazito hidrofobne tvari (log K OW > 5 i topljivost ispod ~ 0,01 – 0,1 mg/l) ispitivanje vodenim izlaganjem može postati znatno otežano. Razlozi za ograničenja može biti činjenica da nije moguće održati koncentraciju u vodi na razini koja se smatra dovoljno stalnom (npr. zbog sorpcije u staklo spremnika u kojima se provodi izlaganje ili zato što ribe brzo konzumiraju ispitnu tvar) ili to da su koncentracije u vodi koje će se primijeniti toliko niske da su na istoj razini kao analitičko ograničenje kvantifikacije ili ispod te razine (41). Za te izrazito hidrofobne tvari preporučuje se ispitivanje izlaganjem kroz hranu, pod uvjetom da je ispitivanje u skladu s relevantnim regulatornim okvirom i potrebama u pogledu procjene rizika. a površinski aktivne tvari trebalo bi razmotriti je li izvedivo ispitivanje biokoncentracije vodenim izlaganjem uzimajući u obzir svojstva tvari, a u suprotnome će vjerojatno biti primjerenije ispitivanje izlaganjem kroz hranu. Površinski su aktivne tvari agensi koji umanjuju površinsku napetost između dvaju fluida. Zbog svoje se amfifilne prirode (tj. činjenice da sadržavaju i hidrofilni i hidrofobni dio) skupljaju u zonama razdvajanja između vode i zraka, vode i hrane te uz staklene stijenke, što onemogućuje utvrđivanje njihove koncentracije u vodi. Ispitivanjem kroz hranu može se zaobići neke od aspekata izlaganja kod složenih smjesa sa sastavnim dijelovima koji imaju različita ograničenja u pogledu topljivosti u vodi zbog toga što je usporediva razina izlaganja svih sastavnih dijelova smjese vjerojatnija nego kod metode vodenog izlaganja (vidjeti 20.). Treba napomenuti da se pristupom izlaganja kroz hranu dobiva faktor biomagnifikacije kroz hranu (BMF), a ne faktor biokoncentracije (BCF)) (42). Postoje pristupi kojima je moguće procijeniti kinetički faktor biokoncentracije (BCFK) iz podataka dobivenih iz ispitivanja kroz hranu (kako je navedeno u Dodatku 8.), ali te bi pristupe trebalo upotrebljavati uz oprez. Općenito, u tim se pristupima primjenjuje kinetika prvog reda te su primjenjivi samo na određene skupine spojeva. Takvi se pristupi vjerojatno ne mogu primjenjivati na površinski aktivne tvari (vidjeti stavak 12.). Smanjeni plan ispitivanja vodenim izlaganjem s manje točaka uzorkovanja radi smanjenja broja životinja i/ili sredstava (vidjeti stavak 83. i dalje) trebalo bi primjenjivati samo na one tvari kod kojih nema razloga očekivati da će se apsorpcija i izlučivanje odvijati približno prema kinetici prvog reda (odnosno kod općenitih neioniziranih organskih tvari, vidjeti stavak 88.). C.13 – I. Ispitivanje biokoncentracije vodenim izlaganjem riba NAČELO ISPITIVANJA Ispitivanjem su obuhvaćene dvije faze: faza izlaganja (apsorpcija) i faza nakon izlaganja (izlučivanje). Tijekom faze apsorpcije skupinu riba jedne vrste izlaže se ispitivanoj tvari u jednoj odabranoj koncentraciji ili više njih, ovisno o svojstvima ispitivane tvari (vidjeti stavak 49.). Zatim ih se prenosi u medij bez ispitivane tvari na fazu izlučivanja. Faza izlučivanja uvijek je potrebna, osim ako je apsorpcija tvari tijekom faze apsorpcije bila neznatna. Koncentracija ispitivane tvari u/na ribi (odnosno njezinu određenom tkivu) prati se tijekom obiju faza ispitivanja. Uz izloženu skupinu, u ispitivanje je uključena i kontrolna skupina riba, koje se drži u istovjetnim uvjetima, ali bez prisutnosti ispitivane tvari, kako bi se mogući štetni učinci uočeni kod ispitivanja biokoncentracije mogli usporediti s odgovarajućom kontrolnom skupinom te da bi se dobile pozadinske koncentracije u ispitivanoj tvari (43). U ispitivanju vodenim izlaganjem faza apsorpcije uobičajeno traje 28 dana. Trajanje se može produljiti prema potrebi (vidjeti stavak 18.) ili skratiti ako se dokaže da je stabilno stanje postignuto ranije (vidjeti Dodatak 1. o definicijama i jedinicama.) Trajanje faze apsorpcije i vrijeme potrebno da se postigne stabilno stanje može se predvidjeti uz pomoć jednadžbi iz Dodatka 5. Tada počinje razdoblje izlučivanja kad se ribe više ne izlaže ispitivanoj tvari te ih se prenosi u čistu posudu, u isti medij, ali bez ispitivane tvari. Ako je to moguće, poželjno je da se faktor biokoncentracije izračunava i kao omjer koncentracije u ribi (C f) i u vodi (C w) u stabilnom stanju (BCFSS; vidjeti Dodatak 1., definicije) i kao kinetički faktor biokoncentracije (BCFK; vidjeti Dodatak 1., definicije i jedinice), koji se procjenjuje kao omjer konstanti brzine apsorpcije (k 1) i izlučivanja (k 2) uz pretpostavku kinetike prvog reda (44). Ako se stabilno stanje ne postigne u roku od 28 dana, BCF se izračunava primjenom kinetičkog pristupa (vidjeti stavak 38.) ili se produljuje faza apsorpcije. Ako to uzrokuje pretjerano dugu fazu apsorpcije radi postizanja stabilnog stanja (vidjeti stavke 37. i 38. Dodatka 5.) prednost se daje kinetičkom pristupu. Kao drugu mogućnost za izrazito hidrofobne tvari treba razmotriti provođenje ispitivanja kroz hranu (45), pod uvjetom da je ono u skladu s relevantnim regulatornim okvirom. Konstanta brzine apsorpcije, konstanta brzine izlučivanja (gubitka) (odnosno konstante, ako se koriste složeniji modeli), faktor biokoncentracije (u stabilnom stanju i/ili kinetički) te, po mogućnosti, granice pouzdanosti svakog od tih parametara izračunavaju se uz pomoć modela koji najbolje opisuje izmjerene koncentracije ispitivane tvari u ribama i vodi (vidjeti Dodatak 5). Povećanje mase riba tijekom ispitivanja za posljedicu će imati smanjenje koncentracije ispitivane tvari u ribama koje rastu (tzv. razrjeđenje zbog rasta) te će zbog toga kinetički BCF biti podcijenjen ako ga se ne ispravi u odnosu na rast (vidjeti stavke 72. i 73.). BCF se temelji na ukupnoj koncentraciji u ribi (tj. prema ukupnoj mokroj masi ribe). Ipak, za određene se potrebe mogu upotrijebiti određena tkiva ili organi (npr. mišići, jetra) ako je riba dovoljno velika odnosno ako je se može podijeliti u jestive (file) i nejestive (utroba) dijelove. Budući da kod mnogih organskih tvari postoji jasna veza između biokoncentracijskog potencijala i hidrofobnosti, isto tako postoji i odgovarajuća povezanost između sadržaja lipida ispitne ribe i zabilježene biokoncentracije tih tvari. Stoga bi radi smanjenja tog izvora varijabilnosti u rezultatima ispitivanja za te tvari visoke lipofilnosti (odnosno one čija je vrijednost log K OW > 3) trebalo izražavati biokoncentraciju kao normiranu na ribe sa sadržajem lipida od 5 % (na temelju ukupne mokre mase ribe) uz onu dobivenu izravno iz ispitivanja. To je potrebno kako bi se dobila osnova na kojoj se rezultati za različite tvari i/ili ispitne vrste mogu uspoređivati jedni s drugima. Sadržaj lipida od 5 % upotrebljava se u velikoj mjeri jer predstavlja prosječni sadržaj lipida u ribama koje se uobičajeno upotrebljavaju u ovoj ispitnoj metodi (21.). INFORMACIJE O ISPITIVANOJ TVARI Uz svojstva ispitivane tvari navedena u Uvodu (stavak 3.), potrebne su i informacije o njezinoj toksičnosti za riblje vrste koje će biti upotrijebljene u ispitivanju, po mogućnosti asimptotski LC50 (tj. neovisan o vremenu) i/ili toksičnost procijenjena dugoročnim ispitivanjima riba (npr. ispitne metode C.47. (22.), C.15. (23.), C.14. (24.)). Trebala bi biti raspoloživa odgovarajuća analitička metoda poznate točnosti, preciznosti i osjetljivosti za kvantifikaciju tvari u ispitnim otopinama i biološkom materijalu, zajedno s podacima o pripremi i skladištenju uzorka. Osim toga, trebaju biti poznate granice analitičke kvantifikacije ispitivane tvari u vodi i ribljim tkivima. Ako se upotrebljava radioaktivno obilježena ispitivana tvar, trebala bi biti najveće čistoće (npr. po mogućnosti > 98 %) te bi trebao biti poznat postotak radioktivnosti povezane s nečistoćama. VALJANOST ISPITIVANJA Da bi ispitivanje bilo valjano, treba zadovoljiti sljedeće uvjete:
REFERENTNE TVARI Upotreba referentnih tvari poznatog potencijala biokoncentracije i slabijeg metaboliziranja bila bi korisna za provjeru postupka izvođenja pokusa, kad je to potrebno (npr. kad određeni laboratorij nema ranijih iskustava u tom ispitivanju ili su izmijenjeni uvjeti pokusa). OPIS METODE Oprema Treba voditi računa o tome da nijedan dio opreme ne sadržava materijale koji se mogu otapati, sorbirati ili ispirati i imati štetni učinak na ribe. Mogu se upotrebljavati standardni pravokutni ili cilindrični bazeni od kemijski inertnog materijala, prikladne zapremnine s obzirom na količinu punjenja (vidjeti stavak 43.). Uporabu mekanih plastičnih cijevi treba svesti na najmanju moguću mjeru. Trebalo bi upotrebljavati cijevi od politetrafluoroetilena, nehrđajućeg čelika i/ili stakla. Iz iskustva je poznato da je za ispitivane tvari s visokim koeficijentom adsorpcije, kao što su sintetički piretroidi, ponekad potrebno upotrebljavati silanizirano staklo. U tom bi slučaju opremu trebalo baciti nakon upotrebe. Po mogućnosti bi prije uvođenja ispitnih organizama sustave za ispitivanje trebalo izložiti koncentracijama ispitivane tvari koja će biti upotrijebljena u ispitivanju toliko dugo koliko je potrebno da se dokaže održavanje stabilnih koncentracija pri izlaganju. Voda Pri ispitivanju se uglavnom upotrebljava prirodna voda dobivena iz neonečišćenog izvora ujednačene kvalitete. Međutim, obrađena bi voda (odnosno demineralizirana voda s određenim hranjivim tvarima koje su joj dodane u poznatim količinama) mogla biti prikladnija radi osiguravanja ujednačene razine kvalitete tijekom vremena. Kvaliteta vode za razrjeđivanje, odnosno voda koju se miješa s ispitivanom tvari prije unošenja u ispitnu posudu (vidjeti stavak 30.), trebala bi omogućivati preživljavanje odabranih ribljih vrsta tijekom razdoblja aklimatizacije i ispitivanja bez pojave neuobičajenog izgleda ili ponašanja. U idealnom slučaju treba dokazati da ispitna vrsta može preživjeti, rasti i razmnožavati se u vodi za razrjeđivanje (npr. u laboratorijskoj kulturi ili toksikološkom ispitivanju unutar životnog ciklusa). Vodu za razrjeđivanje treba opisati barem s obzirom na pH, tvrdoću, ukupni sadržaj krute tvari, ukupni organski ugljik (TOC (47)) i, po mogućnosti, amonijak, nitrit i alkalitet te, kod morskih vrsta, salinitet. Parametri važni za optimalnu dobrobit riba nisu u cijelosti poznati, ali u Dodatku 2. navedene su preporučene maksimalne koncentracije za niz parametara za slatkovodnu i morsku ispitnu vodu. Voda za razrjeđivanje treba biti stalne kvalitete dok traje ispitivanje. pH-vrijednost treba biti u rasponu od 6,0 do 8,5 na početku ispitivanja, pri čemu za vrijeme jednog ispitivanja ne smije odstupati za više od ±0,5 pH jedinica. Kako voda za razrjeđivanje ne bi neprimjereno utjecala na rezultat ispitivanja (na primjer stvaranjem kompleksa s ispitivanom tvari) ili imala negativan utjecaj na riblju populaciju, potrebno je u određenim razmacima uzimati uzorke na analizu, a barem na početku i kraju ispitivanja. Utvrđivanje teških metala (npr. Cu, Pb, Zn, Hg, Cd i Ni), glavnih aniona i kationa (npr. Ca2+, Mg2+, Na+, K+, Cl– i SO4 2–), pesticida (npr. ukupni organofosforni i ukupni organoklorni pesticidi), ukupnog organskog ugljika i suspendiranih krutih tvari treba provoditi, na primjer, svaka tri mjeseca ako se zna da je voda za razrjeđivanje relativno stalne kakvoće. Ako se dokaže da je kvaliteta vode za razrjeđivanje stalna tijekom najmanje jedne godine, ubuduće se kvaliteta može provjeravati rjeđe, a intervali mogu biti dulji (na primjer svakih šest mjeseci). Sadržaj prirodnih čestica i ukupni organski ugljik u vodi za razrjeđivanje trebali bi biti što je moguće niži radi izbjegavanja adsorpscije ispitivane tvari u organsku tvar, zbog čega bi moglo doći do smanjenja njezine bioraspoloživosti te stoga do podcjenjivanja vrijednosti BCF-a. Maksimalna je prihvatljiva vrijednost 5 mg/l za lebdeće čestice (suha tvar koja ne prolazi kroz filtar od 0,45 μm) i 2 mg/l za ukupni organski ugljik (vidjeti Dodatak 2.). Voda za razrjeđivanje se prema potrebi filtrira prije uporabe. Doprinos ispitnih riba (izlučevine) i ostataka hrane sadržaju organskog ugljika u ispitnoj vodi trebao bi biti što je moguće niži (vidjeti stavak 46.). Ispitne otopine Priprema se matična otopina koja sadržava prikladnu koncentraciju ispitivane tvari. Matičnu otopinu po mogućnosti se priprema miješanjem ili protresanjem ispitivane tvari u vodi za razrjeđivanje. U određenim slučajevima može biti primjereno upotrijebiti sustav doziranja za desorpciju krute faze. Upotreba otapala i dispergenata (otapajućih sredstava) uglavnom se ne preporučuje (vidjeti 25.); međutim, upotreba tih materijala može biti prihvatljiva radi proizvodnje matične otopine odgovarajuće koncentracije, ali trebalo bi poduzeti sve kako bi se upotreba tih materijala smanjila na minimum te ne bi trebalo prekoračiti njihovu kritičnu micelizacijsku koncentraciju (ako je relevantno). Otapala koja se mogu upotrebljavati su aceton, etanol, metanol, dimetilformamid i trietilenglikol; dispergenti koji su upotrijebljeni su Tween 80, metil-celuloza 0,01 % i HCO-40. Koncentracija otapala u konačnom ispitnom mediju trebala bi biti ista u svim grupama (odnosno ne ovisiti o koncentraciji ispitivane tvari) i ne bi smjela prelaziti odgovarajuće pragove toksičnosti koji su utvrđeni za otapalo u ispitnim uvjetima. Najviša koncentracija iznosi 100 mg/l (ili 0,1 ml/l). Nije vjerojatno da će koncentracija otapala od 100 mg/l znatno izmijeniti najvišu otopljenu koncentraciju ispitivane tvari koju je moguće postići u mediju (25.). Doprinos otapala (zajedno s ispitivanom tvari) ukupnom sadržaju organskog ugljika u ispitnoj vodi treba biti poznat. Za vrijeme ukupnog trajanja ispitivanja koncentracija ukupnog organskog ugljika u ispitnim posudama ne smije biti više od 10 mg/l (±20 %) veća od koncentracije organskog ugljika koji potječe od ispitivane tvari, kao i otapala ili otapajućeg sredstva (48) ako se upotrebljava. Sadržaj organskih tvari može u velikoj mjeri utjecati na količinu slobodno otopljene ispitivane tvari tijekom ispitivanja s ribama u protočnom postupku, posebno za izrazito lipofilne tvari. Iz mikroekstrakcije iz krute faze (vidjeti stavak 60.) moguće je dobiti važne informacije o omjeru između vezanih i slobodno otopljenih spojeva, pri čemu se za potonje smatra da predstavljaju bioraspoloživi dio. Koncentracija ispitivane tvari trebala bi biti ispod granice topljivosti ispitivane tvari u ispitnom mediju unatoč upotrebi otapala ili otapajućeg sredstva. Kod primjene lako biorazgradivih otapala potreban je poseban oprez jer oni u protočnim ispitivanjima mogu izazvati problem rasta bakterija. Ako nije moguće pripremiti matičnu otopinu bez upotrebe otapajućeg sredstva, trebalo bi razmotriti primjerenost ispitivanja vodenim izlaganjem u usporedbi s ispitivanjem izlaganjem kroz hranu. Kad je riječ o protočnim ispitivanjima, za dopremanje ispitnih koncentracija u ispitne komore potreban je sustav koji stalno odmjerava i razrjeđuje matičnu otopinu ispitivane tvari (npr. dozirna crpka, proporcionalni razrjeđivač, zasićivač) ili sustav doziranja za desorpciju krute tvari. Po mogućnosti bi kroz svaku ispitnu komoru svakodnevno trebalo proći barem pet izmjena volumena. Prednost treba dati protočnoj metodi, ali ako to nije moguće (npr. u slučaju štetnog učinka na ispitne organizme), može se upotrijebiti i polustatička tehnika, pod uvjetom da su zadovoljeni kriteriji valjanosti (vidjeti stavak 24.). Brzinu protoka matičnih otopina i vode za razrjeđivanje treba provjeriti 48 sati prije ispitivanja i zatim barem jedanput dnevno tijekom ispitivanja. Prilikom te provjere treba odrediti brzinu protoka kroz svaku ispitnu komoru i pobrinuti se za to da odstupanja unutar jedne komore i između komora ne budu veća od 20 %. Odabir vrste Važni su kriteriji za odabir vrste laka dostupnost, raspoloživost u praktičnim veličinama i prikladnost za držanje u laboratorijskim uvjetima. U druge kriterije za odabir ribljih vrsta uključene su njihova važnost u rekreativnom, komercijalnom i ekološkom smislu kao i usporediva osjetljivost, prethodna uspješna upotreba itd. Preporučene ispitne vrste navedene su u Dodatku 3. Mogu se upotrebljavati i druge vrste, ali to može zahtijevati prilagodbu ispitnog postupka kako bi se osigurali prikladni ispitni uvjeti. U tom slučaju treba navesti razloge za odabir vrste i pokusnu metodu. U pravilu, upotreba ribljih vrsta manje veličine skratit će vrijeme potrebno za postizanje stabilnog stanja, ali možda će biti potrebno više riba (uzoraka) za odgovarajuću analizu sadržaja lipida i koncentracija ispitivane tvari u ribi. Nadalje, moguće je da će razlike u stopi disanja i metabolizmu između mlađih i starijih riba onemogućiti usporedbu rezultata između različitih ispitivanja i ispitnih vrsta. Treba napomenuti da kod ribljih vrsta koje se ispituje u životnoj fazi brzog rasta (mlade jedinke) može doći do komplikacija pri tumačenju podataka. Držanje riba (koje se odnosi na vodeno izlaganje i izlaganje kroz hranu) Matična populacija riba treba se aklimatizirati najmanje dva tjedna u vodi (vidjeti stavak 28.) pri ispitnoj temperaturi i cijelo vrijeme hraniti na odgovarajući način (vidjeti stavak 45.). Vrste vode i hrane trebale bi odgovarati onima koje će se upotrebljavati tijekom ispitivanja. Nakon razdoblja prilagodbe od 48 sati bilježi se smrtnost uz primjenu sljedećih kriterija:
Ribe koje se upotrebljavaju u ispitivanjima ne smiju imati vidljive znakove bolesti ni abnormalnosti. Odbacuju se sve bolesne ribe. Ribe se ne smiju liječiti dva tjedna prije ispitivanja niti za vrijeme ispitivanja. PROVOĐENJE ISPITIVANJA Preliminarno ispitivanje Preliminarni pokus može biti koristan za optimizaciju uvjeta ispitivanja za glavno ispitivanje, primjerice odabir koncentracija ispitivane tvari, trajanje faza apsorpcije i izlučivanja, ili za utvrđivanje potrebe za provođenjem potpunog ispitivanja. Preliminarno ispitivanje trebalo bi biti isplanirano tako da se njime dobiju potrebne informacije. Može ga se razmotriti ako je za dobivanje BCF-a dovoljno skraćeno ispitivanje ili ako je potrebno potpuno ispitivanje (vidjeti stavke od 83. do 95. u pogledu skraćenog ispitivanja). Uvjeti izlaganja Trajanje faze apsorpcije Predviđanje trajanja faze apsorpcije može se dobiti iz praktičnog iskustva (npr. iz ranijeg ispitivanja ili ispitivanja akumulacije na nekoj strukturno srodnoj tvari) ili iz određenih empirijskih odnosa primjenjujući saznanja o topljivosti u vodi ili podjelnom koeficijentu oktanol-voda ispitivane tvari (pod uvjetom da apsorpcija slijedi kinetiku prvog reda, vidjeti Dodatak 5.). Faza apsorpcije trebala bi trajati 28 dana, osim ako se može dokazati da je stabilno stanje postignuto ranije (vidjeti Dodatak 1., definicije i jedinice). Na grafičkom prikazu ispitivane tvari u ribi (C f) u ovisnosti o vremenu smatra se da je stabilno stanje postignuto kad krivulja postane paralelna s vremenskom osi i kad se tri uzastopne analize C f na uzorcima uzetima u razmacima od najmanje dva dana razlikuju za najviše ±20 % i kad nema znatnog povećanja vrijednosti C f između prve i posljednje uzastopne analize. Kad se analiziraju objedinjeni uzorci potrebne su najmanje četiri uzastopne analize. Kod ispitivanih tvari koje se sporo apsorbiraju, prikladniji su razmaci od sedam dana. Ako stabilno stanje nije postignuto nakon 28 dana, BCF se izračunava primjenom samo kinetičkog pristupa, koji ne ovisi o postizanju stabilnog stanja, ili se produljuje faza apsorpcije, uz dodatna mjerenja, sve dok se ne postigne stabilno stanje ili na 60 dana, ovisno o tome koje je razdoblje kraće. Isto tako, koncentracija ispitivane tvari u ribi na završetku faze apsorpcije mora biti dovoljno visoka kako bi se osigurala pouzdana procjena vrijednosti k 2 iz faze izlučivanja. Ako nakon 28 dana nije zabilježena dostatna apsorpcija, ispitivanje se može prekinuti. Trajanje faze izlučivanja Za tvari koje slijede kinetiku prvog reda uobičajeno je dostatna polovina trajanja faze apsorpcije kako bi došlo do odgovarajućeg (npr. 95 %) smanjenja tjelesnog opterećenja koje nastaje zbog tvari (vidjeti Dodatak 5. za objašnjenje procjene). Ako je vrijeme potrebno da se postigne 95 % gubitka pretjerano dugo, primjerice ako je dvostruko duže od uobičajenog trajanja faze apsorpcije (tj. duže od 56 dana), može se primijeniti kraće razdoblje (npr. dok koncentracija ispitivane tvari ne padne ispod 10 % koncentracije u stabilnom stanju). Međutim, mogla bi biti potrebna dulja razdoblja izlučivanja za tvari sa složenijim obrascima apsorpcije i izlučivanja koji se ne mogu predstaviti modelom s jednim odjeljkom koji se primjenjuje na ribe i daje kinetiku prvog reda. Ako se ti složeniji obrasci uoče i/ili očekuju, preporučuje se potražiti savjet biostatističara i/ili farmakokinetičara radi osiguranja ispravnog plana ispitivanja. S produljenjem razdoblja izlučenja moglo bi doći do ograničenja broja riba za uzorkovanje, a razlike u veličini riba mogu utjecati na rezultate. Međutim, to će razdoblje biti uvjetovano i razdobljem tijekom kojeg se koncentracija ispitivane tvari u ribama zadržava iznad analitičke granice kvantifikacije. Broj ispitnih riba Odabire se broj riba po ispitnoj koncentraciji tako da na svakoj točki uzorkovanja budu raspoložive najmanje četiri ribe. Ribe je potrebno skupiti samo ako analiza pojedinačnih riba nije izvediva. Ako se planira preciznije prilagođavanje krivulje (i izvedenih parametara) ili ako su potrebna ispitivanja metabolizma (na primjer radi razlikovanja metabolita i polazne tvari pri upotrebi radioaktivno obilježenih ispitivanih tvari), bit će potrebno više riba po točki uzorkovanja. Sadržaj lipida treba odrediti na biološkom materijalu koji se upotrebljava za određivanje koncentracije ispitivane tvari. Ako to nije izvedivo, možda će biti potrebno više riba (vidjeti stavke 56. i 57.). Ako se upotrebljavaju odrasle (tj. spolno zrele) jedinke riba, one ne bi trebale biti u stanju mrijesta ili nedavno mriještene (tj. već izmriještene) prije ispitivanja ili tijekom njega. Trebalo bi navesti i upotrebljavaju li se u pokusu muške ili ženske jedinke riba ili obje. Ako se upotrebljavaju oba spola, potrebno je dokumentirati da su razlike u rastu i sadržaju lipida između spolova prije početka izlaganja neznatne, posebno ako se očekuje da će biti potrebno skupljanje muških i ženskih jedinki riba kako bi koncentracije tvari i/ili sadržaj lipida bili dovoljno veliki za detekciju. Kod svih se ispitivanja odabiru ribe slične mase, tako da najmanja riba ne teži manje od dvije trećine mase najveće ribe. Sve ribe trebaju biti istoga godišta i istog podrijetla. Budući da masa i dob ribe mogu znatno utjecati na vrijednosti BCF-a (12.)., te bi pojedinosti trebalo ispravno zabilježiti. Preporučuje se vaganje poduzorka riblje populacije neposredno prije početka ispitivanja radi procjene prosječne mase (vidjeti stavak 61.). Punjenje Potrebno je upotrijebiti visoke omjere vode i riba kako bi se minimiziralo smanjenje koncentracije ispitivanog spoja u vodi koju uzrokuje dodavanje ribe na početku ispitivanja te kako bi se izbjegla smanjenja koncentracije otopljenog kisika. Važno je da gustoća punjenja bude prilagođena ispitnoj vrsti. U svakom se slučaju uobičajeno preporučuje gustoća punjenja od 0,1 – 1,0 g ribe (mokre mase) po litri vode po danu. Više gustoće punjenja ribe u odnosu na vodu mogu se upotrebljavati ako se dokaže da se tražena koncentracija ispitivane tvari može održavati u granicama ±20 % i da koncentracija otopljenog kisika ne pada ispod 60 % zasićenosti (vidjeti stavak 24.). Kod odabira odgovarajućeg režima punjenja uzima se u obzir uobičajeno stanište riblje vrste. Na primjer, ribama koje žive na dnu uobičajeno je potrebno više prostora pri dnu akvarija kod istog volumena vode nego pelagijskim vrstama. Hranjenje Ribe se tijekom razdoblja aklimatizacije i ispitivanja hrani odgovarajućom hranom s poznatim sadržajem lipida i ukupnog sadržaja proteina u količini koja je dovoljna da ostanu zdrave i zadrže tjelesnu masu (dopušteno je da malo narastu). Hrani ih se svakodnevno tijekom razdoblja aklimatizacije i ispitivanja u količini određenoj ovisno o vrsti koja se upotrebljava, uvjetima pokusa i kalorijskoj vrijednosti hrane (na primjer, za kalifornijsku pastrvu između otprilike 1 do 2 % tjelesne mase dnevno). Brzinu hranjenja trebalo bi određivati tako da se izbjegavaju brz rast i veliko povećanje sadržaja lipida. Kako bi se održala ista brzina hranjenja, količinu hrane trebalo bi prema potrebi ponovno izračunavati, na primjer jedanput tjedno. Za potrebe tog izračuna masa riba u pojedinoj ispitnoj komori može se procijeniti iz mase posljednjeg ribljeg uzorka uzetog iz te komore. Ribe koje ostanu u komori ne važu se. Nepojedenu hranu i izmet potrebno je svakodnevno ispustiti iz ispitnih komora ubrzo nakon hranjenja (30 minuta do jedan sat). Komore je tijekom ispitivanja potrebno održavati što čišćima kako bi se koncentraciju organske tvari održavalo što je moguće nižom (vidjeti stavak 29.) jer prisutnost organskog ugljika može ograničiti bioraspoloživost ispitivane tvari (12.). Budući da se brojne vrste hrane dobivaju iz ribljeg brašna, trebalo bi osigurati da hrana ne utječe na rezultate ispitivanja i da ne izaziva štetne učinke, na primjer, zbog prisutnosti (u tragovima) pesticida, teških metala i/ili same ispitivane tvari. Svjetlo i temperatura Preporučuje se fotoperiod od 12 do 16 sati, a temperatura (± 2°C) bi trebala odgovarati ispitnoj vrsti (vidjeti Dodatak 3.). Vrsta i značajke osvjetljenja trebaju biti poznati. Treba uzeti u obzir mogućnost fotokemijske pretvorbe ispitivanih tvari u uvjetima ozračivanja. Treba koristiti odgovarajuće osvjetljenje kako ribe ne bi bile izložene neprirodnim fotoproduktima. U nekim je slučajevima potrebno koristiti filtar koji ne propušta UV zračenje ispod 290 nm. Ispitne koncentracije Ispitivanje je izvorno osmišljeno za nepolarne organske tvari. Za tu se vrstu tvari očekuje da će izlaganje ribe samo jednoj koncentraciji biti dovoljno jer se ne očekuju učinci koncentracije, iako bi mogle biti potrebne dvije koncentracije u skladu s relevantnim regulatornim okvirom. Ako se ispituju tvari izvan te domene ili su poznate druge indikacije u pogledu moguće ovisnosti o koncentraciji, ispitivanje bi trebalo provesti s još dvije koncentracije ili više njih. Ako se ispituje samo jedna koncentracija, to bi trebalo opravdati (vidjeti stavak 79.). Isto tako, ispitivana koncentracija trebala bi biti što je moguće niža u smislu praktičnih ili tehničkih mogućnosti (odnosno ne smije biti blizu granice topljivosti). U određenim se slučajevima može očekivati da će biokoncentracija tvari ovisiti o koncentraciji u vodi (npr. za metale, kod kojih je moguće da će apsorpcija riba biti barem djelomično regulirana). U tim je slučajevima potrebno ispitati najmanje dvije koncentracije koje su relevantne za okoliš, a ako je moguće i više njih (vidjeti stavak 49.) Za tvari kod kojih ispitivane koncentracije moraju iz praktičnih razloga biti blizu granice topljivosti isto se tako preporučuje ispitivanje s najmanje dvije koncentracije jer se tako može dobiti uvid u pouzdanost koncentracija pri izlaganju. U odabir ispitnih koncentracija trebale bi biti uključene koncentracija koja se realistično može javiti u okolišu i koncentracija relevantna za potrebe određene procjene. Koncentracije ispitivane tvari trebalo bi birati tako da budu ispod granice kroničnih učinaka ili ispod 1 % akutnog asimptotskog LC50, unutar raspona koji je relevantan za okoliš i najmanje za jedan red veličine iznad granice kvantifikacije u vodi na temelju upotrijebljene analitičke metode. Najviša dopuštena ispitna koncentracija može se utvrditi i dijeljenjem akutnog 96 h LC50 s odgovarajućim akutnim/kroničnim omjerom (npr. odgovarajući su omjeri za neke tvari oko tri, ali za nekoliko njih iznad 100). Ako se upotrebljava druga koncentracija, trebala bi se razlikovati od one prethodno navedene za faktor deset. Ako to nije moguće zbog kriterija toksičnosti (koji ograničava gornju ispitnu koncentraciju) i analitičke granice (koja ograničava donju ispitnu koncentraciju), moguće je upotrijebiti faktor niži od deset i trebalo bi razmotriti upotrebu radioaktivno obilježene ispitivane tvari (najviše čistoće, po mogućnosti > 98 %). Trebalo bi voditi računa o tome da ni jedna upotrijebljena koncentracija ne bude iznad granice topljivosti ispitivane tvari u ispitnom mediju. Kontrole Uz ispitni bi niz trebalo bi provesti jednu kontrolu s vodom za razrjeđivanje ili prema potrebi (vidjeti stavke 30. i 31.) jednu kontrolu s otapalom. Učestalost mjerenja kvalitete vode Tijekom ispitivanja u svim je ispitnim i kontrolnim posudama potrebno mjeriti otopljeni kisik, TOC, pH i temperaturu. Ukupnu tvrdoću i salinitet (prema potrebi) trebalo bi mjeriti u kontrolnoj posudi (kontrolnim posudama) i jednoj od posuda. Ako se upotrebljavaju dvije koncentracije ili više njih, ti se parametri mjere pri višoj (ili najvišoj) koncentraciji. Otopljeni kisik i salinitet (prema potrebi) trebalo bi mjeriti najmanje tri puta, na početku, oko sredine i na kraju razdoblja apsorpcije te jedanput tjedno u razdoblju izlučivanja. TOC bi trebalo mjeriti na početku ispitivanja (24 sata i 48 sati prije početka faze apsorpcije) prije uvođenja riba i najmanje jedanput tjedno u fazi apsorpcije i izlučivanja. Temperaturu bi trebalo mjeriti i evidentirati svakodnevno, pH-vrijednost na početku i kraju svakog razdoblja, a tvrdoću jedanput tijekom ispitivanja. Temperaturu bi, po mogućnosti, trebalo neprekidno pratiti u najmanje jednoj posudi. Uzorkovanje i analiza riba i vode Raspored uzorkovanja riba i vode Uzorke vode iz ispitnih komora za određivanje koncentracije ispitivane tvari trebalo bi uzimati prije uvođenja riba te tijekom faze apsorpcije i izlučivanja. Vodu bi trebalo uzorkovati prije hranjenja, istovremeno s uzorkovanjem riba. Češćim bi se uzorkovanjem moglo osigurati stabilne koncentracije nakon uvođenja riba. Tijekom faze apsorpcije trebalo bi utvrditi koncentracije ispitivane tvari radi provjere usklađenosti s kriterijima valjanosti (stavak 24.). Činjenicu da su analize uzorka vode na početku faze izlučivanja pokazale da nije uočena ispitivana tvar moguće je iskoristiti kao opravdanje za neprovođenje mjerenja ispitne i kontrolne vode u pogledu ispitivane tvari tijekom preostalog dijela faze izlučivanja. Ribe bi trebalo uzorkovati s obzirom na prisutnost ispitivane tvari u najmanje pet navrata tijekom faze apsorpcije i u najmanje četiri navrata tijekom faze izlučivanja. Budući da je u pojedinim slučajevima na temelju tog broja uzoraka teško napraviti dovoljno preciznu procjenu vrijednosti BCF-a (posebno ako ne vrijedi jednostavna kinetika apsorpcije i izlučivanja prvog reda), preporučuje se češće uzimanje uzoraka u oba razdoblja (vidjeti Dodatak 4.). Sadržaj lipida trebalo bi utvrditi na istom biološkom materijalu koji se upotrebljava za utvrđivanje koncentracije ispitivane tvari barem na početku i kraju faze apsorpcije te na kraju faze izlučivanja. Ako to nije izvedivo, trebalo bi uzorkovati najmanje tri zasebne ribe kako bi se utvrdio sadržaj lipida u svakoj od triju istovjetnih vremenskih točaka. Broj riba po akvariju na početku pokusa trebalo bi prilagoditi na odgovarajući način (49). Druga je mogućnost, ako nisu uočene znatne količine ispitivane tvari kod kontrolnih riba (odnosno riba iz matične populacije), analizirati kontrolne ribe iz ispitivanja samo radi utvrđivanja sadržaja lipida, a analiza ispitivane tvari u ispitnoj skupini ili skupinama (kao i povezana konstanta brzine apsorpcije, konstanta brzine izlučivanja i vrijednosti BCF-a) može se ispraviti u odnosu na promjene u skladu sa sadržajem lipida kod kontrolne skupine tijekom ispitivanja (50). Uginule ili bolesne ribe ne bi trebalo analizirati na koncentraciju ispitivane tvari ili lipida. Primjer prihvatljivog rasporeda uzorkovanja prikazan je u Dodatku 4. Druge je rasporede lako izračunati upotrebom drugih pretpostavljenih vrijednosti K OW radi izračuna vremena izlaganja za apsorpciju od 95 % (izračuni su dostupni u Dodatku 5.). Uzorkovanje bi trebalo nastaviti tijekom faze apsorpcije dok se ne postigne stabilno stanje (vidjeti Dodatak 1., definicije i jedinice) ili, ako se ono ne postigne, prekida faze apsorpcije (nakon 28 ili 60 dana, vidjeti stavke 37. i 38.). Prije početka faze izlučivanja ribe je potrebno premjestiti u čiste posude. Uzorkovanje i priprema uzoraka Uzorke vode potrebno je uzeti za analizu, na primjer, isisavanjem kroz inertnu cijev iz središta ispitne komore. Čini se da se ni filtracijom ni centrifugiranjem ne uspijeva uvijek odvojiti dio ispitivane tvari koji nije bioraspoloživ od onog koji je bioraspoloživ. Ako se primjenjuje tehnika odvajanja, u izvješću o ispitivanju uvijek bi trebalo navesti opravdanje za tehniku odvajanja ili je validirati, uzimajući u obzir poteškoće u pogledu bioraspoloživosti (25.). Posebno u slučaju izrazito hidrofobnih tvari (odnosno onih tvari čija je vrijednost log K OW > 5) (12., 26.), kod kojih bi moglo doći do adsorpcije u matricu filtra ili spremnike za centrifugiranje, uzorke ne bi trebalo podvrgnuti tim tretiranjima. Umjesto toga trebalo bi akvarije održavati što je moguće čišćima (vidjeti stavak 46.), a sadržaj ukupnog organskog ugljika trebalo bi pratiti tijekom faze apsorpcije i faze izlučivanja (vidjeti stavak 53.). Kako bi se izbjegli mogući problemi sa smanjenom bioraspoloživošću, moguće je upotrijebiti tehnike uzorkovanja mikroekstrakcijom iz krute faze u slučaju slabo topljivih tvari i izrazito hidrofobnih tvari. Uzorkovane ribe trebalo bi eutanizirati bez odlaganja, primjenom najprimjerenije humane metode (kod mjerenja cijelih riba ne bi trebalo provoditi nikakve postupke osim ispiranja vodom (vidjeti stavak 28.) i sušenja upijajućim materijalom). Ribe se važe te se mjeri ukupna dužina (51). Kod svake pojedinačne ribe izmjerenu masu i dužinu trebalo bi povezati s koncentracijom analizirane tvari (i, prema potrebi, sadržajem lipida), na primjer upotrebom koda jedinstvenog identifikatora za svaku uzorkovanu ribu. Ribe i vodu treba po mogućnosti analizirati odmah nakon uzorkovanja kako bi se spriječila razgradnja i drugi gubici te kako bi se još dok ispitivanje traje mogle izračunati približne konstante brzine apsorpcije i izlučivanja. Osim toga, ako se analiza provede odmah, izbjegava se kašnjenje u određivanju platoa (stabilnog stanja). Ako se analiza ne obavi odmah, uzorke je potrebno uskladištiti primjerenom metodom. Prije početka ispitivanja potrebno je dobiti informacije o ispravnoj metodi skladištenja za određenu ispitivanu tvar, na primjer, duboko zamrzavanje, čuvanje pri temperaturi od 4 °C, ekstrakcija itd. Trajanje skladištenja određuje se tako da se osigura da se tvar ne razgradi tijekom skladištenja. Kvaliteta analitičke metode Budući da čitav postupak uglavnom ovisi o točnosti, preciznosti i osjetljivosti analitičke metode koja se primjenjuje u odnosu na ispitivanu tvar, potrebno je pokusima provjeriti jesu li točnost, preciznost i obnovljivost analize tvari te izdvajanje ispitivane tvari iz vode i ribe zadovoljavajući za određenu metodu. To bi trebao biti sastavni dio preliminarnih ispitivanja. Također je potrebno potvrditi da ispitivana tvar nije prisutna u vodi za razrjeđivanje koja se upotrebljava. Ako je potrebno, ispravljaju se vrijednosti koncentracije ispitivane tvari u vodi i ribi dobivene iz ispitivanja u odnosu na izdvojenu tvar i pozadinske vrijednosti kontrola. Pri rukovanju uzorcima riba i vode potrebno je stalno voditi računa o tome da se onečišćenje i gubici (npr. uslijed adsorpcije uređajem za uzorkovanje) svedu na najmanju moguću mjeru. Analiza uzoraka riba Ako se u ispitivanju upotrebljavaju radioaktivno obilježeni materijali, uzorke je moguće analizirati na ukupnu radioaktivnu oznaku (tj. polazna tvar i metaboliti) ili pročistiti tako da se polazni spoj može analizirati zasebno. Ako je vrijednost BCF-a potrebno temeljiti na polaznoj tvari, trebalo bi zabilježiti najvažnije metabolite, barem na kraju faze apsorpcije (vidjeti stavak 6.). Najvažniji su metaboliti oni koji čine ≥ 10 % ukupnih ostataka u tkivima riba, oni koji čine ≥ 5 % na dvije uzastopne točke uzorkovanja, oni kod kojih je uočeno povećanje razina tijekom faze apsorpcije i oni koji su toksikološki značajni. Ako BCF za cijelu ribu u smislu ukupnih radioaktivno obilježenih ostataka iznosi ≥ 500, savjetuje se, a u slučaju određenih kategorija tvari poput pesticida svesrdno preporučuje, identificirati i kvantificirati najvažnije metabolite. Određena regulatorna tijela mogla bi zahtijevati kvantifikaciju tih metabolita. Ako se identificiraju i kvantificiraju proizvodi razgradnje koji čine ≥ 10 % ukupnih radioaktivno obilježenih ostataka u ribljim tkivima, preporučuje se da se ti proizvodi razgradnje identificiraju i kvantificiraju i u ispitnoj vodi. Ako to nije izvedivo, u izvješću je potrebno navesti objašnjenje. Koncentraciju ispitivane tvari obično bi trebalo odrediti za svaku pojedinačnu izvaganu ribu. Ako to nije moguće, može se udružiti uzorke pri svakom uzorkovanju, ali udruživanjem se ograničavaju statistički postupci koje se može primijeniti na podatke pa je u ispitivanje potrebno uključiti odgovarajući broj riba za izvršavanje željenog udruživanja, statistički postupak i snagu. Kao uvod u relevantne postupke udruživanja može se pogledati literaturu (27. i 28.). Vrijednost BCF-a trebalo bi izraziti kao normiranu za ribu sa sadržajem lipida od 5 % (na temelju mokre mase) uz onu dobivenu izravno iz ispitivanja (vidjeti stavak 21.), osim ako se može dokazati da se ispitivana tvar ne akumulira prvenstveno u lipidima. Sadržaj lipida u ribi trebalo bi, kad god postoje uvjeti za to, utvrđivati pri svakom uzorkovanju, po mogućnosti na istom ekstraktu kao onome koji je dobiven za analizu ispitivane tvari jer je lipide često potrebno ukloniti iz ekstrakta prije kromatografske analize. Međutim, za analizu ispitivanih tvari često su potrebni posebni postupci ekstrakcije koji mogu biti protivni ispitnim metodama za utvrđivanje lipida. U tom se slučaju (dok ne budu dostupne odgovarajuće nedestruktivne instrumentalne metode) preporučuje primjena drukčije strategije za utvrđivanje sadržaja lipida u ribi (vidjeti stavak 56.). Za utvrđivanje sadržaja lipida potrebno je upotrebljavati prikladne metode (20.). Tehnika ekstrakcije kloroformom/metanolom (29.) može se preporučiti kao standardna metoda (30.), ali kao alternativna metoda preporučuje se Smedesova metoda (31.). Potonju metodu odlikuje usporediva učinkovitost ekstrakcije, visoka razina točnosti, upotreba manje toksičnih organskih otapala i jednostavnost provedbe. Moguće je primijeniti i druge metode kod kojih je točnost veća nego kod preporučenih metoda, ako se tu primjenu opravda na odgovarajući način. Važno je navesti pojedinosti o primijenjenoj metodi. Mjerenje rasta riba Na početku ispitivanja potrebno je pojedinačno izvagati pet do deset riba iz matične populacije te izmjeriti njihovu ukupnu dužinu. To mogu biti iste ribe koje su upotrijebljene za analizu lipida (vidjeti stavak 56.). Masu i dužinu riba koje su upotrijebljene za svako uzorkovanje iz ispitnih i kontrolnih skupina trebalo bi mjeriti prije provođenja kemijske analize ili analize lipida. Mjerenjem tih uzorkovanih riba moguće je procijeniti masu i dužinu riba preostalih u ispitnom i kontrolnom akvariju (vidjeti stavak 45.). PODACI I IZVJEŠĆIVANJE Obrada rezultata Krivulju apsorpcije ispitivane tvari trebalo bi dobiti grafičkim prikazom njezine koncentracije u/na ribi (ili navedenim tkivima) u fazi apsorpcije u odnosu na vrijeme na aritmetičkoj skali. Ako krivulja dosegne plato, odnosno postane približno asimptotična u odnosu na vremensku os, vrijednosti BCF-a u stabilnom stanju (BCFSS) trebalo bi izračunati na sljedeći način:
Na promjenu vrijednosti C f može utjecati rast riba (vidjeti stavke 72. i 73.). Na prosječnu koncentraciju pri izlaganju (Cw ) utječe varijacija tijekom vremena. Može se očekivati da vremenski ponderirana prosječna koncentracija bude važnija i preciznija za ispitivanja bioakumulacije, čak i ako se varijacija nalazi unutar odgovarajućeg raspona valjanosti (vidjeti stavak 24.). Vremenski ponderirana prosječna koncentracija u vodi može se izračunati u skladu s Dodatkom 5. odjeljkom 1. Kinetički faktor biokoncentracije (BCFK) trebalo bi utvrđivati kao omjer vrijednosti k 1/k 2, dviju konstanti brzine kinetike prvog reda. Konstante brzine k 1 i k 2 te vrijednost BCFK mogu se dobiti istovremenom prilagodbom faze apsorpcije i faze izlučivanja. Druga je mogućnost sekvencijalno utvrđivanje k 1 i k 2 (opis i usporedba tih metoda navedeni su u Dodatku 5.) Konstanta brzine izlučivanja (k 2) možda će trebati biti ispravljena u odnosu na razrjeđenje zbog rasta (vidjeti stavke 72. i 73.). Ako je očito da krivulja apsorpcije i/ili izlučivanja nije prvog reda, trebalo bi primijeniti složenije modele (vidjeti literaturu u Dodatku 5.) i potražiti savjet biostatističara i/ili farmakokinetičara. Podaci o masi/dužini riba Mokre mase pojedinačnih riba i njihove ukupne dužine u svim intervalima uzorkovanja iskazuju se odvojeno za ispitne i kontrolne skupine tijekom faza apsorpcije (uključujući matičnu populaciju na početku apsorpcije) i izlučivanja. Kod svake pojedinačne ribe izmjerenu masu i dužinu trebalo bi povezati s koncentracijom analizirane kemikalije, na primjer upotrebom koda jedinstvenog identifikatora za svaku uzorkovanu ribu. Za utvrđivanje rasta u svrhu ispravljanja vrijednosti kinetičkog BCF-a u odnosu na razrjeđivanje zbog rasta prednost se daje masi (vidjeti stavak 73. i Dodatak 5. za metodu koja se upotrebljava za ispravljanje podataka o razrjeđenju zbog rasta). Ispravljanje razrjeđenja zbog rasta i normiranje lipida Zbog rasta riba tijekom faze izlučivanja može doći do snižavanja koncentracija mjerene kemikalije u ribama što za posljedicu ima povećanje konstante brzine izlučivanja (k 2) veće od onog do kojeg bi došlo samo u postupcima uklanjanja (npr. disanje, metabolizam, izlučivanje). Kinetičke faktore biokoncentracije trebalo bi ispraviti u odnosu na razrjeđenje zbog rasta. Na vrijednost BCFSS isto će tako utjecati rast, ali ne postoji dogovoren postupak za ispravljanje vrijednosti BCFSS u odnosu na rast. U slučaju znatnog rasta trebalo bi utvrditi i vrijednost BCFK ispravljenu u odnosu na rast (BCFKg) jer ona može biti važnija mjera faktora biokoncentracije. Sadržaj lipida u ispitnim ribama (koji je u znatnoj mjeri povezan s bioakumulacijom hidrofobnih tvari) može u praksi varirati toliko da je potrebno normirati utvrđen sadržaj lipida u ribi (5 % mokre mase) kako bi i kinetički faktor biokoncentracije i faktor biokoncentracije u stabilnom stanju bili predstavljeni na značajan način, osim ako se može dokazati da se ispitivana tvar ne akumulira ponajprije u lipidima (npr. određene perfluorirane tvari mogu se vezati uz proteine). Jednadžbe i primjeri za te izračune dostupni su u Dodatku 5. Kako bi se kinetički BCF ispravio u odnosu na razrjeđenje zbog rasta, konstantu brzine izlučivanja potrebno je ispraviti u odnosu na rast. Tu se konstantu brzine izlučivanja ispravljenu u odnosu na rast (k 2g) izračunava oduzimanjem konstante brzine rasta (kg, dobiven iz podataka o izmjerenoj masi) od ukupne konstante brzine izlučivanja (k 2). Kinetički faktor biokoncentracije ispravljen u odnosu na rast tada se izračunava dijeljenjem konstante brzine apsorpcije (k 1) s konstantom brzine izlučivanja ispravljenom u odnosu na rast (k 2g) (vidjeti Dodatak 5.). U nekim je slučajevima taj pristup neprikladan. Na primjer, kod tvari koje se izlučuju vrlo polako i ispituju u ribama koje brzo rastu, dobivena vrijednost k 2g može biti vrlo mala pa pogreška u dvjema konstantama brzina upotrijebljenima za dobivanje te vrijednosti postaje kritična te u nekim slučajevima procijenjena vrijednost k g može biti viša od vrijednosti k 2. U drugom se pristupu, kojim se zaobilazi potreba za ispravljanjem u odnosu na razrjeđenje zbog rasta, upotrebljavaju podaci o masi izlučene ispitivane tvari po ribi (na temelju cijele ribe), a ne uobičajeni podaci o masi ispitivane tvari po jediničnoj masi ribe (koncentracija). To je lako postići jer bi se u okviru ispitivanja u skladu s ovom ispitnom metodom trebale povezivati zabilježene koncentracije u tkivu s masama pojedinačnih riba. Jednostavan postupak za to opisan je u Dodatku 5. Treba napomenuti da bi o vrijednosti k 2 trebalo izvijestiti čak i ako se upotrebljava ovaj alternativni pristup. O faktorima kinetičke biokoncentracije i biokoncentracije u stabilnom stanju trebalo bi izvijestiti i u odnosu na zadani sadržaj lipida u ribi od 5 % (mokra masa), osim ako se može dokazati da se ispitivana tvar ne akumulira ponajprije u lipidima. Podaci o koncentraciji u ribama ili vrijednost BCF-a normiraju se u skladu s omjerom između 5 % i stvarnog (pojedinačnog) prosječnog sadržaja lipida (u % mokre mase) (vidjeti stavak 5.). Ako kemijska analiza i analiza lipida nisu provedene na istoj ribi, normirane podatke o pojedinačnom sadržaju lipida u ribi trebalo bi upotrijebiti za izračun vrijednosti BCF-a normirane u odnosu na lipide. Druga je mogućnost, ako je rast kontrolnih i izloženih riba sličan, upotrijebiti samo sadržaj lipida u kontrolnim ribama za ispravljanje lipida (vidjeti stavak 56.). Metoda izračunavanja vrijednosti BCF-a normirane u odnosu na lipide opisana je u Dodatku 5. Tumačenje rezultata Rezultate je potrebno tumačiti s oprezom ako se izmjerene koncentracije ispitnih otopina kreću u blizini granice detekcije analitičke metode. Prosječan se rast u ispitnim i kontrolnim skupinama u načelu ne bi trebao znatno razlikovati kako bi se isključili toksični učinci. Konstante brzine rasta ili krivulje rasta tih dviju skupina trebalo bi usporediti s pomoću odgovarajućeg postupka (52)). Jasno definirane krivulje apsorpcije i izlučivanja ukazuju na dobru kvalitetu podataka o biokoncentraciji. Za konstante brzine rezultati χ2 testa prikladnosti trebali bi ukazivati na dobru razinu prikladnosti (odnosno, na niski postotak pogrešaka u mjerenju (32.)) modela bioakumulacije kako bi se konstante brzine mogle smatrati pouzdanima (vidjeti Dodatak 5.). Ako se upotrebljava više od jedne ispitne koncentracije, razlike u konstantama apsorpcije/izlučivanja između ispitnih koncentracija trebale bi iznositi manje od 20 % (53). U suprotnome bi se mogla utvrditi ovisnost o koncentraciji. Ako se uoče značajne razlike u konstantama brzine apsorpcije/izlučivanja između primijenjenih ispitnih koncentracija, to treba zabilježiti i dati moguća objašnjenja. Općenito se granica pouzdanosti od 95 % vrijednosti BCF-ova kod dobro strukturiranih ispitivanja nalazi blizu ±20 % izvedenog BCF-a. Ako se ispituju dvije koncentracije ili više njih, provjerava se dosljednost rezultata za obje ili sve koncentracije te utvrđuje postoji li ovisnost o koncentraciji. Ako se ispituje samo jedna koncentracija radi smanjene upotrebe životinja i/ili sredstava, to bi trebalo opravdati. Dobiveni BCFSS dvojben je ako je vrijednost BCFK znatno veća od vrijednosti BCFSS jer to može ukazivati na činjenicu da nije postignuto stabilno stanje ili da nisu uzeti u obzir razrjeđenje zbog rasta i procesi kojima nastaju gubici. U slučajevima kad je vrijednost BCFSS mnogo viša od vrijednosti BCFK, potrebno je provjeriti postoje li pogreške u dobivenim konstantama brzine apsorpcije i izlučivanja te ih ponovno izračunati. Različitim bi se postupkom prilagođavanja moglo bolje procijeniti vrijednost BCFK (vidjeti Dodatak 5.). Izvješće o ispitivanju Osim informacija o ispitivanoj tvari navedenih u stavku 3., u izvješće o ispitivanju uključuju se i informacije u nastavku.
C.13. – II. Skraćeno ispitivanje riba vodenim izlaganjem UVOD Iz sve većeg iskustva koje su laboratoriji i regulatorna tijela stekli u provođenju i tumačenju potpunog ispitivanja vidljivo je da, uz određene iznimke, za procjenjivanje konstanti stopa apsorpcije i izlučivanja vrijedi kinetika prvog reda. Stoga je konstante stopa apsorpcije i izlučivanja moguće procijeniti uz minimalan broj točki uzorkovanja te dobiti kinetički BCF. Početna je svrha istraživanja alternativnih planova za ispitivanje vrijednosti BCF-a bila razvoj neopsežnog ispitivanja koje je moguće primijeniti u međukoraku ispitivanja radi pobijanja ili potvrđivanja procjena vrijednosti BCF-a na temelju vrijednosti K OW i alata QSAR te time ukloniti potrebu za potpunim ispitivanjem brojnih tvari te postići smanjenje troškova i upotrebe životinja zahvaljujući smanjenju broja uzoraka i slijedova analize koji se provode. Uz to što se slijedio glavni plan prethodne ispitne metode radi omogućivanja integracije ispitnih rezultata s postojećim podacima o vrijednosti BCF-a, a radi pojednostavnjenja provođenja ispitivanja i tumačenja podataka, cilj je bio pružiti procjene vrijednosti BCF-a odgovarajuće točnosti i preciznosti kako bi se mogle donositi odluke u pogledu procjene rizika. Primjenjuju se brojna ista razmatranja kao u potpunom ispitivanju, na primjer kriteriji valjanosti (vidjeti stavak 24.) i zaustavljanje ispitivanja ako se na kraju faze apsorpcije zaključi da je apsorpcija bila neznatna (vidjeti stavke 16. i 38.). Tvari koje bi ispunjivale uvjete za skraćeno ispitivanje trebale bi pripadati općoj domeni za koju je ta ispitna metoda namijenjena, odnosno nepolarnim organskim tvarima (vidjeti stavak 49.). Ako postoje naznake da bi ispitivana tvar mogla reagirati drukčije (npr. jasno odstupanje od kinetike prvog reda), u regulatorne bi svrhe trebalo provesti potpuno ispitivanje. Uobičajeno trajanje skraćenog ispitivanja nije kraće od trajanja standardnog ispitivanja vrijednosti BCF-a, ali je u njega uključeno manje uzorkovanja riba (obrazloženje se nalazi u Dodatku 6.) Međutim, razdoblje izlučivanja može se skratiti kod tvari koje se brzo izlučuju kako bi se izbjeglo da koncentracije u ribama padnu ispod granice detekcije/kvantifikacije prije kraja ispitivanja. Skraćeno ispitivanje izloženosti riba s jednom koncentracijom može se upotrijebiti kako bi se utvrdilo postoji li potreba za potpunim ispitivanjem, a ako su dobiveni podaci upotrijebljeni za izračunavanje konstanti stopa i BCF-a dobro utemeljeni (vidjeti stavak 93.) moguće je odustati od provođenja potpunog ispitivanja ako je dobiveni BCF daleko od zabrinjavajućih vrijednosti u smislu regulatornih zahtjeva. U određenim bi slučajevima moglo biti korisno provesti skraćeni plan ispitivanja s više od jedne ispitne koncentracije kao preliminarno ispitivanje kojim se utvrđuje ovise li procjene vrijednosti BCF-a za određenu tvar o koncentraciji. Ako se utvrdi da procjene vrijednosti BCF-a iz skraćenog ispitivanja ovise o koncentraciji, bit će potrebno provesti potpuno ispitivanje. Ako se na temelju tog skraćenog ispitivanja utvrdi da procjene vrijednosti BCF-a ne ovise o koncentraciji, ali se te rezultate ne smatra konačnima, može se provesti naknadno potpuno ispitivanje s jednom koncentracijom, time umanjujući upotrebu životinja u usporedbi s potpunim ispitivanjem s dvije koncentracije (ili više njih). Tvari koje bi mogle ispunjavati uvjete za skraćeno ispitivanje trebale bi:
RASPORED UZORKOVANJA ZA SKRAĆENA ISPITIVANJA Uzorkovanje riba Uzorkovanje riba svedeno je na četiri točke uzorkovanja:
Uzorkovanje vode U okviru skraćenog plana vodu se uzorkuje kao i u potpunom ispitivanju (vidjeti stavak 54.) ili u najmanje pet navrata ravnomjerno raspoređenih tijekom faze apsorpcije te na tjednoj osnovi u fazi izlučivanja. Izmjene plana Uzimajući u obzir svojstva ispitivane tvari, valjana predviđanja iz alata QSAR i točnu svrhu ispitivanja, mogu se razmotriti određene izmjene plana ispitivanja:
Izračuni Ovaj se pristup opravdava činjenicom da je faktor biokoncentracije u potpunom ispitivanju moguće utvrditi kao faktor biokoncentracije u stabilnom stanju (BCFSS) izračunavanjem omjera koncentracije ispitivane tvari u tkivu ribe u odnosu na koncentraciju ispitivane tvari u vodi, ili izračunavanjem kinetičkog faktora biokoncentracije (BCFK) kao omjera konstante brzine apsorpcije k 1 u odnosu na konstantu brzine izlučivanja k 2. Vrijednost BCFK valjana je čak i ako se tijekom faze apsorpcije ne postigne koncentracija tvari u stabilnom stanju, pod uvjetom da se faze apsorpcije i izlučivanja odvijaju u skladu s procesima kinetike prvog reda. Potrebne su najmanje dvije podatkovne točke kako bi se procijenile konstante stope apsorpcije i izlučivanja, jedna na kraju faze apsorpcije (odnosno na početku faze izlučivanja) i jedna na kraju (ili nakon znatnog dijela) faze izlučivanja. Srednja točka uzorkovanja preporučuje se radi provjere kinetike apsorpcije i izlučivanja (57). Za izračun vidjeti dodatke 5. i 6. Tumačenje rezultata Kako bi se procijenile valjanost i informacijska vrijednost ispitivanja, provjerava se prelazi li razdoblje izlučivanja jedan poluvijek. Isto tako, vrijednost BCFKm (kinetički BCF dobiven iz skraćenog ispitivanja) trebalo bi usporediti s vrijednošću BCFSS iz skraćenog ispitivanja (vrijednost BCFSS izračunana na kraju faze apsorpcije, pod pretpostavkom da je postignuto stabilno stanje. To je moguće samo pretpostaviti jer dokazivanje nije moguće zbog nedovoljnog broja točki uzorkovanja). Ako je BCFKm < BCFSS iz skraćenog ispitivanja, vrijednosti BCFSS iz skraćenog ispitivanja trebalo bi dati prednost. Ako BCFKm iznosi manje od 70 % vrijednosti BCFSS iz skraćenog ispitivanja, rezultati nisu valjani i trebalo bi provesti potpuno ispitivanje. Ako se iz skraćenog ispitivanja dobije vrijednost BCFKm koja predstavlja razlog za zabrinutost u smislu regulatornih zahtjeva, trebalo bi provesti potpuno ispitivanje. Ako je rezultat daleko od zabrinutosti u smislu regulatornih zahtjeva (znatno iznad ili ispod), potpuno ispitivanje možda neće biti potrebno ili će biti moguće provesti potpuno ispitivanje s jednom koncentracijom ako se to zahtijeva relevantnim regulatornim okvirom. Ako se utvrdi da je potpuno ispitivanje potrebno nakon skraćenog ispitivanja s jednom koncentracijom, može ga se provesti s drugom koncentracijom. Ako su rezultati dosljedni, može se odustati od daljnjeg potpunog ispitivanja pri različitoj koncentraciji jer se ne očekuje da će biokoncentracija tvari ovisiti o koncentraciji. Ako je skraćeno ispitivanje provedeno s dvije koncentracije te rezultati nisu ukazivali na ovisnost o koncentraciji, potpuno ispitivanje moguće je provesti sa samo jednom koncentracijom (vidjeti stavak 87.). Izvješće o ispitivanju U izvješće o ispitivanju za skraćeno ispitivanje trebale bi biti uključene sve informacije potrebne za potpuno ispitivanje (vidjeti stavak 81.), osim onih koje nije moguće obrazložiti (npr. krivulja koja pokazuje vrijeme potrebno za postizanje stabilnog stanja i faktor biokoncentracije u stabilnom stanju; za potonji bi trebalo navesti vrijednost BCFSS iz skraćenog ispitivanja). Nadalje, trebalo bi navesti i razlog za upotrebu skraćenog ispitivanja i vrijednosti BCFKm koja je iz njega proizišla. C.13. – III. Ispitivanje bioakumulacije u ribama izlaganjem kroz hranu UVOD Metodu opisanu u ovom odjeljku trebalo bi upotrebljavati za tvari kod kojih nije izvediva metodologija vodenog izlaganja (na primjer zbog toga što nije moguće održati stabilne, mjerljive koncentracije u vodi ili postići odgovarajuća tjelesna opterećenja unutar 60 dana izlaganja; vidjeti prethodne odjeljke o metodi vodenog izlaganja). Ipak, potrebno je naglasiti da će krajnji rezultat ovog ispitivanja biti faktor biomagnifikacije kroz hranu (BMF), a ne faktor biokoncentracije (BCF) (58). Na konferenciji organizacije SETAC Europe održanoj u Madridu u svibnju 2001. predstavljena je nova metoda za ispitivanje bioakumulacije organskih tvari koje su slabo topljive u vodi (36.). Taj se rad temelji na različitim ispitivanjima bioakumulacije dostupnima u literaturi u kojima je upotrijebljena metoda doziranja koja uključuje hranu s dodatkom (spiked feed) (npr. 37.). Početkom 2004. radnoj skupini EU-a za tvari s postojanim, bioakumulativnim i otrovnim svojstvima dostavljen je nacrt protokola (38.) osmišljenog za mjerenje potencijala bioakumulacije organskih tvari koje su slabo topljive u vodi i za koje nije moguće provesti standardnu metodu ispitivanja biokoncentracije vodenim izlaganjem, zajedno s popratnim dokumentom (39.). Dodatno je pojašnjenje za tu metodu bilo da do potencijalne izloženosti okoliša takvim tvarima slabe topljivosti (odnosno čija je vrijednost log K OW > 5) uglavnom može doći kroz hranu (vidjeti 40., 41., 42., 43., 44.). Stoga se na ispitivanja izlaganjem kroz hranu upućuje u određenim objavljenim uredbama o kemikalijama (59). Međutim, potrebno je naglasiti da se u metodi koja se ovdje opisuje pažljivo izbjegava izlaganje kroz vodenu fazu te se stoga vrijednost BMF-a iz ove ispitne metode ne može izravno usporediti s vrijednošću BMF-a iz terenskih ispitivanja (u kojima je moguće kombinirati vodeno izlaganje i izlaganje kroz hranu). Ovaj se odjeljak trenutačne ispitne metode temelji na protokolu (38.) te je riječ o novoj metodi koja nije objavljena u prethodnoj verziji ispitne metode C.13. Ovim se alternativnim ispitivanjem omogućuje izravno istraživanje puta izlaganja kroz hranu u kontroliranim laboratorijskim uvjetima. Potencijalni istraživači trebali bi konzultirati stavke od 1. do 14. ove ispitne metode kako bi saznali kad se ispitivanju izlaganjem kroz hranu daje prednost nad ispitivanjem vodenim izlaganjem. Navedene su informacije o različitim razmatranjima u pogledu tvari te bi ih trebalo uzeti u obzir prije provođenja ispitivanja. Upotreba radioaktivno obilježenih ispitivanih tvari može se uzeti u obzir uz slična razmatranja kao i kod metode vodenog izlaganja (vidjeti stavke 6. i 65.). Metoda izlaganja kroz hranu može se upotrijebiti kako bi se ispitalo više od jedne tvari u jednom ispitivanju, pod uvjetom da su ispunjeni određeni kriteriji; njih se dodatno istražuje u stavku 112. U svrhu pojednostavnjenja, u ovoj se metodologiji opisuje ispitivanje upotrebom samo jedne ispitivane tvari. Ispitivanje izloženošću kroz hranu u mnogočemu je slično metodi vodenog izlaganja, uz očitu iznimku načina izlaganja. Stoga se brojni aspekti metode koja je ovdje opisana preklapaju s metodom vodenog izlaganja opisanom u prethodnom odjeljku. U najvećoj su mogućoj mjeri omogućena upućivanja na relevantne stavke prethodnog odjeljka, ali u interesu čitljivosti i razumijevanja neophodan je određeni stupanj ponavljanja. NAČELO ISPITIVANJA Mogu se primijeniti protočni ili polustatički uvjeti (vidjeti stavak 4.); protočni se uvjeti preporučuju radi ograničavanja potencijalne izloženosti ispitivane tvari putem vode kao posljedica desorpcije iz hrane s dodatkom ili izmeta. Ispitivanjem su obuhvaćene dvije faze: apsorpcija (hrana s dodatkom ispitivane tvari) i izlučivanje (čista, neobrađena hrana) (vidjeti stavak 16.). U fazi apsorpcije ‚ispitnu’ skupinu riba svakodnevno se hrani utvrđenim obrocima komercijalne hrane za ribe poznatog sastava s dodatkom ispitivane tvari. Ribe bi, po mogućnosti, trebale pojesti svu hranu koja im je ponuđena (vidjeti stavak 141.). Zatim se, u fazi izlučivanja, ribama daje čista, neobrađena komercijalna hrana za ribe. Kao i kod metode vodenog izlaganja, moguće je, prema potrebi, upotrijebiti više od jedne ispitne skupine s različitim koncentracijama dodane ispitivane tvari, ali za većinu je izrazito hidrofobnih organskih ispitivanih tvari dovoljna jedna ispitna skupina (vidjeti stavke 49. i 107.). Ako se upotrebljavaju polustatički uvjeti, ribe bi trebalo premjestiti u novi medij i/ili novu ispitnu komoru na kraju faze apsorpcije (u slučaju da su medij i/ili oprema koji su upotrijebljeni u fazi apsorpcije kontaminirani ispitivanom tvari putem ispiranja). Koncentracije ispitivane tvari u ribama mjere se u objema fazama ispitivanja. Uz skupinu riba koje se hrani hranom s dodatkom (ispitna skupina), u istim se uvjetima drži i kontrolna skupina riba te ih se hrani na isti način, ali njihovoj se komercijalnoj hrani za ribe ne dodaje ispitivana tvar. Tom se kontrolnom skupinom omogućuje dobivanje temeljnih razina ispitivane tvari koje je potrebno kvantificirati kod neizloženih riba i koje služe za usporedbu svih štetnih posljedica vezanih uz tretiranje koje su uočene u ispitnoj skupini (skupinama) (60). Omogućuje se i usporedba konstanti brzine rasta između skupina kao provjera toga jesu li konzumirane slične količine ponuđene hrane (moguće razlike u okusu hrana isto bi tako trebalo uzeti u obzir u obrazloženju različitih konstanti brzine rasta; vidjeti stavak 138.). Važno je da se ispitne i kontrolne skupine tijekom faza apsorpcije i izlučivanja hrani obrocima koji su istovrijedni u smislu hranjivosti. Na temelju iskustva stručnjaka koji su razvili metodu zaključeno je da je uobičajeno dovoljna faza apsorpcije koja traje od 7 do 14 dana (38., 39.). Zahvaljujući tom rasponu trebali bi se smanjiti troškovi provođenja ispitivanja, istovremeno osiguravajući dostatno izlaganje za većinu tvari. Međutim, u određenim je slučajevima moguće produžiti fazu apsorpcije (vidjeti stavak 127.). Tijekom faze apsorpcije koncentracija tvari u ribi možda neće postići stabilno stanje pa se obrada podataka i rezultati iz te metode uglavnom temelje na kinetičkoj analizi ostataka u tkivu. (Napomena: Jednadžbe za procjenu vremena potrebnog za postizanje stabilnog stanja ovdje se mogu primijeniti na isti način kao u ispitivanju vodenim izlaganjem, vidjeti Dodatak 5.). Faza izlučivanja započinje kad se ribe prvi put hrani hranom bez dodatka, a uobičajeno traje najviše 28 dana ili do trenutka kad više nije moguće kvantificirati ispitnu tvar u cijeloj ribi, ovisno o tome što nastupi prije. Faza izlučivanja može se skratiti ili je se može produžiti na dulje od 28 dana, ovisno o promjenama do kojih s vremenom dođe u izmjerenim koncentracijama kemikalije i veličini riba. Tom se metodom omogućuje utvrđivanje poluvijeka vezanog uz tvar (t 1/2, iz konstante stope izlučivanja, k 2), učinkovitosti asimilacije (apsorpcija u cijeloj utrobi; a), kinetičkog faktora biomagnifikacije kroz hranu (BMFK), kinetičkog faktora biomagnifikacije kroz hranu ispravljenog u odnosu na rast (BMFKg) te kinetičkog faktora biomagnifikacije kroz hranu ispravljenog u odnosu na lipide (61) (BMFKL) (i/ili kinetičkog faktora biomagnifikacije kroz hranu ispravljenog u odnosu na rast i lipide, BMFKgL) za ispitivanu tvar u ribi. Kao i u metodi vodenog izlaganja povećanje mase riba tijekom ispitivanja za posljedicu će imati razrjeđenje ispitivane tvari u ribama koje rastu te će se zbog toga podcijeniti kinetički BMF ako ga se ne ispravi u odnosu na rast (vidjeti stavke 162. i 163.). Nadalje, ako se procijeni da je u fazi apsorpcije postignuto stabilno stanje, moguće je izračunati indikativnu vrijednost BMF-a u stabilnom stanju. Dostupni su pristupi zahvaljujući kojima je izvediva procjena kinetičkog faktora biokoncentracije (BCFK) na temelju podataka dobivenih iz ispitivanja kroz hranu (npr. 44., 45., 46., 47., 48.). Prednosti i nedostaci tih pristupa navedeni su u Dodatku 8. Ispitivanje je prije svega osmišljeno za slabo topljive nepolarne organske tvari koje približno prate kinetiku apsorpcije i izlučivanja prvog reda kod riba. Ako se ispituje tvar koja ne prati približno kinetiku apsorpcije i izlučivanja prvog reda, trebalo bi primijeniti složenije modele (vidjeti literaturu u Dodatku 5.) i potražiti savjet biostatističara i/ili farmakokinetičara. Vrijednost BMF uobičajeno se utvrđuje primjenom analize ispitivane tvari na cijeloj ribi (na temelju mokre mase). Ako je to relevantno za ciljeve ispitivanja, određena je tkiva (npr. mišiće, jetra) moguće uzorkovati ako se ribu podijeli u jestive i nejestive dijelove (vidjeti stavak 21.). Nadalje, moguće je ukloniti probavni trakt i zasebno ga analizirati kako bi se utvrdilo koliko su točke uzorkovanja na kraju faze apsorpcije i blizu početka faze izlučivanja pridonijele koncentracijama u cijeloj ribi, ili kao dio pristupa u kojem se primjenjuje bilanca mase. Sadržaj lipida u uzorkovanoj cijeloj ribi trebalo bi mjeriti tako da je moguće ispraviti koncentracije u odnosu na lipide, uzimajući u obzir sadržaj lipida u hrani i u ribi (vidjeti stavke 56. i 57. te Dodatak 7.). Trebalo bi mjeriti i evidentirati masu uzorkovanih jedinki te je povezati s analiziranom koncentracijom kemikalije za tu jedinku (npr. prijavljenu upotrebom koda jedinstvenog identifikatora za svaku uzorkovanu ribu) za potrebe izračuna rasta do kojeg bi moglo doći tijekom ispitivanja. Po mogućnosti bi trebalo izmjeriti i ukupnu dužinu ribe (62). Podaci o masi potrebni su i za procjenu vrijednosti BCF-a upotrebom podataka o izlučivanju dobivenih ispitivanjem kroz hranu. INFORMACIJE O ISPITIVANOJ TVARI Trebale bi biti dostupne informacije o ispitivanoj tvari kako su opisane u stavcima 3. i 22. Analitička metoda za koncentracije ispitivane tvari u vodi uobičajeno nije potrebna; potrebno je primijeniti metode koje su dovoljno osjetljive za mjerenje koncentracija u hrani za ribe i tkivu riba. Metoda se može upotrijebiti kako bi se ispitalo više od jedne tvari u jednom ispitivanju. Međutim, ispitivane tvari trebale bi biti međusobno kompatibilne na način kojim se osigurava da neće doći do interakcije ili promjene njihova kemijskog identiteta nakon što ih se doda hrani za ribe. Cilj je da se izmjereni rezultati za sve ispitivane tvari koje se ispituje zajedno ne razlikuju uvelike od rezultata do kojih bi došlo da su na svakoj ispitivanoj tvari provođena zasebna ispitivanja. Preliminarnim analizama trebalo bi utvrditi da je svaku tvar moguće izdvojiti iz hrane i uzorka tkiva ribe kojima je dodano više tvari uz i. visoku stopu izdvajanja (npr. > 85 % nazivne vrijednosti) i ii. osjetljivost potrebnu za ispitivanje. Ukupna doza tvari koje se ispituje zajedno trebala bi biti ispod kombinirane koncentracije zbog koje bi moglo doći do toksičnih učinaka (vidjeti stavak 51.). Nadalje, moguće štetne učinke u ribama i potencijal za interaktivne učinke (npr. metabolički učinci) povezane s istovremenim ispitivanjem više tvari trebalo bi uzeti u obzir u planu izvođenja pokusa. Trebalo bi izbjegavati istovremeno ispitivanje ionizirajućih tvari. U smislu izlaganja, metoda je primjenjiva i na složene smjese (vidjeti stavak 13., iako se primjenjuju ista ograničenja u analizi kao i u svim drugim metodama). VALJANOST ISPITIVANJA Da bi ispitivanje bilo valjano, treba zadovoljiti sljedeće uvjete (vidjeti stavak 24.):
REFERENTNE TVARI Ako laboratorij nije ranije proveo test ili ako je došlo do znatnih promjena (primjerice promjene riblje subpopulacije ili dobavljača, različite vrste riba, znatne promjene veličine riba, hrana za ribe ili metoda dodavanja tvari (spiking) itd.), savjetuje se provedba studije tehničke osposobljenosti upotrebom referentne tvari. Referentna tvar prije svega se upotrebljava kako bi se utvrdilo je li tehnika dodavanja tvari hrani primjerena za osiguravanje najveće mjere homogenosti i biodostupnosti ispitivanih tvari. Jedan je od primjera upotrijebljenih u slučaju nepolarnih hidrofobnih tvari heksaklorobenzen (HCB), ali bi zbog njegovih opasnih svojstava trebalo razmotriti druge tvari za koje postoje pouzdani podaci o apsorpciji i biomagnifikaciji (63). Ako se upotrebljava referentna tvar, u izvješću o ispitivanju trebalo bi, kao i za ispitivane tvari, navesti osnovne informacije o njoj, uključujući naziv, čistoću, CAS broj, strukturu, podatke o toksičnosti (ako postoje) (vidjeti stavke 3. i 22.). OPIS METODE Oprema Trebalo bi upotrebljavati materijale i opremu opisane u metodi vodenog izlaganja (vidjeti stavak 26.). Trebalo bi upotrebljavati sustav protočnog ispitivanja ili statičkog ispitivanja s obnavljanjem u okviru kojeg se za ispitne akvarije osigurava dostatan obujam vode za razrjeđivanje. Trebalo bi evidentirati brzinu protoka. Voda Trebalo bi upotrebljavati ispitnu vodu kako je opisano u metodi vodenog izlaganja (vidjeti stavke od 27. do 29.). Ispitni medij trebao bi imati opisana obilježja te bi njegova kvaliteta trebala ostati nepromijenjena tijekom cijelog ispitivanja. Sadržaj prirodnih čestica i ukupnog organskog ugljika trebali bi biti što je moguće niži (≤ 5 mg/l lebdećih čestica; ≤ 2 mg/l ukupnog organskog ugljika) prije početka ispitivanja. Ukupni organski ugljik potrebno je mjeriti samo prije ispitivanja kao dio ispitivanja obilježja ispitne vode (vidjeti stavak 53.). Prehrana Preporučuje se komercijalno dostupna hrana za ribe (hrana u peletima koji plutaju i/ili sporo tonu) za koju je barem poznat sadržaj proteina i masti. Peleti u hrani trebali bi biti jednake veličine kako bi se povećala učinkovitost izloženosti hrani, odnosno ribe će pojesti više hrane nego kad jedu veće komade, a ostavljaju manje. Veličina peleta trebala bi odgovarati veličini riba na početku ispitivanja (npr. mogu se upotrebljavati peleti promjera od otprilike 0,6 do 0,85 mm za ribe ukupne dužine između 3 i 7 cm te oni od 0,85 do 1,2 mm za ribe ukupne dužine između 6 i 12 cm). Veličinu peleta moguće je prilagoditi ovisno o rastu riba na početku faze izlučivanja. Primjer odgovarajućeg sastava komercijalne hrane nalazi se u Dodatku 7. U razvoju ove metode upotrijebljena je ispitna hrana ukupnog sadržaja lipida između 15 i 20 % (mokre mase). Hrana za ribe s tako visokom koncentracijom lipida možda nije dostupna u određenim regijama. U tom je slučaju moguće provesti ispitivanja s nižom koncentracijom lipida u hrani te, prema potrebi, prilagoditi brzinu hranjenja na odgovarajući način kako bi se održalo zdravlje riba (na temelju preliminarnog ispitivanja). Ukupni sadržaj lipida u hrani za ispitnu skupinu i kontrolnu skupinu potrebno je izmjeriti i evidentirati prije početka ispitivanja i na kraju faze apsorpcije. Pojedinosti koje je dostavio dobavljač komercijalne hrane u pogledu hranjivih tvari, vlage, vlakana i pepela te mogućih ostataka minerala i pesticida (npr. ‚standardni’ prioritetni onečišćivači) trebalo bi navesti u izvješću o ispitivanju. Pri dodavanju ispitivane tvari hrani trebalo bi učiniti sve kako bi se osigurala njezina homogenost u ispitnoj hrani. Koncentraciju ispitivane tvari u hrani namijenjenoj ispitnoj skupini trebalo bi odabrati uzimajući u obzir osjetljivost analitičke tehnike, toksičnost ispitivane tvari (NOEC ako je poznat) i relevantne fizičko-kemijske podatke. Ako se upotrebljava referentna tvar, njezina bi koncentracija prema mogućnosti trebala iznositi otprilike 10 % koncentracije ispitivane tvari (u svakom slučaju što je moguće niže), podložno analizi osjetljivosti (npr. za heksaklorobenzen kao prihvatljiva je utvrđena koncentracija u hrani od 1 do 100 μg/g; vidjeti (47.) za više informacija o učinkovitosti asimilacije HCB-a). Ispitivanu je tvar moguće dodati hrani za ribe na nekoliko načina, ovisno o njezinim fizičkim svojstvima i topljivosti (više pojedinosti o metodama dodavanja navedeno je u Dodatku 7.):
U nekim će slučajevima, na primjer kod manje hidrofobnih tvari za koje je vjerojatnije da će se desorbirati iz hrane, možda biti potrebno prekriti pelete hrane malom količinom kukuruznog/ribljeg ulja (vidjeti stavak 142.). U tim bi slučajevima kontrolnu hranu trebalo tretirati na sličan način te upotrijebiti konačnu pripremljenu hranu za mjerenje lipida. Ako se upotrebljava referentna tvar, ona bi trebala biti usporediva s podacima iz literature o ispitivanjima provedenima u sličnim uvjetima s usporedivom brzinom hranjenja (vidjeti stavak 45.) te bi parametri specifični za referentnu tvar trebali ispunjavati relevantne kriterije iz stavka 113. (točke 3., 4. i 5.). Ako se kao nosač ispitivane tvari upotrebljava ulje ili otapalo nosač, njegovu bi istovrijednu količinu (bez ispitivane tvari) trebalo umiješati u kontrolnu prehranu radi održavanja istovrijednosti s hranom s dodatkom. Važno je da se ispitne i kontrolne skupine tijekom faza apsorpcije i izlučivanja hrani obrocima koji su istovrijedni u smislu hranjivosti. Hranu s dodatkom trebalo bi skladištiti u uvjetima u kojima se održava stabilnost ispitivane tvari u smjesi hrane (npr. rashlađivanjem) te bi trebalo izvijestiti o tim uvjetima. Odabir ribljih vrsta Mogu se upotrebljavati iste riblje vrste kao za vodeno izlaganje (vidjeti stavak 32. i Dodatak 3.). Kalifornijska pastrva (Oncorhynchus mykiss), šaran (Cyprinus carpio) i debeloglava gavčica (Pimephales promelas) uobičajeno su, prije objave ove ispitne metode, upotrebljavane u ispitivanjima bioakumulacije kroz hranu s organskim tvarima. Odlika ispitne vrste trebala bi biti brzo konzumiranje osiguranog obroka kako bi se osiguralo da se svi čimbenici koji bi mogli utjecati na koncentraciju ispitivane tvari u hrani (npr. ispiranje u vodu i mogućnost vodenog izlaganja) svedu na najmanju moguću razinu. Trebalo bi upotrebljavati ribe unutar preporučenog raspona veličine/mase (vidjeti Dodatak 3.). Ribe ne bi smjele biti toliko male da se ugrozi jednostavnost provođenja analiza na pojedinačnim ribama. Zbog vrsta koje se ispituje tijekom faze života u kojoj brzo rastu može doći do otežanog tumačenja podataka, a velike brzine rasta mogu utjecati na izračun učinkovitosti asimilacije (64). Držanje riba Aklimatizacija, smrtnost i kriteriji prihvatljivosti bolesti prije provođenja ispitivanja jednaki su kao i u metodi vodenog izlaganja (vidjeti stavke od 33. do 35.). PROVOĐENJE ISPITIVANJA Radnje prije ispitivanja i test za određivanje raspona Analize prije ispitivanja potrebne su kako bi se dokazalo izdvajanje tvari iz hrane s dodatkom ili tkiva s dodatkom. Za odabir odgovarajuće koncentracije u hrani nije uvijek potrebno provesti test za utvrđivanje raspona. Za potrebe dokazivanja da nisu otkriveni štetni učinci i radi ocjene okusa hrane s dodatkom, osjetljivosti analitičke metode za tkivo riba i hranu za ribe te odabira odgovarajuće brzine hranjenja i intervala uzorkovanja tijekom faze izlučivanja itd., moguće je provesti preliminarne pokuse u pogledu hranjenja, ali oni nisu obvezni. Preliminarno bi ispitivanje moglo biti korisno radi procjene količine riba potrebne za uzorkovanje tijekom faze izlučivanja. To može za posljedicu imati znatno smanjenje količine riba koje se upotrebljava, posebno kod ispitivanih tvari koje su osobito osjetljive na metaboliziranje. Uvjeti izlaganja Trajanje faze apsorpcije Uobičajeno je dostatna faza apsorpcije u trajanju od 7 do 14 dana, tijekom koje se jednu skupinu riba svakodnevno hrani kontrolnom hranom, a drugu skupinu riba ispitnom hranom, u fiksnim obrocima ovisno o vrsti koju se ispituje i uvjetima pokusa, na primjer u količini od 1 do 2 % tjelesne mase (mokre mase) u slučaju kalifornijske pastrve. Brzinu hranjenja trebalo bi odrediti tako da se izbjegnu brz rast i veliko povećanje sadržaja lipida. Moguće je, prema potrebi, produljiti fazu apsorpcije na temelju praktičnog iskustva iz prethodnih ispitivanja ili znanja u pogledu apsorpcije/izlučivanja ispitivane tvari (ili tvari koja joj je slična). Početkom ispitivanja smatra se trenutak prvog hranjenja hranom s dodatkom. Pokusni dan traje od trenutka hranjenja do neposredno prije trenutka sljedećeg hranjenja (npr. jedan sat). Stoga prvi pokusni dan apsorpcije traje od trenutka prvog hranjenja hranom s dodatkom do neposredno prije trenutka drugog hranjenja hranom s dodatkom. U praksi, faza apsorpcije završava neposredno prije (npr. jedan sat) prvog hranjenja ispitnom tvari bez dodatka jer će ribe i dalje probavljati hranu s dodatkom i apsorbirati ispitivanu tvar tijekom sljedeća 24 sata. Važno je osigurati da se postigne dostatno visoko (netoksično) tjelesno opterećenje ispitivanom tvari u odnosu na analitičku metodu, tako da se tijekom faze izlučivanja može izmjeriti barem smanjenje reda veličine. U posebnim je slučajevima moguće primijeniti dužu fazu apsorpcije (do 28 dana), uz dodatno uzorkovanje, radi dobivanja uvida u kinetiku apsorpcije. Tijekom apsorpcije koncentracija u ribi možda neće postići stabilno stanje. Kao i u ispitivanju vodenim izlaganjem, moguće je primijeniti jednadžbe za procjenu vremena potrebnog do stabilnog stanja, kao pokazatelja vjerojatnog vremena potrebnog za postizanje znatnih koncentracija u ribi (vidjeti Dodatak 5.). U određenim bi slučajevima moglo biti poznato da apsorpcija tvari u ribi tijekom 7 do 14 dana neće biti dovoljna da bi koncentracija hrane koju se upotrebljava postigla koncentraciju u ribi koja je dovoljno visoka da bi se analiziralo barem smanjenje reda veličine tijekom izlučivanja, ili zbog niske analitičke osjetljivosti ili zbog niske učinkovitosti asimilacije. U tim bi slučajevima moglo biti korisno produžiti početnu fazu hranjenja na dulje od 14 dana ili, posebno za tvari s visokim metaboliziranjem, razmotriti višu koncentraciju hrane. Međutim, trebalo bi voditi računa o tome da se tjelesno opterećenje tijekom apsorpcije održava ispod (procijenjene) kronične koncentracije bez učinka u tkivu riba (vidjeti stavak 138.). Trajanje faze izlučivanja Izlučivanje uobičajeno traje do 28 dana, a počinje kad se ispitnu skupinu riba počne hraniti čistom, neobrađenom hranom nakon faze apsorpcije. Izlučivanje započinje prvim hranjenjem hranom bez dodatka (unspiked), a ne neposredno nakon zadnjeg hranjenja hranom s dodatkom (spiked) jer će ribe nastaviti probavljati hranu i apsorbirati ispitivanu tvar u sljedeća 24 sata, kako je navedeno u stavku 126. Stoga se prvi uzorak u fazi izlučivanja uzima neposredno prije drugog hranjenja hranom bez dodatka. To je razdoblje izlučivanja namijenjeno hvatanju tvari čiji potencijalni poluvijek traje do 14 dana, što je u skladu s poluvijekom bioakumulacijskih tvari (65) pa su razdobljem od 28 dana obuhvaćena dva poluvijeka takvih tvari. U slučaju vrlo visoko bioakumulacijskih tvari moglo bi biti korisno produžiti fazu izlučivanja (ako se na to ukazuje u preliminarnom ispitivanju). Ako se tvar izlučuje vrlo sporo tako da nije moguće utvrditi točno trajanje poluvijeka u fazi izlučivanja, informacije bi ipak mogle biti dostatne za potrebe procjene radi utvrđivanja je li riječ o visokoj razini bioakumulacije. Obratno, ako se tvar izlučuje toliko brzo da nije moguće odrediti pouzdanu koncentraciju u nultom vremenu (koncentraciju na kraju apsorpcije / početku izlučivanja, C0,d) ni vrijednost k 2, moguće je konzervativno procijeniti vrijednost k 2 (vidjeti Dodatak 7.). Ako iz analiza ribe u ranijim intervalima (npr. 7 ili 14 dana) proizlazi da je tvar izlučena ispod razina kvantifikacije prije isteka punog razdoblja od 28 dana, moguće je prekinuti naknadno uzorkovanje i ispitivanje. U nekim je slučajevima na kraju razdoblja apsorpcije (ili u drugom uzorku izlučivanja) moglo doći do toga da nema mjerljive apsorpcije ispitivane tvari. Ako se može dokazati i. da su ispunjeni kriteriji valjanosti iz stavka 113. i ii. da do nedostatka apsorpcije nije došlo zbog nekih drugih nedostataka ispitivanja (npr. nedovoljno dugo trajanje apsorpcije, manjkavost tehnike dodavanja dodatka hrani što dovodi do slabe bioraspoloživosti, nedostatak osjetljivosti analitičke metode, ribe ne konzumiraju hranu itd.) moglo bi biti moguće prekinuti ispitivanje bez potrebe za njegovim ponavljanjem uz duže trajanje apsorpcije. Ako je preliminarnim radnjama utvrđeno da je to slučaj, preporučuje se provođenje analize izmeta, po mogućnosti, u pogledu neprobavljene ispitivane tvari, kao sastavni dio pristupa ‚bilance mase’. Broj ispitnih riba Slično kao u ispitivanju vodenim izlaganjem, trebalo bi odabirati ribe slične mase i dužine, pri čemu masa najmanje ribe mora iznositi barem dvije trećine mase najveće ribe (vidjeti stavke 40. do 42.). Ukupan bi broj riba za ispitivanje trebalo odabirati na temelju rasporeda uzorkovanja (najmanje jedan uzorak na kraju faze apsorpcije i četiri do šest uzoraka tijekom faze izlučivanja, ovisno o trajanju faza), uzimajući u obzir osjetljivost analitičke tehnike, koncentraciju koja će vjerojatno biti postignuta na kraju faze apsorpcije (na temelju ranijih znanja) i trajanje izlučivanja (ako ga je moguće procijeniti na temelju ranijih saznanja). Pet do deset riba trebalo bi uzorkovati pri svakom uzorkovanju, pri čemu se parametri rasta (masa i ukupna dužina) mjere prije analize kemikalija ili lipida. Zbog svojstvene varijabilnosti veličine, brzine rasta i fiziologije među ribama te vjerojatnih varijacija u količini osigurane hrane koju konzumira svaka riba, u svakom bi intervalu trebalo uzorkovati najmanje pet riba iz ispitne skupine i pet iz kontrolne skupine kako bi se pravilno utvrdila prosječna koncentracija i njezina varijabilnost. Varijabilnost među upotrijebljenim ribama vjerojatno će više pridonijeti ukupnoj nekontroliranoj varijabilnosti u ispitivanju nego varijabilnost svojstvena primijenjenim analitičkim metodologijama te je stoga u određenim slučajevima opravdana upotreba do deset riba po uzorku. Međutim, ako temeljne vrijednosti koncentracija ispitivane tvari u kontrolnim ribama nisu mjerljive na početku izlučivanja, mogla bi biti dovoljna samo kemijska analiza dviju ili triju kontrolnih riba u konačnom intervalu uzorkovanja ako se preostale kontrolne ribe na svim točkama uzorkovanja ipak uzorkuje u pogledu mase i ukupne dužine (tako da se u pogledu rasta uzorkuje jednak broj riba iz ispitnih i kontrolnih skupina). Ribe bi trebalo skladištiti, vagati pojedinačno (čak i ako se pokaže potrebnim naknadno spajanje rezultata uzorkovanja) i izmjeriti njihovu ukupnu dužinu. Kod standardnog ispitivanja, na primjer, s izlučivanjem u trajanju od 28 dana uključujući pet uzoraka uzetih tijekom izlučivanja, to znači ukupno 59 do 120 riba iz ispitnih i 50 do 110 riba iz kontrolnih skupina, pod pretpostavkom da se analitičkom tehnikom koja se primjenjuje na tvar omogućuje provođenje analize sadržaja lipida na istoj ribi. Ako nije moguće provesti analizu lipida na istoj ribi koja je upotrijebljena za kemijsku analizu, a nije izvediva ni upotreba kontrolne ribe samo za analizu lipida (vidjeti stavak 56.), potrebno je 15 dodatnih riba (tri iz matične populacije na početku ispitivanja, po tri iz kontrolne i ispitne skupine na početku izlučivanja i po tri iz kontrolne i ispitne skupine na kraju pokusa). Primjer rasporeda uzorkovanja s količinama riba dostupan je u Dodatku 4. Punjenje Trebalo bi primjenjivati slično visoke omjere vode i riba kao i kod metode vodenog izlaganja (vidjeti stavke 43. i 44.). Iako količina ribe koja se dodaje u vodu ne utječe na koncentracije pri izlaganju u ovome ispitivanju, preporučuje se gustoća punjenja od 0,1 do 1,0 g ribe (mokre mase) po litri vode dnevno radi održavanja odgovarajućih koncentracija otopljenog kisika i smanjenja stresa kod ispitnih organizama. Ispitna hrana i hranjenje Tijekom razdoblja aklimatizacije ribe bi trebalo hraniti odgovarajućom hranom kako je prethodno opisano (stavak 117.). Ako se ispitivanje provodi u protočnim uvjetima, protok bi trebalo zaustaviti dok se hrani ribe. Tijekom ispitivanja hrana namijenjena ispitnoj skupini trebala bi biti u skladu s prethodnim opisom (stavci od 116. do 121.). Uz razmatranje čimbenika specifičnih za tvar, analitičku osjetljivost, očekivanu koncentraciju u hrani u okolišnim uvjetima i razine kronične toksičnosti / tjelesnog opterećenja, pri odabiru ciljane koncentracije dodatka hrani trebalo bi u obzir uzeti okus hrane (kako ribe ne bi izbjegavale hranu). Nazivnu koncentraciju ispitivane tvari koja je dodana hrani trebalo bi evidentirati u izvješću. Na temelju iskustva, koncentracijama dodatka hrani u rasponu od 1 do 1000 μg/g omogućuje se praktičan radni raspon za ispitivane tvari koje ne pokazuju određen toksični mehanizam. Kod tvari koje djeluju kroz nespecifični mehanizam razine ostataka u tkivu ne bi smjele biti više od 5 μmol/g lipida jer će ostaci iznad te razine vjerojatno imati kronične učinke (19., 48., 50.) (66). Kod drugih bi tvari trebalo voditi računa o tome da iz akumuliranog izlaganja ne proizađu nikakvi štetni učinci (vidjeti stavak 127.). To osobito vrijedi ako se istovremeno ispituje više od jedne tvari (vidjeti stavak 112.). Odgovarajuća količina ispitivane tvari može se dodati hrani za ribe na jedan od tri načina, kako je navedeno u stavku 119. i Dodatku 7. Metode i postupke za dodavanje dodatka hrani trebalo bi evidentirati u izvješću. Neobrađenom hranom hrani se kontrolna riba, a ta hrana sadržava jednaku količinu uljnog nosača bez dodatka ako je on upotrijebljen u hrani s dodatkom za fazu apsorpcije, ili je obrađena ‚čistim’ otapalom ako je otapalo nosač upotrijebljeno za pripremu hrane za ispitnu skupinu. Koncentracija ispitivane tvari u obrađenoj i neobrađenoj hrani mjeri se analitički barem tri puta prije početka faze apsorpcije i na njezinu kraju. Nakon izlaganja obrađenoj hrani (faza apsorpcije), ribu (obje skupine) se hrani neobrađenom hranom (faza izlučivanja). Ribe se hrani fiksnim obrocima (ovisno o vrsti; na primjer, oko 1 do 2 % mokre tjelesne mase na dan u slučaju kalifornijske pastrve). Brzinu hranjenja trebalo bi određivati tako da se izbjegavaju brz rast i veliko povećanje sadržaja lipida. Trebalo bi evidentirati točnu brzinu hranjenja uspostavljenu tijekom pokusa. Inicijalnu količinu hrane trebalo bi temeljiti na planiranim mjerenjima mase matične populacije neposredno prije početka ispitivanja. Količinu hrane trebalo bi prilagoditi na temelju mokre mase uzorkovanih riba pri svakom uzorkovanju kako bi se uzeo u obzir rast tijekom pokusa. Mase i dužine riba u ispitnim i kontrolnim akvarijima moguće je procijeniti na temelju masa i ukupnih dužina riba upotrijebljenih pri svakom uzorkovanju; ne važe se ni ne mjeri preostale ribe u ispitnim i kontrolnim akvarijima. Važno je tijekom cijelog pokusa održavati istu utvrđenu brzinu hranjenja. Hranjenje bi trebalo promatrati kako bi se osiguralo da ribe konzumiraju svu hranu koja im je dana i tako zajamčilo da se u izračunima upotrebljavaju odgovarajuće stope unosa hrane. Preliminarne pokuse hranjenja ili prethodno iskustvo treba uzeti u obzir pri odabiru brzine hranjenja kojom će se osigurati da se konzumira sva hrana iz hranjenja koje se provodi jednom dnevno. Ako hrana sustavno ostaje nekonzumirana, preporučuje se rasporediti dozu na dodatno razdoblje hranjenja u svakom pokusnom danu (npr. zamijeniti hranjenje jednom dnevno hranjenjem polovinom obroka dva puta dnevno). Ako je navedeno potrebno, drugo bi hranjenje trebalo provesti u utvrđeno vrijeme, i to tako da vremenski razmak do uzorkovanja riba bude najdulji mogući (npr. određuje se da se drugo hranjenje provede u prvoj polovini pokusnog dana). Iako ribe uglavnom brzo konzumiraju hranu, važno je osigurati da tvar ostane adsorbirana u hrani. Treba nastojati izbjegavati odvajanje ispitivane tvari od hrane u vodi, čime bi se ribe istovremeno s izlaganjem kroz hranu izložilo i koncentracijama ispitivane tvari putem vode. To se može postići uklanjanjem sve nekonzumirane hrane (i izmeta) iz ispitnih i kontrolnih akvarija unutar jednog sata od hranjenja, ali po mogućnosti unutar 30 minuta. Nadalje, može se upotrijebiti sustav u kojem se vodu kontinuirano čisti s pomoću filtra s aktivnim ugljenom koji upija sve ‚otopljene’ onečišćujuće tvari. Protočnim se sustavima može omogućiti brzo ispiranje čestica hrane i otopljenih tvari (67). U određenim se slučajevima neznatno izmijenjenom tehnikom pripreme hrane s dodatkom može pridonijeti ublažavanju tog problema (vidjeti stavak 119.). Svjetlo i temperatura Kao i u metodi vodenog izlaganja (vidjeti stavak 48.), za ispitnu vrstu koju se upotrebljava preporučuju se fotoperiod od 12 do 16 sati i odgovarajuća temperatura (± 2 °C) (vidjeti Dodatak 3.). Vrsta i značajke osvjetljenja trebaju biti poznati i evidentirani. Kontrole Trebalo bi upotrebljavati jednu kontrolnu skupinu u kojoj se ribe hrani jednakim obrocima kao u ispitnoj skupini, ali bez ispitivane tvari. Ako je za dodavanje dodatka hrani upotrijebljen uljni nosač ili nosač otapalo, kontrolnu bi skupinu trebalo tretirati na potpuno jednak način, ali bez ispitne tvari kako bi prehrana ispitne skupine i kontrolne skupine bila istovjetna (vidjeti stavke 121. i 139.). Učestalost mjerenja kvalitete vode Primjenjuju se uvjeti jednaki onima iz metode vodenog izlaganja, osim što je ukupni organski ugljik potrebno mjeriti samo prije ispitivanja kao dio utvrđivanja obilježja ispitne vode (vidjeti stavak 53.). Uzorkovanje i analiza riba i hrane Analiza uzoraka hrane Uzorke ispitne i kontrolne hrane analizira se najmanje tri puta u pogledu koncentracije ispitivane tvari i sadržaja lipida barem prije početka faze apsorpcije i na njezinu kraju. Metode analize i postupke kojima se osigurava homogenost prehrane trebalo bi uključiti u izvješće. Uzorke bi trebalo analizirati u pogledu ispitivane tvari uspostavljenom i provjerenom metodom. Trebalo bi provesti radnje prije ispitivanja kojima se utvrđuju granica kvantifikacije, postotak izdvajanja ispitivane tvari, interferencije i analitička varijabilnost u planiranoj matrici uzorka. Ako se ispituje radioaktivno obilježen materijal, trebalo bi uzeti u obzir slična razmatranja kao ona u metodi vodenog izlaganja, pri čemu analiza hrane zamjenjuje analizu vode (vidjeti stavak 65.). Analiza riba Pri svakom uzorkovanju riba uzorkuje se pet do deset jedinki iz izloženih i kontrolnih skupina (u određenim slučajevima može se smanjiti broj kontrolnih riba; vidjeti stavak 134.). Uzorkovanje bi trebalo provoditi u isto vrijeme svakog pokusnog dana (u odnosu na vrijeme hranjenja) te u trenutku u kojem je vjerojatnost da će hrana ostati u utrobi tijekom faze apsorpcije i početnog dijela faze izlučivanja svedena na minimum radi sprječavanja prividnih doprinosa ukupnim koncentracijama ispitivane tvari (odnosno, uzorkovane bi ribe trebalo ukloniti na kraju pokusnog dana, imajući na umu da pokusni dan počinje u trenutku hranjenja i završava u trenutku sljedećeg hranjenja, oko 24 sata kasnije. Izlučivanje počinje u trenutku prvog hranjenja hranom bez dodatka; vidjeti stavak 128.). Prvi je uzorak iz faze izlučivanja (uzet neposredno prije drugog hranjenja hranom bez dodatka) važan jer se metoda ekstrapolacije jedan dan unazad iz tog mjerenja upotrebljava za procjenu koncentracije u nultom vremenu (C 0,d, koncentracija u ribi na kraju apsorpcije / početku izlučivanja). Druga je mogućnost uklanjanje probavnog trakta ribe i zasebna analiza na kraju apsorpcije te tijekom prvog i trećeg dana izlučivanja. Pri svakom uzorkovanju ribu je potrebno ukloniti iz obaju ispitnih posuda i tretirati na način koji je opisan za metodu vodenog izlaganja (vidjeti stavke od 61. do 63.). Koncentracije ispitivane tvari u cijeloj ribi (mokra masa) mjere se barem na kraju faze apsorpcije i tijekom faze izlučivanja i u kontrolnim i u ispitnim skupinama. Tijekom faze izlučivanja preporučuje se četiri do šest točaka uzorkovanja (npr. prvi, treći, sedmi, četrnaesti i dvadeset osmi dan). Druga je mogućnost uključiti dodatnu točku uzorkovanja nakon jednog do tri dana apsorpcije radi procjene učinkovitosti asimilacije iz linearnog dijela apsorpcije kod ribe, a opet blizu početka razdoblja izlaganja. Postoje dva glavna odstupanja od rasporeda: i. ako se za potrebe istraživanja kinetike apsorpcije primjenjuje produljena faza apsorpcije, tijekom faze apsorpcije dodaju se dodatne točke uzorkovanja te će biti potrebno uključiti još riba (vidjeti stavak 126.); ii. ako je ispitivanje prekinuto na kraju faze apsorpcije zbog izostanka mjerljive apsorpcije (vidjeti stavak 131.). Pojedinačne ribe koje se uzorkuje trebalo bi izvagati (i izmjeriti njihovu ukupnu dužinu) kako bi se omogućilo utvrđivanje konstanti brzine rasta. Koncentracije tvari u određenom tkivu riba (jestivi i nejestivi dijelovi) isto se tako može mjeriti na kraju apsorpcije i u odabranim trenucima tijekom izlučivanja. Ako se ispituje radioaktivno obilježen materijal, trebalo bi uzeti u obzir slična razmatranja kao ona u metodi vodenog izlaganja, pri čemu analiza hrane zamjenjuje analizu vode (vidjeti stavak 65.). Kod povremene upotrebe referentne tvari (vidjeti stavak 25.) koncentracije bi, prema mogućnosti, trebalo mjeriti u ispitnoj skupini na kraju apsorpcije i pri svim vremenima tijekom izlučivanja navedenima za ispitivanu tvar (cijela riba); koncentracije u kontrolnoj skupini potrebno je analizirati samo na kraju apsorpcije (cijela riba). U određenim okolnostima (na primjer ako analitičke tehnike za ispitivanu tvar i referentnu tvar nisu spojive pa bi za praćenje rasporeda uzorkovanja bilo potrebno još riba) moguće je primijeniti još jedan pristup, kako slijedi, kako bi se potrebna količina dodatnih riba svela na najnižu mjeru. Koncentracije referentne tvari mjere se tijekom izlučivanja samo prvog i trećeg dana i na dvije dodatne točke uzorkovanja odabrane tako da je moguće pouzdano procijeniti koncentraciju u nultom vremenu (C 0,d) i vrijednost k 2 za referentnu tvar. Ako je moguće, sadržaj lipida u pojedinačnim ribama trebalo bi utvrditi pri svakom uzorkovanju ili barem na početku i kraju faze apsorpcije te na kraju faze izlučivanja. (vidjeti stavke 56. i 67.). Ovisno o analitičkoj metodi (vidjeti stavak 67. i Dodatak 4.) moglo bi biti moguće upotrijebiti istu ribu za utvrđivanje sadržaja lipida i koncentracije ispitivane tvari. To je bolja mogućnost jer se njome smanjuje broj riba. Međutim, ako to nije moguće, može se primijeniti pristup koji je opisan u metodi vodenog izlaganja (te su druge mogućnosti mjerenja lipida navedene u stavku 56.). Metodu upotrijebljenu za kvantificiranje sadržaja lipida evidentira se u izvješću. Kvaliteta analitičke metode Trebalo bi provesti provjere s pomoću pokusa kako bi se jamčila specifičnost, točnost, preciznost i obnovljivost analitičke tehnike specifične za tvar, kao i izdvajanje ispitivane tvari iz hrane i ribe. Mjerenje rasta riba Na početku ispitivanja potrebno je izvagati uzorak riba iz matične populacije (i izmjeriti njihovu ukupnu dužinu). Te bi ribe trebalo uzorkovati neposredno prije prvog hranjenja hranom s dodatkom (npr. jedan sat) i pripisati ih nultom pokusnom danu. Broj riba u tom uzorku trebao bi biti barem jednak broju riba namijenjenih uzorkovanju tijekom ispitivanja. Neke od njih mogu biti iste ribe kao one upotrijebljene za analizu lipida prije početka faze apsorpcije (vidjeti stavak 153.). U svakom intervalu uzorkovanja ribe se prvo važe i mjeri se njihova dužina. Kod svake pojedinačne ribe izmjerenu masu (i dužinu) trebalo bi povezati s koncentracijom analizirane kemikalije (i, prema potrebi, sadržajem lipida), na primjer upotrebom koda jedinstvenog identifikatora za svaku uzorkovanu ribu. Mjerenjem tih uzorkovanih riba moguće je procijeniti masu (i dužinu) riba preostalih u ispitnom i kontrolnom akvariju. Ocjena pokusa Trebalo bi svakodnevno pratiti smrtnost i evidentirati je. Trebalo bi dodatno promatrati štetne učinke, na primjer neuobičajeno ponašanje ili pigmentaciju, te ih evidentirati. Ribe se smatra uginulima ako se opaža da nema pokreta disanja i da ne reagiraju na blage mehaničke podražaje. Potrebno je ukloniti sve uginule ribe i ribe za koje je očito da su na umoru. PODACI I IZVJEŠĆIVANJE Obrada rezultata Rezultate ispitivanja upotrebljava se za određivanje konstante brzine izlučivanja (k 2) kao funkcije ukupne mokre mase ribe. Konstanta brzine rasta, k g, temeljena na prosječnom povećanju mase riba izračunava se i upotrebljava za određivanje konstante brzine izlučivanja ispravljene u odnosu na rast, k 2g, prema potrebi. Nadalje, potrebno je izvijestiti o učinkovitosti asimilacije (a; apsorpcija iz utrobe), kinetičkom faktoru biomagnifikacije (BMFK) (prema potrebi ispravljen u odnosu na rast, BMFKg), njegovoj vrijednosti ispravljenoj u odnosu na lipide (BMFKL ili BMFKgL, ako je ispravljeno u odnosu na razrjeđenje zbog rasta) i brzini hranjenja. Isto tako, ako je moguće procijeniti vrijeme potrebno do postizanja stabilnog stanja u fazi apsorpcije (npr. 95 % stabilnog stanja ili t 95 = 3,0/k 2), može se uključiti procjena vrijednosti BMF-a u stabilnom stanju (BMFSS) (vidjeti stavke 105. i 106. te Dodatak 5.) ako je iz vrijednosti t 95 vidljivo da je stabilno stanje možda postignuto. Na tu bi vrijednost BMFSS trebalo primijeniti isti ispravak u odnosu na lipide kao i na kinetički dobivenu vrijednost BMF-a (BMFK) da bi se dobila vrijednost ispravljena u odnosu na lipide, BMFSSL (važno je napomenuti da nije dogovoren postupak za ispravljanje vrijednosti BMF-a u stabilnom stanju u odnosu na razrjeđenje zbog rasta). Formule i primjeri izračuna navedeni su u Dodatku 7. Dostupni su pristupi zahvaljujući kojima je izvediva procjena kinetičkog faktora biokoncentracije (BCFK) na temelju podataka dobivenih iz ispitivanja kroz hranu. O tome se govori u Dodatku 8. Podaci o masi/dužini riba Mokre mase i dužine pojedinačnih riba u svim razdobljima izračunavaju se odvojeno za ispitne i kontrolne skupine za sve dane uzorkovanja tijekom faze apsorpcije (matična populacija na početku apsorpcije; kontrolna skupina i ispitna skupina na kraju apsorpcije i, ako se provodi, u ranoj fazi (npr. prva tri dana apsorpcije) i fazi izlučivanja (npr. prvi, drugi, četvrti, sedmi, četrnaesti i dvadeset osmi dan, za kontrolnu i za ispitnu skupinu). Masa je najvažnija mjera rasta za potrebe ispravljanja u odnosu na rast. Metoda (metode) za ispravljanje podataka u odnosu na razrjeđenje zbog rasta navedene su u nastavku (stavci 162. i 163.) i u Dodatku 5. Podaci o koncentraciji ispitivane tvari u ribama Količine ostataka ispitivane tvari u pojedinačnim ribama (ili skupnim uzorcima riba ako nije moguće mjerenje pojedinačnih riba), izražene kao koncentracija u mokroj masi, iskazuju se za ispitne i kontrolne ribe u pojedinačnim vremenima uzorkovanja. Ako je na svakoj uzorkovanoj ribi provedena analiza lipida, moguće je odrediti i iskazati pojedinačne koncentracije ispravljene u odnosu na lipide, kao koncentraciju lipida (lipidi u mokroj masi).
Brzina izlučivanja i faktor biomagnifikacije Kako bi se mogao izračunati faktor biomagnifikacije iz podataka, prvo je potrebno odrediti učinkovitost asimilacije (apsorpcija ispitivane tvari u cijeloj utrobi, α). Za to bi trebalo upotrijebiti jednadžbu A7.1 iz Dodatka 7., pri čemu je potrebno poznavati dobivenu koncentraciju u ribama u nultom vremenu u fazi izlučivanja (C 0,d), (ukupnu) konstantu brzine izlučivanja (k 2), koncentraciju u hrani (C food), konstantu brzine konzumiranja hrane (I) i trajanje razdoblja apsorpcije (t). Nagib i odsječak linearne veze između ln(koncentracija) i vremena izlučivanja navodi se kao konstanta ukupne brzine izlučivanja (k 2 = nagib) i koncentracije u nultom vremenu (C0,d = eintercept), kako je prethodno navedeno. Dobivene bi vrijednosti trebalo provjeriti u pogledu biološke vjerodostojnosti (npr. učinkovitost asimilacije izražena kao razlomak ne može biti viša od 1). Vrijednost (I) izračunava se dijeljenjem mase hrane s masom riba koje se hrani svakodnevno (ako ih se hrani u ekvivalentu 2 % tjelesne mase, vrijednost (I) iznosit će 0,02). Međutim, brzinu hranjenja primijenjenu u izračunu možda će trebati prilagoditi u odnosu na rast riba (to se može učiniti upotrebom poznate konstante brzine rasta radi procjene mase riba u svakoj vremenskoj točki u fazi apsorpcije; vidjeti Dodatak 7.). Ako se vrijednosti k 2 i C 0,d ne mogu dobiti jer su se, na primjer, koncentracije spustile ispod granice detekcije za drugi uzorak pri izlučivanju, moguće je konzervativno procijeniti vrijednost k 2 i gornje granice vrijednosti BMFk (vidjeti Dodatak 7.). Kad se odredi učinkovitost asimilacije (α), faktor biomagnifikacije može se izračunati množenjem vrijednosti α s konstantom brzine konzumacije (I) i dijeljenjem s (ukupnom) konstantom brzine izlučivanja (k 2). Na isti se način izračunava i faktor biomagnifikacije ispravljen u odnosu na rast, ali se primjenjuje konstanta brzine izlučivanja ispravljena u odnosu na rast (k 2g; vidjeti stavke 162. i 163.). Alternativna se procjena učinkovitosti asimilacije može dobiti ako je analiza tkiva provedena na ribama uzorkovanima u ranoj, linearnoj fazi faze apsorpcije; vidjeti stavak 151. i Dodatak 7. Ta vrijednost predstavlja neovisnu procjenu učinkovitosti asimilacije za uglavnom neizložen organizam (odnosno ribe su blizu početku faze apsorpcije). Za određivanje vrijednosti BMF-a uobičajeno se upotrebljava učinkovitost asimilacije procijenjena iz podataka o izlučivanju. Ispravljanje u odnosu na lipide i ispravljanje u odnosu na razrjeđenje koje nastaje zbog rasta Zbog rasta riba tijekom faze izlučivanja može doći do snižavanja koncentracija mjerene kemikalije u ribama što za posljedicu ima povećanje konstante brzine izlučivanja, k2 , veće od onog do kojeg bi došlo samo u postupcima uklanjanja (npr. metaboliziranje, izlučivanje) (vidjeti stavak 72.). Sadržaji lipida u ispitnim ribama (koji su usko povezani s bioakumulacijom hidrofobnih tvari) i sadržaji lipida u hrani u praksi se mogu razlikovati dovoljno da bude potrebno ispraviti ih kako bi bilo moguće predstaviti faktore biomagnifikacije na smislen način. Faktor biomagnifikacije trebalo bi ispraviti u odnosu na rast (kao što se to čini s kinetičkim BCF-om u metodi vodenog izlaganja) i u odnosu na sadržaj lipida u hrani u odnosu na njihov sadržaj u ribama (faktor ispravka u odnosu na lipide). Jednadžbe i primjeri za te izračune dostupni su u Dodatku 5. odnosno Dodatku 7. Kod ispravljanja u odnosu na razrjeđenje zbog rasta trebalo bi izračunati konstantu brzine rasta ispravljenu u odnosu na rast (k 2g) (jednadžbe su dostupne u Dodatku 5.). Tu se konstantu brzine izlučivanja ispravljenu u odnosu na rast (k 2g) zatim upotrebljava za izračun faktora biomagnifikacije ispravljenog u odnosu na rast, kao u stavku 73. U nekim slučajevima taj pristup nije moguć. U drugom se pristupu, kojim se zaobilazi potreba za ispravljanjem u odnosu na razrjeđenje zbog rasta, upotrebljavaju podaci o masi izlučivanja ispitivane tvari po ribi (na temelju cijele ribe), a ne uobičajeni podaci o masi ispitivane tvari po jediničnoj masi ribe (koncentracija). To je lako postići jer bi se u okviru ispitivanja u skladu s ovom metodom trebale povezivati zabilježene koncentracije u tkivu s masama pojedinačnih riba. Jednostavan postupak za to opisan je u Dodatku 5. Važno je napomenuti da bi vrijednost k 2 trebalo procijeniti i o njoj izvijestiti čak i ako se upotrebljava ovaj alternativni pristup. Kako bi bilo moguće ispravljanje u odnosu na sadržaj lipida u hrani i ribi ako nije provedena analiza na svim uzorkovanim ribama, određuju se prosječni udjeli lipida (mokra masa) u ribi i hrani (68). Faktor ispravljenih lipida (Lc ) tada se izračunava dijeljenjem prosječnog udjela lipida u ribi s prosječnim udjelom lipida u hrani. Faktor biomagnifikacije, prema potrebi ispravljen u odnosu na rast, dijeli se s faktorom ispravljenih lipida radi izračunavanja faktora biomagnifikacije ispravljenog u odnosu na lipide. Ako su na istoj ribi pri svakoj točki uzorkovanja provedene kemijske analize i analize lipida, moguće je upotrijebiti podatke o tkivu pojedine ribe ispravljene u odnosu na lipide kako bi se izravno izračunala vrijednost BMF-a ispravljena u odnosu na lipide (vidjeti 37.). Iz grafičkog prikaza podataka o koncentraciji ispravljenih u odnosu na lipide dobiva se vrijednost C 0,d na temelju lipida i k 2. Tada se može nastaviti s matematičkom analizom upotrebljavajući iste jednadžbe iz Dodatka 7., ali se učinkovitost asimilacije (a) izračunava upotrebom konstante brzine konzumiranja hrane ispravljene u odnosu na lipide (I lipid) i koncentracije u hrani na temelju lipida (C food-lipid). Parametri ispravljeni u odnosu na lipide na sličan se način tada mogu upotrijebiti za izračun vrijednosti BMF-a (ispravljanje konstante brzine rasta trebalo bi primijeniti i na udio lipida umjesto na mokru masu ribe pri izračunu vrijednosti BMFKgL ispravljene u odnosu na lipide i na rast). Tumačenje rezultata Prosječan se rast u ispitnim i kontrolnim skupinama u načelu ne bi trebao znatno razlikovati kako bi se isključili toksični učinci. Konstante brzine rasta ili krivulje rasta tih dviju skupina trebalo bi usporediti s pomoću odgovarajućeg postupka (69)). Izvješće o ispitivanju Nakon završetka ispitivanja priprema se konačno izvješće koje sadržava informacije o ispitivanoj tvari, ispitnoj vrsti i uvjetima ispitivanja kako su navedeni u stavku 81. (kao i u metodi vodenog izlaganja). Nadalje, potrebne su informacije u nastavku.
LITERATURA
Dodatak 1. DEFINICIJE I JEDINICE
LITERATURA
Dodatak 2. ODREĐENA KEMIJSKA SVOJSTVA PRIHVATLJIVE VODE ZA RAZRJEĐIVANJE
Dodatak 3. PREPORUČENE RIBLJE VRSTE ZA ISPITIVANJE
Različite estuarijske i morske vrste rjeđe se upotrebljavaju, na primjer:
Slatkovodne ribe navedene u prethodnoj tablici jednostavne su za uzgoj i/ili su široko raspoložive tijekom čitave godine, dok je raspoloživost morskih i estuarijskih vrsta djelomično ograničena na pojedine zemlje. One se mogu uzgajati i razmnožavati u uzgajalištima ili u laboratoriju, uz nadzor bolesti i nametnika, kako bi se dobile zdrave ispitne životinje poznatog podrijetla. Ove su ribe raspoložive u mnogim dijelovima svijeta. LITERATURA
Dodatak 4. RASPOREDI UZORKOVANJA ZA ISPITIVANJA VODENIM IZLAGANJEM I IZLAGANJEM KROZ HRANU 1. Teoretski primjer rasporeda uzorkovanja za ispitivanje biokoncentracije isključivo vodenim izlaganjem tvari čija je vrijednost log KOW = 4
2. Teoretski primjer rasporeda uzorkovanja za ispitivanje bioakumulacije tvari kroz hranu nakon faze apsorpcije od 10 dana i faze izlučivanja od 42 dana
Napomena o trajanju faza i vremenima uzorkovanja Faza apsorpcije počinje u trenutku prvog hranjenja hranom s dodatkom. Pokusni dan traje od trenutka jednog hranjenja do neposredno prije trenutka sljedećeg hranjenja, 24 sata kasnije. Prvo uzorkovanje (br. 1 u tablici) trebalo bi izvršiti neposredno prije prvog hranjenja (npr. jedan sat). U idealnom slučaju, uzorkovanje tijekom ispitivanja trebalo bi provoditi neposredno prije hranjenja sljedećeg dana (tj. oko 23 sata nakon zadnjeg hranjenja na dan uzorkovanja). Faza apsorpcije završava neposredno prije prvog hranjenja hranom bez dodatka, kada započinje faza izlučivanja (ribe u ispitnoj skupini vjerojatno će i dalje probavljati hranu s dodatkom tijekom 24 sata nakon zadnjeg hranjenja hranom s dodatkom). To znači da bi zadnje uzorkovanje u fazi apsorpcije trebalo izvršiti neposredno prije prvog hranjenja hranom bez dodatka, a prvo uzorkovanje u fazi izlučivanja trebalo bi izvršiti oko 23 sata nakon prvog hranjenja hranom bez dodatka. Dodatak 5. OPĆI IZRAČUNI
1. UVOD Opći model bioakumulacije pri vodenom izlaganju riba može se opisati u smislu procesa apsorpcije i izlučivanja (gubitka), zanemarujući apsorpciju preko hrane. Diferencijalna jednadžba (dC f/dt) kojom se opisuje brzina promjene koncentracije u ribi (mg·kg– 1·dan– 1) glasi (1):
pri čemu je
Za bioakumulacijske tvari može se očekivati da vremenski ponderirana prosječna vrijednost (TWA) bude najvažnija koncentracija pri izlaganju u vodi (Cw ) unutar dopuštenog raspona fluktuacija (vidjeti stavak 24.). Preporučuje se izračunati vremenski ponderiranu prosječnu koncentraciju u vodi u skladu s postupkom iz Dodatka 6. ispitnoj metodi C.20. (2.). Treba napomenuti da je ln-transformacija koncentracije u vodi prikladna ako se očekuje eksponencijalno opadanje između razdoblja obnavljanja, npr. kod polustatičkih uvjeta ispitivanja. Kod protočnog sustava, ln-transformacija koncentracija pri izlaganju nije nužno potrebna. Ako se izračunaju vremenski ponderirane prosječne koncentracije u vodi, trebalo bi ih navesti u izvješću te upotrijebiti u kasnijim izračunima. U standardnom ispitivanju vrijednosti BCF-a kod riba apsorpcija i izlučivanje mogu se opisati u smislu dvaju kinetičkih procesa prvog reda.
U stabilnom stanju, pod pretpostavkom da su rast i metabolizam zanemarivi (tj. vrijednosti za k g i k m nije moguće razlikovati od nule), brzina apsorpcije jednaka je brzini izlučivanja te se kombinacijom jednadžbe A5.2 i jednadžbe A5.3 dobiva sljedeći odnos:
pri čemu je:
Omjer k 1/k 2 poznat je kao kinetički BCF (BCFK) i trebao bi biti jednak BCF-u u stabilnom stanju (BCFSS) dobivenom iz omjera koncentracije u stabilnom stanju u ribi i one u vodi, pri čemu se mogu pojaviti odstupanja ako nije bilo sigurno je li postignuto stabilno stanje ili ako su na kinetički BCF primijenjene korekcije zbog rasta. Međutim, s obzirom na to da su k 1 i k 2 konstante, ne mora se postići stabilno stanje da bi se dobio BCFK. Na temelju navedenih jednadžbi prvog reda, u ovom Dodatku 5. navode se opći izračuni potrebni za metode ispitivanja bioakumulacije pri vodenom izlaganju i izlaganju kroz hranu. Međutim, odjeljci 5., 6. i 8. relevantni su jedino za metodu izlaganja kroz hranu, ali ovdje su uključeni jer se odnose na ‚opće’ tehnike. Sekvencijske metode (odjeljci 4. i 5.) i simultane metode (odjeljak 6.) omogućuju izračunavanje konstanti apsorpcije i izlučivanja koje se upotrebljavaju za dobivanje kinetičkih BCF-ova. Sekvencijska metoda određivanja k 2 (odjeljak 4.) važna je za izlaganje kroz hranu jer se njome izračunavaju i učinkovitost asimilacije i BMF. U Dodatku 7. navode se detalji izračuna specifičnih za metodu izlaganja kroz hranu. 2. PREDVIĐANJE TRAJANJA FAZE APSORPCIJE Vrijednost k 2, a time i određeni postotak vremena potrebnog da se postigne stabilno stanje, može se prije provedbe ispitivanja procijeniti iz empirijskih odnosa između k 2 i podjelnog koeficijenta n-oktanol/voda (K OW) ili k 1 i BCF-a. Međutim, treba imati na umu da se jednadžbe koje su navedene u ovom odjeljku primjenjuju jedino kada obrasci apsorpcije i izlučivanje prate kinetiku prvog reda. Ako to očito nije slučaj, preporučuje se zatražiti mišljenje biostatističara i/ili farmakokinetičara ako su predviđanja koja se odnose na fazu apsorpcije poželjna. Postoji više metoda s pomoću kojih se može procijeniti k 2 (dan– 1). Na primjer, u prvom se redu mogu upotrijebiti sljedeći empirijski odnosi (87):
ili
W = srednja masa tretirane ribe (u gramima mokre mase) na kraju apsorpcije / na početku izlučivanja (88) Za druge odnose vidjeti (6.). Moglo bi biti korisno primijeniti složenije modele za procjenu k2 ako, na primjer, postoji vjerojatnost da će doći do značajnog metabolizma (7., 8.). Međutim, što je model složeniji, to je potrebna veća pažnja pri tumačenju predviđanja. Na primjer, prisutnost nitro skupina mogla bi upućivati na brzi metabolizam, ali ne mora uvijek biti tako. Stoga bi pri planiranju ispitivanja korisnik trebao ocijeniti rezultate modela predviđanja uzimajući u obzir kemijsku strukturu i sve druge relevantne informacije (na primjer preliminarna ispitivanja). Vrijeme potrebno da se postigne određeni postotak stabilnog stanja može se dobiti, primjenom procjene k 2, iz opće kinetičke jednadžbe kojom se opisuju apsorpcija i izlučivanje (kinetika prvog reda), pod pretpostavkom da su rast i metabolizam zanemarivi. Ako dođe do značajnog rasta tijekom ispitivanja, procjene opisane u nastavku neće biti pouzdane. U takvim je slučajevima bolje upotrijebiti k 2g ispravljen u odnosu na rast kako je opisano u nastavku (vidjeti odjeljak 7. ovog Dodatka):
ili, ako je C w stalan:
Približavanjem stabilnom stanju (t → ∞), jednadžba A5.10 može se svesti (vidjeti (9) (10)) na:
ili
Tada je BCF × C w aproksimacija koncentracije u ribi u stabilnom stanju (C f-SS). [Napomena: isti se pristup može primijeniti kada se procjenjuje BMF u stabilnom stanju tijekom ispitivanja izlaganjem kroz hranu. U tom se slučaju u prethodno navedene jednadžbe umjesto BCF-a unosi BMF, a umjesto C w vrijednost C food, koncentracija u hrani] Jednadžba A5.10 može se preoblikovati u:
ili
Primjenom jednadžbe A5.14 vrijeme potrebno da se postigne određeni postotak stabilnog stanja može se predvidjeti ako se prije toga procijeni k 2 s pomoću jednadžbe A5.5 ili jednadžbe A5.6. Za orijentaciju, statistički optimalno trajanje faze apsorpcije za dobivanje statistički prihvatljivih podataka (BCFK) je vrijeme koje je potrebno da logaritamska krivulja koncentracije ispitivane tvari u ribama u ovisnosti o linearnom vremenu dosegne barem 50 % stabilnog stanja (tj. 0,69/k 2), ali ne više od 95 % stabilnog stanja (tj. 3,0/k 2) (11). Ako akumulacija premaši 95 % stabilnog stanja, izračunavanje BCFSS postaje izvedivo. Vrijeme potrebno da se postigne 80 % stabilnog stanja iznosi (primjenom jednadžbe A5.14):
ili
Slično tomu, vrijeme potrebno za postizanje 95 % stabilnog stanja iznosi:
Primjerice, trajanje faze apsorpcije (tj. vrijeme potrebno da se postigne određeni postotak stabilnog stanja, npr. t 80 ili t 95) za ispitivanu tvar čiji je log K OW = 4 bilo bi (primjenom jednadžbe A5.5, jednadžbe A5.16 i jednadžbe A5.17): logk 2 = 1,47 – 0,414 · 4 k 2 = 0,652 dan– 1
ili Druga je mogućnost da se izraz:
upotrijebi za izračun vremena potrebnog za postizanje efektivnog stabilnog stanja (t eSS ) (12.). Za tvar čiji je log K OW = 4 to daje: tSS = 6,54 · 10 – 3 · 104 + 55,31 = 121 sati 3. PREDVIĐANJE TRAJANJA FAZE IZLUČIVANJA Predviđanje vremena potrebnog da se tjelesno opterećenje smanji na određeni postotak početne koncentracije može se isto tako dobiti i iz opće jednadžbe kojom se opisuju apsorpcija i izlučivanje (uz pretpostavku kinetike prvog reda, vidjeti jednadžbu A5.9 (1., 13). Za fazu izlučivanja, pretpostavlja se da je C w (ili C food za ispitivanje izlaganjem kroz hranu) jednak nuli. Jednadžba se potom može svesti na:
ili
pri čemu je C f,0 koncentracija na početku razdoblja izlučivanja. 50 %-tno izlučivanje postiže se u vremenu (t 50):
ili
Isto tako, 95 %-tno izlučivanje postiže se u:
Ako je u prvom razdoblju apsorpcija 80 % (1,6/k 2) te ako je u fazi izlučivanja gubitak 95 % (3,0/k 2), tada će faza izlučivanja trajati otprilike dvostruko duže od faze apsorpcije. Treba napomenuti da se procjene temelje na pretpostavci da obrasci apsorpcije i izlučivanja prate kinetiku prvog reda. Ako je očito da ne vrijedi kinetika prvog reda, te procjene nisu valjane. 4. SEKVENCIJSKA METODA: ODREĐIVANJE KONSTANTE BRZINE IZLUČIVANJA (GUBITKA) K 2 Polazi se od pretpostavke da se većina podataka o biokoncentraciji može ‚prilično’ dobro opisati jednostavnim dvoodjelnim/dvoparametarskim modelom, na što ukazuje pravac koji približno odgovara točkama koncentracija u ribama (na skali ln) tijekom faze izlučivanja.
Treba napomenuti da odstupanja od pravca mogu ukazivati na to da je obrazac izlučivanja složeniji od kinetike prvog reda. Grafičkom se metodom mogu razlučiti obrasci izlučivanja koji odstupaju od kinetike prvog reda. Za izračunavanje k 2 za više vremena uzorkovanja provodi se linearna regresija ln(koncentracija) u odnosu na vrijeme. Nagib regresijskog pravca procjena je konstante brzine izlučivanja k 2 (89). Prosječna koncentracija u ribi na početku faze izlučivanja (C 0,d; što je jednako prosječnoj koncentraciji u ribi na kraju faze apsorpcije) može se lako izračunati iz odsječka pravca (uključujući granice dopuštenih pogrešaka) (89):
Da bi se izračunao k 2 kada postoje samo dva vremena uzorkovanja (kao u smanjenom planu ispitivanja), treba unijeti dvije prosječne koncentracije u sljedeću jednadžbu:
pri čemu su ln(C f1) i ln(C f2) prirodni logaritmi koncentracija u vremenu t 1 odnosno t 2, a t 2 i t 1 su vremena kada su uzeta dva uzorka u odnosu na početak izlučivanja (90). 5. SEKVENCIJSKA METODA: ODREĐIVANJE KONSTANTE BRZINE APSORPCIJE K 1 (JEDINO METODA VODENOG IZLAGANJA) Da bi se za fazu apsorpcije pronašla vrijednost k1 na temelju skupa podataka o koncentracijama u vremenskom slijedu, potrebno je upotrijebiti računalni program koji odgovara sljedećem modelu:
pri čemu je k 2 dobiven prethodnim izračunom, C f(t) i C w(t) su koncentracije u ribi odnosno vodi u vremenu t. Da bi se izračunao k 1 kada postoje samo dva vremena uzorkovanja (kao u smanjenom planu ispitivanja), upotrebljava se sljedeća formula:
pri čemu je k 2 dobiven prethodnim izračunom, C f je koncentracija u ribi na početku faze izlučivanja, a C w je prosječna koncentracija u vodi tijekom faze apsorpcije (91). Kako bi se procijenila valjanost prilagođavanja, nagibi k 1 i k 2 vizualno se pregledavaju u odnosu na grafički prikazane vrijednosti izmjerene u vremenima uzorkovanja. Ako se pokaže da se sekvencijskom metodom dobila slaba procjena za k 1, potrebno je primijeniti simultani pristup za izračunavanje k 1 i k 2 (vidjeti odjeljak 6.). I ovdje bi dobivene nagibe trebalo usporediti s grafički prikazanim izmjerenim podacima kako bi se vizualno provjerila valjanost prilagođavanja. Ako je valjanost prilagođavanja i dalje nezadovoljavajuća, to može ukazivati na činjenicu da ne vrijedi kinetika prvog reda te bi trebalo primijeniti druge, složenije modele. 6. SIMULTANA METODA IZRAČUNAVANJA KONSTANTI BRZINE APSORPCIJE I IZLUČIVANJA (GUBITKA) (JEDINO METODA VODENOG IZLAGANJA) Mogu se upotrijebiti računalni programi za izračunavanje vrijednosti k 1 i k 2 na temelju skupa podataka o koncentracijama u vremenskom slijedu i modela:
pri čemu je:
Ovim se pristupom izravno dobivaju standardne pogreške za procjene k 1 i k 2. Ako se u jednadžbi A5.25 i jednadžbi A5.26 vrijednost k 1/k 2 zamijeni vrijednošću BCF (vidjeti jednadžbu A5.4), mogu se procijeniti standardna pogreška i interval 95 %-tne pouzdanosti za BCF. To je posebno korisno kada se uspoređuju različite procjene koje su posljedica transformacije podataka. Zavisna varijabla (koncentracija u ribi) može se prilagoditi s ln-transformacijom ili bez nje te se može ocijeniti dobivena nesigurnost u pogledu BCF-a. Budući da postoji snažna korelacija između parametara k 1 i k 2 ako se procjenjuju istodobno, možda je bolje prvo izračunati k 2 samo iz podataka o izlučivanju (vidjeti prethodno navedeno); k 2 se u većini slučajeva može prilično precizno procijeniti iz krivulje izlučivanja. Potom se k 1 može izračunati iz podataka o apsorpciji s pomoću nelinearne regresije (92). Savjetuje se da se pri sekvencijskom prilagođavanju podaci transformiraju na isti način. Kako bi se procijenila valjanost prilagođavanja, dobiveni se nagibi mogu vizualno pregledati u odnosu na grafički prikazane vrijednosti izmjerene u vremenima uzorkovanja. Ako se pokaže da se ovom metodom dobila slaba procjena za k1 , potrebno je primijeniti simultani pristup za izračunavanje k 1 i k 2. Kao i prije, prilagođeni model potrebno je usporediti s grafički prikazanim izmjerenim podacima kako bi se vizualno provjerila valjanost prilagođavanja, a dobivene procjene parametara za k 1, k 2 i BCF te njihove standardne pogreške i/ili intervale pouzdanosti trebalo bi usporediti prema različitim vrstama prilagođavanja. Ako valjanost prilagođavanja nije zadovoljavajuća, to može ukazivati na činjenicu da ne vrijedi kinetika prvog reda te bi trebalo primijeniti druge, složenije modele. Jedna od najčešćih komplikacija rast je riba tijekom ispitivanja. 7. ISPRAVLJANJE U ODNOSU NA RAZRJEĐENJE ZBOG RASTA ZA KINETIČKI BCF I BMF U ovom se odjeljku opisuje standardna metoda ispravljanja zbog rasta riba tijekom ispitivanja (tzv. ‚razrjeđenje zbog rasta’), koja je valjana samo ako vrijedi kinetika prvog reda. U slučajevima u kojima postoje pokazatelji da kinetika prvog reda ne vrijedi, preporučuje se potražiti savjet biostatističara o prikladnom ispravljanju u odnosu na razrjeđenje zbog rasta ili primijeniti pristup koji se temelji na masi, koji je opisan u nastavku. U nekim slučajevima metodi ispravljanja u odnosu na razrjeđenje zbog rasta nedostaje preciznosti ili ponekad ne djeluje (na primjer kod tvari koje se izlučuju vrlo polako i ispituju u ribama koje brzo rastu izvedena konstanta brzine izlučivanja ispravljena u odnosu na razrjeđenje zbog rasta k 2g može biti vrlo mala pa pogreška u dvjema konstantama brzina upotrijebljenima za dobivanje te vrijednosti postaje kritična te u nekim slučajevima procijenjena vrijednost k g može biti viša od vrijednosti k 2). U takvim se slučajevima može primijeniti alternativni pristup (tj. pristup na temelju podataka o masi), kojim se izbjegava potreba za ispravljanjem i koji djeluje čak i kada nema kinetike prvog reda. Taj je pristup prikazan na kraju ovog odjeljka. Ispravljanje u odnosu na rast metodom oduzimanja konstante brzine rasta Kod standardne metode sve se pojedinačne mase i dužine preračunavaju u prirodne logaritme te se ln(masa) ili ln(1/masa) grafički prikazuje u odnosu na vrijeme (dan), odvojeno za ispitne i kontrolne skupine. Na isti se način postupa i s podacima koji su odvojeno dobiveni za fazu apsorpcije i fazu izlučivanja. Općenito, za ispravljanje u odnosu na razrjeđenje zbog rasta primjerenije je upotrijebiti podatke o masi iz cijelog ispitivanja da bi se dobila konstanta brzine rasta (k g), ali statistički značajne razlike između konstanti brzine rasta dobivenih za fazu apsorpcije i fazu izlučivanja mogu upućivati na to da bi trebalo upotrijebiti konstantu brzine dobivenu za fazu izlučivanja. Ukupne brzine rasta koje su za ispitne i kontrolne skupine utvrđene ispitivanjima u kojima je primijenjeno vodeno izlaganje mogu se upotrijebiti za provjeru učinaka povezanih s tretiranjem. Linearna korelacija u skladu s metodom najmanjih kvadrata izračunava se za ln(masa ribe) u odnosu na vrijeme (dan) (i za ln(1/masa) u odnosu na vrijeme (dan)) za svaku skupinu (ispitne i kontrolne skupine, pojedinačni podaci, ne dnevne srednje vrijednosti) za cijelo ispitivanje, fazu apsorpcije i fazu izlučivanja, primjenom standardnih statističkih postupaka. Izračunavaju se varijance u nagibu pravaca te se upotrebljavaju za procjenu statističke značajnosti (p = 0,05) razlike u nagibima (konstantama brzine rasta) primjenom Studentova t-testa (ili ANOVA-e ako se ispituje više od jedne koncentracije). Za potrebe ispravljanja u odnosu na rast uglavnom je poželjnije upotrebljavati podatke o masi. Podaci o duljini, s kojima se postupa na isti način, mogu biti korisni za uspoređivanje kontrolnih i ispitnih skupina u pogledu učinaka povezanih s tretiranjem. Ako se analizom podataka o masi ne utvrdi statistički značajna razlika, podaci dobiveni za ispitne i kontrolne skupine mogu se objediniti te se može izračunati ukupna konstanta brzine rasta riba u ispitivanju (k g) kao ukupan nagib linearne korelacije. Ako se opaze statistički značajne razlike, konstante brzine rasta navode se odvojeno za svaku skupinu riba i/ili fazu ispitivanja. Konstantu brzine utvrđenu za pojedinu tretiranu skupinu trebalo bi potom upotrijebiti za potrebe ispravljanja u odnosu na razrjeđenje zbog rasta za tu skupinu. Ako su zabilježene statistički značajne razlike između konstanti brzine apsorpcije i izlučivanja, trebalo bi upotrijebiti konstante brzine dobivene u fazi izlučivanja. Izračunana konstanta brzine rasta (k g iskazan kao dan– 1) može se oduzeti od ukupne konstante brzine izlučivanja (k 2) kako bi se dobila konstanta brzine izlučivanja k 2g.
Konstanta brzine apsorpcije dijeli se s konstantom brzine izlučivanja ispravljenom u odnosu na rast kako bi se dobio kinetički BCF ispravljen u odnosu na rast, koji se označuje kao BCFKg (ili BMFKg).
Konstanta brzine rasta dobivena za ispitivanje u kojemu je primijenjeno izlaganje kroz hranu upotrebljava se u jednadžbi A7.5 kako bi se izračunao BMFKg ispravljen u odnosu na rast (vidjeti Dodatak 7.). Ispravljanje u odnosu na rast metodom koja se temelji na podacima o masi Umjesto prethodno opisane ‚metode oduzimanja konstante brzine rasta’ može se upotrijebiti i sljedeća metoda kako bi se izbjegla potreba za ispravljanjem u odnosu na rast. Temelji se na načelu upotrebe podataka o izlučivanju na osnovi mase po cijeloj ribi, a ne na osnovi koncentracije. Koncentracije opažene u tkivima tijekom faze izlučivanja (masa ispitivane tvari/jedinična masa ribe) preračunavaju se u masu ispitivane tvari po ribi: koncentracije i pojedinačne mase riba povezuju se u obliku tablice (npr. primjenom računalne tablice) te se svaka koncentracija množi s masom cijele ribe kako bi se dobio skup podataka ‚masa ispitivane tvari/riba’ za sve uzorke faze izlučivanja. Prirodni logaritam dobiven iz podataka o masi tvari grafički se prikazuje u odnosu na vrijeme izvođenja pokusa (faza izlučivanja), kao i inače. Za metodu vodenog izlaganja, konstanta brzine apsorpcije izračunava se na uobičajen način (vidjeti odjeljke 4. i 6.; treba napomenuti da bi u jednadžbama za prilagođavanje krivulje za k 1 trebalo upotrijebiti ‚normalnu’ vrijednost k 2) te se iz prethodno navedenih podataka izvodi konstanta brzine izlučivanja. Budući da vrijednost dobivena za konstantu brzine izlučivanja ne ovisi o rastu jer je izračunata na osnovi mase po cijeloj ribi, trebalo bi je označiti kao k 2g, a ne kao k 2. 8. NORMIRANJE LIPIDA NA SADRŽAJ LIPIDA OD 5 % (JEDINO METODA VODENOG IZLAGANJA) O rezultatima za BCF (kinetički i u stabilnom stanju) dobivenima ispitivanjima u kojima je primijenjeno vodeno izlaganje trebalo bi izvijestiti i u odnosu na zadani sadržaj lipida u ribi od 5 % mokre mase, osim ako se može dokazati da se ispitivana tvar ne akumulira ponajprije u lipidima (npr. neke se perfluorirane tvari mogu vezati na proteine). Koncentracije u ribama ili vrijednost BCF potrebno je preračunati u sadržaj lipida od 5 % u odnosu na mokru masu. Ako su u svim točkama uzorkovanja upotrijebljene iste ribe za mjerenje koncentracija tvari i sadržaja lipida, svaku pojedinačnu koncentraciju izmjerenu u ribi potrebno je ispraviti u odnosu na sadržaj lipida u toj ribi.
pri čemu je:
Ako analiza lipida nije provedena na svim uzorkovanim ribama, za normiranje vrijednosti BCF-a upotrebljava se srednja vrijednost lipida. Za BCF u stabilnom stanju trebalo bi upotrijebiti srednju vrijednost zabilježenu u tretiranoj skupini na kraju faze apsorpcije. Za normiranje vrijednosti kinetičkog BCF-a ponekad je opravdano primijeniti drukčiji pristup, primjerice ako se sadržaj lipida znatno promijenio tijekom faze apsorpcije ili faze izlučivanja. Međutim, u svakom bi slučaju brzina hranjenja trebala biti takva da se dramatične promjene u sadržaju lipida svedu na najmanju mjeru.
pri čemu je:
LITERATURA
Dodatak 6. JEDNADŽBE KOJE SE ODNOSE NA ISPITIVANJE U KOJEMU SE PRIMJENJUJE VODENO IZLAGANJE: SKRAĆENO ISPITIVANJE Ovaj se pristup opravdava činjenicom da je faktor biokoncentracije u potpunom ispitivanju moguće utvrditi kao faktor biokoncentracije u stabilnom stanju (BCFSS) izračunavanjem omjera koncentracije ispitivane tvari u tkivu ribe u odnosu na koncentraciju ispitivane tvari u vodi, ili izračunavanjem kinetičkog faktora biokoncentracije (BCFK) kao omjera konstante brzine apsorpcije k 1 u odnosu na konstantu brzine izlučivanja k 2. Vrijednost BCFK valjana je čak i ako se tijekom faze apsorpcije ne postigne koncentracija tvari u stabilnom stanju, pod uvjetom da se faze apsorpcije i izlučivanja odvijaju približno u skladu s procesima kinetike prvog reda. Ako se koncentracija tvari u tkivima (C f1) izmjeri na kraju izlaganja (t 1) te ako se koncentracija u tkivu (C f2) ponovo izmjeri nakon određenog vremena (t 2), konstanta brzine izlučivanja (k 2) može se procijeniti s pomoću formule A5.22 iz Dodatka 5. Konstanta brzine apsorpcije, k 1, može se potom algebarski odrediti s pomoću formule A5.23 iz Dodatka 5. (gdje je C f jednako C f1 i t je jednako t 1) (1). Kinetički faktor biokoncentracije za skraćeno ispitivanje (označen kao BCFKm da bi se razlikovao od kinetičkog faktora biokoncentracije određenog drugim metodama) tada glasi:
Koncentracije ili rezultate trebalo bi ispraviti u odnosu na razrjeđenje zbog rasta te normirati na sadržaj lipida u ribi od 5 % kako je opisano u Dodatku 5. Vrijednost BCFSS iz skraćenog ispitivanja vrijednost je BCF-a izračunana na kraju faze apsorpcije, pod pretpostavkom da je postignuto stabilno stanje To je moguće samo pretpostaviti jer dokazivanje nije moguće zbog nedovoljnog broja točki uzorkovanja.
pri čemu je: C f-minSS = koncentracija u ribi pri pretpostavljenom stabilnom stanju na kraju apsorpcije (mg kg– 1 mokre mase). C w-minSS = koncentracija u vodi pri pretpostavljenom stabilnom stanju na kraju apsorpcije (mg l– 1). LITERATURA
Dodatak 7. JEDNADZBE KOJE SE ODNOSE NA ISPITIVANJE U KOJEMU SE PRIMJENJUJE IZLAGANJE KROZ HRANU
1. PRIMJER SASTAVA PRIKLADNE KOMERCIJALNE HRANE ZA RIBU
2. PRIMJERI TEHNIKA DODAVANJA DODATKA HRANI Opće napomene Kontrolnu hranu trebalo bi pripremiti na isti način kao i hranu s dodatkom, ali bez ispitivane tvari. Kako bi se provjerila koncentracija u tretiranoj hrani, trebalo bi uzeti tri uzorka dozirane hrane prikladnom metodom ekstrakcije te u uzetom ekstraktu izmjeriti koncentraciju ispitivane tvari ili radioaktivnost. Trebalo bi dokazati visoku analitičku stopu izdvajanja (> 85 %) i nisku varijaciju među uzorcima (tri uzorka koncentracije tvari uzeta na početku ispitivanja ne bi smjela odstupati više od ± 15 % od srednje vrijednosti). Tijekom ispitivanja izlaganjem kroz hranu trebalo bi nultog dana ispitivanja i na kraju faze apsorpcije uzeti tri uzorka hrane kako bi se odredio sadržaj ispitivane tvari u hrani. Pripremanje hrane za ribe s tekućim ispitnim materijalom (čistim) Utvrdi se ciljna nazivna ispitna koncentracija u tretiranoj hrani za ribu, na primjer 500 μg ispitivane tvari/g hrane. Odgovarajuća količina (prema molnoj masi ili specifičnoj radioaktivnosti) čiste ispitivane tvari doda se poznatoj masi hrane za ribe u staklenci ili balonu rotacijskog isparivača. Masa hrane za ribe trebala bi biti dovoljna za cijelu fazu apsorpcije (uzimajući u obzir potrebu za povećanjem količina pri svakom hranjenju zbog rasta riba). Hranu za ribe i ispitivanu tvar trebalo bi miješati preko noći sporim okretanjem (npr. s pomoću roto-rack miješalice ili rotiranjem ako se upotrebljava rotacijski isparivač). Hranu s dodatkom trebalo bi do upotrebe čuvati u uvjetima kojima se održava stabilnost ispitivane tvari u smjesi hrane (npr. rashlađivanjem). Pripremanje hrane za ribe s kukuruznim ili ribljim uljem kao nosačem Krute ispitivane tvari trebalo bi usitniti u tarioniku u fini prah. Tekuće ispitivane tvari mogu se izravno dodati u kukuruzno ili riblje ulje. Ispitivana tvar otopi se u poznatoj količini kukuruznog ili ribljeg ulja (npr. 5-15 ml). Dozirano ulje prenese se u balon rotacijskog isparivača prikladne veličine. Tikvicu u kojoj se pripremalo dozirano ulje trebalo bi isprati dvama malim alikvotima ulja koji se potom dodaju u balon kako bi se osiguralo da je sva otopljena ispitivana tvar prenesena. Kako bi se osiguralo potpuno otapanje/disperzija u ulju (ili ako se upotrebljava više ispitivanih tvari u ispitivanju), dodaje se mikromiješalica, tikvica se začepi te se smjesa brzo miješa tijekom noći. U balon se dodaje odgovarajuća količina hrane za ribe (obično u obliku peleta) te se sadržaj balona homogeno izmiješa neprestanim okretanjem staklenog balona najmanje 30 minuta, no po mogućnosti tijekom noći. Potom se hrana s dodatkom skladišti na odgovarajući način (npr. u hladnjaku) kako bi se osigurala stabilnost ispitivane tvari u hrani do upotrebe. Pripremanje hrane za ribe s organskim otapalom Odgovarajuća količina ispitivane tvari (prema molnoj masi ili specifičnoj radioaktivnosti) dovoljna za postizanje ciljane doze otopi se u odgovarajućem organskom otapalu (npr. cikloheksanu ili acetonu; 10 do 40 ml, ili veći volumen ako je potrebno ovisno o količini hrane kojoj će se dodati dodatak). Alikvot ili sva količina (koja se dodaje dio po dio) ove otopine pomiješa se s odgovarajućom masom hrane za ribe dovoljnom da se postigne nazivna razina doze koja je potrebna za ispitivanje. Hrana i ispitivana tvar mogu se izmiješati u posudi od nehrđajućeg čelika te svježe dozirana hrana za ribe držati u toj posudi u laboratorijskom sušioniku dva dana (uz povremeno miješanje) kako bi ispario višak otapala ili se mogu izmiješati u rotacijskom isparivaču uz neprestanu rotaciju. Ako je potrebno, višak otapala može se ukloniti strujom zraka ili dušika. Potrebno je pobrinuti se da ispitivana tvar ne kristalizira tijekom uklanjanja otapala. Hranu s dodatkom trebalo bi do upotrebe čuvati u uvjetima kojima se održava stabilnost ispitivane tvari u smjesi hrane (npr. rashlađivanjem). 3. IZRAČUNAVANJE UČINKOVITOSTI ASIMILACIJE I FAKTORA BIOMAGNIFIKACIJE Da bi se izračunala učinkovitost asimilacije, prvo je potrebno procijeniti ukupnu konstantu brzine izlučivanja u skladu s odjeljkom 4. Dodatka 5. (s pomoću ‚sekvencijske metode’, tj. standardne linearne regresije) na temelju srednjih vrijednosti koncentracija izmjerenih u uzorcima tijekom faze izlučivanja. Konstanta brzine hranjenja, I, i trajanje apsorpcije, t, poznati su parametri ispitivanja. C food, srednja izmjerena koncentracija ispitivane tvari u hrani, varijabla je koja se mjeri tijekom ispitivanja. C 0,d, koncentracija ispitivane tvari u ribi na kraju faze apsorpcije, obično se izvodi iz odsječka pravca koji prikazuje ln(koncentracija) u ovisnosti o danu izlučivanja. Učinkovitost asimilacije tvari (a, apsorpcija ispitivane tvari u cijeloj utrobi) izračunava se kao:
pri čemu je: C 0,d = izvedena koncentracija u ribi u nultom vremenu faze izlučivanja (mg kg– 1); k 2 = ukupna (neispravljena u odnosu na rast) konstanta brzine izlučivanja (dan– 1), izračunana prema jednadžbama iz Dodatka 5. odjeljka 3.; I = konstanta brzine konzumacije hrane (g hrane g-1 ribe dan– 1); C food = koncentracija u hrani (mg kg– 1 hrane); t= trajanje razdoblja hranjenja (u danima) Međutim, možda će brzinu hranjenja, I, koja se upotrebljava u izračunu trebati prilagoditi u odnosu na rast riba kako bi se dobila točna vrijednost učinkovitosti asimilacije a. U ispitivanju u kojemu ribe znatno rastu tijekom faze apsorpcije (u kojoj se količine hrane ne ispravljaju kako bi se održala zadana brzina hranjenja), odvijanjem faze apsorpcije stvarna se brzina hranjenja sve više snižava u odnosu na zadanu, što dovodi do veće ‚stvarne’ učinkovitosti asimilacije (treba napomenuti da ovo nije važno za ukupan izračun vrijednosti BMF-a jer se članovi vrijednosti I poništavaju između jednadžbe A7.1 i jednadžbe A7.4). Srednja vrijednost brzine hranjenja ispravljena u odnosu na razrjeđenje zbog rasta, I g, može se odrediti na više načina, ali jednostavan je i točan način taj da se na temelju poznate konstante brzine rasta (k g) procijene mase ispitne ribe u vremenskim točkama tijekom faze apsorpcije, tj.:
pri čemu je: W f(t)= srednja masa ribe na dan t faze apsorpcije W f,0 = srednja masa ribe na početku pokusa Na ovaj se način (u najmanju ruku) može procijeniti srednja masa ribe zadnjeg dana izlaganja (W f,end-of-uptake). S obzirom na to da je brzina hranjenja utvrđena na temelju W f,0, stvarna brzina hranjenja za svaki dan faze apsorpcije može se izračunati primjenom tih dviju masenih vrijednosti. Brzina hranjenja ispravljena u odnosu na rast, I g (g hrane g– 1 ribe dan– 1), koju treba upotrijebiti umjesto I u slučaju brzog rasta tijekom faze apsorpcije, može se tada izračunati kao:
Nakon što se dobije učinkovitost asimilacije, BMF se može izračunati tako da se ona pomnoži s konstantom brzine hranjenja I (ili I g, ako je upotrijebljen za izračunavanje vrijednosti α) te dobiveni umnožak podijeli s ukupnom konstantom brzine izlučivanja k 2:
Na isti bi način trebalo izračunati i faktor biomagnifikacije ispravljen u odnosu na rast, primjenjujući konstantu brzine izlučivanja ispravljenu u odnosu na rast (izvedenu u skladu s odjeljkom 7. Priloga 5.). Ponovno, ako je za izračunavanje vrijednosti α upotrijebljen I g, i ovdje bi ga trebalo upotrijebiti umjesto I:
pri čemu je: α = učinkovitost asimilacije (apsorpcija ispitivane tvari u cijeloj utrobi); k 2 = ukupna (neispravljena u odnosu na rast) konstanta brzine izlučivanja (dan– 1), izračunana prema jednadžbama iz Dodatka 5. odjeljka 3.; k 2g = konstanta brzine izlučivanja ispravljena u odnosu na rast (dan– 1); I = konstanta brzine konzumacije hrane (g hrane g– 1 ribe dan– 1); Poluvijek ispravljen u odnosu na rast (t 1/2) izračunava se na sljedeći način.
Učinkovitost asimilacije tvari iz hrane može se isto tako procijeniti ako se utvrde ostaci u tkivu tijekom linearne faze faze apsorpcije (između 1. i 3. dana). U tom se slučaju učinkovitost asimilacije tvari (α) može odrediti na sljedeći način:
pri čemu je: C fish (t) = koncentracija ispitivane tvari u ribi u vremenu t (mg kg– 1 mokre mase). 4. ISPRAVAK U ODNOSU NA LIPIDE Ako je sadržaj lipida izmjeren u istim ribama na kojima je provedena kemijska analiza u svim intervalima uzorkovanja, tada bi pojedinačne koncentracije trebalo ispraviti u odnosu na lipide te grafički prikazati prirodni logaritam koncentracije (ispravljene u odnosu na lipide) u ovisnosti o izlučivanju (dan) kako bi se dobili C 0,d i k 2. Učinkovitost asimilacije (jednadžba A7.1) može se tada izračunati na temelju lipida, upotrebljavajući C food na temelju lipida (tj. C food se pomnoži sa srednjom vrijednošću udjela lipida u hrani). Dodatnim izračunom s pomoću jednadžbe A7.4 i jednadžbe A7.5 izravno se dobije BMF ispravljen u odnosu na lipide (i ispravljen u odnosu na razrjeđenje zbog rasta). U protivnom se srednje vrijednosti udjela lipida (na temelju mokre mase) u ribi i u hrani izvode i za izloženu i za kontrolnu skupinu (za hranu i za ribe iz kontrolne skupine ta se vrijednost obično izvodi iz podataka izmjerenih na početku i na kraju izlaganja; za ribe u izloženoj skupini ta se vrijednost obično izvodi iz podataka izmjerenih samo na kraju izlaganja). U nekim ispitivanjima sadržaj lipida u ribi može se značajno povećati; u takvim je slučajevima primjerenije upotrijebiti srednju vrijednost koncentracije lipida u ispitnoj ribi izračunanu s pomoću vrijednosti izmjerenih na kraju izlaganja i na kraju izlučivanja. Općenito, za dobivanje obaju udjela lipida trebali bi se upotrijebiti samo podaci koji se odnose na izloženu skupinu. Faktor ispravka u odnosu na lipide (Lc ) izračunava se kao:
pri čemu su L fish i L food srednje vrijednosti udjela lipida u ribi odnosno hrani. Faktor ispravka u odnosu na lipide upotrebljava se za izračunavanje faktora biomagnifikacije ispravljenog u odnosu na lipide (BMFL):
5. OCJENJIVANJE RAZLIKA IZMEĐU IZMJERENE KONCENTRACIJE U NULTOM VREMENU (C 0,M) I IZVEDENE KONCENTRACIJE U NULTOM VREMENU (C 0,D) Izmjerenu koncentraciju u nultom vremenu (C 0,m) i izvedenu koncentraciju u nultom vremenu (C 0,d) trebalo bi usporediti. Ako su vrlo slične, to ukazuje na to da je model prvog reda koji je upotrijebljen za dobivanje parametara izlučivanja primjeren. U nekim ispitivanjima može postojati izrazita razlika između izvedene vrijednosti u nultom vremenu, C 0,d, i srednje izmjerene koncentracije u nultom vremenu, C 0,m (vidjeti zadnju alineju stavka 159. ove ispitne metode). Ako je C 0,d puno niži od C 0,m (C 0,d << C 0,m), ta razlika može upućivati na to da je u utrobi prisutna neprobavljena hrana s dodatkom. To se može ispitati pokusom provođenjem odvojene analize na izrezanoj utrobi ako su na kraju faze apsorpcije uzeti i pohranjeni dodatni uzorci (cijele ribe). U protivnom, ako statistički valjano ispitivanje netipičnih vrijednosti primijenjeno na linearnu regresiju faze izlučivanja pokaže da je prva točka uzorkovanja izlučivanja pogrešno povećana, može biti primjereno provesti linearnu regresiju da se dobije k 2, ali uz izostavljanje vrijednosti koncentracije u prvoj točki izlučivanja. U takvim slučajevima, ako se nesigurnost u pogledu linearne regresije značajno smanji te je očito da u izlučivanju približno vrijedi kinetika prvog reda, može biti primjereno upotrijebiti dobivene vrijednosti C 0,d i k 2 za izračunavanje učinkovitosti asimilacije. To se mora u cijelosti obrazložiti u izvješću. Isto se tako može dogoditi da u fazi izlučivanja ne vrijedi kinetika prvog reda. Ako je to vjerojatno tako (tj. čini se da podaci transformirani u prirodni logaritam slijede krivulju, a ne pravac linearne regresije), tada izračuni vrijednosti k 2 i C 0,d vjerojatno nisu valjani te bi trebalo zatražiti savjet biostatističara. Ako je C 0,d puno viši od izmjerene vrijednosti (C 0,d >> C 0,m) to može upućivati na sljedeće: da je tvar izlučena vrlo brzo (tj. vrlo rano u fazi izlučivanja točke uzorkovanja približile su se granici kvantifikacije analitičke metode, vidjeti odjeljak 6. dalje u tekstu); da je u izlučivanju došlo do odstupanja od kinetike prvog reda; da je linearna regresija za izvođenje vrijednosti k 2 i C 0,d manjkava; ili da se u nekim vremenskim točkama uzorkovanja pojavio problem u vezi s koncentracijama izmjerenima tijekom ispitivanja. U takvim bi slučajevima trebalo pregledati grafički prikaz linearne regresije kako bi se identificirali uzorci koji se nalaze na granici kvantifikacije ili blizu granice kvantifikacije, netipične vrijednosti i očita iskrivljenja (koja upućuju na to da ne vrijedi kinetika prvog reda) te ih jasno navesti u izvješću. Svako kasnije ponovno ocjenjivanje linearne regresije koje se provodi radi poboljšanja procijenjenih vrijednosti trebalo bi opisati i opravdati. Ako se uoči izrazito odstupanje od kinetike prvog reda, tada izračuni vrijednosti k 2 i C 0,d vjerojatno nisu valjani te bi trebalo zatražiti savjet biostatističara. 6. SMJERNICE ZA ISPITIVANE TVARI KOJE SE VRLO BRZO IZLUČUJU Kao što je navedeno u stavku 129. ove ispitne metode, neke se tvari mogu tako brzo izlučiti da nije moguće odrediti pouzdanu koncentraciju u nultom vremenu, C 0,d, ni k 2 jer se u uzorcima u vrlo ranoj fazi izlučivanja (tj. od drugog uzorka pri izlučivanju pa nadalje) tvar ne može više učinkovito izmjeriti (koncentracije na granici kvantifikacije). Takva je situacija opažena u međulaboratorijskom testu koji je proveden s benzo[a]pirenom u svrhu potvrđivanja ove ispitne metode te je dokumentirana u validacijskom izvješću za ovu metodu. U takvim se slučajevima linearna regresija ne može pouzdano provesti te će vjerojatno dati nerealno visoku procjenu vrijednosti C 0,d, a time i učinkovitost asimilacije koja je očito puno veća od 1. U tim je slučajevima moguće konzervativno procijeniti vrijednost k 2 te izračunati gornju granicu vrijednosti BMF-a. Upotrebljavajući podatkovne točke faze izlučivanja u kojima je izmjerena koncentracija, uključujući i prvu koncentraciju koja ‚nije detektirana’ (koncentracija na granici kvantifikacije), linearnom regresijom (na temelju podataka o koncentraciji transformiranih u prirodni logaritam u ovisnosti o vremenu) dobije se procijenjena vrijednost k 2. U tim vrstama slučajeva vjerojatno će biti uključene samo dvije podatkovne točke (npr. 1. i 2. dan uzorkovanja pri izlučivanju) pa se k 2 može procijeniti s pomoću jednadžbe A5.22 iz Dodatka 5. Ta procijenjena vrijednost k2 može se upotrijebiti za procjenu učinkovitosti asimilacije s pomoću jednadžbe A7.1, pri čemu se u toj jednadžbi vrijednost C0,d zamijeni izmjerenom koncentracijom u nultom vremenu (C0,m) u slučajevima kada je prema procjenama C0,d očito puno viši od vrijednosti koju bi bilo moguće dobiti ispitivanjem. Ako se C0,m nije mogao izmjeriti, trebalo bi upotrijebiti granicu detekcije u tkivu ribe. Ako se, u nekim slučajevima, time dobije vrijednost α > 1, tada se pretpostavlja da je učinkovitost asimilacije od 1 ‚najgori slučaj’. Najveći BMFK može se tada procijeniti s pomoću jednadžbe A7.4 te bi ga trebalo navesti kao vrijednost ‚puno manje od’ (<<). Na primjer, za ispitivanje u kojemu se primjenjuje brzina hranjenja 3 % i poluvijek izlučivanja kraći od tri dana te ‚najgori slučaj’ vrijednosti α od 1, vrijednost BMFK vjerojatno će biti niža od oko 0,13. S obzirom na svrhu ovih procjena i činjenicu da su one oprezne, vrijednosti koje se njima dobiju nije potrebno ispravljati u odnosu na razrjeđenje zbog rasta ili u odnosu na sadržaj lipida u ribi ili hrani. Dodatak 8. PRISTUPI PROCJENJIVANJU PROVIZORNIH BCF-ova NA TEMELJU PODATAKA PRIKUPLJENIH TIJEKOM ISPITIVANJA IZLAGANJEM KROZ HRANU Metoda izlaganja kroz hranu uključena je u ovu ispitnu metodu radi ispitivanja bioakumulacije tvari koje se u praksi ne mogu ispitati metodom vodenog izlaganja. Metodom vodenog izlaganja dobije se faktor biokoncentracije, dok se metodom izlaganja kroz hranu dobiju izravno informacije o potencijalu biomagnifikacije kroz hranu. U mnogim programima kemijske sigurnosti zahtijevaju se informacije o biokoncentraciji u vodenim vrstama (na primjer u procjeni rizika i Globalno usklađenom sustavu razvrstavanja). Stoga postoji potreba da se podaci dobiveni tijekom ispitivanja izlaganjem kroz hranu upotrijebe za procjenu faktora biokoncentracije koji je usporediv s ispitivanjima koja se provode u skladu s metodom vodenog izlaganja (94). U ovom se odjeljku ispituju pristupi koji se mogu primijeniti u tu svrhu, ali navode i nedostaci koji su svojstveni procjenama. Pri ispitivanju izlaganjem kroz hranu mjeri se izlučivanje kako bi se dobila konstanta brzine izlučivanja, k 2. Ako se konstanta brzine apsorpcije može procijeniti s pomoću raspoloživih podataka za situaciju u kojoj je riba bila izložena ispitivanoj tvari putem vode, tada se može procijeniti kinetički BCF. Procjena konstante brzine apsorpcije za vodeno izlaganje počiva na mnogim pretpostavkama, a sve one pridonose nesigurnosti procjene. Nadalje, u ovom se pristupu procjeni BCF-a pretpostavlja da ukupna brzina izlučivanja (uključujući i faktore koji joj pridonose poput raspodjele u tijelu i pojedinačnih procesa izlučivanja) ne ovisi o tehnici izlaganja koja se primjenjuje da bi se postiglo tjelesno opterećenje ispitivanom tvari. Glavne pretpostavke svojstvene ovoj metodi procjene mogu se sažeti kako slijedi: izlučivanje nakon apsorpcije preko hrane jednako je izlučivanju nakon vodenog izlaganja za određenu tvar, pri apsorpciji iz vode vrijedi kinetika prvog reda. Ovisno o metodi upotrijebljenoj za procjenu apsorpcije:
baza podataka (,set za testiranje') koja se upotrebljavala za razvoj metode procjenjivanja apsorpcije reprezentativna je za tvar koju se razmatra. U više radova objavljenih u literaturi izvedene su jednadžbe kojima se apsorpcija iz vode putem škrga riba povezuje s podjelnim koeficijentom oktanol-voda koji se odnosi na tvar, masom ribe (1., 2., 3., 4.), volumenom i/ili sadržajem lipida, prodiranjem/difuzijom kroz membranu (5., 6.), volumenom disanja ribe (7.) te primjenom pristupa koji se temelji na fugacitetu/bilanci mase (8., 9., 10.). Te metode, primijenjene u ovom kontekstu, detaljno su ocijenili Crookes i Brooke (11.). Rad koji je objavio Barber (12.), koji se usredotočuje na modeliranje bioakumulacije povezane s apsorpcijom kroz hranu, isto je tako koristan u ovom kontekstu jer sadržava podatke dobivene modelima brzine apsorpcije preko škrga. Toj problematici posvećen je i dio referentnog dokumenta za protokol iz 2004. (13.). Čini se da je većina tih modela izrađena na temelju ograničenih baza podataka. Kod modela za koje su dostupne pojedinosti o bazi podataka upotrijebljenoj za njegovu izradu, čini se da su vrste upotrijebljenih tvari često slične strukture ili razreda (u smislu djelovanja, npr. organoklorini). To pridonosi nesigurnosti u pogledu primjene modela za predviđanje konstante brzine apsorpcije za različite vrste stvari, a da ne govorimo o razmatranjima koja su specifična za pojedino ispitivanje, poput ispitne vrste, temperature itd. U pregledu raspoloživih tehnika (11.) istaknuto je da nijedna metoda nije,ispravnija' od drugih. Stoga bi trebalo dati jasno obrazloženje za upotrijebljeni model. Ako postoji više metoda čija upotreba može biti opravdana, bilo bi razborito predočiti više procjena vrijednosti k 1 (pa tako i vrijednosti BCF-a) ili raspon vrijednosti k 1 (i BCF-a) prema više metoda procjene apsorpcije. Međutim, s obzirom na razlike u vrstama modela i bazama podataka upotrijebljenih za njihovu izradu, ne bi bilo primjereno uzimati srednju vrijednost iz procjena dobivenih na različite načine. Neki su istraživači postulirali da je kod ovakvih procjena vrijednosti BCF-a potreban ispravak u odnosu na bioraspoloživost kako bi se uzela u obzir adsorpcija tvari na otopljeni organski ugljik (DOC) u uvjetima vodenog izlaganja i time procjena uskladila s rezultatima ispitivanja u kojima je primijenjeno vodeno izlaganje (npr. 13., 14.). Međutim, taj ispravak možda nije primjeren s obzirom na niske razine DOC-a koje su potrebne u ispitivanju vodenim izlaganjem za procjenu u,najgorem slučaju' (tj. omjer bioraspoložive tvari i tvari izmjerene u otopini). U slučaju vrlo hidrofobnih tvari, apsorpciju preko škrga može ograničavati brzina pasivne difuzije blizu površine škrga; u tom je slučaju moguće da se ispravkom više uzima u obzir taj učinak nego ono za što je ispravak bio namijenjen. Savjetuje se usredotočiti se na metode koje zahtijevaju lako dostupne podatke o tvarima koje se ispituju izlaganjem kroz hranu kako je ovdje opisano (tj. log K OW, masa ribe). Mogu se primijeniti druge metode za koje su izvori podataka složeniji, ali će za njih možda trebati dodatna mjerenja tijekom ispitivanja ili detaljni podaci o ispitivanoj tvari ili ribljoj vrsti koji možda nisu lako dostupni. Osim toga, na izbor modela može utjecati razina validacije i domena primjenjivosti (vidjeti 11. za pregled i usporedbu različitih metoda). Trebalo bi imati na umu da procijenjena vrijednost k 1 i procijenjeni BCF nisu sigurni te će ih možda trebati podvrgnuti analizi snage dokaza zajedno s dobivenim BMF-om i parametrima koji se odnose na tvar (npr. molekularna veličina) kako bi se dobila ukupna slika o bioakumulacijskom potencijalu tvari. Tumačenje i upotreba tih parametara mogu ovisiti o regulatornom okviru. LITERATURA
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
(17) |
U dijelu C poglavlje C.20. zamjenjuje se sljedećim: „C.20. Ispitivanje reproduktivne toksičnosti na vrsti Daphnia magna UVOD Ova ispitna metoda odgovara Smjernici OECD-a za ispitivanje 211 (2012.). Smjernice OECD-a za ispitivanje periodično se preispituju uzimajući u obzir znanstveni napredak. Smjernica za ispitivanje reproduktivne toksičnosti 211 razvijena je iz Smjernice za ispitivanje 202 dijela II., Ispitivanje reproduktivne toksičnosti na rodu Daphnia sp. (1984.). Bilo je opće priznato da podaci iz ispitivanja provedenih u skladu sa Smjernicom za ispitivanje 202 mogu varirati. Zbog toga su uloženi znatni napori u utvrđivanje razloga te varijabilnosti s ciljem izrade bolje ispitne metode. Smjernica za ispitivanje 211 temelji se na ishodu tih aktivnosti istraživanja, međulaboratorijskih ispitivanja i validacijskih istraživanja provedenih 1992. (1.), 1994. (2.) i 2008. (3.). Glavne su razlike između početne verzije (Smjernica za ispitivanje 202, 1984.) i druge verzije (Smjernica za ispitivanje 211, 1998.) Smjernice za ispitivanje reproduktivne toksičnosti sljedeće:
Upotrijebljene definicije navedene su u Dodatku 1. NAČELO ISPITIVANJA Primarni je cilj ovog ispitivanja ocijeniti učinak kemikalija na reproduktivnu uspješnost vrste Daphnia magna. S tim se ciljem mlade ženke dafnije (roditeljske životinje), koje su na početku ispitivanja mlađe od 24 sata, izlažu ispitivanoj kemikaliji dodanoj u vodu u određenom rasponu koncentracija. Ispitivanje traje 21 dan. Na kraju ispitivanja ocjenjuje se ukupni broj živih potomaka. Reproduktivna uspješnost roditeljskih životinja može se i drukčije izraziti (npr. kao broj živih potomaka po životinji i danu od prvog dana kad je zapaženo potomstvo), ali to bi trebalo dokumentirati dodatno uz ukupni broj živih potomaka na kraju ispitivanja. Zbog posebnog plana polustatičkog ispitivanja u usporedbi s drugim metodama ispitivanja reproduktivne toksičnosti na beskralježnjacima, moguće je prebrojati i broj živih potomaka po svakoj pojedinačnoj roditeljskoj životinji. Time se, za razliku od drugih metoda ispitivanja reproduktivne toksičnosti na beskralježnjacima, omogućuje da se iz ocjenjivanja podataka isključe potomci roditeljske životinje koja je slučajno i/ili nenamjerno uginula tijekom razdoblja ispitivanja. Stoga, ako se u izloženim ponovljenim uzorcima pojavi smrtnost roditeljskih životinja, trebalo bi razmotriti je li smrtnost povezana s obrascem odgovora na koncentraciju ili nije, npr. postoji li značajna regresija odgovora u odnosu na koncentraciju ispitivane kemikalije s pozitivnim nagibom (za tu se namjenu može primijeniti statističko ispitivanje kao što je Cochran-Armitageov test trenda). Ako smrtnost nije povezana s obrascem odgovora na koncentraciju, ponovljene bi uzorke u kojima se javila smrtnost roditeljskih životinja trebalo isključiti iz analize rezultata ispitivanja. Ako je smrtnost povezana s obrascem odgovora na koncentraciju, smrtnost roditeljskih životinja trebalo bi utvrditi kao učinak ispitivane kemikalije i ponovljene uzorke ne bi trebalo isključiti iz analize. Ako roditeljska životinja ugine tijekom ispitivanja, npr. slučajno zbog nepravilnog postupanja ili nezgode ili nenamjerno zbog neobjašnjenog uzroka koji nije povezan s učinkom ispitivane kemikalije ili ako se utvrdi da je mužjak, ponovljeni se uzorak isključuje iz analize (za više pojedinosti vidjeti stavak 51.). Toksični učinak ispitivane kemikalije na reproduktivnu uspješnost izražava se kao ECx uvrštavanjem podataka u prikladan model nelinearnom regresijom kako bi se ocijenila koncentracija koja bi prouzročila x %-tno smanjenje reproduktivne uspješnosti ili, alternativno, kao vrijednost NOEC-a/LOEC-a (4.). Ispitne koncentracije trebale bi obuhvaćati najnižu upotrijebljenu koncentraciju s učinkom (npr. EC10), što znači da se ta vrijednost izračunava interpolacijom, a ne ekstrapolacijom. Trebalo bi dokumentirati i preživljavanje roditeljskih životinja te vrijeme do pojave prvog legla. Mogu se ispitivati i drugi učinci na parametre povezani s kemikalijom, kao što je rast (npr. dužina) i, možda, intrinzična stopa prirasta populacije (vidjeti stavak 44.). INFORMACIJE O ISPITIVANOJ KEMIKALIJI Rezultati ispitivanja akutne toksičnosti (vidjeti poglavlje C.2. ovog Priloga: Ispitivanje akutne imobilizacije Daphnia sp.) provedenog na vrsti Daphnia magna mogu biti korisni za odabir prikladnog raspona ispitnih koncentracija u ispitivanjima reproduktivne toksičnosti. Topljivost u vodi i tlak pare ispitivane kemikalije trebali bi biti poznati te bi trebalo staviti na raspolaganje pouzdanu analitičku metodu za kvantifikaciju kemikalije u ispitnim otopinama s dokumentiranom učinkovitošću izdvajanja i granicom utvrđivanja. Informacije o ispitivanoj kemikaliji koje mogu biti korisne za uspostavljanje uvjeta ispitivanja uključuju strukturnu formulu, čistoću kemikalije, stabilnost na svjetlosti, stabilnost u uvjetima ispitivanja, pKa, Pow i rezultate ispitivanja lake biorazgradivosti (vidjeti poglavlja C.4. (utvrđivanje ‚lake’ biorazgradivosti) i C.29. (laka biorazgradivost – CO2 u začepljenim posudama) ovog Priloga). VALJANOST ISPITIVANJA Da bi ispitivanje bilo valjano, kontrole bi trebale zadovoljiti sljedeće kriterije uspješnosti:
Napomena: jednaki kriterij valjanosti (20 %) može se primjenjivati za slučajnu i nenamjernu smrtnost roditeljskih životinja za kontrole i za svaku ispitnu koncentraciju. OPIS METODE Oprema Ispitne posude i druga oprema koja dolazi u dodir s ispitnim otopinama trebale bi biti u cijelosti izrađene od stakla ili drugog kemijski inertnog materijala. Ispitne posude uobičajeno su staklene laboratorijske čaše. Osim toga, potrebni su neki ili svi dijelovi opreme u nastavku:
Ispitni organizmi U ispitivanju se upotrebljava vrsta Daphnia magna Straus (95). Po mogućnosti, klon bi trebalo utvrditi genotipizacijom. Istraživanjima (1.) se pokazalo da se reproduktivnom uspješnošću klona A (koji je potekao od IRCHA-a u Francuskoj) (5.) redovito zadovoljava kriterij valjanosti kojim se propisuje srednja izmjerena vrijednost ≥ 60 živih potomaka po preživjeloj roditeljskoj životinji ako se uzgaja u uvjetima opisanima u ovoj ispitnoj metodi. Međutim, prihvatljivi su i drugi klonovi ako se dokaže da se kulturom dafnija zadovoljavaju kriteriji valjanosti ispitivanja. Na početku ispitivanja životinje bi trebale biti mlađe od 24 sata i ne bi trebale biti potomstvo iz prvog legla. Dafnije bi trebale potjecati iz zdrave matične populacije (tj. na njima ne bi trebali biti vidljivi znakovi stresa, kao što su visoka smrtnost, prisutnost mužjaka i efipija, zakašnjelo davanje prvog legla, životinje promijenjene boje itd.). Matične životinje trebalo bi držati u uvjetima uzgoja kulture (svjetlost, temperatura, medij, hranjenje i broj životinja po jedinici volumena) koji su slični uvjetima ispitivanja. Ako se u ispitivanju upotrebljava medij za uzgoj kultura dafnija koji se razlikuje od medija upotrijebljenog za rutinske kulture dafnija, dobrom se praksom smatra uključivanje razdoblja aklimatizacije prije ispitivanja, uobičajeno od približno tri tjedna (tj. jedna generacija), kako roditeljske životinje ne bi bile izložene stresu. Ispitni medij Preporučuje se da se u ovom ispitivanja upotrebljava potpuno definirani medij. Time se može izbjeći uporaba dodataka (npr. morske trave, ekstrakta tla itd.), koje je teško opisati, i tako poboljšati prilike za standardizaciju među laboratorijima. Pokazalo se da su za to prikladni mediji Elendt M4 (6.) i M7 (vidjeti Dodatak 2.). Međutim, prihvatljivi su i drugi mediji (npr. 7. i 8.) pod uvjetom da se dokaže da su svojstva kulture dafnija u skladu s kriterijima valjanosti ispitivanja. Ako se primjenjuju mediji koji sadržavaju nedefinirane dodatke, te dodatke trebalo bi jasno specificirati i u izvješću o ispitivanju trebalo bi navesti informacije o sastavu, posebno s obzirom na sadržaj ugljika jer to može utjecati na prehranu. Preporučuje se da se utvrde ukupni organski ugljik (TOC) i/ili kemijska potrošnja kisika (KPK) radnog pripravka organskog dodatka i ocijeni doprinos TOC-u/KPK-u u ispitnom mediju. Nadalje, preporučuje se da razine TOC-a u mediju (odnosno prije dodavanja algi) budu ispod 2 mg/l (9.). Kada se ispituju kemikalije koje sadržavaju metale, važno je imati na umu da svojstva ispitnog medija (npr. tvrdoća, sposobnost kelatiranja) mogu utjecati na toksičnost ispitivane kemikalije. Iz tog je razloga poželjno upotrebljavati potpuno definirani medij. Međutim, Elendt M4 i M7 trenutačno su jedini poznati potpuno definirani mediji koji su prikladni za dugoročni uzgoj kulture vrste Daphnia magna. Oba medija sadržavaju kelatni agens EDTA. Radovima se pokazalo (2.) da je‚prividna toksičnost’ kadmija općenito niža kada se ispitivanje reproduktivne toksičnosti provodi u medijima M4 i M7 nego u medijima koji ne sadržavaju EDTA. Stoga se M4 i M7 ne preporučuju za ispitivanje kemikalija koje sadržavaju metale, a trebalo bi izbjegavati i druge medije koji sadržavaju poznate kelatne agense. Za kemikalije koje sadržavaju metale može biti preporučljivo upotrijebiti alternativni medij, kao što je, na primjer, obrađena tvrda slatka voda prema ASTM-u (9.) koja ne sadržava EDTA. Ta kombinacija obrađene tvrde slatke vode prema ASTM-u i ekstrakta morske trave (10.) prikladna je za dugoročan uzgoj kulture vrste Daphnia magna (2.). Koncentracija otopljenog kisika trebala bi biti veća od 3 mg/l na početku i tijekom ispitivanja. pH-vrijednost trebala bi biti u rasponu od 6 do 9 i uobičajeno ne bi trebala varirati za više od 1,5 jedinica u okviru pojedinačnog ispitivanja. Preporučuje se tvrdoća iznad 140 mg/l (kao CaCO3). Ispitivanjima pri tim i višim razinama dokazana je reproduktivna uspješnost u skladu s kriterijima valjanosti (11. i 12.). Ispitne otopine Ispitne otopine u odabranim koncentracijama uobičajeno se pripremaju razrjeđivanjem matične otopine. Po mogućnosti, matične otopine trebalo bi, bez primjene bilo kakvih otapala ili dispergenata ako je to moguće, pripremiti miješanjem ili mućkanjem ispitivane kemikalije u ispitnom mediju mehaničkim sredstvima, kao što su mućkalica, mješač ili ultrazvuk, ili drugim prikladnim metodama. Po mogućnosti, sustave ispitivanja trebalo bi prije uvođenja ispitnih organizama izložiti koncentracijama ispitivane kemikalije koja će se upotrebljavati u istraživanju toliko dugo koliko je potrebno da se dokaže održavanje stabilnih koncentracija pri izlaganju. Ako se ispitivana kemikalija teško otapa u vodi, trebalo bi slijediti postupke opisane u Smjernici OECD-a za rukovanje teškim tvarima (13.). Trebalo bi izbjegavati uporabu otapala ili dispergenata, ali ona je u nekim slučajevima možda potrebna kako bi se dobila prikladno koncentrirana matična otopina za primjenu doze. Uz ispitne koncentracije trebalo bi provesti jednu kontrolu s vodom za razrjeđivanje s prikladnim ponovljenim uzorcima i, ako je to neizbježno, jednu kontrolu s otapalom s prikladnim ponovljenim uzorcima. U ispitivanju bi trebalo upotrebljavati samo otapala ili dispergente za koje je istraživanjem utvrđeno da nemaju nikakve značajne učinke ili da imaju samo minimalne učinke na varijablu odgovora. Primjeri prikladnih otapala (kao što su aceton, etanol, metanol, dimetilformamid i trietilen glikol) i dispergenata (kao što su Cremophor RH40, metil-celuloza 0,01 % i HCO-40) navedeni su u (13.). Ako se primjenjuje otapalo ili dispergent, njegova konačna koncentracija ne bi trebala biti veća od 0,1 ml/l (13.) i u svim bi se ispitnim posudama trebala upotrebljavati jednaka koncentracija, osim u kontroli s vodom za razrjeđivanje. Međutim, trebalo bi uložiti sve napore da se održi minimalna koncentracija otapala. POSTUPAK Uvjeti izlaganja Trajanje Ispitivanje traje 21 dan. Punjenje Roditeljske životinje drže se pojedinačno, po jedna u svakoj ispitnoj posudi, uobičajeno s 50 – 100 ml medija (za vrstu Daphnia magna mogući su manji volumeni, posebno za manje dafnije, kao što je npr. Ceriodaphnia dubia) u svakoj posudi, osim ako je za ispitivanje neophodan plan protočnog ispitivanja. Ponekad mogu biti potrebni i veći volumeni kako bi se ispunili zahtjevi analitičkog postupka koji se primjenjuje za utvrđivanje koncentracije ispitivane kemikalije, iako je za kemijsku analizu dopušteno i objedinjavanje ponovljenih uzoraka. Ako se upotrebljavaju volumeni iznad 100 ml, može biti potrebno povećati količinu hrane koja se daje dafnijama kako bi se osigurala prikladna raspoloživost hrane i usklađenost s kriterijima valjanosti. Pokusne životinje U polustatičkim ispitivanjima trebalo bi pojedinačno držati najmanje deset životinja pri svakoj ispitnoj koncentraciji i još najmanje deset životinja pojedinačno u kontrolnim nizovima. Pokazalo se da je u protočnim ispitivanjima prikladno upotrijebiti 40 životinja podijeljenih u četiri skupine od po deset životinja pri svakoj ispitnoj koncentraciji (1.). Može se upotrijebiti i manji broj ispitnih organizama, a preporučuje se najmanje 20 životinja po koncentraciji podijeljenih u dva ili više ponovljenih uzoraka s jednakim brojem životinja (npr. četiri ponovljena uzorka s po pet dafnija). Treba napomenuti da u ispitivanjima u kojima se životinje drže u skupinama neće biti moguće isključiti nijednog potomka iz statističke analize ako dođe do pojave nenamjerne/slučajne smrtnosti roditeljskih životinja nakon što je reprodukcija započela te bi stoga u tim slučajevima reproduktivnu uspješnost trebalo izraziti kao ukupni broj živih potomaka po roditeljskoj životinji prisutnoj na početku ispitivanja. Ispitnim posudama trebalo bi dodijeliti tretiranja, a svako naknadno postupanje s ispitnim posudama trebalo bi se temeljiti na slučajnom odabiru. U protivnom se može javiti pristranost koja bi se mogla tumačiti kao učinak koncentracije. Konkretno, ako se pokusnim jedinicama rukuje redoslijedom tretiranja ili koncentracije, određeni učinci povezani s vremenom, kao što su zamor ispitivača ili neka druga pogreška, mogu za posljedicu imati veće učinke pri višim koncentracijama. Nadalje, ako bi na rezultate ispitivanja mogao utjecati neki početni uvjet ili uvjet okoline ispitivanja, kao što je položaj u laboratoriju, trebalo bi razmisliti o formiranju blokova ispitivanja. Hranjenje Po mogućnosti, u polustatičkim ispitivanjima hranjenje bi trebalo obavljati svakodnevno, a najmanje tri puta tjedno (tj. u skladu s promjenama medija). Moguće razrjeđivanje koncentracija pri izlaganju dodavanjem hrane trebalo bi uzeti u obzir i izbjegavati što je to više moguće dobro koncentriranim suspenzijama algi. Svako odstupanje (npr. u protočnim ispitivanjima) trebalo bi dokumentirati. Po mogućnosti, prehrana roditeljskih životinja tijekom ispitivanja trebala bi se sastojati od živih stanica algi jedne od ili više sljedećih vrsta: Chlorella sp., Pseudokirchneriella subcapitata (prije Selenastrum capricornutum) i Desmodesmus subspicatus (prije Scenedesmus subspicatus). Prehranu bi trebalo temeljiti na količini organskog ugljika (C) koja se osigurava svakoj roditeljskoj životinji. Istraživanjima (14.) se pokazalo da su za vrstu Daphnia magna količine hrane između 0,1 i 0,2 mg C/dafnija/dan dovoljne da se postigne broj živih potomaka potreban za ispunjavanje kriterija valjanosti ispitivanja. Količina hrane može biti ujednačena tijekom čitavog razdoblja ispitivanja ili se, po želji, na početku može davati manja količina hrane koja se zatim povećava tijekom ispitivanja, uzimajući pritom u obzir rast roditeljskih životinja. Ipak, i u tom slučaju količina hrane trebala bi u svakom trenutku biti unutar preporučenog raspona od 0,1 do 0,2 mg C/dafnija/dan. Ako se za utvrđivanje potrebne količine hrane primjenjuju zamjenske mjere, kao što su broj stanica algi ili apsorpcija svjetlosti (iz praktičnih razloga jer je za mjerenje sadržaja ugljika potrebno dosta vremena), svaki laboratorij trebao bi izraditi vlastiti nomogram odnosa zamjenske mjere i sadržaja ugljika u kulturi algi (za savjet o izradi nomograma vidjeti Dodatak 3.). Nomograme bi trebalo provjeravati najmanje jednom godišnje, a češće ako je došlo do promjene uvjeta u uzgoju kulture algi. Pokazalo se da je apsorpcija svjetlosti bolja zamjena za sadržaj ugljika od broja stanica (15.). Dafnije bi trebalo hraniti koncentriranom suspenzijom algi kako bi volumen medija za uzgoj kulture algi koji se prenosi u ispitne posude bio što manji. Koncentracija algi može se postići centrifugiranjem i resuspendiranjem u mediju za uzgoj kulture dafnija. Svjetlo 16-satno osvjetljenje intenziteta do najviše 15 – 20μE ߦ m– 2 ߦ s– 1 mjereno na površini vode u posudi. Kod instrumenata za mjerenje intenziteta svjetlosti kalibriranih u luksima raspon od 1 000 do 1 500 luksa za hladno bijelo svjetlo približno odgovara preporučenom intenzitetu svjetlosti od 15 do 20 μE · m– 2 ߦ s– 1. Temperatura Temperatura ispitnog medija trebala bi biti u rasponu od 18 do 22 °C. Međutim, promjene temperature tijekom pojedinačnog ispitivanja ne bi trebale biti veće, ako je to moguće, od 2 °C unutar tih granica (npr. 18 – 20, 19 – 21 ili 20 – 22 °C). Može biti prikladno upotrijebiti dodatnu ispitnu posudu za praćenje temperature. Dozračivanje Ispitne posude ne bi se trebale dozračivati tijekom ispitivanja. Plan ispitivanja Test za utvrđivanje raspona Ako je to potrebno, provodi se test za utvrđivanje raspona s, na primjer, pet koncentracija ispitivane kemikalije i dva ponovljena uzorka za svako tretiranje i svaku kontrolu. Dodatne informacije, iz ispitivanja sa sličnim kemikalijama ili iz literature, o akutnoj toksičnosti za dafnije i/ili druge vodene organizme mogu jednako tako biti korisne pri odlučivanju o rasponu koncentracija koje će se upotrebljavati pri testiranju za utvrđivanje raspona. Test za utvrđivanje raspona traje 21 dan ili dovoljno dugo za pouzdano predviđanje razina učinka. Na kraju testa ocjenjuje se reprodukcija dafnija. Trebalo bi zabilježiti broj roditeljskih životinja i pojavu potomaka. Glavno ispitivanje Uobičajeno bi trebalo biti najmanje pet ispitnih koncentracija kojima je obuhvaćena efektivna koncentracija (npr. ECx) i koje su raspoređene u geometrijskom nizu i po mogućnosti se ne bi trebale razlikovati za faktor veći od 3,2. Za svaku ispitnu koncentraciju trebalo bi upotrijebiti prikladan broj ponovljenih uzoraka (vidjeti stavke 24. i 25.). Ako se upotrebljava manje od pet koncentracija, trebalo bi navesti obrazloženje. Kemikalije se ne bi trebale ispitivati iznad granice topljivosti u ispitnom mediju. Preporučuje se prije provedbe pokusa razmotriti statističku snagu plana ispitivanja i primjenu prikladnih statističkih metoda (4.). Pri utvrđivanju raspona koncentracija trebalo bi voditi računa o sljedećem:
Ako u testu za utvrđivanju raspona nisu zapaženi nikakvi učinci pri najvišoj koncentraciji (npr. pri 10 mg/l) ili ako je vrlo vjerojatno da ispitivana kemikalija izaziva nisku toksičnost / ne izaziva toksičnost na temelju izostanka toksičnosti za druge organizme i/ili male apsorpcije / izostanka apsorpcije, ispitivanje reproduktivne toksičnosti može se provesti kao granično ispitivanje uz primjenu ispitne koncentracije od npr. 10 mg/l i kontrole. Za tretiranu i kontrolnu skupinu trebalo bi upotrijebiti po deset ponovljenih uzoraka. Ako je možda potrebno provesti granično ispitivanje u protočnom sustavu, prikladan bi bio manji broj ponovljenih uzoraka. Graničnim ispitivanjem osigurat će se mogućnost dokazivanja da ne postoji statistički značajan učinak pri graničnoj koncentraciji, ali ako su zabilježeni učinci, uobičajeno će biti potrebno potpuno ispitivanje. Kontrole Uz ispitni niz trebalo bi provesti jedan kontrolni niz s ispitnim medijem i, ako je to potrebno, jedan kontrolni niz koji sadržava otapalo ili dispergent. Ako se upotrebljava otapalo ili dispergent, njegova koncentracija trebala bi biti jednaka kao u posudama koje sadržavaju ispitivanu kemikaliju. Trebalo bi upotrijebiti prikladan broj ponovljenih uzoraka (vidjeti stavke 23. i 24.). Općenito, u dobro provedenom ispitivanju koeficijent varijacije oko srednje vrijednosti broja živih potomaka po roditeljskoj životinji u kontrolama trebao bi biti ≤ 25 % i to bi trebalo dokumentirati za planove ispitivanja u kojima se upotrebljavaju životinje koje se drže pojedinačno. Obnavljanje ispitnog medija Učestalost obnavljanja medija ovisit će o stabilnosti ispitivane kemikalije, ali bi medij trebalo obnoviti najmanje tri puta tjedno. Ako se preliminarnim ispitivanjima stabilnosti (vidjeti stavak 7.) pokazalo da koncentracija ispitivane kemikalije nije stabilna (odnosno da je izvan raspona od 80 do 120 % nazivne koncentracije ili da je ispod 80 % izmjerene početne koncentracije) u maksimalnom razdoblju obnavljanja (tj. tri dana), trebalo bi razmotriti češće obnavljanje medija ili primjenu protočnog ispitivanja. Kada se medij obnavlja u polustatičkim ispitivanjima, priprema se drugi niz ispitnih posuda u koje se prenose roditeljske životinje, na primjer staklenom pipetom prikladnog promjera. Volumen medija koji se prenosi s dafnijama trebao bi biti što je moguće manji. Zapažanja Rezultate zapažanja tijekom ispitivanja trebalo bi zabilježiti u obrasce za dostavu podataka (vidjeti primjere u dodacima 4. i 5.). Ako su potrebna druga mjerenja (vidjeti stavak 44.), možda će biti potrebna dodatna zapažanja. Potomstvo Po mogućnosti, potomke svake roditeljske životinje trebalo bi ukloniti i prebrojiti svakog dana od pojave prvog legla kako ne bi potrošili hranu namijenjenu roditeljskoj životinji. Za potrebe ove ispitne metode, prebrojavanjem treba utvrditi samo broj živih potomaka, ali trebalo bi zabilježiti i prisutnost propalih jajašaca ili mrtvih potomaka. Smrtnost Po mogućnosti, smrtnost roditeljskih životinja trebalo bi bilježiti svakodnevno, a najmanje u vrijeme prebrojavanja potomstva. Ostali parametri Iako je ova ispitna metoda u načelu namijenjena ocjenjivanju učinaka na reproduktivnu uspješnost, moguće je i da se drugi učinci mogu u dovoljnoj mjeri kvantificirati za statističku analizu. Može se bilježiti reproduktivna uspješnost po preživjeloj roditeljskoj životinji, odnosno broj živih potomaka tijekom ispitivanja po preživjeloj roditeljskoj životinji. To se može usporediti s glavnom varijablom odgovora (reproduktivnom uspješnošću po roditeljskoj životinji na početku ispitivanja koja nije nenamjerno ili slučajno uginula tijekom ispitivanja). Ako se pojavi smrtnost roditeljskih životinja u izloženim ponovljenim uzorcima, trebalo bi razmotriti je li smrtnost povezana s obrascem odgovora na koncentraciju ili nije, npr. postoji li značajna regresija odgovora u odnosu na koncentraciju ispitivane kemikalije s pozitivnim nagibom (za tu se namjenu može primijeniti statističko ispitivanje kao što je Cochran-Armitageov test trenda). Ako smrtnost nije povezana s obrascem odgovora na koncentraciju, ponovljene bi uzorke u kojima se javila smrtnost roditeljskih životinja trebalo isključiti iz analize rezultata ispitivanja. Ako je smrtnost povezana s obrascem odgovora na koncentraciju, smrtnost roditeljskih životinja trebalo bi pripisati učinku ispitivane kemikalije i ponovljene uzorke ne bi trebalo isključiti iz analize rezultata ispitivanja. Mjerenja rasta vrlo su poželjna jer se na temelju njih dobivaju informacije o mogućim subletalnim učincima koja mogu biti korisna uz sama mjerenja reprodukcije; preporučuje se da se na kraju ispitivanja izmjeri dužina roditeljskih životinja (odnosno dužina tijela bez analne bodlje). Ostali parametri koji se mogu mjeriti ili izračunati uključuju vrijeme do pojave prvog legla (i naknadnih legla), broj i veličinu legla po životinji, broj propalih legla, prisutnost novorođenih mužjaka (OECD, 2008.) ili efipija i možda intrinzičnu stopu prirasta populacije (vidjeti Dodatak 1. za definiciju i Dodatak 7. za utvrđivanje spola novorođenih životinja). Učestalost analitičkih utvrđivanja i mjerenja Koncentraciju kisika, temperaturu, tvrdoću i pH-vrijednosti trebalo bi mjeriti najmanje jednom tjedno u svježem i starom mediju, u kontrolama i u najvišoj koncentraciji ispitivane kemikalije. Koncentracije ispitivane kemikalije utvrđuju se u redovitim intervalima tijekom ispitivanja. U polustatičkim ispitivanjima u kojima se očekuje da će koncentracija ispitivane kemikalije ostati u granicama ±20 % nazivne koncentracije (odnosno u rasponu od 80 do 120 %, vidjeti stavke 6., 7. i 39.) preporučuje se da se u prvom tjednu ispitivanja analiziraju najmanje najviša i najniža ispitna koncentracija odmah nakon pripreme i jednom u vrijeme obnavljanja (tj. analize bi trebalo provesti na uzorku iz iste otopine odmah nakon pripreme i pri obnavljanju). Ta bi utvrđivanja zatim trebalo ponavljati najmanje u tjednim intervalima. U ispitivanjima u kojima se ne očekuje da će koncentracija ispitivane kemikalije ostati u granicama ±20 % nazivne koncentracije potrebno je analizirati sve ispitne koncentracije odmah nakon pripreme i pri obnavljanju. Međutim, u ispitivanjima u kojima izmjerena početna koncentracija ispitivane kemikalije nije u granicama ±20 % nazivne koncentracije, ali ima dovoljno dokaza da su početne koncentracije ponovljive i stabilne (odnosno da su unutar raspona od 80 do 120 % početnih koncentracija), kemijska utvrđivanja mogu se u drugom i trećem tjednu ispitivanja ograničiti na najvišu i najnižu ispitnu koncentraciju. U svakom slučaju, utvrđivanje koncentracija ispitivane kemikalije prije obnavljanja treba provesti samo na jednoj posudi s ponovljenim uzorkom pri svakoj ispitnoj koncentraciji. Ako se primjenjuje protočno ispitivanje, prikladan je režim uzorkovanja sličan opisanom za polustatička ispitivanja (ali u tom slučaju nije primjenjivo mjerenje ‚starih’ otopina). Međutim, može biti uputno povećati broj uzorkovanja u prvom tjednu (npr. tri seta mjerenja) kako bi se osigurala stabilnost ispitnih koncentracija. U takvim vrstama ispitivanja trebalo bi svakodnevno provjeravati brzinu protoka razrjeđivača i ispitivane kemikalije. Ako se može dokazati da se koncentracija ispitivane kemikalije cijelo vrijeme ispitivanja na zadovoljavajući način održava u granicama ± 20 % nazivne ili izmjerene početne koncentracije, rezultati se mogu temeljiti na nazivnim ili izmjerenim početnim vrijednostima. Ako je odstupanje od nazivne ili izmjerene početne koncentracije veće od ± 20 %, rezultate bi trebalo izraziti kao vremenski ponderiranu srednju vrijednost (vidjeti smjernice za izračun u Dodatku 6.). PODACI I IZVJEŠĆIVANJE Obrada rezultata Svrha je ovog ispitivanja utvrditi učinke ispitivane kemikalije na reproduktivnu uspješnost. Ukupni broj živih potomaka po roditeljskoj životinji trebalo bi izračunati za svaku ispitnu posudu (odnosno ponovljeni uzorak). Osim toga, reprodukcija se može izračunati na temelju davanja živih potomaka preživjelih roditeljskih organizama. Međutim, ekološki najrelevantnija varijabla odgovora ukupni je broj živih potomaka po roditeljskoj životinji koja ne ugine slučajno (96) ili nenamjerno (97) tijekom ispitivanja. Ako roditeljska životinja slučajno ili nenamjerno ugine tijekom ispitivanja ili ako se ispostavi da je riječ o mužjaku, ponovljeni se uzorak isključuje iz analize. U tom se slučaju analiza temelji na smanjenom broju ponovljenih uzoraka. Ako se pojavi smrtnost roditeljskih životinja u izloženim ponovljenim uzorcima, trebalo bi razmotriti je li smrtnost povezana s obrascem odgovora na koncentraciju ili nije, npr. postoji li značajna regresija odgovora u odnosu na koncentraciju ispitivane kemikalije s pozitivnim nagibom (za tu se namjenu može primijeniti statističko ispitivanje kao što je Cochran-Armitageov test trenda). Ako smrtnost nije povezana s obrascem odgovora na koncentraciju, ponovljene bi uzorke u kojima se javila smrtnost roditeljskih životinja trebalo isključiti iz analize rezultata ispitivanja. Ako je smrtnost povezana s obrascem odgovora na koncentraciju, smrtnost roditeljskih životinja trebalo bi utvrditi kao učinak ispitivane kemikalije i ponovljene uzorke ne bi trebalo isključiti iz analize rezultata ispitivanja. Ukratko, kada se za izražavanja učinaka upotrebljavaju LOEC i NOEC ili ECx, preporučuje se izračunati učinak na reprodukciju primjenom obiju prethodno navedenih varijabli odgovora, odnosno
i zatim kao konačni rezultat upotrijebiti najnižu vrijednost NOEC-a i LOEC-a ili ECx izračunatu primjenom bilo koje od tih dviju varijabli odgovora. Prije primjene statističke analize, npr. postupaka analize varijance (ANOVA), usporedbe tretiranja i kontrole Studentovim t-testom, Dunnettovim testom, Williamsovim testom ili postupnim Jonckheere-Terpstraovim testom, preporučuje se razmotriti pretvorbu podataka ako je to potrebno za ispunjavanje zahtjeva određenog statističkog ispitivanja. Kao neparametrijske alternative mogu se razmotriti Dunnov test ili Mann-Whitneyjev test. Intervali pouzdanosti od 95 % izračunavaju se za pojedinačne srednje izmjerene vrijednosti tretiranja. Broj preživjelih roditeljskih životinja u netretiranim kontrolama kriterij je valjanosti i trebalo bi ga zabilježiti i dokumentirati. Jednako tako, u završnom izvješću trebalo bi dokumentirati sve ostale štetne učinke, npr. neuobičajeno ponašanje i toksikološki značajne nalaze. ECx Vrijednosti ECx, uključujući s njima povezane donje i gornje granice pouzdanosti, izračunavaju se prikladnim statističkim metodama (npr. logističkom ili Weibullovom funkcijom, modificiranom Spearman-Karberovom metodom ili jednostavnom interpolacijom). Za izračun EC10, EC50 ili bilo koje drugog ECx trebalo bi cjelokupan skup podataka podvrgnuti regresijskoj analizi. NOEC/LOEC Ako je cilj statističke analize utvrditi NOEC/LOEC, trebalo bi primijeniti prikladne statističke metode u skladu s Dokumentom OECD-a 54 o postojećim pristupima statističkoj analizi podataka o ekotoksičnosti: Smjernice za primjenu (4.). Općenito, štetni učinci ispitivane kemikalije u usporedbi s kontrolom istražuju se primjenom jednosmjernog ispitivanja hipoteze pri p ≤ 0,05. Uobičajena razdioba i homogenost varijance mogu se ispitati primjenom prikladnog statističkog ispitivanja, npr. Shapiro-Wilkovog ispitivanja i Leveneovog ispitivanja (p ≤ 0,05). Mogu se provesti jednosmjerna ANOVA i naknadna višestruka usporedna ispitivanja. Višestruke usporedbe (npr. Dunnettov test) ili postupni testovi trenda (npr. Williamsov test ili postupni Jonckheere-Terpstraov test) mogu se upotrebljavati kako bi se izračunalo postoje li značajne razlike (p ≤ 0,05) između kontrola i različitih koncentracija ispitivane kemikalije (odabir preporučenog testa u skladu sa Smjernicom OECD-a 54 (4.)). U protivnom, za utvrđivanje NOEC-a i LOEC-a mogle bi se primjenjivati neparametrijske metode (npr. Bonferronijevo-U-ispitivanje u skladu s Holmovim ili Jonckheere-Terpstraovim testom trenda). Granično ispitivanje Ako je provedeno granično ispitivanje (usporedba kontrole i samo jednog tretiranja) i ako su ispunjeni preduvjeti postupaka parametrijskog ispitivanja (normalnost, homogenost), metrički odgovori mogu se ocijeniti Studentovim testom (t-testom). Ako ti uvjeti nisu ispunjeni, mogu se primjenjivati t-test nejednake varijance (kao što je Welchov test) ili neki neparametrijski test, kao što je Mann-Whitheyjev-U-test. Za utvrđivanje značajnih razlika između kontrola (kontrola i kontrola s otapalom ili dispergentom) mogu se ispitati ponovljeni uzorci za svaku kontrolu kako je opisano za granično ispitivanje. Ako se tim ispitivanjima ne otkriju značajne razlike, svi se kontrolni ponovljeni uzorci i kontrolni ponovljeni uzorci s otapalom mogu objediniti. U protivnom, sva tretiranja trebalo bi usporediti s kontrolom s otapalom. Izvješće o ispitivanju Izvješće o ispitivanju uključuje sljedeće.
LITERATURA
Dodatak 1. DEFINICIJE Za potrebe ove ispitne metode upotrebljavaju se sljedeće definicije. Slučajna smrtnost : smrtnost koja nije povezana s kemikalijom i koja je uzrokovana slučajnim događajem (odnosno uzrok je poznat). Kemikalija : tvar ili smjesa. ECx : koncentracija ispitivane kemikalije otopljene u vodi čija je posljedica x %-tno smanjenje reprodukcije dafnija unutar navedenog razdoblja izlaganja. Nenamjerna smrtnost : smrtnost koja nije povezana s kemikalijom i kojoj nije poznat uzrok. Intrinzična stopa prirasta populacije : mjera rasta populacije kojom su objedinjene reproduktivna uspješnost i smrtnost specifična za dob (1., 2. i 3.). Ona će kod populacija u stabilnom stanju biti jednaka nuli. Kod rastućih populacija bit će pozitivna, a kod populacija koje se smanjuju negativna. Jasno je da potonje nisu održive i da je konačan rezultat izumiranje. Granica detekcije : najniža koncentracija koja se može detektirati, ali ne i kvantificirati. Granica utvrđivanja : najniža koncentracija koja se može kvantitativno izmjeriti. Najniža koncentracija s vidljivim učinkom (LOEC) : najniža ispitana koncentracija pri kojoj je unutar navedenog razdoblja izlaganja zapažen statistički značajan učinak kemikalije na reprodukciju i smrtnost roditeljskih životinja (pri p < 0,05) u usporedbi s kontrolom. Međutim, sve ispitne koncentracije iznad LOEC-a trebale bi imati jednak ili veći štetan učinak od onoga koji je zapažen pri LOEC-u. Ako se ne mogu ispuniti ta dva uvjeta, trebalo bi navesti detaljno objašnjenje za odabir LOEC-a (a time i NOEC-a). Smrtnost : životinja se bilježi kao mrtva kada je nepomična, odnosno kada ne može plivati, ili ako nema vidljivih kretnji privjesaka ili postabdomena u roku od 15 sekundi nakon nježnog protresanja ispitnog spremnika (ako se primjenjuje druga definicija, trebalo bi je dokumentirati zajedno s upućivanjem). Najviša koncentracija bez vidljivog učinka (NOEC) : ispitna koncentracija neposredno ispod LOEC-a koja unutar navedenog razdoblja izlaganja nema statistički značajan učinak (p < 0,05) u usporedbi s kontrolom. Potomci : mlade dafnije dobivene od roditeljskih životinja u tijeku ispitivanja. Roditeljska životinja : ženke dafnije koje su prisutne na početku ispitivanja i čija je reproduktivna uspješnost predmet istraživanja. Reproduktivna uspješnost : broj živih potomaka dobivenih od roditeljskih životinja tijekom razdoblja ispitivanja. Ispitivana kemikalija : sve tvari ili smjese koje se ispituju ovom ispitnom metodom. LITERATURA
Dodatak 2. PRIPREMA POTPUNO DEFINIRANIH MEDIJA ELENDT M7 I M4 Aklimatizacija na medije Elendt M7 i M4 Neki su laboratoriji imali poteškoća s izravnim prijenosom dafnija u medije M4 (1.) i M7. Međutim, određeni je uspjeh postignut s postupnom aklimatizacijom, odnosno premještanjem iz vlastitog medija u 30 %-tni Elendt, zatim u 60 %-tni Elendt i zatim u 100 %-tni Elendt. Ponekad je potrebno razdoblje aklimatizacije i do mjesec dana. Priprema Elementi u tragovima Prvo se pripremaju odvojene matične otopine (I.) pojedinih elemenata u tragovima u vodi prikladne čistoće, npr. u deioniziranoj ili destiliranoj vodi ili vodi pročišćenoj obrnutom osmozom. Iz tih različitih matičnih otopina (I.) priprema se druga pojedinačna matična otopina (II.) koja sadržava sve elemente u tragovima (kombinirana otopina) odnosno:
Mediji M4 i M7 Mediji M4 i M7 pripremaju se uporabom matične otopine II., makronutrijenata i vitamina kako slijedi:
Kombinirana vitaminska matična otopina čuva se zamrznuta u malim alikvotima. Vitamini se dodaju mediju neposredno prije uporabe.
Dodatak 3. ANALIZA UKUPNOG ORGANSKOG UGLJIKA (TOC) I IZRADA NOMOGRAMA SADRŽAJA TOC-a U HRANI OD ALGI Priznato je da se sadržaj ugljika u hrani od algi uobičajeno ne mjeri izravno, nego iz korelacija (odnosno nomograma) sa zamjenskim mjerama, kao što su broj stanica algi i apsorpcija svjetlosti. TOC bi trebalo mjeriti visokotemperaturnom oksidacijom, a ne metodama oksidacije UV zračenjem ili persulfatom (za savjet vidjeti: The Instrumental Determination of Total Organic Carbon, Total Oxygen Demand and Related Determinands 1979, HMSO 1980; 49 High Holborn, London WC1V 6HB). Za izradu nomograma alge bi trebalo odvojiti od medija za uzgoj kulture centrifugiranjem i resuspendiranjem u destiliranoj vodi. U svakom se uzorku tri puta mjere zamjenski parametar i koncentracija TOC-a. Trebalo bi analizirati slijepe probe s destiliranom vodom i oduzeti koncentraciju TOC-a od koncentracije TOC-a u uzorku algi. Nomogrami bi trebali biti linearni unutar traženog raspona koncentracija ugljika. Primjeri su prikazani u nastavku.
Chlorella vulgaris var. viridis (CCAP 211/12). Regresija mg/l suhe mase na mg C/1. Podaci iz koncentriranih suspenzija stanica uzgojenih u polukontinuiranim serijama, resuspendiranih u destiliranoj vodi. X-os: mg C/1 koncentrirane hrane od algi Y-os: mg/1 suhe mase koncentrirane hrane od algi Korekcijski koeficijent – 0,980 
Chlorella vulgaris var. viridis (CCAP 211/12). Regresija broja stanica na mg C/1. Podaci iz koncentriranih suspenzija stanica uzgojenih u polukontinuiranim serijama, resuspendiranih u destiliranoj vodi. X-os: mg C/1 koncentrirane hrane od algi Y-os: Broj stanica/1 koncentrirane hrane od algi Korekcijski koeficijent – 0,926 
Chlorella vulgaris var. viridis (CCAP 211/12). Regresija apsorpcije na mg C/1 (duljina puta od 1 cm). Podaci iz koncentriranih suspenzija stanica uzgojenih u polukontinuiranim serijama, resuspendiranih u destiliranoj vodi. X-os: mg C/1 koncentrirane hrane od algi Y-os: Apsorpcija koncentrirane hrane od algi razrijeđene u omjeru 1/10 pri 440 nm Korekcijski koeficijent – 0,998 Dodatak 4. PRIMJER OBRASCA ZA DOSTAVU PODATAKA O OBNAVLJANJU MEDIJA, FIZIČKO-KEMIJSKOM PRAĆENJU, HRANJENJU, REPRODUKCIJI DAFNIJA I SMRTNOSTI RODITELJSKIH ŽIVOTINJA
Dodatak 5. PRIMJER OBRASCA ZA DOSTAVU PODATAKA O REZULTATIMA KEMIJSKE ANALIZE (a) Izmjerene koncentracije
(b) Izmjerene koncentracije kao postotak nazivne koncentracije
Dodatak 6. IZRAČUN VREMENSKI PONDERIRANE SREDNJE VRIJEDNOSTI Vremenski ponderirana srednja vrijednost Budući da se koncentracija ispitivane kemikalije može smanjiti u razdoblju između obnavljanja medija, potrebno je razmotriti koju bi koncentraciju trebalo odabrati kao reprezentativnu za raspon koncentracija kojima su izložene roditeljske dafnije. Odabir bi trebalo temeljiti na biološkim i statističkim čimbenicima. Na primjer, ako se smatra da na reprodukciju najviše utječe vršna koncentracija, trebalo bi upotrijebiti maksimalnu koncentraciju. Međutim, ako se smatra da je važniji akumulirani ili dugoročniji učinak toksične kemikalije, tada je relevantnija prosječna koncentracija. Prosječna koncentracija koju u tom slučaju treba upotrijebiti vremenski je ponderirana srednja koncentracija jer se njome uzima u obzir varijacija trenutačne koncentracije u određenom vremenu. Slika 1. Primjer vremenski ponderirane srednje vrijednosti 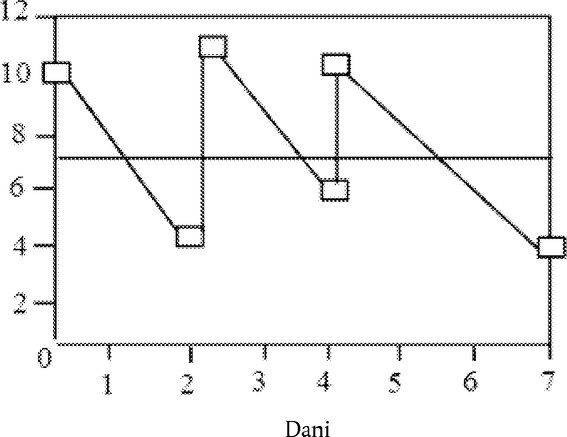
Na slici 1. prikazan je primjer (pojednostavnjenog) ispitivanja u trajanju od sedam dana s obnavljanjem medija 0., 2. i 4. dana.
Vremenski ponderirana srednja vrijednost izračunava se tako da površina ispod vremenski ponderirane srednje vrijednosti bude jednaka površini ispod krivulje koncentracije. Izračun za gornji primjer prikazan je u tablici 1. Tablica 1. Izračun vremenski ponderirane srednje vrijednosti
Površina je površina ispod eksponencijalne krivulje za svako razdoblje obnavljanja. Izračunava se kao:
Vremenski ponderirana srednja vrijednost (VP srednja vrijednost) ukupna je površina podijeljena s ukupnim brojem dana. Naravno, u ispitivanju reproduktivne toksičnosti za dafnije tablicu bi trebalo proširiti na 21 dan. Jasno je da kada se zapažanja bilježe samo na početku i na kraju svakog razdoblja obnavljanja, nije moguće potvrditi da je proces raspadanja doista eksponencijalan. Drukčija krivulja rezultirala bi drukčijim izračunom za površinu. Međutim, eksponencijalni proces raspadanja nije nevjerojatan te je u nedostatku drugih informacija vjerojatno najbolje upotrijebiti tu krivulju. Ipak, potreban je oprez ako se kemijskom analizom na kraju razdoblja obnavljanja ne utvrdi prisutnost nikakve kemikalije. Ako se ne može procijeniti koliko je brzo kemikalija nestala iz otopine, nemoguće je dobiti realističnu površinu ispod krivulje, a time ni razumnu vremenski ponderiranu srednju vrijednost. Dodatak 7. SMJERNICA ZA UTVRĐIVANJE SPOLA NOVOROĐENIH ŽIVOTINJA Do pojave novorođenih mužjaka može doći u promjenjivim okolišnim uvjetima, kao što su skraćivanje fotoperioda, temperatura, smanjenje koncentracije hrane i povećanje gustoće populacije (Hobaek and Larson, 1990; Kleiven et al., 1992). Jednako tako, pojava mužjaka poznati je odgovor na određene regulatore rasta kukaca (Oda et al., 2005). U uvjetima u kojima se kemijskim stresorima izaziva smanjenje broja reproduktivnih potomaka partenogenih ženki bilo bi očekivano povećanje broja mužjaka (OECD, 2008). Na temelju raspoloživih informacija nije moguće predvidjeti koji će omjer spolova ili krajnji učinak povezan s reprodukcijom biti osjetljiviji; međutim, postoje pokazatelji (referentno ‚izvješće o validaciji’ dio 1.) da bi to povećanje broja mužjaka moglo biti manje osjetljivo od smanjenja broja potomaka. Budući da je primarni cilj ispitne metode ocijeniti broj dobivenih potomaka, pojava mužjaka fakultativno je zapažanje. Ako se u istraživanju ocjenjuje ta fakultativna krajnja točka, trebalo bi upotrijebiti dodatni kriterij valjanosti ispitivanja od najviše 5 % mužjaka u kontrolama. Spol dafnija najpraktičnije i najjednostavnije se utvrđuje na temelju njihovih fenotipskih obilježja jer su mužjaci i ženke genetski identični te je njihov spol određen okolišem. Mužjaci i ženke razlikuju se prema dužini i morfologiji prvih ticala, koja su kod mužjaka duža nego kod ženki (slika 1.). Ta je razlika prepoznatljiva odmah nakon rođenja, a tijekom daljnjeg rasta razvijaju se i druga sekundarna spolna obilježja (vidjeti, na primjer, sliku 2. u Olmstead and LeBlanc, 2000). Za zapažanja povezana s morfološkim spolom, novorođene potomke svake pokusne životinje trebalo bi pipetom premjestiti u petrijevu zdjelicu s ispitnim medijem. Količina medija minimalna je kako bi se ograničilo kretanje životinja. Zapažanja prvih ticala mogu se provesti stereomikroskopom (× 10 – 60). Slika 1. Mužjak (lijevo) i ženka (desno) vrste D. magna stari 24 sata. Mužjaci se razlikuju od ženki prema dužini i morfologiji prvih ticala kako je prikazano u krugovima (Tatarazako et al., 2004). 
LITERATURA Hobaek A and Larson P. 1990. Sex determination in Daphnia magna. Ecology 71: 2255-2268. Kleiven O.T., Larsson P., Hobaek A. 1992. Sexual reproduction in Daphnia magna requires three stimuli. Oikos 65, 197-206. Oda S., Tatarazako N, Watanabe H., Morita M., and Iguchi T. 2005. Production of male neonates in Daphnia magna (Cladocera, Crustacea) exposed to juvenile hormones and their analogs. Chemosphere 61:1168-1174. OECD, 2008. Validation report for an enhancement of OECD TG 211 Daphnia magna reproduction test. OECD Series on Testing and Assessment, Number 88. Organisation for Economic Co-operation and Development, Paris. Olmstead, A.W., LeBlanc, G.A., 2000. Effects of endocrine-active chemicals on the development characteristics of Daphnia magna. Environmental Toxicology and Chemistry 19:2107-2113. Tatarazako, N., Oda, S., Abe, R., Morita M. and Iguchi T., 2004. Development of a screening method for endocrine disruptors in crustaceans using Daphnia magna (Cladocera, Crustacea). Environmental Science 17, 439-449. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
(18) |
U dijelu C poglavlju C.29. stavak 66. zamjenjuje se sljedećim:
|
|
19. |
U Dijelu C dodaju se sljedeća poglavlja: „C.47. Ispitivanje toksičnosti na ribama u ranom životnom stadiju UVOD
NAČELO ISPITIVANJA
PODACI O ISPITIVANOJ KEMIKALIJI
VALJANOST ISPITIVANJA
OPIS METODE Ispitne komore
Odabir vrste
Držanje uzgojnih riba
Postupanje s oplođenim jajašcima, embrijima i ličinkama
Voda
Ispitne otopine
POSTUPAK Uvjeti izlaganja Trajanje
Punjenje
Svjetlo i temperatura
Hranjenje
Ispitne koncentracije
Kontrole
Učestalost analitičkih određivanja i mjerenja
Zapažanja 26. Stadij embrionalnog razvoja : embrionalni stadij na početku izlaganja ispitivanoj kemikaliji treba provjeriti što je preciznije moguće. To se može učiniti pomoću reprezentativnog uzorka jajašaca koja su na prikladan način konzervirana i očišćena. 27. Valjenje i preživljavanje : valjenje i preživljavanje treba promatrati najmanje jedanput dnevno i relevantne brojke dokumentirati. Ako se u ranoj fazi embrionalnog razvoja primijete gljivice na jajašcima (npr. tijekom prvog ili drugog dana ispitivanja), ta jajašca treba prebrojiti i ukloniti. Mrtve embrije, ličinke i juvenilne ribe treba ukloniti čim ih se uoči jer se mogu brzo raspasti i druge ih ribe mogu raskomadati. Kod uklanjanja mrtvih jedinki nužan je krajnji oprez kako bi se izbjeglo fizičko ozljeđivanje susjednih jajašaca i ličinaka. Znakovi smrti razlikuju se ovisno o vrsti i životnom stadiju jedinke. Na primjer:
28. Neuobičajen izgled : broj ličinaka ili juvenilnih riba u kojih su vidljive anomalije u obliku tijela treba bilježiti u odgovarajućim vremenskim razmacima ovisno o trajanju ispitivanja i vrsti opisane anomalije. Važno je napomenuti da je pojava abnormalnih ličinaka i juvenilnih riba prirodna i da ih kod nekih vrsta u kontroli odnosno kontrolama može biti i više postotaka. U slučajevima kad se deformacije i s njima povezano neuobičajeno ponašanje smatraju toliko ozbiljnima da uzrokuju značajnu patnju organizma te kad je anomalija došla do točke nakon koje oporavak nije moguć, organizam se može ukloniti iz testiranja. Te životinje treba usmrtiti i u kasnijoj analizi podataka tretirati kao uginule. Za većinu vrsta preporučenih u ovoj ispitnoj metodi zabilježen je normalan embrionalni razvoj (9., 10., 11. i 12.). 29. Neuobičajeno ponašanje : anomalije, npr. hiperventilaciju, nekoordinirano plivanje, neuobičajenu mirnoću i neuobičajeno ponašanje pri hranjenju, treba bilježiti u odgovarajućim vremenskim razmacima, ovisno o trajanju ispitivanja (npr. jednom dnevno za toplovodne vrste). Iako ih je teško kvantificirati, ti učinci mogu, ako se uoče, pomoći pri tumačenju podataka o smrtnosti. 30. Težina : na kraju ispitivanja sve preživjele ribe važu se najmanje na osnovi posuda s ponovljenim uzorcima (pri čemu se izvješćuje o broju životinja u posudama s ponovljenim uzorcima i o srednjoj težini po životinji); prednost se daje mokroj masi (ribe osušene upijajućim materijalom), no mogu se dostaviti i podaci o suhoj masi (13.). 31. Dužina : na kraju ispitivanja mjere se pojedinačne dužine. Preporučuje se mjerenje ukupne dužine, no u slučaju truleži repne peraje ili erozije peraje treba koristiti standardnu dužinu. Trebalo bi primjenjivati istu metodu za sve ribe u određenom ispitivanju. Pojedinačna dužina može se izmjeriti, na primjer, pomičnim mjerilima, digitalnom kamerom ili kalibriranim okularnim mikrometrom. Tipične minimalne dužine definirane su u Dodatku 2. PODACI I IZVJEŠĆIVANJE Obrada rezultata
Izvješće o ispitivanju
LITERATURA
Dodatak 1. DEFINICIJE
Dodatak 2. UVJETI ISPITIVANJA, TRAJANJE I KRITERIJI PREŽIVLJAVANJA ZA PREPORUČENE VRSTE
Dodatak 3. SMJERNICE ZA HRANJENJE UZGOJNIH I ISPITNIH RIBA PREPORUČENIH VRSTA I ZA POSTUPANJE S NJIMA
Dodatak 4. NEKA KEMIJSKA SVOJSTVA PRIHVATLJIVE VODE ZA RAZRJEĐIVANJE
Dodatak 5. STATISTIČKE SMJERNICE ZA ODREĐIVANJE NOEC-A Općenito Jedinica analize je akvarij s ponovljenim uzorkom. Stoga za kontinuirana mjerenja, primjerice veličine, treba izračunati srednju vrijednost ili medijan ponovljenog uzorka i te su vrijednosti ponovljenog uzorka podaci za analizu. Treba dokazati snagu testova, po mogućnosti na temelju odgovarajuće baze podataka s prijašnjim podacima za svaki laboratorij. Za svaku krajnju točku treba navesti promjenu veličine koja se može otkriti sa snagom od 75 do 80 % uz statistički test koji će se primijeniti. Pomoću baza podataka koje su na raspolaganju u trenutku razvoja ove ispitne metode utvrđuje se snaga koja je moguća uz primjenu preporučenih statističkih postupaka. Pojedini laboratoriji trebali bi dokazati svoju sposobnost ispunjavanja tog uvjeta u pogledu snage provođenjem vlastite analize snage ili dokazivanjem da koeficijent varijacije (CV) za svaki odgovor ne prelazi 90. percentil koeficijenata varijacije primijenjenih u razvoju smjernice za ispitivanje. Ti se koeficijenti nalaze u tablici 1. Ako su dostupne samo srednje vrijednosti ili medijani ponovljenog uzorka, koeficijent varijacije unutar ponovljenog uzorka može se zanemariti. Tablica 1. 90. percentil koeficijenata varijacije (CV) za odabrane slatkovodne vrste
Za gotovo sve statističke testove koji se primjenjuju za ocjenu laboratorijskih toksikoloških studija od interesa su usporedbe između tretiranih skupina i kontrole. Stoga nije primjereno zahtijevati značajan F-test analize varijance (ANOVA) prije primjene Dunnettova ili Williamsova testa ili značajan Kruskal-Wallisov test prije primjene Jonckheere-Terpstraova, Mann-Whitneyjeva ili Dunnova testa (Hochberg i Tamhane 1987, Hsu 1996, Dunnett 1955, 1964, Williams 1971, 1972, 1975, 1977, Robertson et al. 1988, Jonckheere 1954, Dunn 1964). Dunnettov test ima ugrađenu prilagodbu multipliciteta i na njegov udio lažno pozitivnih i lažno negativnih rezultata negativno utječe primjena F-testa kao mjere nadzora. Na sličan se način Williamsovim i Jonckheere-Terpstraovim testom trenda postupnim snižavanjem primjenom razine značajnosti od 0,05 u svakom koraku održava ukupan udio lažno pozitivnih rezultata od 5 %, a na taj udio i snagu testa negativno utječe primjena F-testa ili Kruskal-Wallisova testa kao mjere nadzora. Mann-Whitneyjev i Dunnov test treba prilagoditi s obzirom na multiplicitet; preporučuje se Bonferroni-Holmova prilagodba. Detaljna rasprava o većini preporuka u pogledu testiranja hipoteza i provjere valjanosti pretpostavki na kojima se temelje ti testovi nalazi se u Smjernici OECD-a iz 2006., koja sadržava i opsežnu bibliografiju. Postupanje s kontrolama ako se upotrebljava otapalo Ako se upotrebljava otapalo, treba uključiti kontrolu s vodom za razrjeđivanje i kontrolu s otapalom. Te dvije kontrole treba usporediti u odnosu na svaki odgovor i kombinirati za statističku analizu ako se među njima ne utvrdi znatna razlika. U suprotnom bi trebalo primijeniti kontrolu s otapalom za određivanje NOEC-a ili procjenu vrijednosti ECx, a kontrola s vodom se ne primjenjuje. Vidjeti ograničenja kriterija valjanosti (stavak 7.). Za vrijednosti dužine, težine, udjela valjenja iz jajašaca, smrtnosti ličinaka ili abnormalnih ličinaka te za prvi ili zadnji dan valjenja ili isplivavanja treba primijeniti T-test ili Mann-Whitneyjev test radi usporedbe kontrole s vodom za razrjeđivanje i kontrole s otapalom s razinom značajnosti od 0,05, zanemarujući sve tretirane skupine. U izvješću treba navesti rezultate tih testova. Mjerenja veličine (dužine i težine) Vrijednosti dužine i težine pojedinih riba mogu biti normalno ili lognormalno distribuirane. U oba su slučaja srednje vrijednosti ponovljenih uzoraka obično normalno distribuirane zahvaljujući centralnom graničnom teoremu i potvrđene podacima iz preko 100 studija na ribama triju slatkovodnih vrsta u ranom životnom stadiju. Ako podaci ili baze podataka s prijašnjim podacima ukazuju na lognormalnu distribuciju vrijednosti veličine pojedinih riba, druga je mogućnost izračun logaritama srednjih vrijednosti ponovljenih uzoraka za pojedine ribe, a u tom slučaju podaci za analizu mogu biti antilogaritmi tih logaritama srednjih vrijednosti ponovljenih uzoraka. Dosljednost podataka treba ocijeniti normalnom distribucijom i homogenošću varijance. U tu svrhu treba upotrijebiti reziduale iz ANOVA-e s koncentracijom kao jedinom eksplanatornom varijablom klase. Može se primijeniti vizualno određivanje na temelju dijagrama rasipanja i histograma ili dijagrama ‚stabljika – list’. Druga je mogućnost primjena formalnog testa kao što je Shapiro-Wilkov ili Anderson-Darlingov test. Dosljednost s homogenošću varijance može se ocijeniti vizualnim pregledom istog dijagrama rasipanja ili, formalno, Leveneovim testom. Normalnost ili homogenost varijance treba ocijeniti samo za parametarske testove kao što su Williamsov ili Dunnettov test. Treba obratiti pažnju na moguće netipične vrijednosti (eng. outliers) i njihov utjecaj na analizu. Mogu se primijeniti Tukeyev test netipičnih vrijednosti i vizualni pregled istih gore opisanih dijagrama reziduala. Treba imati na umu da su zapažanja čitavi ponovljeni uzorci, pa se ispuštanje netipičnih vrijednosti iz analize može učiniti tek nakon pomnog razmatranja. Statistički testovi u kojima se primjenjuju značajke plana ispitivanja i biološka očekivanja su testovi trenda postupnim snižavanjem, primjerice Williamsov i Jonckheere-Terpstraov test. U tim se testovima pretpostavlja monotoničan odnos između koncentracije i odgovora, a dosljednost podataka treba ocijeniti vodeći računa o toj pretpostavci. To se može učiniti vizualno na temelju dijagrama rasipanja srednje vrijednosti ponovljenih uzoraka u odnosu na ispitnu koncentraciju. Pritom je korisno prekriti taj dijagram rasipanja djelomično linearnim dijagramom i povezati srednje vrijednosti koncentracije ponderirane veličinom ponovljenog uzorka. Veliko odstupanje tog djelomično linearnog dijagrama od monotoničnosti ukazivalo bi na moguću potrebu primjene testova koji nisu testovi trenda. Kao druga mogućnost mogu se primijeniti formalna ispitivanja. Jednostavan formalni test je izračun linearnih i kvadratnih kontrasta srednjih vrijednosti koncentracije. Ako je kvadratni kontrast značajan, a linearni kontrast nije značajan, to ukazuje na mogući problem s monotoničnošću koju bi trebalo dodatno ocijeniti na temelju dijagrama. Ako bi normalnost ili homogenost varijance mogla predstavljati problem, ti se kontrasti mogu konstruirati na temelju transformiranja apsolutnih podataka u raspored. Mogu se primijeniti i alternativni postupci, primjerice Bartholomewov test monotoničnosti, no njima se ispitivanje čini složenijim. Slika 2.: NOEC – dijagram toka za mjerenja veličine (dužine i težine) 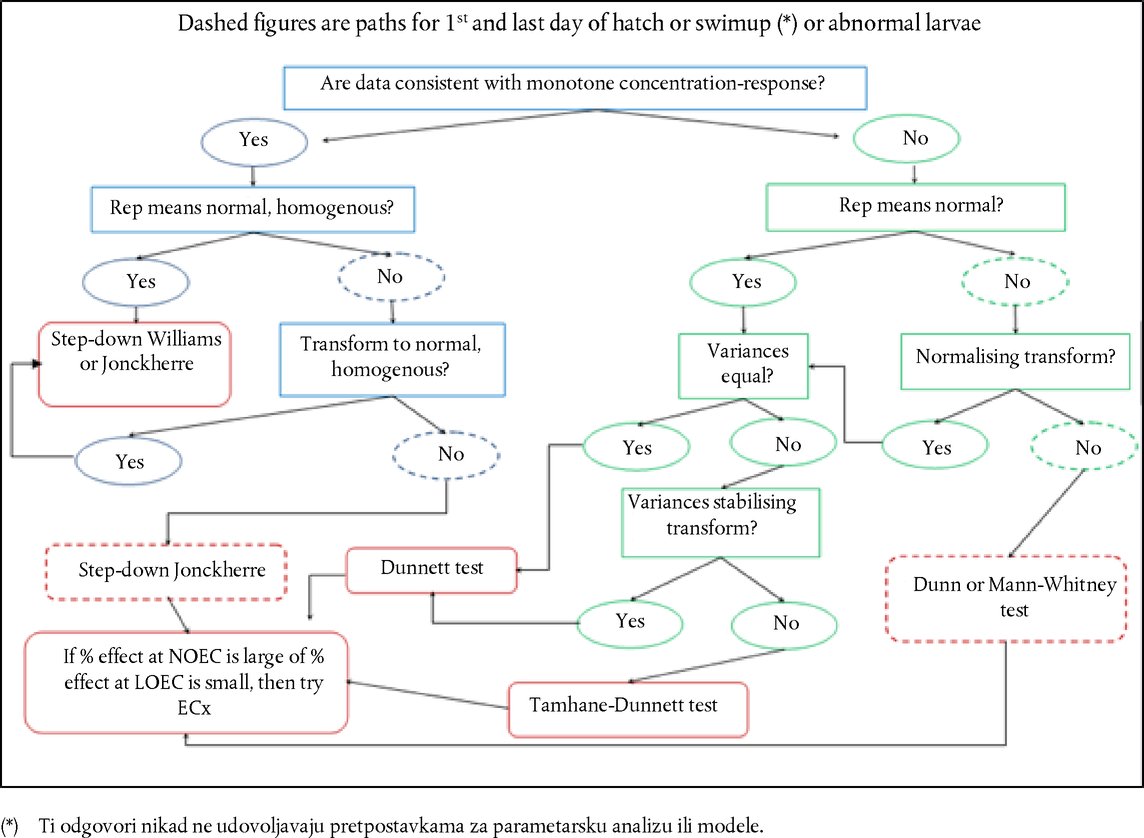
Osim ako podaci nisu u skladu sa zahtjevima za te testove, NOEC se određuje primjenom Williamsova ili Jonckheere-Terpstraova testa trenda postupnim snižavanjem. Detaljni opis tih postupaka nalazi se u dokumentu OECD-a iz 2006. Za podatke koji nisu u skladu sa zahtjevima za testove trenda postupnim snižavanjem može se primijeniti Dunnettov test ili Tamhane-Dunnettov test (T3); oba testa imaju ugrađene prilagodbe za multiplicitet. U tim se testovima pretpostavlja normalnost i, u slučaju Dunnettova testa, homogenost varijance. Ako ti uvjeti nisu ispunjeni, može se primijeniti Dunnov neparametarski test. Detaljni opis svih tih testova nalazi se u dokumentu OECD-a iz 2006. Na slici 2. nalazi se pregled kako pronaći odabrani test. Valjenje iz jajašaca i preživljavanje ličinaka Podaci su udio jajašaca iz kojih se izvale ličinke ili ličinke koje prežive u pojedinim ponovljenim uzorcima. Te bi udjele trebalo ocijeniti u pogledu ekstrabinomne varijance, što je uobičajeno za ta mjerenja, no ne i univerzalno. U dijagramu toka prikazanom na slici 3. daju se smjernice za odabrani test; detaljni opisi nalaze se u tekstu. Obično se upotrebljavaju dva testa. Riječ je o Taroneovu C(α) testu (Tarone 1979) i testovima hi-kvadratom, koji se odvojeno primjenjuju na svaku ispitnu koncentraciju. Ako se makar u jednoj ispitnoj koncentraciji pronađe ekstrabinomna varijanca, treba primijeniti metode kojima se ona uzima u obzir. Formula 1. Taroneov C (α) test (Tarone 1979)
pri čemu je ̂ srednji udio za danu koncentraciju, m je broj akvarija s ponovljenim uzorcima, nj je broj jedinki u ponovljenom uzorku j i xj je broj jedinki s odgovorom u tom ponovljenom uzorku, npr. neizvaljenih ili mrtvih životinja. Taj se test odvojeno primjenjuje na svaku koncentraciju. On se može promatrati kao prilagođeni test hi-kvadratom, no ograničene simulacije snage koje je proveo Tarone pokazale su da je snažniji od testa hi-kvadratom. Slika 3. NOEC – dijagram toka za valjenje iz jajašaca i smrtnost ličinaka 
Ako nema značajnih dokaza u pogledu ekstrabinomne varijance, može se primijeniti Cochran-Armitageov test trenda postupnim snižavanjem. U tom se testu zanemaruju ponovljeni uzorci, pa ako postoje takvi dokazi, Rao-Scottova prilagodba Cochran-Armitageova testa (RSCA) uzima u obzir ponovljene uzorke, veličine ponovljenih uzoraka i ekstrabinomnu varijancu te se preporučuje. Alternativni testovi su Williamsov i Jonckheere-Terpstraov test trenda postupnim snižavanjem te Dunnettov test kako je opisano za mjerenje veličine. Ti se testovi primjenjuju bez obzira na to postoji li ekstrabinomna varijanca ili ne, no njihova je snaga nešto niža (Agresti 2002, Morgan 1992, Rao i Scott 1992, 1999, Fung et al. 1994, 1996). Prvi ili zadnji dan valjenja ili isplivavanja Odgovor je cijeli broj koji se odnosi na broj dana od početka ispitivanja do trenutka kad je primijećeno predmetno zapažanje za određeni akvarij s ponovljenim uzorkom. Raspon vrijednosti općenito je vrlo malen i čest je velik udio povezanih vrijednosti, npr. isti prvi dan valjenja primjećuje se u svim kontrolnim ponovljenim uzorcima i možda u jednoj ili dvije niske ispitne koncentracije. Parametarski testovi kao što su Williamsov ili Dunnettov test nisu primjereni za takve podatke. Osim ako postoje dokazi o ozbiljnoj nemonotoničnosti, Jonckheere-Terpstraov test trenda postupnim snižavanjem vrlo je snažan kad je riječ o otkrivanju učinaka ispitivane kemikalije. U suprotnom se može primijeniti Dunnov test. Abnormalnosti ličinaka Odgovor je broj ličinaka u kojih je utvrđen neki oblik abnormalnosti. Taj je odgovor često niske pojavnosti i kod njega se pojavljuju neki problemi kao i za prvi dan valjenja, a ponekad i nepredvidivost u odnosu između koncentracije i odgovora. Ako podaci barem ugrubo slijede monotoničan oblik koncentracije, Jonckheere-Terpstraov test trenda postupnim snižavanjem snažan je test za otkrivanje učinaka. U suprotnom se može primijeniti Dunnov test. LITERATURA Agresti, A. (2002); Categorical Data Analysis, second edition, Wiley, Hoboken. Dunnett C. W. (1955); A multiple comparison procedure for comparing several treatments with a control, J. American Statistical Association 50, 1096-1121. Dunn O. J. (1964); Multiple Comparisons Using Rank Sums, Technometrics 6, 241-252. Dunnett C. W. (1964); New tables for multiple comparisons with a control, Biometrics 20, 482-491. Fung, K.Y., D. Krewski, J.N.K. Rao, A.J. Scott (1994); Tests for Trend in Developmental Toxicity Experiments with Correlated Binary Data, Risk Analysis 14, 639-648. Fung, K.Y., D. Krewski, R.T. Smythe (1996); A comparison of tests for trend with historical controls in carcinogen bioassay, Canadian Journal of Statistics 24, 431-454. Hochberg, Y. and A. C. Tamhane (1987); Multiple Comparison Procedures, Wiley, New York. Hsu, J.C. (1996); Multiple Comparisons: Theory and Methods; Chapman and Hall/CRC Press, Boca Raton. Jonckheere A. R. (1954); A distribution-free k-sample test against ordered alternatives, Biometrika 41, 133. Morgan, B.J.T. (1992); Analysis of Quantal Response Data, Chapman and Hall, London. OECD (2006). Current approaches in the statistical analysis of ecotoxicity data: A guidance to application. Series on Testing and Assessment, No. 54. Organizacija za gospodarsku suradnju i razvoj (OECD), Pariz. Rao J.N.K. and Scott A.J. (1992) – A simple method for the analysis of clustered binary data, Biometrics 48, 577-585. Rao J.N.K. and Scott A.J. (1999) – A simple method for analyzing overdispersion in clustered Poisson data, Statistics in Medicine 18, 1373-1385. Robertson, T., Wright F.T. and Dykstra R.L. (1988); Order restricted statistical inference, Wiley. Tarone, R.E. (1979); Testing the goodness of fit of the Binomial distribution, Biometrika 66, 585-590. Williams D.A. (1971); A test for differences between treatment means when several dose levels are compared with a zero dose control, Biometrics 27, 103-117. Williams D.A. (1972); The comparison of several dose levels with a zero dose control, Biometrics 28, 519-531. Williams D. A. (1975); The Analysis of Binary Responses from Toxicological Experiments Involving Reproduction and Teratotlogy, Biometrics 31, 949-952. Williams D.A. (1977); Some inference procedures for monotonically ordered normal means, Biometrika 64, 9-14. Dodatak 6. STATISTIČKE SMJERNICE ZA PROCJENE REGRESIJE Općenito Zapažanja koja se upotrebljavaju za prilagodbu modela su srednje vrijednosti ponovljenih uzoraka (dužina i težina) ili udio ponovljenih uzoraka (valjenje iz jajašaca i smrtnost ličinaka) (OECD 2006). Općenito se savjetuje primjena ponderirane regresije u kojoj je ponder veličina ponovljenog uzorka. Moguće su i druge sheme ponderiranja kao što su ponderiranje predviđenom srednjom vrijednošću odgovora ili kombinacija toga i veličine ponovljenog uzorka. Ne preporučuje se ponderiranje recipročnom vrijednošću varijance uzorka unutar koncentracije (Bunke et al. 1999, Seber i Wild 2003, Motulsky i Christopoulos 2004, Huet et al. 2003). U eventualnim transformacijama odgovora prije analize trebala bi se sačuvati neovisnost zapažanja, a vrijednost ECx i njezine granice pouzdanosti trebalo bi izraziti u izvornim mjernim jedinicama umjesto u transformiranim jedinicama. Primjerice, promjena od 20 % u logaritmu dužine nije istovjetna promjeni od 20 % dužine (Lyles et al. 2008, Draper i Smith 1999). U dijagramu toka prikazanom na slici 4. nalazi se pregled procjena vrijednosti ECx. Pojedinosti su opisane u tekstu u nastavku. Slika 4. Dijagram toka za procjenu vrijednosti ECx za srednju vrijednost dužine, težine ili udjela valjenja iz jajašaca ili smrtnosti ličinaka u ponovljenom uzorku; vidjeti tekst za više podataka. 
Razmatranja u pogledu valjenja iz jajašaca i smrtnosti ličinaka Za podatke o valjenju iz jajašaca i smrtnosti ličinaka općenito je najbolje prilagoditi model smanjenja osim ako se prilaagodi probit model kako je opisano u nastavku. Drugim riječima, treba modelirati udio jajašaca iz kojih se ne izvale ličinke ili ličinaka koje uginu. Razlog tome je da se vrijednost ECx odnosi na koncentraciju kod koje postoji promjena jednaka x % srednje vrijednosti odgovora u kontroli. Ako se iz 5 % kontrolnih jajašaca ne izlegnu ličinke i modelira se izostanak valjenja, tada se vrijednost EC20 odnosi na koncentraciju pri kojoj je promjena jednaka 20 % od 5 % izostanaka valjenja u kontroli, a to je promjena od 0,2 × 0,05 = 0,01 ili jedan postotni bod na 6 % izostanaka valjenja. Takva se mala razlika ne može procijeniti ni na kakav smisleni način na temelju raspoloživih podataka i nije biološki značajna. Međutim, ako se modelira udio jajašaca iz kojih se izvale ličinke, kontrolni bi udio u ovom primjeru iznosio 95 %, a smanjenje od 20 % u odnosu na kontrolnu srednju vrijednost bila bi promjena od 0,95 × 0,2 = 0,18, dakle od uspješnosti valjenja od 95 % na 77 % (= 95 – 18) uspješnosti valjenja; ta se koncentracija s učinkom može procijeniti i pretpostavlja se da je od većeg interesa. To ne predstavlja problem u mjerenjima duljine, iako negativni učinci na veličinu općenito znače smanjenje veličine. Modeli za veličinu (dužinu ili težinu) i uspješnost valjenja odnosno preživljavanje ličinaka Svi su modeli, osim Brain-Cousensova modela hormeze, opisani i preporučeni u OECD (2006). Slob (2002) razmatra Smjernice OECD-a od 2. do 5. i za pokuse u pogledu ekotoksičnosti. Naravno, postoje i mnogi drugi modeli koji bi mogli biti korisni. Bunke et al. (1999) navode brojne modele koji nisu ovdje uključeni i upućivanja na druge modele. Modeli navedeni u nastavku osobito su primjereni i često se upotrebljavaju za pokuse u pogledu ekotoksičnosti. S pet ispitnih koncentracija plus kontrola
Sa šest ili više ispitnih koncentracija plus kontrola
Ako postoje vizualni dokazi hormeze (što je malo vjerojatno kad se radi o uspješnosti valjenja ili preživljavanju ličinaka, no ponekad se bilježi u zapažanjima o veličini)
Alternativni modeli za neuspješno valjenje i smrtnost ličinaka
Kakvoća prilagodbe pojedinog modela
Usporedba modela
Kvaliteta procjene vrijednosti ECx Interval pouzdanosti (CI) za vrijednost ECx ne bi smio biti preširok. Pri odlučivanju o tome koliko može biti širok interval pouzdanosti, a vrijednost ECx još uvijek korisna, potrebna je statistička procjena. Simulacije prilagodbe regresijskih modela podacima o valjenju iz jajašaca i o veličini pokazuju da oko 75 % intervala pouzdanosti za vrijednost ECx (x = 10, 20 ili 30) ne obuhvaća više od dvije ispitne koncentracije. To može poslužiti kao općenita uputa u pogledu prihvatljivosti i kao praktična smjernica o tome što se može postići. Brojni autori naglašavaju potrebu za izvješćivanjem o intervalu pouzdanosti za sve parametre modela i napominju da široki intervali pouzdanosti za parametre modela ukazuju na neprihvatljive modele (Ott i Longnecker 2008, Alvord i Rossio 1993, Motulsky i Christopoulos 2004, Lyles et al. 2008, Seber i Wild 2003, Bunke et al. 1999, Environment Canada 2005). Interval pouzdanosti (CI) za vrijednost ECx (ili bilo koji drugi parametar modela) ne bi smio sadržavati nulu (Motulsky i Christopoulos 2004). To je, u regresijskim modelima, ekvivalent minimalnoj značajnoj razlici koja se često citira u pristupima testiranju hipoteze (npr. Wang et al. 2000). On odgovara i intervalu pouzdanosti za srednje vrijednosti odgovora pri vrijednosti LOEC koja ne sadržava kontrolnu srednju vrijednost. Pitanje je jesu li procjene parametara znanstveno vjerodostojne. Primjerice, ako interval pouzdanosti za y0 iznosi ± 20 %, nijedna procjena vrijednosti EC10 nije vjerodostojna. Ako se modelom predviđa učinak od 20 % pri koncentraciji C, a najveći zapaženi učinak pri koncentraciji C i nižim koncentracijama je 10 %, tada vrijednost EC20 nije vjerodostojna (Motulsky i Christopoulos 2004, Wang et al. 2000, Environment Canada 2005). Vrijednost ECx ne bi smjela zahtijevati ekstrapolaciju izvan raspona pozitivnih koncentracija (Draper i Smith 1999, OECD 2006). Na primjer, opća bi uputa mogla biti da vrijednost ECx ne smije biti niža od oko 25 % ispod najniže ispitane koncentracije ili iznad najviše ispitane koncentracije. LITERATURA Alvord, W.G., Rossio, J.L. (1993); Determining confidence limits for drug potency in immunoassay, Journal of Immunological Methods 157, 155-163. Brain P. and Cousens R. (1989); An equation to describe dose responses where there is stimulation of growth at low doses. Weed res. 29: 93-96. Bunke, O., Droge, B. and Polzehl, J. (1999). Model selection, transformations and variance estimation in nonlinear regression. Statistics 33, 197-240. Collett, D. (2002); Modelling Binary Data, second edition, Chapman and Hall, London. Collett, D. (2003); Modelling Survival Data in Medical Research, second edition, Chapman and Hall, London. Draper, N.R. and Smith, H. (1999); Applied Regression Analysis, third edition. New York: John Wiley & Sons. Environment Canada (2005); Guidance Document on Statistical Methods for Environmental Toxicity Tests, Report EPS 1/RM/46 Huet, S., A. Bouvier, M.-A. Poursat, E. Jolivet (2003); Statistical Tools for Nonlinear Regression: A Practical Guide with S-PLUS and R Examples, Springer Series in Statistics, New York. Lyles, R. H., C. Poindexter, A. Evans, M. Brown, and C.R. Cooper (2008); Nonlinear Model-Based Estimates of IC50 for Studies Involving Continuous Therapeutic Dose-Response Data, Contemp Clin Trials. 2008 November; 29(6): 878–886. Morgan, B.J.T. (1992); Analysis of Quantal Response Data, Chapman and Hall, London. Motulsky, H., A. Christopoulos (2004); Fitting Models to Biological Data Using Linear and Nonlinear Regression: A Practical Guide to Curve Fitting, Oxford University Press, USA. O'Hara Hines, R. J. and J. F. Lawless (1993); Modelling Overdispersion in Toxicological Mortality Data Grouped over Time, Biometrics Vol. 49, pp. 107-121 OECD (2006); Current approaches in the statistical analysis of ecotoxicity data: A guidance to application. Series Testing and Assessment, No. 54, Organisation for Economic Co-operation and Development, OECD, Pariz. Ott, R.L., M.T. Longnecker, An Introduction to Statistical Methods and Data Analysis, sixth edition, 2008, Brooks-Cole, Belmont, CA Ratkowsky, D.A. (1993); Principles of nonlinear regression, Journal of Industrial Microbiology 12, 195-199. Seber, G.A.F., C.J. Wild, Nonlinear Regression, Wiley, 2003 Slob W. (2002); Dose-response modelling of continuous endpoints. Toxicol. Sci., 66, 298-312 Wang, Q., D.L. Denton, and R. Shukla (2000); Applications and Statistical Properties Of Minimum Significant Difference-Based Criterion Testing In a Toxicity Testing Program, Environmental Toxicology and Chemistry, Vol. 19, pp. 113–117, 2000. C.48. Kratkoročni reprodukcijski test na ribama UVOD
POČETNA RAZMATRANJA I OGRANIČENJA
NAČELO ISPITIVANJA
KRITERIJI PRIHVATLJIVOSTI ISPITIVANJA
OPIS METODE Oprema
Voda
Ispitne otopine
Držanje riba
Razdoblje prije izlaganja i odabir riba
PLAN ISPITIVANJA
Odabir ispitnih koncentracija
POSTUPAK Odabir i vaganje ispitnih riba
Uvjeti izlaganja Trajanje
Hranjenje
Svjetlo i temperatura
Učestalost analitičkih određivanja i mjerenja
Zapažanja
Preživljavanje
Ponašanje i izgled
Plodnost
Humano usmrćivanje riba
Zapažanja u pogledu sekundarnih spolnih obilježja
Vitelogenin (VTG)
Procjena histopatološke pretrage gonada
PODACI I IZVJEŠĆIVANJE Procjena reakcija biomarkera s pomoću analize varijance (ANOVA)
Izvješćivanje o rezultatima ispitivanja
SMJERNICE ZA TUMAČENJE I PRIHVAĆANJE REZULTATA ISPITIVANJA
LITERATURA
Dodatak 1. KRATICE I DEFINICIJE Kemikalija : tvar ili smjesa. CV : koeficijent varijacije ELISA : imunoenzimski test (eng. Enzyme-Linked Immunosorbent Assay). Os HPG : os hipotalamus-hipofiza-gonade. Gustoća punjenja : mokra masa ribe po volumenu vode. MTK : maksimalna tolerirana koncentracija, iznosi oko 10 % vrijednosti LC50. Gustoća nasada : broj riba po volumenu vode. Ispitivana kemikalija : bilo koja tvar ili smjesa koja se ispituje ovom ispitnom metodom. VTG : vitelogenin je fosfolipoglikoproteinski prekursor proteina žumanjka koji je u pravilu prisutan u spolno aktivnih ženki svih vrsta koje liježu jaja. Dodatak 2. EKSPERIMENTALNI UVJETI ZA TEST PROBIRA ENDOKRINOG SUSTAVA RIBA
Dodatak 3. NEKA KEMIJSKA SVOJSTVA PRIHVATLJIVE VODE ZA RAZRJEĐIVANJE
Dodatak 4.A SUPSTRAT ZA MRIJEŠĆENJE ZEBRICE Ladica za mrijest : staklena, dimenzija primjerice 22 × 15 × 5,5 cm (d × š × v), prekrivena pomičnom žičanom rešetkom od nehrđajućeg čelika (širina otvora 2 mm). Rešetka bi trebala prekrivati otvor posude ispod ruba. 
Supstrat za mriješćenje treba pričvrstiti na rešetku. To bi trebao biti prostor u koji ribe mogu ulaziti. Primjerice, prikladno je umjetno akvarijsko bilje izrađeno od zelene plastike (napomena: potrebno je uzeti u obzir moguću adsorpciju ispitivane kemikalije na plastiku). Plastiku je potrebno dovoljno dugo ispirati dovoljnom količinom tople vode kako bi se osiguralo da ne dođe do otpuštanja kemikalija u ispitnu vodu. Pri upotrebi stakla potrebno je osigurati da ne dođe do ozljeđivanja ili prikliještenja riba tijekom njihova energičnoga kretanja. Udaljenost između ladice i stakla trebala bi biti najmanje 3 cm kako bi se osiguralo da do mriješćenja ne dođe izvan ladice. Jajašca izmriještena u ladicu padaju kroz rešetku i uzorci se mogu uzeti od 45 do 60 minuta nakon početka osvjetljavanja. Prozirna se jajašca ne lijepe i mogu se jednostavno prebrojiti s pomoću transverzalnog svjetla. Pri upotrebi pet ženki po posudi, do 20 jajašaca dnevno može se smatrati malim brojem, do 100 srednjim, a više od 100 velikim. Ladicu za mrijest potrebno je maknuti, jajašca ukloniti i vratiti ladicu u ispitnu posudu što kasnije navečer ili vrlo rano ujutro. Razdoblje do vraćanja ladice ne smije trajati dulje od jednog sata jer u suprotnom supstrat za mriješćenje može potaknuti pojedinačno parenje i mriješćenje u neuobičajeno doba. U slučaju potrebe za kasnijim vraćanjem ladice za mrijest to treba učiniti najmanje devet sati nakon početka osvjetljavanja. U to kasno doba dana više nema mriješćenja. Dodatak 4.B SUPSTRAT ZA MRIJEŠĆENJE DEBELOGLAVE GAVČICE Dvije ili tri kombinirane pločice i ladice za mrijest od plastike/keramike/stakla ili nehrđajućeg čelika smještaju se u svaku ispitnu komoru (primjerice sivi polukružni oluk dužine 80 mm koji se nalazi na ladici U-profila dugačkoj 130 mm) (vidjeti sliku). Pravilno pripremljene plastične ili keramičke pločice pokazale su se prikladnima za supstrat za mriješćenje (Thorpe et al. 2007). Preporučuje se abrazija pločica kako bi se poboljšalo prianjanje. Ladicu treba pregledati kako bi se ribama spriječio pristup palim jajašcima, osim ako je prianjanje jajašaca dokazano za primijenjeni supstrat za mriješćenje. 
Podloga služi zadržavanju svih jajašaca koja se nisu prilijepila za površinu pločice i koja bi pala na dno akvarija (ili jajašaca koja su položena izravno na ravnu plastičnu podlogu). Sve supstrate za mriješćenje prije upotrebe potrebno je ispirati u vodi za razrjeđivanje najmanje 12 sati. Thorpe KL, Benstead R, Hutchinson TH, Tyler CR, 2007. An optimised experimental test procedure for measuring chemical effects on reproduction in the fathead minnow, Pimephales promelas. Aquatic Toxicology, 81, 90. – 98. Dodatak 5.A PROCJENA SEKUNDARNIH SPOLNIH OBILJEŽJA U DEBELOGLAVE GAVČICE RADI OTKRIVANJA ODREĐENIH ENDOKRINO AKTIVNIH KEMIKALIJA Pregled Potencijalno važna obilježja fizičkog izgleda u odraslih debeloglavih gavčica pri ispitivanju endokrinih disruptora uključuju boju tijela (svijetlu/tamnu boju), uzorke boje (postojanje ili izostanak okomitih pruga), oblik tijela (oblik glave i prsnog područja, zaobljenost abdomena) te posebna sekundarna spolna obilježja (broj i veličinu izraslina spolno zrelih riba, veličinu zadebljanja ispred leđne peraje i leglice). Izrasline se nalaze na glavi (zadebljanju ispred leđne peraje) reproduktivno aktivnih mužjaka debeloglave gavčice te su u pravilu raspoređene u bočno simetričnom uzorku (Jensen et al. 2001). U ženki iz kontrolnih skupina i mladih mužjaka i ženki nije uočen razvoj izraslina (Jensen et al. 2001). Moguća je pojava do osam pojedinačnih izraslina oko očiju i između nosnica mužjaka. Najviše izraslina i najveće izrasline nalaze se u dvjema usporednim linijama neposredno ispod nosnica i iznad usta. U brojnih riba skupine izraslina nalaze se ispod donje čeljusti; jedan par izraslina u pravilu se nalazi najbliže ustima, dok se dalje prema trbuhu mogu nalaziti do četiri izrasline. Stvarni broj izraslina rijetko premašuje 30 (raspon od 18 do 28; Jensen et al. 2001). Dominantne izrasline (u brojčanom smislu) prisutne su kao jedinstvena, relativno okrugla struktura čija je visina približno jednaka polumjeru. Većina reproduktivno aktivnih mužjaka ima i barem nekoliko izraslina koje su uvećane i izražene tako da ih je nemoguće razlikovati kao pojedinačne strukture. Neke vrste endokrino disruptivnih kemikalija mogu prouzročiti neuobičajenu pojavu određenih sekundarnih spolnih obilježja u suprotnog spola; primjerice, agonisti receptora za androgene, poput 17α-metiltestosterona ili 17β-trenbolona, mogu prouzročiti razvoj izraslina u ženki debeloglave gavčice (Smith 1974; Ankley et al. 2001; 2003.), dok agonisti receptora za estrogene mogu prouzročiti smanjenje broja ili veličine izraslina u mužjaka (Miles-Richardson et al. 1999; Harries et al. 2000). U nastavku se nalazi opis obilježja izraslina u spolno zrelih debeloglavih gavčica na temelju postupaka koji se primjenjuju u laboratoriju američke Agencije za zaštitu okoliša u Duluthu, Minnesota. Posebne proizvode i/ili opremu moguće je zamijeniti sličnim dostupnim materijalima. Najbolji je pregled s pomoću osvijetljenog povećala ili stereoskopskog mikroskopa s osvjetljenjem i lećom objektiva od 3x. Promatrajte leđa i glave riba (glava prema gledatelju).
Brojanje i ocjenjivanje izraslina Utvrđeno je šest posebnih područja za ocjenu pojave i razvoja izraslina u odraslih debeloglavih gavčica. Izrađen je obrazac za evidentiranje mjesta i broja izraslina (vidjeti završetak ovog Dodatka). Broj se izraslina evidentira, a njihova se veličina ocjenjuje kao: 0 – izostanak, 1 – prisutne, 2 – uvećane i 3 – izražene za svaki organizam (slika 1.). Ocjena 0 – izostanak izraslina. Ocjena ‚1 – prisutne’ odnosi se na sve izrasline s jednostrukim vrhom čija je visina gotovo jednaka polumjeru. Ocjena ‚2 – uvećane’ odnosi se na tkivo koje nalikuje zvjezdici i koje u pravilu ima veliku radijalnu osnovu s udubinama i brazdama koje se izdižu iz središta. Vrh izrasline često je više nazubljen, ali u nekim slučajevima može biti i zaobljen. Ocjena ‚3 – izražene’ odnosi se na prilično velike i zaobljene izrasline slabije definirane strukture. Te će izrasline u nekim slučajevima tvoriti jedinstvenu tvorbu duž jednog ili kombinacije područja (B, C i D, prema opisu u nastavku). Boja i uzorak nalikuju ocjeni 2, ali su u nekim slučajevima prilično neodređeni. Posljedica će primjene ovog sustava ocjenjivanja biti ukupne ocjene izraslina < 50 u normalnog kontrolnog mužjaka koji ima od 18 do 20 izraslina (Jensen et al. 2001). Slika 1. 
Stvarni broj izraslina u nekih riba može premašivati broj polja u obrascu za određeno područje ocjenjivanja. U tom slučaju moguće je dodatne ocjene navesti desno ili lijevo od polja. Stoga obrazac ne treba biti simetričan. Dodatna metoda mapiranja izraslina koje su u paru ili se nalaze u skupinama duž horizontalne ravnine usta jest dvostruko označavanje dviju točaka za ocjenjivanje izraslina u jednom polju. Područja mapiranja:
LITERATURA
Dodatak 5.B PROCJENA SEKUNDARNIH SPOLNIH OBILJEŽJA U MEDAKE RADI OTKRIVANJA ODREĐENIH ENDOKRINO AKTIVNIH KEMIKALIJA U nastavku se opisuje mjerenje papilarnih procesa (*10) koji su sekundarno spolno obilježje u medake (Oryzias latipes).
Mjerenje
Slika 1. Dijagram s prikazom spolnih razlika u obliku i veličini podrepne peraje. A – mužjak; B – ženka. Oka, T. B., 1931. On the processes on the fin rays of the male of Oryzias latipes and other sex characters of this fish. J. Fac. Sci., Tokyo Univ., IV, 2: 209-218. 
Slika 2.A procesi na kostima bodlje šipčice podrepne peraje. J.P. – kost bodlje; A.S. – aksijalni prostor; P. – proces. B – krajnji dio šipčice peraje. Na vrhu se nalaze Actinotrichia (Act.). Oka, T. B., 1931. On the processes on the fin rays of the male of Oryzias latipes and other sex characters of this fish. J. Fac. Sci., Tokyo Univ., IV, 2: 209-218. 
Slika 3. Fotografija tijela ribe i prikaz mjesta reza kad je gonada fiksirana u otopini za fiksiranje koja nije 10-postotni neutralni puferirani formalin. U tom slučaju ostatak tijela odrezat će se između prednjeg dijela podrepne peraje i anusa s pomoću skalpela (crvena linija); glava s prednjim dijelom ribe stavit će se u otopinu za fiksiranje gonade, a repni dio u 10-postotni neutralni puferirani formalin. 
Dodatak 6. PREPORUČENI POSTUPCI ZA UZIMANJE UZORAKA ZA ANALIZU VITELOGENINA Potrebno je paziti da ne dođe do unakrsne kontaminacije uzoraka VTG-a mužjaka i ženki. Postupak 1.A: Debeloglava gavčica, uzimanje krvi iz repne vene/arterije Nakon anestezije, korijen repa djelomično se odvaja skalpelom i uzima se krv iz repne vene/arterije s pomoću heparinizirane mikrohematokritske kapilarne cjevčice. Nakon uzimanja krvi plazma se brzo izolira centrifugiranjem pri 15 000 g u trajanju od tri minute (ili centrifugiranjem u trajanju od deset minuta pri 15 000 g na 4 °C). Postotak hematokrita može se, po želji, utvrditi nakon centrifugiranja. Plazma se potom uklanja iz mikrohematokritske cjevčice i pohranjuje u epruvetu za centrifugu uz 0,13 jedinica aprotinina (inhibitora proteaze) na – 80 °C do mogućnosti određivanja VTG-a. Ovisno o veličini debeloglave gavčice (koja ovisi o spolu), prikupljena količina plazme obično se kreće od pet do 60 mikrolitara po ribi (Jensen et al. 2001). Postupak 1.B: Debeloglava gavčica, uzimanje krvi iz srca Druga je mogućnost uzimanje krvi punkcijom srca s pomoću heparinizirane šprice (1 000 jedinica heparina po ml). Krv se stavlja u Eppendorfove epruvete (koje se čuvaju na ledu) i potom centrifugira (pet minuta, 7 000 g, na sobnoj temperaturi). Plazmu treba premjestiti u čiste Eppendorfove epruvete (u alikvotima ako to dopušta volumen plazme) i odmah smrznuti na – 80 °C do analize (Panter et al. 1998). Postupak 2.A: Japanska medaka, vađenje jetre u medake Uklanjanje ispitne ribe iz ispitne komore
Vađenje jetre
Nakon vađenja jetre truplo ribe podvrgava se histološkoj pretrazi gonade i mjerenju sekundarnih spolnih obilježja. Uzorak Pohranite uzorke jetara ispitnih riba na ≤ – 70 °C ako se ne podvrgavaju preliminarnom tretiranju ubrzo nakon vađenja. Slika 1. Škarama se načini rez neposredno ispred prsnih peraja. 
Slika 2. Škarama se razreže središnja linija abdomena do točke približno 2 mm od kranijalne strane anusa. 
Slika 3. Pincetom se trbušne stijenke šire radi vađenja jetre i ostalih unutarnjih organa. (Druga je mogućnost bočno pričvrstiti trbušne stijenke). Strelica pokazuje jetru. 
Slika 4. Jetra se izrezuje i vadi s pomoću pincete. 
Slika 5. Crijeva se nježno povlače pincetom. 
Slika 6. Škarama se režu oba kraja crijeva i sva mezenterička vezivna tkiva. 
Slika 7. (ženka) Postupak je jednak za ženke. 
Slika 8. Kraj postupka. 
Postupak 2.B: Japanska medaka (Oryzias latipes), preliminarno tretiranje jetre za analizu vitelogenina Uzmite bocu homogenizacijskog pufera iz kompleta za analizu ELISA i ohladite je smrvljenim ledom (temperatura otopine: ≤ 4 °C). U slučaju upotrebe homogenizacijskog pufera iz sustava EnBio ELISA otopite otopinu na sobnu temperaturu, a potom bocu ohladite smrvljenim ledom. Izračunajte volumen homogenizacijskog pufera za jetru na temelju njezine mase (dodajte 50 μl homogenizacijskog pufera po mg mase jetre). Primjerice, ako masa jetre iznosi 4,5 mg, volumen homogenizacijskog pufera za jetru iznosi 225 μl. Sastavite popis volumena homogenizacijskog pufera za sve jetre. Priprema jetre za preliminarno tretiranje
Postupak preliminarnog tretiranja 1) Dodavanje pufera za homogenizaciju Provjerite popis kako biste utvrdili koji je volumen homogenizacijskog pufera potrebno upotrijebiti za određeni uzorak jetre i podesite mikropipetu (raspon volumena: 100 – 1 000 μl) na odgovarajući volumen. Na mikropipetu stavite čisti vrh. Uzmite homogenizacijski pufer iz boce s reagensom i dodajte pufer u mikroepruvetu od 1,5 ml u kojoj se nalazi jetra. Dodajte homogenizacijski pufer u sve mikroepruvete od 1,5 ml u kojima se nalazi jetra prema prethodno opisanom postupku. Vrh mikropipete nije potrebno zamijeniti novim. Međutim, vrh je potrebno zamijeniti ako je kontaminiran ili se sumnja na kontaminaciju. 2) Homogenizacija jetre
3) Centrifugiranje suspendiranog homogenata jetre
4) Vađenje supernatanta
Čuvanje uzorka Mikroepruvete od 0,5 ml u kojima se nalazi supernatant homogenata jetre čuvajte na ≤ –70 °C do upotrebe za test ELISA. Postupak 3.A: Zebrica, uzimanje krvi iz repne vene/arterije Neposredno nakon anestezije korijen repa poprečno se zarezuje i uzima se krv iz repne arterije/vene s pomoću heparinizirane mikrohematokritske kapilarne cjevčice. Volumen krvi kreće se od pet do 15 mikrolitara ovisno o veličini ribe. Jednaki volumen pufera aprotinina (6 mikrograma/ml u fiziološkoj otopini s fosfatnim puferom) dodaje se u mikrokapilarnu cjevčicu, a plazma se centrifugiranjem odvaja od krvi (pet minuta pri 600 g). Plazma se stavlja u ispitne epruvete i čuva na – 20 °C do analize VTG-a ili ostalih proteina koji mogu biti od interesa. Postupak 3.B: Zebrica, uzimanje krvi punkcijom srca Kako bi se izbjeglo zgrušavanje krvi i propadanje proteina, uzorci se uzimaju u fiziološkoj otopini s fosfatnim puferom koja sadržava heparin (1 000 jedinica/ml) i aprotinin (inhibitor proteaze) (2 TIU/ml). Kao sastojci za pufer preporučuju se heparin, amonijeva sol i liofilizirani aprotinin. Za uzimanje uzorka krvi preporučuje se šprica (1 ml) s fiksnom tankom iglom (primjerice Braun Omnican-F). Špricu je potrebno prethodno napuniti puferom (približno 100 mikrolitara) kako bi se iz svake ribe u potpunosti eluirale male količine krvi. Uzorci krvi uzimaju se punkcijom srca. Ribi je prvo potrebno dati anestetik MS-222 (100 mg/l). Pri odgovarajućem stupnju anestezije korisnik može vidjeti otkucaje srca zebrice. Pri punkciji srca klip šprice treba biti blago napet. Izvađene količine krvi kreću se od 20 do 40 mikrolitara. Nakon punkcije srca smjesu krvi i pufera potrebno je staviti u ispitnu epruvetu. Plazma se odvaja od krvi centrifugiranjem (20 minuta; 5 000 g) i do analize čuva na – 80 °C. Postupak 3.C: SOP: Zebrica, homogenizacija glave i repa
Dodatak 7. UZORCI S POJAČANOM RAZINOM VITELOGENINA I REFERENTNI STANDARD MEĐU TESTOVIMA Svakog dana provođenja testova VTG-a analizirat će se uzorak s pojačanom razinom izrađen s pomoću referentnog standarda među testovima. VTG za izradu referentnog standarda među testovima bit će iz različite šarže od one za izradu standarda kalibracije za provođenje testa. Uzorak s pojačanom razinom izradit će se dodavanjem poznate količine standarda među testovima uzorku plazme kontrolnih mužjaka. Uzorak se pojačava radi postizanja koncentracije VTG-a koja je od 10 do 100 puta veća od očekivane koncentracije vitelogenina u kontrolnih mužjaka riba. Uzorak plazme kontrolnih mužjaka koji se pojačava može potjecati od jedne ribe ili nekoliko riba. Poduzorak nepojačane plazme kontrolnih mužjaka analizirat će se u najmanje dva dvostruka bunarića. I pojačani uzorak analizirat će se u najmanje dva dvostruka bunarića. Srednja količina vitelogenina iz dva nepojačana uzorka plazme kontrolnih mužjaka dodat će se izračunanoj količini VTG-a koja je dodana uzorcima s pojačanom razinom; na taj se način određuje očekivana koncentracija. Omjer te očekivane i izmjerene koncentracije bilježit će se uz rezultate svakog kompleta testova provedenog tog dana. Dodatak 8. GRAFIKON ODLUKE ZA STATISTIČKU ANALIZU 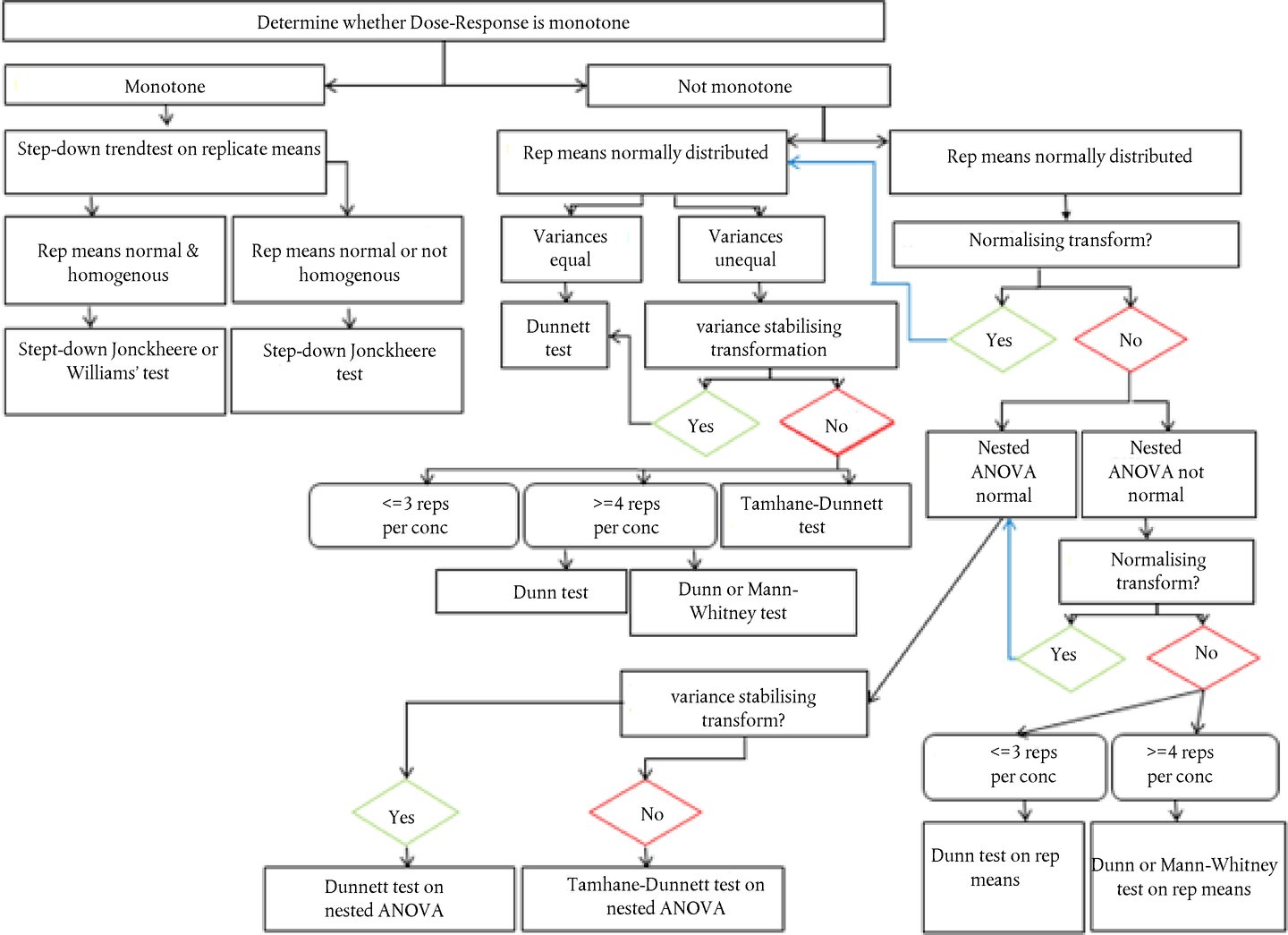
C.49. Ispitivanje akutne toksičnosti na ribljim embrijima UVOD
NAČELO ISPITIVANJA
POČETNA RAZMATRANJA
VALJANOST ISPITIVANJA
OPIS METODE
Oprema
Ispitne komore
Voda i ispitni uvjeti
Ispitne otopine
Držanje uzgojnih riba
Ispitivanje osposobljenosti
Dobivanje jajašaca
Razlikovanje jajašaca
POSTUPAK Uvjeti izlaganja
Ispitne koncentracije
Kontrole
Početak izlaganja i trajanje ispitivanja
Raspodjela jajašaca u ploče s 24 bunarića
Zapažanja
Analitička mjerenja
ISPITIVANJE GRANIČNE KONCENTRACIJE
PODACI I IZVJEŠĆIVANJE Obrada rezultata
Izvješće o ispitivanju
LITERATURA
Dodatak 1. DEFINICIJE Apikalna krajnja točka : uzrokuje učinke na razini populacije. Blastula : stanična formacija oko animalnog pola koja obuhvaća određeni dio žumanjka. Kemikalija : tvar ili smjesa. Epibolija : veliko umnožavanje pretežno epidermalnih stanica u fazi gastrulacije embrija i njihovo premještanje s dorzalne na ventralnu stranu, čime se entodermalni slojevi stanica uvlače u procesu sličnom invaginaciji i žumanjak se ugrađuje u embrij. Protočno ispitivanje : test sa stalnim protokom ispitne otopine kroz ispitni sustav za vrijeme izlaganja. Kontrola unutar ploče : unutarnja kontrola koja se sastoji od 4 bunarića napunjena vodom za razrjeđivanje po ploči s 24 bunarića radi utvrđivanja moguće kontaminacije ploča koju prouzroči proizvođač ili istraživač tijekom postupka i svih učinaka na ploču koji mogu utjecati na rezultat ispitivanja (npr. promjena temperature). IUPAC : Međunarodna unija za čistu i primijenjenu kemiju Voda za držanje : voda u kojoj se drže odrasle ribe. Medijan smrtonosne koncentracije (LC50) : koncentracija ispitivane kemikalije koja je procijenjena kao smrtonosna za 50 % ispitnih organizama za vrijeme ispitivanja. Polustatičko ispitivanje s obnavljanjem : ispitivanje s redovitim obnavljanjem ispitne otopine nakon određenih razdoblja (npr. svaka 24 sata). SMILES : Simplified Molecular Input Line Entry Specification Somit : u embriju kralježnjaka koji se razvija somiti su nakupine mezoderma raspoređene na lateralnom dijelu neuralne cijevi iz kojih se s vremenom razvijaju dermis (dermatom), skeletni mišići (miotom) i kralješci (sklerotom). Statičko ispitivanje : ispitivanje u kojem ispitne otopine ostaju nepromijenjene tijekom cijelog ispitivanja. Ispitivana kemikalija : bilo koja tvar ili smjesa koja se ispituje ovom ispitnom metodom. UVCB : tvari nepoznatog ili promjenjivog sastava, složeni reakcijski proizvodi i biološki materijali. Dodatak 2. DRŽANJE, UZGOJ I TIPIČNI UVJETI ZA ISPITIVANJA AKUTNE TOKSIČNOSTI NA EMBRIJIMA ZEBRICA
Dodatak 3. NORMALAN RAZVOJ ZEBRICE PRI TEMPERATURI OD 26 °C 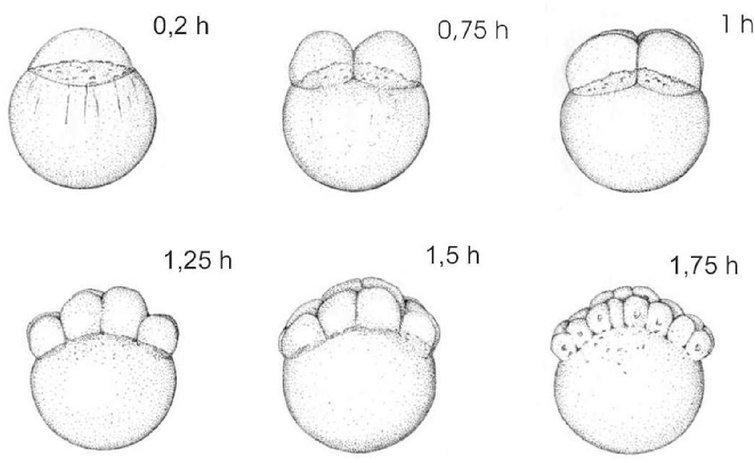
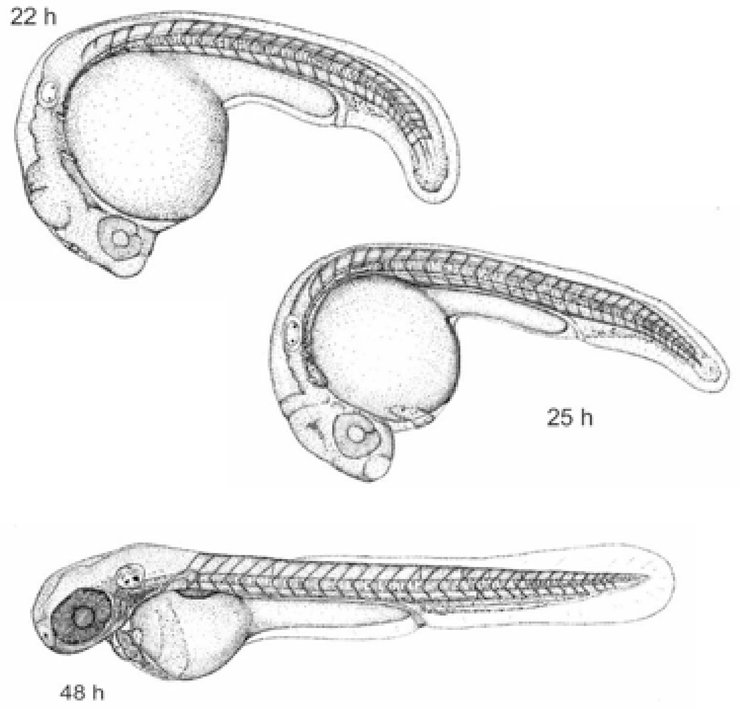
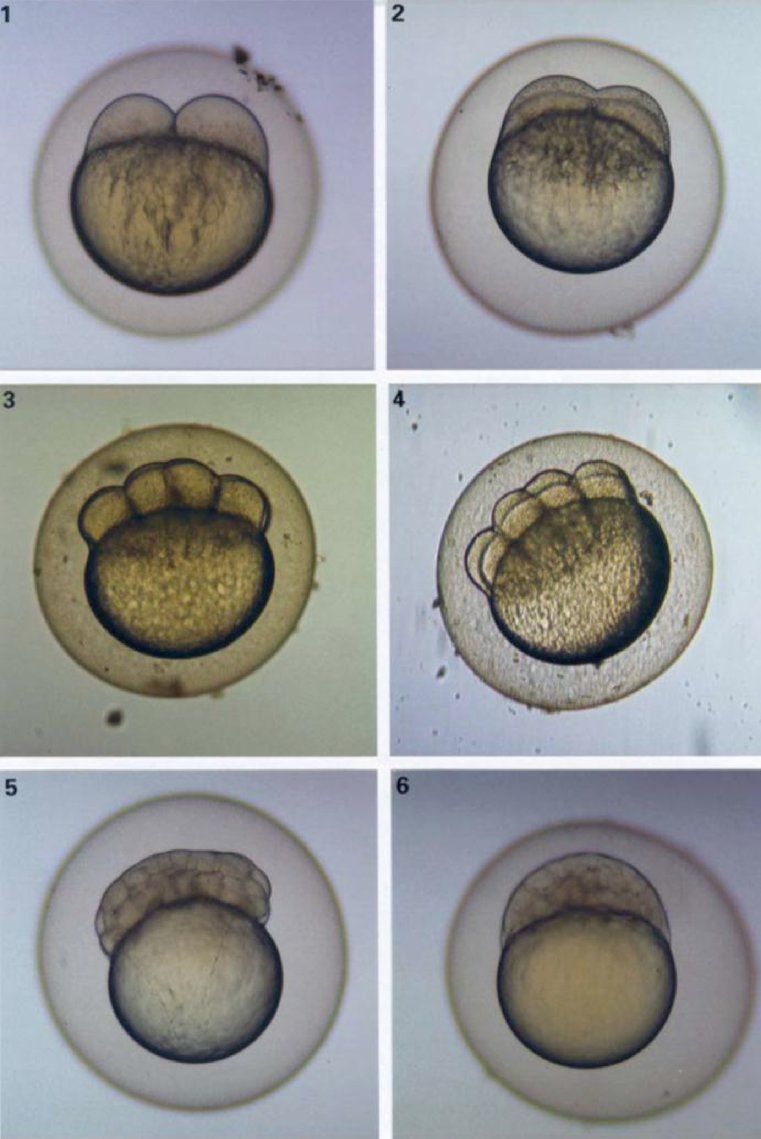
Dodatak 4. Slika 1. Nacrt ploča s 24 bunarića 
Slika 2. Nacrt postupka ispitivanja akutne toksičnosti na embrijima zebrica (slijeva nadesno): proizvodnja jajašaca, sakupljanje jajašaca, prethodno izlaganje u staklenim posudama odmah nakon oplodnje, odabir oplođenih jajašaca s pomoću invertnog mikroskopa i/ili binokularnog mikroskopa i raspodjela oplođenih jajašaca u pripremljene ploče s 24 bunarića s odgovarajućim ispitnim koncentracijama / kontrolama; n = broj jajašaca potrebnih po ispitnoj koncentraciji / kontroli (ovdje 20), hpf = sati nakon oplodnje. 
Dodatak 5. PRIKAZ SMRTNIH KRAJNJIH TOČAKA ZA ISPITIVANJE AKUTNE TOKSIČNOSTI NA EMBRIJIMA ZEBRICA Sljedeće apikalne krajnje točke znak su akutne toksičnosti te, posljedično, smrti embrija: koagulacija embrija, neodvajanje repa, izostanak formiranja somita i izostanak otkucaja srca. Sljedeće mikrofotografije odabrane su za ilustraciju tih krajnjih točaka. Slika 1. Koagulacija embrija 
Pri promatranju uz jako osvjetljenje polja na koaguliranim embrijima zebrica vidljiv je niz neprozirnih nakupina. Slika 2. Izostanak formiranja somita 
Unatoč kašnjenju u razvoju za otprilike 10 sati, u embrija zebrice starog 24 sata na slici a) vide se dobro razvijeni somiti (→), dok u embrija na slici b) nema nikakvog znaka formiranja somita (→). Unatoč velikom edemu žumanjčane vrećice (*), u embrija zebrice starog 48 sati na slici c) dobro se vide formirani somiti (→), dok u embrija zebrice starog 96 sati na slici d) nema nikakvog znaka formiranja somita (→). U embrija na slici d) zamjetni su i zakrivljenost kralježnice (skolioza) i perikardijalni edem (*). Slika 3. Neodvajanje korijena repa u bočnom prikazu 
Slika 4. Izostanak otkucaja srca 
Izostanak otkucaja srca po definiciji je teško pokazati na mikrofotografiji. Na izostanak otkucaja srca upućuje nekontrahirano srce (dvostruka strelica). Nepomičnost krvnih stanica u npr. trbušnoj aorti (→ u isječku) nije pokazatelj izostanka otkucaja srca. Zamjetan je i izostanak formiranja somita u ovog embrija (*, homogen umjesto segmentiranog izgleda mišićnog tkiva). Da bi se zabilježio izostanak otkucaja srca, embrije je potrebno promatrati najmanje jednu minutu pod povećanjem od najmanje 80 puta. C.50. Ispitivanje toksičnosti na klasastom krocnju (Myriophyllum spicatum) u sustavu bez sedimenta UVOD
NAČELO ISPITIVANJA
PODACI O ISPITIVANOJ KEMIKALIJI
VALJANOST ISPITIVANJA
REFERENTNA KEMIKALIJA
OPIS METODE Oprema
Ispitni organizam
Uzgoj kulture
Ispitni medij
Ispitne otopine
Ispitne i kontrolne skupine
Izlaganje
Ispitni uvjeti
Trajanje
Mjerenja i analitička određivanja
Učestalost mjerenja i analitičkih određivanja
Ispitivanje granične koncentracije
PODACI I IZVJEŠĆIVANJE Varijable odgovora
Prosječna specifična brzina rasta
Prirast
Vrijeme udvostručenja
Prikaz krivulja koncentracija-odgovor
Procjena ECx
Statistički postupci
Izvješćivanje
LITERATURA
Dodatak 1. DEFINICIJE
Dodatak 2. MODIFICIRANI ANDREWSOV MEDIJ ZA OSNOVNU KULTURU I PRETKULTURU Modificirani Andrewsov medij potreban za osnovnu kulturu i pretkulturu pripravlja se od pet odvojeno pripremljenih hranjivih matičnih otopina s dodatkom 3 % saharoze. Tablica 1. Sastav Andrewsove hranjive otopine: (ASTM-ov standard E 1913-04)
Matične otopine mogu se čuvati u hladnjaku šest mjeseci (na 5 – 10 °C). Samo matična otopina 5 ima kraći rok trajanja (dva mjeseca). Tablica 2. Pripravljanje matične otopine 3.1 za pripremu matične otopine 3
Nakon što je matična otopina 3.1 pripravljena (tablica 2.), ona se zamrzava u alikvotima od približno 11 ml (na najmanje – 18 °C). Duboko smrznute doze otopine imaju rok trajanja od pet godina. Da bi se pripravila matična otopina 3, treba odmrznuti matičnu otopinu 3.1, uliti 10 ml te otopine u odmjernu tikvicu od 1 l i dodati ultra čistu vodu do oznake na tikvici. Za dobivanje modificiranog Andrewsova medija treba uliti približno 2500 ml ultra čiste vode u odmjernu tikvicu od 5 l. Nakon dodavanja po 50 ml svake matične otopine, 90 % odmjerne tikvice treba napuniti ultra čistom vodom i podesiti pH na 5,8. Zatim treba dodati 150 g otopljene saharoze (3 % na 5 l) te napuniti odmjernu tikvicu ultra čistom vodom do oznake. Naposljetku se hranjiva otopina ulijeva u Schottove boce od 1 l i tretira u autoklavu na 121 °C 20 minuta. Tako dobivena hranjiva otopina može ostati sterilna u hladnjaku (na 5 – 10 °C) tri mjeseca. Modificirani Andrewsov medij za ispitivanje toksičnosti u sustavu bez sedimenta Deseterostruko koncentrirani modificirani Andrewsov medij koji je potreban za dobivanje ispitnih otopina pripravlja se od pet odvojeno pripremljenih hranjivih matičnih otopina iz tablica 1. i 2. s dodatkom 30 % saharoze. Za dobivanje takvog medija treba uliti približno 100 ml ultra čiste vode u odmjernu tikvicu od 1 l. Nakon dodavanja po 100 ml svake matične otopine treba podesiti pH na 5,8. Zatim treba dodati 30 % otopljene saharoze (300 g na 1 000 ml) te napuniti odmjernu tikvicu ultra čistom vodom do oznake. Naposljetku se hranjiva otopina ulijeva u Schottove boce od 0,5 l i tretira u autoklavu na 121 °C 20 minuta. Tako dobivena deseterostruko koncentrirana hranjiva otopina može ostati sterilna u hladnjaku (na 5 – 10 °C) tri mjeseca. Dodatak 3. DRŽANJE OSNOVNE KULTURE U ovom Dodatku opisuje se osnovna kultura klasastog krocnja – Myriophyllum spicatum L (103), podvodne vodene dvosupnice, vrste iz porodice krocanja. Između lipnja i kolovoza njezini sitni ružičasto-bijeli cvjetići izlaze iznad površine vode. Biljke su ukorijenjene u tlu sustavom čvrstih rizoma. Mogu se pronaći u cijeloj sjevernoj hemisferi u eutrofičnim, no neonečišćenim vodama stajaćicama bogatijima kalcijem i s muljevitim supstratom. Klasasti krocanj bolje uspijeva u slatkim vodama, no može se pronaći i u bočatim vodama. Za osnovnu kulturu u sustavu bez sedimenta u laboratorijskim uvjetima potrebne su sterilne biljke. Sterilne biljke mogu se nabaviti iz ekotoksikološkog laboratorija njemačke Savezne agencije za okoliš (Umweltbundesamt). Alternativno, ispitni organizmi mogu se pripremiti od nesterilnih biljaka u skladu s ASTM-ovim standardom E 1913-04. Vidjeti u nastavku: ulomak iz ASTM-ova Standardnog vodiča – postupak za uzgoj kulture Myriophyllum sibiricum prikupljene u prirodi: ‚Ako se počinje raditi s nesterilnim biljkama Myriophyllum sibiricum prikupljenima u prirodi, treba prikupljati njihove pupove (turione) u jesen. Pupove treba staviti u akvarije od 20 l koji sadržavaju 5 cm sterilnog sedimenta prekrivenog silikatnim pijeskom ili primjerice materijalom Turface® i 18 l vode odgovarajuće čistoće. Akvariji se prozračuju i drže na temperaturi od 15 °C s brzinom protoka od 200 do 300 μmol m– 2 s– 1 16 sati dnevno. Biljne kulture u akvariju mogu se držati kao rezervni izvor biljaka u slučaju da sterilne biljne kulture budu uništene zbog mehaničkih neispravnosti u odjeljku za uzgoj kulture, zbog kontaminacije, ili iz drugih razloga. Biljke koje se uzgajaju u akvariju nisu sterilne i sterilne kulture ne mogu se držati u šaržnom sustavu za uzgoj kultura. Za sterilizaciju kulture biljke se uklanjaju iz akvarija i ispiru u tekućoj deioniziranoj vodi oko pola sata. Zatim se dezinficiraju u aseptičkim uvjetima u komorama sa laminarnim protokom zraka manje od 20 minuta (dok većina biljnog tkiva ne izbijeli i samo vrh koji raste ostane zelen) u otopini s masenim udjelom natrijeva hipoklorita od 3 % i s 0,01 % odgovarajuće površinski aktivne tvari. Dezinfekcijsko sredstvo i biljni materijal se miješaju. Segmenti s više nodija prenose se u sterilne epruvete za uzgoj kultura koje sadržavaju po 45 ml steriliziranoga modificiranog Andrewsova medija i začepljene su jednostavnim čepovima za epruvete. U svaku ispitnu komoru stavlja se samo jedan biljni segment. Na posude za uzgoj kultura nanosi se laboratorijski film za brtvljenje. Kad se uspostavi sterilna kultura, biljne segmente koji sadržavaju više nodija treba prenositi u nove ispitne komore sa svježim tekućim hranjivim medijima svakih deset do dvanaest dana. Biljke moraju biti sterilne, što se dokazuje uzgojem kultura na agarnim podlogama, i ostati sterilne osam tjedana prije početka ispitivanja.’ Budući da modificirani Andrewsov medij sadržava saharozu (koja potiče rast gljivica i bakterija), potrebni su sterilni uvjeti za pripremu materijala, držanje otopina i uzgoj kultura. Sve tekućine i oprema steriliziraju se prije upotrebe. Sterilizacija se provodi tretiranjem zagrijanim zrakom (210 °C) 4 sata ili tretiranjem u autoklavu 20 minuta na 121 °C. Usto, sve tikvice, zdjelice, zdjele i ostala oprema tretiraju se plamenom na sterilnoj radnoj površini neposredno prije upotrebe. Osnovne se kulture mogu držati na slabijoj svjetlosti i nižoj temperaturi (50 μE m– 2 s– 1, 20 ± 2 °C) duže vrijeme bez premještanja. Uzgojni medij za krocanj trebao bi biti isti kao onaj koji se upotrebljava za ispitivanje, ali i drugi mediji bogati hranjivim tvarima mogu se upotrebljavati za osnovne kulture. Biljni segmenti raspoređuju se aksenično u nekoliko Erlenmeyerovih tikvica od 500 ml ili/i Fernbachovih tikvica od 2 000 ml, od kojih je svaka napunjena s približno 450 odnosno 1 000 ml modificiranog Andrewsova medija. Zatim se tikvice zatvaraju aksenično celuloznim čepom. Osim toga, apsolutno je nužno temeljito tretirati opremu plamenom na sterilnoj radnoj površini neposredno prije upotrebe. Biljke treba prenositi u svježu hranjivu otopinu otprilike svaka tri tjedna, ovisno o njihovu broju i njihovoj veličini. Za tu obnovljenu kulturu mogu se upotrebljavati i apeksi i segmenti srednjeg dijela stabljike. Broj i veličina biljaka (ili segmenata biljaka) koje se prenose ovise o tome koliko je biljaka potrebno. Na primjer, može se prenijeti pet dijelova izdanka u Fernbachovu tikvicu, a tri dijela u Erlenmeyerovu tikvicu; svaki je dio dug 5 cm. Odbacuju se svi dijelovi s korijenima ili cvjetovima, mrtvi dijelovi te oni s neobičnim značajkama. Slika 1. Rezanje biljaka za osnovnu kulturu i pretkulturu nakon tri tjedana uzgoja. 
Kulture biljaka treba uzgajati u Erlenmeyerovim tikvicama od 500 ml i Fernbachovim tikvicama od 2 000 ml u inkubatoru s hlađenjem na 20 ± 2 °C sa stalnom svjetlošću od otprilike 100 – 150 μE m– 2 s– 1 ili 6 000 – 9 000 lux (iz izvora sobne rasvjete boje ‚toplo bijelo svjetlo’). Slika 2. Uzgoj biljaka u inkubatoru s hlađenjem sa sobnom rasvjetom. 
Upotrebljavaju se kemijski čiste (kiselinom očišćene) i sterilne staklene uzgojne posude, a pri rukovanju se primjenjuju aseptički postupci. U slučaju onečišćenja osnovne kulture npr. algama, gljivicama i/ili bakterijama, treba pripremiti novu kulturu ili upotrijebiti osnovnu kulturu iz drugog laboratorija za obnovu kulture. Dodatak 4. DRŽANJE PRETKULTURE I PRIPREMA ORGANIZAMA ZA ISPITIVANJE Za dobivanje pretkultura treba izrezati izdanke osnovne kulture u segmente od kojih svaki ima dva pršljena; segmenti se stavljaju u Fernbachove tikvice napunjene modificiranim Andrewsovim medijem (s 3 % saharoze). Svaka tikvica može sadržavati do 50 segmenata izdanka. Ipak, treba paziti da su segmenti vitalni i da nemaju korijenje ni bočne grane ili njihove pupoljke (vidjeti sliku 1. u Dodatku 3.). Organizmi pretkulture uzgajaju se 14 dana – 21 dan u sterilnim uvjetima u komori s izmjeničnim fazama svjetlost/tama od 16/8 sati. Intenzitet svjetlosti odabire se u rasponu 100 – 150 μE m– 2 s– 1. Temperatura u ispitnim posudama trebala bi biti 23 ± 2 °C. Budući da modificirani Andrewsov medij sadržava saharozu (koja potiče rast alga, gljivica i bakterija), potrebni su sterilni uvjeti za pripremu otopina ispitivane kemikalije i uzgoj kultura. Sve tekućine i oprema steriliziraju se prije upotrebe. Sterilizacija se provodi tretiranjem zagrijanim zrakom (210 °C) 4 sata ili tretiranjem u autoklavu 20 minuta na 121 °C. Usto, sve tikvice, zdjelice, zdjele i ostala oprema tretiraju se plamenom na sterilnoj radnoj površini neposredno prije upotrebe. Izdanci se aksenično uklanjaju iz tikvica s pretkulturama, pri čemu se bira što homogeniji materijal. Za svako ispitivanje potrebno je najmanje 60 ispitnih organizama (ispitivanje s osam koncentracija ispitivane kemikalije). Za ispitivanje se uzimaju svježe bočne grane iz pretkultura, skraćuju se na 2,5 cm od baze (mjerenje pomičnim mjerilom) i prenose u čašu sa sterilnim modificiranim Andrewsovim medijem. Te svježe bočne grane mogu se upotrijebiti za ispitivanje toksičnosti klasastog krocnja u sustavu bez sedimenta. Slika 2. Rezanje biljaka iz pretkulture za ispitivanje toksičnosti na Myriophyllum spicatum u sustavu bez sedimenta. 
C.51. Ispitivanje toksičnosti na klasastom krocnju (Myriophyllum spicatum) u sustavu voda-sediment UVOD
NAČELO ISPITIVANJA
PODACI O ISPITIVANOJ KEMIKALIJI
VALJANOST ISPITIVANJA
REFERENTNA KEMIKALIJA
OPIS METODE Ispitna oprema
Ispitni organizam
Uzgoj kulture ispitnog organizma
Sediment
Ispitni medij
Plan ispitivanja
Koncentracije kemikalije i kontrolne skupine
Ispitivanje granične koncentracije
Ispitne otopine
ISPITNI POSTUPAK
Faza uspostave kulture
Odabir jednolikog biljnog materijala
Izlaganje u vodenoj fazi
Izlaganje u sedimentu
Održavanje razine vode tijekom ispitivanja
Ispitni uvjeti
Trajanje ispitivanja
Mjerenja i analitička određivanja
Učestalost mjerenja i analitičkih određivanja
Analitička mjerenja ispitivane kemikalije
PROCJENA PODATAKA
Varijable odgovora
Prosječna specifična brzina rasta
Prirast
Prikaz krivulja koncentracija-odgovor
Procjena ECx
Statistički postupci
IZVJEŠĆIVANJE
LITERATURA
Dodatak 1. SASTAV SMARTOVA I BARKOVA MEDIJA
Dodatak 2. DEFINICIJE
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(1) Nije dostupna vrijednost za 20 °C, ali se može pretpostaviti da je varijabilnost rezultata mjerenja veća od očekivane temperaturne ovisnosti
(2) Uredba (EZ) br. 1907/2006 Europskog parlamenta i Vijeća od 18. prosinca 2006. o registraciji, evaluaciji, autorizaciji i ograničavanju kemikalija (REACH) i osnivanju Europske agencije za kemikalije te o izmjeni Direktive 1999/45/EZ i stavljanju izvan snage Uredbe Vijeća (EEZ) br. 793/93 i Uredbe Komisije (EZ) br. 1488/94 kao i Direktive Vijeća 76/769/EEZ i direktiva Komisije 91/155/EEZ, 93/67/EEZ, 93/105/EZ i 2000/21/EZ. OJ L 304, 22.11.2007., str. 1.
(3) The US Interagency Coordinating Committee on the Validation of Alternative Methods (Međuagencijski koordinacijski odbor SAD-a za validaciju alternativnih metoda)
(*1) Područje zamućenosti rožnice treba zabilježiti.
(4) Za primjenu integrirane strategije ispitivanja nadražujućeg djelovanja tvari na oči u skladu s Uredbom REACH vidjeti i ECHA-ine Smjernice o zahtjevima obavješćivanja i procjeni kemijske sigurnosti, poglavlje R.7a: Smjernice o pojedinim krajnjim točkama http://echa.europa.eu/documents/10162/13632/information_requirements_r7a_en.pdf
(5) Statističari koji primjenjuju model poput općih linearnih modela (GLM – General Linear Models) mogu provoditi analizu na drukčiji, ali usporediv način, no rezultat neće nužno biti tradicionalna tablica ANOVA koja datira iz vremena algoritamskih pristupa statističkim izračunima razvijenih u predinformatičko doba.
(6) Statističari koji primjenjuju model poput općih linearnih modela (GLM – General Linear Models) mogu provoditi analizu na drukčiji, ali usporediv način, no rezultat neće nužno biti tradicionalna tablica ANOVA koja datira iz vremena algoritamskih pristupa statističkim izračunima razvijenih u predinformatičko doba.
(7) Uredba (EZ) br. 1272/2008 Europskog parlamenta i Vijeća od 16. prosinca 2008. o razvrstavanju, označivanju i pakiranju tvari i smjesa, o izmjeni i stavljanju izvan snage Direktive 67/548/EEZ i Direktive 1999/45/EZ te o izmjeni Uredbe (EZ) br. 1907/2006, SL L 353, 31.12.2008, str. 1.
(8) Za svaku ispitivanu kemikaliju određen je kemijski razred uz primjenu standardne sheme razvrstavanja na temelju sustava razvrstavanja Nacionalne knjižnice oznaka medicinskog nazivlja (MeSH) (dostupno na http//www.nlm.nih.gov/mesh).
(9) Na temelju rezultata in vivo ispitivanja na oku kunića (OECD TG 405) (17.) i uz primjenu sustava UN GHS (4.).
(10) Razvrstavanje u kategorije 2.A i 2.B ovisi o tumačenju kriterija sustava UN GHS za razlikovanje tih dviju kategorija, odnosno je li za razvrstavanje u kategoriju 2.A potrebno da jedna od triju životinja ili dvije od triju životinja imaju učinke sedmog dana. In vivo istraživanje uključivalo je tri životinje. Osim crvenila konjunktive kod jedne životinje, sve su krajnje točke ponovno imale vrijednost nula do sedmog dana ili ranije. Jedna životinja koja se nije potpuno oporavila do sedmog dana imala je vrijednost crvenila konjunktive 1 (sedmog dana), a potpuno se oporavila desetog dana.
(11) Navedene dimenzije temelje se na držaču rožnice koji se upotrebljava za krave u dobi od 12 do 60 mjeseci. Ako se upotrebljavaju životinje u dobi od šest do 12 mjeseci, držač bi umjesto toga trebalo konstruirati tako da svaka komora ima zapreminu od 4 ml i da svaka unutarnja komora ima promjer od 1,5 cm i dubinu od 2,2 cm. Kod svakog novokonstruiranog držača rožnice vrlo je važno da bi omjer izložene površine rožnice i zapremine stražnje komore trebao biti jednak omjeru kao kod tradicionalnog držača rožnice. To je nužno kako bi se osiguralo točno utvrđivanje vrijednosti propusnosti za izračun IVIS-a na temelju predložene formule.
(12) Uredba (EZ) br. 1272/2008 Europskog parlamenta i Vijeća od 16. prosinca 2008. o razvrstavanju, označivanju i pakiranju tvari i smjesa, o izmjeni i stavljanju izvan snage Direktive 67/548/EEZ i Direktive 1999/45/EZ te o izmjeni Uredbe (EZ) br. 1907/2006, SL L 353, 31.12.2008, str. 1.
(*2) Najveća srednja vrijednost zapažena u bilo kojoj vremenskoj točki.
(*3) Maksimalna srednja vrijednost zapažena u bilo kojoj vremenskoj točki (na temelju vrijednosti zamućenja definiranih u tablici 1.).
(*4) Na temelju vrijednosti definiranih u tablici 2.
(*5) Kombinacije koje se rjeđe javljaju.
(13) Za svaku ispitivanu kemikaliju određeni su kemijski razredi uz primjenu standardne sheme razvrstavanja na temelju sustava razvrstavanja Nacionalne knjižnice oznaka medicinskog nazivlja (MeSH) (dostupno na adresi http//www.nlm.nih.gov/mesh).
(14) Na temelju rezultata in vivo ispitivanja na oku kunića (OECD TG 405) i uz primjenu sustava UN GHS (4. i 6.).
(15) Na temelju rezultata ICE ispitne metode kako je opisano u tablici 6.
(16) Kombinacija vrijednosti iz ICE ispitne metode osim onih opisanih u tablici 6. za utvrđivanje da je kemikalija izvan kategorije prema sustavu GHS i da je razvrstana u kategoriju 1. sustava GHS (vidjeti tablicu 6.).
(17) Razvrstavanje u kategorije 2.A i 2.B ovisi o tumačenju kriterija sustava UN GHS za razlikovanje tih dviju kategorija, odnosno je li za razvrstavanje u kategoriju 2.A potrebno da jedna od triju životinja ili dvije od triju životinja imaju učinke sedmog dana. In vivo istraživanje uključivalo je tri životinje. Osim crvenila konjunktive kod jedne životinje sve su krajnje točke ponovno imale vrijednost nula do sedmog dana ili ranije. Jedna životinja koja se nije potpuno oporavila do sedmog dana imala je vrijednost crvenila konjunktive 1 (sedmog dana), a potpuno se oporavila desetog dana.
(18) Uredba (EZ) br. 1272/2008 Europskog parlamenta i Vijeća od 16. prosinca 2008. o razvrstavanju, označivanju i pakiranju tvari i smjesa, o izmjeni i stavljanju izvan snage Direktive 67/548/EEZ i Direktive 1999/45/EZ te o izmjeni Uredbe (EZ) br. 1907/2006, SL L 353, 31.12.2008, str. 1.
(19) U cijelom ovom dokumentu pojam ‚srednja vrijednost’ znači aritmetička sredina.
(20) Brojevi se odnose na statistički dobivene granične vrijednosti i nisu povezani s preciznošću mjerenja.
(21) Predviđanje na temelju metode DPRA trebalo bi razmatrati u okviru IATA-e te u skladu s odredbama stavaka 9. i 12.
(22) Brojevi se odnose na statistički dobivene granične vrijednosti i nisu povezani s preciznošću mjerenja.
(23) Predviđanje na temelju metode DPRA trebalo bi razmatrati u okviru IATA-e te u skladu s odredbama stavaka 9. i 12.
(24) Predviđanja opasnosti (i jakosti) in vivo temelje se na podacima dobivenima s pomoću metode LLNA (19.). Jakost in vivo utvrđena je prema kriterijima koje je predložio ECETOC (23.).
(25) Predviđanje na temelju metode DPRA trebalo bi razmatrati u okviru IATA-e te u skladu s odredbama stavaka 9. i 11.
(26) Rasponi određeni na temelju najmanje deset vrijednosti potrošnje dobivenih u šest neovisnih laboratorija.
(27) Uredba (EZ) br. 1272/2008 Europskog parlamenta i Vijeća od 16. prosinca 2008. o razvrstavanju, označivanju i pakiranju tvari i smjesa, o izmjeni i stavljanju izvan snage Direktive 67/548/EEZ i Direktive 1999/45/EZ te o izmjeni Uredbe (EZ) br. 1907/2006, SL L 353, 31.12.2008, str. 1.
(28) Predviđanja opasnosti (i jakosti) in vivo temelje se na podacima dobivenima s pomoću metode LLNA (13.). Jakost in vivo utvrđena je prema kriterijima koje je predložio ECETOC (24.).
(29) Predviđanje na temelju testa KeratinoSensTM trebalo bi razmatrati u okviru IATA-e te u skladu s odredbama stavaka 9. i 11. ove ispitne metode.
(30) Na temelju vrijednosti zapaženih u prijašnjim ispitivanjima (12.).
(31) Uredba (EZ) br. 1272/2008 Europskog parlamenta i Vijeća od 16. prosinca 2008. o razvrstavanju, označivanju i pakiranju tvari i smjesa, o izmjeni i stavljanju izvan snage Direktive 67/548/EEZ i Direktive 1999/45/EZ te o izmjeni Uredbe (EZ) br. 1907/2006, SL L 353, 31.12.2008, str. 1.
(32) Za svaku ispitivanu kemikaliju određeni su kemijski razredi uz primjenu standardne sheme razvrstavanja na temelju sustava razvrstavanja Nacionalne knjižnice oznaka medicinskog nazivlja (MeSH) (dostupno na adresi http//www.nlm.nih.gov/mesh).
(33) Na temelju rezultata in vivo ispitivanja na oku kunića (smjernica OECD-a za ispitivanje (TG) 405, ispitna metoda B.5.) i primjenom sustava UN GHS i Uredbe EU-a o CLP-u.
(34) Na temelju rezultata dobivenih s pomoću testa FL (protokol INVITTOX br. 71 (6)).
(35) Statističari koji primjenjuju model poput općih linearnih modela (GLM – General Linear Models) mogu provoditi analizu na drukčiji, ali usporediv način, no rezultat neće nužno biti tradicionalna tablica ANOVA koja datira iz vremena algoritamskih pristupa statističkim izračunima razvijenih u predinformatičko doba.
(36) Definicije i jedinice navedene su u Dodatku 1.
(37) Ponekad označena oznakom P OW; utvrđuje se metodom protresanja tikvice u ispitnoj metodi A.8. (4.), metodom HPLC u ispitnoj metodi A.24. (5.) i metodom sporog miješanja u ispitnoj metodi A.23. (6.). Tehnika generatorskih kolona ponekad se upotrebljava za utvrđivanje vrijednosti log KOW. Dostupan je ograničen broj studija u kojima je upotrijebljena ta tehnika, prije svega za klorirane bifenile i dibenzodioksine (npr. Li i Doucette, 1993.) (3.). Za tvari koje mogu ionizirati, vrijednost log K OW trebala bi se odnositi na neionizirani oblik.
(38) Definicije i jedinice navedene su u Dodatku 1.
(39) TLC: tankoslojna kromatografija; HPLC: visokotlačna tekućinska kromatografija; GC: plinska kromatografija
(40) U određenim bi regulatornim okvirima mogla biti moguća obveza analize metabolita ako su ispunjeni određeni uvjeti (vidjeti stavak 65.).
(41) Općenito bi izmjerene koncentracije u vodi tijekom faze apsorpcije trebale biti barem za jedan red veličine iznad ograničenja kvantifikacije kako bi se u fazi izlučivanja u okviru ispitivanja moglo izmjeriti više od jednog poluvijeka tjelesnog opterećenja.
(42) Definicije i jedinice navedene su u Dodatku 1.
(43) Kod većine ispitivanih tvari u idealnim uvjetima ne bi trebalo doći do detekcije u kontrolnoj vodi. Pozadinske koncentracije trebale bi biti relevantne samo za prirodno nastale materijale (npr. određene metale) i tvari koje su sveprisutne u okolišu.
(44) Ako je očito da opaženo ne slijedi kinetiku prvog reda, treba primijeniti složenije metode (vidjeti literaturu u Dodatku 5.) i potražiti savjet biostatističara.
(45) Apsorpcija može biti ograničena niskom koncentracijom izlaganja zbog niske topljivosti u vodi u ispitivanju biokoncentracije, dok je daleko više koncentracije pri izlaganju moguće postići ispitivanjem kroz hranu.
(46) Kad je riječ o tvarima s više sastojaka, UVCB-ovima i smjesama, trebalo bi razmotriti topljivost u vodi svakog relevantnog sastojka radi utvrđivanja odgovarajućih koncentracija pri izlaganju.
(47) TOC uključuje organski ugljik iz čestica i otopljenog organskog ugljika, odnosno TOC = POC + DOC.
(48) Iako se to uglavnom ne preporučuje, ako se upotrebljava otapalo ili otapajuće sredstvo, organski ugljik koji proizlazi iz tog sredstva trebalo bi dodati organskom ugljiku iz ispitivane tvari radi procjene koncentracije organskog ugljika u ispitnim posudama.
(49) Ako se sadržaj lipida ne analizira kod istih riba kao i ispitivana tvar, ribe bi trebale biti barem iste mase i (prema potrebi) istog spola.
(50) Ta je druga mogućnost moguća samo ako se ribe u svim ispitnim skupinama drži u sličnim veličinama skupine, uklanja ih se u skladu s istim obrascem i hrani na isti način. Time se osigurava da rast riba u svim ispitnim skupinama bude sličan ako je ispitna koncentracija ispod toksične razine. Ako je rast sličan, očekuje se da će i sadržaj lipida biti sličan. Različit rast u kontrolnoj skupini ukazivao bi na učinak tvari i učinio ispitivanje nevaljanim.
(51) Uz masu trebalo bi evidentirati i ukupnu dužinu jer je usporedba mjere u kojoj je došlo do povećanja dužine tijekom ispitivanja dobar pokazatelj toga je li došlo do štetnog učinka.
(52) Na konstantama brzine rasta moguće je izvršiti t-test kako bi se ispitalo razlikuje li se rast između kontrolnih i ispitnih skupina, odnosno F-test u slučaju analize varijance. Prema potrebi, moguće je upotrijebiti F-test ili test omjera vjerojatnosti radi lakšeg odabiranja odgovarajućeg modela rasta (Monografija OECD-a br. 54, literatura (32.)).
(53) U tim se postotcima podrazumijeva da su analitičke metode pouzdane i da trajanje poluvijeka iznosi < 14 dana. Ako su analitičke metode manje pouzdane ili je poluvijek (znatno) produžen, ti će brojevi porasti.
CI: interval pouzdanosti (ako ga je moguće procijeniti)
SD: standardna devijacija (ako ju je moguće procijeniti)
(56) Skraćeno bi se ispitivanje zapravo moglo upotrijebiti za dokazivanje brzog metaboliziranja kad je poznato da bi do njega moglo doći.
(57) Ako se mjere samo dvije podatkovne točke, moguće je procijeniti granice pouzdanosti za vrijednost BCFKm upotrebom metode samodopunjavanja (‚bootstrap’). Ako su dostupne i srednje podatkovne točke, granice pouzdanosti za vrijednost BCFKm moguće je izračunati kao u potpunom ispitivanju.
(58) Definicije i jedinice navedene su u Dodatku 1.
(59) Za potrebe Uredbe (EZ) br. 1907/2006 o registraciji, evaluaciji, autorizaciji i ograničavanju kemikalija (REACH) (SL L 396, 30.12.2006., str. 1.), to je pitanje uključeno u ‚Smjernice o zahtjevima obavješćivanja i procjeni kemijske sigurnosti’, poglavlja R.7c, R.7.10.3.1. i R.7.10.4.1. i slika R7.10-2.
(60) Kod većine ispitivanih tvari u idealnim uvjetima ne bi trebalo doći do detekcije u kontrolnoj vodi. Pozadinske koncentracije trebale bi biti relevantne samo za materijale koji se javljaju prirodno (npr. određene metale) i tvari koje su sveprisutne u okolišu.
(61) Budući da je BMF definiran kao omjer koncentracije tvari u organizmu u odnosu na koncentraciju u hrani kojom se hrani organizam pri stabilnom stanju, lipide se uzima u obzir ispravljanjem vrijednosti u odnosu na sadržaj lipida u organizmu i u hrani te se stoga točnije opisuje kao ‚ispravljanje’. Taj se pristup razlikuje od ‚normiranja’ na određeni sadržaj lipida u organizmu koji se primjenjuje u ispitivanju biokoncentracije vodenim izlaganjem.
(62) Tijekom ispitivanja trebalo bi evidentirati i ukupnu dužinu jer je ona dobar pokazatelj toga je li došlo do štetnog učinka.
(63) HCB je naveden u prilozima A i C Stockholmskoj konvenciji te u prilozima I. i III. Uredbi (EZ) br. 850/2004 o postojanim organskim onečišćujućim tvarima (SL L 158, 30.4.2004., str. 7.).
(64) Zbog brzog rasta u fazi apsorpcije stvarna brzina hranjenja bit će niža od one određene na početku izlaganja.
(65) U ispitivanju vodenim izlaganjem 14-dnevni poluvijek odgovarao bi vrijednosti BCF-a od oko 10 000 L/kg uz upotrebu ribe od 1 g, s odgovarajućom brzinom apsorpcije od oko 500 L/kg/dan (u skladu s jednadžbom Sijm et al (46)).
(66) Budući da je stvarne unutarnje koncentracije moguće utvrditi tek nakon provođenja ispitivanja, potrebno je procijeniti očekivanu unutarnju koncentraciju (npr. na temelju očekivane vrijednosti BMF-a i koncentracije u hrani; vidjeti jednadžbu A5.8 u Dodatku 5.).
(67) Zbog izlučivanja riba ili ispiranja iz hrane možda neće biti moguće u potpunosti izbjeći prisutnost ispitivane tvari u ispitnom mediju. Stoga je jedna od mogućnosti mjerenje koncentracije tvari u vodi na kraju razdoblja apsorpcije, posebno ako se upotrebljava polustatički postav, kako bi se omogućilo utvrđivanje toga je li došlo do vodenog izlaganja.
(68) Taj je pristup specifičan za ispitivanje kroz hranu, a razlikuje se od postupka koji se primjenjuje u vodenom izlaganju te je zato radi izbjegavanja zabune upotrijebljen izraz ‚ispravljanje’, a ne ‚normiranje’, vidjeti i bilješku u stavku 106.
(69) Na konstantama brzine rasta moguće je izvršiti t-test kako bi se ispitalo razlikuje li se rast između kontrolnih i ispitnih skupina, odnosno F-test u slučaju analize varijance. Prema potrebi, moguće je upotrijebiti F-test ili test omjera vjerojatnosti radi lakšeg odabiranja odgovarajućeg modela rasta (Monografija OECD-a br. 54, literatura (32.)).
(70) Tehnika analize hrane u pogledu sadržaja proteina, lipida, sirovih vlakana i pepela; te je informacije uobičajeno moguće dobiti od dobavljača hrane.
CI: interval pouzdanosti (ako ga je moguće procijeniti)
SD: standardna devijacija (ako ju je moguće procijeniti)
(73) Meyer et al. (1)
(74) Potrebno je napomenuti da je u samom testu poželjno upotrebljavati masu kao mjeru za određivanje veličine i konstante brzine rasta. Međutim, priznaje se da je duljina praktičnija mjera ako je ribe potrebno izabrati na temelju vizualnog promatranja na početku pokusa (tj. iz matične populacije).
(75) Ovaj je raspon duljina naveden u japanskom zakonu o kemikalijama: Testing Methods for New Chemical Substances etc. based on the Japan's Chemical Substances Control Law (CSCL).
(76) Vrijednosti u zagradama su količine uzoraka (vode, riba) koje treba uzeti ako se provodi dodatno uzorkovanje.
(77) Predispitna procijenjena vrijednost k 2 za tvar čiji je log K OW = 4,0 iznosi 0,652 dan– 1. Ukupno trajanje pokusa utvrđuje se na 3 × t SS = 3 × 4,6 dana, tj. 14 dana. Za procjenu t SS vidjeti Dodatak 5.
(78) Uzorak vode uzeti nakon što se dopremi količina vode koja odgovara volumenu najmanje triju ispitnih komora.
(79) Te se ribe uzorkuju iz matične populacije.
(80) Ako su potrebne veća preciznost ili studije metabolizma koje zahtijevaju više riba, te bi ribe trebalo uzorkovati posebno na kraju faze apsorpcije i faze izlučivanja (vidjeti stavak 40.).
(81) Za analizu sadržaja lipida mogu biti potrebne najmanje tri dodatne ribe ako nije moguće upotrijebiti iste one ribe koje su uzorkovane za mjerenje koncentracije tvari na početku ispitivanja, na kraju faze apsorpcije i na kraju faze izlučivanja. Potrebno je napomenuti da bi u mnogim slučajevima trebale biti dovoljne tri kontrolne ribe (vidjeti stavak 56.).
(82) Po tri uzorka iz kontrolne skupine i ispitne skupine analizira se radi utvrđivanja koncentracija ispitivane tvari i sadržaja lipida.
(83) Uzorci riba uzimaju se iz matične populacije što je moguće bliže početku ispitivanja; za utvrđivanje sadržaja lipida trebalo bi uzorkovati najmanje tri ribe iz matične populacije na početku ispitivanja.
(84) (Neobveznim) uzorkovanjem početkom faze apsorpcije dobivaju se podaci za izračun asimilacije ispitivane tvari putem hrane, koji se mogu usporediti s učinkovitošću asimilacije izračunate na temelju podataka iz faze izlučivanja.
(85) Može se uzorkovati pet dodatnih riba za analizu specifičnu za određeno tkivo.
(86) Za analizu sadržaja lipida mogu biti potrebne najmanje tri dodatne ribe ako nije moguće upotrijebiti iste one ribe koje su uzorkovane za mjerenje koncentracije tvari na početku ispitivanja, na kraju faze apsorpcije i na kraju faze izlučivanja. Potrebno je napomenuti da bi u mnogim slučajevima trebale biti dovoljne tri kontrolne ribe (vidjeti stavke 56. i 153.).
(87) Kao i kod svakog empirijskog odnosa, trebalo bi provjeriti spada li ispitivana tvar u domenu primjenjivosti odnosa.
(88) Masa ribe na kraju faze apsorpcije može se procijeniti na temelju podataka iz prijašnjeg ispitivanja ili na temelju spoznaja o tome za koliko će se kod ispitivane vrste njezina masa koju ima na početku uobičajenog ispitivanja vjerojatno povećati tijekom uobičajene faze apsorpcije (npr. 28 dana) .
(89) U većini programa koji omogućuju linearnu regresiju daju se i standardne pogreške i interval pouzdanosti procjena, npr. u programu Microsoft Excel s alatnim paketom za analizu podataka.
(90) Za razliku od metode linearne regresije, primjenom ove formule neće se dobiti standardna pogreška za k2.
(91) Za razliku od postupka linearnog prilagođavanja, primjenom ove formule obično se neće dobiti standardna pogreška ili interval pouzdanosti za k1.
(92) Treba imati na umu da se nesigurnost u procjeni k2 ne upotrebljava ispravno u bioakumulacijskom modelu ako se prije svega smatra konstantnom pri prilagođavanju k1 u metodi sekvencijskog prilagođavanja. Dobivena nesigurnost za BCF stoga će se razlikovati ovisno o tome upotrebljava li se simultana ili sekvencijska metoda prilagođavanja.
(93) U nekim je regijama možda dostupna samo hrana za ribe u kojoj je koncentracija lipida puno niža od ove gornje granice. U tim bi slučajevima ispitivanja trebalo provesti s nižom koncentracijom lipida u hrani te u skladu s tim prilagoditi brzinu hranjenja na odgovarajući način kako bi se održalo dobro zdravstveno stanje riba. Sadržaj lipida u hrani ne smije se povećavati umjetnim putem dodavanjem previše ulja.
(94) U prirodi se najveća izloženost u vodenom okolišu najčešće postiže konzumacijom kad je riječ o vrlo hidrofobnim tvarima, pa tako procijenjeni BCF nije strogo reprezentativan za bioakumulacijski potencijal takve tvari.
(95) Mogu se upotrebljavati i druge vrste dafnija pod uvjetom da su ispunjeni odgovarajući kriteriji valjanosti (kriterij valjanosti koji se odnosi na reproduktivnu uspješnost u kontrolama trebao bi biti relevantan za sve vrste). Ako se upotrebljavaju druge dafnije, one bi trebale biti jasno utvrđene, a njihova bi uporaba trebala biti opravdana.
(96) Slučajna smrtnost: smrtnost koja nije povezana s kemikalijom i koja je uzrokovana slučajnim događajem (odnosno uzrok je poznat).
(97) Nenamjerna smrtnost: smrtnost koja nije povezana s kemikalijom i kojoj nije poznat uzrok.
(*6) Navesti koja je posuda upotrijebljena za pokus.
(*7) Upisati propala legla u odgovarajuće polje kao ‚AB’.
(*8) Upisati smrtnost svih roditeljskih životinja u odgovarajuće polje kao ‚M’.
(98) Tipična minimalna srednja ukupna dužina nije kriterij valjanosti, no trebalo bi pažljivo razmotriti odstupanja ispod navedenih vrijednosti u odnosu na osjetljivost ispitivanja. Minimalna srednja ukupna dužina temelji se na odabranim podacima kojima se trenutačno raspolaže.
(99) Ovisno o soju kalifornijske pastrve koji se ispituje, možda će trebati primijeniti druge temperature. Uzgojno jato mora se držati na temperaturi jednakoj onoj koja se upotrebljava za jajašca. Nakon primitka jajašaca od komercijalnog uzgajivača potrebna je kratka prilagodba (npr. sat ili dva) na ispitnu temperaturu.
(100) Ličinke se drže u tami tjedan dana nakon valjenja, osim za vrijeme pregleda, a zatim se tijekom cijelog ispitivanja drže pod prigušenom rasvjetom (fotoperiod 12 – 16 sati). (4).
(101) U svim uvjetima ispitivanja režim svjetlosti mora biti konstantan.
(102) Za svako ispitivanje mora biti u okvirima ± 2 0/00.
(*9) Hranu treba davati do sitosti. Suvišnu hranu i izmet potrebno je po potrebi ukloniti kako bi se izbjeglo nakupljanje otpada.
|
FBS |
zamrznuti račići Artemia; odrasli račići Artemia |
|
BSN |
ličinke račića Artemia; novoizvaljene |
|
BSN48 |
ličinke račića Artemia; starost 48 sati |
(1) ličinkama sa žumanjčanom vrećicom nije potrebna hrana
(2) filtrirane iz miješane kulture
(3) granule iz procesa fermentacije
(*10) Papilarni procesi u pravilu se pojavljuju samo u odraslih mužjaka te se nalaze na šipčicama peraja od druge do sedme ili osme od stražnjeg kraja podrepne peraje (slike 1. i 2.). Međutim, procesi se rijetko nalaze na prvoj šipčici peraje od stražnjeg kraja podrepne peraje. Ovim standardnim operativnim postupkom (SOP) obuhvaćeno je mjerenje procesa na prvoj šipčici peraje (u ovom SOP-u broj šipčice peraje odnosi se na redoslijed od stražnjeg kraja podrepne peraje).
(*11) Pufer za homogenizaciju:
|
— |
(50 mM Tris-HCl pH 7,4; 1-postotni koktel inhibitora proteaze (Sigma)): 12 ml Tris-HCl pH 7,4 + 120 μl koktela inhibitora proteaze. |
|
— |
TRIS: TRIS-ULTRA PURE (ICN), primjerice proizvođača Bie & Berntsen, Danska. |
|
— |
Koktel inhibitora proteaze: proizvođača Sigma (za tkivo sisavaca), broj proizvoda P 8340. |
NAPOMENA: Pufer za homogenizaciju treba upotrijebiti na dan proizvodnje. Tijekom upotrebe držite na ledu.
(103) Carl von Linné (* 23. svibnja 1707. u Råshultu/Älmhultu; † 10. siječnja 1778. u Uppsali).
(*12) demineralizirana (tj. destilirana ili deionizirana) voda.


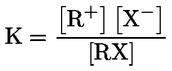
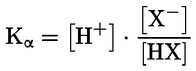
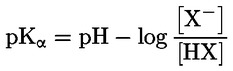


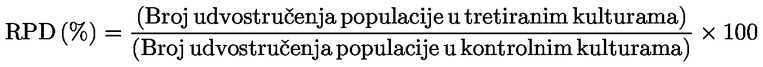

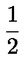 , što je jednako 0,095 mm. Korisnici bi trebali znati da se mikroskopima s različito podešenom širinom procjepa svjetiljke mogu dobiti različita mjerenja debljine rožnice.
, što je jednako 0,095 mm. Korisnici bi trebali znati da se mikroskopima s različito podešenom širinom procjepa svjetiljke mogu dobiti različita mjerenja debljine rožnice.