ISSN 1977-0820
Europeiska unionens
officiella tidning
L 129

Svensk utgåva
Lagstiftning
63 årgången
24 april 2020
|
ISSN 1977-0820 |
||
|
Europeiska unionens officiella tidning |
L 129 |
|

|
||
|
Svensk utgåva |
Lagstiftning |
63 årgången |
|
|
|
|
|
(1) Text av betydelse för EES. |
|
SV |
De rättsakter vilkas titlar är tryckta med fin stil är sådana rättsakter som har avseende på den löpande handläggningen av jordbrukspolitiska frågor. De har normalt en begränsad giltighetstid. Beträffande alla övriga rättsakter gäller att titlarna är tryckta med fetstil och föregås av en asterisk. |
II Icke-lagstiftningsakter
FÖRORDNINGAR
|
24.4.2020 |
SV |
Europeiska unionens officiella tidning |
L 129/1 |
KOMMISSIONENS DELEGERADE FÖRORDNING (EU) 2020/565
av den 13 februari 2020
om rättelse av delegerad förordning (EU) 2019/934 vad gäller övergångsbestämmelser för saluföring av lager av vinprodukter
EUROPEISKA KOMMISSIONEN HAR ANTAGIT DENNA FÖRORDNING
med beaktande av fördraget om Europeiska unionens funktionssätt,
med beaktande av Europaparlamentets och rådets förordning (EU) nr 1308/2013 av den 17 december 2013 om upprättande av en samlad marknadsordning för jordbruksprodukter och om upphävande av rådets förordningar (EEG) nr 922/72, (EEG) nr 234/79, (EG) nr 1037/2001 och (EG) nr 1234/2007 (1), särskilt artiklarna 75.2 och 80.4, och
av följande skäl:
|
(1) |
Genom kommissionens delegerade förordning (EU) 2019/934 (2) ersattes och upphävdes kommissionens förordning (EG) nr 606/2009 (3). Efter offentliggörandet av delegerad förordning (EU) 2019/934 upptäcktes ett fel i alla språkversioner av texten. |
|
(2) |
Felet rör de övergångsbestämmelser för saluföring av lager av vinprodukter som fastställs i artikel 15 i delegerad förordning (EU) 2019/934. Förordning (EG) nr 606/2009 gällde till och med den 6 december 2019. Delegerad förordning (EU) 2019/934 trädde ikraft den 27 juni 2019. För att ge aktörerna tillräckligt med tid att anpassa sig till de nya bestämmelserna beslutades att den förordningen skulle börja tillämpas från och med den 7 december 2019. |
|
(3) |
Övergångsbestämmelserna i artikel 15 i delegerad förordning (EU) 2019/934 var därför avsedda att göra det möjligt att saluföra vinprodukter som framställts i enlighet med förordning (EG) nr 606/2009 före den dag då delegerad förordning (EU) 2019/934 började tillämpas. I artikel 15 anges dock dagen för ikraftträdandet av delegerad förordning (EU) 2019/934 i stället för dagen för tillämpningen av den förordningen. Detta får den oavsiktliga konsekvensen att vinprodukter från den nya vinskörden 2019 som framställts i enlighet med förordning (EG) nr 606/2009 inte får saluföras om de framställts på eller efter dagen för ikraftträdandet. |
|
(4) |
För att möjliggöra saluföring av vinprodukter som framställts i enlighet med förordning (EG) nr 606/2009 mellan den 27 juni och den 6 december 2019 bör de övergångsbestämmelser som fastställs i artikel 15 i delegerad förordning (EU) 2019/934 rättas så att den perioden omfattas. |
|
(5) |
Delegerad förordning (EU) 2019/934 bör därför rättas i enlighet med detta. |
|
(6) |
Felet i delegerad förordning (EU) 2019/934 kräver en rättelse för att göra det möjligt att saluföra vinprodukter som framställts mellan den 27 juni och den 6 december 2019. Denna förordning om rättelse bör därför tillämpas retroaktivt från och med den 27 juni 2019. |
HÄRIGENOM FÖRESKRIVS FÖLJANDE.
Artikel 1
I delegerad förordning (EU) 2019/934 ska artikel 15 ersättas med följande:
”Artikel 15
Övergångsbestämmelser
Lager av vinprodukter som framställts före den dag då denna förordning börjar tillämpas i enlighet med de bestämmelser som gällde före den dagen får saluföras för konsumtion.”.
Artikel 2
Denna förordning träder i kraft den tredje dagen efter det att den har offentliggjorts i Europeiska unionens officiella tidning.
Den ska tillämpas från och med den 27 juni 2019.
Denna förordning är till alla delar bindande och direkt tillämplig i alla medlemsstater.
Utfärdad i Bryssel den 13 februari 2020.
På kommissionens vägnar
Ursula VON DER LEYEN
Ordförande
(1) EUT L 347, 20.12.2013, s. 671.
(2) Kommissionens delegerade förordning (EU) 2019/934 av den 12 mars 2019 om komplettering av Europaparlamentets och rådets förordning (EU) nr 1308/2013 vad gäller vinodlingsområden där alkoholhalten får höjas, tillåtna oenologiska metoder och restriktioner som är tillämpliga på framställning och bevarande av vinprodukter, lägsta alkoholhalt för biprodukter och bortskaffande av dessa samt offentliggörande av OIV-akter (EUT L 149, 7.6.2019, s. 1).
(3) Kommissionens förordning (EG) nr 606/2009 av den 10 juli 2009 om vissa tillämpningsföreskrifter för rådets förordning (EG) nr 479/2008 beträffande kategorier av vinprodukter, oenologiska metoder och restriktioner som ska tillämpas på dessa (EUT L 193, 24.7.2009, s. 1).
|
24.4.2020 |
SV |
Europeiska unionens officiella tidning |
L 129/3 |
KOMMISSIONENS DELEGERADE FÖRORDNING (EU) 2020/566
av den 17 februari 2020
om rättelse av vissa språkversioner av delegerad förordning (EU) 2016/128 om komplettering av Europaparlamentets och rådets förordning (EU) nr 609/2013 vad gäller särskilda sammansättnings- och informationskrav för livsmedel för speciella medicinska ändamål
(Text av betydelse för EES)
EUROPEISKA KOMMISSIONEN HAR ANTAGIT DENNA FÖRORDNING
med beaktande av fördraget om Europeiska unionens funktionssätt,
med beaktande av Europaparlamentets och rådets förordning (EU) nr 609/2013 av den 12 juni 2013 om livsmedel avsedda för spädbarn och småbarn, livsmedel för speciella medicinska ändamål och komplett kostersättning för viktkontroll och om upphävande av rådets direktiv 92/52/EEG, kommissionens direktiv 96/8/EG, 1999/21/EG, 2006/125/EG och 2006/141/EG, Europaparlamentets och rådets direktiv 2009/39/EG och kommissionens förordningar (EG) nr 41/2009 och (EG) nr 953/2009 (1), särskilt artikel 11.1, och
av följande skäl:
|
(1) |
Den estniska språkversionen av kommissionens delegerade förordning (EU) 2016/128 (2) innehåller fel i artikel 8.5 vad gäller särskilda krav för livsmedel för speciella medicinska ändamål som har utvecklats för att tillgodose spädbarns näringsbehov, och i artikel 11 andra stycket vad gäller rättsaktens tillämpning. |
|
(2) |
De bulgariska, estniska, finska, rumänska och tyska språkversionerna av delegerad förordning (EU) 2016/128 innehåller fel i bilaga I del A tabell 1 vad gäller vitamin- och mineralvärden i livsmedel för speciella medicinska ändamål som har utvecklats för att tillgodose spädbarns näringsbehov. |
|
(3) |
De bulgariska, finska, kroatiska och svenska språkversionerna av delegerad förordning (EU) 2016/128 innehåller fel i bilaga I del B tabell 2 vad gäller vitamin- och mineralvärden i livsmedel för speciella medicinska ändamål utom sådana som har utvecklats för att tillgodose spädbarns näringsbehov. |
|
(4) |
De bulgariska, estniska, finska, kroatiska, rumänska, svenska och tyska språkversionerna av delegerad förordning (EU) 2016/128 bör därför rättas i enlighet med detta. Övriga språkversioner berörs inte. |
HÄRIGENOM FÖRESKRIVS FÖLJANDE.
Artikel 1
Delegerad förordning (EU) 2016/128 ska rättas på följande sätt:
|
1. |
(berör ej den svenska versionen) |
|
2. |
(berör ej den svenska versionen) |
|
3. |
(berör ej den svenska versionen) |
|
4. |
Bilaga I del B tabell 2 ska rättas på följande sätt:
|
Artikel 2
Denna förordning träder i kraft den tjugonde dagen efter det att den har offentliggjorts i Europeiska unionens officiella tidning.
Denna förordning är till alla delar bindande och direkt tillämplig i alla medlemsstater.
Utfärdad i Bryssel den 17 februari 2020.
På kommissionens vägnar
Ursula VON DER LEYEN
Ordförande
(1) EUT L 181, 29.6.2013, s. 35.
(2) Kommissionens delegerade förordning (EU) 2016/128 av den 25 september 2015 om komplettering av Europaparlamentets och rådets förordning (EU) nr 609/2013 vad gäller särskilda sammansättnings- och informationskrav för livsmedel för speciella medicinska ändamål (EUT L 25, 2.2.2016, s. 30).
|
24.4.2020 |
SV |
Europeiska unionens officiella tidning |
L 129/5 |
KOMMISSIONENS GENOMFÖRANDEFÖRORDNING (EU) 2020/567
av den 22 april 2020
om ändring av förordning (EG) nr 1484/95 vad gäller fastställandet av representativa priser inom sektorerna för fjäderfäkött och ägg och för äggalbumin
EUROPEISKA KOMMISSIONEN HAR ANTAGIT DENNA FÖRORDNING
med beaktande av fördraget om Europeiska unionens funktionssätt,
med beaktande av Europaparlamentets och rådets förordning (EU) nr 1308/2013 av den 17 december 2013 om upprättande av en samlad marknadsordning för jordbruksprodukter och om upphävande av rådets förordningar (EEG) nr 922/72, (EEG) nr 234/79, (EG) nr 1037/2001 och (EG) nr 1234/2007 (1), särskilt artikel 183 b,
med beaktande av Europaparlamentets och rådets förordning (EU) nr 510/2014 av den 16 april 2014 om systemet för handeln med vissa varor som framställs genom bearbetning av jordbruksprodukter och om upphävande av rådets förordningar (EG) nr 1216/2009 och (EG) nr 614/2009 (2), särskilt artikel 5.6 a, och
av följande skäl:
|
(1) |
I kommissionens förordning (EG) nr 1484/95 (3) fastställs tillämpningsföreskrifter för ordningen för tillämpning av tilläggsbelopp för import samt representativa priser inom sektorerna för fjäderfäkött och ägg och för äggalbumin. |
|
(2) |
Det framgår av den regelbundna kontrollen av de uppgifter som ligger till grund för fastställandet av de representativa priserna för produkterna inom sektorerna för fjäderfäkött och ägg samt för äggalbumin, att de representativa priserna för import av vissa produkter bör ändras med hänsyn till variationerna i pris efter ursprung. |
|
(3) |
Förordning (EG) nr 1484/95 bör därför ändras i enlighet med detta. |
|
(4) |
Eftersom denna åtgärd bör tillämpas så snart som uppdaterade uppgifter föreligger, bör denna förordning träda i kraft samma dag som den offentliggörs. |
HÄRIGENOM FÖRESKRIVS FÖLJANDE.
Artikel 1
Bilaga I till förordning (EG) nr 1484/95 ska ersättas med texten i bilagan till den här förordningen.
Artikel 2
Denna förordning träder i kraft samma dag som den offentliggörs i Europeiska unionens officiella tidning.
Denna förordning är till alla delar bindande och direkt tillämplig i alla medlemsstater.
Utfärdad i Bryssel den 22 april 2020.
På kommissionens vägnar
För ordföranden
Wolfgang BURTSCHER
Generaldirektör
Generaldirektoratet för jordbruk och landsbygdsutveckling
(1) EUT L 347, 20.12.2013, s. 671.
(2) EUT L 150, 20.5.2014, s. 1.
(3) Kommissionens förordning (EG) nr 1484/95 av den 28 juni 1995 om tillämpningsföreskrifter för ordningen för tillämpning av tilläggsbelopp för import och om fastställande av representativa priser för fjäderfäkött och ägg och för äggalbumin samt om upphävande av förordning nr 163/67/EEG (EGT L 145, 29.6.1995, s. 47).
BILAGA
”BILAGA I
|
KN-nummer |
Varuslag |
Representativt pris (euro/100 kg) |
Säkerhet som avses i artikel 3 (euro/100 kg) |
Ursprung (1) |
|
0207 12 90 |
Plockade och urtagna höns av arten Gallus domesticus, (s.k. 65 %-kycklingar), frysta |
128,7 |
0 |
AR |
|
0207 14 10 |
Styckningsdelar av höns av arten Gallus domesticus, frysta |
212,3 195,3 269,6 220,7 |
26 32 9 24 |
AR BR CL TH |
|
1602 32 11 |
Inte kokta eller på annat sätt värmebehandlade beredningar av höns av arten Gallus domesticus |
192,6 |
28 |
BR |
(1) Landsbeteckningar som fastställs i kommissionens förordning (EU) nr 1106/2012 av den 27 november 2012 om tillämpning av Europaparlamentets och rådets förordning (EG) nr 471/2009 om gemenskapsstatistik över utrikeshandeln med icke-medlemsstater vad gäller uppdateringen av nomenklaturen avseende länder och territorier (EUT L 328, 28.11.2012, s. 7).
|
24.4.2020 |
SV |
Europeiska unionens officiella tidning |
L 129/7 |
KOMMISSIONENS GENOMFÖRANDEFÖRORDNING (EU) 2020/568
av den 23 april 2020
om att kräva uppvisande av exporttillstånd för export av vissa produkter
EUROPEISKA KOMMISSIONEN HAR ANTAGIT DENNA FÖRORDNING
med beaktande av fördraget om Europeiska unionens funktionssätt,
med beaktande av Europaparlamentets och rådets förordning (EU) 2015/479 av den 11 mars 2015 om gemensamma exportregler (1), särskilt artikel 6, och
av följande skäl:
|
(1) |
Den 15 mars 2020 offentliggjorde Europeiska kommissionen genomförandeförordning (EU) 2020/402 (2) om att kräva uppvisande av exporttillstånd för export av vissa produkter, i enlighet med artikel 5 i förordning (EU) 2015/479. Den förordningen ändrades genom kommissionens genomförandeförordning (EU) 2020/426 av den 19 mars 2020 (3). |
|
(2) |
Förordning (EU) 2020/402 och dess ändring gäller för en begränsad period av sex veckor. |
|
(3) |
Eftersom den epidemiologiska kris som orsakas av covid-19 fortsätter är efterfrågan inom unionen på personlig skyddsutrustning i form av skyddsmasker (och kirurgiska masker), handskar, skyddsglasögon, ansiktsskärmar och overaller fortfarande mycket hög och ökar till och med kontinuerligt. I synnerhet efterfrågan på personlig skyddsutrustning har lett till brister på den inre marknaden. Med tanke på utrustningens beskaffenhet och de rådande förhållandena är utrustningen en nödvändig vara, eftersom den behövs för att förhindra ytterligare spridning av sjukdomen och för att skydda hälsan hos den vårdpersonal som behandlar smittade patienter. |
|
(4) |
Kontinuerliga insatser görs för att bidra till att säkerställa en skyndsam och tillräcklig tillgång till skyddsutrustning i hela EU. Tillverkningskapaciteten för personlig skyddsutrustning har stärkts. Kommissionen har slutfört en gemensam upphandling för personlig skyddsutrustning i vilken 25 medlemsstater deltog. Dessa initiativ har visat sig framgångsrika och utrustning planeras bli tillgänglig två veckor efter det att medlemsstaterna undertecknat avtalen med anbudsgivarna. |
|
(5) |
Inom ramen för unionens civilskyddsmekanism har Europeiska kommissionen beslutat att inrätta ett strategiskt rescEU-lager av medicinsk utrustning, till exempel respiratorer och skyddsmasker, för att hjälpa EU-länderna i samband med covid-19-pandemin. Denna reserv som helt och hållet finansieras av kommissionen genom direkta bidrag kommer att förläggas till en eller flera medlemsstater. |
|
(6) |
Kommissionen har också inrättat en clearingorganisation, inbegripet för personlig skyddsutrustning, i syfte att samordna insatserna för att matcha utbud och efterfrågan i EU och underlätta en väl fungerande inre marknad. |
|
(7) |
Trots dessa åtgärder och med tanke på de ökade behoven av personlig skyddsutrustning i unionen, kvarstår ett gap mellan utbud och efterfrågan inom unionen, särskilt när det gäller personlig skyddsutrustning som är avgörande för att förhindra att sjukdomen sprids. |
|
(8) |
Mot bakgrund av dessa insatser för att avhjälpa den kritiska situationen med brist på vissa typer av personlig skyddsutrustning i unionen krävs ytterligare åtgärder för att bidra till att åtgärda och förebygga brist på personlig skyddsutrustning. |
|
(9) |
Dessa åtgärder, som syftar till att skydda hälsa och som inverkar på handeln, bör vara riktade, proportionerliga, transparenta och tillfälliga. |
|
(10) |
I ett gemensamt uttalande av den 26 mars betonade Europeiska rådets medlemmar att antagandet av beslutet om tillstånd för export av personlig skyddsutrustning bör leda till att alla former av inhemska förbud och restriktioner hävs fullt ut och på ett verkningsfullt sätt. |
|
(11) |
Det är inte unionens avsikt att begränsa exporten mer än vad som är absolut nödvändigt och unionen önskar även iaktta principen om internationell solidaritet i denna situation med en global pandemi. Unionsåtgärder bör därför vara proportionerliga och säkerställa att export fortfarande är möjlig, med förbehåll för ett förhandstillstånd. För detta ändamål bör medlemsstaterna bevilja exporttillstånd under särskilda omständigheter, när sändningen i fråga inte utgör något hot med avseende på det faktiska behovet av personlig skyddsutrustning inom unionen och avser ett legitimt behov i samband med officiell eller professionell medicinsk användning i ett tredjeland. Medlemsstaterna bör däremot inte tillåta export som skulle skapa spekulativa snedvridningar och bidra till lagring och hamstring av nödvändig utrustning som utförs av personer som har föga eller inget objektivt behov. |
|
(12) |
Ett system för exporttillstånd bör åtgärda eller förhindra en situation med brist på nödvändiga varor inom unionens gränser. Huvudsyftet med ett sådant system är att skydda folkhälsan inom unionen. |
|
(13) |
De administrativa förfarandena för dessa tillstånd bör överlåtas åt medlemsstaterna så länge detta tillfälliga system tillämpas. |
|
(14) |
På grundval av principen om internationell solidaritet bör medlemsstaterna tillåta export för att möjliggöra tillhandahållande av förnödenheter för nödsituationer i samband med humanitärt bistånd. |
|
(15) |
Medlemsstaterna bör se gynnsamt på att bevilja tillstånd om exporten är avsedd för statliga organ, offentliga organ och andra organ som lyder under offentlig rätt och som ansvarar för att distribuera eller tillhandahålla personlig skyddsutrustning till personer som drabbas av eller är utsatta för covid-19 eller som är inblandade i bekämpningen av utbrottet av covid-19. |
|
(16) |
Tillstånd bör endast beviljas i den utsträckning som exportvolymen inte är sådan att den utgör ett hot mot tillgången till personlig skyddsutrustning på marknaden i medlemsstaten i fråga, eller någon annanstans i unionen för att uppnå syftet med denna förordning. Medlemsstaterna bör i detta syfte kontakta den clearingorganisation som inrättats av kommissionen innan ett sådant tillstånd beviljas. Medlemsstaterna behöver dock inte kontakta clearingorganisationen när det gäller tillstånd avseende förnödenheter för nödsituationer i samband med humanitärt bistånd. |
|
(17) |
När medlemsstaterna beslutar om de ska bevilja ett exporttillstånd bör de också ta hänsyn till uppfyllandet av en leveransskyldighet inom ramen för en gemensam upphandling av unionen och medlemsstaterna eller inom ramen för rescEU, stöd till Världshälsoorganisationens (WHO) verksamhet, stöd till samordnade insatser på EU-nivå för att hantera krissituationer eller begäran om bistånd från tredjeländer eller internationella organisationer. |
|
(18) |
Graden av marknadsintegration för de berörda produkterna mellan delar av unionens tullområde och andra länder eller territorier, oavsett om den uppnås inom ramen för arrangemang som upprättar ett frihandelsområde eller av andra skäl såsom geografisk närhet eller historiska band, bör också beaktas. Det vore också kontraproduktivt att störa nära integrerade värdekedjor och distributionsnätverk som redan upprättats på grundval av sådana arrangemang eller på annat sätt, särskilt när det gäller länder och ekonomier som gränsar till varandra. |
|
(19) |
Denna förordning bör tillämpas på vissa typer av personlig skyddsutrustning. För att säkerställa samstämmighet bör beskrivningen av de typer av personlig skyddsutrustning som är föremål för det tillståndssystem som fastställs i denna förordning anpassas till motsvarande specifikationer för den utrustning som är föremål för den gemensamma upphandlingen, i vilken de särskilda behoven i unionen har fastställts. KN-nummer bör endast anges i informationssyfte. |
|
(20) |
Syftet med clearingorganisationen är att säkerställa att utbudet är tillräckligt för att tillgodose efterfrågan på alla typer av personlig skyddsutrustning på unionsmarknaden. På grundval av detta kan det uppstå ett behov av att se över tillämpningsområdet för bilaga I och de produkter som omfattas av denna förordning. En översyn av tillämpningsområdet bör bygga på en kontinuerlig bedömning av behoven av kritisk utrustning i samband med kampen mot covid-19 och eventuell brist på sådan utrustning. Särskild uppmärksamhet bör ägnas de produkter som omfattas av den gemensamma upphandlingen samt de produkter som begärs inom ramen för unionens civilskyddsmekanism, till exempel andra typer av personlig skyddsutrustning, respiratorer och laboratorieprodukter (testutrustning). |
|
(21) |
Den inre marknaden för medicinsk och personlig skyddsutrustning är nära integrerad med marknader utanför unionens gränser, vilket även gäller dess produktionsvärdekedjor och distributionsnät. Detta gäller i synnerhet de stater som är medlemmar i Europeiska frihandelssammanslutningen och staterna i västra Balkan som är inne i en djupgående integrationsprocess med unionen. Det skulle vara kontraproduktivt att låta export av viss personlig skyddsutrustning till dessa länder omfattas av kravet på exporttillstånd, med tanke på hur nära integrerade produktionsvärdekedjorna och distributionsnäten är, när den aktuella utrustningen är en nödvändig vara som behövs för att förhindra ytterligare spridning av sjukdomen och skydda hälsan hos den vårdpersonal som behandlar smittade patienter. Det är därför lämpligt att dessa länder undantas från denna förordnings tillämpningsområde. |
|
(22) |
Det är också lämpligt att från kravet på exporttillstånd undanta de utomeuropeiska länder och territorier som förtecknas i bilaga II till fördraget samt Färöarna, Andorra, San Marino, Vatikanstaten och Gibraltar, eftersom dessa är särskilt beroende av de centrala leverantörskedjorna i de medlemsstater till vilka de är knutna, respektive av leverantörskedjor i angränsande medlemsstater. |
|
(23) |
Denna förordning bör tillämpas på export av unionsvaror från unionens tullområde. Länder som ingår i det tullområdet behöver därför inte undantas för att få obegränsade sändningar från unionen. Detta gäller särskilt för Furstendömet Monaco (4). Territorier som uttryckligen inte ingår i unionens tullområde bör däremot inte omfattas av kravet på exporttillstånd och bör därför också undantas. Detta gäller Büsingen, Helgoland, Livigno, Ceuta och Melilla. Export till en medlemsstats kontinentalsockel eller till den exklusiva ekonomiska zon som angetts av en medlemsstat i enlighet med havsrättskonventionen bör likaledes undantas från tillämpningen av denna förordning. |
|
(24) |
De åtgärder som föreskrivs i denna förordning bör inte tillämpas på handel mellan EU:s medlemsstater. Enligt artikel 127.3 i utträdesavtalet ska Förenade konungariket Storbritannien och Nordirland under övergångsperioden anses vara en medlemsstat och inte ett tredjeland. |
|
(25) |
Vissa av de ovan nämnda länderna upprätthåller för närvarande begränsningar för export av personlig skyddsutrustning. |
|
(26) |
Myndigheterna i de länder och territorier som undantas från systemet med exporttillstånd bör erbjuda tillräckliga garantier för att de kommer att kontrollera sin egen export av de berörda produkterna, för att inte undergräva det mål som eftersträvas genom genomförandeförordning (EU) 2020/402. Kommissionen bör noga övervaka denna aspekt. |
|
(27) |
För att inte undergräva syftet med denna förordning bör myndigheterna i de länder och territorier som undantas göra sådan export till unionen tillgänglig. |
|
(28) |
För att bedöma situationen regelbundet och för att säkerställa transparens och enhetlighet bör medlemsstaterna rapportera sina beslut om beviljande av eller avslag på ansökningar om exporttillstånd till kommissionen. Kommissionen bör regelbundet göra denna information tillgänglig för allmänheten, med vederbörlig hänsyn till dess konfidentiella natur. |
|
(29) |
Kraven på förhandstillstånd är av undantagskaraktär och bör vara riktade och tidsbegränsade. För att säkerställa att åtgärderna inte gäller längre än nödvändigt bör de tillämpas under en period på 30 dagar. På grundval av utvecklingen när det gäller både spridningen av sjukdomen covid-19 och balansen mellan utbud och efterfrågan ska kommissionen se över situationen regelbundet och överväga behovet av att förkorta eller förlänga åtgärdernas varaktighet. |
|
(30) |
De åtgärder som föreskrivs i denna förordning är förenliga med yttrandet från den kommitté som inrättats genom artikel 3.1 i förordning (EU) 2015/479. |
HÄRIGENOM FÖRESKRIVS FÖLJANDE.
Artikel 1
Definitioner
I denna förordning gäller följande definitioner:
|
1) |
export: ett förfarande för export enligt artikel 269 i förordning (EU) nr 952/2013. |
|
2) |
Europeiska unionens tullområde: de områden som avses i artikel 4 i förordning (EU) nr 952/2013. |
Artikel 2
Exporttillstånd
1. Ett exporttillstånd som upprättats i enlighet med formuläret i bilaga II ska krävas för export av vissa typer av personlig skyddsutrustning som förtecknas i bilaga I, oavsett om den har sitt ursprung i unionen eller inte. Ett sådant tillstånd är begränsat till unionsvaror (5) och krävs inte för icke-unionsvaror. Det ska beviljas av de behöriga myndigheterna i den medlemsstat där exportören är etablerad och ska utfärdas skriftligt eller på elektronisk väg.
2. Ett exporttillstånd krävs för all export och ska tillhandahållas när varorna deklareras för export och senast vid tidpunkten för varornas frigörande.
3. Utan uppvisande av ett giltigt exporttillstånd är export av sådana varor förbjuden.
4. Export till Republiken Albanien, Andorra, Bosnien och Hercegovina, Färöarna, territoriet Gibraltar, Republiken Island, Kosovo (6), Furstendömet Liechtenstein, Montenegro, Kungariket Norge, Republiken Nordmakedonien, Republiken San Marino, Serbien, Schweiziska edsförbundet, Vatikanstaten och de utomeuropeiska länder och territorier som förtecknas i bilaga II till fördraget ska inte omfattas av de åtgärder som anges i punkterna 1 och 2. Detsamma gäller export till Büsingen, Helgoland, Livigno, Ceuta och Melilla.
5. Export till anläggningar belägna på en medlemsstats kontinentalsockel eller till den exklusiva ekonomiska zon som deklarerats av en medlemsstat i enlighet med havsrättskonventionen ska inte omfattas av de åtgärder som anges i punkterna 1 och 2.
6. På grundval av principen om internationell solidaritet ska medlemsstaterna tillåta export för användning i tredjeländer för att möjliggöra tillhandahållande av förnödenheter för nödsituationer i samband med humanitärt bistånd. Medlemsstaterna ska skyndsamt handlägga ansökningar om exporttillstånd, så snabbt som möjligt, men inte senare än två arbetsdagar räknat från den dag då all nödvändig information lämnats till de behöriga myndigheterna.
7. Medlemsstaterna bör se gynnsamt på att bevilja tillstånd om exporten är avsedd för statliga organ, offentliga organ och andra organ som lyder under offentlig rätt och som ansvarar för att distribuera eller tillhandahålla personlig skyddsutrustning till personer som drabbas av eller är utsatta för covid-19 eller som är inblandade i bekämpningen av utbrottet av covid-19. Dessa tillstånd bör endast beviljas i den utsträckning som exportvolymen inte är sådan att den utgör ett hot mot tillgången till den personliga skyddsutrustning som förtecknas i bilaga I på marknaden i medlemsstaten i fråga, eller någon annanstans i unionen. I detta syfte ska medlemsstaterna innan de beviljar ett sådant tillstånd underrätta kommissionen på följande e-postadress: SG-CCH@ec.europa.eu. Kommissionen ska avge ett yttrande inom 48 timmar efter det att den underrättats.
Artikel 3
Procedurfrågor
1. Om den personliga skyddsutrustning som förtecknas i bilaga I befinner sig i en annan eller flera andra medlemsstater än den medlemsstat där ansökan om exporttillstånd har lämnats in ska detta anges i ansökan. De behöriga myndigheterna i den medlemsstat där ansökan om exporttillstånd har lämnats in ska omedelbart samråda med de behöriga myndigheterna i den eller de medlemsstater där varan befinner sig och förse dem med relevant information. Den eller de medlemsstater som ingår i samrådet ska så snart som möjligt, men senast inom fem arbetsdagar, framföra eventuella invändningar mot beviljandet av ett sådant tillstånd, vilka ska vara bindande för den medlemsstat där ansökan har lämnats in.
2. Medlemsstaterna ska handlägga ansökningar om exporttillstånd så snart som möjligt, men inte senare än fem arbetsdagar från det datum då alla de uppgifter som krävs har lämnats till de behöriga myndigheterna. I undantagsfall och av vederbörligen motiverade skäl får denna period förlängas med ytterligare fem arbetsdagar.
3. Vid beslut om beviljande av exporttillstånd enligt denna förordning ska medlemsstaterna beakta alla relevanta omständigheter, inbegripet, i förekommande fall, huruvida exporten används till exempel för följande ändamål:
|
— |
För att fullgöra leveransskyldigheter inom ramen för ett gemensamt upphandlingsförfarande i enlighet med artikel 5 i Europaparlamentets och rådets beslut nr 1082/2013/EU (7). |
|
— |
För att stödja rescEUs medicinska lagerhållning eller lagerhållning av personlig skyddsutrustning som syftar till att bekämpa allvarliga gränsöverskridande hot mot människors hälsa, i enlighet med kommissionens genomförandebeslut (EU) 2019/570 (8). |
|
— |
För att bemöta en begäran om bistånd som riktas till och hanteras av unionens civilskyddsmekanism och för att stödja samordnade stödåtgärder som samordnas av EU-arrangemanget för integrerad politisk krishantering (IPCR), kommissionen eller andra unionsinstitutioner. |
|
— |
För att stödja den stadgeenliga verksamheten hos utländska stödorganisationer som åtnjuter skydd enligt Genèvekonventionen, förutsatt att de inte försämrar deras möjligheter att fungera som nationella stödorganisationer. |
|
— |
För att stödja verksamheten inom WHO:s Global Outbreak Alert & Response Network (GOARN). |
|
— |
För att tillhandahålla leveranser till EU-medlemsstaternas utlandsoperationer, inbegripet militära operationer, internationella polisuppdrag och/eller civila internationella fredsbevarande uppdrag. |
|
— |
För att tillhandahålla leveranser till unionens och medlemsstaternas delegationer utomlands. |
4. Medlemsstaterna får beakta andra faktorer, till exempel graden av marknadsintegration för de berörda produkterna, oavsett om den uppnås genom arrangemang som upprättar ett frihandelsområde med det avsedda exportlandet, eller geografisk närhet.
5. När medlemsstaterna beslutar huruvida de ska bevilja ett exporttillstånd bör de också se till att utbudet är tillräckligt i unionen för att tillgodose behovet av den personliga skyddsutrustning som förtecknas i bilaga I. Exporttillstånd får därför endast beviljas när sändningen i fråga inte utgör ett hot mot tillgången till dessa varor på den berörda medlemsstatens marknad eller annorstädes i unionen. För att på bästa sätt bedöma situationen ska medlemsstaterna underrätta kommissionen på följande e-postadress: SG-CCH@ec.europa.eu, i synnerhet när den planerade exportens volym kan leda till att brister uppstår.
6. Kommissionen ska avge ett yttrande inom 48 timmar från mottagandet av begäran.
7. Medlemsstaterna får besluta att använda elektroniska dokument för handläggningen av ansökningar om exporttillstånd.
Artikel 4
Underrättelser
1. Medlemsstaterna ska omedelbart underrätta kommissionen om de tillstånd som beviljats respektive avslagits.
2. Dessa underrättelser ska innehålla följande:
|
a) |
Den behöriga myndighetens namn och kontaktuppgifter. |
|
b) |
Exportörens identitet. |
|
c) |
Bestämmelseland. |
|
d) |
Slutmottagare. |
|
e) |
Beviljande eller avslag av exporttillstånd. |
|
f) |
Varukod. |
|
g) |
Kvantitet. |
|
h) |
Antal enheter och varubeskrivning. |
Underrättelsen ska skickas elektroniskt till följande adress: TRADE-EXPORTAUTHORISATIONPPE@ec.europa.eu
3. Kommissionen ska göra informationen om beviljade och avslagna tillstånd offentligt tillgänglig, med vederbörlig hänsyn tagen till de lämnade uppgifternas konfidentiella natur.
Artikel 5
Översynsklausul
Kommissionen ska övervaka situationen och, vid behov, skyndsamt se över tillämpningsperioden för denna förordning och dess produktomfattning, med beaktande av utvecklingen av den epidemiologiska kris som orsakas av sjukdomen covid-19 och balansen mellan utbud och efterfrågan på unionsmarknaden.
Artikel 6
Slutbestämmelser
Denna förordning träder i kraft den 26 april 2020. Den ska gälla i 30 dagar.
Denna förordning är till alla delar bindande och direkt tillämplig i alla medlemsstater.
Utfärdad i Bryssel den 23 april 2020.
På kommissionens vägnar
Ursula VON DER LEYEN
Ordförande
(1) Kommissionens genomförandeförordning (EU) 2020/402 av den 14 mars 2020 om att kräva uppvisande av exporttillstånd för export av vissa produkter (EUT L 83, 27.3.2015, s. 34).
(2) Kommissionens genomförandeförordning (EU) 2020/426 av den 19 mars 2020 om ändring av genomförandeförordning (EU) 2020/402 om att kräva uppvisande av exporttillstånd för export av vissa produkter (EUT L 77 I, 15.3.2020, s. 1).
(3) EUT L 84 I, 20.3.2020, s. 1.
(4) Se artikel 4.2 a i Europaparlamentets och rådets förordning (EU) nr 952/2013 av den 9 oktober 2013 om fastställande av en tullkodex för unionen (EUT L 269, 10.10.2013, s. 1).
(5) För undantagna transaktioner se artikel 269.2 i Europaparlamentets och rådets förordning (EU) nr 952/2013 av den 9 oktober 2013 om fastställande av en tullkodex för unionen (EUT L 269, 10.10.2013, s. 1) i dess ändrade lydelse.
(6) Denna beteckning påverkar inte ståndpunkter om Kosovos status och är i överensstämmelse med FN:s säkerhetsråds resolution 1244/1999 och med Internationella domstolens utlåtande om Kosovos självständighetsförklaring.
(7) Europaparlamentets och rådets beslut nr 1082/2013/EU av den 22 oktober 2013 om allvarliga gränsöverskridande hot mot människors hälsa och om upphävande av beslut nr 2119/98/EG (EUT L 293, 5.11.2013, s. 1).
(8) Kommissionens genomförandebeslut (EU) 2019/570 av den 8 april 2019 om fastställande av regler för genomförande av Europaparlamentets och rådets beslut 1313/2013/EU vad gäller rescEU-resurser och om ändring av kommissionens genomförandebeslut 2014/762/EU (EUT L 99, 10.4.2019, s. 41).
BILAGA I
Skyddsutrustning
Den utrustning som förtecknas i denna bilaga överensstämmer med bestämmelserna i Europaparlamentets och rådets förordning (EU) 2016/425 (1) respektive rådets direktiv 93/42/EEG (2), medicintekniska produkter klass I.
|
Kategori |
Beskrivning |
KN-nummer |
||||||||||||
|
Skyddsglasögon och visir |
|
ex 9004 90 10 ex 9004 90 90 |
||||||||||||
|
Skyddsutrustning för mun och näsa |
|
ex 6307 90 98 ex 9020 00 00 |
||||||||||||
|
Skyddsdräkter |
|
ex 3926 20 00 ex 4015 90 00 ex 6113 00 ex 6114 ex 6210 10 10 6210 10 92 ex 6210 10 98 ex 6210 20 00 ex 6210 30 00 ex 6210 40 00 ex 6210 50 00 ex 6211 32 10 ex 6211 32 90 ex 6211 33 10 ex 6211 33 90 ex 6211 39 00 ex 6211 42 10 ex 6211 42 90 ex 6211 43 10 ex 6211 43 90 ex 6211 49 00 ex 9020 00 00 |
(1) Europaparlamentets och rådets förordning (EU) 2016/425 av den 9 mars 2016 om personlig skyddsutrustning och om upphävande av rådets direktiv 89/686/EEG (EUT L 81, 31.3.2016, s. 51).
(2) Rådets direktiv 93/42/EEG av den 14 juni 1993 om medicintekniska produkter (EGT L 69, 12.7.1993, s. 1).
BILAGA II
Ansökan om exporttillstånd enligt artikel 2
När medlemsstaterna beviljar exporttillstånd ska de se till att det på det utfärdade formuläret framgår vilken typ av tillstånd som avses. Detta exporttillstånd gäller till sista giltighetsdag i alla Europeiska unionens medlemsstater.
|
EUROPEISKA UNIONEN |
Export av personlig skyddsutrustning (förordning (EU) 2020/568) |
||||||||||
|
|
|
|||||||||
|
|
|
|
||||||||
|
|
|
|
||||||||
|
|||||||||||
|
|
|
|
||||||||
|
|||||||||||
|
|
|
|
||||||||
|
|||||||||||
|
|
|
|
||||||||
|
|||||||||||
|
|||||||||||
Förklarande anmärkningar till formuläret för exporttillstånd
Alla fält måste fyllas i om inget annat anges.
Fälten 7–11 upprepas fyra gånger så att tillstånd kan sökas för fyra olika produkter.
|
Fält 1 |
Exportör |
Fullständigt namn på och fullständig adress till den exportör som tillståndet utfärdas för samt Eori-nummer, om tillämpligt. |
|
Fält 2 |
Tillståndsnummer |
Tillståndsnumret fylls i av den myndighet som utfärdar exporttillståndet och ska ha följande format: XXyyyy999999, där XX är den utfärdande medlemsstatens tvåställiga geonomenklaturkod (1), yyyy är tillståndets utfärdandeår angivet med fyra siffror, 999999 är ett sexsiffrigt nummer som är unikt inom XXyyyy och som tilldelas av den utfärdande myndigheten. |
|
Fält 3 |
Sista giltighetsdag |
Den utfärdande myndigheten kan fastställa en sista giltighetsdag för tillståndet. Denna sista giltighetsdag får infalla högst 30 dagar efter denna förordnings ikraftträdande. Om ingen sista giltighetsdag fastställs av den utfärdande myndigheten upphör tillståndet att gälla senast 30 dagar efter denna förordnings ikraftträdande. |
|
Fält 4 |
Utfärdande myndighet |
Fullständigt namn på och fullständig adress till den myndighet i en medlemsstat som utfärdar exporttillståndet. |
|
Fält 5 |
Bestämmelseland |
Den tvåställiga geonomenklaturkoden för bestämmelselandet för de varor för vilka tillståndet utfärdas. |
|
Fält 6 |
Slutmottagare |
Fullständigt namn på och fullständig adress till slutmottagaren av varorna, om denna är känd då tillståndet utfärdas, samt Eori-nummer, om tillämpligt. Om slutmottagaren inte är känd då tillståndet utfärdas ska fältet lämnas tomt. |
|
Fält 6a |
Bidrar exporten till en av de omständigheter som förtecknas i artikel 3 eller är exporten avsedd att möjliggöra tillhandahållande av förnödenheter för nödsituationer i samband med humanitärt bistånd enligt artikel 2.6? |
Om exporten bidrar till en av de omständigheter som förtecknas i artikel 3 eller om exporten är avsedd att möjliggöra tillhandahållande av förnödenheter för nödsituationer i samband med humanitärt bistånd enligt artikel 2.6 ska detta anges. |
|
Fält 7 |
Varukod |
Det nummer ur Harmoniserade systemet eller Kombinerade nomenklaturen (2) enligt vilket de varor som ska exporteras klassificeras när tillståndet utfärdas. |
|
Fält 8 |
Kvantitet |
Kvantiteten varor mätt i den enhet som anges i fält 9. |
|
Fält 9 |
Enhet |
Den måttenhet i vilken den kvantitet som anges i fält 8 uttrycks. De enheter som ska användas är ”P/ST” för varor som räknas per styck (t.ex. masker). |
|
Fält 10 |
Varubeskrivning |
En beskrivning i klartext som är tillräckligt exakt för att varorna ska kunna identifieras. |
|
Fält 11 |
Plats |
Geonomenklaturkoden för den medlemsstat där varorna befinner sig. Om varorna befinner sig i den utfärdande myndighetens medlemsstat ska detta fält lämnas tomt. |
|
Fält 12 |
Underskrift, stämpel, ort och datum |
Den utfärdande myndighetens underskrift och stämpel. Ort och datum för utfärdande av tillståndet. |
(1) Kommissionens förordning (EU) nr 1106/2012 av den 27 november 2012 om tillämpning av Europaparlamentets och rådets förordning (EG) nr 471/2009 om gemenskapsstatistik över utrikeshandeln med icke-medlemsstater vad gäller uppdateringen av nomenklaturen avseende länder och territorier (EUT L 328, 28.11.2012, s. 7).
(2) Rådets förordning (EEG) nr 2658/87 av den 23 juli 1987 om tulltaxe- och statistiknomenklaturen och om Gemensamma tulltaxan (EUT L 256, 7.9.1987, s. 1).
BESLUT
|
24.4.2020 |
SV |
Europeiska unionens officiella tidning |
L 129/16 |
KOMMISSIONENS GENOMFÖRANDEBESLUT (EU) 2020/569
av den 16 april 2020
om fastställande av ett gemensamt format och informationsinnehåll för överlämnande av den information som ska rapporteras av medlemsstaterna i enlighet med Europaparlamentets och rådets direktiv 2010/63/EU om skydd av djur som används för vetenskapliga ändamål och om upphävande av kommissionens genomförandebeslut 2012/707/EU
[delgivet med nr C(2020) 2179]
(Text av betydelse för EES)
EUROPEISKA KOMMISSIONEN HAR ANTAGIT DETTA BESLUT
med beaktande av fördraget om Europeiska unionens funktionssätt,
med beaktande av Europaparlamentets och rådets direktiv 2010/63/EU av den 22 september 2010 om skydd av djur som används för vetenskapliga ändamål (1), särskilt artiklarna 43.4 och 54.4, och
av följande skäl:
|
(1) |
Till följd av de ändringar som föreskrivs i Europaparlamentets och rådets förordning (EU) 2019/1010 (2) ska medlemsstaterna enligt direktiv 2010/63/EU nu lämna in icke-tekniska projektsammanfattningar av godkända projekt och eventuella uppdateringar av dessa, genom elektronisk överföring till kommissionen. För att kommissionen ska kunna upprätta och upprätthålla en central databas för dessa sammanfattningar och uppdateringar och för att säkerställa att meningsfulla sökningar kan utföras bland dessa uppgifter, behöver dessa sammanfattningar och uppdateringar presenteras på ett enhetligt sätt. Det bör därför fastställas mallar för de icke-tekniska projektsammanfattningarna och eventuella uppdateringar av dessa, och medlemsstaterna bör åläggas att ladda upp dessa sammanfattningar och uppdateringar till den databas som upprättats av kommissionen. |
|
(2) |
I direktiv 2010/63/EU föreskrivs också att medlemsstaterna ska lämna information om genomförandet av det direktivet, liksom även statistisk information om användningen av djur i försök, genom elektronisk överföring till kommissionen. |
|
(3) |
På grundval av de uppgifter som medlemsstaterna lämnat om genomförandet av direktiv 2010/63/EU ska kommissionens avdelningar offentliggöra och regelbundet uppdatera en unionsomfattande översikt. I direktiv 2010/63/EU föreskrivs också att kommissionens avdelningar varje år ska göra den statistiska information som medlemsstaterna lämnat in och en sammanfattande rapport av informationen tillgänglig för allmänheten. För att kommissionen ska kunna uppfylla båda dessa krav bör innehållet i denna information fastställas genom informationskategorier. |
|
(4) |
När det gäller information om genomförandet bör de informationskategorier som ska rapporteras korrelera med de relevanta kraven i direktiv 2010/63/EU. I fråga om statistisk information måste det anges vilka statistiska uppgiftskategorier som finns tillgängliga i den sökbara databasen med öppen åtkomst, som inrättats av kommissionen i enlighet med direktiv 2010/63/EU. |
|
(5) |
För att förbättra insynen och minska den administrativa bördan bör medlemsstaterna åläggas att använda den databas som inrättats av kommissionen för att lämna information om genomförandet av direktiv 2010/63/EU samt statistisk information om användning av djur i försök. |
|
(6) |
Innehållet i och formatet för den detaljerade information som medlemsstaterna ska lämna om sådana metoder som anses vara minst lika humana som de som anges i bilaga IV till direktiv 2010/63/EU bör specificeras så att den förteckning över metoder för avlivning av djur som finns i den berörda bilagan kan hållas aktuell. Det är därför lämpligt att fastställa en mall som gör det möjligt att lämna information om typen av metod, arten i fråga och motiveringen för att bevilja undantag, och att ålägga medlemsstaterna att använda denna mall. |
|
(7) |
De befogenheter som ligger till grund för detta beslut är nära sammankopplade, eftersom de båda är relaterade till medlemsstaternas rapportering av information enligt direktiv 2010/63/EU. Med tanke på detta konkreta samband och för att säkerställa ett konsekvent och enhetligt tillvägagångssätt är det lämpligt att anta ett enda beslut där samtliga krav som gäller dessa befogenheter fastställs. Det är därför nödvändigt att ersätta kommissionens genomförandebeslut 2012/707/EU (3), i vilket det gemensamma formatet för att överlämna den information som avses i artikel 54 i direktiv 2010/63/EU fastställs, med ett nytt genomförandebeslut grundat på både artikel 43.4 och artikel 54.4 i direktiv 2010/63/EU. Genomförandebeslut 2012/707/EU bör därför upphöra att gälla. |
|
(8) |
De åtgärder som föreskrivs i detta beslut är förenliga med yttrandet från kommittén för djur inom vetenskapen, Animals in Science Committee. |
HÄRIGENOM FÖRESKRIVS FÖLJANDE.
Artikel 1
Vid tillämpning av artikel 43.3 andra meningen i direktiv 2010/63/EU ska medlemsstaterna lämna in de uppgifter som anges i bilaga I till detta beslut, med hjälp av den databas som upprättats av kommissionen i enlighet med artikel 43.4 tredje meningen i det direktivet. De icke-tekniska projektsammanfattningarna och uppdateringarna av dessa ska överensstämma med de mallar som anges i bilaga I till detta beslut.
Artikel 2
Vid tillämpning av artikel 54.1 i direktiv 2010/63/EU ska medlemsstaterna lämna in de uppgifter som anges i bilaga II till detta beslut med hjälp av den databas som upprättats av kommissionen i enlighet med 54.2 tredje stycket första meningen i det direktivet.
Artikel 3
Vid tillämpning av artikel 54.2 i direktiv 2010/63/EU ska medlemsstaterna lämna in de uppgifter som anges i bilaga III till detta beslut med hjälp av den databas som upprättats av kommissionen i enlighet med artikel 54.2 tredje stycket första meningen i det direktivet.
Artikel 4
Vid tillämpning av artikel 54.3 i direktiv 2010/63/EU ska medlemsstaterna lämna de uppgifter som anges i bilaga IV till detta beslut med hjälp av den mall som fastställs i den bilagan.
Artikel 5
Genomförandebeslut 2012/707/EU ska upphöra att gälla från och med den 17 april 2020. Hänvisningar till det upphävda beslutet ska anses som hänvisningar till det här beslutet och läsas i enlighet med jämförelsetabellen i bilaga V.
Artikel 6
Detta beslut riktar sig till medlemsstaterna.
Utfärdat i Bryssel den 16 april 2020.
På kommissionens vägnar
Virginijus SINKEVIČIUS
Ledamot av kommissionen
(1) EUT L 276, 20.10.2010, s. 33.
(2) Europaparlamentets och rådets förordning (EU) 2019/1010 av den 5 juni 2019 om samordning av rapporteringsskyldigheter inom miljöanknuten lagstiftning och om ändring av Europaparlamentets och rådets förordningar (EG) nr 166/2006 och (EU) nr 995/2010, Europaparlamentets och rådets direktiv 2002/49/EG, 2004/35/EG, 2007/2/EG, 2009/147/EG och 2010/63/EU, rådets förordningar (EG) nr 338/97 och (EG) nr 2173/2005 samt rådets direktiv 86/278/EEG (EUT L 170, 25.6.2019, s. 115).
(3) Kommissionens genomförandebeslut 2012/707/EU av den 14 november 2012 om fastställande av ett gemensamt format för överlämnande av information i enlighet med Europaparlamentets och rådets direktiv 2010/63/EU om skydd av djur som används för vetenskapliga ändamål (EUT L 320, 17.11.2012, s. 33).
BILAGA I
DEL A
Mall för icke-tekniska projektsammanfattningar som avses i artikel 43.1 i direktiv 2010/63/EU
|
Projektets namn |
|
||||||||||||||||||||||||||||||||
|
Varaktighet (antal månader) |
|
||||||||||||||||||||||||||||||||
|
Nyckelord (högst 5) (1) |
|
||||||||||||||||||||||||||||||||
|
Projektets syfte (2) (det är möjligt välja flera alternativ) |
|
||||||||||||||||||||||||||||||||
|
Projektets mål och förväntade nytta |
|||||||||||||||||||||||||||||||||
|
Beskriv projektets mål (de vetenskapliga frågorna, eller de vetenskapliga/kliniska behov som ska mötas). |
|
||||||||||||||||||||||||||||||||
|
Vilken nytta kan projektet medföra? Vilka vetenskapliga framsteg kommer att nås, hur kan människor, djur eller miljö i förlängningen dra nytta av projektet. I tillämpliga fall, gör åtskillnad mellan kortsiktig nytta (inom projektets löptid) och långsiktig nytta (som kan uppkomma efter att projektet avslutats). |
|
||||||||||||||||||||||||||||||||
|
Skador som kan förutses |
|||||||||||||||||||||||||||||||||
|
Vilka försöksåtgärder kommer djuren vanligtvis att utsättas för (t.ex. injektioner, kirurgiska ingrepp)? Ange försöksåtgärdernas antal och varaktighet. |
|
||||||||||||||||||||||||||||||||
|
Vilka typer av påverkan/negativa effekter på djuren kan förutses, till exempel smärta, viktminskning, inaktivitet/nedsatt rörlighet, stress, onormalt beteende, och hur lång är varaktigheten av dessa effekter? |
|
||||||||||||||||||||||||||||||||
|
Vilka arter och hur många djur förväntas användas? Vilka är de förväntade svårhetsgraderna och hur många djur omfattas av varje svårhetsgrad (specificera antal per art)? |
Arter (4) |
Uppskattat totalt antal |
Uppskattat antal per svårhetsgrad |
||||||||||||||||||||||||||||||
|
Terminal |
Ringa svårhet |
Måttlig svårhet |
Avsevärd svårhet |
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
Vad kommer att hända med djuren som hålls vid liv i slutet av försöket? (5) (6) |
Uppskattat antal som ska återanvändas |
Uppskattat antal som ska återföras till livsmiljö/ djurhållningssystem |
Uppskattat antal som ska utplaceras |
||||||||||||||||||||||||||||||
|
Ange skälen för djurens planerade öde efter försöket. |
|
||||||||||||||||||||||||||||||||
|
Tillämpning av 3R-principen |
|||||||||||||||||||||||||||||||||
|
1. Ersättning Ange vilka djurfria alternativ som finns tillgängliga på detta område och varför de inte kan användas för projektets ändamål. |
|
||||||||||||||||||||||||||||||||
|
2. Begränsning Förklara hur antalet djur för detta projekt fastställdes. Beskriv vilka åtgärder som har vidtagits för att minska antalet djur som ska användas, och vilka principer som tillämpas för att utforma studier. I förekommande fall, beskriv vilka metoder som kommer att användas i hela projektet för att minimera antalet djur som används, i enlighet med vetenskapliga mål. Dessa metoder kan omfatta exempelvis pilotstudier, datormodellering, gemensamt utnyttjande av vävnader och återanvändning. |
|
||||||||||||||||||||||||||||||||
|
3. Förfining Ge exempel på specifika åtgärder (t.ex. ökad övervakning, postoperativ vård, smärtlindring, träning av djur) som kommer att vidtas i samband med försöken för att minimera hälsokostnader (skador) hos djuren. Beskriv mekanismerna för att ta fram nya förfiningstekniker under projektets livstid. |
|
||||||||||||||||||||||||||||||||
|
Förklara valet av art och de relaterade utvecklingsstadierna. |
|
||||||||||||||||||||||||||||||||
|
Projekt valt för utvärdering i efterhand (7) |
Tidsfrist |
Inbegriper försök i kategorin avsevärd svårhet |
Icke-mänskliga primater används |
Annan orsak |
|||||||||||||||||||||||||||||
DEL B
Mall för inlämning av en uppdatering av den icke-tekniska projektsammanfattning som avses i artikel 43.2 i direktiv 2010/63/EU
|
Titel (i enlighet med den icke-tekniska projektsammanfattningen) |
|
||||
|
Anledning till utvärdering i efterhand (8) |
Användning av icke-mänskliga primater |
Inbegriper försök i kategorin ”avsevärd svårhet” |
Annan orsak |
||
|
Förklara valet av alternativet ”annan orsak” |
|
||||
|
Måluppfyllelse |
|||||
|
Förklara kortfattat om och i vilken utsträckning de mål som anges i det godkända projektet har uppnåtts. Ange skälen, om målen inte har uppnåtts. Har det kommit fram några andra viktiga resultat? Vilken nytta har det hittills utförda arbetet resulterat i, och kan ytterligare nytta väntas? Har resultaten av detta projekt spridits, även i de fall där hypoteserna inte har bevisats? Beskriv i så fall hur. Om inte, ange hur och när resultaten förväntas offentliggöras. |
|
||||
|
Skada |
|||||
|
Art (9) |
Totalt antal djur som använts |
Antal djur per faktisk svårhetsgrad |
|||
|
Terminal |
Ringa svårhet |
Måttlig svårhet |
Avsevärd svårhet |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Hur överensstämmer antalet djur som använts och de faktiska svårhetsgraderna med de uppskattade? Lämna en förklaring i förekommande fall om de faktiska siffrorna är högre än de uppskattade siffrorna. Lämna en förklaring i förekommande fall om de faktiska siffrorna är lägre, såvida inte denna skillnad beror på en begränsning eller förfining. |
|
||||
|
Vad händer med djuren som hålls vid liv i slutet av studien, och stämmer detta överens med deras planerade öde? Lämna en förklaring. |
|
||||
|
Alla faktorer som kan bidra till det fortsatta genomförandet av 3R-principen enligt nedanstående: |
|||||
|
1. Ersättning |
|||||
|
Ange baserat på den kunskap som erhållits från detta projekt om nya metoder har identifierats/utvecklats (inklusive utveckling/validering av nya in vitro- eller in silico-tekniker) genom vilka användningen av djur i liknande projekt delvis eller helt kan ersättas? |
|
||||
|
2. Begränsning |
|||||
|
Ange baserat på den kunskap som erhållits från detta projekt om experimentdesignen kan förbättras för att möjliggöra ytterligare begränsning av användningen av djur, och i så fall hur? Lämna en förklaring om antalet djur som användes var lägre än vad som ursprungligen uppskattades. |
|
||||
|
3. Förfining |
|||||
|
Lämna en förklaring om de faktiska svårhetsgraderna var lägre än vad som ursprungligen uppskattades. Ange baserat på den kunskap som erhållits från detta projekt om de använda djurmodellerna fortfarande är lämpligast. Lämna en förklaring per art/modell, i förekommande fall. Räkna upp eventuella nya förfiningar som införts under projektet för att minska skadorna på djuren eller för att förbättra deras välbefinnande. Vilka är de potentiella möjligheterna till ytterligare förfining i framtiden, till exempel genom ny teknik, andra arbetsmetoder, förbättrade metoder för bedömning av välbefinnande, tidigare slutpunkter, åtgärder för inhysning/djurhållning? |
|
||||
|
4. Övrigt |
|||||
|
Hur sprids resultaten för det fortsatta genomförandet av 3R-principen? |
|
||||
|
Kompletterande upplysningar |
|
||||
(1) Inklusive vetenskapliga termer som kan bestå av mer än fem enskilda ord och exklusive arter och syften som anges på annan plats i dokumentet.
(2) Välj syfte i rullgardinsmenyn.
(3) Förteckning över syften i enlighet med statistiska rapporteringskategorier och underkategorier i bilaga III till detta beslut.
(4) Arter i enlighet med de statistiska rapporteringskategorierna i bilaga III till detta beslut, med ”icke specificerat däggdjur” som ytterligare alternativ för att skydda anonymiteten i undantagsfall.
(5) Arter ska fyllas i utifrån föregående svar och väljas från den relevanta kategorin (proportioner).
(6) Det är möjligt att välja flera alternativ för varje art.
(7) Det är möjligt att välja flera alternativ. Tillämpligt för de medlemsstater där denna information krävs enligt lagstiftningen.
(8) Det är möjligt att välja flera alternativ.
(9) Arter i enlighet med de statistiska rapporteringskategorierna i bilaga III till detta beslut, med ”icke specificerat däggdjur” som ytterligare alternativ för att skydda anonymiteten i undantagsfall.
BILAGA II
INFORMATION SOM AVSES I ARTIKEL 54.1 I DIREKTIV 2010/63/EU
A. NATIONELLA ÅTGÄRDER FÖR GENOMFÖRANDET AV DIREKTIV 2010/63/EU
Lämna information om ändringar av nationella åtgärder som avser genomförandet av direktiv 2010/63/EU sedan föregående rapport.
B. STRUKTURER OCH RAMAR
1. Behöriga myndigheter (artikel 59 i direktiv 2010/63/EU)
Beskriv ramarna för de behöriga myndigheterna, inklusive antal och typer av myndigheter samt deras respektive uppgifter, och förklara vilka åtgärder som vidtagits för att säkerställa efterlevnaden av kraven i artikel 59.1 i direktiv 2010/63/EU.
2. Nationell kommitté (artikel 49 i direktiv 2010/63/EU)
Beskriv den nationella kommitténs struktur och arbete samt de åtgärder som vidtagits för att säkerställa att kraven i artikel 49 i direktiv 2010/63/EU uppfylls.
3. Utbildning av personal (artikel 23 i direktiv 2010/63/EU)
Lämna uppgifter om de minimikrav som avses i artikel 23.3 i direktiv 2010/63/EU; beskriv eventuella ytterligare utbildningskrav för personal som kommer från andra medlemsstater.
4. Projektbedömning och projektgodkännande (artiklarna 38 och 40 i direktiv 2010/63/EU)
Förklara förfarandena för projektbedömning och projektgodkännande och vilka åtgärder som vidtagits för att säkerställa efterlevnaden av kraven i artiklarna 38 och 40 i direktiv 2010/63/EU.
C. VERKSAMHET
1. Projekt
1.1 Beviljande av projektgodkännande (artiklarna 40 och 41 i direktiv 2010/63/EU)
|
1.1.1 |
För varje år, ange antal för följande:
|
|
1.1.2 |
Vid tillämpning av led c, ge sammanfattande information som omfattar den femåriga rapporteringscykeln och som beskriver skälen till att tidsfristen på 40 dagar har förlängts. |
1.2 Utvärdering i efterhand, icke-tekniska projektsammanfattningar (artiklarna 38.2 f, 39 och 43 i direktiv 2010/63/EU)
|
1.2.1 |
Förklara vilka åtgärder som vidtagits för att säkerställa efterlevnaden av kraven i artikel 43.1 i direktiv 2010/63/EU och ange om det finns ett krav på att icke-tekniska projektsammanfattningar ska specificera att ett projekt ska genomgå en utvärdering i efterhand (artikel 43.2 i direktiv 2010/63/EU). |
|
1.2.2 |
Ange för varje år hur många godkända projekt som ska genomgå en utvärdering i efterhand i enlighet med artikel 39.2 i direktiv 2010/63/EU och hur många godkända projekt som ska genomgå en utvärdering i efterhand enligt artikel 38.2 f i detta direktiv. Kategorisera vart och ett av projekten enligt följande typer:
|
|
1.2.3 |
Ge sammanfattande information som omfattar den femåriga rapporteringscykeln och som beskriver vilka slags projekt som valts ut för utvärdering i efterhand i enlighet med artikel 38.2 f i direktiv 2010/63/EU men som inte automatiskt omfattas av en utvärdering i efterhand i enlighet med artikel 39.2. |
2. Djur som föds upp för att användas i försök (artiklarna 10, 28 och 30 i direktiv 2010/63/EU)
|
2.1 |
Ange art och antal djur som fötts upp och fötts fram (även med kejsarsnitt) för att användas i försök men som inte har använts i något försök och avlivats under det kalenderår som närmast föregår det år då femårsrapporten lämnas in. |
|
2.1.1 |
Inkludera djur som avlivats för att få organ eller vävnader samt djur som har sitt ursprung i att det framställs och upprätthålls genetiskt förändrade djurstammar, vilka inte omfattas av den årliga statistiken enligt artikel 54.2 i direktiv 2010/63/EU. |
|
2.1.2 |
Kategorisera djuren som en av följande typer:
|
|
2.1.3 |
Den kategori som avses i led a utesluter sådana djur som är resultatet av att en ny genetiskt förändrad stam framställs och att en genetiskt förändrad stam upprätthålls, och som i stället ska rapporteras i de kategorier som avses i led d respektive e. |
|
2.1.4 |
De kategorier som avses i leden b och c omfattar sådana djur som är resultatet av att en ny genetiskt förändrad stam framställs och att en genetiskt förändrad stam upprätthålls, när de tillhandahåller organ och/eller vävnader. |
|
2.1.5 |
De kategorier som avses i punkterna 2.1.2 d och e utesluter följande djur, som ska rapporteras i den årliga statistiken enligt artikel 54.2 i direktiv 2010/63/EU:
|
|
2.2 |
Förklara vilka åtgärder som vidtagits för att säkerställa efterlevnaden av kraven i artiklarna 10 och 28 i direktiv 2010/63/EU när icke-mänskliga primater används. |
3. Undantag
|
3.1 |
Ge sammanfattande information, som omfattar den femåriga rapporteringscykeln, och som beskriver de omständigheter under vilka undantag medgavs i enlighet med artikel 10.3, artikel 12.1 andra stycket och artikel 33.3 i direktiv 2010/63/EU. |
|
3.2 |
Ge information för samma period om sådana exceptionella förhållanden som avses i artikel 16.2 i det berörda direktivet, om återanvändning av ett djur godkändes efter ett försök där djuret enligt bedömning har utsatts för svårt lidande. |
4. Djurskyddsorgan (artiklarna 26 och 27 i direktiv 2010/63/EU)
Förklara de åtgärder som vidtagits för att säkerställa efterlevnaden av kraven avseende djurskyddsorganens struktur och funktion i artiklarna 26 och 27 i direktiv 2010/63/EU.
D. PRINCIPER FÖR ERSÄTTNING, BEGRÄNSNING OCH FÖRFINING
1. Princip för ersättning, begränsning och förfining (artiklarna 4 och 13 i och bilaga VI till direktiv 2010/63/EU)
|
1.1 |
Lämna information om de åtgärder som vidtagits för att säkerställa att principerna för a) ersättning, b) begränsning och c) förfining behandlas på ett tillfredsställande sätt inom godkända projekt i enlighet med artiklarna 4 och 13 i direktiv 2010/63/EU. |
|
1.2 |
Lämna information om de åtgärder som vidtagits för att säkerställa att principerna för a) begränsning och b) förfining behandlas på ett tillfredsställande sätt vid inhysning och skötsel i uppfödnings- och leveransanläggningar i enlighet med artikel 4 i direktiv 2010/63/EU. |
2. Undvikande av dubblering (artikel 46 i direktiv 2010/63/EU)
Förklara hur dubblering av försök undviks för att följa artikel 46 i direktiv 2010/63/EU.
3. Vävnadsprovtagning från genetiskt förändrade djur (artiklarna 4, 30 och 38 i direktiv 2010/63/EU)
|
3.1 |
Med avseende på vävnadsprovtagning för genetisk karakterisering som utförs med och utan projektgodkännande, lämna representativ information och sifferuppgifter om arter, metoder och deras därtill hörande faktiska svårhetsgrad. Denna information ska endast lämnas för det kalenderår som närmast föregår det år då femårsrapporten lämnas in. |
|
3.2 |
Ange de kriterier som används för att säkerställa att informationen i punkt 3.1 är representativ. |
|
3.3 |
Ge information om de ansträngningar som gjorts för att förfina metoderna för vävnadsprovtagning. |
E. GENOMFÖRANDE
1. Godkännande av uppfödare, leverantörer och användare (artiklarna 20 och 21 i direktiv 2010/63/EU)
|
1.1 |
För varje år, ange hur många aktiva godkända uppfödare, leverantörer och användare det finns i varje grupp separat. |
|
1.2 |
Ge sammanfattande information, som omfattar den femåriga rapporteringscykeln, om skäl för tillfälligt återkallande eller indragning av godkännanden av uppfödare, leverantörer och användare. |
2. Inspektioner (artikel 34 i direktiv 2010/63/EU)
|
2.1 |
För varje år, ange antalet inspektioner, uppdelade efter aviserade och oanmälda. |
|
2.2 |
Ge sammanfattande information, som omfattar den femåriga rapporteringscykeln, om de viktigaste resultaten av inspektionerna. |
|
2.3 |
Förklara vilka åtgärder som vidtagits för att säkerställa att kraven i artikel 34.2 i direktiv 2010/63/EU uppfylls. |
3. Indragningar av projektgodkännande (artikel 44 i direktiv 2010/63/EU)
Ge sammanfattande information, som omfattar den femåriga rapporteringscykeln, om orsakerna till att projektgodkännanden dragits in.
4. Sanktioner (artikel 60 i direktiv 2010/63/EU)
|
4.1 |
Ge sammanfattande information, som omfattar den femåriga rapporteringscykeln, om följande:
|
BILAGA III
DEL A
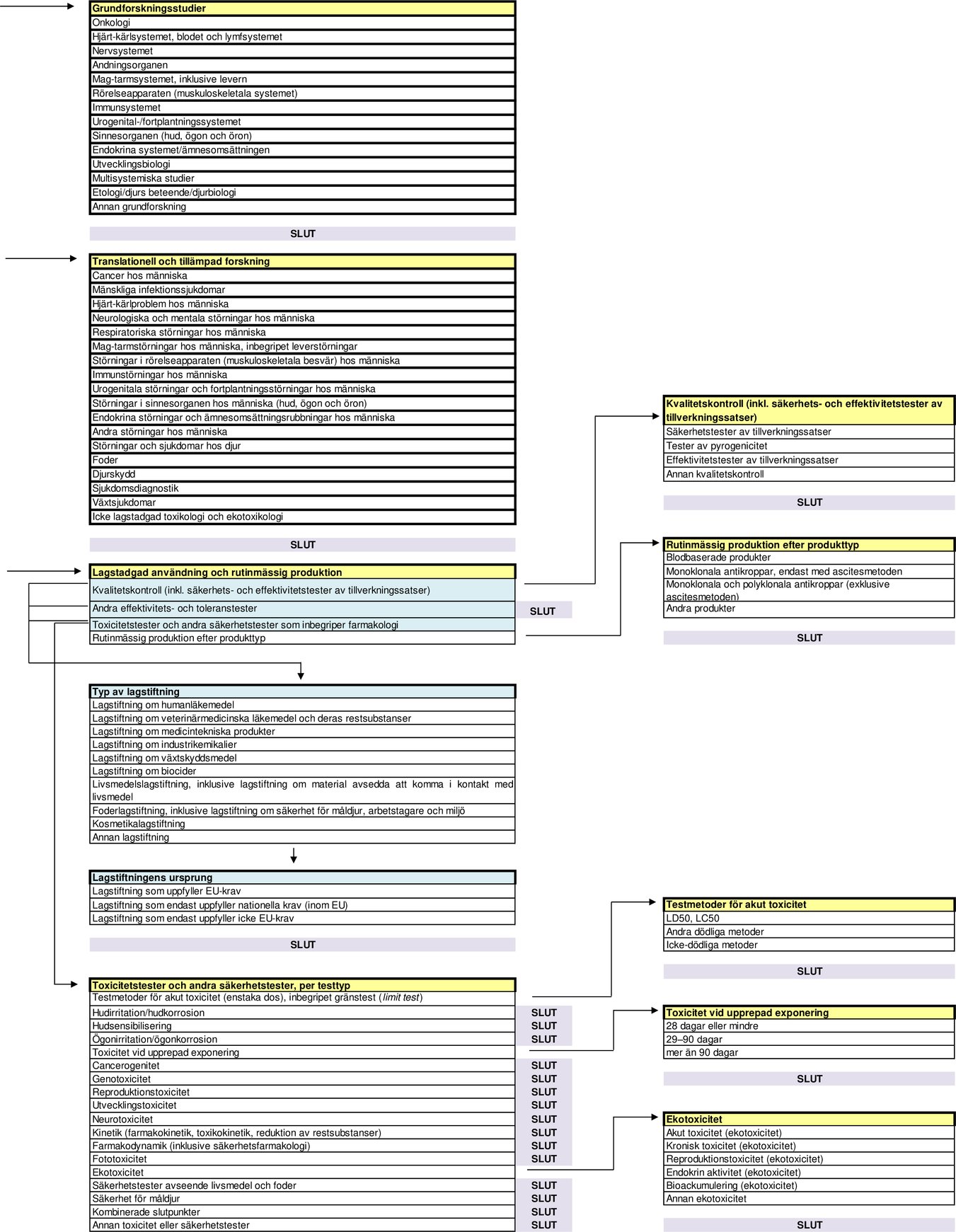
Flödesschema med statistiska uppgiftskategorier enligt artikel 54.2 i direktiv 2010/63/EU

DEL B
Information som avses i artikel 54.2 i direktiv 2010/63/EU
A. ALLMÄNNA BESTÄMMELSER
|
1. |
Uppgifterna ska rapporteras varje gång när ett djur används. |
|
2. |
När uppgifter om ett djur rapporteras ska endast ett alternativ inom en kategori väljas. |
|
3. |
Djur som avlivas för organ och vävnader
|
|
4. |
Djur som föds upp och avlivas utan att användas i ett försök
|
|
5. |
Genetiskt normala djur som föds under framställandet av en ny genetisk stam ska undantas från tillhandahållandet av årliga statistiska uppgifter och ska i stället rapporteras som en del av den femåriga genomföranderapporten i enlighet med bilaga II till detta beslut, såvida inte sådana djur har genotypats med en invasiv metod. |
|
6. |
Larvformer ska inkluderas från det att de själva kan inta föda. |
|
7. |
Däggdjursfoster och -embryon ska inte ingå i rapporteringen av årliga statistiska uppgifter. Endast djur som är födda, även med kejsarsnitt, och som lever ska räknas. När studier involverar både moderdjur och avkomma ska moderdjuret rapporteras när det har varit föremål för ett försök där tröskelvärdet för minsta möjliga smärta, lidande, ångest och bestående men har överskridits. Avkomma ska rapporteras när de utgör en integrerad del av försöket. |
|
8. |
Om användningen av ett djur i ett försök innebär svår smärta, svårt lidande eller svår ångest som är långvarig och inte kan lindras, oberoende av om förhandsgodkännande föreligger eller inte, ska djuret rapporteras under kategorin ”avsevärd svårhet”. I enlighet med avsnitt C i denna bilaga ska uppgifter lämnas i avsnittet ”Beskrivningar från medlemsstaten” avseende arter, antal, huruvida undantag beviljats på förhand, närmare uppgifter om användningen och skälen till att klassificeringen ”avsevärd svårhet” har överskridits. |
|
9. |
Uppgifter om djur som används i ett försök ska rapporteras för det år då försöket avslutas. När det gäller studier som löper över två kalenderår, får samtliga djur rapporteras tillsammans för det år då det sista försöket slutförs, om detta undantag från årlig rapportering godkänns av den behöriga myndigheten. För projekt som löper under längre tid än två kalenderår ska uppgifter om djur rapporteras för det år då djuret avlivas eller dör. |
|
10. |
Om kategorierna ”andra”/”annan” används ska en ny punkt läggas till i beskrivningarna för att ge en mer detaljerad redogörelse av innehållet i ”andra”/”annan”. |
|
11. |
Genetiskt förändrade djur
|
B. UPPGIFTSKATEGORIER
Nedanstående avsnitt redovisas i samma ordning som kategorierna och rubrikerna i flödesschemat i del A.
1. Typ av djur
|
Husmus (Mus musculus) |
|
Brunråtta (Rattus norvegicus) |
|
Marsvin (Cavia porcellus) |
|
Guldhamster (Mesocricetus auratus) |
|
Kinesisk dvärghamster (Cricetulus griseus) |
|
Vanlig ökenråtta (gerbil) (Meriones unguiculatus) |
|
Andra gnagare (andra Rodentia) |
|
Kanin (Oryctolagus cuniculus) |
|
Katt (Felis catus) |
|
Hund (Canis familiaris) |
|
Iller (Mustela putorius furo) |
|
Andra rovdjur (andra Carnivora) |
|
Hästar, åsnor och korsningar (Equidae) |
|
Gris (Sus scrofa domesticus) |
|
Get (Capra aegagrus hircus) |
|
Får (Ovis aries) |
|
Nötkreatur (Bos taurus) |
|
Halvapor (Prosimia) |
|
Silkesapor och tamariner (t.ex. Callithrix jacchus) |
|
Krabbmakak (Macaca fascicularis) |
|
Rhesusapa (Macaca mulatta) |
|
Grön markatta (Chlorocebus spp.) (vanligtvis antingen pygerythrus eller sabaeus) |
|
Babianer (Papio spp.) |
|
Dödskalleapor (t.ex. Saimiri sciureus) |
|
Andra arter av västapor (andra arter av Ceboidea) |
|
Andra arter av östapor (andra arter av Cercopithecoidea) |
|
Människoartade primater (Hominoidea) |
|
Andra däggdjur (andra Mammalia) |
|
Tamhöna (Gallus gallus domesticus) |
|
Kalkon (Meleagris gallopavo) |
|
Andra fåglar (andra Aves) |
|
Kräldjur (Reptilia) |
|
Grodor (Rana temporaria och Rana pipiens) |
|
Klogrodor (Xenopus laevis och Xenopus tropicalis) |
|
Andra groddjur (andra Amphibia) |
|
Sebrafisk (Danio rerio) |
|
Havsabborrfiskar (arter från familjer som t.ex. Serranidae, Moronidae) |
|
Lax, öring, röding och harr (Salmonidae) |
|
Levandefödande tandkarpar (Poeciliidae) |
|
Andra fiskar (andra Pisces) |
|
Bläckfiskar (Cephalopoda) |
|
1.1 |
Fiskar ska rapporteras från det stadium då de själva kan inta föda när tarmen är helt öppen, och fiskarna normalt skulle äta mat. |
|
1.2 |
Den tidpunkt vid vilken fiskar självständigt kan inta föda är olika för varje art och i många fall beroende av den temperatur vid vilken de hålls. Temperaturen bör ställas in för att bibehålla optimalt välbefinnande, enligt vad som fastställts av den person som ansvarar för djurens välbefinnande och skötsel, och för artspecifik information i samordning med den utsedda veterinären. Sebrafiskyngel, som hålls vid cirka + 28 °C, ska rapporteras 5 dagar efter befruktningen. |
|
1.3 |
På grund av vissa fisk- och bläckfiskarters ringa storlek får räkningen göras genom uppskattning. |
|
1.4 |
Alla bläckfiskarter ska rapporteras under rubriken ”bläckfiskar” från det stadium då djuret själv kan inta föda, det vill säga omedelbart efter kläckningen. |
2. Återanvändning
|
Återanvändning (nej/ja) |
|
2.1 |
Allmänt
|
|
2.2 |
Återanvändning kontra fortsatt användning
För att avgöra om det är fråga om återanvändning ska följande gälla:
|
3. Andra arter än icke-mänskliga primater – födelseort
|
Djur födda hos en godkänd uppfödare i unionen |
|
Djur födda i unionen men inte hos en godkänd uppfödare |
|
Djur födda i övriga Europa |
|
Djur födda någon annanstans |
|
3.1 |
Ursprunget bestäms av födelseorten, dvs. den plats där djuret är fött, och inte den plats från vilken det har levererats. |
|
3.2 |
”Djur födda hos en godkänd uppfödare i unionen” avser djur som fötts hos uppfödare som är godkända och registrerade enligt artikel 20 i direktiv 2010/63/EU. |
|
3.3 |
”Djur födda i unionen men inte hos en godkänd uppfödare” omfattar bland annat vilda djur, husdjur (om inte uppfödaren är godkänd enligt artikel 20 i direktiv 2010/63/EU), samt alla undantag som beviljats enligt artikel 10.3 i direktiv 2010/63/EU. |
|
3.4 |
”Djur födda i övriga Europa” omfattar bland annat djur födda i Schweiz, Turkiet, Ryssland och Israel, och i denna kategori sammanförs alla djur, oavsett om de har fötts upp i registrerade uppfödningsanläggningar eller i andra anläggningar, och kategorin omfattar också bland annat djur som har fångats i naturen. |
|
3.5 |
”Djur födda någon annanstans” är en kategori där alla djur sammanförs, oavsett om de har fötts upp i registrerade uppfödningsanläggningar eller i andra anläggningar, och kategorin omfattar också bland annat djur som fångats i naturen. |
4. Icke-mänskliga primater – födelseort
|
Icke-mänskliga primater födda hos en godkänd uppfödare i unionen |
|
Icke-mänskliga primater födda i unionen men inte hos en godkänd uppfödare, och icke-mänskliga primater födda i övriga Europa |
|
Icke-mänskliga primater födda i Asien |
|
Icke-mänskliga primater födda i Amerika |
|
Icke-mänskliga primater födda i Afrika |
|
Icke-mänskliga primater födda någon annanstans |
|
4.1 |
Ursprunget bestäms av födelseorten, dvs. den plats där djuret är fött, och inte den plats från vilken det har levererats. |
|
4.2 |
”Icke-mänskliga primater födda hos en godkänd uppfödare i unionen” (och Norge) avser icke-mänskliga primater födda hos uppfödare som är godkända och registrerade enligt artikel 20 i direktiv 2010/63/EU. |
|
4.3 |
”Icke-mänskliga primater födda i unionen men inte hos en godkänd uppfödare, och icke-mänskliga primater födda i övriga Europa” omfattar bland annat djur födda i Schweiz, Turkiet, Ryssland och Israel. |
|
4.4 |
”Icke-mänskliga primater födda i Asien” omfattar bland annat djur födda i Kina. |
|
4.5 |
”Icke-mänskliga primater födda i Amerika” avser djur födda i Nord-, Central- och Sydamerika. |
|
4.6 |
”Icke-mänskliga primater födda i Afrika” omfattar även djur födda i Mauritius. |
|
4.7 |
”Icke-mänskliga primater födda någon annanstans” omfattar även djur födda i Australasien. Ursprung för icke-mänskliga primater födda någon annanstans ska rapporteras. |
5. Icke-mänskliga primater – kolonityp
|
Självförsörjande koloni (nej/ja) |
”Självförsörjande koloni” avser icke-mänskliga primater som erhållits från en koloni i vilken djuren föds upp endast inom kolonin eller kommer från andra självförsörjande kolonier, men inte fångas i naturen, och i vilken djuren hålls på ett sätt som säkerställer att de är vana vid människor.
6. Icke-mänskliga primater – generation
|
F0 |
|
F1 |
|
F2 eller senare |
|
6.1 |
”F0” avser djur som fångas i naturen. |
|
6.2 |
”F1” avser djur som föds i fångenskap och är avkomma till föräldradjur varav det ena eller båda fångades i naturen. |
|
6.3 |
”F2 eller senare” avser djur som föds i fångenskap och är avkomma till föräldradjur som också fötts i fångenskap. |
7. Genetisk status
|
Icke genetiskt förändrad |
|
Genetiskt förändrad utan skadlig fenotyp |
|
Genetiskt förändrad med skadlig fenotyp |
|
7.1 |
”Icke genetiskt förändrad” avser alla djur som inte har blivit genetiskt förändrade, inbegripet även genetiskt normala föräldradjur som används för att framställa en ny genetiskt förändrad djurstam. |
|
7.2 |
”Genetiskt förändrad utan skadlig fenotyp” avser följande:
|
|
7.3 |
”Genetiskt förändrad med skadlig fenotyp” avser följande:
|
8. Framställande av en ny genetiskt förändrad stam
|
Djur som används för att framställa en ny genetiskt förändrad stam (nej/ja) |
Med djur som används för att framställa en ny genetiskt förändrad stam avses djur som används för att framställa en ny genetiskt förändrad stam, till skillnad från andra djur som används för ”grundforskning” eller ”translationell och tillämpad forskning”. Detta inbegriper korsning av olika stammar för att framställa en ny genetiskt förändrad stam där fenotypen för den nya stammen inte på förhand kan fastställas som icke-skadlig.
9. Svårhetsgrad
|
Terminal |
|
Ringa svårhet (upp till och med) |
|
Måttlig svårhet |
|
Avsevärd svårhet |
|
9.1 |
Faktisk svårhetsgrad ska rapporteras för varje enskilt djur med hänsyn till de allvarligaste effekter som djuret upplever under loppet av hela försöket. Dessa effekter kan inträffa under vilket som helst av stegen (inte nödvändigtvis det sista) i ett försök med flera steg. Den faktiska svårhetsgraden kan vara högre eller lägre än den i förväg förväntade klassificeringen. Kumulativt lidande ska också beaktas vid bestämmandet av faktisk svårhetsgrad. |
|
9.2 |
Svårhetskategorier
|
|
9.3 |
Djur som påträffas döda
|
|
9.4 |
Fångst och transport av djur som fångats i naturen
Den faktiska svårhetsgraden ska endast avse effekterna av det vetenskapliga försök som utförts på detta djur. Fångst och transport (om inte dessa är de specifika syftena eller en del av syftet med de vetenskapliga försöken) ska därför inte beaktas vid rapporteringen av faktisk svårhetsgrad, även om djuret dör under fångsten eller transporten. |
10. Syften
|
Grundforskning |
|
Translationell och tillämpad forskning |
|
Lagstadgad användning och rutinmässig produktion |
|
Skydd av den naturliga miljön för att bevara människors eller djurs hälsa eller välfärd |
|
Artskydd |
|
Högre utbildning |
|
Utbildning för att förvärva, vidmakthålla eller förbättra yrkesfärdigheter |
|
Rättsmedicinska undersökningar |
|
Upprätthållande av kolonier av etablerade genetiskt förändrade djur som inte används i andra försök |
|
10.1 |
Grundforskning
|
|
10.2 |
Translationell och tillämpad forskning
|
|
10.3 |
Lagstadgad användning och rutinmässig produktion
|
|
10.4 |
Skydd av den naturliga miljön för att bevara människors eller djurs hälsa eller välfärd
|
|
10.5 |
Högre utbildning
Denna kategori avser djur som används för att tillhandahålla teoretiska kunskaper inom ett högre utbildningsprogram. |
|
10.6 |
Utbildning för att förvärva, vidmakthålla eller förbättra yrkesfärdigheter
Denna kategori avser djur som används i utbildningssyfte för att förvärva och vidmakthålla yrkesfärdigheter, t.ex. sådana djur som används i utbildningen av läkare. |
|
10.7 |
Upprätthållande av kolonier av etablerade genetiskt förändrade djur som inte används i andra försök
|
11. Grundforskningsstudier
|
Onkologi |
|
Hjärt-kärlsystemet, blodet och lymfsystemet |
|
Nervsystemet |
|
Andningsorganen |
|
Mag-tarmsystemet, inklusive levern |
|
Rörelseapparaten (muskuloskeletala systemet) |
|
Immunsystemet |
|
Urogenital-/fortplantningssystemet |
|
Sinnesorganen (hud, ögon och öron) |
|
Endokrina systemet/ämnesomsättningen |
|
Utvecklingsbiologi |
|
Multisystemiska studier |
|
Etologi/beteende hos djur/djurbiologi |
|
Annan grundforskning |
|
11.1 |
Onkologi
All forskning i onkologi ska inkluderas i denna kategori oberoende av målsystem. |
|
11.2 |
Nervsystemet
Denna kategori omfattar bland annat neurovetenskap, studier av perifera och centrala nervsystemet, samt psykologi. |
|
11.3 |
Rörelseapparaten (muskuloskeletala systemet)
I denna kategori ingår bland annat tandvård. |
|
11.4 |
Sinnesorganen (hud, ögon och öron)
Studier om näsan ska rapporteras under ”Andningsorganen” och studier om tungan under ”Mag-tarmsystemet, inklusive levern”. |
|
11.5 |
Utvecklingsbiologi omfattar studier av förändringar hos en organism från embryogenes (när de inte utförs som en del av reproduktionstoxicitetsstudier), till tillväxt, åldrande och död, och innefattar bland annat celldifferentiering, vävnadsdifferentiering och organogenes. |
|
11.6 |
Multisystemiska studier
Denna kategori ska endast omfatta forskning där fler än ett system är av huvudsakligt intresse, t.ex. forskning om vissa infektionssjukdomar. Onkologi omfattas inte. |
|
11.7 |
Kategorin ”Etologi/djurs beteende/djurbiologi” omfattar studier av både djur i det vilda och djur i fångenskap med det huvudsakliga målet att fördjupa kunskaperna om en specifik art. |
|
11.8 |
Annan grundforskning
|
|
11.9 |
Anmärkningar
|
|
12. |
Translationell och tillämpad forskning
|
|
12.1 |
All tillämpad forskning om cancer hos människa ska inkluderas i kategorin ”Cancer hos människa” oberoende av målsystem. |
|
12.2 |
All tillämpad forskning om mänskliga infektionssjukdomar ska ingå i kategorin ”Mänskliga infektionssjukdomar” oberoende av målsystem. |
|
12.3 |
All lagstadgad användning av djur, såsom lagstadgade cancerogenitetsstudier, ska undantas från kategorin ”Translationell och tillämpad forskning” och rapporteras under kategorin ”Lagstadgad användning och rutinmässig produktion”. |
|
12.4 |
Studier om näsåkommor ska rapporteras under ”Respiratoriska störningar hos människa” och studier om störningar i tungan under ”Mag-tarmsystemet, inklusive levern”. |
|
12.5 |
Innan kategorin ”Andra störningar hos människa” används måste det noggrant kontrolleras och säkerställas att ingen av de fördefinierade kategorierna kan användas. |
|
12.6 |
Kategorin ”Sjukdomsdiagnostik” omfattar bland annat djur som används i direkt diagnosticering av exempelvis rabies och botulism, men inte djur som omfattas av lagstadgad användning. |
|
12.7 |
Kategorin ”Icke lagstadgad toxikologi och ekotoxikologi” avser utforskande toxikologi, utredningar för att förbereda en registreringsansökan och metodutveckling. Denna kategori omfattar inte studier som krävs för registreringsansökningar (preliminära studier, bestämning av maximal tolererad dos). Dosfinnande studier, när de utförs i syfte att uppfylla lagstiftningskrav, är också undantagna och omfattas av ”Lagstadgad användning och rutinmässig produktion” under ”Andra effektivitets- och toleranstester”. |
|
12.8 |
”Djurskydd” avser studier för de syften som anges i artikel 5 b iii i direktiv 2010/63/EU. |
|
12.9 |
Anmärkningar
|
13. Lagstadgad användning och rutinmässig produktion
|
Kvalitetskontroll (inkl. säkerhets- och effektivitetstester av tillverkningssatser) |
|
Andra effektivitets- och toleranstester |
|
Toxicitetstester och andra säkerhetstester som inbegriper farmakologi |
|
Rutinmässig produktion efter produkttyp |
|
13.1 |
Effektivitetstester som genomförs under utvecklandet av nya läkemedel omfattas inte, utan ska i stället rapporteras i kategorin ”Translationell och tillämpad forskning”. |
|
13.2 |
Kvalitetskontroll avser djur som använts vid tester av renhet, stabilitet, effektivitet, styrka och andra parametrar för kvalitetskontroll av slutprodukten och dess beståndsdelar samt alla kontroller som utförts under tillverkningsprocessen för registreringsändamål, för att uppfylla andra nationella eller internationella lagstadgade krav eller för att efterleva tillverkarens interna policy. Detta inkluderar bland annat tester av pyrogenicitet. |
|
13.3 |
Andra effektivitets- och toleranstester
Effektivitetstester av biocider och bekämpningsmedel ingår i denna kategori, liksom även toleranstester av fodertillsatser. Kategorin omfattar också dosfinnande studier när de genomförs i syfte att uppfylla lagstiftningskraven. |
|
13.4 |
Toxicitetstester och andra säkerhetstester (inklusive säkerhetsutvärdering av produkter och utrustning för humanmedicin och tandvård och veterinärmedicin).
|
|
13.5 |
Rutinmässig produktion efter produkttyp
|
14. Kvalitetskontroll (inkl. säkerhets- och effektivitetstester av tillverkningssatser)
|
Säkerhetstester av tillverkningssatser |
|
Tester av pyrogenicitet |
|
Effektivitetstester av tillverkningssatser |
|
Annan kvalitetskontroll |
Säkerhetstester av tillverkningssatser omfattar inte tester av pyrogenicitet, vilket ska rapporteras separat under ”Tester av pyrogenicitet”.
15. Toxicitetstester och andra säkerhetstester, per testtyp
|
Testmetoder för akut toxicitet (enstaka dos), inbegripet gränstest (limit test) |
|
Hudirritation/hudkorrosion |
|
Hudsensibilisering |
|
Ögonirritation/ögonkorrosion |
|
Toxicitet vid upprepad exponering |
|
Cancerogenitet |
|
Genotoxicitet |
|
Reproduktionstoxicitet |
|
Utvecklingstoxicitet |
|
Neurotoxicitet |
|
Kinetik (farmakokinetik, toxikokinetik, reduktion av restsubstanser) |
|
Farmakodynamik (inklusive säkerhetsfarmakologi) |
|
Fototoxicitet |
|
Ekotoxicitet |
|
Säkerhetstester avseende livsmedel och foder |
|
Säkerhet för måldjur |
|
Kombinerade slutpunkter |
|
Annan toxicitet eller säkerhetstester |
|
15.1 |
”Toxicitet vid upprepad exponering” omfattar även immuntoxikologiska studier. |
|
15.2 |
”Reproduktionstoxicitet” omfattar bland annat utvidgade undersökningar av reproduktionstoxicitet på en enda generation, även när det inbegriper kohorter för utvecklingsmässig neuro- och immunotoxicitet. |
|
15.3 |
”Utvecklingstoxicitet” omfattar även studier i utvecklingsneurotoxicitet. Utvidgade undersökningar av reproduktionstoxicitet på en enda generation, inklusive kohorter för utvecklingsneurotoxicitet, ska rapporteras under reproduktionstoxicitet. |
|
15.4 |
”Neurotoxicitet” omfattar bland annat akuta fördröjda effekter (t.ex. fördröjd neurotoxicitet orsakad av organiska fosforföreningar till följd av akut exponering) och studier av upprepad exponering med avseende på neurotoxicitet, men utesluter utvecklingsneurotoxicitet. Utvidgade undersökningar av reproduktionstoxicitet på en enda generation, inklusive kohorter för utvecklingsneurotoxicitet, ska rapporteras under reproduktionstoxicitet. |
|
15.5 |
”Kinetik” avser farmakokinetik, toxikokinetik och reduktion av restsubstanser. Om testning för toxikokinetik utförs som en del av den lagstadgade studien av toxicitet vid upprepad exponering ska den dock rapporteras under ”Toxicitet vid upprepad exponering”. |
|
15.6 |
”Säkerhetstester avseende livsmedel och foder” omfattar även tester av dricksvatten (inbegripet tester av säkerhet för måldjur). |
|
15.7 |
”Säkerhet för måldjur” är tester för att säkerställa att en produkt för ett visst djur kan användas säkert för den arten (och omfattar alltså inte säkerhetstester av tillverkningssatser, vilka omfattas av kategorin kvalitetskontroll). |
|
15.8 |
”Kombinerade slutpunkter” omfattar bland annat kombinationen av studier av cancerogenitet och kronisk toxicitet samt screeningstudier som kombinerar reproduktionstoxicitet och toxicitet vid upprepad exponering. |
16. Testmetoder för akut toxicitet
|
LD50, LC50 |
|
Andra dödliga metoder |
|
Icke-dödliga metoder |
|
16.1 |
Underkategorin ska rapporteras på grundval av den typ av metod som används och inte på grundval av den svårhetsgrad som påfrestningen innebär för djuret då denna metod har tillämpats. |
|
16.2 |
”LD50, LC50” avser endast testmetoder som ger en punktskattning för LD50/LC50 såsom OECD:s testriktlinjer 203, 403 och 425. |
|
16.3 |
Med ”Andra dödliga metoder” avses de metoder som kategoriserar substanser i en klass, det vill säga metoder som innebär tilldelning av ett intervall där LD50 skulle falla, såsom fasta doseringsmetoder och metoder för bestämning av akut toxicitetsklass. Det är troligt att ett antal dödsfall kommer att inträffa, men inte lika många som förväntas om metoder av typen LD50 tillämpas. |
17. Toxicitet vid upprepad exponering
|
28 dagar eller mindre |
|
29–90 dagar |
|
mer än 90 dagar |
18. Ekotoxicitet
|
Akut toxicitet (ekotoxicitet) |
|
Kronisk toxicitet (ekotoxicitet) |
|
Reproduktionstoxicitet (ekotoxicitet) |
|
Endokrin aktivitet (ekotoxicitet) |
|
Bioackumulering (ekotoxicitet) |
|
Annan ekotoxicitet |
|
18.1 |
Ekotoxicitet avser toxicitet i samband med vatten- och landmiljön. |
|
18.2 |
Ekotoxicitetsstudier som behandlar kortvarig toxicitet för bestämning av LC/LD50 ska rapporteras under ”Akut toxicitet (ekotoxicitet)”. |
|
18.3 |
Ekotoxicitetsstudier som behandlar långvarig toxicitet, till exempel tidiga livscykeltester eller fullständiga livscykeltester, ska rapporteras under ”Kronisk toxicitet (ekotoxicitet)”. |
|
18.4 |
Ekotoxicitetsstudier som utförs för att i första hand bedöma substansers hormonella egenskaper och behandla exempelvis metamorfos, utveckling och tillväxt hos groddjur, samt sexuell utveckling och reproduktion hos fiskar ska rapporteras under ”Endokrin aktivitet (ekotoxicitet)”. |
19. Typ av lagstiftning
|
Lagstiftning om humanläkemedel |
|
Lagstiftning om veterinärmedicinska läkemedel och deras restsubstanser |
|
Lagstiftning om medicintekniska produkter |
|
Lagstiftning om industrikemikalier |
|
Lagstiftning om växtskyddsmedel |
|
Lagstiftning om biocider |
|
Livsmedelslagstiftning, inklusive lagstiftning om material avsedda att komma i kontakt med livsmedel |
|
Foderlagstiftning, inklusive lagstiftning om säkerhet för måldjur, arbetstagare och miljö |
|
Kosmetikalagstiftning |
|
Annan lagstiftning |
|
19.1 |
Typen av lagstiftning ska inte rapporteras för djur vars användning omfattas av kategorin ”Rutinmässig produktion”. |
|
19.2 |
Typen av lagstiftning ska rapporteras med hänvisning till det avsedda primära användningssyftet. |
|
19.3 |
Provning av vattenkvaliteten, annat än av avloppsvatten, ska rapporteras under ”Livsmedelslagstiftning”. Kvalitetsprovning av avloppsvatten ska rapporteras under ”Annan lagstiftning”. |
20. Lagstiftningens ursprung
|
Lagstiftning som uppfyller unionskrav |
|
Lagstiftning som endast uppfyller nationella krav (inom unionen) |
|
Lagstiftning som endast uppfyller icke unionskrav |
|
20.1 |
Lagstiftningens ursprung ska inte rapporteras för djur vars användning omfattas av kategorin ”Rutinmässig produktion”. |
|
20.2 |
Användningen ska rapporteras med hänvisning till den region för vilken provningen utförs, inte var den utförs. |
|
20.3 |
Om den nationella lagstiftningen härrör från unionslagstiftningen ska användningen rapporteras under ”Lagstiftning som uppfyller unionskrav”. |
|
20.4 |
”Lagstiftning som uppfyller unionskrav” omfattar också alla internationella krav som samtidigt uppfyller unionskrav (såsom tester enligt riktlinjer från ICH (1), VICH (2) eller OECD och monografier i Europeiska farmakopén). |
|
20.5 |
Om provningen utförs för att uppfylla lagstiftningen i en eller flera medlemsstater (inte nödvändigtvis den där provningen utförs), och kravet inte härrör från unionslagstiftningen, ska användningen rapporteras under ”Lagstiftning som endast uppfyller nationella krav (inom EU)”. |
|
20.6 |
”Lagstiftning som endast uppfyller icke unionskrav” ska väljas enbart när det inte finns något motsvarande krav att utföra provningen i syfte att efterleva unionslagstiftning. |
21. Rutinmässig produktion efter produkttyp
|
Blodbaserade produkter |
|
Monoklonala antikroppar, endast med ascitesmetoden |
|
Monoklonala och polyklonala antikroppar (exklusive ascitesmetoden) |
|
Andra produkter |
|
21.1 |
Rutinmässig produktion efter produkttyp omfattar produktion av antikroppar och blodprodukter genom etablerade metoder. Detta utesluter immunisering av djur för efterföljande hybridomproduktion när den utförs i syftet grundforskning eller tillämpad forskning inom ett givet projekt. Den immuniseringen ska tas upp under grundforskning eller tillämpad undersökning under lämplig kategori. |
|
21.2 |
All användning av ascitesmetoden för odling av monoklonala antikroppar ska rapporteras under ”Monoklonala antikroppar, endast med ascitesmetoden”. |
|
21.3 |
Användning av djur för produktion av antikroppar för kommersiella ändamål, inklusive immunisering för den efterföljande hybridomproduktionen, ska rapporteras under ”Monoklonala och polyklonala antikroppar (exklusive ascitesmetoden)”. |
C. BESKRIVNINGAR FRÅN MEDLEMSSTATEN
|
1. |
Medlemsstaterna ska lämna en beskrivning av de statistiska uppgifterna. Denna beskrivning ska innehålla följande:
|
|
2. |
Vid tillämpning av punkt 1 g ska följande rapporteras:
|
(1) Internationella konferensen om harmonisering av tekniska krav för registrering av humanläkemedel.
(2) International Cooperation on Harmonisation of Technical Requirements for Registration of Veterinary Medicinal Products.
BILAGA IV
MALL FÖR DEN INFORMATION SOM AVSES I ARTIKEL 54.3 I DIREKTIV 2010/63/EU
|
Medlemsstat: |
År: |
|
Typ av metod |
Art |
Motivering |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
BILAGA V
JÄMFÖRELSETABELL
|
Genomförandebeslut 2012/707/EU |
Detta beslut |
|
Artikel 1 |
Artikel 2 |
|
Artikel 2 |
Artikel 3 |
|
Artikel 3 |
Artikel 4 |
|
Artikel 4 |
Artikel 6 |
|
BILAGA I |
BILAGA II |
|
BILAGA II |
BILAGA III |
|
BILAGA III |
BILAGA IV |