ISSN 1977-0820
Europeiska unionens
officiella tidning
L 204

Svensk utgåva
Lagstiftning
62 årgången
2 augusti 2019
|
ISSN 1977-0820 |
||
|
Europeiska unionens officiella tidning |
L 204 |
|

|
||
|
Svensk utgåva |
Lagstiftning |
62 årgången |
|
|
|
|
|
(1) Text av betydelse för EES. |
|
SV |
De rättsakter vilkas titlar är tryckta med fin stil är sådana rättsakter som har avseende på den löpande handläggningen av jordbrukspolitiska frågor. De har normalt en begränsad giltighetstid. Beträffande alla övriga rättsakter gäller att titlarna är tryckta med fetstil och föregås av en asterisk. |
II Icke-lagstiftningsakter
FÖRORDNINGAR
|
2.8.2019 |
SV |
Europeiska unionens officiella tidning |
L 204/1 |
RÅDETS GENOMFÖRANDEFÖRORDNING (EU) 2019/1292
av den 31 juli 2019
om genomförande av artikel 21.2 i förordning (EU) 2016/44 om restriktiva åtgärder med hänsyn till situationen i Libyen
EUROPEISKA UNIONENS RÅD HAR ANTAGIT DENNA FÖRORDNING
med beaktande av fördraget om Europeiska unionens funktionssätt,
med beaktande av rådets förordning (EU) 2016/44 av den 18 januari 2016 om restriktiva åtgärder med hänsyn till situationen i Libyen och om upphävande av förordning (EU) nr 204/2011 (1), särskilt artikel 21.2,
med beaktande av förslaget från unionens höga representant för utrikes frågor och säkerhetspolitik, och
av följande skäl:
|
(1) |
Den 18 januari 2016 antog rådet förordning (EU) 2016/44. |
|
(2) |
I enlighet med artikel 21.6 i förordning (EU) 2016/44 har rådet sett över förteckningen över uppförda personer och enheter i bilaga III till den förordningen. |
|
(3) |
Posterna för två personer bör strykas från förteckningen över personer och enheter i bilaga III till förordning (EU) 2016/44. |
|
(4) |
Bilaga III till förordning (EU) 2016/44 bör därför ändras i enlighet med detta. |
HÄRIGENOM FÖRESKRIVS FÖLJANDE.
Artikel 1
Bilaga III till förordning (EU) 2016/44 ska ändras i enlighet med bilagan till den här förordningen.
Artikel 2
Denna förordning träder i kraft dagen efter det att den har offentliggjorts i Europeiska unionens officiella tidning.
Denna förordning är till alla delar bindande och direkt tillämplig i alla medlemsstater.
Utfärdad i Bryssel den 31 juli 2019.
På rådets vägnar
T. TUPPURAINEN
Ordförande
BILAGA
I bilaga III (Förteckning över de fysiska och juridiska personer och enheter som avses i artikel 6.2) till förordning (EU) 2016/44, ska posterna 1 (om ABDUSSALAM, Abdussalam Mohammed) och 14 (om AL-BAGHDADI, Dr Abdulqader Mohammed) strykas från förteckningen i del A (Personer) och de kvarvarande posterna omnumreras i enlighet därmed.
|
2.8.2019 |
SV |
Europeiska unionens officiella tidning |
L 204/3 |
KOMMISSIONENS GENOMFÖRANDEFÖRORDNING (EU) 2019/1293
av den 29 juli 2019
om ändring av genomförandeförordning (EU) nr 577/2013 vad gäller förteckningen över territorier och tredjeländer i bilaga II och förlagan till djurhälsointyg för hundar, katter och illrar i bilaga IV
(Text av betydelse för EES)
EUROPEISKA KOMMISSIONEN HAR ANTAGIT DENNA FÖRORDNING
med beaktande av fördraget om Europeiska unionens funktionssätt,
med beaktande av Europaparlamentets och rådets förordning (EU) nr 576/2013 av den 12 juni 2013 om förflyttning av sällskapsdjur utan kommersiellt syfte och om upphävande av förordning (EG) nr 998/2003 (1), särskilt artikel 13.2 och 25.2, och
av följande skäl:
|
(1) |
I kommissionens genomförandeförordning (EU) nr 577/2013 (2) fastställs bland annat de förteckningar över territorier och tredjeländer som avses i artikel 13 i förordning (EU) nr 576/2013 och det djurhälsointyg som krävs för förflyttning utan kommersiellt syfte till en medlemsstat av hundar, katter och illrar från territorier och tredjeländer. |
|
(2) |
Genomförandeförordning (EU) nr 577/2013 införlivades i EES-avtalet genom gemensamma EES-kommitténs beslut nr 66/2016 (3) och är fullt ut tillämplig på Norge på samma sätt som för EU-medlemsstaterna. |
|
(3) |
Norge är förtecknat i del 1 i bilaga II till genomförandeförordning (EU) nr 577/2013. I gemensamma EES-kommitténs beslut nr 66/2016 regleras förflyttning utan kommersiellt syfte till en medlemsstat av hundar, katter och illrar från Norge. Därför är det nödvändigt att stryka Norge från förteckningen över territorier och tredjeländer i del 1 i bilaga II till genomförandeförordning (EU) nr 577/2013. |
|
(4) |
Det är också nödvändigt att ange f.d. jugoslaviska republiken Makedoniens nya namn i förteckningen över territorier och tredjeländer i del 2 i bilaga II till genomförandeförordning (EU) nr 577/2013. |
|
(5) |
I förordning (EU) nr 576/2013 föreskrivs, bland annat, att hundar, katter och illrar som förflyttas utan kommersiellt syfte till en medlemsstat från ett territorium eller ett tredjeland ska uppfylla alla förebyggande hälsoåtgärder mot andra sjukdomar eller infektioner än rabies som antagits i enlighet med artikel 19.1 och ska åtföljas av en identitetshandling i form av ett djurhälsointyg. I del 1 i bilaga IV till kommissionens genomförandeförordning (EU) nr 577/2013 fastställs förlagan till djurhälsointyget. |
|
(6) |
Efter den obligatoriska översynen av kommissionens delegerade förordning (EU) nr 1152/2011 (4) antog kommissionen delegerad förordning (EU) 2018/772 (5) som bland annat fastställer bestämmelserna för kategorisering av medlemsstater eller delar därav när det gäller huruvida de har rätt att tillämpa dessa förebyggande hälsoåtgärder för kontroll av infektion med Echinococcus multilocularis hos hundar. Genom delegerad förordning (EU) 2018/772 upphävdes delegerad förordning (EU) nr 1152/2011 med verkan den 1 juli 2018. |
|
(7) |
Den förteckning över medlemsstater som uppfyller villkoren för kategorisering som fastställs i delegerad förordning (EU) 2018/772 för hela sitt territorium eller delar därav fastställs i bilagan till kommissionens genomförandeförordning (EU) 2018/878 (6). |
|
(8) |
Därför bör man ersätta hänvisningarna till delegerad förordning (EU) nr 1152/2011 med hänvisningar till delegerad förordning (EU) 2018/772 och till genomförandeförordning (EU) 2018/878 i förlagan för hälsointyg i bilaga IV till genomförandeförordning (EU) nr 577/2013. |
|
(9) |
Bilagorna II och IV till genomförandeförordning (EU) nr 577/2013 bör därför ändras i enlighet med detta. |
|
(10) |
För att undvika eventuella störningar i förflyttningen av hundar, katter och illrar bör djurhälsointyg som utfärdats i enlighet med del 1 i bilaga IV till genomförandeförordning (EU) nr 577/2013, i dess ändrade lydelse enligt kommissionens genomförandeförordning (EU) 2016/561 (7), få användas till och med den 28 februari 2020. |
|
(11) |
De åtgärder som föreskrivs i denna förordning är förenliga med yttrandet från ständiga kommittén för växter, djur, livsmedel och foder. |
HÄRIGENOM FÖRESKRIVS FÖLJANDE.
Artikel 1
Genomförandeförordning (EU) nr 577/2013 ska ändras på följande sätt:
|
1. |
Del 1 i bilaga II ska ersättas med texten i bilaga I till den här förordningen. |
|
2. |
Del 2 i bilaga II ska ersättas med texten i bilaga II till den här förordningen. |
|
3. |
Del 1 i bilaga IV ska ersättas med texten i bilaga III till den här förordningen. |
Artikel 2
Under en övergångsperiod till och med den 28 februari 2020 ska medlemsstaterna tillåta införsel av hundar, katter och illrar som förflyttas utan kommersiellt syfte till en medlemsstat från ett territorium eller tredjeland och som åtföljs av ett djurhälsointyg som utfärdats senast den 31 oktober 2019 enligt förlagan i del 1 i bilaga IV till genomförandeförordning (EU) nr 577/2013 i dess ändrade lydelse enligt genomförandeförordning (EU) 2016/561.
Artikel 3
Denna förordning träder i kraft den tjugonde dagen efter det att den har offentliggjorts i Europeiska unionens officiella tidning.
Den ska tillämpas från och med den 1 november 2019.
Denna förordning är till alla delar bindande och direkt tillämplig i alla medlemsstater.
Utfärdad i Bryssel den 29 juli 2019.
På kommissionens vägnar
Jean-Claude JUNCKER
Ordförande
(1) EUT L 178, 28.6.2013, s. 1.
(2) Kommissionens genomförandeförordning (EU) nr 577/2013 av den 28 juni 2013 om förlagan till identitetshandlingar för förflyttning av hundar, katter och illrar utan kommersiellt syfte, om fastställande av förteckningar över territorier och tredjeländer samt om krav på format, utformning och språk för de förklaringar som visar att vissa villkor som fastställs i Europaparlamentets och rådets förordning (EU) nr 576/2013 uppfyllts (EUT L 178, 28.6.2013, s. 109).
(3) Gemensamma EES-kommitténs beslut nr 66/2016 av den 29 april 2016 om ändring av bilaga I (Veterinära frågor och växtskyddsfrågor) till EES-avtalet [2017/2017] (EUT L 300, 16.11.2017, s. 1).
(4) Kommissionens delegerade förordning (EU) nr 1152/2011 av den 14 juli 2011 som kompletterar Europaparlamentets och rådets förordning (EG) nr 998/2003 vad gäller förebyggande hälsoåtgärder för kontroll av infektion med Echinococcus multilocularis hos hundar (EUT L 296, 15.11.2011, s. 6).
(5) Kommissionens delegerade förordning (EU) 2018/772 av den 21 november 2017 om komplettering av Europaparlamentets och rådets förordning (EU) nr 576/2013 vad gäller förebyggande hälsoåtgärder för kontroll av infektion med Echinococcus multilocularis hos hundar och om upphävande av delegerad förordning (EU) nr 1152/2011 (EUT L 130, 28.5.2018, s. 1).
(6) Kommissionens genomförandeförordning (EU) 2018/878 av den 18 juni 2018 om anpassning av förteckningen över medlemsstater, eller delar av medlemsstaternas territorier, som följer de kategoriseringsbestämmelser som anges i artikel 2.2 och 2.3 i den delegerade förordningen (EU) 2018/772 om tillämpningen av förebyggande hälsoåtgärder för kontroll av infektion med Echinococcus multilocularis hos hundar (EUT L 155, 19.6.2018, s. 1).
(7) Kommissionens genomförandeförordning (EU) 2016/561 av den 11 april 2016 om ändring av bilaga IV till genomförandeförordning (EU) nr 577/2013 vad gäller förlagan till djurhälsointyg för hundar, katter och illrar som förflyttas utan kommersiellt syfte till en medlemsstat från ett territorium eller tredjeland (EUT L 96, 12.4.2016, s. 26).
BILAGA I
”DEL 1
Förteckning över territorier och tredjeländer enligt artikel 13.1 i förordning (EU) nr 576/2013
|
ISO-kod |
Territorium eller tredjeland |
|
AD |
Andorra |
|
CH |
Schweiz |
|
FO |
Färöarna |
|
GI |
Gibraltar |
|
GL |
Grönland |
|
IS |
Island |
|
LI |
Liechtenstein |
|
MC |
Monaco |
|
SM |
San Marino |
|
VA |
Vatikanstaten” |
BILAGA II
”DEL 2
Förteckning över territorier och tredjeländer enligt artikel 13.2 i förordning (EU) nr 576/2013
|
ISO-kod |
Territorium eller tredjeland |
Territorier som ingår |
|
AC |
Ascension |
|
|
AE |
Förenade Arabemiraten |
|
|
AG |
Antigua och Barbuda |
|
|
AR |
Argentina |
|
|
AU |
Australien |
|
|
AW |
Aruba |
|
|
BA |
Bosnien och Hercegovina |
|
|
BB |
Barbados |
|
|
BH |
Bahrain |
|
|
BM |
Bermuda |
|
|
BQ |
Bonaire, Sint Eustatius och Saba (BES-öarna) |
|
|
BY |
Vitryssland |
|
|
CA |
Kanada |
|
|
CL |
Chile |
|
|
CW |
Curaçao |
|
|
FJ |
Fiji |
|
|
FK |
Falklandsöarna |
|
|
HK |
Hongkong |
|
|
JM |
Jamaica |
|
|
JP |
Japan |
|
|
KN |
Saint Kitts och Nevis |
|
|
KY |
Caymanöarna |
|
|
LC |
Santa Lucia |
|
|
MS |
Montserrat |
|
|
MK |
Nordmakedonien |
|
|
MU |
Mauritius |
|
|
MX |
Mexiko |
|
|
MY |
Malaysia |
|
|
NC |
Nya Kaledonien |
|
|
NZ |
Nya Zeeland |
|
|
PF |
Franska Polynesien |
|
|
PM |
Saint-Pierre-et-Miquelon |
|
|
RU |
Ryssland |
|
|
SG |
Singapore |
|
|
SH |
Sankt Helena |
|
|
SX |
Sint-Maarten |
|
|
TT |
Trinidad och Tobago |
|
|
TW |
Taiwan |
|
|
US |
Förenta staterna |
AS — Amerikanska Samoa GU — Guam MP — Nordmarianerna PR — Puerto Rico VI — Amerikanska Jungfruöarna” |
|
VC |
Saint Vincent och Grenadinerna |
|
|
VG |
Brittiska Jungfruöarna |
|
|
VU |
Vanuatu |
|
|
WF |
Wallis och Futuna |
|
BILAGA III
”DEL 1
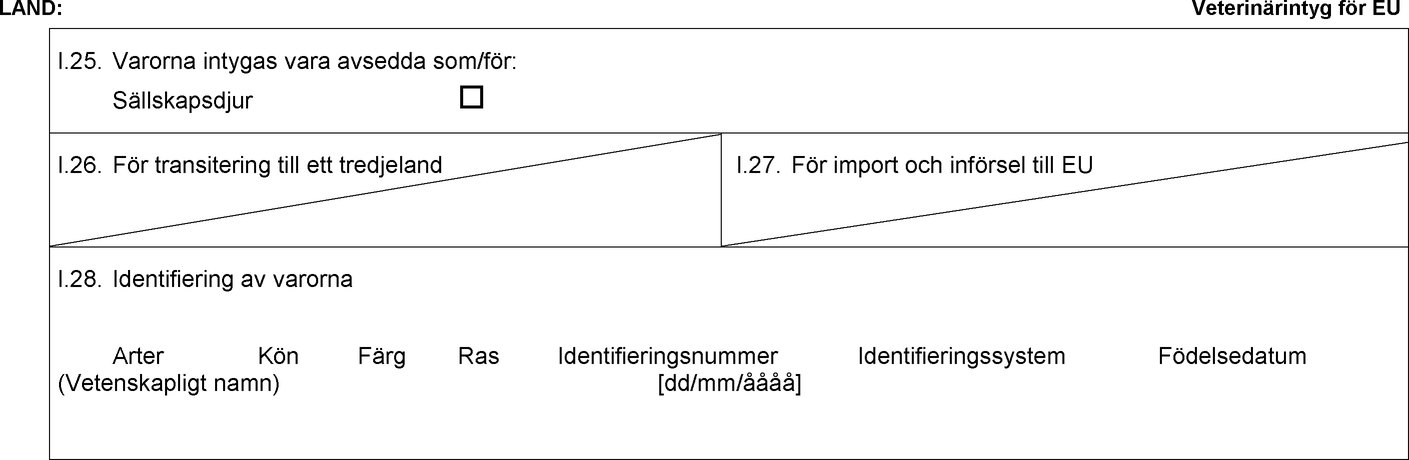
Förlaga till djurhälsointyg för förflyttning av hundar, katter eller illrar utan kommersiellt syfte från ett territorium eller tredjeland till en medlemsstat i enlighet med artikel 5.1 och 5.2 i förordning (EU) nr 576/2013
 Text av bilden
Text av bilden
 Text av bilden
Text av bilden
 Text av bilden
Text av bilden
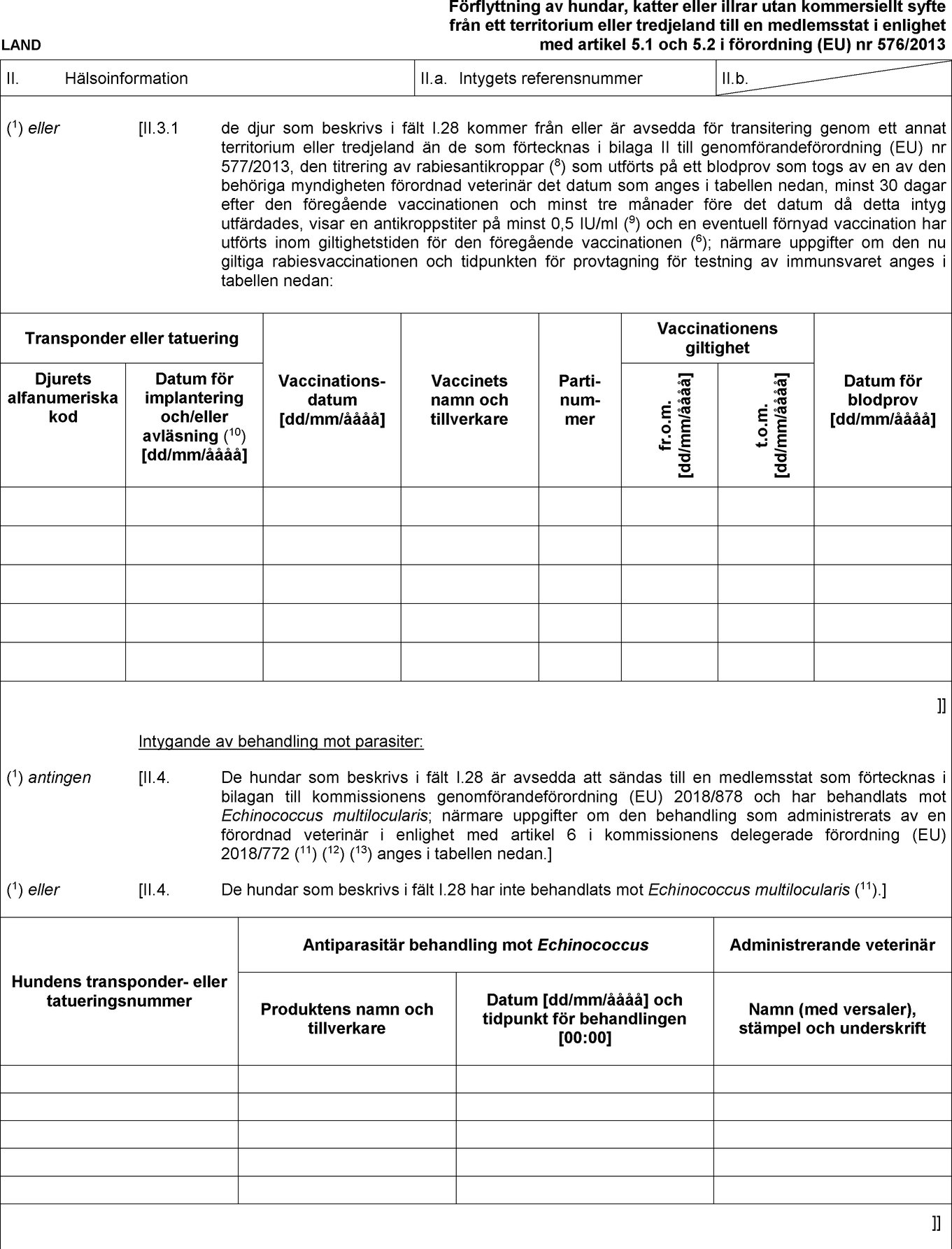 Text av bilden
Text av bilden
 Text av bilden
Text av bilden
 Text av bilden
Text av bilden
 Text av bilden
”
Text av bilden
”|
2.8.2019 |
SV |
Europeiska unionens officiella tidning |
L 204/16 |
KOMMISSIONENS GENOMFÖRANDEFÖRORDNING (EU) 2019/1294
av den 1 augusti 2019
om godkännande för utsläppande på marknaden av betain som ett nytt livsmedel enligt Europaparlamentets och rådets förordning (EU) 2015/2283 och om ändring av kommissionens genomförandeförordning (EU) 2017/2470
(Text av betydelse för EES)
EUROPEISKA KOMMISSIONEN HAR ANTAGIT DENNA FÖRORDNING
med beaktande av fördraget om Europeiska unionens funktionssätt,
med beaktande av Europaparlamentets och rådets förordning (EU) 2015/2283 av den 25 november 2015 om nya livsmedel och om ändring av Europaparlamentets och rådets förordning (EU) nr 1169/2011 och upphävande av Europaparlamentets och rådets förordning (EG) nr 258/97 och kommissionens förordning (EG) nr 1852/2001 (1), särskilt artikel 12, och
av följande skäl:
|
(1) |
Enligt förordning (EU) 2015/2283 får endast nya livsmedel som godkänts och införts i unionsförteckningen släppas ut på marknaden i unionen. |
|
(2) |
I enlighet med artikel 8 i förordning (EU) 2015/2283 antogs kommissionens genomförandeförordning (EU) 2017/2470 (2) genom vilken en unionsförteckning över godkända nya livsmedel upprättas. |
|
(3) |
Enligt artikel 12 i förordning (EU) 2015/2283 ska kommissionen besluta om godkännande och utsläppande av ett nytt livsmedel på marknaden i unionen och om uppdatering av unionsförteckningen. |
|
(4) |
Den 12 juni 2015 ansökte företaget DuPont Nutrition Biosciences ApS. (nedan kallat sökanden) hos den behöriga myndigheten i Finland om att få släppa ut betain på marknaden i unionen som en ny livsmedelsingrediens i den mening som avses i artikel 1.2 e i Europaparlamentets och rådets förordning (EG) nr 258/97 (3). Ansökan gäller användning av betain i müsli- och proteinstänger, pulver för drycker, isotoniska drickfärdiga drycker för personer över 10 år som ägnar sig åt idrottsaktiviteter, samt i müsli- och proteinstänger och livsmedel för speciella medicinska ändamål och/eller komplett kostersättning enligt definitionen i Europaparlamentets och rådets förordning (EU) nr 609/2013 (4), med undantag för livsmedel för spädbarn och små barn. |
|
(5) |
Enligt artikel 35.1 i förordning (EU) 2015/2283 ska en ansökan om att få släppa ut ett nytt livsmedel på marknaden i unionen som inlämnats till en medlemsstat i enlighet med artikel 4 i förordning (EG) nr 258/97 och för vilken inget slutligt beslut fattats före den 1 januari 2018 behandlas som en ansökan enligt förordning (EU) 2015/2283. |
|
(6) |
Ansökan om att få släppa ut betain som ett nytt livsmedel på marknaden i unionen lämnades in till en medlemsstat i enlighet med artikel 4 i förordning (EG) nr 258/97, men den uppfyller också kraven i förordning (EU) 2015/2283. |
|
(7) |
Den 21 oktober 2015 utfärdade den behöriga myndigheten i Finland sin första utvärderingsrapport. I rapporten drogs slutsatsen att betain uppfyller kriterierna för nya livsmedelsingredienser i artikel 3.1 i förordning (EG) nr 258/97. |
|
(8) |
Kommissionen vidarebefordrade den första utvärderingsrapporten till de andra medlemsstaterna den 23 oktober 2015. Motiverade invändningar framfördes av andra medlemsstater inom den period på 60 dagar som fastställs i artikel 6.4 första stycket i förordning (EG) nr 258/97. Invändningarna gällde ogynnsamma effekter som observerats vid den NOAEL-nivå (no-observed-adverse-effect) som föreslagits av sökanden för studien av kronisk oral toxicitet och karcinogenitet, den smala marginalen för exponering mellan de doser av betain där effekter kunnat iakttas i de toxikologiska studierna och det föreslagna dagliga intaget av betain. |
|
(9) |
Mot bakgrund av invändningarna rådgjorde kommissionen med Europeiska myndigheten för livsmedelssäkerhet (nedan kallad myndigheten) den 4 april 2016 och bad myndigheten göra en kompletterande utvärdering av betain som ny livsmedelsingrediens i enlighet med förordning (EG) nr 258/97. |
|
(10) |
Den 25 oktober 2017 antog myndigheten sitt vetenskapliga yttrande ”Safety of Betaine as a novel food pursuant to Regulation (EC) No 258/97” (5). Yttrandet utarbetades och antogs av myndigheten i enlighet med förordning (EG) nr 258/97, men det uppfyller också kraven i artikel 11 i förordning (EU) 2015/2283. |
|
(11) |
I sitt vetenskapliga yttrande använde myndigheten metoden med benchmarkdos (BMD) (6) och drog slutsatsen att betain är säkert för de avsedda befolkningsgrupperna när det tillsätts till livsmedel i en maximal daglig dos på 400 mg/dag (6 mg/kg kroppsvikt per dag). I samma yttrande konstaterade myndigheten att säkerheten för betain vid de användningar och de användningsnivåer som föreslagits av sökanden, vilka skulle leda till dagliga intag på 2 500 mg betain, inte har fastställts. |
|
(12) |
Den 25 januari 2018 ansökte sökanden hos kommissionen om skydd av äganderättsligt skyddade data för nio studier som lämnats in till stöd för ansökan, närmare bestämt rapporterna för studien av akut oral toxicitet (7), två studier av subakut (14 dagar (8) respektive 28 dagar (9)) oral toxicitet, en studie av subkronisk (10) (42 dagar) oral toxicitet, tre studier av mutagenitet och genotoxicitet (11), en studie av kronisk oral toxicitet och karcinogenitet (12) samt en kronisk (sex månader) kostundersökning på människor (13). |
|
(13) |
Den 18 februari 2018 ansåg myndigheten (14) att uppgifterna från studien av kronisk oral toxicitet och karcinogenitet tjänade som underlag för BMD-analysen och för att ta fram säkra nivåer av betain för målbefolkningen, uppgifterna från den kroniska kostundersökningen på människor tjänade som grund för att ta fram säkra intagsnivåer av betain för målbefolkningen, och uppgifterna från de tre studierna av genotoxicitet tjänade som grund för att dämpa farhågorna avseende den potentiellt genotoxiska verkan av betain. Det anses därför att det inte hade gått att dra några slutsatser om säkerheten för betain utan de opublicerade rapporterna från dessa studier. |
|
(14) |
Efter att ha fått myndighetens yttrande bad kommissionen sökanden att ytterligare klargöra sin motivering till begäran om skydd av äganderättsligt skyddade data för studien av kronisk oral toxicitet och karcinogenicitet, den kroniska kostundersökningen på människor och de tre studierna av mutagenitet och genotoxicitet, samt att klargöra sin begäran om ensamrätt att använda dessa studier, i enlighet med artikel 26.2 b i förordning (EU) 2015/2283. |
|
(15) |
Sökanden har förklarat att när ansökan lämnades in hade sökanden äganderätt och ensamrätt till studierna enligt nationell rätt, och att tredje part därför inte kunde få tillgång till eller använda studierna på laglig väg. |
|
(16) |
Kommissionen bedömde alla uppgifter som sökanden uppgett och ansåg att sökanden framlagt tillräckliga belägg för att kraven i artikel 26.2 i förordning (EU) 2015/2283 ska vara uppfyllda. Därför bör studien av kronisk oral toxicitet och karcinogenitet, den kroniska kostundersökningen på människor och de tre studierna av genotoxicitet som ingår i sökandens dokumentation inte användas av myndigheten till förmån för en senare sökande under en period av fem år från och med det datum då den här förordningen träder i kraft. Följaktligen bör godkännandet enligt denna förordning att släppa ut betain på marknaden i unionen vara begränsat till sökanden under den tidsperioden. |
|
(17) |
Att godkännandet av betain enbart gäller sökanden och att enbart sökanden får hänvisa till studierna i ansökan innebär dock inte att andra sökande förbjuds att ansöka om godkännande att få släppa ut samma nya livsmedel på marknaden, förutsatt att deras ansökan bygger på lagligen erhållna uppgifter till stöd för ett godkännande enligt denna förordning. |
|
(18) |
Den 2 november 2018 ansökte sökanden hos kommissionen i enlighet med artikel 10.1 i förordning (EU) 2015/2283 om en ändring av de användningsvillkor för betain som ingick i sökandens begäran av den 12 juni 2015 till den behöriga myndigheten i Finland om att få släppa ut betain på marknaden i unionen som en ny livsmedelsingrediens. De begärda ändringarna gäller de avsedda användningarna och användningsnivåerna för betain i pulver för drycker, isotoniska drycker, protein- och müslistänger och måltidsersättningar avsedda för idrottsutövande personer, samt vid användning av betain i komplett kostersättning för viktkontroll och i livsmedel för speciella medicinska ändamål enligt definitionen i förordning (EU) nr 609/2013, med undantag för livsmedel för spädbarn och små barn. De begärda ändringarna skulle säkerställa att intaget av betain hos den allmänna befolkningen inte överstiger 400 mg/dag (6 mg/kg kroppsvikt per dag), som enligt myndighetens yttrande från 2017 bedömdes vara säkert. |
|
(19) |
Den 12 december 2018 rådgjorde kommissionen med myndigheten och bad den att genomföra ytterligare en bedömning om ändringarna i de avsedda användningarna och användningsnivåerna för betain som ett nytt livsmedel i enlighet med artikel 10.3 i förordning (EU) 2015/2283. |
|
(20) |
Den 14 mars 2019 antog myndigheten sitt vetenskapliga yttrande ”Safety of Betaine as a novel food pursuant to Regulation (EC) No 2015/2283” (15). Detta vetenskapliga yttrande uppfyller kraven i artikel 11 i förordning (EU) 2015/2283. |
|
(21) |
I det yttrandet konstaterade myndigheten att betain är säkert med de nya föreslagna användningsvillkoren. Det vetenskapliga yttrandet ger därför tillräcklig grund för att fastställa att betain, med de föreslagna användningarna och användningsnivåerna, när det används som ingrediens i pulver för drycker, isotoniska drycker, protein- och müslistänger och måltidsersättningar avsedda för idrottsutövande personer samt i komplett kostersättning för viktkontroll och i livsmedel för speciella medicinska ändamål enligt definitionen i förordning (EU) nr 609/2013, med undantag för livsmedel för spädbarn och små barn, uppfyller kraven i artikel 12.1 i förordning (EU) 2015/2283. |
|
(22) |
Den säkra nivån för intag av betain skulle kunna överstigas när livsmedel som innehåller betain används tillsammans med kosttillskott som innehåller betain. Det är därför nödvändigt att informera konsumenterna genom lämplig märkning att livsmedel som innehåller betain inte ska användas om även kosttillskott som innehåller betain konsumeras samma dag. |
|
(23) |
Användningen av betain bör godkännas utan att det påverkar tillämpningen av förordning (EU) nr 609/2013 som fastställer krav på livsmedel som är avsedda för spädbarn och små barn, livsmedel för speciella medicinska ändamål och komplett kostersättning för viktkontroll. |
|
(24) |
De åtgärder som föreskrivs i denna förordning är förenliga med yttrandet från ständiga kommittén för växter, djur, livsmedel och foder. |
HÄRIGENOM FÖRESKRIVS FÖLJANDE.
Artikel 1
1. Betain enligt specifikationen i bilagan till den här förordningen ska införas i den unionsförteckning över godkända nya livsmedel som upprättats genom genomförandeförordning (EU) 2017/2470.
2. Under en period av fem år från och med det datum då denna förordning träder i kraft får endast den ursprungliga sökanden,
|
|
Företag: DuPont Nutrition Biosciences ApS |
|
|
Adress: Langebrogade 1, DK-1411 Köpenhamn K, Danmark, |
släppa ut det nya livsmedel som avses i punkt 1 på marknaden i unionen, såvida inte en senare sökande erhåller godkännande för det nya livsmedlet utan hänvisning till de äganderättsligt skyddade uppgifterna i enlighet med artikel 2 i denna förordning eller med medgivande av DuPont Nutrition Biosciences ApS.
3. Uppgifterna i den unionsförteckning som avses i punkt 1 ska omfatta de användningsvillkor och märkningskrav som anges i bilagan till den här förordningen.
4. Godkännandet enligt denna artikel ska inte påverka tillämpningen av bestämmelserna i förordning (EU) nr 609/2013.
Artikel 2
Studierna som ingår i ansökan och som ligger till grund för myndighetens bedömning av det nya livsmedel som avses i artikel 1, som sökanden uppger sig ha äganderätt till och utan vilka det nya livsmedlet inte hade kunnat godkännas, får inte utan medgivande av DuPont Nutrition Biosciences ApS användas till förmån för en senare sökande under en period av fem år från och med det datum då denna förordning träder i kraft.
Artikel 3
Bilagan till genomförandeförordning (EU) 2017/2470 ska ändras i enlighet med bilagan till den här förordningen.
Artikel 4
Denna förordning träder i kraft den tjugonde dagen efter det att den har offentliggjorts i Europeiska unionens officiella tidning.
Denna förordning är till alla delar bindande och direkt tillämplig i alla medlemsstater.
Utfärdad i Bryssel den 1 augusti 2019.
På kommissionens vägnar
Jean-Claude JUNCKER
Ordförande
(1) EUT L 327, 11.12.2015, s. 1.
(2) Kommissionens genomförandeförordning (EU) 2017/2470 av den 20 december 2017 om upprättande av en unionsförteckning över nya livsmedel i enlighet med Europaparlamentets och rådets förordning (EU) 2015/2283 om nya livsmedel (EUT L 351, 30.12.2017, s. 72).
(3) Europaparlamentets och rådets förordning (EG) nr 258/97 av den 27 januari 1997 om nya livsmedel och nya livsmedelsingredienser (EGT L 43, 14.2.1997, s. 1).
(4) Europaparlamentets och rådets förordning (EU) nr 609/2013 av den 12 juni 2013 om livsmedel avsedda för spädbarn och småbarn, livsmedel för speciella medicinska ändamål och komplett kostersättning för viktkontroll och om upphävande av rådets direktiv 92/52/EEG, kommissionens direktiv 96/8/EG, 1999/21/EG, 2006/125/EG och 2006/141/EG, Europaparlamentets och rådets direktiv 2009/39/EG och kommissionens förordningar (EG) nr 41/2009 och (EG) nr 953/2009 (EUT L 181, 29.6.2013, s. 35).
(5) The EFSA Journal, vol. 15(2017):11, artikelnr 5057.
(6) The EFSA Journal, vol. 15(2017): 1, artikelnr 4658.
(7) Life Science Research Limited, 1990, ej publicerad.
(8) TNO BIBRA, 2001, ej publicerad.
(9) TNO BIBRA, 2001, ej publicerad.
(10) Imasde Aglomentaria, 2012, ej publicerad.
(11) Asquith 1989 a, b, c., ej publicerad.
(12) Hatano Research Institute. 2002, ej publicerade studier.
(13) Ej publicerad rapport, ej daterad.
(14) ”Minutes of the 83rd Plenary meeting, Held on 7–8 February 2018, Parma (Italy) (Agreed on 18 February 2018)”, Efsas vetenskapliga panel för dietprodukter, nutrition och allergier (https://www.efsa.europa.eu/sites/default/files/event/180207-1-m.pdf).
(15) The EFSA Journal, vol. 17(2019): 4, artikelnr 5658.
BILAGA
Bilagan till genomförandeförordning (EU) 2017/2470 ska ändras på följande sätt:
|
1. |
Följande post ska införas i tabell 1 (Godkända nya livsmedel) i alfabetisk ordning:
|
||||||||||||||||||||||
|
2. |
Följande post ska införas i tabell 2 (Specifikationer) i alfabetisk ordning:
|
||||||
(*1) Gränsvärden för användning av den slutliga produkten när den är färdig att användas, saluförd som sådan eller utspädd enligt tillverkarens anvisningar.”
|
2.8.2019 |
SV |
Europeiska unionens officiella tidning |
L 204/22 |
KOMMISSIONENS GENOMFÖRANDEFÖRORDNING (EU) 2019/1295
av den 1 augusti 2019
om ändring av genomförandeförordning (EU) 2018/1469 om införande av en slutgiltig antidumpningstull på import av vissa sömlösa rör av järn eller stål med ursprung i Ryska federationen och Ukraina till följd av en partiell interimsöversyn i enlighet med artikel 11.3 i förordning (EU) 2016/1036
EUROPEISKA KOMMISSIONEN HAR ANTAGIT DENNA FÖRORDNING
med beaktande av fördraget om Europeiska unionens funktionssätt,
med beaktande av Europaparlamentets och rådets förordning (EU) 2016/1036 av den 8 juni 2016 om skydd mot dumpad import från länder som inte är medlemmar i Europeiska unionen (1) (nedan kallad grundförordningen), särskilt artikel 11.3, och
av följande skäl:
1. FÖRFARANDE
1.1. Gällande åtgärder
|
(1) |
Genom förordning (EG) nr 954/2006 (2) införde rådet efter en undersökning (nedan kallad den ursprungliga undersökningen) en slutgiltig antidumpningstull på import av vissa sömlösa rör av järn eller stål med ursprung i Kroatien, Ryssland och Ukraina. Åtgärderna bestod av en antidumpningstull i form av en värdetull på mellan 12,3 % och 25,7 % på import från individuellt namngivna exporterande tillverkare i Ukraina och en övrig tullsats på 25,7 % på import från alla andra företag i Ukraina. Den slutgiltiga antidumpningstullen för den exporterande tillverkaren som omfattas av den nuvarande översynen, CJSC Nikopolsky Seamless Tubes Plant Niko Tube och OJSC Nizhnedneprovsky Tube Rolling Plant, numera LLC Interpipe Niko Tube och OJSC Interpipe Nizhnedneprovsky Tube Rolling Plant (nedan kallade sökanden eller Interpipe) var 25,1 %. |
|
(2) |
Sedan Interpipe begärt en ogiltigförklaring av rådets förordning (EG) nr 954/2006 ogiltigförklarade Europeiska unionens tribunal artikel 1 i den förordningen i den mån den antidumpningstull som fastställts för Interpipe överskred den antidumpningstull som skulle ha varit tillämplig om det inte hade gjorts en justering av exportpriset med hänsyn till en provision som utgick när försäljningen ägde rum genom den närstående handlaren Sepco SA (3). Den 16 februari 2012 fastställde Europeiska unionens domstol tribunalens dom (4). |
|
(3) |
Efter dessa domar ändrade rådet förordning (EG) nr 954/2006 genom genomförandeförordning (EU) nr 540/2012 (5) för att korrigera den antidumpningstull som fastställts för Interpipe i den mån den fastställts felaktigt. Följaktligen ändrades den tullsats som är tillämplig på Interpipe till 17,7 %. |
|
(4) |
Genom genomförandeförordning (EU) nr 585/2012 (6) bibehöll rådet efter en översyn vid giltighetstidens utgång de åtgärder som infördes genom rådets förordning (EG) nr 954/2006 på import av sömlösa rör av järn eller stål med ursprung i Ryssland och Ukraina. |
|
(5) |
Efter en ansökan från Interpipe i enlighet med artikel 11.3 i grundförordningen ändrade rådet genom genomförandeförordning (EU) nr 795/2012 (7) de slutgiltiga åtgärder som införts genom genomförandeförordning (EU) nr 585/2012 vad gäller Interpipe (nedan kallad den senaste interimsöversynen). Följaktligen ändrades den tullsats som är tillämplig på Interpipe till 13,8 %. |
|
(6) |
Genom genomförandeförordning (EU) 2018/1469 (8) bibehöll kommissionen, efter en översyn vid giltighetstidens utgång, de åtgärder som infördes genom genomförandeförordning (EU) nr 585/2012, senast ändrad genom genomförandeförordning (EU) nr 795/2012 och rådets genomförandeförordning (EU) nr 1269/2012 (9), om införande av en slutgiltig antidumpningstull på import av sömlösa rör av järn eller stål med ursprung i Ryssland och Ukraina (nedan kallad översyn vid giltighetstidens utgång). |
|
(7) |
De gällande antidumpningstullarna varierar mellan 35,8 % och 24,1 % för import med ursprung i Ryssland och mellan 25,7 % och 12,3 % för import med ursprung i Ukraina. |
1.2. Begäran om en partiell interimsöversyn
|
(8) |
Den 7 maj 2018 tillkännagav kommissionen genom ett meddelande som offentliggjordes i Europeiska unionens officiella tidning att en partiell interimsöversyn skulle inledas (nedan kallat tillkännagivandet om inledande) (10) i enlighet med artikel 11.3 i grundförordningen beträffande de antidumpningsåtgärder som tillämpas på import av vissa sömlösa rör av järn eller stål med ursprung i Ukraina. |
|
(9) |
Översynen, som har begränsats till en undersökning av dumpning av den exporterande tillverkaren Interpipe, inleddes sedan Interpipe lämnat in en välgrundad begäran. I begäran lämnade Interpipe tillräckliga bevis för att de omständigheter som låg till grund för införandet av gällande åtgärder har ändrats och att dessa ändringar är av bestående karaktär. |
1.3. Undersökning
|
(10) |
Undersökningen av dumpningsnivån omfattade perioden från och med den 1 april 2017 till och med den 31 mars 2018 (nedan kallad översynsperioden). |
|
(11) |
Kommissionen underrättade officiellt sökanden, myndigheterna i exportlandet och unionsindustrin om inledandet av den partiella interimsöversynen. Berörda parter gavs tillfälle att inom den tidsfrist som angavs i tillkännagivandet om inledande skriftligen lämna sina synpunkter och begära att bli hörda. |
|
(12) |
För att kommissionen skulle få de uppgifter som den ansåg vara nödvändiga för sin undersökning sände den ett frågeformulär till sökanden, som svarade inom den angivna tidsfristen. |
|
(13) |
Kommissionen inhämtade och kontrollerade alla uppgifter som den ansåg vara nödvändiga för att fastställa dumpningsnivån. Kontrollbesök gjordes på plats hos sökanden och dess närstående handelsföretag LLC Interpipe Ukraine, Interpipe Europe SA och Interpipe Central Trade GmbH. |
2. PRODUKT SOM ÖVERSYNEN GÄLLER OCH LIKADAN PRODUKT
2.1. Produkt som översynen gäller
|
(14) |
Den produkt som översynen gäller är samma som den som definieras i genomförandeförordning (EU) 2018/1469 som ledde till att de gällande åtgärderna infördes, dvs. sömlösa rör av järn eller stål med runt tvärsnitt, med en ytterdiameter som inte överstiger 406,4 mm med ett motsvarande kolvärde (CEV) på högst 0,86 enligt formeln från International Institute of Welding (IIW) och kemiska analyser (11) med ursprung i bland annat Ukraina, som för närvarande klassificeras enligt KN-nummer ex 7304 11 00, ex 7304 19 10, ex 7304 19 30, ex 7304 22 00, ex 7304 23 00, ex 7304 24 00, ex 7304 29 10, ex 7304 29 30, ex 7304 31 80, ex 7304 39 58, ex 7304 39 92, ex 7304 39 93, ex 7304 51 89, ex 7304 59 92 och ex 7304 59 93 (nedan kallad den produkt som översynen gäller). |
2.2. Likadan produkt
|
(15) |
I likhet med vad som fastställdes i den ursprungliga undersökningen och i efterföljande översyner bekräftades det vid den aktuella undersökningen att den produkt som tillverkas i Ukraina och exporteras till EU har samma grundläggande fysiska och tekniska egenskaper och samma användningsområden som den produkt som tillverkas och säljs på den inhemska marknaden i Ukraina och den produkt som tillverkas och säljs i EU av unionstillverkarna. De anses därför vara likadana produkter i den mening som avses i artikel 1.4 i grundförordningen. |
3. DE ÄNDRADE OMSTÄNDIGHETERNAS BESTÅENDE KARAKTÄR
|
(16) |
I enlighet med artikel 11.3 i grundförordningen undersöktes det huruvida de ändrade omständigheterna beträffande dumpningen kunde anses vara av bestående karaktär. |
|
(17) |
Under den ursprungliga antidumpningsundersökningen 2006 samt i den senaste interimsöversynen av Interpipe 2012, som omfattade översynsperioden från den 1 oktober 2010 till den 30 september 2011, upphandlades den viktigaste råvaran för tillverkning av den produkt som översynen gäller, dvs. runda rörämnen av stål, av Interpipe från oberoende leverantörer. |
|
(18) |
I sin begäran om en partiell interimsöversyn hävdade sökanden att den vertikala integrationen av LLC Metallurgical Plant ”Dneprosteel” under 2013 ledde till intern produktion av de viktigaste råvarorna (rörämnen av stål), vilket i stor utsträckning minskat kostnaderna och ändrat produktportföljen. Sökanden hävdade också att den i jämförelse med de produkttyper som tillverkades och exporterades under översynsperioden i den senaste interimsöversynen, dvs. stål av standardkvalitet, nu har lagt till nya och mer sofistikerade produkter (höglegerat stål, linjerör och mekaniska rördelar) till sin produktportfölj, som utgjorde en betydande andel av den totala exporten till EU under den aktuella översynsperioden från den 1 april 2017 till den 31 mars 2018. |
|
(19) |
Undersökningen bekräftade att den viktigaste råvaran hade tillverkats internt av sökanden och att denna ändring resulterade i en betydande ändring av kostnaderna och produktportföljen. Undersökningen bekräftade att de produkttyper som Interpipe exporterar till EU i mycket stor utsträckning skilde sig från de produkttyper som exporterades under översynsperioden i den senaste interimsöversynen. Mot bakgrund av detta och med tanke på dessa ändringars strukturella karaktär drogs slutsatsen att de ändringar som beskrivs i skäl (17) var av varaktig karaktär och sannolikt inte kommer att ändras inom den närmaste framtiden. Följaktligen ansågs det att tillämpningen av de gällande åtgärderna på nuvarande nivå borde omprövas. |
|
(20) |
En ytterligare ändring som sökanden begärde efter det att denna översyn inleddes, dvs. förekomsten eller inrättandet av ett gemensamt företag mellan Interpipe och Vallourec Tubes, beaktades inte, eftersom det skedde efter det att denna interimsöversyn inleddes. |
4. DUMPNING
4.1.1. Företagsstruktur och metod för beräkning av dumpning
|
(21) |
Under översynsperioden hade Interpipe två helt ägda och kontrollerade exporterande tillverkare (nedan kallade tillverkningsenheterna), LLC Interpipe Niko Tube (NIKO) och OJSC Interpipe Nizhnedneprovsky Tube Rolling Plant (NTRP). |
|
(22) |
I den ursprungliga undersökningen beräknades en gemensam dumpningsmarginal, eftersom sökandens redovisningssystem inte medgav identifiering av det berörda tillverkningsföretaget i fråga om försäljning, genom att sammanställa alla uppgifter om de två tillverkande företagens tillverkning, lönsamhet och försäljning i EU. |
|
(23) |
Efter en markant ändring av gruppens företagsstruktur som gör det möjligt att identifiera det berörda tillverkningsföretaget när det gäller försäljning och tillverkning, och i enlighet med artikel 2.11 och 2.12 i grundförordningen, samlade kommissionen från och med den senaste interimsöversynen inte längre in några uppgifter om tillverkningsföretagen, utan använde standardmetoden. Denna standardmetod bestod i att beräkna en gemensam dumpningsmarginal för de två exporterande tillverkarna genom att först beräkna dumpningsbeloppet för varje enskild exporterande tillverkare innan man fastställde en enda vägd genomsnittlig dumpningsmarginal för båda företagen. |
|
(24) |
I den aktuella undersökningen var det också möjligt att identifiera det berörda tillverkningsföretaget när det gäller försäljning. I enlighet med artikel 2.11 och 2.12 i grundförordningen och i linje med EU-institutionernas enhetliga praxis tillämpades därför samma metod som vid den senaste interimsöversynen. |
4.1.2. Normalvärde
|
(25) |
I enlighet med artikel 2.2 i grundförordningen undersökte kommissionen först om varje exporterande tillverkares totala försäljning på hemmamarknaden av den likadana produkten till oberoende kunder var representativ i jämförelse med deras totala volym av exportförsäljningen av den berörda produkten till EU, dvs. om totalvolymen av denna försäljning motsvarade minst 5 % av den totala volymen exportförsäljning till EU. Av undersökningen framgick att försäljningen på hemmamarknaden var representativ för båda de exporterande tillverkarna. |
|
(26) |
Kommissionen undersökte sedan huruvida Interpipes försäljning på hemmamarknaden av den produkttyp som är identisk eller jämförbar med den produkttyp som säljs på export till EU var representativ, i enlighet med artikel 2.2 i grundförordningen. Försäljningen på hemmamarknaden av en produkttyp är representativ om den totala försäljningsvolymen av den till oberoende kunder på hemmamarknaden under undersökningsperioden motsvarar minst 5 % av den totala exportförsäljningen till EU av den identiska eller jämförbara produkttypen. Kommissionen fastställde att försäljningen på hemmamarknaden av produkttypen, som var identisk eller jämförbar med den produkttyp som såldes på export till EU, till stor del var representativ under undersökningsperioden, eftersom 60–80 % (12) av de exporterade modellerna såldes i representativa volymer på den inhemska marknaden. |
|
(27) |
I enlighet med artikel 2.4 i grundförordningen undersöktes vidare om den inhemska försäljningen av varje produkttyp som sålts i representativa volymer kunde anses ha skett vid normal handel. Detta gjordes genom att man för varje exporterad typ av den produkt som översynen gäller under översynsperioden fastställde andelen lönsam inhemsk försäljning till oberoende kunder på hemmamarknaden. |
|
(28) |
För de produkttyper där mer än 80 % av den inhemska försäljningsvolymen av produkttypen överskred tillverkningskostnaderna och vars vägda genomsnittliga försäljningspris minst motsvarade tillverkningskostnaden per enhet, fastställdes normalvärdet för varje produkttyp som ett vägt genomsnitt av de faktiska inhemska försäljningspriserna för all försäljning av den berörda produkttypen, oavsett om denna försäljning var lönsam eller inte. |
|
(29) |
I de fall där volymen av den lönsamma försäljningen av produkttypen utgjorde högst 80 % av den totala försäljningsvolymen för den produkttypen, eller där det vägda genomsnittliga priset för den produkttypen var lägre än tillverkningskostnaden per enhet, grundades normalvärdet på det faktiska priset på hemmamarknaden, beräknat som ett vägt genomsnitt av endast den lönsamma försäljningen av denna produkttyp på hemmamarknaden under översynsperioden. |
|
(30) |
Analysen av försäljningen på hemmamarknaden visade att 35–55 % (13) av all inhemsk försäljning av den produkttyp som var identisk eller jämförbar med den produkttyp som såldes på export till EU var lönsam och att det vägda genomsnittliga försäljningspriset var högre än tillverkningskostnaden. Normalvärdet beräknas därför som ett vägt genomsnittspris bara för den lönsamma försäljningen. |
|
(31) |
Normalvärdet beräknades för icke-representativa produkttyper (dvs. de vars försäljning på hemmamarknaden utgjorde mindre än 5 % av exportförsäljningen till EU eller som inte såldes alls på hemmamarknaden) utifrån tillverkningskostnaden per produkttyp plus ett belopp för försäljnings- och administrationskostnader, andra allmänna omkostnader samt vinst. Om försäljning på hemmamarknaden förekommer används transaktionsvinsterna vid normal handel på hemmamarknaden per produkttyp för de berörda produkttyperna. Om ingen försäljning på hemmamarknaden förekommer används en genomsnittsvinst. (14) |
|
(32) |
Efter det slutliga meddelandet ifrågasatte Interpipe Group vissa av de inslag som kommissionen använde vid beräkningen av normalvärdet. Påstående gällde bland annat följande: i) Beräkning av försäljnings- och administrationskostnader och andra allmänna kostnader. ii) Påstådd uteslutning av andra rörelsekostnader. iii) Användning av finansiella kostnader. iv) Dubbelräkning i samband med justeringarna av kostnaderna för försäljnings- och administrationskostnader och andra allmänna kostnader. |
|
(33) |
Efter att ha granskat uppgifterna i ärendet beslutade kommissionen att godta ovannämnda påståendena ii) och iv) och avvisa påståendena i) och iii). På grund av den konfidentiella karaktären hos affärsuppgifterna i Interpipe Groups påståenden och kommissionens analys av dessa argument tillhandahöll kommissionen Interpipe Group ytterligare uppgifter om datumet för antagandet av denna förordning, med en detaljerad motivering. |
|
(34) |
Efter att ha godtagit påståendena ii) och iv), omprövade kommissionen Interpipes dumpningsmarginal. Företaget fick ett ytterligare utlämnande av uppgifter som beskrev påverkan på dumpningsmarginalen och uppmanades att lämna synpunkter. Kommissionen underrättade också unionsindustrin om ändringarna av företagets dumpningsmarginal. |
|
(35) |
Efter det ytterligare utlämnandet av uppgifter vidhöll Interpipe de påståenden som kommissionen hade avvisat, utan att lägga till några nya uppgifter som kunde ändra kommissionens slutsatser som meddelats företaget. |
4.1.3. Exportpris
|
(36) |
Exportförsäljningen av den produkt som översynen gäller till EU omfattade flera olika enheter inom Interpipe Group, dvs. anläggningarna, ett samordningsföretag baserat i Ukraina (nedan kallat Interpipe Ukraine eller IPU), en närstående importör baserad i Tyskland (nedan kallat Interpipe Central Trade GmbH eller IPCT) och en närstående handlare baserad i Schweiz (nedan kallat Interpipe Europe SA eller IPE). |
|
(37) |
Exportpriset fastställdes i enlighet med artikel 2.8 i grundförordningen, med undantag för transaktioner genom det närstående företag som fungerade som importör (IPCT). I detta fall fastställdes exportpriset på grundval av det pris till vilket den importerade produkten första gången såldes vidare till oberoende kunder i EU, i enlighet med artikel 2.9 i grundförordningen. Därför gjordes justeringar av priset för alla kostnader som tillkommit mellan importen och återförsäljningen samt för en rimlig vinst. Dessa justeringar beräknades på grundval av IPE:s försäljnings- och administrationskostnader och andra allmänna kostnader samt teoretiska vinster som en icke-närstående importör uppnått (2,5 % av omsättningen). |
4.1.4. Jämförelse
|
(38) |
De båda exporterande tillverkarnas normalvärde och exportpris jämfördes utifrån priset fritt fabrik. För att få en rättvis jämförelse mellan normalvärdet och exportpriset gjordes i enlighet med artikel 2.10 i grundförordningen justeringar för olikheter som påverkade priserna och prisernas jämförbarhet. På denna grund gjordes justeringar för transport-, försäkrings-, hanterings- och lastningskostnader och därmed sammanhängande kostnader, importavgifter, tullar, provisioner och kreditkostnader. |
|
(39) |
Under översynsperioden exporterade Interpipe den produkt som översynen gäller till EU genom två olika försäljningskanaler, dvs. genom samma närstående handlare i Schweiz som i den senaste interimsöversynen (IPE) och genom ett dotterbolag i EU (IPCT) som grundades 2014. Den sistnämnda distributionskanalen fanns inte i den senaste interimsöversynen. På grund av den konfidentiella karaktären hos affärsuppgifterna i kommissionens analys tillhandahöll kommissionen Interpipe Group ytterligare uppgifter om datumet för antagandet av denna förordning, med en detaljerad motivering. |
|
(40) |
Kommissionen ansåg därför att en justering i enlighet med artikel 2.10 i i grundförordningen var motiverad. Denna justering beräknades genom att man drog av den närstående handlarens försäljnings- och administrationskostnader och andra allmänna kostnader, som inte rapporterades som avdrag och en teoretisk vinst som uppnåddes av en icke-närstående handlare (2,5 % av omsättningen) från försäljningspriset till den första icke-närstående kunden. |
|
(41) |
Efter det slutliga utlämnandet av uppgifter ifrågasatte Interpipe Group kommissionens slutsats att inte behandla IPE som en del av en enda ekonomisk enhet tillsammans med de andra enheterna NIKO, NTRP och IPU. Efter att ha granskat uppgifterna i ärendet beslutade kommissionen att avvisa detta påstående. Enligt vad som anges i skäl (34) fick företaget ett ytterligare utlämnande av uppgifter som beskrev påverkan på dumpningsmarginalen och uppmanades att lämna synpunkter. I sitt svar vidhöll Interpipe de yrkanden som kommissionen hade avvisat. Inga ytterligare synpunkter erhölls i detta hänseende. |
|
(42) |
På grund av den konfidentiella karaktären hos affärsuppgifterna i Interpipe Groups påståenden och kommissionens analys av dessa argument tillhandahöll kommissionen Interpipe Group ytterligare uppgifter om datumet för antagandet av denna förordning, med en detaljerad motivering. |
4.1.5. Dumpningsmarginal
|
(43) |
I enlighet med artikel 2.11 och 2.12 i grundförordningen jämfördes det vägda genomsnittliga normalvärdet för varje produkttyp med det vägda genomsnittliga exportpriset fritt fabrik för var och en av de båda exporterande tillverkarna. En gemensam dumpningsmarginal fastställdes därefter för Interpipe genom att en enda vägd genomsnittlig dumpningsmarginal beräknades för de båda exporterande tillverkarna inom Interpipe. |
|
(44) |
Dumpningsmarginalen uppgår, uttryckt som andel av cif-priset vid unionens gräns före tull, till 8,1 %. |
|
(45) |
Efter det ytterligare utlämnandet av uppgifter hävdade ESTA att minskningen av Interpipes dumpningsmarginal skulle skapa ytterligare skada för industrin för sömlösa stålrör i EU. Kommissionen noterar att antidumpningstullen i enlighet med artikel 9.4 i grundförordningen inte får överstiga dumpningsmarginalen, som i detta fall fastställdes till 8,1 %. |
|
(46) |
Den kommitté som inrättats i enlighet med artikel 15.1 i grundförordningen har inte avgett något yttrande. |
HÄRIGENOM FÖRESKRIVS FÖLJANDE.
Artikel 1
I tabellen i artikel 1.2 i genomförandeförordning (EU) nr 585/2012 ska posten för LLC Interpipe Niko Tube och OJSC Interpipe Nizhnedneprovsky Tube Rolling Plant (Interpipe NTRP) ersättas med följande:
|
”LLC Interpipe Niko Tube och OJSC Interpipe Nizhnedneprovsky Tube Rolling Plant (Interpipe NTRP) |
8,1 % |
A743” |
Artikel 2
Denna förordning träder i kraft dagen efter det att den har offentliggjorts i Europeiska unionens officiella tidning.
Denna förordning är till alla delar bindande och direkt tillämplig i alla medlemsstater.
Utfärdad i Bryssel den 1 augusti 2019.
På kommissionens vägnar
Jean-Claude JUNCKER
Ordförande
(1) EUT L 176, 30.6.2016, s. 21.
(2) Rådets förordning (EG) nr 954/2006 av den 27 juni 2006 om införande av en slutgiltig antidumpningstull på import av vissa sömlösa rör av järn eller stål med ursprung i Kroatien, Rumänien, Ryssland och Ukraina, om upphävande av rådets förordning (EG) nr 2320/97 och rådets förordning (EG) nr 348/2000 och om avslutande av interimsöversynen och översynen vid giltighetens utgång av antidumpningstullarna på import av vissa sömlösa rör av järn eller olegerat stål med ursprung i bland annat Ryssland och Rumänien och om avslutande av interimsöversynen av antidumpningstullarna på import av vissa sömlösa rör av järn eller olegerat stål med ursprung i bland annat Ryssland, Rumänien, Kroatien och Ukraina (EUT L 175, 29.6.2006, s. 4).
(3) Dom av den 10 mars 2009 i mål T-249/06, Interpipe Niko Tube och Interpipe NTRP mot rådet, EU:T:2009:62.
(4) Dom av den 16 februari 2012 i förenade målen C-191/09 P och C-200/09 P, rådet och kommissionen mot Interpipe Niko Tube och Interpipe NTRP, EU:C:2012:78.
(5) Rådets genomförandeförordning (EU) nr 540/2012 av den 21 juni 2012 om ändring av förordning (EG) nr 954/2006 om införande av en slutgiltig antidumpningstull på import av vissa sömlösa rör av järn eller stål med ursprung i Kroatien, Rumänien, Ryssland och Ukraina (EUT L 165, 26.6.2012, s. 1).
(6) Rådets genomförandeförordning (EU) nr 585/2012 av den 26 juni 2012 om införande av en slutgiltig antidumpningstull på import av vissa sömlösa rör av järn eller stål med ursprung i Ryssland och Ukraina, efter en översyn vid giltighetstidens utgång enligt artikel 11.2 i förordning (EG) nr 1225/2009 och om avslutande av översynen vid giltighetens utgång av import av vissa sömlösa rör av järn eller stål med ursprung i Kroatien (EUT L 174, 4.7.2012, s. 5).
(7) Rådets genomförandeförordning (EU) nr 795/2012 av den 28 augusti 2012 om ändring av genomförandeförordning (EU) nr 585/2012 om införande av en slutgiltig antidumpningstull på import av vissa sömlösa rör av järn eller stål med ursprung i Ryssland och Ukraina, efter en partiell interimsöversyn enligt artikel 11.3 i förordning (EG) nr 1225/2009 (EUT L 238, 4.9.2012, s. 1).
(8) Kommissionens genomförandeförordning (EU) 2018/1469 av den 1 oktober 2018 om införande av en slutgiltig antidumpningstull på import av vissa sömlösa rör av järn eller stål med ursprung i Ryska federationen och Ukraina till följd av en översyn vid giltighetstidens utgång i enlighet med artikel 11.2 i Europaparlamentets och rådets förordning (EU) 2016/1036 (EUT L 246, 2.10.2018, s. 20).
(9) Rådets genomförandeförordning (EU) nr 1269/2012 av den 21 december 2012 om ändring av genomförandeförordning (EU) nr 585/2012 vad gäller införandet av en slutgiltig antidumpningstull på import av vissa sömlösa rör av järn eller stål med ursprung i bl.a. Ryssland, efter en partiell interimsöversyn enligt artikel 11.3 i förordning (EG) nr 1225/2009 (EUT L 357, 28.12.2012, s. 1).
(10) EUT C 159, 7.5.2018, s. 18.
(11) CEV-värdet ska fastställas i enlighet med den tekniska rapport (IIW dok. IX-555-67, 1967) som publicerats av International Institute of Welding (IIW).
(12) Exakta siffror har inte tillhandahållits, eftersom dessa utgör företagsspecifika uppgifter.
(13) Exakta siffror har inte tillhandahållits, eftersom dessa utgör företagsspecifika uppgifter.
(14) Detta byte av metod beror på att en WTO-panel efter den ursprungliga undersökningen utfärdade – och WTO:s tvistlösningsorgan antog – en rapport i tvisten European Communities – Anti-dumping Measure on Farmed Salmon from Norway, där det fastställs att man inte kan bortse från den faktiska vinstmarginal som fastställts för transaktioner vid normal handel med de relevanta produkttyper för vilka normalvärdet måste konstrueras. Se WT/DS337/R av den 16 november 2007 – antagen av tvistlösningsorganet den 15 januari 2008, punkterna 7.289–7.319.
BESLUT
|
2.8.2019 |
SV |
Europeiska unionens officiella tidning |
L 204/29 |
RÅDETS BESLUT (GUSP) 2019/1296
av den 31 juli 2019
till stöd för stärkt biosäkerhet och bioskydd i Ukraina i linje med genomförandet av Förenta nationernas säkerhetsråds resolution 1540 (2004) om icke-spridning av massförstörelsevapen och bärare av dessa
EUROPEISKA UNIONENS RÅD HAR ANTAGIT DETTA BESLUT
med beaktande av fördraget om Europeiska unionen, särskilt artiklarna 28.1 och 31.1,
med beaktande av förslaget från unionens höga representant för utrikes frågor och säkerhetspolitik, och
av följande skäl:
|
(1) |
Den 12 december 2003 antog Europeiska rådet EU:s strategi mot spridning av massförstörelsevapen, vars kapitel II innehåller en förteckning över åtgärder mot sådan spridning. Sådana åtgärder måste vidtas såväl i unionen som i tredjeländer. |
|
(2) |
Unionen genomför aktivt den strategin och ger verkan åt de åtgärder som förtecknas i kapitel III i denna, särskilt genom att frigöra finansiella medel till stöd för särskilda projekt som drivs av multilaterala institutioner, genom att förse stater med tekniskt stöd och sakkunskap avseende ett brett spektrum av icke-spridningsåtgärder och genom att främja Förenta nationernas säkerhetsråds roll. |
|
(3) |
Den 28 april 2004 antog Förenta nationernas säkerhetsråd resolution 1540 (2004) (nedan kallad resolution 1540 (2004)), som var det första internationella instrument som på ett integrerat och övergripande sätt behandlade massförstörelsevapen, bärare av dessa vapen och material med koppling till dessa. I resolution 1540 (2004) fastställdes bindande skyldigheter för alla stater, och dessa skyldigheter syftade till att förhindra och avhålla icke-statliga aktörer från att få tillgång till sådana vapen och sådant material med koppling till vapen. FN:s säkerhetsråd beslutade också att alla stater ska vidta och genomdriva kraftfulla åtgärder i syfte att införa inhemska kontroller för att förhindra spridningen av nukleära, kemiska och biologiska vapen samt bärare av dessa, inbegripet genom att införa lämpliga kontroller av material med koppling till dessa. |
|
(4) |
Den 11 maj 2017 antog rådet beslut (Gusp) 2017/809 (1) till stöd för genomförande av Förenta nationernas säkerhetsråds resolution 1540 (2004). Det tekniska genomförandet av verksamheten enligt beslut (Gusp) 2017/809 ska anförtros FN:s kontor för nedrustningsfrågor (Unoda) i samarbete med relevanta regionala internationella organisationer, särskilt Organisationen för säkerhet och samarbete i Europa (OSSE). |
|
(5) |
Den 11 juli 2017 antog rådet beslut (Gusp) 2017/1252 (2) till stöd för stärkt kemikalieskydd och kemikaliesäkerhet i Ukraina i linje med genomförandet av Förenta nationernas säkerhetsråds resolution 1540 (2004). Det tekniska genomförandet av verksamheten enligt beslut (Gusp) 2017/1252 ska anförtros OSSE:s sekretariat. |
|
(6) |
En allmän anslutning till och ett fullständigt genomförande av BTV-konventionen (BTWC) och resolution 1540 (2004) hör till Ukrainas främsta prioriteringar när det gäller icke-spridning av massförstörelsevapen. |
|
(7) |
Den 21 mars och den 27 juni 2014 undertecknade unionen och Ukraina ett associeringsavtal (3) som bland annat föreskriver skyndsam harmonisering av Ukrainas nationella lagstiftning med relevant unionslagstiftning, inbegripet i fråga om undanröjande av eventuella hinder för ett heltäckande genomförande i Ukraina av resolution 1540 (2004). Vissa delar av associeringsavtalet mellan EU och Ukraina har tillämpats provisoriskt sedan den 1 november 2014. Associeringsavtalet mellan EU och Ukraina trädde i kraft den 1 september 2017. |
|
(8) |
Enligt den ukrainska regeringens handlingsplan för genomförandet av associeringsavtalet mellan EU och Ukraina för åren 2018–2020 åtog sig Ukraina att utveckla och förbättra bestämmelserna och mekanismerna på området för biosäkerhet och bioskydd i linje med Ukrainas skyldigheter enligt BTWC och resolution 1540 (2004) samt internationella normer och standarder, i synnerhet relevant EU-lagstiftning. |
|
(9) |
I detta sammanhang utarbetade OSSE:s sekretariat i nära samarbete med de behöriga myndigheterna i Ukraina tre förslag till projekt i syfte att stärka den övergripande biosäkerheten och det övergripande bioskyddet i Ukraina. |
|
(10) |
OSSE:s sekretariat bör anförtros det tekniska genomförandet av de projekt som ska genomföras enligt detta beslut. |
|
(11) |
Projekten bör genomföras i enlighet med respektive bestämmelser i Ukrainas regerings handlingsplan för genomförande av associeringsavtalet EU–Ukraina. Verksamheten bör ta hänsyn till relevant god praxis och tillvaratagna erfarenheter som identifierats under genomförandet av beslut (Gusp) 2017/1252. |
|
(12) |
OSSE:s sekretariat bör säkerställa ett effektivt samarbete med relevanta internationella organisationer och organ, såsom stödenheten för BTWC:s genomförande, den kommitté som FN:s säkerhetsråd inrättat enligt resolution 1540 (2004), Världsorganisationen för djurhälsa (OIE) och det globala partnerskapet mot spridning av massförstörelsevapen och material för massförstörelse. OSSE:s sekretariat bör också säkerställa komplementaritet och synergi mellan projekt enligt detta beslut och relevanta tidigare och pågående projekt och verksamheter i Ukraina som stöds av enskilda EU-medlemsstater och andra unionsfinansierade program på detta område, inbegripet instrumentet som bidrar till stabilitet och fred och EU:s kompetenscentrum för motverkande av kemiska, biologiska, radiologiska och nukleära risker. |
HÄRIGENOM FÖRESKRIVS FÖLJANDE.
Artikel 1
1. I syfte att främja fred och säkerhet samt effektiv multilateralism på global och regional nivå ska unionen eftersträva följande mål:
|
— |
Stärka biosäkerheten och bioskyddet i Ukraina genom att förbättra Ukrainas förutsättningar för lagstiftning och reglering och systemen för människors och djurs hälsa samt genom att öka kunskapen bland forskare inom livsvetenskaper. |
|
— |
Förstärka effektiv multilateralism på regional nivå genom att stödja OSSE:s åtgärder för att stärka kapaciteten hos de behöriga myndigheterna i Ukraina på området biosäkerhet och bioskydd i linje med skyldigheterna enligt resolution 1540 (2004) och BTWC. |
2. För att nå de mål som anges i punkt 1 ska unionen genomföra följande projekt:
|
— |
Harmonisering av gällande ukrainska bestämmelser om biosäkerhet och bioskydd med internationella standarder. |
|
— |
Upprättande av ett hållbart veterinärt övervakningssystem i Ukraina för sjukdomar med koppling till nya och farliga patogener. |
|
— |
Ökad medvetenhet, utbildning och fortbildning för forskare inom livsvetenskaper med inriktning på biosäkerhet och bioskydd. |
En närmare beskrivning av ovannämnda projekt finns i bilagan.
Artikel 2
1. Unionens höga representant för utrikes frågor och säkerhetspolitik (den höga representanten) ska ansvara för genomförandet av detta beslut.
2. Det tekniska genomförandet av de projekt som avses i artikel 1.2 ska ske genom OSSE:s sekretariat. Det ska utföra denna uppgift under den höga representantens kontroll. Den höga representanten ska i detta syfte ingå lämpliga överenskommelser med OSSE:s sekretariat.
Artikel 3
1. Det finansiella referensbeloppet för genomförandet av de projekt som avses i artikel 1.2 ska vara 1 913 900 EUR.
2. De utgifter som ska finansieras med det belopp som anges i punkt 1 ska förvaltas i enlighet med budgetförfaranden och budgetregler för unionens allmänna budget.
3. Kommissionen ska övervaka att de utgifter som avses i punkt 1 förvaltas korrekt. I detta syfte ska kommissionen ingå en finansieringsöverenskommelse med OSSE:s sekretariat. I överenskommelsen ska det fastställas att OSSE:s sekretariat ska säkerställa att unionens bidrag synliggörs på ett sätt som står i proportion till bidragets storlek.
4. Kommissionen ska sträva efter att ingå den finansieringsöverenskommelse som avses i punkt 3 så snart som möjligt efter det att detta beslut har trätt i kraft. Kommissionen ska informera rådet om alla eventuella svårigheter i samband med detta och om dagen för ingåendet av finansieringsöverenskommelsen.
Artikel 4
Den höga representanten ska rapportera till rådet om genomförandet av detta beslut, och ska göra det på grundval av regelbundna rapporter som utarbetats av OSSE:s sekretariat. Dessa rapporter ska ligga till grund för rådets utvärdering. Kommissionen ska informera om de finansiella aspekterna av de projekt som avses i artikel 1.2.
Artikel 5
1. Detta beslut träder i kraft samma dag som det antas.
2. Detta beslut ska upphöra att gälla 36 månader efter ingåendet av den finansieringsöverenskommelse som avses i artikel 3.3 eller sex månader efter dagen för antagandet om ingen finansieringsöverenskommelse har ingåtts inom denna period.
Utfärdat i Bryssel den 31 juli 2019.
På rådets vägnar
T. TUPPURAINEN
Ordförande
(1) Rådets beslut (Gusp) 2017/809 av den 11 maj 2017 till stöd för genomförande av Förenta nationernas säkerhetsråds resolution 1540 (2004) om icke-spridning av massförstörelsevapen och bärare av dessa (EUT L 121, 12.5.2017, s. 39).
(2) Rådets beslut (Gusp) 2017/1252 av den 11 juli 2017 till stöd för stärkt kemikalieskydd och kemikaliesäkerhet i Ukraina i linje med genomförandet av Förenta nationernas säkerhetsråds resolution 1540 (2004) om icke-spridning av massförstörelsevapen och bärare av dessa (EUT L 179, 12.7.2017, s. 8).
(3) Associeringsavtal mellan europeiska unionen och Europeiska atomenergigemenskapen och deras medlemsstater, å ena sidan, och Ukraina, å andra sidan (EUT L 161, 29.5.2014, s. 3).
BILAGA
Att stärka biosäkerheten och bioskyddet i Ukraina i linje med FN:s säkerhetsråds resolution 1540 (2004)
1. Bakgrund
Den ukrainska lagstiftning som förbjuder biologiska vapen är detaljerad och omfattande. En betydande del av dessa lagar och förordningar är dock föråldrad och uppfyller inte internationella normer och standarder. Det brådskar därför med översyn och uppdatering för att ytterligare harmonisera lagstiftningen med respektive internationella standarder.
Det finns ingen ramlag om biosäkerhet och bioskydd i Ukraina om inrättandet av ett system för biosäkerhet och bioskydd och dess funktionssätt (som bland annat skulle fastställa vilket som juridiskt sett är det centrala verkställande organ som hanterar biosäkerhet och bioskydd och utföra expert- och övervakningsfunktioner). Det finns inte heller något omfattande samarbete mellan alla berörda ministerier, byråer och organisationer för att förebygga och vidta åtgärder vid nödsituationer i samband med biologiska hot.
Det saknas också mekanismer för statlig kontroll av att krav på bioskydd följs vid arbete med biologiska agenser. Det finns inget register över ekonomiska och icke-ekonomiska aktörer som arbetar med farliga biologiska agenser på Ukrainas territorium. De aktörer som arbetar med farliga biologiska agenser är inte enligt lag skyldiga att ha relevanta tillstånd för detta. Faktum är att avskaffandet av tillståndssystemet ledde till en situation där det inte förekommer någon rapportering om och kontroll av efterlevnaden av kraven på biosäkerhet och bioskydd i mikrobiologiska laboratorier, vilkas faktiska antal är okänt. Ett normgivande dokument som reglerade bokföring, transport, lagring och överföring av farligt biologiskt material ogiltigförklarades. I de gällande dokumenten ägnas liten uppmärksamhet åt andra aspekter av bioskydd, exempelvis verifiering av personalens tillförlitlighet och skydd av konfidentiell information.
Mot bakgrund av tillväxttakten inom jordbruksproduktion, bioproduktion, transporter och den moderna världens yttre handelsförbindelser ställs human- och veterinärmedicinen inför många problem som är särskilt förknippade med risken för spridning av biologiska material, särskilt infektionssjukdomar och parasitsjukdomar som är vanliga bland människor och djur.
De största hoten med avseende på bioskyddet och livsmedelstryggheten i Ukraina är i dag afrikansk svinpest, fågelinfluensa, mul- och klövsjuka samt multiresistenta bakteriella patogener. Det finns naturliga centrala risker för utbrott av mjältbrand, rabies, klassisk svinpest och harpest. Säkerställandet av livsmedelstrygghet och bioskydd är en känslig fråga som inte kan lösas utan tillförlitliga metoder för övervakning, prognoser och tidig diagnos av nya och ekonomiskt signifikanta infektioner hos djur, inbegripet zoonotiska infektioner. Bioskydd och livsmedelstrygghet i Ukraina kan åtgärdas endast genom att grundforskning inom genetik och molekylär bioteknik integreras i veterinär- och humanmedicin och diagnostik.
Personalen vid de flesta ukrainska laboratorier för livsvetenskaper har relativt god erfarenhet av att hantera farliga biologiska material. De moderna principerna och metoderna för biosäkerhet och bioskydd, modern teknik och praxis samt uppförandekoder med koppling till modern praxis är dock mycket ovanliga i laboratorier. Ett antal laboratorier för livsvetenskaper har en måttlig mängd modern utrustning, men på grund av bristen på handhavandeutbildning använder laboratoriepersonalen inte utrustningen, eller också använder de den på ett felaktigt sätt. Dessutom omfattar inte det befintliga systemet med avancerad utbildning för vissa kategorier av forskare inom livsvetenskaper alla lämpliga frågor om biosäkerhet och bioskydd. Alla dessa faktorer kan leda till en sänkning av nivån av biosäkerhet och bioskydd i laboratorier där farliga biologiska material hanteras.
Som ett resultat av denna analys har tre projekt tagits fram av OSSE i syfte att stärka övergripande biosäkerhet och bioskydd i Ukraina. Dessa projekt har utarbetats i samarbete med de berörda ukrainska myndigheterna. Samtliga projekt kommer att genomföras i enlighet med respektive bestämmelser i Ukrainas regerings handlingsplanen för genomförande av associeringsavtalet EU–Ukraina.
Projekten kommer också att genomföras med hänsyn till relevant god praxis och tillvaratagna erfarenheter som identifierats under det pågående genomförandet av beslut (Gusp) 2017/1252 till stöd för stärkt kemikalieskydd och kemikaliesäkerhet i Ukraina.
2. Syfte
Det övergripande syftet med detta beslut är att stödja projekt utarbetade av OSSE som syftar till att stärka biosäkerheten och bioskyddet i Ukraina i linje med Ukrainas skyldigheter enligt BTWC och resolution 1540 (2004) och i enlighet med associeringsavtalet mellan EU och Ukraina.
3. Beskrivning av projekten
3.1 Harmonisering av gällande ukrainska bestämmelser om biosäkerhet och bioskydd med internationella standarder
3.1.1 Projektets syfte
|
— |
Förbättrade förutsättningar för lagstiftning och reglering i Ukraina vad gäller biosäkerhet och bioskydd, i linje med skyldigheterna enligt resolution 1540 (2004), nämligen antagande och verkställande av lämpliga effektiva lagar som förbjuder alla icke-statliga aktörer att tillverka, förvärva, inneha, utveckla, transportera, överföra eller använda biologiska vapen och bärare av dessa, särskilt för terroriständamål. |
3.1.2 Beskrivning av projektet
|
— |
De särskilda åtgärder i samband med förbättringarna av lagstiftningen och regleringen på området biosäkerhet och bioskydd som kräver prioriterat genomförande och som kommer att få direkt stöd genom detta projekt omfattar följande:
|
3.1.3 Förväntade resultat av projektet
|
— |
Förbättra Ukrainas system för biosäkerhet och bioskydd genom att stärka den nationella ramen för lagstiftning och reglering på området. |
|
— |
Främja samarbete mellan olika organ som ansvarar för biosäkerhet och bioskydd. |
|
— |
Säkerställa att Ukrainas system för biosäkerhet och bioskydd är hållbart. |
3.1.4 Projektmottagare
|
— |
Hälsovårdsministeriet |
3.2 Upprättande av ett hållbart veterinärt övervakningssystem i Ukraina för sjukdomar med koppling till nya och farliga patogener
3.2.1 Projektets syfte
|
— |
Förbättra biosäkerheten och bioskyddet genom att stärka systemen för människors och djurs hälsa i Ukraina i linje med skyldigheterna enligt resolution 1540 (2004), i synnerhet verkställandet av effektiva åtgärder i syfte att införa inhemska kontroller för att förhindra spridningen av biologiska vapen och bärare av dessa, inbegripet genom att införa lämpliga kontroller av material med koppling till dessa. |
3.2.2 Beskrivning av projektet
|
— |
Införande av effektiv övervakning av sjukdomar hos människor och djur genom inrättande av ett gemensamt centrum för sekvensering och genetisk karakterisering av utvalda agenser och utrustande av de deltagande instituten med realtids-PCR-maskiner med omvänd transkription (RT-PCR-maskiner). |
|
— |
Inrättande av åtgärder för snabb respons i nödsituationer och införande av snabba diagnoser av särskilt farliga djursjukdomar genom utveckling av RT-PCR-baserade diagnosverktyg för PCR-baserad detektering av utvalda agenser (agenser för fågelinfluensa, Newcastlesjuka, multiresistent tuberkulos, lumpy skin disease, harpest, afrikansk svinpest, klassisk svinpest, mul- och klövsjuka, brucellos, multiresistent salmonella och mjältbrand) som baseras på interna protokoll som utvecklats i Ukraina. |
|
— |
Utarbeta säker lagring av patogener, inbegripet zoonotiska patogener, virala och bakteriella patogener i laboratorier och vid förvaring genom utarbetande av registreringsunderlagen för RT-PCR-baserade kit. |
|
— |
Tillhandahålla en enhetlig teknisk policy inom bedömning av överensstämmelse för provningslaboratorier, säkerställa nationellt och internationellt förtroende, tillhandahålla villkor för ömsesidigt erkännande av prestanda och öppenhet och säkerställa medvetenhet och kompetens på bioskyddsområdet. |
|
— |
Bygga upp kapaciteten inom molekylär diagnostik av sjukdomar med koppling till nya och farliga patogener. |
3.2.3 Förväntade resultat av projektet
|
— |
Förstärkning av den nationella kapaciteten för övervakning och prognostisering inom veterinärmedicin. |
|
— |
Utarbetande av effektiva nationella diagnos- och övervakningsverktyg, baserat på RT-PCR och isoterma PCR-instrument (FoU, validering och genomförande i laboratorierna). |
|
— |
Genomförande av effektiv övervakning av djursjukdomar (inklusive zoonotiska sjukdomar). |
|
— |
Upprättande av mänsklig kapacitet inom ramen för molekylär diagnostik av sjukdomar med koppling till nya och farliga patogener (laboratorieutbildningar i PCR-teknik). |
3.2.4 Projektets stödmottagare
|
— |
State service of Ukraine on food safety and consumer protection (Ukrainas statliga myndighet för livsmedelssäkerhet och konsumentskydd). |
|
— |
Mottagare av bistånd: National scientific center Institute for experimental and clinical veterinary medicine (statligt vetenskapligt centrum för experimentell och klinisk veterinärmedicin) (Charkiv, Ukraina). |
3.3 Ökad medvetenhet, utbildning och fortbildning för forskare inom livsvetenskaper med inriktning på biosäkerhet och bioskydd
3.3.1 Projektets syfte
|
— |
Förbättra biosäkerheten, bioskyddet och bioetiken i Ukraina genom att öka medvetenheten hos forskare inom livsvetenskaper om biosäkerhet och bioskydd, i enlighet med skyldigheterna i resolution 1540 (2004), inbegripet verkställandet av effektiva inhemska åtgärder för att förhindra spridning av biologiska vapen och bärare av dessa. |
3.3.2 Beskrivning av projektet
|
— |
Inrätta en grupp med utbildare från olika ukrainska livsvetenskapliga institut som ska kunna sprida modern kunskap om biosäkerhet, bioskydd och bioetiska principer, bästa laboratoriepraxis samt tekniker och metoder för bioriskhantering i laboratorier. |
|
— |
Förbättra de nuvarande resurserna för vidare spridning av kunskap och medvetenhet om biosäkerhet, bioskydd och bioetik bland lärare, studenter och forskare inom livsvetenskaper och andra relevanta aktörer, med fullt beaktande av projekt P633 – om utbildning och ökad medvetenhet i Ukraina – vid det vetenskapliga och tekniska centrumet i Ukraina. |
|
— |
Säkerställa en hållbar utbildningskapacitet efter det att projektet har slutförts. |
3.3.3 Förväntade resultat av projektet
|
— |
Ökad medvetenhet bland nationella och lokala aktörer på området biosäkerhet och bioskydd. |
|
— |
Ökad kapacitet hos forskare inom livsvetenskaper att hantera farliga biologiska material på ett säkert sätt. |
|
— |
Ökad kapacitet hos ukrainska forskare inom livsvetenskaper att minska riskerna för att material och utrustning potentiellt används på ett felaktigt sätt under deras forskning samt för missbruk av deras kunskaper och resultat. |
|
— |
Inrättande av en robust grupp av utbildare inom biosäkerhet och bioskydd för forskare inom livsvetenskaper. |
|
— |
Förbättrade och hållbara resurser för spridning av kunskap om biosäkerhet, bioskydd och bioetik på distans. |
3.4 Projektmottagare
|
— |
Hälsovårdsministeriet |
4. Administrativt stöd för projektens genomförande
Särskilt avsatt personal vid OSSE:s sekretariat och kontoret för OSSE:s projektsamordnare i Ukraina kommer att samordna och leda genomförandet av projektverksamheterna enligt avsnitt 3 i syfte att ytterligare utveckla ramverket för samarbete mellan de ukrainska partnerna, inklusive genom att utveckla relevanta nya projektförslag och nationella åtgärder.
Stödpersonalen kommer att utföra följande uppgifter:
|
— |
Förvalta projekten under alla stadier av projektcykeln. |
|
— |
Utöva löpande finansiell tillsyn av projekten. |
|
— |
Tillhandahålla teknisk och rättslig expertis, stöda större upphandlingar, upprätta kontakter med andra internationella organisationer, genomföra kvalitetssäkring och kvalitetskontroll av de godkända projektens resultat samt rapportera till Europeiska unionen. |
5. Varaktighet
Projektens beräknade sammanlagda varaktighet är 36 månader.
6. Tekniskt genomförandeorgan
Det tekniska genomförandet av detta beslut kommer att anförtros OSSE:s sekretariat och centrum för konfliktförebyggande och OSSE:s projektsamordnare i Ukraina. OSSE kommer att genomföra verksamheten inom ramen för detta beslut i samarbete med andra internationella organisationer och organ, särskilt i syfte att säkerställa effektiva synergier och undvika dubbelarbete.
7. Rapportering
OSSE:s sekretariat kommer att utarbeta regelbundna rapporter samt rapporter efter fullbordandet av var och en av de angivna verksamheterna. De slutliga rapporterna bör läggas fram för Europeiska unionen senast sex veckor efter det att den berörda verksamheten har avslutats.
8. Styrkommittén
Styrkommittén för dessa projekt kommer att bestå av en företrädare för den höga representanten och en företrädare för det genomförandeorgan som avses i avsnitt 6 i denna bilaga. Styrkommittén ska regelbundet, åtminstone var sjätte månad, se över genomförandet av detta beslut, inbegripet med hjälp av elektroniska kommunikationsmedel.
9. Uppskattad totalkostnad för projekten och Europeiska unionens ekonomiska bidrag
Den totala kostnaden för projekten är 1 913 900 EUR.
|
2.8.2019 |
SV |
Europeiska unionens officiella tidning |
L 204/36 |
RÅDETS BESLUT (GUSP) 2019/1297
av den 31 juli 2019
om ändring av beslut (Gusp) 2016/2382 om inrättande av en europeisk säkerhets- och försvarsakademi (Esfa)
EUROPEISKA UNIONENS RÅD HAR ANTAGIT DETTA BESLUT
med beaktande av fördraget om Europeiska unionen, särskilt artiklarna 28.1, 42.4 och 43.2,
med beaktande av förslaget från unionens höga representant för utrikes frågor och säkerhetspolitik, och
av följande skäl:
|
(1) |
Den 21 december 2016 antog rådet beslut (Gusp) 2016/2382 (1) om inrättande av en europeisk säkerhets- och försvarsakademi (Esfa). |
|
(2) |
Den 14 maj 2018 antog rådet beslut (Gusp) 2018/712 (2), genom vilket Esfa anförtroddes att skapa en it-plattform för utbildning, utvärdering och övning (Cyber Education, Training, Evaluation and Exercise platform), samtidigt som behovet av att säkerställa komplementaritet med andra unionsinsatser och unionsinitiativ noterades. |
|
(3) |
Den 6 november 2018 antog rådet beslut (Gusp) 2018/1655 (3) om ändring av beslut (Gusp) 2016/2382 och fastställande av ett finansiellt referensbelopp för perioden 1 januari 2019–31 december 2019. |
|
(4) |
Den 20 september 2018 fastställde kommittén för utrikes- och säkerhetspolitik mandatet för EU Civilian Training Group som en särskild konstellation av kommittén för de civila aspekterna av krishantering. |
|
(5) |
Den 15 mars 2019, under mötet med EU Civilian Training Group, uttryckte medlemsstaterna ett behov av finansiellt stöd från unionen till civila samordnare för utbildning. |
|
(6) |
Den 3 juni 2019 beslutade Esfas styrkommitté att Esfa bör administrera och förvalta kostnader för resa och logi för de civila samordnarna för utbildning. |
|
(7) |
Beslut (Gusp) 2016/2382 bör därför ändras i enlighet med detta. |
HÄRIGENOM FÖRESKRIVS FÖLJANDE.
Artikel 1
I artikel 4.3 i beslut (Gusp) 2016/2382 ska följande led läggas till:
|
”j) |
ge stöd till kommittén för de civila aspekterna av krishantering och EU Civilian Training Group genom administration och hantering av kostnader för resor och logi i samband med den verksamhet som de civila samordnarna för utbildning bedriver.” |
Artikel 2
Detta beslut träder i kraft samma dag som det antas.
Utfärdat i Bryssel den 31 juli 2019.
På rådets vägnar
T. TUPPURAINEN
Ordförande
(1) Rådets beslut (Gusp) 2016/2382 av den 21 december 2016 om inrättande av en europeisk säkerhets- och försvarsakademi (Esfa) och om upphävande av beslut 2013/189/Gusp (EUT L 352, 23.12.2016, s. 60).
(2) Rådets beslut (Gusp) 2018/712 av den 14 maj 2018 om ändring av beslut (Gusp) 2016/2382 om inrättande av en europeisk säkerhets- och försvarsakademi (Esfa) (EUT L 119, 15.5.2018, s. 37).
(3) Rådets beslut (Gusp) 2018/1655 av den 6 november 2018 om ändring av beslut (Gusp) 2016/2382 om inrättande av en europeisk säkerhets- och försvarsakademi (Esfa) (EUT L 276, 7.11.2018, s. 9).
|
2.8.2019 |
SV |
Europeiska unionens officiella tidning |
L 204/37 |
RÅDETS BESLUT (GUSP) 2019/1298
av den 31 juli 2019
till stöd för dialog och samarbete Afrika–Kina–Europa om förhindrande av avledning av vapen och ammunition i Afrika
EUROPEISKA UNIONENS RÅD HAR ANTAGIT DETTA BESLUT
med beaktande av fördraget om Europeiska unionen, särskilt artiklarna 28.1 och 31.1,
med beaktande av förslaget från unionens höga representant för utrikes frågor och säkerhetspolitik, och
av följande skäl:
|
(1) |
Vapenhandelsfördraget trädde i kraft den 24 december 2014 och alla medlemsstater är parter i det. Syftet med vapenhandelsfördraget är att fastställa högsta möjliga gemensamma internationella normer för att reglera den lagliga handeln med konventionella vapen, och att förebygga och utrota den olagliga handeln med konventionella vapen samt förhindra deras avledning. |
|
(2) |
Den 19 november 2018 antog rådet EU:s strategi mot olagliga skjutvapen, handeldvapen och lätta vapen samt deras ammunition: Vapensäkerhet och skydd av allmänheten (nedan kallad strategin). Huvudsyftet med strategin är ett fullständigt och effektivt genomförande av FN:s handlingsprogram från 2001 för att förebygga, bekämpa och utrota alla former av olaglig handel med handeldvapen och lätta vapen. Enligt strategin kommer EU att fortsätta att främja ansvarskrävande och effektiva kontroller av vapenexport och fortsätta att stödja universaliseringen och genomförandet av vapenhandelsfördraget. I strategin anges också att EU kommer att fortsätta att stödja Afrikanska unionen och relevanta regionala ekonomiska gemenskaper i deras insatser mot den olagliga handeln med handeldvapen och lätta vapen och deras ammunition. |
|
(3) |
I januari 2017 antogs vid det 28:e ordinarie sammanträdet i Afrikanska unionens församling African Union Master Roadmap of Practical Steps to Silence the Guns in Africa by Year 2020, varigenom Afrikanska unionens medlemsstater ålades att motverka det olagliga inflödet och omloppet av vapen, förhindra rebellers tillgång till vapen och bryta länkarna till leverantörer och mottagare av olagliga vapen, inbegripet införande av förbud, i linje med vapenhandelsfördraget. |
|
(4) |
I rådets slutsatser av den 18 juli 2016 om EU:s strategi avseende Kina stöder rådet upprättandet av en regelbunden och djupgående dialog med Kina i syfte att tillsammans med medlemsstaterna försöka nå ett större samförstånd om nedrustning, icke-spridning, terroristbekämpning, migration och it-säkerhet. |
|
(5) |
Den 30 juni 2018 antog FN:s tredje översynskonferens för att se över genomförandet av FN:s handlingsprogram mot handeldvapen och lätta vapen ett slutdokument där staterna förnyar sitt åtagande att förhindra och bekämpa spridning av handeldvapen och lätta vapen. Staterna bekräftar sin vilja att bedriva internationellt samarbete och stärka det regionala samarbetet genom förbättrad samordning och förbättrat samråd, informationsutbyte och operativt samarbete med medverkan av relevanta regionala och subregionala organisationer och brottsbekämpande myndigheter, gränskontroll och export- och importlicensmyndigheter. Staterna åtar sig även att utbyta och, i enlighet med sina nationella rättsliga ramar och säkerhetskrav, tillämpa erfarenheter, erfarenhetsöverföring och bästa praxis avseende kontroll av export, import och transitering av handeldvapen och lätta vapen, inbegripet certifiering/slutanvändarintyg. |
|
(6) |
I Agenda 2030 för hållbar utveckling bekräftas det att bekämpning av olaglig handel med handeldvapen och lätta vapen krävs för att nå många av målen för hållbar utveckling, bland annat dem som avser fred, rättvisa och starka institutioner, fattigdomsminskning, ekonomisk tillväxt, hälsa, jämställdhet och säkra städer. Därför har alla stater inom ramen för mål 16.4 för hållbar utveckling åtagit sig att avsevärt minska de olagliga finansiella flödena och vapenflödena. |
|
(7) |
Den 27 februari 2012 antog rådet beslut 2012/121/Gusp (1) till stöd för verksamhet som främjar dialogen EU–Kina–Afrika och samarbete om kontroll av konventionella vapen. Saferworld genomförde detta projekt med framgång, men det krävs fler ansträngningar på detta område för att nå de mål som avses i det beslutet. |
|
(8) |
Sedan 2008 har rådet antagit elva beslut till stöd för utåtriktad verksamhet för ansvarskrävande vapenexportkontroll i enlighet med vapenhandelsfördraget och med rådets gemensamma ståndpunkt 2008/944/Gusp (2), men kontakterna med Kina avseende ämnet har varit begränsade. |
HÄRIGENOM FÖRESKRIVS FÖLJANDE.
Artikel 1
1. Syftet med detta beslut är att bidra till att förhindra och bekämpa avledning av vapen och ammunition i Afrika.
2. Enligt punkt 1 ska unionen stödja följande mål:
|
a) |
Att bland aktörer i Afrika, Kina och unionen öka medvetenheten om hur det olagliga flödet av vapen, särskilt handeldvapen och lätta vapen och deras ammunition, till obehöriga i betydande grad bidrar till att förvärra osäkerheten och våldet i olika delar av Afrika, varigenom den sociala sammanhållningen, allmänna säkerheten, socioekonomiska utvecklingen och de statliga institutionernas funktionssätt undergrävs. |
|
b) |
Att främja ansvarsutkrävande och ansvar vad gäller den lagliga vapenhandeln och genom att för aktörer i Afrika, Kina och unionen visa hur effektiv vapenexportkontroll kan bidra till minskad avledning av vapen till den olagliga marknaden. |
3. För att nå dessa mål ska detta beslut stödja inrättandet och utvecklingen av en gemensam icke-statlig expertgrupp Afrika–Kina–Europa för kontroll av konventionella vapen (nedan kallad expertgruppen) vars huvuduppgifter ska vara att öka medvetenheten och engagemanget, få beslutsfattarna i Afrika, Kina och unionen att vidta åtgärder och stärka det regionala och internationella samarbetet för förhindrande av avledning av vapen och ammunition i Afrika.
4. De förväntade resultaten av detta beslut är följande:
|
a) |
Förbättrad kunskap om konsekvenserna av avledning och missbruk av vapen i Afrika genom gemensamma forsknings- och åtgärdsinriktade analyser av forskare och akademiker i Afrika, Kina och unionen med rekommendationer till särskilda Kinastödda projekt. |
|
b) |
Ökad medvetenhet bland aktörerna i Afrika, Kina och unionen om betydelsen av en effektiv vapenexportkontroll när det gäller att minska risken för avledning och negativa följder av olagliga vapen och olaglig ammunition i Afrika. |
|
c) |
Ökat bidrag från Kina till relevanta internationella och regionala initiativ, inbegripet Afrikanska Unionens initiativ Silencing the Guns in Africa by 2020 och genomförandet av vapenhandelsfördraget. |
|
d) |
Beaktande av kontroll av handeldvapen på agendan för dialogen i forumet för samarbete mellan Kina och Afrika. |
|
e) |
Inrättandet av nya forum som samlar experter från myndigheter, civilsamhället, näringslivet och akademiska institutioner i Afrika, Kina och unionen och som ska bidra till den strategiska högnivådialogen mellan EU och Kina. |
5. Projektens direkta stödmottagare ska vara uppskattningsvis 500 beslutsfattande aktörer i Afrika, Kina och unionen, bland annat icke-statliga organisationer, tankesmedjor, företrädare för industrin, regeringstjänstemän med ansvar för frågor som rör kontroll av konventionella vapen samt parlamentariker. De indirekta stödmottagarna ska vara den befolkning, de samhällen, de grupper och de enskilda människor i Afrika som påverkas negativt av spridningen av olagliga vapen och olaglig ammunition på kontinenten.
6. En utförlig beskrivning av projektet återfinns i bilagan till detta beslut.
Artikel 2
1. Unionens höga representant för utrikes frågor och säkerhetspolitik (nedan kallad den höga representanten) ska ansvara för genomförandet av detta beslut.
2. Det tekniska genomförandet av det projekt som avses i artikel 1 ska anförtros den icke-statliga organisationen Saferworld.
3. Saferworld ska genomföra sina uppgifter under den höga representantens ansvar. Den höga representanten ska i detta syfte ingå nödvändiga överenskommelser med Saferworld.
Artikel 3
1. Det finansiella referensbeloppet för genomförandet av det unionsfinansierade projekt som avses i artikel 1 ska vara 994 007 EUR.
2. De utgifter som ska finansieras med det referensbelopp som fastställs i punkt 1 ska förvaltas i enlighet med de förfaranden och regler som gäller för unionens budget.
3. Kommissionen ska övervaka att de utgifter som avses i punkt 1 förvaltas korrekt. Den ska i detta syfte ingå en finansieringsöverenskommelse med Saferworld. I finansieringsöverenskommelsen ska det anges att Saferworld ska säkerställa att unionens bidrag synliggörs, i proportion till dess storlek.
4. Kommissionen ska sträva efter att ingå den finansieringsöverenskommelse som avses i punkt 3 så snart som möjligt efter beslutets ikraftträdande. Den ska informera rådet om eventuella svårigheter i samband med detta och om tidpunkten för finansieringsöverenskommelsens ingående.
Artikel 4
1. Den höga representanten ska rapportera till rådet om genomförandet av detta beslut på grundval av regelbundna rapporter varje kvartal som Saferworld ska utarbeta. Dessa rapporter ska ligga till grund för den utvärdering som rådet ska göra.
2. Kommissionen ska rapportera om de finansiella aspekterna av det projekt som avses i artikel 1.
Artikel 5
1. Detta beslut träder i kraft samma dag som det antas.
2. Detta beslut upphör att gälla 36 månader efter dagen för ingåendet av den finansieringsöverenskommelse som avses i artikel 3.3. Det ska dock upphöra att gälla sex månader efter ikraftträdandet om någon överenskommelse inte har ingåtts inom den perioden.
Utfärdat i Bryssel den 31 juli 2019.
På rådets vägnar
T. TUPPURAINEN
Ordförande
(1) Rådets beslut 2012/121/Gusp av den 27 februari 2012 till stöd för verksamhet som främjar dialogen EU–Kina–Afrika och samarbete om kontroll av konventionella vapen (EUT L 54, 28.2.2012, s. 8).
(2) Rådets gemensamma ståndpunkt 2008/944/Gusp av den 8 december 2008 om fastställande av gemensamma regler för kontrollen av export av militär teknik och krigsmateriel (EUT L 335, 13.12.2008, s. 99).
BILAGA
DIALOGEN OCH SAMARBETET AFRIKA–KINA–EUROPA OM FÖRHINDRANDE AV AVLEDNING AV VAPEN OCH AMMUNITION I AFRIKA
1. Beskrivning av projektverksamheten
Projektet ska bestå av de två huvudsakliga faser som sammanfattas i avsnitt 1.1 om inrättandet av en expertgrupp och i avsnitt 1.2 om kontakter med aktörer i Afrika, Kina och unionen som främjar åtgärder som ska vidtas för att förhindra avledning av vapen och ammunition i Afrika.
1.1 Fas 1: Inrättande och utveckling av en gemensam icke-statlig expertgrupp Afrika–Kina–Europa för förhindrande av avledning av vapen och ammunition i Afrika
1.1.1 Mål
Att inrätta en gemensam icke-statlig expertgrupp Afrika–Kina–Europa som ska samla icke-statliga experter från Afrika, Kina och unionen som ska ägna sig åt kontakter med aktörer i Afrika, Kina och unionen och stödja trilateral dialog och trilateralt samarbete för att förhindra avledning av vapen och ammunition i Afrika, i syfte att
|
a) |
tydliggöra den säkerhetsrelaterade, socioekonomiska och humanitära kostnaden för avledning av vapen, särskilt handeldvapen och lätta vapen och deras ammunition, i Afrika och visa hur förbättrad kontroll av överföring av vapen, även på tillgångssidan, kan bidra till att minska risken för avledning av vapen i obehörigas händer, |
|
b) |
hjälpa till med underlag för den strategiska högnivådialogen mellan EU och Kina, särskilt om säkerhets- och vapenkontrollsamarbete i Afrika, |
|
c) |
utbyta information, idéer, sakkunskap och forskning mellan dess medlemmar och bedöma de gällande strategiernas och initiativens ändamålsenlighet, |
|
d) |
aktivt uppvakta och lämna rekommendationer till myndighetsaktörer. Tjänstemän från Afrika, Kina och unionen samt från medlemsstaterna ska bjudas in att närvara som observatörer i expertgruppen och bidra till dess arbete. |
1.1.2 Verksamhet
Verksamhet som ska stödjas vid genomförandet av uppgifterna under fas 1 ska omfatta följande:
|
a) |
Saferworld ska ange och utveckla en strategi för kontakter med nyckelpartner och aktörer inom regeringarna, företagssektorn, civilsamhällesorganisationerna, de akademiska institutionerna, multilaterala organ och regionala och lokala aktörer, som kommer att ha avgörande betydelse för projektets framgång och hållbarhet. |
|
b) |
På grundval av resultaten av unionsprojektet som stöddes av beslut 2012/121/Gusp, i) anordna upp till 20 förberedande möten och uppföljningsmöten i Afrika, Kina och Europa för att öka medvetenheten om projektet, inbegripet struktur och tidsplan, och säkerställa stöd från relevanta myndigheter, ii) identifiera framstående experter i Afrika, Kina och Europeiska unionen som ska medverka i expertgruppen, iii) utarbeta detaljerade arbetsplaner för expertgruppens inrättande och funktion, iv) inrätta ett projektsamordningsteam, v) avgränsa och fördela ansvar mellan gruppens medlemmar, samt vi) övervaka och utvärdera framstegen i genomförandet av verksamheten. |
|
c) |
Inrätta expertgruppen till stöd för trepartsdialogen och trepartssamarbetet. Expertgruppen väntas bestå av nio experter på kontroll av handeldvapen från tankesmedjor, forskningscentrum och akademiska institutioner i Afrika, Kina och Europa. Experterna kommer att väljas ut på grundval av sina intressen och sin sakkunskap och förmåga att engagera sig i projektet. |
|
d) |
Skapa en webbplats för expertgruppen. Webbplatsen ska fungera som en onlineplattform för arbetsgruppens kontakter utåt. |
|
e) |
Anordna tre expertgruppsmöten (ett i Afrika, ett i Kina och ett i Europa), för att få till stånd ett samspel och ett erfarenhetsutbyte mellan expertgruppens medlemmar och tjänstemän från Afrika, Kina och unionen och medlemsstaterna, samt för att ge vägledning i genomförandet av informations- och forskningsverksamheten. |
1.1.3 Resultat
Expertgruppen ska utgöra grunden för den dialog som främjas genom detta beslut. Den kommer att ha en avgörande roll när det gäller att samla experter på handeldvapenkontroll från Afrika, Kina och Europa, och bidra till att överbrygga klyftan mellan forskare och beslutsfattare. Den ska säkerställa att projektens output faktiskt överförs till regeringarna i Afrika, Kina, Europa och till unionsinstitutionerna.
1.2 Fas 2: Kontakter med statliga aktörer i Afrika, Kina och unionen om förhindrande av avledning och bekämpning av olagligt innehav och olaglig överföring och användning av vapen och ammunition i Afrika
1.2.1 Mål
|
a) |
Att uppnå en minskning av avledningen av vapen och ammunition på den afrikanska kontinenten och därigenom minska hoten mot människors säkerhet och bidra till en fredlig och säker miljö för de afrikanska medborgarna och till att främja utveckling. |
|
b) |
Att stödja de afrikanska staterna i genomförandet av African Union Master Roadmap of Practical Steps to Silence the Guns in Africa by 2020 och av de relevanta strategierna i de regionala ekonomiska gemenskaperna. |
|
c) |
Att främja synergier med genomförandet av andra relevanta internationella och regionala initiativ, bland annat vapenhandelsfördraget, FN:s handlingsprogram för handeldvapen och lätta vapen och FN:s vapenprotokoll. |
|
d) |
Att samordna och skapa synergier med relevanta unionsstödda initiativ i Afrika, bland annat EU:s vapenexportkontroll och utåtriktade projekt relaterade till vapenhandelsfördraget vilka stöds av rådets beslut (Gusp) 2018/299 (1) och (Gusp) 2018/101 (2) och iTrace-projektet inom ramen för Conflict Armament Research Ltd. (CAR), som stöds av rådets beslut (Gusp) 2017/2283 (3). |
|
e) |
Att engagera sig i den fleråriga rättsliga översynsprocess som för närvarande pågår i Kina och som kommer att leda till antagandet av en ny exportkontrollag. |
|
f) |
Att stödja kontroller av handeldvapen på lokal nivå genom att nå ut till människor på gräsrotsnivå och ge dem möjlighet att uttrycka sig och komma med förslag om hur de mänskliga kostnaderna för olagliga vapen och olaglig ammunition kan reduceras. |
|
g) |
Att stödja gemensamma forsknings- och åtgärdsinriktade analyser av afrikanska, kinesiska och unionens experter om de problem som sammanhänger med avledning och missbruk av vapen och ammunition i Afrika, med rekommendationer för särskilda åtgärder som bidrar till att ta itu med och minska hoten i samband med olagliga vapen och olaglig ammunition. Dessa kan omfatta, men är inte begränsade till, exportkontroll, trygg och säker lagring av vapen och ammunition, destruering av överskottsvapen och överskottsammunition, märkning, registerhållning och spårning, inbegripet samarbete med de FN-uppdrag som har till uppgift att identifiera och spåra olagliga vapen, övervakning och verkställighet av vapenembargon, samt utbyte av operativ information i syfte att spränga vapensmugglingsnätverk. |
1.2.2 Verksamhet
Verksamhet som ska stödjas vid genomförandet av uppgifterna under fas 2 kommer att omfatta följande:
|
a) |
Två seminarier (ett i Afrika och ett i Kina) om Främjande av ansvarsutkrävande och ansvar när det gäller vapenhandel och förhindrande av avledning av vapen och ammunition till icke auktoriserade och destabiliserande aktörer i Afrika, som ska hållas under överinseende av expertgruppen, vars medlemmar kommer att bistå Saferworld och även delta i evenemangen. |
|
b) |
Utarbetande och spridning av ett briefingdokument om Bekämpning av spridningen av olagliga vapen och ammunition i Afrika: rekommendationer till forumet för samarbete mellan Kina och Afrika (FOCAC), inför 2021 års FOCAC-toppmöte. |
|
c) |
Utarbetande och spridning av ett briefingdokument på engelska och kinesiska om Spridning av olagliga vapen och ammunition i Afrika: vad kan levererande stater göra för att minska risken för avledning? |
|
d) |
Expertgruppen genomför tre tiodagars fältstudier i tre utvalda afrikanska länder för att ta itu med frågor som rör spridning och okontrollerat omlopp av olagliga vapen och olaglig ammunition (inbegripet komplexiteten i processerna för avledning från auktoriserade överföringar eller innehav, och problematiska gränsöverskridande företeelser, t.ex. boskapsstölder, som stimuleras av spridningen av olagliga vapen och olaglig ammunition). |
|
e) |
Tre forskningsrapporter (på kinesiska, engelska och franska) utarbetas av expertgruppen om fältstudierna, med rekommendationer om de praktiska insatser som krävs för att ta itu med olagliga vapen och olaglig ammunition, och med särskild inriktning på vapenleverantörernas roll i Afrika, Kina och unionen när det gäller att minska risken för avledning. |
|
f) |
Omkring 20 bilaterala möten med tjänstemän från Afrika, Kina och medlemsstaterna i syfte att utbyta och på ett effektivt sätt förmedla expertgruppens rekommendationer, öka medvetenheten och skapa en politisk drivkraft för samarbetsprojekt på officiell nivå. |
|
g) |
Utarbetande och spridning av en forskningsrapport (på kinesiska, engelska och franska) om spridningen av olagliga vapen och olaglig ammunition i Afrika. I rapporten ska en bedömning göras av effektiviteten i de aktuella insatserna, och den ska innehålla rekommendationer om genomförbara projekt som kan bidra till att bättre bekämpa olagliga vapen och olaglig ammunition och därmed minska deras skadliga effekter och medverka till stärkt nationell, regional och internationell fred och säkerhet. I rapporten kommer särskilt fokus att sättas på vapenleverantörernas roll i Afrika, Kina och unionen när det gäller att minska risken för avledning av vapen i Afrika. |
|
h) |
Genomförande av ett avslutande seminarium i Kina för att informera om rekommendationerna från forsknings- och dialogprocessen och visa på fördelarna med samarbetet mellan Afrika, Kina och unionen och medlemsstaterna och med deltagandet i den gemensamma verksamheten, samt utforma processer för att upprätthålla dialogen i framtiden. |
1.2.3 Resultat
|
— |
Ökad medvetenhet, kunskap och förståelse bland 500 beslutsfattare i Afrika, Kina och unionen, inbegripet tjänstemän som ansvarar för kontroll av export av konventionella vapen, akademiker, parlamentariker, icke-statliga organisationer, näringslivsföreträdare och journalister, vad avser de faktorer som bidrar till den utbredda tillgången till olagliga vapen och olaglig ammunition i Afrika, de viktigaste problemen och konsekvenserna på fältet samt vapenleverantörernas roll och ansvar när det gäller att minska risken för avledning vid överföring av vapen. |
|
— |
Bättre dialog, samverkan och samarbete mellan 60 tjänstemän och civilsamhällesaktörer från Afrika, Kina och unionen och medlemsstaterna när det gäller att förhindra och bekämpa avledning av vapen och ammunition, bland annat genom kartläggning av områden där ett ändamålsenligt samarbete kan upprättas mellan Afrika, Kina och unionen, vilket kommer att bidra till att minska avledningen av vapen och ammunition i Afrika. |
|
— |
Minskning av antalet förekomster och fall då vapen och ammunition avletts till icke auktoriserade och destabiliserande aktörer i Afrika. |
|
— |
Stöd till genomförandet av African Union Master Roadmap of Practical Steps to Silence the Guns in Africa by Year 2020 och till FN:s handlingsprogram om olaglig handel med handeldvapen och lätta vapen. |
|
— |
Bättre anpassning av nationella normer och föreskrifter i Afrika och Kina till internationella normer för vapenexportkontroll, t.ex. vapenhandelsfördraget, i syfte att minska risken för avledning vid handel med vapen. |
|
— |
Återinförande av vapenkontroll på dagordningen för FOCAC är en viktig ingångspunkt för att stärka dialogen och samarbetet mellan Afrika och Kina om förhindrande av avledning av vapen till icke auktoriserade och destabiliserande aktörer i Afrika. |
|
— |
Utarbetande av ett stort evidensbaserat analysmaterial vad avser problemet med olagliga vapen och olaglig ammunition i Afrika, med utgångspunkt i gemensamma fältstudier av experter från Afrika, Kina och unionen. Detta analysmaterial kommer att bidra till en bättre allsidig förståelse av avledning och återöverföring av vapen till icke auktoriserade och destabiliserande aktörer i Afrika och ge Afrika, Kina och unionen en starkare gemensam grund till ett mer effektivt samarbete i syfte att komma till rätta med problemet. |
|
— |
Identifiering av praktiska metoder för att ta itu med de hot som sammanhänger med spridningen av olagliga vapen och olaglig ammunition och behovet av kollektiva och samarbetsbaserade internationella reaktioner, i linje med viktiga internationella och regionala åtaganden och politiska initiativ, t.ex. FN:s handlingsprogram mot olagliga handeldvapen och lätta vapen, det internationella spårningsinstrumentet, Agenda 2030 för hållbar utveckling, vapenhandelsfördraget, Afrikanska unionens strategi för bekämpning av olaglig spridning och handel och olagligt omlopp vad avser handeldvapen och lätta vapen, den strategiska agendan för samarbete mellan EU och Kina fram till 2020, EU:s strategi avseende Kina, EU:s strategi mot olagliga handeldvapen och lätta vapen och ammunition till dessa, samt relevanta strategier och handlingsplaner för de regionala ekonomiska gemenskaperna. |
|
— |
Ökad förmåga hos afrikanska nationella myndigheter och regionala organisationer när det gäller att kartlägga särskilda behov av tekniskt stöd, och identifiering av lämpliga plattformar i deras dialog med Kina och EU i avsikt att kanalisera resurser för att dessa behov ska kunna tillgodoses. |
2. Deltagare och platser vad gäller seminarier/workshoppar samt inledning- och avslutningsevenemang
Om inte annat anges i denna bilaga kommer Saferworld att föreslå potentiella deltagare och platser för seminarier och andra evenemang som planeras inom ramen för projektet. Dessa kommer därefter att godkännas av den höga representanten i samråd med behöriga rådsorgan.
3. Jämställdhet
Saferworld kommer att integrera ett jämställdhetsperspektiv i strategier och verksamheter med anknytning till genomförandet av detta projekt, så att kvinnor och män på ett likvärdigt sätt kan påverka, delta i och dra nytta av projektet. Så långt det är möjligt kommer Saferworld att uppmuntra projektpartnerna att föreslå delegationer med både kvinnor och män för deltagande i projektverksamheter och se till att könskonsekvenserna av olagliga vapen och olaglig ammunition tas upp på alla seminarier och studiebesök.
4. Partner
Man räknar med att de viktigaste projektpartnerna kommer att vara China Arms Control and Disarmament Association (Kinas vapenkontroll- och nedrustningsförbund) och Säkerhetsforsknings- och informationscentrumet (Kenya).
5. Styrkommitté
Styrkommittén för detta projekt ska bestå av en företrädare för den höga representanten, en för kommissionen och en för Saferworld. Styrkommittén ska var sjätte månad se över genomförandet av detta beslut, bland annat med hjälp av elektroniska kommunikationsmedel.
6. Rapportering
Var sjätte månad kommer Saferworld att utarbeta beskrivande rapporter för att utvärdera framstegen i riktning mot att uppnå projektresultaten. Saferworld kommer också att lägga fram beskrivande och finansiella årsrapporter samt en slutrapport inom sex månader efter genomförandeperiodens slut.
7. Unionens synlighet och tillgången till material om biståndsverksamheten
Material som produceras inom ramen för projektet och den särskilda webbplatsen ska säkerställa unionens synlighet, särskilt genom logotypen och den grafiska framställningen i handboken om kommunikation och synliggörande av unionens yttre åtgärder. Unionens delegationer bör medverka i evenemang i tredjeländer för att stärka den politiska uppföljningen och synligheten.
(1) Rådets beslut (Gusp) 2018/299 av den 26 februari 2018 om främjande av det europeiska nätverket av oberoende tankesmedjor för icke-spridning och nedrustning till stöd för genomförandet av EU:s strategi mot spridning av massförstörelsevapen (EUT L 56, 28.2.2018, s. 46).
(2) Rådets beslut (Gusp) 2018/101 av den 22 januari 2018 om främjande av effektiv vapenexportkontroll (EUT L 17, 23.1.2018, s. 40).
(3) Rådets beslut (Gusp) 2017/2283 av den 11 december 2017 till stöd för en global rapporteringsmekanism för olagliga handeldvapen och lätta vapen och andra olagliga konventionella vapen och ammunition avsedd att minska risken för olaglig handel med dessa (”iTrace III”) (EUT L 328, 12.12.2017, s. 20).
|
2.8.2019 |
SV |
Europeiska unionens officiella tidning |
L 204/44 |
RÅDETS GENOMFÖRANDEBESLUT (GUSP) 2019/1299
av den 31 juli 2019
om genomförande av beslut (Gusp) 2015/1333 om restriktiva åtgärder med anledning av situationen i Libyen
EUROPEISKA UNIONENS RÅD HAR ANTAGIT DETTA BESLUT
med beaktande av fördraget om Europeiska unionen, särskilt artikel 31.2,
med beaktande av rådets beslut (Gusp) 2015/1333 av den 31 juli 2015 om restriktiva åtgärder med anledning av situationen i Libyen och om upphävande av beslut 2011/137/Gusp (1), särskilt artikel 12.2,
med beaktande av förslaget från unionens höga representant för utrikes frågor och säkerhetspolitik, och
av följande skäl:
|
(1) |
Den 31 juli 2015 antog rådet beslut (Gusp) 2015/1333. |
|
(2) |
I enlighet med artikel 17.2 i beslut (Gusp) 2015/1333 har rådet sett över förteckningen över uppförda personer och enheter i bilagorna II och IV till det beslutet. |
|
(3) |
Posten för en person bör strykas från bilaga II till beslut (Gusp) 2015/1333 och posterna för två personer bör strykas från bilaga IV till det beslutet. |
|
(4) |
Beslut (Gusp) 2015/1333 bör ändras i enlighet med detta. |
HÄRIGENOM FÖRESKRIVS FÖLJANDE.
Artikel 1
Bilagorna II och IV till beslut (Gusp) 2015/1333 ska ändras i enlighet med bilagan till det här beslutet.
Artikel 2
Detta beslut träder i kraft dagen efter det att det har offentliggjorts i Europeiska unionens officiella tidning.
Utfärdat i Bryssel den 31 juli 2019.
På rådets vägnar
T. TUPPURAINEN
Ordförande
BILAGA
Beslut (Gusp) 2015/1333 ska ändras på följande sätt:
|
1. |
I bilaga II (Förteckning över de personer och enheter som avses i artikel 8.2), ska post 1 (om ABDUSSALAM, Abdussalam Mohammed) strykas från förteckningen i del A (Personer). |
|
2. |
I bilaga IV (Förteckning över de personer och enheter som avses i artikel 9.2), ska posterna 1 (om ABDUSSALAM, Abdussalam Mohammed) och 14 (om AL-BAGHDADI, Dr Abdulqader Mohammed) strykas från förteckningen i del A (Personer). |
|
2.8.2019 |
SV |
Europeiska unionens officiella tidning |
L 204/46 |
KOMMISSIONENS GENOMFÖRANDEBESLUT (EU) 2019/1300
av den 26 juli 2019
om utsläppande på marknaden av en genetiskt modifierad nejlika (Dianthus caryophyllus L., linje FLO-40685-2)
[delgivet med nr C(2019) 5496]
(Endast den nederländska texten är giltig)
(Text av betydelse för EES)
EUROPEISKA KOMMISSIONEN HAR ANTAGIT DETTA BESLUT
med beaktande av fördraget om Europeiska unionens funktionssätt,
med beaktande av Europaparlamentets och rådets direktiv 2001/18/EG av den 12 mars 2001 om avsiktlig utsättning av genetiskt modifierade organismer i miljön och om upphävande av rådets direktiv 90/220/EEG (1), särskilt artikel 18.1 första stycket,
efter samråd med Europeiska myndigheten för livsmedelssäkerhet, och
av följande skäl:
|
(1) |
För att en produkt, som innehåller eller består av en genetiskt modifierad organism eller en kombination av genetiskt modifierade organismer, ska få släppas ut på marknaden krävs enligt direktiv 2001/18/EG att den behöriga myndigheten i den medlemsstat som har mottagit anmälan om utsläppande på marknaden av produkten lämnar ett skriftligt medgivande. |
|
(2) |
Företaget Suntory Holdings Limited, Osaka, Japan, anmälde i oktober 2013 till Nederländernas behöriga myndighet sina planer på att släppa ut en genetiskt modifierad nejlika (Dianthus caryophyllus L., linje FLO-40685-2) på marknaden. |
|
(3) |
Anmälan avser import, distribution och återförsäljning av snittblommor av den genetiskt modifierade nejlikan Dianthus caryophyllus L., linje FLO-40685-2. |
|
(4) |
I enlighet med artikel 14 i direktiv 2001/18/EG har Nederländernas behöriga myndighet utarbetat en bedömningsrapport, där det fastställs att det inte finns några skäl att vägra medgivande för utsläppande på marknaden av snittblommor av den genetiskt modifierade nejlikan Dianthus caryophyllus L., linje FLO-40685-2, för prydnadsändamål, förutsatt att särskilda villkor uppfylls. |
|
(5) |
Bedömningsrapporten lämnades till kommissionen och de behöriga myndigheterna i övriga medlemsstater, av vilka en del framförde invändningar mot att produkten släpps ut på marknaden. En medlemsstat vidhöll sina invändningar. |
|
(6) |
I ett yttrande av den 10 mars 2016 drog Europeiska myndigheten för livsmedelssäkerhet (nedan kallad myndigheten) slutsatsen att det inte finns några vetenskapliga skäl för att anse att import, distribution och återförsäljning i unionen av snittblommor av den genetiskt modifierade nejlikan FLO-40685-2 för prydnadsändamål kommer att medföra några negativa effekter på människors hälsa eller miljön (2). Myndigheten ansåg också att den övervakningsplan som utarbetats av tillståndsinnehavaren var godtagbar mot bakgrund av avsedd användning av nejlikan FLO-40685-2. |
|
(7) |
En granskning av myndighetens yttrande som beaktade den fullständiga anmälan, den bedömningsrapport som utarbetats av Nederländernas behöriga myndighet, medlemsstaternas invändningar och ytterligare uppgifter från anmälaren som svar på medlemsstaternas invändningar ger inte någon anledning att anta att snittblommor av den genetiskt modifierade nejlikan Dianthus caryophyllus L., linje FLO-40685-2, kommer att ge upphov till negativa effekter på människors hälsa eller på miljön, om de släpps ut på marknaden för det föreslagna prydnadsändamålet. |
|
(8) |
En unik identitetsbeteckning bör tilldelas den genetiskt modifierade nejlikan Dianthus caryophyllus L., linje FLO-40685-2, i enlighet med Europaparlamentets och rådets förordning (EG) nr 1830/2003 (3) samt kommissionens förordning (EG) nr 65/2004 (4). |
|
(9) |
Mot bakgrund av yttrandet från myndigheten är det inte nödvändigt att fastställa särskilda villkor för den avsedda användningen när det gäller produktens hantering eller förpackning eller för skyddet av särskilda ekosystem, miljöer eller geografiska områden. |
|
(10) |
Märkningen av produkten bör innehålla information om att snittblommor av den genetiskt modifierade nejlikan Dianthus caryophyllus L., linje FLO-40685-2, inte får användas som livsmedel eller som foder och att den inte heller får odlas. |
|
(11) |
En detektionsmetod som krävs enligt punkt D.12 i bilaga III B i direktiv 2001/18/EG kontrollerades och testades för den genetiskt modifierade nejlikan Dianthus caryophyllus L., linje FLO-40685-2, i december 2016. |
|
(12) |
Den kommitté som inrättats enligt artikel 30.1 i direktiv 2001/18/EG har inte lämnat något yttrande inom den tidsfrist som kommitténs ordförande bestämt. En genomförandeakt ansågs vara nödvändig och ordföranden lämnade utkastet till genomförandeakt till omprövningskommittén för ytterligare överläggningar. Omprövningskommittén avgav inget yttrande. |
HÄRIGENOM FÖRESKRIVS FÖLJANDE.
Artikel 1
Medgivande
1. Nederländernas behöriga myndighet ska skriftligen ge sitt medgivande till att den produkt som anges i artikel 2, nämligen den genetiskt modifierade nejlikan Dianthus caryophyllus L., linje FLO-40685-2, och som har anmälts av Suntory Holdings Limited, Osaka, Japan (referens C/NL/13/02), släpps ut på marknaden.
2. Medgivandet ska lämnas skriftligen, och i det ska man uttryckligen ange de krav som anges i artiklarna 3 och 4 och den unika identitetsbeteckning som anges i artikel 2.3.
3. Medgivandet ska begränsas till utsläppande på marknaden av snittblommor av den genetiskt modifierade nejlikan Dianthus caryophyllus L., linje FLO-40685-2 som produkt.
4. Medgivandet ska inbegripa avkomma genom vegetativ förökning av den genetiskt modifierade nejlikan Dianthus caryophyllus L., linje FLO-40685-2.
5. Medgivandet ska vara giltigt i tio år från och med den dag då det utfärdas.
Artikel 2
Produkt
1. Den genetiskt modifierade organism som ska släppas ut på marknaden är en nejlika (Dianthus caryophyllus L.), med modifierad blomfärg, härrörande från en cellkultur av Dianthus caryophyllus L. som transformerats med Agrobacterium tumefaciens, stam AGL0, med hjälp av vektorn pCGP1991 och som resulterat i linje FLO-40685-2.
Den genetiskt modifierade nejlikan innehåller följande DNA i tre kassetter:
|
a) |
Kassett 1 Genen dfr från petunia som kodar för dihydroflavonol-4-reduktas (DFR), ett nyckelenzym i antocyanins biosyntesväg, inklusive den egna promotorn och terminatorn. |
|
b) |
Kassett 2 Promotorsekvensen från lejongaps chalkonsyntasgen, Viola hortensis flavonoid-3′5′-hydroxylas (f3′5′h)-gen i form av cDNA som kodar för F3′5′H, ett nyckelenzym i antocyanins biosyntesväg, och terminatorn från den D8-petuniagen som kodar för ett putativt fosfolipid-transferprotein. Dessa två kassetter fördes in i växtens genom för att skapa den önskade färgen på blomman. |
|
c) |
Kassett 3 Blomkålsmosaikvirusets 35S-promotor, den icke-translaterade 5′-regionen från den petuniagen som kodar för klorofyll a/b-bindande protein och SuRB (als)-genen från Nicotiana tabacum som kodar för ett mutant-acetolaktatsyntas (ALS) som ger tolerans mot sulfonylurea, inklusive den egna terminatorn. Denna egenskap användes som markör i valet av transformanter. |
2. Den genetiskt modifierade nejlikan innehåller insertionen eller en del därav i fyra lokus:
|
— |
Lokus 1: En kopia av T-DNA som innehåller de tre kassetterna och en ofullständigt kopia av T-DNA som innehåller endast kassetten f3′5′h med höger T-DNA-gräns. De två kopiorna av T-DNA skiljs åt av en genomisk DNA-region för nejlika. |
|
— |
Lokus 2: En insertion som innehåller D8-terminatorn och den högra T-DNA-gränsen. |
|
— |
Lokus 3: En fullständig och en ofullständig kopia av f3′5′h -kassetten som båda innehåller D8-terminatorsekvenser och de högra T-DNA-gränserna i en tail-to-tail-orientering. |
|
— |
Lokus 4: En ofullständig kopia av als-kassetten och den vänstra T-DNA gränsen. |
3. Den unika identitetsbeteckningen för den genetiskt modifierade nejlikan är FLO-4Ø685-2.
Artikel 3
Villkor för utsläppande på marknaden
Den genetiskt modifierade nejlikan Dianthus caryophyllus L., linje FLO-40685-2 får släppas ut på marknaden under förutsättning att följande villkor är uppfyllda:
|
a) |
Den genetiskt modifierade nejlikan får endast användas för prydnadsändamål. |
|
b) |
Den genetiskt modifierade nejlikan får inte odlas. |
|
c) |
Utan att det påverkar tillämpningen av sekretesskraven i artikel 25 i direktiv 2001/18/EG ska uppgifter om den metod för påvisande och identifiering av genetiskt modifierad nejlika, inklusive experimentella data som visar metodens specificitet, som validerats av EU:s referenslaboratorium, vara offentligt tillgängliga på http://gmo-crl.jrc.ec.europa.eu/valid-2001-18.htm |
|
d) |
Utan att det påverkar tillämpningen av sekretesskraven i artikel 25 i direktiv 2001/18/EG ska tillståndsinnehavaren på begäran tillhandahålla positiva och negativa kontrollprover av produkten, dess genetiska material eller referensmaterial till medlemsstaternas behöriga myndigheter eller kontrollorgan och EU:s kontrollaboratorier. |
|
e) |
Texterna ”Denna produkt innehåller genetiskt modifierade organismer” eller ”Denna produkt innehåller genetiskt modifierad nejlika” och ”Inte avsedd att användas som livsmedel eller foder eller för odling” ska återfinnas antingen på etiketten eller för oförpackade produkter i följedokumentet till genetiskt modifierade nejlikor. |
Artikel 4
Övervakning
1. Under medgivandets hela giltighetstid ska tillståndsinnehavaren ansvara för upprättandet och genomförandet av den övervakningsplan som ingår i anmälan och som består av en allmän plan för övervakning av att hanteringen eller användningen av den genetiskt modifierade nejlikan Dianthus caryophyllus L., linje FLO-40685-2 inte ger upphov till negativa effekter på människors hälsa eller på miljön.
Övervakningsplanen finns på [Link: plan published on the internet].
2. Tillståndsinnehavaren ska direkt informera företagarna och användarna om säkerhetsaspekter och allmänna egenskaper för den genetiskt modifierade nejlikan samt om villkoren för övervakning, inklusive lämpliga åtgärder som ska vidtas vid ofrivillig förökning.
3. Tillståndsinnehavaren ska till kommissionen och medlemsstaternas behöriga myndigheter överlämna årsrapporter om resultaten av övervakningsverksamheten.
4. Tillståndsinnehavaren ska för kommissionen och medlemsstaternas behöriga myndigheter kunna styrka
|
a) |
att de befintliga övervakningsnätverken, inklusive de nationella botaniska övervakningsnätverken och växtskyddsinspektionerna, i enlighet med övervakningsplanen i anmälan, samlar in information som är relevant för övervakningen av den genetiskt modifierade nejlikan, |
|
b) |
att de befintliga övervakningsnätverk som avses i led a har samtyckt till att göra informationen tillgänglig för tillståndsinnehavaren före den dag då övervakningsrapporterna ska överlämnas till kommissionen och medlemsstaternas behöriga myndigheter enligt punkt 3. |
Artikel 5
Adressat
Detta beslut riktar sig till Konungariket Nederländerna.
Utfärdat i Bryssel den 26 juli 2019.
På kommissionens vägnar
Vytenis ANDRIUKAITIS
Ledamot av kommissionen
(1) EGT L 106, 17.4.2001, s. 1.
(2) Efsas GMO-panel (Efsas panel för genetiskt modifierade organismer), 2016, ”Scientific Opinion on a Part C notification (reference C/NL/13/02) from Suntory Holdings Limited for the import, distribution and retailing of carnation FLO-40685-2 cut flowers with modified petal colour for ornamental use”. EFSA Journal, vol. 14(2016):4, artikelnr 4431 [18 s.], doi: 10.2903/j.efsa.2016.4431.
(3) Europaparlamentets och rådets förordning (EG) nr 1830/2003 av den 22 september 2003 om spårbarhet och märkning av genetiskt modifierade organismer och spårbarhet av livsmedel och foderprodukter som är framställda av genetiskt modifierade organismer och om ändring av direktiv 2001/18/EG (EUT L 268, 18.10.2003, s. 24).
(4) Kommissionens förordning (EG) nr 65/2004 av den 14 januari 2004 om inrättande av ett system för skapande och tilldelning av unika identitetsbeteckningar för genetiskt modifierade organismer (EUT L 10, 16.1.2004, s. 5).
|
2.8.2019 |
SV |
Europeiska unionens officiella tidning |
L 204/50 |
KOMMISSIONENS GENOMFÖRANDEBESLUT (EU) 2019/1301
av den 26 juli 2019
om ändring av genomförandebeslut 2013/327/EU vad gäller förlängning av godkännandet för utsläppande på marknaden av foder som innehåller eller består av genetiskt modifierad Ms8-, Rf3- och Ms8 × Rf3-raps enligt Europaparlamentets och rådets förordning (EG) nr 1829/2003
[delgivet med nr C(2019) 5499]
(Endast den tyska texten är giltig)
(Text av betydelse för EES)
EUROPEISKA KOMMISSIONEN HAR ANTAGIT DETTA BESLUT
med beaktande av fördraget om Europeiska unionens funktionssätt,
med beaktande av Europaparlamentets och rådets förordning (EG) nr 1829/2003 av den 22 september 2003 om genetiskt modifierade livsmedel och foder (1), särskilt artiklarna 11.3 och 23.3, och
av följande skäl:
|
(1) |
Genom kommissionens genomförandebeslut 2013/327/EU (2) godkändes utsläppande på marknaden av livsmedel som innehåller eller består av genetiskt modifierad Ms8-, Rf3- och Ms8 × Rf3-raps eller livsmedel och foder som har framställts av sådana genetiskt modifierade rapssorter. |
|
(2) |
Tidigare godkändes genom kommissionens beslut 2007/232/EG (3) utsläppande på marknaden av foder som innehåller eller består av de genetiskt modifierade rapssorterna Ms8, Rf3 och Ms8 × Rf3. Detta godkännande omfattade även produkter som innehåller eller består av rapssorterna Ms8, Rf3 och Ms8 × Rf3 för annan användning än som livsmedel eller foder, med undantag av odling. |
|
(3) |
Den 20 maj 2016 lämnade Bayer CropScience AG in en ansökan till kommissionen i enlighet med artikel 11 och artikel 23 i förordning (EG) nr 1829/2003 om förlängning av godkännandet för utsläppande på marknaden av de produkter som omfattas av beslut 2007/232/EG. |
|
(4) |
Europeiska myndigheten för livsmedelssäkerhet (nedan kallad myndigheten) lämnade den 28 november 2017 ett positivt yttrande (4) i enlighet med artiklarna 6 och 18 i förordning (EG) nr 1829/2003. Myndigheten konstaterade att det i ansökan om förlängning inte fanns några belägg för några nya faror eller någon modifierad exponering och inte heller några nya vetenskapliga osäkerheter som ändrar de slutsatser som drogs vid den ursprungliga riskbedömning av Ms8-, Rf3- och Ms8 × Rf3-raps som myndigheten antog 2005 (5). |
|
(5) |
Myndigheten tog i sitt yttrande ställning till alla de specifika frågor och farhågor som medlemsstaterna tog upp under samrådet med de behöriga nationella myndigheterna i enlighet med artiklarna 6.4 och 18.4 i förordning (EG) nr 1829/2003. |
|
(6) |
Myndigheten konstaterade också att planen för övervakning av miljöpåverkan i form av en allmän tillsynsplan som sökanden har lämnat in ligger i linje med de avsedda användningsområdena för produkterna. |
|
(7) |
Mot bakgrund av detta bör godkännandet för utsläppande på marknaden av de produkter som omfattas av beslut 2007/232/EG förlängas. |
|
(8) |
Den 30 november 2017 bad sökanden Bayer CropScience kommissionen att i ett enda godkännande samla de användningsområden för rapssorterna Ms8, Rf3 och Ms8 × Rf3 som omfattas av ansökan om förlängning och de användningsområden för dessa rapssorter som omfattas av genomförandebeslut 2013/327/EU. I en skrivelse av den 5 december 2017 underrättade kommissionen sökanden om att sammanslagningen skulle få verkan genom en utvidgning av tillämpningsområdet för genomförandebeslut 2013/327/EU till de produkter som omfattas av ansökan om förlängning av den 20 maj 2016. Sökanden har således informerats om att de produkter som omfattas av ansökan om förlängning till följd av sammanslagningen kommer att omfattas av villkoren för godkännande i genomförandebeslut 2013/327/EU. |
|
(9) |
Kommissionen anser att sökandens begäran är motiverad av förenklingsskäl. Genomförandebeslut 2013/327/EU bör därför ändras så att dess räckvidd omfattar de produkter som för närvarande omfattas av beslut 2007/232/EG. |
|
(10) |
I en skrivelse av den 1 augusti 2018 ansökte Bayer CropScience AG om att kommissionen skulle överföra rättigheter och skyldigheter avseende samtliga godkännanden till BASF Agricultural Solutions Seed US LLC. I en skrivelse av den 6 augusti 2018 gav BASF SE sitt samtycke till denna överföring på uppdrag av BASF Agricultural Solutions Seed US LLC. Denna överföring påverkar beslut 2007/232/EG och genomförandebeslut 2013/327/EU. |
|
(11) |
En unik identitetsbeteckning har tilldelats rapssorterna Ms8, Rf3 och Ms8 × Rf3, i enlighet med kommissionens förordning (EG) nr 65/2004 (6). Denna unika identitetsbeteckning bör användas även i fortsättningen. |
|
(12) |
Enligt myndighetens yttrande verkar det, för de produkter som omfattas av detta beslut, inte behövas några andra särskilda märkningskrav än de som fastställs i artiklarna 13.1 och 25.2 i förordning (EG) nr 1829/2003 och i artikel 4.6 i Europaparlamentets och rådets förordning (EG) nr 1830/2003 (7). För att säkerställa att dessa produkter används på ett sätt som är godkänt enligt detta beslut bör det dock tydligt anges på märkningen av de produkter, med undantag av livsmedelsprodukter, som innehåller eller består av rapssorterna Ms8, Rf3 och Ms8 × Rf3 att produkterna i fråga inte är avsedda för odling. |
|
(13) |
Planen för övervakning av miljöpåverkan enligt genomförandebeslut 2013/327/EU behöver inte ändras, eftersom den är väsentligen identisk med den som myndigheten bedömde i samband med ansökan om förlängning. |
|
(14) |
Alla relevanta uppgifter om godkännandet av produkterna bör föras in i det gemenskapsregister över genetiskt modifierade livsmedel och foder som avses i artikel 28.1 i förordning (EG) nr 1829/2003. |
|
(15) |
Beslut 2007/232/EG bör upphöra att gälla. |
|
(16) |
Detta beslut bör genom förmedlingscentrumet för biosäkerhet (Biosafety Clearing-House) delges parterna i Cartagenaprotokollet om biosäkerhet till konventionen om biologisk mångfald, i enlighet med artiklarna 9.1 och 15.2 c i Europaparlamentets och rådets förordning (EG) nr 1946/2003 (8). |
|
(17) |
Ständiga kommittén för växter, djur, livsmedel och foder lämnade inget yttrande inom den tid som kommitténs ordförande bestämt. Denna genomförandeakt ansågs vara nödvändig och ordföranden lämnade den till omprövningskommittén för ytterligare överläggningar. Omprövningskommittén avgav inget yttrande. |
HÄRIGENOM FÖRESKRIVS FÖLJANDE.
Artikel 1
Ändringar
1. Genomförandebeslut 2013/327/EU ska ändras på följande sätt:
|
1) |
Rubriken ska ersättas med följande: ”Kommissionens genomförandebeslut 2013/327/EU av den 25 juni 2013 om godkännande för utsläppande på marknaden av livsmedel och foder som innehåller, består av eller har framställts av genetiskt modifierad Ms8-, Rf3- och Ms8 × Rf3-raps i enlighet med Europaparlamentets och rådets förordning (EG) nr 1829/2003” |
|
2) |
Artikel 2 ska ersättas med följande: ”Artikel 2 Godkännande Följande produkter godkänns i enlighet med artiklarna 4.2 och 16.2 i förordning (EG) nr 1829/2003 enligt villkoren i detta beslut:
|
|
3) |
I artikel 3 ska följande införas som andra stycket: ”Uppgiften ’inte avsedd för odling’ ska finnas på etiketten och i de handlingar som åtföljer produkter som innehåller eller består av den genetiskt modifierade raps som avses i artikel 2, med undantag för livsmedel och livsmedelsingredienser.” |
|
4) |
Följande artikel ska införas som artikel 3a: ”Artikel 3a Detektionsmetod Den metod som fastställs i led d i bilagan ska gälla för detektion av ACS-BNØØ5-8-, ACS-BNØØ3-6- och ACS-BNØØ5-8 × ACS-BNØØ3-6-raps.” |
|
5) |
Artikel 6 ska ersättas med följande: ”Artikel 6 Innehavare av godkännandet Innehavaren av godkännandet är BASF Agricultural Solutions Seed US LLC i Förenta staterna, som företräds av BASF SE, Tyskland.” |
|
6) |
Artikel 8 ska ersättas med följande: ”Artikel 8 Adressat Detta beslut riktar sig till BASF SE, Carl-Bosch-Str. 38, D-67063 Ludwigshafen, Tyskland.” |
2. Bilagan till genomförandebeslut 2013/327/EU ska ändras på följande sätt:
|
1) |
Led a ska ersättas med följande: ”a) Sökande och innehavare av godkännandet
Företräds av BASF SE, Carl-Bosch-Str. 38, D-67063 Ludwigshafen, Tyskland.” |
|
2) |
Led b ska ersättas med följande: ”b) Beteckning och specifikation av produkterna
|
|
3) |
I led c ska följande läggas till som andra stycket: ”Uppgiften ’inte avsedd för odling’ ska finnas på etiketten och i de handlingar som åtföljer produkter som innehåller eller består av den genetiskt modifierade raps som avses i led b, med undantag för livsmedel och livsmedelsingredienser.” |
Artikel 2
Upphävande
Beslut 2007/232/EG ska upphöra att gälla.
Artikel 3
Adressat
Detta beslut riktar sig till BASF SE, Carl-Bosch-Str. 38, D-67063 Ludwigshafen, Tyskland.
Utfärdat i Bryssel den 26 juli 2019.
På kommissionens vägnar
Vytenis ANDRIUKAITIS
Ledamot av kommissionen
(1) EUT L 268, 18.10.2003, s. 1.
(2) Kommissionens genomförandebeslut 2013/327/EU av den 25 juni 2013 om godkännande för utsläppande på marknaden av livsmedel som innehåller eller består av genetiskt modifierad Ms8-, Rf3- och Ms8 × Rf3-raps eller livsmedel och foder som har framställts av sådana genetiskt modifierade organismer enligt Europaparlamentets och rådets förordning (EG) nr 1829/2003 (EUT L 175, 27.6.2013, s. 57).
(3) Kommissionens beslut 2007/232/EG av den 26 mars 2007 om utsläppande på marknaden i enlighet med Europaparlamentets och rådets direktiv 2001/18/EG av rapsprodukter (Brassica napus L., linjerna Ms8, Rf3 och Ms8 × Rf3) som modifierats genetiskt för tolerans mot herbiciden ammoniumglyfosinat (EUT L 100, 17.4.2007, s. 20).
(4) Myndighetens GMO-panel 2017. Scientific opinion on the assessment of genetically modified oilseed rape MS8, RF3 and MS8 x RF3 for renewal of authorisation under regulation (EC) No 1829/2003 (application EFSA-GMO-RX-004). EFSA Journal, vol. 15(2017):11, artikelnr 5067.
(5) Myndigheten, 2005. Opinion of the Scientific Panel on Genetically Modified Organisms on a request from the Commission related to the application (Reference C/BE/96/01) for the placing on the market of glufosinate-tolerant hybrid oilseed rape Ms8 × Rf3, derived from genetically modified parental lines (Ms8, Rf3), for import and processing for feed and industrial uses, under Part C of Directive 2001/18/EC from Bayer CropScience. EFSA Journal, vol. 3(2005):10, artikelnr 281, s. 23.
(6) Kommissionens förordning (EG) nr 65/2004 av den 14 januari 2004 om inrättande av ett system för skapande och tilldelning av unika identitetsbeteckningar för genetiskt modifierade organismer (EUT L 10, 16.1.2004, s. 5).
(7) Europaparlamentets och rådets förordning (EG) nr 1830/2003 av den 22 september 2003 om spårbarhet och märkning av genetiskt modifierade organismer och spårbarhet av livsmedel och foderprodukter som är framställda av genetiskt modifierade organismer och om ändring av direktiv 2001/18/EG (EUT L 268, 18.10.2003, s. 24).
(8) Europaparlamentets och rådets förordning (EG) nr 1946/2003 av den 15 juli 2003 om gränsöverskridande förflyttning av genetiskt modifierade organismer (EUT L 287, 5.11.2003, s. 1).
|
2.8.2019 |
SV |
Europeiska unionens officiella tidning |
L 204/54 |
KOMMISSIONENS GENOMFÖRANDEBESLUT (EU) 2019/1302
av den 26 juli 2019
om godkännande för utsläppande på marknaden av produkter som innehåller, består av eller har framställts av genetiskt modifierad bomull GHB614 × LLCotton25 × MON 15985 i enlighet med Europaparlamentets och rådets förordning (EG) nr 1829/2003
[delgivet med nr C(2019) 5501]
(Endast den tyska texten är giltig)
(Text av betydelse för EES)
EUROPEISKA KOMMISSIONEN HAR ANTAGIT DETTA BESLUT
med beaktande av fördraget om Europeiska unionens funktionssätt,
med beaktande av Europaparlamentets och rådets förordning (EG) nr 1829/2003 av den 22 september 2003 om genetiskt modifierade livsmedel och foder (1), särskilt artiklarna 7.3 och 19.3, och
av följande skäl:
|
(1) |
Den 11 februari 2011 lämnade Bayer CropScience AG (nedan kallad sökanden) in en ansökan till den behöriga nederländska myndigheten, i enlighet med artiklarna 5 och 17 i förordning (EG) nr 1829/2003, om att få släppa ut livsmedel, livsmedelsingredienser och foder som innehåller, består av eller har framställts av bomullen GHB614 × LLCotton25 × MON 15985 och klyvningsprodukten LLCotton25 × MON 15985 på marknaden (nedan kallad ansökan). Ansökan gällde även utsläppande på marknaden av genetiskt modifierad bomull GHB614 × LLCotton25 × MON 15985 och klyvningsprodukten LLCotton25 × MON 15985 i produkter som består av eller innehåller denna bomull för annan användning än som livsmedel och foder, med undantag för odling. |
|
(2) |
I en skrivelse av den 20 april 2011 underrättades sökanden om att klyvningsprodukten LLCotton25 × MON 15985, p.g.a. reproduktionsegenskaperna hos bomullen GHB614 × LLCotton25 × MON 15985, skulle tas bort från ansökan så att den kunde bedömas separat. I en skrivelse av den 15 juni 2015 lämnade sökanden en uppdaterad version av ansökan till Europeiska myndigheten för livsmedelssäkerhet (nedan kallad myndigheten) där ansökan endast omfattade utsläppande på marknaden av livsmedel, livsmedelsingredienser och foder som innehåller, består av eller har framställts av bomullen GHB614 × LLCotton25 × MON 15985. |
|
(3) |
I enlighet med artiklarna 5.5 och 17.5 i förordning (EG) nr 1829/2003 innehöll ansökan information och slutsatser om den riskbedömning som genomförts enligt principerna i bilaga II till Europaparlamentets och rådets direktiv 2001/18/EG (2) och den information som krävs i bilagorna III och IV till det direktivet. Den innehöll även en plan för övervakning av miljöpåverkan i enlighet med bilaga VII till direktiv 2001/18/EG. |
|
(4) |
Myndigheten lämnade den 20 april 2018 ett positivt yttrande i enlighet med artiklarna 6 och 18 i förordning (EG) nr 1829/2003 (3). Myndigheten drog slutsatsen att den genetiskt modifierade bomullen GHB614 × LLCotton25 × MON 15985 vid användning enligt ansökan är lika säker och förväntas ha samma näringsmässiga effekt som den icke genetiskt modifierade motsvarigheten. |
|
(5) |
Myndigheten tog i sitt yttrande ställning till alla de specifika frågor och farhågor som togs upp av medlemsstaterna under samrådet med de behöriga nationella myndigheterna i enlighet med artiklarna 6.4 och 18.4 i förordning (EG) nr 1829/2003. |
|
(6) |
Myndigheten konstaterade också att planen för övervakning av miljöpåverkan i form av en allmän tillsynsplan som sökanden har lämnat in ligger i linje med de avsedda användningsområdena för produkterna. |
|
(7) |
Mot bakgrund av detta bör godkännande beviljas för utsläppande på marknaden av produkter som innehåller, består av eller har framställts av den genetiskt modifierade bomullen GHB614 × LLCotton25 × MON 15985. |
|
(8) |
I en skrivelse av den 1 augusti 2018 uppmanade Bayer CropScience AG kommissionen att överföra Bayer CropScience AG:s rättigheter och skyldigheter rörande samtliga godkännanden av och pågående ansökningar avseende genetiskt modifierade produkter till BASF Agricultural Solutions Seed US LLC. I en skrivelse av den 6 augusti 2018 gav BASF SE på uppdrag av BASF Agricultural Solutions Seed US LLC sitt samtycke till denna överföring. |
|
(9) |
En unik identitetsbeteckning bör tilldelas den genetiskt modifierade bomullen GHB614 × LLCotton25 × MON 15985 i enlighet med kommissionens förordning (EG) nr 65/2004 (4). |
|
(10) |
Enligt myndighetens yttrande verkar det, för de produkter som omfattas av detta beslut, inte behövas några andra särskilda märkningskrav än de som fastställs i artiklarna 13.1 och 25.2 i förordning (EG) nr 1829/2003 och i artikel 4.6 i Europaparlamentets och rådets förordning (EG) nr 1830/2003 (5). För att säkerställa att dessa produkter används på ett sätt som är godkänt enligt detta beslut bör det dock tydligt anges på märkningen av de produkter, med undantag av livsmedelsprodukter, som innehåller eller består av den genetiskt modifierade bomullen GHB614 × LLCotton25 × MON 15985 att de inte är avsedda för odling. |
|
(11) |
Innehavaren av godkännandet bör lämna årliga rapporter om genomförandet och resultaten av den verksamhet som beskrivs i planen för övervakning av miljöpåverkan. Dessa resultat bör läggas fram i enlighet med det standardformulär för rapportering som föreskrivs i kommissionens beslut 2009/770/EG (6). |
|
(12) |
Det framgår av myndighetens yttrande att det inte finns någon anledning att införa särskilda villkor för eller begränsningar av utsläppandet på marknaden och/eller särskilda villkor för eller begränsningar av användning eller hantering, däribland krav på övervakning av livsmedels eller foders användning efter försäljningen, eller för skydd av specifika ekosystem, miljöer och/eller geografiska områden i enlighet med artiklarna 6.5 e och 18.5 e i förordning (EG) nr 1829/2003. |
|
(13) |
Alla relevanta uppgifter om godkännandet av produkterna bör föras in i det gemenskapsregister över genetiskt modifierade livsmedel och foder som avses i artikel 28.1 i förordning (EG) nr 1829/2003. |
|
(14) |
Detta beslut bör genom förmedlingscentrumet för biosäkerhet (Biosafety Clearing-House) delges parterna i Cartagenaprotokollet om biosäkerhet till konventionen om biologisk mångfald, i enlighet med artiklarna 9.1 och 15.2 c i Europaparlamentets och rådets förordning (EG) nr 1946/2003 (7). |
|
(15) |
Ständiga kommittén för växter, djur, livsmedel och foder lämnade inget yttrande inom den tid som kommitténs ordförande bestämt. Denna genomförandeakt ansågs vara nödvändig och ordföranden lämnade den till omprövningskommittén för ytterligare överläggningar. Omprövningskommittén avgav inget yttrande. |
HÄRIGENOM FÖRESKRIVS FÖLJANDE.
Artikel 1
Genetiskt modifierad organism och unik identitetsbeteckning
Genetiskt modifierad bomull (Gossypium hirsutum) GHB614 × LLCotton25 × MON 15985, enligt specifikationen i led b i bilagan till detta beslut, tilldelas den unika identitetsbeteckningen BCS-GHØØ2-5 × ACS-GHØØ1-3 × MON-15985-7 i enlighet med förordning (EG) nr 65/2004.
Artikel 2
Godkännande
Följande produkter godkänns i enlighet med artiklarna 4.2 och 16.2 i förordning (EG) nr 1829/2003 enligt villkoren i detta beslut:
|
a) |
Livsmedel och livsmedelsingredienser som innehåller, består av eller har framställts av bomullen GHB614 × LLCotton25 × MON 15985. |
|
b) |
Foder som innehåller, består av eller har framställts av bomullen GHB614 × LLCotton25 × MON 15985. |
|
c) |
Produkter som innehåller eller består av bomullen GHB614 × LLCotton25 × MON 15985 för annan användning än den som anges i leden a och b i denna artikel, med undantag för odling. |
Artikel 3
Märkning
1. Vid tillämpningen av märkningskraven i artiklarna 13.1 och 25.2 i förordning (EG) nr 1829/2003 och i artikel 4.6 i förordning (EG) nr 1830/2003 ska ”organismens namn” vara ”bomull”.
2. Uppgiften ”inte avsedd för odling” ska finnas på etiketten och i de handlingar som åtföljer produkter som innehåller eller består av den genetiskt modifierade bomull som anges i artikel 1, med undantag för livsmedel och livsmedelsingredienser.
Artikel 4
Detektionsmetod
Den metod som fastställs i led d i bilagan ska gälla för detektion av den genetiskt modifierade bomull som anges i artikel 1.
Artikel 5
Övervakning av miljöpåverkan
1. Innehavaren av godkännandet ska se till att planen för övervakning av miljöpåverkan enligt led h i bilagan införs och tillämpas.
2. Innehavaren av godkännandet ska lämna årliga rapporter till kommissionen om genomförandet och resultaten av den verksamhet som beskrivs i övervakningsplanen i enlighet med beslut 2009/770/EG.
Artikel 6
Gemenskapsregister
Uppgifterna i bilagan till detta beslut ska föras in i det gemenskapsregister över genetiskt modifierade livsmedel och foder som avses i artikel 28.1 i förordning (EG) nr 1829/2003.
Artikel 7
Innehavare av godkännande
Innehavare av godkännandet ska vara BASF Agricultural Solutions Seed US LLC, Förenta staterna, som företräds av BASF SE, Tyskland.
Artikel 8
Giltighet
Detta beslut ska gälla i tio år från och med dagen för delgivningen.
Artikel 9
Adressat
Detta beslut riktar sig till BASF SE, Carl-Bosch-Str. 38, 67063 Ludwigshafen, Tyskland.
Utfärdat i Bryssel den 26 juli 2019.
På kommissionens vägnar
Vytenis ANDRIUKAITIS
Ledamot av kommissionen
(1) EUT L 268, 18.10.2003, s. 1.
(2) Europaparlamentets och rådets direktiv 2001/18/EG av den 12 mars 2001 om avsiktlig utsättning av genetiskt modifierade organismer i miljön och om upphävande av rådets direktiv 90/220/EEG (EGT L 106, 17.4.2001, s. 1).
(3) Efsas GMO-panel (Efsas panel för genetiskt modifierade organismer), 2018, ”Scientific opinion on the assessment of genetically modified cotton GHB614 × LLCotton25 × MON 15985 for food and feed uses, under Regulation (EC) No 1829/2003 (application EFSA-GMO-NL-2011-94)”, EFSA Journal, vol. 16(2018):4, artikelnr 5213 [27 s.], doi: 10.2903/j.efsa.2018.5213.
(4) Kommissionens förordning (EG) nr 65/2004 av den 14 januari 2004 om inrättande av ett system för skapande och tilldelning av unika identitetsbeteckningar för genetiskt modifierade organismer (EUT L 10, 16.1.2004, s. 5).
(5) Europaparlamentets och rådets förordning (EG) nr 1830/2003 av den 22 september 2003 om spårbarhet och märkning av genetiskt modifierade organismer och spårbarhet av livsmedel och foderprodukter som är framställda av genetiskt modifierade organismer och om ändring av direktiv 2001/18/EG (EUT L 268, 18.10.2003, s. 24).
(6) Kommissionens beslut 2009/770/EG av den 13 oktober 2009 om utarbetande av standardformulär för rapportering av övervakningsresultat rörande avsiktlig utsättning i miljön av produkter som består av eller innehåller genetiskt modifierade organismer, i syfte att släppa ut dessa på marknaden, i enlighet med Europaparlamentets och rådets direktiv 2001/18/EG (EUT L 275, 21.10.2009, s. 9).
(7) Europaparlamentets och rådets förordning (EG) nr 1946/2003 av den 15 juli 2003 om gränsöverskridande förflyttning av genetiskt modifierade organismer (EUT L 287, 5.11.2003, s. 1).
BILAGA
a) Sökande och innehavare av godkännandet
|
Namn |
: |
BASF Agricultural Solutions Seed US LLC |
|
Adress |
: |
100 Park Avenue, Florham Park, New Jersey 07932, Förenta staterna |
Företrädd av BASF SE, Carl-Bosch-Str. 38, 67063 Ludwigshafen, Tyskland.
b) Beteckning och specifikation av produkterna
|
1) |
Livsmedel och livsmedelsingredienser som innehåller, består av eller har framställts av bomullen GHB614 × LLCotton25 × MON 15985. |
|
2) |
Foder som innehåller, består av eller har framställts av bomullen GHB614 × LLCotton25 × MON 15985. |
|
3) |
Produkter som innehåller eller består av bomullen GHB614 × LLCotton25 × MON 15985 för annan användning än enligt punkterna 1 och 2, med undantag för odling. |
Den genetiskt modifierade bomullen GHB614 × LLCotton25 × MON 15985, enligt beskrivningen i ansökan, uttrycker 2mEPSPS-protein, som ger tolerans mot herbicider som innehåller glyfosat, PAT-protein som ger tolerans mot glufosinatammoniumbaserade herbicider samt Cry1Ac-protein och Cry1Ab2-protein som ger skydd mot vissa skadedjur av ordningen fjärilar. En uidA-gen som kodar för GUS-protein, en nptII-gen, som ger resistens mot kanamycin och neomycin, och en aadA-gen, som ger resistens mot spektinomycin och streptomycin, har använts som selektionsmarkörer under modifieringsprocessen.
c) Märkning
|
1) |
Vid tillämpningen av märkningskraven i artiklarna 13.1 och 25.2 i förordning (EG) nr 1829/2003 och i artikel 4.6 i förordning (EG) nr 1830/2003 ska ”organismens namn” vara ”bomull”. |
|
2) |
Uppgiften ”inte avsedd för odling” ska finnas på etiketten och i de handlingar som åtföljer de produkter som innehåller eller består av bomullen GHB614 × LLCotton25 × MON 15985 enligt led e, med undantag för livsmedel och livsmedelsingredienser. |
d) Detektionsmetod
|
1) |
Händelsespecifika metoder baserade på kvantitativ PCR för detektion av bomullen GHB614 × LLCotton25 × MON 15985 är de som har validerats för transformationshändelserna BCS-GHØØ2-5, ACS-GHØØ1-3 och MON-15985-7. Detektionsmetoderna har validerats på genomiskt DNA som extraherats ur blad av bomullen BCS-GHØØ2-5, ACS-GHØØ1-3 och MON-15985-7. |
|
2) |
Validerad av EU:s referenslaboratorium, som inrättats i enlighet med förordning (EG) nr 1829/2003, och offentliggjord på http://gmo-crl.jrc.ec.europa.eu/statusofdossiers.aspx; |
|
3) |
Referensmaterial: AOCS 1108-A5 (för BCS-GHØØ2-5), AOCS 0306-E2 (för ACS-GHØØ1-3) och AOCS 0804-D (MON-15985-7) är tillgängliga via American Oil Chemists Society på https://www.aocs.org/crm |
e) Unik identitetsbeteckning
BCS-GHØØ2-5 × ACS-GHØØ1-3 × MON-15985-7
f) Uppgifter som ska lämnas enligt bilaga II till Cartagenaprotokollet om biosäkerhet till konventionen om biologisk mångfald
[Biosafety Clearing House, Record ID: offentliggjord i registret över genetiskt modifierade livsmedel och foder i samband med delgivning]
g) Villkor för eller begränsningar av utsläppande på marknaden, användning och hantering av produkterna
Ej tillämpligt.
h) Plan för övervakning av miljöpåverkan
Plan för övervakning av miljöpåverkan i överensstämmelse med bilaga VII till direktiv 2001/18/EG.
[Länk: plan offentliggjord i gemenskapsregistret över genetiskt modifierade livsmedel och foder]
i) Krav på övervakning efter försäljningen avseende användning av produkten som livsmedel
Ej tillämpligt.
Anmärkning: Länkar till relevanta dokument kan behöva ändras med tiden. Allmänheten kommer att informeras om dessa ändringar genom uppdatering av registret över genetiskt modifierade livsmedel och foder.
|
2.8.2019 |
SV |
Europeiska unionens officiella tidning |
L 204/60 |
KOMMISSIONENS GENOMFÖRANDEBESLUT (EU) 2019/1303
av den 26 juli 2019
om godkännande för utsläppande på marknaden av produkter som innehåller, består av eller har framställts av den genetiskt modifierade majsen 5307 (SYN-Ø53Ø7-1) i enlighet med Europaparlamentets och rådets förordning (EG) nr 1829/2003 om genetiskt modifierade livsmedel och foder
[delgivet med nr C(2019) 5493]
(Endast de franska och nederländska texterna är giltiga)
(Text av betydelse för EES)
EUROPEISKA KOMMISSIONEN HAR ANTAGIT DETTA BESLUT
med beaktande av fördraget om Europeiska unionens funktionssätt,
med beaktande av Europaparlamentets och rådets förordning (EG) nr 1829/2003 av den 22 september 2003 om genetiskt modifierade livsmedel och foder (1), särskilt artiklarna 7.3 och 19.3, och
av följande skäl:
|
(1) |
Den 7 april 2011 lämnade Syngenta Crop Protection AG genom sitt dotterbolag Syngenta Crop Protection NV/SA (nedan kallad sökanden) in en ansökan till den behöriga tyska myndigheten, i enlighet med artiklarna 5 och 17 i förordning (EG) nr 1829/2003, om att få släppa ut livsmedel, livsmedelsingredienser och foder som innehåller, består av eller har framställts av den genetiskt modifierade majsen 5307 på marknaden (nedan kallad ansökan). Ansökan gällde även utsläppande på marknaden av produkter som innehåller eller består av den genetiskt modifierade majsen 5307 för annan användning än som livsmedel och foder, med undantag för odling. |
|
(2) |
I enlighet med artiklarna 5.5 och 17.5 i förordning (EG) nr 1829/2003 innehöll ansökan information och slutsatser om den riskbedömning som genomförts enligt principerna i bilaga II till Europaparlamentets och rådets direktiv 2001/18/EG (2) och den information som krävs i bilagorna III och IV till det direktivet. Den innehöll även en plan för övervakning av miljöpåverkan i enlighet med bilaga VII till direktiv 2001/18/EG. |
|
(3) |
Europeiska myndigheten för livsmedelssäkerhet (nedan kallad myndigheten) lämnade den 5 maj 2015 ett yttrande i enlighet med artiklarna 6 och 18 i förordning (EG) nr 1829/2003 (3). På grund av ett ofullständigt 28-dagars toxicitetstest för eCry3.1Ab-protein kunde myndigheten inte dra någon övergripande slutsats om majs 5307. |
|
(4) |
Den 8 december 2016 lämnade sökanden in ett nytt 28-dagars toxicitetstest för eCry3.1Ab-protein. |
|
(5) |
Den 11 april 2018 offentliggjorde myndigheten ett uttalande som kompletterade dess vetenskapliga yttrande (4), i vilket den tog hänsyn till det kompletterande toxicitetstestet. Myndigheten drog slutsatsen att majs 5307, enligt bedömningen i det ursprungliga yttrandet och det kompletterande toxicitetstestet, är lika säker och näringsrik som den konventionella motsvarigheten, vid användning enligt ansökan. |
|
(6) |
Myndigheten tog i sitt yttrande ställning till alla de frågor och farhågor som hade tagits upp av medlemsstaterna under samrådet med de behöriga nationella myndigheterna i enlighet med artiklarna 6.4 och 18.4 i förordning (EG) nr 1829/2003. |
|
(7) |
Myndigheten konstaterade också att planen för övervakning av miljöpåverkan i form av en allmän tillsynsplan som sökanden har lämnat in låg i linje med de avsedda användningsområdena för produkterna. |
|
(8) |
Mot bakgrund av detta bör godkännande beviljas för utsläppande på marknaden av produkter som innehåller, består av eller har framställts av den genetiskt modifierade majsen 5307, för de användningsområden som anges i ansökan. |
|
(9) |
En unik identitetsbeteckning bör tilldelas den genetiskt modifierad majsen 5307 i enlighet med kommissionens förordning (EG) nr 65/2004 (5). |
|
(10) |
Enligt myndighetens yttrande verkar det, för de produkter som omfattas av detta beslut, inte behövas några andra särskilda märkningskrav än de som fastställs i artiklarna 13.1 och 25.2 i förordning (EG) nr 1829/2003 och i artikel 4.6 i Europaparlamentets och rådets förordning (EG) nr 1830/2003 (6). För att säkerställa att dessa produkter används på ett sätt som är godkänt enligt detta beslut bör det dock tydligt anges på märkningen av de produkter, med undantag av livsmedelsprodukter, som innehåller eller består av den genetiskt modifierade majsen 5307 att de inte är avsedda för odling. |
|
(11) |
För att redogöra för genomförandet och resultaten av den verksamhet som beskrivs i planen för övervakning av miljöpåverkan bör innehavaren av godkännandet lämna in årliga rapporter, som läggs fram i enlighet med det standardformulär för rapportering som föreskrivs i kommissionens beslut 2009/770/EG (7). |
|
(12) |
Det framgår av myndighetens yttrande att det inte finns någon anledning att införa särskilda villkor för eller begränsningar av utsläppandet på marknaden, användning och hantering, däribland krav på övervakning av livsmedels eller foders användning efter försäljningen, eller för skydd av specifika ekosystem, miljöer eller geografiska områden i enlighet med artiklarna 6.5 e och 18.5 e i förordning (EG) nr 1829/2003. |
|
(13) |
Alla relevanta uppgifter om godkännandet av produkterna bör föras in i det gemenskapsregister över genetiskt modifierade livsmedel och foder som avses i artikel 28.1 i förordning (EG) nr 1829/2003. |
|
(14) |
Detta beslut bör genom förmedlingscentrumet för biosäkerhet (Biosafety Clearing-House) delges parterna i Cartagenaprotokollet om biosäkerhet till konventionen om biologisk mångfald, i enlighet med artiklarna 9.1 och 15.2 c i Europaparlamentets och rådets förordning (EG) nr 1946/2003 (8). |
|
(15) |
Ständiga kommittén för växter, djur, livsmedel och foder lämnade inget yttrande inom den tid som kommitténs ordförande bestämt. Denna genomförandeakt ansågs vara nödvändig och ordföranden lämnade den till omprövningskommittén för ytterligare överläggningar. Omprövningskommittén avgav inget yttrande. |
HÄRIGENOM FÖRESKRIVS FÖLJANDE.
Artikel 1
Genetiskt modifierad organism och unik identitetsbeteckning
Genetiskt modifierad majs (Zea mays L.) 5307, enligt specifikationen i led b i bilagan till detta beslut, tilldelas den unika identitetsbeteckningen SYN-Ø53Ø7-1 i enlighet med förordning (EG) nr 65/2004.
Artikel 2
Godkännande
Följande produkter godkänns i enlighet med artiklarna 4.2 och 16.2 i förordning (EG) nr 1829/2003 enligt villkoren i detta beslut:
|
a) |
Livsmedel och livsmedelsingredienser som innehåller, består av eller har framställts av SYN-Ø53Ø7-1-majs. |
|
b) |
Foder som innehåller, består av eller har framställts av SYN-Ø53Ø7-1-majs. |
|
c) |
Produkter som innehåller eller består av SYN-Ø53Ø7-1-majs för annan användning än den som anges i leden a och b i denna artikel, med undantag för odling. |
Artikel 3
Märkning
1. Vid tillämpningen av märkningskraven i artiklarna 13.1 och 25.2 i förordning (EG) nr 1829/2003 och i artikel 4.6 i förordning (EG) nr 1830/2003 ska ”organismens namn” vara ”majs”.
2. Uppgiften ”inte avsedd för odling” ska finnas på etiketten och i de handlingar som åtföljer produkter som innehåller eller består av SYN-Ø53Ø7-1-majs, med undantag av de produkter som avses i artikel 2 a.
Artikel 4
Detektionsmetod
Den metod som fastställs i led d i bilagan ska gälla för detektion av SYN-Ø53Ø7-1-majs.
Artikel 5
Övervakning av miljöpåverkan
1. Innehavaren av godkännandet ska se till att planen för övervakning av miljöpåverkan enligt led h i bilagan införs och tillämpas.
2. Innehavaren av godkännandet ska lämna årliga rapporter till kommissionen om genomförandet och resultaten av den verksamhet som beskrivs i övervakningsplanen i enlighet med beslut 2009/770/EG.
Artikel 6
Gemenskapsregister
Uppgifterna i bilagan till detta beslut ska föras in i det gemenskapsregister över genetiskt modifierade livsmedel och foder som avses i artikel 28.1 i förordning (EG) nr 1829/2003.
Artikel 7
Innehavare av godkännande
Innehavare av godkännandet ska vara Syngenta Crop Protection AG, Schweiz, som företräds av Syngenta Crop Protection NV/SA, Belgien.
Artikel 8
Giltighet
Detta beslut ska gälla i tio år från och med dagen för delgivningen.
Artikel 9
Adressat
Detta beslut riktar sig till Syngenta Crop Protection NV/SA, Avenue Louise/Louizalaan 489, 1050 Bruxelles/Brussel, Belgien.
Utfärdat i Bryssel den 26 juli 2019.
På kommissionens vägnar
Vytenis ANDRIUKAITIS
Ledamot av kommissionen
(1) EUT L 268, 18.10.2003, s. 1.
(2) Europaparlamentets och rådets direktiv 2001/18/EG av den 12 mars 2001 om avsiktlig utsättning av genetiskt modifierade organismer i miljön och om upphävande av rådets direktiv 90/220/EEG (EGT L 106, 17.4.2001, s. 1).
(3) Efsas GMO-panel (Efsas panel för genetiskt modifierade organismer), 2015, ”Scientific Opinion on application (EFSA-GMO-DE-2011-95) for the placing on the market of genetically modified maize 5307 for food and feed uses, import and processing under Regulation (EC) No 1829/2003 from Syngenta Crop Protection AG”, EFSA Journal, vol. 13(2015):5, artikelnr 4083 [29 s.], https://doi.org/10.2903/j.efsa.2015.4083
(4) Efsas GMO-panel (Efsas panel för genetiskt modifierade organismer), 2018, ”Statement complementing the EFSA Scientific Opinion on application (EFSA-GMO-DE-2011-95) for the placing on the market of genetically modified maize 5307 for food and feed uses, import and processing under Regulation (EC) No 1829/2003 from Syngenta Crop Protection AG taking into consideration an additional toxicological study”, EFSA Journal, vol. 16(2018):4, artikelnr 5233 [9 s.], https://doi.org/10.2903/j.efsa.2018.5233
(5) Kommissionens förordning (EG) nr 65/2004 av den 14 januari 2004 om inrättande av ett system för skapande och tilldelning av unika identitetsbeteckningar för genetiskt modifierade organismer (EUT L 10, 16.1.2004, s. 5).
(6) Europaparlamentets och rådets förordning (EG) nr 1830/2003 av den 22 september 2003 om spårbarhet och märkning av genetiskt modifierade organismer och spårbarhet av livsmedel och foderprodukter som är framställda av genetiskt modifierade organismer och om ändring av direktiv 2001/18/EG (EUT L 268, 18.10.2003, s. 24).
(7) Kommissionens beslut 2009/770/EG av den 13 oktober 2009 om utarbetande av standardformulär för rapportering av övervakningsresultat rörande avsiktlig utsättning i miljön av produkter som består av eller innehåller genetiskt modifierade organismer, i syfte att släppa ut dessa på marknaden, i enlighet med Europaparlamentets och rådets direktiv 2001/18/EG (EUT L 275, 21.10.2009, s. 9).
(8) Europaparlamentets och rådets förordning (EG) nr 1946/2003 av den 15 juli 2003 om gränsöverskridande förflyttning av genetiskt modifierade organismer (EUT L 287, 5.11.2003, s. 1).
BILAGA
a) Sökande och innehavare av godkännandet
|
Namn |
: |
Syngenta Crop Protection AG |
|
Adress |
: |
Schwarzwaldallee 215, CH-4058 Basel, Schweiz |
Företrädd av Syngenta Crop Protection NV/SA, Avenue Louise/Louizalaan 489, 1050 Bruxelles/Brussel, Belgien
b) Beteckning och specifikation av produkterna
|
1. |
Livsmedel som innehåller, består av eller har framställts av SYN-Ø53Ø7-1-majs. |
|
2. |
Foder som innehåller, består av eller har framställts av SYN-Ø53Ø7-1-majs. |
|
3. |
Produkter som innehåller eller består av SYN-Ø53Ø7-1-majs för annan användning än den som anges i punkterna 1 och 2, med undantag för odling. |
Den genetiskt modifierade majsen SYN-Ø53Ø7-1, så som den beskrivs i ansökan, uttrycker eCry3.1Ab-protein som ger resistens mot vissa växtskadegörande skalbaggar, och PMI-protein som användes som en selektionsmarkör.
c) Märkning
|
1. |
Vid tillämpningen av märkningskraven i artiklarna 13.1 och 25.2 i förordning (EG) nr 1829/2003 och i artikel 4.6 i förordning (EG) nr 1830/2003 ska ”organismens namn” vara ”majs”. |
|
2. |
Uppgiften ”inte avsedd för odling” ska finnas på etiketten och i de handlingar som åtföljer sådana produkter som innehåller eller består av SYN-Ø53Ø7-1-majs, med undantag av de produkter som avses i artikel 2 a. |
d) Detektionsmetod
|
1. |
Händelsespecifik metod baserad på kvantitativ realtids-PCR för detektion av den genetiskt modifierade majsen SYN-Ø53Ø7-1. |
|
2. |
Validerad av EU:s referenslaboratorium, som inrättats i enlighet med förordning (EG) nr 1829/2003, och offentliggjord på http://gmo-crl.jrc.ec.europa.eu/StatusOfDossiers.aspx |
|
3. |
Referensmaterial: AOCS 0411-C och AOCS 0411-D finns på https://www.aocs.org/crm (American Oil Chemists Society). |
e) Unik identitetsbeteckning
SYN-Ø53Ø7-1
f) Uppgifter som ska lämnas enligt bilaga II till Cartagenaprotokollet om biosäkerhet till konventionen om biologisk mångfald'
[Biosafety Clearing-House, Record ID: offentliggjord i gemenskapsregistret över genetiskt modifierade livsmedel och foder i samband med delgivningen]
g) Villkor för eller begränsningar av utsläppande på marknaden, användning och hantering av produkterna
Ej tillämpligt.
h) Plan för övervakning av miljöpåverkan
Plan för övervakning av miljöpåverkan i överensstämmelse med bilaga VII till direktiv 2001/18/EG.
[Länk: plan offentliggjord i registret över genetiskt modifierade livsmedel och foder]
i) Krav på övervakning efter försäljningen avseende användning av produkten som livsmedel
Ej tillämpligt.
Anmärkning: Länkar till relevanta dokument kan behöva ändras med tiden. Allmänheten kommer att informeras om dessa ändringar genom uppdatering av registret över genetiskt modifierade livsmedel och foder.
|
2.8.2019 |
SV |
Europeiska unionens officiella tidning |
L 204/65 |
KOMMISSIONENS GENOMFÖRANDEBESLUT (EU) 2019/1304
av den 26 juli 2019
om godkännande för utsläppande på marknaden av produkter som innehåller, består av eller har framställts av den genetiskt modifierade majsen 4114 (DP-ØØ4114-3), i enlighet med Europaparlamentets och rådets förordning (EG) nr 1829/2003
[delgivet med nr C(2019) 5491]
(Endast de franska och nederländska texterna är giltiga)
(Text av betydelse för EES)
EUROPEISKA KOMMISSIONEN HAR ANTAGIT DETTA BESLUT
med beaktande av fördraget om Europeiska unionens funktionssätt,
med beaktande av Europaparlamentets och rådets förordning (EG) nr 1829/2003 av den 22 september 2003 om genetiskt modifierade livsmedel och foder (1), särskilt artiklarna 7.3 och 19.3, och
av följande skäl:
|
(1) |
Den 27 november 2014 lämnade Pioneer Overseas Corporation, på uppdrag av Pioneer Hi-Bred International Inc., Förenta staterna, i enlighet med artiklarna 5 och 17 i förordning (EG) nr 1829/2003 in en ansökan till Nederländernas behöriga myndighet (nedan kallad ansökan). Ansökan gällde utsläppande på marknaden av livsmedel, livsmedelsingredienser och foder som innehåller, består av eller har framställts av den genetiskt modifierade majsen 4114. Ansökan gällde även utsläppande på marknaden av produkter som innehåller eller består av den genetiskt modifierade majsen 4114 för annan användning än som livsmedel och foder, med undantag för odling. |
|
(2) |
I enlighet med artiklarna 5.5 och 17.5 i förordning (EG) nr 1829/2003 innehöll ansökan information och slutsatser om den riskbedömning som genomförts enligt principerna i bilaga II till Europaparlamentets och rådets direktiv 2001/18/EG (2). Ansökan innehöll även den information som krävs i bilagorna III och IV till det direktivet och en plan för övervakning av miljöpåverkan i enlighet med bilaga VII till samma direktiv 2001/18/EG. |
|
(3) |
Europeiska myndigheten för livsmedelssäkerhet (nedan kallad myndigheten) lämnade den 24 maj 2018 ett positivt yttrande i enlighet med artiklarna 6 och 18 i förordning (EG) nr 1829/2003 (3). Myndigheten konstaterade att den genetiskt modifierade majsen 4114, så som den beskrivs i ansökan, är lika säker som de icke genetiskt modifierade motsvarigheterna och de testade icke genetiskt modifierade referenssorterna när det gäller potentiella effekter på människors och djurs hälsa och på miljön. |
|
(4) |
Myndigheten tog i sitt yttrande ställning till alla de frågor och farhågor som hade tagits upp av medlemsstaterna under samrådet med de behöriga nationella myndigheterna i enlighet med artiklarna 6.4 och 18.4 i förordning (EG) nr 1829/2003. |
|
(5) |
Myndigheten konstaterade också att planen för övervakning av miljöpåverkan i form av en allmän tillsynsplan som sökanden har lämnat in ligger i linje med produkternas avsedda användning. |
|
(6) |
Mot bakgrund av detta bör godkännande beviljas för utsläppande på marknaden av produkter som innehåller, består av eller har framställts av den genetiskt modifierade majsen 4114, för de användningsområden som anges i ansökan. |
|
(7) |
En unik identitetsbeteckning bör tilldelas den genetiskt modifierad majsen 4114 i enlighet med kommissionens förordning (EG) nr 65/2004 (4). |
|
(8) |
Enligt myndighetens yttrande verkar det, för de produkter som omfattas av detta beslut, inte behövas några andra särskilda märkningskrav än de som fastställs i artiklarna 13.1 och 25.2 i förordning (EG) nr 1829/2003 och i artikel 4.6 i Europaparlamentets och rådets förordning (EG) nr 1830/2003 (5). För att säkerställa att dessa produkter används på ett sätt som är godkänt enligt detta beslut bör det dock tydligt anges på märkningen av de produkter, med undantag för livsmedel och livsmedelsprodukter, som innehåller eller består av den genetiskt modifierade majsen 4114 att de inte är avsedda för odling. |
|
(9) |
För att redogöra för genomförandet och resultaten av den verksamhet som beskrivs i planen för övervakning av miljöpåverkan bör innehavaren av godkännandet lämna in årliga rapporter, som läggs fram i enlighet med det standardformulär för rapportering som föreskrivs i kommissionens beslut 2009/770/EG (6). |
|
(10) |
Myndighetens yttrande motiverar inte att det införs särskilda villkor för eller begränsningar av utsläppande på marknaden, användning och hantering, däribland krav på övervakning av konsumtionen av livsmedel eller foder efter försäljningen, eller för skydd av särskilda ekosystem, miljöer eller geografiska områden i enlighet med artiklarna 6.5 e och 18.5 e i förordning (EG) nr 1829/2003. |
|
(11) |
Alla relevanta uppgifter om godkännandet av produkterna bör föras in i det gemenskapsregister över genetiskt modifierade livsmedel och foder som avses i artikel 28.1 i förordning (EG) nr 1829/2003. |
|
(12) |
Detta beslut bör genom förmedlingscentrumet för biosäkerhet (Biosafety Clearing-House) delges parterna i Cartagenaprotokollet om biosäkerhet till konventionen om biologisk mångfald, i enlighet med artiklarna 9.1 och 15.2 c i Europaparlamentets och rådets förordning (EG) nr 1946/2003 (7). |
|
(13) |
Ständiga kommittén för växter, djur, livsmedel och foder lämnade inget yttrande inom den tid som kommitténs ordförande bestämt. Denna genomförandeakt ansågs vara nödvändig och ordföranden lämnade den till omprövningskommittén för ytterligare överläggningar. Omprövningskommittén avgav inget yttrande. |
HÄRIGENOM FÖRESKRIVS FÖLJANDE.
Artikel 1
Genetiskt modifierad organism och unik identitetsbeteckning
Genetiskt modifierad majs (Zea mays L.) 4114 enligt specifikationen i led b i bilagan till detta beslut tilldelas den unika identitetsbeteckningen DP-ØØ4114-3, i enlighet med förordning (EG) nr 65/2004.
Artikel 2
Godkännande
Vid tillämpningen av artiklarna 4.2 och 16.2 i förordning (EG) nr 1829/2003 godkänns följande produkter i enlighet med villkoren i detta beslut:
|
a) |
Livsmedel och livsmedelsingredienser som innehåller, består av eller har framställts av den genetiskt modifierade majsen 4114. |
|
b) |
Foder som innehåller, består av eller har framställts av den genetiskt modifierade majsen 4114. |
|
c) |
Produkter som innehåller eller består av den genetiskt modifierade majsen 4114 för annan användning än den som anges i leden a och b, med undantag för odling. |
Artikel 3
Märkning
1. Vid tillämpningen av märkningskraven i artiklarna 13.1 och 25.2 i förordning (EG) nr 1829/2003 och i artikel 4.6 i förordning (EG) nr 1830/2003 ska ”organismens namn” vara ”majs”.
2. Uppgiften ”inte avsedd för odling” ska finnas på etiketten och i de handlingar som åtföljer sådana produkter som innehåller eller består av den genetiskt modifierade majsen 4114, med undantag för livsmedel och livsmedelsingredienser.
Artikel 4
Detektionsmetod
Den metod som fastställs i led d i bilagan ska tillämpas för detektion av den genetiskt modifierade majsen 4114.
Artikel 5
Övervakning av miljöpåverkan
1. Innehavaren av godkännandet ska se till att planen för övervakning av miljöpåverkan enligt led h i bilagan införs och tillämpas.
2. Innehavaren av godkännandet ska lämna årliga rapporter till kommissionen om genomförandet och resultaten av den verksamhet som beskrivs i övervakningsplanen i enlighet med beslut 2009/770/EG.
Artikel 6
Gemenskapsregister
Uppgifterna i bilagan till detta beslut ska föras in i det gemenskapsregister över genetiskt modifierade livsmedel och foder som avses i artikel 28.1 i förordning (EG) nr 1829/2003.
Artikel 7
Innehavare av godkännandet
Innehavare av godkännandet ska vara Pioneer Hi-Bred International, Inc., Förenta staterna, som företräds av Pioneer Overseas Corporation, Belgien.
Artikel 8
Giltighet
Detta beslut ska gälla i tio år från och med dagen för delgivningen.
Artikel 9
Adressat
Detta beslut riktar sig till Pioneer Overseas Corporation, Avenue des Arts 44, 1040 Bruxelles/Brussel, Belgien.
Utfärdat i Bryssel den 26 juli 2019.
På kommissionens vägnar
Vytenis ANDRIUKAITIS
Ledamot av kommissionen
(1) EUT L 268, 18.10.2003, s. 1.
(2) Europaparlamentets och rådets direktiv 2001/18/EG av den 12 mars 2001 om avsiktlig utsättning av genetiskt modifierade organismer i miljön och om upphävande av rådets direktiv 90/220/EEG (EGT L 106, 17.4.2001, s. 1).
(3) Efsas GMO-panel (Efsas panel för genetiskt modifierade organismer), 2018, ”Scientific Opinion on the assessment of genetically modified maize 4114 for food and feed uses, under Regulation (EC) No 1829/2003 (application EFSA-GMO-NL-2014-123)”, EFSA Journal, vol. 16(2018):5, artikelnr 5280, [25 s.], https://doi.org/10.2903/j.efsa.2018.5280
(4) Kommissionens förordning (EG) nr 65/2004 av den 14 januari 2004 om inrättande av ett system för skapande och tilldelning av unika identitetsbeteckningar för genetiskt modifierade organismer (EUT L 10, 16.1.2004, s. 5).
(5) Europaparlamentets och rådets förordning (EG) nr 1830/2003 av den 22 september 2003 om spårbarhet och märkning av genetiskt modifierade organismer och spårbarhet av livsmedel och foderprodukter som är framställda av genetiskt modifierade organismer och om ändring av direktiv 2001/18/EG (EUT L 268, 18.10.2003, s. 24).
(6) Kommissionens beslut 2009/770/EG av den 13 oktober 2009 om utarbetande av standardformulär för rapportering av övervakningsresultat rörande avsiktlig utsättning i miljön av produkter som består av eller innehåller genetiskt modifierade organismer, i syfte att släppa ut dessa på marknaden, i enlighet med Europaparlamentets och rådets direktiv 2001/18/EG (EUT L 275, 21.10.2009, s. 9).
(7) Europaparlamentets och rådets förordning (EG) nr 1946/2003 av den 15 juli 2003 om gränsöverskridande förflyttning av genetiskt modifierade organismer (EUT L 287, 5.11.2003, s. 1).
BILAGA
a) Sökande och innehavare av godkännandet
|
Namn |
: |
Pioneer Hi-Bred International, Inc. |
|
Adress |
: |
7100 NW 62nd Avenue, P.O. Box 1014, Johnston, IA 50131-1014, Förenta staterna |
Företrädd av: Pioneer Overseas Corporation, Avenue des Arts, 44, 1040 Bruxelles/Brussel, Belgien.
b) Beteckning och specifikation av produkterna
|
1. |
Livsmedel och livsmedelsingredienser som innehåller, består av eller har framställts av den genetiskt modifierade majsen 4114. |
|
2. |
Foder som innehåller, består av eller har framställts av den genetiskt modifierade majsen 4114. |
|
3. |
Produkter som innehåller eller består av den genetiskt modifierade majsen 4114 för annan användning än den som anges i punkterna 1 och 2, med undantag för odling. |
Den genetiskt modifierade majsen 4114 uttrycker Cry1F-protein (trunkerad version), Cry34Ab1-protein och Cry35Ab1-protein, som ger skydd mot särskilda skadedjur av ordningen fjärilar respektive skalbaggar, och PAT-protein som ger tolerans mot glufosinatammoniumbaserade herbicider.
c) Märkning
|
1. |
Vid tillämpningen av märkningskraven i artiklarna 13.1 och 25.2 i förordning (EG) nr 1829/2003 och i artikel 4.6 i förordning (EG) nr 1830/2003 ska ”organismens namn” vara ”majs”. |
|
2. |
Uppgiften ”inte avsedd för odling” ska finnas på etiketten och i de handlingar som åtföljer produkter som innehåller eller består av genetiskt modifierad majs 4114, med undantag för de produkter som avses i led b punkt 1 i denna bilaga. |
d) Detektionsmetod
|
1. |
I realtid händelsespecifik metod baserad på PCR för detektion av genetiskt modifierad majs DP-ØØ4114-3. |
|
2. |
Validerad av EU:s referenslaboratorium, som inrättats i enlighet med förordning (EG) nr 1829/2003, och offentliggjord på http://gmo-crl.jrc.ec.europa.eu/StatusOfDossiers.aspx |
|
3. |
Referensmaterial: ERM®-BF439 är tillgängligt via Europeiska kommissionens gemensamma forskningscentrum (JRC) på https://ec.europa.eu/jrc/en/reference-materials/catalogue/ |
e) Unik identitetsbeteckning
DP-ØØ4114-3
f) Uppgifter som ska lämnas enligt bilaga II till Cartagenaprotokollet om biosäkerhet till konventionen om biologisk mångfald
[Biosafety Clearing-House, Record ID: offentliggjort i gemenskapsregistret över genetiskt modifierade livsmedel och foder i samband med delgivningen]
g) Villkor för eller begränsningar av utsläppande på marknaden, användning och hantering av produkterna
Ej tillämpligt.
h) Plan för övervakning av miljöpåverkan
Plan för övervakning av miljöpåverkan i enlighet med bilaga VII till direktiv 2001/18/EG.
[Länk: plan offentliggjord i gemenskapsregistret över genetiskt modifierade livsmedel och foder]
i) Krav på övervakning efter försäljningen avseende användning av produkten som livsmedel
Ej tillämpligt.
Anmärkning: Länkar till relevanta dokument kan behöva ändras med tiden. Allmänheten kommer att informeras om dessa ändringar genom uppdatering av gemenskapsregistret över genetiskt modifierade livsmedel och foder.
|
2.8.2019 |
SV |
Europeiska unionens officiella tidning |
L 204/69 |
KOMMISSIONENS GENOMFÖRANDEBESLUT (EU) 2019/1305
av den 26 juli 2019
om godkännande för utsläppande på marknaden av produkter som innehåller, består av eller har framställts av den genetiskt modifierade majsen Bt11 × MIR162 × 1507 × GA21 och klyvningsprodukterna Bt11 × MIR162 × 1507, MIR162 × 1507 × GA21 och MIR162 × 1507, i enlighet med Europaparlamentets och rådets förordning (EG) nr 1829/2003
[delgivet med nr C(2019) 5502]
(Endast de nederländska och franska texterna är giltiga)
(Text av betydelse för EES)
EUROPEISKA KOMMISSIONEN HAR ANTAGIT DETTA BESLUT
med beaktande av fördraget om Europeiska unionens funktionssätt,
med beaktande av Europaparlamentets och rådets förordning (EG) nr 1829/2003 av den 22 september 2003 om genetiskt modifierade livsmedel och foder (1), särskilt artiklarna 7.3 och 19.3, och
av följande skäl:
|
(1) |
Den 10 augusti 2010 lämnade Syngenta Crop Protection AG genom sitt dotterbolag Syngenta Crop Protection NV/SA in en ansökan i enlighet med artiklarna 5 och 17 i förordning (EG) nr 1829/2003 till Tysklands behöriga myndighet, om att få släppa ut livsmedel, livsmedelsingredienser och foder som innehåller, består av eller har framställts av den genetiskt modifierade majsen Bt11 × MIR162 × 1507 × GA21 på marknaden (nedan kallad ansökan). Ansökan gällde även utsläppande på marknaden av produkter som innehåller eller består av den genetiskt modifierade majsen Bt11 × MIR162 × 1507 × GA21 för annan användning än som livsmedel och foder, med undantag för odling. |
|
(2) |
I enlighet med artiklarna 5.5 och 17.5 i förordning (EG) nr 1829/2003 innehöll ansökan information och slutsatser om den riskbedömning som genomförts enligt principerna i bilaga II till Europaparlamentets och rådets direktiv 2001/18/EG (2) och den information som krävs i bilagorna III och IV till det direktivet. Ansökan innehöll även en plan för övervakning av miljöpåverkan i enlighet med bilaga VII till direktiv 2001/18/EG. |
|
(3) |
Den 30 juli 2013 utvidgade Syngenta ansökan till att omfatta alla tio klyvningsprodukter av de enskilda transformationshändelser som utgör Bt11 × MIR162 × 1507 × GA21-majs. |
|
(4) |
Den 31 mars 2016 uppdaterade Syngenta tillämpningsområdet för sin ansökan genom att utesluta de klyvningsprodukter som omfattades av andra ansökningar: Bt11 × MIR162 × GA21, Bt11 × MIR162, Bt11 × GA21 och MIR162 × GA21, godkända genom kommissionens genomförandebeslut (EU) 2016/1685 (3) och klyvningsprodukterna Bt11 × 1507 × GA21, Bt11 × 1507 och 1507 × GA21, godkända genom kommissionens genomförandebeslut (EU) 2017/1209 (4). Ansökan omfattar därför klyvningsprodukterna Bt11 × MIR162 × 1507, MIR162 × 1507 × GA21 och MIR162 × 1507. |
|
(5) |
Europeiska myndigheten för livsmedelssäkerhet (nedan kallad myndigheten) lämnade den 11 juli 2018 ett positivt yttrande i enlighet med artiklarna 6 och 18 i förordning (EG) nr 1829/2003 (5). Myndigheten konstaterade att den genetiskt modifierade majsen Bt11 × MIR162 × 1507 × GA21, så som den beskrivs i ansökan, är lika säker och näringsrik som den icke genetiskt modifierade motsvarigheten vid användning enligt ansökan. När det gäller de tre klyvningsprodukter som omfattas av ansökan konstaterade myndigheten att de förväntas vara lika säkra som de enskilda transformationshändelserna Bt11, MIR162, 1507 och GA21, som de tidigare bedömda klyvningsprodukterna och som de fyra staplade transformationshändelserna Bt11 × MIR162 × 1507 × GA21. |
|
(6) |
Myndigheten tog i sitt yttrande ställning till de frågor och farhågor som hade tagits upp av medlemsstaterna under samrådet med de behöriga nationella myndigheterna i enlighet med artiklarna 6.4 och 18.4 i förordning (EG) nr 1829/2003. |
|
(7) |
Myndigheten konstaterade också att planen för övervakning av miljöpåverkan i form av en allmän tillsynsplan som sökanden har lämnat in ligger i linje med produkternas avsedda användning. |
|
(8) |
Mot bakgrund av dessa slutsatser bör godkännande beviljas för utsläppande på marknaden av produkter som innehåller, består av eller har framställts av den genetiskt modifierade majsen Bt11 × MIR162 × 1507 × GA21 och av de tre klyvningsprodukterna Bt11 × MIR162 × 1507, MIR162 × 1507 × GA21 och MIR162 × 1507, för den användning som anges i ansökan. |
|
(9) |
En unik identitetsbeteckning bör tilldelas varje genetiskt modifierad organism som omfattas av detta beslut i enlighet med kommissionens förordning (EG) nr 65/2004 (6). |
|
(10) |
Enligt myndighetens yttrande verkar det, för de produkter som omfattas av detta beslut, inte behövas några andra särskilda märkningskrav än de som föreskrivs i artiklarna 13.1 och 25.2 i förordning (EG) nr 1829/2003 och i artikel 4.6 i Europaparlamentets och rådets förordning (EG) nr 1830/2003 (7). För att säkerställa att dessa produkter används på ett sätt som är godkänt enligt detta beslut bör det dock tydligt anges på märkningen av produkterna, med undantag för livsmedelsprodukter, att de inte är avsedda för odling. |
|
(11) |
För att redogöra för genomförandet och resultaten av den verksamhet som beskrivs i planen för övervakning av miljöpåverkan bör innehavaren av godkännandet lämna in årliga rapporter, som läggs fram i enlighet med det standardformulär för rapportering som föreskrivs i kommissionens beslut 2009/770/EG (8). |
|
(12) |
Myndighetens yttrande motiverar inte att det införs särskilda villkor för eller begränsningar av utsläppande på marknaden, användning och hantering, däribland krav på övervakning av konsumtionen av livsmedel eller foder efter försäljningen, eller för skydd av särskilda ekosystem, miljöer eller geografiska områden i enlighet med artiklarna 6.5 e och 18.5 e i förordning (EG) nr 1829/2003. |
|
(13) |
Alla relevanta uppgifter om godkännandet av produkterna bör föras in i det gemenskapsregister över genetiskt modifierade livsmedel och foder som avses i artikel 28.1 i förordning (EG) nr 1829/2003. |
|
(14) |
Detta beslut bör genom förmedlingscentrumet för biosäkerhet (Biosafety Clearing-House) delges parterna i Cartagenaprotokollet om biosäkerhet till konventionen om biologisk mångfald, i enlighet med artiklarna 9.1 och 15.2 c i Europaparlamentets och rådets förordning (EG) nr 1946/2003 (9). |
|
(15) |
Ständiga kommittén för växter, djur, livsmedel och foder lämnade inget yttrande inom den tid som kommitténs ordförande bestämt. Denna genomförandeakt ansågs vara nödvändig och ordföranden lämnade den till omprövningskommittén för ytterligare överläggningar. Omprövningskommittén avgav inget yttrande. |
HÄRIGENOM FÖRESKRIVS FÖLJANDE.
Artikel 1
Genetiskt modifierade organismer och unika identitetsbeteckningar
Genetiskt modifierad majs enligt specifikationen i led b i bilagan till detta beslut tilldelas följande unika identitetsbeteckningar, i enlighet med förordning (EG) nr 65/2004:
|
a) |
Den unika identitetsbeteckningen SYN-BTØ11-1 × SYN-IR162-4 × DAS-Ø15Ø7-1 × MON-ØØØ21-9 för den genetiskt modifierade majsen (Zea mays L.) Bt11 × MIR162 × 1507 × GA21. |
|
b) |
Den unika identitetsbeteckningen SYN-BTØ11-1 × SYN-IR162-4 × DAS-Ø15Ø7-1 för den genetiskt modifierade majsen (Zea mays L.) Bt11 × MIR162 × 1507. |
|
c) |
Den unika identitetsbeteckningen SYN-IR162-4 × DAS-Ø15Ø7-1 × MON-ØØØ21-9 för den genetiskt modifierade majsen (Zea mays L.) MIR162 × 1507 × GA21. |
|
d) |
Den unika identitetsbeteckningen SYN-IR162-4 × DAS-Ø15Ø7-1 för den genetiskt modifierade majsen (Zea mays L.) MIR162 × 1507. |
Artikel 2
Godkännande
Vid tillämpningen av artiklarna 4.2 och 16.2 i förordning (EG) nr 1829/2003 godkänns följande produkter i enlighet med villkoren i detta beslut:
|
a) |
Livsmedel och livsmedelsingredienser som innehåller, består av eller har framställts av den genetiskt modifierade majs som avses i artikel 1. |
|
b) |
Foder som innehåller, består av eller har framställts av den genetiskt modifierade majs som avses i artikel 1. |
|
c) |
Produkter som innehåller eller består av den genetiskt modifierade majs som avses i artikel 1 för annan användning än den som anges i leden a och b, med undantag för odling. |
Artikel 3
Märkning
1. Vid tillämpningen av märkningskraven i artiklarna 13.1 och 25.2 i förordning (EG) nr 1829/2003 och i artikel 4.6 i förordning (EG) nr 1830/2003 ska ”organismens namn” vara ”majs”.
2. Uppgiften ”inte avsedd för odling” ska finnas på etiketten och i de handlingar som åtföljer sådana produkter som innehåller eller består av den genetiskt modifierade majs som avses i artikel 1, med undantag för de produkter som avses i artikel 2 a.
Artikel 4
Detektionsmetod
Den metod som fastställs i led d i bilagan ska tillämpas för detektion av den genetiskt modifierade majs som avses i artikel 1.
Artikel 5
Övervakning av miljöpåverkan
1. Innehavaren av godkännandet ska se till att planen för övervakning av miljöpåverkan enligt led h i bilagan införs och tillämpas.
2. Innehavaren av godkännandet ska lämna årliga rapporter till kommissionen om genomförandet och resultaten av den verksamhet som beskrivs i övervakningsplanen i enlighet med beslut 2009/770/EG.
Artikel 6
Gemenskapsregister
Uppgifterna i bilagan till detta beslut ska föras in i det gemenskapsregister över genetiskt modifierade livsmedel och foder som avses i artikel 28.1 i förordning (EG) nr 1829/2003.
Artikel 7
Innehavare av godkännandet
Innehavare av godkännandet ska vara Syngenta Crop Protection AG, Schweiz, som företräds av Syngenta Crop Protection NV/SA, Belgien.
Artikel 8
Giltighet
Detta beslut ska gälla i tio år från och med dagen för delgivningen.
Artikel 9
Adressat
Detta beslut riktar sig till Syngenta Crop Protection NV/SA, Avenue Louise/Louizalaan 489, 1050 Bruxelles/Brussel, Belgien.
Utfärdat i Bryssel den 26 juli 2019.
På kommissionens vägnar
Vytenis ANDRIUKAITIS
Ledamot av kommissionen
(1) EUT L 268, 18.10.2003, s. 1.
(2) Europaparlamentets och rådets direktiv 2001/18/EG av den 12 mars 2001 om avsiktlig utsättning av genetiskt modifierade organismer i miljön och om upphävande av rådets direktiv 90/220/EEG (EGT L 106, 17.4.2001, s. 1).
(3) Kommissionens genomförandebeslut (EU) 2016/1685 av den 16 september 2016 om godkännande för utsläppande på marknaden av produkter som innehåller, består av eller har framställts av genetiskt modifierad Bt11 × MIR162 × MIR604 × GA21-majs och av genetiskt modifierad majs som kombinerar två eller tre av händelserna Bt11, MIR162, MIR604 och GA21 samt om upphävande av besluten 2010/426/EU, 2011/892/EU, 2011/893/EU och 2011/894/EU (EUT L 254, 20.9.2016, s. 22).
(4) Kommissionens genomförandebeslut (EU) 2017/1209 av den 4 juli 2017 om godkännande för utsläppande på marknaden av produkter som innehåller, består av eller har framställts av den genetiskt modifierade majsen Bt11 × 59122 × MIR604 × 1507 × GA21, och av genetiskt modifierad majs som kombinerar två, tre eller fyra av transformationshändelserna Bt11, 59122, MIR604, 1507 och GA21 i enlighet med Europaparlamentets och rådets förordning (EG) nr 1829/2003 om genetiskt modifierade livsmedel och foder (EUT L 173, 6.7.2017, s. 28).
(5) Efsas GMO-panel (Efsas panel för genetiskt modifierade organismer), 2018, ”Scientific Opinion on the assessment of genetically modified maize Bt11 x MIR162 x 1507 x GA21 and three subcombinations independently of their origin, for food and feed uses under Regulation (EC) No 1829/2003 (application EFSA-GMO-DE-2010-86)”, EFSA Journal, vol. 16(2018):7, artikelnr 5309.
(6) Kommissionens förordning (EG) nr 65/2004 av den 14 januari 2004 om inrättande av ett system för skapande och tilldelning av unika identitetsbeteckningar för genetiskt modifierade organismer (EUT L 10, 16.1.2004, s. 5).
(7) Europaparlamentets och rådets förordning (EG) nr 1830/2003 av den 22 september 2003 om spårbarhet och märkning av genetiskt modifierade organismer och spårbarhet av livsmedel och foderprodukter som är framställda av genetiskt modifierade organismer och om ändring av direktiv 2001/18/EG (EUT L 268, 18.10.2003, s. 24).
(8) Kommissionens beslut 2009/770/EG av den 13 oktober 2009 om utarbetande av standardformulär för rapportering av övervakningsresultat rörande avsiktlig utsättning i miljön av produkter som består av eller innehåller genetiskt modifierade organismer, i syfte att släppa ut dessa på marknaden, i enlighet med Europaparlamentets och rådets direktiv 2001/18/EG (EUT L 275, 21.10.2009, s. 9).
(9) Europaparlamentets och rådets förordning (EG) nr 1946/2003 av den 15 juli 2003 om gränsöverskridande förflyttning av genetiskt modifierade organismer (EUT L 287, 5.11.2003, s. 1).
BILAGA
a) Sökande och innehavare av godkännandet
|
Namn |
: |
Syngenta Crop Protection AG |
|
Adress |
: |
Schwarzwaldallee 215, CH-4058 Basel, Schweiz |
Företrädd av Syngenta Crop Protection NV/SA, 489, Avenue Louise/Louizalaan, 1050 Bruxelles/Brussel, Belgien
b) Beteckning och specifikation av produkterna
|
1) |
Livsmedel och livsmedelsingredienser som innehåller, består av eller har framställts av den genetiskt modifierade majs (Zea mays L.) som anges i led e. |
|
2) |
Foder som innehåller, består av eller har framställts av den genetiskt modifierade majs (Zea mays L.) som anges i led e. |
|
3) |
Produkter som innehåller eller består av den genetiskt modifierade majs som anges i led e för all annan användning än den som anges i punkterna 1 och 2, med undantag för odling. |
Den genetiskt modifierade majsen SYN-BTØ11-1 uttrycker Cry1Ab-protein, som ger skydd mot vissa skadedjur av ordningen fjärilar, och PAT-protein som ger tolerans mot glufosinatammoniumbaserade herbicider.
Den genetiskt modifierade majsen SYN-IR162-4 uttrycker Vip3Aa20-protein, som ger skydd mot vissa skadedjur av ordningen fjärilar, och PMI-protein som användes som selektionsmarkör.
Den genetiskt modifierade majsen DAS-Ø15Ø7-1 uttrycker Cry1F-protein, som ger skydd mot vissa skadedjur av ordningen fjärilar, och PAT-protein som ger tolerans mot glufosinatammoniumbaserade herbicider.
Den genetiskt modifierade majsen MON-ØØØ21-9 uttrycker mEPSPS-protein som ger tolerans mot glyfosatbaserade herbicider.
c) Märkning
|
1) |
Vid tillämpningen av märkningskraven i artiklarna 13.1 och 25.2 i förordning (EG) nr 1829/2003 och i artikel 4.6 i förordning (EG) nr 1830/2003 ska ”organismens namn” vara ”majs”. |
|
2) |
Uppgiften ”inte avsedd för odling” ska finnas på etiketten och i de handlingar som åtföljer produkter som innehåller eller består av den majs som anges i led e, med undantag för de produkter som avses i led b punkt 1 i denna bilaga. |
d) Detektionsmetod
|
1) |
De händelsespecifika metoder baserade på kvantitativ PCR för detektion av majs Bt11 × MIR162 × 1507 × GA21 som har validerats för transformationshändelserna SYN-BTØ11-1, SYN-IR162-4, DAS-Ø15Ø7-1 och MON-ØØØ21-9. |
|
2) |
Validerad av EU:s referenslaboratorium, som inrättats i enlighet med förordning (EG) nr 1829/2003, och offentliggjord på http://gmo-crl.jrc.ec.europa.eu/statusofdossiers.aspx. |
|
3) |
Referensmaterial: ERM®-BF412 (för SYN-BTØ11-1) och ERM®-BF418 (för DAS-Ø15Ø7-1) är tillgängliga via Europeiska kommissionens gemensamma forskningscentrum (JRC) på https://ec.europa.eu/jrc/en/reference-materials/catalogue/, och AOCS 1208-A och AOCS 0407-A (för SYN-IR162-4), AOCS 0407-A och AOCS 0407-B (för MON-ØØØ21-9) är tillgängliga via American Oil Chemists Society på https://www.aocs.org/crm#maize. |
e) Unika identitetsbeteckningar
SYN-BTØ11-1 × SYN-IR162-4 × DAS-Ø15Ø7-1 × MON-ØØØ21-9,
SYN-BTØ11-1 × SYN-IR162-4 × DAS-Ø15Ø7-1,
SYN-IR162-4 × DAS-Ø15Ø7-1 × MON-ØØØ21-9,
SYN-IR162-4 × DAS-Ø15Ø7-1.
f) Uppgifter som ska lämnas enligt bilaga II till Cartagenaprotokollet om biosäkerhet till konventionen om biologisk mångfald
[Biosafety Clearing-House, Record ID: offentliggjort i gemenskapsregistret över genetiskt modifierade livsmedel och foder i samband med delgivningen]
g) Villkor för eller begränsningar av utsläppande på marknaden, användning och hantering av produkterna
Ej tillämpligt.
h) Plan för övervakning av miljöpåverkan
Plan för övervakning av miljöpåverkan i enlighet med bilaga VII till direktiv 2001/18/EG.
[Länk: plan offentliggjord i gemenskapsregistret över genetiskt modifierade livsmedel och foder]
i) Krav på övervakning efter försäljningen avseende användning av produkten som livsmedel
Ej tillämpligt.
Anmärkning: Länkar till relevanta dokument kan behöva ändras med tiden. Allmänheten kommer att informeras om dessa ändringar genom uppdatering av gemenskapsregistret över genetiskt modifierade livsmedel och foder.
|
2.8.2019 |
SV |
Europeiska unionens officiella tidning |
L 204/75 |
KOMMISSIONENS GENOMFÖRANDEBESLUT (EU) 2019/1306
av den 26 juli 2019
om förlängning av godkännandet för utsläppande på marknaden av produkter som innehåller, består av eller har framställts av den genetiskt modifierade majsen 1507 × NK603 (DAS-Ø15Ø7-1 × MON-ØØ6Ø3-6), i enlighet med Europaparlamentets och rådets förordning (EG) nr 1829/2003
[delgivet med nr C(2019) 5503]
(Endast de franska och nederländska texterna är giltiga)
(Text av betydelse för EES)
EUROPEISKA KOMMISSIONEN HAR ANTAGIT DETTA BESLUT
med beaktande av fördraget om Europeiska unionens funktionssätt,
med beaktande av Europaparlamentets och rådets förordning (EG) nr 1829/2003 av den 22 september 2003 om genetiskt modifierade livsmedel och foder (1), särskilt artiklarna 11.3 och 23.3, och
av följande skäl:
|
(1) |
Genom kommissionens beslut 2007/703/EG (2) godkändes utsläppande på marknaden av livsmedel och foder som innehåller, består av eller har framställts av den genetiskt modifierade majsen 1507 × NK603 (nedan kallad majs 1507 × NK603). Godkännandet gäller också utsläppande på marknaden av andra produkter än livsmedel och foder som innehåller eller består av majs 1507 × NK603 för samma användningsområden som all annan slags majs, med undantag för odling. |
|
(2) |
Den 20 oktober 2016 lämnade Pioneer Overseas Corporation, på uppdrag av Pioneer Hi-Bred International Inc., och Dow AgroSciences Europe, på uppdrag av Dow AgroSciences LLC, i enlighet med artiklarna 11 och 23 i förordning (EG) nr 1829/2003 in en gemensam ansökan till kommissionen om förlängning av godkännandet. |
|
(3) |
Europeiska myndigheten för livsmedelssäkerhet (nedan kallad myndigheten) lämnade den 25 juli 2018 ett positivt yttrande i enlighet med artiklarna 6 och 18 i förordning (EG) nr 1829/2003 (3). Myndigheten konstaterade att det i ansökan om förlängning inte fanns några belägg för några nya faror eller någon modifierad exponering och inte heller några nya vetenskapliga osäkerheter som ändrar de slutsatser som dragits vid den ursprungliga riskbedömning av majs 1507 × NK603 som myndigheten antog 2006 (4). |
|
(4) |
Myndigheten tog i sitt yttrande av den 25 juli 2018 ställning till alla de frågor och farhågor som hade tagits upp av medlemsstaterna under samrådet med de behöriga nationella myndigheterna i enlighet med artiklarna 6.4 och 18.4 i förordning (EG) nr 1829/2003. |
|
(5) |
Myndigheten konstaterade också att planen för övervakning av miljöpåverkan i form av en allmän tillsynsplan som sökandena har lämnat in ligger i linje med de avsedda användningsområdena för produkterna. |
|
(6) |
Mot bakgrund av detta bör godkännandet för utsläppande på marknaden av livsmedel och foder som innehåller, består av eller har framställts av genetiskt modifierad majs 1507 × NK603 och av produkter som består av eller innehåller majs 1507 × NK603 för annan användning än som livsmedel och foder, med undantag för odling, förlängas. |
|
(7) |
Genom en skrivelse av den 13 september 2018 till kommissionen begärde Dow AgroSciences Europe, mot bakgrund av Förenade kungarikets utträde ur unionen, att företrädaren i unionen för Dow AgroSciences LLC, Förenta staterna, skulle vara Dow AgroSciences Distribution S.A.S., med säte i Frankrike. Genom en skrivelse av den 7 september 2018 bekräftade Dow AgroSciences Distribution S.A.S. sitt samtycke. |
|
(8) |
Genom en skrivelse av den 12 oktober 2018 bekräftade Dow AgroSciences LLC också sitt samtycke till att företrädas av Dow AgroSciences Distribution S.A.S. och klargjorde att Mycogen Seeds är ett dotterbolag till Dow AgroSciences LLC. |
|
(9) |
Inom ramen för det ursprungliga godkännandet har en unik identitetsbeteckning tilldelats genetiskt modifierad majs 1507 × NK603, i enlighet med kommissionens förordning (EG) nr 65/2004 (5). Denna unika identitetsbeteckning bör användas även i fortsättningen. |
|
(10) |
Enligt myndighetens yttrande verkar det, för de produkter som omfattas av detta beslut, inte behövas några andra särskilda märkningskrav än de som fastställs i artiklarna 13.1 och 25.2 i förordning (EG) nr 1829/2003 och i artikel 4.6 i Europaparlamentets och rådets förordning (EG) nr 1830/2003 (6). För att säkerställa att produkter som innehåller eller består av majs 1507 × NK603 används på ett sätt som är godkänt enligt detta beslut bör det dock tydligt anges på märkningen av produkterna, med undantag för livsmedelsprodukter, att de inte är avsedda för odling. |
|
(11) |
Innehavarna av godkännandet bör lämna in gemensamma årliga rapporter om genomförandet och resultaten av den verksamhet som beskrivs i övervakningsplanen. Dessa resultat bör läggas fram i enlighet med de krav som föreskrivs i kommissionens beslut 2009/770/EG (7). |
|
(12) |
Myndighetens yttrande motiverar inte att det införs särskilda villkor för eller begränsningar av utsläppande på marknaden, användning och hantering, däribland krav på övervakning av konsumtionen av livsmedel eller foder efter försäljningen, eller för skydd av särskilda ekosystem, miljöer eller geografiska områden i enlighet med artiklarna 6.5 e och 18.5 e i förordning (EG) nr 1829/2003. |
|
(13) |
Alla relevanta uppgifter om godkännandet av produkterna bör föras in i det gemenskapsregister över genetiskt modifierade livsmedel och foder som avses i artikel 28.1 i förordning (EG) nr 1829/2003. |
|
(14) |
Detta beslut bör genom förmedlingscentrumet för biosäkerhet (Biosafety Clearing-House) delges parterna i Cartagenaprotokollet om biosäkerhet till konventionen om biologisk mångfald, i enlighet med artiklarna 9.1 och 15.2 c i Europaparlamentets och rådets förordning (EG) nr 1946/2003 (8). |
|
(15) |
Ständiga kommittén för växter, djur, livsmedel och foder lämnade inget yttrande inom den tid som kommitténs ordförande bestämt. Denna genomförandeakt ansågs vara nödvändig och ordföranden lämnade den till omprövningskommittén för ytterligare överläggningar. Omprövningskommittén avgav inget yttrande. |
HÄRIGENOM FÖRESKRIVS FÖLJANDE.
Artikel 1
Genetiskt modifierad organism och unik identitetsbeteckning
Genetiskt modifierad majs (Zea mays L.) 1507 × NK603 enligt specifikationen i led b i bilagan till detta beslut tilldelas den unika identitetsbeteckningen DAS-Ø15Ø7-1 × MON-ØØ6Ø3-6, i enlighet med förordning (EG) nr 65/2004.
Artikel 2
Förlängning av godkännandet
Godkännandet för utsläppande på marknaden av följande produkter förlängs enligt villkoren i detta beslut:
|
a) |
Livsmedel och livsmedelsingredienser som innehåller, består av eller har framställts av den genetiskt modifierade majsen 1507 × NK603. |
|
b) |
Foder som innehåller, består av eller har framställts av den genetiskt modifierade majsen 1507 × NK603. |
|
c) |
Produkter som innehåller eller består av den genetiskt modifierade majsen 1507 × NK603 för annan användning än den som anges i leden a och b, med undantag för odling. |
Artikel 3
Märkning
1. Vid tillämpningen av märkningskraven i artiklarna 13.1 och 25.2 i förordning (EG) nr 1829/2003 och i artikel 4.6 i förordning (EG) nr 1830/2003 ska ”organismens namn” vara ”majs”.
2. Uppgiften ”inte avsedd för odling” ska finnas på etiketten och i de handlingar som åtföljer sådana produkter som innehåller eller består av genetiskt modifierad majs 1507 × NK603, med undantag för de produkter som avses i artikel 2 a.
Artikel 4
Detektionsmetod
Den metod som fastställs i led d i bilagan ska tillämpas för detektion av den genetiskt modifierade majsen 1507 × NK603.
Artikel 5
Övervakning av miljöpåverkan
1. Innehavarna av godkännandet ska se till att planen för övervakning av miljöpåverkan enligt punkt h i bilagan införs och tillämpas.
2. Innehavarna av godkännandet ska lämna gemensamma årliga rapporter till kommissionen om genomförandet och resultaten av den verksamhet som beskrivs i övervakningsplanen i enlighet med det format som fastställs i beslut 2009/770/EG.
Artikel 6
Gemenskapsregister
Uppgifterna i bilagan till detta beslut ska föras in i det gemenskapsregister över genetiskt modifierade livsmedel och foder som avses i artikel 28.1 i förordning (EG) nr 1829/2003.
Artikel 7
Innehavare av godkännandet
1. Innehavarna av godkännandet ska vara
|
a) |
Pioneer Hi-Bred International, Inc., Förenta staterna, som företräds av Pioneer Overseas Corporation, Belgien, och |
|
b) |
Dow AgroSciences LLC, Förenta staterna, som företräds av Dow AgroSciences Distribution S.A.S., Frankrike. |
2. Båda innehavarna av godkännandet ska ansvara för att fullgöra de åtaganden som innehavarna åläggs enligt detta beslut och förordning (EG) nr 1829/2003.
Artikel 8
Giltighet
Detta beslut ska gälla i tio år från och med dagen för delgivningen.
Artikel 9
Adressater
Detta beslut riktar sig till
|
a) |
Pioneer Overseas Corporation, Avenue des Arts/Kunstlaan 44, 1040 Bryssel, Belgien, och |
|
b) |
Dow AgroSciences Distribution S.A.S., 6, rue Jean Pierre Timbaud, 78180 Montigny-le-Bretonneux, Frankrike. |
Utfärdat i Bryssel den 26 juli 2019.
På kommissionens vägnar
Vytenis ANDRIUKAITIS
Ledamot av kommissionen
(1) EUT L 268, 18.10.2003, s. 1.
(2) Kommissionens beslut 2007/703/EG av den 24 oktober 2007 om godkännande för utsläppande på marknaden av produkter som innehåller, består av eller har framställts av den genetiskt modifierade majsen 1507xNK603 (DAS-Ø15Ø7-1xMON-ØØ6Ø3-6) enligt Europaparlamentets och rådets förordning (EG) nr 1829/2003 (EUT L 285, 31.10.2007, s. 47).
(3) Myndighetens GMO-panel 2018. ”Scientific Opinion on the assessment of genetically modified maize 1507 x NK603 for renewal of authorisation under Regulation (EC) No 1829/2003 (application EFSA-GMO-RX-008)”, EFSA Journal, vol. 16(2018):7, artikelnr 5347.
(4) ”Opinion of the Scientific Panel on Genetically Modified Organisms on an application (Reference EFSA-GMO-UK-2004-05) for the placing on the market of insect-protected and glufosinate and glyphosate-tolerant genetically modified maize 1507 x NK603, for food and feed uses, import and processing under Regulation (EC) No 1829/2003 from Pioneer Hi-Bred and Mycogen Seeds”, EFSA Journal, vol. 4(2006):5, artikelnr 355.
(5) Kommissionens förordning (EG) nr 65/2004 av den 14 januari 2004 om inrättande av ett system för skapande och tilldelning av unika identitetsbeteckningar för genetiskt modifierade organismer (EUT L 10, 16.1.2004, s. 5).
(6) Europaparlamentets och rådets förordning (EG) nr 1830/2003 av den 22 september 2003 om spårbarhet och märkning av genetiskt modifierade organismer och spårbarhet av livsmedel och foderprodukter som är framställda av genetiskt modifierade organismer och om ändring av direktiv 2001/18/EG (EUT L 268, 18.10.2003, s. 24).
(7) Kommissionens beslut 2009/770/EG av den 13 oktober 2009 om utarbetande av standardformulär för rapportering av övervakningsresultat rörande avsiktlig utsättning i miljön av produkter som består av eller innehåller genetiskt modifierade organismer, i syfte att släppa ut dessa på marknaden, i enlighet med Europaparlamentets och rådets direktiv 2001/18/EG (EUT L 275, 21.10.2009, s. 9).
(8) Europaparlamentets och rådets förordning (EG) nr 1946/2003 av den 15 juli 2003 om gränsöverskridande förflyttning av genetiskt modifierade organismer (EUT L 287, 5.11.2003, s. 1).
BILAGA
a) Sökande och innehavare av godkännandet
|
Namn |
: |
Pioneer Hi-Bred International, Inc. |
|
Adress |
: |
7100 NW 62nd Avenue, P.O. Box 1014, Johnston, IA 50131-1014, Förenta staterna |
Företrädd av: Pioneer Overseas Corporation, Avenue des Arts, 44, 1040 Bruxelles/Brussel, Belgien,
och
|
Namn |
: |
Dow AgroSciences LLC |
|
Adress |
: |
9330 Zionsville Road, Indianapolis, IN 46268-1054, Förenta staterna |
Företrädd av: Dow AgroSciences Distribution S.A.S., 6, rue Jean Pierre Timbaud, 78180 Montigny-le-Bretonneux, Frankrike.
b) Beteckning och specifikation av produkterna
|
1. |
Livsmedel och livsmedelsingredienser som innehåller, består av eller har framställts av den genetiskt modifierade majsen 1507 × NK603. |
|
2. |
Foder som innehåller, består av eller har framställts av den genetiskt modifierade majsen 1507 × NK603. |
|
3. |
Produkter som innehåller eller består av den genetiskt modifierade majsen 1507 × NK603 för annan användning än den som anges i punkterna 1 och 2, med undantag för odling. |
Den genetiskt modifierade majsen 1507 × NK603 uttrycker cry1F-genen, som ger skydd mot vissa skadedjur av ordningen fjärilar, pat-genen, som ger tolerans mot glufosinatammoniumbaserade herbicider, och cp4 epsps-genen, som ger tolerans mot glyfosatbaserade herbicider.
c) Märkning
|
1. |
Vid tillämpningen av märkningskraven i artiklarna 13.1 och 25.2 i förordning (EG) nr 1829/2003 och i artikel 4.6 i förordning (EG) nr 1830/2003 ska ”organismens namn” vara ”majs”. |
|
2. |
Uppgiften ”inte avsedd för odling” ska finnas på etiketten och i de handlingar som åtföljer produkter som innehåller eller består av den genetiskt modifierade majsen 1507 × NK603, med undantag för de produkter som avses i led b punkt 1 i denna bilaga. |
d) Detektionsmetod
|
1. |
Metoder baserade på händelsespecifik kvantitativ realtids-PCR för genetiskt modifierad DAS-Ø15Ø7-1-majs och MON-ØØ6Ø3-6-majs som validerats på DAS-Ø15Ø7-1 × MON-ØØ6Ø3-6-majs. |
|
2. |
Validerad av EU:s referenslaboratorium, som inrättats i enlighet med förordning (EG) nr 1829/2003, och offentliggjord på http://gmo-crl.jrc.ec.europa.eu/StatusOfDossiers.aspx |
|
3. |
Referensmaterial: ERM®-BF418 (för DAS-Ø15Ø7-1) och ERM®-BF415 (för MON-ØØ6Ø3-6) är tillgängliga via Europeiska kommissionens gemensamma forskningscentrum (JRC) på https://ec.europa.eu/jrc/en/reference-materials/catalogue/ |
e) Unik identitetsbeteckning
DAS-Ø15Ø7-1 × MON-ØØ6Ø3-6.
f) Uppgifter som ska lämnas enligt bilaga II till Cartagenaprotokollet om biosäkerhet till konventionen om biologisk mångfald
[Biosafety Clearing-House, Record ID: offentliggjort i gemenskapsregistret över genetiskt modifierade livsmedel och foder i samband med delgivningen]
g) Villkor för eller begränsningar av utsläppande på marknaden, användning och hantering av produkterna
Ej tillämpligt.
h) Plan för övervakning av miljöpåverkan
Plan för övervakning av miljöpåverkan i enlighet med bilaga VII till Europaparlamentets och rådets direktiv 2001/18/EG (1).
[Länk: plan offentliggjord i gemenskapsregistret över genetiskt modifierade livsmedel och foder]
i) Krav på övervakning efter försäljningen avseende användning av produkten som livsmedel
Ej tillämpligt.
Anmärkning: Länkar till relevanta dokument kan behöva ändras med tiden. Allmänheten kommer att informeras om dessa ändringar genom uppdatering av gemenskapsregistret över genetiskt modifierade livsmedel och foder.
(1) Europaparlamentets och rådets direktiv 2001/18/EG av den 12 mars 2001 om avsiktlig utsättning av genetiskt modifierade organismer i miljön och om upphävande av rådets direktiv 90/220/EEG (EGT L 106, 17.4.2001, s. 1).
|
2.8.2019 |
SV |
Europeiska unionens officiella tidning |
L 204/81 |
KOMMISSIONENS GENOMFÖRANDEBESLUT (EU) 2019/1307
av den 26 juli 2019
om godkännande för utsläppande på marknaden av produkter som innehåller, består av eller har framställts av den genetiskt modifierade majsen MON 87403 (MON-874Ø3-1) i enlighet med Europaparlamentets och rådets förordning (EG) nr 1829/2003
[delgivet med nr C(2019) 5481]
(Endast de nederländska och franska texterna är giltiga)
(Text av betydelse för EES)
EUROPEISKA KOMMISSIONEN HAR ANTAGIT DETTA BESLUT
med beaktande av fördraget om Europeiska unionens funktionssätt,
med beaktande av Europaparlamentets och rådets förordning (EG) nr 1829/2003 av den 22 september 2003 om genetiskt modifierade livsmedel och foder (1), särskilt artiklarna 7.3 och 19.3, och
av följande skäl:
|
(1) |
På uppdrag av Monsanto Company lämnade Monsanto Europe SA/N.V. den 26 juni 2015, på uppdrag av företaget Montesanto Förenta staterna, in en ansökan till den behöriga belgiska myndigheten, i enlighet med artiklarna 5 och 17 i förordning (EG) nr 1829/2003, om att få släppa ut livsmedel, livsmedelsingredienser och foder som innehåller, består av eller har framställts av den genetiskt modifierade majsen MON 87403 på marknaden (nedan kallad ansökan). Ansökan gällde även utsläppande på marknaden av produkter som innehåller eller består av den genetiskt modifierade majsen MON 87403 för annan användning än som livsmedel och foder, med undantag för odling. |
|
(2) |
I enlighet med artiklarna 5.5 och 17.5 i förordning (EG) nr 1829/2003 innehöll ansökan information och slutsatser om den riskbedömning som genomförts enligt principerna i bilaga II till Europaparlamentets och rådets direktiv 2001/18/EG (2) och den information som krävs i bilagorna III och IV till det direktivet. Den innehöll även en plan för övervakning av miljöpåverkan i enlighet med bilaga VII till direktiv 2001/18/EG. |
|
(3) |
Europeiska myndigheten för livsmedelssäkerhet (nedan kallad myndigheten) lämnade den 26 april 2018 ett positivt yttrande i enlighet med artiklarna 6 och 18 i förordning (EG) nr 1829/2003 (3). Efsa drog slutsatsen att den genetiskt modifierade majsen MON 87403, såsom den beskrivs i ansökan, är lika säker som den konventionella motsvarigheten och de testade icke genetiskt modifierade referenssorterna när det gäller potentiella effekter på människors och djurs hälsa och på miljön. |
|
(4) |
Myndigheten tog i sitt yttrande ställning till alla de frågor och farhågor som hade tagits upp av medlemsstaterna under samrådet med de behöriga nationella myndigheterna i enlighet med artiklarna 6.4 och 18.4 i förordning (EG) nr 1829/2003. |
|
(5) |
Myndigheten konstaterade också att planen för övervakning av miljöpåverkan i form av en allmän tillsynsplan som sökanden har lämnat in ligger i linje med de avsedda användningsområdena för produkterna. |
|
(6) |
Mot bakgrund av detta bör utsläppande på marknaden av produkter som innehåller består av eller har framställts av den genetiskt modifierade majsen MON 87403 tillåtas, för de användningsområden som anges i ansökan. |
|
(7) |
Genom en skrivelse av den 27 augusti 2018 har Monsanto Europe NV meddelat kommissionen att Monsanto Europe NV ändrat sin rättsliga form och bytt namn till Bayer Agriculture BVBA, Belgien. |
|
(8) |
En unik identitetsbeteckning bör tilldelas den genetiskt modifierade majsen MON 87403 i enlighet med kommissionens förordning (EG) nr 65/2004 (4). |
|
(9) |
Enligt myndighetens yttrande verkar det, för de produkter som omfattas av detta beslut, inte behövas några andra särskilda märkningskrav än de som fastställs i artiklarna 13.1 och 25.2 i förordning (EG) nr 1829/2003 (5) och i artikel 4.6 i Europaparlamentets och rådets förordning (EG) nr 1830/2003. För att säkerställa att dessa produkter också i fortsättningen används på ett sätt som är godkänt enligt detta beslut bör det dock tydligt anges på märkningen av de produkter, med undantag för livsmedelsprodukter, som innehåller eller består av genetiskt modifierad majs MON 87403 att de inte är avsedda för odling. |
|
(10) |
För att redogöra för genomförandet och resultaten av den verksamhet som beskrivs i planen för övervakning av miljöpåverkan bör innehavaren av godkännandet lämna in årliga rapporter, som läggs fram i enlighet med det standardformulär för rapportering som föreskrivs i kommissionens beslut 2009/770/EG (6). |
|
(11) |
Det framgår av myndighetens yttrande att det inte finns någon anledning att införa särskilda villkor för eller begränsningar av utsläppandet på marknaden, användning eller hantering, däribland krav på övervakning av livsmedels eller foders användning efter försäljningen, eller för skydd av specifika ekosystem, miljöer eller geografiska områden i enlighet med artiklarna 6.5 e och 18.5 e i förordning (EG) nr 1829/2003. |
|
(12) |
Alla relevanta uppgifter om godkännandet av produkterna bör föras in i det gemenskapsregister över genetiskt modifierade livsmedel och foder som avses i artikel 28.1 i förordning (EG) nr 1829/2003. |
|
(13) |
Detta beslut bör genom förmedlingscentrumet för biosäkerhet (Biosafety Clearing-House) delges parterna i Cartagenaprotokollet om biosäkerhet till konventionen om biologisk mångfald, i enlighet med artiklarna 9.1 och 15.2 c i Europaparlamentets och rådets förordning (EG) nr 1946/2003 (7). |
|
(14) |
Ständiga kommittén för växter, djur, livsmedel och foder lämnade inget yttrande inom den tid som kommitténs ordförande bestämt. Denna genomförandeakt ansågs vara nödvändig och ordföranden lämnade den till omprövningskommittén för ytterligare överläggningar. Omprövningskommittén avgav inget yttrande. |
HÄRIGENOM FÖRESKRIVS FÖLJANDE.
Artikel 1
Genetiskt modifierad organism och unik identitetsbeteckning
Genetiskt modifierad majs (Zea mays L.) MON 87403, enligt specifikationen i led b i bilagan till detta beslut, tilldelas den unika identitetsbeteckningen MON-874Ø3-1 i enlighet med förordning (EG) nr 65/2004.
Artikel 2
Godkännande
Följande produkter ska godkännas i enlighet med artiklarna 4.2 och 16.2 i förordning (EG) nr 1829/2003, enligt villkoren i detta beslut:
|
a) |
Livsmedel och livsmedelsingredienser som innehåller, består av eller har framställts av MON-874Ø3-1-majs. |
|
b) |
Foder som innehåller, består av eller har framställts av MON-874Ø3-1-majs. |
|
c) |
Produkter som innehåller eller består av MON-874Ø3-1-majs för annan användning än den som anges i leden a och b i denna artikel, med undantag för odling. |
Artikel 3
Märkning
1. Vid tillämpningen av märkningskraven i artiklarna 13.1 och 25.2 i förordning (EG) nr 1829/2003 och i artikel 4.6 i förordning (EG) nr 1830/2003 ska ”organismens namn” vara ”majs”.
2. Uppgiften ”inte avsedd för odling” ska finnas på etiketten och i de handlingar som åtföljer sådana produkter som innehåller eller består av MON-874Ø3-1-majs, med undantag av de produkter som avses i artikel 2 a.
Artikel 4
Detekteringsmetod
Den metod som fastställs i led d i bilagan ska gälla för detektering av majs MON-874Ø3-1.
Artikel 5
Övervakning av miljöpåverkan
1. Innehavaren av godkännandet ska se till att planen för övervakning av miljöpåverkan enligt led h i bilagan införs och tillämpas.
2. Innehavaren av godkännandet ska lämna årliga rapporter till kommissionen om genomförandet och resultaten av den verksamhet som beskrivs i övervakningsplanen i enlighet med beslut 2009/770/EG.
Artikel 6
Gemenskapsregister
Uppgifterna i bilagan till detta beslut ska föras in i det gemenskapsregister över genetiskt modifierade livsmedel och foder som avses i artikel 28.1 i förordning (EG) nr 1829/2003.
Artikel 7
Innehavare av godkännande
Innehavare av godkännandet ska vara Monsanto Company i Förenta staterna, som företräds av Bayer Agriculture BVBA i Belgien.
Artikel 8
Giltighet
Detta beslut ska gälla i tio år från och med dagen för delgivningen.
Artikel 9
Adressat
Detta beslut riktar sig till Bayer Agriculture BVBA, Scheldelaan 460, 2040 Antwerpen, Belgien
Utfärdat i Bryssel den 26 juli 2019.
På kommissionens vägnar
Vytenis ANDRIUKAITIS
Ledamot av kommissionen
(1) EUT L 268, 18.10.2003, s. 1.
(2) Europaparlamentets och rådets direktiv 2001/18/EG av den 12 mars 2001 om avsiktlig utsättning av genetiskt modifierade organismer i miljön och om upphävande av rådets direktiv 90/220/EEG (EGT L 106, 17.4.2001, s. 1).
(3) Efsas GMO-panel (Efsas panel för genetiskt modifierade organismer), 2018, Scientific Opinion on the assessment of genetically modified maize MON 87403 for food and feed uses, import and processing, under Regulation (EC) No 1829/2003 (ansökan EFSA-GMO-BE-2015-125). EFSA Journal, vol. 16(2018):3, artikelnr 5225, [28 s.]. https://doi.org/10.2903/j.efsa.2018.5225
(4) Kommissionens förordning (EG) nr 65/2004 av den 14 januari 2004 om inrättande av ett system för skapande och tilldelning av unika identitetsbeteckningar för genetiskt modifierade organismer (EUT L 10, 16.1.2004, s. 5).
(5) Europaparlamentets och rådets förordning (EG) nr 1830/2003 av den 22 september 2003 om spårbarhet och märkning av genetiskt modifierade organismer och spårbarhet av livsmedel och foderprodukter som är framställda av genetiskt modifierade organismer och om ändring av direktiv 2001/18/EG (EUT L 268, 18.10.2003, s. 24).
(6) Kommissionens beslut 2009/770/EG av den 13 oktober 2009 om utarbetande av standardformulär för rapportering av övervakningsresultat rörande avsiktlig utsättning i miljön av produkter som består av eller innehåller genetiskt modifierade organismer, i syfte att släppa ut dessa på marknaden, i enlighet med Europaparlamentets och rådets direktiv 2001/18/EG (EUT L 275, 21.10.2009, s. 9).
(7) Europaparlamentets och rådets förordning (EG) nr 1946/2003 av den 15 juli 2003 om gränsöverskridande förflyttning av genetiskt modifierade organismer (EUT L 287, 5.11.2003, s. 1).
BILAGA
a) Sökande och innehavare av godkännandet:
|
Namn |
: |
Monsanto Company |
|
Adress |
: |
800 N. Lindbergh Boulevard, St. Louis, Missouri 63167, Förenta staterna |
Företrädd av Bayer jordbruk BVBA, Scheldelaan 460, 2040 Antwerpen, Belgien.
b) Beteckning och specifikation av produkterna:
|
1) |
Livsmedel och livsmedelsingredienser som innehåller, består av eller har framställts av MON-874Ø3-1-majs. |
|
2) |
Foder som innehåller, består av eller har framställts av MON-874Ø3-1-majs. |
|
3) |
Produkter som innehåller eller består av MON-874Ø3-1-majs för all annan användning än enligt punkterna 1 och 2, med undantag för odling. |
Den genetiskt modifierade majsen MON-874Ø3-1 har utvecklats för att axets biomassa i en tidig reproduktionsfas genom uttrycket av proteinet AtHB17Δ113 (kodat av en gen från Arabidopsis thaliana).
c) Märkning:
|
1) |
Vid tillämpningen av märkningskraven i artiklarna 13.1 och 25.2 i förordning (EG) nr 1829/2003 och i artikel 4.6 i förordning (EG) nr 1830/2003 ska ”organismens namn” vara ”majs”. |
|
2) |
Uppgiften ”inte avsedd för odling” ska finnas på etiketten och i de handlingar som åtföljer sådana produkter som innehåller eller består av MON-874Ø3-1-majs, med undantag av de produkter som avses i artikel 2 a. |
d) Detektionsmetod:
|
1) |
Händelsespecifik metod baserad på kvantitativ realtids-PCR för detektering av genetiskt modifierad MON-874Ø3-1 majs. |
|
2) |
Validerad av EU:s referenslaboratorium, som inrättats i enlighet med förordning (EG) nr 1829/2003, och offentliggjord på http://gmo-crl.jrc.ec.europa.eu/StatusOfDossiers.aspx. |
|
3) |
Referensmaterial: AOCS 0216-A på https://www.aocs.org/crm (American Oil Chemists Society). |
e) Unik identitetsbeteckning:
MON-874Ø3-1
f) Uppgifter som ska lämnas enligt bilaga II till Cartagenaprotokollet om biosäkerhet till konventionen om biologisk mångfald:
[Biosafety Clearing House, Record ID: offentliggjord i registret över genetiskt modifierade livsmedel och foder i samband med delgivning]
g) Villkor för eller begränsningar av utsläppande på marknaden, användning och hantering av produkterna:
Ej tillämpligt.
h) Plan för övervakning av miljöpåverkan:
Plan för övervakning av miljöpåverkan i överensstämmelse med bilaga VII till direktiv 2001/18/EG.
[Länk: plan offentliggjord i registret över genetiskt modifierade livsmedel och foder]
i) Krav på övervakning efter försäljningen avseende användning av produkten som livsmedel:
Ej tillämpligt.
Anmärkning: Länkar till relevanta dokument kan behöva ändras med tiden. Allmänheten kommer att informeras om dessa ändringar genom uppdatering av registret över genetiskt modifierade livsmedel och foder.
|
2.8.2019 |
SV |
Europeiska unionens officiella tidning |
L 204/85 |
KOMMISSIONENS GENOMFÖRANDEBESLUT (EU) 2019/1308
av den 26 juli 2019
om godkännande för utsläppande på marknaden av produkter som innehåller, består av eller har framställts av den genetiskt modifierade majsen MON 87411 (MON-87411-9), i enlighet med Europaparlamentets och rådets förordning (EG) nr 1829/2003
[delgivet med nr C(2019) 5487]
(Endast de nederländska och franska texterna är giltiga)
(Text av betydelse för EES)
EUROPEISKA KOMMISSIONEN HAR ANTAGIT DETTA BESLUT
med beaktande av fördraget om Europeiska unionens funktionssätt,
med beaktande av Europaparlamentets och rådets förordning (EG) nr 1829/2003 av den 22 september 2003 om genetiskt modifierade livsmedel och foder (1), särskilt artiklarna 7.3 och 19.3, och
av följande skäl:
|
(1) |
Den 5 februari 2015 lämnade Monsanto Europe NV, på uppdrag av Monsanto Company, Förenta staterna, i enlighet med artiklarna 5 och 17 i förordning (EG) nr 1829/2003 in en ansökan till Nederländernas behöriga myndighet om att få släppa ut livsmedel, livsmedelsingredienser och foder som innehåller, består av eller har framställts av majsen MON 87411 på marknaden (nedan kallad ansökan). Ansökan gällde även utsläppande på marknaden av produkter som består av den genetiskt modifierade majsen MON 87411 för all annan användning än som livsmedel och foder som är tillåten för annan majs, med undantag för odling. |
|
(2) |
I enlighet med artiklarna 5.5 och 17.5 i förordning (EG) nr 1829/2003 innehöll ansökan information och slutsatser om den riskbedömning som genomförts enligt principerna i bilaga II till Europaparlamentets och rådets direktiv 2001/18/EG (2) och den information som krävs i bilagorna III och IV till det direktivet. Ansökan innehöll även en plan för övervakning av miljöpåverkan i enlighet med bilaga VII till direktiv 2001/18/EG. |
|
(3) |
Europeiska myndigheten för livsmedelssäkerhet (nedan kallad myndigheten) lämnade den 2 juli 2018 ett positivt yttrande i enlighet med artiklarna 6 och 18 i förordning (EG) nr 1829/2003 (3). Myndigheten konstaterade att den genetiskt modifierade majsen MON 87411, så som den beskrivs i ansökan, är lika säker och näringsrik som den konventionella motsvarigheten och de testade icke genetiskt modifierade referenssorterna när det gäller potentiella effekter på människors och djurs hälsa och på miljön. |
|
(4) |
Myndigheten tog i sitt yttrande ställning till alla de frågor och farhågor som hade tagits upp av medlemsstaterna under samrådet med de behöriga nationella myndigheterna i enlighet med artiklarna 6.4 och 18.4 i förordning (EG) nr 1829/2003. |
|
(5) |
Myndigheten konstaterade också att planen för övervakning av miljöpåverkan i form av en allmän tillsynsplan som sökanden har lämnat in ligger i linje med produkternas avsedda användning. |
|
(6) |
Mot bakgrund av dessa slutsatser bör godkännande beviljas för utsläppande på marknaden av produkter som innehåller, består av eller har framställts av den genetiskt modifierade majsen MON 87411, för den användning som anges i ansökan. |
|
(7) |
Genom en skrivelse av den 27 augusti 2018 har Monsanto Europe NV meddelat kommissionen att Monsanto Europe NV ändrat sin rättsliga form och bytt namn till Bayer Agriculture BVBA, Belgien. |
|
(8) |
En unik identitetsbeteckning bör tilldelas den genetiskt modifierad majsen MON 87411 i enlighet med kommissionens förordning (EG) nr 65/2004 (4). |
|
(9) |
Enligt myndighetens yttrande verkar det, för de produkter som omfattas av detta beslut, inte behövas några andra särskilda märkningskrav än de som föreskrivs i artiklarna 13.1 och 25.2 i förordning (EG) nr 1829/2003 och i artikel 4.6 i Europaparlamentets och rådets förordning (EG) nr 1830/2003 (5). För att säkerställa att dessa produkter också i fortsättningen används på ett sätt som är godkänt enligt detta beslut bör det dock tydligt anges på märkningen av de produkter, med undantag för livsmedelsprodukter, som innehåller eller består av den genetiskt modifierad majsen MON 87411 att de inte är avsedda för odling. |
|
(10) |
För att redogöra för genomförandet och resultaten av den verksamhet som beskrivs i planen för övervakning av miljöpåverkan bör innehavaren av godkännandet lämna in årliga rapporter, som läggs fram i enlighet med det standardformulär för rapportering som föreskrivs i kommissionens beslut 2009/770/EG (6). |
|
(11) |
Myndighetens yttrande motiverar inte att det införs särskilda villkor för eller begränsningar av utsläppande på marknaden, användning och hantering, däribland krav på övervakning av konsumtionen av livsmedel eller foder efter försäljningen, eller för skydd av särskilda ekosystem, miljöer eller geografiska områden i enlighet med artiklarna 6.5 e och 18.5 e i förordning (EG) nr 1829/2003. |
|
(12) |
Alla relevanta uppgifter om godkännandet av produkterna bör föras in i det gemenskapsregister över genetiskt modifierade livsmedel och foder som avses i artikel 28.1 i förordning (EG) nr 1829/2003. |
|
(13) |
Detta beslut bör genom förmedlingscentrumet för biosäkerhet (Biosafety Clearing-House) delges parterna i Cartagenaprotokollet om biosäkerhet till konventionen om biologisk mångfald, i enlighet med artiklarna 9.1 och 15.2 c i Europaparlamentets och rådets förordning (EG) nr 1946/2003 (7). |
|
(14) |
Ständiga kommittén för växter, djur, livsmedel och foder lämnade inget yttrande inom den tid som kommitténs ordförande bestämt. Denna genomförandeakt ansågs vara nödvändig och ordföranden lämnade den till omprövningskommittén för ytterligare överläggningar. Omprövningskommittén avgav inget yttrande. |
HÄRIGENOM FÖRESKRIVS FÖLJANDE.
Artikel 1
Genetiskt modifierad organism och unik identitetsbeteckning
Genetiskt modifierad majs (Zea mays L.) MON 87411 enligt specifikationen i led b i bilagan till detta beslut tilldelas den unika identitetsbeteckningen MON-87411-9, i enlighet med förordning (EG) nr 65/2004.
Artikel 2
Godkännande
Vid tillämpningen av artiklarna 4.2 och 16.2 i förordning (EG) nr 1829/2003 godkänns följande produkter i enlighet med villkoren i detta beslut:
|
a) |
Livsmedel och livsmedelsingredienser som innehåller, består av eller har framställts av majs MON-87411-9. |
|
b) |
Foder som innehåller, består av eller har framställts av majs MON-87411-9. |
|
c) |
Produkter som innehåller eller består av majs MON-87411-9 för annan användning än den som anges i leden a och b i denna artikel, med undantag för odling. |
Artikel 3
Märkning
1. Vid tillämpningen av märkningskraven i artiklarna 13.1 och 25.2 i förordning (EG) nr 1829/2003 och i artikel 4.6 i förordning (EG) nr 1830/2003 ska ”organismens namn” vara ”majs”.
2. Uppgiften ”inte avsedd för odling” ska finnas på etiketten och i de handlingar som åtföljer sådana produkter som innehåller eller består av majs MON-87411-9, med undantag för de produkter som avses i artikel 2 a.
Artikel 4
Detektionsmetod
Den metod som fastställs i led d i bilagan ska tillämpas för detektion av majs MON-87411-9.
Artikel 5
Övervakning av miljöpåverkan
1. Innehavaren av godkännandet ska se till att planen för övervakning av miljöpåverkan enligt led h i bilagan införs och tillämpas.
2. Innehavaren av godkännandet ska lämna årliga rapporter till kommissionen om genomförandet och resultaten av den verksamhet som beskrivs i övervakningsplanen i enlighet med beslut 2009/770/EG.
Artikel 6
Gemenskapsregister
Uppgifterna i bilagan till detta beslut ska föras in i det gemenskapsregister över genetiskt modifierade livsmedel och foder som avses i artikel 28.1 i förordning (EG) nr 1829/2003.
Artikel 7
Innehavare av godkännandet
Innehavare av godkännandet ska vara Monsanto Company, Förenta staterna, som företräds av Bayer Agriculture BVBA, Belgien.
Artikel 8
Giltighet
Detta beslut ska gälla i tio år från och med dagen för delgivningen.
Artikel 9
Adressat
Detta beslut riktar sig till Bayer Agriculture BVBA, Scheldelaan 460, 2040 Antwerpen, Belgien.
Utfärdat i Bryssel den 26 juli 2019.
På kommissionens vägnar
Vytenis ANDRIUKAITIS
Ledamot av kommissionen
(1) EUT L 268, 18.10.2003, s. 1.
(2) Europaparlamentets och rådets direktiv 2001/18/EG av den 12 mars 2001 om avsiktlig utsättning av genetiskt modifierade organismer i miljön och om upphävande av rådets direktiv 90/220/EEG (EGT L 106, 17.4.2001, s. 1).
(3) Efsas GMO-panel (Efsas panel för genetiskt modifierade organismer), 2018, ”Scientific opinion on the assessment of genetically modified maize MON 87411 for food and feed uses, import and processing, under Regulation (EC) No 1829/2003 (application EFSA-GMO-NL-2015-124)”. EFSA Journal, vol. 16(2018):6, artikelnr 5310, [29 s.], 10.2903/j.efsa.2018.5310.
(4) Kommissionens förordning (EG) nr 65/2004 av den 14 januari 2004 om inrättande av ett system för skapande och tilldelning av unika identitetsbeteckningar för genetiskt modifierade organismer (EUT L 10, 16.1.2004, s. 5).
(5) Europaparlamentets och rådets förordning (EG) nr 1830/2003 av den 22 september 2003 om spårbarhet och märkning av genetiskt modifierade organismer och spårbarhet av livsmedel och foderprodukter som är framställda av genetiskt modifierade organismer och om ändring av direktiv 2001/18/EG (EUT L 268, 18.10.2003, s. 24).
(6) Kommissionens beslut 2009/770/EG av den 13 oktober 2009 om utarbetande av standardformulär för rapportering av övervakningsresultat rörande avsiktlig utsättning i miljön av produkter som består av eller innehåller genetiskt modifierade organismer, i syfte att släppa ut dessa på marknaden, i enlighet med Europaparlamentets och rådets direktiv 2001/18/EG (EUT L 275, 21.10.2009, s. 9).
(7) Europaparlamentets och rådets förordning (EG) nr 1946/2003 av den 15 juli 2003 om gränsöverskridande förflyttning av genetiskt modifierade organismer (EUT L 287, 5.11.2003, s. 1).
BILAGA
a) Sökande och innehavare av godkännandet
|
Namn |
: |
Monsanto Company |
|
Adress |
: |
800 N. Lindbergh Boulevard, St. Louis, Missouri 63167, Förenta staterna |
Företrädd av Bayer Agriculture BVBA, Scheldelaan 460, 2040 Antwerpen, Belgien.
b) Beteckning och specifikation av produkterna
|
1) |
Livsmedel och livsmedelsingredienser som innehåller, består av eller har framställts av majs MON-87411-9. |
|
2) |
Foder som innehåller, består av eller har framställts av majsen MON-87411-9. |
|
3) |
Produkter som innehåller eller består av majsen MON-87411-9 för annan användning än den som anges i punkterna 1 och 2, med undantag för odling. |
Den genetiskt modifierade majsen MON-87411-9 uttrycker CP4 EPSPS-protein, som ger skydd mot herbicider som innehåller glyfosat samt Cry3Bb1-protein och DvSnf7 dsRNA, som ger resistens mot majsrotbaggen (Diabrotica spp.).
c) Märkning
|
1) |
Vid tillämpningen av märkningskraven i artiklarna 13.1 och 25.2 i förordning (EG) nr 1829/2003 och i artikel 4.6 i förordning (EG) nr 1830/2003 ska ”organismens namn” vara ”majs”. |
|
2) |
Uppgiften ”inte avsedd för odling” ska finnas på etiketten och i de handlingar som åtföljer produkter som innehåller eller består av majs MON-87411-9, med undantag för de produkter som avses i led b punkt 1 i denna bilaga. |
d) Detektionsmetod
|
1) |
I realtid händelsespecifik metod baserad på kvantitativ PCR för detektion av genetiskt modifierad majs MON 87411. |
|
2) |
Validerad av EU:s referenslaboratorium, som inrättats i enlighet med förordning (EG) nr 1829/2003, och offentliggjord på http://gmo-crl.jrc.ec.europa.eu/statusofdossiers.aspx. |
|
3) |
Referensmaterial: AOCS 0215-B är tillgängligt via American Oil Chemists' Society (AOCS) på https://www.aocs.org/crm. |
e) Unik identitetsbeteckning
MON-87411-9
f) Uppgifter som ska lämnas enligt bilaga II till Cartagenaprotokollet om biosäkerhet till konventionen om biologisk mångfald
[Biosafety Clearing-House, Record ID: offentliggjort i gemenskapsregistret över genetiskt modifierade livsmedel och foder i samband med delgivningen]
g) Villkor för eller begränsningar av utsläppande på marknaden, användning och hantering av produkterna
Ej tillämpligt.
h) Plan för övervakning av miljöpåverkan
Plan för övervakning av miljöpåverkan i enlighet med bilaga VII till direktiv 2001/18/EG.
[Länk: plan offentliggjord i gemenskapsregistret över genetiskt modifierade livsmedel och foder]
i) Krav på övervakning efter försäljningen avseende användning av produkten som livsmedel
Ej tillämpligt.
Anmärkning: Länkar till relevanta dokument kan behöva ändras med tiden. Allmänheten kommer att informeras om dessa ändringar genom uppdatering av gemenskapsregistret över genetiskt modifierade livsmedel och foder.
|
2.8.2019 |
SV |
Europeiska unionens officiella tidning |
L 204/90 |
KOMMISSIONENS GENOMFÖRANDEBESLUT (EU) 2019/1309
av den 26 juli 2019
om godkännande för utsläppande på marknaden av produkter som innehåller, består av eller har framställts av den genetiskt modifierade sojabönan MON 87751 (MON-87751-7), i enlighet med Europaparlamentets och rådets förordning (EG) nr 1829/2003
[delgivet med nr C(2019) 5489]
(Endast de franska och nederländska texterna är giltiga)
(Text av betydelse för EES)
EUROPEISKA KOMMISSIONEN HAR ANTAGIT DETTA BESLUT
med beaktande av fördraget om Europeiska unionens funktionssätt,
med beaktande av Europaparlamentets och rådets förordning (EG) nr 1829/2003 av den 22 september 2003 om genetiskt modifierade livsmedel och foder (1), särskilt artiklarna 7.3 och 19.3, och
av följande skäl:
|
(1) |
Den 26 september 2014 lämnade Monsanto Europe NV, på uppdrag av Monsanto Company, Förenta staterna, i enlighet med artiklarna 5 och 17 i förordning (EG) nr 1829/2003 in en ansökan till Nederländernas behöriga myndighet om att få släppa ut livsmedel, livsmedelsingredienser och foder som innehåller, består av eller har framställts av den genetiskt modifierade sojabönan MON 87751 på marknaden (nedan kallad ansökan). Ansökan gällde även utsläppande på marknaden av produkter som innehåller eller består av den genetiskt modifierade sojabönan MON 87751 för annan användning än som livsmedel och foder, med undantag för odling. |
|
(2) |
I enlighet med artiklarna 5.5 och 17.5 i förordning (EG) nr 1829/2003 innehöll ansökan information och slutsatser om den riskbedömning som genomförts enligt principerna i bilaga II till Europaparlamentets och rådets direktiv 2001/18/EG (2) och den information som krävs i bilagorna III och IV till det direktivet. Ansökan innehöll även en plan för övervakning av miljöpåverkan i enlighet med bilaga VII till direktiv 2001/18/EG. |
|
(3) |
Europeiska myndigheten för livsmedelssäkerhet (nedan kallad myndigheten) lämnade den 2 augusti 2018 ett positivt yttrande i enlighet med artiklarna 6 och 18 i förordning (EG) nr 1829/2003 (3). Myndigheten konstaterade att den genetiskt modifierade sojabönan MON 87751, så som den beskrivs i ansökan, är lika säker och näringsrik som den konventionella motsvarigheten och de testade icke genetiskt modifierade referenssorterna när det gäller potentiella effekter på människors och djurs hälsa och på miljön. |
|
(4) |
Myndigheten tog i sitt yttrande ställning till alla de frågor och farhågor som hade tagits upp av medlemsstaterna under samrådet med de behöriga nationella myndigheterna i enlighet med artiklarna 6.4 och 18.4 i förordning (EG) nr 1829/2003. |
|
(5) |
Myndigheten konstaterade också att planen för övervakning av miljöpåverkan i form av en allmän tillsynsplan som sökanden har lämnat in ligger i linje med produkternas avsedda användning. |
|
(6) |
Mot bakgrund av detta bör godkännande beviljas för utsläppande på marknaden av produkter som innehåller, består av eller har framställts av den genetiskt modifierade sojabönan MON 87751, för de användningsområden som anges i ansökan. |
|
(7) |
Genom en skrivelse av den 27 augusti 2018 har Monsanto Europe NV meddelat kommissionen att Monsanto Europe NV ändrat sin rättsliga form och bytt namn till Bayer Agriculture BVBA, Belgien. |
|
(8) |
En unik identitetsbeteckning bör tilldelas den genetiskt modifierade sojabönan MON 87751 i enlighet med kommissionens förordning (EG) nr 65/2004 (4). |
|
(9) |
Enligt myndighetens yttrande verkar det, för de produkter som omfattas av detta beslut, inte behövas några andra särskilda märkningskrav än de som fastställs i artiklarna 13.1 och 25.2 i förordning (EG) nr 1829/2003 och i artikel 4.6 i Europaparlamentets och rådets förordning (EG) nr 1830/2003 (5). För att säkerställa att dessa produkter också i fortsättningen används på ett sätt som är godkänt enligt detta beslut bör det dock tydligt anges på märkningen av de produkter, med undantag för livsmedelsprodukter, som innehåller eller består av den genetiskt modifierade sojabönan MON 87751, att de inte är avsedda för odling. |
|
(10) |
För att redogöra för genomförandet och resultaten av den verksamhet som beskrivs i planen för övervakning av miljöpåverkan bör innehavaren av godkännandet lämna in årliga rapporter, som läggs fram i enlighet med det standardformulär för rapportering som föreskrivs i kommissionens beslut 2009/770/EG (6). |
|
(11) |
Myndighetens yttrande motiverar inte att det införs särskilda villkor för eller begränsningar av utsläppande på marknaden, användning och hantering, däribland krav på övervakning av konsumtionen av livsmedel eller foder efter försäljningen, eller för skydd av särskilda ekosystem, miljöer eller geografiska områden i enlighet med artiklarna 6.5 e och 18.5 e i förordning (EG) nr 1829/2003. |
|
(12) |
Alla relevanta uppgifter om godkännandet av produkterna bör föras in i det gemenskapsregister över genetiskt modifierade livsmedel och foder som avses i artikel 28.1 i förordning (EG) nr 1829/2003. |
|
(13) |
Detta beslut bör genom förmedlingscentrumet för biosäkerhet (Biosafety Clearing-House) delges parterna i Cartagenaprotokollet om biosäkerhet till konventionen om biologisk mångfald, i enlighet med artiklarna 9.1 och 15.2 c i Europaparlamentets och rådets förordning (EG) nr 1946/2003 (7). |
|
(14) |
Ständiga kommittén för växter, djur, livsmedel och foder lämnade inget yttrande inom den tid som kommitténs ordförande bestämt. Denna genomförandeakt ansågs vara nödvändig och ordföranden lämnade den till omprövningskommittén för ytterligare överläggningar. Omprövningskommittén avgav inget yttrande. |
HÄRIGENOM FÖRESKRIVS FÖLJANDE.
Artikel 1
Genetiskt modifierad organism och unik identitetsbeteckning
Den genetiskt modifierade sojabönan (Glycine max (L.) Merr.) MON 87751 enligt specifikationen i led b i bilagan till detta beslut tilldelas den unika identitetsbeteckningen MON-87751-7, i enlighet med förordning (EG) nr 65/2004.
Artikel 2
Godkännande
Vid tillämpningen av artiklarna 4.2 och 16.2 i förordning (EG) nr 1829/2003 godkänns följande produkter i enlighet med villkoren i detta beslut:
|
a) |
Livsmedel och livsmedelsingredienser som innehåller, består av eller har framställts av den genetiskt modifierade sojabönan MON-87751-7. |
|
b) |
Foder som innehåller, består av eller har framställts av den genetiskt modifierade sojabönan MON-87751-7. |
|
c) |
Produkter som innehåller eller består av den genetiskt modifierade sojabönan MON-87751-7 för annan användning än den som anges i leden a och b, med undantag för odling. |
Artikel 3
Märkning
1. Vid tillämpningen av märkningskraven i artiklarna 13.1 och 25.2 i förordning (EG) nr 1829/2003 och i artikel 4.6 i förordning (EG) nr 1830/2003 ska ”organismens namn” vara ”sojaböna”.
2. Uppgiften ”inte avsedd för odling” ska finnas på etiketten och i de handlingar som åtföljer sådana produkter som innehåller eller består av genetiskt modifierad sojaböna MON-87751-7, med undantag för de produkter som avses i artikel 2 a.
Artikel 4
Detektionsmetod
Den metod som fastställs i led d i bilagan ska tillämpas för detektion av den genetiskt modifierade sojabönan MON-87751-7.
Artikel 5
Övervakning av miljöpåverkan
1. Innehavaren av godkännandet ska se till att planen för övervakning av miljöpåverkan enligt led h i bilagan införs och tillämpas.
2. Innehavaren av godkännandet ska lämna årliga rapporter till kommissionen om genomförandet och resultaten av den verksamhet som beskrivs i övervakningsplanen i enlighet med beslut 2009/770/EG.
Artikel 6
Gemenskapsregister
Uppgifterna i bilagan ska föras in i det gemenskapsregister över genetiskt modifierade livsmedel och foder som avses i artikel 28.1 i förordning (EG) nr 1829/2003.
Artikel 7
Innehavare av godkännandet
Innehavare av godkännandet ska vara Monsanto Company, Förenta staterna, som företräds av Bayer Agriculture BVBA, Belgien.
Artikel 8
Giltighet
Detta beslut ska gälla i tio år från och med dagen för delgivningen.
Artikel 9
Adressat
Detta beslut riktar sig till Bayer Agriculture BVBA, Scheldelaan 460, 2040 Antwerpen, Belgien.
Utfärdat i Bryssel den 26 juli 2019.
På kommissionens vägnar
Vytenis ANDRIUKAITIS
Ledamot av kommissionen
(1) EUT L 268, 18.10.2003, s. 1.
(2) Europaparlamentets och rådets direktiv 2001/18/EG av den 12 mars 2001 om avsiktlig utsättning av genetiskt modifierade organismer i miljön och om upphävande av rådets direktiv 90/220/EEG (EGT L 106, 17.4.2001, s. 1).
(3) Efsas GMO-panel (Efsas panel för genetiskt modifierade organismer), 2018, ”Scientific opinion on the assessment of genetically modified soybean MON 87751 for food and feed uses under Regulation (EC) No 1829/2003 (application EFSA-GMO-NL-2014-121)”, EFSA Journal, vol. 16(2018):8, artikelnr 5346, [32 s.], doi: 10.2903/j.efsa.2018.5346.
(4) Kommissionens förordning (EG) nr 65/2004 av den 14 januari 2004 om inrättande av ett system för skapande och tilldelning av unika identitetsbeteckningar för genetiskt modifierade organismer (EUT L 10, 16.1.2004, s. 5).
(5) Europaparlamentets och rådets förordning (EG) nr 1830/2003 av den 22 september 2003 om spårbarhet och märkning av genetiskt modifierade organismer och spårbarhet av livsmedel och foderprodukter som är framställda av genetiskt modifierade organismer och om ändring av direktiv 2001/18/EG (EUT L 268, 18.10.2003, s. 24).
(6) Kommissionens beslut 2009/770/EG av den 13 oktober 2009 om utarbetande av standardformulär för rapportering av övervakningsresultat rörande avsiktlig utsättning i miljön av produkter som består av eller innehåller genetiskt modifierade organismer, i syfte att släppa ut dessa på marknaden, i enlighet med Europaparlamentets och rådets direktiv 2001/18/EG (EUT L 275, 21.10.2009, s. 9).
(7) Europaparlamentets och rådets förordning (EG) nr 1946/2003 av den 15 juli 2003 om gränsöverskridande förflyttning av genetiskt modifierade organismer (EUT L 287, 5.11.2003, s. 1).
BILAGA
a) Sökande och innehavare av godkännandet
|
Namn |
: |
Monsanto Company |
|
Adress |
: |
800 N. Lindbergh Boulevard, St. Louis, Missouri 63167, Förenta staterna |
Företrädd av Bayer Agriculture BVBA, Scheldelaan 460, 2040 Antwerpen, Belgien.
b) Beteckning och specifikation av produkterna
|
1. |
Livsmedel och livsmedelsingredienser som innehåller, består av eller har framställts av den genetiskt modifierade sojabönan MON-87751-7. |
|
2. |
Foder som innehåller, består av eller har framställts av den genetiskt modifierade sojabönan MON-87751-7. |
|
3. |
Produkter som innehåller eller består av den genetiskt modifierade sojabönan MON-87751-7 för annan användning än den som anges i punkterna 1 och 2, med undantag för odling. |
Den genetiskt modifierade sojabönan MON-87751-7 har utvecklats för att ge skydd mot vissa skadedjur av ordningen fjärilar genom uttryck av generna cry1A.105 och cry2Ab2.
c) Märkning
|
1. |
Vid tillämpningen av märkningskraven i artiklarna 13.1 och 25.2 i förordning (EG) nr 1829/2003 och i artikel 4.6 i förordning (EG) nr 1830/2003 ska ”organismens namn” vara ”sojaböna”. |
|
2. |
Uppgiften ”inte avsedd för odling” ska finnas på etiketten och i de handlingar som åtföljer produkter som innehåller eller består av den genetiskt modifierade sojabönan MON-87751-7, med undantag för de produkter som avses i led b punkt 1 i denna bilaga. |
d) Detektionsmetod
|
1. |
Metoder baserade på händelsespecifik kvantitativ realtids-PCR för den genetiskt modifierade sojabönan MON-87751-7. |
|
2. |
Validerad av EU:s referenslaboratorium, som inrättats i enlighet med förordning (EG) nr 1829/2003, och offentliggjord på http://gmo-crl.jrc.ec.europa.eu/statusofdossiers.aspx |
|
3. |
Referensmaterial: AOCS 0215-A är tillgängligt via American Oil Chemists' Society (AOCS) på https://www.aocs.org/crm |
e) Unik identitetsbeteckning
MON-87751-7
f) Uppgifter som ska lämnas enligt bilaga II till Cartagenaprotokollet om biosäkerhet till konventionen om biologisk mångfald
[Biosafety Clearing-House, Record ID: offentliggjort i gemenskapsregistret över genetiskt modifierade livsmedel och foder i samband med delgivningen]
g) Villkor för eller begränsningar av utsläppande på marknaden, användning och hantering av produkterna
Ej tillämpligt.
h) Plan för övervakning av miljöpåverkan
Plan för övervakning av miljöpåverkan i enlighet med bilaga VII till direktiv 2001/18/EG.
[Länk: plan offentliggjord i gemenskapsregistret över genetiskt modifierade livsmedel och foder]
i) Krav på övervakning efter försäljningen avseende användning av produkten som livsmedel
Ej tillämpligt.
Anmärkning: Länkar till relevanta dokument kan behöva ändras med tiden. Allmänheten kommer att informeras om dessa ändringar genom uppdatering av gemenskapsregistret över genetiskt modifierade livsmedel och foder.
|
2.8.2019 |
SV |
Europeiska unionens officiella tidning |
L 204/94 |
KOMMISSIONENS GENOMFÖRANDEBESLUT (EU) 2019/1310
av den 31 juli 2019
om fastställande av regler för driften av Europeiska civilskyddspoolen och rescEU
[delgivet med nr C(2019) 5614]
(Text av betydelse för EES)
EUROPEISKA KOMMISSIONEN HAR ANTAGIT DETTA BESLUT
med beaktande av fördraget om Europeiska unionens funktionssätt,
med beaktande av Europaparlamentets och rådets beslut nr 1313/2013/EU av den 17 december 2013 om en civilskyddsmekanism för unionen (1), särskilt artikel 32.1 g, och
av följande skäl:
|
(1) |
Civilskyddsmekanismen ska, samtidigt som den respekterar att medlemsstaterna har det primära ansvaret när det gäller förebyggande av, beredskap för och insatser vid naturkatastrofer och katastrofer som orsakats av människor, främja solidaritet och samarbete mellan medlemsstaterna i enlighet med artikel 3.3 i Fördraget om Europeiska unionen (EU-fördraget) och artikel 196 i fördraget om Europeiska unionens funktionssätt (EUF-fördraget). |
|
(2) |
Antagandet av Europaparlamentets och rådets beslut (EU) 2019/420 (2) innebär att civilskyddsmekanismen förstärkts genom en ökning av unionens ekonomiska stöd till civilskyddsmekanismen och inrättandet av rescEU. |
|
(3) |
I enlighet med artikel 21.2 c i beslut nr 1313/2013/EU ska insatskapacitet som är berättigad till ekonomiskt stöd från unionen för anpassningskostnader göras tillgänglig för Europeiska civilskyddspoolen under en minimiperiod, vilken är kopplad till den erhållna finansieringen och kan uppgå till mellan tre till tio år räknat från den dag insatskapaciteten faktiskt gjorts tillgänglig. Den exakta tillgänglighetsperioden ska närmare anges i syfte att garantera rättssäkerheten. |
|
(4) |
RescEU ska ge stöd i övermäktiga situationer där den totala befintliga kapaciteten på nationell nivå och den kapacitet som medlemsstaterna ställt till Europeiska civilskyddspoolens förfogande inte räcker till för att garantera en effektiv insats vid katastrofer. Regler för inrättande, förvaltning och upprätthållande av rescEU-kapacitet bör antas i syfte att säkerställa ett effektivt genomförande av rescEU. |
|
(5) |
RescEU-kapacitet görs tillgänglig för insatser inom ramen för civilskyddsmekanismen. Efter det att en begäran gjorts genom Centrumet för samordning av katastrofberedskap (ERCC) ska kommissionen, i nära samordning med den begärande medlemsstaten och den medlemsstat som äger, hyr eller leasar rescEU-kapaciteten, fatta beslut om insättande av kapaciteten. Det bör fastställas kriterier för beslut om insättande och förfaranden för driften i syfte att garantera en effektiv och transparent beslutsprocess. Det bör även fastställas kriterier för beslut om insättande vid motstridiga begäranden om användande av rescEU-kapacitet. |
|
(6) |
RescEU-kapacitet kan användas för nationella ändamål när den inte används eller behövs för insatser inom ramen för civilskyddsmekanismen. För att säkerställa att rescEU-kapacitet finns tillgänglig och kan sättas in inom ramen för civilskyddsmekanismen inom de tidsfrister som fastställs i kvalitetskraven för varje typ av rescEU-kapacitet bör det fastställas lämpliga regler för det nationella användandet av sådan kapacitet. |
|
(7) |
När rescEU-kapacitet används för nationella ändamål ska medlemsstaterna ska anmäla detta till kommissionen. Systemet för anmälan av nationellt användande av rescEU-kapacitet bör vara enkelt och ändamålsenligt. |
|
(8) |
Det bör fastställas tydliga regler för demobilisering och tillbakadragande av rescEU-kapacitet i syfte att säkerställa en effektiv drift. |
|
(9) |
I enlighet med artikel 12.10 i beslut nr 1313/2013/EU kan medlemsstaterna i särskilda fall vägra att bidra med personal för drift av rescEU-kapacitet som sätts in utanför unionen. Det bör fastställas regler för dessa särskilda fall. |
|
(10) |
Genom antagandet av kommissionens genomförandebeslut (EU) 2019/570 (3) fastställs det att luftburen skogsbrandsbekämpning utgör rescEU-kapacitet. För att ekonomiskt bistånd från unionen ska kunna tillhandahållas till utvecklingen av denna kapacitet i enlighet med artikel 21.3 i beslut nr 1313/2013/EU bör den totala uppskattade kostnaden fastställas. Den totala uppskattade kostnaden ska beräknas med hänsyn tagen till kategorierna av stödberättigande kostnader i bilaga IA till beslut nr 1313/2013/EU. |
|
(11) |
I syfte att minska insättandetiden och förbättra rättssäkerheten bör villkoren för hysande och drift av rescEU-kapacitet klargöras. Dessa villkor bör utgöra grunden för kontrakten för operativa ändamål mellan kommissionen och medlemsstaterna. |
|
(12) |
I syfte att garantera synlighet för unionen när rescEU-kapacitet sätts in och för att säkerställa enhetliga villkor vid tillämpningen av artikel 20a i beslut nr 1313/2013/EU bör det i detta beslut fastställas regler om lämpliga synlighetsarrangemang. |
|
(13) |
RescEU-kapacitet bör registreras, certifieras och upprätthållas på lämpligt sätt av medlemsstaterna i enlighet med gällande nationella och internationella bestämmelser. Dessutom bör civilskyddsmekanismens certifieringsprocess slutföras. |
|
(14) |
I och med att beslut (EU) 2019/420 trädde i kraft den 21 mars 2019 kan unionen nu tillhandahålla ekonomiskt bistånd till operativa kostnader. Följaktligen är det nödvändigt att fastställa de regler och förfaranden som medlemsstaterna ska följa när de begär sådant bistånd. |
|
(15) |
De åtgärder som föreskrivs i detta beslut är förenliga med yttrandet från den kommitté som avses i artikel 33.1 i beslut nr 1313/2013/EU. |
HÄRIGENOM FÖRESKRIVS FÖLJANDE.
Artikel 1
Syfte
Genom detta beslut fastställs bestämmelser för genomförande av beslut nr 1313/2013/EU vad gäller
|
a) |
tillgängliggörande för Europeiska civilskyddspoolen av kapacitet som erhåller finansiering för anpassningskostnader, |
|
b) |
kriterier för beslut om insättande av rescEU-kapacitet, inbegripet vid motstridiga begäranden, |
|
c) |
kriterier för beslut om demobilisering och tillbakadragande, |
|
d) |
nationellt användande av rescEU-kapacitet, |
|
e) |
vägran att bidra med personal utanför unionen, |
|
f) |
allmänt innehåll i kontrakt för operativa ändamål, |
|
g) |
krav på synlighet vid användande av rescEU-kapacitet, |
|
h) |
certifiering och registrering av rescEU-kapacitet, |
|
i) |
totala uppskattade kostnader för rescEU-kapacitet för luftburen skogsbrandsbekämpning, och |
|
j) |
arrangemang för att begära ekonomiskt bistånd till operativa kostnader. |
Artikel 2
Tillgängliggörande för Europeiska civilskyddspoolen av kapacitet som erhåller finansiering för anpassningskostnader
1. Medlemsstater som erhåller ekonomiskt stöd för anpassningskostnader för kapacitet i enlighet med artikel 21.2 c i beslut nr 1313/2013/EU ska ställa kapaciteten i fråga till förfogande för Europeiska civilskyddspoolen under olika långa minimiperioder, vilka varierar i förhållande till storleken på den erhållna finansieringen.
Följande minimiperioder fastställs:
|
a) |
En minimiperiod av tre år för kapacitet som erhåller upp till 300 000 euro i ekonomiskt stöd från unionen. |
|
b) |
En minimiperiod av fem år för kapacitet som erhåller mellan 300 001 euro och 1 000 000 euro i ekonomiskt stöd från unionen. |
|
c) |
En minimiperiod av sju år för kapacitet som erhåller mellan 1 000 001 euro och 2 000 000 euro i ekonomiskt stöd från unionen. |
|
d) |
En minimiperiod av tio år för kapacitet som erhåller mer än 2 000 000 euro i ekonomiskt stöd från unionen. |
2. Om kapacitetens ekonomiska livslängd är kortare än den minimiperiod som anges i punkt 1 ska minimiperioden fastställas till den ekonomiska livslängden.
3. Kommissionen och ERCC får komma överens om att avsluta den minimiperiod som avses i punkt 1 för en viss kapacitet om detta kan motiveras av en medlemsstat.
Artikel 3
Kriterier för beslut om insättande av rescEU-kapacitet
1. När ERCC mottar en begäran om bistånd ska det bedöma huruvida den befintliga kapacitet som tillhandahålls av medlemsstaterna genom civilskyddsmekanismen och den kapacitet som på förhand ställts till Europeiska civilskyddspoolens förfogande är tillräcklig för att garantera en effektiv insats när det gäller denna begäran. I de fall en effektiv insats inte kan garanteras ska kommissionen genom ERCC fatta beslut om insättande av rescEU-kapacitet i enlighet med det förfarande som fastställs i artikel 12.6 i beslut nr 1313/2013/EU.
2. Beslutet om insättande av rescEU-kapacitet ska fattas med särskild hänsyn tagen till följande faktorer:
|
a) |
Den operativa situationen i medlemsstaterna och potentiella katastrofrisker, |
|
b) |
RescEU-kapacitetens lämplighet för att användas vid katastrofen samt huruvida den är tillräcklig för att hantera katastrofen. |
|
c) |
RescEU-kapacitetens geografiska belägenhet, inbegripet den uppskattade transporttiden till det drabbade området. |
|
d) |
Andra relevanta kriterier, inbegripet de villkor som anges för rescEU-kapaciteten i kontrakten för operativa ändamål. |
3. Vid motstridiga begäranden om bistånd ska hänsyn tas till följande ytterligare kriterier när det fattas beslut om var rescEU-kapaciteten ska sättas in:
|
a) |
Den beräknade risken för förlust av människoliv. |
|
b) |
Den beräknade risken för kritisk infrastruktur enligt artikel 2 a i rådets direktiv 2008/114/EG (4), oavsett om denna infrastruktur är belägen inom eller utanför unionen. |
|
c) |
Katastrofens beräknade konsekvenser, inbegripet dess miljökonsekvenser. |
|
d) |
De behov som identifierats av ERCC samt eventuella befintliga insättandeplaner. |
|
e) |
Risken för att katastrofen ska sprida sig. |
|
f) |
De sociala och ekonomiska konsekvenserna. |
|
g) |
Utlösandet av solidaritetsklausulen i enlighet med artikel 222 i fördraget om Europeiska unionens funktionssätt. |
|
h) |
Andra relevanta operativa faktorer |
Artikel 4
Kriterier för beslut om demobilisering och tillbakadragande
1. RescEU-kapacitet ska demobiliseras i följande fall:
|
a) |
Vid mottagandet av en förhandsanmälan om avslutande av katastrofen i Cecis, eller |
|
b) |
när det fattas ett beslut om tillbakadragande enligt punkt 2. |
2. Kommissionen ska fatta ett beslut om tillbakadragande genom ERCC när det finns ett större operativt behov av kapaciteten någon annanstans eller behoven på fältet inte längre är sådana att kapaciteten behövs. Detta beslut ska fattas i nära samordning med den medlemsstat som hyser rescEU-kapacitet och den eller de medlemsstater som begär bistånd samt, i tillämpliga fall, med tredjeländer eller internationella organisationer.
3. När kommissionen fattar ett beslut enligt punkt 2 ska den bland annat överväga de kriterier som anges i artikel 3.2 och 3.3.
Artikel 5
Nationellt användande av rescEU-kapacitet
1. När en medlemsstat använder rescEU-kapacitet för nationella ändamål ska den säkerställa
|
a) |
att rescEU-kapaciteten är tillgänglig och redo att användas för insatser inom ramen för civilskyddsmekanismen inom de tidsfrister som fastställs i de relevanta kvalitetskraven, såvida inte något annat överenskommits med kommissionen, |
|
b) |
att rescEU-kapaciteten och annan nationell kapacitet behandlas lika när det gäller underhåll, lagring, försäkring, personal och annan relevant förvaltnings- och underhållsverksamhet, |
|
c) |
att rescEU-kapaciteten repareras snabbt vid skada. |
2. Medlemsstaterna ska, genom ERCC, anmäla till kommissionen när den använder rescEU-kapacitet nationellt och lämna en rapport efter användandet.
3. I de fall nationellt användande påverkar tillgängligheten enligt punkt 1 a i denna artikel ska medlemsstaterna inhämta kommissionens samtycke, genom ERCC, före insättandet.
Medlemsstaterna ska säkerställa att rescEU-kapaciteten i fråga är tillgänglig så snabbt som möjligt när den behövs till insatser inom ramen för civilskyddsmekanismen.
Artikel 6
Vägran att bidra med personal utanför unionen
1. När det fattats ett beslut om att sätta in rescEU-kapacitet utanför unionen i enlighet med artikel 12.10 i beslut nr 1313/2013/EU får medlemsstaterna vägra att bidra med sin egen personal i följande fall:
|
a) |
De diplomatiska förbindelserna mellan medlemsstaten i fråga och det begärande tredjelandet har brutits. |
|
b) |
När det föreligger en väpnad konflikt, eller risk för en sådan konflikt, eller andra lika allvarliga skäl som kan äventyra personalens säkerhet och hindra medlemsstaten i fråga från att uppfylla sin aktsamhetsplikt. |
2. En medlemsstat som vägrar att bidra med sin egen personal ska omedelbart underrätta kommissionen om detta och lämna en motivering.
Artikel 7
Allmänt innehåll i kontrakt för operativa ändamål
De kontrakt för operativa ändamål som avses i artikel 12.5 i beslut nr 1313/2013/EU ska bland annat
|
a) |
närmare ange vilken typ av enhet som hyser rescEU-kapaciteten, |
|
b) |
närmare ange var den hysta rescEU-kapaciteten är belägen, |
|
c) |
innehålla information om relevant logistik och försäkring, |
|
d) |
en beskrivning av den nationella beslutsprocessen för att säkerställa att rescEU-kapacitet är tillgänglig och redo för insatser inom ramen för skyddsmekanismen inom de tidsfrister som fastställs i de relevanta kvalitetskraven, |
|
e) |
innehålla aktuell information om personal, inbegripet deras anställningsvillkor, försäkringskontrakt och utbildning, samt en beskrivning av de åtgärder som behöver vidtas för att garantera att de kan sättas in internationellt, |
|
f) |
innehålla en plan för underhållsarbeten, |
|
g) |
fastställa särskilda rapporteringskrav, |
|
h) |
föreskriva krav på synlighet för unionen i enlighet med artikel 20a i beslut nr 1313/2013/EU. |
Artikel 8
Synlighetsarrangemang vid användande av rescEU-kapacitet
När rescEU-kapacitet används i insatser inom ramen för civilskyddsmekanismen ska den medlemsstat som hyser rescEU-kapaciteten och den medlemsstat som begär bistånd ge lämplig synlighet åt unionen i enlighet med artikel 20a i beslut nr 1313/2013/EU.
Artikel 9
Ansvar och ersättning för skada
Medlemsstaterna ska avstå från att rikta några skadestånd mot kommissionen för skador till följd av insatser inom ramen för civilskyddsmekanismen eller för konsekvenser på grund av att rescEU-kapacitet som tillhandahålls inom ramen för civilskyddsmekanismen och detta beslut inte satts in, demobiliserats eller dragits tillbaka, såvida det inte kan bevisas att dessa beror på bedrägeri eller allvarlig försummelse.
Artikel 10
Certifierings- och registreringsregler
1. Medlemsstaterna ska se till att rescEU-kapacitet certifieras och registreras i enlighet med tillämpliga nationella och internationella regler och bestämmelser.
2. När rescEU-kapacitet är avsedd för flera olika ändamål ska certifieringen och registreringen ske i enlighet med detta.
3. Medlemsstaterna ska certifiera rescEU-kapacitet inom ramen för civilskyddsmekanismens certifieringsprocess så snart som möjligt och i enlighet med artikel 11.4 i beslut nr 1313/2013/EU och kapitel 5 i kommissionens genomförandebeslut 2014/762/EU (5). RescEU-kapacitet för vilka certifieringsprocessen pågår kan sättas in i enlighet med artikel 3.
Artikel 11
Totala uppskattade kostnader för rescEU-kapacitet för luftburen skogsbrandsbekämpning
1. De kategorier av kostnader som anges i punkterna 2–6 och punkt 8 i bilaga IA till beslut nr 1313/2013/EU ska beräknas med hänsyn tagen till de totala uppskattade kostnaderna för rescEU-kapacitet för luftburen skogsbrandsbekämpning.
2. Kostnader som hänför sig till kategorin kostnader för utrustning som anges i punkt 1 i bilaga IA till beslut nr 1313/2013/EU när det gäller luftburen skogsbrandsbekämpning med hjälp av flygplan ska beräknas på grundval av de marknadspriser som är tillämpliga när kapaciteten förvärvas, hyrs eller leasas i enlighet med artikel 12.3 i beslut nr 1313/2013/EU. När medlemsstaterna förvärvar, hyr eller leasar rescEU-kapacitet ska de lämna styrkande handlingar till kommissionen om de faktiska tillämpliga marknadspriserna.
Kostnader som hänför sig till kategorin kostnader för utrustning som anges i punkt 1 i bilaga IA till beslut nr 1313/2013/EU när det gäller luftburen skogsbrandsbekämpning med hjälp av helikopter ska beräknas på grundval av de marknadspriser som är tillämpliga när kapaciteten förvärvas, hyrs eller leasas i enlighet med artikel 12.3 i beslut nr 1313/2013/EU. När medlemsstaterna förvärvar, hyr eller leasar rescEU-kapacitet ska de lämna styrkande handlingar till kommissionen om de faktiska tillämpliga marknadspriserna.
3. Kostnader som hänför sig till de kategorier av kostnader som anges i punkterna 1–6 och punkt 8 i bilaga IA till beslut nr 1313/2013/EU när det gäller luftburen skogsbrandsbekämpning med hjälp av flygplan ska beräknas minst en gång för varje flerårig budgetram, med början från och med perioden 2014–2020, varvid hänsyn ska tas till den information som kommissionen har tillgång till, bland annat om inflationen och om de kostnadsberäkningar som gjorts för finansieringen av nationell kapacitet i enlighet med artikel 35 i beslut nr 1313/2013/EU. Kommissionen använder sig av dessa kostnader i samband med tillhandahållandet av det årliga ekonomiska biståndet.
Kostnader som hänför sig till de kategorier av kostnader som anges i punkterna 2–6 och punkt 8 i bilaga IA till beslut nr 1313/2013/EU när det gäller luftburen skogsbrandsbekämpning med hjälp av helikopter ska beräknas minst en gång för varje flerårig budgetram, med början från och med perioden 2014–2020, varvid hänsyn ska tas till den information som kommissionen har tillgång till, bland annat om inflationen och om de kostnadsberäkningar som gjorts för finansieringen av nationell kapacitet i enlighet med artikel 35 i beslut nr 1313/2013/EU. Kommissionen använder sig av dessa kostnader i samband med tillhandahållandet av det årliga ekonomiska biståndet.
Artikel 12
Stödberättigande operativa kostnader
1. De operativa kostnader som avses i artikel 23.2, 23.4b och 23.4c i beslut nr 1313/2013/EU omfattar alla kostnader för driften av en kapacitet under en insats som krävs för att den ska bli driftsmässigt effektiv. Dessa kostnader kan, där så är lämpligt, omfatta kostnader för personal, internationella och lokala transporter, logistik, förbrukningsvaror och förnödenheter, underhåll och andra kostnader som krävs för att kapaciteten ska kunna användas på ett effektivt sätt.
2. De kostnader som avses i punkt 1 ska inte vara stödberättigande i de fall de omfattas av värdnationsstöd i enlighet med artikel 39 i genomförandebeslut 2014/762/EU eller i enlighet med artikel 3.2 i genomförandebeslut (EU) 2019/570 eller om de finansieras genom något annat av unionens finansieringsinstrument.
3. Det förfarande för att begära transportstöd som fastställs i artikel 48, artikel 49.1 och 49.3, artikel 51 och artikel 53 och i bilaga VIII i genomförandebeslut 2014/762/EU ska tillämpas med nödvändiga anpassningar till begäranden om ekonomiskt bistånd till operativa kostnader, till dess att de ersätts om så är nödvändigt.
Artikel 13
Adressater
Detta beslut riktar sig till medlemsstaterna.
Utfärdat i Bryssel den 31 juli 2019.
På kommissionens vägnar
Christos STYLIANIDES
Ledamot av kommissionen
(1) EUT L 347, 20.12.2013, s. 924.
(2) Europaparlamentets och rådets beslut (EU) 2019/420 av den 13 mars 2019 om ändring av beslut nr 1313/2013/EU om en civilskyddsmekanism för unionen (EUT L 77I, 20.3.2019, s. 1).
(3) Kommissionens genomförandebeslut (EU) 2019/570 av den 8 april 2019 om fastställande av regler för genomförande av Europaparlamentets och rådets beslut 1313/2013/EU vad gäller rescEU-resurser och om ändring av kommissionens genomförandebeslut 2014/762/EU (EUT L 99, 10.4.2019, s. 41).
(4) Rådets direktiv 2008/114/EG av den 8 december 2008 om identifiering av, och klassificering som, europeisk kritisk infrastruktur och bedömning av behovet att stärka skyddet av denna (EUT L 345, 23.12.2008, s. 75).
(5) Kommissionens genomförandebeslut 2014/762/EU av den 16 oktober 2014 om tillämpningsföreskrifter för Europaparlamentets och rådets beslut nr 1313/2013/EU om en civilskyddsmekanism för unionen och om upphävande av kommissionens beslut 2004/277/EG, Euratom och 2007/606/EG, Euratom (EUT L 320, 6.11.2014, s. 1).
|
2.8.2019 |
SV |
Europeiska unionens officiella tidning |
L 204/100 |
EUROPEISKA CENTRALBANKENS BESLUT (EU) 2019/1311
av den 22 juli 2019
om en tredje serie med riktade långfristiga refinansieringstransaktioner (ECB/2019/21)
ECB-RÅDET HAR ANTAGIT DETTA BESLUT
med beaktande av fördraget om Europeiska unionens funktionssätt, särskilt artikel 127.2 första strecksatsen,
med beaktande av stadgan för Europeiska centralbankssystemet och Europeiska centralbanken, särskilt artikel 3.1 första strecksatsen, artikel 12.1, artikel 18.1 andra strecksatsen samt artikel 34.1 andra strecksatsen, och
av följande skäl:
|
(1) |
Beslut ECB/2014/34 (1) innehåller bestämmelser om en serie riktade långfristiga refinansieringstransaktioner (targeted longer-term refinancing operations, TLTRO) som ska genomföras under tvåårsperioden 2014–2016 (TLTRO I) och Europeiska centralbankens beslut (EU) 2016/810 (ECB/2016/10) (2) innehåller bestämmelser om en andra serie riktade långfristiga refinansieringstransaktioner (TLTRO II) som ska genomföras från juni 2016 till mars 2017. |
|
(2) |
Den 7 mars 2019 beslutade ECB-rådet, inom ramen för sitt mandat att upprätthålla prisstabilitet, att initiera en ny serie med sju riktade långfristiga refinansieringstransaktioner (TLTRO III) som ska genomföras från september 2019 till mars 2021, var och en med en löptid på två år. Dessa TLTRO III är avsedda att bidra till fortsatt gynnsamma förutsättningar för bankernas utlåning och för att stödja den expansiva inriktningen på penningpolitiken i de medlemsstater som har euron som valuta. Godtagbar utlåning inom ramen för denna åtgärd inkluderar lån till den icke-finansiella privata sektorn med undantag för utlåning till hushållen för husköp. Tillsammans med övriga icke-standardåtgärder är syftet med TLTRO III att bidra till att inflationstakten på medellång sikt återgår till en nivå som ligger strax under 2 procent. |
|
(3) |
För att institut som av organisatoriska skäl lånar från Eurosystemet genom en gruppstruktur lättare ska kunna delta kommer det, precis som i den första och andra serien TLTRO:er, att vara möjligt att delta i TLTRO III på gruppbasis, förutsatt att vissa villkor är uppfyllda. Grupper bör kunna delta genom en specifik gruppmedlem när gällande villkor uppfylls. För att lösa frågor som rör den gruppinterna likviditetsfördelningen bör alla medlemmar i grupper som etablerats utifrån nära förbindelser mellan medlemmarna formellt bekräfta sitt deltagande i gruppen i skriftform. En TLTRO-grupp som godkänts för TLTRO II i enlighet med beslut (EU) ECB/2016/810 (ECB/2016/10) bör kunna delta i TLTRO III som en TLTRO III-grupp om vissa förfaranden avseende information och godkännande beaktas. |
|
(4) |
Det sammanlagda belopp som kan lånas inom ramen för alla TLTRO III bör bestämmas utifrån deltagarens utestående belopp av godtagbara lån till den icke-finansiella privata sektorn per den 28 februari 2019, med beaktande av eventuella belopp som tidigare lånats av TLTRO III-deltagaren under TLTRO II i enlighet med beslut (EU) 2016/810 (ECB/2016/10) och fortfarande är utestående. Under vissa förutsättningar kan dessutom godtagbara lån till den icke-finansiella privata sektorn vilka har värdepapperiserats internt (dvs. där värdepapperiseringens resulterande värdepapper med bakomliggande tillgångar som säkerhet behålls till 100 %). Detta kommer att förbättra förhållandet mellan lånebelopp och långivningen till ekonomin. |
|
(5) |
En högsta anbudsgräns bör tillämpas för varje TLTRO III. Syftet med att begränsa anbudens storlek är att undvika en alltför stor koncentration av anbud till ett fåtal transaktioner. |
|
(6) |
Den ränta som utgår för varje TLTRO III bör fastställas utifrån deltagarens lånehistorik under perioden 1 april 2019 till 31 mars 2021 i enlighet med de principer som fastställts i detta beslut. |
|
(7) |
Varje TLTRO III ska ha en löptid på två år. Med tanke på att löptiden är kortare än för TLTRO I och TLTRO II bör deltagare inte ha möjlighet att frivilligt återbetala belopp som har tilldelats inom ramen för TLTRO III före förfallodagen. |
|
(8) |
De institut som önskar delta i TLTRO III bör omfattas av vissa rapporteringskrav. De rapporterade uppgifterna kommer att användas för att a) fastställa lånebeloppet, b) beräkna respektive tröskelvärde, c) bedöma hur deltagarnas nyckeltal utvecklas samt d) utföra andra analytiska uppgifter som är nödvändiga för att genomföra Eurosystemets uppgifter. Dessutom kommer de nationella centralbankerna i de medlemsstater som har euron som valuta (nedan kallade nationella centralbanker) som erhåller de inrapporterade uppgifterna att tillåtas vidarebefordra uppgifterna inom Eurosystemet i den utsträckning och på den nivå som är nödvändig för att genomföra och analysera effekterna av ramverket för TLTRO III samt utföra andra analytiska uppgifter som Eurosystemet ska göra. För att validera de inrapporterade uppgifterna får dessa vidarebefordras inom Eurosystemet. |
|
(9) |
För att ge kreditinstituten tillräckligt med tid för sina operativa förberedelser inför den första transaktionen inom ramen för TLTRO III, bör detta beslut träda i kraft så snart som möjligt. |
HÄRIGENOM FÖRESKRIVS FÖLJANDE:
Artikel 1
Definitioner
I detta beslut gäller följande definitioner:
1) tröskelvärde för nettoutlåning : det belopp för godtagbar nettoutlåning som en deltagare måste överskrida under perioden 1 april 2019 till 31 mars 2021 för att kvalificera sig för en räntesats på deltagarens TLTRO III-lån som är lägre än den ursprungliga räntesatsen som tillämpas och som beräknas enligt de principer och anvisningar som framgår av artikel 4 respektive bilaga I.
2) tröskelvärde för utestående belopp : summan av en deltagares utestående belopp av godtagbara lån per den 31 mars 2019 och deltagarens tröskelvärde för nettoutlåning som beräknas enligt de principer och anvisningar som framgår av artikel 4 respektive bilaga I.
3) anbudsgräns : det högsta belopp som en deltagare kan låna inom ramen för en enskild TLTRO III, beräknad enligt de principer och anvisningar som framgår av artikel 4 respektive bilaga I.
4) lånebelopp : det sammanlagda belopp som en deltagare kan låna inom ramen för alla TLTRO III, beräknat enligt de principer och anvisningar som framgår av artikel 4 respektive bilaga I.
5) kreditinstitut : ett kreditinstitut såsom det definieras i artikel 2.14 i Europeiska centralbankens riktlinje (EU) 2015/510 (ECB/2014/60) (3).
6) avvikelse från tröskelvärdet för utestående belopp : en angivelse i procentenheter av hur mycket en deltagares godtagbara lån som beviljats under perioden 1 april 2019 till 31 mars 2021 har ökat eller minskat i förhållande till tröskelvärdet för utestående belopp, beräknat enligt de anvisningar som framgår av artikel 4 och bilaga I.
7) godtagbara lån : lån till icke-finansiella företag och hushåll (inklusive hushållens icke-vinstdrivande organisationer) med hemvist, enligt definitionen i artikel 1.4 i rådets förordning (EG) nr 2533/98 (4), i medlemsstater som har euron som valuta, exklusive lån till hushåll för husköp, enligt vad som framgår ytterligare i bilaga II.
8) godtagbar nettoutlåning : bruttoutlåning i form av godtagbara lån netto utan återbetalningar på utestående belopp avseende godtagbara lån under en specifik period enligt vad som framgår av bilaga II.
9) finansiellt bolag (FVC) : ett finansiellt bolag som ägnar sig åt värdepapperiseringstransaktioner enligt definitionen i artikel 1.1 I Europeiska centralbankens förordning nr 1075/2013 (ECB/2013/40) (5).
10) första referensperioden : perioden 1 april 2018 till 31 mars 2019.
11) FVC-kod : en unik kod för att identifiera ett FVC i den förteckning över FVC som Europeiska centralbanken upprättar och publicerar för statistiska ändamål i enlighet med artikel 3 i förordning (EU) nr 1075/2013 (ECB/2013/40).
12) justering av ränteincitament : den eventuella sänkning av räntesatsen som ska tillämpas på de belopp som lånats inom ramen för TLTRO III, angiven som bråkdel av den genomsnittliga skillnaden mellan den högsta möjliga räntan och den lägsta möjliga räntan, beräknad enligt de anvisningar som framgår av bilaga I.
13) LEI-kod : en alfanumerisk referenskod i enlighet med ISO 17442 som tilldelats en juridisk enhet.
14) monetärt finansinstitut (MFI) : ett monetärt finansinstitut enligt definitionen i artikel 1 a i Europeiska centralbankens förordning (EU) nr 1071/2013 (ECB/2013/33). (6)
15) MFI-kod : en unik kod för att identifiera ett monetärt finansinstitut i den förteckning över monetära finansinstitut som Europeiska centralbanken upprättar och publicerar för statistiska ändamål i enlighet med artikel 4 i förordning (EU) nr 1071/2013 (ECB/2013/33).
16) utestående belopp avseende godtagbara lån : utestående godtagbara lån i balansräkningen, exklusive godtagbara lån som värdepapperiserats eller på annat sätt överförts utan att de avförts från balansräkningen, enligt vad som framgår av bilaga II.
17) deltagare : en motpart som är godkänd för Eurosystemets penningpolitiska öppna marknadsoperationer i enlighet med riktlinje (EU) 2015/510 (ECB/2014/60), som lämnar ett individuellt anbud i anbudsförfaranden avseende TLTRO III eller agerar huvudinstitut för en grupp och som omfattas av alla de rättigheter och skyldigheter som följer av ett deltagande i sådana TLTRO III-anbudsförfaranden.
18) referensvärde för utestående belopp : summan av utestående belopp av godtagbara lån samt, när alternativet i artikel 6.3 har utövats, utestående internt värdepapperiserade godtagbara lån per den 28 februari 2019.
19) relevant nationell centralbank : i förhållande till en viss deltagare, den nationella centralbanken i den medlemsstat där deltagaren är etablerad.
20) andra referensperioden : perioden 1 april 2019 till 31 mars 2021.
21) värdepapperisering : en transaction som är a) en traditionell värdepapperisering enligt definitionen i artikel 2.9 i Europaparlamentets och rådets förordning (EU) nr 2017/2402 (7), och/eller b) en värdepapperisering enligt definitionen i artikel 1.2 i förordning (EU) nr 1075/2013 (ECB/2013/40) där de värdepapperiserade lånen överförs till ett FVC.
22) internt värdepapperiserade godtagbara lån : godtagbara lån som har utgetts och värdepapperiserats av en deltagare eller en medlem i en TLTRO III-grupp, där värdepapperiseringens resulterande värdepapper med bakomliggande tillgångar som säkerhet behålls till 100 procent av den deltagaren eller medlemmen i TLTRO III-gruppen.
Artikel 2
Den tredje serien med riktade långfristiga refinansieringstransaktioner
1. Eurosystemet ska genomföra sju riktade långfristiga refinansieringstransaktioner (TLTRO III) i enlighet med den vägledande kalendern för TLTRO III som offentliggörs på ECB:s webbplats.
2. Varje TLTRO III förfaller till betalning, utan möjlighet till frivillig förtida återbetalning, två år efter respektive avvecklingsdag, på en dag som även är avvecklingsdag för en av Eurosystemets huvudsakliga refinansieringstransaktioner, i enlighet med den vägledande kalendern för TLTRO III som offentliggörs på ECB:s webbplats.
3. TLTRO III ska
|
a) |
vara likvidiserande reverserade transaktioner, |
|
b) |
genomföras decentraliserat av de nationella centralbankerna, |
|
c) |
genomföras med hjälp av standardiserade anbudsförfaranden, och |
|
d) |
genomföras i form av anbudsförfaranden till fast ränta. |
4. De standardvillkor enligt vilka de nationella centralbankerna är beredda att genomföra lånetransaktioner ska gälla för TLTRO III såvida inget annat framgår av detta beslut. Dessa villkor inkluderar förfarandena för att genomföra öppna marknadsoperationer, de kriterier som avgör huruvida motparter och säkerheter godkänns för Eurosystemets kredittransaktioner samt de sanktioner som tillämpas om en motpart inte fullgör sina skyldigheter. Alla dessa villkor framgår av de allmänna och tillfälliga ramverk som gäller för refinansieringstransaktioner och som genomförs via de avtal och föreskrifter som de nationella centralbankerna tillämpar.
5. Om det förekommer diskrepanser mellan det här beslutet och riktlinje (EU) 2015/510 (ECB/2014/60) eller andra ECB-rättsakter som utgör den rättsliga ramen för långfristiga refinansieringstransaktioner och/eller någon nationell åtgärd som genomför dessa på nationell nivå, ska det här beslutet ges tolkningsföreträde.
Artikel 3
Deltagande
1. Institut får delta i TLTRO III individuellt om de är godkända som motparter för Eurosystemets penningpolitiska öppna marknadsoperationer.
2. Institut får delta i TLTRO III på gruppbasis genom att skapa en TLTRO III-grupp. Deltagande på gruppbasis har betydelse för beräkningen av de lånebelopp och tröskelvärden som framgår av artikel 4 samt de tillhörande rapporteringsskyldigheter som framgår av artikel 6. Deltagande på gruppbasis omfattas av följande begränsningar:
|
a) |
Ett institut får inte vara medlem i mer än en TLTRO III-grupp. |
|
b) |
Ett institut som deltar i en TLTRO III på gruppbasis får inte delta individuellt. |
|
c) |
Ett institut som utsetts till huvudinstitut för en grupp är den enda medlemmen i TLTRO III-gruppen som får delta i ett TLTRO III-anbudsförfarande. |
|
d) |
En TLTRO III-grupp måste ha samma sammansättning och huvudinstitut för alla TLTRO III-transaktioner, med beaktande av punkterna 5 och 6 i denna artikel. |
3. För att få delta i en TLTRO III genom en TLTRO III-grupp måste nedanstående villkor uppfyllas.
|
a) |
Från och med den sista dagen i den månad som föregår den ansökan som avses nedan i punkt d, ska varje medlem i en viss grupp
|
|
b) |
Varje grupp ska utse en gruppmedlem som huvudinstitut för gruppen. Huvudinstitutet ska vara en godtagbar motpart för Eurosystemets penningpolitiska öppna marknadsoperationer. |
|
c) |
Varje medlem i en TLTRO III-grupp ska vara ett kreditinstitut som är etablerat i en medlemsstat som har euron som valuta och uppfylla de kriterier som framgår av artikel 55 a, b och c i riktlinje (EU) 2015/510 (ECB/2014/60). |
|
d) |
Om inte annat följer av led e ska huvudinstitutet hos sin nationella centralbank ansöka om deltagande på gruppbasis i enlighet med den vägledande kalendern för TLTRO III som offentliggörs på ECB:s webbplats. Av en ansökan ska framgå
|
|
e) |
En TLTRO II-grupp som godkänts för TLTRO II i enlighet med beslut (EU) 2016/810 (ECB/2016/10) får delta i TLTRO III som en TLTRO III-grupp om dess huvudinstitut lämnat ett skriftligt meddelande med detta innehåll till den relevanta nationella centralbanken i enlighet med den vägledande kalendern för TLTRO III som offentliggörs på ECB:s webbplats. Meddelandet ska innehålla
|
|
f) |
Huvudinstitutet ska inhämta en bekräftelse från sin nationella centralbank att TLTRO III-gruppen har godkänts. Innan denna bekräftelse ges kan den relevanta nationella centralbanken begära mer information från huvudinstitutet som behövs för att bedöma den föreslagna TLTRO III-gruppen. I sin bedömning av en gruppansökan ska den relevanta nationella centralbanken även beakta den bedömning som kan vara nödvändig av gruppmedlemmarnas nationella centralbanker, t.ex. kontrollen av den dokumentation som lämnats i enlighet med leden d eller e ovan. |
Inom ramen för detta beslut ska kreditinstitut som är föremål för gruppbaserad tillsyn, inklusive filialer till dessa kreditinstitut, också ansöka om att godkännas som en TLTRO III-grupp och ska då i tillämpliga delar uppfylla villkoren enligt denna artikel. Denna bestämmelse underlättar för sådana institut att skapa TLTRO III-grupper om instituten ingår i samma juridiska person. Vad gäller bekräftelsen avseende inrättande eller ändringar av sammansättningen av en sådan TLTRO III-grupp, ska respektive bestämmelser i punkterna 3 d v och 6 b ii 5 tillämpas.
4. Om ett eller flera av de institut som omfattas av en ansökan om att godkännas som en TLTRO III-grupp inte uppfyller villkoren i punkt 3, kan den relevanta nationella centralbanken delvis avslå ansökan. I ett sådant fall kan de institut som lämnat in ansökan antingen besluta att agera som en TLTRO III-grupp bestående av sådana gruppmedlemmar som uppfyller de nödvändiga villkoren eller dra tillbaka sin ansökan om att godkännas som en TLTRO III-grupp
5. I undantagsfall får ECB-rådet, på objektiva grunder, besluta om avsteg från de villkor som framgår av punkterna 2 och 3.
6. Utan att det påverkar tillämpningen av punkt 5 får sammansättningen på en grupp som godkänts i enlighet med punkt 3 ändras under följande omständigheter:
|
a) |
En medlem ska exkluderas från TLTRO III-gruppen om denne inte längre uppfyller kraven enligt punkt 3 a eller 3 c. Den relevanta gruppmedlemmens nationella centralbank ska informera huvudinstitutet om att gruppmedlemmen inte uppfyller kraven. I sådana fall ska huvudinstitutet informera den relevanta nationella centralbanken om att statusen för en av dess gruppmedlemmar ändrats. |
|
b) |
Om, i relation till TLTRO III-gruppen, ytterligare nära förbindelser eller indirekta innehav av obligatoriska kassakrav för Eurosystemet etablerats efter den sista dagen i den månad som föregår den ansökan som avses i punkt 3 d, får TLTRO III-gruppens sammansättning ändras så att en ny medlem kan tas upp i gruppen, förutsatt att
|
|
c) |
Om det, i relation till TLTRO III-gruppen, sker fusioner, förvärv eller uppdelningar som berör en TLTRO III-gruppmedlem efter den sista dagen i den månad som föregår den ansökan som avses i punkt 3 d, och den operationen inte resulterar i någon förändring i uppsättningen godtagbara lån, får TLTRO III-gruppens sammansättning ändras för att spegla fusionen, förvärvet eller uppdelningen, förutsatt att villkoren enligt led b uppfylls. |
7. Om förändringar i en TLTRO III-grupps sammansättning godkänts av ECB-rådet i enlighet med punkt 5, eller förändringar i en TLTRO III-grupps sammansättning skett i enlighet med punkt 6, ska följande gälla om inte ECB-rådet beslutar något annat:
|
a) |
avseende förändringar för vilka punkterna 5, 6b eller 6c gäller, får huvudinstitutet delta i en TLTRO III utifrån TLTRO III-gruppens nya sammansättning först när det erhållit en bekräftelse från sin nationella centralbank om att TLTRO III-gruppens nya sammansättning godkänts, och. |
|
b) |
ett institut som inte längre är medlem i en TLTRO III-grupp ska inte delta i några ytterligare TLTRO III-transaktioner, varken individuellt eller som medlem i en annan TLTRO III-grupp, om det inte lämnar in en ny ansökan om att få delta i enlighet med punkterna 1, 3 eller 6. |
8. Om ett huvudinstitut inte längre är godkänt för Eurosystemets penningpolitiska öppna marknadsoperationer, ska dess TLTRO III-grupp inte längre godkännas och huvudinstitutet ska då återbetala alla belopp som lånats inom ramen för TLTRO III.
Artikel 4
Lånebelopp, anbudsgränser och tröskelvärden
1. Det maximala lånebeloppet för en individuell deltagare beräknas utifrån låneuppgifterna om referensvärdet för utestående belopp för den individuella deltagaren. Det maximala lånebeloppet för en deltagare som är huvudinstitut för en TLTRO III-grupp beräknas utifrån de aggregerade låneuppgifterna om referensvärdet för utestående belopp för alla medlemmarna i TLTRO III-gruppen.
2. Det maximala lånebeloppet för en deltagare ska motsvara 30 procent av dess referensvärde för utestående belopp minus eventuella belopp som tidigare lånats av denna TLTRO III-deltagare under TLTRO:er i enlighet med beslut (EU) 2016/810 (ECB/2016/10) och fortfarande är utestående på avvecklingsdagen för en TLTRO III, med beaktande av alla rättsligen bindande meddelanden om förtida återbetalning som deltagaren lämnat i enlighet med artikel 6 i beslut (EU) 2016/810 (ECB/2016/10). Beräkningsmetoderna framgår av bilaga I.
3. Om en medlem i en TLTRO-grupp som godkänts för TLTRO II enligt beslut (EU) 2016/810 (ECB/2016/10) inte önskar vara medlem i respektive TLTRO III-grupp ska det institutet, vid beräkningen av TLTRO III-lånebeloppet för det kreditinstitutet som individuell deltagare, under de TLTRO II:er som anses ha lånat ett belopp som motsvarar det belopp som huvudinstitutet för TLTRO II-gruppen lånat inom ramen för TLTRO II och som fortfarande är utestående på avvecklingsdagen för en TLTRO III, multiplicerat med andelen godtagbara lån som den medlemmen hade i relation till TLTRO II-gruppen den 31 januari 2016. Det sistnämnda beloppet kommer att subtraheras från det belopp som respektive TLTRO III-grupp anses ha lånat under de TLTRO II:er som genomfördes vid beräkningen av det maximala TLTRO III-lånebeloppet för huvudinstitutet.
4. Varje deltagares anbudsgräns för varje TLTRO III motsvarar i) dennes lånebelopp minus de belopp som lånats under tidigare TLTRO III, eller, ii) en tiondel av det sammanlagda referensvärdet för utestående belopp, beroende på vilket belopp som är lägst. Detta belopp ska utgöra den högsta anbudsgränsen för varje deltagare och de regler som gäller för anbud som överstiger denna högsta anbudsgräns, som framgår av artikel 36 till riktlinje (EU) 2015/510 (ECB/2014/60), ska tillämpas. Beräkningsmetoderna framgår av bilaga I.
5. En deltagares tröskelvärde för nettoutlåning fastställs utifrån den godtagbara nettoutlåningen under den första referensperioden enligt följande:
|
a) |
För deltagare som rapporterar en positiv eller noll godtagbar nettoutlåning under första referensperioden är tröskelvärdet för nettoutlåning noll. |
|
b) |
För deltagare som rapporterar en negativ godtagbar nettoutlåning under första referensperioden är tröskelvärdet för nettoutlåning lika med den godtagbara nettoutlåningen under första referensperioden. |
Beräkningsmetoderna framgår av bilaga I. För deltagare som erhållit tillstånd att bedriva bankverksamhet efter den 28 februari 2019 är tröskelvärdet för nettoutlåning noll, utom i fall där ECB-rådet på objektiva grunder beslutar något annat.
6. En deltagares tröskelvärde för utestående belopp beräknas som summan av utestående belopp av godtagbara lån per den 31 mars 2019 och tröskelvärdet för nettoutlåning. Beräkningsmetoderna framgår av bilaga I.
Artikel 5
Ränta
1. Om inte annat följer av punkt 2 ska räntan som utgår för det belopp som lånats inom ramen för varje TLTRO III fastställas till 10 baspunkter över den genomsnittliga räntan på den huvudsakliga refinansieringstransaktionen under respektive TLTRO III:s livslängd.
2. Den ränta som utgår för de belopp som lånats av deltagare vars godtagbara nettoutlåning under den andra referensperioden överstiger deras tröskelvärde för nettoutlåning ska vara lägre än den ränta som specificeras i punkt 1 och kan vara så låg som 10 baspunkter över den genomsnittliga ränta på insättningsfaciliteten som gäller under respektive TLTRO III:s livslängd, beroende på avvikelsen från tröskelvärdet för utestående belopp. Anvisningar och beräkningsmetoder framgår av bilaga I.
3. Deltagarna ska informeras om avvikelsen från tröskelvärdet för utestående belopp, den resulterande eventuella justeringen av ränteincitamentet, och de slutliga räntesatserna i enlighet med den vägledande kalendern för TLTRO III som offentliggörs på ECB:s webbplats.
4. Ränta ska avvecklas i efterhand när varje TLTRO III förfaller.
5. Om en deltagare, pga. att en nationell centralbank vidtar åtgärder i enlighet med sina avtal och föreskrifter, måste återbetala utestående TLTRO III-belopp innan deltagaren informeras om avvikelsen från tröskelvärdet för utestående belopp och den resulterande eventuella justeringen av ränteincitamentet, ska räntan som utgår för de belopp som deltagaren lånat inom ramen för TLTRO III fastställas till 10 baspunkter över den genomsnittliga räntan på den huvudsakliga refinansieringstransaktionen under relevant TLTRO III:s livslängd fram till det datum då den nationella centralbanken krävde återbetalning. Om det krävs en sådan återbetalning sedan deltagaren har informerats om en avvikelse från tröskelvärdet för utestående belopp och den resulterande eventuella justeringen av ränteincitamentet, ska den ränta som utgår för de belopp som deltagaren lånat inom ramen för varje TLTRO III fastställas med hänsyn till avvikelsen från tröskelvärdet för utestående belopp.
Artikel 6
Rapporteringskrav
1. Varje deltagare i en TLTRO III ska till den relevanta nationella centralbanken rapportera de uppgifter som framgår av rapporteringsmallarna i bilaga II enligt följande:
|
a) |
Referensvärdet för utestående belopp avseende godtagbara lån för att fastställa deltagarens lånebelopp och anbudsgränser, samt uppgifter om den första referensperioden för fastställande av deltagarens tröskelvärden (nedan kallad den första rapporten). |
|
b) |
Uppgifter som avser den andra referensperioden för att fastställa de tillämpliga räntorna (nedan kallad den andra rapporten). |
2. Uppgifterna ska tillhandahållas i enlighet med följande:
|
a) |
Den vägledande kalendern för TLTRO III som offentliggörs på ECB:s webbplats. |
|
b) |
De riktlinjer som framgår av bilaga II. |
|
c) |
De minimistandarder för rapporteringsskyldighet avseende noggrannhet och begreppsmässig överensstämmelse som framgår av bilaga IV till förordning (EU) nr 1071/2013 (ECB/2013/33). |
3. Deltagare som avser att inkludera internt värdepapperiserade godtagbara lån för beräkningen av sina lånebelopp ska utöva detta alternativ genom att tillhandahålla tilläggsposterna för samtliga internt värdepapperiserade godtagbara lån som framgår av bilaga II, tillsammans med revisorns bedömning av dessa tilläggsposter, i enlighet med följande regler:
|
a) |
Deltagare som deltar i den första eller andra TLTRO III-transaktionen kan delta på grundval av en första rapport som inte innehåller tilläggsposterna. För att internt värdepapperiserade lån ska kunna inkluderas i beräkningen av deras lånebelopp och anbudsgränser från och med den andra eller tredje transaktionen, ska dock tilläggsposterna och den respektive revisorns bedömning av tilläggsposterna tillhandahållas den relevanta nationella centralbanken inom tidsfristen för den första rapporten för endera av dessa transaktioner, enligt vad som framgår av den vägledande kalendern för TLTRO som offentliggörs på ECB:s webbplats. |
|
b) |
Deltagare som deltar först i den tredje TLTRO III-transaktionen eller senare TLTRO III-transaktioner ska tillhandahålla den relevanta nationella centralbanken både den första rapporten med tilläggsposter och den respektive revisorns bedömning av tilläggsposterna inom den relevanta tidsfristen som framgår av den vägledande kalendern för TLTRO som offentliggörs på ECB:s webbplats |
4. Termer som används i den rapport som deltagarna lämnar in kommer att tolkas i enlighet med definitionerna av dessa termer i förordning (EU) nr 1071/2013 (ECB/2013/33).
5. Huvudinstitut för TLTRO III-grupper ska lämna rapporter med aggregerade uppgifter för alla medlemmarna i TLTRO III-gruppen. Dessutom kan huvudinstitutets nationella centralbank eller den nationella centralbanken för en medlem av en TLTRO III-grupp, efter samordning med huvudinstitutets nationella centralbank, begära att huvudinstitutet lämnar in disaggregerade uppgifter för varje enskild gruppmedlem.
6. Varje deltagare ska säkerställa att kvaliteten på de uppgifter som rapporteras enligt punkterna 1– granskas av en extern revisor enligt följande regler:
|
a) |
Revisorns bedömning av den första rapporten ska lämnas till den relevanta nationella centralbanken inom den relevanta tidsfrist som framgår av den vägledande kalendern för TLTRO III som offentliggörs på ECB:s webbplats. |
|
b) |
Resultaten av revisorns bedömning av den andra rapporten ska lämnas till den relevanta nationella centralbanken inom den relevanta tidsfrist som framgår av den vägledande kalendern för TLTRO III som offentliggörs på ECB:s webbplats. |
|
c) |
Revisorns bedömningar ska inriktas på de krav som framgår av punkterna 2 och 4. Revisorn ska särskilt
Om det gäller en grupps deltagande ska resultat av revisorns bedömningar delas med de nationella centralbankerna för övriga medlemmar i TLTRO III-gruppen. På begäran från deltagarens nationella centralbank ska detaljerad information från bedömningar som genomförts med stöd av denna punkt tillhandahållas den nationella centralbanken och ska sedan, när det gäller en grupps deltagande, delas med gruppmedlemmarnas nationella centralbanker. |
|
d) |
Revisorns bedömning ska som minimum omfatta följande:
|
Eurosystemet får ge ytterligare anvisningar om hur revisorns bedömning ska genomföras och deltagarna ska säkerställa att revisorn tillämpar dessa anvisningar i sin bedömning.
7. Om inte annat följer av punkt 8 ska en reviderad första rapport lämnas i enlighet med instruktioner från deltagarens nationella centralbank om det sker förändringar i en TLTRO III-grupps sammansättning eller i en företagsstruktur, t.ex. fusioner, förvärv eller uppdelningar (inklusive om den uppstått till följd av en deltagares resolution eller likvidation), som påverkar deltagarens uppsättning av godtagbara lån. Den relevanta nationella centralbanken ska bedöma konsekvenserna av revideringen och vidta lämpliga åtgärder. Sådana åtgärder kan omfatta krav på återbetalning av lånade belopp som, med beaktande av förändringarna i TLTRO III-gruppens sammansättning eller i företagsstrukturen, överstiger det relevanta lånebeloppet. Den berörda deltagaren, som efter förändringen av företagsstrukturen kan inkludera en nyetablerad enhet, ska tillhandahålla all information som den relevanta nationella centralbanken begär för att underlätta bedömningen av de konsekvenser som förändringen medför.
8. Genom undantag från punkt 7 krävs det ingen granskning av den första rapporten, men de relevanta konsekvenserna för godtagbara lån kan i stället registreras som en justering i den andra rapporten i fall där
|
a) |
förändringen av företagsstrukturen omfattar institutioner som före denna förändring varit föremål för tillsyns- eller resolutionsåtgärder och dessa åtgärder, som har bekräftats av den relevanta nationella centralbanken, har inverkat negativt på deras utlåningskapacitet under åtminstone den senare delen av den andra referensperioden, |
|
b) |
förändringen av företagsstrukturen omfattar ett förvärv som genomförts av en deltagare under de sex sista månaderna av den andra referensperioden, eller |
|
c) |
den relevanta nationella centralbanken bedömer att förändringen av gruppens sammansättning eller förändringen av företagsstrukturen inte föranleder någon reviderad rapport. |
För fall b och c kan deltagare fortfarande välja att revidera den första rapporten för att beakta förändringar av företagsstrukturen.
9. De uppgifter som deltagarna tillhandahåller inom ramen för denna artikel får användas av Eurosystemet för att genomföra och analysera effekterna av ramverket för TLTRO III samt för att utföra andra analytiska uppgifter som Eurosystemet ska göra. För dessa ändamål tillåts de nationella centralbanker som erhåller uppgifter som inrapporterats enligt denna artikel att vidarebefordra uppgifterna inom Eurosystemet. Uppgifter som inrapporteras enligt denna artikel får även vidarebefordras inom Eurosystemet för validering.
Artikel 7
Om rapporteringskraven åsidosätts
1. Om en deltagare åsidosätter skyldigheten att rapportera eller uppfylla revisionskrav, eller om de rapporterade uppgifterna innehåller felaktigheter, gäller följande:
|
a) |
Om en deltagare åsidosätter skyldigheten att tillhandahålla den relevanta nationella centralbanken den första rapporten inom tidsfristen sätts lånebeloppet till noll. |
|
b) |
Om en deltagare åsidosätter skyldigheten att tillhandahålla den relevanta nationella centralbanken resultaten av revisorns bedömning av den första rapporten inom den relevanta tidsfrist som framgår av den vägledande kalendern för TLTRO III som offentliggörs på ECB:s webbplats, ska deltagaren återbetala alla utestående belopp som lånats inom ramen för TLTRO III på avvecklingsdagen för nästa huvudsakliga refinansieringstransaktion till en ränta av 10 baspunkter över den huvudsakliga refinansieringstransaktionen under respektive TLTRO III:s livslängd. |
|
c) |
Om en deltagare åsidosätter skyldigheten att tillhandahålla den relevanta nationella centralbanken den andra rapporten inom den relevanta tidsfristen ska räntan på 10 baspunkter över den genomsnittliga räntan på den huvudsakliga refinansieringstransaktionen under respektive TLTRO III:s livslängd tillämpas på de belopp som den deltagaren lånat inom ramen för TLTRO III tillsammans med en extra straffavgift på 500 euro per dag tills den andra rapporten har lämnats in, dock högst 15 000 euro. Denna straffavgift ska ackumuleras och tas ut när den relevanta nationella centralbanken har tagit emot den andra rapporten eller när den maximala straffavgiften har uppnåtts om den andra rapporten fortfarande inte har erhållits. |
|
d) |
Om en deltagare åsidosätter skyldigheten att tillhandahålla den relevanta nationella centralbanken resultaten av revisorns bedömning av den andra rapporten inom den relevanta tidsfristen, ska räntan på 10 baspunkter över den genomsnittliga räntan på den huvudsakliga refinansieringstransaktionen under respektive TLTRO III:s livslängd tillämpas på de belopp som den deltagaren lånat inom ramen för TLTRO III. |
|
e) |
Om en deltagare på annat sätt försummar att uppfylla kraven enligt artikel 6.6 eller 6.7, ska räntan på 10 baspunkter över den genomsnittliga räntan på den huvudsakliga refinansieringstransaktionen under respektive TLTRO III:s livslängd tillämpas på de belopp som den deltagaren lånat inom ramen för TLTRO III. |
|
f) |
Om en deltagare, antingen i samband med den revision som avses i artikel 6.6 eller på annat sätt, upptäcker fel i de uppgifter som rapporterats, inklusive oriktiga eller ofullständiga uppgifter, ska deltagaren snarast informera den relevanta nationella centralbanken om detta. Om den relevanta nationella centralbanken har informerats om sådana felaktiga, oriktiga eller ofullständiga uppgifter, eller om sådana felaktiga, oriktiga eller ofullständiga uppgifter kommer till dess kännedom på annat sätt i) ska deltagaren snarast tillhandahålla all information som den relevanta nationella centralbanken begär för att underlätta bedömningen av de konsekvenser som dessa felaktiga, oriktiga eller ofullständiga uppgifter medför, och ii) den relevanta nationella centralbanken får vidta åtgärder, inklusive en förnyad beräkning av relevanta värden, som i sin tur kan påverka den ränta som utgår på deltagarens TLTRO III-lån och krav på återbetalning av lånade belopp som pga. felaktiga, oriktiga eller ofullständiga uppgifter överstiger deltagarens lånebelopp. |
2. Punkt 1 ska inte påverka tillämpningen av eventuella sanktioner som kan vidtas med stöd av beslut ECB/2010/10 (9) avseende de rapporteringsskyldigheter som framgår av förordning (EU) nr 1071/2013 (ECB/2013/33).
Artikel 8
Ikraftträdande
Detta beslut träder i kraft den 3 augusti 2019.
Utfärdat i Frankfurt am Main den 22 juli 2019.
Mario DRAGHI
ECB:s ordförande
(1) Beslut ECB/2014/34 av den 29 juli 2014 om åtgärder avseende riktade långfristiga refinansieringstransaktioner (EUT L 258, 29.8.2014, s. 11).
(2) Europeiska centralbankens beslut (EU) 2016/810 av den 28 april 2016 om en andra serie med riktade långfristiga refinansieringstransaktioner (ECB/2016/10) (EUT L 132, 21.5.2016, s. 107).
(3) Europeiska centralbankens riktlinje (EU) 2015/510 av den 19 december 2014 om genomförandet av Eurosystemets penningpolitiska ramverk (ECB/2014/60) (EUT L 91, 2.4.2015, s. 3).
(4) Rådets förordning (EG) nr 2533/98 av den 23 november 1998 om Europeiska centralbankens insamling av statistiska uppgifter (EGT L 318, 27.11.1998, s. 8).
(5) Europeiska centralbankens förordning EU nr 1075/2013 av den 18 oktober 2013 om statistik över tillgångar och skulder hos finansiella bolag som ägnar sig åt värdepapperiseringstransaktioner (ECB/2013/40) (EUT L 297, 7.11.2013, s. 107).
(6) Europeiska centralbankens förordning (EU) nr 1071/2013 av den 24 september 2013 om de monetära finansinstitutens balansräkningar (ECB/2013/33) (EUT L 297, 7.11.2013, s. 1).
(7) Europaparlamentets och rådets förordning (EU) 2017/2402 av den 12 december 2017 om ett allmänt ramverk för värdepapperisering och om inrättande av ett särskilt ramverk för enkel, transparent och standardiserad värdepapperisering samt om ändring av direktiven 2009/65/EG, 2009/138/EG och 2011/61/EU och förordningarna (EG) nr 1060/2009 och (EU) nr 648/2012 (EUT L 347, 28.12.2017, s. 35).
(8) Europeiska centralbankens förordning (EG) nr 1745/2003 av den 12 september 2003 om tillämpningen av minimireserver (kassakrav) (ECB/2003/9) (EUT L 250, 2.10.2003, s. 10).
(9) Beslut ECB/2010/10 av den 19 augusti 2010 om åtgärder i fall där rapporteringskraven i fråga om statistiska uppgifter ej uppfylls (EUT L 226, 28.8.2010, s. 48).
BILAGA I
HUR DEN TREDJE SERIEN MED RIKTADE LÅNGFRISTIGA REFINANSIERINGSTRANSAKTIONER SKA GENOMFÖRAS
1. Beräkning av lånebelopp och anbudsgränser
Deltagare i den tredje serien med riktade långfristiga refinansieringstransaktioner (TLTRO III), vare sig de agerar individuellt eller som huvudinstitut för en TLTRO III-grupp, omfattas av ett lånebelopp. De beräknade lånebeloppen avrundas uppåt till närmaste multipel av 10 000 euro.
Det lånebelopp som gäller för en individuell deltagare i en TLTRO III beräknas utifrån referensvärdet för utestående belopp, som omfattar det utestående beloppet av godtagbara utestående lån samt, när alternativet i artikel 6.3 har utövats, internt värdepapperiserade godtagbara lån per den 28 februari 2019. Lånebeloppet för ett huvudinstitut för en TLTRO III-grupp beräknas utifrån referensvärdet för utestående belopp avseende alla medlemmarna i TLTRO III-gruppen.
Lånebeloppet motsvarar 30 procent av referensvärdet för utestående belopp avseende deltagare (1) minus de belopp som deltagaren lånat inom ramen för de riktade långfristiga refinansieringstransaktioner som genomförts i enlighet med beslut (EU) 2016/810 (ECB/2016/10) (TLTRO II) och som fortfarande är utestående på avvecklingsdagen för en TLTRO III, eller noll om detta belopp är negativt, dvs:
BAk = max(0,3 × ORFeb 2019 - OBk , 0) för k = 1,…,7.
där BAk är lånebeloppet i en TLTRO III k (med k = 1,…,7), ORFeb 2019 är referensvärdet för utestående belopp per den 28 februari 2019 och OB k är det belopp som deltagaren lånat i TLTRO II och som fortfarande är utestående på avvecklingsdagen för TLTRO III k.
Anbudsgränsen för varje deltagare i varje TLTRO III är antingen: a) dennes lånebelopp BAk minus de belopp som lånats under tidigare TLTRO III, eller b) en tiondel av referensvärdet för utestående belopp, beroende på vilket belopp som är lägst. Ck ≥ 0 utgör deltagarens lån i TLTRO III k och Ck ≤ BLk anbudsgränsen BLk för denna deltagare i transaktion k som definieras enligt följande:
BL 1 = min(BA 1, 0,1 × ORFeb 2019)
och

för k = 2,…,7.
2. Beräkning av tröskelvärden
Om NLm är deltagarens godtagbara nettoutlåning under kalendermånad m, beräknad som deltagarens bruttoflöden av nya godtagbara lån under den månaden minus återbetalningar av godtagbara lån, enligt definitionen i bilaga II.
NLB anger tröskelvärdet för denna deltagares nettoutlåning. Detta definieras enligt följande:
NLB = min (NLApr 2018 + NLMay 2018 + … + NLMar 2019, 0)
Detta implicerar att en deltagare med positiv eller noll godtagbar nettoutlåning under första referensperioden NLB = 0. Skulle deltagaren dock ha en negativ godtagbar nettoutlåning under första referensperioden så NLB = NLApr 2018 + NLMay 2018 + … + NLMar 2019.
OAB anger en deltagares tröskelvärde för utestående belopp. Detta definieras enligt följande:
OAB = max (OLMar 2019 + NLB, 0),
där OLMar 2019 är det utestående beloppet av godtagbara lån vid utgången av mars 2019.
3. Ränteberäkning
NSMar 2021 anger det belopp som erhålls om man summerar den godtagbara nettoutlåningen under perioden 1 april 2019 till 31 mars 2021 och det utestående beloppet av godtagbara lån per den 31 mars 2019. Detta beräknas som NSMar 2021 = OLMar 2019 + NLApr 2019 + … + NLMar 2021.
EX anger den procentuella avvikelsen av NSMar 2021 från tröskelvärdet för utestående belopp, dvs.

EX anges i procent avrundat till 15 decimaler. där OAB är lika med noll, EX är lika med 2,5.
 utgör genomsnittet av räntan på den huvudsakliga refinansieringstransaktionen under livslängden för TLTRO III k, angiven i procent på årsbasis, och
utgör genomsnittet av räntan på den huvudsakliga refinansieringstransaktionen under livslängden för TLTRO III k, angiven i procent på årsbasis, och  utgör genomsnittet av räntan för inlåningsfaciliteten under livslängden för TLTRO III, angiven i procent på årsbasis, dvs.:
utgör genomsnittet av räntan för inlåningsfaciliteten under livslängden för TLTRO III, angiven i procent på årsbasis, dvs.:


I ovanstående ekvationer anger nk (för k = 1,..7) antalet dagar för TLTRO III k, MROk,t anger den räntesats som tillämpas på den huvudsakliga refinansieringstransaktionen (MRO) den n:e dagen för TLTRO III k, om denna huvudsakliga refinansieringstransaktion genomförs enligt en ordning till fast ränta och full tilldelning, alternativt MROk,t som anger den lägsta anbudsränta som tillämpas på den huvudsakliga refinansieringstransaktionen den n:e dagen för TLTRO III k, om denna huvudsakliga refinansieringstransaktion genomförs enligt ett anbudsförfarande till rörlig ränta, angivet i procent på årsbasis. I ovanstående ekvationer anger DFk,t den räntesats som tillämpas på inlåningsfaciliteten den n:e dagen av TLTRO III k, angivet i procent på årsbasis.
Den resulterande eventuella justeringen av ränteincitamentet, mätt som bråkdel av den genomsnittliga korridoren mellan högsta möjliga räntesats ( ) och lägsta möjliga räntesats (
) och lägsta möjliga räntesats ( ), anges som iri; den räntesats som ska tillämpas på TLTRO III k, angivet i procent på årsbasis, ska anges rk; och rk och fastställs på följande sätt:
), anges som iri; den räntesats som ska tillämpas på TLTRO III k, angivet i procent på årsbasis, ska anges rk; och rk och fastställs på följande sätt:
|
a) |
Om en deltagare inte överskrider sitt tröskelvärde för utestående belopp av godtagbara lån per den 31 mars 2021, ska räntan som utgår för alla belopp som deltagaren lånat inom ramen för TLTRO III fastställas till 10 baspunkter över den genomsnittliga räntan för den huvudsakliga refinansieringstransaktionen under respektive TLTRO III:s livslängd, dvs. om EX ≤ 0 är iri = 0 % och |
|
b) |
Om en deltagare överskrider sitt tröskelvärde för utestående belopp av godtagbara lån med minst 2,5 procent per den 31 mars 2021, ska räntan som utgår för alla belopp som deltagaren lånat inom ramen för TLTRO III motsvara 10 baspunkter över den genomsnittliga ränta på inlåningsfaciliteten som gäller under respektive TLTRO III:s livslängd, dvs. om EX ≥ 2,5 är iri = 100 % och |
|
c) |
Om en deltagare överskrider sitt tröskelvärde för utestående belopp avseende godtagbara lån men inte når upp till 2,5 procent per den 31 mars 2021, ska räntan som utgår för alla belopp som deltagaren lånat inom ramen för TLTRO III beräknas linjärt utifrån den procentsats med vilken deltagaren överträffar sitt tröskelvärde för utestående belopp av godtagbara lån, dvs. om 0 < EX < 2,5 är |
Den resulterande eventuella justeringen av ränteincitamentet (iri) anges avrundat till 15 decimaler.
Räntan (rk ) anges i procent på årsbasis och avrundas nedåt till fjärde decimalen.
(1) Hänvisningar till en deltagare avser både individuella deltagare och TLTRO III-grupper.
BILAGA II
DEN TREDJE SERIEN MED RIKTADE LÅNGFRISTIGA REFINANSIERINGSTRANSAKTIONER – ANVISNINGAR FÖR ATT SAMMANSTÄLLA UPPGIFTER FÖR RAPPORTERINGSMALLARNA
1. Inledning (1)
Dessa anvisningar förklarar hur uppgifterna för de rapporter som deltagarna i TLTRO III ska lämna in i enlighet med artikel 6 ska sammanställas. Rapporteringskraven framgår av rapporteringsmallarna i slutet av denna bilaga. Dessa riktlinjer beskriver även rapporteringsskyldigheten för huvudinstitut för TLTRO III-grupper som deltar i transaktioner.
Avsnitten 2 och 3 innehåller allmän information om sammanställning och inrapportering av uppgifter och avsnitt 4 beskriver de indikatorer som ska rapporteras.
2. Allmän information
De parametrar som ska användas vid beräkningen av lånebeloppen avser de monetära finansinstitutens (MFI) lån till euroområdets icke-finansiella företag och MFI:s lån till euroområdets hushåll (2), exklusive lån för husköp, oavsett valuta. I enlighet med artikel 6 ska två rapporter lämnas: den första rapporten omfattar uppgifter om referensvärdet för utestående belopp samt uppgifter om den första referensperioden, och den andra rapporten omfattar uppgifter om den andra referensperioden. Beloppen ska rapporteras separat för icke-finansiella företag och hushåll. Utestående lånebelopp avseende godtagbara lån ska justeras så att lån som värdepapperiserats eller på annat sätt överförts men som inte har avförts från balansräkningen beaktas; deltagare får dock utöva alternativet enligt artikel 6.3 för att beräkna sitt lånebelopp, oberoende av redovisningsstatus i balansräkningen. Detaljerad information ska ges även om dessa posters relevanta underkomponenter, samt om de effekter som resulterar i förändringar av utestående belopp avseende godtagbara lån men som inte är relaterade till godtagbar nettoutlåning (nedan kallade justeringar av utestående belopp), även omfattande försäljningar och köp av lån samt andra överföringar av lån.
Det är viktigt att understryka att den insamlade informationen om referensvärdet för utestående belopp kommer att användas för beräkningen av lånebeloppet. Uppgifterna om den godtagbara nettoutlåningen under den första referensperioden kommer att användas för beräkningen av tröskelvärdet för nettoutlåning och tröskelvärdet för utestående belopp. Uppgifterna om den godtagbara nettoutlåningen under den andra referensperioden kommer att användas för att bedöma låneutvecklingen och därmed även vilken räntesats som tillämpas. Alla andra indikatorer som inkluderas i mallen är nödvändiga för att kontrollera att uppgifterna är konsekventa både inbördes och i förhållande till den statistik som Eurosystemet samlar in, samt även för den ingående granskningen av TLTRO II-programmets effekt.
Ramverket som ligger till grund för rapporteringen utgörs av de uppgifter som euroområdets MFI rapporterar inom ramen för sin balansräkningsstatistik i enlighet med förordning (EU) nr 1071/2013 (ECB/2013/33). Artikel 8.2 i förordning (EU) nr 1071/2013 (ECB/2013/33) föreskriver att denna ”ska redovisas med utestående kapitalbelopp vid slutet av månaden. Av- och nedskrivningar som sker enligt gällande redovisningsregler ska exkluderas från detta belopp. […] utlåning ska inte nettas mot andra tillgångar eller skulder”. Som undantag till reglerna i artikel 8.2, som alltså anger att lån ska rapporteras brutto, anger artikel 8.4 att ”de nationella centralbankerna får tillåta att lån med reserveringar rapporteras netto utan reserveringar och att köpta lån rapporteras till det vid förvärvet överenskomna priset [dvs. transaktionsvärdet], förutsatt att sådan rapporteringspraxis tillämpas av alla inhemska uppgiftslämnare”. Internt värdepapperiserade godtagbara lån får inte rapporteras netto utan reserveringar om de har avförts från balansräkningen. De konsekvenser som detta avsteg från huvudriktlinjerna för BSI får när man sammanställer rapporter diskuteras mer i detalj nedan.
Förordning (EU) nr 1071/2013 (ECB/2013/33) bör också användas som referensdokument för de definitioner som ska användas vid rapporteringen. Se särskilt artikel 1 för allmänna definitioner och delarna 2 och 3 i bilaga II för en definition av de instrument som omfattas av uttrycket lån respektive för sektorsklassificeringar av deltagarna. Det bör noteras att, enligt BSI-ramverket, ska upplupen ränta på utlåning normalt tas upp i balansräkningen allt eftersom den uppkommer (dvs. enligt bokföringsmässiga grunder och inte när beloppet inkommer), men inte ingå i uppgifterna om utestående lånebelopp. Kapitaliserad ränta ska dock tas upp som en del av de utestående beloppen.
Trots att många av de uppgifter som ska rapporteras redan sammanställs av MFI i enlighet med förordning nr 1071/2013 (ECB/2013/33) måste en del ny information sammanställas av TLTRO III-deltagarna. Det metodologiska ramverket för BSI-statistiken, som framgår av Manual on MFI balance sheet statistics (3), innehåller upplysningar om hur dessa nya uppgifter ska sammanställas, och ytterligare information om definitioner av indikatorerna finns i punkt 4.
3. Allmänna rapporteringsinstruktioner
a) Rapporteringsmallarnas utformning
I mallarna anges vilka referensdatum uppgifterna avser och indikatorerna grupperas i två kategorier: MFI-lån till euroområdets icke-finansiella företag och MFI-lån till euroområdets hushåll, exklusive lån för husköp. Uppgifterna i de gulmarkerade cellerna beräknas utifrån de uppgifter som matas in i andra celler, baserat på respektive formel. Mallarna innehåller även valideringsregler som kontrollerar att uppgifterna är konsekventa inbördes.
Inom ramen för TLTRO III används två rapporter:
|
— |
I den första rapporten ska uppgiftsmallen A fyllas i vad gäller referensvärdet för utestående belopp med avseende på beräkning av lånebelopp och anbudsgränser. Deltagare som utövar alternativet enligt artikel 6.3 måste tillhandahålla tilläggsposter avseende internt värdepapperiserade godtagbara lån och revisorns bedömning av dessa poster, i enlighet med artikel 6.6 c v. I den första rapporten ska mall B även fyllas i för ”den första referensperioden”, dvs. 1 april 2018 till 31 mars 2019, för att beräkna godtagbar nettoutlåning och tröskelvärden. |
|
— |
I den andra rapporten ska uppgiftsmallen B fyllas i för ”den andra referensperioden”, dvs. 1 april 2019 till 31 mars 2021, med avseende på beräkning av godtagbar nettoutlåning och jämförelser i förhållande till de tröskelvärden som ligger till grund för tillämpliga räntor. |
I mall B ska indikatorer som avser utestående belopp ska rapporteras per utgången av den månad som föregår starten på rapporteringsperioden och rapporteringsperiodens utgång, dvs. för den första referensperioden ska utestående belopp rapporteras per den 31 mars 2018 och den 31 mars 2019, och för den andra referensperioden ska utestående belopp rapporteras per den 31 mars 2019 och den 31 mars 2021. Uppgifterna om transaktioner och justeringar ska omfatta alla relevanta effekter som sker under rapporteringsperioden.
b) Rapportering avseende TLTRO III-grupper
Uppgifter från deltagande TLTRO III-grupper ska normalt rapporteras i aggregerad form. Om de nationella centralbankerna i medlemsstater som har euron som valuta (NCB) finner det lämpligt får de dock samla in individuell information från varje institut.
c) Överföring av rapporter
De ifyllda rapporterna ska överföras till den relevanta nationella centralbanken enligt anvisningarna i artikel 6 och i enlighet med den vägledande kalendern för TLTRO III som offentliggörs på ECB:s webbplats som även anger vilka referensperioder som varje enskild överföring omfattar och vilka uppgifter som ska användas när man sammanställer uppgifterna.
d) Enhet som används för uppgifterna
Uppgifterna ska rapporteras i tusental euro.
4. Definitioner
Detta avsnitt innehåller definitioner av de poster som ska rapporteras; den numrering som används på rapporteringsmallarna anges inom parentes.
a) Utestående belopp avseende godtagbara lån (1 och 4)
Uppgifterna i dessa celler beräknas utifrån de uppgifter som matas in för följande balansräkningsposter: ”Utestående belopp i balansräkningen” (1.1 och 4.1) minus ”Utestående belopp avseende lån som värdepapperiserats eller på annat sätt överförts utan att ha avförts från balansräkningen” (1.2 och 4.2) plus ”Utestående reserveringar” (1.3 och 4.3). Den senare kategorin är endast relevant i fall där man, med avsteg från allmän BSI-praxis, rapporterar lån netto utan reserveringar.
De underliggande postern för utestående belopp av godtagbara lån är som följer:
|
i) |
Utestående belopp i balansräkningen (1.1 och 4.1) Denna post består av utestående lån som beviljats euroområdets icke-finansiella företag och hushåll, exklusive lån till hushåll för husköp. Till skillnad från kapitaliserad ränta exkluderas upplupen ränta från indikatorerna. Dessa celler har ett direkt samband med kraven enligt del 2 i bilaga I till förordning (EU) nr 1071/2013 (ECB/2013/33) (kategori 2 i tabell 1 om månadsvisa stockar). För mer detaljerade definitioner av de poster som ska inkluderas i rapporterna se del 2 i bilaga II till förordning (EU) nr 1071/2013 (ECB/2013/33) och avsnitt 4.3 i Manual on MFI balance sheet statistics. |
|
ii) |
Utestående belopp avseende lån som värdepapperiserats eller på annat sätt överförts utan att ha avförts från balansräkningen (1.2 och 4.2) Denna post består av utestående belopp avseende lån som värdepapperiserats eller på annat sätt överförts utan att ha avförts från balansräkningen. All värdepapperisering ska rapporteras oavsett om de inblandade värdepapperiseringsinstituten är inhemska eller ej. Lån som ställs som säkerhet vid Eurosystemets penningpolitiska lånetransaktioner i form av kreditfordringar, som medför en överföring utan att de avförs från balansräkningen, ingår inte i denna post. Del 5 i bilaga I till förordning (EU) nr 1071/2013 (ECB/2013/33) (kategori 5.1 i tabell 5a om månadsvisa uppgifter) omfattar information om värdepapperiserade lån till icke-finansiella företag och hushåll som inte har avförts från balansräkningen, men kräver inte att den senare delas upp efter ändamål. Utestående belopp avseende lån som har överförts på annat sätt (dvs. inte genom värdepapperisering) men som inte har avförts från balansräkningen omfattas inte av förordning (EU) nr 1071/2013 (ECB/2013/33). För att sammanställa rapporterna måste därför separata uppgifter hämtas från MFI:s interna databaser. För mer information om de poster som ska inkluderas i rapporterna se del 5 i bilaga I till förordning (EU) nr 1071/2013 (ECB/2013/33) och avsnitt 4.3.11 i Manual on MFI balance sheet statistics. |
|
iii) |
Utestående reserveringar (1.3 och 4.3) Dessa uppgifter är endast relevanta för de institut som, med avsteg från allmän BSI-praxis, rapporterar lån netto utan reserveringar. Om institut avger anbud som en TLTRO III-grupp gäller detta krav endast för de institut i gruppen som bokför lån netto utan reserveringar. Posten innehåller individuella och kollektiva avsättningar för värdeminskningar och låneförluster (innan nedskrivningar och avskrivningar görs). Uppgifterna ska avse ”Utestående belopp av lån i balansräkningen (1.1 och 4.1), exklusive ”Utestående belopp av lån som värdepapperiserats eller på annat sätt överförts men som inte har avförts från balansräkningen” (1.2 och 4.2). Såsom beskrivis i punkt 2, tredje stycket ska BSI-lånestatistiken som huvudregel redovisas med det utestående kapitalbeloppet, och de tillhörande avsättningarna redovisas under posten ”Eget kapital och reserver”. I sådana fall behöver man inte rapportera någon separat information. I fall där lån rapporteras netto utan reserveringar måste dock denna extra information rapporteras så att uppgifterna blir fullt jämförbara mellan alla MFI. Om det är praxis att rapportera utestående lån netto utan reserveringar får de nationella centralbankerna besluta att rapporteringen av informationen är frivillig. I sådana fall kommer dock beräkningarna inom ramen för TLTRO III-ramverket att baseras på balansräkningens uppgifter om utestående lån netto utan reserveringar (4). För mer detaljerad information se hänvisningen i definitionen av eget kapital och reserver som anges i del 2 i bilaga II till förordning (EU) nr 1071/2013 (ECB/2013/33). |
b) Godtagbar nettoutlåning (2)
Dessa celler visar den nettoutlåning (transaktioner) som beviljats under rapporteringsperioden. Uppgifterna beräknas utifrån uppgifterna som rapporterats för underposterna ”Bruttoutlåning” (2.1) minus ”Återbetalningar” (2.2).
Lån som omförhandlas under rapporteringsperioden bör rapporteras både som ”Återbetalningar” och som ”Bruttoutlåning” vid tidpunkten för omförhandlingen. Justeringsuppgifter ska inkludera konsekvenser av omförhandlingar.
Reverserade transaktioner under perioden (dvs. lån som beviljas och återbetalas under perioden) bör i princip rapporteras som ”Bruttoutlåning” och ”Återbetalningar”. Anbudsgivande MFI får dock exkludera dessa transaktioner när de sammanställer rapporter ifall detta minskar deras rapporteringsbörda. I sådana fall bör de informera den berörda nationella centralbanken och uppgifterna om justeringar av utestående belopp måste också exkludera effekterna från dessa reverserade transaktioner. Undantaget gäller dock inte för lån som beviljats under samma period då de har värdepapperiserats eller på annat sätt överförts.
Kreditkortsfordringar, revolverande lån och checkräkningskrediter bör också beaktas. För dessa instrument fungerar de belopp som använts eller tagits ut under rapporteringsperioden som riktmärke för nettoutlåningen. Positiva belopp bör rapporteras som ”Bruttoutlåning” (2.1) medan negativa belopp rapporteras (med positivt tecken) som ”Återbetalningar” (2.2).
|
i) |
Bruttoutlåning (2.1) Denna post omfattar bruttoflöden av ny utlåning under rapporteringsperioden, exklusive eventuella anskaffningar av lån. Kredit som beviljats avseende kreditkortsfordringar, revolverande lån och checkräkningskrediter bör också rapporteras enligt vad som beskrivs ovan. Belopp som under perioden adderats till kundsaldona till följd av t.ex. räntekapitalisering (till skillnad från upplupna räntor) och avgifter bör också tas med. |
|
ii) |
Återbetalningar (2.2) Denna post omfattar återbetalningsflöden av kapitalbelopp under rapporteringsperioden, exklusive sådana som avser värdepapperiserade eller på annat sätt överförda lån som inte avförts från balansräkningen. Återbetalningar avseende kreditkortsfordringar, revolverande lån och checkräkningskrediter bör också rapporteras enligt vad som beskrivs ovan. Räntebetalningar som avser upplupen ränta som ännu ej kapitaliserats, avyttringar av lån och andra justeringar av de utestående beloppen (inklusive nedskrivningar och avskrivningar) bör inte rapporteras. Enligt förordning (EU) nr 1071/2013 (ECB/2013/33) ska omvandling av skulder till eget kapital behandlas som transaktioner. Vid sammanställning av TLTRO III-rapporter kan emellertid omvandling av skulder till eget kapital, varvid en deltagares lån till icke-finansiella företag ersätts med deltagarens innehav av eget kapital i dessa icke-finansiella företag, rapporteras som omklassificering i stället för återbetalning, förutsatt att det inte resulterar i att deltagaren bidrar med lägre finansiering till realekonomin, vilket ska fastställas av den relevanta nationella centralbanken. Deltagaren ska lämna alla uppgifter som den nationella centralbanken behöver för att avgöra hur omvandlingen ska behandlas. |
c) Justeringar av utestående belopp (3)
Dessa celler används för att rapportera förändringar av utestående belopp av godtagbara lån (minskningar [–] och ökningar [+]) som skett under rapporteringsperioden men inte är relaterade till godtagbar nettoutlåning. Sådana förändringar uppstår genom t.ex. värdepapperisering och andra överföringar av lån under rapporteringsperioden eller från andra justeringar för omvärderingar orsakade av växelkursförändringar, av- och nedskrivningar på lån samt omklassificeringar.
Poster avseende justeringar av utestående belopp beräknas utifrån uppgifterna som rapporterats för underposterna ”Försäljningar och köp av lån samt andra överföringar av lån under rapporteringsperioden” (3.1) plus ”Andra justeringar” (3.2).
|
i) |
Försäljningar och köp av lån samt andra överföringar av lån under rapporteringsperioden (3.1)
|
|
ii) |
Andra justeringar (3.2) Följande poster avseende andra justeringar ska rapporteras för utestående lån i balansräkningen, exklusive lån som värdepapperiserats eller på annat sätt överförts men som inte har avförts från balansräkningen.
|
d) Tilläggsposter avseende internt värdepapperiserade godtagbara lån (S.1)
Deltagare som utövar alternativet enligt artikel 6.3 måste även tillhandahålla följande tilläggsposter avseende utestående belopp av internt värdepapperiserade godtagbara lån i mall A:
|
i) |
”Utestående belopp av internt värdepapperiserade godtagbara lån som inte avförts från balansräkningen” (S.1.1) Dessa uppgifter avser lån som har värdepapperiserats internt och som ingår i beloppen som rapporteras under post 1.2. |
|
ii) |
”Utestående belopp av internt värdepapperiserade godtagbara lån som avförts från balansräkningen” (S.1.2) Dessa uppgifter avser lån som har värdepapperiserats internt och som inte längre redovisas i balansräkningen eftersom de har avförts. Om lånen fortsätter att förvaltas av deltagaren ska de fortfarande rapporteras under del 5 i bilaga I till förordning (EU) nr 1071/2013 (ECB/2013/33) (kategori 3.1 i tabellerna 5a och 5b). |
|
iii) |
”Utestående belopp av avsättningar i förhållande till internt värdepapperiserade godtagbara lån som inte avförts från balansräkningen” (S.1.3) Dessa uppgifter avser lån som inte har avförts från balansräkningen – dvs. rapporteras under S.1.1. Dessa poster ska endast rapporteras i de fall då lån inte rapporteras enligt generell BSI-praxis, utan rapporteras netto utan reserveringar. I så fall kan emellertid deltagarna besluta att inte tillhandahålla dessa uppgifter och de relevanta beloppen kommer då inte att inkluderas I beräkningen av utestående belopp av godtagbara lån. |
Rapportering avseende TLTRO III
TLTRO III rapporteringsmall A
|
Rapporteringsperiod:28 februari 2019 |
|||||||||
|
|
|||||||||
|
Lån till icke-finansiella företag och hushåll, exklusive bostadslån till hushåll (tusen euro) |
|||||||||
|
|
|||||||||
|
|
Huvudaggregat för referensvärdet för utestående belopp |
|
Lån till icke-finansiella företag |
Lån till hushåll (inklusive hushållens icke-vinstdrivande organisationer), exklusive bostadslån |
|
|
|
||
|
|
|
|
|
|
|
|
post |
formel |
validering |
|
|
1 |
Utestående belopp avseende godtagbara lån … |
|
0 |
0 |
1 |
1 = 1.1 – 1.2 (+ 1.3) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S.1 |
Tilläggsbelopp avseende internt värdepapperiserade godtagbara lån … |
|
0 |
0 |
S.1 |
S.1 = S.1.1 + S.1.2 (+ S.1.3) |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
Underliggande poster |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Utestående belopp avseende godtagbara lån i balansräkningen |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1,1 |
Utestående belopp i balansräkningen … |
|
|
|
1,1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1,2 |
Utestående belopp avseende lån som värdepapperiserats eller på annat sätt överförts utan att ha avförts från balansräkningen … |
|
|
|
1,2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1,3 |
Utestående avsättningar i förhållande till lån som rapporterats under post 1.1 exklusive 1.2 (*1)… |
|
|
|
1,3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Tilläggsposter avseende internt värdepapperiserade godtagbara lån |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S.1.1 |
Utestående belopp avseende internt värdepapperiserade godtagbara lån som inte har avförts från balansräkningen … |
|
|
|
S.1.1 |
|
S.1.1 <= 1.2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S.1.2 |
Utestående belopp avseende internt värdepapperiserade godtagbara lån som har avförts från balansräkningen … |
|
|
|
S.1.2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S.1.3 |
Utestående belopp av avsättningar i förhållande till internt värdepapperiserade godtagbara lån som inte har avförts från balansräkningen (*1)… |
|
|
|
S.1.3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
TLTRO III rapporteringsmall B
|
Rapporteringsperiod:1 april 2018 till 31 mars 2019 (första referensperioden) / 1 april 2019 till 31 mars 2021 (andra referensperioden) |
|||||||||
|
|
|||||||||
|
Lån till icke-finansiella företag och hushåll, exklusive bostadslån till hushåll (tusen euro) |
|||||||||
|
|
|||||||||
|
|
Huvudaggregat |
|
Lån till icke-finansiella företag |
Lån till hushållen (inklusive hushållens icke-vinstdrivande organisationer), exklusive bostadslån |
|
|
|
||
|
|
|
|
|
|
|
|
post |
formel |
validering |
|
|
1 |
Utestående belopp avseende godtagbara lån vid utgången av den månad som föregår starten på rapporteringsperioden … |
|
0 |
0 |
1 |
1 = 1.1 – 1.2 (+ 1.3) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
Godtagbar nettoutlåning under rapporteringsperioden … |
|
0 |
0 |
2 |
2 = 2.1 – 2.2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3 |
Justeringar av utestående belopp: minskningar (–) och ökningar (+) … |
|
0 |
0 |
3 |
3 = 3.1 + 3.2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
Utestående belopp avseende godtagbara lån vid utgången av rapporteringsperioden … |
|
0 |
0 |
4 |
4 = 4.1 – 4.2 (+ 4.3) |
4 = 1 + 2 + 3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Underliggande poster |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Utestående belopp avseende godtagbara lån vid utgången av den månad som föregår starten på rapporteringsperioden |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1.1 |
Utestående belopp i balansräkningen … |
|
|
|
1.1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1.2 |
Utestående belopp avseende lån som värdepapperiserats eller på annat sätt överförts utan att ha avförts från balansräkningen … |
|
|
|
1.2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1.3 |
Utestående avsättningar i förhållande till lån som rapporterats under post 1.1 exklusive 1.2 (*2)… |
|
|
|
1.3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Godtagbar nettoutlåning under rapporteringsperioden |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2.1 |
Bruttoutlåning … |
|
|
|
2.1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2.2 |
Återbetalningar … |
|
|
|
2.2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Justeringar av utestående belopp: minskningar (–) och ökningar (+) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3.1 |
Försäljningar och köp av lån samt andra överföringar av lån under rapporteringsperioden … |
|
0 |
0 |
3.1 |
3.1 = 3.1A + 3.1B + 3.1C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3.1A |
Nettoflöden av lån som värdepapperiserats med konsekvenser för lånestockar … |
|
|
|
3.1A |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3.1B |
Nettoflöden av lån som överförts på annat sätt med konsekvenser för lånestockar … |
|
|
|
3.1B |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3.1C |
Nettoflöden av lån som värdepapperiserats eller överförts på annat sätt utan konsekvenser för lånestockar … |
|
|
|
3.1C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3.2 |
Andra justeringar … |
|
0 |
0 |
3.2 |
3.2 = 3.2A + 3.2B + 3.2C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3.2A |
Omvärderingar orsakade av växelkursförändringar … |
|
|
|
3.2A |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3.2B |
Avskrivningar/nedskrivningar … |
|
|
|
3.2B |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3.2C |
Omklassificeringar … |
|
|
|
3.2C |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Utestående belopp avseende godtagbara lån vid utgången av rapporteringsperioden |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4.1 |
Utestående belopp i balansräkningen … |
|
|
|
4.1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4.2 |
Utestående belopp avseende lån som värdepapperiserats eller på annat sätt överförts utan att ha avförts från balansräkningen … |
|
|
|
4.2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4.3 |
Utestående avsättningar i förhållande till lån som rapporterats under post 4.1 exklusive 4.2 (*2)… |
|
|
|
4.3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1) Ramverket som ligger till grund för rapporteringskraven är detsamma som framgår av beslut ECB/2014/34 och (EU) 2016/810 (ECB/2016/10), med undantag för förändringar som hänger samman med att internt värdepapperiserade godtagbara lån har inkluderats för att beräkna lånebeloppet.
(2) I rapporteringen omfattar hushåll även hushållens icke-vinstdrivande organisationer.
(3) Se Manual on MFI balance sheet statistics, ECB, januari 2019, finns på ECB:s webbplats www.ecb.europa.eu. I avsnitt 4.3 (s. 40) ges mer ingående förklaringar till rapporteringen av lån.
(4) Detta undantag har konsekvenser för rapporteringen av uppgifter om nedskrivningar och avskrivningar såsom förklaras närmare nedan.
(5) Teckenkonventionen, som skiljer sig från kraven enligt förordning (EU) nr 1071/2013 (ECB/2013/33), är förenlig med det allmänna kravet avseende justeringsuppgifter enligt vad som framgår ovan – dvs. effekter som medför ökningar (eller minskningar) i utestående belopp ska rapporteras med ett positivt eller negativt förtecken.
(6) Förordning (EU) nr 1071/2013 (ECB/2013/33) tillåter att MFI rapporterar köpta lån till transaktionsvärdet förutsatt att detta är nationell praxis och tillämpas av alla MFI med hemvist i landet. I sådana fall ska eventuella omvärderingskomponenter rapporteras i post 3.2B.
(7) ECB:s växelkurs bör användas. Se pressrelease av den 8 juli 1998 om gemensamma marknadsstandarder som finns på ECB:s webbplats www.ecb.europa.eu.
(8) Detta krav avviker från rapporteringskraven enligt förordning (EU) nr 1071/2013 (ECB/2013/33).
(9) Detta krav är detsamma som den information som ska rapporteras enligt förordning (EU) nr 1071/2013 (ECB/2013/33) av MFI som bokför lån netto utan reserveringar.
(*1) Endast tillämpligt i sådana fall där lån rapporteras netto utan reserveringar; se rapporteringsanvisningarna för mer information.
(*2) Endast tillämpligt i sådana fall där lån rapporteras netto utan reserveringar; se rapporteringsanvisningarna för mer information.
|
2.8.2019 |
SV |
Europeiska unionens officiella tidning |
L 204/123 |
EUROPEISKA CENTRALBANKENS BESLUT (EU) 2019/1312
av den 22 juli 2019
om ändring av beslut (EU) 2016/810 (ECB/2016/10) om en andra serie med riktade långfristiga refinansieringstransaktioner (ECB/2019/22)
ECB-RÅDET HAR ANTAGIT DETTA BESLUT
med beaktande av fördraget om Europeiska unionens funktionssätt, särskilt artikel 127.2 första strecksatsen,
med beaktande av stadgan för Europeiska centralbankssystemet och Europeiska centralbanken, särskilt artikel 3.1 första strecksatsen, artikel 12.1, artikel 18.1 andra strecksatsen samt artikel 34.1 andra strecksatsen,
med beaktande av Europeiska centralbankens riktlinje (EU) 2015/510 av den 19 december 2014 om genomförandet av Eurosystemets penningpolitiska ramverk (ECB/2014/60) (1), och
av följande skäl:
|
(1) |
Enligt artikel 1.4 i riktlinje (EU) 2015/510 (ECB/2014/60) får ECB-rådet när som helst ändra de verktyg, instrument, krav, kriterier och förfaranden som används för att genomföra Eurosystemets penningpolitiska transaktioner. |
|
(2) |
Inom ramen för sitt mandat att upprätthålla prisstabilitet och för att förbättra den penningpolitiska transmissionen genom att skapa ytterligare incitament för bankernas utlåning till den icke-finansiella privata sektorn, antog ECB-rådet den 28 april 2016 Europeiska centralbankens beslut (EU) 2016/810 (ECB/2016/10) (2). Det beslutet innehåller bestämmelser om att genomföra en andra serie riktade långfristiga refinansieringstransaktioner (targeted longer-term refinancing operations, TLTRO II) under perioden juni 2016 till mars 2017. |
|
(3) |
Den 7 mars 2019 beslutade ECB-rådet att genomföra en ny serie med sju riktade långfristiga refinansieringstransaktioner (TLTRO III) för att bidra till fortsatt gynnsamma förutsättningar för bankernas utlåning och för att stödja den expansiva inriktningen på penningpolitiken i de medlemsstater som har euron som valuta. Bestämmelserna kring dessa TLTRO III kommer att fastställas i ett separat beslut. |
|
(4) |
För att underlätta beräkningen av anbudsgränserna för TLTRO III, och med beaktande av belopp som lånats inom ramen för TLTRO II men som frivilligt återbetalats i förtid, är det nödvändigt att ändra perioden för meddelanden om sådan förtida återbetalning. |
|
(5) |
För att ge kreditinstituten tillräckligt med tid för sina operativa förberedelser inför den första transaktionen inom ramen för TLTRO III, bör detta beslut träda i kraft så snart som möjligt. |
|
(6) |
Beslut (EU) 2016/810 (ECB/2016/10) bör därför ändras i enlighet med detta. |
HÄRIGENOM FÖRESKRIVS FÖLJANDE.
Artikel 1
Ändringar
I beslut (EU) 2016/810 (ECB/2016/10) ska artikel 6.3 och 6.4 ersättas med följande:
”3. En deltagare som vill utnyttja möjligheten till förtida återbetalning måste informera den relevanta nationella centralbanken om detta samt även ange återbetalningsdatumet, minst två veckor före den dag då den förtida återbetalningen ska ske.
4. Den informationsplikt som avses i punkt 3 blir bindande för den berörda deltagaren två veckor före den dag då den förtida återbetalningen ska ske. Om en deltagare inte helt eller delvis återbetalar beloppet avseende den förtida återbetalningen på återbetalningsdagen kan en ekonomisk sanktion utdömas. Straffavgiften ska beräknas enligt bilaga VII till riktlinje (EU) 2015/510 (ECB/2014/60) och ska motsvara den straffavgift som tillämpas om skyldigheten att ställa adekvat säkerhet och avveckla det belopp som motparten tilldelats inom ramen för reverserade transaktioner för penningpolitiska ändamål åsidosätts. Det faktum att en ekonomisk sanktion utdöms ska inte påverka den nationella centralbankens rätt till sådana åtgärder som får vidtas då fallissemang inträffar enligt vad som framgår av artikel 166 i riktlinje (EU) 2015/510 (ECB/2014/60).”
Artikel 2
Ikraftträdande
Detta beslut träder i kraft den 3 augusti 2019.
Utfärdat i Frankfurt am Main den 22 juli 2019.
På ECB-rådets vägnar
Mario DRAGHI
ECB:s ordförande
(1) Europeiska centralbankens riktlinje (EU) 2015/510 av den 19 december 2014 om genomförandet av Eurosystemets penningpolitiska ramverk (ECB/2014/60) (riktlinjen om den allmänna dokumentationen) (EUT L 91, 2.4.2015, s. 3).
(2) Europeiska centralbankens beslut (EU) 2016/810 av den 28 april 2016 om en andra serie med riktade långfristiga refinansieringstransaktioner (ECB/2016/10) (EUT L 132, 21.5.2016, s. 107).