ISSN 1977-0820
Europeiska unionens
officiella tidning
L 71

Svensk utgåva
Lagstiftning
66 årgången
9 mars 2023
|
ISSN 1977-0820 |
||
|
Europeiska unionens officiella tidning |
L 71 |
|

|
||
|
Svensk utgåva |
Lagstiftning |
66 årgången |
|
|
|
Rättelser |
|
|
|
* |
||
|
|
* |
||
|
|
* |
||
|
|
* |
|
|
|
|
|
(1) Text av betydelse för EES. |
|
SV |
De rättsakter vilkas titlar är tryckta med fin stil är sådana rättsakter som har avseende på den löpande handläggningen av jordbrukspolitiska frågor. De har normalt en begränsad giltighetstid. Beträffande alla övriga rättsakter gäller att titlarna är tryckta med fetstil och föregås av en asterisk. |
II Icke-lagstiftningsakter
FÖRORDNINGAR
|
9.3.2023 |
SV |
Europeiska unionens officiella tidning |
L 71/1 |
KOMMISSIONENS DELEGERADE FÖRORDNING (EU) 2023/511
av den 24 november 2022
om komplettering av Europaparlamentets och rådets förordning (EU) nr 575/2013 vad gäller tekniska tillsynsstandarder för beräkning av riskvägda exponeringsbelopp för företag för kollektiva investeringar enligt den mandatbaserade metoden
(Text av betydelse för EES)
EUROPEISKA KOMMISSIONEN HAR ANTAGIT DENNA FÖRORDNING
med beaktande av fördraget om Europeiska unionens funktionssätt,
med beaktande av Europaparlamentets och rådets förordning (EU) nr 575/2013 av den 26 juni 2013 om tillsynskrav för kreditinstitut och om ändring av förordning (EU) nr 648/2012 (1), särskilt artikel 132a.4 tredje stycket, och
av följande skäl:
|
(1) |
För att undvika omotiverade variationer i kapitalkrav mellan institut, och för att göra den mandatbaserade metoden möjlig att använda i situationer där informationen är otillräcklig, är det nödvändigt att ange metoden för att beräkna det riskvägda exponeringsbeloppet för ett företag för kollektiva investeringar (fond) enligt den mandatbaserade metoden i fall när det riskvägda exponeringsbeloppet inte kan beräknas på grund av saknade ingångsvärden. |
|
(2) |
Om en fond ingår derivattransaktioner och det saknas information om derivatens underliggande exponeringar eller derivatpositionernas underliggande risk kan instituten inte fastställa ersättningskostnaden för positionerna, och därför inte heller exponeringsvärdet. I ett sådant fall bör instituten basera sina beräkningar på det teoretiska beloppet för en derivatposition, vilket vanligtvis är känt och utgör den bästa indikatorn på positionens storlek och därmed ger en approximering av exponeringsvärdet. |
|
(3) |
Om fondens mandat inte utesluter ingående av derivat men inte innehåller tillräcklig information för att man ska kunna avgöra om en underliggande exponering utgör en exponering i eller utanför balansräkningen, kan det inte uteslutas att en sådan exponering föreligger. Det är därför nödvändigt att inkludera denna exponering i beräkningen av de riskvägda exponeringsbeloppen för fondens exponeringar. |
|
(4) |
Om mandatet inte ger tillräcklig information om positionens exponeringsvärde kan det inte uteslutas att exponeringsvärdet är derivatpositionens hela teoretiska belopp. |
|
(5) |
När mandatet inte specificerar derivatpositionens teoretiska belopp bör man, för att tillämpa tillräcklig försiktighet, härleda detta belopp från det högsta teoretiska belopp för derivat som tillåts enligt mandatet. |
|
(6) |
Vid beräkning av exponeringsbeloppet för motpartsrisk bör instituten, om de saknar information om ersättningskostnaderna eller den potentiella framtida exponeringen, basera sina beräkningar på summan av de teoretiska beloppen för transaktionerna i nettningsmängden, vilket är den bästa tillgängliga försiktiga skattningen för att möjliggöra användning av den mandatbaserade metoden. |
|
(7) |
I vissa fall är det inte möjligt för instituten att fastställa de relevanta nettningsmängderna för en viss typ av derivat i fonden, eftersom det inte finns någon tillgänglig information om motparterna eller om huruvida transaktionerna omfattas av ett sådant rättsligt bindande bilateralt nettningsavtal som avses i artikel 272.4 i förordning (EU) nr 575/2013. I dessa fall bör instituten anta att varken nettningseffekter eller motpartsdiversifiering föreligger för den typen av derivat. Instituten bör därför anta att fonden har ingått ett enda derivat med det högsta teoretiska belopp som enligt mandatet är tillåtet för den typen av derivat. |
|
(8) |
Denna förordning grundar sig på det förslag till tekniska tillsynsstandarder som Europeiska bankmyndigheten har lagt fram för kommissionen. |
|
(9) |
Europeiska bankmyndigheten har genomfört öppna offentliga samråd om det förslag till tekniska tillsynsstandarder som denna förordning grundar sig på, gjort en analys av de möjliga kostnaderna och fördelarna och begärt råd från den bankintressentgrupp som inrättats i enlighet med artikel 37 i Europaparlamentets och rådets förordning (EU) nr 1093/2010 (2). |
HÄRIGENOM FÖRESKRIVS FÖLJANDE.
Artikel 1
Fastställande av exponeringsvärdet för en fonds derivatpositioner om information om underliggande exponeringar saknas vid tillämpning av artikel 132a.2 i förordning (EU) nr 575/2013
1. Vid tillämpning av den mandatbaserade metoden i enlighet med artikel 132a.2 i förordning (EU) nr 575/2013, ska institutet, om fondens mandat inte utesluter att en fonds derivatpositions underliggande exponering utgör en exponering i eller utanför balansräkningen men exponeringsvärdet inte är känt – eller, i fråga om exponeringar utanför balansräkningen, den tillämpliga procentandelen enligt artikel 111 i förordning (EU) nr 575/2013 inte är känd – använda hela det teoretiska beloppet för derivatpositionen som exponeringsvärde för beräkningen av de riskvägda exponeringsbeloppen.
2. För att fastställa exponeringsvärdet enligt punkt 1 ska institutet, om det teoretiska beloppet för derivatpositionerna inte är känt, som exponeringsvärde använda en försiktig skattning baserad på det högsta teoretiska belopp som enligt fondens mandat är tillåtet för derivaten.
Artikel 2
Beräkning av exponeringsvärdena för motpartsrisken för en nettningsmängd av en fonds derivatpositioner
1. Vid beräkning av exponeringsvärdet för en nettningsmängd för motpartsrisk i enlighet med de metoder som anges i del 3 avdelning II kapitel 6 avsnitten 3, 4 eller 5, i tillämpliga fall, i förordning (EU) nr 575/2013 ska instituten tillämpa följande:
|
a) |
Om institutet på grund av att ingångsvärden saknas inte kan beräkna ersättningskostnaden för nettningsmängden enligt den relevanta metoden, ska summan av de teoretiska beloppen för alla derivat i nettningsmängden användas som ersättningskostnad. |
|
b) |
Om institutet på grund av att ingångsvärden saknas inte kan beräkna nettningsmängdens potentiella framtida exponering enligt den relevanta metoden, ska denna exponering ersättas med 0,15 gånger summan av de teoretiska beloppen för alla derivat i nettningsmängden. |
2. Vid beräkning av exponeringsvärdet för motpartsrisken i enlighet med punkt 1 ska institutet, om det teoretiska beloppet för derivaten i nettningsmängden är okänt, använda en försiktig skattning baserad på det högsta teoretiska belopp som enligt fondens mandat är tillåtet för derivaten för att fastställa exponeringsvärdet för den nettningsmängden.
3. Vid tillämpning av punkterna 1 och 2 ska institutet, om det inte kan fastställa de relevanta nettningsmängderna för en viss typ av derivat i fonden, anta att fonden har ingått ett enda derivat med det högsta teoretiska belopp som enligt mandatet är tillåtet för den typen av derivat.
Artikel 3
Ikraftträdande
Denna förordning träder i kraft den tjugonde dagen efter det att den har offentliggjorts i Europeiska unionens officiella tidning.
Denna förordning är till alla delar bindande och direkt tillämplig i alla medlemsstater.
Utfärdad i Bryssel den 24 november 2022.
På kommissionens vägnar
Ursula VON DER LEYEN
Ordförande
(1) EUT L 176, 27.6.2013, s. 1.
(2) Europaparlamentets och rådets förordning (EU) nr 1093/2010 av den 24 november 2010 om inrättande av en europeisk tillsynsmyndighet (Europeiska bankmyndigheten), om ändring av beslut nr 716/2009/EG och om upphävande av kommissionens beslut 2009/78/EG (EUT L 331, 15.12.2010, s. 12).
|
9.3.2023 |
SV |
Europeiska unionens officiella tidning |
L 71/4 |
KOMMISSIONENS GENOMFÖRANDEFÖRORDNING (EU) 2023/512
av den 2 mars 2023
om godkännande av en annan ändring än en mindre ändring av produktspecifikationen för ett namn som tagits upp i registret över skyddade ursprungsbeteckningar och skyddade geografiska beteckningar (”Aceto Balsamico di Modena” (SGB))
EUROPEISKA KOMMISSIONEN HAR ANTAGIT DENNA FÖRORDNING
med beaktande av fördraget om Europeiska unionens funktionssätt,
med beaktande av Europaparlamentets och rådets förordning (EU) nr 1151/2012 av den 21 november 2012 om kvalitetsordningar för jordbruksprodukter och livsmedel (1), särskilt artikel 52.3 b, och
av följande skäl:
|
(1) |
I enlighet med artikel 50.2 a i förordning (EU) nr 1151/2012 har Italiens ansökan om godkännande av en annan ändring än en mindre ändring av produktspecifikationen för den skyddade geografiska beteckningen ”Aceto Balsamico di Modena” offentliggjorts i Europeiska unionens officiella tidning (2). |
|
(2) |
Den 31 augusti 2021 mottog kommissionen tre meddelanden om invändning och en motiverad invändning från Tyskland. Två ytterligare motiverade invändningar från Tyskland lämnades in den 11 oktober 2021. Den 16 september 2021 mottog kommissionen det fjärde meddelandet om invändning från en invändare i Turkiet. Den tillhörande motiverade invändningen lämnades in den 16 november 2021. |
|
(3) |
Efter att ha granskat de motiverade invändningarna och fastställt att de är giltiga, i enlighet med artikel 51.3 i förordning (EU) nr 1151/2012, uppmanade kommissionen genom en skrivelse av den 10 december 2021 till lämpliga samråd mellan Italien och Tyskland respektive Italien och invändaren från Turkiet i syfte att nå en överenskommelse. |
|
(4) |
Den 4 mars 2021 meddelade Tyskland kommissionen att en av invändningarna hade dragits tillbaka, men att de två andra invändarna från Tyskland bibehöll sina invändningar. |
|
(5) |
Samråden mellan Italien och Tyskland respektive Italien och invändaren från Turkiet avslutades utan att någon överenskommelse nåddes. Kommissionen bör därför fatta beslut om ändringen i enlighet med det förfarande som avses i artikel 52.3 b i förordning (EU) nr 1151/2012, med beaktande av resultaten av samråden. |
|
(6) |
Invändarna ansåg att ändringarna av produktspecifikationen skulle leda till bristande efterlevnad av villkoren i artikel 5.2 i förordning (EU) nr 1151/2012, särskilt eftersom sambandet mellan produkten och det geografiska området skulle brytas. Därför ifrågasattes de påstådda ändringarna av de organoleptiska egenskaperna hos ”Aceto Balsamico di Modena”, ändringen av lägsta totala syrahalt för den lagrade produkten och ett korrigeringsförfarande för eventuella avvikelser från parametrarna. Ändringarna ifrågasattes också för att de ansågs försämra kvaliteten på ”Aceto Balsamico di Modena” och leda till bristande efterlevnad av kraven för vinättika i del II punkt 17 i bilaga VII till Europaparlamentet och rådets förordning (EU) nr 1308/2013 (3) om upprättande av en samlad marknadsordning för jordbruksprodukter (en syrahalt på minst 60 gram per liter = minst 6 %). |
|
(7) |
Invändarna hävdade dessutom att minimikraven i fråga om innehållet i produktspecifikationen enligt artikel 7.1 g i förordning (EU) nr 1151/2012 inte uppfylldes, eftersom uppgiften om kontrollorgan för ”Aceto Balsamico di Modena” hade strukits. |
|
(8) |
Invändarna hävdade även att det befintliga tillämpningsområdet för skyddet hade utvidgats på ett otillbörligt sätt och att registreringen av ändringarna skulle äventyra förekomsten av namn, varumärken eller produkter, inbegripet balsamvinäger av annat ursprung. Detta gällde särskilt det påstådda införandet av kravet på tappning i det avgränsade området, en ytterligare regel om behållarnas form samt införandet av parametrar för isotopförhållande. Invändarna hävdar därför att de planerade ändringarna skadar intresset för företag som tappar ”Aceto Balsamico di Modena” på flaska och för tyska producenter av andra sorters vinäger. |
|
(9) |
Slutligen hävdade invändarna att den nyligen införda minskningen av lägsta syrahalt skulle kunna leda till sammanblandning mellan den skyddade geografiska beteckningen ”Aceto Balsamico di Modena” och den skyddade ursprungsbeteckningen ”Aceto Balsamico Tradizionale di Modena”. |
|
(10) |
Kommissionen har bedömt de argument som framförts i Tysklands och Turkiets motiverade invändningar mot bakgrund av bestämmelserna i förordning (EU) nr 1151/2012, med beaktande av resultaten av de lämpliga samråd som hållits mellan sökanden och invändarna, och har kommit fram till att ändringen av produktspecifikationen för den skyddade geografiska beteckningen ”Aceto Balsamico di Modena” bör godkännas. |
|
(11) |
Italien hävdade att invändarna inte hade påvisat sitt berättigade intresse att lämna in invändningarna, såsom krävs enligt artikel 51.1 i förordning (EU) nr 1151/2012, eftersom de ifrågasatte ändringar som inte ingick i någon ansökan eller som inte medförde några handels- och/eller marknadshinder. När det gäller det tillämpliga förfarandet för ansökningar om andra ändringar än mindre ändringar av produktspecifikationen får varje fysisk eller juridisk person med ett berättigat intresse lämna in en invändning mot ansökan om ändring. I det aktuella fallet ansågs risken för att motparternas intressen skulle skadas inte vara helt osannolik eller hypotetisk, och därför konstaterades att invändarna hade ett berättigat intresse att lämna in invändningarna. |
|
(12) |
Analysen av invändningarna visade att vissa av påståendena gällde element i produktspecifikationen som i själva verket inte har ändrats till följd av de aktuella ändringarna, utan som endast utgörs av redaktionella ändringar. Syftet med dessa redaktionella ändringar var att anpassa det sammanfattande dokumentet till artikel 8.1 c i förordning (EU) nr 1151/2012 och bättre återspegla villkoren i produktspecifikationen för den skyddade geografiska beteckningen ”Aceto Balsamico di Modena”. Detta gäller särskilt de påstådda ändringarna av de organoleptiska egenskaperna, de påstådda ändringarna av användningen av tillsatser och plastbehållare samt det påstådda kravet på tappning i det avgränsade området. Dessa regler har inte ändrats, medan den omformulering som förekommer i det sammanfattande dokumentet – och som kan ha uppfattats som ändringar av produktspecifikationen – i själva verket är en följd av att avvikelser mellan produktspecifikationen och den sammanfattning av produktspecifikationen som offentliggjordes i Europeiska unionens officiella tidning (4) har rättats till. Kommissionens bedömning av ansökan om ändring av ”Aceto Balsamico di Modena” har fokuserat på de väsentliga ändringar som har begärts. |
|
(13) |
Ändringarna av lägsta syrahalt för typen ”invecchiato” (lagrad) från 6 % till 5,5 % eller av det tillåtna korrigeringsförfarandet för eventuella avvikelser kan inte anses inverka negativt på sambandet mellan produkten och dess geografiska ursprung. Skälen till dessa ändringar har förklarats och vederbörligen motiverats i offentliggörandet av ansökan, samtidigt som det är uppenbart att ändringarnas beskaffenhet och omfattning inte ändrar de väsentliga egenskaperna hos den skyddade geografiska beteckningen ”Aceto Balsamico di Modena” och följaktligen inte kan leda till att sambandet försvinner. |
|
(14) |
Dessutom kan likheterna i fråga om syrahalt inte leda till sammanblandning mellan den skyddade geografiska beteckningen ”Aceto Balsamico di Modena” och den skyddade ursprungsbeteckningen ”Aceto Balsamico Tradizionale di Modena” eller leda till en anspelning på den sistnämnda. Även om produkter som omfattas av båda beteckningarna delar vissa egenskaper, såsom syrahalten, framställs de av olika råvaror och enligt olika produktionsmetoder och skiljer sig därmed från varandra. |
|
(15) |
Slutligen definieras den skyddade geografiska beteckningen ”Aceto Balsamico di Modena” inte som vinättika och omfattas därför inte av de regler som gäller för vinättika, särskilt vad gäller lägsta syrahalt. |
|
(16) |
När det gäller invändningarna mot ett utökat utbud av flaskstorlekar kan ändringen inte anses medföra några begränsningar för aktörer som förpackar ”Aceto Balsamico di Modena”. Tvärtom kan det faktum att man tillåter fler storlekar på behållarna (0,100 liter, 0,150 liter, 0,200 liter eller 1,5 liter) ses som en lättnad av villkoren för tappning. Eventuella effekter av ökad konkurrens till följd av att ”Aceto Balsamico di Modena” saluförs med ett större utbud av flaskstorlekar skulle vara i linje med de grundläggande principerna för EU:s konkurrenspolitik och bör inte anses skada anseendet för den skyddade geografiska beteckningen ”Aceto Balsamico di Modena”. |
|
(17) |
Syftet med egenskaperna hos de behållare med en volym på mindre än 0,250 liter som anges i avsnitt 3.5 i det sammanfattande dokumentet är att säkerställa en miniminivå av enhetlighet avseende de flaskor som produkten säljs i. Denna förpackningsregel ingår inte i beskrivningen av produkten och förklaras inte heller närmare i fråga om produktens särskilda egenskaper i avsnittet om samband i det sammanfattande dokumentet. Regeln kan därför inte anses vara en väsentlig del av produktens presentation. Eftersom dessa krav endast gäller nya behållare med en volym på mindre än 0,250 liter, vilka inte var tillåtna innan den aktuella ändringen, kommer den ifrågasatta ändringen inte att inverka negativt på de investeringar i behållare som tappningsföretagen för ”Aceto Balsamico di Modena” redan har gjort och därmed inte att leda till någon ekonomisk förlust för dem. |
|
(18) |
Information om kontrollorganet finns inte angiven i det sammanfattande dokumentet eftersom detta inte krävs enligt bilaga I till kommissionens genomförandeförordning (EU) nr 668/2014 (5). Informationen anges dock i produktspecifikationen i enlighet med artikel 7.1 g i förordning (EU) nr 1151/2012. |
|
(19) |
Vad gäller invändningarna mot att parametrarna för isotopförhållande måste iakttas har dessa införts för att man lättare ska kunna upptäcka eventuella tillsatser i eller eventuell utspädning av vinättikan och för att förbättra kontrollsystemet för ”Aceto Balsamico di Modena”. Kontrollen av isotopförhållandet genomförs i alla händelser i produktionsledet och berör därför bara producenter av ”Aceto Balsamico di Modena”. |
|
(20) |
Den ändring av produktspecifikationen som har offentliggjorts i Europeiska unionens officiella tidning rörande namnet ”Aceto Balsamico di Modena” (SGB) bör därför godkännas. |
|
(21) |
De åtgärder som föreskrivs i denna förordning är förenliga med yttrandet från kommittén för kvalitetspolitik för jordbruksprodukter. |
HÄRIGENOM FÖRESKRIVS FÖLJANDE.
Artikel 1
Den ändring av produktspecifikationen som har offentliggjorts i Europeiska unionens officiella tidning rörande namnet ”Aceto Balsamico di Modena” (SGB) godkänns.
Artikel 2
Denna förordning träder i kraft den tjugonde dagen efter det att den har offentliggjorts i Europeiska unionens officiella tidning.
Denna förordning är till alla delar bindande och direkt tillämplig i alla medlemsstater.
Utfärdad i Bryssel den 2 mars 2023.
På kommissionens vägnar
Ursula VON DER LEYEN
Ordförande
(1) EUT L 343, 14.12.2012, s. 1
(2) EUT C 231, 16.6.2021, s. 11.
(3) Europaparlamentets och rådets förordning (EU) nr 1308/2013 av den 17 december 2013 om upprättande av en samlad marknadsordning för jordbruksprodukter och om upphävande av rådets förordningar (EEG) nr 922/72, (EEG) nr 234/79, (EG) nr 1037/2001 och (EG) nr 1234/2007 (EUT L 347, 20.12.2013, s. 671).
(4) EUT C 152, 6.7.2007, s. 18 och kommissionens förordning (EG) nr 583/2009 av den 3 juli 2009 om registrering av en beteckning i registret över skyddade ursprungsbeteckningar och skyddade geografiska beteckningar (Aceto Balsamico di Modena (SGB)) (EUT L 175, 4.7.2009, s. 7).
(5) Kommissionens genomförandeförordning (EU) nr 668/2014 av den 13 juni 2014 om tillämpningsföreskrifter för Europaparlamentets och rådets förordning (EU) nr 1151/2012 om kvalitetsordningar för jordbruksprodukter och livsmedel (EUT L 179, 19.6.2014, s. 36).
|
9.3.2023 |
SV |
Europeiska unionens officiella tidning |
L 71/8 |
KOMMISSIONENS GENOMFÖRANDEFÖRORDNING (EU) 2023/513
av den 8 mars 2023
om ändring av bilagorna XV och XIX till genomförandeförordning (EU) 2021/404 vad gäller förteckningen över tredjeländer, territorier eller zoner däri från vilka köttprodukter från hov- och klövdjur, fjäderfä och fjädervilt samt ägg och äggprodukter får föras in till unionen
(Text av betydelse för EES)
EUROPEISKA KOMMISSIONEN HAR ANTAGIT DENNA FÖRORDNING
med beaktande av fördraget om Europeiska unionens funktionssätt,
med beaktande av Europaparlamentets och rådets förordning (EU) 2016/429 av den 9 mars 2016 om överförbara djursjukdomar och om ändring och upphävande av vissa akter med avseende på djurhälsa (”djurhälsolag”) (1), särskilt artikel 230.1, och
av följande skäl:
|
(1) |
I förordning (EU) 2016/429, som tillämpas från och med den 21 april 2021, fastställs bland annat djurhälsokrav för införsel till unionen av sändningar av djur, avelsmaterial och produkter av animaliskt ursprung. Ett av dessa djurhälsokrav är att dessa sändningar ska komma från ett tredjeland eller territorium, eller en zon eller anläggningskrets däri, som är upptagen på en förteckning i enlighet med artikel 230.1 i den förordningen. |
|
(2) |
Genom kommissionens delegerade förordning (EU) 2020/692 (2) kompletteras förordning (EU) 2016/429 vad gäller djurhälsokrav för införsel till unionen av sändningar av vissa arter och kategorier av djur, avelsmaterial och produkter av animaliskt ursprung från tredjeländer eller territorier, eller zoner eller anläggningskretsar däri. I delegerad förordning (EU) 2020/692 föreskrivs att sändningar av djur, avelsmaterial och produkter av animaliskt ursprung som omfattas av den delegerade förordningen endast får föras in till unionen om de kommer från ett tredjeland eller territorium, eller en zon eller anläggningskrets däri, som förtecknas för de specifika arterna och kategorierna av djur, det specifika avelsmaterialet och de specifika produkterna av animaliskt ursprung i enlighet med djurhälsokraven i samma delegerade förordning. |
|
(3) |
I kommissionens genomförandeförordning (EU) 2021/404 (3) fastställs förteckningar över tredjeländer eller territorier, eller zoner eller anläggningskretsar däri, från vilka de specifika arterna och kategorierna av djur, det specifika avelsmaterialet och de specifika produkterna av animaliskt ursprung som omfattas av delegerad förordning (EU) 2020/692 får föras in till unionen. Förteckningarna och vissa allmänna bestämmelser avseende förteckningarna anges i bilagorna I–XXII till den genomförandeförordningen. |
|
(4) |
I del 1 i bilaga XV till genomförandeförordning (EU) 2021/404 fastställs en förteckning över tredjeländer, territorier eller zoner däri från vilka köttprodukter från hov- och klövdjur, fjäderfä och fjädervilt får föras in till unionen. I del 1 i bilaga XIX till genomförandeförordning (EU) 2021/404 fastställs en förteckning över tredjeländer, territorier eller zoner däri från vilka sändningar av ägg och äggprodukter får föras in till unionen. |
|
(5) |
Moldavien har till kommissionen lämnat in en ansökan om att få föra in sändningar av köttprodukter från fjäderfä, utom strutsfåglar, och ägg till unionen och lämnade garantier för att landet uppfyller kraven på anmälning och rapportering av de förtecknade sjukdomar som avses i bilaga I till delegerad förordning (EU) 2020/692 och som är relevanta för fjäderfä, och garantier för att landet uppfyller tillämpliga djurhälsokrav i unionen eller lika stränga krav. Mot bakgrund av detta och med beaktande av hälsosituationen för fjäderfä i Moldavien bör det tredjelandet tas upp på förteckningen i del 1 i bilaga XV och i del 1 i bilaga XIX till genomförandeförordning (EU) 2021/404 vad gäller köttprodukter från fjäderfä, utom strutsfåglar, och ägg. |
|
(6) |
Bilagorna XV och XIX till genomförandeförordning (EU) 2021/404 bör därför ändras i enlighet med detta. |
|
(7) |
De åtgärder som föreskrivs i den här förordningen är förenliga med yttrandet från ständiga kommittén för växter, djur, livsmedel och foder. |
HÄRIGENOM FÖRESKRIVS FÖLJANDE.
Artikel 1
Bilagorna XV och XIX till genomförandeförordning (EU) 2021/404 ska ändras i enlighet med bilagan till den här förordningen.
Artikel 2
Denna förordning träder i kraft den tjugonde dagen efter det att den har offentliggjorts i Europeiska unionens officiella tidning.
Denna förordning är till alla delar bindande och direkt tillämplig i alla medlemsstater.
Utfärdad i Bryssel den 8 mars 2023.
På kommissionens vägnar
Ursula VON DER LEYEN
Ordförande
(1) EUT L 84, 31.3.2016, s. 1.
(2) Kommissionens delegerade förordning (EU) 2020/692 av den 30 januari 2020 om komplettering av Europaparlamentets och rådets förordning (EU) 2016/429 vad gäller bestämmelser för införsel till unionen samt förflyttning och hantering efter införsel av sändningar av vissa djur, avelsmaterial och produkter av animaliskt ursprung (EUT L 174, 3.6.2020, s. 379).
(3) Kommissionens genomförandeförordning (EU) 2021/404 av den 24 mars 2021 om fastställande av förteckningar över tredjeländer, territorier eller zoner däri från vilka djur, avelsmaterial och produkter av animaliskt ursprung får föras in till unionen i enlighet med Europaparlamentets och rådets förordning (EU) 2016/429 (EUT L 114, 31.3.2021, s. 1).
BILAGA
Bilagorna XV och XIX till genomförandeförordning (EU) 2021/404 ska ändras på följande sätt:
|
1. |
I del 1 i bilaga XV ska följande post för Moldavien föras in mellan posten för Marocko och posten för Montenegro:
|
|
2. |
I del 1 i bilaga XIX ska posten för Moldavien ersättas med följande:
|
|
9.3.2023 |
SV |
Europeiska unionens officiella tidning |
L 71/11 |
KOMMISSIONENS GENOMFÖRANDEFÖRORDNING (EU) 2023/514
av den 8 mars 2023
om ändring av genomförandeförordning (EU) 2021/405 vad gäller högförädlade produkter, förteckningen över tredjeländer med en godkänd kontrollplan och upptagandet av Moldavien på förteckningen över tredjeländer från vilka sändningar av ägg avsedda att släppas ut på marknaden som ägg av klass A får föras in till unionen
(Text av betydelse för EES)
EUROPEISKA KOMMISSIONEN HAR ANTAGIT DENNA FÖRORDNING
med beaktande av fördraget om Europeiska unionens funktionssätt,
med beaktande av Europaparlamentets och rådets förordning (EU) 2017/625 av den 15 mars 2017 om offentlig kontroll och annan offentlig verksamhet för att säkerställa tillämpningen av livsmedels- och foderlagstiftningen och av bestämmelser om djurs hälsa och djurskydd, växtskydd och växtskyddsmedel samt om ändring av Europaparlamentets och rådets förordningar (EG) nr 999/2001, (EG) nr 396/2005, (EG) nr 1069/2009, (EG) nr 1107/2009, (EU) nr 1151/2012, (EU) nr 652/2014, (EU) 2016/429 och (EU) 2016/2031, rådets förordningar (EG) nr 1/2005 och (EG) nr 1099/2009 och rådets direktiv 98/58/EG, 1999/74/EG, 2007/43/EG, 2008/119/EG och 2008/120/EG och om upphävande av Europaparlamentets och rådets förordningar (EG) nr 854/2004 och (EG) nr 882/2004, rådets direktiv 89/608/EEG, 89/662/EEG, 90/425/EEG, 91/496/EEG, 96/23/EG, 96/93/EG och 97/78/EG samt rådets beslut 92/438/EEG (förordningen om offentlig kontroll) (1), särskilt artikel 127.2, och
av följande skäl:
|
(1) |
Kommissionens delegerade förordning (EU) 2022/2292 (2) kompletterar förordning (EU) 2017/625 och syftar till att säkerställa att sändningar av livsmedelsproducerande djur och vissa varor avsedda att användas som livsmedel från tredjeländer eller regioner i tredjeländer uppfyller vissa unionskrav på livsmedelssäkerhet eller andra krav som konstaterats vara åtminstone likvärdiga. I den delegerade förordningen anges i synnerhet de djur och varor avsedda att användas som livsmedel som omfattas av kravet på att de måste komma från ett tredjeland eller en region i ett tredjeland som ingår i den förteckning som avses i artikel 126.2 a i förordning (EU) 2017/625. |
|
(2) |
I artikel 7 i delegerad förordning (EU) 2022/2292 föreskrivs att vissa sändningar av livsmedelsproducerande djur, produkter av animaliskt ursprung och sammansatta produkter endast får föras in i unionen från ett tredjeland som är upptaget på förteckningen över tredjeländer som är godkända för införsel till unionen av sådana sändningar som är avsedda att användas som livsmedel. |
|
(3) |
I kommissionens genomförandeförordning (EU) 2021/405 (3) fastställs en förteckning över tredjeländer eller regioner i tredjeländer från vilka sändningar av vissa högförädlade produkter avsedda att användas som livsmedel tillåts för införsel till unionen. |
|
(4) |
Efter ändringen (4) nyligen av Europaparlamentets och rådets förordning (EG) nr 853/2004 (5) omfattar högförädlade produkter även fettderivat och aromer som godkänts i enlighet med Europaparlamentets och rådets förordning (EG) nr 1334/2008 (6) och som genomgått behandlingar som eliminerar eventuella risker för människors och djurs hälsa. Genomförandeförordning (EU) 2021/405 bör ändras så att den överensstämmer med denna ändring. |
|
(5) |
Azerbajdzjan har lämnat in en kontrollplan som omfattar rom och mjölke samt kaviar. Planen ger tillräckliga garantier och bör därför godkännas. |
|
(6) |
Libanon har lämnat in en kontrollplan som omfattar honung. Planen ger tillräckliga garantier och bör därför godkännas. |
|
(7) |
Isle of Man förtecknas i tabellen i bilaga -I till genomförandeförordning (EU) 2021/405 för sin export till unionen av får- och getkött. Isle of Man har emellertid meddelat kommissionen att ön inte längre är intresserad av att exportera getkött till unionen. Posten för Isle of Man när det gäller får- och getkött i den tabellen i bilaga -I till genomförandeförordning (EU) 2021/405 bör därför enbart omfatta fårkött. |
|
(8) |
Japan förtecknas i tabellen i bilaga -I till genomförandeförordning (EU) 2021/405 för sin export till unionen av svinkött. Japan har emellertid meddelat kommissionen att landet inte längre är intresserat av att lämna in en kontrollplan för svinkött utan landet ämnar endast använda svinkött som har sitt ursprung i medlemsstater eller tredjeländer från vilka sådana produkter får föras in till unionen. Posten för Japan när det gäller svinkött bör därför anpassas i enlighet med detta i bilaga -I till genomförandeförordning (EU) 2021/405. |
|
(9) |
Förenade kungariket förtecknas i tabellen i bilaga -I till genomförandeförordning (EU) 2021/405 för sin export till unionen av kaninkött. Förenade kungariket har emellertid meddelat kommissionen att landet inte längre är intresserat av att lämna in en kontrollplan för kaninkött utan landet ämnar endast använda kaninkött som har sitt ursprung i medlemsstater eller tredjeländer från vilka sådana produkter får föras in till unionen. Posten för Förenade kungariket när det gäller kaninkött bör därför anpassas i enlighet med detta i bilaga -I till genomförandeförordning (EU) 2021/405. |
|
(10) |
Thailand har inte lämnat in någon kontrollplan till kommissionen för mjölk. Thailand har emellertid lämnat garantier att landet endast ämnar använda mjölk som har sitt ursprung i medlemsstater eller tredjeländer från vilka mjölk får föras in till unionen. Landet har också informerat kommissionen om att mjölk som ska exporteras till unionen inte kommer att begränsas till sammansatta produkter som innehåller bearbetade mjölkprodukter. Posten för Thailand när det gäller mjölk bör därför anpassas i enlighet med detta i bilaga -I till genomförandeförordning (EU) 2021/405. |
|
(11) |
Förenta staterna har lämnat in en kontrollplan som omfattar fjälster. Planen ger tillräckliga garantier och bör därför godkännas. |
|
(12) |
Rwanda förtecknas för närvarande i tabellen i bilaga -I till genomförandeförordning (EU) 2021/405 för honung, och Colombia och Syrien förtecknas för fjälster. Eftersom dessa tredjeländer inte har lämnat in några planer avseende respektive produkt till kommissionen bör dessa poster strykas från tabellen i den bilagan. |
|
(13) |
Moldavien lämnade in ett program för bekämpning av salmonella i flockar av värphöns för att få föra in ägg av klass A till unionen i enlighet med artikel 7 i genomförandeförordning (EU) 2021/405. Kommissionen har bedömt bekämpningsprogrammet och anser att det är tillräckligt. Efterlevnaden av kraven på bekämpning av salmonella i enlighet med artikel 10.6 i Europaparlamentets och rådets förordning (EG) nr 2160/2003 (7) dubbelkontrollerades under den revision som kommissionen gjorde i april 2022 (8). Moldavien bör därför få föra in ägg av klass A till unionen. |
|
(14) |
Genomförandeförordning (EU) 2021/405 bör därför ändras i enlighet med detta. |
|
(15) |
De åtgärder som föreskrivs i den här förordningen är förenliga med yttrandet från ständiga kommittén för växter, djur, livsmedel och foder. |
HÄRIGENOM FÖRESKRIVS FÖLJANDE.
Artikel 1
Ändringar av genomförandeförordning (EU) 2021/405
Genomförandeförordning (EU) 2021/405 ska ändras på följande sätt:
|
1. |
I artikel 22 ska inledningsfrasen ersättas med följande: ”Sändningar av högförädlade produkter enligt avsnitt XVI i bilaga III till förordning (EG) nr 853/2004 avsedda att användas som livsmedel får endast föras in till unionen om de kommer från följande tredjeländer eller regioner i tredjeländer:” |
|
2. |
Bilaga -I ska ersättas med texten i bilaga I till denna förordning. |
|
3. |
Bilaga IV ska ersättas med texten i bilaga II till denna förordning. |
Artikel 2
Ikraftträdande och tillämpning
Denna förordning träder i kraft den tjugonde dagen efter det att den har offentliggjorts i Europeiska unionens officiella tidning.
Denna förordning är till alla delar bindande och direkt tillämplig i alla medlemsstater.
Utfärdad i Bryssel den 8 mars 2023.
På kommissionens vägnar
Ursula VON DER LEYEN
Ordförande
(2) Kommissionens delegerade förordning (EU) 2022/2292 av den 6 september 2022 om komplettering av Europaparlamentets och rådets förordning (EU) 2017/625 vad gäller krav för införsel till unionen av sändningar av livsmedelsproducerande djur och vissa varor avsedda att användas som livsmedel (EUT L 304, 24.11.2022, s. 1).
(3) Kommissionens genomförandeförordning (EU) 2021/405 av den 24 mars 2021 om fastställande av förteckningar över tredjeländer eller regioner i tredjeländer från vilka det i enlighet med Europaparlamentets och rådets förordning (EU) 2017/625 är tillåtet att föra in vissa djur och varor avsedda att användas som livsmedel till unionen (EUT L 114, 31.3.2021, s. 118).
(4) Kommissionens delegerade förordning (EU) 2022/2258 av den 9 september 2022 om ändring och rättelse av bilaga III till Europaparlamentets och rådets förordning (EG) nr 853/2004 om särskilda hygienkrav för livsmedel av animaliskt ursprung vad gäller fiskeriprodukter, ägg och vissa högförädlade produkter samt om ändring av kommissionens delegerade förordning (EU) 2019/624 vad gäller vissa musslor (EUT L 299, 18.11.2022, s. 5).
(5) Europaparlamentets och rådets förordning (EG) nr 853/2004 av den 29 april 2004 om fastställande av särskilda hygienregler för livsmedel av animaliskt ursprung (EUT L 139, 30.4.2004, s. 55).
(6) Europaparlamentets och rådets förordning (EG) nr 1334/2008 av den 16 december 2008 om aromer och vissa livsmedelsingredienser med aromgivande egenskaper för användning i och på livsmedel och om ändring av rådets förordning (EEG) nr 1601/91, förordningarna (EG) nr 2232/96 och (EG) nr 110/2008 samt direktiv 2000/13/EG (EUT L 354, 31.12.2008, s. 34).
(7) Europaparlamentets och rådets förordning (EG) nr 2160/2003 av den 17 november 2003 om bekämpning av salmonella och vissa andra livsmedelsburna zoonotiska smittämnen (EUT L 325, 12.12.2003, s. 1).
(8) DG(SANTE)2021–7268 – den slutliga rapporten finns på https://ec.europa.eu/food/audits-analysis/audit-report/details/4533.
BILAGA I
Bilaga -I till genomförandeförordning (EU) 2021/405 ska ersättas med följande:
”BILAGA -I
Förteckning över tredjeländer eller regioner i tredjeländer med godkända kontrollplaner för vissa livsmedelsproducerande djur och produkter av animaliskt ursprung avsedda att användas som livsmedel enligt artikel 2a, artikel 3, artikel 6 första stycket, artikel 7 första stycket, artikel 10 andra stycket, artiklarna 11, 15, 16, 21 samt 25 a och c
|
ISO-kod |
Tredjeland (1) eller regioner i ett tredjeland |
Nötkreatur |
Får/get |
Svin |
Hästdjur |
Fjäderfä |
Vattenbruk (17) |
Mjölk |
Ägg |
Kanin |
Frilevande vilt |
Hägnat vilt |
Honung |
Fjälster |
|
AD |
Andorra |
X |
X |
Δ |
X |
|
P |
|
|
|
|
|
X |
|
|
AE |
Förenade Arabemiraten |
|
|
|
|
|
Δ P |
X (2) O |
O |
|
|
|
X (3) |
|
|
AL |
Albanien |
|
X |
|
|
|
X (14) P |
O |
X |
|
|
|
|
X |
|
AM |
Armenien |
|
|
|
|
|
X (14) P |
O |
O |
|
|
|
X |
|
|
AR |
Argentina |
X |
X |
|
X |
X |
X (14) P |
X |
X |
X |
X |
X |
X |
X |
|
AU |
Australien |
X |
X |
|
X |
|
X M |
X |
X |
|
X |
X |
X |
X |
|
AZE |
Azerbajdzjan |
|
|
|
|
|
X (16) P |
|
|
|
|
|
|
|
|
BA |
Bosnien och Hercegovina |
X |
X |
X |
|
X |
X (14) P |
X |
X |
|
|
|
X |
|
|
BD |
Bangladesh |
|
|
|
|
|
X P |
O |
O |
|
|
|
|
|
|
BF |
Burkina Faso |
|
|
|
|
|
|
|
|
|
|
|
X |
|
|
BJ |
Benin |
|
|
|
|
|
|
|
|
|
|
|
X |
|
|
BN |
Brunei |
|
|
|
|
|
X (15) P |
O |
O |
|
|
|
|
|
|
BR |
Brasilien |
X |
|
|
X |
X |
X P |
O |
O |
|
|
|
X |
X |
|
BW |
Botswana |
X |
|
|
|
|
P |
|
|
|
|
|
|
|
|
BY |
Belarus |
|
|
|
X (8) |
|
X (14) P |
X |
X |
|
|
|
X |
X |
|
BZ |
Belize |
|
|
|
|
|
X (15) P |
O |
O |
|
|
|
|
|
|
CA |
Kanada |
X |
X |
X |
X |
X |
X M |
X |
X |
X |
X |
X |
X |
|
|
CH |
Schweiz (7) |
X |
X |
X |
X |
X |
X (14) M |
X |
X |
X |
X |
X |
X |
X |
|
CL |
Chile |
X |
X5 |
X |
|
X |
X (14) M |
X |
O |
|
X |
|
X |
X |
|
CM |
Kamerun |
|
|
|
|
|
|
|
|
|
|
|
X |
|
|
CN |
Kina |
|
|
|
|
X |
X P |
O |
X |
X |
|
|
X |
X |
|
CO |
Colombia |
|
|
|
|
|
X P |
X |
Δ |
|
|
|
|
|
|
CR |
Costa Rica |
|
|
|
|
|
X P |
O |
O |
|
|
|
|
|
|
CU |
Kuba |
|
|
|
|
|
X (15) P |
O |
O |
|
|
|
X |
|
|
DO |
Dominikanska republiken |
|
|
|
|
|
|
|
|
|
|
|
X |
|
|
EC |
Ecuador |
|
|
|
|
|
X P |
O |
O |
|
|
|
|
|
|
EG |
Egypten |
|
|
|
|
|
|
|
|
|
|
|
|
X |
|
ET |
Etiopien |
|
|
|
|
|
|
|
|
|
|
|
X |
|
|
FK |
Falklandsöarna |
X |
X (5) |
|
|
|
X (14) P |
O |
O |
|
|
|
|
|
|
FO |
Färöarna |
|
|
|
|
|
X (14) P |
O |
O |
|
|
|
|
|
|
GB |
Förenade kungariket (6) |
X |
X |
X |
X |
X |
X (14) Δ M |
X |
X |
Δ |
X |
X |
X |
X |
|
GE |
Georgien |
|
|
|
|
|
|
|
|
|
|
|
X |
|
|
GG |
Guernsey |
|
|
|
|
|
O M |
X |
O |
|
|
|
|
|
|
GL |
Grönland |
|
X (5) |
|
|
|
M |
|
|
|
|
X |
|
|
|
GT |
Guatemala |
|
|
|
|
|
X (15) P |
O |
O |
|
|
|
X |
|
|
HK |
Hongkong |
|
|
|
|
|
Δ P |
|
Δ |
|
|
|
|
|
|
HN |
Honduras |
|
|
|
|
|
X P |
O |
O |
|
|
|
|
|
|
ID |
Indonesien |
|
|
|
|
|
X P |
O |
O |
|
|
|
|
|
|
IL |
Israel (4) |
|
|
|
|
X |
X (14) P |
X |
X |
|
|
|
X |
|
|
IM |
Isle of Man |
X |
X (5) |
X |
|
|
X (14) M |
X |
O |
|
|
|
X |
|
|
IN |
Indien |
|
|
|
|
O |
X P |
O |
X |
|
|
|
X |
X |
|
IR |
Iran |
|
|
|
|
|
X (15) X (16) P |
O |
O |
|
|
|
|
X |
|
JE |
Jersey |
X |
|
|
|
|
M |
X |
O |
|
|
|
|
|
|
JM |
Jamaica |
|
|
|
|
|
M |
|
|
|
|
|
X |
|
|
JP |
Japan |
X |
|
Δ |
|
X |
X (14) M |
X |
X |
|
|
|
Δ |
X |
|
KE |
Kenya |
|
|
|
|
|
X (14) P |
O |
O |
|
|
|
|
|
|
KR |
Sydkorea |
|
|
|
|
X |
X M |
O |
O |
|
|
|
Δ |
|
|
LB |
Libanon |
|
|
|
|
|
|
|
|
|
|
|
X |
X |
|
LK |
Sri Lanka |
|
|
|
|
|
X P |
O |
O |
|
|
|
|
|
|
MA |
Marocko |
|
|
|
|
X |
X (14) Δ M |
O |
O |
|
|
|
|
X |
|
MD |
Moldavien |
|
|
|
|
X |
X (14) P |
X |
X |
|
|
|
X |
|
|
ME |
Montenegro |
X |
X (5) |
X |
|
X |
X (14) P |
X |
X |
|
|
|
X |
|
|
MG |
Madagaskar |
|
|
|
|
|
X P |
O |
O |
|
|
|
X |
|
|
MK |
Nordmakedonien |
X |
X |
X |
|
X |
X (14) P |
X |
X |
|
X |
|
X |
|
|
MM |
Myanmar/Burma |
|
|
|
|
|
X P |
O |
O |
|
|
|
X |
|
|
MN |
Mongoliet |
|
|
|
|
|
|
|
|
|
|
|
|
X |
|
MU |
Mauritius |
|
|
|
|
|
X (14) P |
O |
O |
|
|
|
Δ |
|
|
MX |
Mexiko |
|
|
Δ |
|
|
X P |
O |
X |
|
|
|
X |
|
|
MY |
Malaysia |
|
|
|
|
Δ |
X P |
O |
O |
|
|
|
|
|
|
MZ |
Moçambique |
|
|
|
|
|
X (15) P |
O |
O |
|
|
|
|
|
|
NA |
Namibia |
X |
X (5) |
|
|
|
P |
|
|
|
X |
|
|
|
|
NC |
Nya Kaledonien |
|
|
|
|
|
X (15) P |
O |
O |
|
|
X |
X |
|
|
NG |
Nigeria |
|
|
|
|
|
X (15) P |
O |
O |
|
|
|
|
|
|
NI |
Nicaragua |
|
|
|
|
|
X (15) P |
O |
O |
|
|
|
X |
|
|
NZ |
Nya Zeeland |
X |
X |
O |
X |
O |
X (14) M |
X |
O |
O |
X |
X |
X |
X |
|
PA |
Panama |
|
|
|
|
|
X P |
O |
O |
|
|
|
|
|
|
PE |
Peru |
|
|
|
|
|
X M |
O |
O |
|
|
|
|
|
|
PH |
Filippinerna |
|
|
|
|
|
X P |
O |
O |
|
|
|
|
|
|
PK |
Pakistan |
|
|
|
|
|
|
|
|
|
|
|
|
X |
|
PM |
Saint-Pierre-et-Miquelon |
|
|
|
|
X |
P |
|
|
|
|
|
|
|
|
PN |
Pitcairnöarna |
|
|
|
|
|
|
|
|
|
|
|
X |
|
|
PY |
Paraguay |
X |
|
|
|
|
P |
|
|
|
|
|
|
X |
|
RS |
Serbien |
X |
X |
X |
X (8) |
X |
X (14) P |
X |
X |
X |
X |
|
X |
X |
|
RU |
Ryssland |
X |
X |
X |
|
X |
O P |
X |
X |
|
|
X (9) |
X |
X |
|
RW |
Rwanda |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
SA |
Saudiarabien |
|
|
|
|
|
X P |
O |
O |
|
|
|
|
|
|
SG |
Singapore |
Δ |
Δ |
Δ |
X (10) |
Δ |
X (14) P |
Δ |
Δ |
|
X (10) |
X (10) |
|
|
|
SM |
San Marino |
X |
|
Δ |
|
|
O P |
X |
O |
|
|
|
X |
|
|
SV |
El Salvador |
|
|
|
|
|
|
|
|
|
|
|
X |
|
|
SY |
Syrien |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
SZ |
Eswatini |
X |
|
|
|
|
P |
|
|
|
|
|
|
|
|
TG |
Togo |
|
|
|
|
|
|
|
|
|
|
|
X |
|
|
TH |
Thailand |
O |
|
O |
|
X |
X M |
Δ |
Δ |
|
|
|
X |
|
|
TN |
Tunisien |
|
|
|
|
|
X (14) M |
O |
O |
|
|
|
|
X |
|
TR |
Turkiet |
|
|
|
|
X |
X (14) M |
X |
X |
|
|
|
X |
X |
|
TW |
Taiwan |
|
|
|
|
|
X P |
O |
X |
|
|
|
X |
|
|
TZ |
Tanzania |
|
|
|
|
|
X (15) P |
O |
O |
|
|
|
X |
|
|
UA |
Ukraina |
X |
|
X |
|
X |
X (14) M |
X |
X |
X |
|
|
X |
X |
|
UG |
Uganda |
|
|
|
|
|
|
|
|
|
|
|
X |
|
|
US |
Förenta staterna |
X |
X (11) |
X |
|
X |
X M |
X |
X |
X |
X |
X |
X |
X |
|
UY |
Uruguay |
X |
X |
|
X |
|
X (14) M |
X |
O |
|
X |
|
X |
X |
|
UZ |
Uzbekistan |
|
|
|
|
|
|
|
|
|
|
|
|
X |
|
VE |
Venezuela |
|
|
|
|
|
X (15) P |
O |
O |
|
|
|
|
|
|
VN |
Vietnam |
|
|
|
|
|
X M |
O |
O |
|
|
|
X |
|
|
WF |
Wallis och Futuna |
|
|
|
|
|
|
|
|
|
|
|
X |
|
|
XK |
Kosovo (12) |
|
|
|
|
Δ |
|
|
|
|
|
|
|
|
|
ZA |
Sydafrika |
|
|
|
|
|
P |
|
|
|
X |
X (13) |
|
|
|
ZM |
Zambia |
|
|
|
|
|
|
|
|
|
|
|
X |
|
(1) Förteckning över tredjeländer och territorier. Den innehåller inte enbart tredjeländer som erkänts av unionen.
(2) Endast kamelmjölk.
(3) Endast regionen Ras al Khaimah.
(4) I det följande avses staten Israel, med undantag för de territorier som står under israelisk förvaltning sedan den 5 juni 1967, nämligen Golanhöjderna, Gazaremsan, östra Jerusalem och övriga Västbanken.
(5) Endast får.
(6) I enlighet med avtalet om Förenade konungariket Storbritannien och Nordirlands utträde ur Europeiska unionen och Europeiska atomenergigemenskapen, särskilt artikel 5.4 i protokollet om Irland/Nordirland jämförd med bilaga 2 till det protokollet, ska hänvisningar till Förenade kungariket vid tillämpningen av denna bilaga inte omfatta Nordirland.
(7) I enlighet med avtalet av den 21 juni 1999 mellan Europeiska gemenskapen och Schweiziska edsförbundet om handel med jordbruksprodukter (EGT L 114, 30.4.2002, s. 132).
(8) Export till unionen av levande hästdjur avsedda för slakt (endast livsmedelsproducerande djur).
(9) Endast renar.
(10) Endast för sändningar av färskt kött som har sitt ursprung i Nya Zeeland, som är avsett för unionen och som lossas och eventuellt lagras i Singapore samt omlastas i en godkänd anläggning under transiteringen genom Singapore.
(11) Endast getter.
(12) Denna beteckning påverkar inte ståndpunkter om Kosovos status och är i överensstämmelse med FN:s säkerhetsråds resolution 1244/1999 och med Internationella domstolens utlåtande om Kosovos självständighetsförklaring.
(13) Endast ratiter.
(14) Endast fisk.
(15) Endast kräftdjur.
(16) Endast rom och mjölke samt kaviar.
(17) Vattenbruk omfattar fisk, inklusive ål, och produkter från fisk (t.ex. rom och mjölke, kaviar) samt kräftdjur. De tredjeländer eller regioner i tredjeländer som förtecknas för levande, kylda, frysta eller bearbetade musslor, tagghudingar, manteldjur och marina snäckor i bilaga VIII ska markeras med ”M” i denna kolumn.
BILAGA II
Bilaga IV till genomförandeförordning (EU) 2021/405 ska ersättas med följande:
”BILAGA IV
Förteckning över tredjeländer från vilka sändningar av ägg avsedda att släppas ut på marknaden som ägg av klass A får föras in till unionen, enligt artikel 7 andra stycket
|
ISO-KOD |
TREDJELAND |
ANMÄRKNINGAR |
|
CH |
Schweiz (1) |
|
|
GB |
Förenade kungariket (2) |
|
|
JP |
Japan |
|
|
MD |
Moldavien |
|
|
MK |
Nordmakedonien |
|
|
UA |
Ukraina |
|
(1) I enlighet med avtalet av den 21 juni 1999 mellan Europeiska gemenskapen och Schweiziska edsförbundet om handel med jordbruksprodukter (EGT L 114, 30.4.2002, s. 132).
(2) I enlighet med avtalet om Förenade konungariket Storbritannien och Nordirlands utträde ur Europeiska unionen och Europeiska atomenergigemenskapen, särskilt artikel 5.4 i protokollet om Irland/Nordirland jämförd med bilaga 2 till det protokollet, ska hänvisningar till Förenade kungariket vid tillämpningen av den här bilagan inte omfatta Nordirland.”
|
9.3.2023 |
SV |
Europeiska unionens officiella tidning |
L 71/22 |
KOMMISSIONENS GENOMFÖRANDEFÖRORDNING (EU) 2023/515
av den 8 mars 2023
om förnyelse av godkännandet av det verksamma ämnet abamektin i enlighet med Europaparlamentets och rådets förordning (EG) nr 1107/2009 och om ändring av kommissionens genomförandeförordning (EU) nr 540/2011
(Text av betydelse för EES)
EUROPEISKA KOMMISSIONEN HAR ANTAGIT DENNA FÖRORDNING
med beaktande av fördraget om Europeiska unionens funktionssätt,
med beaktande av Europaparlamentets och rådets förordning (EG) nr 1107/2009 av den 21 oktober 2009 om utsläppande av växtskyddsmedel på marknaden och om upphävande av rådets direktiv 79/117/EEG och 91/414/EEG (1), särskilt artikel 20.1, och
av följande skäl:
|
(1) |
Genom kommissionens direktiv 2008/107/EG (2) togs abamektin upp som verksamt ämne i bilaga I till rådets direktiv 91/414/EEG (3). |
|
(2) |
Verksamma ämnen som har tagits upp i bilaga I till direktiv 91/414/EEG anses vara godkända enligt förordning (EG) nr 1107/2009 och de förtecknas i del A i bilagan till kommissionens genomförandeförordning (EU) nr 540/2011 (4). |
|
(3) |
Godkännandet av det verksamma ämnet abamektin enligt del A i bilagan till genomförandeförordning (EU) nr 540/2011 löper ut den 30 april 2023. |
|
(4) |
En ansökan om förnyelse av godkännandet av det verksamma ämnet abamektin lämnades in till Österrike, den rapporterande medlemsstaten, och Malta, den medrapporterande medlemsstaten, i enlighet med artikel 1 i kommissionens genomförandeförordning (EU) nr 844/2012 (5) inom den tidsfrist som föreskrivs i den artikeln. |
|
(5) |
Sökanden lämnade in de kompletterande dokumenten till den rapporterande medlemsstaten, den medrapporterande medlemsstaten, kommissionen och Europeiska myndigheten för livsmedelssäkerhet (livsmedelsmyndigheten) i enlighet med artikel 6 i genomförandeförordning (EU) nr 844/2012. Den rapporterande medlemsstaten konstaterade att ansökan var fullständig. |
|
(6) |
Den rapporterande medlemsstaten utarbetade ett utkast till bedömningsrapport om förnyelse i samråd med den medrapporterande medlemsstaten och överlämnade det till livsmedelsmyndigheten och kommissionen den 17 april 2019. I utkastet till bedömningsrapport om förnyelse föreslog den rapporterande medlemsstaten att godkännandet av abamektin skulle förnyas. |
|
(7) |
Livsmedelsmyndigheten skickade utkastet till bedömningsrapport om förnyelse till sökanden och medlemsstaterna för synpunkter, och vidarebefordrade därefter de mottagna synpunkterna till kommissionen. Livsmedelsmyndigheten gjorde även den kompletterande sammanfattningen tillgänglig för allmänheten. |
|
(8) |
Den 15 juli 2020 meddelade livsmedelsmyndigheten kommissionen sin slutsats (6) om huruvida abamektin kan förväntas uppfylla kriterierna för godkännande i artikel 4 i förordning (EG) nr 1107/2009. Livsmedelsmyndigheten identifierade ett antal frågor som inte kunde slutföras. Framför allt identifierades risker vad gäller fåglar och däggdjur, vattenlevande organismer och marklevande makroorganismer. |
|
(9) |
Den 1 februari 2022 gav kommissionen livsmedelsmyndigheten i uppdrag att se över exponerings- och riskbedömningarna vad gäller fåglar och däggdjur, vattenlevande organismer och marklevande makroorganismer. Livsmedelsmyndigheten skickade en uppdaterad slutsats till kommissionen den 27 juli 2022 (7). I sin uppdaterade slutsats bekräftade livsmedelsmyndigheten de risker som identifierats i den föregående bedömningen. |
|
(10) |
Kommissionen lade fram en förnyelserapport och ett utkast till förordning avseende abamektin för ständiga kommittén för växter, djur, livsmedel och foder den 25 mars 2021 och reviderade versioner av de två dokumenten den 8 december 2022 för att beakta livsmedelsmyndighetens uppdaterade slutsatser. |
|
(11) |
Kommissionen uppmanade sökanden att lämna synpunkter på livsmedelsmyndighetens slutsats och, i enlighet med artikel 14.1 tredje stycket i genomförandeförordning (EU) nr 844/2012, på förnyelserapporten. Sökanden lämnade synpunkter på båda versionerna av förnyelserapporten, och dessa har granskats omsorgsfullt. |
|
(12) |
Det har konstaterats att kriterierna för godkännande i artikel 4 i förordning (EG) nr 1107/2009 är uppfyllda med avseende på ett eller flera representativa användningsområden för minst ett växtskyddsmedel som innehåller abamektin. |
|
(13) |
Riskbedömningen i samband med förnyelsen av godkännandet av det verksamma ämnet abamektin grundar sig på representativ användning som en insekticid och akaricid för skyddade grödor. Även om det mot bakgrund av denna riskbedömning inte är nödvändigt att bibehålla begränsningen till användning endast som insekticid och akaricid är det nödvändigt att, i enlighet med artikel 14.1 i förordning (EG) nr 1107/2009 jämförd med artikel 6 i samma förordning och mot bakgrund av aktuella vetenskapliga och tekniska rön, föreskriva vissa villkor och begränsningar. Framför allt bör användningen av växtskyddsmedel innehållande abamektin begränsas till användningsområden som möjliggör kontrollerat utbyte av material och energi med omgivningen, för att förhindra utsläpp av växtskyddsmedel i miljön och minska den höga risk som identifierats för vattenlevande organismer och vilda landlevande organismer som inte är målarter. Användning i fasta växthus får därför godkännas. |
|
(14) |
Genomförandeförordning (EU) nr 540/2011 bör därför ändras i enlighet med detta. |
|
(15) |
Genom kommissionens genomförandeförordning (EU) 2022/378 (8) förlängdes godkännandeperioden för abamektin till den 30 april 2023 så att förnyelseförfarandet hinner slutföras innan godkännandeperioden för det verksamma ämnet löper ut. Eftersom ett beslut om förnyelse har fattats innan den förlängda godkännandeperioden löper ut, och med hänsyn till att det nuvarande godkännandet av abamektin löper ut den 30 april 2023, bör den här förordningen träda i kraft så snart som möjligt och tillämpas tidigare än det datumet. |
|
(16) |
De åtgärder som föreskrivs i denna förordning är förenliga med yttrandet från ständiga kommittén för växter, djur, livsmedel och foder. |
HÄRIGENOM FÖRESKRIVS FÖLJANDE.
Artikel 1
Förnyelse av godkännandet av det verksamma ämnet
Godkännandet av det verksamma ämnet abamektin enligt specifikationen i bilaga I förnyas under förutsättning att de villkor som anges i den bilagan uppfylls.
Artikel 2
Ändringar av genomförandeförordning (EU) nr 540/2011
Bilagan till genomförandeförordning (EU) nr 540/2011 ska ändras i enlighet med bilaga II till den här förordningen.
Artikel 3
Ikraftträdande och tillämpningsdatum
Denna förordning träder i kraft den tredje dagen efter det att den har offentliggjorts i Europeiska unionens officiella tidning.
Den ska tillämpas från och med den 1 april 2023.
Denna förordning är till alla delar bindande och direkt tillämplig i alla medlemsstater.
Utfärdad i Bryssel den 8 mars 2023.
På kommissionens vägnar
Ursula VON DER LEYEN
Ordförande
(1) EUT L 309, 24.11.2009, s. 1.
(2) Kommissionens direktiv 2008/107/EG av den 25 november 2008 om ändring av rådets direktiv 91/414/EEG för att ta upp abamektin, epoxikonazol, fenpropimorf, fenpyroximat och tralkoxydim som verksamma ämnen (EUT L 316, 26.11.2008, s. 4).
(3) Rådets direktiv 91/414/EEG av den 15 juli 1991 om utsläppande av växtskyddsmedel på marknaden (EGT L 230, 19.8.1991, s. 1).
(4) Kommissionens genomförandeförordning (EU) nr 540/2011 av den 25 maj 2011 om tillämpning av Europaparlamentets och rådets förordning (EG) nr 1107/2009 vad gäller förteckningen över godkända verksamma ämnen (EUT L 153, 11.6.2011, s. 1).
(5) Kommissionens genomförandeförordning (EU) nr 844/2012 av den 18 september 2012 om fastställande av de bestämmelser som behövs för att genomföra förnyelseförfarandet för verksamma ämnen enligt Europaparlamentets och rådets förordning (EG) nr 1107/2009 om utsläppande av växtskyddsmedel på marknaden (EUT L 252, 19.9.2012, s. 26).
(6) EFSA Journal, vol. 18(2020):8, artikelnr 6227. Tillgänglig på (www.efsa.europa.eu).
(7) EFSA Journal, vol. 20(2022):8, artikelnr 7544. Tillgänglig på (www.efsa.europa.eu).
(8) Kommissionens genomförandeförordning (EU) 2022/378 av den 4 mars 2022 om ändring av genomförandeförordning (EU) nr 540/2011 vad gäller förlängning av godkännandeperioderna för de verksamma ämnena abamektin, Bacillus subtilis (Cohn 1872) stam QST 713, Bacillus thuringiensis subsp. aizawai stammarna ABTS-1857 och GC-91, Bacillus thuringiensis subsp. israeliensis (serotyp H-14) stam AM65-52, Bacillus thuringiensis subsp. kurstaki stammarna ABTS 351, PB 54, SA 11, SA 12 och EG 2348, Beauveria bassiana stammarna ATCC 74040 och GHA, klodinafop, Cydia pomonella granulovirus (CpGV), cyprodinil, diklorprop-P, fenpyroximat, fosetyl, malation, mepanipyrim, metkonazol, metrafenon, pirimikarb, Pseudomonas chlororaphis stam MA342, pyrimetanil, Pythium oligandrum M1, rimsulfuron, spinosad, Trichoderma asperellum (tidigare T. harzianum) stammarna ICC012, T25 och TV1, Trichoderma atroviride (tidigare T. harzianum) stam T11, Trichoderma gamsii (tidigare T. viride) stam ICC080, Trichoderma harzianum stammarna T-22 och ITEM 908, triklopyr, trinexapak, tritikonazol och ziram (EUT L 72, 7.3.2022, s. 2).
BILAGA I
|
Trivialnamn, identifikationsnummer |
Namn enligt IUPAC |
Renhetsgrad (1) |
Datum för godkännande |
Godkännande till och med |
Särskilda bestämmelser |
||||
|
Abamektin CAS-nr 71751-41-2 Avermektin B1a CAS-nr 65195-55-3 Avermektin B1b CAS-nr 65195-56-4 Abamektin CIPAC-nr 495 |
Avermektin B1a (10E,14E,16E)-(1R,4S,5′S,6S,6′R,8R,12S,13S,20R,21R,24S)-6′-[(S)-sek-butyl]-21,24-dihydroxi-5′,11,13,22-tetrametyl-2-oxo-(3,7,19-trioxatetracyklo[15.6.1.14,8020,24]pentakosa-10,14,16,22-tetraen)-6-spiro-2′-(5′,6′-dihydro-2′H-pyran)-12-yl 2,6-dideoxi-4-O-(2,6-dideoxi-3-O-metyl-α-L-arabino-hexopyranosyl)-3-O-metyl-α-L-arabino-hexopyranosid Avermektin B1b (10E,14E,16E)-(1R,4S,5′S,6S,6′R,8R,12S,13S,20R,21R,24S)-21,24-dihydroxi-6′-isopropyl-5′,11,13,22-tetrametyl-2-oxo-(3,7,19-trioxatetracyklo[15.6.1.14,8020,24]pentakosa-10,14,16,22-tetraen)-6-spiro-2′-(5′,6′-dihydro-2′H-pyran)-12-yl 2,6-dideoxi-4-O-(2,6-dideoxi-3-O-metyl-α-L-arabino-hexopyranosyl)-3-O-metyl-α-L-arabino-hexopyranosid |
≥ 850 g/kg abamektin (summan av avermektin B1a och avermektin B1b), minst 800 g/kg avermektin B1a och högst 200 g/kg avermektin B1b |
1 april 2023 |
31 mars 2038 |
Får endast godkännas för användning som möjliggör kontrollerat utbyte av material och energi med omgivningen och som förhindrar utsläpp av växtskyddsmedel i miljön, särskilt användning i fasta växthus. Vid tillämpningen av de enhetliga principer som avses i artikel 29.6 i förordning (EG) nr 1107/2009 ska hänsyn tas till slutsatserna i förnyelserapporten om abamektin, särskilt tilläggen I och II. Vid den samlade bedömningen ska medlemsstaterna vara särskilt uppmärksamma på följande:
|
(1) Ytterligare uppgifter om det verksamma ämnets identitet och specifikation finns i förnyelserapporten.
BILAGA II
Bilagan till genomförandeförordning (EU) nr 540/2011 ska ändras på följande sätt:
|
(1) |
I del A ska post 210 om Abamektin utgå. |
|
(2) |
I del B ska följande post läggas till:
|
(1) Ytterligare uppgifter om det verksamma ämnets identitet och specifikation finns i förnyelserapporten.
|
9.3.2023 |
SV |
Europeiska unionens officiella tidning |
L 71/27 |
KOMMISSIONENS GENOMFÖRANDEFÖRORDNING (EU) 2023/516
av den 8 mars 2023
om ändring av genomförandeförordning (EU) 2020/2236 vad gäller förlagan till djurhälsointyg för införsel till unionen av sändningar av vattenlevande djur avsedda för vissa vattenbruksanläggningar, utsättning i naturen eller andra ändamål, utom för direkt användning som livsmedel
(Text av betydelse för EES)
EUROPEISKA KOMMISSIONEN HAR ANTAGIT DENNA FÖRORDNING
med beaktande av fördraget om Europeiska unionens funktionssätt,
med beaktande av Europaparlamentets och rådets förordning (EU) 2016/429 av den 9 mars 2016 om överförbara djursjukdomar och om ändring och upphävande av vissa akter med avseende på djurhälsa (”djurhälsolag”) (1), särskilt artikel 238.3 a och c,
med beaktande av Europaparlamentets och rådets förordning (EU) 2017/625 av den 15 mars 2017 om offentlig kontroll och annan offentlig verksamhet för att säkerställa tillämpningen av livsmedels- och foderlagstiftningen och av bestämmelser om djurs hälsa och djurskydd, växtskydd och växtskyddsmedel samt om ändring av Europaparlamentets och rådets förordningar (EG) nr 999/2001, (EG) nr 396/2005, (EG) nr 1069/2009, (EG) nr 1107/2009, (EU) nr 1151/2012, (EU) nr 652/2014, (EU) 2016/429 och (EU) 2016/2031, rådets förordningar (EG) nr 1/2005 och (EG) nr 1099/2009 och rådets direktiv 98/58/EG, 1999/74/EG, 2007/43/EG, 2008/119/EG och 2008/120/EG och om upphävande av Europaparlamentets och rådets förordningar (EG) nr 854/2004 och (EG) nr 882/2004, rådets direktiv 89/608/EEG, 89/662/EEG, 90/425/EEG, 91/496/EEG, 96/23/EG, 96/93/EG och 97/78/EG samt rådets beslut 92/438/EEG (förordningen om offentlig kontroll) (2), särskilt artikel 90, och
av följande skäl:
|
(1) |
I kommissionens genomförandeförordning (EU) 2020/2236 (3) fastställs förlagorna till djurhälsointyg för införsel till unionen och förflyttningar inom unionen av sändningar av vattenlevande djur och av vissa produkter av animaliskt ursprung från vattenlevande djur. |
|
(2) |
I bilaga II till genomförandeförordning (EU) 2020/2236 fastställs förlagan till djurhälsointyg för införsel till unionen av sändningar av vattenlevande djur avsedda för vissa vattenbruksanläggningar, utsättning i naturen eller andra ändamål, utom för direkt användning som livsmedel (förlaga AQUA-ENTRY-ESTAB/RELEASE/OTHER). Artikel 166 i kommissionens delegerade förordning (EU) 2020/692 (4) ändrades nyligen genom delegerad förordning (EU) 2023/119 (5) för att tillåta yrkesverksamma inom vattenlevande djurs hälsa att utföra kliniska besiktningar av sändningar av vattenlevande djur före export till unionen, förutsatt att de är bemyndigade att göra det enligt lagstiftningen i det exporterande tredjelandet eller territoriet. Dessa nya krav för införsel till unionen av dessa sändningar bör återspeglas i punkt II.3.2 i den förlagan till djurhälsointyg. Bilaga II till genomförandeförordning (EU) 2020/2236 bör därför ändras i enlighet med detta. |
|
(3) |
För att undvika störningar i handeln när det gäller införsel till unionen av sändningar av vattenlevande djur avsedda för vissa vattenbruksanläggningar, utsättning i naturen eller andra ändamål, utom för direkt användning som livsmedel, bör det under en övergångsperiod fortsatt vara tillåtet att på vissa villkor använda djurhälsointyg som utfärdats i enlighet med genomförandeförordning (EU) 2020/2236, i dess lydelse före de ändringar som införs genom den här förordningen. |
|
(4) |
Eftersom genomförandeförordning (EU) 2020/2236 tillämpas från och med den 21 april 2021 bör de ändringar som ska göras i genomförandeförordning (EU) 2020/2236 genom den här förordningen av rättssäkerhetsskäl och för att underlätta handeln träda i kraft så snart som möjligt. |
|
(5) |
De åtgärder som föreskrivs i denna förordning är förenliga med yttrandet från ständiga kommittén för växter, djur, livsmedel och foder. |
HÄRIGENOM FÖRESKRIVS FÖLJANDE.
Artikel 1
Bilaga II till genomförandeförordning (EU) 2020/2236 ska ändras i enlighet med bilagan till den här förordningen.
Artikel 2
Under en övergångsperiod till och med den 15 december 2023 ska sändningar av vattenlevande djur avsedda för vissa vattenbruksanläggningar, utsättning i naturen eller andra ändamål, utom för direkt användning som livsmedel, som åtföljs av ett djurhälsointyg som utfärdats i enlighet med förlagan i bilaga II till genomförandeförordning (EU) 2020/2236, i dess lydelse före de ändringar som införs i den genomförandeförordningen genom den här förordningen, även fortsättningsvis få föras in till unionen förutsatt att intyget utfärdades senast den 15 september 2023.
Artikel 3
Denna förordning träder i kraft dagen efter det att den har offentliggjorts i Europeiska unionens officiella tidning.
Denna förordning är till alla delar bindande och direkt tillämplig i alla medlemsstater.
Utfärdad i Bryssel den 8 mars 2023.
På kommissionens vägnar
Ursula VON DER LEYEN
Ordförande
(1) EUT L 84, 31.3.2016, s. 1.
(3) Kommissionens genomförandeförordning (EU) 2020/2236 av den 16 december 2020 om fastställande av tillämpningsföreskrifter för Europaparlamentets och rådets förordningar (EU) 2016/429 och (EU) 2017/625 vad gäller förlagor till djurhälsointyg för införsel till unionen och förflyttningar inom unionen av sändningar av vattenlevande djur och av vissa produkter av animaliskt ursprung från vattenlevande djur samt officiellt intygande avseende sådana intyg, och om upphävande av förordning (EG) nr 1251/2008 (EUT L 442, 30.12.2020, s. 410).
(4) Kommissionens delegerade förordning (EU) 2020/692 av den 30 januari 2020 om komplettering av Europaparlamentets och rådets förordning (EU) 2016/429 vad gäller bestämmelser för införsel till unionen samt förflyttning och hantering efter införsel av sändningar av vissa djur, avelsmaterial och produkter av animaliskt ursprung (EUT L 174, 3.6.2020, s. 379).
(5) Kommissionens delegerade förordning (EU) 2023/119 av den 9 november 2022 om ändring av delegerad förordning (EU) 2020/692 om komplettering av Europaparlamentets och rådets förordning (EU) 2016/429 vad gäller bestämmelser för införsel till unionen samt förflyttning och hantering efter införsel av sändningar av vissa djur, avelsmaterial och produkter av animaliskt ursprung (EUT L 16, 18.1.2023, s. 5).
BILAGA
Bilaga II till genomförandeförordning (EU) 2020/2236 ska ersättas med följande:
”BILAGA II
Bilaga II innehåller följande förlaga till djurhälsointyg:
Förlaga
|
AQUA-ENTRY-ESTAB/RELEASE/OTHER |
Förlaga till djurhälsointyg för införsel till unionen av vattenlevande djur avsedda för vissa vattenbruksanläggningar, utsättning i naturen eller andra ändamål, utom för direkt användning som livsmedel |
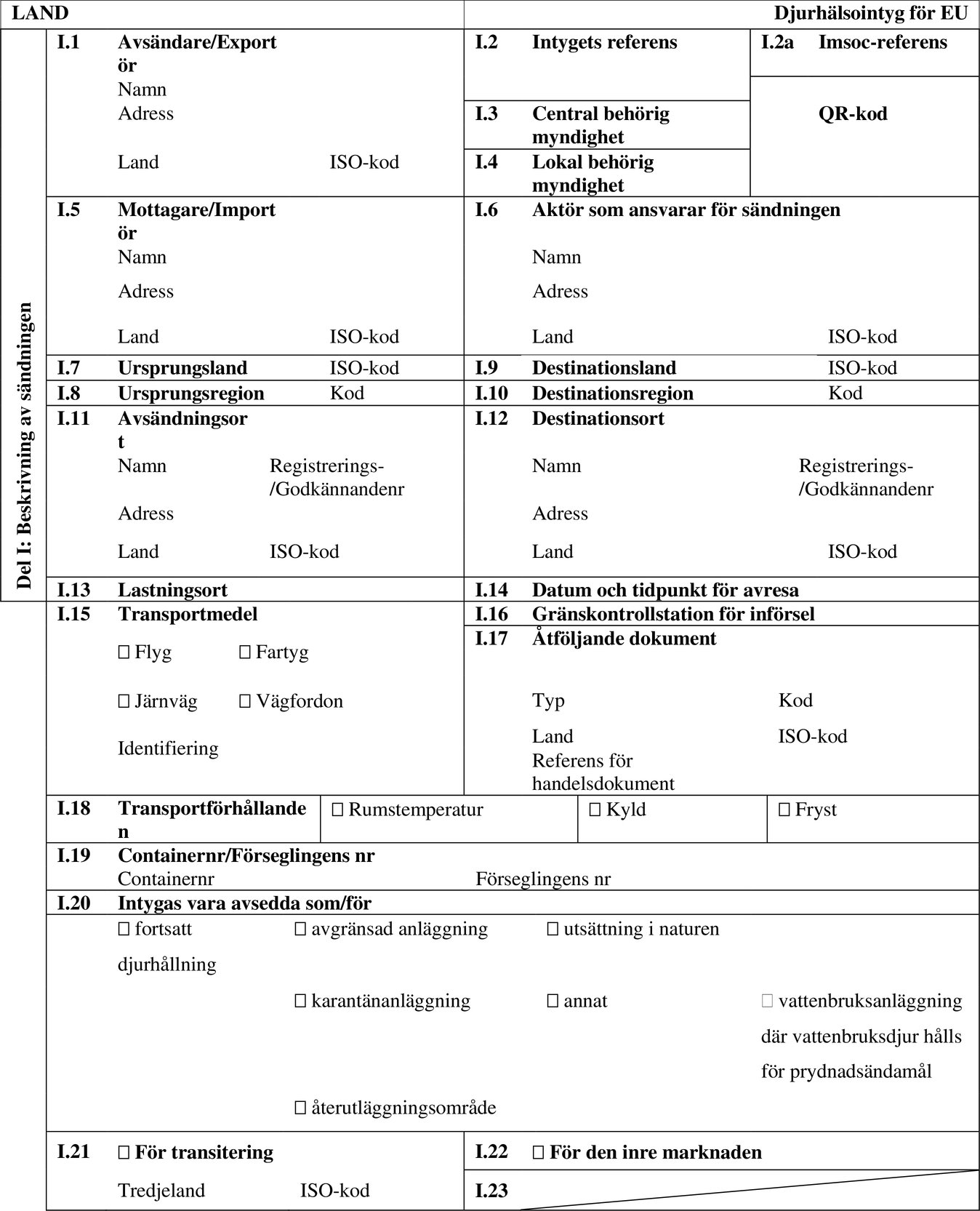
FÖRLAGA TILL DJURHÄLSOINTYG FÖR INFÖRSEL TILL UNIONEN AV VATTENLEVANDE DJUR AVSEDDA FÖR VISSA VATTENBRUKSANLÄGGNINGAR, UTSÄTTNING I NATUREN ELLER ANDRA ÄNDAMÅL, UTOM FÖR DIREKT ANVÄNDNING SOM LIVSMEDEL (FÖRLAGA AQUA-ENTRY-ESTAB/RELEASE/OTHER)






Rättelser
|
9.3.2023 |
SV |
Europeiska unionens officiella tidning |
L 71/37 |
Rättelse till Europaparlamentets och rådets förordning (EU) 2022/123 av den 25 januari 2022 om en förstärkt roll för Europeiska läkemedelsmyndigheten vid krisberedskap och krishantering avseende läkemedel och medicintekniska produkter
( Europeiska unionens officiella tidning L 20 av den 31 januari 2022 )
|
1. |
Sidan 11, artikel 1 a |
I stället för:
|
”a) |
förberedelse inför, förebyggande, samordning och hantering av konsekvenserna av hot mot folkhälsan för läkemedel och för medicintekniska produkter och konsekvenserna av större händelser för läkemedel och för medicintekniska produkter på unionsnivå,” |
ska det stå:
|
”a) |
förberedelse inför, förebyggande, samordning och hantering av konsekvenserna av hot mot folkhälsan för läkemedel och för medicintekniska produkter och konsekvenserna av större händelser för läkemedel på unionsnivå,”. |
|
2. |
Sidan 14, artikel 4.2 |
I stället för:
”2. För att underlätta den övervakning som avses i punkt 1 ska de nationella behöriga myndigheterna för läkemedel, genom de kontaktpunkter som avses i artikel 3.6 eller den plattform som avses i artikel 13 (ESMP) när denna är fullt fungerande, med erforderlig skyndsamhet rapportera till läkemedelsmyndigheten […].”
ska det stå:
”2. För att underlätta den övervakning som avses i punkt 1 ska de nationella behöriga myndigheterna för läkemedel, genom de kontaktpunkter som avses i artikel 3.6 andra stycket eller den plattform som avses i artikel 13 (ESMP) när denna är fullt fungerande, med erforderlig skyndsamhet rapportera till läkemedelsmyndigheten […].”
|
3. |
Sidan 16, artikel 8.1 |
I stället för:
”1. Under den tid som ett hot mot folkhälsan föreligger eller efter det att en större händelse har erkänts enligt artikel 4.3 och till dess att det har bekräftats att den större händelsen har åtgärdats i tillräcklig grad enligt artikel 4.4, ska styrgruppen för läkemedelsbrister regelbundet rapportera resultaten av den övervakning som avses i artikel 7 till kommissionen och de kontaktpunkter som avses i artikel 3.6 och särskilt påtala faktiska eller potentiella brister på läkemedel som ingår i förteckningarna över kritiska läkemedel eller varje händelse som sannolikt kommer att leda till en större händelse.”
ska det stå:
”1. Under den tid som ett hot mot folkhälsan föreligger eller efter det att en större händelse har erkänts enligt artikel 4.3 och till dess att det har bekräftats att den större händelsen har åtgärdats i tillräcklig grad enligt artikel 4.4, ska styrgruppen för läkemedelsbrister regelbundet rapportera resultaten av den övervakning som avses i artikel 7 till kommissionen och de kontaktpunkter som avses i artikel 3.6 andra stycket och särskilt påtala faktiska eller potentiella brister på läkemedel som ingår i förteckningarna över kritiska läkemedel eller varje händelse som sannolikt kommer att leda till en större händelse.”
|
4. |
Sidan 16, artikel 8.2 |
I stället för:
”2. På begäran av kommissionen eller en eller flera av de kontaktpunkter som avses i artikel 3.6 ska styrgruppen för läkemedelsbrister tillhandahålla aggregerade uppgifter och efterfrågeprognoser till stöd för sina resultat och slutsatser. I det avseendet ska styrgruppen för läkemedelsbrister”
ska det stå:
”2. På begäran av kommissionen eller en eller flera av de kontaktpunkter som avses i artikel 3.6 andra stycket ska styrgruppen för läkemedelsbrister tillhandahålla aggregerade uppgifter och efterfrågeprognoser till stöd för sina resultat och slutsatser. I det avseendet ska styrgruppen för läkemedelsbrister”.
|
5. |
Sidan 18, artikel 9.2 d |
I stället för:
|
”d) |
begära information om läkemedel som ingår i förteckningen över kritiska läkemedel från de kontaktpunkter som avses i artikel 3.6 på grundval av den uppsättning information som avses i artikel 6.4 och ange en tidsfrist för inlämning av den informationen om den informationen inte redan finns att tillgå på ESMP.” |
ska det stå:
|
”d) |
begära information om läkemedel som ingår i förteckningen över kritiska läkemedel från de kontaktpunkter som avses i artikel 3.6 andra stycket på grundval av den uppsättning information som avses i artikel 6.4 och ange en tidsfrist för inlämning av den informationen om den informationen inte redan finns att tillgå på ESMP.” |
|
6. |
Sidan 18, artikel 10.2 andra stycket |
I stället för:
”De innehavare av godkännande för försäljning som avses i första stycket i denna punkt ska lämna den begärda informationen inom den tidsfrist som läkemedelsmyndigheten angett, genom de kontaktpunkter som avses i artikel 9.2 b, med användning av de metoder och system för övervakning och rapportering som inrättats enligt artikel 9.1 b respektive c. Dessa innehavare av godkännande för försäljning ska tillhandahålla uppdateringar vid behov.”
ska det stå:
”De innehavare av godkännande för försäljning som avses i första stycket i denna punkt ska lämna den begärda informationen inom den tidsfrist som läkemedelsmyndigheten angett, genom de kontaktpunkter som avses i artikel 9.2 a, med användning av de metoder och system för övervakning och rapportering som inrättats enligt artikel 9.1 b respektive c. Dessa innehavare av godkännande för försäljning ska tillhandahålla uppdateringar vid behov.”
|
7. |
Sidan 19, artikel 11.1 a |
I stället för:
|
”a) |
lämna in den uppsättning information som avses i artikel 6.4, inklusive tillgängliga och uppskattade uppgifter om efterfrågevolym och efterfrågeprognoser, genom den kontaktpunkt som avses i artikel 3.6 och med användning av de metoder och system för rapportering som inrättats enligt artikel 9.1 b respektive c,” |
ska det stå:
|
”a) |
lämna in den uppsättning information som avses i artikel 9.2 d, inklusive tillgängliga och uppskattade uppgifter om efterfrågevolym och efterfrågeprognoser, genom den kontaktpunkt som avses i artikel 3.6 andra stycket, med användning av de metoder och system för rapportering som inrättats enligt artikel 9.1 b respektive c,”. |
|
8. |
Sidan 20, artikel 11.3 |
I stället för:
”3. I fall då medlemsstaterna förfogar över eventuell information utöver den information som ska tillhandahållas i enlighet med punkterna 1 och 2 i denna artikel om försäljnings- och förskrivningsvolymer för läkemedel som styrker att det föreligger en faktisk eller potentiell brist på ett läkemedel som ingår i förteckningarna över kritiska läkemedel, inbegripet uppgifter och upplysningar enligt artikel 23a tredje stycket i direktiv 2001/83/EG, ska de omedelbart lämna sådan information till styrgruppen för läkemedelsbrister via sina respektive kontaktpunkter enligt artikel 3.6 i denna förordning.”
ska det stå:
”3. I fall då medlemsstaterna förfogar över eventuell information utöver den information som ska tillhandahållas i enlighet med punkterna 1 och 2 i denna artikel om försäljnings- och förskrivningsvolymer för läkemedel som styrker att det föreligger en faktisk eller potentiell brist på ett läkemedel som ingår i förteckningarna över kritiska läkemedel, inbegripet uppgifter och upplysningar enligt artikel 23a tredje stycket i direktiv 2001/83/EG, ska de omedelbart lämna sådan information till styrgruppen för läkemedelsbrister via sina respektive kontaktpunkter enligt artikel 3.6 andra stycket i denna förordning.”
|
9. |
Sidan 21, artikel 13.3 b |
I stället för:
|
”b) |
ska medlemsstaterna använda ESMP för att rapportera information om läkemedel på förteckningarna över kritiska läkemedel till läkemedelsmyndigheten, genom de kontaktpunkter som avses i artikel 9.1 d, i enlighet med artiklarna 9 och 11.” |
ska det stå:
|
”b) |
ska medlemsstaterna använda ESMP för att rapportera information om läkemedel på förteckningarna över kritiska läkemedel till läkemedelsmyndigheten, genom de kontaktpunkter som avses i artikel 3.6 andra stycket, i enlighet med artiklarna 9 och 11.” |
|
10. |
Sidan 21, artikel 13.4 b |
I stället för:
|
”b) |
ska medlemsstaterna använda ESMP för att till läkemedelsmyndigheten rapportera om brister på läkemedel som sannolikt kommer att leda till ett hot mot folkhälsan eller en större händelse i enlighet med artikel 4.2, genom de kontaktpunkter som avses i artikel 9.1 e.” |
ska det stå:
|
”b) |
ska medlemsstaterna använda ESMP för att till läkemedelsmyndigheten rapportera om brister på läkemedel som sannolikt kommer att leda till ett hot mot folkhälsan eller en större händelse i enlighet med artikel 4.2, genom de kontaktpunkter som avses i artikel 3.6 andra stycket.” |
|
11. |
Sidan 28, artikel 22.2 |
I stället för:
”2. För tillämpningen av artikel 25.2 ska styrgruppen för brister på medicintekniska produkter anta, och göra allmänt tillgänglig, den uppsättning information som avses i artikel 25.2 b och c som är nödvändig för att övervaka tillgång och efterfrågan på medicintekniska produkter som ingår i förteckningen över kritiska medicintekniska produkter vid hot mot folkhälsan och underrätta den arbetsgrupp som avses i artikel 21.5 om denna uppsättning information.”
ska det stå:
”2. För tillämpningen av artikel 25.2 ska styrgruppen för brister på medicintekniska produkter anta, och göra allmänt tillgänglig, den uppsättning information som avses i artikel 25.2 c och d som är nödvändig för att övervaka tillgång och efterfrågan på medicintekniska produkter som ingår i förteckningen över kritiska medicintekniska produkter vid hot mot folkhälsan och underrätta den arbetsgrupp som avses i artikel 21.5 om denna uppsättning information.”
|
12. |
Sidan 28, artikel 24.1 |
I stället för:
”1. Under den tid som ett hot mot folkhälsan föreligger ska styrgruppen för brister på medicintekniska produkter regelbundet rapportera resultaten av den övervakning som avses i artikel 23 till kommissionen och de kontaktpunkter som avses i artikel 25.2 a och särskilt påtala faktiska eller potentiella brister på medicintekniska produkter som ingår i förteckningen över kritiska medicintekniska produkter vid ett hot mot folkhälsan.”
ska det stå:
”1. Under den tid som ett hot mot folkhälsan föreligger ska styrgruppen för brister på medicintekniska produkter regelbundet rapportera resultaten av den övervakning som avses i artikel 23 till kommissionen och de kontaktpunkter som avses i artikel 21.5 andra stycket och särskilt påtala faktiska eller potentiella brister på medicintekniska produkter som ingår i förteckningen över kritiska medicintekniska produkter vid ett hot mot folkhälsan.”
|
13. |
Sidan 29, artikel 24.5 |
I stället för:
”5. Om kommissionen så begär får styrgruppen för brister på medicintekniska produkter samordna åtgärder som vidtas av de nationella behöriga myndigheterna för medicintekniska produkter, tillverkare av medicintekniska produkter, anmälda organ och andra enheter, i relevanta fall, för att förebygga eller begränsa faktiska eller potentiella brister på medicintekniska produkter i samband med ett hot mot folkhälsan eller en större händelse.”
ska det stå:
”5. Om kommissionen så begär får styrgruppen för brister på medicintekniska produkter samordna åtgärder som vidtas av de nationella behöriga myndigheterna för medicintekniska produkter, tillverkare av medicintekniska produkter, anmälda organ och andra enheter, i relevanta fall, för att förebygga eller begränsa faktiska eller potentiella brister på medicintekniska produkter i samband med ett hot mot folkhälsan.”
|
14. |
Sidan 31, artikel 27.1 a |
I stället för:
|
”a) |
lämna in den uppsättning information som avses i artikel 22.2, inklusive tillgänglig information om behov avseende de medicintekniska produkter som ingår i förteckningen över kritiska medicintekniska produkter vid hot mot folkhälsan samt tillgängliga och uppskattade uppgifter om efterfrågevolym och efterfrågeprognoser för de medicintekniska produkterna, genom den respektive kontaktpunkt som avses i artikel 25.2 a och med användning av de metoder och system för övervakning och rapportering som fastställts enligt artikel 25.1 b,” |
ska det stå:
|
”a) |
lämna in den uppsättning information som avses i artikel 25.2 d, inklusive tillgänglig information om behov avseende de medicintekniska produkter som ingår i förteckningen över kritiska medicintekniska produkter vid hot mot folkhälsan samt tillgängliga och uppskattade uppgifter om efterfrågevolym och efterfrågeprognoser för de medicintekniska produkterna, genom den respektive kontaktpunkt som avses i artikel 21.5 andra stycket, med användning av de metoder och system för övervakning och rapportering som fastställts enligt artikel 25.1 b,”. |
|
15. |
Sidan 32, artikel 27.3 |
I stället för:
”3. I fall då medlemsstaterna förfogar över eventuell information utöver den information som ska tillhandahållas i enlighet med punkterna 1 och 2 i denna artikel som styrker att det föreligger en faktisk eller potentiell brist på medicintekniska produkter ska de omedelbart lämna sådan information till styrgruppen för brister på medicintekniska produkter via sina respektive kontaktpunkter enligt artikel 25.2 a.”
ska det stå:
”3. I fall då medlemsstaterna förfogar över eventuell information utöver den information som ska tillhandahållas i enlighet med punkterna 1 och 2 i denna artikel som styrker att det föreligger en faktisk eller potentiell brist på medicintekniska produkter ska de omedelbart lämna sådan information till styrgruppen för brister på medicintekniska produkter via sina respektive kontaktpunkter enligt artikel 21.5 andra stycket.”
|
16. |
Sidan 32, artikel 27.4 b |
I stället för:
|
”b) |
ta hänsyn till eventuella rekommendationer enligt artikel 24.3 och eventuella riktlinjer enligt artikel 28 b samt samordna sina åtgärder med avseende på de åtgärder som vidtagits på unionsnivå enligt artikel 12 a,” |
ska det stå:
|
”b) |
ta hänsyn till eventuella rekommendationer enligt artikel 24.3 och eventuella riktlinjer enligt artikel 28 b samt samordna sina åtgärder med avseende på de åtgärder som vidtagits på unionsnivå enligt artikel 28 a,”. |
|
9.3.2023 |
SV |
Europeiska unionens officiella tidning |
L 71/42 |
Rättelse till Europaparlamentets och rådets förordning (EU) 2019/631 av den 17 april 2019 om fastställande av normer för koldioxidutsläpp för nya personbilar och för nya lätta nyttofordon och om upphävande av förordningarna (EG) nr 443/2009 och (EU) nr 510/2011
( Europeiska unionens officiella tidning L 111 av den 25 april 2019 )
|
1. |
I hela bilaga I ska ”har ett värde enligt vad som anges i” ersättas med ”är enligt definitionen i”. |
|
2. |
Sidan 36, bilaga I, del A, punkt 6.2.1 |
Istället för:
”

”
ska det stå:
”

”.
|
3. |
Sidan 36, bilaga I, del A, punkt 6.2.1, vänsterkanten |
I stället för:
”average emissions2021”
ska det stå:
”genomsnittliga utsläpp2021”.
|
4. |
Sidan 39, bilaga I, del B, punkt 6.0 |
I stället för:
”reference-value2021”
ska det stå:
”referensvärde2021”.
|
5. |
Sidan 40, bilaga I, del B, punkt 6.2.1 |
I stället för:
”

”
ska det stå:
”

”.
|
6. |
Sidan 40, bilaga I, del B, punkt 6.2.1, vänsterkanten |
I stället för:
”average emissions2021”
ska det stå:
”genomsnittliga utsläpp2021”.
|
9.3.2023 |
SV |
Europeiska unionens officiella tidning |
L 71/44 |
Rättelse till rådets genomförandeförordning (EU) 2023/419 av den 24 februari 2023 om genomförande av artikel 8a i förordning (EG) nr 765/2006 om restriktiva åtgärder med anledning av situationen i Belarus och Belarus inblandning i Rysslands aggression mot Ukraina
( Europeiska unionens officiella tidning L 61 av den 27 februari 2023 )
Sidan 22, bilagan, inledningen
I stället för:
”Bilaga I till förordning (EG) nr 765/2006 ska ändras på följande sätt:
|
1. |
I tabellen ’A. Fysiska personer som avses i artikel 2.1’, ska posterna 10, 17, 20, 22, 35, 39, 41, 42, 64, 65, 71, 73, 75, 78, 85, 87, 89, 90, 123, 125 och 179 ersättas med följande:” |
ska det stå:
”Bilaga I till förordning (EG) nr 765/2006 ska ändras på följande sätt:
|
1. |
I tabellen ’A. Fysiska personer som avses i artikel 2.1’, ska posterna 10, 17, 20, 22, 35, 39, 41, 42, 64, 65, 71, 73, 75, 78, 85, 87, 89, 90, 104, 123, 125, 129, 131, 179 och 195 ersättas med följande:”. |
|
9.3.2023 |
SV |
Europeiska unionens officiella tidning |
L 71/45 |
Rättelse till Kommissionens delegerade förordning (EU) 2023/206 av den 5 oktober 2022 om komplettering av Europaparlamentets och rådets förordning (EU) nr 575/2013 vad gäller tekniska tillsynsstandarder som specificerar de typer av faktorer som ska beaktas vid bedömningen av riskvikters lämplighet för exponeringar säkrade genom panträtt i fast egendom och de villkor som ska beaktas vid bedömningen av LGD-minimivärdens lämplighet för exponeringar säkrade genom panträtt i fast egendom
( Europeiska unionens officiella tidning L 29 av den 1 februari 2023 )
Sidan 5, artikel 2.2 b iv
I stället för:
|
”iv) |
Andra instrument som är inriktade på utlåningskrav.” |
ska det stå:
|
”iv) |
Andra instrument som är inriktade på utlåningsstandarder.” |