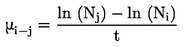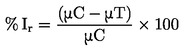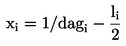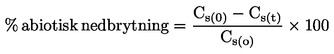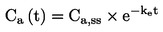|
(6)
|
Följande kapitel C.31–C.46 ska läggas till: ”C.31. TEST PÅ LANDVÄXTER: TEST AV GRODDPLANTORS UTVECKLING OCH TILLVÄXT
INLEDNING
|
1.
|
Denna testmetod motsvarar OECD:s testriktlinje (TG) 208 (2006). Testmetoder ses regelbundet över med avseende på den vetenskapliga utvecklingen och tillämpligheten för lagstadgad användning. Syftet med denna uppdaterade testmetod är att bedöma de potentiella effekterna av kemikalier på groddplantors utveckling och tillväxt. Den omfattar inte kroniska effekter eller effekter på fortplantningen (dvs. fröproduktion, blomning, fruktmognad). Exponeringsförhållandena och testkemikaliens egenskaper måste beaktas för att säkerställa att lämpliga testmetoder används (t.ex. då man testar metaller eller metallföreningar bör man beakta effekterna av pH och tillhörande motjoner) (1). Denna testmetod omfattar inte plantor som utsätts för kemiska ångor. Testmetoden kan användas för kontroll av allmänna kemikalier, biocider och växtskyddsmedel (dvs. bekämpningsmedel). Den har utarbetats på grundval av befintliga metoder (2) (3) (4) (5) (6) (7). Andra hänvisningar som gäller växttester beaktades också (8) (9) (10). De definitioner som används återfinns i tillägg 1.
|
PRINCIP FÖR TESTMETODEN
|
2.
|
Testet utgör en utvärdering av effekterna på utvecklingen och tillväxten av högre växters groddplantor efter att de har exponerats för testkemikalien i jord (eller annan lämplig jordmatris). Fröna placeras i kontakt med jord som behandlats med testkemikalien och utvärderas i regel efter 14–21 dagar efter det att 50 % av plantorna i kontrollgruppen har grott. Som endpoints används visuell bedömning av fröplantornas grodd, groddarnas torrvikt (alternativt färskvikt) och i vissa fall groddarnas höjd, samt en bedömning av synliga skadliga effekter på plantans olika delar. Dessa mätningar och observationer jämförs med dem som görs på obehandlade kontrollväxter.
|
|
3.
|
Beroende på den förväntade exponeringsvägen blandas testkemikalien antingen ner i jorden (eller eventuellt i en syntetisk jordmatris) eller appliceras ovanpå jorden, vilket i båda fallen är lämpliga motsvarigheter för kemikaliens potentiella exponeringsvägar. Iblandning i jord sker genom att behandla jord i större partier. Efter iblandningen av kemikalien överförs jorden till krukor, och därefter planteras de växtarter som ska testas i jorden. Applicering ovanpå jorden ska göras i krukor i vilka fröna redan har planterats. Testenheterna (dvs. kontroller samt behandlad jord och frön) placeras sedan under förhållanden som främjar växternas grobarhet och tillväxt.
|
|
4.
|
Testet kan utföras för att fastställa dos-respons-kurvan, eller som ett toleranstest vid en enda koncentration/frekvens beroende på syftet med studien. Om resultaten från testet med en enda koncentration/frekvens överskrider en viss toxicitetsnivå (t.ex. om effekter större än x % observeras), ska ett preliminärt test utföras för att fastställa toxicitetens övre och nedre gränser, följt av ett test med flera olika koncentrationer/frekvenser för att generera en dos-responskurva. En lämplig statistisk analys används för att erhålla den effektiva koncentrationen ECx eller den effektiva appliceringsfrekvensen ERx (t.ex. EC25, EC50, ER25, ER50) för den/de känsligaste parametern/parametrarna som är av intresse. Den högsta koncentrationen utan observerad effekt (NOEC) och den lägsta koncentrationen med observerad effekt (LOEC) kan också beräknas i detta test.
|
INFORMATION OM TESTKEMIKALIEN
|
5.
|
Följande information är användbar för identifiering av förväntad exponeringsväg för kemikalien och vid utformningen av testet: strukturformel, renhetsgrad, vattenlöslighet, löslighet i organiska lösningsmedel, fördelningskoefficient 1-oktanol/vatten, sorptionsegenskaper i jord, ångtryck, kemisk stabilitet i vatten och ljus, samt bionedbrytbarhet.
|
TESTETS GILTIGHET
|
6.
|
För att testet ska anses vara giltigt måste följande kriterier uppfyllas för kontrollerna:
|
—
|
Fröplantornas grobarhet ska vara minst 70 %.
|
|
—
|
Fröplantorna får inte uppvisa synliga fytotoxiska effekter (t.ex. kloros, nekros, vissning, deformerade blad och stjälkar), och plantorna ska uppvisa normala variationer i tillväxt och morfologi för den berörda arten.
|
|
—
|
Den genomsnittliga överlevnaden för grodda fröplantor i kontrollerna är minst 90 % under testets gång.
|
|
—
|
Miljöförhållandena för en viss art ska vara identiska och växtmedierna ska innehålla samma mängd jordmatris, stödmedier eller substrat från samma källa.
|
|
REFERENSKEMIKALIE
|
7.
|
Ett referensämne kan testas regelbundet för att kontrollera att testets utförande, de aktuella testplantornas respons och provningsvillkoren inte förändrats nämnvärt under testets gång. Alternativt kan mätningshistoriken för biomassa eller tillväxt i kontrollerna användas för att utvärdera testsystemets prestanda vid ett särskilt laboratorium, och kan då fungera som en åtgärd för intern kvalitetskontroll.
|
BESKRIVNING AV TESTMETODEN
Naturlig jord – artificiellt substrat
|
8.
|
Växter kan odlas i krukor med lerig sand, sandjord eller sandig lättlera som innehåller upp till 1,5 % organiskt kol (ca 3 % organiskt material). Kommersiell planteringsjord eller syntetisk jord som innehåller upp till 1,5 % organiskt kol kan också användas. Lerjord bör inte användas om testkemikalien är känd för att ha en hög affinitet för lera. Jord tagen på fältet bör siktas till 2 mm partikelstorlek i syfte att homogenisera den och avlägsna grova partiklar. Typ och textur, procentandel organiskt kol, pH-värde och salthalt såväl som den elektroniska värmeledningsförmågan i den färdigberedda jorden ska rapporteras. Jorden bör klassificeras enligt ett enhetligt klassificeringssystem (11). Jorden kan pastöriseras eller värmebehandlas i syfte att minska effekterna av patogener.
|
|
9.
|
Naturlig jord kan försvåra tolkningen av resultaten och öka variabiliteten på grund av olika fysikaliska/kemiska egenskaper och populationer av mikroorganismer. Dessa variabler påverkar i sin tur vattenbindningsförmågan, förmågan att binda kemikalier, luftningen och innehållet av näringsämnen och spårelement. Utöver skillnaderna i dessa fysikaliska faktorer finns det även skillnader när det gäller kemiska egenskaper såsom pH och redoxpotential, som kan påverka testkemikaliens biotillgänglighet (12) (13) (14).
|
|
10.
|
Artificiella substrat används normalt inte för testning av bekämpningsmedel, men de kan användas för testning av allmänna kemikalier eller om man vill minimera variabiliteten i naturliga jordar och förbättra jämförbarheten i analysresultaten. De substrat som används bör bestå av inaktivt material som minimerar interaktionen med testkemikalien, lösningsmedlet, eller båda. Syratvättad kvartssand, mineralull och glaspärlor (t.ex. 0,35–0,85 mm i diameter) har konstaterats vara lämpliga inaktiva material som absorberar testkemikalien i lägsta möjliga grad (15) och gör det möjligt för fröplantan att ta upp största möjliga mängd av kemikalien via rötterna. Olämpliga substrat inbegriper vermikulit, perlit eller andra högabsorberande material. Näringsämnen för växternas tillväxt bör tillhandahållas för att se till att plantorna inte utsätts för stress på grund av näringsbrist, och om möjligt bör detta bedömas genom kemisk analys eller visuell bedömning av kontrollplantorna.
|
Kriterier för urvalet av testarter
|
11.
|
De arter som valts ut ska vara tillräckligt omfattande, t.ex. med tanke på deras taxonomiska mångfald inom växtriket, deras utbredning, mängd, artspecifika livscykelegenskaper och naturligt förekomstområde, så att en rad olika reaktioner uppstår(8) (10) (16) (17) (18) (19) (20). Följande egenskaper hos eventuella testarter bör beaktas vid urvalet:
|
—
|
arten har likformiga frön som lätt kan erhållas från tillförlitliga standardutsädeskällor och som har enhetlig, tillförlitlig och jämn grobarhet, liksom en enhetlig planttillväxt,
|
|
—
|
plantan kan enkelt laboratorietestas, och kan ge tillförlitliga och reproducerbara resultat inom och mellan provningsanläggningar,
|
|
—
|
känsligheten hos den art som testas bör överensstämma med reaktionen hos växter i miljön som exponeras för kemikalien,
|
|
—
|
arterna har i viss utsträckning använts i tidigare toxicitetstester, och deras användning exempelvis i bioanalyser av herbicider, undersökningar av tungmetaller, stresstester med salthalt eller mineraler eller allelopatistudier visar på känslighet för många olika stressfaktorer,
|
|
—
|
de är kompatibla med testmetodens tillväxtförutsättningar,
|
|
—
|
de uppfyller giltighetskriterierna för testet.
|
Vissa av de historiskt sett mest använda testarterna förtecknas tillägg 2 och potentiella växtarter som inte är grödor i tillägg 3.
|
|
12.
|
Det antal arter som ska testas beror på de tillämpliga lagstadgade kraven, och därför anges detta inte i denna testmetoden.
|
Applicering av testkemikalien
|
13.
|
Kemikalien ska appliceras via en lämplig vehikel (t.ex. vatten, aceton, etanol, polyetylenglykol, gummi arabicum, sand). Blandningar (sammansatta produkter eller beredningar) som innehåller olika aktiva substanser och hjälpämnen kan också testas.
|
Iblandning i jord/artificiellt substrat
|
14.
|
Kemikalier som är vattenlösliga eller suspenderade i vatten kan tillsättas i vatten, och lösningen kan sedan blandas med jord med en lämplig blandningsanordning. Denna typ av test kan vara lämplig om exponering för kemikalien sker via jord eller jordens porvatten och man oroar sig för plantans upptagning av kemikalien genom rötterna. Jordens vattenbindningsförmåga bör inte överskridas genom tillsättning av testkemikalien. Den mängd vatten som tillsatts ska vara samma för varje testkoncentration, men bör begränsas för att förhindra att jorden klumpar ihop sig.
|
|
15.
|
Ämnen med låg vattenlöslighet bör lösas upp i ett lämpligt flyktigt lösningsmedel (t.ex. aceton, etanol) och blandas med sand. Lösningsmedlet kan därefter avlägsnas från sanden med hjälp av en luftström medan sanden ständigt blandas. Den behandlade sanden blandas med testjorden. En andra kontroll bereds med endast sand och lösningsmedel. Lika stora mängder sand, med lösningsmedel som blandas i och avlägsnas, tillsätts alla behandlingsnivåer och den andra kontrollen. För fasta, olösliga testkemikalier blandas torr jord med kemikalien i en lämplig blandare. Därefter fylls krukorna med jord och fröna sås omedelbart.
|
|
16.
|
När ett artificiellt substrat används i stället för jord kan kemikalier som är lösliga i vatten upplösas i näringslösningen strax innan testet inleds. Kemikalier som är olösliga i vatten, men som kan suspenderas i vatten med hjälp av ett lösningsmedel, bör tillsättas näringslösningen med bärämnet. Icke vattenlösliga kemikalier, för vilka det inte finns något giftfritt vattenlösligt bärämne, bör lösas i ett lämpligt flyktigt lösningsmedel. Lösningen blandas med sand eller glaspärlor, placeras i en vacuumrotationsapparat och evaporeras, vilket gör att sanden eller glaspärlorna täcks med ett jämnt lager av kemikalien. En vägd andel pärlor bör extraheras med samma organiska lösningsmedel och testkemikalien innan krukorna fylls.
|
Applicering på ytan
|
17.
|
För växtskyddsprodukter appliceras testkemikalien ofta genom att jordytan besprutas med provlösningen. All utrustning som används i testerna, inklusive utrustning som används för att bereda och tillföra testkemikalien, bör ha sådan utformning och kapacitet att testerna där denna utrustning används kan genomföras på ett korrekt sätt och ger en reproducerbar täckning. Täckningen bör vara enhetlig på alla jordytor. Man bör undvika att kemikalierna adsorberas till eller reagerar med utrustningen (t.ex. plaströr och lipofila kemikalier eller delar av stål). Testkemikalien sprutas på jordytan på ett sätt som simulerar besprutning med typiska besprutningsbehållare. I allmänhet bör besprutningsvolymerna motsvara normal jordbrukspraxis och volymerna (mängd vatten etc.) bör rapporteras. Munstyckets typ bör väljas ut för att ge en jämn täckning av jordytan. Om lösningsmedel och bärämnen används bör en andra grupp kontrollplantor etableras som endast besprutas med lösningsmedlet eller bärämnet. Detta är inte nödvändigt för växtskyddsprodukter som testas som beredningar.
|
Kontroll av testkemikaliens koncentration/dos
|
18.
|
Koncentrationerna och appliceringsdosen måste bekräftas genom en lämplig analytisk kontroll. För lösliga kemikalier kan alla koncentrationer/doser bekräftas genom en analys av testlösningen med den högsta koncentrationen som används för testet och med dokumentering av senare utspädning och användning av kalibrerad appliceringsutrustning (t.ex. kalibrerade glaskärl för analys, kalibrerad besprutningsutrustning). För olösliga kemikalier måste en kontroll av ämnen som består av föreningar kompletteras med vikten av den testkemikalie som tillförs jorden. Om homogeniteten måste påvisas kan det bli nödvändigt att göra en analys av jorden.
|
FÖRFARANDE
Testupplägg
|
19.
|
Frön av samma arter planteras i krukor. Antalet frön per kruka beror på arten, krukstorleken och testets varaktighet. Antalet plantor per kruka bör inte vara större än att det finns lämpliga förutsättningar för tillväxt och att man undviker trängsel under hela testet. Högsta tillåtna planteringstäthet är cirka 3–10 frön per 100 cm2 beroende på frönas storlek. Till exempel är det lämpligt att ha en till två plantor av majs, sojabönor, tomat, gurka eller sockerbetor per 15 cm behållare, tre plantor av raps eller ärtor per 15 cm behållare, och fem till tio plantor av lök, vete eller andra små frön per 15 cm behållare. Antalet frön och replikatkrukor (replikatet definieras som en kruka, vilket betyder att plantor i samma kruka inte utgör ett replikat) bör vara lämpligt för att en optimal statistisk analys ska kunna utföras (21). Det bör noteras att variabiliteten blir större för arter med färre stora frön per kruka (replikat) jämfört med arter där det är möjligt att använda ett större antal små frön per kruka. Genom att plantera lika många frön i varje kruka kan denna variabilitet minimeras.
|
|
20.
|
Kontrollgrupperna används för att säkerställa att observerade effekter endast kan länkas till eller tillskrivas exponering för testkemikalien. En lämplig kontrollgrupp bör vara identisk i alla avseenden med testgruppen med undantag för exponeringen för testämnet. I ett givet test ska alla testplantor inklusive kontrollerna komma från samma källa. För att förhindra systematiska avvikelser måste en slumpmässig anvisning av test- och kontrollkrukor göras.
|
|
21.
|
Frön som behandlats med en insekticid eller fungicid (dvs. behandlade frön) bör undvikas. Användningen av vissa icke-systemiska kontaktfungicider (t.ex. kaptan, tiram) är dock tillåten enligt vissa tillsynsmyndigheter (22). Om utsädesburna patogener utgör ett problem får fröna kortvarigt doppas i en svag 5-procentig hypokloritlösning och sedan tvättas noggrant i rinnande vatten och torkas. Ingen efterbehandling med andra bekämpningsmedel är tillåten.
|
Testbetingelser
|
22.
|
Testförhållandena ska likna de nödvändiga förhållandena för normal tillväxt för de arter och sorter som testas (i tillägg 4 finns exempel på testförhållanden). De groende plantorna bör hållas enligt god odlingspraxis i miljökammare, fytotroner eller växthus. När man använder dessa drivanläggningar omfattar denna praxis vanligen kontroll och tillräckligt frekvent (t.ex. dagligen) registrering av temperatur, luftfuktighet, koldioxidhalt, belysning (ljusintensitet, våglängd, fotosyntetiskt aktiv strålning) och ljusperiod, bevattning, m.m. för att säkerställa god tillväxt, vilken bedöms genom kontroll av de utvalda arterna. Temperaturen i växthusen bör regleras genom ventilation, uppvärmning och/eller kylning. Följande förhållanden rekommenderas vanligen för tester i växthus:
|
—
|
temperatur: 22 ± 10 °C,
|
|
—
|
fotoperiod: minst 16 h ljus,
|
|
—
|
ljusintensitet: 350 ± 50 μE/m2/s. Det kan bli nödvändigt med extrabelysning om intensiteten minskar till under 200 μE/m2/s, våglängd 400–700 nm, med undantag för vissa arter som är mindre ljuskrävande.
|
Miljöförhållandena bör övervakas och rapporteras under undersökningens gång. Växterna ska odlas i krukor av icke-porös plast eller glaserade krukor med en bricka eller ett fat under. Krukorna kan placeras om regelbundet för att minimera variabiliteten i växternas tillväxt (på grund av skillnader i testbetingelserna inom tillväxtanläggningen). Krukorna måste vara tillräckligt stora för att möjliggöra normal tillväxt.
|
|
23.
|
Näringsämnen i jorden får kompletteras vid behov för att upprätthålla god växtkraft. Man kan bedöma om det finns behov av ytterligare näringsämnen och när dessa ska tillsättas genom observation av kontrollplantorna. Det rekommenderas att man vattnar testbehållarna underifrån (t.ex. med hjälp av glasfibervekar). Till att börja med kan man emellertid vattna ovanifrån för att stimulera frönas groning, och vid applicering på jordytan underlättar det även upptagningen av kemikalien i jorden.
|
|
24.
|
De särskilda växtförhållandena bör anpassas för den art som testas och den testkemikalie som undersöks. Kontroller och testade plantor måste hållas under samma miljöförhållanden, men lämpliga åtgärder bör vidtas för att förhindra korsexponering (t.ex. av flyktiga kemikalier) mellan olika testkärl och av testkemikalien till kontrollerna.
|
Att testa en enda koncentration/dos
|
25.
|
I syfte att fastställa lämplig koncentration/dos av en kemikalie för att utföra tester med en enda koncentration eller dos (belastningstest/gränstest), måste ett antal faktorer beaktas. För allmänna kemikalier inbegriper dessa faktorer kemikaliens fysikalisk-kemiska egenskaper. För växtskyddsprodukter måste man beakta testkemikaliens fysikalisk-kemiska egenskaper och användningsmönster, dess högsta koncentration eller appliceringsdos, antalet behandlingar per säsong och/eller testkemikaliens beständighet. För att avgöra om en allmän kemikalie har fytotoxiska egenskaper kan det vara lämpligt att testa vid en högsta halt på 1 000 mg/kg torr jord.
|
Preliminärt test
|
26.
|
Vid behov kan ett preliminärt test utföras för att ge vägledning om de koncentrationer och doser som ska testas i den definitiva dos-responsstudien. I det preliminära testet ska testkoncentrationerna/-doserna vara jämnt fördelade (t.ex. 0,1, 1,0, 10, 100 och 1 000 mg/kg torr jord). För växtskyddsprodukter kan koncentrationerna/doserna grundas på den rekommenderade eller högsta tillåtna koncentrationen eller appliceringsdosen, t.ex. 1/100, 1/10, 1/1 av den rekommenderade/högsta tillåtna koncentrationen eller dosen.
|
Testning av flera olika koncentrationer/doser
|
27.
|
Syftet med tester med flera koncentrationer/doser är att fastställa ett dos-responssamband och att fastställa ett ECx- eller ERx-värde för grodd, biomassa och/eller synliga effekter jämfört med kontroller som inte exponerats, beroende på vad som krävs av tillsynsmyndigheterna.
|
|
28.
|
Antalet koncentrationer eller doser och intervallen mellan dem ska vara tillräckligt stora för att ett tillförlitligt dos-responssamband och en regressionsformel ska framträda och för att ge en uppskattning av ECx eller ERx. De valda koncentrationerna och doserna bör omfatta de ECx- och ERx-värden som ska fastställas. Om till exempel ett EC50-värde krävs det skulle vara önskvärt för att testa doser som framkallar en effekt på mellan 20 och 80 %. Det rekommenderade antalet testkoncentrationer och testdoser som behövs för att uppnå detta är minst fem i en geometrisk serie plus en obehandlad kontroll, och ska skilja sig åt med en faktor på högst tre. För varje test- och kontrollgrupp bör antalet replikat vara minst fyra och det totala antalet frön bör vara minst 20. Ytterligare replikat av vissa växter med låg grobarhet eller varierande tillväxt kan behövas för att öka testets statistiska styrka. Om ett större antal koncentrationer och doser används kan antalet replikat minskas. Om NOEC ska uppskattas kan det behövas ytterligare replikat för att uppnå önskad statistisk styrka (23).
|
Observationer
|
29.
|
Under observationsperioden, dvs. 14 till 21 dagar efter det att 50 % av kontrollplantorna har grott (även i kontroller med lösningsmedel i förekommande fall), studeras plantorna ofta (minst en gång i veckan och om möjligt dagligen) med avseende på groning och visuell fytotoxicitet och mortalitet. I slutet av provet registreras mätningarna av groningen i procent och de överlevande plantornas biomassa, samt synliga skadliga effekter på olika delar av plantorna. Det sistnämnda inbegriper yttre avvikelser hos de fröplantor som grott, hämmad tillväxt, kloros, missfärgning, mortalitet och effekter på växternas utveckling. Den slutliga biomassan kan mätas med hjälp av den slutliga genomsnittliga torrvikten för de överlevande växternas skott, genom att skörda skotten vid markytan och torka dem tills de uppnår konstant vikt vid 60 °C. Alternativt kan den slutliga biomassan fastställas med hjälp av skottens färskvikt. Skottens höjd kan utgöra en annan endpoint, om så krävs av tillsynsmyndigheterna. Ett enhetligt system för bedömning av visuella skador bör användas för att utvärdera observerbara toxiska reaktioner. Exempel på kvalitativa och kvantitativa visuella bedömningar återfinns i hänvisningarna (23) (24).
|
DATA OCH RAPPORTERING
Statistisk analys
Test av en enda koncentration/dos
|
30.
|
Data för varje växtart bör analyseras med hjälp av en lämplig statistisk metod (21). Effektnivån vid testkoncentrationen/-dosen bör rapporteras, eller avsaknaden av en viss effekt vid testkoncentrationen/dosen (t.ex. <x % effekt iakttagen vid koncentrationen eller dosen y).
|
Test av flera koncentrationer/doser
|
31.
|
Ett dos/respons-samband fastställs i form av en regressionsformel. Olika modeller kan användas. För uppskattning av ECx eller ERx (t.ex. EC25, ER25, EC50, ER50) och dess konfidensgränser för groning kan det till exempel vara lämpligt att använda dikotoma data eller logit-, probit-, Weibull- eller Spearman-Karbermetoderna, den modifierade Spearman-Karbermetoden osv. Om plantornas tillväxt (vikt och höjd) utgör kontinuerliga endpoints kan ECx eller ERx och motsvarande konfidensgränser uppskattas med hjälp av en lämplig regressionsanalys (t.ex. Bruce och Versteegs icke-linjära regressionsanalys (25)). Om möjligt ska R2 vara 0,7 eller högre för de mest känsliga arterna, och de testkoncentrationer/doser som används ska omfatta effekter på 20–80 %. Om NOEC ska uppskattas bör företrädesvis kraftfulla statistiska tester användas, och dessa bör väljas på grundval av datafördelningen (21) (26).
|
Testrapport
|
32.
|
Testrapporten ska presentera resultaten av undersökningarna samt en detaljerad beskrivning av testbetingelserna, en grundlig diskussion av resultaten, en dataanalys och de slutsatser som dragits från analysen. En schematisk sammanställning och sammanfattning av resultaten bör tillhandahållas. Rapporten ska innehålla följande:
|
|
Testkemikalie:
|
—
|
kemiska identifieringsdata, testkemikaliens relevanta egenskaper (t.ex. log Pow, vattenlöslighet, ångtryck och uppgifter om omvandling, spridning och fördelning i miljön, om dessa finns tillgängliga),
|
|
—
|
uppgifter om beredning av provlösningen och kontroll av testkoncentrationerna enligt vad som anges i punkt 18.
|
|
|
|
Testade arter:
|
—
|
uppgifter om testorganismen: art/sort, växtfamilj, vetenskapligt namn och svenskt namn, fröets källa och historia (så detaljerat som möjligt, dvs. namnet på leverantören, grobarhet i procent, fröstorleksklass, klass, sändnings- och partinummer, frösättningsår eller den växtsäsong då fröet insamlades, datum då grobarheten fastställdes), grobarhet osv.,
|
|
—
|
antal testade arter med enkla eller dubbla hjärtblad,
|
|
—
|
motivering för val av arter,
|
|
—
|
beskrivning av lagring, behandling och underhåll av fröna.
|
|
|
|
Testbetingelser:
|
—
|
testanordningar (t.ex. odlingskammare, fytotron och växthus).
|
|
—
|
beskrivning av testsystemet (t.ex. krukmått, krukmaterial och jordmängder),
|
|
—
|
jordegenskaper (textur eller typ: fördelning och klassificering av jordpartiklar, fysikaliska och kemiska egenskaper inklusive procentandel organiska ämnen, procentandel organiskt kol och pH-värde),
|
|
—
|
förberedelse av jorden/substratet (t.ex. jord, syntetisk jord, sand och annat) innan testet,
|
|
—
|
beskrivning av näringsmediet om ett sådant använts,
|
|
—
|
applicering av testkemikalien: beskrivning av appliceringsmetoden, beskrivning av utrustningen, exponeringsdos och volym inklusive kemisk verifiering, beskrivning av kalibreringsmetoden och beskrivning av miljöförhållandena under appliceringen,
|
|
—
|
tillväxtförhållanden: ljusintensitet (t.ex. fotosyntetiskt aktiv strålning), fotoperiod, högsta/lägsta temperatur, bevattningsschema och -metod, gödsling,
|
|
—
|
antal frön per kruka, antal plantor per dos, antal replikat (krukor) per exponeringsdos,
|
|
—
|
antal och typ av kontroller (negativa och /eller positiva kontroller, lösningsmedelskontroll i förekommande fall),
|
|
|
|
Resultat:
|
—
|
tabell för alla endpoints för varje replikat, testkoncentration/-dos och art,
|
|
—
|
antal groddar och procentandel groning jämfört med kontrollerna,
|
|
—
|
mätning av plantornas biomassa (skottens torrvikt eller färskvikt) uttryckt som en procentandel av kontrollerna,
|
|
—
|
skottens höjd uttryckt som en procentandel av kontrollerna, om detta har uppmätts,
|
|
—
|
synbara skador i procent och kvalitativ och kvantitativ beskrivning av synbara skador (kloros, nekros, vissning, deformerade blad och stjälkar såväl som eventuell frånvaro av effekter) orsakade av testkemikalien i jämförelse med kontrollplantorna,
|
|
—
|
beskrivning av den bedömningsskala som används för att bedöma synbara skador, om en visuell bedömning görs,
|
|
—
|
för endosstudier bör procentandelen skador rapporteras,
|
|
—
|
ECx eller ERx (t.ex. EC50, ER50, EC25, ER25) och därtill hörande konfidensgränser. Om regressionsanalys utförs ska standardfelet för regressionsformeln anges, och standardfelet för bedömningar av enskilda parametrar (t.ex. lutning, skärningspunkt),
|
|
—
|
NOEC (och LOEC) om dessa värden beräknas,
|
|
—
|
beskrivning av de statistiska metoder och antaganden som använts,
|
|
—
|
grafisk framställning av dessa uppgifter och dos-responssambandet för den art som testats.
|
|
Avvikelser från de förfaranden som beskrivs i denna testmetod och ovanliga händelser under testets gång.
|
LITTERATUR
|
(1)
|
Schrader, G., Metge, K., och Bahadir, M. (1998). Importance of salt ions in ecotoxicological tests with soil arthropods. Applied Soil Ecology, 7, 189–193.
|
|
(2)
|
Internationella standardiseringsorganisationen. (1994). ISO 11269-1 Markundersökningar – Bestämning av föroreningars effekt på markfloran – Del 1: Metod för bestämning av tillväxthämning hos rötter.
|
|
(3)
|
Internationella standardiseringsorganisationen. (1996). ISO 11269-2 Markundersökningar – Bestämning av föroreningars effekt på markfloran – Del 2: Kemikaliers inverkan på utveckling och tillväxt hos högre växter.
|
|
(4)
|
American Standard for Testing Material (ASTM). (2002). E 1963-98. Standard Guide for Conducting Terrestrial Plant Toxicity Tests.
|
|
(5)
|
U.S. EPA. (1982). FIFRA, 40CFR, Del 158.540. Underavdelning J, delarna 122-1 och 123-1.
|
|
(6)
|
US EPA. (1996). OPPTS Harmonized Test Guidelines, Series 850. Ecological Effects Test Guidelines:
|
—
|
850.4000: Background – Non-target Plant Testing;
|
|
—
|
850.4025: Target Area Phytotoxicity;
|
|
—
|
850.4100: Terrestrial Plant Toxicity, Tier I (Seedling Emergence);
|
|
—
|
850.4200: Seed Germination/Root Elongation Toxicity Test;
|
|
—
|
850.4225: Seedling Emergence, Tier II;
|
|
—
|
850.4230: Early Seedling Growth Toxicity Test.
|
|
|
(7)
|
AFNOR, X31-201. (1982). Essai d'inhibition de la germination de semences par une substance. AFNOR X31-203/ISO 11269-1. (1993). Determination des effets des polluants sur la flore du sol: Méthode de mesurage de l'inhibition de la croissance des racines.
|
|
(8)
|
Boutin, C., Freemark, K. E. and Keddy, C. J. (1994). Proposed guidelines for registration of chemical pesticides: Non-target plant testing and evaluation. Technical Report Series No.145. Canadian Wildlife Service (Headquarters), Environment Canada, Hull, Québec, Kanada.
|
|
(9)
|
Forster, R., Heimbach, U., Kula, C. och Zwerger, P. (1997). Effects of Plant Protection Products on Non-Target Organisms – A contribution to the Discussion of Risk Assessment and Risk Mitigation for Terrestrial Non-Target Organisms (Flora and Fauna). Nachrichtenbl. Deut. Pflanzenschutzd. Nr 48.
|
|
(10)
|
Hale, B., Hall, J. C., Solomon, K. och Stephenson, G. (1994). A Critical Review of the Proposed Guidelines for Registration of Chemical Pesticides; Non-Target Plant Testing and Evaluation, Centre for Toxicology, University of Guelph, Ontario, Kanada.
|
|
(11)
|
Soil Texture Classification (US and FAO systems): Weed Science, 33, Suppl. 1 (1985) och Soil Sc. Soc. Amer. Proc. 26:305 (1962).
|
|
(12)
|
Audus, L. J. (1964). Herbicide behaviour in the soil. I: Audus, L. J. (red.) The Physiology and Biochemistry of Herbicides, London, New York, Academic Press, NY, kapitel 5, s. 163–206.
|
|
(13)
|
Beall, M. L., Jr. och Nash, R. G. (1969). Crop seedling uptake of DDT, dieldrin, endrin, and heptachlor from soil, J. Agro. 61, 571–575.
|
|
(14)
|
Beetsman, G. D., Kenney, D. R. och Chesters, G. (1969). Dieldrin uptake by corn as affected by soil properties, J. Agro. 61, 247–250.
|
|
(15)
|
U.S. Food and Drug Administration (FDA). (1987). Environmental Assessment Technical Handbook. Environmental Assessment Technical Assistance Document 4.07, Seedling Growth, 14 s., FDA, Washington, DC.
|
|
(16)
|
McKelvey, R. A., Wright, J. P., Honegger, J. L. och Warren, L. W. (2002). A Comparison of Crop and Non-crop Plants as Sensitive Indicator Species for Regulatory Testing. Pest Management Science, vol. 58, 1161–1174.
|
|
(17)
|
Boutin, C., Elmegaard, N. och Kjær, C. (2004). Toxicity testing of fifteen non-crop plant species with six herbicides in a greenhouse experiment: Implications for risk assessment. Ecotoxicology, vol. 13:4, 349–369.
|
|
(18)
|
Boutin, C. och Rogers, C. A. (2000). Patterns of sensitivity of plant species to various herbicides – An analysis with two databases. Ecotoxicology, vol. 9:4, 255–271.
|
|
(19)
|
Boutin, C. och Harper, J. L. (1991). A comparative study of the population dynamics of five species of Veronica in natural habitats. J. Ecol. 9, 155–271.
|
|
(20)
|
Boutin, C., Lee, H.-B., Peart, T. E., Batchelor, S. P. och Maguire, R. J. (2000). Effects of the sulfonylurea herbicide metsulfuron methyl on growth and reproduction of five wetland and terrestrial plant species. Envir. Toxicol. Chem. 19:10, 2532–2541.
|
|
(21)
|
OECD (2006). Guidance Document, Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. Series on Testing and Assessment nr 54, Organisationen för ekonomiskt samarbete och utveckling, Paris.
|
|
(22)
|
Hatzios, K. K. och Penner, D. (1985). Interactions of herbicides with other agrochemicals in higher plants. Rev. Weed Sci. 1, 1–63.
|
|
(23)
|
Hamill, P. B., Marriage, P. B. och G. Friesen. (1977). A method for assessing herbicide performance in small plot experiments. Weed Science 25, 386–389.
|
|
(24)
|
Frans, R. E. och Talbert, R. E. (1992). Design of field experiments and the measurement and analysis of plant response. I: B. Truelove (red.) Research Methods in Weed Science, andra upplagan, Southern Weed Science Society, Auburn, 15–23.
|
|
(25)
|
Bruce, R. D. och Versteeg, D. J. (1992). A Statistical Procedure for Modelling Continuous Toxicity Data. Environmental Toxicology and Chemistry 11, 1485–1492.
|
|
(26)
|
Kapitel C.33 i denna bilaga: Reproduktionstest för daggmaskar (Eisenia fetida och Eisenia andrei).
|
Tillägg 1
Definitioner
Aktiv substans (eller verksamt ämne)
: ett ämne som har skapats för att ge en viss biologisk verkan (t.ex., insektsbekämpning, bekämpning av växtsjukdomar, ogräsbekämpning på exponeringsområdet), även kallat verksam beståndsdel av teknisk kvalitet, verksamt ämne.
Kemikalie
: ett ämne eller en blandning.
Växtskyddsprodukter eller växtskyddsmedel eller bekämpningsmedel
: ämnen med en särskild biologisk aktivitet som avsiktligt används för att skydda grödor mot skadedjur (t.ex. svampsjukdomar, insekter och konkurrerande plantor).
ECx (x % Effect Concentration) eller ERx (x % Effect Rate)
: den koncentration eller den dos som leder till en oönskad ändring med x % av den endpoint i testet som mäts i förhållande till kontrollen (t.ex. en 25 % eller 50 % minskning av grobarheten, skottens vikt, det slutliga antalet plantor, eller ökning av de synbara skadorna skulle utgöra EC25/ER25 respektive EC50/ER50).
Groning
: koleoptilens eller hjärtblandens framträdande ovanför markytan.
Beredning
: den kommersiella sammansatta produkt som innehåller det verksamma ämnet (den aktiva substansen), även kallat slutlig beredning (8) eller typisk slutanvändningsprodukt (TEP, typical end-use product).
Lägsta koncentration med observerad effekt (LOEC)
: den lägsta koncentration av testkemikalien vid vilken effekt har noterats. I detta test har en koncentration som motsvarar LOEC en statistiskt signifikant effekt (p < 0,05) efter en given exponeringstid jämfört med kontrollen, och är högre än NOEC-värdet.
Växter som inte är målarter
: växter som befinner sig utanför målområdet. För växtskyddsprodukter gäller detta vanligtvis växter som befinner sig utanför det behandlade området.
Nolleffektkoncentrationen (NOEC)
: den högsta koncentrationen av testkemikalien vid vilken ingen effekt har noterats. I detta test har en halt som motsvarar NOEC ingen statistiskt signifikant effekt (p < 0,05) efter en given exponeringstid jämfört med ett kontrollprov.
Fytotoxicitet
: negativa avvikelser (av uppmätta och visuella utvärderingar) från plantornas normala typexempel när det gäller utseende och tillväxt som reaktion på en bestämd kemikalie.
Replikat
: den experimentella enhet som motsvarar kontrollgruppen och/eller testgruppen. I dessa undersökningar definieras en kruka som replikat.
Visuell bedömning
: värdering av synliga skador som grundar sig på observationer av upprätt växt, växtkraft, missbildningar, kloros, nekros och helhetsutseende jämfört med en kontroll.
Testkemikalie
: alla ämnen eller blandningar som testas med denna testmetod.
Tillägg 2
Förteckning över arter som historiskt sett har använts för växttester
|
Familj
|
Art
|
Svenskt namn
|
|
DICOTYLEDONAE
|
|
Apiaceae (Umbelliferae)
|
Daucus carota
|
Morot
|
|
Asteraceae (Compositae)
|
Helianthus annuus
|
Solros
|
|
Asteraceae (Compositae)
|
Lactuca sativa
|
Sallat
|
|
Brassicaceae (Cruciferae)
|
Sinapis alba
|
Vitsenap
|
|
Brassicaceae (Cruciferae)
|
Brassica campestris var. chinensis
|
Salladskål
|
|
Brassicaceae (Cruciferae)
|
Brassica napus
|
Raps
|
|
Brassicaceae (Cruciferae)
|
Brassica oleracea var. capitata
|
Vitkål
|
|
Brassicaceae (Cruciferae)
|
Brassica rapa
|
Rova
|
|
Brassicaceae (Cruciferae)
|
Lepidium sativum
|
Kryddkrasse
|
|
Brassicaceae (Cruciferae)
|
Raphanus sativus
|
Rädisa
|
|
Chenopodiaceae
|
Beta vulgaris
|
Sockerbeta
|
|
Cucurbitaceae
|
Cucumis sativus
|
Gurka
|
|
Fabaceae (Leguminosae)
|
Glycine max (G. soja)
|
Sojaböna
|
|
Fabaceae (Leguminosae)
|
Phaseolus aureus
|
Mungböna
|
|
Fabaceae (Leguminosae)
|
Phaseolus vulgaris
|
Böna
|
|
Fabaceae (Leguminosae)
|
Pisum sativum
|
Ärtor
|
|
Fabaceae (Leguminosae)
|
Trigonella foenum-graecum
|
Bockhornsklöver
|
|
Fabaceae (Leguminosae)
|
Lotus corniculatus
|
Käringtand
|
|
Fabaceae (Leguminosae)
|
Trifolium pratense
|
Rödklöver
|
|
Fabaceae (Leguminosae)
|
Vicia sativa
|
Vicker
|
|
Linaceae
|
Linum usitatissimum
|
Lin
|
|
Polygonaceae
|
Fagopyrum esculentum
|
Bovete
|
|
Solanaceae
|
Solanum Lycopersicon
|
Tomat
|
|
MONOCOTYLEDONAE
|
|
Liliaceae (Amarylladaceae)
|
Allium cepa
|
Lök
|
|
Poaceae (Gramineae)
|
Avena sativa
|
Havre
|
|
Poaceae (Gramineae)
|
Hordeum vulgare
|
Korn
|
|
Poaceae (Gramineae)
|
Lolium perenne
|
Engelskt rajgräs
|
|
Poaceae (Gramineae)
|
Oryza sativa
|
Ris
|
|
Poaceae (Gramineae)
|
Secale cereale
|
Råg
|
|
Poaceae (Gramineae)
|
Sorghum bicolor
|
Durra
|
|
Poaceae (Gramineae)
|
Triticum aestivum
|
Vete
|
|
Poaceae (Gramineae)
|
Zea mays
|
Majs
|
Tillägg 3
Förteckning över potentiellt användbara arter som inte är grödor
OECD:s potentiellt användbara arter för testning av toxicitet
Anmärkning: Följande tabell innehåller uppgifter om 52 arter som inte är grödor (hänvisningar ges inom parentes för varje post). Grobarhetssiffrorna kommer från publicerade källor och är bara tänkta som allmän vägledning. Den enskilda erfarenheten kan variera beroende på den källa fröna kommer ifrån och andra faktorer.
|
FAMILJ Arter Vetenskapligt namn
(svenskt namn)
|
Livslängd (9) & livsmiljö
|
Frövikt
(mg)
|
Fotoperiod för groning eller tillväxt (10)
|
Planteringsdjup
(mm) (11)
|
Groningstid
(dagar) (12)
|
Särskild behandling (13)
|
Toxicitetstest (14)
|
Fröleve-rantörer (15)
|
Andra hänvisningar (16)
|
|
APIACEAE
Torilis japónica
(rödkörvel)
|
А, В störda områden, häckar, betesmarker (16, 19)
|
1,7–1,9 (14, 19)
|
L = M (14)
|
0
(1, 19)
|
5 (50 %) (19)
|
kall stratifiering (7, 14, 18, 19) mognande evt. nödvändigt (19) grobarheten hämmas av mörker (1, 19) inga särskilda behandlingar (5)
|
EFTER (5)
|
|
|
|
ASTERACEAE
Bellis perennis
(tusensköna)
|
Ρ
gräsmark, åkermark, gräsmattor (16, 19)
|
0,09–0,17 (4, 19)
|
L = M (14)
|
0
(4)
|
3 (50 %) (19)
11 (100 %) (18)
|
grobarheten påverkas ej av strålning (18, 19) inga särskilda behandlingar (4, 14)
|
EFTER (4)
|
A, D, F
|
7
|
|
Centaurea cyanus
(blåklint)
|
A
fält, vägkanter, öppen miljö (16)
|
4,1–4,9 (4, 14)
|
L = M (14)
|
0–3 (2, 4, 14)
|
14–21 (100 %) (14)
|
Inga särskilda behandlingar (2, 4)
|
EFTER (2,4)
|
A, D, E, F
|
7
|
|
Centaurea nigra
(svartklint)
|
Ρ
fält, vägkanter, öppen miljö (16, 19)
|
2,4–2,6 (14, 19)
|
L = M (14)
|
0 (19)
|
3 (50 %) (19)
4 (97 %) (18)
|
mognande evt. nödvändigt (18, 19) grobarheten hämmas av mörker (19) inga särskilda behandlingar (5, 14, 26)
|
EFTER (5, 22, 26)
|
A
|
|
|
Inula helenium
(ålandsrot)
|
Ρ
fuktiga, störda områden
(16)
|
1–1,3 (4, 14, 29)
|
|
0
(4, 29)
|
|
inga särskilda behandlingar (4)
|
EFTER (4)
|
A, F
|
|
|
Leontodon hispidus
(sommarfibbla)
|
Ρ
fält, vägkanter, störda områden (16, 19)
|
0,85–1,2 (14, 19)
|
L = M (14)
|
0 (19)
|
4 (50 %) (19)
7 (80 %) (18)
|
grobarheten hämmas av mörker (17, 18, 19) inga särskilda behandlingar (5, 23)
|
EFTER (5, 22, 23)
|
|
|
|
Rudbeckia hirta
(sträv rudbeckia)
|
Β, Ρ störda områden
(16)
|
0,3 (4, 14)
|
L = M (14)
|
0
(4, 33)
|
< 10 (100 %) (33)
|
inga särskilda behandlingar
(4, 14, 33)
|
EFTER (4, 33)
|
C, D, E, F
|
|
|
Solidago canadensis
(kanadensiskt gullris)
|
Ρ
betesmark, öppna områden (16)
|
0,06–0,08 (4, 14)
|
L = M (11)
|
0
(4)
|
14–21
(11)
|
blanda med lika delar sand och blötlägg i 500ppm gibberellinsyra i 24 timmar (11) inga särskilda behandlingar (4)
|
EFTER (4)
|
E, F
|
|
|
Xanthium pensylvanicum
(gullfrö)
|
A
fält, öppen miljö (16)
|
25–61 (14, 29)
|
|
0 (1)
5 (29)
|
|
grobarheten kan begränsas av mörker (1) blötlägg i varmt vatten i 12 timmar (29)
|
FÖRE & EFTER (31)
|
A
|
|
|
Xanthium spinosum
(tistelgullfrö)
|
A
öppen miljö (16)
|
200 (14)
|
L = M (14)
L > M (6)
|
10
(6)
|
|
scarifiering (14) inga särskilda behandlingar (6)
|
FÖRE & EFTER (6)
|
A
|
|
|
Xanthium strumarium
(mörkt gullfrö)
|
A
fält, öppen miljö (16)
|
67,4 (14)
|
L = M (14)
|
10–20 (6, 21)
|
|
inga särskilda behandlingar
(6, 14, 21)
|
FÖRE & EFTER (6, 21, 28, 31)
|
A
|
|
|
BRASSICACEAE
Cardamine pratensis
(ängsbräsma)
|
Ρ
fält, vägkanter, gräsmattor(16, 19)
|
0,6 (14, 19)
|
L = M (14)
|
0 (19)
|
5 (50 %) (19)
15 (98 %) (18)
|
grobarheten hämmas av mörker (18, 19) inga särskilda behandlingar (5, 14, 22)
|
EFTER (5, 22)
|
F
|
|
|
CARYOPHYLLACEAE
Lychnis flos-cuculi
(gökblomster)
|
Ρ
(16)
|
0,21 (14)
|
L = M (14)
|
|
< 14 (100 %) (14, 25)
|
mognande evt. nödvändigt (18) inga särskilda behandlingar (5, 14, 15, 22 och 26)
|
EFTER (5, 15, 22–26)
|
F
|
|
|
CHENOPODIACEAE
Chenopodium album
(svinmålla)
|
A
åkerkanter, störda områden (16, 19)
|
0,7–1,5 (14, 19, 34)
|
L = M (14)
|
0
(1, 19)
|
2 (50 %) (19)
|
behandlingen varierar beroende på frönas färg (19) torrlagring under vintervila (19) grobarheten hämmas av mörker (1, 18, 19) kall stratifiering (18) inga särskilda behandlingar (14, 34)
|
FÖRE & EFTER (28, 31, 34)
|
A
|
32
|
|
CLUSIACEAE
Hypericum perforatum
(johannesört)
|
Ρ
fält, åkermark, öppen miljö (16, 19)
|
0,1–0,23
(14, 19)
|
L = M
(14)
|
0
(1, 19)
|
3 (19)
11 (90 %) (18)
|
grobarheten hämmas av mörker (1, 18, 19)
inga särskilda behandlingar (5, 14, 15, 25, 27)
|
EFTER
(5, 15, 25, 27)
|
A, E, F
|
|
|
CONVOLVULACEAE
Ipomoea hederacea
(murgrönsvinda)
|
A
vägkanter, öppen miljö, veteåkrar (16)
|
28,2
(14)
|
L > M
(6, 10)
|
10–20
(6, 10, 21)
|
4 (100 %)
(10)
|
grobarheten påverkas inte av strålning (1)
inga särskilda behandlingar (6, 21)
|
FÖRE & EFTER
(6, 12, 21, 28)
|
A
|
|
|
CYPERACEAE
Cyperus rotundus
(runt cypergräs)
|
Ρ
åkermark, betesmark, vägkanter (16, 30)
|
0,2
(14)
|
L = M
(14)
|
0 (1)
10–20 (6, 10).
|
12 (91 %)
(10)
|
grobarheten hämmas av mörker (1)
inga särskilda behandlingar (6, 10, 14)
|
FÖRE & EFTER
(6, 28, 31)
|
B
|
7
|
|
FABACEAE
Lotus corniculatus
(käringtand)
|
Ρ
gräsbevuxna områden, vägkanter, öppen miljö (16, 19)
|
1–1,67
(14, 19)
|
L = M (14)
|
|
1 (50 %)
(19)
|
scarifiering (14, 19)
grobarheten påverkas inte av strålning (18, 19) inga särskilda behandlingar (23, 25)
|
EFTER
(5, 23, 25)
|
A, D, E, F
|
|
|
Senna obtusifolia
(sojasenna)
|
A
fuktiga skogar (16)
|
23–28
(9)
|
L = M (14)
L > M (9)
|
10–20
(6,9)
|
|
blötlägg fröna i vatten i 24 timmar (9)
scarifiering (14) frönas livskraft beror på färgen (1) inga särskilda behandlingar (6)
|
EFTER
(6,9)
|
A
|
|
|
Sesbania exaltata
(svenskt namn saknas)
|
A
alluvial jord (16)
|
11–13
(9, 14)
|
L > M (9)
|
10–20
(9, 21)
|
|
blötlägg fröna i vatten i 24 timmar (9)
grobarheten påverkas inte av strålning (1) inga särskilda behandlingar (21)
|
FÖRE & EFTER
(9, 21, 28, 31)
|
A
|
|
|
Trifolium pratense
(rödklöver)
|
Ρ
fält, vägkanter, åkermark (16, 19)
|
1,4–1,7
(14, 19)
|
L = M (14)
|
|
1 (50 %)
(19)
|
scarifiering (14, 18)
mognande evt. nödvändigt (19) grobarheten påverkas inte av strålning (1, 19) inga särskilda behandlingar (5)
|
EFTER
(5)
|
A, E, F
|
|
|
LAMIACEAE
Leonurus cardiaca
(hjärtstilla)
|
Ρ
öppna områden (16)
|
0,75–1,0
(4, 14)
|
L = M (14)
|
0
(4)
|
|
inga särskilda behandlingar
(4, 14)
|
EFTER
(4)
|
F
|
|
|
Mentha spicata
(grönmynta)
|
Ρ
fuktiga områden (16)
|
2,21
(4)
|
|
0
(4)
|
|
inga särskilda behandlingar
(4)
|
EFTER
(4)
|
F
|
|
|
Nepeta cataria
(kattmynta)
|
Ρ
störda områden (16)
|
0,54
(4, 14)
|
L = M (14)
|
0
(4)
|
|
inga särskilda behandlingar
(2, 4, 14)
|
EFTER
(2, 4)
|
F
|
|
|
Prunella vulgaris
(brunört)
|
Ρ
åkermark, gräsbevuxna områden, störda områden (16, 19)
|
0,58–1,2
4, 14, 19
|
L = M (14)
|
0
4, 19
|
5 (50 %) (19)
7 (91 %) (18)
|
grobarheten hämmas av mörker (18, 19)
större grobarhet med större frön (1) inga särskilda behandlingar (4, 14, 22)
|
EFTER
(4, 22)
|
A, F
|
|
|
Stachys officinalis
(humlesuga)
|
Ρ
gräsmark, åkerkanter (19)
|
14–18
(14, 19)
|
L = M (14)
|
|
7 (50 %)
(19)
|
inga särskilda behandlingar
(5, 14, 22)
|
EFTER
(5, 22)
|
F
|
|
|
MALVACEAE
Abutilón theophrasti
(lindmalva)
|
A
fält, öppen miljö (16)
|
8,8
(14)
|
L = M (14)
|
10–20
(6, 10, 21)
|
4 (84 %)
(10)
|
scarifiering (14)
inga särskilda behandlingar (5, 10, 21)
|
FÖRE & EFTER
(6, 22, 28, 31)
|
A, F
|
|
|
Sida spinosa
(taggmalva)
|
A
fält, vägkanter (16)
|
3,8
(14)
|
L = M (14)
|
10–20
6, 21
|
|
scarifiering (14)
grobarheten påverkas inte av strålning (1) inga särskilda behandlingar (6, 21)
|
FÖRE & EFTER
6, 21, 28, 31
|
A, F
|
|
|
PAPAVERACEAE
Papaver rhoeas
(kornvallmo)
|
A
fält, åkermark, störda områden (16, 19)
|
0,1–0,3
4, 14, 19, 29
|
L = M (14)
|
0
(4, 29)
|
4 (50 %)
(19)
|
kall stratifiering & scarifiering (1, 19, 32)
inga särskilda behandlingar (4, 14, 29)
|
EFTER
(4)
|
A, D, E, F, G
|
|
|
POACEAE
Agrostis tenuis
(rödven)
|
gräsmattor, betesmark (16)
|
0,07 (14)
|
L > M (Ю)
|
20 (10)
|
10 (62 %) (10)
|
grobarheten hämmas av mörker (1, 17–19) inga särskilda behandlingar (10)
|
EFTER (10)
|
A, E
|
|
|
Alopecurus myosuroides
(renkavle)
|
A
fält, öppen miljö (16)
|
0,9–1,6
(29, 34)
|
L = M (14)
|
2
(29)
|
< 24 (30 %) (34)
|
scarifiering (14) behandla med 101 mg/l KNO3 (14) varm stratifiering (1) grobarheten hämmas av mörker (1) inga särskilda behandlingar (34)
|
FÖRE & EFTER
(28, 34)
|
A
|
32
|
|
Avena fatua
(flyghavre)
|
A
odlade områden, öppen miljö (16)
|
7–37,5 (14, 30)
|
L = M (14)
L > M (6)
|
10–20 (6, 10).
|
3 (70 %) (18)
|
scarifiering (7, 32) mörker hämmar grobarheten (1)
kall stratifiering (1, 18) inga särskilda behandlingar (6, 10, 14)
|
FÖRE & EFTER (6, 10, 28, 31)
|
A
|
|
|
Bromus tectorum
(taklosta)
|
A
fält, vägkanter, åkermark (16)
|
0,45–2,28 (14, 29)
|
L = M (14)
|
3 (29)
|
|
mognadsperiod (1, 7, 32) grobarheten hämmas av ljus (1) inga särskilda behandlingar (14)
|
FÖRE & EFTER (28, 31)
|
A
|
|
|
Cynosurus cristatus
(kamäxing)
|
P
fält, vägkanter, öppen miljö (16, 19)
|
0,5–0,7 (14, 19, 29)
|
L = M (14)
|
0 (29)
|
3 (50 %) (19)
|
grobarheten påverkas inte av strålning (19) inga särskilda behandlingar (14, 29)
|
EFTER (5)
|
A
|
|
|
Digitaria sanguinalis
(blodhirs)
|
A
fält, gräsmattor, öppen miljö (16)
|
0,52–0,6 (14, 30)
|
L = M (14)
|
10-20 (21)
|
7 (75 %)
14 (94 %) (7)
|
scarifiering, kall stratifiering, & mognande (1, 7, 14, 32) behandlas med 101 mg/l KNO3 (14) grobarheten hämmas av mörker (1) inga särskilda behandlingar (21)
|
FÖRE & EFTER (18, 25, 31)
|
A
|
|
|
Echinochloa crus-galli
(hönshirs)
|
A
(16)
|
1,5 (14)
|
L = M (14)
L > M (3)
|
10–20 (7, 21)
|
|
scarifiering (7, 32) grobarheten påverkas inte av strålning (1) inga särskilda behandlingar (3, 14, 21)
|
FÖRE & EFTER (3, 21, 28, 31)
|
A
|
|
|
Elymus canadensis
(kanadaelm)
|
P
strandnära, störda områden (16)
|
4–5 (14, 30)
|
L = M (11)
|
1
(11)
|
14–28
(11)
|
inga särskilda behandlingar
(2, 11)
|
EFTER (2)
|
C, D, E
|
|
|
Festuca pratensis
(ängssvingel)
|
P
fält, fuktiga områden (16, 19)
|
1,53–2,2 (16, 19)
|
L = M (14)
L > M (10)
|
20 (10)
|
9 (74 %) (10)
2 (50 %) (19)
|
inga särskilda behandlingar
(10, 19)
|
EFTER (10)
|
A
|
7
|
|
Hordeum pusillum
(dvärgkorn)
|
A
betesmark, vägkanter, öppen miljö (16)
|
3,28 (14)
|
|
|
|
Varm stratifiering (1) grobarheten påverkas inte av strålning (1)
|
FÖRE (31)
|
|
7
|
|
Phieum pratense
(timotej)
|
P
betesmark, åkermark, störda områden (16, 19)
|
0,45 (14, 19)
|
L > M (10, 14)
|
0–10 (10, 19)
|
2 (74 %) (10)
8 (50 %) (19)
|
grobarheten hämmas av mörker (19) grobarheten påverkas inte av strålning (17) inga särskilda behandlingar (10, 14, 17, 19)
|
EFTER (10)
|
A, E
|
|
|
POLYGONACEAE
Polygonum convolvulus
(åkerbinda)
|
A
öppen miljö, vägkanter (16)
|
5–8 (4, 14, 29)
|
L = M (20)
|
0–2 (4, 29)
|
|
Kall stratifiering i 4–8 veckor (1, 2, 4, 20, 29) grobarheten påverkas inte av strålning (1)
|
FÖRE & EFTER 1, 2, 20, 28, 31
|
A
|
32
|
|
Polygonum lapathifolium
(pilört)
|
A
fuktig jord (16)
|
1,8–2,5 (14)
|
L > M (6)
|
|
5 (94 %) (18)
|
Grobarheten påverkas inte av strålning (1) grobarheten hämmas av mörker (18) kall stratifiering (1) inga särskilda behandlingar (5)
|
FÖRE & EFTER (6)
|
A, E
|
|
|
Polygonum pennsylvanicum
(svenskt namn saknas)
|
A
fält, öppen miljö (16)
|
3,6–7 (14, 29)
|
|
2 (29)
|
|
kall stratifiering i 4 v. vid 0–5 °C (1, 29) grobarheten hämmas av mörker (1)
|
FÖRE (31)
|
A, E
|
|
|
Polygonum persicaria
(åkerpilört)
|
A
störda områden, åkermark (16, 19)
|
2,1–2,3 (14, 19)
|
L > M (13)
|
0 (19)
|
< 14 (13)
2 (50 %) (19)
|
scarifiering, kall stratifiering, behandling med gibberellinsyra (14) kall stratifiering, mognande (17–19) grobarheten hämmas av mörker (19) inga särskilda behandlingar (13)
|
EFTER (13)
|
A
|
32
|
|
Rumex crispus
(krusskräppa)
|
P
åkermark, vägkanter, öppna områden (16, 19)
|
1,3–1,5 (4, 14, 19)
|
L = M (14, 33)
|
0
(4, 19, 33)
|
3 (50 %) (19)
6 (100 %) (33)
|
grobarheten hämmas av mörker (18, 19) mognande evt. nödvändigt (18) inga särskilda behandlingar (4, 14, 33)
|
EFTER (4, 33)
|
A, E
|
32
|
|
PRIMULACEAE
Anagallis arvensis
(rödmire)
|
A
åkermark, öppna områden, störda områden (16, 19)
|
0,4–0,5 (4, 14, 19)
|
L = M (14)
|
|
1 (50 %) (19)
|
kall stratifiering, behandling med gibberellinsyra (1,14, 18, 19, 32) ljus krävs för groning (1) inga särskilda behandlingar (2, 4)
|
EFTER (2,4)
|
A, F
|
|
|
RANUNCULACEAE
Ranunculus acris
(smörblomma)
|
Ρ
åkermark, vägkanter, öppna områden (16, 19)
|
1,5–2 (14, 19, 29)
|
L = M (14)
|
1
(29)
|
41–56 (19, 29)
|
inga särskilda behandlingar
(5, 14, 22, 24–26)
|
EFTER (5, 22, 24–26)
|
|
32
|
|
ROSACEAE
Geum urbanum
(nejlikrot)
|
Ρ
häckar, fuktiga områden
(16, 19)
|
0,8–1,5 (14, 19)
|
L = M (14)
|
0 (19)
|
5 (50 %) (19)
16 (79 %) (18)
|
grobarheten hämmas av mörker (18, 19) varm stratifiering (1) inga särskilda behandlingar (5, 14, 22, 25, 26)
|
EFTER (5, 22, 25, 26)
|
A
|
|
|
RUBIACEAE
Galium aparine
(snärjmåra)
|
A
åkermark, fuktiga områden, störda områden (16, 19)
|
7–9 (14, 19)
|
L = M (14)
|
|
5 (50 %) (19)
6 (100 %) (18)
|
kall stratifiering (1, 18, 19) grobarheten påverkas inte av strålning (18, 19) ljus hämmar grobarheten (1) inga särskilda behandlingar (6, 14)
|
FÖRE & EFTER (6, 28)
|
A
|
32
|
|
Galium mollugo
(stormåra)
|
Ρ
häckvallar, öppna områden (8)
|
7
(29)
|
L = M (14)
|
2
(29)
|
|
inga särskilda behandlingar
(5, 14, 22, 24, 26, 29)
|
EFTER (5, 22, 24, 26)
|
A
|
|
|
SCROPHULARIACEAE
Digitalis purpurea
(fingerborgsblomma)
|
Β, P häckar, öppna områden (16, 19)
|
0,1–0,6 (4, 14, 19)
|
L = M (14)
|
0
4, 19
|
6 (50 %) (19)
8 (99 %) (18)
|
grobarheten hämmas av mörker (1, 17 och 19) inga särskilda behandlingar (4, 22 och 26)
|
EFTER (4, 22–26)
|
D, F, G
|
|
|
Veronica persica
(trädgårdsveronika)
|
A
åkermark, öppna områden, störda områden (16, 19)
|
0,5–0,6 (14, 19)
|
L = M (14)
|
0 (19)
|
3 (19)
5 (96 %) (18)
|
grobarheten hämmas av mörker (18, 19) kall stratifiering (18) inga särskilda behandlingar (14)
|
FÖRE & EFTER (28)
|
A
|
32
|
Fröleverantörer som anges i tabellen
|
Leverantörs-ID
|
Leverantörsuppgifter
|
|
A
|
|
Herbiseed
|
|
New Farm, Mire Lane, West End, Twyford RG10 0NJ ENGLAND +44 (0) 1189 349 464
|
|
www.herbiseed.com
|
|
|
B
|
|
Tropilab Inc.
|
|
8240 Ulmerton Road, Largo, FL 33771-3948 USA
|
|
(727) 344 – 4050
|
|
www.tropilab.com
|
|
|
C
|
|
Pterophylla – Native Plants & Seeds
|
|
#316 Regional Road 60, RR#1, Walsingham, ON N0E 1X0 KANADA (519) 586 – 3985
|
|
|
D
|
|
Applewood Seed Co.
|
|
5380 Vivian St., Arvada, CO 80002 USA (303) 431 – 7333
|
|
www.applewoodseed.com
|
|
|
E
|
|
Ernst Conservation Seeds
|
|
9006 Mercer Pike, Meadville, PA 16335 USA
|
|
(800) 873 – 3321
|
|
www.ernstseed.com
|
|
|
F
|
|
Chiltern Seeds
|
|
Bortree Stile, Ulverston, Cumbria LA12 7PB ENGLAND
|
|
+ 44 1229 581137
|
|
www.chilternseeds.co.uk
|
|
|
G
|
|
Thompson & Morgan
|
|
P.O. Box 1051, Fort Erie, ON L2A 6C7 KANADA (800) 274 – 7333
|
|
www.thompson-morgan.com
|
|
HÄNVISNINGAR
|
(1)
|
Baskin, C. C. och Baskin, J. M. (1998). Seeds. Academic Press, Toronto
|
|
(2)
|
Blackburn, L. G. och Boutin, C. (2003). Subtle effects of herbicide use in the context of genetically modified crops: a case study with glyphosate (Round-Up®). Ecotoxicology, 12, 271–285.
|
|
(3)
|
Boutin, C., Lee, H-B., Peart, T., Batchelor, P. S och Maguire, R. J. (2000). Effects of the sulfonylurea herbicide metsulfuron methyl on growth and reproduction of five wetland and terrestrial plant species. Environmental Toxicology & Chemistry, 19:10, 2532–2541.
|
|
(4)
|
Boutin, C., Elmegaard, N. och Kjaer, C. (2004). Toxicity testing of fifteen non-crop plant species with six herbicides in a greenhouse experiment: implications for risk assessment. Ecotoxicology, 13, 349–369.
|
|
(5)
|
Breeze, V., Thomas, G. och Butler, R. (1992). Use of a model and toxicity data to predict the risks to some wild plant species from drift of four herbicides. Annals of Applied Biology, 121, 669–677.
|
|
(6)
|
Brown, R. A. och Farmer, D. (1991). Track-sprayer and glasshouse techniques for terrestrial plant bioassays with pesticides. I: Plants for toxicity assessment, vol. 2. ASTM STP 1115, J. W. Gorsuch, W. R. Lower, W. Wang och M. A. Lewis (red.). American Society for Testing & Materials, Philadelphia. s. 197–208.
|
|
(7)
|
Buhler, D. D. och Hoffman, M. L. (1999). Anderson's guide to practical methods of propagating weeds and other plants. Weed Science Society of America, Lawrence, K.
|
|
(8)
|
Clapham, P. A., Tutin, T. G. och Warburg, E .F. (1981). Excursion flora of the British Isles, tredje upplagan. Cambridge University Press, Cambridge
|
|
(9)
|
Clay, P. A. och Griffin, J. L. (2000). Weed seed production and seedling emergence response to late-season glyphosate applications. Weed Science, 48, 481–486.
|
|
(10)
|
Cole, J. F. H. och Canning, L. (1993). Rationale for the choice of species in the regulatory testing of the effects of pesticides on terrestrial non-target plants. BCPC – Weeds. s. 151–156.
|
|
(11)
|
Fiely, M. (Ernst Conservation Seeds). (2004). Pers. med. (www.ernstseed.com)
|
|
(12)
|
Fletcher, J. S., Johnson, F. L. och McFarlane, J. C. (1990). Influence of greenhouse versus field testing and taxonomic differences on plant sensitivity to chemical treatment. Environmental Toxicology & Chemistry, 9, 769–776.
|
|
(13)
|
Fletcher, J. S., Pfleeger, T. G., Ratsch, H. C. och Hayes, R. (1996). Potential impact of low levels of chlorsulfuron and other herbicides on growth and yield of nontarget plants. Environmental Toxicology & Chemistry, 15:7, 1189–1196.
|
|
(14)
|
Flynn, S., Turner, R. M., och Dickie, J. B. (2004). Seed Information Database (utgåva 6.0, oktober 2004) Royal Botanic Gardens, Kew (www.rbgkew.org.uk/data/sid)
|
|
(15)
|
Franzaring, J., Kempenaar, C. och van der Eerden, L. J. M. (2001). Effects of vapours of chlorpropham and ethofumesate on wild plant species. Environmental Pollution, 114, 21–28.
|
|
(16)
|
Gleason, H.A. och Cronquist, A. (1991). Manual of vascular plants of northeastern United States and adjacent Canada, andra upplagan. New York Botanical Garden, Bronx, NY
|
|
(17)
|
Grime, J. P. (1981). The role of seed dormancy in vegetation dynamics. Annals of Applied Biology, 98, 555–558.
|
|
(18)
|
Grime, J. P., Mason, G., Curtis, A. V., Rodman, J., Band, S. R., Mowforth, M. A. G., Neal, A. M. och Shaw, S. (1981). A comparative study of germination characteristics in a local flora. Journal of Ecology, 69, 1017–1059.
|
|
(19)
|
Grime, J. P., Hodgson, J. G. och Hunt, R. (1988). Comparative plant ecology: a functional approach to common British species. Unwin Hyman Ltd., London
|
|
(20)
|
Kjaer, C. (1994). Sublethal effects of chlorsulfuron on black bindweed (Polygonum convolvulus L.). Weed Research, 34, 453–459.
|
|
(21)
|
Klingaman, T. E., King, C. A. och Oliver, L. R. (1992). Effect of application rate, weed species, and weed stage of growth on imazethapyr activity. Weed Science, 40, 227–232.
|
|
(22)
|
Marrs, R. H., Williams, C. T., Frost, A. J. och Plant, R. A. (1989). Assessment of the effects of herbicide spray drift on a range of plant species of conservation interest. Environmental Pollution, 59, 71–86.
|
|
(23)
|
Marrs, R. H., Frost, A. J. och Plant, R.A. (1991). Effects of herbicide spray drift on selected species of nature conservation interest: the effects of plant age and surrounding vegetation structure. Environmental Pollution, 69, 223–235.
|
|
(24)
|
Marrs, R. H., Frost, A. J. och Plant, R.A. (1991). Effects of mecoprop drift on some plant species of conservation interest when grown in standardized mixtures in microcosms. Environmental Pollution, 73, 25–42.
|
|
(25)
|
Marrs, R. H., Frost, A. J., Plant, R. A. och Lunnis, P. (1993). Determination of buffer zones to protect seedlings of non-target plants from the effects of glyphosate spray drift. Agriculture, Ecosystems, & Environment, 45, 283–293.
|
|
(26)
|
Marrs, R. H. och Frost, A. J. (1997). A microcosm approach to detection of the effects of herbicide spray drift in plant communities. Journal of Environmental Management, 50, 369–388.
|
|
(27)
|
Marshall, E. J. P. och Bernie, J. E. (1985). Herbicide effects on field margin flora. BCPC – Weeds. s. 1021–1028.
|
|
(28)
|
McKelvey, R. A., Wright, J. P. och Honegger, J. L. (2002). A comparison of crop and non-crop plants as sensitive species for regulatory testing. Pest Management Science, 58, 1161–1174.
|
|
(29)
|
Morton, S. (Herbiseed). (2004). Pers. med. (http://www.herbiseed.com)
|
|
(30)
|
USDA, NRCS. (2004). The Plants Database, version 3.5. (http://plants.usda.gov). National Plant Data Centre, Baton Rouge, LA 70874-4490 USA
|
|
(31)
|
USEPA. (1999). One-Liner Database. [U.S. E.P.A./Office of Pesticide Programs/Environmental Fate and Effects Division/Environmental Epidemiology Branch].
|
|
(32)
|
Webster, R. H. (1979). Technical Report No. 56: Growing weeds from seeds and other propagules for experimental purposes. Agricultural Research Council Weed Research Organization, Oxford.
|
|
(33)
|
White, A. L. och Boutin, C. (National Wildlife Research Centre, Environment Canada). (2004). Pers. med.
|
|
(34)
|
Zwerger, P. och Pestemer, W. (2000). Testing the phytotoxic effects of herbicides on higher terrestrial non-target plants using a plant life-cycle test. Z. PflKrankh. Pflschutz: Sonderh., 17, 711–718.
|
Tillägg 4
Exempel på lämpliga odlingsbetingelser för vissa arter av grödor
Följande betingelser har befunnits lämpliga för tio arter av grödor, och de kan användas som vägledning för tester i odlingskammare med vissa andra arter:
|
|
Koncentration av koldioxid: 350 ± 50 ppm.
|
|
|
Relativ luftfuktighet 70 ± 5 % under ljusperioder och 90 ± 5 % under mörkerperioder.
|
|
|
Temperatur: 25 ± 3 °C under dagen, 20 ± 3 °C under natten.
|
|
|
Fotoperiod: 16 h ljus/8 h mörker. Ljuset ska ha en genomsnittlig våglängd på 400–700 nm.
|
|
|
Ljus: luminans 350 ± 50 μE/m2/s, uppmätt högst upp i krontaket.
|
Grödorna är följande:
|
—
|
tomat (Solanum lycopersicon),
|
|
—
|
gurka (Cucumis sativus),
|
|
—
|
trädgårdssallat (Lactuca sativa),
|
|
—
|
sojaböna (Glycine max),
|
|
—
|
kål (Brassica oleracea var. capitata),
|
|
—
|
engelskt rajgräs (Lolium perenne),
|
C.32. REPRODUKTIONSTEST FÖR SMÅRINGMASKAR (ENCHYTRAEIDAE)
INLEDNING
|
1.
|
Denna testmetod motsvarar OECD:s testriktlinje (TG) 220 (2004). Den är utformad för att användas för bestämning av effekterna av kemikalier på reproduktionskapaciteten hos småringmasken Enchytraeus albidus (vit ringmask) Henle 1873, i jord. Den bygger främst på en metod som har utvecklats av den federala tyska miljöskyddsmyndigheten (1) och som har ringtestats (2). Andra metoder för testning av kemikaliers toxicitet för småringmaskar och daggmaskar har också övervägts (3) (4) (5) (6) (7) (8).
|
INLEDANDE ÖVERVÄGANDEN
|
2.
|
Marklevande ringmaskar av släktet Enchytraeus är ekologiskt relevanta för ekotoxikologisk testning. Småringmaskar påträffas ofta i jordar som innehåller daggmaskar, men samtidigt är de ofta vanliga i många jordar där daggmaskar saknas. Småringmaskar kan användas i laboratorietester samt i studier under fältliknande förhållanden och i fältstudier. Ur praktisk synvinkel är många småringmaskar lätta att hantera och föda upp, och deras reproduktionscykel är betydligt kortare än daggmaskarnas. Ett reproduktionstest med småringmaskar tar därför bara 4–6 veckor, medan det för daggmaskar (Eisenia fetida) tar 8 veckor.
|
|
3.
|
Grundläggande information om småringmaskarnas ekologi och ekotoxikologi i terrester miljö finns i (9) (10) (11) (12).
|
PRINCIP FÖR TESTMETODEN
|
4.
|
Adulta småringmaskar exponeras för en serie koncentrationer av testkemikalien som blandats ner i syntetisk jord. Testet kan delas upp i två etapper: (a) ett preliminärt test, om inte tillräcklig information finns att tillgå, där dödligheten är den huvudsakliga endpoint som ska bedömas efter två veckors exponering och (b) ett definitivt reproduktionstest där det totala antalet avkommor som produceras av föräldradjuren samt föräldradjurens överlevnad bedöms. Varaktigheten för det definitiva testet är 6 veckor. Efter de första tre veckorna avlägsnas adulterna och morfologiska förändringar registreras. Efter ytterligare tre veckor räknas den avkomma som kläckts ur de kokonger som producerats av adulterna. Reproduktionskapaciteten hos de djur som exponerats för testkemikalien jämförs med kontrollen eller kontrollerna för att fastställa (i) den koncentation vid vilken inga verkningar observeras (NOEC) och/eller (ii) ECx (t.ex. EC10, EC50) genom att använda en regressionsmodell för att beräkna den koncentration som orsakar en minskning av reproduktionskapaciteten med x %. ECx bör ligga inom intervallet av testkoncentrationer (t.ex. EC10, EC50) så att ECx interpoleras snarare än extrapoleras.
|
INFORMATION OM TESTKEMIKALIEN
|
5.
|
Testkemikaliens vattenlöslighet, log Kow, fördelningskoefficient jord/vatten (t.ex. kapitel C.18 eller C.19 i denna bilaga) och ångtryck bör helst vara kända. Helst ska det finnas ytterligare information om testkemikaliens omvandling, spridning och fördelning i jord, såsom fotolys- och hydrolyshastighet.
|
|
6.
|
Testmetoden kan användas för kemikalier som är lösliga eller olösliga i vatten. Testkemikaliens appliceringsmetod måste dock anpassas i enlighet med detta. Testmetoden kan inte användas för flyktiga kemikalier, dvs. kemikalier för vilka Henrys konstant eller fördelningskoefficienten luft/vatten är större än ett, eller kemikalier för vilka ångtrycket överstiger 0,0133 Pa vid 25 °C.
|
TESTETS GILTIGHET
|
7.
|
För att testet ska vara giltigt måste följande kriterier uppfyllas för kontrollerna:
|
—
|
Dödligheten hos adulter bör inte överstiga 20 % i slutet av det preliminära testet och efter de första tre veckorna av reproduktionstestet.
|
|
—
|
Om man antar att tio adulter per kärl används i testets inledning bör i genomsnitt minst 25 juveniler per kärl ha producerats i slutet av testet.
|
|
—
|
Variationskoefficienten för det genomsnittliga antalet avkommor bör inte vara högre än 50 % i slutet av reproduktionstestet.
|
Om ett test inte uppfyller ovanstående kriterier för testresultatens giltighet bör testet avslutas, såvida inte en motivering för att fortsätta med testet kan ges. Motiveringen ska ingå i testrapporten.
|
REFERENSKEMIKALIE
|
8.
|
En referenskemikalie ska testas antingen regelbundet eller eventuellt som ett inslag i varje test för att kontrollera att testorganismernas reaktion inte har förändrats avsevärt med tiden. En lämplig referenskemikalie är karbendazim, som visat sig påverka småringmaskars överlevnad och fortplantning (13) (14). Andra kemikalier vars toxicitetsdata är välkända kan också användas. En beredning av karbendazim som har handelsbeteckningen Derosal™ och levereras av företaget AgrEvo (Frankfurt, Tyskland), och som innehåller 360 g/l (32,18 %) verksamt ämne har använts i ett ringtest (2). EC50-värdet för reproduktionen som fastställdes i ringtestet var i storleksordningen 1,2 ± 0,8 mg verksamt ämne/kg torrvikt (2). Om en positiv giftekvivalent ingår i testserien används en koncentration och antalet replikat bör vara detsamma som i kontrollerna. För karbendazim rekommenderas testning av 1,2 mg verksamt ämne/kg torrvikt (testad som en flytande beredning).
|
BESKRIVNING AV TESTET
Utrustning
|
9.
|
Testkärlen bör vara tillverkade av glas eller annat kemiskt inert material. Glasburkar (t.ex. kärlvolym: 0,20–0,25 liter, diameter: ≈ 6 cm) är lämpliga att använda. Kärlen bör ha transparenta lock (t.ex. glas eller polyeten) som utformats för att minska vattenavdunstningen samtidigt som de möjliggör gasväxling mellan jord och luft. Locken bör vara genomskinliga för att möjliggöra ljusgenomsläpplighet.
|
|
10.
|
Dessutom behövs normal laboratorieutrustning, särskilt följande:
|
—
|
pH-mätare och fotometer,
|
|
—
|
lämplig utrustning för temperaturreglering,
|
|
—
|
lämplig utrustning för reglering av luftfuktigheten (inte nödvändigt om exponeringskärlen har lock),
|
|
—
|
inkubator eller ett litet rum med luftkonditionering,
|
|
—
|
pincett, krokar eller öglor,
|
|
Beredning av den syntetiska jorden
|
11.
|
I detta test används en syntetisk jord (5) (7) med följande sammansättning (baserad på torrvikt, torkad till en konstant vikt vid 105 °C):
|
—
|
10 % vitmosstorv (Sphagnum), lufttorkad och finfördelad (en partikelstorlek på 2 ± 1 mm är godtagbar). Man bör kontrollera att en jord som bereds med en färsk torvblandning är lämplig för maskodling innan den används i ett test,
|
|
—
|
20 % kaolinlera (kaolinithalt helst över 30 %),
|
|
—
|
cirka 0,3–1,0 % kalciumkarbonat (CaCO3, pulvriserat, av analyskvalitet) som tillsätts för att få ett pH-värde på 6,0 ± 0,5. Mängden tillsatt kalciumkarbonat beror främst på torvens kvalitet/beskaffenhet,
|
|
—
|
ungefär 70 % lufttorkad kvartssand (beroende på vilken mängd CaCO3 som krävs), främst fin sand där mer än 50 % av partiklarna har storleken 50–200 μm.
|
Man bör kunna visa att en artificiell jord är lämplig för odling av maskar och för att uppnå kriterierna för testresultatets giltighet innan jorden används i ett definitivt test. Det är särskilt tillrådligt att göra en sådan kontroll för att säkerställa att testutförandet inte äventyras om halten av organiskt kol i den syntetiska jorden minskar, t.ex. genom att sänka torvhalten till 4–5 % och öka sandhalten i motsvarande grad. Med en sådan minskning av halten organiskt kol kan möjligheterna till adsorption av testkemikalien till jorden (organiskt kol) minskas, och då blir testkemikalien bättre tillgänglig för maskarna. Det har visats att Enchytraeus albidus kan uppfylla giltighetskriterierna för reproduktion vid testning i fältjordar med en halt av organiskt kol som är lägre än den ovannämnda (t.ex. 2,7 %) (15), och det finns viss erfarenhet av att detta också kan uppnås i syntetisk jord med 5 % torv.
Anmärkning: Vid användning av naturlig jord i ytterligare tester (t.ex. senare steg) bör jordens lämplighet och uppnåendet av kriterierna för testresultatets giltighet också påvisas.
|
|
12.
|
Jordens torra beståndsdelar blandas omsorgsfullt (t.ex. i en storskalig laboratorieblandare). Detta bör göras minst en vecka innan testet inleds. Jordblandningen ska lagras i två dagar i syfte att nå surhetsjämvikt. För bestämning av pH-värdet används en blandning av jord och en lösning med 1 M kaliumklorid (KCl) eller 0,01 M kalciumklorid (CaCl2) i förhållandet 1:5 (se (16) och tillägg 3). Om marken är surare än det intervall som krävs (se punkt 11) kan detta justeras genom tillsats av lämplig mängd CaCO3. Om marken är för alkalisk kan detta justeras genom tillsats av en större mängd av blandningen som avses i punkt 11, förutom att CaCO3 utesluts.
|
|
13.
|
Den syntetiska jordens maximala vattenhållningskapacitet (WHC) bestäms i enlighet med de förfaranden som beskrivs i tillägg 2. En eller två dagar innan testet inleds förhandsfuktas den torra syntetiska jorden med tillräcklig mängd avjonat vatten till dess att den har en vattenhalt som motsvarar cirka hälften av den slutliga vattenhalten, dvs. 40–60 % av maximal vattenhållningskapacitet. I början av testet delas den förhandsfuktade jorden upp i portioner som motsvarar antalet testkoncentrationer (och referenskemikalie i förekommande fall) och kontroller som används i testet. Fukthalten justeras till 40–60 % av maximal vattenhållningskapacitet genom tillsats av testkemikalielösningen och/eller av destillerat eller avjonat vatten (se punkterna 19–21). Fukthalten bestäms i början och i slutet av testet (genom torkning till konstant vikt vid 105 °C) och bör hållas inom det optimala intervallet för maskarnas överlevnad. En summarisk kontroll av jordens fukthalt kan göras genom att man försiktigt pressar jorden i handen. Om vattenhalten är korrekt ska små vattendroppar sippra ut mellan fingrarna.
|
Urval och förberedelse av försöksdjuren
|
14.
|
Den rekommenderade testarten är Enchytraeus albidus Henle 1837 (vit ringmask), en medlem av familjen Enchytraeidae (ordning Oligochaeta, fylum Annelida). E. albidus är en av de största arterna av småringmaskar, med dokumenterade exemplar på upp till 35 mm längd (17) (18). E. albidus förekommer över hela världen och återfinns i marina, limniska och terrestra livsmiljöer på land, främst i multnande organiskt material (tång, kompost) och i sällsynta fall på ängar (9). Dess breda ekologiska tolerans och vissa morfologiska variationer tyder på att det finns olika raser.
|
|
15.
|
E. albidus finns kommersiellt tillgänglig som fiskfoder. Man bör kontrollera om odlingen är kontaminerad av andra, vanligtvis mindre arter (1) (19). Om kontaminering förekommer bör alla maskar tvättas med vatten i en petriskål. Stora adulta exemplar av E. albidus bör därefter väljas ut (med hjälp av stereomikroskop) för att starta en ny odling, och alla andra maskar kasseras. E. albidus kan lätt odlas i många olika organiska material (se tillägg 4). Livscykeln för E. albidus är kort eftersom maskarna blir könsmogna mellan 33 dagars (vid 18 °C) och 74 dagars ålder (vid 12 °C) (1). Endast odlingar som har hållits utan problem i laboratoriet i minst fem veckor (en generation) används för testet.
|
|
16.
|
Andra arter av släktet Enchytraeus är också lämpliga, t.ex. E. buchholzi Vejdovsky 1879 eller E. crypticus Westheide & Graefe 1992 (se tillägg 5). Om andra arter av släktet Enchytraeus används bör de identifieras tydligt och motiveringen för valet av art bör rapporteras.
|
|
17.
|
I testerna används adulta maskar. De bör ha ägg (vita fläckar) i clitellum (gördeln), och de bör vara av ungefär samma storlek (ca 1 cm långa). Det är inte nödvändigt att synkronisera uppfödningskulturen.
|
|
18.
|
Om småringmaskarna inte föds upp i samma jordtyp och under de förutsättningar (inklusive utfodring) som ska användas för det slutliga testet måste de acklimatiseras i minst 24 timmar och upp till 3 dagar. Ett större antal adulter än vad som krävs för att utföra testet bör inledningsvis acklimatiseras för att skadade eller på annat sätt olämpliga exemplar ska kunna kasseras. I slutet av acklimatiseringsperioden ska endast maskar som innehåller ägg och som inte uppvisar några beteendestörningar (t.ex. försöker ge sig iväg upp ur jorden) väljas ut för testet. Maskarna avlägsnas försiktigt med hjälp av urmakarpincett, krokar eller öglor och placeras i en petriskål som innehåller en mindre mängd sötvatten. Rekonstituerat sötvatten som föreslås i kapitel C.20 i denna bilaga (Reproduktionstest för Daphnia magna) lämpar sig bäst för detta ändamål eftersom avjonat eller avmineraliserat vatten eller kranvatten skulle kunna skada odlingen. Maskarna kontrolleras under stereomikroskop och de som inte innehåller ägg kasseras. Man måste vara noga med att avlägsna och kasta bort eventuella kvalster eller hoppstjärtar som kan ha infekterat kulturerna. Friska maskar som inte används i testet återbördas till stamkulturen.
|
Beredning av testkoncentrationer
Testkemikalier som är lösliga i vatten
|
19.
|
En lösning av testkemikalien bereds i avjonat vatten i tillräcklig mängd för att räcka till alla replikat av en testkoncentration. Det rekommenderas att man använder en lämplig mängd vatten för att nå önskad fukthalt, dvs. 40–60 % av maximal vattenhållningskapacitet (se punkt 13). Varje lösning av testkemikalien blandas grundligt med ett parti förhandsfuktad jord innan den tillsätts i testkärlet.
|
Testkemikalier som är olösliga i vatten
|
20.
|
För kemikalier som inte är lösliga i vatten men som är lösliga i organiska lösningsmedel kan testkemikalien lösas upp i minsta möjliga volym i en lämplig vehikel (t.ex. aceton). Endast flyktiga lösningsmedel bör användas. Vehikeln sprejas på eller blandas med en liten mängd fin kvartssand, till exempel 2,5 g. Vehikeln avlägsnas genom avdunstning i ett dragskåp i minst 1 timme. Blandningen av kvartssand och testkemikalie tillförs den på förhand fuktade jorden och blandas omsorgsfullt efter tillsats av lämplig mängd avjonat vatten för att få den fuktighet som krävs. Den slutliga blandningen överförs till testkärlen.
|
|
21.
|
För kemikalier som är svårlösliga i vatten och i organiska lösningsmedel blandas motsvarande 2,5 g finmald kvartssand per testkärl med den mängd testkemikalie som ger önskad testkoncentration. Blandningen av kvartssand och testkemikalie tillförs den förhandsfuktade jorden och blandas omsorgsfullt efter tillsats av lämplig mängd avjonat vatten för att få önskad fukthalt. Den slutliga blandningen fördelas mellan testkärlen. Förfarandet upprepas för varje testkoncentration, och en lämplig kontroll upprättas också.
|
|
22.
|
Kemikalier bör normalt inte testas i koncentrationer som överstiger 1 000 mg/kg torrvikt jord. Testning vid högre koncentrationer kan dock vara nödvändig i enlighet med syftet för ett visst test.
|
TESTFÖRFARANDE
Testgrupper och kontroller
|
23.
|
För varje koncentration av testkemikalien placeras en mängd jord som motsvarar 20 g torrvikt i testkärlet (se punkterna 19–21). Man bereder även kontroller utan testkemikalien. Foder tillsätts varje kärl i enlighet med de förfaranden som beskrivs i punkt 29. Tio maskar fördelas slumpvis till varje testkärl. Maskarna överförs försiktigt till varje testkärl och placeras på ytan av jorden, t.ex. med hjälp av urmakarpincett, krokar eller öglor. Antalet replikat för testkoncentrationer och för kontroller beror på testupplägget (se punkt 34). Testkärlen placeras slumpvis i inkubatorn och deras positioner ändras slumpvis varje vecka.
|
|
24.
|
Om en vehikel används för applicering av testkemikalien bör man utöver testserierna även ha en kontrollserie som innehåller kvartssand som sprejats eller blandats med lösningsmedel. Lösningsmedlet eller dispergeringsmedlet bör ha samma koncentration som den som används i de testkärl som innehåller testkemikalien. Man bör ha en kontrollserie som innehåller ytterligare kvartssand (2,5 g per kärl) för kemikalier som kräver tillförsel i enlighet med de förfaranden som beskrivs i punkt 21.
|
Testbetingelser
|
25.
|
Testtemperaturen ska vara 20 ± 2 °C. För att minska risken för att maskar tar sig upp ur jorden ska testet utföras under kontrollerade ljus-/mörkercykler (helst 16 h ljus/8 h mörker) med en belysning på 400–800 lux i området med testkärlen.
|
|
26.
|
För att kontrollera jordens fuktighet ska kärlen vägas vid testets början och därefter en gång i veckan. Viktförluster ska utjämnas genom tillsats av lämplig mängd avjonat vatten. Det bör noteras att förlusten av vatten kan minskas genom att man bibehåller en hög luftfuktighet (> 80 %) i inkubatorn.
|
|
27.
|
Fukthalt och pH ska mätas i början och slutet av både det preliminära och det definitiva testet. Mätningarna bör göras i de kontroller och de behandlade jordprover (alla koncentrationer) som beretts och underhålls på samma sätt som testkulturerna men som inte innehåller maskar. Foder bör endast tillföras dessa jordprover i början av testet för att främja den mikrobiella aktiviteten. Mängden foder bör vara densamma som i testkulturerna. Det är inte nödvändigt att tillföra ytterligare foder till dessa kärl under testets gång.
|
Utfodring
|
28.
|
Ett foder som kan livnära populationen med småringmaskar kan användas. Valsad havre, som helst ska autoklaveras före användning för att undvika kontaminering av mikroorganismer (uppvärmning går också bra), har befunnits vara ett lämpligt foder.
|
|
29.
|
Fodret tillförs först genom att 50 mg malda havregryn blandas ned i jorden i varje kärl innan maskarna införs. Därefter tillförs födan veckovis fram till dag 21. Ingen utfodring görs på dag 28 eftersom adulterna har avlägsnats i detta skede och juvenilerna har relativt lite behov av extra foder efter denna dag. Utfodringen under testet utgörs av 25 mg malda havregryn per kärl försiktigt placerad på ytan av jorden för att undvika att skada maskarna. För att minska tillväxten av mögel bör havreflingorna grävas ner i jorden genom att man täcker dem med små mängder jord. Om fodret förblir oätet bör fodergivan minskas.
|
Utformning av det preliminära testet
|
30.
|
Vid behov kan ett preliminärt test utföras med t.ex. fem koncentrationer av testkemikalien på 0,1, 1,0, 10, 100 och 1 000 mg/kg (torrvikt jord). Ett replikat för varje exponering och kontroll är tillräckligt.
|
|
31.
|
Det preliminära testets varaktighet är två veckor. Vid slutet av provet bedöms maskarnas dödlighet. En mask registreras som död om den inte reagerar på mekanisk retning på främre delen. Ytterligare information rörande dödligheten kan också vara användbar för att avgöra vilket koncentrationsintervall som ska användas i det definitiva testet. Förändringar i adulternas beteende (t.ex. oförmåga att gräva ner sig i jorden, maskar ligger orörliga mot testkärlets glasvägg) och morfologi (t.ex. öppna sår) bör därför också registreras, liksom eventuell förekomst av juveniler. Det senare kan fastställas med hjälp av den färgningsmetod som beskrivs i tillägg 6.
|
|
32.
|
Ett approximativt värde på LC50 kan fastställas genom beräkning av mortalitetsuppgifternas geometriska medelvärde. När man fastställer koncentrationsintervallet för det definitiva testet antas effekterna på fortplantningen vara lägre än LC50 med en faktor på upp till 10. Detta är dock ett empiriskt förhållande och i ett enskilt fall kan det skilja sig. Ytterligare iakttagelser i det preliminära testet, t.ex. förekomst av juveniler, kan bidra till att finjustera det koncentrationsintervall för testkemikalien som ska användas i det definitiva testet.
|
|
33.
|
För att en noggrann bestämning av LC50 ska kunna göras rekommenderas att testet utförs med minst fyra replikat för varje koncentration av testkemikalien och ett tillräckligt antal koncentrationer för att framkalla minst fyra olika statistiskt signifikanta genomsnittliga responser på dessa koncentrationer. Ett liknande antal koncentrationer och replikat för kontrollerna ska användas när detta är tillämpligt.
|
Utformning av det definitiva reproduktionstestet
|
34.
|
Tre utformningar föreslås på grundval av de rekommendationer som ett ringtest ger upphov till (2).
|
—
|
För bestämning av NOEC bör minst fem koncentrationer i en geometrisk serie testas. Det rekommenderas att man använder fyra replikat för varje testkoncentration plus åtta kontroller. Koncentrationerna bör skilja sig åt med en faktor på högst 1,8.
|
|
—
|
För bestämning av ECx (t.ex. EC10, EC50), bör minst fem koncentrationer testas, och ECx ska ligga innanför intervallet av testkoncentrationer så att det blir möjligt att interpolera snarare än extrapolera ECx. Det rekommenderas att man använder minst fyra replikat för varje testkoncentration och fyra kontrollreplikat. Koncentrationernas inbördes avståndsfaktor kan variera, dvs. den kan vara mindre än eller lika med 1,8 i det förväntade effektintervallet och större än 1,8 vid högre och lägre koncentrationer.
|
|
—
|
Ett kombinerat tillvägagångssätt möjliggör bestämning av både NOEC och ECx. Man bör använda åtta testkoncentrationer i en geometrisk serie. Fyra replikat per exponering plus åtta kontroller rekommenderas. Koncentrationerna bör skilja sig åt med en faktor på högst 1,8.
|
|
|
35.
|
Varje testkärl ska innehålla tio adulter (se punkt 23). Foder tillsätts i testbehållarna i början av testet och därefter en gång per vecka (se punkt 29) upp till och inklusive dag 21. Dag 21 genomsöks jordproven försiktigt för hand och de levande adulta maskarna undersöks och räknas, och förändringar i beteende (t.ex. oförmåga att gräva ner sig i jorden, maskar ligger orörliga mot testkärlets glasvägg) och morfologi (t.ex. öppna sår) registreras. Alla adulter avlägsnas från testkärlen och testjorden. Testjorden med de kokonger som har producerats inkuberas i ytterligare tre veckor under samma testförhållanden, förutom att utfodring sker endast dag 35 (25 mg malda havregryn per kärl).
|
|
36.
|
Efter sex veckor räknas de nykläckta maskarna. Det rekommenderas att man använder metoden som bygger på kontrastfärgning med rött (se tillägg 6), även om andra våta (men inte varma) extraktions- och flotationstekniker (se tillägg 6) också har visat sig vara lämpliga (4) (10) (11) (20). Röd kontrastfärgning rekommenderas eftersom våt extraktion från ett jordsubstrat kan förhindras av grumlighet som orsakas av suspenderade lerpartiklar.
|
Toleranstest
|
37.
|
Om inga effekter observeras vid den högsta koncentrationen i det preliminära testet (dvs. 1 000 mg/kg), kan reproduktionstestet utföras som ett toleranstest med 1 000 mg/kg för att visa att NOEC för reproduktion är större än detta värde.
|
Sammanfattning och tidsplan för testet
|
38.
|
Stegen i testet kan sammanfattas på följande sätt:
|
Tid
|
Preliminärt test
|
Definitivt test
|
|
Dag – 7 eller tidigare
|
|
—
|
Bered syntetisk jord (blanda torra beståndsdelar)
|
|
|
—
|
Bered syntetisk jord (blanda torra beståndsdelar)
|
|
|
Dag – 5
|
|
—
|
Kontrollera pH i den syntetiska jorden
|
|
—
|
Mät jordens maximala vattenhållningskapacitet
|
|
|
—
|
Kontrollera pH i den syntetiska jorden
|
|
—
|
Mät jordens maximala vattenhållningskapacitet
|
|
|
Dag – 5 till – 3
|
|
—
|
Sortera maskar för acklimatisering
|
|
|
—
|
Sortera maskar för acklimatisering
|
|
|
Dag – 3 till 0
|
|
—
|
Låt maskarna acklimatisera sig i minst 24 timmar
|
|
|
—
|
Låt maskarna acklimatisera sig i minst 24 timmar
|
|
|
Dag – 1
|
|
—
|
Förhandsfukta den syntetiska jorden och fördela i partier
|
|
|
—
|
Förhandsfukta den syntetiska jorden och fördela i partier
|
|
|
Dag 0
|
|
—
|
Applicera testkemikalien
|
|
—
|
Väg testsubstratet i testkärlen
|
|
—
|
Mät jordens pH-värde och vattenhalt
|
|
|
—
|
Applicera testkemikalien
|
|
—
|
Väg testsubstratet i testkärlen
|
|
—
|
Mät jordens pH-värde och vattenhalt
|
|
|
Dag 7
|
|
—
|
Kontrollera jordens fukthalt
|
|
|
—
|
Kontrollera jordens fukthalt
|
|
|
Dag 14
|
|
—
|
Fastställ dödligheten bland adulter
|
|
—
|
Uppskatta antalet juveniler
|
|
—
|
Mät jordens pH-värde och vattenhalt
|
|
|
—
|
Kontrollera jordens fukthalt
|
|
|
Dag 21
|
|
|
—
|
Observera beteendet hos adulter
|
|
—
|
Fastställ dödligheten bland adulter
|
|
—
|
Kontrollera jordens fukthalt
|
|
|
Dag 28
|
|
|
—
|
Kontrollera jordens fukthalt
|
|
|
Dag 35
|
|
|
—
|
Kontrollera jordens fukthalt
|
|
|
Dag 42
|
|
|
—
|
Mät jordens pH-värde och vattenhalt
|
|
|
DATA OCH RAPPORTERING
Behandling av resultaten
|
39.
|
Även om en översikt ges i tillägg 7 ges ingen definitiv statistisk vägledning för hur testresultaten ska analyseras i denna testmetod.
|
|
40.
|
I det preliminära testet är den huvudsakliga endpointen dödlighet. Förändringar i adulternas beteende (t.ex. oförmåga att gräva ner sig i jorden, maskar ligger orörliga mot testkärlets glasvägg) och morfologi (t.ex. öppna sår) bör dock också registreras, liksom eventuell förekomst av juveniler. Probitanalys (21) eller logistisk regressionsanalys bör normalt användas för bestämning av LC50. I de fall då denna analysmetod är olämplig (t.ex. om färre än tre koncentrationer med partiell dödlighet finns tillgängliga) kan alternativa metoder tillämpas. Exempel på sådana är glidande medelvärden (22), den modifierade Spearman-Karbermetoden (23) eller enkel interpolering (t.ex. det geometriska medelvärdet av LC0 och LC100, som beräknats genom att kvadratroten av LC0 multiplicerats med LC100).
|
|
41.
|
I det definitiva testet är endpointen fekunditet (dvs. antalet avkommor som producerats). Liksom i det preliminära testet bör alla andra skadliga tecken registreras i slutrapporten. Den statistiska analysen gör det nödvändigt att beräkna det aritmetiska medelvärdet och standardavvikelsen per testkärl och per kontroll för reproduktionen.
|
|
42.
|
Om en variansanalys har utförts kan standardavvikelsen s och frihetsgraderna df ersättas av den sammanlagda uppskattningen av variansen som erhållits från variansanalysen (ANOVA) respektive dess frihetsgrader – förutsatt att variansen inte är beroende av koncentrationen. I detta fall ska de enskilda varianserna i kontroll- och testenheter användas. Dessa värden beräknas normalt med hjälp av kommersiell programvara för statistik med användning av resultaten per kärl som replikat. Om det förefaller vara rimligt att slå ihop data för negativa kontroller och kontroller med lösningsmedel snarare än att testa mot en av dem bör de testas för att säkerställa att det inte finns betydande skillnader mellan dem (för lämpliga tester se punkt 45 och tillägg 7).
|
|
43.
|
Ytterligare statistisk testning och slutsatser beror på om värdena för replikaten är normalt fördelade och enhetliga med avseende på variansen.
|
Uppskattning av NOEC
|
44.
|
Man bör främst använda kraftfulla tester. Man bör använda information t.ex. från tidigare erfarenheter med ringtester eller andra tidigare uppgifter om huruvida data är ungefär normalt fördelade. Variansens homogenitet (homoskedasticitet) är av mer avgörande betydelse. Erfarenheter visar att variansen ofta ökar med ett ökande medelvärde. I dessa fall kan en datatransformation leda till homoskedasticitet. En sådan omvandling bör dock bygga på erfarenheterna från tidigare uppgifter i stället för på uppgifter som håller på att undersökas. Med homogena data bör flera t-tester, såsom Williams test (α = 0,05, asymmetriskt) (24) (25) eller i vissa fall Dunnetts test (26) (27), utföras. När det gäller ojämn förökning bör det noteras att t-värdena i tabellen måste korrigeras i enlighet med Dunnett och Williams. Ibland ökar/minskar reaktionerna inte regelbundet på grund av stor variation. I ett sådant fall med kraftig avvikelse från monotonicitet är Dunnetts test lämpligare. Om det finns avvikelser från homoskedasticiteten kan det vara rimligt att närmare undersöka de möjliga effekterna på variansen för att besluta om t-testerna kan tillämpas utan att förlora mycket av sin effekt (28). Alternativt kan ett multipelt U-test tillämpas, t.ex. Bonferronis U-test enligt Holm (29), eller, när dessa data uppvisar heteroskedasticitet men i övrigt är förenliga med en bakomliggande monoton dos-respons, ett annat icke-parametriskt test (t.ex. Jonckheere-Terpstra (30) (31) eller Shirley (32) (33)), och är i allmänhet att föredra framför t-tester med ojämn varians (se även diagrammet i tillägg 7).
|
|
45.
|
Om ett toleranstest har utförts och de nödvändiga förutsättningarna för parametriska testförfaranden (normalitet, homogenitet) är uppfyllda, kan ett parvist Students t-test användas eller i annat fall Mann och Whitneys U-testförfarande (29).
|
Bestämning av ECx
|
46.
|
När man beräknar ECx-värden används medelvärdena per testkärl för regressionsanalys (linjär eller icke-linjär), efter att en lämplig dos-responsfunktion har erhållits. För maskarnas tillväxt som en kontinuerlig respons kan ECx-värdena uppskattas genom användning av en lämplig regressionsanalys (35). Bland lämpliga funktioner för dikotoma data (mortalitet/överlevnad och antal avkommor) återfinns de normala sigmoida eller logistiska funktionerna eller Weibull-funktionen med två till fyra parametrar, varav vissa även kan uttrycka hormetiska responser. Om en dos-respons-funktion anpassas genom linjär regressionsanalys bör en signifikant determinationskoefficient (r2) och/eller lutning konstateras med regressionsanalysen innan ECx uppskattas genom att ett värde som motsvarar x % av genomsnittet för kontrollen infogas i den ekvation som utgör resultatet av regressionsanalysen. De 95-procentiga konfidensgränserna beräknas enligt Fieller (hänvisning i Finney (21)) eller andra lämpliga moderna metoder.
|
|
47.
|
Alternativt kan responsen uttryckas som en procentandel eller en andel av den modellparameter som tolkas som den genomsnittliga responsen för kontrollen. I dessa fall kan den normala (logistiska, Weibullska) sigmoida kurvan ofta lätt anpassas till resultaten med hjälp av probitregressionsförfarandet (21). I dessa fall måste viktningsfunktionen justeras för metriska responser i enlighet med Christensen (36). Om hormesis har iakttagits bör probitanalysen dock ersättas med en logistisk funktion eller en Weibullfunktion, i båda fallen med fyra parametrar, anpassad genom ett icke-linjärt regressionsförfarande (36). Om en lämplig dos-responsfunktion inte kan anpassas till data kan man använda alternativa metoder för att uppskatta ECx och dess konfidensgränser, t.ex. glidande medelvärden efter Thompson (22) och det modifierade Spearman-Karberförfarandet (23).
|
TESTRAPPORT
|
48.
|
Testrapporten ska innehålla följande uppgifter:
|
|
Testkemikalie:
|
—
|
fysikalisk form och i tillämpliga fall fysikalisk-kemiska egenskaper (t.ex. vattenlöslighet, ångtryck),
|
|
—
|
kemisk identifiering av testkemikalien i enlighet med IUPAC-nomenklatur, CAS-nummer, sändning, parti, strukturformel och renhet,
|
|
|
|
Testade arter:
|
—
|
de använda försöksdjuren: art, vetenskapligt namn, källa och uppfödningsbetingelser.
|
|
|
|
Testbetingelser:
|
—
|
ingredienser till och beredning av den syntetiska jorden,
|
|
—
|
appliceringsmetod för testkemikalien,
|
|
—
|
beskrivning av testbetingelserna, inklusive temperatur, vattenhalt, pH-värde etc.,
|
|
—
|
fullständig beskrivning av experimentets utformning och förfaranden.
|
|
|
|
Testresultat:
|
—
|
dödligheten bland adulter efter två veckor samt antal juveniler i slutet av det preliminära testet,
|
|
—
|
dödligheten bland adulter efter tre veckors exponering och fullständiga uppgifter om juvenilerna i slutet av det definitiva testet,
|
|
—
|
alla observerade fysiska eller patologiska symtom eller beteendeförändringar hos testorganismerna,
|
|
—
|
LC50, NOEC och/eller ECx (t.ex. EC50, EC10) för reproduktionen om vissa av dem är tillämpliga med konfidensintervallen, och en kurva som representerar den anpassade modell som har använts för beräkningen, samt alla uppgifter och observationer som kan vara till nytta vid tolkningen av resultaten.
|
|
Avvikelser från de förfaranden som beskrivs i denna testmetod och ovanliga händelser under testets gång.
|
LITTERATUR
|
(1)
|
Römbke, J. (1989). Entwicklung eines Reproduktionstests an Bodenorganismen – Enchytraeen. Abschlußbericht des Battelle-Instituts e.V. Frankfurt für das Umweltbundesamt (Berlin), FE-Vorhaben 106 03 051/01.
|
|
(2)
|
Römbke J. och Moser, T. (1999). Organisation and Performance of an International Ringtest for the Validation of the Enchytraeid Reproduction Test. UBA-Texte 4/99, s. 150 + 223.
|
|
(3)
|
Westheide, W. och Bethge-Beilfuss, D. (1991). The sublethal enchytraeid test system: guidelines and some results, i: Modern Ecology: Basic and Applied Aspects. Esser, G. och Overdieck, D. (red.), s. 497–508. Elsevier, Amsterdam.
|
|
(4)
|
Dirven-Van Breemen, E., Baerselmann, R. och Notenboom, J. (1994). Onderzoek naar de Geschiktheid van de Potwormsoorten Enchytraeus albidus en Enchytraeus crypticus (Oligochaeta, Annelida) i Bodemecotoxicologisch Onderzoek. RIVM Rapport nr 719102025, s. 46.
|
|
(5)
|
Kapitel C.8 i denna bilaga: Toxicitet för daggmaskar.
|
|
(6)
|
ISO (Internationella standardiseringsorganisationen) (1999). Markundersökningar – Föroreningars effekt på daggmaskar (Eisenia fetida) – Del 1: Bestämning av akut toxicitet med artificiell jord, nr 11268-1. ISO, Genève.
|
|
(7)
|
ISO (Internationella standardiseringsorganisationen) (1999). Markundersökningar – Föroreningars effekt på daggmaskar (Eisenia fetida) – Del 2: Bestämning av effekter på reproduktion, nr 11268-2. ISO, Genève.
|
|
(8)
|
Rundgren, S. och A. K. Augustsson. (1998). Test on the enchytraeid Cognettia sphagnetorum (Vejdovsky 1877). I: Løkke, H. och C. A. M. Van Gestel, Handbook of soil invertebrate toxicity tests. John Wiley and Sons, Chichester, 73–94.
|
|
(9)
|
Kasprzak, K. (1982). Review of enchytraeid community structure and function in agricultural ecosystems. Pedobiologia 23, 217–232.
|
|
(10)
|
Römbke, J. (1996). Enchytraeen (Oligochaeta) als Bioindikator, UWSF – Z. Umweltchem. Ökotox. 7, 246–249.
|
|
(11)
|
Dunger, W. och Fiedler, H. J. (1997). Methoden der Bodenbiologie. G. Fischer Verlag, Stuttgart, New York.
|
|
(12)
|
Didden, W. A. M. (1994). Ecology of terrestrial Enchytraeidae. Pedobiologia 37, 2–29.
|
|
(13)
|
Becker, H. (1991). Bodenorganismen – Prüfungskategorien der Forschung. UWSF – Z. Umweltchem. Ökotox. 3, 19–24.
|
|
(14)
|
Römbke, J. och Federschmidt, A. (1996). Effects of the fungicide Carbendazim on Enchytraeidae in laboratory and field tests, Newsletter on Enchytraeidae 4, 79–96.
|
|
(15)
|
Römbke, J., Riepert, F. och Achazi R. (2000). Enchytraeen als Testorganismen. I: Toxikologische Beurteilung von Böden. Heiden, S., Erb, R., Dott, W. och Eisentraeger, A. (red.). Spektrum Verl., Heidelberg. 59–81.
|
|
(16)
|
ISO (Internationella standardiseringsorganisationen) (1994). Markundersökningar – Bestämning av pH, nr 10390. ISO, Genève.
|
|
(17)
|
Bell, A. W. (1958). The anatomy of Enchytraeus albidus, with a key to the species of the genus Enchytraeus. Ann. Mus. Novitat. 1902, 1–13.
|
|
(18)
|
Nielsen, C.O. och Christensen, B. (1959). The Enchytraeidae, critical revision and taxonomy of European species. Natura Jutlandica 8–9, 1–160.
|
|
(19)
|
Bouguenec, V. och Giani, N. (1987). Deux nouvelles especes d'Enchytraeus (Oligochaeta, Enchytraeidae) et rediscription d'E. bigeminus. Remarques sur le genre Enchytraeus. Ann. Limnol. 23, 9–22.
|
|
(20)
|
Korinkova, J. och Sigmund, J. (1968). The colouring of bottom-fauna samples before sorting, Vestnik Ceskoslovensko Spolecnosti Zoologicke 32, 300–305.
|
|
(21)
|
Finney D. J. (1971). Probit Analysis (tredje upplagan), s. 19–76. Cambridge Univ. Press.
|
|
(22)
|
Finney D. J. (1978). Statistical Method in Biological Assay. Charles Griffin & Company Ltd, London.
|
|
(23)
|
Hamilton, M. A., R. C. Russo och R. V. Thurston. (1977). Trimmed Spearman-Karber Method for estimating median lethal concentrations in toxicity bioassays. Environ. Sci. Technol. 11:7, 714–719; korrigering i Environ. Sci. Technol. 12 (1998), 417.
|
|
(24)
|
Williams, D. A., (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics, 27, 103–117.
|
|
(25)
|
Williams, D. A., (1972). The comparison of several dose levels with a zero dose control. Biometrics, 28, 519–531.
|
|
(26)
|
Dunnett, C. W., (1955). A multiple comparison procedure for comparing several treatments with a control. Amer. Statist. Ass. J. 50, 1096–1121.
|
|
(27)
|
Dunnett, C. W., (1964) New Tables for Multiple Comparisons with a Control. Biometrics, 20, 482–491.
|
|
(28)
|
Hoeven, N. van der, (1998). Power analysis for the NOEC: What is the probability of detecting small toxic effects on three different species using the appropriate standardized test protocols? Ecotoxicology 7, 355–361.
|
|
(29)
|
Holm, S. (1979): A simple sequentially rejective multiple test procedure. Scand. J. Statist. 6, 65–70.
|
|
(30)
|
Jonckheere, A. R. (1954). A Distribution-free k-Sample Test Against Ordered Alternatives, Biometrika 41, 133–145.
|
|
(31)
|
Terpstra, T. J. (1952). The Asymptotic Normality and Consistency of Kendall's Test Against Trend, When Ties are Present in One Ranking, Indagationes Math. 14, 327–333.
|
|
(32)
|
Shirley, E. A. (1979). The comparison of treatment to control group means in toxicology studies, Applied Statistics 28, 144–151.
|
|
(33)
|
Williams, D. A. (1986). A Note on Shirley's Nonparametric Test for Comparing Several Dose Levels with a Zero-Dose Control, Biometrics 42, 183–186.
|
|
(34)
|
Sokal, R. R. och F. J. Rohlf. (1981). Biometry. The Principle and practice of statistics in biological research. Andra upplagan. W. H. Freeman and Company. New York.
|
|
(35)
|
Christensen, E.R. (1984). Dose-response functions in aquatic toxicity testing and the Weibull model. Water Research 18, 213–221.
|
|
(36)
|
Van Ewijk, P. H. och J. A. Hoekstra. (1994). Calculation of the EC50 and its confidence interval when sub-toxic stimulus is present. Ecotox, Environ. Safety. 25, 25–32.
|
Tillägg 1
Definitioner
I denna testmetod gäller följande definitioner:
Kemikalie
: ett ämne eller en blandning.
ECx
(koncentration som orsakar x % effekt): den koncentration som orsakar en x-procentig effekt på testorganismerna efter en given exponeringstid jämfört med ett kontrollprov. I detta test uttrycks effektkoncentrationerna som testkemikaliens vikt per torrvikt testjord.
LC0
(letal koncentration 0 %): den koncentration av testkemikalien som inte orsakar någon av de exponerade testorganismernas död under en given tidsperiod. I detta test uttrycks LC0-värdet som testkemikaliens vikt per torrvikt testjord.
LC50
(letal koncentration 50 %): den koncentration av testkemikalien som orsakar 50 % av de exponerade testorganismernas död under en given tidsperiod. I detta test uttrycks LC50-värdet som testkemikaliens vikt per torrvikt testjord.
LC100
(letal koncentration 100 %): den koncentration av testkemikalien som orsakar alla de exponerade testorganismernas död under en given tidsperiod. I detta test uttrycks LC100-värdet som testkemikaliens vikt per torrvikt testjord.
Lägsta koncentration med observerad effekt (LOEC)
: den lägsta koncentrationen av testkemikalien som har en statistiskt signifikant effekt (p < 0,05). I detta test uttrycks LOEC-värdet som testkemikaliens vikt per torrvikt testjord. Alla testkoncentrationer som överstiger LOEC bör normalt uppvisa en effekt som statistiskt skiljer sig från kontrollen. Eventuella avvikelser från detta när man fastställer LOEC måste motiveras i testrapporten.
Nolleffektkoncentrationen (NOEC)
: den högsta koncentration av testkemikalien omedelbart under LOEC-värdet vid vilken ingen effekt observeras. I detta test har en halt som motsvarar NOEC ingen statistiskt signifikant effekt (p < 0,05) efter en given exponeringstid jämfört med ett kontrollprov.
Reproduktionstakt
: det genomsnittliga antalet avkommor som producerats per ett antal adulter under testperioden.
Testkemikalie
: varje ämne eller blandning som testas med denna testmetod.
Tillägg 2
Fastställande av den maximala vattenhållningskapaciteten
Bestämning av den syntetiska jordens vattenhållningskapacitet
Följande metod har visat sig vara lämplig. Den beskrivs i bilaga C till ISO DIS 11268-2.
Samla in en fastställd kvantitet (t.ex. 5 g) testjordsubstrat med hjälp av en lämplig anordning (jordborr med rör osv.). Täck botten av röret med en bit filterpapper och fyll det med vatten. Placera det därefter på en ställning i ett vattenbad. Röret bör gradvis nedsänkas i vattnet tills vattenytan är ovanför jordytan. Det bör därefter lämnas i vattnet i cirka 3 timmar. Eftersom allt vatten som absorberas av jordens kapillärer inte kan hållas kvar bör jordprovet dräneras i 2 timmar genom att röret placeras på en bädd av mycket fuktig finmald kvartssand i ett slutet kärl (för att förhindra uttorkning). Provet bör sedan torkas till en konstant vikt vid 105 °C och vägas. Vattenhållningskapaciteten (WHC) ska beräknas enligt följande:

där
|
S
|
=
|
vattenmättat substrat + rörets vikt + filterpapprets vikt
|
|
T
|
=
|
emballagevikt (rörets vikt + filterpapprets vikt)
|
|
D
|
=
|
substratets torrvikt
|
HÄNVISNINGAR:
ISO (Internationella standardiseringsorganisationen) (1999). Markundersökningar – Föroreningars effekt på daggmaskar (Eisenia fetida). Del 2: Bestämning av effekter på reproduktion, nr 11268-2. ISO, Genève.
Tillägg 3
Bestämning av jordens ph-värde
Följande metod för bestämning av pH-värdet i ett jordprov bygger på beskrivningen i ISO 10390 (Markundersökningar – Bestämning av pH).
En bestämd mängd jord torkas i rumstemperatur i minst 12 timmar. En suspension av jorden (som innehåller minst 5 gram jord) bereds därefter i fem gånger sin volym med antingen 1 M kaliumklorid (KCl) av analyskvalitet eller 0,01 M kalciumkloridlösning (CaCl2) av analyskvalitet. Suspensionen skakas därefter omsorgsfullt i fem minuter. Efter skakning får suspensionen stå och klarna i minst 2 timmar men högst 24 timmar. Vätskefasens pH mäts sedan med en pH-mätare som före varje mätning kalibrerats med lämpliga buffertlösningar (t.ex. pH 4,0 och 7,0).
HÄNVISNINGAR:
ISO (Internationella standardiseringsorganisationen) (1994). Markundersökningar – Bestämning av pH, nr 10390. ISO, Genève.
Tillägg 4
Odlingsförhållanden för Enchytraeus sp.
Småringmaskar av arten Enchytraeus albidus (liksom andra Enchytraeus-arter) kan odlas i stora plastlådor (t.ex. 30 × 60 × 10 cm) fyllda med en blandning av syntetisk jord och naturlig, okontaminerad trädgårdsjord i förhållandet 1:1. Kompostmaterial bör undvikas eftersom det kan innehålla giftiga kemikalier såsom tungmetaller. Fauna bör avlägsnas från jorden före användning (t.ex. genom djupfrysning). Ett substrat som består endast av syntetisk jord kan också användas men reproduktionstakten kan vara lägre än den som kan uppnås med ett blandat jordsubstrat. Det substrat som används för odling bör ha pH 6,0 ± 0,5.
Kulturen förvaras mörkt vid en temperatur på 15–20 ± 2 °C. Temperaturen får inte överstiga 23 °C. Jorden ska hållas fuktig men får inte bli våt. Fukthalten är lämplig om det sipprar fram små vattendroppar mellan fingrarna när jorden pressas försiktigt i handen. Man måste undvika att anoxiska förhållanden utvecklas genom att se till att odlingsbehållarnas lock möjliggör tillräckligt gasutbyte med atmosfären. Jorden luckras försiktigt varje vecka för att underlätta luftning.
Maskarna kan utfodras med havreflingor. Havreflingorna bör förvaras i slutna kärl och autoklaveras eller hettas upp före användning för att undvika angrepp av mjölkvalster (t.ex. Glyzyphagus sp., Astigmata, Acarina) eller rovkvalster (t.ex. Hypoaspis (Cosmolaelaps) miles, Gamasida, Acarina). Efter värmebehandlingen bör flingorna malas så att de enkelt kan spridas på jordytan. Havreflingorna kan då och då kompletteras med vitaminer, mjölk och torskleverolja. Andra lämpliga foderkällor är bagerijäst och fiskfodret TetraMin.
Utfodring sker ungefär två gånger i veckan. En lämplig mängd havreflingor strös på jordytan eller blandas omsorgsfullt ner i substratet när jorden luckras upp för att underlätta luftning. Den absoluta mängden foder som ges beror på antalet maskar i substratet. Mängden foder bör ökas om allt äts upp inom en dag efter utfodring. Omvänt gäller att om fodret ligger kvar på markytan vid den andra utfodringen (en vecka senare) bör mängden foder minskas. Foder som är angripet av svamp avlägsnas och ersätts. Efter tre månader överförs maskarna till ett nyberett substrat.
Odlingsförhållandena anses vara tillfredsställande om maskarna: (a) inte försöker ta sig upp ur jordsubstratet, (b) rör sig snabbt genom jorden, (c) har en glansig yta utan vidhäftande jordpartiklar, (d) har en mer eller mindre vitaktig färg, (e) är av varierande ålder i odlingarna och (f) förökar sig kontinuerligt.
Tillägg 5
Testförfarande med andra Enchytraeus-arter
Val av art
Andra arter än E. albidus kan användas, men testförfarandet och giltighetskriterierna bör anpassas i enlighet med detta. Eftersom många Enchytraeus-arter är lätt tillgängliga och kan hållas på ett tillfredsställande sätt i laboratoriemiljö, är det viktigaste kriteriet för urval av andra arter än E. albidus artens ekologiska betydelse och dessutom likvärdig känslighet. Det kan också finnas formella skäl för ett byte av arter. I länder där E. albidus inte förekommer och inte kan importeras (t.ex. på grund av karantäntvång) är det till exempel nödvändigt att använda en annan Enchytraeus-art.
Exempel på lämpliga alternativa arter
|
—
|
Enchytraeus crypticus (Westheide & Graefe 1992): Under de senaste åren har denna art ofta använts i ekotoxikologiska studier eftersom den är lätt att odla och testa. Den är dock liten, och detta gör hanteringen svårare jämfört med E. albidus (särskilt i de skeden som föregår kontrastfärgningen). E. crypticus existens på fältet har inte med säkerhet kunnat bekräftas, eftersom den endast har beskrivits i daggmaskodlingar. Dess ekologiska krav är därför inte kända.
|
|
—
|
Enchytraeus buchholzi (Vejdovsky 1879): Detta namn omfattar förmodligen en grupp närbesläktade arter som är svåra att särskilja morfologiskt. Dess användning för testning rekommenderas inte förrän man kan fastställa arttillhörigheten för de exemplar som används i testet. E. buchholzi brukar återfinnas på ängsmark och i störda områden såsom vägkanter.
|
|
—
|
Enchytraeus luxuriosus: Denna art var ursprungligen känd som E. ’minutus’, men har nyligen beskrivits (1). Den upptäcktes av U. Graefe (Hamburg) på en äng nära St. Peter-Ording (Schleswig-Holstein, Tyskland). E. luxuriosus är ungefär hälften så stor som E. albidus men är större än övriga arter som diskuteras här och kan därför vara ett bra alternativ till E. albidus.
|
|
—
|
Enchytraeus bulbosus (Nielsen & Christensen 1963): Denna art har hittills rapporterats från tyska och spanska mineraljordar, där den är allmän men vanligtvis inte rikt förekommande. I jämförelse med andra små arter av detta släkte är den relativt lätt att identifiera. Ingenting är känt om dess beteende i laboratorieförsök eller dess känslighet för kemikalier. Den har dock visat sig vara lätt att odla (E. Belotti, personlig kommunikation).
|
Uppfödningsförhållanden
Alla Enchytraeus-arterna kan odlas i samma substrat som används för E. albidus. Deras ringa storlek innebär att odlingskärlen kan vara mindre och att samma foder kan användas men med justerad portionsstorlek. Livscykeln för dessa arter är kortare än för E. albidus och utfodringen bör ske oftare.
Testbetingelser
Testbetingelserna är i allmänhet desamma som de som gäller för E. albidus, med följande undantag:
|
—
|
storleken på testkärlet kan (men behöver inte) vara mindre,
|
|
—
|
reproduktionstestets varaktighet kan (men behöver inte) vara kortare, dvs. fyra i stället för sex veckor, men det preliminära testets varaktighet bör inte förändras,
|
|
—
|
mot bakgrund av juvenilernas ringa storlek rekommenderas kontrastfärgning å det bestämdaste för fastställande av antalet,
|
|
—
|
det kriterium för testresultatets giltighet som utgörs av ’antalet juveniler per testkärl i kontrollen’ bör ändras till ’50’.
|
HÄNVISNINGAR
|
(1)
|
Schmelz, R. M. och Collado, R. (1999). Enchytraeus luxuriosus sp.nov., a new terrestrial oligochaete species (Enchytraeidae, Clitellata, Annelida). Carolinea 57, 93–100.
|
Tillägg 6
Detaljerad beskrivning av extraktionstekniker
Kontrastfärgning med färgämnet Rose Bengal
Denna metod, som ursprungligen togs fram för limnologiska ändamål (1), föreslogs från början för bestämning av antalet juveniler i reproduktionstestet för småringmaskar av W. de Coen (Gents universitet, Belgien). Oberoende av detta utvecklades en modifierad version (Rose Bengal blandas med formaldehyd i stället för etanol) av RIVM Bilthoven (2) (3).
I slutet av det definitiva testet (dvs. efter sex veckor), överförs jorden i testkärlen till en grund behållare. Ett Bellaplast-kärl eller ett framkallningskärl med räfflad botten är användbart för detta ändamål, eftersom ’revbenen’ begränsar maskarnas rörelser inom undersökningsområdet. Juvenilerna fixeras med etanol (ca 5 ml per replikat). Kärlen fylls därefter med ett vattenskikt på 1–2 cm. Några droppar (200–300 μl) av färgämnet Rose Bengal (1 % lösning i etanol) tillsätts (0,5 % eosin är ett alternativ) och de två beståndsdelarna blandas noggrant. Efter 12 timmar kommer maskarna att ha färgats röda och bör vara lätta att räkna eftersom de ligger på substratets yta. Alternativt kan substrat/alkohol-blandningen tvättas genom en 0,250 mm sikt innan maskarna räknas. Genom detta förfarande kommer kaoliniten, torven och en del av sanden att sköljas bort och de rödaktiga maskarna blir lättare att se och räkna. Linser med belysning (linsstorlek minst 100 x 75 mm med en förstoringsfaktor på 2 till 3x) underlättar också räkningen.
Kontrastfärgningen minskar den tid det tar att räkna maskarna till några minuter per kärl och som vägledning bör det ta högst två dagar för en person att bedöma alla kärlen från ett test.
Våtextraktion
Våtextraktionen bör inledas omedelbart testets slut. Jorden från varje kärl placeras i plastsiktar med en maskstorlek på ca 1 mm. Siktarna placeras sedan över plastskålar utan att vidröra botten. Skålarna fylls noggrant med vatten tills proven i siktarna befinner sig helt under vattenytan. För att säkerställa en extraktionsgrad på mer än 90 % av de befintliga maskarna bör en extraktionsperiod på 3 dagar vid 20 ± 2 °C användas. I slutet av extraktionsperioden avlägsnas siktarna och vattnet (bortsett från en liten mängd) hälls långsamt av, utan att störa sedimentet i skålarnas botten. Plastskålarna skakas sedan lätt för att suspendera sedimentet i det överliggande vattnet. Vattnet hälls i en petriskål, och när jordpartiklarna har sjunkit till botten kan småringmaskarna identifieras, avlägsnas och räknas genom användning av ett stereomikroskop och en mjuk stålpincett.
Flotation
En metod som bygger på flotation har beskrivits i en not av R. Kuperman (4). Efter det att innehållet i kärlet har fixerats med etanol dränks jorden med Ludox (AM-30 kolloidal kiseldioxid, 30 viktprocent suspension i vatten) upp till 10 till 15 mm över jordytan. Efter grundlig blandning av jorden med flotationsmedlet i 2–3 minuter kan juveniler som flyter på ytan lätt räknas.
HÄNVISNINGAR
|
(1)
|
Korinkova, J. och Sigmund, J. (1968). The colouring of bottom-fauna samples before sorting, Vestnik Ceskoslovensko Spolecnosti Zoologicke 32, 300–305.
|
|
(2)
|
Dirven-Van Breemen, E., Baerselmann, R. och Notenboom, J. (1994). Onderzoek naar de Geschiktheid van de Potwormsoorten Enchytraeus albidus en Enchytraeus crypticus (Oligochaeta, Annelida) in Bodemecotoxicologisch Onderzoek. RIVM Rapport nr 719102025. 46 s.
|
|
(3)
|
Posthuma, L., Baerselmann, R., Van Veen, R. P. M. och Dirven-Van Breemen, E. M. (1997). Single and joint toxic effects of copper and zinc on reproduction of Enchytraeus crypticus in relation to sorption of metals in soils. Ecotox. Envir. Safety 38, s. 108–121.
|
|
(4)
|
Phillips, C. T., Checkai, R. T. och Kuperman, R. G. (1998). An alternative to the O'Connor Method for Extracting Enchytraeids from Soil. SETAC:s 19:e årsmöte, Charlotte, USA. Abstract Book No. PMP069, s. 157.
|
Tillägg 7
Översikt över de statistiska dataanalyserna (bestämning av NOEC)
C.33. REPRODUKTIONSTEST FÖR DAGGMASKAR (EISENIA FETIDA OCH EISENIA ANDREI)
INLEDNING
|
1.
|
Denna testmetod motsvarar OECD:s testriktlinje (TG) 222 (2004). Den är utformad för att användas för bestämning av effekterna av kemikalier i jord på reproduktionskapaciteten (och andra subletala endpoints) hos daggmaskar av arten Eisenia fetida (Savigny 1826) eller Eisenia andrei (Andre 1963) (1) (2). Testet har ringtestats (3). Det finns en testmetod för det akuta toxicitetstestet för daggmaskar (4). Ett antal andra internationella och nationella riktlinjer för test avseende kronisk toxicitet och akut toxicitet för daggmaskar har offentliggjorts (5) (6) (7) (8).
|
|
2.
|
Eisenia fetida och Eisenia andrei anses vara representativa för markfaunan och för daggmaskar i synnerhet. Bakgrundsinformation om daggmaskarnas ekologi och deras användning för ekotoxikologisk testning finns att tillgå (7) (9) (10) (11) (12).
|
PRINCIP FÖR TESTMETODEN
|
3.
|
Adulta daggmaskar exponeras för en serie koncentrationer av testkemikalien antingen nerblandad i jorden eller, när det gäller bekämpningsmedel, applicerad i eller på jorden med förfaranden som är förenliga med kemikaliens användning. Appliceringsmetoden är särskilt utvald för testets syfte. Testkoncentrationsintervallet väljs ut så att det omfattar koncentrationer som kan orsaka både letala och subletala effekter under en period på åtta veckor. Dödligheten och effekterna på de adulta maskarnas tillväxt bestäms efter fyra veckors exponering. Adulterna avlägsnas då ur jorden och reproduktionseffekterna utvärderas efter ytterligare fyra veckor genom att antalet juveniler i jorden räknas. Reproduktionskapaciteten hos de maskar som exponerats för testkemikalien jämförs med kontrollen eller kontrollerna för att fastställa (i) den koncentration vid vilken inga verkningar observeras (NOEC) och/eller (ii) ECx (t.ex. EC10, EC50) genom att använda en regressionsmodell för att beräkna den koncentration som orsakar en minskning av reproduktionskapaciteten med x %. ECx bör ligga innanför intervallet av testkoncentrationer (t.ex. EC10, EC50) så att ECx interpoleras snarare än extrapoleras (se tillägg 1 för definitioner).
|
INFORMATION OM TESTKEMIKALIEN
|
4.
|
Följande uppgifter om testkemikalien bör finnas tillgängliga för att vara till hjälp vid utformningen av lämpliga testförfaranden:
|
—
|
information om omvandling, spridning och fördelning i miljön, där så är möjligt (t.ex. fotolys- och hydrolyshastighet om detta är relevant för appliceringsmodellen).
|
|
|
5.
|
Denna testmetod kan användas för alla kemikalier, oberoende av deras vattenlöslighet. Testmetoden kan inte användas för flyktiga kemikalier, vilket här definieras som kemikalier för vilka Henrys konstant eller fördelningskoefficienten luft/vatten är större än ett, eller för kemikalier med ångtryck som överstiger 0,0133 Pa vid 25 °C.
|
|
6.
|
Ingen hänsyn tas i denna testmetod till eventuell nedbrytning av testkemikalien under testperioden. Följaktligen kan man inte förutsätta att exponeringskoncentrationernas ursprungliga värden kommer att bibehållas under hela testet. Kemiska analyser av testkemikalien i början och slutet av testet rekommenderas i dessa fall.
|
REFERENSKEMIKALIEN
|
7.
|
Referenskemikaliens NOEC eller ECx måste fastställas för att säkerställa att testbetingelserna i laboratorium är tillräckligt goda och för att kontrollera att testorganismernas respons inte ändras statistiskt över tiden. Det är lämpligt att testa en referenskemikalie minst en gång per år eller, om tester utförs mer sällan, parallellt med fastställandet av testkemikaliens toxicitet. Karbendazim och benomyl är lämpliga referenskemikalier som har visat sig påverka reproduktionen (3). Signifikanta effekter bör kunna iakttas mellan (a) 1 och 5 mg verksamt ämne/kg torrvikt eller (b) 250 och 500 g/ha eller 25 och 50 mg/m2. Om en positiv giftekvivalent ingår i testserien används en koncentration och antalet replikat bör vara detsamma som i kontrollerna.
|
TESTETS GILTIGHET
|
8.
|
Följande kriterier bör uppfyllas i kontrollerna för att testresultatet ska anses vara giltigt:
|
—
|
varje replikat (innehållande tio adulter) ska ha producerat ≥ 30 juveniler i slutet av testet,
|
|
—
|
variationskoefficienten för reproduktionen ska vara ≤ 30 %,
|
|
—
|
dödligheten hos adulter under testets första fyra veckor ska vara ≤10 %.
|
Om ett test inte uppfyller ovanstående kriterier för testresultatens giltighet bör testet avslutas, såvida inte en motivering för att fortsätta med testet kan ges. Motiveringen ska anges i rapporten.
|
BESKRIVNING AV TESTET
Utrustning
|
9.
|
Man bör använda testbehållare av glas eller annat kemiskt inert material med cirka 1–2 liters kapacitet. Behållarna ska ha en tvärsnittsarea på ungefär 200 cm2 så att man får ett fuktigt substrat med ett djup på omkring 5–6 cm när 500–600 g torrvikt substrat tillsätts. Behållarens lock bör vara konstruerat så att det möjliggör gasutbyte mellan substratet och atmosfären samt tillgång till ljus (t.ex. genom att locket är perforerat och genomskinligt), samtidigt som det förhindrar maskarna från att ta sig ut. Om den använda mängden testsubstrat är betydligt större än 500–600 g per testbehållare bör antalet maskar ökas i proportion till detta.
|
|
10.
|
Dessutom behövs normal laboratorieutrustning, särskilt följande:
|
—
|
pH-mätare och fotometer,
|
|
—
|
lämplig utrustning för temperaturreglering,
|
|
—
|
lämplig utrustning för reglering av luftfuktigheten (inte nödvändigt om exponeringskärlen har lock),
|
|
—
|
inkubator eller ett litet rum med luftkonditionering,
|
|
—
|
pincett, krokar eller öglor,
|
|
Beredning av den syntetiska jorden
|
11.
|
Syntetisk jord används i detta test (5) (7) med följande sammansättning (baserat på torrvikt, torkad till en konstant vikt vid 105 °C):
|
—
|
10 % vitmosstorv (Sphagnum) (så nära pH 5,5–6,0 som möjligt, utan synliga plantrester, finfördelad, torkad till den uppmätta vattenhalten),
|
|
—
|
20 % kaolinlera (kaolinithalt helst över 30 %),
|
|
—
|
0,3–1,0 % kalciumkarbonat (CaCO3, pulvriserat, av analyskvalitet) för att erhålla ett initialt pH-värde på 6,0 ± 0,5,
|
|
—
|
70 % lufttorkad kvartssand (beroende på mängden CaCO3), främst fin sand där mer än 50 % av partiklarna har storleken 50–200 μm.
|
Anmärkning 1: Den mängd CaCO3 som krävs beror på beståndsdelarna i jordsubstratet inklusive foder, och bör bestämmas genom mätning av delprov av jorden omedelbart före testet påbörjas. pH-värdet mäts i ett blandat prov med 1 M kaliumkloridlösning (KCl) eller 0,01 M kalciumkloridlösning (CaCl2) (13).
Anmärkning 2: Halten av organiskt kol i den syntetiska jorden kan minskas, t.ex. genom att sänka torvhalten till 4–5 % och öka sandhalten i motsvarande grad. Med en sådan minskning av halten organiskt kol kan möjligheterna till adsorption av testkemikalien till jorden (organiskt kol) minskas, och då blir testkemikalien bättre tillgänglig för maskarna. Det har visats att Eisenia fetida kan uppfylla giltighetskriterierna för reproduktion vid testning i fältjordar med lägre halt av organiskt kol (t.ex. 2,7 %) (14), och det finns erfarenhet av att detta också kan uppnås i syntetisk jord med 5 % torv. Det är inte nödvändigt att, innan den syntetiska jorden används i ett definitivt test, påvisa dess lämplighet för att testet ska uppfylla giltighetskriterierna såvida inte torvhalten sänks mer än vad som anges ovan.
Anmärkning 3: Vid användning av naturlig jord i ytterligare tester (t.ex. senare steg) bör jordens lämplighet och uppnåendet av kriterierna för testresultatets giltighet också påvisas.
|
|
12.
|
Jordens torra beståndsdelar blandas omsorgsfullt (t.ex. i en storskalig laboratorieblandare) i ett väl ventilerat område. Innan testet inleds fuktas den torra syntetiska jorden med tillräcklig mängd avjonat vatten till dess att den har en vattenhalt som motsvarar cirka hälften av den slutliga vattenhalten, dvs. 40–60 % av maximal vattenhållningskapacitet (motsvarande 50 ± 10 % torrvikt). Resultatet av detta blir ett substrat som inte har stående eller obundet vatten när det pressas i handen. Den syntetiska jordens maximala vattenhållningskapacitet (WHC) bestäms i enlighet med de förfaranden som beskrivs i tillägg 2, ISO 11274 (15) eller motsvarande EU-standard.
|
|
13.
|
Om testkemikalien appliceras på markytan eller blandas ner i jorden utan vatten kan den slutliga mängden vatten blandas ner i den syntetiska jorden när jorden bereds. Om testkemikalien blandas ner i jorden tillsammans med en del vatten kan ytterligare vatten tillsättas tillsammans med testkemikalien (se punkt 19).
|
|
14.
|
Jordens fukthalt bestäms i början och i slutet av testet i enlighet med ISO 11465 (16) eller motsvarande EU-standard, och markens pH-värde i enlighet med tillägg 3 eller ISO 10390 (13) eller motsvarande EU-standard. Dessa bestämningar ska utföras på ett prov med kontrolljord och ett jordprov med varje testkoncentration. Jordens pH-värde bör inte justeras när sura och basiska kemikalier testas. Vattenhalten bör övervakas under hela testet genom att behållarna vägs med jämna mellanrum (se punkt 26 och 30).
|
Urval och förberedelse av försöksdjuren
|
15.
|
Den art som används i testet är Eisenia fetida eller Eisenia andrei (1) (2). För att påbörja testet behövs adulta maskar som är mellan två månader och ett år och som är försedda med clitellum (gördel). Maskarna bör väljas ut från en synkroniserad kultur med en relativt homogen åldersstruktur (tillägg 4). Individerna i en testgrupp får inte variera i ålder med mer än 4 veckor.
|
|
16.
|
De utvalda maskarna bör acklimatiseras under minst en dag med den typ av syntetiskt jordsubstrat som används i testet. Under denna period bör maskarna utfodras med samma foder som används i testet (se punkterna 31–33).
|
|
17.
|
Grupper med tio maskar vägs individuellt, och grupperna tilldelas sedan slumpvis testbehållare vid testets början. Maskarna tvättas före vägningen (med avjonat vatten), och överflödigt vatten avlägsnas genom att maskarna under en kort stund placeras på filterpapper. De enskilda maskarnas våtvikt bör vara 250–600 mg.
|
Beredning av testkoncentrationer
|
18.
|
Två metoder för applicering av testkemikalien kan användas: testkemikalien kan blandas ner i jorden (se punkterna 19–21) eller appliceras på jordytan (se punkterna 22–24). Valet av metod beror på syftet med provet. I allmänhet rekommenderas att testkemikalien blandas ner i jorden. Appliceringsmetoder som är förenliga med normal lantbrukspraxis kan dock krävas (t.ex. besprutning med flytande beredning eller användning av särskilda beredningar av bekämpningsmedel såsom granulat eller betningsmedel). Lösningsmedel som används till att underlätta behandlingen av jorden med testkemikalien bör väljas på grundval av deras låga toxicitet för daggmaskar, och en lämplig lösningsmedelskontroll ska tas med i testupplägget (se punkt 27).
|
Nedblandning av testkemikalien i jorden
Testkemikalier som är lösliga i vatten
|
19.
|
En lösning av testkemikalien i avjonat vatten bereds omedelbart före testets inledning i tillräcklig mängd för att räcka till alla replikat av en testkoncentration. Det kan vara nödvändigt att använda ett hjälplösningsmedel för att underlätta beredningen av testlösningen. Det är lämpligt att bereda den mängd lösning som krävs för att nå den slutliga vattenhalten (40–60 % av maximal vattenhållningskapacitet). Lösningen blandas grundligt med jordsubstratet innan detta placeras i en testbehållare.
|
Testkemikalier som är olösliga i vatten
|
20.
|
Testkemikalien upplöses i en liten volym lämpligt organiskt lösningsmedel (t.ex. aceton), och därefter sprejas den på, eller blandas ner i, en liten mängd fin kvartssand. Lösningsmedlet avlägsnas därefter genom avdunstning i ett dragskåp under minst ett par minuter. Den behandlade sanden blandas därefter grundligt med den förhandsfuktade syntetiska jorden. Därefter tillsätts avjonat vatten (i den mängd som krävs) för att uppnå en slutlig fukthalt på 40–60 % av maximal vattenhållningskapacitet och blandas ner. Jorden är nu redo att placeras i testbehållare. Det är viktigt att tänka på att vissa lösningsmedel kan vara toxiska för daggmaskar.
|
Testkemikalier som är olösliga i vatten och organiska lösningsmedel
|
21.
|
En blandning bestående av 10 g finmald industriell kvartssand med den mängd av testkemikalien som krävs för att uppnå testkoncentrationen i jorden bereds. Blandningen ska sedan blandas grundligt med den förhandsfuktade syntetiska jorden. Avjonat vatten tillsätts sedan i den mängd som krävs för att man ska erhålla den slutliga fukthalten på 40–60 % av maximal vattenhållningskapacitet och blandas ner. Jorden är nu redo att placeras i testbehållare.
|
Applicering av testkemikalien på jordytan
|
22.
|
Jorden behandlas efter det att maskarna har tillsatts. Testbehållarna fylls först med det fuktiga jordsubstratet och de vägda daggmaskarna placeras på ytan. Friska maskar gräver sig normalt omedelbart ner i substratet, varför de som fortfarande befinner sig på ytan efter 15 minuter definieras som skadade och måste bytas ut. Om maskarna byts ut bör de nya och de utbytta maskarna vägas, så att den totala levande vikten av den grupp maskar som ska exponeras och den totala vikten av behållaren med maskar vid testets början är kända.
|
|
23.
|
Testkemikalien appliceras sedan. Man bör vänta minst en halvtimme efter det att maskarna införts (och inte applicera kemikalien om maskar befinner sig på jordytan), så att man undviker direktexponering för testkemikalien genom hudkontakt. När testkemikalien är ett bekämpningsmedel kan det vara lämpligt att applicera den på jordytan genom besprutning. Testkemikalien ska appliceras på jordytan så jämnt som möjligt med hjälp av en lämplig besprutningsanordning i laboratorieskala för att simulera besprutning på fältet. Före appliceringen bör testbehållarens lock avlägsnas och ersättas med en skyddsfilm som skyddar behållarens sidoväggar från stänk. Skyddsfilmen kan tillverkas av en testbehållare med basen borttagen. Appliceringen bör ske vid en temperatur på 20 ± 2 °C och för vattenlösningar, emulsioner eller dispersioner med en vattenappliceringshastighet på 600–800μl/m2. Hastigheten bör kontrolleras med hjälp av lämplig kalibreringsteknik. Särskilda beredningar som granulat eller betningsmedel bör appliceras på ett sätt som är förenligt med lantbrukspraxis.
|
|
24.
|
Testbehållarna bör få stå utan lock i 1 timme, så att alla flyktiga lösningsmedel som använts i samband med appliceringen av testkemikalien avdunstar. Se till att inga maskar tar sig ut ur testkärlen under denna tid.
|
FÖRFARANDE
Testgrupper och kontroller
|
25.
|
En djurtäthet på tio daggmaskar i 500–600 g torrvikt syntetisk jord (dvs. 50–60 g jord per mask) rekommenderas. Om större mängder jord används, vilket kan vara fallet om man testar bekämpningsmedel med särskilda appliceringsmetoder såsom betningsmedel, bör en djurtäthet motsvarande 50–60 g jord per mask bibehållas genom att man ökar antalet maskar. Tio maskar förbereds för varje kontroll- och testbehållare. Maskarna tvättas med vatten och torkas av och placeras sedan på absorberande papper under en kort tid för att överskottsvattnet ska rinna av.
|
|
26.
|
För att undvika systematiska fel i fördelningen av maskarna i testbehållarna bör testpopulationens homogenitet bestämmas genom individuell vägning av 20 slumpmässigt utvalda maskar ur den population från vilken testmaskarna ska tas. Efter att ha säkerställt homogeniteten väljs partier av maskar sedan ut, vägs och tilldelas testbehållare genom ett randomiseringsförfarande. Efter det att testmaskarna tillsatts vägs varje testbehållare för att man ska fastställa en initialvikt som kan användas som grund för kontroll av jordens fukthalt under hela testet på det sätt som beskrivs i punkt 30. Testbehållarna täcks enligt beskrivning i punkt 9 och placeras i testkammaren.
|
|
27.
|
Lämpliga kontroller bereds för var och en av de appliceringsmetoder för testkemikalien som beskrivs i punkterna 18–24. De relevanta förfarandena för beredning av kontrollerna följs förutom att testkemikalien inte läggs till. I förekommande fall tillsätts organiska lösningsmedel, kvartssand eller andra vehiklar i kontrollerna i de koncentrationer eller mängder som motsvarar dem som används i testkärlen. Om ett lösningsmedel eller annan vehikel används för tillsats av testkemikalien bör en ytterligare kontroll utan vehikeln eller testkemikalien också beredas och testas för att säkerställa att vehikeln inte påverkar resultatet.
|
Testbetingelser
|
28.
|
Testtemperaturen ska vara 20 ± 2 °C. Testet utförs under kontrollerade ljus-/mörkercykler (helst 16 h ljus/8 h mörker) med en belysning på 400–800 lux i området med testkärlen.
|
|
29.
|
Testbehållarna luftas inte under testet men utformningen av testkärlens lock bör möjliggöra gasutbyte samtidigt som de begränsar avdunstningen av vatten (se punkt 9).
|
|
30.
|
Vattenhalten i jordsubstratet i testbehållarna bibehålls under hela testet genom regelbunden omvägning av testbehållarna (minus deras lock). Förluster fylls på vid behov med avjonat vatten. Vattenhalten får inte variera med mer än 10 % jämfört med vattenhalten vid testets början.
|
Utfodring
|
31.
|
Allt foder som har en kvalitet som visats vara lämplig för att maskarna åtminstone ska hålla vikten under provet anses godtagbart. Erfarenheten har visat att havremjöl, ko- eller hästgödsel är lämpligt foder. Kontroller ska göras för att se till att de nötkreatur eller hästar från vilka gödseln kommer inte genomgår medicinering eller behandling med kemikalier, t.ex. tillväxtbefrämjande medel, nematicider eller liknande veterinärmedicinska produkter, som kan påverka maskarna under testet. Det rekommenderas att man själv samlar in kogödseln, eftersom erfarenheten har visat att kommersiellt tillgänglig kogödsel som används som trädgårdsgödsel kan påverka maskarna negativt. Gödseln ska lufttorkas, finmalas och pastöriseras före användning.
|
|
32.
|
Innan den används i ett test bör varje ny fodersats ges till en maskkultur som inte testas för att säkerställa att den är av lämplig kvalitet. Tillväxten och kokongproduktionen bör inte minska jämfört med maskar hålls i ett substrat som inte innehåller den nya fodersatsen (samma betingelser som de som beskrivs i testmetod C.8 (4)).
|
|
33.
|
Första fodergivan ges en dag efter det att maskarna har införts och testkemikalien har tillsatts jorden. Ca 5 g foder sprids ut på jordytan i varje behållare och fuktas med avjonat vatten (ca 5 till 6 ml per behållare). Foder ges därefter en gång i veckan under testperioden på fyra veckor. Om fodret förblir oätet bör mängden minskas för att undvika svampangrepp eller mögel. Adulterna avlägsnas från jorden på testdag 28. Ytterligare 5 g foder ska därefter ges i varje behållare. Ingen ytterligare utfodring sker under de återstående fyra veckorna av testet.
|
Val av testkoncentrationer
|
34.
|
Tidigare kunskap om testämnets toxicitet är till hjälp vid valet av lämpliga testkoncentrationer, t.ex. från ett akut test (4) och/eller preliminära test. Vid behov utförs ett preliminärt test med t.ex. fem testkoncentrationer på 0,1, 1,0, 10, 100 och 1 000 mg/kg (torrvikt jord). Ett replikat för varje exponering och kontroll är tillräckligt. Varaktigheten av det preliminära testet är två veckor och dödligheten bedöms i slutet av testet.
|
Testets utformning
|
35.
|
Eftersom det inte går att fastställa en enda sammanfattande statistik för detta prov tillhandahåller testmetoden möjligheter att bestämma NOEC och ECx. Ett NOEC-värde kommer sannolikt att krävas av tillsynsmyndigheterna inom en överskådlig framtid. På grund av statistiska och ekologiska överväganden kan ECx komma att få en mer omfattande användning inom en nära framtid. Därför föreslås tre utformningar på grundval av rekommendationerna från ett ringtest av ett reproduktionstest för småringmaskar (17).
|
|
36.
|
Vid valet av koncentrationsintervall bör man beakta följande:
|
—
|
För bestämning av NOEC bör man testa minst fem/tolv koncentrationer i en geometrisk serie. Det rekommenderas att man använder fyra replikat för varje testkoncentration plus åtta kontroller. Koncentrationerna bör skilja sig åt med en faktor på högst 2,0.
|
|
—
|
För bestämning av ECx (t.ex. EC10, EC50) rekommenderas ett tillräckligt antal koncentrationer för att framkalla minst fyra olika statistiskt signifikanta genomsnittliga responser vid dessa koncentrationer. Det rekommenderas att man använder minst två replikat för varje testkoncentration och sex kontrollreplikat. Koncentrationernas inbördes avståndsfaktor kan variera, dvs. den kan vara mindre än eller lika med 1,8 i det förväntade effektintervallet och större än 1,8 vid högre och lägre koncentrationer.
|
|
—
|
Ett kombinerat tillvägagångssätt möjliggör bestämning av både ECx och NOEC. Man bör använda åtta testkoncentrationer i en geometrisk serie. Fyra replikat per exponering plus åtta kontroller rekommenderas. Koncentrationerna bör skilja sig åt med en faktor på högst 1,8.
|
|
Testets varaktighet och mätningar
|
37.
|
Dag 28 iakttas och räknas de levande adulta maskarna. Alla förändringar i adulternas beteende (t.ex. oförmåga att gräva ner sig i jorden, maskar ligger orörliga mot testkärlets glasvägg) och morfologi (t.ex. öppna sår) registreras också. Alla adulter avlägsnas sedan från testkärlen samt räknas och vägs. Om jorden med maskarna överförs till en ren bricka före bedömningen kan adulterna bli lättare att hitta. Maskar som tagits upp ur jorden rengörs (med avjonat vatten) före vägning, och överflödigt vatten avlägsnas genom att maskarna under en kort stund placeras på filterpapper. Alla maskar som inte hittas vid denna tidpunkt ska registreras som döda, eftersom det kan antas att dessa maskar dött och brutits ned före bedömningen.
|
|
38.
|
Om jorden har avlägsnats från behållaren ska den sedan läggas tillbaka (utan de adulta maskarna men med de kokonger som har producerats). Därefter inkuberas jorden i ytterligare fyra veckor under samma testförhållanden, förutom att utfodring sker endast en gång i början av denna fas av testet (se punkt 33).
|
|
39.
|
Vid utgången av den andra fyraveckorsperioden ska antalet juveniler som kläcks ur kokongerna i testjorden och antalet kokonger fastställas enligt de förfaranden som beskrivs i tillägg 5. Alla tecken på skador på maskarna bör också registreras under hela testperioden.
|
Toleranstest
|
40.
|
Om inga effekter observeras vid den högsta koncentrationen i det preliminära testet (dvs. 1 000 mg/kg), utförs reproduktionstestet som ett toleranstest med en testkoncentration på 1 000 mg/kg. Ett toleranstest gör det möjligt att visa att NOEC-värdet för reproduktion är större än gränskoncentrationen, samtidigt som man minimerar antalet maskar som används i testet. Åtta replikat bör användas både för den behandlade jorden och för kontrollen.
|
DATA OCH RAPPORTERING
Behandling av resultaten
|
41.
|
Även om en översikt ges i tillägg 6, tillhandahålls ingen definitiv statistisk vägledning för analys av testresultaten i denna testmetod.
|
|
42.
|
En endpoint är dödlighet. Förändringar i adulternas beteende (t.ex. oförmåga att gräva ner sig i jorden, maskar ligger orörliga mot testkärlets glasvägg) och morfologi (t.ex. öppna sår) bör dock också registreras, liksom eventuell förekomst av juveniler. Probitanalys (18) eller logistisk regressionsanalys bör normalt tillämpas för bestämning av LC50. I de fall då denna analysmetod är olämplig (t.ex. om färre än tre koncentrationer med partiell dödlighet finns tillgängliga) kan alternativa metoder dock användas. Dessa metoder kan omfatta glidande medelvärden (19), den modifierade Spearman-Karbermetoden (20) eller enkel interpolering (t.ex. det geometriska medelvärdet av LC0 och LC100, som beräknats genom att kvadratroten av LC0 multiplicerats med LC100).
|
|
43.
|
Den andra endpointen är fekunditet (dvs. antalet avkommor som producerats). Liksom i det preliminära testet bör alla andra skadliga tecken registreras i slutrapporten. Den statistiska analysen kräver att man beräknar det aritmetiska medelvärdet

och standardavvikelsen per testkärl och per kontroll för reproduktionen. |
|
44.
|
Om en variansanalys har utförts kan standardavvikelsen, s, och frihetsgraderna, df, ersättas av den sammanlagda uppskattningen av variansen som erhållits från variansanalysen (ANOVA) respektive dess frihetsgrader – förutsatt att variansen inte är beroende av koncentrationen. I detta fall ska de enskilda varianserna i kontroll- och testenheter användas. Dessa värden beräknas normalt med hjälp av kommersiell programvara för statistik med användning av resultaten per kärl som replikat. Om det förefaller vara rimligt att slå ihop data för negativa kontroller och kontroller med lösningsmedel snarare än att testa mot en av dem bör de testas för att säkerställa att det inte finns betydande skillnader mellan dem (för lämpligt test, se punkt 47 och tillägg 6).
|
|
45.
|
Ytterligare statistisk testning och slutsatser beror på om värdena för replikaten är normalt fördelade och enhetliga med avseende på variansen.
|
Uppskattning av NOEC
|
46.
|
Man bör främst använda kraftfulla tester. Man bör använda information t.ex. från tidigare erfarenheter med ringtester eller andra tidigare uppgifter om huruvida data är ungefär normalt fördelade. Variansens homogenitet (homoskedasticitet) är av mer avgörande betydelse. Erfarenheter visar att variansen ofta ökar med ett ökande medelvärde. I dessa fall kan en datatransformation leda till homoskedasticitet. En sådan transformation bör baseras på erfarenheterna från tidigare uppgifter i stället för på uppgifter som håller på att undersökas. Med homogena data bör flera t-tester, såsom Williams test (α = 0,05, asymmetriskt) (21) (22) eller i vissa fall Dunnetts test (23) (24), utföras. När det gäller ojämn förökning bör det noteras att t-värdena i tabellen måste korrigeras i enlighet med Dunnett och Williams. Ibland ökar/minskar reaktionerna inte regelbundet på grund av stor variation. I ett sådant fall med kraftig avvikelse från monotonicitet är Dunnetts test lämpligare. Om det finns avvikelser från homoskedasticiteten kan det vara rimligt att närmare undersöka de möjliga effekterna på variansen för att besluta om t-testerna kan tillämpas utan att förlora mycket av sin effekt (25). Alternativt kan ett multipelt U-test tillämpas, t.ex. Bonferronis U-test enligt Holm (26), eller, när dessa data uppvisar heteroskedasticitet men i övrigt är förenliga med en bakomliggande monoton dos-respons, ett annat icke-parametriskt test (t.ex. Jonckheere-Terpstra (27) (28) eller Shirley (29) (30)), och är i allmänhet att föredra framför t-tester med ojämn varians (se även diagrammet i tillägg 6).
|
|
47.
|
Om ett toleranstest har utförts och de nödvändiga förutsättningarna för parametriska testförfaranden (normalitet, homogenitet) är uppfyllda, kan ett parvist Students t-test användas eller i annat fall Mann och Whitneys U-testförfarande (31).
|
Bestämning av ECx
|
48.
|
När man beräknar ECx-värden används medelvärdena per testkärl för regressionsanalys (linjär eller icke-linjär) efter att en lämplig dos-responsfunktion har erhållits. När det gäller maskarnas tillväxt som en kontinuerlig respons kan ECx-värdena uppskattas med hjälp av en lämplig regressionsanalys (32). Bland lämpliga funktioner för dikotoma data (mortalitet/överlevnad) och antal avkommor återfinns de normala sigmoida eller logistiska funktionerna eller Weibull-funktionen med två till fyra parametrar, varav vissa även kan uttrycka hormetiska responser. Om en dos-respons-funktion anpassas genom linjär regressionsanalys bör en signifikant determinationskoefficient (r2) och/eller lutning konstateras med regressionsanalysen innan ECx uppskattas genom att ett värde som motsvarar x % av genomsnittet för kontrollen infogas i den ekvation som utgör resultatet av regressionsanalysen. De 95-procentiga konfidensgränserna beräknas enligt Fieller (hänvisning i Finney (18)) eller andra lämpliga moderna metoder.
|
|
49.
|
Alternativt kan responsen uttryckas som en procentandel eller en andel av den modellparameter som tolkas som den genomsnittliga responsen för kontrollen. I dessa fall kan den normala (logistiska, Weibullska) sigmoida kurvan ofta lätt anpassas till resultaten med hjälp av probitregressionsförfarandet (18). I dessa fall måste viktningsfunktionen justeras för metriska responser i enlighet med Christensen (33). Om hormesis har iakttagits bör probitanalysen dock ersättas med en logistisk funktion eller en Weibullfunktion, i båda fallen med fyra parametrar, anpassad genom ett icke-linjärt regressionsförfarande (34). Om en lämplig dos-responsfunktion inte kan anpassas till data kan man använda alternativa metoder för att uppskatta ECx och dess konfidensgränser, t.ex. glidande medelvärden efter Thompson (19) och det modifierade Spearman-Karberförfarandet (20).
|
TESTRAPPORT
|
50.
|
Testrapporten ska innehålla följande uppgifter:
|
|
Testkemikalie:
|
—
|
en definitiv beskrivning av testkemikalien, sändnings- och partinummer, CAS-nummer, renhet,
|
|
—
|
testkemikaliens egenskaper (t.ex. log Kow, vattenlöslighet, ångtryck, Henrys konstant (H) och information om omvandling, spridning och fördelning).
|
|
|
|
Testorganismer:
|
—
|
de använda försöksdjuren: art, vetenskapligt namn, källa och uppfödningsbetingelser,
|
|
—
|
testorganismernas ålder, storleksintervall (vikt).
|
|
|
|
Testbetingelser
|
—
|
detaljer om förberedelse av testjorden,
|
|
—
|
jordens maximala vattenhållningskapacitet,
|
|
—
|
en beskrivning av den teknik som används för att applicera testkemikalien på jorden,
|
|
—
|
uppgifter om hjälpkemikalier som används för tillförsel av testkemikalien,
|
|
—
|
detaljer om kalibreringen av besprutningsutrustningen i förekommande fall,
|
|
—
|
beskrivning av testets utformning och testförfarandet,
|
|
—
|
testbehållarnas storlek och testjordens volym,
|
|
—
|
testbetingelser: ljusintensitet, ljus/mörker-cyklernas varaktighet, temperatur,
|
|
—
|
en beskrivning av utfodringsprogrammet, typen och mängden av det foder som används i testet, datum för utfodringar,
|
|
—
|
jordens pH-värde och vattenhalt vid början och slutet av testet.
|
|
|
|
Testresultat:
|
—
|
dödligheten hos adulter (%) i varje testbehållare vid utgången av de första fyra veckorna,
|
|
—
|
den totala vikten av alla adulter i början av testet i varje testbehållare,
|
|
—
|
förändringar i kroppsvikt hos levande adulter (% av ursprunglig vikt) i varje testbehållare efter de första fyra veckorna,
|
|
—
|
antalet avkommor som producerats i varje testbehållare vid testets slut,
|
|
—
|
en beskrivning av olika uppenbara eller patologiska symtom eller tydliga beteendeförändringar,
|
|
—
|
de resultat som erhållits med referenstestkemikalien,
|
|
—
|
LC50, NOEC eller ECx (t.ex. EC50, EC10) för reproduktionen om vissa av dem är tillämpliga med konfidensintervaller, och en kurva som representerar den anpassade modell som har använts för beräkningen, samt alla uppgifter och observationer som kan vara till nytta vid tolkningen av resultaten,
|
|
—
|
ett diagram över förhållandet mellan dos och respons,
|
|
—
|
resultaten för varje testbehållare.
|
|
Avvikelser från de förfaranden som beskrivs i denna testmetod och ovanliga händelser under testets gång.
|
LITTERATUR
|
(1)
|
Jaenicke, J. (1982). 'Eisenia foetida' is two biological species. Megadrilogica 4, 6–8.
|
|
(2)
|
Oien, N. och J. Stenerson (1984). Esterases of earthworm – III. Electrophoresis reveals that Eisenia foetida (Savigny) is two species. Comp. Biochem. Physiol. 78c (2), 277–282.
|
|
(3)
|
Kula, C. (1996). Development of a test method on sublethal effects of pesticides on the earthworm species Eisenia fetida/Eisenia andrei – comparison of two ringtests. I: Riepert, F. och Kula, C. (1996). Development of laboratory methods for testing effects of chemicals and pesticides on collembola and earthworms. Mitt. Biol. Bundesamst. f. Land- Forstwirtsch. Berlin-Dahlem, 320, s. 50–82.
|
|
(4)
|
Kapitel C.8 i denna bilaga: Toxicitet för daggmaskar.
|
|
(5)
|
ISO (Internationella standardiseringsorganisationen) (1999). Markundersökningar – Föroreningars effekt på daggmaskar (Eisenia fetida). Del 2: Bestämning av effekter på reproduktion, nr 11268-2. ISO, Genève.
|
|
(6)
|
ISO (Internationella standardiseringsorganisationen) (1999). Markundersökningar – Föroreningars effekt på daggmaskar (Eisenia fetida). Del 1: Bestämning av akut toxicitet med artificiell jord, nr 11268-1. ISO, Genève.
|
|
(7)
|
SETAC (1998). Advances in Earthworm Ecotoxicology. Sheppard, S. C., Bembridge, J. D. Holmstrup, M., och L. Posthuma, (red.). SETAC Press, 456 s.
|
|
(8)
|
EPA (1996). Ecological effects test guidelines. Earthworm Subchronic Toxicity Test (850.62.00). United States Environmental Protection Agency. Office of Prevention, Pesticides and Toxic Substances. EPA712-C- 96-167, april 1996.
|
|
(9)
|
Bouché, M. B. (1972). Lombriciens de France, Ecologie et systématique. Publication de l'Institut National de la Recherche Agronomique.
|
|
(10)
|
Edwards, C. A. (1983). Development of a standardized laboratory method for assessing the toxicity of chemical substances to earthworms. Rapport EUR 8714 EN, Europeiska gemenskapernas kommission.
|
|
(11)
|
Greig-Smith, P. W., H. Becker, P. J. Edwards och F. Heimbach (red.) (1992). Ecotoxicology of Earthworms. Intercept.
|
|
(12)
|
Edwards, C. A. och Bohlen P. J. (1996). Biology and ecology of earthworms, tredje upplagan. Chapman and Hall, London.
|
|
(13)
|
ISO (Internationella standardiseringsorganisationen) (1994). Markundersökningar – Bestämning av pH, nr 10390. ISO, Genève.
|
|
(14)
|
Hund-Rinke, K, Römbke, J., Riepert, F. och Achazi R. (2000). Beurteilung der Lebensraumfunktion von Böden mit Hilfe von Regenwurmtests. I: Toxikologische Beurteilung von Böden. Heiden, S., Erb, R., Dott, W. och Eisentraeger, A. (red.). Spektrum Verl., Heidelberg. 59–81.
|
|
(15)
|
ISO (Internationella standardiseringsorganisationen) (1999). Markundersökningar – Bestämning av den vattenhållande förmågan – Laboratoriemetoder, nr 11274. ISO, Genève.
|
|
(16)
|
ISO (Internationella standardiseringsorganisationen) (1995). Markundersökningar – Bestämning av torrsubstans och vattenkvot – Gravimetrisk metod, nr 11465. ISO, Genève.
|
|
(17)
|
Römbke J. och Th. Moser (1999). Organisation and Performance of an International Ringtest for the validation of the Enchytraeid Reproduction Test. UBA-Texte 4/99, s. 150 + 223.
|
|
(18)
|
Finney D. J. (1971). Probit Analysis (tredje upplagan), s. 19–76. Cambridge Univ. Press.
|
|
(19)
|
Finney D. J. (1978). Statistical Method in Biological Assay. Charles Griffin & Company Ltd, London.
|
|
(20)
|
Hamilton, M. A., R. C. Russo och R. V. Thurston. (1977). Trimmed Spearman-Karber Method for estimating median lethal concentrations in toxicity bioassays. Environ. Sci. Technol. 11:7, 714–719; korrigering i Environ. Sci. Technol. 12 (1998), 417.
|
|
(21)
|
Williams, D. A., (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics, 27, 103–117.
|
|
(22)
|
Williams, D. A., (1972). The comparison of several dose levels with a zero dose control. Biometrics, 28, 519–531.
|
|
(23)
|
Dunnett, C. W., (1955). A multiple comparison procedure for comparing several treatments with a control. Amer. Statist. Ass. J. 50, 1096–1121.
|
|
(24)
|
Dunnett, C. W., (1964) New Tables for Multiple Comparisons with a Control. Biometrics, 20, 482–491.
|
|
(25)
|
Hoeven, N. van der, (1998). Power analysis for the NOEC: What is the probability of detecting small toxic effects on three different species using the appropriate standardized test protocols? Ecotoxicology 7, 355–361
|
|
(26)
|
Holm, S. (1979): A simple sequentially rejective multiple test procedure. Scand. J. Statist. 6, 65–70.
|
|
(27)
|
Jonckheere, A. R. (1954). A Distribution-free k-Sample Test Against Ordered Alternatives, Biometrika 41, 133–145.
|
|
(28)
|
Terpstra, T. J. (1952). The Asymptotic Normality and Consistency of Kendall's Test Against Trend, When Ties are Present in One Ranking, Indagationes Math. 14, 327–333.
|
|
(29)
|
Shirley, E. A. (1979). The comparison of treatment to control group means in toxicology studies, Applied Statistics 28, 144–151.
|
|
(30)
|
Williams, D. A. (1986). A Note on Shirley's Nonparametric Test for Comparing Several Dose Levels with a Zero-Dose Control, Biometrics 42, 183–186.
|
|
(31)
|
Sokal, R. R. och F. J. Rohlf. (1981). Biometry. The Principle and practice of statistics in biological research. Andra upplagan. W. H. Freeman and Company. New York.
|
|
(32)
|
Bruce R. D. och Versteeg D. J. (1992) A statistical procedure for modelling continuous toxicity data. Environmental Toxicology and Chemistry 11, 1485–1494.
|
|
(33)
|
Christensen, E.R. (1984). Dose-response functions in aquatic toxicity testing and the Weibull model. Water Research 18, 213–221.
|
|
(34)
|
Van Ewijk, P. H. och J. A. Hoekstra. (1994). Calculation of the EC50 and its confidence interval when sub-toxic stimulus is present. Ecotox, Environ. Safety. 25, 25–32.
|
Tillägg 1
Definitioner
Följande definitioner gäller för denna testmetod:
Kemikalie
: ett ämne eller en blandning.
ECx
(koncentration som orsakar x % effekt): den koncentration som orsakar en x-procentig effekt på testorganismerna efter en given exponeringstid jämfört med ett kontrollprov. EC50 är till exempel den koncentration som beräknas ha en effekt för en av testets endpoints på 50 % av en exponerad population under en fastställd exponeringstid. I detta test uttrycks effektkoncentrationerna som testkemikaliens vikt per torrvikt testjord eller som testkemikaliens vikt per ytenhet av jorden.
LC0
(letal koncentration 0 %): den koncentration av testkemikalien som inte orsakar någon av de exponerade testorganismernas död under en given tidsperiod. I detta test uttrycks LC0-värdet som testkemikaliens vikt per torrvikt testjord.
LC50
(letal koncentration 50 %): den koncentration av testkemikalien som orsakar 50 % av de exponerade testorganismernas död under en given tidsperiod. I detta test uttrycks LC50-värdet som testkemikaliens vikt per torrvikt testjord eller som testkemikaliens vikt per ytenhet av jorden.
LC100
(letal koncentration 100 %): den koncentration av testkemikalien som orsakar alla de exponerade testorganismernas död under en given tidsperiod. I detta test uttrycks LC100-värdet som testkemikaliens vikt per torrvikt testjord.
Lägsta koncentration med observerad effekt (LOEC)
: den lägsta koncentrationen testkemikalien som har en statistiskt signifikant effekt (p < 0,05). I detta test uttrycks LOEC som testkemikaliens vikt per torrvikt testjord eller som testkemikaliens vikt per ytenhet av marken. Alla testkoncentrationer som överstiger LOEC bör normalt uppvisa en effekt som statistiskt skiljer sig från kontrollen. Eventuella avvikelser från ovan måste motiveras i testrapporten.
Nolleffektkoncentrationen (NOEC)
: den högsta koncentrationen av testkemikalien omedelbart under LOEC-värdet vid vilken ingen effekt observeras. I detta test har en halt som motsvarar NOEC ingen statistiskt signifikant effekt (p < 0,05) efter en given exponeringstid jämfört med ett kontrollprov.
Reproduktionstakt
: det genomsnittliga antalet avkommor som producerats per ett antal adulta maskar under testperioden.
Testkemikalie
: alla ämnen eller blandningar som testas med denna testmetod.
Tillägg 2
Fastställande av jordens maximala vattenhållningskapacitet
Följande metod för att bestämma jordens maximala vattenhållningskapacitet har visat sig vara lämplig. Den beskrivs i bilaga C till ISO DIS 11268-2 (1).
Samla in en fastställd kvantitet (t.ex. 5 g) testjordsubstrat med hjälp av en lämplig anordning (jordborr med rör osv.). Täck botten av röret med en bit filterpapper och fyll det med vatten. Placera det därefter på en ställning i ett vattenbad. Röret bör gradvis nedsänkas i vattnet tills vattenytan är ovanför jordytan. Det bör därefter lämnas i vattnet i cirka 3 timmar. Eftersom allt vatten som absorberas av jordens kapillärer inte kan hållas kvar bör jordprovet dräneras i 2 timmar genom att röret placeras på en bädd av mycket fuktig finmald kvartssand i ett slutet kärl (för att förhindra uttorkning). Provet bör sedan torkas till en konstant vikt vid 105 °C och vägas. Vattenhållningskapaciteten (WHC) ska beräknas enligt följande:

där
|
S
|
=
|
vattenmättat substrat + rörets vikt + filterpapprets vikt
|
|
T
|
=
|
emballagevikt (rörets vikt + filterpapprets vikt)
|
|
D
|
=
|
substratets torrvikt
|
HÄNVISNINGAR:
|
(1)
|
ISO (Internationella standardiseringsorganisationen) (1999). Markundersökningar – Föroreningars effekt på daggmaskar (Eisenia fetida). Del 2: Bestämning av effekter på reproduktion, nr 11268-2. ISO, Genève.
|
Tillägg 3
Bestämning av jordens pH-värde
Följande metod för bestämning av pH-värdet i jord bygger på beskrivningen i ISO DIS 10390: Markundersökningar – Bestämning av pH (1).
En bestämd mängd jord torkas i rumstemperatur i minst 12 timmar. En suspension av jorden (som innehåller minst 5 gram jord) bereds därefter i fem gånger dess volym med antingen 1 M kaliumkloridlösning (KCl) av analyskvalitet eller 0,01 M kalciumkloridlösning (CaCl2) av analyskvalitet. Suspensionen skakas därefter omsorgsfullt i fem minuter och får sedan stå och klarna i minst 2 timmar men högst 24 timmar. Vätskefasens pH mäts sedan med en pH-mätare som har kalibrerats före varje mätning med hjälp av ett antal lämpliga buffertlösningar (t.ex. pH 4,0 och 7,0).
HÄNVISNINGAR:
|
(1)
|
ISO (Internationella standardiseringsorganisationen) (1994). Markundersökningar – Bestämning av pH, nr 10390. ISO, Genève.
|
Tillägg 4
Odling av Eisenia fetida och Eisenia andrei
Maskarna bör helst födas upp i en klimatkammare vid en temperatur på 20 ± 2 °C. Vid denna temperatur och med tillräckligt mycket foder blir maskarna könsmogna vid 2–3 månaders ålder.
Båda arterna kan odlas i ett stort antal olika typer av animaliskt avfall. Som odlingsmedium rekommenderas en 50/50-blandning av häst- eller boskapsgödsel och torv. Kontroller ska göras för att se till att de nötkreatur eller hästar från vilka gödseln kommer inte genomgår medicinering eller behandling med kemikalier, t.ex. tillväxtbefrämjande medel, nematicider eller liknande veterinärmedicinska produkter, som kan påverka maskarna under testet. Det rekommenderas att man själv samlar in gödseln, eftersom erfarenheten har visat att kommersiellt tillgänglig gödsel som används som trädgårdsgödsel kan påverka maskarna negativt. Mediet bör ha ett pH på cirka 6–7 (reglerat med kalciumkarbonat), låg jonisk konduktivitet (lägre än 6 mS/cm eller en salthalt på under 0,5 %), och bör inte ha för hög halt av ammoniak eller animaliskt urin. Substratet bör vara fuktigt men inte för vått. Odlingslådor med en storlek på 10–50 liter är lämpliga.
För att få maskar med standardålder och storlek (vikt), är det bäst att inleda odlingen med kokonger. När kulturen har etablerats underhålls den genom att man placerar adulta daggmaskar i en avelslåda med färskt substrat i mellan 14 och 28 dagar för att möjliggöra produktion av ytterligare kokonger. Adulterna avlägsnas sedan, och de juveniler som produceras ur kokongerna används som utgångsmaterial för nästa kultur. Maskarna utfodras kontinuerligt med animaliskt avfall och överförs då och då till ett färskt substrat. Erfarenheten har visat att lufttorkad finmald ko- eller hästgödsel eller havremjöl är ett lämpligt foder. Det bör säkerställas att de nötkreatur eller hästar från vilka gödseln kommer inte genomgår medicinering eller behandling med kemikalier, såsom tillväxtbefrämjande medel, som kan påverka maskarna under testet. De daggmaskar som kläcks ur kokongerna används för testning när de är mellan 2 och 12 månader gamla och betraktas som adulta.
Maskarna anses vara friska om de rör sig genom substratet, inte försöker lämna substratet och förökar sig kontinuerligt. Om maskarna rör sig mycket långsamt och har en gul bakre del tyder det på att substratet har utarmats. I detta fall rekommenderas tillhandahållande av färskt substrat och/eller minskad djurtäthet.
Tillägg 5
Metoder för räkning av juvenila maskar som kläcks ur kokongerna
Det är mycket tidskrävande att sortera maskarna från jordsubstratet för hand. Två alternativa metoder rekommenderas därför:
|
(a)
|
Testbehållarna placeras i ett vattenbad med en temperatur initialt på 40 °C men som stiger till 60 °C. Efter cirka 20 minuter har de juvenila maskarna i regel tagit sig upp på substratets yta och kan då lätt avlägsnas och räknas.
|
|
(b)
|
Testjorden kan tvättas genom en sikt med den metod som utvecklats av van Gestel m.fl. (1) under förutsättning att den torv och stallgödsel eller havremjöl som tillförs jorden har mals ner till ett fint pulver. Två 0,5 mm siktar (diameter 30 cm) placeras ovanpå varandra. Innehållet i en testbehållare tvättas genom siktarna med ett kraftigt flöde av kranvatten, vilket gör att ungmaskarna och kokongerna främst blir kvar på den övre sikten. Det är viktigt att notera att hela den övre siktens yta bör hållas våt under detta moment så att de juvenila maskarna flyter på ett tunt skikt med vatten, vilket därmed hindrar dem från att krypa ner genom siktens maskor. De bästa resultaten uppnås när ett duschmunstycke används.
|
När allt jordsubstrat har tvättats genom sikten, kan juvenilerna och kokongerna sköljas från den övre sikten ner i en skål. Innehållet i skålen får sedan stå så att tomma kokonger flyter upp till vattenytan och fulla kokonger och ungmaskar sjunker till botten. Vattnet kan sedan hällas bort och ungmaskarna och kokongerna flyttas till en petriskål som innehåller lite vatten. Maskarna kan avlägsnas för att räknas med en nål eller en pincett.
Erfarenheten har visat att metod (a) passar bättre till extraktion av ungmaskar som kan tvättas genom en 0,5 mm sikt.
Effektiviteten av den metod som används för att avlägsna maskarna (och vid behov kokongerna) från jordsubstratet bör alltid fastställas. Om juvenilerna samlas in med hjälp av sortering för hand rekommenderas att man genomför proceduren två gånger på alla prov.
HÄNVISNINGAR:
|
(1)
|
Van Gestel, C. A. M., W. A. van Dis, E. M. van Breemen, P. M. Sparenburg (1988). Comparison of two methods determining the viability of cocoons produced in earthworm toxicity experiments. Pedobiologia 32, 367–371.
|
Tillägg 6
Översikt över de statistiska dataanalyserna (bestämning av NOEC)

C.34. BESTÄMNING AV HÄMNINGEN AV DEN ANAEROBA BAKTERIEAKTIVITETEN – MINSKNINGEN AV GASPRODUKTIONEN FRÅN ANAEROBT SLAM (AVLOPPSVATTEN) SOM GENOMGÅR RÖTNING
INLEDNING
|
1.
|
Den här testmetoden motsvarar OECD:s testriktlinje (TG) 224 (2007). Kemikalier som släpps ut i vattenmiljön passerar genom både aeroba och anaeroba zoner där de kan brytas ner och/eller hindra bakterieaktiviteten. I vissa fall kan de bli kvar opåverkade i anaeroba zoner i decennier eller längre. Vid behandling av avloppsvatten är det första steget (försedimenteringen) aerobt i supernatanten och anaerobt i det underliggande slammet. Detta följs i det andra steget av en aerob zon i luftningstanken med det aktiva slammet och en anaerob zon i det underliggande slammet i den sekundära sedimenteringstanken. Slam från båda dessa steg genomgår normalt anaerob behandling, då metan och koldioxid produceras som normalt används för att framställa elektricitet. Ute i miljön stannar sannolikt kemikalier som tillförs sediment kvar i bukter, flodmynningar och hav i dessa anaeroba zoner på obestämd tid om de inte är bionedbrytbara. Större mängder av vissa kemikalier kommer framför allt att nå dessa områden på grund av sina fysiska egenskaper, t.ex. låg löslighet i vatten, hög adsorption till uppslammade fasta ämnen samt oförmåga att genomgå aerob bionedbrytning.
|
|
2.
|
Även om det är önskvärt att kemikalier som släpps ut i miljön är bionedbrytbara under både aeroba och anaeroba förhållanden är det nödvändigt att dessa kemikalier varken hämmar aktiviteten av mikroorganismer i den ena zonen eller den andra. I Storbritannien har det förekommit några fall av fullständig hämning av metanproduktionen orsakad t.ex. av pentaklorfenol i industriella utsläpp, vilket leder till mycket kostsamma transporter av slam från rötkamrarna till ’säkra’ områden och import av friskt rötslam från närliggande anläggningar. Men det finns många fall av mindre allvarliga störningar av rötningen på grund av flera andra kemikalier, inbegripet alifatiska halogenerade kolväten (kemtvätt) och rengöringsmedel, vilket leder till betydande försämring av effektiviteten i rötkamrarna.
|
|
3.
|
Endast en testmetod C.11 (1), gäller hämningen av bakteriell aktivitet (respiration i aktiverat slam), och bedömer effekten av testkemikalierna på syreupptagningshastigheten i närvaro av substratet. Metoden har använts i stor utsträckning för att ge tidig varning om kemikaliers eventuella skadeverkningar på den aeroba behandlingen av avloppsvatten, samt för att ge en indikation på de icke-hämmande koncentrationer av testkemikalier som ska användas i olika tester för bionedbrytning. Testmetod C.43 (2) ger en begränsad möjlighet att fastställa en testkemikalies toxicitet för gasproduktionen i anaerobt slam utspätt till en tiondel av sin normala koncentration av fasta ämnen, så att man uppnår den noggrannhet som krävs vid bedömningen av den procentuella bionedbrytningen. Eftersom utspätt slam skulle kunna vara mer känsligt för hämmande kemikalier beslutade ISO-gruppen att utarbeta en metod i vilken man använder outspätt slam. Minst tre texter undersöktes (från Danmark, Tyskland och Storbritannien), och till slut utarbetades två ISO-standarder, en med outspätt slam, ISO 13641-1 (3), och en med slam utspätt till en hundradel, ISO 13641-2 (4), som representerar gyttja och sediment med låga bakteriepopulationer. Båda metoderna genomgick ett ringtest (5). Del 1 bekräftades som en godtagbar standard men det rådde oenighet om del 2. Storbritannien ansåg att metoden behövde utredas ytterligare eftersom en betydande andel av deltagarna rapporterade mycket liten eller ingen gasproduktion, delvis på grund av att procentandelen för gasutrymmet var för hög (75 %) för optimal känslighet.
|
|
4.
|
I tidigare arbeten i Storbritannien (6) (7) beskrivs en manometrisk metod där man använder outspätt rötslam, plus obehandlat avloppsslam som substrat, i 500 ml mätkolvar. Utrustningen var dock ohanterlig och stanken från det obearbetade slammet vidrig. Shelton och Tiedjes (8) mer kompakta och praktiska utrustning i den form som utvecklats av Battersby och Wilson (9) användes senare framgångsrikt av Wilson m.fl. (10). Kawahara m.fl. (11) behandlade vanligare typer av slam framgångsrikt i laboratoriet för användning i tester av ett antal kemikalier för anaerob bionedbrytbarhet och hämning. Obehandlat slam som substrat ersattes också för att man skulle kunna genomföra tester antingen med anaerobt slam utspätt till en hundradel eller med gyttja, sediment etc. med låg bakteriell aktivitet.
|
|
5.
|
Denna metod kan ge information som är värdefull vid bedömning av den sannolika effekten av en testkemikalie på gasproduktionen i anaeroba rötkammare. Endast längre tester som är bättre på att simulera arbetande rötkammare kan dock ge en indikation huruvida det kan ske en anpassning av mikroorganismerna till testkemikalien eller om koncentrationen av kemikalier som sannolikt absorberas och adsorberas till slammet kan byggas upp till toxiska nivåer under en längre period än vad som medges i detta test.
|
PRINCIP FÖR TESTMETODEN
|
6.
|
Alikvoter av en blandning av anaerobt rötslam (20–40 g/l fasta ämnen totalt) och en nedbrytbar substratlösning inkuberas enskilt och tillsammans med en rad koncentrationer av testkemikalien i slutna kärl i upp till tre dagar. Den mängd gas (metan plus koldioxid) som produceras mäts genom det ökade trycket (Pa) i flaskorna. Den procentuella hämningen av gasproduktionen som de olika koncentrationerna av testkemikalien förorsakar beräknas utifrån den gasmängd som produceras i test- respektive kontrollflaskorna. EC50 och andra effektiva koncentrationer beräknas utifrån plottar över den procentuella hämningen mot koncentrationen av testkemikalierna eller, mer vanligtvis, dess logaritm.
|
INFORMATION OM TESTKEMIKALIEN
|
7.
|
Testkemikalier bör normalt användas i den renaste form som är lätt tillgänglig eftersom orenheter i vissa kemikalier, t.ex. klorfenoler, kan vara mycket mer toxiska än testkemikalien i sig. Man bör dock överväga behovet av att testa kemikalier i den form i vilken de framställs/är kommersiellt tillgängliga. Användningen av sammansatta produkter rekommenderas i regel inte. För svårlösliga testkemikalier kan dock användningen av sammansatt material vara lämpligt. De av testkemikaliens egenskaper som bör finnas tillgängliga omfattar löslighet i vatten och i vissa organiska lösningsmedel, ångtryck, adsorptionskoefficient, hydrolys och bionedbrytbarhet under anaeroba förhållanden.
|
METODENS TILLÄMPBARHET
|
8.
|
Testet kan tillämpas på kemikalier som är lösliga eller olösliga i vatten, inklusive flyktiga kemikalier. Särskild försiktighet bör dock iakttagas med material med låg löslighet (se hänvisning (12)) och hög volatilitet. Även inokulat från andra anaeroba anläggningar, t.ex. gyttja, mättade jordar, sediment, får användas. Anaeroba bakteriella system som tidigare har exponerats för giftiga kemikalier kan anpassas till att bibehålla sin aktivitet i närvaro av xenobiotiska kemikalier. Inokulat från anpassade bakteriella system kan visa en högre tolerans för testkemikalien jämfört med inokulat från icke-anpassade system.
|
REFERENSKEMIKALIER
|
9.
|
För att kontrollera förfarandet testas en referenskemikalie genom att man inrättar lämpliga kärl parallellt som en del av ett normalt testförfarande. 3,5-diklorfenol har visat sig konsekvent hämma såväl anaerob gasproduktion som syreförbrukningen i aktiverat slam samt andra biokemiska reaktioner. Två andra kemikalier har visat sig vara mer hämmande på metanproduktionen än 3,5-diklorfenol, nämligen metylenbistiocyanat och pentaklorfenol, men resultaten med dessa kemikalier har inte validerats. Pentaklorfenol rekommenderas inte, eftersom det inte finns lätt tillgängligt i ren form.
|
TESTRESULTATENS REPRODUCERBARHET
|
10.
|
I ett internationellt ringtest (5) fanns det endast god reproducerbarhet för EC50-värden mellan de tio deltagande laboratorierna för 3,5-diklorfenol och 2-bromoetansulfonsyra (intervallet för det förstnämnda var 32–502 mg/l och för det sistnämnda 220–2 190 mg/l).
|
Antal laboratorier
|
Som mg/l
|
Som mg/g slam
|
|
medel-värde
|
sd
|
cv (%)
|
medel-värde
|
sd
|
cv (%)
|
|
|
3,5-diklorfenol
|
|
10
|
153
|
158
|
103
|
5
|
4,6
|
92
|
|
|
2-bromoetansulfonsyra
|
|
10
|
1 058
|
896
|
85
|
34
|
26
|
76
|
|
EC50-värden från ringtest – outspätt slam
|
11.
|
De höga variationskoefficienterna mellan laboratorierna återspeglar i stor utsträckning skillnader i känslighet hos slammets mikroorganismer på grund av huruvida de tidigare exponerats eller inte exponerats för testkemikalien eller andra kemiskt besläktade kemikalier. Den noggrannhet med vilken man fastställde EC50-värdet grundat på koncentrationen i slammet var knappast bättre än det ’volymetriska’ värdet (mg/l). De tre laboratorier som rapporterat noggrannheten för sina EC50-värden för 3,5-diklorfenol visade på mycket lägre variationskoefficienter (22,9 respektive 18 % för EC50 mg/g) än variationskoefficienterna för medelvärdet för alla tio laboratorier. De enskilda medelvärdena för dessa tre laboratorier var 3,1, 3,2 respektive 2,8 mg/g. De lägre, godtagbara variationskoefficienterna inom laboratorierna jämfört med de mycket högre koefficienter mellan laboratorierna, det vill säga 9–22 % jämfört med 92 %, visar att det finns stora skillnader i egenskaperna hos de enskilda slammen.
|
BESKRIVNING AV TESTMETODEN
Utrustning
|
12.
|
Vanlig laboratorieutrustning samt följande krävs:
|
a)
|
Inkubator – gnistsäker och validerad vid 35 ± 2 °C.
|
|
b)
|
Trycksäkra testkärl av glas av lämplig nominell storlek (17), som vart och ett är försett med ett gastätt belagt septum som tål cirka 2 bar eller 2 × 105 Pa (för beläggning använd t.ex. PTFE = polytetrafluoreten). Injektionsflaskor av glas med en nominell volym på 125 ml och en faktisk volym på cirka 160 ml som är förseglade med ampullpackningar (18) och aluminiumringar rekommenderas, men flaskor med en total volym på mellan 0,1 och 1 liter kan också användas.
|
|
c)
|
Precisionstryckmätare
(19)
och nålfäste
Den totala gasproduktionen (metan och koldioxid) mäts med hjälp av en tryckmätare som anpassats till att möjliggöra mätning och uttömning av den producerade gasen. Ett exempel på ett lämpligt instrument är en handhållen precisionstryckmätare som är kopplad till nålen på en injektionsspruta. En gastät trevägsventil underlättar utsläpp av övertryck (tillägg 1). Den inre volymen hos tryckomvandlarens slang och ventil måste vara så låg som möjligt så att de fel som uppkommer när man underlåter att beakta utrustningens volym är obetydliga.
|
|
d)
|
Isolerade behållare för transport av rötslam.
|
|
f)
|
Sikt med 1 mm kvadratiska maskor.
|
|
g)
|
Tank för rötslammet, en flaska av glas eller HD-polyeten med en kapacitet på 5 liter, försedd med en omrörare och utrustning som gör det möjligt för en ström av kvävgas (se punkt 13) att passera genom gasutrymmet.
|
|
h)
|
Membranfilter (0,2 μm) för sterilisering av substratet.
|
|
i)
|
Mikrosprutor för gastät anslutning av tryckomvandlaren (se punkt 12 c) till flaskornas gasutrymme (se punkt 12 b), och även för att tillsätta olösliga testämnen i vätskeform i flaskorna.
|
|
j)
|
Handskbox, valfritt men rekommenderas, med ett litet positivt tryck av kväve.
|
|
Reagens
|
13.
|
Reagens av analyskvalitet bör användas genomgående. Kvävgas med hög renhet och med en syrgashalt på mindre än 5μl/l bör användas genomgående.
|
Vatten
|
14.
|
Om utspädning är nödvändig i något steg används avjonat vatten som tidigare avluftats. Det är inte nödvändigt att utföra analytiska kontroller av detta vatten, men se till att avjoniseringsapparaten underhålls regelbundet. Använd avjonat vatten också för beredning av stamlösningar. Innan det anaeroba inokulatet tillsätts någon testämneslösning eller någon utspädning av testämnet, se till att dessa är syrefria. Detta görs antingen genom att man blåser kvävgas genom utspädningsvattnet (eller utspädningarna) i 1 timme före tillsatsen av inokulat, eller genom att man hettar upp utspädningsvattnet till kokpunkten och låter det svalna till rumstemperatur i en syrefri atmosfär.
|
Rötslam
|
15.
|
Samla in aktivt rötslam från rötkammaren vid ett reningsverk eller från en laboratorierötkammare som båda behandlar slam som huvudsakligen kommer från avloppsvatten från hushåll. Praktisk information om slam från laboratorierötkammare finns att tillgå i (11). Om man avser att använda ett anpassat inokulat kan man överväga att använda rötslam från ett reningsverk som behandlar industriavloppsvatten. För insamling av slam ska man använda vidhalsade flaskor tillverkade av högdensitetspolyeten eller liknande material som kan vidga sig. Tillsätt slammet i provflaskorna upp till cirka 1 cm från överkanten och försegla dem så att de blir täta, helst med en försegling med säkerhetsventil (punkt 12 e), och placera dem i isolerade behållare (punkt 12 d) för att minimera temperaturchocker tills de kan flyttas till en inkubator med en temperatur på 35 ± 2 °C. När flaskorna öppnas ska man vara noga med att släppa ut gasövertrycket antingen genom att försiktigt lossa på förseglingen, eller genom en trevägstryckutlösningsventil (punkt 12 e). Det är bäst att använda slammet inom några timmar från insamlingen. I annat fall ska det förvaras vid 35 ± 2 °C under ett gasutrymme med kväve i upp till tre dagar, under vilka aktivitetsförlusten normalt är liten.
Varning! Slam som genomgår rötning producerar lättantändliga gaser som medför brand- och explosionsrisker, och innehåller även potentiellt patogena organismer. Lämpliga försiktighetsåtgärder bör därför vidtas vid hantering av slam. Av säkerhetsskäl ska glasbehållare inte användas för insamling av slam.
|
Inokulat
|
16.
|
Omedelbart före användningen blandas slammet genom försiktig omrörning, och passeras sedan genom en sikt med maskstorleken 1 mm (punkt 12 f) ner i en lämplig flaska (punkt 12 g) genom gasutrymmet, genom vilket passerar ett kvävgasflöde. Ta ett prov för mätning av koncentrationen av den totala torrsubstansen (se t.ex. ISO 11923 (13) eller motsvarande EU-standard). I allmänhet används slammet utan utspädning. Koncentrationen av fasta ämnen är normalt mellan 2 % och 4 % (w/v). Kontrollera pH-värdet i slam och justera vid behov till 7 ± 0,5.
|
Testsubstrat
|
17.
|
Lös upp 10 g näringslösning (t.ex. Oxoid), 10 g jästextrakt och 10 g D-glukos i avjonat vatten och späd till 100 ml. Sterilisera genom filtrering genom ett 0,2 μm membranfilter (punkt 12 h) och använd omedelbart eller förvara vid 4 °C i högst en dag.
|
Testkemikalie
|
18.
|
Bered en separat stamlösning för varje vattenlöslig testkemikalie så att den innehåller t.ex. 10 g/l av kemikalien i syrefritt utspädningsvatten (punkt 14). Använd lämpliga volymer av stamlösningarna till bereda reaktionsblandningar med graderade koncentrationer. Som ett alternativ kan man bereda en spädningsserie av varje stamlösning så att den volym som tillsätts testflaskorna är densamma för varje föreskriven slutlig koncentration. pH-värdet i stamlösningen justeras vid behov till 7 ± 0,2.
|
|
19.
|
För testkemikalier som inte är tillräckligt lösliga i vatten ska ISO 10634 (12) eller motsvarande EU-standard konsulteras. Om ett organiskt lösningsmedel måste användas bör lösningsmedel såsom kloroform och koltetraklorid, som är kända för att starkt hämma metanproduktionen, undvikas. Bered en lösning med lämplig koncentration av icke vattenlösliga kemikalier i ett lämpligt flyktigt lösningsmedel, t.ex. aceton eller dietyleter. Häll de erforderliga volymerna av lösningsmedelslösning i de tomma testflaskorna (punkt 12 b) och avdunsta lösningsmedlet innan slammet tillsätts. För andra behandlingar ska ISO 10634 (12) eller motsvarande EU-standard användas, men var medveten om att alla ytaktiva ämnen som används för att framställa emulsioner kan verka hämmande på den anaeroba gasproduktionen. Om förekomsten av organiska lösningsmedel och emulgeringsmedel anses orsaka artefakter, kan testkemikalien tillsättas direkt i testblandningen i pulver- eller vätskeform. Flyktiga kemikalier och icke vattenlösliga flytande testkemikalier kan injiceras i inokulerade injektionsflaskor med mikrosprutor (punkt 12 i).
|
|
20.
|
Tillsätt testkemikalierna i flaskorna så att en geometrisk serie koncentrationer erhålls, t.ex. 500 mg/l, 250 mg/l, 125 mg/l, 62,5 mg/l, 31,2 mg/l och 15,6 mg/l. Om toxicitetsintervallet inte är känt från liknande kemikalier ska ett preliminärt test först utföras med koncentrationerna 1 000 mg/l, 100 mg/l och 10 mg/l för att fastställa ett lämpligt intervall.
|
Referenskemikalie
|
21.
|
Bered en lösning av 3,5-diklorfenol (10 g/l) genom att gradvis tillsätta den minsta möjliga mängden natriumhydroxidlösning (5 mol/l) till det fasta ämnet under omskakning tills det har lösts. Tillsätt sedan syrefritt utspädningsvatten (punkt 14) till den erforderliga volymen. Sonikering kan underlätta upplösningen. Andra referenskemikalier kan användas när det genomsnittliga referensintervallet för EC50 har erhållits i minst tre tester med olika inokulat (olika källor eller olika tidpunkter för insamling).
|
STÖRNINGAR/FEL
|
22.
|
Vissa beståndsdelar i slammet skulle förmodligen kunna reagera med potentiella hämmare och göra dem otillgängliga för mikroorganismer, vilket skulle ge lägre eller ingen hämning. Om slammet dessutom redan innehåller en kemikalie som är hämmande kommer felaktiga resultat att erhållas när en sådan kemikalie testas. Utöver dessa möjligheter finns det ett antal identifierade faktorer som kan leda till felaktiga resultat. Dessa förtecknas i tillägg 3 jämte metoder för att avskaffa eller åtminstone reducera fel.
|
TESTFÖRFARANDE
|
23.
|
Antalet nödvändiga replikat beror på den grad av precision som krävs för hämningsmätningarna. Om flaskornas förseglingar är tillräckligt gastäta under hela testet räcker det att man inrättar endast ett parti (minst tre exemplar) med testflaskor för varje erforderlig koncentration. På samma sätt inrättas ett parti flaskor med referenskemikalien och en uppsättning kontroller. Om flaskornas förseglingar endast är tillförlitliga för en eller ett fåtal nålstick inrättas ett parti (t.ex. tre exemplar) med testflaskor för varje intervall (t) för vilket resultat krävs för alla koncentrationer av testkemikalien som ska testas. På samma sätt inrättas ’t’-partier med flaskor för referenskemikalien och för kontrollerna.
|
|
24.
|
Det rekommenderas att man använder en handskbox (punkt 12 j). Minst 30 minuter innan testet påbörjas leds en ström av kväve genom handskboxen som innehåller all nödvändig utrustning. Se till att temperaturen i slammet ligger på 35 ± 2 °C under hanteringen och förseglingen av flaskorna.
|
Preliminärt test
|
25.
|
Om aktiviteten i slammet är okänd rekommenderas det att man utför ett preliminärt test. Inrätta kontroller för att få t.ex. koncentrationer av fasta ämnen på 10 g/l, 20 g/l och 40 g/l plus substrat, men använd ingen testkemikalie. Använd dessutom olika volymer reaktionsblandning för att få tre eller fyra förhållanden mellan gasutrymmesvolymen och vätskevolymen. Byggt på resultaten rörande de gasvolymer som produceras vid olika tidsintervaller väljs de mest lämpliga villkor som gör det möjligt att utföra två dagliga mätningar som ger betydande gasmängder och tryckutsläpp per dag vid optimal känslighet (20) utan risk för explosioner.
|
Tillsättning av testkemikalier
|
26.
|
Häll vattenlösliga testkemikalier i tomma testflaskor (se punkt 12 b) som vattenlösningar (punkt 18). Använd minst tre uppsättningar flaskor för var och en av koncentrationerna i en serie (punkt 20). När det gäller olösliga och svårlösliga testkemikalier ska lösningar av dessa i organiska lösningsmedel injiceras med hjälp av en mikrospruta i tomma flaskor så att man får replikatuppsättningar av varje serie med fem koncentrationer av testkemikalien. Avdunsta lösningsmedlet genom att låta en stråle av kvävgas passera över ytan på lösningarna i testflaskorna. Ett annat alternativ är att tillsätta olösliga kemikalier i fast form som vägda mängder av det fasta ämnet direkt i testflaskorna.
|
|
27.
|
Om flytande testkemikalier som är olösliga eller svårlösliga i vatten inte tillsätts via ett lösningsmedel ska de tillsättas direkt i testflaskorna med hjälp av en mikrospruta efter tillsättning av inokulat och testsubstrat (se punkt 30). Flyktiga testkemikalier kan tillsättas på samma sätt.
|
Tillsättning av inokulat och substrat
|
28.
|
Rör ner en lämplig volym av siktat rötslam (se punkt 16) i en flaska på 5 liter (punkt 12 g), medan en ström av kväve passeras genom gasutrymmet. Spola ur testflaskorna, som innehåller vattenlösningar eller evaporerade lösningsmedelslösningar av testkemikalier, med en ström av kvävgas i ungefär två minuter för att avlägsna luft. Fördela alikvoter, t.ex. 100 ml, av väl uppblandat slam i testflaskorna med hjälp av en pipett med bred spets eller en mätcylinder. Det är mycket viktigt att fylla pipetten i ett enda steg till den exakta volymen slam som krävs eftersom det är lätt att de fasta ämnena i slammet sjunker till botten. Om mer tas upp i pipetten än vad som behövs, töm den och börja om på nytt.
|
|
29.
|
Därefter tillsätts så mycket substratlösning (punkt 17) som krävs för att få en koncentration på 2 g/l för vart och ett av näringslösningen, jästextraktet och D-glukosen i blandningen, samtidigt som kvävet fortfarande spolas igenom. Följande är ett exempel på ett testparti.
|
Slutlig masskoncentra-tion av testkemikalien i testflaskorna
(mg/l)
|
Testkemikaliens volym
(ml)
|
Reagens och medier
(ml)
|
|
Stamlösning a)10 g/lpunkt 18
|
Stamlösning b)1 g/lpunkt 18
|
Spädnings-vatten
punkt 14
|
Inokulat
punkt 16
|
Substrat
punkt 17
|
|
0
|
—
|
0
|
1,0
|
100
|
2
|
|
1
|
—
|
0,1
|
0,9
|
100
|
2
|
|
3.3
|
—
|
0,33
|
0,67
|
100
|
2
|
|
10
|
0,1
|
—
|
0,9
|
100
|
2
|
|
33
|
0,33
|
—
|
0,67
|
100
|
2
|
|
100
|
1,0
|
—
|
0
|
100
|
2
|
|
Flaskans totala volym = 160 ml. Vätskans volym = 103 ml
Gasvolymen = 57 ml eller 35,6 % av den totala volymen.
|
|
|
30.
|
Spola på samma sätt ur tillräckligt tomma testflaskor med kvävgas för att handskas med eventuella flyktiga och olösliga vätskeformiga testkemikalier (se punkt 27).
|
Kontroller och referenskemikalie
|
31.
|
Inrätta minst tre uppsättningar flaskor med endast slam och substrat som fungerar som kontroller. Inrätta ytterligare replikatflaskor som innehåller slam och substrat plus tillräckligt med stamlösning av referenskemikalien 3,5-diklorfenol (punkt 21) tills man erhåller en slutkoncentration på 150 mg/l. Denna koncentration bör hämma produktionen med omkring 50 %. Som ett alternativ kan man inrätta en serie koncentrationer av referenskemikalien. Inrätta dessutom fyra extra flaskor för pH-mätning som innehåller slam, syrefritt vatten och substrat. Tillsätt testkemikalien i två flaskor med den högsta koncentrationen som testas och tillsätt syrefritt vatten i de återstående två flaskorna.
|
|
32.
|
Se till att alla flaskor – test- och referenskemikalier samt kontrollerna – innehåller samma volym (VR) vätska. Tillsätt vid behov syrefritt avjonat vatten (punkt 14) för att få korrekt volym. Gasutrymmet bör utgöra mellan 10 % och 40 % av flaskans volym (det faktiska värdet ska väljas från de uppgifter som erhållits från det preliminära testet). Efter att alla komponenterna har tillsatts i flaskorna avlägsnas kanylen som tillhandahåller gasen och varje flaska förseglas med en gummipropp och ett aluminiumlock (punkt 12 b). Proppen fuktas med avjonat vatten för att underlätta införandet. Blanda innehållet i varje flaska genom skakning.
|
Inkubering av flaskorna
|
33.
|
Flytta över flaskorna till en termostatreglerad inkubator, som helst bör vara försedd med en skakapparat, och bibehåll en temperatur på 35 ± 2 °C. Flaskorna inkuberas i mörker. Jämna efter ca 1 timme ut trycket i flaskorna till atmosfären genom att införa en kanyl kopplad till en tryckmätare (punkt 12 c) genom förseglingen på varje enskild flaska. Öppna ventilen tills tryckmätaren visar noll och stäng sedan ventilen. Nålen bör införas i en vinkel på ungefär 45° för att förhindra att gas läcker ut från flaskorna. Om flaskorna inkuberas utan skakapparat ska de skakas manuellt två gånger per dag under hela inkuberingen så att systemet hålls i jämvikt. Inkubera flaskorna och vänd dem upp och ner för att förhindra gasförlust genom septumet. Det är dock inte lämpligt att vända flaskorna upp och ner om man riskerar att olösliga testkemikalier bildar en beläggning i botten.
|
Tryckmätning
|
34.
|
När flaskorna har nått temperaturen 35 ± 2 °C mäts och registreras innehållets pH-värde i två av de fyra flaskor som har inrättats för detta syfte. Innehållet kasseras sedan. Fortsätt att inkubera de återstående flaskorna i mörker. Mät och registrera trycket i flaskorna två gånger om dagen under de följande 48 till 72 timmarna genom att föra in tryckmätarens nål genom förseglingen i var flaska för sig, och torka av nålen mellan mätningarna. Håll alla delarna av flaskan vid inkuberingstemperatur under mätningen, som bör genomföras så snabbt som möjligt. Låt tryckavläsningen stabiliseras och registrera den. Öppna sedan ventilen för tryckutjämning och stäng den när trycket mäter noll. Fortsätt testet i normalt 48 timmar från den tidpunkt då trycket först utjämnades, vilken betecknas med ’0’. För flyktiga kemikalier bör antalet avläsningar och tryckutjämningar begränsas till en (vid inkuberingens slut) eller två för att minimera förlusten av testkemikalien (10).
|
|
35.
|
Öppna inte ventilen om tryckmätningen ger ett negativt värde. Fukt ansamlas ibland i kanylen och dithörande slangar, och detta visar sig i form av ett litet undertryck vid mätning. Avlägsna i detta fall nålen, skaka slangarna, torka med mjukt papper och sätt i en ny nål.
|
pH-mätning
|
36.
|
Mät och registrera pH-värdet i varje flaska efter den sista tryckmätningen.
|
DATA OCH RAPPORTERING
Resultatredovisning
|
37.
|
Beräkna summan och genomsnittet av de tryck som registrerats under varje tidsintervall för varje uppsättning replikatflaskor och beräkna det genomsnittliga kumulativa bruttogastrycket under varje tidsintervall för varje uppsättning replikat. Plotta sedan kurvor som visar den genomsnittliga sammanlagda gasproduktionen (Pa) mot tiden för kontroll-, test- och referensflaskorna. Välj en tid på den linjära delen av kurvan, normalt 48 timmar, och beräkna den procentuella hämningen (I) för varje koncentration med hjälp av formeln [1]
|
I = (1 – Pt/PC) × 100
|
[1],
|
där
|
I
|
=
|
den procentuella hämningen, i %,
|
|
Pt
|
=
|
det gastryck som alstras med testmaterialet vid en utvald tidpunkt, i pascal (Pa),
|
|
Pc
|
=
|
det gastryck som alstras i kontrollen vid samma tidpunkt, i pascal (Pa).
|
Det rekommenderas att man ritar båda plottarna, dvs. plotta I mot koncentrationen och även mot logaritmen till koncentrationen så att man kan välja ut den kurva som är mest lineär. Bestäm EC50 (mg/l) visuellt eller genom regressionsanalys utifrån den kurva som är mest lineär. I jämförande syfte kan det vara bättre att uttrycka kemikaliens koncentration i mg/g av den totala torrsubstansen. För att uppnå denna koncentration delar man den volymetriska koncentrationen (mg/l) med den volymetriska koncentrationen av slammets torrsubstans (g/l) (punkt 16).
|
|
38.
|
Beräkna antingen den procentuella hämning som erhålls med den enda koncentrationen av den använda referenskemikalien eller EC50 om ett tillräckligt antal koncentrationer har undersökts.
|
|
39.
|
Omvandla det genomsnittliga trycket hos den gas som produceras i kontrollen Pc (Pa) till volymen genom hänvisning till tryckmätarens kalibreringskurva (tillägg 2), och beräkna utifrån denna den producerade mängden gas, uttryckt som den volym som produceras under 48 timmar ur 100 ml outspätt slam vid en koncentration torrsubstans på 2 % (20 g/l) till 4 % (40 g/l).
|
Kriterier för testresultatens giltighet
|
40.
|
Resultaten från ISO:s jämförelse mellan laboratorier (5) visade att referenskemikalien (3,5-diklorfenol) orsakade en 50-procentig hämning av gasproduktionen i en serie koncentrationer på 32–510 mg/l, med medelvärdet 153 mg/l (punkt 10). Detta intervall är så brett att det inte går att fastställa fasta gränser för hämningen som giltighetskriterier. Detta bör dock vara möjligt när utvecklingen kommit så långt att man kan producera enhetligare inokulat. Den mängd gas som produceras i kontrollflaskorna under 48 timmar varierade från 21 ml/g torrsubstans slam till 149 ml/g (medelvärde 72 ml/g). Det fanns inte något uppenbart samband mellan den volym gas som producerades och det motsvarande EC50-värdet. Det slutliga pH-värdet varierade mellan 6,1 och 7,5.
|
|
41.
|
Testet anses vara giltigt om en hämning på mer än 20 % erhålls i den referenskontroll som innehåller 150 mg/l 3,5-diklorfenol, mer än 50 ml gas per g torrvikt produceras i blankprovet och pH-värdet ligger inom intervallet 6,2–7,5 vid testets slut.
|
Testrapport
|
42.
|
Testrapporten ska innehålla följande uppgifter:
|
|
Testkemikalie
|
—
|
trivialnamn, kemiskt namn, CAS-nummer, strukturformel och relevanta fysikalisk-kemiska egenskaper,
|
|
—
|
testkemikaliens renhet (orenheter i testkemikalien).
|
|
|
|
Testbetingelser
|
—
|
de flytande beståndsdelarnas volymer och gasutrymmets volym i testkärlen,
|
|
—
|
beskrivningar av testkärlen och mätningen av gaser (t.ex. typ av tryckmätare),
|
|
—
|
appliceringen av test- och referenskemikalien i testsystemet, de testkoncentrationer som använts och eventuell användning av lösningsmedel,
|
|
—
|
detaljer om inokulatet: reningsverkets namn, beskrivning av källan för det avloppsvatten som behandlats (t.ex. driftstemperatur, slammets retentionstid, huvudsakligen avloppsvatten från hushåll eller industrier etc.), koncentration torrsubstans, gasproduktionsaktiviteten i den anaeroba rötkammaren, tidigare exponering för eller möjlig tidigare anpassning till toxiska kemikalier, insamlingsplats för gyttja, sediment etc.,
|
|
—
|
inkuberingstemperatur och temperaturintervall,
|
|
|
|
Resultat
|
—
|
pH-värden vid testets avslutning,
|
|
—
|
alla uppmätta data som insamlats från kontrollkärlen för testkemikalien, blankprovet och referenskemikalien i lämplig enhet (t.ex. tryck i Pa eller millibar) i tabellform,
|
|
—
|
procentuell hämning i test- och referensflaskorna, och hämning/koncentrationskurvorna,
|
|
—
|
beräkning av EC50-värden, uttryckt i mg/l och mg/g,
|
|
—
|
gasproduktion per gram slam under 48 timmar,
|
|
—
|
motivering för eventuella förkastade testresultat,
|
|
—
|
diskussion av resultaten, inklusive eventuella avvikelser från förfarandena i denna testmetod; diskutera även eventuella avvikelser i testresultaten från vad man skulle kunna förvänta sig på grund av störningar och fel,
|
|
—
|
ange även om syftet med testet var att mäta toxiciteten antingen för förhandsexponerade eller icke förhandsexponerade mikroorganismer.
|
|
|
LITTERATUR
|
(1)
|
Kapitel C.11 i denna bilaga: Aktiverat slam – respirationshämningstest.
|
|
(2)
|
Kapitel C.43 i denna bilaga: Anaerob nedbrytbarhet av organiska föreningar i rötslam: metod genom mätning av gasproduktionen.
|
|
(3)
|
Internationella standardiseringsorganisationen (2003) ISO 13641-1 Water Quality – Determination of inhibition of gas production of anaerobic bacteria – Part 1: General Test.
|
|
(4)
|
Internationella standardiseringsorganisationen (2003) ISO 13641-2 Water Quality – Determination of inhibition of gas production of anaerobic bacteria – Part 2: Test for low biomass concentrations.
|
|
(5)
|
ISO (2000) Ring test of ISO 13641-1 and ISO 13641-2. Determination of inhibition of activity of anaerobic bacteria. BL 6958/A. Evans, M. R. och Painter, H. A. Brixham Environmental Laboratory, AstraZeneca UK Ltd., Brixham, TQ5 8BA UK.
|
|
(6)
|
Swanwick, J. D. och Foulkes, M. (1971). Inhibition of anaerobic digestion of sewage sludge by chlorinated hydrocarbons. Wat. Pollut. Control, 70, 58–70.
|
|
(7)
|
HMSO (1986) Determination of the inhibitory effects of chemicals and waste waters on the anaerobic digestion of sewage sludge. ISBN 0 117519 43 X, i: Methods for the Examination of Waters and Associated Materials, Storbritannien.
|
|
(8)
|
Shelton, D.R. och Tiedje, J. M. (1984). General method for determining anaerobic biodegradation potential. Appl. Env. Microbiol. 47 850–857.
|
|
(9)
|
Battersby, N. S. och Wilson, V. (1988). Evaluation of a serum bottle technique for assessing the anaerobic biodegradability of organic compounds under methanogenic conditions. Chemosphere 17, 2441–2460.
|
|
(10)
|
Wilson, V., Painter, H. A. och Battersby, N. S. (1992). A screening method for assessing the inhibition of the anaerobic gas production from sewage sludge. Proc. Int. Symp. on Ecotoxicology. Ecotoxicological Relevance of Test Methods, GSF Forschungzentrum, Neuherberg, Tyskland (1990). Redaktörer: Steinberg, C. och Kettrup, A., s. 117–132 (1992).
|
|
(11)
|
Kawahara, K., Yakabe, Y., Chida, T. och Kida, K. (1999). Evaluation of laboratory-made sludge for an anaerobic biodegradability test and its use for assessment of 13 chemicals. Chemosphere, 39 (12), 2007–2018.
|
|
(12)
|
Internationella standardiseringsorganisationen (1995) ISO 10634 Vattenundersökningar – Handledning för beredning och handhavande av i vatten svårlösliga organiska föreningar för efterföljande utvärdering av deras bionedbrytbarhet i vattenlösning.
|
|
(13)
|
Internationella standardiseringsorganisationen (1997) ISO 11923 Water Quality – Determination of suspended solids by filtration through glass-fibre filters.
|
Tillägg 1
Exempel på utrustning för mätning av biogasproduktion via gastrycket

Teckenförklaring:
|
1
|
–
|
Tryckmätare
|
|
2
|
–
|
Gastät trevägsventil
|
|
3
|
–
|
Kanyl
|
|
4
|
–
|
Gastät förslutning (kraglock och septum)
|
|
5
|
–
|
Gasutrymme
|
|
6
|
–
|
Rötslaminokulat
|
Testkärl i en miljö med temperaturen 35 ± 2 °C
Tillägg 2
Omvandling av tryckmätningarna
Avläsningarna från tryckmätaren kan relateras till gasvolymerna genom en standardkurva och utifrån denna kan man beräkna den volym gas som produceras per g torrvikt slam per 48 timmar. Detta aktivitetsindex används som ett av kriterierna för att bedöma testresultatens giltighet. Kalibreringskurvan framställs genom att man injicerar kända volymer gas vid 35 ± 2 °C i injektionsflaskor som innehåller samma mängd vatten som reaktionsblandningen, VR.
|
—
|
Fördela alikvoter på VR ml vatten som bibehålls vid 35 ± 2 °C i fem injektionsflaskor. Tillslut flaskorna och placera dem i vattenbad vid 35 ± 2 °C i 1 timme så att jämvikt uppnås.
|
|
—
|
Slå på tryckmätaren, låt den stabiliseras och justera till noll.
|
|
—
|
För in kanylen genom förseglingen på en av flaskorna, öppna ventilen tills tryckmätaren visar noll och stäng ventilen.
|
|
—
|
Upprepa detta förfarande med de återstående flaskorna.
|
|
—
|
Injicera 1 ml luft vid 35 ± 2 °C i varje flaska. För in nålen (på mätaren) genom förseglingen på en av flaskorna och låt tryckavläsningen stabiliseras. Registrera trycket, öppna ventilen tills trycket mäter noll och stäng därefter ventilen.
|
|
—
|
Upprepa detta förfarande med de återstående flaskorna.
|
|
—
|
Upprepa hela förfarandet med 2 ml, 3 ml, 4 ml, 5 ml, 6 ml, 8 ml, 10 ml, 12 ml, 16 ml, 20 ml respektive 50 ml luft.
|
|
—
|
Rita en omvandlingskurva över trycket (Pa) mot den insprutade gasvolymen (ml). Mätresultaten från instrumentet är linjära i intervallet mellan 0 Pa till 70 000 Pa, och 0 ml till 50 ml gasproduktion.
|
Tillägg 3
Identifierade faktorer som kan leda till felaktiga resultat
(a) Kvaliteten på flaskornas korkar
Olika typer av septum för injektionsflaskorna finns kommersiellt tillgängliga, men många av dem, t.ex. butylgummi, förlorar sin täthet när de genomborras av en nål under betingelserna i detta test. Ibland sjunker trycket mycket långsamt när kanylen har införts genom septumet. Användning av gastäta septum rekommenderas för att undvika läckor (punkt 12 b).
(b) Fukt i kanylen
Fukt ansamlas ibland i kanylen och dithörande slangar, och detta visar sig i form av ett litet undertryck vid mätning. Avlägsna kanylen för att korrigera detta, skaka slangarna, torka med mjukt papper och sätt i en ny kanyl (punkterna 12 c och 35).
(c) Kontaminering med syre
Anaeroba metoder är känsliga för fel som härrör från kontaminering med syre, vilket kan leda till lägre gasproduktion. I denna metod bör denna möjlighet minimeras genom användningen av uteslutande anaeroba tekniker, inbegripet användning av en handskbox.
(d) Grovt substrat i slammet
Den anaeroba gasproduktionen och slammets känslighet påverkas av substrat som överförs med inokulatet till testflaskorna. Rötslam från privata anaeroba rötkammare innehåller ofta igenkännbart material som hår och växtrester av cellulosa, som brukar göra det svårt att ta representativa prover. Genom siktning av slammet kan grova olösliga material avlägsnas, vilket gör det mer sannolikt att de prov som tas är representativa (punkt 16).
(e) Flyktiga testkemikalier
Flyktiga testkemikalier kommer att släppas ut i gasutrymmet i testflaskorna. Detta kan leda till förlust av en del av testmaterialet från systemet under avluftning efter tryckmätningarna, vilket ger felaktigt höga EC50-värden. Genom ett lämpligt val av andelen gasutrymme jämfört med vätskevolymen och genom att inte släppa ut trycket efter tryckmätningarna kan felet minskas (10).
(f) Gasproduktionens icke-linjäritet
Om den plott som visar den genomsnittliga sammanlagda gasproduktionen mot inkuberingstiden inte är ungefärligen linjär under en 48-timmarsperiod, kan testets noggrannhet sänkas. För att lösa detta problem kan det vara tillrådligt att använda rötslam från en annan källa och/eller öka koncentrationen i testsubstrat-näringslösningen, jästextraktet och glukosen (punkt 29).
Tillägg 4
Tillämplighet på miljöprover med låg koncentration av biomassa – anaerob gyttja, sediment etc.
INLEDNING
A.1 I allmänhet är den särskilda mikrobiella aktiviteten (volym gas som produceras per gram torrsubstans) i naturligt förekommande anaerob gyttja, sediment, jord etc. mycket lägre än i anaerobt slam som härrör från avloppsvatten. På grund av detta kan vissa experimentella förhållanden behöva ändras när den hämmande effekten av kemikalier på dessa mindre aktiva prover ska mätas. För dessa mindre aktiva prover kan någon av följande allmänna åtgärder vidtas:
|
(a)
|
Utför ett modifierat preliminärt test (punkt 25) med det outspädda provet med gyttja, jord etc. vid 35 ± 2 °C eller vid temperaturen på insamlingsplatsen för provet för att erhålla en mer noggrann simulering (som i del 1 i ISO 13641).
|
|
(b)
|
Genomför testet med utspätt (1:100) rötkammarslam för att simulera den låga aktivitet som förväntas från miljöprovet, men håll temperaturen vid 35 ± 2 °C (som i del 2 i ISO 13641).
|
A.2 Alternativ (a) kan utföras med hjälp av den metod som beskrivs här (motsvarande del 1 i ISO 13641), men det är viktigt att göra ett preliminärt test (punkt 25) för att fastställa de optimala förhållandena, såvida inte dessa redan är kända från tidigare tester. Gyttjan eller sedimentet bör blandas ordentligt, t.ex. i en blandare, och, om så krävs, spädas med en liten andel avluftat utspädningsvatten (punkt 14) så att den är tillräckligt rörlig för att kunna överföras med en pipett med bred spets eller en mätcylinder. Om man anser att näringsämnen eventuellt saknas, kan gyttjeprovet centrifugeras (under anaeroba förhållanden) och återsuspenderas i ett oorganiskt medium innehållande jästextrakt (A.11).
A.3 Alternativ (b). Detta efterliknar rimligen den låga aktiviteten i miljöproverna men saknar den höga koncentration av suspenderade fasta ämnen som finns i dessa prov. Den roll som dessa fasta ämnen spelar för hämningen är inte känd, men det är möjligt att reaktioner mellan testkemikalierna och beståndsdelarna i gyttjan, liksom adsorption av testkemikalien till de fasta ämnena, skulle kunna leda till en sänkning av testkemikaliens toxicitet.
A.4 Temperatur är en annan viktig faktor: För en strikt simulering bör testerna göras vid den temperatur som uppmäts på insamlingsplatsen, eftersom olika grupper av metanproducerande bakteriekonsortier är kända för att vara aktiva inom olika temperaturintervaller, nämligen termofiler (ung. 30–35 °C), mesofiler (20–25 °C) och psykrofiler (< 20 °C), vilket kan göra att olika hämningsmönster uppvisas.
A.5 Varaktighet. I det allmänna testet, del 1, med outspätt slam producerades tillräckligt med gas på två till fyra dagar, medan det i del 2 med slam utspätt 1:100 producerades otillräckliga mängder gas eller ingen gas alls under denna period i ringtestet. I sin beskrivning av det senare testet anger Madsen m.fl. (1996) att man ska sätta av minst sju dagar för detta.
Testning med låg koncentration av biomassa (alternativ b)
Följande ändringar bör göras för att komplettera eller ersätta vissa befintliga punkter och stycken i huvudtexten.
A.6 Lägg till i punkt 6: Princip för testmetoden
’Denna teknik kan användas med anaerobt slam utspätt 1:100, delvis för att simulera den låga aktiviteten i gyttja och sediment. Inkuberingstemperaturen kan antingen vara 35 °C eller temperaturen på den plats där provet samlades in. Eftersom bakterieaktiviteten är mycket lägre än i outspätt slam bör inkuberingstiden förlängas till minst sju dagar.’
A.7 Lägg till i punkt 12 a:
’inkubatorn ska kunna fungera ner till en temperatur på 15 °C.’
A. 8 Lägg till en extra reagens efter punkt 13:
’Fosforsyra (H3PO4), 85 % i vikt i vatten.’
A.9 Lägg till följande i slutet av punkt 16:
’Använd en slutkoncentration på 0,20 ± 0,05 g/l total torrsubstans i testet.’
A.10 Punkt 17. Testsubstrat
Detta substrat ska inte användas, utan ersätts med jästextrakt (se punkterna 17, A.11, A.12 och A.13).
A.11 Det behövs ett oorganiskt medium, inklusive spårämnen, för utspädning av anaerobt slam, och för enkelhetens skull tillsätts det organiska substratet, jästextrakt, till detta medium.
Lägg till efter punkt 17:
|
’(a)
|
Oorganiskt testmedium, med jästextrakt.
|
Detta bereds från ett testmedium med tio gånger så hög koncentration (punkterna 17 b och A.12) med en spårelementlösning (punkterna 17 c och A.13). Använd nyanskaffad natriumsulfidnonahydrat (punkterna 17 b och A.12) eller tvätta och torka den före användning för att säkerställa att den har tillräcklig hämningskapacitet. Om testet utförs utan användning av en handskbox (punkt 12 j) bör koncentrationen av natriumsulfid i stamlösningen ökas till 2 g/l (från 1 g/l). Natriumsulfid kan också tillsättas från en lämplig stamlösning genom de förslutna testflaskornas septum, eftersom detta förfarande minskar risken för oxidering, för att erhålla en slutkoncentration på 0,2 g/l. Alternativt kan titan(III)citrat (punkt 17 b) användas. Tillsätt det genom de förslutna testflaskornas septum tills en koncentration på mellan 0,8 mmol/l och 1,0 mmol/l erhålls. Titan(III)citrat är ett mycket effektivt och lågtoxiskt reduktionsmedel som bereds på följande sätt: Lös 2,94 g trinatriumcitratdihydrat i 50 ml syrefritt utspädningsvatten (punkt 14) (vilket ger en 200 mmol/l lösning) och tillsätt 5 ml titan(III)kloridlösning (15 g/100 ml utspädningsvatten). Neutralisera till pH 7 ± 0,5 med natriumkarbonat och fördela i en lämplig injektionsflaska under en ström av kvävgas. Koncentrationen av titan(III)citrat i denna stamlösning är 164 mmol/l. Använd testmediet omedelbart eller förvara vid 4 °C i högst en dag.
|
A.12
|
(b)
|
Tiofalt koncentrerat testmedium, berett med följande:
|
vattenfritt kaliumdivätefosfat (KH2PO4)
|
2,7 g
|
|
dinatriumvätefosfat (Na2HPO4)
|
4,4 g
|
|
(eller 11,2 g dodekahydrat)
ammoniumklorid (NH4CI)
|
5,3 g
|
|
kalciumkloriddihydrat (CaCl2 · 2H2O)
|
0,75 g
|
|
magnesiumkloridhexahydrat (MgCl2 · 6H2O)
|
1,0 g
|
|
järn(II)kloridtetrahydrat (FeCl2 · 4H2O)
|
0,2 g
|
|
resazurin (redoxindikator)
|
0,01 g
|
|
natriumsulfidnonahydrat (Na2S · 9H2O)
|
1,0 g
|
|
(eller titan(III)citrat) slutlig koncentration
|
0,8–1,0 mmol/l
|
|
spårelementlösning (se punkterna 17 c och A.13)
|
10,0 ml
|
|
jästextrakt
|
100 g
|
|
Lös i utspädningsvatten (punkt 14) och späd till
|
1 000 ml
|
|
|
A.13
|
(c)
|
Spårelementlösning som beretts med följande:
|
mangan(II)kloridtetrahydrat (MnCl2 · 4H2O)
|
0,5 g
|
|
ortoborsyra (H3BO3)
|
0,05 g
|
|
zinkklorid (ZnCl2)
|
0,05 g
|
|
koppar(II)klorid (CuCl2)
|
0,03 g
|
|
natriummolybdatdihydrat (Na2MoO4 · 2H2O)
|
0,01 g
|
|
kobolt(II)kloridhexahydrat (CoCl2 · 6H2O)
|
1,0 g
|
|
nickel(II)kloridhexahydrat (NiCl2 · 6H2O)
|
0,1 g
|
|
dinatriumselenit (Na2SeO3)
|
0,05 g
|
|
Lös i utspädningsvatten (punkt 14) och späd till
|
1 000 ml’
|
|
A.14 Punkt 25: Preliminärt test
Det är viktigt att ett preliminärt test utförs så som beskrivs i punkt 24, förutom att koncentrationen fasta ämnen i slammet bör vara en hundradel av det som anges, dvs. 0,1 g/l, 0,2 g/l och 0,4 g/l. Inkuberingstiden bör vara minst sju dagar.
Anmärkning: I ringtestet (5) var gasutrymmet alldeles för stort med 75 % av den totala volymen. Det bör i stället ligga inom det rekommenderade intervallet på 10–40 %. Det relevanta kriteriet är att den volym gas som produceras vid omkring 80 % hämning bör vara mätbar med godtagbar precision (t.ex. ± 5 % till ± 10 %).
A.15 Punkterna 26 till 30: Tillsättning av testämne, inokulat och substrat.
Dessa tillsatser görs på samma sätt som beskrivs i dessa punkter, men substratlösningen (punkt 17) ersätts av testmediet plus jästextraktsubstrat (A.11).
Den slutliga koncentrationen av slammets torrsubstans minskas dessutom från 2–4 g/l till 0,2 ± 0,05 g/l (A.9). Två exempel på tillsättning av beståndsdelar i testblandningen ges i tabell A.1, som ersätter tabellen i punkt 29.
A.16 Punkt 33: Inkubering av flaskorna
På grund av den förväntat lägre gasproduktionshastigheten pågår inkuberingen i minst sju dagar.
A.17 Punkt 34: Tryckmätningar
Samma förfarande för att mäta trycket i gasutrymmet i flaskorna ska användas som i beskrivningen i punkt 34 om mängderna i gasfasen måste mätas. Om de totala mängderna för CO2 plus CH4 ska mätas sänks pH-värdet i vätskefasen till ca pH 2 genom injektion av H3PO4 i varje relevant flaska och mätning av trycket efter 30 minuters omskakning vid testtemperaturen. Emellertid kan mer information om kvaliteten på inokulatet erhållas genom mätning av trycket i varje flaska före och efter surgörning. När till exempel produktionshastigheten för CO2 är mycket högre än den för metan kan känsligheten hos jäsningsbakterierna ändras, och/eller främst metanbildande bakterier påverkas av testkemikalien.
A.18 Punkt 36: Mätning av pH-värdet
Om H3PO4 ska användas måste en del extra flaskor, i vilka H3PO4 inte tillsätts, inrättas särskilt för pH-mätning.
HÄNVISNING:
Madsen, T., Rasmussen, H. B och Nilsson, L. (1996), Methods for screening anaerobic biodegradability and toxicity of organic chemicals. Projekt nr 336, Vandkvalitetsinstituttet, danska miljöstyrelsen, Köpenhamn.
Tabell A.1
Exempel på testuppställning för testgrupper
|
Reaktionsblandning, beståndsdelar
|
Exempel 1
|
Exempel 2
|
Normal tillsatsordning
|
|
Det beredda inokulatets koncentration (g/l)
|
0,42
|
2,1
|
—
|
|
Det tillsatta inokulatets volym (ml)
|
45
|
9
|
4
|
|
Inokulatets koncentration i testflaskorna (g/l)
|
0,20
|
0,20
|
—
|
|
Det tillsatta testmediets volym (ml)
|
9
|
9
|
2
|
|
Det tillsatta utspädningsvattnets volym (ml)
|
36
|
72
|
3
|
|
Jästextraktets koncentration i testflaskorna (g/l)
|
9,7
|
9,7
|
—
|
|
Volym för stamlösningen med testkemikalie (ml)
|
3
|
3
|
1
|
|
Total vätskevolym (ml)
|
93
|
93
|
—
|
Tillägg 5
Definitioner
I denna testmetod gäller följande definitioner:
Kemikalie
: ett ämne eller en blandning.
Testkemikalie
: alla ämnen eller blandningar som testas med denna testmetod.
C.35. TOXICITETSTEST I SEDIMENT- OCH VATTENFAS FÖR LUMBRICULUS MED SPIKAT SEDIMENT
INLEDNING
|
1.
|
Denna testmetod motsvarar OECD:s testriktlinje (TG) 225 (2007). Sedimentförtärande endobentiska djur utsätts för potentiellt höga exponeringar av sedimentbundna kemikalier, och man bör därför ägna dessa ökad uppmärksamhet, t.ex. (1), (2), (3). Bland dessa sedimentförtärare spelar de vattenlevande oligochaeterna en viktig roll i vattensystemens sediment. Genom att dessa sköter bioturberingen av sediment och även har rollen som bytesdjur kan de ha en stark inverkan på biotillgängligheten av sådana kemikalier för andra organismer, t.ex. bentivora fiskar. I motsats till de epibentiska organismerna gräver endobentiska vattenlevande oligochaeter (t.ex. Lumbriculus variegatus) sig fram genom sedimentet, och förtär sedimentpartiklar under sedimentytan. Detta gör att testorganismerna exponeras för testkemikalien via alla tänkbara upptagningsvägar (t.ex. kontakt med och intag av förorenade sedimentpartiklar, men även via porvatten och överliggande vatten).
|
|
2.
|
Syftet med testmetoden är att bedöma effekterna av långvarig exponering för sedimentbundna kemikalier på den endobentiska oligochaeten Lumbriculus variegatus (Müller). Metoden bygger på befintliga testprotokoll för sedimenttoxicitet och bioackumulering, t.ex. (3), (4), (5), (6), (7), (8), (9), (10). Metoden beskrivs för statiska testbetingelser. Exponeringsscenariot i denna testmetod går ut på att kontaminera sedimentet med testkemikalien. Det spikade sedimentet är avsett att simulera ett sediment som är förorenat med testkemikalien.
|
|
3.
|
Kemikalier som behöver testas på sedimentlevande organismer är vanligen sådana som blir kvar i sedimentet under långa tidsperioder. Sedimentlevande organismer kan exponeras via ett antal vägar. Den relativa betydelsen av varje exponeringsväg och den tid det tar för var och en av dem att bidra till de totala toxiska effekterna beror på den berörda kemikaliens fysikalisk-kemiska egenskaper och dess slutliga omvandling, spridning och fördelning i djuret. För starkt adsorberande kemikalier (t.ex. log Kow > 5) eller för kemikalier som binds kovalent till sedimentet, kan förtäring av förorenad föda vara en betydande exponeringsrutt. För att inte underskatta toxiciteten av sådana kemikalier tillsätts det foder som krävs för testorganismernas reproduktion och tillväxt till sedimentet före applicering av testkemikalien (11). Den testmetod som beskrivs är tillräckligt detaljerad så att testet kan utföras samtidigt som man ger utrymme för anpassningar av testutformningen beroende på förhållandena i enskilda laboratorier och testkemikaliernas varierande egenskaper.
|
|
4.
|
Testmetoden syftar till att fastställa effekterna av en testkemikalie på testorganismernas reproduktion och biomassa. De uppmätta biologiska parametrarna är det totala antalet överlevande maskar och biomassan (torrvikt) i slutet av exponeringen. Dessa data analyseras genom användning antingen av en regressionsmodell i syfte att uppskatta den koncentration som framkallar en effekt på x % (t.ex. EC50, EC25 och EC10) eller genom användning av statistisk hypotesprövning för att bestämma den högsta koncentrationen utan observerad effekt (NOEC) och den lägsta koncentrationen med observerad effekt (LOEC).
|
|
5.
|
Kapitel C.27 i denna bilaga, ’Toxicitetstest i sediment- och vattenfas på chironomidlarver med spikat sediment’ (6), innehåller många viktiga och användbara detaljer om hur man kan genomföra den beskrivna testmetoden för sedimenttoxicitet. Detta dokument ligger sålunda till grund för utarbetandet av de ändringar som var nödvändiga för att kunna genomföra sedimenttoxicitetstester med Lumbriculus variegatus. Andra dokument som det hänvisas till här är t.ex. ASTM Standard Guide for Determination of the Bioaccumulation of Sediment-Associated Contaminants by Benthic Invertebrates (3), den amerikanska miljöskyddsmyndighetens (EPA) Methods for Measuring the Toxicity and Bioaccumulation of Sediment-Associated Contaminants with Freshwater Invertebrates (7), samt ASTM Standard Guide for Collection, Storage, Characterization, and Manipulation of Sediments for Toxicological Testing and for Selection of Samplers Used to Collect Benthic Invertebrates (12). Dessutom har praktiska erfarenheter som förvärvats när testmetoden ringtestades ((13), ringtestrapport), och uppgifter från referenslitteraturen utgjort viktiga informationskällor när detta dokument utarbetades.
|
FÖRUTSÄTTNINGAR OCH VÄGLEDANDE INFORMATION
|
6.
|
Information om testkemikalien, såsom säkerhetsåtgärder, lämpliga lagringsförhållanden och analysmetoder, bör inhämtas innan studien inleds. Vägledning för testning av kemikalier vars fysikalisk-kemiska egenskaper gör det svårt att genomföra detta test finns i (14).
|
|
7.
|
Innan ett test utförs bör följande upplysningar om testkemikalien finnas tillgängliga:
|
—
|
trivialnamn, kemiskt namn (helst enligt IUPAC), strukturformel, CAS-nummer, renhet,
|
|
|
8.
|
Dessutom anses följande information vara användbar innan testet inleds:
|
—
|
fördelningskoefficient oktanol/vatten, Kow,
|
|
—
|
fördelningskoefficient organiskt kol/vatten, uttryckt som Koc,
|
|
|
9.
|
Information om vissa egenskaper hos de sediment som ska användas bör förvärvas innan testet inleds (7). För närmare information, se punkterna 22–25.
|
PRINCIP FÖR TESTMETODEN
|
10.
|
Maskar i liknande fysiologiska stadier (synkroniserade som beskrivs i tillägg 5) exponeras för en serie koncentrationer av ett giftämne som tillsätts i sedimentfasen av sediment/vattensystemet. Syntetiskt sediment och rekonstituerat vatten bör användas som media. Testkärl utan tillsats av testkemikalien fungerar som kontroller. Sedimentet spikas med testkemikalien i bulk för varje koncentrationsnivå i syfte att minimera variabiliteten mellan replikaten för varje koncentrationsnivå, och testorganismerna tillförs därefter i testkärlen, i vilka koncentrationen för vatten och sediment har bringats i jämvikt (se punkt 29). Försöksdjuren exponeras för sediment/vattensystemen under en period på 28 dagar. Med hänsyn till det syntetiska sedimentets låga näringsvärde bör ett foder tillsättas sedimentet (se punkterna 22–23 och tillägg 4) för att se till att maskarna ska växa och reproducera sig under kontrollerade villkor. På detta sätt säkerställer man att försöksdjuren exponeras via vattnet och sedimentet såväl som genom deras föda.
|
|
11.
|
Den lämpligaste endpointen i denna typ av undersökning är ECx (t.ex. EC50, EC25 och EC10 – effektkoncentrationen, den koncentration som påverkar x % av försöksdjuren) för reproduktion respektive biomassa jämfört med kontrollen. Man bör dock notera att EC50 anses vara den mest tillförlitliga endpointen med tanke på den höga osäkerheten hos låga ECx-värden (t.ex. EC10, EC25) med extremt höga 95-procentiga konfidensgränser (t.ex. (15)) och den statistiska styrka som beräknats under hypotesprövningen. Dessutom kan den högsta koncentrationen utan observerad effekt (NOEC) och den lägsta koncentrationen med observerad effekt (LOEC) beräknas för biomassan och reproduktionen om testupplägget och uppgifterna stöder dessa beräkningar (se punkterna 34–38). Syftet med studien – att fastställa ECx eller NOEC – avgör testupplägget.
|
REFERENSTESTNING
|
12.
|
Kontrollorganismernas beteende förväntas vara ett tillräckligt bevis på ett laboratoriums förmåga för att utföra testet, och, om historiska uppgifter finns tillgängliga, testets repeterbarhet. Dessutom kan toxicitetstester genomföras med jämna mellanrum med hjälp av ett referensgiftämne för att bedöma känsligheten hos testorganismerna. Endast 96-timmars referenstoxicitetstester i vatten kan på ett tillfredsställande sätt påvisa försöksdjurens känslighet och tillstånd (4) (7). Information om toxiciteten för pentaklorfenol (PCP) i fullständiga tester (28-dagars exponering för spikat sediment) finns att tillgå i tillägg 6, och i rapporten om testmetodens ringtest (13). Den akuta toxiciteten av pentaklorfenol i endast vatten beskrivs t.ex. i (16). Denna information kan användas för jämförelser av testorganismens känslighet i referenstester med PCP som referensgiftämne. Kaliumklorid (KCl) eller kopparsulfat (CuSO4) har rekommenderats som referensgiftämnen för L. variegatus (4) (7). Hittills har det varit svårt att fastställa kvalitetskriterier grundat på toxicitetsdata för KCl på grund av bristande uppgifter i litteraturen för L. variegatus. Information om toxiciteten av koppar för L. variegatus finns i (17) till (21).
|
TESTETS GILTIGHET
|
13.
|
För att testet ska vara giltigt måste följande krav vara uppfyllda:
|
—
|
Resultaten från ett ringtest (13) har visat att för Lumbriculus variegatus bör det genomsnittliga antalet levande maskar per replikat i kontrollerna ha ökat med en faktor på minst 1,8 i slutet av exponeringen jämfört med antalet maskar per replikat i början av exponeringen.
|
|
—
|
pH i överliggande vatten bör vara mellan 6 och 9 under hela testet.
|
|
—
|
Syrekoncentrationen i överliggande vatten bör vara minst 30 % av luftmättnadsvärdet (ASV) vid testtemperaturen under testets gång.
|
|
BESKRIVNING AV TESTMETODEN
Testsystem
|
14.
|
Statiska system utan förnyelse av överliggande vatten rekommenderas. Om förhållandet mellan sediment och vatten (se punkt 15) är lämpligt räcker det normalt med försiktig luftning för att hålla vattenkvaliteten på godtagbara nivåer för testorganismerna (t.ex. maximera halten löst syre, minimera ackumuleringen av avfallsprodukter). Semistatiska system eller genomflödessystem med periodisk eller kontinuerlig förnyelse av det överliggande vattnet bör endast användas i undantagsfall, eftersom regelbunden förnyelse av överliggande vatten förväntas påverka den kemiska jämvikten (t.ex. förlust av testkemikalien från testsystemet).
|
Testkärl och apparater
|
15.
|
Exponeringen bör genomföras i glasbägare på t.ex. 250 ml som mäter 6 cm i diameter. Andra lämpliga glaskärl kan användas, men det måste gå att garantera att det överliggande vattnet och sedimentet har ett lämpligt djup. Varje kärl ska ha ett skikt på ca 1,5–3 cm syntetiskt sediment. Förhållandet mellan sedimentskiktets djup och det överliggande vattnets djup bör vara 1:4. Kärlens kapacitet ska vara anpassad efter djurtätheten, dvs. antalet testmaskar som tillsätts per viktenhet sediment (se även punkt 39).
|
|
16.
|
Testkärl och annan apparatur som kommer i kontakt med testkemikalien bör vara tillverkade uteslutande av glas eller annat kemiskt inert material. För all utrustning gäller att man nogsamt bör undvika användning av material som kan lösas upp, absorbera testkemikalien eller läcka andra kemikalier och ha negativa effekter på försöksdjuren. Polytetrafluoreten (PTFE), rostfritt stål och/eller glas kan användas för all utrustning som kommer i kontakt med testmediet. För organiska kemikalier som är kända för att adsorberas till glas kan det vara nödvändigt att använda silaniserat glas. I dessa fall ska utrustningen kasseras efter användningen.
|
Testarter
|
17.
|
Den testart som används i denna typ av studier är den sötvattenslevande oligochaeten Lumbriculus variegatus (Müller). Denna art tolererar ett brett spektrum av sedimenttyper, och används ofta för testning av sedimenttoxicitet och bioackumulering [t.ex. (3), (5), (7), (9), (13), (15), (16), (22), (23), (24), (25), (26), (27), (28), (29), (30), (31), (32), (33), (34), (35)]. Man bör rapportera försöksdjurens ursprung, bekräftelse av artidentiteten (t.ex. (36)) såväl som odlingsförhållandena. Det är inte nödvändigt att identifiera arten före varje test om organismerna härrör från en odling inom laboratoriet.
|
Odling av testorganismer
|
18.
|
För att ha ett tillräckligt antal maskar för utförandet sedimenttoxicitetstester är det lämpligt att hålla maskarna i en permanent laboratorieodling. Vägledning om laboratorieodlingsmetoder för Lumbriculus variegatus och källor för startkulturer anges i tillägg 5. Närmare uppgifter om odling av denna art finns i hänvisningarna (3), (7), (27).
|
|
19.
|
För att säkerställa att testerna utförs med djur av samma art rekommenderas starkt att man inrättar kulturer med en enda art. Se till att kulturerna och särskilt maskarna som används för testet inte har några synliga sjukdomar eller abnormaliteter.
|
Vatten
|
20.
|
Rekonstituerat vatten enligt kapitel C.1 i denna bilaga (37) rekommenderas som överliggande vatten i testerna. Det kan även användas för laboratoriekulturerna med maskar (för beredning, se tillägg 2). Om så behövs kan naturligt vatten användas. Det valda vattnet ska vara av en kvalitet som möjliggör tillväxt och förökning av testarten under acklimatiserings- och testperioderna, utan att den uppvisar ett onormalt utseende eller beteende. Lumbriculus variegatus har visat sig överleva, växa och föröka sig i denna typ av vatten (30), och arten medger också maximal standardisering av test- och odlingsförhållandena. Om rekonstituerat vatten används bör dess sammansättning uppges, och vattnet ska beskrivas före användning med åtminstone uppgifter om pH, syrehalt och hårdhet (uttryckt i mg CaCO3/l). En analys av vattnet för mikroföroreningar före användning kan ge värdefull information (se t.ex. tillägg 3).
|
|
21.
|
pH i det överliggande vattnet bör vara 6,0–9,0 (se punkt 13). Om man förväntar sig en ökad utveckling av ammoniak anses det lämpligt att hålla pH-värdet mellan 6,0 och 8,0. För testning av t.ex. svaga organiska syror är det lämpligt att justera pH-värdet genom buffring av det vatten som används i testet, enligt beskrivning t.ex. av (16). Den totala hårdheten hos det vatten som används i testet bör vara 90–300 mg CaCO3/liter för naturligt vatten. Tillägg 3 innehåller en sammanfattning av kompletterande kriterier för godtagbart utspädningsvatten enligt OECD:s riktlinje 210 (38).
|
Sediment
|
22.
|
Eftersom oförorenade naturliga sediment från en viss källa inte alltid finns att tillgå under hela året, och inhemska organismer och förekomsten av mikroföroreningar kan påverka testet, bör ett syntetiskt sediment (även kallat rekonstituerat eller konstgjort sediment) helst användas. Användning av syntetiskt sediment minimerar testbetingelsernas variabilitet samt införandet av inhemsk fauna. Följande syntetiska sediment bygger på det konstgjorda sedimentet i enlighet med (6), (39) och (40). Det rekommenderas för användning i denna typ av test ((6), (10), (30), (41), (42) och (43)):
|
(a)
|
4–5 % (torrvikt) vitmosstorv (Sphagnum). Det är viktigt att använda torv i pulverform; nedbrytningsgrad: ’medium’, finmald (partikelstorlek ≤ 0,5 mm), och uteslutande lufttorkad.
|
|
(b)
|
20 ± 1 % (torrvikt) kaolinlera (kaolinithalt helst över 30 %).
|
|
(c)
|
75–76 % (torrvikt) kvartssand (bestående av fin sand, kornstorlek: ≤ 2 mm, men > 50 % av partiklarna bör ha en storlek på 50–200 μm).
|
|
(d)
|
Avjonat vatten, 30–50 % av sedimentets torrsubstans, utöver sedimentets torra beståndsdelar.
|
|
(e)
|
Kemiskt ren kalciumkarbonat (CaCO3) tillsätts för att justera den slutliga sedimentblandningens pH.
|
|
(f)
|
Halten av organiskt kol (TOC) i den slutliga blandningen bör vara 2 % (± 0,5 %) torrvikt sediment och bör justeras med lämpliga mängder torv och sand enligt (a) och (c).
|
|
(g)
|
Foder, till exempel pulvriserade blad av brännässla (Urtica sp., i enlighet med apoteksstandarder för livsmedel), eller en blandning av pulvriserade blad av Urtica sp. och alfacellulosa (1: 1) vid 0,4–0,5 % torrvikt sediment, utöver sedimentets torra beståndsdelar. För detaljer se tillägg 4.
|
|
|
23.
|
Källorna till torv, kaolinlera, fodermaterial och sand ska vara kända. Utöver punkt g) anges i kapitel C.27 i denna bilaga (6) alternativa växtmaterial som kan användas som näringskälla: torkade mullbärsblad (Morus alba), vitklöver (Trifolium repens), spenat (Spinacia oleracea) eller sädesslag.
|
|
24.
|
Den valda foderkällan bör tillsättas före eller under spikningen av sedimentet med testkemikalien. Den valda foderkällan bör möjliggöra åtminstone godtagbar reproduktion i kontrollerna. Analys av det syntetiska sedimentet eller dess beståndsdelar innan användning med avseende på mikroföroreningar kan ge användbar information. Ett exempel på hur det syntetiska sedimentet kan beredas beskrivs i tillägg 4. Det är också godtagbart att blanda torra beståndsdelar om det går att visa att det inte förekommer en uppdelning av sedimentets beståndsdelar efter tillsats av det överliggande vattnet (t.ex. flytande torvpartiklar) och att torven eller sedimentet konditionerats tillräckligt (se även punkt 25 och tillägg 4). För det syntetiska sedimentet bör minst anges beståndsdelarnas ursprung, kornstorleksfördelningen (procentandel sand, dy och lera), halten av organiskt kol (TOC), vattenhalt och pH. Mätningen av redoxpotentialen är valfri.
|
|
25.
|
Om så krävs, t.ex. för specifika testningsändamål, kan naturliga sediment från oförorenade platser också användas som test- och/eller kultursediment (3). Om naturligt sediment används bör minst anges ursprung (insamlingsplats), pH och ammoniak i porvatten, halten av organiskt kol (TOC) och kväve, partikelstorleksfördelning (procentandel sand, dy och lera) och procentuell andel vatten (7), och sedimentet bör vara fritt från alla föroreningar och andra organismer som kan konkurrera med eller leva på testorganismerna. Mätningen av redoxpotentialen och katjonutbyteskapaciteten är valfri. Dessutom rekommenderas att det naturliga sedimentet, innan det spikas med testkemikalien, konditioneras i sju dagar under samma betingelser som råder i det efterföljande testet. I slutet av denna konditioneringsperiod bör det överliggande vattnet avlägsnas och kasseras.
|
|
26.
|
Sediment som ska användas måste hålla en kvalitet som möjliggör kontrollorganismernas överlevnad och reproduktion under hela exponeringsperioden utan att de uppvisar ett onormalt utseende eller beteende. Kontrollmaskarna bör gräva sig igenom sedimentet, och de bör förtära sedimentet. Reproduktionen i kontrollerna bör åtminstone överensstämma med giltighetskriteriet i enlighet med punkt 13. Förekomsten eller frånvaron av fekala pelletar på sedimentytan, vilket är ett tecken på om maskarna förtär sedimentet eller inte, bör registreras och kan vara till hjälp för att tolka testresultaten med avseende på exponeringsvägar. Ytterligare information om sedimentförtäring kan erhållas med hjälp av metoder som beskrivs i (24), (25), (44) och (45), som i detalj anger testorganismernas sedimentintag och partikelurval.
|
|
27.
|
De förfaranden som används för hantering av naturliga sediment innan de används i laboratoriet beskrivs i (3), (7) och (12). Beredningen och lagringen av det syntetiska sediment som rekommenderas för användning i Lumbriculus-testet beskrivs i tillägg 4.
|
Applicering av testkemikalien
|
28.
|
Sedimentet ska spikas med testkemikalien. Eftersom de flesta testkemikalier förväntas ha låg vattenlöslighet bör de lösas upp i ett lämpligt organiskt lösningsmedel (t.ex. aceton, n-hexan, cyklohexan) i en så liten volym som möjligt för beredning av stamlösningen. Stamlösningen ska spädas med samma lösningsmedel som används för beredning av testlösningarna. Lösningsmedlets toxicitet och flyktighet samt testkemikaliens löslighet i det valda lösningsmedlet bör vara de huvudsakliga kriterier som används vid valet av lämpligt solubiliseringsmedel. För varje koncentrationsnivå bör samma volym av motsvarande lösning användas. Sedimentet ska spikas i bulk för varje koncentrationsnivå för att minimera variabiliteten i testkemikaliens koncentration mellan replikaten. Var och en av dessa testlösningar blandas därefter med kvartssand på det sätt som beskrivs i punkt 22 (t.ex. 10 g kvartssand per testkärl). För att genomdränka kvartssanden helt har en volym på 0,20–0,25 ml per gram sand befunnits räcka. Därefter ska lösningsmedlet avdunsta till torrhet. För att minimera förlusterna av testkemikalien genom samtidig avdunstning (t.ex. beroende på kemikaliens ångtryck) används den belagda sanden omedelbart efter torkning. Den torra sanden blandas med en lämplig mängd syntetiskt sediment med motsvarande koncentrationsnivå. Mängden sand som tillhandahålls av testkemikalie-och-sandblandningen måste beaktas när man bereder sedimentet (dvs. sedimentet ska sålunda beredas med mindre mängd sand). En viktig fördel med detta förfarande är att så gott som inget lösningsmedel tillsätts i sedimentet (7). Alternativt, t.ex. för fältsediment, kan testkemikalien tillsättas genom att spika en torkad och finfördelad del av sedimentet på det sätt som beskrivs ovan för kvartssanden, eller genom att blanda ner testkemikalien i det våta sedimentet och därefter avdunsta det eventuella solubiliseringsmedel som använts. Man bör vara noga med att se till att testkemikalien som tillsätts sedimentet fördelas omsorgsfullt och jämnt i sedimentet. Vid behov kan delprover analyseras för att bekräfta målkoncentrationerna i sedimentet, och för att bestämma homogenitetsgraden. Det kan också vara lämpligt att analysera delprover av testlösningarna för att bekräfta målkoncentrationerna i sedimentet. Eftersom ett lösningsmedel används för att belägga kvartssanden med testkemikalien bör en lösningsmedelskontroll användas som bereds med samma mängd lösningsmedel som testsedimentet. Metoden för spikning och motiveringen av valet av ett visst spikningsförfarande annat än de som beskrivs ovan bör rapporteras. Metoden för spikning kan anpassas till testkemikaliens fysikalisk-kemiska egenskaper, t.ex. för att undvika förluster på grund av avdunstning under spikningen eller stabiliseringsförloppet. Ytterligare vägledning om spikningsförfaranden finns i Environment Canada (1995) (46).
|
|
29.
|
Efter det att det spikade sedimentet har beretts, fördelats i replikattestkärlen och fyllts på med testvatten är det önskvärt att testkemikalien ska kunna fördelas från sedimentet till vattenfasen (t.ex. (3) (7) (9)). Detta bör helst göras under samma temperatur- och luftningsförhållanden som används i testet. Stabiliseringstiden beror på sedimentet och kemikalien, och kan variera mellan några timmar och flera dagar, i sällsynta fall upp till flera veckor (4–5 veckor) (t.ex. (27)(47)). I detta test väntar man inte på att jämvikt ska uppnås, men det rekommenderas att man har en stabiliseringstid på mellan 48 timmar och 7 dagar. På så sätt minimeras tiden för nedbrytning av testkemikalien. Beroende på syftet med studien, t.ex. om man ska efterlikna vissa miljöförhållanden, kan det spikade sedimentet stabiliseras eller åldras under en längre period.
|
|
30.
|
I slutet av denna stabiliseringsperiod bör prover tas åtminstone av det överliggande vattnet och bulksedimentet, minst vid den högsta koncentrationen och en lägre koncentration, för analys av testkemikaliens koncentration. Dessa analytiska bestämningar av testkemikalien gör det möjligt att beräkna massbalansen och uttrycka resultaten på grundval av uppmätta startkoncentrationer. I allmänhet stör eller förstör provtagningen sedimentets vattensystem. Därför är det ofta omöjligt att använda samma replikat för provtagning av sediment och maskar. Ytterligare ’analyskärl’ av lämpliga dimensioner måste inrättas som behandlas på samma sätt (inklusive förekomsten av testorganismer) men som inte används för biologiska observationer. Kärlens dimensioner bör väljas ut för att ge prov av de mängder som krävs enligt analysmetoden. Detaljer rörande provtagningen beskrivs i punkt 53.
|
TESTFÖRFARANDE
Preliminärt test
|
31.
|
Om ingen information finns tillgänglig om testkemikaliens toxicitet för Lumbriculus variegatus kan det vara lämpligt att göra ett preliminärt test för att fastställa koncentrationerna som ska testas vid det definitiva testet och för att optimera provningsförhållandena för det definitiva testet. För detta ändamål används en serie med vitt spridda koncentrationer av testkemikalien. Maskarna exponeras för varje koncentration av testkemikalien under en period (t.ex. 28 dagar som vid det definitiva testet) som möjliggör uppskattning av lämpliga testkoncentrationer. Inga replikat behövs. Den aspekt av maskarnas beteende, t.ex. undvikande av sedimentet, som kan ha orsakats av testkemikalien och/eller sedimentet bör observeras och noteras under det preliminära testet. Koncentrationer som överstiger 1 000 mg/kg torrvikt sediment bör inte testas i det preliminära testet.
|
Definitivt test
|
32.
|
Vid det definitiva testet används minst fem koncentrationer som väljs ut t.ex. på grundval av resultatet av det preliminära testet (punkt 31), och på det sätt som beskrivs i punkterna 35, 36, 37 och 38.
|
|
33.
|
Utöver själva testserierna bör man ha en kontroll (för replikation se punkterna 36, 37 och 38) som innehåller alla beståndsdelar utom testkemikalien. Om solubiliseringsmedel används för applicering av testkemikalien bör detta inte ha någon betydande effekt på testorganismerna, något som uppdagas i en ytterligare kontroll med enbart lösningsmedel.
|
Testupplägg
|
34.
|
Testupplägget avser antalet koncentrationer och intervallen mellan dem, antalet kärl per koncentration och antalet tillsatta maskar per kärl. Testutformningar för bestämning av ECx, för uppskattning av NOEC och för utförande av toleranstest beskrivs i punkterna 35, 36, 37 och 38.
|
|
35.
|
Effektkoncentrationen (t.ex. EC50, EC25, EC10) och det koncentrationsintervall som är relevant för testkemikalien bör omges av de koncentrationer som ingår i testet. Man bör undvika att extrapolera långt under den lägsta koncentration som påverkar testorganismerna eller över den högsta koncentration som testas. Om en sådan extrapolering – i undantagsfall – sker måste en fullständig förklaring ges i rapporten.
|
|
36.
|
Om man ska uppskatta ECx bör minst fem koncentrationer och minst tre replikat för varje koncentration testas. Sex replikat rekommenderas för kontrollen eller – i förekommande fall – lösningsmedelskontrollen för att förbättra uppskattningen av variabiliteten i kontrollen. Det är under alla omständigheter tillrådligt att använda tillräckligt många testkoncentrationer för att få en god modelluppskattning. Faktorn mellan koncentrationerna bör inte vara större än två (undantag kan göras i fall där dos-respons-kurvan har liten lutning). Antalet replikat per testkärl kan minskas om antalet testkoncentrationer med responser inom intervallet 5–95 % ökar. En ökning av antalet replikat eller en minskning av testkoncentrationsintervallerna tenderar att leda till smalare konfidensintervaller för testet.
|
|
37.
|
Om LOEC eller NOEC ska uppskattas bör minst fem testkoncentrationer med minst fyra replikat (sex replikat rekommenderas för kontrollen eller – i förekommande fall – lösningsmedelskontrollen för att förbättra uppskattningen av variabiliteten i kontrollen) användas och faktorn mellan koncentrationerna bör inte vara större än två. Vissa uppgifter om den statistiska styrka som konstaterats under hypotesprövningen i ringtestet för testmetoden finns i tillägg 6.
|
|
38.
|
Ett toleranstest kan utföras (med en testkoncentration och kontroller) om inga effekter förväntas upp till 1 000 mg/kg torrvikt sediment (t.ex. utifrån ett preliminärt test), eller om ett test vid en enda koncentration är tillräckligt för att bekräfta ett NOEC-värde som är av intresse. I det senare fallet ska en detaljerad motivering för valet av koncentrationsgräns ingå i testrapporten. Syftet med toleranstestet är att genomföra ett test vid en koncentration som är tillräckligt hög för att beslutsfattare ska kunna utesluta att kemikalien eventuellt har toxiska effekter, och gränsen sätts vid en koncentration som inte förväntas förekomma i någon situation. 1 000 mg/kg (torrvikt) rekommenderas. Normalt är det nödvändigt att ha minst sex replikat både för test och kontroll. Vissa uppgifter om den statistiska styrka som konstaterats under hypotesprövningen i ringtestet för testmetoden finns i tillägg 6.
|
Exponeringsförhållanden
Testorganismer
|
39.
|
Testet ska utföras med minst tio maskar i varje replikat som används för bestämning av de biologiska parametrarna. Detta antal maskar motsvarar ungefär 50–100 mg våt biomassa. Om man antar att torrinnehållet är 17,1 % (48) leder detta till omkring 9–17 mg torr biomassa per kärl. Den amerikanska miljöskyddsmyndigheten (EPA) (2000 (7)) rekommenderar att djurtätheten inte överskrider 1:50 (torr biomassa: totalt innehåll av organiskt kol (TOC)). För det syntetiska sediment som beskrivs i punkt 22 motsvarar detta ungefär 43 g sediment (torrvikt) per tio maskar vid ett TOC på 2,0 % för torrt sediment. Om fler än tio maskar används per kärl bör mängderna sediment och överliggande vatten anpassas i enlighet med detta.
|
|
40.
|
Testmaskarna bör komma från samma källa och vara djur som befinner sig i liknande fysiologiska stadier (se tillägg 5). Man bör välja maskar i liknande storlekar (se punkt 39). Det rekommenderas att ett delprov av partiet eller beståndet av maskar vägs före testet i syfte att uppskatta medelvikten.
|
|
41.
|
Maskar som ska användas i ett test tas bort ur odlingen (för detaljer, se tillägg 5). Stora (adulta) djur som inte visar tecken på att nyligen ha delats överförs till glaskärl (t.ex. petriskålar) med rent vatten. De synkroniseras senare på det sätt som beskrivs i tillägg 5. Efter regenerering under 10–14 dagar bör intakta hela maskar av liknande storlek som aktivt simmar eller kryper efter lätt mekanisk retning användas för testet. Om testbetingelserna avviker från odlingsbetingelserna (t.ex. i fråga om temperatur, ljusförhållanden, och överliggande vatten), bör det räcka med en acklimatiseringsfas på t.ex. 24 timmar vid samma temperatur, ljusförhållanden och överliggande vatten som i testet för att maskarna ska anpassa sig till testbetingelserna. De anpassade oligochaeterna bör fördelas slumpmässigt i provkärlen.
|
Utfodring
|
42.
|
Eftersom foder tillsätts i sedimentet före (eller under) applicering av testkemikalien utfodras maskarna inte under testet.
|
Ljus och temperatur
|
43.
|
Fotoperioden i kulturen och testet är normalt 16 timmar (3), (7). Ljusintensiteten bör vara låg (t.ex. 100–500 lux) för att imitera de naturliga förhållandena vid sedimentytan, och bör mätas minst en gång under exponeringstiden. Temperaturen ska vara 20 ± 2 °C under hela testet. På en bestämd mätningsdag bör temperaturskillnaden mellan testkärlen inte överstiga ± 1 °C. Testkärlen bör placeras slumpmässigt i testinkubatorn eller i testområdet, t.ex. för att minimera systematiska avvikelser i reproduktionen på grund av kärlens placering.
|
Luftning
|
44.
|
Det överliggande vattnet i testkärlen bör luftas försiktigt (t.ex. 2–4 bubblor per sekund) genom en pasteurpipett som placeras ca 2 cm ovanför sedimentytan för att minimera grumling av sedimentet. Man bör vara noga med att halten löst syre inte faller under 30 % av luftmättnadsvärdet (ASV). Lufttillförseln bör kontrolleras och vid behov justeras minst en gång per dag under vardagarna.
|
Mätning av vattenkvalitet
|
45.
|
Följande parametrar för vattenkvalitet bör mätas i det överliggande vattnet:
|
Temperatur:
|
i minst ett testkärl för varje koncentrationsnivå och ett testkärl av kontrollerna en gång per vecka och i början och slutet av exponeringsperioden. Om möjligt kan även temperaturen i det omgivande mediet (den omgivande luften eller vattenbadet) registreras t.ex. en gång per timme.
|
|
Halten löst syre:
|
i minst ett testkärl för varje koncentrationsnivå och ett testkärl av kontrollerna en gång per vecka och i början och slutet av exponeringsperioden. Detta ska uttryckas i mg/l och % ASV (luftmättnadsvärde).
|
|
Lufttillförsel:
|
bör kontrolleras minst en gång dagligen på vardagar och justeras vid behov.
|
|
pH-värde:
|
i minst ett testkärl för varje koncentrationsnivå och ett testkärl av kontrollerna en gång per vecka och i början och slutet av exponeringsperioden.
|
|
Total vattenhårdhet:
|
i minst ett kontrollreplikat och ett testkärl vid den högsta koncentrationen i början och slutet av exponeringsperioden. Detta ska uttryckas i mg/l CaCO3.
|
|
Total ammoniakhalt:
|
i minst ett kontrollreplikat och ett testkärl för varje koncentrationsnivå i början av exponeringstiden, och därefter tre gånger per vecka. Detta uttrycks i mg/l NH4
+ eller NH3 eller total mängd ammoniak-N.
|
Om mätningen av parametrarna för vattenkvalitet innebär att betydande mängder vatten måste avlägsnas från kärlen kan det vara tillrådligt att inrätta separata kärl för mätningar av vattenkvalitet så att man undviker att rubba förhållandet mellan vattenvolymen och sedimentvolymen.
|
Biologiska observationer
|
46.
|
Under exponeringen bör testkärlen granskas visuellt för att bedöma eventuella skillnader i maskarnas beteende (t.ex. undvikande av sedimentet, fekala pelletar synliga på sedimentytan) jämfört med kontrollerna. Dessa observationer ska registreras.
|
|
47.
|
Vid slutet av testet undersöks varje replikat (ytterligare kärl som används för kemiska analyser kan undantas från undersökningen). En lämplig metod ska användas för att avlägsna alla maskar från testkärlet. Det är viktigt att se till att alla maskar avlägsnas utan att skadas. En möjlig metod är siktning av maskarna från sedimentet. Ett nät av rostfritt stål med lämplig maskstorlek kan användas. Det mesta av det överliggande vattnet hälls försiktigt av och det återstående sedimentet och vattnet omröres så att man får en sörja som kan passeras genom sikten. Om man använder ett nät vars maskor är 500 μm kommer de flesta av sedimentpartiklarna att snabbt passera igenom, men siktningen bör göras snabbt för att undvika att maskar kryper in i eller genom nätet. Om man använder ett nät på 250 μm hindrar man maskarna från att krypa in i eller genom nätet, men man bör vara noga med att se till att så få sedimentpartiklar som möjligt blir kvar i nätet. Den siktade sörjan i varje replikatkärl kan passeras genom sikten en andra gång för att se till att alla maskar avlägsnas. En alternativ metod är att man värmer sedimentet genom att placera testkärlen i ett vattenbad med en temperatur på 50–60 °C. Maskarna kryper då upp ur sedimentet och kan samlas upp på ytan med hjälp av en flampolerad pipett med bred spets. Ett annat alternativ är att man framställer en sedimentsörja och häller denna i en grund skål av lämplig storlek. Från det tunna skiktet av sörjan kan maskarna plockas upp med en nål av stål eller en pincett (som används mer som en gaffel än en pincett för att undvika att skada maskarna) och överföras till rent vatten. Efter att maskarna har separerats från sedimentsörjan ska de sköljas i testmediet och räknas.
|
|
48.
|
Oberoende av vilken metod som används bör laboratorierna kunna visa att deras personal kan avlägsna i genomsnitt minst 90 % av testorganismerna från sedimentet. Till exempel kan ett visst antal testorganismer tillsättas kontroll- eller testsediment och andelen avlägsnade maskar kan fastställas efter 1 timme (7).
|
|
49.
|
Det totala antalet levande och döda individer per replikat bör registreras och utvärderas. Följande grupper av maskar anses vara döda:
|
a)
|
maskar som inte reagerar på lätt mekanisk retning
|
|
b)
|
maskar som visar tecken på förruttnelse (i kombination med a))
|
Dessutom kan de levande maskarna hänföras till en av tre grupper:
|
a)
|
stora, hela maskar (adulter) utan återbildade kroppspartier
|
|
b)
|
hela maskar med återbildade kroppspartier med ljusare färg (dvs. med nya bakre delar, med nya främre delar, eller med både nya bakre och främre delar)
|
|
c)
|
ofullständiga maskar (dvs. maskar som nyligen delats med kroppspartier som inte återbildats)
|
Dessa ytterligare överväganden är inte obligatoriska, men kan användas för utökad tolkning av de biologiska resultaten (t.ex. ett stort antal maskar i grupp c) kan tyda på en försening av reproduktionen eller återbildandet i en viss testgrupp). Om man upptäcker skillnader i utseendet (t.ex. skador på integumentet, ödematösa kroppspartier) mellan testmaskar och kontrollmaskar bör dessa registreras.
|
|
50.
|
Omedelbart efter räkningen/bedömningen ska de levande maskarna i varje replikat överföras till torra, tidigare vägda och märkta vågskålar (en per replikat) och avlivas med en droppe etanol per vågskål. Vågskålarna placeras i ett torkskåp med en temperatur på 100 ± 5 °C och får torka över natten, varefter de vägs efter att de har svalnat i en exsickator och torrvikten maskar fastställs (helst i gram, med minst fyra decimaler).
|
|
51.
|
Utöver den totala torrvikten kan man fastställa den askfria torrvikten enligt beskrivningen i (49) för att redovisa oorganiska komponenter som härrör från förtärt sediment som förekommer i maskarnas matsmältningsorgan.
|
|
52.
|
Biomassan fastställs som biomassa totalt per replikat inklusive adulter och juveniler. Döda maskar bör inte beaktas vid fastställandet av biomassa per replikat.
|
Kontroll av koncentrationer av testkemikalien
Provtagning
|
53.
|
Prover för kemisk analys av testkemikalien bör tas åtminstone för den högsta koncentrationen och en lägre koncentration, samt åtminstone i slutet av stabiliseringsfasen (före tillsats av testorganismerna) och i slutet av testet. Prover bör tas åtminstone av bulksedimentet och det överliggande vattnet för analys. Minst två prover bör tas per matris och behandling för varje provtagningsdag. Ett av duplikatproverna får lagras som reserv (för att analyseras t.ex. om den inledande analysen faller utanför det ± 20-procentiga intervallet för den nominella koncentrationen). När det gäller särskilda kemiska egenskaper, t.ex. om man förväntar sig en snabb nedbrytning av testkemikalien, kan den analytiska tidsplanen vidareutvecklas (t.ex. ökad provtagningsfrekvens, analys av flera koncentrationsnivåer) på grundval av en expertbedömning. Prover kan sedan tas på mellanliggande provtagningsdagar (t.ex. på dag sju efter exponeringens början).
|
|
54.
|
Prover på det överliggande vattnet bör tas genom att det noggrant hälls av eller tappas av genom en hävert för att minimera grumlingen av sedimentet. Provens volymer ska registreras.
|
|
55.
|
Efter att det överliggande vattnet har avlägsnats bör sedimentet homogeniseras och överföras till en lämplig behållare. Vikten för det våta sedimentprovet registreras.
|
|
56.
|
Om det även måste göras en analys av testkemikalien i porvattnet centrifugeras de homogeniserade och vägda sedimentproverna så att porvattnet erhålls. Cirka 200 ml vått sediment kan till exempel överföras till 250 ml centrifugeringsbägare. Därefter centrifugerar man proverna utan filtrering för att isolera porvattnet, t.ex. vid 10 000 ± 600 × g i 30–60 min vid en temperatur som inte överstiger testtemperaturen. Efter centrifugeringen hälls eller pipetteras supernatanten av. Man bör då se till att inga sedimentpartiklar tillförs, och att volymen registreras. Den återstående sedimentpelletens vikt registreras. Det kan underlätta uppskattningen av massbalansen eller utbytet av testkemikalien i vatten/sediment-systemet om sedimentets torrvikt bestäms för varje provtagningsdag. I vissa fall är det kanske inte möjligt att analysera koncentrationerna i porvattnet på grund av att provet är för litet.
|
|
57.
|
Om analysen inte görs omedelbart ska alla prover förvaras på lämpligt sätt, exempelvis under de lagringsförhållanden som rekommenderas för minsta möjliga nedbrytning av testkemikalien i fråga (miljöprover lagras t.ex. vanligtvis i mörker vid – 18 °C). Ta reda på de korrekta lagringsförhållandena för testkemikalien – t.ex. varaktighet och förvaringstemperatur, extraktionsmetoder osv. – innan studien inleds.
|
Analysmetod
|
58.
|
Eftersom hela proceduren i huvudsak styrs av den noggrannhet, precision och känslighet som analysmetoden för testkemikalien har ska man kontrollera experimentellt att precisionen och reproducerbarheten för den kemiska analysen, såväl som utbytet av testkemikalien från vatten- och sedimentproverna, är tillfredsställande för den aktuella metoden, åtminstone vid de högsta och lägsta testkoncentrationerna. Dessutom bör man kontrollera att testkemikalien inte kan påvisas i kontrollkamrarna i koncentrationer som är högre än bestämningsgränsen. Korrigera vid behov de nominella koncentrationerna för utbytet från kvalitetskontrolltopparna (t.ex. när utbytet ligger utanför 80–120 % av den spikade mängden). Hantera alla prover under hela testet på ett sådant sätt att förorening och förlust minimeras (t.ex. till följd av att testkemikalien adsorberas på provtagningsutrustningen).
|
|
59.
|
Utbytet av testkemikalien, bestämningsgränsen och detektionsgränsen i sedimentet och vattnet bör registreras och rapporteras.
|
DATA OCH RAPPORTERING
Behandling av resultaten
|
60.
|
De viktigaste av testets obligatoriska responsvariabler som ska utvärderas statistiskt är biomassan och det totala antalet maskar per replikat. Alternativt kan reproduktionen (ökningen av antalet maskar) och tillväxten (ökningen av den torra biomassan) också utvärderas. I så fall ska en uppskattning av maskarnas torrvikt i början av exponeringen göras, t.ex. genom att man fastställer torrvikten av ett representativt delprov av det parti med synkroniserade maskar som ska användas i testet.
|
|
61.
|
Även om dödlighet är inte en endpoint i detta test bör dödligheten utvärderas så långt det är möjligt. När dödligheten uppskattas ska antalet maskar som inte reagerar på lätt mekanisk retning eller visar tecken på förruttnelse samt de maskar som saknas anses vara döda. Dödligheten bör som minst registreras och beaktas vid tolkningen av testresultaten.
|
|
62.
|
Effektkoncentrationerna uttrycks i mg/kg torrvikt sediment. Om det utbyte av testkemikalien som uppmätts i sedimentet, eller i sedimentet och det överliggande vattnet i början av exponeringen, motsvarar mellan 80 och 120 % av de nominella koncentrationerna kan effektkoncentrationerna (ECx, NOEC, LOEC) uttryckas utifrån de nominella koncentrationerna. Om utbytet avviker från de nominella koncentrationerna med mer än ± 20 % av de nominella koncentrationerna bör effektkoncentrationerna (ECx, NOEC, LOEC) baseras på de ursprungligen uppmätta koncentrationerna vid början av exponeringen, t.ex. genom att man tar hänsyn till massbalansen för testkemikalien i testsystemet (se punkt 30). I dessa fall kan ytterligare information erhållas från en analys av stam- och/eller appliceringslösningarna för att bekräfta att testsedimentet bereddes på ett korrekt sätt.
|
ECx
|
63.
|
ECx-värden för de parametrar som beskrivs i punkt 60 beräknas med hjälp av lämpliga statistiska metoder (t.ex. probit-analys, logistiska funktioner eller Weibull-funktioner, den modifierade Spearman-Karbermetoden eller enkel interpolering). Riktlinjer för statistisk utvärdering finns i (15) och (50). ECx beräknas genom att ett värde som motsvarar x % av medelvärdet för kontrollen införs i den ekvation som erhållits. För att beräkna EC50 eller något annat ECx-värde bör en regressionsanalys utföras på medelvärdena för varje testkärl (

). |
NOEC/LOEC
|
64.
|
Om en statistisk analys används för att bestämma NOEC/LOEC är det nödvändigt att sammanställa statistiska uppgifter för varje enskilt kärl (enskilda kärl anses utgöra replikat). Lämpliga statistiska metoder ska användas. I allmänhet ska negativa effekter av testämnet jämfört med kontrollen undersökas genom en ensidig (mindre) hypotesprövning vid p ≤ 0,05. Exempel ges i de följande punkterna. Vägledning rörande val av lämpliga statistiska metoder ges i (15) och (50).
|
|
65.
|
Normalfördelningen av data kan kontrolleras t.ex. med Kolmogorov-Smirnovs test av anpassningsgraden, kvoten mellan variationsvidden och standardavvikelsen (R/s-testet) eller Shapiro-Wilks test (dubbelsidigt, p ≤ 0,05). Cochrans test, Levenes test eller Bartletts test (dubbelsidigt, p ≤ 0,05) kan användas för att testa varianshomogeniteten. Om förutsättningarna för parametriska testförfaranden (normalitet, varianshomogenitet) är uppfyllda, kan ensidiga variansanalyser (ANOVA) och därpå följande flerjämförelsetester utföras. Parvisa jämförelser (t.ex. Dunnetts t-test) eller step-down-grundade trendtester (t.ex. Williams test) kan användas för att beräkna om det finns betydande skillnader (p ≤ 0,05) mellan kontrollerna och de olika testämneskoncentrationerna. I annat fall bör icke-parametriska metoder (t.ex. Bonferronis U-test enligt Holm eller Jonckheere-Terpstras trendtest) användas för att bestämma NOEC och LOEC.
|
Toleranstest
|
66.
|
Om ett toleranstest (jämförelse av endast ett testkärl och en kontroll) har utförts och de nödvändiga förutsättningarna för parametriska testförfaranden (normalitet, homogenitet) är uppfyllda, kan metriska responser (maskarnas totala antal och biomassan som maskarnas torrvikt) utvärderas genom Students test (t-test). Om dessa krav inte uppfylls kan man använda t-testet med olika varians (Welchs t-test) eller ett icke-parametriskt test, såsom Mann-Whitneys U-test. En del information om den statistiska styrka som konstaterats under hypotesprövningen i ringtestet för metoden finns i tillägg 6.
|
|
67.
|
För att se om det finns betydande skillnader mellan kontrollerna (kontroll och kontroll med lösningsmedel), kan replikaten för varje kontroll testas enligt beskrivningen för toleranstestet. Om man inte upptäcker betydande skillnader med dessa tester kan alla kontroll- och lösningsmedelskontrollreplikat sammanföras. I annat fall bör alla testkärl jämföras med lösningsmedelskontrollen.
|
Tolkning av resultaten
|
68.
|
Resultaten bör tolkas med försiktighet om det föreligger avvikelser från denna testmetod, och om de uppmätta koncentrationerna av testkoncentrationer befinner sig på nivåer som ligger nära den använda analysmetodens detektionsgräns. Alla avvikelser från denna metod ska noteras.
|
Testrapport
|
69.
|
Testrapporten ska innehålla åtminstone följande information:
|
—
|
Testkemikalie:
|
—
|
kemiska identifieringsdata (trivialnamn, kemiskt namn, strukturformel, CAS-nummer osv.) samt renhet och analysmetod för kvantifiering av testkemikalien; dessutom källan till testkemikalien samt namn på och koncentration av de lösningsmedel som eventuellt använts,
|
|
—
|
all tillgänglig information om fysikalisk form och fysikalisk-kemiska egenskaper som erhållits före testets början, (t.ex. vattenlöslighet, ångtryck, fördelningskoefficient i jord (eller i sediment, om denna information finns tillgänglig), log Kow, stabilitet i vatten osv.).
|
|
|
—
|
Testade arter:
|
—
|
vetenskapligt namn, källa, eventuell förbehandling, acklimatisering, odlingsförhållanden etc.
|
|
|
—
|
Testbetingelser:
|
—
|
tillämpat testförfarande (t.ex. statiskt, semistatiskt eller genomflöde),
|
|
—
|
testupplägg, t.ex. testkamrarnas antal och storlek, vattenvolymen per kärl, sedimentets vikt och volym per kärl, (för genomflöde eller semistatiskt förfarande: vattenväxlingshastigheten), eventuell luftning före och under testet, antalet replikat, antalet maskar per replikat, antalet testkoncentrationer, konditioneringstidens längd, stabiliserings- och exponeringstiden samt provtagningsfrekvensen,
|
|
—
|
sedimentets och det överliggande vattnets djup,
|
|
—
|
förbehandlings- och spiknings-/appliceringsmetod för testkemikalien,
|
|
—
|
de nominella testkoncentrationerna, uppgifter om provtagning för kemisk analys och de analytiska metoder med vilka koncentrationerna av testkemikalien bestämdes,
|
|
—
|
sedimentets egenskaper enligt beskrivning i punkterna 24–25, och eventuella andra gjorda mätningar samt beredningen av syntetiskt sediment,
|
|
—
|
beredningen av testvattnet (om rekonstituerat vatten används) och dess egenskaper (syrehalt, pH, konduktivitet, hårdhet och alla andra utförda mätningar) innan testets början,
|
|
—
|
detaljerad information om utfodringen, inklusive typ av foder, beredning, mängd och utfodringsprogram,
|
|
—
|
ljusintensitet och fotoperiod(er),
|
|
—
|
de metoder som använts för bestämning av alla biologiska parametrar (t.ex. provtagning, inspektion, vägning av testorganismer) och abiotiska faktorer (t.ex. kvalitetsparametrar för vatten och sediment),
|
|
—
|
volymen och/eller vikten av alla prover för kemisk analys,
|
|
—
|
detaljerad information om behandlingen av alla prover för kemisk analys, inbegripet detaljer om beredning, lagring, spikningsförfaranden, extraktion och analytiska förfaranden (inklusive precision) för testkemikalien och utbyte av testkemikalien.
|
|
|
—
|
Resultat:
|
—
|
vattenkvaliteten i testkärlen (pH, temperatur, halten löst syre, hårdhet, ammoniakkoncentrationerna och alla andra utförda mätningar),
|
|
—
|
halten av organiskt kol (TOC), förhållandet mellan torrvikt och våtvikt, pH i sedimentet, och eventuella andra gjorda mätningar,
|
|
—
|
det totala antalet maskar och, om detta fastställts, antalet hela och ofullständiga maskar i varje testkammare vid testets slut,
|
|
—
|
maskarnas torrvikt i varje testkammare vid testets slut och, om detta har uppmätts, torrvikten av ett delprov av maskarna vid testets början,
|
|
—
|
allt onormalt beteende som observerats i jämförelse med kontrollerna (t.ex. undvikande av sedimentet, närvaro eller frånvaro av fekala pelletar),
|
|
—
|
all observerad dödlighet,
|
|
—
|
uppskattningar av toxiska endpoints (t.ex. ECx, NOEC och/eller LOEC), och de statistiska metoder som använts för bestämningen av dem,
|
|
—
|
de nominella testkoncentrationerna, de uppmätta testkoncentrationerna och resultaten av alla analyser som gjorts för att bestämma koncentrationen av testkemikalien i testkärlen,
|
|
—
|
eventuella avvikelser från giltighetskriterierna.
|
|
|
—
|
Utvärdering av resultaten:
|
—
|
resultatens överensstämmelse med giltighetskriterierna enligt förteckningen i punkt 13,
|
|
—
|
diskussion av resultaten, inbegripet eventuell inverkan på testresultatet som kan tillskrivas avvikelser från denna testmetod.
|
|
|
LITTERATUR
|
(1)
|
Europeiska kommissionen (2003). Technical Guidance Document in support of Commission Directive 93/67/EEC on Risk Assessment for new notified substances, Commission Regulation (EC) No 1488/94 on Risk Assessment for existing substances and Directive 98/8/EC of the European Parliament and of the Council concerning the placing of biocidal products on the market, del I–IV. Byrån för Europeiska gemenskapernas officiella publikationer, Luxemburg.
|
|
(2)
|
OECD (1992a). Report of the OECD workshop on effects assessment of chemicals in sediment. OECD Monographs nr 60. Organisationen för ekonomiskt samarbete och utveckling (OECD), Paris.
|
|
(3)
|
ASTM International (2000). Standard guide for the determination of the bioaccumulation of sediment-associated contaminants by benthic invertebrates, E 1688-00a. I ASTM International 2004 Annual Book of Standards. Vol. 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
|
|
(4)
|
ASTM International (2002). Standard Test Method for Measuring the Toxicity of Sediment-Associated Contaminants with Freshwater Invertebrates, E1706-00. I ASTM International 2004 Annual Book of Standards. Vol. 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
|
|
(5)
|
Phipps, G. L., Ankley, G. T., Benoit, D. A. och Mattson, V. R. (1994). Use of the aquatic Oligochaete Lumbriculus variegatus for assessing the toxicity and bioaccumulation of sediment-associated contaminants. Environ.Toxicol. Chem. 12, 269–279.
|
|
(6)
|
Kapitel C.27 i denna bilaga: Toxicitetstest i sediment- och vattenfas på chironomidlarver med spikat sediment.
|
|
(7)
|
U.S. EPA (2000). Methods for measuring the toxicity and bioaccumulation of sediment-associated contaminants with freshwater invertebrates. Andra upplagan. EPA 600/R-99/064, U.S. Environmental Protection Agency, Duluth, MN, March 2000.
|
|
(8)
|
Environment Canada (1997). Test for Growth and Survival in Sediment using Larvae of Freshwater Midges (Chironomus tentans or Chironomus riparius). Biological test method. Report SPE 1/RM/32. December 1997.
|
|
(9)
|
Hill, I. R., Matthiessen, P. och Heimbach, F. (red.), 1993, Guidance document on Sediment Toxicity Tests and Bioassays for freshwater and Marine Environments, From the SETAC-Europe Workshop On Sediment Toxicity Assessment, 8–10 November 1993, Renesse (NL).
|
|
(10)
|
BBA (1995). Long-term toxicity test with Chironomus riparius: Development and validation of a new test system. Redaktörer: M. Streloke och H.Köpp. Berlin 1995.
|
|
(11)
|
Riedhammer, C. och B. Schwarz-Schulz (2001). The Newly Proposed EU Risk Assessment Concept for the Sediment Compartment. J. Soils Sediments 1(2), 105–110.
|
|
(12)
|
ASTM International (2004). Standard guide for collection, storage, characterisation, and manipulation of sediment for toxicological testing and for selection of samplers used to collect benthic invertebrates. American Society for Testing and Materials, E 1391-03.
|
|
(13)
|
Egeler, Ph., Meller, M., Schallnaß, H. J. och Gilberg, D. (2005). Validation of a sediment toxicity test with the endobenthic aquatic oligochaete Lumbriculus variegatus by an international ring test. I samarbete med R. Nagel och B. Karaoglan. Rapport till den federala tyska miljöskyddsmyndigheten (Umweltbundesamt, Berlin), R&D nr: 202 67 429.
|
|
(14)
|
OECD (2000). Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. OECD Environment, Health and Safety Publications, Series on Testing and Assessment No. 23.
|
|
(15)
|
Environment Canada (2003). Guidance Document on Statistical Methods for Environmental Toxicity Tests, femte utkastet, mars 2003, Report EPS 1/RM/
|
|
(16)
|
Nikkilä A., Halme A. och Kukkonen J. V. K. (2003). Toxicokinetics, toxicity and lethal body residues of two chlorophenols in the oligochaete worm, Lumbriculus variegatus, in different sediments. Chemosphere 51: 35–46.
|
|
(17)
|
Baily, H. C. och Liu, D. H. W. (1980). Lumbriculus variegatus, a Benthic Oligochaete, as a Bioassay Organism, s. 205–215. I J. C. Eaton, P. R. Parrish och A. C. Hendricks (red.). Aquatic Toxicology, ASTM STP 707. American Society for Testing and Materials.
|
|
(18)
|
Chapman, K. K., Benton, M. J., Brinkhurst, R. O. och Scheuerman P. R. (1999). Use of the aquatic oligochaetes Lumbriculus variegatus and Tubifex tubifex for assessing the toxicity of copper and cadmium in a spiked-artificial-sediment toxicity test. Environmental Toxicology. 14(2): 271–278.
|
|
(19)
|
Meyer, J. S., Boese, C. J. och Collyard, S. A. (2002). Whole-body accumulation of copper predicts acute toxicity to an aquatic oligochaete (Lumbriculus variegatus) as pH and calcium are varied. Comp. Biochem. Physiol. Del C 133:99–109.
|
|
(20)
|
Schubauer-Berigan, M. K., Dierkes, J. R., Monson, P. D. och Ankley, G. T. (1993). pH-dependent toxicity of cadmium, copper, nickel, lead and zinc to Ceriodaphnia dubia, Pimephales promelas, Hyalella azteca and Lumbriculus variegatus. Environ. Toxciol. Chem. 12(7):1261–1266.
|
|
(21)
|
West, C. W., V. R. Mattson, E. N. Leonard, G. L. Phipps och G. T. Ankley (1993). Comparison of the relative sensitivity of three benthic invertebrates to copper-contaminated sediments from the Keweenaw Waterway. Hydrobiol. 262:57–63.
|
|
(22)
|
Ingersoll, C. G., Ankley, G. T., Benoit D. A., Brunson, E. L., Burton, G. A., Dwyer, F. J., Hoke, R. A., Landrum, P. F., Norberg-King, T. J. och Winger, P. V. (1996). Toxicity and bioaccumulation of sediment-associated contaminants using freshwater invertebrates: A review of methods and applications. Environ. Toxicol. Chem. 14, 1885–1894.
|
|
(23)
|
Kukkonen, J. och Landrum, P. F. (1994). Toxicokinetics and toxicity of sediment-associated Pyrene to Lumbriculus variegatus (Oligochaeta). Environ. Toxicol. Chem. 13, 1457–1468.
|
|
(24)
|
Leppänen, M. T. och Kukkonen, J. V. K. (1998a). Relationship between reproduction, sediment type and feeding activity of Lumbriculus variegatus (Müller): Implications for sediment toxicity testing. Environ. Toxicol. Chem. 17, 2196–2202.
|
|
(25)
|
Leppänen, M. T. och Kukkonen, J. V. K. (1998b). Factors affecting feeding rate, reproduction and growth of an oligochaete Lumbriculus variegatus (Müller). Hydrobiologia 377, 183–194.
|
|
(26)
|
Landrum, P. F., Gedeon, M. L., Burton, G. A., Greenberg, M. S. och Rowland, C. D. (2002). Biological Responses of Lumbriculus variegatus Exposed to Fluoranthene-Spiked Sediment. Arch. Environ. Contam. Toxicol. 42: 292–302.
|
|
(27)
|
Brunson, E. L., Canfield, T. J., Ingersoll, C. J. och Kemble, N. E. (1998). Assessing the bioaccumulation of contaminants from sediments of the Upper Mississippi river using field-collected oligochaetes and laboratory-exposed Lumbriculus variegatus. Arch. Environ. Contam. Toxicol. 35, 191–201.
|
|
(28)
|
Ingersoll, C. G., Brunson, E. L., Wang, N., Dwyer, F. J., Ankley, G. T., Mount, D. R., Huckins, J., Petty, J. och Landrum, P. F. (2003). Uptake and depuration of non-ionic organic contaminants from sediment by the oligochaete, Lumbriculus variegatus. Environmental Toxicology and Chemistry 22, 872–885.
|
|
(29)
|
Rodriguez, P. och Reynoldson, T. B. (1999). Laboratory methods and criteria for sediment bioassessment. I: A. Mudroch, J. M. Azcue och P. Mudroch (red.): Manual of Bioassessment of aquatic sediment quality. Lewis Publishers, Boca Raton, CRC Press LLC.
|
|
(30)
|
Liebig, M., Egeler, Ph., Oehlmann, J. och Knacker, Th. (2005). Bioaccumulation of 14C-17α-ethinylestradiol by the oligochaete Lumbriculus variegatus in artificial sediment. Chemosphere 59, 271–280.
|
|
(31)
|
Brust, K., O. Licht, V. Hultsch, D. Jungmann och R. Nagel (2001). Effects of Terbutryn on Aufwuchs and Lumbriculus variegatus in Artificial Indoor Streams. Environ. Toxicol. Chemistry, vol. 20, s. 2000–2007.
|
|
(32)
|
Oetken, M., K.-U. Ludwichowski och R. Nagel (2000). Sediment tests with Lumbriculus variegatus and Chironomus riparius and 3,4-dichloroaniline (3,4-DCA) within the scope of EG-AltstoffV. På uppdrag av den federala tyska miljöskyddsmyndigheten (Umweltbundesamt, Berlin), FKZ 360 12 001, mars 2000.
|
|
(33)
|
Leppänen, M. T. och Kukkonen, J. V. K. (1998). Relative importance of ingested sediment and porewater as bioaccumulation routes for pyrene to oligochaete (Lumbriculus variegatus, Müller). Environ. Sci. Toxicol. 32, 1503–1508.
|
|
(34)
|
Dermott, R. och Munawar, M. (1992). A simple and sensitive assay for evaluation of sediment toxicity using Lumbriculus variegatus (Müller). Hydrobiologia 235/236: 407–414.
|
|
(35)
|
Drewes, C. D. och Fourtner, C. R. (1990). Morphallaxis in an aquatic oligochaete, Lumbriculus variegatus: Reorganisation of escape reflexes in regenerating body fragments. Develop. Biol. 138: 94–103.
|
|
(36)
|
Brinkhurst, R. O. (1971). A guide for the identification of British aquatic oligochaeta. Freshw. Biol. Assoc., Sci. Publ. No. 22.
|
|
(37)
|
Kapitel C.1 i denna bilaga: Test avseende akut toxicitet för fisk.
|
|
(38)
|
OECD (1992c). Guidelines for Testing of Chemicals No. 210. Fish, Early-life Stage Toxicity Test. OECD, Paris.
|
|
(39)
|
Egeler, Ph., Römbke, J., Meller, M., Knacker, Th., Franke, C., Studinger, G. och Nagel, R. (1997). Bioaccumulation of lindane and hexachlorobenzene by tubificid sludgeworms (Oligochaeta) under standardised laboratory conditions. Chemosphere 35, s. 835–852.
|
|
(40)
|
Meller, M., P. Egeler, J. Roembke, H. Schallnass, R. Nagel och B. Streit. (1998). Short-term Toxicity of Lindane, Hexachlorobenzene and Copper Sulphate on Tubificid Sludgeworms (Oligochaeta) in Artificial Media. Ecotox. and Environ. Safety, 39, 10–20.
|
|
(41)
|
Egeler, Ph., Römbke, J., Knacker, Th., Franke, C. och Studinger, G. (1999). Workshop on ’Bioaccumulation: Sediment test using benthic oligochaetes’, 26–27 april 1999, Hochheim/Main, Tyskland. Report on the R+D-project No. 298 67 419, Umweltbundesamt, Berlin.
|
|
(42)
|
Suedel, B. C. och Rodgers, J. H. (1994). Development of formulated reference sediments for freshwater and estuarine sediment testing. Environ. Toxicol. Chem. 13, 1163–1175.
|
|
(43)
|
Naylor, C. och C. Rodrigues. (1996). Development of a test method for Chironomus riparius using a formulated sediment. Chemosphere 31: 3291–3303.
|
|
(44)
|
Kaster, J. L., Klump, J. V., Meyer, J., Krezoski, J. och Smith, M. E. (1984). Comparison of defecation rates of Limnodrilus hoffmeisteri using two different methods. Hydrobiologia 11, 181–184.
|
|
(45)
|
Martinez-Madrid, M., Rodriguez, P., Perez-Iglesias, J. I. och Navarro, E. (1999). Sediment toxicity bioassays for assessment of contaminated sites in the Nervion river (Northern Spain). 2. Tubifex tubifex (Müller) reproduction sediment bioassay. Ecotoxicology 8, 111–124.
|
|
(46)
|
Environment Canada (1995). Guidance document on measurement of toxicity test precision using control sediments spiked with a reference toxicant. Environmental Protection Series Report EPS 1/RM/30.
|
|
(47)
|
Landrum, P. F. (1989). Bioavailability and toxicokinetics of polycyclic aromatic hydrocarbons sorbed to sediments for the amphipod Pontoporeia hoyi. Environ. Sci. Technol. 23, 588–595.
|
|
(48)
|
Brooke, L. T., Ankley, G. T., Call, D. J. och Cook, P. M. (1996). Gut content and clearance for three species of freshwater invertebrates. Environ. Toxicol. Chem. 15, 223–228.
|
|
(49)
|
Mount, D. R., Dawson, T. D. och Burkhard, L. P. (1999). Implications of gut purging for tissue residues determined in bioaccumulation testing of sediment with Lumbriculus variegatus. Environ. Toxicol. Chem. 18, 1244–1249.
|
|
(50)
|
OECD (2006). Current approaches in the statistical analysis of ecotoxicity data: A guidance to application. OECD Series on Testing and Assessment nr 54, OECD, Paris, Frankrike.
|
|
(51)
|
Liebig, M., Meller, M. och Egeler, P. (2004). Sedimenttoxizitätstests mit aquatischen Oligochaeten – Einfluss verschiedener Futterquellen im künstlichen Sediment auf Reproduktion und Biomasse von Lumbriculus variegatus. Proceedings 5/2004: Statusseminar Sedimentkontakttests. 24–25 mars 2004. BfG (Bundesanstalt für Gewässerkunde), Koblenz, Tyskland, s. 107–119.
|
Ytterligare litteratur om statistiska metoder:
Dunnett, C. W. (1955). A multiple comparison procedure for comparing several treatments with a control. Amer. Statist. Ass. J. 50, 1096–1121.
Dunnett, C. W. (1964). New tables for multiple comparisons with a control. Biometrics, 20, 482–491.
Finney D. J. (1971). Probit Analysis (tredje upplagan), s. 19–76. Cambridge Univ. Press.
Finney D. J. (1978). Statistical Method in Biological Assay. Charles Griffin & Company Ltd, London.
Hamilton, M. A., R. C. Russo och R. V. Thurston. (1977). Trimmed Spearman-Karber Method for estimating median lethal concentrations in toxicity bioassays. Environ. Sci. Technol. 11(7), 714–719; Rättelse: Environ. Sci. Technol. 12 (1998), 417.
Holm, S. (1979). A simple sequentially rejective multiple test procedure. Scand. J. Statist. 6, 65–70.
Sokal, R. R. och F. J. Rohlf. (1981) Biometry. The principles and practice of statistics in biological research. Andra upplagan. W. H. Freeman and Company. New York.
Miller, R. G., Jr. (1986). Beyond ANOVA, basics of applied statistics. John Wiley & Sons. New York.
Shapiro, S. S. och Wilk, M. B. (1965). An analysis of variance test for normality (complete samples). Biometrika 52: 591–611.
Williams, D. A. (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics, 27, 103–117.
Williams, D. A. (1972). The comparison of several dose levels with a zero dose control. Biometrics, 28, 519–531.
Tillägg 1
Definitioner
I denna testmetod gäller följande definitioner:
Kemikalie
: ett ämne eller en blandning.
Konditioneringsperioden
: används för att stabilisera den mikrobiella komponenten i sedimentet och avlägsna t.ex. ammoniak från sedimentets beståndsdelar. Den äger rum före spikningen av sedimentet med testkemikalien. Vanligtvis kastas det överliggande vattnet bort efter konditioneringen.
ECx
: den koncentration av testkemikalien i sedimentet som leder till x % (t.ex. 50 %) effekt på en biologisk parameter efter en given exponeringstid.
Stabiliseringsperiod
: används för att låta testkemikalien fördela sig mellan den fasta fasen, porvattnet och det överliggande vattnet. Den äger rum efter spikningen av sedimentet med testkemikalien och före tillsatsen av testorganismerna.
Exponeringsfasen
: den tid under vilken testorganismerna exponeras för testkemikalien.
Syntetiskt sediment eller rekonstituerat eller konstgjort sediment: en blandning av material som är avsedda att efterlikna de fysiska beståndsdelarna i naturligt sediment.
Lägsta koncentration med observerad effekt (LOEC – ’Lowest Observed Effect Concentration’): den lägsta testade koncentration vid vilken man kan fastställa att testkemikalien har en signifikant toxisk effekt (vid p < 0,05) jämfört med kontrollen. Alla testkoncentrationer ovanför LOEC måste dock ha en effekt som är minst lika stor som den som observeras vid LOEC. Om båda dessa villkor inte är uppfyllda måste en fullständig redogörelse lämnas för hur LOEC (och därmed NOEC) har valts.
Högsta koncentrationen utan observerad effekt (NOEC): den testkoncentration omedelbart under LOEC som jämfört med kontrollgruppen inte framkallar några statistiskt signifikanta verkningar (p < 0,05) efter en given exponeringstid.
Fördelningskoefficienten n-oktanol/vatten (Kow, uttrycks ibland även som Pow): förhållandet mellan en kemikalies löslighet i n-oktanol och vatten vid jämvikt. Detta är ett mått på hur lipofil kemikalien är (kapitel A.24 i denna bilaga). Kow eller logaritmen av Kow (log Kow) används som indikator för en kemikalies potential för bioackumulering i vattenlevande organismer.
Fördelningskoefficienten organiskt kol/vatten (Koc): förhållandet mellan en kemikalies koncentration i eller på sedimentets fraktion av organiskt kol och kemikaliens koncentration i vatten vid jämvikt.
Överliggande vatten
: det vatten som täcker sedimentet i testkärlet.
Porvatten
: det vatten som finns i mellanrummen mellan sediment- eller jordpartiklar.
Spikat sediment
: sediment till vilket en testkemikalie har tillsatts.
Testkemikalie
: alla ämnen eller blandningar som testas med denna testmetod.
Tillägg 2
Det rekommenderade rekonstituerade vattnets sammansättning
(hämtat från kapitel C.1 i denna bilaga (1))
|
(a)
|
Kalciumkloridlösning
Lös upp 11,76 g CaCl2 · 2 H2O i avjonat vatten och späd till 1 liter med avjonat vatten.
|
|
(b)
|
Magnesiumsulfatlösning
Lös upp 4,93 g MgSO4 · 7 H2O i avjonat vatten och späd till 1 liter med avjonat vatten.
|
|
(c)
|
Natriumbikarbonatlösning
Lös upp 2,59 g NaHCO3 i avjonat vatten och späd till 1 liter med avjonat vatten.
|
|
(d)
|
Kaliumkloridlösning
Lös upp 0,23 g KCl i avjonat vatten och späd till 1 liter med avjonat vatten.
|
Alla kemikalier ska vara av analyskvalitet.
Konduktiviteten i det destillerade eller avjonade vattnet bör inte överstiga 10 μScm– 1.
25 ml av var och en av lösningarna (a) till (d) blandas och den totala volymen späds till 1 liter med avjonat vatten. Summan av kalcium- och magnesiumjonerna i dessa lösningar är 2,5 mmol/l.
Förhållandet mellan Ca- och Mg-joner är 4:1 och mellan Na- och K-joner 10:1. Syrakapaciteten KS4.3 i denna lösning är 0,8 mmol/l.
Lufta utspädningsvattnet tills syremättnad uppnås, och lagra det sedan i ungefär två dagar utan ytterligare luftning före användning.
HÄNVISNING
|
(1)
|
Kapitel C.1 i denna bilaga: Test avseende akut toxicitet för fisk.
|
Tillägg 3
De fysikalisk-kemiska egenskaperna hos godtagbart utspädningsvatten
|
Komponent
|
Koncentrationer
|
|
Partiklar
|
< 20 mg/l
|
|
Halt av organiskt kol
|
< 2 μg/l
|
|
Ojoniserad ammoniak
|
< 1 μg/l
|
|
Resterande mängd klor
|
< 10 μg/l
|
|
Total mängd bekämpningsmedel som innehåller organiska fosforföreningar
|
< 50 ng/l
|
|
Total mängd bekämpningsmedel som innehåller organiska klorföreningar plus polyklorerade bifenyler
|
< 50 ng/l
|
|
Total mängd organiskt klor
|
< 25 ng/l
|
|
(hämtade från OECD (1992) (1))
|
HÄNVISNING
|
(1)
|
OECD (1992). Guidelines for Testing of Chemicals No. 210. Fish, Early-life Stage Toxicity Test. OECD, Paris.
|
Tillägg 4
Rekommenderat syntetiskt sediment – vägledning om beredning och lagring
Sedimentets beståndsdelar
|
Beståndsdel
|
Egenskaper
|
% av sedimentets torrvikt
|
|
Torv
|
Vitmosstorv (Sphagnum), nedbrytningsgrad: ’medium’, lufttorkad, inga synliga plantrester, finmald (partikelstorlek ≤ 0,5 mm)
|
5 ± 0,5
|
|
Kvartssand
|
Kornstorlek: ≤ 2 mm, men > 50 % av partiklarna bör vara av storleken 50–200 μm
|
75–76
|
|
Kaolinlera
|
Kaolinithalt ≥ 30 %
|
20 ± 1
|
|
Foderkälla
|
t.ex. nässelpulver (Folia urticae) från blad av Urtica ciodica (brännässla), finmalet (partikelstorlek ≤ 0,5 mm), av apotekskvalitet för livsmedelsbruk, som tillsats till torrt sediment
|
0,4–0,5
|
|
Organiskt kol
|
Justeras genom tillsats av torv och sand
|
2 ± 0,5
|
|
Kalciumkarbonat
|
CaCO3, pulvriserat, kemiskt rent, som tillsats till torrt sediment
|
0,05–1
|
|
Avjonat vatten
|
Konduktivitet ≤ 10 μS/cm, som tillsats till torrt sediment
|
30–50
|
Anmärkning: Om man förväntar sig förhöjda ammoniakkoncentrationer, t.ex. om testkemikalien är känd för att hämma nitrifikationen, kan det vara lämpligt att ersätta 50 % av det kväverika nässelpulvret med cellulosa (t.ex. alfacellulosapulver, kemiskt rent, partikelstorlek ≤ 0,5 mm, (1) (2)).
Beredning
Torven lufttorkas och mals ner till ett fint pulver. En suspension med den erforderliga mängden torvpulver i avjonat vatten bereds med hjälp av en högpresterande homogeniseringsapparat. Suspensionens pH justeras till 5,5 ± 0,5 med CaCO3. Suspensionen konditioneras i minst två dagar under skonsam omrörning vid 20 ± 2 °C för att stabilisera pH-värdet och etablera en stabil mikrobiell komponent, varefter pH uppmäts på nytt och bör då vara 6,0 ± 0,5. Torvsuspensionen blandas sedan med de övriga beståndsdelarna (sand och kaolinlera) och avjonat vatten till ett homogent sediment med en vattenhalt som ger kring 30–50 % av sedimentets torrvikt. Den slutliga blandningens pH mäts på nytt och justeras vid behov till 6,5–7,5 med CaCO3. Om man förväntar sig utveckling av ammoniak kan det vara lämpligt att hålla pH-värdet i sedimentet under 7,0 (t.ex. mellan 6,0 och 6,5). Prover tas av sedimentet för att bestämma torrvikten och halten av organiskt kol. Om man förväntar sig utveckling av ammoniak kan det syntetiska sedimentet konditioneras i sju dagar under samma betingelser som råder i det efterföljande testet (t.ex. ett förhållande mellan sediment och vatten på 1:4, med samma höjd på sedimentskiktet som i testkärlen) innan det spikas med testkemikalien, dvs. man bör fylla på med vatten, som bör vara luftat. I slutet av konditioneringsperioden avlägsnas det överliggande vattnet och kasseras. Därefter blandas den spikade kvartssanden med sedimentet för varje behandlingsnivå, och sedimentet fördelas sedan i replikattestkärlen, som fylls på med testvatten. Kärlen inkuberas därefter under samma betingelser som råder i det efterföljande testet. Det är nu stabiliseringsperioden inleds. Det överliggande vattnet bör luftas.
Den valda foderkällan bör tillsättas före eller under spikningen av sedimentet med testkemikalien. Inledningsvis kan den blandas med torvsuspensionen (se ovan). Man kan dock undvika onödig försämring av foderkällan före tillsatsen av testorganismerna – t.ex. vid långa stabiliseringsperioder – genom att man påbörjar exponeringen så snart som möjligt efter fodertillsatsen. För att se till att fodret spikas med testkemikalien bör foderkällan blandas med sedimentet senast samma dag som sedimentet spikas med testkemikalien.
Förvaring
Det syntetiska sedimentets torra beståndsdelar kan lagras i ett torrt och svalt utrymme eller vid rumstemperatur. Det beredda sedimentet som spikats med testkemikalien ska omedelbart användas i testet. Prover av spikat sediment kan förvaras under de förhållanden som rekommenderas för testkemikalien i fråga fram till analysen.
HÄNVISNINGAR
|
(1)
|
Egeler, Ph., Meller, M., Schallnaß, H. J. och Gilberg, D. (2005). Validation of a sediment toxicity test with the endobenthic aquatic oligochaete Lumbriculus variegatus by an international ring test. I samarbete med R. Nagel och B. Karaoglan. Rapport till den federala tyska miljöskyddsmyndigheten (Umweltbundesamt, Berlin), R&D nr: 202 67 429.
|
|
(2)
|
Liebig, M., Meller, M. och Egeler, P. (2004). Sedimenttoxizitätstests mit aquatischen Oligochaeten – Einfluss verschiedener Futterquellen im künstlichen Sediment auf Reproduktion und Biomasse von Lumbriculus variegatus. Proceedings 5/2004: Statusseminar Sedimentkontakttests. 24–25 mars 2004. BfG (Bundesanstalt für Gewässerkunde), Koblenz, Tyskland, s. 107–119.
|
Tillägg 5
Odlingsmetoder för Lumbriculus variegatus
Lumbriculus variegatus (Müller) (Lumbriculidae, Oligochaeta) lever i sötvattenssediment och används ofta i ekotoxikologisk testning. Den kan lätt odlas under laboratorieförhållanden. En sammanfattning av odlingsmetoderna ges nedan.
Odlingsmetoder
Odlingsbetingelser för Lumbriculus variegatus beskrivs i detalj i Phipps m.fl. (1993) (1), Brunson m.fl. (1998) (2), ASTM (2000) (3), den amerikanska miljöskyddsmyndigheten (EPA) (2000) (4). En kort sammanfattning av dessa betingelser ges nedan. En stor fördel med L. variegatus är dess snabba reproduktionstakt, vilket leder till en snabbt ökande biomassa i laboratorieodlade populationer (t.ex. (1), (3), (4), (5)).
Maskarna kan odlas i stora akvarier (57–80 liter) vid 23 °C med en fotoperiod på 16 L:8 M (100–1 000 lux). Man använder då naturligt vatten som förnyas dagligen (45–50 liter per akvarium). Substratet bereds genom att oblekta bruna pappersservetter klipps till remsor som sedan blandas med odlingsvatten i några sekunder, vilket leder till att man får små bitar av papperssubstrat. Detta substrat kan sedan omedelbart användas i odlingsakvarierna för Lumbriculus genom att botten av behållaren täcks, eller lagras frysta i avjonat vatten för senare användning. Det nya substratet i akvariet räcker i allmänhet i cirka två månader.
Varje maskodling inleds med 500–1 000 maskar som utfodras tre gånger per vecka under förnyelse- eller genomflödesförhållanden med en 10 ml lösning innehållande 6 g yngelfoder för foreller. Statiska eller semistatiska odlingar bör utfodras mindre ofta för att förebygga tillväxt av bakterier och svampar.
Under dessa förhållanden kommer antalet individer i odlingen i allmänhet att fördubblas på cirka 10–14 dagar.
Alternativt kan Lumbriculus variegatus också odlas i ett system med ett skikt av kvartssand som används som syntetiskt sediment (1–2 cm djupt) och rekonstituerat vatten. Behållare av glas eller rostfritt stål med en höjd på 12–20 cm kan användas som odlingskärl. Vattnet ska luftas försiktigt (t.ex. två bubblor per sekund) med en pasteurpipett placerad ca 2 cm ovanför sedimentets yta. För att undvika ackumulering t.ex. av ammoniak bör det överliggande vattnet bytas med hjälp av ett genomflödessystem, eller manuellt minst en gång i veckan. Oligochaeterna kan hållas vid rumstemperatur med en fotoperiod på 16 h ljus (ljusintensitet 100–1 000 lux) och 8 h mörker. I den semistatiska odlingen (förnyelse av vattnet en gång per vecka) utfodras maskarna med TetraMin två gånger per vecka (t.ex. 0,6–0,8 mg per cm2 sedimentyta), vilket kan appliceras som en suspension med 50 mg TetraMin per ml avjonat vatten.
Lumbriculus variegatus kan avlägsnas från odlingarna t.ex. genom överföring av substrat med hjälp av ett finmaskat nät, eller med hjälp av en flampolerad glaspipett med bred spets (ca 5 mm i diameter), till en separat bägare. Om man också överför substrat till denna bägare låter man bägaren som innehåller maskar och substrat stå över natten under genomflödesförhållanden, vilket gör att substratet avlägsnas från bägaren medan maskarna blir kvar på kärlets botten. Maskarna kan sedan överföras till nyligen beredda odlingsakvarier eller bearbetas ytterligare för testet enligt beskrivning i (3) och (4), eller nedan.
Något som bör beaktas kritiskt vid användning av L. variegatus i sediment är dess reproduktionssätt (fragmentering (architomy) eller regenerering (morphallaxis), t.ex. (6)). Resultatet av denna asexuella förökning är två delar som inte intar någon föda förrän den främre eller bakre delen regenererats (t.ex. (7), (8)). Detta innebär att L. variegatus inte exponeras kontinuerligt via intag av förorenat sediment.
Därför bör en synkronisering utföras för att minimera okontrollerad reproduktion och regenerering, som båda leder till stora variationer i testresultaten. Denna variation kan inträffa om vissa individer, som har genomgått delning och därmed inte intar någon föda under en viss tid, i mindre grad exponeras för testkemikalien än andra individer som inte genomgår delning under testet (9), (10), (11). Maskarna bör delas på konstgjord väg 10 till 14 dagar före början av exponeringen (synkronisering). Stora (adulta) maskar, som helst inte visar några tecken på nyligen genomgången regenerering (morphallaxis) bör väljas ut för synkronisering. Dessa maskar kan placeras på ett objektglas med en droppe odlingsvatten och skäras av på den mittersta kroppsregionen med en skalpell. Man bör se till att de bakre ändarna är av liknande storlek. Man bör sedan låta de bakre ändarna återbilda nya huvuden i ett kulturkärl som innehåller samma substrat som används i kulturen och rekonstituerat vatten tills exponeringen inleds. Tecknet på att regenereringen av nya främre delar pågår är att de synkroniserade maskarna gräver sig igenom i substratet (närvaron av återbildade huvuddelar kan bekräftas genom att ett representativt delprov granskas i ett binokulärt mikroskop). Testorganismerna kan därefter förväntas befinna sig i ett liknande fysiologiskt tillstånd. Detta innebär att när de synkroniserade maskarna reproducerar sig genom regenerering (morphallaxis) under testets gång exponeras praktiskt taget alla djur i lika hög grad för det spikade sedimentet. De synkroniserade maskarna bör utfodras så snart de börjar gräva sig genom substratet, eller sju dagar efter delningen. Utfodringen bör vara jämförbar med den i de vanliga odlingarna, men det är tillrådligt att ge de synkroniserade maskarna samma foder som ska användas i testet. Maskarna bör hållas i samma temperatur som i testet, dvs. 20 ± 2 °C. Efter regenerering under 10–14 dagar bör intakta hela maskar som aktivt simmar eller kryper efter lätt mekanisk retning användas för testet. Skador eller autotomi bör undvikas, t.ex. genom att man använder pipetter med flampolerade kanter eller tandläkarsonder av rostfritt stål vid hanteringen av maskarna.
Källor för startkulturer för Lumbriculus variegatus (adresserna i USA har tagits från (4))
|
Europa
|
|
ECT Oekotoxikologie GmbH
|
|
Böttgerstr. 2–14
|
|
D- 65439 Flörsheim/Main
|
|
TYSKLAND
|
|
|
Bayer Crop Science AG
|
|
Development – Ecotoxicology
|
|
Alfred-Nobel-Str. 50
|
|
D-40789 Monheim
|
|
TYSKLAND
|
|
|
|
|
|
University of Joensuu
|
|
Laboratory of Aquatic Toxicology
|
|
Dept. of Biology
|
|
Yliopistokatu 7, P.O. Box 111
|
|
FI-80101 Joensuu
|
|
FINLAND
|
|
|
Technische Universität Dresden
|
|
Institut für Hydrobiologie
|
|
Fakultät für Forst-, Geo- und Hydrowissenschaften
|
|
Mommsenstr. 13
|
|
D-01062 Dresden
|
|
TYSKLAND
|
|
|
|
|
|
C.N.R.- I.R.S.A.
|
|
Italian National Research Council
|
|
Water Research Institute
|
|
Via Mornera 25
|
|
I- 20047 Brugherio MI
|
|
|
|
|
|
|
Förenta staterna
|
|
U.S. Environmental Protection Agency
|
|
Mid-Continent Ecological Division
|
|
6201 Congdon Boulevard
|
|
Duluth, MN 55804
|
|
|
Michigan State University
|
|
Department of Fisheries and Wildlife
|
|
No. 13 Natural Resources Building
|
|
East Lansing, MI 48824-1222
|
|
|
|
|
|
U.S. Environmental Protection Agency
|
|
Environmental Monitoring System Laboratory
|
|
26 W. Martin Luther Dr.
|
|
Cincinnati, OH 45244
|
|
|
Wright State University
|
|
Institute for Environmental Quality
|
|
Dayton, OH 45435
|
|
|
|
|
|
Columbia Environmental Research Center
|
|
U.S. Geological Survey
|
|
4200 New Haven Road
|
|
Columbia, MO 65201
|
|
|
Great Lakes Environmental Research
|
|
Laboratorium, NOAA
|
|
2205 Commonwealth Boulevard
|
|
Ann Arbor, MI 48105-1593
|
|
HÄNVISNINGAR
|
(1)
|
Phipps, G. L., Ankley, G. T., Benoit, D. A. och Mattson, V. R. (1994). Use of the aquatic Oligochaete Lumbriculus variegatus for assessing the toxicity and bioaccumulation of sediment-associated contaminants. Environ.Toxicol. Chem. 12, 269–279.
|
|
(2)
|
Brunson, E. L., Canfield, T. J., Ingersoll, C. J. och Kemble, N. E. (1998). Assessing the bioaccumulation of contaminants from sediments of the Upper Mississippi river using field-collected oligochaetes and laboratory-exposed Lumbriculus variegatus. Arch. Environ. Contam. Toxicol. 35, 191–201.
|
|
(3)
|
ASTM International (2000). Standard guide for the determination of the bioaccumulation of sediment-associated contaminants by benthic invertebrates, E 1688-00a. I ASTM International 2004 Annual Book of Standards. Vol. 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
|
|
(4)
|
U.S. EPA (2000). Methods for measuring the toxicity and bioaccumulation of sediment-associated contaminants with freshwater invertebrates. Andra upplagan. EPA 600/R-99/064, amerikanska miljöskyddsmyndigheten (EPA), Duluth, MN, mars 2000.
|
|
(5)
|
Kukkonen, J. och Landrum, P. F. (1994). Toxicokinetics and toxicity of sediment-associated Pyrene to Lumbriculus variegatus (Oligochaeta). Environ. Toxicol. Chem. 13, 1457–1468.
|
|
(6)
|
Drewes, C. D. och Fourtner, C. R. (1990). Morphallaxis in an aquatic oligochaete, Lumbriculus variegatus: Reorganisation of escape reflexes in regenerating body fragments. Develop. Biol. 138: 94–103.
|
|
(7)
|
Leppänen, M. T. och Kukkonen, J. V. K. (1998a). Relationship between reproduction, sediment type and feeding activity of Lumbriculus variegatus (Müller): Implications for sediment toxicity testing. Environ. Toxicol. Chem. 17, 2196–2202.
|
|
(8)
|
Leppänen, M. T. och Kukkonen, J. V. K. (1998b). Factors affecting feeding rate, reproduction and growth of an oligochaete Lumbriculus variegatus (Müller). Hydrobiologia 377, 183–194.
|
|
(9)
|
Brust, K., O. Licht, V. Hultsch, D. Jungmann och R. Nagel (2001). Effects of Terbutryn on Aufwuchs and Lumbriculus variegatus in Artificial Indoor Streams. Environ. Toxicol. Chemistry, vol. 20, s. 2000–2007.
|
|
(10)
|
Oetken, M., K.-U. Ludwichowski och R. Nagel (2000). Sediment tests with Lumbriculus variegatus and Chironomus riparius and 3,4-dichloroaniline (3,4-DCA) within the scope of EG-AltstoffV. På uppdrag av den federala tyska miljöskyddsmyndigheten (Umweltbundesamt, Berlin), FKZ 360 12 001, mars 2000.
|
|
(11)
|
Leppänen, M. T. och Kukkonen, J. V. K. (1998). Relative importance of ingested sediment and porewater as bioaccumulation routes for pyrene to oligochaete (Lumbriculus variegatus, Müller). Environ. Sci. Toxicol. 32, 1503–1508.
|
Tillägg 6
Sammanfattning av ringtestresultaten
Sedimenttoxicitetstest med Lumbriculus variegatus
Tabell 1
Resultat av enskilda ringtestomgångar: Genomsnittligt antal maskar i kontrollerna och i kontrollerna med lösningsmedel vid testets slut; SD = standardavvikelse; CV = variationskoefficient.
|
|
antal maskar i kontrollerna (genomsnitt)
|
SD
|
CV (%)
|
n
|
antal maskar i kontrollerna med lösn. medel (genomsnitt)
|
SD
|
CV (%)
|
n
|
|
|
32,3
|
7,37
|
22,80
|
3
|
39,0
|
3,61
|
9,25
|
3
|
|
|
40,8
|
6,55
|
16,05
|
6
|
36,0
|
5,29
|
14,70
|
3
|
|
|
41,5
|
3,54
|
8,52
|
2
|
38,5
|
7,05
|
18,31
|
4
|
|
|
16,3
|
5,99
|
36,67
|
6
|
30,8
|
6,70
|
21,80
|
4
|
|
|
24,3
|
10,69
|
43,94
|
3
|
26,3
|
3,06
|
11,60
|
3
|
|
|
28,5
|
8,29
|
29,08
|
4
|
30,7
|
1,15
|
3,77
|
3
|
|
|
28,3
|
3,72
|
13,14
|
6
|
28,8
|
2,56
|
8,89
|
6
|
|
|
25,3
|
5,51
|
21,74
|
3
|
27,7
|
1,53
|
5,52
|
3
|
|
|
23,8
|
2,99
|
12,57
|
4
|
21,3
|
1,71
|
8,04
|
4
|
|
|
36,8
|
8,80
|
23,88
|
6
|
35,0
|
4,20
|
11,99
|
6
|
|
|
33,0
|
3,58
|
10,84
|
6
|
33,5
|
1,73
|
5,17
|
4
|
|
|
20,7
|
2,73
|
13,22
|
6
|
15,0
|
6,68
|
44,56
|
4
|
|
|
42,0
|
7,07
|
16,84
|
6
|
43,7
|
0,58
|
1,32
|
3
|
|
|
18,2
|
3,60
|
19,82
|
6
|
21,7
|
4,04
|
18,65
|
3
|
|
|
32,0
|
3,95
|
12,34
|
6
|
31,3
|
4,79
|
15,32
|
4
|
|
interlaborativt medelvärde
|
29,59
|
|
20,10
|
|
30,61
|
|
13,26
|
|
|
SD
|
8,32
|
|
10,03
|
|
7,57
|
|
10,48
|
|
|
n
|
15
|
|
|
|
15
|
|
|
|
|
min
|
16,3
|
|
|
|
15,0
|
|
|
|
|
max
|
42,0
|
|
|
|
43,7
|
|
|
|
|
CV (%)
|
28,1
|
|
|
|
24,7
|
|
|
|
Tabell 2
Resultat av enskilda ringtestomgångar: Maskarnas genomsnittliga totala torrvikt per replikat i kontroller och kontroller med lösningsmedel i slutet av testet; SD = standardavvikelse; CV = variationskoefficient.
|
|
maskarnas torrvikt totalt per replikat (kontroller)
|
SD
|
CV (%)
|
n
|
maskarnas torrvikt totalt per replikat (kontroller med lösningsmedel)
|
SD
|
CV (%)
|
n
|
|
|
24,72
|
6,31
|
25,51
|
3
|
27,35
|
4,08
|
14,93
|
3
|
|
|
30,17
|
2,04
|
6,75
|
6
|
33,83
|
10,40
|
30,73
|
3
|
|
|
23,65
|
3,61
|
15,25
|
2
|
28,78
|
4,68
|
16,28
|
4
|
|
|
12,92
|
6,83
|
52,91
|
6
|
24,90
|
6,84
|
27,47
|
4
|
|
|
21,31
|
4,17
|
19,57
|
3
|
25,87
|
5,30
|
20,49
|
3
|
|
|
22,99
|
4,86
|
21,16
|
4
|
24,64
|
5,09
|
20,67
|
3
|
|
|
18,91
|
1,91
|
10,09
|
6
|
19,89
|
1,77
|
8,89
|
6
|
|
|
24,13
|
1,63
|
6,75
|
3
|
25,83
|
2,17
|
8,41
|
3
|
|
|
22,15
|
3,18
|
14,34
|
4
|
22,80
|
2,60
|
11,40
|
4
|
|
|
35,20
|
8,12
|
23,07
|
6
|
31,42
|
8,45
|
26,90
|
6
|
|
|
41,28
|
5,79
|
14,02
|
6
|
41,42
|
4,37
|
10,55
|
4
|
|
|
15,17
|
5,78
|
38,09
|
6
|
10,50
|
3,42
|
32,53
|
4
|
|
|
35,69
|
8,55
|
23,94
|
6
|
38,22
|
1,23
|
3,21
|
3
|
|
|
19,57
|
5,21
|
26,65
|
6
|
28,58
|
6,23
|
21,81
|
3
|
|
|
29,40
|
2,16
|
7,34
|
6
|
31,15
|
2,70
|
8,67
|
4
|
|
interlaborativt medelvärde
|
25,15
|
|
20,36
|
|
27,68
|
|
17,53
|
|
|
SD
|
7,87
|
|
12,56
|
|
7,41
|
|
9,10
|
|
|
n
|
15
|
|
|
|
15
|
|
|
|
|
min
|
12,9
|
|
|
|
10,5
|
|
|
|
|
max
|
41,3
|
|
|
|
41,4
|
|
|
|
|
CV (%)
|
31,3
|
|
|
|
26,8
|
|
|
|
Tabell 3
Toxicitet, PCP: Sammanfattning av endpoints i ringtestet; interlaborativa medelvärden för EC50, NOEC och LOEC; SD = standardavvikelse; CV = variationskoefficient.
|
biologisk parameter
|
|
inter-laborativt medelvärde (mg/kg)
|
min
|
max
|
inter-laborativ faktor
|
SD
|
CV (%)
|
geo-metriskt medel-värde (mg/kg)
|
|
totalt antal maskar
|
EC50
|
23,0
|
4,0
|
37,9
|
9,4
|
10,7
|
46,3
|
19,9
|
|
NOEC
|
9,9
|
2,1
|
22,7
|
10,7
|
7,2
|
72,3
|
7,6
|
|
LOEC
|
27,9
|
4,7
|
66,7
|
14,2
|
19,4
|
69,4
|
20,9
|
|
MDD (%)
|
22,5
|
7,1
|
39,1
|
|
|
|
|
|
maskarnas torrvikt totalt
|
EC50
|
20,4
|
7,3
|
39,9
|
5,5
|
9,1
|
44,5
|
18,2
|
|
NOEC
|
9,3
|
2,1
|
20,0
|
9,4
|
6,6
|
70,4
|
7,4
|
|
LOEC
|
25,7
|
2,1
|
50,0
|
23,5
|
16,8
|
65,5
|
19,4
|
|
MDD (%)
|
24,8
|
10,9
|
44,7
|
|
|
|
|
|
dödlighet/överlevnad
|
LC50
|
25,3
|
6,5
|
37,2
|
5,7
|
9,4
|
37,4
|
23,1
|
|
NOEC
|
16,5
|
2,1
|
40,0
|
18,8
|
10,3
|
62,4
|
12,8
|
|
LOEC
|
39,1
|
4,7
|
66,7
|
14,2
|
18,1
|
46,2
|
32,6
|
|
reproduktion (ökning av antalet maskar per replikat)
|
EC50
|
20,0
|
6,7
|
28,9
|
4,3
|
7,6
|
37,9
|
18,3
|
|
NOEC
|
7,9
|
2,1
|
20,0
|
9,4
|
5,2
|
66,0
|
6,4
|
|
LOEC
|
22,5
|
2,1
|
50,0
|
23,5
|
15,4
|
68,6
|
16,0
|
|
MDD (%)
|
29,7
|
13,9
|
47,9
|
|
|
|
|
|
tillväxt (ökning av biomassan per replikat)
|
EC50
|
15,3
|
5,7
|
29,9
|
5,2
|
7,1
|
46,5
|
13,7
|
|
NOEC
|
8,7
|
2,1
|
20,0
|
9,4
|
6,0
|
68,1
|
6,9
|
|
LOEC
|
24,0
|
2,1
|
50,0
|
23,5
|
15,7
|
65,5
|
17,3
|
|
MDD (%)
|
32,2
|
13,6
|
65,2
|
|
|
|
|
|
MDD: minsta observerbara skillnad jämfört med kontrollvärdena under hypotesprövningen, använt som ett mått på statistisk styrka
|
HÄNVISNING
Egeler, Ph., Meller, M., Schallnaß, H. J. och Gilberg, D. (2005). Validation of a sediment toxicity test with the endobenthic aquatic oligochaete Lumbriculus variegatus by an international ring test. I samarbete med R. Nagel och B. Karaoglan. Rapport till den federala tyska miljöskyddsmyndigheten (Umweltbundesamt, Berlin), R&D nr: 202 67 429.
C.36 REPRODUKTIONSTEST FÖR ROVKVALSTER (HYPOASPIS (GEOLAELAPS) ACULEIFER) I JORD
INLEDNING
|
1.
|
Denna testmetod motsvarar OECD:s testriktlinje (TG) 226 (2008). Metoden är avsedd att användas för bestämning av effekterna av kemikalier i jord på reproduktionskapaciteten hos den jordlevande kvalsterarten Hypoaspis (Geolaelaps) aculeifer Canestrini (Acari: Laelapidae), och gör det möjligt att fastställa hämningen av den specifika tillväxthastigheten hos en population (1) (2). Reproduktionskapaciteten innebär här antalet juveniler i slutet av testperioden. H. aculeifer representerar ytterligare en trofisk nivå jämfört med de arter för vilka testmetoder redan finns tillgängliga. Ett reproduktionstest utan särskiljning och kvantifiering av reproduktionscykelns olika stadier anses tillräckligt för denna testmetod. För kemiska ämnen med en annan exponeringsväg än via jord kan andra metoder vara lämpligare (3).
|
|
2.
|
Hypoaspis (Geolaelaps) aculeifer anses vara en lämplig representant för markfaunan i allmänhet och rovkvalster i synnerhet. Arten finns över hela världen (5) och kan lätt samlas in och odlas i laboratoriet. En sammanfattning av biologin hos H. aculeifer finns i tillägg 7. Bakgrundsinformation om kvalsterartens ekologi och dess användning i ekotoxikologisk testning finns i (4), (5), (6), (7), (8), (9), (10), (11), (12).
|
PRINCIP FÖR TESTMETODEN
|
3.
|
Adulta honor exponeras för en serie koncentrationer av testkemikalien som blandas ner i jorden. Testet inleds med tio adulta honor per replikatkärl. Hanar införs inte i testet, eftersom erfarenheten har visat att honor parar sig omedelbart eller kort efter att de kläckts från deutonymfstadiet om det är hanar närvarande. Dessutom skulle hanarnas närvaro förlänga testet på ett sätt som gör att ett arbetskrävande särskiljande av olika åldersstadier blir nödvändigt. Parning ingår således inte i testet. Honorna införs i provet 28–35 dagar efter äggläggningsperiodens början under synkroniseringsstadiet (se tillägg 4), eftersom man då kan betrakta det som att honorna redan har parat sig och genomgått förstadiet till äggläggningen. Vid en temperatur på 20 °C slutar testet på dag 14 efter införandet av honor (dag 0) vilket gör det möjligt för den första kontrollavkomman att nå deutonymfstadiet (se tillägg 4). Den viktigaste uppmätta variabeln är antalet juveniler per testkärl och dessutom antalet överlevande honor. Reproduktionskapaciteten hos de kvalster som exponeras för testkemikalien jämförs med reproduktionskapaciteten i kontrollerna för att bestämma ECx-värden (t.ex. EC10, EC50) och den högsta koncentrationen utan observerad effekt (NOEC) (se tillägg 1 för definitioner), beroende på försökets utformning (se punkt 29). En översikt över testschemat finns i tillägg 8.
|
INFORMATION OM TESTKEMIKALIEN
|
4.
|
Testkemikaliens vattenlöslighet, log Kow, fördelningskoefficient jord/vatten och ångtryck ska helst vara kända. Det är önskvärt med ytterligare uppgifter om testkemikaliens omvandling, spridning och fördelning i jord, t.ex. i form av biotisk och abiotisk nedbrytningshastighet.
|
|
5.
|
Testmetoden kan användas för kemikalier som är lösliga eller olösliga i vatten. Testkemikaliens appliceringsmetod måste dock anpassas i enlighet med detta. Testmetoden kan inte användas för flyktiga kemikalier, dvs. kemikalier för vilka Henrys konstant eller fördelningskoefficienten luft/vatten är större än ett, eller kemikalier för vilka ångtrycket överstiger 0,0133 Pa vid 25 °C.
|
TESTETS GILTIGHET
|
6.
|
Följande kriterier bör uppfyllas i de obehandlade kontrollerna för att testresultatet ska anses vara giltigt:
|
—
|
Honornas genomsnittliga dödlighet bör inte överskrida 20 % vid testets slut.
|
|
—
|
Det genomsnittliga antalet juveniler per replikat (med ursprungligen tio adulta honor) bör vara minst 50 vid testets slut.
|
|
—
|
Variationskoefficienten som beräknas för antalet juveniler per replikat bör inte överstiga 30 % vid det definitiva testets slut.
|
|
REFERENSKEMIKALIE
|
7.
|
ECx eller NOEC för en referenskemikalie måste fastställas för att säkerställa att testförhållandena i laboratoriet är tillräckliga goda och för att kontrollera att testorganismernas respons inte har förändrats med tiden. Dimetoat (CAS-nr 60-51-5) är en lämplig referenskemikalie som har visat sig påverka populationsstorleken (4). Borsyra (CAS-nr 10043-35-3) kan användas som en alternativ referenskemikalie. Man har mindre erfarenhet av denna kemikalie. Två utformningslösningar är möjliga:
|
—
|
Referenskemikalien kan testas parallellt med att toxiciteten bestäms för varje testkemikalie vid en koncentration vars kapacitet att leda till en effekt på > 50 % reducering av avkomman måste styrkas på förhand i en dos-responsstudie. I detta fall bör antalet replikat vara detsamma som i kontrollerna (se punkt 29).
|
|
—
|
Alternativt kan referenskemikalien testas 1–2 gånger per år i ett dos-responstest. Antalet koncentrationer, replikat, och avståndsfaktorn varierar beroende på den valda utformningen (se även punkt 29), men man bör uppnå en respons på 10–90 % effekt (avståndsfaktor 1,8). EC50 för dimetoat baserat på antalet juveniler bör ligga i intervallet mellan 3,0 och 7,0 mg verksamt ämne/kg jord (torrvikt). På grundval av de resultat som hittills erhållits med borsyra bör EC50 baserat på antalet juveniler ligga i intervallet 100–500 mg/kg torrvikt jord.
|
|
BESKRIVNING AV TESTET
Testkärl och annan utrustning
|
8.
|
Man bör använda testkärl av glas eller annat kemiskt inert material med en storlek på 3–5 cm i diameter (jordlagrets höjd ≥ 1,5 cm) och som har tättslutande lock. Skruvlock är att föredra och i så fall kan kärlen luftas två gånger i veckan. Alternativt kan man använda lock som möjliggör direkt gasutbyte mellan substratet och den omgivande luften (t.ex. gasväv). Eftersom vattenhalten måste vara tillräckligt hög under testet är det viktigt att kontrollera varje testkärls vikt under testets gång och vid behov fylla på med vatten. Detta kan vara särskilt viktigt om inga skruvlock finns att tillgå. Om ett ogenomskinligt testkärl används ska locket vara gjort av ett material som möjliggör tillgång till ljus (t.ex. ett perforerat genomskinligt lock) och samtidigt förhindrar att kvalster slipper ut. Testkärlets storlek och typ beror på extraktionsmetoden (se tillägg 5 för detaljer). Om värmeextraktion ska användas direkt i testkärlet kan man infoga ett bottennät med lämplig maskstorlek (som hålls förseglat till dess att extraktionen inleds), och jorden bör vara tillräckligt djup för att tillåta en ökning av temperatur och fuktighet.
|
|
9.
|
Normal laboratorieutrustning krävs, och i synnerhet följande:
|
—
|
helst glasbehållare med skruvlock,
|
|
—
|
borstar för överföring av kvalster,
|
|
—
|
pH-mätare och luxmätare,
|
|
—
|
lämplig utrustning för temperaturreglering,
|
|
—
|
lämplig utrustning för reglering av luftfuktigheten (inte nödvändigt om exponeringskärlen har lock),
|
|
—
|
temperaturreglerad inkubator eller ett temperaturreglerat litet rum,
|
|
—
|
utrustning för extraktion (se tillägg 5) (13),
|
|
—
|
överliggande ljusarmatur med ljusreglage,
|
|
—
|
insamlingsburkar för extraherade kvalster.
|
|
Beredning av den syntetiska jorden
|
10.
|
I detta test används syntetisk jord. Den syntetiska jorden består av följande komponenter (alla värden baseras på torrvikt):
|
—
|
5 % vitmosstorv (Sphagnum), lufttorkad och finmald (en partikelstorlek på 2 ± 1 mm kan godtas),
|
|
—
|
20 % kaolinlera (kaolinithalt helst över 30 %).
|
|
—
|
Cirka 74 % lufttorkad industrisand (beroende på den mängd CaCO3 som behövs), främst fin sand där mer än 50 % av partiklarna har storleken 50–200 μm. Den exakta mängden sand beror på mängden CaCO3 (se nedan). De bör tillsammans utgöra 75 %.
|
|
—
|
< 1,0 % kalciumkarbonat (CaCO3, pulvriserat, av analyskvalitet) tillsatt för att få ett pH-värde på 6,0 ± 0,5. Mängden kalciumkarbonat som ska tillsättas beror främst på torvens kvalitet/beskaffenhet (se anmärkning 1).
|
Anmärkning 1: Den mängd CaCO3 som behövs beror på jordsubstratets beståndsdelar och bör bestämmas genom mätning av pH-värdet i delproverna med jord omedelbart före testets början (14).
Anmärkning 2: Torvinnehållet i den syntetiska jorden avviker från torvinnehållet i andra testmetoder för markorganismer, där man i de flesta fall använder 10 % torv (t.ex. (15)). Enligt EPPO (16) innehåller en typisk jordbruksmark dock högst 5 % organiskt material, och minskningen av torvinnehållet återspeglar således de minskade möjligheterna i en naturlig jord till sorption av testkemikalien till organiskt kol.
Anmärkning 3: Om så krävs, t.ex. för särskilda teständamål, kan även naturliga jordar från oförorenade platser användas som test- och/eller odlingssubstrat. Om naturjord används bör man minst ange dess ursprung (insamlingsplats), pH, textur (partikelstorleksfördelning) och halten av organiskt material. Om möjligt bör man även ange jordens typ och namn i enlighet med jordklassificering, och jorden måste vara fri från eventuella föroreningar. Om testkemikalien är en metall eller en metallorganisk förening bör även katjonbyteskapaciteten (CEC) hos den naturliga jorden fastställas. Särskild uppmärksamhet bör ägnas åt att uppfylla giltighetskriterierna eftersom bakgrundsinformation om naturjordar vanligtvis är sällsynt.
|
|
11.
|
Jordens torra beståndsdelar blandas omsorgsfullt (t.ex. i en storskalig laboratorieblandare). För bestämning av pH-värdet används en blandning av jord och 1 M kaliumklorid (KCl) eller 0,01 M kalciumkloridlösning (CaCl2) i förhållandet 1:5 (se (14) och tillägg 3). Om jorden är surare än det intervall som krävs (se punkt 10) kan detta justeras genom tillsats av en lämplig mängd CaCO3. Om jorden är för alkalisk kan detta justeras genom tillsats av mer av en blandning innehållande de första tre komponenterna som beskrivs i punkt 10, men inget CaCO3.
|
|
12.
|
Den syntetiska jordens maximala vattenhållningskapacitet (WHC) bestäms i enlighet med de förfaranden som beskrivs i tillägg 2. Två till sju dagar innan testet inleds förhandsfuktas den torra syntetiska jorden med tillräcklig mängd destillerat eller avjonat vatten till en vattenhalt som motsvarar cirka hälften av den slutliga vattenhalten, dvs. 40–60 % av den maximala vattenhållningskapaciteten (WHC). Fukthalten justeras till 40–60 % av den maximala vattenhållningskapaciteten (WHC) genom tillsats av lösningen med testkemikalien och/eller destillerat eller avjonat vatten (se punkterna 16–18). Ytterligare en summarisk kontroll av jordens fukthalt kan göras genom att man försiktigt pressar jorden i handen, och om vattenhalten är korrekt sipprar små vattendroppar ut mellan fingrarna.
|
|
13.
|
Jordens fukthalt bestäms i början och i slutet av testet genom torkning till konstant vikt vid 105 °C i enlighet med ISO 11465 (17), och jordens pH-värde i enlighet med tillägg 3 eller ISO 10390 (14). Dessa mätningar bör utföras på ytterligare prover utan kvalster, både från jorden i kontrollerna och från testjorden för varje testkoncentration. Jordens pH-värde bör inte justeras när sura och basiska kemikalier testas. Vattenhalten bör övervakas under testets gång genom att kärlen regelbundet vägs (se punkterna 20 och 24).
|
Urval och förberedelse av försöksdjuren
|
14.
|
Den art som används i testet är Hypoaspis (Geolaelaps) aculeifer (Canestrini, 1883). Man måste ha adulta kvalsterhonor som kommer från en synkroniserad kohort för att påbörja testet. Kvalstren bör introduceras ca 7–14 dagar efter att de har nått adult stadium, 28–35 dagar efter inledningen av äggläggningen under synkroniseringen (se punkt 3 och tillägg 4). Kvalstrens ursprung eller leverantören av laboratorieodlingen samt underhållet av denna bör anges. Om man håller en laboratorieodling rekommenderas det att man bekräftar identiteten på den art som används minst en gång om året. En identifieringsblankett bifogas som tillägg 6.
|
Beredning av testkoncentrationer
|
15.
|
Testkemikalien blandas ner i jorden. Organiska lösningsmedel som används för att underlätta behandlingen av jorden med testkemikalien bör väljas på grundval av deras låga toxicitet för kvalster och en lämplig kontroll med lösningsmedel ska tas med i testupplägget (se punkt 29).
|
Testkemikalier som är lösliga i vatten
|
16.
|
En lösning av testkemikalien bereds i avjonat vatten i tillräcklig mängd för att räcka till alla replikat av en testkoncentration. Det rekommenderas att man använder en lämplig mängd vatten för att nå önskad fukthalt, dvs. 40–60 % av den maximala vattenhållningskapaciteten (WHC) (se punkt 12). Varje lösning av testkemikalien blandas grundligt med ett parti förhandsfuktad jord innan den tillsätts i testkärlet.
|
Testkemikalier som är olösliga i vatten
|
17.
|
För kemikalier som inte är lösliga i vatten men som är lösliga i organiska lösningsmedel kan testkemikalien lösas upp i minsta möjliga volym i en lämplig vehikel (t.ex. aceton). Endast flyktiga lösningsmedel bör användas. När sådana vehiklar används ska alla testkoncentrationer och kontrollen innehålla samma minsta mängd av vehikeln. Vehikeln sprejas på eller blandas ner i en liten mängd, till exempel 10 g, fin kvartssand. Den totala halten av sand i substratet bör korrigeras för denna mängd. Vehikeln avlägsnas genom avdunstning i dragskåp under minst 1 timme. Blandningen av kvartssand och testkemikalie tillförs den på förhand fuktade jorden och blandas omsorgsfullt med en lämplig mängd avjonat vatten för att få den fuktighet som krävs. Den slutliga blandningen tillsätts i testkärlen. Observera att vissa lösningsmedel kan vara toxiska för kvalster. Det rekommenderas därför att man använder en extra vattenkontroll utan vehikel om lösningsmedlets toxicitet för kvalster inte är känd. Om det kan påvisas att lösningsmedlet (i de koncentrationer som ska användas) inte har någon effekt, kan vattenkontrollen uteslutas.
|
Testkemikalier som är svårlösliga i vatten och i organiska lösningsmedel
|
18.
|
För kemikalier som är svårlösliga i vatten och i organiska lösningsmedel blandas motsvarande 2,5 g finmald kvartssand per testkärl (t.ex. 10 g fin kvartssand för fyra replikat) med den mängd testkemikalie som behövs för att få önskad testkoncentration. Den totala halten av sand i substratet bör korrigeras för denna mängd. Blandningen av kvartssand och testkemikalie tillförs den förhandsfuktade jorden och blandas omsorgsfullt efter tillsats av lämplig mängd avjonat vatten för att få önskad fukthalt. Den slutliga blandningen fördelas mellan testkärlen. Förfarandet upprepas för varje testkoncentration, och en lämplig kontroll upprättas också.
|
FÖRFARANDE
Testgrupper och kontroller
|
19.
|
Tio adulta honor i 20 g torrvikt syntetisk jord rekommenderas för varje kontrollkärl och testkärl. Testorganismerna bör tillföras inom 2 timmar efter beredningen av det slutliga testsubstratet (dvs. efter applicering av testämnet). I särskilda fall (t.ex. om åldrande betraktas som en avgörande faktor) kan tiden mellan beredningen av det slutliga testsubstratet och tillförandet av kvalster förlängas (för detaljer om sådant åldrande, se (18)). I sådana fall ska en vetenskaplig motivering lämnas.
|
|
20.
|
Efter det att man tillsatt kvalster i jorden utfodras kvalstren och den ursprungliga vikten av varje testkärl mäts för att användas som referens vid kontrollen av vattenhalten under testets gång enligt beskrivning i punkt 24. Testkärlen täcks därefter enligt beskrivningen i punkt 8 och placeras i testkammaren.
|
|
21.
|
Lämpliga kontroller bereds för varje metod för applicering av testkemikalien enligt beskrivning i punkterna 15–18. De relevanta förfarandena för beredning av kontrollerna följs förutom att testkemikalien inte läggs till. I förekommande fall tillsätts organiska lösningsmedel, kvartssand eller andra vehiklar i kontrollerna i de koncentrationer eller mängder som motsvarar dem som används i testkärlen. Om ett lösningsmedel eller annan vehikel används för tillsats av testkemikalien bör en ytterligare kontroll utan vehikeln eller testkemikalien också beredas och testas om toxiciteten för lösningsmedlet inte är känd (se punkt 17).
|
Testbetingelser
|
22.
|
Testtemperaturen bör vara 20 ± 2 °C. Temperaturen registreras minst en gång per dag och justeras vid behov. Testet utförs under kontrollerade ljus-/mörkercykler (helst 16 h ljus/8 h mörker) med belysning på 400–800 lux där testkärlen förvaras. För jämförbarhetens skull bör dessa villkor vara desamma som i andra ekotoxikologiska jordtester (t.ex. (15)).
|
|
23.
|
Om skruvlock används bör gasutbytet säkras genom att testkärlen luftas minst två gånger per vecka. Om gasvävsöverdrag används bör man vara särskilt noga med att upprätthålla jordens fukthalt (se punkterna 8 och 24).
|
|
24.
|
Jordsubstratets vatteninnehåll i testkärlen bibehålls under hela provningen genom att kärlen vägs, och vid behov tillsätts vatten regelbundet till testkärlen (t.ex. en gång per vecka). Förluster fylls på vid behov med avjonat vatten. Vattenhalten under provningen bör inte avvika med mer än 10 % från startvärdet.
|
Utfodring
|
25.
|
Ostor (Tyrophagus putrescentiae (Schrank, 1781)) har visat sig vara en lämplig foderkälla. Små hoppstjärtar (t.ex. juveniler av Folsomia candida Willem, 1902 eller Onychiurus fimatus) (19), (20), småringmaskar (t.ex. Enchytraeus crypticus Westheide & Graefe, 1992) eller rundmaskar (t.ex. Turbatrix silusiae de Man, 1913) kan också användas (21). Det rekommenderas att man kontrollerar fodret innan man använder det i ett test. Fodret bör vara av en typ och mängd som säkerställer att ett tillräckligt antal juveniler produceras för att uppfylla kriterierna för testresultatens giltighet (punkt 6). Vid valet av bytesdjur bör verkningssättet hos testkemikalien beaktas (en acaricid kan t.ex. vara toxisk även för foderkvalstren, se punkt 26).
|
|
26.
|
Testorganismerna bör ha fri tillgång till foder (dvs. en liten mängd varje gång (så mycket som ryms på spetsen av en spatel)). I detta syfte kan även en exhaustor med låg sugkraft användas, som föreslogs i testet för hoppstjärtar. Det är vanligtvis tillräckligt att tillhandahålla foder i början av testet och därefter två till tre gånger per vecka. När testämnet förefaller vara giftigt för bytesdjuren bör man överväga en ökad utfodringstakt och/eller en alternativ foderkälla.
|
Val av testkoncentrationer
|
27.
|
Tidigare kunskap om testkemikaliens toxicitet är till hjälp vid valet av lämpliga testkoncentrationer, t.ex. från preliminära test. Vid behov kan ett preliminärt test utföras med fem koncentrationer av testkemikalien i intervallet 0,1–1 000 mg/kg torrvikt jord, med minst ett replikat för testkärl och kontroll. Varaktigheten för det preliminära testet är 14 dagar, varefter dödligheten för adulta kvalster och antalet avkommor fastställs. Koncentrationsintervallet i det slutliga testet bör helst väljas så att det omfattar koncentrationer vid vilka antalet juveniler påverkas medan föräldragenerationens överlevnad inte påverkas. Detta kan eventuellt inte vara möjligt för kemikalier som orsakar letala och subletala effekter vid nästan samma koncentrationer. Effektkoncentrationen (t.ex. EC50, EC25, EC10) och det koncentrationsintervall som är relevant för testkemikalien bör omges av de koncentrationer som ingår i testet. Man bör endast i undantagsfall extrapolera långt under den lägsta koncentration som påverkar testorganismerna eller över den högsta koncentration som testats, och en fullständig förklaring ska då ingå i rapporten.
|
Testets utformning
Dos-responstester
|
28.
|
Tre testupplägg föreslås, utifrån rekommendationerna från ett annat ringtest (reproduktionstest för småringmaskar (22)). Den allmänna lämpligheten hos dessa upplägg bekräftades genom resultatet från valideringen för H. aculeifer.
|
|
29.
|
Vid valet av koncentrationsintervall bör man beakta följande:
|
—
|
För bestämning av ECx (t.ex. EC10, EC50) bör tolv koncentrationer testas. Det rekommenderas att man använder minst två replikat för varje koncentration av testkemikalien och sex kontrollreplikat. Koncentrationernas inbördes avståndsfaktor kan variera, dvs. den kan vara mindre än eller lika med 1,8 i det förväntade effektintervallet och större än 1,8 vid högre och lägre koncentrationer.
|
|
—
|
För bestämning av NOEC bör minst fem koncentrationer i en geometrisk serie testas. Det rekommenderas att man använder fyra replikat för varje testkoncentration plus åtta kontroller. Koncentrationerna bör skilja sig åt med en faktor på högst 2,0.
|
|
—
|
Ett kombinerat tillvägagångssätt möjliggör bestämning av både ECx och NOEC. Man bör använda åtta testkoncentrationer i en geometrisk serie. Fyra replikat per exponering plus åtta kontroller rekommenderas. Koncentrationerna bör skilja sig åt med en faktor på högst 1,8.
|
|
Toleranstest
|
30.
|
Om inga effekter observeras vid den högsta koncentrationen i det preliminära testet (dvs. 1 000 mg/kg torrvikt jord), kan det definitiva reproduktionstestet utföras som ett toleranstest med en koncentration på 1 000 mg/kg torrvikt jord. Ett toleranstest gör det möjligt att visa att NOEC eller EC10 för reproduktion är större än gränskoncentrationen, samtidigt som man minimerar antalet kvalster som används i testet. Åtta replikat bör användas både för den behandlade jorden och för kontrollen.
|
Testets varaktighet och mätningar
|
31.
|
Alla observerade skillnader mellan kvalstrens beteende och morfologi i kontrollen och i testkärlen bör registreras.
|
|
32.
|
På dag 14 extraheras de överlevande kvalstren från jorden genom värme-/ljusextraktion eller med en annan lämplig metod (se tillägg 5). Antalet juveniler (dvs. larver, protonymfer och deutonymfer) och adulter räknas separat. Alla adulter som inte hittats vid denna tidpunkt ska registreras som döda, under förutsättning att dessa kvalster har dött och brutits ned före bedömningen. Extraktionens effektivitet ska valideras en eller två gånger per år i kontroller med ett känt antal adulter och juveniler. Effektiviteten bör vara över 90 % i genomsnitt för alla utvecklingsstadier tillsammans (se tillägg 5). Summorna av adulter och juveniler är inte effektivitetsjusterade.
|
DATA OCH RAPPORTERING
Behandling av resultaten
|
33.
|
Information om de statistiska metoder som kan användas för att analysera testresultaten ges i punkterna 36–41. OECD:s dokument 54, Current Approaches in the Statistical Analysis of Ecotoxicity Data: a Guidance to Application (31), bör konsulteras.
|
|
34.
|
Testets huvudsakliga endpoint är reproduktionskapacitet, i det här fallet det antal avkommor som produceras per replikattestkärl (i vilka tio adulta honor införts). I den statistiska analysen ska det aritmetiska medelvärdet (X) och variansen (s2) för reproduktionskapaciteten beräknas per testkärl och kontroll. X och s2 används för ANOVA-förfaranden såsom Students t-test, Dunnetts test eller Williams test samt för beräkning av konfidensintervaller på 95 %.
Anmärkning: denna huvudsakliga endpoint motsvarar fekunditeten mätt som antalet levande avkommor som producerats under testets gång dividerat med antalet moderdjur som infördes i början av testet.
|
|
35.
|
Antalet överlevande honor i de obehandlade kontrollerna är ett viktigt giltighetskriterium och måste dokumenteras. Liksom i det preliminära testet bör alla andra skadliga tecken registreras även i den slutliga rapporten.
|
ECx
|
36.
|
ECx-värdena, inklusive deras sammanhörande nedre och övre 95-procentiga konfidensintervall för den parameter som beskrivs i punkt 34, beräknas med hjälp av lämpliga statistiska metoder (t.ex. probit-analys, logistiska funktioner eller Weibull-funktioner, den modifierade Spearman-Kärbermetoden eller enkel interpolering). ECx beräknas genom att ett värde som motsvarar x % av medelvärdet för kontrollen införs i den ekvation som erhållits. För att beräkna EC50 eller något annat ECx-värde bör en regressionsanalys utföras på medelvärdena per testkärl (X).
|
NOEC/LOEC
|
37.
|
Om en statistisk analys används för att bestämma NOEC/LOEC är det nödvändigt att sammanställa statistiska uppgifter för varje enskilt kärl (enskilda kärl anses utgöra replikat). Lämpliga statistiska metoder ska användas (enligt OECD:s dokument 54, Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application). I allmänhet ska negativa effekter av testämnet jämfört med kontrollen undersökas genom en ensidig (mindre) hypotesprövning vid p ≤ 0,05. Exempel ges i de följande punkterna.
|
|
38.
|
Normalfördelningen av data kan kontrolleras t.ex. med Kolmogorov-Smirnovs test av anpassningsgraden, kvoten mellan variationsvidden och standardavvikelsen (R/s-testet) eller Shapiro-Wilks test (dubbelsidigt, p ≤ 0,05). Cochrans test, Levenes test eller Bartletts test (dubbelsidigt, p ≤ 0,05) kan användas för att testa varianshomogeniteten. Om förutsättningarna för parametriska testförfaranden (normalitet, varianshomogenitet) är uppfyllda, kan ensidiga variansanalyser (ANOVA) och därpå följande flerjämförelsetester utföras. Multipla jämförelser (t.ex. Dunnetts t-test) eller step-down-grundade trendtester (t.ex. Williams test) kan användas för att beräkna om det finns betydande skillnader (p ≤ 0,05) mellan kontrollerna och de olika testämneskoncentrationerna (välj rekommenderat test i enlighet med OECD:s dokument 54, Current Approaches in the Statistical Analysis of Ecotoxicity Data: a Guidance to Application). I annat fall bör icke-parametriska metoder (t.ex. Bonferronis U-test enligt Holm eller Jonckheere-Terpstras trendtest) användas för att bestämma NOEC och LOEC.
|
Toleranstest
|
39.
|
Om ett toleranstest (jämförelse av endast ett testkärl och kontrollen) har utförts och de nödvändiga förutsättningarna för parametriska testförfaranden (normalitet, homogenitet) är uppfyllda, kan metriska responser utvärderas med hjälp av Students test (t-test). Om dessa krav inte uppfylls kan man använda t-testet med olika varians (Welchs t-test) eller ett icke-parametriskt test, såsom Mann-Whitneys U-test.
|
|
40.
|
För att se om det finns betydande skillnader mellan kontrollerna (kontroll och kontroll med lösningsmedel), kan replikaten för varje kontroll testas enligt beskrivningen för toleranstestet. Om man inte upptäcker betydande skillnader med dessa tester kan alla kontroll- och lösningsmedelskontrollreplikat sammanföras. I annat fall bör alla behandlingar jämföras med lösningsmedelskontrollen.
|
Testrapport
|
41.
|
Testrapporten ska innehålla åtminstone följande information:
|
—
|
Testkemikalie
|
—
|
testkemikaliens identitet, namn, sändnings- och partinummer, CAS-nummer, renhet,
|
|
—
|
fysikalisk-kemiska egenskaper (t.ex. log Kow, vattenlöslighet, ångtryck, Henrys konstant (H) och helst information om testkemikaliens omvandling, spridning och fördelning i jord).
|
|
|
—
|
Testorganismer
|
—
|
identifiering av testorganismerna, leverantör, beskrivning av odlingsbetingelserna,
|
|
—
|
testorganismernas åldersintervall.
|
|
|
—
|
Testbetingelser
|
—
|
beskrivning av testets utformning och testförfarandet,
|
|
—
|
detaljer om testjordens beredning, detaljerade specifikationer om naturjord används (ursprung, historia, partiklarnas storleksfördelning, pH-värde, halt av organiskt material och, om denna uppgift finns tillgänglig, jordens klassificering),
|
|
—
|
jordens maximala vattenhållningskapacitet,
|
|
—
|
en beskrivning av den teknik som används för att applicera testkemikalien på jorden,
|
|
—
|
uppgifter om hjälpkemikalier som används för tillförsel av testkemikalien,
|
|
—
|
testkärlens storlek och torrvikten jord per testkärl,
|
|
—
|
testbetingelser: ljusintensitet, ljus/mörker-cyklernas varaktighet, temperatur,
|
|
—
|
en beskrivning av utfodringsprogrammet, typen och mängden av det foder som används i testet, datum för utfodringen,
|
|
—
|
pH-värdet och vattenhalten i jorden vid testets början samt under testets gång (kontroll och varje testkärl),
|
|
—
|
detaljerad beskrivning av extraktionsmetoden och extraktionseffektiviteten.
|
|
|
—
|
Testresultat
|
—
|
antalet avkommor som fastställts i varje provkärl vid testets slut,
|
|
—
|
antalet adulta honor och de adulta djurens dödlighet (%) i varje provkärl vid testets slut,
|
|
—
|
beskrivning av uppenbara symtom eller tydliga beteendeförändringar,
|
|
—
|
de resultat som erhållits med referenstestkemikalien,
|
|
—
|
sammanfattande statistik (ECx eller NOEC) inklusive 95-procentiga konfidensgränser, och en beskrivning av beräkningsmetoden,
|
|
—
|
en plott som visar koncentration/responsförhållandet,
|
|
—
|
avvikelser från de förfaranden som beskrivs i denna testmetod och ovanliga händelser under testets gång.
|
|
|
LITTERATUR
|
(1)
|
Casanueva, M. E. (1994). Phylogenetic studies of the free-living and arthropod associated Laelapidae (Acari: Mesostigmata). Gayana Zool. 57, 21–46.
|
|
(2)
|
Tenorio, J. M. (1982). Hypoaspidinae (Acari: Gamasida: Laelapidae) of the Hawaiian Islands. Pacific Insects 24, 259–274.
|
|
(3)
|
Bakker, F. M., Feije, R., Grove, A. J., Hoogendorn, G., Jacobs, G., Loose, E. D. och van Stratum, P. (2003). A laboratory test protocol to evaluate effects of plant protection products on mortality and reproduction of the predatory mite Hypoaspis aculeifer Canestrini (Acari: Laelapidae) in standard soil. JSS – Journal of Soils and Sediments 3, 73–77.
|
|
(4)
|
Karg, W. (1994). Die freilebenden Gamasina (Gamasides), Raubmilben. andra upplagan, i: Dahl, F. (red.): Die Tierwelt Deutschlands, vol. 59, G., Fischer, Jena, s. 523.
|
|
(5)
|
Ruf, A. (1991). Do females eat males?: Laboratory studies on the population development of Hypoaspis aculeifer (Acari: Parasitiformes). I: F. Dusbabek och V. Bukva (red.): Modern Acarology. Academia Prague & SPD Academic Publishing bv, Haag, vol. 2, 487–492
|
|
(6)
|
Ruf, A. (1996). Sex ratio and clutch size control in the soil inhabiting predatory mite Hypoaspis aculeifer (Canestrini 1883) (Mesostigmata, Dermanyssidae). Proc. 2nd Symp. EURAAC, s. 241–249.
|
|
(7)
|
Ruf, A. (1996). Life-history patterns in soil-inhabiting mesostigmatid mites. Proc. IXth Internat. Congr. Acarol. 1994, Columbus, Ohio, s. 621–628.
|
|
(8)
|
Krogh, P. H. och Axelsen, J. A. (1998). Test on the predatory mite Hypoaspis aculeifer preying on the collembolan Folsomia fimetaria. I: Lokke, H. och van Gestel, C. A. M. Handbook of soil invertebrate toxicity tests. John Wiley Sons, Chichester, s. 239–251.
|
|
(9)
|
Løkke, H., Janssen, C. R., Lanno, R. P., Römbke J., Rundgren, S. och Van Straalen, N. M. (2002). Soil Toxicity Tests – Invertebrates. I: Test Methods to Determine Hazards of Sparingly Soluble Metal Compounds in Soils. Fairbrother, A., Glazebrook, P. W., van Straalen, N. M. och Tarazona, J. V. (red.). SETAC Press, Pensacola, USA. 128 s.
|
|
(10)
|
Schlosser, H.-J. och Riepert, F. (1991/92). Entwicklung eines Prüfverfahrens für Chemikalien an Bodenraubmilben (Gamasina). Teil 1: Biologie der Bodenraubmilbe Hypoaspis aculeifer Canestrini, 1883 (Gamasina) unter Laborbedingungen. Zool. Beiträge, 34, 395–433.
|
|
(11)
|
Schlosser, H.-J. och Riepert, F. (1992). Entwicklung eines Prüfverfahrens für Chemikalien an Boden-raubmilben (Gamasina). Teil 2: Erste Ergebnisse mit Lindan und Kaliumdichromat in subletaler Dosierung. Zool. Beitr. N.F. 34, 413–433.
|
|
(12)
|
Heckmann, L.-H., Maraldo, K. och Krogh, P. H. (2005). Life stage specific impact of dimethoate on the predatory mite Hypoaspis aculeifer Canestrini (Gamasida: Laelapidae). Environmental Science & Technology 39, 7154–7157.
|
|
(13)
|
Petersen, H. (1978). Some properties of two high-gradient extractors for soil microarthropods, and an attempt to evaluate their extraction efficiency. Natura Jutlandica 20, 95–122.
|
|
(14)
|
ISO (Internationella standardiseringsorganisationen) (1994). Markundersökningar – Bestämning av pH, nr 10390. ISO, Genève.
|
|
(15)
|
Kapitel C.8 i denna bilaga: Toxicitet för daggmaskar.
|
|
(16)
|
EPPO (2003): EPPO Standards. Environmental risk assessment scheme for plant protection products. Kapitel 8: Soil Organisms and Functions. Bull. OEPP/EPPO Bull. 33, 195–209.
|
|
(17)
|
ISO (Internationella standardiseringsorganisationen) (1995). Markundersökningar – Bestämning av torrsubstans och vattenkvot – Gravimetrisk metod, nr 11465. ISO, Genève.
|
|
(18)
|
Fairbrother, A., Glazebrock, P. W., van Straalen, N. M. och Tarazona, J. V. (2002). Test methods to determine hazards of sparingly soluble metal compounds in soils. SETAC Press, Pensacola, FL, USA.
|
|
(19)
|
Chi, H. (1981). Die Vermehrungsrate von Hypoaspis aculeifer Canestrini (Acarina, Laelapidae) bei Ernährung mit Onychiurus fimatus Gisin (Collenbola). Mitt. Dtsch. Ges. allg. angew. Entomol. 3, 122–125.
|
|
(20)
|
Schlosser, H. J., och Riepert, F. (1992). Entwicklung eines Prüfverfahrens für Chemikalien an Bodenraubmilben (Gamasina). Zool. Beitr. N.F. 34:3, 395–433.
|
|
(21)
|
Heckmann, L.-H., Ruf, A., Nienstedt, K. M. och Krogh, P. H. 2007. Reproductive performance of the generalist predator Hypoaspis aculeifer (Acari: Gamasida) when foraging on different invertebrate prey. Applied Soil Ecology 36, 130–135.
|
|
(22)
|
Kapitel C.32 i denna bilaga: Reproduktionstest för småringmaskar (Enchytraeidae).
|
|
(23)
|
ISO (Internationella standardiseringsorganisationen) (1994). Markundersökningar – Föroreningars effekt på daggmaskar (Eisenia fetida). Del 2: Bestämning av effekter på reproduktion, nr 11268-2. ISO, Genève.
|
|
(24)
|
Southwood, T. R. E. (1991). Ecological methods. With particular reference to the study of insect populations (andra upplagan). Chapman & Hall, London, 524 s.
|
|
(25)
|
Dunger, W. och Fiedler, H. J. (1997). Methoden der Bodenbiologie (andra upplagan). G. Fischer, Jena, 539 s.
|
|
(26)
|
Lesna, I. och Sabelis, M. W. (1999). Diet-dependent female choice for males with ’good genes’ in a soil predatory mite. Nature 401, 581–583.
|
|
(27)
|
Ruf, A. (1989). Die Bedeutung von Arrhenotokie und Kannibalismus für die Populationsentwicklung von Hypoaspis aculeifer (Canestrini 1883) (Acari, Gamasina). Mitt. Deut. Ges. Allg. Angew. Entomol. 7, 103–107.
|
|
(28)
|
Ruf, A. (1994). Die morphologische Variabilität und Fortpflanzungsbiologie der Raubmilbe Hypoaspis aculeifer (Canestrini 1883) (Mesostigmata, Dermanyssidae). Avhandling, Universität Bremen.
|
|
(29)
|
Ignatowicz, S. (1974). Observations on the biology and development of Hypoaspis aculeifer Canestrini, 1885 (Acarina, Gamasides). Zoologica Poloniae 24, 11–59.
|
|
(30)
|
Kevan, D. K. McE. och Sharma, G. D. (1964). Observations on the biology of Hypoaspis aculeifer (Canestrini, 1884), apparently new to North America (Acarina: Mesostigmata: Laelaptidae). Acarologia 6, 647–658.
|
|
(31)
|
OECD (2006c). Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. OECD Environmental Health and Safety Publications Series on Testing and Assessment nr 54. ENV/JM/MONO (2006)18
|
Tillägg 1
Definitioner
Följande definitioner gäller för denna testmetod (i detta test uttrycks alla effektkoncentrationer som testkemikaliens vikt per torrvikt testjord):
Kemikalie
: ett ämne eller en blandning.
Nolleffektkoncentrationen (NOEC)
: den koncentration av testkemikalien vid vilken ingen effekt har noterats. I detta test har en halt som motsvarar NOEC ingen statistiskt signifikant effekt (p < 0,05) efter en given exponeringstid jämfört med ett kontrollprov.
Lägsta koncentration med observerad effekt (LOEC)
: den lägsta koncentrationen av testkemikalien som jämfört med ett kontrollprov har en statistiskt signifikant effekt (p < 0,05) efter en given exponeringstid.
ECx (koncentration som ger x % effekt): den koncentration som orsakar en x-procentig effekt på testorganismerna efter en given exponeringstid jämfört med ett kontrollprov. EC50 är till exempel den koncentration som beräknas ha en effekt för en av testets endpoints på 50 % av en exponerad population under en fastställd exponeringstid.
Testkemikalie
: varje ämne eller blandning som testas med denna testmetod.
Tillägg 2
Fastställande av jordens maximala vattenhållningskapacitet
Följande metod för att bestämma jordens maximala vattenhållningskapacitet anses vara lämplig. Den beskrivs i bilaga C till ISO DIS 11268-2 (Markundersökningar – Föroreningars effekt på daggmaskar (Eisenia fetida) – Del 2: Bestämning av effekter på reproduktion (23)).
Samla in en fastställd kvantitet (t.ex. 5 g) testjordsubstrat med hjälp av en lämplig anordning (jordborr med rör osv.). Täck botten med en bit filterpapper genomdränkt med vatten och placera det därefter på en ställning i ett vattenbad. Röret bör gradvis nedsänkas i vattnet tills vattenytan är ovanför jordytan. Det bör därefter lämnas i vattnet i cirka 3 timmar. Eftersom allt vatten som absorberas av jordens kapillärer inte kan hållas kvar bör jordprovet dräneras i 2 timmar genom att röret placeras på en bädd av mycket fuktig finmald kvartssand i ett slutet kärl (för att förhindra uttorkning). Provet bör sedan torkas till en konstant vikt vid 105 °C och vägas. Vattenhållningskapaciteten (WHC) beräknas enligt följande:

där
S= vattenmättat substrat + rörets vikt + filterpapprets vikt
T= emballagevikt (rörets vikt + filterpapprets vikt)
D= substratets torrvikt
Tillägg 3
Bestämning av jordens ph-värde
Följande metod för bestämning av pH-värdet i jord bygger på beskrivningen i ISO DIS 10390: Markundersökningar – Bestämning av pH (16).
En bestämd mängd jord torkas i rumstemperatur i minst 12 timmar. En suspension av jorden (som innehåller minst 5 gram jord) bereds därefter i fem gånger dess volym med antingen 1 M kaliumkloridlösning (KCl) av analyskvalitet eller 0,01 M kalciumkloridlösning (CaCl2) av analyskvalitet. Suspensionen skakas därefter omsorgsfullt i fem minuter och får sedan stå och klarna i minst 2 timmar men högst 24 timmar. Vätskefasens pH mäts sedan med en pH-mätare som har kalibrerats före varje mätning med hjälp av ett antal lämpliga buffertlösningar (t.ex. pH 4,0 och 7,0).
Tillägg 4
Uppfödning av Hypoaspis (Geolaelaps) aculeifer, foderkvalster och synkronisering av odlingen
Uppfödning av Hypoaspis (Geolaelaps) aculeifer:
Kulturer kan hållas i plastkärl eller glasburkar fyllda med en blandning av gips och kolpulver i förhållandet 9:1. Gipset kan hållas fuktigt genom att man vid behov tillsätter några droppar destillerat eller avjonat vatten. Uppfödningstemperaturen är optimal mellan 20 ± 2 °C. Ljus-/mörkerförhållandena är inte relevanta för denna art. Bytesdjuren kan vara kvalster av arterna Tyrophagus putrescentiae eller Caloglyphus sp. (foderkvalster bör hanteras med försiktighet eftersom de kan orsaka allergier hos människor), men rundmaskar, småringmaskar och hoppstjärtar är också lämpliga bytesdjur. Deras ursprung bör anges. Utvecklingen av en population kan börja med en enda hona eftersom hanar utvecklas ur obefruktade ägg. Generationerna är till stor del överlappande. En hona kan leva i över 100 dagar och lägga ungefär 100 ägg under sin livstid. Den maximala äggläggningstakten uppnås mellan 10 och 40 dagar efter att honorna nått adult stadium och uppgår till 2,2 ägg per hona och dygn. Utvecklingstiden från ägg till adult hona är ungefär 20 dagar vid 20 °C. Mer än en kultur bör hållas innan testet påbörjas.
Uppfödning av Tyrophagus putrescentiae:
Kvalstren hålls i ett glaskärl fyllt med finmalt bryggerijästpulver. Kärlet bör placeras i en plastspann fylld med KNO3-lösning för att undvika att kvalstren tar sig ut. Foderkvalstren placeras på pulvrets yta. De blandas sedan noggrant med pulvret (som måste ersättas två gånger i veckan) med hjälp av en spatel.
Synkronisering av kulturen:
Exemplar som används i testet bör ha ungefär samma ålder (ca 7 dagar efter att det adulta stadiet inletts). Vid en uppfödningstemperatur på 20 °C uppnås detta på följande sätt:
Överför honorna till ett rent uppfödningskärl och tillsätt tillräckligt med foder.
|
—
|
Låt honorna lägga ägg i 2–3 dagar och avlägsna dem sedan.
|
|
—
|
Använd adulta honor för testning mellan den 28:e och 35:e dagen efter att moderdjuren placerats i rena uppfödningskärl.
|
Adulta honor lätt kan skiljas från hanar och andra utvecklingsstadier genom deras större storlek, svällande form och bruna ryggsköld (hanarna är tunnare och platta). Juvenilerna är vita till gräddfärgade. Utvecklingen av kvalstren vid 20 °C följer ungefär det mönster som beskrivs nedan (figur): ägg (5 dagar), larv (2 dagar), protonymf (5 dagar), deutonymf (7 dagar), honornas förstadium till äggläggning (2 dagar). Därefter är kvalstren adulta.
Figur
Utveckling av Hypoaspis (Geolaelaps) aculeifer vid 20 °C (avlägsnande = honor som används i testet)

De adulta försöksdjuren avlägsnas från den synkroniserade kulturen och tillförs testkärlen mellan den 28:e och 35:e dagen efter att moderdjuren har börjat lägga ägg (dvs. 7–14 dagar efter att de nått adult stadium). Detta garanterar att försöksdjuren redan har genomgått förstadiet till äggläggningen och har parat sig med hanar som också befinner sig i odlingskärlen. Iakttagelser i laboratoriekulturer visar att honor parar sig omedelbart eller kort efter att de har nått adult stadium om det finns hanar närvarande (Ruf, Vaninnen, egen observation). Perioden på sju dagar har valts för att underlätta integrationen i laboratorierutinerna och för att fungera som en buffert för den utvecklingsmässiga variabiliteten bland enskilda kvalster. Äggläggningen bör inledas med minst samma antal honor som senare krävs i testet (om t.ex. 400 honor behövs i testet bör minst 400 honor tillåtas att lägga ägg i två till tre dagar. Minst 1 200 ägg bör vara utgångspunkten för den synkroniserade populationen (förhållande mellan könen ca 0,5, dödlighet ca 0,2). För att undvika kannibalism är det lämpligare att hålla högst 20–30 äggläggande honor i ett kärl.
Tillägg 5
Extraktionsmetoder
För mikroartropoder är värmeextraktion en lämplig metod för att skilja individer från jorden/substratet (se figur nedan). Metoden bygger på organismernas aktivitet, varför endast exemplar som rör sig kommer att kunna registreras. Principen för värmeextraktion är att gradvis försämra villkoren i provet för organismerna så att de lämnar substratet och faller ner i en fixeringsvätska (t.ex. etanol). Viktiga omständigheter är extraktionens varaktighet och skillnaden mellan goda till måttliga till dåliga villkor för organismerna. Extraktionens varaktighet i ekotoxikologiska test måste vara så kort som möjligt, eftersom en populationsökning under tiden då extraktionen pågår skulle förvränga resultaten. Å andra sidan måste temperatur- och fuktbetingelserna i provet alltid befinna sig inom ett intervall som gör det möjligt för kvalstren att röra på sig. Uppvärmning av ett jordprov leder till uttorkning av substratet. Om uttorkningen sker alltför snabbt kan en del kvalster också torka ut innan de hinner fly.
Därför föreslås följande förfarande (24) (25):
|
|
Utrustning: tullgrentratt eller jämförbara metoder, t.ex. McFadyen (uppvärmning ovanifrån, provet placeras över en tratt)
|
|
|
Uppvärmning: 25 °C i 12 timmar, 35 °C i 12 timmar, 45 °C i 24 timmar (totalt 48 timmar). Temperaturen bör mätas i substratet.
|
|
|
Fixeringsvätska: 70 % etanol
|
|
|
Detaljuppgifter: Ta glasbägaren som använts för testet. Avlägsna locket och linda en bit nät eller väv runt öppningen. Väven bör ha en maskstorlek på 1,0–1,5 mm. Fäst väven med ett gummiband. Vänd försiktigt bägaren upp och ner och placera den i extraktionsanordningen. Väven hindrar substratet från att falla ner i fixeringsvätskan men gör det möjligt för kvalstren att lämna provet. Påbörja uppvärmningen efter att alla bägare har placerats i extraktionsanordningen. Avsluta extraktionen efter 48 timmar. Avlägsna bägarna med fixeringsvätska och räkna kvalstren med hjälp av ett dissektionsmikroskop.
|
Den valda metodens extraktionseffektivitet måste ha bevisats en eller två gånger per år med hjälp av kärl som innehåller ett känt antal juveniler och adulter som hålls i obehandlade testsubstrat. Effektiviteten bör i genomsnitt vara ≥ 90 % totalt för alla utvecklingsstadier.
Extraktionsanordning av tullgrentyp

Hur man förbereder testbägaren efter att testet avslutats men före extraktionen

Tillägg 6
Identifiering av Hypoaspis (Geolaelaps) aculeifer
|
Underklass/ordning/underordning:
|
|
Familj:
|
|
Släkte/undersläkte/art:
|
|
Kvalster/Parasitiformes/Gamasida
|
|
Laelapidae
|
|
Hypoaspis (Geolaelaps) aculeifer
|
|
Auktorsnamn och datum:
|
Fil. dr. F. Faraji (MITOX), 23 januari 2007
|
|
Hänvisningar:
|
Karg, W. (1994). Die freilebenden Gamasina (Gamasides), Raubmilben. Tierwelt Deutschlands 59, andra reviderade upplagan: 1–523.
Hughes, A. M. (1976). The mites of stored food and houses. Brittiska jordbruks-, fiskeri- och livsmedelsdepartementet, Technical Bulletin 9: 400 s.
Krantz, G. W. (1978). A manual of Acarology. Oregon State University Book Stores, Inc., 509 s.
|
|
Utmärkande kännetecken:
|
Tectum med rundad fintandad kant; hypostomfåror med minst sex tänder; kaudala och dorsala borst på Z4 ej särskilt långa; borstformiga dorsala borst; den genitala skölden normal, ej särskilt förstorad och når ej den anala skölden; bakre halvan av ryggskölden saknar parvisa borst; ben II och IV med något tjocka makroborst; dorsala borst Z5 ca två gånger längre än J5; fast digitus på chelicererna med 12–14 tänder och rörligt digitus med två tänder; kroppen (idiosoma) 520–685 μm lång.
Hypoaspis miles används också inom biologisk bekämpning och kan förväxlas med H. aculeifer. Den största skillnaden är:
H. miles tillhör undersläktet Cosmolaelaps och har knivliknande ryggborst medan H. aculeifer tillhör undersläktet Geolaelaps och har borstformiga ryggborst.
|
Tillägg 7
Grundläggande information om biologin hos Hypoaspis (Geolaelaps) aculeifer
Hypoaspis aculeifer tillhör familjen Lealapidae, ordningen kvalster (acari), klassen spindeldjur (arachnida), fylum leddjur (arthropoda). De lever i alla typer av jord och livnär sig på andra kvalster, rundmaskar, småringmaskar och hoppstjärtar (26). Om födobrist uppstår övergår de till kannibalism (27). Rovkvalstren består av kropp (idiosoma) och huvudsköld (gnathosoma). Kroppen (idiosoma) saknar tydlig differentiering mellan prosoma (huvudet) och opisthosoma (buken). Huvudskölden innehåller mundelar såsom palper och chelicerer. Chelicererna är tredelade och försedda med tänder av olika former. Hanarna använder sina chelicerer delvis för intag av föda, men huvudsakligen för att överföra spermatoforer till honorna. En ryggsköld täcker nästan hela kroppen (idiosoma). En stor del av honornas kropp utgörs av reproduktionsorganen, som är särskilt framträdande strax innan äggläggningen. På buksidan återfinns två sköldar, den bakre och den genitala skölden. Alla ben har borst och taggar. Borsten används för att förankra kvalstren när de rör sig i jord eller ovanpå jordytan. Det första benparet används främst som antenner. Det andra benparet används inte bara för förflyttning utan även för att hålla fast bytesdjuren. Taggarna på det fjärde benparet kan fungera både som skydd och som ’framdrivande motor’ (28). Hanarna är 0,55–0,65 mm långa och väger 10–15 μg. Honorna är 0,8–0,9 mm långa och väger 50–60 μg (8) (28) (figur 1).
Figur 1
hona, hane, protonymf och larv av H. aculeifer.

Vid 23 °C blir kvalstren könsmogna efter 16 dagar (honor) respektive 18 dagar (hanar) (6). Honorna överför sperman via könsöppningar (solenostom) till ovarierna. I ovarierna lagras och mognar sperman. Befruktningen sker endast efter att spermierna har mognat i ovarierna. De befruktade eller obefruktade äggen läggs i klumpar eller enskilt, helst i springor eller hål. Honor som parat sig kan få avkomma av båda könen, men ägg från oparade honor ger endast upphov till hanar. Under utvecklingen till adulter genomgår kvalstren fyra utvecklingsstadier (ägg–larv, larv–protonymf, protonymf–deutonymf, deutonymf–adult).
Äggen är mjölkvita, genomskinliga, elliptiska och cirka 0,37 mm långa med ett fast ytterhölje. Larverna är mellan 0,42 och 0,45 mm långa (8). De har endast tre par ben. I huvudregionen utvecklas palper och chelicerer. Chelicererna, som har ett fåtal småtänder, används vid kläckningen. Efter den första skalömsningen, 1–2 dagar efter kläckningen, utvecklas protonymferna. De är också vita, storleken är 0,45–0,62 mm (8) och de har fyra benpar. Chelicererna har nu alla sina tänder. Från och med detta stadium börjar kvalstren söka efter föda. Bytesdjurens yttre hinna genomborras då med chelicererna och ett matsmältningssekret sprutas in i bytesdjuren. Den delvis smälta födan kan sedan sugas upp av kvalstret. Chelicererna kan också användas till att riva loss större foderpartiklar från foderklumpar (28). Efter ytterligare en skalömsning utvecklas deutonymferna. De är 0,60–0,80 mm (8) i storlek och gula till ljusbruna i färgen. Från och med denna fas kan honorna differentieras från hanarna. Efter ytterligare en hudömsning, under vilken djuren är inaktiva och den bruna skölden utvecklas (efter cirka 14 dagar), har kvalstren nått adult stadium (28) (29) (30). Deras livslängd är mellan 48 och 100 dagar vid 25 °C (27).
Tillägg 8
Sammanfattning och tidsplan för de viktigaste åtgärderna som ska vidtas för att utföra Hypoaspis-testet
|
Tid (dagar)
testets början = dag 0
|
Åtgärd/uppgift
|
|
Dag – 35
till – 28
|
Flytta honor från stamkulturerna till rengjorda kärl för att inleda synkroniseringen
Två dagar senare: honorna avlägsnas
Två eller tre gånger i veckan: ge djuren tillräckligt med foder
|
|
Dag – 5 (+/– 2)
|
Bered den syntetiska jorden
|
|
Dag – 4 (+/– 2)
|
Bestäm den syntetiska jordens vattenhållningskapacitet (WHC)
Låt torka över natten
Följande dag: väg proverna och beräkna vattenhållningskapaciteten
|
|
Dag – 4 (+/– 2)
|
Förhandsfukta den syntetiska jorden för att uppnå 20–30 % av vattenhållningskapaciteten
|
|
Dag 0
|
Inled testet: tillsätt testkemikalien till den syntetiska jorden
Inför tio honor i varje replikat
Väg varje replikat
Inrätta abiotiska kontroller för fukthalten och pH-värdet, två replikat per testkärl
Låt fuktkontrollerna torka över natten
Följande dag: väg fuktkontrollerna
Följande dag: mät pH-värdet i de uttorkade abiotiska kontrollerna
|
|
Dag 3, 6, 9, 12 (ungefär)
|
Förse varje replikat med en tillräcklig mängd bytesorganismer
Väg varje replikat och tillsätt därefter förångat vatten
|
|
Dag 14
|
Avsluta testet, anordna extraktion med alla replikat plus extraktionseffektivitetskontroller
Låt vattenhaltkontrollerna torka över natten
Följande dag: väg vattenhaltkontrollerna
Följande dag: mät pH-värdet i de uttorkade kontrollerna
|
|
Dag 16
|
Avsluta extraktionen
|
|
Dag 16 +
|
Registrera antalet adulter och juveniler i det extraherade materialet
Rapportera resultaten i malltabeller
Rapportera testförfarandet på testprotokollblanketter
|
C.37. 21-DAGARS TEST PÅ FISK: EN KORTSIKTIG SCREENING FÖR ÄMNEN MED ÖSTROGEN OCH ANDROGEN AKTIVITET SAMT AROMATASHÄMMANDE VERKAN
INLEDNING
|
1.
|
Denna testmetod motsvarar OECD:s testriktlinje (TG) 230 (2009). Behovet av att utveckla och validera ett test på fisk som kan påvisa vissa endokrint aktiva kemikalier härrör från farhågor att koncentrationen av kemikalier i miljön kan orsaka negativa effekter både hos människor och vilda djur på grund av samspelet mellan dessa kemikalier och det endokrina systemet. OECD inledde 1998 en högprioriterad verksamhet för att se över befintliga riktlinjer och utveckla nya riktlinjer för undersökning och testning av potentiellt endokrinstörande ämnen. Ett inslag i verksamheten var att utveckla en testmetod för undersökning av kemikalier som är verksamma på det endokrina systemet hos fiskarter. Det 21 dagar långa endokrina screeningtestet på fisk genomgick ett omfattande valideringsprogram bestående av interlaborativa studier med utvalda kemikalier för att demonstrera testets relevans och tillförlitlighet för påvisning av östrogen- och aromatashämmande kemikalier (1) (2) (3) (4) (5) hos de tre undersökta fiskarterna (knölskallelöja, japansk risfisk och sebrafisk). Påvisning av androgen verksamhet är möjlig i knölskallelöja och japansk risfisk, men inte hos sebrafisk. Det går inte att påvisa antiandrogena kemikalier med denna testmetod. Valideringen har fackgranskats av en panel av experter utsedda av de nationella samordnarna för programmet för testriktlinjer (Test Guideline Programme) (6). Testet är inte utformat för att upptäcka särskilda hormonstörande mekanismer eftersom försöksdjuren har en intakt hypotalamus-hypofys-gonad-axel (HPG-axel), som kan reagera på kemikalier som påverkar HPG-axeln på olika nivåer. Det kortvariga reproduktionstestet på fisk (OECD TG 229) inkluderar fruktsamhet och, när så är lämpligt, histopatologiska undersökningar av könskörtlarna hos knölskallelöja, samt alla endpoints som ingår i denna testmetod. OECD TG 229 tillhandahåller en screening av kemikalier som påverkar fortplantningen genom olika mekanismer, bland annat endokrina modaliteter. Detta bör beaktas innan den lämpligaste testmetoden väljs ut.
|
|
2.
|
Denna metod beskriver ett screeningtest in vivo där könsmogna lekande hanar och honor hålls tillsammans och exponeras för en kemikalie under en begränsad del av deras livscykel (21 dagar). Vid slutet av den 21 dagar långa exponeringstiden, beroende på den art som används, mäts en eller två biomarkörer som endpoints hos hanar och honor som indikatorer på testkemikaliens östrogena aromatashämning eller androgena aktivitet. Dessa endpoints är vitellogenin och sekundära könskaraktärer. Vitellogenin mäts hos knölskallelöja, japansk risfisk och sebrafisk, medan de sekundära könskaraktärerna endast mäts hos knölskallelöja och japansk risfisk.
|
|
3.
|
Detta biologiska test fungerar som ett screeningtest in vivo av vissa endokrina verkningsmekanismer och dess tillämpning bör ses mot bakgrund av OECD Conceptual Framework for the Testing and Assessment of Endocrine Disrupting Chemicals (28).
|
INLEDANDE ÖVERVÄGANDEN OCH BEGRÄNSNINGAR
|
4.
|
Vitellogenin produceras vanligen i levern hos honor av äggläggande ryggradsdjur som respons på cirkulerande endogent östrogen. Det är en prekursor till ägguleproteiner, och när det väl har producerats i levern förs det med blodet till äggstockarna, där det tas upp och modifieras av ägg som är under utveckling. Vitellogenin är nästan inte påvisbart i plasman hos icke könsmogna hon- och hanfiskar eftersom de saknar tillräckliga halter av cirkulerande östrogen. Levern kan dock bilda och utsöndra vitellogenin som respons på exogen östrogenstimulans.
|
|
5.
|
Mätningen av vitellogenin gör det möjligt att påvisa kemikalier med olika östrogena verkningsmekanismer. Man kan påvisa ämnen med östrogena kemikalier genom mätning av vitellogenininduktionen hos hanfiskar, och detta har dokumenterats många gånger i den fackgranskade vetenskapliga litteraturen (t.ex. (7)). Vitellogenininduktion har också påvisats efter exponering för aromatiserbara androgener (8, 9). En minskning av nivåerna av cirkulerande östrogen hos honor, till exempel genom hämning av aromatas som omvandlar det endogena androgenet till det naturliga östrogenet 17-beta-östradiol, orsakar en minskning av vitellogeninkoncentrationen, som används för att påvisa kemikalier med aromatashämmande egenskaper (10, 11). Den biologiska relevansen av den vitellogeninrespons som följer östrogen hämning och aromatashämning har fastställts och har dokumenterats i stora drag. Det är dock möjligt att produktionen av VTG hos honor även kan påverkas av allmän toxicitet och icke-endokrina toxiska verkningsmekanismer, t.ex. hepatotoxicitet.
|
|
6.
|
Flera mätmetoder har framgångsrikt utvecklats och standardiserats för rutinmässig användning. Detta gäller artspecifika testmetoder för ELISA (enzyme-linked immunosorbent assay) som använder immunokemiska tekniker för kvantifiering av det vitellogenin som producerats i små blod- eller leverprover som insamlats från enskilda fiskar (12, 13, 14, 15, 16, 17, 18). Prov tas på blod från knölskallelöja, blod eller huvud/stjärthomogenat från sebrafisk och lever från risfisk för mätning av VTG. Hos risfisk finns det en god korrelation mellan VTG mätt i blod och i leverprover (19). Tillägg 6 innehåller rekommenderade förfaranden för provtagning för analys av vitellogenin. Utrustning för mätning av vitellogenin är lätt att få tag på. Denna utrustning bör bygga på en validerad artspecifik ELISA-metod.
|
|
7.
|
De sekundära könskaraktärerna hos hanarna av vissa fiskarter är externt synliga, kvantifierbara och mottagliga för cirkulerande nivåer av endogena androgener. Detta är fallet för knölskallelöja och risfisk, men inte för sebrafisk, som inte har några kvantifierbara sekundära könskaraktärer. Honor behåller förmågan att utveckla sekundära hanliga könskaraktärer om de exponeras för androgena kemikalier i vattnet. Flera studier finns tillgängliga i den vetenskapliga litteraturen som dokumenterar denna typ av respons hos knölskallelöja (20) och risfisk (21). En minskning av de sekundära könskaraktärerna hos hanar bör tolkas med försiktighet på grund av dålig statistisk giltighet, och bör i stället bygga på en expertbedömning och på vikten av de sammanlagda bevisen. Möjligheten att använda sebrafisk i detta test är begränsad, eftersom dessa fiskar inte har några kvantifierbara sekundära könskaraktärer som är mottagliga för androgena kemikalier.
|
|
8.
|
Hos knölskallelöja är den viktigaste indikatorn på exogen exponering för androgener antalet parningstuberkler på honornas nosar. Hos risfisk utgör antalet papillära utväxter det huvudsakliga kännetecknet hos honor för exogen exponering för androgena kemikalier. I tilläggen 5A och 5B anges rekommenderade förfaranden som bör följas vid utvärdering av könskaraktärerna hos knölskallelöja och risfisk.
|
|
9.
|
Definitioner som används i denna testmetod finns i tillägg 1.
|
PRINCIP FÖR TESTMETODEN
|
10.
|
Med denna metod exponeras han- och honfiskar som befinner sig i ett reproduktivt tillstånd tillsammans i testkärlen. Deras status som vuxna djur som befinner sig i ett reproduktionsstadium innebär att könen är tydligt särskiljbara och att de är mottagliga för exogena kemikalier, och därmed kan man göra en könsrelaterad analys av varje endpoint. Vid slutet av testet bekräftas könet med hjälp av makroskopisk undersökning av könskörtlarna efter att buken öppnats ventralt med sax. En översikt över de relevanta betingelserna för ett biologiskt test återfinns i tillägg 2. Testet inleds normalt med fisk som tagits från en population som befinner sig i lekstadium. Åldrade djur bör inte användas. Vägledning om fiskarnas ålder och reproduktiva status finns i avsnittet om urval av fisk. Testet genomförs med tre kemiska exponeringskoncentrationer och en vattenkontroll, och vid behov en lösningsmedelskontroll. Två kärl eller replikat per behandling används för risfisk och sebrafisk (varje kärl innehåller fem hanar och fem honor), medan fyra kärl eller replikat per behandling används för knölskallelöja (varje kärl innehåller två hanar och fyra honor). Detta är för att tillgodose knölskallelöjhanens territoriella beteende samtidigt som testets statistiska styrka upprätthålls. Exponeringens varaktighet är 21 dagar, och provtagningen på fiskarna sker på dag 21 av exponeringen.
|
|
11.
|
Vid provtagningen på dag 21 avlivas alla djuren på ett humant sätt. De sekundära könskaraktärerna mäts hos knölskallelöja och risfisk (se tillägg 5A och 5B), blodprov tas för bestämning av vitellogenin hos sebrafisk och knölskallelöja eller huvud/stjärt samlas in för bestämning av vitellogenin hos sebrafisk (tillägg 6), och levern samlas in för VTG-analys hos risfisk (tillägg 6).
|
KRITERIER FÖR GODKÄNNANDE AV TESTET
|
12.
|
För att testresultaten ska kunna godtas måste följande villkor uppfyllas:
|
—
|
Mortaliteten i vatten- eller lösningsmedelskontrollen bör inte överstiga 10 % i slutet av exponeringsperioden.
|
|
—
|
Halten av löst syre bör vara minst 60 % av luftmättnadsvärdet (ASV) under hela exponeringsperioden.
|
|
—
|
Vattentemperaturen bör inte vid någon tidpunkt under exponeringsperioden variera med mer än ± 1,5 °C mellan olika testkärl, och får variera med högst 2 °C från de temperaturgränser som specificerats för den art som används i testet (se tillägg 2).
|
|
—
|
Bevis bör finnas tillgängliga som visar att koncentrationen av testkemikalien i lösningen på ett tillfredsställande sätt har hållits inom ± 20 % av de genomsnittliga uppmätta värdena.
|
|
BESKRIVNING AV TESTMETODEN
Utrustning
|
13.
|
Normal laboratorieutrustning, och särskilt
|
(a)
|
syrgas- och pH-mätare,
|
|
(b)
|
utrustning för bestämning av vattnets hårdhet och alkalinitet,
|
|
(c)
|
lämplig utrustning för temperaturreglering, helst med kontinuerlig övervakning,
|
|
(d)
|
akvarier tillverkade av kemiskt inert material och tillräckligt stora för den rekommenderade fisk- och antalstätheten (se tillägg 2),
|
|
(e)
|
leksubstrat för knölskallelöja och sebrafisk (tillägg 4 innehåller de uppgifter som behövs),
|
|
(f)
|
lämplig precisionsvåg (t.ex. noggrannhet ± 0,5 mg).
|
|
Vatten
|
14.
|
Allt vatten i vilket testarten uppvisar lämplig överlevnad och tillväxt kan användas som testvatten. Vattnet ska hålla jämn kvalitet under hela testperioden. Vattnets pH bör ligga inom intervallet 6,5–8,5 men får dock under ett givet test variera med högst ± 0,5 pH-enheter. För att säkerställa att utspädningsvattnet inte påverkar testresultaten på oönskat sätt (t.ex. genom komplexbildning med testkemikalien) bör vattenprover tas regelbundet för analys. Mätningar av tungmetaller (t.ex. Cu, Pb, Zn, Hg, Cd och Ni), viktiga anjoner och katjoner (t.ex. Ca2+, Mg2+, Na+, K+, Cl– och SO4
2–), bekämpningsmedel (t.ex. total mängd organiska fosforföreningar eller total mängd organiska klorföreningar), halten organiskt kol och uppslammade partiklar bör göras t.ex. var tredje månad i fall där man vet att utspädningsvattnet håller en relativt jämn kvalitet. Om vattenkvaliteten har visat sig vara jämn under minst ett år kan dessa kontroller göras med längre intervaller (t.ex. var sjätte månad). Några kemiska egenskaper för godtagbart utspädningsvatten anges i tillägg 3.
|
Testlösningar
|
15.
|
Testlösningar med de valda koncentrationerna bereds genom utspädning av en stamlösning. Stamlösningen bör helst beredas genom att man helt enkelt blandar eller skakar testkemikalien i utspädningsvattnet på mekanisk väg (t.ex. omrörning eller ultraljud). Mättnadskolonner (löslighetskolonner) kan användas för att få en stamlösning med lämplig koncentration. Användning av lösningsmedel som bärämne rekommenderas inte. Om ett lösningsmedel måste användas kan man dock inrätta en lösningsmedelskontroll som testas parallellt med samma lösningsmedelskoncentration som i de kemiska behandlingarna. För kemikalier som är svåra att testa kan lösningsmedel tekniskt sett vara den bästa lösningen. OECD:s vägledningsdokument om akvatisk toxicitetstestning av svåra ämnen och blandningar bör konsulteras i sådana fall (22). Valet av lösningsmedel avgörs av testkemikaliens kemiska egenskaper. OECD:s vägledningsdokument rekommenderar högst 100 μl/l, en rekommendation som bör iakttas. En färsk undersökning (23) visade dock på ytterligare problem vid användning av lösningsmedel när man testar för endokrin aktivitet. Det rekommenderas därför att koncentrationen av ett eventuellt lösningsmedel begränsas till ett minimum om det är tekniskt genomförbart (beroende på testkemikaliens fysikalisk-kemiska egenskaper).
|
|
16.
|
Ett genomflödestestsystem ska användas. Ett sådant system portionerar och späder kontinuerligt ut en stamlösning av testkemikalien (t.ex. med mätpump, proportionalitetslösningssystem och mättnadskärlsystem) för att tillföra en serie koncentrationer till testbehållarna. Stamlösningens och utspädningsvattnets flödeshastighet bör kontrolleras regelbundet under testets gång, helst dagligen, och får inte variera med mer än 10 % under hela testet. Man bör vara noga med att undvika att använda plaströr av låg kvalitet eller andra material som kan innehålla biologiskt aktiva kemikalier. Vid val av materialet för genomflödessystemet bör man beakta möjligheten att testkemikalien eventuellt kan adsorberas till detta material.
|
Fiskhållning
|
17.
|
Testfiskarna ska tas från en laboratoriepopulation från en enda stam som under minst två veckor före testets början har acklimatiserats för testet genom att hållas i vatten med samma kvalitet och ljusförhållanden som det som används i testet. Det är viktigt att fisk- och antalstätheten (för definitioner, se tillägg 1) anpassas för de arter som testas (se tillägg 2).
|
|
18.
|
Efter en anpassningsperiod på 48 timmar ska mortaliteten registreras och följande kriterier tillämpas:
|
—
|
Om mortaliteten under sju dagar är högre än 10 % av populationen ska hela partiet förkastas.
|
|
—
|
Om mortaliteten ligger mellan 5 och 10 % av populationen fortsätts acklimatiseringen under ytterligare sju dagar. Om mer än 5 % av populationen har dött under den andra sjudagarsperioden ska hela partiet förkastas.
|
|
—
|
Om mortaliteten under sju dagar är lägre än 5 % av populationen ska partiet godtas.
|
|
|
19.
|
Fiskarna bör inte ges någon behandling mot sjukdomar under acklimatiseringsperioden, under förexponeringen, eller under exponeringsperioden.
|
Förexponering och urval av fisk
|
20.
|
En veckolång förexponeringsperiod rekommenderas då djuren placeras i kärl som liknar de som används i det verkliga testet. Fiskarna bör utfodras ad libitum under hela hållningsperioden och under exponeringsfasen. Exponeringen inleds med sexuellt dimorf vuxen fisk från en laboratoriesamling med könsmogna djur (t.ex. med tydligt synbara sekundära könskaraktärer när det gäller knölskallelöja och risfisk) som aktivt leker. För allmän vägledning (detta bör inte betraktas isolerat från observationer av ett fiskbestånds faktiska reproduktiva status), bör knölskallelöjorna vara ungefär 20 (± 2) veckor gamla, förutsatt att de har odlats vid en temperatur på 25 ± 2 °C under hela deras livstid. Japanska risfiskar bör vara ungefär 16 (± 2) veckor, förutsatt att de har odlats vid en temperatur på 25 ± 2 °C under hela deras livstid. Sebrafiskar bör vara ungefär 16 (± 2) veckor, förutsatt att de har odlats vid en temperatur på 26 ± 2 °C under hela deras livstid.
|
TESTETS UTFORMNING
|
21.
|
Tre koncentrationer av testkemikalien, en kontroll (vatten) och, vid behov, en lösningsmedelskontroll används. Uppgifterna kan analyseras för att fastställa statistiskt signifikanta skillnader mellan responsen i behandlingarna och i kontrollen. Dessa analyser kommer att klargöra huruvida ytterligare testning av mer långsiktiga negativa effekter (dvs. överlevnad, utveckling, tillväxt och reproduktion) krävs för kemikalien, snarare än att de används för riskbedömning (24).
|
|
22.
|
För sebrafisk och risfisk undersöks på testdag 21 hanar och honor från varje behandlingsnivå (fem hanar och fem honor i vart och ett av de två replikaten) och från kontrollgruppen eller -grupperna för mätning av vitellogenin och sekundära könskaraktärer, i tillämpliga fall. För knölskallelöja undersöks på dag 21 av exponeringen hanar och honor (två hanar och fyra honor i vart och ett av de fyra replikaten) och från kontrollgruppen eller -grupperna för mätning av vitellogenin och sekundära könskaraktärer.
|
Val av testkoncentrationer
|
23.
|
Vid utförandet av detta test bör den högsta testkoncentrationen fastställas utifrån den högsta tolererade koncentrationen (MTC), vilken bestäms på grundval av ett preliminärt test eller andra uppgifter om toxicitet, eller 10 mg/l, eller högsta löslighet i vatten, beroende på vilket som är lägst. MTC definieras som den högsta testade koncentrationen av testkemikalien som leder till mindre än 10 % mortalitet. Denna metod förutsätter att det finns empiriska uppgifter om akut toxicitet eller toxikologiska uppgifter utifrån vilka MTC kan uppskattas. Uppskattningar av MTC-koncentrationen kan vara otillförlitliga och kräver vanligen ett visst mått av fackmässigt omdöme.
|
|
24.
|
För detta krävs tre testkoncentrationer som skiljer sig åt med en konstant faktor som inte överstiger 10 och en kontroll med utspädningsvatten (och en lösningsmedelskontroll vid behov). Ett intervall för spridningsfaktorer på mellan 3,2 och 10 rekommenderas.
|
FÖRFARANDE
Val och vägning av testfiskarna
|
25.
|
Det är viktigt att minimera fiskarnas variationer i vikt vid början av testet. I tillägg 2 anges lämpliga storleksintervall för de arter som rekommenderas för användning i detta test. För hela det fiskbestånd som används i testet bör variationen mellan individernas vikt för hanar och honor vid testets början om möjligt hållas inom ± 20 % av den aritmetiska medelvikten för samma kön. Det rekommenderas att ett delprov av fiskbeståndet vägs före testet i syfte att uppskatta medelvikten.
|
Exponeringsförhållanden
Varaktighet
|
26.
|
Testperiodens längd är 21 dagar efter en förexponeringsperiod. Den rekommenderade förexponeringsperioden är en vecka.
|
Utfodring
|
27.
|
Fiskarna bör utfodras ad libitum med lämpligt foder (tillägg 2) i tillräcklig mängd för att upprätthålla kroppskonditionen. Det är viktigt att se till att det inte uppstår mikrobtillväxt eller att vattnet blir grumligt. Som en allmän vägledning kan sägas att den dagliga fodergivan kan delas upp i två eller tre lika stora delar för flera utfodringstillfällen per dag, med minst tre timmar mellan varje utfodring. Det kan vara godtagbart med en enda större giva, särskilt under veckosluten. Fiskarna ska inte ges något foder under de tolv timmar som föregår provtagningen/obduktionen.
|
|
28.
|
Fiskfodret bör utvärderas med avseende på förekomst av föroreningar såsom bekämpningsmedel som innehåller organiska klorföreningar, polycykliska aromatiska kolväten (PAH) och polyklorerade bifenyler (PCB). Man bör undvika att ge foder som har en hög nivå av fytoöstrogener som kan äventyra testresponsen för kända östrogenagonister (t.ex. 17-beta-östradiol).
|
|
29.
|
Oätet foder och fekalt material ska avlägsnas från testkärlen minst två gånger i veckan, t.ex. genom omsorgsfull rengöring av akvariets botten med hjälp av en hävert.
|
Ljus och temperatur
|
30.
|
Fotoperioden och vattentemperaturen bör vara anpassade efter den art som testas (se tillägg 2).
|
Frekvens för analytiska bestämningar och mätningar
|
31.
|
Innan exponeringstiden inleds bör man se till att det kemiska tillsatssystemet fungerar på lämpligt sätt. Alla nödvändiga analysmetoder bör fastställas, och man bör ha tillräckliga kunskaper om den kemiska stabiliteten i testsystemet. Under testets gång bestäms testkemikaliens koncentrationer med jämna mellanrum, enligt följande: flödeshastigheten för stamlösningarna med utspädnings- och testämne bör helst kontrolleras dagligen men minst två gånger per vecka, och bör inte variera med mer än 10 % genom hela testet. Det rekommenderas att de faktiska testkoncentrationerna mäts i samtliga kärl vid testets början och därefter varje vecka.
|
|
32.
|
Det rekommenderas att resultaten baseras på de uppmätta koncentrationerna. Om koncentrationen av testkemikalien i lösningen på ett tillfredsställande sätt har hållits inom ± 20 % av den nominella koncentrationen under hela testperioden kan resultaten baseras antingen på nominella eller på uppmätta värden.
|
|
33.
|
Proverna kan behöva filtreras (t.ex. genom porstorlek 0,45 μm) eller centrifugeras. I sådana fall rekommenderas centrifugering. Om testmaterialet inte adsorberas på filter kan dock även filtrering godtas.
|
|
34.
|
Under testet bör halten löst syre, temperaturen och pH-värdet mätas i samtliga kärl minst en gång per vecka. Den totala hårdheten och alkaliniteten bör mätas i kontrollerna och i ett kärl med den högsta koncentrationen minst en gång per vecka. Temperaturen ska helst övervakas kontinuerligt i minst ett testkärl.
|
Observationer
|
35.
|
Ett antal allmänna (t.ex. överlevnad) och grundläggande biologiska responser (t.ex. vitellogeninnivåer) bedöms under testets gång eller vid testets slut. Mätningen och utvärderingen av dessa endpoints och deras användbarhet beskrivs nedan.
|
Överlevnad
|
36.
|
Fiskarna bör undersökas en gång per dag under testperioden. All mortalitet bör registreras, och döda fiskar bör avlägsnas så snart som möjligt. Döda fiskar ska inte ersättas, vare sig i kontrollerna eller behandlingskärlen. Könet på de fiskar som dött under testet bör fastställas genom makroskopisk utvärdering av könskörtlarna.
|
Beteende och utseende
|
37.
|
Allt onormalt beteende (i jämförelse med kontrollerna) ska registreras. Detta kan omfatta tecken på allmän toxicitet, inklusive hyperventilering, okoordinerat simbeteende, förlust av balansen och atypisk passivitet eller atypiskt ätbeteende. Dessutom bör yttre abnormiteter (t.ex. blödningar eller missfärgning) noteras. Sådana tecken på toxicitet bör övervägas noga vid tolkningen av data eftersom de kan vara tecken på koncentrationer vid vilka biomarkörerna för endokrin aktivitet inte är tillförlitliga. Sådana observationer rörande beteendet kan också ge kvalitativ information som påverkar framtida krav för test på fisk. Till exempel har territoriell aggressivitet observerats hos normala hanar och maskuliniserade honor av knölskallelöja under exponering för androgener, och för sebrafiskar har det typiska parnings- och romläggningsbeteendet efter ljusperiodens början vid gryningen reducerats eller fördröjts på grund av exponering för östrogener eller antiandrogener.
|
|
38.
|
Eftersom vissa aspekter av utseendet (huvudsakligen färgen) snabbt kan ändras vid hantering är det viktigt att kvalitativa iakttagelser görs innan djuren avlägsnas från testsystemet. Erfarenheterna hittills med knölskallelöja tyder på att vissa endokrint aktiva kemikalier kan till en början åstadkomma förändringar av följande yttre egenskaper: kroppsfärg (ljus eller mörk), färgmönster (förekomst av vertikala strimmor) och kroppsform (huvudet och bröstpartiet). Därför bör observationer av fiskarnas fysiska utseende göras under testets gång och vid studiens slut.
|
Human avlivning av fisk
|
39.
|
På dag 21, dvs. vid slutet av exponeringen, bör fiskarna avlivas med lämpliga mängder trikain (trikainmetansulfonat, metakain, MS-222 (CAS-nr 886-86-2), 100–500 mg/l buffrat med 300 mg/l NaHCO3 (natriumvätekarbonat, CAS-nr 144-55-8) för att minska irritationen på slemhinnorna. Prov tas sedan på blod eller vävnad för bestämning av vitellogenin, så som förklarades i avsnittet om vitellogenin.
|
Observation av sekundära könskaraktärer
|
40.
|
Vissa endokrint aktiva kemikalier kan medföra förändringar i särskilda sekundära könskaraktärer (antal parningstuberkler hos knölskallelöjhanar, papillära utväxter hos risfiskhanar). Framför allt kan kemikalier med vissa verkningsmekanismer ge upphov till en onormal förekomst av sekundära könskaraktärer hos djur av det motsatta könet. Till exempel kan agonister som påverkar androgenreceptorer, såsom trenbolon, metyltestosteron och dihydrotestosteron, göra så att honor av knölskallelöja utvecklar tydliga parningstuberkler och att risfiskhonor utvecklar papillära utväxter (11, 20, 21). Det har också rapporterats att agonister som påverkar östrogenreceptorer kan minska antalet parningstuberkler och storleken på den dorsala nackvalken hos vuxna hanar (25, 26). Sådana makromorfologiska iakttagelser kan ge användbar kvalitativ och kvantitativ information som kan påverka eventuella framtida krav för test på fisk. Antalet och storleken på parningstuberklerna hos knölskallelöja och de papillära utväxterna hos risfiskar kan mätas direkt eller mer praktiskt på konserverade exemplar. Rekommenderade förfaranden för utvärdering av sekundära könskaraktärer hos knölskallelöja och risfisk finns i bilaga 5A respektive 5B.
|
Vitellogenin (VTG)
|
41.
|
Blod samlas in från den kaudala artären/venen med ett hepariniserat mikrohematokrit-centrifugerat kapillärrör, eller alternativt genom hjärtpunktering med en spruta. Beroende på fiskens storlek kan man i allmänhet samla in mellan 5–60 μl blod per individ för knölskallelöja, och 5–15 μl per individ för sebrafisk. Plasman avskiljs från blodet genom centrifugering och lagras med proteashämmare vid – 80 °C tills de analyseras med avseende på vitellogenin. Alternativt använder man levern hos risfiskar, och för sebrafiskar kan huvud/stjärthomogenatet användas som vävnadskälla för bestämning av vitellogenin (tillägg 6). Mätningen av VTG bör baseras på en validerad homolog ELISA-metod med användning av en homolog VTG-standard och homologa antikroppar. Det rekommenderas att man använder en metod som kan påvisa VTG-nivåer som är så låga som ett fåtal ng/ml plasma (eller ng/mg vävnad), vilket är bakgrundsnivån hos oexponerade hanfiskar.
|
|
42.
|
Kvalitetskontrollen av vitellogeninanalysen genomförs med hjälp av standarder, blankprov och analys av minst två replikat. För varje ELISA-metod bör ett test för matriseffekt (effekten av provutspädning) genomföras för att bestämma den minsta utspädningsfaktorn för proven. Varje ELISA-platta som används för VTG-tester bör omfatta följande kvalitetskontrollprov: minst sex kalibreringsstandarder som täcker intervallet för de väntade vitellogeninkoncentrationerna, och minst ett icke-specifikt blankprov för bindningsbestämning (som analyseras i två exemplar). Absorbansen i dessa blankprov bör vara mindre än 5 % av den högsta absorbansen i kalibreringsstandarderna. Minst två alikvoter (brunnsduplikat) av varje provutspädning analyseras. Brunnsduplikat som avviker med mer än 20 % bör analyseras på nytt.
|
|
43.
|
Korrelationskoefficienten (R2) för kalibreringskurvor ska vara högre än 0,99. En hög korrelation är dock inte tillräckligt för att garantera en adekvat prediktion av koncentrationerna inom alla intervaller. Förutom att kalibreringskurvan har en tillräckligt hög korrelationsgrad bör koncentrationen för varje standard, som beräknats utifrån kalibreringskurvan, ligga på mellan 70 och 120 % av dess nominella koncentration. Om de nominella koncentrationerna tenderar att avvika från kalibreringens regressionslinje (t.ex. vid lägre koncentrationer) kan det vara nödvändigt att dela upp kalibreringskurvan i låga respektive höga intervaller eller att använda en icke-linjär modell som gör att absorbansdata kan passas in på ett lämpligt sätt. Om kurvan delas upp bör R2 > 0,99 gälla för båda linjesegmenten.
|
|
44.
|
Detektionsgränsen (LOD) definieras som koncentrationen i den lägsta analytiska standarden, och kvantifieringsgränsen (LOQ) definieras som koncentrationen i den lägsta analytiska standarden multiplicerad med den lägsta utspädningsfaktorn.
|
|
45.
|
Varje dag som vitellogenintester utförs ska ett berikningsprov analyseras som beretts med en referensstandard för tester (inter-assay) (tillägg 7). Förhållandet mellan den förväntade koncentrationen och den uppmätta koncentrationen rapporteras tillsammans med resultaten från varje försöksomgång som utförs på samma dag.
|
DATA OCH RAPPORTERING
Utvärdering av biomarkörresponser med variansanalys (ANOVA)
|
46.
|
För att identifiera en kemikalies potentiella endokrina aktivitet jämförs responser mellan behandlings- och kontrollgrupperna med hjälp av variansanalys (ANOVA). Om en lösningsmedelskontroll används bör ett lämpligt statistiskt test utföras mellan utspädningsvatten- och lösningsmedelskontrollerna för varje endpoint. Vägledning om hur man ska hantera data rörande utspädningsvatten- och lösningsmedelskontrollerna i den efterföljande statistiska analysen finns i OECD, 2006c (27). Alla biologiska responsdata bör analyseras och rapporteras separat per kön. Om de antaganden som krävs för parametriska metoder inte uppfylls – onormal fördelning (t.ex. Shapiro-Wilks test) eller heterogen varians (Bartletts test eller Levenes test) – bör man överväga att homogenisera varianserna genom transformering av data före ANOVA utförs. Alternativt kan en viktad ANOVA övervägas. Dunnetts test (parametriserade) på en eller flera parvisa jämförelser eller Mann-Whitneys test med parametrisk justering (Bonferroni) kan användas för icke-monotona dos-responser. Andra statistiska tester kan användas (t.ex. Jonckheere-Terpstras test eller Williams test) om dos-responsen är approximativt monoton. Det statistiska flödesschemat i bilaga 8 kan vara till hjälp när man beslutar vilket statistiskt test som är det mest ändamålsenliga att använda. Ytterligare information kan också erhållas från OECD:s dokument Current Approaches to Statistical Analysis of Ecotoxicity Data (27).
|
Rapportering av testresultat
|
47.
|
Studiedata bör inbegripa följande:
|
|
Testanläggning:
|
—
|
ansvarig personal och deras studieansvar,
|
|
—
|
varje laboratorium ska ha demonstrerat sina kunskaper i användningen av ett antal representativa kemikalier.
|
|
|
|
Testkemikalie:
|
—
|
karakterisering av testkemikalien,
|
|
—
|
fysikalisk form och relevanta fysikalisk-kemiska egenskaper,
|
|
—
|
metod för beredning av testkoncentrationerna och hur ofta detta sker,
|
|
—
|
information om stabilitet och biologisk nedbrytbarhet.
|
|
|
|
Lösningsmedel:
|
—
|
karakterisering av lösningsmedlet (beskaffenhet, använd koncentration),
|
|
—
|
motivering av valet av lösningsmedel (om annat än vatten).
|
|
|
|
Försöksdjur:
|
—
|
leverantör och specifik leverantörsanläggning,
|
|
—
|
fiskens ålder vid testets början och dess reproduktiva status samt lekstatus,
|
|
—
|
uppgifter om förfarandet för acklimatisering av djuren,
|
|
—
|
fiskens kroppsvikt vid början av exponeringen (från ett delprov av fiskbeståndet).
|
|
|
|
Testbetingelser:
|
—
|
testförfarande som har använts (typ av test, fisktäthet, antalstäthet, osv.),
|
|
—
|
metod för beredning av stamlösningar och flödeshastighet,
|
|
—
|
nominella testkoncentrationer, uppmätta koncentrationer av testlösningarna varje vecka och den använda analysmetoden, medelvärden av de uppmätta värdena och standardavvikelserna i testkärlen samt bevis för att mätningarna hänför sig till testkemikaliens koncentrationer i en äkta lösning,
|
|
—
|
utspädningsvattnets egenskaper (t.ex. pH, hårdhet, alkalinitet, temperatur, halten löst syre, restklornivåer, halten organiskt kol, suspenderade fasta ämnen och eventuella andra gjorda mätningar),
|
|
—
|
vattenkvaliteten i testkärlen: pH, hårdhet, temperatur och halten löst syre,
|
|
—
|
detaljerade uppgifter om utfodringen (t.ex. typ av foder, källa, hur mycket fiskarna har fått och hur ofta samt, om möjligt, en analys av relevanta förorenande ämnen (t.ex. PCB, polycykliska aromatiska kolväten och bekämpningsmedel som innehåller organiska klorföreningar).
|
|
|
|
Resultat
|
—
|
bevis för att kontrollerna uppfyller testets godkännandekriterier,
|
|
—
|
uppgifter om mortalitet i alla koncentrationer och i kontrollen,
|
|
—
|
de statistiska analystekniker som har använts, behandlingen av data och motivering av de tekniker som har använts,
|
|
—
|
uppgifter om biologiska observationer av makromorfologi, inklusive sekundära könskaraktärer och vitellogenin,
|
|
—
|
resultaten av dataanalyserna, helst i tabellform och grafisk form,
|
|
—
|
förekomsten av eventuella ovanliga reaktioner hos fiskarna och eventuella synliga effekter som har orsakats av testkemikalien.
|
|
|
RIKTLINJER FÖR TOLKNING OCH GODKÄNNANDE AV TESTRESULTATEN
|
48.
|
Detta avsnitt innehåller några överväganden som måste göras vid tolkningen av testresultaten för de olika endpoints som uppmätts. Resultaten bör tolkas med försiktighet när testkemikalien förefaller orsaka uppenbar toxicitet eller inverka på försöksdjurens allmäntillstånd.
|
|
49.
|
När man fastställer intervallet för testkoncentrationerna bör man vara noga med att inte överskrida den högsta tolererade koncentrationen för att möjliggöra en meningsfull tolkning av data. Det är viktigt att ha minst en behandling där det inte finns några tecken på toxiska effekter. Tecken på sjukdom och tecken på toxiska effekter bör utvärderas noggrant och rapporteras. Det är till exempel möjligt att produktionen av VTG hos honor även kan påverkas av den allmänna toxiciteten och av icke-endokrina toxiska verkningsmekanismer, t.ex. hepatotoxicitet. Tolkningen av effekterna kan dock stärkas av andra behandlingsnivåer på vilka effekterna inte kompliceras av systemisk toxicitet.
|
|
50.
|
Det finns en del aspekter att beakta vid godkännandet av testresultaten. Som vägledning bör VTG-nivåerna i kontrollgrupperna med hanar och honor vara klart avgränsade och åtskilda med omkring tre storleksordningar för knölskallelöja och sebrafisk, och med ungefär en storleksordning för risfisk. Exempel på intervallerna för de värden som påträffats i kontroll- och behandlingsgrupperna finns i godkännanderapporterna (1, 2, 3, 4). Höga VTG-värden hos hanar i kontrollen skulle kunna äventyra testresponsen och testets förmåga att påvisa svaga östrogenagonister. Låga VTG-värden hos honor i kontrollen skulle kunna äventyra testresponsen och testets förmåga att påvisa aromatashämmare och östrogenantagonister. Valideringsstudierna användes för att utarbeta dessa riktlinjer.
|
|
51.
|
Om ett laboratorium inte har utfört testet tidigare eller väsentliga förändringar (t.ex. byte av fiskstam eller leverantör) har gjorts är det lämpligt att en teknisk kompetensstudie utförs. Det rekommenderas att man använder kemikalier som omfattar en rad olika verkningsmekanismer eller som påverkar ett antal olika endpoints. I praktiken uppmuntras varje laboratorium att samla in egna historiska kontrolldata för hanar och honor och att utföra ett test med en positiv kontrollkemikalie för östrogenaktivitet (t.ex. 17-beta-östradiol vid 100 ng/l, eller en känd svag agonist) som leder till ökade VTG-nivåer i hanfiskar, en positiv kontrollkemikalie för aromatashämmande effekter (t.ex. fadrozol eller prokloraz vid 300 μg/l) som leder till minskade VTG-nivåer hos honfiskar, och en positiv kontrollkemikalie för androgen aktivitet (t.ex. 17-beta-trenbolon vid 5 μg/l), som leder till induktion av sekundära könskaraktärer hos honor av knölskallelöja och risfisk. Alla dessa data kan jämföras med tillgängliga data från valideringsstudierna (1, 2, 3) för att säkerställa laboratoriekompetensen.
|
|
52.
|
I allmänhet bör mätningar av vitellogenin anses vara positiva om det finns en statistiskt signifikant ökning av VTG hos hanar (p < 0,05), eller en statistiskt signifikant minskning hos honor (p < 0,05) åtminstone vid den högsta testdosen jämfört med kontrollgruppen, och i avsaknad av tecken på allmän toxicitet. Ett positivt resultat bekräftas ytterligare om man kan påvisa ett biologiskt sannolikt samband mellan dosen och responskurvan. Som nämndes tidigare behöver inte minskningen av vitellogenin uteslutande bero på endokrina orsaker. I allmänhet bör ett positivt resultat dock tolkas som bevis för endokrin aktivitet in vivo, och normalt bör man då vidta åtgärder för ytterligare klargöranden.
|
LITTERATUR
|
(1)
|
OECD (2006a). Report of the Initial Work Towards the Validation of the 21-Day Fish Screening Assay for the Detection of Endocrine active Substances (Phase 1A). OECD Environmental Health and Safety Publications Series on Testing and Assessment No.60, ENV/JM/MONO(2006)27.
|
|
(2)
|
OECD (2006b). Report of the Initial Work Towards the Validation of the 21-Day Fish Screening Assay for the Detection of Endocrine active Substances (Phase 1B). OECD Environmental Health and Safety Publications Series on Testing and Assessment No.61, ENV/JM/MONO(2006)29.
|
|
(3)
|
OECD (2007). Final report of the Validation of the 21-day Fish Screening Assay for the Detection of Endocrine Active Substances. Phase 2: Testing Negative Substances. OECD Environmental Health and Safety Publications Series on Testing and Assessment No.78, ENV/JM/MONO(2007)25.
|
|
(4)
|
Owens, J. W. (2007). Phase 3 report of the validation of the OECD Fish Screening Assay. CEFIC LRI Project, Endocrine. http://www.cefic-lri.org/index.php?page=projects (hämtad 18 september 2008).
|
|
(5)
|
U.S. EPA (2007). Validation of the Fish Short-Term Reproduction Assay: Integrated Summary Report. Opublicerad rapport av den 15 december 2007. US Environmental Protection Agency, Washington, DC. 104 s.
|
|
(6)
|
OECD (2008). Report of the Validation Peer Review for the 21-Day Fish Endocrine Screening Assay and Agreement of the Working Group of the National Coordinators of the Test Guidelines Programme on the Follow-up of this Report. OECD Environmental Health and Safety Publications Series on Testing and Assessment No.94, ENV/JM/MONO(2008)21.
|
|
(7)
|
Sumpter och Jobling (1995). Vitellogenesis as a biomarker for estrogenic contamination of the aquatic environment. Environmental Health Perspective,103 Suppl 7,173–8 Redogörelse.
|
|
(8)
|
Pawlowski, S., Sauer, A., Shears, J. A., Tyler, C. R. och Braunbeck, T. (2004). Androgenic and estrogenic effects of the synthetic androgen 17alpha-methyltestosterone on sexual development and reproductive performance in the fathead minnow (Pimephales promelas) determined using the gonadal recrudescence assay. Aquatic Toxicology, 68:3, 277–91.
|
|
(9)
|
Andersen, L., Goto-Kazato, R., Trant, J. M., Nash, J. P., Korsgaard, B. och Bjerregaard, P. (2006). Short-term exposure to low concentrations of the synthetic androgen methyltestosterone affects vitellogenin and steroid levels in adult male zebrafish (Danio rerio). Aquatic Toxicology, 76:3–4, 343–52.
|
|
(10)
|
Ankley, G. T., Kahl, M. D., Jensen, K. M., Hornung, M. W., Korte, J. J., Makynen, E. A. och Leino, R. L. (2002). Evaluation of the aromatase inhibitor fadrozole in a short-term reproduction assay with the fathead minnow (Pimephales promelas). Toxicological Sciences, 67:1, 121–30.
|
|
(11)
|
Panter, G. H., Hutchinson, T. H., Hurd, K. S., Sherren, A., Stanley, R. D. och Tyler, C. R. (2004). Successful detection of (anti-)androgenic and aromatase inhibitors in pre-spawning adult fathead minnows (Pimephales promelas) using easily measured endpoints of sexual development. Aquatic Toxicology, 70:1, 11–21.
|
|
(12)
|
Parks, L. G., Cheek, A. O., Denslow, N. D., Heppell, S. A., McLachlan, J. A., LeBlanc, G. A. och Sullivan, C. V. (1999). Fathead minnow (Pimephales promelas) vitellogenin: purification, characterization and quantitative immunoassay for the detection of estrogenic compounds. Comparative Biochemistry and Physiology. Part C: Pharmacology, toxicology and endocrinology, 123:2, 113–25.
|
|
(13)
|
Panter, G. H., Tyler, C. R., Maddix, S., Campbell, P. M., Hutchinson, T. H., Länge, R., Lye, C. och Sumpter, J. P. (1999). Application of an ELISA to quantify vitellogenin concentrations in fathead minnows (Pimephales promelas) exposed to endocrine disrupting chemicals. CEFIC-EMSG research report reference AQ001. CEFIC, Bryssel, Belgien.
|
|
(14)
|
Fenske M., van Aerle, R. B., Brack, S. C., Tyler, C. R. och Segner, H., (2001). Development and validation of a homologous zebrafish (Danio rerio Hamilton- Buchanan) vitellogenin enzyme-linked immunosorbent assay (ELISA) and its application for studies on estrogenic chemicals. Comp. Biochem. Phys. C 129:3, 217–232.
|
|
(15)
|
Holbech, H., Andersen, L., Petersen, G. I., Korsgaard, B., Pedersen, K. L. och Bjerregaard, P. (2001). Development of an ELISA for vitellogenin in whole body homogenate of zebrafish (Danio rerio). Comparative Biochemistry and Physiology. Part C: Pharmacology, toxicology and endocrinology 130, 119–131.
|
|
(16)
|
Rose, J., Holbech, H., Lindholst, C., Noerum, U., Povlsen, A., Korsgaard, B. och Bjerregaard, P. (2002). Vitellogenin induction by 17ß-estradiol and 17ß-ethinylestradiol in male zebrafish (Danio rerio). Comp. Biochem. Physiol. C. 131, 531–539.
|
|
(17)
|
Brion, F., Nilsen, B. M., Eidem, J. K., Goksoyr, A. och Porcher, J. M. Development and validation of an enzyme-linked immunosorbent assay to measure vitellogenin in the zebrafish (Danio rerio). Environmental Toxicology and Chemistry, vol. 21, 1699–1708.
|
|
(18)
|
Yokota, H., Morita, H., Nakano, N., Kang, I. J., Tadokoro, H., Oshima, Y., Honjo, T. och Kobayashi, K. (2001). Development of an ELISA for determination of the hepatic vitellogenin in Medaka (Oryzias latipes). Jpn J Environ Toxicol 4, 87–98.
|
|
(19)
|
Tatarazako, N., Koshio, M., Hori, H., Morita, M. och Iguchi, T. (2004). Validation of an enzyme-linked immunosorbent assay method for vitellogenin in the Medaka. Journal of Health Science 50, 301–308.
|
|
(20)
|
Ankley, G. T., Jensen, K. M., Makynen, E. A., Kahl, M. D., Korte, J. J., Homung, M. W., Henry, T. R., Denny, J. S., Leino, R. L., Wilson, V. S., Cardon, M. C., Hartig, P. C. och Gray, L. E. (2003). Effects of the androgenic growth promoter 17-beta-trenbolone on fecundity and reproductive endocrinology of the fathead minnow. Environmental Toxicology and Chemistry, 22:6, 1350–60.
|
|
(21)
|
Seki, M., Yokota, H., Matsubara, H., Maeda, M., Tadokoro, H. och Kobayashi, K. (2004). Fish full life-cycle testing for androgen methyltestosterone on medaka (Oryzias latipes). Environmental Toxicology and Chemistry, 23:3, 774–81.
|
|
(22)
|
OECD (2000) Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. Environmental Health and Safety Publications. Series on Testing and Assessment. Nr 23. Paris
|
|
(23)
|
Hutchinson, T. H., Shillabeer, N., Winter, M.J. och Pickford, D. B. (2006a). Acute and chronic effects of carrier solvents in aquatic organisms: A critical review. Redogörelse. Aquatic Toxicology 76, s. 69–92.
|
|
(24)
|
Hutchinson, T. H., Ankley, G. T., Segner, H. och Tyler, C. R. (2006b). Screening and testing for endocrine disruption in fish-biomarkers as ’signposts,’ not ’traffic lights,’ in risk assessment. Environmental Health Perspectives 114 Suppl 1,106–14.
|
|
(25)
|
Miles-Richardson, S. R., Kramer, V. J., Fitzgerald, S. D., Render, J. A., Yamini, B., Barbee, S. J. och Giesy, J. P. (1999). Effects of waterborne exposure to 17B-estradiol on secondary sex characteristics and gonads of the fathead minnow (Pimephales promelas). Aquat. Toxicol. 47, 129–145.
|
|
(26)
|
Martinovic, D., L. S. Blake, E. J. Durhan, K. J. Greene, M. D. Kahl, K. M., Jensen, E. A. Makynen, D. L. Villeneuve och G. T. Ankley. (2008). Characterization of reproductive toxicity of vinclozolin in the fathead minnow and co-treatment with an androgen to confirm an anti-androgenic mode of action. Environ. Toxicol. Chem. 27, 478–488.
|
|
(27)
|
OECD (2006c). Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. OECD environmental Health and Safety Publications Series on Testing and Assessment nr 54. ENV/JM/MONO(2006)18
|
|
(28)
|
OECD (2012) OECD Conceptual Framework for Testing and Assessment of Endocrine Disrupters (reviderad). Annex I to Draft Guidance Document on Standardised Test Guidelines for Evaluating Chemicals for Endocrine Disruption. Series on Testing and Assessment nr 150. ENV/JM/MONO(2012)22
|
Tillägg 1
Förkortningar och definitioner
Kemikalie
: ett ämne eller en blandning.
CV
: variationskoefficient.
ELISA
: Enzyme-Linked Immunosorbent Assay.
Fisktäthet
: våtvikten fisk per vattenvolym.
Antalstäthet
: antalet exemplar per vattenvolym.
VTG (vitellogenin)
: ett fosfolipoglykoprotein, en prekursor till ägguleprotein som normalt förekommer hos alla sexuellt aktiva honor av äggläggande arter.
HPG-axel
: stressaxeln, bestående av hypotalamus, hypofysen och binjurebarken.
MTC
: den högsta tolererade koncentrationen, dvs. ungefär 10 % av LC50.
Testkemikalie
: alla ämnen eller blandningar som testas med denna testmetod.
Tillägg 2
Försöksbetingelser för endokrint screeningtest på fisk
|
|
Knölskallelöja
(Pimephales promelas)
|
Japansk risfisk
(Oryzias latipes)
|
Sebrafisk
(Danio rerio)
|
|
|
Genomflödestest
|
Genomflödestest
|
Genomflödestest
|
|
|
25 ± 2 °C
|
25 ± 2 °C
|
26 ± 2 °C
|
|
|
Fluorescerande lampor (brett spektrum)
|
Fluorescerande lampor (brett spektrum)
|
Fluorescerande lampor (brett spektrum)
|
|
|
10–20 μE/m2/s, 540–1 000 lux, eller 50–100 ft-c (omgivande ljusnivåer i laboratoriet)
|
10–20 μE/m2/s, 540–1 000 lux, eller 50–100 ft-c (omgivande ljusnivåer i laboratoriet)
|
10–20 μE/m2/s, 540–1 000 lux, eller 50–100 ft-c (omgivande ljusnivåer i laboratoriet)
|
|
6.
|
Fotoperiod (övergångar mellan gryning och skymning är frivilliga, men anses dock inte vara nödvändiga)
|
|
16 timmar ljus, 8 timmar mörker
|
12–16 timmar ljus, 12–8 timmar mörker
|
12–16 timmar ljus, 12–8 timmar mörker
|
|
|
< 5 g/l
|
< 5 g/l
|
< 5 g/l
|
|
8.
|
Testbehållarens storlek
|
|
Minst 10 l
|
Minst 2 l
|
Minst 5 l
|
|
|
Minst 8 l
|
Minst 1,5 l
|
Minst 4 l
|
|
10.
|
Volymutbyte av testlösningar
|
|
Minst 6 per dag
|
Minst 5 per dag
|
Minst 5 per dag
|
|
11.
|
Testorganismernas ålder
|
|
Se punkt 20
|
Se punkt 20
|
Se punkt 20
|
|
12.
|
Ungefärlig färskvikt för en vuxen fisk (g)
|
|
Honor: 1,5 ± 20 %
Hanar: 2,5 ± 20 %
|
Honor: 0,35 ± 20 %
Hanar: 0,35 ± 20 %
|
Honor: 0,65 ± 20 %
Hanar: 0,4 ± 20 %
|
|
13.
|
Antal fiskar per testkärl
|
|
6 (2 hanar och 4 honor)
|
10 (5 hanar och 5 honor)
|
10 (5 hanar och 5 honor)
|
|
|
= 3 (plus lämpliga kontroller)
|
= 3 (plus lämpliga kontroller)
|
= 3 (plus lämpliga kontroller)
|
|
15.
|
Antal kärl per behandling
|
|
Minst 4
|
Minst 2
|
Minst 2
|
|
16.
|
Antal fiskar per testkoncentration
|
|
16 vuxna honor och 8 hanar (4 honor och 2 hanar i varje replikatkärl)
|
10 vuxna honor och 10 hanar (5 honor och 5 hanar i varje replikatkärl)
|
10 vuxna honor och 10 hanar (5 honor och 5 hanar i varje replikatkärl)
|
|
|
Levande eller frysta vuxna eller nauplier av Artemia två eller tre gånger dagligen (ad libitum), kommersiellt tillgängligt foder eller en blandning av dessa
|
Artemia-nauplier två eller tre gånger dagligen (ad libitum), kommersiellt tillgängligt foder eller en blandning av dessa
|
Artemia-nauplier två eller tre gånger dagligen (ad libitum), kommersiellt tillgängligt foder eller en blandning av dessa
|
|
|
Ingen såvida inte halten löst syre sjunker under 60 % luftmättnad
|
Ingen såvida inte halten löst syre sjunker under 60 % luftmättnad
|
Ingen såvida inte halten löst syre sjunker under 60 % luftmättnad
|
|
|
Rent yt- eller brunnsvatten, rekonstituerat vatten eller avklorerat kranvatten
|
Rent yt- eller brunnsvatten, rekonstituerat vatten eller avklorerat kranvatten
|
Rent yt- eller brunnsvatten, rekonstituerat vatten eller avklorerat kranvatten
|
|
|
7 dagar rekommenderas
|
7 dagar rekommenderas
|
7 dagar rekommenderas
|
|
21.
|
Den kemiska exponeringens varaktighet
|
|
21 dagar
|
21 dagar
|
21 dagar
|
|
|
överlevnad
beteende
sekundära könskaraktärer
VTG
|
överlevnad
beteende
sekundära könskaraktärer
VTG
|
överlevnad
beteende
VTG
|
|
23.
|
Testets godkännandekriterier
|
|
Löst syre > 60 % av luftmättnadsvärdet, medeltemperatur 25 ± 2 °C, 90 % överlevnad i kontrollerna, uppmätta testkoncentrationer inom 20 % av medelvärdet för de uppmätta värdena per behandlingsnivå.
|
Löst syre > 60 % av luftmättnadsvärdet, medeltemperatur 24 ± 2 °C, 90 % överlevnad i kontrollerna, uppmätta testkoncentrationer inom 20 % av medelvärdet för de uppmätta värdena per behandlingsnivå.
|
Löst syre > 60 % av luftmättnadsvärdet, medeltemperatur 26 ± 2 °C, 90 % överlevnad i kontrollerna, uppmätta testkoncentrationer inom 20 % av medelvärdet för de uppmätta värdena per behandlingsnivå.
|
Tillägg 3
Några kemiska egenskaper för godtagbart utspädningsvatten
|
Komponent
|
Koncentrationer
|
|
Partiklar
|
< 20 mg/l
|
|
Halt av organiskt kol
|
< 2 mg/l
|
|
Ojoniserad ammoniak
|
< 1 μg/l
|
|
Resterande mängd klor
|
< 10 μg/l
|
|
Total mängd bekämpningsmedel som innehåller organiska fosforföreningar
|
< 50 ng/l
|
|
Total mängd bekämpningsmedel som innehåller organiska klorföreningar samt polyklorerade bifenyler
|
< 50 ng/l
|
|
Total mängd organiskt klor
|
< 25 ng/l
|
Tillägg 4A
Leksubstrat för sebrafisk
Lekskål
: en instrumentskål av glas, t.ex. 22 × 15 × 5,5 cm (längd × bredd × djup), täckt med ett avtagbart trådgaller av rostfritt stål (maskstorlek 2 mm). Gallret bör täcka instrumentskålens öppning på en nivå som ligger under kanten.

På gallret fästs ett leksubstrat. Det ger fiskarna en struktur som de kan simma in i. Konstgjorda akvarieväxter av grön plast är till exempel lämpliga (Obs! man bör beakta möjligheten att testkemikalien adsorberas till plastmaterialet). Plastmaterialet bör lakas ut i en tillräcklig volym med varmt vatten under tillräckligt lång tid för att säkerställa att inga kemikalier läcker ut i testvattnet. Vid användning av material av glas bör man se till att fiskarna varken skadas eller blir trängda under sina intensiva rörelser.
Avståndet mellan skålen och glasrutorna bör vara minst 3 cm för att säkerställa att fiskarna inte leker utanför skålen. Den rom som läggs i skålen faller ner genom gallret och kan samlas in 45–60 minuter efter att belysningen tänts. De genomskinliga äggen är inte vidhäftande och kan lätt räknas i transversellt ljus. Om man använder fem honor per kärl kan äggantal på under 20 per dag räknas som ett lågt, upp till 100 som ett genomsnittligt och mer än 100 som ett högt antal. Lekskålen bör tas bort, äggen samlas in och lekskålen återinföras i testkärlet antingen så sent som möjligt på kvällen eller mycket tidigt på morgonen. Tiden fram till återinförandet inte bör överstiga en timme. I annat fall kan leksubstratet som trigger framkalla individuell parning och lek på ovanliga tider. Om situationen kräver ett senare införande av lekskålen bör detta göras tidigast nio timmar efter att belysningen har tänts. Vid denna sena tidpunkt på dagen framkallas inte lekbeteendet längre.
Tillägg 4B
Leksubstrat för knölskallelöja
Två eller tre kombinerade lekplattor och -skålar av keramik/plast/glas eller rostfritt stål placeras i varje testbehållare (t.ex. en 80 mm lång grå halvcirkelformad ränna i en 130 mm lång skål med uppvikt kant) (se bilden). Korrekt härdad PVC eller keramiska plattor har visat sig vara lämpliga som leksubstrat (Thorpe et al, 2007).
Det rekommenderas att plattorna är nötta för att förbättra vidhäftningen. Skålen bör också avskärmas för att förhindra fiskarna från komma åt de lagda äggen såvida inte äggens vidhäftningsförmåga har påvisats för det leksubstrat som används.

Basen är utformad för att samla upp alla ägg som inte fastnar på plattans yta och därför annars skulle falla till akvariets botten (eller de ägg som läggs direkt på den platta plastbasen). Alla leksubstrat bör lakas ur i utspädningsvatten under minst tolv timmar före användning.
HÄNVISNINGAR
Thorpe, K. L, Benstead, R., Hutchinson, T.H och Tyler C. R. (2007). An optimised experimental test procedure for measuring chemical effects on reproduction in the fathead minnow, Pimephales promelas. Aquatic Toxicology 81, 90–98.
Tillägg 5A
Bedömning av sekundära könskaraktärer hos knölskallelöja för påvisande av vissa endokrint aktiva kemikalier
Översikt
Potentiellt viktiga kännetecken för det fysiska utseendet hos vuxna knölskallelöjor i tester av hormonstörande ämnen omfattar kroppsfärgen (dvs. ljus/mörk), färgmönster (dvs. förekomst eller avsaknad av vertikala strimmor), kroppsformen (dvs. formen på huvudet och det pektorala området, uttänjd buk), och särskilda sekundära könskaraktärer (dvs. parningstuberklernas antal och storlek, storleken på nackvalken och äggläggningsröret).
Parningstuberklerna återfinns på huvudet (nackvalken) på reproduktivt aktiva hanar av knölskallelöja, och sitter normalt i ett bilateralt symmetriskt mönster (Jensen m.fl., 2001). Kontrollhonor och unga hanar och honor utvecklar inte några tuberkler (Jensen m.fl., 2001). Det kan förekomma upp till åtta enskilda tuberkler runt ögonen och mellan hanarnas luktgropar. Det flesta och största tuberklerna är belägna i två parallella linjer omedelbart under luktgroparna och ovanför munnen. Många fiskar har grupper av tuberkler under underkäken. De som sitter närmast munnen förekommer i regel som ett enda par, medan de som är belägna mer ventralt kan bestå av upp till fyra tuberkler. Det faktiska antalet tuberkler är sällan mer än 30 (intervall 18–28; Jensen m.fl., 2001). De mest framträdande tuberklerna (mätt i antal) utgörs av en enda, relativt rund struktur med en höjd som ungefär motsvarar radien. De flesta reproduktivt aktiva hanar har också åtminstone några tuberkler som är förstorade och framträdande så att de inte kan särskiljas som enskilda strukturer.
Vissa typer av endokrinstörande kemikalier kan förorsaka abnorma förekomster av vissa sekundära könskaraktärer hos det motsatta könet. Agonister som påverkar androgenreceptorer, såsom 17-beta-metyltestosteron eller 17-beta-trenbolon, kan få honor av knölskallelöja att utveckla tydliga parningstuberkler (Smith 1974; Ankley m.fl., 2001, 2003), medan agonister som påverkar östrogenreceptorer kan minska parningstuberklernas antal eller storlek hos hanar (Miles-Richardson m.fl., 1999, Harries m.fl., 2000).
Nedan följer en redogörelse av karakteriseringen av parningstuberkler hos knölskallelöja på grundval av de förfaranden som används vid den amerikanska miljöskyddsmyndighetens (EPA) laboratorium i Duluth, Minnesota. Särskilda produkter och/eller utrustning kan ersättas med tillgängliga jämförbara material.
Fiskarna kan bäst observeras med hjälp av ett belyst förstoringsglas eller i ett belyst dissekeringsmikroskop med 3x förstoring. Observera fiskarna dorsalt och med den främre delen framåt (huvudet mot betraktaren).
|
a)
|
Placera fisken i liten petriskål (t.ex. 100 mm i diameter), med främre delen framåt och buksidan nedåt. Fokusera sökaren för att göra det möjligt att identifiera tuberklerna. Rulla långsamt och försiktigt fisken från sida till sida för att identifiera tuberkelområdena. Räkna och klassificera tuberklerna.
|
|
b)
|
Upprepa observationen på den ventrala huvudytan genom att placera fisken på ryggen med huvudet framåt i petriskålen.
|
|
c)
|
Observationerna bör göras inom två minuter för varje fisk.
|
Tuberkelräkning och klassificering
Sex särskilda områden har fastställts för bedömning av förekomsten och utvecklingen av tuberkler hos vuxna knölskallelöjor. En mall har utarbetats för att kartlägga var och i vilket antal tuberklerna förekommer (se slutet av detta tillägg). Antalet tuberkler registreras och deras storlek rangordnas kvantitativt enligt följande: 0–saknas, 1–förekommer, 2–förstorad och 3–framträdande för varje organism (figur 1).
Klassificera avsaknaden av tuberkler som 0. Klassificeringen 1–förekommer definieras som alla tuberkler som har en enda punkt vars höjd är nästan lika med dess radie (diameter). Klassificeringen 2–förstorad definieras som vävnad som liknar en asterisk, vanligtvis med en stor radial bas med räfflor eller fåror som utgår från medelpunkten. På höjden är tuberkeln ofta mer taggig men kan ibland vara något avrundad. Klassificeringen 3–framträdande refererar till vanligtvis ganska stora och rundade tuberkler med mindre definition i strukturen. Ibland växer dessa tuberkler ihop och utgör en enda massa längs ett enskilt område eller en kombination av områden (B, C och D enligt beskrivning nedan). Färgen och utformningen liknar dem för klassificering 2 men är ibland ganska godtyckliga. Med hjälp av detta klassificeringssystem får man i allmänhet ett totalt tuberkelpoängvärde på < 50 för en normal kontrollhane som har 18–20 tuberkler (Jensen m.fl., 2001).
Figur 1

Det faktiska antalet tuberkler hos vissa fiskar kan vara större än antalet mallrutor (tillägg A) för ett visst klassificeringsområde. Om detta är fallet kan ytterligare klassificeringsnummer läggas till inom, till höger eller till vänster om rutan. Mallen behöver därför inte vara symmetrisk. Ytterligare en metod för kartläggning av tuberklerna som sitter ihop två och två eller vertikalt längs munnens horisontalplan är att dubbelmarkera två tuberkelklassificeringspoäng i en enda ruta.
Kartläggningsregioner:
A– Tuberkler belägna runt ögat. Kartläggs från rygg till buk runt främre kanten på ögat. Vanligtvis i flertal hos fullt utvecklade kontrollhanar, saknas hos kontrollhonor, vanligtvis parvis (en nära varje öga) eller i ental hos honor som exponerats för androgener.
B– Tuberkler belägna mellan luktgroparna (sinneskanalporer). Vanligtvis parvis hos kontrollhanar vid mer förhöjda nivåer (2–förstorad eller 3–framträdande). Saknas hos kontrollhonor med viss förekomst och utveckling hos honor som exponerats för androgener.
C– Tuberkler belägna omedelbart framför luktgroparna, parallellt med munnen. I allmänhet förstorade eller framträdande hos fullt utvecklade kontrollhanar. Förekommer eller förstorade hos mindre utvecklade hanar eller androgenbehandlade honor.
D– Tuberkler belägna parallellt med munlinjen. I allmänhet klassificeras dessa som ’utvecklade’ hos kontrollhanar. Saknas hos kontrollhonor men förekommer hos androgenexponerade honor.
E– Tuberkler belägna på underkäken, nära munnen, vanligtvis små och vanligen i par. Varierar hos kontrollhanar och behandlade hanar samt behandlade honor.
F– Tuberkler belägna ventralt jämfört med E. Vanligen små och i par. Förekommer hos kontrollhanar och androgenexponerade honor.
HÄNVISNINGAR
|
(1)
|
Ankley, G. T., Jensen, K. M., Kahl, M. D., Korte, J. J. och Makynen, M. E. (2001). Description and evaluation of a short-term reproduction test with the fathead minnow (Pimephales promelas). Environ Toxicol Chem 20, 1276–1290.
|
|
(2)
|
Ankley, G. T., Jensen, K. M., Makynen, E. A., Kahl, M. D., Korte, J. J., Hornung, M. W., Henry, T. R., Denny, J. S., Leino, R. L., Wilson, V. S., Cardon, M. C., Hartig, P. C. och Gray, E. L. (2003). Effects of the androgenic growth promoter 17-β trenbolone on fecundity and reproductive endocrinology of the fathead minnow. Environ Toxicol Chem 22, 1350–1360.
|
|
(3)
|
Harries, J. E., Runnalls, T., Hill, E., Harris, C. A.,Maddix, S., Sumpter, J. P. och Tyler, C. R. (2000). Development of a reproductive performance test for endocrine disrupting chemicals using pair-breeding fathead minnows (Pimephales promelas). Environ Sci Technol 34, 3003–3011.
|
|
(4)
|
Jensen, K. M., Korte, J. J., Kahl, M. D., Pasha, M. S. och Ankley, G. T. (2001). Aspects of basic reproductive biology and endocrinology in the fathead minnow (Pimephales promelas). Comp Biochem Physiol C 128, 127–141.
|
|
(5)
|
Kahl, M. D., Jensen, K. M., Korte, J. J. och Ankley, G. T. (2001). Effects of handling on endocrinology and reproductive performance of the fathead minnow. J Fish Biol 59, 515–523.
|
|
(6)
|
Miles-Richardson, S. R., Kramer, V. J., Fitzgerald, S. D., Render, J. A., Yamini, B., Barbee, S. J. och Giesy. J. P. (1999). Effects of waterborne exposure of 17-estradiol on secondary sex characteristics and gonads of fathead minnows (Pimephales promelas). Aquat Toxicol 47, 129–145.
|
|
(7)
|
Smith, R. J. F. (1974). Effects of 17-methyltestosterone on the dorsal pad and tubercles of fathead minnows (Pimephales promelas). Can J Zool 52, 1031–1038.
|
|
Tuberkelmall
|
Klassificering
|
|
ID
|
1–förekommer
|
|
Datum
|
2–förstorad
|
|
Poäng totalt
|
3–framträdande
|
|
|
C
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
|
|
D
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
Tillägg 5B
Bedömning av sekundära könskaraktärer hos risfisk för påvisande av vissa endokrint aktiva kemikalier
Nedan följer en redogörelse av mätningen av de papillära utväxter (21) som utgör de sekundära könskaraktärerna hos risfiskar (Oryzias latipes).
|
(1)
|
Efter avlägsnandet av levern (tillägg 6) ska kroppen placeras i en konisk tub innehållande ca 10 ml 10 % neutral buffrad formalin (huvudet uppåt, stjärten nedåt). Om könskörteln fixeras i en annan lösning än 10 % neutral buffrad formalin lägger man ett transversellt snitt över kroppen mellan den främre delen av analfenan och anus med ett rakblad, samtidigt som man undviker att skada gonoporen och könskörteln i sig (figur 3). Placera den kraniala delen av fiskkroppen i fixeringslösningen för att bevara könskörteln, och stjärtdelen av fiskkroppen i 10 % neutral buffrad formalin enligt beskrivning ovan.
|
|
(2)
|
Efter att fiskkroppen placerats i 10 % neutral buffrad formalin fattar man tag i analfenans främre del med en pincett och viker den i ca 30 sekunder så att analfenan hålls utspänd. När man lyfter upp analfenan med pincetten bör man försiktigt fatta tag i den främre delen så att man inte skadar de papillära utväxterna.
|
|
(3)
|
Efter att analfenan hållits utspänd i ca 30 sekunder bevaras fiskkroppen i 10 % neutral buffrad formalin vid rumstemperatur fram till mätningen av de papillära utväxterna (mätningen ska utföras efter fixering i minst 24 timmar).
|
Mätning
|
(1)
|
Fiskkroppen fixeras i 10 % neutral buffrad formalin i minst 24 timmar. Ta därefter upp fiskkroppen ur den koniska tuben och torka av formalinet på filterpapper (eller en pappersservett).
|
|
(2)
|
Lägg fisken med buksidan upp. Klipp sedan försiktigt av analfenan med en liten dissektionssax (det är lämpligt att klippa av analfenan tillsammans med en liten bit vävnad från fenfästet (pterygiofor)).
|
|
(3)
|
Fatta tag i den främre delen av den avskurna analfenan med en pincett och lägg den på ett objektglas med flera droppar vatten. Täck därefter analfenan med ett täckglas. Var noga med att inte skada de papillära utväxterna när analfenan hålls fast med pincetten.
|
|
(4)
|
Räkna antalet ledplattor med papillära utväxter med hjälp av räknaren under ett biologiskt mikroskop (upprätt eller inverterat mikroskop). De papillära utväxterna kan kännas igen på en liten bildning av utväxter som är synbar på den bakre kanten av fenstrålen. Skriv in antalet ledplattor med papillära utväxter på varje fenstråle i tabellen (t.ex. första fenstrålen: 0, andra fenstrålen: 10, tredje fenstrålen: 12 osv.), och skriv in summan av dessa antal i Excel-tabellen per enskild fisk. Vid behov kan man fotografera analfenan och räkna antalet ledplattor med papillära utväxter på fotot.
|
|
(5)
|
Efter mätningen läggs analfenan i den koniska tuben som beskrivs i (1) och bevaras.
|
Fig.1.
Diagram som visar könsskillnaden i analfenans storlek och form. A, hane, B, hona. Oka, T. B. (1931). On the processes on the fin rays of the male of Oryzias latipes and other sex characters of this fish. J. Fac. Sci., Tokyo Univ., IV:2, 209–218.

Fig.2.
A, Utväxter på fenstrålarnas ledplattor i analfenan. J.P. = ledplatta, A.S. = axelavstånd, P. = utväxt. B, Fenstrålens distala ände. Aktinotrikierna (Act.) sitter på spetsen. Oka, T. B. (1931). On the processes on the fin rays of the male of Oryzias latipes and other sex characters of this fish. J. Fac. Sci., Tokyo Univ., IV:2, 209–218.
Fig.3.
Fotografi av fiskkropp som visar var snittet ska läggas när könskörteln fixeras i en annan fixeringslösning än 10 % neutral buffrad formalin. I detta fall ska den övriga kroppen skäras av mellan analfenans främre kant och analöppningen med ett rakblad (röd linje), och fiskkroppens huvudsida läggs sedan i samma fixeringslösning som könskörteln och stjärtsidan läggs i 10 % neutral buffrad formalin.

Tillägg 6
Rekommenderade förfaranden för provtagning för vitellogeninanalys
Man bör vara noga med att undvika korskontaminering mellan VTG-prover från hanar och honor.
Förfarande 1A: knölskallelöja, insamling av blod från stjärtvenen/-artären
Efter bedövning skärs stjärtspolen delvis av med en skalpell och blod insamlas från den kaudala venen/artären med ett hepariniserat mikrohematokrit-centrifugerat kapillärrör. Efter att blodet har samlats in isoleras plasman snabbt genom centrifugering vid 15 000 g i 3 minuter (eller vid 15 000 g i 10 minuter vid 4 °C). Om så önskas kan procentandelen hematokrit fastställas efter centrifugeringen. Plasmadelen avlägsnas sedan från mikrohematokritröret och lagras i ett centrifugrör med 0,13 enheter aprotinin (en proteashämmare) vid – 80 °C tills bestämningen av vitellogenin kan göras. Beroende på knölskallelöjans storlek (som är könsbestämd) uppgår mängden blod som kan samlas in till 5–60 μl per fisk (Jensen m.fl., 2001).
Förfarande 1B: Knölskallelöja, insamling av blod från hjärtat
Alternativt kan blod också samlas in genom hjärtpunktering med en hepariniserad spruta (1 000 enheter heparin per ml). Blodet överförs till eppendorfrör (på is) och centrifugeras sedan (5 minuter, 7 000 g, rumstemperatur). Plasman bör överföras till rena eppendorfrör (i alikvoter om volymen plasma är tillräckligt stor) och omedelbart frysas vid – 80 °C tills den kan analyseras (Panter m.fl., 1998).
Förfarande 2A: Japansk risfisk, utskärning av levern hos risfisk
Avlägsna testfisken från testbehållaren
|
(1)
|
Testfisken bör avlägsnas ur testbehållaren med hjälp av en liten rund håv. Var noga med att inte tappa ner testfisken i de andra testbehållarna.
|
|
(2)
|
I princip ska testfiskarna avlägsnas i följande ordning: kontroll, lösningsmedelskontroll (i förekommande fall), lägsta koncentrationen, mittersta koncentrationen, högsta koncentrationen och positiv kontroll. Dessutom bör alla hanar avlägsnas från en testbehållare innan de återstående honorna avlägsnas.
|
|
(3)
|
Könet på varje testfisk fastställs på grundval av externa sekundära könskaraktärer (t.ex. formen på analfenan).
|
|
(4)
|
Placera testfisken i en behållare för transport och för den till arbetsstationen där levern skärs ut. Kontrollera att etiketterna på testbehållaren och transportbehållaren stämmer och bekräfta att det antal fiskar som har avlägsnats från testbehållaren och den antal fiskar som återstår i behållaren stämmer överens med vad som förväntas.
|
|
(5)
|
Om könet inte kan fastställas genom fiskens externa utseende avlägsnas alla fiskarna från testbehållaren. I detta fall bör könet identifieras genom granskning av könskörteln eller de sekundära könskaraktärerna under ett stereomikroskop.
|
Utskärning av levern
|
(1)
|
Överför testfisken från transportbehållaren till bedövningslösningen med den lilla runda håven.
|
|
(2)
|
Efter bedövning av testfisken överförs den till ett filterpapper (eller en pappersservett) med hjälp av en anatomisk pincett. När man lyfter upp testfisken bör man fatta tag med pincetten på sidorna av huvudet för att undvika att stjärten bryts av.
|
|
(3)
|
Torka av vattnet på ytan av testfisken på filterpappret (eller pappersservetten).
|
|
(4)
|
Lägg fisken med buksidan upp. Lägg därefter ett mindre tvärgående snitt halvvägs mellan den ventrala halsregionen och den mellersta abdominala regionen med hjälp av en dissektionssax.
|
|
(5)
|
För in dissektionssaxen i det lilla snittet och öppna buken från en punkt som är belägen kaudalt från gälmanteln till den kraniala sidan av anus längs bukens mittlinje. Var noga med att inte föra in dissektionssaxen för djupt så att levern och könskörteln skadas.
|
|
(6)
|
Utför följande steg under ett stereomikroskop.
|
|
(7)
|
Placera testfisken med buksidan upp på pappersservetten (en petriskål av glas eller ett objektglas går också bra).
|
|
(8)
|
Vik ut bukhålans väggar med en precisionspincett och blottlägg de inre organen. Det är även godtagbart att blottlägga de inre organen genom att vid behov avlägsna den ena sidan av bukhålans vägg.
|
|
(9)
|
Blotta den del som förbinder levern med gallblåsan med hjälp av en annan precisionspincett. Tag därefter fatt i gallgången och skär av gallblåsan. Var noga med att inte skada gallblåsan.
|
|
(10)
|
Tag fatt i matstrupen och skär loss mag-tarmkanalen från levern på samma sätt. Var försiktig så att inte tarminnehållet läcker ut. Skär loss den kaudala mag-tarmkanalen från anus och avlägsna den från bukhålan.
|
|
(11)
|
Skär bort fettmassan och andra vävnader från leverns utsida. Var noga med att inte skada levern.
|
|
(12)
|
Tag fatt i portasystemet med hjälp av en precisionspincett och avlägsna levern från bukhålan.
|
|
(13)
|
Placera levern på objektglaset. Avlägsna om så behövs allt övrigt fett och all främmande vävnad (t.ex. bukhinna) från leverns yta med hjälp av precisionspincetten.
|
|
(14)
|
Väg levern med ett 1,5 ml mikrorör som emballagevikt med en elektronisk analysvåg. Registrera värdet i en tabell (läs: 0,1 mg). Bekräfta identifieringsinformationen på mikroröret som innehåller levern.
|
|
(15)
|
Stäng mikrorörets lock. Förvara det i ett kylställ (eller ett isställ).
|
|
(16)
|
När levern har avlägsnats diskas dissektionsinstrumenten eller ersätts med rena.
|
|
(17)
|
Avlägsna levrarna från alla fiskar i transportbehållaren enligt beskrivning ovan.
|
|
(18)
|
När levrarna har skurits ut från alla fiskarna i transportbehållaren (dvs. alla hanar och honor i en testbehållare) placeras alla leverprover i ett provrörsställ med en etikett för identifiering och förvaras i en frys. När levrarna förs vidare till förbehandlingen strax efter utskärningen bärs proverna till nästa arbetsstation i ett kylställ (eller isställ).
|
Efter utskärningen av levern kan fiskkroppens sekundära könskaraktärer mätas.
Prov
Lagra leverproverna från testfiskarna vid ≤ – 70 °C om de inte ska användas i förbehandlingen kort efter utskärningen.
Fig-1
Ett snitt läggs precis framför bröstfenorna med en sax.

Fig-2
Buken öppnas längs mittlinjen med en sax till en punkt ungefär 2 mm kranialt från anus.

Fig-3
Bukväggarna öppnas med en pincett för blottläggning av levern och andra interna organ. (Alternativt kan bukväggarna fästas lateralt).
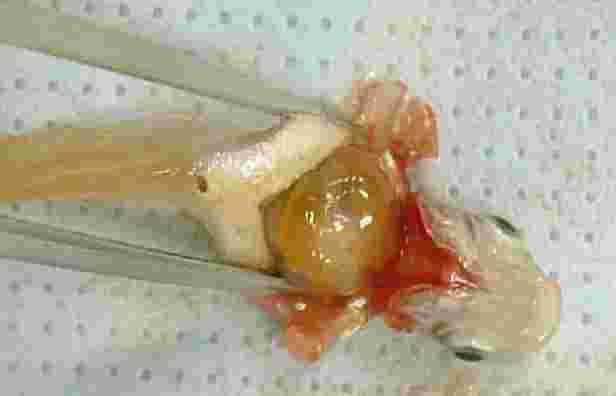
Fig-4
Levern friläggs och avlägsnas utan att skära med hjälp av en peang.

Fig-5
Tarmarna dras försiktigt ut med hjälp av peangen.

Fig-6
Båda ändarna av tarmarna och eventuellt vidhängande tarmkäx klipps av med en sax.
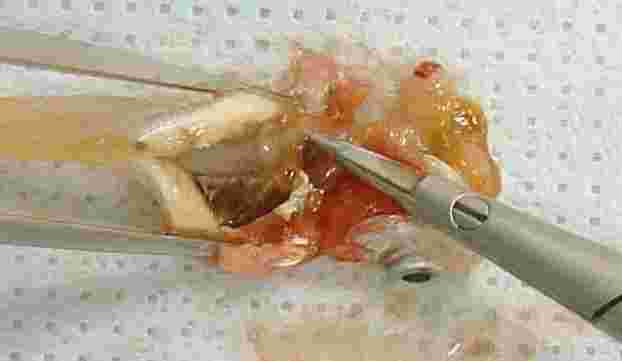
Fig-7 (hona)
Förfarandet är exakt detsamma för honor.

Fig-8
Det avslutade förfarandet.
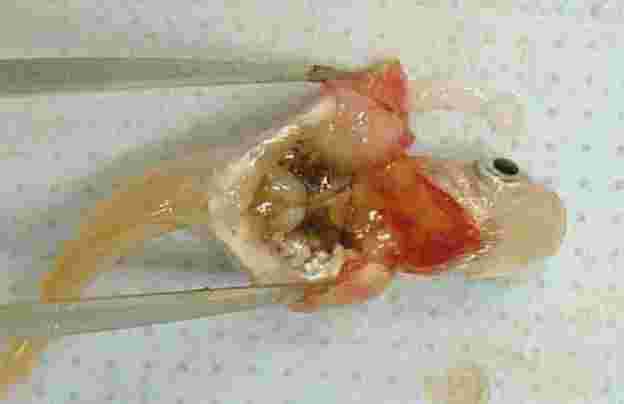
Förfarande 2B: Japansk risfisk (Oryzias latipes), förbehandling av levern för analys av vitellogenin
Ta fram flaskan med homogenatbuffertlösning från ELISA-utrustningen och kyl den med krossad is (lösningens temperatur: ≤ 4 °C). Om man använder homogenatbuffertlösningen från EnBio:s ELISA-system ska lösningen tinas vid rumstemperatur. Kyl sedan ner flaskan med krossad is.
Beräkna volymen av homogenatbuffertlösningen för levern på grundval av dess vikt (tillsätt 50 μl av homogenatbuffertlösningen per mg av levervikten för homogenatet). Om levern till exempel väger 4,5 mg är homogenatbuffertlösningens volym för levern 225 μl. Gör upp en förteckning över homogenatbuffertlösningens volym för alla levrarna.
Förberedelse av levern för förbehandling
|
(1)
|
Ta ut det 1,5 ml mikrorör som innehåller levern ur frysen strax före förbehandlingen.
|
|
(2)
|
Förbehandlingen av levrar från hanar bör genomföras före förbehandlingen av honornas levrar för att undvika kontaminering av vitellogenin. Förbehandlingen för testgrupperna bör dessutom utföras i följande ordning: kontroll, lösningsmedelskontroll (i förekommande fall), lägsta koncentrationen, mittersta koncentrationen, högsta koncentrationen och positiv kontroll.
|
|
(3)
|
Antalet 1,5 ml mikrorör som innehåller leverprover som tagits ut ur frysen vid en viss tidpunkt bör inte överstiga det antal som kan centrifugeras vid den tidpunkten.
|
|
(4)
|
Ordna 1,5 ml mikrorören som innehåller leverprover efter de nummer proven har i isstället (levern behöver inte tinas).
|
Utförandet av förbehandlingen
1. Tillsats av homogeniseringsbuffertlösningen
|
(1)
|
Kontrollera på förteckningen vilken volym av homogenatbuffertlösningen som ska användas för ett visst leverprov och ställ in mikropipetten (volym: 100–1 000 μl) på den lämpliga volymen. Fäst en ren spets på mikropipetten.
|
|
(2)
|
Pipettera upp homogenatbuffertlösningen från reagensflaskan och tillsätt 1,5 ml buffertlösning i det 1,5 ml mikrorör som innehåller levern.
|
|
(3)
|
Tillsätt homogenatbuffertlösningen i alla 1,5 ml mikrorör som innehåller levrar enligt det förfarande som beskrivs ovan. Det finns ingen anledning att byta ut mikropipettspetsen med en ny. Om spetsen har blivit kontaminerad eller misstänks vara kontaminerad bör den dock bytas ut.
|
2. Homogenisering av levern
|
(1)
|
Fäst en ny mortelstöt för homogenisering på mikrorörshomogenisatorn.
|
|
(2)
|
För in mortelstöten i 1,5 ml mikroröret. Håll mikrorörshomogenisatorn och pressa levern mellan mortelstötens yta och innerväggen på 1,5 ml mikroröret.
|
|
(3)
|
Kör mikrorörshomogenisatorn i 10–20 sekunder. Kyl ner 1,5 ml mikroröret med krossad is när detta görs.
|
|
(4)
|
Ta ut mortelstöten från 1,5 ml mikroröret och låt det stå i ca 10 sekunder. Kontrollera därefter suspensionen visuellt.
|
|
(5)
|
Om man kan se delar av lever i suspensionen ska steg (3) och (4) upprepas tills ett godtagbart leverhomogenat har beretts.
|
|
(6)
|
Kyl ner det suspenderade leverhomogenatet i isstället till dess att centrifugeringen utförs.
|
|
(7)
|
Byt ut mortelstöten mot en ny för varje homogenat.
|
|
(8)
|
Homogenisera alla levrar med homogenatbuffertlösningen enligt det förfarande som beskrivs ovan.
|
3. Centrifugering av det suspenderade leverhomogenatet
|
(1)
|
Bekräfta att temperaturen i kylcentrifugkammaren är ≤ 5 °C.
|
|
(2)
|
Ställ in 1,5 ml mikrorören som innehåller de suspenderade leverhomogenaten i kylcentrifugen (justera jämvikten vid behov).
|
|
(3)
|
Centrifugera de suspenderade leverhomogenaten vid 13 000 g i 10 minuter vid ≤ 5 °C. Om supernatanterna är tillräckligt separerade kan dock centrifugalkraften och varaktigheten justeras efter behov.
|
|
(4)
|
Efter centrifugeringen kontrolleras att supernatanterna är tillräckligt separerade (yta: fett, mellanparti: supernatant, bottenskikt: levervävnad). Om skikten inte är tillräckligt separerade centrifugeras suspensionen igen under samma betingelser.
|
|
(5)
|
Avlägsna alla prov från kylcentrifugen och ordna dem efter de nummer proven har i isstället. Var noga med att inte återsuspendera de åtskilda skikten efter centrifugeringen.
|
4. Insamling av supernatanten
|
(1)
|
Placera fyra 0,5 ml mikrorör i provrörsstället för lagring av supernatanten.
|
|
(2)
|
Samla in 30 μl supernatant (separerad som det mellanliggande skiktet) med mikropipetten och tillsätt supernatanten till ett 0,5 ml mikrorör. Var noga med att inte få med fettet på ytan eller levervävnaden i det undre lagret.
|
|
(3)
|
Samla in supernatanten och tillsätt den till två andra 0,5 ml mikrorör på samma sätt som beskrivs ovan.
|
|
(4)
|
Samla in resten av supernatanten med mikropipetten (om möjligt: ≥ 100 μl). Tillsätt därefter supernatanten till de återstående 0,5 ml mikrorören. Var noga med att inte få med fettet på ytan eller levervävnaden i det undre lagret.
|
|
(5)
|
Stäng locket på 0,5 ml mikroröret och anteckna supernatantens volym på etiketten. Kyl därefter omedelbart ner mikrorören i isstället.
|
|
(6)
|
Byt ut spetsen på mikropipetten till en ny för varje supernatant. Om en stor mängd fett fäster sig vid spetsen bör den omedelbart bytas ut mot en ny för att undvika kontaminering av leverextraktet med fett.
|
|
(7)
|
Fördela hela den centrifugerade supernatanten i 0,5 ml mikrorör enligt det förfarande som beskrivs ovan.
|
|
(8)
|
Efter att supernatanten har tillsatts till 0,5 ml mikrorör placeras de alla i provrörsstället med identifieringsetiketten och fryses sedan omedelbart ner i frysen. Om VTG-halterna ska mätas omedelbart efter förbehandlingen hålls ett 0,5 ml mikrorör (med 30 μl supernatant) kallt i provrörsstället och överförs sedan till arbetsstationen där ELISA-testet utförs. I ett sådant fall ska alla övriga mikrorör placeras i provrörsställen och frysas ner i frysen.
|
|
(9)
|
Efter insamling av supernatanten kasseras restprodukterna på lämpligt sätt.
|
Lagring av provet
Lagra 0,5 ml mikrorören som innehåller supernatanten av leverhomogenatet vid ≤ – 70 °C tills de används för ELISA-testet.
Förfarande 3A: Sebrafisk, insamling av blod från den kaudala venen/artären
Omedelbart efter bedövning skärs stjärtspolen av transversalt, och blodet insamlas från den kaudala artären/venen med ett hepariniserat mikrohematokrit-centrifugerat kapillärrör. Volymerna blod varierar mellan 5 och 15 μl beroende på fiskens storlek. En lika stor mängd buffertlösning med aprotinin (6 μgml i fosfatbuffrad saltlösning (PBS)) tillsätts i mikrokapillärröret och plasman separeras från blodet genom centrifugering (5 minuter vid 600 g). Plasman samlas i provrören och lagras vid – 20 °C tills de analyseras med avseende på vitellogenin eller andra proteiner av intresse.
Förfarande 3B: Sebrafisk, insamling av blod genom hjärtpunktering
För att undvika koagulering av blod och nedbrytning av proteiner tas proven i en buffertlösning bestående av fosfatbuffrad saltlösning (PBS) som innehåller heparin (1 000 enheter/ml) och proteashämmaren aprotinin (2 TIU/ml). Som ingredienser i buffertlösningen rekommenderas heparin (ammoniumsalt) och frystorkad aprotinin. För blodprovstagning rekommenderas en spruta (1 ml) med en fast tunn nål (t.ex. Braun omnikan-F). Sprutan ska fyllas på förhand med en buffert (ca 100 μl) för att helt eluera de små blodvolymerna från varje fisk. Blodproven tas genom hjärtpunktering. Till att börja med bör fisken bedövas med MS-222 (100 mg/l). En lämplig bedövningsnivå gör det möjligt för användaren att urskilja sebrafiskens hjärtslag. Medan hjärtpunkteringen utförs ska sprutans kolv hållas under svagt tryck. Samla in blodvolymer på mellan 20 och 40 ml. Efter hjärtpunkteringen ska blod/buffert-blandningen tillsättas i provröret. Plasman separeras från blodet genom centrifugering (20 min., 5 000 g) och bör förvaras vid – 80 °C tills den behövs för analys.
Förfarande 3C: Standardförfarande: Sebrafisk, homogenisering av huvud och stjärt
|
(1)
|
Fiskarna bedövas eller avlivas i enlighet med testbeskrivningen.
|
|
(2)
|
Huvudet och stjärten skärs av i enlighet med figur 1.
|
Obs! Alla dissektionsinstrument och skärbrädan bör sköljas och rengöras ordentligt (t.ex. med 96 % etanol) mellan hanteringen av varje enskild fisk att förhindra ’vitellogenin-förorening’ från honor eller inducerade hanar till oinducerade hanar.
Figur 1

|
(3)
|
Den sammanlagda vikten av huvud och stjärt från varje fisk mäts till närmaste mg.
|
|
(4)
|
Efter vägning placeras delarna i lämpliga rör (t.ex. 1,5 ml eppendorfrör) och fryses vid – 80 °C tills homogeniseringen, eller homogeniseras direkt på is med två mortelstötar av plast. (Andra metoder kan användas om de utförs på is och resultatet är en homogen massa). Obs! Rören ska numreras noggrant så att fiskarnas huvud och stjärt kan hänföras till deras respektive kroppar, som används för histologisk undersökning av könskörtlarna.
|
|
(5)
|
När en homogen massa erhållits tillsätts iskall homogeniseringsbuffertlösning (22) med en mängd på 4 gånger vävnadens vikt. Fortsätt att arbeta med mortelstötarna tills blandningen är homogen. Viktig anmärkning: Nya mortelstötar används för varje fisk.
|
|
(6)
|
Proven läggs på is tills centrifugeringen vid 4 °C och 50 000 × g i 30 minuter.
|
|
(7)
|
Använd en pipett för att dosera ut portioner på 20 μl supernatant i minst två rör genom att doppa pipettens spets under fettlagret på ytan och försiktigt suga upp supernatanten utan att få med fragment av fett eller små bitar.
|
|
(8)
|
Rören förvaras vid – 80 °C fram till användningen.
|
Tillägg 7
Vitellogeninberikade prover och referensstandard för tester
Varje dag som vitellogenintester utförs ska ett berikningsprov analyseras som beretts med en referensstandard för tester (inter-assay). Vitellogeninet som används för beredning av referensstandarden ska komma från ett annat parti än det som används för att bereda kalibreringsstandarderna för det test som utförs.
Ett berikningsprov bereds genom att man tillsätter en känd mängd av referensstandarden till ett prov med plasma från kontrollhanar. Provet berikas tills en vitellogeninkoncentration på mellan 10 och 100 gånger den förväntade vitellogeninkoncentrationen i hanliga kontrollfiskar uppnås. Det berikade provet med hanlig kontrollplasma kan komma från en enda fisk eller vara en blandning av flera olika fiskar.
Ett delprov av den oberikade hanliga kontrollplasman analyseras i minst två duplikatbrunnar. Det berikade provet analyseras också i minst två duplikatbrunnar. Den genomsnittliga mängden vitellogenin i de två icke-berikade hanliga kontrollproven läggs till den beräknade mängden vitellogenin som lagts till berikningsproverna i syfte att fastställa en förväntad koncentration. Förhållandet mellan denna förväntade koncentration och den uppmätta koncentrationen rapporteras tillsammans med resultaten från varje försöksomgång som utförs på samma dag.
Tillägg 8
Flödesschema över beslutsgången för den statistiska analysen
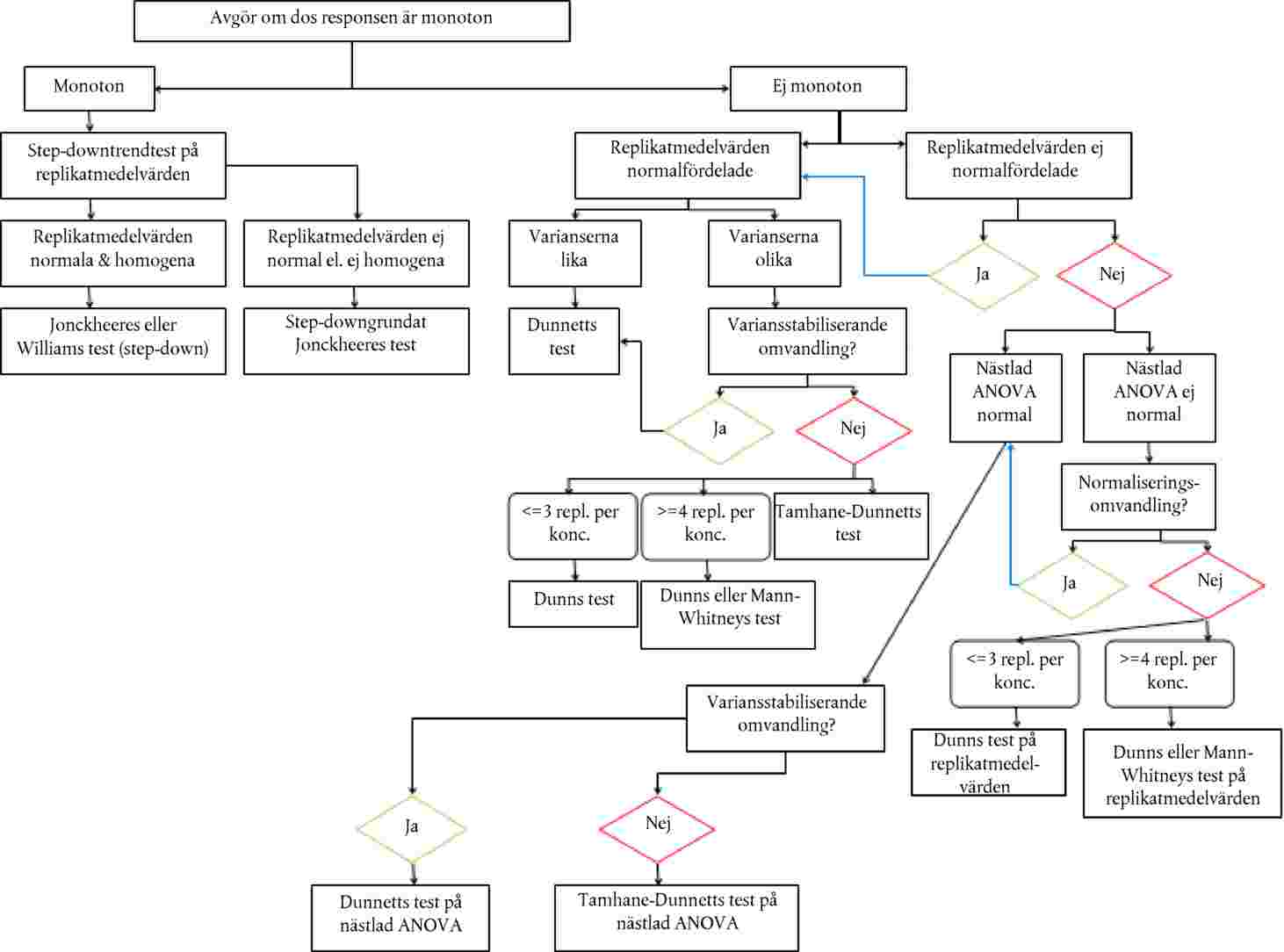
C.38. TEST PÅ GRODDJURSMETAMORFOS
INLEDNING
|
1.
|
Denna testmetod motsvarar OECD:s testriktlinje (TG) 231 (2009). Behovet av att utveckla och validera ett testsystem som kan påvisa verksamma kemikalier i sköldkörtelsystemet hos ryggradsdjur härrör från farhågor att koncentrationen av kemikalier i miljön kan orsaka negativa effekter både hos människor och vilda djur. År 1998 inledde OECD en högprioriterad verksamhet för att se över befintliga testriktlinjer och utveckla nya testriktlinjer för screening och testning av potentiellt endokrinstörande ämnen. Ett inslag i verksamheten var att utveckla en testriktlinje för screening av verksamma kemikalier i sköldkörtelsystemet hos ryggradsdjur. Både en förbättrad version av studien i kapitel B.7 i denna bilaga, 28-dagars toxicitetsstudie med upprepad oral dosering på gnagare, och testet på groddjursmetamorfos (Amphibian Metamorphosis Assay, AMA) föreslogs. Den förbättrade testmetoden B.7 har genomgått validering och en reviderad testmetod har presenterats. Testet på groddjursmetamorfos genomgick ett omfattande valideringsprogram som innefattade studier både inom och mellan laboratorier, vilka påvisade analysens relevans och tillförlitlighet (1) (2). Valideringen av analysen var därefter föremål för utvärdering av en oberoende expertpanel (3). Denna testmetod är resultatet av de erfarenheter som gjorts under valideringsundersökningarna för påvisande av sköldkörtelaktiva kemikalier, och under arbete som utförts annorstädes i OECD:s medlemsländer.
|
PRINCIP FÖR TESTMETODEN
|
2.
|
Test på groddjursmetamorfos är ett screeningtest avsett att empiriskt identifiera kemikalier som kan störa den normala funktionen i hypotalamus-hypofys-tyroideaaxeln (nedan kallad HPT-axeln). Testet på groddjursmetamorfos representerar en allmän ryggradsdjursmodell såtillvida att det är baserat på HPT-axelns oförändrade strukturer och funktioner. Det är ett viktigt test eftersom groddjursmetamorfosen utgör en grundligt undersökt sköldkörtelberoende process som svarar på kemikalier som är verksamma inom HPT-axeln, och det är det enda befintliga test som påvisar sköldkörtelaktivitet hos ett djur som genomgår en morfologisk utveckling.
|
|
3.
|
Den allmänna utformningen av testet innebär att grodyngel av arten Xenopus laevis (afrikansk klogroda) som befinner sig i stadium 51 utsätts för minst tre olika koncentrationer av testkemikalien och för en kontroll med utspädningsvatten under 21 dagar. Det finns fyra replikat för varje testkärl. Djurtätheten vid testets början är 20 grodyngel per testakvarium för alla behandlingsgrupper. Observerbara endpoints är bakbenslängd, längd från nos till kloak, utvecklingsstadium, våtvikt, sköldkörtelns histologi och dagliga observationer av dödligheten.
|
BESKRIVNING AV TESTMETODEN
Testarter
|
4.
|
Xenopus laevis odlas i laboratorier världen över och kan lätt erhållas från kommersiella leverantörer. Reproduktionen kan lätt framkallas i denna art under hela året med hjälp av injektioner av humant koriongonadotropin (hCG), och stora antal av de yngel som utvecklas till följd av detta kan rutinmässigt uppfödas till utvalda utvecklingsstadier för att möjliggöra användningen av stadiumspecifika testprotokoll. Det är att föredra att ynglen som används i testet härrör från vuxna djur som odlats i eget laboratorium. Som ett alternativ, även om detta inte är att föredra, kan ägg eller embryon sändas till det laboratorium som genomför testet och genomgå acklimatisering. Att skicka yngelstadier för användning i testet är ett oacceptabelt förfarande.
|
Utrustning och materiel
|
5.
|
Följande utrustning och materiel behövs för att utföra detta test:
|
a)
|
exponeringssystem (se beskrivning nedan),
|
|
b)
|
akvarier av glas eller rostfritt stål (se beskrivning nedan),
|
|
d)
|
temperaturkontrollanordning (t.ex. värmare eller kylare (reglerbara till 22 ± 1 °C)),
|
|
f)
|
binokulärt dissektionsmikroskop,
|
|
g)
|
digitalkamera med minst fyra megapixels upplösning och mikrofunktion,
|
|
h)
|
bilddigitaliseringsprogram,
|
|
i)
|
petriskål (t.ex. 100 × 15 mm) eller genomskinlig plastbehållare av jämförbar storlek,
|
|
j)
|
analysvåg som kan mäta värden med tre decimalers noggrannhet (mg),
|
|
m)
|
ljusintensitetsmätare som kan mäta i lux,
|
|
n)
|
diverse laboratorieglas och verktyg,
|
|
o)
|
justerbara pipetter (10–5 000 μl) eller diverse pipetter av motsvarande storlek,
|
|
p)
|
testkemikalie i tillräckliga mängder för att utföra undersökningen, helst från ett enda parti,
|
|
q)
|
lämpliga analysinstrument för testkemikalien eller upphandlade analystjänster.
|
|
Kemisk testbarhet
|
6.
|
Testet på groddjursmetamorfos bygger på ett exponeringsprotokoll i vatten enligt vilket testkemikalien tillförs testbehållarna via ett genomflödessystem. Genomflödestestmetoder medför dock begränsningar av de typer av kemikalier som kan testas, grundat på kemikaliens fysikalisk-kemiska egenskaper. Innan detta protokoll används bör därför grundläggande uppgifter om kemikalien inhämtas som är relevanta för att fastställa testbarheten, och OECD:s vägledningsdokument Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures (4) bör konsulteras. Egenskaper som pekar på att kemikalien kan vara svår att testa i akvatiska system inbegriper höga fördelningskoefficienter oktanol/vatten (log Kow), hög flyktighet, känslighet för hydrolys och känslighet för fotolys under omgivande laboratorieljusförhållanden. Även andra faktorer kan vara relevanta för att fastställa testbarheten och bör fastställas från fall till fall. Om det är omöjligt att genomföra ett framgångsrikt test med testkemikalien med hjälp av ett genomflödessystem kan ett statiskt förnyelsesystem användas. Om ingetdera system lämpar sig för testkemikalien är standardförfarandet att inte testa den med detta protokoll.
|
Exponeringssystem
|
7.
|
Ett utspädningssystem med genomströmning är att föredra, när så är möjligt, framför ett statiskt förnyelsesystem. Om någon av testkemikaliernas fysikaliska och/eller kemiska egenskaper inte lämpar sig för ett utspädningssystem med genomströmning kan ett alternativt exponeringssystem (t.ex. statisk förnyelse) användas. Systemet bör ha komponenter av glas, rostfritt stål och/eller polytetrafluoreten, som klarar kontakt med vatten. Lämpliga plaster kan dock användas om de inte äventyrar undersökningen. Exponeringsakvarierna ska vara av glas eller rostfritt stål och vara utrustade med ståndrör som klarar en ungefärlig tankvolym på mellan 4,0 och 10,0 liter och ett minsta vattendjup på 10–15 cm. Systemet bör kunna underhålla alla exponeringskoncentrationer och en kontroll, med fyra replikat per testkärl. Flödeshastigheten till varje akvarium ska vara konstant, både med tanke på bibehållandet av de biologiska betingelserna och den kemiska exponeringen (t.ex. 25 ml/min). Behandlingsakvarierna bör slumpmässigt ges en plats i exponeringssystemet för att minska eventuella positionsberoende effekter, inbegripet små variationer i temperatur, ljusintensitet osv. Lysrör bör användas för att ge en fotoperiod på 12 timmar ljus/12 timmar mörker vid en intensitet som varierar från 600–2 000 lux (lumen/m2) vid vattenytan. Vattentemperaturen bör hållas vid 22 ± 1 °C, pH-värdet mellan 6,5–8,5, och halten löst syre > 3,5 mg/l (> 40 % av luftens mättnad) i varje testakvarium. Vattentemperaturen, pH-värdet och halten löst syre bör mätas minst en gång i veckan. Temperaturen bör helst mätas kontinuerligt i minst ett testkärl. I tillägg 1 beskrivs de försöksbetingelser under vilka protokollet bör utföras. För ytterligare information om inrättandet av exponeringssystem med genomströmning och/eller statiska förnyelsesystem, se ASTM:s Standard Guide for Conducting Acute Toxicity Tests on Test Materials with Fishes, Macroinvertebrates, and Amphibians (5) och allmänna akvatiska toxikologiska tester.
|
Vattenkvalitet
|
8.
|
Allt vatten som är tillgängligt lokalt (t.ex. källvatten eller kolfiltrerat kranvatten) och tillåter normal tillväxt och utveckling av grodyngel av X. laevis kan användas. Eftersom den lokala vattenkvaliteten kan variera avsevärt från ett område till ett annat bör vattenkvaliteten analyseras, särskilt om historiska uppgifter om vattnets användbarhet för odling av Xenopus inte finns att tillgå. Man bör vara särskilt noga med att se till att vattnet är fritt från koppar, klor och kloraminer, som alla är giftiga för grodor och grodyngel. Det rekommenderas vidare att man analyserar vattnets bakgrundsnivåer av fluorid, perklorat och klorat (biprodukter från rening av dricksvatten), eftersom alla dessa anjoner är substrat av sköldkörtelns jodtransportör och ökade halter av var och en av dessa anjoner kan påverka undersökningens resultat. Analysen bör utföras innan testet inleds och testvattnet bör normalt bör vara fritt från dessa anjoner.
|
Jodidkoncentrationen i testvattnet
|
9.
|
För att sköldkörteln ska kunna bilda sköldkörtelhormoner måste tillräckligt med jodid vara tillgängligt för ynglen via en kombination av vatten- och födokällor. För närvarande finns det inga empiriskt härledda riktlinjer för minsta möjliga koncentrationer av jodid. Tillgången på jodid kan dock påverka sköldkörtelsystemets mottaglighet för sköldkörtelaktiva ämnen, och man vet att ämnet justerar sköldkörtelns grundläggande aktivitet, en aspekt som bör uppmärksammas vid tolkningen av resultaten från sköldkörtelns histopatologi. Uppmätta koncentrationer av vattenbaserat jodid i testvattnet ska därför rapporteras. Man har kunnat påvisa, grundat på tillgängliga uppgifter från valideringsstudierna, att protokollet fungerar bra när koncentrationerna av jodid (I–) i testvattnet ligger på mellan 0,5 och 10 μg/l. Helst ska jodidkoncentrationen i testvattnet vara minst 0,5 μg/l. Om testvattnet har rekonstituerats från avjonat vatten bör jod tillsättas med en koncentration på minst 0,5 μg/l. Alla ytterligare tillsatser av jod eller andra salter till testvattnet bör noteras i rapporten.
|
Djurhållning
Skötsel och avel av vuxna djur
|
10.
|
Skötsel och avel av vuxna djur bedrivs enligt standardiserade riktlinjer, och läsaren hänvisas till standardvägledningen för utförande av test avseende fosterskador hos grodor (FETAX) (6) för mer utförlig information. Sådana standardiserade riktlinjer ger exempel på lämplig skötsel och lämpliga avelsmetoder, men behöver inte strikt följas. För att framkalla parning injiceras 3–5 par vuxna honor och hanar med humant koriongonadotropin (hCG). Hon- och hanexemplar injiceras med ca 800 IU–1 000 respektive 600 IU–800 IU hCG upplöst i en 0,6–0,9-procentig saltlösning. Avelspar hålls i stora akvarier, ostört och under statiska förhållanden i syfte att uppmuntra till amplexus. Varje avelsakvarium bör ha en falsk botten av rostfritt stål eller plastnät som gör att äggen sjunker till akvariets botten. Grodor som injiceras sent på eftermiddagen kommer vanligtvis att lägga sina ägg mitt på förmiddagen dagen därpå. Efter att en tillräcklig mängd ägg har lagts och befruktats bör de vuxna djuren avlägsnas från avelsakvarierna.
|
Skötsel och urval av yngel
|
11.
|
Efter att de vuxna djuren avlägsnats från avelsakvarierna samlas äggen in och deras livsduglighet utvärderas med hjälp av en representativ delmängd av embryon från alla avelsakvarierna. De bästa enskilda romkornen (2–3 rekommenderas för att utvärdera kvaliteten på rommen) bör behållas grundat på embryots livskraft och förekomsten av ett tillräckligt antal (minst 1 500) embryon. Alla organismer som används i en undersökning ska komma från en enstaka äggläggningshändelse (dvs. rommen ska inte blandas med rom från andra individer). Embryona överförs till en stor flat bunke eller skål och alla synliga döda eller onormala ägg (se definitionen i (5)) avlägsnas med hjälp av en pipett eller ett droppglas. De friska embryona från var och en av de tre äggläggningshändelserna överförs till tre separata kläckningsakvarier. Fyra dagar efter att de har placerats i kläckningsakvarierna väljs de bästa ynglen ut, byggt på livskraft och kläckningsframgång, och ynglen överförs till ett lämpligt antal uppfödningsakvarier med en temperatur på 22 ± 1 °C. Dessutom överförs ett ytterligare antal yngel till extraakvarier för att ha i reserv om yngel dör i uppfödningsakvarierna under den första veckan. Detta förfarande bibehåller en konsekvent organismtäthet och minskar därmed de utvecklingsmässiga skillnaderna inom kohorten från samma äggläggningshändelse. Alla uppfödningsakvarier bör dagligen sugas rena. Som en försiktighetsåtgärd bör vinyl- eller nitrilhandskar användas i stället för latexhandskar. Döda djur bör avlägsnas dagligen och ersättningsyngel bör tillsättas för att upprätthålla organismtätheten under den första veckan. Utfodring bör ske minst två gånger per dag.
|
|
12.
|
Under förexponeringsfasen acklimatiseras grodynglen till betingelserna i den faktiska exponeringsfasen, inklusive fodertyp, temperatur, ljus/mörker-cykel och odlingsmediet. Det rekommenderas därför att samma odlings-/utspädningsvatten används både under förexponeringsfasen och under exponeringen. Om ett statiskt odlingssystem används för att hålla grodynglen under förexponeringsfasen bör odlingsmediet ersättas helt minst två gånger per vecka. Trängsel på grund av hög yngeltäthet under förexponeringsperioden bör undvikas, eftersom sådana effekter avsevärt skulle kunna påverka grodynglens utveckling under den påföljande testfasen. Djurtätheten under uppfödningen bör därför inte överstiga ca fyra grodyngel/l odlingsmedium (för statiska exponeringssystem) eller tio grodyngel/l odlingsmedium (med t.ex. 50 ml/min flödeshastighet i förexponerings- eller odlingssystemet). Under dessa förhållanden bör grodynglen utvecklas från stadium 45/46 till stadium 51 inom tolv dagar. Representativa grodyngel från detta bestånd bör inspekteras dagligen under utvecklingsstadiet i syfte att uppskatta den lämpliga tidpunkten för exponeringens inledning. Man bör vara noga med att inte utsätta grodynglen för stress och trauman, särskilt under förflyttning, rengöring av akvarierna och hanteringen av yngel. Stressande förhållanden/händelser bör undvikas, såsom högt och/eller ständigt buller, knackningar på akvarierna, vibrationer i akvarierna, alltför stor aktivitet i laboratoriet och snabba förändringar av miljöfaktorerna (ljus, temperatur, pH-värde, halten av löst syre, vattenflödeshastighet osv.). Om grodynglen inte utvecklas till stadium 51 inom 17 dagar efter befruktningen bör en alltför hög stressnivå betraktas som en möjlig orsak.
|
Odling och utfodring av yngel
|
13.
|
Grodynglen utfodras t.ex. med kommersiellt tillgängligt grodyngelfoder som används i valideringsstudier (se även tillägg 1) under hela förexponeringsperioden (efter stadium 45/46 enligt Nieuwkoop och Faber (NF) (8)) och under hela testperioden på 21 dagar, eller annat foder som har visat sig göra det möjligt att utföra testet på groddjursmetamorfos på ett likvärdigt sätt. Utfodringsprogrammet under förexponeringsperioden bör vara väl anpassat för att uppfylla de växande grodynglens behov. Detta innebär att små fodergivor bör ges till de nykläckta grodynglen flera gånger per dag (minst två gånger). Överbliven mat bör undvikas för att i) bevara vattenkvaliteten och ii) förhindra att grodynglens gälar täpps igen av foderpartiklar och slam. För det grodyngelfoder som används i valideringsstudierna bör den dagliga fodergivan ökas allteftersom grodynglen växer till ca 30 mg/djur/dag strax innan testet inleds. Detta kommersiellt tillgängliga foder har i valideringsstudierna visat sig stödja god tillväxt och utveckling hos yngel av X. laevis och utgörs av fina partiklar som förblir suspenderat i vattnet under en lång tid och kan sköljas bort med flödet. Den dagliga mängden foder bör därför delas upp i mindre givor och ges minst två gånger per dag. En översikt av utfodringsprogrammet för detta foder visas i tabell 1. Utfodringstakten bör registreras. Fodret kan ges torrt eller som en stamlösning som bereds i utspädningsvatten. Färsk stamlösning bör beredas varannan dag och lagras vid 4 °C när den inte används.
Tabell 1.
Utfodringsprogram med kommersiellt tillgängligt grodyngelfoder som används i valideringsstudier för yngel av X. laevis under livsdelen av testet på groddjursmetamorfos under genomflödesförhållanden
|
Undersökningsdag
|
Fodergiva (mg foder/djur/dag)
|
|
0–4
|
30
|
|
5–7
|
40
|
|
8–10
|
50
|
|
11–14
|
70
|
|
15–21
|
80
|
|
Analytisk kemi
|
14.
|
Innan man utför en studie bör testkemikaliens stabilitet utvärderas med hjälp av befintlig information om dess löslighet, nedbrytbarhet och flyktighet. Prover ska tas på testlösningarna från varje replikatakvarium vid varje koncentration för kemiska analyser vid testets inledning (dag 0), och varje vecka under testets gång med minst fyra prover. Det rekommenderas också att varje testkoncentration analyseras i samband med systemförberedelser innan testet inleds för att kontrollera systemets prestanda. Dessutom rekommenderas att stamlösningarna analyseras när de byts, särskilt om stamlösningens volym inte tillhandahåller tillräckliga mängder av kemikalien för att räcka över hela rutinprovtagningsperioden. När det gäller kemikalier som inte kan detekteras vid några av eller alla de koncentrationer som används i ett test bör stamlösningarna mätas och flödeshastigheten i systemet registreras för att beräkna de nominella koncentrationerna.
|
Tillsats av kemikalier
|
15.
|
Den metod som används för tillsats av testkemikalien i systemet kan variera beroende på kemikaliens fysikalisk-kemiska egenskaper. Vattenlösliga kemikalier kan upplösas i alikvoter av testvatten vid koncentrationer som möjliggör tillsats vid den avsedda testkoncentrationen i ett genomflödessystem. Kemikalier som är flytande vid rumstemperatur och svårlösliga i vatten kan tillsättas med hjälp av vätska/vätska-mättningsmetoder. Kemikalier som är fasta vid rumstemperatur och svårlösliga i vatten kan tillsättas med hjälp av kolonnmättnadskärl med glasull (7). Helst ska man använda ett bärämnesfritt testsystem, men olika testkemikalier har olika fysikalisk-kemiska egenskaper som sannolikt kräver olika strategier för beredning av exponeringsvattnet med kemikalien. Lösningsmedel eller bärämnen för om möjligt undvikas av följande skäl: i) vissa lösningsmedel kan i sig leda till toxicitet och/eller oönskade eller oväntade endokrinologiska responser, ii) testning av kemikalier över deras vattenlöslighetsnivå (som ofta är fallet vid användning av lösningsmedel) kan leda till felaktiga bestämningar av de effektiva koncentrationerna, och iii) användning av lösningsmedel i mer långsiktiga tester kan leda till bildning av en betydande mängd ’biofilm’ (dvs. hinnor bestående av mikroorganismer) på grund av den mikrobiella aktiviteten. För kemikalier som är svåra att testa kan lösningsmedel användas som en sista utväg, och OECD:s vägledningsdokument om akvatisk toxicitetstestning av svåra ämnen och blandningar bör konsulteras (4) för att fastställa vilken metod som är bäst lämpad. Valet av lösningsmedel avgörs av testkemikaliens kemiska egenskaper. Lösningsmedel som har visat sig vara lämpliga för akvatisk toxicitetstestning inbegriper aceton, etanol, metanol, dimetylformamid och trietylenglykol. Om ett lösningsmedel används som bärämne bör lösningsmedlets koncentrationer ligga under den kroniska nolleffektkoncentrationen (NOEC). I OECD:s vägledningsdokument rekommenderas en koncentration på högst 100 μl/l, och i en nyligen utgiven redogörelse rekommenderas att lösningsmedelskoncentrationerna ska vara så låga som 20 μl/l utspädningsvatten (12). Om lösningsmedel används som bärämnen bör lämpliga kontroller med lösningsmedel utvärderas utöver kontrollerna utan lösningsmedel (rent vatten). Om det inte är möjligt att tillsätta en kemikalie via vattnet, antingen på grund av dess fysikalisk-kemiska egenskaper (låg löslighet) eller kemikaliens begränsade tillgång, kan man överväga att tillsätta den via födan. Begynnande forskning har gjorts på exponering via födan, men denna exponeringsväg används dock vanligen inte. Valet av metod ska dokumenteras och verifieras analytiskt.
|
Val av testkoncentrationer
Fastställande av den högsta testkoncentrationen
|
16.
|
I detta test ska den högsta testkoncentrationen bestämmas av testkemikaliens löslighetsgräns, den högsta tolererade koncentrationen (nedan kallad MTC-koncentrationen) för starkt toxiska kemikalier, eller 100 mg/l, beroende på vilken som är lägst.
|
|
17.
|
MTC-koncentrationen definieras som den högsta testkoncentration av kemikalien som leder till mindre än 10 % akut dödlighet. Om man använder denna metod förutsätter man att det finns befintliga empiriska data om den akuta dödligheten på grundval av vilka MTC-koncentrationen kan uppskattas. Uppskattningar av MTC-koncentrationen kan vara otillförlitliga och kräver vanligen ett visst mått av fackmässigt omdöme. Även om användningen av regressionsmodeller kan vara den mest tekniskt välgrundade metoden för uppskattning av MTC-koncentrationen, kan ett användbart närmevärde för MTC-koncentrationen härledas ur befintliga akuta toxicitetsuppgifter genom att använda 1/3 av det akuta LC50-värdet. Uppgifter om akut toxicitet kan dock saknas för den art som testas. Om artspecifika uppgifter om akut toxicitet inte finns att tillgå, kan ett 96-timmars LC50-test genomföras med grodyngel som är representativa för (dvs. i samma utvecklingsstadium som) ynglen som testas i testet på groddjursmetamorfos. Om data från andra vattenlevande arter finns tillgängliga (t.ex. LC50-studier av fiskar eller andra groddjursarter) kan som ett alternativ en professionell bedömning göras för att uppskatta en sannolik MTC-koncentration baserat på extrapolering mellan arter.
|
|
18.
|
Om kemikalien inte är akut toxisk och dessutom är löslig vid koncentrationer över 100 mg/l kan, som ett ytterligare alternativ, 100 mg/l betraktas som den högsta testkoncentrationen (HTC), eftersom denna koncentration vanligtvis betraktas som ’praktiskt taget icke-toxisk’.
|
|
19.
|
Även om de inte utgör det rekommenderade förfarandet kan metoder med statisk förnyelse användas om genomflödestestmetoder visar sig vara otillräckliga för att uppnå MTC-koncentrationen. Om statisk förnyelse används ska stabiliteten hos testkemikaliens koncentration dokumenteras och förbli inom gränsvärdena för utförandekriterierna. Förnyelseperioder på 24 timmar rekommenderas. Förnyelseperioder som överskrider 72 timmar kan inte godtas. Dessutom bör parametrar för vattenkvalitet (t.ex. halten löst syre, temperatur, pH osv.) mätas vid utgången av varje förnyelseperiod, omedelbart före förnyelsen.
|
Testkoncentrationsintervall
|
20.
|
Minst tre testkoncentrationer och en kontroll med rent vatten (och vid behov en vehikelkontroll) ska användas. Minsta möjliga skillnad mellan den högsta och lägsta testkoncentrationen ska vara ungefär en storleksordning. Högsta separationsfaktor mellan doserna är 0,1 och minsta 0,33.
|
FÖRFARANDE
Testets inledning och genomförande
Dag 0
|
21.
|
Exponeringen bör inledas när ett tillräckligt antal grodyngel i förexponeringspopulationen har nått utvecklingsstadium 51 enligt Nieuwkoop och Faber (8), vilket är mindre än eller lika med 17 dagars ålder efter befruktningen. Vid val av försöksdjur ska friska grodyngel med normalt utseende från stampopulationen samlas i ett enda kärl som innehåller en lämplig volym utspädningsvatten. Vid bestämning av utvecklingsstadiet ska grodynglen avlägsnas ett och ett från samlingsakvariet med hjälp av ett litet nät eller en liten sil och överföras till ett genomskinligt mätkärl (t.ex. en 100 mm petriskål) med utspädningsvatten. När man fastställer utvecklingsstadiet ska man helst inte använda bedövning, men man kan bedöva grodynglen ett och ett före hanteringen med hjälp av 100 mg/l trikainmetansulfonat (t.ex. MS-222), tillräckligt buffrat med natriumbikarbonat (pH 7,0). Om man använder bedövning ska metoder för lämplig användning av t.ex. MS-222 för bedövning erhållas från laboratorier med erfarenhet av detta och rapporteras tillsammans med testresultaten. Djuren bör hanteras varsamt under denna överföring i syfte att minimera hanteringsstress och för att undvika skada.
|
|
22.
|
Djurens utvecklingsstadium fastställs med hjälp av ett binokulärt dissektionsmikroskop. För att minska de grundläggande variationerna i utvecklingsstadier är det viktigt att fastställandet av stadierna genomförs så noggrant som möjligt. Enligt Nieuwkoop och Faber (8) är det främsta utvecklingsmässiga kännetecknet för urval av organismer i stadium 51 bakbenens morfologi. Bakbenens morfologiska egenskaper bör granskas under mikroskop. Även om Nieuwkoop och Fabers (8) kompletta riktlinjer bör konsulteras för heltäckande information om hur grodynglens utvecklingsstadier kan fastställas kan man tillförlitligt fastställa ynglens stadier genom att studera framträdande morfologiska kännetecken. Tabellen nedan kan användas för att förenkla och standardisera bestämningen av utvecklingsstadier under hela studien eftersom den fastställer de framträdande morfologiska kännetecken som är förbundna med olika stadier, under förutsättning att utvecklingen är normal.
Tabell 2.
Framträdande morfologiska kännetecken för bestämning av utvecklingsstadier baserat på Nieuwkoop och Fabers vägledning.
|
Framträdande morfologiska kännetecken
|
Utvecklingsstadium
|
|
51
|
52
|
53
|
54
|
55
|
56
|
57
|
58
|
59
|
60
|
61
|
62
|
63
|
64
|
65
|
66
|
|
Bakben
|
X
|
X
|
X
|
X
|
X
|
X
|
X
|
|
|
|
|
|
|
|
|
|
|
Framben
|
|
|
|
|
|
X
|
X
|
X
|
X
|
X
|
|
|
|
|
|
|
|
Kraniofacial struktur
|
|
|
|
|
|
|
|
|
|
X
|
X
|
X
|
X
|
|
|
|
|
Luktnervens morfologi
|
|
|
|
|
|
|
|
|
|
|
X
|
X
|
X
|
|
|
|
|
Svanslängd
|
|
|
|
|
|
|
|
|
|
|
|
|
X
|
X
|
X
|
X
|
|
|
23.
|
För att testet ska kunna inledas bör alla grodyngel befinna sig i stadium 51. Den mest framträdande morfologiska kännetecknet för detta stadium är bakbenets morfologi, som visas i figur 1.
Figur 1.
Bakbenets morfologi i stadium 51 för yngel av arten X. laevis.

|
|
24.
|
Utöver val av utvecklingsstadium kan man även välja storlek på försöksdjuren (valfritt). För detta ändamål ska hela kroppslängden (inte längden från nos till kloak) mätas på dag 0 i ett delprov på ungefär 20 grodyngel i stadium 51 enligt Nieuwkoop och Faber. Efter beräkningen av den genomsnittliga kroppslängden för denna grupp av djur kan övre och nedre gränser för försöksdjurens hela kroppslängd bestämmas genom att man tillåter längder inom ett intervall på medelvärdet ± 3 mm (genomsnittliga värden för hela kroppslängdsintervallet varierar mellan 24,0 och 28,1 mm för grodyngel i stadium 51). Fastställandet av utvecklingsstadiet är dock den primära parametern vid bedömningen av huruvida varje försöksdjur är redo att delta i testet. Grodyngel som uppvisar kraftiga synliga missbildningar eller skador används inte i testet.
|
|
25.
|
Grodyngel som uppfyller de kriterier som beskrivs ovan hålls i ett akvarium med rent odlingsvatten till dess att bestämningen av utvecklingsstadium är färdig. När bestämningen av utvecklingsstadium är färdig fördelas ynglen slumpmässigt i akvarier för exponeringsbehandling tills varje akvarium innehåller 20 yngel. Varje akvarium ska därefter kontrolleras med avseende på djur med onormalt utseende (t.ex. skador, onormalt simbeteende, etc.). Grodyngel som uppenbart verkar sjuka eller skadade bör avlägsnas från behandlingsakvarierna och ersättas med nyutvalda yngel från samlingsakvariet.
|
Observationer
|
26.
|
För mer ingående information om förfaranden vid testets slut och bearbetningen av grodynglen, se OECD:s vägledningsdokument om groddjurs sköldkörtelhistologi (Guidance Document on Amphibian Thyroid Histology) (9).
|
Mätningar, dag 7
|
27.
|
På dag 7 avlägsnas fem slumpmässigt utvalda grodyngel per replikat från varje testakvarium. Detta slumpmässiga förfarande gör att det är lika sannolikt att varje enskild organism väljs ut. Detta kan uppnås genom att man använder en randomiseringsmetod men kräver att varje grodyngel fångas i ett nät. Grodyngel som inte valts ut återbördas till sitt ursprungliga akvarium och de utvalda grodynglen avlivas på ett humant sätt, t.ex. i 150 till 200 mg/l MS-222, tillräckligt buffrad med natriumbikarbonat för att uppnå pH 7,0. De avlivade grodynglen sköljs med vatten och torkas av, varefter kroppsvikten fastställs till närmaste hela milligram. Bakbenslängd, längden från nos till kloak, och utvecklingsstadium fastställs (med hjälp av ett binokulärt dissektionsmikroskop) för varje grodyngel.
|
Mätningar, dag 21 (testavslutning)
|
28.
|
Vid testets slut (dag 21) avlägsnas de återstående grodynglen från testakvarierna och avlivas humant, t.ex. i 150 till 200 mg/l MS-222, tillräckligt buffrad med natriumbikarbonat enligt ovan. Grodynglen sköljs med vatten och torkas av, varefter kroppsvikten fastställs till närmaste hela milligram. Utvecklingsstadium, längd från nos till kloak och bakbenslängd mäts för varje grodyngel.
|
|
29.
|
Alla yngel placeras i Davidsons fixativ i 48–72 timmar antingen som helkroppsprover eller som putsade huvudvävnadsprover innehållande underkäken för histologiska bedömningar. För histopatologiska undersökningar väljs sammanlagt fem grodyngel ut från varje replikatakvarium. Eftersom höjden på de follikulära cellerna är beroende av det stadium ynglen befinner sig i (10) är den lämpligaste urvalsmetoden för histologiska analyser att använda stadium-matchade individer när så är möjligt. För att välja ut stadium-matchade individer måste alla yngels utvecklingsstadium först fastställas innan urvalet och den därpå följande bearbetningen för datainsamling och konservering. Detta är nödvändigt eftersom de normala utvecklingsskillnaderna kommer att leda till olika fördelningar av stadier inom varje replikatakvarium.
|
|
30.
|
Djur som valts ut för histopatologisk undersökning (n = 5 från varje replikat) bör matchas till medianstadiet i kontrollerna (samlade replikat) där så är möjligt. Om det finns replikatakvarier med fler än fem yngel i ett lämpligt stadium väljs fem yngel ut slumpmässigt.
|
|
31.
|
Om det finns replikatakvarier med färre än fem yngel i ett lämpligt stadium ska individer från det föregående eller efterföljande utvecklingsstadiet väljas ut slumpmässigt tills man har fem yngel totalt per replikat. Beslutet att välja ut ytterligare yngel från det föregående eller efterföljande utvecklingsstadiet bör baseras på en övergripande utvärdering av fördelningen av stadier i kontrollen och i de akvarier som utsatts för behandling med kemikalier. Detta betyder att ytterligare yngel bör tas från det föregående stadiet om den kemiska behandlingen är förbunden med en fördröjning av ynglens utveckling. Om den kemiska behandlingen är förbunden med en snabbare utveckling ska ytterligare yngel tas från det efterföljande utvecklingsstadiet.
|
|
32.
|
Om det förekommer allvarliga förändringar av grodynglens utveckling på grund av behandling med en testkemikalie kan det eventuellt inte finnas någon överlappning i fördelningen av stadier mellan de akvarier som utsatts för kemiska behandlingar och det beräknade medianutvecklingsstadiet i kontrollen. Endast i dessa fall bör urvalsprocessen modifieras genom att man använder ett stadium som skiljer sig från kontrollens medianstadium för att uppnå ett stadium-matchat urval av yngel för histopatologiska undersökningar av sköldkörteln. Om stadierna är obestämbara (dvs. asynkrona) bör fem grodyngel från varje replikat väljas ut slumpmässigt för histologisk undersökning. Den logiska grunden för urval av de yngel som inte befinner sig i ett stadium som motsvarar kontrollens medianutvecklingsstadium bör anges.
|
Bestämning av biologiska endpoints
|
33.
|
Under den 21 dagar långa exponeringsfasen mäts primära endpoints på dag 7 och dag 21, men det är nödvändigt att observera djuren dagligen. I tabell 3 ges en översikt över de endpoints som ska mätas och motsvarande observationstidpunkter. Mer detaljerad information om de tekniska förfarandena för mätning av apikala endpoints och histologiska bedömningar finns i OECD:s vägledningsdokument (9).
Tabell 3.
Observationstidpunkter för primära endpoints i testet på groddjursmetamorfos.
|
Apikala endpoints
|
Dagligen
|
Dag 7
|
Dag 21
|
|
|
ߦ
|
|
|
|
|
|
ߦ
|
ߦ
|
|
|
|
ߦ
|
ߦ
|
|
—
|
Längd från nos till kloak
|
|
|
ߦ
|
ߦ
|
|
|
|
ߦ
|
ߦ
|
|
—
|
Sköldkörtelns histologi
|
|
|
|
ߦ
|
|
Apikala endpoints
|
34.
|
Utvecklingsstadium, bakbenslängd, längd från nos till kloak och våtvikt är apikala endpoints för testet på groddjursmetamorfos, och varje endpoint diskuteras nedan i korthet. Ytterligare teknisk information för insamling av dessa uppgifter finns i de vägledande dokument som det hänvisas till, inbegripet de rekommenderade förfarandena för datorstödd analys.
|
Utvecklingsstadium
|
35.
|
Utvecklingsstadiet för grodyngel av arten X. laevis bestäms med hjälp av Nieuwkoop och Fabers kriterier för bestämning av utvecklingsstadier (8). Uppgifter om utvecklingsstadier används för att fastställa om utvecklingen är accelererad, asynkron, försenad eller opåverkad. Accelererad eller försenad utveckling bestäms genom en jämförelse mellan de medianstadier som uppnåtts i kontroll- och behandlingsgrupperna. Asynkron utveckling rapporteras när de undersökta vävnaderna inte är deformerade eller onormala men de relativa tidpunkterna för morfogenesen eller utvecklingen av olika vävnader är rubbade hos ett enda grodyngel.
|
Bakbenslängd
|
36.
|
Differentieringen och tillväxten av bakbenen styrs av sköldkörtelhormoner och utgör viktiga utvecklingsmässiga kännetecken som redan använts vid fastställandet av utvecklingsstadierna. Bakbenens utveckling används kvalitativt vid fastställandet av utvecklingsstadier, men bedöms här som en kvantitativ endpoint. Bakbenslängden mäts därför som endpoint för att upptäcka påverkan på sköldkörtelaxeln (figur 2). För konsekvensens skull mäts bakbenslängden på vänster bakben. Bakbenslängden utvärderas både på testets dag 7 och dag 21. På dag 7 är det enkelt att mäta bakbenens längd, enligt illustration i figur 2. Det är dock svårare att mäta bakbenens längd på dag 21 på grund av att benet då är böjt. Därför ska bakbenslängden på dag 21 mätas från kroppsväggen och följa mittlinjen på benet genom alla kantiga avvikelser. Förändringar i bakbenslängden på dag 7, även om de inte är uppenbara på dag 21, anses ändå vara viktiga för den potentiella sköldkörtelaktiviteten. Längdmätningar tas från digitala fotografier med hjälp av bildanalysprogram i enlighet med beskrivningen i OECD:s vägledningsdokument om sköldkörtelns histopatologi hos groddjur (Guidance Document on Amphibian Thyroid Histology) (9).
|
Kroppslängd och våtvikt
|
37.
|
Bestämningar av längd från nos till kloak (figur 2) och våtvikt ingår i testprotokollet för att bedöma eventuella effekter av testkemikalier på tillväxttakten hos grodyngel jämfört med tillväxttakten i kontrollgruppen och är mycket värdefulla för att spåra testkemikaliens allmänna toxicitet. Eftersom avlägsnandet av vatten på kroppen för viktkontroller kan orsaka stress och hudskador hos grodynglen, utförs dessa mätningar på grodynglen i delprovet på dag 7 och på alla återstående grodyngel i slutet av testet (dag 21). För konsekvensens skull anses den kraniala kanten av kloaken utgöra svansens gräns vid mätningen.
|
|
38.
|
Längden från nos till kloak används för att utvärdera grodynglens tillväxt såsom visas i figur 2.
Figur 2.
(A) Olika typer av mätningar av kroppslängden och (B) mätningar av bakbenslängden för grodyngel av arten X. laevis (1).

|
Sköldkörtelns histologi
|
39.
|
Utvecklingsstadium och bakbenslängd är viktiga endpoints för att bedöma exponeringsrelaterade förändringar i den metamorfa utvecklingen, men förseningar i utvecklingen kan i sig inte anses vara en diagnostisk indikator på sköldkörtelhämmande aktivitet. Vissa ändringar är endast iakttagbara vid en rutinmässig histopatologisk analys. Diagnostiska kriterier inbegriper förstorad/förminskad sköldkörtel, förstorade follikulära celler, follikulär hyperplasi och, som ytterligare kvalitativa kriterier, storleken på follikulära lumen, kolloidkvaliteten och de follikulära cellernas höjd/form. Allvarlighetsgrad (4 grader) bör rapporteras. Information om hur man erhåller och hanterar prover för histologisk undersökning och hur man utför histologiska analyser av vävnadsprover finns i Amphibian Metamorphosis Assay: Part 1 – Technical guidance for morphologic sampling and histological preparation och Amphibian Metamorphosis Assay: Part 2 – Approach to reading studies, diagnostic criteria, severity grading and atlas (9). Laboratorier som utför detta test för första gången bör söka råd från erfarna patologer i utbildningssyfte innan den histologiska analysen och utvärderingen av sköldkörteln påbörjas. Tydliga och viktiga ändringar i apikala endpoints som pekar på accelererad utveckling eller utvecklingsmässig asynkroni kan leda till att behovet av histopatologisk analys av sköldkörteln försvinner. En avsaknad av tydliga morfologiska förändringar eller tecken på försenad utveckling motiverar dock utförandet av histologiska analyser.
|
Dödlighet
|
40.
|
I alla testakvarier bör man dagligen kontrollera förekomsten av döda grodyngel, och antalet bör registreras för varje akvarium. Datum, koncentration och akvarienummer anges vid alla observationer av dödlighet. Döda djur tas bort från testakvariet så snart de har upptäckts. En dödlighet som överstiger 10 % kan vara tecken på olämpliga testbetingelser eller på testkemikaliens toxiska effekter.
|
Övriga anmärkningar
|
41.
|
Exempel på onormalt beteende och tydligt synliga missbildningar och skador registreras. Datum, koncentration och akvarienummer anges vid alla observationer av onormala beteenden, grova missbildningar eller skador. Normalt beteende kännetecknas av att grodynglen simmar fritt i vattenpelaren med svansen något högre än huvudet och med regelbundna rytmiska slag med svansen, att de periodvis stiger till ytan, rör på gällocken när de andas och reagerar på stimulus. Onormalt beteende kan till exempel omfatta att ynglen flyter på ytan eller ligger på botten av akvariet, simmar upp och nedvända eller med ojämna rörelser, inte går upp till ytan, och inte reagerar på stimulus. Dessutom bör stora skillnader i foderintaget mellan de olika behandlingarna registreras. Grova missbildningar och skador kan omfatta morfologiska abnormiteter (t.ex. missbildningar av armar och ben), blödande sår, bakteriella infektioner eller svampinfektioner, för att bara nämna några få. Dessa bestämningar är kvalitativa och bör betraktas som motsvarigheter till kliniska tecken på sjukdom eller stress, och ska göras i jämförelse med kontrolldjuren. Om förekomsten eller frekvensen är större i exponerade akvarier än i kontrollerna bör detta betraktas som bevis på uppenbar toxicitet.
|
DATA OCH RAPPORTERING
Datainsamling
|
42.
|
Alla uppgifter bör samlas in med hjälp av elektroniska eller manuella system som överensstämmer med god laboratoriesed. Studiedata bör omfatta följande:
|
|
Testkemikalie:
|
—
|
beskrivning av testkemikalien: fysikalisk-kemiska egenskaper, information om stabilitet och biologisk nedbrytbarhet,
|
|
—
|
kemisk information och kemiska uppgifter: metod och frekvens för beredning av utspädningar. Informationen om testkemikalien omfattar faktiska och nominella koncentrationer av testkemikalien och i vissa fall metaboliten, beroende på vad som är lämpligt. Mätningar av testkemikalien kan krävas för stamlösningar och testlösningar,
|
|
—
|
lösningsmedel (annat än vatten): motivering av valet av lösningsmedel, och beskrivning av lösningsmedlet (beskaffenhet, den använda koncentrationen).
|
|
|
|
Testbetingelser:
|
—
|
operativa uppgifter: observationer som rör hur väl testsystemet, laboratoriemiljön och infrastrukturen fungerar. Typiska uppgifter inbegriper omgivande temperatur, testtemperatur, fotoperiod, status för de viktiga komponenterna i exponeringssystemet (t.ex. pumpar, räknare för cykler, tryck), flödeshastigheter, vattennivåer, byten av flaskor med stamlösning och utfodringsuppgifter. Allmänna parametrar för vattenkvaliteten inbegriper pH-värde, halt av löst syre, konduktivitet, total jodhalt, alkalinitet, hårdhet,
|
|
—
|
avvikelser från testmetoden: denna information bör innehålla uppgifter om eller eventuella förklarande beskrivningar av avvikelser från testmetoden.
|
|
|
|
Resultat:
|
—
|
biologiska observationer och uppgifter: dessa inkluderar dagliga observationer av dödlighet, foderintag, onormalt simbeteende, letargi, förlust av balansen, missbildningar, skador osv. Observationer och uppgifter som samlas in vid förutbestämda intervall omfattar följande: utvecklingsstadium, bakbenslängd, längd från nos till kloak samt våtvikt,
|
|
—
|
statistiska analystekniker och motivering av de tekniker som använts, statistiska analysresultat, helst i tabellform,
|
|
—
|
histologiska uppgifter: dessa innehåller förklarande beskrivningar samt allvarlighetsgrad och frekvens för särskilda observationer, enligt beskrivningen i vägledningsdokumentet för histopatologi,
|
|
—
|
särskilda observationer: dessa observationer bör inbegripa förklarande beskrivningar av undersökningen som inte passar in i de tidigare angivna kategorierna.
|
|
|
Rapportering av uppgifter
|
43.
|
Tillägg 2 innehåller kalkylblad för daglig datainsamling som kan användas som vägledning för notering av rådata och för beräkning av sammanfattande statistik. Dessutom tillhandahålls rapporteringstabeller som är lämpliga för inrapportering av sammanfattningar av endpointdata. Rapporteringstabeller för histologiska bedömningar finns i tillägg 2.
|
Utförandekriterier och testets godtagbarhet och giltighet
|
44.
|
I allmänhet kommer stora avvikelser från testmetoden att resultera i uppgifter som inte går att använda för tolkning och rapportering. Därför har följande kriterier i tabell 4 utarbetats som vägledning för att fastställa kvaliteten på det utförda testet och hur väl bruket av kontrollorganismerna har fungerat i allmänhet.
Tabell 4.
Utförandekriterier för testet på groddjursmetamorfos.
|
Kriterium
|
Godtagbara gränser
|
|
Testkoncentrationer
|
Bibehålls vid ≤ 20 % CV (variationer av den uppmätta testkoncentrationen) under testets 21 dagar
|
|
Dödlighet i kontrollerna
|
≤ 10 % – dödligheten i ett enskilt replikat i kontrollerna bör inte överstiga två grodyngel
|
|
Minsta medianutvecklingsskede i kontrollerna vid testets avslutning
|
57
|
|
Fördelning av utvecklingsstadierna i kontrollgruppen
|
Den 10:e och den 90:e percentilen i utvecklingsfasfördelningen bör inte skilja sig åt med mer än fyra stadier
|
|
Löst syre
|
≥ 40 % luftmättnad (23)
|
|
pH-värde
|
pH-värdet bör hållas mellan 6,5 och 8,5. Skillnaderna mellan olika replikat och mellan olika testkärl bör inte överstiga 0,5.
|
|
Vattentemperatur
|
22 ± 1 °C – skillnaderna mellan olika replikat och mellan olika testkärl bör inte överstiga 0,5 °C.
|
|
Testkoncentrationer utan uppenbar toxicitet
|
≥ 2
|
|
Resultat, replikaten
|
≤ 2 replikat från testet som helhet kan gå förlorade
|
|
Särskilda villkor för användning av ett lösningsmedel
|
Om ett lösningsmedel används som bärämne bör både en lösningsmedelskontroll och en kontroll med rent vatten användas och resultaten rapporteras
|
|
Statistiskt signifikanta skillnader mellan lösningsmedels- och vattenkontrollgrupper behandlas för sig. Se nedan för mer information
|
|
Särskilda villkor för statiska förnyelsesystem
|
Representativa kemiska analyser som utförs före och efter förnyelsen bör rapporteras
|
|
Ammoniaknivåerna ska mätas omedelbart före förnyelsen
|
|
Alla parametrar för vattenkvalitet som anges i tabell 1 i tillägg 1 bör mätas omedelbart före förnyelsen
|
|
Förnyelseperioden bör inte överstiga 72 timmar
|
|
Lämpligt utfodringsschema (50 % av den dagliga fodergivan av kommersiellt tillgängligt grodyngelfoder)
|
|
Testets giltighet
|
45.
|
Följande krav måste vara uppfyllda för att ett test ska anses vara godtagbart/giltigt:
|
|
Giltigt försök i ett test som fastställs vara negativt med avseende på sköldkörtelaktiviteten:
|
(1)
|
Dödligheten får inte överstiga 10 % för ett givet testkärl (inklusive kontroller). Dödligheten får inte överstiga tre grodyngel för ett givet replikat, annars anses replikatet ha gått förlorat.
|
|
(2)
|
Minst två behandlingsnivåer med alla fyra giltiga replikat bör finnas tillgängliga för analys.
|
|
(3)
|
Minst två behandlingsnivåer utan uppenbar toxicitet bör finnas tillgängliga för analys.
|
|
|
|
Giltigt försök i ett test som fastställs vara positivt med avseende på sköldkörtelaktiviteten:
|
(1)
|
En dödlighet på högst två grodyngel/replikat i kontrollgruppen får förekomma.
|
|
|
Beslutsgången för genomförandet av testet på groddjursmetamorfos
|
46.
|
Beslutsgången utarbetades för testet på groddjursmetamorfos för att tillhandahålla logisk hjälp med genomförandet och tolkningen av resultaten från biotestet (se flödesdiagram i figur 3). Beslutsgången väger i huvudsak endpoints mot varandra i det att accelererad utveckling, asynkron utveckling och sköldkörtelns histopatologi är av stor vikt, medan fördröjd utveckling, längd från nos till kloak och våt kroppsvikt, parametrar som potentiellt kan påverkas av den allmänna toxiciteten, är av mindre vikt.
Figur 3.
Beslutsgången för testet på groddjursmetamorfos.
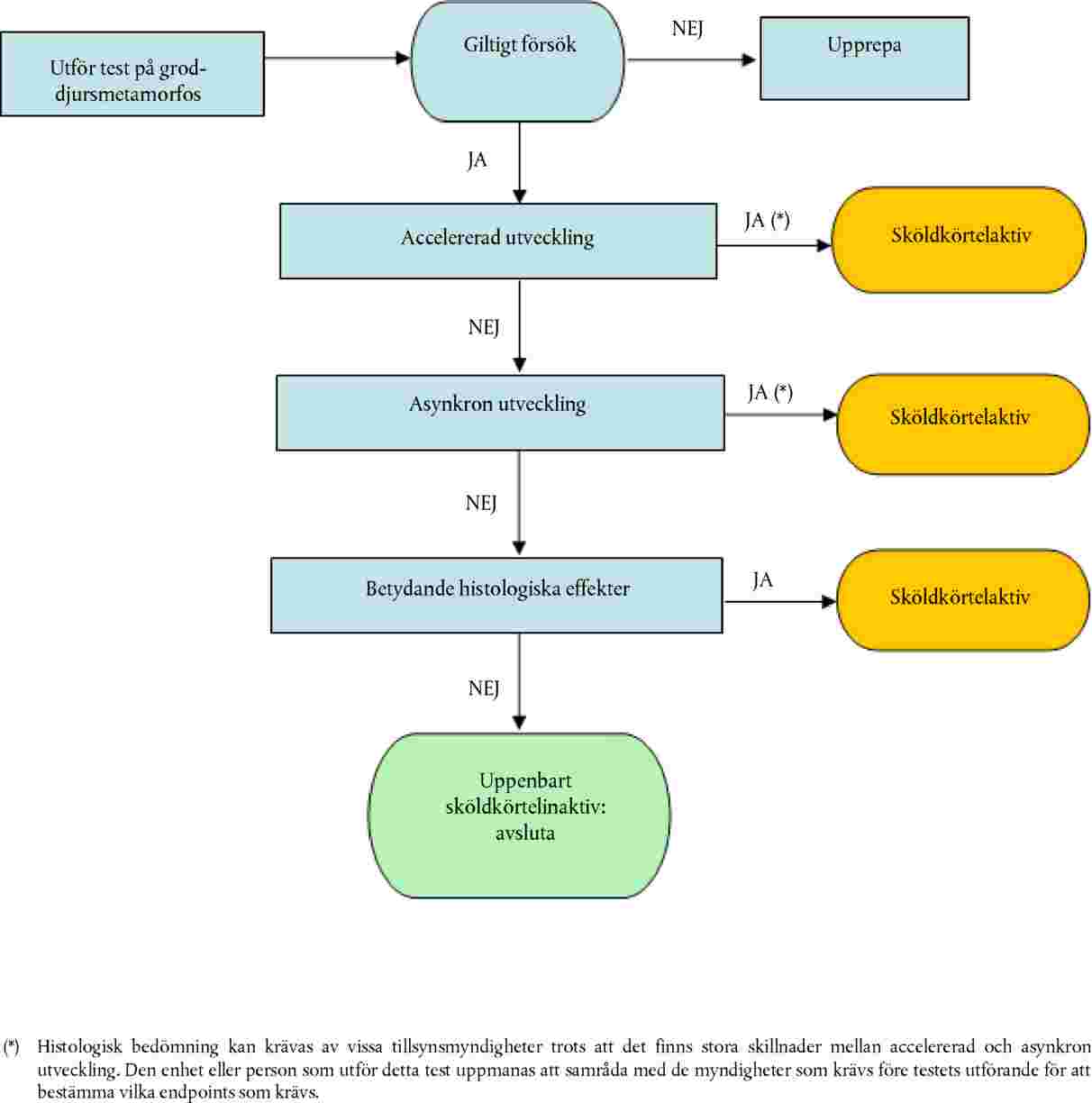
|
Accelererad utveckling (bestäms på basis av utvecklingsstadium, längd från nos till kloak och bakbenslängd)
|
47.
|
Accelererad utveckling inträffar endast genom effekter som är sköldkörtelhormonrelaterade. Dessa kan utgöras av perifera vävnadseffekter såsom direkt interaktion med sköldkörtelhormonreceptorn (t.ex. T4) eller effekter som förändrar nivåerna av cirkulerande sköldkörtelhormon. I vilket fall som helst kan detta betraktas som tillräckliga bevis för att kemikalien framkallar sköldkörtelaktivitet. Accelererad utveckling utvärderas på ett av två möjliga sätt. Det ena är att det allmänna utvecklingsstadiet kan bedömas med hjälp av standardmetoden som beskrivits i Nieuwkoop och Faber (8). Det andra är att särskilda morfologiska egenskaper kan kvantifieras, t.ex. bakbenslängden, både på dag 7 och 21, vilket är förenat med agonistiska effekter på sköldkörtelhormonreceptorn. Om statistiskt signifikanta accelerationer av utvecklingen eller bakbenslängden inträffar visar testet att kemikalien är sköldkörtelaktiv.
|
|
48.
|
Utvärderingen av försöksdjur med avseende på accelererad utveckling i förhållande till kontrollpopulationen bygger på resultaten av statistiska analyser som utförs med inriktning på följande fyra endpoints:
|
—
|
bakbenslängden (normaliserad genom längden från nos till kloak) på testdag 7,
|
|
—
|
bakbenslängden (normaliserad genom längden från nos till kloak) på testdag 21,
|
|
—
|
utvecklingsstadiet på testdag 7,
|
|
—
|
utvecklingsstadiet på testdag 21.
|
|
|
49.
|
Statistiska analyser av bakbenslängden bör utföras på grundval av mätningar av det vänstra bakbenets längd. Bakbenslängden normaliseras genom att fastställa förhållandet mellan bakbenslängden och längden från nos till kloak för varje individ. Medelvärdet av de normaliserade värdena för varje behandlingsnivå jämförs därefter. En accelererad utveckling utvisas då av en betydande ökning av den genomsnittliga bakbenslängden (normaliserad) i en kemikaliebehandlingsgrupp jämfört med kontrollgruppen på testdag 7 och/eller testdag 21 (se tillägg 3).
|
|
50.
|
Statistiska analyser av utvecklingsstadier bör utföras på grundval av fastställandet av utvecklingsstadier enligt de morfologiska kriterier som beskrivits av Nieuwkoop och Faber (8). En accelererad utveckling anges när en ’multikvantal’ analys påvisar en avsevärd ökning av värdena för utvecklingsstadier i en kemikaliebehandlingsgrupp jämfört med kontrollgruppen på testdag 7 och/eller 21.
|
|
51.
|
I metoden för testet på groddjursmetamorfos anses en betydande effekt på någon av de fyra ovannämnda endpoints vara tillräckligt för att man ska kunna fastställa förekomsten av accelererad utveckling. Betydande effekter på bakbenslängden vid en viss tidpunkt behöver alltså inte bekräftas av betydande effekter på bakbenslängden vid den alternativa tidpunkten eller av betydande effekter på utvecklingsstadierna vid denna särskilda tidpunkt. Betydande effekter på utvecklingsstadiet vid en viss tidpunkt behöver i sin tur inte bekräftas av betydande effekter på utvecklingsstadiet på den alternativa tidpunkten eller av betydande effekter på bakbenslängden vid denna särskilda tidpunkt. Beviskraften för accelererad utveckling ökar dock om betydande effekter påvisas för mer än en endpoint.
|
Asynkron utveckling (fastställs med hjälp av kriterier för utvecklingsstadier)
|
52.
|
Asynkron utveckling kännetecknas av störningar i de relativa tidpunkterna för morfogenesen eller utvecklingen av olika vävnader hos ett enda grodyngel. Oförmåga att tydligt fastställa utvecklingsstadiet hos en organism med hjälp av den uppsättning morfologiska endpoints som anses typiska för ett visst stadium antyder att vävnaderna utvecklas asynkront genom metamorfosen. Asynkron utveckling är en indikator för sköldkörtelaktivitet. De enda kända verkningssätt som orsakar asynkron utveckling är effekterna av kemikalier på den perifera sköldkörtelhormonaktiviteten och/eller på metabolismen av sköldkörtelhormon i vävnader under utveckling, såsom kan observeras med deiodinashämmare.
|
|
53.
|
Utvärderingen av försöksdjuren med avseende på förekomsten av asynkron utveckling i förhållande till kontrollpopulationen ska grundas på en makromorfologisk bedömning av försöksdjuren på testdag 7 och testdag 21.
|
|
54.
|
Nieuwkoop och Fabers (8) beskrivning av den normala utvecklingen hos Xenopus laevis utgör en ram för fastställande av ordningsföljden för den normala ombildningen av vävnader. Termen ’asynkron utveckling’ refererar särskilt till avvikelser i grodynglens makromorfologiska utveckling som gör det omöjligt att fastställa ett utvecklingsstadium enligt kriterierna i Nieuwkoop och Faber (8), eftersom viktiga morfologiska kännetecken har särdrag som är typiska för olika stadier.
|
|
55.
|
Termen ’asynkron utveckling’ innebär att endast fall som uppvisar avvikelser i omvandlingsförloppet för vissa vävnader i förhållande till omvandlingsförloppet för andra vävnader bör övervägas. I vissa klassiska fenotyper förekommer försening eller avsaknad av utvecklingen av framben trots normal eller accelererad utveckling av vävnaderna i bakben och svans, eller en tidig resorption av gälarna i förhållande till det stadium som morfogenesen för bakbenen och resorptionen av svansen befinner sig i. Man registrerar att ett djur uppvisar asynkron utveckling om det inte kan hänföras till ett stadium på grund av att det inte uppfyller en majoritet av de viktiga utvecklingsrelaterade kriterierna för ett visst stadium enligt Nieuwkoop och Faber (8), eller om en eller flera grundläggande egenskaper är extremt försenade eller accelererade (t.ex. om svansen helt har resorberats men frambenen inte har utvecklats). Denna bedömning görs kvalitativt och bör innefatta en undersökning av samtliga viktiga kännetecken som anges av Nieuwkoop och Faber (8). Det är dock inte nödvändigt att registrera utvecklingsstadiet för dessa olika viktiga kännetecken för de djur som undersöks. Djur som har registrerats som asynkront utvecklade hänförs inte till ett utvecklingsstadium enligt Nieuwkoop och Faber (8).
|
|
56.
|
Ett centralt kriterium för att beteckna fall med onormal morfologisk utveckling som ’asynkron utveckling’ är att de relativa tidpunkterna för utvecklingen eller morfogenesen av olika vävnader är rubbade men att de påverkade vävnadernas morfologi inte är uppenbart onormal. Ett exempel som illustrerar denna tolkning av makromorfologiska abnormiteter är att en försenad morfogenes av bakbenen i förhållande till utvecklingen av andra vävnader uppfyller kriterierna för ’asynkron utveckling’, men att fall där bakbenen saknas, onormalt utvecklade fingrar och tår (t.ex. ektrodaktyli, polydaktyli) eller andra synliga missbildningar förekommer inte bör betraktas som exempel på ’asynkron utveckling’.
|
|
57.
|
De viktigaste morfologiska kännetecknen som i detta sammanhang bör utvärderas med avseende på deras samordnade metamorfa utveckling omfattar bakbenens morfogenes, utvecklingen av frambenen, stadiet under vilket svansen resorberas (särskilt resorptionen av svansfenan) och huvudets morfologi (t.ex. gälstorleken och resorptionen av gälarna, underkäkens morfologi, protrusionen av Meckels brosk).
|
|
58.
|
Olika makromorfologiska fenotyper kan förekomma beroende på typen av kemiskt verkningssätt. I vissa klassiska fenotyper förekommer försening eller avsaknad av utvecklingen av framben trots normal eller accelererad utveckling av vävnaderna i bakben och svans, eller en tidig resorption av gälarna i förhållande till omvandlingen av bakben och svans.
|
Histopatologi
|
59.
|
Om kemikalien inte orsakar uppenbar toxicitet och inte accelererar utvecklingen eller orsakar asynkron utveckling, utvärderas sköldkörtelns histopatologi med hjälp av lämpliga vägledningsdokument (9). Utvecklingsstörningar i frånvaron av toxicitet är ett tydligt tecken på sköldkörtelhämmande aktivitet, men analysen av utvecklingsstadier är mindre känslig och mindre diagnostisk än en histopatologisk undersökning av sköldkörteln. Därför är det i detta fall nödvändigt att utföra histopatologiska analyser av sköldkörteln. Effekter på sköldkörtelns histologi har påvisats i frånvaro av effekter på utvecklingen. Om det förekommer förändringar av sköldkörtelns histopatologi anses kemikalien vara sköldkörtelaktiv. Om inga förseningar i utvecklingen eller sjukliga histologiska förändringar i sköldkörteln observeras anses kemikalien vara sköldkörtelinaktiv. Den logiska grunden för detta beslut är att sköldkörteln påverkas av TSH (tyreoideastimulerande hormon), och alla kemikalier som har tillräckligt stor effekt på cirkulerande sköldkörtelhormon för att ändra utsöndringen av TSH leder till histopatologiska förändringar i sköldkörteln. Olika verkningssätt och -mekanismer kan ändra cirkulerande sköldkörtelhormon. Nivån av sköldkörtelhormon vittnar om en sköldkörtelrelaterad effekt, men detta är alltså inte tillräckligt för att avgöra vilka verkningssätt eller verkningsmekanismer som står i samband med responsen.
|
|
60.
|
Eftersom man inte kan använda sig av grundläggande statistiska metoder när det gäller denna endpoint kan man fastställa att en effekt inträffar som är förknippad med exponeringen för kemikalien genom ett expertutlåtande från en patolog.
|
Fördröjd utveckling (bestäms på basis av utvecklingsstadium, bakbenslängd, kroppsvikt och längd från nos till kloak)
|
61.
|
Fördröjd utveckling kan inträffa på grund av sköldkörtelhämmande mekanismer och på grund av indirekt toxicitet. Små förseningar i utvecklingen tillsammans med tydliga tecken på toxicitet tyder sannolikt på icke-specifika toxiska effekter. Utvärderingen av toxicitet som inte påverkar sköldkörteln är en viktig del av testet som minskar sannolikheten för falskt positiva resultat. En överdrivet hög dödlighet är ett tydligt tecken på närvaron av andra toxiska mekanismer. På samma sätt tyder små minskningar i tillväxten, som bestämts av våtvikten och/eller längden från nos till kloak, också på toxicitet som inte påverkar sköldkörteln. Tydliga ökningar i tillväxten observeras ofta med kemikalier som påverkar den normala utvecklingen negativt. Följaktligen tyder förekomsten av djur med större storlek inte nödvändigtvis på toxicitet som inte påverkar sköldkörteln. Man bör dock inte enbart förlita sig på tillväxten för att fastställa sköldkörteltoxicitet. Man bör hellre använda tillväxten, i kombination med utvecklingsstadier och sköldkörtelns histopatologi, för att fastställa sköldkörtelaktivitet. Andra endpoints bör också beaktas för att fastställa tydlig toxicitet, inklusive ödem, blödande sår, letargi, minskat foderintag, erratiskt/förändrat simbeteende, etc. Om alla testkoncentrationer uppvisar tecken på uppenbar toxicitet bör testkemikalien utvärderas på nytt vid lägre testkoncentrationer innan man fastställer om kemikalien är potentiellt sköldkörtelaktiv eller sköldkörtelinaktiv.
|
|
62.
|
I frånvaro av andra tecken på uppenbar toxicitet tyder statistiskt signifikanta förseningar i utvecklingen på att kemikalien är sköldkörtelaktiv (antagonistisk). I avsaknad av tydliga statistiska responser kan detta resultat kompletteras med resultat från sköldkörtelns histopatologi.
|
Statistiska analyser
|
63.
|
Statistiska analyser av data bör helst följa de förfaranden som beskrivs i dokumentet Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application (11). För alla kontinuerliga kvantitativa endpoints (bakbenslängd, längd från nos till kloak, våtvikt) som är förenliga med en monoton dos-respons bör Jonckheere-Terpstras test tillämpas på step-down-grund för att fastställa en betydande behandlingseffekt.
|
|
64.
|
För alla kontinuerliga kvantitativa endpoints som inte är förenliga med en monoton dos-respons bör erhållna data bedömas med avseende på normalitet (helst med hjälp av Shapiro-Wilks test eller Anderson-Darlings test) och på varianshomogenitet (helst med hjälp av Levenes test). Båda testerna utförs på residualerna från en variansanalys (ANOVA). Expertbedömning kan användas i stället för dessa formella tester med avseende på normalitet och varianshomogenitet, även om de formella testerna är att föredra. Om resultaten visar på icke-normalitet eller variansheterogenitet bör man försöka göra en variansstabiliserande omvandling. Om erhållna data (kanske efter en omvandling) är normalfördelade med homogen varians kan en signifikant behandlingseffekt fastställas med hjälp av Dunnetts test. Om erhållna data (kanske efter en omvandling) är normalfördelade med heterogen varians kan en signifikant behandlingseffekt fastställas med hjälp av Tamhane-Dunnetts test, även kallat T3, eller Mann-Whitney-Wilcoxons U-test. Om det inte går att finna någon normaliserande omvandling kan en signifikant behandlingseffekt fastställas med hjälp av Mann-Whitney-Wilcoxons U-test med en Bonferroni-Holm-justering av p-värdena. Dunnetts test tillämpas oberoende av eventuella ANOVA (F-test), och Mann-Whitneys test tillämpas oberoende av eventuella övergripande Kruskall-Wallis test.
|
|
65.
|
Signifikant dödlighet är inte ett väntevärde utan bör bedömas utifrån ett step-down-grundat Cochran-Armitages test om erhållna data överensstämmer med dos-responsmonotoniteten, och i annat fall utifrån Fishers exakta test med en Bonferroni-Holm-justering.
|
|
66.
|
En signifikant behandlingseffekt med avseende på utvecklingsstadium fastställs genom step-down-tillämpningen av Jonckheere-Terpstras test, tillämpat på replikatens medianvärden. Alternativt, och företrädesvis, bör ett ’multikvantalt’ Jonckheeres test från den 20:e till den 80:e percentilen användas för bestämning av effekten, eftersom det tar hänsyn till förändringar av fördelningsprofilen.
|
|
67.
|
Den lämpliga analysenheten är replikatet, så data består av replikatens medianvärden om Jonckheere-Terpstras test eller Mann-Whitneys u-test används, eller replikatens medelvärden om Dunnetts test används. Dos-responsmonotonitet kan bedömas visuellt utifrån replikatens och testkärlens medelvärden eller medianvärden eller utifrån formella test så som beskrivits ovan (11). Med färre än fem replikat per testkärl eller kontroll bör man om möjligt använda den exakta/randomiserade versionen av Jonckheere-Terpstras test och Mann-Whitneys test. Den statistiska signifikansen av alla de angivna testerna bedöms på signifikansnivå 0,05.
|
|
68.
|
Figur 4 är ett flödesschema över utförande av statistiska tester på kontinuerliga data.
Figur 4.
Flödesschema över statistiska metoder för kontinuerliga responsdata.

|
Särskilda överväganden för dataanalys
Användning av behandlingsnivåer som inte gått förlorade
|
69.
|
Flera faktorer ska beaktas när man fastställer huruvida ett replikat eller en hel behandling uppvisar uppenbar toxicitet och bör avlägsnas ur analysen. Uppenbar toxicitet definieras som > 2 dödsfall i varje enskilt replikat som endast kan förklaras av toxicitet snarare än av tekniska fel. Andra tecken på uppenbar toxicitet omfattar blödning, onormala beteenden, onormala simmönster, anorexi och andra kliniska tecken på sjukdom. För subletala tecken på toxicitet kan det bli nödvändigt att göra kvalitativa utvärderingar, och dessa bör alltid göras i jämförelse med kontrollgruppen med rent vatten.
|
Kontroller med lösningsmedel
|
70.
|
Användningen av lösningsmedel bör endast ses som en sista utväg när alla andra alternativ för kemiska bärämnen har övervägts. Om lösningsmedel används ska man samtidigt ha en kontroll med rent vatten. I slutet av testet bör en utvärdering göras av lösningsmedlets eventuella effekter. Detta görs genom en statistisk jämförelse av kontrollgruppen med lösningsmedel och kontrollgruppen med rent vatten. De mest relevanta endpoints som ska beaktas i denna analys är utvecklingsstadier, längd från nos till kloak och våtvikt, eftersom dessa kan påverkas av toxicitet som inte påverkar sköldkörteln. Om statistiskt signifikanta skillnader med avseende på dessa endpoints påvisas mellan kontrollen med rent vatten och kontrollgruppen med lösningsmedel ska studiens endpoints för responsmåtten fastställas med hjälp av kontrollen med rent vatten. Om det inte finns några statistiskt signifikanta skillnader mellan kontrollen med rent vatten och kontrollerna med lösningsmedel för alla uppmätta responsvariabler ska studiens endpoints för responsmåtten fastställas med hjälp av de sammanlagda kontrollerna med utspädningsvatten och lösningsmedel.
|
Behandlingsgrupper som uppnår utvecklingsstadium 60 och däröver
|
71.
|
Efter stadium 60 minskar grodynglen i storlek och vikt på grund av vävnadsresorption och minskning av den absoluta vattenhalten. Mätningar av våtvikt och längd från nos till kloak kan således inte användas på lämpligt sätt i de statistiska analyserna av skillnader i tillväxttakt. Våtvikt och längddata från organismer > stadium 60 enligt Nieuwkoop och Faber bör därför strykas och kan inte användas vid analyser av replikatmedelvärden eller replikatmedianvärden. Två olika metoder kan användas för att analysera dessa tillväxtrelaterade parametrar.
|
|
72.
|
En metod är att endast beakta grodyngel som är i utvecklingsstadium 60 eller tidigare för statistiska analyser av våtvikt och/eller längd från nos till kloak. Denna metod anses ge tillräckligt tillförlitlig information om de möjliga tillväxteffekternas allvarlighetsgrad förutsatt att bara en liten andel av försöksdjuren avlägsnas från analyserna (≤ 20 %). Om ett ökat antal grodyngel utvecklas bortom stadium 60 (≥ 20 %) i en eller flera nominella koncentrationer bör en tvåfaktors ANOVA med en nästlad (hierarkisk) variansstruktur utföras för samtliga grodyngel för att bedöma tillväxteffekter som beror på kemiska behandlingar, samtidigt som man tar hänsyn till den effekt de senare utvecklingsstadierna har på tillväxten. Tillägg 3 innehåller vägledning om tvåfaktors variansanalys av vikt och längd.
|
LITTERATUR
|
(1)
|
OECD (2004) Report of the Validation of the Amphibian Metamorphosis Assay for the detection of thyroid active substances: Phase 1 – Optimisation of the Test Protocol. Environmental Health and Safety Publications. Series on Testing and Assessment. Nr 77. Paris.
|
|
(2)
|
OECD (2007) Final Report of the Validation of the Amphibian Metamorphosis Assay: Phase 2 – Multi-chemical Interlaboratory Study. Environmental Health and Safety Publications. Series on Testing and Assessment. Nr 76. Paris.
|
|
(3)
|
OECD (2008) Report of the Validation Peer Review for the Amphibian Metamorphosis Assay and Agreement of the Working Group of the National Coordinators of the Test Guidelines Programme on the Follow-up of this Report. Environmental Health and Safety Publications. Series on Testing and Assessment. Nr 92. Paris.
|
|
(4)
|
OECD (2000) Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. Environmental Health and Safety Publications. Series on Testing and Assessment. Nr 23. Paris.
|
|
(5)
|
ASTM (2002) Standard Guide for Conducting Acute Toxicity Tests on Test Materials with Fishes, Macroinvertebrates, and Amphibians. American Society for Testing and Materials, ASTM E729-96 (2002), Philadelphia, PA.
|
|
(6)
|
ASTM (2004) Standard Guide for Conducting the Frog Embryo Teratogenesis Assay – Xenopus (FETAX). E 1439-98.
|
|
(7)
|
Kahl, M. D., Russom, C. L., DeFoe, D. L. och Hammermeister, D. E. (1999) Saturation units for use in aquatic bioassays. Chemosphere 39, s. 539–551.
|
|
(8)
|
Nieuwkoop, P. D. och Faber, J. (1994) Normal Table of Xenopus laevis. Garland Publishing, New York.
|
|
(9)
|
OECD (2007) Guidance Document on Amphibian Thyroid Histology. Environmental Health and Safety Publications. Series on Testing and Assessment. Nr 82. Paris.
|
|
(10)
|
Dodd, M. H. I. och Dodd, J. M. (1976) The Biology of Metamorphosis. I: Physiology of Amphibia. Lofts, B. (red.), Academic Press, New York, s. 467–599.
|
|
(11)
|
OECD (2006) Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. Environmental Health and Safety Publications. Series on Testing and Assessment. Nr 54. Paris.
|
|
(12)
|
Hutchinson, T. H., Shillabeer, N., Winter, M. J., Pickford, D. B. (2006) Acute and chronic effects of carrier solvents in aquatic organisms: A critical review. Review. Aquatic Toxicology, 76, s. 69–92.
|
Tillägg 1
Tabell 1
Försöksbetingelser för det 21 dagar långa testet på groddjursmetamorfos
|
Försöksdjur
|
Yngel av Xenopus laevis
|
|
Inledande yngelstadium
|
Stadium 51 enligt Nieuwkoop och Faber
|
|
Exponeringstid
|
21 dagar
|
|
Urvalskriterier, yngel
|
Utvecklingsstadium och total längd (frivilligt)
|
|
Testkoncentrationer
|
Minst tre koncentrationer som spänner över ungefär en storleksordning
|
|
Exponeringssystem
|
Genomflöde (föredras) och/eller statisk förnyelse
|
|
Testsystemets flödeshastighet
|
25 ml/min (fullständig förnyelse av volymen ungefär per 2,7 timmar)
|
|
Primära endpoints/Bestämningsdag
|
Dödlighet
|
Dagligen
|
|
Utvecklingsstadium
|
Dag 7 och 21
|
|
Bakbenslängd
|
Dag 7 och 21
|
|
Längd från nos till kloak
|
Dag 7 och 21
|
|
Våt kroppsvikt
|
Dag 7 och 21
|
|
Sköldkörtelns histologi
|
Dag 21
|
|
Utspädningsvatten/Laboratoriekontroll
|
Avklorerat kranvatten (kolfiltrerat) eller motsvarande laboratoriekälla
|
|
Yngeltäthet
|
20 larver per testkärl (5/l)
|
|
Testlösning/Testkärl
|
4–10 l (10–15 cm minsta vattendjup)/Testkärl av glas eller rostfritt stål (t.ex. 22,5 cm × 14 cm × 16,5 cm)
|
|
Replikation
|
Fyra replikattestkärl per testkoncentration och kontroll
|
|
Godtagbar dödlighetsfrekvens i kontrollerna
|
≤ 10 % per replikattestkärl
|
|
Sköldkörtelfixering
|
Antal fixerade
|
Samtliga grodyngel (fem per replikat utvärderas initialt)
|
|
Område
|
Huvudet eller hela kroppen
|
|
Fixermedel
|
Davidsons fixativ
|
|
Utfodring
|
Foder
|
Sera Micron® eller motsvarande
|
|
Mängd/Frekvens
|
Se tabell 1 för utfodringsprogram med Sera Micron®
|
|
Belysning
|
Fotoperiod
|
12 h ljus/12 h mörker
|
|
Intensitet
|
600–2 000 lux (mätt vid vattenytan)
|
|
Vattentemperatur
|
22 ± 1 °C
|
|
pH-värde
|
6,5–8,5
|
|
Halt av löst syre
|
> 3,5 mg/l (>40 % luftmättnad)
|
|
Provtagningsschema, analytisk kemi
|
En gång per vecka (fyra provtagningar per test)
|
Tillägg 2
Rapporteringstabeller för rådata och sammanställda data
Tabell 1
Allmän information om testkemikalien
|
Kemisk information
|
|
|
Ange testkemikalie, koncentrationsenheter och behandlingar
|
|
|
Testkemikalie:
|
|
|
|
|
Koncentrationsenheter:
|
|
|
|
|
Behandling 1
|
|
|
|
|
Behandling 2
|
|
|
|
|
Behandling 3
|
|
|
|
|
Behandling 4
|
|
|
|
|
|
|
|
|
|
Datum (dag 0):
|
|
Ange datum (dd/mm/åå)
|
|
|
Datum (dag 7):
|
|
Ange datum (dd/mm/åå)
|
|
|
Datum (dag 21):
|
|
Ange datum (dd/mm/åå)
|
Tabell 2
Insamlingsformulär för rådata för dagarna 7 och 21
|
DAG X
DATUM 00/00/00
|
|
|
Koncentration
|
Behandlings-nummer
|
Replikat nummer
|
Individ nummer
|
Individuellt igenkännings-tecken
|
Utvecklings-stadium
|
Längd från nos till kloak (mm)
|
Bakbenslängd (mm)
|
Hela organismens våtvikt (mg)
|
|
ROW
|
TRT
|
TRT#
|
REP
|
IND
|
ID#
|
STAGE
|
BL
|
HLL
|
WEIGHT
|
|
1
|
0,00
|
1
|
|
|
|
|
|
|
|
|
2
|
0,00
|
1
|
|
|
|
|
|
|
|
|
3
|
0,00
|
1
|
|
|
|
|
|
|
|
|
4
|
0,00
|
1
|
|
|
|
|
|
|
|
|
5
|
0,00
|
1
|
|
|
|
|
|
|
|
|
6
|
0,00
|
1
|
|
|
|
|
|
|
|
|
7
|
0,00
|
1
|
|
|
|
|
|
|
|
|
8
|
0,00
|
1
|
|
|
|
|
|
|
|
|
9
|
0,00
|
1
|
|
|
|
|
|
|
|
|
10
|
0,00
|
1
|
|
|
|
|
|
|
|
|
11
|
0,00
|
1
|
|
|
|
|
|
|
|
|
12
|
0,00
|
1
|
|
|
|
|
|
|
|
|
13
|
0,00
|
1
|
|
|
|
|
|
|
|
|
14
|
0,00
|
1
|
|
|
|
|
|
|
|
|
15
|
0,00
|
1
|
|
|
|
|
|
|
|
|
16
|
0,00
|
1
|
|
|
|
|
|
|
|
|
17
|
0,00
|
1
|
|
|
|
|
|
|
|
|
18
|
0,00
|
1
|
|
|
|
|
|
|
|
|
19
|
0,00
|
1
|
|
|
|
|
|
|
|
|
20
|
0,00
|
1
|
|
|
|
|
|
|
|
|
21
|
0,00
|
2
|
|
|
|
|
|
|
|
|
22
|
0,00
|
2
|
|
|
|
|
|
|
|
|
23
|
0,00
|
2
|
|
|
|
|
|
|
|
|
24
|
0,00
|
2
|
|
|
|
|
|
|
|
|
25
|
0,00
|
2
|
|
|
|
|
|
|
|
|
26
|
0,00
|
2
|
|
|
|
|
|
|
|
|
27
|
0,00
|
2
|
|
|
|
|
|
|
|
|
28
|
0,00
|
2
|
|
|
|
|
|
|
|
|
29
|
0,00
|
2
|
|
|
|
|
|
|
|
|
30
|
0,00
|
2
|
|
|
|
|
|
|
|
|
31
|
0,00
|
2
|
|
|
|
|
|
|
|
|
32
|
0,00
|
2
|
|
|
|
|
|
|
|
|
33
|
0,00
|
2
|
|
|
|
|
|
|
|
|
34
|
0,00
|
2
|
|
|
|
|
|
|
|
|
35
|
0,00
|
2
|
|
|
|
|
|
|
|
|
36
|
0,00
|
2
|
|
|
|
|
|
|
|
|
37
|
0,00
|
2
|
|
|
|
|
|
|
|
|
38
|
0,00
|
2
|
|
|
|
|
|
|
|
|
39
|
0,00
|
2
|
|
|
|
|
|
|
|
|
40
|
0,00
|
2
|
|
|
|
|
|
|
|
|
41
|
0,00
|
3
|
|
|
|
|
|
|
|
|
42
|
0,00
|
3
|
|
|
|
|
|
|
|
|
43
|
0,00
|
3
|
|
|
|
|
|
|
|
|
44
|
0,00
|
3
|
|
|
|
|
|
|
|
|
45
|
0,00
|
3
|
|
|
|
|
|
|
|
|
46
|
0,00
|
3
|
|
|
|
|
|
|
|
|
47
|
0,00
|
3
|
|
|
|
|
|
|
|
|
48
|
0,00
|
3
|
|
|
|
|
|
|
|
|
49
|
0,00
|
3
|
|
|
|
|
|
|
|
|
50
|
0,00
|
3
|
|
|
|
|
|
|
|
|
51
|
0,00
|
3
|
|
|
|
|
|
|
|
|
52
|
0,00
|
3
|
|
|
|
|
|
|
|
|
53
|
0,00
|
3
|
|
|
|
|
|
|
|
|
54
|
0,00
|
3
|
|
|
|
|
|
|
|
|
55
|
0,00
|
3
|
|
|
|
|
|
|
|
|
56
|
0,00
|
3
|
|
|
|
|
|
|
|
|
57
|
0,00
|
3
|
|
|
|
|
|
|
|
|
58
|
0,00
|
3
|
|
|
|
|
|
|
|
|
59
|
0,00
|
3
|
|
|
|
|
|
|
|
|
60
|
0,00
|
3
|
|
|
|
|
|
|
|
|
61
|
0,00
|
4
|
|
|
|
|
|
|
|
|
62
|
0,00
|
4
|
|
|
|
|
|
|
|
|
63
|
0,00
|
4
|
|
|
|
|
|
|
|
|
64
|
0,00
|
4
|
|
|
|
|
|
|
|
|
65
|
0,00
|
4
|
|
|
|
|
|
|
|
|
66
|
0,00
|
4
|
|
|
|
|
|
|
|
|
67
|
0,00
|
4
|
|
|
|
|
|
|
|
|
68
|
0,00
|
4
|
|
|
|
|
|
|
|
|
69
|
0,00
|
4
|
|
|
|
|
|
|
|
|
70
|
0,00
|
4
|
|
|
|
|
|
|
|
|
71
|
0,00
|
4
|
|
|
|
|
|
|
|
|
72
|
0,00
|
4
|
|
|
|
|
|
|
|
|
73
|
0,00
|
4
|
|
|
|
|
|
|
|
|
74
|
0,00
|
4
|
|
|
|
|
|
|
|
|
75
|
0,00
|
4
|
|
|
|
|
|
|
|
|
76
|
0,00
|
4
|
|
|
|
|
|
|
|
|
77
|
0,00
|
4
|
|
|
|
|
|
|
|
|
78
|
0,00
|
4
|
|
|
|
|
|
|
|
|
79
|
0,00
|
4
|
|
|
|
|
|
|
|
|
80
|
0,00
|
4
|
|
|
|
|
|
|
|
Tabell 3
Beräknade sammanfattningar för endpointdata från dag 7 och 21
|
|
|
Utvecklingsstadium
|
Längd från nos till kloak (mm)
|
Bakbenslängd (mm)
|
Vikt (mg)
|
|
TRT
|
REP
|
MIN
|
MEDIAN
|
MAX
|
MEAN
|
STD DEV
|
MEAN
|
STD DEV
|
MEAN
|
STD DEV
|
|
1
|
1
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
1
|
2
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
1
|
3
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
1
|
4
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
2
|
1
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
2
|
2
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
2
|
3
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
2
|
4
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
3
|
1
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
3
|
2
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
3
|
3
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
3
|
4
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
4
|
1
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
4
|
2
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
4
|
3
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
4
|
4
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
Anmärkning: Cellberäkningarna bygger på införda data i tabell 2.
|
Tabell 4
Daglig dödlighet
|
Testdag
|
Datum
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
|
0
|
00/00/00
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
11
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
12
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
13
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
14
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
15
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
16
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
17
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
18
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
19
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
20
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
21
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Summa, replikat
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
|
Summa, behandling
|
0
|
|
|
|
0
|
|
|
|
0
|
|
|
|
0
|
|
|
|
|
Anmärkning: Cellberäkningarna bygger på införda data i tabell 1.
|
Tabell 5
Kriterier för vattenkvalitet
Exponeringssystem (genomflöde/statisk förnyelse):
Temperatur:
Ljusintensitet:
Ljus/mörkercykel:
Foder:
Utfodringsfrekvens:
Vattnets pH:
Jodkoncentration i testvattnet:
Tabell 6
Sammanfattning, kemiska data
|
Kemiskt namn:
|
|
CAS-nummer:
|
|
Testdag
|
Datum
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
|
0
|
00/00/00
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
11
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
12
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
13
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
14
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
15
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
16
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
17
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
18
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
19
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
20
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
21
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Anmärkning: Cellberäkningarna bygger på införda data i tabell 1.
|
Tabell 7
Histopatologiska rapporteringstabeller för kärnkriterier
|
Datum:
|
Kemikalie:
|
|
|
Patolog:
|
|
|
Förstorad sköldkörtel
|
Förminskad sköldkörtel
|
Förstorade follikulära celler
|
Follikulär hyperplasi
|
|
Förstorad sköldkörtel
|
Förminskad sköldkörtel
|
Förstorade follikulära celler
|
Follikulär hyperplasi
|
|
ID, kontrolldjur – replikat 1
|
|
|
|
|
|
ID, doserat djur – replikat 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ID, kontrolldjur – replikat 2
|
|
|
|
|
|
ID, doserat djur – replikat 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Totalt:
|
|
|
|
|
Totalt:
|
|
|
|
|
|
|
Förstorad sköldkörtel
|
Förminskad sköldkörtel
|
Förstorade follikulära celler
|
Follikulär hyperplasi
|
|
|
Förstorad sköldkörtel
|
Förminskad sköldkörtel
|
Förstorade follikulära celler
|
Follikulär hyperplasi
|
|
ID, doserat djur – replikat 1
|
|
|
|
|
|
ID, doserat djur – replikat 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ID, doserat djur – replikat 2
|
|
|
|
|
|
ID, doserat djur – replikat 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Totalt:
|
|
|
|
|
Totalt:
|
|
|
|
|
Tabell 8
Ytterligare histopatologiska kriterier
|
Datum:
|
Kemikalie:
|
|
|
Patolog:
|
|
|
|
|
|
|
|
|
Storleksökning, follikulär lumen
|
Storleksminskning, follikulär lumen
|
Storleksökning, follikulär lumen
|
Storleksminskning, follikulär lumen
|
|
ID, kontrolldjur – replikat 1
|
|
|
|
ID, doserat – djur replikat 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ID, kontrolldjur – replikat 2
|
|
|
|
ID, doserat – djur replikat 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Totalt:
|
|
|
Totalt:
|
|
|
|
|
Storleksökning, follikulär lumen
|
Storleksminskning, follikulär lumen
|
|
|
Storleksökning, follikulär lumen
|
Storleksminskning, follikulär lumen
|
|
ID, doserat djur – replikat 1
|
|
|
|
ID, doserat djur – replikat 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ID, doserat djur – replikat 2
|
|
|
|
ID, doserat djur – replikat 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Totalt:
|
|
|
Totalt:
|
|
|
Tabell 9
Förklarande beskrivningar för histopatologiska resultat
|
Datum:
|
|
Kemikalie:
|
|
Patolog:
|
|
|
Förklarande beskrivning
|
|
ID, kontrolldjur – replikat 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ID, kontrolldjur – replikat 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ID, doserat djur – replikat 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ID, doserat djur – replikat 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ID, doserat djur – replikat 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ID, doserat djur – replikat 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ID, doserat djur – replikat 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ID, doserat djur – replikat 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Tabell 10
Mall för sammanfattande rapporteringstabell för dag × (7 eller 21) för testet på groddjursmetamorfos
|
|
|
Kontroll
|
Dos 1
|
Dos 2
|
Dos 3
|
|
Endpoint
|
Replikat
|
Medel
|
sd
|
cv
|
N
|
Medel
|
sd
|
cv
|
N
|
p-värde
|
Medel
|
sd
|
cv
|
N
|
p-värde
|
Medel
|
sd
|
cv
|
N
|
p-värde
|
|
Bakbens-längd
(mm)
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Medelvärde:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Längd från nos till kloak
(mm)
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Medelvärde:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Våtvikt
(mg)
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Medelvärde:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Tabell 11
Mall för sammanfattande rapporteringstabell för dag x (7 eller 21) för uppgifter om utvecklingsstadier för testet på groddjursmetamorfos
|
|
|
Kontroll
|
Dos 1
|
Dos 2
|
Dos 3
|
|
|
Replikat
|
Median
|
Min.
|
Max
|
N
|
Median
|
Min.
|
Max
|
N
|
p-värde
|
Median
|
Min.
|
Max
|
N
|
p-värde
|
Median
|
Min.
|
Max
|
Median
|
p-värde
|
|
Utvecklings-stadium
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Medelvärde:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Tillägg 3
Alternativ analys av vikt och längd om mer än 20 % av grodynglen genomgår de senare utvecklingsstadierna vid en eller flera koncentrationer
Om ett ökat antal grodyngel utvecklas bortom stadium 60 (≥ 20 %) i en eller flera nominella koncentrationer bör en tvåfaktors ANOVA med en nästlad variansstruktur utföras för samtliga grodyngel för att bedöma tillväxteffekter som beror på kemiska behandlingar, samtidigt som man tar hänsyn till den effekt de senare utvecklingsstadierna har på tillväxten.
Detta förslag innebär att man använder alla data, men att man tar hänsyn till den effekt som de senare utvecklingsfaserna har. Detta kan göras med en tvåfaktors ANOVA med en nästlad variansstruktur. Ange LateStage = ’ja’ för ett djur om dess utvecklingsstadium är 61 eller mer. I annat fall anges LateStage = ’nej’. Därefter kan en tvåfaktors ANOVA för koncentrationen och LateStage och deras interaktion utföras, med Rep(Conc) som slumpmässig faktor och Tadpole(Rep) en ytterligare slumpmässig effekt. Detta behandlar ’rep’ som analysenhet och ger i stort sett samma resultat som en vägd analys av medelvärdena för rep*latestage, vägda mot antalet djur per medelvärde. Om erhållna data strider mot variansanalysens krav på normalitet eller varianshomogenitet kan en normaliserad rangordningsomvandling göras för att undanröja denna invändning.
Utöver de vanliga ANOVA F-testerna för effekterna av Conc, LateStage, och deras interaktioner kan F-testet för interaktion ’delas upp’ i ytterligare två ANOVA F-tester, ett för de genomsnittliga responserna över alla koncentrationer för LateStage = ’Nej’ och ett annat för de genomsnittliga responserna över alla koncentrationer för LateStage = ’ja’. Ytterligare jämförelser av testkärlens medelvärden mot kontrollen görs inom varje nivå av LateStage. Ett trendtest kan utföras med hjälp av lämpliga kontraster, eller enklare parvisa jämförelser kan göras om det finns bevis på icke-monoton dos-respons inom en nivå av variabeln LateStage. En Bonferroni-Holm-justering av p-värdena görs endast om motsvarande F-skärning inte är signifikant. Detta kan göras i SAS och förmodligen även i andra statistiska programvarupaket. Komplikationer kan uppstå när det inte finns några djur som har utvecklats till sena stadier i vissa koncentrationer, men dessa situationer kan hanteras på ett okomplicerat sätt.
Tillägg 4
Definitioner
Kemikalie
: ett ämne eller en blandning
Testkemikalie
: varje ämne eller blandning som testas med denna testmetod.
C.39. REPRODUKTIONSTEST FÖR HOPPSTJÄRTAR I JORD
INLEDNING
|
1.
|
Denna testmetod motsvarar OECD:s testriktlinje (TG) 232 (2009). Testmetoden är avsedd för bestämning av kemikaliers effekter på reproduktionskapaciteten hos hoppstjärtar i jord. Metoden bygger på befintliga förfaranden (1) (2). Den partenogenetiska Folsomia candida och den sexuellt reproducerande Folsomia fimetaria är två av de mest tillgängliga arterna av hoppstjärtar (Collembola), och de är odlingsbara och kommersiellt tillgängliga. När särskilda livsmiljöer behöver utvärderas som inte täcks av de två arterna kan förfarandet utökas även till andra arter av hoppstjärtar om de uppfyller giltighetskriterierna för testet.
|
|
2.
|
Jordlevande hoppstjärtar är ekologiskt relevanta arter för ekotoxikologisk testning. Hoppstjärtar är insekter med ett tunt exoskelett som är mycket genomsläppligt för luft och vatten, och de företräder leddjursarter med en annan exponeringsväg och en annan exponeringsfrekvens än daggmaskar (Lumbricidae) och småringmaskar (Enchytraeidae).
|
|
3.
|
Populationstätheten för hoppstjärtar uppgår vanligen till 105 m– 2 i skikt med jord och lövförna i många terrestra ekosystem (3) (4). Vuxna djur är vanligtvis 0,5–5 mm långa, och deras bidrag till den totala animaliska biomassan och respirationen i jord är låg, uppskattningsvis mellan 1 % och 5 % (5). Deras viktigaste roll kan därför vara som potentiella reglerare av processer genom mikrobivori och predation på mikrofauna. Hoppstjärtar är bytesdjur för ett stort antal endogeiska och epigeiska ryggradslösa djur, såsom kvalster, enkelfotingar, spindlar, jordlöpare och kortvingar. Hoppstjärtar bidrar till nedbrytningsprocesser i sura jordar, där de kan vara de viktigaste jordlevande ryggradslösa djuren jämte småringmaskar, eftersom daggmaskar och dubbelfotingar vanligtvis är frånvarande.
|
|
4.
|
F. fimetaria har en världsomspännande utbredning och är vanlig i många jordtyper, alltifrån sandig till lerig jord och från mull till mår. Denna hoppstjärt saknar ögon och pigment. Den har påträffats i jordbruksmark i hela Europa (6). Den är allätare, och i dess föda ingår svamphyfer, bakterier, protozoer och detritus. När den betar interagerar den med infektioner av växtpatogena svampar (7) och kan påverka mykorrhiza, vilket är känt för F. candida. Liksom de flesta hoppstjärtar har den sexuell reproduktion som kräver ständig närvaro av hanar för befruktning av ägg.
|
|
5.
|
F. candida är också utbredd över hela världen. Den inte är vanligt förekommande i de flesta naturliga jordar, men den förekommer ofta i mycket stort antal i humusrika områden. Denna hoppstjärt saknar ögon och pigment. Den har en välutvecklad furca (hoppgaffel) och ett aktivt löpande rörelsemönster, och den hoppar gärna om den störs. Den ekologiska rollen för F. candida liknar den roll som F. fimetaria innehar, men dess livsmiljöer är mer organiskt rika jordar. Den förökar sig genom partenogenes (jungfrufödsel). Förekomsten av hanar är mindre än en promille.
|
PRINCIP FÖR TESTMETODEN
|
6.
|
Synkrona vuxna djur (adulter) (F. fimetaria) eller unga djur (juveniler) (F. candida) exponeras för en serie koncentrationer av testkemikalien som blandats ner i en modifierad syntetisk jord (8) med ett innehåll av organiskt material (eller en annan jordtyp) på 5 %. Testet kan delas upp i två etapper:
|
—
|
Ett preliminärt (range-finding) test, om tillräcklig information om toxicitet inte finns att tillgå, där dödlighet och reproduktion är de viktigaste endpoints som utvärderas efter två veckor för F. fimetaria och tre veckor för F. candida.
|
|
—
|
Ett slutgiltigt reproduktionstest där det totala antalet juveniler som produceras av föräldradjuren samt föräldradjurens överlevnad bedöms. Detta definitiva test pågår i tre veckor för F. fimetaria eller fyra veckor för F. candida.
|
Testkemikaliens toxiska effekter på adulters dödlighet och reproduktionskapacitet uttrycks som LCx och ECx genom att man passar in data in en lämplig modell genom icke-linjär regression för att uppskatta den koncentration som skulle orsaka x % dödlighet eller minskning av reproduktionskapaciteten, eller alternativt som NOEC/LOEC-värdet (9).
|
INFORMATION OM TESTKEMIKALIEN
|
7.
|
De fysikaliska egenskaperna, vattenlösligheten, log Kow, fördelningskoefficienten jord/vatten och ångtrycket för testkemikalien ska helst vara kända. Det är önskvärt att ha ytterligare uppgifter om testkemikaliens omvandling, spridning och fördelning i jord, såsom fotolys- och hydrolyshastigheterna och den biotiska nedbrytningshastigheten. Kemisk identifiering av testkemikalien i enlighet med IUPAC-nomenklatur, CAS-nummer, parti, sats, strukturformel och renhet bör dokumenteras om dessa uppgifter finns tillgängliga.
|
|
8.
|
Testmetoden kan användas för kemikalier som är lösliga eller olösliga i vatten. Testkemikaliens appliceringsmetod måste dock anpassas i enlighet med detta. Testmetoden kan inte användas för flyktiga kemikalier, dvs. kemikalier för vilka Henrys konstant eller fördelningskoefficienten luft/vatten är större än ett, eller kemikalier för vilka ångtrycket överstiger 0,0133 Pa vid 25 °C.
|
TESTETS GILTIGHET
|
9.
|
Följande kriterier bör uppfyllas i de obehandlade kontrollerna för att testresultatet ska anses vara giltigt:
|
—
|
Den genomsnittliga dödligheten hos adulter bör inte överskrida 20 % vid testets slut.
|
|
—
|
Det genomsnittliga antalet juveniler per kärl ska vara minst 100 vid testets slut.
|
|
—
|
Variationskoefficienten som beräknas för antalet juveniler bör vara mindre än 30 % vid slutet av det definitiva testet.
|
|
REFERENSKEMIKALIEN
|
10.
|
En referenskemikalie ska testas vid sin EC50-koncentration för den valda testjorden antingen vid regelbundna intervaller eller eventuellt som ett inslag i varje testomgång för att kontrollera att testorganismernas respons i testsystemet ligger inom normala gränser. En lämplig referenskemikalie är borsyra, vilket bör minska reproduktionen med 50 % (10) (11) vid ca 100 mg/kg torrvikt jord för båda arterna.
|
BESKRIVNING AV TESTET
Testkärl och annan utrustning
|
11.
|
Behållare som rymmer 30 g fuktig jord lämpar sig som testkärl. Testkärlen bör antingen vara av glas eller inert plast (giftfri). Man bör dock undvika att använda plastbehållare om exponeringen för testkemikalien minskas på grund av sorption. Testkärlen bör ha en tvärsnittsarea som gör det möjligt för jordens faktiska djup i testkärlet att vara 2–4 cm. Kärlen bör ha lock (t.ex. glas eller polyeten) som utformats för att minska vattenavdunstningen samtidigt som de tillåter gasutbyte mellan jorden och den omgivande luften. Behållaren ska vara åtminstone delvis genomskinlig för att möjliggöra ljusgenomsläpplighet.
|
|
12.
|
Dessutom behövs normal laboratorieutrustning, särskilt följande:
|
—
|
pH-mätare och luxmätare,
|
|
—
|
lämplig utrustning för temperaturreglering,
|
|
—
|
lämplig utrustning för reglering av luftfuktigheten (inte nödvändigt om exponeringskärlen har lock),
|
|
—
|
temperaturreglerad inkubator eller ett temperaturreglerat litet rum,
|
|
—
|
pincett eller en luftflödesanordning med låg sugkraft.
|
|
Förberedelse av testjorden
|
13.
|
En modifierad syntetisk jord (8) med en halt av organiskt material på 5 % ska användas. Alternativt kan naturlig jord användas, eftersom den syntetiska jorden inte är lik naturliga jordtyper. Den rekommenderade sammansättningen av den syntetiska jorden är följande (baserat på torrvikt, torkad till en konstant vikt vid 105 °C):
|
—
|
5 % vitmosstorv (Sphagnum), lufttorkad och finfördelad (en partikelstorlek på 2 ± 1 mm kan godtas),
|
|
—
|
20 % kaolinlera (kaolinithalt helst över 30 %),
|
|
—
|
ca 74 % lufttorkad sand av industrikvalitet (beroende på den mängd CaCO3 som behövs), övervägande fin sand där mer än 50 % av partiklarna har en storlek mellan 50 och 200 μm. Den exakta mängden sand beror på mängden CaCO3 (se nedan). De bör tillsammans uppgå till 75 %.
|
|
—
|
1,0 % kalciumkarbonat (CaCO3, i pulverform, analyskvalitet) tillsatt för att få ett pH-värde på 6,0 ± 0,5. Mängden kalciumkarbonat som ska tillsättas beror främst på torvens kvalitet/beskaffenhet (se anmärkning 1),
|
Anmärkning 1: Mängden CaCO3 som behövs beror på jordsubstratets beståndsdelar och bör bestämmas genom mätning av pH-värdet i förinkuberade fuktiga delprover av jord omedelbart före testet.
Anmärkning 2: Det rekommenderas att man mäter pH-värdet och eventuellt C/N-kvoten, katjonutbyteskapaciteten (CEC) och halten av organiskt material i jorden i syfte att möjliggöra en normalisering i ett senare skede och att bättre kunna tolka resultaten.
Anmärkning 3: Om så krävs, t.ex. för särskilda teständamål, kan även naturliga jordar från oförorenade platser användas som test- och/eller odlingssubstrat. Om naturjord används bör man minst ange dess ursprung (insamlingsplats), pH, textur (partikelstorleksfördelning), CEC och innehåll av organiskt material, och jorden bör vara fri från alla föroreningar. För naturjord bör man kunna visa att den är lämpad för testet och att den uppfyller kriterierna för testresultatets giltighet innan den används i ett definitivt test.
|
|
14.
|
Jordens torra beståndsdelar blandas omsorgsfullt (t.ex. i en storskalig laboratorieblandare). Den maximala vattenhållningskapaciteten (WHC) för den syntetiska jorden bestäms i enlighet med de förfaranden som beskrivs i tillägg 5. Vattenhalten i testjorden bör optimeras så att en lös porös struktur uppnås som gör det möjligt för hoppstjärtarna att ta sig in i porerna. Detta är vanligtvis mellan 40–60 % av maximal vattenhållningskapacitet (WHC).
|
|
15.
|
Två till sju dagar innan testet inleds förhandsfuktas den torra syntetiska jorden med tillräcklig mängd avjonat vatten så att den får en vattenhalt som motsvarar cirka hälften av den slutliga vattenhalten, i syfte att nå surhetsjämvikt. För bestämning av pH använder man en blandning av jord och 1 M kaliumklorid (KCl) eller 0,01 M kalciumklorid (CaCl2) i förhållandet 1:5 (enligt tillägg 6). Om marken är surare än det intervall som krävs kan detta justeras genom tillsats av en lämplig mängd CaCO3. Om jorden är för alkalisk kan detta justeras genom tillägg av en oorganisk syra som är ofarlig för hoppstjärtar.
|
|
16.
|
Den förhandsfuktade jorden delas upp i portioner som motsvarar antalet testkoncentrationer (och referenskemikalie i förekommande fall) och kontroller som används i testet. Testkemikalierna tillförs och vattenhalten regleras enligt punkt 24.
|
Urval och förberedelse av försöksdjuren
|
17.
|
Den partenogenetiska F. candida är den rekommenderade arten, eftersom denna art i ringtestet (11) av testmetoden uppfyllde validitetskriterierna för överlevnad oftare än F. fimetaria. Om någon annan art används bör den uppfylla giltighetskriterierna som beskrivs i punkt 9. Vid testets början bör djuren ha utfodrats väl och deras ålder bör vara mellan 23–26 dagar för F. fimetaria och 9–12 dagar för F. candida. För varje replikat bör antalet F. fimetaria vara tio hanar och tio honor, och för F. candida bör tio honor användas (se tillägg 2 och tillägg 3). De synkrona djuren väljs slumpvis ut från skålarna och deras hälsa och fysiska tillstånd kontrolleras för varje parti som läggs till ett replikat. Varje grupp med 10/20 individer läggs i en slumpmässigt utvald testbehållare. Stora honor av F. fimetaria väljs ut för att se till att man korrekt kan skilja dem från hanarna av F. fimetaria.
|
Beredning av testkoncentrationer
|
18.
|
Fyra metoder för applicering av testkemikalien kan användas: 1) nedblandning av testkemikalien i jorden med vatten som bärämne, 2) nedblandning av testkemikalien i jorden med ett organiskt lösningsmedel som bärämne, 3) nedblandning av testkemikalien i jorden med sand som bärämne, eller 4) applicering av testkemikalien på jordytan. Valet av lämplig metod beror på kemikaliens egenskaper och syftet med testet. I allmänhet rekommenderas att man blandar ner testkemikalien i jorden. Emellertid kan man behöva använda appliceringsmetoder som är förenliga med testkemikaliens praktiska användning (t.ex. besprutning med en flytande beredning eller användning av särskilda beredningar av bekämpningsmedel såsom granulat eller betningsmedel). Jorden behandlas före hoppstjärtarna tillsätts, utom när testkemikalien tillsätts på jordytan, då hoppstjärtarna bör tillåtas att först komma ner i jorden.
|
Testkemikalier som är lösliga i vatten
|
19.
|
En lösning av testkemikalien bereds i avjonat vatten, i tillräcklig mängd för att det ska räcka till alla replikat av en testkoncentration. Varje lösning av testkemikalien blandas grundligt med ett parti förhandsfuktad jord innan den tillsätts i testkärlet.
|
Testkemikalier som är olösliga i vatten
|
20.
|
För kemikalier som inte är lösliga i vatten men som är lösliga i organiska lösningsmedel kan testkemikalien lösas upp i minsta möjliga volym lämpligt lösningsmedel (t.ex. aceton). Man ser alltjämt till att kemikalien blandas ordentligt med jorden och att den blandas med den del kvartssand som krävs. Endast flyktiga lösningsmedel bör användas. Om ett organiskt lösningsmedel används ska alla testkoncentrationer och en negativ lösningsmedelskontroll innehålla samma minimimängd av lösningsmedlet. Appliceringsbehållarna bör få stå utan lock under en viss tid så att lösningsmedlet som använts i samband med appliceringen av testkemikalien kan avdunsta, och då bör man se till att den toxiska kemikalien inte skingras under denna tid.
|
Testkemikalier som är svårlösliga i vatten och i organiska lösningsmedel
|
21.
|
För kemikalier med dålig löslighet i vatten och i organiska lösningsmedel blandas kvartssand, som bör vara en del av den totala mängden sand som tillförs jorden, med mängden testkemikalie för att få önskad testkoncentration. Blandningen av kvartssand och testkemikalie tillförs den förhandsfuktade jorden och blandas omsorgsfullt efter tillsats av en lämplig mängd avjonat vatten för att få önskad fukthalt. Den slutliga blandningen fördelas mellan testkärlen. Förfarandet upprepas för varje testkoncentration, och en lämplig kontroll upprättas också.
|
Applicering av testkemikalien på jordytan
|
22.
|
När testkemikalien är ett bekämpningsmedel kan det vara lämpligt att applicera den på jordytan genom besprutning. Jorden behandlas efter det att hoppstjärtarna har tillsatts. Testbehållarna fylls först med det fuktade jordsubstratet, därefter tillförs djuren, och sedan vägs testbehållarna. För att undvika att djuren direktexponeras för testkemikalien genom direktkontakt appliceras testkemikalien minst en halvtimme efter införandet av hoppstjärtarna. Testkemikalien bör appliceras så jämnt som möjligt på jordytan med hjälp av en lämplig besprutningsanordning i laboratoriestorlek för att simulera besprutning på fältet. Appliceringen bör ske vid en temperatur som varierar med ± 2 °C, och för vattenlösningar, emulsioner eller dispersioner med en vattenappliceringshastighet som motsvarar riskbedömningens rekommendationer. Hastigheten bör kontrolleras med hjälp av lämplig kalibreringsteknik. Särskilda beredningar som granulat eller betningsmedel kan appliceras på ett sätt som är förenligt med lantbrukspraxis. Foder tillsätts efter besprutningen.
|
FÖRFARANDE
Testbetingelser
|
23.
|
Testets medeltemperatur bör vara 20 ± 1 °C med ett temperaturintervall på 20 ± 2 °C. Testet utförs under kontrollerade ljus/mörker-cykler (helst 12 timmar ljus och 12 timmar mörker) med belysning på 400–800 lux i området där testkärlen förvaras.
|
|
24.
|
För att kontrollera jordens fuktighet vägs kärlen i början, mitten och slutet av testet. Viktförlust > 2 % ska kompenseras genom tillsättning av avjonat vatten. Det bör noteras att förlusten av vatten kan minskas genom att man bibehåller en hög luftfuktighet (> 80 %) i testinkubatorn.
|
|
25.
|
pH-värdet bör mätas i början och slutet av både det preliminära (range-finding) och det definitiva testet. Mätningarna bör göras i ett extra kontrollprov och ett extra prov från de behandlade jordproverna (alla koncentrationer) som beretts och underhållits på samma sätt som testkulturerna men utan tillsats av hoppstjärtar.
|
Testförfarande och mätningar
|
26.
|
För varje testkoncentration placeras en mängd testjord som motsvarar 30 g färskvikt i testkärlet. Vattenkontroller utan testkemikalie upprättas också. Om en vehikel används för applicering av testkemikalien bör man utöver testserierna även ha en kontrollserie som innehåller endast vehikeln. Lösningsmedlet eller dispergeringsmedlet bör ha samma koncentration som den som används i testkärlen med testkemikalien.
|
|
27.
|
De enskilda hoppstjärtarna överförs försiktigt till varje testkärl (fördelas slumpmässigt i testkärlen) och placeras på jordytan. För att förflytta djuren effektivt kan en luftflödesanordning med låg sugkraft användas. Antalet replikat för testkoncentrationer samt för kontroller beror på testutformningen. Testkärlen placeras slumpvis i inkubatorn och deras positioner omfördelas slumpvis varje vecka.
|
|
28.
|
För testet med F. fimetaria används tjugo adulter per testkärl, tio hanar och tio honor, 23–26 dagar gamla. På dag 21 insamlas hoppstjärtarna från jorden och räknas. För F. fimetaria använder man storleken för att skilja könen åt i det synkroniserade partiet djur som används i testet. Honorna är klart större än hanarna (se tillägg 3).
|
|
29.
|
För testet med F. candida används tio 9–12 dagar gamla juveniler per testkärl. På dag 28 insamlas hoppstjärtarna från jorden och räknas.
|
|
30.
|
Som en lämplig foderkälla tillsätts en tillräcklig mängd, t.ex. 2–10 mg, torkad granulerad bagerijäst, som finns kommersiellt tillgänglig för hushållsbruk, i varje behållare vid testets inledning och efter ca två veckor.
|
|
31.
|
Vid slutet av testet bedöms dödligheten och reproduktionen. Efter tre veckor (F. fimetaria) eller fyra veckor (F. candida) insamlas hoppstjärtarna från testjorden (se tillägg 4) och räknas (12). En hoppstjärt registreras som död om den inte är närvarande i det insamlade provet. Extraktions- och räknemetoden bör valideras. Valideringen inbegriper en extraktionseffektivitet för juveniler som överstiger 95 %, och utförs t.ex. genom att ett känt antal tillsätts i jorden.
|
|
32.
|
En praktisk sammanfattning och tidsplan för testförfarandet beskrivs i tillägg 2.
|
Testets utformning
Preliminärt (range-finding) test
|
33.
|
Vid behov utförs ett preliminärt test med t.ex. fem koncentrationer av testkemikalien på 0,1, 1,0, 10, 100 och 1 000 mg/kg torrvikt jord och två replikat för varje testkärl och kontroll. Ytterligare information, från tester med likartade kemikalier eller från litteraturen, om hoppstjärtarnas dödlighet eller fortplantning kan också vara användbar för att avgöra vilka koncentrationsintervall som ska användas i det preliminära testet.
|
|
34.
|
Det preliminära testets varaktighet är två veckor för F. fimetaria och tre veckor för F. candida för att garantera att en kull med juveniler har producerats. Vid slutet av testet bedöms hoppstjärtarnas dödlighet och reproduktion. Antalet adulter och förekomsten av juveniler bör registreras.
|
Definitivt test
|
35.
|
För bestämning av ECx (t.ex. EC10, EC50) bör tolv koncentrationer testas. Det rekommenderas att man har minst två replikat för varje testkoncentrationsbehandling och sex kontrollreplikat. Avståndsfaktorn kan variera beroende på dos-responsmönstret.
|
|
36.
|
För bestämning av NOEC/LOEC bör minst fem koncentrationer i en geometrisk serie testas. Fyra replikat för varje testkoncentrationsbehandling plus åtta kontroller rekommenderas. Koncentrationerna bör skilja sig åt med en faktor på högst 1,8.
|
|
37.
|
Ett kombinerat tillvägagångssätt gör det möjligt att bestämma både NOEC/LOEC och ECx. I denna kombinerade strategi bör man använda åtta behandlingskoncentrationer i en geometrisk serie. Det rekommenderas att man har fyra replikat per testkärl plus åtta kontroller. Koncentrationerna bör skilja sig åt med en faktor på högst 1,8.
|
|
38.
|
Om inga effekter observeras vid den högsta koncentrationen i det preliminära testet (dvs. 1 000 mg/kg), kan reproduktionstestet utföras som ett toleranstest med en testkoncentration på 1 000 mg/kg och en kontroll. Ett toleranstest gör det möjligt att visa att det inte förekommer någon statistiskt signifikant effekt vid gränskoncentrationen. Åtta replikat bör användas både för den behandlade jorden och för kontrollen.
|
DATA OCH RAPPORTERING
Behandling av resultaten
|
39.
|
Reproduktionskapaciteten är den viktigaste endpointen (dvs. antalet juveniler som produceras per testkärl). I den statistiska analysen, t.ex. ANOVA-förfaranden, jämförs testkärlen med hjälp av Students t-test eller Williams test. 95-procentiga konfidensintervaller beräknas för medelvärden för enskilda testkärl.
|
|
40.
|
Antalet överlevande adulter i de obehandlade kontrollerna är ett viktigt giltighetskriterium och bör dokumenteras. Liksom i det preliminära testet bör alla andra skadliga tecken rapporteras i den slutliga rapporten.
|
LCx och ECx
|
41.
|
ECx-värden, inklusive deras sammanhörande lägre och övre 95-procentiga konfidensgränser för parametern i fråga, beräknas med hjälp av lämpliga statistiska metoder (t.ex. logistiska funktioner eller Weibull-funktioner, den modifierade Spearman-Kärbermetoden eller enkel interpolering). ECx-värdet beräknas genom att man inför ett värde som motsvarar x % av medelvärdet för kontrollen i den ekvation som erhållits. För att beräkna EC50 eller något annat ECx-värde bör en regressionsanalys utföras på hela uppsättningen data. LC50 beräknas vanligen med hjälp av probitanalys eller liknande analys som beaktar binomialfördelade dödlighetsdata.
|
NOEC/LOEC
|
42.
|
Om en statistisk analys används för att bestämma NOEC/LOEC är det nödvändigt att sammanställa statistiska uppgifter för varje enskilt kärl (enskilda kärl anses utgöra replikat). Lämpliga statistiska metoder bör användas i enlighet med OECD:s dokument 54, Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application (9). I allmänhet ska negativa effekter av testkemikalien jämfört med kontrollen undersökas genom en ensidig hypotesprövning vid p ≤ 0,05.
|
|
43.
|
Normalfördelning och varianshomogenitet kan testas med hjälp av ett lämpligt statistiskt test, t.ex. Shapiro-Wilks test respektive Levenes test (p ≤ 0,05). Ensidig variansanalys (ANOVA) och därpå följande flerjämförelsetester kan utföras. Multipla jämförelser (t.ex. Dunnetts test) eller step-down-grundade trendtester (t.ex. Williams test) kan användas för att beräkna huruvida det finns betydande skillnader (p ≤ 0,05) mellan kontrollerna och de olika testkemikaliekoncentrationerna (välj rekommenderat test i enlighet med OECD:s dokument 54 (9)). I annat fall kan icke-parametriska metoder (t.ex. Bonferronis U-test enligt Holm eller Jonckheere-Terpstras trendtest) användas för att bestämma NOEC och LOEC.
|
Toleranstest
|
44.
|
Om ett toleranstest (jämförelse av endast ett testkärl och kontrollen) har utförts och de nödvändiga förutsättningarna för parametriska testförfaranden (normalitet, homogenitet) är uppfyllda, kan metriska responser utvärderas med hjälp av Students test (t-test). Om dessa krav inte uppfylls kan man använda t-testet med olika varians (Welchs t-test) eller ett icke-parametriskt test, såsom Mann-Whitneys U-test.
|
|
45.
|
För att se om det finns betydande skillnader mellan kontrollerna (kontroll och kontroll med lösningsmedel), kan replikaten för varje kontroll testas enligt beskrivningen för toleranstestet. Om man inte upptäcker betydande skillnader med dessa tester kan alla kontroll- och lösningsmedelskontrollreplikat sammanföras. I annat fall bör alla testkärl jämföras med lösningsmedelskontrollen.
|
Testrapport
|
46.
|
Testrapporten ska innehålla åtminstone följande information:
|
|
Testkemikalie
|
—
|
testkemikaliens identitet, sändnings- och partinummer, CAS-nummer, renhet,
|
|
—
|
testkemikaliens fysikalisk-kemiska egenskaper (t.ex. log Kow, vattenlöslighet, ångtryck, Henrys konstant (H) och helst information om testkemikaliens omvandling, spridning och fördelning i jorden), om dessa uppgifter finns tillgängliga,
|
|
—
|
testkemikaliens och tillsatsernas beredning bör specificeras om inte den rena kemikalien testas.
|
|
|
|
Testorganismer
|
—
|
testorganismernas art och leverantör, beskrivning av odlingsbetingelserna och testorganismernas åldersintervall.
|
|
|
|
Testbetingelser
|
—
|
beskrivning av testets utformning och testförfarandet,
|
|
—
|
detaljer om testjordens beredning, detaljerade specifikationer om naturjord används (ursprung, historia, partiklarnas storleksfördelning, pH-värde, halt av organiskt material),
|
|
—
|
jordens vattenhållningskapacitet,
|
|
—
|
en beskrivning av den teknik som används för att applicera testkemikalien på jorden,
|
|
—
|
testbetingelser: ljusintensitet, ljus/mörker-cyklernas varaktighet, temperatur,
|
|
—
|
en beskrivning av utfodringsprogrammet, typen och mängden av det foder som används i testet, datum för utfodringen,
|
|
—
|
pH-värdet och vattenhalten i jorden vid testets början och slut (kontroll och varje behandling),
|
|
—
|
detaljerad beskrivning av extraktionsmetoden och extraktionseffektiviteten.
|
|
|
|
Testresultat
|
—
|
antalet juveniler som fastställts i varje provkärl vid testets slut,
|
|
—
|
antalet adulter och deras dödlighet (%) i alla provkärl vid testets slut,
|
|
—
|
en beskrivning av uppenbara eller fysiologiska eller patologiska symtom eller tydliga beteendeförändringar,
|
|
—
|
de resultat som erhållits med referenstestkemikalien,
|
|
—
|
NOEC/LOEC-värdena, LCx för dödlighet och ECx för reproduktion (främst LC50, LC10 och EC50 och EC10) samt de 95-procentiga konfidensintervallen. En kurva med den anpassade modell som har använts för beräkningen, dess funktionsekvation och dess parametrar (se (9)),
|
|
—
|
alla upplysningar och observationer som kan vara till nytta vid tolkningen av resultaten,
|
|
—
|
det faktiska testets giltighet om hypotestestning utförs (9),
|
|
—
|
avvikelser från de förfaranden som beskrivs i denna testmetod och ovanliga händelser under testets gång,
|
|
—
|
den lägsta påvisbara skillnaden när NOEC beräknas.
|
|
|
LITTERATUR
|
(1)
|
Wiles, J. A. och Krogh, P. H. (1998) Testing with the collembolans I. viridis, F. candida and F. fimetaria. I Handbook of soil invertebrate toxicity tests (red. H. Løkke och C. A. M. Van Gestel), s. 131–156. John Wiley & Sons, Ltd., Chichester
|
|
(2)
|
ISO (1999) Markundersökningar – Reproduktionshämning av Collembola (Folsomia candida) på grund av markföroreningar. Nr 11267. Internationella standardiseringsorganisationen, Genève
|
|
(3)
|
Burges, A. och Raw, F. (red.) (1967) Soil Biology. Academic Press. London
|
|
(4)
|
Petersen, H. och Luxton, M. (1982) A comparative analysis of soil fauna populations and their role in decomposition processes. Oikos 39: 287–388
|
|
(5)
|
Petersen, H. (1994) A review of collembolan ecology in ecosystem context. Acta Zoologica Fennica 195: 111–118
|
|
(6)
|
Hopkin, S. P. (1997). Biology of the Springtails (Insecta: Collembola). Oxford University Press. 330 s. (ISBN 0-19-854084-1)
|
|
(7)
|
Ulber, B. (1983) Einfluss von Onychirurus fimatus Gisin (Collembola, Onychiuridae) und Folsomia fimetaria L. (Collembola, Isotomidae) auf Pythium ultimum Trow. einen Erreger des Wurzelbrandes der Zuckerrübe. I New Trends in Soil Biology (Lebrun, Ph., André, H. M., De Medts, A., Grégoire-Wibo, Wauthy, G. (red.). Proceedings of the VI. international colloquium on soil zoology, Louvain-la-neuve (Belgium), 30 August–2 September 1982, Dieu-Brichart, Ottignies-Louvain-la-Neuve, s. 261–268
|
|
(8)
|
Kapitel C.36 i denna bilaga, Reproduktionstest i jord för rovkvalster (Hypoaspis (Geolaelaps) aculeifer).
|
|
(9)
|
OECD (2006), Current approaches in the statistical analysis of ecotoxicity data: a guidance to application. OECD series on testing and assessment, nr 54, ENV/JM/MONO(2006)18, OECD Paris
|
|
(10)
|
Scott-Fordsmand, J. J. och Krogh, P. H. (2005) Background report on prevalidation of an OECD springtail test guideline. Miljöprojekt nr 986. Miljøstyrelsen. 61 s. Danska miljöministeriet.
|
|
(11)
|
Krogh, P. H. (2009). Toxicity testing with the collembolans Folsomia fimetaria and Folsomia candida and the results of a ringtest. Danska miljöstyrelsen, miljöprojekt nr 1256, 66 s.
|
|
(12)
|
Krogh, P. H., Johansen, K. och Holmstrup, M. (1998) Automatic counting of collembolans for laboratory experiments. Appl. Soil Ecol. 7, 201–205
|
|
(13)
|
Fjellberg, A. (1980) Identification keys to Norwegian Collembola. Norsk Entomologisk Forening.
|
|
(14)
|
Edwards, C. A. (1955) Simple techniques for rearing Collembola, Symphyla and other small soil inhabiting arthropods. I Soil Zoology (Kevan, D. K. McE., red.). Butterworths, London, s. 412–416
|
|
(15)
|
Goto, H. E. (1960) Simple techniques for the rearing of Collembola and a note on the use of a fungistatic substance in the cultures. Entomologists' Monthly Magazine 96:138–140.
|
Tillägg 1
Definitioner
Följande definitioner gäller för denna testmetod (i detta test uttrycks alla effektkoncentrationer som massan av testkemikalien per torrmassa av testjorden):
Kemikalie
: ett ämne eller en blandning.
Nolleffektkoncentrationen (NOEC)
: den högsta koncentrationen av testkemikalien vid vilken ingen effekt har noterats. I detta test har en halt som motsvarar NOEC ingen statistiskt signifikant effekt (p < 0,05) inom en given exponeringstid jämfört med ett kontrollprov.
Lägsta koncentration med observerad effekt (LOEC)
: den lägsta koncentrationen av testkemikalien som jämfört med ett kontrollprov har en statistiskt signifikant effekt (p < 0,05) inom en given exponeringstid.
ECx (koncentration som orsakar x % effekt): den koncentration som orsakar en x-procentig effekt på testorganismerna inom en given exponeringstid jämfört med ett kontrollprov. EC50 är till exempel den koncentration som beräknas ha en effekt på en av testets endpoints i 50 % av en exponerad population under en fastställd exponeringstid.
Testkemikalie
: varje ämne eller blandning som testas med denna testmetod.
Tillägg 2
De viktigaste åtgärderna och tidsplan för att utföra ett test på hoppstjärtar
Stegen i testet kan sammanfattas på följande sätt:
|
Tid (dag)
|
Åtgärd
|
|
– 23 till – 26
|
Förberedelse av synkron kultur med F. fimetaria
|
|
– 14
|
Bered syntetisk jord (blandning av torra beståndsdelar).
Kontrollera den syntetiska jordens pH och justera efter behov.
Mät jordens maximala vattenhållningskapacitet.
|
|
– 9 till – 12
|
Förberedelse av synkron kultur med F. candida.
|
|
– 2 till – 7
|
Förhandsfukta jorden.
|
|
– 1
|
Fördela juveniler i partier.
Bered stamlösningar och tillsätt testkemikalie om lösningsmedel krävs.
|
|
0
|
Bered stamlösningar och tillsätt testkemikalie om den är fast, vattenlöslig eller om ytapplicering krävs.
Mät jordens pH och väg behållarna.
Tillsätt föda. Introducera hoppstjärtar.
|
|
14
|
Preliminärt test med F. fimetaria: Avsluta testet, ta ut djuren, mät jordens pH och vattenförlust (vikt).
Definitiva test: Mät fukthalten, fyll på vatten och tillsätt 2–10 mg jäst.
|
|
21
|
Definitivt test med F. fimetaria: Avsluta testet, ta ut djuren, mät jordens pH och vattenförlust (vikt).
Preliminärt test med F. candida: Avsluta testet, ta ut djuren, mät jordens pH och vattenförlust (vikt).
|
|
28
|
Definitivt test med F. candida: Avsluta testet, ta ut djuren, mät jordens pH och vattenförlust (vikt).
|
Tillägg 3
Vägledning om odling och synkronisering av F. fimetaria och F. candida
De tidpunkter och den varaktighet som anges i denna vägledning bör kontrolleras för varje särskild hoppstjärtsart för att se till att tidsplanen möjliggör tillräckligt synkroniserade juveniler. I princip bestämmer äggläggningen efter att adulterna överförts till färskt substrat samt äggkläckningen den lämpliga dagen för insamling av ägg och insamling av synkrona juveniler.
Det rekommenderas att man har en permanent stamodling med t.ex. 50 kärl/petriskålar. Stamodlingen ska hållas i gott skick genom att man utfodrar den varje vecka, vattnar den och avlägsnar gammalt foder och döda djur. Alltför få hoppstjärtar på substratet kan leda till hämning på grund av hög svamptillväxt. Om stamodlingen används alltför ofta för äggproduktion kan odlingen drabbas av utmattning. Tecken på utmattning är döda adulter och mögel på substratet. De återstående äggen från produktionen av synkrona djur kan användas för att vitalisera odlingen.
I en synkron kultur med F. fimetaria kan hanar särskiljas från honor främst genom storleken. Hanarna är betydligt mindre än honorna och hanarnas gånghastighet är snabbare än honornas. Ett korrekt val av kön kräver inte särskilt mycket träning och kan bekräftas genom en mikroskopisk undersökning av djurens genitalier (13).
1. Uppfödning
1.a. Beredning av odlingssubstrat
Odlingssubstratet är gips (kalciumsulfat) med aktivt träkol. Detta ger ett fuktigt substrat. Kolets uppgift är att absorbera spillgaser och exkret (14) (15). Olika former av träkol kan användas för att underlätta observationer av hoppstjärtarna. Pulvriserat träkol används till exempel för F. candida och F. fimetaria (vilket ger ett svart eller grått gips).
Substratets beståndsdelar:
|
—
|
200 ml destillerat vatten
|
eller
|
—
|
50 g aktivt pulvriserat träkol
|
|
—
|
260–300 ml destillerat vatten
|
Substratblandningen får stelna innan användning.
1.b. Avel
Hoppstjärtarna förvaras i behållare såsom petriskålar (90 mm × 13 mm) med botten täckt av ett 0,5 cm tjockt skikt av gips/kolsubstrat. De odlas vid 20 ± 1 °C med en ljus/mörkercykel på 12:12 timmar (400–800 lux). Behållarna hålls alltid fuktiga, och man måste se till att den relativa luftfuktigheten i behållarna är 100 %. Detta kan säkerställas genom förekomsten av fritt vatten i det porösa gipset, men man ska undvika att ett vattenskikt bildas på gipsytan. Vattenförluster kan förhindras genom att man tillhandahåller en fuktig omgivande luft. Alla döda individer bör avlägsnas från behållarna, liksom allt mögligt foder. För att stimulera äggproduktionen är det nödvändigt att överföra adulterna till petriskålar med nyberett gips/kolsubstrat.
1.c. Foderkälla
Torkad granulerad bagerijäst används som enda foderkälla för både F. candida och F. fimetaria. Färskt foder ges en eller två gånger i veckan, för att undvika att fodret angrips av mögel. Det placeras direkt på gipset i en liten hög. Mängden bagerijäst bör anpassas efter storleken på hoppstjärtpopulationen, men i regel räcker det med 2–15 mg.
2. Synkronisering
Testet bör utföras med synkroniserade djur så att man får enhetliga försöksdjur som befinner sig i samma stadium och har samma storlek. Dessutom gör synkroniseringen av F. fimetaria att man kan särskilja hanar och honor från och med tre veckors ålder på grund av sexuell dimorfism, dvs. skillnader i storleken. Det förfarande som beskrivs nedan är ett förslag till hur man kan få fram synkroniserade djur (de praktiska stegen är valfria).
2.a. Synkronisering.
|
—
|
Förbered behållare med ett 0,5 cm tjockt skikt med gips/kolsubstrat.
|
|
—
|
För över för äggläggningsändamål 150–200 adulta F. fimetaria och 50–100 F. candida från de 15–20 bästa stamodlingsbehållarna med 4–8 veckor gammalt substrat till de nya behållarna och utfodra med 15 mg bagerijäst. Undvik att få med juveniler tillsammans med adulter eftersom närvaron av juveniler kan hämma äggproduktionen.
|
|
—
|
Förvara odlingen i 20 ± 1 °C (medelvärdet ska vara 20 °C) med en ljus/mörker-cykel på 12/12 timmar (400–800 lux). Se till att det finns tillgång till färskt foder och att luften är vattenmättad. Foderbrist kan göra att djuren lämnar sin avföring på äggen, vilket leder till svampangrepp på äggen, och F. candida kan kannibalisera på sina egna ägg. Samla efter tio dagar försiktigt in äggen med en nål och en spatel och flytta över dem på ’äggpapper’ (små bitar filterpapper som doppats i gips/kolblandning) som placeras i en behållare med färskt gips/kolsubstrat. Ett fåtal jästkorn tillsätts till substratet för att locka till sig juvenilerna och få dem att lämna äggpappret. Det är viktigt att äggpappret och substratet är fuktiga, annars kommer äggen att torka ut. Som ett alternativ kan adulterna avlägsnas från de synkroniserade odlingslådorna efter att de har lagt ägg i två eller tre dagar.
|
|
—
|
Efter tre dagar har de flesta äggen på äggpappret kläckts, och en del juveniler kan finnas under äggpappret.
|
|
—
|
För att få juveniler av samma ålder avlägsnar man äggpappret med ägg som fortfarande inte har kläckts från petriskålen med en pincett. Juvenilerna, som nu är 0–3 dagar gamla, blir kvar i skålen och utfodras med bagerijäst. Okläckta ägg kastas bort.
|
|
—
|
Ägg och kläckta juveniler odlas på samma sätt som adulter. I synnerhet när det gäller F. fimetaria bör följande åtgärder vidtas: se till att det finns tillräckligt med färskt foder, avlägsna gammalt mögligt foder, fördela efter en vecka juvenilerna i nya petriskålar om densiteten är högre än 200.
|
2.b. Hanteringen av hoppstjärtar vid testets inledning
|
—
|
Samla in de 9–12 dagar gamla F. candida eller de 23–26 dagar gamla F. fimetaria, t.ex. genom uppsugning, och överför dem till en liten behållare med fuktigt gips/kolsubstrat. Deras fysiska tillstånd kontrolleras under ett binokulärt mikroskop (skadade djur kastas bort). Alla åtgärder bör vidtas samtidigt som hoppstjärtarna hålls i en fuktig atmosfär för att undvika stress på grund av torka, t.ex. genom att man använder fuktade ytor osv.
|
|
—
|
Vänd behållaren upp och ner och knacka på den för att överföra hoppstjärtarna till jorden. Statisk elektricitet bör neutraliseras, annars kan djuren komma att flyga ut i luften, eller fastna på testbehållarens sidor och torka ut. En joniserare eller en fuktig trasa under behållaren kan användas för neutralisering.
|
|
—
|
Fodret bör fördelas över hela jordytan och inte bara i en enda klump.
|
|
—
|
Under transporten och under testperioden bör man undvika att knacka på eller på annat sätt fysiskt rubba testbehållarna, eftersom detta kan öka jordens sammanpackning och försvåra interaktionen mellan hoppstjärtarna.
|
3. Alternativa hoppstjärtarter
Andra hoppstjärtarter kan väljas för testning enligt denna testmetod, t.ex. Proisotoma minuta, Isotoma viridis, Isotoma anglicana, Orchesella cincta, Sinella curviseta, Paronychiurus kimi, Orthonychiurus folsomi, Mesaphorura macrochaeta. Ett antal förutsättningar bör vara uppfyllda innan man använder alternativa arter:
|
—
|
De bör vara otvetydigt identifierbara.
|
|
—
|
Motivering för valet av art bör anges.
|
|
—
|
Det bör säkerställas att reproduktionsbiologin ingår i testfasen så att den utgör ett potentiellt mål under exponeringen.
|
|
—
|
Deras livshistoria bör vara känd: ålder vid könsmognad, äggutvecklingens varaktighet och stadier som utsätts för exponering.
|
|
—
|
Optimala förutsättningar för tillväxt och reproduktion bör tillhandahållas genom testsubstratet och fodret.
|
|
—
|
Variabiliteten bör vara tillräckligt låg för att en exakt och tillförlitlig uppskattning av toxiciteten ska kunna göras.
|
Tillägg 4
Insamling och räkning av djur
1. Två insamlingsmetoder kan användas.
|
1.a.
|
Första metoden: En extraktor med kontrollerad temperaturökning baserad på MacFadyens principer kan användas (1). Värmen kommer från ett värmeelement överst i extraktionslådan (som regleras med hjälp av en termistor som placeras på ytan av jordprovet). Temperaturen i den kylda vätskan som omger insamlingskärlet regleras med hjälp av en termistor som sitter på insamlingskärlets yta (som placeras under jordprovet). Termistorerna är kopplade till en programmerbar kontrollenhet som höjer temperaturen enligt en förprogrammerad tidsplan. Djuren samlas upp i den kylda insamlingslådan (2 °C) med ett bottenskikt av gips/kol. Extraktionen inleds vid 25 °C, temperaturen ökas automatiskt varje tolvtimmarsperiod med 5 °C, och extraktionen varar sammanlagt 48 timmar. Efter tolv timmar vid 40 °C avslutas extraktionen.
|
|
1.b.
|
Andra metoden: Efter den experimentella inkubationstiden bedöms antalet juvenila hoppstjärtar med hjälp av flotation. För detta ändamål utförs testet i kärl med en volym på ca 250 ml. Vid testets slut tillsätts ca 200 ml destillerat vatten. Jorden rörs försiktigt om med en liten pensel så att hoppstjärtarna flyter upp till vattenytan. En liten mängd, ca 0,5 ml, svart Kentmeres fotografiska färgämne kan tillsättas vattnet för att underlätta räkningen genom att öka kontrasten mellan vattnet och de vita hoppstjärtarna. Färgämnet inte är giftigt för hoppstjärtar.
|
2. Räkning:
Räkning av antalet djur kan utföras med blotta ögat eller under ljusmikroskop med hjälp av ett rutnät som placeras över flotationskärlet eller genom att fotografera ytan i varje kärl och senare att räkna hoppstjärtarna på uppförstorade foton eller projicerade diabilder. Räkningarna kan även utföras med hjälp av digitala bildbehandlingstekniker (12). Alla tekniker bör valideras.
Tillägg 5
Bestämning av jordens maximala vattenhållningskapacitet (WHC)
Följande metod för bestämning av den maximala vattenhållningskapaciteten (WHC) har konstaterats vara lämplig. Den beskrivs i bilaga C till ISO DIS 11268-2 (Markundersökningar – Föroreningars effekt på daggmaskar (Eisenia fetida). Del 2: Bestämning av effekter på reproduktion).
Samla in en fastställd kvantitet (t.ex. 5 g) testjordsubstrat med hjälp av en lämplig anordning (jordborr med rör osv.). Täck rörets botten med bit vått filterpapper och placera det sedan i en ställning i ett vattenbad. Röret bör gradvis nedsänkas i vattnet tills vattnet står över jordytan. Det bör därefter lämnas i vattnet i cirka tre timmar. Eftersom allt vatten som absorberas av jordens kapillärer inte kan hållas kvar bör jordprovet dräneras i två timmar genom att röret placeras på en bädd av mycket fuktig finmald kvartssand i ett slutet kärl (för att förhindra uttorkning). Provet bör sedan torkas till en konstant vikt vid 105 °C och vägas. Vattenhållningskapaciteten (WHC) ska beräknas enligt följande:

där
|
S
|
=
|
vattenmättat substrat + rörets massa + filterpapprets massa
|
|
T
|
=
|
emballagevikt (rörets massa + filterpapprets massa)
|
|
D
|
=
|
substratets torrvikt
|
Tillägg 6
Bestämning av jordens pH-värde
Följande metod för bestämning av pH-värdet i jord bygger på beskrivningen i ISO DIS 10390: Markundersökningar – Bestämning av pH.
En bestämd mängd jord torkas i rumstemperatur i minst 12 timmar. En suspension av jorden (som innehåller minst 5 gram jord) bereds därefter i fem gånger dess volym med antingen 1 M kaliumkloridlösning (KCl) av analyskvalitet eller 0,01 M kalciumkloridlösning (CaCl2) av analyskvalitet. Suspensionen skakas därefter omsorgsfullt i fem minuter och får sedan stå och klarna i minst 2 timmar men högst 24 timmar. Vätskefasens pH mäts sedan med en pH-mätare som har kalibrerats före varje mätning med hjälp av ett antal lämpliga buffertlösningar (t.ex. pH 4,0 och 7,0).
C.40. TOXICITETSTEST I SEDIMENT- OCH VATTENFAS PÅ CHIRONOMIDLARVER MED SPIKAT SEDIMENT ELLER SPIKAT VATTEN
INLEDNING
|
1.
|
Denna testmetod motsvarar OECD:s testriktlinje (TG) 233 (2010). Den är utformad för att bedöma effekterna av livslång exponering för kemikalier på sötvattenslevande fjädermyggor Chironomus spp., och täcker helt den första generationen (P-generationen) och inledningen av den andra generationen (F1-generationen). Det är en utvidgning av de befintliga testmetoderna C.28 (1) och C.27 (15) med användning av ett exponeringsscenario med spikat vatten eller ett scenario med spikat sediment. Det tar hänsyn till befintliga toxicitetstestprotokoll för Chironomus riparius och Chironomus dilutus (tidigare benämnd C. tentans (2)) som har tagits fram i Europa och Förenta staterna (3) (4) (5) (6) (7) (8) (9) och därefter ringtestats (1) (7) (10) (11) (12). Även andra väldokumenterade chironomider kan användas, t.ex. Chironomus yoshimatsui (13) (14). Exponeringens totala varaktighet är ca 44 dagar för C. riparius och C. yoshimatsui och ca 100 dagar för C. dilutus.
|
|
2.
|
Exponeringsscenarier för både vatten och sediment beskrivs i denna testmetod. Valet av lämpligt exponeringsscenario beror på den avsedda tillämpningen för testet. Vattenexponeringsscenariot, i vilket vattenkolumnen spikas, är avsett att simulera vindavdrift av bekämpningsmedel och täcker den inledande maximala koncentrationen i ytvattnet. Spikning av vatten kan även användas för andra typer av exponering (inklusive utsläpp av kemikalier), men inte för ackumuleringsprocesser i sedimentet som varar längre än testperioden. I ett sådant fall, och även när avrinning är bekämpningsmedlets huvudsakliga tillförselväg till vattenmassor, kan ett spikat sediment vara lämpligare. Om andra exponeringsscenarier är av intresse, kan man lätt anpassa utformningen av testet till detta. Om till exempel fördelningen av testkemikalien mellan vattenfas och sedimentlager inte är av intresse och adsorptionen till sedimentet måste minimeras kan man överväga att använda ett alternativt syntetiskt sediment (t.ex. kvartssand).
|
|
3.
|
Kemikalier som behöver testas på sedimentlevande organismer kan finnas kvar i sedimentet under lång tid. Sedimentlevande organismer kan exponeras via ett antal vägar. Den relativa betydelsen av varje exponeringsväg och den tid det tar för var och en av dem att bidra till den totala toxiska effekten beror på kemikaliens fysikalisk-kemiska egenskaper. För starkt adsorberande kemikalier eller för kemikalier som binds kovalent till sedimentet kan förtäring av förorenat foder vara en viktig exponeringsväg. För att inte underskatta toxiciteten hos starkt lipofila kemikalier kan man överväga att tillsätta foder till sedimentet innan testkemikalien appliceras (se punkt 31). Det är därför möjligt att ta med alla exponeringsvägar och alla levnadsstadier.
|
|
4.
|
De endpoints som mäts är det totala antalet kläckta vuxna exemplar (både för första och andra generationen), utvecklingshastigheten (både för första och andra generationen) könsfördelningen för fullständigt kläckta levande vuxna djur (både för första och andra generationen), antal äggband per honor (endast för första generationen) och äggbandens fertilitet (endast för första generationen).
|
|
5.
|
Det rekommenderas starkt att använda syntetiskt sediment. Syntetiskt sediment har flera fördelar jämfört med naturliga sediment:
|
—
|
variationen mellan testen reduceras eftersom syntetiskt sediment bildar en reproducerbar ’standardmatris’, och behovet av att få fram oförorenade och rena sediment elimineras,
|
|
—
|
testen kan inledas när som helst utan att beakta säsongvariationer i testsedimentet och det behövs ingen förbehandling av sedimentet för att få bort naturligt förekommande fauna,
|
|
—
|
kostnaden är lägre jämfört med insamling på fältet av tillräckliga mängder sediment för rutintestning,
|
|
—
|
syntetiskt sediment ger möjlighet till jämförelser av toxicitet mellan undersökningarna och till klassificering av kemikalierna i enlighet med detta (3).
|
|
|
6.
|
De definitioner som används finns i tillägg 1.
|
PRINCIP FÖR TESTMETODEN
|
7.
|
Första stadiets chironomidlarver exponeras för ett urval koncentrationer av testämnet i ett sediment/vattensystem. Testet inleds genom att man placerar första stadiets larver (första generationen) i testbägare som innehåller spikat sediment eller alternativt att vattnet spikas med testkemikalien efter tillsättning av larverna. Andelen kläckta chironomider, tid fram till kläckningen och könsfördelningen för fullständigt kläckta och levande myggor bedöms. Kläckta vuxna exemplar överförs till odlingsbehållare för att underlätta svärmning, parning och äggläggning. Antalet producerade äggband och deras fertilitet bedöms. Från dessa äggband erhålls andra generationens larver i första stadiet. Dessa larver placeras i nyberedda testbägare (samma spikningsförfarande som för den första generationen) för att fastställa den andra generationens livskraft genom en bedömning av andelen kläckta individer, tid fram till kläckningen och könsfördelningen för fullständigt kläckta och levande myggor (en schematisk presentation av livscykeltestet finns i tillägg 5). Alla data analyseras antingen med en regressionsmodell i syfte att uppskatta den koncentration som skulle orsaka X % minskning av endpointen i fråga, eller med hjälp av hypotesprövning för att bestämma koncentrationen utan observerad effekt (NOEC). Det senare kräver en jämförelse av behandlingsresponserna med lämpliga kontrollresponser med hjälp av statistiska tester. När det gäller snabbt nedbrytbara kemikalier bör noteras att i scenariot med spikat vatten kan de senare livsstadierna i varje generation (t.ex. puppfasen) exponeras för en betydligt lägre koncentrationsnivå i det överliggande vattnet än det första stadiets larver. Om detta är ett problem, och det behövs en jämförbar exponering i varje stadium av livscykeln, kan följande ändringar av testmetoden kan övervägas:
|
—
|
parallella testomgångar med spikning under olika stadier i livscykeln, eller
|
|
—
|
upprepad spikning (eller förnyelse av det överliggande vattnet) i testsystemet under båda testfaserna (första och andra generationen), varvid spikningsintervallerna (förnyelseintervallerna) bör anpassas till testkemikaliens egenskaper när det gäller dess omvandling, spridning och fördelning i miljön.
|
Sådana ändringar är endast möjliga i scenariot med spikat vatten, och inte i scenariot med spikat sediment.
|
INFORMATION OM TESTKEMIKALIEN
|
8.
|
Testkemikaliens vattenlöslighet, ångtryck och log K
ow
, uppmätta eller beräknade fördelning i sedimentet samt stabilitet i vatten och sediment bör vara kända. Det ska finnas en tillförlitlig analysmetod för kvantifiering av testkemikalien i det överliggande vattnet, porvattnet och sedimentet med känd och rapporterad noggrannhet och detektionsgräns. Användbar information inbegriper testkemikaliens strukturformel och renhet. Hur testkemikalien reagerar kemiskt (t.ex. upplösning, abiotisk och biotisk nedbrytning osv.) hör också till den information som är användbar. Närmare vägledning för testning av kemikalier vars fysikalisk-kemiska egenskaper gör dem svåra att testa finns i (16).
|
REFERENSKEMIKALIER
|
9.
|
Referenskemikalier kan regelbundet testas för att säkerställa att känsligheten hos laboratoriets försöksdjurspopulation inte har ändrats. Med dafnier skulle det räcka att göra ett 48-timmars akut test (efter 17). Innan en validerad akut riktlinje finns tillgänglig kan man dock överväga att utföra ett kroniskt test enligt kapitel C.28 i denna bilaga. Exempel på toxiska referensämnen som med framgång har använts i ringtest och valideringsstudier är lindan, trifluranid, pentaklorfenol, kadmiumklorid och kaliumklorid (1) (3) (6) (7) (18).
|
TESTETS GILTIGHET
|
10.
|
För att testet ska vara giltigt måste följande villkor uppfyllas:
|
—
|
den genomsnittliga andelen kläckta djur i kontrollförfarandet bör vara minst 70 % i slutet av exponeringsperioden för båda generationerna (1) (7),
|
|
—
|
för C. riparius och C. yoshimatsui bör 85 % av det totala antalet vuxna myggor från kontrollbehandlingen i båda generationerna kläckas mellan 12 och 23 dagar efter införandet av det första stadiets larver i kärlen. För C. dilutus är en period på 20 till 65 dagar godtagbar,
|
|
—
|
den genomsnittliga könsfördelningen för fullständigt kläckta levande vuxna djur (som en andel honor eller hanar) i kontrollbehandlingen för båda generationerna bör vara minst 0,4 men högst 0,6,
|
|
—
|
för varje odlingsbehållare bör antalet äggband i kontrollerna för den första generationen vara minst 0,6 per hona som har placerats i odlingsbehållaren,
|
|
—
|
andelen fertila äggband i varje kontrollodlingsbehållare för den första generationen bör vara minst 0,6,
|
|
—
|
i slutet av exponeringsperioden för båda generationerna bör pH-värdet och halten löst syre mätas i varje kärl. Syrekoncentrationen bör vara minst 60 % av luftmättnadsvärdet (ASV (24)), och pH-värdet i det överliggande vattnet bör vara mellan 6 och 9 i alla testkärl,
|
|
—
|
variationen i vattentemperaturen får inte vara större än ± 1,0 °C.
|
|
BESKRIVNING AV TESTMETODEN
Testkärl och odlingsbehållare
|
11.
|
Larverna exponeras i 600 ml glasbägare som mäter cirka 8,5 cm i diameter (se tillägg 5). Även andra slags kärl kan användas, men då måste det gå att garantera att det överliggande vattnet och sedimentet har lämpliga djup. Sedimentytan bör vara tillräckligt stor för att ge 2–3 cm° per larv. Förhållandet mellan sedimentskiktets djup och det överliggande vattnets djup bör vara ca 1:4. Odlingsbehållare (minst 30 cm i samtliga tre dimensioner) med gasväv (maskstorlek ca 1 mm) åtminstone på ovansidan och den ena sidan av behållaren bör användas (se tillägg 5). En tvåliters kristalliseringsskål innehållande testvatten och sediment placeras i varje behållare för myggorna att lägga ägg i. Även för kristalliseringsskålen bör förhållandet mellan sedimentskiktets djup och det överliggande vattnets djup vara ca 1:4. Efter att äggbanden har samlas in från kristalliseringsskålen placeras de i en 12-brunnars mikrotiterplatta (ett band per brunn innehållande minst 2,5 ml vatten från den spikade kristalliseringsskålen) varefter plattorna täcks med ett lock för att förhindra betydande avdunstning. Andra kärl som är lämpliga att ha äggbanden i kan också användas. Med undantag för mikrotiterplattor bör alla testkärl och annan apparatur som kommer i kontakt med testsystemet vara gjorda uteslutande av glas eller annat kemiskt inert material (t.ex. polytetrafluoreten).
|
Val av art
|
12.
|
Den art som används i testet ska helst vara Chironomus riparius. C. yoshimatsui kan också användas. C. dilutus kan också vara lämplig, men den är svårare att hantera och kräver en längre testperiod. Uppgifter om odlingsmetoder ges i tillägg 2 för C. riparius. Information om odlingsbetingelser finns också att tillgå för C. dilutus (5) och C. yoshimatsui (14). Identifieringen av arterna bör bekräftas före testningen men är inte nödvändig före varje test om organismerna härrör från en odling inom laboratoriet.
|
Sediment
|
13.
|
Helst ska syntetiskt sediment användas (även kallat rekonstituerat eller konstgjort sediment). Om naturligt sediment används bör dess egenskaper dock fastställas (minst pH, halten organiskt kol, och gärna även andra parametrar såsom förhållandet C/N och granulometri). Sedimentet bör även vara fritt från föroreningar och andra organismer som kan konkurrera med eller leva på chironomiderna. Det rekommenderas också att sedimenten konditioneras före testet i sju dagar under testbetingelser. Följande syntetiska sediment, såsom beskrivs i (1), rekommenderas (1) (20) (21):
|
a.
|
4–5 % (torrvikt) vitmosstorv (Sphagnum), så nära pH 5,5–6,0 som möjligt. Det är viktigt att använda torv i pulverform, finmald (partikelstorlek ≤ 1 mm), och uteslutande lufttorkad,
|
|
b.
|
20 % (torrvikt) kaolinlera (kaolinithalt helst över 30 %),
|
|
c.
|
75–76 % (torrvikt) kvartssand (till största delen bestående av fin sand där mer än 50 % av partiklarna har storleken 50–200 μm),
|
|
d.
|
avjonat vatten tillsätts så att blandningen får en slutlig fukthalt på omkring 30–50 %,
|
|
e.
|
kemiskt rent kalciumkarbonat CaCO3) tillsätts för att justera den slutliga sedimentblandningens pH till 7,0 ± 0,5,
|
|
f.
|
Den slutliga blandningens kolhalt bör vara 2 % (± 0,5 %) och kan justeras med hjälp av lämpliga mängder torv och sand, enligt punkterna (a) och (c).
|
|
|
14.
|
Torvens, kaolinlerans och sandens ursprung ska vara känt. Sedimentkomponenterna ska kontrolleras med avseende på avsaknaden av kemiska föroreningar (t.ex. tungmetaller, organiska klorföreningar, organiska fosforföreningar). Ett exempel på hur syntetiskt sediment kan tillredas beskrivs i tillägg 3. Det är också godtagbart att blanda torra beståndsdelar om det går att visa att tillsats av överliggande vatten inte leder till att sedimentets beståndsdelar separerar (t.ex. flytande torvpartiklar) och att torven eller sedimentet konditionerats tillräckligt.
|
Vatten
|
15.
|
Allt vatten som uppfyller de kemiska kriterierna för godtagbart utspädningsvatten (se tilläggen 2 och 4) är lämpligt som testvatten. Allt lämpligt vatten, naturligt vatten (ytvatten eller grundvatten), rekonstituerat vatten (se tillägg 2) och avklorerat kranvatten är godtagbart som odlings- och testvatten om chironomiderna överlever i det under odlingen och under testet utan att uppvisa tecken på stress. Vid teststart ska testvattnets pH vara mellan 6 och 9 och totalhårdheten får inte vara högre än 400 mg/l uttryckt som CaCO3. Om man misstänker växelverkan mellan hårdhetsjoner och testkemikalien bör dock vatten med lägre hårdhet användas (och därmed bör Elendt Medium M4 inte användas i detta läge). Samma typ av vatten bör användas under hela undersökningen. De vattenkvalitetsegenskaper som förtecknas i tillägg 4 bör mätas minst två gånger om året eller om man misstänker att egenskaperna har ändrats betydligt.
|
Stamlösningar – spikat vatten
|
16. a.
|
Testkoncentrationerna beräknas på grundval av koncentrationerna i det överliggande vattnet, dvs. vattnet ovanför sedimentet. Testlösningar av de valda koncentrationerna bereds i regel genom utspädning av en stamlösning. Stamlösningarna bör helst beredas genom upplösning av testkemikalien i testvattnet. I vissa fall kan det krävas lösningsmedel eller dispergeringsmedel för att få en stamlösning med lämplig koncentration. Lämpliga lösningsmedel är t.ex. aceton, etylenglykolmonoetyleter, etylenglykoldimetyleter, dimetylformamid och trietylenglykol. Dispergeringsmedel som kan användas är Cremophor RH40, Tween 80, metylcellulosa 0,01 % och HCO-40. Solubiliseringsmedlets koncentration i det slutliga testmediet bör vara minimal (t.ex. ≤ 0,1 ml/l) och bör vara samma för alla testkärl. Om ett solubiliseringsmedel används bör det inte ha någon betydande effekt på överlevnaden enligt vad som framkommer vid en lösningsmedelskontroll jämfört med en negativ (vatten-)kontroll. Man bör dock så långt som möjligt undvika att använda sådana ämnen.
|
Stamlösningar – spikat sediment
|
16. b.
|
Spikat sediment med vald koncentration bereds i regel genom tillsättning av en lösning av testkemikalien direkt i sedimentet. En stamlösning av testkemikalien upplöst i avjonat vatten blandas med det syntetiska sedimentet i en rullkvarn, matningsblandare eller manuellt. Om testkemikalien är svårlöslig i vatten kan den lösas upp i minsta möjliga volym lämpligt organiskt lösningsmedel (t.ex. hexan, aceton eller kloroform). Denna lösning blandas sedan med 10 g fin kvartssand för varje testkärl. Lösningsmedlet får avdunsta och måste då helt avlägsnas ur sanden, och därefter blandas sanden med lämplig mängd sediment. Endast ämnen som avdunstar lätt får användas för att upplösa, dispergera eller emulgera testkemikalien. Man bör hålla i åtanke att den sand som följer med blandningen av testkemikalie och sand måste beaktas när sedimentet förbereds (dvs. sedimentet bör beredas med en mindre mängd sand). Man bör vara noga med att se till att testkemikalien som tillsätts sedimentet fördelas omsorgsfullt och jämnt i sedimentet. Vid behov kan delprover analyseras för att bestämma homogeniteten.
|
TESTETS UTFORMNING
|
17.
|
Testets utformning avser antalet koncentrationer och intervallen mellan dem, antalet kärl per koncentration och antalet larver per kärl, antalet kristalliseringsskålar och odlingsbehållare. Utformning för ECx, NOEC och för toleranstest beskrivs nedan.
|
Utformning för regressionsanalys
|
18.
|
Den effektkoncentration (ECx) och det koncentrationsintervall inom vilket effekterna av testkemikalien är av intresse bör omfattas av testet, så att endpointen inte extrapoleras utom ramarna för de data som genereras. Extrapolering långt under lägsta eller över högsta koncentration bör undvikas. Ett preliminärt (range-finding) test enligt testmetod C.27 eller C.28 kan vara till hjälp vid valet av lämpliga testkoncentrationsintervall.
|
|
19.
|
För bestämning av ECx krävs minst fem koncentrationer och åtta replikat för varje koncentration. För varje koncentration bör två odlingsbehållare användas (A och B). De åtta replikaten indelas i två grupper med fyra replikat till varje odlingsbehållare. Denna sammanslagning av replikat är nödvändig på grund av antalet myggor som behövs i behållaren för välgrundade bedömningar av reproduktionen. Den andra generationen har dock återigen åtta replikat, som påbörjas utifrån de exponerade populationerna i odlingsbehållarna. Faktorn mellan koncentrationerna bör inte vara större än två (undantag kan göras i fall där dos-respons-kurvan har liten lutning). Antalet replikat per testkärl kan minskas till sex (tre för varje odlingsbehållare) om antalet testkoncentrationer med olika responser ökas. En ökning av antalet replikat eller en minskning av testkoncentrationsintervallerna tenderar att leda till smalare konfidensintervall kring ECx.
|
Utformning för bestämning av NOEC
|
20.
|
För bestämning av NOEC bör fem testkoncentrationer med minst åtta replikat användas (fyra för varje odlingsbehållare, A och B), och faktorn mellan koncentrationerna bör inte vara större än två. Antalet replikat bör vara tillräckligt för att säkerställa tillräcklig statistisk giltighet för att upptäcka en skillnad på 20 % jämfört med kontrollen vid en signifikansnivå på 5 % (α = 0,05). För utvecklingshastighet, fruktsamhet och fertilitet är det vanligen lämpligt att använda variansanalys (ANOVA), följd av Dunnetts eller Williams test (22–25). För andelen kläckta djur och könsfördelningen kan Cochran-Armitages test, Fishers exakta test (med Bonferronikorrigering) eller Mantel-Haentzals test vara lämpliga.
|
Toleranstest
|
21.
|
Ett toleranstest kan utföras (en testkoncentration och kontroll(er)) om inga effekter observeras i det frivilliga preliminära testet upp till en högsta koncentration. Syftet med toleranstestet är att få en indikation om att testkemikaliens toxiska effekter förekommer vid nivåer som är högre än den testade gränskoncentrationen. För vatten föreslås 100 mg/l och 1 000 mg/kg för sediment (torrvikt). Normalt behövs minst åtta replikat både för testkärl och kontroll. Tillräcklig statistisk giltighet för att upptäcka en skillnad på 20 % jämfört med kontrollen vid en signifikansnivå på 5 % (α = 0,05) bör påvisas. Eftersom t-testet ger kvantitativ respons (t.ex. utvecklingshastighet) är det en lämplig statistisk metod förutsatt att data uppfyller testkraven (normalitet, homogena varianser osv.). Om dessa krav inte uppfylls kan man använda t-testet med olika varians eller ett icke-parametriskt test, såsom Wilcoxon-Mann-Whitneys test. För andelen kläckta djur är Fishers exakta test lämpligt att använda.
|
FÖRFARANDE
Exponeringsförhållanden
Beredning av vatten/sediment-systemet (spikat vatten)
|
22. a.
|
Syntetiskt sediment (se punkterna 13 och 14 samt tillägg 3) placeras i varje testkärl och kristalliseringsskål så att det bildar ett skikt på minst 1,5 cm (det kan vara något lägre i kristalliseringsskålen) men högst 3 cm. Vatten (se punkt 15) tillsätts så att förhållandet mellan sedimentskiktets djup och vattnets djup inte överskrider 1:4. Efter beredning av testkärlen bör sediment/vatten-systemet luftas skonsamt i ca sju dagar före tillsats av första stadiets larver i första eller andra generationen (se punkt 14 och tillägg 3). Sediment/vatten-systemet i kristalliseringsskålarna luftas inte under testets gång, eftersom det inte behöver stödja larvernas överlevnad (äggbanden samlas in redan före kläckningen). För att undvika separation av sedimentets beståndsdelar och återsuspension av finfördelat material medan testvatten tillsätts i vattenkolumnen kan sedimentet täckas med en plastplatta medan vattnet tillsätts. Plattan avlägsnas sedan omedelbart. Även andra metoder kan vara lämpliga.
|
Beredning av vatten/sediment-systemet (spikat sediment)
|
22. b.
|
Spikade sediment som beretts enligt punkt 16b placeras i kärlen och i kristalliseringsskålen, och det överliggande vattnet tillsätts så att förhållandet mellan sediment- och vattenvolymen är 1:4. Sedimentskiktets djup bör ligga i intervallet 1,5–3 cm (det kan vara något lägre för kristalliseringsskålen). För att undvika separation av sedimentets beståndsdelar och återsuspension av finfördelat material medan testvatten tillsätts i vattenkolumnen kan sedimentet täckas med en plastplatta medan vattnet tillsätts, varefter plattan avlägsnas omedelbart. Även andra metoder kan vara lämpliga. Efter beredningen av spikat sediment och överliggande vatten rekommenderas att testkemikalien får fördela sig från sedimentet till vattenfasen (4) (5) (7) (18). Detta bör helst göras under samma temperatur- och luftningsbetingelser som används i testet. Den lämpliga stabiliseringstiden beror på sedimentet och kemikalien, och kan variera mellan några timmar och flera dagar, i sällsynta fall upp till fem veckor. Eftersom en lång stabiliseringstid kan leda till att många kemikalier sönderfaller eftersträvas här inte jämvikt, utan i stället rekommenderas en stabiliseringstid på 48 timmar. När halveringstiden för nedbrytning i sedimentet är känd för att vara lång (se punkt 8) kan stabiliseringstiden dock förlängas. I slutet av denna stabiliseringsperiod bör koncentrationen av testkemikalien mätas i det överliggande vattnet, porvattnet och sedimentet, åtminstone vid den högsta koncentrationen och en lägre koncentration (se punkt 38). Dessa analytiska bestämningar av testkemikalien gör det möjligt att beräkna massbalansen och uttrycka resultaten på grundval av uppmätta koncentrationer.
|
|
23.
|
Testkärlen bör vara täckta (t.ex. med glasplattor). Vid behov kan vattennivåerna fyllas på under testets gång till deras ursprungliga volym för att kompensera för avdunstning. Detta bör göras med destillerat eller avjonat vatten för att förebygga ackumulering av salter. Kristalliseringsskålarna i odlingsbehållarna ska inte täckas och kan, men behöver inte nödvändigtvis, justeras för att kompensera för vattenförluster under testperioden, eftersom äggbanden endast kommer i kontakt med vattnet under ca en dag och skålarna endast används under en kort fas i testet.
|
Tillförsel av testorganismer
|
24.
|
Fyra till fem dagar innan det första stadiets larver från den första generationen tillsätts bör äggmassorna avlägsnas från odlingen och placeras i små kärl i ett odlingsmedium. Mognat medium från stamodlingen eller ett nyberett medium kan användas. Under alla omständigheter bör en liten mängd foder, t.ex. några droppar filtrat från en finmald suspension av fiskfoder i flingform, tillsättas odlingsmediet (se tillägg 2). Endast nylagda äggmassor får användas. I regel börjar larverna kläckas några dagar efter att äggen har lagts (2–3 dagar för C. riparius vid 20 °C och 1–4 dagar för C. dilutus vid 23 °C och C. yoshimatsui vid 25 °C), och larvernas tillväxt sker i fyra stadier på 4–8 dagar per stadium. Första stadiets larver (högst 48 timmar efter kläckningen) bör användas i testet. Bestämningen av larvstadium kan eventuellt göras genom mätning av huvudkapseldiameter (7).
|
|
25.
|
Tjugo första stadiets larver från den första generationen fördelas slumpvis i varje testkärl som innehåller sediment/vatten-systemet med hjälp av en trubbig pipett. Luftningen av vattnet stängs av medan larverna tillsätts i testkärlen och bör förbli avstängd under 24 timmar efter tillsättningen av larver (se punkt 32). Enligt det testupplägg som används (se punkterna 19 och 20) är antalet larver per testkoncentration minst 120 (6 replikat per koncentration) för bestämningen av ECx och 160 för bestämningen av NOEC (8 replikat per koncentration). I scenariot med spikat sediment inleds exponeringen i och med tillsättningen av larverna.
|
Spikning av det överliggande vattnet
|
26.
|
Tjugofyra timmar efter tillsättningen av första stadiets larver från den första generationen spikas den överliggande vattenkolumnen med testkemikalien, och en lätt luftning görs på nytt (för eventuella ändringar i testförfarandet, se punkt 7). Små volymer av stamlösningar med testkemikalien tillsätts under vattenytan med hjälp av en pipett. Därefter görs en försiktig omrörning av det överliggande vattnet utan att störa sedimentet. I scenariot med spikat vatten inleds exponeringen med spikningen av vattnet (dvs. en dag efter tillsättningen av larverna).
|
Insamling av nykläckta vuxna exemplar
|
27.
|
Nykläckta myggor från den första generationen samlas in minst en gång, men helst två gånger per dag (se punkt 36) från testkärlen med hjälp av en aspirator, exhauster eller liknande anordning (se tillägg 5). Stor försiktighet bör iakttas för att inte skada de vuxna djuren. De insamlade myggorna från fyra testkärl inom en behandling släpps ut i den odlingsbehållare som de tidigare har tilldelats. På dagen då (hanarna) börjar kläckas spikas kristalliseringsskålarna genom att en liten mängd stamlösning med testkemikalien pipetteras ner under vattenytan (utformning med spikat vatten). Därefter görs en försiktig omrörning av det överliggande vattnet utan att störa sedimentet. Testkemikaliens koncentration i kristalliseringsskålen är praktiskt taget densamma som i det behandlingskärl som har avsatts för odlingsbehållaren i fråga. För utformningen med spikat sediment förbereds kristalliseringsskålarna ungefär på dag 11 efter exponeringens början (dvs. tillsatsen av den första generationens larver) så att de kan stabiliseras i cirka 48 timmar före de första äggbanden produceras.
|
|
28.
|
Äggbanden samlas in från kristalliseringsskålarna i odlingsbehållarna med hjälp av en pincett eller en trubbig pipett. Varje äggband placeras i en behållare som innehåller odlingsmedium från den kristalliseringsskål som det insamlats ifrån (t.ex. ett hål i en 12-brunnars mikrotiterplatta tillsammans med minst 2,5 ml medium). Kärlen med äggbanden täcks med lock för att förhindra betydande avdunstning. Äggbanden hålls under observation under minst sex dagar efter att de har lagts så att de kan klassificeras som befruktade eller obefruktade.
För att initiera den andra generationen väljs minst tre, men helst sex, befruktade band ut från varje odlingsbehållare och tillåts att kläckas tillsammans med lite foder. Dessa äggband ska ha lagts när äggläggningen nådde sitt maximum, vilket normalt inträffar omkring testdag 19 i kontrollerna. Helst ska andra generationen i alla testkärl initieras på samma dag, men på grund av kemikaliens effekter på larvernas utveckling är detta emellertid inte alltid möjligt. I sådana fall kan de högre koncentrationerna initieras senare än de lägre behandlingarna och (lösningsmedels-)kontrollen.
|
|
29. a.
|
I scenariot med spikat vatten bereds sediment/vatten-systemet för den andra generationen genom att den överliggande vattenkolumnen spikas med testämnet ca en timme före larverna i det första stadiet tillsätts i testkärlen. Små volymer av testkemikalielösningar tillsätts under vattenytan med hjälp av en pipett. Därefter görs en försiktig omrörning av det överliggande vattnet utan att störa sedimentet. Efter spikningen görs en lätt luftning.
|
|
29. b.
|
I scenariot med spikat sediment bereds exponeringskärlen som innehåller sediment/vatten-systemet för den andra generationen på samma sätt som för den första generationen.
|
|
30.
|
Tjugo larver i första stadiet (högst 48 timmar efter kläckningen) från den andra generationen fördelas slumpvis i varje testkärl som innehåller det spikade sediment/vatten-systemet med hjälp av en trubbig pipett. Luftningen av vattnet bör stängas av medan larverna i det första stadiet tillsätts i testkärlen och hållas avstängd i ytterligare 24 timmar efter tillsättning av larverna. Enligt det testupplägg som används (se punkterna 19 och 20) är antalet larver per testkoncentration minst 120 (6 replikat per koncentration) för bestämningen av ECx och 160 för bestämningen av NOEC (8 replikat per koncentration).
|
Foder
|
31.
|
Man måste utfodra larverna i testkärlen, helst dagligen eller minst tre gånger per vecka. En lagom mängd foder för unga larver under de första tio dagarna av deras utveckling är 0,25–0,5 mg fiskfoder (eller en suspension i vatten av finmalt foder, t.ex. Tetra-Min eller Tetra-Phyll, se uppgifter i tillägg 2) per larv och dag (0,35–0,5 mg för C. yoshimatsui). Något större mängder foder kan krävas för äldre larver: 0,5–1,0 mg per larv och dag bör vara tillräckligt för återstoden av testet. Fodergivan bör minskas i alla testkärl och kontroller om det uppstår svamptillväxt eller om mortalitet observeras i kontrollerna. Om svamptillväxten inte kan stoppas måste testet upprepas.
Den toxikologiska betydelsen av exponering via foderintag är i allmänhet högre för kemikalier med en hög affinitet för organiskt kol eller kemikalier som är kovalent bundna till sedimentet. När man testar kemikalier med sådana egenskaper kan dock den mängd foder som krävs för att säkerställa larvernas överlevnad och naturliga tillväxt tillsättas i det syntetiska sedimentet före stabiliseringsperioden, beroende på de föreskrivna kraven. För att förhindra försämring av vattenkvaliteten bör växtmaterial användas i stället för fiskfoder, t.ex. 0,5 % (torrvikt) finmalda blad från brännässla (Urtica dioica), mullbär (Morus alba), vitklöver (Trifolium repens), spenat (Spinacia oleracea) eller annat växtmaterial (Cerophyl eller alfacellulosa). Att tillsätta hela ransonen av en ekologisk foderkälla till sedimentet innan spikningen är inte försumbart när det gäller vattenkvaliteten och det biologiska resultatet (21), och är inte heller en standardmetod, men färska studier tyder på att denna metod fungerar (19) (26). De vuxna myggorna i odlingsbehållarna behöver normalt inget foder, men fruktsamheten och produktiviteten förbättras när bomullskompresser indränkta i mättad sackaroslösning erbjuds som en födokälla för vuxna exemplar (34).
|
Inkuberingsförhållanden
|
32.
|
Skonsam luftning av det överliggande vattnet i testkärlen införs 24 timmar efter tillsättning av första stadiets larver i båda generationerna och får pågå under hela testet (se till att halten löst syre inte faller under 60 % av luftmättnadsvärdet (ASV)). Luftningen tillhandahålls genom en pasteurpipett av glas vars öppning fästs 2–3 cm ovanför sedimentlagret och släpper ut några bubblor per sekund. Vid testning av flyktiga kemikalier kan man överväga att utesluta luftningen av sediment/vattensystemet samtidigt som giltighetskriteriet rörande ett luftmättnadsvärde på minst 60 % (punkt 10) ska uppfyllas. Ytterligare vägledning finns i (16).
|
|
33.
|
Testet med C. riparius genomförs vid en konstant temperatur på 20 °C (± 2 °C). För C. dilutus och C. yoshimatsui rekommenderas temperaturer på 23 °C respektive 25 °C (± 2 °C). En ljusperiod på 16 timmar används och ljusintensiteten ska vara 500–1 000 lux. För odlingsbehållarna kan ytterligare en timmes grynings- och skymningsfas ingå.
|
Exponeringstid
|
34.
|
Utformning med spikat sediment: Exponeringsperioden för den första generationen inleds när testkemikalien spikas i det överliggande vattnet i testkärlen (dvs. en dag efter införandet av larver – för eventuella ändringar av exponeringsutformningen, se punkt 7). Exponeringen av den andra generationens larver inleds omedelbart, eftersom de har införts i ett sediment/vatten-system som redan är spikat. Den maximala exponeringstiden för den första generationen är 27 dagar och för den andra generationen 28 dagar (den första generationens larver tillbringar en dag i kärlen utan exponering) för C. riparius och C. yoshimatsui. Med tanke på överlappningen är testperioden ungefär 44 dagar totalt. För C. dilutus är de maximala exponeringstiderna 64 respektive 65 dagar för första och andra generationens larver. Den totala testperioden är ungefär 100 dagar.
Utformning med spikat sediment: exponeringen inleds i och med tillsättningen av larverna, och exponeringstiden är högst 28 dagar för båda generationerna för C. riparius och C. yoshimatsui och högst 65 dagar för båda generationerna för C. dilutus.
|
Observationer
Kläckning
|
35.
|
Utvecklingstiden och det totala antalet fullständigt kläckta levande han- och honmyggor bestäms för båda generationerna. Hanarna är lätta att känna igen på sina fjäderantenner och smala kroppsställning.
|
|
36.
|
Testkärlen med båda generationerna bör granskas minst tre gånger i veckan för att visuellt bedöma förekomsten av onormalt beteende hos larverna (t.ex. exemplar som lämnar sedimentet, ovanligt simbeteende) jämfört med kontrollen. Under kläckningstiden, som inleds ca tolv dagar efter att larver för C. riparius och C. yoshimatsui införts (efter tjugo dagar för C. dilutus), räknas och könsbestäms de kläckta myggorna minst en gång, men helst två gånger om dagen (tidig morgon och sen eftermiddag). Efter identifieringen avlägsnas den första generationens myggor försiktigt från kärlen och överförs till en odlingsbehållare. Den andra generationens myggor avlägsnas och dödas efter identifiering. Alla äggband som lagts i den första generationens testkärl ska samlas in ett och ett och överföras tillsammans med minst 2,5 ml av testkärlens vatten till 12-brunnars mikrotiterplattor (eller annat lämpligt kärl) som täcks med lock för att förhindra betydande avdunstning. Antalet döda larver och synliga puppor som inte har kläckts bör också registreras. Exempel på odlingsbehållare, testkärl och exhauster finns i tillägg 5.
|
Reproduktion
|
37.
|
Effekter på reproduktionen bedöms genom antalet äggband som produceras av den första generationens myggor och fertiliteten för dessa äggband. En gång per dag samlas äggbanden in från kristalliseringsskålen som placerats i varje odlingsbehållare. Äggbanden bör samlas in och överföras tillsammans med minst 2,5 ml av testkärlens vatten till 12-brunnars mikrotiterplattor (ett äggband i varje brunn) eller andra lämpliga kärl som täcks med lock för att förhindra betydande avdunstning. Följande egenskaper registreras för varje äggband: läggningsdag, storlek (normal, dvs. 1,0 ± 0,3 cm, eller liten, vanligtvis ≤ 0,5 cm) och struktur (normal = bananformad med spiralformad äggsnodd, eller onormal, t.ex. med rak äggsnodd) samt fertiliteten (fertilt eller sterilt). Under sex dagar efter läggningen bedöms fertiliteten hos varje äggband. Ett äggband anses vara fertilt när minst en tredjedel av äggen kläcks. Det totala antalet honor som tillsatts i odlingsbehållaren används för att beräkna antalet äggband per hona och antalet fertila äggband per hona. Om så krävs kan antalet ägg i ett äggband uppskattas utan att förstöra dem med hjälp av ringräkningsmetoden (se 32 och 33).
|
Analysmätningar
Testkemikaliens koncentration
|
38.
|
Som ett minimum bör prover av det överliggande vattnet, porvattnet och sedimentet analyseras i början av exponeringen (helst en timme efter tillsatsen när det gäller spikat vatten) och i slutet av testet, vid den högsta koncentrationen och en lägre koncentration. Detta gäller för båda generationernas kärl. När det gäller kristalliseringsskålarna i odlingsbehållaren analyseras endast det överliggande vattnet, eftersom det är vad äggbanden kommer i kontakt med (i upplägget med spikat sediment kan man överväga att göra en analytisk bekräftelse av koncentrationen i sedimentet). Ytterligare mätningar av sedimentet, porvattnet eller det överliggande vattnet får utföras under testets gång om det anses nödvändigt. Dessa bestämningar av testkemikaliens koncentration ger information om testkemikaliens sätt att reagera/fördelning i vatten/sediment-systemet. Provtagningen av sedimentet och porvattnet vid testets inledning samt under testets gång (se punkt 39) kräver ytterligare testkärl för att utföra analytiska bestämningar. I upplägget med spikat vatten är det eventuellt inte nödvändigt att utföra mätningar i sedimentet om fördelningen av testkemikalien mellan vatten och sediment har fastställts tydligt under motsvarande betingelser (t.ex. förhållandet mellan sediment och vatten, appliceringstyp, sedimentets halt av organiskt kol), eller om de uppmätta koncentrationerna i det överliggande vattnet visar sig stadigt ligga inom 80–120 % av de nominella eller uppmätta startkoncentrationerna.
|
|
39.
|
Om mellanliggande mätningar görs (t.ex. dag 7 och/eller 14) och om analysen kräver stora prover som inte kan tas från testkärlen utan att testsystemet påverkas, bör de analytiska bestämningarna göras på prover från ytterligare testkärl som behandlas på samma sätt (inklusive förekomsten av testorganismer) men som inte används för biologiska observationer.
|
|
40.
|
Centrifugering t.ex. vid 10 000 g vid 4 °C i 30 minuter är det rekommenderade förfarandet för att isolera porvattnet. Om testämnet bevisligen inte adsorberas på filter kan även filtrering godtas. I vissa fall är det eventuellt inte möjligt att analysera koncentrationerna i porvattnet därför att provvolymen är för liten.
|
Fysikalisk-kemiska parametrar
|
41.
|
Mätning av pH, löst syre i testvattnet och temperatur i testkärlen och kristalliseringsskålarna bör utföras på lämpligt sätt (se punkt 10). Hårdhet och ammoniak bör mätas i kontrollerna samt i ett testkärl och en kristalliseringsskål vid den högsta koncentrationen i början och slutet av testet.
|
DATA OCH RAPPORTERING
Behandling av resultaten
|
42.
|
Syftet med detta livscykeltest är att bestämma hur testkemikalien påverkar reproduktionen och, i två generationer, utvecklingshastigheten och det totala antalet fullständigt kläckta levande han- och honmyggor. För andelen kläckta djur bör data rörande hanar och honor läggas samman. Om det inte finns några statistiskt signifikanta skillnader mellan känsligheten när det gäller utvecklingshastigheten för de båda könen var för sig kan resultaten för hanar och honor läggas samman för statistiska analyser.
|
|
43.
|
Effektkoncentrationerna uttryckta som koncentrationer i det överliggande vattnet (för spikat vatten) eller i sedimentet (för spikat sediment) beräknas vanligen på grundval av uppmätta koncentrationer vid exponeringens början (se punkt 38). För spikat vatten beräknas medelvärdet för varje behandling av de koncentrationer som normalt sett uppmäts i början av exponeringen i det överliggande vattnet i kärlen för båda generationerna och i kristalliseringsskålarna. För spikat sediment beräknas medelvärdet av de koncentrationer som normalt sett uppmäts i början av exponeringen i kärlen för båda generationerna (och valfritt även i kristalliseringsskålarna) för varje behandling.
|
|
44.
|
För att beräkna en punktvis uppskattning, dvs. ett ECx-värde, kan statistiken per kärl och per odlingsbehållare användas som äkta replikat. Vid beräkning av konfidensintervallet för ett ECx-värde bör variabiliteten mellan kärlen beaktas, eller så bör man påvisa att variabiliteten är så liten att den kan försummas. Om modellen anpassas med minsta kvadratmetoden bör transformation tillämpas på den kärlvisa statistiken i syfte att förbättra variansens homogenitet. ECx-värdena bör dock beräknas när responsen har transformerats tillbaka till det ursprungliga värdet (31).
|
|
45.
|
När syftet med den statistiska analysen är att bestämma NOEC genom hypotestestning måste variabiliteten mellan kärlen beaktas, vilket garanteras om man använder ANOVA-metoder (t.ex. Williams och Dunnetts testförfaranden). Williams test kan vara lämpligt att använda när en monoton dos-respons förväntas i teorin, och Dunnetts test kan vara lämpligt om monotonitetshypotesen inte håller. Alternativt kan mer robusta tester (27) vara lämpliga i situationer där de vanliga ANOVA-antagandena inte gäller (31).
|
Andelen kläckta djur
|
46.
|
Data rörande andelen kläckta djur är dikotoma (tvåpunktsfördelade) och kan analyseras genom Cochran-Armitages test som tillämpas på step-down-grund där en monoton dos-respons förväntas och dessa data stämmer överens med denna förväntning. Om inte, kan Fishers exakta test eller Mantel-Haentzals med Bonferroni-Holm-korrigerade p-värden användas. Om det finns bevis på större variabilitet mellan replikaten inom samma koncentration än en binomial fördelning skulle utvisa (ofta kallad ’extra-binomial’ fördelning), bör man använda ett robust Cochran-Armitages test eller Fischers exakta test, såsom föreslås i (27).
Summan av levande myggor (hanar plus honor) som kläckts per kärl, ne
, bestäms och divideras med antalet tillsatta larver, na
enligt följande:

där
|
ER
|
=
|
andelen kläckta djur
|
|
ne
|
=
|
antalet levande myggor som kläckts per kärl
|
|
na
|
=
|
antalet larver som tillsatts per kärl (normalt 20)
|
När ne
är större än na
(dvs. när mer än det planerade antalet larver oavsiktligt infördes) bör na
göras lika med ne
.
|
|
47.
|
Ett alternativt tillvägagångssätt, som bäst lämpar sig för stora prov när det finns extra-binomial varians, är att behandla antalet kläckta djur som en kontinuerlig respons och använda förfaranden som är förenliga med dessa data för antalet kläckta djur. I detta sammanhang definieras begreppet ’stort prov’ som ett prov där både antalet kläckta och antalet okläckta överstiger fem per replikatkärl.
|
|
48.
|
Vid användning av ANOVA-metoder bör värdena för antalet kläckta djur först transformeras genom arcsin-kvadratsrotstransformation eller Freeman-Tukeytransformation för att få en ungefärlig normalfördelning och jämna ut varianserna. Cochran-Armitages test, Fishers exakta test (Bonferroni) eller Mantel-Haenszels test kan användas när absoluta frekvenser används. För att göra en arcsin-kvadratrotstransformation tar man inverterad sinus (sin– 1) av kvadratroten av antalet kläckta djur.
|
|
49.
|
För antalet kläckta djur beräknas ECx-värdena med regressionsanalys (t.ex. probit-, logit- eller Weibullmodellerna (28)). Om regressionsanalysen inte lyckas (om det t.ex. finns mindre än två partiella responser) kan man använda andra icke-parametriska metoder, såsom glidande medelvärde eller enkel interpolering.
|
Utvecklingshastighet
|
50.
|
Med genomsnittlig utvecklingstid avses den genomsnittliga tidsperioden mellan tillsättningen av larver (testdag 0) och kläckningen av den experimentella kohorten myggor (för beräkning av den faktiska utvecklingstiden bör man ta hänsyn till larvernas ålder vid tillsättningstidpunkten). Utvecklingshastigheten (enhet: 1/dag) är det reciproka värdet av tidsenheten för utveckling och representerar den andel larvutveckling som sker per dag. Utvecklingshastigheten är det mått som helst ska användas för utvärdering av dessa sedimenttoxicitetsstudier eftersom variansen är lägre och homogenare samt ligger närmare normalfördelningen i jämförelse med utvecklingstiden. Mer kraftfulla parametriska testförfaranden kan alltså användas baserade på utvecklingshastighet i stället för på utvecklingstid. För utvecklingshastigheten som en kontinuerlig respons kan ECx-värden uppskattas med hjälp av regressionsanalys (t.ex. (29) (30)). NOEC för den genomsnittliga utvecklingshastigheten kan fastställas med hjälp av ANOVA-metoder, t.ex. Dunnetts eller Williams test. Eftersom hanar kläcks tidigare än honor, dvs. har en högre utvecklingshastighet, är det lämpligt att beräkna utvecklingshastigheten för vartdera könet separat utöver utvecklingshastigheten för alla myggor totalt.
|
|
51.
|
För statistiska test antas antalet myggor observerade på inspektionsdag x ha kläckts i mitten av tidsintervallet mellan dag x och dag x – l (l är inspektionsintervallets längd, i regel en dag). Den genomsnittliga utvecklingshastigheten per kärl (

) beräknas enligt följande:

där
|

|
:
|
genomsnittlig utvecklingshastighet per kärl
|
|
i
|
:
|
index för inspektionsintervall
|
|
m
|
:
|
maximalt antal inspektionsintervall
|
|
fi
|
:
|
antal myggor som kläckts under inspektionsintervallet i
|
|
ne
|
:
|
totalt antal myggor som kläckts i slutet av experimentet (Σfi
)
|
|
xi
|
:
|
utvecklingshastighet för myggor som kläckts under intervallet i
|
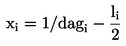
där
|
dagi
|
:
|
inspektionsdag (dagar från införandet av larverna)
|
|
li
|
:
|
inspektionsintervallets längd i (dagar, i regel en dag)
|
|
Könsfördelning
|
52.
|
Data rörande könsfördelningen är dikotoma (tvåpunktsfördelade) och bör därför utvärderas genom ett Fishers exakta test eller andra lämpliga metoder. Den naturliga könsfördelningen för C. riparius är ett, dvs. hanar och honor är lika många. Data rörande könsfördelningen bör behandlas på samma sätt för båda generationerna. Eftersom det högsta antalet myggor per kärl (dvs. 20) är för lågt för att en meningsfull statistisk analys ska kunna utföras, lägger man ihop det totala antalet fullständigt kläckta levande myggor av varje kön för alla kärlen i en behandling. Dessa otransformerade data testas mot kontrollen (med lösningsmedel) eller mot hoplagda data för kontrollerna i en 2 × 2 kontingenstabell.
|
Reproduktion
|
53.
|
Reproduktionen, uttryckt som fekunditet, beräknas som antalet äggband per hona. Mer exakt divideras det totala antalet äggband som producerats i en odlingsbehållare med det totala antalet levande och oskadade honor som tillsatts denna behållare. NOEC för fekunditeten kan fastställas med hjälp av ANOVA-metoder, t.ex. Dunnetts eller Williams test.
|
|
54.
|
Äggbandens fertilitet används för att fastställa antalet fertila äggband per hona. Det totala antalet fertila äggband som produceras i en odlingsbehållare divideras med det totala antalet levande och oskadade honor som tillsatts denna behållare. NOEC för fertiliteten kan fastställas med hjälp av ANOVA-metoder, t.ex. Dunnetts eller Williams test.
|
Testrapport
|
55.
|
Testrapporten ska innehålla följande uppgifter:
|
|
Testkemikalie:
|
—
|
fysikalisk natur och fysikalisk-kemiska egenskaper (vattenlöslighet, ångtryck, log K
ow
, fördelningskoefficient i jord (eller i sediment, om denna uppgift finns tillgänglig), stabilitet i vatten och sediment etc.),
|
|
—
|
kemiska identifieringsdata (trivialnamn, kemiskt namn, strukturformel, CAS-nummer osv.) inklusive renhet och analysmetod för kvantifiering av testkemikalien.
|
|
|
|
Testade arter:
|
—
|
de testorganismer som använts: art, vetenskapligt namn, ursprung och odlingsbetingelser,
|
|
—
|
information om hur äggmassorna och larverna hanterats,
|
|
—
|
information om hanteringen av vuxna exemplar från den första generationen med hjälp av en exhauster osv. (se tillägg 5),
|
|
—
|
den ålder testorganismerna från den första och andra generationen hade vid tidpunkten för införandet i provkärlen.
|
|
|
|
Testbetingelser:
|
—
|
det sediment som använts (dvs. naturligt eller syntetiskt (konstgjort) sediment),
|
|
—
|
naturligt sediment: insamlingsplatsens belägenhet och en beskrivning av denna plats (inklusive, om möjligt, föroreningshistoria); sedimentets egenskaper: pH, halten av organiskt kol, C/N-kvot och granulometri (om tillämpligt),
|
|
—
|
syntetiskt sediment: beredning, beståndsdelar och egenskaper (halten organiskt kol, pH, fukthalt osv. vid testets början),
|
|
—
|
beredning av testvatten (om rekonstituerat vatten används) och egenskaper (syrehalt, pH, hårdhet osv. vid testets början).
|
|
—
|
sediments och det överliggande vattnets djup i testkärlen och kristalliseringsskålarna,
|
|
—
|
det överliggande vattnets och porvattnets volym, det våta sedimentets vikt med och utan porvatten för testkärlen och kristalliseringsskålarna,
|
|
—
|
testkärl (material och storlek),
|
|
—
|
kristalliseringsskålar (material och storlek),
|
|
—
|
odlingsbehållare (material och storlek),
|
|
—
|
metoden för beredning av stamlösningar och testkoncentrationer för testkärlen och kristalliseringsskålarna,
|
|
—
|
applicering av testkemikalien i testkärlen och kristalliseringsskålarna: testkoncentrationer, antal replikat och lösningsmedel om sådana behövs,
|
|
—
|
inkuberingsförhållanden för testkärlen: temperatur, ljuscykel och intensitet, luftning (bubblor per sekund),
|
|
—
|
inkuberingsförhållanden för odlingsbehållarna och kristalliseringsskålarna: temperatur, ljuscykel och intensitet,
|
|
—
|
inkuberingsförhållanden för äggbanden i mikrotiterplattorna (eller andra typer av kärl): temperatur, ljuscykel och intensitet,
|
|
—
|
detaljerad information om utfodringen, inklusive typ av foder, beredning, mängd och utfodringsschema.
|
|
|
|
Resultat:
|
—
|
nominella testkoncentrationer, uppmätta testkoncentrationer och resultaten av alla analyser för att fastställa koncentrationen av testkemikalien i testkärlen och kristalliseringsskålarna,
|
|
—
|
vattenkvaliteten i testkärlen och kristalliseringsskålarna, dvs. pH, temperatur, löst syre, hårdhet och ammoniak,
|
|
—
|
ersättning av avdunstat testvatten för testkärlen, i förekommande fall,
|
|
—
|
antalet kläckta hon- och hanmyggor per kärl och dag för första och andra generationen,
|
|
—
|
könsfördelning för fullständigt kläckta levande myggor per behandling för första och andra generationen,
|
|
—
|
antalet larver som inte utvecklats till myggor per kärl för första och andra generationen,
|
|
—
|
procentandel/andel kläckta exemplar per replikat- och testkoncentration (han- och honmyggor sammanlagt) för första och andra generationen,
|
|
—
|
den genomsnittliga utvecklingshastigheten för fullständigt kläckta och levande myggor per replikat och behandlingsnivå (han- och honmyggor separat och även sammanlagt) för första och andra generationen,
|
|
—
|
antalet äggband som lagts i kristalliseringskärlen per odlingsbehållare och dag,
|
|
—
|
egenskaperna hos varje äggband (storlek, form och fertilitet),
|
|
—
|
fekunditet – det totala antalet äggband per totalt antal honor som tillsatts i odlingsbehållaren,
|
|
—
|
fertilitet – det totala antalet fertila äggband per totalt antal honor som tillsatts i odlingsbehållaren,
|
|
—
|
uppskattning av toxiska endpoints, t.ex. ECx (och därmed förbundna konfidensintervall), NOEC och de statistiska metoder som använts för bestämningen av dem,
|
|
—
|
diskussion av resultaten, inbegripet eventuell inverkan på testresultatet som kan tillskrivas avvikelser från denna testmetod.
|
|
|
LITTERATUR
|
(1)
|
Kapitel C.28 i denna bilaga, Toxicitetstest i sediment- och vattenfas på Chironomid-larver med kontaminerat vatten.
|
|
(2)
|
Shobanov, N. A., Kiknadze, I. I. och M. G. Butler (1999), Palearctic and Nearctic Chironomus (Camptochironomus) tentans Fabricius are different species (Diptera: Chironomidae). Entomologica Scandinavica, 30: 311–322.
|
|
(3)
|
Fleming, R. m.fl. (1994), Sediment Toxicity Tests for Poorly Water-Soluble Substances, Slutlig rapport till Europeiska kommissionen, rapport nr EC 3738. augusti 1994. WRc, Storbritannien.
|
|
(4)
|
SETAC (1993), Guidance Document on Sediment toxicity Tests and Bioassays for Freshwater and Marine Environments, från WOSTA:s workshop i Nederländerna.
|
|
(5)
|
ASTM International (2009), E 1706-05E01: Test Method for Measuring the Toxicity of Sediment-Associated Contaminants with Freshwater Invertebrates, In: Annual Book of ASTM Standards, vol. 11.06, Biological Effects and Environmental Fate; Biotechnology. ASTM International, West Conshohocken, PA.
|
|
(6)
|
Environment Canada (1997), Test for Growth and Survival in Sediment using Larvae of Freshwater Midges (Chironomus tentans or Chironomus riparius), Biological Test Method, Report SPE 1/RM/32, december 1997.
|
|
(7)
|
US-EPA (2000), Methods for Measuring the Toxicity and Bioaccumulation of Sediment-associated Contaminants with Freshwater Invertebrates, andra upplagan, EPA 600/R-99/064, mars 2000, omarbetning av den första upplagan daterad juni 1994.
|
|
(8)
|
US-EPA/OPPTS 850.1735 (1996), Whole Sediment Acute Toxicity Invertebrates.
|
|
(9)
|
US-EPA/OPPTS 850.1790 (1996), Chironomid Sediment Toxicity Test.
|
|
(10)
|
Milani, D., Day, K. E., McLeay, D. J. och R. S. Kirby (1996), Recent intra- and inter-laboratory studies related to the development and standardisation of Environment Canada's biological test methods for measuring sediment toxicity using freshwater amphipods (Hyalella azteca) and midge larvae (Chironomus riparius), Technical Report, Environment Canada, National Water Research Institute, Burlington, Ontario, Kanada.
|
|
(11)
|
Norberg-King, T. J., Sibley, P. K., Burton, G. A., Ingersoll, C. G., Kemble, N. E., Ireland, S., Mount, D. R. och C. D. Rowland (2006), Interlaboratory evaluation of Hyalella azteca and Chironomus tentans short-term and long-term sediment toxicity tests, Environ. Toxicol. Chem., 25: 2662–2674.
|
|
(12)
|
Taenzler, V., Bruns, E., Dorgerloh, M., Pfeifle, V. och L. Weltje (2007), Chironomids: suitable test organisms for risk assessment investigations on the potential endocrine-disrupting properties of pesticides, Ecotoxicology, 16: 221–230.
|
|
(13)
|
Sugaya, Y. (1997), Intra-specific variations of the susceptibility of insecticides in Chironomus yoshimatsui, Jp. J. Sanit. Zool., 48: 345–350.
|
|
(14)
|
Kawai, K. (1986), Fundamental studies on chironomid allergy, I. Culture methods of some Japanese chironomids (Chironomidae, Diptera), Jp. J. Sanit. Zool., 37: 47–57.
|
|
(15)
|
Kapitel C.27 i denna bilaga, Toxicitetstest i sediment- och vattenfas på Chironomid-larver med kontaminerat sediment.
|
|
(16)
|
OECD (2000), Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures, Environment, Health and Safety Publications, Series on Testing and Assessment nr 23, ENV/JM/MONO(2000)6, OECD, Paris.
|
|
(17)
|
Weltje, L., Rufli, H., Heimbach, F., Wheeler, J., Vervliet-Scheebaum, M. och M. Hamer (2010), The chironomid acute toxicity test: development of a new test system, Integr. Environ. Assess. Management.
|
|
(18)
|
Environment Canada. (1995), Guidance Document on Measurement of Toxicity Test Precision Using Control Sediments Spiked with a Reference Toxicant, Report EPS 1/RM/30, september 1995.
|
|
(19)
|
Oetken, M, Nentwig, G., Löffler, D, Ternes, T. och J. Oehlmann (2005), Effects of pharmaceuticals on aquatic invertebrates, Part I, The antiepileptic drug carbamazepine, Arch. Environ. Contam. Toxicol., 49. 353–361.
|
|
(20)
|
Suedel, B. C. and J. H. Rodgers (1994), Development of formulated reference sediments for freshwater and estuarine sediment testing, Environ. Toxicol. Chem., 13: 1163–1175.
|
|
(21)
|
Naylor, C. och C. Rodrigues (1995), Development of a test method for Chironomus riparius using a formulated sediment, Chemosphere, 31: 3291–3303.
|
|
(22)
|
Dunnett, C. W. (1964), A multiple comparisons procedure for comparing several treatments with a control. J. Amer. Statis. Assoc., 50: 1096–1121.
|
|
(23)
|
Dunnett, C. W. (1964), New tables for multiple comparisons with a control, Biometrics, 20: 482–491.
|
|
(24)
|
Williams, D. A. (1971), A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics, 27. 103–117.
|
|
(25)
|
Williams, D. A. (1972), The comparison of several dose levels with a zero dose control. Biometrics, 28. 510–531.
|
|
(26)
|
Jungmann, D., Bandow, C., Gildemeister, T., Nagel, R., Preuss, T. G., Ratte, H. T., Shinn, C., Weltje, L. och H. M. Maes (2009), Chronic toxicity of fenoxycarb to the midge Chironomus riparius after exposure in sediments of different composition. J Soils Sediments, 9: 94–102.
|
|
(27)
|
Rao, J. N. K. och A. J. Scott (1992), A simple method for the analysis of clustered binary data. Biometrics, 48. 577–585.
|
|
(28)
|
Christensen, E. R. (1984), Dose-response functions in aquatic toxicity testing and the Weibull model, Water Res., 18: 213–221.
|
|
(29)
|
Bruce, R. D. and D. J. Versteeg (1992), A statistical procedure for modelling continuous toxicity data, Environ. Toxicol. Chem., 11: 1485–1494.
|
|
(30)
|
Slob, W. (2002), Dose-response modelling of continuous endpoints. Toxicol. Sci., 66: 298–312.
|
|
(31)
|
OECD (2006), Current Approaches in the Statistical Analysis of Ecotoxicity Data: a Guidance to Application, OECD Series on Testing and Assessment nr 54, 146 s., ENV/JM/MONO(2006)18, OECD, Paris.
|
|
(32)
|
Benoit, D. A., Sibley, P. K., Juenemann, J. L. och G. T. Ankley (1997), Chironomus tentans life-cycle test: design and evaluation for use in assessing toxicity of contaminated sediments, Environ. Toxicol. Chem., 16: 1165–1176.
|
|
(33)
|
Vogt, C., Belz, D., Galluba, S., Nowak, C., Oetken, M. och J. Oehlmann (2007), Effects of cadmium and tributyltin on development and reproduction of the non-biting midge Chironomus riparius (Diptera) – baseline experiments for future multi-generation studies, J. Environ. Sci. Health, Part A, 42: 1–9.
|
|
(34)
|
OECD (2010), Validation report of the Chironomid full life-cycle toxicity test, utkommande skrift i Series on Testing and Assessment, OECD, Paris.
|
Tillägg 1
Definitioner
I denna testmetod gäller följande definitioner:
Kemikalie
: ett ämne eller en blandning.
Syntetiskt sediment eller rekonstituerat eller konstgjort sediment
: en blandning av material som är avsedda att efterlikna de fysiska beståndsdelarna i naturligt sediment.
Överliggande vatten
: det vatten som täcker sedimentet i testkärlet.
Porvatten
: det vatten som finns i mellanrummen mellan sediment- eller jordpartiklar.
Spikat vatten
: testvatten till vilket testkemikalien har tillsatts.
Testkemikalie
: varje ämne eller blandning som testas med denna testmetod.
Tillägg 2
Rekommendationer för odling av Chironomus riparius
|
1.
|
Chironomus-larver kan odlas i kristalliseringskärl eller större behållare. Fin kvartssand sprids ut i ett tunt skikt på cirka 5–10 mm på behållarens botten. Kiselgur (t.ex. Merck, Art. 8117) har visat sig vara ett lämpligt substrat (det räcker med ett tunt lager på några mm). Lämpligt vatten tillsätts sedan till ett djup på flera cm. Vattennivåerna bör fyllas på efter behov för att ersätta avdunstat vatten och förebygga uttorkning. Vattnet kan ersättas vid behov. Skonsam luftning bör tillhandahållas. De kärl som innehåller larver bör förvaras i en lämplig behållare som hindrar kläckta exemplar från att rymma. Behållaren bör vara tillräckligt stor för att de vuxna exemplaren ska kunna svärma, annars kan kopulationen utebli (minimum är cirka 30 × 30 × 30 cm).
|
|
2.
|
Behållarna ska hållas i rumstemperatur eller i ett tempererat utrymme vid 20 ± 2 °C med en fotoperiod på 16 timmar ljus (intensitet ca 1 000 lux) och 8 timmar mörker. Det har rapporterats att en luftfuktighet på under 60 % relativ luftfuktighet kan hämma reproduktionen.
|
Utspädningsvatten
|
3.
|
Allt lämpligt naturligt eller syntetiskt vatten kan användas. Ofta används källvatten, avklorerat kranvatten och artificiella medier (t.ex. Elendt M4 eller M7, se nedan). Vattnet måste luftas före användningen. Vid behov kan odlingsvattnet förnyas genom att man försiktigt häller eller med en hävert tappar av använt vatten från odlingskärlen utan att förstöra larvrören.
|
Utfodring av larver
|
4.
|
Chironomus-larverna ges fiskfoder i flingform (Tetra Min ®, Tetra Phyll ® eller motsvarande patenterat märke), cirka 250 mg per kärl och dag. Detta kan ges som torrt malet pulver eller som en suspension i vatten: tillsätt 1,0 g flingfoder i 20 ml utspädningsvatten och blanda till en homogen blandning. Beredningen kan ges med en dosering på cirka 5ml per kärl och dag (skaka om före användning). Äldre larver kan få en större dos.
|
|
5.
|
Utfodringen justeras i enlighet med vattenkvaliteten. Om odlingsmediet blir grumligt bör dosen sänkas. Foderdoseringen måste övervakas noggrant. För liten mängd leder till att larverna emigrerar mot vattenkolumnen och för stor mängd leder till ökad mikrobiell aktivitet och lägre syrekoncentrationer. Båda omständigheterna kan leda till minskad tillväxt.
|
|
6.
|
Även celler av vissa grönalger (t.ex. Scenedesmus subspicatus, Chlorella vulgaris) kan tillsättas när nya odlingskärl inrättas.
|
Utfodring av vuxna exemplar
|
7.
|
Vissa testutövare har föreslagit att bomullskompresser indränkta i mättad sackaroslösning kan användas som foder för vuxna exemplar.
|
Kläckning
|
8.
|
Vid 20 ± 2 °C börjar de vuxna exemplaren kläckas i odlingskärlen efter cirka 13–15 dagar. Hanarna är lätta att känna igen på sina fjäderantenner och smala kroppar.
|
Äggmassor
|
9.
|
När vuxna exemplar finns i odlingsbehållaren bör alla odlingskärl kontrolleras tre gånger per vecka för att se om geléartade äggmassor har lagts. Om sådana upptäcks, bör de försiktigt avlägsnas. Äggmassorna överförs till ett litet kärl som innehåller ett prov av odlingsvattnet. De används sedan för att starta nya odlingskärl (t.ex. 2–4 äggmassor per kärl) eller för toxicitetstest.
|
|
10.
|
Första stadiets larver bör kläckas efter 2–3 dagar.
|
Inrättning av nya odlingskärl
|
11.
|
När odlingarna är etablerade bör det vara möjligt att inrätta ett nytt odlingskärl för larver varje vecka eller med längre intervall beroende på testningskraven. Äldre kärl avlägsnas efter att de vuxna myggorna har kläckts. På detta sätt får man en regelbunden tillgång till vuxna exemplar med minimalt behov av skötsel.
|
Beredning av testlösningarna M4 och M7
|
12.
|
M4-mediet har beskrivits i Elendt (1990). M7-mediet bereds på samma sätt som M4-mediet med undantag för de ämnen som anges i tabell 1, för vilka koncentrationerna är fyra gånger lägre i M7 jämfört med M4. Testlösningen ska inte beredas enligt Elendt och Bias (1990) eftersom de koncentrationer av NaSiO3 · 5H2O, NaNO3, KH2PO4 och K2HPO4 som anges för beredning av stamlösningar inte är lämpliga.
|
Beredning av M7-medium
|
13.
|
Varje stamlösning (I) bereds för sig och en kombinerad stamlösning (II) bereds av dessa stamlösningar (I) (se tabell 1). Femtio ml av den kombinerade stamlösningen (II) och de mängder av varje stamlösning med makronäring som anges i tabell 2 samt avjonat vatten tillsätts upp till 1 liter för att bereda M7-mediet. En stamlösning med vitaminer bereds genom att man tillsätter tre vitaminer till avjonat vatten enligt tabell 3, och 0,1 ml av den kombinerade vitaminstamlösningen tillsätts till det slutliga M7-mediet strax före användningen. Vitaminstamlösningen förvaras djupfryst i små alikvoter. Mediet luftas och stabiliseras.
|
Tabell 1
Stamlösningar av spårelement för M4- och M7-medium
|
Stamlösningar (I)
|
Mängd (mg) som fylls upp till 1 liter med avjonat vatten
|
För den kombinerade stamlösningen (II): blanda följande mängder (ml) stamlösning (I) och fyll upp till 1 liter med avjonat vatten
|
Slutliga koncentrationer i testlösningarna (mg/l)
|
|
M4
|
M7
|
M4
|
M7
|
|
H3BO3
(25)
|
57 190
|
1,0
|
0,25
|
2,86
|
0,715
|
|
MnCl2 · 4H2O (25)
|
7 210
|
1,0
|
0,25
|
0,361
|
0,090
|
|
LiCl (25)
|
6 120
|
1,0
|
0,25
|
0,306
|
0,077
|
|
RbCl (25)
|
1 420
|
1,0
|
0,25
|
0,071
|
0,018
|
|
SrCl2 · 6H2O (25)
|
3 040
|
1,0
|
0,25
|
0,152
|
0,038
|
|
NaBr (25)
|
320
|
1,0
|
0,25
|
0,016
|
0,004
|
|
Na2MoO4 · 2H2O (25)
|
1 260
|
1,0
|
0,25
|
0,063
|
0,016
|
|
CuCl2 · 2H2O (25)
|
335
|
1,0
|
0,25
|
0,017
|
0,004
|
|
ZnCl2
|
260
|
1,0
|
1,0
|
0,013
|
0,013
|
|
CaCl2 · 6H2O
|
200
|
1,0
|
1,0
|
0,010
|
0,010
|
|
KI
|
65
|
1,0
|
1,0
|
0,0033
|
0,0033
|
|
Na2SeO3
|
43,8
|
1,0
|
1,0
|
0,0022
|
0,0022
|
|
NH4VO3
|
11,5
|
1,0
|
1,0
|
0,00058
|
0,00058
|
|
Na2EDTA · 2H2O (25)
(26)
|
5 000
|
20,0
|
5,0
|
2,5
|
0,625
|
|
FeSO4 · 7H2O (25)
(26)
|
1991
|
20,0
|
5,0
|
1,0
|
0,249
|
Tabell 2:
Stamlösningar med makronäringsämnen för medium M4 och M7
|
|
Mängd som fylls upp till 1 liter med avjonat vatten
(mg)
|
Mängd stamlösning med makronäringsämnen som tillsätts för att bereda medium M4 och M7
(ml/l)
|
Slutliga koncentrationer i testlösningarna M4 och M7
(mg/l)
|
|
CaCl2 · 2H2O
|
293 800
|
1,0
|
293,8
|
|
MgSO4 · 7H2O
|
246 600
|
0,5
|
123,3
|
|
KCl
|
58 000
|
0,1
|
5,8
|
|
NaHCO3
|
64 800
|
1,0
|
64,8
|
|
NaSiO3 · 9H2O
|
50 000
|
0,2
|
10,0
|
|
NaNO3
|
2 740
|
0,1
|
0,274
|
|
KH2PO4
|
1 430
|
0,1
|
0,143
|
|
K2HPO4
|
1 840
|
0,1
|
0,184
|
Tabell 3:
Stamlösningar med vitaminer för medium M4 och M7
Alla tre vitaminlösningarna kombineras till en enda vitaminstamlösning.
|
|
Mängd som fylls upp till 1 liter med avjonat vatten
(mg)
|
Mängd stamlösning med vitaminer som tillsätts för att bereda medium M4 och M7
(ml/l)
|
Slutliga koncentrationer i testlösningarna M4 och M7
(mg/l)
|
|
Tiaminhydroklorid
|
750
|
0,1
|
0,075
|
|
Cyanokobalamin (B12)
|
10
|
0,1
|
0,0010
|
|
Biotin
|
7,5
|
0,1
|
0,00075
|
HÄNVISNINGAR
BBA (1995), Long-term toxicity test with Chironomus riparius: Development and validation of a new test system, red. M. Streloke och H. Köpp. Berlin.
Elendt, B. P. (1990), Selenium deficiency in Crustacea, Protoplasma, 154: 25–33.
Elendt, B. P. och W.-R. Bias (1990), Trace nutrient deficiency in Daphnia magna cultured in standard medium for toxicity testing, Effects on the optimisation of culture conditions on life history parameters of D. magna, Water Research, 24: 1157–1167.
Tillägg 3
Beredning av syntetiskt sediment
SEDIMENTSAMMANSÄTTNING
Syntetiskt sediment ska ha följande sammansättning:
|
Beståndsdel
|
Egenskaper
|
% av sedimentets torrvikt
|
|
Torv
|
Vitmosstorv (Sphagnum), så nära pH 5,5–6,0 som möjligt, utan synliga växtrester, finfördelad (partikelstorlek ≤ 1 mm) och lufttorkad
|
4–5
|
|
Kvartssand
|
Partikelstorlek: > 50 % av partiklarna bör vara av storleken 50–200 μm
|
75–76
|
|
Kaolinlera
|
Kaolinithalt ≥ 30 %
|
20
|
|
Organiskt kol
|
Justeras genom tillsats av torv och sand
|
2 (± 0,5)
|
|
Kalcium-karbonat
|
CaCO3, i pulverform, kemiskt rent
|
0,05–0,1
|
|
Vatten
|
Konduktivitet ≤ 10 μS/cm
|
30–50
|
BEREDNING
Torven lufttorkas och mals ner till ett fint pulver. En suspension med den erforderliga mängden torvpulver i avjonat vatten bereds med hjälp av en högpresterande homogeniseringsapparat. Suspensionens pH justeras till 5,5 ± 0,5 med CaCO3. Suspensionen konditioneras i minst två dagar med skonsam omrörning vid 20 ± 2 °C för att stabilisera pH-värdet och etablera en stabil mikrobiell komponent, varefter pH mäts på nytt och då bör vara 6,0 ± 0,5. Torvsuspensionen blandas sedan med de övriga beståndsdelarna (sand och kaolinlera) och avjonat vatten till ett homogent sediment med en vattenhalt som ligger på omkring 30–50 procent av sedimentets torrvikt. Därefter mäts den slutliga blandningens pH på nytt och justeras vid behov till 6,5–7,5 med CaCO3. Prover tas av sedimentet för att bestämma torrvikten och halten organiskt kol. Likaså rekommenderas att det syntetiska sediment som ska användas i ett chironomidtoxicitetstest konditioneras före användningen i sju dagar under samma betingelser som råder i det efterföljande testet.
FÖRVARING
Det syntetiska sedimentets torra beståndsdelar kan lagras i ett torrt och svalt utrymme vid rumstemperatur. Berett (vått) sediment ska inte lagras innan det används i ett test. Det bör användas omedelbart efter den sju dagar långa konditioneringsperioden, som är sista steget i beredningen.
HÄNVISNINGAR
OECD (1984), Earthworm, Acute Toxicity Test, Test Guideline No. 207, Guidelines for the Testing of Chemicals, OECD, Paris.
Meller, M., Egeler, P., Roembke, J., Schallnass, H., Nagel, R. och B. Streit (1998), Short-term toxicity of lindane, hexachlorobenzene and copper sulfate on tubificid sludgeworms (Oligochaeta) in artificial media, Ecotox. Environ. Safety, 39: 10–20.
Tillägg 4
Ett godtagbart utspädningsvattens kemiska egenskaper
|
BESTÅNDSDEL
|
KONCENTRATIONER
|
|
Partiklar
|
< 20 mg/l
|
|
Halt av organiskt kol
|
< 2 mg/l
|
|
Ojoniserad ammoniak
|
< 1 μg/l
|
|
Hårdhet som CaCO3
|
< 400 mg/l (27)
|
|
Resterande mängd klor
|
< 10 μg/l
|
|
Total mängd bekämpningsmedel som innehåller organiska fosforföreningar
|
< 50 ng/l
|
|
Total mängd bekämpningsmedel som innehåller organiska klorföreningar plus polyklorerade bifenyler
|
< 50 ng/l
|
|
Total mängd organiskt klor
|
< 25 ng/l
|
Tillägg 5
Riktlinjer för testets genomförande
Exempel på en odlingsbehållare:

|
A
|
:
|
gasväv på ovansidan och åtminstone den ena sidan av behållaren (maskstorlek ca 1 mm)
|
|
B
|
:
|
öppning för placering av kläckta adulta exemplar i odlingsbehållaren och för avlägsnande av de äggband som lagts i kristalliseringsskålen (visas ej i denna figur)
|
|
C
|
:
|
odlingsbehållarens storlek minst 30 cm längd, 30 cm höjd och 30 cm bredd
|
Exempel på ett testkärl:

|
A
|
:
|
pasteurpipett för lufttillförsel i det överliggande vattnet
|
|
B
|
:
|
glaslock som förhindrar de kläckta myggorna från att rymma
|
|
C
|
:
|
vattnets ytskikt
|
|
D
|
:
|
testkärl (glasbägare, minst 600 ml)
|
|
E
|
:
|
sedimentskikt
|
Exempel på en exhauster som används för att insamla vuxna myggor (pilarna anger flödesriktningen):

|
A
|
:
|
glasrör (innerdiameter ca 5 mm) som är ansluten till en självsugande pump
|
|
B
|
:
|
kork av mjukgummi, perforerad med glasrör (A). På insidan täcks öppningen av glasröret (A) med lite bomull och gasväv (maskstorlek ca 1 mm) för att förhindra att myggorna skadas när man suger upp dem i exhaustern
|
|
C
|
:
|
genomskinlig behållare (plast eller glas, längd ca 15 cm) för de infångade myggorna
|
|
D
|
:
|
kork av mjukgummi, perforerad med rör (E). För att släppa ut myggorna i odlingsbehållaren avlägsnas kork D från behållare C
|
|
E
|
:
|
rör (plast eller glas, innerdiameter ca 8 mm) för insamling av vuxna myggor från kärlet
|
Schematisk presentation av ett livscykeltest:

|
A
|
:
|
första generationen – testkärl som innehåller ett sediment/vatten-system, åtta replikat och tjugo första stadiets larver per kärl
|
|
B
|
:
|
fyra testkärl för varje odlingsbehållare, A och B
|
|
C
|
:
|
odlingsbehållare (A och B) för svärmning, parning och äggläggning
|
|
D
|
:
|
kristalliseringsskålar i vilka äggbanden läggs
|
|
E
|
:
|
mikrotiterplattor, en brunn för varje äggband
|
|
F
|
:
|
andra generationen – testkärl som innehåller ett sediment/vatten-system, åtta replikat och tjugo första stadiets larver per kärl
|
C.41. TEST PÅ FISKARS KÖNSUTVECKLING
INLEDNING
|
1.
|
Denna testmetod motsvarar OECD:s testriktlinje (TG) 234 (2011). Den bygger på ett beslut från 1998 att utveckla nya eller uppdatera befintliga testmetoder för screening och testning av potentiellt hormonstörande ämnen. Testet på fiskars könsutveckling (Fish Sexual Development Test, FSDT) konstaterades vara en lovande metod som täcker ett känsligt livsstadium som kan påverkas av både östrogen- och androgenliknande kemikalier. Testmetoden genomgick ett valideringstest mellan laboratorier från 2006 till 2010, där japanska risfiskar (Oryzias latipes), sebrafisk (Danio rerio) och storspigg (Gasterosteus aculeatus) validerades, och knölskallelöja (Pimephales promelas) delvis validerades (41) (42) (43). Detta protokoll omfattar japansk risfisk, storspigg och sebrafisk. Protokollet är i princip en förbättring av OECD TG 210: Fish, Early Life Stage Toxicity Test (1) som föreskriver att exponeringen fortsätter till dess att fiskarna är könsdifferentierade, dvs. cirka 60 dagar efter kläckningen för japansk risfisk, storspigg och sebrafisk (exponeringstiden kan vara kortare eller längre för andra arter som godkänns i framtiden) och endokrinkänsliga endpoints läggs till. Testet på fiskars könsutveckling bedömer effekterna på tidiga utvecklingsstadier och de eventuella negativa konsekvenserna av förmodat hormonstörande kemikalier (t.ex. östrogener, androgener och hämmare av steroidogenes) på könsutvecklingen. Kombinationen av två centrala endokrina endpoints, koncentrationen av vitellogenin (VTG) och den fenotypiska könsfördelningen, gör att testet kan indikera testkemikaliens verkningssätt. På grund av den populationsrelevanta förändringen av den fenotypiska könsfördelningen kan testet på fiskars könsutveckling användas för faro- och riskbedömning. Om testet används för faro- och riskbedömning bör man dock inte använda storspigg, eftersom de valideringsdata som hittills finns att tillgå visar att i denna art är ändringar av den fenotypiska könsfördelningen på grund av testkemikalier ovanliga.
|
|
2.
|
Protokollet bygger på fiskar som exponeras via vattnet för kemikalier under deras könslabila period, under vilken fisken förväntas vara mest känslig för effekterna av hormonstörande kemikalier som kan störa könsutvecklingen. Två centrala endpoints mäts som indikatorer på dessa hormonrelaterade avvikelser: VTG-koncentrationerna och könsfördelningen (förhållandet mellan könen), som fastställs via histologisk analys av könskörtlarna. Histopatologisk analys av könskörtlarna (utvärdering och stadieindelning av oocyter och spermatogena celler) är frivillig. Dessutom bestäms det genetiska könet närhelst det är möjligt (t.ex. i japanska risfiskar och storspigg). Förekomsten av en genetisk könsmarkör är en avsevärd fördel, eftersom den ökar giltigheten av statistiken över könsfördelningen och möjliggör upptäckter av individuella fenotypiska könsbyten. Andra apikala endpoints som ska mätas inbegriper andelen kläckta djur, överlevnad, längd och kroppsvikt. Testmetoden kan anpassas till andra arter än de som anges ovan under förutsättning att de övriga arterna genomgår en validering som motsvarar den som genomförts för japanska risfiskar, storspigg och sebrafisk, att fiskarna i kontrollerna är könsdifferentierade vid testets slut, att VTG-nivåerna är tillräckligt höga för att man ska kunna upptäcka betydande kemikalierelaterade variationer, och att testsystemets känslighet fastställs med hjälp av endokrint aktiva referenskemikalier ((anti-)östrogener, (anti-)androgener, aromatashämmare, etc.). Dessutom ska alla valideringsrapporter som hänvisar till data från testet på fiskars könsutveckling i vilket andra arter har testats granskas av OECD, och resultatet av valideringen bör anses vara tillfredsställande.
|
Inledande överväganden och begränsningar
|
3.
|
VTG produceras vanligen i levern hos honor av äggläggande ryggradsdjur som respons på cirkulerande endogent östrogen (2). Det är en prekursor till ägguleproteiner, och när det väl har producerats i levern förs det med blodet till äggstockarna, där det tas upp och modifieras av ägg som är under utveckling. VTG-syntesen är mycket begränsad, men är påvisbar i ungfisk och vuxna hanfiskar eftersom de saknar tillräcklig mängd cirkulerande östrogen. Levern kan dock producera och utsöndra VTG som respons på exogen stimulans av östrogen (3) (4) (5).
|
|
4.
|
Mätning av VTG gör det möjligt att påvisa kemikalier med östrogena, antiöstrogena och androgena verkningssätt samt kemikalier som stör steroidogenesen, som till exempel aromatashämmare. Man kan påvisa ämnen med östrogena kemikalier genom mätning av VTG-induktionen hos hanfiskar, och detta har dokumenterats många gånger i den fackgranskade vetenskapliga litteraturen. VTG-induktion har också påvisats efter exponering för aromatiserbara androgener (6) (7). En minskning av nivåerna av cirkulerande östrogen hos honor, till exempel genom hämning av aromatas som omvandlar det endogena androgenet till det naturliga östrogenet 17-beta-östradiol, orsakar en minskning av VTG-koncentrationen som används för att påvisa kemikalier med aromatashämmande egenskaper eller mer allmänna steroidogeneshämmare (33). Den biologiska relevansen av den VTG-respons som följer östrogen- och aromatashämning har fastställts och har dokumenterats i stora drag (8) (9). Det är dock möjligt att produktionen av VTG hos honor även kan påverkas av allmän toxicitet och icke-endokrina toxiska verkningssätt.
|
|
5.
|
Flera mätmetoder har framgångsrikt utvecklats och standardiserats för rutinmässig användning för att kvantifiera VTG i blodprov, leverprov, helkroppsprov eller huvud/stjärthomogenatprov som samlats in från enskilda fiskar. Detta är fallet för sebrafiskar, storspigg och japanska risfiskar, och även för den delvis validerade arten knölskallelöja. Artspecifika metoder för ELISA (enzyme-linked immunosorbent assay) som använder immunokemi för kvantifiering av VTG finns att tillgå (5) (10) (11) (12) (13) (14) (15) (16). I japanska risfiskar och sebrafisk finns det en god korrelation mellan VTG mätt i blodplasma-, lever- och homogenatprover även om homogenater tenderar att uppvisa något lägre värden än plasma (17) (18) (19). Tillägg 5 innehåller de rekommenderade förfarandena för provtagning för analys av VTG.
|
|
6.
|
Förändringar i den fenotypiska könsfördelningen (könsproportioner) är en endpoint som återspeglar könsbyten. I princip kan östrogener, antiöstrogener, androgener, antiandrogener och steroidogeneshämmande kemikalier påverka könsfördelningen hos ungfiskar som håller på att utvecklas (20). Det har visat sig att dessa könsbyten delvis är reversibla hos sebrafiskar (21) efter exponering för östrogenliknande kemikalier, medan könsbyten efter exponering för androgenliknande kemikalier är permanenta (30). Könet definieras som honkön, hankön, intersexuellt (såväl oocyter och spermatogena celler förekommer i samma könskörtel) eller odifferentierat, fastställt i enskilda fiskar genom histologisk undersökning av könskörtlarna. Vägledning ges i tillägg 7 och i OECD:s vägledningsdokument Diagnosis of Endocrine-Related Histopathology of Fish Gonads (22).
|
|
7.
|
Genetiskt kön analyseras via genetiska markörer när dessa förekommer hos en viss fiskart. Hos japanska risfiskar kan de honliga XX- eller hanliga XY-generna påvisas genom polymeraskedjereaktion (PCR), eller så kan den Y-länkade DM-domängenen (DMY) analyseras (DMY-negativ eller -positiv) på det sätt som beskrivs i (23) (24). Hos storspigg finns en motsvarande PCR-metod för bestämning av genetiskt kön som beskrivs i tillägg 10. När det genetiska könet kan länkas individuellt till det fenotypiska könet förbättras testets tillförlitlighet och därför bör det genetiska könet bestämmas för arter med dokumenterade genetiska könsmarkörer.
|
|
8.
|
Kombinationen av två viktiga endokrina endpoints, VTG och könsfördelning, kan påvisa kemikaliens endokrina verkningssätt (tabell 1). Könsfördelningen är en populationsrelevant biomarkör (25) (26), och för vissa väldefinierade verkningssätt kan resultaten från testet på fiskars könsutveckling användas för faro- och riskbedömning när så anses lämpligt av den reglerande myndigheten. Dessa verkningssätt är för närvarande östrogener, androgener och steroidogeneshämmare.
Tabell 1
De endokrina endpoints reaktion på de olika verkningssätten hos kemikalier:
↑ = ökning, ↓ = minskning, — = ej undersökt
|
Verkningssätt
|
VTG ♂
|
VTG ♀
|
Könsfördelning
|
Hänvisningar
|
|
Svag östrogenagonist
|
↑
|
↑
|
↑♀ eller ↑odiff.
|
(27) (40)
|
|
Stark östrogenagonist
|
↑
|
↑
|
↑♀ eller ↑odiff., inga ♂
|
(28) (40)
|
|
Östrogenantagonist
|
—
|
—
|
↓♀, ↑odiff.
|
(29)
|
|
Androgenagonist
|
↓ eller —
|
↓ eller —
|
↑ ♂, inga ♀
|
(28) (30)
|
|
Androgenantagonist
|
—
|
—
|
↑♀
↑intersexuellt
|
(31)
|
|
Aromatashämmare
|
↓
|
↓
|
↓♀
|
(33)
|
|
|
9.
|
Testet på fiskars könsutveckling omfattar inte fiskens reproduktiva livsstadium och därför bör kemikalier som misstänks påverka fortplantningen vid lägre halter än könsutvecklingen undersökas i ett test som omfattar reproduktionen.
|
|
10.
|
Definitioner som används i denna testmetod finns i tillägg 1.
|
|
11.
|
In vivo-testet på fiskars könsutveckling är avsett att påvisa kemikalier med androgena och östrogena egenskaper såväl som antiandrogena, antiöstrogena och steroidogeneshämmande egenskaper. Valideringsfaserna i testet på fiskars könsutveckling (1 och 2) omfattade östrogena, androgena och steroidogeneshämmande kemikalier. Effekterna i testet på fiskars könsutveckling av östrogen- och androgenantagonister framgår av tabell 1, men dessa verkningssätt är för närvarande mindre dokumenterade.
|
PRINCIP FÖR TESTMETODEN
|
12.
|
I testet exponeras fisken, från nyligen befruktat ägg till och med genomgången könsdifferentiering, för minst tre koncentrationer av testkemikalien upplöst i vatten. Testbetingelserna bör vara genomflödestest såvida detta inte är möjligt på grund av testkemikaliens tillgänglighet eller beskaffenhet (t.ex. begränsad löslighet). Testet inleds med att de nyligen befruktade äggen (före groddskivans klyvning) placeras i testbehållarna. Fyllandet av behållarna beskrivs för varje art i punkt 27. För de validerade fiskarterna, japansk risfisk, storspigg och sebrafisk, avslutas testet på dag 60 efter kläckningen. Vid slutet av testet avlivas alla fiskar på ett humant sätt. Ett biologiskt prov (blodplasma, lever eller huvud/stjärthomogenat) samlas in för analys av VTG från varje fisk, och den återstående delen fixeras för en histologisk utvärdering av könskörtlarna för att fastställa det fenotypiska könet. Alternativt kan en histopatologisk analys utföras (t.ex. stadiebestämning av könskörtlarna och graden av intersexualitet). Ett biologiskt prov (anal- eller ryggfenan) för bestämning av genetiskt kön tas för arter med lämpliga markörer (tillägg 9 och 10).
|
|
13.
|
En översikt över de relevanta testbetingelser som är specifika för validerade arter (japansk risfisk, storspigg och sebrafisk) återfinns i tillägg 2.
|
INFORMATION OM TESTKEMIKALIEN
|
14.
|
Resultat från ett akut toxicitetstest eller annat korttidstest av toxicitet (t.ex. testmetod C.14 (34) och OECD TG 210 (1)), som helst ska ha utförts med samma art som används för detta test, bör finnas tillgängliga. Detta innebär att testkemikaliens vattenlöslighet och ångtryck är kända och att en tillförlitlig analysmetod för kvantifiering av kemikalien i testbehållarna, med känd och rapporterad noggrannhet och detektionsgräns, finns att tillgå.
|
|
15.
|
Annan användbar information inbegriper strukturformel, kemikaliens renhet, stabilitet i vatten och ljus, pKa, Pow samt resultaten från ett test avseende lätt bionedbrytbarhet (testmetod C.4) (35).
|
Kriterier för godkännande av testet
|
16.
|
För att testresultaten ska kunna godtas måste följande villkor uppfyllas:
|
—
|
Halten löst syre bör vara minst 60 procent av luftmättnadsvärdet (ASV) under hela testet.
|
|
—
|
Vattentemperaturen bör inte variera med mer än ± 1,5 °C mellan olika testbehållare vid någon tidpunkt under exponeringsperioden och bör hållas inom de temperaturgränser som specificerats för den art som används (se tillägg 2).
|
|
—
|
En validerad metod för analys av exponeringskemikalien med en detektionsgräns som ligger långt under den lägsta nominella koncentrationen bör finnas tillgänglig och belägg bör samlas in för att visa att testkemikaliens koncentrationen i lösningen har på ett tillfredsställande sätt hållits inom ± 20 % av de genomsnittliga uppmätta värdena.
|
|
—
|
Den totala överlevnaden för de befruktade äggen i kontrollgrupperna, och i tillämpliga fall i kontrollerna med lösningsmedel, måste vara större än eller lika med de gränsnivåer som definieras i tillägg 2.
|
|
—
|
Godkännandekriterierna rörande tillväxt och könsförhållanden vid slutet av testet bygger på data från kontrollgruppen (de sammanlagda kontrollerna för lösningsmedel och vatten, såvida de inte är betydligt olika – då enbart lösningsmedlet):
|
|
Japansk risfisk
|
Sebrafisk
|
Storspigg
|
|
Tillväxt
|
Den avtorkade fiskens våtvikt
|
>150 mg
|
>75 mg
|
>120 mg
|
|
Längd (normallängd)
|
>20 mm
|
>14 mm
|
>20 mm
|
|
Könsfördelning (% hanar och honor)
|
30–70 %
|
30–70 %
|
30–70 %
|
|
|
—
|
Om ett lösningsmedel används bör det inte ha en statistiskt signifikant effekt på överlevnaden och bör inte ha några hormonstörande eller andra skadliga verkningar på tidiga levnadsstadier enligt vad som framkommit av en lösningsmedelskontroll.
|
Om en avvikelse från kriterierna för godkännande av testet observeras, bör konsekvenserna av detta betraktas i förhållande till testuppgifternas tillförlitlighet. Dessa överväganden bör ingå i rapporteringen.
|
BESKRIVNING AV TESTMETODEN
Testbehållare
|
17.
|
Alla typer av behållare av glas, rostfritt stål eller annat kemiskt inert material kan användas. Måtten på behållarna bör vara tillräckligt stora för att uppfylla fisktäthetskriterierna som anges nedan. Testbehållarna ska helst placeras slumpvis i testutrymmet. En randomiserad blockutformning med en koncentration per block är att föredra framför en fullständigt randomiserad utformning. Testbehållarna bör avskärmas från oönskade störningar.
|
Val av art
|
18.
|
Rekommenderade fiskarter anges i tillägg 2. Förfarandena för att införa nya arter anges i punkt 2.
|
Skötsel av föräldragenerationen
|
19.
|
Närmare uppgifter om lämplig skötsel av föräldragenerationen under tillfredsställande betingelser finns i OECD TG 210 (1). Föräldragenerationen bör utfodras en eller två gånger per dag med lämpligt foder.
|
Hantering av embryon och yngel
|
20.
|
Till att börja med kan embryon och yngel exponeras inom huvudbehållaren i mindre kammare av stål eller glas försedda med sidor eller ändar av nät som möjliggör ett flöde av testkemikalien genom kammaren. För att få ett icke-turbulent flöde genom dessa små kammare kan de hängas på en arm som sänker och höjer kamrarna (de får dock inte höjas över ytan).
|
|
21.
|
Om äggbehållare, galler eller nät har använts för att hålla äggen inom huvudbehållaren tas dessa tillbehör bort efter att ynglen har kläckts, med undantag av nät som behövs för att hålla fiskarna på plats. Om ynglen måste flyttas får de inte utsättas för luft, och håvar får inte användas för att släppa ut fiskarna från äggbehållarna. Överföringstidpunkten varierar beroende på art och det är inte alltid nödvändigt med en överföring.
|
Vatten
|
22.
|
Allt vatten i vilket testarternas kontrollgrupper har minst lika hög överlevnadsgrad som i sådant vatten som beskrivs i tillägg 3 är lämpligt som testvatten. Vattnet ska hålla jämn kvalitet under hela testperioden. För att säkerställa att utspädningsvattnet inte påverkar testresultaten på oönskat sätt (t.ex. genom att reagera med testkemikalien) eller negativt påverkar avelsbeståndets förutsättningar, ska vattenprover regelbundet tas för analys. Den totala halten organiskt kol, konduktiviteten, pH-värdet och mängden uppslammade partiklar bör mätas exempelvis var tredje månad när utspädningsvattnets kvalitet är känd för att vara relativt jämn. Mätningar av tungmetaller (t.ex. Cu, Pb, Zn, Hg, Cd och Ni), viktiga anjoner och katjoner (t.ex. ca Ca2+, Mg2+, Na+, K+, Cl–, SO4
2–) samt bekämpningsmedel bör göras om vattenkvaliteten kan ifrågasättas. Uppgifter om kemisk analys och insamling av vatten återfinns i punkt 34.
|
Testlösningar
|
23.
|
Genomflödessystem bör användas om det är praktiskt möjligt. För genomflödestest behövs ett system som kontinuerligt släpper ut och späder ut en stamlösning av testkemikalien (t. ex. med mätpump, proportionalitetslösningssystem och mättnadskärlsystem) för att tillföra en serie koncentrationer till testbehållarna. Stamlösningens och utspädningsvattnets flödeshastighet bör kontrolleras regelbundet under testets gång och får inte variera med mer än 10 % under hela testet. En flödeshastighet som motsvarar minst fem testbehållarvolymer per 24 timmar har konstaterats vara lämplig (1). Man bör vara noga med att undvika att använda plaströr eller andra material som kan innehålla biologiskt aktiva kemikalier eller som kan adsorbera testkemikalien.
|
|
24.
|
Stamlösningen bör helst beredas utan användning av lösningsmedel genom att helt enkelt blanda eller skaka testkemikalien i utspädningsvattnet på mekanisk väg (t.ex. omrörning eller ultraljud). Om testkemikalien är svårlöslig i vatten bör man följa de förfaranden som beskrivs i OECD:s vägledningsdokument om akvatisk toxicitetstestning av svåra ämnen och blandningar (36). Man bör undvika att använda lösningsmedel, men det kan i vissa fall vara nödvändigt för att framställa en stamlösning med lämplig koncentration. Exempel på lämpliga lösningsmedel ges i (36).
|
|
25.
|
Semistatiska testbetingelser bör undvikas om de inte kan motiveras med tvingande skäl som är förbundna med testkemikalien (t.ex. stabilitet, begränsad tillgänglighet, höga kostnader eller risker). Vid ett semistatiskt test kan man välja mellan två olika förnyelseförfaranden. Antingen kan nya testlösningar beredas i rena behållare och de överlevande äggen och ynglen försiktigt överföras till de nya behållarna, eller så kan testorganismerna vara kvar i kärlen medan en andel (minst två tredjedelar) av testvattnet byts ut varje dag.
|
FÖRFARANDE
Exponeringsförhållanden
Insamling av ägg och varaktighet
|
26.
|
För att undvika systematiska genetiska avvikelser samlas ägg in från minst tre avelspar eller avelsgrupper, blandas och väljs slumpvis ut för att inleda testet. För storspigg, se beskrivningen av konstgjord befruktning i tillägg 11. Testet bör inledas så snart som möjligt efter befruktningen av äggen. Embryona ska helst befinna sig i testlösningarna innan groddskivornas klyvning inleds, eller så snart som möjligt efter denna tidpunkt och senast tolv timmar efter befruktningen. Testet bör fortsätta tills könsdifferentieringen i kontrollgruppen är avslutad (60 dagar efter kläckningen för japansk risfisk, storspigg och sebrafisk).
|
Djurtäthet
|
27.
|
Antalet befruktade ägg vid testperiodens början bör vara minst 120 per koncentration uppdelade mellan minst fyra replikat (det är godtagbart att använda kvadratrotsfördelning till kontrollen). Äggen ska fördelas slumpmässigt (med hjälp av statistiska tabeller för randomisering) mellan testkärlen. Fisktätheten (för definition, se tillägg 1) får inte vara högre än att halten löst syre kan hållas vid minst 60 % av luftmättnadsvärdet utan direkt luftning av behållarna. För genomflödestester rekommenderas en fisktäthet som inte överskrider 0,5 g/l per 24 timmar och som inte vid någon tidpunkt överskrider 5 g/l lösning. Senast 28 dagar efter befruktningen bör antalet fiskar per replikat omfördelas, så att varje replikat innehåller ett så lika antal fiskar som möjligt. Vid exponeringsrelaterad dödlighet bör antalet replikat minskas på lämpligt sätt så att fisktätheten mellan behandlingsnivåerna förblir så lika som möjligt.
|
Ljus och temperatur
|
28.
|
Fotoperioden och vattentemperaturen bör vara anpassade efter den art som testas (se tillägg 2 för försöksbetingelser för testet på fiskars könsutveckling).
|
Utfodring
|
29.
|
Foder och utfodring är av avgörande betydelse, och det är viktigt att man vid lämpliga tidsintervaller ger rätt foder för varje stadium och i en tillräckligt stor mängd för att stödja normal tillväxt. Fiskarna bör ha fri tillgång till foder (ad libitum), men överutfodring bör undvikas i möjligaste mån. För att få en tillräcklig tillväxttakt bör fiskarna utfodras minst två gånger per dag (under veckosluten kan en gång per dag vara godtagbart), med minst tre timmars mellanrum mellan varje utfodring. Överbliven mat och avföring bör avlägsnas, om så behövs, för att undvika ackumulering av avfallsprodukter. Allteftersom erfarenheterna tilltar förfinas kontinuerligt utfodringsprogrammen för att förbättra överlevnaden och optimera tillväxten. Man måste därför försöka bekräfta det föreslagna systemet hos erkända experter. Inget foder bör ges 24 timmar innan testet avslutas. Exempel på lämpligt foder finns i tillägg 2 (se även OECD:s Fish Testing Framework (39).
|
Testkoncentrationer
|
30.
|
Testkemikalierna bör ha den spridning som beskrivs i tillägg 4. Minst tre testkoncentrationer med minst fyra replikat bör användas. När man väljer koncentrationsintervall är det viktigt att beakta kurvan som visar sambandet mellan LC50 och exponeringsperioden i befintliga undersökningar av akut toxicitet. Fem testkoncentrationer rekommenderas om erhållna data ska användas för riskbedömning.
|
|
31.
|
Koncentrationer av kemikalien som är högre än 10 % av det akuta LC50-värdet för vuxna djur eller 10 mg/l, beroende på vilket som är lägre, behöver inte testas. Den maximala testkoncentrationen bör vara 10 % av LC50 för larvstadiet/ungfiskstadiet.
|
Kontroller
|
32.
|
En kontroll med utspädningsvatten (≥ 4 replikat) och, i förekommande fall, en lösningsmedelskontroll (≥ 4 replikat) bör inrättas utöver testkoncentrationerna. Endast lösningsmedel som har befunnits inte ha en statistiskt signifikant effekt på testets statistiska endpoints bör användas i testet.
|
|
33.
|
Om ett lösningsmedel används får dess slutkoncentration inte överskrida 0,1 ml/l (36), och koncentrationen bör vara densamma i alla testbehållare, utom i kontrollen med utspädningsvatten. Man bör dock sträva efter att undvika sådana lösningsmedel eller att hålla lösningsmedlets koncentrationer till ett minimum.
|
Frekvens för analytiska bestämningar och mätningar
|
34.
|
En kemisk bestämning av testkemikaliens koncentration bör genomföras före testets början för att kontrollera att godtagbarhetskriterierna uppfylls. Alla replikat bör analyseras var för sig i början och slutet av testet. Ett replikat per testkoncentration analyseras minst en gång per vecka under testets gång, och man bör då växla systematiskt mellan replikaten (1,2,3,4,1,2…). Om proverna lagras för att analyseras vid en senare tidpunkt bör förvaringsmetoden för proverna ha validerats i förväg. Proverna bör filtreras (t.ex. med porstorlek 0,45 μm) eller centrifugeras för att se till att de analytiska bestämningarna görs på kemikalien i äkta lösning.
|
|
35.
|
Under testets gång ska löst syre, pH, total hårdhet, konduktivitet, salthalt (om relevant) och temperatur mätas i alla testbehållare. Som ett minimum bör löst syre, salthalt (om relevant) och temperatur mätas varje vecka, och pH, konduktivitet och hårdhet i början och i slutet av testet. Temperaturen ska helst övervakas kontinuerligt i minst en testbehållare.
|
|
36.
|
Resultaten bör baseras på de uppmätta koncentrationerna. Om testkemikaliens koncentration i lösningen på ett tillfredsställande sätt har hållits inom ± 20 % av den nominella koncentrationen under hela testperioden kan dock resultaten antingen grunda sig på nominella eller på uppmätta värden.
|
Observationer och mätningar
Det embryonala utvecklingsstadiet
|
37.
|
Exponeringen ska inledas så snart som möjligt efter befruktningen, innan groddskivans klyvning påbörjas och senast 12 timmar efter befruktningen för att garantera exponering under den tidiga embryonala utvecklingen.
|
Kläckning och överlevnad
|
38.
|
Observationer av kläckning och överlevnad bör göras minst en gång per dag. Alla antal bör registreras. Döda embryon, yngel och ungfisk bör avlägsnas så snart de observeras, eftersom nedbrytningen går snabbt och de kan sönderdelas av de andra fiskarna. Man bör iaktta stor försiktighet när döda individer avlägsnas så att man inte stöter till eller orsakar fysiska skador på närliggande ägg eller yngel, eftersom de är extremt ömtåliga och känsliga. Dödskriterierna varierar beroende på levnadsstadiet:
|
—
|
för ägg: i synnerhet i tidiga stadier, en tydligt förlust av genomskinlighet och färgförändringar orsakade av koagulering och/eller utfällning av protein, vilket leder till ett vitt ogenomskinligt utseende,
|
|
—
|
för yngel och ungfisk: orörlighet och/eller avsaknad av andningsrörelse och/eller avsaknad av hjärtslag och/eller en vit ogenomskinlig färgning av centrala nervsystemet och/eller avsaknad av reaktion på mekanisk retning.
|
|
Onormalt utseende
|
39.
|
Antalet yngel eller fisk som har onormal kroppsform bör registreras, och missbildningens utseende och beskaffenhet beskrivas. Det bör noteras att onormala embryon och yngel även förekommer av naturliga skäl, och kan för vissa arter uppgå till flera procent i kontrollgruppen (kontrollgrupperna). Onormala djur bör inte avlägsnas från testbehållarna förrän de avlider. Enligt Europaparlamentets och rådets direktiv 2010/63/EU av den 22 september 2010 om skydd av djur som används för vetenskapliga ändamål ska djuren sövas och avlivas i enlighet med beskrivningen i punkt 44 om missbildningar leder till smärta, lidande och ångest eller bestående skador, och deras död tillförlitligt kan förutsägas. De avlivade djuren registreras under ’dödlighet’ för dataanalys.
|
Onormalt beteende
|
40.
|
Abnormiteter, t.ex. hyperventilering, okoordinerat simbeteende, atypisk passivitet och avvikande ätbeteende, bör registreras när de först uppträder.
|
Vikt
|
41.
|
I slutet av testet avlivas alla överlevande fiskar (eller bedövas om blodprov ska tas), och våtvikten för varje (avtorkad) individ mäts.
|
Längd
|
42.
|
Vid testets slut mäts individernas längd (normallängd).
|
|
43.
|
Dessa observationer leder till att några eller alla av följande uppgifter är tillgängliga för rapportering:
|
—
|
antal friska exemplar vid testets avslutning,
|
|
—
|
tidpunkten för kläckningens början och slut,
|
|
—
|
de överlevande djurens längd och vikt,
|
|
—
|
antal deformerade yngel,
|
|
—
|
antal fiskar som beter sig onormalt.
|
|
Provtagning på fisk
|
44.
|
Provtagning på fiskarna utförs vid slutet av testet. Provtagningsfiskarna avlivas med t.ex. MS-222 (100–500 mg per liter buffrad med 200 mg NaHCO3 per liter) eller FA-100 (4-allyl-2-metoxifenol: eugenol) och mäts och vägs var för sig som våtvikt (avtorkade) eller bedövade om ett blodprov ska tas (se punkt 49).
|
Provtagning för analys av VTG och könsbestämning genom histologisk utvärdering
|
45.
|
Prover bör tas på alla fiskar och de bör sedan beredas för analys av kön och VTG. Alla fiskar bör undersökas histologiskt för att bestämma könet. För att mäta VTG godtas ett delprov från minst 16 fiskar från varje replikat. Fler fiskar bör analyseras rörande VTG om resultaten i delprovet visar sig vara oklara.
|
|
46.
|
Provtagningsmetoderna för VTG och könsbestämningen är beroende av analysmetoden för VTG:
|
Huvud/stjärthomogenatmetoden för analys av VTG
|
47.
|
Fisken avlivas. Huvudet och stjärten på varje fisk skiljs från kroppen genom snitt som görs rakt bakom bröstfenorna och rakt bakom ryggfenan med en skalpell (se figur 1). Huvud- och stjärtdelarna från varje fisk läggs samman, vägs och numreras individuellt, fryses i flytande kväve och lagras vid – 70 °C eller kallare för analys av VTG. Fiskarnas kropp numreras och fixeras i ett lämpligt fixativ för histologisk utvärdering (22). Med hjälp av denna metod utvärderas VTG och histopatologin för varje individ, och en eventuell ändring av VTG-nivån kan sålunda sättas i samband med fiskens fenotypiska eller genetiska kön (japansk risfisk och storspigg). För ytterligare information, se riktlinjerna för homogenisering (tillägg 5) och för kvantifiering av VTG (tillägg 6).
|
Leverhomogenatmetoden för analys av VTG
|
48.
|
Fisken avlivas. Levern dissekeras ut och lagras vid – 70 °C eller kallare. Rekommenderade förfaranden för excision och förbehandling av levern finns i OECD TG 229 (37) eller kapitel C.37 i denna bilaga (38). Levrarna homogeniseras sedan var för sig på det sätt som beskrivs i OECD TG 229 eller kapitel C.37 i denna bilaga. Supernatanten samlas upp och används för mätning av VTG med en motsvarande ELISA-teknik (se bilaga 6 som innehåller ett exempel på kvantifiering för sebrafisk eller OECD TG 229 (37) för japansk risfisk). Enligt detta tillvägagångssätt är det också möjligt att få uppgifter om enskilda fiskar, både rörande VTG och könskörtlarnas histologi.
|
Blodplasmametoden för analys av VTG
|
49.
|
Blod samlas in från de bedövade fiskarna genom hjärtpunktering eller snitt i den kaudala venen eller i stjärten och centrifugeras vid 4 °C för insamling av plasma. Plasman lagras vid – 70 °C eller kallare fram till användningen. Hela fisken avlivas och fixeras för histologi. Både plasmaproven och fiskarna numreras individuellt för att man ska kunna relatera VTG-nivåerna till fiskens kön.
Figur 1
Hur man skär upp en fisk för mätning av VTG i huvud/stjärthomogenatet och histologisk utvärdering av den mellersta delen

|
Bestämning av genetiskt kön
|
50.
|
Ett biologiskt prov för bestämning av genetiskt kön tas från enskilda fiskar som tillhör arter som har lämpliga markörer. För japansk risfisk insamlas analfenan eller ryggfenan. En detaljerad beskrivning finns i tillägg 9, inklusive vävnadsprovtagning och könsbestämning genom en PCR-metod. Även för storspigg finns en beskrivning av vävnadsprovtagning och PCR-metod för könsbestämning i tillägg 10.
|
Mätning av VTG
|
51.
|
Mätning av VTG bör baseras på en kvantitativt och analytiskt validerad metod. Information bör finnas tillgänglig om variabiliteten rörande tester inom och mellan laboratorier för den metod som används i ett visst laboratorium. Källan till variabiliteten mellan och inom laboratorierna är (sannolikt) de olika utvecklingsstadierna i fiskpopulationen. Med tanke på variationen i VTG-mätningarna bör NOEC-värden som uteslutande bygger på denna endpoint behandlas med stor försiktighet. Det finns olika metoder för att bedöma produktionen av VTG i fiskarterna i detta test. En mätteknik som både är förhållandevis känslig och specifik är bestämningen av proteinkoncentrationer genom ELISA-metoden (enzyme-linked immunosorbent assay). Homologa antikroppar (som bildats mot VTG i samma art) och de viktigaste homologa standarderna bör användas.
|
Könsbestämning
|
52.
|
Beroende på provtagningsmetoden för VTG placeras hela fisken eller den återstående mellersta delen av varje fisk i en behandlingskassett som märkts i förväg och fixeras i ett lämpligt fixativ för histologisk könsbestämning (eventuellt också för utvärdering av det stadium könskörtlarna befinner sig i). Riktlinjer för fixering och inbäddning finns i tillägg 7 samt i OECD:s vägledning, Diagnosis of Endocrine-Related Histopathology of Fish Gonads (22). Efter bearbetningen bäddas fiskarna in i paraffinblock. Enskilda individer bör placeras på längden i paraffinblocken. Minst sex längsgående preparat (3-5 μm tjocka) i frontalplanet inklusive vävnad från båda könskörtlarna tas från varje individ. Intervallet mellan dessa preparat bör vara ungefär 50 μm för hanar och 250 μm för honor. Eftersom varje block ofta innehåller både hanar och honor (om mer än en individ inbäddats i varje block), bör dock intervallet mellan preparaten från dessa block vara ungefär 50 μm tills man erhåller minst sex preparat från könskörtlarna från varje hane. Därefter kan intervallet mellan preparaten ökas till cirka 250 μm för honorna. Preparaten färgas med hematoxylin och eosin och granskas i ett ljusmikroskop med avseende på kön (hankön, honkön, intersexuellt eller odifferentierat). Intersexualitet definieras som närvaron av mer än en oocyt i testikeln per sex analyserade preparat eller spermatogena celler (ja/nej) i äggstockarna. Det är valfritt att utföra histopatologisk analys och stadiebestämning av ovarier och testiklar, men om dessa undersökningar utförs bör resultaten analyseras och redovisas statistiskt. Det bör noteras att vissa fiskarter av naturen saknar ett fullt utvecklat par könskörtlar och att endast en könskörtel kan förekomma (t.ex. japansk risfisk och ibland sebrafisk). Alla sådana observationer ska registreras.
|
|
53.
|
Bestämning av genetiskt kön för enskilda individer av japansk risfisk bygger på förekomsten eller avsaknaden av risfiskens hanliga könsbestämmande gen, DMY, som finns på Y-kromosomen. Risfiskarnas genetiska kön kan fastställas genom att man sekvenserar DMY-genen från DNA som t.ex. extraherats från en bit av analfenan eller ryggfenan. Förekomsten av DMY visar på en XY-individ (hane) oavsett fenotyp, och avsaknaden av DMY visar på en XX-individ (hona) oavsett fenotyp (23). Vägledning för vävnadsberedning och PCR-metoden finns i tillägg 9. Bestämningen av det genetiska könet i enskilda storspigg utförs också med en PCR-metod som beskrivs i tillägg 10.
|
|
54.
|
Förekomsten av intersexualitet (för definition, se tillägg 1) bör rapporteras.
|
Sekundära könskaraktärer
|
55.
|
Sekundära könskaraktärer kontrolleras av hormoner i arter som japansk risfisk, och därför bör observationer av fiskens fysiska utseende om möjligt göras vid slutet av exponeringen. Hos japansk risfisk är den vårtliknande bildningen på bakre delen av honans analfena androgenkänslig. I kapitel C.37 i denna bilaga (38) finns relevanta fotografier av hanens sekundära könskaraktärer och av androgeniserade honor.
|
DATA OCH RAPPORTERING
Behandling av resultaten
|
56.
|
Det är viktigt att man använder de mest kraftfulla giltiga statistiska testerna för att fastställa endpoints. Den experimentella enheten är replikatet, men variationer mellan replikaten bör ingå i den statistiska testningen. Ett flödesschema över beslutsgången finns i tillägg 8 för att hjälpa till med att finna det mest ändamålsenliga statistiska testet på grundval av egenskaperna hos de data som erhållits från testet. Den statistiska signifikansnivån är 0,05 för alla endpoints som ingår.
|
Könsförhållanden och genetiskt kön
|
57.
|
Förhållandet mellan könen bör analyseras med avseende på signifikanta effekter (NOEC/LOEC-metoden) av exponeringen med Jonckheere-Terpstras (trendtest) om det föreligger en monoton dos-respons. Om icke-monotonicitet föreligger ska ett parvist test användas: använd Dunnetts test om det går att uppnå normalitet och homogen varians, och Tamhane-Dunnetts test om det föreligger heterogen varians. Använd i annat fall Mann-Whitneys exakta test med Bonferroni-Holm-justering. Ett flödesschema över statistiken rörande förhållandet mellan könen finns i tillägg 8. Förhållandet mellan könen bör presenteras i tabeller som koncentrationsandelar ± standardavvikelser för hanar, honor, intersexuella och odifferentierade. Den statistiska signifikansen bör lyftas fram. Exempel ges i valideringsrapporten för testet på fiskars könsutveckling fas 2 (42). Genetiskt kön bör rapporteras som en procentandel av de fenotypiska könsbytena hos hanar, honor, intersexuella och odifferentierade.
|
Koncentrationer av VTG
|
58.
|
Koncentrationerna av VTG bör analyseras med avseende på signifikant effekt (NOEC/LOEC-metoden) av exponeringen. Det är bättre att använda Dunnetts test än t-testet med Bonferronikorrigering. Om en Bonferronikorrigering används är Bonferroni-Holm-korrigeringen att föredra. Man bör räkna med att en logaritmisk transformation av VTG måste göras för att uppnå normalitet och varianshomogenitet. Om koncentration-responsen är förenlig med monotoniciteten är Jonckheere-Terpstras test att föredra framför något av de ovanstående. Om t-tester eller Dunnetts test används finns det inget behov av ett ANOVA-signifikans F-test för att gå vidare. För närmare detaljer, se flödesschemat i tillägg 8. Resultaten bör rapporteras i tabeller som medelvärden av koncentrationen ± standardavvikelser för hanar, honor, intersexuella och odifferentierade var för sig. Den statistiska signifikansen för fenotypiska honor och fenotypiska hanar bör framhävas. Exempel ges i valideringsrapporten för testet på fiskars könsutveckling fas 2 (42).
|
Faktiska koncentrationer av testkemikalien
|
59.
|
De faktiska koncentrationerna av testkemikalien i behållaren bör analyseras i frekvenser som beskrivs i punkt 34. Man bör rapportera resultaten i tabeller som medelvärdet av koncentrationen ± standardavvikelser på replikat- och koncentrationsbasis med information om antalet prover, och då markera avvikelser från den genomsnittliga behandlingskoncentrationen ± 20 %. Exempel finns att tillgå i valideringsrapporten för testet på fiskars könsutveckling fas 2 (42).
|
Tolkning av resultaten
|
60.
|
Resultaten bör tolkas med försiktighet när de uppmätta koncentrationerna av testkemikalien i testlösningen ligger på nivåer nära analysmetodens detektionsgräns.
|
Testrapport
|
61.
|
Testrapporten ska innehålla följande information:
|
|
Testkemikalie
|
—
|
relevanta fysikalisk-kemiska egenskaper, kemiska identifieringsdata inklusive renhet och analysmetod för kvantifiering av testkemikalien.
|
|
|
|
Testbetingelser
|
—
|
testmetod (t.ex. genomflödestest eller semistatiskt/förnyelse), testets utformning inklusive testkoncentrationer, metoden för beredning av stamlösningar (i en bilaga), förnyelsefrekvensen (solubiliseringsmedlet och dess koncentration bör anges i förekommande fall),
|
|
—
|
nominella testkoncentrationer, de uppmätta värdenas medelvärden och deras standardavvikelser i testkärlen samt den metod med vilken dessa erhölls (den analysmetod som används bör presenteras i en bilaga) och bevis för att mätningarna hänför sig till testkemikaliens koncentrationer i en äkta lösning,
|
|
—
|
vattenkvaliteten i testbehållarna: pH, hårdhet, temperatur och halten löst syre,
|
|
—
|
detaljerade uppgifter om utfodringen (t.ex. typ av foder, källa, hur mycket fiskarna har fått och hur ofta samt analys av förorenande ämnen (t.ex. PCB, polycykliska aromatiska kolväten och bekämpningsmedel som innehåller organiska klorföreningar) i tillämpliga fall.
|
|
|
|
Resultat
|
—
|
belägg för att kontrollerna uppfyller giltighetskriterierna: uppgifter om andelen kläckta djur bör presenteras i tabeller som en procentandel per replikat och per koncentration. Avvikelser från kriterierna för godkännande (i kontrollerna) bör lyftas fram. Överlevnaden bör presenteras som en procentandel per replikat och per koncentration. Avvikande mätvärden från giltighetskriterierna (i kontrollerna) bör lyftas fram,
|
|
—
|
en klar indikering av de erhållna resultaten för de olika endpoints som observerats: embryonas överlevnad och kläckningsframgång, externa abnormiteter, längd och vikt, mätvärden för VTG (ng/g homogenat, ng/ml plasma eller ng/mg lever), histologisk undersökning av könskörtlarna, könsfördelning, uppgifter om genetiskt kön, förekomst av alla ovanliga reaktioner hos fisken och alla synbara effekter av testkemikalien.
|
|
|
|
62.
|
Resultaten bör presenteras som medelvärden ± standardavvikelse eller standardfel. Statistiken ska rapporteras åtminstone som LOEC och NOEC samt konfidensintervall. Man bör följa det statistiska flödesschemat (tillägg 8).
|
LITTERATUR
|
(1)
|
OECD (1992), Fish, Early Life Stage Toxicity Test, Test Guideline No. 210, Guidelines for the Testing of Chemicals, OECD, Paris.
|
|
(2)
|
Jobling, S., D. Sheahan, J. A. Osborne, P. Matthiessen och J. P. Sumpter, 1996, ’Inhibition of testicular growth in rainbow trout (Oncorhynchus mykiss) exposed to estrogenic alkylphenolic chemicals’, Environmental Toxicology and Chemistry 15, s. 194–202.
|
|
(3)
|
Sumpter, J. P. och S. Jobling, 1995, ’Vitellogenesis As A Biomarker for Estrogenic Contamination of the Aquatic Environment’, Environmental Health Perspectives 103, s. 173–178.
|
|
(4)
|
Tyler, C. R., R.van Aerle, T. H. Hutchinson, S. Maddix och H. Trip (1999), ’An in vivo testing system for endocrine disruptors in fish early life stages using induction of vitellogenin’, Environmental Toxicology and Chemistry 18, s. 337–347.
|
|
(5)
|
Holbech, H., L. Andersen, G. I. Petersen, B. Korsgaard, K. L. Pedersen och P. Bjerregaard (2001a), ’Development of an ELISA for vitellogenin in whole body homogenate of zebrafish (Danio rerio)’, Comparative Biochemistry and Physiology C – Toxicology & Pharmacology 130, s. 119–131.
|
|
(6)
|
Andersen, L., P. Bjerregaard och B. Korsgaard ( 2003), ’Vitellogenin induction and brain aromatase activity in adult male and female zebrafish exposed to endocrine disrupters’, Fish Physiology and Biochemistry 28, s. 319–321.
|
|
(7)
|
Orn, S., H. Holbech, T. H. Madsen, L. Norrgren och G. I. Petersen (2003), ’Gonad development and vitellogenin production in zebrafish (Danio rerio) exposed to ethinylestradiol and methyltestosterone’, Aquatic Toxicology 65, s. 397–411.
|
|
(8)
|
Panter, G. H., T. H. Hutchinson, R. Lange, C. M. Lye, J. P. Sumpter, M. Zerulla och C. R. Tyler (2002), ’Utility of a juvenile fathead minnow screening assay for detecting (anti-)estrogenic substances’, Environmental Toxicology and Chemistry 21, s. 319–326.
|
|
(9)
|
Sun, L. W., J. M. Zha, P. A. Spear och Z. J. Wang (2007), ’Toxicity of the aromatase inhibitor letrozole to Japanese medaka (Oryzias latipes) eggs, larvae and breeding adults’, Comparative Biochemistry and Physiology C – Toxicology & Pharmacology 145, s. 533–541.
|
|
(10)
|
Parks, L. G., A. O. Cheek, N. D. Denslow, S. A. Heppell, J. A. McLachlan, G. A. LeBlanc och C. V. Sullivan (1999), ’Fathead minnow (Pimephales promelas) vitellogenin: purification, characterization and quantitative immunoassay for the detection of estrogenic compounds’, Comparative Biochemistry and Physiology C – Toxicology & Pharmacology 123, s. 113–125.
|
|
(11)
|
Brion, F., B. M. Nilsen, J. K. Eidem, A. Goksoyr och J. M. Porcher (2002), ’Development and validation of an enzyme-linked immunosorbent assay to measure vitellogenin in the zebrafish (Danio rerio)’, Environmental Toxicology and Chemistry 21, s. 1699–1708.
|
|
(12)
|
Nishi, K., M. Chikae, Y. Hatano, H. Mizukami, M. Yamashita, R. Sakakibara och E. Tamiya (2002), ’Development and application of a monoclonal antibody-based sandwich ELISA for quantification of Japanese medaka (Oryzias latipes) vitellogenin’, Comparative Biochemistry and Physiology C – Toxicology & Pharmacology 132, s. 161–169.
|
|
(13)
|
Hahlbeck, E., I. Katsiadaki, I. Mayer, M. Adolfsson-Erici, J. James och B. E. Bengtsson (2004), ’The juvenile three-spined stickleback (Gasterosteus aculeatus L.) as a model organism for endocrine disruption – II – kidney hypertrophy, vitellogenin and spiggin induction’, Aquatic Toxicology 70, s. 311–326.
|
|
(14)
|
Tatarazako, N., M. Koshio, H. Hori, M. Morita och T. Iguchi (2004), ’Validation of an enzyme-linked immunosorbent assay method for vitellogenin in the medaka’, Journal of Health Science 50, s. 301–308.
|
|
(15)
|
Eidem, J. K., H. Kleivdal, K. Kroll, N. Denslow, R. van Aerle, C. Tyler, G. Panter, T. Hutchinson och A. Goksoyr (2006), ’Development and validation of a direct homologous quantitative sandwich ELISA for fathead minnow (Pimephales promelas) vitellogenin.’ Aquatic Toxicology, 78, s. 202–206.
|
|
(16)
|
Jensen, K. M. och G. T. Ankley (2006), ’Evaluation of a commercial kit for measuring vitellogenin in the fathead minnow (Pimephales promelas)’, Ecotoxicology and Environmental Safety 64, s. 101–105.
|
|
(17)
|
Holbech, H., Petersen, G. I., Norman, A., Örn, S, Norrgren, L. och Bjerregaard, P (2001b), ’Suitability of zebrafish as test organism for detection of endocrine disrupting chemicals. Comparison of vitellogenin in plasma and whole body homogenate from zebrafish (Danio rerio) and rainbow trout (Oncorhynchus mykiss)’, Nordiska ministerrådet, TemaNord 2001:597, s. 48–51.
|
|
(18)
|
Nilsen, B. M., K. Berg, J. K. Eidem, S. I. Kristiansen, F. Brion, J. M. Porcher och A. Goksoyr (2004), ’Development of quantitative vitellogenin-ELISAs for fish test species used in endocrine disruptor screening’, Analytical and Bioanalytical Chemistry 378, s. 621–633.
|
|
(19)
|
Orn, S., S. Yamani och L. Norrgren (2006), ’Comparison of vitellogenin induction, sex ratio, and gonad morphology between zebrafish and Japanese medaka after exposure to 17 alpha-ethinylestradiol and 17 beta-trenbolone’, Archives of Environmental Contamination and Toxicology 51, s. 237–243.
|
|
(20)
|
Scholz, S. och N. Kluver (2009), ’Effects of Endocrine Disrupters on Sexual, Gonadal Development in Fish’, Sexual Development 3, s. 136–151.
|
|
(21)
|
Fenske, M., G. Maack, C. Schafers och H. Segner (2005), ’An environmentally relevant concentration of estrogen induces arrest of male gonad development in zebrafish, Danio rerio’, Environmental Toxicology and Chemistry 24, s. 1088–1098.
|
|
(22)
|
OECD (2010), Guidance Document on the Diagnosis of Endocrine-related Histopathology in Fish Gonads, Series on Testing and Assessment No. 123, ENV/JM/MONO(2010)14, OECD, Paris.
|
|
(23)
|
Kobayashi, T., M. Matsuda, H. Kajiura-Kobayashi, A. Suzuki, N. Saito, M. Nakamoto, N. Shibata, och Y. Nagahama (2004), ’Two DM domain genes, DMY and DMRT1, involved in testicular differentiation and development in the medaka, Oryzias latipes’, Developmental Dynamics 231, s. 518–526.
|
|
(24)
|
Shinomiya, A., H. Otake, K. Togashi, S. Hamaguchi och M. Sakaizumi (2004), ’Field survey of sex-reversals in the medaka, Oryzias latipes: genotypic sexing of wild populations’, Zoological Science 21, s. 613–619.
|
|
(25)
|
Kidd, K. A., P. J. Blanchfield, K. H. Mills, V. P. Palace, R. E. Evans, J. M. Lazorchak och R.W. Flick (2007), ’Collapse of a fish population after exposure to a synthetic estrogen’, Proceedings of the National Academy of Sciences of the United States of America 104, s. 8897–8901.
|
|
(26)
|
Palace,V. P., R. E. Evans, K. G. Wautier, K. H. Mills, P. J. Blanchfield, B. J. Park, C. L. Baron och K. A. Kidd (2009), ’Interspecies differences in biochemical, histopathological, and population responses in four wild fish species exposed to ethynylestradiol added to a whole lake’, Canadian Journal of Fisheries and Aquatic Sciences 66, s. 1920–1935.
|
|
(27)
|
Panter, G. H., T. H. Hutchinson, K. S. Hurd, J. Bamforth, R. D. Stanley, S. Duffell, A. Hargreaves, S. Gimeno och C. R. Tyler (2006), ’Development of chronic tests for endocrine active chemicals – Part 1. An extended fish early-life stage test for oestrogenic active chemicals in the fathead minnow (Pimephales promelas)’, Aquatic Toxicology 77, s. 279–290.
|
|
(28)
|
Holbech, H., K. Kinnberg, G. I. Petersen, P. Jackson, K. Hylland, L. Norrgren och P. Bjerregaard (2006), ’Detection of endocrine disrupters: Evaluation of a Fish Sexual Development Test (FSDT)’, Comparative Biochemistry and Physiology C – Toxicology & Pharmacology 144, s. 57–66.
|
|
(29)
|
Andersen, L., K. Kinnberg, H. Holbech, B. Korsgaard och P. Bjerregaard (2004), ’Evaluation of a 40 day assay for testing endocrine disrupters: Effects of an anti-estrogen and an aromatase inhibitor on sex ratio and vitellogenin concentrations in juvenile zebrafish (Danio rerio)’, Fish Physiology and Biochemistry 30, s. 257–266.
|
|
(30)
|
Morthorst, J. E., H. Holbech och P. Bjerregaard (2010), ’Trenbolone causes irreversible masculinization of zebrafish at environmentally relevant concentrations’, Aquatic Toxicology 98, s. 336–343.
|
|
(31)
|
Kiparissis,Y., T. L. Metcalfe, G. C. Balch och C. D. Metcalf (2003), ’Effects of the antiandrogens, vinclozolin and cyproterone acetate on gonadal development in the Japanese medaka (Oryzias latipes)’, Aquatic Toxicology 63, s. 391–403.
|
|
(32)
|
Panter, G. H., T. H. Hutchinson, K. S. Hurd, A. Sherren, R. D. Stanley och C. R. Tyler (2004), ’Successful detection of (anti-) androgenic and aromatase inhibitors in pre-spawning adult fathead minnows (Pimephales promelas) using easily measured endpoints of sexual development’, Aquatic Toxicology 70, s. 11–21.
|
|
(33)
|
Kinnberg, K., H. Holbech, G. I. Petersen och P. Bjerregaard (2007), ’Effects of the fungicide prochloraz on the sexual development of zebrafish (Danio rerio)’, Comparative Biochemistry and Physiology C – Toxicology & Pharmacology 145, s. 165–170.
|
|
(34)
|
Kapitel C.14 i denna bilaga, Tillväxttest på unga exemplar av fisk.
|
|
(35)
|
Kapitel C.4 i denna bilaga, Lätt bionedbrytbarhet.
|
|
(36)
|
OECD (2000), Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures, Series on Testing and Assessment No. 23, OECD, Paris.
|
|
(37)
|
OECD (2009), Fish Short Term Reproduction Assay, Test Guideline No. 229, Guidelines for the Testing of Chemicals, OECD, Paris.
|
|
(38)
|
Kapitel C.37 i denna bilaga, 21-dagars test på fisk: En kortsiktig screening för ämnen med östrogen och androgen aktivitet samt aromatashämmande verkan.
|
|
(39)
|
OECD (2012), Fish Toxicity Testing Framework, Series on Testing and Assessment No. 171, OECD, Paris
|
|
(40)
|
Schäfers, C., Teigeler, M., Wenzel, A., Maack, G., Fenske, M., Segner, H (2007), ’Concentration- and time-dependent effects of the synthetic estrogen, 17 alpha-ethinylestradiol, on reproductive capabilities of the zebrafish, Danio rerio’, Journal of Toxicology and Environmental Health – Del A, 70, 9–10, s. 768–779.
|
|
(41)
|
OECD (2011), Validation Report (Phase 1) for the Fish Sexual Development Test, Series on Testing and Assessment No 141, ENV/JM/MONO(2011)22, OECD, Paris.
|
|
(42)
|
OECD (2011), Validation Report ( Phase 2) for the Fish Sexual Development Test, Series on Testing and Assessment No 142, ENV/JM/MONO(2011)23, OECD, Paris.
|
|
(43)
|
OECD (2011), Peer Review Report of the validation of the Fish Sexual Development Test, Series on Testing and Assessment No 143, ENV/JM/MONO(2011)24, OECD, Paris.
|
|
(44)
|
Europaparlamentets och rådets direktiv 2010/63/EU av den 22 september 2010 om skydd av djur som används för vetenskapliga ändamål. EUT L 276, 20.10.2010, s. 33.
|
Tillägg 1
Förkortningar och definitioner
Apikal endpoint
: orsakar effekter på populationsnivå
Luftmättnadsvärde (ASV)
: luftmättnadsvärdet
Biomarkör
: orsakar effekter på individnivå
Kemikalie
: ett ämne eller en blandning
Dph, days post hatch
: dagar efter kläckningen
DMY
: Y-länkad DM-domängen som krävs för den hanliga utvecklingen i risfiskar
ELISA
: Enzyme-Linked Immunosorbent Assay
Fiskvikt
: fiskens våtvikt (avtorkad)
FSDT
: Test på fiskars könsutveckling
HPG-axeln
: stressaxeln, bestående av hypotalamus, hypofysen och binjurebarken
Intersexuella fiskar
: fiskar med mer än en oocyt i testikeln per sex analyserade preparat eller spermatogena celler i äggstockarna (ja/nej)
Fisktäthet
: våtvikten fisk per vattenvolym
MOA
: verkningssätt
RT-PCR
: PCR med omvänd transkription
Testkemikalie
: alla ämnen eller blandningar som testas med denna testmetod
Odifferentierad fisk
: fisk med könskörtlar som inte har några märkbara könsceller
VTG
: vitellogenin
Tillägg 2
Försöksbetingelser för testet på fiskars könsutveckling (sötvattensarter)
|
|
Japansk risfisk (Oryzias latipes)
|
Sebrafisk (Danio rerio)
|
Storspigg (Gasterostreus aculeatus)
|
|
|
Genomflödestest eller semistatiskt test
|
Genomflödestest eller semistatiskt test
|
Genomflödestest eller semistatiskt test
|
|
|
25 ± 2 °C
|
27 ± 2 °C
|
20 ± 2 °C
|
|
|
Fluorescerande lampor (brett spektrum)
|
Fluorescerande lampor (brett spektrum)
|
Fluorescerande lampor (brett spektrum)
|
|
|
10–20 μE/m2/s, 540–1 080 lux, eller 50–100 ft-c (omgivande ljusnivåer i laboratoriet)
|
10–20 μE/m2/s, 540–1 080 lux, eller 50–100 ft-c (omgivande ljusnivåer i laboratoriet)
|
10–20 μE/m2/s, 540–1 080 lux, eller 50–100 ft-c (omgivande ljusnivåer i laboratoriet)
|
|
|
12–16 timmar ljus, 8–12 timmar mörker
|
12–16 timmar ljus, 8–12 timmar mörker
|
16 timmar ljus, 8 timmar mörker
|
|
7.
|
Behållarens minsta storlek
|
|
Enskilda behållare bör innehålla minst 7 liter vatten
|
Enskilda behållare bör innehålla minst 7 liter vatten
|
Enskilda behållare bör innehålla minst 7 liter vatten
|
|
8.
|
Volymutbyte av testlösningar
|
|
Minst fem per dag
|
Minst fem per dag
|
Minst fem per dag
|
|
9.
|
Testorganismernas ålder i början av exponeringen
|
|
Nyligen befruktade ägg (tidigt blastulastadium)
|
Nyligen befruktade ägg (tidigt blastulastadium)
|
Nyligen befruktade ägg
|
|
10.
|
Antal ägg per testkärl
|
|
Minst 120
|
Minst 120
|
Minst 120
|
|
|
Minst tre (plus lämpliga kontroller)
|
Minst tre (plus lämpliga kontroller)
|
Minst tre (plus lämpliga kontroller)
|
|
12.
|
Antal replikat per testkärl
|
|
Minst fyra (om man inte använder kvadratrotsfördelning till kontrollerna)
|
Minst fyra (om man inte använder kvadratrotsfördelning till kontrollerna)
|
Minst fyra (om man inte använder kvadratrotsfördelning till kontrollerna)
|
|
|
Levande Artemia, frysta vuxna saltkräftor, flingfoder, etc. Det rekommenderas att man utfodrar två gånger dagligen
|
Särskilt yngelfoder, levande Artemia, frysta vuxna saltkräftor, flingfoder, etc. Det rekommenderas att man utfodrar två gånger dagligen
|
Levande Artemia, frysta vuxna saltkräftor, flingfoder, etc. Det rekommenderas att man utfodrar två gånger dagligen
|
|
|
Ingen såvida inte koncentrationen av löst syre sjunker under 60 % mättnad
|
Ingen såvida inte koncentrationen av löst syre sjunker under 60 % mättnad
|
Ingen såvida inte koncentrationen av löst syre sjunker under 70 % mättnad
|
|
|
Rent yt- eller brunnsvatten eller rekonstituerat vatten
|
Rent yt- eller brunnsvatten eller rekonstituerat vatten
|
Rent yt- eller brunnsvatten eller rekonstituerat vatten
|
|
16.
|
Den kemiska exponeringens varaktighet
|
|
60 dagar efter kläckningen
|
60 dagar efter kläckningen
|
60 dagar efter kläckningen
|
|
|
Kläckningsframgång, överlevnad, makromorfologi, VTG könskörtlarnas histologi, genetiskt kön könsfördelning
|
Kläckningsframgång, överlevnad makromorfologi, VTG könskörtlarnas histologi, könsfördelning
|
Kläckningsframgång, överlevnad makromorfologi, VTG könskörtlarnas histologi, könsfördelning
|
|
18.
|
Testets godtagbarhetskriterier för sammanlagda kontrollreplikat
|
|
Kläckningsframgång > 80 %
|
Kläckningsframgång > 80 %
|
Kläckningsframgång > 80 %
|
|
Överlevnad efter kläckningen ≥ 70 %
|
Överlevnad efter kläckningen ≥ 70 %
|
Överlevnad efter kläckningen ≥ 70 %
|
|
Tillväxt (den avtorkade fiskens våtvikt) > 150 mg
|
Tillväxt (den avtorkade fiskens våtvikt) > 75 mg
|
Tillväxt (den avtorkade fiskens våtvikt) > 120 mg
|
|
Längd (normallängd) > 20 mm
|
Längd (normallängd) > 14 mm
|
Längd (normallängd) > 20 mm
|
|
Könsfördelning (% hanar och honor)
30–70 %
|
Könsfördelning (% hanar och honor) 30–70 %
|
Könsfördelning (% hanar och honor) 30–70 %
|
Tillägg 3
Ett godtagbart utspädningsvattens kemiska egenskaper
|
BESTÅNDSDEL
|
KONCENTRATION
|
|
Partiklar
|
< 20 mg/l
|
|
Halt av organiskt kol
|
< 2 mg/l
|
|
Ojoniserad ammoniak
|
< 1 μg/l
|
|
Resterande mängd klor
|
< 10 μg/l
|
|
Total mängd bekämpningsmedel som innehåller organiska fosforföreningar
|
< 50 ng/l
|
|
Total mängd bekämpningsmedel som innehåller organiska klorföreningar plus polyklorerade bifenyler
|
< 50 ng/l
|
|
Total mängd organiskt klor
|
< 25 ng/l
|
Tillägg 4
Från testmetod c.14 /Vägledning om testkoncentrationer
|
Kolumn (antal koncentrationer mellan 100 och 10 eller mellan 10 och 1) (28)
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
|
100
|
100
|
100
|
100
|
100
|
100
|
100
|
|
32
|
46
|
56
|
63
|
68
|
72
|
75
|
|
10
|
22
|
32
|
40
|
46
|
52
|
56
|
|
3,2
|
10
|
18
|
25
|
32
|
37
|
42
|
|
1,0
|
4,6
|
10
|
16
|
22
|
27
|
32
|
|
|
2,2
|
5,6
|
10
|
15
|
19
|
24
|
|
|
1,0
|
3,2
|
6,3
|
10
|
14
|
18
|
|
|
|
1,8
|
4,0
|
6,8
|
10
|
13
|
|
|
|
1,0
|
2,5
|
4,6
|
7,2
|
10
|
|
|
|
|
1,6
|
3,2
|
5,2
|
7,5
|
|
|
|
|
1,0
|
2,2
|
3,7
|
5,6
|
|
|
|
|
|
1,5
|
2,7
|
4,2
|
|
|
|
|
|
1,0
|
1,9
|
3,2
|
|
|
|
|
|
|
1,4
|
2,4
|
|
|
|
|
|
|
1,0
|
1,8
|
|
|
|
|
|
|
|
1,3
|
|
|
|
|
|
|
|
1,0
|
Tillägg 5
Vägledning för homogenisering av huvud och stjärt från unga exemplar av sebrafisk, knölskallelöja, storspigg och japansk risfisk
Syftet med detta avsnitt är att beskriva de förfaranden som föregår bestämningen av VTG-koncentrationen. Andra förfaranden som leder till en jämförbar bestämning av VTG kan också användas. Alternativt kan man fastställa VTG-koncentrationen i blodplasma eller lever i stället för i huvud/stjärthomogenat.
Förfarande
|
1.
|
Fiskarna bedövas eller avlivas i enlighet med testbeskrivningen.
|
|
2.
|
Huvudet och stjärten skärs av i enlighet med testbeskrivningen. Obs! Alla dissektionsinstrument och skärbrädan bör sköljas och rengöras ordentligt (t.ex. med 96 % etanol) mellan hanteringen av varje enskild fisk att förhindra ’VTG-förorening’ från honor eller inducerade hanar till oinducerade hanar.
|
|
3.
|
Den sammanlagda vikten av huvud och stjärt från varje fisk mäts till närmaste mg.
|
|
4.
|
Efter vägning placeras delarna i lämpliga rör (t.ex. 1,5 ml eppendorfrör) och fryses vid – 80 °C tills homogeniseringen, eller homogeniseras direkt på is med två mortelstötar av plast. (Andra metoder kan användas om de utförs på is och resultatet är en homogen massa). Obs! Rören ska numreras noggrant så att fiskarnas huvud och stjärt kan hänföras till deras respektive kroppar, som används för histologisk undersökning av könskörtlarna.
|
|
5.
|
När en homogen massa erhållits tillsätts iskall homogeniseringsbuffertlösning (29) med en mängd på 4–10 gånger vävnadens vikt (lägg märke till utspädningen). Fortsätt att arbeta med mortelstötarna tills blandningen är homogen. Viktig anmärkning: Nya mortelstötar används för varje fisk.
|
|
6.
|
Proven läggs på is tills centrifugeringen vid 4 °C och 50 000 g i 30 minuter.
|
|
7.
|
Använd en pipett för att dosera ut portioner på 20–50 μl (lägg märke till mängden) supernatant i minst två rör genom att doppa pipettens spets under fettlagret på ytan och försiktigt suga upp supernatanten utan att få med fragment av fett eller små bitar.
|
|
8.
|
Rören förvaras vid – 80 °C fram till användningen.
|
Anmärkning: Buffertlösningen för homogenisering bör användas samma dag som den beretts. Lägg den på is under användningen.
Tillägg 6
Vägledning för beräkning av vitellogenin för huvud/stjärthomogenat av sebrafisk (Danio rerio) (modifierat från Holbech m.fl., 2001). Andra förfaranden som använder homologa antikroppar och standarder kan användas
|
1.
|
Mikrotiterplattor (certifierade Maxisorp F96, Nunc, Roskilde Danmark) som i förväg belagts med 5 μg/ml anti-sebrafisk lipovitellin-IgG tinas upp och tvättas tre gånger med en tvättbuffert (*).
|
|
2.
|
Renad sebrafisk-vitellogenin-standardlösning (30) späds ut i omgångar till 0,2, 0,5, 1, 2, 5, 10 och 20 ng/ml i en utspädningsbuffert (**), och proven späds ut minst 200 gånger (för att förhindra matriseffekter) i en utspädningsbuffert och appliceras på plattorna. En testkontroll appliceras i två exemplar. 150 μl tillsätts i varje brunn. Standarderna appliceras i två exemplar och proverna i tre exemplar. Inkubera över natten vid 4 °C i en skakapparat.
|
|
3.
|
Plattorna tvättas fem gånger med en tvättbuffert (*)
|
|
4.
|
HRP bunden till en dextrankedja (t.ex. AMDEX A/S, Danmark) och konjugerade antikroppar späds i en tvättbuffert. Den faktiska utspädningen varierar beroende på parti och ålder. 150 μl tillsätts i varje brunn och plattorna inkuberas i en timme i rumstemperatur i en skakapparat.
|
|
5.
|
Plattorna tvättas fem gånger med tvättbuffert (*) och plattornas botten rengörs noggrant med etanol.
|
|
6.
|
150 μl TMB plus (***) tillsätts i varje brunn. Skydda plattan mot ljus med aluminiumfolie, och observera färgutvecklingen i en skakapparat.
|
|
7.
|
När standardkurvan är fullt utvecklad hejdas enzymaktiviteten genom tillsats av 150 μl 0,2 M H2SO4 i varje brunn.
|
|
8.
|
Absorbansen mäts vid 450 nm (t.ex. med en Molecular Devices Thermomax läsare för mikrotiterplattor). Erhållna data analyseras med lämplig programvara (t.ex. Softmax).
|
|
(*)
|
Tvättbuffert:
|
PBS-stamlösning (****)
|
500,0
|
ml
|
|
BSA
|
5,0
|
g
|
|
Tween 20
|
5,0
|
ml
|
|
Justera pH till 7,3 och fyll upp till 5 l med Millipore H2O. Förvara vid 4 °C.
|
|
|
(**)
|
Utspädningsbuffert:
|
PBS-stamlösning (****)
|
100,0
|
ml
|
|
BSA
|
3,0
|
g
|
|
Tween 20
|
1,0
|
ml
|
|
Justera pH till 7,3 och fyll upp till 1 l med Millipore H2O. Förvara vid 4 °C.
|
|
|
(***)
|
TMB plus är ett ’bruksfärdigt’ substrat framställt av KemEnTec (Danmark). Det är ljuskänsligt. Förvara vid 4 °C.
|
|
(****)
|
PBS-stamlösning
|
NaCl
|
160,0
|
g
|
|
KH2PO4
|
4,0
|
g
|
|
Na2HPO4 · 2H2O
|
26,6
|
g
|
|
KCl
|
4,0
|
g
|
|
Justera pH till 6,8 och fyll upp till 2 l med Millipore H2O. Förvara vid rumstemperatur.
|
|
Tillägg 7
Vägledning för beredning av vävnadspreparat för könsbestämning och stadiebestämning av könskörtlar
Syftet med detta avsnitt är att beskriva de förfaranden som föregår utvärderingen av histologiska preparat. Andra förfaranden som leder liknande resultat för könsbestämningen och stadiebestämningen av könskörtlarna kan också användas.
Med några få undantag är dessa förfaranden är likartade för japansk risfisk (JMD) och sebrafisk (ZF).
Avlivning, obduktion och fixering av vävnader
Mål:
|
1.
|
Sörja för human avlivning av fisk.
|
|
2.
|
Erhålla nödvändiga data rörande kroppsvikt och kroppsmätningar.
|
|
3.
|
Utvärdera sekundära könskaraktärer.
|
|
4.
|
Dissekera vävnader för VTG-analys.
|
|
5.
|
Fixering av könskörtlarna.
|
Förfaranden:
|
1.
|
Fiskarna bör avlivas omedelbart innan obduktionen. Om det inte står flera prosektorer till förfogande bör därför inte flera fiskar avlivas samtidigt.
|
|
2.
|
Med hjälp av en liten håv avlägsnas fisken från testbehållaren och förs till obduktionsplatsen i transportbehållaren.
|
|
3.
|
Fisken släpps ut i avlivningslösningen. Fisken avlägsnas från lösningen när andningen upphör och fisken inte reagerar på extern retning.
|
|
4.
|
Fiskens våtvikt fastställs.
|
|
5.
|
För beredning av vävnader för VTG-analys kan fisken kan placeras på en korkplatta på objektbordet i ett dissektionsmikroskop.
|
a.
|
För sebrafisk skärs huvudet av rakt bakom bröstfenan och stjärten skärs av rakt bakom ryggfenan.
|
|
b.
|
För japansk risfisk öppnas buken genom ett försiktigt gjort snitt som sträcker sig längs den ventrala mittlinjen från skuldergördeln till en punkt som ligger precis kranialt från anus. Med hjälp av en liten pincett och en liten sax avlägsnas levern försiktigt.
|
|
|
6.
|
Prov för VTG-analys placeras i eppendorfrör och fryses omedelbart i flytande kväve.
|
|
7.
|
Kroppen, inklusive könskörtlar, placeras i en på förhand märkt vävnadskassett av plast som överförs till Davidsons eller Bouins fixativ. Fixativets volym ska vara minst tio gånger den uppskattade vävnadsvolymen. Fixeringsbehållaren omskakas varsamt i fem sekunder för att lösgöra luftbubblor från kassetten.
|
|
8.
|
|
a.
|
Alla vävnader blir kvar i Davidsons fixativ över natten, och överförs sedan till separata behållare med 10 % neutral buffrad formalin följande dag. Behållare med kassetter omskakas varsamt i fem sekunder för att säkerställa tillräcklig infiltrering av formalinet i kassetterna.
|
|
b.
|
Vävnaderna blir kvar i Bouins fixativ i 24 timmar och överförs därefter till 70 % etanol.
|
|
Bearbetning av vävnader
Mål:
|
1.
|
Torka ut vävnaden för tillräcklig infiltrering av paraffin.
|
|
2.
|
Impregnera vävnaden med paraffin för att bevara vävnadsintegriteten och skapa en fast yta för mikrotomi.
|
Förfaranden:
|
3.
|
Märkta vävnadskassetter avlägsnas från lagringen i formalin/etanol och kassetterna placeras i beredningskorgarna. Beredningskorgen fylls i vävnadsberedaren.
|
|
4.
|
Tidsplanen för beredningen väljs ut.
|
|
5.
|
Efter det att vävnadsberedaren har slutfört behandlingscykeln kan korgarna överföras till inbäddningsstationen.
|
Inbäddning
Mål:
Att korrekt justera provexemplarets position i stelnat paraffin för mikrotomi.
Förfaranden:
|
1.
|
Korgen med kassetter avlägsnas från beredaren och sänks ned i den paraffinfyllda främre behållaren i inbäddningsstationens värmekonsol, eller så flyttas kassetterna till en separat paraffinvärmare.
|
|
2.
|
Den första kassetten som ska bäddas in avlägsnas från den främre behållaren i inbäddningsstationens värmekonsol eller från paraffinvärmaren. Kassettens lock avlägsnas och kasseras, och kassettens etikett kontrolleras mot djurregistret för att lösa eventuella problem med avvikelser innan inbäddningen.
|
|
3.
|
En lagom stor inbäddningsform väljs ut.
|
|
4.
|
Formen hålls under fördelningskonsolens påfyllningspip och fylls med flytande paraffin.
|
|
5.
|
Provexemplaret avlägsnas från kassetten och placeras i det flytande paraffinet i formen. Detta ska upprepas med 4–8 exemplar för varje paraffinform. De enskilda fiskarnas position markeras genom att fisk nr 1 placeras 180 grader mot fisk nr 2–4/8.
|
|
6.
|
Ytterligare paraffin tillsätts för att täcka provexemplaret.
|
|
7.
|
Formen och kassettens underdel placeras på kylplattan i kryokonsolen.
|
|
8.
|
Efter att paraffinet har stelnat avlägsnas blocket (dvs. det stelnade paraffinet innehållande vävnaderna och kassettens underdel) från formen.
|
Mikrotomi
Mål:
Skära ut och montera histologiska preparat för färgning.
Förfaranden:
|
1.
|
Den inledande fasen av mikrotomin, som går under benämningen ’skiktning’, utförs enligt följande:
|
a.
|
Paraffinblocket placeras i mikrotomens fastspänningschuck.
|
|
b.
|
Chucken förs framåt genom att mikrotomhjulet roteras, och tjocka preparat skärs ut från paraffinblockets yta tills kniven når de inbäddade vävnaderna.
|
|
c.
|
Mikrotomens preparattjocklek ställs in på mellan 3–5 mikrometer. Chucken förs framåt och flera preparat skärs ut från blocket för att avlägsna alla artefakter som skapats på vävnadens snittyta under grovputsningen.
|
|
d.
|
Blocket kan avlägsnas från chucken och placeras på is med framsidan nedåt för att blöta ur vävnaden.
|
|
|
2.
|
Nästa fas av mikrotomin är den slutliga uppdelningen och monteringen av vävnadspreparaten på objektglasen. Dessa förfaranden genomförs på följande sätt:
|
a.
|
Om blocket har lagts på is avlägsnas det från isen och sätts återigen fast i mikrotomens chuck.
|
|
b.
|
Med mikrotomens preparattjocklek inställd på 3–5 mikrometer förs chucken framåt genom att mikrotomhjulet roteras. Preparat skärs ut från blocket tills ett ’band’ som innehåller minst ett godtagbart preparat inklusive könskörtlar har framställts. (Vid behov kan blocket avlägsnas från chucken under sektioneringen, läggas på is för att blöta ur vävnaden och återigen sättas fast i chucken.)
|
|
c.
|
Preparaten lägges plant på vattenytan i ett vattenbad. Man ska försöka erhålla minst ett preparat som inte innehåller några veck och inte har några instängda luftbubblor.
|
|
d.
|
Ett objektglas sänks ner under det bästa preparatet, som lyfts upp ur vattnet med hjälp av objektglaset. Denna process kallas för ’montering’ av preparatet på objektglaset.
|
|
e.
|
Tre preparat bereds för en uppsättning fiskar. Det andra och tredje preparatet tas efter intervaller på 50 mikrometer efter det första preparatet. Om fiskarna inte bäddats in med könskörtlarna på samma snittnivå ska fler preparat tas för att se till att minst sex preparat inklusive könskörtlarna erhålls från varje fisk.
|
|
f.
|
Med en objektglasmärkpenna antecknas numret på blocket från vilket objektglaset framställdes.
|
|
g.
|
Objektglaset placeras i en färgningsställning.
|
|
h.
|
Blocket avlägsnas från chucken och placeras med framsidan nedåt för lagring.
|
|
Färgning, täckning av preparaten med täckglas, märkning av objektglasen
Mål:
|
—
|
Färga preparaten för histopatologisk undersökning
|
|
—
|
Permanent försegla de monterade och färgade vävnaderna.
|
|
—
|
Permanent identifiera färgade preparat på ett sätt som möjliggör fullständig spårbarhet.
|
Förfaranden:
|
1.
|
Färgning
|
a.
|
Täckglasen lufttorkas över natten före färgningen.
|
|
b.
|
Preparaten färgas med hematoxylin-eosin.
|
|
|
2.
|
Täckning av preparaten med täckglas
|
a.
|
Täckglas kan läggas på antingen manuellt eller automatiskt.
|
|
b.
|
Ett objektglas sänks ned i xylen eller TissueClear, och överskottet av xylen/TissueClear skakas försiktigt av från glaset.
|
|
c.
|
Ca 0,1 ml monteringsmedium appliceras nära objektglasets kant mitt emot den mattslipade kanten eller på täckglaset.
|
|
d.
|
Täckglaset vinklas i spetsig vinkel när det anbringas mot objektglaset.
|
|
|
3.
|
Märkning
|
a.
|
Etiketten på varje objektglas ska innehålla följande information.
|
iii.
|
Provexemplar nr/Objektglas nr
|
|
iv.
|
Kemikalie / Behandlingsgrupp
|
|
|
Tillägg 8
Statistiskt flödesschema för vitellogeninanalys

Statistiskt flödesschema för analys av könsfördelningen
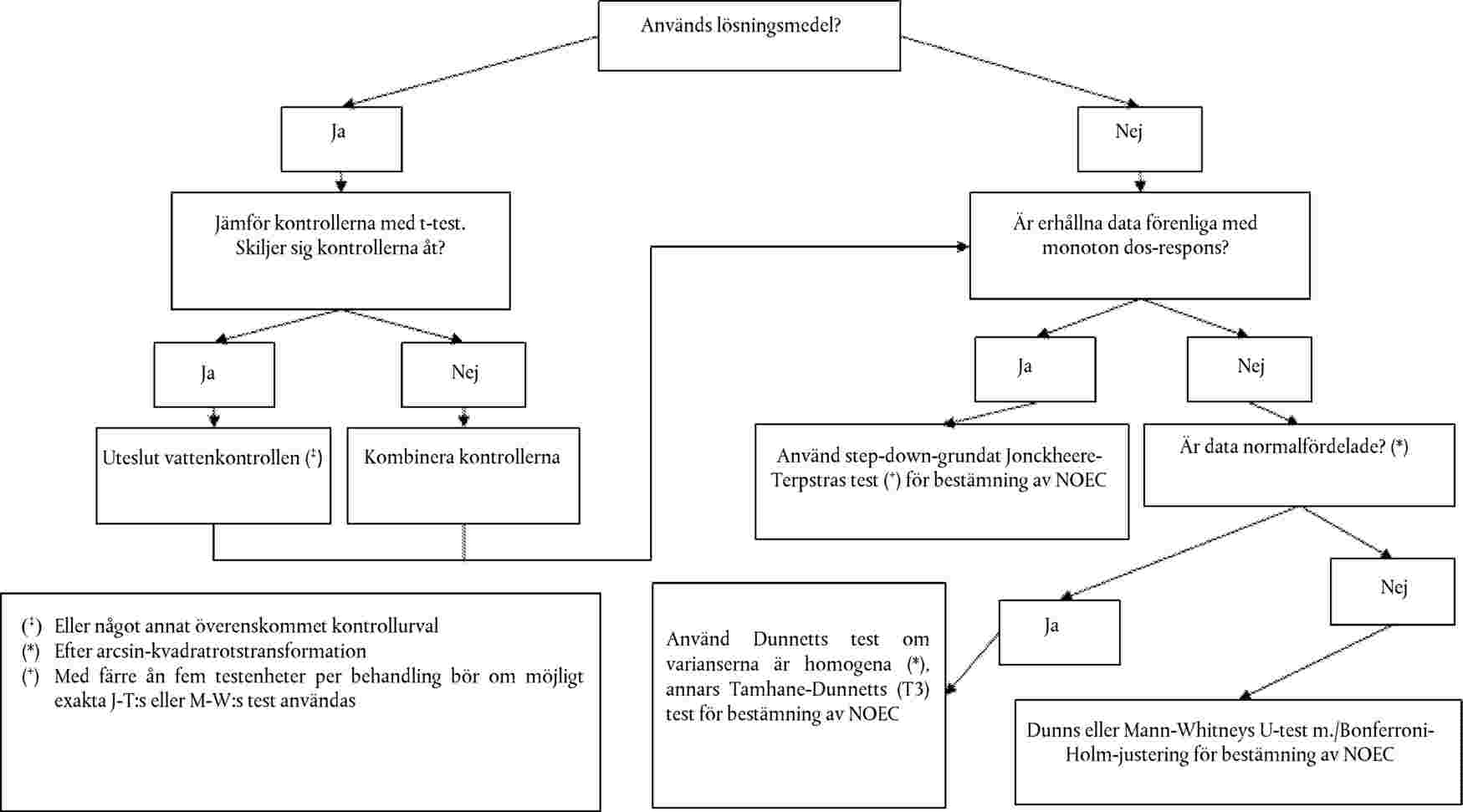
Tillägg 9
Vägledning för vävnadsprovtagning för bestämning av genetiskt kön och för bestämning av genetiskt kön med PCR-metoden
Vävnadsprovtagning, beredning och lagring före bestämning av det genetiska könet hos risfiskar med PCR-metoden (utarbetad av Laboratory for Aquatic Organisms hos Bayer CropScience AG)
|
1.
|
Analfenan eller ryggfenan klipps av från varje fisk med en fin sax och placeras i ett rör med 100 μl extraktionsbuffert 1 (för information om beredning av buffertlösning, se nedan). Saxen ska rengöras efter varje enskild fisk i en bägare fylld med destillerat H2O och torkas av med ett mjukt papper.
|
|
2.
|
Fenvävnaderna homogeniseras nu med en teflonbelagd mortelstöt för mikrorör för att uppnå lysis hos cellerna. För varje rör används en ny mortelstöt för att förhindra kontaminering. Mortelstötarna placeras över natten i 0,5 M NaOH, sköljs sedan i fem minuter i destillerat H2O och lagras i etanol eller steriliseras efter autoklavering fram till användningen.
|
|
3.
|
Det är också möjligt att lagra fenvävnaderna utan extraktionsbuffert 1 i torris och därefter i kylskåp vid – 80 °C för att förhindra degeneration av DNA. Extraktionen går dock lättare om man extraherar DNA samtidigt (hantering se ovan; proven ska tinas på is efter lagring vid – 80 °C innan bufferten fyllas på i rören).
|
|
4.
|
Efter homogeniseringen placeras alla rör i vattenbad och kokas i 15 minuter vid 100 °C.
|
|
5.
|
Sedan pipetteras 100 μl av extraktionsbuffert 2 (information om beredning av buffertlösning finns nedan) till varje provrör. Proven förvaras vid rumstemperatur i 15 minuter, och skakas ibland under tiden försiktigt för hand.
|
|
6.
|
Därefter placeras alla rör i vattenbadet igen och kokas i ytterligare 15 minuter vid 100 °C.
|
|
7.
|
Rören fryses vid – 20 °C och lagras för ytterligare analys.
|
Beredning av buffertlösning
PCR-buffert 1:
|
|
500 mg N-lauroylsarkosin (t.ex. Merck KGaA, Darmstadt, Tyskland)
|
PCR-buffert 2:
|
|
20 g Chelex (t.ex. Biorad, München, Tyskland)
|
|
|
Låt svälla i 100 ml dest. H2O
|
Bestämning av det genetiska könet (genom PCR-metoden) hos risfiskar (utarbetad av Laboratory for Aquatic Organisms hos Bayer CropScience AG och Universität Würzburg Biozentrum)
De beredda och frysta rören (som beskrivs i avsnittet ovan) tinas på is. Efter detta centrifugeras de i en eppendorfcentrifug (30 sek. på högsta hastighet vid rumstemperatur). Den klara supernatanten som separerats från utfällningen används för PCR. Man måste absolut undvika att några spår av Chelex (lokaliserad i utfällningen) överförs till PCR-reaktionen, eftersom detta skulle påverka ’Taq’-polymerasaktiviteten. Supernatanten ska användas direkt eller kan lagras fryst (vid – 20 °C) och tinas upp igen i flera omgångar utan några negativa effekter på DNA:t för senare analyser.
1. Beredning av reaktionsblandning ’Reaction Mix’ (25 μl per prov):
|
|
Volym
|
Slutlig koncentration
|
|
Templat-DNA
|
0,5 μl–2 μl
|
|
|
10xPCR-buffert med MgCl2
|
2,5 μl
|
1x
|
|
Nukleotider (var och en av dATP, dCTP, dGTP, dTTP)
|
4 μl (5 mM)
|
200 μM
|
|
Forward primer (10μM) (se nedan 3–5)
|
0,5 μl
|
200 nM
|
|
Reverse primer (10 μM) (se nedan 3–5)
|
0,5 μl
|
200 nM
|
|
DMSO
|
1,25 μl
|
5 %
|
|
Vatten (av PCR-kvalitet)
|
upp till 25 μl
|
|
|
Taq E-polymeras
|
0,3 μl
|
1,5 U
|
|
10xPCR-buffert med MgCl2: 670 mM Tris/HCl (pH 8,8 vid 25 °C), 160 mM (NH4)2SO4, 25 mM MgCl2, 0,1 % Tween 20
|
För varje PCR (se nedan 3–5) behövs den särskilda primer som utgörs av en ny kombination av ’Reaction Mix’ och den lämpliga mängden templat-DNA som behövs för varje prov (se ovan). Respektive volymer överförs till nya rör med hjälp av pipetter. Därefter försluts alla rör, omröres (ca 10 sek.) och centrifugeras (10 sek. vid rumstemperatur). Nu kan respektive PCR-program påbörjas. Dessutom används en positiv kontroll (typiskt DNA-prov med känd aktivitet och tydliga resultat) och en negativ kontroll (1 μl dest. H2O) i varje PCR-program.
2. Beredning av agarosgel (1 %) – medan PCR-programmen pågår:
|
—
|
Lös upp 3 g agaros i 300 ml 1 × TAE-buffert (1 % agarosgel)
|
|
—
|
Denna lösning bör kokas i en mikrovågsugn (ca 2–3 minuter)
|
|
—
|
Överför den varma lösningen till en särskild gjutlåda, som ligger på is
|
|
—
|
Efter ca 20 min är agarosgelen färdig för användning
|
|
—
|
Förvara agarosgelen i 1 × TAE-buffert till dess att PCR-programmen avslutats
|
3. Aktin-PCR-program:
Denna PCR-reaktion syftar till att visa att DNA i provet inte skadas.
|
—
|
Särskild primer:
|
—
|
’Mact1(upper/forward)’ → TTC AAC AGC CCT GCC ATG TA
|
|
—
|
’Mact2(lower/reverse)’ → GCA GCT CAT AGC TCT TCT CCA GGG AG
|
|
|
—
|
Program:
|
—
|
Cykel (35 ggr):
|
Denaturering
|
→ 45 sek. vid 95 °C
|
|
Hybridisering
|
→ 45 sek. vid 56 °C
|
|
Elongering
|
→ 1 min. vid 68 °C
|
|
|
4. X- och Y-gen-PCR-program:
Proven med intakt DNA används i detta PCR-program för att påvisa X- och Y-gener. Hanligt DNA bör uppvisa ett dubbelband och honligt DNA bör uppvisa ett enda band (efter färgning och gel-elektrofores). I denna programkörning bör en positiv kontroll för hanar (XY-prov) och en för honor (XX-prov) inkluderas.
|
—
|
Särskild primer:
|
—
|
’PG 17.5’ (upper/forward) → CCG GGT GCC CAA GTG CTC CCG CTG
|
|
—
|
’PG 17.6’ (lower/reverse) → GAT CGT CCC TCC ACA GAG AAG AGA
|
|
|
—
|
Program:
|
—
|
Cykel (40 ggr):
|
Denaturering
|
→ 45 sek. vid 95 °C
|
|
Hybridisering
|
→ 45 sek. vid 55 °C
|
|
Elongering
|
→ 1 min. 30 sek. vid 68 °C
|
|
|
5. Y-gen-PCR-program som ’kontroll’ för X- och Y-gen-PCR-programmet:
Detta PCR-program verifierar resultatet av ’X- och Y-gen-PCR-programmet’. De hanliga proven bör uppvisa ett band och de honliga proven bör inte uppvisa något band (efter färgning och gel-elektrofores).
|
—
|
Särskild primer:
|
—
|
’DMTYa (upper/forward)’ → GGC CGG GTC CCC GGG TG
|
|
—
|
’DMTYd (lower/reverse)’ → TTT GGG TGA ACT CAC ATG G
|
|
|
—
|
Program:
|
—
|
Cykel (40 ggr):
|
Denaturering
|
→ 45 sek. vid 95 °C
|
|
Hybridisering
|
→ 45 sek. vid 56 °C
|
|
Elongering
|
→ 1 min. vid 68 °C
|
|
|
6. Färgning av PCR-proven:
Färgningslösning:
Pipettera 1 μl av färglösningen till varje enskilt rör
7. Påbörja gelelektroforesen:
|
—
|
Den beredda 1 % agarosgelen överförs till en gelelektrofores-kammare fylld med 1 × TAE-buffert
|
|
—
|
10–15 μl av varje färgat PCR-prov pipetteras till en agarosgel-brunn
|
|
—
|
Även 5–15 μl av 1kb-’stegen’ (Invitrogen) pipetteras till en separat brunn
|
|
—
|
Inled elektroforesen med 200 V
|
|
—
|
Avsluta efter 30–45 minuter
|
8. Bestämning av banden:
|
—
|
Rengör agarosgelen i destillerat H2O
|
|
—
|
Placera sedan agarosgelen i etidiumbromid i 15–30 minuter
|
|
—
|
Därefter ska en bild tas av agarosgelen i en UV-ljusbox
|
|
—
|
Slutligen analyseras proverna genom att jämföra dem med banden i den positiva kontrollen och stegen
|
Tillägg 10
Riktlinjer för vävnadsprov för bestämning av genetiskt kön hos storspigg med PCR-metoden
Vävnadsprov och DNA-extraktion
DNA kan extraheras med hjälp av olika kommersiellt tillgängliga reagens och både manuella och automatiserade extraktionssystem. Det protokoll som används vid Cefas Weymouth-laboratoriet beskrivs nedan, och alternativa metoder har lagts till där så är lämpligt.
|
1.
|
En liten bit vävnad (10–20 mg) från det dorsolaterala området (efter att huvudet och stjärten avlägsnats för VTG-analys), avlägsnas från varje enskild fisk med en fin sax. Vävnaden läggs i ett rör och placeras antingen direkt i flytande kväve (för lagring vid – 80 °C) eller så fylls röret med 70 % etanol (för transport och efterföljande lagring vid 4 °C). Saxen rengörs efter varje enskild fisk i 70 % etanol och därefter i destillerat vatten, och torkas sedan med mjukt papper.
|
|
2.
|
Etanolen (i förekommande fall) avlägsnas genom aspiration och vävnaden bryts sedan ned över natten med hjälp av proteas K i 400 μl ATL-buffert (Qiagen). En alikvot (200 μl) av den nedbrutna vävnaden överförs till ett 96-brunns S-block (Qiagen), och DNA extraheras i ett 96-brunnsformat med hjälp av Qiagen BioRobot Universal System och QIAamp Investigator BioRobot Kit. DNA elueras i 50 μl vatten som är fritt från DNAas och RNAas. Om man använder hårda vävnader för att extrahera DNA (t.ex. en tagg eller en bröstfena) kan det bli nödvändigt att homogenisera provet i en lyseringsbuffert med hjälp av ett FastPrep®-instrument för vävnadslysering eller motsvarande vävnadsnedbrytningssystem.
Alternativ:
|
a)
|
Vävnaden bryts ned över natten med proteas K i 400 μl G2 lyseringsbuffert (Qiagen) och DNA extraheras från 200 μl av den nedbrutna vävnaden med hjälp av antingen EZ1 DNA Tissue Kit och BioRobot EZ1 eller DNA easy tissue mini kit. DNA elueras i en volym på 50 μl.
|
|
b)
|
Vävnaderna bearbetas med hjälp av DNAzol-reagenset. Vävnadsproven lyseras i 1 ml DNAzol i 10 minuter i ett 1,5 ml mikrocentrifugrör och centrifugeras därefter vid 13 000 rpm i 5 minuter för att avlägsna alla partiklar. Det lyserade provet överförs sedan till ett nytt 1,5 ml mikrocentrifugrör som innehåller 500 μl 100 % etanol av molekylärbiologisk kvalitet, och centrifugeras därefter vid 13 000 rpm i 10 minuter för att fälla ut DNA. Etanolen avlägsnas och ersätts med 400 μl 70 % etanol av molekylärbiologisk kvalitet som centrifugeras vid 13 000 rpm i 5 minuter, och DNA-pelleten löses upp i 50 μl molekylärt vatten som är fritt från DNAas och RNAas. Återigen kan det bli nödvändigt, om man använder sig av hårda vävnader (bröstfena), att homogenisera provet i en lyseringsbuffert med hjälp av ett FastPrep®-instrument för vävnadslysering eller motsvarande vävnadsnedbrytningssystem innan DNA extraheras.
|
|
|
3.
|
DNA förvaras vid – 20 °C fram till användning.
|
Obs! Handskar måste användas under dessa förfaranden.
Analys genom polymeraskedjereaktion (PCR)
Amplifieringar genomförs med 2,5 μl av DNA-extraktet i en reaktionsvolym på 50 μl med hjälp av primers för genlocus ldh (enligt beskrivning av Peichel m.fl., 2004. Current Biology 1, 1416–1424):
|
Forward primer
|
5' GGG ACG AGC AAG ATT TAT TGG 3'
|
|
Reverse Primer
|
5' TAT AGT TAG CCA GGA GAT GG 3'
|
Det finns många leverantörer av lämpliga PCR-reagens. Den metod som beskrivs nedan är den som för närvarande används vid Cefas Weymouth-laboratoriet.
1. Beredning av reaktionsblandning ’Reaction Mix’ (50 μl per prov):
En masterblandning bereds på det sätt som beskrivs här. Den kan beredas i förväg och lagras fryst vid – 20 °C fram till användning. Bered tillräckligt med masterblandning för en negativ kontroll (endast vatten av molekylärbiologisk kvalitet).
|
|
Volym (stamlösningskonc.)/prov
|
Slutlig koncentration
|
|
5xGoTaq® Reaction Buffer
|
10 μl
|
1x
|
|
MgCl2
|
5 μl (25 mM)
|
2,5 mM
|
|
Nukleotider (dATP, dCTP, dGTP, dTTP)
|
0,5 μl (25 mM vardera)
|
250 μM vardera
|
|
Forward primer
|
0,5 μl (0,1 nmol/μl)
|
2,0 μM
|
|
Reverse primer
|
0,5 μl (0,1 nmol/μl)
|
2,0 μM
|
|
Vatten av molekylärbiologisk kvalitet
|
30,75 μl
|
|
|
GoTaq-polymeras
|
0,25 μl
|
1,25 U
|
|
—
|
Mät upp 47,5 μl i ett etiketterat 0,5 ml tunnväggigt PCR-rör.
|
|
—
|
Tillsätt 2,5 μl renat DNA till röret med lämplig etikett. Upprepa för alla prover och den negativa kontrollen.
|
|
—
|
Täck med 2 droppar mineralolja. Alternativt kan man använda en termocykler med uppvärmt lock.
|
|
—
|
Proven denatureras i en Peltier PTC-225 termocykler vid 94 ± 2 °C i 5 minuter följt av 39 cykler vid 94 ± 2 °C i 1 minut, 55 ± 2 °C i 1 minut, 72 ± 2 °C i 1 minut, och en avslutande förlängning vid 72 ± 2 °C i 10 minuter.
|
2. Beredning av agarosgelen (2 %):
Vanligtvis löses PCR-produkterna upp på 20 % agarosgel som innehåller etidiumbromid.
Kapillärbaserade elektroforessystem kan också användas.
|
—
|
Väg upp 2 g agaros i 100 ml 1 × TAE-buffert.
|
|
—
|
Värm i mikrovågsugn (ca 2–3 minuter) för att lösa upp agarosen.
|
|
—
|
Tillsätt 2 droppar etidiumbromid, slutkoncentration 0,5 μg/ml.
|
|
—
|
Överför den varma lösningen till gelgjutningsutrustningen.
|
3. Gelelektrofores:
|
—
|
Överför agarosgelen till elektroforesutrustningen och sänk ner den i 1 × TAE-buffert.
|
|
—
|
Ladda 20 μl av varje prov i en separat brunn och lägg till en molekylviktsmarkör (100 bp DNA-stege, Promega) i en tom brunn.
|
|
—
|
Elektroforesen utförs vid 120 V i 30–45 minuter.
|
4. Visualisering av amplifieringsprodukterna
Om etidiumbromiden tillsattes till agarosgelen enligt beskrivning ovan kan DNA-produkterna visualiseras under en ultraviolett ljuskälla. Alternativt kan agarosgelen färgas genom att gelen täcks med en lösning av upplöst etidiumbromid (0,5 μg/ml i vatten) i 30 minuter innan visualiseringen.
Tillägg 11
Vägledning för konstgjord befruktning av storspigg
Syftet med detta avsnitt är att beskriva de förfaranden som används för att erhålla befruktade ägg från storspigg i syfte att använda dem i testet på fiskars könsutveckling.
Förfaranden
Insamling av sperma från hanar
|
1.
|
En välfärgad hane från den önskade populationen avlivas.
|
|
2.
|
Testiklarna avlägsnas från båda sidorna av fisken. Testiklarna är i allmänhet starkt pigmenterade, stavformiga strukturer som är lätta att urskilja vid kroppens laterala mittlinje. Använd någon av följande metoder:
|
|
3.
|
Med hjälp av en fin sax gör man med början vid kloaken ett 1–1,5 cm långt vinklat snitt (45 grader) med ett enda klipp.
|
|
4.
|
Använd en skalpell för att göra ett litet snitt i sidan på fisken något framför bäckenet och precis ventralt från de laterala benplattorna.
|
|
5.
|
Testiklarna avlägsnas med hjälp av en liten pincett och placeras i en petriskål.
|
|
6.
|
Varje testikel täcks med 100 μl nyberedd Hanks lösning
(31).
|
|
7.
|
Testiklarna skärs i små tärningar med ett rakblad eller en skalpell. Detta kommer att frigöra sperman och ger Hanks lösning ett mjölkvitt utseende.
|
|
8.
|
Vätskan som innehåller sperman samlas upp i ett provrör. Försök undvika att få med bitar av testikelvävnad vid pipetteringen.
|
|
9.
|
800 μl Hanks lösning tillsätts i röret och blandas väl.
|
|
10.
|
Om så krävs kan hanen bevaras genom att fixeras i 100 % etanol eller annat utvalt fixativ. Detta är särskilt viktigt om man i undersökningen bestämmer avkommans föräldraursprung.
|
Viktig anmärkning: Även om de flesta stamlösningar som behövs kan göras i förväg bör
stamlösning 5
och därefter
Hanks lösning nyberedas
samma dag som de används.
|
Stamlösning 1
|
|
NaCl
|
8,00 g
|
|
KCl
|
0,40 g
|
|
Destillerat vatten
|
100 ml
|
|
Stamlösning 2
|
|
Na2HPO4 (vattenfri)
|
0,358 g
|
|
KH2PO4
|
0,60 g
|
|
Destillerat vatten
|
100 ml
|
|
Stamlösning 3
|
|
CaCl2
|
0,72 g
|
|
Destillerat vatten
|
50 ml
|
|
Stamlösning 4
|
|
MgSO4 · 7H2O
|
1,23 g
|
|
Destillerat vatten
|
50 ml
|
|
Stamlösning 5 (nyberedd)
|
|
NaHCO3
|
0,35 g
|
|
Destillerat vatten
|
10 ml
|
Anmärkning: Om man redan har en del av ovanstående salter men med en annan vattenhalt (dvs. 2H2O i stället för vattenfri) kan dessa ändå användas, men vikten måste först justeras på grundval av molekylvikten.
För Hanks lösning kombineras i följande ordning
|
stamlösning 1
|
1,0 ml
|
|
stamlösning 2
|
0,1 ml
|
|
stamlösning 3
|
0,1 ml
|
|
destillerat vatten
|
8,6 ml
|
|
stamlösning 4
|
0,1 ml
|
|
stamlösning 5
|
0,1 ml
|
Blanda väl före användning.
Befruktning
|
1.
|
Stora lekmogna honor med ägg väljs ut från den önskade populationen. Honorna är färdiga att kramas ur först när man kan se äggen sticka fram i kloaken. Honor som är lekmogna har en karaktäristisk kroppsställning med huvudet uppåt.
|
|
2.
|
För försiktigt ett finger eller tummen längs sidan av fisken mot stjärten för att uppmuntra till utstötning av en äggsäck i en ny petriskål. Upprepa på andra sidan och släpp tillbaka fisken i dess akvarium.
|
|
3.
|
Äggen kan spridas ut (till ett enskiktslager) med en liten pensel. Det är viktigt att försöka exponera så många ägg som möjligt för sperman, så det är till stor hjälp om man maximerar äggskiktets ytareal. Viktig anmärkning: Håll äggen fuktiga genom att täcka dem runt om med fuktigt mjukt papper (det är viktigt att äggen inte kommer i direkt beröring med vatten eftersom detta kan göra att korion hårdnar i förtid och därmed förhindrar befruktningen). Antalet ägg som varje hona kan producera varierar kraftigt, men i genomsnitt bör man enkelt kunna erhålla cirka 150 ägg från en enda lekmogen hona.
|
|
4.
|
25μl sperma i Hanks blandning fördelas jämnt över äggskiktets hela yta med hjälp av penseln. Äggen kommer snabbt att hårdna och ändra färg (inom en minut) när befruktningen har inletts. Upprepa förfarandet om det uppskattade antalet ägg är mer än 150. Likaledes ska man tillsätta lite mer sperma om äggen inte hårdnar inom en minut. Viktig anmärkning: Att tillsätta mer sperma ökar inte nödvändigtvis befruktningsfrekvensen.
|
|
5.
|
Äggen och spermielösningen bör få stå och ’interagera’ i minst 15 minuter och de befruktade äggen placeras i exponeringsakvarierna inom 1,5 timmar efter befruktningen.
|
|
6.
|
Förfarandet upprepas med en annan hona till dess att det önskade antalet ägg har samlats in.
|
|
7.
|
Behåll ett fåtal ägg från den sista omgången och fixera dem i 10 % ättiksyra.
|
Räkning och fördelning av äggen i testakvarier
|
1.
|
Äggen bör fördelas jämnt mellan varje behandlingsnivå för att undvika systematiska genetiska avvikelser. Varje parti befruktade ägg bör delas upp i lika stora grupper (lika många som behandlingsnivåerna) med hjälp av ett trubbigt instrument (t.ex. en insektspincett med bred spets eller med hjälp av en ympögla). Om man ämnar ha fyra replikat per testkärl med 20 ägg i varje måste man fördela 80 ägg per exponeringsakvarium. Viktig anmärkning: Det rekommenderas att man lägger till ytterligare 20 % (dvs. 96 ägg per behandlingsnivå) till dess att man är säker på att man har 100 % befruktningsfrekvens.
|
|
2.
|
Spiggägg är mycket känsliga för svampinfektioner utanför boet, som vaktas av fadern. I detta hänseende är det av avgörande betydelse att alla ägg behandlas med metylenblått under de fem första dagarna av testet. En stamlösning med metylenblått bereds vid 1 mg/ml och tillsätts i exponeringsakvarierna för att ge en högsta slutlig koncentration på 2,125 mg/l. Viktig anmärkning: Spigg bör inte exponeras för metylenblått när de har kläckts. Systemet bör vara fritt från metylenblått senast på dag 6.
|
|
3.
|
Äggen ska kontrolleras dagligen och eventuella döda eller obefruktade ägg registreras som sådana. Viktig anmärkning: Äggen bör aldrig befinna sig utanför vattnet innan kläckningen ens under mycket korta perioder.
|
C.42 BIOLOGISK NEDBRYTBARHET I HAVSVATTEN
ALLMÄN INLEDNING
|
1.
|
Denna testmetod motsvarar OECD:s testriktlinje (TG) 306 (1992). När de ursprungliga testmetoderna utarbetades var det inte känt i vilken utsträckning resultaten från ett screeningtest för lätt bionedbrytbarhet där man använder sötvatten, och spillvatten eller aktiverat slam som inokulat, kan tillämpas på den marina miljön. Olika resultat på denna punkt har rapporterats (t.ex. 1)
|
|
2.
|
Många industriella avloppsvatten som innehåller ett stort antal kemikalier når havet antingen genom direkt utsläpp eller genom flodmynningar och floder där retentionstiden är kort jämfört med den tid som krävs för fullständig biologisk nedbrytning av många av de kemikalier som förekommer i avloppsvattnet. På grund av den ökande medvetenheten om behovet av att skydda den marina miljön mot ökad belastning av kemikalier och behovet av att uppskatta den sannolika koncentrationen av kemikalier i havet har testmetoder för biologisk nedbrytbarhet i havsvatten utarbetats.
|
|
3.
|
I de metoder som beskrivs här används naturligt havsvatten både som vattenfas och som källa till mikroorganismer. I en strävan att använda samma metoder som för lätt bionedbrytbarhet i sötvatten undersökte man möjligheten att använda ultrafiltrerat havsvatten, och även användningen av marina sediment som inokulat. Dessa undersökningar rönte ingen framgång. Testmediet är därför naturligt havsvatten som förbehandlats för att avlägsna grova partiklar.
|
|
4.
|
För att bedöma den fullständiga biologiska nedbrytbarheten med skakkolvmetoden måste relativt höga koncentrationer av testämnet användas på grund av den dåliga känsligheten hos analysmetoden med löst organiskt kol (DOC). Detta gör i sin tur att man måste tillsätta oorganiska näringsämnen (N och P) till havsvattnet, eftersom mineralnäringsämnenas låga koncentration i annat fall skulle begränsa elimineringen av DOC. Det är även nödvändigt att lägga till dessa näringsämnen i closed bottle-metoden på grund av det tillagda testämnets koncentration.
|
|
5.
|
Metoderna är sålunda inte tester för lätt bionedbrytbarhet eftersom man inte lägger till något inokulat utöver de mikroorganismer som redan finns i havsvatten. Inte heller simulerar testerna den marina miljön, eftersom näringsämnen läggs till och testämnets koncentration är mycket högre än i havet. Av dessa skäl föreslås dessa metoder inom ramen för ett nytt underavsnitt, ’Biologisk nedbrytbarhet i havsvatten’.
|
TILLÄMPNING
|
6.
|
Resultaten av testet, som skulle tillämpas om mönstret för det aktuella ämnets användning och omhändertagande tyder på det hamnar i havet, ger en första indikation på den biologiska nedbrytbarheten i havsvatten. Om resultatet är positivt (> 70 % DOC-eliminering, > 60 % ThOD – teoretisk syreförbrukning) kan man dra slutsatsen att det finns en kapacitet för biologisk nedbrytning i den marina miljön. Ett negativt resultat utesluter dock inte denna kapacitet utan anger att det behövs ytterligare undersökningar, till exempel genom användning av en så låg koncentration av testämnet som möjligt.
|
|
7.
|
Om man behöver ett mer definitivt värde på den biologiska nedbrytningens hastighet eller omfattning i havsvatten på en särskild plats, måste man i vilket fall som helst använda andra metoder som är mer komplexa och sofistikerade, och därmed dyrare. Exempelvis kan ett simuleringstest göras med en koncentration av testämnet som ligger närmare den förväntade koncentrationen i miljön. Även icke-mättat, icke-förbehandlat havsvatten från det område som undersöks kan användas, och den primära bionedbrytningen kan följas med hjälp av särskilda kemiska analyser. För fullständig biologisk nedbrytbarhet skulle det vara nödvändigt att använda 14C-märkta ämnen så att elimineringshastigheterna för lösligt organiskt 14C och produktionen av 14CO2 vid miljömässigt realistiska koncentrationer kan mätas.
|
VAL AV METOD
|
8.
|
Valet av den metod som ska användas beror på en mängd olika faktorer. Följande tabell kan användas som hjälp vid metodvalet. Ämnen med vattenlöslighet som ligger under motsvarande cirka 5 mg C/l kan inte testas med skakkolvmetoden, men svårlösliga ämnen kan, åtminstone i princip, testas med closed bottle-metoden.
Tabell
Fördelar och nackdelar med skakkolv- och closed bottle-metoden
|
METOD
|
FÖRDELAR
|
NACKDELAR
|
|
SKAKKOLV-METODEN
|
|
—
|
enkel utrustning med undantag för C-analysatorn
|
|
—
|
varaktigheten på 60 dagar utgör inte ett problem
|
|
—
|
ingen interferens från nitrifikationen
|
|
—
|
kan anpassas för flyktiga ämnen
|
|
|
—
|
det behövs en C-analysator
|
|
—
|
använder 5–40 mg DOC/1, skulle kunna verka hämmande
|
|
—
|
DOC-bestämningen är svår vid låga koncentrationer i havsvatten (klorideffekt)
|
|
—
|
DOC-värdena ibland höga i havsvatten
|
|
|
CLOSED BOTTLE-METODEN
|
|
—
|
enkel bestämning av slutdatum
|
|
—
|
mindre risk för hämning p.g.a. låga koncentrationer av testämnet (2 mg/l)
|
|
—
|
kan lätt anpassas till flyktiga ämnen
|
|
|
—
|
lufttätheten i kolvarna kan vara svår att upprätthålla
|
|
—
|
tillväxt av bakterier på kärlväggarna kan leda till felaktiga värden
|
|
—
|
blankprovets upptagningsvärden för O2 kan vara höga, särskilt efter 28 dagar; detta kan hanteras genom att havsvattnet får åldras
|
|
—
|
möjlig interferens från upptagningen av O2 genom nitrifikation
|
|
|
SKAKKOLVMETODEN
INLEDNING
|
1.
|
Denna metod är en havsvattenvariant av det modifierade OECD-screeningtest som beskrivs i kapitel C.4B i denna bilaga (2). Det fick slutgiltigt godkännande efter ett ringtest som organiserades för Europeiska kommissionen (EC) av det danska vattenkvalitetsinstitutet (3).
|
|
2.
|
I likhet med den åtföljande marina closed bottle-metoden ska resultaten från detta test inte anses utgöra indikatorer på lätt bionedbrytbarhet, men ska uttryckligen användas för att skaffa information om bionedbrytbarheten för ämnen i marina miljöer.
|
PRINCIP FÖR TESTMETODEN
|
3.
|
En förutbestämd mängd testämne löses upp i testmediet till dess att koncentrationen löst organiskt kol (DOC)/l når 5–40 mg. Om känslighetsgränserna för analyser av organiskt kol förbättras kan det vara en fördel att använda lägre koncentrationer av testämnet, i synnerhet för ämnen som verkar hämmande. Testämneslösningen i testmediet inkuberas under skakning i mörker eller indirekt ljus under aeroba förhållanden vid en konstant temperatur (med en variation på högst ± 2 °C) som normalt ligger inom intervallet 15–20 °C. Om syftet med undersökningen är att simulera situationer i miljön kan testerna utföras bortom detta normala temperaturintervall. Den rekommenderade maximala varaktigheten för testet är cirka 60 dagar. Nedbrytningen följs med hjälp av mätningar av DOC (fullständig nedbrytning) samt, i vissa fall, med hjälp av särskilda analyser (primär nedbrytning).
|
INFORMATION OM TESTÄMNET
|
4.
|
För att veta om testet kan tillämpas på ett visst ämne måste vissa av dess egenskaper vara kända. Ämnets halt av organiskt kol måste fastställas, dess flyktighet ska vara sådan att betydande förluster inte förekommer under testets gång och dess löslighet i vatten bör vara större än motsvarande 25–40 mg C/l. Testämnet bör dessutom inte adsorberas på glasytor i större mängd. Uppgifter om renheten eller de relativa proportionerna av testämnets huvudbeståndsdelar är nödvändiga för att de erhållna resultaten ska kunna tolkas, särskilt om resultatet ligger nära ’godkänd’ nivå.
|
|
5.
|
Information om testämnets toxicitet för bakterier, t.ex. uppmätt i kortvariga respirationstester (4), kan vara användbar vid valet av lämpliga testkoncentrationer och kan vara väsentlig när det gäller den korrekta tolkningen av låga värden för biologisk nedbrytbarhet. Sådan information är dock inte alltid tillräcklig för tolkning av resultaten från testet av biologisk nedbrytbarhet, och det förfarande som beskrivs i punkt 18 är lämpligare.
|
REFERENSÄMNEN
|
6.
|
Lämpliga referensämnen måste användas för att kontrollera den mikrobiella aktiviteten i havsvattenproven. Natriumacetat, natriumbensoat och anilin är exempel på ämnen som kan användas för detta ändamål. Referensämnena måste brytas ned inom en rimligt kort tidsperiod, och om detta inte sker rekommenderas att testet upprepas med ett annat havsvattenprov.
|
|
7.
|
I kommissionens ringtest, där havsvattenprover togs på olika platser och vid olika tider på året (3), var lagfasen (tL) och den tid som behövdes för att uppnå en 50-procentig nedbrytning (t50) exklusive lagfasen 1–4 dagar respektive 1–7 dagar för natriumbensoat. För anilin varierade tL mellan 0 och 10 dagar, medan t50 varierade mellan 1 och 10 dagar.
|
METODENS REPRODUCERBARHET OCH KÄNSLIGHET
|
8.
|
Metodens reproducerbarhet fastställdes i ringtestet (3). Testämnets lägsta koncentration vid vilken denna metod kan användas med DOC-analys beror till största delen på detektionsgränsen för den organiska kolanalysen (för närvarande cirka 0,5 mg C/l) och koncentrationen av löst organiskt kol i det havsvatten som används (vanligen i storleksordningen 3–5 mg/l för vatten från öppna havet). Bakgrundskoncentrationen av DOC bör inte överstiga ca 20 % av den totala DOC-koncentration efter tillförsel av testämnet. Om detta inte är möjligt kan bakgrundskoncentrationen av DOC ibland minskas genom åldrande av havsvattnet före testet. Om metoden endast används tillsammans med särskild kemisk analys (genom vilken den primära nedbrytningen mäts), måste utredaren genom att tillhandahålla ytterligare information ange huruvida man kan förvänta sig fullständig nedbrytbarhet. Denna ytterligare information kan bestå av resultat från andra test för lätt eller inneboende bionedbrytbarhet.
|
BESKRIVNING AV TESTMETODEN
Utrustning
|
9.
|
Vanlig laboratorieutrustning och följande:
|
a.
|
skakapparat som rymmer 0,5–2 liter erlenmeyerkolvar, antingen med automatisk temperaturreglering eller placerad i en lokal med konstant temperatur på 15–20 °C med högst ± 2 °C variation,
|
|
b.
|
smalhalsade 0,5–2 ml erlenmeyerkolvar,
|
|
c.
|
utrustning för membranfiltrering eller en centrifug,
|
|
d.
|
membranfilter, 0,2–0,45μm,
|
|
f.
|
utrustning för särskild analys (frivilligt).
|
|
Havsvatten
|
10.
|
Samla in ett prov med havsvatten i en väl rengjord behållare och transportera det till laboratoriet, helst inom en eller två dagar efter insamlingen. Under transporten får provets temperatur inte väsentligt överstiga den temperatur som ska användas i testet. Ange insamlingsplatsen exakt och beskriv den i fråga om förorenings- och näringsstatus. Särskilt när det gäller kustvatten bör antalet kolonier av heterotrofa mikroorganismer och en bestämning av koncentrationerna av upplöst nitrat, ammonium och fosfat ingå i denna beskrivning.
|
|
11.
|
Ange följande uppgifter för havsvattenprovet i sig:
|
—
|
provets utseende – grumligt osv.,
|
|
—
|
temperatur vid insamlingstillfället,
|
|
—
|
tid mellan provtagningen och användningen i testet.
|
|
|
12.
|
Om halten löst organiskt kol (DOC) i havsvattenprovet befinns vara hög (punkt 8) rekommenderas att havsvattnet får åldras i cirka en vecka före användning. Lagra provet under aeroba förhållanden vid testtemperaturen och i mörker eller indirekt ljus. Bibehåll de aeroba förhållandena genom skonsam luftning vid behov. Under åldringsprocessen minskar innehållet av lätt nedbrytbara organiska material. I ringtestet (3) framkom det inga skillnader mellan potentialen för nedbrytning i åldrade och nyinsamlade havsvattenprov. Före användning ska havsvattnet förbehandlas för att avlägsna grova partiklar, exempelvis genom filtrering genom ett nylonfilter eller grovt pappersfilter (inte membran eller GF/C-filter), eller genom sedimentering och dekantering. Det förfarande som används måste anges. Om man låter vattnet åldras, görs förbehandlingen efter detta.
|
Stamlösningar för oorganiska näringsämnen
|
13.
|
Följande stamlösningar framställs av reagens av analyskvalitet:
|
(a)
|
Kaliumdivätefosfat, KH2PO4
|
8,50 g
|
|
Dikaliumväteortofosfat, K2HPO4
|
21,75 g
|
|
Dinatriumväteortofosfat dihydrat, Na2HPO4 · 2H2O
|
33,30 g
|
|
Ammoniumklorid, NH4Cl
|
0,50 g
|
|
Lös upp och fyll på till 1 liter med destillerat vatten.
|
|
|
(b)
|
Kalciumklorid, CaCl2
|
27,50 g
|
|
Lös upp och fyll på till 1 liter med destillerat vatten.
|
|
|
(c)
|
Magnesiumsulfatheptahydrat, MgSO4 · 7H2O
|
22,50 g
|
|
Lös upp och fyll på till 1 liter med destillerat vatten.
|
|
|
(d)
|
Järn(III)kloridhexahydrat, FeCl3 · 6H2O
|
0,25 g
|
|
Lös upp och fyll på till 1 liter med destillerat vatten.
|
|
Utfällning i lösning (d) kan förebyggas genom tillsats av en droppe koncentrerad HCl eller 0,4 g etylendiamintetraättiksyra (EDTA, dinatriumsalt) per liter. Om utfällning konstateras i en stamlösning ersätts den med nyberedd lösning.
|
Beredning av testmediet
|
14.
|
Tillsätt 1 ml av var och en av stamlösningarna ovan per liter förbehandlat havsvatten.
|
Inokulat
|
15.
|
Tillsätt inte särskilda inokulat utöver de mikroorganismer som redan finns i havsvattnet. Fastställ (eventuellt) antalet kolonibildande heterotrofer i havsvattentestmediet (och helst också i de ursprungliga havsvattenproverna), t.ex. genom platträkning med marin agar. Detta är särskilt lämpligt för prover från kustområden eller förorenade områden. Kontrollera den heterotrofa mikrobiella aktiviteten i havsvattnet genom att utföra ett test med ett referensämne.
|
Förberedelse av kolvar
|
16.
|
Se till att alla glaskärl är ytterst noggrant rengjorda men inte nödvändigtvis steriliserade (t.ex. med hjälp av alkoholisk saltsyra), sköljda och torkade före användning för att undvika kontaminering med rester från tidigare tester. Kolvarna ska också rengöras före första användningen.
|
|
17.
|
Utvärdera testämnet i två flaskor samtidigt, tillsammans med en enda kolv för referensämnet. Utför ett blankprov i två exemplar med varken test- eller referensämne för bestämning av analytiska blanklösningar. Lös upp testämnena i testmediet – de kan enkelt tillsättas via en koncentrerad stamlösning – så att man får de önskade startkoncentrationerna, som normalt är 5–40 mg DOC/l. Referensämnet testas normalt vid en startkoncentration motsvarande 20 mg DOC/l. Se till att salthalten i havsvattenmediet inte ändras avsevärt om stamlösningar av test- och/eller referensämnen används.
|
|
18.
|
Om toxiska effekter kan förväntas eller inte kan uteslutas kan det vara lämpligt att ett hämningsexperiment i två exemplar läggs till i testets utformning. Eftersom referensämnets koncentration normalt är densamma som i kontrolltestet (dvs. 20 mg DOC/l) tillsätts test- och referensämnen i samma kärl för att möjliggöra jämförelser.
|
|
19.
|
Fördela tillräckliga mängder testlösningar i erlenmeyerkolvarna (upp till omkring hälften av flaskvolymen är en lämplig mängd) och lägg därefter ett löst lock på varje kolv (t.ex. aluminiumfolie) som möjliggör gasutbyte mellan kolven och den omgivande luften. (Bomullspluggar är olämpliga om man använder en DOC-analys). Placera kärlen i skakapparaten och skaka dem kontinuerligt vid låg frekvens (t.ex. 100 rpm) under hela testet. Kontrollera temperaturen (15–20 °C med ± 2 °C noggrannhet), och skydda kärlen mot ljus i syfte att undvika tillväxt av alger. Se till att luften är fri från giftiga ämnen.
|
Fysikalisk-kemiskt kontrolltest (frivilligt)
|
20.
|
Om man misstänker att det förekommer abiotisk nedbrytning eller abiotiska förlustmekanismer, t.ex. hydrolys (ett problem endast i särskilda analyser), avdunstning eller adsorption, är det lämpligt att genomföra ett fysikalisk-kemiskt kontrollexperiment. Detta kan göras genom tillägg av kvicksilver(II)klorid (HgCl2) (32) (50–100 mg/l) i kärlen med testämne i syfte att hejda den mikrobiella aktiviteten. En betydande minskning av DOC eller av det särskilda ämnets koncentration i det fysikalisk-kemiska kontrolltestet tyder på abiotiska elimineringsmekanismer. (Om kvicksilverklorid används, bör man ägna särskild uppmärksamhet åt interferenser eller katalysatorförgiftning i DOC-analysen.)
|
Antal kolvar
|
21.
|
I en typisk testomgång används följande kolvar:
|
Kolv 1 & 2
|
–
|
innehåller testämne (testsuspension),
|
|
Kolv 3 & 4
|
–
|
innehåller endast havsvatten (blank),
|
|
Kolv 5
|
–
|
innehåller referensämne (förfarandekontroll),
|
|
Kolv 6
|
–
|
innehåller test- och referensämne (toxicitetskontroll) – frivilligt,
|
|
Kolv 7
|
–
|
innehåller testämne och steriliseringsämnet (abiotisk steril kontroll) – frivilligt.
|
|
Analys av löst organiskt kol (DOC)
|
22.
|
Under testets gång tas prover med lämpliga intervaller för analys av DOC (tillägg 1). Ta alltid prover vid testets början (dag 0) och på dag 60. Minst fem prover totalt krävs för att beskriva nedbrytningens tidsförlopp. Något bestämt tidsschema för provtagningen kan inte anges eftersom den biologiska nedbrytningshastigheten varierar. Bestäm DOC i två exemplar för varje prov.
|
Provtagning
|
23.
|
Den erforderliga provmängden beror på analysmetoden (särskild analys), på den använda kolanalysatorn, och på det valda förfarandet (membranfiltrering eller centrifugering) för behandlingen av proverna före kolbestämningen (punkterna 25 och 26). Se före provtagningen till att testmediet blandats väl och att allt material som sitter fast på kolvens väggar har lösts upp eller suspenderats.
|
|
24.
|
Membranfiltrera eller centrifugera omedelbart efter provtagningen. Förvara vid behov de filtrerade eller centrifugerade proverna vid 2–4 °C i upp till 48 timmar, eller under – 18 °C under längre perioder (om det är känt att ämnet kommer att förbli oförändrat ska det surgöras till pH 2 före lagring).
|
|
25.
|
Membranfilter (0,2–0,45 μm) är lämpliga om det kan garanteras att de varken frigör kol eller adsorberar ämnet i filtreringssteget, t.ex. membranfilter av polykarbonat. Vissa membranfilter är impregnerade med ytaktiva ämnen för hydrofilering, vilket kan leda till att de frigör betydande mängder upplöst kol. Bearbeta sådana filter genom kokning i avjonat vatten i tre på varandra följande perioder på en timme vardera. Efter kokning lagras filtren i avjonat vatten. Kassera de första 20 ml av filtratet.
|
|
26.
|
Centrifugering av proverna kan väljas som ett alternativ till membranfiltrering. Centrifugera vid 40 000 m.s– 2 (ca 4 000 g) i 15 minuter, helst i en kylcentrifug.
Anmärkning: Det tycks inte fungera att differentiera mellan totalhalten organiskt kol (TOC) och DOC (TOC/DOC) genom centrifugering vid mycket låga koncentrationer, eftersom antingen alla bakterier inte avlägsnas eller kolet som är en del av bakteriernas cytoplasma återupplöses. Vid högre testkoncentrationer (> 10 mg C per liter) tycks felen efter centrifugering vara jämförelsevis små.
|
Provtagningsfrekvens
|
27.
|
Om analyserna utförs omedelbart efter provtagningen bör man uppskatta nästa provtagningstid genom att beakta resultatet av den analytiska bestämningen.
|
|
28.
|
Om proverna bevaras (punkt 24) för analys vid en senare tidpunkt ska man ta fler prover än fem, som är det minsta tillåtna antalet. De sista proverna ska analyseras först, och genom ett stegvis urval ’bakåt’ av lämpliga prover för analys är det möjligt att erhålla en god beskrivning av den biologiska nedbrytningskurvan med ett relativt litet antal analytiska bestämningar. Om ingen nedbrytning har skett i slutet av testet behöver inga ytterligare prov analyseras, och i denna situation kan ’bakåt’-strategin innebära stora besparingar i analyskostnader.
|
|
29.
|
Om en platå på nedbrytningskurvan iakttas före dag 60 ska testet avslutas. Om det på dag 60 är tydligt att nedbrytningen har inletts men inte har nått en platå, ska försöket förlängas med ytterligare en tidsperiod.
|
DATA OCH RAPPORTERING
Behandling av resultaten
|
30.
|
Registrera analysresultaten på bifogade resultatformulär (tillägg 2) och beräkna bionedbrytningsvärdena både för test- och referensämnena med följande ekvation:

där
|
Dt
|
=
|
nedbrytning i procent DOC eller eliminering av ett särskilt ämne vid tidpunkten t,
|
|
Co
|
=
|
startkoncentration för DOC eller det särskilda ämnet i testmediet,
|
|
Ct
|
=
|
koncentration för DOC eller det särskilda ämnet i testmediet vid tidpunkten t,
|
|
Cbl(0)
|
=
|
startkoncentration för DOC eller det särskilda ämnet i blankprovet,
|
|
Cbl(t)
|
=
|
koncentration för DOC eller det särskilda ämnet i blankprovet vid tidpunkten t.
|
|
|
31.
|
Ange nedbrytningen som procentandelen DOC som har eliminerats (fullständig nedbrytning) eller av det särskilda ämne som har eliminerats (primär nedbrytning) vid tidpunkten t. Beräkna DOC-koncentrationerna till närmaste 0,1 mg per liter, och avrunda medelvärdena för Dt-värdena till närmaste hela procent.
|
|
32.
|
Illustrera nedbrytningens förlopp grafiskt i ett diagram på det sätt som visas i figuren i ’Resultatens giltighet och deras tolkning’. Om det finns tillräckliga data bör man utifrån nedbrytningskurvan beräkna lagfasen (tL) och den tid som krävs för att nå 50 procents eliminering från lagfasens slut (t50).
|
Testrapport
|
33.
|
Testrapporten måste innehålla följande information:
|
|
Testämne:
|
—
|
fysikalisk form och, när så är tillämpligt, fysikalisk-kemiska egenskaper,
|
|
—
|
identifikationsuppgifter.
|
|
|
|
Testbetingelser:
|
—
|
beskrivning av provtagningsstället och dess läge: förorenings- och näringsstatus (koloniräkning, nitrat, ammonium, fosfat i tillämpliga fall),
|
|
—
|
beskrivning av provet (datum för provtagning, djup, utseende, temperatur, salthalt, DOC (frivillig uppgift), tid mellan provtagning och användning i testet),
|
|
—
|
metod som används (i förekommande fall) för åldrande av havsvatten,
|
|
—
|
metod som används för förbehandling (filtrering/sedimentering) av havsvattnet,
|
|
—
|
metod som används för bestämning av DOC,
|
|
—
|
metod som används för särskild analys (frivillig uppgift),
|
|
—
|
metod som används för att fastställa antalet heterotrofer i havsvattnet (platträkning eller alternativt förfarande) (frivilligt),
|
|
—
|
andra metoder (frivillig uppgift) som används för att karakterisera havsvattnet (mätning av ATP-halten osv.).
|
|
|
|
Resultat:
|
—
|
analysdata rapporteras på ett resultatformulär (tillägg 2),
|
|
—
|
nedbrytningstestets förlopp illustreras grafiskt i ett diagram som visar lagfasen (tL), lutningen och den tid det tar (från lagfasens slut) för att nå 50 procents eliminering (t50). Lagfasen kan uppskattas grafiskt såsom visas i figuren i avsnittet ’Resultatens giltighet och deras tolkning’ eller kan lämpligen antas vara den tid som krävs för 10 procents nedbrytning,
|
|
—
|
den procentuella nedbrytningen mäts efter 60 dagar, eller vid testets avslutning.
|
|
|
|
Diskussion av resultaten.
|
|
Resultatens giltighet och deras tolkning
|
34.
|
De resultat som erhålls med referensämnen, t.ex. natriumbensoat, natriumacetat och anilin, bör vara jämförbara med resultaten i ringtestet (3) (se avsnittet om ’Referensämnen’, punkt 7). Om de resultat som erhållits med referensämnen är atypiska bör testet upprepas med ett annat havsvattenprov. Resultaten från hämningstester är inte alltid lätta att tolka på grund av att testämnet bidrar till DOC, men en betydande minskning av den totala graden av DOC-eliminering jämfört med kontrollen är ett positivt tecken på toxiska effekter.
|
|
35.
|
På grund av de relativt höga testkoncentrationer som används jämfört med de koncentrationer som förekommer i de flesta naturliga system (och följaktligen ett ogynnsamt förhållande mellan testämnens och andra kolkällors koncentrationer) bör metoden betraktas som ett preliminärt test som kan användas för att ge en antydan om huruvida ett ämne är lätt biologiskt nedbrytbart. Ett lågt resultat behöver därför inte nödvändigtvis betyda att testämnet inte är bionedbrytbart i marina miljöer, men visar att det krävs mer arbete för att detta förhållande ska kunna fastställas.
Ett exempel på ett teoretiskt nedbrytningsförsök som illustrerar ett möjligt sätt att beräkna värdena för tL (lagfasens längd) och t50 (den tid som behövs från lagfasens slut för att uppnå 50 procents eliminering) finns i figuren nedan.

|
CLOSED BOTTLE-METODEN
INLEDNING
|
1.
|
Denna metod är en havsvattenvariant av closed bottle-testet (5), och fick slutligt godkännande efter ett ringtest som organiserades för Europeiska kommissionen (EC) av det danska vattenkvalitetsinstitutet (3).
|
|
2.
|
I likhet med den åtföljande marina skakkolvmetoden ska resultaten från detta test inte uppfattas som indikationer på lätt bionedbrytbarhet, utan ska uttryckligen användas för att skaffa information om bionedbrytbarheten för ämnen i marina miljöer.
|
PRINCIP FÖR TESTMETODEN
|
3.
|
Ett förutbestämd mängd av testämnet upplöses i testmediet med en koncentration på vanligen 2–10 mg testämne per liter (en eller flera koncentrationer kan användas). Lösningen förvaras i en fylld försluten kolv i mörker i ett bad eller rum med konstant temperatur på 15–20 °C med en variation på högst ± 1 °C. Om syftet med undersökningen är att simulera situationer i miljön kan testerna utföras bortom detta normala temperaturintervall förutsatt att lämpliga justeringar görs för temperaturreglering. Nedbrytningen följs med hjälp av syreanalyser under en 28-dagarsperiod.
|
|
4.
|
Ringtestet visade att om testet förlängdes efter 28 dagar kunde i de flesta fall ingen användbar information inhämtas på grund av allvarliga störningar. Värdena för den biokemiska syreförbrukningen (BOD) i blankprovet var mycket höga, förmodligen på grund av algväxt på kärlets väggar som orsakades av brist på skakning, och på grund av nitrifikation. Den rekommenderade varaktigheten är därför 28 dagar, men om BOD-värdet i blankprovet håller sig inom 30-procentsgränsen (punkterna 15 och 40) kan testet förlängas.
|
INFORMATION OM TESTÄMNET
|
5.
|
För att veta om testet kan tillämpas på ett visst ämne måste vissa av dess egenskaper vara kända. Man måste ha den empiriska formeln så att den teoretiska syreförbrukningen (ThOD) kan beräknas (se tillägg 3). I annat fall måste ämnets kemiska syreförbrukning (COD) fastställas och tjäna som referensvärde. Användningen av COD är mindre tillfredsställande eftersom vissa ämnen inte oxideras helt i COD-testet.
|
|
6.
|
Ämnets löslighet bör vara minst 2 mg/l, men i princip kan mindre lösliga ämnen testas (t.ex. med hjälp av ultrasonikering), liksom flyktiga ämnen. Uppgifter om renheten eller de relativa proportionerna av testämnets huvudbeståndsdelar är nödvändiga för att de erhållna resultaten ska kunna tolkas, särskilt om resultatet ligger nära ’godkänd’ nivå.
|
|
7.
|
Information om testämnets toxicitet för bakterier, t.ex. uppmätt i kortvariga respirationstester (4), kan vara mycket användbar vid valet av lämpliga testkoncentrationer och kan vara väsentlig när det gäller den korrekta tolkningen av låga värden för biologisk nedbrytbarhet. Sådan information är dock inte alltid tillräcklig för tolkning av resultaten från testet av biologisk nedbrytbarhet, och det förfarande som beskrivs i punkt 27 är lämpligare.
|
REFERENSÄMNEN
|
8.
|
Lämpliga referensämnen måste användas för att kontrollera den mikrobiella aktiviteten i havsvattenproven. Anilin, natriumacetat eller natriumbensoat (exempelvis) kan användas för detta ändamål. En nedbrytning av dessa ämnen på minst 60 procent (av deras ThOD) måste äga rum inom en rimligt kort tidsperiod, annars rekommenderas att testet upprepas med ett annat havsvattenprov.
|
|
9.
|
I kommissionens ringtest, där havsvattenprover togs på olika platser och vid olika tider på året, var lagfasen (tL) och den tid som behövdes för att uppnå en 50-procentig nedbrytning (t50) exklusive lagfasen 0–2 dagar respektive 1–4 dagar för natriumbensoat. För anilin var tL och t50-värdena 0–7 respektive 2–12 dagar.
|
REPRODUCERBARHET
|
10.
|
Metodernas reproducerbarhet fastställdes i kommissionens ringtest (3).
|
BESKRIVNING AV TESTMETODEN
Utrustning
|
11.
|
Normal laboratorieutrustning och
|
(a)
|
250–300 ml BOD-kolvar med glaspropp eller smalhalsade 250 ml kolvar med glaspropp kan användas,
|
|
(b)
|
flera 2-, 3- och 4-liters kolvar med litergradering för förberedelse av försöket och för tappning av BOD-kolvarna,
|
|
(c)
|
vattenbad eller rum med konstant temperatur för att hålla kolvarna vid konstant temperatur (± 1 °C) i mörker,
|
|
(d)
|
utrustning för analys av löst syre,
|
|
(e)
|
membranfilter, 0,2–0,45 μm (frivilligt),
|
|
(f)
|
utrustning för särskild analys (frivilligt).
|
|
Havsvatten
|
12.
|
Samla in ett havsvattenprov i en väl rengjord behållare och transportera det till laboratoriet, helst inom en eller två dagar efter insamlingen. Provets temperatur under transporten får inte avsevärt överstiga den temperatur som råder vid testet.
|
|
13.
|
Ange insamlingsplatsen exakt och beskriv den i fråga om förorenings- och näringsstatus. Särskilt när det gäller kustvatten eller förorenade vatten bör det i denna beskrivning ingå en räkning av kolonier av heterotrofa mikroorganismer och en bestämning av koncentrationerna för löst nitrat, ammonium och fosfat.
|
|
14.
|
Ange följande uppgifter för havsvattenprovet i sig:
|
—
|
provets utseende – grumligt osv.,
|
|
—
|
temperatur vid provtagningstillfället,
|
|
—
|
löst organiskt kol (DOC),
|
|
—
|
tid mellan provtagningen och användningen i testet.
|
|
|
15.
|
Om DOC-halten i provet befinns vara hög eller om det kan antas att det blankprovets BOD efter 28 dagar kommer att mer än 30 procent högre än för referensämnena rekommenderas att havsvattnet får åldras i cirka en vecka före användning.
|
|
16.
|
Låt provet åldras genom lagring under aeroba förhållanden vid testtemperaturen och i mörker eller indirekt ljus. Bibehåll de aeroba förhållandena genom skonsam luftning vid behov. Under åldringsprocessen minskar innehållet av lätt nedbrytbara organiska material. I ringtestet (3) framkom det inga skillnader mellan nedbrytningspotentialen i åldrade och nyinsamlade havsvattenprov.
|
|
17.
|
Före användning ska havsvattnet förbehandlas för att avlägsna grova partiklar, exempelvis genom filtrering genom ett nylonfilter eller grovt pappersfilter (inte membran eller GF/C-filter), eller genom sedimentering och dekantering. Ange den metod som har använts. Om man låter vattnet åldras, görs förbehandlingen efter detta.
|
Stamlösningar för oorganiska näringsämnen
|
18.
|
Följande stamlösningar framställs av reagens av analyskvalitet:
|
(a)
|
Kaliumdivätefosfat, KH2PO4
|
8,50 g
|
|
Dikaliumväteortofosfat, K2HPO4
|
21,75 g
|
|
Dinatriumväteortofosfat dihydrat, Na2HPO4 · 2H2O
|
33,30 g
|
|
Ammoniumklorid, NH4Cl
|
0,50 g
|
|
Lös upp och fyll på till 1 liter med destillerat vatten.
|
|
|
(b)
|
Kalciumklorid, CaCl2
|
27,50 g
|
|
Lös upp och fyll på till 1 liter med destillerat vatten.
|
|
|
(c)
|
Magnesiumsulfatheptahydrat, MgSO4 · 7H2O
|
22,50 g
|
|
Lös upp och fyll på till 1 liter med destillerat vatten.
|
|
|
(d)
|
Järn(III)kloridhexahydrat, FeCl3 · 6H2O
|
0,25 g
|
|
Lös upp och fyll på till 1 liter med destillerat vatten.
|
|
Utfällning i lösning (d) kan förebyggas genom tillsats av en droppe koncentrerad HCl eller 0,4 g etylendiamintetraättiksyra (EDTA, dinatriumsalt) per liter. Om utfällning konstateras i en stamlösning ersätts den med nyberedd lösning.
|
Beredning av testmediet
|
19.
|
Tillsätt 1 ml av var och en av de ovannämnda stamlösningarna per liter förbehandlat havsvatten. Mätta testmediet med luft vid testtemperaturen genom luftning med ren tryckluft i ca 20 minuter. Bestäm halten löst syre för kontrolländamål. Mättnadskoncentrationen för löst syre som en funktion av salthalt och temperatur kan avläsas i det nomogram som bifogas denna testmetod (tillägg 4).
|
Inokulat
|
20.
|
Tillsätt inte särskilda inokulat utöver de mikroorganismer som redan finns i havsvattnet. Fastställ (eventuellt) antalet kolonibildande heterotrofer i havsvattentestmediet (och helst också i de ursprungliga havsvattenproverna), t.ex. genom platträkning med marin agar. Detta är särskilt lämpligt för prover från kustområden eller förorenade områden. Kontrollera den heterotrofa mikrobiella aktiviteten i havsvattnet genom att utföra ett test med ett referensämne.
|
Beredning av testkolvarna
|
21.
|
Utför alla nödvändiga modifieringar inbegripet åldrande och förbehandling av havsvattnet vid den valda testtemperaturen mellan 15–20 °C, och se till att alla glaskärl är rena men inte sterila.
|
|
22.
|
Förbered grupper av BOD-kolvar för bestämningen av BOD för test- och referensämnena i samtidiga försöksserier. Utför alla analyser på två kolvar (blankprov, referens- och testämnen), dvs. bered två kolvar för varje bestämning. Utför analyser åtminstone på dag 0, 5, 15 och 28 (fyra bestämningar). För syreanalyser måste man för fyra bestämningar ha sammanlagt 3 × 2 × 4 = 24 kolvar (blankprov, referens- och testämne), och därmed ca 8 liter testmedium (för en testämneskoncentration).
|
|
23.
|
Bered separata lösningar av test- och referensämnen i stora kolvar med tillräckligt stor volym (punkt 11) genom att först tillsätta test- och referensämnena, antingen direkt eller via en koncentrerad stamlösning, till de delvis fyllda stora kolvarna. Tillsätt ytterligare testmedium till dess att de önskade slutliga koncentrationerna erhålls. Se till att salthalten i havsvattenmediet inte ändras avsevärt om stamlösningar av test- och/eller referensämnen används.
|
|
24.
|
Välj koncentrationer för test- och referensämnen genom att beakta
|
(a)
|
lösligheten för syre i havsvatten vid den rådande testtemperaturen och salthalten (se bifogat nomogram – tillägg 4),
|
|
(b)
|
blankprovets BOD i havsvatten, och
|
|
(c)
|
testämnets förväntade biologiska nedbrytbarhet.
|
|
|
25.
|
Vid 15 °C och 20 °C och en salthalt på 32 promille (vatten från öppet hav) är lösligheten för syre ca 8,1 respektive 7,4 mg/l. Syreförbrukningen i havsvattnet i sig (respirationen i blankprovet) kan vara 2 mg O2/l eller mer om havsvattnet inte har fått åldras. För att garantera att en betydande koncentration av syre återstår efter oxidering av testämnet använder man en startkoncentration för testämnet på ca 2–3 mg/l (beroende på ThOD) för de ämnen som förväntas brytas ned helt under testbetingelserna (t.ex. referensämnen). Testa mindre nedbrytbara ämnen vid högre koncentrationer, upp till ca 10 mg/l, under förutsättning att det inte förekommer några toxiska verkningar. Det kan vara fördelaktigt att köra parallella test med en låg (cirka 2 mg/l) och en hög (cirka 10 mg/l) koncentration av testämnet.
|
|
26.
|
Ett blankvärde för syre ska bestämmas parallellt i kolvar som innehåller varken test- och referensämne.
|
|
27.
|
Om hämmande effekter ska fastställas bereds följande rad lösningar i separata stora kolvar (punkt 13):
|
(a)
|
2 mg per liter lätt nedbrytbart ämne, t.ex. någon av de referensämnen som anges,
|
|
(b)
|
x mg per liter testämne (x är vanligtvis 2),
|
|
(c)
|
2 mg per liter lätt nedbrytbart ämne plus x mg per liter testämne.
|
|
Fysikalisk-kemiskt kontrolltest (frivilligt)
|
28.
|
Om man använder sig av möjligheten att använda särskilda analyser ska ett fysikalisk-kemiskt experiment utföras för att kontrollera huruvida testämnet elimineras genom abiotiska mekanismer, t.ex. hydrolys eller adsorption. Ett fysikalisk-kemiskt kontrolltest kan utföras genom tillsats av kvicksilver(II)klorid (HgCl2) (33) (50–100 mg/l) i två kolvar med testämne i syfte att hejda den mikrobiella aktiviteten. En betydande minskning av det särskilda ämnets koncentration under testets gång visar på abiotiska elimineringsmekanismer.
|
Antal BOD-kolvar i en typisk testomgång
|
29.
|
I en typisk testomgång används följande antal kolvar:
|
—
|
minst 8 som innehåller testämne,
|
|
—
|
minst 8 som endast innehåller näringsmättat havsvatten,
|
|
—
|
minst 8 som innehåller referensämne, och, vid behov,
|
|
—
|
6 kolvar som innehåller test- och referensämnen (toxicitetskontroll).
|
|
FÖRFARANDE
|
30.
|
Tappa efter beredningen omedelbart upp varje lösning med en hävert från den nedersta fjärdedelen (inte från botten) av de stora kolvarna för att fylla respektive grupp med BOD-kolvar. Analysera omedelbart nollkontrollerna (tid: noll) med avseende på löst syre (punkt 33) eller bevara dem för senare kemisk analys genom utfällning med MnCl2 (mangan(II)klorid) och NaOH (natriumhydroxid).
|
|
31.
|
Inkubera återstående parallella BOD-kolvar vid testtemperaturen (15–20 °C), förvara dem mörkt och avlägsna dem från inkubationsområdet vid lämpliga tidsintervall (t.ex. efter 5, 15 och 28 dagar som ett minimum) och analysera dem med avseende på löst syre (punkt 33).
|
|
32.
|
Membranfiltrera (0,2–0,45 μm) eller centrifugera i 15 minuter proven för särskilda analyser (frivilligt). Lagra i upp till 48 timmar vid 2–4 °C eller under längre tid vid -18 °C om de inte analyseras omedelbart (om det är känt att testämnet förblir oförändrat, surgör innehållet till pH 2 före lagring).
|
Bestämning av löst syre
|
33.
|
Bestäm koncentrationen av det upplösta syret med hjälp av kemiska eller elektrokemiska metoder som erkänts på nationell eller internationell nivå.
|
DATA OCH RAPPORTERING
Behandling av resultaten
|
34.
|
Registrera analysresultaten på de bifogade resultatformulären (tillägg 5).
|
|
35.
|
Beräkna BOD som skillnaden mellan syreförlusten i ett blankprov och en testämneslösning under testbetingelserna. Dividera nettosyreförlusten med ämnets koncentration (w/v) för att uttrycka BOD som mg BOD/mg testämne. Nedbrytningen definieras som förhållandet mellan den biokemiska syreförbrukningen och antingen, företrädesvis, den teoretiska syreförbrukningen (ThOD) eller den kemiska syreförbrukningen (COD) uttryckt i procent (se punkt 36).
|
|
36.
|
Beräkna bionedbrytningsvärden för varje provtagningstillfälle för både test- och referensämnen med någon av följande ekvationer:


där
|
ThOD
|
=
|
teoretisk syreförbrukning (beräkning, tillägg 3)
|
|
COD
|
=
|
kemisk syreförbrukning, bestäms på experimentell väg.
|
Anmärkning: Ibland får man olika resultat med de två beräkningsmetoderna (procent av ThOD eller procent av COD). Det bästa är att använda ThOD, eftersom en del ämnen inte oxideras helt i COD-testet.
|
|
37.
|
Illustrera nedbrytningstestets förlopp grafiskt i ett diagram (se exempel i avsnittet ’Resultatens giltighet och deras tolkning’. Om det finns tillräckliga data bör man utifrån bionedbrytningskurvan beräkna lagfasen (tL) och den tid som krävs för att nå 50 procents eliminering från lagfasens slut (t50).
|
|
38.
|
Om en särskild analys har utförts (valfritt) ska procentandelen primär nedbrytning anges som procentandelen av det särskilda ämne som har eliminerats inom testperioden (korrigerat för analytiska blankprov).
|
Testrapport
|
39.
|
Testrapporten måste innehålla följande information:
|
|
Testämne:
|
—
|
fysikalisk form och, när så är tillämpligt, fysikalisk-kemiska egenskaper,
|
|
—
|
identifikationsuppgifter.
|
|
|
|
Testbetingelser:
|
—
|
beskrivning av provtagningsstället och dess läge: förorenings- och näringsstatus (koloniräkning, nitrat, ammonium, fosfat i tillämpliga fall),
|
|
—
|
beskrivning av provet (datum för provtagning, djup, utseende, temperatur, salthalt, DOC (frivillig uppgift), tid mellan provtagningen och användning i testet),
|
|
—
|
metod som används (i förekommande fall) för åldrande av havsvatten,
|
|
—
|
metod som används för förbehandling (filtrering/sedimentering) av havsvattnet,
|
|
—
|
metod som används för bestämning av COD (om detta utförts),
|
|
—
|
metod som används för syremätningar,
|
|
—
|
dispergeringsförfarande för ämnen som är svårlösliga under försöksbetingelserna,
|
|
—
|
metod som används för att fastställa antalet heterotrofer i havsvattnet (platträkning eller alternativt förfarande),
|
|
—
|
metod för bestämning av DOC i havsvatten (frivillig uppgift),
|
|
—
|
metod som används för särskild analys (frivillig uppgift),
|
|
—
|
andra metoder som används för att karakterisera havsvattnet (mätning av ATP-halten osv.).
|
|
|
|
Resultat:
|
—
|
analysdata som rapporteras på ett resultatformulär (se bifogat exempel, tillägg 5),
|
|
—
|
nedbrytningstestets förlopp representerat grafiskt i ett diagram som visar lagfasen (tL), lutningen och den tid det tar (från lagfasens slut) för att nå 50 procent av den slutliga syreupptagningen som orsakas av oxidering av testämnet (t50). Lagfasen kan uppskattas grafiskt såsom visas i den bifogade figuren, eller kan lämpligen antas vara den tid som krävs för 10 procents nedbrytning,
|
|
—
|
procent nedbrytning mätt efter 28 dagar.
|
|
|
|
Diskussion av resultaten.
|
|
Resultatens giltighet och deras tolkning
|
40.
|
Respirationen i blankprovet bör inte överstiga 30 procent av syrehalten i testkolven. Om det inte är möjligt att uppfylla detta kriterium med nyligen insamlat havsvatten måste havsvattnet åldras (stabiliseras) före användning.
|
|
41.
|
Man bör beakta möjligheten att ämnen som innehåller kväve kan påverka resultaten.
|
|
42.
|
Resultat som erhållits med referensämnena natriumbensoat och anilin bör vara jämförbara med de resultat som uppnåddes i ringtestet (3) (punkt 9). Om de resultat som erhållits med referensämnen är atypiska bör testet upprepas med ett annat havsvattenprov.
|
|
43.
|
Testämnet kan anses vara bakteriehämmande (vid den koncentration som används) om BOD för blandningen av referens- och testämnen är mindre än summan av BOD för de separata lösningarna av dessa två ämnen.
|
|
44.
|
På grund av de relativt höga testkoncentrationer som används jämfört med de koncentrationer som förekommer i de flesta naturliga system (och följaktligen ett ogynnsamt förhållande mellan testämnets och andra kolkällors koncentrationer) bör metoden betraktas som ett preliminärt test som kan användas för att ge en antydan om huruvida ett ämne är lätt biologiskt nedbrytbart. Ett lågt resultat behöver därför inte nödvändigtvis betyda att testämnet inte är bionedbrytbart i marina miljöer, men visar att det krävs mer arbete för att detta förhållande ska kunna fastställas.
Ett exempel på ett teoretiskt nedbrytningsförsök som illustrerar ett möjligt sätt att uppskatta värdena för tL (lagfasens längd) och t50, det tidsintervall (med början vid tL) som krävs för att uppnå 50 % av den slutliga syreupptagningen orsakad av oxidering av testämnet, återges nedan:

|
LITTERATUR
|
(1)
|
de Kreuk J. F. och Hanstveit A. O. (1981). Determination of the biodegradability of the organic fraction of chemical wastes. Chemosphere, 10 (6); 561–573.
|
|
(2)
|
Kapitel C.4-B i denna bilaga: Bestämning av ’lätt’ bionedbrytbarhet, del III: modifierat OECD-screeningtest
|
|
(3)
|
Nyholm N. och Kristensen P. (1987). Screening Test Methods for Assessment of Biodegradability of Chemical Substances in Seawater. Slutrapport från ringtestprogrammet 1984–1985, mars 1987, Europeiska kommissionen.
|
|
(4)
|
Kapitel C.11 i denna bilaga: Biologisk nedbrytbarhet – Aktiverat slam – respirationshämningstest.
|
|
(5)
|
Kapitel C.4-E i denna bilaga: Bestämning av ’lätt’ bionedbrytbarhet, del VI. Closed bottle-test.
|
Tillägg 1
Bestämning av organiskt kol i havsvatten
SKAKKOLVMETODEN
För bestämning av det organiska kolet i ett vattenprov oxideras de organiska föreningarna i provet till koldioxid, i allmänhet med hjälp av en av följande tre tekniker:
|
—
|
våtoxidation av persulfat/UV-strålning,
|
|
—
|
våtoxidation av persulfat/förhöjd temperatur (116–130 °C),
|
Utvecklad CO2 kvantifieras med hjälp av infraröd spektrometri eller titrering. Alternativt kan CO2 reduceras till metan, som kvantifieras med en flamjoniseringsdetektor (FID).
Persulfat/UV-metoden används vanligen för analys av ’rent’ vatten med låg halt av partiklar. De senare två metoderna kan användas för de flesta typer av vattenprover. Persulfat/förhöjd temperatur-oxidation är den mest lämpliga metoden för prov med låga nivåer och förbränningstekniken kan tillämpas på prov som har en halt av icke-flyktigt organiskt kol (NVOC) som ligger långt över 1 mg C/l.
Störningar
Alla tre metoderna är beroende av att man eliminerar eller kompenserar för oorganiskt kol (IC) som finns i provet. Avgasning av koldioxid från det surgjorda provet är den vanligaste metoden för att eliminera det oorganiska kolet, även om detta också leder till en förlust av flyktiga organiska föreningar (1). En fullständig eliminering eller kompensation för oorganiskt kol måste garanteras för varje provmatris, och det flyktiga organiska kolet (VOC) måste bestämmas utöver NVOC beroende på provtypen.
Höga koncentrationer av klorid leder till minskad oxidationseffektivitet när man använder persulfat/UV-metoden (2). Genom användning av ett oxidationsreagens som modifierats genom tillsats av kvicksilver(II)nitrat kan man dock avlägsna denna störning. Det rekommenderas att den högsta tillåtliga provvolymen används för att utvärdera varje typ av kloridhaltigt prov. Höga saltkoncentrationer i prov som analyserats med förbränningsmetoden kan orsaka saltbeläggning på katalysatorn och kraftig korrosion av förbränningsröret. Åtgärder bör vidtas enligt tillverkarens anvisningar.
Mycket grumliga prover och prover som innehåller partiklar kan oxideras ofullständigt när man använder persulfat/UV-metoden.
Exempel på en lämplig metod
Icke-flyktigt organiskt kol bestäms genom oxidation med persulfat/UV-strålning och därpå följande kvantifiering av utvecklad CO2 med hjälp av icke-dispersiv infraröd spektroskopi.
Oxidationsreagenset modifieras i enlighet med de förslag som anges i (2) på de sätt som beskrivs i tillverkarens manual:
|
a)
|
8,2 g HgCl2 och 9,6 g Hg(NO3)2 · H2O löses upp i flera hundra milliliter reagensvatten med låg kolhalt.
|
|
b)
|
20 g K2S2O8 löses upp i den kvicksilverhaltiga saltlösningen.
|
|
c)
|
5 ml HNO3 (konc.) tillsätts till blandningen.
|
|
d)
|
reagenset späds ut till 1 000 ml.
|
Störningen från klorid avlägsnas om man använder 40 μl provvolym för 10 procent klorid och 200 μl provvolym för 1,9 procent klorid. Prover med höga kloridkoncentrationer och/eller större provvolymer kan analyseras enligt denna metod förutsatt att man förhindrar att klorid ackumuleras i oxidationskärlet. Bestämningen av flyktigt organiskt kol kan därefter utföras, om det är relevant för provtypen i fråga.
LITTERATUR
|
(1)
|
ISO, Water quality – determination of total organic carbon. Draft International Standard ISO/DIS 8245, 16 januari 1986.
|
|
(2)
|
American Public Health Association, Standard Methods for the Estimation of Water and Wastewater. American Water Works Association & Water Pollution Control Federation, 16:e upplagan, 1985.
Också av intresse (ger en beskrivning av ett autoanalyssystem):
|
|
(3)
|
Schreurs W. (1978). An automated colorimetric method for the determination of dissolved organic carbon in seawater by UV destruction. Hydrobiological Bulletin 12, 137–142.
|
Tillägg 2
Biologisk nedbrytning i havsvatten
SKAKKOLVMETODEN
RESULTATFORMULÄR
|
2.
|
DATUM FÖR INLEDNING AV TESTET:
|
|
3.
|
TESTÄMNE:
Namn:
|
Stamlösningens koncentration:
|
mg/l som ämne
|
|
Startkoncentration i mediet, t0:
|
mg/l som ämne
|
|
:
|
mg DOC/l
|
|
|
4.
|
HAVSVATTEN:
Källa:
Insamlingsdatum:
Provtagningsdjup:
Utseende vid insamlingstillfället (t.ex. grumligt, etc.):
|
Salthalt vid insamlingen:
|
‰
|
|
Temperatur vid insamlingen:
|
°C
|
|
DOC ’x’ timmar efter insamlingen:
|
mg/l
|
Förbehandling före testning (t.ex. filtrering, sedimentering, åldrande, etc.):
|
Räkning av kolonier av mikroorganismer
|
|
kolonier/ml
|
|
|
|
kolonier/ml
|
|
Andra egenskaper:
|
|
|
|
|
5.
|
KOLBESTÄMNINGAR:
Kolanalysator:
|
|
Kolv nr
|
|
DOC efter n dagar (mg/l)
|
|
0
|
n1
|
n2
|
n3
|
nx
|
|
Test: näringsmättat havsvatten med testämne
|
1
|
a1
|
|
|
|
|
|
|
a2
|
|
|
|
|
|
|
medelvärdet, Ca(t)
|
|
|
|
|
|
|
2
|
b1
|
|
|
|
|
|
|
b2
|
|
|
|
|
|
|
medelvärdet, Cb(t)
|
|
|
|
|
|
|
Blankprov: näringsmättat havsvatten utan testämne
|
1
|
c1
|
|
|
|
|
|
|
c2
|
|
|
|
|
|
|
medelvärdet, Cc(t)
|
|
|
|
|
|
|
2
|
d1
|
|
|
|
|
|
|
d2
|
|
|
|
|
|
|
medelvärdet, Cd(t)
|
|
|
|
|
|
| medelvärdet,

|
|
|
|
|
|
|
|
|
|
|
|
|
|
6.
|
UTVÄRDERING AV RÅDATA:
|
Kolv nr
|
Beräkning av resultaten
|
% nedbrytning efter n dagar
|
|
0
|
n1
|
n2
|
n3
|
nx
|
|
1
|

|
0
|
|
|
|
|
|
2
|

|
0
|
|
|
|
|
|
Medelvärde (34)
|

|
0
|
|
|
|
|
|
Anmärkning:
|
Liknande format kan användas när nedbrytningen följs av särskild analys, och för referensämnet och toxicitetskontrollproverna.
|
|
|
7.
|
ABIOTISK NEDBRYTNING (valfritt)
|
|
Tid (dagar)
|
|
0
|
t
|
|
DOC-koncentration (mg/l) i steril kontroll
|
Cs(o)
|
Cs(t)
|
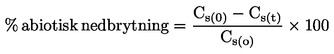
|
Tillägg 3
Beräkning av den teoretiska biokemiska syreförbrukningen
CLOSED BOTTLE-METODEN
ThOD för ämnet CcHhClclNnNanaOoPpSs med molekylvikten MW beräknas enligt följande:
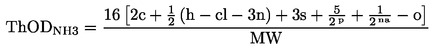
Denna beräkning tyder på att C mineraliseras till CO2, H till H2O, P till P2O5 och Na till Na2O. Halogen elimineras som vätehalid och kväve som ammoniak.
Exempel:
Glukos C6H12O6, MW = 180

Molekylvikten av salter annat än alkalimetaller beräknas med antagandet att salterna har hydrolyserats.
Svavel antas oxideras till oxidationstillståndet +6.
Exempel:
Natrium n-dodekylbensensulfonat C18H29SO3Na, MW = 348
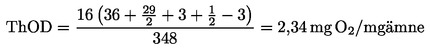
När det gäller kvävehaltiga ämnen kan kvävet elimineras som ammoniak, nitrit eller nitrat, motsvarande olika teoretiska biokemiska syreförbrukningar.


Anta när det gäller en sekundär amin att fullständig nitratbildning har iakttagits genom analys:
(C12H25)2 NH, MW = 353

Tillägg 4

Tillägg 5
Biologisk nedbrytning i havsvatten
CLOSED BOTTLE-METODEN
RESULTATFORMULÄR
|
2.
|
DATUM FÖR INLEDNING AV TESTET:
|
|
3.
|
TESTÄMNE:
Namn:
|
Stamlösningens koncentration:
|
mg/l
|
|
Startkoncentration i havsvattenmediet:
|
mg/l
|
|
ThOD eller COD:
|
mg O2/mg testämne
|
|
|
4.
|
HAVSVATTEN:
Källa:
Insamlingsdatum:
Provtagningsdjup:
Utseende vid insamlingstillfället (t.ex. grumligt, etc.):
|
Salthalt vid insamlingen:
|
‰
|
|
Temperatur vid insamlingen:
|
°C
|
|
DOC ’x’ timmar efter insamlingen:
|
mg/l
|
Förbehandling före testning (t.ex. filtrering, sedimentering, åldrande osv.):
|
Räkning av kolonier av mikroorganismer
|
|
kolonier/ml
|
|
|
|
kolonier/ml
|
|
Andra egenskaper:
|
|
|
|
|
5.
|
TESTMEDIUM:
|
Temperatur efter luftningen:
|
°C
|
|
O2-koncentration efter luftningen och vilan före testets inledning:
|
mg O2/l
|
|
|
6.
|
BESTÄMNING AV LÖST SYRE:
Metod: Winkler/elektrod
|
|
Kolv nr
|
|
mg O2/l efter n dagar
|
|
0
|
5
|
15
|
28
|
|
Test: näringsmättat havsvatten med testämne
|
1
|
a1
|
|
|
|
|
|
2
|
a2
|
|
|
|
|
|
Medelvärde för testämnesprovet
|

|
|
|
|
|
|
Blankprov: näringsmättat havsvatten utan testämne
|
1
|
c1
|
|
|
|
|
|
2
|
c2
|
|
|
|
|
|
Medelvärde för blankprovet
|

|
|
|
|
|
Anmärkning: en motsvarande uppställning kan användas för referensämnes- och toxicitetskontrollproverna.
|
|
7.
|
FÖRLUST AV LÖST SYRE: % NEDBRYTNING ( %D):
|
|
Förlust av löst syre efter n dagar
|
|
5
|
15
|
28
|
|
(mb
– mt
) (35)
|
|
|
|
|

|
|
|
|
|
C.43. ANAEROB BIOLOGISK NEDBRYTBARHET AV ORGANISKA ÄMNEN I RÖTSLAM: GENOM MÄTNING AV GASPRODUKTIONEN
INLEDNING
|
1.
|
Denna testmetod motsvarar OECD:s testriktlinje (TG) 311 (2006). Det finns ett antal screeningtester för bedömning av aerob bionedbrytbarhet av organiska ämnen (testmetoderna C.4, C.9, C.10 och C.11 (1) och OECD TG 302C (2)), och resultaten från tillämpningen av dessa har framgångsrikt använts för att förutsäga omvandlingen, spridningen och nedbrytningen av ämnen i den aeroba miljön, särskilt i de aeroba stadierna av reningen av avloppsvatten. Olika delar av icke vattenlösliga ämnen, såväl som ämnen som adsorberas på fasta ämnen i avloppsvatten, behandlas också aerobt eftersom de ingår i sedimenterat spillvatten. De större delarna av dessa ämnen är dock bundna till det primära sedimenterade slammet, som separeras från orenat avloppsvatten i sedimenteringsbassänger innan det sedimenterade avloppsvattnet, eller supernatanten, behandlas aerobt. Slammet, som innehåller vissa av de lösliga ämnena i den interstitiella vätskan, överförs därefter till uppvärmda rötkammare för anaerob behandling. Ännu finns det inga tester i denna serie för bedömning av anaerob bionedbrytbarhet i anaeroba rötkammare och detta test är avsett att fylla denna lucka. Det är inte nödvändigtvis tillämpbart på andra anoxa miljökammare.
|
|
2.
|
Respirometriska metoder för att mäta de mängder gas som bildas, huvudsakligen metan (CH4) och koldioxid (CO2), under anaeroba förhållanden har med framgång använts för att bedöma den anaeroba nedbrytbarheten. Birch m.fl. (3) granskade dessa förfaranden och konstaterade att Shelton och Tiedjes artikel (4), som bygger på tidigare undersökningar (5) (6) (7), var den mest omfattande. Metoden (4), som vidareutvecklades av andra (8) och har blivit den amerikanska normen (9) (10), löste inte problemen rörande de olika lösligheterna för CO2 och CH4 i testmediet och beräkningen av testämnets teoretiska gasproduktion. I ECETOC:s rapport (3) rekommenderades ytterligare mätning av halten löst oorganiskt kol i supernatanten, vilket gjorde tekniken mer allmänt tillämpbar. ECETOC-metoden genomgick ett internationellt kalibreringstest (eller ringtest) och blev ISO-standarden ISO 11734 (11).
|
|
3.
|
Denna testmetod, som bygger på ISO 11734 (11), beskriver en screeningmetod för utvärdering av den potentiella anaeroba bionedbrytbarheten för organiska ämnen under särskilda förhållanden (dvs. i en anaerob rötkammare vid en viss tidpunkt och med ett visst koncentrationsintervall med mikroorganismer). Eftersom man använder utspätt slam med relativt hög koncentration av testämnet och testtiden normalt är längre än retentionstiden i anaeroba rötkammare, motsvarar testförhållandena inte nödvändigtvis förhållandena i anaeroba rötkammare, och inte heller kan testet användas för bedömning av anaerob bionedbrytbarhet för organiska ämnen under olika miljöförhållanden. Slam exponeras för testämnet i upp till 60 dagar, vilket är längre än den normala retentionstiden (25–30 dagar) i anaeroba rötkammare, men när det gäller industriavloppsvatten kan retentionstiderna vara mycket längre. Prognoser utifrån resultaten av detta test kan inte göras på ett lika övertygande sätt som när det gäller aerob bionedbrytbarhet. Det har framkommit tillräckliga bevis på hur testämnen reagerar i ’lätta’ aeroba tester och i simuleringstester i aerob miljö för att man ska kunna vara säker på att det finns en förbindelse, men det finns endast ett fåtal liknande bevis för den anaeroba miljön. Fullständig biologisk nedbrytbarhet i anaerob miljö kan antas förekomma om 75–80 % av den teoretiska gasproduktionen uppnås. De höga proportionerna för ämnet jämfört med den biomassa som används i dessa tester innebär att ett ämne som klarar testet är mer benäget att brytas ned i en anaerob rötkammare. Det är inte nödvändigtvis så att ämnen som inte omvandlas till gas i testet består vid mer miljömässigt realistiska förhållanden mellan ämne och biomassa. Även andra anaeroba reaktioner förkommer som åtminstone delvis bryter ner ämnen, t.ex. avklorering, men i detta test påvisas inga sådana reaktioner. Genom tillämpning av särskilda analysmetoder för bestämning av testämnet kan dess eliminering dock kartläggas (se punkterna 6, 30, 44 och 53).
|
PRINCIP FÖR TESTMETODEN
|
4.
|
Tvättat rötslam (36) som innehåller låga (< 10 mg/l) koncentrationer av oorganiskt kol (IC), späds cirka tio gånger till en koncentration av fasta ämnen på 1 g/l till 3 g/l totalt och inkuberas vid 35 ± 2 °C i slutna kärl med 20–100 mg C/l av testämnet i upp till 60 dagar. Man bör räkna med att mäta aktiviteten i slammet genom att köra parallella blankkontrollprov med slam som inokulat i mediet men utan testämne.
|
|
5.
|
Ökningen av trycket i gasutrymmet i kärlen på grund av produktionen av koldioxid och metan mäts. Mycket av den CO2 som bildas kommer att upplösas i vätskefasen eller omvandlas till karbonat eller vätekarbonat under testförhållandena. Detta oorganiska kol mäts i slutet av testet.
|
|
6.
|
Mängden kol (oorganiskt kol plus metan) som uppkommer till följd av biologisk nedbrytning av testämnet beräknas utifrån nettogasproduktionen och nettobildningen av oorganiskt kol i vätskefasen utöver värdena från blankprovet. Den biologiska nedbrytningens omfattning beräknas utifrån den totala mängden oorganiskt kol och metan-C som bildas som en procentandel av den uppmätta eller beräknade mängden kol som tillsatts som testämne. Den biologiska nedbrytningens förlopp kan följas genom att man tar mellanliggande mätningar endast av gasproduktionen. Dessutom kan den primära biologiska nedbrytningen fastställas genom särskilda analyser i början och i slutet av testet.
|
INFORMATION OM TESTÄMNET
|
7.
|
Testkemikaliens renhet, vattenlöslighet, flyktighet och adsorption ska vara kända för att möjliggöra en korrekt tolkning av resultaten. Halten av organiskt kol (% w/w) i testämnet måste vara känd, antingen från den kemiska strukturen eller genom mätning. För flyktiga testämnen kan en uppmätt eller beräknad Henrys lags konstant användas för att avgöra huruvida testet är tillämpligt. Information om testämnets toxicitet för anaeroba bakterier är till hjälp vid valet av en lämplig testkoncentration och för tolkning av de resultat som påvisar dålig nedbrytbarhet. Det rekommenderas att man inkluderar hämningskontrollen såvida det inte är känt att testämnet inte hämmar den anaeroba mikrobiella aktiviteten (se punkt 21 och ISO 13641-1 (12)).
|
TESTMETODENS TILLÄMPBARHET
|
8.
|
Testmetoden kan tillämpas på vattenlösliga ämnen, och även på dåligt lösliga och olösliga ämnen förutsatt att en exakt doseringsmetod används (t.ex. ISO 10634) (13). I allmänhet behöver ett beslut fattas från fall till fall för flyktiga ämnen. Särskilda åtgärder kan behöva vidtas, t.ex. att inte släppa ut gas under testets gång.
|
REFERENSÄMNEN
|
9.
|
För att kontrollera förfarandet testas ett referensämne genom att man inrättar lämpliga kärl i två exemplar som en del av de normala provomgångarna. Fenol, natriumbensoat och polyetylenglykol 400 är exempel på referensämnen som kan förväntas brytas ner med mer än 60 % av den teoretiska gasproduktionen (dvs. metan och oorganiskt kol) inom 60 dagar (3) (14).
|
TESTRESULTATENS REPRODUCERBARHET
|
10.
|
I ett internationellt ringtest (14) befanns det vara god reproducerbarhet i mätningarna av gastrycket mellan tredubbla kärl. Den relativa standardavvikelsen (variationskoefficienten, COV) var i regel under 20 %, även om detta värde ofta ökade till > 20 % vid förekomsten av toxiska ämnen eller mot slutet av inkubationstiden på 60 dagar. Högre avvikelser konstaterades även i kärl med en volym på < 150 ml. De slutliga pH-värdena i testmediet låg i intervallet 6,5–7,0.
|
|
11.
|
Följande resultat erhölls i ringtestet.
|
Testämne
|
Totala data
n1
|
Medelvärde för nedbryt-ningen
(av totala data)
(%)
|
Relativ standard-avvikelse
(av totala data)
(%)
|
Giltiga data
n2
|
Medelvärde för nedbryt-ningen
(av giltiga data)
(%)
|
Relativ standard-avvikelse
(av giltiga data)
(%)
|
Data > 60 % nedbryt-ning i giltiga prov
n3
|
|
Palmitinsyra
|
36
|
68,7 ± 30,7
|
45
|
27
|
72,2 ± 18,8
|
26
|
19 = 70 % (37)
|
|
Polyetylen-glykol 400
|
38
|
79,8 ± 28,0
|
35
|
29
|
77,7 ± 17,8
|
23
|
24 = 83 % (37)
|
|
|
12.
|
Variationskoefficienterna för medelvärdet för alla värden som erhölls med palmitinsyra och polyetylenglykol 400 var så höga som 45 % (n = 36) respektive 35 % (n = 38). När värden < 40 % och > 100 % utelämnades (de förstnämnda antogs bero på suboptimala betingelser, de senare på okända skäl), minskade variationskoefficienterna till 26 % respektive 23 %. Andelen giltiga värden som uppnådde minst 60 % nedbrytning var 70 % för palmitinsyra och 83 % för polyetylenglykol 400. Andelen av den procentuella bionedbrytningen som härrörde från mätningar av löst oorganiskt kol var relativt låg men varierande. För palmitinsyra var intervallet 0–35 % och medelvärdet 12 % med en variationskoefficient på 92 %, och för polyetylenglykol 400 var intervallet 0–40 % och medelvärdet 24 %, med en variationskoefficient på 54 %.
|
BESKRIVNING AV TESTMETODEN
Utrustning
|
13.
|
Vanlig laboratorieutrustning samt följande krävs:
|
a.
|
Inkubator – gnistsäker och inställd på 35 ± 2 °C.
|
|
b.
|
Trycksäkra testkärl av glas av lämplig nominell storlek (38), som vart och ett är försett med ett gastätt septum som tål cirka 2 bar. Gasutrymmet bör vara ungefär 10 % till 30 % av den totala volymen. Om biogas släpps ut regelbundet är det lämpligt med ca 10 % gasutrymmesvolym, men om gasen endast släpps ut vid slutet av testet är det lämpligt med 30 %. Injektionsflaskor av glas med en nominell volym på 125 ml och en faktisk volym på cirka 160 ml, förseglade med ampullpackningar (39) och aluminiumringar, rekommenderas när trycket släpps ut vid varje provtagningstidpunkt.
|
|
c.
|
Tryckmätningsanordning (40) anpassad för att möjliggöra mätning och avluftning av den gas som bildas, till exempel en handhållen precisionstryckmätare ansluten till en lämplig kanyl. En gastät trevägsventil underlättar utsläpp av övertryck (tillägg 1). Den inre volymen hos tryckomvandlarens slang och ventil måste vara så låg som möjligt så att de fel som uppkommer när man underlåter att beakta utrustningens volym är obetydliga.
Obs! Tryckavläsningarna används direkt för att beräkna den mängd koldioxid som bildas i gasutrymmet (punkterna 42–44). Alternativt kan tryckavläsningarna omvandlas till volym (vid 35 °C, atmosfärstryck) gas som bildats med hjälp av ett omvandlingsdiagram. Detta diagram har framställts utifrån data som erhållits genom att injicera kända volymer kväve i en serie testkärl (t.ex. injektionsflaskor) vid 35 ± 2 °C och registrera de stabiliserade tryckavläsningar som erhållits (se tillägg 2). Beräkningen visas i anmärkningen i punkt 44.
Varning! Undvik nålsticksskador vid användning av mikrosprutor.
|
|
d.
|
Kolanalysator, lämplig för direkt bestämning av oorganiskt kol i intervallet 1 mg/l till 200 mg/l.
|
|
e.
|
Högprecisionssprutor för gas- och vätskeformiga prover.
|
|
f.
|
Magnetomrörare och magnetloppor (frivilligt).
|
|
g.
|
Handskbox (rekommenderas).
|
|
Reagens
|
14.
|
Alla reagens som används ska vara av analyskvalitet.
|
Vatten
|
15.
|
Destillerat eller avjonat vatten (som gjorts syrefritt genom bubbling med kvävgas som innehåller mindre än 5 μl/l syre) som innehåller mindre än 2 mg/l löst organiskt kol (DOC).
|
Testmedium
|
16.
|
Utspädningsmediet bör beredas med följande beståndsdelar i angivna mängder:
|
Vattenfritt kaliumdivätefosfat (KH2PO4)
|
0,27 g
|
|
Dinatriumvätefosfatdodekahydrat (Na2HPO4 · 12H2O)
|
1,12 g
|
|
Ammoniumklorid (NH4Cl)
|
0,53 g
|
|
Kalciumkloriddihydrat (CaCl2 · 2H2O)
|
0,075 g
|
|
Magnesiumkloridhexahydrat (MgCl2 · 6H2O)
|
0,10 g
|
|
Järn(II)kloridtetrahydrat (FeCl2 · 4H2O)
|
0,02 g
|
|
Resazurin (syreindikator)
|
0,001 g
|
|
Natriumsulfidnonahydrat (Na2S · 9H2O)
|
0,10 g
|
|
Stamlösning av spårelement (frivilligt, punkt 18)
|
10 ml
|
|
Tillsätt syrefritt vatten (punkt 15)
|
till 1 liter
|
Anmärkning: Man bör använda nyanskaffad natriumsulfid eller så bör den tvättas och torkas före användning för att garantera tillräcklig reduktiv kapacitet. Testet kan utföras utan användning av en handskbox (se punkt 26). I detta fall bör koncentrationen av natriumsulfid i mediet ökas till 0,20 g Na2S · 9H2O per liter. Natriumsulfid kan också tillsättas från en lämplig anaerob stamlösning genom det förseglade testkärlets septum eftersom detta förfarande minskar risken för oxidation. Natriumsulfid kan ersättas med titan(III)citrat som tillsätts genom de förseglade testkärlens septum vid en slutlig koncentration på 0,8 till 1,0 mmol/l. Titan(III)citrat är ett mycket effektivt och lågtoxiskt reduktionsmedel som bereds som följer: Lös upp 2,94 g trinatriumcitratdihydrat i 50 ml syrefritt vatten (till dess att man har en lösning på 200 mmol/l) och tillsätt 5 ml 15 % (w/v) titan(III)kloridlösning. Neutralisera till pH 7 ± 0,2 med oorganisk alkali och fördela i ett lämpligt kärl under en ström av kvävgas. Koncentrationen av titan(III)citrat i denna stamlösning är 164 mmol/l.
|
|
17.
|
Blanda testmediets komponenter utom reduktionsmedlet (natriumsulfidtitancitrat) oträskyddsmedlet som kan uppnå den angivna upptagningen när den applicerasch låt kvävgas bubbla genom lösningen i ca 20 minuter omedelbart före användning för att avlägsna syret. Tillsätt en lämplig volym nyberedd lösning av reduktionsmedel (beredd i syrefritt vatten) strax före användningen av mediet. Justera pH i mediet vid behov med en utspädd oorganisk syra eller bas till 7 ± 0,2.
|
Stamlösning med spårelement (frivilligt)
|
18.
|
Det rekommenderas att testmediet bör innehålla följande spårämnen för att förbättra de anaeroba nedbrytningsprocesserna, framför allt om låga inokulatkoncentrationer (t.ex. 1 g/l) används (11).
|
Mangan(II)kloridtetrahydrat (MnCl2 · 4H2O)
|
50 mg
|
|
Borsyra (H3BO3)
|
5 mg
|
|
Zinkklorid (ZnCl2)
|
5 mg
|
|
Koppar(II)klorid (CuCl2)
|
3 mg
|
|
Dinatriummolybdatdihydrat (Na2MoO4 · 2H2O)
|
1 mg
|
|
Koboltkloridhexahydrat (CoCl2 · 6H2O)
|
100 mg
|
|
Nickelkloridhexahydrat (NiCl2 · 6H2O)
|
10 mg
|
|
Dinatriumselenit (Na2SeO3)
|
5 mg
|
|
Tillsätt syrefritt vatten (punkt 15)
|
till 1 liter
|
|
Testämne
|
19.
|
Lägg till testämnet som en stamlösning, suspension, emulsion eller direkt som ett fast eller vätskeformigt ämne eller absorberat till ett glasfiberfilter så att koncentrationen blir högst 100 mg/l organiskt kol. Om man använder stamlösningar ska man bereda en lämplig lösning med vatten (punkt 15) (som tidigare gjorts syrefritt genom bubbling med kvävgas) med en sådan koncentration att den tillsatta volymen är mindre än 5 % av reaktionsblandningens totala volym. Justera vid behov stamlösningens pH till pH 7 ± 0,2. För testämnen som inte är tillräckligt lösliga i vatten bör ISO 10634 (13) konsulteras. Om ett lösningsmedel används bereder man en ytterligare kontroll med endast lösningsmedlet tillsatt till det inokulerade mediet. Organiska lösningsmedel som är kända för att hindra metanproduktionen, såsom kloroform och koltetraklorid, bör undvikas.
Obs! Handskas försiktigt med giftiga testämnen och ämnen vars egenskaper inte är kända.
|
Referensämnen
|
20.
|
Referensämnen som natriumbensoat, fenol och polyetylenglykol 400 har med framgång använts för att kontrollera förfarandet eftersom de bryts ner biologiskt med mer än 60 % inom 60 dagar. Bered en stamlösning (i syrefritt vatten) med det valda referensämnet på samma sätt som med testämnet och justera vid behov till pH 7 ± 0,2.
|
Hämningskontroll (villkorligt)
|
21.
|
För att få information om testämnets toxicitet för anaeroba mikroorganismer för att finna de lämpligaste testkoncentrationerna tillsätter man testämnet och referensämnet till ett kärl som innehåller testmediet (se punkt 16), vart och ett vid samma koncentration som respektive tillsatt koncentration (se punkterna 19 och 20, och se även ISO 13641-1 (12)).
|
Rötslam
|
22.
|
Samla in rötslam från en rötkammare vid ett reningsverk som huvudsakligen behandlar spillvatten från hushåll. Slammet bör beskrivas fullständigt och dess bakgrundsinformation bör redovisas (se punkt 54). Om man avser att använda ett anpassat inokulat kan man överväga att använda rötslam från ett reningsverk som behandlar industriavloppsvatten. För insamling av slam ska man använda vidhalsade flaskor tillverkade av högdensitetspolyeten eller liknande material som kan vidga sig. Tillsätt slam till ungefär 1 cm under kolvarnas överkant och försegla dem tätt, helst med en säkerhetsventil. Efter transport till laboratoriet kan det insamlade slammet användas direkt eller placeras i en laboratorierötkammare. Släpp ut överskott av biogas genom att försiktigt öppna kolvarna med slam. Alternativt kan laboratorieproducerat anaerobt slam användas som inokulat, men dess aktivitetsspektrum kan vara försämrat.
Varning! Slam som genomgår rötning producerar lättantändliga gaser som utgör brand- och explosionsrisker, och innehåller även potentiellt patogena organismer. Lämpliga försiktighetsåtgärder bör observeras vid hantering av slam. Av säkerhetsskäl ska glasbehållare inte användas för insamling av slam.
|
|
23.
|
För att minska bakgrundsproduktionen av gas och minska blankkontrollkärlens påverkan kan förberedande rötbehandling av slammet övervägas. Om slammet måste genomgå en förberedande rötbehandling bör det få röta utan tillsats av näringsämnen eller substrat vid 35 ± 2 °C i upp till sju dagar. Det har konstaterats att förberedande rötbehandling i omkring fem dagar vanligen leder till en optimal minskning av gasproduktionen i blankprovet utan oacceptabla ökningar antingen av lagfasen eller inkubationsperioden under testperioden eller aktivitetsförluster med avseende på ett litet antal av de ämnen som testas.
|
|
24.
|
För testämnen som är eller förväntas vara biologiskt svårnedbrytbara bör man överväga att förexponera slammet för testämnet för att erhålla ett inokulat som är bättre anpassat. I ett sådant fall ska testämnet tillsättas till rötslammet vid en koncentration för organiskt kol på 5 mg/l till 20 mg/l och inkuberas i upp till två veckor. Tvätta det förexponerade slammet noggrant före användning (se punkt 25) och ange betingelserna för förexponeringen i testrapporten.
|
Inokulat
|
25.
|
Tvätta slammet (se punkterna 22–24) strax före användningen för att minska koncentrationen oorganiskt kol till mindre än 10 mg/l i den slutliga testsuspensionen. Centrifugera slammet i förseglade rör (t.ex. 3 000 g i 5 minuter) och häll ut supernatanten. Blanda upp den resulterande pelleten i ett syrefritt medium (punkterna 16 och 17), centrifugera om suspensionen och häll ut supernatantvätskan. Om halten oorganiskt kol inte har blivit tillräckligt låg kan slammet tvättas högst två gånger till. Detta tycks inte påverka mikroorganismerna negativt. Blanda slutligen upp pelleten i den erforderliga volymen testmedium och fastställ koncentrationen av fasta ämnen totalt (t.ex. ISO 11923 (15)). Den slutliga koncentrationen av fasta ämnen totalt bör vara mellan 1 g/l och 3 g/l (eller ca 10 % av koncentrationen i det outspädda rötslammet). Utför de ovan beskrivna stegen på ett sådant sätt att slammet har så liten kontakt med syret som möjligt (t.ex. genom användning av kväveatmosfär).
|
TESTFÖRFARANDE
|
26.
|
Utför följande inledande förfaranden med hjälp av metoder som gör att kontakten mellan rötslammet och syret är så liten som möjligt. Det kan till exempel vara nödvändigt att arbeta i en handskbox i en kväveatmosfär och/eller att rena flaskorna med kväve (4).
|
Beredning av test- och kontrollanalyser
|
27.
|
Bered minst tredubbla testkärl (se punkt 13-b) för testämnet, blankproverna, referensämnet, hämningskontrollerna (villkorligt) och tryckregleringskamrarna (frivilligt) (se punkterna 7 och 19–21). Ytterligare kärl för utvärdering av den primära bionedbrytningen med hjälp av särskilda analyser för testämnet kan också beredas. Samma uppsättning blankprovskontroller kan användas för flera testämnen i samma test förutsatt att gasutrymmesvolymerna är konsekventa.
|
|
28.
|
Bered det utspädda inokulatet innan det tillsätts i kärlen, t.ex. med hjälp av en pipett med stor mynning. Tillsätt alikvoter av väl uppblandat inokulat (punkt 25) så att koncentrationen av fasta ämnen totalt är densamma i alla kärl (mellan 1 g/l och 3 g/l). Tillsätt stamlösningar av test- och referensämnena efter justering av pH till 7 ± 0,2 vid behov. Testämnet och referensämnet bör tillsättas via den lämpligaste tillförselvägen (punkt 19).
|
|
29.
|
Testkoncentrationen av organiskt kol bör normalt vara mellan 20 och 100 mg/l (punkt 4). Om testämnet är toxiskt bör testkoncentrationen sänkas till 20 mg C/l, eller ännu mindre om endast den primära bionedbrytningen ska mätas med särskilda analyser. Det bör noteras att testresultatens variabilitet ökar vid lägre testkoncentrationer.
|
|
30.
|
I kärlen med blankprov ska man lägga till en motsvarande mängd av bärämnet som används för dosering av testämnet i stället för en stamlösning, suspension eller emulsion. Om testämnet tillsattes med hjälp av glasfiberfilter eller organiska lösningsmedel ska ett filter eller motsvarande volym lösningsmedel som har avdunstat tillsättas till blankproven. Bered ett extra replikat med testämne för mätning av pH-värdet. Justera vid behov pH till 7 ± 0,2 med små mängder utspädd oorganisk syra eller alkali. Samma mängd neutraliserande ämnen bör tillsättas i alla testkärl. Dessa tillsatser bör inte vara nödvändiga eftersom pH-värdet i stamlösningarna med testämnet och referensämnet redan har justerats (se punkterna 19 och 20). Om den primära bionedbrytningen ska mätas bör ett lämpligt prov tas från pH-kontrollkärlet eller från ett ytterligare testkärl, och testämnets koncentration bör mätas med hjälp av särskilda analyser. Belagda magneter kan läggas till i alla kärl om reaktionsblandningarna ska röras om (frivilligt).
|
|
31.
|
Se till att den totala mängden vätska V1 och gasutrymmesvolymen Vh är desamma i alla kärl, och notera och registrera värdena för V1 och Vh. Varje kärl ska förseglas med ett gasseptum och överföras från handskboxen (se punkt 26) till inkubatorn (se punkt 13 a).
|
Svårlösliga testämnen
|
32.
|
Tillsätt vägda mängder av ämnen som är svårlösliga i vatten direkt i de beredda kärlen. När det är nödvändigt att använda ett lösningsmedel (se punkt 19) ska testämneslösningen eller -suspensionen överföras till det tomma kärlet. Låt lösningsmedlet om möjligt avdunsta genom att kväve leds genom kärlen, och tillsätt därefter övriga ingredienser, nämligen utspätt slam (punkt 25) och syrefritt vatten efter behov. En ytterligare kontroll med lösningsmedel bör också beredas (se punkt 19). För andra metoder för tillsats av olösliga ämnen kan man konsultera ISO 10634 (13). Testämnen i flytande form kan tillsättas med en spruta i helt förberedda och förslutna kärl om det kan förväntas att det ursprungliga pH-värdet inte kommer att överstiga 7 ± 1; tillsätt i annat fall testämnet på det sätt som beskrivs ovan (se punkt 19).
|
Inkubering och mätningar av gastrycket
|
33.
|
Inkubera de förberedda kärlen vid 35 ± 2 °C i omkring en timme så att jämvikt uppnås, och släpp ut överskottsgasen i den omgivande atmosfären, till exempel genom att skaka varje kärl för sig, föra in tryckmätarens nål (punkt 13 c) genom förseglingen och öppna ventilen till dess att tryckmätaren visar noll. Om trycket i gasutrymmet i detta skede, eller när mellanliggande mätningar görs, är mindre än det atmosfäriska trycket bör kväve införas för att återupprätta det atmosfäriska trycket. Stäng ventilen (se punkt 13 c) och fortsätt inkuberingen i mörker. Se till att alla delar av kärlen förblir vid nedbrytningstemperaturen. Observera kärlen efter inkubering i 24–48 timmar. Kassera kärlen om supernatanten har en markant rosa färg, dvs. om resazurinet (se punkt 16) har ändrat färg, vilket påvisar närvaro av syre (se punkt 50). Små mängder syre kan tolereras av systemet men högre koncentrationer kan allvarligt hämma den anaeroba bionedbrytningens förlopp. Man kan acceptera att ett enstaka kärl ur en uppsättning med tre då och då måste kasseras, men förekomsten av fler fel än så måste föranleda en undersökning av de experimentella förfarandena såväl som en upprepning av testet.
|
|
34.
|
Blanda omsorgsfullt innehållet i varje kärl genom omrörning eller skakning i några minuter minst två eller tre gånger per vecka samt precis före varje tryckmätning. Skakningen återuppslammar inokulatet och garanterar att gasen förblir i jämvikt. Alla tryckmätningar bör göras snabbt så att inte temperaturen i testkärlen sänks, vilket leder till felaktiga avläsningar. Medan tryckmätningen utförs bör hela testkärlet, inklusive gasutrymmet, förbli vid rötningstemperaturen. Mät gastrycket, t.ex. genom att föra in kanylen (punkt 13 c) som är kopplad till tryckmätaren genom septumet. Man bör noga se till att inte vatten kommer in i kanylen. Om detta skulle ske ska de våta delarna torkas och kanylen bytas ut mot en ny. Trycket ska mätas i millibar (se punkt 42). Gastrycket i kärlen kan mätas regelbundet, t.ex. varje vecka, och överskottsgasen släpps eventuellt ut i den omgivande atmosfären. Alternativt mäts trycket endast i slutet av testet för att fastställa den mängd biogas som bildats.
|
|
35.
|
Det rekommenderas att man gör mellanliggande avläsningar av gastrycket, eftersom tryckökningen ger vägledning om när testet kan avslutas och gör det möjligt att observera de kinetiska värdena (se punkt 6).
|
|
36.
|
Testet ska normalt avslutas efter en inkuberingstid på 60 dagar förutsatt att bionedbrytningskurvan som har erhållits från tryckmätningarna har nått platåfasen innan dag 60, dvs. den fas i vilken den maximala nedbrytningen har uppnåtts och bionedbrytningskurvan har jämnats ut. Om platåvärdet är mindre än 60 % blir tolkningen problematisk eftersom detta antyder att endast en del av molekylen har brutits ner eller att ett fel har begåtts. Om det vid utgången av den normala inkubationstiden bildas gas men platåfasen uppenbarligen inte har nåtts, bör man överväga att förlänga testet för att kontrollera om platån (> 60 %) kommer att uppnås.
|
Mätning av oorganiskt kol
|
37.
|
Vid slutet av testet efter den sista mätningen av gastrycket ska man låta slammet sedimenteras. Öppna varje kärl var för sig och ta omedelbart ett prov för bestämning av koncentrationen (mg/l) oorganiskt kol (IC) i supernatanten. Man bör varken centrifugera eller filtrera supernatantvätskan, eftersom det skulle innebära en oacceptabel förlust av upplöst koldioxid. Om vätskan inte kan analyseras när den insamlas kan den förvaras i en försluten flaska utan gasutrymme och kylas till cirka 4 °C i upp till två dagar. Efter mätningen av halten oorganiskt kol mäts och registreras pH-värdet.
|
|
38.
|
Alternativt kan halten oorganiskt kol i supernatanten fastställas indirekt genom frigöringen av upplöst oorganiskt kol som koldioxid, vilket kan mätas i gasutrymmet. Efter den sista mätningen av gastrycket justeras trycket i vart och ett av testkärlen till atmosfäriskt tryck. Surgör innehållet i varje kärl till cirka pH 1 genom tillsats av en koncentrerad oorganisk syra (t.ex. H2SO4) genom de slutna kärlens septum. Inkubera de omskakade kärlen vid 35 ± 2 °C i cirka 24 timmar och mät gastrycket som uppstår som en följd av den utvecklade koldioxiden genom att använda tryckmätaren.
|
|
39.
|
Gör liknande avläsningar för motsvarande kärl med blankprov och referensämne och, i förekommande fall, hämningskontrollerna (se punkt 21).
|
|
40.
|
I vissa fall, särskilt om samma kontrollkärl används för flera testämnen, bör man överväga att göra mellanliggande mätningar av halten oorganiskt kol i test- och kontrollkärlen, beroende på vad som är lämpligt. I detta fall ska ett tillräckligt antal kärl förberedas för alla mellanliggande mätningar. Detta förfarande är att föredra framför att ta alla prov från endast ett kärl. Det senare kan endast göras om den erforderliga volymen för analys av löst oorganiskt kol inte anses vara för hög. Mätningen av löst oorganiskt kol bör göras efter mätningen av gastrycket utan utsläpp av överskottsgas enligt beskrivning nedan:
|
—
|
Ta en så liten volym av supernatantproverna som möjligt med en spruta genom septumet utan att öppna kärlen och bestäm halten oorganiskt kol i provet.
|
|
—
|
Efter provtagningen släpps överskottsgasen ut, eller inte.
|
|
—
|
Man bör beakta att även en liten minskning av supernatantens volym (t.ex. ca 1 %) kan ge en betydande ökning av gasens volym i gasutrymmet (Vh).
|
|
—
|
Ekvationerna (se punkt 44) korrigeras genom att vid behov öka Vh i ekvation 3.
|
|
Särskilda analyser
|
41.
|
Om den primära anaeroba nedbrytningen (se punkt 30) ska bestämmas ska en lämplig mängd prov tas för särskilda analyser i början och i slutet av testet från de kärl som innehåller testämnet. Notera att om detta görs kommer gasutrymmets (Vh) och vätskans (Vl) volymer att ändras, och man måste därför ta hänsyn till detta vid beräkningen av resultaten rörande gasproduktionen. Alternativt kan prover tas för särskilda analyser från ytterligare blandningar som tidigare inrättats för detta syfte (punkt 30).
|
DATA OCH RAPPORTERING
Behandling av resultaten
|
42.
|
Av praktiska skäl mäts gastrycket i millibar (1 mbar = 1hPa = 102 Pa; 1 Pa = 1 N/m2), volymen i liter och temperaturen i grader Celsius.
|
Kol i gasutrymmet
|
43.
|
Eftersom 1 mol metan och 1 mol koldioxid innehåller 12 g kol var, kan kolets massa i en given volym utvecklad gas uttryckas som
|
m= 12 × 103×n
|
Ekvation [1]
|
där
|
m
|
=
|
massan kol (mg) i en given mängd utvecklad gas,
|
|
12
|
=
|
relativ atommassa för kol,
|
|
n
|
=
|
antal mol gas i den givna volymen.
|
Om en annan gas än metan eller koldioxid (t.ex. N2O) bildas i stora mängder bör formeln [1] ändras för att beskriva eventuella effekter av de gaser som bildas.
|
|
44.
|
Från gaslagarna kan n uttryckas som
|

|
Ekvation [2]
|
där
|
p
|
=
|
gastrycket (Pascal),
|
|
V
|
=
|
gasens volym (m3),
|
|
R
|
=
|
den allmänna gaskonstanten (8,314J/(mol K)),
|
|
T
|
=
|
inkubationstemperaturen (Kelvin).
|
Genom en kombination av ekvationerna [1] och [2] och genom att rationalisera för att ta hänsyn till produktionen av gas i blankkontrollen får man
|

|
Ekvation [3]
|
där
|
mh
|
=
|
nettomassan kol som bildas som gas i gasutrymmet (mg),
|
|
Δp
|
=
|
medelvärdet av skillnaden mellan det initiala och det slutliga trycket i testkärlen minus motsvarande medelvärde i blankkärlen (millibar),
|
|
Vh
|
=
|
gasutrymmets volym i kärlet (l),
|
|
0,1
|
=
|
omvandling både av Newton/m2 till millibar och m3 till liter.
|
Ekvation [4] bör användas för den normala inkuberingstemperaturen på 35 °C (308 K):
|
mh
= 0,468(Δp·Vh
)
|
Ekvation [4]
|
Anmärkning: Alternativ volymberäkning. Tryckmätaravläsningarna omvandlas till ml gas som bildats med hjälp av standardkurvan som genereras genom att man plottar den injicerade volymen (ml) mot mätaravläsningen (tillägg 2). Antalet mol (n) gas i gasutrymmet i varje kärl beräknas genom att man dividerar den sammanlagda gasproduktionen (ml) med 25 286 ml/mol, som är den volym som upptas av en mol gas vid 35 °C och normalt atmosfäriskt tryck. Eftersom 1 mol CH4 och 1 mol CO2 innehåller 12 g kol var, kan mängden koldioxid (m, mg) i gasutrymmet (mh
) beräknas enligt ekvation [5]:
|
mh
= 12 × 103×n
|
Ekvation [5]
|
Rationalisera för att ta hänsyn till produktionen av gas i blankkontrollen:
|

|
Ekvation [6]
|
där
|
mh
|
=
|
nettomassan kol som bildas som gas i gasutrymmet (mg),
|
|
ΔV
|
=
|
medelvärdet av skillnaden mellan volymen av den gas som bildas i gasutrymmet i testkärlet och i kärlen med blankprov,
|
|
25 286
|
=
|
den volym som upptas av 1 mol gas vid 35 °C, 1 atmosfär.
|
|
|
45.
|
Den biologiska nedbrytningens förlopp kan följas genom att man plottar den kumulativa tryckökningen Δp (i millibar) mot tiden, om så är lämpligt. Från denna kurva kan lagfasen (dagar) fastställas och registreras. Lagfasen är tiden mellan testets inledning till dess att en betydande nedbrytning inleds (för exempel, se tillägg 3). Om mellanliggande prov av supernatanten togs och analyserades (se punkterna 40, 46 och 47) kan den sammanlagda mängden kol som bildas (i gas plus i vätska) plottas i stället för endast det sammanlagda trycket.
|
Kol i vätskan
|
46.
|
Mängden metan i vätskan kan försummas eftersom man vet att dess löslighet i vatten är mycket låg. Beräkna massan av oorganiskt kol i vätskan i testkärlen med hjälp av ekvation [7]:
|
ml
=Cnet
×Vl
|
Ekvation [7]
|
där
|
ml
|
=
|
massan av oorganiskt kol i vätskan (mg),
|
|
Cnet
|
=
|
koncentrationen av oorganiskt kol i testkärlen minus koncentrationen i kontrollerna vid slutet av testet (mg/l),
|
|
Vl
|
=
|
vätskans volym i kärlet (l).
|
|
Den totala massan av gasformigt kol
|
47.
|
Beräkna den totala massan av gasformigt kol i kärlet med hjälp av ekvation [8]:
där
|
|
mt = den totala massan av gasformigt kol (mg).
|
|
|
mh
och ml
definieras som ovan.
|
|
Kol i testämnet
|
48.
|
Beräkna massan kol i testkärlen som härrör från det tillsatta testämnet med hjälp av ekvation [9]:
där
|
mv
|
=
|
massan av kol i testämnet (mg).
|
|
Cc
|
=
|
koncentrationen av kol i testämnet i testkärlen (mg/l)
|
|
Vl
|
=
|
vätskans volym i testkärlet (l).
|
|
Den biologiska nedbrytningens omfattning
|
49.
|
Beräkna den procentuella bionedbrytningen utifrån gasen i gasutrymmet med hjälp av ekvation [10] och den totala procentuella bionedbrytningen med hjälp av ekvation [11]:
|
Dh
= (mh
/mv
) × 100
|
Ekvation [10]
|
|
Dt
= (mt
/mv
) × 100
|
Ekvation [11]
|
där
|
|
Dh = biologisk nedbrytbarhet utifrån gasen i gasutrymmet (%).
|
|
|
Dt = den totala biologiska nedbrytningen (%),
|
|
|
mh
, mv
och mt
definieras som ovan.
|
Den primära bionedbrytningsgraden beräknas från de (frivilliga) mätningarna av koncentrationen av testämnet vid inkuberingens början och slut, med hjälp av ekvation [12]:
|
Dp
= (1 –Se
/Si
) × 100
|
Ekvation [12]
|
där
|
Dp
|
=
|
primär nedbrytning av testämnet (%),
|
|
Si
|
=
|
testämnets ursprungliga koncentration (mg/l),
|
|
Se
|
=
|
testämnets koncentration i slutet av testet (mg/l).
|
Om analysmetoden tyder på betydande koncentrationer av testämnet i det oändrade anaeroba slaminokulatet, använd ekvation [13]:
|
Dp
1
= [1 – (Se
–Seb
)/(Si
–Sib
)] × 100
|
Ekvation [13]
|
där
|
Dp
1
|
=
|
korrigerad primär nedbrytning av testämnet (%),
|
|
Sib
|
=
|
testämnets ’uppenbara’ koncentration i blankkontrollerna (mg/l),
|
|
Seb
|
=
|
testämnets ’uppenbara’ koncentrationen i blankkontrollerna i slutet av testet (mg/l).
|
|
Resultatens giltighet
|
50.
|
Man bör endast använda tryckavläsningar från kärl som inte uppvisar rosa färgning (se punkt 33). Kontamineringen av syre minimeras genom användning av lämpliga anaeroba hanteringsmetoder.
|
|
51.
|
Testet bör anses som giltigt om referensämnet har nått en platå som representerar en bionedbrytning på mer än 60 % (41).
|
|
52.
|
Om pH-värdet i slutet av testet har överskridit 7 ± 1 och bionedbrytningen har varit otillräcklig måste testet upprepas med ökad buffertkapacitet i mediet.
|
Hämning av nedbrytningen
|
53.
|
Gasproduktionen i kärl som innehåller både testämne och referensämne bör vara minst lika hög som i de kärl som endast innehåller referensämne. Om detta inte är fallet tyder det på att gasproduktionen är hämmad. I vissa fall kommer gasproduktionen i kärl som innehåller testämne utan referensämne att vara lägre än i blankkontrollerna, vilket tyder på att testämnet är hämmande.
|
Testrapport
|
54.
|
Testrapporten ska innehålla följande uppgifter:
|
|
Testämne:
|
—
|
trivialnamn, kemisk beteckning, CAS-nummer, strukturformel och relevanta fysikalisk-kemiska egenskaper,
|
|
—
|
testämnets renhet (orenheter i testämnet),
|
|
|
|
Testbetingelser:
|
—
|
volymerna av den utspädda rötvätskan (Vl
) och gasutrymmet (Vh
) i kärlet,
|
|
—
|
beskrivning av testkärlen, de huvudsakliga kännetecknen (t.ex. typ av tryckmätare) för biogasmätningarna och för analysatorn av oorganiskt kol,
|
|
—
|
tillsatsen av testämnet och referensämnet till testsystemet: den använda testkoncentrationen och den eventuella användningen av lösningsmedel,
|
|
—
|
uppgifter om det inokulat som används: namn på avloppsreningsverket, beskrivning av källan till det behandlade avloppsvattnet (t.ex. driftstemperatur, slamretentionstid, huvudsakligen hushållsavlopp, osv.), koncentration, all information som behövs för att bestyrka detta och information om eventuell förbehandling av inokulatet (t.ex. förberedande rötbehandling, förexponering),
|
|
|
|
Resultat:
|
—
|
pH-värde och värdet för oorganiskt kol vid testets slut.
|
|
—
|
testämnets koncentration i början och i slutet av testet om en särskild mätning har genomförts,
|
|
—
|
alla uppmätta data som samlas in i kärlen för testämnet, blankprovet, referensämnet och hämningskontrollen, beroende på vad som är tillämpligt (t.ex. tryck i millibar, koncentrationen av oorganiskt kol (mg/l)), i tabellform (uppmätta data för gasutrymmet och vätskan ska rapporteras separat),
|
|
—
|
statistisk behandling av data, testets varaktighet och ett diagram över den biologiska nedbrytningen av testämnet, referensämnet och hämningskontrollerna,
|
|
—
|
procentandel biologisk nedbrytning av testämnet och referensämnet,
|
|
—
|
motivering för eventuella förkastade testresultat,
|
|
—
|
diskussion av resultaten.
|
|
|
LITTERATUR
|
(1)
|
Följande kapitel i denna bilaga:
|
|
C.4, Bestämning av ’lätt’ bionedbrytbarhet,
|
|
|
C.9, Bionedbrytning – Zahn-Wellens test,
|
|
|
C.10, Simulationstest – aerob avloppsvattenbehandling:
A: Enheterna för aktiverat slam, B: Biofilmer
|
|
|
C.11, Biologisk nedbrytbarhet – Aktiverat slam – respirationshämningstest
|
|
|
(2)
|
OECD (2009) Inherent Biodegradability: Modified MITI Test (II), OECD Guideline for Testing of Chemicals, No. 302C, OECD, Paris
|
|
(3)
|
Birch, R. R., Biver, C., Campagna, R., Gledhill, W. E., Pagga,U., Steber, J., Reust, H. och Bontinck, W. J. (1989) Screening of chemicals for anaerobic biodegradation. Chemosphere 19, 1527–1550. (också publicerad som ECETOC Technical Report No. 28, juni 1988).
|
|
(4)
|
Shelton, D. R. och Tiedje, J. M. (1984) General method for determining anaerobic biodegradation potential. Appl. Environ. Microbiology, 47, 850–857.
|
|
(5)
|
Owen, W. F., Stuckey, D. C., Healy Jr., J. B., Young L.,Y. och McCarty, P. L. (1979) Bioassay for monitoring biochemical methane potential and anaerobic toxicity. Water Res. 13, 485–492.
|
|
(6)
|
Healy Jr., J. B. och Young, L. Y. (1979) Anaerobic biodegradation of eleven aromatic compounds to methane. Appl. Environ. Microbiol. 38, 84–89.
|
|
(7)
|
Gledhill, W. E. (1979) Proposed standard practice for the determination of the anaerobic biodegradation of organic chemicals. Working document. Draft 2 no.35.24. American Society for Testing Materials, Philadelphia.
|
|
(8)
|
Battersby, N. S. och Wilson, V. (1988) Evaluation of a serum bottle technique for assessing the anaerobic biodegradability of organic chemicals under methanogenic conditions. Chemosphere, 17, 2441–2460.
|
|
(9)
|
E1192-92. Standard Test Method for Determining the Anaerobic Biodegradation Potential of Organic Chemicals. ASTM, Philadelphia.
|
|
(10)
|
US-EPA (1998) Fate, Transport and Transformation Test Guidelines OPPTS 835.3400 Anaerobic Biodegradability of Organic Chemicals.
|
|
(11)
|
Internationella standardiseringsorganisationen (1999) ISO 11734 Vattenundersökningar – Bestämning av den ’ultimata’ anaeroba bionedbrytbarheten av organiska föreningar i rötslam – Metod genom mätning av mängden producerad biogas.
|
|
(12)
|
Internationella standardiseringsorganisationen (2003) ISO 13641-1 Water Quality – Determination of inhibition of gas production of anaerobic bacteria – Part 1 General Test.
|
|
(13)
|
Internationella standardiseringsorganisationen (1996) ISO 10634 Vattenundersökningar – Handledning för beredning och handhavande av i vatten svårlösliga organiska föreningar för efterföljande utvärdering av deras bionedbrytbarhet i vattenlösning.
|
|
(14)
|
Pagga, U. och Beimborn, D. B., (1993) Anaerobic biodegradation test for organic compounds. Chemosphere, 27, 1499–1509.
|
|
(15)
|
Internationella standardiseringsorganisationen (1997) ISO 11923 Water Quality – Determination of suspended solids by filtration through glass-fibre filters.
|
Tillägg 1
Exempel på utrustning för mätning av biogasproduktion via gastrycket

Teckenförklaring:
|
1
|
–
|
Tryckmätare
|
|
2
|
–
|
Gastät trevägsventil
|
|
3
|
–
|
Kanyl
|
|
4
|
–
|
Gastät förslutning (kraglock och septum)
|
|
5
|
–
|
Gasutrymme (Vh
)
|
|
6
|
–
|
Rötslaminokulat (Vl
)
|
Testkärl i en miljö med temperaturen 35 ± 2 °C
Tillägg 2
Omvandling av tryckmätningarna
Avläsningarna från tryckmätaren kan relateras till gasvolymer med hjälp av en standardkurva som genereras genom injicering av kända volymer luft vid 35 ± 2 °C i injektionsflaskor som innehåller en volym vatten som motsvarar volymen av reaktionsblandningen, V
R:
|
—
|
Fördela V
R ml alikvoter av vatten vars temperatur bibehålls vid 35 ± 2 °C i fem injektionsflaskor. Försegla flaskorna och placera dem i ett vattenbad vid 35 °C i en timme för att uppnå jämvikt.
|
|
—
|
Slå på tryckmätaren, låt den stabiliseras, och justera till noll.
|
|
—
|
För in kanylen genom förseglingen på en av flaskorna, öppna ventilen till dess att tryckmätaren visar noll och stäng därefter ventilen.
|
|
—
|
Upprepa detta förfarande med de återstående flaskorna.
|
|
—
|
Injicera 1 ml luft vid 35 ± 2 °C i varje flaska. För in nålen (på mätaren) genom förseglingen på en av flaskorna och låt tryckavläsningen stabiliseras. Registrera trycket, öppna ventilen till dess att trycket visar noll och stäng därefter ventilen.
|
|
—
|
Upprepa förfarandet med de återstående flaskorna.
|
|
—
|
Upprepa hela förfarandet ovan med 2 ml, 3 ml, 4 ml, 5 ml, 6 ml, 8 ml, 10 ml, 12 ml, 16 ml, 20 ml och 50 ml luft.
|
|
—
|
Rita en omvandlingskurva över trycket (Pa) mot volymen gas som injicerats Vb (ml). Mätresultaten från instrumentet är linjära i intervallet mellan 0 Pa till 70 000 Pa, och 0 ml till 50 ml gasproduktion.
|
Tillägg 3
Exempel på en nedbrytningskurva (kumulativ nettotryckökning)
Tillägg 4
Exempel på resultatformulär för testet för anaerob nedbrytning – Resultatformulär för testämnet
|
Laboratorium: …
|
Testämne: …
|
Test nr: …
|
|
Testtemperatur (°C): …
|
Gasutrymmets volym (Vh): …l)
|
Vätskans volym (Vl ): …l)
|
|
Mängden kol i testämnet Cc,v: …(mg/l)
|
mv
(42): …(mg)
|
|
|
Dag
|
p
1 (test-ämne)
(mbar)
|
p
2 (test-ämne)
(mbar)
|
p
3 (test-ämne)
(mbar)
|
p (test-ämne)
medel-värde
(mbar)
|
p
4 (blank-prov)
(mbar)
|
p
5 (blank-prov)
(mbar)
|
p
6 (blank-prov)
(mbar)
|
p (blank-prov)
medel-värde
(mbar)
|
p (netto)
testämne – blankprov
medelvärde (mbar)
|
Δ
p (netto)
Kumulativt
(mbar)
|
m
h
kol, gasutrymmet (43)
(mg)
|
D
h
Biologisk nedbrytbarhet (44)
(%)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C
IC, 1
test-ämne
(mg)
|
C
IC, 2
test-ämne
(mg)
|
C
IC, 3
test-ämne
(mg)
|
C
IC
medel-värde, test-ämne
(mg)
|
C
IC, 4
blankprov
(mg)
|
C
IC, 5
blankprov
(mg)
|
C
IC, 6
blankprov
(mg)
|
C
IC
medel-värde, blank-prov
(mg)
|
C
IC, netto
testämne – blankprov
medel-värde
(mg)
|
m
l
vätske-formigt kol (45)
(mg)
|
m
t
kol, totalt (46)
(mg)
|
D
t
Biologisk nedbrytbarhet (47)
(%)
|
|
oorganiskt kol (vid testslut)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
pH (vid testslut)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Laboratorium: …
|
Referensämne: …
|
Test nr: …
|
|
Testtemperatur (°C): …
|
Gasutrymmets volym (V
h): …l)
|
Vätskans volym (V
l ) (liter): …
|
|
Kol i referensämne C
c,v (mg/l): …
|
mv
(48) (mg): …
|
|
|
Dag
|
p
1 (ref.)
(mbar)
|
p
2 (ref.)
(mbar)
|
p
3 (ref.)
(mbar)
|
p (ref.)
medel-värde
(mbar)
|
p
4 (hämn.)
(mbar)
|
p
5 (hämn.)
(mbar)
|
p
6 (hämn.)
(mbar)
|
p (hämn.)
medel-värde
(mbar)
|
p (ref.)
ref. – blankprov
(mbar)
|
Δ
p (ref.)
kumulativt
(mbar)
|
m
h
kol, gasutrymmet (49)
(mg)
|
D
h
Biologisk nedbrytbarhet (50)
(%)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C
IC, 1
ref.
(mg)
|
C
IC, 2
ref.
(mg)
|
C
IC, 3
ref.
(mg)
|
C
IC
medel-värde, ref.
(mg)
|
C
IC, 4
hämn.
(mg)
|
C
IC, 5
hämn.
(mg)
|
C
IC, 6
hämn.
(mg)
|
C
IC
medel-värde, hämn.
(mg)
|
C
IC, netto
ref. – hämn.
(mg)
|
m
l
vätske-formigt kol (51)
(mg)
|
m
t
kol, totalt (52)
(mg)
|
D
t
Biologisk nedbrytbarhet (53)
(%)
|
|
oorganiskt kol (vid testslut)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
pH (vid testslut)
|
|
|
|
|
|
|
|
|
|
|
|
|
C.44. URLAKNING I JORDKOLONNER
INLEDNING
|
1.
|
Denna testmetod motsvarar OECD:s testriktlinje (TG) 312 (2004). Syntetiska kemikalier kan nå jorden direkt genom avsiktlig applicering (t.ex. jordbrukskemikalier) eller på indirekt väg (t.ex. via avloppsvatten → avloppsslam → jord eller luft → våt-/torrdeposition). För riskbedömning av dessa kemikalier är det viktigt att uppskatta deras potential för omvandling i jord och för rörlighet (urlakning) till djupare jordlager och så småningom till grundvattnet.
|
|
2.
|
Det finns flera metoder för att mäta risken för urlakning av kemikalier i jord under kontrollerade laboratoriebetingelser, t.ex. jordanalys med tunnskiktskromatografi, jordanalys med tjockskiktkromatografi, jordanalys med kolonnkromatografi och mätningar av adsorption – desorption (1) (2). För icke-joniserade kemikalier möjliggör fördelningskoefficienten n-oktanol/vatten (Pow) en tidig uppskattning av deras adsorptions- och urlakningspotential (3) (4) (5).
|
|
3.
|
Den metod som beskrivs i denna testmetod bygger på jordkolonnkromatografi i störd jord (se tillägg 1 för en definition). Två typer av försök utförs för bedömning av (i) testkemikaliens urlakningspotential, och (ii) omvandlingsprodukternas urlakningspotential (studie med åldrade rester [aged residues]) i jord under kontrollerade laboratoriebetingelser (54). Testmetoden baserar sig på befintliga metoder (6) (7) (8) (9) (10) (11).
|
|
4.
|
Vid en OECD-workshop om valet av jord och sediment i Belgirate, Italien, 1995 (12) kom man överens om hur många och vilka jordtyper som ska användas i denna testmetod. Workshopen i Belgirate resulterade också i rekommendationer rörande insamling, hantering och lagring av jordprover för urlakningsexperiment.
|
PRINCIP FÖR TESTMETODEN
|
5.
|
Kolonner tillverkade av lämpligt inert material (t.ex. glas, rostfritt stål, aluminium, teflon, PVC, etc.) packas med jord och mättas, och bringas därefter i jämvikt med en ’artificiellt regn’-lösning (för definition, se tillägg 1) och dräneras. Därefter behandlas ytan i varje jordkolonn med testkemikalien och/eller med åldrade rester av testkemikalien. Artificiellt regn tillförs därefter till jordkolonnerna och lakvattnet samlas upp. Efter urlakningsprocessen avlägsnas jorden från kolonnerna och delas upp i ett lämpligt antal segment beroende på den information man önskar få ifrån undersökningen. Varje jordsegment och lakvattnet analyseras därefter med avseende på testkemikalien och, om tillämpligt, omvandlingsprodukter eller andra kemikalier av intresse.
|
TESTMETODENS TILLÄMPBARHET
|
6.
|
Testmetoden kan tillämpas på alla testkemikalier (omärkta eller radioaktivt märkta, t.ex. 14C) för vilka det finns en analysmetod som är tillräckligt noggrann och känslig. Testmetoden bör inte användas för kemikalier som är lättflyktiga från jord och vatten och därmed inte stannar kvar i jorden och/eller lakvattnet under de försöksbetingelser som gäller för denna testmetod.
|
INFORMATION OM TESTKEMIKALIEN
|
7.
|
Omärkta eller radioaktivt märkta testkemikalier kan användas för att mäta urlakningsegenskaperna i jordkolonner. Radioaktivt märkt material behövs för undersökning av urlakning av omvandlingsprodukter (åldrade rester av testkemikalien) och för bestämningar av massbalansen. 14C-märkning rekommenderas, men även andra isotoper, t.ex. 14C, 15N, 3H och 32P, kan användas. Om möjligt bör märkningen placeras i molekylens mest stabila del(ar). Testämnets renhet bör vara minst 95 %.
|
|
8.
|
De flesta kemikalier bör appliceras som ett enda ämne. För verksamma ämnen i växtskyddsmedel kan dock blandade produkter användas för att studera urlakningen av det ursprungliga testämnet, men det är i synnerhet viktigt att testa dessa medel när blandningen kan påverka frisättningshastigheten (t.ex. granulat eller depåpreparat). När det gäller särskilda krav på testets utformning för blandningar kan det vara lämpligt att samråda med tillsynsmyndigheten före testet. För urlakningsstudier av åldrade rester bör man använda ett rent ursprungligt testämne.
|
|
9.
|
Innan man utför laktester i jordkolonnerna ska följande uppgifter om testkemikalien finnas tillgängliga:
|
(1)
|
löslighet i vatten [testmetod A.6] (13),
|
|
(2)
|
löslighet i organiska lösningsmedel,
|
|
(3)
|
ångtryck [testmetod A.4] (13) och Henrys lags konstant,
|
|
(4)
|
fördelningskoefficienten n-oktanol/vatten [testmetoderna A.8 och A.24] (13),
|
|
(5)
|
adsorptionskoefficienten (Kd, Kf eller KOC) [testmetoderna C.18 och C.19] (13),
|
|
(6)
|
hydrolys [testmetod C.7] (13),
|
|
(7)
|
dissociationskonstant (pKa) [OECD:s TG 112] (25),
|
|
(8)
|
aerob och anaerob omvandling i jord [testmetod C.23] (13).
|
Anmärkning: Den temperatur vid vilken mätningarna görs bör rapporteras i respektive testrapport.
|
|
10.
|
Mängden testkemikalie som tillförs jorden i kolonnerna bör vara tillräcklig för att möjliggöra påvisning av minst 0,5 % av den tillförda dosen i ett och samma segment. För verksamma kemikalier i växtskyddsmedel kan mängden testkemikalie som appliceras motsvara den högsta rekommenderade bruksdosen (en enstaka applicering).
|
|
11.
|
En lämplig analysmetod med känd noggrannhet, precision och känslighet för kvantifiering av testkemikalien och, i förekommande fall, dess omvandlingsprodukter i jord och lakvatten ska vara tillgänglig. Den analytiska detektionsgränsen för testkemikalien och dess viktigaste omvandlingsprodukter (normalt minst alla omvandlingsprodukter som utgör ≥ 10 % av den tillförda dosen och som observerats i studier av omvandlingsmönster, men helst alla relevanta omvandlingsprodukter av intresse) bör också vara kända (se punkt 17).
|
REFERENSKEMIKALIER
|
12.
|
Referenskemikalier med känt urlakningsbeteende, såsom atrazin eller monuron, som kan anses vara måttliga urlakningsämnen på fältet, bör användas för att utvärdera testkemikaliens relativa rörlighet i jord (1) (8) (11). En icke-sorberande och icke biologiskt nedbrytbar polär referenskemikalie (t.ex. tritium, bromid, fluorescein, eosin) som kan spåra vattnets rörelse i kolonnen kan också vara till nytta för att bekräfta jordkolonnens hydrodynamiska egenskaper.
|
|
13.
|
Standardkemikalier för analys kan också vara till nytta för karakterisering och/eller identifiering av omvandlingsprodukter i jordsegmenten och i lakvattnet genom kromatografiska och spektroskopiska metoder eller andra relevanta metoder.
|
DEFINITIONER OCH ENHETER
KVALITETSKRITERIER
Utbyte
|
15.
|
Summan av procentandelarna av testkemikalien som återfinns i jordsegmenten och kolonnens lakvatten efter urlakningen ger utbytet för urlakningsförsöket. Utbytet bör ligga på mellan 90 % och 110 % för radioaktivt märkta kemikalier (11) och mellan 70 % och 110 % för omärkta kemikalier (8).
|
Analysmetodens repeterbarhet och känslighet
|
16.
|
Analysmetodens repeterbarhet när det gäller att kvantifiera testämnet och omvandlingsprodukterna kan kontrolleras genom en duplikatanalys av samma extrakt från ett jordsegment eller från lakvattnet (se punkt 11).
|
|
17.
|
Analysmetodens detektionsgräns (LOD) för testkemikalien och för omvandlingsprodukterna bör vara minst 0,01 mg · kg– 1 i varje jordsegment eller i lakvattnet (som testkemikalie) eller 0,5 % av den tillförda dosen i ett enskilt segment, beroende på vilket som är lägst. Kvantifieringsgränsen (LOQ) bör också anges.
|
BESKRIVNING AV TESTMETODEN
Testsystem
|
18.
|
Urlakningskolonner (delbara eller icke-delbara) tillverkade av lämpligt inert material (t.ex. glas, rostfritt stål, aluminium, teflon, PVC, etc.) med en inre diameter på minst 4 cm och en höjd på minst 35 cm används för testet. Kolonnmaterialet bör testas för möjliga reaktioner med testkemikalien och/eller dess omvandlingsprodukter. Exempel på lämpliga delbara och icke-delbara kolonner visas i tillägg 2.
|
|
19.
|
Sked, kolv och vibrationsapparat används för att fylla och packa jordkolonnerna.
|
|
20.
|
För tillförsel av artificiellt regn till jordkolonnerna kan man använda kolvpumpar eller peristaltiska pumpar, duschhuvuden, Mariotteflaskor eller enkla dropptrattar.
|
Laboratorieutrustning och kemikalier
|
21.
|
Normal laboratorieutrustning krävs, i synnerhet följande:
|
(1)
|
analysinstrument såsom utrustning för gas-vätskekromatografi (GLC), högtrycksvätskekromatografi (HPLC) och tunnskiktskromatografi (TLC), inbegripet lämpliga detektionssystem för analys av radioaktivt märkta eller omärkta ämnen eller för metoden med invers isotoputspädning,
|
|
(2)
|
instrument för identifiering (t.ex. masspektrometer, gaskromatograf-masspektrometer, vätskekromatograf-masspektrometer, NMR-spektrometer, etc.),
|
|
(3)
|
vätskescintillationsräknare för radioaktivt märkta testkemikalier,
|
|
(4)
|
oxidationsmedel för förbränning av märkt material,
|
|
(5)
|
extraktionsapparatur (till exempel centrifugrör för kallextraktion och Soxhlet-apparatur för kontinuerlig extraktion med återflöde),
|
|
(6)
|
instrument för att koncentrera lösningar och extrakt (t.ex. rotationsevaporator).
|
|
|
22.
|
Kemikalier som kan användas inbegriper organiska lösningsmedel av analyskvalitet, såsom aceton, metanol, etc., scintillatorvätska, 0,01 M CaCl2-lösning i destillerat eller avjonat vatten (artificiellt regn).
|
Testkemikalie
|
23.
|
Innan tillsättning av testkemikalien till jordkolonnerna bör den först lösas upp i vatten (avjonat eller destillerat). Om testkemikalien är svårlöslig i vatten kan den appliceras antingen som beredningar (efter att vid behov ha suspenderats eller emulgerats i vatten) eller i organiska lösningsmedel. Om ett organiskt lösningsmedel används bör det begränsas till ett minimum, och det bör få avdunsta från jordytan i kolonnen innan utlakningsförfarandet påbörjas. Fasta beredningar, såsom granulat, bör appliceras i fast form utan vatten. För att se till att den fördelas bättre över ytan i jordkolonnen kan beredningen blandas med en liten mängd kvartssand (t.ex. 1 g) före appliceringen.
|
|
24.
|
Mängden testkemikalie som tillförs jorden i kolonnerna bör vara tillräcklig för att möjliggöra påvisning av minst 0,5 % av den tillförda dosen i ett och samma segment. För verksamma ämnen i växtskyddsmedel kan detta baseras på den rekommenderade maximala bruksdosen (enstaka applicering) och bör, för både ursprungligt och åldrat lakvatten, stå i förhållande till ytarean på den jordkolonn som används (55).
|
Referenskemikalie
|
25.
|
En referenskemikalie bör användas i urlakningsexperimenten (se punkt 12). Den bör appliceras på jordytan i kolonnen på ett liknande sätt som testkemikalien och i lämplig grad som möjliggör nöjaktig påvisning antingen som intern standard tillsammans med testkemikalien i samma jordkolonn eller för sig i en separat jordkolonn. Man bör helst använda båda kemikalierna i samma kolonn, utom när båda kemikalierna är märkta på samma sätt.
|
Jord
Val av jord
|
26.
|
För urlakningsstudier med den ursprungliga testkemikalien bör man använda 3–4 jordtyper med varierande pH, halt organiskt kol och textur (12). Anvisningar för val av jordar för urlakningsexperiment ges i tabell 1 nedan. För joniserbara testkemikalier bör de utvalda jordarna omfatta ett stort pH-område för att man ska kunna bedöma kemikaliens rörlighet i sin joniserade och ojoniserade form. Minst tre jordtyper bör ha ett pH-värde vid vilket testkemikalien förekommer i sin mobila form.
Tabell 1
Anvisningar för val av jordar för urlakningsstudier
|
Jord nr
|
pH-värde
|
Organiskt kol
%
|
Lerhalt
%
|
Textur (56)
|
|
1
|
> 7,5
|
3,5–5,0
|
20–40
|
clay loam
|
|
2
|
5,5–7,0
|
1,5–3,0
|
15–25
|
silt loam
|
|
3
|
4,0–5,5
|
3,0–4,0
|
15–30
|
loam
|
|
4
|
< 4,0–6,0 (57)
|
< 0,5–1,5 (57)
(58)
|
< 10–15 (57)
|
loamy sand
|
|
5
|
< 4,5
|
> 10 (59)
|
< 10
|
loamy sand/sand
|
|
|
27.
|
Det kan ibland vara nödvändigt att använda andra jordtyper för att representera svalare, tempererade och tropiska regioner. Om andra jordtyper väljs ska de karakteriseras med samma parametrar och ha liknande variationer i fråga om de egenskaper som beskrivs i vägledningen för val av jordar för urlakningsstudier (se tabell 1 ovan), även om de inte behöver motsvara kriterierna exakt.
|
|
28.
|
För urlakningsstudier med ’åldrade rester’ bör en enda jord användas (12). Den bör ha en sandhalt på > 70 % och en organisk kolhalt på 0,5–1,5 % (t.ex. jord nr 4 i tabell 1). Man kan behöva använda fler jordtyper om data rörande omvandlingsprodukter är viktiga.
|
|
29.
|
All jord bör karakteriseras åtminstone med avseende på textur (% sand, % silt, % lera enligt FAO:s och USDA:s klassificeringssystem (14)), pH, katjonbyteskapacitet, halt organiskt kol, bulktäthet (för störda jordar) och vattenhållningskapacitet. Mätning av den mikrobiella biomassan krävs endast för jord som används i åldrandet/inkubationstiden som föregår experimentet med åldrad urlakning. Ytterligare information om jordens egenskaper (t.ex. jordmånsklassificering, lermineralogi, särskild ytarea) kan vara användbar för tolkningen av de erhållna resultaten i denna studie. För bestämning av jordens egenskaper kan de metoder som rekommenderas i hänvisningarna (15), (16), (17), (18) (19) användas.
|
Insamling och lagring av jordprover
|
30.
|
Jorden bör tas från det översta lagret (horisont A) till ett maximidjup på 20 cm. Rester av vegetation, makrofauna och stenar avlägsnas. Jordarna (utom de som används för att åldra testkemikalien) lufttorkas vid rumstemperatur (helst 20–25 °C). Finfördelningen ska göras så varsamt som möjligt för att minimera förändringarna i jordens ursprungliga textur. Jordarna sållas genom en < 2 mm sikt. Omsorgsfull homogenisering rekommenderas eftersom resultatens reproducerbarhet då förbättras. Före användning kan jorden förvaras vid omgivande temperatur och ska hållas lufttorkad (12). Det finns ingen rekommenderad gräns för hur länge jorden bör lagras, men jordprover som lagrats i mer än tre år före användning bör analyseras på nytt med avseende på halten av organiskt kol och pH-värdet.
|
|
31.
|
Detaljerad information om insamlingsplatsernas historia bör finnas tillgänglig. Upplysningarna bör omfatta det exakta läget (anges exakt med UTM-koordinater (Universal Transversal Mercator-Projection/European Horizontal Datum) eller geografiska koordinater), vegetationstäcke, behandlingar med växtskyddskemikalier, behandlingar med organiska och oorganiska gödselmedel, tillförsel av biologiska material eller oavsiktlig förorening (12). Om jorden har behandlats med testkemikalien eller ett strukturellt analogt ämne inom de fyra senaste åren bör den inte användas för undersökningar rörande urlakning.
|
Testbetingelser
|
32.
|
Under testperioden bör urlakningskolonnerna med jord förvaras i mörker vid samma temperatur som omgivningen förutsatt att denna temperatur hålls inom ± 2 °C. Rekommenderad temperatur är mellan 18 och 25 °C.
|
|
33.
|
Konstgjort regn (0,01 M CaCl2) bör tillföras kontinuerligt på jordytan i kolonnerna med en mängd på 200 mm under en period på 48 timmar (60). Denna volym motsvarar en tillsats av 251 ml i en kolonn med en innerdiameter på 4 cm. Om det krävs för testsyftet kan andra volymer artificiellt regn och längre varaktighet dessutom användas.
|
Testförfarande
Urlakning med ursprunglig testkemikalie
|
34.
|
Minst två urlakningskolonner packas med obehandlad, lufttorkad och siktad jord (< 2 mm) upp till en höjd av ca 30 cm. För att uppnå enhetlig packning bör jorden tillsättas kolonnerna i små portioner med en sked och pressas med en kolv under samtidig vibrering av kolonnerna till dess att jordkolonnens yta inte sjunker ytterligare. Det krävs att packningen är enhetlig för att man ska uppnå reproducerbara resultat från urlakningskolonnerna. För närmare information om kolonnpackningsmetoder, se hänvisningarna (20), (21) och (22). För att kontrollera packningsförfarandets reproducerbarhet fastställs den totala vikten av den jord som packats i kolonnerna (61). Duplikatkolonnerna bör ha liknande vikt.
|
|
35.
|
Efter packningen förhandsfuktas kolonnerna med artificiellt regn (0,01 M CaCl2) nedifrån och upp för att vattnet ska tränga bort luften i jordens porer. Därefter får jordkolonnerna stå och stabiliseras, och överflödigt vatten får rinna av med hjälp av gravitationen. Olika metoder för kolonnmättnad granskas i hänvisning (23).
|
|
36.
|
Efter detta appliceras testkemikalien och referenskemikalien på jordkolonnerna (se även punkterna 23–25). För att erhålla en homogen fördelning av lösningarna, suspensionerna eller emulsionerna av test- och/eller referenskemikalien bör dessa anbringas jämnt fördelade över jordkolonnernas yta. Om det rekommenderas att testkemikalien appliceras genom nedblandning i jorden bör den blandas ner i små mängder (t.ex. 20 g) jord och läggas till på jordkolonnens yta.
|
|
37.
|
Jordkolonnernas ytor täcks sedan med en sintringsplatta av glas, glaspärlor, glasfiberfilter eller ett runt filterpapper för att det artificiella regnet ska fördelas jämnt över hela ytan och för att undvika att regndropparna stör jordytan. Ju större kolonndiametern är desto försiktigare måste man vara när man tillför det artificiella regnet i jordkolonnerna för att säkerställa en jämn fördelning av det artificiella regnet över markytan. Därefter tillförs det artificiella regnet droppvis till jordkolonnerna med hjälp av en kolv eller en peristaltisk pump eller en dropptratt. Helst bör lakvattnet samlas in i delar och deras respektive volymer registreras (62).
|
|
38.
|
Efter urlakning och dränering av kolonnerna delas de upp i ett lämpligt antal segment beroende på den information man önskar få ifrån undersökningen. Segmenten extraheras därefter med lämpliga lösningsmedel eller lösningsmedelsblandningar och analyseras med avseende på testkemikalien och, om tillämpligt, med avseende på omvandlingsprodukter, total radioaktivitet och referenskemikalien. Lakvattnet eller lakvattensfraktionerna analyseras direkt eller efter extraktionen med avseende på samma produkter. När radioaktivt märkta testkemikalier används bör alla fraktioner som innehåller ≥ 10 % av den tillförda radioaktiviteten identifieras.
|
Urlakning med åldrade rester
|
39.
|
Färsk jord (inte jord som tidigare lufttorkats) behandlas med en volym av den radioaktivt märkta testkemikalien som motsvarar ytarealen i jordkolonnerna (se punkt 24) och inkuberas under aeroba förhållanden i enlighet med testmetod C.23 (13). Inkubationstiden (åldringsperioden) bör vara så lång att betydande mängder omvandlingsprodukter hinner bildas. En åldringsperiod på testkemikaliens halveringstid rekommenderas (63), men den bör inte överstiga 120 dagar. Före urlakningen analyseras den åldrade jorden med avseende på testkemikalien och dess omvandlingsprodukter.
|
|
40.
|
Urlakningskolonnerna packas upp till en höjd av 28 cm med samma jord (fast lufttorkad) som används i åldringsförsöket enligt beskrivning i punkt 34, och vikten av de packade jordkolonnerna totalt bestäms också. Jordkolonnerna förhandsfuktas sedan enligt beskrivningen i punkt 35.
|
|
41.
|
Därefter appliceras testämnet och dess omvandlingsprodukter på jordytan i kolonnerna i form av åldrade rester i jord (se punkt 39) i ett 2 cm jordskikt. Jordkolonnernas totala höjd (obehandlad jord + åldrad jord) bör helst inte överskrida 30 cm (se punkt 34).
|
|
42.
|
Urlakningen utförs enligt beskrivning i punkt 37.
|
|
43.
|
Efter urlakningen analyseras jordsegmenten och lakvattnet på det sätt som anges i tabellen i punkt 38 med avseende på testkemikalien, dess omvandlingsprodukter och icke-extraherbara radioaktivitet. För att fastställa hur mycket av åldrade rester som finns kvar i det översta 2 cm tjocka lagret efter urlakningen bör detta skikt analyseras separat.
|
DATA OCH RAPPORTERING
Behandling av resultaten
|
44.
|
Mängden testkemikalie, omvandlingsprodukter, icke-extraherbar radioaktivitet och, i förekommande fall, referenskemikalie bör anges som en procentandel av initialdosen för varje jordsegment och lakvattensfraktion. En grafisk presentation bör tillhandahållas för varje kolonn i vilken procentandelarna som erhållits plottas som en funktion av jordskiktens djup.
|
|
45.
|
När en referenskemikalie ingår i dessa kolonnurlakningsstudier kan urlakningen av en kemikalie utvärderas på en relativ skala med hjälp av relativa rörlighetsfaktorer (RMF, för definition se tillägg 3) (1) (11) som möjliggör en jämförelse av urlakningsdata för olika kemikalier som erhållits med olika jordtyper. Exempel på RMF-värden för olika växtskyddskemikalier anges i tillägg 3.
|
|
46.
|
Uppskattningar av Koc (den normaliserade adsorptionskoefficienten för organiskt kol) och Kom (den normaliserade fördelningskoefficienten för organiskt material) kan också erhållas utifrån kolonnurlakningsresultat med hjälp av genomsnittligt urlakningsavstånd eller fastställda samband mellan RMF och Koc respektive Kom (4), eller genom tillämpning av enkel kromatografisk teori (24). Den senare metoden bör dock användas med försiktighet, framför allt med tanke på att urlakningsprocessen inte endast gäller mättade flödesförhållanden, utan snarare omättade system.
|
Tolkning av resultaten
|
47.
|
Kolonnurlakningsstudierna som beskrivs i denna metod det möjligt att fastställa testkemikaliens urlaknings- eller rörlighetspotential i jord (i den ursprungliga urlakningsstudien) och/eller dess omvandlingsprodukter (i studien om urlakning av åldrade rester). Dessa tester tillhandahåller inte en kvantitativ prognos för urlakningsprocesser under fältförhållanden, men de kan användas för att jämföra ’lakbarheten’ av en kemikalie med andra kemikalier vars urlakningsbeteende kan vara känt (24). På samma sätt mäter de inte kvantitativt procentandelen av den tillförda mängden kemikalie som kan nå grundvattnet (11). Resultaten av kolonnurlakningsstudier kan dock vara till hjälp för att avgöra om ytterligare studier under fältliknande förhållanden och fälttester måste utföras för kemikalier som uppvisar en hög rörlighetspotential i laboratorietester.
|
Testrapport
|
48.
|
Rapporten ska innehålla följande:
|
|
Testkemikalie och referenskemikalie (i förekommande fall):
|
—
|
trivialnamn, kemisk beteckning (IUPAC- och CAS-namn), CAS-nummer, kemisk struktur (med angivelse av märkningsposition om radioaktivt märkt material används) och relevanta fysikalisk-kemiska egenskaper,
|
|
—
|
testkemikaliens renhet (orenheter i testkemikalien),
|
|
—
|
strålningskemisk renhet hos märkta kemikalier och specifik aktivitet (i tillämpliga fall).
|
|
|
|
Testjord:
|
—
|
uppgifter om provtagningsstället,
|
|
—
|
jordens egenskaper, såsom pH, halten organiskt kol och lera, textur och skrymdensitet (för störd jord),
|
|
—
|
jordens mikrobiella aktivitet (endast för jord som används för åldring av testkemikalien),
|
|
—
|
hur länge jorden har lagrats och lagringsbetingelserna.
|
|
|
|
Testbetingelser:
|
—
|
datum för utförandet av studierna,
|
|
—
|
urlakningskolonnernas längd och diameter,
|
|
—
|
jordens totala vikt i jordkolonnerna,
|
|
—
|
mängden testkemikalie och, i förekommande fall, referenskemikalie som applicerats,
|
|
—
|
mängd, frekvens och varaktighet för tillförsel av artificiellt regn,
|
|
—
|
antal replikat (minst två),
|
|
—
|
metoder för analys av testkemikalien, omvandlingsprodukterna och, i förekommande fall, referenskemikalien i de olika jordsegmenten och lakvattnen,
|
|
—
|
metoder för karakterisering och identifiering av omvandlingsprodukter i jordsegmenten och i lakvattnet.
|
|
|
|
Testresultat:
|
—
|
tabeller med resultaten uttryckta som koncentrationer och procentandelar av den tillförda dosen för jordsegment och lakvatten,
|
|
—
|
massbalans, om så är lämpligt,
|
|
—
|
urlakningsavstånd och, i förekommande fall, relativa rörlighetsfaktorer,
|
|
—
|
grafisk avbildning av de erhållna procentandelarna i jordsegmenten mot respektive jordsegments djup,
|
|
—
|
diskussion och tolkning av resultaten.
|
|
|
LITTERATUR
|
(1)
|
Guth, J. A., Burkhard, N. och Eberle, D. O. (1976). Experimental Models for Studying the Persistence of Pesticides in Soil. Proc. BCPC Symposium: Persistence of Insecticides and Herbicides.
|
|
(2)
|
Russel, M. H. (1995). Recommended approaches to assess pesticide mobility in soil. I Progress in Pesticide Biochemistry and Toxicology, Vol. 9: Environmental Behaviour of Agrochemicals – T. R. Roberts och P. C. Kearney, red.). J. Wiley & Sons.
|
|
(3)
|
Briggs, G. G. (1981). Theoretical and experimental relationships between soil adsorption, octanol-water partition coefficient, water solubilities, bioconcentration factors, and the parachor. J. Agric. Food Chem. 29, 1050–1059.
|
|
(4)
|
Chiou, C. T., Porter, P. E. och Schmedding, D. W. (1983). Partition equilibria of non-ionic organic compounds between soil organic matter and water. Environ. Sci. Technol. 17, 227–231.
|
|
(5)
|
Guth, J. A. (1983). Untersuchungen zum Verhalten von Pflanzenschutzmitteln im Boden. Bull. Bodenkundliche Gesellschaft Schweiz 7, 26–33.
|
|
(6)
|
US-Environmental Protection Agency (1982). Pesticide Assessment Guidelines, Subdivision N. Chemistry: Environmental Fate.
|
|
(7)
|
Agriculture Canada (1987). Environmental Chemistry and Fate Guidelines for registration of pesticides in Canada.
|
|
(8)
|
Bilaga I till kommissionens direktiv 95/36/EG av den 14 juli 1995 om ändring av rådets direktiv 91/414/EEG om utsläppande av växtskyddsprodukter på marknaden, EGT L 172, 22.7.1995, s. 8.
|
|
(9)
|
Dutch Commission for Registration of Pesticides (1991). Application for registration of a pesticide. Section G: Behaviour of the product and its metabolites in soil, water and air.
|
|
(10)
|
BBA (1986). Richtlinie für die amtliche Prüfung von Pflanzenschutzmitteln, Teil IV, 4-2. Versickerungsverhalten von Pflanzenschutzmitteln.
|
|
(11)
|
SETAC (1995). Procedures for Assessing the Environmental Fate and Ecotoxicity of Pesticides. Mark R. Lynch, red.
|
|
(12)
|
OECD (1995). Final Report of the OECD Workshop on Selection of Soils/Sediments. Belgirate, Italien, 18–20 januari 1995.
|
|
(13)
|
Följande kapitel i denna bilaga:
|
|
Kapitel A.6, Vattenlöslighet
|
|
|
Kapitel A.8, Fördelningskoefficient, skakkolvmetoden
|
|
|
Kapitel A.24, Fördelningskoefficient, HPLC-metoden
|
|
|
Kapitel C.7, Nedbrytning – abiotisk nedbrytning: hydrolys som funktion av pH.
|
|
|
Kapitel C.18, Bestämning av adsorption och desorption i jord vid jämvikt i uppslammat jordprov
|
|
|
Kapitel C.23, Aerob och anaerob omvandling i jord
|
|
|
(14)
|
Soil Texture Classification (US and FAO systems). Weed Science, 33, Suppl. 1 (1985) and Soil Sci. Soc. Amer. Proc. 26, 305 (1962).
|
|
(15)
|
Methods of Soil Analysis (1986). Part 1, Physical and Mineralogical Methods (A. Klute, red.). Agronomy Series No. 9, andra upplagan.
|
|
(16)
|
Methods of Soil Analysis (1982). Part 2, Chemical and Microbiological Properties (A. L. Page, R. H. Miller och D. R. Kelney, red.). Agronomy Series No. 9, andra upplagan.
|
|
(17)
|
ISO Standard Compendium Environment (1994). Soil Quality – General aspects; chemical and physical methods of analysis; biological methods of analysis. Första upplagan.
|
|
(18)
|
Mückenhausen, E. (1975). Die Bodenkunde und ihre geologischen, geomorphologischen, mineralogischen und petrologischen Grundlagen. DLG-Verlag, Frankfurt/Main.
|
|
(19)
|
Scheffer, F. och Schachtschabel, P. (1998). Lehrbuch der Bodenkunde. F. Enke Verlag, Stuttgart.
|
|
(20)
|
Weber, J. B. och Peeper, T. F. (1977). I Research Methods in Weed Science, andra upplagan (B. Truelove, red.). Soc. Weed Sci., Auburn, Alabama, 73–78.
|
|
(21)
|
Weber, J. B., Swain, L. R., Strek, H. J. och Sartori, J. L. (1986). I Research Methods in Weed Science, tredje upplagan (N.D. Camper, red.). Soc. Weed Sci., Champaign, IL, 190–200.
|
|
(22)
|
Oliveira, m.fl. (1996). Packing of sands for the production of homogeneous porous media. Soil Sci. Soc. Amer. J. 60(1): 49–53.
|
|
(23)
|
Shackelford, C. D. (1991). Laboratory diffusion testing for waste disposal. – A review. J. Contam. Hydrol. 7, 177–217.
|
|
(24)
|
(Hamaker, J. W. (1975). Interpretation of soil leaching experiments. I Environmental Dynamics of Pesticides (R. Haque, V. H. Freed, red.), 115–133. Plenum Press, New York.
|
|
(25)
|
OECD (1981). Dissociation constants in water. OECD Guideline for Testing of Chemicals, No. 4112, OECD, Paris
|
Tillägg 1
Definitioner och enheter
Åldrade rester i jord
: Testkemikalie och omvandlingsprodukter som finns i jorden efter applicering och efter en period som är tillräckligt lång för att göra det möjligt för transport-, adsorptions- och dissipationsprocesser samt metaboliska processer att ändra fördelningen av och de kemiska egenskaperna hos en del av den applicerade kemikalien (1).
Artificiellt regn
: 0,01 M CaCl2-lösning i destillerat eller avjonat vatten.
Genomsnittligt urlakningsavstånd
: Undre delen av jordsektionen där det kumulativa kemikalieutbytet = 50 % av utbytet för testkemikalien totalt [normalt urlakningsexperiment], eller (undre delen av jordsektionen där det kumulativa kemikalieutbytet = 50 % av utbytet för testkemikalien totalt) – ((tjockleken på skiktet med åldrade rester)/2) [studie av urlakning av åldrade rester]
Kemikalie
: ett ämne eller en blandning.
Lakvatten
: Vätskefas som filtrerats genom en jordprofil eller en jordkolonn (1).
Urlakning
: Process genom vilken en kemikalie flyttas nedåt genom markprofilen eller en kolonn (1).
Urlakningsavstånd
: Det djupaste jordsegment i vilket ≥ 0,5 % av den applicerade testkemikalien eller åldrade rester konstaterades efter utlakningsprocessen (motsvarande penetrationsdjup).
Detektionsgräns (LOD) och kvantifieringsgräns (LOQ)
: Detektionsgränsen (LOD) är den koncentration av en kemikalie under vilken kemikalien inte kan särskiljas från analytiska artefakter. Kvantifieringsgränsen (LOQ) är den koncentration av en kemikalie under vilken koncentrationen inte kan bestämmas med tillräcklig noggrannhet.
RMF relativ rörlighetsfaktor
: (urlakningsavstånd för testkemikalien (cm))/(urlakningsavstånd för referenskemikalien (cm)
Testkemikalie
: alla ämnen eller blandningar som testas med denna testmetod
Omvandlingsprodukt
: Alla kemikalier som uppstår till följd av testkemikaliens biotiska eller abiotiska omvandlingsreaktioner, inbegripet CO2 och produkter som är bundna i rester.
Jord
: En blandning av mineraliska och organiska kemiska beståndsdelar i vilken små (huvudsakligen mikroskopiska) organismer lever. De kemiska beståndsdelarna består av föreningar med hög kol- och kvävehalt samt hög molekylvikt. Jord kan hanteras i två olika tillstånd:
|
—
|
ostörd, såsom den har utvecklats under tidens gång, i karakteristiska skikt med ett flertal olika jordtyper,
|
|
—
|
störd, vilket normalt gäller för odlad mark eller när jordprover tas genom grävning och därefter undersöks med denna testmetod (2).
|
|
(1)
|
Holland, P. T. (1996). Glossary of Terms Relating to Pesticides. IUPAC Reports on Pesticide (36). Pure & Appl. Chem. 68, 1167–1193.
|
|
(2)
|
OECD Test Guideline 304 A: Inherent Biodegradability in Soil (antagen 12 maj 1981).
|
Tillägg 2
Figur 1
Exempel på icke-delbara urlakningskolonner av glas
med en längd på 35 cm och en innerdiameter på 5 cm (1)

|
(1)
|
Drescher, N. (1985). Moderner Acker- und Pflanzenbau aus Sicht der Pflanzenschutzmittelindustrie. In Unser Boden – 70 Jahre Agrarforschung der BASF AG, 225–236. Verlag Wissenschaft und Politik, Köln.
|
Figur 2
Exempel på en delbar metallkolonn med 4 cm innerdiameter (1)

|
(1)
|
Burkhard, N., Eberle D. O. och Guth, J. A. (1975). Model systems for studying the environmental behaviour of pesticides. Environmental Quality and Safety, Suppl. Vol. III, 203–213.
|
Tillägg 3
Exempel på relativa rörlighetsfaktorer
(64)
(RMF) för olika växtskyddskemikalier (1) (2) och motsvarande rörlighetsklasser
(66)
|
RMF-intervall
|
Kemikalie (RMF)
|
Rörlighetsklass
|
|
≤ 0,15
|
Paration (< 0,15), fluorodifen (0,15)
|
I
orörlig
|
|
0,15–0,8
|
Profenofos (0,18), propikonazol (0,23), diazinon (0,28), diuron (0,38), terbutylazin (0,52), metidation (0,56), prometryn (0,59), propazin (0,64), alaklor (0,66), metolaklor (0,68)
|
II
något rörlig
|
|
0,8–1,3
|
Monuron (65) (1,00), atrazin (1,03), simazin (1,04), fluometuron (1,18)
|
III
måttligt rörlig
|
|
1,3–2,5
|
Prometon (1,67), cyanazin (1,85), bromacil (1,91), karbutilat (1,98)
|
IV
ganska rörlig
|
|
2,5–5,0
|
Karbofuran (3,00), dioxakarb (4,33)
|
V
rörlig
|
|
> 5,0
|
Monokrotofos (> 5,0), dikrotofos (> 5,0)
|
VI
mycket rörlig
|
|
(1)
|
Guth, J. A. (1985). Adsorption/desorption. I Joint International Symposium ’Physicochemical Properties and their Role in Environmental Hazard Assessment.’ Canterbury, Storbritannien, 1–3 juli 1985.
|
|
(2)
|
Guth, J. A. och Hörmann, W. D. (1987). Problematik und Relevanz von Pflanzenschutzmittel-Spuren im Grund (Trink-) Wasser. Schr.Reihe Verein WaBoLu, 68, 91–106.
|
|
(3)
|
Harris, C. I. (1967). Movement of herbicides in soil. Weeds 15, 214–216.
|
|
(4)
|
Helling, C. S. (1971). Pesticide mobility in soils. Soil Sci. Soc. Am. Proc. 35, 743–748.
|
|
(5)
|
McCall, P. J., Laskowski, D. A., Swann, R. L. och Dishburger, H. J. (1981). Measurements of sorption coefficients of organic chemicals and their use in environmental fate analysis. I Test Protocols for Environmental Fate and Movement of Toxicants. Proceedings of AOAC Symposium, AOAC, Washington D.C.
|
|
(6)
|
Hollis, J. M. (1991). Mapping the vulnerability of aquifers and surface waters to pesticide contamination at the national/regional scale. BCPC Monograph No. 47 Pesticides in Soil and Water, 165–174.
|
C.45. UPPSKATTNING AV UTSLÄPP FRÅN TRÄSKYDDSBEHANDLAT VIRKE TILL MILJÖN: LABORATORIEMETOD FÖR TRÄBASERADE RÅVAROR SOM INTE ÄR TÄCKTA OCH SOM ÄR I KONTAKT MED SÖTVATTEN ELLER HAVSVATTEN
INLEDNING
|
1.
|
Denna testmetod motsvarar OECD:s testriktlinje (TG) 313 (2007). Utsläppen från träskyddsbehandlat virke till miljön måste kvantifieras för att möjliggöra en miljöriskbedömning av behandlat trä. Genom denna testmetod beskrivs en laboratoriemetod för uppskattning av utsläpp från träskyddsbehandlat virke i två situationer där utsläpp kan komma ut i miljön:
|
—
|
Utsläpp från behandlat trä som är i kontakt med sötvatten. Utsläpp från ytan av det behandlade träet kan komma ut i vattnet.
|
|
—
|
Utsläpp från behandlat trä som är i kontakt med havsvatten. Utsläpp från ytan av det behandlade träet kan komma ut i havsvattnet.
|
|
|
2.
|
Denna testmetod är avsedd för testning av utsläpp från trä och trävaror som inte är täckta och som är i kontakt med sötvatten eller havsvatten. Användningsklasserna används internationellt och kategoriserar den biologiska fara som den behandlade varan kommer att utsättas för. Användningsklasserna definierar även den situation i vilken den behandlade varan används och fastställer de delar av miljön (luft, vatten, jord) som potentiellt är utsatta för den risk som det träskyddsbehandlade virket utgör.
|
|
3.
|
Testmetoden är ett laboratorieförfarande genom vilket man erhåller prov (emissat) från vatten som används för att indränka behandlat trä, under allt längre tidsintervall efter exponeringen. Mängden utsläpp i emissatet relateras till träets ytarea och exponeringens varaktighet, vilket gör att man erhåller ett flödesvärde i mg/m2/dag. Flödet (urlakningen) efter förlängda exponeringstider kan därmed uppskattas.
|
|
4.
|
Mängden utsläpp kan användas i en miljöriskbedömning av behandlat virke.
|
INLEDANDE ÖVERVÄGANDEN
|
5.
|
Mekanismen för urlakning från träets yta i sötvatten antas inte vara identisk till sin natur och grad med urlakning från en träyta i havsvatten. För träskyddsmedel eller blandningar som används för behandling av trä som används i havsvattenmiljöer är det därför nödvändigt att genomföra en urlakningsstudie för havsvatten.
|
|
6.
|
Träet, när det gäller trä som behandlats med träskyddsmedel, bör vara representativt för trä som används kommersiellt. Det bör behandlas i enlighet med träskyddsmedeltillverkarens instruktioner och i enlighet med lämpliga standarder och specifikationer. Parametrarna för efterbehandlingskonditioneringen av träet innan testets början bör anges.
|
|
7.
|
De virkesprover som används bör vara representativa för de råvaror som används (t.ex. med avseende på art, täthet och andra egenskaper).
|
|
8.
|
Testet kan tillämpas på trä med hjälp av en invasiv process eller ytlig applicering eller på behandlat trä som har en ytterligare obligatorisk ytbehandling (t.ex. färg som appliceras som krav för kommersiellt bruk).
|
|
9.
|
Vattnets sammansättning, mängd, pH och fysikaliska form är viktiga för fastställandet av kvantiteten, innehållet och karaktären av utsläppen från träprodukter.
|
PRINCIP FÖR TESTMETODEN
|
10.
|
Provexemplar av behandlat trä doppas i vatten. Vattnet (emissatet) samlas in och analyseras kemiskt flera gånger under exponeringsperioden i tillräcklig utsträckning för att man ska kunna utföra statistiska beräkningar. Utsläpp i mg/m2/dag beräknas utifrån analysresultaten. Provtagningsperioderna bör registreras. Tester med obehandlade prover kan avbrytas om inget bakgrundsvärde konstateras i de tre första datapunkterna.
|
|
11.
|
Att testet omfattar provexemplar av obehandlat trä gör det möjligt att fastställa bakgrundsnivåerna för emissat från virket annat än de träskyddsmedel som används.
|
KVALITETSKRITERIER
Noggrannhet
|
12.
|
Testmetodens noggrannhet när det gäller att uppskatta utsläpp beror på om provexemplaren är representativa för kommersiellt behandlat trä, hur representativt vattnet är för naturligt vatten och hur representativa exponeringsförhållandena är för naturliga förhållanden.
|
|
13.
|
Analysmetodens noggrannhet, precision och repeterbarhet bör fastställas före testet.
|
Reproducerbarhet
|
14.
|
Tre vattenprover samlas in och analyseras, och medelvärdet fastställs som utsläppsvärdet. Reproducerbarheten för resultaten inom ett och samma laboratorium och mellan olika laboratorier och beror på doppningsprocessen och det trä som används som provexemplar.
|
Godtagbar variationsvidd för resultaten
|
15.
|
Variationsvidden för resultaten från detta test är godtagbar om det högsta och lägsta värdet inte varierar med mer än en storleksordning.
|
TESTBETINGELSER
Vatten
|
16.
|
Urlakningsscenarier för sötvatten: avjonat vatten (t.ex. ASTM D 1193 typ II) rekommenderas för användning i laktester när trä som utsätts för sötvatten ska bedömas. Vattentemperaturen ska vara 20 ± 2 °C och pH-värdet och vattentemperaturen ska inkluderas i testrapporten. En analys av vattenprover tagna innan doppbehandlingen av provexemplaren gör det möjligt att uppskatta de analyserade kemikalierna i vattnet. Denna kontroll fastställer bakgrundsnivåerna för kemikalier som sedan analyseras kemiskt.
|
|
17.
|
Urlakningsscenarier för havsvatten: syntetiskt havsvatten (t.ex. ASTM D 1141 Substitute Ocean Water, without Heavy Metals) rekommenderas för användning i laktester när trä som utsätts för havsvatten ska bedömas. Vattentemperaturen ska vara 20 ± 2 °C och pH-värdet och vattentemperaturen ska inkluderas i testrapporten. En analys av vattenprover tagna innan doppbehandlingen av provexemplaren gör det möjligt att uppskatta de analyserade kemikalierna i vattnet. Denna kontroll fastställer bakgrundsnivåerna för de kemikalier som är av betydelse.
|
Virkesprover
|
18.
|
Träslagen bör vara typiska för de träslag som används för effektivitetstester av träskyddsmedel. Rekommenderade arter är Pinus sylvestris L. (tall), Pinus resinosa Ait. (rödtall) eller Pinus spp. (Southern Pine [långbarrig tall, loblollytall m.fl.]). Ytterligare tester kan göras med andra arter.
|
|
19.
|
Man bör använda virke med rak ådring och utan kvistar. Trä med hartsliknande utseende bör undvikas. Träet ska vara typiskt för kommersiellt tillgängligt virke. Källan, tätheten och antalet årsringar per 10 mm bör registreras.
|
|
20.
|
Det rekommenderas att virkesproverna utgörs av uppsättningar om fem klossar med storlek i enlighet med EN 113 (25 mm × 50 mm × 15 mm) och med de längsgående sidorna parallella med ådringen, men andra dimensioner, t.ex. 50 mm x 150 mm x 10 mm, kan också användas. Provexemplaren ska nedsänkas helt i vattnet. Provexemplaren ska bestå av 100 % splintved. Varje prov ska vara märkt individuellt så att det kan identifieras genom hela testet.
|
|
21.
|
Alla provexemplar ska vara hyvlade eller sågade jämna, och ytorna bör inte vara slipade.
|
|
22.
|
Antalet uppsättningar virkesprover som används för analysen är minst fem: tre provuppsättningar behandlas med träskyddsmedel, en provuppsättning är obehandlad och en provuppsättning används för uppskattningen av fukthalten i ugnstorkade provexemplar före behandlingen. Ett tillräckligt antal provexemplar förbereds för att man ska kunna välja ut tre uppsättningar som ligger inom 5 % av medelvärdet för upptagningen av träskyddsmedel för hela samlingen av provexemplar.
|
|
23.
|
Ändträet på alla provexemplar förseglas med en kemikalie som hindrar inträngning av träskyddsmedel i ändträet eller förhindrar urlakning från provexemplaren via ändträet. När det gäller förseglingen av ändträet är det nödvändigt att skilja mellan exemplar som används för ytapplicering och exemplar som används för impregneringsprocesser. Förseglingen av ändträet ska göras före behandlingen endast när det gäller ytapplicering.
|
|
24.
|
Ändträet måste vara öppet för behandlingar med impregneringsprocesser. Därför ska provexemplarens ändträ förseglas i slutet av konditioneringsperioden. Utsläppen ska endast uppskattas för den längsgående ytan. Förseglingarna ska kontrolleras och vid behov förnyas innan urlakningen påbörjas, och bör inte förnyas efter urlakningen har påbörjats.
|
Doppbehållare
|
25.
|
Behållaren består av ett inert material och är tillräckligt stor för att rymma fem provexemplar av storleken EN 113 i 500 ml vatten, vilket ger ett förhållande mellan ytarean och vattenvolymen på 0,4 cm2/ml.
|
Ställning för provexemplaren
|
26.
|
Provexemplaren ska ligga på en ställning som gör att alla exponerade ytor på provexemplaret är i kontakt med vattnet.
|
FÖRFARANDE FÖR BEHANDLING MED TRÄSKYDDSMEDEL
Förberedelse av de behandlade provexemplaren
|
27.
|
Virkesprovet som ska behandlas med träskyddsmedel under testet behandlas med den metod som anges för träskyddsmedlet, vilket kan vara en impregneringsbehandling eller en ytbehandling som kan antingen utgöras av doppning, sprejning eller pensling.
|
Träskyddsmedel som appliceras genom impregnering
|
28.
|
Bered en lösning av träskyddsmedlet som kan uppnå den angivna upptagningen när den appliceras genom en impregneringsbehandling. Virkesprovet vägs och dess dimensioner mäts. Impregneringsbehandlingen bör vara såsom specificeras för applicering av träskyddsmedlet på virke för användning i användningsklass 4 eller 5. Provexemplaret vägs igen efter behandlingen och upptagningen av träskyddsmedlet (kg/m3) beräknas enligt följande ekvation:

|
|
29.
|
Observera att virke som behandlats i industriella impregneringsverk (t.ex. genom vakuumtryckimpregnering) kan användas i detta test. De förfaranden som används bör registreras och upptagningen i materialet som har behandlats på detta sätt ska analyseras och registreras.
|
Träskyddsmedel som appliceras genom ytbehandling
|
30.
|
Ytappliceringsprocessen omfattar doppning, sprejning eller pensling av virkesproverna. Processen och appliceringsgraden (t.ex. liter/m2) bör vara såsom specificeras för ytapplicering av skyddsmedlet.
|
|
31.
|
Notera i detta fall också att man kan använda trä som har behandlats i industriella impregneringsverk i detta test. De förfaranden som används bör registreras och upptagningen i materialet som har behandlats på detta sätt ska analyseras och registreras.
|
Konditionering av provexemplaren efter behandlingen
|
32.
|
Efter behandling bör de behandlade provexemplaren konditioneras i enlighet med rekommendationerna från leverantören av testskyddsmedlet enligt skyddsmedlets märkeskrav eller enligt kommersiell behandlingspraxis eller i enlighet med standard EN 252.
|
Beredning och urval av provexemplar
|
33.
|
Efter avslutad konditionering beräknas medelvärdet för provexemplargruppens upptagning, och tre representativa uppsättningar provexemplar med en upptagning på inom 5 % av gruppens medelvärde väljs ut slumpmässigt för mätning av urlakningen.
|
FÖRFARANDE FÖR MÄTNINGAR AV TRÄSKYDDSMEDELSUTSLÄPP
Doppmetoden
|
34.
|
Testexemplaren vägs och nedsänks därefter helt i vattnet, och datum och tidpunkt registreras. Behållaren täcks för att minska avdunstningen.
|
|
35.
|
Vattnet byts ut vid följande tidpunkter: 6 timmar, 1 dag, 2 dagar, 4 dagar, 8 dagar, 15 dagar, 22 dagar, 29 dagar (obs! detta är totala tider, inte intervallens längd). Tid och datum för vattenbyte och massan av det vatten som återfås från behållaren ska registreras.
|
|
36.
|
Efter varje vattenbyte behåller man ett vattenprov i vilket man har doppat uppsättningen provexemplar för påföljande kemisk analys.
|
|
37.
|
Provtagningsförfarandet möjliggör beräkning av profilen för mängden utsläpp mot tiden. Proven ska förvaras under förhållanden som bevarar analyten, t.ex. i ett kylskåp i mörker för att minska den mikrobiella tillväxten i provet före analys.
|
UTSLÄPPSMÄTNINGAR
Behandlade prover
|
38.
|
Det insamlade vattnet analyseras kemiskt med avseende på det verksamma ämnet och/eller dithörande nedbrytnings- och omvandlingsprodukter, om så är lämpligt.
|
Obehandlade prover
|
39.
|
Uppsamling av vatten (emissat) i detta system och därpå följande analys av kemikalier som har urlakats från de obehandlade virkesproverna gör det möjligt att uppskatta utsläppsmängden träskyddsmedel från obehandlat virke. Insamling och analys av emissatet efter ökande exponeringstider gör det möjligt att uppskatta förändringar i utsläppsmängden över tiden. Denna analys är ett kontrollförfarande som fastställer bakgrundsnivåerna av testkemikalien i obehandlat trä för att bekräfta att det virke som används som källa för proven inte tidigare har behandlats med träskyddsmedel.
|
DATA OCH RAPPORTERING
Kemiska analyser
|
40.
|
Det uppsamlade vattnet analyseras kemiskt och resultatet från vattenanalysen uttrycks i lämpliga enheter, t.ex. μg/l.
|
Datarapportering
|
41.
|
Alla resultat ska registreras. I tillägget visas ett exempel på ett förslag till formulär för registrering av en uppsättning behandlade provexemplar, och en sammanfattande tabell för beräkning av de genomsnittliga utsläppsvärdena under varje provtagningsintervall.
|
|
42.
|
Det dagliga utsläppsflödet i mg/m2/dag beräknas genom att man tar medelvärdet för de tre mätningarna från de tre replikaten och dividerar det med antalet dagar som träet har legat i vattnet.
|
Testrapport
|
43.
|
Testrapporten ska innehålla åtminstone följande information:
|
—
|
namnet på leverantören av det testade skyddsmedlet,
|
|
—
|
det särskilda och unika namnet eller koden för det testade skyddsmedlet,
|
|
—
|
handelsnamnet eller trivialnamnet på den eller de aktiva beståndsdelarna med en allmän beskrivning av tillsatsämnen (t.ex. hjälplösningsmedel, harts) och ingrediensernas sammansättning i % m/m,
|
|
—
|
den relevanta upptagningen eller mättnaden (i kg/m3 respektive l/m2) som anges för trä som används i kontakt med vatten,
|
|
—
|
det träslag som används, med dess densitet, och tillväxthastigheten i ringar per 10 mm,
|
|
—
|
mättnaden eller upptagningen av det testade skyddsmedlet och den formel som används för att beräkna upptagningen, uttryckt i l/m2 eller kg/m3,
|
|
—
|
appliceringsmetoden för skyddsmedlet, med uppgift om det använda behandlingsschemat om en impregneringsprocess har använts, och appliceringsmetoden om en ytbehandling har använts,
|
|
—
|
appliceringsdatum för skyddsmedlet, och en uppskattning av fukthalten i provexemplaren, uttryckt i procent,
|
|
—
|
de konditioneringsförfaranden som har används, med uppgift om typ, betingelser och varaktighet,
|
|
—
|
uppgift om den försegling av ändträet som har använts och det antal gånger den har applicerats,
|
|
—
|
uppgift om eventuell efterföljande behandling av träet, t.ex. uppgift om leverantören, typ, kännetecken och mättnad av en färg,
|
|
—
|
tid och datum för varje doppning, den mängd doppningsvatten som använts vid varje doppning av provexemplaren, och den mängd vatten som absorberats av träet under den tid som doppningen varar,
|
|
—
|
alla avvikelser från den beskrivna metoden och eventuella faktorer som kan ha påverkat resultaten.
|
|
LITTERATUR
|
(1)
|
Europeisk standard EN 84:1997. Träskydd – Accelererad åldring av träskyddsbehandlat virke före biologisk provning – Laboratoriemetod.
|
|
(2)
|
Europeisk standard EN 113/A1:2004. Träskydd – Bestämning av den förebyggande skyddseffekten hos träskyddsmedel mot rötsvampar – Provning.
|
|
(3)
|
Europeisk standard EN 252:1989. Träskydd – Bestämning av den relativa förebyggande skyddseffekten hos ett träskyddsmedel i markkontakt – Fältprovning
|
|
(4)
|
Europeisk standard, EN 335 – Del 1: 2006. Träskydd – Definition av riskklasser avseende biologiska angrepp – Del 1: Allmänt.
|
|
(5)
|
American Society for Testing and Materials standard, ASTM D 1141-1998. Standard Practice for the Preparation of Substitute Ocean Water, Without Heavy Metals. Annual Book of ASTM Standards, Volume 11.02.
|
|
(6)
|
American Society for Testing and Materials Standards, ASTM D 1193-77 Type II – 1983. Specifications for Reagent Water. Annual Book of ASTM Standards, Volume 11.01.
|
Tillägg 1
Datablankett för testmetoden
Uppskattning av utsläpp från träskyddsbehandlat virke till miljön: laboratoriemetod för träbaserade råvaror som inte är täckta och som är i kontakt med sötvatten eller havsvatten
|
Provningslaboratorium
|
|
|
Träskyddsmedel
|
|
Träskyddsmedlets leverantör
|
|
|
Träskyddsmedlets särskilda och unika namn eller kod
|
|
|
Träskyddsmedlets handels- eller trivialnamn
|
|
|
Tillsatsämnen
|
|
|
Den relevanta upptagningen för trä som används i kontakt med vatten
|
|
|
Applicering
|
|
Appliceringsmetod
|
|
|
Datum för applicering
|
|
|
Formel som används för att beräkna upptagningen:
|
|
|
Konditioneringsförfarande
|
|
|
Konditioneringens varaktighet
|
|
|
Försegling av ändträet / antal gånger den applicerats
|
|
|
Efterbehandling
|
(om tillämpligt)
|
|
Provexemplar
|
|
Träslag
|
|
|
Träets densitet
|
(minsta värde … medelvärde … högsta värde)
|
|
Tillväxthastighet (ringar per 10 mm)
|
(minsta värde … medelvärde … högsta värde)
|
|
Fukthalt
|
|
|
Testkombinationer
(67)
|
Upptagning (t.ex. kg/m3)
|
|
Behandlat ’x’
|
Medelvärde och standardavvikelse för fem exemplar
|
|
Behandlat ’y’
|
Medelvärde och standardavvikelse för fem exemplar
|
|
Behandlat ’z’
|
Medelvärde och standardavvikelse för fem exemplar
|
|
Obehandlat
|
|
|
Ändring av testmetodens parametrar
|
t.ex. vattenkvalitet, provexemplarens dimensioner, osv.
|
|
Tid
|
Vattenbyte
|
Provmassa
|
Vattenupptagning
|
Vattenprov
|
|
Behandlat (medelvärde)
|
Obehandlat
|
Behandlat (medelvärde)
|
Obehandlat
|
|
Testvatten
|
x
|
y
|
z
|
|
|
Datum
|
g
|
g
|
g
|
g
|
nr
|
pH-värde
|
pH-värde
|
pH-värde
|
pH-värde
|
|
start
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6 h
|
|
|
|
|
|
1
|
|
|
|
|
|
24 h
|
|
|
|
|
|
2
|
|
|
|
|
|
2 d.
|
|
|
|
|
|
3
|
|
|
|
|
|
4 d.
|
|
|
|
|
|
4
|
|
|
|
|
|
8 d.
|
|
|
|
|
|
5
|
|
|
|
|
|
15 d.
|
|
|
|
|
|
6
|
|
|
|
|
|
22 d.
|
|
|
|
|
|
7
|
|
|
|
|
|
29 d.
|
|
|
|
|
|
8
|
|
|
|
|
|
|
|
V.g. fyll i separata tabeller för varje aktiv substans
|
Tid
|
Vattenbyte
|
Analysresultat
|
|
Obehandlade exemplar
|
Behandlade exemplar
|
|
Koncentration verksamt ämne i vatten
mg/l
|
Utsläpps-kvantitet
mg/m2
|
Utsläpps-hastighet
mg/m2/d
|
Koncentration verksamt ämne i vatten
|
Utsläppskvantitet
|
Utsläppshastighet
|
|
x
|
y
|
z
|
Medel
|
x
|
y
|
z
|
Medel
|
x
|
y
|
z
|
Medel
|
|
|
Datum
|
mg/l
|
mg/l
|
mg/l
|
mg/l
|
mg/m2
|
mg/m2
|
mg/m2
|
mg/m2
|
mg/m2/d
|
mg/m2/d
|
mg/m2/d
|
mg/m2/d
|
|
6 h
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
24 h
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 d.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 d.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8 d.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
15 d.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
22 d.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
29 d.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Anmärkning: Eftersom man kan behöva använda resultaten från obehandlade prover för att korrigera utsläppshastigheten från behandlade prover bör de obehandlade resultaten komma först och alla värden för behandlade prover blir då ’korrigerade värden’. En korrigering kan också behöva göras för den ursprungliga vattenundersökningen.
Tillägg 2
Definitioner
Kemikalie
: ett ämne eller en blandning
Testkemikalie
: alla ämnen eller blandningar som testas med denna testmetod
C.46. BIOACKUMULERING I SEDIMENTLEVANDE BOTTENLEVANDE OLIGOCHAETER
INLEDNING
|
1.
|
Den här testmetoden motsvarar OECD:s testriktlinje (TG) 315 (2008). Sedimentätande endobentiska djur kan exponeras för sedimentbundna ämnen (1). Bland dessa sedimentätare spelar vattenlevande oligochaeter (fåborstmaskar, Oligochaeta) en viktig roll på vattensystemens bottnar. De lever i sedimentet och är ofta den vanligaste arten, i synnerhet i livsmiljöer med miljöförhållanden som är ogynnsamma för andra djur. Genom bioomlagring av sedimentet och genom att utgöra byten kan oligochaeterna ha en stark inverkan på sedimentbundna ämnens biotillgänglighet för andra organismer, t.ex. bentivora fiskar. I motsats till epibentiska organismer gräver endobentiska vattenlevande oligochaeter ner sig i sedimentet, och förtär sedimentpartiklar under sedimentytan. På grund av detta exponeras dessa organismer för ämnen via många upptagningsvägar, inbegripet direktkontakt, förtäring av förorenade sedimentpartiklar, porvatten och överliggande vatten. Några arter av bottenlevande oligochaeter som för närvarande används för ekotoxikologisk testning beskrivs i tillägg 6.
|
|
2.
|
De parametrar som kännetecknar bioackumuleringen av ett ämne omfattar först och främst bioackumuleringsfaktorn (BAF) och konstanterna för sedimentupptagningshastigheten (ks) och elimineringshastigheten (ke). Detaljerade definitioner av dessa parametrar finns i tillägg 1.
|
|
3.
|
För att kunna bedöma bioackumuleringsförmågan hos ämnen i allmänhet, och undersöka bioackumuleringen av ämnen som tenderar att fördelas i eller på sedimentet, behövs en miljöspecifik testmetod (1) (2) (3) (4).
|
|
4.
|
Denna testmetod är utformad för att bedöma bioackumuleringen av sedimentrelaterade ämnen i endobentiska oligochaeter. Testämnet spikas i sedimentet. Det spikade sedimentet är avsett att simulera ett förorenat sediment.
|
|
5.
|
Denna metod baseras på befintliga testmetoder för sedimenttoxicitet och bioackumulering (1) (4) (5) (6) (7) (8) (9). Andra användbara dokument är diskussionerna och resultaten av en internationell workshop (11), och resultatet av ett internationellt ringtest (12).
|
|
6.
|
Detta test gäller stabila, neutrala organiska ämnen som tenderar att förenas med sediment. Bioackumuleringen av sedimentrelaterade stabila metallorganiska föreningar kan också mätas med denna metod (12). Den är inte tillämplig på metaller och andra spårelement (11) utan ändring av testutformningen med avseende på substrat och vattenvolymer, och eventuellt storleken på vävnadsproverna.
|
NÖDVÄNDIGA FÖRUTSÄTTNINGAR FÖR OCH INFORMATION OM TESTÄMNET
|
7.
|
För närvarande finns endast ett fåtal väl etablerade kvantitativa struktur-aktivitetssamband (QSAR) tillgängliga (14) rörande bioackumuleringsprocesser. Det mest allmänt använda sambandet är korrelationen mellan bioackumuleringen och biokoncentrationen av stabila organiska ämnen respektive deras lipofilicitet (uttryckt som logaritmen av variationskoefficienten oktanol/vatten (log Kow); se tillägg 1 för definitioner), som har utarbetats för beskrivning av en ämnesfördelning mellan vatten och fisk. Korrelationer för sedimentdelen har också fastställts med hjälp av detta förhållande (15) (16) (17) (18). Korrelationen mellan log kow och log BCF som en viktig QSAR kan vara till hjälp för en första preliminär uppskattning av de sedimentrelaterade ämnenas bioackumuleringspotential. BAF kan dock påverkas av testorganismens fettinnehåll och sedimentets halt av organiskt kol. Därför kan fördelningskoefficienten organiskt kol/vatten (Koc) också användas som en bestämmande faktor för bioackumuleringen av sedimentrelaterade organiska ämnen.
|
|
8.
|
Detta test kan tillämpas på följande:
|
—
|
stabila, organiska ämnen med log Kow-värden mellan 3,0 och 6,0 (5) (19) och superlipofila ämnen som har ett log Kow-värde på mer än 6,0 (5),
|
|
—
|
ämnen som tillhör en klass av organiska ämnen som är kända för sin bioackumuleringspotential i levande organismer, t.ex. ytaktiva eller starkt adsorptiva ämnen (t.ex. hög Koc).
|
|
|
9.
|
Information om testämnet, t.ex. säkerhetsåtgärder, lämpliga lagringsförhållanden och stabilitet samt analysmetoder bör inhämtas innan studien inleds. Vägledning för testning av ämnen med fysikalisk-kemiska egenskaper som gör dem svåra att testa ges i (20) och (21). Innan man påbörjar ett bioackumuleringstest med vattenlevande oligochaeter ska följande information om det undersökta ämnet finnas tillgänglig:
|
—
|
trivialnamn, kemiskt namn (helst enligt IUPAC), strukturformel, CAS-nummer, renhet,
|
|
—
|
löslighet i vatten (testmetod A.6 (22)),
|
|
—
|
fördelningskoefficient oktanol/vatten, Kow (testmetoderna A.8, A.24 (22)),
|
|
—
|
fördelningskoefficient sediment/vatten, uttryckt som Kd eller Koc (testmetod C.19 (22)),
|
|
—
|
hydrolys (testmetod C.7 (22)),
|
|
—
|
ångtryck (testmetod A.4 (22)),
|
|
—
|
lätt bionedbrytbarhet (testmetoderna C.4 och C.29 (22)),
|
|
—
|
ytspänning (testmetod A.5 (22)),
|
|
—
|
kritisk micellkoncentration (24).
|
Dessutom är följande information tillämplig, om den finns tillgänglig:
|
—
|
biologisk nedbrytning i vattenmiljön (testmetoderna C.24 och C.25 (22)),
|
|
|
10.
|
Radioaktiv märkning av testämnen kan underlätta analysen av vatten- och sedimentprover samt biologiska prover och kan användas för att fastställa huruvida identifiering och kvantifiering av nedbrytningsprodukter bör utföras. Den metod som beskrivs här har validerats i ett internationellt ringtest (12) för 14C-märkta ämnen. Om de totala radioaktiva resterna mäts, baseras bioackumuleringsfaktorn (BAF) på det ursprungliga ämnet inklusive eventuella kvarvarande nedbrytningsprodukter. Det är också möjligt att kombinera en metabolismstudie med en undersökning av bioackumuleringen genom en analys och kvantifiering av procentandelen av det ursprungliga ämnet och dess nedbrytningsprodukter i prov som tas vid slutet av upptagningsfasen eller vid bioackumuleringens högsta nivå. Det rekommenderas att beräkning av BAF baseras på det ursprungliga ämnets koncentration i organismerna och inte endast på de totala radioaktiva resterna.
|
|
11.
|
Den information som behövs, utöver testämnets egenskaper, är giftigheten för de arter av oligochaeter som används i testet, t.ex. den dödliga mediankoncentrationen (LC50) för den tid som krävs för upptagningsfasen, för att se till att de valda exponeringskoncentrationerna är mycket lägre än de toxiska nivåerna. Man bör först och främst använda toxicitetsvärden från långvariga studier om subletala endpoints (EC50), om sådana finns att tillgå. Om sådana uppgifter inte finns tillgängliga kan ett akut toxicitetstest under betingelser som är identiska med betingelserna i bioackumuleringstestet, eller data rörande toxiciteten för andra alternativa arter, ge användbar information.
|
|
12.
|
En lämplig analysmetod med känd noggrannhet, precision och känslighet för kvantifiering av ämnet i testlösningarna, i sedimentet och i det biologiska materialet måste finnas tillgänglig, tillsammans med uppgifter om beredning och lagring av prover såväl som med säkerhetsdatablad. De analytiska detektionsgränserna för testämnet i vatten, sediment och maskvävnad bör också vara kända. Om ett radioaktivt märkt testämne används måste den specifika radioaktiviteten (dvs. Bq mol– 1), placeringen av den radioaktivt märkta atomen, och den procentuella andelen radioaktivitet associerad med orenheter vara kända. Testämnets specifika radioaktivitet bör vara så hög som möjligt i syfte att påvisa så låga testkoncentrationer som möjligt (11).
|
|
13.
|
Information om egenskaperna hos det sediment som ska användas (t.ex. sedimentets ursprung eller beståndsdelar, pH-värde och porvattnets koncentration av ammoniak (sediment från fältet), halt av organiskt kol (TOC), partikelstorleksfördelning (procent sand, silt och lera) och procent torrvikt) bör finnas tillgänglig (6).
|
PRINCIP FÖR TESTMETODEN
|
14.
|
Testet består av två faser: upptagningsfasen (exponeringsfasen) och elimineringsfasen (post-exponeringsfasen). Under upptagningsfasen exponeras maskarna för sediment som spikats med testämnet, varefter systemet fyllts på med rekonstituerat vatten och bringats i jämvikt på det sätt som är lämpligt (11). Kontrollgrupper med maskar hålls under identiska förhållanden utan testämnet.
|
|
15.
|
För elimineringsfasen överförs maskarna till ett sediment-vatten-system som är fritt från testämnet. En elimineringsfas är nödvändig för att man ska få information om hastigheten med vilken testämnet utsöndras av testorganismerna (19) (25). En elimineringsfas krävs alltid, med undantag för om upptaget av testämne under exponeringen har varit obetydligt (till exempel om det inte finns någon statistisk skillnad mellan koncentrationen av testämnet i testmaskarna och kontrollmaskarna). Om ett stabilt tillstånd inte har uppnåtts under upptagningsfasen bör bestämningen av de kinetiska värdena – BAFk samt konstanterna för upptagnings- och elimineringshastigheterna – göras med hjälp av resultaten från elimineringsfasen. Förändringar i testämnets koncentration i/på maskarna kontrolleras under testets båda faser.
|
|
16.
|
Under upptagningsfasen görs mätningar till dess att BAF har nått en platå eller ett stabilt tillstånd. Som standard ska upptagningsfasen vara 28 dagar. Erfarenheten har visat att en 12- till 14-dagars upptagningsfas räcker för att flera stabila, neutrala organiska ämnen ska kunna uppnå ett stabilt tillstånd (6) (8) (9).
|
|
17.
|
Om ett stabilt tillstånd inte uppnås inom 28 dagar påbörjas elimineringsfasen genom att de exponerade oligochaeterna överförs till kärl som innehåller samma medium fast utan testämnet. Elimineringsfasen avslutas antingen när nivån på 10 % av koncentrationen uppmäts i maskarna på dag 28 av upptagningsfasen, eller efter en längsta varaktighet på 10 dagar. Nivån av rester i maskarna vid slutet av elimineringsfasen rapporteras som en ytterligare endpoint, dvs. som icke-eliminerade rester (NER). Bioackumuleringsfaktorn vid stabilt tillstånd (BAFss) beräknas helst både som kvoten mellan koncentrationen i maskarna (Ca) och i sedimentet (Cs) vid ett uppenbart stabilt tillstånd, och som en kinetisk bioackumuleringsfaktor (BAFK) som kvoten mellan konstanterna för upptagningshastigheten från sedimentet (ks) och elimineringshastigheten (ke) utifrån ett antagande om första ordningens kinetik. Om ett stabilt tillstånd inte uppnås inom 28 dagar ska BAFK beräknas utifrån konstanterna för upptagnings- och elimineringshastigheterna. För uträkning se tillägg 2. Om första ordningens kinetik inte är tillämplig ska mer komplexa modeller tillämpas (se tillägg 2 och hänvisning (25)).
|
|
18.
|
Om ett stabilt tillstånd inte uppnås inom 28 dagar kan upptagningsfasen valfritt förlängas och de exponerade grupperna av maskar – om dessa finns tillgängliga – utsätts för ytterligare mätningar till dess att ett stabilt tillstånd uppnås. Parallellt med detta bör elimineringsfasen ändå påbörjas på dag 28 av upptagningsfasen.
|
|
19.
|
Konstanterna för upptagningshastigheten och elimineringshastigheten (eller konstanterna om mer komplexa modeller används), den kinetiska bioackumuleringsfaktorn (BAFK), och, när så är möjligt, konfidensgränserna för var och en av dessa parametrar beräknas utifrån datoriserade modellekvationer (se tillägg 2 för modeller). Anpassningsgraden (’goodness of fit’) för valfri modell kan bestämmas utifrån korrelationskoefficienten eller determinationskoefficienten (koefficienter nära 1 tyder på hög anpassningsgrad).
|
|
20.
|
För att minska variationen i testresultaten för organiska ämnen med hög lipofilicitet bör bioackumuleringsfaktorerna dessutom uttryckas i förhållande till fettinnehållet i testorganismerna och till halten av organiskt kol (TOC) i sedimentet (ackumuleringsfaktorn biota/sediment eller BSAF i kg sediment TOC kg– 1 fettinnehåll i mask). Detta tillvägagångssätt grundar sig på erfarenheter och teoretiska korrelationer rörande vattenmiljön, där det – för vissa kemiska klasser – finns ett klart samband mellan ett ämnes bioackumuleringsförmåga och dess lipofilicitet, vilket har klart etablerats för fisk som modellorganismer (14) (25) (27). Det finns också ett förhållande mellan fettinnehållet i den undersökta fisken och den observerade bioackumuleringen av sådana ämnen. För bottenlevande organismer har man funnit liknande korrelationer (15) (16) (17) (18). Om tillräcklig mängd maskvävnad finns att tillgå, kan testdjurens fettinnehåll bestämmas utifrån samma biologiska material som används för bestämning av testämnets koncentration. Emellertid är det praktiskt att använda acklimatiserade kontrolldjur åtminstone i början eller – företrädesvis – i slutet av upptagningsfasen för att mäta fettinnehållet, som sedan kan användas för att normalisera BAF-värdena.
|
TESTETS GILTIGHET
|
21.
|
För att ett test ska vara giltigt måste följande villkor uppfyllas:
|
—
|
Maskarnas kumulativa dödlighet (kontroller och behandlingar) vid testets slut bör inte överstiga 20 % av det ursprungliga antalet.
|
|
—
|
Dessutom bör det påvisas att maskarna gräver sig igenom i sedimentet så att maximal exponering möjliggörs. För mer om detta, se punkt 28.
|
|
BESKRIVNING AV TESTMETODEN
Testarter
|
22.
|
Flera arter vattenlevande oligochaeter kan användas för testet. De oftast använda arterna anges i tillägg 6.
|
|
23.
|
Toxicitetstester (96 timmar, endast i vatten) bör genomföras regelbundet (t.ex. varje månad) med ett referensgiftämne såsom kaliumklorid (KCl) eller kopparsulfat (CuSO4) (1) för att visa på hälsotillståndet hos försöksdjuren (1) (6). Om man inte regelbundet utför referenstoxicitetstester bör uppsättningen organismer som ska användas i ett bioackumuleringstest för sediment kontrolleras med hjälp av ett referensgiftämne. En mätning av fettinnehållet kan också tillhandahålla värdefull information om djurens tillstånd.
|
Odling av testorganismerna
|
24.
|
För att man ska få ett tillräckligt antal maskar för bioackumuleringstest kan man behöva hålla maskarna permanent i en laboratorieodling med en enda art. Laboratorieodlingsmetoder för de utvalda djurarterna sammanfattas i tillägg 6. För närmare upplysningar se hänvisningarna (8) (9) (10) (18) (28) (29) (30) (31) (32).
|
Utrustning
|
25.
|
Man bör vara noga med att i alla delar av utrustningen undvika användningen av material som kan lösas upp, absorbera testämnen eller laka ut andra ämnen och ha negativa effekter på försöksdjuren. Vanliga rektangulära eller cylindriska behållare, tillverkade av kemiskt inert material och med lämplig kapacitet i enlighet med djurtätheten, dvs. antalet testmaskar, kan användas. Man bör undvika att använda mjuka plaströr för tillsats av vatten eller luft. Polytetrafluoreten, rostfritt stål och/eller glas bör användas för utrustning som kommer i kontakt med testmediet. För ämnen med höga adsorptionskoefficienter, såsom syntetiska pyretroider, kan det vara nödvändigt att använda silaniserat glas. I sådana situationer måste utrustningen kasseras efter användning (5). För radioaktivt märkta testämnen och flyktiga ämnen bör man undvika avdrivning till luft (strippning) och läckage av strippat testämne. Man bör använda fällor (t.ex. gastvättflaskor av glas) som innehåller lämpliga absorbenter som håller kvar eventuella rester som avdunstar från testbehållarna (11).
|
Vatten
|
26.
|
Det överliggande vattnet måste vara av en kvalitet som möjliggör testartens överlevnad under acklimatiserings- och testperioderna utan att djuren uppvisar onormala förändringar eller onormalt beteende. Rekonstituerat vatten enligt testmetod C.1 (25) rekommenderas som överliggande vatten i testerna samt i laboratoriekulturerna med maskar. Det har visats att flera olika testarter kan överleva, växa och föröka sig i detta vatten (8), och det ger även maximal standardisering och maximala odlingsbetingelser. Vattnet ska beskrivas åtminstone med pH-värde, konduktivitet och hårdhet. Analys av vattnet med avseende på mikroföroreningar kan ge användbar information (tillägg 4).
|
|
27.
|
Vattnet bör hålla jämn kvalitet under hela testet. pH-värdet i det överliggande vattnet bör vara mellan 6 och 9. Den totala hårdheten bör vara mellan 90 och 400 mg CaCO3 per liter vid testets början (7). Intervaller för pH och vattenhårdhet i det nämnda rekonstituerade vattnet anges i testmetod C.1 (25). Om det förekommer växelverkan mellan hårdhetsjoner och testämnet bör vatten med lägre hårdhet användas. I tillägg 4 sammanfattas ytterligare kriterier för acceptabelt utspädningsvatten enligt OECD TG 210 (34).
|
Sediment
|
28.
|
Sedimentet måste hålla en kvalitet som möjliggör testorganismernas överlevnad och helst förökning under acklimatiserings- och testperioderna utan att djuren uppvisar onormala förändringar eller onormalt beteende. Maskarna bör gräva ner sig i sedimentet. Grävbeteendet kan påverka exponeringen, och därmed också BAF-värdet. Därför bör undvikande av sedimentet eller testorganismernas grävbeteende registreras, om grumligheten i det överliggande vattnet tillåter sådana observationer. Maskarna (i kontroll och behandlingar) bör gräva ner sig i sedimentet inom 24 timmar efter att de har släppts ner i testkärlen. Om man observerar permanent undvikande av sedimentet eller avsaknad av grävbeteende (t.ex. över 20 % under mer än hälften av upptagningsfasen), tyder detta på att testbetingelserna är olämpliga eller att testorganismerna inte är friska, eller att koncentrationen av testämnet framkallar detta beteende. I ett sådant fall bör testet avbrytas och upprepas vid förbättrade betingelser. Ytterligare information om sedimentförtäring kan fås med hjälp av metoder som beskrivs i (35) (36), vilka närmare anger testorganismernas sedimentförtäring eller partikelval. Om man observerar närvaro eller frånvaro av fekala pelletar på sedimentytan, vilka tyder på maskarnas sedimentförtäring, bör detta registreras och beaktas vid tolkningen av testresultaten med avseende på exponeringsvägar.
|
|
29.
|
Ett syntetiskt sediment baserat på den syntetiska jord som beskrivs i testmetod C.8 (40) rekommenderas för användning både i testerna och laboratoriekulturerna med maskar (tillägg 5), eftersom naturliga sediment av lämplig kvalitet inte alltid finns att tillgå under hela året. Dessutom kan naturligt förekommande organismer och den eventuella närvaron av mikroföroreningar i naturliga sediment påverka testet. Flera olika testarter kan överleva, växa och föröka sig i syntetiskt sediment (8).
|
|
30.
|
För syntetiskt sediment bör man minst ange beståndsdelarnas ursprung, kornstorleksfördelning (procentandel sand, silt och lera), halt av organiskt kol (TOC), vattenhalt och pH-värde. Mätning av redoxpotentialen är valfri. Naturligt sediment från oförorenade platser kan dock användas som test- och/eller odlingssediment (1). För naturliga sediment bör minst anges ursprung (insamlingsplats), pH-värde och ammoniak i porvattnet, halt av organiskt kol (TOC), partikelstorleksfördelning (procent sand, silt och lera) och den procentuella vattenhalten (6). Om man förväntar sig utveckling av ammoniak rekommenderas att det naturliga sedimentet, innan det spikas med testämnet, konditioneras i sju dagar under samma betingelser som råder i det efterföljande testet. I slutet av denna konditioneringsperiod bör det överliggande vattnet avlägsnas och kasseras. En analys av sedimentet eller dess beståndsdelar med avseende på mikroföroreningar kan ge användbar information före användningen.
|
Beredning
|
31.
|
Hantering av naturliga sediment innan de används i laboratoriet beskrivs i (1) (6) (44). Beredning av syntetiskt sediment beskrivs i tillägg 5.
|
Lagring
|
32.
|
Lagringen av naturliga sediment i laboratoriet bör vara så kortvarig som möjligt. Den amerikanska miljöskyddsmyndigheten (EPA) (6) rekommenderar en maximal lagringsperiod på åtta veckor vid 4 ± 2 °C i mörker. Det bör inte finnas något gasutrymme ovanför sedimentet i lagringsbehållarna. Rekommendationer för lagring av syntetiskt sediment anges i tillägg 5.
|
Applicering av testämnet
|
33.
|
Sedimentet spikas med testämnet. Spikningsförfarandet omfattar beläggning av en eller flera av sedimentets beståndsdelar med testämnet. Till exempel kan kvartssanden, eller en del därav (t.ex. 10 g kvartssand per testkärl), indränkas med en lösning av testämnet i lämpligt lösningsmedel, som sedan långsamt får avdunsta tills det har torkat bort. Därefter kan den belagda fraktionen blandas ner i det våta sedimentet. Mängden sand som följer med i blandningen av testämne och sand måste beaktas vid beredningen av sedimentet (dvs. sedimentet ska således beredas med mindre mängd sand (6)).
|
|
34.
|
Med naturligt sediment kan testämnet tillsättas genom spikning av en torkad del av sedimentet enligt beskrivning ovan för syntetiskt sediment, eller genom att blanda ner testämnet i det våta sedimentet, och därefter låta det solubiliseringsmedel som eventuellt använts avdunsta. Lämpliga lösningsmedel för spikning av vått sediment är etanol, metanol, etylenglykolmonometyleter, etylenglykoldimetyleter, dimetylformamid och trietylenglykol (5) (34). Lösningsmedlets toxicitet och flyktighet samt testämnets löslighet i det valda lösningsmedlet bör vara de huvudsakliga kriterierna vid valet av ett lämpligt solubiliseringsmedel. Ytterligare vägledning om spikningsförfaranden finns i Environment Canada (1995) (41). Det är viktigt att se till att testämnet som tillsätts sedimentet fördelas omsorgsfullt och jämnt i sedimentet. Man bör analysera replikatdelprover av det spikade sedimentet för att kontrollera testämnets koncentrationer i sedimentet, och för att fastställa graden av homogenitet för testämnets distribution.
|
|
35.
|
Efter att det spikade sedimentet med överliggande vatten har beretts rekommenderas att man låter testämnet fördelas mellan sediment- och vattenfaserna. Detta bör helst göras under samma temperatur- och luftningsbetingelser som används i testet. Den lämpliga stabiliseringstiden beror på sedimentet och testämnet och kan vara i storleksordningen några timmar upp till flera dagar, och i sällsynta fall upp till flera veckor (4–5 veckor) (28) (42). I detta test förväntar man inte att jämvikt ska uppnås, men en stabiliseringstid på 48 timmar till 7 dagar rekommenderas. Beroende på syftet med studien, t.ex. om man ska efterlikna vissa miljöförhållanden, kan det spikade sedimentet stabiliseras eller åldras under en längre period (11).
|
TESTFÖRFARANDE
Preliminärt test
|
36.
|
Det kan vara lämpligt att utföra ett preliminärt test för att optimera testbetingelserna i det slutgiltiga testet, t.ex. val av testämneskoncentration och längd på upptagnings- och elimineringsfaserna. Maskarnas beteende, t.ex. undvikande av sedimentet, dvs. att maskarna flyr från sedimentet, något som kan orsakas av testämnet och/eller sedimentet i sig, bör observeras och registreras under ett preliminärt test. Undvikande av sedimentet kan också användas som en subletal parameter i ett preliminärt test för att uppskatta den eller de testämneskoncentrationer som ska användas i ett bioackumuleringstest.
|
Exponeringsförhållanden
Upptagningsfasens längd
|
37.
|
Testorganismerna exponeras för testämnet under upptagningsfasen. Den första provtagningen bör göras 4–24 timmar efter upptagningsfasens början. Upptagningsfasen ska vara i upp till 28 dagar (1) (6) (11), såvida man inte kan visa att jämvikt har uppnåtts tidigare. Ett stabilt tillstånd inträffar när (i) en plott av bioackumuleringsfaktorerna vid varje provtagningsperiod mot tiden är parallell med tidsaxeln, (ii) tre på varandra följande analyser av BAF på prover som har tagits med intervaller på minst två dagar inte varierar med mer än ± 20 % jämfört med varandra, och (iii) det inte finns några betydande skillnader mellan de tre provtagningsperioderna (baserat på statistiska jämförelser, t.ex. variansanalys och regressionsanalys). Om ett stabilt tillstånd inte har uppnåtts inom 28 dagar kan upptagningsfasen avslutas genom att starta elimineringsfasen, och BAFK kan beräknas utifrån konstanterna för upptagnings- och elimineringshastigheterna (se även punkterna 16–18).
|
Elimineringsfasens varaktighet
|
38.
|
Det första provet bör tas 4–24 timmar efter elimineringsfasens början, eftersom snabba förändringar av resterna i vävnaderna kan förekomma under den inledande perioden. Det rekommenderas att man avslutar elimineringsfasen antingen när testämneskoncentrationen är mindre än 10 % av koncentrationen vid stabilt tillstånd, eller efter en period på högst tio dagar. Nivån av rester i maskarna vid slutet av elimineringsfasen rapporteras som en sekundär endpoint. Periodens längd bör emellertid styras utifrån längden på den period under vilken koncentrationen av testämnet i maskarna ligger kvar över analysmetodens detektionsgräns.
|
Testorganismer
Antalet testmaskar
|
39.
|
Antalet maskar per prov måste tillhandahålla en tillräcklig mängd maskvävnad så att massan av testämnet per prov i början av upptagningsfasen respektive vid slutet av elimineringsfasen är betydligt högre än detektionsgränsen för testämnet i biologiskt material. I de nämnda stadierna av upptagnings- och elimineringsfaserna är koncentrationen i försöksdjuren ofta relativt låg (6) (8) (18). Eftersom vikten av varje enskild individ är mycket låg i många arter av vattenlevande oligochaeter (5–10 mg våtvikt per individ för Lumbriculus variegatus och Tubifex tubifex), kan maskarna i en given replikattestbehållare läggas samman för vägning och analys av testkemikalien. För testarter med högre individuell vikt (t.ex. Branchiura sowerbyi) kan replikat med en enda individ användas, men i sådana fall bör antalet replikat utökas till fem per provtagningsplats (11). Det bör dock noteras att B. sowerbyi inte ingick i ringtestet (12), och därför inte rekommenderas som lämplig art i metoden.
|
|
40.
|
Maskar av liknande storlek bör användas (för L. variegatus se tillägg 6). De bör komma från samma källa och vara vuxna eller stora djur i samma åldersklass (se tillägg 6). Ett djurs vikt och ålder kan ha betydande inverkan på BAF-värdena (t.ex. beroende på varierande fettinnehåll och/eller förekomsten av ägg). Dessa parametrar bör registreras noggrant. För att mäta den genomsnittliga våt- och torrvikten bör delprov med maskar vägas innan testet inleds.
|
|
41.
|
Man kan förvänta sig att Tubifex tubifex och Lumbriculus variegatus förökar sig under testperioden. En brist på förökning i ett bioackumuleringstest bör registreras och beaktas vid tolkningen av testresultaten.
|
Djurtäthet
|
42.
|
Höga förhållanden mellan vatten och maskar samt sediment och maskar bör användas för att minimera minskningen av testämneskoncentrationen i sedimentet under upptagningsfasen, och för att undvika en ökning av halten löst syre. Den valda djurtätheten bör också överensstämma med den valda artens naturligt förekommande populationstäthet (43). För Tubifex tubifex rekommenderas till exempel en djurtäthet på 1–4 mg maskvävnad (våtvikt) per gram vått sediment (8) (11). Hänvisningarna (1) och (6) rekommenderar en djurtäthet på ≤ 1 g torrvikt maskvävnad per 50 g organiskt kol i sedimentet för L. variegatus.
|
|
43.
|
Maskar som används i ett test avlägsnas från odlingen genom siktning av odlingssedimentet. Djuren (vuxna eller stora maskar som inte visar tecken på att nyligen ha delats) överförs till glaskärl (t.ex. petriskålar) som innehåller rent vatten. Om testbetingelserna avviker från odlingsbetingelserna bör en acklimatiseringsfas på 24 timmar vara tillräcklig. Före vägningen ska överskottsvatten avlägsnas från maskarna. Detta kan göras genom att försiktigt lägga maskarna på förhandsfuktat mjukt papper. Det är inte lämpligt att använda absorberande papper för att torka maskarna eftersom detta kan orsaka stress och skador på maskarna. Brunson m.fl. (1998) rekommenderar att man använder icke avtorkade maskar med en vikt på ungefär 1,33 gånger den eftersträvade biomassan. Dessa ytterligare 33 % motsvarar skillnaden mellan avtorkade och icke avtorkade maskar (28).
|
|
44.
|
I början av upptagningsfasen (testdag 0) avlägsnas testorganismerna från acklimatiseringsbehållaren och fördelas slumpmässigt i kärl (t.ex. petriskålar) som innehåller rekonstituerat vatten genom att man tillsätter maskarna två och två i varje kärl tills varje kärl innehåller tio maskar. Var och en av dessa grupper av maskar överförs sedan slumpmässigt till separata testkärl, t.ex. med hjälp av en mjuk stålpincett. Testkärlen inkuberas sedan under testbetingelserna.
|
Utfodring
|
45.
|
Med hänsyn till det låga näringsvärdet i syntetiskt sediment bör man lägga till en foderkälla i sedimentet. För att inte underskatta exponeringen av testorganismerna, t.ex. genom att selektivt utfodra dem med icke-förorenat foder, bör det foder som krävs för testorganismernas reproduktion och tillväxt tillsättas i sedimentet en gång före eller under appliceringen av testämnet (se tillägg 5).
|
Förhållandet mellan sediment och vatten
|
46.
|
Den rekommenderade förhållandet mellan sediment och vatten är 1:4 (45). Detta förhållande anses vara lämpligt för att syrgaskoncentrationerna ska hållas på lämplig nivå, och för att undvika ackumulering av ammoniak i det överliggande vattnet. Syrehalten i det överliggande vattnet bör hållas på ≥ 40 % mättnad. Det överliggande vattnet i testkärlen bör försiktigt luftas (t.ex. 2–4 bubblor per sekund) genom en pasteurpipett placerad ca 2 cm ovanför sedimentytan för att minimera grumlingen av sedimentet.
|
Ljus och temperatur
|
47.
|
Ljusperioden i odlingen och testet är 16 timmar (1) (6). Ljusintensiteten i testområdet ska ligga på omkring 500–1 000 lux. Temperaturen bör vara 20 ± 2 °C under hela testet.
|
Testkoncentrationer
|
48.
|
En enda testkoncentration (så låg som möjligt) används för bestämning av upptagningskinetiken, men en andra (högre) koncentration kan användas (t.ex. (46)). I detta fall ska prover tas och analyseras vid ett stabilt tillstånd eller efter 28 dagar för att bekräfta de BAF-värden som uppmätts vid den lägre koncentrationen (11). Den högre koncentrationen bör väljas så att negativa effekter kan uteslutas (exempelvis genom att man väljer ungefär 1 % av den lägsta kända koncentrationen vid vilken kroniska effekter har observeras (ECx), vilken erhålls från relevanta studier av kronisk toxicitet). Den lägre testkoncentrationen bör vara betydligt högre än detektionsgränsen i sedimentproverna och de biologiska proverna enligt den analysmetod som används. Om testämneskoncentrationen ligger nära den analytiska detektionsgränsen rekommenderas användning av ett radioaktivt märkt testämne med hög specifik radioaktivitet.
|
Behandlat replikat och kontrollreplikat
|
49.
|
Det minsta antalet behandlade replikat för kinetiska mätningar bör vara tre per provtagningsplats (11) under hela upptagnings- och elimineringsfaserna. Ytterligare replikat bör användas, t.ex. för ytterligare valfria provtagningstillfällen. För elimineringsfasen bereds ett motsvarande antal replikat med icke-spikat sediment och överliggande vatten, så att de behandlade maskarna kan överföras från utsedda behandlade kärl till obehandlade kärl vid slutet av upptagningsfasen. Det totala antalet behandlade replikat bör vara tillräckligt stort för både upptagnings- och elimineringsfaserna.
|
|
50.
|
Alternativt kan maskarna som valts ut för provtagning under elimineringsfasen exponeras i en stor behållare som innehåller spikat sediment från samma sats som används för upptagningskinetiken. Det bör visas att testförhållandena (t.ex. sedimentets djup, förhållandet mellan sediment och vatten, djurtäthet, temperatur, vattenkvalitet) är jämförbara med de replikat som valts ut för upptagningsfasen. Vid slutet av upptagningsfasen bör vatten-, sediment- och maskprover tas från denna behållare för analys, och ett tillräckligt antal stora maskar som inte visar några tecken på att nyligen ha delats bör försiktigt avlägsnas och överföras till de replikat som beretts för elimineringsfasen (t.ex. 10 organismer per replikatkärl).
|
|
51.
|
Om inget annat lösningsmedel än vatten används bör minst nio replikat av en negativ kontroll (minst tre där prover tagits i början, tre i slutet av upptagningsfasen och tre i slutet av elimineringsfasen) tillhandahållas för biologisk analys och bakgrundsanalys. Om ett solubiliseringsmedel används för applicering av testämnet bör en lösningsmedelskontroll utföras (prover bör tas från minst tre replikat i början, tre i slutet av upptagningsfasen och tre i slutet av elimineringsfasen). I sådana fall ska minst fyra replikat av en negativ kontroll (inget lösningsmedel) tillhandahållas för provtagning i slutet av upptagningsfasen. Dessa replikat kan jämföras biologiskt med lösningsmedelskontrollen för att få information om lösningsmedlets eventuella effekter på testorganismerna. Närmare uppgifter finns i tillägg 3.
|
Frekvens för mätningar av vattenkvaliteten
|
52.
|
Åtminstone följande parametrar för vattenkvalitet bör mätas i det överliggande vattnet under upptagnings- och elimineringsfaserna:
|
Temperatur
|
i ett kärl för varje behandlingsnivå per provtagningsdatum, och i ett kontrollkärl en gång per vecka och i början och slutet av upptagnings- och elimineringsperioderna; temperatur i det omgivande mediet (den omgivande luften eller ett vattenbad) eller i ett representativt testkärl kan också registreras, t.ex. kontinuerligt eller med timslånga mellanrum,
|
|
Halten av löst syre
|
i ett kärl för varje behandlingsnivå, och i ett kontrollkärl per provtagningsdatum, uttryckt i mg/l och % av luftmättnadsvärdet (ASV),
|
|
Lufttillförsel
|
kontrolleras minst en gång per dag (arbetsdagar) och justeras vid behov,
|
|
pH-värde
|
i ett behandlat kärl för varje behandlingsnivå per provtagningsdatum, och i ett kontrollkärl en gång per vecka och i början och slutet av upptagnings- och elimineringsperioderna,
|
|
Total vattenhårdhet
|
i minst ett behandlat kärl och ett kontrolltestkärl vid början och slutet av upptagnings- och elimineringsfasen, uttryckt i mg/l CaCO3,
|
|
Total ammoniakhalt
|
i minst ett behandlat kärl och ett kontrolltestkärl vid början och slutet av upptagnings- och elimineringsfasen, uttryckt i NH4
+ eller NH3 eller total mängd ammoniak-N.
|
|
Provtagning och analys av maskar, sediment och vatten
Schema för provtagning
|
53.
|
Exempel på provtagningsschema för en 28-dagars upptagningsfas och en 10-dagars elimineringsfas finns i tillägg 3.
|
|
54.
|
Ta prover på vattnet och sedimentet i testkärlen för bestämning av testämnets koncentration före maskarna tillsätts, och under både upptagnings- och elimineringsfaserna. Under testets gång bestäms testämnets koncentrationer i maskarna, sedimentet och vattnet i syfte att övervaka fördelningen av testämnet i de olika delarna av testsystemet.
|
|
55.
|
Ta prover av maskarna, sedimentet och vattnet vid minst sex tillfällen under upptagnings- och elimineringsfaserna.
|
|
56.
|
Fortsätt provtagningen till dess att en platå (stabilt tillstånd) har uppnåtts (se tillägg 1) eller i 28 dagar. Påbörja elimineringsfasen om platån inte har uppnåtts inom 28 dagar. När elimineringsfasen påbörjas överförs de utsedda maskarna till replikatbehållare som innehåller obehandlat sediment och vatten (se även punkterna 17 och 18).
|
Provtagning och provberedning
|
57.
|
Ta vattenprover genom dekantering, avtappning med en hävert eller pipettering av en tillräcklig volym för att kunna fastställa kvantiteten av testämnet i provet.
|
|
58.
|
Det återstående överliggande vattnet dekanteras noggrant eller tappas av med en hävert från provbehållaren eller -behållarna. Sedimentprover bör tas försiktigt, för att orsaka minsta möjliga störning av maskarna.
|
|
59.
|
Avlägsna alla maskar från testreplikatet vid provtagningstillfället, t.ex. genom att suspendera sedimentet med överliggande vatten, sprida ut innehållet i varje replikat på en grund bricka och plocka upp maskarna med en mjuk stålpincett. Skölj dem snabbt i vatten på en grund glas- eller stålbricka. Avlägsna överflödigt vatten. Överför maskarna försiktigt till ett förhandsvägt kärl och väg dem. Avliva maskarna genom frysning (t.ex. ≤ –18 °C). Förekomsten av och antalet kokonger och/eller juveniler bör registreras.
|
|
60.
|
I allmänhet bör maskarna avlivas och vägas omedelbart efter provtagningen utan en tarmtömningsfas för att man ska erhålla ett lågt räknat BAF-värde som omfattar förorenat tarminnehåll, och för att undvika förluster av rester i kroppen under en eventuell tarmtömningsfas i endast vatten (8). Ämnen med log Kow på över 5 förväntas inte elimineras betydligt under eventuella tarmtömningsperioder i endast vatten, medan betydande mängder av ämnen med log Kow på mindre än 4 kan gå förlorade (47).
|
|
61.
|
Under elimineringsfasen tömmer maskarna sitt tarminnehåll i rent sediment. Det betyder att mätningar omedelbart före elimineringsfasen inkluderar förorenat tarmsediment, medan den största delen av det förorenade tarminnehållet kan antas ersättas med rent sediment efter de första 4–24 timmarna av elimineringsfasen (11) (47). Koncentrationen i maskarna i detta prov kan därför anses vara samma som koncentrationen i vävnad efter tarmtömning. För att beakta utspädningen av testämneskoncentrationen med oförorenat sediment under elimineringsfasen kan tarminnehållets vikt uppskattas från förhållandena mellan maskarnas våtvikt/askvikt eller maskarnas torrvikt/askvikt.
|
|
62.
|
Om syftet med en särskild undersökning är att mäta biotillgängligheten och de verkliga resterna i testorganismernas vävnader bör åtminstone ett delprov av de behandlade djuren (t.ex. från tre ytterligare replikatkärl), som helst insamlas under ett stabilt tillstånd, vägas, laxeras i rent vatten under en period av sex timmar (47) och vägas igen före analysen. Uppgifterna om maskarnas vikt och kroppskoncentration i detta delprov kan sedan jämföras med värdena från olaxerade maskar. Maskarna som utsetts för mätning av elimineringen bör inte laxeras innan överflyttningen till rent sediment för att minimera den ökade stress som djuren utsätts för.
|
|
63.
|
Helst ska vattnet, sedimentet och maskproverna analyseras omedelbart (dvs. inom 1–2 dagar) efter avlägsnandet för att förhindra nedbrytning eller andra förluster samt för att beräkna de ungefärliga värdena för upptagning och eliminering under testets gång. Mellananalyser förhindrar också förseningar när det gäller fastställandet av när platån har uppnåtts.
|
|
64.
|
Om mellananalyser inte görs ska proverna förvaras under lämpliga förhållanden. Ta reda på stabiliteten och de lämpliga lagringsförhållandena rörande det aktuella testämnet innan studien inleds (t.ex. varaktighet och förvaringstemperatur, extraktionsmetoder osv.). Om inga sådana uppgifter finns tillgängliga och de bedöms vara nödvändiga kan spikade kontrollvävnader testas parallellt för att bestämma stabiliteten vid lagring.
|
Analysmetodens kvalitet
|
65.
|
Eftersom hela proceduren i huvudsak styrs av noggrannheten, precisionen och känsligheten hos den analysmetod som används för testämnet ska man kontrollera experimentellt att den kemiska analysens precision och reproducerbarhet, samt utbytet av testämnet från vatten-, sediment- och maskprover, är tillfredsställande med den aktuella metoden. Kontrollera också att testämnet inte kan påvisas i kontrollbehållarna i koncentrationer som är högre än bakgrundskoncentrationen. Korrigera vid behov värdena för Cw, Cs och Ca för kontrollernas utbytes- och bakgrundsvärden. Hantera alla prover under hela testet på ett sådant sätt att förorening och förlust minimeras (t.ex. till följd av att testämnet adsorberas på provtagningsutrustningen).
|
|
66.
|
Det totala utbytet, och utbytet av testämnet i maskar, sediment och, i förekommande fall, i fällor med absorbenter som fångar upp avdunstat testämne, bör registreras och rapporteras.
|
|
67.
|
Eftersom användningen av radioaktivt märkta ämnen rekommenderas är det möjligt att analysera den totala radioaktiviteten (dvs. ursprungs- och nedbrytningsprodukter). Om det är analytiskt möjligt kan en kvantifiering av ursprungsämnet och nedbrytningsprodukterna vid ett stabilt tillstånd eller i slutet av upptagningsfasen ge viktig information. Om man avser att utföra sådana mätningar ska proven därefter underkastas lämpliga extraktionsmetoder så att det ursprungliga ämnet kan kvantifieras separat. Om en påvisad nedbrytningsprodukt utgör en betydande andel (t.ex. > 10 %) av radioaktiviteten som uppmätts i testorganismerna vid ett stabilt tillstånd eller i slutet av upptagningsfasen rekommenderas att man identifierar sådana nedbrytningsprodukter (5).
|
|
68.
|
På grund av den låga biomassan för varje individ är det ofta inte möjligt att bestämma testämnets koncentration i varje enskild mask, såvida inte Branchiura sowerbyi (40–50 mg våtvikt per mask) används som försöksdjur (11). Därför är det godtagbart att lägga samman individerna som tagits som prov från ett givet testkärl, men detta begränsar de statistiska metoder som kan tillämpas på erhållna data. Om en viss statistisk metod och dess statistiska styrka är viktiga faktorer måste testet omfatta ett tillräckligt antal försöksdjur och/eller replikattestkärl för att tillgodose den önskade sammanläggningen, metoden och styrkan.
|
|
69.
|
Det rekommenderas att BAF-värdet uttrycks både som en funktion av den totala våtvikten, den totala torrvikten och, när så krävs (t.ex. för starkt lipofila ämnen) som en funktion av fettinnehållet och sedimentets halt av organiskt kol (TOC). Lämpliga metoder ska användas för fastställandet av fettinnehållet (48) (49). Extraktionstekniken med kloroform/metanol (50) kan rekommenderas som standardmetod (48). För att undvika klorerade lösningsmedel bör dock en ringtestad modifiering av Bligh & Dyer-metoden (50) enligt beskrivningen i (51) användas. Eftersom de olika metoderna inte ger identiska värden (48), är det viktigt att beskriva den metod som använts. Om möjligt, dvs. om det finns tillräckligt med maskvävnad att tillgå, ska fettinnehållet mätas i samma prov eller extrakt som tagits fram för analys av testämnet, eftersom fettet ofta måste tas bort från extraktet innan det kan analyseras genom kromatografi (5). Emellertid är det praktiskt att använda acklimatiserade kontrolldjur åtminstone i början eller – företrädesvis – i slutet av upptagningsfasen för att mäta fettinnehållet, t.ex. i tre prover.
|
DATA OCH RAPPORTERING
Behandling av resultaten
|
70.
|
Upptagningskurvan för testämnet fås genom att man i aritmetisk skala plottar koncentrationen av testämnet i/på maskarna under upptagningsfasen mot tiden. Om kurvan når en platå beräknar man BAFss vid stabilt tillstånd:

|
|
71.
|
Fastställ den kinetiska bioackumuleringsfaktorn (BAFK) som kvoten ks/ke. Elimineringskonstanten (ke) bestäms i regel utifrån elimineringskurvan (dvs. en plott som visar koncentrationen av testämnet i maskarna under elimineringsfasen). Konstanten för upptagningshastigheten ks beräknas därefter utifrån upptagningskurvan för kinetiken. För att få fram BAFK och hastighetskonstanterna ks och ke rekommenderas datorstödda icke-linjära parameteruppskattningsmetoder (se tillägg 2). Om elimineringen uppenbart inte är av första ordningen bör mer komplexa modeller användas (25) (27) (52).
|
|
72.
|
Ackumuleringsfaktorn biota/sediment (BSAF) bestäms genom att BAFK normaliseras för fettinnehållet i maskarna och sedimentets totala innehåll av organiskt kol.
|
Tolkning av resultaten
|
73.
|
Resultaten bör tolkas med försiktighet när de uppmätta testkoncentrationerna ligger på nivåer nära den använda analysmetodens detektionsgräns.
|
|
74.
|
Tydligt definierade upptagnings- och elimineringskurvor utgör en indikation på att uppmätta bioackumuleringsdata är av god kvalitet. Rent allmänt bör konfidensgränserna för BAF-värdena från väl utformade studier inte vara högre än 25 % (5).
|
Testrapport
|
75.
|
Testrapporten måste innehålla följande information:
|
|
Testämne
|
—
|
fysikalisk form och fysikalisk-kemiska egenskaper, t.ex. log Kow, vattenlöslighet,
|
|
—
|
kemiska identifieringsdata, testämnets källa, samt identitet och koncentration för eventuella lösningsmedel som använts,
|
|
—
|
om ämnet är radioaktivt märkt ska de märkta atomernas exakta position, den specifika radioaktiviteten och andelen radioaktivitet kopplad till föroreningar anges.
|
|
|
|
Testarter
|
—
|
vetenskapligt namn, stam, källa, eventuell förbehandling, acklimatisering, ålder, storleksintervall osv.
|
|
|
|
Testbetingelser
|
—
|
tillämpat testförfarande (t.ex. statiskt, semistatiskt eller genomflöde),
|
|
—
|
belysningens typ och egenskaper samt ljusperiod(er),
|
|
—
|
testutformning (t.ex. provningsbehållarnas antal, material och storlek, vattenvolymen, sedimentets vikt och volym, vattenväxlingshastigheten (för genomflödestest eller semistatiskt förfarande), all luftning som används före och under testet, antalet replikat, antalet maskar per replikat, antalet testkoncentrationer, upptagnings- och elimineringsfasernas varaktighet samt provtagningsfrekvens),
|
|
—
|
metod för beredning och applicering av testämnet samt motivering av valet av en specifik metod,
|
|
—
|
de nominella testkoncentrationerna,
|
|
—
|
källa för beståndsdelarna i det syntetiska vattnet och sedimentet eller – om ett naturligt medium används – vattnets och sedimentets härkomst, beskrivning av eventuell förbehandling, resultat från eventuella demonstrationer av försöksdjurens förmåga att leva och/eller fortplanta sig i de medier som används, sedimentegenskaper (pH och ammoniak i porvattnet (naturliga sediment), halt av organiskt kol (TOC), partikelstorleksfördelning (procent sand, silt och lera), procentuell andel vatten, och eventuella andra gjorda mätningar) och vattnets egenskaper (pH, hårdhet, konduktivitet, temperatur, halten löst syre, restklornivåer (om de har uppmätts), och eventuella andra gjorda mätningar),
|
|
—
|
den nominella och uppmätta torrvikten i procent av våtvikten (eller förhållandet mellan torrvikt och våtvikt) för syntetiskt sediment, den uppmätta torrvikten i procent av våtvikten (eller förhållandet mellan torrvikt och våtvikt) för fältsediment,
|
|
—
|
vattenkvaliteten i testkärlen beskriven med uppgifter om temperatur, pH, ammonium, total hårdhet och halten löst syre,
|
|
—
|
detaljerad information om behandlingen av vatten-, sediment- och maskprover, inbegripet detaljer om beredningen, lagringen, spikningsförfaranden, extraktionsmetoder och analysförfaranden samt deras noggrannhet för testämnet och fettinnehållet, och utbyte för testämnet.
|
|
|
|
Resultat
|
—
|
dödligheten för kontrollmaskarna och maskarna i varje testbehållare, samt eventuella observerade subletala effekter inklusive onormalt beteende (t.ex. undvikande av sedimentet, närvaro eller frånvaro av fekala pelletar, avsaknad av fortplantning),
|
|
—
|
den uppmätta torrvikten i procent av våtvikten (eller förhållandet mellan torrvikt och våtvikt) för sedimentet och testorganismerna (används vid normaliseringen),
|
|
—
|
fettinnehållet i maskarna,
|
|
—
|
kurvor som visar upptagnings- och elimineringskinetiken för testämnet i maskarna, och den tid det tar för att uppnå ett stabilt tillstånd,
|
|
—
|
Ca, Cs och Cw (med standardavvikelse och intervall, om tillämpligt) för samtliga provtagningstillfällen (Ca uttryckt som g kg– 1 våt- och torrvikt för hela kroppen, Cs uttryckt som g kg– 1 våt- och torrvikt för sedimentet, och Cw i mg l– 1). Om det krävs en ackumuleringsfaktor för biota/sediment (BSAF, se bilaga 1 för en definition), t.ex. för jämförelse av resultaten från två eller flera tester som utförts med djur som har olika fettinnehåll, kan Ca även uttryckas som g kg– 1 fettinnehåll i organismen, och Cs kan uttryckas som g kg– 1 organiskt kol (OC) i sedimentet.
|
|
—
|
BAF (uttryckt i kg vått sediment kg– 1 våt mask), sedimentets upptagningskonstant ks (uttryckt i g vått sediment kg– 1 våt mask d– 1), och elimineringskonstanten ke (uttryckt i d– 1). BSAF (uttryckt i kg sediment OC kg– 1 maskarnas fettinnehåll) kan dessutom rapporteras,
|
|
—
|
icke-eliminerade rester (NER) i slutet av elimineringsfasen,
|
|
—
|
om de har uppmätts: de procentsatser av det ursprungliga ämnet, nedbrytningsprodukterna och de bundna resterna (dvs. den procentandel testämne som inte kan extraheras med vanliga extraktionsmetoder) som påvisas i försöksdjuren,
|
|
—
|
metoder som använts för statistiska analyser av data.
|
|
|
|
Utvärdering av resultaten
|
—
|
resultatens överensstämmelse med giltighetskriterierna som förtecknas i punkt 21,
|
|
—
|
oförväntade eller ovanliga resultat, t.ex. ofullständig eliminering av testämnet från försöksdjuren. I sådana fall kan resultaten från eventuella preliminära studier tillhandahålla användbar information.
|
|
|
Tillägg 1
Definitioner och enheter
|
|
Syntetiskt sediment eller rekonstituerat eller konstgjort sediment: en blandning av material som är avsedda att efterlikna de fysiska beståndsdelarna i naturligt sediment.
|
|
|
Bioackumulering: ökningen av testämnets koncentration i eller på en organism i förhållande till testämnets koncentration i det omgivande mediet. Bioackumulering uppstår till följd av både biokoncentrations- och biomagnifieringsprocesser (se nedan).
|
|
|
Bioackumuleringsfaktorn (BAF): den koncentration av testämnet under valfri tidpunkt under upptagningsfasen som förekommer i eller på testorganismen (Ca uttryckt som g kg– 1 torr- eller våtvikt) dividerad med testämnets koncentration i det omgivande mediet (Cs uttryckt som g kg– 1 torr- eller våtvikt sediment). För att hänvisa till enheterna för Ca och Cs har BAF-värdet enheten kg sediment kg– 1 mask (15).
|
|
|
Bioackumuleringsfaktorer som beräknas direkt utifrån kvoten av sedimentets upptagningskonstant dividerad med konstanterna för elimineringshastighet (ks respektive ke, se nedan) kallas kinetiska bioackumuleringsfaktorer (BAFK).
|
|
|
Biokoncentration: ökningen i testämnets koncentration i eller på en organism uteslutande till följd av upptagning via kroppsytan, i förhållande till testämnets koncentration i det omgivande mediet.
|
|
|
Biomagnifiering: ökningen i testämnets koncentration i eller på en organism, främst till följd av upptagning från förorenad föda eller förorenat byte, i förhållande till testämnets koncentration i födan eller bytet. Biomagnifiering kan leda till överföring eller ackumulering av testämnet inom näringskedjor.
|
|
|
Ackumuleringsfaktorn biota/sediment (BSAF): den fettnormaliserade testämneskoncentrationen vid ett stabilt tillstånd i eller på testorganismen dividerad med den organiskt kol-normaliserade koncentrationen av ämnet i sedimentet vid ett stabilt tillstånd. Ca uttrycks då som g kg– 1 fettinnehåll i organismen och Cs som g kg– 1 organiskt innehåll i sedimentet.
|
|
|
Konditioneringsperioden: används för att stabilisera den mikrobiella komponenten i sedimentet och avlägsna t.ex. ammoniak från sedimentets beståndsdelar. Den äger rum före spikningen av sedimentet med testämnet. Vanligtvis kastas det överliggande vattnet bort efter konditioneringen.
|
|
|
Eliminering av ett testämne: förlusten av detta ämne från testorganismens vävnad genom aktiva eller passiva processer som inträffar oberoende av förekomsten eller frånvaron av testämnet i det omgivande mediet.
|
|
|
Elimineringsfas: den tid efter överföringen av testorganismerna från ett förorenat medium till ett medium som inte innehåller testämne under vilken elimineringen (eller nettoförlusten) av ämnet från testorganismerna studeras.
|
|
|
Elimineringskonstant (ke): det numeriska värde som definierar reduktionshastigheten för testämneskoncentrationen i eller på testorganismen efter överföring av testorganismerna från ett medium som innehåller testämnet till ett kemikaliefritt medium (ke uttrycks i d– 1).
|
|
|
Stabiliseringsperiod: används för att låta testämnet fördela sig mellan den fasta fasen, porvattnet och det överliggande vattnet. Den äger rum efter spikningen av sedimentet med testämnet och före tillsatsen av testorganismerna.
|
|
|
Fördelningskoefficienten oktanol/vatten (Kow): förhållandet mellan ämnets löslighet i n-oktanol och i vatten vid jämvikt, ibland även uttryckt som Pow. Logaritmen av Kow (log Kow) används som en indikation på ett ämnes potential för bioackumulering i vattenlevande organismer.
|
|
|
Fördelningskoefficienten organiskt kol/vatten (Koc): förhållandet mellan ett ämnes koncentration i eller på sedimentets fraktion av organiskt kol och ämnets koncentration i vatten vid jämvikt.
|
|
|
Överliggande vatten: det vatten som täcker sedimentet i testkärlet.
|
|
|
Platå eller stabilt tillstånd: ett tillstånd där jämvikt råder mellan de upptagnings- och elimineringsprocesser som inträffar samtidigt under exponeringsfasen. Det stabila tillståndet uppnås i diagrammet över BAF vid varje provtagningsperiod mot tiden när kurvan blir parallell med tidsaxeln och tre på varandra följande analyser av BAF på prover tagna med intervaller på minst två dagar ligger inom 20 % av varandra, och det inte finns några statistiskt signifikanta skillnader mellan de tre provtagningsperioderna. För testämnen som tas upp långsamt är det lämpligare med intervall på sju dagar (5).
|
|
|
Porvatten: det vatten som finns i mellanrummen mellan sediment- eller jordpartiklar.
|
|
|
Konstanten för sedimentets upptagningshastighet (ks): ett numeriskt värde som definierar ökningshastigheten av testämneskoncentrationen i eller på testorganismen till följd av upptagning från sedimentfasen (ks uttrycks som g sediment kg– 1 maskar d– 1).
|
|
|
Spikat sediment: sediment till vilket ett testämne har tillsatts.
|
|
|
Bioackumuleringsfaktor vid stabilt tillstånd (BAFss): den BAF som gäller vid ett stabilt tillstånd och som inte förändras betydligt över en längre tidsperiod, förutsatt att testämneskoncentrationen i det omgivande mediet (Cs uttryckt som g kg– 1 våt- eller torrvikt sediment) är konstant under denna tidsperiod.
|
|
|
Upptagnings- eller exponeringsfasen: den tid under vilken testorganismerna exponeras för testämnet.
|
Tillägg 2
Beräkning av upptagnings- och elimineringsparametrar
Den viktigaste endpointen i ett bioackumuleringstest är bioackumuleringsfaktorn, BAF. Det uppmätta BAF-värdet kan beräknas genom att dividera testämneskoncentrationen i testorganismen, Ca, med testämneskoncentrationen i sedimentet, Cs, vid stabilt tillstånd. Om ett stabilt tillstånd inte uppnås under upptagningsfasen beräknas BAF på samma sätt för dag 28. Man bör dock notera huruvida BAF är baserat på koncentrationer vid stabilt tillstånd eller inte.
Den bästa metoden för att få fram den kinetiska bioackumuleringsfaktorn (BAFK), konstanten för upptagningshastigheten i sedimentet (ks) och elimineringskonstanten (ke) är att använda icke-linjära datorbaserade parameteruppskattningsmetoder. Förutsatt att man känner till tidsserien av genomsnittliga ackumuleringsfaktorer (Ca, medelvärden för varje provtagningsdatum/Cs, medelvärden för varje provtagningsdatum = AF) för upptagningsfasen på grundval av maskarnas och sedimentets våtvikt, och modellekvationen
|
AF(t) = BAF × (1 – eke × t)
|
[ekvation 1]
|
där AF(t) är förhållandet mellan testämneskoncentrationen i maskarna och testämneskoncentrationen i sedimentet vid en given tidpunkt (t) i upptagningsfasen, kan dessa datorprogram beräkna värden för BAFK, ks och ke.
Om ett stabilt tillstånd inte uppnås under upptagningsfasen, (dvs. t = ∞), kan ekvation 1 förenklas till
|

|
[ekvation 2]
|
där
|
ks
|
=
|
konstanten för upptagningshastigheten i vävnad (g sediment kg– 1 maskar d– 1)
|
|
ke
|
=
|
elimineringskonstanten (d– 1)
|
Då är ks/ke×Cs en tillnärmning av testämneskoncentrationen i maskvävnad vid ett stabilt tillstånd (Ca,ss).
Ackumuleringsfaktorn biota/sediment (BSAF) beräknas på följande sätt:

där foc är fraktionen organiskt kol i sedimentet och flip är fraktionen fett i maskarna, båda baserade antingen på torrvikt eller på våtvikt.
Förutsatt att man känner till en tidsserie med koncentrationsvärden kan elimineringskinetiken modelleras med hjälp av följande modellekvationer och en icke-linjär datorbaserad parameteruppskattningsmetod.
Det genomsnittliga uppmätta värdet för rester i kroppen vid slutet av upptagningsfasen rekommenderas som standardutgångspunkt. Värdet som modellerats/beräknats från upptagningsfasen bör endast användas t.ex. om det uppmätta värdet avviker väsentligt från det modellerade värdet för rester i kroppen. Se även punkt 50 för alternativa förhandsexponeringar av de maskar som valts ut för elimineringen. Med detta tillvägagångssätt anses proverna från dessa förhandsexponerade maskar på dag 0 av elimineringsfasen ge en realistisk mängd rester i kroppen att inleda elimineringskinetiken med.
Om datapunkterna plottade mot tiden indikerar en konstant exponentiell minskning av testämneskoncentrationen i djuren kan en one-compartment-modell (ekvation 4) användas för att beskriva elimineringens tidsförlopp.
|
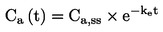
|
[ekvation 3]
|
Elimineringsprocesserna verkar ibland ha två faser med en snabb minskning av Ca till en början och därefter en långsammare avgång av testämnen senare under elimineringen (8) (19) (25)). De två faserna kan tolkas med antagandet att det finns två olika avdelningar (compartments) i organismen från vilka testämnet avgår med olika hastighet. I sådana fall bör information inhämtas från specifik litteratur (15) (16) (17) (25).
En two-compartment-eliminering beskrivs t.ex. genom följande ekvation (25):
|
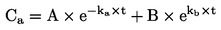
|
[ekvation 4]
|
A och B utgör storleken på avdelningarna (i procent av de totala resterna i vävnaderna), där A är avdelningen med snabb förlust av ämnet och B avdelningen med långsam förlust av testämnet. Summan av A och B motsvarar 100 % av hela djurets avdelningsvolym vid ett stabilt tillstånd. ka och kb representerar motsvarande elimineringskonstanter (d– 1). Om two-compartmentmodellen anpassas till depureringsdata kan upptagningskonstanten ks bestämmas på följande sätt (53) (54):
|

|
[ekvation 5]
|
Dessa modellekvationer bör dock användas med försiktighet, särskilt när förändringar i testämnets biotillgänglighet inträffar under testets gång (42).
Som ett alternativ till de ovan beskrivna modellekvationerna kan kinetiken (ks och ke) även beräknas i ett steg genom att tillämpa modellen för första ordningens kinetik på alla data från både upptagnings- och elimineringsfasen tillsammans. För en beskrivning av en metod som möjliggör en sådan kombinerad beräkning av upptagnings- och elimineringskonstanterna, se hänvisningarna (55), (56) och (57).
De icke-eliminerade resterna (NER) bör beräknas som en sekundär endpoint genom att multiplicera förhållandet mellan den genomsnittliga koncentrationen i maskarna (Ca) på dag 10 av elimineringsfasen och den genomsnittliga koncentrationen i maskarna (Ca) vid ett stabilt tillstånd (dag 28 i upptagningsfasen) med 100:

Tillägg 3
Exempel på provtagningsschema för ett 28-dagars bioackumuleringstest
a) Upptagningsfas (inbegripet en fyra dagars stabiliseringsfas)
|
Dag
|
Aktiviteter
|
|
– 6
|
Bered torvlösningen för sedimentet, konditionera lösningen i 48 timmar.
|
|
– 4
|
Spika sedimentet eller sedimentfraktionen, blanda alla beståndsdelar till sedimentet, ta sedimentprover på behandlat kontrollsediment och kontrollsediment med lösningsmedel för bestämning av testämneskoncentrationen, tillsätt det överliggande vattnet, inkubera under testförhållanden (stabiliseringsfasen).
|
|
– 3/– 2
|
Skilj testorganismerna från odlingen för acklimatisering.
|
|
0
|
Mät vattenkvaliteten (se punkt 52), avlägsna replikat för provtagning av vatten och sediment för bestämning av testämneskoncentrationer, fördela maskarna slumpmässigt i testbehållarna, behåll tillräcklig mängd delprov med maskar för bestämning av de analytiska bakgrundsvärdena, kontrollera lufttillförseln vid användning av ett slutet testsystem.
|
|
1
|
Avlägsna replikat för provtagning, kontrollera lufttillförseln, maskarnas beteende, vattenkvaliteten (se punkt 56), ta vatten-, sediment- och maskprover för bestämning av testämneskoncentrationen.
|
|
2
|
Kontrollera lufttillförseln, maskarnas beteende och temperaturen.
|
|
3
|
Samma som dag 1.
|
|
4–6
|
Samma som dag 2.
|
|
7
|
Samma som dag 1, fyll på vatten vid behov för att kompensera för avdunstat vatten.
|
|
8–13
|
Samma som dag 2.
|
|
14
|
Samma som dag 1, fyll på vatten vid behov för att kompensera för avdunstat vatten.
|
|
15–20
|
Samma som dag 2.
|
|
21
|
Samma som dag 1, fyll på vatten vid behov för att kompensera för avdunstat vatten.
|
|
22–27
|
Samma som dag 2.
|
|
28
|
Samma som dag 1, mät vattenkvaliteten (se punkt 52), slutet på upptagningsfasen, behåll tillräcklig mängd delprov med maskar för bestämning av de analytiska bakgrundsvärdena, våt- och torrvikt samt fettinnehåll, överför maskarna från de kvarvarande exponeringskärlen till kärl som innehåller rent sediment för elimineringsfasen (ingen tarmtömning), ta vatten-, sediment- och maskprover på lösningsmedelskontrollerna, ta prover på lösningarna i fällorna, om sådana används.
|
|
|
Förhandsexponeringsaktiviteterna (stabiliseringsfasen) bör planeras med hänsyn tagen till egenskaperna hos det ämne som testas. Om så krävs, konditionera det beredda sedimentet under överliggande vatten vid 20 ± 2 °C i sju dagar – bered i så fall sedimentet tidigare!
|
|
|
Aktiviteterna för dag 2 bör genomföras dagligen (åtminstone på arbetsdagar).
|
b) Elimineringsfas
|
Dag
|
Aktiviteter
|
|
– 6
|
Bered torvlösningen för sedimentet, konditionera lösningen i 48 timmar.
|
|
– 4
|
Blanda alla beståndsdelar till sedimentet, ta sedimentprover på behandlat kontrollsediment och kontrollsediment med lösningsmedel för bestämning av testämneskoncentrationen, tillsätt det överliggande vattnet, inkubera under testförhållanden.
|
|
0 (dag 28 i upp-tagnings-fasen)
|
Mät vattenkvaliteten (se punkt 52), överför maskarna från de återstående exponeringsreplikatkärlen till kärl som innehåller rent sediment, avlägsna replikaten efter 4–6 timmar för provtagning av vatten, sediment och maskar för bestämning av testämneskoncentrationen, fördela maskarna slumpvis i testbehållarna.
|
|
1
|
Avlägsna replikat för provtagning, kontrollera lufttillförseln, maskarnas beteende, vattenkvaliteten (se punkt 52), ta vatten-, sediment- och maskprover för bestämning av testämneskoncentrationen.
|
|
2
|
Kontrollera lufttillförseln, maskarnas beteende och temperaturen.
|
|
3
|
Samma som dag 1.
|
|
4
|
Samma som dag 2.
|
|
5
|
Samma som dag 1.
|
|
6
|
Samma som dag 2.
|
|
7
|
Samma som dag 1, fyll på vatten vid behov för att kompensera för avdunstat vatten.
|
|
8–9
|
Samma som dag 2.
|
|
10
|
Samma som dag 1, slutet på elimineringsfasen, mät vattenkvaliteten (se punkt 52), ta vatten-, sediment- och maskprover på lösningsmedelskontrollerna, ta prover på lösningarna i fällorna, om sådana används.
|
|
|
Beredningen av sedimentet före elimineringsfasens början bör göras på samma sätt som före upptagningsfasens början.
|
|
|
Aktiviteterna för dag 2 bör genomföras dagligen (åtminstone på arbetsdagar).
|
Tillägg 4
Vissa fysikalisk-kemiska egenskaper hos godtagbart utspädningsvatten
|
BESTÅNDSDEL
|
KONCENTRATIONER
|
|
Partiklar
|
< 20 mg/l
|
|
Halt av organiskt kol
|
< 2μg/l
|
|
Ojoniserad ammoniak
|
< 1 μg/l
|
|
Resterande mängd klor
|
< 10 μg/l
|
|
Total mängd bekämpningsmedel som innehåller organiska fosforföreningar
|
< 50 ng/l
|
|
Total mängd bekämpningsmedel som innehåller organiska klorföreningar plus polyklorerade bifenyler
|
< 50 ng/l
|
|
Total mängd organiskt klor
|
< 25 ng/l
|
DET REKOMMENDERADE REKONSTITUERADE VATTNETS SAMMANSÄTTNING
|
(a)
|
Kalciumkloridlösning
Lös upp 11,76 g CaCl2 · 2H2O i avjonat vatten och späd till 1 liter med avjonat vatten
|
|
(b)
|
Magnesiumsulfatlösning
Lös upp 4,93 g MgSO4 · 7H2O i avjonat vatten och späd till 1 liter med avjonat vatten
|
|
(c)
|
Natriumbikarbonatlösning
Lös upp 2,59 g NaHCO3 i avjonat vatten och späd till 1 liter med avjonat vatten
|
|
(d)
|
Kaliumkloridlösning
Lös upp 0,23 g KCl i avjonat vatten och späd till 1 liter med avjonat vatten
|
Alla kemikalier ska vara av analyskvalitet.
Konduktiviteten i det destillerade eller avjonade vattnet bör inte överstiga 10 μScm– 1.
25 ml av var och en av lösningarna (a) till (d) blandas och den totala volymen späds till 1 liter med avjonat vatten. Summan av kalcium- och magnesiumjoner i denna lösning är 2,5 mmol/l.
Förhållandet mellan Ca- och Mg-joner är 4:1 och mellan Na- och K-joner 10:1. Syrakapaciteten KS4,3 i denna lösning är 0,8 mmol/l.
Lufta utspädningsvattnet till dess att syremättnad uppnås, och lagra det sedan i ungefär två dagar utan ytterligare luftning före användning.
pH-värdet för godtagbart utspädningsvatten bör ligga i intervallet 6–9.
Tillägg 5
Syntetiskt sediment – rekommendationer om beredning och lagring
I motsats till kraven i testmetod C.8 (40) rekommenderas att torvinnehållet i det syntetiska sedimentet ska vara 2 % i stället för 10 % torrsubstans, för att motsvara en låg till måttlig halt av organiska ämnen i naturliga sediment (58).
Den procentuella andelen torra beståndsdelar i det syntetiska sedimentet:
|
Beståndsdel
|
Egenskaper
|
% av torrt sediment
|
|
Torv
|
Vitmosstorv (Sphagnum), nedbrytningsgrad: ’medium’, lufttorkad, inga synliga växtrester, finfördelad (partikelstorlek ≤ 0,5 mm)
|
2 ± 0,5
|
|
Kvartssand
|
Kornstorlek: ≤ 2 mm, men > 50 % av partiklarna bör vara av storleken 50–200 μm
|
76
|
|
Kaolinlera
|
Kaolinithalt ≥ 30 %
|
22 ± 1
|
|
Foderkälla
|
Folia urticae, pulvriserade blad av Urtica sp. (nässla), finmalda (partikelstorlek ≤ 0,5 mm), eller en blandning av pulvriserade blad från Urtica sp. med alfacellulosa (1: 1), i enlighet med apoteksstandarder, lämplig som livsmedel, dessutom torrt sediment
|
0,4–0,5 %
|
|
Kalcium-karbonat
|
CaCO3, i pulverform, kemiskt rent, dessutom torrt sediment
|
0,05–1
|
|
Avjonat vatten
|
Konduktivitet ≤ 10 μS/cm, utöver torrt sediment
|
30–50
|
Om man förväntar sig förhöjda koncentrationer av ammoniak, t.ex. om det är känt att testämnet hämmar nitrifikationen, kan det vara lämpligt att ersätta 50 % av det kväverika nässlelpulvret med cellulosa (t.ex. alfacellulosapulver, kemiskt rent, partikelstorlek ≤ 0,5 mm).
Beredning
Torven lufttorkas och mals ner till ett fint pulver (kornstorlek ≤ 0,5 mm, inga synliga växtrester). En suspension med den erforderliga mängden torvpulver bereds med en del av det avjonade vatten som ska tillsättas det torra sedimentet (en vattenvolym på 11,5 × torrvikt torv har visat sig användbar för att producera en rörbar torvsörja (8)) med hjälp av en högpresterande homogeniseringsapparat.
Suspensionens pH justeras till 5,5 ± 0,5 med CaCO3. Suspensionen konditioneras i minst två dagar med skonsam omrörning vid 20 ± 2 °C, för att stabilisera pH-värdet och skapa en stabil mikrobiell komponent. pH uppmäts på nytt och justeras vid behov till 6,0 ± 0,5 med CaCO3. Sedan blandas hela suspensionen med övriga torra beståndsdelar, med hänsyn tagen till de delar som används för spikning. Det återstående avjonade vattnet tillsätts för att erhålla ett homogent sediment. pH uppmäts på nytt och justeras vid behov till 6,5–7,5 med CaCO3. Om man förväntar sig utveckling av ammoniak kan det vara lämpligt att hålla pH-värdet i sedimentet under 7,0 (t.ex. mellan 6,0 och 6,5). Prover tas av sedimentet för att bestämma torrvikten och halten av organiskt kol. Om man förväntar sig utveckling av ammoniak, kan det syntetiska sedimentet konditioneras i sju dagar under samma betingelser som råder i det efterföljande testet (t.ex. ett förhållande mellan sediment och vatten på 1: 4, sedimentskiktets tjocklek som i testkärlen) innan det spikas med testämnet, dvs. det bör fyllas på med vatten, som bör luftas. I slutet av konditioneringsperioden bör det överliggande vattnet avlägsnas och kasseras. Prover tas av sedimentet för att bestämma torrvikten och halten av organiskt kol (t.ex. tre prov).
Därefter blandas den spikade kvartssanden med sedimentet för varje behandlingsnivå, och sedimentet fördelas till replikattestkärlen, som fylls på med testvatten (t.ex. förhållande mellan sediment och vatten 1:4, sedimentskiktets tjocklek samma som i testkärlen). Kärlen inkuberas sedan under samma betingelser som råder i det efterföljande testet. Det är nu stabiliseringsperioden inleds. Det överliggande vattnet bör luftas.
Den valda foderkällan bör läggas till före eller under spikningen av sedimentet med testämnet. Inledningsvis kan den blandas med torvsuspensionen (se ovan). Man kan dock undvika onödig försämring av foderkällan före tillsatsen av testorganismerna – t.ex. vid långa stabiliseringsperioder – genom att man påbörjar exponeringen så snart som möjligt efter fodertillsatsen. För att se till att fodret är i tillräcklig kontakt med testämnet bör foderkällan blandas med sedimentet senast samma dag som sedimentet spikas med testämnet. Undantag kan göras om stabiliseringsperiodens längd leder till en alltför stor mikrobiell nedbrytning av fodret innan testorganismerna tillförs. Prover tas av sedimentet för att bestämma torrvikten och halten av organiskt kol (t.ex. tre prover av det spikade sedimentet eller kontrollsedimentet).
Komponenternas (torv, sand, kaolin) torrvikt ska rapporteras i gram och i procent av den totala torrvikten.
Den volym vatten som ska tillsättas till de torra beståndsdelarna under beredningen av sedimentet bör också rapporteras i procent av den totala torrvikten (t.ex. 100 % torrvikt + 46 % vatten betyder att till 1 000 g torrvikt tillsätts sammanlagt 460 ml vatten, vilket ger 1 460 g vått sediment).
Lagring
Det syntetiska sedimentets torra beståndsdelar kan lagras i ett torrt och svalt utrymme vid rumstemperatur. Det färdigberedda våta sedimentet kan lagras (endast för fortsatt användning i kulturen) vid 4 ± 2 °C i mörker under en period på 2–4 veckor från beredningsdagen (8).
Sediment som spikats med testämne bör användas omedelbart, med undantag för om det finns information om att sedimentet i fråga kan förvaras utan att testämnets toxicitet och biotillgänglighet påverkas. Prover av spikat sediment kan lagras under de förhållanden som rekommenderas för testämnet i fråga fram till analysen.
Tillägg 6
Arter av oligochaeta som rekommenderas för bioackumuleringstester
Tubifex tubifex (MÜLLER), Tubificidae, Oligochaeta
Glattmasken Tubifex tubifex (Müller) (Tubificidae, Oligochaeta) lever i sötvattenssediment i rör som är fodrade med slem. Maskarna lever i dessa rör med huvudet nedåt och äter sedimentpartiklar från vilka de tillgodogör sig mikroorganismer och organiskt material. Bakdelen tjänar som andningsorgan och vajar normalt sett i det överliggande vattnet. Även om denna art lever i ett stort antal sedimenttyper över hela norra halvklotet, föredrar Tubifex tubifex relativt små kornstorlekar (59). Denna arts lämplighet för ekotoxikologisk testning beskrivs exempelvis i (8) (29) (31) (39) (60) (62) (63).
Odlingsmetoder
För att man ska få ett tillräckligt antal Tubifex tubifex för bioackumuleringstester måste maskarna hållas i en permanent laboratorieodling. Ett system som består av syntetiskt sediment baserat på syntetisk jord i enlighet med testmetod C.8 (40) och rekonstituerat vatten i enlighet med testmetod C.1 rekommenderas för odling av T. tubifex (8).
Behållare av glas eller rostfritt stål med en höjd på 12–20 cm kan användas som odlingskärl. Varje odlingsbehållare fylls med ett skikt fuktigt syntetiskt sediment som beretts enligt anvisningarna i tillägg 5. Sedimentskiktets djup bör vara lämpligt för maskarnas naturliga grävbeteende (minst 2 cm djup för T. tubifex). Rekonstituerat vatten tillsätts till systemet. Man bör undvika att störa sedimentet. Vattnet ska luftas försiktigt (t.ex. 2 bubblor per sekund med 0,45 μm-filtrerad luft) via en pasteurpipett placerad 2 cm ovanför sedimentets yta. Den rekommenderade odlingstemperaturen är 20 ± 2 °C.
Maskarna tillförs till odlingssystemet med en högsta djurtäthet på 20 000 individer/m2 sedimentyta. En större djurtäthet kan leda till minskad tillväxt och fortplantning (43).
I odlingar med syntetiskt sediment måste maskarna utfodras. Foder bestående av finmalt fiskfoder, t.ex. TetraMin®, kan tjäna som tilläggsnäring (8); Klerks 1994, pers. medd. Utfodringsfrekvensen bör möjliggöra tillräcklig tillväxt och fortplantning och minimera ackumuleringen av ammoniak och svamptillväxt i odlingen. Utfodring bör ske två gånger per vecka (t.ex. 0,6–0,8 mg per cm2 sedimentyta). Praktiska erfarenheter har visat att applicering av foder som suspenderats och homogeniserats i avjonat vatten kan underlätta en homogen foderdistribution på sedimentytan i odlingsbehållarna.
För att undvika ackumulering av ammoniak bör det överliggande vattnet bytas ut via ett genomflödessystem, eller manuellt åtminstone en gång i veckan. Sedimentet bör bytas ut var tredje månad i stamodlingarna.
Provtagning av maskar från odlingen kan göras genom att sikta odlingssedimentet genom en 1 mm sikt om man endast behöver vuxna djur. För insamling av kokonger behövs en 0,5 mm sikt, och för juvenila maskar en 0,25 mm sikt. Siktarna kan placeras i rekonstituerat vatten efter det att sedimentet har passerat igenom dem. Maskarna lämnar nätet och kan därefter plockas upp ur vattnet med hjälp av en mjuk stålpincett eller en pipett med flampolerade kanter.
Endast intakta och tydligt identifierade exemplar av Tubifex tubifex (t.ex. (64)) används för att inleda ett test eller starta nya odlingar. Sjuka eller skadade maskar samt kokonger angripna av svamphyfer måste kastas bort.
En synkroniserad odling kan tillhandahålla maskar med specificerad ålder i lämpliga intervall när så önskas. Vid de valda intervallen (t.ex. varannan vecka) startas nya odlingar i separata kärl med djur i en viss ålder (t.ex. kokonger). Vid de odlingsbetingelser som beskrivs här når maskarna vuxen ålder efter 8–10 veckor. Odlingarna kan skördas när maskarna har producerat nya kokonger, t.ex. efter tio veckor. De insamlade vuxna djuren kan användas för tester, och nya kulturer kan startas med kokongerna.
Lumbriculus variegatus (MÜLLER), Lumbriculidae, Oligochaeta
Lumbriculus variegatus (Lumbriculidae, Oligochaeta) lever också i sötvattenssediment över hela världen och används allmänt för ekotoxikologisk testning. Information om arternas biologi, odlingsförhållanden och känslighet finns i (1) (6) (9) (36). Lumbriculus variegatus kan med vissa begränsningar också odlas i det syntetiska sediment som rekommenderas för T. tubifex enligt (8). Eftersom L. variegatus i naturen föredrar grövre sediment än T. tubifex (59) kan laboratorieodlingar med det syntetiska sediment som används för T. tubifex upphöra efter 4–6 månader. Praktiska erfarenheter visar att L. variegatus kan hållas i ett sandigt substrat (t.ex. kvartssand, fint grus) i ett genomflödessystem med fiskfoder som näringskälla under flera år utan att man behöver förnya substratet. En stor fördel med L. variegatus framför andra vattenlevande oligochaeter är dess snabba fortplantning, vilket leder till en snabbt ökande biomassa i laboratorieodlade populationer (1) (6) (9) (10).
Odlingsmetoder
Odlingsbetingelser för Lumbriculus variegatus beskrivs i detalj i Phipps m.fl. (1993) (10), Brunson m.fl. (1998) (28), ASTM (2000) (1), U.S. EPA (2000) (6). En kort sammanfattning av dessa betingelser ges nedan.
Maskarna kan odlas i stora akvarier (57–80 liter) vid 23 °C med fotoperiod på 16 timmar ljus (100–1 000 lux) och 8 timmar mörker med dagligen förnyat naturligt vatten (45–50 liter per akvarium). Substratet bereds genom att oblekta bruna pappersservetter klipps till remsor, som sedan blandas med odlingsvatten i några sekunder, vilket leder till att man får små bitar av papperssubstrat. Detta substrat kan sedan omedelbart användas i odlingsakvarier för Lumbriculus genom att man täcker botten av akvariet med det, eller lagras fryst i avjonat vatten för senare användning. Nytt substrat i akvariet räcker i allmänhet i ungefär två månader.
Varje maskodling startas upp med 500–1 000 maskar som utfodras med en 10 ml suspension innehållande 6 g yngelfoder för öring tre gånger per vecka under förnyelse- eller genomflödesförhållanden. Statiska eller semistatiska odlingar bör ha lägre utfodringsfrekvens för att förebygga tillväxt av bakterier och svamp. Foder och papperssubstrat bör analyseras med avseende på de ämnen som ska användas i bioackumuleringstesterna.
Under dessa förhållanden fördubblas vanligen antalet individer i odlingen på cirka 10–14 dagar.
Lumbriculus variegatus kan avlägsnas från odlingarna t.ex. genom att substratet överförs med ett finmaskigt nät, eller med hjälp av en glaspipett med bred spets (cirka 5 mm i diameter), till en separat bägare. Om man också överför substrat till denna bägare låter man bägaren som innehåller maskar och substrat stå över natten under genomflödesförhållanden, vilket gör att substratet avlägsnas från bägaren medan maskarna blir kvar på kärlets botten. De kan sedan överföras till nyligen beredda odlingsakvarier eller bearbetas ytterligare för testet enligt beskrivning i (1) och (6). Skador eller autotomi bör undvikas, t.ex. genom att man använder pipetter med flampolerade kanter eller tandläkarsonder av rostfritt stål vid hanteringen av maskarna.
En fråga som man bör kritiskt beakta vid användning av L. variegatus i bioackumuleringstest med sediment är dess reproduktionssätt (fragmentering (architomy) följt av regenerering (morphallaxis)). Resultatet av denna asexuella reproduktion är två delar som inte intar någon föda förrän den främre eller bakre delen regenererats (t.ex. (36)(37)). Detta innebär när det gäller L. variegatus att upptagningen av sediment och föroreningar genom födan eventuellt inte sker löpande som hos glattmaskar (Tubificidae), vilka inte fortplantar sig genom delning.
Därför bör en synkronisering utföras för att minimera okontrollerad reproduktion och regenerering, som båda leder till stora variationer i testresultaten. Denna variation kan inträffa om vissa individer, som har genomgått delning och därmed inte intar någon föda under en viss tid, i mindre grad exponeras för testkemikalien än andra individer som inte genomgår delning under testet, t.ex. (38). Maskarna bör delas på konstgjord väg 10–14 dagar före början av exponeringen (synkronisering) (65). Stora maskar bör användas som helst inte visar några tecken på att nyligen ha delats. Dessa maskar kan placeras på ett objektglas med en droppe odlingsvatten och skäras av på den mittersta kroppsregionen med en skalpell. Man bör se till att de bakre ändarna är av liknande storlek. Man bör sedan låta de bakre ändarna återbilda nya huvuden i ett kulturkärl som innehåller samma substrat som används i kulturen och rekonstituerat vatten tills exponeringen inleds. Tecknet på att regenereringen av nya främre delar pågår är att de synkroniserade maskarna gräver sig igenom i substratet (närvaron av återbildade huvuddelar kan bekräftas genom att ett representativt delprov granskas i ett binokulärt mikroskop). Testorganismerna kan därefter förväntas befinna sig i ett liknande fysiologiskt tillstånd. Detta innebär att när de synkroniserade maskarna regenererar genom morphallaxis under testets gång exponeras praktiskt taget alla djur i lika hög grad för det spikade sedimentet. De synkroniserade maskarna bör utfodras så snart de börjar gräva sig genom substratet, eller sju dagar efter delningen. Utfodringen bör vara jämförbar med den i de vanliga odlingarna, men det är tillrådligt att ge de synkroniserade maskarna samma foder som ska användas i testet. Maskarna bör hållas i samma temperatur som i testet, dvs. 20 ± 2 °C. Efter regenerering bör intakta hela maskar av liknande storlek som aktivt simmar eller kryper efter lätt mekanisk retning användas för testet. Skador eller autotomi bör undvikas, t.ex. genom att man använder pipetter med flampolerade kanter eller tandläkarsonder av rostfritt stål vid hanteringen av maskarna.
Vid användning av Lumbriculus variegatus i testet bör en ökning av antalet maskar ske under testet på grund av artens specifika fortplantningssätt, om betingelserna är lämpliga (6). Avsaknad av fortplantning i bioackumuleringstest med L. variegatus bör registreras och beaktas vid tolkningen av testresultaten.
Branchiura sowerbyi (BEDDARD), Tubificidae, Oligochaeta (ej validerad i ringtestet)
Branchiura sowerbyi lever i en mängd olika sedimenttyper i vattenmagasin, sjöar, dammar och floder, ursprungligen i tropiska områden. De finns också i varma vattenmassor på norra halvklotet. De är emellertid mer vanligt förekommande i gyttje-lersediment med hög halt av organiskt material. Maskarna lever i sedimentskiktet. Även maskarnas bakre ände är vanligen nergrävd. Denna art kan lätt identifieras på grund av gältrådarna på dess bakre del. Vuxna djur kan nå en längd på 9–11 cm och en vikt på 40–50 mg. Maskarna har en hög reproduktionstakt och uppvisar populationsfördubblingstider på mindre än två veckor under samma temperatur- och utfodringsförhållanden som beskrivs nedan (Aston m.fl., 1982 (65)). B. sowerbyi har använts i både toxicitets- och bioackumuleringsstudier (Marchese & Brinkhurst, 1996 (31) respektive Roghair m.fl., 1996, (67)).
Odlingsmetoder
En sammanfattning av odlingsbetingelserna för Branchiura sowerbyi återges nedan (tillhandahållna av Mercedes R. Marchese, INALI, Argentina, och Carla J. Roghair, RIVM, Nederländerna).
Man behöver inte hålla sig till en enda teknik för odling av testorganismerna. Organismerna kan odlas i oförorenade naturliga sediment (31). Praktiska erfarenheter har visat att ett medium bestående av naturligt sediment och sand förbättrar maskarnas tillstånd jämfört med rent naturligt sediment (32) (67). Trelitersbägare som innehåller 1 500 ml sediment/vattenmedium bestående av 375 ml naturligt oförorenat sediment (ca 10 % halt av organiskt kol, ca 17 % partiklar ≤ 63 μm), 375 ml ren sand (M32) och 750 ml rekonstituerat eller avklorerat vattenledningsvatten kan användas för odlingen (31) (32) (67). Pappersservetter kan också användas som substrat i odlingarna, men populationstillväxten är då lägre än i naturligt sediment. I semistatiska system luftas vattenskiktet i bägaren långsamt, och det överliggande vattnet bör förnyas en gång per vecka.
Varje bägare innehåller till att börja med 25 unga maskar. Efter två månader plockas de stora maskarna ut från sedimentet med en pincett och placeras i en ny bägare med nyberett sediment/vattenmedium. Den gamla bägaren innehåller också kokonger och unga maskar. Upp till 400 unga maskar per bägare kan insamlas på detta sätt. Vuxna maskar kan användas för fortplantning under minst ett år.
Temperaturen i kulturerna ska hållas mellan 21–25 °C. Temperaturvariationerna bör hållas under ± 2 °C. Den tid som krävs för embryots utveckling från äggläggning till dess att de unga maskarna lämnar kokongerna är ungefär tre veckor vid 25 °C. Äggproduktionen per överlevande mask befanns för B. sowerbyi vara från 6,36 (31) till 11,2 (30) i gyttja vid 25 °C. Antalet ägg per kokong varierar mellan 1,8 till 2,8 (66) (69) eller upp till 8 (68).
Löst syre, vattnets hårdhet, temperatur och pH bör mätas varje vecka. Fiskfoder (t.ex. TetraMin®) kan läggas till ad libitum som suspension två eller tre gånger per vecka. Maskarna kan också ad lib-utfodras med tinad sallat.
En stor fördel med denna art är den höga individuella biomassan (upp till 40–50 mg våtvikt per individ). Därför kan denna art användas för testning av bioackumuleringen av icke-radioaktivmärkta testämnen. Den kan exponeras i de system som används för T. tubifex eller L. variegatus med en enda individ per replikat (11). I sådana fall bör dock antalet replikat ökas, såvida inte större testbehållare används (11). Även giltighetskriteriet avseende grävbeteendet behöver justeras för denna art.
LITTERATUR
|
(1)
|
ASTM International (2000). Standard guide for the determination of the bioaccumulation of sediment-associated contaminants by benthic invertebrates, E 1688-00a. I ASTM International 2004 Annual Book of Standards. Vol. 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
|
|
(2)
|
Europeiska kommissionen (EC) (2003). Tekniska riktlinjer till stöd för kommissionens direktiv 93/67/EEG om riskbedömning för nya anmälda ämnen, kommissionens förordning (EG) nr 1488/94 om riskbedömning för existerande ämnen samt Europaparlamentets och rådets direktiv 98/8/EG om utsläppande av biocidprodukter på marknaden, del I–IV. Byrån för Europeiska gemenskapernas officiella publikationer, Luxemburg.
|
|
(3)
|
OECD (1992a). Report of the OECD workshop on effects assessment of chemicals in sediment. OECD Monographs No. 60. Organisationen för ekonomiskt samarbete och utveckling (OECD), Paris.
|
|
(4)
|
Ingersoll, C. G., Ankley, G. T., Benoit D. A., Brunson, E. L., Burton, G. A., Dwyer, F. J., Hoke, R. A., Landrum, P. F., Norberg-King, T. J. och Winger, P. V. (1996). Toxicity and bioaccumulation of sediment-associated contaminants using freshwater invertebrates: A review of methods and applications. Environ. Toxicol. Chem. 14, 1885–1894.
|
|
(5)
|
Kapitel C.13 i denna bilaga, Biokoncentration: Genomflödesprovning med fisk.
|
|
(6)
|
U.S. EPA (2000). Methods for measuring the toxicity and bioaccumulation of sediment-associated contaminants with freshwater invertebrates. Andra upplagan. EPA 600/R-99/064, U.S. Environmental Protection Agency, Duluth, MN, mars 2000.
|
|
(7)
|
Kapitel C.27 i denna bilaga, Toxicitetstest i sediment- och vattenfas på chironomidlarver med spikat sediment
|
|
(8)
|
Egeler, Ph., Römbke, J., Meller, M., Knacker, Th., Franke, C., Studinger, G. och Nagel, R. (1997). Bioaccumulation of lindane and hexachlorobenzene by tubificid sludgeworms (Oligochaeta) under standardised laboratory conditions. Chemosphere 35, 835–852.
|
|
(9)
|
Ingersoll, C. G., Brunson, E. L., Wang N., Dwyer, F. J., Ankley, G. T., Mount D. R., Huckins J., Petty, J. och Landrum, P. F. (2003). Uptake and depuration of nonionic organic contaminants from sediment by the oligochaete, Lumbriculus variegatus. Environmental Toxicology and Chemistry 22, 872–885.
|
|
(10)
|
Phipps, G. L., Ankley, G. T., Benoit, D. A. och Mattson, V. R. (1993). Use of the aquatic Oligochaete Lumbriculus variegatus for assessing the toxicity and bioaccumulation of sediment-associated contaminants. Environ.Toxicol. Chem. 12, 269–279.
|
|
(11)
|
Egeler, Ph., Römbke, J., Knacker, Th., Franke, C. och Studinger, G. (1999). Workshop on ’Bioaccumulation: Sediment test using benthic oligochaetes’, 26–27 april 1999, Hochheim/Main, Tyskland. Report on the R+D-project No. 298 67 419, Umweltbundesamt, Berlin.
|
|
(12)
|
Egeler, Ph., Meller, M., Schallnaß, H. J. och Gilberg, D. (2006). Validation of a sediment bioaccumulation test with endobenthic aquatic oligochaetes by an international ring test. Rapport till den federala miljöbyrån (Umweltbundesamt Dessau), R&D nr: 202 67 437.
|
|
(13)
|
Kelly, J. R., Levine, S. N., Buttel, L. A., Kelly, A. C., Rudnick, D. T. och Morton, R. D. (1990). Effects of tributyltin within a Thalassia seagrass ecosystem. Estuaries 13, 301–310.
|
|
(14)
|
Nendza, M. (1991). QSARs of bioaccumulation: Validity assessment of log Kow/log BCF correlations. I: R. Nagel och R. Loskill (red.): Bioaccumulation in aquatic systems. Contributions to the assessment. Proceedings of an international workshop, Berlin 1990. VCH, Weinheim.
|
|
(15)
|
Landrum, P. F., Lee II, H. och Lydy, M. J. (1992). Toxicokinetics in aquatic systems: Model comparisons and use in hazard assessment. Environ. Toxicol. Chem. 11, 1709–1725.
|
|
(16)
|
Markwell, R. D., Connell, D. W. och Gabric, A. J. (1989). Bioaccumulation of lipophilic compounds from sediments by oligochaetes. Wat. Res. 23, 1443–1450.
|
|
(17)
|
Gabric, A. J., Connell, D. W. och Bell, P. R. F. (1990). A kinetic model for bioconcentration of lipophilic compounds by oligochaetes. Wat. Res. 24, 1225–1231.
|
|
(18)
|
Kukkonen, J. och Landrum, P. F. (1994). Toxicokinetics and toxicity of sediment-associated Pyrene to Lumbriculus variegatus (Oligochaeta). Environ. Toxicol. Chem. 13, 1457–1468.
|
|
(19)
|
Franke, C., Studinger, G., Berger, G., Böhling, S., Bruckmann, U., Cohors-Fresenborg, D. och Jöhncke, U. (1994). The assessment of bioaccumulation. Chemosphere 29, 1501–1514.
|
|
(20)
|
OECD (2000). Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. OECD Environment, Health and Safety Publications, Series on Testing and Assessment No. 23.
|
|
(21)
|
U.S. EPA (1996). Special Considerations for Conducting Aquatic Laboratory Studies. Ecological Effects Test Guidelines. OPPTS 850.1000. Public Draft. EPA 712-C-96-113. U.S. Environmental Protection Agency.
|
|
(22)
|
Följande kapitel i denna bilaga:
|
|
Kapitel A.6, Vattenlöslighet
|
|
|
Kapitel A.8, Fördelningskoefficient, skakkolvmetoden
|
|
|
Kapitel A.24, Fördelningskoefficient, HPLC-metoden
|
|
|
Kapitel C.7, Nedbrytning – abiotisk nedbrytning: hydrolys som funktion av pH.
|
|
|
Kapitel C.4 A–F Bestämning av ’lätt’ bionedbrytbarhet
|
|
|
Kapitel C.19 Uppskattning av adsorptionskoefficienten (Koc) i jord och avloppsslam med användning av högtrycksvätskekromatografi (HPLC)
|
|
|
Kapitel C.29, Lätt bionedbrytbarhet – CO2 i förslutna kärl (headspace-test)
|
|
|
(23)
|
OECD (1996). Direct phototransformation of chemicals in water. Environmental Health and Safety Guidance Document Series on Testing and Assessment of Chemicals No. 3. OECD, Paris.
|
|
(24)
|
Antoine, M. D., Dewanathan, S. och Patonay, G. (1991). Determination of critical micelles concentration of surfactants using a near-infrared hydrophobicity probe. Microchem. J. 43, 165–172.
|
|
(25)
|
Beek, B., S. Boehling, U. Bruckmann, C. Franke, U. Joehncke och G. Studinger (2000). The assessment of bioaccumulation. I Hutzinger, O. (red.), The Handbook of Environmental Chemistry, Vol. 2, Del J (volymredaktör: B. Beek): Bioaccumulation – New Aspects and Developments. Springer-Verlag Berlin Heidelberg: 235–276.
|
|
(26)
|
Spacie, A. och Hamelink, J. L. (1982). Alternative models for describing the bioconcentration of organics in fish. Environ. Toxicol. Chem. 1, 309–320.
|
|
(27)
|
Hawker, D. W. och Connell, D. W. (1988). Influence of partition coefficient of lipophilic compounds on bioconcentration kinetics with fish. Wat. Res. 22, 701–707.
|
|
(28)
|
Brunson, E. L., Canfield, T. J., Ingersoll, C. J. och Kemble, N. E. (1998). Assessing the bioaccumulation of contaminants from sediments of the Upper Mississippi river using field-collected oligochaetes and laboratory-exposed Lumbriculus variegatus. Arch. Environ. Contam. Toxicol. 35, 191–201.
|
|
(29)
|
Reynoldson, T. B., Thompson, S. P. och Bamsey, J. L. (1991). A sediment bioassay using the tubificid oligochaete worm Tubifex tubifex. Environ. Toxicol. Chem. 10, 1061–1072.
|
|
(30)
|
Aston, R. J. och Milner, A. G. P. (1981). Conditions for the culture of Branchiura sowerbyi (Oligochaeta: Tubificidae) in activated sludge. Aquaculture 26, 155–160.
|
|
(31)
|
Marchese, M. R. och Brinkhurst, R. O. (1996). A comparison of two tubificid species as candidates for sublethal bioassay tests relevant to subtropical and tropical regions. Hydrobiologia 334, 163–168.
|
|
(32)
|
Roghair, C. J. och Buijze, A. (1994). Development of sediment toxicity tests. IV. A bioassay to determine the toxicity of field sediments to the oligochaete worm Branchiura sowerbyi. RIVM Report 719102027.
|
|
(33)
|
Kapitel C.1 i denna bilaga, Test avseende akut toxicitet för fisk.
|
|
(34)
|
OECD (1992c). Guidelines for Testing of Chemicals No. 210. Fish, Early-life Stage Toxicity Test. OECD, Paris.
|
|
(35)
|
Kaster, J. L., Klump, J. V., Meyer, J., Krezoski, J. och Smith, M. E. (1984). Comparison of defecation rates of Limnodrilus hoffmeisteri using two different methods. Hydrobiologia 11, 181–184.
|
|
(36)
|
Leppänen, M. T. och Kukkonen, J. V. K. 1998: Factors affecting feeding rate, reproduction and growth of an oligochaete Lumbriculus variegatus (Müller). Hydrobiologia 377, 183–194.
|
|
(37)
|
Leppänen, M. T. och Kukkonen, J. V. K. 1998: Relationship between reproduction, sediment type and feeding activity of Lumbriculus variegatus (Müller): Implications for sediment toxicity testing. Environ. Toxicol. Chem. 17, 2196–2202.
|
|
(38)
|
Leppänen, M. T. och Kukkonen, J. V. K. (1998). Relative importance of ingested sediment and porewater as bioaccumulation routes for pyrene to oligochaete (Lumbriculus variegatus, Müller). Environ. Sci. Toxicol. 32, 1503–1508.
|
|
(39)
|
Martinez-Madrid, M., Rodriguez, P., Perez-Iglesias, J. I. och Navarro, E. (1999). Sediment toxicity bioassays for assessment of contaminated sites in the Nervion river (Northern Spain). 2. Tubifex tubifex (Müller) reproduction sediment bioassay. Ecotoxicology 8, 111–124.
|
|
(40)
|
Kapitel C.8 i denna bilaga, Toxicitet hos daggmaskar.
|
|
(41)
|
Environment Canada (1995). Guidance document on measurement of toxicity test precision using control sediments spiked with a reference toxicant. Environmental Protection Series Report EPS 1/RM/30.
|
|
(42)
|
Landrum, P. F. (1989). Bioavailability and toxicokinetics of polycyclic aromatic hydrocarbons sorbed to sediments for the amphipod Pontoporeia hoyi. Environ. Sci. Toxicol. 23, 588–595.
|
|
(43)
|
Poddubnaya, T. L. (1980). Life cycles of mass species of Tubificidae (Oligochaeta). I: R. O. Brinkhurst och D. G. Cook (red.): Aquatic Oligochaeta Biology, 175–184. Plenum Press, New York.
|
|
(44)
|
ASTM (1998). Standard guide for collection, storage, characterisation, and manipulation of sediment for toxicological testing. American Society for Testing and Materials, E 1391-94.
|
|
(45)
|
Hooftman, R. N., van de Guchte, K. och Roghair, C. J. (1993). Development of ecotoxicological test systems to assess contaminated sediments. Joint report no. 1: Acute and (sub)chronic tests with the model compound chlorpyrifos. RIVM-719102022.
|
|
(46)
|
Franke, C. (1996). How meaningful is the bioconcentration factor for risk assessment?. Chemosphere 32, 1897–1905.
|
|
(47)
|
Mount, D. R., Dawson, T. D. och Burkhard, L. P. (1999). Implications of gut purging for tissue residues determined in bioaccumulation testing of sediment with Lumbriculus variegatus. Environ. Toxicol. Chem. 18, 1244–1249.
|
|
(48)
|
Randall, R. C., Lee II, H., Ozretich, R. J., Lake, J. L. och Pruell, R. J. (1991). Evaluation of selected lipid methods for normalising pollutant bioaccumulation. Environ.Toxicol. Chem. 10, 1431–1436.
|
|
(49)
|
Gardner, W. S., Frez, W. A., Cichocki, E. A. och Parrish, C. C. (1985). Micromethods for lipids in aquatic invertebrates. Limnology and Oceanography, 30, 1099–1105.
|
|
(50)
|
Bligh, E. G. och Dyer, W. J. (1959). A rapid method of total lipid extraction and purification. Can. J. Biochem. Physiol. 37, 911–917.
|
|
(51)
|
De Boer, J., Smedes, F., Wells, D. och Allan, A. (1999). Report on the QUASH interlaboratory study on the determination of total-lipid in fish and shellfish. Round 1 SBT-2. Exercise 1000. EU, Standards, Measurement and Testing Programme.
|
|
(52)
|
Kristensen, P. (1991). Bioconcentration in fish: comparison of bioconcentration factors derived from OECD and ASTM testing methods; influence of particulate matter to the bioavailability of chemicals. Vandkvalitetsinstituttet, Danmark.
|
|
(53)
|
Zok, S., Görge, G., Kalsch, W. och Nagel, R. (1991). Bioconcentration, metabolism and toxicity of substituted anilines in the zebrafish (Brachydanio rerio). Sci. Total Environment 109/110, 411–421
|
|
(54)
|
Nagel, R. (1988). Umweltchemikalien und Fische – Beiträge zu einer Bewertung. Habilitationsschrift, Johannes Gutenberg-Universität Mainz, Tyskland.
|
|
(55)
|
Janssen, M. P. M., A. Bruins, T. H. De Vries och Van Straalen, N. M. (1991). Comparison of cadmium kinetics in four soil arthropod species. Arch. Environ. Contam. Toxicol. 20, 305–312.
|
|
(56)
|
Van Brummelen, T. C. och Van Straalen, N. M. (1996). Uptake and elimination of benzo(a)pyrene in the terrestrial isopod Porcellio scaber. Arch. Environ. Contam. Toxicol. 31, 277–285.
|
|
(57)
|
Sterenborg, I., Vork, N. A., Verkade, S. K., Van Gestel, C. A. M. och Van Straalen, N. M. (2003). Dietary zinc reduces uptake but not metallothionein binding and elimination of cadmium in the springtail Orchesella cincta. Environ. Toxicol. Chemistry 22, 1167–1171.
|
|
(58)
|
Suedel, B. C. och Rodgers, J. H. (1994). Development of formulated reference sediments for freshwater and estuarine sediment testing. Environ. Toxicol. Chem. 13, 1163–1175.
|
|
(59)
|
Wachs, B. (1967). Die Oligochaeten-Fauna der Fließgewässer unter besonderer Berücksichtigung der Beziehung zwischen der Tubificiden-Besiedlung und dem Substrat. Arch. Hydr. 63, 310–386.
|
|
(60)
|
Oliver, B. G. (1987). Biouptake of chlorinated hydrocarbons from laboratory-spiked and field sediments by oligochaete worms. Environ. Sci. Technol. 21, 785–790.
|
|
(61)
|
Chapman, P. M., Farrell, M. A. och Brinkhurst, R. O. (1982a). Relative tolerances of selected aquatic oligochaetes to individual pollutants and environmental factors. Aquatic Toxicology 2, 47–67.
|
|
(62)
|
Chapman, P. M., Farrell, M. A. och Brinkhurst, R. O. (1982b). Relative tolerances of selected aquatic oligochaetes to combinations of pollutants and environmental factors. Aquatic Toxicology 2, 69–78.
|
|
(63)
|
Rodriguez, P. och Reynoldson, T. B. (1999). Laboratory methods and criteria for sediment bioassessment. I: A. Mudroch, J. M. Azcue och P. Mudroch (red.): Manual of Bioassessment of aquatic sediment quality. Lewis Publishers, Boca Raton, CRC Press LLC.
|
|
(64)
|
Brinkhurst, R. O. (1971). A guide for the identification of British aquatic oligochaeta. Freshw. Biol. Assoc., Sci. Publ. No. 22.
|
|
(65)
|
Egeler, Ph., Meller, M., Schallnaß, H. J. och Gilberg, D. (2005). Validation of a sediment toxicity test with the endobenthic aquatic oligochaete Lumbriculus variegatus by an international ring test. I samarbete med R. Nagel och B. Karaoglan. Rapport till den federala miljöbyrån (Umweltbundesamt Berlin), R&D nr: 202 67 429.
|
|
(66)
|
Aston, R. J., Sadler, K. och Milner, A. G. P. (1982). The effect of temperature on the culture of Branchiura sowerbyi (Oligochaeta: Tubificidae) on activated sludge. Aquaculture 29, 137–145.
|
|
(67)
|
Roghair, C. J., Buijze, A., Huys, M. P. A., Wolters-Balk, M. A. H., Yedema, E. S. E. och Hermens, J. L. M. (1996). Toxicity and toxicokinetics for benthic organisms; II: QSAR for base-line toxicity to the midge Chironomus riparius and the tubificid oligochaete worm Branchiura sowerbyi. RIVM Report 719101026.
|
|
(68)
|
Aston, R. J. (1984). The culture of Branchiura sowerbyi (Tubificidae, Oligochaeta) using cellulose substrate. Aquaculture 40, 89–94.
|
|
(69)
|
Bonacina, C., Pasteris, A., Bonomi, G. och Marzuoli, D. (1994). Quantitative observations on the population ecology of Branchiura sowerbyi (Oligochaeta, Tubificidae). Hydrobiologia, 278, 267–274
|
” |