1992L0065 — SV — 01.03.2012 — 012.002
Detta dokument är endast avsett som dokumentationshjälpmedel och institutionerna ansvarar inte för innehållet
Ändrad genom:
Ändrad genom:
|
A1
|
|
C 241
|
21
|
29.8.1994
|
|
|
|
L 001
|
1
|
..
|
|
►A2
|
|
L 236
|
33
|
23.9.2003
|
Rättad genom:
▼B
RÅDETS DIREKTIV 92/65/EEG
av den 13 juli 1992
om fastställande av djurhälsokrav i handeln inom och importen till gemenskapen av djur, sperma, ägg (ova) och embryon som inte faller under de krav som fastställs i de specifika gemenskapsregler som avses i bilaga A.I till direktiv 90/425/EEG
EUROPEISKA GEMENSKAPERNAS RÅD HAR ANTAGIT DETTA DIREKTIV
med beaktande av Fördraget om upprättandet av Europeiska ekonomiska gemenskapen, särskilt artikel 43 i detta,
med beaktande av kommissionens förslag (
1
),
med beaktande av Europaparlamentets yttrande (
2
),
med beaktande av Ekonomiska och sociala kommitténs yttrande (
3
), och
med beaktande av följande:
Levande djur samt animaliska produkter är upptagna i produktlistan i bilaga 2 till fördraget. Utsläppandet på marknaden av sådana djur och produkter är en inkomstkälla för en del av jordbruksbefolkningen.
För att säkerställa en rationell utveckling inom denna sektor och öka produktiviteten bör djurhälsoskyddsbestämmelser för dessa djur och produkter fastställas på gemenskapsnivå.
Gemenskapen måste fortlöpande fram till den 31 december 1992 anta de åtgärder som syftar till att förverkliga den inre marknaden.
I syfte att uppnå dessa mål har rådet fastställt djurhälsobestämmelser för nötboskap, svin, får och getter, hästdjur, fjäderfä och kläckningsägg, fisk och fiskprodukter, tvåskaliga blötdjur, sperma från tjurar och galtar, embryon från får, färskt kött, fjäderfäkött, köttprodukter, kött av vilt samt kaninkött.
Djurhälsobestämmelser bör antas för utsläppandet på marknaden av djur och animaliska produkter som ännu inte omfattas av ovannämnda regler.
Förutsättningar bör skapas så att detta direktiv kan tillämpas utan att det påverkar tillämpningen av rådets förordning (EEG) nr 3626/82 av den 3 december 1982 om genomförande inom gemenskapen av konventionen om internationell handel med utrotningshotade vilda djur och växter (
4
).
I fråga om vissa tekniska aspekter måste hänvisning ske till rådets direktiv 64/432/EEG av den 26 juni 1964 om djurhälsoproblem som påverkar handeln med nötkreatur och svin inom gemenskapen (
5
) och direktiv 85/511/EEG av den 18 november 1985 om införande av gemenskapsåtgärder för bekämpning av mul- och klövsjuka (
6
).
När det gäller hur kontrollerna skall organiseras och följas upp och hur skyddsåtgärderna skall verkställas, måste hänvisning ske till de allmänna regler som fastställs i rådets direktiv 90/425/EEG av den 26 juni 1990 om veterinära och avelstekniska kontroller i handeln med vissa levande djur och varor inom gemenskapen med sikte på att förverkliga den inre marknaden (
7
).
När inte annat föreskrivs måste handeln med djur och animaliska produkter liberaliseras, men oberoende av detta skall skyddsåtgärder kunna vidtas om så behövs.
Med hänsyn till den betydande risken för spridning av sjukdomar som drabbar djur, bör särskilda krav preciseras för att gälla vid utsläppandet på marknaden av vissa djur och animaliska produkter, särskilt om de är avsedda för regioner med hög hälsomässig status.
De särskilda förhållandena i Förenade kungariket Storbritannien, Nordirland och Irland på grund av att dessa länder är öar, liksom det faktum att de under avsevärd tid har varit fria från rabies, kräver särskilda bestämmelser för att säkerställa att utsläppande på marknaden i Förenade kungariket Storbritannien, Nordirland och Irland av hundar och katter från andra länder inte medför någon risk för att rabies införs i dessa stater. Detta får dock inte påverka avskaffandet av veterinärkontrollerna vid medlemsstaternas gränser.
Ett hälsointyg är det lämpligaste medlet för att garantera och övervaka att dessa bestämmelser följs.
För att vidmakthålla hälsoläget i gemenskapen när de djur och animaliska produkter som avses i detta direktiv skall släppas ut på marknaden, bör dessa bli föremål för de minimikrav som fastställs för handeln och överensstämmelsen därmed bör övervakas i enlighet med de principer och regler som fastställs i rådets direktiv 90/675/EEG av den 10 december 1990 om principerna för organisering av veterinärkontroller av produkter som förs in i gemenskapen från tredje land (
8
).
Ett förfarande bör fastställas som gör det möjligt att inom Ständiga veterinärkommittén upprätta ett nära samarbete mellan medlemsstaterna och kommissionen.
Fristen för införlivandet i de nationella lagarna, vilken enligt artikel 29 utgår den 1 januari 1994, bör inte inverka på avskaffandet av veterinärkontrollerna vid gränserna den 1 januari 1993.
HÄRIGENOM FÖRESKRIVS FÖLJANDE.
KAPITEL I
Allmänna bestämmelser
Artikel 1
▼C1
I detta direktiv fastställs de djurhälsokrav som vid handeln inom och vid importen till gemenskapen skall gälla för djur, sperma, ägg (ova) och embryon som inte faller under de krav som fastställs i de specifika gemenskapsregler som avses i bilaga F.
▼B
Detta direktiv skall gälla utan att påverka tillämpningen av bestämmelserna i förordning (EEG) nr 3626/82.
Detta direktiv skall inte inverka på nationella bestämmelser som rör sällskapsdjur men samtidigt får sådana nationella bestämmelser inte hindra avskaffandet av veterinärkontroller vid gränserna mellan medlemsstaterna.
Artikel 2
1. I detta direktiv används följande beteckningar med de betydelser som här anges:
|
a)
|
handel : handel enligt definition i artikel 2.3 i direktiv 90/425/EEG.
|
|
b)
|
djur : exemplar av djurarter av annat slag än de som anges i direktiv 64/432/EEG, 90/426/EEG (
9
), 90/539/EEG (
10
), 91/67/EEG (
11
), 91/68/EEG (
12
), 91/492/EEG (
13
) och 91/493/EEG (
14
).
|
|
c)
|
”godkänt organ, institut eller centrum” : varje permanent, geografiskt begränsad anläggning som är godkänd enligt artikel 13 och där en eller flera djurarter är ständigt inhysta eller föremål för uppfödning med eller utan kommersiellt syfte och uteslutande av ett eller flera av följande skäl:
— Utställning av djuren och undervisning av allmänheten.
— Djurarternas bevarande.
— Grundforskning eller tillämpad forskning eller uppfödning av djur som skall användas för sådan forskning.
|
|
d)
|
anmälningspliktiga sjukdomar : de sjukdomar som räknas upp i bilaga A.
|
2. Bortsett från definitioner på godkända centrer och organ skall definitionerna enligt artikel 2 i direktiv 64/432/EEG, 91/67/EEG och 90/539/EEG också gälla i tilllämpliga delar.
KAPITEL II
Bestämmelser för handeln
Artikel 3
Medlemsstaterna skall se till att den handel som avses i artikel 1 första stycket inte förbjuds eller hindras av andra djurhälsoskäl än sådana som motiveras av detta direktivs tillämpning eller av gemenskapens lagstiftning och särskilt av vidtagna skyddsåtgärder.
▼
I avvaktan på gemenskapsbestämmelser om ormar och andra reptiler får Sverige behålla sina nationella bestämmelser om leveranser av sådana djur till Sverige.
▼B
Artikel 4
När artikel 4.1 a i direktiv 90/425/EEG skall tillämpas, skall medlemsstaterna, utan att det påverkar tillämpningen av artikel 13 och de särskilda bestämmelser som skall antas vid genomförandet av artikel 24, vidta de åtgärder som behövs för att säkerställa att de djur som avses i artikel 5—10 i det här direktivet endast får förekomma i handeln om de uppfyller villkoren enligt artikel 5—10 och kommer från sådana anläggningar eller företag som avses i artikel 12.1 och 12.3 i det här direktivet och som är registrerade av den ansvariga myndigheten och som förbinder sig att
— regelbundet låta undersöka djuren enligt artikel 3.3 i direktiv 90/425/EEG,
— utöver utbrott av anmälningspliktiga sjukdomar till den ansvariga myndigheten rapportera om utbrott av sådana sjukdomar som anges i bilaga B och för vilka den berörda medlemsstaten har gjort upp ett program för bekämpning eller bevakning,
— följa de särskilda nationella bestämmelserna för bekämpning av en sådan sjukdom som är av särskild betydelse för en viss medlemsstat och för vilken det finns ett särskilt program enligt artikel 14 eller ett beslut enligt artikel 15.2,
— endast släppa ut sådana djur på marknaden som är fria från sjukdomstecken och kommer från anläggningar eller områden som inte är belagda med förbud av djurhälsoskäl och, i fråga om djur som inte åtföljs av ett hälsointyg eller handelsdokument av det slag som föreskrivs i artikel 5—11, endast sådana djur som åtföljs av driftsledarens försäkran om att de vid tiden för avsändningen inte visat något tydligt sjukdomstecken och att hans anläggning inte är föremål för några restriktioner i fråga om djurens hälsa,
— uppfylla de krav som säkerställer djurens välbefinnande.
Artikel 5
1. Medlemsstaterna skall se till att handeln med apor (simiae och prosimiae) begränsas till enbart djur som skickas från och till ett organ, institut eller centrum som är godkänt av de behöriga myndigheterna i medlemsstaterna i enlighet med artikel 13 och att sådana djur åtföljs av ett veterinärintyg av det slag som återges i bilaga E. I detta skall den officiella veterinären vid det organ, institut eller centrum som djuren kommer ifrån intyga att djuren är friska.
2. Den behöriga myndigheten i en medlemsstat får trots punkt 1 godkänna att apor som tillhör en privatperson förvärvas av ett godkänt organ, institut eller centrum.
Artikel 6
A. Utan att tillämpningen av artikel 14 och 15 påverkas skall medlemsstaterna se till att hov- och klövdjur av andra arter än de som anges i direktiv 64/432/EEG, 90/426/EEG och 91/68/EEG får köpas eller säljas endast om de uppfyller följande krav:
1. Allmänt gäller att
a) de skall identifieras i enlighet med artikel 3.1 c i direktiv 90/425/EEG,
b) de inte får vara avsedda att slaktas inom ramen för ett program för utrotning av någon smittsam sjukdom,
c) de inte får ha vaccinerats mot mul- och klövsjuka och de skall uppfylla alla tillämpliga krav enligt direktiv 85/511/EEG och artikel 4a i direktiv 64/432/EEG,
d) de skall komma från en sådan anläggning som avses i artikel 3.2 b och c i direktiv 64/432/EEG och som inte är föremål för djurhälsoskyddsåtgärder, särskilt sådana som har beslutats på grund av direktiv 85/511/EEG, 80/217/EEG (
15
) och 91/68/EEG och har varit inhysta där oavbrutet sedan födseln eller under 30 dagar närmast före avsändningsdagen,
▼M7
e) de skall åtföljas av ett intyg av det slag som återges i bilaga E med följande försäkran:

▼M7 —————
▼B
2. För idisslare gäller att
a) de skall komma från en officiellt tuberkulosfri och officiellt brucellosfri besättning enligt direktiv 64/432/EEG eller direktiv 91/68/EEG och i fråga om djurhälsobestämmelser i tillämpliga delar uppfyller de krav som fastställs för nötkreatur i artikel 3.2 c, d, f, g och h i direktiv 64/432/EEG eller artikel 3 i direktiv 91/68/EEG,
▼M7
b) om de inte kommer från en besättning som uppfyller villkoren i a, skall de komma från en anläggning där inga fall av brucellos eller tuberkulos har registrerats under 42 dagar närmast före lastningen av djuren och där idisslarna under 30 dagar närmast före avsändningen med negativt resultat har genomgått ett tuberkulos- och ett brucellostest,
▼
c) bestämmelser om leukos får antas i enlighet med förfarandet i artikel 26.
▼B
3. För svindjur gäller att
a) de inte får ha kommit från ett område som är föremål för förbud mot förekomsten av afrikansk svinpest enligt artikel 9a i direktiv 64/432/EEG,
b) de skall komma från en anläggning där inga av de restriktioner gäller som har fastställts i direktiv 80/217/EEG på grund av klassisk svinpest,
c) de skall komma från en anläggning som är brucellosfri enligt direktiv 64/432/EEG och uppfyller de djurhälsokrav för svin som fastställs i direktiv 64/432/EEG,
d) om de inte kommer från en besättning som uppfyller villkoren i c, skall de under 30 dagar närmast före avsändningen ha visat negativt resultat vid ett test som avser att påvisa frånvaron av antikroppar mot brucellos.
▼M7 —————
▼M7
4. De krav i samband med tester som avses i denna artikel samt kriterierna för dessa får fastställas i enlighet med förfarandet i artikel 26. När dessa beslut fattas skall hänsyn tas till idisslare som uppfötts i gemenskapens arktiska områden.
I avvaktan på beslut enligt föregående stycke skall de nationella bestämmelserna fortsätta att gälla.
▼B
B. Direktiv 64/432/EEG skall ändras på följande sätt:
1. I artikel 2 b och c skall ”nötkreatur” ändras till ”djur som räknas till nötkreaturen (inklusive Bubalus bubalus) ”.
2. Följande artikel skall införas:
”Artikel 10a
Enligt förfarandet i artikel 12 får hälsointygen, av vilka en förebild återges i bilaga F, ändras eller kompletteras, särskilt för att tillgodose kraven i artikel 6 i direktiv 92/65/EEG.”
Artikel 7
A. Medlemsstaterna skall se till att fåglar av annat slag än de som avses i direktiv 90/539/EEG får förekomma i handeln endast om de uppfyller följande krav:
1. Allmänt gäller följande:
a) De skall komma från en anläggning där ingen diagnos på aviär influensa har ställts under 30 dagar närmast före avsändningen.
b) De skall komma från en anläggning eller ett område som inte är föremål för de restriktioner som gäller i samband med bekämpning av newcastlesjukan.
I avvaktan på att gemenskapens åtgärder enligt artikel 19 i direktiv 90/539/EEG skall genomföras, skall nationella åtgärder för bekämpning av newcastlesjukan fortsätta att tillämpas i överensstämmelse med fördragets allmänna bestämmelser.
c) De skall, om de har importerats från ett tredje land, ha varit i karantän enligt artikel 10.1 tredje strecksatsen i direktiv 91/496/EEG i den anläggning dit de förts vid ankomsten till gemenskapens territorium.
2. För papegojor gäller dessutom följande:
a) De får inte komma från någon anläggning eller ha varit i kontakt med djur från någon anläggning där papegojsjukan (Chlamydia psittaci) har diagnostiserats.
Tiden för förbudet efter det senast registrerade fallet och tiden för behandlingen under överinseende av en veterinär som utsetts enligt förfarandet i artikel 26 skall vara minst två månader.
b) De skall identifieras i enlighet med artikel 3.1 c i direktiv 90/425/EEG.
Metoderna för identifiering av papegojor och i synnerhet sjuka sådana skall fastställas enligt förfarandet i artikel 26.
c) De skall åtföljas av ett handelsdokument som är undertecknat av den officiella veterinären eller av den veterinär som har ansvaret för ursprungsanläggningen och som har fått den behöriga myndighetens bemyndigande att göra detta.
B. I artikel 2.2 andra stycket i rådets direktiv 91/495/EEG av den 27 november 1990 om frågor om livsmedelshygien och djurhälsa som påverkar produktion och utsläppande på marknaden av kaninkött och kött från vilda djur i hägn (
16
) skall orden ”och strutsfåglar (Ratitae)” införas på tredje raden efter orden ”direktiv 90/539/EEG”.
I artikel 2.2.1 i rådets direktiv 90/539/EEG av den 15 oktober 1990 om djurhälsovillkor för handel inom gemenskapen och för import från tredje land av fjäderfä och kläckningsägg (
17
), skall orden ”och strutsfåglar (Ratitae)” införas efter orden ”och rapphöns”.
Artikel 8
Medlemsstaterna skall se till att bin (Apis melifera) får förekomma i handeln endast om de uppfyller följande krav:
a) De skall komma från ett område som inte är föremål för förbud på grund av amerikansk yngelröta.
Förbudet skall gälla i minst 30 dagar efter det senast registrerade fallet och den dag då alla kupor inom en radie av tre kilometer har kontrollerats av den behöriga myndigheten och alla smittade kupor har bränts upp eller behandlats och inspekterats till den behöriga myndighetens belåtenhet.
I enlighet med förfarandet i artikel 26 och efter samråd med Vetenskapliga veterinärkommittén skall de krav som gäller för bin (Apis melifera) eller likvärdiga krav också tillämpas på humlor.
b) De skall åtföljas av ett hälsointyg enligt förebilden i bilaga E med en försäkran i vilken den behöriga myndigheten intygar att kraven enligt a är uppfyllda.
Artikel 9
1. Medlemsstaterna skall se till att dubbeltandade gnagare får förekomma i handeln endast om de uppfyller följande krav:
a) De får inte komma från eller ha varit i kontakt med djur från någon anläggning där rabies har förekommit eller misstänkts den senaste månaden.
b) De skall komma från en anläggning där alla djur är fria från kliniska symtom på kaninpest (Myxomatos).
2. Sådana medlemsstater som kräver hälsointyg vid förflyttning av dubbeltandade gnagare inom sitt territorium får kräva att djur som skickas till dem åtföljs av ett hälsointyg enligt förebilden i bilaga E och som åtföljs av följande försäkran:
”Som… intygar jag härmed att ovannämnda sändning uppfyller kraven enligt artikel 9 i direktiv 92/65/EEG och att djuren inte visat några kliniska sjukdomssymtom vid undersökning.”
Detta intyg skall utfärdas av den officiella veterinären eller av den veterinär som ansvarar för den anläggning som djuren kommer ifrån och som har fått den behöriga myndighetens bemyndigande för detta ändamål, samt i fråga om industriell uppfödning av den officiella veterinären.
Medlemsstater som önskar utnyttja denna möjlighet skall underrätta kommissionen som skall se till att kraven enligt första stycket har blivit tillgodosedda.
3. Irland och Förenade kungariket Storbritannien får begära att ett hälsointyg visas upp som garanterar att kravet enligt punkt 1 a har blivit tillgodosett.
Artikel 10
1. Om inget program för systematisk vaccination tillämpas skall medlemsstaterna se till att all handel förbjuds med
►M5
————— ◄ mink och räv som kommer från eller har varit i kontakt med djur från anläggningar där rabies har förekommit eller misstänks ha förekommit under de senaste sex månaderna.
▼M5
2. För att få förekomma i handeln skall hundar, katter och illrar uppfylla kraven i artiklarna 5 och 16 i Europaparlamentets och rådets förordning (EG) nr 998/2003 av den 26 maj 2003 om djurhälsovillkor som skall tillämpas vid transporter av sällskapsdjur utan kommersiellt syfte och om ändring av rådets direktiv 92/65/EEG (
18
).
Det intyg som åtföljer djuren skall dessutom visa att en av den behöriga myndigheten godkänd veterinär har genomfört en klinisk undersökning 24 timmar före utfärdandet samt att djuren är vid god hälsa och i stånd att tåla transporten till bestämmelseorten.
3. När det gäller export till Irland, Förenade kungariket eller Sverige skall, med avvikelse från punkt 2, hundar, katter och illrar uppfylla kraven i artiklarna 6 och 16 i förordning (EG) nr 998/2003.
Det intyg som åtföljer djuren skall dessutom visa att en av den behöriga myndigheten godkänd veterinär har genomfört en klinisk undersökning 24 timmar före utfärdandet samt att djuren är vid god hälsa och i stånd att tåla transporten till bestämmelseorten.
▼A2
4. Irland, Cypern, Malta och Förenade kungariket får utan att tillämpningen av punkt 2 och 3 påverkas behålla sina nationella karantänsbestämmelser för sådana köttätare
►M5
, med undantag av de arter som anges i punkterna 2 och 3 ◄ , primater, fladdermöss och andra djur som kan smittas av rabies och som omfattas av detta direktiv, om det inte kan styrkas att djuren är födda på den anläggning som de kommer ifrån och har hållits i fångenskap sedan födseln; dock får bibehållandet av dessa bestämmelser inte hindra att veterinärkontrollerna avskaffas vid gränserna mellan medlemsstaterna.
▼B
5. Beslut 90/638/EEG skall ändras på följande sätt:
1. Följande strecksats skall läggas till i artikel 1:
— ”för program för bekämpning av rabies: de kriterier som anges i bilaga 3.”
2. Följande bilaga skall läggas till:
”BILAGA 3
Kriterier för program för bekämpning av rabies
Program för bekämpning av rabies skall omfatta minst följande:
a) De kriterier som anges i punkterna 1-7 i bilaga 1.
b) Närmare uppgifter om den eller de regioner där oral immunisering av rävar skall ske och om regionens eller regionernas naturliga gränser. Regionen eller regionerna skall omfatta minst 6 000 km2 eller en medlemsstats hela nationella område och får även omfatta angränsande områden i ett tredje land.
c) Närmare uppgifter om de vacciner som skall användas, hur de skall distribueras samt om hur ofta och på vilka avstånd beten skall läggas ut.
d) I tillämpliga fall alla uppgifter om samt kostnader och målet för program som utförts av frivilliga organisationer och som syftar till att bevara och skydda flora och fauna på det territorium som täckts av dessa projekt.”
6. På kommissionens förslag skall rådet med kvalificerad majoritet utse ett särskilt institut för att fastställa de kriterier som behövs för att standardisera de serologiska testerna samt besluta om institutets ansvarsområden.
7. Medlemsstaterna skall se till att importörerna betalar kostnaderna för de serologiska testerna.
▼M5 —————
▼
Artikel 10a
Vad gäller rabies skall — enligt förfarandet i artikel 26 sedan den utredning lagts fram som saken kräver — artikel 9 och 10 ändras så att hänsyn tas till situationen i Finland och Sverige och så att samma bestämmelser kommer att gälla för dessa länder som för medlemsstater i en motsvarande situation.
▼M9
Artikel 11
1. Medlemsstaterna ska se till att endast sperma, ägg och embryon som uppfyller villkoren enligt punkterna 2, 3, 4 och 5 förekommer i handeln, dock utan att detta påverkar tillämpningen av de beslut som fattas vid genomförandet av artiklarna 21 och 23.
2. Utan att tillämpningen av de kriterier som gäller för stambokföring av vissa hästraser påverkas, ska sperma från får-, get- och hästdjur
— ha tagits, behandlats och lagrats för artificiell insemination vid en seminstation som ur hälsosynpunkt är godkänd enligt bilaga D I eller, i fråga om får- och getdjur med avvikelse från det ovannämnda, vid en anläggning som uppfyller kraven enligt direktiv 91/68/EEG,
— ha tagits från djur som uppfyller villkoren enligt bilaga D II,
— ha tagits, behandlats, bevarats, lagrats och transporterats i enlighet med bilaga D III,
— under transport till en annan medlemsstat åtföljas av ett hälsointyg enligt en förlaga vars utformning ska bestämmas enligt förfarandet i artikel 26.
3. Ägg (ova) och embryon av olika slags får, getter, hästdjur och svin ska
— ha tagits från donerande hondjur som uppfyller villkoren enligt bilaga D IV av ett uppsamlingslag eller framställts av ett produktionslag som är godkänt av den behöriga myndigheten i medlemsstaten och uppfyller de villkor som ska fastställas i bilaga D I enligt förfarandet i artikel 26,
— ha tagits, behandlats och förvarats i vederbörligt labortorium, lagrats och transporterats i enlighet med bilaga D III,
— under transporten till en annan medlemsstat åtföljas av ett hälsointyg enligt en förebild vars utformning ska bestämmas enligt förfarandet i artikel 26.
Sperma som används för insemination av donerande hondjur ska, i fråga om får, getter och hästdjur, uppfylla bestämmelserna i punkt 2 och, i fråga om svin, bestämmelserna i direktiv 90/429/EEG.
Ytterligare garantier får bestämmas enligt förfarandet i artikel 26.
4. De godkända seminstationer som avses i punkt 2 första strecksatsen och de godkända uppsamlingslag som avses i punkt 3 första strecksatsen ska registreras av den behöriga myndigheten i den berörda medlemsstaten, varvid varje seminstation och uppsamlingslag ska tilldelas ett veterinärt registreringsnummer.
Varje medlemsstat ska upprätta och upprätthålla en aktuell förteckning över dessa godkända seminstationer och uppsamlingslag och deras veterinära registreringsnummer och göra den tillgänglig för övriga medlemsstater och för allmänheten.
Närmare föreskrifter för den enhetliga tillämpningen av denna punkt kan antas i enlighet med förfarandet i artikel 26.
5. De djurhälsokrav och förlagor till hälsointyg som ska gälla för sperma, ägg (ova) och embryon från arter som inte anges i punkterna 2 och 3 ska fastställas i enlighet med förfarandet i artikel 26.
I avvaktan på att det fastställs djurhälsokrav och förlagor till hälsointyg för handel med sperma, ägg (ova) och embryon av sådant slag ska nationella bestämmelser fortsatt gälla.
▼B
Artikel 12
1. Kontrollreglerna enligt direktiv 90/425/EEG skall, särskilt i fråga om organisation och uppföljning av de föreskrivna kontrollerna, gälla för djur, sperma, ägg (ova) och embryon enligt det här direktivet som åtföljs av ett hälsointyg. Övriga djur skall komma från anläggningar för vilka principerna i det direktivet gäller vid kontrollen av ursprung och destination.
2. Artikel 10 i direktiv 90/425/EEG skall gälla för djur, sperma, ägg (ova) och embryon som omfattas av det här direktivet.
3. I samband med handel skall artikel 12 i direktiv 90/425/EEG även gälla för återförsäljare som stadigvarande eller tillfälligt håller sådana djur som avses i artikel 7, 9 och 10.
4. Upplysningar om destinationsorten enligt artikel 4.2 i direktiv 90/425/EEG skall ske med hjälp av Animosystemet vad gäller djur, sperma, ägg (ova) eller embryon som åtföljs av ett hälsointyg enligt det här direktivet.
5. Vid misstanke om att direktivet inte har följts, eller om djurens hälsa eller kvaliteten på sperma, ägg (ova) eller embryon enligt artikel 1 ifrågasätts, skall den behöriga myndigheten, utan att tillämpningen av de särskilda bestämmelserna i detta direktiv påverkas, utföra alla kontroller som den anser påkallade.
6. Medlemsstaterna skall vidta lämpliga administrativa eller straffrättsliga åtgärder för att beivra varje kränkning av detta direktiv, särskilt om det kommer fram att de upprättade intygen eller handlingarna inte motsvarar det verkliga tillståndet hos de djur som avses i artikel 1, att identifieringen av djuren eller märkningen av ifrågavarande sperma, ägg (ova) eller embryon inte följer detta direktiv, eller att djuren eller produkterna i fråga inte har genomgått de kontroller som föreskrivs i detta direktiv.
Artikel 13
1. Vid handel med djur av sådana arter som är mottagliga för sjukdomarna som räknas upp i bilaga A eller bilaga B och om den mottagande medlemsstaten tillämpar garantin enligt artiklarna 14 och 15, liksom vid handel med sperma, ägg (ova) eller embryon av sådana djur till eller från ett organ, institut eller centrum som är godkända enligt bilaga C, skall ett transportdokument enligt förebilden i bilaga E uppvisas. Dokumentet skall följa med under transporten och vara ifyllt av den veterinär som ansvarar för det organ, institut eller centrum som är avsändare, och det skall visa att ifrågavarande djur, sperma, ägg (ova) eller embryon kommer från ett organ, institut eller centrum som är godkänt enligt bilaga C.
2.
a) För att bli godkänt skall ett organ, institut eller centrum vad gäller anmälningspliktiga sjukdomar till den behöriga myndigheten i medlemsstaten överlämna alla handlingar som behövs för att styrka att kraven i bilaga C är uppfyllda.
b) När den dokumentation har överlämnats som hänför sig till en begäran om godkännande eller förnyat godkännande, skall den ansvariga myndigheten ta ställning mot bakgrund av den lämnade informationen och resultatet av en eventuell undersökning på platsen.
c) Den behöriga myndigheten skall återkalla ett godkännande under de förhållanden som anges under punkt 3 i bilaga C.
▼M9
d) Alla godkända organ, institut och centrer ska registreras och tilldelas ett godkännandenummer av den behöriga myndigheten.
Varje medlemsstat ska upprätta och hålla en uppdaterad förteckning över godkända organ, institut och centrer och deras godkännandenummer och göra den tillgänglig för övriga medlemsstater och för allmänheten.
Närmare föreskrifter för den enhetliga tillämpningen av denna punkt kan antas i enlighet med förfarandet i artikel 26.
▼
e) Sverige skall få en frist på två år från dagen för anslutningsfördragets ikraftträdande för att införa de bestämmelser som gäller organisationer, institutioner och centraler.
▼B
Artikel 14
1. Om en medlemsstat direkt eller genom uppfödarna har utarbetat eller utarbetar ett frivilligt eller obligatoriskt program för bekämpning eller övervakning av någon av de sjukdomar som anges i bilaga B, får den presentera programmet för kommissionen och skall därvid särskilt ange
— sjukdomens utbredning inom dess territorium,
— om det råder anmälningsplikt för sjukdomen,
— varför programmet utarbetats med beaktande av dess lönsamhet och sjukdomens betydelse,
— det geografiska område inom vilket programmet skall genomföras,
— vilka statusformer som skall gälla för anläggningarna, vilka krav som skall gälla för varje art när den ankommer till en anläggning och vilka testmetoder som skall användas,
— hur programmet skall övervakas, inklusive i vilken omfattning uppfödaren skall medverka när bekämpnings- eller övervakningsprogrammet genomförs,
— vilka åtgärder som skall vidtas om en anläggning av något skäl förlorar sin status,
— vilka åtgärder som skall vidtas om testerna enligt programmet ger positiva resultat,
— att handeln inom medlemsstaten inte har sådan karaktär att den medför diskriminering av handeln inom gemenskapen.
2. Kommissionen skall granska de av medlemsstaterna framlagda programmen. Dessa får godkännas enligt förfarandet i artikel 26 och i överensstämmelse med de kriterier som fastställs i punkt 1. De ytterligare allmänna eller begränsade garantier som kan krävas i handeln skall enligt samma förfarande bestämmas samtidigt eller senast tre månader efter det att programmen har framlagts. Sådana garantier får inte gå utöver de garantier som medlemsstaten tillämpar nationellt.
3. De av medlemsstaterna framlagda programmen får ändras eller kompletteras enligt förfarandet i artikel 26. Ändringar av de garantier som avses i punkt 2 får göras enligt samma förfarande.
Artikel 15
1. Om en medlemsstat anser att dess territorium eller en del av dess territorium är fritt från några av de sjukdomar som räknas upp i bilaga B och för vilka djuren som omfattas av detta direktiv är mottagliga, skall medlemsstaten förelägga kommissionen tillräcklig dokumentation till stöd för detta och då i synnerhet om
— sjukdomens art och historiken över dess förekomst på medlemsstatens territorium,
— resultaten av övervakningstesterna på basis av serologiska, mikrobiologiska, patologiska eller epidemiologiska undersökningar,
— den tid under vilken sjukdomen varit anmälningspliktig till de behöriga myndigheterna,
— den tid under vilken övervakning har skett,
— i tillämpliga fall, den tid under vilken vaccinering mot sjukdomen har varit förbjuden och det geografiska område som berörts av förbudet,
— de åtgärder som vidtagits för att kontrollera att sjukdomen inte förekommer.
2. Kommissionen skall undersöka den dokumentation som avses i punkt 1 och förelägga Ständiga veterinärkommittén ett beslut som godkänner eller avvisar den plan som medlemsstaten har lagt fram. Om planen godkänns skall omfattningen av de ytterligare allmänna eller särskilda garantier som kan krävas i handeln fastställas enligt förfarandet i artikel 26. Dessa får inte gå utöver de garantier som medlemsstaten tillämpar nationellt.
I avvaktan på ett beslut får den berörda medlemsstaten i sina handelsförbindelser ha kvar de krav som är nödvändiga för att upprätthålla dess status.
3. Den berörda medlemsstaten skall underrätta kommissionen om varje ändring av de uppgifter som anges i punkt 1. De garantier som avses i punkt 2 får mot bakgrund av en sådan underrättelse ändras eller upphävas enligt förfarandet i artikel 26.
KAPITEL III
Bestämmelser om import till gemenskapen
Artikel 16
Villkoren för import av djur, sperma, ägg (ova) och embryon enligt detta direktiv skall minst motsvara dem som fastställs i kapitel II.
▼M5
I fråga om hundar, katter och illrar skall villkoren för import minst motsvara importvillkoren i kapitel III i förordning (EG) nr 998/2003.
Det intyg som åtföljer djuren skall dessutom visa att en av den behöriga myndigheten godkänd veterinär har genomfört en klinisk undersökning 24 timmar före utfärdandet samt att djuren är vid god hälsa och i stånd att tåla transporten till bestämmelseorten.
▼B
Artikel 17
1. För att säkerställa en enhetlig tillämpning av artikel 16 skall bestämmelserna i följande punkter gälla.
▼C2
2. Endast djur och i artikel 11 avsedda sperma, ägg (ova) och embryon vilka uppfyller följande krav får importeras till gemenskapen:
▼M9
a) De ska komma från ett tredjeland som förekommer på en lista som ska utarbetas enligt punkt 3 a.
b) De ska åtföljas av ett hälsointyg enligt en förlaga vars utformning ska bestämmas enligt förfarandet i artikel 26, undertecknat av den behöriga myndigheten i exportlandet, där det intygas att
i) djuren
— uppfyller tilläggsvillkoren eller ger garantier av det slag som avses i punkt 4, och
— kommer från godkända centraler, organ och institut som ger garantier som åtminstone är likvärdiga med dem i bilaga C,
ii) sperma, ägg och embryon kommer från godkända uppsamlings- och lagringscentraler eller uppsamlingslag och produktionsgrupper som ger garantier som åtminstone är likvärdiga med dem som ska fastställas i bilaga D I i enlighet med förfarandet i artikel 26.
I väntan på att det fastställs listor över tredjeländer, godkända anläggningar enligt punkt b, djurhälsokrav och förlagor till hälsointyg enligt punkterna a och b, ska nationella bestämmelser fortsatt gälla, dock under förutsättning att dessa inte är gynnsammare än de som fastställs i kapitel II.
3. Följande ska fastställas:
a) I enlighet med förfarandet i artikel 26 en lista över de tredjeländer eller delar därav som till medlemsstaterna och till kommissionen kan lämna garantier som är likvärdiga med dem som anges i kapitel II avseende djur, sperma, ägg (ova) och embryon.
b) I enlighet med denna punkt en förteckning över de godkända seminstationer och lag som avses i artikel 11.2 första strecksatsen och artikel 11.3 första strecksatsen som är belägna i ett av de tredjeländer som upptas i den förteckning som avses i led a och för vilka den behöriga myndigheten i tredjelandet kan lämna de garantier som anges i artikel 11.2 och 11.3.
Den förteckning över godkända seminstationer eller lag som avses i första stycket samt deras veterinära registreringsnummer ska överlämnas till kommissionen.
Den behöriga myndigheten i tredjelandet ska omedelbart återkalla eller tillfälligt dra in stationernas eller lagens godkännande om dessa inte längre uppfyller de villkor som fastställs i artikel 11.2 och 11.3 samt omedelbart informera kommissionen om detta.
Kommissionen ska till medlemsstaterna lämna alla nya och uppdaterade förteckningar som den får från den behöriga myndigheten i tredjelandet i enlighet med andra och tredje stycket och göra dem tillgängliga för allmänheten i informationssyfte.
Närmare föreskrifter för den enhetliga tillämpningen av denna punkt kan antas i enlighet med förfarandet i artikel 26.
c) I enlighet med förfarandet i artikel 26 särskilda djurhälsokrav, särskilt för att skydda gemenskapen från vissa exotiska sjukdomar, eller garantier som är likvärdiga med dem som fastställs i detta direktiv.
De särskilda krav och likvärdiga garantier som gäller för tredjeländer får inte vara gynnsammare än de som har fastställts i kapitel II.
▼B
4. Listan enligt punkt 3 får endast omfatta sådana tredje länder eller delar av tredje länder
a) från vilka import inte har förbjudits
— genom förekomsten av någon av de sjukdomar som anges i bilaga A eller av någon annan för gemenskapen exotisk sjukdom,
— enligt artiklarna 6, 7 och 14 i direktiv 72/462/EEG och artikel 17 i direktiv 91/495/EEG och i direktiv 71/118/EEG (
19
) eller i fråga om de övriga djur som omfattas av detta direktiv, enligt ett beslut som fattats i enlighet med förfarandet i artikel 26, med hänsyn till deras hälsotillstånd,
b) som med hänsyn till sin lagstiftning och hur de har organiserat veterinär- och inspektionsfunktionerna, befogenheterna hos dessa samt den kontroll dessa funktioner är föremål för, har erkänts kunna säkerställa att gällande lagstiftning genomförs i enlighet med artikel 3.2 i direktiv 72/462/EEG,
c) vilkas veterinärfunktioner kan säkerställa att hälsokraven tillgodoses på ett sätt som minst är likvärdigt med det som har fastställts i kapitel II.
5. Experter från kommissionen och medlemsstaterna skall genom inspektioner på platsen kontrollera om de garantier som det tredje landet har lämnat vad gäller produktion och utsläppande på marknaden kan anses likvärdiga med dem som tillämpas inom gemenskapen.
Medlemsstaternas experter som ansvarar för dessa inspektioner skall utses av kommissionen efter förslag från medlemsstaterna.
Dessa inspektioner skall utföras på gemenskapens vägnar och denna skall också betala alla kostnader i detta sammanhang.
6. Tills inspektionerna enligt punkt 5 kan genomföras, skall de nationella bestämmelser som gäller vid inspektioner i tredje land fortsätta att tillämpas, och om det under dessa inspektioner visar sig att de givna garantierna enligt punkt 3 inte uppfylls, skall detta anmälas genom Ständiga veterinärkommittén.
Artikel 18
1. Medlemsstaterna skall se till att djur, sperma, ägg (ova) och embryon som omfattas detta direktiv importeras till gemenskapen endast om de uppfyller följande villkor:
— De skall åtföljas av ett intyg som skall upprättas av den officiella veterinären.
— Intygets utformning skall fastställas enligt förfarandet i artikel 26 och vara anpassat efter djurets art.
— De skall ha godkänts i de kontroller som krävs enligt direktiv 90/675/EEG och 91/496/EEG (
20
).
— De skall före transporten till gemenskapens territorium ha kontrollerats av en officiell veterinär för att säkerställa att transportbetingelserna enligt direktiv 91/628/EEG (
21
) är uppfyllda, särskilt i fråga om vattning och utfodring.
— De skall i fråga om sådana djur som avses i artiklarna 5-10, innan de importeras ha varit placerade i karantän enligt de närmare regler som skall fastställas enligt förfarandet i artikel 26.
2. Tills särskilda regler har utarbetats för denna artikel skall de nationella bestämmelser fortsätta att gälla som tilllämpas vid import från sådana tredje länder för vilka inga regler på gemenskapsnivå har antagits, dock under förutsättning att de nationella bestämmelserna inte är gynnsammare än de som fastställs i kapitel II.
Artikel 19
Följande skall beslutas enligt förfarandet i artikel 26:
a) Särskilda djurhälsokrav med hänsyn till arten av djur samt de medföljande handlingarnas karaktär och innehåll vid import till gemenskapen av djur som är avsedda för djurparker, cirkusar och nöjesfält eller för laboratorier som utför experiment med djur.
b) Garantier utöver dem som avser de olika djurarterna i detta direktiv i syfte att skydda de berörda arter som finns inom gemenskapen.
Artikel 20
▼M9
Reglerna i direktiv 97/78/EG ska tillämpas särskilt på organisationen och uppföljningen av de kontroller som ska utföras av medlemsstaterna liksom genomförandet av de säkerhetsåtgärder som ska vidtas i enlighet med förfarandet i artikel 22 i det direktivet.
▼B
►C3
Tills besluten enligt artikel 8.B och artikel 30 i direktiv 91/496/EEG har genomförts, ◄ skall nuvarande nationella bestämmelser för tillämpningen av artikel 8.1 och 8.2 i nämnda direktiv fortsätta att gälla, dock utan att detta påverkar iakttagandet av de principer och regler som avses i första stycket i denna artikel.
KAPITEL IV
Gemensamma slutbestämmelser
Artikel 21
Varje förebild för intyg som skall användas i handeln, och de djurhälsovillkor som skall uppfyllas för att djur, sperma, ägg (ova) och embryon av annat slag än de som avses i artiklarna 5-11 skall få förekomma i handeln, skall vid behov fastställas enligt förfarandet i artikel 26.
Artikel 22
Bilagorna till detta direktiv skall om så behövs ändras enligt förfarandet i artikel 26.
▼
Bilaga B skall ses över innan anslutningsfördraget träder i kraft och då särskilt för att ändra förteckningen över sjukdomar och inkludera de som idisslare och svindjur är mottagliga för och de som är överförbara genom fårsperma, ägg (ova) och embryon.
▼B
Artikel 23
För förflyttning av cirkus- och varietédjur och för handel med djur, sperma, ägg (ova) och embryon som är avsedda för djurparker får särskilda krav fastställas enligt förfarandet i artikel 26, i förekommande fall genom avsteg
►M7
————— ◄ från kapitel II.
Artikel 24
1. Vid införsel till eget territorium av djur (inklusive burfåglar), sperma, ägg (ova) och embryon som anges i detta direktiv och som har passerat genom ett tredje lands territorium, skall medlemsstaterna ha rätt att kräva att ett hälsointyg uppvisas som anger att kraven enligt detta direktiv är uppfyllda.
2. De medlemsstater som utnyttjar möjligheten enligt punkt 1 skall genom Ständiga veterinärkommittén underrätta kommissionen och de övriga medlemsstaterna om detta.
Artikel 25
Följande skall läggas till i bilaga A till direktiv 90/425/EEG:
”Direktiv 92/65/EEG av den 13 juli 1992 om fastställande av djurhälsokrav i handeln inom och importen till gemenskapen av djur, sperma, ägg (ova) och embryon som inte faller under de krav som fastställs i de särskilda gemenskapsregler som avses i bilaga A.1 till direktiv 90/425/EEG (EGT nr L 268, 14.9.1992, s. 54).”
▼M7
Artikel 26
1. Kommissionen skall biträdas av Ständiga kommittén för livsmedelskedjan och djurhälsa som inrättats genom artikel 58 i Europaparlamentets och rådets förordning (EG) nr 178/2002 (
22
).
2. När det hänvisas till denna punkt skall artiklarna 5 och 7 i beslut 1999/468/EG tillämpas.
Den tid som avses i artikel 5.6 i beslut 1999/468/EG (
23
) skall vara tre månader.
3. Kommittén skall själv anta sin arbetsordning.
▼B
Artikel 27
Medlemsstater som genomför ett alternativt kontrollsystem med sådana garantier som motsvarar dem som fastställs i detta direktiv i fråga om rörelser inom sitt territorium av djur, sperma, ägg (ova) och embryon av de slag som omfattas av detta direktiv, får ömsesidigt tillåta avsteg från artikel 6. A.1 f, artikel 8 b och artikel 11.1 d.
Artikel 28
Enligt förfarandet i artikel 26 kan övergångsbestämmelser antas för en tid av tre år för att underlätta övergången till den nya ordning som fastställs genom detta direktiv.
Artikel 29
1. Medlemsstaterna skall före den 1 januari 1994 sätta i kraft de lagar och andra författningar som behövs för att följa detta direktiv. De skall omedelbart underrätta kommissionen om detta.
När medlemsstaterna antar dessa bestämmelser skall dessa innehålla en hänvisning till detta direktiv eller åtföljas av en sådan hänvisning när de offentliggörs. Närmare föreskrifter om hur hänvisningen skall göras skall varje medlemsstat själv utfärda.
2. Medlemsstaterna skall till kommissionen överlämna texterna till centrala bestämmelser i nationell lagstiftning som de antar inom det område som omfattas av detta direktiv.
3. Bestämningen av den senaste tidpunkten för införlivandet i den nationella lagstiftningen till den 1 januari 1994 skall inte påverka avskaffandet av veterinärkontrollerna vid gränserna enligt direktiven 89/662/EEG och 90/425/EEG.
Artikel 30
Detta direktiv riktar sig till medlemsstaterna.
▼M6
BILAGA A
Anmälningspliktiga sjukdomar inom ramen för detta direktiv
|
Sjukdom
|
Berörda klasser, ordningar, familjer, släkten, etc.
|
|
Afrikansk hästpest
|
Equidae
|
|
Afrikansk svinpest
|
Suidae och Tayassuidae
|
|
Aviär influensa
|
Aves
|
|
Amerikansk yngelröta
|
Apis
|
|
Mjältbrand
|
Bovidae, Camelidae, Cervidae, Elephantidae, Equidae och Hippopotamidae
|
|
Bluetongue
|
Antilocapridae, Bovidae, Cervidae, Giraffidae och Rhinocerotidae
|
|
Brucella abortus
|
Antilocapridae, Bovidae, Camelidae, Cervidae, Giraffidae, Hippopotamidae och Tragulidae
|
|
Brucella melitensis
|
Antilocapridae, Bovidae, Camelidae, Cervidae, Giraffidae, Hippopotamidae och Tragulidae
|
|
Brucella ovis
|
Camelidae, Tragulidae, Cervidae, Giraffidae, Bovidae och Antilocapridae
|
|
Brucella suis
|
Cervidae, Leporidae, Ovibos moschatus, Suidae och Tayassuidae
|
|
Klassisk svinpest
|
Suidae och Tayassuidae
|
|
Elakartad lungsjuka hos nötkreatur
|
Nötkreatur (inklusive zebu, buffel, bison och yak)
|
|
Ebola
|
Primater
|
|
Mul- och klövsjuka
|
Artiodactyla och indisk elefant
|
|
Infektiös hematopoetisk nekros
|
Salmonidae
|
|
Lumpy skin disease
|
Bovidae och Giraffidae
|
|
Apkoppor
|
Rodentia och primater
|
|
Mycobacterium bovis
|
Mammalia, i synnerhet Antilocapridae, Bovidae, Camelidae, Cervidae, Giraffidae och Tragulidae
|
|
Newcastlesjuka
|
Aves
|
|
Peste des petits ruminants
|
Bovidae och Suidae
|
|
Enterovirusencephalomyelit hos svin
|
Suidae
|
|
Psitacosis
|
Psittaciformes
|
|
Rabies (vattuskräck)
|
Carnivora och Chiroptera
|
|
Rift valley fever
|
Bovidae, Camelus species och Rhinocerotidae
|
|
Boskapspest
|
Artiodactyla
|
|
Skalbaggar av typen Aethina tumida
|
Apis och Bombus
|
|
Får- och getkoppor
|
Bovidae
|
|
Vesikulär svinsjuka
|
Suidae och Tayassuidae
|
|
Tropilaelaps mite (Tropilaelaps spp).
|
Apis
|
|
Vesikulär stomatit
|
Artiodactyla och Equidae
|
|
TSE
|
Bovidae, Cervidae, Felidae och Mustelidae
|
▼B
BILAGA B
LISTA ÖVER SJUKDOMAR FÖR VILKA NATIONELLA PROGRAM KAN GODKÄNNAS ENLIGT DETTA DIREKTIV
|
Mink
|
Viral enterit
Aleutiska sjukan
|
|
Bin
|
Europeisk yngelröta
Varronos och akarinos
|
|
Apor och kattdjur
|
Tuberkulos
|
|
Idisslare
|
Tuberkulos
|
|
Dubbeltandade gnagare
|
Myxomatos
Viralhemorragiska sjukdomar
Tularemi (harpest)
|
▼M3
BILAGA C
VILLKOR FÖR GODKÄNNANDE AV ORGAN, INSTITUT OCH CENTER
1. För att få ett officiellt godkännande enligt artikel 13.2 i detta direktiv, skall ett organ, institut eller centrum enligt definitionen i artikel 2.1 c
a) vara klart avgränsat och avskilt från omgivningarna eller de hållna djuren och vara beläget så att det inte utgör någon hälsorisk för jordbruksanläggningar vilkas hälsostatus kan äventyras,
b) ha tillräckliga resurser för att fånga, stänga in och isolera djur, och lämpliga karantänresurser och godkända förfaranden för djur som kommer ifrån icke godkända källor,
c) vara fritt från de sjukdomar som räknas upp i bilaga A och, i fråga om sådana sjukdomar som i den berörda staten ingår i ett program av det slag som avses i artikel 14, även från de sjukdomar som räknas upp i bilaga B. För att ett organ, institut eller center skall förklaras vara fritt från dessa sjukdomar skall den behöriga myndigheten bedöma de uppgifter om djurhälsotillståndet som registrerats under åtminstone de tre senaste åren och resultatet av kliniska tester och laboratorieprover som tagits på djuren i organet, institutet eller centret. Undantag från denna bestämmelse skall emellertid beviljas nya anläggningar om djuren där kommer från godkända anläggningar,
d) dagligen föra journal med uppgift om
i) antalet djur av varje art som finns i anläggningen och deras identitet (ålder, kön, art och i tillämpliga fall individuell märkning),
ii) antalet djur som levereras till eller lämnar anläggningen, med uppgift om deras identitet (ålder, kön art och i tillämpliga fall individuell märkning), ursprung eller bestämmelseort, transporten från eller till anläggningen och djurens hälsotillstånd,
iii) resultaten från blodprov eller annan diagnostik,
iv) sjukdomsfall och i förekommande fall uppgift om behandlingen,
v) resultaten från obduktion av djur som dött i anläggningen, även dödfödda djur,
vi) iakttagelser som har gjorts under tiden i isolering eller karantän,
e) antingen ha ett avtal med ett behörigt laboratorium att utföra obduktioner eller ha ett eller flera lämpliga utrymmen där dessa undersökningar kan göras av en behörig person under den godkände veterinärens ledning,
f) antingen ha ett lämpligt arrangemang eller utrymmen inom anläggningen där kadaver efter djur som dör av sjukdom eller avlivas kan omhändertas på ett korrekt sätt,
g) genom kontrakt eller rättsligt instrument anställa en veterinär som är godkänd av och kontrolleras av den behöriga myndigheten, som
i) i tillämpliga delar skall uppfylla de villkor som avses i artikel 14.3 B i direktiv 64/432/EEG,
ii) skall se till att lämplig sjukdomsövervakning och kontrollåtgärder i förhållande till sjukdomssituationen i det berörda landet är godkänt av den behöriga myndigheten och tillämpas vid organet, instititutet eller centret. Bland de åtgärderna skall ingå
— en årlig plan för övervakning av sjukdomar, inklusive lämpliga zoonoskontroller av djuren,
— kliniska prov, laboratorieprov och obduktionsprov på djur som misstänks ha drabbats av smittsamma sjukdomar,
— lämplig vaccinering av djur som är mottagliga för sjukdomar, endast i enlighet med gemenskapslagstiftningen,
iii) genast till den behöriga myndigheten skall anmäla varje misstänkt dödsfall eller förekomsten av något annat symtom som kan tyda på att djur har smittats av en eller flera av de sjukdomar som anges i bilaga A och B, om sjukdomen är anmälningspliktig i den berörda medlemsstaten,
iv) skall se till att de djur som anländer har isolerats i nödvändig grad och enligt kraven i detta direktiv och eventuella instruktioner från den behöriga myndigheten,
v) skall ha ansvaret för den dagliga efterlevnaden av de djurhälsovillkor som fastställs i detta direktiv och gemenskapslagstiftningen om skydd av djur under transport och hantering av animaliskt avfall,
h) om den håller djur som är avsedda för laboratorier som gör försök på djur efterleva bestämmelserna i artikel 5 i direktiv 86/609/EEG.
2. Godkännandet skall kvarstå om följande krav har uppfyllts:
a) anläggningen kontrolleras av en officiell veterinär från den behöriga myndigheten, som
i) skall besöka organet, institutet eller centret minst en gång om året,
ii) skall övervaka den godkände veterinärens verksamhet och genomförandet av den årliga planen för övervakning av smittsamma sjukdomar,
iii) skall se till att bestämmelserna i detta direktiv efterlevs.
b) De djur som förs till anläggningen skall komma från ett annat godkänt organ, institut eller centrum i enlighet med bestämmelserna i detta direktiv.
c) Den officielle veterinären skall kontrollera att
— bestämmelserna i detta direktiv efterlevs,
— resultaten från kliniska prov, obduktioner och laboratorieundersökningar inte visar några spår av bärare av de sjukdomar som anges i bilagorna A och B.
d) organet, institutet eller centret skall behålla de uppgifter som avses i punkt 1.d i minst tio år.
3. Genom undantag från artikel 5.1 i detta direktiv och punkt 2 b i denna bilaga kan djur, inklusive apor (simiae och prosimiae) vars ursprung är något annat än ett godkänt organ, institut eller centrum, föras till ett godkänt organ, institut eller centrum, under förutsättning att de genomgår officiellt kontrollerad karantän i enlighet med de instruktioner som ges av den behöriga myndigheten innan de släpps in i gruppen.
När det gäller apor (simiae och prosimiae) skall de karantänkrav som fastställs i OIE:s regler för djurhälsa (kapitel 2.10.1 och bilaga 3.5.1) respekteras.
För andra djur som hålls i karantän enligt punkt 2.b i denna bilaga skall perioden i karantän vara minst 30 dagar med beaktande av de sjukdomar som anges i bilaga A.
4. Djur som är inhysta i ett godkänt organ, institut eller centrum får lämna anläggningen endast för att föras till ett annat godkänt organ, institut eller centrum i den medlemsstaten eller en annan medlemsstat, eller, om de inte skall föras till ett godkänt organ, institut eller centrum, får de endast föras ut i enlighet med de krav som den behöriga myndigheten ställer för att tillförsäkra att det inte finns någon risk för eventuell spridning av smitta.
5. Om en medlemsstat åtnjuter ytterligare garantier enligt gemenskapslagstiftningen kan den begära lämpliga ytterligare villkor och intyg för den mottagliga art som skall föras till det godkända organet, institutet eller centret.
6. Följande förfaranden skall användas för att helt eller delvis stänga av, återkalla eller återställa godkännandet:
a) Om den behöriga myndigheten finner att villkoren i punkt 2 inte har uppfyllts eller att det har inträffat en förändring som inte omfattas av artikel 2 i detta direktiv skall godkännandet återkallas eller avstängas.
b) Om anmälan görs om misstanke om någon av de sjukdomar som anges i bilagorna A och B skall den behöriga myndigheten stänga av godkännandet för organet, institutet eller centret till dess att misstanken officiellt har avskrivits. Beroende på vilken sjukdom det gäller och risken för smittspridning kan avstängningen omfatta hela anläggningen eller bara vissa kategorier av djur som är mottagliga för den aktuella sjukdomen. Den behöriga myndigheten skall se till att nödvändiga åtgärder vidtas för att bekräfta eller avskriva misstankarna och undvika sjukdomsspridning, i enlighet med gemenskapslagstiftningen om åtgärder som skall vidtas mot sjukdomen i fråga, och om handel med djur.
c) Om misstankarna om sjukdomen bekräftas skall organet, institutet eller centret inte godkännas igen förrän de villkor återigen uppfylls som anges i punkt 1 i denna bilaga, med undantag för punkt 1.c, sedan smittan och smittkällorna på anläggningen har utplånats, inbegripet med hjälp av lämplig rengöring och desinfektion.
d) Den behöriga myndigheten skall informera kommissionen om avstängning, återkallande eller återställande av godkännandet av ett organ, institut eller center.
▼M10
BILAGA D
KAPITEL I
Villkor för seminstationer, spermastationer, embryosamlingsgrupper och embryoproduktionsgrupper
I.
Villkor för godkännande av seminstationer och spermastationer
|
1.
|
En seminstation ska, för att bli godkänd och få sig tilldelat det veterinärregistreringsnummer som avses i artikel 11.4, uppfylla följande villkor:
1.1 Den ska stå under ständig tillsyn av en stationsveterinär som förordnats av den behöriga myndigheten.
1.2 Den ska minst vara utrustad med
a) ett låsbart djurstall och vid behov ett motionsutrymme för hästdjuren som är åtskilt från samlingslokalerna och från behandlings- och lagerutrymmena,
b) isoleringsutrymmen som inte har direkt kommunikation med det vanliga djurstallet,
c) utan att det påverkar tillämpningen av led 1.4, lokaler för samling av sperma, eventuellt utomhuslokaler skyddade mot ogynnsamma väderförhållanden, med halksäkert underlag som skyddar mot allvarliga skador i händelse av fall, på och runt om spermasamlingsplatsen,
d) ett särskilt rum för rengöring och desinfektion eller sterilisering av utrustning,
e) ett spermabehandlingsrum som ska vara avskilt från spermasamlingslokalerna och den lokal för rengöring av utrustning som avses i led d, men som inte nödvändigtvis behöver vara beläget på samma plats,
f) ett rum för lagring av sperma, som inte nödvändigtvis behöver vara beläget på samma plats.
1.3 Den ska vara så konstruerad eller isolerad att kontakt med boskap utanför stationen förhindras.
1.4 Den ska vara så konstruerad att hela seminstationen utom kontorslokalerna och eventuella motionsutrymmen för hästdjur lätt kan rengöras och desinfekteras.
|
|
2.
|
En spermastation ska för att bli godkänd uppfylla följande villkor:
a) Den ska ha tilldelats det särskilda veterinärregistreringsnummer som avses i artikel 11.4 för var och en av de arter från vilka det lagras sperma i spermastationen, om lagringsverksamheten inte är begränsad till sådan sperma från en enskild art som har samlats in på en seminstation vilken godkänts i enlighet med detta direktiv, eller om embryon lagras på spermastationen i enlighet med detta direktiv.
b) Den ska stå under ständig tillsyn av en stationsveterinär som förordnats av den behöriga myndigheten.
c) Den ska ha ett spermalagringsrum försett med installationer som gör det möjligt att lagra sperman och/eller embryona och som är byggt så att det skyddar produkterna och installationerna mot ogynnsamma väderförhållanden och miljöpåverkan.
d) Den ska vara så konstruerad att kontakt med boskap eller andra djur utanför stationen förhindras.
e) Den ska vara så konstruerad att hela stationen utom kontorslokalerna och eventuella motionsutrymmen för hästdjur lätt kan rengöras och desinfekteras.
f) Den ska vara så konstruerad att obehöriga effektivt hindras från att skaffa sig tillträde till spermastationen.
|
II.
Villkor för tillsyn över seminstationer
|
1.
|
Följande villkor ska gälla för seminstationer:
1.1 De ska stå under tillsyn så att följande säkerställs:
a) Att de endast håller djur av de arter vars sperma ska samlas.
Andra husdjur får emellertid också tas in på stationen under förutsättning att de inte innebär någon infektionsrisk för de arter vars sperma ska samlas och att de uppfyller de villkor som fastställts av stationsveterinären.
Om seminstationen delar lokaler med en station för insemination eller en servicestation, gäller i fråga om hästdjur att ston, proberhingstar och hingstar som används för betäckning får tas in där under förutsättning att de uppfyller kraven i kapitel II avsnitt I.1.1, 1.2, 1.3 och 1.4.
b) Att personer utan tillstånd inte bereds tillträde till seminstationen och att besökare med tillstånd uppfyller de villkor som stationsveterinären fastställt.
c) Att stationen endast anställer kompetent personal med lämplig utbildning i desinfektion och hygienteknik så att sjukdomsspridning förhindras.
1.2 De ska övervakas så att följande säkerställs:
a) Att det förs register med uppgifter om
i) art, ras, födelsedatum och identitet för djuren som hålls på stationen,
ii) eventuella förflyttningar av de djur som kommer till eller lämnar stationen,
iii) sjukdomshistoria och resultat av alla de diagnostiska test som genomförts samt de behandlingar och vaccinationer vilka utförts på djuren som hålls på stationen,
iv) datum för spermauppsamling och spermabehandling,
v) spermans bestämmelseort,
vi) lagringen av sperman.
b) Att inget av djuren som hålls på stationen används för betäckning minst 30 dagar före den första spermauppsamlingen och under samlingsperioden.
c) Att samling, behandling och lagring av sperma endast utförs i lokaler som reserverats för dessa ändamål.
d) Att alla instrument som kommer i kontakt med sperman eller donatordjuret under spermasamlingen och behandlingen är ordentligt desinfekterade eller steriliserade före användningen, frånsett nya engångsinstrument som kasseras efter användningen.
Om seminstationen delar lokaler med en station för insemination eller en servicestation ska det i fråga om hästdjur göras strikt åtskillnad mellan å ena sidan sperma, instrument och utrustning för insemination eller betäckning och å andra sidan instrument och utrustning som kommer i kontakt med donatordjuren eller andra djur som hålls på seminstationen.
e) Att produkter av animaliskt ursprung som används vid behandlingen av sperman, däribland spädningsvätskor, tillsatser och förtunningsmedel, härrör från källor som inte medför någon risk för djurens hälsa eller har behandlats före användningen på ett sätt som förebygger varje sådan risk.
f) Att de kylmedier som används för bevarande eller lagring av sperma inte tidigare har använts för andra animaliska produkter.
g) Att förvaringskärl och transportkärl är ordentligt desinfekterade eller steriliserade innan varje påfyllning påbörjas, frånsett nya engångsinstrument som kasseras efter användningen.
h) Att varje enskild dos av sperma eller varje ejakulat av färsk sperma avsedd för vidare behandling är tydligt märkt på sådant sätt att datum för spermanuppsamlingen, donatordjurets art, ras och identitet samt seminstationens registreringsnummer lätt kan fastställas.
1.3 De ska inspekteras av en officiell veterinär under avelsperioden, minst en gång per kalenderår vad gäller djur med säsongsbetonad avel och två gånger per kalenderår vad gäller djur med icke säsongsbetonad avel, om så krävs på grundval av förteckningar, standardiserade arbetsförfaranden och egenkontroll, så att alla förhållanden rörande villkoren för godkännande, tillsyn och övervakning kan beaktas och kontrolleras.
|
|
2.
|
Spermastationer ska uppfylla följande villkor:
2.1 De ska stå under tillsyn så att följande säkerställs:
a) Att statusen för de donatordjur vars sperma lagras i spermastationen uppfyller kraven i detta direktiv.
b) Att kraven i led 1.1 b och c är uppfyllda.
c) Att det förs en förteckning över all sperma som inkommer till och lämnar spermastationen.
2.2 De ska övervakas så att följande säkerställs:
a) Att endast sperma som har samlats i och härrör från godkända seminstationer eller spermastationer, som transporterats under betingelser vilka ger full hälsomässig garanti och som inte kommit i kontakt med sperma som inte uppfyller kraven i detta direktiv, tas in på en godkänd spermastation.
b) Att lagring av sperma endast sker i de utrymmen som reserverats för detta ändamål och under strikta hygieniska betingelser.
c) Att alla instrument, frånsett engångsinstrument, som kommer i kontakt med sperman är ordentligt desinfekterade eller steriliserade före användningen.
d) Att förvaringskärl och transportkärl, frånsett engångskärl, är ordentligt desinfekterade eller steriliserade innan varje påfyllning påbörjas.
e) Att de kylmedier som används för bevarande eller lagring av sperma inte tidigare har använts för andra animaliska produkter.
f) Att varje enskild dos av sperma är tydligt märkt på sådant sätt att datum för spermauppsamlingen, donatordjurets ras och identitet samt spermastationens registreringsnummer lätt kan fastställas. Varje medlemsstat ska till kommissionen och övriga medlemsstater lämna en beskrivning av den märkning som används på dess territorium.
2.3 Genom undantag från led 2.2 a är lagring av embryon i den godkända spermastationen tillåten, förutsatt att de uppfyller kraven i detta direktiv och lagras i separata förvaringsbehållare.
2.4 De ska inspekteras av en officiell veterinär minst två gånger per kalenderår, om så krävs på grundval av förteckningar, standardiserade arbetsförfaranden och egenkontroll, så att alla förhållanden rörande villkoren för godkännande, tillsyn och övervakning kan beaktas och kontrolleras.
|
III.
Villkor för godkännande av och tillsyn över embryosamlingsgrupper och embryoproduktionsgrupper
|
1.
|
Varje embryosamlingsgrupp ska för att godkännas uppfylla följande krav:
1.1 Samling, behandling och lagring av embryon ska utföras antingen av en gruppveterinär eller under dennes ansvar av en eller flera tekniker som besitter kompetens och har fått utbildning av gruppveterinären i såväl hygienisk metodik och teknik som teknik och principer för sjukdomsbekämpning.
1.2 Gruppveterinären ska ansvara för gruppens hela verksamhet, bl.a. följande:
a) Kontroll av donatordjurets identitet och hälsostatus.
b) Hälsomässigt korrekt hantering av och operativa ingrepp på donatordjur.
c) Desinfektions- och hygienförfaranden.
d) Registrering av
i) art, ras, födelsedatum och identitet för alla djur,
ii) sjukdomshistoria och resultat av alla de diagnostiska test som genomförts samt de behandlingar och vaccinationer som utförts på donatordjuren,
iii) ort och datum för uppsamling, behandling och lagring av såväl oocyter som ägg och embryon,
iv) embryonas identitet samt uppgifter om deras bestämmelseort, om den är känd.
1.3 Gruppen ska stå under allmän tillsyn av den officiella veterinären, som minst en gång varje kalenderår ska avlägga kontrollbesök för att säkerställa, om så krävs på grundval av förteckningar, standardiserade arbetsförfaranden och egenkontroll, att alla villkor för samling, behandling och lagring av embryon uppfylls och för att kontrollera alla förhållanden som rör villkoren för godkännande och tillsyn.
1.4 Gruppen ska ha tillgång till ett fast eller rörligt laboratorium där embryona kan undersökas, behandlas och förpackas, bestående av åtminstone en arbetsyta, ett optiskt mikroskop eller stereomikroskop och kylutrustning om så krävs.
1.5 Ett fast laboratorium ska ha
a) ett rum där embryona kan behandlas och som är beläget i direkt anslutning till, men avskilt från, det utrymme som används för hanteringen av donatordjuren när embryona samlas,
b) ett rum eller ett område för rengöring och sterilisering av instrument, frånsett när engångsutrustning används,
c) ett rum för lagring av embryon.
1.6 Om det rör sig om ett rörligt laboratorium ska det uppfylla följande krav:
a) Det ska ha en särskilt utrustad del som består av två från varandra avskilda avdelningar, nämligen
i) en avdelning som endast är avsedd för undersökning och behandling av embryon, och
ii) en annan avdelning som endast är avsedd för lagring av den utrustning och materiel som kommer i kontakt med donatordjuren.
b) Det ska endast användas engångsutrustning i laboratoriet, utom i sådana fall då det går att säkerställa steriliseringen av utrustningen och tillgången till vätskor och andra produkter som krävs för samlingen och behandlingen av embryon, via kontakt med ett laboratorium med fast placering.
1.7 Byggnader och laboratorier ska vara så utformade och inrättade att korskontaminering av embryon inte kan ske, och gruppen ska utföra sitt arbete i enlighet med detta krav.
1.8 Gruppen ska till sitt förfogande ha lagringslokaler som ska
a) ha minst ett låsbart rum avsett för lagring av ägg och embryon,
b) vara lätta att rengöra och desinfektera,
c) ha permanenta förteckningar över alla inkommande och utgående ägg eller embryon,
d) ha förvaringskärl för ägg och embryon som lagras på ett ställe vilket står under kontroll av gruppveterinären och inspekteras regelbundet av en officiell veterinär.
1.9 Den behöriga myndigheten kan ge tillåtelse till lagring av sperma i de lagringslokaler som avses i led 1.8, förutsatt att sperman
a) uppfyller kraven antingen i detta direktiv, vad gäller får och getter eller hästdjur, eller i rådets direktiv 90/429/EEG av den 26 juni 1990 om djurhälsokrav som är tillämpliga vid handel inom gemenskapen med och import av sperma från tamdjur av svin (
24
) vad gäller svin,
b) lagras för gruppens verksamhet i separata förvaringsbehållare i de lokaler där godkända embryon lagras.
|
|
2.
|
Varje embryoproduktionsgrupp ska för att godkännas uppfylla följande ytterligare krav:
2.1 Personalen ska ha fått lämplig utbildning i sjukdomskontroll- och laboratorietekniker, särskilt när det gäller arbete under sterila förhållanden.
2.2 Gruppen ska till sitt förfogande ha ett fast laboratorium som ska uppfylla följande villkor:
a) Det ska ha lämplig utrustning och lokaler, inklusive separata rum för
— uttagning av oocyter från ovarier,
— behandling av oocyter, ägg och embryon,
b) Det ska ha en lokal med laminarflow-anordning eller annan lämplig lokal där alla tekniska operationer som associeras med specifika sterila villkor (behandling av sperma, ägg och embryon) utförs.
Centrifugeringen av sperma får dock ske utanför laminarflow-lokalen eller den andra lämpliga lokalen om tillfredsställande hygieniska säkerhetsåtgärder vidtas.
2.3 Om oocyter och annan vävnad ska samlas på ett slakteri ska detta ha tillgång till lämplig utrustning för samling och transport av ovarierna och annan vävnad till behandlingslaboratoriet på ett hygieniskt och säkert sätt.
|
KAPITEL II
Villkor för donatordjur
I.
Villkor för donatorhingstar
|
1.
|
Donatorhingstar som ska användas för samling av sperma ska uppfylla följande krav, enligt stationsveterinärens bedömning:
1.1 De får inte visa några kliniska tecken på infektion eller smittsam sjukdom vid tidpunkten för mottagandet och den dag då sperman uppsamlas.
1.2 De ska komma från en medlemsstats territorium eller, vid regionalisering, från den berörda delen av en medlemsstats territorium eller ett tredjelands territorium samt från en anläggning som står under veterinär tillsyn och som uppfyller villkoren i direktiv 90/426/EEG.
1.3 De ska under 30 dagar före spermauppsamlingen ha hållits på anläggningar där inga hästdjur har visat kliniska tecken på EVA (ekvin virusarterit) eller CEM (smittsam livmoderinflammation hos häst) under den berörda perioden.
1.4 De får inte användas för betäckning under de 30 dagar som föregår den första spermauppsamlingen och under samlingsperioden.
1.5 De ska genomgå följande test, som ska utföras och bestyrkas av ett laboratorium som godkänts av den behöriga myndigheten, i enlighet med det program som föreskrivs i led 1.6:
a) En agargel immunodiffusionstest (Coggins-test) eller ett Elisa-test för påvisande av ekvin infektiös anemi med negativt resultat.
b) Ett virusisoleringstest för påvisande av ekvin viral arterit med negativt resultat på en lämplig mängd av hela sädesvätskan från donatorhingsten, om inte ett negativt resultat erhålls vid en serumutspädning av 1:4 i ett serumneutraliseringstest för ekvin viral arterit.
c) Ett test för påvisande av CEM (smittsam livmoderinflammation hos häst) vilket genomförts vid två tillfällen på prover som samlats från donatorhingsten med sju dagars mellanrum genom isolering av Taylorella equigenitalis-bakterien från preejakulationsvätska eller ett spermaprov, och från genitala svabbprov som tagits åtminstone från förhuden, urinröret och fossa urethralis, i samtliga fall med negativt resultat.
1.6 De ska ha genomgått något av följande testprogram:
a) Om donatorhingsten utan uppehåll hålls på seminstationen under minst 30 dagar före den första spermauppsamlingen och under samlingsperioden, och om inga hästdjur vid seminstationen kommer i direkt kontakt med hästdjur med en lägre hälsostatus än donatorhingsten, ska de test som föreskrivs i led 1.5 utföras på prover som samlats in från donatorhingsten före den första spermauppsamlingen, minst 14 dagar efter det att ovannämnda vistelseperiod om minst 30 dagar har inletts.
b) Om donatorhingsten hålls på seminstationen i minst 30 dagar före den första spermauppsamlingen och under samlingsperioden, men med stationsveterinärens medgivande tillfälligtvis får lämna seminstationen under en sammanhängande period om mindre än 14 dagar, och/eller andra hästdjur på seminstationen kommer i direkt kontakt med hästdjur med en lägre hälsostatus, ska de test som föreskrivs i led 1.5 utföras på prover som samlats från donatorhingsten enligt följande villkor:
i) Minst en gång om året vid avelssäsongens början eller före den första spermauppsamlingen, minst 14 dagar efter det att ovannämnda vistelseperiod om minst 30 dagar har inletts.
ii) Under spermasamlingsperioden minst
— var 90:e dag för det prov som föreskrivs i led 1.5 a,
— var 30:e dag för det prov som föreskrivs i led 1.5 b, om det inte bekräftas att en hingst som är seropositiv för ekvin viral arterit erhållit icke utsöndrande status genom virusisoleringstest två gånger om året,
— var 60:e dag för det prov som föreskrivs i led 1.5 c.
c) Om donatorhingsten inte uppfyller villkoren i leden a och b, och/eller sperman samlas in för handel med frusen sperma, ska de test som föreskrivs i led 1.5 genomföras på prover som samlats in från donatorhingsten enligt följande villkor:
i) Minst en gång om året vid avelssäsongens början.
ii) Under den lagringsperiod som fastställs i kapitel III avsnitt I.1.3 b och innan sperman förs bort från stationen eller används, på prover som samlats in högst 14 dagar och senast 90 dagar efter spermauppsamlingen.
Genom undantag från led ii krävs inte provtagning och testning för ekvin viral arterit efter spermasamlingen enligt led 1.5 b om det bekräftas att en hingst som är seropositiv för ekvin viral arterit erhållit icke utsöndrande status genom virusisoleringstest två gånger om året.
1.7 Om en donatorhingst reagerar positivt på något av de prover som föreskrivs i led 1.5 ska den isoleras, och den sperma som har samlats från den efter det datum då djuret senast reagerade negativt får inte bli föremål för handel, med undantag för sperma från ejakulat som har genomgått virusisoleringstestet för ekvin viral arterit med negativt resultat.
Sperma som samlats från alla andra hingstar på seminstationen sedan uppsamlingen av det senaste prov som gav ett negativt resultat i ett av de prover som föreskrivs i led 1.5, ska förvaras isolerat och får inte bli föremål för handel innan seminstationens hälsostatus har återupprättats och den lagrade sperman har genomgått blivit föremål för lämpliga officiella undersökningar för att utesluta att sperman innehåller patogener som orsakar de sjukdomar som anges i led 1.5.
1.8 Sperma som samlats från hingstar på en seminstation som omfattas av ett förbud i enlighet med artiklarna 4 eller 5 i direktiv 90/426/EEG, ska förvaras isolerat och får inte bli föremål för handel innan seminstationens hälsostatus har återupprättats av den officiella veterinären i enlighet med direktiv 90/426/EEG och den lagrade sperman har genomgått lämpliga officiella undersökningar för att utesluta att sperman innehåller patogener som orsakar de sjukdomar som anges i bilaga A till direktiv 90/426/EEG.
|
II.
Villkor för donatorbaggar och donatorbockar
|
1.
|
Alla får och getter som tas emot vid en seminstation ska uppfylla följande krav:
1.1 De har tillbringat en karantänperiod på minst 28 dagar i ett utrymme som av den behöriga myndigheten godkänts särskilt för detta ändamål och där enbart djur med minst samma hälsostatus befunnit sig (nedan kallad karantänanläggning).
1.2 De har före sin vistelse på karantänanläggningen tillhört en får- eller getanläggning som officiellt är fri från brucellos enligt artikel 2 i direktiv 91/68/EEG och har inte tidigare hållits på en anläggning med en lägre hälsostatus vad gäller brucellos.
1.3 De kommer från en anläggning där de under de 60 dagar som föregår flyttningen till karantänanläggningen har genomgått en serologisk undersökning för smittsam epididymit hos baggar (B. ovis), utförd i enlighet med bilaga D till direktiv 91/68/EEG, eller ett annat test med motsvarande dokumenterad sensitivitet och specificitet.
1.4 De har genomgått följande test och undersökningar som utförts på ett blodprov som tagits högst 28 dagar före inledningen av den karantänperiod som anges i led 1.1, med negativt resultat i varje enskilt fall, med undantag för den undersökning som avses i led c ii för Border disease:
a) För brucellos (B. melitensis), ett serologiskt test i enlighet med bilaga C till direktiv 91/68/EEG.
b) För smittsam epididymit (B. ovis), ett serologiskt test i enlighet med bilaga D till direktiv 91/68/EEG, eller varje annat test med motsvarande dokumenterad känslighet och specificitet.
c) För Border disease ska följande test genomföras:
i) Ett virusisoleringstest eller ett test för att påvisa virusantigen.
ii) Ett serologiskt prov för att påvisa närvaro eller frånvaro av antikroppar (antikroppsprov).
Den behöriga myndigheten får tillåta att de undersökningar som avses i detta led utförs på prov som tagits vid karantänanläggningen. Om ett sådant tillstånd ges får den karantän som fastställs i led 1.1. inte inledas före tidpunkten för provtagningen. Om emellertid någon av undersökningarna som avses i detta led utfaller positivt ska det berörda djuret omedelbart avlägsnas från isoleringsanläggningen. Vid gruppisolering får den karantän som fastställs i led 1.1 inte inledas för övriga djur förrän det djur som testats positivt har avlägsnats.
1.5 De har med negativt resultat genomgått följande undersökningar, utförda på prover som tagits under den karantänperiod som avses i led 1.1 och efter minst 21 dagars vistelse i karantänanläggningen:
a) För brucellos (B. melitensis), ett serologiskt test i enlighet med bilaga C till direktiv 91/68/EEG.
b) För smittsam epididymit (B. ovis), ett serologiskt test i enlighet med bilaga D till direktiv 91/68/EEG, eller varje annat test med motsvarande dokumenterad känslighet och specificitet.
1.6 De har genomgått de test och undersökningar för Border disease som avses i led 1.4 c i och ii, utförda på blodprover som tagits under den karantänperiod som avses i led 1.1 och efter minst 21 dagars vistelse i karantänanläggningen.
Endast under förutsättning att ingen serokonversion inträffar hos djur med seronegativt testresultat före den dag då de tas emot på karantänanläggningen, får djuren (seronegativa eller seropositiva) tas emot på spermastationerna.
Om en serokonversion inträffar ska samtliga djur som fortfarande är seronegativa hållas i karantän under en förlängd period, tills dess att det inte har inträffat något fall av serokonversion i gruppen under en treveckorsperiod räknat från den dag då serokonversionen inträffade.
Serologiskt positiva djur kan flyttas till seminstationen om de har genomgått det test som avses i led 1.4 c i med negativt resultat.
|
|
2.
|
Djur får tas emot vid seminstationen endast efter uttryckligt tillstånd av stationsveterinären. Alla flyttningar av djur till och från seminstationen ska registreras.
|
|
3.
|
Inget djur som tas emot vid seminstationen får visa något kliniskt tecken på sjukdom vid ankomsten.
Utan att det påverkar tillämpningen av led 4 ska alla djur komma från en karantänanläggning som den dag då djuren flyttas till seminstationen uppfyller följande villkor:
a) Den är belägen i ett område där det inom en radie av 10 km inte har förekommit något fall av mul- och klövsjuka under de senaste 30 dagarna.
b) Den har under de senaste tre månaderna varit fri från mul- och klövsjuka och brucellos.
c) Den har under de senaste 30 dagarna varit fri från anmälningspliktiga sjukdomar enligt definitionen i artikel 2 b 6 i direktiv 91/68/EEG.
|
|
4.
|
Om de villkor som fastställs under led 3 är uppfyllda och de rutinundersökningar som avses i led 5 har utförts under de tolv månader som närmast föregår flyttningen av djuren, får de flyttas från en godkänd seminstation till en annan med likvärdig hälsostatus utan isolering eller undersökning, om överföringen sker direkt. Det berörda djuret får inte komma i direkt eller indirekt kontakt med klövbärande djur med en lägre hälsostatus och de transportmedel som används ska ha desinfekterats före användningen. Om ett djur flyttas från en seminstation till en annan seminstation i en annan medlemsstat, ska flyttningen ske i enlighet med direktiv 91/68/EEG.
|
|
5.
|
Alla får och getter som hålls vid en godkänd seminstation ska minst en gång per kalenderår genomgå följande undersökningar, med negativt resultat:
a) För brucellos (B. melitensis), ett serologiskt test i enlighet med bilaga C till direktiv 91/68/EEG.
b) För smittsam epididymit (B. ovis), ett serologiskt test i enlighet med bilaga D till direktiv 91/68/EEG, eller varje annat test med motsvarande dokumenterad känslighet och specificitet.
c) För Border disease, det antikroppsprov som avses i led 1.4 c ii och som endast ska utföras på seronegativa djur.
|
|
6.
|
Alla test och undersökningar som nämns i detta avsnitt ska utföras av ett godkänt laboratorium.
|
|
7.
|
Om ett djur reagerar positivt på något av de test som avses i led 5 ska det isoleras, och den sperma som har samlats in från djuret efter den dag då djuret senast reagerade negativt får inte bli föremål för handel.
Djur som avses i första stycket ska avlägsnas från stationen, med undantag för om det rör sig om Border disease, i vilket fall djuret ska genomgå och reagera negativt på en undersökning enligt led 1.4 c i.
All sperma som samlats från andra djur på seminstationen sedan den dag då man samlade det senaste prov som gav ett negativt resultat i ett av de test som beskrivs i led 5, ska förvaras isolerat och får inte bli föremål för handel innan seminstationens hälsostatus har återupprättats och den lagrade sperman har genomgått lämpliga officiella undersökningar med syftet att utesluta att sperman innehåller patogener som orsakar de sjukdomar som anges i led 5.
|
|
8.
|
Sperman ska samlas från djur som uppfyller följande villkor:
a) De uppvisar inte några kliniska sjukdomstecken den dag då sperman samlas.
b) Under de tolv månader som föregår den dag då sperman samlas har de antingen
i) inte vaccinerats mot mul- och klövsjuka, eller
ii) vaccinerats mot mul- och klövsjuka minst 30 dagar före spermauppsamlingen, i vilket fall 5 % (dock med minst fem payetter) av varje spermasamling ska genomgå virusisoleringstest för mul- och klövsjuka med negativt resultat.
c) De har hållits vid en godkänd seminstation under en sammanhängande period av minst 30 dagar före spermauppsamlingen, när det gäller färsk sperma.
d) De uppfyller kraven i artiklarna 4, 5 och 6 i direktiv 91/68/EEG.
e) Om de hålls på sådana anläggningar som avses i artikel 11.2 första strecksatsen har de under de 30 dagar som föregår spermauppsamlingen med negativt resultat genomgått följande test:
i) För brucellos (B. melitensis), ett serologiskt test i enlighet med bilaga C till direktiv 91/68/EEG.
ii) För smittsam epididymit (B. ovis), ett serologiskt test i enlighet med bilaga D till direktiv 91/68/EEG, eller varje annat test med motsvarande dokumenterad känslighet och specificitet.
iii) Ett test för påvisning av Border disease virus (BDV).
f) De används inte för betäckning under minst 30 dagar före den första spermauppsamlingen samt mellan den dag då det första prov tas som avses i leden 1.5 och 1.6 eller i led e och slutet av spermasamlingsperioden.
|
|
9.
|
Sperma som samlats från baggar och bockar på en seminstation eller anläggning som avses i artikel 11.2 första strecksatsen och för vilken det gäller ett förbud på djurhälsomässiga grunder i enlighet med artikel 4 i direktiv 91/68/EEG, ska förvaras isolerat och får inte bli föremål för handel innan seminstationens eller anläggningens hälsostatus har återupprättats av den officiella veterinären i enlighet med direktiv 91/68/EEG, och den lagrade sperman har genomgått lämpliga officiella undersökningar för att utesluta att sperman innehåller patogener som orsakar de sjukdomar som anges i bilaga B.I till direktiv 91/68/EEG.
|
KAPITEL III
Krav för sperma, ägg och embryon
I.
Villkor för samling, behandling, bevarande, lagring och transport av sperma
1.1 Utan att det påverkar tillämpningen av Europaparlamentets och rådets direktiv 2001/82/EG (
25
) ska man vid tillsättning av antibiotika eller antibiotikablandningar med en bakteriedödande aktivitet som minst motsvarar aktiviteten i 1 ml sperma av gentamicin (250 μg) blandat med tylosin (50 μg) och linkomycin-spektinomycin (150/300 μg), penicillin (500 IU) blandat med streptomycin (500 μg) och linkomycin-spektinomycin (150/300 μg) eller amikacin (75μg) blandat med divekacin (25μg), ange namnen på den tillsatta antibiotikan och koncentrationen av denna i det hälsointyg som avses i artikel 11.2 fjärde strecksatsen.
1.2 Alla instrument som används för samling, behandling, bevarande eller nedfrysning av sperma ska desinfekteras eller steriliseras före användningen, frånsett engångsinstrument.
1.3 Frusen sperma ska hanteras på följande vis:
a) Den ska placeras och lagras i förvaringsbehållare
i) som rengjorts och desinfekterats eller steriliserats före användningen eller är engångsbehållare,
ii) där det kylmedium som används inte tidigare har använts för andra produkter av animaliskt ursprung.
b) Före avsändandet eller användningen ska den lagras under godkända förhållanden i minst 30 dagar räknat från den dag då sperman uppsamlades.
1.4 Sperma avsedd för handel ska hanteras på följande vis:
a) Den ska transporteras till bestämmelsemedlemsstaten i transportbehållare som har rengjorts och desinfekterats eller steriliserats före användningen, frånsett engångskärl, och som har förseglats och numrerats före avsändandet från de godkända seminstationerna eller spermastationerna.
b) Den ska märkas på ett sådant sätt att numret på payetterna eller emballaget av annan typ stämmer överens med numret på det hälsointyg som avses i artikel 11.2 fjärde strecksatsen och den behållare som de förvaras och transporteras i.
II.
Villkor för ägg och embryon
1. Samling och behandling av embryon som tillkommit genom befruktning in vivo.
Embryon som tillkommit genom befruktning in vivo ska vara befruktade genom konstgjord insemination med sperma som uppfyller kraven i detta direktiv samt samlas in, behandlas och bevaras enligt följande villkor:
1.1 Embryona ska samlas och hanteras av en godkänd embryosamlingsgrupp utan att komma i kontakt med andra partier av embryon som inte uppfyller kraven i detta direktiv.
1.2 Embryona ska samlas på en plats som dels är avskild från andra delar av de lokaler eller den anläggning där embryona samlas, dels är väl underhållen och konstruerad i material som är lätta att rengöra och desinfektera effektivt.
1.3 Embryona ska behandlas (undersökas, rengöras, behandlas och placeras i identifierade och sterila payetter eller ampuller eller identifierat och sterilt emballage av annan typ) i antingen ett laboratorium med fast placering eller ett mobilt laboratorium som, när det rör sig om mottagliga arter, är beläget i ett område där det inom en radie av 10 km inte har förekommit något fall av mul- och klövsjuka under de senaste 30 dagarna.
1.4 All utrustning som används för samling, hantering, rengöring, nedfrysning och lagring av embryona, ska antingen rengöras och desinfekteras grundligt före användningen enligt IETS-handboken (
26
), eller vara engångsutrustning.
1.5 Alla biologiska produkter av animaliskt ursprung som finns i medier och lösningar som används för samling, behandling, rengöring eller lagring av embryon ska vara fria från patogena mikroorganismer. Medier och lösningar som används för samling, nedfrysning och lagring av embryon ska steriliseras med metoder som är godkända enligt IETS-handboken och hanteras på ett sådant sätt att de förblir sterila. Antibiotika kan om så krävs tillsättas medier som används för samling, behandling, rengöring och lagring enligt IETS-handboken.
1.6 De kylmedier som används för bevarande eller lagring av embryon får inte tidigare ha använts för andra animaliska produkter.
1.7 Varje enskild payett eller ampull eller enskilt emballage av annan typ med embryon i ska vara entydigt identifierat med etiketter enligt det standardsystem som beskrivs i IETS-handboken
1.8 Embryona ska rengöras enligt IETS-handboken och deras zona pellucida ska vara intakt före och omedelbart efter rengöring. Rengöringsförfarandet ska ändras så att det omfattar ytterligare rengöringar med enzymet trypsin enligt IETS-handboken, när det är nödvändigt att inaktivera eller avlägsna vissa virus.
1.9 Embryon från olika donatordjur får inte rengöras tillsammans.
1.10 Hela ytan av varje enskilt embryos zona pellucida ska undersökas i en förstoring på minst 40 gånger och intygas vara intakt och fri från vidhängande material.
1.11 Embryon i ett parti som har uppnått ett tillfredsställande resultat i den undersökning som avses i led 1.10 ska placeras i en steril payett eller ampull eller sterilt emballage av annan typ märkt i enlighet med led 1.7 och omedelbart förseglas.
1.12 Varje enskilt embryo ska om så krävs frysas ned så snabbt som möjligt och lagras på en plats som står under tillsyn av stationsveterinären.
1.13 Varje enskild embryosamlingsgrupp ska för officiell undersökning av bakteriell och viral förorening rutinmässigt sända in prover av icke-livskraftiga embryon och ägg samt sköljvätskor eller rengöringsvätskor som används i samband med gruppens arbete enligt IETS-handboken.
1.14 Varje enskild embryosamlingsgrupp ska föra en förteckning över sitt embryosamlingsarbete under en period av två år efter det att embryona har blivit föremål för antingen handel eller import, med angivande av
a) ras, ålder och identitet för de berörda donatordjuren,
b) den plats där gruppen samlat, hanterat och lagrat embryona,
c) embryonas identitet liksom närmare uppgifter om mottagaren av sändningen.
2. Samling och behandling av ägg, ovarier och annan vävnad i syfte att producera embryon genom befruktning in vitro
Villkoren som fastställs i led 1.1–1.14 ska tillämpas när så är lämpligt för samling och behandling av ägg, ovarier och annan vävnad för användning vid befruktning in vitro och/eller odling in vitro. Dessutom ska följande villkor gälla:
2.1 Den behöriga myndigheten ska ha kunskap om och behörighet över donatordjurens ursprungsanläggning(ar).
2.2 Om ovarier och annan vävnad samlas på ett slakteri, antingen från enskilda djur eller från partier av donatorer (nedan kallat partiuppsamling), ska slakteriet vara officiellt godkänt i enlighet med Europaparlamentets och rådets förordning (EG) nr 854/2004 av den 29 april 2004 om fastställande av särskilda bestämmelser för genomförandet av offentlig kontroll av produkter av animaliskt ursprung avsedda att användas som livsmedel (
27
) och stå under tillsyn av en veterinär som dels ska se till att potentiella donatordjur undersöks före och efter slakt, dels intyga att djuren inte uppvisar tecken på de relevanta smittsamma sjukdomar som kan överföras till djur. Slakteriet ska, när det rör sig om mottagliga arter, vara beläget i ett område där det inom en radie av 10 km inte har förekommit något fall av mul- och klövsjuka under de senaste 30 dagarna.
2.3 Partier av ovarier får inte komma in på behandlingslaboratoriet innan undersökningen efter slakt av donatordjuren har avslutats.
2.4 Utrustning för avlägsnande och transport av ovarier och annan vävnad ska steriliseras och desinfekteras eller steriliseras före användningen och får endast användas för dessa syften.
3. Behandling av embryon som tillkommit genom befruktning in vitro
Villkoren i led 1.1–1.14 ska i tillämpliga delar tillämpas på behandling av embryon som tillkommit genom befruktning in vitro. Dessutom ska följande villkor gälla:
3.1 Embryon som tillkommit genom befruktning in vitro ska vara befruktade in vitro med sperma som uppfyller kraven i detta direktiv.
3.2 Efter det att odlingsperioden in vitro avslutats, men före nedfrysning, lagring och transport av embryona, ska dessa rengöras och behandlas i enlighet med leden 1.8, 1.10 och 1.11.
3.3 Embryon från olika donatordjur, när det gäller embryosamling från enskilda djur, eller embryon från olika partiuppsamlingar, får inte rengöras tillsammans.
3.4 Embryon från olika donatordjur, när det gäller embryosamling från enskilda djur, eller embryon från olika partiuppsamlingar får inte förvaras i samma payett, ampull eller emballage av annan typ.
4. Behandling av mikromanipulerade embryon
Före alla mikromanipuleringar som inverkar på zona pellucida, ska alla embryon eller ägg samlas in och behandlas i enlighet med de villkor som föreskrivs i leden 1, 2 och 3. Dessutom ska följande villkor gälla:
4.1 Om det företas en mikromanipulering av embryot som innebär att zona pellucida genomträngs, ska detta göras i lämpliga laboratorielokaler under tillsyn av en godkänd stationsveterinär.
4.2 Varje enskild embryosamlingsgrupp ska föra en förteckning över gruppens verksamhet enligt led 1.14, inklusive närmare uppgifter om mikromanipuleringsmetoder som innebär genomträngning av zona pellucida och som har använts på embryon. I fråga om embryon som tillkommit genom befruktning in vitro kan identifieringen av embryona göras på grundval av ett parti, men ska innehålla närmare uppgifter om datum och plats för uppsamlingen av ovarier och/eller ägg. Det ska också vara möjligt att identifiera donatordjurens ursprungsanläggning.
5. Lagring av embryon
5.1 Varje enskild embryosamlingsgrupp och varje enskild embryoproduktionsgrupp ska se till att embryona lagras vid lämplig temperatur i lagringslokaler enligt kapitel I avsnitt III.1.8.
5.2 Frusna embryon ska före avsändandet lagras under godkända förhållanden i minst 30 dagar räknat från den dag då de uppsamlades eller producerades.
6. Transport av embryon
6.1 Embryon avsedda för handel ska transporteras till bestämmelsemedlemsstaten i behållare som har rengjorts och desinfekterats eller steriliserats före användningen, frånsett engångskärl, och som har förseglats och numrerats före avsändandet från de godkända lagringslokalerna.
6.2 Payetter, ampuller eller emballage av annan typ ska märkas på ett sådant sätt att numret på payetterna, ampullerna eller emballaget av annan typ stämmer överens med numret på det hälsointyg som avses i artikel 11.3 tredje strecksatsen och den behållare som de förvaras och transporteras i.
KAPITEL IV
Krav för donatordjur av honkön
|
1.
|
Donatordjur av honkön ska endast användas för samling av embryon eller ägg om de och de anläggningar som de härrör från, enligt den officiella veterinärens bedömning uppfyller kraven i de relevanta direktiven för handel inom unionen med avels- och produktionsdjur för den berörda rasen.
|
|
2.
|
Utöver de krav som fastställs i direktiv 64/432/EEG gäller att donatorsuggor, om inte det rör sig om embryon som tillkommit genom befruktning in vivo och som har genomgått en trypsinbehandling, ska uppfylla kraven för Aujeszkys sjukdom i artikel 9 eller 10 i det direktivet.
|
|
3.
|
Bestämmelserna i direktiv 91/68/EEG ska tillämpas på donatortackor och donatorgetter (av honkön).
|
|
4.
|
Utöver de krav som fastställs i direktiv 90/426/EEG ska följande krav gälla för donatorston:
4.1 De får inte användas för betäckning under minst 30 dagar före den dag då äggen eller embryona uppsamlas samt mellan den dag då det första prov som avses i led 4.2 och 4.3 tas och den dag då äggen eller embryona uppsamlas.
4.2 De ska med negativt resultat genomgå ett agargel immunodiffusionstest (Coggins-test) eller ett Elisa-test för ekvin infektiös anemi på blodprov som först tagits under de 30 dagar som föregår den första ägg- eller embryouppsamlingen, och därefter var 90:e dag.
4.3 De ska genomgå ett prov för CEM (smittsam livmoderinflammation hos häst) genom isolering av Taylorella equigenitalis, utförd på prover som tagits från slemhinneytorna i fossa clitoridis och sinus clitoridis under två på varandra följande brunstperioder, samt under en av brunstperioderna ett kompletterande odlingsprov taget från livmoderhalsens slemhinna, med negativt resultat i varje enskilt fall efter odling i 7–14 dagar.
|
▼M8
BILAGA E
▼M13
Del 1 – Hälsointyg för handel med djur från anläggningar (hov- och klövdjur, fåglar som vaccinerats mot aviär influensa, hardjur, hundar, katter och illrar) 92/65 EI
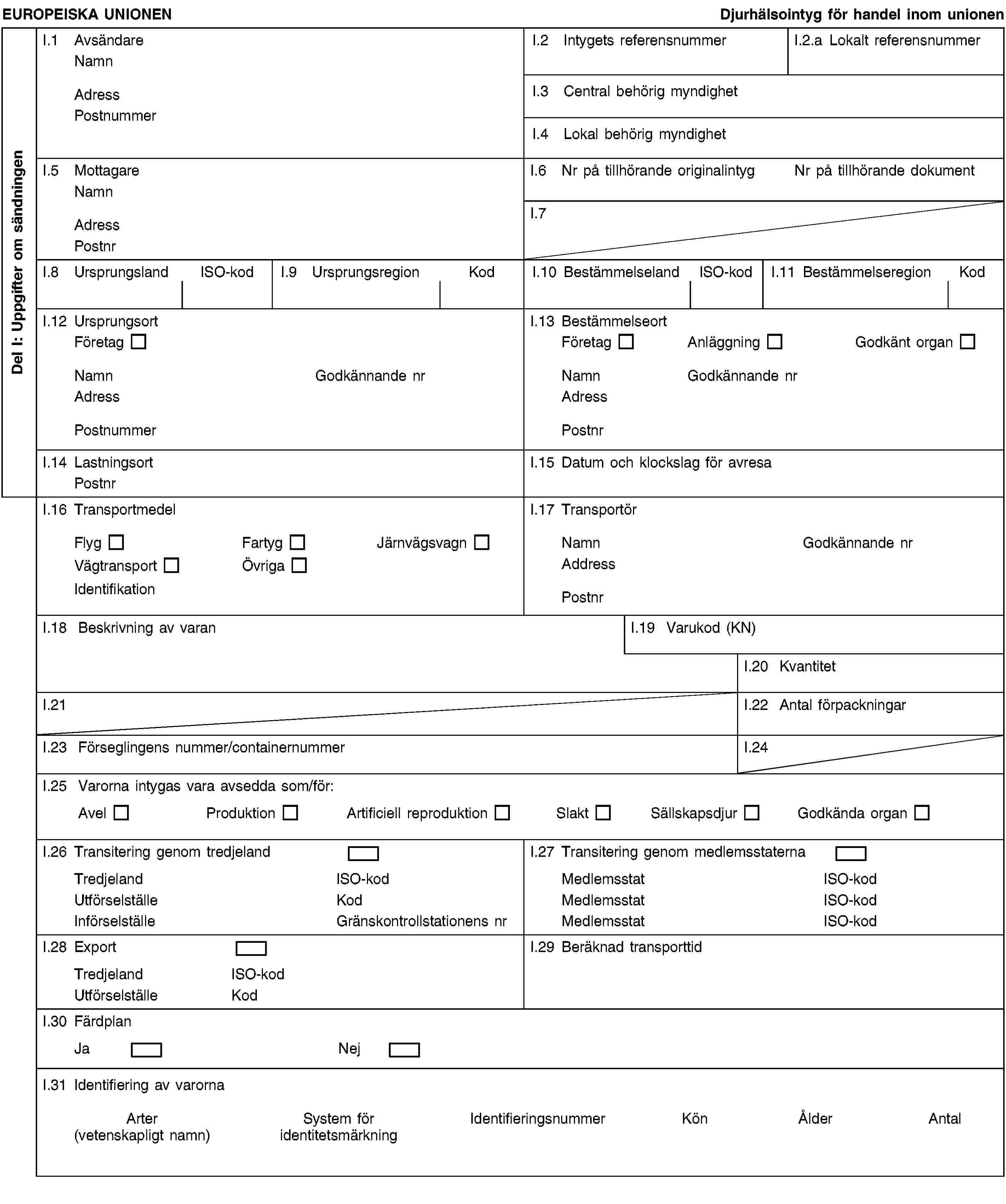
 eller [II.1 Vid besiktningen befann sig de hundar (1)/katter (1)/illrar (1) som ska transporteras utan kommersiellt syfte i enlighet med kommissionens förordning (EU) nr 338/2010 i ett hälsotillstånd som tillät transport.](1) antingen [II.2 Villkoren i artikel 4 i rådets direktiv 92/65/EEG uppfylls och idisslarna (1)/svindjuren (1) andra arter än de som omfattas av rådets direktiv 64/432/EEG (1) eller rådets direktiv 91/68/EEG (1):a) tillhör arten …,b) visade vid undersökningen inga kliniska tecken på någon sjukdom som de är mottagliga för,c) kommer från en officiellt tuberkulosfri (1)/officiellt brucellosfri (1) eller brucellosfri (1) besättning (1)/anläggning (1) som inte omfattas av restriktioner avseende svinpest eller från en anläggning där de med negativt resultat har genomgått testerna i artikel 6.2 b (1)/testet i artikel 6.3 d (1) i rådets direktiv 92/65/EEG.](1) (2) eller [II.2 Villkoren i artikel 4 i rådets direktiv 92/65/EEG uppfylls och fåglarna av andra arter än de som avses i rådets direktiv 2009/158/EGa) är förenliga med beslut 2007/598/EG och vaccinerades mot aviär influensa den … (datum) med vaccinet … (namn) och kommer från en anläggning där vaccinering mot aviär influensa genomfördes under de senaste 12 månaderna,b) uppfyller kraven i artikel 7 i rådets direktiv 92/65/EEG,c) visade vid undersökningen inga kliniska tecken på någon sjukdom som de är mottagliga för.](1) eller [II.2 Villkoren i artikel 4 i rådets direktiv 92/65/EEG uppfylls och hardjurena) uppfyller kraven i artikel 9 i rådets direktiv 92/65/EEG,b) visade vid undersökningen inga kliniska tecken på någon sjukdom som de är mottagliga för.](1) eller [II.2. Villkoren i artikel 4 i rådets direktiv 92/65/EEG uppfylls och hundarna genomgick inom 24 timmar före avsändningen en klinisk undersökning av en av den behöriga myndigheten godkänd veterinär, och djuren visade sig vid denna undersökning vara vid god hälsa, och uppfyller i enlighet med artikel 10.2 i rådets direktiv 92/65/EEG kraven i artikel 5 i Europaparlamentet och rådets förordning (EG) nr 998/2003,och (1) antingen [har inte behandlats mot Echinococcus multilocularis.](1) eller [har behandlats mot Echinococcus multilocularis i enlighet med kommissionens delegerade förordning (EU) nr 1152/2011.]](1) eller [II.2 Villkoren i artikel 4 i rådets direktiv 92/65/EEG uppfylls och katterna (1)/illrarna (1) genomgick inom 24 timmar före avsändningen en klinisk undersökning av en av den behöriga myndigheten godkänd veterinär, och djuren visade sig vid denna undersökning vara vid god hälsa, och uppfyller i enlighet med artikel 10.2 i rådets direktiv 92/65/EEG kraven i artikel 5 i Europaparlamentet och rådets förordning (EG) nr 998/2003.](1) eller [II.2 Sändningen av mer än fem hundar som ska transporteras utan kommersiellt syfte i enlighet med kommissionens förordning (EU) nr 338/2010 genomgick inom 24 timmar före avsändningen en klinisk undersökning av en av den behöriga myndigheten godkänd veterinär, och djuren visade sig vid denna undersökning vara vid god hälsa, och djuren uppfyller i enlighet med artikel 10.2 i rådets direktiv 92/65/EEG kraven i artikel 5 i Europaparlamentet och rådets förordning (EG) nr 998/2003,och (1) antingen [deras reguljära destination enligt fält I.10, eller fält I.11 om regionalisering tillämpas, kräver inte en behandling mot Echinococcus multilocularis i enlighet med kommissionens delegerade förordning (EU) nr 1152/2011.](1) eller [de har behandlats mot Echinococcus multilocularis i enlighet med artikel 7 i kommissionens delegerade förordning (EU) nr 1152/2011.]]](./../../../../resource.html?uri=celex:01992L0065-20120301.SWE.xhtml.L_2012050SV.01005401.tif.jpg)
![EUROPEISKA UNIONEN92/65 EI Djur från anläggningar (hov- och klövdjur, fåglar (2), hardjur, hundar, katter och illrar)II. HälsoinformationII.a. Intygets referensnummerII.b.(1) eller [II.2 Sändningen av mer än fem katter (1)/illrar (1) som ska transporteras utan kommersiellt syfte i enlighet med kommissionens förordning (EU) nr 388/2010 genomgick inom 24 timmar före avsändningen en klinisk undersökning av en av den behöriga myndigheten godkänd veterinär, och djuren visade sig vid denna undersökning vara vid god hälsa, och djuren uppfyller i enlighet med artikel 10.2 i rådets direktiv 92/65/EEG kraven i artikel 5 i Europaparlamentet och rådets förordning (EG) nr 998/2003.]II.3 Ytterligare garantier om sjukdomar som förtecknas i bilaga B (3) till rådets direktiv 92/65/EEG enligt följande (1):SjukdomBeslutSjukdomBeslutSjukdomBeslutII.4 Detta intyg gäller t.o.m. den … (4)AnmärkningarDel I:Fälten I.1–I.4, I.8, I.20, I.25 och I.31: Krävs för transporter av fler än fem hundar, katter och illrar utan kommersiellt syfte.Fält I.6: Nummer på tillhörande dokument: I tillämpliga fall Cites.Fält I.19: Ange lämplig HS-kod: 01.06.19, 01.06.31, 01.06.32, 01.06.39.Fält I.25: ’Sällskapsdjur’ anges endast när intyg utfärdas för transporter av mer än fem hundar, katter eller illrar helt utan kommersiellt syfte.Fält I.31: System för identitetsmärkning: När det är möjligt ska individuell identifiering göras, men när det gäller små djur är det tillåtet att enbart identifiera partiet.Del II:(1) Stryk det som inte är tillämpligt.(2) Intygskraven gäller endast för fåglar som har vaccinerats mot aviär influensa enligt en plan för förebyggande vaccinering som godkänts genom kommissionens beslut 2007/598/EG.(3) På begäran av en medlemsstat som åtnjuter ytterligare garantier enligt unionslagstiftningen.(4) Detta intyg gäller i tio dagar från utfärdandet, utom för hundar, katter och illrar som transporteras utan kommersiellt syfte i enlighet med kommissionens förordning (EU) nr 388/2010, för vilka det gäller i fyra månader eller fram till det datum då rabiesvaccineringen i avsnitt IV i passet slutar gälla, beroende på vilket som infaller först.Stämpeln och namnteckningen ska vara i en annan färg än övriga uppgifter i intyget.Officiell veterinär eller officiell inspektörNamn (med versaler):Titel och befattning:Lokal veterinärenhet:Lokal veterinärenhets nr:Datum:Namnteckning:Stämpel:](./../../../../resource.html?uri=celex:01992L0065-20120301.SWE.xhtml.L_2012050SV.01005501.tif.jpg)
▼M11
Del 2 – Hälsointyg för handel med bin och humlor
92/65 EII

![Del II: IntygLAND92/65 EII Bin (Apis mellifera) och humlor (Bombus spp.)II. HälsoinformationII.a. Intyg nrII.b.Härmed intygar jag följande:II.1antingen (2)[a) Bina/humlorna (2) kommer från ett område som inte omfattas av förbud på grund av förekomst av amerikansk yngelröta. (Förbudet har gällt i minst 30 dagar efter det senast registrerade fallet och den dag då alla kupor inom en radie av 3 km kontrollerades av den behöriga myndigheten och alla smittade kupor brändes upp eller behandlades och inspekterades till den behöriga myndighetens belåtenhet.)]eller (2)[a) Humlorna kommer från en installation som är isolerad från den omgivande miljön, som erkänts av den behöriga myndigheten i medlemsstaten och står under dennas tillsyn och som är fri från amerikansk yngelröta och inspekterades omedelbart före avsändningen, och varken humlor eller yngel visade tecken på eller misstanke om sjukdomen.]ochb) Bina/humlorna (2) kommer från ett område med en radie av minst 100 km som inte omfattas av restriktioner i samband med misstanke om eller bekräftad förekomst av den lilla kupskalbaggen (Aethina tumida) eller tropilaelapskvalster (Tropilaelaps spp.) och där det inte förekommer angrepp av dessa.ochc) Både bina/humlorna (2) och deras förpackning har genomgått visuell undersökning för påvisande av den lilla kupskalbaggen (Aethina tumida) eller dess ägg och larver eller andra skadegörare, särskilt tropilaelapskvalster (Tropilaelaps spp.), som angriper bin.II.2Ytterligare garantier om sjukdomar i bilaga B (1) till direktiv 92/65/EEG enligt följande (2):SjukdomBeslutSjukdomBeslutSjukdom BeslutAnmärkningarDel I:Fält I.31:Art: Ange Apis mellifera eller Bombus spp.Antal: Ange antal samhällen.Partinummer: Ange i tillämpliga fall förseglingsnummer.Del II:(1) På begäran av en medlemsstat som åtnjuter ytterligare garantier enligt unionslagstiftningen.(2) Stryk det som inte är tillämpligt.Stämpeln och namnteckningen ska vara i en annan färg än övriga uppgifter i intyget.Godkänd veterinär eller utfärdande tjänstemanNamn (med versaler):Titel och befattning:Datum:Underskrift:Stämpel:](./../../../../resource.html?uri=celex:01992L0065-20120301.SWE.xhtml.L_2010118SV.01006201.tif.jpg)
▼M13
Del 3 – Hälsointyg för handel med djur, sperma, ägg (ova) och embryon från godkända organ, institut eller centrum 92/65 EIII

![Del II: IntygEUROPEISKA UNIONEN92/65 EIII Djur från godkända organ, institut eller centrumII. HälsoinformationII.a Intyg nrII.bI egenskap av officiell veterinär (1)/veterinär med ansvar för ursprungsföretaget och godkänd av den behöriga myndigheten (1) intygar jag följande:II.1 Ursprungsorganet, -institutet eller -centrumet är godkänt för handel med de djur, den sperma, de ägg (ova) eller embryon som beskrivs i fält I.18. i enlighet med bilaga C till rådets direktiv 92/65/EEG.II.2 De djur (1)/donatordjur (1) som beskrivs i detta intyg har i dag undersökts (1)/undersöktes på insamlingsdagen (1) och konstaterades vara friska och fria från kliniska tecken på smittsam sjukdom inklusive de som förtecknas i bilaga A till direktiv 92/65/EEG, och de är inte föremål för några officiella restriktioner och har vistats på anläggningen hos detta organ, institut eller centrum sedan födelsen eller under följande tidsperiod … (månader eller år).II.3 Vid besiktningen befann sig ovannämnda djur i ett hälsotillstånd som tillät den planerade transporten i enlighet med bestämmelserna i rådets förordning (EG) nr 1/2005 och i tillämpliga fall IATA:s krav och/eller Cites riktlinjer för transporter.II.4 Ytterligare garantier om sjukdomar som förtecknas i bilaga B (2) till rådets direktiv 92/65/EEG enligt följande (1)SjukdomBeslutSjukdomBeslutSjukdomBeslut[II.5 Fåglarna är förenliga med beslut 2007/598/EG och vaccinerades mot aviär influensa den … (datum) med vaccinet … (namn) och kommer från ett godkänt ursprungsorgan, -institut eller -centrum där vaccinering mot aviär influensa genomfördes under de senaste 12 månaderna.] (1)AnmärkningarDel I:Fält I.6: Nummer på tillhörande dokument: I tillämpliga fall Cites.Fält I.19: Ange lämplig HS-kod: 01.06.11, 01.06.19, 01.06.31, 01.06.32, 01.06.39, 05.11.99.85.Fält I.31: System för identitetsmärkning: När det är möjligt ska individuell identifiering göras, men när det gäller små djur är det tillåtet att enbart identifiera partiet.För sperma, ägg (ova) och embryon ska den överensstämma med givarens identitet och insamlingsdatum och ska anges i följande format: Djurets officiella identifiering/dd/mm/åååå.Ålder och kön: Fylls bara i om det rör sig om levande djur.Antal: När det gäller sperma, ägg (ova) och embryon ska antalet strån, ampuller eller annan förpackning uttryckt som enheter anges.Del II:(1) Stryk det som inte är tillämpligt.(2) På begäran av en medlemsstat som åtnjuter ytterligare garantier enligt unionslagstiftningen.Stämpeln och namnteckningen ska vara i en annan färg än övriga uppgifter i intyget.Officiell veterinär eller officiell inspektörNamn (med versaler):Titel och befattning:Lokal veterinärenhet:Lokal veterinärenhets nr:Datum:Namnteckning:Stämpel:](./../../../../resource.html?uri=celex:01992L0065-20120301.SWE.xhtml.L_2012050SV.01005701.tif.jpg)
▼M7
BILAGA F
Rådets direktiv 64/432/EEG av den 26 juni 1964 om djurhälsoproblem som påverkar handeln med nötkreatur och svin inom gemenskapen.
Rådets direktiv 88/407/EEG av den 14 juni 1988 om djurhälsokrav som är tillämpliga vid handel inom gemenskapen med och import av djupfryst sperma från tamdjur av nötkreatur.
Rådets direktiv 89/556/EEG av den 25 september 1989 om djurhälsovillkor för handel inom gemenskapen med och import från tredjeland av embryon från tamdjur av nötkreatur.
Rådets direktiv 90/426/EEG av den 26 juni 1990 om djurhälsovillkor vid förflyttning och import av hästdjur från tredjeland.
Rådets direktiv 90/429/EEG av den 26 juni 1990 om djurhälsokrav som är tillämpliga vid handel inom gemenskapen med och import av sperma från tamdjur av svin.
Rådets direktiv 90/539/EEG av den 15 oktober 1990 om djurhälsovillkor för handel inom gemenskapen med och import från tredjeland av fjäderfä och kläckningsägg.
Rådets direktiv 91/67/EEG av den 28 januari 1991 om djurhälsovillkor för utsläppande på marknaden av djur och produkter från vattenbruk.
Rådets direktiv 91/68/EEG av den 28 januari 1991 om djurhälsovillkor för handeln med får och getter inom gemenskapen.
Rådets direktiv 2004/68/EG av den 26 april 2004 om fastställande av djurhälsoregler för import och transistering till gemenskapen av vissa levande hov- och klövdjur samt om ändring av direktiven 90/426/EEG och 92/65/EEG samt upphävande av direktiv 72/462/EEG.


 eller [II.1 Vid besiktningen befann sig de hundar (1)/katter (1)/illrar (1) som ska transporteras utan kommersiellt syfte i enlighet med kommissionens förordning (EU) nr 338/2010 i ett hälsotillstånd som tillät transport.](1) antingen [II.2 Villkoren i artikel 4 i rådets direktiv 92/65/EEG uppfylls och idisslarna (1)/svindjuren (1) andra arter än de som omfattas av rådets direktiv 64/432/EEG (1) eller rådets direktiv 91/68/EEG (1):a) tillhör arten …,b) visade vid undersökningen inga kliniska tecken på någon sjukdom som de är mottagliga för,c) kommer från en officiellt tuberkulosfri (1)/officiellt brucellosfri (1) eller brucellosfri (1) besättning (1)/anläggning (1) som inte omfattas av restriktioner avseende svinpest eller från en anläggning där de med negativt resultat har genomgått testerna i artikel 6.2 b (1)/testet i artikel 6.3 d (1) i rådets direktiv 92/65/EEG.](1) (2) eller [II.2 Villkoren i artikel 4 i rådets direktiv 92/65/EEG uppfylls och fåglarna av andra arter än de som avses i rådets direktiv 2009/158/EGa) är förenliga med beslut 2007/598/EG och vaccinerades mot aviär influensa den … (datum) med vaccinet … (namn) och kommer från en anläggning där vaccinering mot aviär influensa genomfördes under de senaste 12 månaderna,b) uppfyller kraven i artikel 7 i rådets direktiv 92/65/EEG,c) visade vid undersökningen inga kliniska tecken på någon sjukdom som de är mottagliga för.](1) eller [II.2 Villkoren i artikel 4 i rådets direktiv 92/65/EEG uppfylls och hardjurena) uppfyller kraven i artikel 9 i rådets direktiv 92/65/EEG,b) visade vid undersökningen inga kliniska tecken på någon sjukdom som de är mottagliga för.](1) eller [II.2. Villkoren i artikel 4 i rådets direktiv 92/65/EEG uppfylls och hundarna genomgick inom 24 timmar före avsändningen en klinisk undersökning av en av den behöriga myndigheten godkänd veterinär, och djuren visade sig vid denna undersökning vara vid god hälsa, och uppfyller i enlighet med artikel 10.2 i rådets direktiv 92/65/EEG kraven i artikel 5 i Europaparlamentet och rådets förordning (EG) nr 998/2003,och (1) antingen [har inte behandlats mot Echinococcus multilocularis.](1) eller [har behandlats mot Echinococcus multilocularis i enlighet med kommissionens delegerade förordning (EU) nr 1152/2011.]](1) eller [II.2 Villkoren i artikel 4 i rådets direktiv 92/65/EEG uppfylls och katterna (1)/illrarna (1) genomgick inom 24 timmar före avsändningen en klinisk undersökning av en av den behöriga myndigheten godkänd veterinär, och djuren visade sig vid denna undersökning vara vid god hälsa, och uppfyller i enlighet med artikel 10.2 i rådets direktiv 92/65/EEG kraven i artikel 5 i Europaparlamentet och rådets förordning (EG) nr 998/2003.](1) eller [II.2 Sändningen av mer än fem hundar som ska transporteras utan kommersiellt syfte i enlighet med kommissionens förordning (EU) nr 338/2010 genomgick inom 24 timmar före avsändningen en klinisk undersökning av en av den behöriga myndigheten godkänd veterinär, och djuren visade sig vid denna undersökning vara vid god hälsa, och djuren uppfyller i enlighet med artikel 10.2 i rådets direktiv 92/65/EEG kraven i artikel 5 i Europaparlamentet och rådets förordning (EG) nr 998/2003,och (1) antingen [deras reguljära destination enligt fält I.10, eller fält I.11 om regionalisering tillämpas, kräver inte en behandling mot Echinococcus multilocularis i enlighet med kommissionens delegerade förordning (EU) nr 1152/2011.](1) eller [de har behandlats mot Echinococcus multilocularis i enlighet med artikel 7 i kommissionens delegerade förordning (EU) nr 1152/2011.]]](./../../../../resource.html?uri=celex:01992L0065-20120301.SWE.xhtml.L_2012050SV.01005401.tif.jpg)
![EUROPEISKA UNIONEN92/65 EI Djur från anläggningar (hov- och klövdjur, fåglar (2), hardjur, hundar, katter och illrar)II. HälsoinformationII.a. Intygets referensnummerII.b.(1) eller [II.2 Sändningen av mer än fem katter (1)/illrar (1) som ska transporteras utan kommersiellt syfte i enlighet med kommissionens förordning (EU) nr 388/2010 genomgick inom 24 timmar före avsändningen en klinisk undersökning av en av den behöriga myndigheten godkänd veterinär, och djuren visade sig vid denna undersökning vara vid god hälsa, och djuren uppfyller i enlighet med artikel 10.2 i rådets direktiv 92/65/EEG kraven i artikel 5 i Europaparlamentet och rådets förordning (EG) nr 998/2003.]II.3 Ytterligare garantier om sjukdomar som förtecknas i bilaga B (3) till rådets direktiv 92/65/EEG enligt följande (1):SjukdomBeslutSjukdomBeslutSjukdomBeslutII.4 Detta intyg gäller t.o.m. den … (4)AnmärkningarDel I:Fälten I.1–I.4, I.8, I.20, I.25 och I.31: Krävs för transporter av fler än fem hundar, katter och illrar utan kommersiellt syfte.Fält I.6: Nummer på tillhörande dokument: I tillämpliga fall Cites.Fält I.19: Ange lämplig HS-kod: 01.06.19, 01.06.31, 01.06.32, 01.06.39.Fält I.25: ’Sällskapsdjur’ anges endast när intyg utfärdas för transporter av mer än fem hundar, katter eller illrar helt utan kommersiellt syfte.Fält I.31: System för identitetsmärkning: När det är möjligt ska individuell identifiering göras, men när det gäller små djur är det tillåtet att enbart identifiera partiet.Del II:(1) Stryk det som inte är tillämpligt.(2) Intygskraven gäller endast för fåglar som har vaccinerats mot aviär influensa enligt en plan för förebyggande vaccinering som godkänts genom kommissionens beslut 2007/598/EG.(3) På begäran av en medlemsstat som åtnjuter ytterligare garantier enligt unionslagstiftningen.(4) Detta intyg gäller i tio dagar från utfärdandet, utom för hundar, katter och illrar som transporteras utan kommersiellt syfte i enlighet med kommissionens förordning (EU) nr 388/2010, för vilka det gäller i fyra månader eller fram till det datum då rabiesvaccineringen i avsnitt IV i passet slutar gälla, beroende på vilket som infaller först.Stämpeln och namnteckningen ska vara i en annan färg än övriga uppgifter i intyget.Officiell veterinär eller officiell inspektörNamn (med versaler):Titel och befattning:Lokal veterinärenhet:Lokal veterinärenhets nr:Datum:Namnteckning:Stämpel:](./../../../../resource.html?uri=celex:01992L0065-20120301.SWE.xhtml.L_2012050SV.01005501.tif.jpg)

![Del II: IntygLAND92/65 EII Bin (Apis mellifera) och humlor (Bombus spp.)II. HälsoinformationII.a. Intyg nrII.b.Härmed intygar jag följande:II.1antingen (2)[a) Bina/humlorna (2) kommer från ett område som inte omfattas av förbud på grund av förekomst av amerikansk yngelröta. (Förbudet har gällt i minst 30 dagar efter det senast registrerade fallet och den dag då alla kupor inom en radie av 3 km kontrollerades av den behöriga myndigheten och alla smittade kupor brändes upp eller behandlades och inspekterades till den behöriga myndighetens belåtenhet.)]eller (2)[a) Humlorna kommer från en installation som är isolerad från den omgivande miljön, som erkänts av den behöriga myndigheten i medlemsstaten och står under dennas tillsyn och som är fri från amerikansk yngelröta och inspekterades omedelbart före avsändningen, och varken humlor eller yngel visade tecken på eller misstanke om sjukdomen.]ochb) Bina/humlorna (2) kommer från ett område med en radie av minst 100 km som inte omfattas av restriktioner i samband med misstanke om eller bekräftad förekomst av den lilla kupskalbaggen (Aethina tumida) eller tropilaelapskvalster (Tropilaelaps spp.) och där det inte förekommer angrepp av dessa.ochc) Både bina/humlorna (2) och deras förpackning har genomgått visuell undersökning för påvisande av den lilla kupskalbaggen (Aethina tumida) eller dess ägg och larver eller andra skadegörare, särskilt tropilaelapskvalster (Tropilaelaps spp.), som angriper bin.II.2Ytterligare garantier om sjukdomar i bilaga B (1) till direktiv 92/65/EEG enligt följande (2):SjukdomBeslutSjukdomBeslutSjukdom BeslutAnmärkningarDel I:Fält I.31:Art: Ange Apis mellifera eller Bombus spp.Antal: Ange antal samhällen.Partinummer: Ange i tillämpliga fall förseglingsnummer.Del II:(1) På begäran av en medlemsstat som åtnjuter ytterligare garantier enligt unionslagstiftningen.(2) Stryk det som inte är tillämpligt.Stämpeln och namnteckningen ska vara i en annan färg än övriga uppgifter i intyget.Godkänd veterinär eller utfärdande tjänstemanNamn (med versaler):Titel och befattning:Datum:Underskrift:Stämpel:](./../../../../resource.html?uri=celex:01992L0065-20120301.SWE.xhtml.L_2010118SV.01006201.tif.jpg)

![Del II: IntygEUROPEISKA UNIONEN92/65 EIII Djur från godkända organ, institut eller centrumII. HälsoinformationII.a Intyg nrII.bI egenskap av officiell veterinär (1)/veterinär med ansvar för ursprungsföretaget och godkänd av den behöriga myndigheten (1) intygar jag följande:II.1 Ursprungsorganet, -institutet eller -centrumet är godkänt för handel med de djur, den sperma, de ägg (ova) eller embryon som beskrivs i fält I.18. i enlighet med bilaga C till rådets direktiv 92/65/EEG.II.2 De djur (1)/donatordjur (1) som beskrivs i detta intyg har i dag undersökts (1)/undersöktes på insamlingsdagen (1) och konstaterades vara friska och fria från kliniska tecken på smittsam sjukdom inklusive de som förtecknas i bilaga A till direktiv 92/65/EEG, och de är inte föremål för några officiella restriktioner och har vistats på anläggningen hos detta organ, institut eller centrum sedan födelsen eller under följande tidsperiod … (månader eller år).II.3 Vid besiktningen befann sig ovannämnda djur i ett hälsotillstånd som tillät den planerade transporten i enlighet med bestämmelserna i rådets förordning (EG) nr 1/2005 och i tillämpliga fall IATA:s krav och/eller Cites riktlinjer för transporter.II.4 Ytterligare garantier om sjukdomar som förtecknas i bilaga B (2) till rådets direktiv 92/65/EEG enligt följande (1)SjukdomBeslutSjukdomBeslutSjukdomBeslut[II.5 Fåglarna är förenliga med beslut 2007/598/EG och vaccinerades mot aviär influensa den … (datum) med vaccinet … (namn) och kommer från ett godkänt ursprungsorgan, -institut eller -centrum där vaccinering mot aviär influensa genomfördes under de senaste 12 månaderna.] (1)AnmärkningarDel I:Fält I.6: Nummer på tillhörande dokument: I tillämpliga fall Cites.Fält I.19: Ange lämplig HS-kod: 01.06.11, 01.06.19, 01.06.31, 01.06.32, 01.06.39, 05.11.99.85.Fält I.31: System för identitetsmärkning: När det är möjligt ska individuell identifiering göras, men när det gäller små djur är det tillåtet att enbart identifiera partiet.För sperma, ägg (ova) och embryon ska den överensstämma med givarens identitet och insamlingsdatum och ska anges i följande format: Djurets officiella identifiering/dd/mm/åååå.Ålder och kön: Fylls bara i om det rör sig om levande djur.Antal: När det gäller sperma, ägg (ova) och embryon ska antalet strån, ampuller eller annan förpackning uttryckt som enheter anges.Del II:(1) Stryk det som inte är tillämpligt.(2) På begäran av en medlemsstat som åtnjuter ytterligare garantier enligt unionslagstiftningen.Stämpeln och namnteckningen ska vara i en annan färg än övriga uppgifter i intyget.Officiell veterinär eller officiell inspektörNamn (med versaler):Titel och befattning:Lokal veterinärenhet:Lokal veterinärenhets nr:Datum:Namnteckning:Stämpel:](./../../../../resource.html?uri=celex:01992L0065-20120301.SWE.xhtml.L_2012050SV.01005701.tif.jpg)