EUR-Lex Access to European Union law

This document is an excerpt from the EUR-Lex website
Document 32020D0569
Commission Implementing Decision (EU) 2020/569 of 16 April 2020 establishing a common format and information content for the submission of the information to be reported by Member States pursuant to Directive 2010/63/EU of the European Parliament and of the Council on the protection of animals used for scientific purposes and repealing Commission Implementing Decision 2012/707/EU (notified under document C(2020) 2179) (Text with EEA relevance)
Kommissionens genomförandebeslut (EU) 2020/569 av den 16 april 2020 om fastställande av ett gemensamt format och informationsinnehåll för överlämnande av den information som ska rapporteras av medlemsstaterna i enlighet med Europaparlamentets och rådets direktiv 2010/63/EU om skydd av djur som används för vetenskapliga ändamål och om upphävande av kommissionens genomförandebeslut 2012/707/EU [delgivet med nr C(2020) 2179] (Text av betydelse för EES)
Kommissionens genomförandebeslut (EU) 2020/569 av den 16 april 2020 om fastställande av ett gemensamt format och informationsinnehåll för överlämnande av den information som ska rapporteras av medlemsstaterna i enlighet med Europaparlamentets och rådets direktiv 2010/63/EU om skydd av djur som används för vetenskapliga ändamål och om upphävande av kommissionens genomförandebeslut 2012/707/EU [delgivet med nr C(2020) 2179] (Text av betydelse för EES)
C/2020/2179
OJ L 129, 24.4.2020, p. 16–50
(BG, ES, CS, DA, DE, ET, EL, EN, FR, HR, IT, LV, LT, HU, MT, NL, PL, PT, RO, SK, SL, FI, SV)
 In force
In force
|
24.4.2020 |
SV |
Europeiska unionens officiella tidning |
L 129/16 |
KOMMISSIONENS GENOMFÖRANDEBESLUT (EU) 2020/569
av den 16 april 2020
om fastställande av ett gemensamt format och informationsinnehåll för överlämnande av den information som ska rapporteras av medlemsstaterna i enlighet med Europaparlamentets och rådets direktiv 2010/63/EU om skydd av djur som används för vetenskapliga ändamål och om upphävande av kommissionens genomförandebeslut 2012/707/EU
[delgivet med nr C(2020) 2179]
(Text av betydelse för EES)
EUROPEISKA KOMMISSIONEN HAR ANTAGIT DETTA BESLUT
med beaktande av fördraget om Europeiska unionens funktionssätt,
med beaktande av Europaparlamentets och rådets direktiv 2010/63/EU av den 22 september 2010 om skydd av djur som används för vetenskapliga ändamål (1), särskilt artiklarna 43.4 och 54.4, och
av följande skäl:
|
(1) |
Till följd av de ändringar som föreskrivs i Europaparlamentets och rådets förordning (EU) 2019/1010 (2) ska medlemsstaterna enligt direktiv 2010/63/EU nu lämna in icke-tekniska projektsammanfattningar av godkända projekt och eventuella uppdateringar av dessa, genom elektronisk överföring till kommissionen. För att kommissionen ska kunna upprätta och upprätthålla en central databas för dessa sammanfattningar och uppdateringar och för att säkerställa att meningsfulla sökningar kan utföras bland dessa uppgifter, behöver dessa sammanfattningar och uppdateringar presenteras på ett enhetligt sätt. Det bör därför fastställas mallar för de icke-tekniska projektsammanfattningarna och eventuella uppdateringar av dessa, och medlemsstaterna bör åläggas att ladda upp dessa sammanfattningar och uppdateringar till den databas som upprättats av kommissionen. |
|
(2) |
I direktiv 2010/63/EU föreskrivs också att medlemsstaterna ska lämna information om genomförandet av det direktivet, liksom även statistisk information om användningen av djur i försök, genom elektronisk överföring till kommissionen. |
|
(3) |
På grundval av de uppgifter som medlemsstaterna lämnat om genomförandet av direktiv 2010/63/EU ska kommissionens avdelningar offentliggöra och regelbundet uppdatera en unionsomfattande översikt. I direktiv 2010/63/EU föreskrivs också att kommissionens avdelningar varje år ska göra den statistiska information som medlemsstaterna lämnat in och en sammanfattande rapport av informationen tillgänglig för allmänheten. För att kommissionen ska kunna uppfylla båda dessa krav bör innehållet i denna information fastställas genom informationskategorier. |
|
(4) |
När det gäller information om genomförandet bör de informationskategorier som ska rapporteras korrelera med de relevanta kraven i direktiv 2010/63/EU. I fråga om statistisk information måste det anges vilka statistiska uppgiftskategorier som finns tillgängliga i den sökbara databasen med öppen åtkomst, som inrättats av kommissionen i enlighet med direktiv 2010/63/EU. |
|
(5) |
För att förbättra insynen och minska den administrativa bördan bör medlemsstaterna åläggas att använda den databas som inrättats av kommissionen för att lämna information om genomförandet av direktiv 2010/63/EU samt statistisk information om användning av djur i försök. |
|
(6) |
Innehållet i och formatet för den detaljerade information som medlemsstaterna ska lämna om sådana metoder som anses vara minst lika humana som de som anges i bilaga IV till direktiv 2010/63/EU bör specificeras så att den förteckning över metoder för avlivning av djur som finns i den berörda bilagan kan hållas aktuell. Det är därför lämpligt att fastställa en mall som gör det möjligt att lämna information om typen av metod, arten i fråga och motiveringen för att bevilja undantag, och att ålägga medlemsstaterna att använda denna mall. |
|
(7) |
De befogenheter som ligger till grund för detta beslut är nära sammankopplade, eftersom de båda är relaterade till medlemsstaternas rapportering av information enligt direktiv 2010/63/EU. Med tanke på detta konkreta samband och för att säkerställa ett konsekvent och enhetligt tillvägagångssätt är det lämpligt att anta ett enda beslut där samtliga krav som gäller dessa befogenheter fastställs. Det är därför nödvändigt att ersätta kommissionens genomförandebeslut 2012/707/EU (3), i vilket det gemensamma formatet för att överlämna den information som avses i artikel 54 i direktiv 2010/63/EU fastställs, med ett nytt genomförandebeslut grundat på både artikel 43.4 och artikel 54.4 i direktiv 2010/63/EU. Genomförandebeslut 2012/707/EU bör därför upphöra att gälla. |
|
(8) |
De åtgärder som föreskrivs i detta beslut är förenliga med yttrandet från kommittén för djur inom vetenskapen, Animals in Science Committee. |
HÄRIGENOM FÖRESKRIVS FÖLJANDE.
Artikel 1
Vid tillämpning av artikel 43.3 andra meningen i direktiv 2010/63/EU ska medlemsstaterna lämna in de uppgifter som anges i bilaga I till detta beslut, med hjälp av den databas som upprättats av kommissionen i enlighet med artikel 43.4 tredje meningen i det direktivet. De icke-tekniska projektsammanfattningarna och uppdateringarna av dessa ska överensstämma med de mallar som anges i bilaga I till detta beslut.
Artikel 2
Vid tillämpning av artikel 54.1 i direktiv 2010/63/EU ska medlemsstaterna lämna in de uppgifter som anges i bilaga II till detta beslut med hjälp av den databas som upprättats av kommissionen i enlighet med 54.2 tredje stycket första meningen i det direktivet.
Artikel 3
Vid tillämpning av artikel 54.2 i direktiv 2010/63/EU ska medlemsstaterna lämna in de uppgifter som anges i bilaga III till detta beslut med hjälp av den databas som upprättats av kommissionen i enlighet med artikel 54.2 tredje stycket första meningen i det direktivet.
Artikel 4
Vid tillämpning av artikel 54.3 i direktiv 2010/63/EU ska medlemsstaterna lämna de uppgifter som anges i bilaga IV till detta beslut med hjälp av den mall som fastställs i den bilagan.
Artikel 5
Genomförandebeslut 2012/707/EU ska upphöra att gälla från och med den 17 april 2020. Hänvisningar till det upphävda beslutet ska anses som hänvisningar till det här beslutet och läsas i enlighet med jämförelsetabellen i bilaga V.
Artikel 6
Detta beslut riktar sig till medlemsstaterna.
Utfärdat i Bryssel den 16 april 2020.
På kommissionens vägnar
Virginijus SINKEVIČIUS
Ledamot av kommissionen
(1) EUT L 276, 20.10.2010, s. 33.
(2) Europaparlamentets och rådets förordning (EU) 2019/1010 av den 5 juni 2019 om samordning av rapporteringsskyldigheter inom miljöanknuten lagstiftning och om ändring av Europaparlamentets och rådets förordningar (EG) nr 166/2006 och (EU) nr 995/2010, Europaparlamentets och rådets direktiv 2002/49/EG, 2004/35/EG, 2007/2/EG, 2009/147/EG och 2010/63/EU, rådets förordningar (EG) nr 338/97 och (EG) nr 2173/2005 samt rådets direktiv 86/278/EEG (EUT L 170, 25.6.2019, s. 115).
(3) Kommissionens genomförandebeslut 2012/707/EU av den 14 november 2012 om fastställande av ett gemensamt format för överlämnande av information i enlighet med Europaparlamentets och rådets direktiv 2010/63/EU om skydd av djur som används för vetenskapliga ändamål (EUT L 320, 17.11.2012, s. 33).
BILAGA I
DEL A
Mall för icke-tekniska projektsammanfattningar som avses i artikel 43.1 i direktiv 2010/63/EU
|
Projektets namn |
|
||||||||||||||||||||||||||||||||
|
Varaktighet (antal månader) |
|
||||||||||||||||||||||||||||||||
|
Nyckelord (högst 5) (1) |
|
||||||||||||||||||||||||||||||||
|
Projektets syfte (2) (det är möjligt välja flera alternativ) |
|
||||||||||||||||||||||||||||||||
|
Projektets mål och förväntade nytta |
|||||||||||||||||||||||||||||||||
|
Beskriv projektets mål (de vetenskapliga frågorna, eller de vetenskapliga/kliniska behov som ska mötas). |
|
||||||||||||||||||||||||||||||||
|
Vilken nytta kan projektet medföra? Vilka vetenskapliga framsteg kommer att nås, hur kan människor, djur eller miljö i förlängningen dra nytta av projektet. I tillämpliga fall, gör åtskillnad mellan kortsiktig nytta (inom projektets löptid) och långsiktig nytta (som kan uppkomma efter att projektet avslutats). |
|
||||||||||||||||||||||||||||||||
|
Skador som kan förutses |
|||||||||||||||||||||||||||||||||
|
Vilka försöksåtgärder kommer djuren vanligtvis att utsättas för (t.ex. injektioner, kirurgiska ingrepp)? Ange försöksåtgärdernas antal och varaktighet. |
|
||||||||||||||||||||||||||||||||
|
Vilka typer av påverkan/negativa effekter på djuren kan förutses, till exempel smärta, viktminskning, inaktivitet/nedsatt rörlighet, stress, onormalt beteende, och hur lång är varaktigheten av dessa effekter? |
|
||||||||||||||||||||||||||||||||
|
Vilka arter och hur många djur förväntas användas? Vilka är de förväntade svårhetsgraderna och hur många djur omfattas av varje svårhetsgrad (specificera antal per art)? |
Arter (4) |
Uppskattat totalt antal |
Uppskattat antal per svårhetsgrad |
||||||||||||||||||||||||||||||
|
Terminal |
Ringa svårhet |
Måttlig svårhet |
Avsevärd svårhet |
||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
Vad kommer att hända med djuren som hålls vid liv i slutet av försöket? (5) (6) |
Uppskattat antal som ska återanvändas |
Uppskattat antal som ska återföras till livsmiljö/ djurhållningssystem |
Uppskattat antal som ska utplaceras |
||||||||||||||||||||||||||||||
|
Ange skälen för djurens planerade öde efter försöket. |
|
||||||||||||||||||||||||||||||||
|
Tillämpning av 3R-principen |
|||||||||||||||||||||||||||||||||
|
1. Ersättning Ange vilka djurfria alternativ som finns tillgängliga på detta område och varför de inte kan användas för projektets ändamål. |
|
||||||||||||||||||||||||||||||||
|
2. Begränsning Förklara hur antalet djur för detta projekt fastställdes. Beskriv vilka åtgärder som har vidtagits för att minska antalet djur som ska användas, och vilka principer som tillämpas för att utforma studier. I förekommande fall, beskriv vilka metoder som kommer att användas i hela projektet för att minimera antalet djur som används, i enlighet med vetenskapliga mål. Dessa metoder kan omfatta exempelvis pilotstudier, datormodellering, gemensamt utnyttjande av vävnader och återanvändning. |
|
||||||||||||||||||||||||||||||||
|
3. Förfining Ge exempel på specifika åtgärder (t.ex. ökad övervakning, postoperativ vård, smärtlindring, träning av djur) som kommer att vidtas i samband med försöken för att minimera hälsokostnader (skador) hos djuren. Beskriv mekanismerna för att ta fram nya förfiningstekniker under projektets livstid. |
|
||||||||||||||||||||||||||||||||
|
Förklara valet av art och de relaterade utvecklingsstadierna. |
|
||||||||||||||||||||||||||||||||
|
Projekt valt för utvärdering i efterhand (7) |
Tidsfrist |
Inbegriper försök i kategorin avsevärd svårhet |
Icke-mänskliga primater används |
Annan orsak |
|||||||||||||||||||||||||||||
DEL B
Mall för inlämning av en uppdatering av den icke-tekniska projektsammanfattning som avses i artikel 43.2 i direktiv 2010/63/EU
|
Titel (i enlighet med den icke-tekniska projektsammanfattningen) |
|
||||
|
Anledning till utvärdering i efterhand (8) |
Användning av icke-mänskliga primater |
Inbegriper försök i kategorin ”avsevärd svårhet” |
Annan orsak |
||
|
Förklara valet av alternativet ”annan orsak” |
|
||||
|
Måluppfyllelse |
|||||
|
Förklara kortfattat om och i vilken utsträckning de mål som anges i det godkända projektet har uppnåtts. Ange skälen, om målen inte har uppnåtts. Har det kommit fram några andra viktiga resultat? Vilken nytta har det hittills utförda arbetet resulterat i, och kan ytterligare nytta väntas? Har resultaten av detta projekt spridits, även i de fall där hypoteserna inte har bevisats? Beskriv i så fall hur. Om inte, ange hur och när resultaten förväntas offentliggöras. |
|
||||
|
Skada |
|||||
|
Art (9) |
Totalt antal djur som använts |
Antal djur per faktisk svårhetsgrad |
|||
|
Terminal |
Ringa svårhet |
Måttlig svårhet |
Avsevärd svårhet |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Hur överensstämmer antalet djur som använts och de faktiska svårhetsgraderna med de uppskattade? Lämna en förklaring i förekommande fall om de faktiska siffrorna är högre än de uppskattade siffrorna. Lämna en förklaring i förekommande fall om de faktiska siffrorna är lägre, såvida inte denna skillnad beror på en begränsning eller förfining. |
|
||||
|
Vad händer med djuren som hålls vid liv i slutet av studien, och stämmer detta överens med deras planerade öde? Lämna en förklaring. |
|
||||
|
Alla faktorer som kan bidra till det fortsatta genomförandet av 3R-principen enligt nedanstående: |
|||||
|
1. Ersättning |
|||||
|
Ange baserat på den kunskap som erhållits från detta projekt om nya metoder har identifierats/utvecklats (inklusive utveckling/validering av nya in vitro- eller in silico-tekniker) genom vilka användningen av djur i liknande projekt delvis eller helt kan ersättas? |
|
||||
|
2. Begränsning |
|||||
|
Ange baserat på den kunskap som erhållits från detta projekt om experimentdesignen kan förbättras för att möjliggöra ytterligare begränsning av användningen av djur, och i så fall hur? Lämna en förklaring om antalet djur som användes var lägre än vad som ursprungligen uppskattades. |
|
||||
|
3. Förfining |
|||||
|
Lämna en förklaring om de faktiska svårhetsgraderna var lägre än vad som ursprungligen uppskattades. Ange baserat på den kunskap som erhållits från detta projekt om de använda djurmodellerna fortfarande är lämpligast. Lämna en förklaring per art/modell, i förekommande fall. Räkna upp eventuella nya förfiningar som införts under projektet för att minska skadorna på djuren eller för att förbättra deras välbefinnande. Vilka är de potentiella möjligheterna till ytterligare förfining i framtiden, till exempel genom ny teknik, andra arbetsmetoder, förbättrade metoder för bedömning av välbefinnande, tidigare slutpunkter, åtgärder för inhysning/djurhållning? |
|
||||
|
4. Övrigt |
|||||
|
Hur sprids resultaten för det fortsatta genomförandet av 3R-principen? |
|
||||
|
Kompletterande upplysningar |
|
||||
(1) Inklusive vetenskapliga termer som kan bestå av mer än fem enskilda ord och exklusive arter och syften som anges på annan plats i dokumentet.
(2) Välj syfte i rullgardinsmenyn.
(3) Förteckning över syften i enlighet med statistiska rapporteringskategorier och underkategorier i bilaga III till detta beslut.
(4) Arter i enlighet med de statistiska rapporteringskategorierna i bilaga III till detta beslut, med ”icke specificerat däggdjur” som ytterligare alternativ för att skydda anonymiteten i undantagsfall.
(5) Arter ska fyllas i utifrån föregående svar och väljas från den relevanta kategorin (proportioner).
(6) Det är möjligt att välja flera alternativ för varje art.
(7) Det är möjligt att välja flera alternativ. Tillämpligt för de medlemsstater där denna information krävs enligt lagstiftningen.
(8) Det är möjligt att välja flera alternativ.
(9) Arter i enlighet med de statistiska rapporteringskategorierna i bilaga III till detta beslut, med ”icke specificerat däggdjur” som ytterligare alternativ för att skydda anonymiteten i undantagsfall.
BILAGA II
INFORMATION SOM AVSES I ARTIKEL 54.1 I DIREKTIV 2010/63/EU
A. NATIONELLA ÅTGÄRDER FÖR GENOMFÖRANDET AV DIREKTIV 2010/63/EU
Lämna information om ändringar av nationella åtgärder som avser genomförandet av direktiv 2010/63/EU sedan föregående rapport.
B. STRUKTURER OCH RAMAR
1. Behöriga myndigheter (artikel 59 i direktiv 2010/63/EU)
Beskriv ramarna för de behöriga myndigheterna, inklusive antal och typer av myndigheter samt deras respektive uppgifter, och förklara vilka åtgärder som vidtagits för att säkerställa efterlevnaden av kraven i artikel 59.1 i direktiv 2010/63/EU.
2. Nationell kommitté (artikel 49 i direktiv 2010/63/EU)
Beskriv den nationella kommitténs struktur och arbete samt de åtgärder som vidtagits för att säkerställa att kraven i artikel 49 i direktiv 2010/63/EU uppfylls.
3. Utbildning av personal (artikel 23 i direktiv 2010/63/EU)
Lämna uppgifter om de minimikrav som avses i artikel 23.3 i direktiv 2010/63/EU; beskriv eventuella ytterligare utbildningskrav för personal som kommer från andra medlemsstater.
4. Projektbedömning och projektgodkännande (artiklarna 38 och 40 i direktiv 2010/63/EU)
Förklara förfarandena för projektbedömning och projektgodkännande och vilka åtgärder som vidtagits för att säkerställa efterlevnaden av kraven i artiklarna 38 och 40 i direktiv 2010/63/EU.
C. VERKSAMHET
1. Projekt
1.1 Beviljande av projektgodkännande (artiklarna 40 och 41 i direktiv 2010/63/EU)
|
1.1.1 |
För varje år, ange antal för följande:
|
|
1.1.2 |
Vid tillämpning av led c, ge sammanfattande information som omfattar den femåriga rapporteringscykeln och som beskriver skälen till att tidsfristen på 40 dagar har förlängts. |
1.2 Utvärdering i efterhand, icke-tekniska projektsammanfattningar (artiklarna 38.2 f, 39 och 43 i direktiv 2010/63/EU)
|
1.2.1 |
Förklara vilka åtgärder som vidtagits för att säkerställa efterlevnaden av kraven i artikel 43.1 i direktiv 2010/63/EU och ange om det finns ett krav på att icke-tekniska projektsammanfattningar ska specificera att ett projekt ska genomgå en utvärdering i efterhand (artikel 43.2 i direktiv 2010/63/EU). |
|
1.2.2 |
Ange för varje år hur många godkända projekt som ska genomgå en utvärdering i efterhand i enlighet med artikel 39.2 i direktiv 2010/63/EU och hur många godkända projekt som ska genomgå en utvärdering i efterhand enligt artikel 38.2 f i detta direktiv. Kategorisera vart och ett av projekten enligt följande typer:
|
|
1.2.3 |
Ge sammanfattande information som omfattar den femåriga rapporteringscykeln och som beskriver vilka slags projekt som valts ut för utvärdering i efterhand i enlighet med artikel 38.2 f i direktiv 2010/63/EU men som inte automatiskt omfattas av en utvärdering i efterhand i enlighet med artikel 39.2. |
2. Djur som föds upp för att användas i försök (artiklarna 10, 28 och 30 i direktiv 2010/63/EU)
|
2.1 |
Ange art och antal djur som fötts upp och fötts fram (även med kejsarsnitt) för att användas i försök men som inte har använts i något försök och avlivats under det kalenderår som närmast föregår det år då femårsrapporten lämnas in. |
|
2.1.1 |
Inkludera djur som avlivats för att få organ eller vävnader samt djur som har sitt ursprung i att det framställs och upprätthålls genetiskt förändrade djurstammar, vilka inte omfattas av den årliga statistiken enligt artikel 54.2 i direktiv 2010/63/EU. |
|
2.1.2 |
Kategorisera djuren som en av följande typer:
|
|
2.1.3 |
Den kategori som avses i led a utesluter sådana djur som är resultatet av att en ny genetiskt förändrad stam framställs och att en genetiskt förändrad stam upprätthålls, och som i stället ska rapporteras i de kategorier som avses i led d respektive e. |
|
2.1.4 |
De kategorier som avses i leden b och c omfattar sådana djur som är resultatet av att en ny genetiskt förändrad stam framställs och att en genetiskt förändrad stam upprätthålls, när de tillhandahåller organ och/eller vävnader. |
|
2.1.5 |
De kategorier som avses i punkterna 2.1.2 d och e utesluter följande djur, som ska rapporteras i den årliga statistiken enligt artikel 54.2 i direktiv 2010/63/EU:
|
|
2.2 |
Förklara vilka åtgärder som vidtagits för att säkerställa efterlevnaden av kraven i artiklarna 10 och 28 i direktiv 2010/63/EU när icke-mänskliga primater används. |
3. Undantag
|
3.1 |
Ge sammanfattande information, som omfattar den femåriga rapporteringscykeln, och som beskriver de omständigheter under vilka undantag medgavs i enlighet med artikel 10.3, artikel 12.1 andra stycket och artikel 33.3 i direktiv 2010/63/EU. |
|
3.2 |
Ge information för samma period om sådana exceptionella förhållanden som avses i artikel 16.2 i det berörda direktivet, om återanvändning av ett djur godkändes efter ett försök där djuret enligt bedömning har utsatts för svårt lidande. |
4. Djurskyddsorgan (artiklarna 26 och 27 i direktiv 2010/63/EU)
Förklara de åtgärder som vidtagits för att säkerställa efterlevnaden av kraven avseende djurskyddsorganens struktur och funktion i artiklarna 26 och 27 i direktiv 2010/63/EU.
D. PRINCIPER FÖR ERSÄTTNING, BEGRÄNSNING OCH FÖRFINING
1. Princip för ersättning, begränsning och förfining (artiklarna 4 och 13 i och bilaga VI till direktiv 2010/63/EU)
|
1.1 |
Lämna information om de åtgärder som vidtagits för att säkerställa att principerna för a) ersättning, b) begränsning och c) förfining behandlas på ett tillfredsställande sätt inom godkända projekt i enlighet med artiklarna 4 och 13 i direktiv 2010/63/EU. |
|
1.2 |
Lämna information om de åtgärder som vidtagits för att säkerställa att principerna för a) begränsning och b) förfining behandlas på ett tillfredsställande sätt vid inhysning och skötsel i uppfödnings- och leveransanläggningar i enlighet med artikel 4 i direktiv 2010/63/EU. |
2. Undvikande av dubblering (artikel 46 i direktiv 2010/63/EU)
Förklara hur dubblering av försök undviks för att följa artikel 46 i direktiv 2010/63/EU.
3. Vävnadsprovtagning från genetiskt förändrade djur (artiklarna 4, 30 och 38 i direktiv 2010/63/EU)
|
3.1 |
Med avseende på vävnadsprovtagning för genetisk karakterisering som utförs med och utan projektgodkännande, lämna representativ information och sifferuppgifter om arter, metoder och deras därtill hörande faktiska svårhetsgrad. Denna information ska endast lämnas för det kalenderår som närmast föregår det år då femårsrapporten lämnas in. |
|
3.2 |
Ange de kriterier som används för att säkerställa att informationen i punkt 3.1 är representativ. |
|
3.3 |
Ge information om de ansträngningar som gjorts för att förfina metoderna för vävnadsprovtagning. |
E. GENOMFÖRANDE
1. Godkännande av uppfödare, leverantörer och användare (artiklarna 20 och 21 i direktiv 2010/63/EU)
|
1.1 |
För varje år, ange hur många aktiva godkända uppfödare, leverantörer och användare det finns i varje grupp separat. |
|
1.2 |
Ge sammanfattande information, som omfattar den femåriga rapporteringscykeln, om skäl för tillfälligt återkallande eller indragning av godkännanden av uppfödare, leverantörer och användare. |
2. Inspektioner (artikel 34 i direktiv 2010/63/EU)
|
2.1 |
För varje år, ange antalet inspektioner, uppdelade efter aviserade och oanmälda. |
|
2.2 |
Ge sammanfattande information, som omfattar den femåriga rapporteringscykeln, om de viktigaste resultaten av inspektionerna. |
|
2.3 |
Förklara vilka åtgärder som vidtagits för att säkerställa att kraven i artikel 34.2 i direktiv 2010/63/EU uppfylls. |
3. Indragningar av projektgodkännande (artikel 44 i direktiv 2010/63/EU)
Ge sammanfattande information, som omfattar den femåriga rapporteringscykeln, om orsakerna till att projektgodkännanden dragits in.
4. Sanktioner (artikel 60 i direktiv 2010/63/EU)
|
4.1 |
Ge sammanfattande information, som omfattar den femåriga rapporteringscykeln, om följande:
|
BILAGA III
DEL A
Flödesschema med statistiska uppgiftskategorier enligt artikel 54.2 i direktiv 2010/63/EU

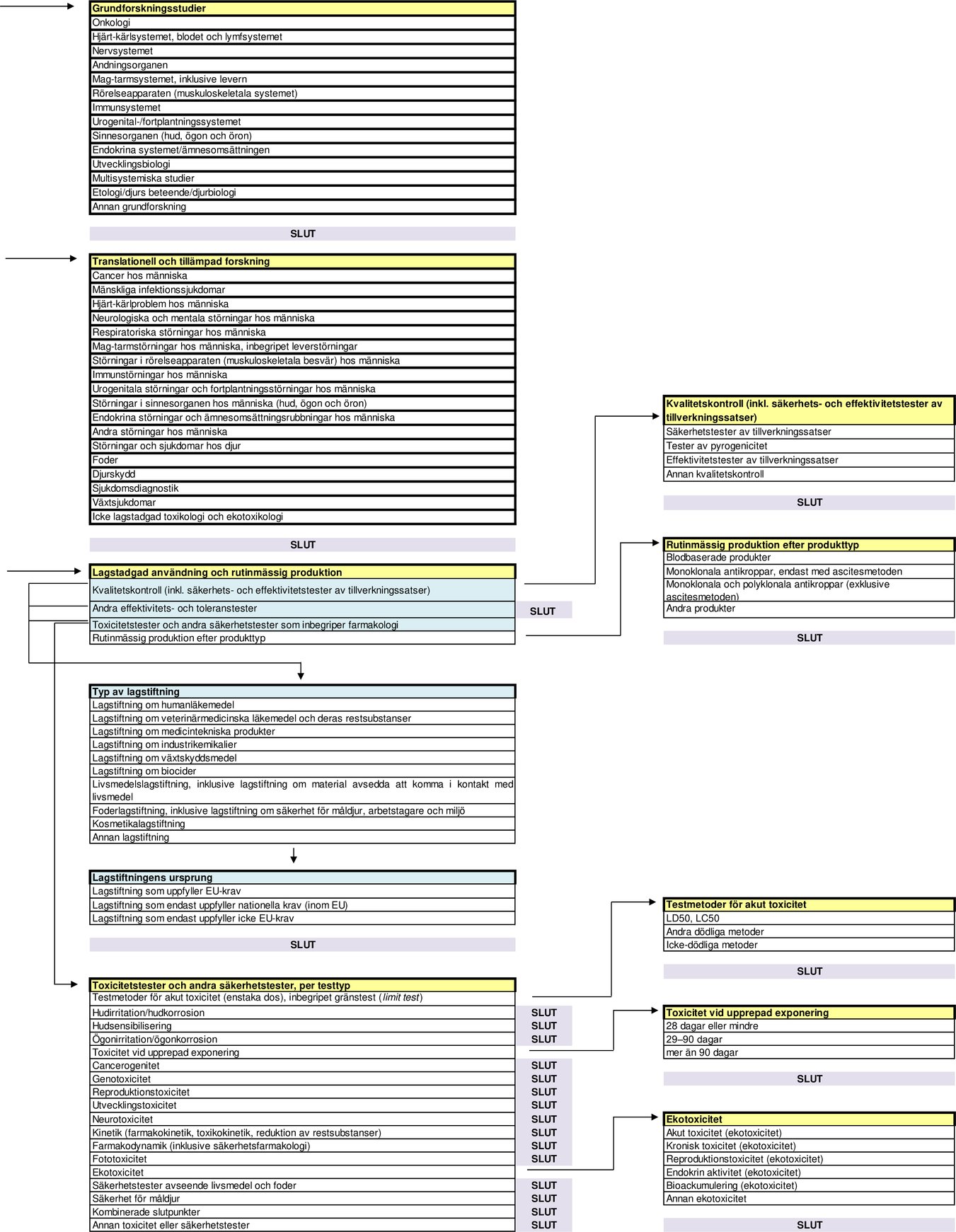
DEL B
Information som avses i artikel 54.2 i direktiv 2010/63/EU
A. ALLMÄNNA BESTÄMMELSER
|
1. |
Uppgifterna ska rapporteras varje gång när ett djur används. |
|
2. |
När uppgifter om ett djur rapporteras ska endast ett alternativ inom en kategori väljas. |
|
3. |
Djur som avlivas för organ och vävnader
|
|
4. |
Djur som föds upp och avlivas utan att användas i ett försök
|
|
5. |
Genetiskt normala djur som föds under framställandet av en ny genetisk stam ska undantas från tillhandahållandet av årliga statistiska uppgifter och ska i stället rapporteras som en del av den femåriga genomföranderapporten i enlighet med bilaga II till detta beslut, såvida inte sådana djur har genotypats med en invasiv metod. |
|
6. |
Larvformer ska inkluderas från det att de själva kan inta föda. |
|
7. |
Däggdjursfoster och -embryon ska inte ingå i rapporteringen av årliga statistiska uppgifter. Endast djur som är födda, även med kejsarsnitt, och som lever ska räknas. När studier involverar både moderdjur och avkomma ska moderdjuret rapporteras när det har varit föremål för ett försök där tröskelvärdet för minsta möjliga smärta, lidande, ångest och bestående men har överskridits. Avkomma ska rapporteras när de utgör en integrerad del av försöket. |
|
8. |
Om användningen av ett djur i ett försök innebär svår smärta, svårt lidande eller svår ångest som är långvarig och inte kan lindras, oberoende av om förhandsgodkännande föreligger eller inte, ska djuret rapporteras under kategorin ”avsevärd svårhet”. I enlighet med avsnitt C i denna bilaga ska uppgifter lämnas i avsnittet ”Beskrivningar från medlemsstaten” avseende arter, antal, huruvida undantag beviljats på förhand, närmare uppgifter om användningen och skälen till att klassificeringen ”avsevärd svårhet” har överskridits. |
|
9. |
Uppgifter om djur som används i ett försök ska rapporteras för det år då försöket avslutas. När det gäller studier som löper över två kalenderår, får samtliga djur rapporteras tillsammans för det år då det sista försöket slutförs, om detta undantag från årlig rapportering godkänns av den behöriga myndigheten. För projekt som löper under längre tid än två kalenderår ska uppgifter om djur rapporteras för det år då djuret avlivas eller dör. |
|
10. |
Om kategorierna ”andra”/”annan” används ska en ny punkt läggas till i beskrivningarna för att ge en mer detaljerad redogörelse av innehållet i ”andra”/”annan”. |
|
11. |
Genetiskt förändrade djur
|
B. UPPGIFTSKATEGORIER
Nedanstående avsnitt redovisas i samma ordning som kategorierna och rubrikerna i flödesschemat i del A.
1. Typ av djur
|
Husmus (Mus musculus) |
|
Brunråtta (Rattus norvegicus) |
|
Marsvin (Cavia porcellus) |
|
Guldhamster (Mesocricetus auratus) |
|
Kinesisk dvärghamster (Cricetulus griseus) |
|
Vanlig ökenråtta (gerbil) (Meriones unguiculatus) |
|
Andra gnagare (andra Rodentia) |
|
Kanin (Oryctolagus cuniculus) |
|
Katt (Felis catus) |
|
Hund (Canis familiaris) |
|
Iller (Mustela putorius furo) |
|
Andra rovdjur (andra Carnivora) |
|
Hästar, åsnor och korsningar (Equidae) |
|
Gris (Sus scrofa domesticus) |
|
Get (Capra aegagrus hircus) |
|
Får (Ovis aries) |
|
Nötkreatur (Bos taurus) |
|
Halvapor (Prosimia) |
|
Silkesapor och tamariner (t.ex. Callithrix jacchus) |
|
Krabbmakak (Macaca fascicularis) |
|
Rhesusapa (Macaca mulatta) |
|
Grön markatta (Chlorocebus spp.) (vanligtvis antingen pygerythrus eller sabaeus) |
|
Babianer (Papio spp.) |
|
Dödskalleapor (t.ex. Saimiri sciureus) |
|
Andra arter av västapor (andra arter av Ceboidea) |
|
Andra arter av östapor (andra arter av Cercopithecoidea) |
|
Människoartade primater (Hominoidea) |
|
Andra däggdjur (andra Mammalia) |
|
Tamhöna (Gallus gallus domesticus) |
|
Kalkon (Meleagris gallopavo) |
|
Andra fåglar (andra Aves) |
|
Kräldjur (Reptilia) |
|
Grodor (Rana temporaria och Rana pipiens) |
|
Klogrodor (Xenopus laevis och Xenopus tropicalis) |
|
Andra groddjur (andra Amphibia) |
|
Sebrafisk (Danio rerio) |
|
Havsabborrfiskar (arter från familjer som t.ex. Serranidae, Moronidae) |
|
Lax, öring, röding och harr (Salmonidae) |
|
Levandefödande tandkarpar (Poeciliidae) |
|
Andra fiskar (andra Pisces) |
|
Bläckfiskar (Cephalopoda) |
|
1.1 |
Fiskar ska rapporteras från det stadium då de själva kan inta föda när tarmen är helt öppen, och fiskarna normalt skulle äta mat. |
|
1.2 |
Den tidpunkt vid vilken fiskar självständigt kan inta föda är olika för varje art och i många fall beroende av den temperatur vid vilken de hålls. Temperaturen bör ställas in för att bibehålla optimalt välbefinnande, enligt vad som fastställts av den person som ansvarar för djurens välbefinnande och skötsel, och för artspecifik information i samordning med den utsedda veterinären. Sebrafiskyngel, som hålls vid cirka + 28 °C, ska rapporteras 5 dagar efter befruktningen. |
|
1.3 |
På grund av vissa fisk- och bläckfiskarters ringa storlek får räkningen göras genom uppskattning. |
|
1.4 |
Alla bläckfiskarter ska rapporteras under rubriken ”bläckfiskar” från det stadium då djuret själv kan inta föda, det vill säga omedelbart efter kläckningen. |
2. Återanvändning
|
Återanvändning (nej/ja) |
|
2.1 |
Allmänt
|
|
2.2 |
Återanvändning kontra fortsatt användning
För att avgöra om det är fråga om återanvändning ska följande gälla:
|
3. Andra arter än icke-mänskliga primater – födelseort
|
Djur födda hos en godkänd uppfödare i unionen |
|
Djur födda i unionen men inte hos en godkänd uppfödare |
|
Djur födda i övriga Europa |
|
Djur födda någon annanstans |
|
3.1 |
Ursprunget bestäms av födelseorten, dvs. den plats där djuret är fött, och inte den plats från vilken det har levererats. |
|
3.2 |
”Djur födda hos en godkänd uppfödare i unionen” avser djur som fötts hos uppfödare som är godkända och registrerade enligt artikel 20 i direktiv 2010/63/EU. |
|
3.3 |
”Djur födda i unionen men inte hos en godkänd uppfödare” omfattar bland annat vilda djur, husdjur (om inte uppfödaren är godkänd enligt artikel 20 i direktiv 2010/63/EU), samt alla undantag som beviljats enligt artikel 10.3 i direktiv 2010/63/EU. |
|
3.4 |
”Djur födda i övriga Europa” omfattar bland annat djur födda i Schweiz, Turkiet, Ryssland och Israel, och i denna kategori sammanförs alla djur, oavsett om de har fötts upp i registrerade uppfödningsanläggningar eller i andra anläggningar, och kategorin omfattar också bland annat djur som har fångats i naturen. |
|
3.5 |
”Djur födda någon annanstans” är en kategori där alla djur sammanförs, oavsett om de har fötts upp i registrerade uppfödningsanläggningar eller i andra anläggningar, och kategorin omfattar också bland annat djur som fångats i naturen. |
4. Icke-mänskliga primater – födelseort
|
Icke-mänskliga primater födda hos en godkänd uppfödare i unionen |
|
Icke-mänskliga primater födda i unionen men inte hos en godkänd uppfödare, och icke-mänskliga primater födda i övriga Europa |
|
Icke-mänskliga primater födda i Asien |
|
Icke-mänskliga primater födda i Amerika |
|
Icke-mänskliga primater födda i Afrika |
|
Icke-mänskliga primater födda någon annanstans |
|
4.1 |
Ursprunget bestäms av födelseorten, dvs. den plats där djuret är fött, och inte den plats från vilken det har levererats. |
|
4.2 |
”Icke-mänskliga primater födda hos en godkänd uppfödare i unionen” (och Norge) avser icke-mänskliga primater födda hos uppfödare som är godkända och registrerade enligt artikel 20 i direktiv 2010/63/EU. |
|
4.3 |
”Icke-mänskliga primater födda i unionen men inte hos en godkänd uppfödare, och icke-mänskliga primater födda i övriga Europa” omfattar bland annat djur födda i Schweiz, Turkiet, Ryssland och Israel. |
|
4.4 |
”Icke-mänskliga primater födda i Asien” omfattar bland annat djur födda i Kina. |
|
4.5 |
”Icke-mänskliga primater födda i Amerika” avser djur födda i Nord-, Central- och Sydamerika. |
|
4.6 |
”Icke-mänskliga primater födda i Afrika” omfattar även djur födda i Mauritius. |
|
4.7 |
”Icke-mänskliga primater födda någon annanstans” omfattar även djur födda i Australasien. Ursprung för icke-mänskliga primater födda någon annanstans ska rapporteras. |
5. Icke-mänskliga primater – kolonityp
|
Självförsörjande koloni (nej/ja) |
”Självförsörjande koloni” avser icke-mänskliga primater som erhållits från en koloni i vilken djuren föds upp endast inom kolonin eller kommer från andra självförsörjande kolonier, men inte fångas i naturen, och i vilken djuren hålls på ett sätt som säkerställer att de är vana vid människor.
6. Icke-mänskliga primater – generation
|
F0 |
|
F1 |
|
F2 eller senare |
|
6.1 |
”F0” avser djur som fångas i naturen. |
|
6.2 |
”F1” avser djur som föds i fångenskap och är avkomma till föräldradjur varav det ena eller båda fångades i naturen. |
|
6.3 |
”F2 eller senare” avser djur som föds i fångenskap och är avkomma till föräldradjur som också fötts i fångenskap. |
7. Genetisk status
|
Icke genetiskt förändrad |
|
Genetiskt förändrad utan skadlig fenotyp |
|
Genetiskt förändrad med skadlig fenotyp |
|
7.1 |
”Icke genetiskt förändrad” avser alla djur som inte har blivit genetiskt förändrade, inbegripet även genetiskt normala föräldradjur som används för att framställa en ny genetiskt förändrad djurstam. |
|
7.2 |
”Genetiskt förändrad utan skadlig fenotyp” avser följande:
|
|
7.3 |
”Genetiskt förändrad med skadlig fenotyp” avser följande:
|
8. Framställande av en ny genetiskt förändrad stam
|
Djur som används för att framställa en ny genetiskt förändrad stam (nej/ja) |
Med djur som används för att framställa en ny genetiskt förändrad stam avses djur som används för att framställa en ny genetiskt förändrad stam, till skillnad från andra djur som används för ”grundforskning” eller ”translationell och tillämpad forskning”. Detta inbegriper korsning av olika stammar för att framställa en ny genetiskt förändrad stam där fenotypen för den nya stammen inte på förhand kan fastställas som icke-skadlig.
9. Svårhetsgrad
|
Terminal |
|
Ringa svårhet (upp till och med) |
|
Måttlig svårhet |
|
Avsevärd svårhet |
|
9.1 |
Faktisk svårhetsgrad ska rapporteras för varje enskilt djur med hänsyn till de allvarligaste effekter som djuret upplever under loppet av hela försöket. Dessa effekter kan inträffa under vilket som helst av stegen (inte nödvändigtvis det sista) i ett försök med flera steg. Den faktiska svårhetsgraden kan vara högre eller lägre än den i förväg förväntade klassificeringen. Kumulativt lidande ska också beaktas vid bestämmandet av faktisk svårhetsgrad. |
|
9.2 |
Svårhetskategorier
|
|
9.3 |
Djur som påträffas döda
|
|
9.4 |
Fångst och transport av djur som fångats i naturen
Den faktiska svårhetsgraden ska endast avse effekterna av det vetenskapliga försök som utförts på detta djur. Fångst och transport (om inte dessa är de specifika syftena eller en del av syftet med de vetenskapliga försöken) ska därför inte beaktas vid rapporteringen av faktisk svårhetsgrad, även om djuret dör under fångsten eller transporten. |
10. Syften
|
Grundforskning |
|
Translationell och tillämpad forskning |
|
Lagstadgad användning och rutinmässig produktion |
|
Skydd av den naturliga miljön för att bevara människors eller djurs hälsa eller välfärd |
|
Artskydd |
|
Högre utbildning |
|
Utbildning för att förvärva, vidmakthålla eller förbättra yrkesfärdigheter |
|
Rättsmedicinska undersökningar |
|
Upprätthållande av kolonier av etablerade genetiskt förändrade djur som inte används i andra försök |
|
10.1 |
Grundforskning
|
|
10.2 |
Translationell och tillämpad forskning
|
|
10.3 |
Lagstadgad användning och rutinmässig produktion
|
|
10.4 |
Skydd av den naturliga miljön för att bevara människors eller djurs hälsa eller välfärd
|
|
10.5 |
Högre utbildning
Denna kategori avser djur som används för att tillhandahålla teoretiska kunskaper inom ett högre utbildningsprogram. |
|
10.6 |
Utbildning för att förvärva, vidmakthålla eller förbättra yrkesfärdigheter
Denna kategori avser djur som används i utbildningssyfte för att förvärva och vidmakthålla yrkesfärdigheter, t.ex. sådana djur som används i utbildningen av läkare. |
|
10.7 |
Upprätthållande av kolonier av etablerade genetiskt förändrade djur som inte används i andra försök
|
11. Grundforskningsstudier
|
Onkologi |
|
Hjärt-kärlsystemet, blodet och lymfsystemet |
|
Nervsystemet |
|
Andningsorganen |
|
Mag-tarmsystemet, inklusive levern |
|
Rörelseapparaten (muskuloskeletala systemet) |
|
Immunsystemet |
|
Urogenital-/fortplantningssystemet |
|
Sinnesorganen (hud, ögon och öron) |
|
Endokrina systemet/ämnesomsättningen |
|
Utvecklingsbiologi |
|
Multisystemiska studier |
|
Etologi/beteende hos djur/djurbiologi |
|
Annan grundforskning |
|
11.1 |
Onkologi
All forskning i onkologi ska inkluderas i denna kategori oberoende av målsystem. |
|
11.2 |
Nervsystemet
Denna kategori omfattar bland annat neurovetenskap, studier av perifera och centrala nervsystemet, samt psykologi. |
|
11.3 |
Rörelseapparaten (muskuloskeletala systemet)
I denna kategori ingår bland annat tandvård. |
|
11.4 |
Sinnesorganen (hud, ögon och öron)
Studier om näsan ska rapporteras under ”Andningsorganen” och studier om tungan under ”Mag-tarmsystemet, inklusive levern”. |
|
11.5 |
Utvecklingsbiologi omfattar studier av förändringar hos en organism från embryogenes (när de inte utförs som en del av reproduktionstoxicitetsstudier), till tillväxt, åldrande och död, och innefattar bland annat celldifferentiering, vävnadsdifferentiering och organogenes. |
|
11.6 |
Multisystemiska studier
Denna kategori ska endast omfatta forskning där fler än ett system är av huvudsakligt intresse, t.ex. forskning om vissa infektionssjukdomar. Onkologi omfattas inte. |
|
11.7 |
Kategorin ”Etologi/djurs beteende/djurbiologi” omfattar studier av både djur i det vilda och djur i fångenskap med det huvudsakliga målet att fördjupa kunskaperna om en specifik art. |
|
11.8 |
Annan grundforskning
|
|
11.9 |
Anmärkningar
|
|
12. |
Translationell och tillämpad forskning
|
|
12.1 |
All tillämpad forskning om cancer hos människa ska inkluderas i kategorin ”Cancer hos människa” oberoende av målsystem. |
|
12.2 |
All tillämpad forskning om mänskliga infektionssjukdomar ska ingå i kategorin ”Mänskliga infektionssjukdomar” oberoende av målsystem. |
|
12.3 |
All lagstadgad användning av djur, såsom lagstadgade cancerogenitetsstudier, ska undantas från kategorin ”Translationell och tillämpad forskning” och rapporteras under kategorin ”Lagstadgad användning och rutinmässig produktion”. |
|
12.4 |
Studier om näsåkommor ska rapporteras under ”Respiratoriska störningar hos människa” och studier om störningar i tungan under ”Mag-tarmsystemet, inklusive levern”. |
|
12.5 |
Innan kategorin ”Andra störningar hos människa” används måste det noggrant kontrolleras och säkerställas att ingen av de fördefinierade kategorierna kan användas. |
|
12.6 |
Kategorin ”Sjukdomsdiagnostik” omfattar bland annat djur som används i direkt diagnosticering av exempelvis rabies och botulism, men inte djur som omfattas av lagstadgad användning. |
|
12.7 |
Kategorin ”Icke lagstadgad toxikologi och ekotoxikologi” avser utforskande toxikologi, utredningar för att förbereda en registreringsansökan och metodutveckling. Denna kategori omfattar inte studier som krävs för registreringsansökningar (preliminära studier, bestämning av maximal tolererad dos). Dosfinnande studier, när de utförs i syfte att uppfylla lagstiftningskrav, är också undantagna och omfattas av ”Lagstadgad användning och rutinmässig produktion” under ”Andra effektivitets- och toleranstester”. |
|
12.8 |
”Djurskydd” avser studier för de syften som anges i artikel 5 b iii i direktiv 2010/63/EU. |
|
12.9 |
Anmärkningar
|
13. Lagstadgad användning och rutinmässig produktion
|
Kvalitetskontroll (inkl. säkerhets- och effektivitetstester av tillverkningssatser) |
|
Andra effektivitets- och toleranstester |
|
Toxicitetstester och andra säkerhetstester som inbegriper farmakologi |
|
Rutinmässig produktion efter produkttyp |
|
13.1 |
Effektivitetstester som genomförs under utvecklandet av nya läkemedel omfattas inte, utan ska i stället rapporteras i kategorin ”Translationell och tillämpad forskning”. |
|
13.2 |
Kvalitetskontroll avser djur som använts vid tester av renhet, stabilitet, effektivitet, styrka och andra parametrar för kvalitetskontroll av slutprodukten och dess beståndsdelar samt alla kontroller som utförts under tillverkningsprocessen för registreringsändamål, för att uppfylla andra nationella eller internationella lagstadgade krav eller för att efterleva tillverkarens interna policy. Detta inkluderar bland annat tester av pyrogenicitet. |
|
13.3 |
Andra effektivitets- och toleranstester
Effektivitetstester av biocider och bekämpningsmedel ingår i denna kategori, liksom även toleranstester av fodertillsatser. Kategorin omfattar också dosfinnande studier när de genomförs i syfte att uppfylla lagstiftningskraven. |
|
13.4 |
Toxicitetstester och andra säkerhetstester (inklusive säkerhetsutvärdering av produkter och utrustning för humanmedicin och tandvård och veterinärmedicin).
|
|
13.5 |
Rutinmässig produktion efter produkttyp
|
14. Kvalitetskontroll (inkl. säkerhets- och effektivitetstester av tillverkningssatser)
|
Säkerhetstester av tillverkningssatser |
|
Tester av pyrogenicitet |
|
Effektivitetstester av tillverkningssatser |
|
Annan kvalitetskontroll |
Säkerhetstester av tillverkningssatser omfattar inte tester av pyrogenicitet, vilket ska rapporteras separat under ”Tester av pyrogenicitet”.
15. Toxicitetstester och andra säkerhetstester, per testtyp
|
Testmetoder för akut toxicitet (enstaka dos), inbegripet gränstest (limit test) |
|
Hudirritation/hudkorrosion |
|
Hudsensibilisering |
|
Ögonirritation/ögonkorrosion |
|
Toxicitet vid upprepad exponering |
|
Cancerogenitet |
|
Genotoxicitet |
|
Reproduktionstoxicitet |
|
Utvecklingstoxicitet |
|
Neurotoxicitet |
|
Kinetik (farmakokinetik, toxikokinetik, reduktion av restsubstanser) |
|
Farmakodynamik (inklusive säkerhetsfarmakologi) |
|
Fototoxicitet |
|
Ekotoxicitet |
|
Säkerhetstester avseende livsmedel och foder |
|
Säkerhet för måldjur |
|
Kombinerade slutpunkter |
|
Annan toxicitet eller säkerhetstester |
|
15.1 |
”Toxicitet vid upprepad exponering” omfattar även immuntoxikologiska studier. |
|
15.2 |
”Reproduktionstoxicitet” omfattar bland annat utvidgade undersökningar av reproduktionstoxicitet på en enda generation, även när det inbegriper kohorter för utvecklingsmässig neuro- och immunotoxicitet. |
|
15.3 |
”Utvecklingstoxicitet” omfattar även studier i utvecklingsneurotoxicitet. Utvidgade undersökningar av reproduktionstoxicitet på en enda generation, inklusive kohorter för utvecklingsneurotoxicitet, ska rapporteras under reproduktionstoxicitet. |
|
15.4 |
”Neurotoxicitet” omfattar bland annat akuta fördröjda effekter (t.ex. fördröjd neurotoxicitet orsakad av organiska fosforföreningar till följd av akut exponering) och studier av upprepad exponering med avseende på neurotoxicitet, men utesluter utvecklingsneurotoxicitet. Utvidgade undersökningar av reproduktionstoxicitet på en enda generation, inklusive kohorter för utvecklingsneurotoxicitet, ska rapporteras under reproduktionstoxicitet. |
|
15.5 |
”Kinetik” avser farmakokinetik, toxikokinetik och reduktion av restsubstanser. Om testning för toxikokinetik utförs som en del av den lagstadgade studien av toxicitet vid upprepad exponering ska den dock rapporteras under ”Toxicitet vid upprepad exponering”. |
|
15.6 |
”Säkerhetstester avseende livsmedel och foder” omfattar även tester av dricksvatten (inbegripet tester av säkerhet för måldjur). |
|
15.7 |
”Säkerhet för måldjur” är tester för att säkerställa att en produkt för ett visst djur kan användas säkert för den arten (och omfattar alltså inte säkerhetstester av tillverkningssatser, vilka omfattas av kategorin kvalitetskontroll). |
|
15.8 |
”Kombinerade slutpunkter” omfattar bland annat kombinationen av studier av cancerogenitet och kronisk toxicitet samt screeningstudier som kombinerar reproduktionstoxicitet och toxicitet vid upprepad exponering. |
16. Testmetoder för akut toxicitet
|
LD50, LC50 |
|
Andra dödliga metoder |
|
Icke-dödliga metoder |
|
16.1 |
Underkategorin ska rapporteras på grundval av den typ av metod som används och inte på grundval av den svårhetsgrad som påfrestningen innebär för djuret då denna metod har tillämpats. |
|
16.2 |
”LD50, LC50” avser endast testmetoder som ger en punktskattning för LD50/LC50 såsom OECD:s testriktlinjer 203, 403 och 425. |
|
16.3 |
Med ”Andra dödliga metoder” avses de metoder som kategoriserar substanser i en klass, det vill säga metoder som innebär tilldelning av ett intervall där LD50 skulle falla, såsom fasta doseringsmetoder och metoder för bestämning av akut toxicitetsklass. Det är troligt att ett antal dödsfall kommer att inträffa, men inte lika många som förväntas om metoder av typen LD50 tillämpas. |
17. Toxicitet vid upprepad exponering
|
28 dagar eller mindre |
|
29–90 dagar |
|
mer än 90 dagar |
18. Ekotoxicitet
|
Akut toxicitet (ekotoxicitet) |
|
Kronisk toxicitet (ekotoxicitet) |
|
Reproduktionstoxicitet (ekotoxicitet) |
|
Endokrin aktivitet (ekotoxicitet) |
|
Bioackumulering (ekotoxicitet) |
|
Annan ekotoxicitet |
|
18.1 |
Ekotoxicitet avser toxicitet i samband med vatten- och landmiljön. |
|
18.2 |
Ekotoxicitetsstudier som behandlar kortvarig toxicitet för bestämning av LC/LD50 ska rapporteras under ”Akut toxicitet (ekotoxicitet)”. |
|
18.3 |
Ekotoxicitetsstudier som behandlar långvarig toxicitet, till exempel tidiga livscykeltester eller fullständiga livscykeltester, ska rapporteras under ”Kronisk toxicitet (ekotoxicitet)”. |
|
18.4 |
Ekotoxicitetsstudier som utförs för att i första hand bedöma substansers hormonella egenskaper och behandla exempelvis metamorfos, utveckling och tillväxt hos groddjur, samt sexuell utveckling och reproduktion hos fiskar ska rapporteras under ”Endokrin aktivitet (ekotoxicitet)”. |
19. Typ av lagstiftning
|
Lagstiftning om humanläkemedel |
|
Lagstiftning om veterinärmedicinska läkemedel och deras restsubstanser |
|
Lagstiftning om medicintekniska produkter |
|
Lagstiftning om industrikemikalier |
|
Lagstiftning om växtskyddsmedel |
|
Lagstiftning om biocider |
|
Livsmedelslagstiftning, inklusive lagstiftning om material avsedda att komma i kontakt med livsmedel |
|
Foderlagstiftning, inklusive lagstiftning om säkerhet för måldjur, arbetstagare och miljö |
|
Kosmetikalagstiftning |
|
Annan lagstiftning |
|
19.1 |
Typen av lagstiftning ska inte rapporteras för djur vars användning omfattas av kategorin ”Rutinmässig produktion”. |
|
19.2 |
Typen av lagstiftning ska rapporteras med hänvisning till det avsedda primära användningssyftet. |
|
19.3 |
Provning av vattenkvaliteten, annat än av avloppsvatten, ska rapporteras under ”Livsmedelslagstiftning”. Kvalitetsprovning av avloppsvatten ska rapporteras under ”Annan lagstiftning”. |
20. Lagstiftningens ursprung
|
Lagstiftning som uppfyller unionskrav |
|
Lagstiftning som endast uppfyller nationella krav (inom unionen) |
|
Lagstiftning som endast uppfyller icke unionskrav |
|
20.1 |
Lagstiftningens ursprung ska inte rapporteras för djur vars användning omfattas av kategorin ”Rutinmässig produktion”. |
|
20.2 |
Användningen ska rapporteras med hänvisning till den region för vilken provningen utförs, inte var den utförs. |
|
20.3 |
Om den nationella lagstiftningen härrör från unionslagstiftningen ska användningen rapporteras under ”Lagstiftning som uppfyller unionskrav”. |
|
20.4 |
”Lagstiftning som uppfyller unionskrav” omfattar också alla internationella krav som samtidigt uppfyller unionskrav (såsom tester enligt riktlinjer från ICH (1), VICH (2) eller OECD och monografier i Europeiska farmakopén). |
|
20.5 |
Om provningen utförs för att uppfylla lagstiftningen i en eller flera medlemsstater (inte nödvändigtvis den där provningen utförs), och kravet inte härrör från unionslagstiftningen, ska användningen rapporteras under ”Lagstiftning som endast uppfyller nationella krav (inom EU)”. |
|
20.6 |
”Lagstiftning som endast uppfyller icke unionskrav” ska väljas enbart när det inte finns något motsvarande krav att utföra provningen i syfte att efterleva unionslagstiftning. |
21. Rutinmässig produktion efter produkttyp
|
Blodbaserade produkter |
|
Monoklonala antikroppar, endast med ascitesmetoden |
|
Monoklonala och polyklonala antikroppar (exklusive ascitesmetoden) |
|
Andra produkter |
|
21.1 |
Rutinmässig produktion efter produkttyp omfattar produktion av antikroppar och blodprodukter genom etablerade metoder. Detta utesluter immunisering av djur för efterföljande hybridomproduktion när den utförs i syftet grundforskning eller tillämpad forskning inom ett givet projekt. Den immuniseringen ska tas upp under grundforskning eller tillämpad undersökning under lämplig kategori. |
|
21.2 |
All användning av ascitesmetoden för odling av monoklonala antikroppar ska rapporteras under ”Monoklonala antikroppar, endast med ascitesmetoden”. |
|
21.3 |
Användning av djur för produktion av antikroppar för kommersiella ändamål, inklusive immunisering för den efterföljande hybridomproduktionen, ska rapporteras under ”Monoklonala och polyklonala antikroppar (exklusive ascitesmetoden)”. |
C. BESKRIVNINGAR FRÅN MEDLEMSSTATEN
|
1. |
Medlemsstaterna ska lämna en beskrivning av de statistiska uppgifterna. Denna beskrivning ska innehålla följande:
|
|
2. |
Vid tillämpning av punkt 1 g ska följande rapporteras:
|
(1) Internationella konferensen om harmonisering av tekniska krav för registrering av humanläkemedel.
(2) International Cooperation on Harmonisation of Technical Requirements for Registration of Veterinary Medicinal Products.
BILAGA IV
MALL FÖR DEN INFORMATION SOM AVSES I ARTIKEL 54.3 I DIREKTIV 2010/63/EU
|
Medlemsstat: |
År: |
|
Typ av metod |
Art |
Motivering |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
BILAGA V
JÄMFÖRELSETABELL
|
Genomförandebeslut 2012/707/EU |
Detta beslut |
|
Artikel 1 |
Artikel 2 |
|
Artikel 2 |
Artikel 3 |
|
Artikel 3 |
Artikel 4 |
|
Artikel 4 |
Artikel 6 |
|
BILAGA I |
BILAGA II |
|
BILAGA II |
BILAGA III |
|
BILAGA III |
BILAGA IV |

