EUR-Lex Access to European Union law

This document is an excerpt from the EUR-Lex website
Document 02005R2074-20121126
Commission Regulation (EC) No 2074/2005 of 5 December 2005 laying down implementing measures for certain products under Regulation (EC) No 853/2004 of the European Parliament and of the Council and for the organisation of official controls under Regulation (EC) No 854/2004 of the European Parliament and of the Council and Regulation (EC) No 882/2004 of the European Parliament and of the Council, derogating from Regulation (EC) No 852/2004 of the European Parliament and of the Council and amending Regulations (EC) No 853/2004 and (EC) No 854/2004 (Text with EEA relevance)
Consolidated text: Kommissionens förordning (EG) nr 2074/2005 av den 5 december 2005 om tillämpningsåtgärder för vissa produkter enligt Europaparlamentets och rådets förordning (EG) nr 853/2004 och för genomförandet av offentliga kontroller enligt Europaparlamentets och rådets förordningar (EG) nr 854/2004 och (EG) nr 882/2004, om undantag från Europaparlamentets och rådets förordning (EG) nr 852/2004 och om ändring av förordningarna (EG) nr 853/2004 och (EG) nr 854/2004 (Text av betydelse för EES)
Kommissionens förordning (EG) nr 2074/2005 av den 5 december 2005 om tillämpningsåtgärder för vissa produkter enligt Europaparlamentets och rådets förordning (EG) nr 853/2004 och för genomförandet av offentliga kontroller enligt Europaparlamentets och rådets förordningar (EG) nr 854/2004 och (EG) nr 882/2004, om undantag från Europaparlamentets och rådets förordning (EG) nr 852/2004 och om ändring av förordningarna (EG) nr 853/2004 och (EG) nr 854/2004 (Text av betydelse för EES)
2005R2074 — SV — 26.11.2012 — 007.005
Detta dokument är endast avsett som dokumentationshjälpmedel och institutionerna ansvarar inte för innehållet
|
KOMMISSIONENS FÖRORDNING (EG) nr 2074/2005 av den 5 december 2005 om tillämpningsåtgärder för vissa produkter enligt Europaparlamentets och rådets förordning (EG) nr 853/2004 och för genomförandet av offentliga kontroller enligt Europaparlamentets och rådets förordningar (EG) nr 854/2004 och (EG) nr 882/2004, om undantag från Europaparlamentets och rådets förordning (EG) nr 852/2004 och om ändring av förordningarna (EG) nr 853/2004 och (EG) nr 854/2004 (EGT L 338, 22.12.2005, p.27) |
Ändrad genom:
|
|
|
Officiella tidningen |
||
|
No |
page |
date |
||
|
KOMMISSIONENS FÖRORDNING (EG) nr 1664/2006 av den 6 november 2006 |
L 320 |
13 |
18.11.2006 |
|
|
KOMMISSIONENS FÖRORDNING (EG) nr 1244/2007 av den 24 oktober 2007 |
L 281 |
12 |
25.10.2007 |
|
|
KOMMISSIONENS FÖRORDNING (EG) nr 1022/2008 av den 17 oktober 2008 |
L 277 |
18 |
18.10.2008 |
|
|
KOMMISSIONENS FÖRORDNING (EG) nr 1250/2008 av den 12 december 2008 |
L 337 |
31 |
16.12.2008 |
|
|
KOMMISSIONENS FÖRORDNING (EU) nr 15/2011 av den 10 januari 2011 |
L 6 |
3 |
11.1.2011 |
|
|
KOMMISSIONENS GENOMFÖRANDEFÖRORDNING (EU) nr 809/2011 av den 11 augusti 2011 |
L 207 |
1 |
12.8.2011 |
|
|
KOMMISSIONENS GENOMFÖRANDEFÖRORDNING (EU) nr 1012/2012 av den 5 november 2012 |
L 306 |
1 |
6.11.2012 |
|
Rättad genom:
KOMMISSIONENS FÖRORDNING (EG) nr 2074/2005
av den 5 december 2005
om tillämpningsåtgärder för vissa produkter enligt Europaparlamentets och rådets förordning (EG) nr 853/2004 och för genomförandet av offentliga kontroller enligt Europaparlamentets och rådets förordningar (EG) nr 854/2004 och (EG) nr 882/2004, om undantag från Europaparlamentets och rådets förordning (EG) nr 852/2004 och om ändring av förordningarna (EG) nr 853/2004 och (EG) nr 854/2004
(Text av betydelse för EES)
EUROPEISKA GEMENSKAPERNAS KOMMISSION HAR ANTAGIT DENNA FÖRORDNING
med beaktande av fördraget om upprättandet av Europeiska gemenskapen,
med beaktande av Europaparlamentets och rådets förordning (EG) nr 852/2004 av den 29 april 2004 om livsmedelshygien ( 1 ), särskilt artikel 13.2,
med beaktande av Europaparlamentets och rådets förordning (EG) nr 853/2004 av den 29 april 2004 om fastställande av särskilda hygienregler för livsmedel av animaliskt ursprung ( 2 ), särskilt artiklarna 9, 10 och 11,
med beaktande av Europaparlamentets och rådets förordning (EG) nr 854/2004 av den 29 april 2004 om fastställande av särskilda bestämmelser för genomförandet av offentlig kontroll av produkter av animaliskt ursprung avsedda att användas som livsmedel ( 3 ), särskilt artiklarna 16, 17 och 18,
med beaktande av Europaparlamentets och rådets förordning (EG) nr 882/2004 av den 29 april 2004 om offentlig kontroll för att säkerställa kontrollen av efterlevnaden av foder- och livsmedelslagstiftningen samt bestämmelserna om djurhälsa och djurskydd ( 4 ), särskilt artikel 63, och
av följande skäl:|
(1) |
I förordning (EG) nr 853/2004 fastställs särskilda hygienregler för livsmedel av animaliskt ursprung. Vissa tillämpningsåtgärder måste fastställas för kött, levande musslor, fiskeriprodukter, mjölk, ägg, grodlår och snäckor samt för bearbetade produkter av dessa. |
|
(2) |
I förordning (EG) nr 854/2004 fastställs särskilda bestämmelser för genomförandet av offentlig kontroll av produkter av animaliskt ursprung avsedda att användas som livsmedel. Vissa bestämmelser behöver ändras, medan andra krav måste specificeras ytterligare. |
|
(3) |
I förordning (EG) nr 882/2004 fastställs på gemenskapsnivå en harmoniserad ram med allmänna bestämmelser för genomförandet av offentlig kontroll. Vissa bestämmelser behöver ändras, medan andra krav måste specificeras ytterligare. |
|
(4) |
Genom kommissionens beslut 20XX/…/EG ( 5 ) upphävs vissa beslut om åtgärder i Europaparlamentets och rådets direktiv 2004/41/EG av den 21 april 2004 om upphävande av vissa direktiv om livsmedelshygien och hygienkrav för tillverkning och utsläppande på marknaden av vissa produkter av animaliskt ursprung avsedda att användas som livsmedel och om ändring av rådets direktiv 89/662/EEG och 92/118/EEG samt rådets beslut 95/408/EG ( 6 ). Vissa delar av de berörda besluten bör därför behållas i denna förordning. |
|
(5) |
Enligt förordning (EG) nr 852/2004 skall livsmedelsföretagare föra och spara journaler och på begäran göra relevanta uppgifter i dessa journaler tillgängliga för den behöriga myndigheten och den mottagande livsmedelsföretagaren. |
|
(6) |
I förordning (EG) nr 853/2004 föreskrivs dessutom att den som ansvarar för driften på ett slakteri skall begära, ta emot, kontrollera och reagera på information från livsmedelskedjan när det gäller alla djur, utom frilevande vilt, som sänds eller som kommer att sändas till slakteriet. Den driftsansvarige skall också se till att informationen från livsmedelskedjan innehåller alla de uppgifter som krävs enligt förordning (EG) nr 853/2004. |
|
(7) |
Informationen från livsmedelskedjan hjälper den som ansvarar för driften på slakteriet att organisera slakteriverksamheten och den officiella veterinären att bestämma vilka inspektionsförfaranden som krävs. Informationen från livsmedelskedjan bör analyseras av den officiella veterinären och användas som en del av inspektionsförfarandena. |
|
(8) |
Befintliga system för informationsförmedling bör i största möjliga utsträckning utnyttjas och anpassas till de krav på information från livsmedelskedjan som föreskrivs i förordning (EG) nr 854/2004. |
|
(9) |
För att förbättra djurhållningen vid jordbruksanläggningarna och i enlighet med förordning (EG) nr 854/2004 bör den officiella veterinären dokumentera och vid behov underrätta livsmedelsföretagaren vid den jordbruksanläggning djuren kommer från och den veterinär som anlitas av denna anläggning eller den berörda behöriga myndigheten, om eventuella sjukdomar eller förhållanden som konstateras vid slakterier hos enskilda djur eller hos djurbesättningen och som kan påverka människors eller djurs hälsa eller äventyra djurskyddet. |
|
(10) |
I förordningarna (EG) nr 853/2004 och (EG) nr 854/2004 fastställs de krav som gäller för kontroll av parasiter vid hantering av fiskeriprodukter på land och ombord på fartyg. Livsmedelsföretagare skall utföra sina egna kontroller av fiskeriprodukterna i samtliga produktionsled i enlighet med bestämmelserna i avsnitt VIII kapitel V del D i bilaga III till förordning (EG) nr 853/2004, så att fisk som är tydligt angripen av parasiter inte saluförs som livsmedel. För att närmare bestämmelser om okulärbesiktning skall kunna antas måste begreppen synliga parasiter och okulärbesiktning definieras, och observationernas typ och frekvens fastställas. |
|
(11) |
De kontroller som föreskrivs i förordning (EG) nr 853/2004 för att undvika att fiskeriprodukter som är otjänliga som livsmedel släpps ut på marknaden kan omfatta vissa kemiska undersökningar, inklusive kontroll av total mängd flyktiga kvävebaser (TVB-N). Det är nödvändigt att fastställa gränsvärden för TVB-N i fråga om vissa kategorier av arter och att ange vilka analysmetoder som skall användas. De vetenskapligt erkända analysmetoderna för TVB-N-kontroller bör även fortsättningsvis användas rutinmässigt, men en referensmetod som kan användas vid tvivel om resultaten eller vid tvister bör fastställas. |
|
(12) |
Gränsvärdena för paralytiskt skaldjursgift (PSP), amnesiframkallande skaldjursgift (ASP) och fettlösliga gifter fastställs i förordning (EG) nr 853/2004. Bioassay (analyser på levande materia) används som referensmetod för att påvisa vissa toxiner och för att undvika att giftiga skaldjur tas upp. Medlemsstaterna bör harmonisera och införa de gränsvärden och analysmetoder de använder för att skydda människors hälsa. Utöver biologiska testmetoder bör även andra detektionsmetoder, till exempel kemiska metoder och metoder för in vitro-analys tillåtas, om det kan påvisas att den valda metoden är minst lika effektiv som den biologiska metoden och ger motsvarande skydd för människors hälsa när den tillämpas. De föreslagna gränsvärdena för fettlösliga gifter grundas på preliminära data och bör därför ses över när nya vetenskapliga rön blir tillgängliga. Bristen på referensmaterial och det faktum att endast andra än biologiska testmetoder används innebär för närvarande att människors hälsa inte skyddas mot alla angivna toxiner på ett lika bra sätt som genom biologiska test. Åtgärder bör snarast möjligt vidtas för att ersätta de biologiska testmetoderna. |
|
(13) |
Maskinurbenat kött som framställts med metoder som inte förändrar strukturen på de ben som används vid framställningen av det maskinurbenade köttet bör behandlas på annat sätt än maskinurbenat kött som framställs med metoder som förändrar strukturen på benen. |
|
(14) |
Maskinurbenat kött av det första slaget som framställts enligt fastställda villkor och som har en fastställd sammansättning bör tillåtas i köttberedningar som uppenbart inte är avsedda att konsumeras utan föregående värmebehandling. Dessa villkor gäller särskilt det maskinurbenade köttets kalciumhalt, som bör fastställas i enlighet med artikel 11.2 i förordning (EG) nr 853/2004. Den högsta kalciumhalt som fastställs i denna förordning bör justeras så snart det finns närmare information om de variationer som förekommer när olika typer av råvaror används. |
|
(15) |
I artikel 31.2 f i förordning (EG) nr 882/2004 föreskrivs att medlemsstaterna skall hålla förteckningar över godkända anläggningar aktuella. Gemensamma regler för hur relevant information skall lämnas till andra medlemsstater och till allmänheten bör fastställas. |
|
(16) |
I avsnitt XI i bilaga III till förordning (EG) nr 853/2004 anges villkor för beredning av grodlår och snäckor som är avsedda att användas som livsmedel. Särskilda krav, inbegripet förlagor till hälsointyg, bör också fastställas när det gäller import från tredjeländer av grodlår och snäckor avsedda att användas som livsmedel. |
|
(17) |
I avsnitten XIV och XV i bilaga III till förordning (EG) nr 853/2004 anges villkor för framställning och utsläppande på marknaden av gelatin och kollagen avsett att användas som livsmedel. Särskilda krav, inbegripet förlagor till hälsointyg, bör också fastställas när det gäller import från tredjeländer av gelatin och kollagen samt av råvaror för framställning av gelatin och kollagen avsett att användas som livsmedel. |
|
(18) |
Flexibilitet krävs för att traditionella livsmedel skall kunna fortsätta att tillverkas. Medlemsstaterna har redan beviljat undantag för många typer av sådana livsmedel i enlighet med gällande lagstiftning före den 1 januari 2006. Livsmedelsföretagare bör utan avbrott kunna fortsätta att tillämpa nuvarande praxis efter detta datum. Ett förfarande som ger medlemsstaterna möjlighet till flexibilitet föreskrivs i förordningarna (EG) nr 852/2004, (EG) nr 853/2004 och (EG) nr 854/2004. I de flesta fall där undantag redan har beviljats handlar det endast om att fortsätta med etablerad praxis. Om ett fullständigt anmälningsförfarande med en komplett riskanalys tillämpas kan detta därför leda till en onödig och oproportionerlig börda för medlemsstaterna. Traditionella livsmedel bör därför definieras och allmänna krav på sådana livsmedel bör fastställas genom undantag från de strukturella krav som föreskrivs i förordning (EG) nr 852/2004, med vederbörlig hänsyn till målen för livsmedelssäkerhet. |
|
(19) |
Eftersom förordningarna (EG) nr 853/2004 och (EG) nr 854/2004 antogs före utvidgningen den 1 maj 2004 hänvisade de inte till de nya medlemsstaterna. ISO-koderna för dessa medlemsstater och förkortningarna för Europeiska gemenskapen på deras språk bör därför läggas till i de tillämpliga bestämmelserna i de förordningarna. |
|
(20) |
I avsnitt I i bilaga III till förordning (EG) nr 853/2004 anges villkor för framställning och utsläppande på marknaden av kött från tama hov- och klövdjur. Undantag från kravet på fullständig avhudning av slaktkroppen och andra delar av kroppen som är avsedda att användas som livsmedel anges i kapitel IV punkt 8 i det avsnittet. Åtgärder bör vidtas för att utvidga dessa undantag till att även omfatta fötter från vuxna nötkreatur, förutsatt att de uppfyller de villkor som gäller fötter från kalvar. |
|
(21) |
Viss praxis kan vilseleda konsumenten i fråga om vissa produkters sammansättning. För att konsumenterna inte skall vilseledas bör exempelvis fjäderfäkött som behandlats med vattenbindande ämnen inte få säljas som färskt kött. |
|
(22) |
Europeiska myndigheten för livsmedelssäkerhet antog den 30 augusti 2004 ett yttrande som visade att fiskeriprodukter som tillhör familjen Gempylidae, särskilt Ruvettus pretiosus och Lepidocybium flavobrunneum, kan orsaka problem i matsmältningsorganen, om de konsumeras under vissa förhållanden. Fiskeriprodukter som tillhör denna familj bör därför omfattas av villkor för saluföring. |
|
(23) |
I avsnitt IX i bilaga III till förordning (EG) nr 853/2004 anges särskilda hygienkrav för obehandlad mjölk och mjölkprodukter. Enligt del II.B punkt 1 e i kapitel I får spendoppnings- eller spraymedel endast användas om den behöriga myndigheten har godkänt dem. I denna del finns dock inga närmare föreskrifter om förfarandet för godkännande. För att garantera enhetliga förfaranden i medlemsstaterna är det därför nödvändigt att klargöra hur sådana godkännanden skall beviljas. |
|
(24) |
Enligt förordning (EG) nr 853/2004 skall livsmedelsföretagare se till att de metoder för värmebehandling som används för bearbetning av obehandlad mjölk och mjölkprodukter uppfyller kraven enligt en internationellt erkänd standard. På grund av den särskilda karaktären hos vissa värmebehandlingsmetoder som används inom denna bransch och deras effekter på livsmedelssäkerheten och djurhälsan bör livsmedelsföretagarna få tydligare vägledning i detta avseende. |
|
(25) |
I förordning (EG) nr 853/2004 införs en ny definition för att täcka produkter från ägg som inte har bearbetats efter det att skalet har avlägsnats. De bestämmelser som gäller för dessa produkter måste därför förtydligas och avsnitt X kapitel II i bilaga III till förordning (EG) nr 853/2004 ändras i enlighet med detta. |
|
(26) |
I avsnitt XIV i bilaga III till förordning (EG) nr 853/2004 anges särskilda hygienkrav för gelatin. I dessa bestämmelser ingår krav på de typer av råvaror som får användas för att framställa gelatin samt transport och lagring av sådana råvaror. Bestämmelserna omfattar också specifikationer för framställningen av gelatin. Det bör dock även fastställas bestämmelser om märkning av gelatin. |
|
(27) |
Vetenskapliga framsteg har lett till att ISO 16649-3 har etablerats som en godkänd referensmetod för analys av E. coli i musslor. Denna referensmetod är redan vedertagen för levande musslor från A-områden i enlighet med kommissionens förordning (EG) nr 2073/2005 om mikrobiologiska kriterier för livsmedel ( 7 ) ISO 16649-3 bör därför fastställas som MPN-referensmetod (Most Probable Number) även för analys av E. coli i musslor från B- och C-områden. Användning av andra metoder bör tillåtas endast om de anses vara likvärdiga med referensmetoden. |
|
(28) |
Förordningarna (EG) nr 853/2004 och (EG) nr 854/2004 bör därför ändras i enlighet med detta. |
|
(29) |
De åtgärder som föreskrivs i denna förordning är förenliga med yttrandet från ständiga kommittén för livsmedelskedjan och djurhälsa. |
HÄRIGENOM FÖRESKRIVS FÖLJANDE.
Artikel 1
Krav på information från livsmedelskedjan i enlighet med förordningarna (EG) nr 853/2004 och (EG) nr 854/2004
Krav på information från livsmedelskedjan enligt avsnitt III i bilaga II till förordning (EG) nr 853/2004 och avsnitt I kapitel II del A i bilaga I till förordning (EG) nr 854/2004 anges i bilaga I till denna förordning.
Artikel 2
Krav på fiskeriprodukter i enlighet med förordningarna (EG) nr 853/2004 och (EG) nr 854/2004
Krav på fiskeriprodukter enligt artikel 11.9 i förordning (EG) nr 853/2004 och artikel 18.14 och 18.15 i förordning (EG) nr 854/2004 anges i bilaga II till denna förordning.
Artikel 3
Erkända metoder för provtagning av marina biotoxiner i enlighet med förordningarna (EG) nr 853/2004 och (EG) nr 854/2004
De erkända metoderna för provtagning för påvisande av marina biotoxiner enligt artikel 11.4 i förordning (EG) nr 853/2004 och artikel 18.13 a i förordning (EG) nr 854/2004 anges i bilaga III till denna förordning.
Artikel 4
Kalciumhalt i maskinurbenat kött i enlighet med förordning (EG) nr 853/2004
Kalciumhalten i maskinurbenat kött enligt artikel 11.2 i förordning (EG) nr 853/2004 anges i bilaga IV till denna förordning.
Artikel 5
Förteckningar över anläggningar i enlighet med förordning (EG) nr 882/2004
Krav på förteckningar över anläggningar enligt artikel 31.2 f i förordning (EG) nr 882/2004 anges i bilaga V till denna förordning.
Artikel 6
Förlagor till hälsointyg och dokument för import av vissa produkter av animaliskt ursprung i enlighet med förordningarna (EG) nr 853/2004 och (EG) nr 854/2004
1. De förlagor till hälsointyg och dokument enligt artikel 6.1 d i förordning (EG) nr 853/2004 som ska användas vid import av de produkter av animaliskt ursprung som förtecknas i bilaga VI till den här förordningen fastställs i samma bilaga.
2. Förlagan till det dokument som ska undertecknas av kaptenen och som i enlighet med artikel 15.3 i förordning (EG) nr 854/2004 får ersätta det dokument som enligt artikel 14 i den förordningen krävs när fiskeriprodukter importeras direkt från frysfartyg fastställs i bilaga VI till den här förordningen.
Artikel 6a
Testmetoder för obehandlad mjölk och värmebehandlad mjölk
Analysmetoderna i bilaga VIa till den här förordningen skall användas av de behöriga myndigheterna, och i förekommande fall av livsmedelsföretagarna, för att kontrollera att de gränsvärden som anges i avsnitt IX kapitel I del III i bilaga III till förordning (EG) nr 853/2004 inte överskrids och för att säkerställa att den pastöriseringsprocess för mjölkprodukter som anges i avsnitt IX kapitel II del II i bilaga III till den förordningen tillämpas korrekt.
Artikel 6b
Krav för offentlig kontroll vid besiktning av kött i enlighet med förordning (EG) nr 854/2004
Kraven för offentlig kontroll vid besiktning av kött fastställs i bilaga VIb.
Artikel 7
Undantag från förordning (EG) nr 852/2004 för traditionella livsmedel
1. I denna förordning avses med traditionella livsmedel, livsmedel som i den medlemsstat där de traditionellt framställs,
a) av hävd är erkända som traditionella produkter, eller
b) tillverkas enligt lagbestämda eller registrerade tekniska referenser för den traditionella processen eller enligt traditionella framställningsmetoder, eller
c) skyddas som traditionella livsmedelsprodukter i gemenskapslagstiftningen eller genom en nationell, regional eller lokal lagstiftning.
2. Medlemsstaterna får bevilja anläggningar som framställer traditionella livsmedel enskilda eller generella undantag från de krav som föreskrivs i följande bestämmelser:
a) Kapitel II punkt 1 i bilaga II till förordning (EG) nr 852/2004, när det gäller de lokaler där dessa produkter utsätts för sådana förhållanden som bidrar till att utveckla deras egenskaper. Väggar, innertak och dörrar i dessa lokaler behöver till exempel inte vara släta, ogenomträngliga, icke-absorberande och korrosionsbeständiga. De får också bestå av naturligt geologiskt material.
b) Kapitel II punkt 1 f och kapitel V punkt 1 i bilaga II till förordning (EG) nr 852/2004, när det gäller den typ av material som de redskap och den utrustning är gjorda av som används för beredning, förpackning och emballering av dessa produkter.
När det gäller rengöring och desinficering av de lokaler som avses i a skall åtgärderna och frekvensen anpassas till typen av verksamhet med särskild hänsyn till den specifika den särskilda miljöfloran.
De redskap och den utrustning som avses i b skall alltid hållas i ett gott hygieniskt skick och regelbundet rengöras och desinficeras.
3. Medlemsstater som beviljar de undantag som föreskrivs i punkt 2 skall anmäla detta till kommissionen och de övriga medlemsstaterna senast tolv månader efter det att ett enskilt eller generellt undantag har beviljats. Varje anmälan skall innehålla
a) en kort beskrivning av de krav som har anpassats,
b) en beskrivning av de livsmedel och anläggningar som berörs, och
c) all annan relevant information.
Artikel 8
Ändringar av förordning (EG) nr 853/2004
Bilagorna II och III till förordning (EG) nr 853/2004 skall ändras i enlighet med bilaga VII till denna förordning.
Artikel 9
Ändringar av förordning (EG) nr 854/2004
Bilagorna I, II och III till förordning (EG) nr 854/2004 skall ändras i enlighet med bilaga VIII till denna förordning.
Artikel 10
Ikraftträdande och tillämpning
Denna förordning träder i kraft den tjugonde dagen efter det att den har offentliggjorts i Europeiska unionens officiella tidning.
Den skall tillämpas från och med den 1 januari 2006, med undantag av kapitel II och III i bilaga V, som skall tillämpas från och med den 1 januari 2007.
Denna förordning är till alla delar bindande och direkt tillämplig i alla medlemsstater.
BILAGA I
INFORMATION FRÅN LIVSMEDELSKEDJAN
AVSNITT I
LIVSMEDELSFÖRETAGARNAS SKYLDIGHETER
Livsmedelsföretagare som föder upp djur som sänds till slakt skall se till att den information från livsmedelskedjan som avses i förordning (EG) nr 853/2004 i tillämpliga delar antecknas i journalerna för de djur som sänds till slakt på ett sådant sätt att den är tillgänglig för den som ansvarar för driften vid det berörda slakteriet.
AVSNITT II
DE BEHÖRIGA MYNDIGHETERNAS SKYLDIGHETER
KAPITEL I
BESTÄMMELSER OM INFORMATION FRÅN LIVSMEDELSKEDJAN
1. Den behöriga myndigheten på avsändningsorten skall informera den avsändande livsmedelsföretagaren om minimikraven för den information från livsmedelskedjan som skall lämnas till slakteriet i enlighet med avsnitt III i bilaga II till förordning (EG) nr 853/2004.
a) Att information från livsmedelskedjan konsekvent och effektivt förmedlas mellan den livsmedelsföretagare som fött upp eller hållit djuret innan det sändes till slakt och den som ansvarar för driften vid slakteriet.
b) Att informationen från livsmedelskedjan är giltig och tillförlitlig.
c) Att relevant information vid behov återrapporteras till jordbruksanläggningen.
3. När djur sänds för slakt till en annan medlemsstat skall de behöriga myndigheterna på avsändningsorten och på den ort där slakten utförts samarbeta för att se till att den information som den avsändande livsmedelsföretagaren lämnar är lättillgänglig för den som ansvarar för driften vid det slakteri som tar emot informationen.
KAPITEL II
RAPPORTERING TILL JORDBRUKSFÖRETAG SOM DJUREN KOMMER IFRÅN
1. Den officiella veterinären får använda den förlaga som finns i tillägg I för de inspektionsresultat som skall förmedlas till den jordbruksanläggning där djuren föddes upp före slakt i samma medlemsstat, i enlighet med avsnitt II kapitel I i bilaga I till förordning (EG) 854/2004.
2. Den behöriga myndigheten ansvarar för förmedlingen av relevanta inspektionsresultat i de fall där djuren föds upp på en jordbruksanläggning i en annan medlemsstat och skall använda en version av den förlaga som finns i tillägget på både det avsändande och det mottagande landets språk.
Tillägg till bilaga I
FÖRLAGA
|
1. |
Identifieringsuppgifter |
||
|
1.1 |
Jordbruksanläggning som djuret kommer ifrån (t.ex. ägare eller ansvarig person) |
||
|
Namn/nummer |
|||
|
Fullständig adress |
|||
|
Telefonnummer |
|||
|
1.2 |
Identifieringsnummer (bifoga separat förteckning) |
||
|
Antalet djur totalt (efter art) |
|||
|
Ev. identifieringsproblem |
|||
|
1.3 |
Besättningens/flockens/burens identitet (i förekommande fall) |
||
|
1.4 |
Djurart |
||
|
1.5 |
Hälsointygets referensnummer |
||
|
2. |
Resultat av besiktning före slakt |
||
|
2.1 |
Djurskydd |
||
|
Antal berörda djur |
|||
|
Typ/klass/ålder |
|||
|
Iakttagelser (t.ex. svansbitning) |
|||
|
2.2 |
Djur som levererats smutsiga |
||
|
2.3 |
Kliniska fynd (sjukdom) |
||
|
Antal berörda djur |
|||
|
Typ/klass/ålder |
|||
|
Iakttagelser |
|||
|
Inspektionsdatum |
|||
|
2.4 |
Laboratorieresultat (1) |
||
|
3. |
Resultat av besiktning efter slakt |
||
|
3.1 |
(Makroskopiska) fynd |
||
|
Antal berörda djur |
|||
|
Typ/klass/ålder |
|||
|
Angripet organ eller lokalisering på djuret |
|||
|
Datum för slakt |
|||
|
3.2 |
Sjukdom (kod kan användas (2)) |
||
|
Antal berörda djur |
|||
|
Typ/klass/ålder |
|||
|
Angripet organ eller del av djuret |
|||
|
Delvis eller helt kasserad slaktkropp (ange skäl) |
|||
|
Datum för slakt |
|||
|
3.3 |
Laboratorieresultat (3) |
||
|
3.4 |
Övriga resultat (t.ex. parasiter, främmande föremål) |
||
|
3.5 |
Djurskyddsrelaterade fynd (t.ex. brutna ben) |
||
|
4. |
Ytterligare information |
||
|
5. |
Kontaktinformation |
||
|
5.1 |
Slakteri (godkännandenummer) |
||
|
Namn |
|||
|
Fullständig adress |
|||
|
Telefonnummer |
|||
|
5.2 |
E-postadress om sådan finns |
||
|
6. |
Officiell veterinär (namn med tryckbokstäver) |
||
|
Underskrift och stämpel |
|||
|
7. |
Datum |
||
|
8. |
Antal sidor som bifogas denna blankett |
||
|
(1) Mikrobiologiska, kemiska, serologiska osv. (bifoga resultaten). (2) Den behöriga myndigheten får införa följande koder: Kod A för sjukdomar förtecknade av OIE, koderna B100 och B200 för djurskyddsfrågor (avsnitt I kapitel II del C i bilaga I till förordning (EG) nr 854/2004) samt koderna C100 till C290 för beslut om kött (avsnitt II kapitel V punkt 1 a–u i bilaga I till förordning (EG) nr 854/2004). Kodsystemet kan vid behov innehålla ytterligare underkategorier (t.ex. C141 för en mild allmän sjukdom, C142 för en allvarligare sjukdom osv.). Om koder används skall de vara lättillgängliga för livsmedelsföretagaren och åtföljas av lämpliga förklaringar om vad de innebär. (3) Mikrobiologiska, kemiska, serologiska osv. (bifoga resultaten). |
|||
BILAGA II
FISKERIPRODUKTER
AVSNITT I
LIVSMEDELSFÖRETAGARNAS SKYLDIGHETER
I detta avsnitt anges närmare bestämmelser för okulärbesiktning i syfte att upptäcka parasiter i fiskeriprodukter.
KAPITEL I
DEFINITIONER
1. Synlig parasit: en parasit eller grupp av parasiter av en storlek, färg eller struktur som är klart urskiljbar från fiskvävnad.
2. Okulärbesiktning: en icke-destruktiv undersökning av fisk eller fiskeriprodukter med eller utan optisk förstoring och under goda ljusförhållanden för det mänskliga ögat, och som vid behov inbegriper genomlysning.
3. Genomlysning: plattfiskar och fiskfiléer skall hållas upp mot en ljuskälla i ett mörklagt rum för att upptäcka parasiter.
KAPITEL II
OKULÄRBESIKTNING
1. Okulärbesiktning skall göras på ett representativt stickprov. De personer som är ansvariga för anläggningar på land och sakkunnig personal ombord på fabriksfartygen skall bestämma hur omfattande besiktningarna skall vara och hur ofta de skall göras med hänsyn till fiskeriprodukternas art, geografiska ursprung och användning. Sakkunnig personal skall under tillverkningen okulärbesikta den rensade fiskens bukhåla samt lever och rom, avsedda som livsmedel. Beroende på rensningstekniken skall okulärbesiktningen utföras
a) fortlöpande under rensningen och sköljningen av den som utför arbetet då det är fråga om manuell rensning,
b) genom stickprov på ett representativt urval av minst tio fiskar per parti då det är fråga om mekanisk rensning.
2. Sakkunnig personal skall okulärbesikta fiskfiléerna eller fiskskivorna under putsningen och efter filetering eller skivning. Om en individuell undersökning inte kan göras på grund av filéernas storlek eller fileteringsmetoderna skall en plan för stickprovskontroll utarbetas och hållas tillgänglig för den behöriga myndigheten i enlighet med avsnitt VIII kapitel II punkt 4 i bilaga III till förordning (EG) nr 853/2004. Om genomlysning av filéerna är tekniskt nödvändig skall sådan ingå i planen.
AVSNITT II
DE BEHÖRIGA MYNDIGHETERNAS SKYLDIGHETER
KAPITEL I
GRÄNSVÄRDEN FÖR DEN TOTALA MÄNGDEN FLYKTIGA KVÄVEBASER (TVB-N) FÖR VISSA KATEGORIER AV FISKERIPRODUKTER OCH ANALYSMETODER SOM SKALL ANVÄNDAS
1. När den organoleptiska bedömningen föranleder tvivel om produkternas färskhet ska obearbetade fiskeriprodukter betraktas som otjänliga som livsmedel om den kemiska kontrollen visar att följande gränsvärden för TVB-N har överskridits:
a) 25 milligram kväve/100 gram fiskkött för de arter som avses i kapitel II punkt 1.
b) 30 milligram kväve/100 gram fiskkött för de arter som avses i kapitel II punkt 2.
c) 35 milligram kväve/100 gram fiskkött för de arter som avses i kapitel II punkt 3.
d) 60 milligram kväve/100 gram hela fiskeriprodukter som används direkt för framställning av fiskolja som är avsedd att användas som livsmedel i enlighet med avsnitt VIII kapitel IV del B.1 andra stycket i bilaga III till förordning (EG) nr 853/2004. När råvaran uppfyller kraven i del B.1 a, b och c i det kapitlet får dock medlemsstaterna fastställa högre gränsvärden för vissa arter i väntan på att särskild gemenskapslagstiftning antas.
Den referensmetod som ska användas för kontroll av gränsvärdena för TVB-N innebär destillation av ett extrakt som har gjorts proteinfritt med sådan perklorsyra som avses i kapitel III.
2. Den destillation som avses i punkt 1 måste utföras med en apparat som överensstämmer med bilden i kapitel IV.
3. Följande rutinmetoder kan användas för kontroll av gränsvärdet för TVB-N:
— Den av Conway och Byrne (1933) beskrivna mikrodiffusionsmetoden.
— Den direkta destillationsmetod som beskrivits av Antonacopoulos (1968).
— Destillation av ett extrakt som gjorts proteinfritt med triklorättiksyra (Codex Alimentariuskommittén för fisk och fiskprodukter (1968).
4. Provet skall utgöras av cirka 100 gram fiskkött som tagits på minst tre olika ställen och som malts samman.
Medlemsstaterna skall rekommendera de officiella laboratorierna att rutinmässigt använda den referensmetod som anges ovan. Om resultaten är tvetydiga eller vid tvister om de resultat som har erhållits vid en analys med en av rutinmetoderna får endast referensmetoden användas för att kontrollera resultaten.
KAPITEL II
KATEGORIER AV ARTER FÖR VILKA ETT GRÄNSVÄRDE FÖR TVB-N ÄR FASTSTÄLLT
1. Sebastes spp., Helicolenus dactylopterus, Sebastichthys capensis.
2. Arter tillhörande familjen Pleuronectidae (med undantag av hälleflundra: Hippoglossus spp.).
3. Salmo salar, arter tillhörande familjen Merlucciidae, arter tillhörande familjen Gadidae.
KAPITEL III
BESTÄMNING AV HALTEN FLYKTIGA KVÄVEBASER (TVB-N) HOS FISKAR OCH FISKERIPRODUKTER
Referensmetod
1. Syfte och tillämpningsområde
Denna metod beskriver en referensmetod för bestämning av kvävehalten i flyktiga kvävebaser (TVB-N) hos fiskar och fiskeriprodukter. Metoden tillämpas på de halter TVB-N som ligger mellan 5 mg/100 g och minst 100 mg/100 g.
2. Definition
Med halten TVB-N avses den halt av kväve i flyktiga kvävebaser som bestäms enligt den beskrivna metoden.
Halten skall uttryckas i mg/100 g.
3. Kortfattad beskrivning
De flyktiga kvävebaserna fås från ett extrakt av ett prov med hjälp av en 0,6 mol perklorlösning. Efter alkalisering får extraktet genomgå ångdestillation och de flyktiga grundbeståndsdelarna absorberas av en syrarecipient. Halten TVB-N bestäms genom titrering av de absorberade baserna.
4. Kemikalier
Om inget annat anges skall analysrena (reagent-grade) kemikalier användas som reagensmedel. Det vatten som används skall antingen destilleras eller avmineraliseras och det skall ha minst samma renhetsgrad. Om inget annat anges, avses med lösning en vattenlösning enligt följande:
a) Perklorsyralösning = 6 g/100 ml.
b) Natriumhydroxidlösning = 20 g/100 ml.
c) Standardlösning av saltsyra 0,05 mol/l (0,05 N).
|
Anmärkning: |
När en automatisk destillationsapparat används skall titreringen göras med en standardlösning av saltsyra på 0,01 mol/l (0,01 N). |
d) Borsyrelösning = 3 g/100 ml.
e) Skumhämmande silikonemulsion.
f) Fenolftaleinlösning = 1 g/100 ml 95 % etanol.
g) Indikatorlösning (Tashiro Mixed Indicator) 2 g metylrött och 1 g metylenblått upplöses i 1 000 ml 95 % etanol.
5. Instrument och tillbehör
a) En köttkvarn som ger en tillräckligt homogen fiskfärs.
b) Blandare med mycket hög hastighet (mellan 8 000 och 45 000 varv/min).
c) Veckat filter, 150 mm i diameter, med snabbfiltrering.
d) Byrett, 5 ml, med 0,01 ml-gradering.
e) Apparat för ångdestillation. Denna apparat skall kunna reglera olika kvantiteter ånga och producera en konstant kvantitet ånga under en bestämd tidsperiod. Den skall vara konstruerad på ett sådant sätt att de fria baserna inte kan försvinna under tillsättningen av alkaliska ämnen.
6. Utförande
Observera: Vid hantering av den starkt frätande perklorsyran skall nödvändiga försiktighetsåtgärder och förebyggande åtgärder vidtas. Proverna bör förberedas snarast möjligt efter ankomsten i enlighet med följande anvisningar:
a)
Det prov som skall analyseras skall noggrant malas sönder i en sådan köttkvarn som avses i punkt 5 a. Väg noggrant upp 10 g ± 0,1 g av det malda i en lämplig behållare. Blanda med 90,0 ml perklorsyralösning i enlighet med punkt 4 a, homogenisera under två minuter i en sådan blandare som avses i punkt 5 b, filtrera därefter.
Det på detta sätt erhållna extraktet kan förvaras under minst sju dagar vid en temperatur på mellan 2 oC och 6 oC.
b)
Placera 50,0 ml av det extrakt som har erhållits i enlighet med led a i en sådan ångdestillationsapparat som beskrivs i punkt 5 e. För en sista kontroll om alkaliseringen av extraktet räcker, tillsätt ytterligare några droppar fenolftalein i enlighet med punkt 4 f. Efter det att några droppar skumhämmande silikonemulsion har tillsatts skall till extraktet tillsättas 6,5 ml natriumhydroxidlösning i enlighet med punkt 4 b varefter ångdestillationen omedelbart inleds.
Reglera ångdestillationen på ett sådant sätt att cirka 100 ml destillat bildas på tio minuter. Sänk ned slutstycket med destillatet i en behållare innehållande 100 ml av en borsyrelösning i enlighet med punkt 4 d till vilken 3–5 droppar av den indikatorlösning som beskrivs under punkt 4 g tillsätts. Efter exakt tio minuter är destillationen avslutad. Ta upp slutstycket ur behållaren och skölj det under vatten. Bestäm de flyktiga baser som finns i lösningen i behållaren genom titrering i en standardlösning av saltsyra i enlighet med punkt 4 c.
pH-värdet i slutfasen bör vara 5,0 ± 0,1.
c)
Analyserna skall utföras två gånger. Den metod som tillämpas är riktig om skillnaden mellan de båda analyserna inte överstiger 2 mg/100 g.
d)
Utför ett blankprov i enlighet med punkt b. I stället för extraktet används 50,0 ml perklorsyralösning i enlighet med punkt 4 a.
7. Beräkning av TVB-N
Beräkna halten TVB-N genom titrering av saltsyralösningen i behållaren i enlighet med punkt 4 c genom tillämpning av följande ekvation:
![]()
V1 = volym saltsyralösning 0,01 mol i ml per prov
V0 = volym saltsyralösning 0,01 mol i ml per blankprov
M = vikt per prov i g
Anmärkningar
1. Analyserna skall utföras två gånger. Den metod som tillämpas är riktig om skillnaden mellan de båda analyserna inte överstiger 2 mg/100 g.
2. Kontrollera utrustningen genom att destillera NH4Cl–lösningar motsvarande 50 mg TVB-N/100 g.
3. Reproducerbarhetens standardavvikelse Sr = 1,20 mg/100 g. Jämförbarhetens standardavvikelse SR = 2,50mg/100 g.
KAPITEL IV
ÅNGDESTILLATIONSAPPARAT FÖR TVB-N
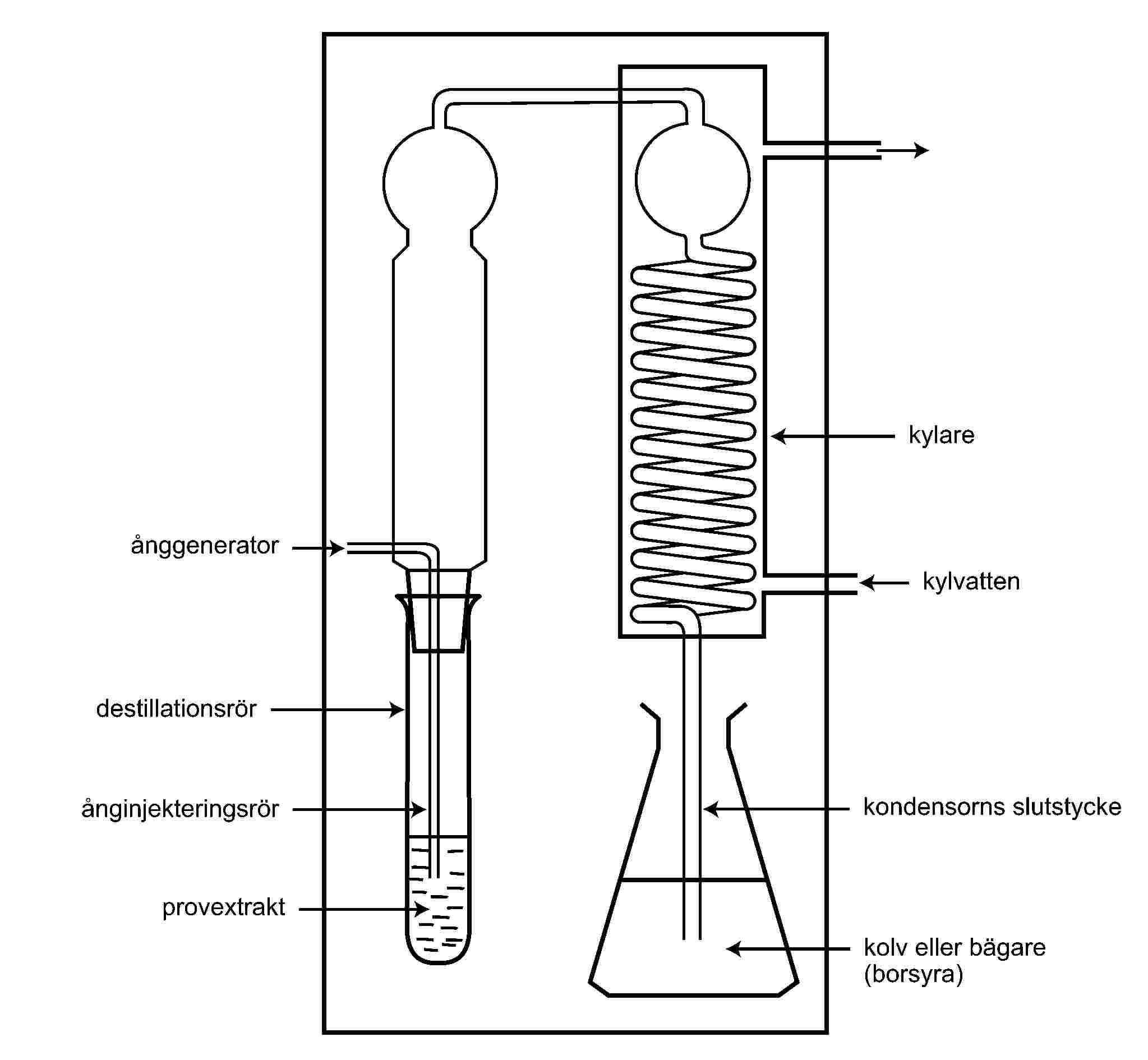
BILAGA III
ERKÄNDA TESTMETODER FÖR DETEKTION AV MARINA BIOTOXINER
Följande analysmetoder skall användas av de behöriga myndigheterna, och i förekommande fall av livsmedelsföretagarna, för att kontrollera att de gränsvärden som anges i avsnitt VII kapitel V punkt 2 i bilaga III till förordning (EG) nr 853/2004 inte överskrids.
I enlighet med artikel 7.2 och 7.3 i rådets direktiv 86/609/EEG ( 8 ) skall ersättning, förbättring och inskränkning övervägas när biologiska metoder används.
KAPITEL I
METOD FÖR DETEKTION AV PARALYTISKT SKALDJURSGIFT (PSP)
1. Halten paralytiskt skaldjursgift (PSP) i blötdjurets ätbara delar (hela kroppen eller varje ätbar del separat) måste påvisas i enlighet med den biologiska testmetoden eller någon annan internationellt erkänd metod. Den s.k. Lawrencemetoden, som publicerades i AOAC Official Method 2005.06 (Paralytic Shellfish Poisoning Toxins in Shellfish), får också användas som alternativ metod för att påvisa dessa toxiner.
2. Om det råder tvivel om resultaten skall den biologiska metoden vara referensmetod.
3. Punkterna 1 och 2 kommer att ses över när gemenskapens referenslaboratorium för marina biotoxiner har lyckats harmonisera genomförandestegen för Lawrencemetoden.
KAPITEL II
METOD FÖR DETEKTION AV AMNESIFRAMKALLANDE SKALDJURSGIFT (ASP)
Den totala halten amnesiframkallande skaldjursgift (ASP) i blötdjurets ätbara delar (hela kroppen eller varje ätbar del separat) skall påvisas med hjälp av högtrycksvätskekromatografi (HPLC) eller någon annan internationellt erkänd metod.
Vid screening får dock även ELISA-metoden 2006.02 för ASP, sådan den beskrivs i juniutgåvan 2006 av AOAC Journal, användas för detektion av den totala halten ASP i blötdjurets ätbara delar.
Om resultaten ifrågasätts skall HPLC vara referensmetod.
KAPITEL III
METODER FÖR DETEKTION AV FETTLÖSLIGA TOXINER
A. Kemiska metoder
1. LC-MS/MS-metoden från EU:s referenslaboratorium för marina biotoxiner ska vara referensmetod för detektion av de marina toxiner som anges i avsnitt VII kapitel V punkt 2 c, d och e i bilaga III till förordning (EG) nr 853/2004. Denna metod ska åtminstone detektera följande föreningar:
|
— |
Toxiner som hör till gruppen okadasyra : OA, DTX1, DTX2 och DTX3, inklusive deras estrar. |
|
— |
Toxiner som hör till gruppen pectenotoxiner : PTX1 och PTX2. |
|
— |
Toxiner som hör till gruppen yessotoxiner : YTX, 45-OH-YTX, homo-YTX och 45-OH-homo-YTX. |
|
— |
Toxiner som hör till gruppen azaspiracider : AZA1, AZA2 och AZA3. |
2. Toxiska ekvivalensfaktorer (TEF) ska användas för att beräkna den totala halten toxiska ekvivalenter, enligt Efsas rekommendationer.
3. Om nya analoger av betydelse för människors hälsa påvisas ska dessa inbegripas i analysen. Toxiska ekvivalensfaktorer (TEF) ska användas för att beräkna den totala halten toxiska ekvivalenter, enligt Efsas rekommendationer.
4. Andra metoder, till exempel vätskekromatografi-masspektrometri (LC-MS), högtrycksvätskekromatografi (HPLC) med lämplig detektion, immunanalyser och funktionella analyser, såsom fosfatasinhiberingsmetoden, kan användas som alternativ eller komplement till LC-MS/MS-metoden från EU:s referenslaboratorium för marina biotoxiner om följande villkor är uppfyllda:
a) Med en av dessa metoder eller med en kombination kan man åtminstone detektera de analoger som anges i punkt A.1 i detta kapitel. Vid behov ska lämpligare kriterier definieras.
b) Metoderna uppfyller prestandakraven för metoden som EU:s referenslaboratorium för marina biotoxiner fastställt. ►C1 Sådana metoder bör genomgå intern validering och de bör framgångsrikt ha genomgått en erkänd kvalifikationsprövning. ◄ EU:s referenslaboratorium för marina biotoxiner ska stödja aktiviteter som syftar till en kollaborativ avprövning av metoden för att möjliggöra en formell standardisering.
c) Genom att tillämpa dessa metoder uppnår man ett likvärdigt skydd för människors hälsa.
B. Biologiska metoder
1. För att ge medlemsstaterna möjlighet att anpassa sina metoder till LC-MS/MS-metoden som definieras i punkt A.1 i detta kapitel kan en rad förfaranden för bioassay på möss, som skiljer sig åt vad gäller provstorlek (hepatopancreas eller hela kroppen) och vad gäller de lösningsmedel som använts för extraktion och rening, användas till och med den 31 december 2014 för detektion av de marina toxiner som anges i avsnitt VII kapitel V punkt 2 c, d och e i bilaga III till förordning (EG) nr 853/2004.
2. Känslighet och selektivitet beror på vilket lösningsmedel som används för extraktion och rening, vilket bör beaktas när det bestäms vilken metod som ska användas så att samtliga toxiner omfattas.
3. En enda bioassay på möss med acetonextraktion kan användas för detektion av okadasyra, dinophysistoxiner, azaspiracider, pectenotoxiner och yessotoxiner. Denna bioassay kan vid behov kompletteras med vätske-vätskeextraktion med etylacetat/vatten eller diklormetan/vatten för att avlägsna eventuella interferenser.
4. Tre möss ska användas för varje test. Om två av de tre mössen dör inom 24 timmar efter det att de injicerats med extrakt motsvarande 5 g hepatopancreas eller 25 g helkroppssubstans ska det anses vara en indikation på att ett eller flera av de toxiner som anges i avsnitt VII kapitel V punkt 2 c, d och e i bilaga III till förordning (EG) nr 853/2004 förekommer i halter som överstiger de fastställda gränsvärdena.
5. En bioassay på möss med acetonextraktion följt av vätske-vätskeextraktion med dietyleter kan användas för detektion av okadasyra, dinophysistoxiner, pectenotoxiner och azaspiracider, men den kan inte användas för detektion av yessotoxiner eftersom det kan förekomma förluster av dessa toxiner under separationen. Tre möss ska användas för varje test. Om två av de tre mössen dör inom 24 timmar efter det att de injicerats med extrakt motsvarande 5 g hepatopancreas eller 25 g helkroppssubstans ska det anses vara en indikation på att okadasyra, dinophysistoxiner, pectenotoxiner och azaspiracider förekommer i halter som överstiger de gränsvärden som anges i avsnitt VII kapitel V punkt 2 c och e i bilaga III till förordning (EG) nr 853/2004.
6. Bioassay på råttor kan användas för detektion av okadasyra, dinophysistoxiner och azaspiracider. Tre råttor ska användas för varje test. Om någon av de tre råttorna reagerar med diarré ska det anses vara en indikation på att okadasyra, dinophysistoxiner och azaspiracider förekommer i halter som överstiger de gränsvärden som anges i avsnitt VII kapitel V punkt 2 c och e i bilaga III till förordning (EG) nr 853/2004.
|
C. |
Efter den period som fastställs i punkt B.1 i detta kapitel ska bioassay på möss endast användas vid periodisk kontroll av produktions- och återutläggningsområden för detektion av nya eller okända marina toxiner på grundval av nationella kontrollprogram som utarbetats av medlemsstaterna. |
BILAGA IV
KALCIUMHALTEN I MASKINURBENAT KÖTT
Kalciumhalten i maskinurbenat kött enligt förordning (EG) nr 853/2004
1. får inte överskrida 0,1 % (=100 mg/100 g eller 1 000 ppm) av färskvaran,
2. skall bestämmas genom en standardiserad internationell metod.
BILAGA V
FÖRTECKNINGAR ÖVER GODKÄNDA LIVSMEDELSANLÄGGNINGAR
KAPITEL I
TILLGÅNG TILL FÖRTECKNINGAR ÖVER GODKÄNDA LIVSMEDELSANLÄGGNINGAR
För att medlemsstaterna lättare skall kunna ge övriga medlemsstater och allmänheten tillgång till aktuella förteckningar över godkända livsmedelsanläggningar skall kommissionen tillhandahålla en webbplats med länkar till varje medlemsstats nationella webbplats.
KAPITEL II
DE NATIONELLA WEBBPLATSERNAS UTFORMNING
A. Huvudförteckning
1. Varje medlemsstat skall se till att kommissionen får en länkadress till en enda nationell webbplats med en huvudförteckning över godkända livsmedelsanläggningar för sådana produkter av animaliskt ursprung som definieras i punkt 8.1 i bilaga I till förordning (EG) nr 853/2004.
2. Huvudförteckningen enligt punkt 1 skall bestå av ett blad och skall sammanställas på ett eller flera av gemenskapens officiella språk.
B. Utformning
1. Webbplatsen med huvudförteckningen skall utformas av den behöriga myndigheten eller, i förekommande fall, av någon av de behöriga myndigheter som avses i artikel 4 i förordning (EG) nr 882/2004.
2. Huvudförteckningen skall innehålla länkar till
a) andra webbsidor på samma webbplats,
b) webbplatser som administreras av andra behöriga myndigheter, enheter eller organ, om vissa förteckningar över godkända livsmedelsanläggningar inte administreras av den behöriga myndighet som avses i punkt 1.
KAPITEL III
LAYOUT OCH KODER FÖR FÖRTECKNINGAR ÖVER GODKÄNDA ANLÄGGNINGAR
Layouten, inbegripet relevanta uppgifter och koder, skall fastställas för att garantera att informationen om godkända livsmedelsanläggningar är lättillgänglig och för att göra förteckningarna mer användarvänliga.
KAPITEL IV
TEKNISKA SPECIFIKATIONER
De uppgifter och det arbete som avses i kapitlen II och III skall utföras i enlighet med de tekniska specifikationer som kommissionen har offentliggjort.
BILAGA VI
FÖRLAGOR TILL HÄLSOINTYG OCH DOKUMENT FÖR IMPORT AV VISSA PRODUKTER AV ANIMALISKT URSPRUNG
AVSNITT I
KAPITEL I
GRODLÅR OCH SNÄCKOR
Hälsointygen enligt artikel 6.1 d i förordning (EG) nr 853/2004 för import av grodlår och snäckor ska följa förlagorna i del A respektive del B i tillägg I till denna bilaga.
KAPITEL II
GELATIN
Hälsointygen enligt artikel 6.1 d i förordning (EG) nr 853/2004 för import av gelatin och råvaror för framställning av gelatin ska följa förlagorna i del A respektive del B i tillägg II till denna bilaga, utan att det påverkar tillämpningen av annan särskild unionslagstiftning, särskilt lagstiftning om transmissibla spongiforma encefalopatier och hormoner.
KAPITEL III
KOLLAGEN
Hälsointygen enligt artikel 6.1 d i förordning (EG) nr 853/2004 för import av kollagen och råvaror för framställning av kollagen ska följa förlagorna i del A respektive del B i tillägg III till denna bilaga, utan att det påverkar tillämpningen av annan särskild unionslagstiftning, särskilt lagstiftning om transmissibla spongiforma encefalopatier och hormoner.
KAPITEL IV
FISKERIPRODUKTER
Hälsointyget enligt artikel 6.1 d i förordning (EG) nr 853/2004 för import av fiskeriprodukter ska följa förlagan i tillägg IV till denna bilaga.
KAPITEL V
LEVANDE MUSSLOR
Hälsointyget enligt artikel 6.1 d i förordning (EG) nr 853/2004 för import av levande musslor ska följa förlagan i tillägg V till denna bilaga.
KAPITEL VI
HONUNG OCH ANDRA BIODLINGSPRODUKTER
Hälsointyget enligt artikel 6.1 d i förordning (EG) nr 853/2004 för import av honung och andra biodlingsprodukter ska följa förlagan i tillägg VI till denna bilaga.
AVSNITT II
FÖRLAGA TILL DOKUMENT SOM SKA UNDERTECKNAS AV KAPTENEN
Det dokument som ska undertecknas av kaptenen och som i enlighet med artikel 15.3 i förordning (EG) nr 854/2004 får ersätta det dokument som krävs enligt artikel 14 i den förordningen ska följa förlagan i tillägg VII till denna bilaga.
Tillägg I till bilaga VI
DEL A
FÖRLAGA TILL HÄLSOINTYG FÖR IMPORT AV KYLDA, FRYSTA ELLER BEREDDA GRODLÅR AVSEDDA ATT ANVÄNDAS SOM LIVSMEDEL


DEL B
FÖRLAGA TILL HÄLSOINTYG FÖR IMPORT AV KYLDA, FRYSTA, SKALADE, KOKTA, BEREDDA ELLER KONSERVERADE SNÄCKOR AVSEDDA ATT ANVÄNDAS SOM LIVSMEDEL


Tillägg II till bilaga VI
DEL A
FÖRLAGA TILL HÄLSOINTYG FÖR IMPORT AV GELATIN AVSETT ATT ANVÄNDAS SOM LIVSMEDEL


DEL B
FÖRLAGA TILL HÄLSOINTYG FÖR IMPORT AV RÅVAROR FÖR FRAMSTÄLLNING AV GELATIN AVSETT ATT ANVÄNDAS SOM LIVSMEDEL


Tillägg III till bilaga VI
DEL A
FÖRLAGA TILL HÄLSOINTYG FÖR IMPORT AV KOLLAGEN AVSETT ATT ANVÄNDAS SOM LIVSMEDEL


DEL B
FÖRLAGA TILL HÄLSOINTYG FÖR IMPORT AV RÅVAROR FÖR FRAMSTÄLLNING AV KOLLAGEN AVSETT ATT ANVÄNDAS SOM LIVSMEDEL


Tillägg IV till bilaga VI
Förlaga till hälsointyg för import av fiskeriprodukter avsedda att användas som livsmedel

![Del II: IntygLANDFiskeriprodukterII. HälsoinformationII.a. Intyg nrII.b.II.1. (1) HälsointygJag intygar att jag är förtrogen med de tillämpliga bestämmelserna i förordningarna (EG) nr 178/2002, (EG) nr 852/2004, (EG) nr 853/2004 och (EG) nr 854/2004 och att de ovan beskrivna fiskeriprodukterna har framställts i enlighet med kraven i dessa förordningar, särskilt när det gäller följande:De kommer från en anläggning (anläggningar) som tillämpar ett HACCP-baserat program i enlighet med förordning (EG) nr 852/2004.De har fångats och hanterats ombord på fartyg, landats, hanterats och, i förekommande fall, beretts, bearbetats, frysts och tinats under hygieniska förhållanden i enlighet med kraven i avsnitt VIII kapitlen I–IV i bilaga III till förordning (EG) nr 853/2004.De uppfyller hälsokraven i avsnitt VIII kapitel V i bilaga III till förordning (EG) nr 853/2004 och kriterierna i förordning (EG) nr 2073/2005 om mikrobiologiska kriterier för livsmedel.De har förpackats, lagrats och transporterats i enlighet med avsnitt VIII kapitlen VI–VIII i bilaga III till förordning (EG) nr 853/2004.De har märkts i enlighet med avsnitt I i bilaga II till förordning (EG) nr 853/2004.De uppfyller de garantier för levande djur och produkter framställda därav, när det gäller produkter från vattenbruk, som föreskrivs i de program för påvisande av restsubstanser som lämnats in enligt direktiv 96/23/EG, särskilt artikel 29.De har utan anmärkning underkastats de offentliga kontroller som fastställs i bilaga III till förordning (EG) nr 854/2004.II.2. (2) (4) Djurhälsointyg för fisk och kräftdjur från vattenbrukII.2.1. (3) (4) Krav för arter som är mottagliga för epizootisk hematopoietisk nekros (EHN), Taura-syndrom och Yellowhead diseaseI egenskap av officiell inspektör intygar jag att de djur/produkter från vattenbruk som avses i del I i detta intyg(5) härrör från ett land/område, en zon eller ett delområde som av den behöriga myndigheten i mitt land har förklarats fri/fritt från (4) [EHN] (4) [Taura-syndrom] (4) [Yellowhead disease] i enlighet med kapitel VII i direktiv 2006/88/EG eller relevant OIE-standard,i) där de relevanta sjukdomarna är anmälningspliktiga till den behöriga myndigheten och den behöriga myndigheten omedelbart ska undersöka rapporter om misstanke om infektion av den relevanta sjukdomen,ii) där all införsel av arter som är mottagliga för de relevanta sjukdomarna sker från ett område som förklarats fritt från sjukdomen, ochiii) arter som är mottagliga för de relevanta sjukdomarna inte har vaccinerats mot dessa sjukdomar.]II.2.2. (3) (4) [Krav för arter som är mottagliga för viral hemorragisk septikemi (VHS), infektiös hematopoietisk nekros (IHN), infektiös laxanemi (ISA), koiherpesvirus (KHV) och vit pricksjuka och som är avsedda för en medlemsstat, en zon eller ett delområde som förklarats fri/fritt från sjukdom eller som omfattas av ett övervaknings- eller utrotningsprogram för den relevanta sjukdomenI egenskap av officiell inspektör intygar jag att de djur/produkter från vattenbruk som avses i del I i detta intyg(6) härrör från ett land/område, en zon eller ett delområde som av den behöriga myndigheten i mitt land har förklarats fri/fritt från (4) [VHS] (4) [IHN] (4) [ISA] (4) [KHV] (4) [vit pricksjuka] i enlighet med kapitel VII i direktiv 2006/88/EG eller relevant OIE-standard,i) där de relevanta sjukdomarna är anmälningspliktiga till den behöriga myndigheten och den behöriga myndigheten omedelbart ska undersöka rapporter om misstanke om infektion av den relevanta sjukdomen,ii) där all införsel av arter som är mottagliga för de relevanta sjukdomarna sker från ett område som förklarats fritt från sjukdomen, ochiii) arter som är mottagliga för de relevanta sjukdomarna inte har vaccinerats mot dessa sjukdomar.]II.2.3. Transport- och märkningskravI egenskap av officiell inspektör intygar jag följande:II.2.3.1. De ovannämnda vattenbruksdjuren har transporterats under förhållanden, bland annat vad gäller vattenkvalitet, som inte påverkar deras hälsostatus.II.2.3.2. Transportbehållaren eller brunnbåten hade rengjorts och desinficerats före lastning eller var oanvänd.](./../../../resource.html?uri=celex:02005R2074-20121126.SWE.xhtml.L_2012306SV.01000401.tif.jpg)
![LANDFiskeriprodukterII. HälsoinformationII.a. Intyg nrII.b.II.2.3.3. Sändningen har identifierats genom en läslig etikett på utsidan av behållaren, eller vid transport med brunnbåt i fartygsmanifestet, med de relevanta uppgifterna i fälten I.7–I.11 i del I i detta intyg och följande text:”(4) [Fiskar] (4) [Kräftdjur] avsedda att användas som livsmedel i unionen”.AnmärkningarDel I:Fält I.8: Ursprungsregion: Ange produktionsområde för frysta eller bearbetade musslor.Fält I.11: Ursprungsort: Den avsändande anläggningens namn och adress.Fält I.15: Registreringsnummer (järnvägsvagn eller containrar och lastbilar), flightnummer (flyg) eller namn (fartyg). Särskilda uppgifter ska lämnas vid eventuell ur- och omlastning.Fält I.19: Ange lämplig kod enligt Harmoniserade systemets (HS) nomenklatur (Världstullorganisationen) som omfattas av följande rubriker: 0301, 0302, 0303, 0304, 0305, 0306, 0307, 0308, 0511, 1504, 1516, 1518, 1603, 1604, 1605 eller 2106.Fält I.23: Identifiering av container/förseglingsnummer: Om förseglingen har ett löpnummer ska detta anges.Fält I.28: Typ av vara: Ange om odlade eller vildfångade.Typ av behandling: Ange om levande, kylda, frysta eller bearbetade.Tillverkningsanläggning: Omfattar fabriksfartyg, frysfartyg, kyl-/fryshus, bearbetningsanläggning.Del II:(1) Del II.1 i detta intyg gäller inte länder där det tillämpas särskilda krav för utfärdande av hälsointyg som fastställts i likvärdighetsavtal eller annan unionslagstiftning.(2) Del II.2 i detta intyg gäller intea) icke livsdugliga kräftdjur, dvs. kräftdjur som inte längre kan överleva om de återinsätts i den miljö de kommer ifrån,b) fisk som har slaktats och rensats innan den avsänds,c) djur och produkter från vattenbruk som släpps ut på marknaden utan vidarebearbetning för att användas som livsmedel förutsatt att de är förpackade i detaljhandelsförpackningar som uppfyller bestämmelserna för sådana förpackningar i förordning (EG) nr 853/2004,d) kräftdjur avsedda för bearbetningsanläggningar som godkänts enligt artikel 4.2 i direktiv 2006/88/EG, eller leveransanläggningar, reningsanläggningar eller liknande företag som är utrustade med ett system för rening av utloppsvatten varigenom patogenerna i fråga inaktiveras, eller där utloppsvattnet renas på annat sätt som minskar risken för överföring av sjukdomar till naturliga vatten till en acceptabel nivå,e) kräftdjur som är avsedda för vidarebearbetning före användning som livsmedel utan tillfällig lagring vid platsen för bearbetningen och som har förpackats och märkts för detta ändamål i enlighet med förordning (EG) nr 853/2004.(3) Delarna II.2.1 och II.2.2 i detta intyg gäller endast arter som är mottagliga för en eller flera av de sjukdomar som anges i rubriken till den berörda delen. Mottagliga arter förtecknas i bilaga IV till direktiv 2006/88/EG.(4) Stryk det som inte är tillämpligt.(5) För att få föras in i någon del av unionen ska denna förklaring göras om sändningen innehåller arter som är mottagliga för EHN, Taura-syndrom och/eller Yellowhead disease.](./../../../resource.html?uri=celex:02005R2074-20121126.SWE.xhtml.L_2012306SV.01000501.tif.jpg)

Tillägg V till bilaga VI
DEL A
FÖRLAGA TILL HÄLSOINTYG FÖR IMPORT AV LEVANDE MUSSLOR, TAGGHUDINGAR, MANTELDJUR OCH MARINA SNÄCKOR AVSEDDA ATT ANVÄNDAS SOM LIVSMEDEL

![Del II: IntygLANDLevande musslor, tagghudingar, manteldjur och marina snäckorII. HälsodeklarationII.a. Intyg nrII.b.II.1 (1)Hälsointyg för levande musslor, tagghudingar, manteldjur och marina snäckorJag intygar att jag är förtrogen med de tillämpliga bestämmelserna i förordningarna (EG) nr 178/2002, (EG) nr 852/2004, (EG) nr 853/2004 och (EG) nr 854/2004 och att de ovan beskrivna (4)[levande musslorna] (4)[levande tagghudingarna] (4)[levande manteldjuren] (4)[levande marina snäckorna] har producerats i enlighet med kraven i dessa förordningar, särskilt när det gäller följande:De kommer från en anläggning (anläggningar) som tillämpar ett HACCP-baserat program i enlighet med förordning (EG) nr 852/2004.De har upptagits, eventuellt återutlagts och transporterats i enlighet med avsnitt VII kapitlen I och II i bilaga III till förordning (EG) nr 853/2004.De har hanterats, eventuellt rengjorts och förpackats i enlighet med avsnitt VII kapitlen III och IV i bilaga III till förordning (EG) nr 853/2004.De uppfyller hälsokraven i avsnitt VII kapitel V i bilaga III till förordning (EG) nr 853/2004 och kriterierna i förordning (EG) nr 2073/2005 om mikrobiologiska kriterier för livsmedel.De har förpackats, lagrats och transporterats i enlighet med avsnitt VII kapitlen VI och VIII i bilaga III till förordning (EG) nr 853/2004.De har märkts i enlighet med avsnitt I i bilaga II och avsnitt VII kapitel VII i bilaga III till förordning (EG) nr 853/2004.Om det rör sig om kammusslor som upptagits utanför de klassificerade produktionsområdena uppfyller dessa de särskilda kraven i avsnitt VII kapitel IX i bilaga III till förordning (EG) nr 853/2004.De har utan anmärkning underkastats de offentliga kontroller som fastställs i bilaga II till förordning (EG) nr 854/2004.II.2 (2)(4)Djurhälsointyg för levande musslor från vattenbrukII.2.1 (3)(4)[Krav för arter som är mottagliga för Bonamia exitiosa, Perkinsus marinus och Microcytos mackiniI egenskap av officiell inspektör intygar jag att de levande musslor som avses i del I i detta intyg(5)härrör från ett land/område, en zon eller ett delområde som av den behöriga myndigheten i mitt land har förklarats fri/fritt från (4)[Bonamia exitios] (4)[Perkinsus marinus] (4)[Mikrocytos mackini] i enlighet med kapitel VII i direktiv 2006/88/EG eller relevant OIE- standard,där de relevanta sjukdomarna är anmälningspliktiga till den behöriga myndigheten och de offentliga myndigheterna omedelbart ska undersöka rapporter om misstanke om infektion av den relevanta sjukdomen, ochdär all införsel av arter som är mottagliga för de relevanta sjukdomarna sker från ett område som förklarats fritt från sjukdomen.II.2.2 (3)(4)[Krav för arter som är mottagliga för Marteilia refringens och Bonamia ostreae och som är avsedda för en medlemsstat, en zon eller ett delområde som förklarats fri/fritt från sjukdom eller som omfattas av ett övervaknings- eller utrotningsprogram för den relevanta sjukdomenI egenskap av officiell inspektör intygar jag att de ovannämnda levande musslorna(6)härrör från ett land/område, en zon eller ett delområde som av den behöriga myndigheten i mitt land har förklarats fri/fritt från (4)[Marteilia refringens] (4)Bonamia ostreae] i enlighet med kapitel VII i direktiv 2006/88/EG eller relevant OIE-standard,(i) där de relevanta sjukdomarna är anmälningspliktiga till den behöriga myndigheten och de offentliga myndigheterna omedelbart ska undersöka rapporter om misstanke om infektion av den relevanta sjukdomen, och(ii) där all införsel av arter som är mottagliga för de relevanta sjukdomarna sker från ett område som förklarats fritt från sjukdomen.II.2.3 Transport- och märkningskravI egenskap av officiell inspektör intygar jag följande:II.2.3.1 De ovannämnda levande musslorna har transporterats under förhållanden, bland annat vad gäller vattenkvalitet, som inte påverkar deras hälsostatus.II.2.3.2 Transportbehållaren eller brunnbåten hade rengjorts och desinficerats före lastning eller var oanvänd.II.2.3.3 Sändningen har identifierats genom en läslig etikett på utsidan av transportlådan, eller vid transport med brunnbåt i fartygsmanifestet, med de relevanta uppgifterna i fälten I.7–I.11 i del I i detta intyg och följande text:’Levande musslor avsedda att användas som livsmedel i gemenskapen’](./../../../resource.html?uri=celex:02005R2074-20121126.SWE.xhtml.L_2008337SV.01003901.tif.jpg)

DEL B
FÖRLAGA TILL EXTRA HÄLSOINTYG FÖR BEARBETADE MUSSLOR AV ARTEN ACANTHOCARDIA TUBERCULATUM
Jag intygar härmed, i egenskap av officiell inspektör, att de bearbetade musslor av arten Acanthocardia tuberculatum som omfattas av hälsointyget med referensnummer uppfyller följande krav:…
1. De har upptagits i produktionsområden som tydligt angivits, övervakats och godkänts av den behöriga myndigheten enligt kommissionens beslut 2006/766/EG ( 9 ) och i vilka halten av paralytiskt skaldjursgift (PSP) i de ätbara delarna av dessa musslor är mindre än 300 μg per 100 g.
2. De har transporterats direkt till följande anläggning i containrar eller fordon som förseglats av den behöriga myndigheten:
…
…
(Namn och officiellt godkännandenummer för den anläggning som godkänts särskilt av den behöriga myndigheten för att utföra behandlingen)
3. De har under transporten till denna anläggning åtföljts av ett dokument som utfärdats av den behöriga myndighet som godkänt transporten och som styrker produktens typ och kvalitet, ursprungsområde och den mottagande anläggningen.
4. De har genomgått den värmebehandling som anges i bilagan till beslut 96/77/EG.
5. De innehåller inte sådana halter av paralytiskt skaldjursgift (PSP) som kan påvisas genom bioassay, vilket framgår av de bifogade analysrapporterna av det test som utförts på varje parti som ingår i den sändning som omfattas av detta intyg.
Jag intygar härmed att den behöriga myndigheten har kontrollerat att de egna hälsokontroller som genomförs i den anläggning som avses i punkt 2 uttryckligen tillämpas på den värmebehandling som avses i punkt 4.
Jag intygar härmed att jag är förtrogen med bestämmelserna i beslut 96/77/EG och att de bifogade analysrapporterna överensstämmer med det test som utförts på produkterna efter bearbetning.
|
Officiell inspektör |
|
|
Namn (med versaler): Titel och befattning: Datum: |
Underskrift: Stämpel: |
Tillägg VI till bilaga VI
FÖRLAGA TILL HÄLSOINTYG FÖR IMPORT AV HONUNG OCH ANDRA BIODLINGSPRODUKTER AVSEDDA ATT ANVÄNDAS SOM LIVSMEDEL


Tillägg VII till bilaga VI
FÖRLAGA TILL DOKUMENT SOM SKA UNDERTECKNAS AV KAPTENEN OCH SOM ÅTFÖLJER FRYSTA FISKERIPRODUKTER SOM IMPORTERAS DIREKT TILL EUROPEISKA UNIONEN FRÅN FRYSFARTYG



BILAGA VIA
TESTMETODER FÖR OBEHANDLAD MJÖLK OCH VÄRMEBEHANDLAD MJÖLK
KAPITEL I
BESTÄMNING AV ANTAL BAKTERIER OCH SOMATISKT CELLTAL
1. Vid prövningen mot kriterierna i avsnitt IX kapitel I del III i bilaga III till förordning (EG) nr 853/2004 skall följande standarder användas som referensmetoder:
a) EN/ISO 4833 för antalet bakterier vid 30 oC.
b) ISO 13366-1 för det somatiska celltalet.
2. Användning av alternativa analysmetoder kan godtas:
a) När det gäller bestämning av antalet bakterier vid 30 oC om metoderna har validerats mot den referensmetod som anges i punkt 1 a i enlighet med protokollet i standarden EN/ISO 16140 eller andra liknande internationellt erkända protokoll.
Omräkningsförhållandet mellan den alternativa metoden och referensmetoden i punkt 1 a skall fastställas i enlighet med standarden ISO 21187.
b) När det gäller bestämning av det somatiska celltalet om metoderna har validerats mot den referensmetod som anges i punkt 1 b i enlighet med protokollet i standarden ISO 8196, och om den genomförs i enlighet med standarden ISO 3366-2, eller andra liknande internationellt erkända protokoll.
KAPITEL II
BESTÄMNING AV ALKALISK FOSFATASAKTIVITET
1. Vid bestämningen av alkalisk fosfatasaktivitet skall standarden ISO 11816-1 användas som referensmetod.
2. Den alkaliska fosfatasaktiviteten uttrycks i millienheter enzymaktivitet per liter (mU/l). En enhet alkalisk fosfatasaktivitet är den mängd alkalisk fosfatasenzym som katalyserar omvandlingen av 1 mikromol substrat per minut.
3. Ett alkaliskt fosfatastest anses ge negativt resultat om den uppmätta aktiviteten i komjölk inte överstiger 350 mU/l.
4. Användning av alternativa analysmetoder kan godtas om metoderna har validerats mot den referensmetod som fastställs i punkt 1 i enlighet med internationellt erkända protokoll.
BILAGA VIb
KRAV SOM SKALL GÄLLA FÖR OFFENTLIG KONTROLL VID BESIKTNING AV KÖTT
|
1. |
I denna bilaga skall följande definitioner gälla:
|
|
2. |
Besiktning efter slakt i anläggningar som bedriver icke-kontinuerlig slakt eller vilthantering.
|
|
3. |
Krav för riskbaserad köttbesiktning utan anskärning.
|
|
4. |
Ytterligare krav för besiktning efter slakt av hästdjur.
|
Tillägg till bilaga VIb
I denna bilaga anses kontrollerade uppfödningsförhållanden i integrerade produktionssystem föreligga endast om livsmedelsföretagaren uppfyller följande villkor:
a) Allt foder kommer från en produktionsanläggning som producerar foder i enlighet med kraven i artiklarna 4 och 5 i Europaparlamentets och rådets förordning (EG) nr 183/2005 ( 10 ). Om grovfoder eller grödor ges till djuren som foder, skall de behandlas korrekt, och om möjligt torkas och/eller pelleteras.
b) Ett allt-in-allt-ut-system tillämpas så långt det är möjligt. När djur tas in i besättningen skall de hållas isolerade så länge som veterinärmyndigheterna kräver detta, i syfte att förhindra att sjukdomar kommer in.
c) Inga djur får vistas utomhus om inte livsmedelsföretagaren på grundval av en riskanalys kan bevisa för den behöriga myndigheten att tidsperioden, platsen och förhållandena utomhus inte medför någon risk för att sjukdom kommer in i besättningen.
d) Utförlig information finns tillgänglig om djuren från födelse till slakt och om de förhållanden som de hållits under i enlighet med avdelning III i bilaga II till förordning (EG) nr 853/2004.
e) Om strö används, behandlas strömaterialet adekvat så att sjukdom inte kan komma in eller få fäste.
f) Personalen på jordbruksanläggningen följer de allmänna hygienbestämmelserna i bilaga I till förordning (EG) nr 852/2004.
g) Det finns förfaranden för att kontrollera tillträdet till de utrymmen där djuren hålls.
h) Jordbruksanläggningen upplåter inte plats till turister eller camping om inte livsmedelsföretagaren på grundval av en riskanalys kan bevisa för den behöriga myndigheten att platsen är tillräckligt avskild från djuruppfödningsenheterna och att direktkontakt mellan människor och djur inte är möjlig.
i) Djuren kan inte komma åt avstjälpningsplatser eller hushållsavfall.
j) Det finns ett program för skadedjursbekämpning.
k) Djuren utfodras inte med ensilage om inte livsmedelsföretagaren på grundval av en riskanalys kan visa på ett övertygande sätt för den behöriga myndigheten att inga risker för djuren kan överföras genom fodret.
l) Avloppsvatten och slam från reningsverk släpps inte ut på områden dit djuren har tillträde och får inte användas som gödning av betesmarker där det odlas grödor som skall användas som foder, om det inte behandlats adekvat på ett sätt som den behöriga myndigheten godkänner.
BILAGA VII
ÄNDRINGAR AV FÖRORDNING (EG) NR 853/2004
Bilagorna II och III till förordning (EG) nr 853/2004 skall ändras på följande sätt:
1) Avsnitt I del B i bilaga II skall ändras på följande sätt:
a) I punkt 6 skall andra stycket ersättas med följande:
”BE, CZ, DK, DE, EE, GR, ES, FR, IE, IT, CY, LV, LT, LU, HU, MT, NL, AT, PL, PT, SI, SK, FI, SE och UK.”
b) Punkt 8 skall ersättas med följande:
”8. Om märket anbringas i en anläggning som är belägen inom gemenskapen, skall det vara ovalt och innehålla förkortningen CE, EC, EF, EG, EK, EY, ES, EÜ, EK, EB eller WE.”
2) Bilaga III skall ändras på följande sätt:
a) I avsnitt I kapitel IV skall punkt 8 ersättas med följande:
”8. Fullständig avhudning av slaktkroppen och andra delar av kroppen som är avsedda att användas som livsmedel måste utföras, utom för svin och för skallar av får, getter och kalvar samt för fötter av nötkreatur, får och getter. Skallar och fötter skall hanteras på ett sådant sätt att kontaminering undviks.”
b) I avsnitt II skall följande kapitel VII läggas till:
”KAPITEL VII: VATTENBINDANDE ÄMNEN
Livsmedelsföretagare skall se till att fjäderfäkött som har behandlats speciellt för att öka vattenbindningen inte släpps ut på marknaden som färskt kött, utan som köttberedningar, eller används för framställning av bearbetade produkter.”
c) I avsnitt VIII kapitel V del E skall punkt 1 ersättas med följande:
”1. Fiskeriprodukter som härrör från giftiga fiskar av följande familjer får inte släppas ut på marknaden: Tetraodontidae, Molidae, Diodontidae och Canthigasteridae. Färska, beredda och bearbetade fiskeriprodukter som tillhör familjen Gempylidae, särskilt Ruvettus pretiosus och Lepidocybium flavobrunneum, får endast släppas ut på marknaden förpackade och skall vara märkta på ett sådant sätt att de ger konsumenten upplysningar om metoder för beredning och tillagning och om risken i samband med förekomsten av ämnen som kan orsaka problem i matsmältningsorganen. Det vetenskapliga namnet skall åtfölja det vanliga namnet i märkningen.”
d) Avsnitt IX skall ändras på följande sätt:
i) I kapitel I del II punkt B.1 skall led e ersättas med följande:
”e) Spendoppnings- eller spraymedel får användas endast efter godkännande eller registrering i enlighet med de förfaranden som föreskrivs i Europaparlamentets och rådets direktiv 98/8/EG av den 16 februari 1998 om utsläppande av biocidprodukter på marknaden ( 11 ).”
ii) I kapitel II del II skall punkt 1 ersättas med följande:
”1. När obehandlad mjölk eller mjölkprodukter värmebehandlas, skall livsmedelsföretagare se till att kraven i kapitel XI i bilaga II till förordning (EG) nr 852/2004 är uppfyllda. När nedanstående processer tillämpas skall de särskilt se till att de angivna specifikationerna iakttas:
a) Pastörisering uppnås genom en behandling
i) vid en hög temperatur under en kort period (minst 72 oC under 15 sekunder),
ii) vid en låg temperatur under en lång period (minst 63 oC under 30 minuter), eller
iii) genom någon annan kombination av tid- och temperaturförhållande som ger motsvarande effekt,
så att produkterna, i tillämpliga fall, reagerar negativt på ett test för alkalisk fosfatas omedelbart efter en sådan behandling.
b) Ultrahög temperaturbehandling (UHT) uppnås genom en behandling
i) med ett kontinuerligt värmeflöde vid en hög temperatur under en kort period (minst 135 oC med en lämplig hålltid) så att det inte finns några livsdugliga mikroorganismer eller sporer som kan växa i den behandlade produkten när den förvaras i en steril försluten behållare i rumstemperatur, och
ii) som är tillräcklig för att garantera att produkterna förblir mikrobiologiskt stabila efter inkubation under 15 dagar vid en temperatur på 30 oC i förslutna behållare, eller under sju dagar vid en temperatur på 55 oC i förslutna behållare, eller efter någon annan metod som visar att en korrekt värmebehandling har utförts.”
e) I avsnitt X skall kapitel II ändras på följande sätt:
i) I del III skall punkt 5 ersättas med följande:
”5. Efter knäckningen skall varje del av det flytande ägget så snart som möjligt genomgå en bearbetning för att eliminera de mikrobiologiska faror eller reducera dem till godtagbara nivåer. Ett parti som har blivit otillräckligt bearbetat får dock omedelbart utsättas för ny bearbetning vid samma anläggning, förutsatt att denna bearbetning gör partiet tjänligt som livsmedel. När ett parti visar sig vara otjänligt som livsmedel, skall det först denatureras för att se till att det inte används som livsmedel.”
ii) I del V skall punkt 2 ersättas med följande:
”2. När det gäller flytande ägg skall etiketten enligt punkt 1 även innehålla texten ’opastöriserade flytande ägg – skall behandlas på destinationsorten’ samt ange datum och klockslag då äggen knäcktes.”
f) I avsnitt XIV skall följande kapitel V läggas till:
”KAPITEL V: MÄRKNING
Innerförpackningar och emballage som innehåller gelatin skall märkas med texten ’gelatin avsett som livsmedel’ och ha uppgift om tillverkningsdag.”
BILAGA VIII
ÄNDRINGAR AV FÖRORDNING (EG) NR 854/2004
Bilagorna I, II och III till förordning (EG) nr 854/2004 skall ändras på följande sätt:
1) I bilaga I skall punkt 3 i avsnitt I kapitel III ändras på följande sätt:
a) I led a skall andra stycket ersättas med följande:
”BE, CZ, DK, DE, EE, GR, ES, FR, IE, IT, CY, LV, LT, LU, HU, MT, NL, AT, PL, PT, SI, SK, FI, SE och UK.”
b) Led c skall ersättas med följande:
”c) Om märket anbringas i ett slakteri inom gemenskapen skall det innehålla någon av följande förkortningar: CE, EC, EF, EG, EK, EY, ES, EÜ, EK, EB eller WE.”
2) I bilaga II skall punkterna 4 och 5 i kapitel II del A ersättas med följande:
”4. Den behöriga myndigheten får som kategori B-områden klassificera områden från vilka levande musslor får tas upp, men släppas ut på marknaden som livsmedel endast efter behandling i en reningsanläggning eller efter återutläggning så att de hälsokrav som avses i punkt 3 uppfylls. Levande musslor från dessa områden får inte överskrida gränsen 4 600 E. coli per 100 g kött och intravalvulär vätska. Referensmetoden för denna analys är MPN-femrörstest med tre utspädningar enligt ISO 16649-3. Andra metoder får användas om de har validerats mot denna referensmetod i enlighet med kriterierna i EN/ISO 16140.
5. Den behöriga myndigheten får som kategori C-områden klassificera områden från vilka levande musslor får tas upp, men släppas ut på marknaden endast efter återutläggning under en lång tid så att de hälsokrav som avses i punkt 3 uppfylls. Levande musslor från dessa områden får inte överskrida gränsen 46 000 E. coli per 100 g kött och intravalvulär vätska. Referensmetoden för denna analys är det MPN-femrörstest med tre utspädningar som anges i ISO 16649-3. Andra metoder får användas om de har validerats mot denna referensmetod i enlighet med kriterierna i EN/ISO 16140.”
3) I bilaga III skall punkt 1 i kapitel II del G ersättas med följande:
”1. Fiskeriprodukter som härrör från giftiga fiskar av följande familjer får inte släppas ut på marknaden: Tetraodontidae, Molidae, Diodontidae och Canthigasteridae. Färska, beredda och bearbetade fiskeriprodukter som tillhör familjen Gempylidae, särskilt Ruvettus pretiosus och Lepidocybium flavobrunneum, får endast släppas ut på marknaden förpackade och skall vara märkta på ett sådant sätt att de ger konsumenten upplysningar om metoder för beredning och tillagning och om risken i samband med förekomsten av ämnen som kan orsaka problem i matsmältningsorganen. Det vetenskapliga namnet skall åtfölja det vanliga namnet i märkningen.”
( 1 ) EUT L 139, 30.4.2004, s. 1. Rättad i EUT L 226, 25.6.2004, s. 3.
( 2 ) EUT L 139, 30.4.2004, s. 55. Rättad EUT L 226, 25.6.2004, s. 22.
( 3 ) EUT L 139, 30.4.2004, s. 1. Rättad i EUT L 226, 25.6.2004, s. 83.
( 4 ) EUT L 165, 30.4.2004, s. 1. Rättad i EUT L 191, 28.5.2004, s. 1.
( 5 ) Ännu ej offentliggjort i EUT.
( 6 ) EUT L 157, 30.4.2004, s. 33. Rättat i EUT L 195, 2.6.2004, s. 12.
( 7 ) Se sidan 1 i detta nummer av EUT.
( 8 ) EGT L 358, 18.12.1986, s. 1.
( 9 ) Se sidan 53 i detta nummer av EUT.
( 10 ) EUT L 35, 8.2.2005, s. 1.
( 11 ) EGT L 123, 24.4.1998, s. 1.


