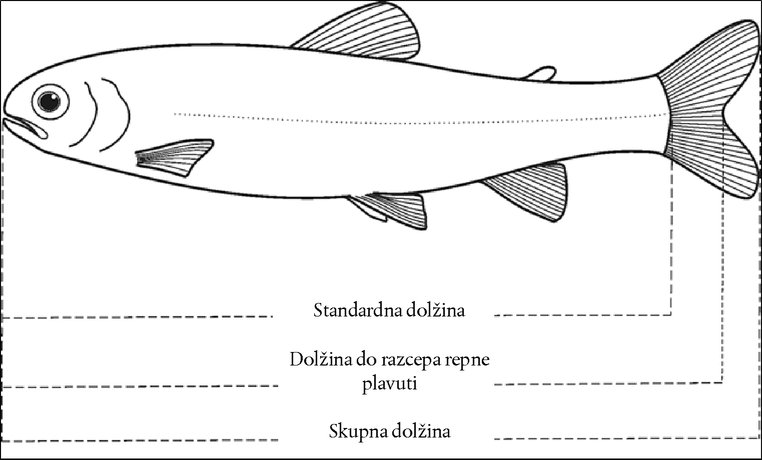
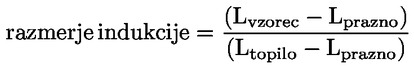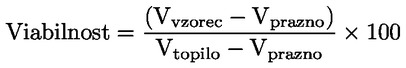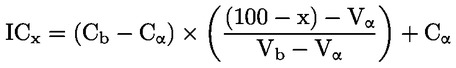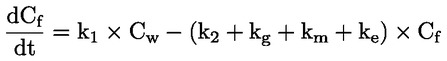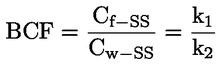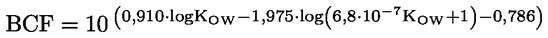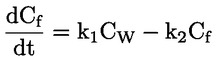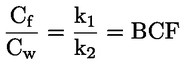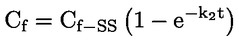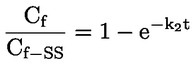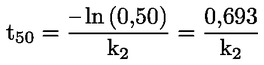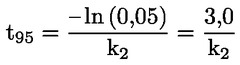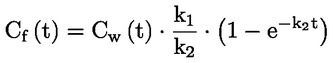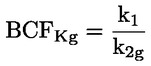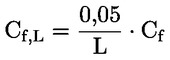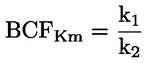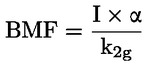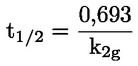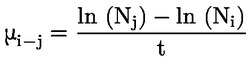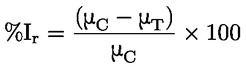PRILOGA
Priloga k Uredbi (ES) št. 440/2008 se spremeni:
|
(1) |
V delu A se doda naslednje poglavje: „A.25 DISOCIACIJSKE KONSTANTE V VODI (TITRACIJSKA METODA – SPEKTROFOTOMETRIČNA METODA – KONDUKTOMETRIČNA METODA) UVOD Ta preskusna metoda je enakovredna Smernici za preskušanje OECD 112 (1981). Predpogoji
Napotki
Omejitvene izjave
Standardni dokumenti Ta preskusna metoda temelji na metodah iz virov, navedenih v oddelku „Viri“, in na Predhodnem osnutku smernic za prijavo nove snovi (Preliminary Draft Guidance for Premanufacture Notification) Agencije za varstvo okolja ZDA (EPA), 18. avgust 1978. METODA – UVOD, NAMEN, PODROČJE UPORABE, POMEN, UPORABA IN OMEJITVE PRESKUSA Pri oceni vpliva snovi na okolje je pomembna njena disociacija v vodi. Ta vpliva na obliko snovi, ki določa njeno vedenje in transport. Lahko vpliva na adsorpcijo kemikalije v tla in sedimente ter absorpcijo v biološke celice. Opredelitve in enote Disociacija je reverzibilen razcep v eno ali več kemijskih oblik, ki so lahko ionske. Proces je običajno označen z enačbo: RX ⇌ R ++ X – in konstanta ravnotežnih koncentracij, ki vpliva na reakcijo, je
Na primer v posebnem primeru, v katerem je R vodik (snov je kislina), je konstanta:
ali
Referenčne snovi Naslednjih referenčnih snovi ni treba uporabiti vsakič, ko se preučuje nova snov. Navedene so zlasti zato, da se lahko občasno izvede kalibracija metode ter da se lahko v primeru uporabe druge metode primerjajo rezultati.
Koristno bi bilo imeti snov z več vrednostmi pK, kot je navedeno v Načelu metode v nadaljevanju. Taka snov bi lahko bila:
Načelo preskusne metode Opisani kemijski proces je na splošno le malo odvisen od temperature v okoljsko ustreznem temperaturnem območju. Za določanje konstante disociacije je potrebno merjenje koncentracij disociiranih in nedisociiranih oblik kemijske snovi. Ustrezna konstanta se lahko določi na podlagi poznavanja stehiometrije disociacijske reakcije, kot je navedeno v Opredelitvah in enotah. V posebnem primeru, opisanem pri tej preskusni metodi, se snov vede kot kislina ali baza, in najprimernejši način za določitev je ugotovitev relativnih koncentracij ioniziranih in neioniziranih oblik snovi ter vrednosti pH raztopine. Razmerje med temi elementi se izračuna po enačbi za pKa, ki je navedena v Opredelitvah in enotah. Nekatere snovi imajo več kot eno konstanto disociacije in razviti je mogoče podobne enačbe. Nekatere tukaj opisane metode so primerne tudi za disociacijo nekislin/baz. Merila kakovosti Ponovljivost Konstanto disociacije bi bilo treba ponoviti (najmanj tri določanja) v območju ± 0,1 logaritemske enote. OPIS PRESKUSNEGA POSTOPKA Za določitev vrednosti pKa obstajata dva osnovna pristopa. Eden vključuje titracijo znane količine snovi s standardno kislino ali bazo, kot je ustrezno; drugi pa ugotovitev relativne koncentracije ioniziranih in neioniziranih oblik ter njihove odvisnosti od vrednosti pH. Priprave Metode, ki temeljijo na navedenih načelih, se lahko razvrstijo kot titracija, spektrofotometrični in konduktometrični postopek. Preskusne raztopine Pri titracijski in konduktometrični metodi je treba kemično snov raztopiti v destilirani vodi. Pri spektrofotometrični metodi in drugih metodah se uporabljajo pufrske raztopine. Koncentracija preskusne snovi ne sme presegati 0,01 M ali polovice koncentracije nasičenosti in pri pripravi raztopin je treba uporabiti najčistejšo obliko snovi, ki je na voljo. Če je snov le težko topna, se lahko raztopi v majhni količini topila, ki se meša z vodo, preden se doda k zgoraj navedenim koncentracijam. Z uporabo Tyndallovega pramena svetlobe je treba preveriti, ali so v raztopinah prisotne emulzije, zlasti če je bilo za povečanje topnosti uporabljeno sotopilo. Kadar se uporabljajo pufrske raztopine, koncentracija pufra ne bi smela presegati 0,05 M. Preskusni pogoji Temperatura Temperaturo je treba nadzorovati pri vsaj ± 1 °C. Določanje bi bilo treba po možnosti izvesti pri 20 °C. Če obstaja sum odvisnosti od temperature, je treba določanje izvesti pri vsaj še dveh drugih temperaturah. V tem primeru morajo biti temperaturni intervali 10 °C, nadzor temperature pa pri ± 0,1 °C. Analize Metoda se določi glede na naravo snovi, ki se preskuša. Biti mora dovolj občutljiva, da se lahko pri vsaki posamezni koncentraciji preskusne raztopine določijo različne oblike. Izvedba preskusa Titracijska metoda Preskusna raztopina se določi s titracijo s raztopino standardne baze ali kisline, kot je ustrezno, pri čemer se po vsakem dodajanju titranta izmeri vrednost pH. Pred ekvivalentno točko ga je treba posamično dodati vsaj desetkrat. Če je ravnotežje doseženo dokaj hitro, se lahko uporabi zapisovalni potenciometer. Pri tej metodi mora biti natančno znana skupna količina snovi in njena koncentracija. Izvajati je treba ukrepe za preprečitev vdora ogljikovega dioksida. Podrobnosti o postopku, ukrepih in izračunu so navedene v standardnih preskusih, npr. v virih (1) (2) (3) (4). Spektrofotometrična metoda Kadar se koeficienti ekstinkcije ioniziranih in neioniziranih oblik snovi znatno razlikujejo, se določi valovna dolžina. Absorpcijski spekter UV/vidne svetlobe se pridobi iz raztopin s konstantno koncentracijo pri vrednosti pH, pri kateri je snov v glavnem neionizirana in popolnoma ionizirana, ter pri več vmesnih vrednostih pH. To je mogoče izvesti bodisi tako, da se v razmeroma veliko količino raztopine snovi v večkomponentnem pufru postopoma dodaja koncentrirana kislina (baza), sprva pri visoki (nizki) vrednosti pH (ref. 5), bodisi tako, da se v konstantne količine različnih pufrskih raztopin, ki obsegajo želeni razpon vrednosti pH, dodajajo enake količine osnovne raztopine snovi v npr. vodi, metanolu. Zadostno število vrednosti za pKa se iz vrednosti pH in absorbance pri izbrani valovni dolžini izračuna tako, da se uporabijo podatki za vsaj 5 vrednosti pH, pri katerih je snov ionizirana v razponu od vsaj 10 % do manj kot 90 %. Nadaljnje podrobnosti o preskusu in metodi izračuna so na voljo v viru (1). Konduktometrična metoda Z uporabo celice z majhno, znano celično konstanto se izmeri prevodnost približno 0,1 M raztopine snovi v prevodni vodi. Izmerijo se tudi prevodnosti določenega števila natančno narejenih razredčitev te raztopine. Koncentracija se vsakič prepolovi, serije pa bi morale obsegati vsaj en red velikosti v koncentraciji. Omejena prevodnost pri neskončni razredčitvi se ugotovi z izvedbo podobnega poskusa z natrijevo soljo in ekstrapolacijo. Nato se lahko z Onsagerjevo enačbo iz prevodnosti vsake raztopine izračuna stopnja disociacije, iz česar se lahko z Ostwaldovim zakonom razredčenja izračuna konstanta disociacije po enačbi K = α2C / (1 – α), pri čemer je C koncentracija v molih na liter, α pa disociirana frakcija. Izvajati je treba ukrepe za preprečitev vdora CO2. Nadaljnje podrobnosti o preskusu in metodi izračuna so na voljo v standardnih besedilih ter virih (1) (6) (7). PODATKI IN POROČANJE Obdelava rezultatov Titracijska metoda Vrednost pKa se izračuna za 10 merjenih točk na titracijski krivulji. Izračunata se odklon srednje vrednosti in standardni odklon takih vrednosti pKa. Poleg predstavitve v preglednicah bi bilo treba vključiti grafični prikaz vrednosti pH glede na volumen standardne baze ali kisline. Spektrofotometrične metode Absorbanco in vrednost pH je treba za vsak spekter predstaviti v preglednicah. Vsaj pet vrednosti za vrednost pKa se izračuna iz podatkovnih točk znotraj spektra, izračunata se tudi srednja vrednost in standardni odklon teh rezultatov. Konduktometrična metoda Za vsako koncentracijo kisline in vsako koncentracijo mešanice enega ekvivalenta kisline in 0,98 ekvivalenta natrijevega hidroksida brez karbonatov, se izračuna ekvivalent prevodnosti Λ. Kislina je v presežku, da se prepreči presežni OH– zaradi hidrolize. Razmerje 1 / Λ je grafično prikazano glede na √C in Λo soli se lahko ugotovi z ekstrapolacijo na nično koncentracijo. Vrednost Λo kisline se lahko izračuna z uporabo vrednosti za H+ in Na+ iz virov. Vrednost pKa za vsako koncentracijo se lahko izračuna po enačbi α = Λi / Λo in Ka = α2C / (1 – α). Za Ka se lahko dobijo boljše vrednosti s popravki za mobilnost in aktivnost. Izračunati bi bilo treba srednjo vrednost in standardni odklon vrednosti pKa. Poročilo o preskusu Vse neobdelane podatke in izračunane vrednosti pKa je treba predložiti skupaj z metodo izračuna (po možnosti v obliki preglednic, kot je predlagano v ref. 1) ter opisanimi statističnimi parametri. Pri titracijski metodi je treba navesti podrobnosti o standardizaciji titrantov. Pri spektrofotometrični metodi je treba navesti vse spektre. Pri konduktometrični metodi je treba poročati o podrobnostih določanja konstante celice. Navesti bi bilo treba informacije o uporabljeni tehniki, analitski metodi in naravi vseh uporabljenih pufrov. Poročati bi bilo treba o preskusnih temperaturah. VIRI
|
|
(2) |
Poglavje B.5 dela B se nadomesti z naslednjim: „B.5 AKUTNO DRAžENJE OČI/JEDKOST ZA OČI UVOD Ta preskusna metoda je enakovredna Smernici za preskušanje OECD (TG) 405 (2012). Smernice OECD za preskušanje kemikalij se redno preverjajo, s čimer se zagotovi, da izražajo najboljša razpoložljiva znanstvena spoznanja. Pri prejšnjih preverjanjih te smernice za preskušanje je bila posebna pozornost namenjena možnim izboljšavam z ocenjevanjem vseh obstoječih podatkov o preskusni kemikaliji, da bi se izognili nepotrebnim testiranjem na živalih v laboratoriju in tako obravnavali pomisleke glede dobrobiti živali. V smernico TG 405 (sprejeto leta 1981 ter posodobljeno v letih 1987, 2002 in 2012) je vključeno priporočilo, da je treba pred začetkom izvajanja opisanega preskusa akutnega draženja oči/jedkosti za oči in vivo izvesti analizo, ki temelji na zanesljivosti dokazov (1), na podlagi ustreznih obstoječih podatkov. Kadar ni na voljo dovolj podatkov, je priporočljivo, da se pridobijo z uporabo zaporednega preskušanja (2) (3). Strategija preskušanja vključuje izvajanje validiranih in sprejetih preskusov in vitro ter se zagotovi kot dodatek k tej preskusni metodi. Celovita strategija preskušanja je za namen Uredbe (ES) št. 1907/2006 o registraciji, evalvaciji, avtorizaciji in omejevanju kemikalij (REACH) (2) vključena tudi v ustrezne smernice agencije ECHA (21). Testiranja na živalih je treba izvesti šele, če se po proučitvi razpoložljivih alternativnih metod ugotovi, da so nujni in da je uporaba navedenih metod primerna. Ob pripravi te posodobljene preskusne metode se pojavljajo primeri, ko je njena uporaba še vedno potrebna ali se zahteva v skladu z nekaterimi regulativnimi okviri. Zadnja posodobitev je bila v glavnem usmerjena na uporabo analgetikov in anestetikov ter ni vplivala na osnovni koncept in strukturo smernice za preskušanje. ICCVAM (3) in neodvisna mednarodna znanstvena strokovna skupina za ocenjevanje sta pregledala uporabnost in omejitve redne uporabe topičnih anestetikov, sistemskih analgetikov in humanih končnih točk med oceno varnosti draženja oči in vivo (12). V pregledu sta ugotovila, da bi se z uporabo topičnih anestetikov in sistemskih analgetikov lahko izognili večini bolečine in trpljenja ali vsej bolečini in trpljenju, ne da bi to vplivalo na rezultate poskusa, ter priporočila, da bi bilo treba te snovi vedno uporabljati. Pri tej preskusni metodi se upošteva ta pregled. Med preskušanjem akutnega draženja oči in jedkosti za oči in vivo bi bilo treba redno uporabljati topične anestetike, sistemske analgetike in humane končne točke. Izjeme glede njihove uporabe bi bilo treba utemeljiti. Z izboljšanji, opisanimi v tej metodi, se bosta v večini primerov preskušanja, pri katerih je še vedno potrebno in vivo preskušanje varnosti za oči, bolečina in trpljenje živali znatno zmanjšala ali se bo bolečini in trpljenju živali mogoče izogniti. Uravnoteženo vnaprejšnje lajšanje bolečin bi moralo vključevati (i) redno dajanje topičnih anestetikov (npr. proparakain ali tetrakain) in sistemskih analgetikov (npr. buprenorfin) pred preskušanjem, (ii) redni program dajanja sistemskih analgetikov po tretiranju (npr. buprenorfin in meloksikam), (iii) načrt opazovanja, spremljanja in evidentiranja živali za odkrivanje kliničnih znakov bolečine in/ali trpljenja ter (iv) načrt opazovanja, spremljanja in evidentiranja narave, resnosti in napredovanja poškodb oči. Nadaljnje podrobnosti so navedene v posodobljenih postopkih v nadaljevanju. Po dajanju preskusne kemikalije se ne smejo uporabiti nobeni dodatni topični anestetiki ali analgetiki, da ne bi prihajalo do motenja študije. Protivnetni analgetiki (npr. meloksikam) se ne smejo nanašati topično, sistemsko uporabljeni odmerki pa ne smejo vplivati na učinke na oči. Opredelitve so navedene v dodatku k preskusni metodi. ZAČETNI PREUDARKI Za znanstveno zanesljivost in dobrobit živali je koristno, da se preskusi in vivo začnejo izvajati šele, ko se z analizo, ki temelji na zanesljivosti dokazov, ocenijo vsi razpoložljivi podatki, ki se nanašajo na potencial kemikalije za draženje oči/jedkost za oči. V take podatke so vključeni dokazi iz obstoječih študij na ljudeh in/ali laboratorijskih živalih, dokazi o draženju oči/jedkosti za oči ene ali več strukturno sorodnih snovi ali mešanic takih snovi, podatki, ki kažejo visoko kislost ali alkalnost kemikalije (4) (5), ter rezultati iz potrjenih in sprejetih preskusov jedkosti za kožo in jedkosti za oči/draženje oči in vitro ali ex vivo (6) (13) (14) (15) (16) (17). Študije se lahko izvedejo pred analizo, ki temelji na zanesljivosti dokazov, ali kot posledica take analize. S tako analizo se lahko pri nekaterih kemikalijah nakaže potreba po in vivo študijah potenciala kemikalije za jedkost za oči/draženje oči. V vseh takih primerih je treba pred proučitvijo uporabe očesne študije in vivo po možnosti najprej izvesti študijo in vitro in/ali in vivo učinkov jedkosti za kožo, ki jih ima kemikalija, ter jih oceniti v skladu s strategijo zaporednega preskušanja s preskusno metodo B.4 (7) ali celovito strategijo preskušanja, opisano v smernicah agencije ECHA (21). Strategija zaporednega preskušanja, v katero so vključeni potrjeni preskusi in vitro ali ex vivo jedkosti za oči/draženja oči, je k tej preskusni metodi vključena kot dodatek, za namen uredbe REACH pa v smernice agencije ECHA (21). Priporočljivo je, da se ta strategija preskušanja upošteva pred izvedbo preskusa in vivo. Za nove kemikalije je priporočljivo, da se znanstveno zanesljivi podatki o jedkosti/draženju kemikalije pridobijo s postopnim načinom preskušanja. Za obstoječe kemikalije, za katere ni na voljo dovolj podatkov o jedkosti za kožo in oči/draženju kože in oči, se lahko s to strategijo zapolnijo vrzeli v podatkih. Uporabo drugačne strategije ali postopka preskušanja ali odločitev o tem, da se ne bo uporabil postopen način preskušanja, je treba utemeljiti. NAČELO PRESKUSA IN VIVO Po predhodnem tretiranju s sistemskimi analgetiki in nanosu ustreznih topičnih anestetikov se kemikalija, ki jo je treba preskusiti, v enkratnem odmerku nanese na eno oko poskusne živali; netretirano oko se uporablja za kontrolo. Stopnja dražilnosti/jedkosti za oči se oceni s seštevanjem lezij na očesni veznici, roženici in šarenici, v točno določenih intervalih. Drugi učinki na oko in škodljivi sistemski učinki se prav tako opišejo, da se vsi učinki celovito ocenijo. Študija mora trajati dovolj dolgo, da se oceni popravljivost ali nepopravljivost učinkov. Živali, ki kažejo znake hudega trpljenja in/ali bolečine v kateri koli fazi poskusa ali imajo lezije, skladne s humanimi končnimi točkami, opisanimi v tej preskusni metodi (glej odstavek 26), je treba humano usmrtiti in kemikalijo skladno s tem oceniti. Merila za sprejem odločitve o humani usmrtitvi umirajočih in hudo trpečih živali so navedena v dokumentu s smernicami OECD (8). PRIPRAVA ZA PRESKUS IN VIVO Izbira vrst Kunec beličnik je najbolj zaželena laboratorijska žival in uporabljajo se zdrave mlade odrasle živali. Uporabo drugih sevov ali vrst je treba obrazložiti. Priprava živali Obe očesi vsake poskusne živali, začasno izbrane za poskus, je treba pregledati v 24 urah pred začetkom poskusa. Živali, pri katerih so vidni draženje oči, očesne napake ali že prej nastala poškodba roženice, se ne smejo uporabiti. Pogoji nastanitve in hranjenja Živali morajo biti nastanjene posamično. Temperatura v prostoru s poskusnimi živalmi mora biti za kunce 20 °C (± 3 °C). Čeprav mora biti relativna vlažnost vsaj 30-odstotna in po možnosti ne sme presegati 70 %, razen med čiščenjem prostora, si je treba prizadevati za 50–60-odstotno vlažnost. Osvetlitev mora biti umetna, pri čemer je zaporedje 12 ur svetlobe in 12 ur teme. Izogibati se je treba preveč intenzivni svetlobi. Za hranjenje se lahko uporabijo običajne predpisane laboratorijske vrste hrane z neomejeno količino pitne vode. PRESKUSNI POSTOPEK Uporaba topičnih anestetikov in sistemskih analgetikov V postopkih ocene varnosti za oči so priporočljivi naslednji postopki, da se bolečini in trpljenju izogne ali se ju zmanjša. Nadomestijo jih lahko alternativni postopki, ki so bili določeni kot dobra ali boljša možnost za izogibanje bolečini in trpljenju ali njuno lajšanje.
Nanašanje preskusne kemikalije Preskusno kemikalijo je treba dati v mešiček veznice enega očesa vsake živali, potem ko se spodnja veka nežno potegne stran od zrkla. Veke se nato nežno držijo skupaj približno eno sekundo, da se prepreči izguba materiala. Drugo oko, ki ni tretirano, se uporablja za kontrolo. Izpiranje Oči poskusnih živali se ne smejo umivati najmanj 24 ur po vkapanju preskusne kemikalije, z izjemo trdnih snovi (glej odstavek 18) in v primeru takojšnjih jedkih ali dražilnih učinkov. Po 24 urah se lahko oko izpere, če je to ustrezno. Uporaba satelitske skupine živali za raziskovanje vpliva izpiranja ni priporočena, razen če je znanstveno upravičena. Če je satelitska skupina potrebna, je treba uporabiti dva kunca. Pogoje izpiranja je treba skrbno dokumentirati, npr. čas izpiranja, sestava in temperatura raztopine za izpiranje, trajanje, volumen in hitrost nanašanja. Velikost odmerka (1) Preskušanje tekočih snovi Za preskušanje tekočih snovi se uporablja odmerek v višini 0,1 ml. Razpršila se ne smejo uporabljati za vkapanje kemikalije neposredno v oko. Tekoče razpršilo je treba iztisniti in zbrati v posodo pred vkapanjem odmerka v višini 0,1 ml v oko. (2) Preskušanje trdnih snovi Pri preskušanju trdnih snovi, kašnatih zmesi in zdrobljenih kemikalij, mora imeti uporabljena količina volumen 0,1 ml ali težo, ki ne presega 100 mg. Preskusno kemikalijo je treba zdrobiti v fin prah. Volumen trdnega materiala je treba izmeriti po rahlem zgoščevanju, npr. z rahlim potrkavanjem na merilno posodo. Če fiziološki mehanizmi trdne preskusne kemikalije niso odstranili iz očesa poskusne živali na prvi časovni točki opazovanja 1 uro po nanosu, se lahko oko izplakne s fiziološko raztopino ali destilirano vodo. (3) Preskušanje razpršil Priporočeno je, da se vsa utekočinjena razpršila in razpršila pod pritiskom zberejo v posodo pred vkapanjem v oko. Izjema so kemikalije v posodah za razpršila pod pritiskom, ki jih ni mogoče zbrati zaradi izhlapevanja. V takih primerih je treba držati oko odprto in preskusno kemikalijo nanesti v oko z enostavnim vbrizgom, ki traja približno eno sekundo, z razdalje 10 cm neposredno pred očesom. Ta razdalja se lahko spreminja glede na pritisk razpršila in njegovo vsebino. Paziti je treba, da se oko ne poškoduje zaradi pritiska razpršila. V ustreznih primerih bo morda treba oceniti potencial za nastanek „mehanske“ poškodbe očesa zaradi moči razpršila. Oceno odmerka iz razpršila je mogoče dobiti z naslednjim poskusom: kemikalija se razprši na tehtalni papir skozi odprtino velikosti kunčjega očesa, ki je nameščena neposredno pred papir. Povečanje teže papirja se uporabi za določitev približne količine, razpršene v oko. Za hlapne kemikalije je odmerek mogoče oceniti s tehtanjem v zbirni posodi pred odstranitvijo preskusne kemikalije ali po njej. Začetni preskus (in vivo preskus draženja oči/jedkosti za oči z uporabo ene živali) Zelo priporočljivo je, da se poskus in vivo izvede najprej na eni živali (glej dodatek k tej preskusni metodi: Strategija zaporednega preskušanja draženja oči in jedkosti za oči). Na podlagi opazovanj je mogoče določiti resnost in popravljivost učinkov pred izvedbo potrditvenega poskusa na drugi živali. Če rezultati tega poskusa pokažejo, da je kemikalija z uporabo opisanega postopka jedka ali zelo dražilna za oko, se nadaljnji poskusi o dražilnosti za oko ne izvedejo. Potrditveni preskus (in vivo preskus draženja oči z dodatnimi živalmi) Če se jedek ali zelo dražilen učinek ne opazi v začetnem poskusu, je treba dražilni ali negativni odziv potrditi z uporabo do dveh dodatnih živali. Če se pri začetnem poskusu opazi dražilni učinek, je priporočljivo, da se potrditveni poskus izvede zaporedoma – najprej na eni in šele nato na drugi živali, namesto da se dve dodatni živali izpostavita hkrati. Če se pri drugi živali pojavijo jedki ali zelo dražilni učinki, se poskus ne nadaljuje. Če rezultati pri drugi živali zadostujejo, da se določi razvrstitev glede na nevarnosti, se ne sme izvesti noben poskus več. Obdobje opazovanja Obdobje opazovanja mora biti dovolj dolgo, da se lahko v celoti ovrednoti obseg in popravljivost opaženih učinkov. Preskus je treba zaključiti, kadar koli žival pokaže znake hude bolečine ali trpljenja (8). Za določitev popravljivosti učinkov je običajno treba živali opazovati 21 dni po nanašanju preskusne kemikalije. Če se popravljivost opazi pred 21. dnem, je treba poskus takrat zaključiti. Klinična opazovanja in uvrstitev očesnih reakcij v stopnje Podrobno je treba oceniti, ali so eno uro po nanosu preskusne kemikalije na očeh prisotne ali odsotne očesne lezije, tako ocenjevanje pa je treba nato ponoviti vsaj enkrat dnevno. Živali je treba prve 3 dni ocenjevati večkrat na dan zaradi pravočasnega sprejetja odločitve o zaključku preskusa. Poskusne živali je treba v celotnem trajanju študije vsaj dvakrat dnevno – ali po potrebi pogosteje – redno ocenjevati, da se odkrijejo klinični znaki bolečine in/ali trpljenja (npr. ponavljajoče se praskanje ali drgnjenje očesa, čezmerno mežikanje, čezmerno solzenje) (9) (10) (11), pri čemer mora med opazovanji preteči vsaj 6 ur. To je potrebno, (i) da se ustrezno oceni, ali živali kažejo znake bolečine in trpljenja, da se sprejmejo informirane odločitve o potrebi po povečanju odmerka analgetikov, ter (ii) da se oceni, ali živali kažejo znake določenih humanih končnih točk, da se sprejmejo informirane odločitve o tem, ali jih je ustrezno humano evtanazirati, in da se zagotovi pravočasno sprejetje takih odločitev. Redno je treba uporabljati obarvanost s fluoresceinom in biomikroskop, kadar je to ustrezno (npr. pri ocenjevanju globine poškodbe v primeru ulceracije roženice), kot pripomoček pri odkrivanju in merjenju očesne poškodbe ter pri oceni, ali so bila izpolnjena določena merila za humano evtanazijo. Za referenčne namene in za trajno evidenco obsega očesnih poškodb se lahko zbirajo digitalne fotografije opaženih lezij. Testiranja na živalih se lahko izvajajo le toliko časa, kolikor je potrebno za pridobitev dokončnih informacij. Živali, ki kažejo hudo bolečino ali trpljenje, je treba nemudoma humano usmrtiti, kemikalijo pa oceniti skladno s tem. Humano je treba usmrtiti živali z naslednjimi očesnimi lezijami, nastalimi po vkapanju kemikalije (za opis stopenj lezije glej preglednico 1): perforacija roženice ali značilna ulceracija roženice vključno s stafilomom, kri v sprednjem delu očesa, stopnja 4 motnjave roženice, odsotnost svetlobnega refleksa (odziv šarenice stopnje 2), ki traja 72 ur, ulceracija veznične vrečke, nekroza veznične membrane ali žmurke ali odstopanje. Te lezije so namreč na splošno nepopravljive. Poleg tega se priporoča, da se naslednje očesne lezije uporabijo kot humane končne točke za zaključek študij pred koncem načrtovanega 21-dnevnega obdobja opazovanja. Šteje se, da take lezije napovedujejo resne poškodbe, ki jih povzroči draženje ali jedkost, in poškodbe, za katere se pričakuje, da do konca 21-dnevnega obdobja opazovanja ne bodo popolnoma popravljive: velika globina poškodbe (npr. ulceracija roženice, ki se širi prek zgornjih plasti strome), uničenje limbusa > 50 % (kar je razvidno iz bledice veznega tkiva) in resna okužba očesa (gnojni izcedek). Ali kombinacija: vaskularizacije površine roženice (npr. panus), površine obarvanosti s fluoresceinom, ki se na podlagi dnevne ocene sčasoma ne zmanjšuje, in/ali odsotnosti reepitelizacije 5 dni po nanosu preskusne kemikalije se prav tako lahko štejejo kot morebitno uporabna merila, ki vplivajo na klinično odločitev o prezgodnjem zaključku študije. Vendar pa take ugotovitve posamično ne zadostujejo za utemeljitev predčasnega zaključka študije. Ko se ugotovijo resni učinki na oči, se je treba z lečečim veterinarjem ali veterinarjem, usposobljenim za laboratorijske živali, ali osebjem, usposobljenim za odkrivanje kliničnih lezij, posvetovati za klinični pregled, da se oceni, ali bi bilo treba zaradi kombinacije teh učinkov študijo predčasno zaključiti. Pridobiti je treba stopnje očesne reakcije (veznice, roženice in šarenice) ter jih zabeležiti po 1 uri, 24, 48 in 72 urah po nanosu preskusne kemikalije (preglednica 1). Živali, pri katerih se očesne lezije ne pojavijo, se ne smejo usmrtiti prej kot 3 dni po vkapanju. Živali z zmernimi očesnimi lezijami je treba opazovati, dokler lezije ne izginejo ali 21 dni, tj. do takrat, ko se raziskava zaključi. Izvesti in zabeležiti je treba opazovanja vsaj po 1 uri, 24 urah, 48 urah, 72 urah, 7 dneh, 14 dneh in 21 dneh, da se ugotovi status lezij in njihova popravljivost oziroma nepopravljivost. Opazovanja morajo biti po potrebi pogostejša, da se ugotovi, ali je treba poskusno žival iz humanih razlogov evtanazirati ali izključiti iz študije zaradi negativnih rezultatov. Stopnje očesne reakcije (preglednica 1) je treba zabeležiti pri vsakem pregledu. Poročati je treba tudi o vseh drugih očesnih lezijah (npr. panus, obarvanost, spremembe v sprednjem delu očesa) ali škodljivih sistemskih učinkih. Za lažji pregled reakcij se lahko uporablja binokularna lupa, ročni oftalmoskop, biomikroskop ali drug ustrezen pripomoček. Potem ko se po 24 urah zabeležijo rezultati opazovanja, se lahko oči nadalje pregledajo s fluoresceinom. Določanje stopnje očesnih odzivov je neizogibno subjektivno. Da bi izboljšali usklajenost pri določanju stopnje očesnega odziva in pomagali preskuševalnim laboratorijem ter vsem sodelujočim pri oblikovanju in razlagi rezultatov opazovanj, mora biti osebje, ki izvaja ta opazovanja, ustrezno usposobljeno za uporabo sistema določanja stopnje. PODATKI IN POROČANJE Vrednotenje rezultatov Rezultate draženja oči je treba oceniti v povezavi z vrsto in resnostjo lezij ter njihovo popravljivostjo oziroma nepopravljivostjo. Posamezni rezultati ne pomenijo absolutnega standarda za dražilne lastnosti kemikalije, ker se ocenjujejo tudi drugi učinki preskusne kemikalije. Namesto tega je treba posamezne rezultate obravnavati kot referenčne vrednosti, ki so pomembni le, če so potrjeni s popolnim opisom in vrednotenjem vseh opažanj. Poročilo o preskusu V poročilo o preskusu se vključijo naslednji podatki:
Razlaga rezultatov Sklepanje o veljavnosti rezultatov študij draženja oči na laboratorijskih živalih za ljudi je veljavno le v omejeni meri. V mnogih primerih je kunec beličnik bolj občutljiv na snovi, ki dražijo oči ali so jedke za oči, kot ljudje. Pri razlagi podatkov je treba paziti, da se izključi draženje, ki je posledica sekundarne infekcije. VIRI
Preglednica 1 Razvrščanje očesnih lezij v stopnje
Dodatek OPREDELITVE POJMOV Kisla/alkalna rezerva : Za kisle pripravke je to količina natrijevega hidroksida (v g)na 100 g pripravka, ki je potrebna za proizvodnjo določene vrednosti pH. Za alkalne pripravke je to količina natrijevega hidroksida (v g), ki je enakovredna količini žveplove kisline v g na 100 g pripravka, potrebna za proizvodnjo določene vrednosti pH (Young idr. 1988). Kemikalija : snov ali zmes. Nedražilne snovi : snovi, ki niso razvrščene v kategorije I, II ali III po EPA, kategorije 1, 2, 2A ali 2B po GHS ali kategoriji 1 ali 2 po EU dražilnih snovi za oči (17) (18) (19). Jedka snov za oči : (a) kemikalija, ki povzroča nepopravljivo poškodbo očesnega tkiva; (b) kemikalije, ki so razvrščene v kategorijo 1 po GHS, kategorijo I po EPA ali kategorijo 1 po EU dražilnih snovi za oči (17) (18) (19). Dražilna snov za oči : (a) kemikalija, ki povzroči popravljivo poškodbo očesa; (b) kemikalije, ki so razvrščene v kategoriji II ali III po EPA, kategorije 2, 2A ali 2B po GHS ali kategorijo 2 po EU dražilnih snovi za oči (17) (18) (19). Zelo dražilna snov za oči : (a) kemikalija, ki povzroči poškodbo tkiva, ki po 21 dneh po nanosu ne izgine ali resno fizično poslabša vid; (b) kemikalije, ki so razvrščene v kategorijo 1 po GHS, kategorijo I po EPA ali kategorijo 1 po EU dražilnih snovi za oči (17) (18) (19). Preskusna kemikalija : vsaka snov ali zmes, preskušena s to preskusno metodo. Stopenjski pristop : stopenjsko preskušanje, pri katerem se v posebnem vrstnem redu pregledajo vsi obstoječi podatki o preskusni kemikaliji, pri čemer se na vsaki stopnji uporabi postopek, ki temelji na zanesljivosti dokazov, da se določi, ali je pred nadaljevanjem na naslednji stopnji na voljo dovolj podatkov za odločitev o razvrstitvi kemikalije glede na nevarnost, ki jo povzroča. Če se za preskusno kemikalijo na podlagi razpoložljivih podatkov lahko določi potencial za draženje, dodatno preskušanje ni potrebno. Če preskusni kemikaliji na podlagi razpoložljivih podatkov ni mogoče določiti potenciala za draženje, se izvede postopno zaporedno testiranje na živalih, dokler kemikalije ni mogoče jasno razvrstiti. Zanesljivost dokazov (proces) : prednosti in slabosti zbirke podatkov se uporabijo kot podlaga za sprejetje sklepa, ki iz posameznih podatkov morda ni razviden. DODATEK K PRESKUSNI METODI B.5 (4) ZAPOREDNO TESTIRANJE DRAŽENJA OČI IN JEDKOSTI ZA OČI Splošni preudarki Za znanstveno zanesljivost in dobrobit živali se je treba izogniti nepotrebni uporabi živali in zmanjšati število poskusov, ki bi najverjetneje povzročili resne odzive pri živalih. Vse informacije o kemikalijah, ki se nanašajo na njihovo morebitno dražilnost/jedkost za oči, je treba oceniti pred odločitvijo o preskušanju in vivo. Morda že obstaja dovolj dokazov za razvrstitev preskusne kemikalije glede na njen potencial jedkosti za oči ali draženja oči, ne da bi bilo treba izvesti poskuse na laboratorijskih živalih. Analiza, ki temelji na zanesljivosti dokazov, in zaporedno testiranje bosta zato zmanjšala potrebo po preskušanju in vivo, zlasti če bi kemikalija verjetno povzročila resne reakcije. Priporočljivo je, da se z analizo, ki temelji na zanesljivosti dokazov, ocenijo obstoječe informacije v zvezi s tem, ali kemikalija draži oči in je jedka za oči, ter za odločitev, ali je treba poleg študij in vivo na očeh izvesti dodatne študije, ki bi pomagale opredeliti takšen potencial. Kadar so potrebne nadaljnje študije, je priporočljiva uporaba zaporednega preskušanja, da se pridobijo ustrezni eksperimentalni podatki. Pri snoveh, ki nimajo zgodovine preskušanja, je treba za pridobitev podatkov, potrebnih za oceno njihovega potenciala jedkosti za oči/draženja oči, uporabiti strategijo zaporednega preskušanja. Prvotna strategija preskušanja, opisana v tem dodatku, je bila razvita na delavnici OECD (1). Kasneje je bila potrjena in razširjena v Usklajen celostni sistem razvrstitve kemijskih snovi glede na nevarnosti za zdravje ljudi in vplive na okolje, kot sta ga novembra 1998 na 28. skupnem zasedanju potrdila Odbor za kemikalije in Delovna skupine za kemikalije (2) ter kot ga je leta 2011 posodobila skupina strokovnjakov OECD. Čeprav to testiranje ni sestavni del preskusne metode B.5, predstavlja priporočeni pristop za določitev lastnosti, ki se nanašajo na draženje oči/jedkost za oči. Ta pristop je hkrati dobra praksa in etično merilo uspešnosti za preskušanje draženja oči/jedkosti za oči in vivo. Preskusna metoda vsebuje smernice za izvajanje preskusa in vivo in povzema dejavnike, ki jih je treba obravnavati pred začetkom takega preskusa. Z zaporednim testiranjem se zagotavlja, da se s pristopom, ki temelji na zanesljivosti dokazov, ocenijo obstoječi podatki o lastnostih kemikalij, ki dražijo oči/so jedke za oči, in da se s stopenjskim pristopom pridobijo ustrezni podatki o kemikalijah, za katere so potrebne dodatne študije ali študije niso bile izvedene. V testiranje je najprej vključena izvedba potrjenih in sprejetih preskusov in vitro ali ex vivo, nato pa študije v okviru preskusne metode B.4 v posebnih okoliščinah (3) (4). Opis postopnega preskušanja Preden se začnejo izvajati preskusi kot deli zaporednega testiranja (diagram), je treba oceniti vse razpoložljive podatke, da se določi potreba po preskušanju in vivo na očeh. Čeprav se pomembne informacije lahko pridobijo iz ocene posameznih parametrov (npr. najvišje vrednosti pH), je treba oceniti vse obstoječe podatke. Pri sprejemanju odločitve, ki temelji na zanesljivosti dokazov, je treba oceniti vse ustrezne podatke o učinkih zadevne kemikalije ali strukturno podobnih kemikalij in navesti obrazložitev za tako odločitev. Glavni poudarek mora biti namenjen obstoječim podatkom o vplivu kemikalije na ljudi in živali, čemur sledijo rezultati preskušanja in vitro ali ex vivo. Študijam in vivo jedkih kemikalij je treba izogibati, kadar koli je to mogoče. Dejavniki, ki se upoštevajo v strategiji preskušanja, so med drugim:
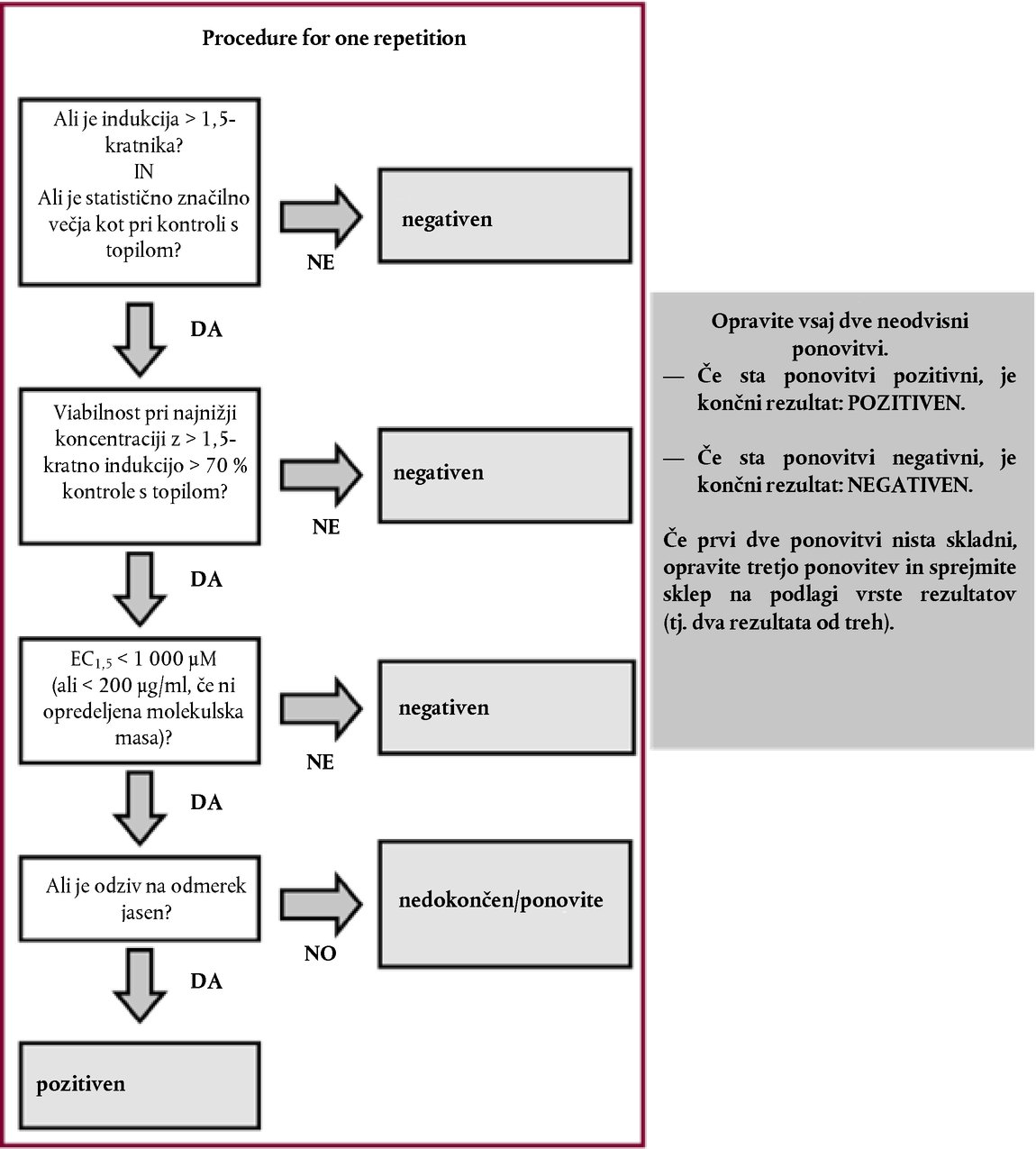
STRATEGIJA PRESKUŠANJA IN OCENJEVANJA DRAŽENJA OČI/JEDKOSTI ZA OČI
VIRI
|
|
(3) |
Poglavje B.10 dela B se nadomesti z naslednjim: „B.10 In vitro preskus kromosomskih aberacij pri sesalcih UVOD Ta preskusna metoda je enakovredna Smernici za preskušanje OECD 473 (2016). Je del sklopa preskusnih metod o genetski toksikologiji. Pripravljen je dokument OECD, ki zagotavlja jedrnate informacije o preskušanju v zvezi z genetsko tokskikologijo in pregled nedavnih sprememb teh preskusnih smernic (1). Namen in vitro preskusa kromosomskih aberacij je opredeliti kemikalije, ki povzročajo strukturne kromosomske aberacije v kultiviranih celicah sesalcev (2) (3) (4). Ločimo dva tipa strukturnih aberacij, in sicer: kromosomski in kromatidni tip. Pri preskusih in vitro bi se lahko pojavila poliploidija (vključno z endoreduplikacijo). Čeprav lahko anevgene snovi povzročijo poliploidijo, ta sama ne pomeni anevgenega potenciala in lahko samo nakazuje motnjo celičnega cikla ali citotoksičnost (5). Ta preskus ni zasnovan za merjenje anevploidije. Za odkrivanje anevploidije je priporočljiv preskus mikronukleusov in vitro (6). Pri in vitro preskusu kromosomskih aberacij se lahko uporabijo kulture trajnih celičnih linij ali primarne celične kulture človeškega ali glodalskega izvora. Uporabljene celice je treba izbrati glede na zmožnost rasti v kulturi, stabilnost kariotipa (vključno s kromosomskim številom) in pogostnost spontanih kromosomskih aberacij (7). Na podlagi razpoložljivih podatkov za zdaj ni mogoče navesti trdnih priporočil, vendar je iz njih razvidno, da je treba pri ocenjevanju kemične nevarnosti upoštevati status beljakovine p53, gensko stabilnost (stabilnost kariotipa), sposobnost popravljanja DNK in izvor (glodalski/človeški) celic, izbranih za preskušanje. Uporabnikom te preskusne metode se torej priporoča, naj upoštevajo vpliv te in drugih lastnosti celic na vpliv celične linije pri odkrivanju indukcije kromosomskih aberacij, saj se znanje na tem področju razvija. Uporabljene opredelitve pojmov so navedene v Dodatku 1. ZAČETNI PREUDARKI IN OMEJITVE Pri preskusih, izvedenih in vitro, je običajno treba uporabiti zunanji vir presnovne aktivacije, razen če so celice v zvezi s preskusno kemikalijo sposobne presnavljanja. Zunanji sistem presnovne aktivacije ne posnema pogojev in vivo v celoti. Paziti je treba, da se izogibamo pogojem, ki bi lahko vodili do lažno pozitivnih rezultatov, tj. kromosomskih poškodb, ki jih ne bi povzročilo neposredno medsebojno delovanje preskusnih kemikalij in kromosomov; med take pogoje so vključene spremembe vrednosti pH ali osmolarnosti (8) (9) (10), medsebojno delovanje sestavin gojišča (11) (12) ali previsoke ravni citotoksičnosti (13) (14) (15) (16). Ta preskus se uporablja za odkrivanje kromosomskih aberacij, ki so lahko posledica klastogenih dogodkov. Analizo indukcije kromosomskih aberacij je treba izvesti z uporabo celic v metafazi. Zato je bistveno, da v celicah tretiranih in netretiranih kultur poteka mitoza. Pri proizvedenih nanomaterialih so morda potrebne posebne prilagoditve te preskusne metode, ki pa pri tej metodi niso opisane. Pred uporabo te preskusne metode za preskušanje zmesi in pridobivanje podatkov za predvideni regulativni namen bi bilo treba proučiti, ali bo zagotovila sprejemljive rezultate za navedeni namen in, če jih bo, zakaj. Kadar obstaja regulativna zahteva za preskušanje zmesi, taki preudarki niso potrebni. NAČELO PRESKUSA Človeške celične kulture ali celične kulture drugih sesalcev so preskusni kemikaliji izpostavljene z zunanjim virom presnovne aktivacije ali brez njega, razen če se uporabijo celice, ki imajo ustrezno sposobnost presnavljanja (glej odstavek 13). Po tem ko so celične kulture izpostavljene preskusni kemikaliji, se v ustreznih, vnaprej določenih intervalih tretirajo s kemikalijo, ki zavira metafazo (npr. kolcemidom ali kolhicinom), nato se odvzamejo in obarvajo, celice v metafazi pa se mikroskopsko analizirajo, da se ugotovi prisotnost aberacij kromatidnega in kromosomskega tipa. OPIS METODE Priprave Celice Uporabijo se lahko različne celične linije (npr. celice jajčnikov kitajskega hrčka (CHO), pljuča kitajskega hrčka V79, pljuča kitajskega hrčka (CHL)/IU, TK6) ali primarne celične kulture, vključno z limfociti periferne krvi človeka ali drugih sesalcev (7). Izbiro celičnih linij je treba znanstveno utemeljiti. Pri uporabi primarnih celic je treba zaradi dobrobiti živali razmisliti o uporabi človeških primarnih celic, če je to izvedljivo, ter jih vzorčiti v skladu s človeškimi etičnimi načeli in predpisi. Limfocite periferne krvi človeka je treba pridobiti od mladih oseb (starih med približno 18 in 35 let), ki ne kadijo, nimajo znanih bolezni ali niso bili nedavno izpostavljeni takim stopnjam genotoksičnih snovi (npr. kemikalijam, ionizirajočemu sevanju), zaradi katerih bi se povečala pojavnost kromosomskih aberacij v ozadju. Tako se zagotovi, da je pojavnost kromosomskih aberacij v ozadju nizka in konsistentna. Osnovna pojavnost kromosomskih aberacij se povečuje s starostjo in ta trend je izrazitejši pri ženskah kot pri moških (17) (18). Če se za uporabo zberejo celice več kot enega darovalca, je treba navesti število darovalcev. Prikazati je treba, da so se celice delile od začetka tretiranja s preskusno kemikalijo do njihovega vzorčenja. Celične kulture se vzdržujejo v eksponentni fazi rasti celic (celične linije) ali se stimulira njihova delitev (primarne kulture limfocitov), da se izpostavijo celice v različnih fazah celičnega cikla, saj morda ni znano, kako so posamezne faze celičnega cikla občutljive na preskusne kemikalije. Primarne celice, katerih delitev je treba stimulirati z mitogeni, med izpostavljenostjo preskusni kemikaliji v splošnem niso več sinhronizirane (npr. človeški limfociti po 48-urni stimulaciji z mitogeni). Uporaba sinhronih celic med tretiranjem ni priporočljiva, vendar je lahko na podlagi utemeljitve sprejemljiva. Gojišča in pogoji kultiviranja Za vzdrževanje kultur je treba uporabiti ustrezno gojišče in pogoje inkubacije (posode za gojenje, vlažno ozračje s 5 % CO2, če je ustrezno, temperatura inkubacije 37 °C). Redno je treba preverjati, ali je modalno kromosomsko število v celičnih linijah stabilno in ali te linije niso okužene z mikoplazmo (7) (19); celice se ne smejo uporabljati, če so okužene ali če se je spremenilo modalno kromosomsko število. Določiti je treba običajno trajanje celičnega cikla celičnih linij ali primarnih kultur, uporabljenih v preskuševalnem laboratoriju, ki mora biti skladno z objavljenimi lastnostmi celic (20). Priprava kultur Celične linije: celice se namnožijo iz osnovnih kultur, nasadijo v gojišče tako na gosto, da celice v suspenzijah ali monosloju še naprej eksponentno rastejo do odvzema celic (npr. pri celicah, ki rastejo v monosloju, se je treba izogibati konfluenci). Limfociti: celotna kri, obdelana z antikoagulantom (npr. heparinom), ali ločeni limfociti se dodajo v gojišče (človeški limfociti npr. za 48 ur), ki vsebuje mitogen [za človeške limfocite npr. fitohemaglutinin], da se spodbudi delitev celic pred izpostavitvijo preskusni kemikaliji. Presnovna aktivacija Pri uporabi celic, ki nimajo ustrezne notranje sposobnosti presnavljanja, je treba uporabiti zunanje presnovne sisteme. Najpogosteje uporabljani sistem, ki je priporočen kot privzet, razen če ni drugače utemeljeno, je s kofaktorjem dopolnjena postmitohondrijska frakcija (S9), pripravljena iz jeter glodalcev (običajno podgan), ki so bila obdelana s sredstvi za encimsko indukcijo, kot je Aroclor 1254 (21) (22) (23), ali z mešanico fenobarbitala in β–naftoflavona (24) (25) (26) (27) (28) (29). Ta mešanica ni v nasprotju s Stockholmsko konvencijo o obstojnih organskih onesnaževalih (30) ter se je v primerjavi s sredstvom Aroclor 1254 izkazala kot enako učinkovita za induciranje oksidaz z mešano funkcijo (24) (25) (26) (28). Frakcija S9 se v končnem preskusnem gojišču običajno uporablja v koncentracijah, ki se gibljejo v razponu od 1 do 2 vol. %, lahko pa se poveča na 10 vol. %. Med tretiranjem se je treba izogibati kemičnim izdelkom, ki zmanjšujejo mitotični indeks, zlasti snovem, ki tvorijo kalcijev kompleks (31). Na izbiro vrste in koncentracije zunanjega sistema presnovne aktivacije ali sredstva za indukcijo presnove lahko vpliva razred kemikalij, ki se preskušajo. Priprava preskusne kemikalije Trdne preskusne kemikalije je treba pred tretiranjem celic pripraviti v ustreznih topilih in, če je ustrezno, razredčiti (glej odstavek 23). Tekoče preskusne kemikalije se lahko dodajo neposredno v preskusni sistem in/ali razredčijo pred tretiranjem preskusnega sistema. Plinaste ali hlapne preskusne kemikalije je treba preskusiti z ustrezno prilagojenimi standardnimi protokoli, kot je tretiranje v zatesnjenih posodah za gojenje (32) (33) (34). Preskusne kemikalije je treba pripraviti tik pred tretiranjem, razen če podatki o stabilnosti kažejo, da je shranjevanje sprejemljivo. Preskusni pogoji Topila Izbrati je treba tako topilo, ki optimizira topnost preskusne kemikalije in ne vpliva negativno na izvedbo preskusa, npr. ne spremeni rast celic, ne vpliva na celovitost preskusne kemikalije, ne reagira s posodami za gojenje, ne ovira sistema presnovne aktivacije. Priporočljivo je, da se, kadar koli je to mogoče, najprej razmisli o uporabi vodnega topila (ali gojišča). Zelo uveljavljeni topili sta na primer voda ali dimetil sulfoksid. Organska topila v končnem obdelovalnem gojišču v splošnem ne smejo presegati 1 vol. %, vodna topila (fiziološka raztopina ali voda) pa ne 10 vol. %. Če se uporabljajo neuveljavljena topila (npr. etanol ali aceton), je treba njihovo uporabo podpreti s podatki, ki dokazujejo njihovo združljivost s preskusnimi kemikalijami in preskusnim sistemom ter odsotnost genotoksičnosti pri uporabljeni koncentraciji. Če takšnih podpornih podatkov ni, je treba vključiti netretirane kontrole (glej Dodatek 1), ki dokazujejo, da izbrano topilo ne povzroča škodljivih ali klastogenih učinkov. Merjenje celične proliferacije in citotoksičnosti ter izbira koncentracij za tretiranje Pri določanju najvišje koncentracije preskusne kemikalije se je treba izogibati koncentracijam, pri katerih se lahko pojavijo lažni pozitivni odzivi, kot so tisti, ki povzročajo preveliko citotoksičnost (glej odstavek 22), obarjanje v gojiščih (glej odstavek 23) ali znatne spremembe vrednosti pH ali osmolarnosti (glej odstavek 5). Če preskusna kemikalija ob dodajanju povzroči znatno spremembo vrednosti pH v gojišču, se lahko vrednost pH prilagodi z dodajanjem pufra v končno obdelovalno gojišče, da se izogne lažno pozitivnim rezultatom in vzdržujejo ustrezni pogoji kultiviranja. Z meritvami celične proliferacije se zagotovi, da med preskusom poteka mitoza v zadostnem številu tretiranih celic in da se tretiranja izvedejo pri ustreznih ravneh citotoksičnosti (glej odstavka 18 in 22). Citotoksičnost je treba v glavnem preskusu določiti s presnovno aktivacijo ali brez nje, pri čemer je treba uporabiti ustrezni kazalnik celične smrti in rasti. Čeprav je lahko koristno, da se zaradi boljšega določanja koncentracij, ki jih je treba uporabiti v glavnem preskusu, citotoksičnost oceni v začetnem preskusu, ta preskus ni obvezen. Če se izvede, ne sme nadomestiti merjenja citotoksičnosti v glavnem preskusu. Za oceno citotoksičnosti v citogenetskih preskusih sta ustrezni metodi relativna podvojitev populacije ali relativno povečanje števila celic (13) (15) (35) (36) (55) (glej Dodatek 2 za formule). V primeru dolgotrajnega tretiranja in časov vzorčenja po začetku tretiranja, ki so daljši od 1,5 dolžine normalnega celičnega cikla (tj. daljši od skupaj 3 celičnih ciklov), se lahko pri relativni podvojitvi populacije vrednost citotoksičnosti podceni (37). V tem primeru je boljše merilo relativno povečanje števila celic ali je v pomoč ocena citotoksičnosti po 1,5 dolžine normalnega celičnega cikla, pri čemer se uporabi relativna podvojitev populacije. Glede limfocitov v primarnih kulturah je mitotični indeks, čeprav je merilo citotoksičnih/citostatskih učinkov, odvisen od časa meritve po tretiranju, uporabljenega mitogena in morebitne motnje celičnega cikla. Vendar je mitotični indeks sprejemljiv, ker so druge meritve citotoksičnosti lahko težavne in nepraktične ter jih morda ni mogoče uporabiti za ciljno populacijo limfocitov, ki rastejo zaradi stimulacije s fitohemaglutininom. Čeprav sta relativno povečanje števila celic in relativna podvojitev populacije priporočena parametra citotoksičnosti za celične linije, mitotični indeks pa za primarno kulturo limfocitov, lahko drugi kazalniki (npr. celična neokrnjenost, nekroza, apoptoza, celični cikel) zagotovijo koristne dodatne podatke. Oceniti je treba vsaj tri preskusne koncentracije (v kar niso vključeni topilo in pozitivne kontrole), ki izpolnjujejo merila za sprejemljivost (ustrezna citotoksičnost, število celic itd.). Ne glede na vrsto celic (celične linije ali primarne kulture limfocitov) se lahko pri vsaki preskušeni koncentraciji tretira ponovitev kulture ali le ena sama kultura. Čeprav je priporočljiva uporaba podvojenih kultur, je sprejemljiva tudi ena sama kultura, če je skupno število celic v eni kulturi ali ponovitvah kulture enako. Uporaba ene kulture je zlasti pomembna, če se ocenjujejo več kot 3 koncentracije (glej odstavek 31). Za analizo podatkov se lahko zberejo rezultati, pridobljeni pri neodvisnih ponovitvah kulture za zadevno koncentracijo (38). Za preskusne kemikalije, ki kažejo malo ali nič citotoksičnosti, bodo ustrezni približno 2- do 3-kratni intervali med koncentracijami. V primeru citotoksičnosti morajo izbrane preskusne koncentracije zajemati območje iz navedene nastale citotoksičnosti, kot je opisano v odstavku 22, ter vključevati koncentracije, pri katerih je citotoksičnost zmerna oziroma majhna ali je ni. Pri številnih preskusnih kemikalijah so vidne strme krivulje odziva na koncentracijo, zato je treba za pridobitev podatkov za nizko in zmerno citotoksičnost ali podrobno proučevanje razmerja med odzivom in odmerkom uporabiti večje število koncentracij, ki so tesno skupaj, in/ali več kot tri koncentracije (ena kultura ali ponovitve kultur), zlasti kadar je treba poskus ponoviti (glej odstavek 47). Če največja koncentracija temelji na citotoksičnosti, si je treba pri najvišji koncentraciji prizadevati, da citotoksičnost ne preseže razpona 55 ± 5 %, pri čemer se uporabljajo priporočeni parametri citotoksičnosti (tj. zmanjšanje relativnega povečanja števila celic in relativne podvojitve populacije za celične linije ter zmanjšanje mitotičnega indeksa za primarne kulture limfocitov na razpon 45 ± 5 % sočasne negativne kontrole). Pozitivne rezultate, ki se nahajajo le na višjem koncu tega razpona citotoksičnosti, ki znaša 55 ± 5 %, je treba razlagati previdno (13). Pri slabo topnih preskusnih kemikalijah, ki pri koncentracijah, nižjih od najnižje netopne koncentracije, niso citotoksične, mora najvišja analizirana koncentracija ob koncu tretiranja s preskusno kemikalijo povzročiti nastanek motnosti ali oborine, ki je vidna s prostim očesom ali pod invertnim mikroskopom. Tudi če se citotoksičnost pojavi nad najnižjo netopno koncentracijo, je priporočljivo, da se preskusi le pri eni koncentraciji, ki povzroči nastanek motnosti ali vidne oborine, saj lahko oborina povzroči lažne učinke. Pri koncentraciji, ki povzroči nastanek oborine, je treba paziti, da oborina ne vpliva na izvedbo preskusa (npr. barvanje ali štetje). Koristno je lahko, če se pred preskusom določi topnost v gojišču. Če oborina ni vidna ali ni opažene mejne citotoksičnosti, mora biti najvišja preskusna koncentracija 10 mM, 2 mg/ml ali 2 μl/ml, pri čemer se upošteva najnižja od teh koncentracij (39) (40) (41). Če preskusna kemikalija nima določene sestave, kot so npr. snovi z neznano ali spremenljivo sestavo, kompleksni reakcijski produkti ali biološki materiali (UVCB) (42), okoljski ekstrakt itd., je v primeru odsotnosti ustrezne citotoksičnosti morda treba povečati najvišjo koncentracijo (npr. 5 mg/ml), da bi se povečala koncentracija vsake posamezne sestavine. Vendar je treba opozoriti, da se lahko pri zdravilih za uporabo v humani medicini te zahteve razlikujejo (43). Kontrole V vsak odvzem celic je treba vključiti sočasne negativne kontrole (glej odstavek 15), sestavljene le iz topila v obdelovalnem gojišču, ki je obdelano enako kot kulture za tretiranje. Sočasne pozitivne kontrole so potrebne, da se dokaže zmožnost laboratorija, da odkrije klastogene pod pogoji uporabljenega preskusnega protokola, in učinkovitost zunanjega sistema presnovne aktivacije, če je ustrezno. Primeri pozitivnih kontrol so navedeni v preglednici 1. Za pozitivno kontrolo se lahko uporabijo tudi druge kemikalije, če je to utemeljeno. Ker in vitro preskusi genotoksičnosti za celice sesalcev niso dovolj standardizirani, je lahko uporaba pozitivnih kontrol omejena na klastogen, pri katerem je potrebna presnovna aktivacija. Če se izvaja sočasno z neaktiviranim preskusom, pri katerem se uporablja enak čas tretiranja, se pri tem enem odzivu pozitivne kontrole pokaže tako delovanje sistema presnovne aktivacije kot tudi odzivnost preskusnega sistema. Vendar je treba pri dolgotrajnem tretiranju (brez S9) uporabiti lastno pozitivno kontrolo, saj se trajanje tretiranja razlikuje od preskusa, pri katerem se uporablja presnovna aktivacija. Vsako pozitivno kontrolo je treba uporabiti pri eni ali več koncentracijah, pri katerih se pričakuje obnovljivo in zaznavno povečanje glede na ozadje, da se dokaže občutljivost preskusnega sistema (kar pomeni, da so učinki jasni, vendar pri odčitavanju ne razkrijejo takoj identitete označenih mikroskopskih preparatov), odziva pa ne sme ogroziti citotoksičnost, ki bi presegla meje, določene za to preskusno metodo. Preglednica 1 Referenčne kemikalije, ki se priporočajo za ocenjevanje usposobljenosti laboratorija in izbor pozitivne kontrole
POSTOPEK Tretiranje s preskusno kemikalijo Množeče se celice se tretirajo s preskusno kemikalijo v prisotnosti in odsotnosti sistema presnovne aktivacije. Čas odvzema celic iz kulture Za temeljito oceno, ki bi bila potrebna za sklep o negativnem rezultatu, je treba izvesti vse tri naslednje preskusne pogoje ter pri tem uporabiti kratkotrajno tretiranje s presnovno aktivacijo in brez nje ter dolgotrajno tretiranje brez presnovne aktivacije (glej odstavke 43, 44 in 45):
Če so pri katerem koli od navedenih preskusnih pogojev rezultati pozitivni, morda ni treba raziskovati nobenih drugih režimov tretiranja. Priprava kromosomov Celične kulture se obdelajo s kolcemidom ali kolhicinom, in sicer običajno eno do tri ure pred odvzemom celic. Celice se odvzamejo in obdelajo za pripravo kromosomov iz vsake kulture posebej. Priprava kromosomov vključuje hipotonično obdelavo celic, fiksiranje in barvanje. V monosloju so lahko po zaključku obdelave, ki traja od 3 do 6 ur, prisotne mitotične celice (so okrogle in se ločujejo od površine). Ker se te mitotične celice zlahka ločijo, se lahko ob odstranitvi gojišča s preskusno kemikalijo izgubijo. Če obstaja dokaz o znatnem povečanju števila mitotičnih celic v primerjavi s kontrolnimi vzorci, ki kažejo verjetno mitotično zaviranje, je treba celice zbrati s centrifugiranjem in jih dodati nazaj h kulturam, da ne bi izgubili celic, v katerih poteka mitoza in pri katerih ob odvzemu obstaja tveganje kromosomske aberacije. Analiza Vse preparate, vključno s pozitivnimi in negativnimi kontrolami, je treba pred mikroskopsko analizo kromosomskih aberacij neodvisno označiti. Ker fiksiranje pogosto povzroči pretrganje dela celic v metafazi, ki imajo izgubljene kromosome, mora biti število centromer v štetih celicah pri vseh vrstah celic enako modalnemu številu ± 2. Na vsako koncentracijo in vsako kontrolo je treba v štetje vključiti vsaj 300 dobro vidnih metafaz, da se lahko sklepa, da je preskusna kemikalija jasno negativna (glej odstavek 45). Če se uporabljajo ponovitve kulture, mora biti teh 300 celic enakomerno porazdeljenih med ponovitvami. V primeru uporabe ene kulture na koncentracijo (glej odstavek 21) je treba v tej kulturi v štetje vključiti vsaj 300 dobro vidnih metafaz. Prednost štetja 300 celic je v tem, da poveča statistično moč preskusa in da se redko opazijo ničelne vrednosti (po pričakovanjih le 5 %) (44). Število štetih metafaz se lahko zmanjša, če se opazi veliko število celic s kromosomskimi aberacijami in se sklepa, da je preskusna kemikalija jasno pozitivna. Šteti je treba celice s strukturnimi kromosomskimi aberacijami, vključno z vrzelmi in brez njih. Prelomi in vrzeli so opredeljeni v Dodatku 1 v skladu s (45) (46). Kromatidne in kromosomske aberacije je treba zabeležiti posebej in jih razvrstiti v podvrste (prelomi, izmenjave). S postopki, ki se uporabljajo v laboratoriju, je treba zagotoviti, da analizo kromosomskih aberacij izvajajo osebe, ki so zelo usposobljene za štetje, in da se po potrebi izvede medsebojni strokovni pregled. Čeprav je preskus namenjen odkrivanju strukturnih kromosomskih aberacij, je pomembno, da se poliploidija in endoreduplikacija zabeležita, ko se opazita. (Glej odstavek 2.) Usposobljenost laboratorija Preden se začne laboratorij uporabljati za rutinsko preskušanje, mora izvesti sklop preskusov z referenčnimi pozitivnimi kemikalijami, ki delujejo z različnimi mehanizmi in različnimi negativnimi kontrolami (z uporabo različnih topil/vehiklov), s čimer dokaže, da ima zadostne izkušnje s preskusom. Ti odzivi pozitivnih in negativnih kontrol morajo biti skladni z viri. To ne velja za laboratorije, ki imajo izkušnje, tj. ki imajo na voljo zbirko podatkov iz preteklih preskusov, kot je opredeljena v odstavku 37. Izbor kemikalij za pozitivno kontrolo (glej preglednico 1 v odstavku 26) je treba preiskati s kratkotrajnim ali dolgotrajnim tretiranjem brez presnovne aktivacije ter kratkotrajnim tretiranjem ob presnovni aktivaciji, da se dokaže usposobljenost za odkrivanje klastogenih snovi in določi učinkovitost sistema presnovne aktivacije. Izbrati je treba območje koncentracij izbranih kemijskih snovi, kar omogoča ponovljiva in s koncentracijo povezana povečanja glede na ozadje, da se pokaže občutljivost in dinamično območje preskusnega sistema. Podatki o kontroli iz preteklih preskusov Laboratorij mora določiti:
Ko se podatki za porazdelitev negativnih kontrol iz preteklih preskusov pridobivajo prvič, morajo biti sočasne negativne kontrole skladne z objavljenimi podatki o kontrolah, če obstajajo. Ko se k porazdelitvi kontrol dodaja več podatkov o preskusu, sočasne negativne kontrole po možnosti ne bi smele preseči 95-odstotne kontrolne meje za navedeno porazdelitev (44) (47). Zbirka podatkov laboratorija o negativnih kontrolah iz preteklih preskusov mora sprva temeljiti na vsaj 10 preskusih, po možnosti pa mora biti sestavljena iz vsaj 20 preskusov, izvedenih v primerljivih preskusnih pogojih. Laboratoriji morajo uporabljati metode nadzora kakovosti, kot so kontrolne karte (npr. c-karte ali „X-črta“ karte (48)), da opredelijo, kako variabilni so njihovi podatki o pozitivnih in negativnih kontrolah, in pokažejo, da je metodologija v njihovem laboratoriju „pod nadzorom“ (44). Nadaljnja priporočila o načinu oblikovanja in uporabe podatkov iz preteklih preskusov (npr. merila za vključitev podatkov med podatke iz preteklih preskusov in njihovo izključitev iz teh podatkov ter merila za sprejemljivost za zadevni poskus) so navedena v virih (47). Vsako spremembo v protokolu preskusa je treba proučiti glede na skladnost z obstoječimi zbirkami podatkov laboratorija o kontrolah iz preteklih preskusov. Če se pojavijo večje neskladnosti, je treba ustvariti novo zbirko podatkov o kontrolah iz preteklih preskusov. V podatke o negativnih kontrolah je treba vključiti pojav celic s kromosomskimi aberacijami iz ene kulture ali vsote ponovitev kulture, kot je opisano v odstavku 21. Sočasne negativne kontrole po možnosti ne smejo preseči 95-odstotne kontrolne meje porazdelitve iz zbirke podatkov laboratorija o negativnih kontrolah iz preteklih preskusov (44) (47). Kadar podatki o sočasni negativni kontroli presežejo 95-odstotno kontrolno mejo, jih je sprejemljivo vključiti v porazdelitev kontrol iz preteklih preskusov, če ti podatki niso izjemni osamelci ter če obstaja dokaz, da je preskusni sistem „pod nadzorom“ (glej odstavek 37), in dokaz o odsotnosti tehničnih ali človeških napak. PODATKI IN POROČANJE Predstavitev rezultatov Oceniti je treba odstotek celic s strukturnimi kromosomskimi aberacijami. Ločeno je treba navesti kromatidne in kromosomske aberacije, razvrščene glede na podvrste (prelomi, izmenjave), skupaj z njihovim številom in pogostostmi za poskusne in kontrolne kulture. Vrzeli se zabeležijo in o njih se poroča ločeno, vendar se ne vključijo v skupno število pogostnosti aberacij. Ko se opazi poliploidija in/ali endoreduplicirane celice, se poroča o njihovem odstotku. Zabeležiti je treba sočasne meritve citotoksičnosti za vse tretirane, negativne in pozitivne kontrolne kulture v glavnih poskusih, ki se nanašajo na aberacije. Navedejo se podatki za posamezne kulture. Poleg tega se vsi podatki povzamejo v obliki preglednice. Merila za sprejemljivost Sprejemljivost preskusa temelji na naslednjih merilih:
Vrednotenje in razlaga rezultatov Pod pogojem, da so izpolnjena vsa merila za sprejemljivost, se preskusna kemikalija šteje za jasno pozitivno, če se v katerem koli od proučevanih preskusnih pogojev (glej odstavek 28):
Ko so izpolnjena vsa ta merila, se nato šteje, da lahko preskusna kemikalija povzroči nastanek kromosomskih aberacij v kultiviranih celicah sesalcev v tem preskusnem sistemu. Priporočila glede najustreznejših statističnih metod so navedena v virih (49) (50) (51). Pod pogojem, da so izpolnjena vsa merila za sprejemljivost, se preskusna kemikalija šteje za jasno negativno, če se v katerem koli od proučevanih preskusnih pogojev (glej odstavek 28):
Nato se šteje, da preskusna kemikalija ne more povzročiti nastanka kromosomskih aberacij v kultiviranih celicah sesalcev v tem preskusnem sistemu. Preverjanje jasno pozitivnega ali jasno negativnega odziva ni potrebno. Če odziv ni niti jasno negativen niti jasno pozitiven, kot je opisano zgoraj, ali za podporo pri ugotavljanju biološke pomembnosti rezultatov, je treba podatke oceniti s strokovno presojo in/ali nadaljnjimi preiskavami. Štetje dodatnih celic (po potrebi) ali izvedba ponovitve poskusa je lahko koristna, po možnosti z uporabo spremenjenih preskusnih pogojev (npr. razmik med koncentracijami, drugi pogoji za presnovno aktivacijo (tj. koncentracija ali izvor S9)). Zbirka podatkov v redkih primerih celo po izvedbi nadaljnjih preiskav onemogoča sprejetje sklepa o pozitivnih ali negativnih rezultatih, zato se zaključi, da je odziv na preskusno kemikalijo dvoumen. Povečanje števila poliploidnih celic kaže na to, da ima preskusna kemikalija potencial za zaviranje mitotičnih procesov in povzročanje numeričnih kromosomskih aberacij (52). Povečanje števila celic z endoredupliciranimi kromosomi lahko pomeni, da lahko preskusne kemikalije zavirajo potek celičnega cikla (53) (54) (glej odstavek 2). Pojav poliploidnih celic in celic z endoredupliciranimi kromosomi je zato treba zabeležiti ločeno. Poročilo o preskusu V poročilo o preskusu se vključijo naslednji podatki:
VIRI
Dodatek 1 OPREDELITVE POJMOV Anevplodija : vsako odstopanje od normalnega diploidnega (ali haploidnega) števila kromosomov za en ali več kot en kromosom, vendar ne za celotni set kromosomov (poliploidija). Apoptoza : programirana celična smrt, za katero je značilna vrsta korakov, ki vodijo v razgradnjo celic na delce, obdane z membrano, ki se nato odstranijo s fagocitozo ali osipanjem. Celična proliferacija : povečanje števila celic kot posledica mitotične delitve celic. Kemikalija : snov ali zmes. Kromatidni prelom : prekinitev ene kromatide, pri čemer je jasno vidna neporavnanost ene od kromatid. Kromatidna vrzel : neobarvano območje (akromatska lezija) posamezne kromatide, pri čemer je neporavnanost kromatide minimalna. Aberacija kromatidnega tipa : strukturna poškodba kromosoma, izražena kot prelom posamezne kromatide ali prelom in združitev med kromatidama. Aberacija kromosomskega tipa : strukturna poškodba kromosoma, izražena kot prelom ali prelom in združitev obeh kromatid na istem mestu. Klastogen : vsaka kemikalija, ki povzroči strukturne kromosomske aberacije v populacijah celic ali evkariotskih organizmih. Koncentracije : se nanašajo na končne koncentracije preskusne kemikalije v gojišču. Citotoksičnost : za poskuse, zajete v to preskusno metodo, pri katerih se uporabljajo celične linije, je citotoksičnost opredeljena kot zmanjšanje relativne podvojitve populacije (RPD) ali relativnega povečanja števila celic (RICC) pri tretiranih celicah v primerjavi z negativnimi kontrolami (glej odstavek 17 in Dodatek 2). Za poskuse, zajete v to preskusno metodo, pri katerih se uporabljajo primarne kulture limfocitov, je citotoksičnost opredeljena kot zmanjšanje mitotičnega indeksa pri tretiranih celicah v primerjavi z negativnimi kontrolami (glej odstavek 18 in Dodatek 2). Endoreduplikacija : proces, pri katerem v jedru po podvajanju DNK v fazi S ne začne potekati mitoza, temveč takoj nastopi druga faza S. Rezultat tega je, da nastanejo kromosomi s 4, 8, 16, … kromatidami. Genotoksičen : splošni pojem, ki zajema vse vrste poškodb DNK ali kromosomov, vključno s prelomi, delecijami, adukti, nukleotidnimi spremembami in povezavami, prerazporeditvami, mutacijami genov, kromosomskimi aberacijami in anevploidijo. Vsi genotoksični učinki ne vplivajo na nastanek mutacij ali trajno poškodbo kromosomov. Mitotični indeks (MI) : razmerje med številom celic v metafazi in skupnim številom celic v opazovani populaciji celic; kazalnik stopnje proliferacije te populacije. Mitoza : delitev celičnega jedra, ki je običajno razdeljena na profazo, prometafazo, metafazo, anafazo in telofazo. Mutageno : povzroča dedno spremembo zaporedij baznih parov DNK v genih ali strukturi kromosomov (kromosomske aberacije). Numerična aberacija : sprememba števila kromosomov, ki se razlikuje od običajnega števila, ki je značilno za uporabljene celice. Poliploidija : numerične kromosomske aberacije v celicah ali organizmih, ki ne vplivajo na posamezen kromosom ali kromosome (anevploidija), temveč na celoten set kromosomov. Status beljakovine p53 : beljakovina p53 je vključena v reguliranje celičnega cikla, apoptozo in popravljanje DNK. Celice brez funkcionalne beljakovine p53, ki ne morejo zaustaviti celičnega cikla ali odstraniti poškodovanih celic z apoptozo ali drugimi mehanizmi (npr. indukcijo popravljanja DNK), povezanimi s funkcijami beljakovine p53, s katerimi se ta odzove na poškodbo DNK, so teoretično bolj nagnjene h genskim mutacijam ali kromosomskim aberacijam. Relativno povečanje števila celic (RICC) : povečanje števila celic v kulturah, izpostavljenih kemikalijam, v primerjavi s povečanjem v netretiranih kulturah, pri čemer je razmerje izraženo kot odstotek. Relativna podvojitev populacije (RPD) : povečanje števila podvojitev populacije v kulturah, izpostavljenih kemikalijam, v primerjavi s povečanjem v netretiranih kulturah, pri čemer je razmerje izraženo kot odstotek. Frakcija S9, pripravljena iz jeter : supernatant iz homogenata jeter po centrifugiranju pri 9 000 g, tj. izvleček surovih jeter. Mešanica S9 : mešanica S9, pripravljene iz jeter, in kofaktorjev, potrebnih za dejavnosti presnovnih encimov. Kontrola s topilom : plošni pojem za opredelitev kontrolnih kultur, ki prejmejo samo topilo, uporabljeno za raztopitev preskusne kemikalije. Strukturna aberacija : sprememba v strukturi kromosoma, ki je vidna pri mikroskopskem pregledu metafazne stopnje celične delitve, v obliki delecij in fragmentov, transpozicij ali interkromosomskih translokacij. Preskusna kemikalija : vsaka snov ali zmes, preskušena s to preskusno metodo. Netretirane kontrole : kulture, ki se ne tretirajo (tj. niti s preskusno kemikalijo niti s topilom), temveč se sočasno tretirajo enako kot kulture, v katere se doda preskusna kemikalija. Dodatek 2 FORMULE ZA OCENJEVANJE CITOTOKSIČNOSTI Mitotični indeks (MI):
Priporočljiva sta relativno povečanje števila celic (RICC) ali relativna podvojitev populacije (RPD), saj se pri obeh metodah upošteva delež celične populacije, ki se je delil.
pri čemer je: podvojitev populacije = [log (število celic po tretiranju ÷ prvotno število celic)] ÷ log 2 Na primer RICC ali RPD s 53 % pomeni 47-odstotno citotoksičnost/citostazo, 55-odstotna citotoksičnost/citostaza, izmerjena z MI, pa pomeni, da dejanski MI znaša 45 % vrednosti kontrole. V vsakem primeru je treba izmeriti število celic pred tretiranjem ter število celic v tretiranih kulturah in negativnih kontrolnih kulturah. Čeprav se je v preteklosti kot parameter citotoksičnosti uporabljalo relativno število celic (RCC) (tj. število celic v tretiranih kulturah/število celic v kontrolnih kulturah), to ni več priporočljivo, saj lahko podceni vrednost citotoksičnosti. V negativnih kontrolnih kulturah mora biti podvojitev populacije združljiva z zahtevo po vzorčenju celic po tretiranju v času, ki ustreza približno 1,5 dolžine normalnega celičnega cikla, mitotični indeks pa mora biti dovolj visok, da v zadostnem številu celic poteka mitoza in se zanesljivo izračuna 50-odstotno zmanjšanje. |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
(4) |
Poglavje B.11 dela B se nadomesti z naslednjim: „B.11 Preskus kromosomskih aberacij v kostnem mozgu sesalcev UVOD Ta preskusna metoda je enakovredna Smernici za preskušanje OECD 475 (2016). Je del sklopa preskusnih metod o genetski toksikologiji. Pripravljen je dokument OECD, ki zagotavlja jedrnate informacije o preskušanju v zvezi z genetsko tokskikologijo in pregled nedavnih sprememb teh preskusnih smernic (1). Preskus kromosomskih aberacij in vivo v kostnem mozgu sesalcev je posebej primeren za ocenjevanje genotoksičnosti, saj so pri tem aktivni dejavniki metabolizma in vivo, farmakokinetike in popravljanja DNK, ki prispevajo k odzivom, čeprav se lahko od vrste do vrste razlikujejo. Preskus in vivo je uporaben tudi za nadaljnjo preiskavo genotoksičnosti, odkrite s sistemom in vitro. Preskus kromosomskih aberacij in vivo pri sesalcih se uporablja za odkrivanje strukturnih kromosomskih aberacij, ki jih povzroči preskusna kemikalija v celicah kostnega mozga živali, običajno glodalcev (2) (3) (4) (5). Ločimo dva tipa strukturnih kromosomskih aberacij, in sicer: kromosomski in kromatidni tip. Večina genotoksičnih, kemijsko induciranih aberacij je kromatidnih, lahko pa se pojavijo tudi aberacije kromosomskega tipa. Kromosomske poškodbe in podobni pojavi so vzrok številnih genskih bolezni pri človeku in obstajajo tehtni dokazi, da so te lezije in podobni pojavi, ki povzročajo spremembe v onkogenih in genih zaviralcih rasti tumorjev, povezani z rakom pri človeku in v poskusnih sistemih. Pri in vivo preskusih kromosomske aberacije lahko pride do poliploidije (vključno z endoreduplikacijo). Poliplodija sama po sebi še ne pomeni anevgenega potenciala, pač pa lahko samo nakazuje motnjo celičnega cikla ali citotoksičnost. Ta preskus ni zasnovan za merjenje anevploidije. Preskus mikronukleusov v eritrocitih sesalcev in vivo (poglavje B.12 te priloge) ali preskus mikronukleusov in vitro pri celicah sesalcev (poglavje B.49 te priloge) sta preskus in vivo oziroma in vitro, ki se priporočata za odkrivanje anevploidije. Opredelitve ključnih pojmov so navedene v Dodatku 1. ZAČETNI PREUDARKI V tem preskusu se običajno uporabljajo glodalci, vendar so lahko v nekaterih primerih primerne tudi druge vrste, če je to znanstveno upravičeno. Ciljno tkivo pri tem preskusu je kostni mozeg, saj je zelo vaskularizirano in vsebuje populacijo celic s hitrim potekom cikla, ki se z lahkoto izolirajo in obdelajo. V poročilu je treba znanstveno utemeljiti uporabo drugih vrst glodalcev, ki niso podgane in miši. Če se ne uporabljajo glodalci, temveč druge vrste, je priporočljivo, da se merjenje kromosomskih aberacij v kostnem mozgu vključi v drug ustrezen preskus toksičnosti. Če obstajajo dokazi, da preskusne kemikalije ali njihovi metaboliti ne bodo dosegli ciljnega tkiva, ta preskus morda ni primeren. Pred uporabo te preskusne metode za preskušanje zmesi in pridobivanje podatkov za predvideni regulativni namen bi bilo treba proučiti, ali bo zagotovila sprejemljive rezultate za navedeni namen in, če jih bo, zakaj. Kadar obstaja regulativna zahteva za preskušanje zmesi, taki preudarki niso potrebni. NAČELO PRESKUSNE METODE Živali se preskusni kemikaliji izpostavijo z ustreznim načinom izpostavljenosti in se humano evtanazirajo ob primernem času po tretiranju. Pred evtanazijo se živali tretirajo z zaviralcem metafaze (npr. kolhicinom ali kolcemidom). Nato se pripravijo in obarvajo preparati kromosomov iz celic kostnega mozga ter se analizirajo kromosomske aberacije v celicah v metafazi. PREVERJANJE USPOSOBLJENOSTI LABORATORIJA Preverjanje usposobljenosti Preden se začne laboratorij uporabljati za rutinsko preskušanje, mora dokazati, da je sposoben ponoviti pričakovane rezultate iz objavljenih podatkov (npr. (6)) za pogostost kromosomskih aberacij z vsaj dvema kemikalijama za pozitivno kontrolo (vključno z blagimi odzivi, ki jih povzročijo majhni odmerki v pozitivnih kontrolah), kot so tiste iz preglednice 1, in z združljivimi kontrolami z vehiklom/topilom (glej odstavek 22); s tem laboratorij tudi dokaže, da ima zadostne izkušnje z izvajanjem poskusov. Pri teh poskusih je treba uporabiti odmerke, pri katerih se omogočajo ponovljiva in z odmerkom povezana povečanja ter se pokažeta občutljivost in dinamično območje preskusnega sistema v zadevnem tkivu (kostni mozeg) in uporabi metoda štetja, ki jo je treba uporabljati v laboratoriju. To ne velja za laboratorije, ki imajo izkušnje, tj. ki imajo na voljo zbirko podatkov iz preteklih preskusov, kot je opredeljeno v odstavkih 10 do 14. Podatki o kontrolah iz preteklih preskusov Med preverjanjem usposobljenosti mora laboratorij določiti:
Ko se podatki o porazdelitvi negativnih kontrol iz preteklih preskusov pridobivajo prvič, morajo biti sočasne negativne kontrole skladne z objavljenimi podatki o kontrolah, če ti obstajajo. Ko se k porazdelitvi kontrol iz preteklih preskusov dodaja več podatkov o preskusu, sočasne negativne kontrole po možnosti ne bi smele preseči 95-odstotne kontrolne meje za navedeno porazdelitev. Zbirka podatkov laboratorija o negativnih kontrolah iz preteklih preskusov mora biti statistično zanesljiva, s čimer se zagotovi, da je laboratorij sposoben oceniti porazdelitev svojih podatkov o negativnih kontrolah. Iz virov je razvidno, da je potrebnih vsaj 10 preskusov, po možnosti pa mora biti zbirka sestavljena iz vsaj 20 preskusov, izvedenih v primerljivih preskusnih pogojih. Laboratoriji morajo uporabljati metode nadzora kakovosti, kot so kontrolne karte (npr. c-karte ali „X-črta“ karte (7)), da opredelijo, kako variabilni so njihovi podatki, in pokažejo, da je metodologija v njihovem laboratoriju „pod nadzorom“. Nadaljnja priporočila o načinu oblikovanja in uporabe podatkov iz preteklih preskusov (npr. merila za vključitev podatkov med podatke iz preteklih preskusov in njihovo izključitev iz teh podatkov ter merila za sprejemljivost za zadevni poskus) so navedena v virih (8). Kadar laboratorij med preverjanjem usposobljenosti (opisanim v odstavku 9) ne izvede zadostnega števila preskusov za določitev statistično zanesljive porazdelitve negativnih kontrol (glej odstavek 11), je sprejemljivo, da se lahko porazdelitev razvije med prvimi rutinskimi preskusi. Pri tem pristopu je treba upoštevati priporočila, navedena v virih (8), rezultati negativnih kontrol, pridobljeni pri teh poskusih, pa morajo ostati skladni z objavljenimi podatki o negativnih kontrolah. Vsako spremembo v protokolu poskusa je treba proučiti glede na vpliv, ki ga ima na to, da pridobljeni podatki ostanejo skladni z obstoječo zbirko podatkov laboratorija o kontrolah iz preteklih preskusov. Novo zbirko podatkov o kontrolah iz preteklih preskusov je treba ustvariti le v primeru večjih neskladnosti, kadar se s strokovno presojo oceni, da se razlikuje od prejšnje porazdelitve (glej odstavek 11). Ko se zbirka podatkov ustvarja na novo, za izvedbo dejanskega preskusa ni potrebna celotna zbirka podatkov o negativnih kontrolah, če lahko laboratorij dokaže, da vrednosti njegovih sočasnih negativnih kontrol ostajajo skladne s prejšnjo zbirko podatkov ali z ustreznimi objavljenimi podatki. V podatke o negativnih kontrolah je treba vključiti pojav strukturnih kromosomskih aberacij (razen vrzeli) za vsako žival. Sočasne negativne kontrole po možnosti ne smejo preseči 95-odstotne kontrolne meje porazdelitve iz zbirke podatkov laboratorija o negativnih kontrolah iz preteklih preskusov. Kadar podatki o sočasni negativni kontroli presežejo 95-odstotno kontrolno mejo, jih je sprejemljivo vključiti v porazdelitev kontrole iz preteklih preskusov, če ti podatki niso izjemni osamelci ter če obstaja dokaz, da je preskusni sistem „pod nadzorom“ (glej odstavek 11), in dokaz o odsotnosti tehničnih ali človeških napak. OPIS METODE Priprave Izbira živalske vrste Uporabiti je treba splošno uporabljane laboratorijske seve mladih zdravih odraslih živali. Običajno se uporabljajo podgane, primerne pa so lahko tudi miši. Uporabi se lahko katera koli druga ustrezna vrsta sesalcev, če je to v poročilu znanstveno utemeljeno. Pogoji nastanitve in hranjenja živali Pri glodalcih mora biti temperatura v prostoru s poskusnimi živalmi 22 °C (± 3 °C). Čeprav mora biti relativna vlažnost vsaj 40-odstotna in po možnosti ne sme presegati 70 %, razen med čiščenjem prostora, si je treba prizadevati za 50–60-odstotno vlažnost. Osvetlitev mora biti umetna, pri čemer je zaporedje 12 ur svetlobe in 12 ur teme. Za hranjenje se lahko uporablja običajna laboratorijska hrana z neomejeno količino pitne vode. Na izbiro hrane lahko vpliva potreba po zagotovitvi ustrezne mešanice preskusne kemikalije, kadar se daje na ta način. Glodalce je treba nastaniti v majhnih skupinah (ne več kot pet na kletko), tako da so razporejeni glede na spol in tretirano skupino, če ni pričakovati agresivnega vedenja, in sicer po možnosti v kletke s trdimi tlemi z ustrezno okoljsko obogatitvijo. Živali so lahko nastanjene posamično le, če je to znanstveno utemeljeno. Priprava živali Običajno se uporabljajo zdrave mlade živali (kar pri glodalcih pomeni, da so ob začetku tretiranja stare po možnosti od 6 do 10 tednov, čeprav so sprejemljive tudi nekoliko starejše živali), ki se naključno razporedijo v kontrolno in tretirano skupino. Posamezne živali se označijo z edinstvenimi oznakami s humano, čim manj invazivno metodo (npr. z namestitvijo obročkov ali trakov, z vsaditvijo mikročipa ali biometrično identifikacijo, ne pa z zarezovanjem ušesa ali prsta) ter se vsaj pet dni prilagajajo laboratorijskim pogojem. Kletke je treba razporediti tako, da so morebitni učinki zaradi njihovega položaja čim manjši. Izogibati se je treba navzkrižni kontaminaciji s pozitivno kontrolo in preskusno kemikalijo. Ob začetku študije mora biti razlika med težami živali čim manjša in ne sme presegati ± 20 % srednje vrednosti teže za vsak spol. Priprava odmerkov Trdne preskusne kemikalije je treba raztopiti ali suspendirati v ustreznih topilih ali vehiklih ali primešati hrani ali pitni vodi, preden se odmerijo živalim. Tekoče preskusne kemikalije se lahko odmerijo neposredno ali pa se pred odmerjanjem razredčijo. Pri izpostavljenosti z vdihavanjem se lahko preskusne kemikalije dajejo v obliki plina, pare ali trdnega/tekočega aerosola, in sicer odvisno od njihovih fizikalno-kemijskih lastnosti. Uporabiti je treba sveže pripravljene preskusne kemikalije, razen če je iz podatkov o stabilnosti razvidno, da je shranjevanje sprejemljivo, in so v njih opredeljeni ustrezni pogoji shranjevanja. Topilo/vehikel Topilo/vehikel ne sme imeti toksičnih učinkov pri uporabljenih odmerkih in ne sme zbujati suma, da lahko kemično reagira s preskusnimi kemikalijami. Če se uporabijo druga, manj znana topila/vehikli, je treba njihovo uporabo podpreti z referenčnimi podatki, ki dokazujejo njihovo združljivost. Priporočljivo je, da se, kadar koli je to mogoče, najprej razmisli o uporabi vodnega topila/vehikla. Primeri pogosto uporabljenih, združljivih topil/vehiklov so voda, fiziološka raztopina, raztopina metilceluloze, raztopina natrijeve soli karboksimetil celuloze, oljčno olje ali koruzno olje. Če ni podatkov iz preteklih preskusov ali objavljenih podatkov, iz katerih bi bilo razvidno, da izbrano neobičajno topilo/vehikel ne povzroča strukturnih aberacij ali drugih škodljivih učinkov, je treba izvesti začetno študijo, da se dokaže sprejemljivost kontrol s topilom/vehiklom. Kontrole Pozitivne kontrole V vsak preskus je treba običajno vključiti skupino živali, tretiranih s kemikalijo za pozitivno kontrolo. To se lahko odpravi, ko preskusni laboratorij dokaže svojo usposobljenost za izvajanje preskusov in določi območje pozitivnih kontrol iz preteklih preskusov. Če sočasna pozitivna kontrolna skupina ni vključena, je treba v vsak poskus vključiti kontrole za štetje (fiksirani in nebarvani mikroskopski preparati). Ti se lahko pridobijo tako, da se pri študiji v štetje vključijo ustrezni referenčni vzorci, pridobljeni in shranjeni v okviru ločenega poskusa s pozitivnimi kontrolami, ki se redno izvaja (npr. vsakih 6 do 18 mesecev) v laboratoriju, kjer se preskus izvaja; na primer med preverjanjem usposobljenosti in po tem redno, če je to potrebno. Kemikalije za pozitivno kontrolo morajo zanesljivo povzročiti zaznavno povečanje pogostosti celic s spontanimi strukturnimi kromosomskimi aberacijami. Odmerke za pozitivno kontrolo je treba izbrati tako, da so učinki jasni, vendar osebi, ki ugotovitve beleži, ne razkrijejo takoj identitete označenih mikroskopskih preparatov. Sprejemljivo je, da se odmerki v pozitivno kontrolo dajejo na način, ki ni enak kot pri preskusni kemikaliji, in da se pri tem uporabi drugačen časovni razpored tretiranja ter se vzorčenje opravi le enkrat. Poleg tega se lahko, če je ustrezno, za pozitivno kontrolo uporabijo kemikalije, ki spadajo v isto skupino nevarnosti kot preskusna kemikalija. Primeri kemikalij za pozitivno kontrolo so navedeni v preglednici 1. Preglednica 1 Primeri kemikalij za pozitivno kontrolo
Negativne kontrole V vsak čas vzorčenja je treba vključiti negativno kontrolno skupino živali, ki jo je treba sicer obravnavati enako kot tretirane skupine, vendar se je ne sme tretirati s preskusno kemikalijo. Če se pri dajanju preskusne kemikalije uporablja topilo/vehikel, ga mora prejeti tudi kontrolna skupina. Toda če sta iz podatkov o negativnih kontrolah iz preteklih preskusov pri vsakem času vzorčenja za preskusni laboratorij razvidni konsistentna variabilnost med posameznimi živalmi in pogostost celic s strukturnimi aberacijami, potem za negativno kontrolo zadostuje le eno samo vzorčenje. Če se za negativne kontrole uporablja eno samo vzorčenje, mora biti to prvi čas vzorčenja, uporabljen v študiji. POSTOPEK Število in spol živali Na splošno je odziv mikronukleusov pri živalih moškega in ženskega spola podoben (9) in pričakovati je, da bo to veljajo tudi za strukturne kromosomske aberacije; zato se lahko študije izvajajo na živalih enega ali drugega spola. Če se pri podatkih pokažejo pomembne razlike med moškim in ženskim spolom (npr. razlike v sistemski toksičnosti, metabolizmu, biološki razpoložljivosti, toksičnosti za kostni mozeg itd., vključno s študijo za ugotavljanje območja), je treba spodbujati uporabo obeh spolov. V takem primeru je študijo primerno izvajati na živalih obeh spolov, npr. kot del toksikološke študije s ponavljajočim odmerkom. V primeru uporabe obeh spolov je primerno uporabiti zasnovo preskusa z več dejavniki. Podrobnosti o tem, kako analizirati podatke z uporabo te zasnove, so navedene v Dodatku 2. Ob začetku študije je treba določiti skupine, v katerih je vsaj 5 živali enega spola ali vsakega od spolov, če se uporabljata oba, ki jih je mogoče analizirati, na skupino. Kadar bi bila lahko izpostavljenost ljudi kemikalijam omejena na en spol, na primer pri nekaterih farmacevtskih izdelkih, je treba preskus opraviti na živalih ustreznega spola. Praviloma je za študijo kostnega mozga pri dveh časih vzorčenja s tremi skupinami, ki prejemajo odmerke, ter sočasno negativno in pozitivno kontrolo (pri čemer je vsaka skupina sestavljena iz vsaj petih živali enega spola) običajno potrebnih 45 živali. Velikost odmerkov Če se izvede predhodna študija za določanje območja, ker ustrezni podatki, ki bi bili v pomoč pri izbiri odmerkov, niso na voljo, jo je treba izvesti v istem laboratoriju ter pri tem uporabiti iste vrste, sev, spol in režim tretiranja kot v glavni študiji (10). S študijo je treba določiti največji tolerančni odmerek (MTD), ki je opredeljen kot največji odmerek, ki ga je mogoče prenesti, ne da bi se pri tem pokazala toksičnost, ki bi v povezavi z obdobjem trajanja študije slednjo omejevala (na primer s povzročitvijo upočasnitve pridobivanja telesne teže ali citotoksičnosti za hematopoetski sistem, ne pa smrti ali znakov bolečine ali trpljenja, zaradi katerih je potrebna humana evtanazija (11)). Največji odmerek se lahko opredeli tudi kot odmerek, ki povzroči nastanek nekaterih znakov toksičnosti za kostni mozeg. Kemikalije, ki kažejo nasičenost toksikokinetičnih lastnosti ali povzročajo procese razstrupljanja, zaradi katerih se lahko po dolgotrajnem tretiranju zmanjša izpostavljenost, so lahko izjeme pri merilih za določanje odmerkov in jih je treba oceniti za vsak primer posebej. Da se pridobijo informacije o odzivu na odmerek, je treba v popolno študijo vključiti skupino negativne kontrole in vsaj tri velikosti odmerkov, ki so običajno ločeni s faktorjem 2, vendar ne več kot 4. Če preskusna kemikalija v študiji za ugotavljanje območja ali na podlagi obstoječih podatkov ne povzroča toksičnosti, mora biti najvišji odmerek pri enkratnem dajanju enak 2 000 mg/kg telesne teže. Če pa preskusna kemikalija povzroča toksičnost, mora biti največji tolerančni odmerek najvišji dani odmerek, v uporabljene velikosti odmerkov pa je treba po možnosti zajeti razpon od največjega odmerka do odmerka, ki povzroča malo ali nič toksičnosti. Kadar se toksičnost za ciljno tkivo (kostni mozeg) opazi pri vseh preskušanih velikostih odmerkov, je priporočljiva dodatna študija pri netoksičnih odmerkih. Pri študijah, namenjenih celovitejši opredelitvi kvantitativnih informacij o razmerju med odmerkom in odzivom, so morda potrebne dodatne skupine, ki prejemajo odmerke. Za določene vrste preskusnih kemikalij (npr. zdravila za uporabo v humani medicini), za katere veljajo posebne zahteve, se lahko te meje razlikujejo. Mejni preskus Če poskusi za ugotavljanje območja odmerka ali obstoječi podatki iz povezanih živalskih sevov kažejo, da režim tretiranja z vsaj mejnim odmerkom (opisan v nadaljevanju) ne povzroči vidnih toksičnih učinkov (tudi brez upočasnitve proliferacije kostnega mozga ali drugih dokazov o citotoksičnosti za ciljno tkivo), ter če genotoksičnost na podlagi in vitro študij genotoksičnosti ali podatkov o strukturno sorodnih kemikalijah ni pričakovana, ni potrebna popolna študija z uporabo treh velikosti odmerkov, če se dokaže, da preskusne kemikalije dosežejo ciljno tkivo (kostni mozeg). V takih primerih morda zadostuje že ena velikost odmerka pri mejnem odmerku. Pri obdobju dajanja, ki presega 14 dni, je mejni odmerek 1 000 mg/kg telesne teže na dan. Pri obdobju odmerjanja, ki je enako 14 dnem ali manj, je mejni odmerek 2 000 mg/kg telesne teže na dan. Dajanje odmerkov Pri načrtovanju preskusa je treba upoštevati predvideni način izpostavljenosti pri ljudeh. Zato se lahko ob ustrezni utemeljitvi izberejo načini izpostavljenosti, kot so s prehrano, pitno vodo, topično podkožno, intravenozno, oralno (z gavažo), z vdihavanjem, intratrahealno ali z vsadkom. V vsakem primeru je treba način izpostavljenosti izbrati tako, da se zagotovi ustrezna izpostavljenost ciljnih tkiv. Dajanje z intraperitonealno injekcijo v splošnem ni priporočljivo, saj to ni predvideni način izpostavljenosti pri ljudeh, in se lahko uporabi samo na podlagi posebne znanstvene utemeljitve. Če je preskusna kemikalija primešana hrani ali pitni vodi, zlasti v primeru enega samega odmerka, je treba paziti, da med zaužitjem hrane in vode ter vzorčenjem preteče dovolj časa, da se lahko odkrijejo učinki (glej odstavka 33 in 34). Največja količina tekočine, ki se lahko da naenkrat z gavažo ali injekcijo, je odvisna od velikosti poskusne živali. Količina običajno ne sme presegati 1 ml na 100 g telesne teže, razen pri vodnih raztopinah, pri katerih se lahko uporabi največ 2 ml na 100 g telesne teže. Uporabo večjih količin je treba utemeljiti. Razen pri dražilnih ali jedkih preskusnih kemikalijah, ki pri višjih koncentracijah običajno povzročajo močnejše učinke, je treba variabilnost preskusne količine s prilagajanjem koncentracije obdržati na čim nižji ravni, da se zagotovi konstanten volumen glede na telesno težo pri vseh odmerkih. Časovni razpored tretiranja Preskusne kemikalije se običajno dajo v enem odmerku, lahko pa tudi v razdeljenem odmerku (kar pomeni dva ali več odmerkov v istem dnevu na največ 2 do 3 ure), s čimer se olajša dajanje velike količine kemikalije. V teh okoliščinah ali v primeru dajanja preskusne kemikalije z vdihavanjem je treba čas vzorčenja načrtovati glede na čas zadnjega odmerka ali konca izpostavljenosti. Za ta preskus je na voljo malo podatkov o ustreznosti protokola s ponavljajočimi se odmerki. Vendar je treba v okoliščinah, v katerih je ta preskus zaželeno vključiti v preskus s ponavljajočimi se odmerki, paziti, da se izognemo izgubi kromosomsko poškodovanih mitotičnih celic, ki se lahko pojavi pri toksičnih odmerkih. Taka vključitev je sprejemljiva, kadar je najvišji odmerek enak ali večji od mejnega odmerka (glej odstavek 29) in se skupini, ki prejema odmerke, med celotnim obdobjem tretiranja daje mejni odmerek. Preskus mikronukleusov (preskusna metoda B.12) je treba šteti kot priporočeni in vivo preskus kromosomskih aberacij, kadar je zaželeno, da se vključi v druge študije. Vzorce kostnega mozga je treba odvzeti dvakrat ob različnih časih po prejemu posameznih odmerkov. Pri glodalcih je prvi čas vzorčenja enak času, ki potreben za dokončanje 1,5 dolžine normalnega celičnega cikla (pri čemer je slednji običajno 12 do 18 ur po obdobju tretiranja). Čas, potreben za sprejem in metabolizem preskusnih kemikalij ter njihov učinek na dinamiko celičnega cikla, lahko vpliva na optimalni čas za odkritje kromosomskih aberacij, zato je priporočljivo, da se vzorci ponovno odvzamejo 24 ur po prvem času vzorčenja. Pri prvem času vzorčenja je treba tretirati vse skupine, ki prejemajo odmerke, in vzeti vzorce za analizo; pri poznejših časih vzorčenja pa je treba dati le najvišje odmerke. Če se na podlagi znanstvene utemeljitve uporabljajo režimi odmerjanja, ki trajajo več kot en dan, je treba na splošno uporabljati en čas vzorčenja ob približno 1,5 dolžine normalnega celičnega cikla po zadnjem tretiranju. Živalim se po tretiranju in pred vzorčenjem intraperitonealno vbrizga ustrezen odmerek zaviralca metafaze (npr. kolcemid ali kolhicin), nato pa se ob ustreznem intervalu odvzamejo vzorci. Pri miših je ta interval približno 3 do 5 ur, pri podganah pa 2 do 5 ur pred vzorčenjem. Celice se odvzamejo iz kostnega mozga, nabreknejo, fiksirajo in obarvajo ter analizirajo, da se odkrijejo kromosomske aberacije (12). Opazovanja Vsaj enkrat na dan je treba opraviti splošna klinična opazovanja preskusnih živali in zabeležiti klinične znake, po možnosti vsak dan ob istem času in ob upoštevanju obdobja največje intenzivnosti pričakovanih učinkov po vnosu odmerka. Vse živali je treba med obdobjem odmerjanja vsaj dvakrat na dan opazovati za odkrivanje obolevnosti in smrtnosti. Vse živali je treba stehtati ob začetku študije, vsaj enkrat na teden med študijami s ponavljajočimi se odmerki in ob evtanaziji. V študijah, ki trajajo en teden ali več, je treba vsaj enkrat na teden izmeriti porabo hrane. Če se preskusna kemikalija daje s pitno vodo, je treba izmeriti porabo vode ob vsaki menjavi vode in vsaj tedensko. Živali, ki kažejo neletalne znake čezmerne toksičnosti, je treba humano evtanazirati pred koncem preskusnega obdobja (11). Izpostavljenost ciljnega tkiva Ob ustreznih časih je treba odvzeti vzorec krvi, da se lahko preišče raven preskusnih kemikalij v plazmi, s čimer se dokaže, da je prišlo do izpostavljenosti kostnega mozga, če je to utemeljeno in če ne obstajajo drugi podatki o izpostavljenosti (glej odstavek 44). Preparati kostnega mozga in kromosomov Takoj po humani evtanaziji se pridobijo celice kostnega mozga iz stegnenic ali golenic živali in se nato izpostavijo hipotonični raztopini in fiksirajo. Celice v metafazi so nato nanesejo na objektna stekelca in obarvajo z uporabo uveljavljenih metod (glej (3) in (12)). Analiza Vse mikroskopske preparate, vključno s tistimi s pozitivnimi in negativnimi kontrolami, je treba pred analizo neodvisno označiti in naključno razdeliti, tako da oseba, ki beleži ugotovitve, ne pozna pogojev tretiranja. Kot merilo citotoksičnosti je treba določiti mitotični indeks v vsaj 1 000 celicah na žival za vse tretirane živali (vključno s pozitivnimi kontrolami), netretirane živali negativne kontrole ali živali negativne kontrole z nosilcem/vehiklom. Pri vsaki živali je treba analizirati vsaj 200 metafaz za strukturne kromosomske aberacije, vključno z vrzelmi in brez njih (6). Če je v zbirki podatkov o negativnih kontrolah iz preteklih preskusov v preskusnem laboratoriju srednja vrednost pogostosti strukturnih kromosomskih aberacij v ozadju < 1 %, je treba razmisliti o štetju dodatnih celic. Kromatidne in kromosomske aberacije je treba zabeležiti posebej in razvrstiti v podvrste (prelomi, izmenjave). S postopki, ki se uporabljajo v laboratoriju, je treba zagotoviti, da analizo kromosomskih aberacij izvajajo osebe, ki so zelo usposobljene za štetje, in da se po potrebi izvede medsebojni strokovni pregled. Ob priznavanju, da postopki pripravljanja preparatov pogosto povzročijo pretrganje dela metafaz in posledično izgubo kromosomov, število centromer v štetih celicah torej ne sme biti manjše od 2n ± 2, pri čemer je n haploidno število kromosomov za zadevno vrsto. PODATKI IN POROČANJE Obdelava rezultatov Podatke za posamezne živali je treba prikazati v obliki preglednic. Za vsako žival je treba oceniti mitotični indeks, število štetih metafaznih celic, število aberacij na celico v metafazi in odstotek celic s strukturnimi kromosomskimi aberacijami. Različne vrste strukturnih kromosomskih aberacij je treba navesti skupaj z njihovimi števili in pogostostjo za tretirane in kontrolne skupine. Vrzeli ter poliploidne celice in celice z endoredupliciranimi kromosomi je treba zabeležiti ločeno. O pogostosti vrzeli se poroča, vendar se tega običajno ne vključi v analizo celotne pogostosti strukturnih aberacij. Če ni dokaza o razliki v odzivu med spoloma, se lahko pri statistični analizi podatki za oba spola združijo. Sporočiti je treba tudi podatke o toksičnosti za živali in klinične znake. Merila za sprejemljivost Sprejemljivost preskusa je določena z naslednjimi merili:
Vrednotenje in razlaga rezultatov Pod pogojem, da so izpolnjena vsa merila za sprejemljivost, se preskusna kemikalija šteje za jasno pozitivno, če:
Če se pri določenem času vzorčenja prouči le najvišji odmerek, se preskusna kemikalija šteje kot jasno pozitivna, če obstaja statistično značilno povečanje v primerjavi s sočasno negativno kontrolo in so rezultati zunaj porazdelitve podatkov o negativnih kontrolah iz preteklih preskusov (npr. 95-odstotna kontrolna meja, ki temelji na Poissonovi porazdelitvi). Priporočila glede najustreznejših statističnih metod so navedena v virih (13). Pri analizi razmerja med odmerkom in odzivom je treba analizirati vsaj tri tretirane skupine, ki prejemajo odmerke. V statističnih preskusih se kot poskusna enota uporabi žival. Pozitivni rezultati preskusa kromosomskih aberacij kažejo, da preskusna kemikalija povzroči nastanek strukturnih kromosomskih aberacij v kostnem mozgu preskušane vrste. Pod pogojem, da so izpolnjena vsa merila za sprejemljivost, se preskusna kemikalija šteje za jasno negativno, če se v katerem koli od proučevanih preskusnih pogojev:
Priporočila glede najustreznejših statističnih metod so navedena v virih (13). Dokazi o izpostavljenosti kostnega mozga preskusni kemikaliji lahko vključujejo zmanjšanje mitotičnega indeksa ali meritve ravni preskusnih kemikalij v plazmi ali krvi. Pri intravenoznem dajanju dokaz o izpostavljenosti ni potreben. Druga možnost za dokaz izpostavljenosti kostnega mozga je uporaba podatkov ADME (Absorption, Distribution, Metabolism, and Excretion – absorpcija, porazdelitev, metabolizem in izločanje), pridobljenih v neodvisni študiji, ki je bila opravljena z enakim načinom izpostavljenosti in istimi vrstami. Negativni rezultati pomenijo, da preskusna kemikalija pri preskusnih pogojih ne povzroča strukturnih kromosomskih aberacij v kostnem mozgu preskušane vrste. Preverjanje jasno pozitivnega ali jasno negativnega odziva ni potrebno. V primerih, ko odziv ni jasno negativen ali pozitiven, in za pomoč pri opredelitvi biološke pomembnosti rezultatov (npr. šibko ali mejno povečanje), je treba podatke oceniti s strokovno presojo in/ali nadaljnjimi preiskavami zaključenih obstoječih poskusov. V nekaterih primerih je koristno, če se analizira več celic ali poskus ponovi s spremenjenimi preskusnimi pogoji. Podatki v redkih primerih celo po izvedbi nadaljnjih preiskav ne omogočajo sklepa o tem, ali preskusna kemikalija povzroča pozitivne ali negativne rezultate, zato se zaključi, da je odziv dvoumen. Pogostost poliploidnih in endoredupliciranih metafaz med skupnim številom metafaz je treba zabeležiti posebej. Povečanje števila poliploidnih/endoredupliciranih celic kaže na to, da ima preskusna kemikalija potencial za zaviranje mitotičnih procesov ali poteka celičnega cikla (glej odstavek 3). Poročilo o preskusu V poročilo o preskusu se vključijo naslednji podatki: Povzetek
VIRI
Dodatek 1 OPREDELITVE POJMOV Anevplodija : je vsako odstopanje od normalnega diploidnega (ali haploidnega) števila kromosomov za en ali več kot en kromosom, vendar ne za večkratnik celotnega števila kromosomov (prim.: poliploidija). Centromera : del kromosoma, s katerim se med delitvijo celic povežejo niti delitvenega vretena, kar omogoči urejeno gibanje hčerinskih kromosomov proti poloma hčerinskih celic. Kemikalija : snov ali zmes. Aberacija kromatidnega tipa : strukturna poškodba kromosoma, izražena kot prelom posameznih kromatid ali prelom in združitev med kromatidama. Aberacija kromosomskega tipa : strukturna poškodba kromosoma, izražena kot prelom ali prelom in združitev obeh kromatid na istem mestu. Endoreduplikacija : proces, pri katerem v jedru po podvajanju DNK v fazi S ne začne potekati mitoza, temveč takoj nastopi druga faza S. Rezultat tega so kromosomi s 4, 8, 16 … kromatidami. Vrzel : akromatska lezija, ki je manjša od širine ene kromatide, z zelo majhno neporavnanostjo kromatid. Mitotični indeks : razmerje med številom celic v mitozi in skupnim številom celic v populaciji, ki je merilo statusa proliferacije navedene celične populacije. Numerična aberacija : sprememba števila kromosomov, ki se razlikuje od normalnega števila, ki je značilno za uporabljene živali (anevploidija). Poliploidija : numerična kromosomska aberacija, ki vključuje spremembo števila celotnega seta kromosomov v primerjavi s spremembo števila v delu seta kromosomov (prim.: anevploidija). Strukturna kromosomska aberacija : sprememba v strukturi kromosoma, ki se lahko odkrije pri mikroskopskem pregledu metafaze celične delitve in je vidna v obliki delecij in fragmentov, transpozicij ali interkromosomskih translokacij. Preskusna kemikalija : vsaka snov ali zmes, preskušena s to preskusno metodo. Dodatek 2 ZASNOVA PRESKUSA Z VEČ DEJAVNIKI ZA OPREDELITEV RAZLIK MED SPOLOMA PRI PRESKUSU KROMOSOMSKIH ABERACIJ IN VIVO Zasnova preskusa z več dejavniki in analiza v njenem okviru Pri tej zasnovi se preskusi vsaj 5 živali moškega in vsaj 5 živali ženskega spola pri vsaki koncentraciji, tako da se uporabi vsaj 40 živali (20 moškega in 20 ženskega spola ter ustrezne pozitivne kontrole). Ta zasnova, ki je ena enostavnejših zasnov preskusa z več dejavniki, je enakovredna dvosmerni analizi variance, pri čemer sta glavna učinka spol in koncentracija. Podatki se lahko analizirajo z različnimi standardnimi statističnimi programskimi paketi, kot so SPSS, SAS, STATA, Genstat, ter z uporabo programskega jezika R. Z analizo se variabilnost v naboru podatkov popolnoma razvrsti v variabilnost med spoloma, variabilnost med koncentracijami in variabilnost, povezano z medsebojnim vplivom med spoloma in koncentracijami. Vsak pogoj se preskusi glede na oceno variabilnosti med živalmi iz ponovljenih preskusov v skupinah živali istega spola pri isti koncentraciji. Celotne podrobnosti osnovne metodologije so na voljo v številnih standardnih statističnih učbenikih (glej vire) in pomoči uporabnikom, ki jo zagotavljajo statistični paketi. Analiza se začne s pregledom pogojev medsebojnega vpliva „spol x koncentracija“ v preglednici z analizo variance (5). Če ni precejšnjega medsebojnega vpliva, zagotavljajo skupne vrednosti za spola ali koncentracije veljavne statistične preskuse med koncentracijami, ki temeljijo na združenem vplivu variabilnosti znotraj skupine v preglednici z analizo variance. Analiza se nadaljuje s popolno razvrstitvijo ocene med variabilnostjo koncentracij v kontraste, s čimer se zagotovi preskus za linearne in kvadratne kontraste odzivov med različnimi koncentracijami. Če „spol x koncentracija“ kaže znaten medsebojni vpliv, se lahko ta vpliv popolnoma razvrsti v medsebojne vplive „linearni kontrast x spol“ in „kvadratni kontrast x spol“. S temi vplivi se zagotavljajo preskusi tega, ali so odzivi na koncentracije za oba spola vzporedni ali pa so odzivi med spoloma različni. Ocena združene variabilnosti znotraj skupine se lahko uporabi za pare preskusov v zvezi z razlikami med srednjimi vrednostmi. Te primerjave se lahko naredijo med srednjimi vrednostmi za oba spola in med srednjimi vrednostmi za različne koncentracije, kot na primer za primerjave s stopnjami v negativnih kontrolah. V primerih z znatnim medsebojnim vplivom se lahko primerjajo srednje vrednosti različnih koncentracij pri istem spolu ali srednje vrednosti obeh spolov pri isti koncentraciji. Viri Obstajajo številni statistični učbeniki, v katerih se razpravlja o teoriji, zasnovi, metodologiji, analizi in razlagi zasnove preskusov z več dejavniki, ki se gibljejo od najenostavnejših analiz z dvema dejavnikoma do bolj zapletenih oblik, uporabljenih v metodologiji zasnove poskusov. Naslednji seznam ni izčrpen. V nekaterih knjigah so obdelani primeri primerljivih zasnov, ki imajo v nekaterih primerih kodo za izvajanje analize z uporabo različnih programskih paketov.
|
|
(5) |
Poglavje B.12 dela B se nadomesti z naslednjim: „B.12 Preskus mikronukleusov v eritrocitih sesalcev UVOD Ta preskusna metoda je enakovredna Smernici za preskušanje OECD 474 (2016). Je del sklopa preskusnih metod o genetski toksikologiji. Pripravljen je dokument OECD, ki zagotavlja jedrnate informacije o preskušanju v zvezi z genetsko tokskikologijo in pregled nedavnih sprememb teh preskusnih smernic (1). Preskus mikronukleusov in vivo pri sesalcih je posebej primeren za ocenjevanje genotoksičnosti, saj so pri tem aktivni dejavniki metabolizma in vivo, farmakokinetike in procesi popravljanja DNK, ki prispevajo k odzivom, čeprav se lahko med posameznimi vrstami razlikujejo. Preskus in vivo je uporaben tudi za nadaljnjo preiskavo genotoksičnosti, odkrite s sistemom in vitro. Preskus mikronukleusov in vivo pri sesalcih se uporablja za odkrivanje škode, ki jo preskusna kemikalija povzroči na kromosomih ali mitotičnem aparatu eritroblastov. Pri preskusu se ocenjuje nastajanje mikronukleusov v eritrocitih, vzorčenih v kostnem mozgu ali celicah periferne krvi živali, običajno glodalcev. Namen preskusa mikronukleusov je opredeliti kemikalije, ki povzročajo citogenetske poškodbe, zaradi katerih nastanejo mikronukleusi, ki vsebujejo zaostale fragmente kromosomov ali cele kromosome. Kadar se eritroblast kostnega mozga razvije v nezrel eritrocit (ki se včasih imenuje tudi polikromatski eritrocit ali retikulocit), se jedro izvrže; vsak nastali mikronukleus lahko ostane v citoplazmi. V teh celicah je lažje videti ali odkriti mikronukleuse, saj nimajo jedra. Povečanje pogostosti nezrelih eritrocitov z mikronukleusi pri tretiranih živalih je znak nastanka strukturnih ali numeričnih kromosomskih aberacij. Novo nastali eritrociti z mikronukleusi se opredelijo in količinsko določijo z barvanjem, čemur sledi bodisi vizualno štetje z mikroskopom bodisi z avtomatizirano analizo. Štetje zadostnega števila nezrelih eritrocitov v periferni krvi ali kostnem mozgu odraslih živali se precej olajša z uporabo avtomatizirane platforme za štetje. Take platforme so sprejemljive alternative ročnemu ocenjevanju (2). Iz primerjalnih študij je razvidno, da lahko take metode, pri katerih so uporabljeni ustrezni kalibracijski standardi, zagotovijo boljšo ponovljivost in občutljivost v enem in več laboratorijih kot ročno štetje pod mikroskopom (3) (4). Avtomatizirani sistemi, s katerimi se lahko izmeri pogostost eritrocitov z mikronukleusi, vključujejo, niso pa omejeni na pretočne citometre (5), platforme za analizo slike (6) (7) in laserske vrstične citometre (8). Čeprav se to običajno ne izvaja kot del preskusa, se lahko fragmenti kromosomov od celih kromosomov razlikujejo po številnih merilih. Mednje je vključena opredelitev prisotnosti ali odsotnosti kinetohora ali centromerne DNK, kar je oboje lastnost nepoškodovanih kromosomov. Če kinetohor ali centromerna DNK nista prisotna, to pomeni, da mikronukleusi vsebujejo samo fragmente kromosomov, če pa eden od njiju je, to označuje izgubo kromosomov. Opredelitve ključnih pojmov so navedene v Dodatku 1. ZAČETNI PREUDARKI Ciljno tkivo za genetske poškodbe v tem preskusu je kostni mozeg mladih odraslih glodalcev, saj v tem tkivu nastajajo eritrociti. Sprejemljive so tudi meritve mikronukleusov v nezrelih eritrocitih periferne krvi pri drugih sesalcih, za katere je bila dokazana ustrezna občutljivost za odkrivanje kemikalij, ki v teh celicah povzročajo strukturne in numerične kromosomske aberacije (z nastajanjem mikronukleusov v nezrelih eritrocitih), in podana znanstvena utemeljitev. Glavna končna točka je pogostost nezrelih eritrocitov z mikronukleusi. Kot končna točka pri vrstah brez močne vranične selekcije proti celicam z mikronukleusi in v primeru, ko se živali tretirajo nepretrgano v obdobju, ki presega življenjsko dobo eritrocita v uporabljenih vrstah (npr. 4 tedne ali več za miš), se lahko uporabi tudi pogostost zrelih eritrocitov periferne krvi, ki vsebujejo mikronukleuse. Če obstajajo dokazi, da preskusne kemikalije ali njihovi metaboliti ne bodo dosegli ciljnega tkiva, ta preskus morda ni primeren. Pred uporabo te preskusne metode za preskušanje zmesi in pridobivanje podatkov za predvideni regulativni namen bi bilo treba proučiti, ali bo zagotovila sprejemljive rezultate za navedeni namen in, če jih bo, zakaj. Kadar obstaja regulativna zahteva za preskušanje zmesi, taki preudarki niso potrebni. NAČELO PRESKUSNE METODE Živali se primerno izpostavijo preskusni kemikaliji. Če se uporabi kostni mozeg, se živali ob primernem času po tretiranju humano evtanazirajo, nato se ekstrahira kostni mozeg ter naredijo in obarvajo preparati (9) (10) (11) (12) (13) (14) (15). Če se uporabi periferna kri, se ta odvzame ob primernem času po tretiranju, nato se pripravijo in obarvajo preparati (12) (16) (17) (18). Pri akutnem dajanju odmerka je pomembno izbrati kostni mozeg ali čas odvzema krvi, pri katerem se lahko odkrije nastanek s tretiranjem povezanih nezrelih eritrocitov z mikronukleusi. V primeru vzorčenja periferne krvi mora preteči dovolj časa, da se ti dogodki pojavijo tudi v krvnem obtoku. Preparati se analizirajo, da se določi prisotnost mikronukleusov, in sicer z vizualizacijo z mikroskopom, analizo slike, pretočnim citometrom ali laserskim vrstičnim citometrom. PREVERJANJE USPOSOBLJENOSTI LABORATORIJA Preverjanje usposobljenosti Preden se začne laboratorij uporabljati za rutinsko preskušanje, mora dokazati, da je sposoben ponoviti pričakovane rezultate iz objavljenih podatkov (17) (19) (20) (21) (22) za pogostost mikronukleusov z vsaj dvema kemikalijama pozitivne kontrole (vključno z blagimi odzivi, ki jih povzročijo majhni odmerki v pozitivnih kontrolah), kot so tiste iz preglednice, 1 in z združljivimi kontrolami z vehiklom/topilom (glej odstavek 26); s tem laboratorij tudi dokaže, da ima zadostne izkušnje z izvajanjem preskusa. Pri teh poskusih je treba uporabiti odmerke, pri katerih se omogočajo ponovljiva in z odmerkom povezana povečanja ter se pokažeta občutljivost in dinamično območje preskusnega sistema v zadevnem tkivu (kostni mozeg ali periferna kri) in uporabi metoda štetja, ki jo je treba uporabljati v laboratoriju. To ne velja za laboratorije, ki imajo izkušnje, tj. ki imajo na voljo zbirko podatkov iz preteklih preskusov, kot je opredeljeno v odstavkih 14 do 18. Podatki o kontrolah iz preteklih preskusov Med preverjanjem usposobljenosti mora laboratorij določiti:
Ko se podatki o porazdelitvi negativnih kontrol iz preteklih preskusov pridobivajo prvič, morajo biti sočasne negativne kontrole skladne z objavljenimi podatki o kontrolah, če ti obstajajo. Ko se k porazdelitvi kontrol iz preteklih preskusov dodaja več podatkov o preskusu, sočasne negativne kontrole po možnosti ne bi smele preseči 95-odstotne kontrolne meje za navedeno porazdelitev. Zbirka podatkov laboratorija o negativnih kontrolah iz preteklih preskusov mora biti statistično zanesljiva, s čimer se zagotovi, da je laboratorij sposoben oceniti porazdelitev svojih podatkov o negativnih kontrolah. Iz virov je razvidno, da je potrebnih vsaj 10 preskusov, po možnosti pa mora biti zbirka sestavljena iz vsaj 20 preskusov, izvedenih v primerljivih preskusnih pogojih. Laboratoriji morajo uporabljati metode nadzora kakovosti, kot so kontrolne karte (npr. c-karte ali „X-črta“ karte (23)), da opredelijo, kako variabilni so njihovi podatki, in pokažejo, da je metodologija v njihovem laboratoriju „pod nadzorom“. Nadaljnja priporočila o načinu oblikovanja in uporabe podatkov iz preteklih preskusov (tj. merila za vključitev podatkov med podatke iz preteklih preskusov in njihovo izključitev iz teh podatkov ter merila za sprejemljivost za zadevni poskus) so navedena v virih (24). Kadar laboratorij med preverjanjem usposobljenosti (opisanim v odstavku 13) ne izvede zadostnega števila preskusov za določitev statistično zanesljive porazdelitve negativnih kontrol (glej odstavek 15), je sprejemljivo, da se lahko porazdelitev razvije med prvimi rutinskimi preskusi. Pri tem pristopu je treba upoštevati priporočila, navedena v virih (24), rezultati negativnih kontrol, pridobljeni pri teh poskusih, pa morajo ostati skladni z objavljenimi podatki o negativnih kontrolah. Vsako spremembo v protokolu poskusa je treba proučiti glede na vpliv, ki ga ima na to, da pridobljeni podatki ostanejo skladni z obstoječo zbirko podatkov laboratorija o kontrolah iz preteklih preskusov. Novo zbirko podatkov o kontrolah iz preteklih preskusov je treba ustvariti le v primeru večjih neskladnosti, kadar se s strokovno presojo oceni, da se razlikuje od prejšnje porazdelitve (glej odstavek 15). Ko se zbirka podatkov ustvarja na novo, za izvedbo dejanskega preskusa ni potrebna celotna zbirka podatkov o negativnih kontrolah, če lahko laboratorij dokaže, da vrednosti njegovih sočasnih negativnih kontrol ostajajo skladne s prejšnjo zbirko podatkov ali z ustreznimi objavljenimi podatki. V podatke o negativnih kontrolah je treba vključiti pojav nezrelih eritrocitov z mikronukleusi za vsako žival. Sočasne negativne kontrole po možnosti ne smejo preseči 95-odstotne kontrolne meje porazdelitve iz zbirke podatkov laboratorija o negativnih kontrolah iz preteklih preskusov. Kadar podatki o sočasni negativni kontroli presežejo 95-odstotno kontrolno mejo, jih je sprejemljivo vključiti v porazdelitev kontrole iz preteklih preskusov, če ti podatki niso izjemni osamelci ter če obstaja dokaz, da je preskusni sistem „pod nadzorom“ (glej odstavek 15), in dokaz o odsotnosti tehničnih ali človeških napak. OPIS METODE Priprave Izbira živalske vrste Uporabiti je treba splošno uporabljane laboratorijske seve mladih zdravih odraslih živali. Uporabijo se lahko miši, podgane ali druge ustrezne vrste sesalcev. Če se uporablja periferna kri, je treba zagotoviti, da odstranjevanje vraničnih celic z mikronukleusi iz krvnega obtoka ne vpliva na odkrivanje nastalih mikronukleusov pri izbranih vrstah. To je bilo jasno prikazano za periferno kri pri miših in podganah (2). V poročilu je treba znanstveno utemeljiti uporabo drugih vrst glodalcev, ki niso podgane in miši. Če se ne uporabljajo glodalci, temveč druge vrste, je priporočljivo, da se merjenje nastalih mikronukleusov vključi v drug ustrezen preskus toksičnosti. Pogoji nastanitve in hranjenja živali Pri glodalcih mora biti temperatura v prostoru s poskusnimi živalmi 22 °C (± 3 °C). Čeprav mora biti relativna vlažnost vsaj 40-odstotna in po možnosti ne sme presegati 70 %, razen med čiščenjem prostora, si je treba prizadevati za 50–60-odstotno vlažnost. Osvetlitev mora biti umetna, pri čemer je zaporedje 12 ur svetlobe in 12 ur teme. Za hranjenje se lahko uporablja običajna laboratorijska hrana z neomejeno količino pitne vode. Na izbiro hrane lahko vpliva potreba po zagotovitvi ustrezne mešanice preskusne kemikalije, kadar se daje na ta način. Glodalce je treba nastaniti v majhnih skupinah (ne več kot pet na kletko), tako da so razporejeni glede na spol in tretirano skupino, če ni pričakovati agresivnega vedenja, in sicer po možnosti v kletke s trdimi tlemi z ustrezno okoljsko obogatitvijo. Živali so lahko nastanjene posamično le, če je to znanstveno utemeljeno. Priprava živali Običajno se uporabljajo zdrave mlade živali (kar pri glodalcih pomeni, da so ob začetku tretiranja stare po možnosti od 6 do 10 tednov, čeprav so sprejemljive tudi nekoliko starejše živali), ki se naključno razporedijo v kontrolno in tretirano skupino. Posamezne živali se označijo z edinstvenimi oznakami s humano, čim manj invazivno metodo (npr. z namestitvijo obročkov ali trakov, z vsaditvijo mikročipa ali biometrično identifikacijo, ne pa z zarezovanjem ušesa ali prsta) ter se vsaj pet dni prilagajajo laboratorijskim pogojem. Kletke je treba razporediti tako, da so morebitni učinki zaradi njihovega položaja čim manjši. Izogibati se je treba navzkrižni kontaminaciji s pozitivno kontrolo in preskusno kemikalijo. Ob začetku študije mora biti razlika med težami živali čim manjša in ne sme presegati ± 20 % srednje vrednosti teže za vsak spol. Priprava odmerkov Trdne preskusne kemikalije je treba raztopiti ali suspendirati v ustreznih topilih ali vehiklih ali primešati hrani ali pitni vodi, preden se odmerijo živalim. Tekoče preskusne kemikalije se lahko odmerijo neposredno ali pa se pred odmerjanjem razredčijo. Pri izpostavljenosti z vdihavanjem se lahko preskusne kemikalije dajejo v obliki plina, pare ali trdnega/tekočega aerosola, in sicer odvisno od njihovih fizikalno-kemijskih lastnosti. Uporabiti je treba sveže pripravljene preskusne kemikalije, razen če je iz podatkov o stabilnosti razvidno, da je shranjevanje sprejemljivo, in so v njih opredeljeni ustrezni pogoji shranjevanja. Preskusni pogoji Topilo/vehikel Topilo/vehikel ne sme imeti toksičnih učinkov pri uporabljenih odmerkih in ne sme biti sposoben kemično reagirati s preskusnimi kemikalijami. Če se uporabijo druga, manj znana topila/vehikli, je treba njihovo uporabo podpreti z referenčnimi podatki, ki dokazujejo njihovo združljivost. Priporočljivo je, da se, kadar koli je to mogoče, najprej razmisli o uporabi vodnega topila/vehikla. Primeri pogosto uporabljenih, združljivih topil/vehiklov so voda, fiziološka raztopina, raztopina metilceluloze, raztopina natrijeve soli karboksimetil celuloze, oljčno olje ali koruzno olje. Če ni podatkov iz preteklih preskusov ali objavljenih podatkov, iz katerih bi bilo razvidno, da izbrano neobičajno topilo/vehikel ne povzroča nastanka mikronukleusov ali drugih škodljivih učinkov, je treba izvesti začetno študijo, da se dokaže sprejemljivost kontrol s topilom/vehiklom. Kontrole Pozitivne kontrole V vsak preskus je treba običajno vključiti skupino živali, tretiranih s kemikalijo za pozitivno kontrolo. To se lahko odpravi, ko preskusni laboratorij dokaže svojo usposobljenost za izvajanje preskusov in določi območje pozitivnih kontrol iz preteklih preskusov. Če sočasna pozitivna kontrolna skupina ni vključena, je treba v vsak poskus vključiti kontrole za štetje (fiksirane in nebarvane mikroskopske preparate ali vzorce celične suspenzije, kar je ustrezno za metodo štetja). Ti se lahko pridobijo tako, da se pri študiji v štetje vključijo ustrezni referenčni vzorci, pridobljeni in shranjeni v okviru ločenega poskusa s pozitivnimi kontrolami, ki se redno izvaja (npr. vsakih 6 do 18 mesecev); na primer med preverjanjem usposobljenosti in po tem redno, če je to potrebno. Kemikalije za pozitivno kontrolo morajo zanesljivo povzročiti zaznavno spontano povečanje pogostosti mikronukleusov. Pri ročnem štetju z mikroskopijo je treba odmerke pozitivnih kontrol izbrati tako, da so učinki jasni, vendar osebi, ki ugotovitve beleži, ne razkrijejo takoj identitete označenih mikroskopskih preparatov. Sprejemljivo je, da se odmerki v pozitivno kontrolo dajejo na način, ki ni enak kot pri preskusni kemikaliji, in da se pri tem uporabi drugačen časovni razpored tretiranja ter se vzorčenje opravi le enkrat. Poleg tega se lahko, če je ustrezno, za pozitivno kontrolo uporabijo kemikalije, ki spadajo v isto skupino nevarnosti kot preskusna kemikalija. Primeri kemikalij za pozitivno kontrolo so navedeni v preglednici 1. Preglednica 1 Primeri kemikalij za pozitivno kontrolo Kemikalije in št. CAS etil metansulfonat [št. CAS: 62-50-0] metil metansulfonat [št. CAS: 66-27-3] etilnitrozourea [št. CAS: 759-73-9] mitomicin C [št. CAS: 50-07-7] ciklofosfamid (monohidrat) [št. CAS: 50-18-0 (št. CAS: 6055-19-2)] trietilenmelamin [št. CAS: 51-18-3] kolhicin [št. CAS: 64-86-8] ali vinblastin [št. CAS: 865-21-4] – kot anevgena Negativne kontrole V vsak čas vzorčenja je treba vključiti negativno kontrolno skupino živali, ki jo je treba sicer obravnavati enako kot tretirane skupine, vendar se je ne sme tretirati s preskusno kemikalijo. Če se pri dajanju preskusne kemikalije uporablja topilo/vehikel, ga mora prejeti tudi kontrolna skupina. Toda če sta iz podatkov o negativnih kontrolah iz preteklih preskusov pri vsakem času vzorčenja za preskusni laboratorij razvidni konsistentna variabilnost med posameznimi živalmi in pogostost celic z mikronukleusi, potem za negativno kontrolo zadostuje le eno samo vzorčenje. Če se za negativne kontrole uporablja eno samo vzorčenje, mora biti to prvi čas vzorčenja, uporabljen v študiji. Če se uporablja periferna kri, je namesto sočasne negativne kontrole sprejemljiv vzorec, vzet pred tretiranjem, kadar so podatki, ki iz tega izhajajo, skladni z zbirko podatkov o kontrolah iz preteklih preskusov za preskusni laboratorij. Za podgane se je pokazalo, da ima vzorčenje majhnih količin (npr. pod 100 μl na dan) pred tretiranjem minimalen učinek na pogostost mikronukleusov v ozadju (25). POSTOPEK Število in spol živali Na splošno je odziv mikronukleusov pri živalih moškega in ženskega spola podoben, zato se lahko študije izvajajo na živalih enega ali drugega spola (26). Če se pri podatkih pokažejo pomembne razlike med moškim in ženskim spolom (npr. razlike v sistemski toksičnosti, metabolizmu, biološki razpoložljivosti, toksičnosti za kostni mozeg itd., vključno na primer v študiji za ugotavljanje območja), je treba spodbujati uporabo obeh spolov. V takem primeru je študijo primerno izvajati na živalih obeh spolov, npr. kot del toksikološke študije s ponavljajočim odmerkom. V primeru uporabe obeh spolov je primerno uporabiti zasnovo preskusa z več dejavniki. Podrobnosti o tem, kako analizirati podatke z uporabo te zasnove, so navedene v Dodatku 2. Ob začetku študije je treba določiti skupine, v katerih je vsaj 5 živali enega spola ali vsakega od spolov, če se uporabljata oba, ki jih je mogoče analizirati, na skupino. Kadar bi bila lahko izpostavljenost ljudi kemikalijam omejena na en spol, na primer pri nekaterih farmacevtskih izdelkih, je treba preskus opraviti na živalih ustreznega spola. Praviloma je za študijo kostnega mozga, izvedeno v skladu s parametri iz odstavka 37 s tremi skupinami, ki prejemajo odmerke, ter sočasno negativno in pozitivno kontrolo (pri čemer je vsaka skupina sestavljena iz vsaj petih živali enega spola), potrebnih od 25 do 35 živali. Velikost odmerkov Če se izvede predhodna študija za določanje območja, ker ustrezni podatki, ki bi bili v pomoč pri izbiri odmerkov, niso na voljo, jo je treba izvesti v istem laboratoriju ter pri tem uporabiti iste vrste, sev, spol in režim tretiranja kot v glavni študiji (27). S študijo je treba določiti največji tolerančni odmerek (MTD), ki je opredeljen kot največji odmerek, ki ga je mogoče prenesti, ne da bi se pri tem pokazala toksičnost, ki bi v povezavi z obdobjem trajanja študije slednjo omejevala (na primer s povzročitvijo upočasnitve pridobivanja telesne teže ali citotoksičnosti za hematopoetski sistem, ne pa smrti ali znakov bolečine ali trpljenja, zaradi katerih je potrebna humana evtanazija (28)). Največji odmerek se lahko opredeli tudi kot odmerek, ki povzroči toksičnost za kostni mozeg (npr. zmanjšanje deleža nezrelih eritrocitov med vsemi eritrociti v kostnem mozgu ali periferni krvi za več kot 50 %, vendar ne za manj kot 20 % kontrolne vrednosti). Vendar se pri analiziranju CD71-pozitivnih celic v perifernem krvnem obtoku (npr. s pretočno citometrijo) ta zelo mlada frakcija nezrelih eritrocitov hitreje odziva na toksične učinke kot večja RNK-pozitivna kohorta nezrelih eritrocitov. Zato je lahko pri proučevanju frakcije CD71-pozitivnih nezrelih eritrocitov z zasnovami akutne izpostavljenosti vidna višja očitna toksičnost v primerjavi s tistimi, pri katerih se nezreli eritrociti opredelijo na podlagi vsebnosti RNK. Kadar tretiranje pri poskusih traja pet dni ali manj, se zato lahko najvišja velikost odmerka preskusnih kemikalij, ki povzroča toksičnost, opredeli kot odmerek, ki povzroča statistično značilno zmanjšanje deleža CD71-pozitivnih nezrelih eritrocitov med vsemi eritrociti, vendar ne na manj kot 5 % vrednosti v kontroli (29). Kemikalije, ki kažejo nasičenost toksikokinetičnih lastnosti ali povzročajo procese razstrupljanja, zaradi katerih se lahko po dolgotrajnem tretiranju zmanjša izpostavljenost, so lahko izjeme pri merilih za določanje odmerkov in jih je treba oceniti za vsak primer posebej. Da se pridobijo informacije o odzivu na odmerek, je treba v popolno študijo vključiti skupino negativne kontrole in vsaj tri velikosti odmerkov, ki so običajno ločeni s faktorjem 2, vendar ne več kot 4. Če preskusna kemikalija v študiji za ugotavljanje območja ali na podlagi obstoječih podatkov ne povzroča toksičnosti, je največji odmerek za 14- ali večdnevno obdobje dajanja kemikalije 1 000 mg/kg telesne teže na dan, za manj kot 14-dnevno obdobje dajanja kemikalije pa 2 000 mg/kg telesne teže na dan. Če pa preskusna kemikalija povzroča toksičnost, mora biti največji tolerančni odmerek najvišji dani odmerek, v uporabljene velikosti odmerkov pa je treba po možnosti zajeti razpon od največjega odmerka do odmerka, ki povzroča malo ali nič toksičnosti. Kadar se toksičnost za ciljno tkivo (kostni mozeg) opazi pri vseh preskušanih velikostih odmerkov, je priporočljiva dodatna študija pri netoksičnih odmerkih. Pri študijah, namenjenih celovitejši opredelitvi kvantitativnih informacij o razmerju med odmerkom in odzivom, so morda potrebne dodatne skupine, ki prejemajo odmerke. Za določene vrste preskusnih kemikalij (npr. zdravila za uporabo v humani medicini), za katere veljajo posebne zahteve, se lahko te meje razlikujejo. Mejni preskus Če poskusi za ugotavljanje območja odmerka ali obstoječi podatki iz povezanih živalskih sevov kažejo, da režim tretiranja z vsaj mejnim odmerkom (opisan v nadaljevanju) ne povzroči vidnih toksičnih učinkov (tudi brez upočasnitve proliferacije kostnega mozga ali drugih dokazov o citotoksičnosti za ciljno tkivo), ter če genotoksičnost na podlagi in vitro študij genotoksičnosti ali podatkov o strukturno sorodnih kemikalijah ni pričakovana, ni potrebna popolna študija z uporabo treh velikosti odmerkov, če se dokaže, da preskusne kemikalije dosežejo ciljno tkivo (kostni mozeg). V takih primerih morda zadostuje že ena velikost odmerka pri mejnem odmerku. Kadar se kemikalija daje 14 dni ali več, je mejni odmerek 1 000 mg/kg telesne teže na dan. Pri obdobju odmerjanja, krajšem od 14 dni, je mejni odmerek 2 000 mg/kg telesne teže na dan. Dajanje odmerkov Pri načrtovanju preskusa je treba upoštevati predvideni način izpostavljenosti pri ljudeh. Zato se lahko ob ustrezni utemeljitvi izberejo načini izpostavljenosti, kot so s prehrano, pitno vodo, topično podkožno, intravenozno, oralno (z gavažo), z vdihavanjem, intratrahealno ali z vsadkom. V vsakem primeru je treba način izpostavljenosti izbrati tako, da se zagotovi ustrezna izpostavljenost ciljnih tkiv. Dajanje z intraperitonealno injekcijo v splošnem ni priporočljivo, saj to ni predvideni način izpostavljenosti pri ljudeh, in se lahko uporabi samo na podlagi posebne znanstvene utemeljitve. Če je preskusna kemikalija primešana hrani ali pitni vodi, zlasti v primeru enega samega odmerka, je treba paziti, da med zaužitjem hrane in vode ter vzorčenjem preteče dovolj časa, da se lahko odkrijejo učinki (glej odstavek 37). Največja količina tekočine, ki se lahko da naenkrat z gavažo ali injekcijo, je odvisna od velikosti poskusne živali. Količina običajno ne sme presegati 1 ml na 100 g telesne teže, razen pri vodnih raztopinah, pri katerih se lahko uporabi največ 2 ml na 100 g telesne teže. Uporabo večjih količin je treba utemeljiti. Razen pri dražilnih ali jedkih preskusnih kemikalijah, ki pri višjih koncentracijah običajno povzročajo močnejše učinke, je treba variabilnost preskusne količine s prilagajanjem koncentracije obdržati na čim nižji ravni, da se zagotovi konstanten volumen glede na telesno težo pri vseh odmerkih. Časovni razpored tretiranja Po možnosti se izvedeta 2 tretiranji ali več s preskusno kemikalijo, ki se daje v 24-urnih intervalih, zlasti kadar je ta preskus vključen v druge študije toksičnosti. Druga možnost je dajanje posamičnih odmerkov, če je to znanstveno utemeljeno (npr. če je za preskusne kemikalije znano, da zavirajo celični cikel). Preskusne kemikalije se lahko dajejo tudi v razdeljenem odmerku, kar pomeni dva ali več odmerkov v istem dnevu na največ 2 do 3 ure, s čimer se olajša dajanje velike količine kemikalije. V teh okoliščinah ali v primeru dajanja preskusne kemikalije z vdihavanjem je treba čas vzorčenja načrtovati glede na čas zadnjega odmerka ali konca izpostavljenosti. Preskus na miših ali podganah se lahko izvede na enega od naslednjih treh načinov:
Uporabljajo se lahko tudi drugi režimi odmerjanja in vzorčenja, če so ustrezni in znanstveno utemeljeni, da se olajša povezovanje z drugimi študijami toksičnosti. Opazovanja Vsaj enkrat na dan je treba opraviti splošna klinična opazovanja preskusnih živali in zabeležiti klinične znake, po možnosti vsak dan ob istem času in ob upoštevanju obdobja največje intenzivnosti pričakovanih učinkov po vnosu odmerka. Vse živali je treba med obdobjem odmerjanja vsaj dvakrat na dan opazovati za odkrivanje obolevnosti in smrtnosti. Vse živali je treba stehtati ob začetku študije, vsaj enkrat na teden med študijami s ponavljajočimi se odmerki in ob evtanaziji. V študijah, ki trajajo en teden ali več, je treba vsaj enkrat na teden izmeriti porabo hrane. Če se preskusna kemikalija daje s pitno vodo, je treba izmeriti porabo vode ob vsaki menjavi vode in vsaj tedensko. Živali, ki kažejo neletalne znake čezmerne toksičnosti, je treba humano evtanazirati pred koncem preskusnega obdobja (28). Pod določenimi pogoji se lahko spremlja telesna temperatura živali, saj sta v nastajanje napačnih rezultatov vključeni hiper- in hipotermija, ki ju povzroči tretiranje (32) (33) (34). Izpostavljenost ciljnega tkiva Ob ustreznih časih je treba odvzeti vzorec krvi, da se lahko preišče raven preskusnih kemikalij v plazmi, s čimer se dokaže, da je prišlo do izpostavljenosti kostnega mozga, če je to utemeljeno in če ne obstajajo drugi podatki o izpostavljenosti (glej odstavek 48). Priprava kostnega mozga/krvi Takoj po humani evtanaziji se celice kostnega mozga običajno pridobijo iz stegnenic ali golenic živali. Celice se običajno odstranijo, preparirajo in obarvajo z uporabo uveljavljenih metod. Majhne količine periferne krvi se lahko v skladu z ustreznimi standardi dobrobiti živali pridobijo z metodo, ki omogoča preživetje poskusne živali, kot je s puščanjem krvi iz repne vene ali druge primerne žile, ali pa s punkcijo srca ali vzorčenjem iz velike žile pri evtanaziji živali. Pri kostnem mozgu ali eritrocitih iz periferne krvi se lahko celice glede na metodo analize takoj supravitalno obarvajo (16) (17) (18) ali pa se pripravijo razmazi, ki se nato obarvajo za mikroskopijo ali fiksirajo in ustrezno obarvajo za analizo s pretočnim citometrom. Uporaba DNK-specifičnega barvila [npr. akridin oranž (35) ali Hoechst 33258 plus pyronin-Y (36)] lahko prepreči nastajanje nekaterih artefaktov, povezanih z uporabo barvila, ki ni DNK-specifično. Kljub tej prednosti pa se lahko uporabijo običajna barvila (npr. Giemsa za mikroskopsko analizo). Lahko se uporabijo tudi dodatni sistemi [npr. celulozne kolone za odstranitev celic z jedri (37) (38)], če je bilo dokazano, da so ti sistemi združljivi s pripravo vzorcev v laboratoriju. Če se uporabljajo te metode, se lahko za opredelitev narave mikronukleusov (kromosom/fragment kromosoma) uporabijo antikinetohorna protitelesa (39), fluorescentna in situ hibridizacija (FISH) s pancentromernimi DNK-sondami (40) ali označevanje začetnih oligonukleotidov in situ s premazi, specifičnimi za centromere, skupaj z ustreznim nasprotnim barvanjem DNK (41), zato da se določi, ali mehanizem nastajanja mikronukleusov povzroča klastogena in/ali anevgena dejavnost. Za razlikovanje med anevgeni in klastogeni se lahko uporabijo druge metode, če so se izkazale za učinkovite. Analiza (ročna in avtomatizirana) Vse mikroskopske preparate ali vzorce, vključno s tistimi s pozitivnimi in negativnimi kontrolami, je treba pred analizo neodvisno označiti in naključno razdeliti, tako da oseba, ki beleži ugotovitve, ne pozna pogojev tretiranja; če se uporablja avtomatiziran sistem štetja, ki se ne opira na vizualne preglede in nanj izvajalec ne more vplivati, tako označevanje ni potrebno. Za vsako žival se določi delež nezrelih eritrocitov med vsemi (nezrelimi + zrelimi) eritrociti, tako da se prešteje skupno vsaj 500 eritrocitov pri kostnem mozgu in 2 000 eritrocitov pri periferni krvi (42). V določanje pojavnosti nezrelih eritrocitov z mikronukleusi je treba vključiti vsaj 4 000 nezrelih eritrocitov na žival (43). Če je v zbirki podatkov o negativnih kontrolah iz preteklih preskusov v preskusnem laboratoriju srednja vrednost pogostosti nezrelih eritrocitov z mikronukleusi v ozadju < 0,1 %, je treba razmisliti o štetju dodatnih celic. Pri analiziranju vzorcev delež nezrelih eritrocitov med vsemi eritrociti v tretiranih živalih pri štetju z mikroskopijo ne sme biti nižji od 20 % deleža v kontroli z vehiklom/topilom, pri štetju CD71-pozitivnih nezrelih eritrocitov s citometričnimi metodami pa nižji od približno 5 % deleža v kontroli z vehiklom/topilom (glej odstavek 31) (29). Če je na primer pri preskusu kostnega mozga pri štetju z mikroskopijo kontrolni delež nezrelih eritrocitov v kostnem mozgu 50 %, je zgornja meja toksičnosti enaka 10 % nezrelih eritrocitov. Ker vranica podgane zadrži in uniči eritrocite z mikronukleusi, je za vzdrževanje visoke občutljivosti poskusa pri analiziranju periferne krvi podgane analizo nezrelih eritrocitov z mikronukleusi bolje omejiti na najmlajšo frakcijo. Pri metodah za avtomatizirano analizo je mogoče te najbolj nezrele eritrocite opredeliti na podlagi njihove visoke vsebnosti RNK ali visoke ravni receptorjev transferina (CD71-pozitivni), izraženih na njihovi površini (31). Vendar je neposredna primerjava različnih metod obarvanja pokazala, da je zadovoljive rezultate mogoče dobiti z različnimi metodami, vključno z običajnim barvanjem z barvilom akridin oranž (3) (4). PODATKI IN POROČANJE Obdelava rezultatov Podatke za posamezne živali je treba prikazati v obliki preglednic. Za vsako analizirano žival posebej je treba navesti število štetih nezrelih eritrocitov, število nezrelih eritrocitov z mikronukleusi in število nezrelih eritrocitov med vsemi eritrociti. Kadar se miši tretirajo neprekinjeno 4 tedne ali več, je treba navesti tudi podatke o številu in deležu zrelih eritrocitov z mikronukleusi, če so zbrani. Sporočiti je treba tudi podatke o toksičnosti za živali in klinične znake. Merila za sprejemljivost Sprejemljivost preskusa je določena z naslednjimi merili:
Vrednotenje in razlaga rezultatov Pod pogojem, da so izpolnjena vsa merila za sprejemljivost, se preskusna kemikalija šteje za jasno pozitivno, če:
Če se pri določenem času vzorčenja prouči le najvišji odmerek, se preskusna kemikalija šteje kot jasno pozitivna, če obstaja statistično značilno povečanje v primerjavi s sočasno negativno kontrolo in so rezultati zunaj porazdelitve podatkov o negativnih kontrolah iz preteklih preskusov (npr. 95-odstotna kontrolna meja, ki temelji na Poissonovi porazdelitvi). Priporočila glede najustreznejših statističnih metod so navedena v virih (44) (45) (46) (47). Pri analizi razmerja med odmerkom in odzivom je treba analizirati vsaj tri tretirane skupine, ki prejemajo odmerke. V statističnih preskusih se kot poskusna enota uporabi žival. Pozitivni rezultati pri preskusu mikronukleusov kažejo, da preskusna kemikalija povzroča nastanek mikronukleusov, ki so posledica poškodb kromosomov ali mitotičnega aparata v eritroblastih preskušane vrste. Če je preskus izveden za odkrivanje centromer v mikronukleusih, je preskusna kemikalija, ki povzroča nastanek mikronukleusov s centromerami (centromerne DNK ali kinetohora, ki so znak izgube celih kromosomov), dokaz, da je preskusna kemikalija anevgen. Pod pogojem, da so izpolnjena vsa merila za sprejemljivost, se preskusna kemikalija šteje za jasno negativno, če se v katerem koli od proučevanih preskusnih pogojev:
Priporočila glede najustreznejših statističnih metod so navedena v virih (44) (45) (46) (47). Dokazi o izpostavljenosti kostnega mozga preskusni kemikaliji lahko vključujejo zmanjšanje razmerja nezrelih eritrocitov ali meritve ravni preskusne kemikalije v plazmi ali krvi. Pri intravenoznem dajanju dokaz o izpostavljenosti ni potreben. Druga možnost za dokaz izpostavljenosti kostnega mozga je uporaba podatkov ADME (Absorption, Distribution, Metabolism, and Excretion – absorpcija, porazdelitev, metabolizem in izločanje), pridobljenih v neodvisni študiji, ki je bila opravljena z enakim načinom izpostavljenosti in istimi vrstami. Negativni rezultati pomenijo, da preskusna kemikalija pri preskusnih pogojih ne povzroča nastanka mikronukleusov v nezrelih eritrocitih preskušane vrste. Preverjanje jasno pozitivnega ali jasno negativnega odziva ni potrebno. V primerih, ko odziv ni jasno negativen ali pozitiven, in za pomoč pri opredelitvi biološke pomembnosti rezultatov (npr. šibko ali mejno povečanje), je treba podatke oceniti s strokovno presojo in/ali nadaljnjimi preiskavami zaključenih obstoječih poskusov. V nekaterih primerih je koristno, če se analizira več celic ali poskus ponovi s spremenjenimi preskusnimi pogoji. Podatki v redkih primerih celo po izvedbi nadaljnjih preiskav ne omogočajo sklepa o tem, ali preskusna kemikalija povzroča pozitivne ali negativne rezultate, zato se zaključi, da je odziv dvoumen. Poročilo o preskusu V poročilo o preskusu se vključijo naslednji podatki:
VIRI
Dodatek 1 OPREDELITVE POJMOV Centromera : del kromosoma, s katerim se med delitvijo celic povežejo niti delitvenega vretena, kar omogoči urejeno gibanje hčerinskih kromosomov proti poloma hčerinskih celic. Kemikalija : snov ali zmes. Eritroblast : zgodnja stopnja razvoja eritrocita, takoj pred nezrelim eritrocitom, v kateri celica še vedno vsebuje jedro. Kinetohor : beljakovinska struktura, ki nastane na centromeri evkariotskih celic in povezuje kromosom mikrotubulnimi polimeri iz mitotskega vretena med mitozo in mejozo ter deluje med delitvijo celic, da loči sestrske kromatide. Mikronukleusi : majhna jedra, ki se nahajajo poleg glavnega jedra celic in so od njega ločena ter nastanejo med telofazo mitoze (mejoze) iz zaostalih fragmentov kromosomov ali celih kromosomov. Normokromatski ali zrel eritrocit : popolnoma zrel eritrocit, ki je izgubil ostanek RNK, ki ostane po enukleaciji (izločitvi jedra), in/ali ostale kratkožive celične označevalce, ki značilno izginejo po enukleaciji po končni delitvi eritroblasta. Polikromatski ali nezrel eritrocit : novonastali eritrocit na vmesni stopnji razvoja, ki se zaradi prisotnosti ostanka RNK v novonastalih celicah obarva z modrimi in rdečimi sestavinami pri klasični tehniki barvanja krvnih razmazov, kot je barvanje po Wright-Giemsi. Take novonastale celice so približno enake kot retikulociti, ki postanejo vidni z uporabo supravitalnega obarvanja, zaradi katerega se ostanek RNK nakopiči v retikulumu. Za določanje novonastalih rdečih krvničk se pogosto uporabljajo druge metode, vključno z monokromatskim barvanjem RNK s fluorescentnimi barvili ali označevanjem s kratkoživimi površinskimi označevalci, kot je CD71 s fluorescentnimi protitelesi. Polikromatski eritrociti, retikulociti in CD71-pozitivni eritrociti so nezreli eritrociti, čeprav ima vsak od njih nekoliko drugačno razdelitev po starosti celice. Retikulocit : novonastali eritrocit, obarvan s supravitalnim barvilom, zaradi katerega se ostanek celične RNK nakopiči v značilnem retikulumu. Retikulociti in polikromatski eritrociti imajo podobno razdelitev po starosti celice. Preskusna kemikalija : vsaka snov ali zmes, preskušena s to preskusno metodo. Dodatek 2 ZASNOVA PRESKUSA Z VEČ DEJAVNIKI ZA OPREDELITEV RAZLIK MED SPOLOMA PRI PRESKUSU KROMOSOMSKIH ABERACIJ IN VIVO Zasnova preskusa z več dejavniki in analiza v njenem okviru Pri tej zasnovi se preskusi vsaj 5 živali moškega in vsaj 5 živali ženskega spola pri vsaki koncentraciji, tako da se uporabi vsaj 40 živali (20 moškega in 20 ženskega spola ter ustrezne pozitivne kontrole). Ta zasnova, ki je ena enostavnejših zasnov preskusa z več dejavniki, je enakovredna dvosmerni analizi variance, pri čemer sta glavna učinka spol in koncentracija. Podatki se lahko analizirajo z različnimi standardnimi statističnimi programskimi paketi, kot so SPSS, SAS, STATA, Genstat, ter z uporabo programskega jezika R. Z analizo se variabilnost v naboru podatkov popolnoma razvrsti v variabilnost med spoloma, variabilnost med koncentracijami in variabilnost, povezano z medsebojnim vplivom med spoloma in koncentracijami. Vsak pogoj se preskusi glede na oceno variabilnosti med živalmi iz ponovljenih preskusov v skupinah živali istega spola pri isti koncentraciji. Celotne podrobnosti osnovne metodologije so na voljo v številnih standardnih statističnih učbenikih (glej vire) in pomoči uporabnikom, ki jo zagotavljajo statistični paketi. Analiza se začne s pregledom pogojev medsebojnega vpliva „spol x koncentracija“ v preglednici z analizo variance (6). Če ni precejšnjega medsebojnega vpliva, zagotavljajo skupne vrednosti za spola ali koncentracije veljavne statistične preskuse med koncentracijami, ki temeljijo na združenem vplivu variabilnosti znotraj skupine v preglednici z analizo variance. Analiza se nadaljuje s popolno razvrstitvijo ocene med variabilnostjo koncentracij v kontraste, s čimer se zagotovi preskus za linearne in kvadratne kontraste odzivov med različnimi koncentracijami. Če „spol x koncentracija“ kaže znaten medsebojni vpliv, se lahko ta vpliv popolnoma razvrsti v medsebojne vplive „linearni kontrast x spol“ in „kvadratni kontrast x spol“. S temi vplivi se zagotavljajo preskusi tega, ali so odzivi na koncentracije za oba spola vzporedni ali pa so odzivi med spoloma različni. Ocena združene variabilnosti znotraj skupine se lahko uporabi za pare preskusov v zvezi z razlikami med srednjimi vrednostmi. Te primerjave se lahko naredijo med srednjimi vrednostmi za oba spola in med srednjimi vrednostmi za različne koncentracije, kot na primer za primerjave s stopnjami v negativnih kontrolah. V primerih z znatnim medsebojnim vplivom se lahko primerjajo srednje vrednosti različnih koncentracij pri istem spolu ali srednje vrednosti obeh spolov pri isti koncentraciji. Viri Obstajajo številni statistični učbeniki, v katerih se razpravlja o teoriji, zasnovi, metodologiji, analizi in razlagi zasnove preskusov z več dejavniki, ki se gibljejo od najenostavnejših analiz z dvema dejavnikoma do bolj zapletenih oblik, uporabljenih v metodologiji zasnove poskusov. Naslednji seznam ni izčrpen. V nekaterih knjigah so obdelani primeri primerljivih zasnov, ki imajo v nekaterih primerih kodo za izvajanje analize z uporabo različnih programskih paketov.
|
|
(6) |
Poglavje B.15 dela B se črta. |
|
(7) |
Poglavje B.16 dela B se črta. |
|
(8) |
Poglavje B.18 dela B se črta. |
|
(9) |
Poglavje B.19 dela B se črta. |
|
(10) |
Poglavje B.20 dela B se črta. |
|
(11) |
Poglavje B.24 dela B se črta. |
|
(12) |
Poglavje B.47 dela B se nadomesti z naslednjim: „B.47 Preskusna metoda za določanje motnjave in prepustnosti roženice goveda za opredelitev i) kemikalij, ki povzročajo hude poškodbe oči, in ii) kemikalij, ki jih ni treba razvrstiti glede na draženje oči ali hude poškodbe oči UVOD Ta preskusna metoda je enakovredna Smernici za preskušanje OECD (TG) 437 (2013). Preskusno metodo za določanje motnjave in prepustnosti roženice goveda (Bovine Corneal Opacity and Permeability – preskusna metoda BCOP) je v letih 2006 in 2010 ocenil Medagencijski koordinacijski odbor za validacijo alternativnih metod (ICCVAM) v sodelovanju z Evropskim centrom za validacijo alternativnih metod (ECVAM) ter Japonskim centrom za validacijo alternativnih metod (JaCVAM) (1) (2). Pri prvem ocenjevanju je bila preskusna metoda BCOP ocenjena glede na svojo uporabnost za opredelitev kemikalij (snovi in zmesi), ki povzročajo hude poškodbe oči (1). Pri drugem ocenjevanju je bila navedena preskusna metoda ocenjena glede na svojo uporabnost za opredelitev kemikalij (snovi in zmesi), ki niso razvrščene glede na draženje oči ali hude poškodbe oči (2). Validacijska zbirka podatkov preskusne metode BCOP je vsebovala skupaj 113 snovi in 100 zmesi (2) (3). Na podlagi obeh ocenjevanj in njunega medsebojnega strokovnega pregleda je bilo ugotovljeno, da se lahko s preskusno metodo pravilno opredelijo kemikalije (snovi in zmesi), ki povzročajo hude poškodbe oči (kategorija 1), ter tiste, ki jih ni treba razvrstiti glede na draženje oči ali hude poškodbe oči, kot je opredeljeno v globalno usklajenem sistemu Združenih narodov za razvrščanje in označevanje kemikalij (GHS) (4) ter Uredbi (ES) št. 1272/2008 o razvrščanju, označevanju in pakiranju snovi ter zmesi (CLP) (7), zato je bila za oba namena podprta kot znanstveno veljavna. Huda poškodba oči je povzročitev poškodbe očesnega tkiva ali resne fizične okvare vida po nanosu preskusne kemikalije na sprednjo površino očesa, ki ni v celoti popravljiva v 21 dneh po nanosu. Preskusne kemikalije, ki povzročajo hude poškodbe oči, so razvrščene v kategorijo 1 po sistemu GHS ZN. Kemikalije, ki niso razvrščene glede na draženje oči ali hude poškodbe oči, so opredeljene kot kemikalije, ki ne izpolnjujejo meril za razvrstitev v kategorijo 1 ali 2 (2A ali 2B) po GHS ZN, kar pomeni da se nanje sklicuje kot na kemikalije brez kategorije po GHS ZN. Ta preskusna metoda vključuje priporočeno uporabo in omejitve preskusne metode BCOP, ki temeljijo na njenih ocenah. Najpomembnejše razlike med prvotno različico smernic za preskušanje OECD iz leta 2009 in posodobljeno različico iz leta 2013 se nanašajo, niso pa omejene na: uporabo preskusne metode BCOP za opredelitev kemikalij, ki jih ni treba razvrstiti glede na sistem GHS ZN (odstavka 2 in 7); pojasnila o uporabnosti preskusne metode BCOP za preskušanje alkoholov, ketonov in trdnih snovi (odstavka 6 in 7) ter snovi in zmesi (odstavek 8): pojasnila o tem, kako je treba preskušati površinsko aktivne snovi in zmesi, ki vsebujejo površinsko aktivne snovi (odstavek 28); najnovejše informacije in pojasnila o pozitivnih kontrolah (odstavka 39 in 40); posodobitev meril za odločanje o preskusni metodi BCOP (odstavek 47); posodobitev meril za sprejemljivost študije (odstavek 48); posodobitev elementov poročila o preskusu (odstavek 49); posodobitev Dodatka 1 o opredelitvah pojmov; vključitev Dodatka 2 o napovedovalni zmogljivosti preskusne metode BCOP v okviru različnih sistemov za razvrščanje; posodobitev Dodatka 3 o seznamu kemikalij za preverjanje usposobljenosti ter posodobitev Dodatka 4 o držalu za roženico pri preskusni metodi BCOP (odstavek 1) ter opacitometru (odstavka 2 in 3). Zdaj na splošno velja, da Draizovega preskusa draženja oči in vivo v bližnji prihodnosti ne bo mogoče nadomestiti z enim samim preskusom draženja oči in vitro, da bi se predvidel celoten razpon dražilnih učinkov za različne kemijske razrede. Draizov preskus draženja oči pa bi morda lahko nadomestile strateške kombinacije več alternativnih preskusnih metod v okviru (večstopenjske) strategije preskušanja (5). Pristop od zgoraj navzdol (5) je treba uporabiti takrat, ko se na podlagi obstoječih informacij pričakuje, da bo imela kemikalija visok potencial draženja, pristop od spodaj navzgor (5) pa takrat, ko se na podlagi obstoječih informacij pričakuje, da kemikalija ne bo povzročila tolikšnega draženja oči, da bi jo bilo treba razvrstiti. Preskusna metoda BCOP je metoda preskušanja in vitro, ki se lahko pod določenimi pogoji in s posebnimi omejitvami uporabi za razvrstitev glede na nevarnosti za oči in označevanje kemikalij. Čeprav se preskusna metoda BCOP ne obravnava kot veljaven samostojen nadomestek za preskus draženja oči in vivo na kuncih, se vseeno priporoča kot prvi korak preskusne strategije, kot je pristop od zgoraj navzdol, ki ga priporoča Scott idr. (5), za opredelitev kemikalij, ki povzročajo hude poškodbe oči, tj. kemikalij, ki jih je treba v kategorijo 1 po GHS ZN razvrstiti brez nadaljnjega preskušanja (4). Ta metoda je priporočljiva tudi za opredelitev kemikalij, ki jih ni treba razvrstiti glede na draženje oči ali hude poškodbe oči, kot je opredeljeno v sistemu GHS ZN (brez kategorije po GHS ZN) (4), v okviru strategije preskušanja, kot je pristop od spodaj navzgor (5). Vendar če se s preskusno metodo BCOP ne predvidi, da kemikalija povzroča hude poškodbe oči ali razvrstitev glede na draženje oči/hude poškodbe oči, bi bilo treba to kemikalijo dodatno preskusiti (in vitro in/ali in vivo), da se določi končna razvrstitev. V tej preskusni metodi so opisani postopki za oceno potencialne nevarnosti preskusne kemikalije za oči glede na njeno zmožnost, da v izolirani roženici goveda povzroča motnjavo in povečano prepustnost. Toksični učinki na roženico se merijo z: (i) zmanjšanim prenosom svetlobe (motnjava) in (ii) povečanim prehajanjem barvila natrijevega fluoresceina (prepustnost). Oceni motnjave in prepustnosti roženice po izpostavljenosti preskusni kemikaliji se združita, iz tega rezultata pa se nato izpelje stopnja draženja in vitro (IVIS), ki se uporablja za razvrstitev preskusne kemikalije v različne stopnje draženja. Opredelitve pojmov so navedene v Dodatku 1. ZAČETNI PREUDARKI IN OMEJITVE Ta preskusna metoda temelji na protokolu preskusne metode BCOP odbora ICCVAM (6) (7), ki je bil prvotno razvit na podlagi informacij, pridobljenih iz protokola Inštituta za raziskave in vitro (IIVS) in protokola INVITTOX št. 124 (8). Slednji se je uporabil za predvalidacijsko študijo, ki je bila izvedena med letoma 1997–1998 in jo je sponzorirala Evropska skupnost. Oba protokola temeljita na preskusni metodi BCOP, o kateri so prvi poročali Gautheron idr. (9). Preskusna metoda BCOP se lahko uporabi za opredelitev kemikalij, ki povzročajo hude poškodbe oči, kot je opredeljeno v sistemu GHS ZN, tj. kemikalij, ki jih je treba razvrstiti v kategorijo 1 po GHS ZN (4). Kadar se uporablja za ta namen, je v primerjavi s podatki preskusa draženja oči in vivo na kuncih, razvrščenimi glede na sistem za razvrščanje GHS ZN, njena splošna točnost 79-odstotna (150/191), delež lažno pozitivnih rezultatov je 25-odstoten (32/126), delež lažno negativnih rezultatov pa 14-odstoten (9/65) (3) (glej preglednico 1 v Dodatku 2). Kadar so iz zbirke podatkov izključene preskusne kemikalije iz določenega kemijskega (npr. alkoholi, ketoni) ali fizikalnega (tj. trdne snovi) razreda, je splošna točnost preskusne metode BCOP glede na sistem za razvrščanje GHS ZN 85-odstotna (111/131), delež lažno pozitivnih rezultatov je 20-odstoten (16/81), delež lažno negativnih rezultatov pa 8-odstoten (4/50) (3). Morebitne pomanjkljivosti preskusne metode BCOP, kadar se uporablja za opredelitev kemikalij, ki povzročajo hude poškodbe oči (kategorija 1 po GHS ZN), temeljijo na visokem deležu lažno pozitivnih rezultatov za alkohole in ketone ter visokem deležu lažno negativnih rezultatov za trdne snovi, kot kaže validacijska zbirka podatkov (1) (2) (3). Vendar ker s preskusno metodo BCOP niso precenjene vrednosti vseh alkoholov in ketonov, pač pa so nekatere napovedane pravilno, tj. da spadajo v kategorijo 1 po GHS ZN, se ne šteje, da sta ti dve organski funkcionalni skupini izločeni s področij uporabe preskusne metode. Uporabnik te preskusne metode se mora odločiti, ali so morebitne precenjene vrednosti alkohola ali ketona sprejemljive ali je treba izvesti nadaljnje preskušanje po pristopu, ki temelji na zanesljivosti dokazov. Glede lažno negativnih rezultatov za trdne snovi je treba opozoriti, da lahko trdne snovi pri Draizovem preskusu draženja oči in vivo povzročijo spremenljive in ekstremne pogoje izpostavljenosti, zaradi česar je napoved njihovega resničnega potenciala draženja lahko brezpredmetna (10). Opozoriti je treba tudi na to, da noben od lažno negativnih rezultatov, opredeljenih v validacijski zbirki podatkov odbora ICCVAM (2) (3) v okviru opredeljevanja kemikalij, ki povzročajo hude poškodbe oči (kategorija 1 po GHS ZN), ni povzročil stopnje IVIS ≤ 3, kar je merilo, ki se uporablja za opredelitev preskusne kemikalije kot brez kategorije po GHS ZN. Poleg tega lažno negativni rezultati preskusne metode BCOP v tem okviru niso ključni, saj se vse preskusne kemikalije, pri katerih se stopnja IVIS giblje v razponu od 3 do 55, naknadno preskusijo z drugimi ustrezno potrjenimi preskusi in vitro ali – kot zadnja možnost – s preskusom na kuncih, in sicer glede na regulativne zahteve, pri čemer se uporabi strategija zaporednega preskušanja s pristopom, ki temelji na zanesljivosti dokazov. Ob upoštevanju dejstva, da je mogoče za nekatere trdne kemikalije s preskusno metodo BCOP pravilno napovedati, da spadajo v kategorijo 1 po GHS ZN, se za to fizikalno stanje ne šteje, da je zunaj področja uporabe preskusne metode. Raziskovalci lahko razmislijo o uporabi te preskusne metode za vse vrste kemikalij, pri čemer je treba stopnjo IVIS > 55 sprejeti kot kazalnik za odziv, ki povzroča hude poškodbe oči, ki bi jih bilo treba razvrstiti v kategorijo 1 po GHS ZN brez nadaljnjega preskušanja. Kot je bilo že navedeno, pa je treba pozitivne rezultate, pridobljene z uporabo alkoholov ali ketonov, razlagati previdno zaradi morebitne precenitve vrednosti. Preskusna metoda BCOP se lahko uporabi tudi za opredelitev kemikalij, ki jih ni treba razvrstiti glede na draženje oči ali hude poškodbe oči v skladu s sistemom za razvrščanje GHS ZN (4). Kadar se uporablja za ta namen, je v primerjavi s podatki preskusa draženja oči in vivo na kuncih, razvrščenimi glede na sistem za razvrščanje GHS ZN, njena splošna točnost 69-odstotna (135/196), delež lažno pozitivnih rezultatov je 69-odstoten (61/89), delež lažno negativnih rezultatov pa 0-odstoten (0/107) (3) (glej preglednico 2 v Dodatku 2). Delež dobljenih lažno negativnih rezultatov (kemikalije in vivo, razvrščene kot brez kategorije po GHS ZN, ki povzročajo stopnjo IVIS > 3, glej odstavek 47) je sorazmerno visok, vendar v tem okviru ni ključen, saj se vse preskusne kemikalije, pri katerih se stopnja IVIS giblje v razponu od 3 do 55, naknadno preskusijo z drugimi ustrezno potrjenimi preskusi in vitro ali – kot zadnja možnost – s preskusom na kuncih, in sicer glede na regulativne zahteve, pri čemer se uporabi strategija zaporednega preskušanja s pristopom, ki temelji na zanesljivosti dokazov. Pri preskusni metodi BCOP niso vidne nobene posebne pomanjkljivosti za preskušanje alkoholov, ketonov in trdnih snovi, kadar je namenjena opredelitvi kemikalij, ki jih ni treba razvrstiti glede na draženje oči ali hude poškodbe oči (brez kategorije po GHS ZN) (3). Raziskovalci lahko to preskusno metodo uporabijo za vse vrste kemikalij, pri čemer je treba negativni rezultat (stopnja IVIS ≤ 3) sprejeti kot kazalnik za to, da razvrstitev ni potrebna (brez kategorije po GHS ZN). Ker se lahko s preskusno metodo BCOP pravilno opredeli le 31 % kemikalij, ki jih ni treba razvrstiti glede na draženje oči ali hude poškodbe oči, ta preskusna metoda ne sme biti prva izbira za začetek pristopa od spodaj navzgor (5), če so na voljo druge potrjene in sprejete metode in vitro s podobno visoko občutljivostjo, a večjo specifičnostjo. Validacijska zbirka podatkov preskusne metode BCOP je vsebovala skupaj 113 snovi in 100 zmesi (2) (3). Zato se lahko ta metoda uporabi za preskušanje snovi in zmesi. Preskusna metoda BCOP ni priporočljiva za opredelitev preskusnih kemikalij, ki jih je treba razvrstiti kot dražilne za oči (kategorija 2 ali kategorija 2A po GHS ZN), ali preskusnih kemikalij, ki jih je treba razvrstiti kot zmerno dražilne za oči (kategorija 2B po GHS ZN), saj je precejšnje število kemikalij kategorije 1 po GHS ZN razvrščenih prenizko, in sicer v kategorije 2, 2A ali 2B po GHS ZN, precejšnje število kemikalij brez kategorije po GHS ZN pa je razvrščenih previsoko, in sicer v kategorije 2, 2A ali 2B po GHS ZN (2) (3). Zato je morda potrebno nadaljnje preskušanje z drugo ustrezno metodo. Pri vseh postopkih na očeh in roženicah goveda je treba upoštevati veljavna pravila in postopke preskusnega laboratorija o ravnanju z živalskim materialom, kamor spadajo med drugim tudi tkiva in tkivne tekočine. Priporočajo se splošni previdnostni ukrepi za laboratorije (11). Čeprav se pri preskusni metodi BCOP ne proučujejo poškodbe veznice in šarenice, se obravnavajo učinki na roženico, ki so pomembno gonilo pri razvrščanju in vivo ob upoštevanju razvrščanja po GHS ZN. Popravljivosti poškodb roženice kot take v preskusni metodi BCOP ni mogoče oceniti. Na podlagi očesnih študij na kuncih je bilo predlagano, da se za opredelitev nekaterih vrst nepopravljivih učnikov lahko uporabi ocena prvotne globine poškodbe roženice (12). Vendar je potrebno nadaljnje znanstveno znanje, da bi razumeli, kako nastanejo nepopravljivi učinki, ki niso povezani z začetno hudo poškodbo. Treba je tudi opozoriti, da s preskusno metodo BCOP ni mogoče oceniti potencialne sistemske toksičnosti, povezane z izpostavljenostjo oči. Ta preskusna metoda se bo redno posodabljala ob upoštevanju novih informacij in podatkov. Kadar je potrebna popolnejša opredelitev poškodbe roženice, se je lahko uporabna na primer histopatologija. Kot je navedeno v Dokumentu s smernicami OECD št. 160 (13), se uporabnikom priporoča, naj roženice shranijo in pripravijo histopatološke vzorce, ki se lahko uporabijo pri ustvarjanju zbirke podatkov in oblikovanju meril za odločanje, s katerimi se lahko nadalje izboljša točnost te preskusne metode. Vsak laboratorij, ki to preskusno metodo izvaja prvič, mora uporabiti kemikalije za preverjanje usposobljenosti iz Dodatka 3. Laboratorij lahko te kemikalije uporabi kot dokaz svoje tehnične usposobljenosti za izvajanje preskusne metode BCOP, preden pošlje podatke o tej metodi za regulativno razvrstitev glede na nevarnosti. NAČELO PRESKUSA Preskusna metoda BCOP je organotipski model, s katerim se običajna fiziološka in biokemijska funkcija roženice goveda za kratek čas ohrani in vitro. Pri tej preskusni metodi se poškodba, ki jo povzroči preskusna kemikalija, oceni tako, da se spremembe motnjave in prepustnosti roženice merijo kvantitativno z opacitometrom oziroma spektrofotometrom vidne svetlobe. Obe meritvi se uporabita za izračun stopnje IVIS, na podlagi katere je kemikalija razporejena v kategorijo razvrstitve glede na nevarnost draženja in vitro, da se predvidi zmožnost preskusne kemikalije za draženje oči in vivo (glej merila za odločanje, odstavek 48). Pri preskusni metodi BCOP se uporabljajo izolirane roženice oči sveže zaklanega goveda. Motnjava roženice se meri kvantitativno in ustreza količini svetlobe, ki prodre skozi roženico. Prepustnost se meri kvantitativno in ustreza količini barvila natrijevega fluoresceina, ki prodre skozi celotno debelino roženice in se zazna v mediju v zadnjem delu držala. Preskusne kemikalije se dodajo v sprednji del držala za roženico in se tako nanesejo na epitelno površino roženice. Dodatek 4 vsebuje opis in sliko držala, ki se uporablja za preskusno metodo BCOP. Držala za roženico na trgu ponujajo različna podjetja, laboratoriji pa jih lahko izdelajo tudi sami. Izvor in starost oči goveda ter izbor živalskih vrst Govedo, ki se zakolje v klavnicah, je običajno namenjeno za človeško prehrano ali druge komercialne uporabe. Pri preskusni metodi BCOP se kot vir roženic uporabljajo samo zdrave živali, primerne za vstop v prehransko verigo človeka. Ker so goveda glede na pasmo, starost in spol različno težka, ni priporočene teže v trenutku zakola. Velikost roženice se lahko pri očeh različno starih živali razlikuje. Roženice z vodoravnim premerom > 30,5 mm in centralno debelino roženice (CCT) ≥ 1 100 μm ima običajno govedo, starejše od osem let, roženice z navpičnim premerom < 28,5 mm in CCT < 900 μm, pa govedo, mlajše od pet let (14). Zato se oči goveda, starejšega od 60 mesecev, običajno ne uporabljajo. Oči goveda, mlajšega od 12 mesecev, se običajno prav tako ne uporabljajo, saj še niso popolnoma razvite, debelina in premer roženice pa sta bistveno manjša kot pri očeh starejšega goveda. Kljub temu se lahko uporabljajo roženice mladih živali (tj. starih od 6 do 12 mesecev), saj ima njihova uporaba nekatere prednosti, kot so večja razpoložljivost, manjši starostni razpon in manjša nevarnost izpostavljenosti goveji spongiformni encefalopatiji za osebje klavnice (15). Ker bi bilo koristno nadaljnje ocenjevanje učinka, ki ga imata velikost in debelina roženice na odzivnost na jedke in zelo dražilne snovi za oči, se uporabnikom priporoča, da poročajo o približni starosti in/ali teži živali, katerih roženice so uporabili v študiji. Odvzem in prevoz oči v laboratorij Oči odvzame osebje klavnice. Da bi bilo čim manj mehanskih in drugih vrst poškodb oči, jih je treba odvzeti čim prej po zakolu ter jih takoj po odvzemu in med prevozom hraniti na hladnem. Da oči ne bi bile izpostavljene potencialno dražilnim kemikalijam, osebje klavnice pri spiranju glav živali ne sme uporabljati detergentov. Oči je treba v dovolj veliki posodi popolnoma potopiti v ohlajeno Hanksovo uravnoteženo raztopino soli (HBSS) in prepeljati v laboratorij tako, da se njihovo stanje čim manj poslabša in/ali da ne pride do bakterijske okužbe. Ker se oči odvzamejo med zakolom, lahko pridejo v stik s krvjo in drugimi biološkimi snovmi, vključno z bakterijami in drugimi mikroorganizmi. Zato je treba zagotoviti, da je tveganje kontaminacije čim manjše (npr. tako da je posoda, v kateri so oči, med odvzemom in prevozom na mokrem ledu ter da se v Hanksovo uravnoteženo raztopino soli, ki se uporablja za shranjevanje oči med prevozom, dodajo antibiotiki [npr. 100 IU/ml penicilina in 100 μg/ml streptomicina]). Čas med odvzemom oči in uporabo roženic mora biti pri preskusni metodi BCOP čim krajši (običajno se odvzamejo in uporabijo isti dan) in ne sme vplivati na zanesljivost rezultatov preskusa. Ti temeljijo na merilih za izbor oči ter odzivih pozitivnih in negativnih kontrol. Vse oči, uporabljene v preskusu, morajo pripadati isti skupini oči, odvzeti na določeni dan. Merila za izbor oči, uporabljenih v preskusni metodi BCOP Po prihodu v laboratorij se skrbno pregleda, ali so oči poškodovane, vključno s povečano motnjavo, praskami in neovaskularizacijo. Uporabljajo se lahko samo roženice nepoškodovanih oči. Kakovost vsake roženice se oceni tudi v poznejši fazi preskusa. Roženice z motnjavo, večjo od sedmih enot ali enakovredne stopnje v primeru uporabe opacitometra in držala za roženice. se po začetnem enournem umerjanju zavržejo (OPOZORILO: opacitometer je treba umeriti v skladu s standardi za določevanje enot motnjave, glej Dodatek 4). Vsaka tretirana skupina (preskusna kemikalija, sočasne negativne in pozitivne kontrole) je sestavljena iz najmanj treh oči. Pri preskusni metodi BCOP je treba za negativno kontrolo uporabiti tri roženice. Ker se roženice odstranijo s celotnega zrkla in pritrdijo v držala za roženice, se lahko zaradi artefaktov, ki nastanejo zaradi prijemanja, vrednosti motnjave in prepustnosti v posameznih primerih spremenijo (vključno z negativno kontrolo). Poleg tega se vrednosti motnjave in prepustnosti roženic iz roženic za negativno kontrolo uporabljajo za popravljanje vrednosti motnjave in prepustnosti roženic, tretiranih s preskusno kemikalijo, in za pozitivno kontrolo pri izračunih stopenj IVIS. POSTOPEK Priprava oči Nepoškodovane roženice se secirajo tako, da se ohrani 2 do 3 mm širok rob beločnice, kar olajša nadaljnje ravnanje, pri čemer je treba paziti, da se epitelij in endotelij roženice ne poškodujeta. Izolirane roženice se pritrdijo v posebej za to izdelana držala, sestavljena iz sprednjega in zadnjega dela, na katera je roženica pripeta z epitelno oziroma endotelno stranjo. Oba dela držala se do roba napolnita z ogretim Eaglovim minimalnim osnovnim medijem (EMEM) brez fenol rdečega (in sicer najprej zadnji del držala), pri čemer je treba paziti, da ne nastajajo mehurčki. Naprava se nato vsaj eno uro uravnotežuje pri 32 ± 1 °C, kar omogoči, da se roženice uravnotežijo z medijem in da se doseže čim bolj normalna metabolna dejavnost (približna temperatura na površini roženice in vivo je 32 °C). Po uravnoteženju se v oba dela držala doda svež, ogret medij EMEM brez fenol rdečega, za vsako roženico pa se zabeležijo odčitki izhodiščne vrednosti motnjave. Roženice z makroskopskimi poškodbami tkiva (npr. praskami, pigmentacijo, neovaskularizacijo) ali motnjavo, večjo od sedmih enot ali enakovredne stopnje v primeru uporabe opacitometra in držala za roženice, se zavržejo. Vsaj tri roženice se izberejo kot roženice za negativno kontrolo (ali kontrolo s topilom). Preostale roženice se nato razdelijo v tretirano skupino in skupine za pozitivno kontrolo. Ker ima voda večjo toplotno kapaciteto kot zrak, zagotavlja stabilnejše temperaturne pogoje za inkubacijo. Zato je za ohranjanje držala za roženice in njegove vsebine pri temperaturi 32 ± 1 °C priporočljiva uporaba vodne kopeli. Lahko se uporabljajo tudi inkubatorji za vzdrževanje temperature zraka, če zagotavljajo stabilno temperaturo (tj. s predogrevanjem držal in medijev). Uporaba preskusne kemikalije Uporabljata se dva različna protokola tretiranja, in sicer eden za tekočine in površinsko aktivne snovi (trdne snovi ali tekočine), drugi pa za površinsko neaktivne snovi (trdne snovi). Tekočine se preskušajo nerazredčene. Poltrdne snovi, kreme in voski se običajno preskušajo kot tekočine. Nerazredčene površinsko aktivne snovi se preskusijo pri 10-odstotni masni koncentraciji v 0,9-odstotni raztopini natrijevega klorida, destilirani vodi ali drugem topilu, za katerega je dokazano, da nima škodljivih učinkov na preskusni sistem. Če se uporabljajo druge koncentracije raztopin, jih je treba ustrezno utemeljiti. Zmesi, ki vsebujejo površinsko aktivne snovi, se lahko preskušajo nerazredčene ali razredčene v ustrezni koncentraciji, in sicer odvisno od ustreznega scenarija izpostavljenosti in vivo. Če se uporabljajo druge koncentracije raztopin, jih je treba ustrezno utemeljiti. Roženice so tekočinam in površinsko aktivnim snovem izpostavljene 10 minut. Če je čas izpostavljenosti drugačen, ga je treba ustrezno znanstveno utemeljiti. Za opredelitev površinsko aktivnih snovi in zmesi, ki vsebujejo površinsko aktivne snovi, glej Dodatek 1. Površinsko neaktivne trdne snovi se običajno preskušajo kot raztopine ali suspenzije pri 20-odstotni masni koncentraciji v 0,9-odstotni raztopini natrijevega klorida, destilirani vodi ali drugem topilu, za katerega je dokazano, da nima škodljivih učinkov na preskusni sistem. V določenih okoliščinah in ob ustrezni znanstveni utemeljitvi se lahko trdne snovi preskušajo tudi nerazredčene, tako da se neposredno nanesejo na površino roženice, pri čemer se uporablja odprta metoda (glej odstavek 32). Roženice so trdnim snovem izpostavljene štiri ure, čas izpostavljenosti pa se lahko tako kot pri tekočinah in površinsko aktivnih snoveh spremeni na podlagi ustrezne znanstvene utemeljitve. Uporabljajo se lahko različne metode tretiranja, in sicer glede na fizikalne in kemijske lastnosti preskusne kemikalije (npr. trdne snovi, tekočine, viskozne ali neviskozne tekočine). Najpomembneje je, da preskusna kemikalija dovolj dobro pokriva epitelno površino in da se med spiranjem ustrezno odstrani. Zaprta metoda se običajno uporablja za neviskozne do nekoliko viskozne tekoče preskusne kemikalije, medtem ko se odprta metoda običajno uporablja za polviskozne in viskozne tekoče preskusne kemikalije in nerazredčene trdne snovi. Pri zaprti metodi se prek dozirnih odprtin v zgornji površini v sprednji del držala doda toliko preskusne kemikalije (750 μl), da ta prekrije epitelno stran roženice, odprtine pa se nato med obdobjem izpostavljenosti zatesnijo s tesnilnimi čepki. Vsaka roženica mora biti preskusni kemikaliji izpostavljena dovolj dolgo. Pri odprti metodi se pred tretiranjem s sprednjega dela držala odstranita obroček za zapiranje okenca in stekleno okence. Kontrolna ali preskusna kemikalija (750 μl ali dovolj preskusne kemikalije, da je prekrita celotna roženica) se nanese neposredno na epitelno površino roženice z mikropipeto. Če se preskusna kemikalija težko pipetira, se jo lahko zaradi lažjega doziranja nanese s pipeto za neposredno izpodrivanje tlaka. Konica pipete za neposredno izpodrivanje tlaka se vstavi v dozirno konico brizge, da se material napolni v konico za izpodrivanje pod tlakom. Ob tem ko se potisni bat počasi sprošča, se vlečni bat pipete pomakne navzgor. Če v konici pipete začnejo nastajati zračni mehurčki, se preskusna kemikalija odstrani (zavrže) in postopek ponovi, dokler konica ni polna in v njej ni zračnih mehurčkov. Po potrebi se lahko uporabi običajna brizga (brez igle), saj omogoča merjenje natančne količine preskusne kemikalije in lažji nanos na epitelno površino roženice. Po odmerjanju se na sprednji del držala ponovno namesti stekleno okence in tako ponovno ustvari zaprt sistem. Inkubacija po izpostavljenosti Po obdobju izpostavljenosti se preskusna kemikalija, kemikalija za negativno kontrolo ali kemikalija za pozitivno kontrolo odstrani iz sprednjega dela držala, epitelij pa se najmanj trikrat (oziroma dokler preskusna snov ni več vidna) spere z EMEM (ki vsebuje fenol rdeče). Za spiranje se uporablja medij, ki vsebuje fenol rdeče, saj se lahko s spreminjanjem barv v fenol rdečem nadzoruje, ali je bilo spiranje kislih ali alkalnih preskusnih kemikalij učinkovito. Če je fenol rdeče še vedno razbarvano (rumeno ali vijoličasto) ali če je preskusna kemikalija še vedno vidna, se roženice sperejo več kot trikrat. Ko v mediju ni več preskusne kemikalije, se roženice še zadnjič sperejo z EMEM (brez fenol rdečega). Pri zadnjem spiranju se uporabi EMEM (brez fenol rdečega), s čimer se zagotovi, da je bilo fenol rdeče odstranjeno iz sprednjega dela držala pred merjenjem motnjave. Nato se sprednji del držala ponovno napolni s svežim EMEM brez fenol rdečega. Pri tekočinah ali površinsko aktivnih snoveh se roženice po spiranju dajo v inkubator še za dve dodatni uri pri 32 ± 1 °C. V določenih okoliščinah je po obdobju izpostavljenosti koristna tudi daljša inkubacija, vendar je to odvisno od vsakega primera posebej. Roženice, ki se preskušajo s trdnimi snovmi, se po štirih urah izpostavljenosti temeljito sperejo, vendar pri njih nadaljnja inkubacija ni potrebna. Po koncu inkubacije, ki sledi obdobju izpostavljenosti, za tekočine in površinsko aktivne snovi in po koncu štiriurne izpostavljenosti za površinsko neaktivne trdne snovi se zabeležita motnjava in prepustnost vsake roženice. Poleg tega se vsaka roženica vizualno pregleda in se zabeležijo vsa pomembnejša opažanja (npr. lupljenje tkiva, prisotnost ostanka preskusne kemikalije, neenotni vzorci motnjave). Ta opažanja so lahko pomembna, saj se lahko izražajo z odkloni pri odčitkih opacitometra. Kontrolne kemikalije V vsak poskus sta vključeni sočasna negativna kontrola ali kontrola s topilom/vehiklom ter pozitivna kontrola. Pri preskušanju 100-odstotne tekoče snovi se v preskusno metodo BCOP vključi sočasna negativna kontrola (npr. 0,9-odstotna raztopina natrijevega klorida ali destilirana voda), da se odkrijejo nespecifične spremembe preskusnega sistema in zagotovijo izhodiščne vrednosti za končne točke preskusa. Ta kontrola tudi zagotavlja, da preskusni pogoji ne povzročajo dražilnih reakcij. Pri preskušanju razredčene tekočine, površinsko aktivne ali trdne snovi se v preskusno metodo BCOP vključi primerjalna kontrolna skupina s topilom/vehiklom, da se odkrijejo nespecifične spremembe preskusnega sistema in zagotovijo izhodiščne vrednosti za končne točke preskusa. Uporablja se lahko samo tako topilo/vehikel, za katerega je dokazano, da nima škodljivih učinkov na preskusni sistem. Kemikalija, za katero je znano, da povzroča pozitiven odziv, se v vsak poskus vključi kot sočasna pozitivna kontrola, da se preveri celovitost preskusnega sistema in njegova pravilna izvedba. Da se lahko oceni variabilnost odziva pozitivne kontrole v daljšem časovnem obdobju pa stopnja dražilnega odziva ne sme biti prevelika. Primer pozitivne kontrole za tekoče preskusne kemikalije je 100-odstotni etanol ali 100-odstotni dimetilformamid. Primer pozitivne kontrole za trdne preskusne kemikalije je 20-odstotna masna koncentracija imidazola v 0,9-odstotni raztopini natrijevega klorida. Primerjalne kemikalije so primerne za ocenjevanje potenciala za draženje oči, ki ga imajo neznane kemikalije določenega kemijskega ali proizvodnega razreda, ali za ocenjevanje relativnega potenciala snovi za draženje oči v določenem razponu dražilnih učinkov. Merjene končne točke Motnjava je odvisna od količine svetlobe, ki prodre skozi roženico. Motnjava roženice se meri kvantitativno s pomočjo opacitometra, pri čemer se meri neprekinjeno. Prepustnost je odvisna od količine barvila natrijevega fluoresceina, ki prodre skozi vse celične sloje roženice (tj. od epitelija na zunanji površini roženice do endotelija na notranji površini roženice). V sprednji del držala za roženico, na katerega je pripeta epitelna stran roženice, se doda 1 ml raztopine natrijevega fluoresceina (4 ali 5 mg/ml pri testiranju tekočin in površinsko aktivnih snovi oziroma površinsko neaktivnih snovi), medtem ko se zadnji del držala, na katerega je pripeta endotelna stran roženice, napolni s svežim EMEM. Držalo se nato da v inkubator v vodoravnem položaju za 90 ± 5 minut pri 32 ± 1 °C. Količina natrijevega fluoresceina, ki prodre v zadnji del držala, se meri kvantitativno s pomočjo spektrofotometrije UV/VIS. Spektrofotometrične meritve pri 490 nm se beležijo kot neprekinjeno merjene vrednosti optične gostote (OD490) ali absorbance. Prepuščanje fluoresceina se določa z vrednostmi OD490, ki so bile izmerjene s spektrofotometrom vidne svetlobe pri standardni dolžini poti 1 cm. Namesto spektrofotometra se lahko uporabi tudi bralnik 96-jamičnih mikrotitrskih plošč, pod pogojem, da: (i) se lahko določi linearno merilno območje bralnika za določevanje vrednosti fluoresceina OD490 in (ii) se v 96-jamični mikrotitrski plošči uporablja pravilna količina vzorcev fluoresceina, zaradi česar vrednosti OD490 ustrezajo standardni dolžini poti 1 cm (za to so lahko potrebne popolnoma napolnjene posode [navadno 360 μl]). PODATKI IN POROČANJE Ocenjevanje podatkov Potem ko se popravita vrednost motnjave in srednja vrednost prepustnosti (OD490) za vrednosti ozadja za motnjavo in vrednosti prepustnosti negativne kontrole OD490, se srednji vrednosti motnjave in prepustnosti OD490 za vsako tretirano skupino združita v empirično izpeljani formuli, s katero se izračuna stopnja IVIS za vsako tretirano skupino, kot sledi: stopnja IVIS = srednja vrednost motnjave + (15 × srednja vrednost prepustnosti OD490). Sina idr. (16) so poročali, da je bila ta formula izpeljana na podlagi študij v enem in več laboratorijih. Podatki za 36 spojin, pridobljeni med študijo, izvedeno v več laboratorijih, so bili ocenjeni z multivariantno analizo, s katero se je določila najustreznejša enačba za podatke in vivo ter in vitro. To analizo so izvedli znanstveniki dveh različnih podjetij, ki so izpeljali skoraj identični enačbi. Vrednosti motnjave in prepustnosti je treba oceniti tudi neodvisno, da se ugotovi, ali preskusna kemikalija skozi eno od dveh končnih točk učinkuje jedko ali zelo dražilno (glej merila za odločanje). Merila za odločanje Mejne vrednosti stopnje draženja in vitro (IVIS) za opredelitev preskusnih kemikalij kot takih, ki povzročajo hude poškodbe oči (kategorija 1 po GHS ZN), in takih, ki jih ni treba razvrstiti glede na draženje oči ali hude poškodbe oči (brez kategorije po GHS ZN), so:
Merila za sprejemljivost študije Preskus se šteje za sprejemljivega, če je pri pozitivni kontroli stopnja IVIS znotraj dveh standardnih odklonov veljavne srednje vrednosti iz preteklih preskusov, ki jo je treba posodobiti vsaj vsake tri mesece ali vedno, kadar preskus izvajajo laboratoriji, ki preskuse izvajajo redko (tj. manj kot enkrat mesečno). Iz odzivov negativnih kontrol s topilom/vehiklom morajo biti razvidne vrednosti motnjave in prepustnosti, ki so manjše od veljavnih zgornjih omejitev vrednosti ozadja za motnjavo in prepustnost roženic goveda, obdelanih z zadevnimi negativnimi kontrolami ali kontrolami s topilom/vehiklom. Kadar je razvrstitev nedvoumna, bi moralo za preskusno kemikalijo zadoščati eno samo preskušanje, sestavljeno iz vsaj treh roženic. Vendar je treba v primeru mejnih rezultatov pri prvi ponovitvi preskušanja razmisliti o drugi ponovitvi (ki pa ni nujno potrebna), pa tudi tretji, če srednje vrednosti stopnje IVIS iz prvih dveh ponovitvah niso skladne. V tem okviru se rezultat prve ponovitve preskušanja šteje za mejnega, če napovedi pri treh roženicah niso bile skladne, tako da:
Poročilo o preskusu V poročilo o preskusu se vključijo naslednji podatki, če so pomembni za izvedbo študije:
VIRI
Dodatek 1 OPREDELITVE POJMOV Točnost : stopnja ujemanja rezultatov preskusne metode s sprejetimi referenčnimi vrednostmi. Je merilo učinkovitosti preskusne metode in eden od vidikov „ustreznosti“. Ta izraz in izraz „skladnost“ se pogosto uporabljata kot sopomenki in pomenita delež pravilnih rezultatov preskusne metode. Primerjalna kemikalija : kemikalija, ki se uporablja kot standard za primerjavo s preskusno kemikalijo. Primerjalna kemikalija mora imeti naslednje značilnosti: (i) ima trajen in zanesljiv vir, (ii) je strukturno in funkcijsko podobna kemikalijam iz preskušanega razreda, (iii) ima znane fizikalne/kemijske lastnosti, (iv) ima spremne podatke o znanih učinkih in (v) ima znano moč v razponu želenega odziva. Pristop od spodaj navzgor : stopenjski pristop, ki se uporablja za kemikalijo, za katero se domneva, da ne potrebuje razvrstitve glede na draženje oči ali hude poškodbe oči, pri čemer se najprej določijo kemikalije, ki ne potrebujejo razvrstitve (negativni rezultat), nato pa druge kemikalije (pozitivni rezultat). Kemikalija : snov ali zmes. Roženica : prozoren sprednji del zrkla, ki pokriva šarenico in zenico ter skozi katerega vstopa svetloba. Motnjava roženice : merjenje stopnje motnjave roženice po izpostavljenosti preskusni kemikaliji. Povečana motnjava roženice pomeni, da je roženica poškodovana. Motnjava se lahko ocenjuje subjektivno, na primer z Draizovim testom draženja oči na kuncih, ali objektivno z inštrumentom, kot je „opacitometer“. Prepustnost roženice : kvantitativno merjenje poškodb epitelija roženice z določitvijo količine barvila natrijevega fluoresceina, ki prodre skozi vse celične plasti roženice. Draženje oči : je povzročitev sprememb v očesu po nanosu preskusne kemikalije na sprednjo površino očesa, ki so v celoti popravljive v 21 dneh po nanosu. Ta pojem je sopomenka za „popravljive učinke na oči“ in „kategorijo 2 po GHS ZN“ (4). Delež lažno negativnih rezultatov : delež vseh pozitivnih kemikalij, ki jih preskusna metoda zmotno prikaže kot negativne. To je eden od kazalnikov učinkovitosti preskusne metode. Delež lažno pozitivnih rezultatov : delež vseh negativnih kemikalij, ki jih preskusna metoda zmotno prikaže kot pozitivne. To je eden od kazalnikov učinkovitosti preskusne metode. Nevarnost : neločljiva lastnost sredstva ali stanje, ki ob izpostavljenosti temu sredstvu lahko povzroči neželen učinek na organizem, sistem ali (pod)populacijo. Stopnja draženja in vitro (IVIS) : empirično izpeljana formula, ki se uporablja pri preskusni metodi BCOP, pri kateri se srednje vrednosti motnjave in prepustnosti za vsako tretirano skupino združijo v eno samo vrednost in vitro za vsako tretirano skupino. Stopnja IVIS = srednja vrednost motnjave + (15 x srednja vrednost prepustnosti). Nepopravljivi učinki na oči : glej „Huda poškodba oči“. Zmes : zmes ali raztopina iz dveh ali več snovi, ki v njej ne reagirajo (4). Negativna kontrola : netretiran ponovljen vzorec, ki vsebuje vse komponente preskusnega sistema. Ta vzorec se obdela z vzorci, tretiranimi s preskusno kemikalijo, ali drugimi kontrolnimi vzorci, da se ugotovi, ali topilo reagira s preskusnim sistemom. Brez razvrstitve : kemikalije, ki niso razvrščene glede na draženje oči (kategorija 2, 2A ali 2B po GHS ZN) ali hude poškodbe oči (kategorija 1 po GHS ZN). Ta pojem je sopomenka za „brez kategorije po GHS ZN“. Opacitometer : instrument za merjenje motnjave roženice, ki kvantitativno ocenjuje prenos svetlobe skozi roženico. Običajno je sestavljen iz dveh delov, ki imata vsak svoj vir svetlobe in fotocelico. En del se uporablja za tretirano roženico, drugi pa za umerjanje in nastavitev instrumenta na vrednost nič. Svetloba halogene svetilke se skozi kontrolni del (prazna komora brez okenc ali tekočine) usmeri v fotocelico in primerja s svetlobo, usmerjeno v fotocelico skozi preskusni del, v katerem je komora z roženico. Nato se primerja razlika v svetlobi, prenesene iz fotocelic, in se na digitalnem zaslonu prikaže numerična vrednost motnjave. Pozitivna kontrola : ponovljen vzorec, ki vsebuje vse sestavine preskusnega sistema in se tretira s kemikalijo, za katero je znano, da povzroči pozitiven odziv. Za zagotovitev, da se lahko variabilnost odziva pozitivne kontrole oceni v daljšem časovnem obdobju, pa stopnja pozitivnega odziva ne sme biti prevelika. Popravljivi učinki na oči : glej „Draženje oči“. Zanesljivost : stopnja obnovljivosti preskusne metode v enem ali več laboratorijih v daljšem časovnem obdobju ob uporabi istega protokola. Oceni se z izračunom obnovljivosti v enem ali več laboratorijih in interne laboratorijske ponovljivosti. Huda poškodba oči : povzročitev poškodbe očesnega tkiva ali resne fizične okvare vida po nanosu preskusne kemikalije na sprednjo površino očesa, ki ni v celoti popravljiva v 21 dneh po nanosu. Ta pojem je sopomenka za „nepopravljive učinke na oči“ in „kategorijo 1 po GHS ZN“ (4). Kontrola s topilom/vehiklom : netretiran vzorec, ki vsebuje vse komponente preskusnega sistema, vključno s topilom ali vehiklom, ki se obdela s vzorci, tretiranimi s preskusno kemikalijo, in drugimi kontrolnimi vzorci, da se določi izhodiščni odziv za vzorce, tretirane s preskusno kemikalijo, raztopljeno v istem topilu ali vehiklu. Pri preskušanju s sočasno negativno kontrolo ta vzorec tudi pokaže, ali topilo ali vehikel reagira s preskusnim sistemom. Snov : kemijski elementi in njihove spojine, ki so v naravnem stanju ali pridobljeni s katerim koli proizvodnim postopkom, vključno z vsemi dodatki, potrebnimi za ohranitev stabilnosti produkta, in kakršnimi koli nečistotami, ki so nastale v uporabljenem postopku, vendar brez kakršnega koli topila, ki ga je mogoče ločiti, ne da bi to vplivalo na stabilnost snovi ali spremenilo njeno sestavo (4). Površinsko aktivna snov : je snov, kot je detergent, ki lahko zmanjša površinsko napetost tekočine in tako omogoči, da se speni ali prodre v trdne snovi; znana je tudi kot omakalno sredstvo. Zmes, ki vsebuje površinsko aktivno snov : v okviru te preskusne metode je to zmes, ki vsebuje eno ali več površinsko aktivnih snovi, pri čemer je njihova končna koncentracija > 5 % Pristop od zgoraj navzdol : stopenjski pristop, ki se uporablja za kemikalijo, za katero se domneva, da povzroča hude poškodbe oči, pri čemer se najprej določijo kemikalije, ki jih je treba razvrstiti (pozitivni rezultat), nato pa še druge kemikalije (negativni rezultat). Preskusna kemikalija : vsaka snov ali zmes, preskušena s to preskusno metodo. Večstopenjska strategija preskušanja : stopenjsko preskušanje, pri katerem se v posebnem vrstnem redu pregledajo vsi obstoječi podatki o preskusni kemikaliji, pri čemer se na vsaki stopnji uporabi postopek, ki temelji na zanesljivosti dokazov, da se določi, ali je pred nadaljevanjem na naslednji stopnji na voljo dovolj podatkov za odločitev o razvrstitvi kemikalije glede na nevarnost, ki jo povzroča. Če se za preskusno kemikalijo na podlagi razpoložljivih podatkov lahko določi potencial za draženje, dodatno preskušanje ni potrebno. Če preskusni kemikaliji na podlagi razpoložljivih podatkov ni mogoče določiti potenciala za draženje, se izvede postopno zaporedno testiranje na živalih, dokler kemikalije ni mogoče jasno razvrstiti. Globalno usklajeni sistem Združenih narodov za razvrščanje in označevanje kemikalij (GHS ZN) : sistem za razvrščanje kemikalij (snovi in zmesi) v skladu s standardiziranimi vrstami in stopnjami fizičnih, zdravstvenih in okoljskih nevarnosti ter za obravnavanje ustreznega označevanja, na primer s piktogrami, opozorilnimi besedami, stavki o nevarnosti, previdnostnimi stavki in varnostnimi listi, da bi se razširile informacije o škodljivih učinkih kemikalij ter s tem zaščitili ljudje (vključno z delodajalci, delavci, prevozniki, potrošniki in reševalci) in okolje (4). Kategorija 1 po GHS ZN : glej „Huda poškodba oči“. Kategorija 2 po GHS ZN : glej „Draženje oči“. Brez kategorije po GHS ZN : kemikalije, ki ne izpolnjujejo zahtev za razvrstitev v kategorijo 1 ali 2 (2A ali 2B) po GHS ZN. Ta pojem je sopomenka za „brez razvrstitve“. Validirana preskusna metoda : preskusna metoda, za katero sta bili na podlagi izvedenih validacijskih študij določeni ustreznost (vključno s točnostjo) in zanesljivost za določen namen. Opozoriti je treba, da točnost in zanesljivost validirane preskusne metode nista nujno zadostni, da bi bila sprejemljiva za predlagani namen. Zanesljivost dokazov : postopek obravnavanja prednosti in slabosti različnih informacij v okviru sprejemanja in utemeljevanja sklepne ugotovitve glede potenciala nevarnosti preskusne kemikalije. Dodatek 2 NAPOVEDOVALNA ZMOGLJIVOST PRESKUSNE METODE BCOP Preglednica 1 Napovedovalna zmogljivost preskusne metode BCOP za opredelitev kemikalij, ki povzročajo hude poškodbe oči [kemikalije kategorije 1, proti kemikalijam, ki ne spadajo v kategorijo 1 (kat. 2 + brez kat.) po GHS ZN/uredbi CLP EU; kemikalije kategorije I proti kemikalijam, ki ne spadajo v kategorijo I (kat. II + kat. III + kat. IV) po US EPA]
Preglednica 2 Napovedovalna zmogljivost preskusne metode BCOP za opredelitev kemikalij, ki jih ni treba razvrstiti glede na draženje oči ali hude poškodbe oči („nedražilne snovi za oči“) [kemikalije brez kategorije proti kemikalijam, ki so razvrščene v kategorije (kat. 1 + kat. 2) po GHS ZN/uredbi CLP EU; kemikalije kategorije IV proti kemikalijam, ki ne spadajo v kategorijo IV (kat. I + kat. II + kat. III) po US EPA]
Dodatek 3 KEMIKALIJE ZA PREVERJANJE USPOSOBLJENOSTI ZA PRESKUSNO METODO BCOP Pred redno uporabo te preskusne metode morajo laboratoriji dokazati tehnično usposobljenost tako, da pravilno opredelijo razvrstitev glede na nevarnosti za oči za 13 kemikalij, priporočenih v preglednici 1. Te kemikalije so bile izbrane, ker predstavljajo celoten razpon odzivov pri nevarnostih za oči, temeljijo pa na rezultatih preskusa draženja oči in vivo na kuncih (TG 405) (17) in sistemu za razvrščanje GHS ZN (tj. kategorije 1, 2A, 2B ali brez kategorije) (4). Druga merila za izbiro so bila razpoložljivost kemikalij na trgu, razpoložljivost visokokakovostnih referenčnih podatkov in vivo in razpoložljivost visokokakovostnih podatkov in vitro iz preskusne metode BCOP. Referenčni podatki so na voljo v dokumentu s povzetki) (3) ter dokumentu ICCVAM o pregledu ozadja preskusne metode BCOP (2) (18). Preglednica 1 Priporočene kemikalije za dokazovanje tehnične usposobljenosti za preskusno metodo BCOP
Dodatek 4 DRŽALO ZA ROŽENICO ZA DOLOČANJE MOTNJAVE IN PREPUSTNOSTI ROŽENICE GOVEDA (BCOP) Držala za roženico za BCOP so narejena iz inertnega materiala (npr. polipropilena). Sestavljena so iz dveh polovic (sprednje in zadnje komore) ter dveh podobnih cilindričnih notranjih posodic. Vsaka komora je zasnovana tako, da je njena prostornina približno 5 ml in se konča s steklenim okencem, skozi katerega se beležijo meritve prepustnosti. Premer posamezne notranje komore je 1,7 cm, globina pa 2,2 cm (11). Tesnilni obroček na zadnji komori preprečuje iztekanje. Roženice se z endotelno stranjo navzdol položijo na tesnilni obroček zadnje komore, sprednja komora pa se položi na epitelno stran roženice. Obe komori sta pritrjeni skupaj s tremi vijaki iz nerjavnega jekla, ki so nameščeni na zunanjih robovih komore. Na koncu vsake komore je stekleno okence, ki ga je mogoče za lažji dostop do roženice odstraniti. Med steklenim okencem in komoro je tesnilni obroček, ki preprečuje iztekanje. Skozi luknjici na vrhu vsake komore se vnašajo in odstranjujejo medij in preskusne kemikalije. Med tretiranjem in inkubacijo sta zaprti z gumijastimi čepki. Prenos svetlobe skozi držala za roženice se lahko spremeni, saj lahko učinki fizične obrabe ali kopičenja ostankov preskusnih kemikalij v luknjah notranje komore ali na steklenih okencih vplivajo na razpršitev svetlobe ali odbojnost. Posledice tega so lahko povečanje ali zmanjšanje izhodiščne vrednosti prenosa svetlobe (in, nasprotno, odčitkov izhodiščne vrednosti motnjave) skozi držala za roženice, kar se lahko opazi kot znatne spremembe pri pričakovanih meritvah izhodiščne začetne vrednosti motnjave roženice v posameznih komorah (to pomeni, da se lahko začetne vrednosti motnjave roženice v posebnih posameznih držalih za roženice od pričakovanih izhodiščnih vrednosti redno razlikujejo za več kot dve ali tri enote motnjave). Vsak laboratorij mora razmisliti o vzpostavitvi programa za ocenjevanje sprememb pri prenosu svetlobe skozi držala za roženice, in sicer glede na naravo preskušenih kemijskih lastnosti in pogostost uporabe komor. Za določitev izhodiščnih vrednosti se lahko držala za roženice pregledajo pred redno uporabo, tako da se izmerijo izhodiščne vrednosti motnjave (ali prenosa svetlobe) komor, popolnoma napolnjenih z medijem brez roženic. Držala za roženice se med obdobji uporabe nato redno pregledujejo, da se ugotovi, ali je pri prenosu svetlobe prišlo do sprememb. Vsak laboratorij lahko določi pogostost pregledovanja držal za roženice, in sicer glede na preskušene kemikalije, pogostost uporabe in opažene spremembe v izhodiščnih vrednostih motnjave roženice. Če se opazijo znatne spremembe pri prenosu svetlobe skozi držala za roženice, je treba razmisliti o ustreznih postopkih čiščenja in/ali poliranja notranje površine držal za roženice ali njihovi zamenjavi. Držalo za roženico: tridimenzionalna risba držala z grafično ločenimi deli 
Dodatek 5 OPACITOMETER Opacitometer je naprava, ki meri prenos svetlobe. Na primer pri opremi OP-KIT podjetja Electro Design (Riom, Francija), uporabljeni pri preskusni metodi BCOP, se svetloba halogene svetilke skozi kontrolni del (prazna komora brez okenc ali tekočine) usmeri v fotocelico in primerja s svetlobo, usmerjeno v fotocelico skozi preskusni del, v katerem je komora z roženico. Nato se primerja razlika v svetlobi, prenesene iz fotocelic, in se na digitalnem zaslonu prikaže numerična vrednost motnjave. Enote motnjave so že določene. Uporabijo se lahko druge vrste opacitometrov z drugačno zasnovo (npr. take, pri katerih vzporedne meritve v kontrolnem in poskusnem delu niso potrebne), če je dokazano, da lahko dajo podobne rezultate kot validirana oprema. Opacitometer mora znotraj razpona odčitkov vrednosti motnjave zagotoviti linearni odziv, v katerem so upoštevane mejne vrednosti, ki se uporabljajo v različnih sistemih za razvrščanje, opisanih v modelu za napovedovanje (tj. do mejne vrednosti, ki določa jedkost/močno draženje). Da so izmerjene vrednosti do 75–80 enot motnjave linearne in natančne, je treba opacitometer umeriti s kalibratorji. Kalibratorji se vstavijo v komoro za umerjanje (komora za roženico, ki je zasnovana tako, da se vanjo lahko namestijo kalibratorji) in odčitavajo na opacitometru. Komora za umerjanje je zasnovana tako, da so kalibratorji na približno enaki oddaljenosti med svetlobo in fotocelico kot roženice med merjenjem prepustnosti. Referenčne in začetne nastavljene vrednosti so odvisne od vrste uporabljene opreme. Linearnost meritev prepustnosti je treba zagotoviti z ustreznimi postopki (za posamezne instrumente). Na primer za opremo OP-KIT podjetja Electro Design (Riom, Francija) je opacitometer najprej umerjen na enoto prepustnosti 0, pri čemer se uporabi komora za umerjanje brez kalibratorja. Nato se v komoro za umerjanje eden za drugim namestijo trije različni kalibratorji in izmeri prepustnost. Kalibratorji 1, 2 in 3 morajo zagotoviti odčitke prepustnosti, ki ustrezajo vnaprej določenim vrednostim 75, 150 oziroma 225 enot motnjave ± 5 %. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
(13) |
Poglavje B.48 dela B se nadomesti z naslednjim: „B.48 Preskusna metoda na izoliranih očeh piščancev za opredelitev i) kemikalij, ki povzročajo hude poškodbe oči, in ii) kemikalij, ki jih ni treba razvrstiti glede na draženje oči ali hude poškodbe oči UVOD Ta preskusna metoda je enakovredna Smernici za preskušanje OECD (TG) 438 (2013). Preskusno metodo na izoliranih očeh piščancev (Isolated Chicken Eye – preskusna metoda ICE) je v letih 2006 in 2010 ocenil Medagencijski koordinacijski odbor za validacijo alternativnih metod (ICCVAM) v sodelovanju z Evropskim centrom za validacijo alternativnih metod (ECVAM) ter Japonskim centrom za validacijo alternativnih metod (JaCVAM) (1) (2) (3). Pri prvem ocenjevanju je bila preskusna metoda ICE potrjena kot znanstveno veljavna preskusna metoda, ki se uporablja kot presejalni test za opredelitev kemikalij (snovi in zmesi), ki povzročajo hude poškodbe oči (kategorija 1), kot je opredeljeno v globalno usklajenem sistemu Združenih narodov za razvrščanje in označevanje kemikalij (GHS ZN) (1) (2) (4) ter Uredbi (ES) št. 1272/2008 o razvrščanju, označevanju in pakiranju snovi ter zmesi (CLP) (12). Pri drugem ocenjevanju je bila preskusna metoda ICE ocenjena glede na svojo uporabnost kot presejalni test za opredelitev kemikalij, ki niso razvrščene glede na draženje oči ali hude poškodbe oči, kot je opredeljeno v GHS ZN (3) (4). Rezultati validacijske študije in priporočila odbora za medsebojni strokovni pregled so podprli prvotno priporočilo za uporabo preskusne metode ICE za razvrščanje kemikalij, ki povzročajo hude poškodbe oči (kategorija 1 po GHS ZN), saj se razpoložljiva zbirka podatkov od prvotne validacije odbora ICCVAM ni spremenila. Na tej stopnji nadaljnja priporočila za razširitev področja uporabe preskusne metode ICE, da bi se vanjo vključile tudi druge kategorije, niso bila predlagana. Ponovno se je ocenila zbirka podatkov in vitro ter in vivo, uporabljenih v validacijski študiji, pri čemer se je osredotočilo na oceno uporabnosti preskusne metode ICE za opredelitev kemikalij, ki jih ni treba razvrstiti glede na draženje oči ali hude poškodbe oči (5). Pri tej ponovni oceni je bilo ugotovljeno, da se preskusna metoda ICE lahko uporabi tudi za opredelitev kemikalij, ki jih ni treba razvrstiti glede na draženje oči ali hude poškodbe oči, kot je opredeljeno v GHS ZN (4) (5). Ta preskusna metoda vključuje priporočeno uporabo in omejitve preskusne metode ICE, ki temeljijo na teh ocenah. Najpomembnejše razlike med prvotno različico smernic za preskušanje OECD iz leta 2009 in posodobljeno različico iz leta 2013 se nanašajo, niso pa omejene na: uporabo preskusne metode ICE za opredelitev kemikalij, ki jih ni treba razvrstiti glede na sistem za razvrščanje GHS ZN, posodobitev elementov poročila o preskusu, posodobitev Dodatka 1 o opredelitvah pojmov ter posodobitev Dodatka 2 o seznamu kemikalij za preverjanje usposobljenosti. Zdaj na splošno velja, da Draizovega preskusa draženja oči in vivo v bližnji prihodnosti ne bo mogoče nadomestiti z enim samim preskusom draženja oči in vitro, da bi se predvidel celoten razpon dražilnih učinkov za različne kemijske razrede. Draizov preskus draženja oči pa bi morda lahko nadomestile strateške kombinacije več alternativnih preskusnih metod v okviru (večstopenjske) strategije preskušanja (6). Pristop od zgoraj navzdol (7) je treba uporabiti takrat, ko se na podlagi obstoječih informacij pričakuje, da bo imela kemikalija visok potencial draženja, pristop od spodaj navzgor (7) pa takrat, ko se na podlagi obstoječih informacij pričakuje, da kemikalija ne bo povzročila tolikšnega draženja oči, da bi jo bilo treba razvrstiti. Preskusna metoda ICE je metoda preskušanja in vitro, ki se lahko pod določenimi pogoji in s posebnimi omejitvami, kot so opisane v odstavkih od 8 do 10, uporabi za razvrstitev glede na nevarnosti za oči in označevanje kemikalij. Čeprav se preskusna metoda ICE ne obravnava kot veljaven samostojen nadomestek preskusa draženja oči in vivo na kuncih, se vseeno priporoča kot prvi korak preskusne strategije, kot je pristop od zgoraj navzdol, ki ga priporoča Scott idr. (7), za opredelitev kemikalij, ki povzročajo hude poškodbe oči, tj. kemikalij, ki jih je treba v kategorijo 1 po GHS ZN razvrstiti brez nadaljnjega preskušanja (4). Ta metoda je priporočljiva tudi za opredelitev kemikalij, ki jih ni treba razvrstiti glede na draženje oči ali hude poškodbe oči, kot je opredeljeno v sistemu GHS ZN (brez kategorije) (4), zaradi česar se lahko uporabi kot prvi korak v okviru strategije preskušanja od spodaj navzgor (7). Vendar če se s preskusno metodo ICE ne predvidi, da kemikalija povzroča hude poškodbe oči ali razvrstitev glede na draženje oči/hude poškodbe oči, bi bilo treba to kemikalijo dodatno preskusiti (in vitro in/ali in vivo), da se določi končna razvrstitev. Poleg tega se je treba pred uporabo pristopa od spodaj navzgor pri preskusni metodi ICE v okviru drugih sistemov za razvrščanje, ki niso GHS ZN, posvetovati z ustreznimi regulativnimi organi. V tej preskusni metodi so opisani postopki za oceno potencialne nevarnosti preskusne kemikalije za oči glede na njeno (ne)zmožnost, da v izoliranem očesu piščanca povzroči toksičnost. Toksični učinki na roženico se merijo s: (i) kvalitativnim ocenjevanjem motnjave, (ii) kvalitativnim ocenjevanjem poškodbe epitelija na podlagi nanosa fluoresceina na oko (zadrževanje fluoresceina), (iii) kvantitativnim merjenjem povečane debeline (nabreklosti) in (iv) kvalitativnim ocenjevanjem makroskopske morfološke poškodbe na površini. Motnjava roženice, nabreklost in ocenjevanje poškodb po izpostavljenosti preskusni kemikaliji se najprej ocenijo posamično, nato pa združijo, da se lahko določi razvrstitev glede na draženje oči. Opredelitve pojmov so navedene v Dodatku 1. ZAČETNI PREUDARKI IN OMEJITVE Ta preskusna metoda temelji na protokolu, predlaganem v Dokumentu s smernicami OECD št. 160 (8), ki je bil razvit na podlagi mednarodne validacijske študije (1) (3) (9) odbora ICCVAM, pri kateri so sodelovali Evropski center za validacijo alternativnih metod (ECVAM), Japonski center za validacijo alternativnih metod (JaCVAM) ter Oddelek za toksikologijo in uporabno farmakologijo nizozemskega Inštituta za raziskave TNO (Nizozemska). Protokol temelji na informacijah iz objavljenih protokolov ter protokolu, ki ga trenutno uporablja TNO (10) (11) (12) (13) (14). V validacijski študiji, na kateri temelji ta preskusna metoda, je bil preizkušen širok nabor kemikalij, in v empirično zbirko podatkov validacijske študije je vključenih 152 kemikalij, od tega 72 snovi in 80 zmesi (5). Ta preskusna metoda se uporablja za trdne snovi, tekočine, emulzije in gele. Tekoče snovi so lahko vodne raztopine ali ne, trdne snovi so lahko topne ali netopne v vodi. Plini in aerosoli še niso bili ocenjeni v validacijski študiji. Preskusna metoda ICE se lahko uporabi za opredelitev kemikalij, ki povzročajo hude poškodbe oči, tj. kemikalij, ki jih je treba razvrstiti v kategorijo 1 po GHS ZN (4). Ko se opredeljene omejitve za preskusno metodo ICE uporabljajo za ta namen, temeljijo na visokem deležu lažno pozitivnih rezultatov za alkohole ter lažno negativnih rezultatov za trdne in površinsko aktivne snovi (1) (3) (9). Vendar delež lažno negativnih rezultatov v tem okviru (kategorija 1 po GHS ZN, ki je opredeljena, kot da ni kategorija 1 po GHS ZN) ni ključen, saj se vse preskusne kemikalije, ki se izkažejo za negativne, naknadno preskusijo z drugimi ustrezno potrjenimi preskusi in vitro ali –kot zadnja možnost – s preskusom na kuncih, in sicer glede na regulativne zahteve, pri čemer se uporabi strategija zaporednega preskušanja s pristopom, ki temelji na zanesljivosti dokazov. Opozoriti je treba, da lahko trdne snovi pri Draizovem preskusu draženja oči in vivo povzročijo spremenljive in ekstremne pogoje izpostavljenosti, zaradi česar je napoved njihovega resničnega potenciala draženja lahko brezpredmetna (15). Raziskovalci lahko razmislijo o uporabi te preskusne metode za vse vrste kemikalij, pri čemer je treba pozitivni rezultat sprejeti kot kazalnik za odziv, ki povzroča hude poškodbe oči, kar pomeni razvrstitev v kategorijo 1 po GHS ZN brez nadaljnjega preskušanja. Vendar je treba pozitivne rezultate, pridobljene z uporabo alkoholov, razlagati previdno, saj obstaja tveganje, da je njihova vrednost precenjena. Kadar se preskusna metoda ICE uporablja za opredelitev kemikalij, ki povzročajo hude poškodbe oči (kategorija 1 po GHS ZN), je v primerjavi s podatki preskusa draženja oči in vivo na kuncih, razvrščenimi glede na sistem za razvrščanje GHS ZN (4) (5), njena splošna točnost 86-odstotna (120/140), delež lažno pozitivnih rezultatov je 6-odstoten (7/113), delež lažno negativnih rezultatov pa 48-odstoten (13/27). Preskusna metoda ICE se lahko uporabi tudi za opredelitev kemikalij, ki jih ni treba razvrstiti glede na nevarnost draženja oči ali hudih poškodb oči v skladu s sistemom za razvrščanje GHS ZN (4). Preden se pri preskusni metodi ICE uporabi pristop od spodaj navzgor v okviru drugih sistemov za razvrščanje, se je treba posvetovati z ustreznimi regulativnimi organi. Ta preskusna metoda se lahko uporabi za vse vrste kemikalij, pri čemer se lahko negativni rezultat sprejme, kot da ne razvršča kemikalije glede na draženje oči ali hude poškodbe oči. Vendar se lahko na podlagi enega rezultata iz validacijske zbirke podatkov vrednosti za barve, ki vsebujejo organsko topilo proti obraščanju, podcenijo (5). Kadar se preskusna metoda ICE uporablja za opredelitev kemikalij, ki jih ni treba razvrstiti glede na draženje oči in hude poškodbe oči, je v primerjavi s podatki preskusa draženja oči in vivo na kuncih, razvrščenimi glede na sistem za razvrščanje GHS ZN (4) (5), njena splošna točnost 82-odstotna (125/152), delež lažno pozitivnih rezultatov je 33-odstoten (26/79), delež lažno negativnih rezultatov pa 1-odstoten (1/73). Kadar so iz zbirke podatkov izključene preskusne kemikalije iz določenih razredov (npr. organsko topilo proti obraščanju, ki ga vsebujejo barve), je točnost preskusne metode ICE glede na sistem za razvrščanje GHS ZN (4) (5) 83-odstotna (123/149), delež lažno pozitivnih rezultatov je 33-odstoten (26/78), delež lažno negativnih rezultatov pa 0-odstoten (0/71). Preskusna metoda ICE ni priporočljiva za opredelitev preskusnih kemikalij, ki jih je treba razvrstiti kot dražilne za oči (kategorija 2 ali kategorija 2A po GHS ZN), ali preskusnih kemikalij, ki jih je treba razvrstiti kot zmerno dražilne za oči (kategorija 2B po GHS ZN), saj je precejšnje število kemikalij kategorije 1 po GHS ZN razvrščenih prenizko, in sicer v kategorije 2, 2A ali 2B po GHS ZN, precejšnje število kemikalij brez kategorije po GHS ZN pa je razvrščenih previsoko, in sicer v kategorije 2, 2A ali 2B po GHS ZN. Zato je morda potrebno nadaljnje preskušanje z drugo ustrezno metodo. Pri vseh postopkih na očeh piščancev je treba upoštevati veljavna pravila in postopke preskusnega laboratorija o ravnanju s človeškim ali živalskim materialom, kamor spadajo med drugim tudi tkiva in tkivne tekočine. Priporočajo se splošni previdnostni ukrepi za laboratorije (16). Čeprav se pri preskusni metodi ICE ne proučujejo poškodbe veznice in šarenice, kot se ocenjuje pri preskusu draženja oči na kuncih, se obravnavajo učinki na roženico, ki so pomembno gonilo pri razvrščanju in vivo ob upoštevanju razvrščanja po GHS ZN. Čeprav s preskusno metodo ICE ni mogoče oceniti popravljivosti poškodb roženice kot take, je bilo na podlagi študij na očeh kuncev predlagano, da se lahko za opredelitev nekaterih vrst nepopravljivih učinkov uporabi ocena prvotne globine poškodbe roženice (17). Zlasti je potrebno nadaljnje znanstveno znanje, da bi razumeli, kako nastanejo nepopravljivi učinki, ki niso povezani z začetno hudo poškodbo. Treba je tudi opozoriti, da s preskusno metodo ICE ni mogoče oceniti potencialne sistemske toksičnosti, povezane z izpostavljenostjo oči. Ta preskusna metoda se bo redno posodabljala ob upoštevanju novih informacij in podatkov. Kadar je potrebna popolnejša opredelitev poškodbe roženice, se je lahko uporabna na primer histopatologija. Za oceno te možnosti se uporabnikom priporoča, naj oči shranijo in pripravijo histopatološke vzorce, ki se lahko uporabijo pri ustvarjanju zbirke podatkov in oblikovanju meril za odločanje, s katerimi se lahko nadalje izboljša točnost te preskusne metode. OECD je pripravila dokument s smernicami za uporabo preskusnih metod in vitro za ugotavljanje toksičnosti za oči, ki vključuje podrobne postopke o zbirki histopatoloških vzorcev in informacije o tem, kam poslati vzorce in/ali histopatološke podatke (8). Vsak laboratorij, ki ta preskus izvaja prvič, mora uporabiti kemikalije za preverjanje usposobljenosti iz Dodatka 2. Laboratorij lahko te kemikalije uporabi, da dokaže svojo tehnično usposobljenost za izvajanje preskusne metode ICE, preden podatke o tej metodi predloži za namene regulativne razvrstitve glede na nevarnosti. NAČELO PRESKUSA Preskusna metoda ICE je organotipski model, s katerim se piščančje oko za kratek čas ohrani in vitro. Pri tej preskusni metodi se poškodba, ki jo povzroči preskusna kemikalija, oceni tako, da se določijo nabreklost roženice, njena prepustnost in zadrževanje fluoresceina. Medtem ko se slednja parametra ocenjujeta kvalitativno, je treba nabreklost roženice oceniti kvantitativno. Vsaka meritev se bodisi pretvori v kvantitativni rezultat, ki se uporabi za izračun splošnega indeksa dražilnosti, bodisi kvalitativno razvrsti v kategorijo, ki se uporabi za razvrstitev glede na nevarnosti za oči in vitro kot kategorija 1 po GHS ZN ali brez kategorije po GHS ZN. Kateri koli od teh rezultatov se lahko uporabi za napoved, da je preskusna kemikalija zmožna povzročiti hude poškodbe oči in vivo ali da preskusne kemikalije ne bo treba razvrstiti glede na nevarnosti za oči (glej merila za odločanje). Vendar kemikalij, pri katerih se napove, da ne bodo povzročile hudih poškodb oči, ali ki glede na preskusno metodo ICE niso razvrščene (glej odstavek 11), ni mogoče razvrstiti. Izvor in starost oči piščancev Za ta preskus se običajno uporabljajo oči piščancev, ki so bili zaklani v klavnicah in namenjeni za človeško prehrano, kar pomeni, da poskusne živali niso potrebne. Uporabljajo se samo oči zdravih živali, primernih za vstop v prehransko verigo človeka. Čeprav kontrolirana študija za ocenjevanje najprimernejše starosti piščancev ni bila opravljena, so se v preteklih preskusih po tej metodi uporabljali mladi piščanci, ki so bili zaklani v klavnicah (tj. piščanci, stari približno 7 tednov in težki od 1,5 do 2,5 kg). Odvzem in prevoz oči v laboratorij Glave se odstranijo neposredno po omamljanju piščancev, običajno z električnim šokom, in po izkrvavitvi zaradi prereza vratu. Piščanci morajo izhajati iz lokalnega vira v bližini laboratorija, tako da se njihove glave iz klavnice v laboratorij pripeljejo tako hitro, da se njihovo stanje čim manj poslabša in/ali čim bolj zmanjša možnost bakterijske okužbe. Čas od odvzema glav piščancev in vstavitve oči v komoro naprave za superfuzijo po odvzemu oči mora biti čim krajši (običajno manj kot dve uri), da se izpolnijo merila za sprejemljivost preskusa. Vse oči, uporabljene v preskusu, morajo pripadati isti skupini oči, odvzeti na določeni dan. Ker se oči secirajo v laboratoriju, se nepoškodovane glave iz klavnice v laboratorij prepeljejo pri sobni temperaturi (običajno med 18 °C in 25 °C) v plastičnih posodah, ki so navlažene s krpami, prepojenimi s fiziološko raztopino. Merila za izbor in število oči, uporabljenih v preskusni metodi ICE Oči z močno izhodiščno obarvanostjo s fluoresceinom (tj. > 0,5) ali motno roženico (tj. > 0,5) po odvzemu se zavržejo. Vsaka tretirana skupina in sočasna pozitivna kontrola sta sestavljeni iz vsaj treh oči. Za negativno kontrolno skupino ali kontrolo s topilom (če se namesto fiziološke raztopine uporablja drugo topilo) se uporabi vsaj eno oko. V primeru trdnih materialov, pri katerih se pojavi rezultat brez kategorije po GHS ZN, je priporočljiva druga ponovitev s tremi očmi, da se negativni rezultat potrdi ali zavrže. POSTOPEK Priprava oči Veke se pazljivo odstranijo, pri čemer je treba paziti, da se ne poškoduje roženica. Celovitost roženice se hitro oceni tako, da se na njeno površino za nekaj sekund nanese kapljica 2-odstotnega (m/v) natrijevega fluoresceina, površina pa se nato spere s fiziološko raztopino. Oči, obdelane s fluoresceinom, se nato pregledajo z biomikroskopom s špranjsko svetilko, da se preveri, ali je roženica nepoškodovana (tj. zadrževanje fluoresceina in motnjava roženice ≤ 0,5). Če je oko nepoškodovano, se izreže iz lobanje, pri čemer je treba paziti, da se roženica ne poškoduje. Zrklo se iz očesne votline potegne tako, da se žmurka trdno zagrabi s kirurškimi prijemalkami, očesne mišice pa se prerežejo z ukrivljenimi škarjami s topo konico. Tako se prepreči, da bi se roženica zaradi prevelikega tlaka poškodovala (tj. artefakti zaradi stisnjenja). Ko se oko odstrani iz očesne votline, se ga mora še vedno držati viden del vidnega živca. Po odstranitvi iz očesne votline se oko položi na vpojno podlago, nato pa se odrežeta žmurka in preostalo vezno tkivo. Izolirano oko se namesti v prijemalko iz nerjavnega jekla, tako da je roženica v navpičnem položaju. Prijemalka se nato prenese v komoro naprave za superfuzijo (18). Prijemalke je treba v napravi za superfuzijo namestiti tako, da kapljice fiziološke raztopine močijo celotno roženico (3 do 4 kapljice na minuto ali od 0,1 do 0,15 ml na minuto). Komore naprave za superfuzijo morajo imeti nadzorovano temperaturo, in sicer pri 32 ± 1,5 °C. V Dodatku 3 je diagram običajne naprave za superfuzijo s prijemalkami za oči, ki je na voljo na trgu, laboratoriji pa jo lahko izdelajo tudi sami. Naprava se lahko prilagodi potrebam posameznega laboratorija (tj. za različno število oči). V napravi za superfuzijo se oči še enkrat pregledajo z biomikroskopom s špranjsko svetilko, s čimer se zagotovi, da se med seciranjem niso poškodovale. Pri tem se z nastavkom za merjenje globine na biomikroskopu na apeksu roženice izmeri tudi debelina roženice. Oči z (i) vrednostjo zadržanega fluoresceina > 0,5, (ii) motnjavo roženice > 0,5, ali (iii) dodatnimi znaki poškodb je treba zamenjati. Za oči, ki se na podlagi katerega koli od teh meril ne zavržejo, velja, da jih je treba vseeno zavreči, če se debelina roženice za več kot 10 % razlikuje od srednje vrednosti vseh oči. Uporabniki se morajo zavedati, da se lahko z biomikroskopi s špranjsko svetilko pri različnih širinah špranje pridobijo različne vrednosti meritev debeline roženice. Širino špranje je treba nastaviti na 0,095 mm. Po tem ko se vse oči pregledajo in odobrijo, se inkubirajo za približno 45 do 60 minut, da se pred odmerjanjem uravnotežijo s preskusnim sistemom. Po obdobju uravnoteženja se kot izhodiščna vrednost za debelino in motnjavo roženice zabeleži nična vrednost (tj. čas = 0). Vrednost fluoresceina, določena pri seciranju, se uporabi kot izhodiščna vrednost za to končno točko. Uporaba preskusne kemikalije Takoj po meritvi z ničnimi referenčnimi vrednostmi se oko (skupaj z držalom) vzame iz naprave za superfuzijo in položi vodoravno, nato pa se na roženico nanese preskusna kemikalija. Tekoče preskusne kemikalije se običajno preskusijo nerazredčene, po potrebi pa se lahko tudi razredčijo (tj. kot del zasnove študije). Kot topilo pri razredčenih preskusnih kemikalijah se najpogosteje uporablja fiziološka raztopina. V nadzorovanih pogojih pa se lahko uporabijo tudi druga topila, vendar je ustreznost topil, ki niso fiziološka raztopina, treba dokazati. Tekoče preskusne kemikalije se na roženico nanesejo tako, da je celotna površina roženice enakomerno prekrita z njimi, pri čemer je standardna količina 0,03 ml. Če je mogoče, se trdne preskusne kemikalije čim bolj zdrobijo v terilnici s pestilom ali primerljivim orodjem za drobljenje. Prašek se nanese na roženico tako, da je njena površina enakomerno prekrita s preskusno kemikalijo, pri čemer je standardna količina 0,03 g. Preskusna kemikalija (tekoča ali trdna) se pusti učinkovati 10 sekund, nato pa se z očesa spere s fiziološko raztopino (približno 20 ml) pri sobni temperaturi. Nato se oko (skupaj z držalom) ponovno vstavi v napravo za superfuzijo, in sicer v prvotnem, pokončnem položaju. Po potrebi se lahko dodatno spere po 10-sekundnem učinkovanju in v poznejših časovnih točkah (npr. v primeru odkritja ostankov preskusne kemikalije na roženici). V splošnem dodatno uporabljena količina fiziološke raztopine ni ključnega pomena, pač pa je pomembno to, ali se opazi oprijemanje kemikalije na roženico. Kontrolne kemikalije V vsak poskus je treba vključiti sočasno negativno kontrolo ali kontrolo s topilom/vehiklom ter pozitivne kontrole. Pri preskušanju 100-odstotnih tekočin ali trdnih snovi se kot primerjalna negativna kontrola pri preskusni metodi ICE uporablja fiziološka raztopina, da se odkrijejo nespecifične spremembe preskusnega sistema in da preskusni pogoji ne povzročajo neustreznih dražilnih reakcij. Pri preskušanju razredčenih tekočin se v preskusno metodo vključi sočasna kontrolna skupina s topilom/vehiklom, da se odkrijejo nespecifične spremembe preskusnega sistema in da preskusni pogoji ne povzročajo neustreznih dražilnih reakcij. Kot je navedeno v odstavku 31, se lahko uporablja samo topilo/vehikel, za katerega je dokazano, da na preskusni sistem nima škodljivih učinkov. V vsak poskus se kot sočasna pozitivna kontrola vključi znana dražilna snov za oči, da se preveri, ali se sproži želena reakcija. Ker se preskus ICE pri tej preskusni metodi uporablja za opredelitev jedkih ali zelo dražilnih snovi, je treba za pozitivno kontrolo uporabiti tako referenčno kemikalijo, ki pri tej preskusni metodi povzroči močno reakcijo. Da se lahko oceni variabilnost odziva pozitivne kontrole v daljšem časovnem obdobju pa stopnja močnega odziva ne sme biti prevelika. Za pozitivno kontrolo je treba pridobiti dovolj podatkov in vitro, da se lahko izračuna statistično opredeljeno sprejemljivo območje pozitivne kontrole. Če za določeno pozitivno kontrolo ni na voljo ustreznih podatkov o preskusni metodi ICE iz preteklih preskusov, je treba opraviti študije, v katerih se bodo ti podatki zbrali. Primera pozitivnih kontrol za tekoče preskusne kemikalije sta 10-odstotna ocetna kislina ali 5-odstoten benzalkonijev klorid, primera pozitivnih kontrol za trdne preskusne kemikalije pa natrijev hidroksid in imidazol. Primerjalne kemikalije so primerne za ocenjevanje potenciala za draženje oči, ki ga imajo neznane kemikalije določenega kemijskega ali proizvodnega razreda, ali za ocenjevanje relativnega potenciala snovi za draženje oči v določenem razponu dražilnih učinkov. Merjene končne točke Tretirane roženice se ocenijo pred tretiranjem in nato 30, 75, 120, 180 in 240 minut (± 5 minut) po spiranju, opravljenem po tretiranju. S temi časovnimi točkami se omogoči ustrezno število meritev med štiriurnim tretiranjem in hkrati zagotovi dovolj časa, da se oči med posameznimi meritvami ustrezno pregledajo. Končne točke, ki se ocenijo, so motnjava in nabreklost roženice, zadrževanje fluoresceina in morfološki učinki (tj. luknjičavost ali odstopanje epitelija). Vse končne točke razen zadrževanja fluoresceina (ki se oceni samo pred tretiranjem in 30 minut po izpostavljenosti preskusni kemikaliji) se ocenijo pri vsaki od navedenih časovnih točk. Priporoča se, da se motnjava roženice, zadrževanje fluoresceina, morfološki učinki in morebitni histopatološki izvidi dokumentirajo. Po tem ko se po štirih urah opravi končni pregled, se uporabnikom priporoča, naj oči shranijo v ustrezni fiksirni raztopini (tj. v nevtralnem formalinskem pufru), da se lahko po potrebi opravi histopatološki pregled (za podrobnosti glej odstavek 14 in vir (8)). Nabreklost roženice se določi na podlagi meritev debeline roženice, opravljenih z optičnim pahimetrom na biomikroskopu s špranjsko svetilko. Izrazi se v odstotkih in izračuna iz meritev debeline roženice z naslednjo formulo:
Srednja odstotna vrednost nabreklosti roženice vseh preskusnih oči se izračuna za vse časovne točke opazovanja. Na podlagi najvišje srednje vrednosti nabreklosti roženice, kot je bila opažena v kateri koli časovni točki, se za vsako preskusno kemikalijo določi skupna vrednost za posamezno kategorijo (glej odstavek 51). Pri oceni motnjave roženice se upošteva predel roženice, ki je pri beleženju rezultatov najbolj moten (glej preglednico 1). Za vse časovne točke opazovanja se izračuna srednja vrednost motnjave roženice vseh preskusnih oči. Na podlagi najvišje srednje vrednosti motnjave roženice, kot je bila opažena v kateri koli časovni točki, se za vsako preskusno kemikalijo določi skupna vrednost za posamezno kategorijo (glej odstavek 51). Preglednica 1 Vrednosti motnjave roženice
Zadrževanje fluoresceina se oceni samo v časovni točki opazovanja po 30 minutah, kot je prikazano v preglednici 2. Nato se izračuna srednja vrednost zadržanega fluoresceina vseh preskusnih oči za časovno točko opazovanja po 30 minutah, ki se pri vsaki preskusni kemikaliji uporabi kot skupna vrednost za posamezno kategorijo (glej odstavek 51). Preglednica 2 Vrednost zadržanega fluoresceina
Morfološki učinki vključujejo „luknjičaste“ epitelne celice roženice, epitelij, ki odstopa, „grobo“ roženično površino in „prilepljenost“ preskusne kemikalije na roženico. Te ugotovitve so lahko različno resne in se lahko pojavijo istočasno. Razvrščanje teh ugotovitev poteka subjektivno v skladu z razlago raziskovalca. PODATKI IN POROČANJE Ocenjevanje podatkov Rezultate za motnjavo in nabreklost roženice ter zadrževanje fluoresceina je treba oceniti ločeno, da se ustvari razred ICE za vsako končno točko. Razredi ICE za vsako končno točko se nato združijo, da se vsaka preskusna kemikalija lahko razvrsti v razred dražilnosti. Merila za odločanje Po oceni vsake končne točke se na podlagi vnaprej določenega območja določijo razredi ICE. Pri razlagi debeline roženice (preglednica 3), motnjave roženice (preglednica 4) in zadrževanja fluoresceina (preglednica 5) se uporabljajo štirje razredi ICE v skladu z spodnjimi lestvicami. Opozoriti je treba, da so vrednosti nabreklosti roženice iz preglednice 3 uporabne le, če je debelina izmerjena z biomikroskopom s špranjsko svetilko (npr. z modelom Haag-Streit BP900) z napravo za merjenje globine št. 1 in nastavitvijo širine špranje na 9 Preglednica 3 Merila ICE za razvrstitev glede na nabreklost roženice
Preglednica 4 Merila ICE za razvrstitev motnjave roženice
Preglednica 5 Merila ICE za razvrstitev glede na srednjo vrednost zadržanega fluoresceina
Razvrstitev preskusne kemikalije in vitro se oceni na podlagi razvrstitve po GHS ZN, ki ustreza kombinaciji kategorij, pridobljenih za nabreklost in motnjavo roženice ter zadrževanje fluoresceina, kot je navedeno v preglednici 6. Preglednica 6 Splošne razvrstitve in vitro
Merila za sprejemljivost študije Preskus se šteje za sprejemljivega, če so sočasne negativne kontrole ali kontrole z vehiklom/topilom opredeljene kot brez kategorije po GHS ZN, sočasne pozitivne kontrole pa kot kategorija 1 po GHS ZN. Poročilo o preskusu V poročilo o preskusu se vključijo naslednji podatki, če so pomembni za izvedbo študije:
VIRI
Dodatek 1 OPREDELITVE POJMOV Točnost : stopnja ujemanja rezultatov preskusne metode s sprejetimi referenčnimi vrednostmi. Je merilo učinkovitosti preskusne metode in eden od vidikov „ustreznosti“. Ta izraz in izraz „skladnost“ se pogosto uporabljata kot sopomenki in pomenita delež pravilnih rezultatov preskusne metode. Primerjalna kemikalija : kemikalija, ki se uporablja kot standard za primerjavo s preskusno kemikalijo. Primerjalna kemikalija mora imeti naslednje značilnosti: (i) ima trajen in zanesljiv vir; (ii) je strukturno in funkcijsko podobna kemikalijam iz preskušanega razreda, (iii) ima znane fizikalne/kemijske lastnosti, (iv) ima spremne podatke o znanih učinkih in (v) ima znano moč v razponu želenega odziva. Pristop od spodaj navzgor : stopenjski pristop, ki se uporablja za kemikalijo, za katero se domneva, da ne potrebuje razvrstitve glede na draženje oči ali hude poškodbe oči, pri čemer se najprej določijo kemikalije, ki ne potrebujejo razvrstitve (negativni rezultat), nato pa druge kemikalije (pozitivni rezultat). Kemikalija : snov ali zmes. Roženica : prozoren sprednji del zrkla, ki pokriva šarenico in zenico ter skozi katerega vstopa svetloba. Motnjava roženice : merjenje stopnje motnjave roženice po izpostavljenosti preskusni kemikaliji. Povečana motnjava roženice pomeni, da je roženica poškodovana. Nabreklost roženice : objektivna meritev stopnje raztezanja roženice pri preskusu ICE po izpostavljenosti preskusni kemikaliji. Izražena je kot odstotek, izračuna pa se iz meritev osnovne debeline roženice (pred odmerkom) in debeline, zabeležene v rednih intervalih po izpostavljenosti preskusni kemikaliji v preskusu ICE. Stopnja nabreklosti roženice je kazalnik poškodbe roženice. Draženje oči : je povzročitev sprememb v očesu po nanosu preskusne kemikalije na sprednjo površino očesa, ki so v celoti popravljive v 21 dneh po nanosu. Ta pojem je sopomenka za „popravljive učinke na oči“ in „kategorijo 2 po GHS ZN“ (4). Delež lažno negativnih rezultatov : delež vseh pozitivnih kemikalij, ki jih preskusna metoda zmotno prikaže kot negativne. To je eden od kazalnikov učinkovitosti preskusne metode. Delež lažno pozitivnih rezultatov : delež vseh negativnih kemikalij, ki jih preskusna metoda zmotno prikaže kot pozitivne. To je eden od kazalnikov učinkovitosti preskusne metode. Zadrževanje fluoresceina : subjektivna meritev stopnje natrijevega fluoresceina pri preskusu ICE, ki se zadrži v celicah epitelija v roženici po izpostavitvi preskusni kemikaliji. Stopnja zadržanega fluoresceina je kazalnik poškodb epitelija roženice. Nevarnost : neločljiva lastnost sredstva ali stanje, ki ob izpostavljenosti temu sredstvu lahko povzroči neželen učinek na organizem, sistem ali (pod)populacijo. Nepopravljivi učinki na oči : glej „Huda poškodba oči“ in „Kategorija 1 po GHS ZN“. Zmes : zmes ali raztopina iz dveh ali več snovi, ki v njej ne reagirajo (4). Negativna kontrola : netretiran ponovljen vzorec, ki vsebuje vse komponente preskusnega sistema. Ta vzorec se obdela z vzorci, tretiranimi s preskusno kemikalijo, ali drugimi kontrolnimi vzorci, da se ugotovi, ali topilo reagira s preskusnim sistemom. Brez razvrstitve : kemikalije, ki niso razvrščene glede na draženje oči (kategorija 2 po GHS ZN) ali hude poškodbe oči (kategorija 1 po GHS ZN). Ta pojem je sopomenka za „brez kategorije po GHS ZN“. Pozitivna kontrola : ponovljen vzorec, ki vsebuje vse sestavine preskusnega sistema in se tretira s kemikalijo, za katero je znano, da povzroči pozitiven odziv. Za zagotovitev, da se lahko variabilnost odziva pozitivne kontrole oceni v daljšem časovnem obdobju, pa stopnja močnega odziva ne sme biti prevelika. Zanesljivost : stopnja obnovljivosti preskusne metode v enem ali več laboratorijih v daljšem časovnem obdobju ob uporabi istega protokola. Oceni se z izračunom obnovljivosti v enem ali več laboratorijih in interne laboratorijske ponovljivosti. Popravljivi učinki na oči : glej „Draženje oči“ in „Kategorija 2 po GHS ZN“. Huda poškodba oči : povzročitev poškodbe očesnega tkiva ali resne fizične okvare vida po nanosu preskusne kemikalije na sprednjo površino očesa, ki ni v celoti popravljiva v 21 dneh po nanosu. Ta pojem je sopomenka za „nepopravljive učinke na oči“ in „kategorijo 1 po GHS ZN“ (4). Biomikroskop s špranjsko svetilko : instrument, ki se uporablja za neposredno preiskavo očesa in ki skupaj z binokularnim mikroskopom tvori pokončno stereomikroskopsko sliko. Pri preskusni metodi ICE se ta instrument uporablja za vpogled v sprednje strukture očesa piščanca ter za objektivno merjenje debeline roženice z nastavkom za merjenje globine. Kontrola s topilom/vehiklom : netretiran vzorec, ki vsebuje vse komponente preskusnega sistema, vključno s topilom ali vehiklom, ki se obdela s vzorci, tretiranimi s preskusno kemikalijo, in drugimi kontrolnimi vzorci, da se določi izhodiščni odziv za vzorce, tretirane s preskusno kemikalijo, raztopljeno v istem topilu ali vehiklu. Pri preskušanju s sočasno negativno kontrolo ta vzorec tudi pokaže, ali topilo ali vehikel reagira s preskusnim sistemom. Snov : kemijski elementi in njihove spojine, ki so v naravnem stanju ali pridobljeni s katerim koli proizvodnim postopkom, vključno z vsemi dodatki, potrebnimi za ohranitev stabilnosti produkta, in kakršnimi koli nečistotami, ki so nastale v uporabljenem postopku, vendar brez kakršnega koli topila, ki ga je mogoče ločiti, ne da bi to vplivalo na stabilnost snovi ali spremenilo njeno sestavo (4). Površinsko aktivna snov : je snov, kot je detergent, ki lahko zmanjša površinsko napetost tekočine in tako omogoči, da se speni ali prodre v trdne snovi; znana je tudi kot omakalno sredstvo. Pristop od zgoraj navzdol : stopenjski pristop, ki se uporablja za kemikalijo, za katero se domneva, da povzroča hude poškodbe oči, pri čemer se najprej določijo kemikalije, ki jih je treba razvrstiti (pozitivni rezultat), nato pa še druge kemikalije (negativni rezultat). Preskusna kemikalija : vsaka snov ali zmes, preskušena s to preskusno metodo. Večstopenjska strategija preskušanja : stopenjsko preskušanje, pri katerem se v posebnem vrstnem redu pregledajo vsi obstoječi podatki o preskusni kemikaliji, pri čemer se na vsaki stopnji uporabi postopek, ki temelji na zanesljivosti dokazov, da se določi, ali je pred nadaljevanjem na naslednji stopnji na voljo dovolj podatkov za odločitev o razvrstitvi kemikalije glede na nevarnost, ki jo povzroča. Če se za preskusno kemikalijo na podlagi razpoložljivih podatkov lahko določi potencial za draženje, dodatno preskušanje ni potrebno. Če preskusni kemikaliji na podlagi razpoložljivih podatkov ni mogoče določiti potenciala za draženje, se izvede postopno zaporedno testiranje na živalih, dokler kemikalije ni mogoče jasno razvrstiti. Globalno usklajeni sistem Združenih narodov za razvrščanje in označevanje kemikalij (GHS ZN) : sistem za razvrščanje kemikalij (snovi in zmesi) v skladu s standardiziranimi vrstami in stopnjami fizičnih, zdravstvenih in okoljskih nevarnosti ter za obravnavanje ustreznega označevanja, na primer s piktogrami, opozorilnimi besedami, stavki o nevarnosti, previdnostnimi stavki in varnostnimi listi, da bi se razširile informacije o škodljivih učinkih kemikalij ter s tem zaščitili ljudje (vključno z delodajalci, delavci, prevozniki, potrošniki in reševalci) in okolje (4). Kategorija 1 po GHS ZN : glej „Huda poškodba oči“ in/ali „Nepopravljivi učinki na oči“. Kategorija 2 po GHS ZN : glej „Draženje oči“ in/ali „Popravljivi učinki na oči“. Brez kategorije po GHS ZN : snovi, ki ne izpolnjujejo zahtev za razvrstitev v kategorijo 1 ali 2 (2A ali 2B) po GHS ZN. Ta pojem je sopomenka za „brez razvrstitve“. Validirana preskusna metoda : preskusna metoda, za katero sta bili na podlagi izvedenih validacijskih študij določeni ustreznost (vključno s točnostjo) in zanesljivost za določen namen. Opozoriti je treba, da točnost in zanesljivost validirane preskusne metode nista nujno zadostni, da bi bila sprejemljiva za predlagani namen. Zanesljivost dokazov : postopek obravnavanja prednosti in slabosti različnih informacij v okviru sprejemanja in utemeljevanja sklepne ugotovitve glede potenciala nevarnosti kemikalije. Dodatek 2 KEMIKALIJE ZA PREVERJANJE USPOSOBLJENOSTI ZA PRESKUSNO METODO ICE Pred redno uporabo te preskusne metode, ki izpolnjuje zahteve te preskusne metode, morajo laboratoriji dokazati tehnično usposobljenost tako, da pravilno opredelijo razvrstitev glede na nevarnosti za oči za 13 kemikalij, priporočenih v preglednici 1. Te kemikalije so bile izbrane, ker predstavljajo celoten razpon odzivov pri nevarnostih za oči, temeljijo pa na rezultatih preskusa draženja oči in vivo na kuncih (TG 405) in sistemu za razvrščanje GHS ZN (tj. kategorije 1, 2A, 2B ali brez kategorije) (4) (6). Druga merila za izbiro so bila razpoložljivost kemikalij na trgu, razpoložljivost visokokakovostnih referenčnih podatkov in vivo in visokokakovostni podatki in vitro iz metode ICE. Referenčni podatki so na voljo v dokumentu s povzetkom (5) ter dokumentu ICCVAM o pregledu ozadja preskusne metode ICE (9). Preglednica 1 Priporočene kemikalije za dokazovanje tehnične usposobljenosti za ICE
Dodatek 3 DIAGRAMI NAPRAVE ZA SUPERFUZIJO IN PRIJEMALK ZA OČI PRI ICE (Za dodatne splošne opise naprave za superfuzijo in prijemalk za oči glej Burton idr. (18)) 
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
(14) |
Poglavje B.49 dela B se nadomesti z naslednjim: „B.49 In vitro preskus mikronukleusov na celicah sesalcev UVOD Ta preskusna metoda je enakovredna Smernici za preskušanje OECD 487 (2016).Je del sklopa preskusnih metod o genetski toksikologiji. Pripravljen je dokument OECD, ki zagotavlja jedrnate informacije o preskušanju v zvezi z genetsko tokskikologijo in pregled nedavnih sprememb teh preskusnih smernic (1). In vitro preskus mikronukleusov je preskus genotoksičnosti za odkrivanje mikronukleusov v citoplazmi celic v interfazi. Mikronukleusi lahko izvirajo iz acentričnih fragmentov kromosomov (kar pomeni, da so brez centromere) ali celih kromosomov, ki med anafazo celične delitve ne morejo potovati na pole. Zato je ta preskus metoda, ki zagotavlja celovito podlago za in vitro preiskovanje potenciala za povzročitev poškodb kromosomov, saj se lahko v celicah, pri katerih je med izpostavljenostjo preskusni kemikaliji ali po njej prišlo do delitve celic, zaznajo anevgene in klastogene snovi (2) (3) (za več podrobnosti glej odstavek 13). V mikronukleusih je vidna poškodba, ki se je prenesla na hčerinske celice, medtem ko se kromosomske aberacije v celicah v metafazi ne morejo prenesti. V vsakem primeru spremembe morda niso združljive s preživetjem celic. Pri tej preskusni metodi je mogoče uporabiti protokole z inhibitorjem polimerizacije aktina citohalazinom B ali brez njega. Zaradi dodatka citohalazina B pred mitozo nastanejo celice z dvema jedroma, kar omogoča opredelitev in analizo mikronukleusov le v tistih celicah, v katerih se je zaključila ena mitoza (4) (5). S to preskusno metodo je tudi mogoče uporabiti protokole brez citokinetskega bloka, če obstajajo dokazi, da se je pri analizirani celični populaciji zaključila mitoza. Poleg uporabe in vitro preskusa mikronukleusov za opredelitev kemikalij, ki spodbujajo nastanek mikronukleusov, se lahko dodatne informacije o mehanizmih poškodb kromosomov in nastanka mikronukleusov pridobijo tudi z imunokemijskim označevanjem kinetohorov ali hibridizacijo s centromerno/telomerno sondo (fluorescenčna hibridizacija in situ (FISH)) (6) (7) (8) (9) (10) (11) (12) (13) (14) (15) (16) (17). Navedena postopka označevanja in hibridizacije se lahko uporabita v primeru povečanega nastajanja mikronukleusov, ko želi raziskovalec ugotoviti, ali je povečanje nastalo zaradi klastogenih in/ali anevgenih dogodkov. Ker se mikronukleusi v celicah v interfazi lahko ocenjujejo razmeroma objektivno, morajo zaposleni v laboratoriju določiti število celic z dvema jedroma samo, ko se uporabi citohalazin B, pojavnost celic z mikronukleusi pa v vseh primerih. Zato se lahko rezultati preparatov sorazmerno hitro zabeležijo, analiza pa je lahko avtomatizirana. Zaradi tega se lahko pri vsakem tretiranju praktično oceni na tisoče namesto na stotine celic, s čimer se poveča moč preskusa. Ker lahko mikronukleusi nastanejo iz zaostalih kromosomov, obstaja možnost zaznavanja snovi, ki povzročajo anevploidijo in se pri klasičnih preskusih kromosomskih aberacij težko proučujejo, gl. npr. Poglavje B.10 te priloge (18). Vendar in vitro preskus mikronukleusov, kot je opisan v tej preskusni metodi, ne omogoča razlikovanja med kemikalijami, ki povzročajo spremembe števila kromosomov in/ali ploidijo, in tistimi, ki povzročajo klastogenost, brez posebnih tehnik, kot je fluorescenčna hibridizacija in situ (FISH), omenjena v odstavku 4. In vitro preskus mikronukleusov je zanesljiv in se lahko izvaja na različnih vrstah celic ter ob prisotnosti ali odsotnosti citohalazina B. Veljavnost in vitro preskusa mikronukleusov (MNvit), pri katerem se uporabljajo različne vrste celic (kulture celičnih linij ali primarne celične kulture), je mogoče podpreti z obsežnimi podatki (19) (20) (21) (22) (23) (24) (25) (26) (27) (28) (29) (30) (31) (32) (33) (34) (35) (36). Ti vključujejo zlasti mednarodne validacijske študije, ki jih usklajuje Société Française de Toxicologie Génétique (SFTG) (19) (20) (21) (22) (23), ter poročila International Workshop on Genotoxicity Testing (5) (17). Razpoložljivi podatki so bili tudi ponovno ocenjeni v retrospektivni validacijski študiji, ki temelji na zanesljivosti dokazov, ki jo je izvedel Evropski center za validacijo alternativnih metod (ECVAM) Evropske komisije, Znanstveni svetovalni odbor ECVAM (ESAC) pa je preskusno metodo potrdil kot znanstveno veljavno (37) (38) (39). Pri in vitro preskusu mikronukleusov se lahko uporabijo kulture celičnih linij ali primarne celične kulture človeškega ali glodalskega izvora. Ker pogostost mikronukleusov v ozadju vpliva na občutljivost preskusa, je priporočljivo uporabljati celične vrste s stabilno in opredeljeno pogostostjo nastajanja mikronukleusov v ozadju. Uporabljene celice se izberejo glede na njihovo zmožnost dobre rasti v kulturi, stabilnost kariotipa (vključno s kromosomskim številom) in pogostnost spontanih mikronukleusov (40). Na podlagi razpoložljivih podatkov za zdaj ni mogoče navesti trdnih priporočil, vendar je iz njih razvidno, da je treba pri ocenjevanju kemične nevarnosti upoštevati status beljakovine p53, gensko stabilnost (stabilnost kariotipa), sposobnost popravljanja DNK in izvor (glodalski/človeški) celic, izbranih za preskušanje. Uporabnikom te preskusne metode se torej priporoča, naj upoštevajo vpliv te in drugih lastnosti celic na uspešnost celične linije pri odkrivanju indukcije kromosomskih aberacij, medtem ko se razvija znanje na tem področju. Uporabljene opredelitve pojmov so navedene v Dodatku 1. ZAČETNI PREUDARKI IN OMEJITVE Pri preskusih, izvedenih in vitro, je običajno treba uporabiti zunanji vir presnovne aktivacije, razen če so celice v zvezi s preskusno kemikalijo sposobne presnavljanja. Zunanji sistem presnovne aktivacije ne posnema pogojev in vivo v celoti. Paziti je treba, da se izogibamo pogojem, ki bi lahko povzročili lažno pozitivne rezultate, ki ne odražajo genotoksičnosti preskusnih kemikalij. Med take pogoje so vključene spremembe vrednosti pH (41) (42) (43) ali osmolarnosti, medsebojno delovanje s sestavinami celičnega gojišča (44) (45) ali previsoke ravni citotoksičnosti (glej odstavek 29). Pri analizi nastanka mikronukleusov je bistveno, da mitoza poteče tako v tretiranih kot tudi netretiranih kulturah. Glede štetja mikronukleusov se največ podatkov pridobi s celicami, v katerih se je med tretiranjem s preskusno kemikalijo ali po njej zaključila ena mitoza. Pri proizvedenih nanomaterialih so potrebne posebne prilagoditve te preskusne metode, ki pa pri tej metodi niso opisane. Pred uporabo te preskusne metode za preskušanje zmesi in pridobivanje podatkov za predvideni regulativni namen bi bilo treba proučiti, ali bo zagotovila sprejemljive rezultate za navedeni namen in, če jih bo, zakaj. Kadar obstaja regulativna zahteva za preskušanje zmesi, taki preudarki niso potrebni. NAČELO PRESKUSA Človeške celične kulture ali celične kulture drugih sesalcev so preskusni kemikaliji izpostavljene z zunanjim virom presnovne aktivacije ali brez njega, razen če so uporabljene celice z ustrezno sposobnostjo metabolizma (glej odstavek 19). Med izpostavljenostjo preskusni kemikaliji in po njej se celice gojijo dovolj dolgo, da so mogoči poškodba kromosomov ali drugi učinki na celični cikel/delitev celic, kar povzroči nastanek mikronukleusov v celicah v interfazi. Za nastanek anevploidije mora biti običajno preskusna kemikalija prisotna med mitozo. Odvzete in obarvane celice v interfazi se analizirajo na prisotnost mikronukleusov. Mikronukleuse je treba po možnosti šteti samo v tistih celicah, v katerih se je mitoza zaključila med izpostavljenostjo preskusni kemikaliji ali v morebitnem obdobju po tretiranju. V kulturah, tretiranih z zaviralcem citokineze, se to zlahka doseže tako, da se štejejo le celice z dvema jedroma. Če se zaviralec citokineze ne uporabi, je treba dokazati, da se je v analiziranih celicah najverjetneje zaključila delitev celic, in sicer na podlagi povečanja celične populacije med izpostavljenostjo preskusni kemikaliji ali po njej. Pri vseh protokolih je treba dokazati, da je do celične proliferacije prišlo tako v kontrolnih kot tudi tretiranih kulturah, v vseh kulturah, pri katerih se štejejo mikronukleusi, pa je treba oceniti obseg citotoksičnosti ali citostaze, ki je nastala zaradi preskusne kemikalije. OPIS METODE Celice Uporabijo se lahko gojeni primarni limfociti periferne krvi človeka ali drugih sesalcev (7) (20) (46) (47) in številne celične linije glodalcev, kot so celice CHO, V79, CHL/IU in L5178Y, ali človeške celične linije, kot je TK6 (19) (20) (21) (22) (23) (26) (27) (28) (29) (31) (33) (34) (35) (36) (glej odstavek 6). Pri preskušanju mikronukleusov so bile uporabljene tudi druge celične linije, kot so HT29 (48), Caco-2 (49), HepaRG (50) (51), celice HepG2 (52) (53), A549 in primarne embrionalne celice sirijskega hrčka (54), vendar zaenkrat še niso obširno validirane. Zato je treba uporabo navedenih celičnih linij in vrst utemeljiti na podlagi njihove dokazane učinkovitosti v preskusu, kot je opisano v oddelku o merilih za sprejemljivost. Poročalo se je o morebitnem vplivu citohalazina B na rast celic L5178Y, zato s to celično linijo ni priporočljiv (23). Pri uporabi primarnih celic je treba zaradi dobrobiti živali razmisliti o uporabi človeških primarnih celic, če je to izvedljivo, ter jih vzorčiti v skladu s človeškimi etičnimi načeli in predpisi. Limfocite periferne krvi človeka je treba pridobiti od mladih oseb (starih med približno 18 in 35 let), ki ne kadijo, nimajo znanih bolezni ali niso bili nedavno izpostavljeni takim stopnjam genotoksičnih snovi (npr. kemikalijam, ionizirajočemu sevanju), zaradi katerih bi se povečala pojavnost celic z mikronukleusi v ozadju. Tako se zagotovi, da je pojavnost celic z mikronukleusi v ozadju nizka in konsistentna. Osnovna pojavnost celic z mikronukleusi se povečuje s starostjo in ta trend je izrazitejši pri ženskah kot pri moških (55). Če se za uporabo zberejo celice več kot enega darovalca, je treba navesti število darovalcev. Prikazati je treba, da so se celice delile od začetka tretiranja s preskusno kemikalijo do njihovega vzorčenja. Celične kulture se vzdržujejo v eksponentni fazi rasti celic (celične linije) ali se stimulira njihova delitev (primarne kulture limfocitov), da se izpostavijo celice v različnih fazah celičnega cikla, saj morda ni znano, kako so posamezne faze celičnega cikla občutljive na preskusne kemikalije. Primarne celice, katerih delitev je treba stimulirati z mitogeni, med izpostavljenostjo preskusni kemikaliji v splošnem niso več sinhronizirane (npr. človeški limfociti po 48-urni stimulaciji z mitogeni). Uporaba sinhroniziranih celic med tretiranjem s preskusno kemikalijo ni priporočljiva, vendar je lahko sprejemljiva, če se utemelji. Gojišča in pogoji kultiviranja Za vzdrževanje kultur je treba uporabiti ustrezno gojišče in pogoje inkubacije (posode za gojenje, vlažno ozračje s 5 % CO2, če je ustrezno, temperatura inkubacije 37 °C). Redno je treba preverjati, ali je modalno kromosomsko število v celičnih linijah stabilno in ali te linije niso okužene z mikoplazmo; celice se ne smejo uporabljati, če so okužene ali če se je spremenilo modalno kromosomsko število. Določiti je treba običajno trajanje celičnega cikla celičnih linij ali primarnih kultur, uporabljenih v preskuševalnem laboratoriju, ki mora biti skladno z objavljenimi lastnostmi celic. Priprava kultur Celične linije: celice se namnožijo iz osnovnih kultur, nasadijo v gojišče tako na gosto, da celice v suspenzijah ali monosloju še naprej eksponentno rastejo do odvzema celic (npr. pri celicah, ki rastejo v monosloju, se je treba izogibati konfluenci). Limfociti: celotna kri, obdelana z antikoagulantom (npr. heparinom), ali ločeni limfociti se dodajo v gojišče (človeški limfociti npr. za 48 ur), ki vsebuje mitogen (za človeške limfocite npr. fitohemaglutinin), da se spodbudi delitev celic pred izpostavitvijo preskusni kemikaliji in citohalazinu B. Presnovna aktivacija Pri uporabi celic z neustrezno notranjo sposobnostjo presnavljanja je treba uporabiti zunanje presnovne sisteme. Najpogosteje uporabljani sistem, ki je priporočen kot privzet, razen če ni utemeljen drug sistem, je s kofaktorjem dopolnjena postmitohondrijska frakcija (S9), pripravljena iz jeter glodalcev (običajno podgan), ki so bila obdelana s sredstvi za encimsko indukcijo, kot je Aroclor 1254 (56) (57), ali z mešanico fenobarbitala in b–naftoflavona (58) (59) (60). Ta mešanica ni v nasprotju s Stockholmsko konvencijo o obstojnih organskih onesnaževalih (61) ter se je v primerjavi s sredstvom Aroclor 1254 izkazala kot enako učinkovita za povzročanje oksidaz z mešano funkcijo (58) (59) (60). Frakcija S9 se v končnem preskusnem gojišču običajno uporablja v koncentracijah, ki se gibljejo v razponu od 1 do 2 vol. %, lahko pa se poveča na 10 vol. %. Med tretiranjem se je treba izogibati kemičnim izdelkom, ki zmanjšujejo mitotični indeks, zlasti snovem, ki tvorijo kalcijev kompleks (62). Na izbiro vrste in koncentracije zunanjega sistema presnovne aktivacije ali sredstva za indukcijo presnove lahko vpliva razred kemikalij, ki se preskušajo. Priprava preskusne kemikalije Trdne preskusne kemikalije je treba pred tretiranjem celic pripraviti v ustreznih topilih in, če je ustrezno, razredčiti. Tekoče preskusne kemikalije se lahko dodajo neposredno v preskusni sistem in/ali razredčijo pred tretiranjem preskusnega sistema. Plinaste ali hlapne preskusne kemikalije je treba preskusiti z ustrezno prilagojenimi standardnimi protokoli, kot je tretiranje v zatesnjenih posodah za gojenje (63) (64) (65). Preskusne kemikalije je treba pripraviti tik pred tretiranjem, razen če podatki o stabilnosti kažejo, da je shranjevanje sprejemljivo. Preskusni pogoji Topila Izbrati je treba tako topilo, ki optimizira topnost preskusnih kemikalij in ne vpliva negativno na izvedbo preskusa, tj. ne spremeni rast celic, ne vpliva na celovitost preskusne kemikalije, ne reagira s posodami za gojenje, ne ovira sistema presnovne aktivacije. Priporočljivo je, da se, kadar koli je to mogoče, najprej razmisli o uporabi vodnega topila (ali gojišča). Zelo uveljavljeni topili sta na primer voda ali dimetil sulfoksid (DMSO). Organska topila v splošnem ne smejo presegati 1 vol. %. Če se citohalazin B raztopi v DMSO, skupna količina organskega topila, ki se uporabi za preskusno kemikalijo in citohalazin B, ne sme presegati 1 vol. %; v nasprotnem primeru je treba uporabiti netretirane kontrole, da se zagotovi, da odstotek organskega topila nima škodljivega učinka. Vodna topila (fiziološka raztopina ali voda) v končnem obdelovalnem gojišču ne smejo presegati 10 vol. %. Če se uporabljajo neuveljavljena topila (npr. etanol ali aceton), je treba njihovo uporabo podpreti s podatki, ki dokazujejo njihovo združljivost s preskusno kemikalijo in preskusnim sistemom ter odsotnost genotoksičnosti pri uporabljeni koncentraciji. Če takšnih podpornih podatkov ni, je treba vključiti netretirane kontrole (glej Dodatek 1) ter kontrole s topilom, ki dokazujejo, da izbrano topilo ne povzroča škodljivih ali kromosomskih učinkov (npr. anevploidije ali klastogenosti). Uporaba citohalazina B kot zaviralca citokineze Eden od najpomembnejših dejavnikov za uspešno izvedbo in vitro preskusa mikronukleusov je zagotavljanje, da se je v celicah, ki se štejejo, med tretiranjem ali v morebitnem obdobju inkubacije po tretiranju zaključila mitoza. Zato mora biti štetje mikronukleusov omejeno na celice, v katerih med tretiranjem ali po njem potekla mitoza. Citohalazin B je snov, ki se najpogosteje uporablja za zaviranje citokineze, saj zavira sestavljanje aktina in tako preprečuje ločevanje hčerinskih celic po mitozi, zaradi česar nastanejo celice z dvema jedroma (6) (66) (67). Kadar se uporabi citohalazin B, se lahko sočasno meri učinek preskusne kemikalije na kinetiko celične proliferacije. Citohalazin B je treba kot zaviralec citokineze uporabljati takrat, ko se uporabljajo človeški limfociti, saj se trajanje celičnih ciklov med različnimi darovalci razlikuje in se vsi limfociti ne odzivajo na stimulacijo s fitohemaglutininom (PHA). Ni pa obvezen za druge vrste celic, če se lahko ugotovi, da je v njih prišlo do delitve, kot je opisano v odstavku 27. Poleg tega se citohalazin B običajno ne uporablja, ko se v vzorcih ocenijo mikronukleusi z uporabo pretočnih citometričnih metod. Laboratorij mora za vsako vrsto celic določiti ustrezno koncentracijo citohalazina B, da se doseže optimalna pogostost celic z dvema jedroma v kontrolnih kulturah s topilom, in dokazati je treba, da nastaja dober prirast celic z dvema jedroma za štetje. Ustrezna koncentracija citohalazina B je običajno od 3 do 6 μg/ml (19). Merjenje celične proliferacije in citotoksičnosti ter izbira koncentracij za tretiranje Pri določanju najvišje koncentracije preskusne kemikalije se je treba izogibati koncentracijam, pri katerih se lahko pojavijo lažni pozitivni odzivi, kot so tisti, ki povzročajo preveliko citotoksičnost (glej odstavek 29), obarjanje v gojiščih (glej odstavek 30) ali znatne spremembe vrednosti pH ali osmolarnosti (glej odstavek 9). Če preskusna kemikalija ob dodajanju povzroči znatno spremembo vrednosti pH v gojišču, se lahko vrednost pH prilagodi z dodajanjem pufra v končno obdelovalno gojišče, da se izogne lažno pozitivnim rezultatom in vzdržujejo ustrezni pogoji kultiviranja. Z meritvami celične proliferacije se zagotovi, da med preskusom poteka mitoza v zadostnem številu tretiranih celic in da se tretiranja izvedejo pri ustreznih ravneh citotoksičnosti (glej odstavek 29). Citotoksičnost je treba določiti v glavnem preskusu s presnovno aktivacijo ali brez nje ter pri tem uporabiti ustrezen kazalnik celične smrti in rasti (glej odstavka 26 in 27). Čeprav je lahko koristno, da se zaradi boljšega določanja koncentracij, ki jih je treba uporabiti v glavnem preskusu, citotoksičnost oceni v začetnem predhodnem preskusu, ta preskus ni obvezen. Če se izvede, ne sme nadomestiti merjenja citotoksičnosti v glavnem preskusu. Tretiranje kultur s citohalazinom B in merjenje relativne pogostosti celic z enim, dvema ali več jedri v kulturi zagotavljata natančno metodo za količinsko opredelitev učinka na proliferacijo celic in citotoksično ali citostatično delovanje tretiranja (6) ter zagotavljata, da so pod mikroskopom preštete samo celice, pri katerih je prišlo do delitve med tretiranjem ali po njem. Za oceno citotoksičnega in citostatičnega delovanja tretiranja je priporočljivo uporabiti proliferacijski indeks citokinetskega bloka (cytokinesis-block proliferation index – CBPI) (6) (27) (68) ali indeks pomnoževanja (Replication Index – RI) vsaj 500 celic na kulturo (glej Dodatek 2 za formule), tako da se primerjajo vrednosti v tretirani in kontrolni kulturi. Z oceno drugih znakov citotoksičnosti (npr. celična neokrnjenost, apoptoza, nekroza, štetje v metafazi, celični cikel) se lahko pridobijo uporabne informacije, vendar se ne sme uporabiti namesto proliferacijskega indeksa citokinetskega bloka ali indeksa pomnoževanja. V študijah brez citohalazina B je treba prikazati, da so se celice v kulturi delile, tako da je v precejšnjem deležu štetih celic prišlo do delitve med tretiranjem s preskusno kemikalijo ali po njem, sicer lahko nastanejo lažno negativni odzivi. Za oceno citotoksičnega in citostatičnega učinkovanja tretiranja se priporoča merjenje relativne podvojitve populacije ali relativnega povečanja števila celic (17) (68) (69) (70) (71) (glej Dodatek 2 za formule). Pri daljših časih izpostavljenosti (npr. tretiranje, ki traja od 1,5 do 2 dolžini normalnega celičnega cikla, in odvzem po dodatnih 1,5 do 2 dolžinah normalnega celičnega cikla, kar vodi do časov vzorčenja, daljših od 3 do 4 dolžine normalnega celičnega cikla skupaj, kot je opisano v odstavkih 38 in 39) se lahko pri relativni podvojitvi populacije vrednost citotoksičnosti podceni (71). V tem primeru je boljše merilo relativno povečanje števila celic ali pa je v pomoč ocena citotoksičnosti po 1,5 do 2 dolžinah normalnega celičnega cikla. Ocena drugih označevalcev citotoksičnosti ali citostaze (npr. celična neokrnjenost, apoptoza, nekroza, štetje v metafazi, indeks proliferacije, celični cikel, nukleoplazmatski mostički in jedrni brsti) lahko zagotovi uporabne dodatne informacije, vendar se ne sme uporabiti namesto proliferacijskega indeksa citokinetskega bloka ali indeksa pomnoževanja. Oceniti je treba vsaj tri preskusne koncentracije (v kar niso vključeni topilo in pozitivne kontrole), ki izpolnjujejo merila za sprejemljivost (ustrezna citotoksičnost, število celic itd.). Ne glede na vrsto celic (celične linije ali primarne kulture limfocitov) se lahko pri vsaki preskušeni koncentraciji tretira ponovitev kulture ali le ena sama kultura. Čeprav je priporočljiva uporaba podvojenih kultur, je sprejemljiva tudi ena sama kultura, če je skupno število celic v eni kulturi ali ponovitvah kulture enako. Uporaba ene kulture je pomembna zlasti takrat, ko se ocenjujejo več kot 3 koncentracije (glej odstavka 44 in 45). Za analizo podatkov se lahko zberejo rezultati, pridobljeni iz neodvisnih ponovitev kulture pri določeni koncentraciji. Za preskusne kemikalije, ki kažejo malo ali nič citotoksičnosti, bodo ustrezni približno 2- do 3-kratni intervali med koncentracijami. V primeru citotoksičnosti morajo izbrane preskusne koncentracije zajemati območje iz navedene nastale citotoksičnosti, kot je opisano v odstavku 29, ter vključevati koncentracije, pri katerih je citotoksičnost zmerna oziroma majhna ali je ni. Pri številnih preskusnih kemikalijah so vidne strme krivulje odziva na koncentracijo, zato je treba za pridobitev podatkov za nizko in zmerno citotoksičnost ali podrobno proučevanje razmerja med odzivom in odmerkom uporabiti večje število koncentracij, ki so tesno skupaj, in/ali več kot tri koncentracije (ena kultura ali ponovitve kulture), zlasti kadar je treba poskus ponoviti (glej odstavek 60). Če največja koncentracija temelji na citotoksičnosti, si je treba pri najvišji koncentraciji prizadevati, da citotoksičnost ne preseže razpona 55 ± 5 %, pri čemer se uporabljajo priporočeni parametri citotoksičnosti (tj. zmanjšanje relativnega povečanja števila celic in relativne podvojitve populacije za celične linije, ko se citohalazin B ne doda, ter zmanjšanje proliferacijskega indeksa citokinetskega bloka ali indeksa pomnoževanja, ko se citohalazin B doda, na razpona 45 ± 5 % sočasne negativne kontrole) (72). Pozitivne rezultate, ki se nahajajo le na višjem koncu tega razpona citotoksičnosti, ki znaša 55 ± 5 %, je treba razlagati previdno (71). Pri slabo topnih preskusnih kemikalijah, ki pri koncentracijah, nižjih od najnižje netopne koncentracije, niso citotoksične, mora najvišja analizirana koncentracija ob koncu tretiranja s preskusno kemikalijo povzročiti nastanek motnosti ali oborine, ki je vidna s prostim očesom ali pod invertnim mikroskopom. Tudi če se citotoksičnost pojavi nad najnižjo netopno koncentracijo, je priporočljivo, da se preskusi le pri eni koncentraciji, ki povzroči nastanek motnosti ali vidne oborine, saj lahko oborina povzroči lažne učinke. Pri koncentraciji, ki povzroči nastanek oborine, je treba paziti, da oborina ne vpliva na izvedbo preskusa (npr. barvanje ali štetje). Koristno je lahko, če se pred preskusom določi topnost v gojišču. Če oborina ni vidna ali ni opažene mejne citotoksičnosti, mora najvišja preskusna koncentracija ustrezati 10 mM, 2 mg/ml ali 2 μl/ml, pri čemer se upošteva najnižja od teh koncentracij (73) (74) (75). Če preskusna kemikalija nima določene sestave, kot so npr. snovi z neznano ali spremenljivo sestavo, kompleksni reakcijski produkti ali biološki materiali (UVCB) (76), okoljski ekstrakt itd., je v primeru odsotnosti ustrezne citotoksičnosti morda treba povečati najvišjo koncentracijo (npr. 5 mg/ml), da bi se povečala koncentracija vsake posamezne sestavine. Vendar je treba opozoriti, da se lahko pri zdravilih za uporabo v humani medicini te zahteve razlikujejo (93). Kontrole V vsak odvzem celic je treba vključiti sočasne negativne kontrole (glej odstavek 21), sestavljene le iz topila v obdelovalnem gojišču, ki je obdelano enako kot kulture za tretiranje. Sočasne pozitivne kontrole so potrebne, da se dokaže zmožnost laboratorija, da odkrije klastogene in anevgene pod pogoji uporabljenega preskusnega protokola, ter učinkovitost zunanjega sistema presnovne aktivacije (če je ustrezno). Primeri pozitivnih kontrol so navedeni v preglednici 1. Za pozitivno kontrolo se lahko uporabijo tudi druge kemikalije, če je to utemeljeno. Trenutno niso znani nobeni anevgeni, ki bi za svojo genotoksično delovanje potrebovali presnovno aktivacijo (17). Ker so preskusi genske toksičnosti in vitro za celice sesalcev dovolj standardizirani za kratkotrajna tretiranja, ki se izvedejo sočasno s presnovno aktivacijo in brez nje ter z enakim trajanjem tretiranja, je uporaba pozitivnih kontrol lahko omejena na klastogen, pri katerem je potrebna presnovna aktivacija. V tem primeru en sam klastogen odziv pri pozitivni kontroli dokaže tako dejavnost metabolnega sistema kot tudi odzivnost preskusnega sistema. Vendar je treba pri dolgotrajnem tretiranju (brez S9) uporabiti lastno pozitivno kontrolo, saj se trajanje tretiranja razlikuje od preskusa, pri katerem se uporablja presnovna aktivacija. Če se pri kratkotrajnem tretiranju s presnovno aktivacijo in brez nje za eno samo pozitivno kontrolo izbere klastogen, je treba pri dolgotrajnem tretiranju brez presnovne aktivacije izbrati anevgen. V celicah, ki so sposobne presnavljanja in ne potrebujejo S9, je treba za klastogenost in anevgenost uporabiti pozitivne kontrole. Vsako pozitivno kontrolo je treba uporabiti pri eni ali več koncentracijah, pri katerih se pričakuje obnovljivo in zaznavno povečanje glede na ozadje, da se dokaže občutljivost preskusnega sistema (kar pomeni, da so učinki jasni, vendar pri odčitavanju ne razkrijejo takoj identitete označenih mikroskopskih preparatov), odziva pa ne sme ogroziti citotoksičnost, ki bi presegla meje, določene za to preskusno metodo. Preglednica 1 Referenčne kemikalije, ki se priporočajo za ocenjevanje usposobljenosti laboratorija in izbor pozitivne kontrole
POSTOPEK Časovni razpored tretiranja Da bi bila verjetnost odkritja anevgenih ali klastogenih snovi, ki delujejo v določeni fazi celičnega cikla, čim večja, mora biti s preskusno kemikalijo tretirano zadostno število celic v vseh fazah njihovih celičnih ciklov. Vsa tretiranja je treba začeti in končati med eksponentno rastjo celic, celice pa morajo do vzorčenja še naprej rasti. Zato se lahko časovni razpored tretiranja za celične linije in primarne celične kulture nekoliko razlikuje od tistega za limfocite, pri katerih je treba začetek celičnega cikla stimulirati z mitogeni (17). Pri limfocitih je najučinkovitejši pristop ta, da se tretiranje s preskusno kemikalijo začne 44 do 48 ur po stimulaciji s fitohemaglutininom, ko se celice delijo asinhrono (6). Iz objavljenih podatkov (19) je razvidno, da se anevgeni in klastogeni odkrijejo s kratkotrajnim tretiranjem, ki traja od 3 do 6 ur v prisotnosti S9 ali brez nje, čemur sledi odstranitev preskusne kemikalije in vzorčenje ob času, ki ustreza približno 1,5 do 2,0 dolžine normalnega celičnega cikla po začetku tretiranja (7). Za temeljito oceno, ki bi bila potrebna za sklep o negativnem rezultatu, je treba izvesti vse tri naslednje preskusne pogoje ter pri tem uporabiti kratkotrajno tretiranje s presnovno aktivacijo in brez nje ter dolgotrajno tretiranje brez presnovne aktivacije (glej odstavke 56, 57 in 58):
Če so pri katerem koli od navedenih preskusnih pogojev rezultati pozitivni, morda ni treba raziskovati nobenih drugih režimov tretiranja. Čas vzorčenja ali obnavljanja se lahko podaljša za nadaljnje 1,5 do 2,0 dolžine normalnega celičnega cikla (tj. skupno trajanje 3,0 do 4,0 dolžine celičnega cikla po začetku kratkotrajnega ali dolgotrajnega tretiranja), če je znano ali se domneva, da preskusna kemikalija vpliva na dolžino celičnega cikla (npr. pri preskušanju nukleozidnih analogov), zlasti za p53-kompetentnih celic (35) (36) (77). Te možnosti so namenjene primerom, kjer se lahko pojavijo pomisleki glede morebitnih interakcij med preskusno kemikalijo in citohalazinom B. Ko se uporabljajo daljši časi vzorčenja (tj. skupaj 3,0 do 4,0 dolžine celičnega cikla časa gojitve), je treba biti pozoren na to, da se celice še vedno dejavno delijo. Pri limfocitih se lahko na primer eksponentna rast po 96 urah po stimulaciji zmanjšuje in monoslojne celične kulture lahko postanejo konfluentne. Priporočeni časovni razporedi tretiranja celic so predstavljeni v preglednici 2. Ti splošni časovni razporedi tretiranja se lahko prilagodijo (ob ustrezni utemeljitvi) glede na stabilnost ali reaktivnost preskusne kemikalije ali določene značilnosti rasti uporabljenih celic. Preglednica 2 Trajanja tretiranja in odvzema celic pri in vitro preskusu mikronukleusov
Pri monoslojnih kulturah so lahko po zaključku tretiranja, ki traja 3 do 6 ur, prisotne mitotične celice (so okrogle in se ločujejo od površine). Ker se te mitotične celice zlahka ločijo, se lahko ob odstranitvi gojišča s preskusno kemikalijo izgubijo. Če obstaja dokaz o znatnem povečanju števila mitotičnih celic v primerjavi s kontrolami, ki kažejo verjetno mitotično zaviranje, potem je treba celice zbrati s centrifugiranjem in jih dodati nazaj h kulturi, da ne bi izgubili celic, pri katerih poteka mitoza in pri katerih ob odvzemu celic obstaja tveganje nastanka mikronukleusov/kromosomske aberacije. Odvzem celic in priprava preparatov Vsako kulturo je treba odvzeti in obdelati ločeno. Priprava celic lahko vključuje hipotonično obdelavo, vendar to ni potrebno, če se ustrezno širjenje celic doseže tudi drugače. Za pripravo preparatov se lahko uporabijo različne tehnike, pod pogojem, da se za štetje pridobijo celični preparati visoke kakovosti. Celice z nedotaknjeno celično membrano in citoplazmo je treba ohraniti, da se omogoči odkrivanje mikronukleusov in (v primeru metode citokinetskega bloka) zanesljiva opredelitev celic z dvema jedroma. Preparati se lahko obarvajo z različnimi metodami, kot so barvila Giemsa ali DNK-specifična fluorescentna barvila. Uporaba ustreznih fluorescentnih barvil (npr. akridin oranž (78) ali Hoechst 33258 plus pyronin-Y (79)) lahko prepreči nastanek nekaterih artefaktov, povezanih z uporabo barvila, ki ni DNK-specifično. Antikinetohorna protitelesa, fluorescentna in situ hibridizacija (FISH) s pancentromernimi DNK-sondami ali primarno označevanje in situ s pancentromerno specifičnimi začetnimi oligonukleotidi, skupaj z ustreznim nasprotnim barvanjem DNK, se lahko uporabijo za opredelitev vsebine (obarvajo se celi kromosomi, acentrični kromosomski delci pa ne) mikronukleusov, če se pridobivajo mehanistični podatki o njihovem nastanku (16) (17). Za razlikovanje med anevgenimi in klastogenimi snovmi se lahko uporabijo druge metode, če so se izkazale kot učinkovite in so validirane. Na primer pri določenih celičnih linijah se lahko pridobijo koristne informacije z meritvijo jedra sub-2N kot hipodiploidnega dogodka s tehnikami, kot so analiza slik, laserska vrstična citometrija ali pretočna citometrija (80) (81) (82). Znaki morebitne anevploidije se lahko odkrijejo tudi z morfološkimi opazovanji jeder. Poleg tega je lahko uporaben način za določitev tega, ali so mikronukleusi posledica pretrganja kromosoma (pri čemer vemo, da se izguba kromosomov pri preskusu kromosomskih aberacij ne bi odkrila), preskus kromosomskih aberacij v metafazi, najbolje ob uporabi iste vrste celic in protokola s primerljivo občutljivostjo. Analiza Vse preparate, vključno s tistimi s kontrolo s topilom, netretiranimi (če se uporabljajo) in pozitivnimi kontrolami, je treba pred mikroskopsko analizo pogostosti mikronukleusov neodvisno označiti. Pri uporabi avtomatiziranega sistema štetja, na primer pretočne citometrije, laserske vrstične citometrije ali analize slike, je treba uporabiti ustrezne tehnike za nadzor kakršnih koli izkrivljanj ali sprememb. Ne glede na to, ali se za štetje mikronukleusov uporablja avtomatizirana platforma, je treba sočasno oceniti proliferacijski indeks citokinetskega bloka, indeks pomnoževanja, relativno podvojitev populacije ali relativno povečanje števila celic. V kulturah, tretiranih s citohalazinom B, je treba pogostost mikronukleusov analizirati v vsaj 2 000 celicah z dvema jedroma na koncentracijo in kontrolo (83), enakomerno porazdeljenimi med ponovljenimi vzorci, če se ti uporabljajo. V primeru ene same kulture na odmerek (glej odstavek 28) je treba v tej eni kulturi šteti vsaj 2 000 celic z dvema jedroma na kulturo (83). Če je za štetje pri vsaki koncentraciji uporabljenih precej manj kot 1 000 celic z dvema jedroma na kulturo (v primeru dveh ponovitev kulture) ali 2 000 celic (v primeru ene same kulture) in če ni ugotovljeno znatno povečanje števila mikronukleusov, je treba preskus ponoviti z več celicami ali z manj citotoksičnimi koncentracijami, kar je ustrezneje. Paziti je treba, da se ne štejejo celice z dvema jedroma, ki so nepravilnih oblik ali pri katerih se velikost jeder zelo razlikuje. Prav tako se celice z dvema jedroma ne smejo zamenjevati s slabo razširjenimi celicami z več jedri. Celice, ki imajo več kot dve glavni jedri, se ne analizirajo glede mikronukleusov, saj je lahko izhodiščna pogostost mikronukleusov v teh celicah večja (84). Štetje celic z enim jedrom je sprejemljivo, če je za preskusno snov znano, da vpliva na delovanje citohalazina B. V takih primerih je koristen ponovljen preskus brez citohalazina B. Uporabne informacije se lahko pridobijo s tem, da se poleg celic z dvema jedroma štejejo tudi celice z enim jedrom (85) (86), vendar to štetje ni obvezno. V celičnih linijah, ki se preskušajo brez tretiranja s citohalazinom B, je treba mikronukleuse šteti v vsaj 2 000 celicah z dvema jedroma na koncentracijo in kontrolo (83), enakomerno porazdeljenimi med ponovljenimi vzorci, če se ti uporabljajo. V primeru uporabe ene kulture na koncentracijo (glej odstavek 28) je treba v tej kulturi v štetje vključiti vsaj 2 000 celic na kulturo. Če je za štetje pri vsaki koncentraciji na voljo znatno manj kot 1 000 celic (v primeru dveh ponovitev kulture) ali 2 000 celic (v primeru ene same kulture) in če ni ugotovljeno znatno povečanje števila mikronukleusov, je treba preskus ponoviti z več celicami ali z manj citotoksičnimi koncentracijami, kar je ustrezneje. Kadar se uporabi citohalazin B, je treba za oceno celične proliferacije določiti proliferacijski indeks citokinetskega bloka ali indeks pomnoževanja (glej Dodatek 2) na podlagi vsaj 500 celic na kulturo. Kadar se tretiranje izvaja v odsotnosti citohalazina B, je treba zagotoviti dokaz, da so se celice v kulturi delile, kot je obravnavano v odstavkih od 24 do 28. Usposobljenost laboratorija Preden se začne laboratorij uporabljati za rutinsko preskušanje, mora izvesti sklop preskusov z referenčnimi pozitivnimi kemikalijami, ki delujejo z različnimi mehanizmi (vsaj enega s presnovno aktivacijo in enega brez nje ter enega, ki deluje z anevgenim mehanizmom, pri čemer so kemikalije izbrane izmed kemikalij iz preglednice 1) ter različnimi negativnimi kontrolami (vključno z netretiranimi kulturami in različnimi topili/vehikli), s čimer dokaže, da ima zadostne izkušnje s preskusom. Ti odzivi pozitivnih in negativnih kontrol morajo biti skladni z viri. To ne velja za laboratorije, ki imajo izkušnje, tj. ki imajo na voljo zbirko podatkov iz preteklih preskusov, kot je opredeljena v odstavkih od 49 do 52. Izbor kemikalij za pozitivno kontrolo (glej preglednico 1) je treba preiskati s kratkotrajnim ali dolgotrajnim tretiranjem brez presnovne aktivacije ter kratkotrajnim tretiranjem ob presnovni aktivaciji, da se dokaže usposobljenost za odkrivanje klastogenih in anevgenih kemikalij, določi učinkovitost sistema presnovne aktivacije ter dokaže ustreznost postopkov štetja (mikroskopska vizualna analiza, pretočna citometrija, laserska vrstična citometrija ali analiza slike). Izbrati je treba območje koncentracij izbranih kemijskih snovi, kar omogoča ponovljiva in s koncentracijo povezana povečanja glede na ozadje, da se pokaže občutljivost in dinamično območje preskusnega sistema. Podatki o kontrolah iz preteklih preskusov Laboratorij mora določiti:
Ko se podatki za porazdelitev negativnih kontrol iz preteklih preskusov pridobivajo prvič, morajo biti sočasne negativne kontrole skladne z objavljenimi podatki o kontrolah, če obstajajo. Ko se k porazdelitvi kontrol dodaja več podatkov o preskusu, sočasne negativne kontrole po možnosti ne bi smele preseči 95-odstotne kontrolne meje za navedeno porazdelitev (87) (88). Zbirka podatkov laboratorija o negativnih kontrolah iz preteklih preskusov mora sprva temeljiti na vsaj 10 preskusih, po možnosti pa mora biti sestavljena iz vsaj 20 preskusov, izvedenih v primerljivih poskusnih pogojih. Laboratoriji morajo uporabljati metode nadzora kakovosti, kot so kontrolne karte (npr. c-karte ali „X-črta“ karte (88)), da opredelijo, kako variabilni so njihovi podatki o pozitivnih in negativnih kontrolah, in pokažejo, da je metodologija v njihovem laboratoriju „pod nadzorom“ (83). Nadaljnja priporočila o načinu oblikovanja in uporabe podatkov iz preteklih preskusov (tj. merila za vključitev podatkov med podatke iz preteklih preskusov in njihovo izključitev iz teh podatkov ter merila za sprejemljivost za zadevni poskus) so navedena v virih (87). Vsako spremembo v protokolu poskusa je treba proučiti glede na skladnost z obstoječimi zbirkami podatkov laboratorija o kontrolah iz preteklih preskusov. Če se pojavijo večje neskladnosti, je treba ustvariti novo zbirko podatkov o kontrolah iz preteklih preskusov. V podatke o negativnih kontrolah je treba vključiti pojav celic z mikronukleusi iz ene kulture ali vsote ponovitev kulture, kot je opisano v odstavku 28. Sočasne negativne kontrole po možnosti ne smejo preseči 95-odstotne kontrolne meje porazdelitve iz zbirke podatkov laboratorija o negativnih kontrolah iz preteklih preskusov (87) (88). Kadar podatki o sočasni negativni kontroli presežejo 95-odstotno kontrolno mejo, jih je sprejemljivo vključiti v porazdelitev kontrol iz preteklih preskusov, če ti podatki niso izjemni osamelci ter če obstaja dokaz, da je preskusni sistem „pod nadzorom“ (glej odstavek 50), in dokaz o odsotnosti tehničnih ali človeških napak. PODATKI IN POROČANJE Predstavitev rezultatov Če se uporabi tehnika citokinetskega bloka, se pri ocenjevanju nastajanja mikronukleusov uporabi samo pogostost celic z dvema jedroma z mikronukleusi (ne glede na število mikronukleusov na celico). O štetju števila celic z enim, dvema ali več jedri se lahko poroča ločeno in s takim štetjem se lahko pridobijo uporabne informacije, vendar ni obvezno. Določiti je treba sočasne meritve citotoksičnosti in/ali citostaze za vse tretirane, pozitivne in negativne kontrolne kulture (16). Pri uporabi metode citokinetskega bloka je treba za vse tretirane in kontrolne kulture izračunati proliferacijski indeks citokinetskega bloka ali indeks pomnoževanja kot merili zakasnitve celičnega cikla. V odsotnosti citohalazina B je treba uporabiti relativno podvojitev populacije ali relativno povečanje števila celic (glej Dodatek 2). Navedejo se podatki za posamezne kulture. Poleg tega se vsi podatki povzamejo v obliki preglednice. Merila za sprejemljivost Sprejemljivost preskusa temelji na naslednjih merilih:
Vrednotenje in razlaga rezultatov Pod pogojem, da so izpolnjena vsa merila za sprejemljivost, se preskusna kemikalija šteje kot jasno pozitivna, če se v katerem koli od proučevanih preskusnih pogojev (glej odstavke od 36 do 39):
Ko so izpolnjena vsa ta merila, se nato šteje, da lahko preskusna kemikalija povzroči prelome kromosomov in/ali pridobitev ali izgubo v tem preskusnem sistemu. Priporočila glede najustreznejših statističnih metod so navedena tudi v virih (90) (91) (92). Pod pogojem, da so izpolnjena vsa merila za sprejemljivost, se preskusna kemikalija šteje za jasno negativno, če se v katerem koli od proučevanih preskusnih pogojev (glej odstavke od 36 do 39):
Nato se šteje, da preskusna kemikalija ne more povzročiti preloma kromosomov in/ali pridobitve ali izgube v tem preskusnem sistemu. Priporočila glede najustreznejših statističnih metod so navedena tudi v virih (90) (91) (92). Preverjanje jasno pozitivnega in jasno negativnega odziva ni potrebno. Če odziv ni niti jasno negativen niti jasno pozitiven, kot je opisano zgoraj, in/ali za podporo pri ugotavljanju biološke pomembnosti rezultatov, je treba podatke oceniti s strokovno presojo in/ali nadaljnjimi preiskavami. Štetje dodatnih celic (po potrebi) ali izvedba ponovitve poskusa je lahko koristna, po možnosti z uporabo spremenjenih preskusnih pogojev (npr. razmik med koncentracijami, drugi pogoji za presnovno aktivacijo [tj. koncentracija ali izvor S9]). Zbirka podatkov v redkih primerih celo po izvedbi nadaljnjih preiskav onemogoča sprejetje sklepa o pozitivnih ali negativnih rezultatih, zato se zaključi, da je odziv dvoumen. Preskusne kemikalije lahko pri in vitro preskusu mikronukleusov povzročijo nastanek mikronukleusov zato, ker povzročajo prelom ali izgubo kromosomov ali pa oboje hkrati. Za ugotovitev, ali je mehanizem za nastajanje mikronukleusov posledica klastogenega in/ali anevgenega delovanja, se lahko izvede nadaljnja analiza z uporabo antikinetohornih protiteles, in situ sond, specifičnih za centromere, ali drugih metod. Poročilo o preskusu V poročilo o preskusu se vključijo naslednji podatki:
VIRI
Dodatek 1 OPREDELITVE POJMOV Anevgen : vsaka kemikalija ali proces, na podlagi katerega pride do anevploidije v celicah ali organizmih zaradi reagiranja z elementi mitotskega in mejoznega cikla delitve celic. Anevplodija : vsako odstopanje od normalnega diploidnega (ali haploidnega) števila kromosomov za en ali več kot en kromosom, vendar ne za celotni set kromosomov (poliploidija). Apoptoza : programirana celična smrt, za katero je značilna vrsta korakov, ki vodijo v razgradnjo celic na delce, obdane z membrano, ki se nato odstranijo s fagocitozo ali osipanjem. Celična proliferacija : povečanje števila celic kot posledica mitotične delitve celic. Centromera : območje kromosoma, ki vsebuje DNK, kjer sta spojeni obe kromatidi in na katerem sta na obeh straneh pritrjeni obe kinetohori. Kemikalija : snov ali zmes. Koncentracije : se nanašajo na končne koncentracije preskusne kemikalije v gojišču. Klastogen : vsaka kemikalija, ki povzroči strukturne kromosomske aberacije v populacijah celic ali evkariotskih organizmih. Citokineza : proces delitve celic, ki nastopi takoj po mitozi in vpliva na oblikovanje dveh hčerinskih celic, ki imata vsaka eno samo jedro. Proliferacijski indeks citokinetskega bloka (Cytokinesis-Block Proliferation index – CPBI) : delež celic, pri katerih se je izvedla druga delitev, v tretirani populaciji glede na netretirano kontrolo (glej Dodatek 2 za formulo). Citostaza : zaviranje rasti celic (glej Dodatek 2 za formulo). Citotoksičnost : Za poskuse, zajete v to preskusno metodo in izvedene v prisotnosti citohalazina B, je citotoksičnost opredeljena kot zmanjšanje proliferacijskega indeksa citokinetskega bloka (CBPI) ali indeksa pomnoževanja pri tretiranih celicah v primerjavi z negativno kontrolo (glej odstavek 26 in Dodatek 2). Za poskuse, zajete v to preskusno metodo in izvedene brez citohalazina B, je citotoksičnost opredeljena kot zmanjšanje relativne podvojitve populacije (RPD) ali relativnega povečanja števila celic (RICC) pri tretiranih celicah v primerjavi z negativno kontrolo (glej odstavek 27 in Dodatek 2). Genotoksiče : splošni pojem, ki zajema vse vrste poškodb DNK ali kromosomov, vključno s prelomi, delecijami, adukti, nukleotidnimi spremembami in povezavami, prerazporeditvami, mutacijami genov, kromosomskimi aberacijami in anevploidijo. Vsi genotoksični učinki ne vplivajo na nastanek mutacij ali trajno poškodbo kromosomov. Celice v interfazi : celice, ki niso v fazi mitoze. Kinetohor : beljakovinska struktura, ki nastane na centromeri kromosoma, na katero se med delitvijo celice pripnejo niti delitvenega vretena, kar omogoča pravilno gibanje hčerinskih kromosomov proti poloma hčerinskih celic. Mikronukleusi : majhna jedra, poleg glavnega jedra celic in ločena od njega, ki nastanejo med telofazo mitoze ali mejoze iz zaostalih fragmentov kromosomov ali celih kromosomov. Mitoza : delitev celičnega jedra, ki je običajno razdeljena na profazo, prometafazo, metafazo, anafazo in telofazo. Mitotični indeks : razmerje med številom celic v metafazi in skupnim številom celic v opazovani populaciji celic; kazalnik stopnje celične proliferacije te populacije. Mutagen : povzroča dedno spremembo zaporedij baznih parov DNK v genih ali strukturi kromosomov (kromosomske aberacije). Nerazdvajanje : par kromatid se ne razdvoji in ustrezno loči v razvijajoče se hčerinske celice, zaradi česar imata hčerinski celici nenormalno število kromosomov. Status beljakovine p53 : beljakovina p53 je vključena v reguliranje celičnega cikla, apoptozo in popravljanje DNK. Celice brez funkcionalne beljakovine p53, ki ne morejo zaustaviti celičnega cikla ali odstraniti poškodovanih celic z apoptozo ali drugimi mehanizmi (npr. indukcijo popravljanja DNK), povezanimi s funkcijami beljakovine p53, s katerimi se ta odzove na poškodbo DNK, so teoretično bolj nagnjene h genskim mutacijam ali kromosomskim aberacijam. Poliploidija : numerične kromosomske aberacije v celicah ali organizmih, ki ne vplivajo na posamezen kromosom ali kromosome (anevploidija), temveč na celoten set kromosomov. Proliferacijski indeks : metoda merjenja citotoksičnosti, ko se citohalazin B ne doda (glej Dodatek 2 za formulo). Relativno povečanje števila celic (RICC) : metoda merjenja citotoksičnosti, ko se citohalazin B ne doda (glej Dodatek 2 za formulo). Relativna podvojitev populacije (RPD) : metoda merjenja citotoksičnosti, ko se citohalazin B ne doda (glej Dodatek 2 za formulo). Indeks pomnoževanja (RI) : razmerje ciklov celične delitve v tretirani kulturi glede na netretirano kulturo med obdobjem izpostavljenosti in obnavljanja (glej Dodatek 2 za formulo). Frakcija S9, pripravljena iz jeter : supernatant iz homogenata jeter po centrifugiranju pri 9 000 g, tj. izvleček surovih jeter. Mešanica S9 : mešanica S9, pripravljene iz jeter, in kofaktorjev, potrebnih za dejavnosti presnovnih encimov. Kontrola s topilom : splošni pojem za opredelitev kontrolnih kultur, ki prejmejo samo topilo, uporabljeno za raztopitev preskusne kemikalije. Preskusna kemikalija : vsaka snov ali zmes, preskušena s to preskusno metodo. Netretirana kontrola : kulture, ki se ne tretirajo (tj. niti s preskusno kemikalijo niti s topilom), temveč se sočasno tretirajo enako kot kulture, v katere se doda preskusna kemikalija. Dodatek 2 FORMULE ZA OCENJEVANJE CITOTOKSIČNOSTI Ko se doda citohalazin B , ocena citotoksičnosti temelji na proliferacijskem indeksu citokinetskega bloka (CBPI) ali indeksu pomnoževanja (RI) (17) (69). CBPI označuje srednje število jeder na celico in se lahko uporabi za izračun celične proliferacije. RI označuje relativno število celičnih ciklov na celico med obdobjem izpostavljenosti citohalazinu B v tretiranih kulturah v primerjavi s kontrolnimi kulturami in se lahko uporabi za izračun % citostaze: % citostaze = 100 – 100{(CBPIT – 1) ÷ (CBPIC – 1)} in
pri čemer je:
Tako je CPBI z vrednostjo 1 (vse celice imajo eno jedro) enak 100-odstotni citostazi. Citostaza = 100 – RI
RI v višini 53 % torej pomeni, da se je v primerjavi s številom celic, ki so se delile v kontrolni kulturi in oblikovale celice z dvema jedroma in več jedri, v tretirani kulturi delilo le 53 % tega števila celic, kar pomeni, da je citostaza 47-odstotna. Ko se citohalazin B ne doda , se priporoča ocena citotoksičnosti na podlagi relativnega povečanja števila celic (RICC) ali relativne podvojitve populacije (RPD) (69), saj se pri obeh metodah upošteva delež celične populacije, ki se je delil.
pri čemer je: podvojitev populacije = [log (število celic po tretiranju ÷ prvotno število celic)] ÷ log 2 RICC ali RPD v višini 53 % torej pomeni, da je citotoksičnost/citostaza 47-odstotna. S proliferacijskim indeksom (PI) se lahko citotoksičnost oceni s štetjem števila klonov, ki imajo eno celico (cl1), dve celici (cl2), tri do štiri celice (cl4) ter pet do osem celic (cl8).
PI se uporablja kot dragocen in zanesljiv parameter citotoksičnosti tudi za celične linije, gojene in vitro v odsotnosti citohalazina B (35) (36) (37) (38), ter se lahko šteje za uporaben dodaten parameter. V vsakem primeru mora biti število celic pred tretiranjem v tretiranih in negativnih kontrolnih kulturah enako. Čeprav se je v preteklosti kot parameter citotoksičnosti uporabljalo relativno število celic (RCC) (tj. število celic v tretiranih kulturah/število celic v kontrolnih kulturah), to ni več priporočljivo, saj lahko podceni vrednost citotoksičnosti. Če se uporablja avtomatiziran sistem štetja, na primer pretočna citometrija, laserska vrstična citometrija ali analiza slike, se lahko število celic v formuli zamenja s številom jeder. V negativnih kontrolnih kulturah mora biti podvojitev populacije ali indeks pomnoževanja združljiv z zahtevo po vzorčenju celic po tretiranju v času, ki ustreza približno 1,5 do 2,0 dolžine normalnega celičnega cikla. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
(15) |
V delu B se dodajo naslednja poglavja: „B.59 Preobčutljivost kože in chemico: neposredni preskus reaktivnosti peptidov (DPRA) UVOD Ta preskusna metoda je enakovredna Smernici za preskušanje OECD (TG) 442C (2015). Povzročitelj preobčutljivosti kože je snov, ki povzroči alergijski odziv po stiku s kožo, kot je opredeljeno v globalno usklajenem sistemu Združenih narodov za razvrščanje in označevanje kemikalij (GHS ZN) (1) ter Uredbi (ES) št. 1272/2008 o razvrščanju, označevanju in pakiranju snovi ter zmesi (uredba CLP) (18). Pri tej preskusni metodi se izvede postopek in chemico (Direct Peptide Reactivity Assay (DPRA) – neposredni preskus reaktivnosti peptidov), ki ga je treba uporabiti v podporo razlikovanju med povzročitelji preobčutljivosti kože in snovmi, ki niso povzročitelji preobčutljivosti kože, v skladu z GHS ZN in uredbo CLP. Obstaja splošno soglasje glede ključnih bioloških dogodkov, ki so osnova za preobčutljivost kože. Obstoječe znanje o kemijskih in bioloških mehanizmih, povezanih s preobčutljivostjo kože, je povzeto v obliki poteka neželenega izida (Adverse Outcome Pathway – AOP) (2) od začetnega dogodka na molekulski ravni prek vmesnih dogodkov do škodljivega učinka, tj. alergijskega kontaktnega dermatitisa pri ljudeh ali kontaktne preobčutljivosti pri glodalcih. Pri poteka neželenega izida preobčutljivosti kože je začetni dogodek na molekulski ravni kovalentna vezava elektrofilnih snovi na nukleofilne centre v beljakovinah kože. Ocena preobčutljivosti kože se je običajno izvajala z uporabo laboratorijskih živali. Pri klasični metodi, ki temelji na morskih prašičkih, tj. Magnusson–Kligmanovem maksimizacijskem preskusu na morskih prašičkih (preskus GMPT) in Buehlerjevem preskusu (PM B.6 (3)), se proučuje preobčutljivost kože v fazah indukcije in elicitacije. Lokalna analiza bezgavk pri miših (Local Lymph Node Assay – LLNA, PM B.42 (4)) in njeni dve neradioaktivni prilagoditvi, tj. LLNA: DA (PM B.50 (5)) in LLNA: BrdU-ELISA (PM B.51 (6)), ki vse ocenjujejo le indukcijski odziv, so bile prav tako sprejete, saj je njihova prednost v primerjavi s preskusi pa morskih prašičkih v tem, da upoštevajo dobrobit živali in zagotavljajo objektivne meritve v fazi indukcije preobčutljivosti kože. Pred kratkim pa sta se kot znanstveno veljavni za ocenjevanje nevarnosti kemikalij za preobčutljivost kože začeli šteti preskusni metodi in chemico ter in vitro, ki temeljita na mehanističnih merilih. Da bi bilo mogoče v celoti nadomestiti testiranja na živalih, ki se trenutno uporabljajo, pa bodo potrebne kombinacije metod, ki se ne izvajajo na živalih (in silico, in chemico, in vitro) v okviru celostnih pristopov k testiranju in ocenjevanju (Integrated Approaches to Testing and Assessment (IATA)), pri čemer se upošteva omejeno mehanistično kritje poteka neželenega izida pri vsaki od trenutno razpoložljivih preskusnih metod, ki se ne izvajajo na živalih (2) (7). Predlagano je, da bi DPRA kot začetni dogodek poteka neželenega izida preobčutljivosti kože na molekulski ravni, tj. reaktivnost beljakovin, obravnaval tako, da bi se reaktivnost preskusnih kemikalij količinsko opredelila glede na vzorčne sintetične peptide, ki vsebujejo lizin ali cistein (8). Odstotne vrednosti izgube peptidov za cistein in lizin se nato uporabijo za razvrstitev snovi v enega od štirih razredov reaktivnosti, s čimer se podpira razlikovanje med povzročitelji preobčutljivosti kože in snovmi, ki niso povzročitelji preobčutljivosti kože (9). Preskus DPRA, ki je bil ocenjen v validacijski študiji pod vodstvom Referenčnega laboratorija Evropske unije za alternative testiranju na živalih (European Union Reference Laboratory for Alternatives to Animal Testing – EURL ECVAM), nato pa še z naknadnim neodvisnim medsebojnim strokovnim pregledom, ki sta ga izvedla EURL ECVAM in Znanstveni svetovalni odbor (ESAC), je bil ocenjen kot znanstveno veljaven (10) za uporabo kot del IATA, da se podpre razlikovanje med povzročitelji preobčutljivosti kože in snovmi, ki niso povzročitelji preobčutljivosti kože, zaradi razvrstitve glede na nevarnosti in označevanje. V virih poročajo o primerih uporabe podatkov iz preskusa DPRA v kombinaciji z drugimi informacijami (11) (12) (13) (14). Opredelitve pojmov so navedene v Dodatku 1. ZAČETNI PREUDARKI, UPORABNOST IN OMEJITVE Korelacija med reaktivnostjo beljakovin in potencialom za povzročanje preobčutljivosti kože je dobro dokazana (15) (16) (17). Vendar ker je vezava na beljakovine le en ključni dogodek, čeprav je začetni dogodek poteka neželenega izida preobčutljivosti kože na molekulski ravni, informacije o reaktivnosti beljakovin, pridobljene s preskusnimi in nepreskusnimi metodami, kot take morda ne zadostujejo za ugotovitev, da kemikalija nima potenciala za povzročanje preobčutljivosti kože. Zato je treba podatke, pridobljene s to preskusno metodo, obravnavati v okviru celostnih pristopov, kot je IATA, in jih združiti z drugimi dopolnilnimi informacijami, ki izhajajo na primer iz poskusov in vitro, s katerimi se obravnavajo drugi ključni dogodki poteka neželenega izida preobčutljivosti kože, ter nepreskusnimi metodami, vključno z navzkrižnim branjem pri podobnih kemijskih snoveh. Ta preskusna metoda se lahko v kombinaciji z drugimi dopolnilnimi informacijami uporabi v podporo razlikovanju med povzročitelji preobčutljivosti kože (tj. kategorija 1 po GHS ZN/uredbi CLP) in snovmi, ki niso povzročitelji preobčutljivosti kože, v okviru IATA. Te preskusne metode ni mogoče uporabiti samostojno niti za razvrstitev povzročiteljev preobčutljivosti kože v podkategoriji 1A in 1B, kot sta opredeljeni v GHS ZN/uredbi CLP, niti za napoved stopnje povzročanja preobčutljivosti v okviru odločanja o oceni varnosti. Vendar pa je, odvisno od regulativnega okvira, pozitiven rezultat pri preskusu DPRA kot tak mogoče uporabiti za razvrstitev kemikalije v kategorijo 1 po GHS ZN/uredbi CLP. Izkazalo se je, da se preskus DPRA lahko prenese v laboratorije, ki imajo izkušnje z analizo tekočinske kromatografije visoke ločljivosti (high-performance liquid chromatography – HPLC). Stopnja ponovljivosti napovedi, ki jo je mogoče pričakovati pri preskusni metodi, je v enem laboratoriju 85-odstotna, v več laboratorijih pa 80-odstotna (10). Rezultati, pridobljeni z validacijsko študijo (18) in objavljenimi študijami (19), na splošno kažejo, da je točnost preskusa DPRA pri razlikovanju povzročiteljev preobčutljivosti (tj. kategorija 1 po GHS ZN/uredbi CLP) in snovi, ki niso povzročitelji preobčutljivosti, 80-odstotna (N = 157), pri čemer je občutljivost v primerjavi z rezultati pri preskusu LLNA 80-odstotna (88/109), specifičnost pa 77-odstotna (37/48). Pri preskusu DPRA je bolj verjetno, da se podceni vrednost kemikalij z nizko do zmerno stopnjo povzročanja preobčutljivosti kože (tj. podkategorija 1B po GHS ZN/uredbi CLP) kot pa kemikalij z visoko stopnjo povzročanja preobčutljivosti kože (tj. podkategorija 1A po GHS ZN/uredbi CLP) (18) (19). Vendar so tukaj navedene vrednosti točnosti za preskus DPRA kot samostojno preskusno metodo zgolj okvirne, saj jo je treba obravnavati skupaj z drugimi viri informacij v okviru IATA in v skladu z določbami odstavka 9. Poleg tega je treba pri ocenjevanju metod za preobčutljivost kože, ki se ne izvajajo na živalih, upoštevati, da preskus LLNA ter druga testiranja na živalih razmer v proučevani vrsti, tj. pri človeku, ne odražajo v celoti. Na podlagi splošno razpoložljivih podatkov se je pokazalo, da se preskus DPRA lahko uporablja za preskusne kemikalije, ki zajemajo različne organske funkcionalne skupine, mehanizme reakcije, stopnjo povzročanja preobčutljivosti kože (kot je določena v študijah in vivo) ter fizikalno-kemijske lastnosti (8) (9) (10) (19). Vse te informacije skupaj kažejo, da preskus DPRA uporabno prispeva k opredelitvi nevarnosti za povzročanje preobčutljivosti kože. Pojem „preskusna kemikalija“ se pri tej preskusni metodi nanaša na to, kar se preskuša, in ni povezan z uporabnostjo preskusa DPRA za preskušanje snovi in/ali zmesi. Ta preskusna metoda se ne uporablja za preskušanje kovinskih spojin, saj je znano, da z beljakovinami reagirajo z mehanizmi, ki niso kovalentna vezava. Preskusna kemikalija mora biti topna v ustreznem topilu v končni koncentraciji 100 mM (glej odstavek 18). Za preskusne kemikalije, ki niso topne pri tej koncentraciji, pa se lahko še vedno preskusi, ali so topne pri nižjih koncentracijah. V takem primeru je s pozitivnim rezultatom še vedno mogoče podpreti opredelitev, da je preskusna kemikalija povzročiteljica preobčutljivosti kože, iz negativnega rezultata pa ni mogoče izpeljati trdnega sklepa o pomanjkanju reaktivnosti. Za zdaj so na voljo omejene informacije o uporabnosti preskusa DPRA za zmesi z znano sestavo (18) (19). Preskus DPRA se kljub temu šteje kot tehnično uporaben za preskušanje snovi z več sestavinami in zmesi z znano sestavo (glej odstavek 18). Preden se ta preskusna metoda uporabi na zmesi, da bi se pridobili podatki za predvideni regulativni namen, je treba proučiti, ali in zakaj lahko zagotovi ustrezne rezultate za navedeni namen. Kadar obstaja regulativna zahteva za preskušanje zmesi, taki premisleki niso potrebni. Sedanjega modela za napovedovanje zaradi določenega molskega razmerja preskusne kemikalije in peptida ni mogoče uporabiti za kompleksne zmesi z neznano sestavo ali snovi z neznano ali spremenljivo sestavo, kompleksne reakcijske produkte ali biološke materiale (npr. snovi UVCB). Za to bo treba razviti nov model za napovedovanje, ki temelji na gravimetričnem pristopu. Kadar se lahko dokaže, da preskusne metode ni mogoče uporabljati za druge posebne kategorije kemikalij, se ta preskusna metoda zanje ne sme uporabiti. Ta preskusna metoda je metoda in chemico, ki ne zajema metabolnega sistema. Z njo ni mogoče zaznati kemikalij, pri katerih je za prikaz njihovega potenciala za povzročanje preobčutljivosti kože potrebna encimska bioaktivacija (tj. pro-haptenov). Poroča se, da se s preskusno metodo v nekaterih primerih pravilno zaznajo kemikalije, ki postanejo povzročiteljice preobčutljivosti kože po abiotski pretvorbi (tj. pre-hapteni) (18). Glede na navedeno je treba negativne rezultate, pridobljene s preskusno metodo, razlagati v okviru navedenih omejitev in v povezavi z drugimi viri informacij v okviru IATA. Pri preskusnih kemikalijah, ki se na peptid ne vežejo kovalentno, temveč spodbujajo njegovo oksidacijo (tj. dimerizacija cisteina), se lahko preceni vrednost izgubljanja peptidov, zaradi česar so možni lažni pozitivni rezultati in/ali razvrstitev v višji razred reaktivnosti (glej odstavka 29 in 30). Kot je navedeno, preskus DPRA podpira razlikovanje med povzročitelji preobčutljivosti kože in snovmi, ki niso povzročitelji preobčutljivosti kože. Kadar se uporablja v celostnih pristopih, kot je IATA, pa lahko prispeva tudi k oceni stopnje povzročanja preobčutljivosti kože (11). Vendar je potrebno nadaljnje delo, ki po možnosti temelji na podatkih za ljudi, da se določi, kako bi se lahko na podlagi rezultatov preskusa DPRA ocenila stopnja povzročanja preobčutljivosti. NAČELO PRESKUSA Preskus DPRA je metoda in chemico, s katero se količinsko opredeli preostala koncentracija peptida, sestavljenega iz cisteina ali lizina, po 24-urni inkubaciji s preskusno kemikalijo pri 25 ± 2,5 °C. Sintetični peptidi vsebujejo fenilalanin, ki pomaga pri odkrivanju. Relativna koncentracija peptidov se meri s tekočinsko kromatografijo visoke ločljivosti (HPLC) z gradientno elucijo in UV-detekcijo pri 220 nm. Nato se izračunajo odstotne vrednosti izgube peptidov, sestavljenih iz cisteina in lizina, ter uporabijo v napovednem modelu (glej odstavek 29), kar omogoča razvrstitev preskusne kemikalije v enega izmed štirih razredov reaktivnosti, s katerimi se podpira razlikovanje med povzročitelji preobčutljivosti in snovmi, ki niso povzročitelji preobčutljivosti. Pred redno uporabo metode, opisane pri tej preskusni metodi, morajo laboratoriji dokazati tehnično usposobljenost, tako da uporabijo deset snovi za preverjanje usposobljenosti, navedenih v Dodatku 2. POSTOPEK Ta preskusna metoda temelji na protokolu DPRA DB-ALM št. 154 (20), tj. protokolu, ki se uporablja v validacijski študiji, ki jo usklajuje EURL ECVAM. Priporočljivo je, da se ta protokol uporablja pri izvajanju in uporabi te metode v laboratoriju. V nadaljevanju so opisani glavni elementi in postopki v preskusu DPRA. V primeru uporabe alternativnega sistema HPLC je treba prikazati, da je enakovreden validiranemu sistemu v protokolu DB-ALM (npr. s preskušanjem snovi za preverjanje usposobljenosti iz Dodatka 2). Priprava peptidov, sestavljenih iz cisteina ali lizina Tik pred inkubacijo s preskusno kemikalijo je treba sveže pripraviti osnovne raztopine cisteina (Ac-RFAACAA-COOH) in lizina (Ac-RFAAKAA-COOH), ki vsebujejo sintetične peptide, katerih stopnja čistosti je višja od 85 % in po možnosti v razponu od 90 do 95 %. Končna koncentracija peptida, sestavljenega iz cisteina, mora biti 0,667 mM v fosfatnem pufru z vrednostjo pH 7,5, končna koncentracija peptida, sestavljenega iz lizina, pa 0,667 mM v pufru amonijevega acetata z vrednostjo pH 10,2. Določiti je treba zaporedje ponovitev HPLC, da analiza HPLC ne traja dlje kot 30 ur. Pri sistemu HPLC, uporabljenem v tej validacijski študiji in opisanem v tej preskusni metodi, je mogoče v eno samo ponovitev HPLC vključiti do 26 vzorcev za analizo (ki vključujejo preskusno kemikalijo, pozitivno kontrolo in ustrezno število kontrol s topilom, in sicer glede na število posameznih topil, uporabljenih v preskusu, pri čemer se vsak preskusi v treh ponovitvah). Pri vseh ponovljenih vzorcih, analiziranih v isti ponovitvi, je treba uporabiti enake osnovne raztopine peptidov, sestavljenih iz cisteina in lizina. Priporočljivo je, da se pred uporabo dokaže ustrezna topnost posameznih serij peptidov. Priprava preskusne kemikalije Pred izvedbo preskusa je treba oceniti topnost preskusne kemikalije v ustreznem topilu po postopku solubilizacije, opisanem v protokolu DPRA DB-ALM (20). Ustrezno topilo povsem raztopi preskusno kemikalijo. Ker je pri preskusu DPRA preskusna kemikalija inkubirana v velikem presežku s peptidi, sestavljenimi iz cisteina ali lizina, vizualni pregled nastajanja jasne raztopine zadostuje, da se ugotovi, ali je preskusna kemikalija (in vse njene sestavine v primeru preskušanja snovi z več sestavinami ali zmesi) raztopljena. Ustrezna topila so acetonitril, voda, zmes vode in acetonitrila v razmerju 1: 1, izopropanol, aceton ali zmes acetona in acetonitrila v razmerju 1: 1. Uporabijo se lahko tudi druga topila, če ne vplivajo na stabilnost peptidov, kar se nadzoruje z referenčnimi kontrolnimi vzorci C (tj. vzorci, sestavljenimi iz zgolj peptidov, raztopljenih v ustreznem topilu; glej Dodatek 3). Če preskusna kemikalija ni topna v nobenem od teh topil, jo je treba kot zadnjo možnost poskusiti raztopiti v 300 μL dimetil sulfoksida (DMSO) in nastalo raztopino razredčiti z 2 700 μL acetonitrila; če preskusna kemikalija ni topna v tej zmesi, je treba poskusiti enako količino preskusne kemikalije raztopiti v 1 500 μL DMSO in nastalo raztopino razredčiti z 1 500 μL acetonitrila. Preskusno kemikalijo je treba vnaprej stehtati v steklenih vialah in tik pred preskušanjem raztopiti z ustreznimi topili, da se pripravi 100 mM raztopina. Za zmesi in snovi z več sestavinami z znano sestavo je treba določiti enotno čistost, tako da se seštejejo deleži njihovih sestavin (razen vode), enotno navidezno molekulsko maso pa je treba določiti tako, da se upoštevajo posamezne molekulske mase vsake sestavine v zmesi (razen vode) in njihova posamezna razmerja. Dobljena čistost in navidezna molekulska masa se nato uporabita pri izračunu teže preskusne kemikalije, ki je potrebna za pripravo 100 mM raztopine. Za polimere, pri katerih prevladujoče molekulske mase ni mogoče določiti, se lahko za pripravo 100 mM raztopine uporabi molekulska masa monomera (ali navidezna molekulska masa različnih monomerov, ki sestavljajo polimer). Pri preskušanju zmesi, snovi z več sestavinami ali polimerov z znano sestavo pa je treba razmisliti tudi o preskušanju čiste kemikalije. Pri tekočinah je treba preskusiti čisto kemikalijo kot tako brez predhodnega razredčenja, tako da se s peptidi, sestavljenimi iz cisteina, inkubira v molskem razmerju 1: 10, s peptidi, sestavljenimi iz lizina, pa v molskem razmerju 1: 50. Pri trdnih snoveh je treba preskusno kemikalijo raztopiti do največje možne topne koncentracije v istem topilu, kot je bilo uporabljeno za pripravo navidezne 100 mM raztopine. Nato jo je treba preskusiti kot tako brez dodatnega razredčenja, tako da se s peptidi, sestavljenimi iz cisteina, inkubira v razmerju 1: 10, s peptidi, sestavljenimi iz lizina, pa v razmerju 1: 50. Na podlagi skladnih rezultatov (reaktivnih ali nereaktivnih) med navidezno 100 mM raztopino in čisto kemikalijo je mogoče zanesljivo sklepati o rezultatu. Priprava pozitivnega kontrolnega vzorca, referenčnih kontrolnih vzorcev in koelucijskih kontrolnih vzorcev Za pozitivni kontrolni vzorec je treba uporabiti cimetov aldehid (št. CAS 104-55-2; s prehransko stopnjo čistosti ≥ 95 %) v koncentraciji 100 mM v acetonitrilu. Uporabijo se lahko tudi drugi primerni pozitivni kontrolni vzorci, ki po možnosti zagotavljajo srednje vrednosti izgubljanja, če so na voljo podatki iz preteklih preskusov za izpeljavo primerljivih meril za sprejemljivost ponovitev. Poleg tega je treba referenčne kontrolne vzorce (tj. vzorce, ki vsebujejo le peptid, raztopljen v ustreznem topilu) vključiti v zaporedja ponovitev HPLC, ki se uporabijo za preverjanje ustreznosti sistema HPLC pred analizo (referenčni kontrolni vzorci A), stabilnosti referenčnih kontrolnih vzorcev v daljšem časovnem obdobju (referenčni kontrolni vzorci B) ter tega, da topilo, uporabljeno za raztopitev preskusne kemikalije, ne vpliva na odstotno vrednost izgube peptidov (referenčni kontrolni vzorci C) (glej Dodatek 3). Z ustreznimi referenčnimi kontrolnimi vzorci za vsako kemikalijo se izračuna odstotna vrednost izgube peptidov za navedeno kemikalijo (glej odstavek 26). Poleg tega je treba v zaporedje ponovitev za vsako od analiziranih preskusnih kemikalij vključiti koelucijski kontrolni vzorec, sestavljen iz preskusne kemikalije same, da se zazna morebitna koelucija preskusne kemikalije s peptidom, sestavljenim iz lizina, ali peptidom, sestavljenim iz cisteina. Inkubacija preskusne kemikalije z raztopinama peptidov, sestavljenih iz cisteina in lizina Raztopino peptida, sestavljenega iz cisteina, je treba inkubirati v steklenih vialah za avtomatski vzorčevalnik s preskusno kemikalijo v razmerju 1: 10, raztopino peptida, sestavljenega iz lizina, pa v razmerju 1: 50. Če je takoj po tem, ko se v raztopino peptida doda raztopina preskusne kemikalije, vidna oborina, ki nastane zaradi slabe topnosti preskusne kemikalije v vodi, ne moremo biti prepričani o tem, koliko preskusne kemikalije je ostalo v raztopini za reagiranje s peptidom. Zato se lahko v takem primeru še vedno uporabi pozitivni rezultat, negativni rezultat pa ni zanesljiv in ga je treba razlagati z ustrezno previdnostjo (glej tudi določbe v odstavku 11 za preskušanje kemikalij, ki do koncentracije 100 mM niso topne). Reakcijsko raztopino je treba pred izvedbo analize HPLC za 24 ur ± 2 uri pustiti v temi pri 25 ± 2,5 °C. Vsako preskusno kemikalijo je treba analizirati v treh ponovitvah za oba peptida. Vzorce je treba pred analizo HPLC vizualno pregledati. Če se opazi oborina ali ločitev faz, se lahko vzorci centrifugirajo pri nizki hitrosti (100–400 x g), da se oborina izloči na dno viale kot previdnosti ukrep, saj lahko velike količine oborine zamašijo cevi ali kolone za HPLC. Če je oborina ali ločitev faz vidna po obdobju inkubacije, je vrednost izgubljanja peptidov morda podcenjena in v primeru negativnega rezultata ni mogoče dovolj zanesljivo sklepati o pomanjkanju reaktivnosti. Priprava standardne umeritvene krivulje za HPLC Za peptide, sestavljene iz cisteina in lizina, je treba izdelati standardno umeritveno krivuljo. Standardno raztopino peptida je treba pripraviti v 20- ali 25-odstotni raztopini acetonitrila in pufra, pri čemer se za peptid, sestavljen iz cisteina, uporabi fosfatni pufer (z vrednostjo pH 7,5), za peptid, sestavljen iz lizina, pa pufer amonijevega acetata (z vrednostjo pH 10,2). Pripraviti je treba 6 raztopin za umerjanje, da se vanje zajame razpon od 0,534 do 0,0167 mM, pri čemer se uporabijo standardi za serije razredčitev osnovne raztopine peptida (0,667 mM). V standardno umeritveno krivuljo je treba vključiti tudi prazen vzorec s pufrom za redčenje. Ustrezne umeritvene krivulje morajo imeti r2 > 0,99. Priprava in analiza HPLC Pred izvedbo analize je treba preveriti ustreznost sistema HPLC. Izguba peptidov se nadzoruje s HPLC, ki je povezana z UV-detektorjem (detektor s serijo fotodiod ali detektor absorbance s fiksno valovno dolžino s signalom 220 nm). V sistem HPLC se vstavi ustrezna kolona. V sistemu HPLC, opisanem v validiranem protokolu, je najbolj priporočljiva uporaba kolone Zorbax SB-C-18 2,1 mm × 100 mm × 3,5 mikrona. Celotni sistem s kolono za HPLC z reverzno fazo je treba vsaj 2 uri pred izvedbo uravnotežiti pri 30 °C s 50 % faze A (0,1 vol. % trifluorocetne kisline v vodi) in 50 % faze B (0,085 vol. % trifluorocetne kisline v acetonitrilu). Analizo HPLC je treba izvesti s pretokom 0,35 ml/min in linearnim gradientom od 10 % do 25 % acetonitrila v 10 minutah, čemur sledi hitro povečanje na 90 % acetonitrila, da se odstranijo ostali materiali. Vbrizgati je treba enake volumne standardne raztopine, vzorca in kontrolnega vzorca. Kolono je treba med vbrizgavanji 7 minut ponovno uravnoteževati v začetnih pogojih. Če se uporabi druga kolona HPLC z reverzno fazo, je treba prilagoditi opisane parametre sistema, da se zagotovi ustrezno eluiranje in združevanje peptidov, sestavljenih iz cisteina in lizina, vključno z injekcijskim volumnom, ki se lahko spreminja glede na uporabljeni sistem (običajno v razponu 3 do 10 μl). Pomembno je, da se v primeru uporabe drugega sistema HPLC prikaže, da je enakovreden opisanemu validiranemu sistemu (npr. s preskušanjem snovi za preverjanje usposobljenosti iz Dodatka 2). Absorbanca se nadzoruje pri 220 nm. Če se uporablja detektor s serijo fotodiod, je treba zabeležiti tudi absorbanco pri 258 nm. Opozoriti je treba, da imajo lahko nekatere pošiljke acetonitrila negativen učinek na stabilnost peptidov, kar je treba oceniti, ko se uporabi nova serija acetonitrila. Kot kazalnik koelucije se lahko uporabi razmerje med površinama vrha pri 220 in 258. Za vsak vzorec je razmerje v razponu 90 % < srednja (19) vrednost razmerja kontrolnih vzorcev < 100 % dober znak, da ni prišlo do koelucije. Obstajajo preskusne kemikalije, ki lahko spodbujajo oksidacijo peptidov, sestavljenih iz cisteina. Vrh dimeriziranih peptidov, sestavljenih iz cisteina, se lahko vizualno nadzoruje. Če se pojavi dimerizacija, je treba to zabeležiti, saj se lahko odstotna vrednost izgube peptidov preceni, kar povzroči lažno pozitivne napovedi in/ali razvrstitev v višji razred reaktivnosti (glej odstavka 29 in 30). Analizo HPLC za peptide, sestavljene iz cisteina in lizina, se lahko izvede na isti (če sta na voljo dva sistema HPLC) ali na drug dan. Če se analiza ne izvede na isti dan, je treba vsak dan sveže pripraviti vse raztopine preskusnih kemikalij za oba preskusa. Pri analizi je treba meriti čas, da se zagotovi, da se vbrizgavanje prvega vzorca začne 22 do 26 ur po tem, ko je bila preskusna kemikalija zmešana z raztopino peptidov. Določiti je treba zaporedje ponovitev HPLC, da analiza HPLC ne traja dlje kot 30 ur. Pri sistemu HPLC, uporabljenem v tej validacijski študiji in opisanem v tej preskusni metodi, je mogoče v eno samo ponovitev HPLC vključiti do 26 vzorcev analize (glej tudi odstavek 17). Primer zaporedja analize HPLC je naveden v Dodatku 3. PODATKI IN POROČANJE Ocenjevanje podatkov Koncentracija peptidov, sestavljenih iz cisteina ali lizina, se v vsakem vzorcu fotometrično določi pri 220 nm tako, da se izmeri površina vrha (površina pod krivuljo – PPK) ustreznih vrhov in izračuna koncentracija peptidov z uporabo linearne umeritvene krivulje, izpeljane iz standardnih raztopin. Odstotna vrednost izgube peptidov se v vsakem vzorcu določi tako, da se izmeri površina vrha, ki se nato deli s srednjo vrednostjo površine vrha ustreznih referenčnih kontrolnih vzorcev C (glej Dodatek 3) v skladu s formulo, navedeno v nadaljevanju.
Merila za sprejemljivost Da se ponovitev šteje za veljavno, morajo biti izpolnjena naslednja merila:
Če eno ali več teh meril ni izpolnjenih, je treba ponovitev izvesti še enkrat. Da se rezultati preskusne kemikalije štejejo za veljavne, morajo biti izpolnjena naslednja merila:
Napovedni model Za vsako preskusno kemikalijo se izračuna srednja odstotna vrednost izgube cisteina in lizina. Negativa izguba se pri izračunu srednje vrednosti šteje kot „0“. Če se uporablja napovedni model v razmerju 1: 10 za cistein in v razmerju 1: 50 za lizin iz preglednice 1, je treba v podporo razlikovanju med povzročitelji preobčutljivosti kože in snovmi, ki niso povzročitelji preobčutljivosti kože, v okviru IATA uporabiti prag v višini 6,38 % srednje izgube peptidov. Uporaba napovednega modela za razvrstitev preskusne kemikalije v enega od razredov reaktivnosti (tj. nizka, zmerna in visoka reaktivnost) se lahko včasih izkaže za uporabno pri oblikovanju ocene moči v okviru IATA. Preglednica 1 Napovedni model v razmerju 1: 10 za cistein/ 1: 50 za lizin (20)
Lahko se pojavijo primeri, ko preskusna kemikalija (snov ali ena ali več sestavin snovi z več sestavinami ali zmesi) pri 220 nm močno absorbira in ima isti retencijski čas kot peptidi (koelucija). Koelucija se lahko odpravi z manjšo prilagoditvijo sistema HPLC, da se nadalje loči elucijski čas preskusne kemikalije in peptidov. Če se poskuša koelucija odpraviti z uporabo drugega sistema HPLC, je treba prikazati, da je enakovreden validiranemu sistemu (npr. s preskušanjem snovi za preverjanje usposobljenosti iz Dodatka 2). Ko pride do koelucije, vrha peptidov ni mogoče vključiti in izračun odstotne vrednosti izgube peptidov ni mogoč. Če pride do koelucije takih preskusnih kemikalij s peptidi, sestavljenimi iz cisteina in lizina, je treba poročati, da je analiza „pomanjkljiva“. Če pride do koelucije le s peptidi, sestavljenimi iz lizina, se lahko uporabi napovedni model v razmerju 1: 10 za cistein, o katerem se poroča v preglednici 2. Preglednica 2 Napovedni model v razmerju 1: 10 za cistein (22)
Obstajajo lahko tudi drugi primeri, pri katerih prihaja do prekrivanja retencijskega časa med preskusno kemikalijo in je kateri koli od peptidov nepopoln. V takih primerih se lahko odstotne vrednosti izgube peptidov ocenijo in uporabijo v napovednem modelu, pri katerem je cistein v razmerju 1: 10, lizin pa v razmerju 1: 50, vendar preskusne kemikalije ni mogoče natančno razvrstiti v enega od razredov reaktivnosti. Kadar je rezultat nedvoumen, za preskusno kemikalijo zadostuje ena sama analiza HPLC za peptide, sestavljene iz cisteina in lizina. Kadar pa so rezultati blizu mejne vrednosti, ki se uporablja za razlikovanje med pozitivnimi in negativnimi rezultati (tj. so rezultati mejni), je potrebno dodatno preskušanje. V primerih, ko se srednja odstotna vrednost izgube pri napovednem modelu, pri katerem je cistein v razmerju 1: 10, lizin pa v razmerju 1: 50, giblje v razponu od 3 % do 10 % ali se odstotne vrednosti izgube cisteina pri modelu za napovedovanje, pri katerem je cistein v razmerju 1: 10, gibljejo v razponu od 9 % do 17 %, je treba razmisliti o drugi ponovitvi, v primeru neskladnih rezultatov med prvima dvema ponovitvama pa tudi o tretji. Poročilo o preskusu V poročilo o preskusu se vključijo naslednji podatki:
VIRI
Dodatek 1 OPREDELITVE POJMOV Točnost : stopnja ujemanja rezultatov preskusne metode s sprejetimi referenčnimi vrednostmi. Je merilo učinkovitosti preskusne metode in eden od vidikov „ustreznosti“. Ta izraz in izraz „skladnost“ se pogosto uporabljata kot sopomenki in pomenita delež pravilnih rezultatov preskusne metode (21). Potek neželenega izida (Adverse Outcome Pathway – AOP) : zaporedje dogodkov od kemijske strukture ciljne kemikalije ali skupine podobnih kemikalij prek začetnega dogodka na molekulski ravni do preiskovanega rezultata in vivo (2). Umeritvena krivulja : razmerje med vrednostjo odziva med preskusom in analitsko koncentracijo (imenovana tudi standardna krivulja) znane snovi. Kemikalija : snov ali zmes. Koeficient variacije : merilo variabilnosti, ki se za skupino podatkov za ponovljene vzorce izračuna tako, da se standardni odklon deli s srednjo vrednostjo. Lahko se pomnoži s 100, da se izrazi v odstotkih. Nevarnost : neločljiva lastnost sredstva ali stanje, ki ob izpostavljenosti temu sredstvu lahko povzroči neželen učinek na organizem, sistem ali (pod)populacijo. IATA (Integrated Approach to Testing and Assessment = celostni pristop k testiranju in ocenjevanju) : strukturiran pristop, ki se uporablja za ugotavljanje nevarnosti (potencial), opredeljevanje nevarnosti (moč) in/ali oceno varnosti (potencial/moč in izpostavljenost) kemikalije ali skupine kemikalij ter strateško zajame in oceni vse pomembne podatke, da se lahko sprejme regulativna odločitev v zvezi z morebitno nevarnostjo in/ali tveganjem in/ali potrebo po nadaljnjem, ciljno usmerjenem in s tem minimalnem preskušanju. Začetni dogodek na molekulski ravni : kemijsko povzročena sprememba biološkega sistema na molekulski ravni, ki se v poteku neželenega izida opredeli kot začetni dogodek. Zmes : zmes ali raztopina iz dveh ali več snovi, ki v njej ne reagirajo (1). Snov iz ene sestavine : snov, ki jo opredeljuje njena kvantitativna sestava in v kateri je vsaj 80 mas. % glavne sestavine. Snov z več sestavinami : snov, ki jo opredeljuje njena kvantitativna sestava in v kateri je več glavnih sestavin s koncentracijo ≥ 10 mas. % in < 80 mas. %. Snov z več sestavinami je rezultat proizvodnega postopka. Razlika med zmesjo in snovjo z več sestavinami je v tem, da je zmes pridobljena z mešanjem dveh ali več snovi brez kemične reakcije. Snov z več sestavinami je rezultat kemične reakcije. Pozitivna kontrola : ponovljen vzorec, ki vsebuje vse sestavine preskusnega sistema in se tretira s snovjo, za katero je znano, da povzroči pozitiven odziv. Za zagotovitev, da se lahko variabilnost odziva pozitivne kontrole oceni v daljšem časovnem obdobju, pa stopnja pozitivnega odziva ne sme biti prevelika. Referenčna kontrola : netretiran vzorec, ki vsebuje vse komponente preskusnega sistema, vključno s topilom ali vehiklom, ki se obdela s kontrolnimi vzorci, tretiranimi s preskusno kemikalijo, in drugimi kontrolnimi vzorci, da se določi izhodiščni odziv za vzorce, tretirane s preskusno kemikalijo, raztopljeno v istem topilu ali vehiklu. Pri preskušanju s sočasno negativno kontrolo ta vzorec tudi pokaže, ali topilo ali vehikel reagira s preskusnim sistemom. Ustreznost : opis razmerja med preskusom in preiskovanim učinkom ter njegovega pomena in uporabnosti za določen namen. Pomeni stopnjo, do katere preskus pravilno izmeri ali napove preiskovani biološki učinek. Ustreznost upošteva tudi točnost (skladnost) preskusne metode (21). Zanesljivost : stopnja obnovljivosti preskusne metode v enem ali več laboratorijih v daljšem časovnem obdobju ob uporabi istega protokola. Oceni se z izračunom obnovljivosti v enem ali več laboratorijih in interne laboratorijske ponovljivosti (21). Obnovljivost : ujemanje rezultatov, pridobljenih s preskušanjem iste kemikalije in uporabo istega preskusnega protokola (glej zanesljivost) (21). Občutljivost : delež vseh pozitivnih/aktivnih kemikalij, ki se s preskusno metodo pravilno razvrstijo. Je merilo točnosti za preskusno metodo, s katero se pridobijo kategorični rezultati, in pomemben dejavnik pri ocenjevanju ustreznosti preskusne metode (21). Specifičnost : delež vseh negativnih/neaktivnih preskusnih kemikalij, ki se s preskusno metodo pravilno razvrstijo. To je merilo točnosti za preskusno metodo, s katero se pridobijo kategorični rezultati, in je pomemben dejavnik pri ocenjevanju ustreznosti preskusne metode. (21). Snov : kemijski elementi in njihove spojine, ki so v naravnem stanju ali pridobljeni s katerim koli proizvodnim postopkom, vključno z vsemi dodatki, potrebnimi za ohranitev stabilnosti produkta, in kakršnimi koli nečistotami, ki so nastale v uporabljenem postopku, vendar brez kakršnega koli topila, ki ga je mogoče ločiti, ne da bi to vplivalo na stabilnost snovi ali spremenilo njeno sestavo (1). Ustreznost sistema : določitev učinkovitosti delovanja instrumenta (npr. občutljivost) z analizo referenčnega standarda pred izvedbo analitske serije (22). Preskusna kemikalija : pojem „preskusna kemikalija“ se uporablja za opisovanje tega, kar se preskuša. Globalno usklajeni sistem Združenih narodov za razvrščanje in označevanje kemikalij (GHS ZN) : sistem za razvrščanje kemikalij (snovi in zmesi) v skladu s standardiziranimi vrstami in stopnjami fizičnih, zdravstvenih in okoljskih nevarnosti ter za obravnavanje ustreznega označevanja, na primer s piktogrami, opozorilnimi besedami, stavki o nevarnosti, previdnostnimi stavki in varnostnimi listi, da bi se razširile informacije o škodljivih učinkih kemikalij ter s tem zaščitili ljudje (vključno z delodajalci, delavci, prevozniki, potrošniki in reševalci) in okolje (1). UVCB : snovi z neznano ali spremenljivo sestavo, kompleksni reakcijski produkti ali biološki materiali. Veljavna preskusna metoda : preskusna metoda, ki se obravnava kot dovolj ustrezna in zanesljiva za določeni namen ter temelji na znanstveno utemeljenih načelih. Preskusna metoda ni nikoli veljavna v absolutnem smislu, ampak samo v zvezi z opredeljenim namenom (21). Dodatek 2 SNOVI ZA PREVERJANJE USPOSOBLJENOSTI Preobčutljivost kože in chemico: neposredni preskus reaktivnosti peptidov (DPRA) Pred redno uporabo te preskusne metode morajo laboratoriji dokazati tehnično usposobljenost tako, da pri preskusu DPRA pridobijo pravilne rezultate napovedi, pričakovane za 10 snovi za preverjanje usposobljenosti, ki so priporočene v preglednici 1, ter da pri vsaj 8 od 10 snovi za preverjanje usposobljenosti pridobijo vrednosti izgube cisteina oziroma lizina v ustreznem referenčnem območju za vsak peptid. Te snovi za preverjanje usposobljenosti so bile izbrane, ker predstavljajo celoten razpon odzivov pri nevarnostih v zvezi s povzročanjem preobčutljivosti kože. Druga merila za izbiro so bila razpoložljivost kemikalij na trgu, razpoložljivost visokokakovostnih referenčnih podatkov in vivo in razpoložljivost visokokakovostnih podatkov in vitro za preskus DPRA ter uporaba v validacijski študiji, ki jo usklajuje EURL ECVAM za prikaz uspešne izvedbe preskusne metode v laboratorijih, ki sodelujejo v študiji. Preglednica 1 Priporočene snovi za dokazovanje tehnične usposobljenosti za neposredni preskus reaktivnosti peptidov
Dodatek 3 PRIMERI POTEKA ANALIZE
B.60 Preobčutljivost kože in vitro: luciferazna preskusna metoda z ARE-Nrf2 UVOD Ta preskusna metoda je enakovredna Smernici za preskušanje OECD (TG) 442D (2015). Povzročitelj preobčutljivosti kože je snov, ki povzroči alergijski odziv po stiku s kožo, kot je opredeljeno v globalno usklajenem sistemu Združenih narodov za razvrščanje in označevanje kemikalij (GHS ZN) (1) ter Uredbi (ES) št. 1272/2008 o razvrščanju, označevanju in pakiranju snovi ter zmesi (uredba CLP) (27). Pri tej preskusni metodi se izvede postopek in vitro (luciferazni preskus z ARE-Nrf2) v podporo razlikovanju med povzročitelji preobčutljivosti kože in snovmi, ki niso povzročitelji preobčutljivosti kože, v skladu z GHS ZN (1) in uredbo CLP. Obstaja splošno soglasje glede ključnih bioloških dogodkov, ki so osnova za preobčutljivost kože. Obstoječe znanje o kemijskih in bioloških mehanizmih, povezanih s preobčutljivostjo kože, je povzeto v obliki poteka neželenega izida (Adverse Outcome Pathway – AOP) (2) od začetnega dogodka na molekulski ravni prek vmesnih dogodkov do škodljivega učinka, tj. alergijskega kontaktnega dermatitisa pri ljudeh ali kontaktne preobčutljivosti pri glodalcih (2) (3). Začetni dogodek na molekulski ravni je kovalentna vezava elektrofilnih snovi na nukleofilne centre v beljakovinah kože. Drugi ključni dogodek v tem poteku neželenega izida se odvija v keratinocitih in vključuje vnetni odziv ter izražanje genov, povezano s posebnimi potmi celičnega signaliziranja, kot so poti, odvisne od odzivnega elementa za antioksidante/elektrofile (ARE). Tretji ključni dogodek je aktivacija dendritskih celic, ki se običajno ocenjujejo z izražanjem posebnih označevalcev celične površine, tj. kemokinov in citokinov. Četrti ključni dogodek je proliferacija celic T, kar se posredno ocenjuje pri lokalni analizi bezgavk pri miših (4). Ocena preobčutljivosti kože se je običajno izvajala z uporabo laboratorijskih živali. Pri klasični metodi, ki temelji na morskih prašičkih, tj. Magnusson–Kligmanovem maksimizacijskem preskusu na morskih prašičkih (preskus GMPT) in Buehlerjevem preskusu (PM B.6 (5)), se proučuje preobčutljivost kože v fazah indukcije in elicitacije. Lokalna analiza bezgavk pri miših (Local Lymph Node Assay – LLNA, PM B.42 (4)) in njeni dve neradioaktivni prilagoditvi, tj. LLNA: DA (PM B.50 (6)) in LLNA: BrdU-ELISA (PM B.51 (7)), ki vse ocenjujejo le indukcijski odziv, so bile prav tako sprejete, saj je njihova prednost v primerjavi s preskusi pa morskih prašičkih v tem, da upoštevajo dobrobit živali in zagotavljajo objektivne meritve v fazi indukcije preobčutljivosti kože. Pred kratkim pa sta se kot znanstveno veljavni za ocenjevanje nevarnosti kemikalij za preobčutljivost kože začeli šteti preskusni metodi in chemico ter in vitro, ki temeljita na mehanističnih merilih. Da bi bilo mogoče v celoti nadomestiti testiranja na živalih, ki se trenutno uporabljajo, pa bodo potrebne kombinacije metod, ki se ne izvajajo na živalih (in silico, in chemico, in vitro) v okviru celostnih pristopov k testiranju in ocenjevanju (Integrated Approaches to Testing and Assessment (IATA)), pri čemer se upošteva omejeno mehanistično kritje poteka neželenega izida pri vsaki od trenutno razpoložljivih preskusnih metod, ki se ne izvajajo na živalih (2) (3). Predlagano je, da bi ta preskusna metoda (luciferazni preskus z ARE-Nrf2) obravnavala drugi ključni dogodek, pojasnjen v odstavku 2. Poročalo se je, da povzročitelji preobčutljivosti kože povzročajo nastanek genov, ki jih urejajo odzivni elementi za antioksidante (ARE) (8) (9). Majhne elektrofilne snovi, kot so povzročitelji preobčutljivosti kože, lahko delujejo kot senzorska beljakovina Keap1 (Kelch-like ECH-associated protein 1), npr. s kovalentno spremembo ostanka cisteina, zaradi česar se disociira od transkripcijskega dejavnika Nrf2 (nuclear factor-erythroid 2-related factor 2 – jedrni dejavnik, povezan z eritroidom 2). Ta disociirani dejavnik Nrf2 lahko nato aktivira gene, odvisne od odzivnih elementov za antioksidante, kot so geni, ki kodirajo razstrupljevalne encime v fazi II (8) (10) (11). Trenutno je edini luciferazni preskus z ARE-Nrf2 in vitro, ki ga zajema ta preskusna metoda, preskus KeratinoSensTM, za katerega so bile izvedene validacijske študije (9) (12) (13), ki jim je sledil neodvisni medsebojni strokovni pregled, ki ga je izvedel Referenčni laboratorij Evropske unije za alternative testiranju na živalih (EURL ECVAM) (14). Preskus KeratinoSensTM se je štel kot znanstveno veljaven za uporabo v okviru IATA v podporo razlikovanju med povzročitelji preobčutljivosti kože in snovmi, ki niso povzročitelji preobčutljivosti kože, zaradi razvrstitve glede na nevarnost in označevanje (14). Laboratoriji, ki so preskusno metodo pripravljeni izvajati, lahko rekombinantno celično linijo, ki se uporablja v preskus KeratinoSensTM, dobijo s sklenitvijo licenčne pogodbe z razvijalcem preskusne metode (15). Opredelitve pojmov so navedene v Dodatku 1. ZAČETNI PREUDARKI, UPORABNOST IN OMEJITVE Ker aktivacija poti Keap1-Nrf2-ARE obravnava le drugi ključni dogodek poteka neželenega izida preobčutljivosti kože, informacije iz preskusnih metod, ki temeljijo na aktivaciji te poti, kot take morda ne zadostujejo za sklep o potencialu kemikalij za povzročanje preobčutljivosti kože. Zato je treba podatke, pridobljene s to preskusno metodo, obravnavati v okviru celostnih pristopov, kot je IATA, in jih združiti z drugimi dopolnilnimi informacijami, ki izhajajo na primer iz poskusov in vitro, s katerimi se obravnavajo drugi ključni dogodki poteka neželenega izida preobčutljivosti kože, ter nepreskusnimi metodami, vključno z navzkrižnim branjem pri podobnih kemijskih snoveh V virih poročajo o tem, kako uporabljati luciferazno preskusno metodo z ARE-Nrf2 v kombinaciji z drugimi informacijami (13) (16) (17) (18) (19). Ta preskusna metoda se lahko uporabi v podporo razlikovanju med povzročitelji preobčutljivosti kože (tj. kategorija 1 po GHS ZN/uredbi CLP) in snovmi, ki niso povzročitelji preobčutljivosti kože, v okviru IATA. Te preskusne metode ni mogoče uporabiti samostojno niti za razvrstitev povzročiteljev preobčutljivosti kože v podkategoriji 1A in 1B, kot sta opredeljeni v GHS ZN/uredbi CLP, niti za napoved stopnje povzročanja preobčutljivosti v okviru odločanja o oceni varnosti. Vendar pa je, odvisno od regulativnega okvira, pozitiven rezultat kot tak mogoče uporabiti za razvrstitev kemikalije v kategorijo 1 po GHS ZN/uredbi CLP. Na podlagi zbirke podatkov iz validacijske študije in preskušanja v laboratoriju, ki se uporablja pri neodvisnem medsebojnem strokovnem pregledu preskusne metode, se je pokazalo, da se lahko preskus KeratinoSensTM prenese v laboratorije, ki imajo izkušnje na področju celičnih kultur. Stopnja ponovljivosti napovedi, ki jo je mogoče pričakovati pri preskusni metodi, je v enem in več laboratorijih 85-odstotna (14). V primerjavi z rezultati analize LLNA so bile točnost (77 % – 155/201), občutljivost (78 % – 71/91) in specifičnost (76 % – 84/110) preskusa KeratinoSensTM za razlikovanje med povzročitelji preobčutljivosti kože (npr. kategorija 1 po GHS ZN/uredbi CLP) in snovmi, ki niso povzročitelji preobčutljivosti kože, izračunane ob upoštevanju vseh podatkov, poslanih EURL ECVAM za oceno in medsebojni strokovni pregled preskusne metode (14). Ti podatki so podobni nedavno objavljenim podatkom, ki temeljijo na preskušanju približno 145 snovi v laboratoriju (pri čemer je točnost 77-odstotna, občutljivost 79-odstotna in specifičnost 72-odstotna) (13). Pri preskusu KeratinoSensTM je bolj verjetno, da se podceni vrednost kemikalij z nizko do zmerno stopnjo povzročanja preobčutljivosti kože (tj. podkategorija 1B po GHS ZN/uredbi CLP) kot pa kemikalij z visoko stopnjo povzročanja preobčutljivosti kože (tj. podkategorija 1A po GHS ZN/uredbi CLP) (13) (14). Vse te informacije skupaj kažejo, da preskus KeratinoSensTM uporabno prispeva k opredelitvi nevarnosti za povzročanje preobčutljivosti kože. Vendar so tukaj navedene vrednosti točnosti za preskus KeratinoSensTM kot samostojno preskusno metodo zgolj okvirne, saj jo je treba obravnavati skupaj z drugimi viri informacij v okviru IATA in v skladu z določbami odstavka 9. Poleg tega je treba pri ocenjevanju metod za preobčutljivost kože, ki se ne izvajajo na živalih, upoštevati, da preskus LLNA ter druga testiranja na živalih razmer v proučevani vrsti, tj. pri človeku, ne izražajo v celoti. Pojem „preskusna kemikalija“ se pri tej preskusni metodi nanaša na to, kar se preskuša, in ni povezan z uporabnostjo luciferazne preskusne metode z ARE-Nrf2 za preskušanje snovi in/ali zmesi. Na podlagi trenutno razpoložljivih podatkov se je pokazalo, da se preskus KeratinoSensTM lahko uporablja za preskusne kemikalije, ki zajemajo različne organske funkcionalne skupine, mehanizme reakcije, stopnjo povzročanja preobčutljivosti kože (kot je določena v študijah in vivo) ter fizikalno-kemijske lastnosti (9) (12) (13) (14). V glavnem so bile preskušene snovi iz ene sestavine, čeprav obstaja omejena količina podatkov o preskušanju zmesi (20). Preskusna metoda je kljub temu tehnično ustrezna tudi za preskušanje snovi z več sestavinami in zmesi. Preden se ta preskusna metoda uporabi na zmesi, da bi se pridobili podatki za predvideni regulativni namen, pa je treba proučiti, ali in zakaj lahko zagotovi ustrezne rezultate za navedeni namen. Kadar obstaja regulativna zahteva za preskušanje zmesi, taki preudarki niso potrebni. Poleg tega je treba pri preskušanju snovi z več sestavinami ali zmesi upoštevati morebitno interferenco citotoksičnih sestavin z opaženimi odzivi. Preskusna metoda se uporablja za preskusne kemikalije, ki so topne ali tvorijo stabilno disperzijo (tj. koloid ali suspenzija, v kateri se preskusna kemikalija ne usede ali loči od topila v različne faze), in sicer v vodi ali DMSO (vključno z vsemi sestavinami preskusne kemikalije v primeru preskušanja snovi z več sestavinami ali zmesi). Preskusne kemikalije, ki ne izpolnjujejo teh pogojev pri najvišji končni zahtevani koncentraciji v višini 2 000 μM (prim. odstavek 22), se lahko še vedno preskusijo pri nižjih koncentracijah. V takem primeru se lahko za opredelitev preskusne kemikalije kot povzročiteljice preobčutljivosti kože še vedno uporabijo rezultati, ki izpolnjujejo merila za pozitivnost, opisana v odstavku 39, medtem ko je treba negativni rezultat, pridobljen pri koncentracijah, manjših od 1 000 μM, obravnavati kot nedokončen (glej napovedni model v odstavku 39). V splošnem so bile uspešno preskušene snovi z logP do 5, medtem ko so bile izredno hidrofobne snovi z logP nad 7 zunaj znane uporabnosti preskusne metode (14). Za snovi, pri katerih se logP giblje v razponu od 5 do 7, so na voljo le omejeni podatki. Negativne rezultate je treba razlagati previdno, saj se lahko s preskusno metodo odkrije, da so snovi, ki so reaktivne izključno z lizinskimi ostanki, negativne. Poleg tega se lahko zaradi omejene presnovne zmogljivosti uporabljene celične linije (21) ter preskusnih pogojev pri pro-haptenih (tj. kemikalijah, ki potrebujejo encimsko aktivacijo, na primer z encimi P450) in pre-haptenih (tj. kemikalijah, aktiviranih z avtooksidacijo), zlasti pri tistih s počasno oksidacijo, pojavijo negativni rezultati. Po drugi strani pa se lahko pri preskusnih kemikalijah, ki ne delujejo kot povzročitelji preobčutljivosti, temveč so vseeno kemični stresorji, pojavijo lažno pozitivni rezultati (14). Močno citotoksičnih preskusnih kemikalij prav tako ni mogoče vedno zanesljivo oceniti. Preskusne kemikalije, ki motijo luciferazne encime, lahko motijo dejavnost luciferaze v preskusih na osnovi celic in povzročajo bodisi očitno zaviranje bodisi povečano luminiscenco (22). Poročalo se je na primer o tem, da koncentracije fitoestrogena, višje od 1 μM, motijo luminiscenčne signale v drugih preskusih na luciferaznem poročevalskem genu zaradi prevelike aktivacije luciferaznega poročevalskega gena (23). Izražanje luciferaze, pridobljeno pri visokih koncentracijah fitoestrogenov ali podobnih kemikalij, ki domnevno povzročajo fitoestrogenu podobno preveliko aktivacijo luciferaznega poročevalskega gena, je treba pazljivo proučiti (23). Kadar se lahko dokaže, da preskusne metode ni mogoče uporabljati za druge specifične kategorije preskusnih kemikalij, se ta preskusna metoda zanje ne sme uporabiti. Poleg tega, da preskus KeratinoSensTM podpira razlikovanje med povzročitelji preobčutljivosti kože in snovmi, ki niso povzročitelji preobčutljivosti kože, zagotavlja tudi podatke o razmerju med koncentracijo in odzivom, ki lahko potencialno prispevajo k oceni stopnje povzročanja preobčutljivosti, kadar se uporabljajo v celostnih pristopih, kot je IATA (19). Vendar je potrebno nadaljnje delo, ki po možnosti temelji na zanesljivih podatkih za ljudi, da se določi, kako bi rezultati preskusa KeratinoSensTM lahko prispevali k oceni stopnje povzročanja preobčutljivosti (24) in razvrstitvi povzročiteljev preobčutljivosti v podkategorije po GHS ZN/uredbi CLP. NAČELO PRESKUSA Pri luciferazni preskusni metodi z ARE-Nrf2 se uporabljajo nesmrtna celična linija, pridobljena iz človeških keratinocitov HaCaT, ki so predmet stabilne transfekcije z izbirnim plazmidom. Celična linija vsebuje luciferazni gen, ki je pod transkripcijsko kontrolo konstitutivnega promotorja, združenega z elementom ARE, iz gena, za katerega je znano, da ga povzročitelji preobčutljivosti kože regulirajo navzgor (25) (26). Iz luciferaznega signala je razvidno, da so ga aktivirali povzročitelji preobčutljivosti endogenih od dejavnika Nrf2 odvisnih genov in da je odvisen od luciferaznega signala v rekombinantni celični liniji na dejavniku Nrf2 (27). To omogoča kvantitativno merjenje (z zaznavanjem luminiscence) indukcije luciferaznega gena, pri čemer se kot kazalniki dejavnosti transkripcijskega dejavnika Nrf2 v celicah, po tem ko so izpostavljene elektrofilnim snovem, uporabijo dobro vzpostavljeni luciferazni substrati, ki oddajajo svetlobo. Šteje se, da so preskusne kemikalije pri preskusu KeratinoSens™ pozitivne, če povzročajo statistično značilno indukcijo luciferazne dejavnosti nad danim pragovno vrednostjo (tj. > 1,5 krat ali 50-odstotno povečanje), pod opredeljeno koncentracijo, ki ne vpliva bistveno na viabilnost celic (tj. pod 1 000 μM in pri koncentraciji, pri kateri je viabilnost celic višja od 70 % (9) (12)). Zato se določi najvišje razmerje indukcije luciferazne dejavnosti v kontroli s topilom (negativni kontroli) (Imax). Ker so celice izpostavljene seriji koncentracij preskusnih kemikalij, je treba koncentracijo, potrebno za statistično značilno indukcijo luciferazne dejavnosti nad pragovno vrednostjo (tj. vrednostjo EC1,5), interpolirati iz krivulje odziva na odmerek (za izračune glej odstavek 32). Nazadnje je treba opraviti vzporedne meritve citotoksičnosti, da se oceni, ali se ravni indukcije luciferazne dejavnosti pojavijo pri subcitotoksičnih koncentracijah. Pred redno uporabo luciferaznega preskusa z ARE-Nrf2, ki izpolnjuje zahteve te preskusne metode, morajo laboratoriji dokazati tehnično usposobljenost, tako da uporabijo deset snovi za preverjanje usposobljenosti, navedenih v Dodatku 2. Standardi izvajanja (SI) (28), ki so na voljo, omogočajo poenostavitev validacije novih ali prilagojenih luciferaznih preskusnih metod z ARE-Nrf2 in vitro, ki so podobne preskusu KeratinoSensTM, ter pravočasno spremembo te preskusne metode za njihovo vključitev. Medsebojno priznavanje podatkov v skladu s sporazumom OECD bo zagotovljeno le za preskusne metode, validirane v skladu z SI, če je te preskusne metode pregledala OECD in jih vključila v ustrezno preskusno smernico. POSTOPEK Trenutno je edina metoda, ki jo zajema ta preskusna metoda, znanstveno veljavni preskus KeratinoSensTM (9) (12) (13) (14). Na voljo so standardni delovni postopki za preskus KeratinoSensTM, ki jih je treba uporabljati pri izvajanju in uporabi preskusne metode v laboratoriju (15). Laboratoriji, ki želijo izvajati to preskusno metodo, lahko rekombinantno celično linijo, ki se uporablja pri preskusu KeratinoSensTM, dobijo s sklenitvijo licenčne pogodbe z razvijalcem preskusne metode. V naslednjih odstavkih so opisani glavne sestavine in postopki luciferazne preskusne metode z ARE-Nrf2. Priprava keratinocitnih kultur Uporabiti je treba transgensko celično linijo s stabilno vstavitvijo luciferaznega poročevalskega gena pod kontrolo elementa ARE (npr. celično linijo KeratinoSensTM). Celice se po prejemu namnožijo (npr. 2 do 4 pasaže) in shranijo zamrznjene kot homogena zaloga. Celice iz originalne zaloge se lahko namnožijo do največjega števila pasaž (npr. 25 v primeru KeratinoSensTM) in se uporabijo pri rednem preskušanju z uporabo ustreznega vzdrževalnega gojišča (v primeru KeratinoSensTM to pomeni DMEM, ki vsebuje serum in Geneticin). Za preskušanje mora biti konfluenca celic 80–90-odstotna in zagotoviti je treba, da se celice nikoli ne gojijo do popolne konfluence. Celice je treba odvzeti en dan pred preskušanjem in razdeliti v 96-jamične mikrotitrske plošče (10 000 celic na jamico v primeru KeratinoSensTM). Pozornost je treba posvetiti temu, da se med nasaditvijo izognemo sedimentaciji celic, tako da je število celic homogeno porazdeljeno med jamicami. V nasprotnem primeru lahko pri tem koraku nastane visoka variabilnost med posameznimi celicami. Pri vsaki ponovitvi se za meritev luciferazne dejavnosti uporabijo trije ponovljeni vzorci ter en vzporeden ponovljen vzorec za preskus viabilnosti celic. Priprava preskusne kemikalije in kontrolnih snovi Preskusna kemikalija in kontrolne snovi se pripravijo na dan preskusa. Za preskus KeratinoSensTM se preskusne kemikalije raztopijo v dimetil sulfoksidu (DMSO) do končne želene koncentracije (npr. 200 mM). Za raztopine DMSO se lahko šteje, da se same sterilizirajo, zato sterilna filtracija ni potrebna. Preskusna kemikalija, ki ni topna v DMSO, se raztopi v sterilni vodi ali gojišču, raztopine pa se sterilizirajo, npr. s filtracijo. Za preskusne kemikalije brez določene molekulske mase (MM) se pripravi osnovna raztopina do privzete koncentracije (40 mg/ml ali 4 % (m/v)) v preskusu KeratinoSensTM. Če se uporabljajo druga topila kot DMSO, voda ali gojišče, jih je treba zadostno znanstveno utemeljiti. Iz osnovnih raztopin preskusne kemikalije v DMSO se pripravijo zaporedne razredčitve, pri čemer se uporabi DMSO, da se pridobi 12 izhodiščnih koncentracij kemikalije, ki se preskuša (od 0,098 do 200 mM v preskusu KeratinoSensTM). Pri preskusnih kemikalijah, ki niso topne v DMSO, se razredčine za pridobitev izhodiščnih koncentracij pripravijo s sterilno vodo ali sterilnim gojiščem. Izhodiščne koncentracije se neodvisno od uporabljenega topila nato nadalje 25-kratno razredčijo v gojišču, ki vsebuje serum, nazadnje pa končno uporabijo za tretiranje z nadaljnjim 4-kratnim faktorjem razredčenja, tako da se v preskusu KeratinoSensTM končne koncentracije preskušene kemikalije gibljejo v razponu od 0,98 do 2 000 μM. Če se uporabljajo druge koncentracije, jih je treba utemeljiti (npr. v primeru citotoksičnosti ali slabe topnosti). Negativna kontrola (kontrola s topilom), uporabljena pri preskusu KeratinoSensTM, je DMSO (št. CAS 67-68-5, s čistostjo ≥ 99 %) in zanjo se pripravi šest jamic na pladenj. Ta kontrola se razredči tako kot izhodiščne koncentracije, kar je opisano v odstavku 22, tako da je končna koncentracija negativne kontrole (kontrole s topilom), za katero je znano, da ne vpliva na viabilnost celic, ter ki ustreza enaki koncentraciji DMSO, najdeni v preskusni kemikaliji in pozitivni kontroli, enaka 1 %. Za preskusno kemikalijo, ki ni topna v DMSO, za katero so bile pripravljene razredčitve v vodi, je treba stopnjo DMSO v končni preskusni raztopini prilagoditi na 1 %, kot pri ostalih preskusnih kemikalijah in kontrolnih snoveh. Pozitivna kontrola, uporabljena v primeru preskusa KeratinoSensTM, je cimetov aldehid (št. CAS 14371-10-9, s čistostjo ≥ 98 %) in zanjo se pripravi sklop 5 izhodiščnih koncentracij, ki se gibljejo v razponu od 0,4 do 6,4 mM, v DMSO (iz 6,4 mM osnovne raztopine), ki se razredčijo, kot je za izhodiščne koncentracije opisano v odstavku 22, tako da se končna koncentracija pozitivne kontrole giblje v razponu od 4 do 64 μM. Če so na voljo podatki iz preteklih preskusov za pridobitev primerljivih meril za sprejemljivost ponovitev, se lahko uporabijo druge ustrezne pozitivne kontrole, s katerimi se po možnosti zagotavljajo vrednosti EC1,5 v sredini območja. Nanos preskusne kemikalije in kontrolnih snovi Za vsako preskusno kemikalijo in pozitivno kontrolno snov je potreben en poskus za izpeljavo napovedi (pozitivne ali negativne), ki mora biti sestavljen iz vsaj dveh neodvisnih ponovitev, ki vsebujeta vsaka po tri ponovljene vzorce (tj. n = 6). Če rezultati dveh neodvisnih ponovitev niso skladni, je treba izvesti tretjo ponovitev, ki vsebuje tri ponovljene vzorce (tj. n = 9). Vsaka neodvisna ponovitev se izvede na drug dan s svežo osnovno raztopino preskusnih kemikalij in neodvisno odvzetimi celicami. Vendar lahko celice izhajajo iz iste pasaže. Po nasaditvi, kot je opisano v odstavku 20, se celice gojijo 24 ur v 96-jamičnih mikrotitrskih ploščah. Medij se nato odstrani in zamenja s svežim gojiščem (150 μl gojišča, ki vsebuje serum, vendar v primeru KeratinoSensTM brez Geneticina), v katerega se doda 50 μl 25-kratno razredčene preskusne kemikalije in kontrolnih snovi. Vsaj eno jamico na pladenj je treba pustiti prazno (brez celic in obdelave) zaradi ocene vrednosti v ozadju. Obdelani pladnji se nato v preskusu KeratinoSensTM inkubirajo za približno 48 ur pri 37 ± 1 °C v prisotnosti 5 % CO2. Paziti je treba, da hlapne preskusne kemikalije ne izhlapijo in da ne pride do navzkrižne kontaminacije med jamicami s preskusno kemikalijo, npr. s prekrivanjem pladnjev s folijo pred inkubacijo s preskusnimi kemikalijami. Meritve luciferazne dejavnosti Pri zagotavljanju ustreznih odčitavanj luminiscence so ključni trije dejavniki:
Pred preskušanjem je treba izvesti poskusni kontrolni sistem, kot je opisano v Dodatku 3, s čimer se zagotovi, da so izpolnjene te tri točke. Celice se po 48-urni izpostavljenosti preskusni kemikaliji in kontrolnim snovem v preskusu KeratinoSensTM sperejo s fosfatnim pufrom s soljo, v vsako jamico pa se za 20 min pri sobni temperaturi doda ustrezni lizni pufer za odčitavanje luminiscence. Pladnji s celičnim lizatom se nato vstavijo v luminometer za odčitavanje, ki je v preskusu KeratinoSensTM programiran tako, da (i) se v vsako jamico doda luciferazni substrat (tj. 50 μl), (ii) počaka 1 sekundo in (iii) za 2 sekundi vključi luciferazna dejavnost. Če se uporabijo drugačne nastavitve, npr. glede na uporabljeni model luminometra, jih je treba utemeljiti. Poleg tega se lahko uporabi tudi substrat, ki oddaja svetlobo, če je poskus za nadzor kakovosti iz Dodatka 3 uspešno izveden. Ocena citotoksičnosti Pri preskusu viabilnosti celic KeratinoSensTM se medij po 48-urni izpostavljenosti zamenja s svežim medijem, ki vsebuje MTT (3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazol bromid, tiazolil modro tetrazol bromid, št. CAS 298-93-1), celice pa se za 4 ure inkubirajo pri 37 °C v prisotnosti 5 % CO2. Medij MTT se nato odstrani in celice se čez noč lizirajo (npr. z dodatkom 10-odstotne raztopine natrijevega dodecil sulfata (SDS) v vsako jamico). Po stresanju se s fotometrom izmeri absorpcija pri 600 nm. PODATKI IN POROČANJE Ocenjevanje podatkov Pri preskusu KeratinoSensTM se izračunajo naslednji parametri:
Enačba 1:
pri čemer je:
Vrednost EC1,5 se v skladu z enačbo 2 izračuna z linearno interpolacijo, skupna vrednost EC1,5 pa se izračuna kot geometrijska sredina posameznih ponovitev. Enačba 2:
pri čemer je:
Viabilnost se izračuna z enačbo 3: Enačba 3:
pri čemer je:
Vrednosti IC50 in IC30 se izračunata z linearno interpolacijo v skladu z enačbo 4, skupni vrednosti IC50 in IC30 pa se izračunata kot geometrijska sredina posameznih ponovitev. Enačba 4:
pri čemer je:
Pri vsaki koncentraciji, pri kateri se pokaže razmerje indukcije luciferazne dejavnosti > 1,5, se izračuna statistična značilnost (npr. z dvodelnim Studentovim t-testom), pri čemer se primerjajo vrednosti luminiscence za tri ponovljene vzorce z vrednostmi luminiscence v jamicah s kontrolo s topilom (negativna kontrola), da se določi, ali je indukcija luciferazne dejavnosti statistično značilna (p < 0,05). Najnižja koncentracija z razmerjem indukcije luciferazne dejavnosti > 1,5 je vrednost, ki določa vrednost EC1,5. V vsakem primeru se preveri, ali je ta vrednost nižja od vrednosti IC30, kar pomeni manj kot 30-odstotno zmanjšanje viabilnosti celic pri koncentraciji, s katero se določa EC1,5. Priporočeno je, da se podatki vizualno pregledajo z grafi. Če ni opaziti jasne krivulje odziva na odmerek ali če je krivulja odziva na odmerek bifazna (kar pomeni, da dvakrat prečka mejno vrednost 1,5), je treba poskus ponoviti, da se preveri, ali je to specifično za preskusno kemikalijo ali posledica poskusnega artefakta. Če je bifazni odziv mogoče ponoviti v neodvisnem poskusu, je treba poročati o nižji vrednosti EC1,5 (koncentracija, pri kateri je mejna vrednost 1,5 presežena prvič). V redkih primerih, ko je opaziti statistično neznačilno razmerje indukcije nad 1,5, ki ji sledi višja koncentracija s statistično značilno indukcijo, se rezultati iz te ponovitve štejejo kot veljavni in pozitivni le, če je bilo za necitotoksično koncentracijo pridobljeno statistično značilno razmerje indukcije nad pragovno vrednostjo 1,5. Pri preskusnih kemikalijah, pri katerih se že pri najnižji preskusni koncentraciji, ki je 0,98 μM, ustvari razmerje indukcije v višini 1,5 ali več, se vrednost EC1,5 < 0,98 določi na podlagi vizualnega pregleda krivulje odziva na odmerek. Merila za sprejemljivost Pri uporabi preskusa KeratinoSensTM morajo biti izpolnjena naslednja merila za sprejemljivost. Indukcija luciferazne dejavnosti, pridobljena s pozitivno kontrolo, tj. cimetovim aldehidom, mora v vsaj eni od preskušenih koncentracij (od 4 do 64 μM) statistično značilno presegati pragovno vrednost v višini 1,5 (npr. z uporabo t-preskusa). Vrednost EC1,5 mora biti znotraj dveh standardnih odklonov srednje vrednosti preskusnega laboratorija iz preteklih preskusov (tj. med 7 μM in 30 μM na podlagi validacijske zbirke podatkov), ki jo je treba redno posodabljati. Poleg tega se mora povprečna indukcija treh ponovljenih vzorcev s cimetovim aldehidom pri 64 μM gibati v razponu od 2 do 8. Če slednje merilo ni izpolnjeno, je treba pazljivo preveriti razmerje med odmerkom in odzivom cimetovega aldehida, preskusi pa so sprejemljivi le, če obstaja jasno razmerje med odmerkom in odzivom z naraščajočo indukcijo luciferazne dejavnosti pri večjih koncentracijah za pozitivno kontrolo. Povprečni koeficient variacije odčitkov luminiscence za negativno kontrolo (kontrolo s topilom) v DMSO ne sme presegati 20 % pri vsaki ponovitvi, ki je sestavljena iz 6 jamic, preskušenih v treh ponovitvah. Če je variabilnost višja, je treba rezultate zavreči. Razlaga rezultatov in napovedni model Napoved KeratinoSensTM se obravnava kot pozitivna, če so izpolnjeni vsi naslednji štirje pogoji v dveh od dveh ponovitev ali v enakih dveh od treh ponovitev, v nasprotnem primeru se napoved KeratinoSensTM obravnava kot negativna (slika 1):
Če so v dani ponovitvi izpolnjeni vsi prvi trije pogoji, ni pa mogoče ugotoviti jasnega odziva na odmerek za indukcijo luciferaze, je treba rezultat te ponovitve obravnavati kot nedokončen in morda bodo potrebni nadaljnji preskusi (slika 1). Poleg tega je treba kot nedokončnega obravnavati tudi negativen rezultat, pridobljen s koncentracijami < 1 000 μM (ali < 200 μg/ml za preskusne kemikalije brez opredeljene molekulske mase) (glej odstavek 11). Slika 1 Napovedni model, uporabljen v preskus KeratinoSensTM. Napoved KeratinoSensTM je treba obravnavati v okviru IATA ter v skladu z določbami iz odstavkov 9 in 11.
V redkih primerih so lahko preskusne kemikalije, ki povzročijo dejavnost luciferaze zelo blizu citotoksičnih ravni, pozitivne v nekaterih ponovitvah na necitotoksičnih ravneh (tj. koncentracija za določanje EC1,5 je nižja od (<) IC30), v drugih ponovitvah pa samo na citotoksičnih ravneh (tj. koncentracija za določanje EC1,5 je višja od (>) IC30). Take preskusne kemikalije je treba ponovno preskusiti z ožjo analizo odziva na odmerek, pri čemer se uporabi nižji faktor razredčenja (npr. 1,33- ali Ö2 (= 1,41)-kratno razredčenje med jamicami), da se ugotovi, ali je do indukcije prišlo na citotoksičnih ravneh ali ne (9). Poročilo o preskusu V poročilo o preskusu se vključijo naslednji podatki:
VIRI
Dodatek 1 OPREDELITVE POJMOV Točnost : stopnja ujemanja rezultatov preskusne metode s sprejetimi referenčnimi vrednostmi. Je merilo učinkovitosti preskusne metode in eden od vidikov „ustreznosti“. Ta izraz in izraz „skladnost“ se pogosto uporabljata kot sopomenki in pomenita delež pravilnih rezultatov preskusne metode (29). Potek neželenega izida (Adverse Outcome Pathway – AOP) : zaporedje dogodkov od kemijske strukture ciljne kemikalije ali skupine podobnih kemikalij prek začetnega dogodka na molekulski ravni do preiskovanega rezultata in vivo (2). ARE (element antioksidativnega odziva – antioxidant response element) : (imenuje se tudi EpRE oziroma element elektrofilnega odziva) je element odziva v zgornji promotorski regiji mnogih genov za zaščito celic in genov faze II. Ko se aktivira z Nfr2, posreduje v transkripcijski indukciji teh genov. Kemikalija : snov ali zmes. Koeficient variacije : merilo variabilnosti, ki se za skupino podatkov za ponovljene vzorce izračuna tako, da se standardni odklon deli s srednjo vrednostjo. Lahko se pomnoži s 100, da se izrazi v odstotkih. EC1.5 : interpolirana koncentracija za 1,5-kratno indukcijo luciferaze. IC30 : koncentracija, ki vpliva na zmanjšanje viabilnosti celic za 30 %. IC50 : koncentracija, ki vpliva na zmanjšanje viabilnosti celic za 50 %. Nevarnost : neločljiva lastnost sredstva ali stanje, ki ob izpostavljenosti temu sredstvu lahko povzroči neželen učinek na organizem, sistem ali (pod)populacijo. IATA (Integrated Approach to Testing and Assessment = celostni pristop k testiranju in ocenjevanju) : strukturiran pristop, ki se uporablja za ugotavljanje nevarnosti (potencial), opredeljevanje nevarnosti (moč) in/ali oceno varnosti (potencial/moč in izpostavljenost) kemikalije ali skupine kemikalij ter strateško zajame in oceni vse pomembne podatke, da se lahko sprejme regulativna odločitev v zvezi z morebitno nevarnostjo in/ali tveganjem in/ali potrebo po nadaljnjem, ciljno usmerjenem in s tem minimalnem preskušanju. Imax : največji faktor indukcije luciferazne dejavnosti v primerjavi s kontrolnim vzorcem s topilom (negativno kontrolo), ki se meri za vse koncentracije preskusnih kemikalij. Keap1 : „Kelch-like ECH-associated protein 1“ je senzorska beljakovina, ki lahko uravnava dejavnost Nrf2. V neinduciranih pogojih je senzorska beljakovina Keap1 ciljno usmerjena v transkripcijski dejavnik Nrf2 za ubikvitinacijo in proteolitsko razgradnjo v proteasomu. Kovalentna modifikacija reaktivnih cisteinskih ostankov beljakovine Keap1 z majhnimi molekulami lahko povzroči disociacijo Nrf2 od beljakovine Keap1 (8) (10) (11). Zmes : zmes ali raztopina iz dveh ali več snovi, ki v njej ne reagirajo (1). Snov iz ene sestavine : snov, ki jo opredeljuje njena kvantitativna sestava in v kateri je vsaj 80 mas. % glavne sestavine. Snov z več sestavinami : snov, ki jo opredeljuje njena kvantitativna sestava in v kateri je več glavnih sestavin s koncentracijo ≥ 10 mas. % in < 80 mas. %. Snov z več sestavinami je rezultat proizvodnega postopka. Razlika med zmesjo in snovjo z več sestavinami je v tem, da je zmes pridobljena z mešanjem dveh ali več snovi brez kemične reakcije. Snov z več sestavinami je rezultat kemične reakcije. Nrf2 : jedrni faktor (izpeljan iz eritroblasta 2)-kot 2 je transkripcijski dejavnik, ki sodeluje pri poteku antioksidativnega odziva. Ko Nrf2 ni ubikvitiniran, se nakopiči v citoplazmi in premakne v jedro, kjer se združi z ARE v zgornji promotorski regiji mnogih genov za zaščito celic ter s tem začne njihovo transkripcijo (8) (10) (11). Pozitivna kontrola : ponovljen vzorec, ki vsebuje vse sestavine preskusnega sistema in se tretira s snovjo, za katero je znano, da povzroči pozitiven odziv. Za zagotovitev, da se lahko variabilnost odziva pozitivne kontrole oceni v daljšem časovnem obdobju, pa stopnja pozitivnega odziva ne sme biti prevelika. Ustreznost : opis razmerja med preskusom in preiskovanim učinkom ter njegovega pomena in uporabnosti za določen namen. Pomeni stopnjo, do katere preskus pravilno izmeri ali napove preiskovani biološki učinek. Ustreznost upošteva tudi točnost (skladnost) preskusne metode (29). Zanesljivost : stopnja obnovljivosti preskusne metode v enem ali več laboratorijih v daljšem časovnem obdobju ob uporabi istega protokola. Oceni se z izračunom obnovljivosti v enem ali več laboratorijih in interne laboratorijske ponovljivosti (29). Obnovljivost : ujemanje rezultatov, pridobljenih s preskušanjem iste kemikalije in uporabo istega preskusnega protokola (glej zanesljivost) (29). Občutljivost : delež vseh pozitivnih/aktivnih kemikalij, ki se s preskusno metodo pravilno razvrstijo. Je merilo točnosti za preskusno metodo, s katero se pridobijo kategorični rezultati, in pomemben dejavnik pri ocenjevanju ustreznosti preskusne metode (29). Kontrola s topilom/vehiklom : ponovljen vzorec, ki vsebuje vse komponente preskusnega sistema razen preskusne kemikalije, vključuje pa topilo, ki se uporabi. Uporablja se za določanje izhodiščnega odziva za vzorce, tretirane s preskusno kemikalijo, raztopljeno v istem topilu. Specifičnost : delež vseh negativnih/neaktivnih kemikalij, ki se s preskusno metodo pravilno razvrstijo. To je merilo točnosti za preskusno metodo, s katero se pridobijo kategorični rezultati, in je pomemben dejavnik pri ocenjevanju ustreznosti preskusne metode (29). Snov : kemijski elementi in njihove spojine, ki so v naravnem stanju ali pridobljeni s katerim koli proizvodnim postopkom, vključno z vsemi dodatki, potrebnimi za ohranitev stabilnosti produkta, in kakršnimi koli nečistotami, ki so nastale v uporabljenem postopku, vendar brez kakršnega koli topila, ki ga je mogoče ločiti, ne da bi to vplivalo na stabilnost snovi ali spremenilo njeno sestavo (1). Preskusna kemikalija : pojem „preskusna kemikalija“ se uporablja za opisovanje tega, kar se preskuša. Globalno usklajeni sistem Združenih narodov za razvrščanje in označevanje kemikalij (GHS ZN) : sistem za razvrščanje kemikalij (snovi in zmesi) v skladu s standardiziranimi vrstami in stopnjami fizičnih, zdravstvenih in okoljskih nevarnosti ter za obravnavanje ustreznega označevanja, na primer s piktogrami, opozorilnimi besedami, stavki o nevarnosti, previdnostnimi stavki in varnostnimi listi, da bi se razširile informacije o škodljivih učinkih kemikalij ter s tem zaščitili ljudje (vključno z delodajalci, delavci, prevozniki, potrošniki in reševalci) in okolje (1). UVCB : novi z neznano ali spremenljivo sestavo, kompleksni reakcijski produkti ali biološki materiali. Veljavna preskusna metoda : preskusna metoda, ki se obravnava kot dovolj ustrezna in zanesljiva za določeni namen ter temelji na znanstveno utemeljenih načelih. Preskusna metoda ni nikoli veljavna v absolutnem smislu, ampak samo v zvezi z opredeljenim namenom (29). Dodatek 2 SNOVI ZA PREVERJANJE USPOSOBLJENOSTI Preobčutljivost kože in vitro: luciferazna preskusna metoda z ARE-Nrf2 Pred redno uporabo te preskusne metode morajo laboratoriji dokazati tehnično usposobljenost tako, da pravilno pridobijo napovedi KeratinoSens™, pričakovane za 10 snovi za preverjanje usposobljenosti, ki so priporočene v preglednici 1, ter vrednosti EC1.5 in IC50, ki so za vsaj 8 od 10 snovi za preverjanje usposobljenosti v ustreznem referenčnem območju. Te snovi za preverjanje usposobljenosti so bile izbrane, ker predstavljajo celoten razpon odzivov pri nevarnostih v zvezi s povzročanjem preobčutljivosti kože. Druga merila za izbiro so bila dostopnost na trgu, dostopnost visokokakovostne reference in vivo in dostopnost visokokakovostnih podatkov in vitro iz preskusa KeratinoSensTM. Preglednica 1 Priporočene snovi za dokazovanje tehnične usposobljenosti za preskus KeratinoSensTM
Dodatek 3 KONTROLA KAKOVOSTI ZA MERITVE LUMINISCENCE Osnovni preskus za zagotavljanje optimalnih meritev luminiscence pri preskusu KeratinoSensTM Naslednji trije parametri so ključni za zagotavljanje zanesljivih rezultatov z luminometrom:
Pred preskušanjem je priporočeno, da se zagotovijo ustrezne meritve luminiscence s preskušanjem postavitve kontrolne plošče, kot je opisano spodaj (tri analize). Postavitev plošče za prvi kontrolni poskus
EGDMA= etilen glikol dimetakrilat (št. CAS: 97-90-5), kemikalija z močnimi učinki CA= cimetov aldehid, pozitivna referenčna kemikalija (št. CAS: 104-55-2) Analiza kontrole kakovosti bi morala pokazati:
B.61 Preskusna metoda uhajanja fluoresceina za opredeljevanje jedkih in zelo dražilnih snovi za oči UVOD Ta preskusna metoda je enakovredna Smernici za preskušanje OECD (TG) 460 (2012). Preskusna metoda uhajanja fluoresceina (ang. Fluorescein Leakage, FL) je preskusna metoda in vitro, ki se lahko uporabi v določenih okoliščinah in s posebnimi omejitvami za razvrstitev kemikalij (snovi in zmesi) med jedke in zelo dražilne snovi za oči, kakor to opredeljujejo Globalno usklajeni sistem za razvrščanje in označevanje kemikalij (GHS) Združenih narodov (ZN) (kategorija 1), Uredba (ES) št. 1272/2008 o razvrščanju, označevanju in pakiranju snovi ter zmesi) (CLP) (31) (kategorija 1) in Agencija ZDA za varstvo okolja (US EPA) (kategorija I) (1) (2). Za namen te preskusne metode so zelo dražilne snovi za oči opredeljene kot kemikalije, ki po dajanju preskusne kemikalije povzročijo poškodbo očesnega tkiva, ki ni popravljiva v roku 21 dni, ali povzročijo resno fizično okvaro vida, jedke snovi za oči pa so kemikalije, ki povzročijo nepopravljivo poškodbo očesnega tkiva. Te kemikalije so razvrščene v kategorijo 1 po GHS ZN, kategorijo 1 po CLP EU ali kategorijo I po US EPA. Čeprav se preskusna metoda FL ne obravnava kot veljaven in celovit nadomestek za očesno študijo in vivo na kuncih, se vseeno priporoča za uporabo kot del večstopenjske strategije preskušanja za regulativno razvrščanje in označevanje. Priporoča se torej kot prvi korak v okviru pristopa od zgoraj navzdol, da se opredelijo jedke/zelo dražilne snovi za oči, zlasti za omejene vrste kemikalij (tj. vodotopne snovi in zmesi) (3) (4). Zdaj na splošno velja, da v bližnji prihodnosti noben preskus draženja oči in vitro ne bo mogel nadomestiti očesne študije in vivo (PM B.5 (5)) za napovedi o celotnem razponu dražilnih učinkov za različne kemijske razrede. Strateške kombinacije več alternativnih preskusnih metod v okviru (večstopenjske) strategije preskušanja pa bi morda lahko nadomestile očesno študijo in vivo (4). Pristop od zgoraj navzdol (4) je zasnovan za uporabo takrat, ko se na podlagi obstoječih informacij pričakuje, da bo imela kemikalija visok potencial draženja. Na podlagi napovednega modela, podrobno opisanega v odstavku 35, se s preskusno metodo FL lahko opredelijo kemikalije v okviru omejenega področja uporabe kot jedke/zelo dražilne snovi za oči (kategorija 1 po GHS ZN; kategorija 1 po CLP EU; kategorija I po US EPA) brez kakršnega koli nadaljnjega preskušanja. Enako se domneva za zmesi, čeprav te niso bile uporabljene pri validaciji. Preskusna metoda FL se torej lahko uporabi za določanje dražilnosti/jedkosti kemikalij za oči v okviru zaporedne strategije preskušanja PM B.5 (5). Vendar če se s preskusno metodo FL za kemikalijo ne predvidi, da je jedka ali zelo dražilna snov za oči, bi bilo to kemikalijo treba preskusiti z eno ali več dodatnimi preskusnimi metodami (in vitro in/ali in vivo), s katerimi se lahko točno opredelijo i) kemikalije, ki so in vitro lažno negativne jedke/zelo dražilne snovi za oči na podlagi preskusne metode FL (kategorija 1 po GHS ZN; kategorija 1 po CLP EU; kategorija I po US EPA); ii) kemikalije, ki niso razvrščene med jedke/dražilne snovi za oči (brez kategorije po GHS ZN; brez kategorije po CLP EU; kategorija IV po US EPA); in/ali iii) kemikalije, ki so zmerne/blage dražilne snovi za oči (kategoriji 2A in 2B po GHS ZN; kategorija 2 po CLP EU; kategoriji II in III po US EPA). Namen te preskusne metode je opisati postopke za oceno potencialne jedkosti in močne dražilnosti preskusne snovi za oči glede na njeno sposobnost, da poškoduje neprepusten, konfluenten, epitelijski monosloj. Celovitost transepitelijske prepustnosti je glavna funkcija epitelija, na primer v veznici in roženici. Transepitelijsko prepustnost nadzira več tesnih stikov. Dokazano je bilo, da je povečanje prepustnosti epitelija roženice in vivo povezano s stopnjo vnetja in površinskih poškodb, opaženih, ko pride do draženja oči. S preskusno metodo FL se po kratkem času izpostavljenosti preskusni kemikaliji toksični učinki merijo na podlagi povečanja prepustnosti natrijevega fluoresceina skozi epitelijski monosloj v celicah pasjih ledvic MDCK (ang. Madin-Darby Canine Kidney), ki se gojijo na prepustnih vstavkih. Količina uhajanja fluoresceina, ki se pojavi, je sorazmerna s kemijsko induciranimi poškodbami tesnih stikov, dezmosomskih stikov in celičnih membran ter jo lahko uporabi za oceno potenciala toksičnosti preskusne kemikalije za oči. V Dodatku 1 je diagram celic MDCK, ki se gojijo na membrani vstavka za preskusno metodo FL. Opredelitve pojmov so navedene v Dodatku 2. ZAČETNI PREUDARKI IN OMEJITVE Ta preskusna metoda temelji na protokolu INVITTOX št. 71 (6), ki je bila ocenjen v mednarodni validacijski študiji Evropskega centra za validacijo alternativnih metod (ECVAM) v sodelovanju z Medagencijskim koordinacijskim odborom ZDA za validacijo alternativnih metod (ICCVAM) in Japonskim centrom za validacijo alternativnih metod (JaCVAM). Preskusna metoda FL se ne priporoča za opredeljevanje kemikalij, ki bi morale biti razvrščene med blage/zmerne dražilne snovi za oči, ali kemikalij, ki ne bi smele biti razvrščene med dražilne za oči (snovi in zmesi) (tj. kategorija 2A/2B, brez kategorije po GHS; kategorija 2, brez kategorije po CLP EU; kategorija II/III/IV po US EPA), kot je bilo dokazano v validacijski študiji (3) (7). Ta preskusna metoda je ustrezna samo za vodotopne kemikalije (snovi in zmesi). Potencial zelo močne dražilnosti snovi za oči za kemikalije, ki so topne v vodi in/ali pri katerih razredčenje ne vpliva toksični učinek, se na splošno lahko točno napove z uporabo preskusne metode FL (7). Za razvrstitev kemikalije kot vodotopne v preskusnih pogojih, bi ta morala biti topna v sterilni Hankovi uravnoteženi raztopini soli (ang. Hanks' Balanced Salt Solution (HBSS)) s koncentracijo ≥ 250 mg/ml (ena doza nad mejno vrednostjo 100 mg/ml), ki vsebuje kalcij (s koncentracijo 1,0–1,8 mM) in ne vsebuje fenol rdečega. Če pa je preskusna kemikalija topna pri koncentraciji, nižji od 100 mg/ml, vendar že pri tej koncentraciji povzroči 20-odstotno indukcijo FL (torej, FL20 < 100 mg/ml), se še vedno lahko razvrsti v kategorijo 1 po GHS ali kategorijo I po EPA. Omejitve, opredeljene za to preskusno metodo, s področja uporabe izključujejo močne kisline in baze, fiksirne raztopine za celice in lahko hlapne kemikalije. Za te kemikalije so značilni mehanizmi, ki se ne merijo s preskusno metodo FL, npr. močno strjevanje krvi, umiljenje ali specifične reaktivne kemijske lastnosti. Druge opredeljene omejitve za to metodo temeljijo na rezultatih v zvezi z napovedovalno zmogljivostjo za obarvano in viskozno preskusno kemikalijo (7). Obe vrsti kemikalij naj bi bilo po kratkem obdobju izpostavljenosti težko odstraniti iz monosloja, napovedno zmogljivost preskusne metode pa bi bilo mogoče izboljšati, če bi bilo uporabljenih več korakov spiranja. Trdne kemikalije, suspendirane v tekočini, so nagnjene k obarjanju, in včasih je težko določiti končno koncentracijo glede na celice. Če se kemikalije iz teh kemijskih in fizikalnih razredov izključijo iz zbirke podatkov, se točnost FL v sistemih za razvrščanje EU, EPA in GHS bistveno izboljša (7). Na podlagi namena te preskusne metode (tj. opredeliti samo jedke/zelo dražilne snovi za oči) delež lažno negativnih rezultatov (glej odstavek 13) ni ključen, saj bi bile take kemikalije posledično preskušene z drugimi, ustrezno potrjenimi preskusi in vitro ali na kuncih ob upoštevanju regulativnih zahtev in uporabi večstopenjske strategije preskušanja v okviru pristopa, ki temelji na zanesljivosti dokazov (5) (glej tudi odstavka 3 in 4). Druge opredeljene omejitve preskusne metode FL temeljijo na deležih lažno negativnih in lažno pozitivnih rezultatov. Če se je preskusna metoda FL uporabila kot prvi korak v okviru pristopa od zgoraj navzdol, da bi se opredelile jedke/zelo dražilne snovi in zmesi za oči, ki so topne v vodi (kategorija 1 po GHS ZN; kategorija 1 po CLP EU; kategorija I po US EPA), je delež lažno pozitivnih rezultatov za to metodo znašal od 7 % (7/103; GHS ZN in CLP EU) do 9 % (9/99; US EPA), delež lažno negativnih rezultatov pa od 54 % (15/28; US EPA) do 56 % (27/48; GHS ZN in CLP EU) v primerjavi z rezultati in vivo. Kemijske skupine, ki s preskusno metodo FL pokažejo lažno pozitivne in/ali lažno negativne rezultate, tukaj niso opredeljene. Določene tehnične omejitve so posebej značilne za celično kulturo MDCK. Tesni stiki, ki preprečujejo prehajanje barvila natrijevega fluoresceina skozi monosloj, so z naraščanjem števila pasaž celic vedno bolj ogroženi. Nepopolno nastajanje tesnih stikov pomeni večje FL v netretiranih kontrolnih vzorcih. Torej je pomembno opredeliti največje dopustno uhajanje v netretiranih kontrolnih vzorcih (glej odstavek 38: 0-odstotno uhajanje). Kot pri vseh preskusih in vitro se lahko celice sčasoma spremenijo, zato je ključnega pomena navesti območja števila pasaž za analize. V nekaterih primerih se bo morda trenutno področje uporabe razširilo, vendar samo po analizi obširnejše zbirke podatkov proučenih preskusnih kemikalij, po možnosti pridobljenih na podlagi preskušanja (3). Ta preskusna metoda bo ustrezno posodobljena ob upoštevanju novih informacij in podatkov. Vsak laboratorij, ki ta preskus opravlja prvič, mora uporabiti kemikalije za preverjanje usposobljenosti iz Dodatka 3. Laboratorij lahko te kemikalije uporabi, da dokaže svojo tehnično usposobljenost za izvajanje preskusne metode FL, preden podatke preskusa FL predloži za namene regulativne razvrstitve glede na nevarnosti. NAČELO PRESKUSA Preskusna metoda FL je preskus in vitro, ki temelji na citotoksičnosti in funkciji celic, izvaja pa se jo na konfluentnem monosloju cevastih epitelijskih celic MDCK CB997, ki se gojijo na polprepustnih vstavkih in so model za nemnožeče se stanje epitelija roženice in vivo. Celična linija MDCK je dobro uveljavljena ter tvori tesne stike in dezmosomske stike, podobne tistim na apikalni strani epitelija veznice in roženice. Tesni in dezmosomski stiki in vivo preprečujejo, da bi topljenci in tujki prodrli v epitelij roženice. Izguba transepitelijske neprepustnosti zaradi poškodovanih tesnih stikov in dezmosomskih stikov je eden od zgodnjih dogodkov pri kemijsko induciranem draženju oči. Preskusna kemikalija se doda na konfluentno plast celic, ki se gojijo na apikalni strani vstavka. Običajno se uporablja kratka, enominutna izpostavljenost, ki upošteva normalno stopnjo očistka za izpostavljenost pri ljudeh. Prednost kratkega obdobja izpostavljenosti je možnost preskušanja čistih snovi in zmesi, topnih v vodi, če jih je mogoče po obdobju izpostavljenosti enostavno odstraniti. To omogoča bolj neposredno primerjavo rezultatov s kemičnimi učinki pri ljudeh. Preskusna kemikalija se nato odstrani, na apikalno stran monosloja pa se za 30 minut doda netoksično, zelo flourescentno barvilo natrijevega fluoresceina. Škoda, ki jo preskusna kemikalija povzroči na tesnih stikih, se določi glede na količino fluoresceina, ki uide skozi celično plast v opredeljenem časovnem obdobju. Količina barvila natrijevega fluoresceina, ki prodre skozi monosloj in membrano vstavka v določeno prostornino raztopine v jamici (v katero uhaja barvilo natrijevega fluoresceina), se določi s spektrofluorimetričnim merjenjem koncentracije fluoresceina v jamici. Obseg uhajanja fluoresceina (FL) se izračuna z upoštevanjem meritev intenzitete fluorescence (FI) v dveh kontrolnih vzorcih: slepi kontrolni vzorec in kontrolni vzorec z največjim uhajanjem. Odstotek uhajanja in s tem obseg škode na tesnih stikih se glede na te kontrolne vzorce izrazi za vse določene koncentracije preskusne kemikalije. Nato se izračuna FL20 (tj. koncentracija, ki povzroči 20-odstotno FL glede na vrednost, zabeleženo pri netretiranem konfluentnem monosloju in vstavkih brez celic). Vrednost FL20 (mg/ml) se uporabi v napovednem modelu za opredelitev jedkih in zelo dražilnih snovi za oči (glej odstavek 35). Izkoristek je pomemben del toksičnih lastnosti preskusne kemikalije, ki se tudi oceni s preskusom draženja oči in vivo. Predhodne analize so pokazale, da bi lahko podatki o izkoristku (do 72 ur po izpostavljenosti kemikaliji) morda povečali napovedovalna zmogljivost protokola INVITTOX št. 71, vendar so potrebne nadaljnje ocene in dodatni podatki, po možnosti pridobljeni z nadaljnjim preskušanjem (6). Ta preskusna metoda bo ustrezno posodobljena ob upoštevanju novih informacij in podatkov. POSTOPEK Priprava celičnega monosloja Monosloj celic MDCK CB997 se pripravi z uporabo subkonfluentnih celic, ki se gojijo v bučkah s celično kulturo v zmesi gojišča DMEM/zmesi hranil F12 (1-kratni koncentrat z L-glutaminom, 15 mM pufra HEPES, kalcij (s koncentracijo 1,0–1,8 mM) in 10-odstotni, toplotno inaktivirani FCS/FBS). Pomembno je, da morajo vsi mediji/raztopine, ki se uporabljajo pri preskusu FL, vsebovati kalcij s koncentracijo med 1,8 mM (200 mg/l) in 1,0 mM (111 mg/l), da se zagotovi nastajanje in celovitost tesnih stikov. Območje števila pasaž celic bi se moralo nadzorovati, da se zagotovi enakomerno in ponovljivo nastajanje tesnih stikov. Po možnosti bi morale biti celice znotraj območja pasaž 3–30 od odtajanja, saj majo celice znotraj tega območja podobno funkcionalnost, kar pripomore k ponovljivosti rezultatov preskusa. Pred izvedbo preskusne metode FL se celice ločijo od bučke s tripsinizacijo, centrifugirajo in ustrezno število celic se nasadi v vstavke v ploščah s 24 jamicami (glej Dodatek 1). Za nasaditev celic se morajo uporabiti vstavki s premerom dvanajst mm, membrano iz mešanih celuloznih estrov, debelino 80–150 μm in velikostjo pore 0,45 μm. V validacijski študiji so bili uporabljeni 12 mm vstavki Millicell-HA. Lastnosti vstavka in vrste membrane so pomembni, saj lahko vplivajo na rast celic in vezavo kemikalije. Določene vrste kemikalij se morda vežejo z membrano vstavka Millicell-HA, kar bi lahko vplivalo na razlago rezultatov. Če se uporabijo druge membrane, se morajo za dokazovanje enakovrednosti uporabiti kemikalije za preverjanje usposobljenosti (glej Dodatek 3). Vezava kemikalije na membrano vstavka je pogostejša pri kationskih kemikalijah, na primer benzalkonijevem kloridu, saj jih privlači membrana z nabojem (7). Vezava kemikalije na membrano vstavka lahko podaljša obdobje izpostavljenosti kemikaliji, kar lahko vodi v precenitev potenciala toksičnosti kemikalije, lahko pa tudi fizično zmanjša uhajanje fluoresceina skozi vstavek zaradi vezave barvila na kationsko kemikalijo, ki se veže na membrano vstavka, kar lahko vodi v podcenitev potenciala toksičnosti kemikalije. To se lahko enostavno spremlja tako, da se najvišji koncentraciji preiskovane kemikalije izpostavi samo membrana, nato pa se za standardni čas doda barvilo natrijevega fluoresceina z normalno koncentracijo (kontrola brez celic). Če pride do vezave barvila natrijevega fluoresceina, je po spiranju preskusnega materiala membrana vstavka videti rumena. Zato je bistvenega pomena poznati vezivne lastnosti preskusne kemikalije, da se lahko razloži učinek kemikalije na celice. Ob nasaditvi celic v vstavke bi moral med izpostavljenostjo kemikaliji nastati konfluentni monosloj. Dodati je treba 1,6 x 105 celic na vstavek (400 μl celične suspenzije z gostoto 4 x 105 celic/ml). Pod temi pogoji običajno po 96 urah v kulturi nastane konfluentni monosloj. Vstavke je treba pred nasaditvijo vizualno pregledati in zagotoviti, da so kakršne koli poškodbe, ki so bile zabeležene med vizualno kontrolo, opisano v odstavku 30, nastale zaradi ravnanja. Celične kulture MDCK se morajo hraniti v inkubatorjih z navlaženo atmosfero pri 5 % ± 1 % CO2 in 37 ± 1 °C. Celice ne smejo biti kontaminirane z bakterijami, virusi, mikoplazmo ali glivami. Dodajanje preskusnih in kontrolnih kemikalij Za vsako ponovitev preskusa je treba pripraviti svežo osnovno raztopino s preskusno kemikalijo in jo porabiti v 30 minutah od priprave. Preskusne kemikalije je treba pripraviti v Hankovi uravnoteženi solni raztopini (HBSS) s kalcijem (s koncentracijo 1,0–1,8 mM) in brez fenol rdečega, da se prepreči vezava na serumske beljakovine. Pred preskušanjem je treba oceniti topnost kemikalije pri 250 mg/ml v HBSS. Če pri tej koncentraciji v 30 minutah kemikalija tvori stabilno suspenzijo ali emulzijo (tj. ohrani enakomernost ter se ne usede ali loči v več faz), se HBSS še vedno lahko uporabi kot topilo. Če pa se za kemikalijo ugotovi, da pri tej koncentraciji ni topna v HBSS, je treba razmisliti o uporabi drugih preskusnih metod namesto FL. V primerih, ko se ugotovi, da kemikalija ni topna v HBSS, je treba tehtno razmisliti o uporabi lahkega mineralnega olja kot topila, saj ni na voljo dovolj podatkov, da bi se dokončno ugotovila učinkovitost preskusa FL v takih pogojih. Vse kemikalije, ki bodo preskušene, se pripravijo v sterilni HBSS iz osnovne raztopine s kalcijem (s koncentracijo 1,0–1,8 mM) in brez fenol rdečega, in sicer pri petih nespremenljivih koncentracijah, razredčenih na podlagi teže na prostornino: 1, 25, 100, 250 mg/ml in čista ali nasičena raztopina. Ob preskušanju trdne kemikalije je treba vključiti zelo visoko koncentracijo 750 mg/ml. To koncentracijo kemikalije bo morda treba na celice dodati z uporabo pipete za neposredno izpodrivanje tlaka. Če se ugotovi, da toksičnost znaša med 25 in 100 mg/ml, je treba dvakrat preskusiti naslednje dodatne koncentracije: 1, 25, 50, 75, 100 mg/ml. Če so bila izpolnjena merila za sprejemljivost, je treba iz teh koncentracij izpeljati vrednost FL20. Preskusne kemikalije se dodajo na konfluentne celične monosloje po odstranitvi gojišča celične kulture ter dvakratnem spiranju s sterilno, toplo (37 °C) HBSS s kalcijem (s koncentracijo 1,0–1,8 mM) in brez fenol rdečega. Pred tem se vizualno preveri filtre za kakršne koli predhodne poškodbe, ki bi se lahko zmotno pripisale morebitni nezdružljivosti s preskusnimi kemikalijami. Za vsako koncentracijo preskusne kemikalije in kontrolne vzorce se morajo za vsako ponovitev uporabiti vsaj trije ponovljeni vzorci. Po 1 minuti izpostavljenosti pri sobni temperaturi je treba previdno odstraniti preskusno kemikalijo z aspiracijo, monosloj je treba dvakrat sprati s sterilno, toplo (37 °C) HBSS s kalcijem (s koncentracijo 1,0–1,8 mM) in brez fenol rdečega ter takoj je treba izmeriti uhajanje fluoresceina. V vsaki ponovitvi je treba uporabiti sočasno negativno (NK) in pozitivno kontrolo (PK), da se dokaže, da sta celovitost monosloja (NK) in občutljivost celic (PK) v okviru opredeljenega območja sprejemljivosti iz preteklih preskusov. Predlagana kemikalija PK je Brij 35 (št. CAS 9002-92-0) pri 100 mg/ml. Pri tej koncentraciji bi se moralo ugotoviti približno 30-odstotno uhajanje fluoresceina (sprejemljivo območje uhajanja fluoresceina, tj. poškodovanosti celične plasti, je 20–40 %). Predlagana kemikalija NK je HBSS s kalcijem (s koncentracijo 1,0–1,8 mM) in brez fenol rdečega (netretirani, slepi kontrolni vzorec). Za izračun vrednosti FL20 bi vsaka ponovitev morala vključevati tudi kontrolni vzorec z največjim uhajanjem. Največje uhajanje se določi z uporabo kontrolnih vstavkov brez celic. Določanje stopnje prepuščanja fluoresceina Takoj po odstranitvi preskusnih in kontrolnih kemikalij se v vstavke (npr. Millicell-HA) doda 400 μl 0,1 mg/ml raztopine natrijevega fluoresceina (0,01 % (m/v) v HBSS s kalcijem [s koncentracijo 1,0–1,8 mM] in brez fenol rdečega). Kulture se pustijo 30 minut pri sobni temperaturi. Ob koncu inkubacije s fluoresceinom se vstavki previdno odstranijo iz vsake jamice. Vsak filter se vizualno pregleda in zabeleži se kakršna koli poškodba, ki je morda nastala med uporabo. Količina fluoresceina, ki je prodrla skozi monosloj in vstavek, se količinsko opredeli v raztopini, ki je ostala v jamicah po odstranitvi vstavkov. Meritve se opravijo s spektrofluorimetrom pri valovni dolžini ekscitacije in emisije, ki znaša 485 nm oziroma 530 nm. Občutljivost spektrofluorimetra mora biti nastavljena tako, da je najvišja številčna razlika med največjo FL (vstavki brez celic) in najmanjšo FL (vstavek s konfluentnim monoslojem, tretiran z NK). Zaradi razlik v uporabljenem spektrofluorimetru bi se morala uporabiti občutljivost, ki bo zaznala intenziteto fluorescence > 4 000 pri kontrolnem vzorcu z največjim uhajanjem fluoresceina. Največja vrednost FL ne bi smela biti višja od 9 999. Največja intenziteta uhajanja fluoresceina bi morala biti v linearnem območju uporabljenega spektrofluorimetra. Razlaga rezultatov in napovedni model Količina FL je sorazmerna s kemijsko induciranimi poškodbami tesnih stikov. Odstotek FL za vsako preskušeno koncentracijo kemikalije se izračuna iz vrednosti FL, ki so bile pridobljene za preskusno kemikalijo z upoštevanjem vrednosti FL iz NK (meritev iz konfluentnega monosloja celic, tretiranega z NK) in kontrolni vzorec z največjim uhajanjem (meritev za količino FL skozi vstavek brez celic). Srednja vrednost intenzitete fluorescence pri največjem uhajanju = x Srednja vrednost intenzitete fluorescence pri 0-odstotnem uhajanju (NK) = y Srednja vrednost 100-odstotnega uhajanja se izračuna tako, da se od srednje vrednosti pri največjem uhajanju odšteje srednja vrednost pri 0-odstotnem uhajanju, tj. x – y = z. Odstotek uhajanja za vsak nespremenljivi odmerek se izračuna tako, da se od srednje vrednosti intenzitete fluorescence za meritve treh ponovljenih vzorcev (m) odšteje vrednost pri 0-odstotnem uhajanju, ta vrednost pa nato deli z vrednostjo pri 100-odstotnem uhajanju, tj. % FL = [(m – y) / z] × 100 %, pri čemer je:
Uporabiti je treba naslednjo enačbo za izračun koncentracije kemikalije, ki povzroči 20 % FL: FLD = [(A – B) / (C – B)] × (MC – MB) + MB pri čemer je:
V nadaljevanju je navedena mejna vrednost FL20, s katero se kemikalije predvidijo kot jedke/zelo dražilne snovi za oči:
Preskusna metoda FL se priporoča samo za opredeljevanje vodotopnih jedkih in zelo dražilnih snovi za oči(kategorija 1 po GHS ZN, kategorija 1 po CLP EU, kategorija I po US EPA) (glej odstavka 1 in 10). Za opredelitev vodotopnih kemikalij (snovi in zmesi) (3) (6) (7) kot „povzroča hudo poškodbo oči“ (kategorija 1 po GHS ZN/CLP EU) ali „jedka ali zelo dražilna snov za oči“ (kategorija I po US EPA) bi morala preskusna kemikalija pri koncentraciji ≤ 100 mg/ml inducirati vrednost FL20. Sprejemljivost rezultatov Srednja vrednost pri največjem uhajanju fluoresceina (x) mora biti višja od 4 000 (glej odstavek 31), srednja vrednost pri 0-odstotnem uhajanju (y) mora biti enaka ali nižja od 300, srednja vrednost pri 100-odstotnem uhajanju (z) pa mora biti med 3 700 in 6 000. Preskus se obravnava kot sprejemljiv, če je bila pri pozitivni kontroli opažena 20- do 40-odstotna poškodovanost celične plasti (meritev kot % uhajanja fluoresceina). PODATKI IN POROČANJE Podatki Podatki iz posameznih jamic s ponovljenimi vzorci (npr. vrednosti intenzitete fluorescence in izračunani podatki o odstotku FL za vsako preskusno kemikalijo, vključno z razvrstitvijo) za vsako ponovitev preskusa morajo biti navedeni v obliki preglednice. Poleg tega je treba v poročilu navesti srednje vrednosti ± standardni odklon za posamezne ponovljene meritve v vsaki ponovitvi preskusa. Poročilo o preskusu V poročilo o preskusu se vključijo naslednji podatki:
VIRI
Dodatek 1 DIAGRAM CELIC MDCK, KI SE GOJIJO NA MEMBRANI VSTAVKA ZA PRESKUSNO METODO FL Konfluentni sloj celic MDCK se goji na polprepustni membrani vstavka. Vstavki se položijo v jamice plošče s 24 jamicami. 
Vir slike: Wilkinson, P. J. (2006). Development of an in vitro model to investigate repeat ocular exposure. Doktorska disertacija, Univerza v Nottinghamu, Združeno kraljestvo. Dodatek 2 OPREDELITVE POJMOV Točnost : stopnja ujemanja rezultatov preskusne metode s sprejetimi referenčnimi vrednostmi. Je merilo učinkovitosti preskusne metode in eden od vidikov „ustreznosti“. Ta izraz in izraz „skladnost“ se pogosto uporabljata kot sopomenki in pomenita delež pravilnih rezultatov preskusne metode. Kemikalija : snov ali zmes. Kategorija I po EPA : kemikalije, ki so jedke (nepopravljivo uničenje očesnega tkiva) ali vplivajo na roženico oziroma jo dražijo več kot 21 dni (2). CLP EU (Uredba (ES) št. 1272/2008 o razvrščanju, označevanju in pakiranju snovi ter zmesi): v Evropski uniji (EU) izvaja Globalno usklajeni sistem za razvrščanje kemikalij (snovi in zmesi) Združenih narodov (GHS ZN). Delež lažno negativnih rezultatov : delež vseh pozitivnih kemikalij, ki jih preskusna metoda zmotno prikaže kot negativne. To je eden od kazalnikov učinkovitosti preskusne metode. Delež lažno pozitivnih rezultatov : delež vseh negativnih kemikalij, ki jih preskusna metoda zmotno prikaže kot pozitivne. To je eden od kazalnikov učinkovitosti preskusne metode. FL20 : to vrednost je mogoče oceniti z opredelitvijo koncentracije, pri kateri preskušene kemikalije povzročijo 20-odstotno uhajanje fluoresceina skozi celično plast. Uhajanje fluoresceina : količina fluoresceina, ki prodre skozi celično plast; izmeri se s spektrofluorimetrom. GHS (Globalno usklajeni sistem Združenih narodov (ZN) za razvrščanje in označevanje kemikalij) : sistem za razvrščanje kemikalij (snovi in zmesi) v skladu s standardiziranimi vrstami in stopnjami fizičnih, zdravstvenih in okoljskih nevarnosti ter za obravnavanje ustreznega označevanja, na primer s piktogrami, opozorilnimi besedami, stavki o nevarnosti, previdnostnimi stavki in varnostnimi listi, da bi se razširile informacije o škodljivih učinkih kemikalij ter s tem zaščitili ljudje (vključno z delodajalci, delavci, prevozniki, potrošniki in reševalci) in okolje. Kategorija 1 po GHS : povzročitev poškodbe očesnega tkiva ali resne fizične okvare vida po nanosu preskusne kemikalije na sprednjo površino očesa, ki ni v celoti popravljiva v 21 dneh po nanosu. Nevarnost : neločljiva lastnost sredstva ali stanje, ki ob izpostavljenosti temu sredstvu lahko povzroči neželen učinek na organizem, sistem ali (pod)populacijo. Zmes : v okviru GHS ZN se uporablja kot zmes ali raztopina iz dveh ali več snovi, ki v njej ne reagirajo. Negativna kontrola : netretiran ponovljen vzorec, ki vsebuje vse komponente preskusnega sistema. Ta vzorec se obdela z vzorci, tretiranimi s preskusno kemikalijo, ali drugimi kontrolnimi vzorci, da se ugotovi, ali topilo reagira s preskusnim sistemom. Brez razvrstitve : kemikalije,ki niso razvrščene med dražilne snovi za oči kategorije 1, 2A ali 2B po GHS ZN; kategorije 1 ali 2 po CLP EU; ali kategorije I, II ali III po US EPA. Jedka snov za oči : (a) kemikalija, ki povzroča nepopravljivo poškodbo očesnega tkiva; (b) kemikalije, ki so razvrščene med dražilne snovi za oči kategorije 1 po GHS ZN; kategorije 1 po CLP EU; ali kategorije I po US EPA. Dražilna snov za oči : (a) kemikalija, ki po dodajanju na sprednjo površino očesa povzroča popravljivo poškodbo očesa; (b) kemikalije, ki so razvrščene med dražilne snovi za oči kategorije 2A ali 2B po GHS ZN; kategorije 2 po CLP EU; ali kategorije II ali III po US EPA. Zelo dražilna snov za oči : (a) kemikalija, ki po dodajanju na sprednjo površino očesa povzroči poškodbo očesnega tkiva, ki v 21 dneh po nanosu ne izgine, ali povzroči resno fizično okvaro vida; (b) kemikalije, ki so razvrščene med dražilne snovi za oči kategorije 1 po GHS ZN; kategorije 1 po CLP EU; ali kategorije I po US EPA. Pozitivna kontrola : ponovljen vzorec, ki vsebuje vse sestavine preskusnega sistema in se tretira s kemikalijo, za katero je znano, da povzroči pozitiven odziv. Za zagotovitev, da se lahko oceni variabilnost odziva pozitivne kontrole v daljšem časovnem obdobju, stopnja pozitivnega odziva ne sme biti prevelika. Kemikalije za preverjanje usposobljenosti : podskupina seznama referenčnih kemikalij, ki jih lahko uporabi laboratorij, da dokaže usposobljenost za validirano, referenčno preskusno metodo. Ustreznost : opis razmerja med preskusom in preiskovanim učinkom ter njegovega pomena in uporabnosti za določen namen. Pomeni stopnjo, do katere preskus pravilno izmeri ali napove preiskovani biološki učinek. Ustreznost upošteva tudi točnost (skladnost) preskusne metode (8). Zanesljivost : stopnja obnovljivosti preskusne metode v enem ali več laboratorijih v daljšem časovnem obdobju ob uporabi istega protokola. Oceni se z izračunom obnovljivosti v enem ali več laboratorijih in interne laboratorijske ponovljivosti. Nadomestni preskus : preskus, ki nadomesti preskus, ki se redno uporablja in je uveljavljen za ugotavljanje nevarnosti in/ali oceno tveganja, ter za katerega je bilo ugotovljeno, da v primerjavi z uveljavljenim preskusom v vseh mogočih okoliščinah preskušanja in za vse mogoče preskusne kemikalije zagotavlja enakovredno ali izboljšano varstvo zdravja ljudi ali živali ali okolja, kot se uporablja. Občutljivost : delež vseh pozitivnih/aktivnih kemikalij, ki se s preskusno metodo pravilno razvrstijo. Je merilo točnosti za preskusno metodo, s katero se pridobijo kategorični rezultati, in pomemben dejavnik pri ocenjevanju ustreznosti preskusne metode (8). Huda poškodba oči : povzročitev poškodbe očesnega tkiva ali resne fizične okvare vida po nanosu preskusne kemikalije na sprednjo površino očesa, ki ni v celoti popravljiva v 21 dneh po nanosu. Kontrola s topilom/vehiklom : netretiran vzorec, ki vsebuje vse komponente preskusnega sistema, vključno s topilom ali vehiklom, ki se obdela s kontrolnimi vzorci, tretiranimi s preskusno kemikalijo, in drugimi kontrolnimi vzorci, da se določi izhodiščni odziv za vzorce, tretirane s preskusno kemikalijo, raztopljeno v istem topilu ali vehiklu. Pri preskušanju s sočasno negativno kontrolo ta vzorec tudi pokaže, ali topilo ali vehikel reagira s preskusnim sistemom. Specifičnost : delež vseh negativnih/neaktivnih kemikalij, ki se s tem preskusom pravilno razvrstijo. Je merilo točnosti za preskusno metodo, s katero se pridobijo kategorični rezultati, in pomemben dejavnik pri ocenjevanju ustreznosti preskusne metode. Snov : v okviru GHS ZN se uporablja kot kemijski element in njegove spojine, ki so v naravnem stanju ali pridobljeni s katerim koli proizvodnim postopkom, vključno z vsemi dodatki, potrebnimi za ohranitev stabilnosti produkta, in kakršnimi koli nečistotami, ki so nastale v uporabljenem postopku, vendar brez kakršnega koli topila, ki ga je mogoče ločiti, ne da bi to vplivalo na stabilnost snovi ali spremenilo njeno sestavo. Preskusna kemikalija : vsaka snov ali zmes, preskušena s to preskusno metodo. Večstopenjska strategija preskušanja : stopenjsko preskušanje, pri katerem se v posebnem vrstnem redu pregledajo vsi obstoječi podatki o preskusni kemikaliji, pri čemer se na vsaki stopnji uporabi postopek, ki temelji na zanesljivosti dokazov, da se določi, ali je pred nadaljevanjem na naslednji stopnji na voljo dovolj podatkov za odločitev o razvrstitvi kemikalije glede na nevarnost, ki jo povzroča. Če se za preskusno kemikalijo na podlagi razpoložljivih podatkov lahko določi potencial za draženje, dodatno preskušanje ni potrebno. Če preskusni kemikaliji na podlagi razpoložljivih podatkov ni mogoče določiti potenciala za draženje, se izvede postopno zaporedno testiranje na živalih, dokler kemikalije ni mogoče jasno razvrstiti. Validirana preskusna metoda : preskusna metoda, za katero sta bili na podlagi izvedenih validacijskih študij določeni ustreznost (vključno s točnostjo) in zanesljivost za določen namen. Opozoriti je treba, da točnost in zanesljivost validirane preskusne metode nista nujno zadostni, da bi bila sprejemljiva za predlagani namen (8). Zanesljivost dokazov : postopek obravnavanja prednosti in slabosti različnih informacij v okviru sprejemanja in utemeljevanja sklepne ugotovitve glede potenciala nevarnosti kemikalije. Dodatek 3 KEMIKALIJE ZA PREVERJANJE USPOSOBLJENOSTI ZA PRESKUSNO METODO FL Pred redno uporabo te preskusne metode morajo laboratoriji dokazati tehnično usposobljenost tako, da pravilno opredelijo razvrstitev med jedke snovi za oči za 8 kemikalij, ki so priporočene v preglednici 1. Te kemikalije so bile izbrane tako, da predstavljajo vrsto odzivov za lokalno draženje/jedkost za oči, ki temelji na rezultatih očesne študije in vivo na kuncih (TG 405, PM B.5(5)) (tj. kategorije 1, 2A in 2B ali brez razvrstitve po GHS ZN). Ob upoštevanju validirane uporabnosti preskusa FL (tj. opredeljevanje samo jedkih/zelo dražilnih snovi za oči) pa za dokaz usposobljenosti obstajata samo dva rezultata preskusa za namene razvrstitve (jedka/zelo dražilna snov za oči ali nejedka/lažje dražilna snov za oči). Druga merila za izbiro so bila dostopnost kemikalij na trgu, razpoložljivost visokokakovostnih referenčnih podatkov in vivo in visokokakovostni podatki iz preskusne metode FL. Zato so bile kemikalije za preverjanje usposobljenosti izbrane na podlagi dokumenta „Fluorescein Leakage Assay Background Review Document as an Alternative Method for Eye Irritation Testing“ (dokument o pregledu ozadja v preskusu uhajanja fluoresceina kot alternativne metode za preskušanje dražilnosti oči) (8), ki je bil uporabljen za retrospektivno validacijo preskusne metode FL. Preglednica 1 Priporočene kemikalije za dokazovanje tehnične usposobljenosti za FL
B.62 Kometni preskus in vivo v alkalnih pogojih pri sesalcih UVOD Ta preskusna metoda (PM) je enakovredna Smernici za preskušanje (TG) OECD 489 (2016). Kometni preskus in vivo v alkalnih pogojih (gelska elektroforeza posamezne celice; v nadaljnjem besedilu preprosto kometni preskus) se uporablja za zaznavanje prelomov verige DNK v celicah ali jedrih, izoliranih iz več tkiv živali, navadno glodalcev, ki so bili izpostavljeni potencialno genotoksičnim materialom. Več skupin strokovnjakov je proučilo in objavilo priporočila za kometni preskus (1) (2) (3) (4) (5) (6) (7) (8) (9) (10). Ta preskusna metoda je del nabora preskusnih metod v zvezi z genetsko toksikologijo. Pripravljen je dokument OECD, ki zagotavlja jedrnate informacije o preskušanju v zvezi z genetsko tokskikologijo in pregled nedavnih sprememb teh preskusnih smernic (11). Namen kometnega preskusa je opredeliti kemikalije, ki povzročajo poškodbe DNK. Kometni preskus lahko v alkalnih pogojih (pH > 13) zazna prelome ene in dveh verig, ki na primer izhajajo iz neposrednih interakcij z DNK ali alkalno labilnih mest ali so posledica vmesnih stopenj prelomov verig DNK zaradi popravljanja poškodb DNK z izrezovanjem. Ti prelomi verig se lahko popravijo brez trajnega učinka, so za celico smrtni ali pa se fiksirajo v mutacijo, iz katere nastane stalno spremenjena celica, sposobna preživetja. To lahko povzroči tudi poškodbe kromosomov, ki so povezane z mnogimi boleznimi ljudi, vključno z rakom. Uradni validacijski preskus kometnega preskusa in vivo pri glodalcih je bil izveden v letih 2006–2012, usklajeval pa ga je Japonski center za validacijo alternativnih metod (JaCVAM) v sodelovanju z Evropskim centrom za validacijo alternativnih metod (ECVAM), Medagencijskim koordinacijskim odborom za validacijo alternativnih metod (ICCVAM) in Medagencijskim centrom NTP za ocenjevanje alternativnih toksikoloških metod (NICEATM) (12). Ta preskusna metoda vključuje priporočeno uporabo in omejitve kometnega preskusa ter temelji na končnem protokolu (12), uporabljenem v validacijskem preskusu, ter dodatnih ustreznih objavljenih in neobjavljenih podatkih (ki so v lasti laboratorijev). Opredelitve ključnih pojmov so navedene v Dodatku 1. Opozoriti je treba, da se za ta preskus lahko uporabi veliko različnih sistemov (mikroskopski preparati, gelski nosilci, 96-jamične mikrotitrske plošče itd.). Zaradi večje pripravnosti se v preostalem dokumentu uporablja izraz „objektno stekelce“ ali „preparat“, ki zajema tudi vse druge sisteme. ZAČETNI PREUDARKI IN OMEJITVE Kometni preskus je metoda za merjenje prelomov verig DNK v evkariotskih celicah. Posamezne celice/jedra, vstavljene v agarozo na objektnem stekelcu, se lizirajo z detergentom in visoko koncentracijo soli. Med lizo se razgradijo celične in jedrne membrane, pri čemer se odvijejo spiralaste zanke DNK, ki se na splošno imenujejo nukleoidi in fragmenti DNK. Elektroforeza pri visoki vrednosti pH povzroči oblikovanje struktur, podobnih kometom, ki jih je z uporabo ustreznih fluorescentnih barvil mogoče opazovati s fluorescenčno mikroskopijo; fragmenti DNK migrirajo iz „glave“ v „rep“ kometa glede na njihovo velikost, iz intenzivnosti repa kometa glede na skupno intenzivnost (glava in rep) pa je razvidna količina prelomov DNK (13) (14) (15). Kometni preskus in vivo v alkalnih pogojih je zlasti ustrezen za ocenjevanje genotoksičnih lastnosti, saj so rezultati preskusa odvisni od procesov absorpcije, porazdelitve, metabolizma in izločanja (ADME) in vivo ter tudi od procesov popravljanja poškodb DNK. Ti se lahko razlikujejo med vrstami, tkivi in vrstami poškodb DNK. Za izpolnitev zahtev glede dobrobiti živali, zlasti zmanjšanje uporabe živali (načela 3R – nadomestitev, zmanjšanje in izboljšanje, ang. replacement, reduction and refinement), se ta preskus lahko združi s drugimi toksikološkimi študijami, npr. toksikološkimi študijami s ponavljajočim se odmerkom (10) (16) (17), ali pa se končna točka združi z drugimi genotoksičnimi končnimi točkami, na primer in vivo preskusom mikronukleusov v eritrocitih sesalcev (18) (19) (20). Kometni preskus se najpogosteje izvaja na glodalcih, čeprav je bil uporabljen tudi pri drugih sesalskih in nesesalskih vrstah. Uporaba neglodalskih vrst bi morala biti znanstveno in etično utemeljena za vsak primer posebej in močno se priporoča, da se kometni preskus na neglodalskih vrstah izvede samo v okviru druge študije toksičnosti in ne kot samostojni preskus. Način izpostavljenosti in tkiva, ki bodo proučevana, je treba izbrati na podlagi vseh razpoložljivih/obstoječih informacij o preskusnih kemikalijah, npr. predvidenega/pričakovanega načina izpostavljenosti pri ljudeh, metabolizma in porazdelitve, potenciala za učinke na mestu stika, opozorilne strukture, druge podatke o genotoksičnosti ali toksičnosti in namena študije. Kadar je to ustrezno, se torej lahko potencial genotoksičnosti preskusnih kemikalij analizira v ciljnih tkivih z rakotvornimi in/ali drugimi toksičnimi učinki. Preskus se obravnava kot uporaben tudi za nadaljnje preiskave genotoksičnosti, ki jo zazna sistem in vitro. Izvedba kometnega preskusa in vivo na preiskovanem tkivu je primerna, kadar se lahko razumno pričakuje, da bo preiskovano tkivo ustrezno izpostavljeno. Preskus je bil najobširneje validiran v somatskih tkivih podgan moškega spola v medlaboratorijskih študijah, kot je poskus JaCVAM (12) in kot je navedeno v Rothfuss idr., 2010 (10). V mednarodnem validacijskem preskusu JaCVAM so bila uporabljena jetra in želodec. Jetra zato, ker so najaktivnejši organ v metabolizmu kemikalij, pogosto pa tudi ciljni organ za rakotvornost. Želodec pa zato, ker je običajno prvo mesto kontakta za kemikalije po oralni izpostavljenosti, čeprav bi se kot tkiva, ki so mesto stika, morala upoštevati tudi druga območja prebavnega trakta, na primer dvanajsternik in tešče črevo, ter bi se lahko obravnavala kot pomembnejša za ljudi kot žlezni želodec glodalcev. Treba je paziti, da se zagotovi, da takšna tkiva niso izpostavljena previsokim koncentracijam preskusne kemikalije (21). Ta tehnika se načeloma lahko uporabi za katero koli tkivo, iz katerega je mogoče pripraviti suspenzijo s posameznimi celicami/jedri, ki jo je mogoče analizirati. Iz podatkov, ki so v lasti več laboratorijev, je razvidna uspešna uporaba te tehnike na več različnih tkivih in mnoge publikacije so prikazale njeno uporabnost ne samo na jetrih in želodcu, ampak tudi na drugih organih ali tkivih, npr. teščem črevu (22), ledvicah (23) (24), koži (25) (26) ali mehurju (27) (28), pljučnih celicah in celicah bronhoalveolarnega izpirka (pomembno za študije kemikalij, ki se vdihavajo) (29) (30), preskusi pa so bili izvedeni tudi na več organih (31) (32). Čeprav morda obstaja zanimanje za genotoksične učinke v zarodnih celicah, je treba opozoriti, da se standardni kometni preskus v alkalnih pogojih, kot je opisan v tej preskusni metodi, ne obravnava kot ustrezen za merjenje prelomov verig DNK v zrelih zarodnih celicah. Ker so bile v pregledu virov o uporabi kometnega preskusa za genotoksičnost za zarodne celice (33) navedene visoke in spremenljive ravni ozadja pri poškodbah DNK, bi bilo treba spremeniti protokol ter izboljšati standardizacijo in validacijske študije, preden se lahko kometni preskus na zrelih zarodnih celicah (npr. semenčicah) vključi v preskusno metodo. Poleg tega priporočeni režim izpostavljenosti, opisan v tej preskusni metodi, ni optimalen in bi bila za smiselno analizo prelomov DNK v zrelih semenčicah potrebna daljša izpostavljenost ali vzorčenje. Genotoksični učinki, kot so bili izmerjeni s kometnim preskusom na celicah mod v različnih fazah razločevanja, so bili opisani v virih (34) (35). Treba pa je opozoriti, da spolne žleze vsebujejo mešanico somatskih in zarodnih celic. Zato iz pozitivnih rezultatov za celotno spolno žlezo (modo) ni nujno mogoče sklepati tudi na poškodbe zarodnih celic. Kažejo pa, da so preskušene kemikalije in/ali njihovi metaboliti dosegli spolno žlezo. S standardnimi preskusnimi pogoji kometnega preskusa ni mogoče zanesljivo zaznati navzkrižnih povezav. V določenih prilagojenih preskusnih pogojih se lahko zaznajo navzkrižne povezave DNK-DNK in DNK-beljakovina ter druge spremembe baz, na primer oksidirane baze (23) (36) (37) (38) (39). Vendar je za ustrezno opredelitev potrebnih prilagoditev protokola potrebno nadaljnje delo. Zaznavanje navzkrižnih povezovalcev ni glavni namen preskusa, kot je opisan v tem dokumentu. Preskus kljub prilagoditvam ni primeren za zaznavanje anevgenov. V okviru trenutnega znanja je s kometnim preskusom in vivo povezanih več dodatnih omejitev (glej Dodatek 3). Preskusna metoda se bo v prihodnosti predvidoma pregledala in po potrebi revidirala glede na pridobljene izkušnje. Pred uporabo te preskusne metode za preskušanje zmesi in pridobivanje podatkov za predvideni regulativni namen bi bilo treba proučiti, ali bo zagotovila sprejemljive rezultate za navedeni namen in, če jih bo, zakaj. Kadar obstaja regulativna zahteva za preskušanje zmesi, taki preudarki niso potrebni. NAČELO METODE Živali se primerno izpostavijo preskusni kemikaliji. Podroben opis odmerjanja in vzorčenja je naveden v odstavkih 36 do 40. Ob izbranih časih vzorčenja se secirajo preiskovana tkiva in pripravijo suspenzije s posameznimi celicami/jedri (lahko se izvede perfuzija in situ, kadar velja za uporabno, npr. na jetrih), ki se nato vstavijo v mehki agar, da se lahko nanesejo na objektna stekelca. Celice/jedra se obdelajo z liznim pufrom, da se odstranijo celične in/ali jedrne membrane, in izpostavijo močnim alkalijam, npr. pH ≥ 13, kar povzroči odvitje DNK ter sprostitev sproščenih zank in fragmentov DNK. Jedrna DNK v agarju se nato izpostavi elektroforezi. Normalne, nefragmentirane molekule DNK ostanejo v položaju, v katerem so bile, ko je bila jedrna DNK v agarju, kakršna koli fragmentirana DNK in sproščene zanke DNK pa migrirajo proti anodi. Po elektroforezi se DNK vizualizira s pomočjo ustreznega fluorescentnega barvila. Preparate je treba analizirati z mikroskopom in popolnoma avtomatiziranimi ali polavtomatiziranimi sistemi za analizo slik. Iz obsega DNK, ki je migrirala med elektroforezo, in razdalje migracije sta razvidna količina in velikost fragmentov DNK. Za kometni preskus obstaja več končnih točk. Za oceno poškodb je priporočena vsebnost DNK v repu (odstotek DNK v repu ali odstotna intenzivnost repa) (12) (40) (41) (42). Po analizi zadostnega števila jeder se podatki analizirajo z ustreznimi metodami, da se ocenijo rezultati preskusa. Opozoriti je treba, da je bilo spreminjanje različnih vidikov metodologije, vključno s pripravo vzorca, pogoji elektroforeze, parametri vizualne analize (npr. intenzivnost barvila, intenzivnost svetlobe mikroskopske žarnice ter uporaba mikroskopskih filtrov in dinamike kamere) in okoljskimi pogoji (npr. osvetlitev ozadja), raziskano ter da lahko vpliva na migracijo DNK (43) (44) (45) (46). PREVERJANJE USPOSOBLJENOSTI LABORATORIJA Vsak laboratorij mora dokazati usposobljenost za izvajanje kometnega preskusa, tako da pokaže, da lahko pridobi suspenzije s posameznimi celicami/jedri, ki so ustrezne kakovosti za vsako ciljno tkivo vsake uporabljene vrste. Kakovost preparatov bo najprej ocenjena z odstotkom DNK v repu za živali, tretirane z vehiklom, ki se uvrstijo v ponovljivo nizko območje. Iz trenutnih podatkov je razvidno, da skupinska srednja vrednost odstotka DNK v repu (ki temelji na srednji vrednosti median – glej odstavek 57 za podrobnosti o teh pojmih) pri jetrih podgan načeloma ne bi smela presegati 6 %, kar ustreza vrednostim iz validacijskega preskusa JaCVAM (12) ter drugih objavljenih podatkov in podatkov, ki so v lasti laboratorijev. Za priporočila o optimalnih ali sprejemljivih območjih za druga tkiva trenutno ni dovolj podatkov. To ne izključuje uporabe drugih tkiv, če je ta utemeljena. Poročilo o preskusu bi moralo zagotoviti ustrezen pregled uspešnosti kometnega preskusa teh tkiv glede na objavljeno literaturo ali podatke, ki so v lasti laboratorijev. Predvsem je zaželeno nizko območje odstotka DNK v repu v kontrolah, da se zagotovi zadostno dinamično območje za zaznavanje pozitivnega učinka. Poleg tega pa mora vsak laboratorij biti zmožen obnoviti pričakovane odzive za neposredne mutagene in promutagene z različnimi načini delovanja, kot je predlagano v preglednici 1 (odstavek 29). Pozitivne snovi se lahko na primer izberejo iz validacijskega preskusa JaCVAM (12) ali drugih objavljenih podatkov (glej odstavek 9), kadar je to ustrezno in utemeljeno ter če povzročajo jasne pozitivne odzive v preiskovanih tkivih. Treba je dokazati tudi sposobnost zaznavanja šibkih učinkov znanih mutagenov, npr. EMS, pri nizkih odmerkih, na primer z določanjem razmerja med odzivom in odmerkom z ustreznimi številkami in razporeditvami odmerkov. Laboratorij bi se moral najprej usmeriti v dokazovanje usposobljenosti z najpogosteje uporabljenimi tkivi, npr. jetri glodalcev, pri čemer se lahko izvedejo primerjave z obstoječimi podatki in pričakovanimi rezultati (12). Istočasno se lahko zberejo podatki o drugih tkivih, npr. želodcu/dvanajsterniku/teščem črevu, krvi itd. Laboratorij mora dokazati usposobljenost za vsako posamezno tkivo vsake vrste, ki jo namerava proučiti, in prikazati, da se s tem tkivom lahko pridobi sprejemljiv pozitiven odziv z znanim mutagenom (npr. EMS). Zbrati je treba podatke o negativnih kontrolnih vzorcih/kontrolnih vzorcih z vehiklom, da se lahko prikaže obnovljivost negativnih odzivov in zagotovi, da so bili tehnični vidiki preskusa ustrezno nadzorovani, ali ugotovi potreba po ponovni določitvi kontrolnih območij iz preteklih preskusov (glej odstavek 22). Opozoriti je treba, da je sicer mogoče zbrati več tkiv ob obdukciji in jih obdelati za kometni preskus, vendar mora biti laboratorij usposobljen za odvzem več tkiv ene živali, s čimer zagotovi, da ni izgubljena nobena morebitna poškodba DNK in da kometni preskus ni ogrožen. Čas od evtanazije do odstranitve tkiv za tretiranje je lahko ključen (glej odstavek 44). Med pripravami na usposobljenost za ta preskus je treba poskrbeti za dobrobit živali, zato se lahko med pripravami na usposobljenost za različne vidike preskusa uporabijo tkiva živali, ki so bile uporabljene v drugih preskusih. Poleg tega med fazami vzpostavljanja nove preskusne metode v laboratoriju morda ne bo treba izvesti celotne študije, med pridobivanjem zahtevanih spretnosti pa se lahko uporabi manj živali ali preskusnih koncentracij. Podatki o kontrolah iz preteklih preskusov Med preverjanjem usposobljenosti bi moral laboratorij ustvariti zbirko podatkov iz preteklih preskusov, da lahko določi območja ter porazdelitve pozitivnih in negativnih kontrol za ustrezna tkiva in vrste. Priporočila o tem, kako zbrati in uporabiti podatke iz preteklih preskusov (tj. merila za vključitev in izključitev podatkov v podatke iz preteklih preskusov ter merila za sprejemljivost danega preskusa), so navedena v virih (47). Na podlagi različnih tkiv in vrst ter različnih vehiklov in načinov dajanja kemikalije se lahko pridobijo različne vrednosti odstotka DNK v repu v negativnih kontrolah. Zato je pomembno določiti območja negativnih kontrol za vsako tkivo in vrsto. Laboratoriji morajo uporabljati metode nadzora kakovosti, kot so kontrolne karte (npr. c-karte ali „X-črta“ karte (48)), da opredelijo, kako variabilni so njihovi podatki, in pokažejo, da je metodologija v njihovem laboratoriju „pod nadzorom“. Morda bo treba optimizirati tudi izbiro ustreznih snovi za pozitivno kontrolo, območij odmerkov in preskusnih pogojev (npr. pogojev elektroforeze) za zaznavanje šibkih učinkov (glej odstavek 17). Vsako spremembo v protokolu preskusa je treba proučiti glede na skladnost z obstoječimi zbirkami podatkov laboratorija o kontrolah iz preteklih preskusov. Če se pojavijo večje neskladnosti, je treba ustvariti novo zbirko podatkov o kontrolah iz preteklih preskusov. OPIS METODE Priprave Izbira živalske vrste Navadno se uporabijo običajni laboratorijski sevi zdravih mladih odraslih glodalcev (stari 6 do 10 tednov ob začetku tretiranja, čeprav so sprejemljive tudi rahlo starejše živali). Izbira vrste glodalcev mora temeljiti na (i) vrstah, uporabljenih v drugih študijah toksičnosti (da se lahko primerjajo podatki in izvajajo celovite študije), (ii) vrstah, pri katerih so v študijah rakotvornosti nastali tumorji (med raziskavami mehanizmov razvoja raka), ali (iii) vrstah z metabolizmom, ki najbolj ustreza človeškemu, če so znane. Pri tem preskusu se običajno uporabljajo podgane. Uporabijo pa se lahko tudi druge vrste, če je to etično in znanstveno utemeljeno. Pogoji nastanitve in hranjenja živali Pri glodalcih mora temperatura prostora s poskusnimi živalmi načeloma znašati 22 °C (± 3 °C). Relativna vlažnost mora načeloma znašati 50–60 % oziroma vsaj 30 % in po možnosti ne sme presegati 70 %, razen med čiščenjem prostora. Osvetlitev mora biti umetna, pri čemer je zaporedje 12 ur svetlobe in 12 ur teme. Za hranjenje se lahko uporablja običajna laboratorijska hrana z neomejeno količino pitne vode. Na izbiro hrane lahko vpliva potreba po zagotovitvi ustrezne mešanice preskusne kemikalije, kadar se daje na ta način. Če se ne pričakuje agresivno vedenje, je treba glodalce namestiti v majhnih skupinah (običajno po največ pet živali) istega spola. Živali so lahko nastanjene posamično le, če je to znanstveno utemeljeno. Če je mogoče, je treba uporabiti trdna tla, saj lahko mrežasta tla povzročijo resne poškodbe (49). Okolje je treba ustrezno obogatiti. Priprava živali Živali se naključno dodelijo kontrolnim in tretiranim skupinam. Živali se označijo z edinstvenimi oznakami in vsaj pet dni pred začetkom tretiranja se morajo aklimatizirati na laboratorijske pogoje. Uporabiti je treba najmanj invazivno metodo označevanja živali z edinstvenimi oznakami. Ustrezne metode vključujejo namestitev obročkov ali trakov, vsaditev mikročipa ali biometrično identifikacijo. V teh preskusih zarezovanje ušesa ali prsta ni znanstveno utemeljeno. Kletke je treba razporediti tako, da se čim bolj zmanjšajo morebitni učinki, ki nastanejo zaradi razporeditve kletk. Ob začetku študije mora biti razlika med težami živali čim manjša in ne sme presegati ± 20 %. Priprava odmerkov Trdne preskusne kemikalije je treba pred odmerjanjem živalim raztopiti ali suspendirati v ustreznih vehiklih ali primešati hrani ali pitni vodi. Tekoče preskusne kemikalije se lahko odmerijo neposredno ali pa se pred odmerjanjem razredčijo. Pri izpostavljenosti z vdihavanjem se lahko preskusne kemikalije glede na njihove fizikalno-kemijskih lastnosti dajejo v obliki plina, pare ali trdnega/tekočega aerosola (50) (51). Uporabiti je treba sveže pripravljene preskusne kemikalije, razen če je iz podatkov o stabilnosti razvidno, da je shranjevanje sprejemljivo, in so v njih opredeljeni ustrezni pogoji shranjevanja. Preskusni pogoji Vehikel Vehikel pri uporabljenih količinah odmerkov ne sme imeti toksičnih učinkov in ne sme zbujati suma, da lahko kemično reagira s preskusnimi kemikalijami. Če se uporabijo manj znani vehikli, je treba njihovo uporabo podpreti z referenčnimi podatki, ki dokazujejo njihovo združljivost s poskusnimi živalmi, načinom dajanja in končno točko. Priporočljivo je, da se, kadar koli je to mogoče, najprej razmisli o uporabi vodnega topila/vehikla. Opozoriti je treba, da lahko nekateri vehikli (zlasti viskozni) povzročijo vnetje in povečajo ravni ozadja za prelome verig DNK na mestu kontakta, zlasti pri večkratnem dajanju. Kontrole Pozitivne kontrole V tej fazi mora biti v vsak preskus običajno vključena skupina z najmanj tremi živalmi, ki jih je mogoče analizirati, istega spola ali obeh spolov, če se uporabi oba (glej odstavek 32), tretirana s snovjo za pozitivno kontrolo. V prihodnje bo morda mogoče dokazati ustrezno usposobljenost, da se zmanjša potreba po pozitivnih kontrolah. Če se uporabi več vzorčenj (npr. pri protokolu enkratnega dajanja), je treba vključiti pozitivne kontrole samo ob enem vzorčenju, vendar je treba zagotoviti uravnoteženo zasnovo (glej odstavek 48). Snovi za sočasno pozitivno kontrolo ni treba dajati na isti način kot preskusno kemikalijo, pomembno pa je, da se uporabi isti način za merjenje učinkov na mestu stika. Snovi za pozitivno kontrolo morajo pokazati, da povzročijo prelome verig DNK v vseh preiskovanih tkivih za preskusno kemikalijo, EMS pa bo verjetno najpogosteje izbrana pozitivna kontrola, saj je povzročila prelome verig DNK v vseh tkivih, ki so bila proučena. Odmerki snovi za pozitivno kontrolo morajo biti izbrani tako, da povzročajo zmerne učinke, ki kritično ocenijo uspešnost in občutljivost preskusa, ter lahko bi temeljili na krivuljah odziva na odmerek, ki jih je laboratorij določil med dokazovanjem usposobljenosti. Odstotek DNK v repu za živali sočasne pozitivne kontrole mora biti skladen s predhodno določenim območjem laboratorija za vsako posamezno tkivo in vzorčenje za to vrsto (glej odstavek 16). Primeri snovi za pozitivno kontrolo in nekatera njihova ciljna tkiva (pri glodalcih) so navedeni v preglednici 1. Snovi, ki niso navedene v preglednici 1, se lahko izberejo, če je to znanstveno utemeljeno. Preglednica 1 Primeri snovi za pozitivno kontrolo in nekatera njihova ciljna tkiva Snovi in št. CAS etil metansulfonat (št. CAS 62-50-0) za katero koli tkivo etil nitrozosečnina (št. CAS 759-73-9) za jetra in želodec, dvanajsternik ali tešče črevo metil metansulfonat (št. CAS 66-27-3) za jetra, želodec, dvanajsternik ali tešče črevo, pljučne celice ali celice bronhoalveolarnega izpirka (BAL), ledvice, mehur, pljuča, modo in kostni mozeg/kri N-metil-N'-nitro-N-nitrozogvanidin (št. CAS 70-25-7) za želodec, dvanajsternik ali tešče črevo 1,2-dimetilhidrazin 2HCl (št. CAS 306-37-6) za jetra in črevo N-metil-N-nitrozosečnina (št. CAS 684-93-5) za jetra, kostni mozeg, kri, ledvice, želodec, tešče črevo in možgane Negativne kontrole Skupino živali negativne kontrole, tretirano samo z vehiklom, drugače pa tretirano enako kot tretirane skupine, je treba vključiti v vsak preskus za vsak čas vzorčenja in vsako tkivo. Odstotek DNK v repu pri živalih negativne kontrole mora biti v predhodno določenem območju ozadja laboratorija za vsako posamezno tkivo in vsak čas vzorčenja za to vrsto (glej odstavek 16). Če podatki iz preteklih preskusov ali objavljeni podatki o kontrolah ne kažejo, da izbrani vehikel, število odmerkov ali način dajanja ne povzroča nobenih škodljivih ali genotoksičnih učinkov, je treba pred izvedbo celotne študije izvesti predhodne študije, da se določi sprejemljivost kontrole z vehiklom. POSTOPEK Število in spol živali Čeprav je malo podatkov o živalih ženskega spola, ki bi omogočili primerjavo med spoloma v okviru kometnega preskusa, so si drugi genotoksični odzivi in vivo med živalmi moškega in ženskega spola v splošnem podobni, zato se lahko večino študij izvede na obeh spolih. Podatki, ki kažejo pomembne razlike med samci in samicami (npr. razlike v sistemski toksičnosti, metabolizmu, biološki dostopnosti itd., vključno v npr. študiji za določanje območja), spodbujajo uporabo obeh spolov. V tem primeru je morda ustrezno izvesti študijo na obeh spolih, npr. kot del toksikološke študije s ponavljajočim se odmerkom. V primeru uporabe obeh spolov je primerno uporabiti zasnovo preskusa z več dejavniki. Podrobnosti o tem, kako analizirati podatke z uporabo te zasnove, so navedene v Dodatku 2. Velikosti skupine ob začetku študije (in med preverjanjem usposobljenosti) je treba določiti z namenom, da se zagotovi vsaj 5 živali, ki jih je mogoče analizirati, enega spola ali vsakega od spolov, če se uporabi oba, na skupino (manj za skupino sočasne pozitivne kontrole – glej odstavek 29). Kadar bi bila lahko izpostavljenost ljudi kemikalijam omejena na en spol, na primer pri nekaterih farmacevtskih izdelkih, je treba preskus opraviti na živalih ustreznega spola. Na podlagi zahtev za največje število živali je za študijo, izvedeno v skladu s parametri iz odstavka 33 s tremi skupinami, ki prejemajo odmerke, ter sočasno negativno in pozitivno kontrolo (pri čemer je vsaka skupina sestavljena iz petih živali enega spola) običajno potrebnih od 25 do 35 živali. ČASOVNI RAZPORED TRETIRANJA Živalim je treba dati odmerke vsak dan v obdobju dveh ali več dni (tj. dva ali več odmerkov na približno 24 ur) in vzorce je treba odvzeti enkrat na 2 do 6 ur (ali ob Tmax) po zadnjem odmerku (12). Vzorci iz daljših časovnih razporedov odmerjanja (npr. 28-dnevno vsakodnevno dajanje odmerkov) so sprejemljivi. Dokazana je bila uspešna kombinacija kometnega preskusa in preskusa mikronukleusov v eritrocitih sesalcev (10) (19). Vendar je treba skrbno obravnavati logistiko v zvezi z vzorčenjem tkiv za kometni preskus, skupaj z zahtevami za vzorčenje tkiv za drugimi vrstami toksikoloških ocen. Odvzem 24 ur po zadnjem odmerku, kar je značilno za splošno študijo toksičnosti, v večini primerov ni ustrezen (glej odstavek 40 o času vzorčenja). Uporaba drugih časovnih razporedov tretiranja in vzorčenja mora biti utemeljena (glej Dodatek 3). Lahko se na primer uporabi enkratni odmerek z večkratnimi vzorčenji, treba pa je opozoriti, da bo za študijo z enkratnim odmerkom treba zagotoviti več živali, saj je potrebno večkratno vzorčenje, vendar je včasih to bolj zaželeno, npr. ko preskusna kemikalija povzroči prekomerno toksičnost po ponavljajočih se odmerkih. Ne glede na način izvedbe preskusa je ta sprejemljiv, če preskusna kemikalija povzroči pozitiven odziv, v primeru negativne študije pa je sprejemljiv, če so bili zbrani posredni ali neposredni dokazi za izpostavljenost ciljnih tkiv ali toksičnost za ta tkiva ali če je bil dosežen mejni odmerek (glej odstavek 36). Preskusne kemikalije se lahko dajo tudi v razdeljenem odmerku, tj. v dveh tretiranjih v istem dnevu, ne več kot 2–3 ure narazen, za lažje dajanje večjih odmerkov. Pod temi pogoji je treba vzorčenje načrtovati glede na čas dajanja zadnjega odmerka (glej odstavek 40). Velikost odmerkov Če se izvede predhodna študija za določanje območja, ker ustrezni podatki iz drugih pomembnih študij, ki bi bili v pomoč pri izbiri odmerkov, niso na voljo, jo je treba izvesti v istem laboratoriju ter uporabiti isto vrsto, sev, spol in režim tretiranja kot v glavni študiji, v skladu s trenutnimi pristopi za izvajanje študij za določanje območja. S študijo je treba določiti največji tolerančni odmerek (MTD), ki je opredeljen kot odmerek, ki povzroči blage toksične učinke, povezane s trajanjem študije (na primer jasne klinične znake, kot so nenormalno vedenje ali odzivi, manjša upočasnitev pridobivanja telesne teže ali citotoksičnost za ciljno tkivo), ne pa smrti ali znakov bolečine, trpljenja ali stiske, zaradi katerih je potrebna evtanazija. Za netoksično preskusno kemikalijo z obdobjem odmerjanja, ki traja 14 dni ali več, znaša največji (mejni) odmerek 1 000 mg/kg telesne teže/dan. Za obdobja odmerjanja, krajša od 14 dni, znaša največji (mejni) odmerek 2 000 mg/kg telesne teže/dan. Te omejitve so lahko drugačne za določene vrste preskusnih kemikalij (npr. farmacevtske izdelke za ljudi), za katere veljajo posebni predpisi. Kemikalije, ki kažejo nasičenost toksikokinetičnih lastnosti ali povzročajo procese razstrupljanja, zaradi katerih se lahko po dolgotrajnem tretiranju zmanjša izpostavljenost, so lahko izjeme pri merilih za določanje odmerkov in treba jih je oceniti za vsak primer posebej. Za akutno in subakutno različico kometnega preskusa je poleg največjega odmerka (MTD, največji izvedljiv odmerek, največja izpostavljenost ali mejni odmerek) treba izbrati tudi padajoče zaporedje vsaj dveh dodatnih, ustrezno razporejenih velikosti odmerkov (po možnosti ločeni za manj kot 10) za vsako vzorčenje, da se dokaže z odmerkom povezane odzive. Uporabljene velikosti odmerkov pa bi morale načeloma zajeti tudi območje od največje do majhne toksičnosti ali netoksičnosti. Kadar se opazi toksičnost za ciljno tkivo pri vseh preskušenih velikostih odmerkov, je priporočena nadaljnja študija z netoksičnimi odmerki (glej odstavka 54 in 55). Študije, ki nameravajo bolj poglobljeno raziskati obliko krivulje odziva na odmerek, bodo morda zahtevale dodatne skupine, ki prejemajo odmerke. Dajanje odmerkov Pri načrtovanju preskusa je treba upoštevati predvideni način izpostavljenosti pri ljudeh. Zato se lahko ob ustrezni utemeljitvi izberejo načini izpostavljenosti, kot so s prehrano, pitno vodo, topično podkožno, intravenozno, oralno (z gavažo), z vdihavanjem, intratrahealno ali z vsadkom. V vsakem primeru pa je treba način izbrati tako, da zagotovi ustrezna izpostavljenost ciljnih tkiv. Dajanje z intraperitonealno injekcijo na splošno ni priporočljivo, saj to ni značilen in pomemben način izpostavljenosti ljudi, in se lahko uporabi samo na podlagi posebne utemeljitve (npr. za nekatere snovi za pozitivno kontrolo, namene preiskovanja ali nekatere droge, ki se dajejo intraperitonealno). Največja količina tekočine, ki se lahko da naenkrat z gavažo ali injekcijo, je odvisna od velikosti poskusne živali. Količina ne sme presegati 1 ml/100 g telesne teže, razen v primeru vodnih raztopin, za katere se lahko uporabi 2 ml/100 g telesne teže. Uporabo večjih količin (če to dovoljuje zakonodaja o dobrobiti živali) je treba utemeljiti. Kadar koli je to mogoče, je treba doseči različne velikosti odmerkov s prilagajanjem koncentracije sestave odmerka, da se zagotovi konstanten volumen glede na telesno težo pri vseh velikostih odmerkov. Čas vzorčenja Čas vzorčenja je ključna spremenljivka, saj je določen z obdobjem, ki je potrebno, da preskusne kemikalije dosežejo najvišjo koncentracijo v ciljnem tkivu in da pride do prelomov verig DNK, ampak preden se ti prelomi odstranijo, popravijo ali vodijo v celično smrt. Obstojnost nekaterih poškodb, ki povzročijo prelome verig DNK, ki jih zazna kometni preskus, je lahko zelo kratka, vsaj pri nekaterih kemikalijah, preskušenih in vitro (52) (53). Če obstaja sum takšnih prehodnih poškodb DNK, je treba v skladu s tem sprejeti ukrepe za zmanjšanje izgub teh poškodb, tako da se zagotovi, da so vzorci tkiv odvzeti dovolj zgodaj, po možnosti pred privzetimi časi, ki so navedeni spodaj. Optimalni časi vzorčenja so lahko odvisni od kemikalije ali načina dajanja, kar na primer pomeni hitro izpostavljenost tkiva z intravenoznim dajanjem kemikalije ali izpostavljenost z vdihavanjem. V skladu s tem in kadar je to mogoče, je treba čas vzorčenja določiti na podlagi kinetičnih podatkov (npr. čas (Tmax), ko je dosežena najvišja koncentracija v plazmi ali tkivu (Cmax), ali stabilno stanje pri večkratnih odmerkih). Če kinetični podatki niso na voljo, je ustrezen kompromis za merjenje genotoksičnosti odvzem vzorca 2–6 ur po zadnjem odmerku pri dveh ali več odmerkih ali 2–6 ur in 16–26 ur po enkratnem odmerku, čeprav je treba paziti, da se nekropsija na vseh živalih opravi ob istem času po zadnjem (ali edinem) odmerku. Za izbiro ustreznih časov vzorčenja se lahko uporabijo tudi informacije o pojavljanju toksičnih učinkov v ciljnih organih (če so na voljo). Opazovanja Splošna klinična opazovanja, povezana z zdravjem živali, je treba opraviti in zabeležiti vsaj enkrat dnevno, po možnosti vsak dan ob istem času in ob upoštevanju obdobja največje intenzivnosti pričakovanih učinkov po odmerjanju (54). Vse živali je treba opazovati vsaj dvakrat na dan, da se ugotovita obolevnost in smrtnost. Pri daljših študijah je treba vse živali stehtati vsaj enkrat na teden in ob koncu preskusnega obdobja. Porabo hrane je treba meriti ob vsaki menjavi hrane in vsaj tedensko. Če se preskusna kemikalija daje s pitno vodo, je treba izmeriti porabo vode ob vsaki menjavi vode in vsaj tedensko. Živali, ki kažejo neletalne znake čezmerne toksičnosti, je treba evtanazirati pred koncem preskusnega obdobja in se običajno ne uporabijo za kometno analizo. Odvzem tkiv Ker je mogoče proučevati indukcijo prelomov verig DNK (kometov) v skoraj vsakem tkivu, je treba izbiro tkiv, ki bodo odvzeta, jasno opredeliti ter utemeljiti z razlogom za izvedbo študije in kakršnimi koli obstoječimi podatki o procesih absorpcije, porazdelitve, presnove in izločanja (ADME), genotoksičnosti, rakotvornosti ali drugi toksičnosti za preiskovane preskusne kemikalije. Pomembni dejavniki, ki jih je treba upoštevati, morajo zajemati način dajanja (na podlagi najverjetnejših načinov izpostavljenosti ljudi), predvideno porazdelitev in absorpcijo v tkivu, vlogo metabolizma ter možni mehanizem delovanja preskusnih kemikalij. Jetra so najpogosteje proučevano tkivo in zanj obstaja največ podatkov. Če torej ni na voljo nobenih informacij o ozadju in niso opredeljena nobena posebna preiskovana tkiva, bi bilo vzorčenje jeter utemeljeno, saj so primarno mesto ksenobiotičnega metabolizma in pogosto močno izpostavljene tako matičnim snovem kot tudi metabolitom. V nekaterih primerih bo morda najustrezneje proučiti mesto neposrednega kontakta (na primer žlezni želodec ali dvanajsternik/tešče črevo za kemikalije, ki se dajejo oralno, ali pljuča za kemikalije, ki se vdihavajo). Izbrati je treba dodatna ali druga tkiva glede na posebne razloge za izvedbo preskusa, morda pa je uporabno proučiti več tkiv istih živali, če je laboratorij dokazal usposobljenost za ta tkiva in hkratno obravnavanje več tkiv. Priprava vzorcev Za procese, opisane v naslednjih odstavkih (44–49), je pomembno, da se vse raztopine ali stabilne suspenzije uporabijo do datuma izteka roka njihove uporabnosti ali se po potrebi pripravijo sveže. V naslednjih odstavkih se kot ključne spremenljivke (glej opredelitve pojmov v Dodatku 1) obravnavajo tudi čas, ki je potreben za (i) odstranitev vsakega tkiva po obdukciji, (ii) predelavo vsakega tkiva v suspenzijo s celicami/jedri in (iii) obdelavo suspenzije in pripravo preparatov, sprejemljivo trajanje vsakega od teh korakov pa bi moralo biti določeno med vzpostavljanjem metode in dokazovanjem usposobljenosti. Živali se evtanazirajo v skladu z veljavno zakonodajo o dobrobiti živali in načeli 3R ob ustreznem času po zadnjem tretiranju s preskusno kemikalijo. Izbrana tkiva se odstranijo in secirajo, en del pa se odvzame za kometni preskus; hkrati je treba odrezati rezino istega dela tkiva in jo vstaviti v formaldehidno raztopino ali ustrezen fiksativ za morebitno histopatološko analizo (glej odstavek 55) v skladu s standardnimi metodami (12). Tkivo za kometni preskus se vstavi v pufer za mletje, spere z zadostno količino hladnega pufra za mletje, da se odstranijo ostanki krvi, in shrani v ledeno mrzlem pufru za mletje do obdelave. Izvede se lahko tudi perfuzija in situ, na primer za jetra ali ledvice. Objavljene so številne metode za izolacijo celic/jeder. Te zajemajo mletje tkiv, kot so jetra in ledvice, postrganje vzorca s sluzničnih površin v primeru prebavnega trakta, homogenizacija in encimska prebava. V validacijskem preskusu JaCVAM so bile proučene samo izolirane celice, zato se v okviru določanja metode in možnosti sklicevanja na podatke preskusa JaCVAM za dokazovanje usposobljenosti priporoča uporaba izoliranih celic. Dokazano pa je bilo, da ni bilo bistvenih razlik v rezultatih preskusa, če so bile uporabljene izolirane celice ali jedra (8). Primerljivi rezultati so bili pridobljeni tudi z različnimi metodami za izolacijo celic/jeder (npr. homogenizacija, mletje, encimska prebava in filtriranje skozi mrežo) (55). Zato se lahko uporabijo izolirane celice ali izolirana jedra. Laboratorij mora skrbno oceniti in validirati metode za izolacijo posameznih celic/jeder, ki se uporabljajo za posamezna tkiva. Kot je navedeno v odstavku 40, je lahko obstojnost nekaterih poškodb, ki vodijo v prelome verig DNK, ki jih zazna kometni preskus, zelo kratka (52) (53). Ne glede na to, katera metoda se uporabi za pripravo suspenzij s posameznimi celicami/jedri, je torej pomembno, da se tkiva obdelajo čim prej po evtanaziji živali in vstavijo v pogoje, ki zmanjšajo odstranjevanje poškodb (npr. hranjenje tkiva pri nizki temperaturi). Suspenzije s celicami se morajo hraniti v ledeno mrzlih pogojih, dokler niso pripravljene za uporabo, zato da se lahko dokažejo kar najmanjše variacije med vzorci ter ustrezni odzivi pozitivnih in negativnih kontrol. PRIPRAVA PREPARATOV Preparate je treba pripraviti čim prej (načeloma v roku ene ure) po pripravi posameznih celic/jeder, temperatura in čas med smrtjo živali in pripravo preparata pa morata biti skrbno nadzorovana in validirana v laboratorijskih pogojih. Volumen suspenzije s celicami, ki se jo doda v agarozo z nizkim tališčem (običajno 0,5–1,0 %) za pripravo preparatov, ne sme zmanjšati odstotka agaroze z nizkim tališčem na manj kot 0,45 %. Optimalna gostota celic bo določena na podlagi sistema za analizo slik, ki se uporablja za ocenjevanje kometov. Liza Pogoji lize so prav tako ključna spremenljivka in lahko vplivajo na prelome verig, ki so posledica posebnih tipov sprememb DNK (določene alkilacije DNK in adukti baz). Priporoča se torej, da se za vse preparate v preskusu ohranijo čim bolj konstantni pogoji lize. Ko so preparati pripravljeni, jih je treba potopiti v ohlajeno lizirno raztopino za vsaj eno uro (ali čez noč) pri približno 2–8 °C in zatemnjenih svetlobnih pogojih, npr. pri rumeni svetlobi (ali povsem zatemnjeno), ki preprečujejo, da bi bili izpostavljeni beli svetlobi, ki lahko vsebuje UV-komponente. Po tej inkubacijski dobi je treba preparate sprati, da se odstranijo ostanki detergenta in soli pred korakom odvitja DNK v alkalnih pogojih. To se lahko stori s prečiščeno vodo, nevtralizacijskim pufrom ali fosfatnim pufrom. Uporabi se lahko tudi elektroforezni pufer. V tem primeru se v komori za elektroforezo ohranijo alkalni pogoji. Odvijanje DNK in elektroforeza Preparati se naključno položijo na platformo horizontalne enote za elektroforezo, ki vsebuje dovolj elektroforezne raztopine, da so površine preparatov povsem prekrite (globina pokritja bi morala biti konsistentna v vsaki ponovitvi preskusa). Pri drugem tipu enot za elektroforezo za kometni preskus, tj. z aktivnim hlajenjem, cirkulacijo in visoko zmogljivim napajanjem, bo večje pokritje z raztopino povzročilo večji električni tok pri konstantni napetosti. Uporabiti je treba uravnoteženo zasnovo za namestitev preparatov v elektroforezni bazen, da se zmanjšajo učinki kakršnih koli trendov ali robov v bazenu in variabilnost posameznih serij, tj. v vsaki ponovitvi elektroforeze mora biti enako število preparatov z vzorcem vsake živali v študiji in vključiti je treba vzorce iz različnih skupin, ki prejemajo odmerke, ter pozitivne in negativne kontrole. Preparate je treba pustiti vsaj 20 minut, da se DNK odvije, nato pa jih izpostaviti elektroforezi pod nadzorovanimi pogoji, ki kar najbolj povečajo občutljivost in dinamično območje preskusa (tj. omogočajo sprejemljive ravni odstotka DNK v repu za negativne in pozitivne kontrole, s katerimi se kar najbolj poveča občutljivost). Raven migracije DNK je linearno povezana s trajanjem elektroforeze in tudi s potencialom (V/cm). Glede na preskus JaCVAM lahko potencial znaša 0,7 V/cm vsaj 20 minut. Trajanje elektroforeze se obravnava kot ključna spremenljivka in čas elektroforeze mora biti nastavljen tako, da optimizira dinamično območje. Daljša elektroforeza (npr. 30 ali 40 minut, da se kar najbolj poveča občutljivost) običajno povzroči močnejše pozitivne odzive z znanimi mutageni. Vendar pa lahko daljša elektroforeza povzroči tudi prekomerno migracijo v kontrolnih vzorcih. V vsakem preskusu mora biti napetost konstantna, variabilnost drugih parametrov pa mora biti znotraj ozkega in določenega območja, na primer v preskusu JaCVAM je potencial 0,7 V/cm dal začetni tok v višini 300 mA. Globino pufra je treba prilagoditi, da se doseže zahtevane pogoje, in jo vzdrževati ves čas preskusa. Zabeležiti je treba tok ob začetku in koncu elektroforeze. Optimalne pogoje je torej treba določiti med začetnim dokazovanjem usposobljenosti v laboratoriju v zvezi z vsakim preiskovanim tkivom. Temperatura elektroforezne raztopine med odvijanjem DNK in elektroforezo mora biti nizka, običajno 2–10 °C (10). Temperaturo elektroforezne raztopine je treba zabeležiti ob začetku odvijanja ter ob začetku in koncu elektroforeze. Po koncu elektroforeze je treba preparate potopiti/spirati v nevtralizacijskem pufru vsaj 5 minut. Geli se lahko obarvajo in ocenijo „sveži“ (npr. v roku 1–2 dni) ali pa se dehidrirajo za poznejše ocenjevanje (npr. v roku 1–2 tednov po barvanju) (56). Vendar je treba validirati pogoje med dokazovanjem usposobljenosti ter pridobiti in ohraniti podatke iz preteklih preskusov ločeno za vsakega od teh pogojev. V primeru poznejšega ocenjevanja je treba preparate dehidrirati tako, da se jih potopi v absolutni etanol za vsaj 5 minut, posuši na zraku in nato shrani pri sobni temperaturi ali v posodi v hladilniku do ocenjevanja. Merilne metode Komete je treba oceniti količinsko z avtomatiziranim ali polavtomatiziranim sistemom za analizo slik. Preparati se obarvajo z ustreznim fluorescentnim barvilom, npr. SYBR Gold, Green I, propidijevim jodidom ali etidijevim bromidom, ter izmerijo pri ustrezni povečavi (npr. 200-kratni) na epifluorescenčnem mikroskopu z ustreznimi detektorji ali digitalno kamero (npr. naprava CCD). Celice se lahko razvrstijo v tri kategorije, kot je opisano v atlasu slik kometov (57), in sicer tiste, ki jih je mogoče oceniti, tiste, ki jih ni mogoče oceniti in celice „hedgehog“ (ang. „jež“ oziroma močno poškodovane celice) (glej odstavek 56 za več podrobnosti). Odstotek DNK v repu je treba oceniti samo za celice, ki jih je mogoče oceniti (jasno razločna glava in rep brez motenj zaradi sosednjih celic), da se prepreči izkrivljene rezultate. O pogostosti celic, ki jih ni mogoče oceniti, ni treba poročati. Pogostost močno poškodovanih celic je treba določiti na podlagi vizualnega ocenjevanja (saj analiza slik ne more zlahka zaznati kometov brez jasno razločne glave) pri vsaj 150 celicah na vzorec (glej odstavek 56 za več podrobnosti) in jih ločeno opisati. Vse preparate za analizo, vključno s tistimi s pozitivnimi in negativnimi kontrolami, je treba neodvisno označiti in oceniti „na slepo“, tako da oseba, ki beleži ugotovitve, ne pozna pogojev tretiranja. Za vsak vzorec (na tkivo na žival) je treba analizirati vsaj 150 celic (kar ne vključuje močno poškodovanih celic – glej odstavek 56). Ocenjevanje 150 celic na žival pri vsaj 5 živalih na odmerek (manj pri sočasni pozitivni kontroli – glej odstavek 29) zagotavlja ustrezno statistično moč glede na analizo, ki so jo opravili Smith idr., 2008 (5). Če se uporabljajo preparati, bi to pomenilo od 2 do 3 ocenjene preparate na vzorec, kadar se uporablja pet živali na skupino. Opazovati je treba več predelov preparata pri gostoti, ki zagotavlja, da se repi ne prekrivajo. Izogniti se je treba ocenjevanju ob robovih preparatov. Pri kometnem preskusu se lahko prelomi verig DNK merijo z neodvisnimi končnimi točkami, kot so odstotek DNK v repu, dolžina repa in repni moment. Izvedejo se lahko vse tri meritve, če se uporablja ustrezna programska oprema za analizo slik. Za vrednotenje in razlago rezultatov pa se priporoča odstotek DNK v repu (ki mu pravimo tudi odstotna intenzivnost repa) (12) (40) (41) (42), določen pa je z intenzivnostjo fragmentov DNK v repu, ki je izražena kot odstotek skupne intenzivnosti celice (13). Poškodbe tkiv in citotoksičnost Pozitivne ugotovitve pri kometnem preskusu morda niso pridobljene samo zaradi genotoksičnosti, saj lahko povečano migracijo DNK povzroči tudi toksičnost za ciljna tkiva (12) (41). Obratno pa je mogoče opaziti nizko ali zmerno citotoksičnost pri znanih genotoksinih (12), kar pomeni, da ni mogoče razlikovati med migracijo DNK, ki jo povzroča genotoksičnost, in tisto, ki jo povzroča citotoksičnost, samo s kometnim preskusom. Vendar če je opažena povečana migracija DNK, je priporočeno, da se prouči enega ali več znakov citotoksičnosti, saj lahko to pripomore k razlagi ugotovitev. Povečano migracijo DNK, če so ugotovljeni jasni dokazi za citotoksičnost, je treba razlagati previdno. Predlagana so bila številna merila citotoksičnosti in izmed teh se kot pomembno merilo toksičnosti za tkiva obravnavajo histopatološke spremembe. S povečano migracijo DNK so povezana opažanja, kot so vnetje, infiltracija celic, apoptozne ali nekrotične spremembe, toda kot je razvidno iz validacijskega preskusa JaCVAM (12), ni na voljo nobenega dokončnega seznama histopatoloških sprememb, ki so vedno povezane s povečano migracijo DNK. Spremembe v meritvah klinične kemije (npr. AST, ALT) lahko tudi zagotovijo uporabne informacije o poškodbah tkiv, razmisli pa se lahko tudi o uporabi dodatnih kazalnikov, kot so aktivacija kaspaze, barvilo TUNEL, barvilo aneksin V itd. Vendar je število objavljenih podatkov, kjer so bili ti uporabljeni v študijah in vivo, omejeno in so nekateri lahko manj zanesljivi kot drugi. Celice „hedgehog“ (ali „ježi“, oblaki, fantomske celice) so celice, ki kažejo mikroskopsko sliko, na kateri so majhna glava majhna (ali pa je ni) in veliki, razpršeni repi, ter ki se obravnavajo kot močno poškodovane celice, čeprav je etiologija „ježev“ negotova (glej Dodatek 3). Zaradi njihovega videza so meritve odstotka DNK v repu z analizo slike nezanesljive, zato je treba močno poškodovane celice oceniti ločeno. Pojavljanje močno poškodovanih celic je treba zabeležiti in ga navesti v poročilu, kakršno koli pomembno povečanje, za katero se predvideva, da ga je povzročila preskusna kemikalija, pa je treba previdno raziskati in razložiti. K takemu obravnavanju lahko pripomore poznavanje morebitnega načina delovanja preskusnih kemikalij. PODATKI IN POROČANJE Obdelava rezultatov Preskusna enota je žival, zato je treba podatke o posamezni živali in povzete rezultate predstaviti v obliki preglednice. Zaradi hierarhične narave podatkov je priporočeno, da se določi mediana odstotka DNK v repu za vsak preparat in izračuna srednja vrednost median za vsako žival (12). Nato se določi srednja vrednost srednjih vrednosti za posamezne živali, da se dobi skupinska srednja vrednost. Vse te vrednosti morajo biti vključene v poročilo. Uporabijo se lahko drugi pristopi (glej odstavek 53), če so znanstveno in statistično utemeljeni. Statistična analiza se lahko izvede z različnimi pristopi (58) (59) (60) (61). Pri izbiri statističnih metod, ki bodo uporabljene, je treba obravnavati potrebo po pretvorbi (npr. logaritemski ali s kvadratnim koren) podatkov in/ali prištevanje majhnega števila (npr. 0,001) k vsem vrednostim (tudi tistim, ki niso ničelne), da se zmanjšajo učinki ničelnih vrednosti celic, kot je opisano v že navedenih virih. Podrobnosti analize interakcije tretiranji in spolom, kadar se uporabita oba spola, in posledična analiza podatkov, pri kateri so ugotovljene razlike ali ne, so opisane v Dodatku 2. V poročilu je treba navesti tudi podatke o toksičnosti in kliničnih znakih. Merila za sprejemljivost Sprejemljivost preskusa temelji na naslednjih merilih:
Vrednotenje in razlaga rezultatov Pod pogojem, da so izpolnjena vsa merila za sprejemljivost, se preskusna kemikalija šteje za jasno pozitivno, če:
Ko so izpolnjena vsa ta merila, se nato šteje, da lahko preskusna kemikalija povzroči prelome verig DNK v tkivih, preiskovanih s tem preskusnim sistemom. Če je izpolnjeno samo eno od teh meril ali dva, glej odstavek 62. Pod pogojem, da so izpolnjena vsa merila za sprejemljivost, se preskusna kemikalija šteje za jasno negativno, če:
Za preskusno kemikalijo se nato šteje, da ne more povzročiti prelomov verig DNK v tkivih, preiskovanih s tem preskusnim sistemom. Preverjanje jasno pozitivnega ali jasno negativnega odziva ni potrebno. V primerih, ko odziv ni jasno negativen ali pozitiven (tj. niso izpolnjena vsa merila, navedena v odstavku 59 oziroma 60), in za pomoč pri opredelitvi biološke pomembnosti rezultata, je treba podatke oceniti s strokovno presojo in/ali izvesti nadaljnje preiskave, če je to znanstveno utemeljeno. Uporabno bi lahko bilo ocenjevanje dodatnih celic (kadar je to ustrezno) ali izvajanje ponovitve preskusa, po možnosti z uporabo optimiziranih preskusnih pogojev (npr. razmik med odmerki, drugi načini dajanja, drugi časi vzorčenj ali druga tkiva). Zbirka podatkov v redkih primerih celo po izvedbi nadaljnjih preiskav onemogoča sprejetje sklepa o pozitivnih ali negativnih rezultatih, zato se zaključi, da je dvoumna. Za oceno biološke pomembnosti pozitivnega ali dvoumnega rezultata so zahtevane informacije o citotoksičnosti ciljnega tkiva (glej odstavka 54 in 55). Če so pozitivne ali dvoumne ugotovitve opažene samo takrat, ko obstaja jasen dokaz o citotoksičnosti, se za študijo zaključi, da je dvoumna za genotoksičnost, razen če ni na voljo dovolj informacij, ki omogočajo dokončen sklep. Kadar se v primerih negativnega rezultata študije opazijo znaki toksičnosti pri vseh preskušenih velikostih odmerkov, je morda priporočena nadaljnja študija z netoksičnimi odmerki. Poročilo o preskusu V poročilo o preskusu se vključijo naslednji podatki:
VIRI
Dodatek 1 OPREDELITVE POJMOV Gelska elektroforeza posamezne celice v alkalnih pogojih : občutljiva tehnika za zaznavanje poškodb primarne DNK na ravni posamezne celice/jedra. Kemikalija : snov ali zmes. Komet : oblika, ki jo zavzamejo nukleoidi, ko so izpostavljeni enemu elektroforeznemu polju, poimenovana zaradi svoje podobnosti kometu: glava je jedro, v repu pa je DNK, ki je v električnem polju migrirala iz jedra. Ključna spremenljivka/parameter : spremenljivka protokola, ki lahko zaradi majhne spremembe močno vpliva na sklepno ugotovitev preskusa. Ključne spremenljivke so lahko specifične za tkivo. Ključne spremenljivke se ne smejo spreminjati, zlasti v okviru preskusa, ne da bi se pretehtal vpliv takih sprememb na odziv v preskusu, na primer kot to določajo stopnja in variabilnost pozitivnih in negativnih kontrol. V poročilu o preskusu morajo biti navedene spremembe ključnih spremenljivk, izvedene med preskusom ali v primerjavi s standardnim protokolom za laboratorij, in za vsako spremembo je treba podati utemeljitev. Intenzivnost repa ali odstotek DNK v repu : ustreza intenzivnosti repa kometa glede na skupno intenzivnost (glava in rep). Iz te vrednosti je razvidna količina prelomov DNK, izražena v odstotkih. Preskusna kemikalija : vsaka snov ali zmes, preskušena s to preskusno metodo. UVCB : snovi z neznano ali spremenljivo sestavo, kompleksni reakcijski produkti ali biološki materiali. Dodatek 2 ZASNOVA PRESKUSA Z VEČ DEJAVNIKI ZA OPREDELITEV RAZLIK MED SPOLOMA PRI KOMETNEM PRESKUSU IN VIVO Zasnova preskusa z več dejavniki in analiza v njenem okviru Pri tej zasnovi se preskusi vsaj 5 živali moškega in vsaj 5 živali ženskega spola pri vsaki koncentraciji, tako da se uporabi vsaj 40 živali (20 moškega in 20 ženskega spola ter ustrezne pozitivne kontrole). Ta zasnova, ki je ena enostavnejših zasnov preskusa z več dejavniki, je enakovredna dvosmerni analizi variance, pri čemer sta glavna učinka spol in koncentracija. Podatki se lahko analizirajo z različnimi standardnimi statističnimi programskimi paketi, kot so SPSS, SAS, STATA, Genstat, ter z uporabo programskega jezika R. Z analizo se variabilnost v naboru podatkov popolnoma razvrsti v variabilnost med spoloma, variabilnost med koncentracijami in variabilnost, povezano z medsebojnim vplivom med spoloma in koncentracijami. Vsak pogoj se preskusi glede na oceno variabilnosti med živalmi iz ponovljenih preskusov v skupinah živali istega spola pri isti koncentraciji. Celotne podrobnosti osnovne metodologije so na voljo v številnih standardnih statističnih učbenikih (glej vire) in pomoči uporabnikom, ki jo zagotavljajo statistični paketi. Analiza se začne s pregledom pogojev medsebojnega vpliva „spol x koncentracija“ v preglednici z analizo variance (35). Če ni precejšnjega medsebojnega vpliva, zagotavljajo skupne vrednosti za spola ali koncentracije veljavne statistične preskuse med koncentracijami, ki temeljijo na združenem vplivu variabilnosti znotraj skupine v preglednici z analizo variance. Analiza se nadaljuje s popolno razvrstitvijo ocene med variabilnostjo koncentracij v kontraste, s čimer se zagotovi preskus za linearne in kvadratne kontraste odzivov med različnimi koncentracijami. Če „spol x koncentracija“ kaže znaten medsebojni vpliv, se lahko ta vpliv popolnoma razvrsti v medsebojne vplive „linearni kontrast x spol“ in „kvadratni kontrast x spol“. S temi vplivi se zagotavljajo preskusi tega, ali so odzivi na koncentracije za oba spola vzporedni ali pa so odzivi med spoloma različni. Ocena združene variabilnosti znotraj skupine se lahko uporabi za pare preskusov v zvezi z razlikami med srednjimi vrednostmi. Te primerjave se lahko naredijo med srednjimi vrednostmi za oba spola in med srednjimi vrednostmi za različne koncentracije, kot na primer za primerjave s stopnjami v negativnih kontrolah. V primerih z znatnim medsebojnim vplivom se lahko primerjajo srednje vrednosti različnih koncentracij pri istem spolu ali srednje vrednosti obeh spolov pri isti koncentraciji. Viri Obstajajo številni statistični učbeniki, v katerih se razpravlja o teoriji, zasnovi, metodologiji, analizi in razlagi zasnove preskusov z več dejavniki, ki se gibljejo od najenostavnejših analiz z dvema dejavnikoma do bolj zapletenih oblik, uporabljenih v metodologiji zasnove poskusov. Naslednji seznam ni izčrpen. V nekaterih knjigah so obdelani primeri primerljivih zasnov, ki imajo v nekaterih primerih kodo za izvajanje analize z uporabo različnih programskih paketov.
Dodatek 3 TRENUTNE OMEJITVE PRESKUSA V okviru trenutnega znanja je s kometnim preskusom in vivo povezanih več omejitev. Te omejitve naj bi se zmanjšale ali ožje opredelile na podlagi vedno več izkušenj z uporabo preskusa za reševanje varnostnih vprašanj v regulativnem okviru.
Viri
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
(16) |
V delu C se poglavje C.13 nadomesti z naslednjim: „C.13 Bioakumulacija v ribah: vodna in prehranska izpostavljenost UVOD Ta preskusna metoda ustreza Smernici za preskušanje OECD (TG) 305 (2012). Glavni cilj te revizije preskusne metode zajema dva vidika. Kot prvo je njen namen zajeti preskus prehranske bioakumulacije (36), ki je primeren za določanje bioakumulacijskega potenciala snovi z zelo nizko topnostjo v vodi. Kot drugo pa je njen namen oblikovati preskusno metodo, ki, kadar je to ustrezno, uporablja manj rib zaradi dobrobiti živali in je bolj stroškovno učinkovita. V letih po sprejetju enotne preskusne metode C.13 (1) so bile preskušene številne snovi, laboratoriji in regulativni organi pa so pridobili mnoge izkušnje. Na podlagi tega se je oblikovalo prepričanje, da se lahko kompleksnost preskusa zmanjša, če so izpolnjena določena merila (prim. odstavek 88), in da je mogoč stopenjski pristop. Izkušnje tudi kažejo, da lahko biološki dejavniki, kot sta rast in vsebnost lipidov v ribah, močno vplivajo na rezultate in da jih je morda treba upoštevati. Poleg tega je bilo ugotovljeno, da preskušanje zelo slabo topnih snovi v vodi morda ni tehnično izvedljivo. Za snovi z zelo nizko topnostjo v vodi v vodnem okolju ima morda izpostavljenost prek vode tudi omejen pomen v primerjavi s prehransko izpostavljenostjo. Na podlagi tega se je oblikovala preskusna metoda, pri kateri so ribe izpostavljene prek njihove hrane (prim. odstavki 7–14 in od 97 naprej). Validacija (krožni preskus) preskusa prehranske izpostavljenosti je bila izvedena leta 2010 (51). Glavne spremembe zajemajo:
Pred izvedbo kakršnih koli bioakumulacijskih preskusov morajo biti znane naslednje informacije o preskusni snovi:
Neodvisno od izbrane metode izpostavljenosti ali sheme vzorčenja ta preskusna metoda opisuje postopek za opredelitev lastnosti bioakumulacijskega potenciala snovi v ribah. Čeprav so najbolj zaželeni režimi pretočnega preskusa, se lahko uporabljajo tudi sistemi polstatičnega preskusa, če so izpolnjena merila za veljavnost (prim. odstavka 24 in 113). Pri načinu prehranske izpostavljenosti za ohranjanje koncentracij preskušane snovi v vodi ni potreben pretočni sistem, vendar slednji pomaga ohraniti ustrezne koncentracije raztopljenega kisika ter zagotoviti čisto vodo in odstraniti različne vplive, npr. produktov izločanja. Neodvisno od izbrane preskusne metode je za to preskusno metodo zagotovljenih dovolj podrobnosti za izvajanje preskusa, hkrati pa ostaja dovolj svobode pri prilagajanju načrta preskusa pogojem v določenih laboratorijih in različnim lastnostim preskusnih snovi. Preskus vodne izpostavljenosti je najustrezneje uporabiti za obstojne organske snovi z vrednostmi log K OW med 1,5 in 6,0 (13), vendar se lahko še vedno uporabi za močno hidrofobne snovi (z vrednostjo log K OW > 6,0), če je mogoče dokazati obstojno in povsem raztopljeno koncentracijo preskusne snovi v vodi. Če ni mogoče dokazati obstojne koncentracije preskusne snovi v vodi, študija vodne izpostavljenosti ni primerna, zato je za preskušanje snovi pri ribah treba uporabiti prehranski pristop (čeprav je razlaga in uporaba rezultatov prehranskega preskusa morda odvisna od regulativnega okvira). Predhodne ocene biokoncentracijskega faktorja (BKF, ki je včasih označen z K B) za organske snovi z vrednostmi log K OW do približno 9,0 je mogoče dobiti z uporabo enačbe iz Bintein idr. (14). Predhodna ocena biokoncentracijskega faktorja za tako močno hidrofobne snovi je morda višja od vrednosti stacionarnega biokoncentracijskega faktorja (BKFSS), ki se pričakuje v laboratorijskih preskusih, zlasti ko se za predhodno oceno uporabi preprost linearni model. Parametri, ki opredeljujejo bioakumulacijski potencial, zajemajo konstanto hitrosti absorpcije (k 1), konstante hitrosti izgube, vključno s konstanto hitrosti očiščenja (k 2), stacionarni biokoncentracijski faktor (BKFSS), kinetični biokoncentracijski faktor (BKFK) in prehranski biomagnifikacijski faktor (BMF) (38). Izotopsko označene preskusne snovi lahko pospešijo analizo vodnih, prehranskih in ribjih vzorcev ter se uporabijo pri odločitvi, ali je treba identificirati in količinsko opredeliti metabolite. Pri merjenju skupnih radioaktivnih ostankov (npr. s sežigom ali solubilizacijo tkiva) temeljita BKF in BMF na skupni vrednosti matične snovi, morebitnih ohranjenih metabolitov in tudi asimiliranega ogljika. Vrednosti BKF in BMF, ki temeljijo na skupnih radioaktivnih ostankih, torej morda niso neposredno primerljive z vrednostmi BKF in BMF, ki so izpeljane z določeno kemijsko analizo zgolj matične snovi. Pred analizo v študijah izotopsko označenih spojin se lahko uporabijo postopki ločevanja, kot so TLC, HPLC ali GC (39), da se določi BKF ali BMF glede na matično snov. Kadar se uporabijo tehnike ločevanja, je treba identificirati ter količinsko opredeliti matično snov in ustrezne metabolite (40) (prim. odstavek 65), če naj bi BKF ali BMF temeljil na koncentraciji matične snovi v ribah, ne pa na skupnih izotopsko označenih ostankih. Študija bioakumulacije se lahko tudi združi s študijo metabolizma rib ali študijo porazdelitve in vivo z analizo in identifikacijo ostankov v tkivih. Možnost metabolizma se lahko predvidi z ustreznimi orodji (npr. orodje QSAR OECD (15) in lastniški programi QSAR). Odločitev o tem, ali naj se izvede preskus vodne ali prehranske izpostavljenosti in kakšen naj bo načrt, mora temeljiti na dejavnikih iz odstavka 3 ob upoštevanju ustreznega regulativnega okvira. Na primer za snovi, ki imajo visoko vrednost log K OW, ampak še vedno kažejo precejšnjo topnost v vodi glede na občutljivost razpoložljivih analitskih tehnik, je treba najprej obravnavati preskus vodne izpostavljenosti. Vendar je mogoče, da informacije o topnosti v vodi niso dokončne za te hidrofobne vrste snovi, zato je treba proučiti možnost priprave obstojnih, merljivih, raztopljenih koncentracij v vodi (obstojne emulzije niso dovoljene), ki se lahko uporabijo za študijo vodne izpostavljenosti, preden se sprejme odločitev o tem, katero preskusno metodo uporabiti (16). Ni mogoče zagotoviti točnih predpisanih smernic o metodi, ki naj se uporabi glede na topnost v vodi in merila za mejno vrednost porazdelitvenega koeficienta n-oktanol/voda, saj lahko imajo drugi dejavniki (analitske tehnike, razgradnja, adsorpcija itd.) opazen vpliv na uporabnost metode zaradi zgoraj opisanih razlogov. Vendar vrednosti log K OW nad 5 in topnost v vodi pod ~0,01–0,1 mg/l označujejo območje snovi, pri katerih lahko postane preskušanje prek vodne izpostavljenosti vedno težje. Upoštevati je treba tudi druge dejavnike, ki lahko vplivajo na izbiro preskusa, vključno s potencialom snovi za adsorbcijo v preskusne posode in opremo ter njeno obstojnostjo v vodni raztopini v primerjavi z njeno obstojnostjo v ribji hrani (17), (18) itd. Informacije o takih praktičnih vidikih so morda na voljo v drugih zaključenih študijah vodne izpostavljenosti. Nadaljnje informacije o vrednotenju vidikov v zvezi z učinkovitostjo bioakumulacijskih študij so na voljo v virih (npr. (19)). Za snovi, pri katerih topnost ali ohranjanje koncentracije v vodi in analiza teh koncentracij ne predstavljata nobenih omejitev za izvedbo metode vodne izpostavljenosti, se priporoča ta metoda za določanje biokoncentracijskega potenciala snovi. V vsakem primeru je treba preveriti, da so koncentracije vodne izpostavljenosti, ki bodo uporabljene, v območju topnosti v vodi v preskusnih medijih. Uporabijo se lahko različne metode za ohranjanje obstojnih koncentracij raztopljene preskusne snovi, na primer uporaba osnovnih raztopin ali sistemov pasivnega odmerjanja (npr. metoda z izpiranjem kolone), če se lahko dokaže, da se lahko ohranijo obstojne koncentracije in da preskusni mediji niso drugačni od teh, priporočenih v odstavku 27. Za močno hidrofobne snovi (log K OW > 5 in topnost pod ~0,01–0,1 mg/l) lahko postane preskušanje prek vodne izpostavljenosti vedno težje. Razlogi za omejitve lahko zajemajo to, da se koncentracija v vodi ne more ohranjati na ravni, ki se šteje za dovolj konstantno (npr. zaradi sorpcije v steklo posode za izpostavljenost ali hitra absorpcija v ribe), ali da so koncentracije v vodi, ki bodo uporabljene, tako nizke, da so v istem območju ali pod analitsko mejo določljivosti (41). Za te močno hidrofobne snovi se priporoča prehranski preskus, če je ta preskus skladen z ustreznim regulativnim okvirom in potrebami po oceni tveganja. Pri površinsko aktivnih snoveh je treba obravnavati, ali je preskus vodne biokoncentracije izvedljiv glede na lastnosti snovi, v nasprotnem primeru je verjetno primernejša prehranska študija. Površinsko aktivne snovi so snovi, aktivne na površini, ki znižujejo medploskovno napetost med dvema tekočinama. Zaradi njihove amfifilne narave (tj. imajo hidrofilni in hidrofobni del) se kopičijo na mejnih ploskvah, kot so mejna ploskev med vodo in zrakom, mejna ploskev med vodo in hrano ter steklena stena, kar ovira določanje njihove koncentracije v vodi. Prehranski preskus lahko zaobide nekatere vidike izpostavljenosti za kompleksne zmesi s sestavinami, ki imajo različne meje topnosti v vodi, saj je primerljiva izpostavljenost vsem sestavinam zmesi verjetnejša kot pri vodni metodi (prim. (20)). Opozoriti je treba, da se s prehranskim pristopom dobi prehranski biomagnifikacijski faktor (BMF), ne pa biokoncentracijski faktor (BKF) (42). Na voljo so pristopi za ocenjevanje kinetičnega biokoncentracijskega faktorja (BKFK) na podlagi podatkov, dobljenih v prehranski študiji (kot je opisano v Dodatku 8, ampak te pristope je treba uporabljati previdno). Na splošno ti pristopi sledijo kinetiki prvega reda in se lahko uporabijo samo za določene skupine spojin. Teh pristopov verjetno ni mogoče uporabiti za površinsko aktivne snovi (glej odstavek 12). Minimiziran načrt preskusa vodne izpostavljenosti z manjšim številom vzorčnih točk, da se zmanjša število živali in/ali virov (prim. od odstavka 83 naprej), se lahko uporabi samo za tiste snovi, za katere se lahko upravičeno pričakuje, da bosta absorpcija in očiščenje približno sledili kinetiki prvega reda (tj. na splošno neionizirane organske snovi, prim. odstavek 88). C.13 – I: Preskus vodne izpostavljenosti za ugotavljanje biokoncentracije v ribah NAČELO PRESKUSA Preskus zajema dve fazi: faza izpostavljenosti (absorpcija) in faza po izpostavljenosti (očiščenje). Med fazo absorpcije je skupina rib ene vrste izpostavljena preskusni snovi pri eni ali več izbranih koncentracijah, kar je odvisno od lastnosti preskusne snovi (prim. odstavek 49). Skupina rib se nato za fazo očiščenja prenese v medij, ki ne vsebuje preskusne snovi. Faza očiščenja je vedno potrebna, razen če je absorpcija snovi med fazo absorpcije zanemarljiva. Koncentracija preskusne snovi v/na ribah (ali določenih tkivih rib) se spremlja v obeh fazah preskusa. Poleg izpostavljene skupine se goji kontrolna skupina rib pod enakimi pogoji, le da ti ne vključujejo preskusne snovi, s čimer se morebitni neželeni učinki, opaženi med biokoncentracijskim preskusom, primerjajo z ustrezno kontrolno skupino, pridobijo pa se tudi koncentracije preskusne snovi v ozadju (43). Pri preskusu vodne izpostavljenosti se faza absorpcije običajno izvaja 28 dni. Trajanje se lahko po potrebi podaljša (prim. odstavek 18) ali skrajša, če se dokaže, da je bilo stacionarno stanje doseženo prej (za opredelitev pojmov in enote glej Dodatek 1). Trajanje faze absorpcije in čas, ki je potreben, da se doseže stacionarno stanje, se lahko predvidi z enačbami iz Dodatka 5. Faza očiščenja se nato začne, ko ribe niso več izpostavljene preskusni snovi, tako da se jih prenese v isti medij, vendar v čisto posodo brez preskusne snovi. Kadar je to mogoče, se biokoncentracijski faktor izračuna po možnosti kot razmerje koncentracije v ribah (C f) in v vodi (C w) v stacionarnem stanju (BKFSS; glej Dodatek 1, opredelitev pojmov) in kot kinetični biokoncentracijski faktor (BKFK; za opredelitev pojmov in enote glej Dodatek 1), ki se oceni kot razmerje konstante hitrosti absorpcije (k 1) in očiščenja (k 2), ki sledita kinetiki prvega reda (44). Če se stacionarno stanje ne doseže v 28 dneh, se izračuna BKF na podlagi kinetičnega pristopa (prim. odstavek 38), lahko pa se podaljša faza absorpcije. Če bi to pomenilo nepraktično dolgo fazo absorpcije, da se doseže stacionarno stanje (prim. odstavka 37 in 38, Dodatek 5), se priporoča kinetični pristop. Za močno hidrofobne snovi pa je treba obravnavati izvedbo prehranske študije (45), če je prehranski preskus skladen z ustreznim regulativnim okvirom. Konstanta hitrosti absorpcije, konstanta hitrosti očiščenja (izgube) (ali konstante, kadar se uporabijo kompleksnejši modeli), biokoncentracijski faktor (stacionarni in/ali kinetični) in, kadar je to mogoče, meje zaupanja za vsakega od teh parametrov se izračunajo na podlagi modela, ki najbolje opisuje izmerjene koncentracije preskusne snovi v ribah in vodi (prim. Dodatek 5). Povečanje mase rib med preskusom povzroči zmanjšanje koncentracije preskusne snovi v rastočih ribah (ki se imenuje razredčitev zaradi rasti), zato je kinetični BKF prenizko ocenjen, če se ga ne popravi na podlagi rasti (prim. odstavka 72 in 73). BKF temelji na skupni koncentraciji v ribi (tj. na celotno mokro težo ribe). Vendar se za posebne namene lahko uporabijo določena tkiva ali organi (npr. mišice, jetra), če so ribe dovolj velike, ali pa se ribe razdelijo na užitne (fileji) in neužitne (drobovje) dele. Ker za mnoge organske snovi velja jasna povezava med potencialom za biokoncentracijo in hidrofobnost, obstaja tudi ustrezno razmerje med vsebnostjo lipidov v preskusnih ribah in ugotovljeno biokoncentracijo takih snovi. Da bi se zmanjšal ta vir variabilnosti v rezultatih preskusa za te snovi z visoko lipofilnostjo (tj. z vrednostjo log K OW > 3), je treba biokoncentracijo izraziti kot normalizirano na ribo s 5-odstotno vsebnostjo lipidov (glede na celotno mokro težo telesa) poleg te, ki se izpelje neposredno iz študije. To je potrebno, da se zagotovi podlaga, na podlagi katere se lahko primerjajo rezultati za različne snovi in/ali preskusne vrste. Pogosto se uporablja 5-odstotna vsebnost lipidov, saj predstavlja povprečno vsebnost lipidov v ribah, ki se običajno uporabljajo pri tej preskusni metodi (21). INFORMACIJE O PRESKUSNI SNOVI Poleg lastnosti preskusne snovi, navedene v uvodu (odstavek 3), so zahtevane tudi informacije o toksičnosti za vrsto rib, ki bo uporabljena v preskusu, po možnosti asimptotični LC50 (tj. neodvisen od časa) in/ali toksičnost, ki je bila ocenjena v dolgotrajnih preskusih pri ribah (npr. TM C.47 (22), C.15 (23), C.14 (24)). Na voljo mora biti ustrezna analitska metoda z znano točnostjo, natančnostjo in občutljivostjo, saj mora biti na voljo količinska opredelitev snovi v preskusnih raztopinah in biološkem materialu ter podrobnosti o pripravi in shranjevanju vzorca. Ravno tako mora biti znana analitska meja določljivosti preskusne snovi v vodi in ribjih tkivih. Kadar se uporabi izotopsko označena preskusna snov, mora ta imeti najvišjo čistost (npr. po možnosti > 98 %), in znan mora biti odstotek radioaktivnosti, povezan z nečistočami. VELJAVNOST PRESKUSA Za veljavnost preskusa morajo biti izpolnjeni naslednji pogoji:
REFERENČNE SNOVI Uporaba referenčnih snovi z znanim biokoncentracijskim potencialom in nizkim metabolizmom bi bila uporabna za preverjanje preskusnega postopka, kadar je to zahtevano (npr. ko laboratorij nima predhodnih izkušenj s preskusom ali so bili spremenjeni preskusnimi pogoji). OPIS METODE Oprema Za vse dele opreme se je treba izogniti uporabi materialov, ki se lahko raztopijo, sorbirajo ali lužijo in imajo neželen učinek na ribe. Uporabijo se lahko standardni pravokotni ali valjasti bazeni iz kemično inertnega materiala in ustrezne prostornine, ki je v skladu s stopnjo obremenitve (prim. odstavek 43). Čim manj je treba uporabljati cevni material iz mehke plastike. Uporabiti je treba cevni material iz politetrafluoroetilena, nerjavnega jekla in/ali stekla. Na podlagi izkušenj je za preskusne snovi z visokim koeficientom adsorpcije, na primer sintetične piretroide, morda treba uporabiti silanizirano steklo. V takih primerih je treba opremo po uporabi zavreči. Priporočeno je, da se preskusne sisteme izpostavi koncentracijam preskusne snovi, ki bodo uporabljene v študiji, za tako dolgo, kot je potrebno, da se dokaže ohranjanje obstojnih koncentracij izpostavljenosti, preden se doda preskusne organizme. Voda Za preskus se običajno uporablja naravna voda, ki mora biti pridobljena iz neonesnaženega vira enotne kakovosti. Morda pa je primernejša modelna razredčevalna voda (tj. demineralizirana voda, ki so ji dodana določena hranila v znanih količinah), da se zagotovi enotna kakovost v daljšem časovnem obdobju. Voda za redčenje oziroma voda, ki je zmešana s preskusno snovjo, preden je dodana v preskusno posodo (prim. odstavek 30), mora biti take kakovosti, ki omogoči preživetje izbrane vrste rib ves čas trajanja aklimatizacije in preskušanja, ne da bi pri tem ta vrsta neobičajno spremenila videz ali vedenje. Načeloma je treba dokazati, da lahko preskusne vrste preživijo, rastejo in se razmnožujejo v vodi za redčenje (npr. v laboratorijski kulturi ali preskusu strupenosti življenjskega cikla). Voda za redčenje mora biti opredeljena vsaj s pH, trdoto, vsemi snovmi v trdem stanju in skupnim organskim ogljikom (TOC (47)), če je mogoče, pa tudi z amonijem, nitritom in alkalnostjo ter slanostjo za morske vrste. Parametri, ki so pomembni za optimalno počutje rib, niso povsem znani, vendar so v Dodatku 2 navedene priporočene najvišje koncentracije številnih parametrov za sladko in morsko preskusno vodo. Voda za redčenje mora biti ves čas preskusa enake kakovosti. Vrednost pH mora biti ob začetku preskusa v območju 6,0 do 8,5, med danim preskusom pa mora biti v območju ± 0,5 pH enot. Za zagotovitev, da voda za redčenje ne bi neprimerno vplivala na rezultat preskusa (na primer s kompleksiranjem preskusne snovi) ali imela neželen učinek na vedenje staleža rib, je treba v časovnih intervalih vzeti vzorce za analizo, vsaj na začetku in koncu preskusa. Določiti je treba težke kovine (npr. Cu, Pb, Zn, Hg, Cd in Ni), glavne anione in katione (npr. Ca2+, Mg2+, Na+, K+, Cl- in SO4 2-), pesticide (npr. skupni organofosforni in skupni organoklorni pesticidi), skupni organski ogljik in suspendirane trdne snovi, na primer vsake tri mesece, kadar se ve, da je voda za redčenje razmeroma konstantne kakovosti. Če se dokaže, da je bila kakovost vode za redčenje konstantna vsaj eno leto, se lahko analize izvajajo manj pogosto, časovni intervali pa se lahko podaljšajo (npr. vsakih šest mesecev). Vsebnost naravnih delcev in skupni organski ogljik vode za redčenje morata biti čim nižja, da se prepreči adsorpcija preskusne snovi na organsko snov, saj lahko to zmanjša njeno biološko dostopnost, to pa lahko pomeni prenizko oceno BKF. Najvišja sprejemljiva vrednost je 5 mg/l za delce (suha snov, ki jo zadrži 0,45 μm filter) in 2 mg/l za skupni organski ogljik (prim. Dodatek 2). Voda za redčenje se mora po potrebi pred uporabi filtrirati. Preskusne ribe (izločki) in ostanki hrane morajo čim manj prispevati k vsebnosti organskega ogljika v preskusni vodi (prim. odstavek 46). Preskusne raztopine Pripravi se osnovna raztopina preskusne snovi z ustrezno koncentracijo. Po možnosti je treba osnovno raztopino pripraviti s preprostim mešanjem ali stresanjem preskusne snovi v vodi za redčenje. V nekaterih primerih je morda ustrezno uporabiti drugo možnost, in sicer sistem odmerjanja za desorpcijo iz trdne faze. Na splošno se ne priporoča uporaba topil in disperzijskih sredstev (sredstev za raztapljanje) (prim. (25)); uporaba teh materialov pa je morda sprejemljiva, da se pridobi osnovna raztopina z ustrezno koncentracijo, vendar si je treba čim bolj prizadevati, da se taki materiali uporabljajo čim manj in da se ne preseže njihova kritična koncentracija tvorbe micel (kadar je to ustrezno). Topila, ki se lahko uporabijo, so aceton, etanol, metanol, dimetilformamid in trietilen glikol; disperzijska sredstva, ki so se uporabila, so Tween 80, metilceluloza 0,01 % in HCO-40. Koncentracija topila v končnem preskusnem mediju mora biti enaka v vseh tretiranjih (tj. neodvisno od koncentracije preskusne snovi) in ne sme presegati ustreznih pragov toksičnosti, ki so bili določeni za topilo v preskusnih pogojih. Najvišja raven je koncentracija, ki znaša 100 mg/l (ali 0,1 ml/l). Koncentracija topila, ki znaša 100 mg/l, verjetno ne bo zelo spremenila najvišje raztopljene koncentracije preskusne snovi, ki jo je mogoče doseči v mediju (25). Znano mora biti, koliko prispeva topilo (skupaj s preskusno snovjo) k skupni vsebnosti organskega ogljika v preskusni vodi. Koncentracija skupnega organskega ogljika v preskusnih posodah ves čas preskusa ne sme preseči koncentracije organskega ogljika, ki izvira iz preskusne snovi, ter topila ali sredstva za raztapljanje (48), kadar se uporabi, za več kot 10 mg/l (± 20 %). Vsebnost organske snovi lahko precej vpliva na količino prosto raztopljene preskusne snovi med pretočnimi preskusi na ribah, zlasti za zelo lipofilne snovi. Mikroekstrakcija na trdni fazi (prim. odstavek 60) lahko zagotovi pomembne informacije o razmerju med vezanimi in prosto raztopljenimi spojinami, slednje pa naj bi predstavljale biološko dostopen del. Koncentracija preskusne snovi mora biti pod mejo topnosti preskusne snovi v preskusnih medijih kljub uporabi topila ali sredstva za raztapljanje. Ob uporabi lahko biorazgradljivih topil je treba biti previden, saj lahko povzročijo težave z rastjo bakterij v pretočnih preskusih. Če ni mogoče pripraviti osnovne raztopine brez uporabe sredstva za raztapljanje, je treba obravnavati ustreznost študije vodne izpostavljenosti v primerjavi s študijo prehranske izpostavljenosti. Za pretočne preskuse je potreben sistem, ki neprestano dovaja in redči osnovno raztopino preskusne snovi (npr. metrična črpalka, proporcionalni razredčevalnik, nasičevalnik), ali sistem odmerjanja za desorpcijo iz trdne faze, da se lahko dovajajo preskusne koncentracije v preskusne komore. Po možnosti se mora v vsaki preskusni komori zamenjati vsaj pet prostornin na dan. Priporočena je pretočna metoda, kadar pa to ni mogoče (npr. ko obstajajo neželeni učinki na preskusne organizme), se lahko uporabi polstatična tehnika, če so izpolnjena merila za veljavnost (prim. odstavek 24). Hitrost pretoka osnovnih raztopin in vode za redčenje je treba preveriti 48 ur pred preskusom in nato vsak dan med preskusom. V to preverjanje je treba zajeti določanje hitrosti pretoka skozi vsako preskusno komoro in zagotoviti, da se ne spreminja za več kot 20 % v komori ali med njimi. Izbira vrst Pomembna merila za izbiro vrst so, da so lahko dostopne, da so na razpolago v primernih velikostih in da se lahko ustrezno gojijo v laboratoriju. Druga merila za izbiro rib vključujejo rekreacijsko, komercialno in ekološko pomembnost ter primerljivo občutljivost, preteklo uspešno uporabo itd. Priporočene preskusne vrste so navedene v Dodatku 3. Uporabijo se lahko tudi druge vrste, vendar je morda treba prilagoditi preskusni postopek, da se zagotovijo ustrezni preskusni pogoji. V tem primeru je treba utemeljiti izbiro vrste in preskusne metode. Na splošno uporaba manjših vrst rib skrajša čas za doseganje stacionarnega stanja, ampak je verjetno potrebnih več rib (vzorcev), da se ustrezno analizira vsebnost lipidov in koncentracij preskusne snovi v ribah. Poleg tega lahko razlike v hitrosti dihanja in metabolizmu med mladimi in starejšimi ribami ovirajo primerjave rezultatov med različnimi preskusi in preskusnimi vrstami. Opozoriti je treba, da lahko vrste rib, preskušene med življenjskim ciklom s hitro rastjo (mlade ribe), otežijo razlago podatkov. Vzdrževanje rib (pomembno za vodno in prehransko izpostavljenost) Populacija staleža rib se mora vsaj dva tedna aklimatizirati v vodi (prim. odstavek 28) pri preskusni temperaturi in ves čas ji je treba zagotavljati zadostno hrano (prim. odstavek 45). Voda in hrana morata biti iste vrste kot tisti, ki bosta uporabljeni med preskusom. Po 48 urah prilagajanja se zabeleži smrtnost in uporabijo se naslednja merila:
Ribe, uporabljene v preskusih, morajo biti brez vidnih bolezni in anomalij. Vse bolne ribe je treba zavreči. Ribe v dveh tednih pred preskusom ali med poskusom ne smejo biti zdravljene zaradi bolezni. IZVEDBA PRESKUSA Predhodni preskus Morda je uporabno izvesti predhodni poskus, da se optimizirajo preskusni pogoji dokončnega preskusa, npr. izbira koncentracij preskusne snovi ter trajanje faze absorpcije in očiščenja, ali da se določi, ali je treba izvesti popoln preskus. Načrt predhodnega preskusa mora biti tak, da se pridobijo zahtevane informacije. Obravnava se lahko, ali bo za izračun BKF morda zadoščal minimiziran preskus ali pa bo potrebna popolna študija (prim. odstavke 83–95 o minimiziranem preskusu). Pogoji izpostavljenosti Trajanje faze absorpcije Trajanje faze absorpcije je mogoče napovedati na podlagi praktičnih izkušenj (npr. iz pretekle študije ali študije akumulacije o strukturno sorodni snovi) ali določenih empiričnih razmerij, ki temeljijo na znanju o topnosti v vodi ali porazdelitvenem koeficientu n-oktanol/voda preskusne snovi (pod pogojem, da absorpcija sledi kinetiki prvega reda, prim. Dodatek 5). Fazo absorpcije je treba izvajati 28 dni, razen če se lahko dokaže, da je bilo stacionarno stanje doseženo že prej (za opredelitev pojmov in enote glej Dodatek 1). Stacionarno stanje je doseženo v grafičnem prikazu preskusne snovi v ribah (C f) v odvisnosti od časa, ko krivulja postane vzporedna s časovno osjo in so tri zaporedne analize C f na vzorcih, vzetih v intervalu najmanj dveh dni, v območju ± 20 % druga od druge ter ni precejšnjega povečanja C f v času med prvo in zadnjo zaporedno analizo. Pri analiziranju združenih vzorcev so potrebne najmanj štiri zaporedne analize. Za preskusne snovi, ki se absorbirajo počasi, so primernejši sedemdnevni intervali. Če stacionarno stanje ni bilo doseženo v 28 dneh, se izračuna BKF s kinetičnim pristopom, ki ni odvisen od doseganja stacionarnega stanja, ali pa se podaljša fazo absorpcije in opravlja nadaljnje meritve, dokler ni doseženo stacionarno stanje ali 60 dni, kar koli od tega je krajše. Koncentracija preskusne snovi v ribah ob koncu faze absorpcije mora tudi biti dovolj visoka, da se zagotovi zanesljiva ocena k 2 iz faze očiščenja. Če se po 28 dneh ne pokaže znatna absorpcija, se lahko preskus ustavi. Trajanje faze očiščenja Za snovi, ki sledijo kinetiki prvega reda, je polovica obdobja trajanja faze absorpcije običajno dovolj za ustrezno (npr. 95 %) zmanjšanje v obremenitvi telesa za snov (prim. Dodatek 5 za razlago ocene). Če je čas, ki je potreben, da se doseže 95 % izgube, nepraktično dolg in na primer dvakrat daljši od normalnega trajanja faze absorpcije (tj. več kot 56 dni), se lahko uporabi krajše obdobje (npr. kadar koncentracija preskusne snovi znaša manj kot 10 % koncentracije v stacionarnem stanju). Za snovi z bolj zapletenimi vzorci absorpcije in očiščenja, kot jih predstavlja enodelni model za ribe, ki zagotavlja kinetiko prvega reda, pa bodo morda potrebne daljše faze očiščenja. Če se opazijo in/ali predvidevajo taki zapleteni vzorci, se priporoča, da se poišče nasvet biostatistika in/ali farmakokinetika, da se zagotovi ustrezen načrt preskusa. Če se čas očiščenja podaljša, je lahko na voljo manjše število rib za vzorčenje, razlike v rasti med ribami pa lahko vplivajo na rezultate. Na to obdobje lahko vpliva tudi obdobje, v katerem koncentracija preskusne snovi v ribah ostane nad analitsko mejo določljivosti. Število preskusnih rib Število rib na preskusno koncentracijo je treba izbrati tako, da so za vsako vzorčno točko na voljo najmanj štiri ribe. Ribe se lahko združi samo, če analiza posameznih rib ni izvedljiva. Če se namerava pridobiti višja natančnost pri prilagajanju krivulje (in izpeljanih parametrih) ali če so potrebne študije o metabolizmu (npr. za razlikovanje med metaboliti in matično snovjo pri uporabi izotopsko označenih preskusnih snovi), je potrebnih več rib na vzorčno točko. Vsebnost lipidov je treba določiti na istem biološkem materialu, kot se uporablja za določanje koncentracije preskusne snovi. Če to ni izvedljivo, bodo mora potrebne dodatne ribe (prim. odstavka 56 in 57). Če se uporabijo odrasle (tj. spolno zrele) ribe, ne smejo biti v stanju drstenja ali nedavno po drstitvi (tj. so se že drstile) pred ali med preskusom. V poročilu je treba tudi navesti, ali so bili v preskusu uporabljeni ribji samci ali samice ali oboji. Če se uporabita oba spola, je treba pred začetkom izpostavljenosti zabeležiti, da so razlike v rasti in vsebnosti lipidov med spoloma zanemarljive, zlasti če se predvideva, da bo treba združiti ribje samce in samice, da se zagotovijo zaznavne koncentracije snovi in/ali vsebnost lipidov. Za kateri koli preskus se izberejo ribe podobne teže, tako da najmanjše niso manjše od dveh tretjin teže največjih. Vse morajo biti vzgojene v istem letu in prihajati iz istega vira. Ker lahko teža in starost ribe precej vplivata na vrednosti BKF (12), je treba te podrobnosti točno zabeležiti. Priporočeno je, da se malo pred preskusom stehta podvzorec staleža rib, da se oceni povprečna teža (prim. odstavek 61). Obremenitev Uporabiti je treba visoka razmerja med vodo in ribami, da se čim bolj zmanjša upadanje koncentracije preskusne spojine v vodi zaradi dodajanja rib na začetku preskusa in da se prepreči zmanjšanje koncentracij raztopljenega kisika. Pomembno je, da stopnja obremenitve ustreza uporabljenim preskusnim vrstam. V vsakem primeru se običajno priporoča stopnja obremenitve med vodo in ribami, ki znaša 0,1–1,0 g rib (mokra teža) na liter vode na dan. Visoke stopnje obremenitve med vodo in ribami se lahko uporabijo, če se pokaže, da se zahtevana koncentracija preskusne snovi lahko ohranja v območju ± 20 % mejnih vrednosti, in da koncentracija raztopljenega kisika ne pade pod 60 % nasičenosti (prim.odstavek 24). Pri izbiri ustreznih režimov obremenitve je treba upoštevati naravni habitat vrste rib. Na primer ribe, ki živijo pri dnu, morda zahtevajo več prostora na dnu akvarija pri enaki prostornini vode v primerjavi z vrstami pelagičnih rib. Hranjenje Med aklimatizacijo in preskušanjem se ribe hranijo z ustrezno hrano, ki ima znano vsebnost lipidov in skupnih proteinov, v zadostnih količinah, ki zagotavljajo zdravo stanje in ohranjanje telesne teže (nekaj rasti je dovoljene). Ribe se med prilagajanjem in preskušanjem hranijo vsakodnevno in z vnaprej določeno količino hrane glede na uporabljeno vrsto, preskusne pogoje in kalorično vrednost hrane (na primer za šarenko približno 1 do 2 % telesne teže na dan). Stopnjo hranjenja je treba izbrati tako, da se prepreči hitra rast in veliko povečanje vsebnosti lipidov. Da se ohrani enaka stopnja hranjenja, je treba količino hrane po potrebi znova ustrezno izračunati, na primer enkrat na teden. Za ta izračun se lahko teža rib v vsaki preskusni komori oceni glede na težo ribe, ki je bila nazadnje vzorčena v tej komori. Ribe, ki ostanejo v komori, se ne tehtajo. Ostanki hrane in iztrebki se iz preskusnih komor izčrpajo vsak dan kmalu po hranjenju (v 30 minutah do ene ure). Posode morajo biti ves čas preskusa čim bolj čiste, da ostane koncentracija organskih snovi čim nižja (prim. odstavek 29), saj lahko prisotnost organskega ogljika omeji biološko dostopnost preskusne snovi (12). Ker veliko hrane temelji na ribji moki, je treba zagotoviti, da hrana ne bo vplivala na rezultate preskusa ali povzročila neželenih učinkov, npr. ker vsebuje (sledove) pesticidov, težkih kovin in/ali same preskusne snovi. Svetloba in temperatura Priporoča se obdobje osvetljenosti od 12 do 16 ur in temperatura (± 2 °C) mora biti ustrezna za preskusno vrsto (prim. Dodatek 3). Vrsta in lastnosti svetlobe morajo biti znane. Paziti je treba na morebitno fototransformacijo preskusne snovi pod obsevalnimi pogoji študije. Uporabiti je treba ustrezno svetlobo, da se prepreči izpostavljenost rib nenaravnim fotoproduktom. V nekaterih primerih je morda ustrezno uporabiti filter, da se zaustavi obsevanje UV pod 290 nm. Preskusne koncentracije Preskus je bil izvorno zasnovan za nepolarne organske snovi. Za to vrsto snovi se pričakuje, da je dovolj izpostavljenost rib eni koncentraciji, saj niso pričakovani nobeni učinki koncentracije, čeprav sta morda zahtevani dve koncentraciji zaradi ustreznega regulativnega okvira. Če se preskušajo snovi, ki ne sodijo v to področje, ali so znane druge indikacije morebitne odvisnosti od koncentracije, je treba izvesti preskus z dvema ali več koncentracijami. Če se preskuša samo ena koncentracija, je treba utemeljiti uporabo ene koncentracije (prim. odstavek 79). Preskusna koncentracija mora biti tako nizka, kot je praktično ali tehnično izvedljivo (tj. ne preblizu meje topnosti). V nekaterih primerih se lahko predvideva, da je biokoncentracija snovi odvisna od koncentracije vode (npr. za kovine, pri katerih se lahko absorpcija v ribe vsaj delno regulira). V takem primeru je potrebno, da se preskusita vsaj dve, po možnosti pa več koncentracij (prim. odstavek 49), ki so ustrezne za okolje. Tudi za snovi, pri katerih morajo biti preskušene koncentracije blizu meje topnosti zaradi praktičnih razlogov, se priporoča preskušanje vsaj dveh koncentracij, saj lahko to zagotovi razumevanje zanesljivosti koncentracij izpostavljenosti. Izbira preskusnih koncentracij mora zajeti koncentracijo, ki je realna za okolje, in koncentracijo, ki je pomembna za namen določene ocene. Koncentracije preskusne snovi je treba izbrati tako, da so pod njeno ravnijo kroničnega učinka ali 1 % akutnega asimptotičnega LC50, v območju, ki je ustrezen za okolje, in vsaj en red velikosti nad njeno mejo določljivosti v vodi z uporabljeno analitsko metodo. Največja dovoljena preskusna koncentracija se lahko določi tudi z deljenjem akutnega 96-urnega LC50 z ustreznim akutnim/kroničnim razmerjem (npr. ustrezna razmerja za nekatere snovi so približno tri, nekaj pa jih je nad 100). Če se uporabi druga koncentracija, mora biti za desetkratnik drugačna od navedene. Če to ni mogoče zaradi merila toksičnosti (ki omejuje zgornjo preskusno koncentracijo) in analitske meje (ki omejuje spodnjo preskusno koncentracijo), se lahko uporabi manjši faktor od deset in treba je obravnavati uporabo izotopsko označene preskusne snovi (z najvišjo čistostjo, npr. po možnosti > 98 %). Zagotoviti je treba, da nobena uporabljena koncentracija ni nad mejo topnosti preskusne snovi v preskusnih medijih. Kontrole Poleg preskusne serije je treba izvesti eno kontrolo z vodo za redčenje ali, če je ustrezno (prim. odstavka 30 in 31), eno kontrolo s topilom. Pogostost meritev kakovosti vode Med preskusom je treba meriti raztopljeni kisik, TOC, pH in temperaturo v vseh preskusnih in kontrolnih posodah. Skupna trdota in slanost (če je ustrezno) se morata meriti v kontrolah in eni posodi. Če se preskušata ena dve več koncentracij, se ti parametri merijo pri višji (ali najvišji) koncentraciji. Raztopljeni kisik in slanost (če je ustrezno) se morata meriti najmanj trikrat – na začetku, približno na sredini in na koncu faze absorpcije – in enkrat tedensko v fazi očiščenja. TOC je treba izmeriti na začetku preskusa (24 in 48 ur pred začetkom faze absorpcije v preskusu), preden se dodajo ribe, in najmanj enkrat tedensko med fazo absorpcije in očiščenja. Temperaturo je treba meriti in beležiti vsak dan, pH na začetku in koncu vsake faze, trdoto pa enkrat na preskus. Temperaturo je treba po možnosti neprestano nadzirati v vsaj eni posodi. Vzorčenje ter analiza rib in vode Časovni razpored vzorčenja rib in vode Vodo je treba vzorčiti iz preskusnih komor, da se določi koncentracija preskusne snovi, preden se dodajo ribe ter med fazo absorpcije in očiščenja. Vodo je treba vzorčiti pred hranjenjem, ob istem času kot se vzorči ribe. Morda je uporabno pogostejše vzorčenje, da se zagotovijo stacionarne koncentracije po dodajanju rib. Med fazo absorpcije je treba določiti koncentracije preskusne snovi, da se preveri skladnost z merili za veljavnost (odstavek 24). Če se z analizami vzorcev vode na začetku faze očiščenja ne zazna preskusne snovi, se to lahko uporabi kot utemeljitev, zakaj se v preostali fazi očiščenja ne bodo opravile meritve preskusne in kontrolne vode za preskusno snov. Ribe je treba za preskusno snov vzorčiti vsaj petkrat med fazo absorpcije in vsaj štirikrat med fazo očiščenja. Ker je v nekaterih primerih na podlagi tega števila vzorcev (zlasti če ni nakazana preprosta kinetika absorpcije in očiščenja prvega reda) težko izračunati ustrezno natančno oceno vrednosti BKF, je morda priporočljivo v obeh fazah odvzeti vzorce pogosteje (prim. Dodatek 4). Vsebnost lipidov je treba določiti na istem biološkem materialu, kakršen se uporablja za določanje koncentracije preskusne snovi, vsaj na začetku in koncu faze absorpcije ter ob koncu faze očiščenja. Če to ni izvedljivo, je treba vzorčiti vsaj tri neodvisne ribe, da se določi vsebnost lipidov v vsaki od istih treh časovnih točk. Ustrezno je treba prilagoditi število rib na bazen na začetku preskusa (49). Če pa se v kontrolnih ribah (tj. ribah iz populacije staleža) ne zaznajo znatne količine preskusne snovi, se lahko analizira kontrolne ribe iz preskusa samo za vsebnost lipidov, analizo preskusne snovi v preskusnih skupinah (in z njo povezane konstanto hitrosti absorpcije, konstanto hitrosti očiščenja in vrednosti BKF) pa se lahko popravi glede na spremembe v skladu z vsebnostjo lipidov v kontrolni skupini med preskusom (50). Mrtve ali bolne ribe se ne smejo analizirati glede koncentracije preskusne snovi ali lipidov. Primer sprejemljivega časovnega razporeda vzorčenja je naveden v Dodatku 4. Drugi režimi se lahko preprosto izračunajo z drugimi predvidenimi vrednostmi K OW, da se izračuna čas izpostavljenosti za 95-odstotno absorpcijo (glej Dodatek 5 za izračune). Vzorčenje je treba nadaljevati med fazo absorpcije, dokler se ne vzpostavi stacionarno stanje (za opredelitev pojmov in enote glej Dodatek 1) ali dokler se drugače ne konča faza absorpcije (po 28 ali 60 dneh, prim. odstavka 37 in 38). Pred začetkom faze očiščenja je treba ribe prenesti v čiste posode. Vzorčenje in priprava vzorcev Pridobiti je treba vzorce vode za analizo, na primer tako da se voda prek inertnega cevnega materiala izčrpa iz središčne točke preskusne posode. Filtriranje in centrifugiranje ne ločita vedno biološko nedostopnega dela preskusne snovi od tega, ki je biološko dostopen. Če se uporabi tehnika ločevanja, je treba zaradi težav z biološko dostopnostjo v poročilu o preskusu vedno zagotoviti utemeljitev ali validacijo tehnike ločevanja (25). Vzorci pa se ne smejo tako tretirati zlasti v primeru močno hidrofobnih snovi (tj. snovi, ki imajo log K OW > 5) (12), (26), pri katerih lahko pride do adsorpcije na matriko filtra ali centrifugirne posode. Namesto tega je treba zagotoviti, da so bazeni čim bolj čisti (prim. odstavek 46), vsebnost skupnega organskega ogljika pa je treba spremljati v fazi absorpcije in očiščenja (prim. odstavek 53). Da se preprečijo morebitne težave z manjšo biološko dostopnostjo, se lahko za slabo topne in močno hidrofobne snovi uporabi vzorčenje na podlagi tehnik mikroekstrakcije na trdni fazi. Vzorčene ribe je treba takoj evtanazirati z najustreznejšo in najbolj humano metodo (za meritve celih rib se ne smejo opravljati nobeni nadaljnji postopki razen spiranja z vodo (prim. odstavek 28) in sušenja ribe s pivnikom). Izmeriti je treba težo in skupno dolžino (51). Za vsako posamezno ribo je treba izmerjeno težo in dolžino povezati z analizirano koncentracijo snovi (in vsebnostjo lipidov, kadar je to ustrezno), na primer z uporabo edinstvene identifikacijske kode za vsako vzorčeno ribo. Ribe in vodo je po možnosti treba analizirati takoj po vzorčenju, da se prepreči razgradnja ali druge izgube ter da se med izvajanjem preskusa izračunata približni konstanti hitrosti absorpcije in očiščenja. S takojšnjo analizo se preprečijo tudi zamude pri določanju, kdaj je bilo doseženo stacionarno stanje. Če se analiza ne izvede takoj, je treba vzorce shraniti na ustrezen način. Pred začetkom študije je treba pridobiti informacije o pravilni metodi shranjevanja za določeno preskusno snov, na primer globoka zamrznitev, shranjevanje pri 4 °C, ekstrakcija itd. Trajanje shranjevanja je treba izbrati tako, da se zagotovi, da se snov med shranjevanjem ne razgradi. Kakovost analitske metode Ker so za celoten postopek pomembne predvsem točnost, natančnost in občutljivost analitske metode, uporabljene za preskusno snov, je treba preveriti s preskušanjem, da so natančnost, točnost in obnovljivost analize snovi ter izkoristek preskusne snovi iz vode in rib zadovoljivi za določeno metodo. To mora biti del predhodnih preskusov. Preveriti je treba tudi, da preskusne snovi ni mogoče zaznati v vodi za redčenje. Vrednosti koncentracij preskusne snovi v vodi in ribah, ki so bile pridobljene s preskusi za izkoristke in vrednosti ozadja za kontrole, je treba po potrebi popraviti. Z vzorci rib in vode je treba ves čas ravnati tako, da se čim bolj zmanjša onesnaženost in izguba (npr. zaradi adsorpcije na napravo za vzorčenje). Analiza vzorcev rib Če se v preskusu uporabljajo izotopsko označeni materiali, se lahko analizira skupni izotopski označevalec (tj. matična snov in metaboliti) ali pa se vzorci očistijo, zato da se lahko matična snov analizira ločeno. Če naj bi BKF temeljil na matični snovi, je treba opredeliti glavne metabolite vsaj ob koncu faze absorpcije (prim. odstavek 6). Glavni metaboliti so tisti, ki predstavljajo ≥ 10 % skupnih ostankov v ribjih tkivih, tisti, ki predstavljajo ≥ 5 % v dveh zaporednih točkah vzorčenja, tisti, ki kažejo rastoče ravni med celotno fazo absorpcije, in tisti z znanim toksikološkim učinkom. Če BKF za celo ribo v smislu skupnih izotopsko označenih ostankov znaša ≥ 500, je morda dobro, za določene kategorije snovi, kot so pesticidi, pa močno priporočljivo, identificirati in količinsko opredeliti glavne metabolite. Nekateri regulativni organi morda zahtevajo količinsko opredelitev takih metabolitov. Če so identificirani in količinsko opredeljeni razkrojki, ki predstavljajo > 10 % skupnih izotopsko označenih ostankov v ribjem tkivu, je nato tudi priporočljivo, da se identificirajo in količinsko opredelijo razkrojki v preskusni vodi. Če to ni izvedljivo, je to treba pojasniti v poročilu. Koncentracijo preskusne snovi je treba običajno določiti za vsako posamezno stehtano ribo. Če to ni mogoče, se lahko združi vzorce ob vsakem vzorčenju, vendar združevanje omeji statistične postopke, ki se lahko uporabijo za podatke, zato je treba v preskus vključiti ustrezno število rib, da bodo izpolnjeni pogoji za želeno združevanje, statistični postopek in moč. Vira (27) in (28) se lahko uporabita kot uvod v ustrezne postopke združevanja. BKF je treba izraziti kot normaliziranega na ribo s 5-odstotno vsebnostjo lipidov (na podlagi mokre teže) poleg tega, ki se izpelje neposredno iz študije (prim. odstavek 21), razen če je mogoče utemeljiti, da se preskusna snov primarno ne kopiči v lipidih. Vsebnost lipidov v ribi je treba določiti ob vsakem vzorčenju, če je to mogoče, po možnosti na istem ekstraktu, kot je ta, ki je bila pridobljen za analizo preskusne snovi, saj je treba lipide pogosto odstraniti iz ekstrakta, preden ga je mogoče analizirati s kromatografijo. Vendar analiza preskusnih snovi pogosto zahteva določene postopke ekstrakcije, ki so lahko v nasprotju s preskusnimi metodami za določanje lipidov. V tem primeru (dokler ni na voljo ustreznih nedestruktivnih instrumentalnih metod) je priporočeno, da se uporabi drugačna strategija za določanje vsebnosti lipidov v ribah (prim. odstavek 56). Za določanje vsebnosti lipidov je treba uporabiti ustrezne metode (20). Kot standardna metoda (30) se lahko priporoča tehnika ekstrakcije z mešanico kloroform-metanol (29), kot druga možnost pa se priporoča Smedesova metoda (31). Značilnosti slednje metode so primerljiva učinkovitost ekstrakcije, visoka točnost, uporaba manj toksičnih organskih topil in preprosta izvedba. Uporabijo se lahko druge metode, če je njihova točnost primerljiva s to iz priporočenih metod in so ustrezno utemeljene. Pomembno je navesti podrobnosti o uporabljeni metodi. Meritve rasti rib Na začetku preskusa je treba stehtati od pet do deset posameznih rib iz populacije staleža in izmeriti njihovo skupno dolžino. To so lahko iste ribe, ki se uporabijo za analizo lipidov (prim. odstavek 56). Težo in dolžino rib, ki bodo uporabljene za vsako vzorčenje iz preskusne in kontrolne skupine, je treba izmeriti pred izvedbo analize kemikalij ali lipidov. Meritve teh vzorčenih rib se lahko uporabijo za oceno teže in dolžine preostalih rib v preskusnem in kontrolnem bazenu (prim. odstavek 45). PODATKI IN POROČANJE Obdelava rezultatov Krivuljo absorpcije preskusne snovi je treba pridobiti tako, da se njena koncentracija v/na ribi (ali določenih tkivih) v fazi absorpcije grafično prikaže v odvisnosti od časa na aritmetični lestvici. Če krivulja doseže stacionarno stanje, torej če postane približno asimptotična na časovno premico, se stacionarni BKF (BKFSS) izračuna na podlagi enačbe:
Rast rib lahko vpliva na potek C f (prim. odstavka 72 in 73). Povprečna koncentracija izpostavljenosti (Cw ) se spreminja s časom. Pričakuje se lahko, da je tehtano povprečje koncentracije v določenem časovnem intervalu ustreznejše in natančnejše za bioakumulacijske študije, tudi če so spremembe v ustreznem območju veljavnosti (prim. odstavek 24). Tehtano povprečje koncentracije vode v določenem časovnem intervalu (TWA, time weighted average) se lahko izračuna z enačbami iz Dodatka 5, oddelek 1. Kinetični biokoncentracijski faktor (BKFK) se določi kot razmerje k 1/k 2 med dvema konstantama hitrosti kinetike prvega reda. Konstanti hitrosti k 1 in k 2 ter BKFK se lahko izpeljejo s hkratnim prilagajanjem faz absorpcije in očiščenja. Konstanti k 1 in k 2 pa se lahko določita tudi zaporedno (glej Dodatek 5 za opis in primerjavo teh metod). Konstanto hitrosti očiščenja (k 2) je morda treba prilagoditi glede na razredčitev zaradi rasti (prim. odstavka 72 in 73). Če krivulja absorpcije in/ali očiščenja očitno ni krivulja prvega reda, je treba uporabiti kompleksnejše modele (glej vire v Dodatku 5) ter poiskati nasvet biostatistika in/ali farmakokinetika. Podatki o teži/dolžini rib Mokra teža in skupna dolžina posameznih rib za vsa vzorčenja se predstavita v preglednici ločeno za preskusno in kontrolno skupino med fazo absorpcije (vključno s populacijo staleža na začetku absorpcije) in očiščenja. Za vsako posamezno ribo je treba izmerjeno težo in dolžino povezati z analizirano koncentracijo kemikalije, na primer z uporabo edinstvene identifikacijske kode za vsako vzorčeno ribo. Po možnosti se teža uporabi kot merilo za rast za namene popravljanja vrednosti kinetičnega BKF glede na razredčitev zaradi rasti (glej odstavek 73 in Dodatek 5 za metodo, ki se uporabi za popravljanje podatkov glede na razredčitev zaradi rasti). Popravki glede na razredčitev zaradi rasti in normalizacija lipidov Rast rib med fazo očiščenja lahko zniža izmerjene koncentracije kemikalije v ribah, kar pomeni, da je skupna konstanta hitrosti očiščenja (k 2) višja, kot pa bi bila samo na podlagi procesov odstranjevanja (npr. dihanje, metabolizem, izločanje). Kinetične biokoncentracijske faktorje je treba popraviti glede na razredčitev zaradi rasti. Rast vpliva tudi na BKFSS, toda na voljo ni nobenega dogovorjenega postopka za popravljanje BKFSS glede na rast. V primerih precejšnje rasti je treba izpeljati tudi BKFK, popravljen glede na rast (BKFKg), saj je morda ustreznejše merilo biokoncentracijskega faktorja. Vsebnost lipidov v preskusnih ribah (ki so tesno povezani z bioakumulacijo hidrofobnih snovi) je lahko v praksi dovolj različna, da jo je treba normalizirati na vnaprej določeno vsebnost lipidov v ribah (5 %, masni delež), da se smiselno predstavita kinetični in stacionarni biokoncentracijski faktor, razen če je mogoče utemeljiti, da se preskusna snov primarno ne kopiči v lipidih (npr. nekatere perfluorirane snovi se lahko vežejo na proteine). Enačbe in primeri teh izračunov so opisani v Dodatku 5. Da se popravi kinetični BKF glede na razredčitev zaradi rasti, je treba popraviti konstanto hitrosti očiščenja glede na rast. Ta konstanta hitrosti očiščenja, popravljena glede na rast (k 2g), se izračuna z odštevanjem konstante hitrosti rasti (k g, pridobljene iz izmerjenih podatkov o teži) od skupne konstante hitrosti očiščenja (k 2). Kinetični biokoncentracijski faktor, popravljen glede na rast, se nato izračuna tako, da se konstanta hitrosti absorpcije (k 1) deli s konstanto hitrosti očiščenja, popravljeno glede na rast (k 2g) (prim. Dodatek 5). V nekaterih primerih ta pristop ni zanesljiv. Na primer za snovi, ki se očistijo zelo počasi in se preskušajo v hitro rastočih ribah, je lahko izpeljana konstanta k 2g zelo nizka, zato postanejo napake v dveh konstantah hitrosti, iz katerih se izpelje, ključnega pomena, v nekaterih primerih pa so lahko ocene kg višje kot k 2. Drug pristop, ki ne zahteva popravljanja glede na razredčitev zaradi rasti, pa zajema uporabo mase preskusne snovi na podatke o očiščenju za ribo (celo ribo) in ne običajne mase preskusne snovi na masno enoto podatkov o (koncentraciji v) ribi. Ta pristop je preprost, saj bi v preskusih, skladnih s to preskusno metodo, zabeležene koncentracije v tkivih morale biti povezane s težo posameznih rib. Preprost postopek za ta pristop je opisan v Dodatku 5. Opozoriti je treba, da je v poročilu še vedno treba navesti k 2, čeprav je uporabljen drugi pristop. Navesti je treba tudi kinetični in stacionarni biokoncentracijski faktor glede na privzeto vsebnost lipidov v ribah, ki znaša 5 % (masni delež), razen če je mogoče utemeljiti, da se preskusna snov primarno ne kopiči v lipidih. Podatki o koncentraciji v ribah ali BKF se normalizirajo glede na razmerje med 5-odstotno in dejansko (posamezno) povprečno vsebnostjo lipidov (v % mokre teže) (prim. Dodatek 5). Če so bile analize kemikalije in lipidov izvedene na isti ribi, je treba uporabiti normalizirane podatke o lipidih v posamezni ribi za izračun BKF, ki je normaliziran glede na vsebnost lipidov. Če pa je rast v kontrolnih in izpostavljenih ribah podobna, se lahko za popravljanje vsebnosti lipidov uporabi samo vsebnost lipidov v kontrolnih ribah (prim. odstavek 56). Metoda za izračun BKF, normaliziranega glede na vsebnost lipidov, je opisana v Dodatku 5. Razlaga rezultatov Rezultate je treba razlagati previdno, kadar so izmerjene koncentracije preskusnih raztopin na ravneh, ki so blizu meje zaznavnosti analitske metode. Povprečna rast v preskusni in kontrolni skupini načeloma ne bi smela biti bistveno drugačna, da se lahko izključijo toksični učinki. Konstanti hitrosti rasti ali krivulji rasti obeh skupin je treba primerjati z ustreznim postopkom (52)). Jasno določeni krivulji absorpcije in očiščenja kažeta na kakovostne podatke o biokoncentraciji. Za konstanti rasti bi moral rezultat preskusa prileganja χ2 pokazati dobro prileganje (tj. majhen odstotek napak pri meritvah (32)) za bioakumulacijski model, zato da se lahko konstanti hitrosti obravnavata kot zanesljivi (prim. Dodatek 5). Če se uporabi več preskusnih koncentracij, morajo spremembe v konstantah absorpcije/očiščenja med preskusnimi koncentracijami znašati manj kot 20 % (53). V nasprotnem primeru to morda kaže na odvisnost od koncentracije. Zabeležiti je treba ugotovljene znatne razlike v konstantah hitrosti absorpcije/očiščenja med uporabljenima preskusnima koncentracijama in zagotoviti možna pojasnila. Na splošno se 95-odstotna meja zaupanja BKF iz dobro načrtovanih študij približa ± 20 % izpeljanega BKF. Če se preskusita dve ali več koncentracij, se uporabijo rezultati obeh ali vseh koncentracij, da se prouči, ali so rezultati dosledni, in pokaže, ali obstaja odvisnost od koncentracije. Če se preskusi samo ena koncentracija, da se zmanjša uporaba živali in/ali virov, je treba utemeljiti uporabo ene koncentracije. Dobljeni BKFSS je nezanesljiv, če je BKFK znatno višji od BKFSS, saj to morda kaže na to, da stacionarno stanje ni bilo doseženo ali da nista bila upoštevana postopek razredčitve zaradi rasti in postopek izgube. V primerih, ko je BKFSS veliko višji od BKFK, je treba preveriti, ali izpeljava konstant hitrosti absorpcije in očiščenja vsebuje napake ter jo ponovno ovrednotiti. Oceno BKFK je morda mogoče izboljšati z drugačnim postopkom prilagajanja (prim. Dodatek 5). Poročilo o preskusu Poleg informacij o preskusni snovi iz odstavka 3 se v poročilo o preskusu vključijo naslednji podatki:
C.13 – II: Minimiziran preskus vodne izpostavljenosti rib UVOD Vedno več izkušenj, ki so jih laboratoriji in regulativni organi pridobili z izvedbo in razlago popolnega preskusa, kaže, da se za oceno konstant hitrosti absorpcije in očiščenja uporablja kinetika prvega reda, razen za nekatere izjeme. Zato se lahko konstanti hitrosti absorpcije in očiščenja ocenita s čim manjšim številom točk vzorčenja ter izpelje kinetični BKF. Proučevanje drugačnih načrtov za študije BKF je bilo najprej namenjeno razvoju kratkega preskusa, ki bi bil uporabljen kot vmesni korak preskušanja, da se potrdi ali ovrže ocene BKF na podlagi K OW in QSAR, s tem pa odpravi potreba po popolni študiji za mnoge snovi ter zmanjša stroške in uporabo živali z zmanjšanim vzorčenjem in številom izvedenih analitskih zaporedij. Ob upoštevanju glavnega načrta prejšnje preskusne metode, da se zagotovi združevanje rezultatov preskusa z obstoječimi podatki o BKF ter olajša izvedba preskusov in razlaga podatkov, je bil cilj zagotoviti ocene BKF z ustrezno točnostjo in natančnostjo za sprejemanje odločitev v zvezi z oceno tveganja. Uporabljajo se mnoga ista načela kot pri popolnem preskusu, npr. merila za veljavnost (prim. odstavek 24) in prekinitev preskusa, če se ob koncu faze absorpcije ugotovi zanemarljiva absorpcija (prim. odstavka 16 in 38). Snovi, za katere se lahko izvede minimiziran načrt preskusa, morajo soditi v splošno območje, za katerega je bila razvita ta preskusna metoda, tj. nepolarne organske snovi (prim. odstavek 49). Če kar koli kaže na to, da bi se lahko snov, ki se bo preskusila, vedla drugače (npr. očitno odstopanje od kinetike prvega reda), je treba zaradi regulativnih razlogov izvesti popoln preskus. Minimiziran preskus se običajno ne izvaja v krajšem časovnem obdobju kot standardni preskus BKF, ampak zajema manj vzorčenj rib (glej Dodatek 6 za utemeljitev). Lahko pa se skrajša faza očiščenja za snovi, ki se zelo hitro očistijo, da se prepreči padec koncentracij v ribah pod mejo zaznavnosti/določljivosti pred koncem preskusa. Minimiziran preskus izpostavljenosti rib z eno koncentracijo se lahko uporabi za opredeljevanje potrebe po popolnem preskusu in če so rezultati preskusa, uporabljeni za izračun konstant hitrosti in BKF, zanesljivi (prim. odstavek 93), se lahko opusti izvedba popolnega preskusa, če dobljeni BKF očitno ne sodi v območje vrednosti, ki zahtevajo regulativni nadzor. V nekaterih primerih je morda bolje izvesti minimiziran načrt preskusa z več preskusnimi koncentracijami kot predhodni preskus, da se določi, ali so ocene BKF za snov odvisne od koncentracije. Če ocene BKF iz minimiziranega preskusa kažejo na odvisnost od koncentracije, je treba izvesti popoln preskus. Če na podlagi takega minimiziranega preskusa ocene BKF niso odvisne od koncentracije, ampak se rezultati ne morejo obravnavati kot dokončni, potem se lahko kateri koli nadaljnji popolni preskus izvede z eno koncentracijo, s tem pa se zmanjša uporaba živali v primerjavi s popolnim preskusom z dvema koncentracijama (ali več). Snovi, za katere se lahko morebiti izvede minimiziran preskus, morajo:
ČASOVNI RAZPORED VZORČENJA ZA ŠTUDIJE, KI SLEDIJO MINIMIZIRANEMU NAČRTU Vzorčenje rib Vzorčenje rib je zmanjšano na štiri točke vzorčenja:
Vzorčenje vode Pri minimiziranem načrtu se voda vzorči kot v popolni študiji (prim. odstavek 54) ali vsaj petkrat, ta vzorčenja pa so enakomerno porazdeljena v fazi absorpcije, in enkrat tedensko v fazi očiščenja. Spremembe načrta Ob upoštevanju lastnosti preskusne snovi, veljavnih napovedi QSAR in določenega namena študije se lahko obravnavajo nekatere spremembe načrta študije:
Izračuni Razlog za ta pristop je, da se lahko biokoncentracijski faktor v popolnem preskusu določi kot stacionarni biokoncentracijski faktor (BKFSS), tako da se izračuna razmerje med koncentracijo preskusne snovi v ribjem tkivu in koncentracijo preskusne snovi v vodi, ali z izračunom kinetičnega biokoncentracijskega faktorja (BKFK), ki je razmerje med konstanto hitrosti absorpcije k 1 in konstanto hitrosti očiščenja k 2. BKFK je veljaven, čeprav med absorpcijo ni dosežena stacionarna koncentracija snovi, če absorpcija in očiščenje približno sledita kinetičnim procesom prvega reda. Za oceno konstant hitrosti absorpcije in očiščenja sta potrebni najmanj dve podatkovni točki, ena ob koncu faze absorpcije (tj. na začetku faze očiščenja) in ena ob koncu faze očiščenja (ali po večjem delu te faze). Priporočena je vmesna točka vzorčenja za preverjanje kinetike absorpcije in očiščenja (57). Za izračune glej Dodatka 5 in 6. Razlaga rezultatov Za oceno veljavnosti in informativnosti preskusa je treba preveriti, da faza očiščenja presega eno razpolovno dobo snovi. Poleg tega je BKFKm (kinetični BKF, izpeljan iz minimiziranega preskusa) treba primerjati z minimizirano vrednostjo BKFSS (tj. BKFSS, izračunan ob koncu faze absorpcije na podlagi predvidevanja, da je bilo doseženo stacionarno stanje. To je mogoče zgolj predvidevati, saj število točk vzorčenja ni zadostno, da se lahko dokaže). Če je BKFKm < minimiziranega BKFSS, mora biti minimizirani BKFSS preferenčna vrednost. Če je BKFKm manjši od 70 % minimiziranega BKFSS, rezultati niso veljavni in treba je izvesti popoln preskus. Če se z minimiziranim preskusom dobi BKFKm v območju kakršne koli vrednosti, ki zahteva regulativni nadzor, je treba izvesti popoln preskus. Če rezultat očitno ne sodi v območje kakršne koli vrednosti, ki zahteva regulativni nadzor (je precej nad ali pod tako vrednostjo), morda ni potrebno izvesti popolnega preskusa, ali pa se lahko izvede popoln preskus z eno koncentracijo, če to zahteva ustrezni regulativni okvir. Če se ugotovi, da je po minimiziranem preskusu z eno koncentracijo treba izvesti popoln preskus, se lahko ta izvede s še eno koncentracijo. Če so rezultati dosledni, se lahko opusti nadaljnji popolni preskus z drugačno koncentracijo, saj se za biokoncentracijo snovi predvideva, da ni odvisna od koncentracije. Če je bil izveden minimiziran preskus z dvema koncentracijama in rezultati kažejo na neodvisnost od koncentracije, se lahko popoln preskus izvede samo z eno koncentracijo (prim. odstavek 87). Poročilo o preskusu V poročilo o preskusu za minimizirani preskus morajo biti vključene vse informacije, ki so zahtevane za popoln preskus (prim. odstavek 81), razen tistih, ki jih ni mogoče natančno pojasniti (tj. krivulja, ki kaže čas za doseganje stacionarnega stanja in stacionarni biokoncentracijski faktor; namesto slednjega je treba navesti minimizirani BKFss). Poleg tega mora zajeti razloge za uporabo minimiziranega preskusa in dobljenega BKFKm. C.13 – III: Preskus prehranske izpostavljenosti za ugotavljanje bioakumulacije v ribah UVOD Metodo, opisano v tem oddelku, je treba uporabljati za snovi, pri katerih izvedba metodologije vodne izpostavljenosti ni praktična (na primer zato, ker ni mogoče ohranjati obstojnih, merljivih koncentracij v vodi ali ker ni mogoče doseči ustreznih obremenitev telesa v 60 dneh izpostavljenosti; glej prejšnje oddelke o metodi vodne izpostavljenosti). Vendar se je treba zavedati, da je končna točka tega preskusa prehranski biomagnifikacijski faktor (BMF) in ne biokoncentracijski faktor (BKF) (58). Maja 2001 je bila na konferenci SETAC Europe v Madridu predstavljena nova metoda za preskušanje bioakumulacije organskih snovi, slabo topnih v vodi (36). To delo temelji na različnih objavljenih bioakumulacijskih študijah v virih, ki uporabljajo metodo odmerjanja na podlagi hrane z dodatkom (npr. (37)). Na začetku leta 2004 je bil delovni skupini PBT EU skupaj s podpornim referenčnim dokumentom (39) predložen osnutek protokola (38), zasnovan za merjenje bioakumulacijskega potenciala organskih snovi, slabo topnih v vodi, pri katerih izvedba standardne metode vodne izpostavljenosti za ugotavljanje biokoncentracije ni bila praktična. Nadaljnja utemeljitev za metodo je bila, da lahko do morebitne izpostavljenosti v okolju takim, slabo topnim snovem (tj. log K OW > 5) pride predvsem s prehrano (prim. (40), (41), (42), (43) in (44)). Zato so v nekaterih objavljenih uredbah o kemikalijah navedeni preskusi prehranske izpostavljenosti (59). Vendar je treba vedeti, da je bila v metodi, opisani v tem dokumentu, izpostavljenost prek vodne faze previdno izpuščena, zato vrednosti BMF iz te preskusne metode ni mogoče neposredno primerjati z vrednostjo BMF iz terenske študije (v kateri sta morda združeni vodna in prehranska izpostavljenost). Ta del trenutne preskusne metode temelji na tem protokolu (38) in je nova metoda, ki se ni pojavila v predhodni različici TM C.13. Ta drugačni preskus omogoča neposredno proučevanje poteka prehranske izpostavljenosti pod nadzorovanimi laboratorijskimi pogoji. Morebitni raziskovalci si morajo prebrati odstavke od 1 do 14 te preskusne metode za informacije o tem, kdaj je bolje izvesti preskus prehranske izpostavljenosti kot pa preskus vodne izpostavljenosti. Navedene so informacije o različnih vidikih snovi, ki jih je treba upoštevati pred izvedbo preskusa. Obravnava se lahko uporaba izotopsko označenih preskusnih snovi, pri tem pa je treba upoštevati podobne vidike kot pri metodi vodne izpostavljenosti (prim. odstavka 6 in 65). Prehranska metoda se lahko uporabi za preskušanje več snovi v enem preskusu, če so izpolnjena določena merila, ki so nadalje obravnavana v odstavku 112. Zaradi preprostosti ta metodologija opisuje preskus s samo eno preskusno snovjo. Prehranski preskus je v mnogih vidikih podoben metodi vodne izpostavljenosti, pri čemer je očitna izjema način izpostavljenosti. Zato se mnogo vidikov metode, opisane v tem dokumentu, prekriva z metodo vodne izpostavljenosti, ki je opisana v prejšnjem oddelku. Uporabljenih je bilo čim več sklicevanj na ustrezne odstavke v prejšnjem oddelku, vendar se določenim podvojitvam ni bilo mogoče izogniti zaradi boljše berljivosti in razumevanja. NAČELO PRESKUSA Uporabiti je mogoče pretočne ali polstatične pogoje (prim. odstavek 4), priporočeni pa so pretočni pogoji, da se omeji morebitna izpostavljenost preskusne snovi prek vode zaradi kakršne koli desorpcije iz hrane z dodatkom ali iz iztrebkov. Preskus zajema dve fazi: absorpcija (hrana z dodatkom preskusne snovi) in očiščenje (čista, netretirana hrana) (prim. odstavek 16). V fazi absorpcije se „preskusna“ skupina rib vsak dan hrani z vnaprej določeno prehrano iz ribje hrane, dostopne na trgu, z znano sestavo, ki ji je dodana preskusna snov. Ribe bi načeloma morale pojesti vso hrano, ki jim je dana (prim. odstavek 141). Nato pa se ribe hranijo s čisto, netretirano ribjo hrano, dostopno na trgu, v fazi očiščenja. Pri metodi vodne izpostavljenosti se lahko po potrebi uporabi več preskusnih skupin z različnimi koncentracijami preskusne snovi z dodatkom, čeprav je za večino močno hidrofobnih, organskih preskusnih snovi dovolj ena preskusna skupina (prim. odstavka 49 in 107). Če se uporabijo polstatični pogoji, je treba ribe prenesti v nov medij in/ali novo preskusno komoro ob koncu faze absorpcije (v primeru, da sta bila medij in/ali oprema, uporabljena v fazi absorpcije, onesnažena s preskusno snovjo zaradi luženja). Koncentracije preskusne snovi v ribah se merijo v obeh fazah preskusa. Poleg skupine rib, ki se hranijo s hrano z dodatkom (preskusna skupina), se kontrolna skupina rib goji pod enakimi pogoji in hrani enako, razen da ribji hrani, dostopni na trgu, ni dodana preskusna snov. Ta kontrolna skupina omogoča, da se količinsko opredelijo ravni ozadja preskusne snovi v neizpostavljenih ribah, in se uporablja za primerjavo v zvezi s kakršnimi koli neželenimi učinki, povezanimi z tretiranjem in opaženimi v preskusnih skupinah (60). Omogoča tudi primerjavo konstant hitrosti rasti med skupinami, da se lahko preveri, ali so ribe pojedle podobno količino ponujene hrane (pri pojasnjevanju različnih konstant hitrosti rasti je treba obravnavati tudi morebitne razlike v okusnosti med hranama; prim. odstavek 138). Pomembno je, da se med fazo absorpcije in očiščenja preskusni in kontrolni skupini daje hrano z enako hranilno vrednostjo. Na podlagi izkušenj raziskovalcev, ki so razvili metodo, je običajno dovolj, da faza absorpcije traja 7–14 dni (38), (39). To obdobje bi moralo čim bolj zmanjšati stroške izvedbe preskusa, hkrati pa zagotoviti zadostno izpostavljenost za večino snovi. V nekaterih primerih pa se lahko faza absorpcije podaljša (prim. odstavek 127). Koncentracija snovi v ribah med fazo absorpcije morda ne bo dosegla stacionarnega stanja, zato obdelava podatkov in rezultati te metode običajno temeljijo na kinetični analizi ostankov v tkivih. (Opomba: pri tem se lahko uporabijo enačbe za oceno časa, ki je potreben za doseganje stacionarnega stanja, tako kot pri preskusu vodne izpostavljenosti – glej Dodatek 5). Faza očiščenja se začne, ko se ribam prvič da hrana brez dodatka, in običajno traja do največ 28 dni ali do takrat, ko ni mogoče več količinsko opredeliti preskusne snovi v celi ribi, kar koli od tega je prej. Faza očiščenja se lahko skrajša ali podaljša za več kot 28 dni glede na spremembe v odvisnosti od časa v izmerjenih koncentracijah kemikalij in velikosti rib. S to metodo se lahko opredelijo razpolovna doba, ki je značilna za snov (t 1/2, iz konstante hitrosti očiščenja, k 2), učinkovitost asimilacije (absorpcija v črevesju; a), kinetični prehranski biomagnifikacijski faktor (BMFK), kinetični prehranski biomagnifikacijski faktor, popravljen glede na rast (BMFKg) in kinetični prehranski biomagnifikacijski faktor, popravljen glede na lipide (61) (BMFKL) (in/ali kinetični prehranski biomagnifikacijski faktor, popravljen glede na rast in lipide, BMFKgL) za preskusno snov v ribah. Tako kot pri metodi vodne izpostavljenosti povečanje mase rib med preskusom povzroči razredčitev preskusne snovi v rastočih ribah, zato je (kinetični) BMF prenizko ocenjen, če se ga ne popravi na podlagi rasti (prim. odstavka 162 in 163). Poleg tega se lahko izračuna indikativen stacionarni BMF, če je ocenjeno, da je bilo v fazi absorpcije doseženo stacionarno stanje. Na voljo so pristopi, ki omogočajo oceno kinetičnega biokoncentracijskega faktorja (BKFK) na podlagi podatkov, pridobljenih v prehranski študiji (npr. (44), (45), (46), (47) in (48). Prednosti in slabosti takih pristopov so opisane v Dodatku 8. Preskus je bil primarno zasnovan za nepolarne organske snovi, slabo topne v vodi, ki približno sledijo kinetiki absorpcije in očiščenja prvega reda v ribah. Če se snov preskusi in ne sledi približnosti kinetiki absorpcije in očiščenja prvega reda, je treba uporabiti kompleksnejše modele (glej vire v Dodatku 5) ter poiskati nasvet biostatistika in/ali farmakokinetika. BMF se običajno določi z analizo preskusne snovi v celi ribi (na podlagi mokre teže). Če je to pomembno za cilj študije, se lahko vzorčijo določena tkiva (npr. mišice, jetra), če se riba razdeli na užitne in neužitne dele (prim. odstavek 21). Poleg tega se lahko odstrani gastrointestinalni trakt in izvede ločena analiza, da se opredeli prispevek h koncentracijam v celi ribi za točke vzorčenja ob koncu faze absorpcije in skoraj na začetku faze očiščenja, ali kot del pristopa masne bilance. Izmeriti je treba vsebnost lipidov v celi vzorčeni ribi, zato da se lahko koncentracije popravijo glede na lipide, pri tem pa se upošteva vsebnost lipidov v hrani in ribi (prim. odstavka 56 in 57 ter Dodatek 7). Izmeriti in zabeležiti je treba težo vzorčenih posameznih rib ter jo povezati z analizirano koncentracijo kemikalije v teh posameznih ribah (npr. z uporabo edinstvene identifikacijske kode za vsako vzorčeno ribo), zato da se lahko izračuna rast, do katere je morda prišlo med preskusom. Kadar je mogoče, je treba izmeriti tudi skupno dolžino ribe (62). Podatki o teži so potrebni tudi za oceno BKF, pri čemer se uporabijo podatki o očiščenju iz prehranskega preskusa. INFORMACIJE O PRESKUSNI SNOVI Na voljo morajo biti informacije o preskusni snovi, kot so opisane v odstavkih 3 in 22. Običajno ni potrebna analitska metoda za koncentracije preskusne snovi v vodi, zahtevane pa so metode z zadostno občutljivostjo za merjenje koncentracij v ribji hrani in tkivih. Metoda se lahko uporabi za preskušanje več snovi v enem preskusu. Vendar morajo biti preskusne snovi med sabo združljive, tako da ne vplivajo druga na drugo in ne spremenijo svoje kemijske identitete, ko se jih doda v ribjo hrano. Cilj je, da se izmerjeni rezultati za vse posamezne snovi, ki so preskušene skupaj, ne razlikujejo veliko od rezultatov, ki bi se pridobili, če bi se izvedli posamezni preskusi za vsako preskusno snov. S predhodnimi analitskimi raziskavami je treba ugotoviti, da se lahko vsaka snov ponovno pridobi iz hrane z več dodatki in vzorca ribjega tkiva z i) visokim izkoristkom (npr. > 85 % nominalne vrednosti) in ii) ustrezno občutljivostjo za preskušanje. Skupni odmerek snovi, ki se preskušajo skupaj, mora biti nižji od skupne koncentracije, ki bi lahko povzročila toksične učinke (prim. odstavek 51). Poleg tega je treba pri načrtu preskusa upoštevati morebitne neželene učinke pri ribah in potencial za vzajemne učinke (npr. metabolične učinke), ki so povezani s preskušanjem več snovi hkrati. Izogniti se je treba tudi sočasnemu preskušanju snovi, ki lahko ionizirajo. V smislu izpostavljenosti je metoda primerna tudi za kompleksne zmesi (prim. odstavek 13, čeprav zanjo veljajo enake omejitve pri analizi kot za katero koli drugo metodo). VELJAVNOST PRESKUSA Za veljavnost preskusa morajo biti izpolnjeni naslednji pogoji (prim. odstavek 24):
REFERENČNE SNOVI Če laboratorij še ni izvedel preskusa ali je prišlo do precejšnjih sprememb (npr. sprememba seva ali dobavitelja rib, druga vrsta rib, precejšnje spremembe v velikosti rib, ribji hrani ali metodi dodajanja snovi v hrano itd.), se priporoča izvedba študije tehnične usposobljenosti z referenčno snovjo. Referenčna snov se uporablja predvsem ugotavljanje, ali je tehnika za dodajanje snovi v hrano ustrezna, da se zagotovi čim večja homogenost in biološka dostopnost preskusnih snovi. Primer, ki je bil uporabljen v primeru nepolarnih hidrofobnih snovi, je heksaklorobenzen (HCB), vendar je treba zaradi nevarne lastnosti heksaklorobenzena obravnavati druge snovi, za katere so na voljo obstoječi, zanesljivi podatki o absorpciji in biomagnifikaciji (63). Če se uporabi referenčna snov, je treba v poročilu o preskusu zagotoviti osnovne informacije o tej snovi, vključno z imenom, čistostjo, številko CAS, strukturo in podatki o toksičnosti (če so na voljo), tako kot za preskusne snovi (prim. odstavka 3 in 22). OPIS METODE Oprema Materiali in oprema morajo biti uporabljeni tako, kot je opisano v metodi vodne izpostavljenosti (prim. odstavek 26). Uporabiti je treba pretočni preskusni sistem ali preskusni sistem za statično obnavljanje vode, ki zagotavlja zadostno prostornino vode za redčenje v preskusnih bazenih. Zabeležiti je treba hitrost pretoka. Voda Preskusna voda mora biti uporabljena tako, kot je opisano v metodi vodne izpostavljenosti (prim. odstavka 27–29). Preskusni medij je treba opredeliti, kot je opisano, in kakovost medija mora biti med preskusom konstantna. Vsebnost naravnih delcev in skupni organski ogljik (TOC) morata biti čim nižja (≤ 5 mg/l delcev; ≤ 2 mg/l skupnega organske ogljika) pred začetkom preskusa. TOC je treba izmeriti samo pred preskusom v okviru opredelitve lastnosti preskusne vodi (prim. odstavek 53). Hrana Priporočena je ribja hrana, ki je dostopna na trgu (peleti, ki plavajo in/ali počasi potonejo na dno) in ima opredeljene vsaj vsebnost proteinov in maščob. Peleti morajo biti enake velikosti, da se poveča učinkovitost izpostavljenosti hrani, tj. ribe bodo pojedle več hrane, saj ne bodo jedle samo večjih kosov in zgrešile manjše. Na začetku preskusa je treba izbrati pelete ustrezne velikost glede na velikost rib (npr. uporabijo se lahko peleti s približnim premerom 0,6–0,85 mm za ribe s skupno dolžino od 3 do 7 cm in 0,85–1,2 mm za ribe s skupno velikostjo od 6 do 12 cm). Na začetku faze očiščenja se lahko velikost peletov prilagodi glede na rast rib. Primer ustrezne sestave hrane, ki je dostopna na trgu, je naveden v Dodatku 7. Pri razvoju te metode je bila običajno uporabljena preskusna hrana s skupno vsebnostjo lipidov od 15 do 20 % (masni delež). Na nekaterih območjih morda ni na voljo ribja hrana s tako visoko koncentracijo lipidov. V takih primerih se lahko študije primerov izvedejo z nižjo koncentracijo lipidov v hrani in po potrebi ustrezno prilagodi stopnjo hranjenja za ohranjanje zdravja rib (na podlagi predhodnega preskušanja). Pred začetkom preskusa in ob koncu faze absorpcije je treba izmeriti in zabeležiti skupno vsebnost lipidov v hrani preskusne in kontrolne skupine. V poročilu o študiji je treba predstaviti podrobnosti, ki jih je zagotovil dobavitelj hrane, dostopne na trgu, o analizi za hranila, vlago, vlaknine in pepel ter po možnosti ostanke mineralov in pesticidov (npr. „standardna“ prednostna onesnaževala). Pri dodajanju preskusne snovi v hrano si je treba čim bolj prizadevati, da se zagotovi homogenost v celotni preskusni hrani. Koncentracijo preskusne snovi v hrani za preskusno skupino je treba izbrati ob upoštevanju občutljivosti analitske tehnike, toksičnosti preskusne snovi (NOEC, če je znan) in ustreznih fizikalno-kemijskih podatkov. Če se uporabi referenčna snov, jo je treba po možnosti vključiti pri koncentraciji, ki znaša približno 10 % koncentracije preskusne snovi (oziroma je v vsakem primeru tako nizka, kot je praktično izvedljivo), glede na občutljivost analize (npr. za heksaklorobenzen je bilo ugotovljeno, da sprejemljiva koncentracija v hrani znaša 1–100 μg/g; prim. (47) za več informacij o učinkovitosti asimilacije HCB). Preskusna snov se lahko ribji hrani doda na več načinov glede na njene fizikalne lastnosti in topnost (glej Dodatek 7 za več podrobnosti o metodah za dodajanje snovi v hrano):
V nekaterih primerih, npr. za manj hidrofobne preskusne snovi, za katere obstaja verjetnost desorpcije iz hrane, je morda treba na pripravljene pelete hrane nanesti majhno količino koruznega/ribjega olja (glej odstavek 142). V takih primerih je treba kontrolno hrano tretirati enako in zadnjo pripravljeno hrano uporabiti za merjenje vsebnosti lipidov. Če se uporabi referenčna snov, morajo ti rezultati biti primerljivi s podatki študij iz virov, ki so bile izvedene v podobnih pogojih in s primerljivo stopnjo hranjenja (prim. odstavek 45), in parametri, značilni za referenčno snov, morajo izpolnjevati ustrezna merila iz odstavka 113 (3., 4. in 5. točka). Če se kot vehikel za preskusno snov uporabi olje ali topilo, je treba enako količino istega vehikla (brez preskusne snovi) primešati kontrolni hrani, da je ta enaka hrani z dodatkom. Pomembno je, da se med fazo absorpcije in očiščenja preskusni in kontrolni skupini daje hrano z enako hranilno vrednostjo. Hrano z dodatkom je treba shranjevati pod pogoji, ki ohranjajo obstojnost preskusne snovi v mešanici hrane (npr. hlajenje), in te pogoje navesti v poročilu. Izbira vrste rib Uporabijo se lahko ribe, ki so navedene za preskus vodne izpostavljenosti (prim. odstavek 32 in Dodatek 3). Šarenka (Oncorhynchus mykiss), krap (Cyprinus carpio) in črnoglavi pisanec (Pimephales promelas) so bili pogosto uporabljeni v študijah prehranske bioakumulacije z organskimi snovmi pred objavo te preskusne metode. Vrsta rib se mora pri hranjenju vesti tako, da zelo hitro poje dani obrok hrane, saj se s tem čim bolj omeji kakršen koli dejavnik, ki vpliva na koncentracijo preskusne snovi v hrani (npr. luženje v vodo in možnost vodne izpostavljenosti). Uporabiti je treba ribe z velikostjo/težo v priporočenem območju (prim. Dodatek 3). Ribe ne smejo biti tako majhne, da bi njihova velikost ovirala preprostost analize posameznih rib. Ribje vrste, preskušene v fazi hitre rasti, lahko otežijo razlago podatkov, hitra rast pa lahko vpliva na izračun učinkovitosti asimilacije (64). Vzdrževanje rib Merila za sprejemljivost v zvezi z aklimatizacijo, smrtnostjo in boleznijo so enaka kot pri metodi vodne izpostavljenosti pred izvedbo preskusa (prim. odstavki 33–35). IZVEDBA PRESKUSA Raziskave pred študijo in preskus za določanje območja Analitske raziskave pred študijo so potrebne, da se dokaže izkoristek snovi iz hrane z dodatkom/ribjega tkiva z dodatkom. Preskus za določanje območja, da se izbere ustrezna koncentracija v hrani, ni vedno potreben. Lahko se izvede predhodne prehranske preskuse, vendar ti niso obvezni, da se pokaže, da niso ugotovljeni nobeni neželeni učinki, da se oceni okusnost hrane z dodatkom ter občutljivost analitske metode za ribja tkiva in hrano ter da se izbere ustrezno stopnjo hranjenja in intervale vzorčenja med fazo očiščenja itd. Predhodna študija je lahko dragocena za oceno števila rib, ki je potrebno za vzorčenje med fazo očiščenja. To lahko pomeni precejšnje zmanjšanje števila uporabljenih rib, zlasti za preskusne snovi, ki so še posebej dojemljive za metabolizem. Pogoji izpostavljenosti Trajanje faze absorpcije Običajno je dovolj, da faza absorpcije traja 7–14 dni, in med tem se vsak dan ena skupina rib hrani s kontrolno hrano, druga skupina rib pa s preskusno hrano na podlagi vnaprej določenega obroka, ki je odvisen od preiskovane vrste in preskusnih pogojev, npr. med 1–2 % telesne teže (mokra teža) v primeru šarenke. Stopnjo hranjenja je treba izbrati tako, da se prepreči hitra rast in veliko povečanje vsebnosti lipidov. Faza absorpcije se lahko po potrebi podaljša glede na praktične izkušnje iz preteklih študij ali znanja o absorpciji/očiščenju preskusne (ali druge ustrezne) snovi. Začetek preskusa je opredeljen s prvim hranjenjem s hrano z dodatkom. Preskusni dan traja od hranjenja do malo pred začetkom naslednjega hranjenja (npr. eno uro). Prvi preskusni dan absorpcije torej traja od prvega hranjenja s hrano z dodatkom in se konča malo pred drugim hranjenjem s hrano z dodatkom. V praksi se faza absorpcije konča malo pred (npr. eno uro) prvim hranjenjem s preskusno snovjo brez dodatka, saj bodo ribe še naprej prebavljale hrano z dodatkom in absorbirale preskusno snov v vmesnih 24 urah. Pomembno je zagotoviti, da se s preskusno snovjo doseže dovolj visoko (netoksično) obremenitev telesa glede na analitsko metodo, zato da se lahko med fazo očiščenja izmeri upad vsaj enega reda velikosti. V posebnih primerih se lahko faza absorpcije podaljša (do največ 28 dni) in uporabi dodatno vzorčenje, da se zberejo ugotovitve o kinetiki absorpcije. Med absorpcijo koncentracija v ribah morda ne bo dosegla stacionarnega stanja. Pri tem se lahko tako kot za preskus vodne izpostavljenosti uporabijo enačbe za oceno časa, ki je potreben za doseganje stacionarnega stanja, te pa pokažejo, kako dolgo najverjetneje traja, da se dosežejo znatne koncentracije v ribah (prim. Dodatek 5). V nekaterih primerih je morda znano, da 7–14 dni za absorpcijo snovi v ribe ni dovolj, da bi uporabljena koncentracija hrane dosegla dovolj visoko koncentracijo v ribah, da bi se analiziral upad vsaj enega reda velikosti med očiščenjem, zaradi slabe analitske občutljivosti ali nizke učinkovitosti asimilacije. V takih primerih je morda priporočljivo podaljšati začetno fazo hranjenja na več kot 14 dni ali pa obravnavati višjo koncentracijo v hrani, zlasti za močno prebavljive snovi. Toda treba je paziti, da se obremenitev telesa med absorpcijo ohranja pod (ocenjeno) kronično koncentracijo brez opaznega učinka (NOEC) v ribjem tkivu (prim. odstavek 138). Trajanje faze očiščenja Očiščenje običajno traja do največ 28 dni in se začne, ko se ribe v preskusni skupini nahrani s čisto, netretirano hrano po fazi absorpcije. Očiščenje se začne s prvim dajanjem hrane „brez dodatka“ in ne takoj po zadnjem hranjenju s hrano „z dodatkom“, saj bodo ribe še naprej prebavljale hrano in absorbirale preskusno snov v vmesnih 24 urah, kot je opisano v odstavku 126. Zato se prvi vzorec v fazi očiščenja vzame malo pred drugim hranjenjem s hrano brez dodatka. Ta faza očiščenja je zasnovana tako, da vključuje snovi z morebitno razpolovno dobo do največ 14 dni, kar je skladno z razpolovno dobo bioakumulacijskih snovi (65), pri čemer 28 dni torej zajema dve razpolovni dobi takih snovi. V primerih močno bioakumulacijskih snovi je morda priporočljivo podaljšati fazo očiščenja (če je to razvidno iz predhodnega preskušanja). Če se snov očiščuje tako počasi, da v fazi očiščenja ni mogoče točno določiti razpolovne dobe, je morda še vedno na voljo dovolj informacij za namene ocenjevanja, da se pokaže visoka raven bioakumulacije. Če pa se snov očiščuje tako hitro, da ni mogoče izpeljati zanesljive koncentracije ob času nič (koncentracije ob koncu absorpcije/začetku očiščenja, C 0,d) in k 2, se lahko ugotovi previdna ocena k 2 (prim. Dodatek 7). Če analize rib v zgodnejših intervalih (npr. 7 ali 14 dni) kažejo, da se je snov pred celotnim 28-dnevnim obdobjem očistila do te mere, da je padla pod mejo določljivosti, se lahko nadaljnje vzorčenje in preskus prekineta. V nekaterih primerih ob koncu faze absorpcije (ali z drugim vzorcem očiščenja) morda ne pride do izmerljive absorpcije preskusne snovi. Če se lahko dokaže, da: i) so izpolnjena merila za veljavnost iz odstavka 113 in ii) do pomanjkanja absorpcije ni prišlo zaradi kakšne druge pomanjkljivosti preskusa (npr. prekratko trajanje absorpcije, pomanjkljiva tehnika za dodajanje snovi v hrano, ki povzroči slabo biološko dostopnost, pomanjkanje občutljivosti analitske metode, ribe ne jedo hrane itd.), se lahko študija prekine, ne da bi jo bilo treba znova izvesti z daljšim trajanjem absorpcije. Če so predhodne raziskave pokazale, da lahko pride do tega, je priporočljivo izvesti analizo iztrebkov za neprebavljeno preskusno snov v okviru pristopa „masne bilance“, če je to mogoče. Število preskusnih rib Podobno kot pri preskusu vodne izpostavljenosti je treba izbrati ribe podobne teže in dolžine, tako da najmanjše ribe niso manjše od dveh tretjin teže največjih (prim. odstavki 40–42). Skupno število rib za študijo je treba izbrati na podlagi časovnega razporeda vzorčenja (najmanj en vzorec ob koncu faze absorpcije in štiri do šest vzorcev med fazo očiščenja, vendar je to odvisno od trajanja faz), pri tem pa je treba upoštevati občutljivost analitske tehnike, koncentracijo, ki bo najverjetneje dosežena ob koncu faze absorpcije (na podlagi predhodnega znanja), in trajanje očiščenja (če se lahko na podlagi predhodnega znanja izvede ocena). Ob vsakem dogodku je treba vzorčiti pet do deset rib, pri čemer se parametri rasti (teža in skupna dolžina) izmerijo pred analizo kemikalije in lipidov. Zaradi neločljivih razlik v velikosti, hitrosti rasti in fiziologiji med ribami ter možnih razlik v količini dane hrane, ki jo poje vsaka riba, je v vsakem intervalu treba vzorčiti vsaj pet rib iz preskusne skupine in pet rib iz kontrolne skupine, da se ustrezno oceni povprečna koncentracija in njena variabilnost. Razlike med uporabljenimi ribami bodo verjetno prispevale več k skupni nenadzorovani variabilnosti preskusa kot pa k variabilnosti, ki je del uporabljenih analitskih metodologij, zato je v nekaterih primerih upravičena uporaba do največ deset rib na točko vzorčenja. Če pa koncentracije ozadja preskusne snovi v kontrolnih ribah niso izmerljive na začetku očiščenja, je morda dovolj kemijska analiza pri dveh do treh kontrolnih ribah v zadnjem intervalu vzorčenja, če se ob vseh točkah vzorčenja še vedno vzorčijo teža in skupna dolžina preostalih kontrolnih rib (zato da se vzorči rast istega števila rib iz preskusne in kontrolne skupine). Ribe je treba shraniti, posamezno stehtati (tudi če se izkaže, da je treba pozneje združiti rezultate vzorčenja) in izmeriti skupno dolžino. Za standardni preskus z na primer 28-dnevno fazo očiščenja, vključno s petimi vzorci očiščenja, to pomeni skupno 59–120 rib iz preskusne in 50–110 rib iz kontrolne skupine, pri čemer se predvideva, da se z analitsko tehniko za snov lahko izvede analiza vsebnosti lipidov na istih ribah. Če analize lipidov ni mogoče izvesti na istih ribah kot kemijsko analizo in če tudi ni izvedljivo uporabiti kontrolnih rib samo za analizo lipidov (prim. odstavek 56), je potrebnih dodatnih 15 rib (tri iz populacije staleža ob začetku preskusa, po tri ribe iz kontrolne in preskusne skupine ob začetku očiščenja ter po tri ribe iz kontrolne in preskusne skupine ob koncu preskusa). Primer časovnega razporeda vzorčenja s številom rib je opisan v Dodatku 4. Obremenitev Uporabiti je treba podobno visoka razmerja med vodo in ribami kot pri metodi vodne izpostavljenosti (prim. odstavka 43 in 44). Čeprav stopnje obremenitve med vodo in ribami v tem preskusu ne vplivajo na koncentracije izpostavljenosti, se priporoča stopnja obremenitve, ki znaša 0,1–1,0 g rib (mokra teža) na liter vode na dan, da se ohranijo ustrezne koncentracije raztopljenega kisika in čim bolj omeji stres pri preskusnih organizmih. Preskusna hrana in hranjenje Med aklimatizacijo je treba ribe hraniti z ustrezno hrano, kot je opisano zgoraj (odstavek 117). Če se preskus izvaja pod pretočnimi pogoji, je treba pretok med hranjenjem rib ustaviti. Med preskusom mora hrana za preskusno skupino ustrezati tej, opisani zgoraj (odstavki 116–121). Poleg upoštevanja dejavnikov, značilnih za snov, analitske občutljivosti, pričakovane koncentracije v hrani pod pogoji v okolju in ravni kronične toksičnosti/obremenitve telesa je treba pri izbiri ciljne koncentracije za dodatek k hrani obravnavati tudi okusnost hrane (zato da je ribe ne zavračajo). V poročilu je treba navesti nominalno koncentracijo preskusne snovi za dodatek k hrani. Na podlagi izkušenj koncentracije za dodatek k hrani, ki znašajo 1–1000 μg/g, zagotavljajo praktično delovno območje za preskusne snovi, ki ne kažejo določenih toksičnih mehanizmov. Pri snoveh, ki delujejo z nedoločenim mehanizmom, ravni ostankov v tkivih ne smejo preseči 5 μmol/g lipidov, saj ostanki nad to ravnijo najverjetneje povzročajo kronične učinke (19), (48) in (50) (66). Pri drugih snoveh je treba paziti, da se zaradi akumulirane izpostavljenosti ne pojavijo neželeni učinki (prim. odstavek 127). To še zlasti velja, če se preskuša več kot ena snov hkrati (prim. odstavek 112). Ustrezna količina preskusne snovi se lahko doda k ribji hrani na enega od treh načinov, opisanih v odstavku 119 in Dodatku 7. Metode in postopke za dodajanje preskusne snovi k hrani je treba opisati v poročilu. Kontrolne ribe je treba hraniti z netretirano hrano, ki vsebuje enako količino oljnega vehikla brez dodatka, če je ta bil uporabljen v hrani z dodatkom za fazo absorpcije, ali ki je tretirana s „čistim“ topilom, če je bilo za pripravo hrane za preskusno skupino uporabljeno topilo. Tretirano in netretirano hrano je treba vsaj trikrat analitsko izmeriti glede koncentracije preskusne snovi pred začetkom in ob koncu faze absorpcije. Po izpostavljenosti tretirani hrani (faza absorpcije), se ribe (obe skupini) hrani z netretirano hrano (faza očiščenja). Ribe se hranijo z vnaprej določenim obrokom (glede na vrsto; npr. približno 1–2 % teže mokrega telesa na dan v primeru šarenke). Stopnjo hranjenja je treba izbrati tako, da se prepreči hitra rast in veliko povečanje vsebnosti lipidov. Zabeležiti je treba točno stopnjo hranjenja, določeno med preskusom. Začetno hranjenje mora temeljiti na načrtovanih meritvah teže za populacijo staleža tik pred začetkom preskusa. Količino hrane je treba prilagoditi glede na mokro težo vzorčenih rib ob vsakem vzorčenju, da se upošteva rast med preskusom. Teža in dolžina rib v preskusnem in kontrolnem bazenu se lahko oceni na podlagi teže in skupne dolžine rib, ki se uporabijo ob vsakem vzorčenju; ne smejo se tehtati ali meriti preostale ribe v preskusnem in kontrolnem bazenu. Pomembno je, da se enaka stopnja hranjenja ohrani v celotnem preskusu. Hranjenje je treba opazovati, da se zagotovi, da ribe vidno pojedo vso hrano, ki jim je dana, zato da bodo v izračunih uporabljene ustrezne hitrosti zaužitja. Pri izbiri stopnje hranjenja, ki bo zagotovila zaužitje vse hrane ob hranjenju enkrat na dan, je treba obravnavati predhodne preskuse hranjenja ali pretekle izkušnje Če hrana vedno ostane, je priporočljivo razporediti odmerek na dodatno obdobje hranjenja v vsakem preskusnem dnevu (npr. nadomestiti hranjenje enkrat na dan s hranjenjem polovice obroka dvakrat na dan). Če je to potrebno, je treba drugo hranjenje izvesti ob vnaprej določenem času in ga razporediti tako, da pred vzorčenjem rib preteče čim več časa (npr. čas za drugo hranjenje se določi v prvi polovici preskusnega dne). Čeprav ribe na splošno zelo hitro pojedo hrano, je pomembno zagotoviti, da snov ostane adsorbirana na hrano. Prizadevati si je treba, da se preskusna snov ne bi razpršila iz hrane v vodo, saj bi se s tem ribe izpostavilo vodnim koncentracijam preskusne snovi poleg prehranske izpostavljenosti. To je mogoče zagotoviti tako, da se v eni uri od hranjenja odstranijo vsi ostanki hrane (in iztrebki) iz preskusnega in kontrolnega bazena, po možnosti pa v 30 minutah. Poleg tega se lahko uporabi sistem, pri katerem se voda neprestano čisti prek filtra iz aktivnega ogljika, da se absorbirajo kakršna koli „raztopljena“ onesnaževala. Pretočni sistemi lahko pripomorejo k hitrem spiranju delcev hrane in raztopljenih snovi (67). V nekaterih primerih lahko malo spremenjena tehnika priprave hrane z dodatkom pomaga olajšati to težavo (glej odstavek 119). Svetloba in temperatura Tako kot pri metodi vodne izpostavljenosti (prim. odstavek 48) se priporoča obdobje osvetljenosti od 12 do 16 ur in temperatura (± 2 °C) mora biti ustrezna za uporabljeno preskusno vrsto (prim. Dodatek 3). Vrsta in lastnosti svetlobe morajo biti znane in navedene. Kontrole Uporabiti je treba eno kontrolno skupino z ribami, ki se hranijo z istim obrokom kot preskusna skupina, vendar brez preskusne snovi v hrani. Če se je pri dodajanju preskusne snovi k hrani za preskusno skupino uporabilo olje ali topilo, je treba hrano kontrolne skupine tretirati na povsem enak način, vendar brez preskusne snovi, zato da sta hrani preskusne in kontrolne skupine enaki (prim. odstavka 121 in 139). Pogostost meritev kakovosti vode Pogoji, opisani pri metodi vodne izpostavljenosti, veljajo tudi za to metodo, razen tega, da je treba TOC izmeriti samo pred preskusom v okviru opredelitve lastnosti preskusne vode (prim. odstavek 53). Vzorčenje ter analiza rib in hrane Analiza vzorcev hrane Vzorce preskusne in kontrolne hrane je treba analizirati vsaj trikrat za preskusno snov, za vsebnost lipidov pa vsaj pred začetkom in ob koncu faze absorpcije. V poročilo je treba vključiti metode analize in postopke za zagotavljanje homogenosti hrane. Vzorce je treba analizirati za preskusno snov po uveljavljenih in validiranih metodah. Treba je izvesti predhodne raziskave, da se ugotovijo meja določljivosti, odstotek izkoristka, motnje in analitska variabilnost pri izbrani matriki vzorčenja. Če se preskuša izotopsko označen material, je treba obravnavati podobne ugotovitve kot pri metodi vodne izpostavljenosti, pri čemer prehranska analiza nadomesti vodno analizo (prim. odstavek 65). Analiza rib Ob vsakem vzorčenju rib je treba vzorčiti 5–10 posameznih rib iz preskusne in kontrolne skupine (v nekaterih primerih se število kontrolnih rib lahko zmanjša; prim. odstavek 134). Vzorčenja morajo potekati vsak preskusni dan ob istem času (glede na hranjenje) in morajo biti razporejena tako, da je čim manjša verjetnost, da hrana ostane v črevesju med fazo absorpcije in v zgodnjem delu faze očiščenja, da se prepreči lažno prispevanje k skupnim koncentracijam preskusne snovi (tj. vzorčene ribe je treba odstraniti ob koncu preskusnega dne in pri tem upoštevati, da se preskusni dan začne ob hranjenju in konča ob naslednjem hranjenju, približno 24 ur pozneje. Očiščenje se začne s prvim hranjenjem s hrano brez dodatka; prim. odstavek 128). Prvi vzorec v fazi očiščenja (ki se vzame malo pred drugim hranjenjem s hrano brez dodatka) je pomemben, saj se ekstrapolacija za en dan nazaj iz te meritve uporabi za oceno koncentracije ob času nič (C 0,d, koncentracija v ribi ob koncu absorpcije/začetku očiščenja). Po izbiri se lahko odstrani gastrointestinalni trakt ribe in analizira ločeno ob koncu absorpcije ter 1. in 3. dan med očiščenjem. Ob vsakem vzorčenju je treba odstraniti ribe iz obeh preskusnih posod in jih tretirati na enak način, kot je opisan pri metodi vodne izpostavljenosti (prim. odstavki 61–63). Koncentracije preskusne snovi v celi ribi (mokra teža) se izmerijo vsaj ob koncu faze absorpcije in med fazo očiščenja v kontrolni in preskusni skupini. Med fazo očiščenja je priporočenih štiri do šest točk vzorčenja (npr. 1., 3., 7., 14. in 28. dan). Po izbiri se lahko vključiti dodatno točko vzorčenja po 1–3 dneh absorpcije, da se oceni učinkovitost asimilacije iz linearne faze absorpcije za ribo, ko je še na začetku obdobja izpostavljenosti. Možna sta dva glavna odstopanja od časovnega razporeda: i) če se za namene raziskovanja kinetike absorpcije uporabi podaljšana faza absorpcije, so med fazo absorpcije potrebne dodatne točke vzorčenja, zato je treba vključiti dodatne ribe (prim. odstavek 126); ii) če je bila študija prekinjena ob koncu faze absorpcije, ker ni bilo izmerljive absorpcije (prim. odstavek 131). Posamezne ribe, ki se vzorčijo, je treba stehtati (in izmeriti njihovo skupno dolžino), da se lahko določijo konstante hitrosti rasti. Ob koncu absorpcije in izbranih točkah očiščenja se lahko izmerijo tudi koncentracije snovi v določenem ribjem tkivu (užitnih in neužitnih delih). Če se preskuša izotopsko označen material, je treba obravnavati podobne ugotovitve kot pri metodi vodne izpostavljenosti, pri čemer prehranska analiza nadomesti vodno analizo (prim. odstavek 65). Za periodično uporabo referenčne snovi (prim. odstavek 25) je treba koncentracije po možnosti meriti v preskusni skupini ob koncu absorpcije in vseh točkah očiščenja, ki so določene za preskusno snov (cela riba); v kontrolni skupini je treba analizirati koncentracije samo ob koncu absorpcije (cela riba). V določenih okoliščinah (na primer če sta analitski tehniki za preskusno snov in referenčno snov nezdružljivi, kar pomeni, da so v okviru časovnega razporeda vzorčenja potrebne dodatne ribe) se lahko uporabi drug pristop, opisan v nadaljevanju, da se čim bolj zmanjša število dodatnih rib. Koncentracije referenčne snovi se izmerijo med očiščenjem samo 1. in 3. dan ter ob dveh nadaljnjih točkah vzorčenja, izbranih tako, da se lahko zanesljivo ocenita koncentracija ob času nič (C 0,d) in k 2 za referenčno snov. Če je mogoče, je treba vsebnost lipidov posameznih rib določiti ob vsakem vzorčenju ali vsaj ob začetku in koncu faze absorpcije ter ob koncu faze očiščenja. (prim. odstavka 56 in 67). Glede na analitsko metodo (glej odstavek 67 in Dodatek 4) se lahko morda uporabi iste ribe za določanje vsebnosti lipidov in koncentracije preskusne snovi. To je zaželeno zaradi čim manjšega števila rib. Če pa to ni mogoče, se lahko uporabiti enak pristop, kot je opisan pri metodi vodne izpostavljenosti (glej odstavek 56 za te druge možnosti merjenja lipidov). Metodo, ki se uporabi za količinsko opredelitev vsebnosti lipidov, je treba opisati v poročilu. Kakovost analitske metode Izvesti je treba preverjanja s preskušanjem, da se zagotovi specifičnost, točnost, natančnost in obnovljivost analitske tehnike, značilne za snov, ter izkoristke preskusne snovi iz hrane in rib. Meritve rasti rib Na začetku preskusa je treba stehtati vzorec rib iz populacije staleža (in izmeriti njihovo skupno dolžino). Te ribe je treba vzorčiti malo prvim hranjenjem s hrano z dodatkom (npr. eno uro) in jih dodeliti preskusnemu dnevu 0. Število rib za ta vzorec mora biti vsaj enako kot za vzorce med preskusom. Nekatere od teh rib so lahko iste kot te, ki so uporabljene za analizo lipidov pred začetkom faze absorpcije (prim. odstavek 153). Ob vsakem intervalu vzorčenja se ribe najprej stehtajo in izmeri se njihova dolžina. Za vsako posamezno ribo je treba izmerjeno težo (in dolžino) povezati z analizirano koncentracijo kemikalije (in vsebnostjo lipidov, kadar je to ustrezno), na primer z uporabo edinstvene identifikacijske kode za vsako vzorčeno ribo. Meritve teh vzorčenih rib se lahko uporabijo za oceno teže (in dolžine) preostalih rib v preskusnem in kontrolnem bazenu. Preskusno vrednotenje Vsak dan je treba izvesti in zabeležiti opazovanja v zvezi s smrtnostjo. Izvesti in zabeležiti je treba dodatna opazovanja za neželene učinke, na primer nenavadno vedenje ali pigmentacijo. Ribe se obravnavajo kot mrtve, če ni dihalnega gibanja in ni mogoče zaznati odziva na rahli mehanski dražljaj. Vse mrtve ali jasno umirajoče ribe je treba odstraniti. PODATKI IN POROČANJE Obdelava rezultatov Rezultati preskusa se uporabijo za izpeljavo konstante hitrosti očiščenja (k 2) kot funkcije skupne mokre teže rib. Izračuna se konstanta hitrosti rasti, k g, ki temelji na povprečnem povečanju teže rib, in uporabi za izračun konstante hitrosti očiščenja, popravljene glede na rast, k 2g, kadar je to ustrezno. Poleg učinkovitosti asimilacije (a; absorpcija v črevesju), je treba v poročilu navesti kinetični biomagnifikacijski faktor (BMFK) (ki je po potrebi popravljen glede na rast, BMFKg), njegovo vrednost, popravljeno glede na lipide (BMFKL ali BMFKgL, če je popravljen glede na razredčitev zaradi rasti), in stopnjo hranjenja. Izračunati je mogoče tudi oceno časa, ki je potreben za doseganje stacionarnega stanja v fazi absorpcije (npr. 95 % stacionarnega stanja ali t 95 = 3,0/k 2), in vključi se lahko ocena stacionarnega BMF (BMFSS) (prim. odstavka 105 in 106 ter Dodatek 5), če je iz vrednosti t 95 razvidno, da so bili morda doseženi pogoji stacionarnega stanja. Ta BMFSS je treba popraviti glede na lipide tako kot kinetično izpeljan BMF (BMFK), da se dobi vrednost, popravljena glede na lipide, BMFSSL (opozoriti je treba, da ni na voljo dogovorjenega postopka za popravljanje stacionarnega BMF glede na razredčitev zaradi rasti). Formule in primeri izračunov so predstavljeni v Dodatku 7. Na voljo so pristopi, ki omogočajo oceno kinetičnega biokoncentracijskega faktorja (BKFK) na podlagi podatkov, pridobljenih v prehranski študiji. Ti so opisani v Dodatku 8. Podatki o teži/dolžini rib Mokra teža in dolžina posameznih rib za vsa časovna obdobja se predstavita v preglednici ločeno za preskusno in kontrolno skupino za vse dneve vzorčenj med fazo absorpcije (populacija staleža za začetek absorpcije; kontrolno in preskusno skupino za konec absorpcije in, če se izvede, zgodnjo fazo (npr. 1.–3. dan absorpcije) ter fazo očiščenja (npr. 1., 2., 4., 7., 14. in 28. dan za kontrolno in preskusno skupino). Po možnosti se teža uporabi kot merilo za rast za namene popravljanja glede na razredčitev zaradi rasti Glej opise v nadaljevanju (odstavka 162 in 163) ter Dodatek 5 za metode, uporabljene za popravljanje podatkov glede na razredčitev zaradi rasti. Podatki o koncentraciji preskusne snovi v ribah V preglednici se predstavijo meritve ostankov preskusne snovi v posameznih ribah (ali združenih vzorcev rib, če meritve posameznih rib niso mogoče), izražene v smislu koncentracije na mokro težo (masni delež), za preskusne in kontrolne ribe za posamezna vzorčenja. Če je bila na vsak vzorčeni ribi izvedena analiza lipidov, se lahko izpeljejo in v preglednici predstavijo posamezne koncentracije, popravljene glede na lipide, v smislu koncentracije lipidov (masni delež lipidov).
Hitrost očiščenja in biomagnifikacijski faktor Za izračun bimagnifikacijskega faktorja iz podatkov je naprej treba pridobiti učinkovitost asimilacije (absorpcijo preskusne snovi v črevesju, α). Za to je treba uporabiti enačbo A7.1 iz Dodatka 7, ki zahteva, da so znani izpeljana koncentracija v ribah ob času nič faze očiščenja (C 0,d), (skupna) konstanta hitrosti očiščenja (k 2), koncentracija v hrani (C hrana), konstanta hitrosti zaužitja hrane (I) in trajanje faze absorpcije (t). Naklon in osni odsek linearnega razmerja med ln(koncentracijo) in trajanjem očiščenja se navedeta kot skupna konstanta hitrosti očiščenja (k 2 = naklon) in koncentracija ob času nič (C 0,d = eintercept), kot je opisano zgoraj. Preveriti je treba, da so izpeljane vrednosti biološko verodostojne (npr. učinkovitost asimilacije kot delež ni višja od 1). (I) se izračuna tako, da se masa hrane deli z maso rib, ki se hranijo vsak dan (če se hranijo z 2 % telesne teže, (I) znaša 0,02). Stopnjo hranjenja, uporabljeno v izračunu, pa je morda treba prilagoditi glede na rast rib (to se lahko izvede z znano konstanto hitrosti rasti, da se oceni teža rib v vsaki točki časa med fazo absorpcije; prim. Dodatek 7). Kadar ni mogoče izpeljati k 2 in C 0,d, ker so na primer koncentracije padle pod mejo zaznavnosti za drugi vzorec očiščenja, se lahko izvede previdna ocena k 2 in BMFk„zgornje meje“ (prim. Dodatek 7). Ko se pridobi učinkovitost asimilacije (α), se lahko izračuna biomagnifikacijski faktor tako, da se α množi s konstanto hitrosti zaužitja (I) in deli s (skupno) konstanto hitrosti očiščenja (k 2). Biomagnifikacijski faktor, popravljen glede na rast, se izračuna na enak način, uporabi pa se konstanta hitrosti očiščenja, popravljena glede na rast (k 2g; (prim. odstavka 162 in 163). Izpelje se lahko drugačna ocena učinkovitosti asimilacije, če je bila v zgodnji, linearni fazi faze absorpcije izvedena analiza ribjega tkiva; prim. odstavek 151 in Dodatek 7. Ta vrednost predstavlja neodvisno oceno učinkovitosti asimilacije za organizem, ki v bistvu ni bil izpostavljen (tj. ribe so pred začetkom faze absorpcije). Za izpeljavo BMF se običajno uporabi učinkovitost asimilacije, ocenjena na podlagi podatkov o očiščenju. Popravek glede na lipide in razredčitev zaradi rasti Rast rib med fazo očiščenja lahko zniža izmerjene koncentracije kemikalije v ribah, kar pomeni, da je skupna konstanta hitrosti očiščenja, k2 , višja, kot bi bila zgolj na podlagi procesov odstranjevanja (npr. metabolizem, izločanje) (prim. odstavek 72). Vsebnost lipidov v preskusnih ribah (ki je tesno povezana z bioakumulacijo hidrofobnih snovi) in vsebnost lipidov v hrani se lahko v praksi tako razlikujeta, da jih je treba popraviti, zato da se lahko biomagnifikacijske faktorje smiselno predstavi. Biomagnifikacijski faktor je treba popraviti glede na razredčitev zaradi rasti (tako kot kinetični BKF pri metodi vodne izpostavljenosti) in glede na vsebnost lipidov v hrani, ki je povezana z vsebnostjo lipidov v ribah (korekcijski faktor za lipide). Enačbe in primeri teh izračunov so opisani v Dodatku 5 oziroma Dodatku 7. Za popravek glede na razredčitev zaradi rasti je treba izračunati konstanto hitrosti očiščenja, popravljeno glede na rast (k 2g) (glej Dodatek 5 za enačbe). Ta konstanta hitrosti očiščenja, popravljena glede na rast (k 2g), se nato uporabi za izračun biomagnifikacijskega faktorja, popravljenega glede na rast, kot je opisano v odstavku 73. V nekaterih primerih ta pristop ni mogoč. Drug pristop, ki ne zahteva popravljanja glede na razredčitev zaradi rasti, pa zajema uporabo mase preskusne snovi na podatke o očiščenju za ribo (celo ribo) in ne običajne mase preskusne snovi na masno enoto podatkov o (koncentraciji v) ribi. Ta pristop je preprost, saj bi v preskusih, skladnih s to metodo, zabeležene koncentracije v tkivih morale biti povezane s težo posameznih rib. Preprost postopek za ta pristop je opisan v Dodatku 5. Opozoriti je treba, da je v poročilu še vedno treba oceniti in navesti k 2, čeprav je uporabljen drugi pristop. Da se popravijo vrednosti glede na vsebnost lipidov v hrani in ribah, kadar analiza lipidov ni bila izvedena na vseh vzorčenih ribah, se izpeljejo povprečni deleži lipidov (masni delež) v ribah in hrani (68). Nato se izračuna korekcijski faktor za lipide (Lc ), tako da se povprečni delež lipidov v ribah deli s povprečnim deležem lipidov v hrani. Biomagnifikacijski faktor, popravljen glede na rast ali ne, kot je ustrezno, se deli s korekcijskim faktorjem za lipide, da se izračuna biomagnifikacijski faktor, popravljen glede na lipide. Če so bile analize kemikalije in lipidov izvedene na istih ribah v vsaki točki vzorčenja, se lahko podatki o tkivu, popravljeni glede na lipide, za posamezne ribe uporabijo neposredno za izračun BMF, popravljenega glede na lipide (prim. (37)). Z grafičnim prikazom koncentracije, popravljene glede na lipide, se dobi C 0,d na podlagi lipidov in k 2. Nato se lahko izvede matematična analiza z enakimi enačbami iz Dodatka 7, učinkovitost asimilacije (a) pa se izračuna s konstanto hitrosti zaužitja hrane, normalizirano glede na lipide (I lipid), in koncentracijo v hrani na podlagi lipidov (C hrana-lipid). Parametri, popravljeni glede na lipide, se nato podobno uporabijo za izračun BMF (opozoriti je treba, da se popravek konstante hitrosti rasti uporabi tudi za delež lipidov, ne pa za mokro težo ribe, da se izračuna BMFKgL, popravljen glede na lipide in rast). Razlaga rezultatov Povprečna rast v preskusni in kontrolni skupini načeloma ne bi smela biti bistveno drugačna, da se lahko izključijo toksični učinki. Konstanti hitrosti rasti ali krivulji rasti obeh skupin je treba primerjati z ustreznim postopkom (69)). Poročilo o preskusu Po koncu študije se pripravi končno poročilo z informacijami o preskusni snovi, preskusni vrsti in preskusnih pogojih v skladu z odstavkom 81 (kot pri metodi vodne izpostavljenosti). Poleg tega se zahtevajo naslednji podatki:
VIRI
Dodatek 1 OPREDELITEV POJMOV IN ENOTE
VIRI
Dodatek 2 NEKATERE KEMIJSKE LASTNOSTI SPREJEMLJIVE VODE ZA REDČENJE
Dodatek 3 VRSTE RIB, PRIPOROČENE ZA PRESKUŠANJE
Različne rečne in morske vrste so bile manj uporabljene, na primer:
Sladkovodne ribe, navedene v zgornji preglednici, je preprosto gojiti in/ali so na splošno na voljo celo leto, razpoložljivost morskih in rečnih vrst pa je deloma omejena na posamezne države. Lahko se razmnožujejo in gojijo v ribogojnicah ali laboratoriju v pogojih, kjer se nadzorujejo bolezni in zajedavci, zato da bodo poskusne živali zdrave in znanega porekla. Te ribe so na voljo v mnogih predelih sveta. VIRI
Dodatek 4 ČASOVNI RAZPOREDI VZORČENJA ZA PRESKUSE VODNE IN PREHRANSKE IZPOSTAVLJENOSTI 1. Teoretični primer časovnega razporeda vzorčenja za celotni preskus vodne izpostavljenosti za ugotavljanje biokoncentracije snovi z log KOW = 4.
2. Teoretični primer časovnega razporeda vzorčenja za preskus prehranske bioakumulacije snovi z desetdnevno fazo absorpcije in 42-dnevno fazo očiščenja
Opomba o časovnih razporedih faz in vzorčenja: Faza absorpcije se začne s prvim hranjenjem s hrano z dodatkom. Preskusni dan traja od enega hranjenja do malo pred naslednjim hranjenjem čez 24 ur. Prvo vzorčenje (1 v preglednici) je treba izvesti malo pred prvim hranjenjem (npr. eno uro). Vzorčenje med študijo je treba načeloma izvesti malo pred hranjenjem naslednjega dne (tj. približno 23 ur po hranjenju na dan vzorčenja). Faza absorpcije se konča malo pred prvim hranjenjem s hrano brez dodatka, ko se začne faza očiščenja (preskusna skupina rib bo verjetno še naprej prebavljala hrano z dodatkom v vmesnih 24 urah po zadnjem hranjenju s hrano z dodatkom). To pomeni, je treba vzorec ob koncu faze absorpcije vzeti malo pred prvim hranjenjem s hrano brez dodatka, prvi vzorec v fazi očiščenja pa je treba vzeti približno 23 ur po prvem hranjenju s hrano brez dodatka. Dodatek 5 SPLOŠNI IZRAČUNI
1. UVOD Splošni model vodne bioakumulacije v ribah se lahko opiše v smislu procesov absorpcije in izgube, pri čemer se zanemari absorpcija s hrano. Diferencialna enačba (dC f/dt), ki opisuje hitrost spremembe v koncentraciji v ribah (mg·kg–1·dan–1), je (1):
pri čemer
Za bioakumulacijske snovi se lahko pričakuje, da je tehtano povprečje v določenem časovnem intervalu (TWA, time-weighted average) najustreznejša koncentracija izpostavljenosti v vodi (Cw ) v dovoljenem območju odstopanja (prim. odstavek 24). Priporočeno je, da se tehtano povprečje koncentracije v vodi v določenem časovnem intervalu izračuna v skladu s postopkom iz Dodatka 6 preskusne metode C.20 (2). Opozoriti je treba, da je pretvorba koncentracije v vodi v naravni logaritem ustrezna, ko se pričakuje eksponentno upadanje med obdobji obnavljanja, npr. pri polstatičnem načrtu preskusa. Pri pretočnem sistemu morda ni potrebna pretvorba koncentracij izpostavljenosti v naravni logaritem. Če se izpelje tehtano povprečje koncentracij v vodi v določenem časovnem intervalu, jih je treba navesti v poročilu in uporabiti v nadaljnjih izračunih. V standardnem preskusu BKF na ribah se lahko absorpcija in očiščenje opišeta v smislu dveh procesov kinetike prvega reda.
V stacionarnem stanju in ob predvidevanju, da sta rast in metabolizem zanemarljiva (tj. vrednosti za k g in k m ni mogoče ločiti od nič), je hitrost absorpcije enaka hitrosti očiščenja, zato se z združitvijo enačb A5.2 in A5.3 dobi naslednje razmerje:
pri čemer
Razmerje k 1/k 2 je znano kot kinetični BKF (BKFK) in mora biti enako stacionarnemu BKF (BKFSS), ki se pridobi iz razmerja med stacionarno koncentracijo v ribah in to v vodi, vendar lahko pride do odstopanj, če stacionarno stanje ni bilo zagotovo doseženo ali če je bil kinetični BKF popravljen glede na rast. Ampak ker sta k 1 in k 2 konstanti, za izpeljavo BKFK ni potrebno, da je doseženo stacionarno stanje. Na podlagi teh enačb prvega reda so v ta Dodatek 5 zajeti splošni izračuni, ki so potrebni za metode vodne in prehranske izpostavljenosti za ugotavljanje bioakumulacije. Oddelki 5, 6 in 8 sicer veljajo samo za metodo vodne izpostavljenosti, ampak so v ta dodatek vključeni kot „splošne“ tehnike. Zaporedne (oddelka 4 in 5) in sočasne (oddelek 6) metode omogočajo izračun konstant absorpcije in očiščenja, ki se uporabijo za izpeljavo kinetičnih BKF. Zaporedna metoda za določanje k 2 (oddelek 4) je pomembna pri prehranski metodi, saj je potrebna za izračun učinkovitosti asimilacije in BMF. V Dodatku 7 so izračuni, ki so značilni za prehransko metodo. 2. NAPOVED TRAJANJA FAZE ABSORPCIJE Pred izvedbo preskusa se lahko pridobi ocena k 2 in s tem določen odstotek časa, ki je potreben za doseganje stacionarnega stanja, na podlagi empiričnih razmerij med k 2 in porazdelitvenim koeficientom n-oktanol/voda (K OW) ali k 1 in BKF. Toda opozoriti je treba, da se enačbe v tem oddelku lahko uporabijo samo, če absorpcija in očiščenje sledita kinetiki prvega reda. Če ji očitno ne sledita in če je treba napovedati trajanje faze absorpcije, je priporočeno poiskati nasvet biostatistika in/ali farmakokinetika. Oceno k 2 (dan–1) je mogoče dobiti z več metodami. Naslednja empirična razmerja se lahko na primer uporabijo v prvem primeru (87):
ali
W = povprečna teža tretirane ribe (v gramih mokre teže) ob koncu/začetku očiščenja (88) Za druga zadevna razmerja glej (6). Morda je za oceno k2 bolje uporabiti kompleksnejše modele, če lahko na primer najverjetneje pride do precejšnjega metabolizma (7) (8). Toda bolj kot je kompleksen model, previdneje je treba razlagati napovedi. Prisotnost nitro skupin lahko na primer kaže na hiter metabolizem, vendar ne vedno. Uporabnik mora torej pri načrtovanju študije pretehtati rezultate metode napovedovanja glede na kemijsko strukturo in druge pomembne informacije (na primer predhodne študije). Čas, ki je potreben za doseganje določenega odstotka stacionarnega stanja, se lahko pridobi tako, da se uporabi ocena k 2 na podlagi splošne kinetične enačbe, ki opisuje absorpcijo in očiščenje (kinetika prvega reda), pri čemer se predvideva, da sta rast in metabolizem zanemarljiva. Če med študijo pride do precejšnje rasti, ocene, opisane v nadaljevanju, ne bodo zanesljive. V takih primerih je bolje uporabiti k 2g, popravljeno glede na rast, kot je opisano v nadaljevanju (glej oddelek 7 tega Dodatka):
ali, če je C w konstanten:
Ko se koncentracija približa stacionarnemu stanju (t → ∞), se lahko enačba A5.10 okrajša (prim. (9) (10)) na:
ali
Potem je BKF × C w približek koncentracije v ribi v stacionarnem stanju (C f-SS). [Opomba: enak pristop se lahko uporabi za oceno stacionarnega BMF pri prehranskem preskusu. V tem primeru se v navedenih enačbah BKF nadomesti z BMF, C w pa z C hrana, koncentracija v hrani.] Enačba A5.10 se lahko zapiše kot:
ali
Ob uporabi enačbe A5.14 je mogoče napovedati čas, ki je potreben za doseganje določenega odstotka stacionarnega stanja, kadar se k 2 predhodno oceni z enačbo A5.5 ali A5.6. Kot smernica se lahko upošteva, da je statistično optimalno trajanje faze absorpcije za pridobivanje statistično sprejemljivih podatkov (BKFK) to obdobje, ki je potrebno, da krivulja logaritma koncentracije preskusne snovi v ribi, grafično prikazana v odvisnosti od linearnega časa, doseže vsaj 50-odstotno stacionarno stanje (tj. 0,69/k 2), ampak ne več kot 95-odstotno stacionarno stanje (tj. 3,0/k 2) (11). Če kopičenje snovi doseže več kot 95-odstotno stacionarno stanje, postane izračun BKFSS izvedljiv. Čas, ki je potreben za doseganje 80-odstotnega stacionarnega stanja (z uporabo enačbe A5.14), je:
ali
In podobno, čas, ki je potreben za doseganje 95-odstotnega stacionarnega stanja, je:
Na primer trajanje faze absorpcije (tj. čas, da se doseže določen odstotek stacionarnega stanja, npr. t 80 ali t 95) za preskusno snov z log K OW = 4 bi znašalo (z uporabo enačbe A5.5, A5.16 in A5.17): logk 2 = 1,47 – 0,414 · 4 k 2 = 0,652 dni–1
ali Uporabi se lahko tudi izraz
za izračun časa, ki je potreben za doseganje dejanskega stacionarnega stanja (t eSS ) (12). Za preskusno snov z log K OW = 4 je rezultat: teSS = 6,54 · 10 – 3 · 104 + 55,31 = 121 ur 3. NAPOVED TRAJANJA FAZE OČIŠČENJA Napoved časa, ki je potreben za zmanjšanje obremenitve telesa na določen odstotek začetne koncentracije, se tudi lahko pridobi s splošno enačbo, ki opisuje absorpcijo in očiščenje (ki sledita kinetiki prvega reda, prim. enačba A5.9 (1) (13). Za fazo očiščenja se predvideva, da je C w (ali C hrana pri prehranskem preskusu) nič. Enačba se lahko nato okrajša na:
ali
pri čemer je C f,0 koncentracija na začetku faze očiščenja. 50-odstotno očiščenje bo nato doseženo v času (t 50):
ali
In podobno, 95-odstotno očiščenje bo doseženo v:
Če se za prvo obdobje uporabi 80-odstotna absorpcija (1,6/k 2) in 95-odstotna izguba v fazi očiščenja (3,0/k 2), potem faza očiščenja traja približno dvakrat dlje kot faza absorpcije. Opozoriti je treba, da ocene temeljijo na predvidevanju, da vzorca absorpcije in očiščenja sledita kinetiki prvega reda. Če kinetika prvega reda očitno ni upoštevana, te ocene niso veljavne. 4. ZAPOREDNA METODA: DOLOČITEV KONSTANTE HITROSTI OČIŠČENJA (IZGUBE) K 2 Za večino biokoncentracijskih podatkov se predvideva, da se „ustrezno“ opišejo s preprostim dvodelnim/dvoparametrskim modelom, kot je nakazano s premočrtno krivuljo, ki se približuje točkam za koncentracijo v ribah (na lestvici naravnega logaritma (ln)) med fazo očiščenja.
Opozoriti je treba, da lahko odstopanja od ravne linije kažejo na bolj zapleten vzorec očiščenja, kot je kinetika prvega reda. Za ugotavljanje vrst očiščenja, ki odstopajo od kinetike prvega reda, se lahko uporabi grafična metoda. Za izračun k 2 za več časovnih točk (vzorčenja) se izvede linearna regresija ln(koncentracije) v odvisnosti od časa. Naklon regresijske premice je ocena konstante hitrosti očiščenja k 2 (89). Iz osnega odseka je preprosto izračunati povprečno koncentracijo v ribah na začetku faze očiščenja (C 0,d; ki je enaka povprečni koncentraciji v ribah ob koncu faze absorpcije (vključno z dovoljenimi stopnjami napake)) (89):
Za izračun k 2, ko sta na voljo samo dve časovni točki (vzorčenja) (kot pri minimiziranem načrtu), se nadomestita dve povprečni koncentraciji v naslednji enačbi
pri čemer sta ln(C f1) in ln(C f2) naravna logaritma koncentracij v časovnih točkah t 1 in t 2, t 2 in t 1 pa sta časovni točki, ko sta bila odvzeta ta dva vzorca glede na začetek očiščenja (90). 5. ZAPOREDNA METODA: DOLOČITEV KONSTANTE HITROSTI ABSORPCIJE K 1 (SAMO ZA METODO VODNE IZPOSTAVLJENOSTI) Za iskanje vrednosti k1 na podlagi nabora podatkov o koncentracijah v zaporednih časovnih točkah za fazo absorpcije, se uporabi računalniški program, ki ustreza naslednjemu modelu:
pri čemer se k 2 pridobi s prejšnjim izračunom, C f(t) in C w(t) pa sta koncentraciji v ribah oziroma vodi ob času t. Za izračun k 1, ko sta na voljo samo dve časovni točki (vzorčenja) (kot pri minimiziranem načrtu), se uporabi naslednja enačba:
pri čemer se k 2 pridobi s prejšnjim izračunom, C f je koncentracija v ribah na začetku faze očiščenja, C w pa je povprečna koncentracija v vodi med fazo absorpcije (91). Vizualni pregled naklonov k 1 in k 2, ko sta konstanti grafično prikazani v odvisnosti od izmerjenih podatkov o točkah vzorčenja, se lahko uporabi za oceno prileganja podatkov. Če se izkaže, da je zaporedna metoda zagotovila slabo oceno za k 1, je za izračun k 1 in k 2 treba uporabiti sočasni pristop (glej naslednji oddelek 6). Pridobljene naklone je treba znova primerjati z grafičnim prikazom izmerjenih podatkov, da se vizualno pregleda prileganje podatkov. Če je prileganje podatkov še vedno slabo, lahko to pomeni, da fazi ne sledita kinetiki prvega reda in da je treba uporabiti kompleksnejše modele. 6. SOČASNA METODA ZA IZRAČUN KONSTANT HITROSTI ABSORPCIJE IN OČIŠČENJA (IZGUBE) (SAMO ZA METODO VODNE IZPOSTAVLJENOSTI) Za ugotavljanje vrednosti k 1 in k 2 se lahko uporabijo računalniški programi na podlagi nabora podatkov o koncentracijah v zaporednih časovnih točkah in modela:
pri čemer
Ta pristop neposredno zagotovi standardne napake za oceni k 1 in k 2. Kadar se k 1/k 2 nadomesti z BKF (prim. enačba A5.4) v enačbi A5.25 in A5.26, se lahko ocenita tudi standardna napaka in 95-odstotni interval zaupanja BKF. To je še zlasti uporabno, kadar se primerjajo različne ocene zaradi pretvorbe podatkov. Za odvisno spremenljivko (koncentracija v ribah) se lahko uporabi pretvorba v naravni logaritem ali ne, nato pa se lahko oceni negotovost BKF. Ker je med parametroma k 1 in k 2 tesna povezava, če se ocenita sočasno, je morda priporočljivo najprej izračunati k 2 samo na podlagi podatkov o očiščenju (glej zgoraj); k 2 se v večini primerov lahko oceni na podlagi krivulje očiščenja z razmeroma visoko natančnostjo. k 1 se lahko nato izračuna na podlagi podatkov o absorpciji z nelinearno regresijo (92). Pri zaporednem prilagajanju je priporočeno uporabiti enako pretvorbo podatkov. Vizualni pregled pridobljenih naklonov, ko sta grafično prikazana v odvisnosti od izmerjenih podatkov o točkah vzorčenja, se lahko uporabi za oceno prileganja podatkov. Če se izkaže, da je ta metoda zagotovila slabo oceno za k1 , se lahko za izračun k 1 in k 2 uporabi sočasni pristop. Prilagojeni model je treba znova primerjati z grafičnim prikazom izmerjenih podatkov, da se vizualno pregleda prileganje podatkov in pridobljene ocene parametrov za k 1, k 2 in dobljeni BKF, njihove standardne napake in/ali intervale zaupanja pa je treba primerjati z različnimi vrstami prileganja. Če se podatki slabo prilegajo, lahko to pomeni, da fazi ne sledita kinetiki prvega reda in da je treba uporabiti kompleksnejše modele. Eden od najpogostejših zapletov je rast rib med preskusom. 7. POPRAVEK GLEDE NA RAZREDČITEV ZARADI RASTI ZA KINETIČNI BKF IN BMF V tem oddelku je opisana standardna metoda za popravljanje vrednosti zaradi rasti rib med preskusom (ki se imenuje „razredčitev zaradi rasti“), ki je veljavna samo, kadar fazi sledita kinetiki prvega reda. Če se ugotovi, da fazi ne sledita kinetiki prvega reda, je za ustrezni popravek glede na razredčitev zaradi rasti priporočeno poiskati nasvet biostatistika ali uporabiti pristop, ki temelji na masi in je opisan v nadaljevanju. V nekaterih primerih je za to metodo za popravljanje glede na razredčitev zaradi rasti značilno pomanjkanje natančnosti, včasih pa ne deluje (na primer za snovi, ki se očiščujejo zelo počasi in se preskušajo na ribah, ki hitro rastejo, je lahko izpeljana konstanta hitrosti očiščenja, popravljena glede na razredčitev zaradi rasti, k 2g, zelo majhna, zato napaka v dveh konstantah rasti, ki se uporabita za njeno izpeljavo, postane ključnega pomena, v nekaterih primerih pa so lahko ocene k g višje od k 2). V takih primerih se lahko uporabi drug pristop (tj. pristop, ki temelji na masi), ki deluje tudi takrat, ko snov ne sledi kinetiki rasti prvega reda, in ki odpravi potrebo po popravljanju. Ta pristop je opisan na koncu tega oddelka. Metoda odštevanja s konstanto hitrosti rasti za popravljanje glede na rast Pri standardni metodi se vsi podatki o posameznih težah in dolžinah pretvorijo v naravne logaritme, ln(teža) ali ln(1/teža) pa se grafično prikaže v odvisnosti od časa (dan) ločeno za tretirane in kontrolne skupine. Enak postopek se izvede ločeno za podatke o fazi absorpcije in očiščenja. Na splošno je za popravek glede na razredčitev zaradi rasti ustrezneje uporabiti podatke o teži iz celotne študije, da se izpelje konstanta hitrosti rasti (k g), statistično značilne razlike med konstantama hitrosti rasti, izpeljanimi za fazo absorpcije in očiščenja, pa lahko pokažejo, da je treba uporabiti konstanto hitrosti faze očiščenja. Skupne hitrosti rasti iz študij vodne izpostavljenosti za preskusne in kontrolne skupine se lahko uporabijo za preverjanje kakršnih koli učinkov, povezanih z tretiranjem. Izračuna se linearna korelacija po metodi najmanjših kvadratov za ln(teža ribe) v odvisnosti od dneva (in za ln(1/teža) v odvisnosti od dneva) za vsako skupino (preskusna in kontrolna skupina, podatki o posameznih ribah in ne dnevne povprečne vrednosti) za celotno študijo, za fazo absorpcije in očiščenja, pri čemer se uporabijo standardni statistični postopki. Izračunajo se variance v naklonih črt in uporabijo za ovrednotenje statistične značilnosti (p = 0,05) razlike v naklonih (konstanti hitrosti rasti) s Studentovim t-testom (ali analizo variance, če se preskuša več koncentracij). Za namene popravljanja glede na rast se po možnosti uporabijo podatki o teži. Podatki o dolžini, obdelani enako, so lahko uporabni za primerjanje kontrolne in preskusne skupine, da se preverijo učinki, povezani s tretiranjem. Če ni statistično značilne razlike v analizi podatkov o teži, se lahko združijo preskusni in kontrolni podatki ter izračuna skupna konstanta hitrosti rasti rib za študijo (k g) kot skupni naklon linearne korelacije. Če se ugotovijo statistično značilne razlike, se konstante hitrosti rasti za vsako skupino rib in/ali fazo študije navedejo ločeno. Konstanto hitrosti za vsako tretirano skupino je nato treba uporabiti za namene popravljanja glede na razredčitev zaradi rasti za to skupino. Če so bile opažene statistične razlike med konstantama hitrosti absorpcije in očiščenja, je treba uporabiti konstante hitrosti, izpeljane iz faze očiščenja. Izračunano konstanto hitrosti rasti (k g, izraženo z dan–1) se lahko odšteje od skupne konstante hitrosti očiščenja (k 2), da se dobi konstanta hitrosti očiščenja, k 2g.
Konstanto hitrosti absorpcije se deli s konstanto hitrosti očiščenja, popravljeno glede na rast, da se dobi kinetični BKF, popravljen glede na rast, ki se izrazi z BKFKg (ali BMFKg).
Konstanta hitrosti rasti, izpeljana za prehransko študijo, se uporabi v enačbi A7.5 za izračun BMFKg, popravljenega glede na rast (prim. Dodatek 7). Metoda, ki temelji na masi, za popravljanje glede na rast Metoda, ki nadomešča že opisano „metodo odštevanja s konstanto hitrosti rast“ in odpravlja potrebo po popravljanju na podlagi rasti, se lahko uporabi, kot je opisano v nadaljevanju. Po tem načelu se namesto koncentracije uporabijo podatki o očiščenju glede na maso cele ribe. Koncentracije v tkivu iz faze očiščenja (masa preskusne snovi/masna enota ribe) se pretvorijo v maso preskusne snovi/riba: koncentracije in teže posameznih rib se povežejo v preglednici (npr. z računalniškim programom za obdelavo preglednic) in vsaka koncentracija se pomnoži s skupno težo ribe za to meritev, da se pridobi nabor mas preskusne snovi/riba za vse vzorce iz faze očiščenja. Dobljeni naravni logaritem podatkov o masi snovi se grafično prikaže v odvisnosti od časa za preskus (faza očiščenja), kot običajno. Za metodo vodne izpostavljenosti se kot običajno izpelje konstanta hitrosti absorpcije (glej oddelke 4 in 6) (opozoriti je treba, da je treba uporabiti „normalno“ vrednost k 2 v enačbah za prilagajanje krivulje za k 1), iz navedenih podatkov pa se izpelje konstanta hitrosti očiščenja. Ker je dobljena vrednost za konstanto hitrosti očiščenja neodvisna od rasti, saj je bila izpeljana glede na maso cele ribe, jo je treba poimenovati k 2g in ne k 2. 8. NORMALIZACIJA LIPIDOV NA 5-ODSTOTNO VSEBNOST LIPIDOV (SAMO ZA METODO VODNE IZPOSTAVLJENOSTI) V poročilu je treba navesti tudi rezultate (kinetičnega in stacionarnega) BKF iz preskusa vodne izpostavljenosti glede na privzeto vsebnost lipidov v ribah, ki znaša 5 % mokre teže, razen če je mogoče utemeljiti, da se preskusna snov primarno ne kopiči v lipidih (npr. nekatere perfluorirane snovi se lahko vežejo na proteine). Podatke o koncentraciji v ribah ali BKF je treba pretvoriti glede na 5-odstotno vsebnost lipidov na mokro težo. Če so bile za meritve koncentracije snovi in vsebnosti lipidov v vseh točkah vzorčenja uporabljene iste ribe, je treba vsako posamezno izmerjeno koncentracijo v ribi popraviti glede na vsebnost lipidov v tej ribi.
pri čemer
Če analiza lipidov ni bila izvedena na vseh vzorčenih ribah, se za normalizacijo BKF uporabi povprečna vrednost lipidov. Za stacionarni BKF je treba uporabiti povprečno vrednost, zabeleženo ob koncu faze absorpcije v tretirani skupini. Za normalizacijo kinetičnega BKF je v nekaterih primerih morda bolje uporabiti drugačen pristop, na primer če se je med fazo absorpcije ali očiščenja vsebnost lipidov precej spremenila. V vsakem primeru pa je treba vedno uporabiti stopnjo hranjenja, ki čim bolj zmanjša velike spremembe v vsebnosti lipidov.
pri čemer
VIRI
Dodatek 6 ODDELEK Z ENAČBAMI ZA PRESKUS VODNE IZPOSTAVLJENOSTI: MINIMIZIRAN NAČRT PRESKUSA Razlog za ta pristop je, da se lahko biokoncentracijski faktor v popolnem preskusu določi kot stacionarni biokoncentracijski faktor (BKFSS), tako da se izračuna razmerje med koncentracijo preskusne snovi v ribjem tkivu in koncentracijo preskusne snovi v vodi, ali z izračunom kinetičnega biokoncentracijskega faktorja (BKFK), ki je razmerje med konstanto hitrosti absorpcije k 1 in konstanto hitrosti očiščenja k 2. BKFK je veljaven, čeprav med absorpcijo ni dosežena stacionarna koncentracija snovi, če absorpcija in očiščenje približno sledita kinetičnim procesom prvega reda. Če se meritev koncentracije snovi v tkivih (C f1) opravi ob koncu izpostavljenosti (t 1) in se koncentracija v tkivu (C f2) znova izmeri po določenem časovnem obdobju (t 2), se lahko konstanta hitrosti očiščenja (k 2) oceni z enačbo A5.22 iz Dodatka 5. Konstanta hitrosti absorpcije, k 1, se lahko nato določi algebrsko z enačbo A5.23 iz Dodatka 5 (pri čemer je C f enak C f1, t pa je enak t 1) (1). Kinetični biokoncentracijski faktor za minimiziran načrt preskusa (ki se imenuje BKFKm, da ga je mogoče ločiti od kinetičnih biokoncentracijskih faktorjev, ki se določajo z drugimi metodami) je torej:
Koncentracije ali rezultate je treba popraviti glede na razredčitev zaradi rasti in normalizirati na 5-odstotno vsebnost lipidov v ribah, kot je opisano v Dodatku 5. Minimiziran BKFSS je BKF, izračunan ob koncu faze absorpcije ob predvidevanju, da je bilo doseženo stacionarno stanje. To je mogoče zgolj predvidevati, saj število točk vzorčenja ni zadostno, da se lahko dokaže.
pri čemer C f-minSS = koncentracija v ribah ob predvidenem stacionarnem stanju na koncu absorpcije (mg kg–1 mokra teža). C w-minSS = koncentracija v vodi ob predvidenem stacionarnem stanju na koncu absorpcije (mg l–1). VIRI
Dodatek 7 ODDELEK Z ENAČBAMI ZA PRESKUS PREHRANSKE IZPOSTAVLJENOSTI:
1. PRIMER KOLIČIN ZA SESTAVINE USTREZNE RIBJE HRANE, DOSTOPNE NA TRGU
2. PRIMERI TEHNIK DODAJANJA SNOVI V HRANO Splošne točke Kontrolna hrana mora biti pripravljena na povsem enak način kot hrana z dodatkom, vendar brez preskusne snovi. Za preverjanje koncentracije tretirane hrane je treba ekstrahirati tri vzorce odmerjene hrane z ustrezno metodo ekstrakcije in izmeriti koncentracijo preskusne snovi ali radioaktivnost v ekstraktih. Dokazati je treba visoke analitske izkoristke (> 85 %) z majhnimi razlikami med vzorci (tri koncentracije vzorcev snovi, vzetih ob začetku preskusa, ne smejo odstopati več kot ± 15 % od povprečja). Med prehranskim preskusom je treba zbrati tri vzorce hrane za analizo na dan 0 in ob koncu faze absorpcije, da se določi vsebnost preskusne snovi v hrani. Priprava ribje hrane s (čistim) tekočim preskusnim materialom Določi se ciljna, nominalna preskusna koncentracija v tretirani ribji hrani, na primer 500 μg preskusne snovi/g hrana. Doda se ustrezna količina (molska masa ali določena radioaktivnost) čiste preskusne snovi k znani masi ribje hrane v steklenem kozarcu ali rotacijski uparjalni bučki. Masa ribje hrane mora biti zadostna za trajanje faze absorpcije (ob upoštevanju potrebe po naraščajočih količinah za vsako hranjenje zaradi rasti rib). Ribja hrana/preskusna snov se mora čez noč mešati s počasnim prevračanjem (npr. z mešalno napravo z rotacijskim stojalom ali z rotacijo, če se uporabi rotacijska uparjalna bučka). Hrano z dodatkom je treba do uporabe shranjevati pod pogoji, ki ohranjajo obstojnost preskusne snovi v mešanici hrane (npr. hlajenje). Priprava ribje hrane z vehiklom v obliki koruznega ali ribjega olja Trdne preskusne snovi je treba zmleti v terilnici v fin prah. Tekoče preskusne snovi se lahko dodajo neposredno v koruzno ali ribje olje. Preskusna snov se raztopi v znani količini koruznega ali ribjega olja (npr. 5–15 ml). Odmerjeno olje se količinsko prenese v rotacijsko uparjalno bučko ustrezne velikosti. Bučko, v kateri je bilo pripravljeno odmerjeno olje, je treba sprati z dvema majhnima enakima količinama olja in ju dodati v rotacijsko uparjalno bučko, da se zagotovi prenos celotne raztopljene preskusne snovi. Za zagotovitev popolne raztopljenosti/razpršitve v olju (ali če se v študiji uporablja več preskusnih snovi) se doda mikromešalnik, bučka se zamaši in zmes se čez noč hitro meša. V bučko se doda ustrezna količina ribje hrane (običajno v obliki peletov) za preskus in vsebina bučke se enakomerno zmeša z neprestanim obračanjem steklene bučke vsaj 30 minut, po možnosti pa čez noč. Potem se hrana z dodatkom ustrezno shrani (npr. da na hladno), da se zagotovi obstojnost preskusne snovi v hrani do uporabe. Priprava ribje hrane z organskim topilom Ustrezna količina preskusne snovi (molska masa ali določena radioaktivnost), ki je zadostna, da se doseže ciljni odmerek, se raztopi v ustreznem organskem topilu (npr. cikloheksan ali aceton; 10–40 ml ali po potrebi več glede na količino hrane, ki ji je treba dodati preskusno snov). Del te raztopine ali vsa raztopina (ki se doda glede na odmerek) se zmeša z ustrezno maso ribje hrane, ki je zadostna, da se doseže zahtevani nominalni odmerek v preskusu. Hrana/preskusna snov se lahko zmeša v posodi za mešanje iz nerjavnega jekla in sveže odmerjena ribja hrana se dva dni pusti v posodi v laboratorijskem digestoriju (in se občasno zmeša), da izhlapi odvečno topilo, ali pa se zmeša v rotacijski uparjalni bučki z neprestanim vrtenjem. Odvečno topilo se lahko po potrebi „odpihne“ s tokom zraka ali dušika. Skrbno je treba zagotoviti, da preskusna snov med odstranjevanjem topila ne kristalizira. Hrano z dodatkom je treba shranjevati pod pogoji (npr. hlajenje), ki ohranjajo obstojnost preskusne snovi v mešanici hrane do uporabe. 3. IZRAČUN UČINKOVITOSTI ASIMILACIJE IN BIOMAGNIFIKACIJSKEGA FAKTORJA Za izračun učinkovitosti asimilacije je treba najprej oceniti skupno konstanto hitrosti očiščenja v skladu z oddelkom 4 iz Dodatka 5 (z „zaporedno metodo“, tj. standardno linearno regresijo), pri čemer se uporabijo povprečne koncentracije vzorcev iz faze očiščenja. Konstanta stopnje hranjenja, I, in trajanje absorpcije, t, sta znana parametra študije. C hrana, povprečna izmerjena koncentracija preskusne snovi v hrani, je izmerjena spremenljivka v študiji. C 0,d, koncentracija preskusne snovi v ribah ob koncu faze absorpcije, se običajno izpelje iz osnega odseka v grafičnem prikazu ln(koncentracije) v odvisnosti od dneva očiščenja. Učinkovitost asimilacije snovi (a, absorpcija preskusne snovi v črevesju) se izračuna kot:
pri čemer C 0,d = izpeljana koncentracija v ribah ob času nič faze očiščenja (mg kg–1); k 2 = skupna konstanta hitrosti očiščenja (ki ni popravljena glede na rast) (dan–1), izračunana z enačbami iz Dodatka 5, oddelek 3; I = konstanta hitrosti zaužitja hrane (g hrana g–1 riba dan–1); C hrana = koncentracija v hrani (mg kg–1 hrana); t= trajanje obdobja hranjenja (dan) Morda pa je treba prilagoditi stopnjo hranjenja, I, ki se uporabi pri izračunu, glede na rast rib, da se pridobi točna učinkovitost asimilacije, a. Pri preskusu, v katerem ribe precej rastejo med fazo absorpcije (količine hrane, da bi se ohranila določena stopnja hranjenja, pa se med to fazo ne prilagodijo), je dejanska stopnja hranjenja ob nadaljevanju faze absorpcije nižja kot ta, ki je bila določena, kar pomeni višjo „dejansko“ učinkovitost asimilacije. (Opozoriti je treba, da to ni pomembno za skupni izračun BMF, saj se parametri I dejansko izničijo v enačbi A7.1 in A7.4). Povprečna stopnja hranjenja, popravljena glede na razredčitev zaradi rasti, I g, se lahko izpelje na več načinov, ampak najbolj enostaven in natančen je ta, pri katerem se uporabi znana konstanta hitrosti rasti (k g), da se ocenijo teže preskusnih rib v časovnih točkah med fazo absorpcije, tj.:
pri čemer W f(t)= povprečna teža ribe na dan absorpcije t W f,0 = povprečna teža ribe na začetku preskusa Na ta način se lahko oceni (vsaj) povprečna teža rib na zadnji dan izpostavljenosti (W f,konec absorpcije). Ker je bila stopnja hranjenja določena glede na W f,0, se lahko dejanska stopnja hranjenja za vsak dan absorpcije izračuna s tema dvema vrednostma teže. Stopnja hranjenja, popravljena glede na rast, I g (g hrana g–1 riba dan–1), ki se uporabi namesto I v primerih hitre rasti med fazo absorpcije, se lahko nato izračuna kot
Ko se pridobi učinkovitost asimilacije, se lahko izračuna BMF, tako da se jo pomnoži s konstanto stopnje hranjenja I (ali I g, če se je uporabila za izračun α) in deli produkt s skupno konstanto hitrosti očiščenja, k 2:
Na enak način je treba izračunati tudi biomagnifikacijski faktor, popravljen glede na rast, tako da se uporabi konstanta hitrosti očiščenja, popravljena glede na rast (kot je izpeljana v oddelku 7 iz Dodatka 5). Če je bila I g uporabljena za izračun α, jo je treba uporabiti tudi tukaj namesto I:
pri čemer α = učinkovitost asimilacije (absorpcija preskusne snovi v črevesju); k 2 = skupna konstanta hitrosti očiščenja (ki ni popravljena glede na rast) (dan–1), izračunana z enačbami iz Dodatka 5, oddelek 3; k 2g = konstanta hitrosti očiščenja, popravljena glede na rast (dan–1); I = konstanta hitrosti zaužitja hrane (g hrana g–1 riba dan–1); Razpolovna doba (t 1/2), popravljena glede na rast, se izračuna z naslednjo enačbo:
Učinkovitost asimilacije snovi iz hrane se lahko tudi oceni, če se določijo ostanki v tkivih med linearno fazo faze absorpcije (med prvim in tretjim dnevom). V tem primeru se lahko učinkovitost asimilacije snovi (α) določi z naslednjo enačbo:
pri čemer C riba (t) = koncentracija preskusne snovi v ribi ob času t (mg kg–1 mokra teža). 4. POPRAVLJANJE GLEDE NA LIPIDE Če je bila vsebnost lipidov izmerjena v istih ribah, na katerih je bila izvedena tudi kemijska analiza za vse intervale vzorčenja, je treba posamezne koncentracije popraviti glede na lipide, ln(koncentracija, popravljena glede na lipide) pa se grafično prikaže v odvisnosti od očiščenja (dan), da se pridobita C 0,d in k 2. Učinkovitost asimilacije (enačba A7.1) se lahko nato izračuna glede na lipide, pri čemer se uporabi C hrana glede na lipide (tj. C riba se pomnoži s povprečnim deležem lipidov v hrani). Nato se z izračunom na podlagi enačb A7.4 in A7.5 neposredno pridobi BMF, popravljen glede na lipide (in razredčitev zaradi rasti). V nasprotnem primeru se povprečni delež lipidov (masni delež) v ribah in hrani izpelje za tretirano in kontrolno skupino (za hrano in kontrolno skupino rib je to običajno na podlagi podatkov, izmerjenih ob začetku in koncu izpostavljenosti; za tretirano skupino rib je to običajno na podlagi podatkov, izmerjenih samo ob koncu izpostavljenosti). V nekaterih študijah se lahko vsebnost lipidov v ribah precej poveča; v takih primerih je ustrezneje uporabiti povprečno koncentracijo lipidov v preskusnih ribah, ki se izračuna iz izmerjenih vrednosti ob koncu izpostavljenosti in na začetku očiščenja. Na splošno je podatke iz tretirane skupine treba uporabiti samo za izpeljavo obeh deležev lipidov. Korekcijski faktor za lipide (Lc ) se izračuna kot:
pri čemer sta L riba in L hrana povprečna deleža lipidov v ribah oziroma hrani. Korekcijski faktor za lipide se uporabi za izračun biomagnifikacijskega faktorja, popravljenega glede na lipide (BMFL):
5. VREDNOTENJE RAZLIK MED IZMERJENO KONCENTRACIJO OB ČASU NIČ (C 0,M) IN IZPELJANO KONCENTRACIJO OB ČASU NIČ (C 0,D) Primerjati je treba izmerjeno koncentracijo ob času nič (C 0,m) in izpeljano koncentracijo ob času nič (C 0,d). Če sta si zelo podobni, to podpre model prvega reda, ki je bil uporabljen za izpeljavo parametrov očiščenja. V nekaterih študijah se lahko ugotovi precejšnja razlika med izpeljano vrednostjo ob času nič, C 0,d, in povprečno izmerjeno koncentracijo ob času nič. C 0,m (glej zadnjo alinejo odstavka 159 te preskusne metode). Če je C 0,d veliko nižja od C 0,m (C 0,d << C 0,m), lahko razlika kaže na prisotnost neprebavljene hrane z dodatkom v črevesju. To je mogoče ugotoviti s preskušanjem, tako da se izvede ločena analiza na odstranjenem črevesju, če so bili vzeti dodatni vzorci (celih rib) in shranjeni ob koncu faze absorpcije. V nasprotnem primeru, če statistično veljaven preskus osamelcev, uporabljen za linearno regresijo faze očiščenja, kaže, da je prva točka vzorčenja očiščenja lažno višja, je morda ustrezno izvesti linearno regresijo za izpeljavo k 2, ampak pri tem izpustiti prvo točko koncentracije očiščenja. V takih primerih, kadar se negotovost linearne regresije znatno zmanjša in je jasno, da je bila približno upoštevana kinetika očiščenja prvega reda, je morda ustrezno uporabiti dobljeni vrednosti C 0,d in k 2 pri izračunu asimilacije učinkovitosti. To je treba v celoti utemeljiti v poročilu. Mogoče je tudi, da je faza očiščenja sledila kinetiki, ki ni prvega reda. Če je najverjetneje sledila taki kinetiki (tj. podatki, pretvorjeni v naravni logaritem, na videz sledijo krivulji v primerjavi s prikazom premice linearne regresije), potem izračuni k 2 in C 0,d najverjetneje niso veljavni in treba je poiskati nasveti biostatistika. Če je C 0,d veliko višja od izmerjene vrednosti (C 0,d >> C 0,m), lahko to pomeni, da: se je snov zelo hitro očistila (tj. točke vzorčenja so se približale meji določljivosti analitske metode zelo zgodaj v fazi očiščenja, prim. oddelek 6 v nadaljevanju); je prišlo do odstopanja od kinetike očiščenja prvega reda; je linearna regresija, s katero sta se izpeljali k 2 in C 0,d, napačna; ali pa je nekaterih časovnih točkah vzorčenja prišlo do težave z izmerjenimi koncentracijami v študiji. V takih primerih je treba skrbno proučiti prikaz linearne regresije za dokaze o vzorcih, ki so na meji določljivosti ali blizu nje, za osamelce in očitne krivine (ki kažejo na kinetiko, ki ni prvega reda) ter jih poudariti v poročilu. Opisati in utemeljiti je treba kakršno koli nadaljnjo ponovno vrednotenje linearne regresije za izboljšanje ocenjenih vrednosti. Če je ugotovljeno znatno odstopanje od kinetike prvega reda, izračuni k 2 in C 0,d najverjetneje ne bodo veljavni in treba je poiskati nasvet biostatistika. 6. SMERNICE ZA PRESKUSNE SNOVI, KI SE OČIŠČUJEJO ZELO HITRO Kot je bilo opisano v odstavku 129 te preskusne metode, se lahko nekatere snovi očiščujejo tako hitro, da ni mogoče izpeljati zanesljive koncentracije ob času nič, C 0,d, in k 2, saj se v vzorcih, vzetih zelo zgodaj v fazi očiščenja (tj. od drugega vzorca očiščenja naprej), snov dejansko ne meri več (navedene koncentracije so na meji določljivosti). Ta situacija je bila ugotovljena v krožnem preskusu, ki je bil izveden v podporo tej preskusni metodi z benzo[a]pirenom in naveden v validacijskem poročilu za metodo. V takih primerih ni mogoče zanesljivo izvesti linearne regresije, s katero bi se najverjetneje dobila nerealno visoka ocena C 0,d, s tem pa navidezna učinkovitost asimilacije, ki bi znašala veliko več kot 1. V teh primerih se lahko izračuna previdna ocena k 2 in BMF „zgornje meje“. Če se uporabijo podatkovne točke faze očiščenja, ko je bila izmerjena koncentracija, do in vključno s prvo „nezaznavno“ koncentracijo (koncentracija, določena na meji določljivosti), se lahko z linearno regresijo (pri kateri se uporabijo podatki o koncentraciji, pretvorjeni v naravni logaritem, v odvisnosti od časa) dobi ocena k 2. Take vrste primerov bodo verjetno zajele samo dve podatkovni točki (npr. prvi in drugi dan vzorčenja med fazo očiščenja), nato pa se lahko oceni k 2 z enačbo A5.22 iz Dodatka 5. Ta ocena k2 se lahko uporabi za oceno učinkovitosti asimilacije z enačbo A7.1, pri čemer se vrednost C0,d v enačbi nadomesti z izmerjeno koncentracijo ob času nič (C0,m) v primerih, ko je ocena C0,d očitno veliko višja od te, ki bi se lahko dosegla v preskusu. Če C0,m ni bilo mogoče izmeriti, je treba uporabiti mejo zaznavnosti v ribjem tkivu. Če se s tem v nekaterih primerih dobi vrednost α > 1, se v „najslabšem primeru“ predvideva, da učinkovitost asimilacije znaša 1. Nato se lahko oceni največji BMFK z enačbo A7.4, navesti pa ga je treba kot vrednost „ki je veliko manjša od“ (<<). Na primer za študijo, ki je izvedena s 3-odstotno stopnjo hranjenja, razpolovno dobo očiščenja, ki znaša manj kot tri dni, in vrednostjo α, ki je „najslabšem primeru“ enaka 1, bo vrednost BMFK verjetno znašala manj kot 0,13. Zaradi namena take ocene in dejstva, da bodo ocene vrednosti same po sebi previdne, teh vrednosti ni treba popraviti glede na rast, razredčitev ali vsebnost lipidov hrani in ribah. Dodatek 8 PRISTOPI K OCENJEVANJU OKVIRNIH BKF NA PODLAGI PODATKOV, ZBRANIH V ŠTUDIJI PREHRANSKE IZPOSTAVLJENOSTI Prehranska metoda je vključena v to preskusno metodo za preskušanje bioakumulacije snovi, ki je v praksi ni mogoče preskusiti z metodo vodne izpostavljenosti. Z metodo vodne izpostavljenosti se dobi biokoncentracijski faktor, pri prehranski metodi pa se neposredno dobijo informacije o potencialu za biomagnifikacijo pri hranjenju. V mnogih sistemih za kemijsko varnost se zahtevajo informacije o vodni biokoncentraciji (na primer pri oceni tveganja in Globalno usklajenem sistemu za razvrščanje). Zato je treba uporabiti podatke iz prehranske študije za oceno biokoncentracijskega faktorja, ki je primerljiv s preskusi, izvedenimi v skladu z metodo vodne izpostavljenosti (94). V tem oddelku so opisani pristopi, ki jim je mogoče slediti v ta namen, navedene pa so tudi pomanjkljivosti, ki so del ocen. V prehranski študiji se izmeri očiščenje, da se dobi konstanta hitrosti očiščenja, k 2. Če se lahko na podlagi razpoložljivih podatkov za situacijo, ko so ribe bile izpostavljene preskusni snovi prek vode, oceni konstanta hitrosti absorpcije, se lahko oceni tudi kinetični BKF. Ocena konstante hitrosti absorpcije za vodno izpostavljenost preskusne snovi temelji na mnogih domnevah, vse te domneve pa prispevajo k negotovosti ocene. Poleg tega se s tem pristopom k oceni BKF predvideva, da je skupna hitrost očiščenja (vključno z dejavniki, ki k njej prispevajo, na primer porazdelitev v telesu in posamezni procesi očiščenja) neodvisna od tehnike izpostavljenosti, ki se uporabi za obremenitev telesa s preskusno snovjo. Glavne domneve, ki so del pristopa k ocenjevanju, je mogoče povzeti na naslednji način: očiščenje, ki sledi prehranski absorpciji, je enako očiščenju, ki sledi vodni izpostavljenosti za dano snov; absorpcija iz vode bi sledila kinetiki prvega reda; glede na metodo, ki se uporabi za oceno absorpcije:
zbirka podatkov („nabor za usposabljanje“), ki je bila uporabljena za razvoj metode za ocenjevanje absorpcije, je reprezentativna za preiskovano snov. V več javno dostopnih publikacijah so bile izpeljane enačbe, ki povezujejo absorpcijo iz vode v ribe prek škrg s porazdelitvenim koeficientom n-oktanol/voda za snov, težo rib (1), (2), (3) in (4), prostornino in/ali vsebnostjo lipidov, permeacijo/difuzijo skozi membrano (5), (6), volumnom dihanja rib (7) in s pristopom fugativnosti/masne bilance (8), (9) in (10). Podroben opis takih metod v tem okviru je zajet v Crookes & Brooke (11). Barberjeva publikacija (12), ki se je usmerila v izdelavo modelov za bioakumulacijo na podlagi prehranske absorpcije, je tudi uporabna v tem okviru, saj zajema prispevke na podlagi modelov za hitrost absorpcije prek škrg. Ta vidik je opisan tudi v oddelku referenčnega dokumenta k prehranskem protokolu iz leta 2004 (13). Zdi se, da je večina teh modelov bila izpeljana z uporabo omejene zbirke podatkov. Za modele, pri katerih so na voljo podrobnosti o zbirki podatkov, uporabljeni za izdelavo modela, se zdi, da so vrste uporabljenih snovi pogosto podobne strukture ali razreda (v smislu funkcionalnosti, npr. organoklorne spojine). To prispeva k negotovosti pri uporabi modela za napovedovanje konstante hitrosti absorpcije za drugačno vrsto snovi, poleg drugih vidikov v zvezi s preskusom, kot so vrsta, temperatura itd. V pregledu tehnik, ki so na voljo (11), je bilo poudarjeno, da ne obstaja metoda, ki bi bila „ustreznejša“ kot druge. Zato je treba jasno utemeljiti uporabljeni model. Kadar je na voljo več metod in je njihovo uporabo mogoče utemeljiti, je morda smotrno predstaviti več ocen k 1 (in s tem BKF) ali območje vrednosti k 1 (in BKF) v skladu z več metodami za ocenjevanje absorpcije. Zaradi razlik v vrstah modelov in zbirkah podatkov, uporabljenih za razvoj teh modelov, pa ne bi bilo ustrezno uporabiti povprečne vrednosti ocen, izpeljanih na različne načine. Nekateri raziskovalci so predpostavili, da je treba ocene BKF te vrste popraviti glede na biološko dostopnost, da se upošteva adsorpcija snovi na raztopljeni organski ogljik pod pogoji vodne izpostavljenosti, in jih uskladiti z rezultati iz študij vodne izpostavljenosti (npr. (13) in (14)). Vendar ta popravek morda ni ustrezen zaradi nizkih ravni raztopljenega organske ogljika, ki so zahtevane pri študiji vodne izpostavljenosti za oceno v „najslabšem primeru“ (tj. razmerje med biološko dostopnostjo snovi in snovjo, izmerjeno v raztopini). Za močno hidrofobne snovi lahko postane absorpcija prek škrg omejena zaradi hitrosti pasivne difuzije blizu površine škrg; v tem primeru je mogoče, da se pri popravku upošteva ta učinek, ne pa ta, za katerega je bil zasnovan. Priporočeno se je usmeriti v metode, ki zahtevajo parametre, za katere bodo na voljo podatki o preiskovani snoveh v skladu s tukaj opisano prehransko študijo (tj. log K OW, teža ribe). Uporabijo se lahko druge metode, ki zahtevajo kompleksnejše podatke, ampak morda bo treba opraviti dodatne meritve v preskusu ali pridobiti podrobno znanje o preskusni snovi ali vrsti rib, ki mogoče ni splošno dostopno. Poleg tega lahko na izbiro modela vpliva raven validacije in področje uporabe (glej (11) za pregled in primerjavo različnih metod). Upoštevati je treba, da sta dobljeni oceni k 1 in BKF negotovi ter da jih je morda treba obravnavati s pristopom, ki temelji na zanesljivosti dokazov, skupaj z izpeljanim BMF in parametri snovi (npr. molekulsko velikostjo), da se pridobi celoten pregled bioakumulacijskega potenciala snovi. Razlaga in uporaba teh parametrov je morda odvisna od regulativnega okvira. VIRI
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
(17) |
V delu C se poglavje C.20 nadomesti z naslednjim: „C.20 Preskus razmnoževanja vrste Daphnia magna UVOD Ta preskusna metoda ustreza Smernici za preskušanje OECD (TG) 211 (2012). Preskusne smernice OECD se ob upoštevanju znanstvenega napredka redno pregledujejo. Smernica za preskušanje razmnoževanja 211 temelji na smernici za preskušanje 202, Del II, Preskus razmnoževanja vrste Daphnia sp. (1984). Na splošno je bilo ugotovljeno, da so lahko podatki iz preskusov, izvedenih v skladu s to smernico za preskušanje 202, spremenljivi. Zaradi tega so bila precejšnja prizadevanja namenjena temu, da bi se opredelili razlogi za to spremenljivost in da bi se oblikovala boljša preskusna metoda. Smernica za preskušanje 211 temelji na rezultatih teh raziskovalnih dejavnosti, krožnih preskusov in validacijskih študij, izvedenih v letih 1992 (1), 1994 (2) in 2008 (3). Glavne razlike med prvo (TG 202, 1984) in drugo različico (TG 211, 1998) smernice za preskušanje razmnoževanja so:
Uporabljene opredelitve pojmov so navedene v Dodatku 1. NAČELO PRESKUSA Glavni cilj preskusa je oceniti vpliv kemikalij na sposobnost razmnoževanja vrste Daphnia magna. V ta namen se mlade samice vrste Daphnia (starši), ki so na začetku preskusa mlajše od 24 ur, izpostavijo preskusni kemikaliji, dodani vodi v različnih koncentracijah. Preskus traja 21 dni. Na koncu preskusa se oceni skupno število ustvarjenih živih potomcev. Sposobnost razmnoževanja staršev je mogoče izraziti tudi na druge načine (npr. število živih potomcev, ki jih ustvari žival na dan od prvega dne, ko so opaženi potomci), vendar je treba te navesti v poročilu poleg skupnega števila živih potomcev, ustvarjenih ob koncu preskusa. Zaradi posebnega načrta polstatičnega preskusa v primerjavi z drugimi preskusnimi metodami za razmnoževanje nevretenčarjev se lahko prešteje tudi število živih potomcev, ki jih ustvari vsak posamezni starš. V nasprotju z drugimi preskusnimi metodami za razmnoževanje nevretenčarjev to omogoča, da se ustvarjanje potomcev starša, ki naključno in/ali nenamerno umre med preskusnim obdobjem, izključi iz ocene podatkov. Če se torej smrtnost staršev pojavi v izpostavljenih ponovljenih vzorcih, je treba obravnavati, ali smrtnost sledi vzorcu odziva na koncentracijo ali ne, npr. če obstaja precejšnja regresija odziva v odvisnosti od koncentracije preskusne kemikalije s pozitivnim naklonom (za to se lahko uporabi statistični preskus, kot je Cochran-Armitageov trendnostni test). Če smrtnost ne sledi vzorcu odziva na koncentracijo, je treba navedene ponovljene vzorce s smrtnostjo staršev izključiti iz analize preskusnega rezultata. Če smrtnost sledi vzorcu odziva na koncentracijo, je treba smrtnost staršev obravnavati kot učinek preskusne kemikalije, ponovljeni vzorci pa se ne smejo izključiti iz analize. Če starš med preskusom umre, tj. naključno zaradi neustreznega ravnanja ali nesreče, ali nenamerno zaradi nepojasnjenega dogodka, ki ni povezan z učinkom preskusne kemikalije, ali pa se izkaže, da je samec, se ponovljeni vzorec izključi iz analize (glej več v odstavku 51). Toksični učinek preskusne kemikalije na sposobnost razmnoževanja se izrazi kot ECx, tako da se podatke prilagodi ustreznemu modelu z nelinearno regresijo, da se oceni koncentracija, ki bi povzročila x-odstotno zmanjšanje sposobnosti razmnoževanja, ali pa kot vrednost NOEC/LOEC (4). Preskusne koncentracije morajo po možnosti oklepati najnižjo od uporabljenih učinkovitih koncentracij (npr. EC10), kar pomeni, da se ta vrednost izračuna z interpolacijo, ne pa z ekstrapolacijo. V poročilu je treba navesti tudi preživetje staršev in trajanje obdobja do ustvarjanja prvega zaroda. Proučijo se lahko tudi drugi učinki, ki so povezani s kemikalijo in vplivajo na parametre, kot so rast (npr. dolžina) in morebiti intrinzična hitrost povečanja populacije (glej odstavek 44). INFORMACIJE O PRESKUSNI KEMIKALIJI Rezultati preskusa akutne toksičnosti (glej poglavje C.2 te priloge: Preskus akutne imobilizacije vodnih bolh (Daphnia sp.)), izvedeni z vrsto Daphnia magna, so lahko uporabni pri izbiri ustreznega območja preskusnih koncentracij v preskusih razmnoževanja. Znana morata biti topnost v vodi in parni tlak preskusne kemikalije ter na voljo mora biti zanesljiva analitska metoda za količinsko opredeljevanje kemikalije v preskusnih raztopinah, za katero obstajajo podatki o izkoristku in meji določljivosti. Informacije o preskusni kemikaliji, ki so lahko uporabne pri določanju preskusnih pogojev, zajemajo strukturno formulo, čistost kemikalije, obstojnost na svetlobi, obstojnost pod pogoji preskusa, disociacijsko konstanto (pKa), Pow in rezultate preskusa za dobro biorazgradljivost (glej poglavji C.4 (Določanje „dobre“ biorazgradljivosti) in C.29 (Dobra biorazgradljivost – CO2 v zaprtih posodah) te priloge). VELJAVNOST PRESKUSA Za veljavnost preskusa morajo kontrole izpolnjevati naslednja merila za učinkovitost:
Opomba: Enako merilo za veljavnost (20 %) se lahko uporabi za naključno ali nenamerno smrtnost staršev za kontrole in vsako od preskusnih koncentracij. OPIS METODE Oprema Preskusne posode in druge naprave, ki pridejo v stik s preskusnimi raztopinami, morajo biti v celoti iz stekla ali drugega kemijsko inertnega materiala. Preskusne posode so navadno steklene čaše. Potrebna je tudi nekatera ali vsa naslednja oprema:
Preskusni organizem V preskusu se uporabi vrsta Daphnia magna Straus (95). Klon mora po možnosti biti opredeljen z genotipiziranjem. Raziskave (1) so pokazale, da sposobnost razmnoževanja klona A (ki izvira iz IRCHA v Franciji) (5) dosledno izpolnjuje merilo za veljavnost, ki zahteva, da je povprečno število živih potomcev na preživelega starša ≥ 60, če so gojeni v pogojih, opisanih v tej preskusni metodi. Vendar so sprejemljivi tudi drugi kloni, če se dokaže, da kultura vrste Daphnia izpolnjuje merila za veljavnost preskusa. Na začetku preskusa morajo biti živali mlajše od 24 ur in ne smejo biti prva generacija potomcev. Izvirati morajo iz zdravega staleža (tj. ne kažejo znakov stresa, kot so visoka smrtnost, navzočnost samcev in zimskih jajc, zamuda pri ustvarjanju prvega zaroda, razbarvane živali itd.). Živali v staležu je treba gojiti v pogojih (svetloba, temperatura, medij, hranjenje in živali na enoto prostornine), podobnim tistim, ki bodo uporabljeni v preskusu. Če se bo v preskusu uporabilo gojišče za vrsto Daphnia, ki je drugačno od tistega, ki se uporablja za rutinsko gojenje kulture vrste Daphnia, je dobro pred preskusom izvesti obdobje aklimatizacije, ki navadno traja okoli tri tedne (tj. eno generacijo), da se prepreči izpostavljanje staršev stresu. Preskusni medij Za ta preskus je priporočljivo uporabiti povsem določen medij. S tem se je mogoče izogniti uporabi dodatkov (npr. morske alge, ekstrakt tal itd.), ki jih je težko opredeliti, s tem pa se izboljšajo možnosti za standardizacijo med laboratoriji. Ugotovljeno je bilo, da sta medija Elendt M4 (6) in M7 (glej Dodatek 2) primerna za ta namen. Sprejemljivi pa so tudi drugi mediji (npr. (7) in (8)), če je dokazano, da sposobnost kulture vrste Daphnia izpolnjuje merila za veljavnost preskusa. Če se uporabijo mediji, ki vsebujejo neopredeljene dodatke, je treba te dodatke jasno navesti, v poročilu o preskusu pa je treba zagotoviti informacije o sestavi, zlasti v zvezi z vsebnostjo ogljika, saj lahko vpliva na uporabljeno hrano. Priporočeno je določiti skupni organski ogljik (TOC) in/ali kemijsko potrebo po kisiku (KPK) osnovnega pripravka organskega dodatka ter oceniti, kako ta posledično prispeva k TOC/KPK v ustvarjenem preskusnem mediju. Nadalje je priporočeno, da ravni TOC v mediju (tj. pred dodatkom alg) znašajo manj kot 2 mg/l (9). Pri preskušanju kemikalij, ki vsebujejo kovine, je pomembno vedeti, da lahko lastnosti preskusnega medija (npr. trdota, sposobnost tvorbe kelatov) vplivajo na toksičnost preskusne kemikalije. Zato je zaželen povsem določen medij. Trenutno pa sta edina povsem določena medija, za katera je dokazano, da sta primerna za dolgotrajno gojenje vrste Daphnia magna, Elendt M4 in M7. Oba medija vsebujeta kelatni reagent EDTA. Raziskave so pokazale (2), da je „navidezna toksičnost“ kadmija na splošno manjša, kadar se preskus razmnoževanja izvede v medijih M4 in M7, kot pa če se izvede v medijih, ki ne vsebujejo EDTA. M4 in M7 zato nista priporočljiva za preskušanje kemikalij, ki vsebujejo kovine, izogibati pa se je treba tudi drugim medijem, ki vsebujejo znane kelatne reagente. Za kemikalije, ki vsebujejo kovine, je morda priporočljivo uporabiti drug medij, kot je na primer modelna razredčevalna trda sladka voda ASTM (9), ki ne vsebuje EDTA. Kombinacija modelne razredčevalne trde sladke vode ASTM in ekstrakta morskih alg (10) je primerna za dolgotrajno gojenje vrste Daphnia magna (2). Raztopljena koncentracija kisika mora znašati več kot 3 mg/l ob začetku preskusa in med njim. Vrednost pH mora biti v območju 6–9 in običajno ne sme odstopati za več kot 1,5 enote v katerem koli preskusu. Priporočena je trdota nad 140 mg/l (kot CaCO3). Pri preskusih na tej ravni in nad njo je bila ugotovljena sposobnost razmnoževanja, ki je v skladu z merili za veljavnost (11) in (12). Preskusne raztopine Preskusne raztopine izbranih koncentracij se običajno pripravijo z redčenjem osnovne raztopine. Če je mogoče, se osnovne raztopine pripravijo brez kakršnih koli topil ali disperzijskih sredstev, z mešanjem ali stresanjem preskusne kemikalije v preskusnem mediju z mehanskimi postopki, kot so stresanje, mešanje ali ultrazvočno razbijanje, ali drugimi ustreznimi metodami. Priporočeno je, da se preskusne sisteme izpostavi koncentracijam preskusne kemikalije, ki bodo uporabljene v študiji, za tako dolgo, kot je potrebno, da se dokaže ohranjanje obstojnih koncentracij izpostavljenosti, preden se doda preskusne organizme. Če je preskusno kemikalijo težko raztopiti v vodi, je treba slediti postopkom, ki so opisani v smernici OECD za ravnanje z zahtevnimi snovmi (13). Uporabi topil ali disperzijskih sredstev se je treba izogniti, vendar je v nekaterih primerih morda potrebna za pripravo osnovne raztopine z ustrezno koncentracijo za odmerjanje. Poleg preskusnih koncentracij je treba izvesti tudi kontrolo z vodo za redčenje z ustreznimi ponovljenimi vzorci in, če se temu ne da izogniti, kontrolo s topilom z ustreznimi ponovljenimi vzorci. V preskusu je treba uporabiti samo topila ali disperzijska sredstva, za katera je bilo dokazano, da nimajo znatnega učinka na spremenljivko odziva ali pa imajo nanjo le manjši učinek. Primeri ustreznih topil (npr. aceton, etanol, metanol, dimetilformamid in trietilen glikol) ter disperzijskih sredstev (npr. Cremophor RH40, 0,01-odstotna metilceluloza in HCO-40) so navedeni v (13). Če se uporabi topilo ali disperzijsko sredstvo, njegova končna koncentracija ne sme biti višja od 0,1 ml/l (13) in v vseh preskusnih posodah mora biti ista koncentracija, razen v kontroli z vodo za redčenje. Čim bolj pa si je treba prizadevati, da so koncentracije topil čim nižje. POSTOPEK Pogoji izpostavljenosti Trajanje Preskus traja 21 dni. Obremenitev Starši se gojijo ločeno, en na preskusno posodo, običajno z 50–100 ml (za vrsto Daphnia magna, možne pa so tudi manjše prostornine, zlasti za manjše vrste vodnih bolh, npr. Ceriodaphnia dubia) medija v vsaki posodi, razen če je za preskušanje potreben pretočni načrt preskusa. Včasih so morda potrebne večje prostornine za izpolnitev zahtev analitskega postopka, ki se uporabi za določanje koncentracije preskusne kemikalije, za kemijsko analizo pa se lahko ponovljeni vzorci tudi združijo. Če se uporabijo prostornine, večje od 100 ml, je morda treba povečati obroke za vrsto Daphnia, da se zagotovi zadostna dostopnost hrane in skladnost z merili za veljavnost. Poskusne živali Pri polstatičnih preskusih se goji vsaj deset živali posamezno za vsako preskusno koncentracijo in vsaj deset živali posamezno za kontrolno serijo. Pri pretočnih preskusih je bilo ugotovljeno, da je ustrezno razdeliti 40 živali v štiri skupine po deset živali za vsako preskusno koncentracijo (1). Uporabi se lahko manjše število preskusnih organizmov, priporočeno pa je najmanj 20 živali na koncentracijo, ki so razdeljene v dva ali več ponovljenih vzorcev z enakim številom živali (npr. štiri ponovljeni vzorci, vsak s petimi vodnimi bolhami). Opozoriti je treba, da pri preskusih, v katerih se živali gojijo v skupinah, ne bo iz statistične analize mogoče izključiti nobenih potomcev, če pride do nenamerne/naključne smrtnosti staršev po začetku razmnoževanja, zato je v takih primerih treba izraziti sposobnost razmnoževanja kot skupno število živih potomcev, ustvarjenih na starša iz skupine na začetku preskusa. Tretiranja, ki se dodelijo preskusnim posodam, in vsa nadaljnja ravnanja s preskusnimi posodami, morajo biti naključna. Če ni, lahko pride do pristranskosti, ki bi se lahko razumela kot učinek koncentracije. Zlasti če se s preskusnimi enotami ravna po vrstnem redu tretiranj ali koncentracij, lahko nek učinek, odvisen od časa, kot je utrujenost izvajalca ali druga napaka, pomeni večje učinke pri višjih koncentracijah. Poleg tega, če bodo na rezultate preskusa verjetno vplivali začetni ali okoljski pogoji preskusa, na primer položaj v laboratoriju, je treba obravnavati načrt preskusa z naključnimi bloki. Hranjenje Pri polstatičnih preskusih je treba živali po možnosti hraniti vsak dan oziroma vsaj trikrat na teden (tj. skladno s spremembami medija). Upoštevati je treba morebitno razredčenje koncentracij izpostavljenosti zaradi dodajanja hrane in ga čim bolj preprečiti z ustreznimi koncentracijami suspenzij alg. Odstopanja od tega (npr. za pretočne preskuse) je treba navesti v poročilu. Med preskusom mora biti hrana staršev po možnosti sestavljena iz živih celic alg ene ali več naslednjih vrst: Chlorella sp., Pseudokirchneriella subcapitata (prej znana kot Selenastrum capricornutum) in Desmodesmus subspicatus (prej znana kot Scenedesmus subspicatus). Hrana mora temeljiti na količini organskega ogljika (C), ki se zagotovi za vsakega starša. Raziskave (14) so pokazale, da je velikost obrokov med 0,1 in 0,2 mg C/vodno bolho/dan za vrsto Daphnia magna dovolj, da se doseže zahtevano število živih potomcev in izpolnijo merila za veljavnost preskusa. Obroki se lahko zagotavljajo z enako stopnjo hranjenja ves čas trajanja preskusa, po želji pa se lahko na začetku preskusa uporabi nižja stopnja in se nato med preskusom povečuje, da se upošteva rasti staršev. V tem primeru morajo biti obroki še vedno ves čas v priporočenem območju, ki znaša 0,1–0,2 mg C/vodno bolho/dan. Če se morajo za zagotavljanje zahtevane stopnje obroka uporabiti nadomestne meritve, kot sta število celic alg ali absorbanca svetlobe (tj. zaradi večje pripravnosti, saj je merjenje vsebnosti ogljika zamudno), mora vsak laboratorij pripraviti svoj nomogram, ki povezuje nadomestno meritev z vsebnostjo ogljika v kulturi alg (glej Dodatek 3 za nasvete o izdelavi nomogramov). Nomograme je treba preveriti vsaj enkrat letno in bolj pogosto, če se spremenijo pogoji gojenja alg. Ugotovljeno je bilo, da je absorbanca svetlobe boljše nadomestilo za vsebnost ogljika kot število celic (15). Vrsto Daphnia je treba hraniti s koncentrirano suspenzijo alg, da se čim bolj zmanjša prostornina gojišča alg, ki je bil prenesen v preskusne posode. Koncentracijo alg se lahko doseže s centrifugiranjem, ki mu sledi ponovno suspendiranje v gojišču za vrsto Daphnia. Svetloba 16 ur svetlobe s svetilnostjo, ki ne presega 15–20 μE ߦ m–2 ߦ s–1 in se izmeri na površini vode v posodi. Pri merilnikih svetlobe, umerjenih v luksih, enakovredno območje 1 000–1 500 luksov za hladno belo svetlobo približno ustreza priporočeni svetilnosti 15–20 μE·m-2·s-1). Temperatura Temperatura preskusnega medija mora biti v območju 18–22 °C. Pri katerem koli preskusu pa temperatura ne sme odstopati za več kot 2 °C od teh mej dnevnega območja (npr. 18–20, 19–21 ali 20–22 °C). Za spremljanje temperature je morda ustrezno uporabiti dodatno preskusno posodo. Prezračevanje Preskusne posode se med preskusom ne smejo prezračevati. Načrt preskusa Preskus za določanje območja Po potrebi se preskus za določanje območja izvede na primer s petimi koncentracijami preskusne kemikalije in dvema ponovljenima vzorcema za vsako tretiranje in kontrolo. Pri odločanju o območju koncentracij, ki jih je treba uporabiti pri preskusu za določanje območja, so lahko uporabne tudi dodatne informacije o akutni toksičnosti za vrsto Daphnia in/ali druge vodne organizme iz preskusov s podobnimi kemikalijami ali virov. Preskus za določanje območja traja 21 dni ali tako dolgo, da se lahko zanesljivo predvidijo ravni učinkov. Na koncu preskusa se oceni razmnoževanje vrste Daphnia. Zabeležiti je treba število odraslih in pojav potomcev. Končni preskus Običajno se uporabi vsaj pet preskusnih koncentracij, ki oklepajo učinkovito koncentracijo (npr. ECx) in so razvrščene v geometrijskem zaporedju z razmerjem, ki po možnosti ne presega 3,2. Uporabiti je treba ustrezno število ponovljenih vzorcev za vsako preskusno koncentracijo (glej odstavke 24–25). Če se uporabi manj kot pet koncentracij, je treba to utemeljiti. Kemikalije se ne smejo preskušati nad njihovo mejo topnosti v preskusnem mediju. Pred izvedbo preskusa je priporočljivo obravnavati statistično moč načrta preskusov in uporabo ustreznih statističnih metod (4). Pri določanju območja koncentracij je treba upoštevati naslednje:
Če pri najvišji koncentraciji v preskusu za določanje območja (npr. pri 10 mg/l) niso ugotovljeni učinki ali če je zelo verjetno, da ima preskusna kemikalija nizko toksičnost/ni toksična na podlagi pomanjkanja toksičnosti za druge organizme in/ali nizke absorpcije/ni absorpcije, se lahko preskus razmnoževanja izvede kot mejni preskus, pri čemer se uporabi preskusna koncentracija, ki znaša npr. 10 mg/l, in kontrola. Uporabiti je treba deset ponovljenih vzorcev za tretirano in kontrolno skupino. Če je treba mejni preskus izvesti v pretočnem sistemu, je ustrezno uporabiti manj ponovljenih vzorcev. Z mejnim preskusom se lahko dokaže, da pri mejni koncentraciji ni statistično značilnega učinka, če pa se zabeležijo učinki, je običajno treba izvesti popoln preskus. Kontrole Poleg preskusne serije je treba izvesti kontrolno serijo z enim preskusnim medijem in, če je ustrezno, eno kontrolno serijo s topilom ali disperzijskim sredstvom. Če se uporabi topilo ali disperzijsko sredstvo, mora biti njegova koncentracija enaka tisti, ki je uporabljena v posodah s preskusno kemikalijo. Uporabiti je treba ustrezno število ponovljenih vzorcev (glej odstavke 23–24). Na splošno bi moral pri pravilno izvedenem preskusu koeficient variacije pri povprečnem številu živih potomcev na starša v kontrolah znašati ≤ 25 %, kar je treba navesti pri načrtih preskusa, pri katerih se uporabljajo živali, ki se gojijo posamezno. Obnavljanje preskusnega medija Pogostost obnavljanja medija je sicer odvisna od obstojnosti preskusne kemikalije, vendar ga je treba obnavljati vsaj trikrat na teden. Če je iz predhodnih preskusov obstojnosti (glej odstavek 7) razvidno, da koncentracija preskusne kemikalije ni obstojna (tj. ni v območju 80–120 % nominalne ali pade pod 80 % izmerjene začetne koncentracije) v najdaljšem obdobju obnavljanja (tj. tri dni), je treba obravnavati pogostejše obnavljanje medija ali uporabo pretočnega preskusa. Kadar se pri polstatičnih preskusih obnavlja medij, se pripravi druga serija preskusnih posod, vanje pa se prenese starše, na primer s stekleno pipeto ustreznega premera. Prostornina medija, prenesenega z vrsto Daphnia, mora biti čim manjša. Opazovanja Rezultate opazovanj med preskusom je treba zabeležiti na podatkovnih listih (glej primere v Dodatkih 4 in 5). Če so zahtevane druge meritve (glej odstavek 44), bodo morda potrebna dodatna opazovanja. Potomci Po možnosti je treba odstraniti potomce vsakega starša in jih prešteti vsak dan od pojava prvega zaroda, da ne bi jedli hrane, namenjene staršem. Za namen te metode je treba prešteti samo število živih potomcev, vendar je treba zabeležiti prisotnost nedozorelih jajčec ali mrtvih potomcev. Smrtnost Smrtnost med starši je treba po možnosti beležiti vsak dan ali vsaj tako pogosto, kot se štejejo potomci. Drugi parametri Čeprav je ta preskusna metoda zasnovana predvsem za ocenjevanje učinkov na sposobnost razmnoževanja, se morda lahko v zadostni meri količinsko opredelijo tudi drugi učinki, ki omogočajo statistično analizo. Lahko se zabeleži sposobnost razmnoževanja na preživelega starša, tj. število živih potomcev, ustvarjenih med preskusom na preživelega starša. To se lahko primerja z glavno spremenljivko odziva (sposobnost razmnoževanja na starša na začetku preskusa, ki ni nenamerno ali naključno umrl med preskusom). Če se smrtnost staršev pojavi v izpostavljenih ponovljenih vzorcih, je treba obravnavati, ali smrtnost sledi vzorcu odziva na koncentracijo ali ne, npr. če obstaja precejšnja regresija odziva v odvisnosti od koncentracije preskusne kemikalije s pozitivnim naklonom (za to se lahko uporabi statistični preskus, kot je Cochran-Armitagev trendnostni test). Če smrtnost ne sledi vzorcu odziva na koncentracijo, je treba navedene ponovljene vzorce s smrtnostjo staršev izključiti iz analize preskusnega rezultata. Če smrtnost sledi vzorcu odziva na koncentracijo, je treba smrtnost staršev obravnavati kot učinek preskusne kemikalije, ponovljeni vzorci pa se ne smejo izključiti iz analize preskusnega rezultata. Meritve rasti so zelo zaželene, saj zagotovijo informacije o morebitnih subletalnih učinkih, ki so lahko uporabne poleg zgolj meritev razmnoževanja; priporočeno je merjenje dolžine staršev (tj. dolžine telesa, razen analne osti) na koncu preskusa. Drugi parametri, ki se lahko izmerijo ali izračunajo, zajemajo obdobje do ustvarjanja prvega zaroda (in nadaljnjih zarodov), število in velikost zarodov na žival, število nedozorelih zarodov, prisotnost novorojenih samcev (OECD 2008) ali zimskih jajc ter morebiti intrinzično hitrost povečanja populacije (glej Dodatek 1 za opredelitve in Dodatek 7 za opredeljevanje spola novorojenih živali). Pogostost analitskega določanja in meritev Koncentracijo kisika, temperaturo, trdoto in vrednosti pH je treba meriti vsaj enkrat tedensko v svežih in starih medijih, kontrolah in najvišjih koncentracijah preskusne kemikalije. Med preskusom se v rednih časovnih intervalih določajo koncentracije preskusne snovi. Kadar se pri polstatičnih preskusih pričakuje, da bo koncentracija preskusne kemikalije ostala v območju ± 20 % nominalne vrednosti (tj. v območju 80–120 % – glej odstavke 6, 7 in 39), je priporočeno, da se analizirajo vsaj najvišje in najnižje preskusne koncentracije, ko so sveže pripravljene, in ob enem obnavljanju v prvem tednu preskusa (tj. analize je treba izvesti na vzorcu iz iste raztopine – ko je sveže pripravljena in ob obnavljanju). Te določitve je nato treba ponavljati najmanj enkrat tedensko. Kadar se pri preskusih ne pričakuje, da bo koncentracija preskusne kemikalije ostala v območju ± 20 % nominalne vrednosti, je treba analizirati vse preskusne koncentracije, ko so sveže pripravljene in ob obnavljanju. Kadar pa pri preskusih izmerjena začetna koncentracija preskusne kemikalije ni v območju ± 20 % nominalne vrednosti, ampak se lahko zagotovijo zadostni dokazi, da so začetne koncentracije ponovljive in obstojne (tj. v območju 80–120 % začetnih koncentracij), se kemijske določitve v drugem in tretjem tednu preskusa lahko zmanjšajo na najvišje in najnižje preskusne koncentracije. V vsakem primeru pa je treba koncentracije preskusne kemikalije pred obnavljanjem določiti samo za eno posodo s ponovljenim vzorcem pri vsaki preskusni koncentraciji. Če se uporabi pretočni preskus, je ustrezno uporabiti podoben časovni razpored vzorčenja, kot je opisan za polstatične preskuse (toda v tem primeru se ne merijo „stare“ raztopine). Morda pa bi bilo priporočljivo povečati število vzorčenj v prvem tednu (npr. tri serije meritev), da se zagotovi ohranjanje obstojnosti preskusnih koncentracij. Pri teh vrstah preskusa je treba vsakodnevno preverjati pretok razredčila in preskusne kemikalije. Če obstajajo dokazi, da je bila koncentracija preiskovane kemikalije ves čas trajanja preskusa ustrezno v območju ± 20 % nominalne ali izmerjene začetne koncentracije, lahko rezultati temeljijo na nominalni ali izmerjeni začetni vrednosti. Če je odstopanje od nominalne ali izmerjene začetne koncentracije večje od ± 20 %, je treba rezultate izraziti v smislu tehtanega povprečja v določenem časovnem intervalu (glej smernice za izračun iz Dodatka 6). PODATKI IN POROČANJE Obdelava rezultatov Namen tega preskusa je določiti učinke preskusne kemikalije na sposobnost razmnoževanja. Skupno število živih potomcev na starša je treba izračunati za vsako preskusno posodo (tj. ponovljeni vzorec). Poleg se lahko razmnoževanje izračuna na podlagi živih potomcev, ki jih ustvari preživeli starš. Ekološko najpomembnejša spremenljivka odziva pa je skupno število živih potomcev, ustvarjenih na starša, ki ne umre naključno (96) ali nenamerno (97) med preskusom. Če starš med preskusom naključno ali nenamerno umre, ali pa se izkaže, da je samec, se ponovljeni vzorec izključi iz analize. Analiza bo potem temeljila na zmanjšanem številu ponovljenih vzorcev. Če se smrtnost staršev pojavi v izpostavljenih ponovljenih vzorcih, je treba obravnavati, ali smrtnost sledi vzorcu odziva na koncentracijo ali ne, npr. če obstaja precejšnja regresija odziva v odvisnosti od koncentracije preskusne kemikalije s pozitivnim naklonom (za to se lahko uporabi statistični preskus, kot je Cochran-Armitagev trendnostni test). Če smrtnost ne sledi vzorcu odziva na koncentracijo, je treba navedene ponovljene vzorce s smrtnostjo staršev izključiti iz analize preskusnega rezultata. Če smrtnost sledi vzorcu odziva na koncentracijo, je treba smrtnost staršev obravnavati kot učinek preskusne kemikalije, ponovljeni vzorci pa se ne smejo izključiti iz analize preskusnega rezultata. Torej kadar se za izražanje učinkov uporabijo LOEC in NOEC ali ECx, je priporočeno, da se učinek na razmnoževanje izračuna z obema navedenima spremenljivkama odziva, tj.
nato pa se kot končni rezultat uporabi najnižja vrednost NOEC in LOEC ali ECx, ki se izračuna z eno od teh dveh spremenljivk odziva. Preden se uporabi statistična analiza, npr. postopki analize variance, primerjava tretiranj s kontrolami s Studentovim t-testom, Dunnettovim testom, Williamsovim testom ali testom po Jonckheere-Terpstraju, je priporočeno obravnavati pretvorbo podatkov, če je ta potrebna za izpolnitev zahtev določenega statističnega testa. V okviru drugih, neparametričnih možnosti se lahko obravnava Dunnov ali Mann-Whitneyjev test. Za povprečja posameznih tretiranj se izračunajo 95-odstotni intervali zaupanja. Število preživelih staršev v netretiranih kontrolah je merilo za veljavnost, ki ga je treba dokumentirati in navesti v poročilu. V končnem poročilu je treba navesti tudi vse druge škodljive učinke, npr. nenavadno vedenje in pomembne toksikološke ugotovitve. ECx Vrednosti ECx, vključno z njihovimi pripadajočimi zgornjimi in spodnjimi mejami zaupanja, se izračunajo z ustreznimi statističnimi metodami (npr. logistično ali Weibullovo funkcijo, prilagojeno Spearman-Karberjevo metodo ali enostavno interpolacijo). Za izračun EC10, EC50 ali katere koli druge vrednosti ECx je treba celoten nabor podatkov analizirati z regresijsko analizo. NOEC/LOEC Če je namen statistične analize določiti NOEC/LOEC, je treba uporabiti ustrezne statistične metode v skladu z dokumentom OECD št. 54 z naslovom Sodobni pristopi pri statistični analizi podatkov o ekotoksičnosti: smernice za uporabo (4). Na splošno se neželeni učinki preskusne kemikalije v primerjavi s kontrolo proučujejo s preskušanjem enostransko zastavljene hipoteze pri p ≤ 0,05. Normalna porazdelitev in homogenost varianc se lahko preskusita z ustreznim statističnim testom, npr. Shapiro-Wilkovim testom oziroma Levenovim testom (p ≤ 0,05). Izvedejo se lahko enofaktorska analiza variance (ANOVA) in nadaljnje metode večkratne primerjave. Preskusi večkratne primerjave (npr. Dunnettov test) ali večstopenjski trendnostni testi (npr. Williamsov test ali test po Jonckheere-Terpstraju) se lahko uporabijo za izračun, ali obstajajo znatne razlike (p ≤ 0,05) med kontrolami in različnimi koncentracijami preskusne kemikalije (izbira priporočenega testa v skladu z Dokumentom s smernicami OECD št. 54 (4)). V nasprotnem primeru se lahko za določanje vrednosti NOEC in LOEC uporabijo neparametrične metode (npr. Bonferronijev U-test po Holmu ali trendnostni test po Jonckheere-Terpstraju). Mejni test Če je bil izveden mejni test (primerjava kontrole in samo ene tretirane skupine) in so izpolnjeni predpogoji za postopke parametričnih testov (normalnost, homogenost), je mogoče s Studentovim testom (t-testom) ovrednotiti odzive metrik. Če te zahteve niso izpolnjene, se lahko uporabi t-test za neenake variance (na primer Welchev t-test) ali neparametrični test, kot je Mann-Whitneyjev U-test. Za določanje značilnih razlik med kontrolami (kontrolo in kontrolo s topilom ali kontrolo z disperzijskim sredstvom) se lahko preskusijo ponovljeni vzorci vsake kontrole, kot je opisano za mejni preskus. Če ti preskusi ne zaznajo značilnih razlik, se lahko združijo vsi kontrolni ponovljeni vzorci in kontrolni ponovljeni vzorci s topilom. V nasprotnem primeru je treba vse tretirane vzorce primerjati s kontrolo s topilom. Poročilo o preskusu V poročilo o preskusu se vključijo naslednji podatki:
VIRI
Dodatek 1 OPREDELITEV POJMOV Za to preskusno metodo se uporabljajo naslednje opredelitve pojmov: Naključna smrtnost : smrtnost, ki ni povezana s kemikalijo in jo povzroči naključni dogodek (tj. znani vzrok). Kemikalija : snov ali zmes. Ecx : koncentracija preskusne kemikalije, raztopljene v vodi, ki povzroči x-odstotno zmanjšanje pri razmnoževanju vrste Daphniav navedenem obdobju izpostavljenosti. Nenamerna smrtnost : smrtnost, ki ni povezana s kemikalijo in nima znanega vzroka. Intrinzična hitrost povečanja populacije : je merilo rasti populacije, ki združuje sposobnost razmnoževanja in smrtnost pri določeni starosti (1), (2) in (3). Pri stacionarnih populacijah je enaka nič. Pri rastočih populacijah je pozitivna, pri upadajočih pa negativna. Slednja seveda ni trajnostna in na koncu vodi k izumrtju. Meja zaznavnosti : najnižja koncentracija, ki jo je mogoče zaznati, vendar ne količinsko opredeliti. Meja določljivosti : najnižja koncentracija, ki jo je mogoče količinsko izmeriti. Najnižja koncentracija z opaženim učinkom (LOEC) : je najnižja preskušena koncentracija kemikalije, pri kateri je ugotovljen statistično značilen učinek na razmnoževanje in smrtnost staršev (pri p < 0,05) v primerjavi s kontrolo v navedenem obdobju izpostavljenosti. Toda vse koncentracije nad vrednostjo LOEC morajo imeti škodljiv učinek, ki je enak ali večji od škodljivega učinka, opaženega pri vrednosti LOEC. Če ta dva pogoja nista izpolnjena, je treba v celoti pojasniti, kako je bila izbrana vrednost LOEC (in posledično NOEC). Smrtnost : žival se zabeleži kot mrtva, če se ne premika, tj. če ne more plavati ali če v 15 sekundah po rahlem tresenju preskusne posode ni mogoče opaziti premikanja okončin ali postabdomna. (Če se uporabi druga opredelitev pojmov, jo je treba navesti v poročilu skupaj z virom.) Koncentracija brez opaznega učinka (NOEC) : preskusna koncentracija tik pod vrednostjo LOEC, ki v navedenem obdobju izpostavljenosti v primerjavi s kontrolo nima statistično značilnega učinka (p < 0,05). Potomci : so mladiči vodne bolhe vrste Daphnia, ki jih starši ustvarijo med preskusom. Starši : so samice vodne bolhe vrste Daphnia, ki so prisotne na začetku preskusa in katerih sposobnost razmnoževanja je predmet te študije. Sposobnost razmnoževanja : število živih potomcev, ki jih ustvarijo starši med preskusnim obdobjem. Preskusna kemikalija : vsaka snov ali zmes, preskušena s to preskusno metodo. Viri
Dodatek 2 PRIPRAVA POVSEM DOLOČENIH MEDIJEV ELENDT M7 IN M4 Aklimatizacija na medija Elendt M7 in M4 Nekateri laboratoriji so imeli težave pri neposrednem prenosu vrste Daphnia v medija M4 (1) in M7. V določeni meri pa so to uspešno rešili s postopno aklimatizacijo, tj. s prenosom iz lastnega medija v 30-odstotni, 60-odstotni in nato v 100-odstotni medij Elendt. Aklimatizacijska obdobja lahko trajajo tudi do enega meseca. Priprava Elementi v sledeh Ločene osnovne raztopine (I) s posameznimi elementi v sledeh se najprej pripravijo v vodi z ustrezno čistostjo, npr. deionizirani, destilirani ali pridobljeni z obratno osmozo. Iz teh različnih osnovnih raztopin (I) se pripravi druga osnovna raztopina (II), ki vsebuje vse elemente v sledeh (kombinirana raztopina), tj.:
Medija M4 in M7 Medija M4 in M7 se pripravita z osnovno raztopino II, makrohranili in vitamini na naslednji način:
Kombinirana osnovna raztopina vitaminov se hrani zamrznjena v majhnih enakih količinah. Vitamini se medijem dodajo tik pred uporabo.
Dodatek 3 ANALIZA SKUPNEGA ORGANSKEGA OGLJIKA (TOC) IN IZDELAVA NOMOGRAMA ZA VSEBNOST TOC V HRANI IZ ALG Ugotovljeno je bilo, da se vsebnost ogljika v hrani iz alg običajno ne meri neposredno, ampak na podlagi korelacij (tj. nomogramov) z nadomestnimi meritvami, kot sta število celic alg ali absorbanca svetlobe. Skupni organski ogljik (TOC) je bolje meriti z visokotemperaturno oksidacijo kot pa z UV ali persulfatnimi metodami. (Za nasvet glej: The Instrumental Determination of Total Organic Carbon, Total Oxygen Demand and Related Determinands 1979, HMSO 1980; 49 High Holborn, London WC1V 6HB). Za izdelavo nomograma je treba alge ločiti od gojišča s centrifugiranjem, ki mu sledi ponovno suspendiranje v destilirani vodi. Nadomestni parameter in koncentracija TOC za vsak vzorec se izmerita trikrat. Analizirati je treba slepe kontrolne vzorce z destilirano vodo in izpeljati koncentracijo TOC iz koncentracije TOC v vzorcu alg. Nomogram mora biti linearen v zahtevanem območju koncentracij ogljika. Primeri so prikazani v nadaljevanju.

Chlorella vulgaris var. viridis (CCAP 211/12). Regresija mg/l suhe teže na mg C/1. Podatki iz koncentriranih suspenzij v polkontinuirani seriji gojenih celic, ponovno suspendiranih v destilirani vodi. os x: mg C/1 koncentrirane hrane iz alg os y: mg/1 suhe teže koncentrirane hrane iz alg Korekcijski koeficient -0,980 
Chlorella vulgaris var. viridis (CCAP 211/12). Regresija števila celic na mg C/1. Podatki iz koncentriranih suspenzij v polkontinuirani seriji gojenih celic, ponovno suspendiranih v destilirani vodi. os x: mg C/1 koncentrirane hrane iz alg os y: št. celic/1 koncentrirane hrane iz alg Korekcijski koeficient -0,926 
Chlorella vulgaris var. viridis (CCAP 211/12). Regresija absorbance na mg C/1 (1 cm dolžine poti). Podatki iz koncentriranih suspenzij v polkontinuirani seriji gojenih celic, ponovno suspendiranih v destilirani vodi. os x: mg C/1 koncentrirane hrane iz alg os y: absorbanca pri 440 nm pri 1/10 razredčitvi koncentrirane hrane iz alg Korekcijski koeficient -0,998 Dodatek 4 PRIMER PODATKOVNEGA LISTA ZA BELEŽENJE OBNAVLJANJA MEDIJEV, FIZIKALNIH/KEMIJSKIH PODATKOV O SPREMLJANJU, HRANJENJA, RAZMNOŽEVANJA VODNIH BOLH IN SMRTNOST STARŠEV
Dodatek 5 PRIMER PODATKOVNEGA LISTA ZA BELEŽENJE REZULTATOV KEMIJSKE ANALIZE (a) Izmerjene koncentracije
(b) Izmerjene koncentracije kot odstotek nominalne vrednosti
Dodatek 6 IZRAČUN TEHTANEGA POVPREČJA V DOLOČENEM ČASOVNEM INTERVALU Tehtano povprečje v določenem časovnem intervalu Ker lahko koncentracija preskusne kemikalije v obdobju med obnavljanjem medija upade, je treba obravnavati, kakšno koncentracijo je treba izbrati kot reprezentativno za območje koncentracij, ki so jim izpostavljeni starši vrste Daphnia. Izbira mora temeljiti na bioloških in statističnih vidikih. Če naj bi na razmnoževanje na primer najbolj vplivala najvišja koncentracija, ki so ji živali izpostavljene, je treba uporabiti najvišjo koncentracijo. Če pa naj bi bil pomembnejši akumulirani ali dolgotrajni učinek toksične kemikalije, je ustrezneje izbrati povprečno koncentracijo. V tem primeru je ustrezno uporabiti tehtano povprečje v določenem časovnem intervalu za koncentracijo, saj ta upošteva spreminjanje trenutne koncentracije v odvisnosti od časa. Slika 1 Primer tehtanega povprečja v določenem časovnem intervalu 
Slika 1 prikazuje primer (poenostavljenega) preskusa, ki je trajal sedem dni, medij pa se je obnavljal na dneve 0, 2 in 4.
Tehtano povprečje v določenem časovnem intervalu se izračuna tako, da je površina pod tehtanim povprečjem enaka površini pod krivuljo koncentracije. Izračun za navedeni primer je prikazan v preglednici 1. Preglednica 1 Izračun tehtanega povprečja v določenem časovnem intervalu
Površina je površina pod eksponentno krivuljo za vsako obdobje obnavljanja. Izračuna se z enačbo:
Tehtano povprečje v določenem časovnem intervalu (tehtano povprečje) je skupna površina deljeno s skupno dni. Seveda je treba za preskus razmnoževanja vrste Daphnia preglednico razširiti na 21 dni. Če se opazovanja opravijo samo na začetku in na koncu vsakega obdobja obnavljanje, seveda ni mogoče potrditi, ali je proces upadanja dejansko eksponenten. Drugačna krivulja bi pomenila drugačen izračun za površino. Vendar eksponentni proces upadanja ni nemogoč in je verjetno najboljša krivulja, ki se lahko uporabi, če ni na voljo drugih informacij. Previdno pa je treba obravnavati rezultate, če se s kemijsko analizo na koncu obdobja obnavljanja ne najde nobene kemikalije. Če ni mogoče oceniti, kako hitro je kemikalija izginila iz raztopine, je nemogoče dobiti realistično površino pod krivuljo, zato je tudi nemogoče dobiti ustrezno tehtano povprečje v določenem časovnem intervalu. Dodatek 7 SMERNICE ZA OPREDELJEVANJE SPOLA NOVOROJENIH ŽIVALI Do ustvarjanja novorojenih samcev lahko pride v spremenljivih okoljskih pogojih, kot so skrajšano obdobje osvetljenosti, temperatura, upadanje koncentracije v hrani in vedno večja gostota populacije (Hobaek in Larson, 1990; Kleiven idr., 1992). Ustvarjanje samcev je tudi znan odziv na določene regulatorje rasti žuželk (Oda idr., 2005). V pogojih, ko kemijski obremenilni dejavniki povzročajo upadanje števila za razmnoževanje sposobnih potomcev partenogenetskih samic, je mogoče pričakovati večje število samcev (OECD, 2008). Na podlagi razpoložljivih informacij ni mogoče predvideti, ali bo občutljivejše razmerje med spoloma ali končna točka razmnoževanja, obstajajo pa pokazatelji (glej „validacijsko poročilo“, del 1), da je to povečanje števila samcev morda manj občutljivo kot pa upadanje števila potomcev. Ker je glavni namen te preskusne metode oceniti število ustvarjenih potomcev, je pojavljanje samcev neobvezno opažanje. Če se ta neobvezna končna točka oceni v študiji, je treba uporabiti dodatno merilo za veljavnost preskusa z ne več kot 5 % samci v kontrolah. Spol vrste Daphnia se najbolj praktično in preprosto ugotovi tako, da se uporabi njihove fenotipske značilnosti, saj so samci in samice genetsko identični, na določitev spola pa vpliva okolje. Samci in samice so si različni po dolžini in morfologiji sprednjih tipalk, ki so pri samcih daljše kot pri samicah (slika 1). Razliko je mogoče prepoznati takoj po rojstvu, med odraščanjem pa se razvijejo tudi druge sekundarne spolne značilnosti (npr. glej sliko 2 v Olmstead in LeBlanc, 2000). Za ugotavljanje morfološkega spola je treba novorojene živali, ustvarjene na vsako poskusno žival, prenesi s pipeto in jih vstaviti v petrijevko s preskusnim medijem. Prostornina medija je čim manjša, da se omeji gibanje živali. Sprednje tipalke se lahko opazijo pod stereomikroskopom (10–60). Slika 1 24-ur star samec (levo) in samica (desno) vrste D. magna. Samce je mogoče ločiti od samic po dolžini in morfologiji sprednjih tipalk, kot je prikazano v krogih (Tatarazako idr., 2004). 
VIRI Hobaek A. in Larson P. 1990. Sex determination in Daphnia magna. Ecology 71: 2255–2268. Kleiven O. T., Larsson P., Hobaek A., 1992. Sexual reproduction in Daphnia magna requires three stimuli. Oikos 65, 197–206. Oda S., Tatarazako N., Watanabe H., Morita M., in Iguchi T., 2005. Production of male neonates in Daphnia magna (Cladocera, Crustacea) exposed to juvenile hormones and their analogs. Chemosphere 61: 1168–1174. OECD, 2008. Validation report for an enhancement of OECD TG 211 Daphnia magna reproduction test. OECD Series on Testing and Assessment, št. 88. Organizacija za gospodarsko sodelovanje in razvoj, Pariz. Olmstead, A. W., LeBlanc, G. A., 2000. Effects of endocrine-active chemicals on the development characteristics of Daphnia magna. Environmental Toxicology and Chemistry 19: 2107–2113. Tatarazako, N., Oda, S., Abe, R., Morita, M. in Iguchi T., 2004. Development of a screening method for endocrine disruptors in crustaceans using Daphnia magna (Cladocera, Crustacea). Environmental Science 17, 439–449. |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
(18) |
V delu C se poglavje C.29, odstavek 66, nadomesti z naslednjim:
|
|
(19) |
V delu C se dodajo naslednja poglavja: „C.47 Ribe, preskus toksičnosti za zgodnje razvojne stopnje UVOD
NAČELO PRESKUSA
INFORMACIJE O PRESKUSNI KEMIKALIJI
VELJAVNOST PRESKUSA
OPIS METODE Preskusne komore
Izbira vrst
Vzdrževanje plemenskih rib
Ravnanje z oplojenimi ikrami, zarodki in ličinkami
Voda
Preskusne raztopine
POSTOPEK Pogoji izpostavljenosti Trajanje
Obremenitev
Svetloba in temperatura
Hranjenje
Preskusne koncentracije
Kontrole
Pogostost analitskega določanja in meritev
Opazovanja 26. Stopnje razvoja zarodka : embrionalno stopnjo na začetku izpostavljenosti preskusni kemikaliji je treba čim natančneje preveriti. To se lahko naredi z uporabo reprezentativnega vzorca iker, ki so primerno konzervirane in očiščene. 27. Izvalitev in preživetje : vsaj enkrat na dan je treba opazovati izvalitev in preživetje ter zapisati vrednosti. Če se v zgodnjem razvoju zarodka (na primer prvi ali drugi dan preskusa) na ikrah opazijo glive, je treba te ikre prešteti in odstraniti. Mrtve zarodke, ličinke in mladice je treba odstraniti čim prej po tem, ko se opazijo, ker se lahko hitro razkrojijo in razpadejo zaradi delovanja drugih rib. Izjemna pazljivost je potrebna pri odstranjevanju posameznih mrtvih osebkov, da se fizično ne poškodujejo sosednje ikre/ličinke. Znaki smrti se razlikujejo glede na vrsto in razvojno stopnjo. Na primer:
28. Nenormalen videz : število ličink ali mladic, pri katerih se kaže nenormalna oblika telesa, je treba zapisovati v ustreznih časovnih razmikih, ki so odvisni od trajanja preskusa, pri čemer je treba opisati naravo anomalije. Opozoriti je treba, da so nenormalne ličinke in mladice lahko naraven pojav in jih je v kontrolah pri nekaterih vrstah lahko več odstotkov. Kadar so deformacije in z njimi povezano nenormalno vedenje tako hudi, da organizem znatno trpi in si ne bo več mogel opomoči, se lahko izloči iz preskusa. Te živali je treba evtanazirati in jih v nadaljnji analizi podatkov zajeti v odstotek smrtnosti. Normalen razvoj zarodka je evidentiran za večino vrst, priporočenih za to preskusno metodo (9) (10) (11) (12). 29. Nenormalno vedenje : anomalije, npr. hiperventilacijo, nekoordinirano plavanje, netipično mirovanje in netipično vedenje pri hranjenju, je treba zapisovati v rednih časovnih razmikih, ki so odvisni od trajanja preskusa (npr. enkrat na dan pri toplovodnih vrstah). Čeprav je te učinke težko kvantificirati, lahko, če so opaženi, pripomorejo k razlagi podatkov o smrtnosti. 30. Teža : na koncu preskusa se vse preživele ribe stehtajo vsaj na podlagi ponovljenih vzorcev (v poročilo se vključita število živali v ponovljenem vzorcu in srednja vrednost teže na žival): priporoča se, da se v poročilo vključi mokra teža (osušena s pivnikom), vendar se lahko vanj vključijo tudi podatki o suhi teži (13). 31. Dolžina : na koncu preskusa se izmeri dolžina posameznih osebkov. Priporočljiva je meritev skupne dolžine, če pa pride do razpada repne plavuti ali erozije plavuti, se lahko uporabi standardna dolžina. Izbrano metodo je treba uporabiti pri vseh ribah v danem preskusu. Dolžina posameznega osebka se lahko izmeri na primer s kljunastim merilom, digitalnim fotoaparatom ali kalibriranim okularnim mikrometrom. Običajne najmanjše dolžine so opredeljene v Dodatku 2. PODATKI IN POROČANJE Obdelava rezultatov
Poročilo o preskusu
VIRI
Dodatek 1 OPREDELITVE POJMOV
Dodatek 2 PRESKUSNI POGOJI, TRAJANJE IN MERILA PREŽIVETJA ZA PRIPOROČENE VRSTE
Dodatek 3 NAVODILA ZA HRANJENJE PLEMENSKIH RIB IN PRESKUSNIH ŽIVALI PRIPOROČENIH VRST TER RAVNANJE Z NJIMI
Dodatek 4 NEKATERE KEMIJSKE LASTNOSTI SPREJEMLJIVE VODE ZA REDČENJE
Dodatek 5 STATISTIČNE SMERNICE ZA DOLOČITEV VREDNOSTI NOEC Splošno Enota analize je ponovitveni akvarij. Pri neprekinjenih meritvah, kot je meritev velikosti, je treba izračunati srednjo vrednost ali mediano ponovljenih vzorcev, te vrednosti ponovljenih vzorcev pa so podatki, ki se uporabijo za analizo. Dokazati je treba moč uporabljenih preskusov, po možnosti na podlagi ustrezne zbirke preteklih podatkov za vsak laboratorij. Za vsako končno točko pri statističnem testu, ki bo uporabljen, je treba navesti učinek na velikost, ki ga je mogoče opaziti s 75- do 80-odstotno močjo. V zbirkah podatkov, ki so bile na voljo v času razvoja te preskusne metode, se določi možna moč ob uporabi priporočljivih statističnih postopkov. Posamezni laboratorij mora dokazati, da lahko izpolnjuje to zahtevo po moči, tako da sam izvede analizo moči ali dokaže, da koeficient variacije (v nadaljnjem besedilu: KV) za vsak odziv ne presega 90. centila KV, uporabljenih pri pripravi smernic za preskušanje. Ti KV so navedeni v preglednici 1. Če so na voljo le srednje vrednosti ali mediane ponovljenih vzorcev, KV znotraj ponovljenega vzorca ni treba upoštevati. Preglednica 1 90. centil KV pri izbranih sladkovodnih vrstah
Pri skoraj vseh statističnih testih, ki se uporabljajo za oceno laboratorijskih toksikoloških študij, so najpogostejše primerjave med tretiranimi skupinami in kontrolo. Zato ni ustrezno zahtevati F-testa statistične značilnosti z analizo variance pred uporabo Dunnettovega ali Williamsovega testa oziroma Kruskal-Wallisovega testa statistične značilnosti pred uporabo testa po Jonckheere-Terpstraju, Mann-Whitneyjevega testa ali Dunnovega testa (Hochberg in Tamhane 1987; Hsu 1996; Dunnett 1955, 1964; Williams 1971, 1972, 1975, 1977; Robertson et al. 1988; Jonckheere 1954; Dunn 1964). Dunnettov test vključuje prilagoditev številčnosti, na deleža lažno pozitivnih in lažno negativnih rezultatov pri njem pa negativno vpliva uporaba F-testa za referenco. Podobno regresijski Williamsov test in regresijski test po Jonckheere-Terpstraju, pri katerih se ves čas uporablja stopnja značilnosti 0,05, ohranjata splošni 5-odstotni delež lažnih pozitivnih rezultatov, na ta delež in moč preskusov pa negativno vpliva uporaba F-testa ali Kruskal-Wallisovega testa za referenco. Mann-Whitneyjev in Dunnov test je treba prilagoditi številčnosti, pri čemer se priporoča Bonferroni-Holmova prilagoditev. Za podrobno razpravo o večini priporočil glede preskušanja domnev in preverjanja predpostavk, na katerih temeljijo ti testi, glej OECD (2006), ki vsebuje tudi obširno bibliografijo. Tretiranje kontrol, če se uporabi topilo Če se uporabi topilo, je treba vključiti kontrolo z vodo za redčenje in kontrolo s topilom. Obe kontroli je treba primerjati pri vsakem odzivu in ju združiti za statistično analizo, če med njima niso bile ugotovljene značilne razlike. Sicer je treba za določitev vrednosti NOEC ali oceno ECx uporabiti kontrolo s topilom, kontrola z vodo pa se ne uporabi. Glej omejitve meril za veljavnost preskusa (odstavek 7). Pri dolžini, teži in deležu izleženih iker, umrlih ličink ali nenormalnih ličink ter prvem ali zadnjem dnevu valitve ali splavanja je treba uporabiti T-test ali Mann-Whitneyjev test za primerjavo kontrole z vodo za redčenje in kontrole s topilom z ravnjo značilnosti 0,05, pri čemer tretirane skupine niso upoštevane. Rezultate teh testov je treba vključiti v poročilo. Meritve velikosti (dolžina in teža) Podatki o dolžini in teži posameznih rib so lahko porazdeljeni normalno ali logaritemsko normalno. V obeh primerih so srednje vrednosti ponovljenih vzorcev običajno normalno porazdeljene s centralnim limitnim izrekom in potrjene na podlagi podatkov iz več kot 100 študij o zgodnjih razvojnih fazah treh sladkovodnih vrst. Kadar podatki ali zbirke preteklih podatkov kažejo na logaritemsko normalno porazdelitev podatkov o velikosti posameznih rib, se lahko namesto tega za vrednosti pri posameznih ribah logaritmirajo srednje vrednosti ponovljenih vzorcev, podatki za analizo pa so lahko nato antilogaritem teh logaritmov srednjih vrednosti ponovljenih vzorcev. Oceniti je treba skladnost podatkov z normalno porazdelitvijo in homogenostjo variance. Za ta namen je treba uporabiti ostanke iz analize variance, pri čemer je koncentracija edina razlagalna razredna spremenljivka. Lahko se uporabi vizualno določanje z razsevnih grafikonov in histogramov ali histogramov s številkami. Namesto tega se lahko uporabi formalni test, na primer Shapiro-Wilkov ali Anderson-Darlingov test. Skladnost s homogenostjo variance se lahko oceni z vizualnim pregledom omenjenega razsevnega grafikona ali formalno z Levenejevim testom. Normalnost ali homogenost variance je treba oceniti samo pri parametričnih testih (npr. Williamsov ali Dunnettov test). Pozornost je treba nameniti možnim osamelcem in njihovemu vplivu na analizo. Uporabita se lahko Tukeyjev test osamelcev in vizualni pregled zgoraj opisanih prikazov ostankov. Opozoriti je treba, da opazovanja vključujejo celotne ponovljene vzorce, zato se osamelci izločijo iz analize šele po temeljitem premisleku. Statistični testi, ki upoštevajo značilnosti zasnove preskusa in biološka pričakovanja, so regresijski trendnostni testi, kot sta Williamsov test ali test po Jonckheere-Terpstraju. Ti testi predvidevajo monoton odziv na koncentracijo, zato je treba skladnost podatkov oceniti ob upoštevanju te predpostavke. Mogoča je vizualna ocena razsevnega grafikona srednjih vrednosti ponovljenih vzorcev v odvisnosti od preskusnih koncentracij. Pri tem se lahko razsevni grafikon prekrije z razdeljenim linearnim grafom, kar omogoči povezavo srednjih vrednosti koncentracij, uteženih z velikostjo ponovljenega vzorca. Veliko odstopanje razdeljenega linearnega grafa od monotonosti pomeni, da bo morda treba uporabiti netrendnostne teste. Namesto tega se lahko uporabijo formalni testi. Preprost formalni test je izračun linearnih in kvadratnih kontrastov srednjih vrednosti koncentracij. Če je kvadratni kontrast statistično značilen, linearni kontrast pa ni, to pomeni, da morda obstaja težava, povezana z monotonostjo, ki jo je treba nadalje ovrednotiti na podlagi prikazov. Pri težavah z normalnostjo ali homogenostjo variance se lahko ti kontrasti oblikujejo na podlagi podatkov o pretvorbi porazdelitve. Uporabijo se lahko tudi drugi postopki, na primer Bartholomewjev test monotonosti, vendar so ti kompleksnejši. Slika 2 Diagram poteka za določitev vrednosti NOEC pri meritvah velikosti (dolžina in teža) 
Razen če podatki niso skladni z zahtevami zanju, se vrednosti NOEC določijo z regresijsko uporabo Williamsovega testa ali testa po Jonckheere-Terpstraju. Za podrobnosti o teh postopkih glej OECD (2006). Za podatke, ki niso skladni z zahtevami za regresijski trendnostni test, se lahko uporabita Dunnettov test ali Tamhane-Dunnettov (T3) test, ki vključujeta prilagoditev številčnosti. Oba testa predpostavljata normalnost, Dunnettov test pa tudi homogenost variance. Kadar navedeni pogoji niso izpolnjeni, se lahko uporabi Dunnov neparametrični test. Za podrobnosti o teh testih glej OECD (2006). Slika 2 prikazuje, kako se odločiti za pravi test. Izvalitev iker in preživetje ličink Podatki se nanašajo na delež iker, ki se izležejo, ali ličink, ki preživijo v posameznih ponovljenih vzorcih. Pri teh deležih je treba oceniti ekstrabinomsko varianco, ki je pri takih meritvah običajna, ni pa splošna. Diagram poteka na sliki 3 je smernica za izbiro ustreznega testa; glej besedilo za podrobne opise. Običajno se uporabljata dva testa. To sta Taronejev C(α)-test (Tarone 1979) in test hi-kvadrat, ki se posebej uporabita pri vsaki preskusni koncentraciji. Če se ekstra-binomska varianca odkrije celo pri eni sami preskusni koncentraciji, je treba uporabiti metode, ki so primerne za to. Formula 1 Taronejev C(α)-test (Tarone 1979)
pri čemer je ̂ srednja vrednost deleža pri določeni koncentraciji, m je število ponovitvenih akvarijev, nj je število osebkov v ponovljenem vzorcu j, xj pa število osebkov v navedenem ponovljenem vzorcu, ki se na primer niso izlegli ali so umrli. Ta test se uporabi za vsako koncentracijo posebej. Ta test nekateri vidijo kot prilagojeni test hi-kvadrat, vendar so omejene simulacije moči, ki jih je izvedel Tarone, pokazale, da ima večjo moč od testa hi-kvadrat. Slika 3 Diagram poteka za določitev vrednosti NOEC pri izvalitvi iker in smrtnosti ličink 
Kadar ne obstajajo statistično značilni dokazi o ekstra-binomski varianci, se lahko uporabi regresijski Cochran-Armitagev test. Ta test ne upošteva ponovljenih vzorcev, zato se pri obstoju takih dokazov priporoča uporaba Rao-Scottove prilagoditve Cochran-Armitagevega testa (RSCA), ki upošteva ponovljene vzorce, velikost ponovljenih vzorcev in ekstra-binomsko varianco. Uporabiti je mogoče tudi regresijski Williamsov test, regresijski test po Jonckheere-Terpstraju in Dunnettov test, kakor so opisani za meritve velikosti. Ti testi se lahko uporabijo ne glede na to, ali obstaja ekstra-binomska varianca, vendar je njihova moč nekoliko manjša (Agresti 2002; Morgan 1992; Rao in Scott 1992, 1999; Fung et al. 1994, 1996). Prvi ali zadnji dan valitve ali splavanja Odziv je celo število, ki označuje preskusni dan, ko je bila opažena navedena opazka za določen ponovitveni akvarij. Območje vrednosti je običajno zelo omejeno in deleži povezanih vrednosti so običajno visoki, npr. vsi ponovljeni kontrolni vzorci imajo isti prvi dan valitve, ta pa je isti tudi pri eni ali dveh nizkih preskusnih koncentracijah. Parametrični testi, kot sta Williamsov in Dunnettov test, niso primerni za te podatke. Če ni dokazov o resni nemonotonosti, ima regresijski test po Jonckheere-Terpstraju veliko moč zaznavanja učinkov preskusne kemikalije. V nasprotnem primeru se lahko uporabi Dunnov test. Anomalije pri ličinkah Odziv je število ličink, pri katerih se odkrijejo kakršne koli anomalije. Ta odziv ima pogosto nizko pojavnost, pri njem se pojavljajo nekatere težave, ki so prisotne pri določanju prvega dneva valitve, včasih pa je zanj značilna tudi neenakomernost pri odzivu na koncentracijo. Če podatki vsaj približno sledijo monotoni krivulji koncentracije, je regresijski test po Jonckheere-Terpstraju dovolj močan za zaznavanje učinkov. V nasprotnem primeru se lahko uporabi Dunnov test. Viri Agresti, A. (2002). Categorical Data Analysis, druga izdaja. Wiley, Hoboken. Dunnett, C. W. (1955). A multiple comparison procedure for comparing several treatments with a control. J. American Statistical Association, št. 50, 1096–1121. Dunn, O. J. (1964). Multiple Comparisons Using Rank Sums. Technometrics, št. 6, 241–252. Dunnett, C. W. (1964). New tables for multiple comparisons with a control. Biometrics, zv. 20, 482–491. Fung, K. Y., D. Krewski, J. N. K. Rao, A. J. Scott (1994). Tests for Trend in Developmental Toxicity Experiments with Correlated Binary Data. Risk Analysis, št. 14, 639–648. Fung, K. Y., D. Krewski, R. T. Smythe (1996). A comparison of tests for trend with historical controls in carcinogen bioassay. Canadian Journal of Statistics, št. 24, 431–454. Hochberg, Y. in A. C. Tamhane (1987). Multiple Comparison Procedures. Wiley, New York. Hsu, J. C. (1996). Multiple Comparisons: Theory and Methods. Chapman and Hall/CRC Press, Boca Raton. Jonckheere, A. R. (1954). A distribution-free k-sample test against ordered alternatives. Biometrika, št. 41, 133. Morgan, B. J. T. (1992). Analysis of Quantal Response Data. Chapman and Hall, London. OECD (2006). Current approaches in the statistical analysis of ecotoxicity data: A guidance to application. Series on Testing and Assessment, št. 54. Organizacija za gospodarsko sodelovanje in razvoj (OECD), Pariz. Rao, J. N. K. in Scott A. J. (1992). A simple method for the analysis of clustered binary data. Biometrics, zv. 48, 577–585. Rao, J. N. K. in Scott A. J. (1999). A simple method for analyzing overdispersion in clustered Poisson data. Statistics in Medicine, št. 18, 1373–1385. Robertson, T., Wright F. T. in Dykstra R. L. (1988). Order restricted statistical inference. Wiley. Tarone, R. E. (1979). Testing the goodness of fit of the Binomial distribution. Biometrika, št. 66, 585–590. Williams, D. A. (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics, zv. 27, 103–117. Williams, D. A. (1972). The comparison of several dose levels with a zero dose control. Biometrics, zv. 28, 519–531. Williams, D. A. (1975). The Analysis of Binary Responses from Toxicological Experiments Involving Reproduction and Teratotlogy. Biometrics zv. 31, 949–952. Williams, D. A. (1977). Some inference procedures for monotonically ordered normal means. Biometrika št. 64, 9–14. Dodatek 6 STATISTIČNE SMERNICE ZA REGRESIJSKE OCENE Splošno Opazovanja, uporabljena za prilagoditev modela, so srednje vrednosti ponovljenih vzorcev (dolžina in teža) ali deleži ponovljenih vzorcev (izležene ikre in smrtnost ličink) (OECD 2006). Običajno se priporoča utežena regresija, ki za utež uporablja velikost ponovljenega vzorca. Mogoči so tudi drugi načrti uteženja, kot je uteženje s predvideno srednjo vrednostjo odziva ali kombinacija tega in velikosti ponovljenega vzorca. Uteženje z obratno vrednostjo variance znotraj vzorca koncentracije ni priporočljivo (Bunke et al. 1999; Seber in Wild 2003; Motulsky in Christopoulos 2004; Huet et al. 2003). Pri vseh pretvorbah odzivov pred analizo je treba ohraniti neodvisnost opazovanj in ECx, njihove meje zaupanja pa je treba izraziti v izvirnih enotah meritve in ne v pretvorjenih enotah. 20-odstotna sprememba logaritma dolžine na primer ne ustreza 20-odstotni spremembi dolžine (Lyles et al. 2008; Draper in Smith 1999). V diagramu poteka na sliki 4 je predstavljen pregled ocen ECx. Podrobnosti so opisane v spodnjem besedilu. Slika 4 Diagram poteka za oceno ECx srednjih vrednosti ponovljenih vzorcev pri meritvah dolžine, teže, deleža izleženih iker ali umrlih ličink; za več podrobnosti glej besedilo 
Obravnavanja izvalitve iker in smrtnosti ličink Za izvalitev iker in smrtnost ličink je običajno najbolje prilagoditi padajoči model, lahko pa se prilagodi probit model, kot je opisano spodaj. To pomeni, da je treba modelirati delež iker, ki se ne izležejo, ali ličink, ki umrejo. ECx se namreč nanaša na koncentracijo, pri kateri se zgodi sprememba, ki ustreza x % srednje vrednosti odziva v kontroli. Če se ne izleže 5 % kontrolnih iker in se modelira neuspešnost izvalitve, se EC20 nanaša na koncentracijo, pri kateri se zgodi sprememba, ki ustreza 20 % 5-odstotne neuspešnosti izvalitve v kontroli, to pa je sprememba v višini 0,2 * 0,05 = 0,01 ali 1 odstotne točke 6-odstotne neuspešnosti izvalitve. Tako majhna sprememba se ne more smiselno oceniti na podlagi razpoložljivih podatkov in ni biološko pomembna. Če pa bi se modeliral delež izleženih iker, bi bil kontrolni delež v zgornjem primeru 95 %, 20-odstotno zmanjšanje srednje vrednosti v kontroli pa bi pomenilo spremembo v višini 0,95 * 0,2 = 0,18, tj. spremembo s 95-odstotne uspešnosti izvalitve na 77-odstotno (= 95 – 18) uspešnost izvalitve, to pa je koncentracija z učinkom, ki se lahko oceni in bo za raziskovalce najverjetneje zanimivejša. To ne velja za meritve velikosti, čeprav škodljivi učinki na velikost običajno pomenijo zmanjšanje velikosti. Modeli za velikost (dolžina ali teža), uspešnost izvalitve iker in preživetje ličink Razen Brain-Cousensovega hormetičnega modela so vsi modeli opisani in priporočeni v OECD (2006). Tako imenovani modeli OECD 2–5 so poleg tega obravnavani v okviru preskusov ekotoksičnosti v Slob (2002). Seveda obstajajo tudi številni drugi modeli, ki bi lahko bili uporabni. Bunke et al. (1999) navajajo številne modele, ki niso navedeni tukaj, poleg tega obstaja mnogo sklicevanj na druge modele. Spodaj navedeni modeli so predlagani kot posebej ustrezni za ekotoksikološke preskuse in se pogosto uporabljajo. Pri 5 preskusnih koncentracijah in kontroli:
Pri 6 ali več preskusnih koncentracijah in kontroli:
Kadar je vidna hormeza (najverjetneje ne pri uspešnosti izvalitve iker ali preživetju ličink, včasih pa pri opazovanjih velikosti):
Drugi modeli za neuspešnost izvalitve iker in smrtnost ličink
Prileganje posameznih modelov
Primerjava modelov
Kakovost ocene ECx Interval zaupanja za ECx ne sme biti preširok. Za določitev največje širine intervala zaupanja, ki bo še zagotavljala uporabnost ECx, je potrebna statistična presoja. Simulacije regresijskih modelov, prilagojenih valitvi iker in podatkom o velikosti, kažejo, da približno 75 % intervalov zaupanja za ECx (x = 10, 20 ali 30) zajema največ dve preskusni koncentraciji. To je splošna smernica o tem, kaj je sprejemljivo, in praktična smernica o tem, kaj je mogoče doseči. Številni avtorji trdijo, da bi bilo treba intervale zaupanja za vse parametre modelov vključiti v poročilo in da široki intervali zaupanja za parametre modelov kažejo nesprejemljivost modelov (Ott in Longnecker 2008; Alvord in Rossio 1993; Motulsky in Christopoulos 2004; Lyles et al. 2008; Seber in Wild 2003; Bunke et al. 1999; Environment Canada 2005). Interval zaupanja za ECx (ali kateri koli drug parameter modela) ne sme vključevati ničle (Motulsky in Christopoulos 2004). V regresijskih modelih je to ekvivalent najmanjše značilne razlike, ki se pogosto navaja pri pristopih s preskušanjem predpostavk (npr. Wang et al. 2000). Ustreza tudi intervalu zaupanja za srednje vrednosti odzivov pri LOEC, ki niso zajete v srednjo vrednost v kontroli. Treba se je vprašati, ali je parametre mogoče znanstveno oceniti. Če je interval zaupanja za y0 na primer ± 20 %, ocena EC10 ni verodostojna. Če model predvideva 20-odstotni učinek pri koncentraciji C, največji opaženi učinek pri koncentraciji C in nižjih koncentraciji pa je 10-odstoten, ocena EC20 ni verodostojna (Motulsky in Christopoulos 2004; Wang et al. 2000; Environment Canada 2005). ECx ne bi smela zahtevati ekstrapolacije zunaj območja pozitivnih koncentracij (Draper in Smith 1999; OECD 2006). Splošna smernica bi lahko bila, da ECx ne sme biti za več kot približno 25 % nižja od najnižje ali višja od najvišje preskušene koncentracije. Viri Alvord, W. G., Rossio, J. L. (1993). Determining confidence limits for drug potency in immunoassay. Journal of Immunological Methods št. 157, 155–163. Brain, P. in Cousens, R. (1989). An equation to describe dose responses where there is stimulation of growth at low doses. Weed res. zv. 29: 93–96. Bunke, O., Droge, B. in Polzehl, J. (1999). Model selection, transformations and variance estimation in nonlinear regression. Statistics, št. 33, 197–240. Collett, D. (2002). Modelling Binary Data, druga izdaja. Chapman and Hall, London. Collett, D. (2003). Modelling Survival Data in Medical Research, druga izdaja. Chapman and Hall, London. Draper, N. R., in Smith, H. (1999). Applied Regression Analysis, tretja izdaja. New York: John Wiley & Sons. Environment Canada (2005). Guidance Document on Statistical Methods for Environmental Toxicity Tests, Report EPS 1/RM/46. Huet, S., A. Bouvier, M.-A. Poursat, E. Jolivet (2003). Statistical Tools for Nonlinear Regression: A Practical Guide with S-PLUS and R Examples. Springer Series in Statistics, New York. Lyles, R. H., C. Poindexter, A. Evans, M. Brown in C. R. Cooper (2008). Nonlinear Model-Based Estimates of IC50 for Studies Involving Continuous Therapeutic Dose-Response Data. Contemp Clin Trials, november 2008, št. 29(6): 878–886. Morgan, B. J. T. (1992). Analysis of Quantal Response Data. Chapman and Hall, London. Motulsky, H., A. Christopoulos (2004). Fitting Models to Biological Data Using Linear and Nonlinear Regression: A Practical Guide to Curve Fitting. Oxford University Press, ZDA. O'Hara Hines, R. J. and J. F. Lawless (1993). Modelling Overdispersion in Toxicological Mortality Data Grouped over Time. Biometrics, zv. 49, str. 107–121. OECD (2006). Current approaches in the statistical analysis of ecotoxicity data: A guidance to application. Series Testing and Assessment, št. 54. Organizacija za gospodarsko sodelovanje in razvoj, OECD, Pariz. Ott, R. L., M. T. Longnecker (2008). An Introduction to Statistical Methods and Data Analysis, šesta izdaja. Brooks-Cole, Belmont, California. Ratkowsky, D. A. (1993). Principles of nonlinear regression. Journal of Industrial Microbiology, št. 12, 195–199. Seber, G. A. F., C. J. Wild (2003). Nonlinear Regression. Wiley. Slob W. (2002). Dose-response modelling of continuous endpoints. Toxicol. Sci., št. 66, 298–312. Wang, Q., D. L. Denton in R. Shukla (2000). Applications and Statistical Properties Of Minimum Significant Difference-Based Criterion Testing In a Toxicity Testing Program. Environmental Toxicology and Chemistry, zv. 19, str. 113–117, 2000. C.48 Kratkotrajni preskus razmnoževanja rib. UVOD
ZAČETNI PREUDARKI IN OMEJITVE
NAČELO PRESKUSA
MERILA ZA SPREJEMLJIVOST PRESKUSA
OPIS METODE Oprema
Voda
Preskusne raztopine
Vzdrževanje rib
Obdobje pred izpostavljenostjo in izbira rib
ZASNOVA PRESKUSA
Izbira preskusnih koncentracij
POSTOPEK Izbira in tehtanje preskusnih rib
Pogoji izpostavljenosti Trajanje
Hranjenje
Svetloba in temperatura
Pogostost analitskega določanja in meritev
Opazovanja
Preživetje
Vedenje in videz
Plodnost
Humana usmrtitev rib
Opazovanje sekundarnih spolnih značilnosti
Vitelogenin (VTG)
Ocena histopatologije spolnih žlez
PODATKI IN POROČANJE Ocena odzivov biomarkerja z analizo variance
Poročanje o rezultatih preskusa
SMERNICE ZA RAZLAGO IN SPREJEMLJIVOST REZULTATOV PRESKUSA
VIRI
Dodatek 1 OKRAJŠAVE IN OPREDELITEV POJMOV Kemikalija : snov ali zmes. KV : koeficient variacije. ELISA : encimski imunski test (ang. Enzyme-Linked Immunosorbent Assay). Os HPG : os hipotalamus – hipofiza – spolne žleze. Stopnja obremenitve : mokra teža rib na prostornino vode. MTC : najvišja tolerančna koncentracija, ki predstavlja približno 10 % LC50. Gostota rib : število rib na prostornino vode. Preskusna kemikalija : vsaka snov ali zmes, preskušena s to preskusno metodo. VTG : vitelogenin je fosfolipoglikobeljakovina in predstopnja beljakovin jajčnega rumenjaka, ki se običajno pojavi pri spolno aktivnih samicah vseh oviparnih vrst. Dodatek 2 PRESKUSNI POGOJI ZA PRESEJALNI ENDOKRINI PRESKUS RIB
Dodatek 3 NEKATERE KEMIJSKE LASTNOSTI SPREJEMLJIVE VODE ZA REDČENJE
Dodatek 4A SUBSTRAT ZA DRSTENJE CEBRICE Drstilni pladenj : popolnoma steklena laboratorijska posoda, na primer 22 x 15 x 5,5 cm (d x š x g), pokrita z odstranljivo rešetko iz nerjavnega jekla (širina mreže 2 mm). Rešetka mora prekriti odprtino laboratorijske posode pod robom. 
Na rešetko je treba pritrditi substrat za drstenje. Zagotoviti mora strukturo, v katero se lahko premaknejo ribe. Primerne so na primer umetne akvarijske rastline iz zelene plastike (opomba: proučiti je treba morebitno adsorpcijo preskusne kemikalije na plastičnem materialu). Plastični material je treba dovolj dolgo izpirati v zadostni količini tople vode za zagotovitev, da v preskusno vodo ne bo prešla nobena kemikalija. Pri uporabi steklenih materialov je treba zagotoviti, da se ribe med intenzivnim premikanjem ne poškodujejo in niso utesnjene. Razdalja med pladnjem in steklenimi ploščami mora biti vsaj 3 cm za zagotovitev, da se ribe ne drstijo zunaj pladnja. Ikre, odložene na pladenj, padejo skozi rešetko in se lahko vzorčijo 45–60 minut po začetku osvetlitve. Prozorne ikre niso sprijete in se lahko enostavno štejejo z uporabo prečne svetlobe. Če je v posodi pet samic, se do 20 iker na dan lahko šteje za nizko število, do 100 iker kot srednje in več kot 100 iker kot visoko število. Drstilni pladenj je treba odstraniti, zbrati ikre in drstilni pladenj ponovno postaviti v preskusno posodo čim pozneje zvečer ali zelo zgodaj zjutraj. Čas do ponovne postavitve rešetke ne sme presegati ene ure, saj bi sicer lahko substrat za drstenje spodbudil posamezna parjenja in drstenja ob neobičajnem času. Če je treba zaradi razmer drstilni pladenj vstaviti pozneje, je treba to storiti vsaj 9 ur po začetku osvetljenosti. Drstenje se tako pozno ne začne več. Dodatek 4B SUBSTRAT ZA DRSTENJE ČRNOGLAVEGA PISANCA V vsako preskusno komoro se postavijo dve ali tri kombinirane plastične/keramične/steklene plošče ali plošče iz nerjavnega jekla in drstilni pladnji (npr. 80 mm dolg siv polkrožen žleb na pladenj z robovi, dolg 130 mm) (glej sliko). Ustrezno pripravljene plošče iz PVC ali keramike so dokazano primerne za substrat za drstenje (Thorpe et al. 2007). Priporočeno je, da so plošče obrušene, da se izboljša oprijem. Pladenj mora biti tudi zaščiten, da se ribam prepreči dostop do iker, ki padejo skozi, razen če je bil pri uporabljenem substratu za drstenje dokazan učinkovit oprijem. 
Podlaga je zasnovana tako, da zadrži vse ikre, ki se ne primejo površine plošče in bi zato padle na dno akvarija (ali tiste ikre, ki so odložene neposredno na ravno plastično podlago). Vse substrate za drstenje je treba pred uporabo vsaj 12 ur izpirati v vodi za redčenje. Thorpe, K. L., Benstead, R., Hutchinson, T. H., Tyler, C. R., 2007. An optimised experimental test procedure for measuring chemical effects on reproduction in the fathead minnow, Pimephales promelas. Aquatic Toxicology, zv. 81, 90–98. Dodatek 5A OCENA SEKUNDARNIH SPOLNIH ZNAČILNOSTI PRI ČRNOGLAVEM PISANCU ZA ZAZNAVANJE NEKATERIH KEMIKALIJ Z ENDOKRINIM DELOVANJEM Pregled Potencialno pomembne značilnosti fizičnega videza odraslih črnoglavih pisancev pri preskušanju povzročiteljev endokrinih motenj vključujejo barvo telesa (tj. svetla/temna), vzorce obarvanja (tj. prisotnost ali odsotnost navpičnih prog), obliko telesa (tj. oblika glave in območja prsi, napetost trebuha) in posebne sekundarne spolne značilnosti (tj. število in velikost drstnih izpuščajev, velikost dorzalne strani trupa pred hrbtno plavutjo in leglice). Drstni izpuščaji so na glavi (dorzalna stran trupa pred hrbtno plavutjo) razmnoževalno aktivnih samcev črnoglavega pisanca in so običajno razporejeni v dvostransko simetrični vzorec (Jensen et al. 2001). Kontrolne samice ter mladi samci in samice razvoja izpuščajev ne kažejo (Jensen et al. 2001). Okoli oči in med nosnicama samcev je lahko do osem posameznih izpuščajev. Največ izpuščajev in največji izpuščaji so v dveh vzporednih linijah neposredno pod nosnicama in nad usti. Pri številnih ribah so skupine izpuščajev pod spodnjo čeljustjo; izpuščaji, ki so najbliže ustom, se običajno pojavljajo kot par, medtem ko lahko bolj ventralni sklop sestavljajo do štirje izpuščaji. Dejansko število izpuščajev je redko večje od 30 (območje 18–28; Jensen et al. 2001). Prevladujoči izpuščaji (v smislu števila) so prisotni kot posamezne, razmeroma okrogle strukture, katerih višina je približno enaka polmeru. Večina razmnoževalno aktivnih samcev ima tudi vsaj nekaj izpuščajev, ki so večji in izraziti, da jih ni mogoče razlikovati kot posamezne strukture. Nekatere vrste kemikalij, ki povzročajo endokrine motnje, lahko povzročijo nenormalen pojav nekaterih sekundarnih spolnih značilnosti pri nasprotnem spolu; na primer, agonisti receptorjev za androgene, kot je 17α-metiltestosteron ali 17β-trenbolon, lahko povzročijo razvoj drstnih izpuščajev pri samicah črnoglavega pisanca (Smith 1974; Ankley et al. 2001, 2003), medtem ko lahko agonisti receptorjev za estrogene zmanjšajo število ali velikost drstnih izpuščajev pri samcih (Miles-Richardson et al. 1999; Harries et al. 2000). V nadaljevanju je naveden opis opredelitve lastnosti drstnih izpuščajev pri črnoglavem pisancu na podlagi postopkov, uporabljenih v laboratoriju Agencije ZDA za varstvo okolja v Duluthu (Minnesota). Posebni izdelki in/ali oprema se lahko nadomestijo s primerljivimi materiali, ki so na voljo. Opazovanje je najboljše z uporabo osvetljenega povečevalnega stekla ali trikratno osvetljenega stereomikroskopa. Ribe se opazujejo dorzalno in anteriorno naprej (glava proti opazovalcu).
Štetje in ocenjevanje izpuščajev Za ocenjevanje prisotnosti in razvoja izpuščajev pri odraslih črnoglavih pisancih je bilo opredeljenih šest specifičnih območij. Za določitev lokacije in števila prisotnih izpuščajev je bila pripravljena predloga (glej konec tega dodatka). Število izpuščajev se zapiše, njihova velikost pa se lahko za vsak organizem kvantitativno razvrsti, kot sledi: 0 – odsoten, 1 – prisoten, 2 – povečan in 3 – izrazit (slika 1). Ocena 0 – odsotnost izpuščajev. Ocena 1 – prisoten, tj. vsak izpuščaj z eno točko, pri kateri je višina skoraj enaka polmeru. Ocena 2 – povečan, tj. tkivo, ki je po videzu podobno zvezdici in ima običajno veliko zvezdasto osnovo z brazdami ali gubami, ki izhajajo iz središča. Izpuščaj je v višjem delu pogosto bolj nazobčan, vendar je lahko občasno nekoliko zaokrožen. Ocena 3 – izrazit, tj. običajno razmeroma velik in zaokrožen izpuščaj z manj definirano strukturo. Ti izpuščaji so občasno skupaj in tvorijo celoto s posameznimi ali kombiniranimi območji (B, C in D, opisana v nadaljevanju). Obarvanost in oblika sta podobni kot pri oceni 2, vendar sta občasno razmeroma nedoločljivi. S tem ocenjevalnim sistemom je skupna ocena izpuščajev običajno < 50 pri normalnih kontrolnih samcih s številom izpuščajev od 18 do 20 (Jensen et al. 2001). Slika 1 
Dejansko število izpuščajev je lahko pri nekaterih ribah večje od polj v predlogi za določeno območje ocenjevanja. V tem primeru se lahko označijo dodatne ocene, in sicer desno ali levo od polja. Zato ni treba, da je predloga simetrična. Dodatna tehnika označevanja izpuščajev, ki so v parih ali združeni navpično ob vodoravni ravnini ust, se lahko izvede z dvojnim označevanjem dveh ocen izpuščajev v enem polju. Območja označevanja:
Viri
Dodatek 5B OCENA SEKUNDARNIH SPOLNIH ZNAČILNOSTI PRI MEDAKI ZA ZAZNAVANJE NEKATERIH KEMIKALIJ Z ENDOKRINIM DELOVANJEM V nadaljevanju je naveden opis meritve bradavičastih podaljškov (*10), ki so sekundarna spolna značilnost pri medaki (Oryzias latipes).
Merjenje
Slika 1 Diagram, na katerem so prikazane razlike v obliki in velikosti predrepne plavuti glede na spol. A: samec, B: samica. Oka, T. B. (1931). On the processes on the fin rays of the male of Oryzias latipes and other sex characters of this fish. J. Fac. Sci., Tokyo Univ., IV, 2: 209–218. 
Slika 2 A: podaljški na ploščicah predrepne plavutnice, J.P.: ploščica, A.S.: aksialni prostor, P.: podaljšek, B: distalna okončina plavutnice. Actinotrichia (Act.) so na vrhu. Oka, T. B. (1931). On the processes on the fin rays of the male of Oryzias latipes and other sex characters of this fish. J. Fac. Sci., Tokyo Univ., IV, 2: 209–218. 
Slika 3 Fotografija telesa ribe, na kateri je prikazana stran reza, če so spolne žleze fiksirane v raztopini za fiksiranje, ki ni 10-odstotni nevtralno pufran formalin. V tem primeru se preostalo telo z rezilom (rdeča) prereže med anteriornim delom predrepne plavuti in anusom, sprednji del ribe se vstavi v raztopino za fiksiranje spolnih žlez, zadnji del ribe pa se vstavi v 10-odstotni nevtralno pufran formalin. 
Dodatek 6 PRIPOROČENI POSTOPKI ZA ODVZEM VZORCEV ZA ANALIZO VITELOGENINA Preprečiti je treba navzkrižno kontaminacijo med vzorci VTG samcev in samic. Postopek 1A: Črnoglavi pisanec, odvzem krvi iz repne vene/arterije Po anesteziji se repno steblo delno prereže z rezilom skalpela, pri čemer se kri odvzame iz repne vene/arterije s heparinizirano mikrohematokritsko kapilarno cevko. Ko je kri odvzeta, se plazma hitro izolira s 3-minutnim centrifugiranjem pri 15 000 g (ali z 10-minutnim centrifugiranjem pri 15 000 g in 4 °C). Po želji se lahko po centrifugiranju določi odstotek hematokrita. Plazemski del se nato odstrani iz mikrohematokritske cevke in shrani v centrifugalni epruveti z 0,13 enotami aprotinina (zaviralec proteaze) pri –80 °C, dokler ni mogoče določiti VTG. Glede na velikost črnoglavega pisanca (ki je odvisna od spola) se običajno lahko odvzame od 5 do 60 mikrolitrov plazme na ribo (Jensen et al. 2001). Postopek 1B: Črnoglavi pisanec, odvzem krvi iz srca Namesto tega se lahko kri odvzame tudi s srčno punkcijo s heparinizirano brizgo (1 000 enot heparina na ml). Kri se prenese v Eppendorfove epruvete (shranjene na ledu) in nato centrifugira (5 minut, 7 000 g, sobna temperatura). Plazmo je treba prenesti v čiste Eppendorfove epruvete (v alikvotih, če količina plazme to omogoča) in takoj zamrzniti pri –80 °C, dokler se ne analizira (Panter et al. 1998). Postopek 2A: Japonska medaka, odstranitev jeter pri medaki Odstranitev preskusne ribe iz preskusne komore
Odstranitev jeter
Po odstranitvi jeter je telo ribe na voljo za histologijo spolnih žlez in meritev sekundarnih spolnih značilnosti. Vzorec Vzorci jeter, odvzeti pri preskusnih ribah, se shranijo pri ≤ –70 °C, če se ne uporabijo za predhodno tretiranje kmalu po odstranitvi. Slika 1 Rez se naredi s škarjami neposredno anteriorno od prsne plavuti. 
Slika 2 Po sredinski črti trebuha se s škarjami zareže do točke, ki se nahaja približno 2 mm kranialno od anusa. 
Slika 3 Trebušne stene se razširijo s prijemalkami, da se izpostavijo jetra in drugi notranji organi. (Namesto tega se lahko trebušne stene pripnejo s strani.) Jetra so označena s puščico. 
Slika 4 Jetra se secirajo in odstranijo s prijemalkami. 
Slika 5 Črevesje se s prijemalkami nežno odmakne. 
Slika 6 Oba konca črevesja in vse pritrditve mezenterija se odrežejo s škarjami. 
Slika 7 (samica) Postopek za samico je enak. 
Slika 8 Končan postopek. 
Postopek 2B: Japonska medaka (Oryzias latipes), predhodno tretiranje jeter za analizo vitelogenina Iz kompleta za metodo ELISA se vzame steklenica homogenizacijskega pufra in ohladi z zdrobljenim ledom (temperatura raztopine: ≤ 4 °C). Če se uporabi homogenizacijski pufer iz sistema EnBio ELISA, se raztopina odtaja pri sobni temperaturi, nato pa se steklenica ohladi z zdrobljenim ledom. Količina homogenizacijskega pufra za jetra se izračuna na podlagi njihove teže (doda se 50 μl homogenizacijskega pufra na miligram teže jeter). Če jetra tehtajo na primer 4,5 mg, je količina homogenizacijskega pufra za jetra 225 μl. Za vsa jetra se pripravi seznam s količinami homogenizacijskega pufra. Priprava jeter za predhodno tretiranje
Izvedba predhodnega tretiranja 1) Dodajanje homogenizacijskega pufra Na seznamu se preveri količina homogenizacijskega pufra, ki ga je treba uporabiti za posamezen vzorec jeter, mikropipeta pa se nastavi (območje količine: 100–1 000 μl) na ustrezno količino. Na mikropipeto se namesti čista konica. Homogenizacijski pufer se vzame iz steklenice za reagent in doda v 1,5-mililitrsko mikroepruveto z jetri. Homogenizacijski pufer se doda v vse 1,5-mililitrske mikroepruvete z jetri v skladu z zgoraj opisanim postopkom. Konice mikropipete ni treba zamenjati z novo. Če je konica kontaminirana ali bi lahko bila kontaminirana, jo je treba zamenjati. 2) Homogenizacija jeter
3) Centrifugiranje suspendiranega homogenata jeter
4) Odvzemanje supernatanta
Shranjevanje vzorcev Dokler se 0,5-mililitrske mikroepruvete s supernatantom homogenata jeter ne uporabijo za ELISA, se shranijo pri ≤ –70 °C. Postopek 3A: Cebrica, odvzem krvi iz repne vene/arterije Takoj po anesteziji se repno steblo prečno prereže in odvzame kri iz repne arterije/vene s heparinizirano mikrohematokritsko kapilarno cevko. Količine krvi so v območju 5–15 mikrolitrov in so odvisne od velikosti ribe. V mikrokapilarno cevko se doda enaka količina pufra aprotinina (6 mikrogramov/ml v PBS), plazma pa se od krvi loči s centrifugiranjem (5 minut pri 600 g). Plazma se zbere v preskusnih epruvetah in shrani pri –20 °C, dokler se ne analizira za VTG ali druge želene beljakovine. Postopek 3B: Cebrica, odvzem krvi s punkcijo srca Da se preprečita koagulacija krvi in razgradnja beljakovin, se vzorci odvzamejo v fosfatnem pufru s soljo (PBS), ki vsebuje heparin (1 000 enot/ml) in aprotinin, ki zavira proteazo (2 TIU/ml). Za sestavine pufra se priporočajo heparin, amonijeva sol in liofilizirani aprotinin. Za vzorčenje krvi se priporoča brizga (1 ml) s pritrjeno tanko iglo (npr. Braun Omnikan-F). Brizga mora biti predhodno napolnjena s pufrom (približno 100 mikrolitrov), da se iz vseh rib v celoti eluirajo majhne količine krvi. Vzorci krvi se odvzamejo s punkcijo srca. Najprej je treba ribe anestezirati z MS-222 (100 mg/l). Ustrezna stopnja anestezije uporabniku omogoča, da razloči srčni utrip cebrice. Med punkcijo srca naj bo bat brizge pod rahlo napetostjo. Odvzeta količina krvi je v območju 20–40 mikrolitrov. Po srčni punkciji je treba zmes krvi in pufra prenesti v preskusno epruveto. Plazma se od krvi loči s centrifugiranjem (20 minut, 5 000 g) in jo je treba shraniti pri –80 °C, dokler se ne potrebuje za analizo. Postopek 3C SOP: cebrica, homogenizacija glave in repa
Dodatek 7 OBOGATENI VZORCI VITELOGENINA IN MEDPRESKUSNI REFERENČNI STANDARD Vsak dan izvedbe preskusov VTG se analizira obogateni vzorec, pripravljen z medpreskusnim referenčnim standardom. VTG, uporabljen za pripravo medpreskusnega referenčnega standarda, je iz serije, ki se razlikuje od serije, uporabljene za pripravo kalibracijskih standardov za preskus, ki se izvaja. Obogateni vzorec se pripravi z dodajanjem znane količine medpreskusnega standarda vzorcu plazme kontrolnih samcev. Vzorec se obogati, da se doseže koncentracija VTG, ki je med 10- in 100-krat večja od pričakovane koncentracije vitelogenina pri kontrolnih ribjih samcih. Vzorec plazme kontrolnih samcev, ki se obogati, lahko izvira iz ene ribe ali pa je sestavljen iz več rib. Podvzorec neobogatene plazme kontrolnih samcev se analizira v vsaj dveh podvojenih jamicah. Tudi obogateni vzorec se analizira v vsaj dveh podvojenih jamicah. Srednja količina vitelogenina v dveh neobogatenih vzorcih plazme kontrolnih samcev se prišteje izračunani količini VTG, dodanega obogatenim vzorcem, da se določi pričakovana koncentracija. Razmerje med pričakovano koncentracijo in izmerjeno koncentracijo se sporoči skupaj z rezultati posameznih nizov preskusov, izvedenih na isti dan. Dodatek 8 DIAGRAM POTEKA ZA IZBIRO STATISTIČNE ANALIZE 
C.49 Preskus akutne toksičnosti ribjega zarodka UVOD
NAČELO PRESKUSA
ZAČETNI PREUDARKI
VELJAVNOST PRESKUSA
OPIS METODE
Oprema
Preskusne komore
Voda in preskusni pogoji
Testne raztopine
Vzdrževanje plemenskih rib
Preverjanje usposobljenosti
Proizvajanje iker
Diferenciacija iker
POSTOPEK Pogoji izpostavljenosti
Preskusne koncentracije
Kontrole
Začetek izpostavljenosti in trajanje preskusa
Porazdelitev iker po ploščah s 24 jamicami
Opažanja
Analitske meritve
MEJNI PRESKUS
PODATKI IN POROČANJE Obdelava rezultatov
Poročilo o preskusu
VIRI
Dodatek 1 OPREDELITEV POJMOV Končna točka na višjem nivoju biološke organizacije : povzroča učinke na ravni populacije. Blastula : celična tvorba okoli animalnega pola, ki prekriva določen del rumenjaka. Kemikalija : snov ali zmes. Epibolija : je velika proliferacija zlasti epidermalnih celih v fazi gastrulacije zarodka in njihovo gibanje od dorzalne proti ventralni strani, s katerim se entodermalne celične plasti internalizirajo pri procesu, podobnem invaginaciji, rumenjak pa se vključi v zarodek. Pretočni preskus : preskus, pri katerem se testne raztopine med izpostavljenostjo neprekinjeno pretakajo skozi preskusni sistem. Notranja kontrola plošč : notranja kontrola, ki jo sestavljajo štiri jamice, napolnjene z vodo za redčenje, na vsaki plošči s 24 jamicami, da se ugotovi, ali je proizvajalec ali raziskovalec med postopkom morda kontaminiral plošče in ali lahko katera koli plošča vpliva na rezultat preskusa (npr. zaradi temperaturnega gradienta). IUPAC : Mednarodna zveza za čisto in uporabno kemijo. Voda za vzdrževanje : voda, v kateri poteka oskrba odraslih rib. Srednja smrtna koncentracija (LC50) : koncentracija preskusne kemikalije, za katero se oceni, da je med preskusom smrtonosna za 50 % preskusnih organizmov. Preskus polstatične zamenjave : preskus z redno zamenjavo testnih raztopin po določenih obdobjih (npr. vsakih 24 ur). SMILES : sistem za poenostavljen zapis strukture molekul. Somit : v razvijajočem se zarodku vretenčarja so somiti množice mezoderma, ki je razporejen prečno glede na živčno cev, in ki bodo sčasoma razvili usnjico (dermatom), skeletno mišico (miotom) in vretenca (sklerotom). Statični preskus : preskus, pri katerem se testne raztopine med preskusom ne spremenijo. Preskusna kemikalija : vsaka snov ali zmes, preskušena z uporabo te preskusne metode. UVCB : snovi z neznano ali spremenljivo sestavo, kompleksni reakcijski produkti ali biološki materiali. Dodatek 2 VZDRŽEVANJE, RAZMNOŽEVANJE IN OBIČAJNI POGOJI ZA PRESKUSE AKUTNE TOKSIČNOSTI ZARODKA CEBRICE
Dodatek 3 NORMALEN RAZVOJ CEBRIC PRI 26 °C 

Dodatek 4 Slika 1 Razporeditev plošč s 24 jamicami 
Slika 2: Shema postopka preskusa akutne toksičnosti zarodka cebrice (z leve proti desni): proizvodnja iker, zbiranje iker, predhodna izpostavljenost takoj po oploditvi v steklenih posodah, izbira oplojenih iker z obrnjenim mikroskopom ali binokularnim mikroskopom in porazdelitev oplojenih iker v plošče s 24 jamicami z ustreznimi preskusnimi koncentracijami/kontrolami, n = število iker, potrebnih za posamezno preskusno koncentracijo/kontrolo (tukaj 20), hpf = ure po oploditvi. 
Dodatek 5 ATLAS SMRTONOSNIH KONČNIH TOČK PRI PRESKUSU AKUTNE TOKSIČNOSTI ZARODKA CEBRICE Naslednje končne točke na višjem nivoju biološke organizacijo pomenijo akutno toksičnost in posledično smrt zarodka: koagulacija zarodka, odsotnost ločenosti repa, odsotnost oblikovanja somitov in odsotnost srčnega utripa. Za prikaz teh končnih točk so bili izbrani mikrografi v nadaljevanju. Slika 1 Koagulacija zarodka: 
Pri močni osvetlitvi polja so v koaguliranih zarodkih cebric vidne številne neprozorne inkluzije. Slika 2 Odsotnost oblikovanja somitov: 
Kljub zaostanku pri razvoju za približno 10 ur so na 24 ur starem zarodku cebrice na sliki (a) vidni zelo razviti somiti (→), zarodek na sliki (b) pa ne kaže znakov oblikovanja somitov (→). Čeprav je viden izrazit edem vrečice rumenjaka (*), je na 48 ur starem zarodku cebrice na sliki (c) vidno značilno oblikovanje somitov (→), 96 ur star zarodek cebrice na sliki (d) pa ne kaže znakov oblikovanja somitov (→). Upoštevati je treba tudi ukrivljenost hrbtenice (skoliozo) in perikardialni edem (*) pri zarodku na sliki (d). Slika 3 Odsotnost ločenosti repa 
Slika 4 Odsotnost srčnega utripa 
Odsotnost srčnega utripa je že po naravi težko prikazati na mikrografu. Za odsotnost srčnega utripa je značilno, da se srce ne krči (dvojna puščica). Negibnost krvnih celic, na primer v abdominalni aorti (→ na vstavljeni sličici), ni indikator odsotnosti srčnega utripa. Upoštevati je treba tudi odsotnost oblikovanja somitov v tem zarodku (*, homogen videz mišičnega tkiva namesto razčlenjenega). Čas opazovanja, da se zabeleži odsotnost srčnega utripa, mora trajati vsaj eno minuto pri vsaj 80-kratni povečavi. C.50 Preskus toksičnosti za klasasti rmanec (Myriophyllum spicatum) brez usedline UVOD
NAČELO PRESKUSA
INFORMACIJE O PRESKUSNI KEMIKALIJI
VELJAVNOST PRESKUSA
REFERENČNA KEMIKALIJA
OPIS METODE Oprema
Preskusni organizem
Gojenje
Preskusno gojišče
Testne raztopine
Preskusne in kontrolne skupine
Izpostavljenost
Preskusni pogoji
Trajanje
Meritve in analitske določitve
Pogostost meritev in analitskih določitev
Mejni preskus
PODATKI IN POROČANJE Spremenljivke odziva
Povprečna specifična hitrost rasti
Prirast
Podvojitveni čas
Izdelava krivulj koncentracija–odziv
Ocena vrednosti ECx
Statistični postopki
Poročanje
VIRI
Dodatek 1 OPREDELITEV POJMOV
Dodatek 2 SPREMENJENO GOJIŠČE PO ANDREWSU ZA ZALOŽNO KULTURO IN PREDKULTURO Iz petih ločeno pripravljenih hranilnih osnovnih raztopin se pripravi spremenjeno gojišče po Andrewsu z dodatkom 3 % saharoze za založno kulturo in predkulturo. Preglednica 1 Sestava hranilne raztopine po Andrewsu: (oznaka E 1913-04 ASTM)
Osnovne raztopine se lahko v hladilniku hranijo šest mesecev (pri 5–10 °C). Le osnovna raztopina št. 5 ima krajši rok uporabnosti (dva meseca). Preglednica 2 Priprava osnovne raztopine 3.1 za pripravo osnovne raztopine 3
Ko se pripravi osnovna raztopina 3.1 (preglednica 2), jo je treba globoko zamrzniti v približno 11 ml alikvotih (pri vsaj –18 °C). Globoko zmrznjeni deli imajo rok uporabnosti petih let. Za pripravo osnovne raztopine 3 je treba odtajati osnovno raztopino 3.1, z 10 ml osnovne raztopine 3.1 napolniti merilno bučko s prostornino 1 l in dodati ultra čisto vodo do oznake na merilni bučki. Za pripravo spremenjenega gojišča po Andrewsu je treba merilno bučko s prostornino 5 l napolniti s približno 2 500 ml ultra čiste vode. Ko se doda 50 ml vsake osnovne raztopine, je treba napolniti 90 % merilne bučke z ultra čisto vodo in nastaviti vrednost pH na 5,8. Nato je treba dodati 150 g raztopljene saharoze (3 % na 5 l) in z ultra čisto vodo napolniti merilno bučko do oznake. Nato se hranilna raztopina vlije v bučke Schott s prostornino 1 l in 20 minut avtoklavira pri 121 °C. Tako pridobljena hranilna raztopina se lahko sterilna hrani v hladilniku (pri 5–10 °C) tri mesece. Spremenjeno gojišče po Andrewsu za preskus toksičnosti brez usedline Iz petih hranilnih osnovnih raztopin, navedenih v preglednicah 1 in 2, se pripravi desetkratno koncentrirano spremenjeno gojišče po Andrewsu, ki je potrebno za pridobitev testnih raztopin, z dodatkom 30 % saharoze. Za to je treba merilno bučko s prostornino 1 l napolniti s približno 100 ml ultra čiste vode. Ko se doda 100 ml vsake osnovne raztopine, je treba vrednost pH nastaviti na 5,8. Nato je treba dodati 30 % raztopljene saharoze (300 g na 1 000 ml) in z ultra čisto vodo napolniti merilno bučko do oznake. Nato se hranilna raztopina vlije v bučke Schott s prostornino 0,5 l in 20 minut avtoklavira pri 121 °C. Tako pridobljena desetkratno koncentrirana spremenjena hranilna raztopina se lahko sterilna hrani v hladilniku (pri 5–10 °C) tri mesece. Dodatek 3 VZDRŽEVANJE ZALOŽNE KULTURE V tem Dodatku 3 je opisana založna kultura klasastega rmanca (Myriophyllum spicatum L (103)), vrste potopljene vodne dvokaličnice iz družine rmanca. Med julijem in avgustom se nad vodno gladino pojavijo nevpadljivi rožnato-beli cveti. Rastline so ukoreninjene s trdnim sistemom korenik in rastejo po celotni severni polobli v evtrofnih, vendar neonesnaženih in bolj apnenčastih stoječih vodah z blatnim substratom. Klasasti rmanec (Myriophyllum spicatum) ima raje sladko vodo, vendar raste tudi v somornici. Za založno kulturo brez usedline v laboratorijskih pogojih so potrebne sterilne rastline. Na voljo so sterilne rastline iz ekotoksiloškega laboratorija zvezne agencije za okolje Nemčije (Umweltsbundesamt). Preskusni organizmi se lahko pripravijo tudi iz nesterilnih rastlin v skladu z oznako ASTM E 1913-04. Glej postopek v nadaljevanju za gojenje Myriophyllum sibiricum, zbranega na terenu (izvleček iz standardnih smernic ASTM): „Če se postopek začne z nesterilnimi rastlinami, zbranimi na terenu, se jeseni naberejo zarodni brstiči Myriophyllum sibiricum. Zarodni brstiči se položijo v 20-litrski akvarij, ki vsebuje 5 cm sterilne usedline, prekrite s kremenčevim peskom ali na primer z glino Turface® in 18 l vode z reagentom. Akvarij je treba prezračevati ter vzdrževati pri temperaturi 15 °C in hitrosti pretoka delcev od 200 do 300 μmol m–2 s–1 16 ur na dan. Rastlinska kultura v akvariju se lahko vzdržuje kot pomožni vir rastlin, če mehanska okvara v termostatirani celici za rast, kontaminacija ali drug dejavnik uničijo kulturo sterilizirane rastline. Rastline, ki rastejo v akvariju, niso sterilne in sterilnih kultur ni mogoče vzdrževati v sistemu za gojenje serij. Za sterilizacijo kulture je treba rastline vzeti iz akvarija in približno 0,5 ure spirati pod tekočo deionizirano vodo. V aseptičnih pogojih v laminarni komori z zračnim tokom se rastline razkužujejo manj kot 20 min (da pobeli večina rastlinskega tkiva in je zelen le še rastoči vršiček) v 3-odstotni (w/v) raztopini natrijevega hipoklorita, ki vsebuje 0,01 % primerne površinsko aktivne snovi. Pretresite razkužilo in rastlinski material. Segmenti z več kolenci se prenesejo v sterilne epruvete za gojenje, ki vsebujejo 45 ml steriliziranega spremenjenega gojišča po Andrewsu, in se zaprejo z navadnimi zamaški za epruvete za gojenje. V vsako preskusno komoro se postavi le en rastlinski segment. Za pritrditev zamaška na posodo s kulturo se uporabi sloj laboratorijskega tesnila. Po vzpostavitvi sterilne kulture je treba segmente rastline z več kolenci vsakih deset do dvanajst dni prestaviti v nove preskusne komore, ki vsebujejo sveže tekoče hranilno gojišče. Kot je prikazano z gojenjem na agarskih ploščah, morajo biti rastline sterilne in ostati sterilne osem tednov pred začetkom preskušanja.“ Ker spremenjeno gojišče po Andrewsu vsebuje saharozo (ki spodbuja rast gliv in bakterij), je treba ves material in raztopine pripraviti v sterilnih pogojih, prav tako pa mora v sterilnih pogojih potekati tudi gojenje. Vse tekočine in opremo je treba pred uporabo sterilizirati. Sterilizacija se izvede s štiriurno obdelavo z vročim zrakom (210 °C) ali dvajsetminutnim avtoklaviranjem pri 121 °C. Poleg tega je treba vse bučke, posodice, sklede itd. ter drugo opremo tik pred uporabo obdelati z ognjem na sterilni delovni mizi. Založne kulture se lahko dlje časa vzdržujejo pri manjši osvetlitvi in nižji temperaturi (50 μE m-2 s-1, 20 ± 2 °C), ne da bi jih bilo treba ponovno vzpostaviti. Gojišče za Myriophyllum mora biti enako gojišču, ki se je uporabilo za preskušanje, vendar se lahko za založne kulture uporabijo druga gojišča z veliko hranljivimi snovmi. Segmenti rastline se aksenično razdelijo v več 500-mililitrskih erlenmajeric ali/in 2 000-mililitrskih fernbachovih bučk, vsaka pa je napolnjena s približno 450 ml oziroma 1 000 ml spremenjenega gojišča po Andrewsu. Nato se bučke zamašijo z zamaški iz celuloze. Poleg tega je treba opremo tik pred uporabo obvezno obdelati z ognjem na sterilni delovni mizi. Rastline se glede na število in velikost približno vsake tri tedne prenesejo v svežo hranilno raztopino. Za to zamenjano kulturo se lahko uporabijo vršički in segmenti srednjega dela stebla. Število in velikost prenesenih rastlin (ali segmentov rastlin) sta odvisna tega, koliko rastlin je potrebnih. Lahko se na primer prenese pet segmentov poganjka v eno fernachovo bučko in trije segmenti poganjka v eno erlenmajerico, vsak od njih pa je dolg 5 cm. Zavreči je treba vse ukoreninjene, cvetoče, mrtve ali druge izstopajoče dele. Slika 1 Obrezovanje rastlin za založno kulturo in predkulturo po treh tednih gojenja 
Rastline se gojijo v 500-mililitrskih erlenmajericah in 2 000-mililitrskih fernbachovih bučkah v hlajenih inkubatorjih pri 20± 2 °C in stalni svetlobi približno 100–150 μE m-2 s-1 ali 6 000–9 000 luksov (ki jo oddaja razsvetljava v komori z barvno temperaturo „topla bela svetloba“). Slika 2 Gojenje rastlin v hlajenem inkubatorju z razsvetljavo v komori 
Uporabiti je treba kemično čiste (v kislini oprane) in sterilne steklene posode za gojenje, z njimi pa je treba ravnati po aseptičnih metodah. V primeru kontaminacije založne kulture, npr. z algami, glivami in/ali bakterijami, je treba pripraviti novo kulturo ali pa uporabiti založno kulturo iz drugega laboratorija, da se zamenja navedena kultura. Dodatek 4 VZDRŽEVANJE PREDKULTURE IN PRIPRAVA PRESKUSNEGA ORGANIZMA ZA PRESKUŠANJE Za pridobitev predkulture narežite poganjke iz založne kulture v segmente, ki imajo po dva spiralasto razvrščena lista, nato položite segmente v fernbachove bučke, napolnjene s spremenjenim gojiščem po Andrewsu (s 3 % saharoze). Vsaka bučka lahko vsebuje do 50 segmentov poganjka. Vendar je treba paziti, da so segmenti vitalni in nimajo korenin ali stranskih vej ali zarodnih brstičev (glej sliko 1 v Dodatku 3). Organizmi iz predkulture se gojijo od 14 do 21 dni v sterilnih pogojih v okoljskih komorah z izmenjujočimi se 16 urami svetlobe in 8 urami teme. Izbrana obsevanost mora biti v območju 100–150 μE m-2 s-1. Temperatura preskusnih posod mora biti 23 oC ± 2 oC. Ker spremenjeno gojišče po Andrewsu vsebuje saharozo (ki spodbuja rast alg, gliv in bakterij), je treba raztopine preskusne kemikalije pripraviti v sterilnih pogojih, v sterilnih pogojih pa mora potekati tudi gojenje. Vse tekočine in opremo je treba pred uporabo sterilizirati. Sterilizacija se izvede s štiriurno obdelavo z vročim zrakom (210 oC) ali dvajsetminutnim avtoklaviranjem pri 121 oC. Poleg tega je treba vse bučke, posodice, sklede itd. ter drugo opremo tik pred uporabo obdelati z ognjem na sterilni delovni mizi. Poganjki se aksenično vzamejo iz bučk s predkulturami, pri čemer je treba izbrati čim bolj homogen material. Za vsako preskušanje je potrebnih vsaj 60 preskusnih organizmov (preskušanje z osmimi koncentracijami preskusne kemikalije). Za preskušanje je treba iz predkultur vzeti sveže stranske veje, jih skrajšati na 2,5 cm od dna (izmerjeno z ravnilom) in jih premestiti v čašo, ki vsebuje sterilno spremenjeno gojišče po Andrewsu. Te sveže stranske veje se lahko uporabijo za preskus toksičnosti za klasasti rmanec (Myriophyllum spicatum) brez usedline. Slika 2 Obrezovanje rastlin iz predkulture za preskus toksičnosti za klasasti rmanec (Myriophyllum spicatum) brez usedline. 
C.51 Preskus toksičnosti vode in usedline za klasasti rmanec (Myriophyllum spicatum) UVOD
NAČELO PRESKUSA
INFORMACIJE O PRESKUSNI KEMIKALIJI
VELJAVNOST PRESKUSA
REFERENČNA KEMIKALIJA
OPIS METODE Preskusna oprema
Preskusni organizem
Gojenje preskusnega organizma
Usedlina
Preskusno gojišče
Načrt poskusa
Koncentracije preskusne kemikalije in kontrolne skupine
Mejni preskus
Testne raztopine
PRESKUSNI POSTOPEK
Faza vzpostavitve
Izbira enotnega rastlinskega materiala
Izpostavljenost prek vodne faze
Izpostavljenost prek usedline
Vzdrževanje nivoja vode med preskusom
Preskusni pogoji
Trajanje preskusa
Meritve in analitske določitve
Pogostost meritev in analitskih določitev
Analitske meritve preskusne kemikalije
OVREDNOTENJE PODATKOV
Spremenljivke odziva
Povprečna specifična hitrost rasti
Prirast
Izdelava krivulj koncentracija–odziv
Ocena vrednosti ECx
Statistični postopki
POROČANJE
VIRI
Dodatek 1 SESTAVA GOJIŠČA PO SMARTU IN BARKU
Dodatek 2 OPREDELITEV POJMOV
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
(1) Za 20 °C vrednost ni na voljo, vendar se lahko predvideva, da je variabilnost rezultatov meritev večja kot pričakovana odvisnost od temperature.
(2) Uredba (ES) št. 1907/2006 Evropskega parlamenta in sveta z dne 18. decembra 2006 o registraciji, evalvaciji, avtorizaciji in omejevanju kemikalij (REACH) ter o ustanovitvi Evropske agencije za kemikalije in o spremembi Direktive 1999/45/ES ter o razveljavitvi Uredbe Sveta (EGS) št. 793/93 in Uredbe Komisije (ES) št. 1488/94 ter Direktive Sveta 76/769/EGS in direktiv Komisije 91/155/EGS, 93/67/EGS, 93/105/ES in 2000/21/ES. UL L 304, 22.11.2007, str. 1.
(3) Medagencijski usklajevalni odbor ZDA za validacijo alternativnih metod.
(*1) Zabeležiti je treba predel motnjave roženice.
(4) Za uporabo celostne strategije preskušanja draženja oči v skladu z uredbo REACH glej tudi Smernice agencije ECHA za zahteve po informacijah in oceno kemijske varnosti, Poglavje R.7a: Posebne smernice o končnih točkah: http://echa.europa.eu/documents/10162/13632/information_requirements_r7a_en.pdf.
(5) Statistiki, ki uporabljajo pristop modeliranja, kot so splošni linearni modeli, lahko analizo začnejo na drugačen, a primerljiv način, vendar ne bodo nujno izpeljali običajne preglednice z analizo variance, ki sega v čas algoritemskih pristopov k izračunavanju statističnih podatkov, razvitih v predračunalniški dobi.
(6) Statistiki, ki uporabljajo pristop modeliranja, kot so splošni linearni modeli, lahko analizo začnejo na drugačen, a primerljiv način, vendar ne bodo nujno izpeljali običajne preglednice z analizo variance, ki sega v čas algoritemskih pristopov k izračunavanju statističnih podatkov, razvitih v predračunalniški dobi.
(7) Uredba (ES) št. 1272/2008 Evropskega parlamenta in Sveta z dne 16. decembra 2008 o razvrščanju, označevanju in pakiranju snovi ter zmesi, o spremembi in razveljavitvi direktiv 67/548/EGS in 1999/45/ES ter spremembi Uredbe (ES) št. 1907/2006 (UL L 353, 31.12.2008, str. 1).
(8) Vsaki preskusni kemikaliji so bili dodeljeni kemijski razredi, pri čemer se je uporabil standardni sistem za razvrščanje, ki temelji na sistemu za razvrščanje MeSH (National Library of Medicine Medical Subject Headings) (na voljo na: http//www.nlm.nih.gov/mesh).
(9) Na podlagi rezultatov preskusa draženja oči in vivo na kuncih (OECD TG 405) (17) in z uporabo GHS ZN (4).
(10) Razvrščanje v kategorijo 2A ali 2B je odvisno od razlage merila za razlikovanje med obema kategorijama po GHS ZN, in sicer ena od treh oziroma dve od treh živali, ki imajo na sedmi dan učinke, zaradi katerih je treba kemikalijo razvrstiti v kategorijo 2A. V študijo in vivo so bile vključene 3 živali. Vse končne točke, razen rdečine veznice na eni živali, so se do sedmega dne ali prej popravile in so dosegle vrednost nič. Pri eni živali, ki si do sedmega dne ni popolnoma opomogla, je rdečina veznice (na sedmi dan) dosegla vrednost 1, popolnoma pa si je opomogla deseti dan.
(11) Navedene dimenzije se nanašajo na držala za roženico, ki se uporabljajo za krave, stare od 12 do 60 mesecev. Če se uporabljajo živali, stare od 6 do 12 mesecev, je treba držalo zasnovati tako, da je prostornina vsake komore 4 ml, premer obeh notranjih posodic 1,5 cm in njuna globina 2,2 cm. Pri vsakem novo zasnovanem držalu za roženico je pomembno, da je razmerje med izpostavljeno površino roženice in prostornino zadnje komore enako razmerju pri običajnih držalih za roženico. Tako se zagotovi, da se pravilno določijo vrednosti prepustnosti za izračun stopnje IVIS s predlagano formulo.
(12) Uredba (ES) št. 1272/2008 Evropskega parlamenta in Sveta z dne 16. decembra 2008 o razvrščanju, označevanju in pakiranju snovi ter zmesi, o spremembi in razveljavitvi direktiv 67/548/EGS in 1999/45/ES ter spremembi Uredbe (ES) št. 1907/2006 (UL L 353, 31.12.2008, str. 1).
(*2) Najvišja srednja vrednost, ki se opazi pri kateri koli časovni točki.
(*3) Najvišja srednja vrednost, ki se opazi pri kateri koli časovni točki (na podlagi vrednosti motnjave iz preglednice 1).
(*4) Na podlagi vrednosti iz preglednice 2.
(*5) Manj pogoste kombinacije.
(13) Vsaki preskusni kemikaliji so bili dodeljeni kemijski razredi, pri čemer se je uporabil standardni sistem za razvrščanje, ki temelji na sistemu za razvrščanje MeSH (na voljo na http//www.nlm.nih.gov/mesh).
(14) Na podlagi rezultatov preskusa draženja oči in vivo na kuncih (OECD TG 405) in z uporabo GHS ZN (4) (6).
(15) Na podlagi rezultatov pri preskusni metodi ICE, kot so opisani v preglednici 6.
(16) Kombinacija rezultatov preskusne metode ICE, ki niso opisani v preglednici 6, za opredelitev snovi brez kategorije ali kategorije 1 po GHS ZN (glej preglednico 6).
(17) Razvrščanje v kategorijo 2A ali 2B je odvisno od razlage merila za razlikovanje med obema kategorijama po GHS ZN, in sicer ena od treh oziroma dve od treh živali, ki imajo na sedmi dan učinke, zaradi katerih je treba kemikalijo razvrstiti v kategorijo 2A. V študijo in vivo so bile vključene 3 živali. Vse končne točke, razen rdečine veznice na eni živali, so se do sedmega dne ali prej popravile in so dosegle vrednost nič. Pri eni živali, ki si do sedmega dne ni popolnoma opomogla, je rdečina veznice (na sedmi dan) dosegla vrednost 1, popolnoma pa si je opomogla deseti dan.
(18) Uredba (ES) št. 1272/2008 Evropskega parlamenta in Sveta z dne 16. decembra 2008 o razvrščanju, označevanju in pakiranju snovi ter zmesi, o spremembi in razveljavitvi direktiv 67/548/EGS in 1999/45/ES ter spremembi Uredbe (ES) št. 1907/2006 (UL L 353, 31.12.2008, str. 1).
(19) Srednja vrednost v celotnem dokumentu pomeni aritmetično sredino.
(20) Podatki se nanašajo na statistično pridobljene mejne vrednosti in niso povezani z natančnostjo meritve.
(21) Napoved DPRA je treba obravnavati v okviru IATA ter v skladu z določbami iz odstavkov 9 in 12.
(22) Podatki se nanašajo na statistično pridobljene mejne vrednosti in niso povezani z natančnostjo meritve.
(23) Napoved DPRA je treba obravnavati v okviru IATA ter v skladu z določbami iz odstavkov 9 in 12.
(24) Napovedi nevarnosti (in moči) in vivo temeljijo na podatkih za preskus LLNA (19). Moč in vivo se izpelje s pomočjo meril, ki jih je predlagal ECETOC (23).
(25) Napoved preskusa DPRA je treba proučiti v okviru IATA ter v skladu z določbami odstavkov 9 in 11.
(26) Razponi, določeni na podlagi vsaj 10 vrednosti izgube, ki jih je pridobilo 6 neodvisnih laboratorijev.
(27) Uredba (ES) št. 1272/2008 Evropskega parlamenta in Sveta z dne 16. decembra 2008 o razvrščanju, označevanju in pakiranju snovi ter zmesi, o spremembi in razveljavitvi direktiv 67/548/EGS in 1999/45/ES ter spremembi Uredbe (ES) št. 1907/2006 (UL L 353, 31.12.2008, str. 1).
(28) Napovedi nevarnosti (in moči) in vivo temeljijo na podatkih LLNA (13). Moč in vivo se izpelje s pomočjo meril, ki jih je predlagal ECETOC (24).
(29) Napoved KeratinoSensTM je treba obravnavati v okviru IATA ter v skladu z določbami iz odstavkov 9 in 11 te preskusne metode.
(30) Na podlagi ugotovljenih vrednostih iz preteklih preskusov (12).
(31) Uredba (ES) št. 1272/2008 Evropskega parlamenta in Sveta z dne 16. decembra 2008 o razvrščanju, označevanju in pakiranju snovi ter zmesi, o spremembi in razveljavitvi direktiv 67/548/EGS in 1999/45/ES ter spremembi Uredbe (ES) št. 1907/2006 (UL L 353, 31.12.2008, str. 1).
(32) Vsaki preskusni kemikaliji so bili dodeljeni kemijski razredi, pri čemer se je uporabil standardni sistem za razvrščanje, ki temelji na sistemu za razvrščanje MeSH (na voljo na http//www.nlm.nih.gov/mesh).
(33) Na podlagi rezultatov očesne študije in vivo na kuncih (OECD TG 405, PM B.5) in v skladu z GHS ZN in CLP EU.
(34) Na podlagi rezultatov, pridobljenih s FL (protokol INVITTOX št. 71(6)).
(35) Statistiki, ki uporabljajo pristop modeliranja, kot so splošni linearni modeli, lahko analizo začnejo na drugačen, a primerljiv način, vendar ne bodo nujno izpeljali običajne preglednice z analizo variance, ki sega v čas algoritemskih pristopov k izračunavanju statističnih podatkov, razvitih v predračunalniški dobi.
(36) Za opredelitev pojmov in enote glej Dodatek 1.
(37) Včasih označena s P OW; določena z metodo stresanja bučke v TM A.8 (4), metodo tekočinske kromatografije visoke ločljivosti (HPLC) v TM A.24 (5) in metodo počasnega mešanja v TM A.23 (6). Za določanje log KOW se občasno uporablja tehnika generator-kolona. Na voljo je omejeno število študij, ki uporabljajo to tehniko, predvsem za klorirane bifenile in dibenzodioksine (npr. Li in Doucette, 1993) (3). Za snovi, ki lahko ionizirajo, se mora log K OW nanašati na neionizirano obliko.
(38) Za opredelitev pojmov in enote glej Dodatek 1.
(39) TLC: tankoplastna kromatografija; HPLC: visokotlačna tekočinska kromatografija; GC: plinska kromatografija.
(40) V nekaterih regulativnih okvirih je analiza metabolitov morda obvezna, kadar so izpolnjeni določeni pogoji (prim. odstavek 65).
(41) Na splošno bi izmerjene koncentracije v vodi med fazo absorpcije morale biti vsaj en red velikosti nad mejo določljivosti, zato da se lahko med fazo očiščenja v študiji lahko izmeri več razpolovnih dob obremenitve telesa.
(42) Za opredelitev pojmov in enote glej Dodatek 1.
(43) Večine preskusnih snovi se načeloma ne sme zaznati v kontrolni vodi. Koncentracije ozadja bi morale biti pomembne samo za naravno prisotne materiale (npr. nekatere kovine) in snovi, ki so splošno prisotne v okolju.
(44) Če kinetika prvega reda očitno ni upoštevana, je treba uporabiti kompleksnejše modele (glej vire v Dodatku 5) in poiskati nasvet biostatistika.
(45) Absorpcija je lahko omejena pri nizkih koncentracijah izpostavljenosti zaradi nizke topnosti v vodi pri preskusu biokoncentracije, pri prehranskem preskusu pa se lahko dosežejo veliko višje koncentracije izpostavljenosti.
(46) Za snovi z več sestavinami, UVCB in zmesi je treba upoštevati topnost v vodi vsake ustrezne sestavine, da se določijo ustrezne koncentracije izpostavljenosti.
(47) TOC vključuje organski ogljik iz delcev in raztopljeni organski ogljik, tj. TOC=POC + DOC.
(48) Čeprav to na splošno ni priporočeno, je ob uporabi topila ali sredstva za raztapljanje treba dodati organski ogljik, ki izvira iz tega sredstva, k organskemu ogljiku iz preskusne snovi, da se oceni koncentracija organskega ogljika v preskusnih posodah.
(49) Če se vsebnost lipidov ne analizira na istih ribah kot preskusna snov, morajo ribe imeti vsaj podobno težo in (če je to pomembno) biti istega spola.
(50) Ta možnost se lahko uporabi samo, če se ribe v vseh preskusnih skupinah gojijo v podobnih velikostih skupin, če so odstranjene po istem vzorcu in hranjene na enak način. To zagotovi, da je rast rib v vseh preskusnih skupinah podobna, če je preskušana koncentracija pod mejo območja toksičnosti. Če je rast podobna, se pričakuje, da bo podobna tudi vsebnost lipidov. Drugačna rast v kontrolni skupini bi kazala na učinek snovi, zaradi česar bi se študija razveljavila.
(51) Poleg teže je treba zabeležiti skupno dolžino, saj je primerjava obsega povečanja dolžine med preskusom dober pokazatelj tega, ali je prišlo do neželenega učinka.
(52) Izvede se lahko t-test na konstantah hitrosti rasti, da se preskusi, ali je rast v kontrolni in preskusni skupini različna, ali F-test v primeru analize variance. F-test ali preskus razmerja verjetnosti se lahko po potrebi uporabi za pomoč pri izbiri ustreznega modela rasti (monografija OECD 54, (32)).
(53) Na osnovi teh odstotkov se predvideva, da so analitske metode zanesljive in da je razpolovna doba < 14 dni. Če so analitske metode manj zanesljive ali je razpolovna doba (zelo) povečana, bodo te številke višje.
CI (confidence interval): interval zaupanja (kadar ga je mogoče oceniti)
SD (standard deviation): standardni odklon (kadar ga je mogoče oceniti)
(56) Minimiziran preskus se lahko pravzaprav uporabi, da se dokaže zelo hiter metabolizem, kadar se ve, da je to najverjetneje značilno za snov.
(57) Kadar se merita samo dve podatkovni točki, se lahko ocene meje zaupanja za BKFKm izvedejo z metodami samovzorčenja. Ko so na voljo tudi vmesne podatkovne točke, se lahko meje zaupanja za BKFKm izračunajo kot v popolnem preskusu.
(58) Za opredelitev pojmov in enote glej Dodatek 1.
(59) Za namene Uredbe (ES) št. 1907/2006 o registraciji, evalvaciji, avtorizaciji in omejevanju kemikalij (REACH) (UL L 396, 30.12.2006, str. 1) je to vprašanje obravnavano v „Smernicah za zahteve po informacijah in oceno kemijske varnosti“, poglavja R.7c, R.7.10.3.1 in R.7.10.4.1 ter slika R7.10–2.
(60) Večine preskusnih snovi se načeloma ne sme zaznati v kontrolni vodi. Koncentracije ozadja bi morale biti pomembne samo za naravno prisotne materiale (npr. nekatere kovine) in snovi, ki so splošno prisotne v okolju.
(61) Ker je BMF opredeljen kot razmerje med koncentracijo snovi v organizmu in koncentracijo snovi v hrani organizma v stacionarnem stanju, se upoštevajo lipidi tako, da se vrednost popravi glede na vsebnost lipidov v organizmu in hrani, zato ga je ustrezneje opisati kot „popravek“. Ta pristop se razlikuje od „normalizacije“ na vnaprej določeno vsebnost lipidov v organizmu, ki se izvede pri preskusu vodne izpostavljenosti za ugotavljanje biokoncentracije.
(62) Med preskusom je treba zabeležiti tudi skupno dolžino, saj je dober pokazatelj tega, ali je prišlo do neželenega učinka.
(63) HCB je naveden v prilogah A in C k Stockholmski konvenciji in v prilogah I in III Uredbe (ES) št. 850/2004 o obstojnih organskih onesnaževalih (UL L 158, 30.4.2004, str. 7).
(64) Za hitro rast med fazo absorpcije se dejanska stopnja hranjenja zmanjša na nižjo od te, ki je bila določena na začetku izpostavljenosti.
(65) V študiji vodne izpostavljenosti bi 14-dnevna razpolovna doba ustrezala BKF, ki znaša približno 10 000 l/kg, z uporabo rib z 1 g in ustrezno hitrostjo absorpcije, ki znaša približno 500 l/kg/d (v skladu z enačbo iz Sijm idr. (46)).
(66) Ker se dejanske notranje koncentracije lahko določijo samo po izvedbi preskusa, je treba oceniti pričakovano notranjo koncentracijo (npr. na podlagi pričakovanega BMF in koncentracije v hrani; prim. enačba A5.8 v Dodatku 5).
(67) Morda ni mogoče povsem preprečiti prisotnost preskusne snovi v preskusnem mediju zaradi izločanja rib ali luženja iz hrane. Ena možnost je torej izmeriti koncentracijo snovi v vodi ob koncu faze absorpcije, zlasti če se uporablja polstatični sistem, da se lažje ugotovi, ali je prišlo do kakršne koli vodne izpostavljenosti.
(68) Ta pristop je značilen za prehransko študijo in je drugačen od postopka pri vodni izpostavljenosti, zato je bila namesto „normalizacije“ uporabljena beseda „popravek“, da se prepreči nejasnosti – glej tudi opombo v odstavku 106.
(69) Izvede se lahko t-test na konstantah hitrosti rasti, da se preskusi, ali je rast v kontrolni in preskusni skupini različna, ali F-test v primeru analize variance. F-test ali preskus razmerja verjetnosti se lahko po potrebi uporabi za pomoč pri izbiri ustreznega modela rasti (monografija OECD 54, (32)).
(70) Tehnika za analizo hrane za proteine, lipide, surove vlaknine in pepel; te informacije so običajno na voljo pri dobavitelju hrane.
CI (confidence interval): interval zaupanja (kadar ga je mogoče oceniti)
SD (standard deviation): standardni odklon (kadar ga je mogoče oceniti)
(73) Meyer idr. (1)
(74) Opozoriti je treba, da se v preskusu po možnosti uporablja teža kot merilo za velikost in izpeljave konstant hitrosti rasti. Vendar je dolžina bolj praktično merilo, če je treba na začetku preskusa ribe izbrati na pogled (tj. iz populacije staleža).
(75) To območje je navedeno v Testing Methods for New Chemical Substances etc. (Preskusne metode za nove kemijske snovi), ki temelji na japonskem zakonu za nadzor kemijskih snovi (CSCL, Chemical Substances Control Law).
(76) Vrednosti v oklepajih so števila vzorcev (vode, rib), ki jih je treba vzeti, če se izvede dodatno vzorčenje.
(77) Ocena k 2 pred preskusom za log K OW, ki znaša 4,0, je 0,652 dni– 1. Skupno trajanje preskusa znaša 3 × t SS = 3 × 4,6 dni, tj. 14 dni. Za oceno t SS glej Dodatek 5.
(78) Vodo je treba vzorčiti po najmanj treh zamenjanih prostorninah v komori.
(79) Te ribe se vzorčijo iz populacije staleža.
(80) Če je treba izvesti študije z večjo natančnostjo ali študije metabolizma, ki zahtevajo več rib, je treba te vzorčiti zlasti ob koncu faze absorpcije in očiščenja (prim. odstavek 40).
(81) Za analizo vsebnosti lipidov bodo potrebne vsaj tri dodatne ribe, če ni mogoče uporabiti istih rib, ki so bile vzorčene za koncentracije snovi na začetku preskusa ter ob koncu faze absorpcije in očiščenja. Opozoriti je treba, da se v mnogih primerih lahko uporabijo samo tri kontrolne ribe (prim. odstavek 56).
(82) Trije vzorci hrane iz kontrolne in preskusne skupine, analizirani glede koncentracij preskusne snovi in vsebnosti lipidov.
(83) Ribe se vzorčijo iz populacije staleža čim bližje začetku študije; vsaj tri ribe iz populacije staleža je treba na začetku preskusa vzorčiti za vsebnost lipidov.
(84) (Izbirno) vzorčenje v zgodnji fazi absorpcije zagotovi podatke za izračun prehranske asimilacije preskusne snovi, ki jo je mogoče primerjati z učinkovitostjo asimilacije, ki se izračuna iz podatkov o fazi očiščenja.
(85) Vzorči se lahko pet dodatnih rib za analizo določenega tkiva.
(86) Za analizo vsebnosti lipidov bodo potrebne vsaj tri dodatne ribe, če ni mogoče uporabiti istih rib, ki so bile vzorčene za koncentracije snovi na začetku preskusa ter ob koncu faze absorpcije in očiščenja. Opozoriti je treba, da se v mnogih primerih lahko uporabijo samo tri kontrolne ribe (prim. odstavka 56 in 153).
(87) Kot pri vsakem empiričnem razmerju je treba preveriti, da je preskusna snov v območju uporabe razmerja.
(88) Teža ribe ob koncu faze absorpcije se lahko oceni na podlagi podatkov preteklih študij ali znanja o najverjetnejšem povečanju velikosti za preskusno vrsto na podlagi običajne teže ob začetku preskusa in običajnega trajanja absorpcije (npr. 28 dni).
(89) V večini programov, ki omogočajo linearno regresijo, je mogoče ugotoviti tudi standardne napake in interval zaupanja (CI, confidence interval) za ocene, npr. v Microsoft Excelu z uporabo zbirke orodij Analiza podatkov.
(90) V nasprotju z metodo linearne regresije se s to enačbo ne pridobi standardne napake za k2.
(91) V nasprotju s postopkom linearnega prilagajanja se s to metodo običajno ne pridobi standardne napake ali intervala zaupanja za oceno k1.
(92) Vedeti je treba, da se negotovost pri oceni k2 ne uporablja ustrezno pri bioakumulacijskem modelu, saj se v bistvu obravnava kot konstanta za prilagajanje k1 v metodi zaporednega prilagajanja. Pridobljena negotovost BKF je torej drugačna pri metodah sočasnega in zaporednega prilagajanja.
(93) Na nekaterih območjih je morda dostopna samo ribja hrana s koncentracijo lipidov, ki je veliko nižja od te zgornje meje. V takih primerih je treba študije primerov izvesti s to nižjo koncentracijo lipidov v hrani, ki je bila dostopna, in ustrezno prilagoditi stopnjo hranjenja za ohranjanje zdravja rib. Lipidov v hrani se ne sme umetno povečati z dodajanjem odvečnega olja.
(94) V naravi pot, ki pomeni največjo izpostavljenost v vodnih okoljih, za zelo hidrofobne snovi najverjetneje poteka prek zaužitja, zato ocenjeni BKF ne predstavlja nujno bioakumulacijski potencial take snovi.
(95) Lahko se uporabijo druge vrste vodnih bolh, če ustrezno izpolnjujejo merila za veljavnost (merilo za veljavnost v zvezi s sposobnostjo razmnoževanja v kontrolah mora biti ustrezno za vse vrste). Če se uporabijo druge vrste vodnih bolh, jih je treba jasno opredeliti in utemeljiti njihovo uporabo.
(96) Naključna smrtnost: smrtnost, ki ni povezana s kemikalijo in jo povzroči naključni dogodek (tj. znani vzrok).
(97) Nenamerna smrtnost: smrtnost, ki ni povezana s kemikalijo in nima znanega vzroka.
(*6) Navedite, katera posoda je bila uporabljena za preskus.
(*7) Zabeležite nedozorele zarode kot „AB“ v ustreznem okencu.
(*8) Zabeležite smrtnost katerega koli starša kot „M“ v ustreznem okencu.
(98) Tipična najmanjša srednja skupna dolžina sicer ni merilo za veljavnost, vendar je treba odstopanja, ki so nižja od navedenih vrednosti, skrbno proučiti glede na občutljivost preskusa. Najmanjša srednja skupna dolžina se izpelje na podlagi nabora trenutno razpoložljivih podatkov.
(99) Določeni sevi preskušenih šarenk bodo morda zahtevali uporabo drugačne temperature. Plemenske ribe je treba vzdrževati pri enaki temperaturi kot ikre. Po prejemu iker od komercialnega gojitelja je potrebno krajše prilagajanje (npr. 1–2 h) na preskusno temperaturo.
(100) Ličinke morajo biti do enega tedna po izvalitvi v temi, razen kadar se izvaja pregled, nato pa ves čas preskusa (12- do 16-urno obdobje osvetljenosti) v blagi svetlobi. (4)
(101) Režim osvetlitve mora biti stalen pri vseh preskusnih pogojih.
(102) Pri vseh preskusih se to izvede pri ± 2 0/00.
(*9) Hrana se odmerja tako, da so živali site. Ostanke hrane in iztrebke je treba odstraniti, da se prepreči kopičenje odpadkov.
|
FBS |
zamrznjeni morski rakci (angl. frozen brine shrimps); odrasli rakci vrste Artemia sp. |
|
BSN |
navpliji morskih rakcev (angl. brine shrimp nauplii); pravkar izlegli |
|
BSN48 |
navpliji morskih rakcev (angl. brine shrimp nauplii); stari 48 ur |
(1) ličinke z vrečico rumenjaka ne potrebujejo hrane
(2) prefiltrirane iz mešane kulture
(3) granule, pridobljene v postopku fermentacije
(*10) Bradavičasti podaljški se običajno pojavijo le pri odraslih samcih na plavutnicah, in sicer od druge do sedme ali osme s posteriornega konca predrepne plavuti (sliki 1 in 2). Vendar se podaljški redko pojavijo na prvi plavutnici s posteriornega konca predrepne plavuti. Ta standardni operativni postopek zajema meritev podaljškov na prvi plavutnici (v tem standardnem operativnem postopku se številka plavutnice nanaša na zaporedje od posteriornega konca predrepne plavuti).
(*11) Homogenizacijski pufer:
|
— |
(50 mM Tris-HCl pH 7,4; 1-odstotna zmes zaviralca proteaze (Sigma)): 12 ml Tris-HCl pH 7,4 + 120 μl zmesi zaviralca proteaze. |
|
— |
TRIS: TRIS-ULTRA PURE (ICN), npr. Bie & Berntsen, Danska. |
|
— |
Zmes zaviralca proteaze: Sigma (za tkivo sesalcev), številka izdelka P 8340. |
OPOMBA: homogenizacijski pufer je treba uporabiti na dan priprave. Med uporabo ga je treba postaviti na led.
(103) Carl von Linné (*23. maj 1707 Råshult/Älmhult; † 10. januar 1778 Uppsala).
(*12) Demineralizirana (tj. destilirana ali deionizirana) voda

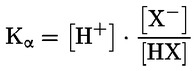





 , kar ustreza 0,095 mm. Uporabniki se morajo zavedati, da se lahko z biomikroskopi pri različnih širinah špranje pridobijo različne vrednosti meritev debeline roženice.
, kar ustreza 0,095 mm. Uporabniki se morajo zavedati, da se lahko z biomikroskopi pri različnih širinah špranje pridobijo različne vrednosti meritev debeline roženice.