|
24.8.2009
|
SL
|
Uradni list Evropske unije
|
L 220/1
|
UREDBA KOMISIJE (ES) št. 761/2009
z dne 23. julija 2009
o spremembi Uredbe (ES) št. 440/2008 o določitvi testnih metod v skladu z Uredbo (ES) št. 1907/2006 Evropskega parlamenta in Sveta o registraciji, evalvaciji, avtorizaciji in omejevanju kemikalij (REACH) zaradi njene prilagoditve tehničnemu napredku
(Besedilo velja za EGP)
KOMISIJA EVROPSKIH SKUPNOSTI JE –
ob upoštevanju Pogodbe o ustanovitvi Evropske skupnosti,
ob upoštevanju Uredbe (ES) št. 1907/2006 Evropskega parlamenta in Sveta z dne 18. decembra 2006 o registraciji, evalvaciji, avtorizaciji in omejevanju kemikalij (REACH) ter o ustanovitvi Evropske agencije za kemikalije in o spremembi Direktive 1999/45/ES ter o razveljavitvi Uredbe Sveta (EGS) št. 793/93 in Uredbe Komisije (ES) št. 1488/94 ter Direktive Sveta 76/769/EGS in direktiv Komisije 91/155/EGS, 93/67/EGS, 93/105/ES in 2000/21/ES (1), ter zlasti člena 13(3) Uredbe,
ob upoštevanju naslednjega:
|
(1)
|
Uredba Komisije (ES) št. 440/2008 (2) vsebuje testne metode za ugotavljanje fizikalno-kemijskih lastnosti, toksičnosti in ekotoksičnosti snovi, ki jih je treba uporabiti za namene Uredbe (ES) št. 1907/2006.
|
|
(2)
|
Uredbo (ES) št. 440/2008 je treba posodobiti, tako da se spremenijo nekatere testne metode in vključi več novih testnih metod, ki jih je sprejela OECD. Posvetovanja o tem predlogu z zainteresiranimi stranmi so bila opravljena. Navedene spremembe prilagajajo zadevne metode znanstvenemu in tehničnemu napredku.
|
|
(3)
|
Spremeniti je treba določbe o parnem tlaku, da bi se vključila nova efuzijska metoda.
|
|
(4)
|
Dodati je treba novo metodo merjenja dolžinsko tehtanega geometričnega povprečnega premera vlaken.
|
|
(5)
|
Primerno je posodobiti Uredbo (ES) št. 440/2008, tako da se prednostno vključi nova testna metoda dražilnosti kože in vitro in se število živali, uporabljenih za testne namene, zmanjša v skladu z Direktivo Sveta 86/609/EGS z dne 24. novembra 1986 o približevanju zakonov in drugih predpisov držav članic o varstvu živali, ki se uporabljajo za poskusne in druge znanstvene namene (3). Čeprav v OECD razprave o osnutku testne metode in vitro za draženje kože še niso končane, je metodo B 46 v tem izjemnem primeru primerno vključiti v to uredbo. Metodo B 46 je treba posodobiti takoj, ko bo v OECD dosežen dogovor ali ko bodo na voljo dodatne informacije, ki upravičujejo takšno posodobitev.
|
|
(6)
|
Spremeniti je treba določbe o preskusu zaviranja rasti alg, da bi se vključile dodatne vrste in izpolnile zahteve glede ocene nevarnosti in razvrstitve kemikalij.
|
|
(7)
|
Dodati je treba novo metodo merjenja aerobne mineralizacije v površinskih vodah na podlagi simulacijskega preskusa biorazgradnje in novo metodo ocenjevanja toksičnosti za rod Lemna na podlagi preskusa zaviranja rasti.
|
|
(8)
|
Uredbo (ES) št. 440/2008 je zato treba ustrezno spremeniti.
|
|
(9)
|
Ukrepi, predvideni s to uredbo, so v skladu z mnenjem odbora, ustanovljenega v skladu s členom 133 Uredbe (ES) št. 1907/2006 –
|
SPREJELA NASLEDNJO UREDBO:
Člen 1
Priloga k Uredbi (ES) št. 440/2008 se spremeni:
|
1.
|
del A se spremeni:
|
(a)
|
poglavje A.4 se nadomesti s poglavjem A.4, kot je določeno v Prilogi I k tej uredbi;
|
|
(b)
|
doda se poglavje A.22, kot je določeno v Prilogi II k tej uredbi;
|
|
|
2.
|
del B se spremeni:
doda se poglavje B.46, kot je določeno v Prilogi III k tej uredbi;
|
|
3.
|
del C se spremeni:
|
(a)
|
poglavje C.3 se nadomesti s poglavjem C.3, kot je določeno v Prilogi IV k tej uredbi;
|
|
(b)
|
dodata se poglavji C.25 in C.26, kot sta določeni v prilogah V in VI k tej uredbi.
|
|
Člen 2
Ta uredba začne veljati tretji dan po objavi v Uradnem listu Evropske unije.
Ta uredba je v celoti zavezujoča in se neposredno uporablja v vseh državah članicah.
V Bruslju, 23. julija 2009
Za Komisijo
Stavros DIMAS
Član Komisije
(1) UL L 396, 30.12.2006, str. 1.
(2) UL L 142, 31.5.2008, str. 1.
(3) UL L 358, 18.12.1986, str. 1.
Priloga I
1. METODA
Ta metoda je enakovredna OECD TG 104 (2004).
1.1 UVOD
Ta revidirana različica metode A.4(1) dodatno vključuje efuzijsko metodo: izotermično termogravimetrijo, namenjeno za snovi z zelo nizkimi tlaki (do 10–10 Pa). Odvisno od zahtev postopka, zlasti pri določanju parnega tlaka snovi z nizkim parnim tlakom, se ponovno ocenijo še drugi postopki za uporabo te metode glede na druga območja uporabe.
V termodinamičnem ravnotežju je parni tlak čiste snovi odvisen samo od temperature. Temeljna načela so opisana drugje (2)(3).
Ni enega samega merilnega postopka, ki bi bil uporaben za celotno območje parnih tlakov od manj kot 10–10 do 105 Pa. Ta metoda vključuje osem metod za merjenje parnega tlaka, ki jih je mogoče uporabiti za različna območja parnih tlakov. Različne metode se primerjajo glede na uporabnost in merilno območje iz tabele 1. Metode se lahko uporabljajo samo za snovi, ki v pogojih preskusa ne razpadejo. Kadar preskusnih metod zaradi tehničnih razlogov ni mogoče uporabiti, se parni tlak lahko tudi oceni, priporočena ocenjevalna metoda je navedena v Dodatku.
1.2 OPREDELITVE IN ENOTE
Parni tlak snovi je opredeljen kot tlak nasičene pare nad trdno ali tekočo snovjo.
Za tlak je treba uporabljati enoto SI, tj. pascal (Pa). V preteklosti uporabljane enote, skupaj s pretvorbnimi faktorji, so navedene spodaj:
|
1 torr
|
=
|
1 mm Hg
|
=
|
1,333 × 102 Pa
|
|
1 atmosfera
|
=
|
1,013 × 105 Pa
|
|
|
|
1 bar
|
=
|
105 Pa
|
|
|
Enota SI za temperaturo je kelvin (K). Za pretvorbo stopinj Celzija v kelvine se uporablja naslednja formula:
T = t + 273,15
pri čemer je T temperatura v kelvinih ali termodinamična temperatura, t pa temperatura v stopinjah Celzija.
Tabela 1
|
Merilna metoda
|
Snovi
|
Ocena ponovljivosti
|
Ocena obnovljivosti
|
Priporočeno območje
|
|
v trdnem stanju
|
v tekočem stanju
|
|
Dinamična metoda
|
nizko tališče
|
Da
|
do 25 %
1 do 5 %
|
do 25 %
1 do 5 %
|
103 Pa do 2 × 103 Pa
2 × 103 Pa do 105 Pa
|
|
Statična metoda
|
Da
|
Da
|
5 do 10 %
|
5 do 10 %
|
10 Pa do 105 Pa
10–2 Pa do 105 Pa (1)
|
|
Izoteniskopska metoda
|
Da
|
Da
|
5 do 10 %
|
5 do 10 %
|
102 Pa do 105 Pa
|
|
Efuzijska metoda: parnotlačna tehtnica
|
Da
|
Da
|
5 do 20 %
|
do 50 %
|
10–3 do 1 Pa
|
|
Efuzijska metoda: Knudsenova celica
|
Da
|
Da
|
10 do 30 %
|
—
|
10–10 do 1 Pa
|
|
Efuzijska metoda: izotermična termogravimetrija
|
Da
|
Da
|
5 do 30 %
|
do 50 %
|
10–10 do 1 Pa
|
|
Metoda nasičenega plina
|
Da
|
Da
|
10 do 30 %
|
do 50 %
|
10–10 do 103 Pa
|
|
Metoda z rotorjem
|
Da
|
Da
|
10 do 20 %
|
—
|
10–4 do 0,5 Pa
|
1.3 PRINCIP PRESKUSA
V splošnem se parni tlak določa pri različnih temperaturah. V omejenem temperaturnem območju je logaritem parnega tlaka čiste snovi linearna funkcija obratne vrednosti termodinamične temperature v skladu s poenostavljeno Clausius-Clapeyronovo enačbo:

pri čemer je:
|
p
|
=
|
parni tlak snovi v pascalih
|
|
ΔHv
|
=
|
izparilna toplota v J mol–1
|
|
R
|
=
|
splošna plinska konstanta, 8,314 J mol–1 K–1
|
|
T
|
=
|
termodinamična temperatura v K
|
1.4 REFERENČNE SNOVI
Referenčnih snovi ni treba uporabljati. Služijo predvsem za občasno preverjanje učinkovitosti metode, pa tudi za omogočanje primerjave med rezultati različnih metod.
1.5 OPIS METODE
1.5.1 Dinamična metoda (Cottrellova metoda)
1.5.1.1 Princip
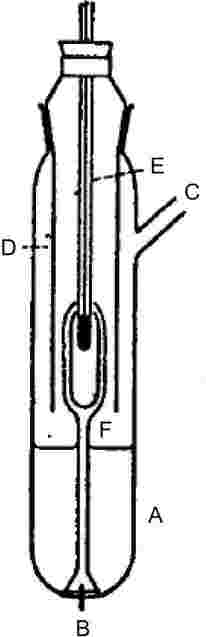
Parni tlak se določi z merjenjem vrelišča snovi pri različnih točno določenih tlakih med približno 103 in 105 Pa. Ta metoda se priporoča tudi za določitev vrelišča. Za ta namen je uporabna do 600 K. Vrelišča tekočin so na globini 3 do 4 cm zaradi hidrostatičnega tlaka tekočine približno 0,1 °C višja kot na površini. Pri Cottrellovi metodi (4) se termometer namesti v paro nad površino tekočine, vrela tekočina pa se neprestano črpa prek bučke termometra. Bučko prekriva tanka plast tekočine, ki je v ravnotežju s paro pri atmosferskem tlaku. Termometer zato kaže pravo vrelišče, brez napak zaradi prevelikega segrevanja ali hidrostatičnega tlaka. Črpalka, ki jo je prvič uporabil Cottrell, je prikazana na sliki 1. Vrela tekočina je v cevki A. Platinasta žica B, ki je zatesnjena v dno, spodbuja enakomerno vrenje. Stranska cevka C je napeljana v kondenzator, obloga D pa mrzlemu kondenzu preprečuje stik s termometrom E. Ko tekočina v A vre, se mehurčki in tekočina, ki se ujamejo v liju, preko dveh ročic črpalke F razlijejo čez bučko termometra.
|
Slika 1
|
Slika 2

|
Cottrellova črpalka (4)
|
B:
|
Vakuumski pufrski volumen
|
|
F:
|
Grelni element, približno 150 W
|
1.5.1.2 Aparatura
Zelo natančna aparatura, ki uporablja Cottrellov princip, je prikazana na sliki 2. Sestavljena je iz cevke z vrelnim delom v spodnjem delu, hladilnikom v srednjem delu in odtočno cevko ter prirobnico v zgornjem delu. Cottrellova črpalka se namesti v vrelni del, ki se segreva z električnim kartušnim grelnikom. Temperatura se meri s termočlenom v plašču ali uporovnim termometrom, ki se vstavi skozi prirobnico na vrhu. Izhod se poveže s sistemom za urejanje tlaka. Ta je sestavljen iz vakuumske črpalke, pufrskega volumna, manostata za spuščanje dušika za urejanje tlaka in manometra.
1.5.1.3 Postopek
Snov se namesti v vrelni del. Pri neuprašenih trdnih snoveh lahko nastanejo težave, ki pa se včasih lahko odpravijo s segrevanjem hladilnega plašča. Aparatura se zatesni pri robnici in snov razplini. Penečih snovi ni mogoče meriti s to metodo.
Nato se nastavi najnižji želeni tlak ter vključi gretje. Hkrati se senzor temperature poveže z zapisovalnikom.
Ravnotežje je doseženo, ko se pri konstantnem tlaku zabeleži konstantno vrelišče. Preprečiti je treba zlasti sunkovito udarjanje med vrenjem. Poleg tega se mora kondenzacija v hladilniku popolnoma končati. Kadar se določa parni tlak trdnih snovi z nizkim tališčem, je treba paziti, da se hladilnik ne zamaši.
Potem ko se zabeleži točka ravnotežja, se nastavi višji tlak. Postopek se nadaljuje na enak način, dokler ni dosežen tlak 105 Pa (skupaj približno 5 do 10 merilnih točk). Za potrditev je treba ponoviti točke ravnotežja pri padajočih tlakih.
1.5.2 Statična metoda
1.5.2.1 Princip
Pri statični metodi (5) se parni tlak pri termodinamičnem ravnotežju določi pri navedeni temperaturi. Ta metoda je primerna za snovi ter večkomponentne tekočine in trdne snovi v območju od 10–1 do 105 Pa in, ob zadostni pazljivosti, tudi v območju 1 do 10 Pa.
1.5.2.2 Aparatura
Oprema je sestavljena iz kopeli s konstantno temperaturo (z natančnostjo ±0,2 K), posode za vzorec, povezane z vakuumsko cevjo, manometra in sistema za urejanje tlaka. Komora za vzorec (slika 3a) je povezana z vakuumsko cevjo preko ventila in diferencialnega manometra (U-cevke, ki vsebuje ustrezno manometrsko tekočino), ki služi kot ničelni indikator. Za uporabo v diferencialnem manometru so primerni živo srebro, silikoni in ftalati, odvisno od območja tlaka in kemijskih lastnosti preskusne snovi. Zaradi varovanja okolja pa se je treba uporabi živega srebra izogibati, če je to mogoče. Preskusna snov se ne sme vidno topiti v tekočini v U-cevki ali z njo reagirati. Namesto U-cevke se lahko uporabi merilnik tlaka (slika 3b). Za manometer se lahko uporabijo živo srebro za območje od normalnega zračnega tlaka do 102 Pa ter silikonska olja in ftalati pri območju pod 102 Pa do 10 Pa. Obstajajo tudi drugi merilniki tlaka, ki se lahko uporabljajo pod 102 Pa, membranski manometri, ki se lahko segrevajo, pa se lahko uporabljajo tudi pod 10–1 Pa. Temperatura se meri ob zunanji steni posode z vzorcem ali v sami posodi.
1.5.2.3 Postopek
S pomočjo aparature, kakor je prikazana na sliki 3a, se U-cevka napolni z izbrano tekočino, ki jo je treba pred odčitavanjem razpliniti pri zvišani temperaturi. V aparaturo se da preskusna snov in razplini pri znižani temperaturi. Pri večkomponentnih vzorcih mora biti temperatura dovolj nizka, da se sestava snovi zagotovo ne spremeni. Vzpostavljanje ravnotežja je mogoče pospešiti z mešanjem. Vzorec se lahko ohladi s tekočim dušikom ali suhim ledom, paziti pa je treba, da zrak ali tekočina v črpalki ne kondenzira. Ob odprtem ventilu nad vzorčno posodo se nekaj minut izsesava zrak. Postopek razplinjevanja se po potrebi večkrat ponovi.
|
Slika 3a

|
Slika 3b

|
Ko se vzorec segreva in je ventil zaprt, parni tlak narašča. To spremeni ravnotežje tekočine v U-cevki. Za izravnavo tega učinka se v aparaturo spusti dušik ali zrak, dokler ni indikator tlaka spet na ničli. Tlak, potreben za to, se lahko odčita z manometra ali zelo preciznega instrumenta. Ta tlak ustreza parnemu tlaku snovi pri tej merilni temperaturi. Pri uporabi aparature, prikazane na sliki 3b, se parni tlak odčita neposredno.
Parni tlak se določi pri ustrezno majhnih temperaturnih intervalih (skupaj približno 5 do 10 merilnih točk) do želenega maksimuma.
Za preveritev je treba meritve ponoviti pri nizkih temperaturah. Če vrednosti, dobljene pri ponovljenih meritvah, ne sovpadajo z dobljeno krivuljo za naraščajočo temperaturo, je to lahko posledica enega od naslednjih vzrokov:
|
(i)
|
v vzorcu je še vedno zrak (npr. snovi z veliko viskoznostjo) ali snovi z nizkim vreliščem, ki se sprosti(-jo) med segrevanjem;
|
|
(ii)
|
v proučevanem temperaturnem območju snov kemično reagira (npr. razpada, polimerizira).
|
1.5.3 Metoda izoteniskopa
1.5.3.1 Princip
Izoteniskop (6) temelji na principu statične metode. Ta metoda zajema namestitev vzorca v bučko, v kateri se ohranja konstantna temperatura in ki je povezana z manometrom ter vakuumsko črpalko. Nečistoče, ki so bolj hlapne kot snov, se odstranijo z razplinjevanjem pri znižanem tlaku. Parni tlak vzorca pri izbranih temperaturah se uravnava z znanim tlakom inertnega plina. Izoteniskop je bil razvit za merjenje parnega tlaka določenih tekočih ogljikovodikov, vendar ga je mogoče uporabiti tudi za proučevanje trdnih snovi. Ta metoda običajno ni primerna za večkomponentne sisteme. Pri vzorcih, ki vsebujejo nehlapne nečistoče, lahko rezultati vsebujejo majhne napake. Priporočeno območje je od 102 do 105 Pa.
1.5.3.2 Aparatura
Primer merilne naprave je prikazan na sliki 4. Popoln opis je mogoče najti v ASTM D 2879–86 (6).
1.5.3.3 Postopek
Pri tekočinah se sama snov uporabi kot tekočina v diferencialnem manometru. V izoteniskop se vlije zadostna količina tekočine, da se napolnita bučka in krajši krak manometrskega dela. Izoteniskop se pritrdi na vakuumski sistem in odzrači, nato pa napolni z dušikom. Odzračevanje in splakovanje sistema se dvakrat ponovi, da se odstrani ves kisik. Napolnjen izoteniskop se postavi v vodoraven položaj, tako da se vzorec razlije v tanko plast v vzorčni bučki in manometrskem delu. Tlak v sistemu se zmanjša na 133 Pa in vzorec se počasi segreva, dokler ravno ne začne vreti (odstranitev raztopljenih plinov). Izoteniskop se nato postavi tako, da se vzorec vrne v bučko in krajši krak manometra ter se oba popolnoma napolnita s tekočino. Vzdržuje se tlak 133 Pa. Podaljšana konica bučke z vzorcem se segreva nad majhnim plamenom, dokler se sproščene pare vzorca toliko ne razširijo, da izpodrinejo del vzorca iz zgornjega dela bučke in kraka manometra, ga potisnejo v manometrski del izoteniskopa, in tako ustvarijo s parami nasičen prostor brez dušika. Izoteniskop se nato postavi v kopel s konstantno temperaturo, tlak dušika pa se naravna tako, da je enak tlaku vzorca. Ob ravnotežju je parni tlak dušika enak parnemu tlaku snovi.
Slika 4

Pri trdnih snoveh se odvisno od območja tlaka in temperature uporabljajo manometrske tekočine, kot so silikonske tekočine ali ftalati. Izboklina na daljšem kraku izoteniskopa se napolni z razplinjeno manometrsko tekočino. Potem se preskusna trdna snov da v bučko in razplini pri zvišani temperaturi. Nato se izoteniskop nagne tako, da manometrska tekočina steče v U-cevko.
1.5.4 Efuzijska metoda: parnotlačna tehtnica (7)
1.5.4.1 Princip
Vzorec preskusne snovi se segreje v majhni peči in namesti v odzračen stekleni zvon. Peč se pokrije s pokrovom, na katerem so majhne luknje z znanimi premeri. Para snovi, ki uhaja skozi eno izmed lukenj, se usmeri v skodelico zelo natančne tehtnice, ki je tudi zaprta v odzračenem steklenem zvonu. Pri nekaterih različicah je skodelica tehtnice obdana s hladilno posodo, ki zagotavlja odvajanje toplote navzven s termično prevodnostjo, in se ohlaja s sevanjem, zato da uhajajoča para kondenzira na njej. Moment curka pare deluje kot sila na tehtnico. Tlak pare je mogoče izpeljati na dva načina: neposredno od sile na skodelico tehtnice, pa tudi iz hitrosti izparevanja s pomočjo Hertz-Knudsenove enačbe (2):

pri čemer je:
|
G
|
=
|
hitrost izhlapevanja (kg s–1 m–2)
|
|
M
|
=
|
molska masa (g mol–1)
|
|
T
|
=
|
temperatura (K)
|
|
R
|
=
|
splošna plinska konstanta (J mol–1 K–1)
|
|
p
|
=
|
parni tlak (Pa)
|
Priporočeno območje je od 10–3 do 1 Pa.
1.5.4.2 Aparatura
Glavni princip aparature je prikazan na sliki 5.
Slika 5

|
A:
|
Osnovna plošča
|
F:
|
Hladilna posoda in hladilna palica
|
|
B:
|
Inštrument z vrtljivo tuljavo
|
G:
|
Uparjalna peč
|
|
C:
|
Stekleni zvon
|
H:
|
Dewarjeva posoda s tekočim dušikom
|
|
D:
|
Tehtnica s skodelico
|
I:
|
Merjenje temperature vzorca
|
|
E:
|
Naprava za merjenje vakuuma
|
J:
|
Preskusna snov
|
1.5.5 Efuzijska metoda: Knudsenova celica
1.5.5.1 Princip
Ta metoda temelji na oceni mase preskusne snovi, ki v obliki pare zapusti Knudsenovo celico (8) v časovni enoti skozi mikroodprtino v pogojih ultra visokega vakuuma. Masa izhajajoče pare se lahko ugotovi tako, da se bodisi določi izguba mase celice bodisi kondenzira para pri nizki temperaturi in določi količina izhlapele snovi s kromatografsko analizo. Parni tlak se izračuna z uporabo Hertz-Knudsenovega razmerja (glej točko 1.5.4.1) s korekcijskimi faktorji, ki so odvisni od parametrov aparature (9). Priporočeno območje je 10–10 to 1 Pa (10)(11)(12)(13)(14).
1.5.5.2 Aparatura
Glavni princip aparature je prikazan na sliki 6.
Slika 6

|
1:
|
Povezava z vakuumom
|
7:
|
Navojni pokrov
|
|
2:
|
Luknje v platinskem uporovnem termometru ali sistemi za merjenje in nadzorovanje temperature
|
8:
|
Krilne matice
|
|
3:
|
Pokrov vakuumske posode
|
9:
|
Vijaki
|
|
4:
|
O-tesnilo
|
10:
|
Efuzijske celice iz nerjavečega jekla
|
|
5:
|
Aluminijasta vakuumska posoda
|
11:
|
Grelni vložki
|
|
6:
|
Naprava za pritrjevanje in odstranjevanje efuzijskih celic
|
|
|
1.5.6 Efuzijska metoda: izotermična termogravimetrija
1.5.6.1 Princip
Ta metoda temelji na določitvi pospešenih hitrosti izhlapevanja preskusne snovi pri povišanih temperaturah in zračnem tlaku s postopkom termogravimetrije (10)(15)(16)(17)(18)(19)(20). Hitrosti izhlapevanja vT nastanejo pri izpostavljanju izbrane snovi počasi tekoči atmosferi inertnega plina in spremljanju izgube teže pri opredeljenih izotermičnih temperaturah T v kelvinih v ustreznih časovnih obdobjih. Parni tlaki pT se izračunajo iz vrednosti vT na podlagi linearnega razmerja med logaritmom parnega tlaka in logaritmom hitrosti izhlapevanja. Po potrebi se izvede ekstrapolacija na temperaturi 20 in 25 °C s pomočjo regresijske analize log pT v odvisnosti od 1/T. Ta metoda je primerna za snovi s parnimi tlaki do 10–10 Pa (10–12 mbar) in s čistostjo, ki je kar najbližje 100 %, da ne pride do napačne razlage izmerjenih izgub teže.
1.5.6.2 Aparatura
Glavni princip postavitve preskusa je prikazan na sliki 7.
Slika 7
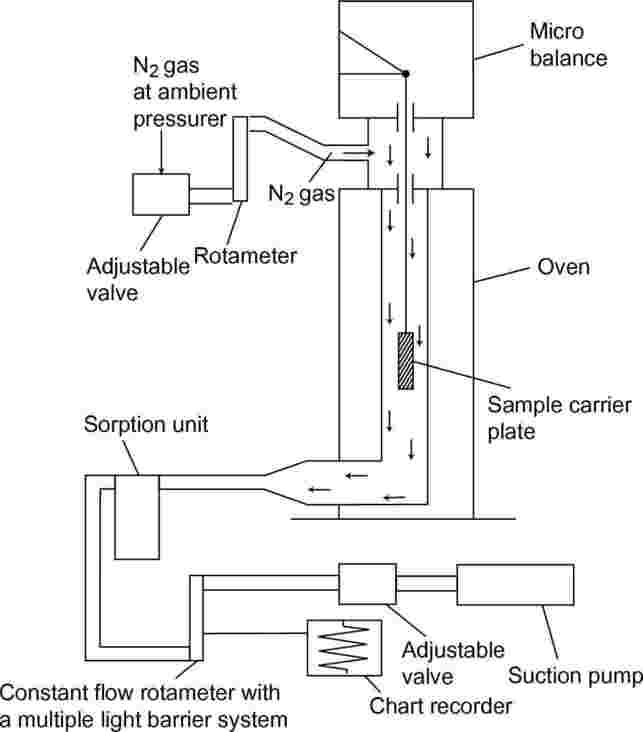
Mimo nosilne plošče z vzorcem, obešene na mikrotehtnici v komori s stalno temperaturo, je speljan tok suhega dušikovega plina, ki odnaša uparjene molekule preskusne snovi. Ko plinski tok zapusti komoro, se očisti v napravi za sorpcijo.
1.5.6.3 Postopek
Preskusna snov se nanese na površino hrapave steklene plošče v enakomerni plasti. Pri trdnih snoveh se plošča enakomerno zmoči z raztopino snovi v ustreznem topilu in posuši v inertni atmosferi. Za izvedbo meritev se prevlečena plošča obesi v termogravimetrični analizator, nato pa se izguba teže neprekinjeno meri kot funkcija časa.
Hitrost izparevanja vT pri dani temperaturi se izračuna iz zmanjšanja mase Δm plošče z vzorcem s pomočjo naslednje enačbe:

kjer je F površina prevlečenih preskusnih snovi, običajno površina plošče z vzorcem, t pa je čas, v katerem se je masa zmanjšala za Δm.
Parni tlak pT se izračuna na podlagi njegove funkcije hitrosti izparevanja vT:
Log pT = C + D log vT
kjer sta C in D konstanti, specifični za uporabljeno preskusno postavitev in odvisni od premera merilne komore ter hitrosti pretoka plina. Ti konstanti se določita enkrat, in sicer z merjenjem nabora snovi z znanimi parnimi tlaki in regresijo log pT v odvisnosti od log vT (11)(21)(22).
Razmerje med parnim tlakom pT in temperaturo T v kelvinih je podano z
Log pT = A + B 1/T
kjer sta A in B konstanti, pridobljeni z regresijo log pT v odvisnosti od 1/T. S to enačbo je mogoče z interpolacijo izračunati parni tlak za katero koli drugo temperaturo.
1.5.7 Metoda z nasičenjem plina (23)
1.5.7.1 Princip
Inertni plin se pri sobni temperaturi in pri znanem pretoku spelje skozi oziroma čez vzorec preskusne snovi, in sicer dovolj počasi, da se zagotovi nasičenje. Ključnega pomena je, da v plinski fazi nastopi nasičenje. Prenesena snov se ujame, običajno s pomočjo sorbenta, nato se določi njena količina. Za določitev količine snovi, ki jo prenese znana količina nosilnega plina, se namesto lovljenja pare in poznejše analize lahko uporabijo neposredne analitske tehnike, kot je kromatografija. Parni tlak se izračuna ob predpostavki, da se upošteva zakon idealnega plina in da je skupni tlak mešanice plinov enak vsoti tlakov posameznih plinov. Delni tlak preskusne snovi, tj. parni tlak, se izračuna iz znane skupne prostornine plina in iz teže prenesenega materiala.
Postopek z nasičenjem plina se lahko uporablja za trdne ali tekoče snovi. Uporabiti ga je mogoče za parne tlake do 10–10 Pa (10)(11)(12)(13)(14). Metoda je najzanesljivejša za parne tlake, nižje od 103 Pa. Pri tlakih nad 103 Pa so parni tlaki običajno precenjeni, najverjetneje zato, ker se tvorijo aerosoli. Ker se meritve parnega tlaka izvajajo pri sobni temperaturi, ni potrebe za ekstrapolacijo podatkov iz visokih temperatur, zato se ekstrapolacija pri visokih temperaturah, ki pogosto povzroča resne napake, ne izvaja.
1.5.7.2 Aparatura
Ta postopek zahteva uporabo posode s konstantno temperaturo. Na skici na sliki 8 je prikazana posoda s tremi pripravami za trdne in tremi pripravami za tekoče vzorce, ki omogočajo trojno analizo trdnega ali tekočega vzorca. Natančnost nadzora temperature je na ±0,5 °C ali boljša.
Slika 8

Običajno se za inertni nosilni plin uporablja dušik, občasno pa je treba uporabiti tudi kak drug plin (24). Nosilni plin mora biti suh. Tok plina se razdeli na 6 tokov, ki jih nadzirajo igelni ventili (z odprtino približno 0,79 mm), in teče v posodo po 3,8 mm i.d. bakreni cevi. Po izenačitvi temperature plin teče skozi vzorec in sorbentno past, nato pa zapusti posodo.
Trdni vzorci se namestijo v 5 mm i.d. stekleno cev med čepe iz steklene volne (glej sliko 9). Na sliki 10 sta prikazana naprava za tekoče vzorce in sorbentni sistem. Najbolj ponovljiva metoda za merjenje parnega tlaka tekočin je, da se tekočina nanese na steklene kroglice ali na inerten sorbent, kot je na primer silicijev oksid, nato pa se naprava napolni s temi kroglicami. Alternativno se lahko nosilni plin spelje mimo hrapavega frita in v obliki mehurčkov skozi steber tekoče preskusne snovi.
|
Slika 9
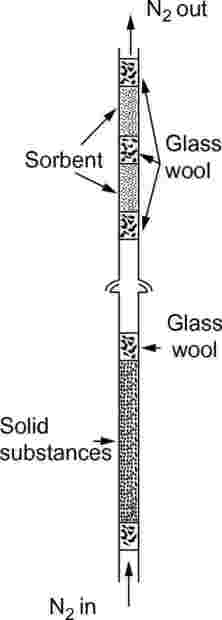
|
Slika 10

|
Sorbentni sistem ima sprednji in pomožni sorbentni del. Pri zelo nizkih parnih tlakih sorbent zadrži le majhne količine, zato lahko adsorpcija na stekleni volni in steklenih ceveh med vzorcem in sorbentom povzroča velike težave.
Pasti, ohlajene s trdnim CO2, so še en učinkovit način za zbiranje uparjenega materiala. Ne povzročajo protitlaka na saturacijsko kolono, prav tako pa je mogoče zelo enostavno kvantitativno odstraniti ujeti material.
1.5.7.3 Postopek
Pretok iztočnega nosilnega plina se meri pri sobni temperaturi. Pretok se med preskusom pogosto preverja, da se zagotovi pravilna vrednost za skupno prostornino nosilnega plina. Zaželeno je spremljanje ves čas z merilnikom masnega pretoka. Nasičenje plinske faze lahko zahteva dolg čas stika in zato precej nizke hitrosti pretoka plina (25).
Ob koncu poskusa se sprednji in pomožni sorbentni del analizirata ločeno. Snov v vsakem delu se desorbira s topilom. Nastali raztopini se kvantitativno analizirata, da se določi teža desorpcije vsakega dela. Izbira analitične metode (prav tako tudi izbira sorbenta in desorbentne raztopine) je odvisna od vrste preskusnega materiala. Učinkovitost desorpcije se določi tako, da se znana količina vzorca injicira na sorbent, desorbira, nato pa analizira preostala količina. Pomembno je, da se preskusi učinkovitost desorpcije pri (ali blizu) koncentraciji vzorca pod preskusnimi pogoji.
Da se zagotovi nasičenost nosilnega plina s preskusno snovjo, se uporabijo tri različne hitrosti pretoka plina. Če izračunani parni tlak ne kaže odvisnosti od pretoka, se predpostavlja, da je nasičen.
Parni tlak se izračuna po enačbi:

pri čemer je:
|
p
|
=
|
parni tlak (Pa)
|
|
W
|
=
|
masa uparjene preskusne snovi (g)
|
|
V
|
=
|
volumen nasičenega plina (m3)
|
|
R
|
=
|
splošna plinska konstanta 8,314 (J mol–1 K–1)
|
|
T
|
=
|
temperatura (K)
|
|
M
|
=
|
molska masa preskusne snovi (g mol–1)
|
Izmerjene volumne je treba popraviti glede na razlike v tlaku in temperaturi med merilnikom pretoka in saturatorjem.
1.5.8 Rotorska metoda
1.5.8.1 Princip
Pri tej metodi se uporablja merilnik viskoznosti z rotorjem, v katerem je merilni element jeklena kroglica, postavljena v magnetno polje, tako da lebdi, njeno vrtenje pa povzročajo rotirajoča polja tuljave (26)(27)(28). Merjenje hitrosti njenega vrtenja omogočajo sprejemne tuljave. Ko kroglica doseže določeno hitrost vrtenja, običajno približno 400 vrtljajev na sekundo, se ustavi dotok energije in zaradi trenja, ki ga povzroča plin, se vrtenje upočasni. Padec vrtilne hitrosti se meri kot funkcija časa. Parni tlak se izpelje iz padca hitrosti kroglice, ki je posledica tlaka. Priporočeno območje je od 10–4 do 0,5 Pa.
1.5.8.2 Aparatura
Shema postavitve preskusa je prikazana na sliki 11. Merilnik se postavi v posodo s konstantno temperaturo, ki se uravnava na 0,1 °C natančno. Posoda z vzorcem se postavi v ločeno posodo, ki se tudi uravnava na 0,1 °C natančno. Vsi ostali deli sestava pa se vzdržujejo pri višji temperaturi, da se prepreči kondenzacija. Celotna aparatura je priključena na visokovakuumski sistem.
Slika 11

2. PODATKI IN POROČANJE
2.1 PODATKI
Pri kateri koli od navedenih metod je treba parni tlak določiti pri najmanj dveh temperaturah. Za preverjanje linearnosti krivulje parnega tlaka so zaželene najmanj tri temperature v območju od 0 do 50 °C. Pri efuzijski metodi (Knudsenova celica in izotermična termogravimetrija) in metodi z nasičenjem plina se priporoča temperaturno območje od 120 do 150 °C, namesto od 0 do 50 °C.
2.2 POROČANJE
V poročilo o preskusu se vključijo naslednje informacije:
|
—
|
natančna specifikacija snovi (identiteta in nečistoče) in predhodno prečiščevanje, če je bilo opravljeno,
|
|
—
|
najmanj po dve vrednosti parnega tlaka in temperature, če je mogoče, pa tri ali več, v območju 0 do 50 °C (ali od 120 do 150 °C),
|
|
—
|
vsaj ena od temperatur mora biti 25 °C ali manj, če je tehnično izvedljivo v skladu z izbrano metodo,
|
|
—
|
vsi neobdelani podatki,
|
|
—
|
krivulja log p v odvisnosti od 1/T,
|
|
—
|
ocenjeni parni tlak pri 20 ali 25 °C.
|
Če pride do prehoda (spremembe stanja, razpada), je treba navesti naslednje podatke:
|
—
|
temperatura, pri kateri pride do spremembe pri atmosferskem tlaku,
|
|
—
|
parni tlak pri 10 in 20 °C pod temperaturo prehoda in pri 10 in 20 °C nad to temperaturo (razen če gre za prehod iz trdnega v plinasto agregatno stanje).
|
Navesti je treba vse informacije in opombe, pomembne za razlago rezultatov, zlasti glede nečistot in agregatnega stanja snovi.
3. VIRI
|
(1)
|
Uradni list Evropskih skupnosti, L 383 A, 26–47 (1992).
|
|
(2)
|
Ambrose, D. (1975). Experimental Thermodynamics, Vol. II, Le Neindre, B., in Vodar, B., Eds., Butterworths, London.
|
|
(3)
|
Weissberger R., ed. (1959). Technique of Organic Chemistry, Physical Methods of Organic Chemistry, 3rd ed., Vol. I, Part I. Chapter IX, Interscience Publ., New York.
|
|
(4)
|
Glasstone, S. (1946). Textbook of Physical Chemistry, 2nd ed., Van Nostrand Company, New York.
|
|
(5)
|
NF T 20–048 AFNOR (September 1985). Chemical products for industrial use – Determination of vapour pressure of solids and liquids within a range from 10–1 to 105 Pa – Static method.
|
|
(6)
|
ASTM D 2879–86, Standard test method for vapour pressure – temperature relationship and initial decomposition temperature of liquids by isoteniscope.
|
|
(7)
|
NF T 20–047 AFNOR (September 1985). Chemical products for industrial use –Determination of vapour pressure of solids and liquids within range from 10–3 to 1 Pa – Vapour pressure balance method.
|
|
(8)
|
Knudsen, M. (1909). Ann. Phys. Lpz., 29, 1979; (1911), 34, 593.
|
|
(9)
|
Ambrose, D., Lawrenson, I.J., Sprake, C.H.S. (1975). J. Chem. Thermodynamics 7, 1173.
|
|
(10)
|
Schmuckler, M.E., Barefoot, A.C., Kleier, D.A., Cobranchi, D.P. (2000), Vapor pressures of sulfonylurea herbicides; Pest Management Science 56, 521–532.
|
|
(11)
|
Tomlin, C.D.S. (ed.), The Pesticide Manual, Twelfth Edition (2000)
|
|
(12)
|
Friedrich, K., Stammbach, K., Gas chromatographic determination of small vapour pressures determination of the vapour pressures of some triazine herbicides. J. Chromatog. 16 (1964), 22–28.
|
|
(13)
|
Grayson, B.T., Fosbraey, L.A., Pesticide Science 16 (1982), 269–278.
|
|
(14)
|
Rordorf, B.F., Prediction of vapor pressures, boiling points and enthalpies of fusion for twenty-nine halogenated dibenzo-p-dioxins, Thermochimia Acta 112 Issue 1 (1987), 117–122.
|
|
(15)
|
Gückel, W., Synnatschke, G., Ritttig, R., A Method for Determining the Volatility of Active Ingredients Used in Plant Protection; Pesticide Science 4 (1973) 137–147.
|
|
(16)
|
Gückel, W., Synnatschke, G., Ritttig, R., A Method for Determining the Volatility of Active Ingredients Used in Plant Protection II. Application to Formulated Products; Pesticide Science 5 (1974) 393–400.
|
|
(17)
|
Gückel, W., Kaestel, R., Lewerenz, J., Synnatschke, G., A Method for Determining the Volatility of Active Ingredients Used in Plant Protection. Part III: The Temperature Relationship between Vapour Pressure and Evaporation Rate; Pesticide Science 13 (1982) 161–168.
|
|
(18)
|
Gückel, W., Kaestel, R., Kroehl, T., Parg, A., Methods for Determining the Vapour Pressure of Active Ingredients Used in Crop Protection. Part IV: An Improved Thermogravimetric Determination Based on Evaporation Rate; Pesticide Science 45 (1995) 27–31.
|
|
(19)
|
Kroehl, T., Kaestel, R., Koenig, W., Ziegler, H., Koehle, H., Parg, A., Methods for Determining the Vapour Pressure of Active Ingredients Used in Crop Protection. Part V: Thermogravimetry Combined with Solid Phase MicroExtraction (SPME); Pesticide Science, 53 (1998) 300–310.
|
|
(20)
|
Tesconi, M., Yalkowsky, S.H., A Novel Thermogravimetric Method for Estimating the Saturated Vapor Pressure of Low-Volatility Compounds; Journal of Pharmaceutical Science 87(12) (1998) 1512–20.
|
|
(21)
|
Lide, D.R. (ed.), CRC Handbook of Chemistry and Physics, 81th ed.(2000), Vapour Pressure in the Range -25 °C to 150 °C.
|
|
(22)
|
Meister, R.T. (ed.), Farm Chemicals Handbook, Vol. 88 (2002).
|
|
(23)
|
40 CFR, 796. (1993). pp 148–153, Office of the Federal Register, Washington DC.
|
|
(24)
|
Rordorf B.F. (1985). Thermochimica Acta 85, 435.
|
|
(25)
|
Westcott et al. (1981). Environ. Sci. Technol. 15, 1375.
|
|
(26)
|
Messer G., Röhl, P., Grosse G., in Jitschin W. (1987). J. Vac. Sci. Technol. (A), 5(4), 2440.
|
|
(27)
|
Comsa G., Fremerey J.K., in Lindenau, B. (1980). J. Vac. Sci. Technol. 17(2), 642.
|
|
(28)
|
Fremerey, J.K. (1985). J. Vac. Sci. Technol. (A), 3(3), 1715.
|
(1) Pri uporabi manometra kapacitivnosti
Dodatek
Ocenjevalna metoda
UVOD
Izračunane vrednosti parnega tlaka se lahko uporabijo:
|
—
|
za izbiro primerne preskusne metode,
|
|
—
|
za pridobitev ocene ali mejne vrednosti v primerih, kadar preskusne metode ni mogoče uporabiti zaradi tehničnih razlogov.
|
OCENJEVALNA METODA
Parni tlak tekočin in trdnih snovi se lahko oceni z uporabo prilagojene Watsonove korelacije (a). Edini potrebni s preskusom pridobljeni podatek je normalno vrelišče. Metoda je uporabna za območje tlaka od 105 Pa do 10–5 Pa.
Podrobne informacije o metodi so navedene v „Priročniku metod za ocenjevanje kemijskih lastnosti“ (b). Glej tudi OECD Environmental Monograph št. 67 (c).
RAČUNSKI POSTOPEK
Parni tlak se izračuna na naslednji način:

pri čemer je:
|
T
|
=
|
izbrana temperatura
|
|
Tb
|
=
|
normalno vrelišče
|
|
Pvp
|
=
|
parni tlak pri temperaturi T
|
|
ΔHvb
|
=
|
izparilna toplota
|
|
ΔZb
|
=
|
faktor stisljivosti (ocenjen na 0,97)
|
|
m
|
=
|
empirični faktor, odvisen od agregatnega stanja pri izbrani temperaturi
|
Nadalje

pri čemer je KF empirični faktor, ki upošteva polarnost snovi. V viru (b) so navedeni faktorji KF za več spojin.
Precej pogosto so na voljo podatki o vrelišču pri znižanem tlaku. Pri takih primerih se parni tlak izračuna na naslednji način:

pri čemer je T1 vrelišče pri znižanem tlaku P1.
POROČILO
Pri uporabi ocenjevalne metode, poročilo vključuje izčrpno dokumentacijo izračuna.
VIRI
|
(a)
|
Watson, K.M. (1943). Ind. Eng. Chem, 35, 398.
|
|
(b)
|
Lyman, W.J., Reehl, W.F., Rosenblatt, D.H. (1982). Handbook of Chemical Property Estimation Methods, McGraw-Hill.
|
|
(c)
|
OECD Environmental Monograph No.67. Application of Structure-Activity Relationships to the Estimation of Properties Important in Exposure Assessment (1993).
|
PRILOGA II
|
A.22.
|
GEOMETRIJSKI SREDNJI PREMER GLEDE NA DOLŽINO VLAKEN
|
1. METODA
1.1 UVOD
Ta metoda opisuje postopek za merjenje geometrijskega srednjega premera glede na dolžino vlaken (LWGMD – Length Weighted Geometric Mean Diameter) velikih ročno izdelanih mineralnih vlaken (MMMF – Man Made Mineral Fibres). Ker ima LWGMD populacije 95 % verjetnosti, da leži med 95 odstotnimi stopnjami zaupanja (LWGMD ± dve standardni napaki) vzorca, bo dejanska vrednost (preskusna vrednost) nižja od 95 % meje zaupanja vzorca (tj. LWGMD ± dve standardni napaki). Metoda temelji na dopolnitvi (junij 1994) osnutka industrijskega postopka HSE, ki je bil usklajen na sestanku med ECFIA in HSE v Chestru dne 26.9.1993 in razvit za in iz drugega medlaboratorijskega poskusa (1, 2). To merilno metodo se lahko uporablja za označevanje premera vlaken velikih snovi ali proizvodov, ki vsebujejo MMMF, vključno z ognjeodpornimi keramičnimi vlakni (RFC), ročno izdelanimi steklenimi vlakni (MMVF), kristalnimi in polikristalnimi vlakni.
Določanje utežnostnega faktorja dolžine je sredstvo za izravnavo učinkov na porazdelitev premera, povzročenega zaradi preloma dolgih vlaken pri vzorčenju ali ravnanju z materialom. Geometrična statistika (geometrično povprečje) se uporablja za merjenje velikosti porazdelitve premera MMMF, ker imajo ti premeri običajno velikost porazdelitve, ki se približuje normalnemu logaritmu.
Merjenje dolžine kot tudi premera je obsežno in zahteva veliko časa, vendar, če se meritve izvedejo samo na tistih vlaknih, ki se dotikajo neskončno tanke črte v vidnem polju SEM, potem je verjetnost izbire danega vlakna sorazmerna njegovi dolžini. Ker to določa dolžino pri izračunih utežnostnega faktorja dolžine, je edina zahtevana meritev, meritev premera, tako da je možno LWGMD-2SE izračunati, kot je to opisano.
1.2 DEFINICIJE
Delec: Predmet z razmerjem dolžina/širina, ki je manjše od 3:1.
Vlakno: Predmet z razmerjem dolžina/širina, ki je manjše od 3:1.
1.3 OBSEG IN OMEJITVE
Ta metoda je zasnovana tako, da je možno pogledati porazdelitev premerov, ki imajo mediano premera od 0,5 μm do 6 μm. Večje premere je možno izmeriti, če se uporabijo manjše povečave SEM, vendar je metoda izredno omejena na natančno porazdelitev vlaken, tako da se priporoča uporaba meritev s TEM (prenosni elektronski mikroskop), če je mediana premera pod 0,5 μm.
1.4 NAČELA METODE PRESKUŠANJA
Število reprezentančnih vzorcev jeder se vzame iz krpe vlaken ali iz prostih velikih vlaken. Velika vlakna se z uporabo postopka drobljenja skrajšajo po dolžini, reprezentativni podvzorci pa se razpršijo v vodi. Alikvoti se izvlečejo in filtrirajo skozi 0,2 μm velike pore polikarbonskega filtra in se pripravijo za preskušanje s tehniko skeniranja z elektronskim mikroskopom (SEM). Premeri vlaken se merijo pri povečavi zaslona × 10 000 ali večji (1), pri tem pa se uporabi metoda sekanja črte, da je tako dosežena nevtralna ocena mediane premera. Izračuna se spodnjih 95 % intervala zaupanja (na osnovi enostranskega preskusa), tako da je možno dati oceno najnižje vrednosti srednjega geometrijskega premera glede na dolžino vlakna materiala.
1.5 OPIS METODE PRESKUŠANJA
1.5.1 Varnostni/previdnost
Do največje možne mere je treba zmanjšati izpostavljenost osebja pred vlakni, ki se uporabljajo v letalstvu, zato je za ravnanje s suhimi vlakni treba uporabljati dimno komoro ali komoro, v katero posegamo z rokavicami. Potrebno je spremljanje občasne izpostavljenosti osebja, da bi se določila učinkovitost kontrolne metode. Pri rokovanju z MMMF je treba nositi rokavice za enkratno uporabo, da se tako zmanjša draženje kože in prepreči navzkrižno onesnaženje.
1.5.2 Aparature/naprave
|
—
|
Stiskalnica in barve (za tlak do 10 MPa),
|
|
—
|
filtri s kapilarnimi karbonatnimi porami velikosti 0,2 μm (premera 25 mm),
|
|
—
|
membranski filtri s 5 μm velikimi celuloznimi porami za uporabo pri podpornih filtrih,
|
|
—
|
aparature za filtriranje stekla (ali sistem za filtriranje odpadkov), ki sprejmejo filtre s premorom 25 mm (npr. Millipore komplet za mikroanalizo stekla, tip št. XX10 025 00),
|
|
—
|
sveže destilirana voda, ki je bila filtrirana skozi filter z velikostjo por 0,2 μm za odstranjevanje mikroorganizmov,
|
|
—
|
naprava za pršenje nanosov na zlato ali zlate/paladijeve površine,
|
|
—
|
skenirni elektronski mikroskop z ločitvijo do 10 nm in s povečavo ×100 000,
|
|
—
|
razno: lopatice, rezilo skalpela tipa 24, pincete, cevi SEM, karbonsko lepilo ali karbonski lepilni trak, koloidno srebro,
|
|
—
|
ultrazvočno tipalo ali namizna ultrazvočna kopel,
|
|
—
|
naprava za jemanje vzorcev jedra ali vrtalnik za pluto za odvzem vzorcev iz MMMF krpe.
|
1.5.3 Postopek preskusa
1.5.3.1 Vzorčenje
Za odvzem vzorcev krp in plošč se uporablja 25 mm naprava za jemanje vzorcev jeder ali vrtalnik za pluto. Vzorce se odvzame enakomerno po vsej dolžini krajše strani krpe ali iz poljubne površine, če so na razpolago daljše strani krpe. Za odvzem naključnih vzorcev prostih vlaken se uporablja ista oprema. Če je le možno, naj se odvzame šest vzorcev, ki odražajo prostorske razlike velikega materiala.
Šest vzorcev jeder je treba z 10 MPa zdrobiti v 50 mm kalupu. Material se meša z lopatico in ponovno stisne z 10 MPa. Nato se material odstrani iz kalupa in shrani v zapečateno steklenico.
1.5.3.2 Priprava vzorca
Po potrebi se organska veziva lahko odstranijo tako, da se vlakna za ca. 1 uro vstavijo v peč pri 450 °C.
Napravite stožčasto obliko in jo razdelite na štiri dele (to je treba narediti v prašni komori).
Z lopatico dodajte majhno količino (< 0,5 g) vzorca v 100 ml sveže destilirane vode, ki ste jo predhodno filtrirali skozi membranski filter 0,2 μm (alternativno se lahko uporabijo izviri izjemno čiste vode, če se pokažejo kot zadovoljivi). Temeljito razpršite s pomočjo ultrazvočnega tipala, ki deluje z močjo 100 W in je uglašeno tako, da povzroča kavitacije. (Če tipalo ni na razpolago, uporabite naslednjo metodo: večkrat pretresite in obrnite za 30 s; za nekaj minut izpostavite ultrazvoku v namizni ultrazvočni napravi; nato ponovno pretresite in obrnite za nadaljnjih 30 s).
S široko pipeto (zmogljivosti 2–5 ml) takoj po razpršitvi vlakna odstranite večje število alikvotov (npr. tri alikvote po 3, 6 in 10 ml).
Vaakumsko filtrirajte vsak alikvot skozi polikarbonski filter 0,2 μm, ki mu pomaga podporni filter MEC s 5 µm porami, in uporablja 25 mm stekleni filtrski lijak z valjastim rezervoarjem. Približno 5 ml filtrirane destilirane vode je treba vliti v lijak in počasi s pipeto nakapati alikvot v vodo, pri tem pa držati vrh pipete pod meniskusom. Pipeto in rezervoar je po kapljanju treba temeljito splahniti, ker tanka vlakna težijo k površini.
Skrbno odstranite filter in ga ločite od podpornega filtra, preden ga vstavite v drugo posodo na sušenje.
S skalpelom tipa 24 odrežite četrtino ali polovico dela filtra z filtrskimi ostanki in pri tem uporabite sunkovite gibe. Previdno pritrdite odrezani del na trn SEM in pri tem uporabite vložke lepljivega ogljika ali ogljikovo lepilo. Koloidno srebro se nanese na najmanj tri mesta, da se izboljša električni stik na robovih filtra in trna. Ko se lepilo/koloidno srebro posuši, nabrizgajte sloj približno 50 nm zlata ali zlata/paladija na površino ostankov.
1.5.3.3 Umerjanje in delovanje SEM
1.5.3.3.1 Umerjanje
Umerjanje SEM je treba preveriti vsaj enkrat tedensko (idealno enkrat na dan) in pri tem uporabiti mrežo za umerjanje. Umerjanje je treba preveriti glede na potrjene standarde in če izmerjena vrednost (SEM) ni v območju ±2 % od potrjene vrednosti, potem je treba umerjanje SEM prilagoditi in ponovno preveriti.
SEM mora biti sposoben ločiti vsaj najmanjši viden premer 0,2 µm pri uporabi prave matrike vzorčenja in pri povečavi × 2 000.
1.5.3.3.2 Delovanje
SEM naj obratuje pri povečavi 10 000 (2) pod pogoji, ki omogočajo dobro ločljivost s sprejemljivimi slikami pri počasnem skeniranju, npr. 5 s za sliko. Čeprav so delovne zahteve za različne SME lahko različne, je za doseganje najboljše vidljivosti in ločljivosti na splošno treba uporabiti nastavitev za majhno površino fokusa in kratko delovno razdaljo, z relativno nizko atomsko težo materialov in pospeševalnimi napetostmi 5–10 keV. Ker se izvaja linearni prehod, se priporoča uporaba naklona 0o za najmanjše potrebno ponovno fokusiranje ali, če je SEM v evcentričnem stanju, evcentrična delovna razdalja. Če material ne vsebuje vlaken majhnega premera in so premeri vlaken veliki (> 5 μm), se lahko uporabi manjša povečava.
1.5.3.4 Določanje velikosti
1.5.3.4.1 Pregled z nizko povečavo za oceno vzorca
Najprej naj se vzorec pregleda z nizko povečavo, da se ugotovi prisotnost kopičenja velikih vlaken in da se oceni gostota vlaken. V primeru prevelikega kopičenja se priporoča priprava novega vzorca.
Za statistično točnost je potrebno izmeriti najmanjše število vlaken, visoka gostota vlaken, ki je na videz primerna za pregled praznih polj, pa zahteva veliko časa in ne prispeva k analizi. Če je filter preobremenjen, je težko meriti vsa merljiva vlakna in ker velika vlakna lahko zakrivajo mala, ki potem niso vidna.
Nagnjenost k precenjevanju LWGMD je lahko rezultat gostote vlaken nad 150 vlaken/mm pri linearnem prehodu. Na drugi strani pa nizke koncentracije vlaken povečujejo čas analize in je pogosto stroškovno ugodno pripraviti vzorec gostote vlakna blizu najugodnejšega, kot vztrajati z oceno pri filtrih z nizko koncentracijo. Najugodnejša gostota vlaken naj bi dala povprečje o enem ali dveh ocenjevanih vlaknih v vidnih poljih pri povečavi 5 000. Najugodnejša gostota je odvisna od velikost (premera) vlaken, zato mora operater uporabiti nekatere strokovne presoje, da lahko odloči ali je gostota vlaken blizu najugodnejše ali ne.
1.5.3.4.2 Določanje utežnostnega faktorja dolžine za premere vlaken
Štejejo se samo vlakna, ki se dotaknejo (ali prečkajo) (neskončno) tanko črto na zaslonu SEM. Zato je na zaslonu narisana vodoravna (ali navpična) črta, ki poteka skozi sredino zaslona.
Alternativno je na sredini zaslona postavljena ena sama točka, v eni smeri pa poteka stalno skeniranje filtra. Premer se izmeri in zapiše za vsako vlakno z razmerjem dolžina/širina večjim od 3:1, ki se dotika ali prečka to točko.
1.5.3.4.3 Določanje velikosti vlakna
Priporoča se merjenje najmanj 300 vlaken. Vsako vlakno se meri le enkrat v sečišču s črto ali točko, narisano na sliki (ali blizu sečišča, če je rob vlakna nejasen). Pri vlaknih z neenakomernim presekom se uporabi meritev, ki predstavlja povprečje premera vlakna. Paziti je treba pri določanju robov in merjenju najkrajše razdalje med robovi vlakna. Določanje velikosti je možno on-line ali off-line na shranjenih slikah ali fotografijah. Priporoča se uporaba polavtomatskih sistemov za merjenje na slikah, ki nalagajo podatke neposredno v razpredelnice, ker se tako prihrani čas, zmanjša število napak pri prepisovanju, izračuni pa so lahko avtomatizirani.
Konci dolgih vlaken naj se preverijo pri majhnih povečavah, da se zagotovi, da se ne zvijajo nazaj v merilno ali vidno polje in so vlakna izmerjena le enkrat.
2. PODATKI
2.1 OBDELAVA REZULTATOV
Premeri vlaken po navadi nimajo normalne porazdelitve. Če pa se izvede logaritmična transformacija, je možno dobiti porazdelitev, ki se približuje normalni.
Izračunajte aritmetično srednjo vrednost (srednji lnD) in standardno deviacijo (SDlnD) logaritma z osnovo e (lnD) za n premerov vlakna (D).
|

|
(1)
|
|

|
(2)
|
Standardna deviacija se deli s kvadratnim korenom števila meritev (n), da dobimo standardno napako (SElnD).
|

|
(3)
|
Dvakrat odštejte standardno napako od srednje vrednosti in izračunajte njen eksponent (srednja vrednost minus dve standardni napaki) in tako dobite geometrijsko srednjo vrednost minus dve geometrijski standardni napaki.
|

|
(4)
|
3. POROČANJE
POROČILO O PRESKUSU)
Poročilo o preskusu naj vsebuje vsaj naslednje informacije:
|
—
|
kakršna koli odstopanja, še zlasti tista, ki vplivajo na natančnost in točnost rezultatov z ustreznimi obrazložitvami.
|
4. VIRI
|
(1)
|
B. Tylee SOP MF 240. Health and Safety Executive. February 1999.
|
|
(2)
|
G. Burdett in G. Revell. Development of a standard method to measure the length-weigthed geometric mean fibre diameter: Results of the Second inter-laboratory exchange. IR/L/MF/94/07. Project R42.75 HPD. Health and Safety Executive. Research and Laboratory Services Division. 1994.
|
(1) Ta vrednost povečave je določena za vlakna s premerom 3 µm, za vlakna s premerom 6 µm pa je primernejša povečava ×5 000.
(2) Za vlakna s premerom 3 μm glej prejšnjo opombo.
PRILOGA III
|
B.46
|
TEST DRAŽENJA KOŽE IN VITRO: TEST Z MODELOM REKONSTRUIRANE ČLOVEŠKE POKOŽNICE
|
1. METODA
1.1 UVOD
Draženje kože pomeni nastanek popravljive poškodbe kože po nanosu testne snovi za čas do 4 ur [kot je opredeljeno v Globalnem usklajenem sistemu za razvrščanje in označevanje kemikalij (GHS) Združenih narodov (ZN)](1). Ta testna metoda zajema postopek in vitro, ki lahko, odvisno od zahtev po podatkih, kot samostojni nadomestni test v okviru testne strategije in na podlagi pristopa določitve zanesljivosti dokazov (weight of evidence approach) omogoči določitev stopnje razdraženosti kože zaradi snovi (2).
Ocenjevanje razdraženosti kože se običajno izvaja na laboratorijskih živalih (glej metodo B.4)(3). V skladu s prizadevanji za dobro počutje živali omogoča metoda B.4 določanje jedkosti za kožo/draženja kože z uporabo zaporedne testne strategije, pri čemer se uporabljata validirani metodi in vitro in ex vivo, da se tako preprečijo bolečine in trpljenje živali. Za del zaporedne testne strategije B.4, ki zadeva jedkost, je smiselno uporabiti tri validirane testne metode ali smernice za testiranje in vitro, in sicer B.40, B.40a in TG 435 (4, 5, 6).
Ta testna metoda temelji na modelih rekonstruirane človeške pokožnice, ki so v svoji zasnovi (uporaba človeških keratinocitov pokožnice kot vira celic, vzorčnega tkiva in citoarhitekture) zelo podobni biološkim in fiziološkim značilnostim zgornjih delov človeške kože, tj. pokožnice. Postopek, ki je opisan v okviru te testne metode, omogoča ugotavljanje nevarnosti dražilnih snovi v skladu s kategorijo 2 GHS ZN. Ta testna metoda vključuje tudi skupino standardov učinkovitosti za ocenjevanje podobnih in spremenjenih testnih metod za rekonstruirano človeško pokožnico (7).
Predvalidacijske, optimizacijske in validacijske študije so dopolnjene z dvema testnima metodama in vitro (8, 9, 10, 11, 12, 13, 14, 15, 16, 17), ki sta na tržišču na voljo pod imenoma EpiSkin™ in EpiDerm™ ter pri katerih se uporabljajo modeli rekonstruirane človeške pokožnice. Te reference so temeljile na R 38. Nekateri vidiki ponovnega izračuna za namene GHS so obravnavani v referenci 25. Metode, katerih učinkovitost je enakovredna EpiSkin™ (validirana referenčna metoda 1), se priporočajo kot samostojne nadomestne testne metode za testiranje in vivo na kuncu za razvrščanje dražilnih snovi kategorije 2 GHS. Metode, katerih učinkovitost je enaka EpiDerm™ (validirana referenčna metoda 2), se priporočajo le kot dodatne testne metode ali kot del zaporedne testne strategije pri načinu določitve zanesljivosti dokazov za razvrščanje dražilnih snovi kategorije 2 GHS. Preden se omogoči uporaba predlaganega testa v zvezi z draženjem kože in vitro z rekonstruirano človeško pokožnico za zakonodajne namene, je treba določiti njegovo zanesljivost, ustreznost (natančnost) in omejitve, kar zadeva predlagano uporabo, da se zagotovi njegova primerljivost z validirano referenčno metodo 1 v skladu s standardi učinkovitosti, ki so določeni v tej testni metodi (Dodatek).
V skladu z zahtevami v okviru te testne metode sta bili validirani še dve testni metodi in vitro z rekonstruirano človeško pokožnico, pri čemer so njuni rezultati podobni rezultatom validirane referenčne metode 1 (18). To sta spremenjena testna metoda EpiDerm™ (spremenjena referenčna metoda 2) in testna metoda SkinEthic RHE™ (podobna metodi 1).
1.2 OPREDELITEV POJMOV
V okviru te testne metode se uporabljajo naslednje opredelitve pojmov:
Natančnost: stopnja ujemanja rezultatov testne metode s sprejetimi referenčnimi vrednostmi. To je merilo učinkovitosti testne metode in eden od vidikov ustreznosti. Ta izraz in izraz „skladnost“ se pogosto izmenično uporabljata za pomen deleža ustreznih rezultatov testne metode.
Snov kontrolne serije: primerjalna snov, ki na tkivu povzroči srednje močen odziv glede viabilnosti celic.
Viabilnost celic: parameter za merjenje celotne dejavnosti celične populacije, npr. zmožnosti celičnih mitohondrijskih dehidrogenaz za redukcijo vitalnega barvila MTT ([3–(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazolijev bromid, Thiazolyl blue;), ki se glede na izmerjeni končni učinek in uporabljeni načrt testa ujema s skupnim številom in/ali viabilnostjo celic.
ET50
: čas izpostavljenosti, ki je potreben za zmanjšanje viabilnosti celic za 50 % po nanosu določene stalne koncentracije označevalca, glej tudi IC50.
Delež lažno negativnih rezultatov: delež vseh pozitivnih snovi, ki jih testna metoda lažno prikaže kot negativne. To je eden od kazalcev učinkovitosti testne metode.
Delež lažno pozitivnih rezultatov: delež vseh negativnih (neaktivnih) snovi, ki jih testna metoda lažno prikaže kot pozitivne. To je eden od kazalnikov učinkovitosti testne metode.
Prevelik odmerek: količina na kožo nanesene testne snovi, ki je večja od količine, potrebne za celotno in enakomerno prekrivanje površine kože.
GHS (globalno usklajen sistem za razvrščanje in označevanje kemikalij): sistem, v okviru katerega se predlaga razvrščanje snovi in zmesi v skladu s standardiziranimi vrstami in stopnjami fizikalnih nevarnosti, nevarnosti za zdravje in okolje, ter obravnavajo ustrezni elementi obveščanja, kot so piktogrami, opozorilne besede, izjave o nevarnosti, varnostne izjave in varnostni listi, da se sporočijo informacije o negativnih vplivih z namenom zaščite ljudi (vključno z delodajalci, zaposlenimi, prevozniki, potrošniki in reševalci) in okolja (1), je v EU izveden z Uredbo (ES) št. 1272/2008.
IC50
: Koncentracija, pri kateri označevalec po določenem času izpostavljenosti zmanjša viabilnost tkiva za 50 % (IC50), glej tudi ET50.
Standardi učinkovitosti: standardi, ki temeljijo na validirani referenčni metodi, na podlagi katere se lahko ocenjuje primerljivost predlagane testne metode, ki je referenčni v mehaničnem in funkcijskem smislu podobna. Vključeni so I) nujni elementi testne metode, II) minimalni seznam referenčnih snovi, izbranih iz skupine snovi, ki se uporabljajo za dokazovanje sprejemljive učinkovitosti validirane referenčne metode, in III) primerljive stopnje natančnosti in zanesljivosti, ki temeljijo na rezultatu uporabe validirane referenčne metode, kar mora dokazati predlagana testna metoda pri ocenjevanju ob uporabi najkrajšega možnega seznama referenčnih snovi.
Zanesljivost: merila za obseg ponovljivosti opravljanja testne metode v enem ali več laboratorijih v določenem časovnem obdobju, kadar poteka ob upoštevanju istega protokola. Oceni se z izračunom ponovljivosti v enem ali več laboratorijih.
Občutljivost: delež vseh pozitivnih/aktivnih snovi, ki se s testom pravilno razvrstijo. To je merilo natančnosti za testno metodo, s katero se dosežejo kategorični rezultati, in je pomemben dejavnik pri ocenjevanju ustreznosti testne metode.
Specifičnost: delež vseh negativnih/neaktivnih snovi, ki se pravilno razvrstijo s testom. To je merilo natančnosti za testno metodo, s katero se dosežejo kategorični rezultati, in je pomemben dejavnik pri ocenjevanju ustreznosti testne metode.
Draženje kože: draženje kože je nastanek popravljive poškodbe kože po nanosu testne snovi za čas do 4 ur. Razdraženost kože je reakcija, ki je prisotna na posameznih mestih, ni imunogena in se pojavi kmalu po izpostavitvi kože draženju (24). Njena glavna lastnost je popravljiv proces, ki vključuje vnetne reakcije in večino značilnih kliničnih znakov razdraženosti (eritem, edem, srbenje in bolečino), povezanih z vnetnim procesom.
1.3 OBSEG IN OMEJITVE
Omejitev testov z rekonstruirano človeško pokožnico v okviru te testne metode je le razvrščanje snovi kot dražil kože v skladu s kategorijo 2 GHS ZN. Ker razvrščanje snovi v neobvezno kategorijo 3, kot je opredeljeno v GHS ZN, ni dovoljeno, ne bo razvrščena nobena od ostalih snovi (v nobeno od kategorij). To testno metodo je treba prilagajati glede na zakonodajne potrebe in možno prihodnjo vključitev novih končnih učinkov, izboljšav ali razvoja novih podobnih testov.
Ta testna metoda omogoča ugotavljanje nevarnosti dražilnih snovi iz ene sestavine (19), vendar ne zagotavlja ustreznih informacij o jedkosti za kožo. Plinov in aerosolov ni mogoče testirati, medtem ko zmesi še niso ocenjene v validacijski študiji.
1.4 NAČELO TESTA
Testna snov se površinsko nanese na tridimenzionalni model rekonstruirane človeške pokožnice, ki vključuje normalne keratinocite človeške pokožnice, gojene za večplastni, zelo raznolik model človeške pokožnice. Sestavljajo ga organizirane bazalne, spinalne in zrnate plasti ter večplastna rožena plast, ki vključuje medcelične lamelarne maščobne plasti, razporejene v vzorce, ki so podobni strukturi in vivo.
Načelo testa z modelom rekonstruirane človeške pokožnice temelji na predpostavki, da lahko dražilne snovi prodrejo v roženo plast z difuzijo in so citotoksične za spodaj ležeče plasti celic. Viabilnost celic se meri s konverzijo dehidrogenaze vitalnega barvila MTT [3–(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazolijev bromid, Thiazolyl blue; številka EINECS 206–069–5, številka CAS 298–93–1] v soli modrega formazana, količina katere se izmeri po ekstrakciji iz tkiv (20). Dražilne snovi so prepoznavne po zmožnosti zmanjšanja viabilnosti celic pod opredeljene vrednosti praga (tj. ≤ 50 %, za dražila kategorije 2 GHS ZN). Snovi, zaradi katerih je viabilnost celic večja od opredeljene vrednosti praga, ne bodo razvrščene (tj. > 50 %, v nobeno kategorijo).
Sistemi modela rekonstruirane človeške pokožnice se lahko uporabljajo za testiranje trdnih snovi, tekočih snovi, poltrdnih snovi in voskov. Tekoče snovi so lahko vodne raztopine ali ne, trdne snovi so lahko topne ali netopne v vodi. Če je mogoče, je treba trdne snovi testirati v obliki finega prahu. Ker je bilo z validacijo sistemov za test z modelom rekonstruirane človeške pokožnice skrbno izbranih 58 snovi, ki predstavljajo veliko različnih kemijskih razredov, se pričakuje splošna veljavnost teh metod za kemijske razrede (16). Validacija vključuje 13 dražilnih snovi kategorije 2 po GHS. Opozoriti je treba, da nejedke kisline, baze, soli in druge anorganske snovi niso bile vključene v validacijo in da nekaj znanih razredov organskih dražilnih snovi, kot na primer hidroperoksidi, fenoli in površinsko aktivne snovi, ni bilo vključenih ali pa so bili vključeni le delno.
1.5 DOKAZOVANJE STROKOVNOSTI
Pred rutinsko uporabo validirane metode, pri kateri se upošteva ta testna metoda, je možno, da želijo laboratoriji z uporabo desetih snovi, ki so priporočene v tabeli 1, dokazati tehnično strokovnost. V okviru te testne metode ni neobvezne kategorije 3 GHS ZN. Za podobne nove testne metode, ki so razvite v okviru te testne metode ter so strukturno in funkcionalno podobne validiranim referenčnim metodam, ali za spremembe validiranih metod, se morajo pred začetkom uporabe novih testnih metod kot predpisanega testiranja za dokazovanje njihove primerljive zanesljivosti in natančnosti upoštevati standardi učinkovitosti, opisani v Dodatku k tej testni metodi.
Tabela 1
Napovedne snovi, ki so podmnožica referenčnih snovi, navedenih v Dodatku
|
Snov
|
Številka CAS
|
Rezultat testa in vivo
|
Agregatno stanje
|
Kategorija GHS
|
|
naftalen ocetna kislina
|
86–87–3
|
0
|
Tr
|
kat. št.
|
|
izopropanol
|
67–63–0
|
0,3
|
Te
|
kat. št.
|
|
metil stearat
|
112–61–8
|
1
|
Tr
|
kat. št.
|
|
heptil butirat
|
5870–93–9
|
1,7
|
Te
|
neobvezna kat. 3
|
|
heksil salicilat
|
6259–76–3
|
2
|
Te
|
neobvezna kat. 3
|
|
ciklamen aldehid
|
103–95–7
|
2,3
|
Te
|
kat. 2
|
|
1-bromoheksan
|
111–25–1
|
2.7
|
Te
|
kat. 2
|
|
butil metakrilat
|
97–88–1
|
3
|
Te
|
kat. 2
|
|
1-metil-3-fenil-1-piperazin
|
5271–27–2
|
3,3
|
Tr
|
kat. 2
|
|
heptanal
|
111–71–7
|
4
|
Te
|
kat. 2
|
1.6 OPIS METODE
V nadaljevanju so opisani elementi in postopki testa za ocenjevanje razdraženosti kože z modelom rekonstruirane človeške pokožnice. Model rekonstruirane človeške pokožnice se lahko izdela, pripravi ali pridobi na tržišču (npr. EpiSkin™, EpiDerm™ in SkinEthic RHE™). Protokoli standardnih testnih metod za EpiSkin™, EpiDerm™ in SkinEthic RHE™ so na voljo na spletni strani [http://ecvam.jrc.ec.europa.eu](21, 22, 23). Testiranje se mora izvajati v skladu z naslednjimi zahtevami:
1.6.1 Elementi modela rekonstruirane človeške pokožnice
1.6.1.1 Splošni pogoji modela
Za izdelavo epitelija se uporabijo običajni človeški keratinociti. Pod funkcionalno roženo plastjo je več slojev živih epitelijskih celic (bazalna plast, trnasta plast, zrnata plast). Rožena plast mora biti razdeljena na več plasti in vsebovati lipidni profil za močno funkcionalno pregrado za zaustavitev hitre penetracije označevalcev citotoksičnosti, npr. natrijevega dodecil sulfata (SDS) ali Tritona X-100. Funkcija pregrade se lahko oceni z določitvijo koncentracije, pri kateri označevalec po določenem času izpostavljenosti zmanjša viabilnost tkiv za 50 % (IC50), ali z določitvijo časa izpostavljenosti, ki je potreben za zmanjšanje viabilnosti celic za 50 % (ET50) po nanosu določene stalne koncentracije označevalca. Zadrževalne značilnosti modela morajo preprečiti prehod materiala okoli rožene plasti v živo tkivo, kar bi preprečilo učinkovitost modelov za raziskovanje v zvezi z izpostavljenostjo kože. V modelu kože ne sme biti bakterij, virusov, mikoplazme ali plesni.
1.6.1.2 Pogoji za funkcionalen model
1.6.1.2.1 Viabilnost
Zaželena analiza za določanje stopnje viabilnosti celic je z MTT (20). Optična gostota izvlečka (topnega) barvila iz negativnega kontrolnega tkiva mora biti vsaj dvajsetkrat večja od optične gostote samega ekstrakcijskega topila. Zabeležiti je treba, da je negativno kontrolno tkivo, kar zadeva celične kulture, med testiranjem stabilno (podobne meritve viabilnosti celic).
1.6.1.2.2 Pregradna funkcija
Rožena plast in njena maščobna sestava morata zadostovati za zaustavitev hitre penetracije citotoksičnih označevalcev, npr. SDS ali Triton X-100, kot se ocenjuje z IC50 ali ET50.
1.6.1.2.3 Morfologija
Histološki pregled rekonstruirane kože/pokožnice za prikaz strukture človeške kože/pokožnici podobne strukture (vključno z večplastno roženo plastjo) mora opraviti ustrezno usposobljeno osebje.
1.6.1.2.4 Obnovljivost
Rezultati metode s posebnim modelom morajo dokazati, da se koža sčasoma obnovi, najbolje z ustrezno (primerjalno) snovjo kontrolne serije (glej Dodatek).
1.6.1.2.5 Nadzor kakovosti modela
Vsaka uporabljena serija modela pokožnice mora izpolnjevati opredeljena merila za sprostitev proizvodnje, med katerimi so najpomembnejša merila v zvezi z viabilnostjo celic (odstavek 1.6.1.2.1) in pregradno funkcijo (odstavek 1.6.1.2.2). Razpon sprejemljivosti (zgornja in spodnja meja) za IC50 ali ET50 mora določiti dobavitelj modela kože (ali raziskovalec ob uporabi lastnega modela). Značilnosti pregrade tkiv se morajo preveriti v laboratoriju po prejetju tkiv. Le rezultati, doseženi z ustreznimi tkivi, se štejejo kot zanesljivi za napovedi v zvezi z vplivi za draženje kože. Kot primer so spodaj navedeni razponi za validirane referenčne metode.
Tabela 2
Primeri meril za nadzor kakovosti serije
|
|
Spodnja meja sprejemljivosti
|
Vrednost razpona sprejemljivosti
|
Zgornja meja sprejemljivosti
|
|
Validirana referenčna metoda 1 (18-urno testiranje z SDS)
|
IC50 = 1,0 mg/ml
|
IC50 = 2,32 mg/ml
|
IC50 = 3,0 mg/ml
|
|
Validirana referenčna metoda 2 (1-odstotni Triton X100)
|
ET50 = 4,8 hr
|
ET50 = 6,7 hr
|
ET50 = 8,7 hr
|
1.6.1.3 Nanos testnih in kontrolnih snovi
Za vsako testiranje in kontrole je treba uporabiti zadostno število dvojnikov tkiv (vsaj tri dvojnike na vsako ponovitev testa). Za tekoče in trdne snovi je treba uporabiti zadostno količino testne snovi, da se enakomerno prekrije površina kože, pri čemer mora biti odmerek natančno določen (glej 1.2 Opredelitve), tj. najmanj 25 μL/cm2 ali 25 mg/cm2. Da se zagotovi dober stik s kožo, je treba v primeru trdnih snovi površino pokožnice pred nanosom navlažiti z deionizirano ali destilirano vodo. Če je mogoče, je treba trdne snovi testirati v obliki finega prahu. Ob koncu časa izpostavljenosti je treba testno snov skrbno sprati s površine kože z vodnim puferjem ali 0,9-odstotnim NaCl. Glede na uporabljeni model rekonstruirane človeške pokožnice lahko čas izpostavljenosti traja od 15 do 60 minut, inkubacijska temperatura pa meri od 20 do 37 °C. Za podrobnejše informacije glej Standardne operativne postopke za te tri metode (21, 22, 23).
Negativna kontrola (NC) in pozitivna kontrola (PC) se morata sočasno uporabiti za vsako študijo, da se dokaže, da so viabilnost celic (negativna kontrola), pregradna funkcija in posledična občutljivost tkiva (pozitivna kontrola) v okviru v preteklosti opredeljenega razpona sprejemljivosti. Predlagana snov za pozitivno kontrolo je 5-odstotni vodni SDS. Predlagani snovi za negativno kontrolo sta voda ali fosfatni pufer s soljo (PBS).
1.6.1.4 Meritve viabilnosti celic
Pri postopku testiranja je zelo pomembno, da se meritve viabilnosti celic ne opravljajo takoj po izpostavljenosti testnim snovem, ampak v svežih gojiščih po dovolj dolgi inkubacijski dobi po testiranju izpranih tkiv. Ta čas omogoča izboljšanje stanja, kar zadeva šibke dražilne vplive, in pojav jasnih citotoksičnih vplivov. V fazi optimizacije testa (9, 10, 11, 12, 13) se je kot najugodnejša izkazala 42-urna inkubacijska doba po testiranju, zato se je uporabljala za validacijo referenčnih testnih metod.
Analiza konverzije MTT je kvantitativna validirana metoda, ki jo je treba uporabljati za merjenje viabilnosti celic. Ustreza uporabi tridimenzionalne konstrukcije tkiva. Vzorec kože se za 3 ure potopi v ustrezno koncentracijo raztopine MTT (npr. 0,3–1 mg/mL). S topilom (npr. izopropanolom, kislim izopropanolom) se izvleče oborina modrega formazana, potem pa se koncentracija formazana izmeri tako, da se določi OD pri valovni dolžini 570 nm ±30 nm.
Optične značilnosti testne snovi ali njenega kemijskega delovanja na MTT lahko zato ovirajo analizo, zaradi česar je lahko ocena viabilnosti celic lažna (ker lahko testna snov prepreči obarvanje ali povzroči, da se razlikuje od običajnega). To se lahko zgodi, če se določena testna snov s splakovanjem ne odstrani s kože v celoti ali če prodre v pokožnico. Če testna snov deluje neposredno na MTT, je običajne barve ali se obarva med testiranjem tkiva, je treba izvesti dodatne kontrole, da se ugotovijo in odpravijo interference testne snovi z merilno tehniko viabilnosti. Za podrobnejši opis načina neposrednega testiranja zmanjšanja MTT glej protokol testne metode za validirane referenčne metode (21, 22, 23). Nespecifična barva zaradi teh interferenc ne sme preseči 30-odstotne negativne kontrole (za popravke). Če je NSC > 30 %, se šteje, da je testna snov neskladna s testom.
1.6.1.5 Merila za sprejemljivost analize
Za vsako analizo, pri kateri se uporabljajo ustrezne/veljavne serije (glej odstavek 1.6.1.2.5), morajo negativna kontrolna tkiva izražati optično gostoto, iz katere je razvidna kakovost tkiv, pri katerih so se upoštevale vse zahtevane stopnje in vsi postopki protokola v zvezi z razdraženostjo kože. Vrednosti kontrol optične gostote ne smejo biti nižje kot v preteklosti postavljene nižje meje. Podobno morajo tkiva s PC, tj. 5-odstotnim vodnim SDS, kazati občutljivost tkiv in njihovo sposobnost odzivanja na dražilne snovi v pogojih vsake posamezne analize (na primer viabilnost celic ≤ 40 % za validirano referenčno metodo 1 in ≤ 20 % za validirano referenčno metodo 2). S tem povezane in ustrezne meritve spremenljivosti med dvojniki tkiv je treba opredeliti (npr. v primeru uporabe standardnih odmikov mora biti njihova vrednost ≤ 18 %).
2. PODATKI
2.1 PODATKI
Za vsako testiranje je treba podatke o posameznih vzorcih dvojnikov testov (npr. vrednosti optične gostote in podatke o izračunanem deležu viabilnosti celic za vsako testno snov, vključno z razvrščanjem) sporočiti v tabeli, po potrebi vključno s podatki o ponovljenih poskusih. To pomeni, da je treba sporočiti standardni odmik ± za vsak poskus. Za vsako testirano kemikalijo je treba sporočiti opaženo medsebojno vplivanje z reagentom MTT in obarvanimi testnimi snovmi.
2.2 RAZLAGA REZULTATOV
Vrednosti OD, pridobljene z vsakim testnim vzorcem, se lahko uporabijo za izračun deleža viabilnosti celic NC, ki je določena na 100 %. Mejna vrednost deleža viabilnosti celic, ki dražilne testne snovi loči od nerazvrščenih, ter statistični postopek(-ki), ki se uporablja(-jo) za ocenjevanje rezultatov ter določanje dražilnih snovi, morata(-jo) biti natančno opredeljena(-i) in zabeležena(-i) ter dokazana(-i) kot ustrezna(-i). Mejne vrednosti za napovedovanje rezultatov v zvezi z razdraženostjo kože, ki zadevajo validirane referenčne metode, so navedene spodaj.
Testna snov se v skladu s kategorijo 2 GHS ZN šteje kot dražilna za kožo:
|
(i)
|
če je viabilnost tkiva po izpostavljenosti in inkubaciji po testiranju manjša kot ali enaka (≤) 50 %.
|
Testna snov se šteje kot snov brez kategorije:
|
(ii)
|
če je viabilnost tkiva po izpostavljenosti in inkubaciji večja (>) kot 50 %.
|
3. POROČANJE
3.1 POROČILO O TESTU
Poročilo o testu mora vključevati naslednje informacije:
Testne in kontrolne snovi:
|
—
|
kemijsko(-a) ime(-na), npr. IUPAC ali ime CAS in številko CAS, če je znana,
|
|
—
|
čistost in sestavo snovi (v odstotku(-ih) mase),
|
|
—
|
fizikalno-kemijske značilnosti, ki so pomembne za izvedbo študije (npr. agregatno stanje, obstojnost in hlapnost, pH, topnost v vodi, če so znane),
|
|
—
|
obdelava testnih/kontrolnih snovi pred testiranjem, če je to smiselno (npr. segrevanje, mletje),
|
Utemeljitev modela kože in uporabljenega protokola.
Testni pogoji:
|
—
|
uporabljeni celični sistem,
|
|
—
|
podatki o umerjanju za merilno napravo, s katero je bila izmerjena viabilnost celic (npr. spektrofotometer),
|
|
—
|
popolne informacije za podporo specifičnemu uporabljenemu modelu kože, vključno z njegovo učinkovitostjo. Ti lahko vključujejo, niso pa omejeni na:
|
(iv)
|
ponovljivost in napovedljivost;
|
|
(v)
|
nadzor kakovosti modela:
|
|
|
—
|
podrobnejše informacije o uporabljenem postopku testiranja,
|
|
—
|
uporabljeni testni odmerki, čas izpostavljenosti in inkubacijska doba po testiranju,
|
|
—
|
opis vseh sprememb postopka testiranja,
|
|
—
|
sklicevanje na podatke o modelu, pridobljene v preteklosti. Ti lahko vključujejo, niso pa omejeni na:
|
(i)
|
sprejemljivost podatkov o nadzoru kakovosti s sklicevanjem na podatke o seriji, pridobljene v preteklosti;
|
|
(ii)
|
sprejemljivost vrednosti pozitivne in negativne kontrole s sklicevanjem na pozitivna ter negativna kontrolna sredstva in razpone,
|
|
|
—
|
opis uporabljenih meril za ocenjevanje, vključno z zagovorom izbire mejne(-ih) vrednosti za napovedni model.
|
Rezultati:
|
—
|
evidentiranje podatkov posameznih testnih vzorcev,
|
|
—
|
opis vseh ostalih opaženih vplivov.
|
Razprava o rezultatih.
Sklepi.
4. VIRI
|
(1)
|
United Nations (UN) (2007) Globally Harmonized System of Classification and Labelling of Chemicals (GHS), druga revidirana izdaja, ZN, New York in Ženeva, 2007. Na voljo na spletni strani: http://www.unece.org/trans/danger/publi/ghs/ghs_rev02/02files_e.html.
|
|
(2)
|
REACH: Guidance on Information Requirements and Chemical Safety Assessment. Na voljo na spletni strani: http://guidance.echa.europa.eu/docs/guidance_document/information_requirements_en.htm?time=1232447649.
|
|
(3)
|
Test Method B.4, ACUTE TOXICITY; DERMAL IRRITATION/CORROSION.
|
|
(4)
|
Test Method B.40, IN VITRO SKIN CORROSION: TRANSCUTANEOUS ELECTRICAL RESISTANCE TEST TER.
|
|
(5)
|
Test Method B.40 a, IN VITRO SKIN CORROSION: HUMAN SKIN MODEL TEST.
|
|
(6)
|
OECD (2006), Test Guideline 435. OECD Guideline for the Testing of Chemicals. In Vitro Membrane Barrier Test Method. Prevzeto 19. julija 2006. Na voljo na spletni strani: http://www.oecd.org/document/22/0,2340,en_2649_34377_1916054_1_1_1_1,00.html.
|
|
(7)
|
ECVAM (2009), Performance Standards for applying human skin models to in vitro skin irritation. Na voljo pod Download Study Documents na spletni strani: http://ecvam.jrc.ec.europa.eu.
|
|
(8)
|
Fentem, J. H., Briggs, D., Chesné, C., Elliot, G. R., Harbell, J. W., Heylings, J. R., Portes, P., Roguet, R., van de Sandt, J. J. M. in Botham, P. (2001), A prevalidation study on in vitro tests for acute skin irritation. Results and evaluation by the Management Team, Toxicology in Vitro, 15, 57–93.
|
|
(9)
|
Portes, P., Grandidier, M. H., Cohen, C. in Roguet, R.(2002), Refinement of the EPISKIN protocol for the assessment of acute skin irritation of chemicals: follow-up to the ECVAM prevalidation study, Toxicology in Vitro, 16, 765–770.
|
|
(10)
|
Kandárová, H., Liebsch, M., Genschow, E., Gerner, I., Traue, D., Slawik, B. in Spielmann, H. (2004), Optimisation of the EpiDerm test protocol for the upcoming ECVAM validation study on in vitro skin irritation tests, ALTEX 21, 107–114.
|
|
(11)
|
Kandárová, H., Liebsch, M., Gerner, I., Schmidt, E., Genschow, E., Traue, D. in Spielmann H. (2005), The EpiDerm Test Protocol fort the Upcoming ECVAM Validation Study on In Vitro Skin Irritation Tests – An Assessment of the Performance of the Optimised Test, ATLA 33, 351–367.
|
|
(12)
|
Cotovio, J., Grandidier, M.–H., Portes, P., Roguet, R. in Rubinsteen, G. (2005), The In Vitro Acute Skin Irritation of Chemicals: Optimisation of the EPISKIN Prediction Model within the Framework of the ECVAM Validation Process, ATLA 33, 329–249.
|
|
(13)
|
Zuang, V., Balls, M., Botham, P. A., Coquette, A., Corsini, E., Curren, R. D., Elliot, G. R., Fentem, J. H., Heylings, J. R., Liebsch, M., Medina, J., Roguet, R., van De Sandt, J. J. M., Wiemann, C. in Worth, A. (2002), Follow-up to the ECVAM prevalidation study on in vitro tests for acute skin irritation. ECVAM Skin Irritation Task Force Report 2, ATLA 30,109–129.
|
|
(14)
|
Hoffmann, S., Liebsch, M., Botham, P., Fentem, J., Eskes, C., Roguet, R., Cotovió, J., Cole, T., Worth, A., Heylings, J., Jones, P., Robles, C., Kandárová, H., Gamer, A., Remmele, M., Curren, R., Raabe, H., Cockshott, A., Gerner, I. in Zuang, V. (2007), The ECVAM International Validation Study on In Vitro Tests for Acute Skin Irritation: Report on the Validity of the EPISKIN and EpiDerm Assays and on the Skin Integrity Function Test, ATLA 35, 559–601.
|
|
(15)
|
Hoffmann, S. (2006), ECVAM Skin Irritation Validation Study Phase II: Analysis of the Primary Endpoint MTT and the Secondary Endpoint IL1-α, str. 135 + priloge. Na voljo pod Download Study Documents na spletni strani: http://ecvam.jrc.ec.europa.eu.
|
|
(16)
|
Eskes, C., Cole, T., Hoffmann, S., Worth, A., Cockshott, A., Gerner, I. in Zuang V. (2007), ECVAM International Validation Study on In Vitro Tests for Acute Skin Irritation: Selection of Test Chemicals, ATLA 35, 603–619.
|
|
(17)
|
Cotovio, J., Grandidier, M–H., Lelièvre, D., Roguet, R., Tinois-Tessonneaud, E., Leclaire, J. (2007), In vitro acute skin irritancy of chemicals using the validated EPISKIN model in a tiered strategy -Results and performances with 184 cosmetic ingredients, AATEX, Special Issue-proceedings from WC6, zvezek 14, 351–358.
|
|
(18)
|
ESAC statement on updated EpiDerm and similar SkinEthic assays, 5. november 2008.
|
|
(19)
|
ES (2006). Uredba (ES) št. 1907/2006 Evropskega parlamenta in Sveta z dne 18. decembra 2006 o registraciji, evalvaciji, avtorizaciji in omejevanju kemikalij (REACH), o ustanovitvi Evropske agencije za kemikalije ter spremembi Direktive 1999/45/ES ter razveljavitvi Uredbe Sveta (EGS) št. 793/93 in Uredbe Komisije (ES) št. 1488/94 ter Direktive Sveta 76/769/EGS in direktiv Komisije 91/155/EGS, 93/67/EGS, 93/105/ES in 2000/21/ES.
Uradni list Evropske unije L 396, 30.12.2006, str. 1. OPOCE, Luxembourg.
|
|
(20)
|
Mosman, T. (1983), Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity asssays. Journal of Immunological Methods 65, 55–63.
|
|
(21)
|
EpiSkin™ SOP, izdaja 1.6 (januar 2005), Validation of the EpiSkin Skin Irritation Test – 42 Hours Assay For The Prediction of Acute Skin Irritation of Chemicals. Na voljo pod Download Study Documents na spletni strani: http://ecvam.jrc.ec.europa.eu.
|
|
(22)
|
EpiDerm™ SOP, izdaja 5.0 (oktober 2004), Draft Standard Operating Procedure. In Vitro Skin Irritation Test: Human Skin Model. Model: EpiDerm™- 200. Na voljo pod Download Study Documents na spletni strani: http://ecvam.jrc.ec.europa.eu.
|
|
(23)
|
SkinEthic RHE™ SOP. Kmalu na voljo pod Download Study Documents na spletni strani: http://ecvam.jrc.ec.europa.eu.
|
|
(24)
|
Harvell, J. D., Lamminstausta, K, Maibach H. I. (1995), Irritant contact dermatitis, v: Guin J. D., Practical Contact Dermatitis, Mc Graw-Hill New York, str. 7–18.
|
|
(25)
|
Griesinger C, Barroso J & Zuang V: ECVAM background document on the recent adaptations of the ECVAM performance standards for in vitro skin irritation testing in the context of the drafting process of an EU test method and an OECD draft test guideline. Ispra, November 13, 2008.
|
Dodatek
Ocena učinkovitosti predlaganega modela rekonstruirane človeške pokožnice in vitro za draženje kože
UVOD
Postopki, ki so predlagani za uporabo v okviru te testne metode, se morajo oceniti tako, da se določi njihova zanesljivost in natančnost ob uporabi snovi, ki predstavljajo celoten razpon rezultatov testa Draize za draženja kože. Ocena predlaganih testnih metod ob uporabi 20 predlaganih referenčnih snovi (tabela 2) mora pokazati, da so ti postopki prav tako zanesljivi in natančni kot validirana referenčna metoda 1 (tabela 3) (1). Standardi natančnosti in zanesljivosti, ki jih je treba doseči, so navedeni v točkah II in III. Nerazvrščene in razvrščene snovi (kategorija 2 GHS ZN), ki predstavljajo ustrezne kemijske razrede, so vključene tako, da je lahko zanesljivost in učinkovitost (občutljivost, specifičnost, lažna negativna stopnja in lažna pozitivna stopnja ter natančnost) predlagane testne metode primerljive z validirano referenčno metodo 1. Zanesljivost testne metode in njena sposobnost zagotovitve ustrezne določitve dražilnih snovi kategorije 2 GHS ZN morata biti določeni pred začetkom uporabe metode za testiranje novih snovi.
STANDARDI UČINKOVITOSTI
Standardi učinkovitosti zajemajo naslednje tri elemente: I) nujni elementi testne metode, II) referenčne snovi ter III) opredeljene vrednosti natančnosti in zanesljivosti (2). Ti standardi učinkovitosti temeljijo na standardih učinkovitosti, ki so bili opredeljeni po končani študiji Evropskega centra za validacijo alternativnih metod draženja kože (3).
I. Nujni elementi testne metode
Splošni pogoji modela
Za izdelavo epitelija se uporabijo običajni človeški keratinociti. Pod funkcionalno roženo plastjo je več plasti živih epitelijskih celic (bazalna plast, trnasta plast, zrnata plast). Rožena plast je razdeljena na več plasti in vsebuje lipidni profil za močno funkcionalno pregrado za zaustavitev hitre penetracije označevalcev citotoksičnosti, npr. SDS ali Tritona X-100. Funkcija ovire se lahko oceni z določitvijo koncentracije, pri kateri označevalec po določenem času izpostavljenosti zmanjša viabilnost tkiv za 50 % (IC50), ali z določitvijo časa izpostavljenosti, ki je potreben za zmanjšanje viabilnosti celic za 50 % (ET50) po nanosu označevalca v določeni stalni koncentraciji. Zadrževalne značilnosti modela morajo preprečiti prehod materiala okoli rožene plasti v živo tkivo, kar bi preprečilo učinkovitost modelov za raziskovanje v zvezi z izpostavljenostjo kože. V modelu kože ne sme biti bakterij, virusov, mikoplazme ali plesni.
Pogoji za funkcionalen model
Viabilnost
Zaželena analiza za določanje stopnje viabilnosti celic je z MTT (4). Optična gostota izvlečka (topnega) barvila iz negativnega kontrolnega tkiva mora biti vsaj dvajsetkrat večja od optične gostote samega ekstrakcijskega topila. Zabeležiti je treba, da je tkivo NC, kar zadeva celične kulture, v času testiranja stabilno (podobne meritve viabilnosti celic).
Pregradna funkcija
Rožena plast in njena maščobna sestava morata zadostovati za zaustavitev hitre penetracije citotoksičnih označevalcev, npr. SDS ali Triton X-100, kot se ocenjuje z IC50 ali ET50.
Morfologija
Histološki pregled rekonstruirane kože/pokožnice za prikaz strukture človeške kože/pokožnici podobne strukture (vključno z večplastno roženo plastjo) mora opraviti ustrezno usposobljeno osebje.
Obnovljivost
Rezultati metode s posebnim modelom morajo dokazati, da se koža sčasoma obnovi, najbolje z ustrezno (primerjalno) snovjo kontrolne serije (glej opredelitve v oddelku 1.2).
Nadzor kakovosti modela
Vsaka uporabljena serija modela pokožnice mora izpolnjevati opredeljena merila za sprostitev trga, med katerimi so najpomembnejša merila za viabilnost in za pregradno funkcijo Razpon sprejemljivosti (zgornja in spodnja meja) za IC50 ali ET50 mora določiti dobavitelj modela kože (ali raziskovalec ob uporabi lastnega modela). Značilnosti pregrade tkiv se morajo preveriti v laboratoriju po prejemu tkiv. Le rezultati, ki se dosežejo z ustreznimi tkivi, se lahko vključijo v zanesljivo napovedovanje vplivov draženja kože. Kot primer so spodaj navedeni razponi za validirane referenčne metode.
Tabela 1
Primeri meril za nadzor kakovosti serije
|
|
Spodnja meja sprejemljivosti
|
Vrednost razpona sprejemljivosti
|
Zgornja meja sprejemljivosti
|
|
Validirana referenčna metoda 1 (18-urno testiranje z SDS)
|
IC50 = 1,0 mg/ml
|
IC50 = 2,32 mg/ml
|
IC50 = 3,0 mg/ml
|
|
Validirana referenčna metoda 2 (1-odstoten Triton X100)
|
ET50 = 4,8 hr
|
ET50 = 6,7 hr
|
ET50 = 8,7 hr
|
II. Referenčne snovi
Referenčne snovi se uporabljajo za določanje, ali sta zanesljivost in natančnost predlagane nove testne metode rekonstruirane človekove pokožnice in vitro, ki se je izkazala za strukturno in funkcionalno dovolj podobno validiranim referenčnim metodam ali ki predstavlja manjšo spremembo validirane referenčne metode, primerljiva z učinkovitostjo validirane referenčne metode 1 (1). Med 20 referenčnimi snovmi, navedenimi v tabeli 2, so snovi, ki predstavljajo različne kemijske razrede in kemikalije iz kategorije 2 GHS ZN. Snovi s tega seznama vključujejo 10 snovi kategorije 2 GHS ZN, 3 snovi iz kategorije 3 GHS ZN in 7 nerazvrščenih snovi. V okviru te metode se neobvezna kategorija 3 ne upošteva. Te referenčne snovi predstavljajo najmanjše možno število snovi, ki jih je treba uporabiti pri ocenjevanju natančnosti in zanesljivosti predlagane testne metode draženja kože z rekonstruirano človeško pokožnico. Če navedena snov ni na voljo, se lahko uporabijo druge snovi, za katere so na voljo ustrezni referenčni podatki in vivo. Po želji se lahko na najkrajši možni seznam referenčnih snovi dodajo druge snovi, ki predstavljajo druge kemijske razrede in za katere so na voljo ustrezni referenčni podatki in vivo, da se dodatno oceni natančnost predlagane testne metode.
Tabela 2
Referenčne snovi za določitev vrednosti natančnosti in zanesljivosti za modele rekonstruirane človeške pokožnice za razdraženost kože
|
Snov (1)
|
Št. CAS
|
Št. EINECS
|
Agregatno stanje
|
Rezultat in vivo
|
Kategorija GHS in vitro
|
Kategorija GHS in vivo
|
|
1-bromo-4-klorobutan
|
6940–78–9
|
230–089–3
|
Te
|
0
|
kat. 2
|
kat. št.
|
|
dietil ftalat
|
84–66–2
|
201–550–6
|
Te
|
0
|
kat. št.
|
kat. št.
|
|
naftalen ocetna kislina
|
86–87–3
|
201–705–8
|
Tr
|
0
|
kat. št.
|
kat. št.
|
|
alil fenoksiacetat
|
7493–74–5
|
231–335–2
|
Te
|
0,3
|
kat. št.
|
kat. št.
|
|
izopropanol
|
67–63–0
|
200–661–7
|
Te
|
0,3
|
kat. št.
|
kat. št.
|
|
4-metiltiobenzaldehid
|
3446–89–7
|
222–365–7
|
Te
|
1
|
kat. 2
|
kat. št.
|
|
metil stearat
|
112–61–8
|
203–990–4
|
Tr
|
1
|
kat. št.
|
kat. št.
|
|
heptil butirat
|
5870–93–9
|
227–526–5
|
Te
|
1,7
|
kat. št.
|
neobvezna kat. 3
|
|
heksil salicilat
|
6259–76–3
|
228–408–6
|
Te
|
2
|
kat. št.
|
neobvezna kat. 3
|
|
triizobutilfosfat
|
126–71–6
|
204–798–3
|
Te
|
2
|
kat. 2
|
neobvezna kat. 3
|
|
1-dekanol
|
112–30–1
|
203–956–9
|
Te
|
2,3
|
kat. 2
|
kat. 2
|
|
ciklamen aldehid
|
103–95–7
|
203–161–7
|
Te
|
2,3
|
kat. 2
|
kat. 2
|
|
1-bromoheksan
|
111–25–1
|
203–850–2
|
Te
|
2,7
|
kat. 2
|
kat. 2
|
|
2-klorometil-3,5-dimetil-4-metoksipiridinhidroklorid
|
86604–75–3
|
434–680–9
|
Tr
|
2,7
|
kat. 2
|
kat. 2
|
|
a-terpineol
|
98–55–5
|
202–680–6
|
Te
|
2,7
|
kat. 2
|
kat. 2
|
|
di-n-propildisulfid
|
629–19–6
|
211–079–8
|
Te
|
3
|
kat. št.
|
kat. 2
|
|
butil metakrilat
|
97–88–1
|
202–615–1
|
Te
|
3
|
kat. 2
|
kat. 2
|
|
benzenetiol, 5–(1,1-dimetiletil)-2-metil
|
7340–90–1
|
438–520–9
|
Te
|
3,3
|
kat. 2
|
kat. 2
|
|
1-metil-3-fenil-1-piperazin
|
5271–27–2
|
431–180–2
|
Tr
|
3,3
|
kat. 2
|
kat. 2
|
|
heptanal
|
111–71–7
|
203–898–4
|
Te
|
4
|
kat. 2
|
kat. 2
|
Snovi iz tabele 2 zagotavljajo reprezentativno razdelitev 58 snovi, uporabljenih v mednarodni študiji Evropskega centra za validacijo alternativnih metod draženja kože (1). Njihov izbor temelji na naslednjih merilih:
|
—
|
snovi so na voljo na tržišču,
|
|
—
|
predstavljajo celoten niz rezultatov testa Draize za draženje kože (od nerazdražene do zelo razdražene kože),
|
|
—
|
njihova kemična struktura je natančno opredeljena,
|
|
—
|
predstavljajo sposobnost ponovljivosti in napovedljivosti validirane metode, kot določa validacijska študija Evropskega centra za validacijo alternativnih metod,
|
|
—
|
predstavljajo kemijsko delovanje, ki je uporabljeno v validacijskem postopku,
|
|
—
|
niso povezane z zelo strupenim profilom (npr. rakotvornim ali strupenim za reprodukcijski sistem) ali stroški zaradi prepovedane izpostavljenosti tem kemikalijam.
|
III. Opredeljene vrednosti natančnosti in zanesljivosti
Učinkovitost (občutljivost, specifičnost, lažna negativna stopnja in lažna pozitivna stopnja ter natančnost) predlagane testne metode morajo biti primerljive z vrednostmi validirane referenčne metode 1 (tabela 3), kar pomeni, da mora biti občutljivost enaka ali večja (≥) kot 80 %, specifičnost enaka ali večja (≥) kot 70 %, natančnost pa enaka ali večja kot (≥) 75 %. Pri izračunu učinkovitosti je treba upoštevati vse razvrstitve 20 snovi, pridobljene v različnih sodelujočih laboratorijih. Vsi laboratoriji morajo pri razvrščanju vseh snovi upoštevati povprečno vrednost viabilnosti v različnih izvedenih ponovitvah testa (najmanj tri veljavne ponovitve).
Tabela 3
Učinkovitost validirane referenčne metode 1 (2)
|
Testna metoda
|
Št. snovi
|
Občutljivost
|
Specifičnost
|
Delež lažno negativnih rezultatov
|
Delež lažno pozitivnih rezultatov
|
Natančnost
|
|
Validirana referenčna metoda 1 (3)
|
58
|
87,2 % (4)
|
71,1 % (5)
|
12,8 %
|
29,9 %
|
74,7 %
|
|
Validirana referenčna metoda 1 (3)
|
20
|
90 %
|
73,3 %
|
10 %
|
26,7 %
|
81,7 %
|
Zanesljivost predlagane testne metode mora biti primerljiva z zanesljivostjo validiranih referenčnih metod.
Ponovljivost v enem laboratoriju
Ocena spremenljivosti v laboratoriju mora kazati skladnost razvrstitev (v kategorijo 2/nobeno kategorijo), ki se doseže z različnimi neodvisnimi ponovitvami testa z 20 referenčnimi snovmi v enem laboratoriju in je enaka ali večja (≥) kot 90 %.
Ponovljivost v različnih laboratorijih
Ocena ponovljivosti v različnih laboratorijih ni potrebna, če se bo predlagana testna metoda uporabljala le v enem laboratoriju. Za metode, ki se bodo uporabljale v več laboratorijih, mora biti skladnost razvrstitev (v kategorijo 2/v nobeno kategorijo), ki se dosežejo z različnimi neodvisnimi ponovitvami testa z 20 referenčnimi snovmi, najbolje v najmanj treh laboratorijih, enaka ali večja (≥) kot 80 %.
VIRI
|
(1)
|
Spielmann, H., Hoffmann, S., Liebsch, M., Botham, P., Fentem, J., Eskes, C., Roguet, R., Cotovió, J., Cole, T., Worth, A., Heylings, J., Jones, P., Robles, C., Kandárová, H., Gamer, A., Remmele, M., Curren, R., Raabe, H., Cockshott, A., Gerner, I. in Zuang, V. (2007), The ECVAM International Validation Study on In Vitro Tests for Acute Skin Irritation: Report on the Validity of the EPISKIN and EpiDerm Assays and on the Skin Integrity Function Test. ATLA 35, 559–601.
|
|
(2)
|
OECD (2005), Guidance Document No. 34 on the validation and international acceptance of new or updated test methods for hazard assessment. OECD, Pariz.
|
|
(3)
|
ECVAM (2007), Performance Standards for applying human skin models to in vitro skin irritation. Na voljo pod Download Study Documents na spletni strani: http://ecvam.jrc.ec.europa.eu. Prevzeto 27.10.2008.
|
|
(4)
|
Mosman, T. (1983), Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity asssays, Journal of Immunological Methods 65, 55–63.
|
|
(5)
|
Eskes, C., Cole, T., Hoffmann, S., Worth, A., Cockshott, A., Gerner, I. in Zuang. V (2007), ECVAM International Validation Study on In Vitro Tests for Acute Skin Irritation: Selection of Test Chemicals, ATLA 35, 603–619.
|
(1) 20 referenčnih snovi predstavlja reprezentativen izbor 58 snovi, ki so se prvotno uporabljale za validacijo referenčne metode 1 (EpiSkin™). Na voljo je celoten seznam testnih snovi in merila za izbor (5).
(2) V tabeli 3 je navedena učinkovitost validirane metode 1 v zvezi z njeno sposobnostjo ustrezne opredelitve dražilnih snovi (kategorija 2 GHS ZN) in nerazvrščenih snovi (ki niso v nobeni kategoriji, vključno z neobvezno kategorijo 3) za 58 in 20 referenčnih snovi (tabela 2).
(3) EpiSkin™
(4) Na podlagi 13 dražilnih snovi kategorije 2 po GHS.
(5) Na podlagi 45 dražilnih snovi kategorije 3 po GHS ali kemikalij, ki niso v nobeni kategoriji po GHS.
PRILOGA IV
|
C.3.
|
SLADKOVODNE ALGE IN CIANOBAKTERIJE, PRESKUS ZAVIRANJA RASTI
|
1. METODA
Ta metoda je enakovredna OECD TG 201 (2006)(1).
1.1 UVOD
Preskusne metode se ob upoštevanju znanstvenega napredka redno spreminjajo in posodabljajo. Preskusno metodo C.3 je bilo treba spremeniti zaradi vključitve dodatnih vrst in izpolnitve zahtev za oceno nevarnosti in razvrstitev kemikalij. Spremembe so bile izvedene na podlagi izčrpnih praktičnih izkušenj, znanstvenega napredka na področju študij toksičnosti za alge in ob široki uporabi ustreznih predpisov od njenega prvotnega sprejetja.
1.2 POMEN IZRAZOV
Za namene preskusnih metod se uporabljajo naslednje opredelitve in okrajšave:
Biomasa: je suha teža žive snovi prisotne v populaciji, izražena v dani prostornini; npr. mg alg/liter preskusne raztopine. „Biomasa“ je običajno opredeljena kot masa, vendar se v tem preskusu ta beseda uporablja za označevanje mase na prostornino. V tem preskusu se običajno merijo tudi nadomestki za biomaso, kot so npr. število celic, fluorescenca itd., zato se izraz „biomasa“ uporablja tudi za meritve teh nadomestkov.
Koeficient variacije: je merilo variabilnosti parametra brez merila, opredeljeno kot razmerje med standardnim odstopanjem in povprečjem. Izraziti ga je mogoče tudi kot odstotno vrednost. Srednji koeficient variacije povprečne specifične stopnje rasti v ponovitvenih kontrolnih kulturah se računa tako, kot sledi:
|
1.
|
Izračuna se KV v odstotkih povprečne specifične stopnje rasti na dan/po posamičnih delih za vsakokratno ponovitev.
|
|
2.
|
Izračuna se srednja vrednost vseh izračunanih vrednosti v točki 1, da se pridobi srednji koeficient variacije specifične stopnje rasti na dan/po posamičnih delih v ponovitvenih kontrolnih kulturah.
|
ECx
: je koncentracija preskusne snovi, raztopljene v preskusnem mediju, katere rezultat je x % (npr. 50 %) zmanjšanje rasti preskusnega organizma v ustreznem obdobju izpostavljenosti (navesti v primeru odstopanja od polnega ali običajnega trajanja preskusa). Za nedvoumno označitev vrednosti EC, pridobljene iz stopnje rasti ali prirasta, se uporabljata simbola „ErC“ ali „EyC“.
Rastno gojišče: je povsem sintetično gojišče, v katerem rastejo preskusne alge med izpostavljenostjo preskusni snovi. Preskusne snovi se običajno raztopijo v preskusnem mediju.
Stopnja rasti (povprečna specifična stopnja rasti): je logaritemsko povečanje biomase v času izpostavljenosti.
Koncentracija z najnižjim opaznim učinkom (LOEC): je najnižja preskušena koncentracija, pri kateri se ugotovi statistično pomemben učinek snovi na zmanjšanje rasti (pri p < 0,05) v primerjavi s kontrolnim vzorcem v ustreznem času izpostavljenosti. Vendar pa morajo imeti vse preskusne koncentracije nad LOEC škodljiv učinek, ki je enak ali večji od učinka, opazovanega pri LOEC. Če teh dveh pogojev ni mogoče izpolniti, je treba izčrpno razložiti, na kak način je bila izbrana LOEC (in ne NOEC).
Koncentracija brez opaznega učinka (NOEC): je preskusna koncentracija tik pod LOEC.
Odvisna spremenljivka: je spremenljivka za ocenitev toksičnosti, izpeljana iz katerih koli izmerjenih parametrov, ki opisujejo biomaso z drugačno računsko metodo. Za to metodo sta stopnja rasti in prirasta odvisni spremenljivki, neposredno izpeljani iz izmerjene biomase ali katerega koli omenjenega nadomestka.
Specifična stopnja rasti: je odvisna spremenljivka, opredeljena kot količnik razlike naravnih logaritmov opazovanega parametra (v tej preskusni metodi je to biomasa) in upoštevanega časovnega obdobja.
Prirast: je vrednost izmerjene spremenljivke ob koncu obdobja izpostavljenosti manj vrednost izmerjene spremenljivke ob začetku obdobja izpostavljenosti, s katero se izrazi povečanje biomase med preskusom.
1.3 UPORABA PRESKUSA
Ta preskusna metoda se najlažje uporabi pri vodotopnih snoveh, za katere je verjetno, da bodo v pogojih preskusa ostale v vodi. Za preskušanje snovi, ki so hlapne, močno adsorptivne, obarvane in slabo topne v vodi, ali snovi, ki lahko vplivajo na razpoložljivost hranilnih snovi ali mineralov v preskusnem mediju, so morda potrebne nekatere prilagoditve opisanega postopka (npr. zaprt sistem ali hlajenje preskusnih posod). Navodila za nekaj primernih prilagoditev so navedena v (2), (3) in (4).
1.4 PRINCIP PRESKUSA
Namen tega preskusa je določiti učinke snovi na rast sladkovodnih mikroalg in/ali cianobakterij. Preskusni organizmi v eksponentni fazi rasti se v šaržnih kulturah izpostavijo preskusni snovi ponavadi za 72 ur. Kljub relativno kratkemu trajanju preskusa je mogoče oceniti učinke na več generacijah.
Odziv sistema je zmanjšanje rasti pri vrsti kultur alg (preskusnih enot), ki so izpostavljene različnim koncentracijam preskusne snovi. Odziv je ocenjen v odvisnosti od koncentracije izpostavljenosti v primerjavi s povprečno rastjo ponovitvenih, neizpostavljenih kontrolnih kultur. Za popolno izražanje odziva sistema na toksične učinke (optimalna občutljivost) se kulturam za merjenje zmanjšanja specifične stopnje rasti omogoči neomejena eksponentna rast pod zadostnimi prehranskimi pogoji ter stalno svetlobo v zadostnem časovnem obdobju.
Rast in zaviranje rasti sta določena z meritvami biomase alg v odvisnosti od časa. Biomasa alg je opredeljena kot suha teža na prostornino, npr. mg alg/liter preskusne raztopine. Vendar je suho težo težko meriti, zato se uporabljajo nadomestni parametri. Od teh nadomestkov se najpogosteje uporablja število celic. Drugi nadomestni parametri vključujejo prostornino celic, fluorescenco, optično gostoto itn. Pretvorni faktor med izmerjenim nadomestnim parametrom in biomaso mora biti znan.
Končna točka preskusa je zaviranje rasti, izraženo kot logaritmično povečanje biomase (povprečne specifične stopnje rasti) med obdobjem izpostavljenosti. Iz povprečnih specifičnih stopenj rasti, zabeleženih v vrsti preskusnih raztopin, je koncentracija, ki doseže določeno zaviranje rasti x % (npr. 50 %), določena in izražena kot ErCx (npr. ErC50).
Za rabo te metode v zakonodajnem okviru EU bi morali za izračun rezultatov uporabiti povprečno specifično hitrost rasti iz razlogov, opisanih v oddelku 2.2 spodaj. Dodatna odvisna spremenljivka, ki se uporablja za to preskusno metodo, je prirastek, ki je lahko potreben za izpolnitev zakonodajnih zahtev v nekaterih državah. Opredeljen je kot biomasa na koncu obdobja izpostavljenosti manj biomasa na začetku obdobja izpostavljenosti. Iz prirastka, zabeleženega v vrsti preskusnih raztopin, se koncentracija, ki doseže določeno zaviranje prirastka x % (npr. 50 %), izračuna in izrazi kot EyCx (npr. EyC50).
Zraven tega je mogoče statistično določiti koncentracijo z najnižjim opaznim učinkom (LOEC) in koncentracijo brez opaznega učinka (NOEC).
1.5 PODATKI O PRESKUSNI SNOVI
Podatki o preskusni snovi, ki so lahko uporabni pri vzpostavitvi preskusnih pogojev, vključujejo strukturno formulo, stopnjo čistosti, stabilnost na svetlobi, stabilnost pod pogoji preskusa, lastnosti absorpcije svetlobe, pKa in rezultate raziskav o preoblikovanju, vključno z biološko razgradljivostjo v vodi.
Topnost v vodi, porazdelitveni koeficient oktanol/voda (Pov) in parni tlak preskusne snovi morajo biti znani, razpoložljiva pa mora biti tudi validirana metoda za količinsko opredelitev snovi v preskusnih raztopinah skupaj z navedeno rekuperacijo in mejo zaznavnosti.
1.6 REFERENČNA SNOV
Referenčna snov/referenčne snovi, kot je na primer 3,5-diklorofenol, ki se uporablja za mednarodni prstanasti preskus (4), se lahko preskusi kot sredstvo preskušanja preskusnega postopka. Kot referenčna snov za zelene alge se prav tako lahko uporabi kalijev dikromat. Referenčno snov je zaželeno preskusiti vsaj dvakrat letno.
1.7 VELJAVNOST PRESKUSA
Za veljavnost preskusa morajo biti izpolnjena naslednja izvedbena merila:
|
—
|
Biomasa v kontrolnih kulturah se mora v 72 urah preskusnega obdobja eksponentno povečati za faktor najmanj 16. To ustreza specifični stopnji rasti v 0,92 dneva1. Za najpogosteje uporabljene vrste je stopnja rasti ponavadi bistveno višja (glej Dodatek 1). Merilo ni izpolnjeno, kadar se uporabijo vrste, ki rastejo počasneje od tistih, ki so navedene v Dodatku 1. V tem primeru se mora preskusno obdobje podaljšati, da se zagotovi 16-kratna rast v kontrolnih kulturah, medtem ko mora biti rast eksponentna skozi celotno preskusno obdobje. Preskusno obdobje se lahko skrajša za najmanj 48 ur za ohranitev neomejene eksponentne rasti med preskusom, dokler je dosežen minimalni množitelj 16.
|
|
—
|
Povprečni koeficient variacije za posamične specifične stopnje rasti (dnevi 0–1, 1–2 in 2–3, za 72-urne preskuse) v kontrolnih kulturah (glej poglavje 1.2 v „koeficient variacije“) ne sme prekoračiti 35 %. Za računanje posamičnih specifičnih stopenj rasti glej drugi odstavek v poglavju 2.2.1. Merilo se uporablja za povprečno vrednost koeficientov variacije, izračunanih za ponovitvene kontrolne kulture.
|
|
—
|
Koeficient variacije za povprečne specifične stopnje rasti med celotnim preskusnim obdobjem v ponovitvenih kontrolnih kulturah ne sme prekoračiti 7 % v preskusih z zelenimi algami Pseudokirchneriella subcapitata in Desmodesmus
subspicatus. Za druge manj pogosto preskušene vrste vrednost ne sme prekoračiti 10 %.
|
1.8 OPIS METODE
1.8.1 Aparatura
Preskusne posode in drugi aparature, ki pridejo v stik s preskusnimi raztopinami, morajo biti v celoti iz stekla ali drugega kemijsko inertnega materiala. Predmete je treba temeljito umiti, da organski ali anorganski onesnaževalci ne ovirajo rasti alg ali sestave preskusnih raztopin.
Preskusne posode so ponavadi steklene bučke z dimenzijami, ki dopuščajo zadostno prostornino kulture za meritve med preskusom in zadosten prenos mase CO2 iz ozračja (glej drugi odstavek v poglavju 1.8.9). Količina tekočine mora biti zadostna za analitsko določanje (glej peti odstavek v poglavju 1.8.11).
Potrebna je tudi nekatera ali vsa oprema v nadaljevanju:
|
—
|
Inkubator za kultiviranje: priporoča se omara ali soba, v kateri se lahko izbrana temperatura inkubacije vzdržuje na ±2 °C.
|
|
—
|
Naprave za merjenje svetlobe: treba je poudariti, da bo metoda za merjenje jakosti svetlobe in še zlasti vrsta sprejemnika (odjemnika) vplivala na izmerjeno vrednost. Meritve naj se po možnosti izvajajo z uporabo okroglega (4 π) sprejemnika (ki reagira na neposredno in odbito svetlobo iz vseh kotov nad in pod ravnino meritve) ali sprejemnika 2 π (ki reagira na svetlobo iz vseh kotov nad ravnino meritve).
|
|
—
|
Aparatura za določanje biomase alg: število celic, ki je najpogosteje uporabljen nadomestni parameter za biomaso alg, se lahko izvede z uporabo elektronskega števca delcev, mikroskopa s števno komoro ali pretočnega citometra. Za merjenje drugih nadomestkov biomase se lahko uporabljajo pretočni citometer, fluorimeter, spektrofotometer ali kolorimeter. Pretvorni faktor, ki povezuje število celic s suho težo, je koristen za preračunavanje. Zaradi zagotovitve uporabnih meritev pri nizkih koncentracijah biomase, ko se uporablja spektrofotometer, je morda treba uporabiti kivete s svetlobno potjo vsaj 4 cm.
|
1.8.2 Preskusni organizmi
Uporabi se lahko nekaj vrst nepritrjenih mikroalg in cianobakterij. Sevi, navedeni v Dodatku 1, so se izkazali kot primerni za uporabo preskusnega postopka, določenega v tej preskusni metodi.
Pri uporabi drugih vrst je treba poročati o sevu in/ali izvoru. Treba je potrditi, da se lahko eksponentna rast izbrane preskusne alge ohrani skozi celotno preskusno obdobje pod prevladujočimi pogoji.
1.8.3 Rastno gojišče
Priporočata se dve alternativni rastni gojišči; gojišče OECD in gojišče AAP. Sestave teh gojišč so prikazane v Dodatku 2. Začetna pH vrednost ter kapaciteta pufrov (ki ureja porast pH) sta v teh dveh gojiščih različni. Zato so rezultati preskusov lahko različni, odvisno od uporabljenega gojišča, še posebno pri preskušanju ionizirajočih snovi.
Morda bo za nekatere namene, npr. pri preskušanju kovin in kelatnih reagentov ali pri preskušanju pri različnih pH vrednostih, treba prilagoditi rastno gojišče. Uporaba prilagojenega gojišča mora biti podrobno opisana in utemeljena (3)(4).
1.8.4 Začetna koncentracija biomase
Začetna biomasa v preskusnih kulturah mora biti enaka v vseh preskusnih kulturah in zadostno nizka, da dopušča eksponentno rast skozi celotno inkubacijsko obdobje brez tveganja izčrpanja hranilnih snovi. Začetna biomasa kot suha snov ne sme prekoračiti 0,5 mg/l. Priporočene so naslednje začetne koncentracije celic:
|
Pseudokirchneriella subcapitata:
|
5 × 103–104
|
celic/ml
|
|
Desmodesmus subspicatus
|
2–5 × 103
|
celic/ml
|
|
Navicula pelliculosa
|
104
|
celic/ml
|
|
Anabaena flos-aquae
|
104
|
celic/ml
|
|
Synechococcus leopoliensis
|
5 × 104–105
|
celic/ml
|
1.8.5 Koncentracija preskusne snovi
Območje koncentracije, v katerem se lahko pojavijo učinki, je lahko določeno na osnovi rezultatov iz preskusov za ugotavljanje območja. Za zadnji dokončni preskus naj se izbere najmanj pet koncentracij, razvrščenih v geometrijskih vrstah s faktorjem, ki ne presega 3,2. Za preskusno snov, ki kaže ravno krivuljo odziva koncentracije, je lahko določen višji faktor. Serije koncentracij naj po možnosti pokrivajo območje, ki povzroča 5–75-odstotno zaviranje stopnje rasti alg.
1.8.6 Ponovitve in kontrolni vzorci
Načrt preskusa mora vključevati tri ponovitve za vsako preskusno koncentracijo. Če ni zahtevana določitev NOEC, se lahko načrt preskusa prilagodi, da se poveča število koncentracij in zmanjša število ponovitev na koncentracijo. Izvedejo se najmanj tri kontrolne ponovitve, v idealnih razmerah pa naj se uporabi dvakratno število ponovitev za vsako preskusno koncentracijo.
Za analitsko določanje koncentracij preskusne snovi se lahko pripravi ločena serija preskusnih raztopin (glej četrti in šesti odstavek v poglavju 1.8.11).
Kadar se za raztapljanje preskusne snovi uporabi topilo, morajo biti v preskusni načrt vključene dodatne kontrolne kulture, ki vsebujejo topilo pri enaki koncentraciji, kot je bila uporabljena pri preskusnih kulturah.
1.8.7 Priprava kulture inokuluma
Kultura inokuluma se pripravi v preskusnem mediju 2–4 dni pred začetkom preskusa zaradi prilagoditve preskusnih alg preskusnim pogojem in zagotovitve, da so alge v eksponentni fazi rasti, ko se uporabijo za inokulacijo preskusnih raztopin. Algalno biomaso je treba prilagoditi, da lahko eksponentna rast do začetka preskusa prevlada v kulturi inokuluma. Kultura inokuluma se inkubira pod enakimi pogoji kot preskusne kulture. V kulturi inokuluma se meri porast biomase, da se zagotovi rast znotraj normalnega obsega za preskusni sev pod pogoji kultiviranja. Primer postopka za kultiviranje alg je opisan v Dodatku 3. Da ne pride do sinhrone delitve celic med preskusom, se lahko zahteva še drugi ukrep razmnoževanja kulture inokuluma.
1.8.8 Priprava preskusne raztopine
Vse preskusne raztopine morajo vsebovati enake koncentracije rastnih gojišč in začetno biomaso preskusnih alg. Preskusne raztopine izbranih koncentracij se ponavadi pripravijo z mešanjem osnovne raztopine preskusne snovi z rastnim gojiščem in kulturo inokuluma. Osnovne raztopine se ponavadi pripravijo tako, da se snov raztopi v preskusnem mediju.
Topila, npr. aceton, t-butil alkohol in dimetilformamid, se lahko uporabljajo kot nosilci za dodajanje snovi z nizko topnostjo v vodi preskusnemu mediju (2)(3). Koncentracija topila naj ne prekorači 100 µl/l in enaka koncentracija topila naj bo dodana vsem kulturam (tudi kontrolnim) v seriji preskusov.
1.8.9 Inkubacija
Preskusne posode se zaprejo z zamaški, ki prepuščajo zrak. Posode se pretresejo in postavijo v inkubator za kultiviranje. Med preskusom je potrebno imeti alge v suspenziji in omogočiti prenos CO2. V ta namen je potrebno nenehno tresenje ali mešanje. Kulture naj se ohranjajo pri temperaturi obsega 21 do 24 °C, kontrolirani pri ±2 °C. Za vrste, razen naštetih v Dodatku 1, npr. tropske vrste, so lahko primerne višje temperature, pod pogojem, da so lahko izpolnjena merila za veljavnost. Priporočeno je, da se bučke v inkubatorju naključno razporedi in dnevno prestavlja.
Vrednost pH kontrolnega medija naj se med preskusom ne poveča za več kot 1,5. Za kovine in spojine, ki delno ionizirajo pri pH okrog preskusne pH, je morda treba omejiti premik (drift) pH, da se zagotovijo ponovljivi in natančni rezultati. Premik za < 0,5 pH enot je tehnično izvedljiv in se lahko doseže tako, da se v preskusni raztopini zagotovi primerna stopnja prenosa mase CO2 iz okoliškega zraka, npr. s povečanjem stopnje tresenja. Druga možnost je zmanjšanje potrebe po CO2 z zmanjšanjem začetne biomase ali skrajšanjem trajanja preskusa.
Površina, na kateri so kulture inkubirane, naj prejema stalno, enotno fluorescentno osvetljenost, npr. „hladno belo“ svetlobo ali „dnevno svetlobo“. Sevi alg in cianobakterij se razlikujejo glede svojih zahtev po svetlobi. Izbrana jakost svetlobe naj ustreza uporabljenemu preskusnemu organizmu. Za priporočene vrst zelenih alg se na stopnji preskusnih raztopin izbere jakost svetlobe od 60 do 120 µE·m–2·s–1, kadar se meri v fotosintetično učinkovitem obsegu valovne dolžine 400–700 nm z uporabo primernega sprejemnika. Nekatere vrste, zlasti Anabaena flos-aquae, dobro rastejo pri nižjih jakostih svetlobe in se pri visokih jakostih lahko poškodujejo. Za takšne vrste naj bo izbrana povprečna jakost svetlobe v obsegu 40–60 µE·m–2·s–1. (Pri merilnikih svetlobe, umerjenih v luksih, enakovredno območje 4 440–8 880 lux za hladno belo svetlobo približno ustreza priporočeni jakosti svetlobe 60–120µE·m–2·s–1.) Jakost svetlobe v inkubacijskem območju ne odstopa od povprečne jakosti svetlobe za več kot ±15 %.
1.8.10 Trajanje preskusa
Preskus ponavadi traja 72 ur. Preskus lahko traja tudi več ali manj časa, pod pogojem da so izpolnjena vsa merila za veljavnost, navedena v poglavju 1.7.
1.8.11 Merjenje in analitsko določanje
Biomasa alg v vsaki bučki se med preskusnim obdobjem določa najmanj enkrat dnevno. Če se merjenje izvaja na majhnih količinah, vzetih iz preskusne raztopine s pipeto, je treba te ohranjati nespremenjene.
Merjenje biomase se izvaja z ročnim štetjem celic s pomočjo mikroskopa ali z elektronskim števcem delcev (s štetjem celic in/ali biovolumnom). Alternativne tehnike, npr. pretočna citometrija, klorofilna fluorescenca in vitro ali in vivo (6)(7) ali optična gostota, se lahko uporabljajo pod pogojem, da je mogoče v območju biomase v preskusu ugotoviti zadovoljivo povezavo z biomaso.
Vrednost pH raztopin se izmeri na začetku in koncu preskusa.
Če je na voljo analitski postopek za določanje preskusne snovi v uporabljenem območju koncentracije, je treba preskusne raztopine analizirati, da se preverijo začetne koncentracije in vzdrževanje koncentracij izpostavljenosti med preskusom.
Analiza koncentracije preskusne snovi na začetku in koncu preskusa nizke in visoke preskusne koncentracije in koncentracija okrog pričakovane EC50 sta lahko zadostni, kadar je verjetno, da se bodo koncentracije izpostavljenosti med preskusom razlikovale za manj kot 20 % od nominalnih vrednosti. Analiza vseh preskusnih koncentracij na začetku in koncu preskusa se priporoča, kadar je malo verjetno, da bodo koncentracije ostale znotraj 80–120 % nominalne vrednosti. Za hlapne, neobstojne ali močno adsorptivne preskusne snovi se priporoča dodatno vzorčenje za analizo v 24-urnih intervalih med obdobjem izpostavljenosti, da se bolje določijo izgube preskusne snovi. Za te snovi so potrebne posebne ponovitve. V vseh primerih je treba izvesti določanje koncentracije preskusne snovi samo na eni ponovitveni posodi pri vsaki preskusni koncentraciji (ali na vsebnostih posod, zbranih s ponovitvijo).
Preskusni medij, pripravljen posebej za analizo koncentracij izpostavljenosti med preskusom, naj se obravnavajo enako kot tisti, uporabljeni za preskušanje; npr. naj se inokulirajo z algami in inkubirajo pod enakimi pogoji. Če se zahteva analiza raztopljene koncentracije preskusne snovi, je morda treba ločiti alge od medija. Najboljše je, da se ločitev izvede s centrifugiranjem z nizkim pospeškom g, ki zadošča, da se alge usedejo.
Če obstajajo dokazi, da se je koncentracija preskušane snovi zadovoljivo ohranila znotraj ±20 % nominalne ali izmerjene začetne koncentracije skozi celoten preskus, se analiza rezultatov lahko utemelji na nominalnih ali izmerjenih začetnih vrednostih. Če je odstopanje od nominalne ali izmerjene začetne koncentracije večje od ±20 %, se analiza rezultatov utemelji na geometrijski povprečni koncentraciji med izpostavljenostjo ali na modelih, ki opisujejo upad koncentracije preskusne snovi (3)(8).
Preskus zaviranja rasti alge je bolj dinamičen preskusni sistem od večine drugih kratkoročnih preskusov toksičnosti za vodno okolje. Posledično je morda težko določiti dejanske koncentracije izpostavljenosti, še posebno za adsorptivne snovi, preskušene pri nizkih koncentracijah. Izginevanje snovi iz raztopine z adsorpcijo v naraščajočo biomaso alg v takih primerih ne pomeni, da se je snov izgubila iz preskusnega sistema. Ko je rezultat preskusa analiziran, je treba preveriti preveriti, ali upadanje v koncentraciji preskusne snovi med preskusom spremlja upadanje v zaviranju rasti. Če je tako, se lahko preuči uporaba primernega modela, ki opisuje upadanje koncentracije v preskusni snovi (8). Če ne, je morda primerno utemeljiti analizo rezultatov na začetnih (nominalnih ali izmerjenih) koncentracijah.
1.8.12 Druga opazovanja
Izvesti je treba mikroskopsko opazovanje, da se preveri normalna in zdrava navzočnost kulture inokuluma in opazuje vsako nenormalno pojavljanje alg (ki ga lahko povzroči izpostavljenost preskusni snovi) na koncu preskusa.
1.8.13 Mejni preskus
V nekaterih okoliščinah, npr. kadar predhodni preskus pokaže, da preskusna snov nima toksičnih učinkov pri koncentracijah do 100 mg·l–1 ali do svoje meje topnosti v preskusnem mediju (karkoli je nižje), se lahko izvede mejni preskus, ki vključuje primerjavo odzivov v kontrolni skupini in eni tretirani skupini (100 mg·l–1 ali koncentracija, ki je enaka meji topnosti). Zelo se priporoča, da je mejni preskus podprt z analizo koncentracije izpostavljenosti. Za mejni preskus se uporabljajo vsi prej opisani preskusni pogoji in merila za veljavnost, razen da je število tretiranih ponovitev najmanj šest. Odvisne spremenljivke v kontrolni in tretirani skupini se lahko analizirajo z uporabo statističnega testa za primerjavo načinov, npr. s študentskim t-preskusom. Če so variance obeh skupin neenake, je treba izvesti t-preskus, prilagojen za neenake variance.
1.8.14 Sprememba za močno barvane snovi
Obsevanje (jakost svetlobe) bi moralo biti na zgornjem koncu območja predvidenega s to preskusno metodo: 120µE m-2 s-1 ali več.
Svetlobna pot bi morala biti zmanjšana z zmanjšanjem količine preskusnih raztopin (v območje od 5 do 25 ml).
Primerno mešanje (na primer z zmernim stresanjem) bi moralo biti zagotovljeno za večjo pogostost izpostavitve alge večjim obsevanjem na površini kulture.
2. PODATKI
2.1 IZRIS RASTNIH KRIVULJ
Biomasa v preskusnih posodah je lahko izražena v enotah nadomestnega parametra, uporabljenega za merjenje (npr. število celic, fluorescenca).
V tabeli se predstavi ocenjena koncentracijo biomase v preskusnih kulturah in kontrolnih skupinah skupaj s koncentracijami preskusnega materiala in časom meritev, zabeleženim z ločljivostjo vsaj celih ur, da se izdela izris rastnih krivulj. Na tej stopnji so lahko uporabne tako logaritmične kot linearne lestvice, vendar so logaritmične lestvice obvezne in na splošno podajo boljšo predstavitev variacij od rastnega vzorca med preskusnim obdobjem. Eksponentna rast pri izrisu na logaritmični lestvici kaže ravno črto in naklonjenost črte (nagib) prikazuje specifično stopnjo rasti.
Z uporabo izrisov se preveri, ali kontrolne kulture skozi celotni preskus rastejo eksponentno glede na pričakovano stopnjo. Zaradi možnih napak se preverijo vse podatkovne točke in videz grafov ter neobdelani podatki in postopki. Zlasti se preverijo vse podatkovne točke, za katere se zdi, da odstopajo zaradi sistematične napake. Če je mogoče postopkovne napake očitno prepoznati in/ali so zelo verjetne, se specifična podatkovna točka označi kot izločena in se ne vključi v kasnejšo statistično analizo. (Koncentracija alg nič v eni od dveh ali treh ponovitvenih posod lahko pokaže, da posoda ni bila pravilno inokulirana ali da je bila neprimerno očiščena.) Razlogi za zavrnitev podatkovnih točk kot izločenih morajo biti jasno navedeni v poročilu o preskusu. Veljavni razlogi so samo (redko) postopkovne napake in ne le slaba natančnost. Statistični postopki za prepoznavanje izločitve imajo za to vrsto problema omejeno uporabnost in ne morejo nadomestiti strokovne presoje. Izločitve (označene kot take) naj se po možnosti ohranijo med podatkovnimi točkami, ki so prikazane v katerikoli grafični ali tabelarni predstavitvi podatkov.
2.2 ODVISNA SPREMENLJIVKA
Namen preskusa je določiti učinke preskusne snovi na rast alg. Ta preskusna metoda opisuje dve odvisni spremenljivki, ker imajo države članice različne preference in zakonodajne potrebe. Da bi bili preskusni rezultati sprejemljivi v vseh državah članicah, se morajo rezultati ovrednotiti z uporabo obeh odvisnih spremenljivk (a) in (b), ki sta:
|
(a)
|
povprečna specifična stopnja rasti: ta odvisna spremenljivka se preračuna na osnovi logaritmičnega naraščanja biomase med preskusnim obdobjem, ki je dnevno izražen;
|
|
(b)
|
prirast: ta odvisna spremenljivka je biomasa na koncu preskusa manj začetna biomasa.
|
Za rabo te metode v zakonodajnem okviru EU bi morali za izračun rezultatov uporabiti povprečno specifično hitrost rasti iz razlogov, ki so opisani spodaj. Treba je opozoriti, da toksične vrednosti, preračunane z uporabo teh dveh odvisnih spremenljivk, niso primerljive, in ta razlika mora biti priznana pri uporabi rezultatov preskusa. Vrednosti ECx, ki temeljijo na povprečni specifični stopnji rasti (ErCx), bodo na splošno višje kot rezultati, ki temeljijo na prirastu (EyCx), če se zaradi matematične osnove zadevnih pristopov upoštevajo preskusni pogoji te preskusne metode. To se ne razlaga kot razlika v občutljivosti med obema odvisnima spremenljivkama, preprosto zato ker so vrednosti matematično različne. Koncept povprečne specifične stopnje rasti temelji na splošnem eksponentnem rastnem vzorcu alg v neomejenih kulturah, kjer je toksičnost ocenjena na osnovi učinkov na stopnjo rasti in ni odvisna od absolutne vrednosti specifične kontrolne stopnje rasti, naklona krivulje koncentracija-odziv ali trajanja preskusa. Nasprotno so rezultati, ki temeljijo na odvisni spremenljivki prirasta, odvisni od vseh teh drugih spremenljivk. EyCx je odvisna od specifične stopnje rasti vrst alg, uporabljenih v vsakem preskusu, in od maksimalne specifične stopnje rasti, ki je lahko različna glede na vrsto in celo glede na seve alg. Ta odvisna spremenljivka se ne uporablja za primerjanje občutljivosti na toksične snovi med vrstami alg ali celo različnimi sevi. Medtem ko ima uporaba povprečne specifične stopnje rasti v znanosti prednost pri ocenjevanju toksičnosti, pa so v to preskusno metodo vključene tudi ocene toksičnosti, ki temeljijo na prirastu, da se zadovolji trenutnim pravnim predpisom v nekaterih državah.
2.2.1 Povprečna stopnja rasti
Povprečna specifična stopnja rasti za določeno obdobje se izračuna kot logaritmično povečanje biomase za vsako posamezno posodo kontrolnih in tretiranih skupin iz enačbe:
 (dan–1)
(dan–1)
kjer je:
|
µ
i–j
:
|
povprečna specifična stopnja rasti od časa i do j;
|
|
X
i
:
|
biomasa v času i;
|
|
X
j
:
|
biomasa v času j.
|
Srednja vrednost stopnje rasti skupaj z ocenami razhajanj se izračuna za vsako tretirano skupino in kontrolno skupino..
Povprečna specifična stopnja rasti se izračuna za celotno preskusno obdobje (ponavadi dnevi 0–3) z uporabo nominalno inokulirane biomase kot začetne vrednosti raje kot izmerjene začetne vrednosti, saj je v tem primeru dosežena večja natančnost. Če oprema za merjenje biomase dopušča zadovoljivo natančno določanje nizke biomase inokuluma (npr. pretočni citometer), potem se lahko uporabi začetna izmerjena koncentracija biomase. Prav tako se ocenijo posamične stopnje rasti, izračunane kot specifične stopnje rasti za vsak dan med potekom preskusa (dnevi 0–1, 1–2 in 2–3) in pregleda se, ali kontrolna stopnja rasti ostaja konstantna (glej merila za veljavnost, poglavje 1.7). Znatno nižja specifična stopnja rasti prvega dne od celotne povprečne specifične stopnje rasti lahko nakazuje fazo prilagajanja. Medtem ko je lahko faza prilagajanja v kontrolnih skupinah s pravilnim razmnoževanjem predkultur zmanjšana in praktično izničena, lahko faza prilagajanja v izpostavljenih kulturah nakazuje obnovitev po začetnem toksičnem stresu ali zmanjšani izpostavljenosti zaradi izgube preskusne snovi (vključno s sorpcijo na biomaso alg) po začetni izpostavljenosti. Zaradi tega se lahko oceni posamična stopnja rasti, da se ocenijo učinki preskusne snovi, ki se pojavi med obdobjem izpostavljenosti. Bistvene razlike med posamično stopnjo rasti in povprečno stopnjo rasti nakazujejo odklon od konstantne eksponentne rasti in da je zagotovljena natančna preiskava rastnih krivulj.
Odstotek zaviranja stopnje rasti za vsako tretirano ponovitev se izračuna po enačbi:
kjer je:
|
% Ir:
|
odstotek zaviranja v povprečni specifični stopnji rasti
|
|
µC:
|
srednja vrednost za povprečno specifično stopnjo rasti (µ) v kontrolni skupini;
|
|
µT:
|
povprečna specifična stopnja rasti za tretirano ponovitev.
|
Če se za pripravo preskusnih raztopin uporabijo topila, naj se pri izračunu odstotka zaviranja raje kot kontrole brez topil uporabi kontrole topil.
2.2.2 Prirast
Prirast se računa kot biomasa ob koncu preskusa manj začetna biomasa za vsako posodo kontrolnega in tretiranega vzorca. Za vsako preskusno koncentracijo in kontrolni vzorec se izračuna srednja vrednost prirasta z ocenjeno varianco. Odstotek zaviranja v prirastu (% Iy) se lahko izračuna za vsako tretirano ponovitev po enačbi:
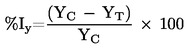
kjer je:
|
% Iy:
|
odstotek zaviranja prirasta
|
|
YC:
|
srednja vrednost prirasta v kontrolni skupini
|
|
YT:
|
vrednost prirasta za tretirano ponovitev.
|
2.3 IZRIS KRIVULJE ODZIVA KONCENTRACIJE
Izriše se odstotek zaviranja glede na logaritem koncentracije preskusne snovi in se natančno pregleda izris, pri čemer se ne upošteva vsaka takšna podatkovna točka, ki je bila izločena v prvi fazi. Skozi podatkovne točke se potegne ravna črta, in sicer ročno ali z računalniško interpolacijo, da se dobi prvi vtis o razmerju odziv-koncentracija, nato se nadaljuje z bolj podrobno metodo, po možnosti z računalniško statistično metodo. Odvisno od predvidene uporabe podatkov, kvalitete (natančnosti) in količine podatkov, kot tudi razpoložljivosti orodij za analizo podatkov, se lahko odloči (in včasih povsem upravičeno), da se ustavi analiza podatkov na tej stopnji in se preprosto prebere ključne vrednosti EC50 in EC10 (in/ali EC20) iz ročno narisane krivulje (glej tudi spodnje poglavje o spodbujevalnih učinkih). Utemeljeni razlogi za neuporabo statistične metode lahko vključujejo:
|
—
|
Podatki niso primerni za računalniške metode, saj le-te ne izdelajo nobenih bolj zanesljivih rezultatov, kot jih lahko pridobi strokovna presoja – nekateri računalniški programi v takšnih situacijah celo ne morejo izdelati zanesljive rešitve (ponovitve se ne združujejo itd.).
|
|
—
|
Spodbujevalni odzivi rasti se z uporabo razpoložljivih računalniških programov ne morejo ustrezno obravnavati (glej spodaj).
|
2.4 STATISTIČNI POSTOPKI
Cilj je pridobiti kvantitativno razmerje koncentracija-odziv z uporabo regresijske analize. Lahko se uporabi tehtana linearna regresija, po tem ko se izvede linearizacijska pretvorba podatkov o odzivu – na primer v verjetnostnih ali logaritmičnih ali Weibullovih enotah (9), vendar so nelinearni regresijski postopki prednostne metode, ki bolje obravnavajo neizogibne podatkovne nepravilnosti in odklone od enakomerne porazdelitve. Če se te nepravilnosti približujejo ničelnemu ali popolnemu zaviranju, se lahko povečajo s pretvorbo in ovirajo analizo (9). Upoštevati je treba, da so standardne metode za analizo, ki uporabljajo verjetnostne, logaritmične ali Weibullove pretvorbe, namenjene za uporabo na kvantiziranih podatkih (npr. umrljivost ali preživetje), in morajo biti ustrezno prirejene zaradi upoštevanja podatkov o rasti ali o biomasi. Posebni postopki za določanje vrednosti ECx iz stalnih podatkov so navedeni v (10), (11) in (12). Uporaba nelinearne regresijske analize je podrobneje opisana v Dodatku 4.
Za vsako odvisno spremenljivko, ki se analizira, se za izračun ocenjenih vrednosti pri vrednostih ECx uporabi razmerje koncentracija-odziv. Kadar je to mogoče, se določijo 95 % meje zaupanja za vsako oceno. Ujemanje podatkov o odzivu z regresijskim modelom naj se oceni grafično ali statistično. Regresijska analiza se izvede z uporabo posamičnih ponovitvenih odzivov in ne srednjih vrednosti tretiranih skupin. Če pa je nelinearno prilagajanje krivulj težko ali zaradi preveč razpršenih podatkov ne uspe, se težava lahko prepreči z izvedbo regresije na skupinskih srednjih vrednostih kot praktični način zmanjševanja vpliva pričakovanih izločitev. Uporaba te možnosti naj se navede v poročilu kot odklon od normalnega postopka, ker ujemanje krivulje s posamičnimi ponovitvami ni dalo dobrih rezultatov.
Ocene EC50 in meje zaupanja se prav tako lahko pridobi z uporabo linearne interpolacije z metodo vezanja (13), če so razpoložljivi regresijski modeli/metode za podatke neustrezni.
Za ocenjevanje LOEC in zato tudi NOEC ter za učinke preskusne snovi na stopnjo rasti je potrebno primerjati srednje vrednosti tretiranih skupin z uporabo tehnik analize variance (ANOVA). Srednja vrednost vsake koncentracije se nato primerja s srednjo vrednostjo kontrolnih skupin z uporabo primerne multiple primerjave ali preskusne metode trenda. Uporabna sta lahko Dunnettov ali Williamsov preskus (14)(15)(16)(17)(18). Potrebno je oceniti, ali predpostavka o homogenosti variance ANOVA drži. Ta ocena se lahko izvede grafično ali s formalnim preskusom (18). Primerna preskusa sta Levenejev in Bartlettov. Neizpolnjevanje predpostavke o homogenosti varianc se lahko včasih popravi z logaritmično pretvorbo podatkov. Če je heterogenost variance velika in je s pretvorbo ni mogoče popraviti, se obravnava analiza z metodami kot so Jonckheerevi step-down preskusi trenda. Dodatna navodila o določanju NOEC so navedena v (12).
Nedavni znanstveni razvoj je privedel do priporočila o opustitvi koncepta NOEC in nadomestitve le-tega z regresijo, ki temelji na ocenjenih vrednostih ECx. Za ta preskus alg ni bila določena primerna vrednost x. Primerno je območje 10 do 20 % (odvisno od izbrane odvisne spremenljivke) in po možnosti naj se poroča tako o EC10 kot tudi o EC20.
2.5 SPODBUJANJE RASTI
Pri nizkih koncentracijah je včasih opaženo spodbujanje rasti (negativno zaviranje). To je lahko posledica hormeze („spodbujanje toksičnosti“) ali dodajanja spodbujevalnih rastnih faktorjev s preskusnim materialom minimalnemu uporabljenemu mediju. Upoštevati je treba, da dodajanje anorganskih hranil naj ne bi imelo nobenih neposrednih učinkov, saj naj bi preskusni medij ohranjal presežek hranil skozi celoten preskus. Nizek odmerek spodbujanja se ponavadi ne upošteva pri računanju EC50, razen če je zelo velik. Če pa je zelo velik ali če se izračuna vrednost ECx za nizek x, so potrebni posebni postopki. Brisanju spodbujevalnih odzivov iz analize podatkov se je treba izogibati, če je mogoče, in če razpoložljiva programska oprema za prilagajanje krivulje ne more sprejeti manjših spodbujanj, se lahko uporabi linearna interpolacija z metodo vezanja. Če je spodbujanje zelo veliko, naj se obravnava model hormeze (19).
2.6 NETOKSIČNO ZAVIRANJE RASTI
Preskusni materiali, ki absorbirajo svetlobo, lahko povzročijo zmanjšanje stopnje rasti, ker senčenje zmanjša količino razpoložljive svetlobe. Takšne fizikalne učinke je treba s prilagoditvijo preskusnih pogojev ločiti od toksičnih učinkov in o njih ločeno poročati. Navodila so navedena v (2) in (3).
3. POROČANJE
3.1 POROČILO O PRESKUSU
Poročilo o preskusu mora vsebovati:
Preskusno snov:
|
—
|
fizične značilnosti in fizikalno kemijske lastnosti, vključno z mejo topnosti v vodi,
|
|
—
|
kemijske identifikacijske podatke, vključno s čistostjo.
|
Preskusne vrste:
|
—
|
sev, dobavitelja ali vir in uporabljene pogoje gojenja.
|
Preskusne pogoje:
|
—
|
podatke o začetku preskusa in njegovo trajanje,
|
|
—
|
opis načrta preskusa: preskusne posode, volumne kultur, gostoto biomase na začetku preskusa,
|
|
—
|
preskusne koncentracije in ponovitve (npr. število ponovitev, število uporabljenih preskusnih koncentracij in geometrijskih naraščanj),
|
|
—
|
opis priprave preskusnih raztopin, vključno z uporabo topil itd.,
|
|
—
|
inkubator za kultiviranje,
|
|
—
|
jakost in kvaliteto svetlobe (vir, homogenost),
|
|
—
|
preskušene koncentracije: nominalne preskusne koncentracije in vsake rezultate analiz, da se določi koncentracija preskusne snovi v preskusnih posodah Poroča naj se o rekuperaciji metode in meji količinske določitve v preskusni matrici,
|
|
—
|
vse odklone od te preskusne metode,
|
|
—
|
metodo za določanje biomase in dokaze o korelaciji med izmerjenim parametrom in suho težo.
|
Rezultate:
|
—
|
pH vrednosti na začetku in koncu preskusa za vsa tretiranja,
|
|
—
|
biomaso za vsako bučko pri vsaki točki meritve in metodo za merjenje biomase,
|
|
—
|
rastne krivulje (izris biomase glede na čas),
|
|
—
|
izračunane odvisne spremenljivke za vsako tretirano ponovitev, s srednjimi vrednostmi in koeficienti variacij za ponovitve,
|
|
—
|
grafično predstavitev razmerja koncentracija/učinek,
|
|
—
|
ocene toksičnosti za odvisne spremenljivke, npr. EC50, EC10, EC20 in pripadajoče intervale zaupanja. Če sta izračunani, LOEC in NOEC in statistične metode, uporabljene za njuno določitev,
|
|
—
|
če je bila uporabljena ANOVA, velikost učinka, ki je bil opažen (npr. najmanj pomembna razlika),
|
|
—
|
vsako spodbujanje rasti, ki se je pokazalo pri katerem koli tretiranju,
|
|
—
|
vse druge opažene učinke, npr. morfološke spremembe alg,
|
|
—
|
razpravo o rezultatih, vključno z vsakim vplivom na izid preskusa, ki izhaja iz odklonov od preskusne metode.
|
4. VIRI
|
(1)
|
OECD TG 201 (2006). Freshwater Alga and Cyanobacteria, Growth Inhibition Test.
|
|
(2)
|
ISO 1998: Water quality – Guidance for algal growth inhibition tests with poorly soluble materials, volatile compounds, metals and waster water. ISO/DIS 14442.
|
|
(3)
|
OECD 2000: Guidance Document on Aquatic Toxicity Testing of Difficult Substances and mixtures. Environmental Health and Safety Publications. Series on Testing and Assessment, št. 23.
|
|
(4)
|
ISO 1998: Water quality – Sampling – Part 16: General Guidance for Biotesting. ISO 5667–16.
|
|
(5)
|
ISO 1993: Water quality – Algal growth inhibition test. ISO 8692.
|
|
(6)
|
Mayer, P., Cuhel, R. in Nyholm, N. (1997). A simple in vitro fluorescence method for biomass measurements in algal growth inhibition tests. Water Research 31: 2525–2531.
|
|
(7)
|
Slovacey, R.E. in Hanna, P.J. In vivo fluorescence determinations of phytoplancton chlorophyll, Limnology & Oceanography 22,5 (1977), str. 919–925.
|
|
(8)
|
Simpson, S.L., Roland, M.G.E., Stauber, J.L. in Batley, G.E. (2003) Effect of declining toxicant concentrations on algal bioassay endpoints. Environ. Toxicol. Chem 22, 2073–2079.
|
|
(9)
|
Christensen, E.R., Nyholm, N. (1984): Ecotoxicological Assays with Algae: Weibull Dose-Response Curves. Env. Sci. Technol. 19, 713–718.
|
|
(10)
|
Nyholm, N. Sørensen, P.S., Kusk, K.O. in Christensen, E.R. (1992): Statistical treatment of data from microbial toxicity tests. Environ. Toxicol. Chem. 11, 157–167.
|
|
(11)
|
Bruce, R.D. in Versteeg, D.J. (1992). A statistical procedure for modelling continuous toxicity data. Env. Toxicol. Chem. 11:1485–1494.
|
|
(12)
|
OECD. (2004). Guidance Document on Statistical Analysis of Ecotoxicity Data.
|
|
(13)
|
Norberg-King T.J. (1988). An interpolation estimate for chronic toxicity: The ICp approach. National Effluent Toxicity Assessment Center Technical Report 05–88. USEPA, Duluth, MN.
|
|
(14)
|
Dunnett, C.W. (1955). A multiple comparisons procedure for comparing several treatments with a control. J. Amer. Statist. Assoc. 50: 1096–1121.
|
|
(15)
|
Dunnett, C.W. (1964). New tables for multiple comparisons with a control. Biometrics 20: 482–491.
|
|
(16)
|
Williams, D.A. (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27: 103–117.
|
|
(17)
|
Williams, D.A. (1972). The comparison of several dose levels with a zero dose control. Biometrics 28: 510–531.
|
|
(18)
|
Draper, N.R. in Smith, H. (1981). Applied Regression Analysis, second edition. Wiley, New York.
|
|
(19)
|
Brain P. in Cousens R. (1989). An equation to describe dose-responses where there is stimulation of growth at low doses. Weed Research, 29, 93–96.
|
Dodatek 1
Sevi, dokazano primerni za preskušanje
Zelene alge
|
—
|
Pseudokirchneriella subcapitata, (prej poznana kot Selenastrum capricornutum), ATCC 22662, CCAP 278/4, 61.81 SAG
|
|
—
|
Desmodesmus subspicatus (prej poznana kot Scenedesmus subspicatus) 86.81 SAG
|
Kremenaste alge
|
—
|
Navicula pelliculosa, UTEX 664
|
Cianobakterije
|
—
|
Anabaena flos-aquae, UTEX 1444, ATCC 29413, CCAP 1403/13A
|
|
—
|
Synechococcus leopoliensis, UTEX 625, CCAP 1405/1
|
Viri sevov
Priporočeni sevi so na voljo v kulturah z eno samo vrsto alg v naslednjih zbirkah (po abecednem vrstnem redu):
|
|
|
ATCC: American Type Culture Collection
|
|
10801 University Boulevard
|
|
Manassas, Virginia 20110–2209
|
|
USA
|
|
|
|
|
CCAP, Culture Collection of Algae and Protozoa
|
|
Institute of Freshwater Ecology,
|
|
Windermere Laboratory
|
|
Far Sawrey, Amblerside
|
|
Cumbria
|
|
LA22 0LP
|
|
UK
|
|
|
|
|
SAG: Sammlung von Algenkulturen
|
|
Albrecht-von-Haller-Institut
|
|
Universität Göttingen
|
|
Nikolausberger Weg 18
|
|
37073 Göttingen
|
|
GERMANY
|
|
|
|
|
UTEX Culture Collection of Algae
|
|
Section of Molecular, Cellular and Developmental Biology
|
|
School of Biological Sciences
|
|
the University of Texas at Austin
|
|
Austin, Texas 78712
|
|
USA
|
|
Videz in značilnosti priporočenih vrst
|
|
P. subcapitata
|
D. subspicatus
|
N. pelliculosa
|
A. flos-aquae
|
S. leopoliensis
|
|
Videz
|
upognjene, zvite posamezne celice
|
ovalne, v glavnem posamezne celice
|
paličice
|
verige ovalnih celic
|
paličice
|
|
Velikost (Lș × șW) µm
|
8–14 × 2–3
|
7–15 × 3–12
|
7,1 × 3,7
|
4,5 × 3
|
6 × 1
|
|
Volumen celice (µm3/celico)
|
40–60 (1)
|
60–80 (1)
|
40–50 (1)
|
30–40 (1)
|
2,5 (2)
|
|
Suha teža celice (mg/celico)
|
2–3 × 10–8
|
3–4 × 10–8
|
3–4 × 10–8
|
1–2 × 10–8
|
2–3 × 10–9
|
|
Stopnja rasti (3) (dan–1)
|
1,5–1,7
|
1,2–1,5
|
1,4
|
1,1–1,4
|
2,0–2,4
|
Posebna priporočila o kultiviranju in ravnanju s priporočenimi preskusnimi vrstami
Pseudokirchneriella subcapitata in Desmodesmus subspicatus
Te zelene alge se na splošno lahko vzdržuje v različnih gojiščih kultur. Podatki o primernih gojiščih so na voljo v zbirkah kultur. Celice so ponavadi samotarske, meritve celične gostote pa se lahko izvedejo na enostaven način z uporabo elektronskega merilca delcev ali mikroskopa.
Anabaena flos-aquae
Za gojenje osnovne kulture se lahko uporabijo različna rastna gojišča. Zelo pomembno je, da se šaržni kulturi ne dopusti, da gre preko logaritemske faze rasti, kadar se obnavlja, saj je na tej stopnji obnova težka.
Anabaena flos-aquae razvije skupke ugnezdenih verig celic. Velikost teh skupkov je glede na pogoje kultiviranja lahko različna. Te skupke je pri štetju s pomočjo mikroskopa ali ob uporabi elektronskega števca delcev za določanje biomase morda treba ločiti.
Za ločevanje verig se lahko uporabi ultrazvočno razbijanje podvzorcev, da se zmanjša variabilnost štetja. Daljše ultrazvočno razbijanje od priporočenega za ločevanje verig v krajše dolžine lahko uniči celice. Jakost in trajanje ultrazvočnega razbijanja morata biti enaka za vse tretirane skupine.
Na hemocitometru se prešteje dovolj polj (najmanj 400 celic), da se nadomesti variabilnost. To bo izboljšalo zanesljivost mikroskopskega določanja gostote.
Elektronski števec delcev se lahko uporabi za določanje celotnega volumna celic alg Anabaena po ločevanju celičnih verig z natančnim ultrazvočnim razbijanjem. Energijo ultrazvočnega razbijanja je treba prilagoditi, da se prepreči razkroj celic.
Da se zagotovi dobro premešano in homogeno suspenzijo alg, ki se uporabi za inokulacijo preskusnih posod, se uporabi mešalnik vortex ali podobna primerna metoda.
Preskusne posode naj se postavijo na krožno in recipročno stresalno mizo pri približno 150 obratih na minuto. Alternativno se lahko uporabi prekinjeno tresenje za zmanjšanje težnje Anabaene po oblikovanju grud. Če se grude pojavijo, je treba paziti, da se doseže reprezentativne vzorce za merjenje biomase. Za razdrobitev grud je lahko pred vzorčenjem potrebno močno tresenje.
Synechococcus leopoliensis
Za gojenje osnovne kulture se lahko uporabijo različna rastna gojišča. Podatki o primernih gojiščih so na voljo v zbirkah kultur.
Synechococcus leopoliensis raste kot samotarske celice v obliki paličic. Celice so zelo majhne, kar otežuje uporabo mikroskopskega štetja za merjenje biomase. Uporabni so elektronski števci delcev, opremljeni za štetje delcev do najmanjše velikosti približno 1 µm. Primerne so tudi in vitro fluorometrične meritve.
Navicula pelliculosa
Za gojenje osnovne kulture se lahko uporabijo različna rastna gojišča. Podatki o primernih gojiščih so na voljo v zbirkah kultur. Pomembno si je zapomniti, da je v gojišču zahtevan silikat.
Navicula pelliculosa lahko pod določenimi rastnimi pogoji oblikuje skupke. Celice alg se zaradi proizvajanja lipidov včasih kopičijo na površinski prevleki. V teh okoliščinah je potrebno zagotoviti posebne ukrepe, ko se vzame podvzorce za določanje biomase, da se pridobi reprezentativne vzorce. Morda je lahko potrebno močno stresanje, npr. z uporabo mešalnika vortex.
(1) Izmerjeno z elektronskim števcem delcev
(2) Izračunano iz velikosti
(3) Najpogosteje opazovana stopnja rasti v gojišču OECD pri jakosti svetlobe približno µE·m–2·s–1 in 21 °C
Dodatek 2
Rastno gojišče
Uporabiti se sme eno od naslednjih dveh rastnih gojišč:
Gojišče OECD: Originalno gojišče OECD TG 201, tudi v skladu z ISO 8692
US. EPA gojišče AAP tudi v skladu z ASTM.
Pri pripravi teh gojišč naj se uporabi reagentne ali analitsko čiste kemikalije in deionizirana voda.
Sestava gojišča AAP (US. EPA) in gojišča OECD TG 201
|
Sestavina
|
EPA
|
OECD
|
|
|
mg/l
|
mM
|
mg/l
|
mM
|
|
NaHCO3
|
15,0
|
0,179
|
50,0
|
0,595
|
|
NaNO3
|
25,5
|
0,300
|
|
|
|
NH4Cl
|
|
|
15,0
|
0,280
|
|
MgCl2·6(H2O)
|
12,16
|
0,0598
|
12,0
|
0,0590
|
|
CaCl2·2(H2O)
|
4,41
|
0,0300
|
18,0
|
0,122
|
|
MgSO4·7(H2O)
|
14,6
|
0,0592
|
15,0
|
0,0609
|
|
K2HPO4
|
1,044
|
0,00599
|
|
|
|
KH2PO4
|
|
|
1,60
|
0,00919
|
|
FeCl3·6(H2O)
|
0,160
|
0,000591
|
0,0640
|
0,000237
|
|
Na2EDTA·2(H2O)
|
0,300
|
0,000806
|
0,100
|
0,000269 (1)
|
|
H3BO3
|
0,186
|
0,00300
|
0,185
|
0,00299
|
|
MnCl2·4(H2O)
|
0,415
|
0,00201
|
0,415
|
0,00210
|
|
ZnCl2
|
0,00327
|
0,000024
|
0,00300
|
0,0000220
|
|
CoCl2·6(H2O)
|
0,00143
|
0,000006
|
0,00150
|
0,00000630
|
|
Na2MoO4·2(H2O)
|
0,00726
|
0,000030
|
0,00700
|
0,0000289
|
|
CuCl2.2(H2O)
|
0,000012
|
0,00000007
|
0,00001
|
0,00000006
|
|
pH
|
7,5
|
8,1
|
V preskusu s kremenasto algo Navicula pelliculosa morata biti obe gojišči dopolnjeni z Na2SiO3·9H20, da se pridobi koncentracija 1,4 mg Si/l.
PH gojišča se pridobi z ravnovesjem med karbonatnim sistemom gojišča in parcialnim tlakom CO2 v atmosferskem zraku. Približno razmerje med pH pri 25 °C in koncentracijo molarnega bikarbonata je:
pHeq = 11,30 + log [HCO3]
S 15 mg NaHCO3/l, pHeq = 7,5 (gojišče U.S. EPA in s 50 mg NaHCO3/l, pHeq = 8,1 (gojišče OECD).
Elementna sestava v preskusnih gojiščih
|
Element
|
EPA
|
OECD
|
|
|
mg/l
|
mg/l
|
|
C
|
2,144
|
7,148
|
|
N
|
4,202
|
3,927
|
|
P
|
0,186
|
0,285
|
|
K
|
0,469
|
0,459
|
|
Na
|
11,044
|
13,704
|
|
Ca
|
1,202
|
4,905
|
|
Mg
|
2,909
|
2,913
|
|
Fe
|
0,033
|
0,017
|
|
Mn
|
0,115
|
0,115
|
Priprava gojišča OECD
|
Hranilo
|
Koncentracija v osnovni raztopini
|
|
Osnovna raztopina 1: makrohranilne snovi
|
|
NH4Cl
MgCl2·6H2O
CaCl2·2H2O
MgSO4·7H2O
KH2PO4
|
1,5 g·l–1
1,2 g·l–1
1,8 g·l–1
1,5 g·l–1
0,16 g·l–1
|
|
Osnovna raztopina 2: železo
|
|
FeCl3·6H2O
Na2EDTA·2H2O
|
64 mg·l–1
100 mg·l–1
|
|
Osnovna raztopina 3: elementi v sledovih
|
|
H3BO3
MnCl2·4H2O
ZnCl2
CoCl2·6H2O
CuCl2·2H2O
Na2MoO4·2H2O
|
185 mg·l–1
415 mg·l–1
3 mg·l–1
1,5 mg·l–1
0,01 mg·l–1
7 mg·l–1
|
|
Osnovna raztopina 4: bikarbonat
|
|
NaHCO3
|
50 g·l–1
|
|
Na2SiO3·9H20
|
|
Osnovne raztopine se sterilizira z membransko filtracijo (s povprečnim premerom por 0,2 µm) ali avtoklaviranjem (120 °C, 15 min). Raztopine se shrani v temnem prostoru pri 4 °C.
Raztopin 2 in 4 se ne avtoklavira, temveč le sterilizira z membransko filtracijo.
Rastno gojišče se pripravi z dodajanjem primerne količine raztopin 1–4 vodi.
K 500 ml sterilizirane vode se doda:.
|
—
|
10 ml osnovne raztopine 1
|
|
—
|
1 ml osnovne raztopine 2
|
|
—
|
1 ml osnovne raztopine 3
|
|
—
|
1 ml osnovne raztopine 4
|
Do 1 000 ml se dopolni s sterilizirano vodo.
Za vzpostavljanje ravnovesja gojišča z atmosferskim CO2 se dopusti dovolj časa; če je potrebno, s pomočjo prepihovanja sterilnega filtriranega zraka za nekaj ur.
Priprava gojišča AAP
|
A1.1
|
Po 1 ml vsake osnovne raztopine A1.2.1–A1.2.7 se dolije v približno 900 ml deionizirane ali destilirane vode, nato se raztopina razredči na 1 liter.
|
|
A1.2
|
Makrohranilne osnovne raztopine se pridobijo z raztapljanjem spodaj navedenih snovi v 500 ml deionizirane ali destilirane vode. Reagenti A1.2.1, A1.2.2, A1.2.3, in A1.2.4 se lahko združijo v eno osnovno raztopino.
|
|
A1.2.2
|
MgCl2
·6H2O – 6,082 g.
|
|
A1.2.3
|
CaCl2
·2H2O – 2,205 g.
|
|
A1.2.4
|
Mikrohranilna osnovna raztopina – (glej A1.3).
|
|
A1.2.5
|
MgSO4·7H2O – 7,350 g.
|
|
A1.2.8
|
Na2SiO3·9H2O – glej opombo A1.1.
Opomba A1.1 – Uporablja se samo za preskusne vrste kremenastih alg. Doda se lahko neposredno (202,4 mg) ali z dodajanjem osnovne raztopine do končne koncentracije 20 mg/l Si v gojišču.
|
|
A1.3
|
Mikrohranilna osnovna raztopina se pridobi z raztapljanjem spodaj navedenih snovi v 500 ml deionozirane ali destilirane vode.
|
|
A1.3.1
|
H3BO3
– 92,760 mg.
|
|
A1.3.2
|
MnCl2·4H2O – 207,690 mg.
|
|
A1.3.4
|
FeCl3·6H2O – 79,880 mg.
|
|
A1.3.5
|
CoCl2·6H2O – 0,714 mg.
|
|
A1.3.6
|
Na2MoO4·2H2O – 3,630 mg.
|
|
A1.3.7
|
CuCl2·2H2O – 0,006 mg.
|
|
A1.3.8
|
Na2EDTA·2H2O – 150,000 mg.
[dinatrijev (etilendinitrilo) tetraacetat].
|
|
A1.3.9
|
Na2SeO4·5H2O – 0,005 mg. Glej opombo A1.2.
Opomba A1.2 – Uporablja se samo za gojišča za osnovne raztopine vrst kremenastih alg.
|
|
A1.4
|
pH se uravna na 7,5 ± 0,1 z 0,1 N ali 1,0 N NaOH ali HCl.
|
|
A1.5
|
Gojišče se filtrira v sterilni vsebnik skozi 0,22-μm membranski filter, če se uporabi števec delcev, ali skozi 0,45-μm filter, če se števec delcev ne uporabi.
|
|
A1.6
|
Gojišče se do uporabe shrani v temnem prostoru pri temperaturi približno 4 °C.
|
(1) Molarno razmerje EDTA in železa neznatno presega enoto. To preprečuje usedline železa in istočasno zmanjšuje kelacijo ionov težkih kovin.
Dodatek 3
Primer postopka kultiviranja alg
Splošne opombe
Namen kultiviranja po naslednjem postopku je pridobiti kulture alg za preskuse toksičnosti.
Uporabiti je treba primerne metode, s katerimi se zagotovi, da se kulture alg ne okužijo z bakterijami. Lahko so zaželene aksenične kulture, vsekakor pa se morajo uvesti in uporabiti kulture z eno samo vrsto alg.
Vse postopke je treba izvesti v sterilnih pogojih, da se prepreči okužba z bakterijami in drugimi algami.
Oprema in materiali
Glej v Preskusni metodi: Aparatura.
Postopki za pridobivanje kultur alg
Priprava hranilnih raztopin (gojišče):
Vse hranilne soli gojišča se pripravi kot koncentrirane osnovne raztopine ter hrani v temnem in hladnem prostoru. Te raztopine se sterilizirajo s filtracijo ali avtoklaviranjem.
Gojišče se pripravi z dodajanjem pravilne količine osnovne raztopine sterilni destilirani vodi, pri čemer se pazi, da ne pride do okužbe. Za trdno gojišče se doda 0,8 % agarja.
Osnovna kultura:
Osnovne kulture so majhne kulture alg, ki se redno prenašajo v sveža gojišča in se uporabljajo kot začetni preskusni material. Če se kulture ne uporabljajo redno, se nanesejo na poševna agarska gojišča v epruvetah. Nato se najmanj enkrat na dva meseca prenesejo na sveže gojišče.
Osnovne kulture se gojijo v erlenmajericah z ustreznim gojiščem (volumen približno 100 ml). Kadar se alge inkubirajo pri 20 °C ob stalni osvetlitvi, jih je treba na sveže gojišče prenesti enkrat na teden.
Med prenosom se del „stare“ kulture s sterilno pipeto prenese v erlenmajerico s svežim gojiščem, tako da je pri hitro rastoči vrsti začetna koncentracija približno 100-krat manjša, kakor v stari kulturi.
Stopnja rasti vrste se lahko določi iz rastne krivulje. Če je ta znana, se lahko oceni gostota, pri kateri je treba kulturo prenesti v novo gojišče. To je treba storiti, preden kultura doseže fazo odmiranja.
Predkultura:
Predkultura je namenjena pridobivanju količine alg, primerne za inokulacijo preskusnih kultur. Predkultura se inkubira v pogojih preskusa in uporabi, ko je še v eksponentni fazi rasti, običajno po 2–4 dneh inkubacije. Kulture alg, ki vsebujejo deformirane ali nenormalne celice, je treba zavreči.
Dodatek 4
Analiza podatkov pri nelinearni regresiji
Splošni premisleki
Odziv v preskusih alg in drugih mikrobioloških rastnih preskusih – rast biomase je po naravi stalna ali metrična spremenljivka – stopnja postopka, če se uporabi stopnja rasti, in njen integral v času, če je izbrana biomasa. Obe sta v povezavi z ustreznim povprečnim odzivom ponovitvenih neizpostavljenih kontrolnih skupin in kažeta največji odziv pri uvedenih pogojih – s svetlobo in temperaturo kot osnovnima določevalnima dejavnikoma v preskusu alg. Sistem je porazdeljen ali homogen in biomasa se lahko šteje za kontinuum brez ozira na posamezne celice. Porazdelitev variance vrste odziva za takšen sistem se nanaša izključno na eksperimentalne dejavnike (opisane značilno z logaritmično normalno ali normalno porazdelitvijo napake). To je v nasprotju s tipičnimi biološkimi odzivi s kvantiziranimi podatki, pri katerih se pogosto pričakuje, da bo toleranca (tipično binominalno porazdeljena) posameznih organizmov prevladujoča komponenta variance. Odzivi kontrole so nič ali raven naravnega ozadja.
V enostavnih razmerah se normiran ali relativni odziv, r, monotono zmanjša od 1 (ničelno zaviranje) do 0 (100-odstotno zaviranje). Zapomniti si je treba, da vse odzive spremlja napaka, tako da se lahko navidezno negativna zaviranja izračuna samo kot rezultat naključne napake.
Regresijska analiza
Modeli
Regresijska analiza je namenjena kvantitativnemu opisovanju krivulje koncentracija-odziv v obliki matematične regresijske funkcije Y = f (C) ali bolj pogoste F (Z), kjer je Z = log C. Če se jo uporabi inverzno, potem C = f–1 (Y) dopušča izračun številk ECx, vključno z EC50, EC10 in EC20, in njihovimi 95 % mejami zaupanja. Za več preprostih matematičnih funkcijskih oblik se je izkazalo, da uspešno opisujejo razmerja koncentracija-odziv, ki nastanejo v preskusih zaviranja rasti alg. Funkcije na primer vključujejo logistično enačbo, nesimetrično Weibullovo enačbo in funkcijo logaritemsko normalne porazdelitve, ki so vse sigmoidne krivulje, ki se asimptotično približujejo ena za C → 0 in nič za C → neskončno.
Uporaba stalnih funkcijskih modelov praga (npr. Kooijmanov model za „zaviranje rasti populacije“ Kooijman et al. 1996) je nedavno predlagana ali alternativna asimptotičnim modelom. Ta model ne pričakuje učinkov pri koncentracijah pod določenim pragom, EC0+, ki je ocenjen z ekstrapolacijo razmerja odziv-koncentracija pri preseku osi koncentracije z uporabo enostavne zvezne funkcije, ki je v začetni točki nediferenciabilna.
Zapomniti si je treba, da je analiza lahko enostavno zmanjšanje vsot preostalih kvadratov (pričakovana konstantna varianca) ali ovrednotenih kvadratov, če se heterogenost variance izravna.
Postopek
Ta postopek se izvede takole: izberemo ustrezno funkcijsko enačbo, Y = f (C), in jo z nelinearno regresijo prilagodimo podatkom. Raje kot srednje vrednosti ponovitev uporabimo meritve iz vsake posamezne bučke, da zberemo toliko podatkov, kot je le mogoče. Če je na drugi strani varianca visoka, praktične izkušnje kažejo, da lahko srednje vrednosti ponovitev zagotavljajo bolj robustno matematično oceno, na katero manj vplivajo naključne napake v podatkih, kot pa pri vsaki ohranjeni posamezni podatkovni točki.
Izrišemo prilagojeno krivuljo in izmerjene podatke ter raziščemo, ali je krivulja ustrezno prilagojena. Analiza ostankov je lahko za ta namen še posebej koristno orodje. Če izbrano funkcijsko razmerje, ki naj ustreza odzivu pri posameznih koncentracijah, ne odraža celotne krivulje ali njenega pomembnega dela, na primer odziva pri nizkih koncentracijah, izberemo drugo možnost prilagajanja krivulje – npr. nesimetrično krivuljo, kot je Weibullova funkcija, namesto simetrične. Negativna zaviranja rasti lahko povzročajo težave, na primer pri logaritmično normalni porazdelitveni funkciji, ki prav tako zahteva alternativno regresijsko funkcijo. Takšnim negativnim vrednostim ni priporočeno dodeliti ničelne ali majhne pozitivne vrednosti, ker to izkrivi porazdelitve napak. Lahko je primerno narediti ločene prilagoditve krivulj na delih krivulje, kot je nizki delež zaviranja rasti, da se oceni številke EClow x. Iz prilagojene enačbe (z „inverzno oceno“, C = f–1 (Y), izračunamo karakteristične ocenjene vrednosti ECx, in poročamo najmanj o ocenah EC50 in eni ali dveh ocenah EClow x. Izkušnje praktičnega preskušanja so pokazale, da natančnost preskusov alg ponavadi dopušča sprejemljivo natančno ovrednotenje pri 10 % stopnji zaviranja rasti, če so podatkovne točke zadovoljive – razen če se pri nizkih koncentracijah kot moteč dejavnik pojavi spodbujanje rasti. Natančnost ocene EC20 je pogosto znatno boljša kot ocena EC10, ker je EC20 ponavadi na približno linearnem delu osrednje krivulje odziva koncentracije. Včasih je EC10 težko razložiti zaradi spodbujanja rasti. Zato je, medtem ko je EC10 ponavadi dosežena z zadostno natančnostjo, priporočeno tudi stalno poročanje o EC20.
Utežni dejavniki
Eksperimentalna varianca pogosto ni konstantna in značilno vsebuje sorazmerno komponento, zato je bolj primerna rutinsko izvedena tehtana regresija. Utežni dejavniki za takšno analizo se ponavadi predpostavljajo kot obratno sorazmerni varianci.
Wi = 1/Var(ri)
Veliko regresijskih programov dopušča možnost analize tehtane regresije z utežnimi dejavniki, ki so navedeni v tabeli. Ustrezno naj se utežni dejavniki normalizirajo tako, da se jih pomnoži z n/Σ wi (n je število podatkovnih točk), tako da je njihova vsota enaka ena.
Normalizacijski odzivi
Normaliziranje s povprečnim odzivom kontrole povzroča nekatere temeljne probleme in prinaša precej zapleteno strukturo variance. Z deljenjem odzivov s povprečnim odzivom kontrole za pridobitev deleža zaviranja rasti predstavimo dodatno napako, ki jo povzroči napaka pri srednji vrednosti kontrole. Razen če je napaka zanemarljivo majhna, morajo biti utežni dejavniki v regresiji in meje zaupanja popravljeni za kovarianco s kontrolo (17). Treba si je zapomniti, da je velika natančnost pri ocenjenem povprečnem odzivu kontrole pomembna, da se lahko zmanjša celotna varianca za relativni odziv. Ta varianca je:
(spodnji indeks i se nanaša na stopnjo koncentracije i in spodnji indeks 0 na kontrole)
Yi = relativni odziv = ri/r0 = 1 – I = f (Ci)
z varianco:
Var (Yi) = Var (ri/r0) ≅ (∂Yi / ∂ ri)2·Var(ri) + (∂ Yi/ ∂ r0)2·Var (r0)
in ker je
(∂ Yi/ ∂ ri) = 1/r0 in (∂ Yi / ∂ r0) = ri/r0
2
z normalno porazdeljenimi podatki ter mi in m0 ponovitvami:
Var(ri) = σ2/mi
celotna varianca relativnega odziva, Yi postane:
Var(Yi) = σ2/(r0
2 mi) + ri
2·σ2/r0
4 m0
Napaka srednje vrednosti kontrole je obratno sorazmerna s kvadratnim korenom števila povprečnih kontrolnih ponovitev, in se včasih lahko določi, da se vključi podatke preteklih študij in tako zelo zmanjša napake. Alternativni postopek ni normaliziranje podatkov in prilagajanje absolutnih odzivov, vključno s podatki odziva kontrole, temveč predstavitev vrednosti odziva kontrole kot dodatnega parametra, ki ga je treba prilagoditi z nelinearno regresijo. Ta metoda potrebuje z običajno 2-parametrsko regresijsko enačbo prilagajanje 3 parametrov in zato zahteva več podatkovnih točk kot nelinearna regresija na podatkih, ki so normalizirani z uporabo vnaprej določenega odziva kontrole.
Obratni intervali zaupanja
Izračun intervalov zaupanja nelinearne regresije z obratno oceno je bolj zapleten in v navadnih statističnih računalniških programskih paketih ni razpoložljiva standardna možnost. Približne meje zaupanja se lahko pridobijo s standardnimi programi nelinearne regresije s ponovno parameterizacijo (Bruce in Versteeg, 1992), ki vključuje predelavo matematične enačbe z želenimi ocenjenimi vrednostmi, npr. EC10 in EC50 kot parametri, ki se jih mora oceniti. Naj bo funkcija I = f (α, β, koncentracija) in izkoristimo razmerja definicij f (α, β, EC10) = 0,1 in f (α, β, EC50) = 0,5, da nadomestimo f (α, β, koncentracija) z enakovredno funkcijo g (EC10, EC50, koncentracija.
Bolj neposredni izračun (Andersen et al, 1998) se izvede tako, da obdržimo izvirno enačbo in uporabimo Taylorjev raztezek pri srednjih vrednostih za ri in r0
Nedavno so postale priljubljene metode vezanja. Take metode uporabljajo izmerjene podatke in naključno število pogostnega ponovnega vzorčenja, ki ga usmerja generator, da se oceni empirična porazdelitev variance.
Viri
Kooijman, S.A.L.M.; Hanstveit, A.O.; Nyholm, N. (1996): No-effect concentrations in algal growth inhibition tests. Water Research, 30, 1625–1632.
Bruce, R.D. in Versteeg, D.J.(1992) A Statistical Procedure for Modelling Continuous Ecotoxicity Data. Env. Toxicol. Chem.11, 1485–1494.
Andersen, J.S., Holst, H., Spliid, H., Andersen, H., Baun, A. & Nyholm, N. (1998): Continuous ecotoxicological data evaluated relative to a control response. Journal of Agricultural, Biological and Environmental Statistics, 3, 405–420.
PRILOGA V
|
C.25.
|
AEROBNA MINERALIZACIJA V POVRŠINSKI VODI – SIMULACIJSKI PRESKUS BIORAZGRADNJE
|
1 METODA
Ta preskusna metoda je enakovredna OECD TG 309 (2004) (1).
1.1 UVOD
Namen tega preskusa je izmeriti časovni potek biorazgradnje preskusne snovi z nizko koncentracijo v aerobni naravni vodi in opažanja količinsko opredeliti v obliki enačbe kinetike. Ta simulacijski preskus je laboratorijski preskus serije stresanih bučk za določitev hitrosti aerobne biorazgradnje organskih snovi v vzorcih naravne površinske vode (sladke, brakične ali morske). Temelji na ISO/DIS 14592–1 (2) in vključuje tudi elemente iz preskusnih metod C.23 in C.24 (3)(4). Pri preskušanjih, ki trajajo dolgo, lahko neobvezno polkontinuirano delovanje zamenja serije, da se prepreči razpad mikrokozma. Glavni cilj simulacijskega preskusa je določitev mineralizacije preskusne snovi v površinski vodi in mineralizacija predstavlja osnovo za izražanje kinetike razgradnje. Vendar je neobvezni sekundarni cilj preskusa pridobiti podatke o primarni razgradnji in o tvorbi poglavitnih produktov transformacije. Določitev produktov transformacije in po možnosti količinska opredelitev njihovih koncentracij, sta zlasti pomembna za snovi, ki se zelo počasi mineralizirajo (npr. ko razpolovna doba skupnega ostanka 14C presega 60 dni). Običajno se za določitev in količinsko opredelitev produktov transformacije uporabijo višje koncentracije preskusne snovi (npr, > 100 μg/l) zaradi analitičnih omejitev.
Nizka koncentracija v tem preskusu pomeni koncentracijo (npr. manj kot 1 μg/l do 100 μg/l), ki je dovolj nizka, da se v preskusu zagotovi biorazgradna kinetika, ki odraža biorazgradno kinetiko, kakršna se pričakuje v okolju. V primerjavi s skupno maso biorazgradljivih substratov iz ogljika, ki so na voljo v naravni vodi, uporabljeni v preskusu, bo preskusna snov v nizki koncentraciji služila kot sekundarni substrat. Ta pomeni, da je pričakovana biorazgradna kinetika prvega reda (kinetika „brez rasti“) in da se lahko preskusna snov razgradi s „sopresnovo“. Kinetika prvega reda pomeni, da je hitrost razgradnje (mg/l/dan) sorazmerna s koncentracijo substrata, ki se s časom znižuje. Pri kinetiki pravega prvega reda je konstanta specifične hitrosti razgradnje k neodvisna od časa in koncentracije. To pomeni, da se k znatno ne spreminja med potekom poskusa in se ne spremeni, če se med poskusi koncentracija doda. Po opredelitvi je konstanta specifične hitrosti razgradnje enaka relativni spremembi koncentracije s časom: k = (1/C) · (dC/dt). Čeprav v predpisanih pogojih običajno pričakujemo kinetiko prvega reda, so določenih okoliščinah bolj primerne druge kinetike. Odstopanja od kinetike prvega reda lahko npr. opazimo, če hitrost biopretvorbe namesto hitrosti biološke reakcije omejuje pojav prenosa mase, kot je hitrost difuzije. Vendar lahko podatke skoraj vedno opišemo s psevdo kinetiko prvega reda s sprejeto konstanto odvisno od koncentracije.
Pred preskušanjem morajo biti na voljo podatki od biorazgradljivosti preskusne snovi v višjih koncentracijah (npr. v standardnih presejalnih preskusih) kot tudi podatki o abiotski razgradljivosti, produktih transformacije in pomembnih fizikalno-kemijskih lastnostih, da se omogoči načrtovanje poskusa in interpretacija rezultatov. Določitev popolne biorazgradljivosti omogočajo preskusne snovi, označene s 14C, in določevanje fazne porazdelitve 14C na koncu preskusa. Če se uporablja neoznačena preskusna snov, se lahko popolna biorazgradnja oceni le, če se preskuša višja koncentracija in če so znani vsi poglavitni produkti transformacije.
1.2 OPREDELITVE
Primarna biorazgradnja: Strukturna sprememba (transformacija) kemijske snovi z mikroorganizmi, pri čemer izgine kemijska identiteta.
Funkcionalna biorazgradnja: Strukturna sprememba (transformacija) kemijske snovi z mikroorganizmi, pri čemer izgine specifična lastnost.
Popolna aerobna biorazgradnja: Razgradnja kemijske snovi z mikroorganizmi v prisotnosti kisika v ogljikov dioksid in mineralne soli katerih koli drugih elementov, ki so prisotni, (mineralizacija) ter nastanek nove biomase in organskih produktov mikrobne biosinteze.
Mineralizacija: Razgradnja kemijske ali organske snovi z mikroorganizmi v prisotnosti kisika v ogljikov dioksid, vodo in mineralne soli katerih koli drugih elementov, ki so prisotni.
Faza prilagajanja: Čas, ki preteče od začetka preskusa, dokler se razgradni mikroorganizmi ne prilagodijo in dokler se stopnja biorazgradnje kemijske ali organske snovi ne poveča do zaznavne ravni (npr. 10 % največje teoretične biorazgradnje ali manj, odvisno od točnosti merilne tehnike).
Največja stopnja biorazgradnje: Stopnja biorazgradnje kemijske ali organske snovi v preskusu v odstotkih, nad katero v preskusu ni bilo dodatne biorazgradnje.
Primarni substrat: Zbirka naravnih virov ogljika in energije, ki omogočajo rast in ohranjanje mikrobne biomase.
Sekundarni substrat: Sestavina substrata, ki je prisotna v tako nizki koncentraciji, da pri svoji razgradnji mikroorganizmom, zmožnim razgradnje te snovi, prinese le nepomembno količino ogljika in energije v primerjavi s količino ogljika in energije, ki jo prinese razgradnja sestavin glavnenega substrata (primarnih substratov).
Konstanta hitrosti razgradnje: Konstanta kinetike prvega reda ali psevdo kinetike prvega reda k (d–1), ki kaže hitrost razgradnje v procesu. V serijskem poskusu se k oceni iz začetnega dela krivulje razgradnje, ki se izdela po koncu faze prilagajanja.
Razpolovna doba, t1/2 (d): Izraz, ki opisuje hitrost reakcije prvega reda. Razpolovna doba je čas, ki ustreza znižanju koncentracije za faktor 2. Razpolovna doba in konstanta hitrosti razgradnje sta v zvezi v enačbi t1/2 = ln2/k.
Razpolovna doba razgradnje, DT50 (d): Izraz, s katerim se količinsko opredeli izid preskusov biorazgradnje. Razpolovna doba razgradnje je čas, vključno s fazo prilagajanja, ki je potreben za doseganje 50-odstotne biorazgradnje.
Meja zaznavnosti (LOD) in meja količinske opredelitve (LOQ): Meja zaznavnosti (LOD) je koncentracija snovi, pod katero identitete snovi ni možno razlikovati od analitičnih artefaktov. Meja količinske opredelitve (LOQ) je koncentracija snovi, pod katero koncentracije ni možno določiti s sprejemljivo natančnostjo.
Raztopljeni organski ogljik (DOC): Tisti del organskega ogljika v vzorcu vode, ki ga ni mogoče odstraniti z navedeno separacijo faz, npr. s centrifugiranjem pri 40 000 ms–2 za 15 min ali z membransko filtracijo z membranami, ki imajo pore s premerom od 0,2 μm do 0,45 μm.
Skupna aktivnost organskega 14C (TOA): Skupna aktivnost 14C, odvisna od organskega ogljika.
Aktivnost raztopljenega organskega 14C (DOA): Skupna aktivnost 14C, odvisna od raztopljenega organskega ogljika.
Aktivnost organskega 14C v delcih (POA): Skupna aktivnost 14C, odvisna od organskega ogljika v delcih.
1.3 UPORABNOST PRESKUSA
Ta simulacijski preskus se uporablja za nehlapne ali rahlo hlapne organske spojine, ki se preskušajo v nizkih koncentracijah. Če se uporabljajo bučke odprte proti atmosferi (npr. zamašene z vato) se snovi s konstantami Henryevega zakona manj od približno 1 Pa·m3/mol (približno 10–5 atm·m3/mol) lahko štejejo za praktično nehlapne. Z uporabo zaprtih bučk z nadprostorom je možno preskušati rahlo hlapne snovi (s konstantami Henryevega zakona < 100 Pa·m3/mol ali < 10–3 atm·m3/mol) brez izgub iz preskusnega sistema. Če se pri odstranjevanju CO2 ne upoštevajo ustrezni previdnostni ukrepi, lahko to povzroči izgubo snovi, označenih s 14C. V takšnih primerih bo morda treba zajeti CO2 v notranjo absorpcijsko posodo z alkalijskimi snovmi ali uporabiti zunanji absorpcijski sistem za CO2 (neposredno določevanje 14CO2; glejte Prilogo 3). Za določevanje kinetike biorazgradnje morajo biti koncentracije preskusne snovi pod lastno topnostjo v vodi. Kljub temu je treba opozoriti, da so lahko vrednosti topnosti v vodi iz literature znatno višje od topnosti preskusne snovi v naravnih vodah. Neobvezno se lahko določi topnost še zlasti slabo vodotopnih preskusnih snovi z uporabo preskušanih naravnih vod.
Ta metoda se lahko uporabi za simuliranje biorazgradnje v površinskih vodah brez grobih delcev (pelagični preskus) ali v motnih površinskih vodah, ki so blizu mejne ploskve med vodo in sedimentom (preskus suspendiranega sedimenta).
1.4 PRINCIP PRESKUSNE METODE
Preskus se opravi v seriji z inkubacijo preskusne snovi bodisi s samo površinsko vodo (pelagični preskus) bodisi s površinsko vodo z dodanimi suspendiranimi trdnimi snovmi/sedimentom v koncenctraciji 0,01 do 1 g/l suhe mase (preskus suspendiranega sedimenta), da se simulira vodno telo s suspendiranim ali resuspendiranim sedimentom. Za večino površinskih vod je značilna koncentracija suspendiranih trdnih snovi/sedimenta na spodnji meji navedenega razpona. Preskusne bučke se inkubirajo v temi pri temperaturi okolja v aerobnih pogojih in ob agitaciji. Za določitev kinetike biorazgradnje je treba uporabiti najmanj dve različni koncentraciji preskusne snovi. Koncentraciji se morata med seboj razlikovati za faktor od 5 do 10. Koncentraciji morata predstavljati pričakovano območje koncentracij v okolju. Najvišja koncentracija preskusne snovi ne sme preseči 100 µg/l, vendar imajo kot najvišje koncentracije prednost preskusne koncentracije pod 10 µg/l ali manj, s čimer se zagotovi, da biorazgradnja sledi kinetiki prvega reda. Najnižja koncentracija ne sme preseči 10 µg/l, vendar imajo kot najnižje koncentracije prednost preskusne koncentracije od 1 do 2 μg/l ali manj kot 1 μg/l. Običajno je mogoče zadostno analizo tako nizkih koncentracij doseči s komercialno dostopnimi snovmi, označenimi s 14C. Če se preskusna snov vnese v koncentraciji ≤ 100 µg/l, je zaradi analitskih omejitev pogosto nemogoče izmeriti koncentracijo preskusne snovi z zahtevano točnostjo (glejte drugi odstavek oddelka 1.7.2). Za določitev in količinsko opredelitev poglavitnih produktov transformacije ali kadar ni na voljo specifična analitska metoda z nizko mejo zaznavnosti, se lahko uporabijo višje koncentracije preskusne snovi (> 100 µg/l ali včasih > 1 mg/l). Če se preskušajo visoke koncentracije preskusne snovi, morda ne ni možno uporabiti rezultatov za oceno konstante razgradnje prvega reda in razpolovne dobe, saj razgradnja ne bo sledila kinetiki prvega reda.
Razgradnjo je treba spremljati v ustreznih časovnih razmikih z merjenjem bodisi preostalega 14C bodisi preostale koncentracije preskusne snovi, če se uporabi specifična kemijska analiza. Označevanje najbolj obstojnega dela molekule s 14C omogoča določevanje skupne mineralizacije. Označevanje manj obstojnega dela molekule s 14C in specifična analiza pa omogočata vrednotenje le primarne biorazgradnje. Vendar ni nujno, da najbolj obstojen del molekule obsega relevantno funkcionalno področje molekule (področje, ki je odvisno od specifične lastnosti, npr. strupenosti, bioakumulacije itn.). V tem primeru je morda treba uporabiti preskusno snov, ki je označena s 14C v funkcionalnem delu, da je mogoče slediti odstranjevanju specifične lastnosti.
1.5 PODATKI O PRESKUSNI SNOVI
V tem preskusu je mogoče uporabiti radioaktivno označene in neoznačene preskusne snovi. Priporočljiva je tehnika označevanja s 14C, pri čemer se običajno označi(-jo) najobstojnejši del(-i) molekule (glejte tudi oddelek 1.4). Za snovi, ki vsebujejo več kot en aromatski obroč, enega ali več ogljikovih atomov v vsakem obroču, je označevanje s 14C prednostno. Poleg tega ima prednost označevanje enega ali več ogljikovih atomov s 14C na obeh straneh lahko cepljivih vezi. Kemijska in/ali radiokemijska čistota preskusne snovi mora biti > 95 %. Pri radioaktivno označenih snoveh ima prednost specifična aktivnost približno 50 μCi/mg (1,85 MBq) ali več, kar omogoči merjenje 14C v preskusih, ki vsebujejo nizke začetne koncentracije. Na voljo morajo biti naslednji podatki o preskusni snovi:
|
—
|
topnost v vodi [metoda A.6],
|
|
—
|
topnost v organskem topilu ali organskih topilih (za snovi, ki se vnesejo s topilom ali imajo majhno topnost v vodi),
|
|
—
|
disociacijska konstanta (pKa), če je snov nagnjena k protonaciji ali deprotonaciji [OECD TG 112] (5),
|
|
—
|
parni tlak [metoda A.4] in konstanta Henryevega zakona,
|
|
—
|
kemijska obstojnost v vodi v temi (hidroliza) [metoda C.7].
|
V primeru preskušanja slabo vodotopnih snovi v morski vodi je morda uporabno poznati konstanto izsoljevanja (ali „Setschenowovo konstanto“) Ks, ki je določena z enačbo: log (S/S’) = Ks Cm, kjer pomeni: S – topnost snovi v sladki vodi, S’ – topnost snovi v morski vodi in Cm – molarnost soli.
Če se preskus opravlja kot „preskus suspendiranega sedimenta“, morajo biti na voljo tudi naslednji podatki:
|
—
|
porazdelitveni koeficient n-oktanol/voda [metoda A.8],
|
|
—
|
adsorpcijski koeficient [metoda C.18].
|
Drugi uporabni podatki so med drugim:
|
—
|
koncentracija v okolju, če je znana ali ocenjena,
|
|
—
|
strupenost preskusne snovi za mikroorganizme [metoda C.11],
|
|
—
|
lahka in/ali inherentna biorazgradljivost [metode C.4 A–F, C.12, C.9, OECD TG 302 (5)],
|
|
—
|
aerobna ali anaerobna biorazgradljivost v raziskavah transformacije v prsti in sedimentu/vodi [metode C.23, C.24].
|
1.6 REFERENČNA SNOV
Kot referenčno snov je treba uporabiti snov, ki se običajno lahko razkraja v aerobnih pogojih (npr. anilin ali natrijev benzoat). Pričakovani časovni interval razgradnje anilina in natrijevega benzoata je ponavadi manj kot 2 tedna. Namen referenčnih snovi je zagotoviti, da je mikrobna aktivnost v preskusni vodi v določenih mejah, tj. da voda vsebuje aktivno mikrobno populacijo.
1.7 MERILA KAKOVOSTI
1.7.1 Izkoristek
Neposredno po dodatku preskusne snovi je treba vsako začetno preskusno koncentracijo najmanj v dveh vzorcih preveriti z meritvami aktivnosti 14C ali s kemijskimi analizami v primeru neoznačenih snovi. S tem se pridobijo podatki o uporabnosti in ponovljivosti analitske metode in podatki o homogenosti porazdelitve preskusne snovi. Običajno se v naknadnih analizah podatkov namesto nazivne koncentracije uporablja izmerjena začetna aktivnost 14C ali koncentracija preskusne snovi, saj se s tem upoštevajo izgube zaradi sorpcije in napak pri odmerjanju. Za snovi, označene s 14C, izkoristek na koncu preskusa daje masna bilanca (glejte zadnji odstavek oddelka 1.8.9.4). V idealnem primeru bi morala biti bilanca radioaktivne mase v območju od 90 % do 110 %, vendar za neoznačene preskusne snovi analitska točnost privede do začetnega izkoristka med 70 % in 110 %. Ta območja se morajo šteti za ciljna in ne kot kriteriji za sprejemljivost preskusa. Neobvezno se lahko za preskusno snov določi analitska točnost pri nižji koncentraciji kot je začetna koncentracija in tudi za poglavitne produkte transformacije.
1.7.2 Ponovljivost in občutljivost analitske metode
Ponovljivost analitske metode (vključno z učinkovitostjo začetne ekstrakcije) za količinsko opredelitev preskusne snovi in proizvodov transformacije, če je smiselno, je treba preveriti s petimi ponovitvami analiz posameznih ekstraktov površinske vode.
Meja zaznavnosti (LOD) analitske metode za preskusno snov in za produkte transformacije mora biti, če je možno, vsaj 1 % začetne vnesene količine v preskusnem sistem. Meja količinske opredelitve (LOQ) mora biti enaka ali manj od 10 % vnesene koncentracije. Kemijske analize številnih organskih snovi in njihovih produktov transformacije pogosto zahtevajo vnos relativno visoke koncentracije preskusne snovi, tj. > 100 μg/l.
1.8 OPIS PRESKUSNE METODE
1.8.1 Oprema
Preskus se lahko opravlja v stožčastih ali valjastih bučkah ustrezne prostornine (npr. 0,5 ali 1,0 litra), ki so zamašene z zamaški iz silikona ali kavčuka. Preskus se lahko opravlja tudi v serumskih bučkah z zaporkami, ki tesnijo CO2 (npr. septumi z butilnega kavčuka). Druga možnost je izvedba preskusa z uporabo več bučk, pri čemer se v vzorčnih časovnih razmikih odvzameta najmanj dve celi bučki (glejte zadnji odstavek oddelka 1.8.9.1). Za nehlapne preskusne snovi, ki niso radioaktivno označene, plinotesni zamaški ali zaporke niso potrebne; primerni so vatirani čepi, ki preprečujejo onesnaženje iz zraka (glejte drugi odstavek oddelka 1.8.9.1). Rahlo hlapne snovi je treba preskusiti v sistemu biometričnega tipa z blagim mešanjem vodne gladine. Zagotoviti je treba, da ne pride do bakterijskega onesnaženja. Neobvezno se lahko posode pred uporabo sterilizirajo s segrevanjem ali avtoklaviranjem. Poleg naštetega, je potrebna naslednja standardna laboratorijska oprema:
|
—
|
stresalna miza ali magnetni mešalniki za neprekinjeno agitacijo preskusnih bučk,
|
|
—
|
turbidimeter za nefelometrične meritve motnosti,
|
|
—
|
pečica ali mikrovalovna pečica za določitev suhe mase,
|
|
—
|
oprema za membransko filtracijo,
|
|
—
|
avtoklav ali pečica za toplotno sterilizacijo steklovine,
|
|
—
|
oprema za ravnanje s snovmi, označenimi s 14C,
|
|
—
|
oprema za količinsko opredelitev aktivnosti 14C v vzorcih iz raztopin za lovljenje CO2 in, če je treba, iz vzorcev sedimenta,
|
|
—
|
analitska oprema za določevanje preskusne (in referenčne) snovi, če se uporablja kemijska analiza (npr. plinski kromatograf, visokotlačni tekočinski kromatograf).
|
1.8.2 Založne raztopine preskusne snovi
Za pripravo založnih raztopin preskusne in referenčne snovi je treba uporabiti deionizirano vodo (glejte prvi odstavek oddelka 1.8.7). Deionizirana voda mora biti brez snovi, ki so lahko strupene za mikroorganizme. Ne sme vsebovati več kot 1 mg/l raztopljenega organskega ogljika (DOC) (6).
1.8.3 Odvzem in prevoz površinske vode
Mesto vzorčenja površinske vode je treba izbrati v skladu z namenom preskusa v dani situaciji. Pri izbiranju mesta vzorčenja je treba upoštevati preteklost morebitnih kmetijskih, industrijskih ali domačih vnosov. Če je bilo vodno okolje v zadnjih štirih letih onesnaženo s preskusno snovjo ali njenimi strukturnimi analogi, se ne sme uporabiti za odvzem preskusne vode, razen če je raziskovanje hitrosti razgrajevanja na predhodno izpostavljenih mestih izrecen namen raziskovalca. Na mestu vzorčenja je treba izmeriti pH in temperaturo vode. Zabeležiti je treba tudi globino vzorčenja in izgled vzorca vode (npr. barva in motnost) (glejte oddelek 3). Izmeriti je treba koncentracijo kisika in/ali redoks potencial v vodi ter v površinskem sloju sedimenta, da se dokažejo aerobni pogoji, razen če je to očitno na podlagi izgleda in preteklih izkušenj na mestu vzorčenja. Površinsko vodo je treba prenesti v temeljito očiščeni posodi. Med prevozom temperatura vzorca ne sme bistveno preseči temperature, ki se uporablja med preskusom. Če trajanje prevoza preseže 2 do 3 ure, je priporočljivo ohlajanje na 4 °C med prevozom. Vzorec vode ne sme zamrzniti.
1.8.4 Shranjevanje in priprava površinske vode
Preskus je treba po možnosti začeti v enem dnevu po odvzemu vzorca. Trajanje shranjevanja vode, kadar je potrebno, je treba čimbolj skrajšati. V nobenem primeru pa ne sme preseči 4 tednov. Do uporabe je treba vzorec vode hraniti pri 4 °C z aeracijo. Pred uporabo je treba odstraniti grobe delce, npr. s filtracijsko skozi najlonski filter z velikostjo mreže približno 100 μm ali skozi grobi filter papir oz. s sedimentacijo.
1.8.5 Priprava vode z dodanim sedimentom (neobvezno)
Za preskus suspendiranega sedimenta je treba v bučke, ki vsebujejo naravno vodo (filtrirano za odstranitev grobih delcev, kakor je opisano v razdelku 1.8.4), dodati površinski sediment, da nastane suspenzija. Koncentracija suspendiranih trdnih snovi mora biti med 0,01 in 1 g/l. Površinski sediment mora izvirati iz istega mesta vzorčenja kot vzorec vode. Odvisno od posameznega vodnega okolja je možno opredeliti površinski sediment kot sediment z visoko vsebnostjo organskega ogljika (2,5–7,5 %) in fino teksturo ali kot sediment z nizko vsebnostjo organskega ogljika (0,5–2,5 %) in grobo teksturo (3). Površinski sediment se lahko pripravi po naslednjem postopku: neposredno po vzorčenju se s cevko iz prosojne plastične mase izvleče več sredic sedimenta, odreže zgornje aerobne plasti (od površine do globine največ 5 mm), nato pa se sredice združijo. Dobljeni vzorec sedimenta je treba prenesti v posodi z dovolj velikim zračnim nadprostorom, da je sediment v aerobnih pogojih (če trajanje prevoza preseže 2 do 3 ure, je potrebno ohlajanje na 4 °C). Vzorec sedimenta je treba suspendirati v preskusni vodi v razmerju 1:10 in do uporabe hraniti pri 4 °C z aeracijo. Trajanje shranjevanja sedimenta, kadar je potrebno, je treba čimbolj skrajšati. V nobenem primeru pa ne sme preseči 4 tednov.
1.8.6 Polkontinuiran postopek (neobvezen)
Če je potrebno dlje časa trajajoče prilagajanje preden je mogoče izmeriti znatno razgradnjo preskusne snovi, bo morda potrebna daljša inkubacija (več mesecev). Če je to znano iz predhodnega preskušanja snovi, se lahko preskus začne s polkontinuiranim postopkom, ki omogoča obdobno obnavljanje dela preskusne vode ali suspenzije (glejte Prilogo 2). Namesto tega se lahko običajni serijski preskus spremeni v polkontinuirani postopek, če v približno 60 dneh ne pride do razgradnje preskusne snovi v serijskem postopku (glejte drugi odstavek oddelka 1.8.8.3).
1.8.7 Dodajanje preskusne (ali referenčne) snovi
Za snovi z veliko topnostjo v vodi (> 1 mg/l) in majhno hlapnostjo (konstante Henryevega zakona < 1 Pa·m3/mol ali < 10–5 atm·m3/mol) se lahko pripravi založna raztopina v deionizirani vodi (glejte oddelek 1.8.2). Ustrezni volumni založne raztopine se lahko dolivajo v preskusne posode, da se doseže želena koncentracija. Volumen kakršne koli dodane založne raztopine mora biti najmanjši praktični volumen (< 10 % končnega volumna tekočine, če je možno). Drugačen postopek je raztapljanje preskusne snovi v večjem volumnu preskusne vode, kar je morda lahko alternativni postopek namesto uporabe organskih topil.
Če se temu ne da izogniti, je treba založne raztopine nehlapnih snovi s slabo topnostjo v vodi pripraviti s hlapnim organskim topilom, vendar količina topila, dodanega v preskusni sistem, ne sme presegati 1 % v/v in ne sme imeti škodljivih učinkov na mikrobno dejavnost. Topilo ne sme vplivati na obstojnost preskusne snovi v vodi. Topilo je treba zmanjšati na izjemno majhno količino, tako da bistveno ne poveča koncentracije DOC v preskusni vodi ali suspenziji. To je treba preveriti z analizo, specifično za snov, ali, če je možno, analizo DOC (6). Zelo veliko pozornosti je treba posvetiti omejevanju količine prenesenega topila na zares potrebno količino. Ravno tako natančno pa je treba preveriti, da se količina preskusne snovi lahko raztopi v končnem volumnu preskusne vode. Uporabijo se lahko druge tehnike za vnos preskusne snovi v preskusne posode, kot so opisane v (7) in (8). Kadar se za vnos preskusne snovi uporablja organsko topilo, je treba kontrolne vzorce s topilom, ki vsebujejo preskusno vodo (brez dodatkov), in preskusno vodo z dodatkom referenčne snovi obdelati podobno kot aktivne preskusne posode z dodatno preskusno snovjo v topilu kot nosilcu. Namen kontrolnih vzorcev s topilom je preveriti možne neželene učinke topila na mikrobno populacijo, kar se pokaže z razgradnjo referenčne snovi.
1.8.8 Preskusni pogoji
1.8.8.1 Preskusna temperatura
Inkubacijo je treba izvajati v temi (prednostno) ali v difuzni svetlobi pri kontrolirani (± 2 °C) temperaturi. Temperatura je lahko temperatura na terenu ali standardna temperatura 20–25 °C. Temperatura na terenu je lahko bodisi dejanska temperatura na mestu vzorčenja v času vzorčenja ali povprečna terenska temperatura na mestu vzorčenja.
1.8.8.2 Agitacija
Zagotoviti je treba agitacijo z neprekinjenim stresanjem ali mešanjem, da se delci in mikroorganizmi ohranjajo v suspenziji. Agitacija tudi olajša prenos kisika iz nadprostora v tekočino, da se lahko zadostno ohranjajo aerobni pogoji. Bučke se postavijo na stresalno mizo (stresanje s hitrostjo približno 100 o/min) ali pa se uporabi magnetno mešanje. Agitacija mora biti neprekinjena. Kljub temu, mora biti stresanje ali mešanje čimbolj nežno, da se še ohranja homogena suspenzija.
1.8.8.3 Trajanje preskusa
Trajanje preskusa običajno ne sme preseči 60 dni, razen če se uporabi polkontinuiran postopek z obdobnim obnavljanjem preskusne suspenzije (glejte oddelek 1.8.6 in Prilogo 2). Če pa se razgradnja preskusne snovi začne v prvih 60 dneh, je možno serijski preskus podaljšati do največ 90 dni. Razgradnjo je treba spremljati v ustreznih časovnih razmikih z določevanje bodisi preostalega 14C bodisi sproščenega 14CO2 (glejte oddelek 1.8.9.4) in/ali s specifično kemijsko analizo (glejte 1.8.9.5). Trajanje inkubacije mora biti dovolj dolgo, da se ovrednoti postopek razgradnje. Obseg razgradnje mora prednostno preseči 50 %; za počasi razgradljive snovi mora biti obseg razgradnje zadosten (običajno večji od 20 %), da se lahko oceni kinetična konstanta hitrosti razgradnje.
V preskusnem sistemu je treba opraviti obdobne meritve pH in koncentracije kisika, razen če so takšne meritve nepotrebne zaradi predhodnih izkušenj iz podobnih preskusov z vodo in sedimenti iz istega mesta vzorčenja. V nekaterih pogojih lahko presnova primarnih substratov v veliko višjih koncentracijah v vodi ali sedimentu povzroči dovolj sproščenega CO2 in izrabo kisika, da se bistveno spremenijo pogoji poskusa.
1.8.9 Postopek
1.8.9.1 Priprava bučk za pelagični preskus
Primeren volumen preskusne vode se prenese v preskusne bučke, ki se napolnijo do približno ene tretjine volumna bučke, vendar ne manj kot približno 100 ml. Če se uporabi več bučk (da je omogočen odvzem celotnih bučk za vsako vzorčenje) je primeren volumen preskusne vode tudi približno 100 ml, saj lahko majhni volumni vzorca vplivajo na dolžino faze prilagajanja. Preskusna snov se doda iz založne raztopine, kakor je opisano v oddelkih 1.8.2 in 1.8.7. Uporabiti je treba najmanj dve različni koncentraciji preskusne snovi, ki se razlikujeta za faktor od 5 do 10, da se določi kinetika razgradnje in izračuna kinetična konstanta hitrosti razgradnje. Obe izbrani koncentraciji morata biti nižji od 100 µg/l in prednostno v območju < 1–10 µg/l.
Bučke se zaprejo z zamaški ali zaporkami, ki ne prepuščajo zraka in CO2. Za nehlapne preskusne kemikalije, ki niso označene s 14C, so primerni razrahljani vatirani čepi, ki preprečujejo onesnaženje iz zraka (glejte oddelek 1.8.1), pod pogojem, da je za poglavitne produkte razgradnje znano, da so nehlapni in da se uporablja posredno določevanje CO2 (glejte Dodatek 3).
Bučke inkubirajte pri izbrani temperaturi (glejte oddelek 1.8.8.1). Vzorci za kemijsko analizo ali meritve 14C se odvzamejo na začetku preskusa (tj. preden se začne biorazgradnja; glejte oddelek 1.7.1) in v primernih časovnih razmikih med preskusom. Vzorčenje se opravi z odvzemom podvzorcev (npr. 5-ml alikvotov) iz vsake ponovitve ali z odvzemom celotnih bučk pri vsakem času vzorčenja. Mineralizacija preskusne snovi se lahko določi posredno ali neposredno (glejte Dodatek 3). Običajno je med fazo razgradnje (tj. po zaključeni fazi prilagajanja) potrebnih najmanj pet vzorčnih točk, da se zanesljivo oceni konstanta hitrosti, razen če se za hitro razgradljive snovi utemelji, da so dovolj tri vzorčne točke. Za snovi, ki se ne razkrajajo hitro, je med fazo razgradnje enostavno opraviti več meritev in zato je treba v oceno k vključiti več podatkovnih točk. Ni mogoče določiti fiksnega časovnega razporeda vzorčenja, saj hitrost biorazgradnje variira. Vendar pa je priporočljivo vzorčiti enkrat tedensko, če je razgradnja počasna. Če se preskusna snov hitro razkraja, je treba vzorčenje opraviti enkrat dnevno v prvih treh dneh in nato vsak drug ali tretji dan. V določenih pogojih, kot so zelo hitro hidrolizirajoče snovi, je morda treba vzorčiti v urnih razmikih. Priporočljivo je, da se pred preskusom opravi predhodna raziskava, v kateri se določijo ustrezni razmiki vzorčenja. Če je treba vzorce ohraniti za dodatne specifične analize, je priporočljivo, da se odvzame več vzorcev in izberejo tisti, ki jih je treba analizirati na koncu poskusa z vzvratno strategijo, tj. zadnji vzorci se analizirajo prvi (glejte drugi odstavek v oddelku 1.8.9.5 za smernice o obstojnosti vzorcem med shranjevanjem).
1.8.9.2 Število bučk in vzorcev
Pripraviti je treba dovolj veliko število preskusnih bučk, da so na voljo:
|
—
|
preskusne bučke; najmanj dvojnik za vsako koncentracijo preskusne snovi (prednostno najmanj 3) ali več preskusnih bučk za vsako koncentracijo, če se ob vsakem vzorčenju odvzamejo cele bučke (označene z FT),
|
|
—
|
preskusne bučke za izračun masne bilance; najmanj dvojnik za vsako preskusno koncentracijo (označeno z FM),
|
|
—
|
slepi kontrolni vzorec brez preskusne snovi; najmanj ena slepa kontrolna preskusna bučka, ki vsebuje le preskusno vodo (označeno z FB),
|
|
—
|
referenčni kontrolni vzorec; dvojnik z referenčno snovjo (npr. anilin ali natrijev benzoat, koncentracija 10 µg/l) (označeno z FC). Namen referenčnega kontrolnega vzorca je potrditev najmanjše mikrobne aktivnosti. Če je ustrezno, se lahko uporabi radioaktivno označena snov, tudi če se razgradnja preskusne snovi spremlja s kemijskimi analizami,
|
|
—
|
sterilni kontrolni vzorec; ena ali dve bučki, ki vsebujeta sterilizirano preskusno vodo, za preučevanje možne abiotske razgradnje ali drugačnega nebiološkega izginevanja preskusne snovi (označeno z FS). Biološko aktivnost je možno ustaviti z avtoklaviranjem (121 °C; 20 min) preskusne vode ali z dodajanjem strupene snovi (npr. natrijevega azida (NaN3) v koncentraciji 10–20 g/l, živosrebrnega klorida (HgCl2) v koncentraciji 100 mg/l ali formalina v koncentraciji 100 mg/l) ali s sevanjem gama. Če se uporabi HgCl2, ga je treba odstraniti kot strupen odpadek. Če se vodi doda sediment v veliki količini, sterilnosti ni enostavno doseči. V tem primeru je priporočljivo zaporedno avtoklaviranje (npr. trikrat). Preučiti je treba, ali avtoklaviranje morda spremeni sorpcijske lastnosti sedimenta,
|
|
—
|
kontrolni vzorci s topilom, vsebujejo preskusno vodo in preskusno vodo z referenčno snovjo; dvojniki bučk, obdelani z enako količino topila in enakim postopkom, kakor se uporablja za vnos preskusne snovi. Namen je preveriti možne neželene učinke topila z določitvijo razgradnje referenčne snovi.
|
V zasnovi preskusa mora raziskovalec preučiti relativni pomen povečanja števila ponovitev proti povečanju števila vzorčenj. Natančno število potrebnih bučk bo odvisno od metode za merjenje razgradnje (glejte tretji odstavek v oddelku 1.8.9.1; oddelek 1.8.9.4 in Dodatek 3).
V vsakem vzorčenju je treba iz vsake preskusne bučke odvzeti dva podvzorca (npr. 5-ml alikvota). Če se uporablja več bučk, da je omogočen odvzem celotnih bučk, je treba pri vsakem vzorčenju žrtvovati najmanj dve bučki (glejte prvi odstavek v oddelku 1.8.9.1).
1.8.9.3 Priprava bučk za preskus s suspendiranim sedimentom [neobvezen]
V preskusne posode se doda potrebni volumen preskusne vode in sedimenta, če je treba (glejte oddelek 1.8.5). Priprava bučk za preskus suspendiranega sedimenta je enaka kot za pelagični preskus (glejte oddelka 1.8.9.1. in 1.8.9.2). Prednostno je treba uporabljati serumske steklenice ali podobno oblikovane bučke. Zaprte bučke se položijo na stresalnik. Seveda je treba odprte bučke za nehlapne snovi, ki niso označene s 14C, postaviti pokonci. V tem primeru je priporočljiva uporaba magnetnega mešanja in magnetnih palčk, ki so prevlečene s steklom. Po potrebi se steklenice aerirajo, da se ohranjajo ustrezni aerobni pogoji.
1.8.9.4 Radiokemijske določitve
Sproščeni 14CO2 se meri posredno ali neposredno (glejte Dodatek 3). 14CO2 se določa posredno z razliko med začetno aktivnostjo 14C v preskusni vodi ali suspenziji in skupno preostalo aktivnostjo v času vzorčenja, ki se izmeri po zakisanju vzorca na pH 2–3 in odstranitvi CO2. S tem se odstrani anorganski ogljik in izmerjena preostala aktivnost izvira iz organskega materiala. Če se med transformacijo preskusne snovi tvorijo poglavitni hlapni produkti transformacije, se posredno določevanje 14CO2 ne sme uporabiti (glejte Dodatek 3). Če je možno, je treba sproščanje 14CO2 meriti neposredno (glejte Dodatek 3) v vsakem času vzorčenja in v najmanj eni preskusni bučki. Ta postopek omogoča preverjanje tako masne bilance in postopka biorazgradnje, vendar je omejen na preskuse, ki se opravljajo v zaprtih bučkah.
Če se sproščeni 14CO2 med preskusom meri neposredno, je treba v ta namen na začetku preskusa pripraviti več bučk. Če se med transformacijo preskusne snovi tvorijo poglavitni hlapni produkti transformacije, je priporočljivo neposredno določevanje 14CO2. V vsaki točki merjenja se dodatne preskusne bučke zakisajo na pH 2–3, nato pa se 14CO2 zbere v notranji ali zunanji absorpcijski posodi (glejte Dodatek 3).
Neobvezno se lahko koncentracije s 14C označene preskusne snovi in poglavitnih produktov transformacije določijo z radiokromatografijo (npr. tankoplastno kromatografijo, RAD-TLC) ali HPLC z radiokemijskim zaznavanjem.
Neobvezno se lahko določi fazna porazdelitev preostale radioaktivnosti (glejte Dodatek 1) ter preostala preskusna snov in produkti transformacije.
Na koncu preskusa je treba določiti masno bilanco z neposrednim merjenjem 14CO2 v ločeni poskusni bučki, iz katere med poskusom ni bil odvzet noben vzorec (glejte Dodatek 3).
1.8.9.5 Specifična kemijska analiza
Če je na voljo specifična analitska metoda, se lahko primarna biorazgradnja določi z merjenjem preostale koncentracije preskusne snovi namesto uporabe tehnik radioaktivnega označevanja. Če se uporabi radioaktivno označena preskusna snov (za merjenje skupne mineralizacije), se lahko vzporedno opravijo specifične kemijske analize, ki dajo uporabne dodatne podatke in s katerimi se preverja postopek. Specifične kemijske analize se lahko tudi uporabijo za merjenje produktov transformacije, ki nastanejo med razgradnjo preskusne snovi. Ta pristop je priporočljiv za snovi, ki se mineralizirajo z razpolovno dobo, daljšo od 60 dni. Koncentracijo preskusne snovi in produktov transformacije je treba pri vsaki ponovitvi vzorčenja izmeriti in o njej poročati (o koncentraciji in o uporabljenem odstotku). Na splošno je treba ugotoviti produkte transformacije, ki se pri katerem koli vzorčenju zaznajo pri ≥ 10 % uporabljene koncentracije, razen če ni upravičeno utemeljeno drugače. Tudi produkte transformacije, pri katerih se koncentracije med raziskavo nenehno povečujejo, je treba upoštevati pri ugotavljanju, tudi če njihove koncentracije ne presegajo zgornje omejitve, ker lahko označujejo obstojnost. Če je možno, da se preskusna snov hitro abiotsko pretvarja (npr. s hidrolizo), je treba preučiti izvedbo analiz produktov transformacije v sterilnih kontrolnih vzorcih. Potrebo po količinski opredelitvi in določevanju produktov transformacije je treba upoštevati glede na vsak primer posebej in v poročilu podati utemeljitev. Tehnike ekstrakcije z organskim topilom je treba uporabiti po navodilih v ustreznem analitičnem postopku.
Če se analiza opravi v 24 urah (prednostno), je treba vse vzorce shranjevati pri 2 do 4 °C in zrakotesno. Če je shranjevanje daljše, je treba vzorce zamrzniti pod –18 °C ali kemijsko konzervirati. Zakisanje ni priporočljiva metoda konzerviranja vzorcev saj so lahko zakisani vzorci neobstojni. Če se vzorci ne analizirajo v 24 urah in so shranjevani dlje, je treba opraviti raziskavo obstojnosti med shranjevanjem, da se dokaže obstojnost želenih kemikalij med shranjevanjem pri –18 °C ali v pogojih konzerviranja. Če analitična metoda vključuje bodisi ekstrakcijo s topili ali ekstrakcijo trdne faze (SPE), je treba ekstrakcijo opraviti nemudoma po vzorčenju ali po ohlajenem shranjevanju za največ 24 ur.
Morda bodo potrebni volumni vzorcev, večji od prikazanih v oddelku 1.8.1, odvisno od občutljivosti analitične metode. Preskus se enostavno izvede s preskusnim volumnom 1 liter v bučkah s prostornino 2–3 litra, ko je možno jemati vzorce približno 100 ml.
2. PODATKI IN POROČANJE
2.1 OBDELAVA REZULTATOV
2.1.1 Prikaz podatkov
Čase vzorčenja je treba zaokrožiti na celo število ur (razen, če se snov bistveno razkraja v minutah do urah), ne pa na celo število dni. Prikazati je treba ocene preostale aktivnosti preskusne snovi (za snovi označene s 14C) ali preostale koncentracije (za neoznačene snovi) v odvisnosti od časa v linearnem in pollogaritemskem prikazu (glejte sliki 1a in 1b). Če je prišlo do razgradnje, se primerjajo rezultati iz bučk FT in bučk FS. Če se povprečne vrednosti rezultatov iz bučk s preskusno snovjo (FT) in sterilnih bučk (FS) razlikujejo za manj kot 10 %, se lahko predpostavi, da je opažena razgradnja pretežno abiotska. Če je razgradnja v bučkah FS manjša, se lahko s temi številkami popravi številke bučk FT (z odštevanjem), da se oceni obseg biorazgradnje. Kadar se opravljajo neobvezne analize za poglavitne produkte transformacije, je treba prikazati njihovo nastajanje ali upad poleg prikaza upada preskusne snovi.
V krivulji razgradnje (pollogaritemski prikaz) se z ekstrapolacijo krivulje do odsotnosti razgradnje oceni dolžina faze prilagajanja. Namesto tega se lahko dolžina faze prilagajanja oceni z določitvijo časa, potrebnega za približno 10 % razgradnje (glejte sliki 1a in 1b). Iz pollogaritemskega prikaza se z linearno regresijo odvisnosti ln (preostale aktivnosti 14C ali koncentracije preskusne snovi) od časa oceni konstanto hitrosti prvega reda, k, in njeno standardno napako. Zlasti pri meritvah 14C se uporabijo le podatki iz začetnega linearnega dela krivulje po zaključku faze prilagajanja, pri čemer se prednostno izbere nekaj reprezentativnih podatkov pred izborov večjega števila bolj negotovih podatkov. Tu negotovost vključuje napake, ki so vezane na priporočljivo neposredno uporabo izmerjenih preostalih aktivnosti 14C (glejte spodaj). V določenih primerih je pomembno izračunati dve različni konstanti hitrosti, če razgradnja sledi bifaznemu vzorcu. Za ta namen se določijo dve različni fazi krivulje razgradnje. Konstanto hitrosti, k, in razpolovno dobo t1 = ln2/k je treba izračunati za vsako posamezno vzporedno bučko, če se iz iste bučke jemlje več podvzorcev, ali s pomočjo povprečnih vrednosti, če se ob vzorčenju jemljejo celotne bučke (glejte zadnji odstavek oddelka 1.8.9.2). Če se uporabi prvi omenjeni postopek, je treba konstanto hitrosti razgradnje in razpolovno dobo navesti za vsako posamezno vzporedno bučko in kot povprečno vrednost s standardno napako. Če se uporabijo visoke koncentracije preskusne snovi, lahko krivulja razgradnje znatno odstopa od premice (pollogaritemski prikaz) in kinetika prvega reda morda ne velja. Določitev razpolovne dobe zato nima smisla. Vendar je mogoče za omejen niz podatkov uporabiti psevdo kinetiko prvega reda in oceni razpolovno dobo DT50 (čas za 50 % razgradnje). Vendar je treba upoštevati, da časovnega poteka razgradnje po izbranem nizu podatkov ni mogoče napovedati z DT50, ki opisuje le dani nabor podatkov. Analitična orodja za statistične izračune in prilagajanje krivulj so enostavno dostopna in uporaba tovrstne programske opreme je priporočljiva.
Če se opravljajo specifične kemijske analize, se ocenijo konstante hitrosti in razpolovne dobe za primarno razgradnjo, kakor je opisano zgoraj za skupno mineralizacijo. Če je primarna razgradnja omejen proces, se lahko v nekaterih primerih uporabijo podatkovne točke iz celotnega poteka razgradnje. To je zato, ker so meritve neposredne, nasprotno kot pri meritvah aktivnosti 14C.
Če so se uporabile s 14C označene snovi, je treba masno ravnovesje izraziti v odstotkih vnesene začetne koncentracije, najmanj na koncu preskusa.
2.1.2 Preostala aktivnost
Ko se biorazkraja s 14C označen del organske snovi, se večji del 14C pretvori v 14CO2, drugi del pa se uporabi za rast biomase in/ali sintezo izvenceličnih presnovkov. Zato dokončna „popolna“ biorazgradnja snovi ne pomeni 100-odstotne pretvorbe ogljika iz te snovi v 14CO2. 14C, ki se vgradi v produkte, nastale v biosintezi, se naknadno počasi sprosti kot 14CO2 zaradi „sekundarne mineralizacije“. Zaradi tega prikazi preostale aktivnosti organskega 14C (izmerjeni po odstranitvi CO2) ali nastalega 14CO2 v odvisnosti od časa kažejo „rep“ po zaključku razgradnje. To zaplete kinetično interpretacijo podatkov in za ta namen je treba za oceno konstante hitrosti razgradnje običajno uporabiti le začetni del krivulje (po zaključku faze prilagajanje in pred 50-odstotno razgradnjo). Če se preskusna snov razkraja, je skupna preostala aktivnost organskega 14C vedno večja od aktivnosti 14C, povezane s preostalo nerazgrajeno preskusno snovjo. Če poteka razgradnja preskusne snovi z reakcijo prvega reda in se v CO2 mineralizira konstantni delež α, je začetni naklon krivulje izginevanja 14C (skupni organski 14C v odvisnosti od časa) α-krat naklon ustrezne krivulje koncentracije preskusne snovi (oz. natančno rečeno, dela preskusne snovi, ki je označen s 14C). Konstanta hitrosti razgradnje, izračunana iz nepopravljenih meritev aktivnosti skupnega organskega 14C, bo zato konzervativna. Postopki za ocenjevanje koncentracij preskusne snovi iz izmerjenih radiokemijskih aktivnosti, ki temeljijo na raznih poenostavitvenih predpostavkah, so opisani v virih (2)(9)(10)(11). Takšne postopke je najenostavneje uporabiti za hitro razgradljive snovi.
2.2 RAZLAGA REZULTATOV
Če se ugotovi, da je k neodvisen od dodane koncentracije (tj. če je izračunani k približno enak pri različnih koncentracijah preskusne snovi), se lahko predpostavi, da je konstanta hitrosti prvega reda reprezentativna za uporabljene pogoje preskušanja, tj. preskusno snov, vzorec vode in preskusno koncentracijo. Do kakšne mere se lahko rezultati generalizirajo ali ekstrapolirajo na druge sisteme, pa je treba ovrednotiti s strokovno presojo. Če se uporabijo visoke koncentracije preskusne snovi in razgradnja zato ne sledi kinetiki prvega reda, podatkov ni mogoče uporabiti za neposredno oceno konstante hitrosti prvega reda ali ustrezne razpolovne dobe. Vendar so podatki, pridobljeni iz preskusa z visokimi koncentracijami preskusne snovi, lahko še vedno uporabni za ocenjevanje stopnje skupne mineralizacije in/ali zaznavanje in količinsko produktov transformacije.
Če so znane hitrosti drugih postopkov izginevanja poleg biorazgradnje (npr. hidrolize ali izhlapevanja), se lahko odštejejo od neto hitrosti izginevanja med preskusom, da se dobi približna ocena hitrosti biorazgradnje. Podatki za hidrolizo se lahko npr. pridobijo iz sterilnega kontrolnega vzorca ali iz vzporednega preskušanja z višjo koncentracijo preskusne snovi.
Posredno in neposredno določevanje 14CO2 (oddelek 1.8.9.4 in Dodatek 3) se lahko uporabita le za merjenje obsega mineralizacije preskusne snovi v CO2. Za analizo koncentracij s 14C označene preskusne snovi in tvorbe poglavitnih produktov transformacije (tretji odstavek oddelka 1.8.9.4) se lahko uporabita radiokromatografija (RAD-TLC) ali HPLC. Da se omogoči neposredno ocenjevanje razpolovne dobe, je nujno, da ni prisotnih drugih poglavitnih produktov transformacije (opredeljeno kot ≥ 10 % vnesene količine preskusne snovi). Če so prisotni poglavitni produkti transformacije, kakor so opredeljeni tu, je potrebno podrobno vrednotenje podatkov. To lahko vključuje ponovitve preskušanja in/ali določitev produktov transformacije (glejte prvi odstavek oddelka 1.8.9.5), razen če lahko usodo produktov transformacije upravičeno ovrednotimo na podlagi izkušenj (npr. podatki o poteh razgradnje). Ker se delež preskusne snovi, ki se pretvori v CO2, razlikuje (odvisno v večji meri od koncentracije preskusne snovi in drugih dostopnih substratov, preskusnih pogojev in mikrobne skupnosti), ta preskus ne omogoča enostavne ocene popolne biorazgradnje kakor v preskusu upadanja DOC, vendar je rezultat podoben kakor pri respirometričnem preskusu. Stopnja mineralizacije bo tako manjša ali enaka najnižji ravni popolne biorazgradnje. Da se določi popolnejša slika popolne biorazgradnje (mineralizacija in vgradnja v biomaso), je treba na koncu preskusa opraviti analizo fazne porazdelitve 14C (glejte Dodatek 1). 14C v delcih bo sestavljen iz 14C, ki je vgrajen v bakterijsko biomaso, in 14C, ki je sorbiran na organske delce.
2.3 VELJAVNOST PRESKUSA
Če se referenčna snov ne razgradi v pričakovanem časovnem obdobju (za anilin in natrijev benzoat običajno prej kot v dveh tednih), obstaja dvom o veljavnosti preskusa, zato je treba veljavnost dodatno preveriti ali pa se preskus ponovi z novim vzorcem vode. V ISO preskusu primerljivosti metode je sedem laboratorijev, izbranih iz cele Evrope, ugotovilo konstante hitrosti razgradnje za anilin, ki so variirale od 0,3 do 1,7 dan–1 s povprečno vrednostjo 0,8 d–1 pri 20 oC in standardno napako ±0,4 d–1 (t½ = 0,9 dni). Tipični časi prilagoditve so bili od 1 do 7 dni. Preiskane vode so imele po navedbah bakterijsko maso, ki je ustrezala 103–104 kolonije tvorečim delcem (CFU) na ml. Hitrosti razgradnje v srednjeevropskih vodah, bogatih s hranili, so bile višje od hitrosti v nordijskih oligotrofnih vodah. Razlike so lahko nastale zaradi različnega trofičnega statusa ali zaradi predhodne izpostavitve kemijskim snovem.
Skupni izkoristek (masna bilanca) na koncu poskusa bi morala biti med 90 % in 110 % za radioaktivno označene snovi, začetni izkoristek na začetku poskusa bi moral biti med 70 % in 110 % za neoznačene snovi. Vendar se morajo nakazana območja šteti le za ciljna in se ne smejo uporabiti kot kriteriji za sprejemljivost preskusa.
3. POROČILO O PRESKUSU
Na poročilu o preskusu je treba jasno navesti vrsto raziskave, tj. pelagični preskus ali preskus suspendiranega sedimenta. Poročilo o preskusu mora vsebovati tudi najmanj naslednje podatke:
Preskusna snov in referenčna snov/referenčne snovi:
|
—
|
splošna imena, kemijska imena (priporočeno poimenovanje po IUPAC in/ali CAS), številke po CAS, strukturne formule (z navedbo položaja 14C, če se uporabi radioaktivno označena snov) in ustrezne fizikalno-kemijske lastnosti preskusne in referenčne snovi (glej oddelka 1.5 in 1.6),
|
|
—
|
kemijska imena, številke po CAS, strukturne formule (z navedbo položaja 14C, če se uporabi radioaktivno označena snov) in ustrezne fizikalno-kemijske lastnosti snovi, ki se uporabijo kot standardi za določitev in količinsko opredelitev produktov transformacije,
|
|
—
|
čistoto (nečistote) preskusne snovi in referenčnih snovi,
|
|
—
|
radiokemijsko čistoto označene kemikalije in specifično aktivnost (kadar je primerno).
|
Površinska voda:
Navesti je treba najmanj naslednje podatke o odvzetem vzorcu vode:
|
—
|
lokacijo in opis mesta vzorčenja, vključno, če je mogoče, s preteklim onesnaženjem,
|
|
—
|
datum in uro vzorčenja,
|
|
—
|
hranila (skupni N, amoniak, nitrit, nitrat, skupni P, raztopljeni ortofosfat),
|
|
—
|
izgled vzorca (npr. barva in motnost),
|
|
—
|
temperaturo in pH na mestu vzorčenja v času vzorčenja,
|
|
—
|
kisikov in redoks potencial (obvezno, če aerobni pogoji niso očitni),
|
|
—
|
slanost ali prevodnost (v primeru morske vode in brakične vode),
|
|
—
|
suspendirane trdne snovi (v primeru motnega vzorca),
|
|
—
|
po možnosti druge pomembne podatke o mestu vzorčenja v času vzorčenja (npr. dejanski ali zgodovinski podatki o pretoku rek ali morskih tokov, bližnji poglavitni iztoki in vrsta iztokov, vremenski pogoji pred časom vzorčenja),
|
in neobvezno:
|
—
|
mikrobno biomaso (npr. neposredno štetje z akridinskim oranžnim ali določitev delcev, ki tvorijo kolonije),
|
|
—
|
koncentracijo klorofila kot specifično oceno biomase alg.
|
Poleg opisanega je treba navesti naslednje podatke o sedimentu, če se opravlja preskus suspendiranega sedimenta:
|
—
|
globina odvzema sedimenta,
|
|
—
|
izgled sedimenta (npr. obarvan, blaten, muljast ali peščen),
|
|
—
|
tekstura (npr. delež grobega peska, drobnega peska, mulja in gline),
|
|
—
|
suha masa v g/l suspendiranih trdnih snovi, koncentracija TOC ali zmanjšanje mase po sežigu kot merilo vsebnosti organske snovi,
|
|
—
|
kisikov in redoks potencial (obvezno, če aerobni pogoji niso očitni).
|
Preskusni pogoji:
|
—
|
zakasnitev med odvzemom in uporabo v laboratorijskem preskus, shranjevanje vzorca in predobdelava vzorca, datum izvedbe raziskav,
|
|
—
|
količina uporabljene preskusne snovi, preskusne koncentracije in referenčne snovi,
|
|
—
|
metoda vnosa preskusne snov, vključno z uporabo topil,
|
|
—
|
uporabljeni volumen površinske vode in sedimenta (če se je uporabil) in volumen vzorcev, odvzetih za analizo v vsakem časovnem obdobju,
|
|
—
|
opis uporabljenega preskusnega sistema.
|
Če se ne uporabi tema, podatki o pogojih „difuzne svetlobe“;
|
—
|
podatke o metodi/metodah uporabljenih za vzpostavitev sterilnih kontrol (npr. temperatura, trajanje in število ciklov avtoklaviranja),
|
|
—
|
inkubacijsko temperaturo,
|
|
—
|
podatke o analitskih tehnika in metodi/metodah, uporabljenih za radiokemijske meritve in za preverjanje masne bilance ter meritve fazne porazdelitve (če so bile opravljene),
|
Rezultati:
|
—
|
odsotki izkoristka (glejte oddelek 1.7.1),
|
|
—
|
ponovljivost in občutljivost uporabljenih analitskih metod, vključno z mejo zaznavnosti (LOD) in mejo količinske opredelitve (LOQ) (glejte oddelek 1.7.2),
|
|
—
|
vse izmerjene podatke (vključno s časom vzorčenja) in izračunane vrednosti v preglednici ter krivulje razgradnje; za vsako preskusno koncentracijo in za vsako vzporedno bučko je treba navesti koeficient linearne korelacije za naklon logaritemske krivulje, ocenjeno fazo prilagajanja in konstanto hitrosti prvega reda ali psevdo prvega reda (če je možno) ter ustrezno razpolovno dobo razgradnje (ali trajanje razpolovne dobe t50),
|
|
—
|
navesti pomembne vrednosti, kot so povprečja rezultatov, opaženih v posameznih ponovitvah, npr. dolžina faze prilagajanja, konstanto hitrosti razgradnje in razpolovno dobo razgradnje (ali t50),
|
|
—
|
uvrstiti sistem kot neprilagojen ali prilagojen na osnovi izgleda krivulje razgradnje in iz možnih vplivov na preskusno koncentracijo,
|
|
—
|
rezultate končnega preverjanja masne bilance in rezultate meritev fazne porazdelitve (če so bile opravljene),
|
|
—
|
delež mineraliziranega 14C in končna raven primarne razgradnje, če se uporabijo specifične analize,
|
|
—
|
določitev, molska koncentracija in odstotek vnesenih in poglavitnih produktov transformacije (glejte prvi odstavek oddelka 1.8.9.5), kadar je primerno,
|
|
—
|
predlagane poti transformacije, kadar je primerno,
|
4. VIRI
|
(1)
|
OECD TG 309 (2004) Aerobic Mineralisation in surface water – Simulation Biodegradation Test.
|
|
(2)
|
ISO/DIS 14592–1 (1999) Water quality – Evaluation of the aerobic biodegradability of organic compounds at low concentrations – Part 1: Shake flask batch test with surface water or surface water/sediment suspensions.
|
|
(3)
|
Testing Method C.23. Aerobic and anaerobic transformation in soil.
|
|
(4)
|
Testing Method C.24. Aerobic and anaerobic transformation in aquatic sediments.
|
|
(5)
|
OECD (1993). Guidelines for the Testing of Chemicals. OECD, Paris.
|
|
(6)
|
ISO 8245 (1999). Water quality – Guidelines on the determination of total organic carbon (TOC) and dissolved organic carbon (DOC).
|
|
(7)
|
ISO 10634 (1995). Water quality – Guidance for the preparation and treatment of poorly water-soluble organic compounds for the subsequent evaluation of their biodegradability in an aqueous medium.
|
|
(8)
|
OECD draft (2000). Guidance Document on aquatic toxicity testing of difficult substances and mixtures. Environmental Health and Safety Publications. Series on Testing and Assessment. No 22 (to be published summer 2000).
|
|
(9)
|
Simkins, S. in Alexander, M. (1984). Models for mineralization kinetics with the variables of substrate concentration and population density. Appl. Environ. Microbiol.47, 394–401.
|
|
(10)
|
Ingerslev, F. in N. Nyholm. (2000). Shake-flask test for determination of biodegradation rates of 14C-labeled chemicals at low concentrations in surface water systems. Ecotoxicol. Environ. Saf. 45, 274–283.
|
|
(11)
|
ISO/CD 14592–1 (1999). Ring test report: Water Quality – Evaluation of the aerobic biodegradability of organic compounds at low concentrations part 1 – report of 1998/1999 ring-test. Shake flask batch test with surface water or surface water/sediment suspensions.
|
Dodatek 1
Fazna porazdelitev 14C
Zaradi preverjanja postopka je treba rutinske meritve preostale skupne aktivnosti organskega 14C (TOA) dopolniti z meritvami masne bilance, ki vključujejo neposredno določevanje sproščenega 14CO2 po zajetju v absorpcijsko posodo (glejte Dodatek 3). Pozitiven rezultat tvorbe 14CO2 je sam po sebi neposreden dokaz biorazgradnje in je v nasprotju z abiotsko razgradnjo ali drugačnim izginevanjem, npr. izhlapevanjem in sorpcijo. Dodatne uporabne podatke, ki opisujejo obnašanje biorazgradnje, je možno dobiti iz meritev porazdelitve TOA med raztopljenim stanjem (raztopljena aktivnost organskega 14C, DOA) in delci (aktivnost organskega 14C v delcih, POA) po ločevanju delcev z membransko filtracijo ali centrifugiranjem. POA obsega preskusno snov, ki je sorbirana na mikrobno biomaso in na druge delce, ter ogljik preskusne snovi, ki je bil uporabljen za sintezo novega celičnega materiala in s tem vgrajen v frakcijo biomase, ki jo predstavljajo delci. Kot oceno nastajanja raztopljenega organskega materiala s 14C lahko uporabimo DOA na koncu biorazgradnje (izravnanje krivulje odvisnosti razgradnje od časa).
Fazna porazdelitev preostalega 14C v izbranih vzorcih se oceni s filtracijo vzorcev skozi 0,22-μm ali 0,45-μm membranski filter iz materiala, ki ne adsorbira znatnih količin preskusne snovi (primerni so lahko polikarbonatni filtri). Če je sorpcija preskusne snovi na filter preobsežna, da bi jo lahko zanemarili (kar je treba preverite pred poskusom), se lahko namesto filtracije uporabi centrifugiranje (2 000 g; 10 min).
S filtratom oziroma centrifugatom ravnajte, kakor je opisano v Dodatku 3 za nefiltrirane vzorce. Membranske filtre je treba raztopiti v primerni scintilacijski tekočini in prešteti, kakor ponavadi. Običajno se uporabi le metoda razmerja zunanjega standarda za korekcijo pojenjanja ali oksidant za vzorec. Če se je uporabilo centrifugiranje, se sediment resuspendira, da nastane frakcija z delci v 1–2 ml destilirane vode, ki se jo prenese v scintilacijsko vialo. Centrifugirano posodo dvakrat speremo z 1 ml destilirane vode in izpirek prenesemo v scintilacijsko vialo. Če je treba, se lahko suspenzijo vklopi v gel za tekočinsko scintilacijsko štetje.
Dodatek 2
Polkontinuiran postopek
Da se doseže zadostna razgradnja odpornih snovi je lahko potrebna podaljšana inkubacija do več mesecev. Trajanje preskusa običajno ne sme preseči 60 dni, razen če se lastnosti prvotnega vzorca vode ohranjajo z obnavljanjem preskusne suspenzije. Vendar je možno preskusno obdobje podaljšati do največ 90 dni brez obnavljanja preskusne suspenzije, če se razgradnja preskusne snovi po prvih 60 dneh še ni začela.
Med inkubacijo za dolga obdobja se lahko raznolikost mikrobne združbe zmanjša zaradi različnih mehanizmov izginjanja in zaradi možnega osiromašenja vzorca vode esencialnih hranil in primarnih substratov ogljika. Zato je priporočljivo, da se uporabi polkontinuiran preskus, s katerim se zadostno določi hitrost razgradnje počasi razgradljivih snovi. Preskus je treba začeti s polkontinuiranim postopkom, če se za 20-odstotno razgradnjo snovi lahko na podlagi predhodnih izkušenj pričakuje trajanje inkubacije tri mesece. V nasprotnem primeru se lahko običajni serijski preskus spremeni v polkontinuiran preskus, če v približno 60 dneh preskušanja v serijskem preskusu ni dosežena nikakršna razgradnja preskusne snovi. Če se opazi znatna razgradnja (npr. > 20 %) se lahko polkontinuiran postopek ustavi in preskus nadaljuje kot serijski poskus.
V polkontinuiranem preskusu se vsake dva tedna približno ena tretjina volumna preskusne suspenzije zamenja s sveže odvzeto vodo, kateri je dodana preskusna snov v začetni koncentraciji. Nadomestni vodi podobno dodamo sediment v začetni koncentraciji (med 0,01 in 1 g/l), če se opravlja preskus suspendiranega sedimenta. Če se opravlja preskus suspendirane trdne snovi iz sedimenta, je pomembno, da popolnoma suspendiran sistem ohranjamo tudi med obnavljanjem vode in da je zadrževalni čas identičen za trdne snovi in vodo, saj lahko v nasprotnem primeru izgubimo nameravano podobnost s homogenim vodnim sistemom brez fiksiranih faz. Iz teh razlogov ima pri uporabi polkontinuiranega postopka prednost začetna koncentracija suspendiranih sedimentov na spodnji meji navedenega intervala.
Predpisano dodajanje preskusne snovi kaže, da se začetne koncentracije preskusne snovi pri delnem obnavljanju preskusne suspenzije ne presežejo, zato ne pride do prilagajanja, ki se sicer pogosto pojavi pri visokih koncentracijah. Ker postopek obsega tako ponovno inokulacijo in nadomestilo osiromašenih hranil in primarnih substratov, se izvirna mikrobna raznolikost obnovi in trajanja preskusa se lahko podaljša v principu do neskončnosti. Kadar se uporabi polkontinuiran postopek, je pomembno upoštevati, da se preostala koncentracija preskusne snovi popravi za količino preskusne snovi, ki se doda in odvzame pri vsakem postopku obnove. Pri spojinah, ki se sorbirajo v majhnem obsegu, se lahko pojma skupna in raztopljena koncentracija preskusne snovi uporabljata enakovredno. V navedenih pogojih (0,1–1 g trdnih snovi/l) je sorpcija nepomembna (< 5 %) za snovi z log Kow < 3 (velja za nevtralne, lipofilne spojine). To ponazarja naslednji primer izračuna. 0,1 g/l trdnih snovi grobo ustreza 10 mg ogljika na liter (delež ogljika, fC = 0,01). Ob predpostavki, da:
Log Kow (preskusne snovi) = 3
Koc = 0,42 × Kow
Porazdelitveni koeficient, Kd = fC × Koc
velja, da raztopljena frakcija skupne koncentracije (C-voda (Cw)/C-skupno (Ct) je:
Cw/Ct = 1/(1 + Kd × SS) = 1(1 + Koc × fC × SS) = 1/(1 + 0,42 × 103 × 0,01 × 0,1 × 10–3) = 0,999
Dodatek 3
Določitev 14CO2
Posredna določitev 14CO2
Za rutinske meritve je posredna metoda ponavadi najhitrejša in najbolj natančna, če je preskusna metoda nehlapna in se ne pretvarja v hlapne produkte transformacije. Nefiltrirane vzorce, npr. 5 ml, se preprosto prenese v scintilacijske viale. Primerna začetna aktivnost v vzorcih je 5 000 dpm–10 000 dpm (80–170 Bq), najmanjša začetna aktivnost pa je približno 1 000 dpm. Po zakisanju na pH 2–3 z 1–2 kapljicama koncentrirane H3PO4 ali HCl je treba CO2 odstraniti. Odstranjevanje CO2 se lahko opravi z uvajanjem zraka za približno ½–1 ure. Namesto tega se lahko viale močno stresa za 1–2 uri (npr. za stresalniku za mikroplošče) ali pusti preko noči pri nežnejšem stresanju. Učinkovitost odstranjevanja CO2 je treba preveriti (s podaljševanjem trajanja aeracije ali stresanja). Nato se doda scintilacijska tekočina, ki je primerna za štetje vodnih vzorcev. Vzorec se homogenizira na vrtinčastem mešalu, nato pa se s tekočinskim scintilacijskim štetjem določi radioaktivnost, pri čemer se odšteje aktivnost ozadja, določena v slepih vzorcih (FB). Če preskusna voda ni zelo obarvana in ne vsebuje visoko koncentracijo delcev, bodo vzorci običajno kazali enakomerno pojenjanje, kar bo dovolj za izvedbo korekcije pojenjanja z zunanjim standardom. Če je preskusna voda zelo obarvana, bo potrebna korekcija pojenjanja z dodatkom notranjega standarda. Če je koncentracija delcev visoka, morda ne bo možno doseči homogene raztopine ali gela ali pa bo variacija pojenjanja med vzorci velika. V tem primeru se lahko uporabi metoda štetja, ki je opisana spodaj za preskusne suspenzije. Če se preskus opravlja kot preskus suspendiranega sedimenta, se lahko meritve 14CO2 opravijo posredno z odvzemom 10 ml homogenega vzorca preskusne vode/suspenzije in ločitvijo faz s centrifugiranjem pri primerni hitrosti (npr. pri 40 000 m/s2 za 15 min). Vodno fazo se nato obdela, kakor je opisano zgoraj. Aktivnost 14C v fazi z delci (POA) je treba določiti z resuspendiranjem sedimenta v majhnem volumnu destilirane vode, prenosom v scintilacijske viale in dodatkom scintilacijske tekočine, da nastane gel (za ta namen so na voljo posebne scintilacijske tekočine). Odvisno od narave delcev (npr. njihove vsebnosti organskega ogljika) je morda možno pred dodatkom scintilacijske tekočine vzorec razkrojiti preko noči v topilniku tkiv in ga nato homogenizirati na vrtinčastem mešalu. Namesto tega se lahko POA določi s sežigom v prebitku kisika v oksidantu vzorca. Pri štetju je treba vedno vključiti notranje standarde. Morda bo treba opraviti korekcijo pojenjanja z dodatkom notranjega standarda v vsak posamezni vzorec.
Neposredna določitev 14CO2
Če se sproščeni 14CO2 meri neposredno, je treba na začetku poskusa začeti z več bučkami, odvzemom preskusnih bučk v vsaki merilni časovni točki z zakisanjem vsebine na pH 2–3 in zajemom 14CO2 v notranji (vstavljenem v vsako preskusno bučko na začetku preskusa) ali zunanji absorpcijski posodi. Kot absorpcijsko sredstvo se lahko uporabi bodisi alkalijska snov (npr. 1-normalna raztopina NaOH ali zrno NaOH) bodisi etanolamin ali absorbent na osnovi etanolamina bodisi komercialno dostopni absorbent. Pri neposrednem merjenju 14CO2 je treba bučke zapreti z npr. septumom iz butilnega kavčuka.
Slika 1a
Primer aritmetičnega prikaza podatkov (preostala aktivnost v odvisnosti od časa)

Slika 1b
Primer pologaritemskega prikaza podatkov (ln preostale aktivnosti v odvisnosti od časa).

PRILOGA VI
|
C.26.
|
PRESKUS ZAVIRANJA RASTI LEMNA SP.
|
1. METODA
Ta preskusna metoda je enakovredna OECD TG 221 (2006) (1). Pristojni organi EU so dosegli širše soglasje o primernosti preskusov z vodno lečo kot druge možnosti za preskuse na algah za močno obarvane snovi (2)(3).
1.1 UVOD
Ta preskusna metoda je zasnovana za določanje strupenosti snovi za sladkovodne rastline iz rodu Lemna (vodolečevke). Temelji na obstoječih smernicah (4)(5)(6)(7)(8)(9), vendar zaradi upoštevanja nedavnih raziskav in posvetovanj o številnih ključnih vprašanjih vključuje spremembe navedenih metod. Predlagana metoda je bila validirana v mednarodnem preskusu primerljivosti (10).
Ta preskusna metoda opisuje preskušanje strupenosti z organizmoma Lemna
gibba in Lemna minor. Oba organizma sta bila obsežno proučena in sta predmet zgoraj navedenih standardov. Taksonomija rodu Lemna je težka zaradi prisotnosti velike množice fenotipov. Čeprav lahko pride do genetske variabilnosti kot odziv na strupene snovi, trenutno ni dovolj podatkov o tej vrsti variabilnosti, na podlagi katerih bi bilo za to preskusno metodo mogoče priporočiti uporabo specifičnega klona. Opozoriti je treba, da se preskus ne opravlja aksenično, ampak se med preskusom uporabljajo postopki, da se čimbolj zmanjša onesnaženje z drugimi organizmi.
Podrobno je opisano preskušanje z obnavljanjem preskusne raztopine (polstatično ali pretočno) ali brez obnavljanja le-te (statično). Glede na cilje preskusa in zakonske zahteve je priporočljivo proučiti možnosti uporabe polstatičnih ali pretočnih metod, npr. za snovi, ki hitro izginjajo iz raztopine zaradi izhlapevanja, svetlobne razgradnje, obarjanja ali biorazgradnje. Več smernic je na voljo v (11).
1.2 OPREDELITVE
Za namene te preskusne metode se uporabljajo naslednje opredelitve in okrajšave:
Biomasa: masa suhe snovi živih organizmov, ki so prisotni v populaciji. V tem preskusu se kot nadomestek za biomaso običajno meri število listov oziroma površina listov. Ravno tako se izraz „biomasa“ nanaša na te nadomestne meritve.
Kloroza: porumenelost listnega tkiva.
Klon: je organizem ali celica, ki se z nespolnim razmnoževanjem razvije iz enega organizma. Zato so osebki iz istega klona genetsko identični.
Kolonija: pomeni skupek materinskih in hčerinskih listov (ponavadi 2 do 4), ki so pritrjeni eden na drugega. V nekaterih primeri to pomeni rastlino.
ECx
: je koncentracija preskusne snovi, raztopljene v preskusnem mediju, ki povzroči x-odstotno (npr. 50-odstotno) zmanjšanje rasti vodne leče v navedenem obdobju izpostavljanja (v primeru, da je trajanje poskusa odstopalo od popolne ali običajne dolžine, ga je treba navesti nedvoumno). Da se nedvoumno označi, da vrednost EC izhaja iz hitrosti rasti ali izplena, se uporabi simbol „ErC“ za hitrost rasti in „EyC“ za izplen, sledi pa merjena spremenljivka, npr. ErC (število listov).
Pretočen: preskus, v katerem se preskusna raztopina neprekinjeno menja.
List: posamezna/ena „listu podobna“ struktura rastline vodne leče. Je najmanjša enota, tj. osebek, ki je zmnožen razmnoževanja.
Grbavost: pomeni liste, ki so grbasti ali otekli.
Rast: je povečanje merjene spremenljivke, npr. števila listov, suhe mase, mokre mase ali površine listov, v času preskusa.
Hitrost rasti (povprečna specifična hitrost rasti): je logaritemsko povečanje biomase v obdobju izpostavljanja.
Najnižja koncentracija z opaznim učinkom (LOEC): je najnižja preskušena koncentracija snovi, pri kateri je opaziti statistično značilen učinek zmanjšanja rasti (pri p < 0,05) v primerjavi s kontrolnim vzorcem v navedenem obdobju izpostavljanja. Vendar morajo imeti vse koncentracije nad LOEC škodljiv učinek, ki je enak ali večji od škodljivega učinka, opaženega pri LOEC. Če ta dva pogoja ni možno izpolniti, je treba navesti popolno razlago izbire LOEC (in posledično NOEC).
Merjene spremenljivke: so vse vrste spremenljivk, ki se merijo, da se izrazi izid preskusa z eno ali več različnimi spremenljivkami odziva. V tej metodi so merjene spremenljivke število listov, površina listov, sveža masa in suha masa.
Monokultura: je kultura z eno rastlinsko vrsto.
Nekroza: je odmrlo (tj. belo ali z vodo prepojeno) listno tkivo.
Koncentracija brez opaznega učinka (NOEC): je preskušena koncentracija neposredno pod LOEC.
Fenotip: so opazne lastnosti organizma, ki jih določajo njegovi geni v interakciji z okoljem.
Spremenljivke odziva: so spremenljivke za oceno strupenosti, ki so izpeljane iz katere koli merjene spremenljivke za opis biomase z različnimi postopki izračuna. V tej metodi sta hitrost rasti in izplen spremenljivki odziva, ki sta izpeljani iz merjenih spremenljivk, kot so število listov, površina listov, sveža masa in suha masa.
Polstatični (obnavljajoči) preskus: je preskus, v katerem se preskusna raztopina v danih časovnih presledkih med preskusom redno menja.
Statični preskus: je preskusna metoda, v kateri preskusna raztopina med preskusom ne obnavlja.
Kazalec izida preskusa: opisuje splošen dejavnik, ki ga preskušana snov spremeni glede na kontrolni vzorec in je cilj preskusa. V tej metodi je kazalec izida zaviranje rasti, ki ga lahko izrazimo z različnimi spremenljivkami odziva, katere temeljijo na eni ali več merjenih spremenljivk.
Preskusni medij: je popolnoma sintetično gojišče, na katerem preskusne rastline rastejo ob izpostavitvi preskusni snovi. Običajno se preskusna snov raztopi v preskusnem mediju.
Izplen: je vrednost merjene spremenljivke za izražanje biomase na koncu obdobja izpostavljanja minus vrednost merjene spremenljivke na začetku obdobja izpostavljanja.
1.3 PRINCIP PRESKUSNE METODE
Kulturam rastlin iz rodu Lemna v eksponentni fazi rasti se omogoči, da sedem dni rastejo kot monokultura v prisotnosti različnih koncentracij preskusne snovi. Cilj preskusa je količinsko opredeliti učinke snovi na vegetativno rast v tem obdobju, na osnovi izbranih merjenih spremenljivk. Primarna merjena spremenljivka je število listov. Poleg nje se meri vsaj še ena merjena spremenljivka (skupna površina listov, suha teža ali sveža teža), saj lahko nekatere snovi bolj vplivajo na druge merjene spremenljivke kot na število listov. Učinki, ki so odvisni od snovi, se količinsko opredelijo tako, da se rast v preskusni raztopini primerja z rastjo kontrolnih vzorcev, nato pa se določi koncentracija, ki je povzročila navedeno x-odstotno zaviranje rasti (npr. 50-odstotno). Ta koncentracija se izrazi kot ECx (npr. EC50).
Kazalec izida je zaviranje rasti, ki je izraženo kot logaritemsko povečanje merjene spremenljivke (povprečne specifične hitrosti rasti) v obdobju izpostavljanja. Iz povprečne specifične hitrosti rasti niza preskusnih raztopin se določi koncentracija, ki je povzročila navedeno x-odstotno zaviranje hitrosti rasti (npr. 50-odstotno). Ta koncentracija se izrazi kot ErCx (npr. ErC50).
Dodatna spremenljivka odziva, ki se uporablja v tej preskusni metodi, je izplen, ki ga je morda treba določiti, da se izpolnijo specifične zakonske zahteve nekaterih držav. Izplen se določi kot vrednost merjenih spremenljivk na koncu obdobja izpostavljanja minus vrednost merjenih spremenljivk na začetku obdobja izpostavljanja. Iz izplena niza preskusnih raztopin se določi koncentracija, ki je povzročila navedeno x-odstotno zaviranje izplena (npr. 50-odstotono). Ta koncentracija se izrazi kot EyCx (npr. EyC50).
Poleg navedenega se lahko statistično določita tudi najnižja koncentracija z opaznim učinkom (LOEC) in koncentracija brez opaznega učinka (NOEC).
1.4 PODATKI O PRESKUSNI SNOVI
Na voljo mora biti analitska metoda z zadostno občutljivostjo za količinsko opredelitev snovi v preskusnem mediju.
Podatki o preskusni snovi, ki so morda uporabni za določevanje pogojev preskusa, so med drugim strukturna formula, čistota, topnost v vodi, obstojnost v vodi in na svetlobi, pKa, Kow, parni tlak in biorazgradljivost. Topnost v vodi in parni tlak se lahko uporabita za izračun konstante Henryevega zakona, ki pokaže, ali so v časovnem obdobju poskusa verjetne bistvene izgube preskusne snovi. To pripomore k odločitvi o uvedbi posameznih postopkov za nadzorovanje takšnih izgub. Če so podatki o topnosti in obstojnosti preskusne snovi negotovi, je priporočljivo, da se te vrednosti določijo v pogojih preskusa, tj. v gojišču, pri temperaturi in režimu osvetljevanja, ki se uporabijo v preskusu.
Kadar je zlasti pomembno nadzorovanje pH preskusnega medija (npr. pri preskušanju kovin ali snovi, ki so hidrolitično neobstojne), je priporočljivo dodajanje pufra v gojišče (glejte prvi odstavek oddelka 1.7.4). Več smernic za preskusne snovi z fizikalno-kemijskimi lastnostmi, zaradi katerih je preskušanje oteženo, je navedenih v (11).
1.5 REFERENČNE SNOVI
Za preverjanje preskusnega postopka, se lahko uporabi referenčna snov oz. referenčne snovi, kot je 3,5-diklorofenol, ki je bil uporabljen v mednarodnem preskusu primerljivosti (10). Priporočljivo je referenčno snov preskusiti najmanj dvakrat letno oz. vzporedno z določevanjem strupenosti preskusne snovi, kadar se preskušanja opravljajo redkeje.
1.6 VELJAVNOST PRESKUSA
Za veljavnost preskusa mora biti podvojitveni čas števila listov v kontrolnem vzorcu krajši od 2,5 dni (60 h), kar ustreza približno sedemkratnemu povečanju v sedmih dneh in povprečni specifični hitrosti 0,275 dan–1. Ta kriterij je mogoče doseči z mediji in pogoji preskusa, ki so opisani v tej preskusni metodi, ter statičnim preskusnim režimom (8). Pričakovati je tudi, da je ta kriterij dosegljiv tudi v polstatičnih in pretočnih pogojih preskusa. Izračun podvojitvenega časa je prikazan v oddelku 2.1
1.7 OPIS METODE
1.7.1 Aparatura
Vsa oprema v stiku s preskusnimi mediji mora biti izdelana iz stekla ali druge kemijsko inertne snovi. Steklovino za gojenje in preskušanje je treba očistiti kemijskih onesnaževalcev, ki se lahko spirajo v preskusni medij. Ta steklovina mora biti sterilna. Preskusne posode morajo biti dovolj široke, da listi posameznih kolonij v posodah kontrolnih vzorcev rastejo brez prekrivanja do konca preskusa. Ni pomembno, ali se korenine dotikajo dna preskusnih posod, vendar je najmanjša priporočljiva globina vsake preskusne posode 20 mm, najmanjša priporočljiva prostornina vsake preskusne posode pa 100 ml. Če se izpolnijo te zahteve, izbira preskusnih posod ni ključna. Kot primerne so se izkazale steklene čaše, kristalizacijske posodice in steklene petrijevke ustreznih mer. Preskusne posode morajo biti pokrite, da se čimbolj zmanjša izhlapevanje in nenamerno onesnaženje, hkrati pa je omogočena potrebna izmenjava zraka. Primerne poskusne posode in zlasti pokrovi ne smejo senčiti ali spremeniti spektralnih značilnosti svetlobe.
Kulture in preskusne posode se ne smejo hraniti skupaj. To je najbolje doseči z ločenimi okoljskimi gojitvenimi komorami, inkubatorji ali prostori. Mora biti omogočeno nadzorovanje osvetlitve in temperature ter ohranjanje teh parametrov na konstantni ravni (glejte oddelek 1.7.8).
1.7.2 Preskusni organizem
V tem preskusu se uporabi bodisi Lemna gibba bodisi Lemna minor. Kratki opisi vrst vodne leče, ki so bile uporabljene v preskušanjih strupenosti, so navedeni v Dodatku 1. Rastlinski material je možno dobiti iz zbirke kultur, drugega laboratorija ali na terenu. Če se rastlinski material odvzame na terenu, je treba rastline ohranjati v kulturi v istem mediju, kakor se uporablja za preskus, najmanj osem tednov pred uporabo. Terenska mesta, kjer se jemljejo začetne kulture, morajo biti brez očitnih virov onesnaženja. Če se kulture pridobijo iz drugega laboratorija ali zbirke kultur, jih je treba na podoben način ohranjati najmanj tri tedne. V poročilu je treba vedno navesti v preskusu uporabljen vir rastlinskega materiala ter vrsta in klon (če sta znana).
Monokulture, za katere se s prostim očesom oceni, da niso onesnažene z drugimi organizmi, npr. algami in praživalmi. Zdrave rastline vrste L. minor bodo sestavljale kolonije, ki imajo od dva do pet listov. Zdrave kolonije vrste L. gibba pa lahko imajo do sedem listov.
Kakovost in enakomernost rastlin, ki se uporabijo v preskusu, bosta pomembno vplivali na izid preskusa, zato je treba rastline natančno izbrati. Uporabiti je treba mlade, hitrorastoče rastline brez vidnih lezij ali sprememb barve (kloroza). Kulture dobre kakovosti nakazuje visoka pojavnost kolonij, ki imajo najmanj dva lista. Veliko število posameznih listov kaže na okoljski stres, npr. omejitev hranil, in rastlinski material, katerega kulture se ne smejo uporabiti za preskušanje.
1.7.3 Gojenje
Kulture se lahko hranijo pri zmanjšani osvetlitvi in znižani temperaturi (4–10 °C), da se zmanjša pogostnost vzdrževanja kultur (npr. kadar se za neko obdobje ne načrtuje preskusov z vodno lečo). Podrobnosti gojenja so navedene v Dodatku 2. Kadar se pojavijo očitni znaki onesnaženja z algami ali drugimi organizmi, je treba podvzorec listov vodne leče površinsko sterilizirati ter nato prenesti v sveži medij (glejte Dodatek 2). V tem primeru je treba preostalo onesnaženo kulturo zavreči.
Najmanj sedem dni pred preskušanjem je treba zadostno število kolonij aseptično prenesti v sveži sterilni medij in gojiti 7–10 dni v pogojih preskusa.
1.7.4 Preskusni medij
Kakor je opisano spodaj, so za Lemna gibba in Lemna minor priporočeni različni mediji. Natančno je treba proučiti vključitev pufra v preskusni medij (MOPS (4-morfolinpropan sulfonska kislina, CAS št.: 1132–61–2; EINECS št.: 214–478–5) v medij za L. minor in NaHCO3 v medij za L. gibba), kadar sumimo, da lahko reagira s preskusno snovjo in vpliva na izražanje strupenosti. Če se izpolnijo zahteve veljavnosti, je sprejemljiv tudi medij po Steinbergu (12).
Za gojenje L. minor in preskušanje z L. minor je priporočljiva modifikacija gojišča za vodno lečo iz švedskega standarda (SIS). Sestava tega medija je navedena v Dodatku 3.
Za gojenje L. gibba in preskušanje z L. gibba je priporočljivo gojišče 20X – AAP, kakor je opisano v Dodatku 3.
Za L. minor je primeren tudi medij po Steinbergu, kakor je opisan v Dodatku 3, vendar se lahko uporabi tudi za L. gibba pod pogojem, da se izpolnijo zahteve veljavnosti.
1.7.5 Preskusne raztopine
Preskusne raztopine se ponavadi pripravijo z razredčitvijo založnih raztopin. Založne raztopine preskusne snovi se običajno pripravijo z raztopitvijo snovi v gojišču.
Najvišja preskušena koncentracija preskusne snovi običajno ne sme preseči topnosti te snovi v vodi v pogojih preskusa. Vendar je treba opozoriti, da Lemna spp. plavajo na gladini in so lahko izpostavljene snovem, ki se zbirajo na mejni ploskvi med vodo in zrakom (npr. slabo vodotopne snovi ali hidrofobne snovi ali površinsko aktivne snovi). V takšnih pogojih izpostavitev ne bo posledica snovi iz raztopine in preskusne koncentracije lahko, odvisno od značilnosti preskusne snovi, presežejo topnost v vodi. Za preskusne snovi z majhno topnostjo v vodi bo morda treba pripraviti koncentrirano založno raztopino ali dispergirati snov s pomočjo organskega topila ali disperzijskega sredstva, da se omogoči dodajanje točnih količin preskusne snovi v preskusni medij ter da se olajša njeno razprševanje in raztapljanje. Čim bolj si je treba prizadevati, da se izognemo uporabi takšnih snovi. Uporaba pomožnih topil ali disperzijskih sredstev ne sme povzročiti fitotoksičnosti. Npr. pogosto uporabljeni topili, ki ne povzročata fitotoksičnosti pri koncentracijah do 100 μl·l–1, sta med drugim aceton in dimetilformamid. Če se uporabi topilo ali disperzijsko sredstvo, je treba končno koncentracijo te snovi navesti v poročilu in jo ohranjati na najnižji ravni (≤ 100 μl·l–1). Ravno tako morajo vsi postopki obdelave in kontrolni vzorci vsebovati enako koncentracijo topila ali disperzijskega sredstva. Več smernic o uporabi disperzijskih sredstev je na voljo v (11).
1.7.6 Preskusne in kontrolne skupine
Pri izbiri primernih preskusnih koncentracij pripomore predhodno poznavanje strupenosti preskusne snovi za vodno lečo, npr. podatki iz preskusa za ugotavljanje območja. V dokončnem preskusu strupenosti mora biti običajno najmanj pet preskusnih koncentracij, ki so urejene v geometrijskem zaporedju. Po možnosti ločilni faktor med preskusnimi koncentracijami ne sme presegati 3,2, vendar se lahko uporabijo večje vrednosti, če je krivulja odziva na koncentracijo ravna. Če se uporabi manj kot pet koncentracij, je treba to utemeljiti. Za vsako preskusno koncentracijo je treba uporabiti najmanj tri ponovitve.
Pri določevanju območja preskusnih koncentracij (pri ugotavljanju območja in/ali v dokončnem preskusu strupenosti) je treba proučiti naslednje možnosti:
|
—
|
Za določitev ECx z ustrezno ravnijo zaupanja morajo preskusne koncentracije oklepati vrednost ECx. Npr. če ocenjujemo EC50, mora biti najvišja preskusna koncentracija višja od vrednosti EC50. Če vrednost EC50 leži izven območja preskusnih koncentracij, bodo povezani intervali zaupanja veliki in pravilna ocena statističnega ujemanja modela morda ne bo možna.
|
|
—
|
Če je cilj določitev LOEC/NOEC, mora biti najnižja preskusna koncentracija dovolj nizka, da rast ni bistveno manjša od kontrole. Poleg tega mora biti najvišja preskusna koncentracija dovolj visoka, da je rast bistveno manjša od kontrole. V nasprotnem primeru bo treba preskus ponoviti z drugačnim območjem koncentracij (razen če je najvišja koncentracija na meji topnosti ali najvišji zahtevani mejni koncentraciji, npr. 100 mg·l–1).
|
Vsak preskus mora vključevati kontrole, ki so sestavljene iz enakega hranilnega medija, števila listov in kolonij, okoljskih pogojev in postopkov, kakor se uporabljajo za preskusne posode, vendar brez preskusne snovi. Če se uporablja pomožno topilo ali disperzijsko sredstvo, je treba vključiti dodatno kontrolno obdelavo s topilom/disperzijskim sredstvom, ki je prisotno v enaki koncentraciji kot v posodah s preskusno snovjo. Število ponovitev kontrolnih posod (in posod s topilom, če je smiselno) mora biti najmanj enako, idealno dvakrat večje, številu posod za vsako preskusno koncentracijo.
Če določevanje NOEC ni zahtevano, se načrt preskusa lahko spremeni, tako da se poveča število koncentracij in zmanjša število ponovitev na koncentracijo. Kljub temu morajo imeti kontrolni vzorci najmanj tri ponovitve.
1.7.7 Izpostavitev
Iz inokulacijske kulture se prenesejo kolonije, ki obsegajo od 2 do 4 vidne liste, in naključno določijo preskusnim posodam v aseptičnih pogojih. Vsaka preskusna posoda mora vsebovati skupno od 9 do 12 listov. Število listov in kolonij mora biti v vsaki preskusni posodi enako. Izkušnje, pridobljene s to metodo in v preskusih primerljivosti, kažejo, da tri ponovitve na postopek obdelave, pri čemer vsaka ponovitev na začetku vsebuje 9 do 12 listov, zadostujejo za odkritje razlike v rasti, ki znaša od 4 do 7 % zaviranja med obdelavami, izračunanega s hitrostjo rasti (od 10 do 15 % zaviranja, izračunanega z izplenom) (10).
Za inkubator je treba pripraviti naključno porazdelitev položajev testnih posod, da se čimbolj zmanjša vpliv prostorskih razlik v temperaturi in jakosti svetlobe. Pri beleženju opažanj se tudi zahteva blokovska zasnova oz. naključna razporeditev posod (ali pogostejše premeščanje).
Če predhodni preskus obstojnosti kaže, da koncentracije preskusne snovi ni možno ohranjati (tj. izmerjena koncentracija pade pod 80 % začetno izmerjene koncentracije) v obdobju trajanja poskusa (7 dni), je priporočljiv polstatični režim preskusa. V tem primeru je treba kolonije izpostaviti sveže pripravljenim preskusnim in kontrolnim raztopinam najmanj dvakrat med poskusom (npr. 3. in 5. dan). Pogostost izpostavitve svežemu mediju mora biti odvisna od obstojnosti preskusne snovi: večja pogostnost bo potrebna za ohranjanje približno konstantnih koncentracij zelo neobstojnih ali hlapnih snovi. V določenih okoliščinah bo morda treba uporabiti pretočni postopek (11)(13).
Izpostavitev s foliarnim nanosom (pršenjem) ni obravnavana v tej preskusni metodi. Glejte (14).
1.7.8 Pogoji inkubacije
Uporabiti je treba neprekinjeno toplo ali hladno belo fluorescentno osvetlitev, da je jakost svetlobe v območju od 85 do 135 μE·m–2·s–1, če se meri v fotosintetsko aktivnem sevanju (400–700 nm) v točkah, ki so enako oddaljene od vira svetlobe kot listi vodne leče (enakovredno 6 500–10 000 lux). Razlike v izbrani jakosti svetlobe preko preskusnega območja ne smejo preseči ± 15 %. Metoda zaznavanja in merjenja svetlobe, zlasti vrsta tipala, vpliva na izmerjeno vrednost. Sferična tipala (ki se odzivajo na svetlobo iz vseh kotov nad in pod ravnino merjenja) in „kosinusnih“ tipal (ki se odzivajo na svetlobo iz vseh kotov nad ravnino merjenja) so bolj primerna od enosmernih tipal in dajejo višje odčitke v primeru več točkovnih virov svetlobe, ki so takšne vrste, kot je opisano tu.
Temperatura preskusnih posod mora biti 24 ± 2 °C. Vrednost pH kontrolnega medija se med preskusom ne bi smela povečati za več kot 1,5 enote. Vendar odstopanje za več kot 1,5 enote ne razveljavi preskusa, če se dokaže, da preskus ustreza kriterijem veljavnosti. Posebno pozornost je treba posvetiti lezenju vrednosti pH v posebnih primerih, ko se preskušajo neobstojne snovi ali kovine. Glejte (11) za dodatne smernice.
1.7.9 Trajanje
Preskus se prekine 7 dni po prenosu rastlin v preskusne posode.
1.7.10 Meritve in analitske določitve
Ob začetku preskusa se prešteje in zabeleži število listov v preskusnih posodah, pri čemer je treba zajeti štrleče, razločno vidne liste. Število listov, ki izgledajo normalni ali nenormalni, je treba določiti na začetku preskusa, najmanj vsake 3 dni v obdobju izpostavljanja (tj. najmanj dvakrat v 7-dnevnem obdobju) in ob prekinitvi preskusa. Zabeležiti je treba spremembe v razvoju rastline, npr. v velikosti in izgledu listov, indikacije nekroze, kloroze ali grbavosti, razpadanje kolonij ali izgubo zmožnosti plavanja na gladini ter spremembe dolžine korenin in izgleda. Zabeležiti je treba tudi bistvene značilnosti preskusnega medija (npr. prisotnost neraztopljenih snovi, rast alge v preskusni posodi).
Poleg določitev števila listov med preskusom je treba določiti tudi učinke preskusne snovi na eno (ali več) od naslednjih merjenih spremenljivk:
|
(i)
|
skupna površina listov;
|
Skupna površina listov ima prednost v tem, da jo je mogoče določiti za vsako preskusno in kontrolno posodo na začetku preskusa, med preskusom in na koncu preskusa. Suho ali svežo maso je treba določiti na začetku preskusa iz vzorca inokulacijske kulture, ki je reprezentativen za material, s katerim se preskus začne, in na koncu preskusa z rastlinskim materialom iz vsake preskusne in kontrolne posode. Če se površina listov ne izmeri, ima suha masa prednost pred svežo maso.
Skupna površina listov, suha masa in sveža masa se lahko izračunajo po naslednjih postopkih:
|
(i)
|
Skupna površina listov: Skupna površina listov vseh kolonij se lahko določi s slikovno analizo. Obris preskusne posode in rastlin se lahko zajame z videokamero (npr. z osvetlitvijo posode od spodaj) in nastala slika nato digitalizira. S kalibracijo s ploskimi oblikami znane površine se lahko določi skupna površina listov v preskusni posodi. Paziti je treba, da se izključijo motnje, ki jih povzroča rob preskusne posode. Druga možnost, ki je delovno zahtevnejša, pa je fotografiranje preskusnih posod in rastlin, izrezovanje nastalih obrisov kolonij in določevanje njihove površine z analizatorjem površine listov ali milimetrskim papirjem. Druge tehnike (npr. razmerje teže papirja s površino obrisa kolonij in površine merske enote) so lahko tudi primerne.
|
|
(ii)
|
Suha masa: Zbere se vse kolonije iz vsake preskusne posode in jih spere z destilirano ali deionizirano vodo. Kolonije se popivna, da se odstrani odvečno vodo. Nato se posušijo pri 60 °C do konstantne mase. Vključiti je treba vse fragmente korenin. Suho maso je treba izraziti z natančnostjo najmanj 0,1 mg.
|
|
(iii)
|
Sveža masa: Vse kolonije se prenese v zatehtane polistirenske epruvete (ali iz druge inertne snovi) z majhnimi (1 mm) odprtinami v zaobljenem dnu. Epruvete se nato centrifugirajo pri 3 000 o/min za 10 minut pri sobni temperaturi. Epruvete, ki vsebujejo sedaj posušene kolonije, se ponovno stehtajo. Sveža masa se izračuna z odštevanjem mase prazne epruvete.
|
1.7.10.1 Pogostost meritev in analitskih določitev
Če se uporabi statično zasnovo preskusa, je treba pH vsake obdelave izmeriti na začetku in na koncu preskusa. Če se uporabi polstatično zasnovo preskusa, je treba pH izmeriti za vsako šaržo „sveže“ preskusne raztopine pred obnovitvijo in za ustrezno „iztrošeno“ raztopino.
Jakost svetlobe je treba meriti v rastni komori, inkubatorju ali prostoru v točkah, ki so enako oddaljene od vira svetlobe kot listi vodne leče. Jakost svetlobe je treba izmeriti najmanj enkrat med preskusom. Najmanj dnevno je treba beležiti temperaturo medija v nadomestni posodi, ki je v enakih pogojih v rastni komoro, inkubatorju ali sobi.
Med preskusom se v primernih časovnih presledkih določajo koncentracije preskusne snovi. V statičnih preskusih je treba določiti koncentracije najmanj na začetku in na koncu preskusa.
V polstatičnih preskusih se ne pričakuje da bo koncentracija preskusne snovi ostala v območju ± 20 % nazivne koncentracije, zato je treba analizirati vse sveže pripravljene preskusne raztopine in enake raztopine pri vsaki obnovitvi (glejte tretji odstavek v oddelku 1.7.7). Pri tistih preskusih, v katerih izmerjena začetna koncentracije preskusne snovi ni v ± 20 % nazivne koncentracije, vendar obstajajo zadostni dokazi, da so začetne koncentracije ponovljive in obstojne (tj. v območju 80–120 % začetne koncentracije), se lahko kemijske določitve opravijo le na najvišji in najnižji koncentraciji. V vseh primerih je treba določitev koncentracije preskusne snovi pred obnovitvijo opraviti le za eno ponovitev vsake preskusne koncentracije (ali združene vsebine posod posameznih ponovitev).
Če se uporabi pretočni preskus, je treba izvajati podoben režim vzorčenja, kakor je opisan za polstatične preskuse, vključno za analizo na začetku, na sredini in na koncu preskusa, če je smiselno. Vendar meritve „iztrošenih“ raztopin niso primerne v tem primeru. V preskusu te vrste je treba pretok redčila in preskusne snovi ali založne raztopine preskusne snovi preverjati dnevno.
Če so na voljo dokazi, da so se koncentracije preskusne snovi zadovoljivo vzdrževale v območju ± 20 % nazivne ali izmerjene začetne koncentracije ves čas preskusa, lahko analiza rezultatov temelji na nazivnih ali izmerjenih začetnih vrednostih. Če je odklon od nazivne ali izmerjene začetne koncentracije več kot ± 20 %, mora analiza rezultatov temeljiti na geometrijskem povprečju koncentracije med izpostavljanjem ali modelih, ki opisujejo zmanjševanje koncentracije preskusne snovi (11).
1.7.11 Mejni preskus
V določenih okoliščinah, npr. ko predhodni preskus kaže, da preskusna snov nima strupenih učinkov pri koncentracijah do 100 mg·l–1 ali do meje topnosti v preskusnem mediju (katera koli vrednost je nižja), je treba opraviti mejni preskus, ki vključuje primerjavo odzivov kontrolne skupine in obdelane skupine (100 mg·l–1 ali koncentracija, ki je enaka meji topnosti). Zelo se priporoča, da se ta poskus podpre z analizo koncentracije izpostavljanja. Vsi predhodni pogoji preskusa in kriteriji veljavnosti veljajo za mejni preskus, le število ponovitev v obdelani skupini je treba podvojiti. Rast v kontrolni in obdelani skupini se lahko analizira s statističnim preskusom za primerjavo sredin, npr. Studentov t-test.
2. PODATKI IN POROČANJE
2.1 PODVOJITVENI ČAS
Podvojitveni čas (Td) števila listov in izpolnjevanje tega kriterija veljavnosti raziskave (oddelek 1.6) se določi po naslednji enačbi skupaj s podatki iz kontrolnih posod:
Td = ln 2/μ
kjer je μ povprečna specifična hitrost, določena, kakor je opisano v prvem in drugem odstavku oddelka 2.2.1.
2.2 SPREMENLJIVKE ODZIVA
Namen tega preskusa je določiti učinke preskusne snovi na vegetativno rast vrst rodu Lemna. Ta preskusna metoda opisuje dve spremenljivki odziva, saj imajo države članice različne prednosti in zakonske zahteve. Rezultati preskusa bodo sprejemljivi v vseh državah članicah, če se učinki ovrednotijo z obema spremenljivkama odziva, (a) in (b), ki sta opisani spodaj.
|
(a)
|
Povprečna specifična hitrost rasti: ta spremenljivka odziva se izračuna na osnovi spremembe logaritmov števila listov in na osnovi spremembe logaritmov drugega merjenega parametra (skupne površine listov, suhe mase ali sveže mase) skozi čas (izražen v dnevih) v kontrolni in vsaki obdelani skupini. Včasih se to imenuje relativna hitrost rasti (15).
|
|
(b)
|
Izplen: ta spremenljivka odziva se izračuna na osnovi spremembe števila listov in na osnovi spremembe drugega merjenega parametra (skupne površine listov, suhe mase ali sveže mase) v kontrolni in vsaki obdelani skupini.
|
Opozoriti je treba, da vrednosti strupenosti, ki se izračunajo iz teh dveh spremenljivk odziva niso primerljive. To razliko je treba upoštevati pri uporabi rezultatov preskusa. Če se upoštevajo pogoji preskusa iz te preskusne metode, bodo vrednosti ECx, ki temeljijo na povprečni specifični hitrosti rasti (ErCx), ponavadi višje od rezultatov, ki temeljijo na izplenu (EyCx), zaradi matematične osnove teh dveh pristopov. To se ne sme razlagati kot razlika v občutljivosti obeh spremenljivk odziva. Razlika enostavno izvira iz različne matematične narave vrednosti. Pojem povprečne specifične hitrosti rasti temelji na splošnem vzorcu eksponentne rasti vodne leče v nelimitiranih kulturah, ko se strupenost ocenjuje na osnovi učinkov na hitrost rasti brez odvisnosti od absolutne ravni specifične hitrosti rasti v kontrolnem vzorcu, naklona krivulje odziva na koncentracijo ali od trajanja preskusa. Nasprotno pa so rezultati, ki temeljijo na odzivni spremenljivki izplen odvisni od vseh teh drugih spremenljivk. Vrednost EyCx je odvisna od specifične hitrosti rasti v posameznem preskusu uporabljene vrste vodne leče in od največje specifične hitrosti rasti, ki se lahko med vrstami razlikuje ali celo med kloni. Ta spremenljivka odziva se ne sme uporabiti za primerjanje občutljivosti za strupene snovi med vrstami vodne leče ali celo med kloni. Iz znanstvenega vidika ima uporaba povprečne specifične hitrosti rasti prednost pri ocenjevanju strupenosti. Ocene strupenosti na osnovi izplena pa so vključene v to preskusno metodo, da se izpolnijo trenutne zakonske zahteve nekaterih držav.
Ocene strupenosti morajo temeljiti na številu listov in še eni dodatni merjeni spremenljivki (skupna površina listov, suha teža ali sveža teža), saj lahko nekatere snovi bolj vplivajo na druge merjene spremenljivke kot na število listov. V primeru izračunavanja le števila listov te razlike ne bi zaznali.
Pri vsaki meritvi se število listov in vse druge zabeležene merjene spremenljivke, tj. skupna površina listov, suha teža ali sveža, predstavi v tabeli skupaj s koncentracijami preskusne snovi. Naknadna analiza podatkov, npr. za oceno LOEC, NOEC ali ECx, mora temeljiti na vrednostih posameznih ponovitev in ne na izračunanih povprečnih vrednostih vsake obdelane skupine.
2.2.1 Povprečna specifična hitrost rasti
Povprečna specifična hitrost rasti se za določeno obdobje za vsako ponovitev v kontrolni in vsaki obdelani skupini izračuna kot logaritemsko povečanje spremenljivk rasti – števila listov in še ene druge merjene spremenljivke (skupna površina listov, suha masa ali sveža masa) – po spodnji enačbi:

pri čemer je:
|
—
|
μi–j:
|
povprečna specifična hitrost rasti od časa i do časa j
|
|
—
|
Ni:
|
merjena spremenljivka v preskusni posodi ali kontrolni posodi v času i
|
|
—
|
Nj:
|
merjena spremenljivka v preskusni posodi ali kontrolni posodi v času j
|
|
—
|
t:
|
časovno obdobje od i do j.
|
Za vsako obdelano skupino in kontrolno skupino se izračuna povprečna vrednost hitrosti rasti in oceni varianca.
Povprečna specifična hitrost rasti se izračuna za celotno preskusno obdobje (čas „i“ v zgornji enačbi pomeni začetek preskusa, čas „j“ pa konec preskusa). Za vsako preskusno koncentracijo in kontrolno skupino se izračuna povprečna vrednost povprečne specifične hitrosti rasti in oceni varianca. Ovrednoti se tudi presečna hitrost rasti, da se ocenijo učinki preskusne snovi, ki se pojavljajo med obdobjem izpostavljanja (npr. pregledovanje logaritemsko pretvorjenih rastnih krivulj). Znatne razlike med presečno hitrostjo rasti in povprečno hitrostjo rasti kažejo odstopanje od konstantne eksponentne rasti. Tedaj je utemeljeno natančno preverjanje rastnih krivulj. Konzervativni pristop v tem primeru je primerjanje specifičnih rastnih krivulj obdelanih kultur v času največjega zaviranja s specifičnimi rastnimi krivuljami kontrolnih kultur v istem času.
Nato se lahko za vsako koncentracijo preskusne snovi (obdelana skupina) izračuna odstotek zaviranja hitrosti rasti (Ir) po naslednji enačbi:
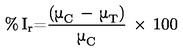
pri čemer je:
|
—
|
% Ir:
|
odstotek zaviranja povprečne specifične hitrosti rasti
|
|
—
|
μC:
|
povprečna vrednost μ v kontrolnem vzorcu
|
|
—
|
μT:
|
povprečna vrednost μ v obdelanem vzorcu.
|
2.2.2 Izplen
Učinki na izplen se določijo na osnovi dveh merjenih spremenljivk, števila listov in še ene druge merjene spremenljivke (skupna površina listov, suha teža ali sveža teža), ki jo je mogoče določiti v vsaki preskusni posodi na začetku in na koncu preskusa. V primeru suhe mase ali sveže mase se določi začetna biomasa na osnovi vzorca listov, odvzetih iz iste šarže, kakor se uporabi za inokulacijo preskusnih posod (glejte drugi odstavek v oddelku 1.7.3). Za vsako preskusno koncentracijo in kontrolno skupino se izračuna povprečna vrednost izplena in oceni varianca. Za vsako obdelano skupino se lahko izračuna odstotek zaviranja v izplenu (% Iy) po naslednji enačbi:
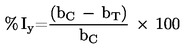
pri čemer je:
|
—
|
% Iy:
|
odstotek zmanjšanja izplena
|
|
—
|
bC:
|
končna biomasa minus začetna biomasa v kontrolni skupini
|
|
—
|
bT:
|
končna biomasa minus začetna biomasa v obdelani skupini.
|
2.2.3 Izdelava krivulj odziva na koncentracijo
Izrisati je treba krivulje odziva na koncentracijo, ki posredujejo povprečno odstotno zaviranje spremenljivke odziva (Ir, ki se izračuna, kakor je prikazano v zadnjem odstavku oddelka 2.2.1, ali Iy, ki se izračuna, kakor je prikazano v zadnjem odstavku oddelka 2.2.2) in logaritemsko pretvorjeno koncentracijo preskusne snovi.
2.2.4 Ocena ECx
Ocene vrednosti ECx (npr. EC50) morajo temeljiti na povprečni specifični hitrosti rasti (ErCx) in izkoristku (EyCx). Vsaka od teh vrednosti pa temelji na številu listov in še eni dodatni merjeni spremenljivki (skupna površina listov, suha masa ali sveža masa). Postopek je takšen, ker obstajajo preskusne snovi, ki različno vplivajo na število listov in druge merjene spremenljivke. Želeni parametri strupenosti so torej štiri vrednosti ECx za vsako izračunano raven zaviranja x: ErCx (število listov), ErCx (skupna površina listov, suha masa ali sveža masa), EyCx (število listov) in EyCx (skupna površina listov, suha masa ali sveža masa).
2.3 STATISTIČNI POSTOPKI
Cilj je količinsko ovrednotiti odziv na koncentracijo z regresijsko analizo. Možno je uporabiti uteženo linearno regresijo po opravljeni linearizacijski transformaciji podatkov odziva – npr. v probit, logit ali Weibullove enote (16), vendar imajo prednost nelinearni regresijski postopki, saj bolje obravnavajo neizogibne nepreavilnosti v podatkih ter odklone od enakomernih porazdelitev. Takšne nepravilnosti se lahko ob približevanju ničli ali popolni inhibiciji s transformacijo povečajo, kar moti analizo (16). Opozoriti je treba, da so standardne metode analize s probit, logit ali Weibullovo transformacijo namenjene uporabi na kvantnih podatkih (npr. smrtnosti ali preživetju), zato jih je treba prilagoditi za uporabo na podatkih o hitrosti rasti ali izplenu. Specifični postopki za določevanje vrednosti ECx iz kontinuiranih podatkov so na voljo v (17), (18) in (19).
Za vsako analizirano spremenljivko odziva se izračuna točkasta ocena vrednosti ECx, pri čemer se uporabi zveza med odzivom in koncentracijo. Če je možno, se za vsako oceno določi 95-odstotni interval zaupanja. Grafično ali statistično je treba določiti ustreznost prileganja podatkov odzivan na regresijski model. Regresijska analiza se mora opraviti na odzivih posameznih ponovitev in ne na povprečnih vrednostih obdelanih skupin.
Če dostopni regresijski modeli/metode niso primerni za podatke, se lahko ocene EC50 in intervali zaupanja določijo tudi z linearno interpolacijo s postopkom bootstrapping (20).
Za oceno LOEC in posledično NOEC je nujno primerjati povprečne vrednosti obdelanih skupin s tehnikami analize variance (ANOVA). Povprečna vrednost za vsako koncentracijo se primerja s povprečno vrednostjo kontrole z ustrezno metodo večkratne primerjave ali preskusa trenda. Uporabna sta lahko preskus po Dunnettu ali preskus Williamsu (21)(22)(23)(24). Po potrebi se ugotovi, ali velja domneva homogenosti variance v ANOVA. To vrednotenje se lahko opravi grafično ali s formalnim preskusom (25). Primerna preskusa sta preskus po Levenu ali preskus po Bartlettu. Če domneva homogenosti variance ni izpolnjena, lahko to odpravimo z logaritemsko transformacijo podatkov. Če je heterogenost variance skrajna in je ni mogoče odpraviti s transformacijo, je treba proučiti možnosti analize z metodami, kot so večstopenjski preskusi Jonkheere. Več smernic o določevanju vrednosti NOEC je na voljo v (19).
Nedavni razvoj znanosti je privedel do priporočila o opuščanju pojma NOEC in njegovi zamenjavi z regresijsko določenimi točkovnimi ocenami ECx. Za ta preskus z vodno lečo ustrezna vrednost x še ni določena. Vendar izgleda, da je primeren razpon od 10 do 20 % (odvisno od izbrane spremenljivke odziva), zato je treba v poročilih prednostno navajati vrednosti EC10 in EC20.
3. POROČANJE
3.1 POROČILO O PRESKUSU
Poročilo o preskusu mora vsebovati naslednje podatke:
Preskušana snov:
|
—
|
agregatno stanje in fizikalno-kemijske lastnosti, vključno z mejo topnosti v vodi,
|
|
—
|
kemijski identifikacijski podatki (npr. CAS številka), vključno s čistoto.
|
Preskusna vrsta:
|
—
|
znanstveno ime, klon (če je znan) in vir.
|
Preskusni pogoji:
|
—
|
uporabljeni preskusni postopek (statični, polstatični ali pretočni),
|
|
—
|
datum začetka preskusa in trajanje preskusa,
|
|
—
|
opis zasnove poskusa: preskusne posode in pokrovi, volumni raztopin, število kolonij in listov na preskusno posodo na začetku preskusa,
|
|
—
|
preskusne koncentracije (nazivne in izmerjene, kakor je smiselno) in število ponovitev na posamezno koncentracijo,
|
|
—
|
metode priprave založnih in preskusnih raztopin, vključno z uporabo kakršnihkoli topil ali disperzivnih sredstev,
|
|
—
|
temperatura med preskusom,
|
|
—
|
vir svetlobe, jakost in homogenost svetlobe,
|
|
—
|
vrednosti pH preskusnega in kontrolnega medija,
|
|
—
|
koncentracije preskusne snovi in analizna metoda z ustreznimi podatki za vrednotenje kakovosti (validacijske raziskave, standardni odkloni in intervali zaupanja analiz),
|
|
—
|
metode za določevanje števila listov in drugih merjenih spremenljivk, npr. suha masa, sveža masa ali površina listov,
|
|
—
|
vsa odstopanja od te preskusne metode.
|
Rezultati:
|
—
|
neobdelani podatki: število listov in druge merjene spremenljivke v vsaki preskusni in kontrolni posodi za vsa opazovanja in analize,
|
|
—
|
povprečne vrednosti in standardni odkloni za vsako merjeno spremenljivko,
|
|
—
|
rastne krivulje za vsako koncentracijo (priporočljivo z logaritemsko pretvorjeno merjeno spremenljivko, glejte drugi odstavek oddelka 2.2.1),
|
|
—
|
podvojitveni čas/hitrost rasti v kontroli na podlagi števila listov,
|
|
—
|
izračunane spremenljivke odziva za vsako ponovitev obdelave s povprečnimi vrednostmi in koeficientom variacije za ponovitve,
|
|
—
|
grafična predstavitev razmerja med koncentracijo in učinkom,
|
|
—
|
ocene strupenih končnih točk spremenljivk odziva, npr. EC50, EC10, EC20 in povezane intervale zaupanja. LOEC in/ali NOEC, če sta izračunani, in statistične metode za njuno določitev,
|
|
—
|
če se uporablja ANOVA, obseg učinka, ki se lahko zazna (npr. najmanjša statistično značilna razlika),
|
|
—
|
kakršni koli stimulacijski učinki na rast v kateri koli obdelani skupini,
|
|
—
|
kakršni koli vidni znaki fitotoksičnosti ter opažanja preskusne raztopine,
|
|
—
|
razprava o rezultatih, ki vključuje vse vplive na izid preskusa, ki so izvirali iz odstopanj od te preskusne metode.
|
4. VIRI
|
(1)
|
OECD TG 221 (2006). Lemna Sp. Growth Inhibition Test.
|
|
(2)
|
Uporaba raziskave o vodni leči za obarvane snovi je razložena v odstavku 13.5.3 Priročnika o odločitvah EU, julij 2006, na naslovu http://ecb.jrc.ec.europa.eu/new-chemicals
|
|
(3)
|
Guidance on information requirements and chemical safety assessment – Poglavje R.7b: Endpoint specific guidance; Preglednica 7.8.3 Summary of difficult substance testing issues, na naslovu
http://guidance.echa.europa.eu/docs/guidance_document/information_requirements_en.htm?time=1234958685#A
|
|
(4)
|
ASTM International. (2003). Standard Guide for Conducting Static Toxicity Test With Lemna gibba G3. E 1415–91 (Reapproved 1998). pp. 733–742. In, Annual Book of ASTM Standards, Vol. 11.05 Biological Effects and Environmental Fate; Biotechnology; Pesticides, ASTM, West Conshohocken, PA.
|
|
(5)
|
USEPA – United States Environmental Protection Agency. (1996). OPPTS 850.4400 Aquatic Plant Toxicity Test Using Lemna spp., „Public draft“. EPA 712-C-96–156. 8pp.
|
|
(6)
|
AFNOR – Association Française de Normalisation. (1996). XP T 90–337: Détermination de l’inhibition de la croissance de Lemna minor. 10pp.
|
|
(7)
|
SSI – Swedish Standards Institute. (1995). Water quality – Determination of growth inhibition (7-d) Lemna minor, duckweed. SS 02 82 13. 15pp. (v švedščini).
|
|
(8)
|
Environment Canada. (1999). Biological Test Method: Test for Measuring the Inhibition of Growth Using the Freshwater Macrophyte, Lemna minor. EPS 1/RM/37–120 pp.
|
|
(9)
|
Environment Canada. (1993). Proposed Guidelines for Registration of Chemical Pesticides: Non-Target Plant Testing and Evaluation. Canadian Wildlife Service, Technical Report Series No. 145.
|
|
(10)
|
Sims I., Whitehouse P., in Lacey R. (1999). The OECD Lemna Growth Inhibition Test. Development and Ring-testing of draft OECD Test Guideline. R&D Technical Report EMA 003. WRc plc – Environment Agency.
|
|
(11)
|
OECD (2000). Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. OECD Environmental Health and Safety Publications, Series on Testing and Assessment No.23.
|
|
(12)
|
ISO DIS 20079. Water Quality – Determination of the Toxic Effect of Water Constituents and Waste Water to Duckweed (Lemna minor) – Duckweed Growth Inhibition Test.
|
|
(13)
|
Walbridge C. T. (1977). A flow-through testing procedure with duckweed (Lemna minor L.). Environmental Research Laboratory – Duluth, Minnesota 55804. US EPA Report No. EPA-600/3–77 108. September 1977.
|
|
(14)
|
Lockhart W. L., Billeck B. N. in Baron C. L. (1989). Bioassays with a floating plant (Lemna minor) for effects of sprayed and dissolved glyphosate. Hydrobiologia, 118/119, 353–359.
|
|
(15)
|
Huebert, D.B. in Shay J.M. (1993). Considerations in the assessment of toxicity using duckweeds. Environmental Toxicology and Chemistry, 12, 481–483.
|
|
(16)
|
Christensen, E.R., Nyholm, N. (1984): Ecotoxicological Assays with Algae: Weibull Dose-Response Curves. Env. Sci. Technol. 19, 713–718.
|
|
(17)
|
Nyholm, N. Sørensen, P.S., Kusk, K.O. in Christensen, E.R. (1992): Statistical treatment of data from microbial toxicity tests. Environ. Toxicol. Chem. 11, 157–167.
|
|
(18)
|
Bruce R.D. in Versteeg D.J. (1992). A statistical procedure for modelling continuous toxicity data. Environmental Toxicology and Chemistry, 11, 1485–1494.
|
|
(19)
|
OECD. (2004). Guidance Document on Statistical Analysis of Ecotoxicity Data.
|
|
(20)
|
Norberg-King T.J. (1988). An interpolation estimate for chronic toxicity: The ICp approach. National Effluent Toxicity Assessment Center Technical Report 05–88. USEPA, Duluth, MN.
|
|
(21)
|
Dunnett, C.W. (1955). A multiple comparisons procedure for comparing several treatments with a control. J. Amer. Statist. Assoc., 50, 1096–1121.
|
|
(22)
|
Dunnett, C.W. (1964). New tables for multiple comparisons with a control. Biometrics, 20, 482–491.
|
|
(23)
|
Williams, D.A. (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics, 27: 103–117.
|
|
(24)
|
Williams, D.A. (1972). The comparison of several dose levels with a zero dose control. Biometrics, 28: 510–531.
|
|
(25)
|
Brain P. in Cousens R. (1989). An equation to describe dose-responses where there is stimulation of growth at low doses. Weed Research, 29, 93–96.
|
Dodatek 1
Opis Lemna spp.
Vodne rastline Lemna spp., ki jih navadno imenujemo vodna leča, spadajo v družino Lemnaceae, ki ima v štirih rodovih številne vrste, ki rastejo po vsem svetu. Njihov raznolik izgled in raznolika taksonomija sta obsežno opisana (1)(2). Vrsti Lemna gibba in L. minor sta predstavnici iz zmernega podnebja. Pogosto se uporabljata za preskuse strupenosti. Obe vrsti imata plavajoče ali potopljeno diskoidno steblo (list) in zelo tanko korenino, ki izhaja iz središča spodnje površine vsakega lista. Predstavnice rodu Lemna spp. redko cvetijo. Rastline se razmnožujejo vegetativno z nastajanjem novih listov (3). Mlajše rastline so v primerjavi s starejšimi rastlinami svetlejše, imajo krajše korenine in dva do tri liste različnih velikosti. Vodna leča je zaradi majhnosti, preproste strukture, nespolnega razmnoževanja in kratkega generacijskega časa zelo primerna za laboratorijsko preskušanje (4)(5).
Zaradi verjetne medvrstne variacije v občutljivosti so veljavne le primerjave znotraj iste vrste.
Primeri vrst vodne leče, ki so bile uporabljene za preskušanje: referenca vrst
Lemna aequinoctialis: Eklund, B. (1996). The use of the red alga Ceramium strictum and the duckweed Lemna aequinoctialis in aquatic ecotoxicological bioassays. Licentiate in Philosophy Thesis 1996:2. Dep. of Systems Ecology, Stockholm University.
Lemna major: Clark, N. A. (1925). The rate of reproduction of Lemna major as a function of intensity and duration of light. J. phys. Chem., 29: 935–941.
Lemna minor: United States Environmental Protection Agency (USEPA). (1996). OPPTS 850.4400 Aquatic Plant Toxicity Test Using Lemna spp., „Public draft“. EPA 712-C-96–156. 8pp.
Association Française de Normalisation (AFNOR). (1996). XP T 90–337: Détermination de l’inhibition de la croissance de Lemna minor. 10pp.
Swedish Standards Institute (SIS). (1995). Water quality – Determination of growth inhibition (7-d) Lemna minor, duckweed. SS 02 82 13. 15pp. (v švedščini).
Lemna gibba: ASTM International. (2003). Standard Guide for Conducting Static Toxicity Test With Lemna gibba G3. E 1415–91 (Reapproved 1998). pp. 733–742.
United States Environmental Protection Agency (USEPA). (1996). OPPTS 850.4400 Aquatic Plant Toxicity Test Using Lemna spp., „Public draft“. EPA 712-C-96–156. 8pp.
Lemna paucicostata: Nasu, Y., Kugimoto, M. (1981). Lemna (duckweed) as an indicator of water pollution. I. The sensitivity of Lemna paucicostata to heavy metals. Arch. Environ. Contam. Toxicol., 10:1959–1969.
Lemna perpusilla: Clark, J. R. et al. (1981). Accumulation and depuration of metals by duckweed (Lemna perpusilla). Ecotoxicol. Environ. Saf., 5:87–96.
Lemna trisulca: Huebert, D. B., Shay, J. M. (1993). Considerations in the assessment of toxicity using duckweeds. Environ. Toxicol. and Chem., 12:481–483.
Lemna valdiviana: Hutchinson, T.C., Czyrska, H. (1975). Heavy metal toxicity and synergism to floating aquatic weeds. Verh.-Int. Ver. Limnol., 19:2102–2111.
Viri vrst vodne leče
|
University of Toronto Culture Collection of Algae and Cyanobacteria
|
|
Department of Botany, University of Toronto
|
|
Toronto, Ontario, Canada, M5S 3 B2
|
|
Tel. +1 416 9783641
|
|
Faks +1 416 9785878
|
|
e-naslov: jacreman@botany.utoronto.ca
|
|
http://www.botany.utoronto.ca/utcc
|
|
North Carolina State University
|
|
Forestry Dept
|
|
Duckweed Culture Collection
|
|
Campus Box 8002
|
|
Raleigh, NC 27695–8002
|
|
United States
|
|
Tel. 001 (919) 515–7572
|
|
astomp@unity.ncsu.edu
|
|
Institute of Applied Environmental Research (ITM) Stockholm University
|
|
SE-106 91 Stockholm
|
|
Sweden
|
|
Tel. +46 86747240
|
|
Faks +46 86747636
|
|
Federal Environmental Agency (UBA)
|
|
FG III 3.4
|
|
Schichauweg 58
|
|
12307 Berlin
|
|
Germany
|
|
e-naslov: lemna@uba.de
|
|
http://www.umweltbundesamt.de/contact.htm
|
Literatura
|
(1)
|
Hillman, W.S. (1961). The Lemnaceae or duckweeds: A review of the descriptive and experimental literature. The Botanical Review, 27:221–287.
|
|
(2)
|
Landolt, E. (1986). Biosystematic investigations in the family of duckweed (Lemnaceae). Vol. 2. Geobotanischen Inst. ETH, Stiftung Rubel, Zürich, Switzerland.
|
|
(3)
|
Björndahl, G. (1982). Growth performance, nutrient uptake and human utilization of duckweeds (Lemnaceae family). ISBN 82–991150–0–0. The Agricultural Research Council of Norway, University of Oslo.
|
|
(4)
|
Wang, W. (1986). Toxicity tests of aquatic pollutants by using common duckweed. Environmental Pollution, Ser B, 11:1–14.
|
|
(5)
|
Wang, W. (1990). Literature review on duckweed toxicity testing. Environmental Research, 52:7–22.
|
Dodatek 2
Vzdrževanje založne kulture
Založne kulture se lahko vzdržujejo pri nizkih temperaturi (4–10 °C) dlje časa brez potrebe po obnovitvi. Gojišče za vodno lečo je lahko enako, kakor se uporablja za preskušanje, vendar se lahko za založne kulture uporabijo tudi drugi mediji, bogati s hranili.
Obdobno se z aseptičnimi tehnikami določeno število mladih, svetlozelenih rastlin prenese v novo gojitveno posodo, ki vsebuje sveži medij. V ohlajenih pogojih, kakor so priporočeni tukaj, se lahko presajanje opravlja v časovnih presledkih, dolgih do tri mesece.
Uporabljati je treba kemijsko čiste (kislinsko oprane) in sterilne steklene gojitvene posode ter aseptične tehnike. V primeru kontaminacije založne kulture, npr. z algami ali glivami, je treba uporabiti postopke, s katerimi odpravimo kontaminirajoče organizme. V primeru alg in večine drugih kontaminirajočih organizmov lahko uporabimo površinsko sterilizacijo. Odvzame se vzorec onesnaženega rastlinskega materiala in odrežejo se korenine. Material se nato močno stresa v čisti vodi, čemur sledi potapljanje v 0,5-odstotno (v/v) raztopino natrijevega hipoklorita za 30 sekund do 5 minut. Rastlinski material nato speremo s sterilno vodo in prenesemo v več šaržah v gojitvene posode, ki vsebujejo sveže gojišče. Veliko listov bo zaradi obdelave odmrlo, zlasti če se uporabijo daljši časi izpostavitve, vendar nekaj preživelih bo ponavadi nekontaminiranih. S temi se lahko inokulirajo nove kulture.
Dodatek 3
Mediji
Za L. minor in L. gibba so priporočena različna gojišča. Za L. minor je priporočljiva modifikacija medija iz švedskega standarda (SIS), za L. gibba pa je priporočljiva modifikacija medija 20X AAP. Sestavi obeh medijev sta navedeni spodaj. Pri pripravi teh medijev je treba uporabiti reagente analitske čistote in deionizirano vodo.
Gojišče za vodno lečo iz švedskega standarda (SIS)
|
—
|
Založne raztopine I–V steriliziramo z avtoklaviranjem (120 °C, 15 minut) ali membransko filtracijo (velikost por približno 0,2 μm).
|
|
—
|
Založno raztopino VI (in neobvezno raztopino VII) steriliziramo le z membransko filtracijo; ti dve raztopini se ne smeta avtoklavirati.
|
|
—
|
Sterilne založne raztopine je treba shranjevati v hladnih in temnih pogojih. Založne raztopine I–V je treba zavreči po šestih mesecih, založna raztopina VI (in neobvezno raztopina VII) pa imajo rok uporabnosti en mesec.
|
Št. založne raztopine
|
Snov
|
Koncentracija v založni raztopini (g·l–1)
|
Koncentracija v pripravljenem mediju (mg·l–1)
|
Pripravljen medij
|
|
Element
|
Koncentracija (mg·l–1)
|
|
I
|
NaNO3
KH2PO4
|
8,50
1,34
|
85
13,4
|
Na; N
K; P
|
32; 14
6,0; 2,4
|
|
II
|
MgSO4 · 7H2O
|
15
|
75
|
Mg; S
|
7,4; 9,8
|
|
III
|
CaCl2 · 2H2O
|
7,2
|
36
|
Ca; Cl
|
9,8; 17,5
|
|
IV
|
Na2CO3
|
4,0
|
20
|
C
|
2,3
|
|
V
|
H3BO3
MnCl2 · 4H2O
Na2MoO4 · 2H2O
ZnSO4 · 7H2O
CuSO4 · 5H2O
Co(NO3)2 · 6H2O
|
1,0
0,20
0,010
0,050
0,0050
0,010
|
1,00
0,20
0,010
0,050
0,0050
0,010
|
B
Mn
Mo
Zn
Cu
Co
|
0,17
0,056
0,0040
0,011
0,0013
0,0020
|
|
VI
|
FeCl3 · 6H2O
Na2-EDTA·2H2O
|
0,17
0,28
|
0,84
1,4
|
Fe
—
|
0,17
—
|
|
VII
|
MOPS (pufer)
|
490
|
490
|
—
|
—
|
|
|
—
|
Za pripravo enega litra medija SIS se naslednje sestavine dodajo v 900 ml deionizirane vode:
|
—
|
10 ml založne raztopine I,
|
|
—
|
5 ml založne raztopine II,
|
|
—
|
5 ml založne raztopine III,
|
|
—
|
5 ml založne raztopine IV,
|
|
—
|
1 ml založne raztopine V,
|
|
—
|
5 ml založne raztopine VI,
|
|
—
|
1 ml založne raztopine VII (neobvezno),
|
Opomba: Za preskušanje določenih preskusnih snovi bo morda potrebna dodatna količina založne raztopine VII (MOPS pufer) (glejte zadnji odstavek v oddelku 1.4).
|
|
—
|
Vrednost pH se uravna na 6,5 ± 0,2 z 0,1 ali 1 molom HCl oziroma NaOH. Volumen se dopolni na en liter z deionizirano vodo.
|
Gojišče 20X AAP
Pripravijo se založne raztopine v sterilni destilirani ali deionizirani vodi.
Sterilne založne raztopine je treba shranjevati v hladnih in temnih pogojih. V teh pogojih imajo založne raztopine rok uporabnosti najmanj 6–8 tednov.
Za medij 20X-AAP se pripravi pet hranilnih založnih raztopin (A1, A2, A3, B in C) iz kemikalij reagentne čistote. Za pripravo gojišča se doda 20 ml vsake hranilne založne raztopine v približno 850 ml deionizrane vode. Vrednost pH se uravna na 7,5 ± 0,1 z bodisi 0,1 bodisi 1 mol HCl oziroma NaOH. Volumen se uravna na en liter z deionizirano vodo. Gojišče se nato filtrira skozi 0,2-μm (približno) membranski filter v sterilno posodo.
Gojišče, namenjeno za preskušanje, je treba pripraviti 1–2 dni pred uporabo, da se pH stabilizira. Pred uporabo je treba preveriti vrednost pH gojišča. Po potrebi se znova uravna z dodajanjem 0,1 ali 1 molom NaOH oziroma HCl, kakor je opisano zgoraj.
|
Št. Založne raztopine
|
Snov
|
Koncentracija v založni raztopini (g·l–1) (1)
|
Koncentracija v pripravljenem mediju (mg·l–1) (1)
|
Pripravljen medij
|
|
Element
|
Koncentracija (mg·l–1) (1)
|
|
A1
|
NaNO3
MgCl2·6H2O
CaCl2·2H2O
|
26
12
4,4
|
510
240
90
|
Na; N
Mg
Ca
|
190; 84
58,08
24,04
|
|
A2
|
MgSO4·7H2O
|
15
|
290
|
S
|
38,22
|
|
A3
|
K2HPO4·3H2O
|
1,4
|
30
|
K; P
|
9,4;3,7
|
|
B
|
H3BO3
MnCl2·4H2O
FeCl3·6H2O
Na2EDTA·2H2O
ZnCl2
CoCl2·6H2O
Na2MoO4·2H2O
CuCl2·2H2O
|
0,19
0,42
0,16
0,30
3,3 mg·l–1
1,4 mg·l–1
7,3 mg·l–1
0,012 mg·l–1
|
3,7
8,3
3,2
6,0
66 μg·l–1
29 μg·l–1
145 μg·l–1
0,24 μg·l–1
|
B
Mn
Fe
—
Zn
Co
Mo
Cu
|
0,65
2,3
0,66
—
31 μg·l–1
7,1 μg·l–1
58 μg·l–1
0,080 μg·l–1
|
|
C
|
NaHCO3
|
15
|
300
|
Na; C
|
220; 43
|
Končna opomba: Teoretično primerna končna koncentracija bikarbonata (pri kateri ni treba znatno uravnavati vrednosti pH) je 15 mg/l, ne 300 mg/l. Vendar zgodovinska uporaba medija 20X-AAP, vključno z uporabo v preskusu primerljivosti, temelji na 300 mg/l. (I. Sims, P. Whitehouse in R. Lacey. (1999) The OECD Lemna Growth Inhibition Test. Development and Ring-testing of draft OECD Test Guideline. R&D Technical Report EMA 003. WRc plc – Environment Agency.)
Medij po STEINBERGU (po ISO 20079)
Koncentracije in založne raztopine:
|
—
|
Modificiran medij po Steinbergu se v ISO 20079 uporablja le za Lemna minor (saj je v tem standardu dovoljena le Lemna minor), vendar so preskusi pokazali, da se lahko dobri rezultati dosežejo tudi z Lemna gibba.
|
|
—
|
Pri pripravi medija je treba uporabiti kemikalije reagentne ali analitske čistote in deionizirano vodo.
|
|
—
|
Gojišče se pripravi iz založnih raztopin ali 10-kratno koncentriranega medija, ki omogoča najvišjo koncentracijo medija brez obarjanja.
|
Tabela 1
pH-stabiliziran medij po STEINBERGU (modificiran po Altenburgerju)
|
Snov
|
Gojišče
|
|
Makroelementi
|
mol. masa
|
mg/l
|
mmol/l
|
|
KNO3
|
101,12
|
350,00
|
3,46
|
|
Ca(NO3)2 · 4H2O
|
236,15
|
295,00
|
1,25
|
|
KH2PO4
|
136,09
|
90,00
|
0,66
|
|
K2HPO4
|
174,18
|
12,60
|
0,072
|
|
MgSO4 · 7H2O
|
246,37
|
100,00
|
0,41
|
|
Mikroelementi
|
mol. masa
|
µg/l
|
µmol/l
|
|
H3BO3
|
61,83
|
120,00
|
1,94
|
|
ZnSO4 · 7H2O
|
287,43
|
180,00
|
0,63
|
|
Na2MoO4 · 2H2O
|
241,92
|
44,00
|
0,18
|
|
MnCl2 · 4H2O
|
197,84
|
180,00
|
0,91
|
|
FeCl3 · 6H2O
|
270,21
|
760,00
|
2,81
|
|
EDTA dinatrijev dihidrat
|
372,24
|
1 500,00
|
4,03
|
Tabela 2
Založne raztopine (makroelementi)
|
1.
|
Makroelementi (50-kratno koncentrirani)
|
|
g/l
|
|
Založna raztopina 1:
|
|
KNO3
|
17,50
|
|
KH2PO4
|
4,5
|
|
K2HPO4
|
0,63
|
|
Založna raztopina 2:
|
|
MgSO4 · 7H2O
|
5,00
|
|
Založna raztopina 3:
|
|
Ca(NO3)2 · 4H2O
|
14,75
|
Tabela 3
Založne raztopine (mikroelementi)
|
2.
|
Mikroelementi (1 000-kratno koncentrirani)
|
|
mg/l
|
|
Založna raztopina 4:
|
|
H3BO3
|
120,0
|
|
Založna raztopina 5:
|
|
ZnSO4 · 7H2O
|
180,0
|
|
Založna raztopina 6:
|
|
Na2MoO4 · 2H2O
|
44,0
|
|
Založna raztopina 7:
|
|
MnCl2 · 4H2O
|
180,0
|
|
Založna raztopina 8:
|
|
FeCl3 · 6H2O
|
760,00
|
|
EDTA dinatrijev dihidrat
|
1 500,00
|
|
—
|
Založni raztopini 2 in 3 je možno združiti (ob upoštevanju zahtevanih koncentracij). Ravno tako založne raztopine 4 do 7.
|
|
—
|
Za daljši rok uporabnosti se lahko založne raztopine obdelajo v avtoklavu pri 121 °C za 20 min. Druga možnost pa je sterilna filtracija (0,2 µm). Za založno raztopino 8 je močno priporočljiva sterilna filtracija (0,2 µm).
|
Priprava končne koncentracije (modificiranega) medija po STEINBERGU
|
—
|
V približno 900 ml deionizrane vode se doda 20 ml založnih raztopin 1, 2 in 3 (glejte tabelo 2), da se prepreči obarjanje.
|
|
—
|
Doda se 1,0 ml založnih raztopin 4, 5, 6 in 7 (glejte tabelo 3).
|
|
—
|
Vrednost pH mora biti 5,5 ± 0,2 (uravnava se z dodajanjem minimalnega volumna raztopine NaOH ali HCl).
|
|
—
|
Z vodo se dopolni do 1 000 ml.
|
|
—
|
Če so založne raztopine sterilizirane in se uporabi ustrezna voda, dodatna sterilizacija ni potrebna. Če se sterilizira končni medij, je treba založno raztopino 8 dodati po avtoklaviranju (pri 121 °C za 20 min).
|
Priprava 10-kratno koncentriranega (modificiranega) medija po STEINBERGU za začasno hranjenje
|
—
|
V približno 30 ml vode se doda 20 ml založnih raztopin 1, 2 in 3 (glejte tabelo 2), da se prepreči obarjanje.
|
|
—
|
Doda se 1,0 ml založnih raztopin 4, 5, 6 in 7 (glejte tabelo 3). Z vodo se dopolni do 100 ml.
|
|
—
|
Če so založne raztopine sterilizirane in se uporabi ustrezna voda, dodatna sterilizacija ni potrebna. Če se sterilizira končni medij, je treba založno raztopino 8 dodati po avtoklaviranju (pri 121 °C za 20 min).
|
|
—
|
Vrednost pH medija (končne koncentracije) mora biti 5,5 ± 0,2.
|
(1) Razen če ni drugačne opombe























 (dan
(dan