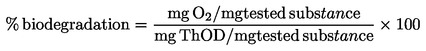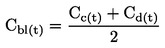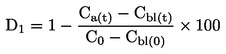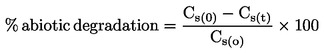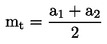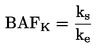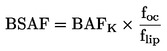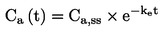|
(6)
|
Dodajo se naslednja poglavja od C.31 do C.46: „C.31 PRESKUS KOPENSKIH RASTLIN: PRESKUS VZNIKA IN RASTI SEJANCEV:
UVOD
|
1.
|
Ta preskusna metoda je enakovredna Smernici za preskušanje OECD (TG) 208 (2006). Preskusne metode se ob upoštevanju znanstvenega napredka in uporabnosti za zakonodajno uporabo redno preverjajo. Ta posodobljena preskusna metoda je zasnovana za ocenjevanje potencialnih učinkov kemikalij na vznik in rast sejancev. Kot taka ne zajema kroničnih učinkov ali učinkov na razmnoževanje (npr. oploditev in razvoj semen, oblikovanje cvetov, zorenje plodov). Treba je upoštevati pogoje izpostavljenosti in lastnosti kemikalije, ki bo preskušena, s čimer se zagotovi uporaba ustreznih preskusnih metod (pri preskušanju kovin/kovinskih spojin je npr. treba upoštevati učinke vrednosti pH in povezanih protiionov) (1). Ta preskusna metoda ni namenjena rastlinam, ki so izpostavljene hlapom kemikalij. To preskusno metodo je mogoče uporabiti pri preskušanju splošnih kemikalij, biocidov in fitofarmacevtskih sredstev (ki so znani tudi kot izdelki za zaščito rastlin ali pesticidi). Razvita je bila na osnovi obstoječih metod (2)(3)(4)(5)(6)(7). Upoštevani so bili tudi drugi viri, ki se nanašajo na preskušanje rastlin (8)(9)(10). Uporabljene opredelitve so navedene v Dodatku 1.
|
NAČELO PRESKUSA
|
2.
|
Preskus ocenjuje učinke na vznik sejancev in zgodnjo rast višjih rastlin po izpostavljenosti preskusni kemikaliji v tleh (ali drugem primernem matriksu tal). Semena se namestijo v stik s tlemi, tretiranimi s preskusno kemikalijo, po obdobju od 14 do 21 dni po 50-odstotnem vzniku sejancev v kontrolni skupini pa se ocenijo učinki nanje. Merjene končne točke so vizualna ocena vznika sejancev, suha teža poganjkov (alternativno sveža teža poganjkov) in v določenih primerih višina poganjkov ter ocena vidnih škodljivih učinkov na različne dele rastline. Meritve in opažanja se primerjajo s tistimi pri netretiranih kontrolnih rastlinah.
|
|
3.
|
Odvisno od pričakovanega načina izpostavljenosti se preskusna kemikalija vnese v tla (ali v morebitni matriks umetnih tal) ali pa se nanese na površino tal; izbere se možnost, ki ustrezno predstavlja potencialni način izpostavljenosti kemikaliji. Vnos v tla se izvede s tretiranjem tal v razsutem stanju. Po nanosu se tla prenesejo v posode, nato pa se vanje posejejo semena dane rastlinske vrste. Nanosi na površino se izvedejo na tleh, prenesenih v posode, v katerih so že posejana semena. Preskusne enote (kontrole ter tretirana tla in semena) se nato namestijo v ustrezne pogoje, ki podpirajo kalitev/rast rastlin.
|
|
4.
|
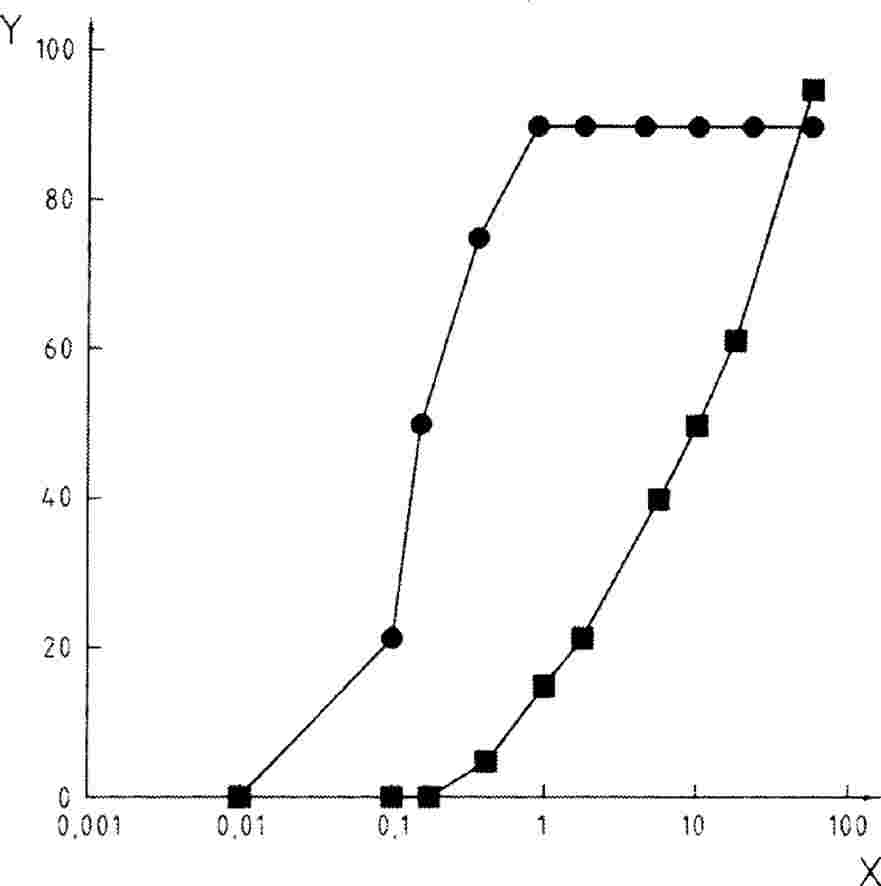
Lahko se izvede preskus za določanje krivulje odmerek-odziv ali pri eni sami koncentraciji/stopnji aplikacije kot mejni preskus v skladu s cilji študije. Če rezultati preskusa z eno samo koncentracijo/stopnjo aplikacije presegajo določeno raven strupenosti (npr. če so opaženi učinki večji od x %), se izvede preskus za določanje območja delovanja, s katerim se določijo zgornje in spodnje meje za strupenost, sledi pa mu preskus z več koncentracijami/stopnjami aplikacije za pridobitev krivulje odmerek-odziv. Uporabi se ustrezna statistična analiza za pridobitev učinkovite koncentracije ECx ali učinkovite stopnje aplikacije ERx (npr. EC25, ER25, EC50, ER50) za najbolj občutljive zadevne parametre. V tem preskusu je mogoče izračunati tudi koncentracijo brez opaznega učinka (NOEC) in najnižjo koncentracijo z opaznim učinkom (LOEC).
|
PODATKI O PRESKUSNI KEMIKALIJI
|
5.
|
Naslednji podatki so uporabni za ugotavljanje pričakovanega načina izpostavljenosti in pri načrtovanju preskusa: strukturna formula, čistost, topnost v vodi, obstojnost v organskih topilih, porazdelitveni koeficient 1-oktanol/voda, vedenje pri sorpciji v tleh, parni tlak, kemijska stabilnost v vodi in na svetlobi ter biorazgradljivost.
|
VELJAVNOST PRESKUSA
|
6.
|
Da bi bil preskus veljaven, morajo kontrole izpolnjevati naslednja merila:
|
—
|
vznik sejancev je vsaj 70-odstoten,
|
|
—
|
sejanci ne kažejo vidnih fitotoksičnih učinkov (npr. kloroze, nekroze, venenja, deformacij listov in stebel), rastline pa izkazujejo le normalno variacijo rasti in morfologije za to določeno vrsto,
|
|
—
|
srednja stopnja preživetja vzniknjenih kontrolnih sejancev v času trajanja študije je vsaj 90 %,
|
|
—
|
okoljski pogoji za določeno vrsto so enaki in rastni substrati vsebujejo enako količino matriksa tal, podpornih substratov ali substrata iz istega vira.
|
|
REFERENČNA KEMIKALIJA
|
7.
|
Referenčno kemikalijo je v rednih časovnih razmikih mogoče preskusiti, da se preveri, ali se izvedba preskusa ter odziv določenih preskusnih rastlin in preskusni pogoji skozi čas niso znatno spremenili. Namesto tega je mogoče za oceno učinkovitosti preskusnega sistema v določenih laboratorijih uporabiti pretekle meritve biomase ali rasti, kar lahko služi kot interni laboratorijski ukrep kontrole kakovosti.
|
OPIS METODE
Naravna tla – umetni substrat
|
8.
|
Rastline je mogoče gojiti v posodah s peščeno ilovico, ilovnatim peskom ali peščeno glinasto ilovico, ki vsebuje do 1,5 odstotka organskega ogljika (pribl. 3 odstotke organske snovi). Uporabi se lahko tudi komercialna prst za sajenje lončnic ali sintetična mešanica tal, ki vsebuje do 1,5 odstotka organskega ogljika. Če je znano, da ima preskusna kemikalija visoko afiniteto za glino, se glinenih tal ne sme uporabljati. Naravna tla je treba presejati na 2-milimetrske delce, da se homogenizirajo in da se odstranijo grobi delci. Poročati je treba o vrsti in teksturi, odstotku organskega ogljika, vrednosti pH in vsebnosti soli, izmerjeni kot električna prevodnost končnih pripravljenih tal. Tla je treba razvrstiti v skladu s standardnim sistemom za razvrščanje (11). Tla se lahko pasterizirajo ali toplotno obdelajo, da se zmanjša učinek talnih patogenov.
|
|
9.
|
Pri naravnih tleh je zaradi spreminjajočih se fizikalnih/kemijskih lastnosti in mikrobnih populacij razlaga rezultatov lahko bolj zapletena. Te spremenljivke spreminjajo sposobnost zadrževanja vlage, sposobnost vezave kemikalije, zračnost ter vsebino hranil in elementov v sledovih. Poleg variacij teh fizikalnih dejavnikov bo obstajala tudi variacija kemijskih lastnosti, kot sta vrednost pH in redoks potencial, ki lahko vpliva na biološko razpoložljivost preskusne kemikalije (12)(13)(14).
|
|
10.
|
Umetni substrati se običajno ne uporabljajo za preskušanje fitofarmacevtskih sredstev, lahko pa so uporabni pri preskušanju splošnih kemikalij ali tam, kjer se želi kar najbolj zmanjšati variabilnost naravnih tal in povečati primerljivost rezultatov preskusa. Uporabljeni substrati morajo biti iz inertnih materialov, ki kar najbolj zmanjšajo interakcijo s preskusno kemikalijo ali topilom kot nosilcem ali pa z obema. Ugotovljeno je, da so s kislino opran kremenov pesek, mineralna volna in steklene kroglice (npr. s premerom od 0,35 do 0,85 mm) primerni inertni materiali, ki kar najmanj absorbirajo preskusno kemikalijo (15), kar omogoča, da je kemikalija z vsrkavanjem prek korenin v kar največji meri na voljo sejancu. Med neprimernimi substrati so vermikulit, perlit in drugi zelo absorptivni materiali. Zagotovljene morajo biti hranilne snovi za rast rastlin, ki poskrbijo, da rastline niso v stresu zaradi pomanjkanja hranilnih snovi, to pa je treba, kadar je le mogoče, oceniti s kemijsko analizo ali z vizualno oceno kontrolnih rastlin.
|
Merila za izbiro preskusnih vrst
|
11.
|
Da izbrana vrsta razvije niz odzivov, mora biti razumno obsežna, npr. glede svoje taksonomske pestrosti v rastlinskem kraljestvu, svoje porazdelitve, pogostnosti, značilnosti življenjskega cikla posamezne vrste in območja pojavljanja v naravi (8)(10)(16)(17)(18)(19)(20). Pri izbiri je treba upoštevati naslednje značilnosti potencialnih preskusnih vrst:
|
—
|
vrste imajo enotna semena, ki so lahko dostopna pri zanesljivih standardnih virih semen ter ki dosegajo skladno, zanesljivo in enakomerno kalivost ter enotno rast sejancev,
|
|
—
|
rastlino je mogoče preskusiti v laboratoriju ter lahko daje zanesljive in ponovljive rezultate v okviru preskusnih infrastruktur in primerjalno med njimi,
|
|
—
|
občutljivost preskušane vrste mora biti skladna z odzivi rastlin, odkritih v okolju, ki je izpostavljeno kemikaliji,
|
|
—
|
vrste so bile do neke mere uporabljene v predhodnih preskusih strupenosti, njihova uporaba, npr. pri bioloških preskusih herbicidov, presejanju za težke kovine, obremenitvenih preskusih za slanost in minerale ali študijah alelopatije, pa kaže občutljivost na mnogo različnih obremenilnih dejavnikov,
|
|
—
|
vrste so združljive z rastnimi pogoji preskusne metode,
|
|
—
|
zadoščajo merilom za veljavnost preskusa.
|
Nekatere od preskusnih vrst, ki so bile v preteklosti najbolj uporabljane, so navedene v Dodatku 2, potencialne nekmetijske rastline pa v Dodatku 3.
|
|
12.
|
Število vrst, ki bodo preskušene, je odvisno od ustreznih zakonskih zahtev, zato v tej preskusni metodi ni navedeno.
|
Uporaba preskusne kemikalije
|
13.
|
Kemikalijo je treba nanesti v ustreznem nosilcu (npr. vodi, acetonu, etanolu, polietilen glikolu, gumi arabikumu, pesku). Mogoče je preskusiti tudi zmesi (formulirane produkte ali formulacije), ki vsebujejo aktivne snovi in različne adjuvanse.
|
Vnos v tla/umetni substrat
|
14.
|
Kemikalije, ki so topne v vodi ali suspendirane v vodi, se lahko dodajo vodi, nato pa se raztopina z ustrezno napravo za mešanje zmeša s tlemi. Ta vrsta preskusa je lahko ustrezna, če izpostavljenost kemikaliji poteka prek tal ali porne vode v tleh in če obstajajo pomisleki glede vsrkavanja prek korenin. Zmogljivost tal za zadrževanje vode zaradi dodajanja preskusne kemikalije ne sme biti presežena. Količina dodane vode mora biti enaka za vsako preskusno koncentracijo, vendar mora biti omejena, da se prepreči zbiranje aglomeratov tal v skupkih.
|
|
15.
|
Kemikalije z nizko topnostjo v vodi je treba raztopiti v ustreznem hlapnem topilu (npr. acetonu, etanolu) in zmešati s peskom. Nato se med nenehnim mešanjem peska topilo lahko iz peska odstrani s tokom zraka. Tretirani pesek se zmeša z eksperimentalnimi tlemi. Vzpostavi se drug kontrolni vzorec, ki prejme le pesek in topilo. Vsem stopnjam tretiranja in drugi kontroli so dodane enake količine peska z zmešanim in odstranjenim topilom. Pri trdnih, netopnih preskusnih kemikalijah se suha tla in kemikalija zmešajo v ustrezni napravi za mešanje. Nato se tla dodajo v posode, v katere se takoj posejejo semena.
|
|
16.
|
Če se namesto tal uporablja umetni substrat, je mogoče kemikalije, ki so topne v vodi, tik pred začetkom preskusa raztopiti v hranilni raztopini. Kemikalije, ki niso topne v vodi, a jih je mogoče v vodi suspendirati z nosilcem topila, je treba z nosilcem dodati hranilni raztopini. Kemikalije, ki niso topne v vodi in za katere ni na voljo nobenega nestrupenega nosilca, topnega v vodi, je treba raztopiti v ustreznem hlapnem topilu. Raztopina se zmeša s peskom ali steklenimi kroglicami in se namesti v rotavapor ter upari; na pesku oziroma kroglicah ostane enakomerna obloga kemikalije. Pred polnjenjem sadilne posode je treba tehtane deleže kroglic ekstrahirati z istim organskim topilom in preskušeno kemikalijo.
|
Nanos na površino
|
17.
|
Za nanos preskusne kemikalije se pri fitofarmacevtskih sredstvih pogosto uporablja škropljenje površine tal s preskusno raztopino. Vsa oprema, uporabljena pri izvajanju preskusov, vključno z opremo za pripravo in dodajanje preskusne kemikalije, mora imeti takšni zasnovo in zmogljivost, da je mogoče preskuse, ki vključujejo to opremo, izvesti natančno, pokritost pa bo ponovljiva. Pokritost mora biti enotna prek celotne površine tal. Poskrbeti je treba, da ni možnosti adsorpcije kemikalije v opremo ali reagiranja kemikalije z opremo (npr. s plastičnimi cevmi in z lipofilnimi kemikalijami ali jeklenimi deli in elementi). Preskusna kemikalija se razprši na površino tal s posnemanjem značilnega nanašanja s škropilnico. V splošnem morajo biti količine razpršila v območju, ki se običajno uporablja v kmetijski praksi, o količinah (količini vode itd.) pa je treba poročati. Izbrati je treba tako vrsto šobe, ki bo omogočala enakomerno pokritost površine tal. Če se nanašajo topila in nosilci, je treba pripraviti drugo skupino kontrolnih rastlin, ki prejemajo le topilo/nosilec. To pri fitofarmacevtskih sredstvih, preskušanih v obliki formulacij, ni potrebno.
|
Preverjanje koncentracije/stopnje aplikacije preskusne kemikalije
|
18.
|
Koncentracije/stopnje aplikacije je treba potrditi z ustreznim analitskim preverjanjem. Pri topnih kemikalijah je mogoče potrditi preverjanje koncentracij/stopenj aplikacije vseh preskusnih kemikalij z analizo preskusne raztopine z najvišjo koncentracijo, uporabljene pri preskusu, z dokumentacijo o naknadni razredčitvi in z uporabo umerjene opreme za nanos (npr. umerjenih steklenih posod za analizo, umerjene opreme za nanos s škropilnikom). Pri netopnih kemikalijah mora biti navedeno preverjanje spojin, poleg tega pa še mase preskusne kemikalije, dodane tlom. Če se zahteva dokazovanje homogenosti, bo morda potrebno analizirati tla.
|
POSTOPEK
Načrt preskusa
|
19.
|
Semena istih vrst se posejejo v posode. Število semen, posejanih v posodo, je odvisno od vrste, velikosti posode in trajanja preskusa. Število rastlin na posodo mora biti takšno, da so v času trajanja preskusa omogočeni primerni rastni pogoji in da se prepreči nagnetenost. Največja gostota rastlin znaša približno 3–10 semen na 100 cm2, odvisno od velikosti semen. Kot primer se za 15-centimetrsko posodo priporočajo od ena do dve sadiki koruze, soje, paradižnika, kumar ali sladkorne pese, tri sadike oljne ogrščice ali graha in od 5 do 10 sadik čebule, pšenice ali drugih sejancev z majhnimi semeni. Število semen in posod za ponovitve (ponovitev je opredeljena kot posoda, zato rastline v isti posodi ne predstavljajo ponovitve) mora biti zadostno za optimalno statistično analizo (21). Treba je opozoriti, da bo variabilnost večja za preskusne vrste, pri katerih je uporabljenih manj večjih semen na posodo (ponovitev), v primerjavi s preskusnimi vrstami, pri katerih je mogoče uporabljati večje število manjših semen na posodo. Ta variabilnost se lahko kar najbolj zmanjša s sejanjem enakega števila semen v vsako posodo.
|
|
20.
|
Z uporabo kontrolnih skupin se zagotovi, da so opazni učinki povezani samo z izpostavljenostjo preskusni kemikaliji ali se jih lahko pripiše tej izpostavljenosti. Ustrezna kontrolna skupina mora biti v vseh vidikih identična preskusni skupini, razen glede izpostavljenosti preskusni kemikaliji. V okviru danega preskusa morajo biti vse preskusne rastline, vključno s kontrolnimi, iz istega vira. Za preprečevanje pristranskosti se zahteva naključno dodeljevanje preskusnih in kontrolnih posod.
|
|
21.
|
Izogibati se je treba semenom, prevlečenim z insekticidom ali fungicidom (tj. ‚obloženim‘ semenom). Vendar nekateri regulativni organi dovoljujejo uporabo določenih nesistemskih kontaktnih fungicidov (npr. kaptana, tirama) (22). Če obstaja skrb glede patogenov, ki se prenašajo s semeni, se semena lahko za kratek čas namočijo v razredčeno 5-odstotno raztopino hipoklorita, nato pa se dobro sperejo pod tekočo vodo in posušijo. Sanacija z drugimi fitofarmacevtskimi sredstvi ni dovoljena.
|
Preskusni pogoji
|
22.
|
Preskusni pogoji se morajo približati pogojem, potrebnim za normalno rast preskušenih vrst in sort (v Dodatku 4 so navedeni primeri preskusnih pogojev). Rastline, ki vznikajo, se morajo vzdrževati glede na dobro vrtnarsko prakso v komorah, fitotronih ali rastlinjakih s kontroliranim okoljem. Pri uporabi prostorov, namenjenih za rast, te prakse običajno vključujejo nadzor in ustrezno pogosto (npr. dnevno) beleženje temperature, vlažnosti, koncentracije ogljikovega dioksida, svetlobe (obsevanosti, valovne dolžine, fotosintetsko aktivnega sevanja) in obdobja osvetljenosti, sredstev za zalivanje itd., s čimer se zagotovi zdrava rast, ki se presoja s kontrolnimi rastlinami izbranih vrst. Temperaturo v rastlinjakih je treba nadzirati z zračenjem, ogrevanjem in/ali hladilnimi sistemi. Za preskušanje v rastlinjakih se v splošnem priporočajo naslednji pogoji:
|
—
|
temperatura: 22 °C ± 10 °C,
|
|
—
|
obdobje osvetljenosti: najmanj 16 ur svetlobe,
|
|
—
|
obsevanost: 350 ± 50 μE/m2/s. Če obsevanost pade pod 200 μE/m2/s, valovna dolžina pa je 400–700 nm, je potrebna dodatna osvetlitev, razen pri določenih vrstah, ki ne potrebujejo toliko svetlobe.
|
Med trajanjem študije je treba spremljati okoljske pogoje in poročati o njih. Rastline je treba gojiti v neporoznih plastičnih ali glaziranih posodah, pod katere so podstavljeni pladnji ali krožnički. Posode se lahko redno premešča, da je variabilnost pri rasti rastlin (zaradi razlik v preskusnih pogojih v prostorih, namenjenih za rast) čim manjša. Posode morajo biti dovolj velike, da se omogoči normalna rast.
|
|
23.
|
Za ohranjanje vitalnosti rastlin se lahko hranilnim snovem v tleh dodajajo dodatki. O potrebah po dodatnih hranilnih snoveh in času njihovega dodajanja je mogoče presoditi z opazovanjem kontrolnih rastlin. Priporočeno je zalivanje preskusnih posod od spodaj (npr. s stenjem iz steklenih vlaken). Vendar je mogoče z začetnim zalivanjem od zgoraj spodbuditi kalivost semen, pri nanosu na površino tal pa takšno zalivanje olajša prehod kemikalije v tla.
|
|
24.
|
Specifični rastni pogoji morajo biti ustrezni za preskušane vrste in preiskovano preskusno kemikalijo. Kontrolne in tretirane rastline je treba gojiti v enakih okoljskih pogojih, vendar je treba izvesti ustrezne ukrepe za preprečevanje navzkrižne izpostavljenosti (npr. hlapnim kemikalijam) med različnimi tretiranji in izpostavljenosti kontrolnih rastlin preskusnim kemikalijam.
|
Preskušanje pri eni sami koncentraciji/stopnji aplikacije
|
25.
|
Za določanje ustrezne koncentracije/stopnje aplikacije kemikalije za izvedbo preskusa z eno samo koncentracijo ali stopnjo (provokacijskega/mejnega preskusa) je treba upoštevati več dejavnikov. Pri splošnih kemikalijah ti dejavniki vključujejo fizikalne/kemijske lastnosti kemikalije. Za fitofarmacevtska sredstva je treba upoštevati fizikalne/kemijske lastnosti in vzorec uporabe preskusne kemikalije, njeno največjo koncentracijo ali stopnjo aplikacije, število aplikacij na sezono in/ali obstojnost preskusne kemikalije. Za ugotavljanje, ali ima splošna kemikalija fitotoksične lastnosti, je lahko primerno preskušanje pri najvišji ravni 1 000 mg/kg suhih tal.
|
Preskus za določanje območja delovanja
|
26.
|
Po potrebi je mogoče izvesti preskus za določanje območja delovanja, s katerim so pridobljene smernice za koncentracije/stopnje, ki bodo preskušane v dokončni študiji odziva v odvisnosti od odmerka. Pri preskusu za določanje območja delovanja morajo biti med vrednostmi preskusnih koncentracij/stopenj precejšnji razmiki (znašati morajo npr. 0,1, 1,0, 10, 100 in 1 000 mg/kg suhih tal). Koncentracije/stopnje pri fitofarmacevtskih sredstvih lahko temeljijo na največji koncentraciji ali stopnji aplikacije, npr. 1/100, 1/10, 1/1 priporočene največje koncentracije ali stopnje aplikacije.
|
Preskušanje z več koncentracijami/stopnjami aplikacije
|
27.
|
Namen preskusa z več koncentracijami/stopnjami aplikacije je ugotoviti razmerje med odmerkom in odzivom ter določiti vrednost ECx ali ERx za vznik, biomaso in/ali vizualne učinke v primerjavi z neizpostavljenimi kontrolami, kot zahtevajo regulativni organi.
|
|
28.
|
Število in razmiki koncentracij ali stopenj aplikacije morajo biti zadostni, da se ustvari zanesljivo razmerje med odmerkom in odzivom ter regresijska enačba in da se poda ocena vrednosti ECx ali ERx. Izbrane koncentracije/stopnje aplikacije morajo zajemati vrednosti ECx ali ERx, ki se bodo ugotavljale. Če je, na primer, zahtevana vrednost EC50, je zaželeno preskušanje pri stopnjah, ki dosegajo od 20- do 80-odstotni učinek. Priporočeno število preskusnih koncentracij/stopenj aplikacij za doseganje tega je vsaj pet v geometrijski vrsti in še netretirana kontrola, faktor razmika med njimi pa ne sme biti večji kot tri. Za vsako tretirano ali kontrolno skupino mora biti število ponovitev vsaj štiri, skupno število semen pa vsaj 20. Za večjo statistično moč preskusa bo morda potrebnih več ponovitev določenih rastlin s slabo kalivostjo ali spremenljivo rastjo. Če se uporablja več preskusnih koncentracij/stopenj aplikacije, se lahko število ponovitev zmanjša. Če se ocenjuje vrednost NOEC, bo za doseganje želene statistične moči morda potrebnih več ponovitev (23).
|
Opažanja
|
29.
|
Med obdobjem opazovanja, tj. od 14 do 21 dni po vzniku 50 % kontrolnih rastlin (tudi kontrol s topili, če je to smiselno), se pri rastlinah pogosto (vsaj tedensko in, če je mogoče, dnevno) opazuje, ali je prišlo do vznika, vidnih znakov fitotoksičnosti in umrljivosti. Ob koncu preskusa je treba zabeležiti meritev odstotka vznika in biomase preživelih rastlin ter vidne znake škodljivih učinkov na različne dele rastline. Med slednjimi so anomalije videza vzniknjenih sejancev, zakrnela rast, kloroza, razbarvanje, umrljivost in učinki na razvoj rastline. Končno biomaso je mogoče meriti s končno povprečno suho težo poganjkov preživelih rastlin, s spravilom poganjkov na površini tal in s sušenjem teh poganjkov pri 60 °C do konstantne teže. Namesto tega je končno biomaso mogoče meriti s svežo težo poganjkov. Če tako zahtevajo regulativni organi, je druga končna točka lahko višina poganjka. Za ocenjevanje opaznih strupenih učinkov je treba uporabljati enoten sistem točkovanja za vidne poškodbe. Primeri kvalitativnih in kvantitativnih vizualnih ocen so podani v virih (23)(24).
|
PODATKI IN POROČANJE
Statistična analiza
Preskus z eno samo koncentracijo/stopnjo
|
30.
|
Podatke o vsaki rastlinski vrsti je treba analizirati z ustrezno statistično metodo (21). Treba je poročati o ravni učinka pri preskusni koncentraciji/stopnji ali nedoseganju danega učinka pri preskusni koncentraciji/stopnji (npr. o učinku, ki je < x % učinka, opaženega pri koncentraciji ali stopnji y).
|
Preskus z več koncentracijami/stopnjami
|
31.
|
Z regresijsko enačbo se ugotovi razmerje med odmerkom in odzivom. Uporabljajo se lahko različni modeli: na primer, za oceno vrednosti ECx ali ERx (npr. EC25, ER25, EC50, ER50) in njenih meja zaupanja za vznik v obliki kvantnih podatkov so lahko primerne metode analiza logit in analiza probit, Weibullova metoda, metoda Spearman-Karber, prilagojena metoda Spearman-Karber itd. Za rast sejancev (težo in višino) kot zvezno končno točko je vrednost ECx ali ERx in njene meje zaupanja mogoče oceniti z ustrezno regresijsko analizo (npr. z Bruce-Versteegovo nelinearno regresijsko analizo (25)). Kadar je mogoče, mora biti R2 za najbolj občutljive vrste enak ali večji od 0,7, uporabljene preskusne koncentracije/stopnje pa zajemajo od 20- do 80-odstotne učinke. Če se ocenjuje vrednost NOEC, mora imeti prednost uporaba učinkovitih statističnih preskusov, ki jih je treba izbrati na podlagi porazdelitve podatkov (21)(26).
|
Poročilo o preskusu
|
32.
|
V poročilu o preskusu morajo biti predstavljeni rezultati študij in podroben opis preskusnih pogojev ter temeljita razprava o rezultatih, analiza podatkov in zaključki, izpeljani iz analize. Treba je podati povzetek v preglednici in izvleček rezultatov. Poročilo mora vključevati naslednje:
|
|
Preskusna kemikalija:
|
—
|
kemijski identifikacijski podatki, relevantne lastnosti preskušane kemikalije (npr. log Pow, topnost v vodi, parni tlak in informacije o usodi in vedenju v okolju, če so na voljo),
|
|
—
|
podrobnosti o pripravi preskusne raztopine in preverjanju preskusnih koncentracij, kot je navedeno v odstavku 18.
|
|
|
|
Preskusne vrste:
|
—
|
podrobnosti preskusnega organizma: vrsta/sorta, družine rastlin, znanstvena in splošna imena, kar najpodrobneje opisana vir in zgodovina semena (npr. ime dobavitelja, odstotek kalivosti, velikost semena, številka razreda, serije ali skupine, leto ali rastna sezono pobiranja semena, datum ocene kalivosti), viabilnost itd.,
|
|
—
|
število preskušanih vrst eno- in dvokaličnic,
|
|
—
|
razlogi za izbiro vrste,
|
|
—
|
opis shranjevanja, tretiranja in vzdrževanja semena.
|
|
|
|
Preskusni pogoji:
|
—
|
oprema za preskušanje (npr. rastna komora, fitotron in rastlinjak),
|
|
—
|
opis preskusnega sistema (npr. velikosti in materialov posod ter količine tal),
|
|
—
|
lastnosti tal (tekstura ali vrsta tal: porazdelitev in razvrstitev delcev tal, fizikalne in kemijske lastnosti, vključno z odstotkom organske snovi, odstotek organskega ogljika in vrednost pH),
|
|
—
|
priprava tal/substrata (npr. tal, umetnih tal, peska in drugega) pred preskusom,
|
|
—
|
opis hranilnega gojišča, če je uporabljeno,
|
|
—
|
nanos kemikalije: opis metode nanosa, opis opreme, stopnje in količine izpostavljenosti, vključno s preverjanjem kemikalije, opis metode umerjanja in opis okoljskih pogojev med nanosom,
|
|
—
|
rastni pogoji: obsevanost (npr. PAR, fotosintetsko aktivno sevanje), obdobje osvetljenosti, največje/najmanjše temperature, program in metoda zalivanja, gnojenje,
|
|
—
|
število semen na posodo, število rastlin na odmerek, število ponovitev (posod) na stopnjo izpostavljenosti,
|
|
—
|
vrsta in število kontrol (negativnih in/ali pozitivnih kontrol, kontrole s topilom, če se uporablja),
|
|
|
|
Rezultati:
|
—
|
preglednica vseh končnih točk za vsako ponovitev, preskusno koncentracijo/stopnjo in vrsto,
|
|
—
|
število in odstotek vzniknjenih semen v primerjavi s kontrolami,
|
|
—
|
meritve biomase (suho težo ali svežo težo poganjkov) rastlin v obliki odstotka kontrol,
|
|
—
|
višina poganjkov rastlin v obliki odstotka kontrol, če je merjena,
|
|
—
|
odstotek vidnih poškodb ter kvantitativni in kvalitativni opis vidnih poškodb (kloroza, nekroza, venenje, deformacije listov in stebel, pa tudi morebitna odsotnost učinkov) zaradi preskusne kemikalije v primerjavi s kontrolnimi rastlinami,
|
|
—
|
opis ocenjevalne lestvice, uporabljene za presojo vidnih poškodb, če obstaja vizualno ocenjevanje,
|
|
—
|
pri študijah z eno samo stopnjo je treba poročati o odstotku poškodb,
|
|
—
|
vrednosti ECx ali ERx (npr. EC50, ER50, EC25, ER25) in z njimi povezane meje zaupanja. Če se izvaja regresijska analiza, je treba določiti standardno napako za regresijsko enačbo in standardno napako za ocene posameznih parametrov (npr. naklon, presek),
|
|
—
|
vrednosti NOEC (in LOEC), če so izračunane,
|
|
—
|
opis uporabljenih statističnih postopkov in predpostavk,
|
|
—
|
grafični prikaz teh podatkov in razmerje med odmerkom in odzivom preskušanih vrst.
|
|
Odstopanja od postopkov, opisanih v tej preskusni metodi, in morebitne nenavadne dogodke med preskusom.
|
LITERATURA
|
(1)
|
Schrader, G., Metge, K., in Bahadir, M. (1998). Importance of salt ions in ecotoxicological tests with soil arthropods. Applied Soil Ecology, 7, 189–193.
|
|
(2)
|
Mednarodna organizacija za standardizacijo. (1993). ISO 11269-1. Kakovost tal – Določevanje učinka onesnažil na rastlinstvo – 1. del: Metoda merjenja zaviranja rasti korenin.
|
|
(3)
|
Mednarodna organizacija za standardizacijo. (1995). ISO 11269-2. Kakovost tal – Določevanje učinka onesnažil na rastlinstvo – 2. del: Učinki kemikalij na vznik in rast višjih rastlin.
|
|
(4)
|
American Standard for Testing Material (ASTM). (2002). E 1963-98. Standard Guide for Conducting Terrestrial Plant Toxicity Tests.
|
|
(5)
|
U.S. EPA. (1982). FIFRA, 40CFR, Part 158.540. Subdivision J, Parts 122-1 and 123-1.
|
|
(6)
|
US EPA. (1996). OPPTS Harmonized Test Guidelines, Series 850. Ecological Effects Test Guidelines:
|
—
|
850.4000: Background – Non-target Plant Testing,
|
|
—
|
850.4025: Target Area Phytotoxicity,
|
|
—
|
850.4100: Terrestrial Plant Toxicity, Tier I (Seedling Emergence),
|
|
—
|
850.4200: Seed Germination/Root Elongation Toxicity Test,
|
|
—
|
850.4225: Seedling Emergence, Tier II,
|
|
—
|
850.4230: Early Seedling Growth Toxicity Test.
|
|
|
(7)
|
AFNOR, X31-201. (1982). Essai d'inhibition de la germination de semences par une substance. AFNOR X31-203/ISO 11269-1. (1993) Determination des effets des polluants sur la flore du sol: Méthode de mesurage de l'inhibition de la croissance des racines.
|
|
(8)
|
Boutin, C., Freemark, K. E., in Keddy, C. J. (1993). Proposed guidelines for registration of chemical pesticides: Non-target plant testing and evaluation. Technical Report Series, št. 145. Canadian Wildlife Service (Headquarters), Environment Canada, Hull, Québec, Kanada.
|
|
(9)
|
Forster, R., Heimbach, U., Kula, C., in Zwerger, P. (1997). Effects of Plant Protection Products on Non-Target Organisms – A contribution to the Discussion of Risk Assessment and Risk Mitigation for Terrestrial Non-Target Organisms (Flora and Fauna). Nachrichtenbl. Deut. Pflanzenschutzd., št. 48.
|
|
(10)
|
Hale, B., Hall, J. C., Solomon, K., in Stephenson, G. (1994). A Critical Review of the Proposed Guidelines for Registration of Chemical Pesticides; Non-Target Plant Testing and Evaluation, Centre for Toxicology, University of Guelph, Ontario, Kanada.
|
|
(11)
|
Soil Texture Classification (US and FAO systems): Weed Science, 33, Suppl. 1 (1985) in Soil Sc. Soc. Amer. Ind. 26:305 (1962).
|
|
(12)
|
Audus, L. J. (1964). Herbicide behaviour in the soil. V: Audus, L. J., ur. The Physiology and biochemistry of Herbicides, London, New York, Academic Press, NY, poglavje 5, str. 163–206.
|
|
(13)
|
Beall, M. L., Jr., in Nash, R. G. (1969). Crop seedling uptake of DDT, dieldrin, endrin, and heptachlor from soil, J. Agro. 61:571–575.
|
|
(14)
|
Beetsman, G. D., Kenney, D. R., in Chesters, G. (1969). Dieldrin uptake by corn as affected by soil properties, J. Agro. 61:247–250.
|
|
(15)
|
U.S. Food and Drug Administration (FDA). (1987). Environmental Assessment Technical Handbook. Environmental Assessment Technical Assistance Document 4.07, Seedling Growth, 14 str., FDA, Washington, DC.
|
|
(16)
|
McKelvey, R. A., Wright, J. P., Honegger, J. L., in Warren, L. W. (2002). A Comparison of Crop and Non-crop Plants as Sensitive Indicator Species for Regulatory Testing. Pest Management Science vol. 58:1161– 1174.
|
|
(17)
|
Boutin, C.; Elmegaard, N., in Kjær, C. (2004). Toxicity testing of fifteen non-crop plant species with six herbicides in a greenhouse experiment: Implications for risk assessment. Ecotoxicology vol. 13(4): 349–369.
|
|
(18)
|
Boutin, C. in Rogers, C. A. (2000). Patterns of sensitivity of plant species to various herbicides – An analysis with two databases. Ecotoxicology vol. 9(4):255–271.
|
|
(19)
|
Boutin, C., in Harper, J. L. (1991). A comparative study of the population dynamics of five species of Veronica in natural habitats. J. Ecol. 9:155–271.
|
|
(20)
|
Boutin, C., Lee, H.-B., Peart, T. E., Batchelor, S. P., in Maguire, R. J. (2000). Effects of the sulfonylurea herbicide metsulfuron methyl on growth and reproduction of five wetland and terrestrial plant species. Envir. Toxicol. Chem. 19 (10): 2532–2541.
|
|
(21)
|
OECD (2006). Guidance Document, Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. Series on Testing and Assessment, št. 54, Organizacija za gospodarsko sodelovanje in razvoj, Pariz.
|
|
(22)
|
Hatzios, K. K., in Penner, D. (1985). Interactions of herbicides with other agrochemicals in higher plants. Rev. Weed Sci. 1:1–63.
|
|
(23)
|
Hamill, P. B., Marriage, P. B., in Friesen, G. (1977). A method for assessing herbicide performance in small plot experiments. Weed Science 25:386–389.
|
|
(24)
|
Frans, R. E., in Talbert, R. E. (1992). Design of field experiments and the measurement and analysis of plant response. V: B. Truelove (ur.) Research Methods in Weed Science, 2. izdaja. Southern weed Science Society, Auburn, 15–23.
|
|
(25)
|
Bruce, R. D., in Versteeg, D. J.(1992). A Statistical Procedure for Modelling Continuous Toxicity Data. Environmental Toxicology and Chemistry 11, 1485– 1492.
|
|
(26)
|
Poglavje C.33 te priloge: Preskus razmnoževanja deževnikov (Eisenia fetida/Eisenia andrei).
|
Dodatek 1
Opredelitve pojmov
|
|
Aktivna sestavina (a.i.) (ali aktivna snov (a.s.)) je snov, zasnovana za doseganje določenega biološkega učinka (npr. nadzora nad insekti, preprečevanje bolezni rastlin, zatiranje plevela na tretiranem območju), ki je znana tudi kot aktivna sestavina oziroma snov na tehnični stopnji.
|
|
|
Kemikalija pomeni snov ali zmes.
|
|
|
Fitofarmacevtska sredstva (sredstva za zaščito pridelka ali rastlin) ali pesticidi so snovi s posebno biološko aktivnostjo, ki se uporabljajo za zaščito pridelka pred škodljivimi organizmi (npr. glivičnimi boleznimi, insekti in kompetitivnimi rastlinami).
|
|
|
ECx – koncentracija z x-odstotnim učinkom ali ERx – stopnja z x-odstotnim učinkom je koncentracija ali stopnja, ki povzroči neželeno menjavo ali spremembo odstotka x v končni točki preskusa, merjeni glede na kontrolo (25- oziroma 50-odstotno zmanjšanje vznika, teže poganjkov, končnega števila prisotnih rastlin ali povečanje vidnih poškodb bi predstavljalo vrednost EC25/ER25 oziroma EC50/ER50).
|
|
|
Vznik je pojav koleoptila ali kotiledona nad površino tal.
|
|
|
Formulacija je komercialno formulirani produkt, ki vsebuje aktivno snov (aktivno sestavino), znan tudi kot končni pripravek (8) ali značilni končni izdelek (TEP (‚typical end-use product‘)).
|
|
|
Vrednost LOEC (Lowest Observed Effect Concentration) je najnižja koncentracija preskusne kemikalije, pri kateri je bil opažen učinek. V tem preskusu ima koncentracija, ki ustreza vrednosti LOEC, v danem obdobju izpostavljenosti statistično značilen učinek (p < 0,05) v primerjavi s kontrolo in je višja od vrednosti NOEC.
|
|
|
Neciljne rastline: rastline, ki so zunaj ciljnega območja rastlin. Pri fitofarmacevtskih sredstvih to navadno pomeni rastline zunaj tretiranega območja.
|
|
|
Vrednost NOEC (No Observed Effect Concentration) je najvišja koncentracija preskusne kemikalije, pri kateri ni bilo opaženega nobenega učinka. V tem preskusu koncentracija, ki ustreza vrednosti NOEC, v danem obdobju izpostavljenosti v primerjavi s kontrolo nima statistično značilnega učinka (p < 0,05).
|
|
|
Fitotoksičnost: škodljiva odstopanja (ocenjena z meritvami in vizualno) od normalnega vzorca videza in rasti rastlin kot odziv na dano kemikalijo.
|
|
|
Ponovitev je preskusna enota, ki predstavlja kontrolno skupino in/ali tretirano skupino. V teh študijah je posoda opredeljena kot ponovitev.
|
|
|
Vizualna ocena: ocena vidnih poškodb na podlagi opazovanja rastlinskega sestoja, vitalnosti, deformacij, kloroze, nekroze in splošnega videza v primerjavi s kontrolo.
|
|
|
Preskusna kemikalija: katera koli snov ali zmes, preskušena s to metodo.
|
Dodatek 2
Seznam vrst, uporabljenih pri preskušanju rastlin v preteklosti
|
Družina
|
Vrsta
|
Splošna imena
|
|
DICOTYLEDONAE (DVOKALIČNICE)
|
|
Apiaceae (Umbelliferae) (kobulnice)
|
Daucus carota
|
korenje
|
|
Asteraceae (Compositae) (nebinovke (košarnice))
|
Helianthus annuus
|
sončnice
|
|
Asteraceae (Compositae) (nebinovke (košarnice))
|
Lactuca sativa
|
solata
|
|
Brassicaceae (Cruciferae) (križnice (kapusnice))
|
Sinapis alba
|
bela gorjušica
|
|
Brassicaceae (Cruciferae) (križnice (kapusnice))
|
Brassica campestris var. chinensis
|
kitajski kapus
|
|
Brassicaceae (Cruciferae) (križnice (kapusnice))
|
Brassica napus
|
oljna ogrščica
|
|
Brassicaceae (Cruciferae) (križnice (kapusnice))
|
Brassica oleracea var. capitata
|
zelje
|
|
Brassicaceae (Cruciferae) (križnice (kapusnice))
|
Brassica rapa
|
strniščna repa
|
|
Brassicaceae (Cruciferae) (križnice (kapusnice))
|
Lepidium sativum
|
kreša
|
|
Brassicaceae (Cruciferae) (križnice (kapusnice))
|
Raphanus sativus
|
redkev
|
|
Chenopodiaceae (metlikovke)
|
Beta vulgaris
|
sladkorna pesa
|
|
Cucurbitaceae (bučevke)
|
Cucumis sativus
|
kumara
|
|
Fabaceae (Leguminosae) (metuljnice (stročnice))
|
Glycine max (G. soja)
|
soja
|
|
Fabaceae (Leguminosae) (metuljnice (stročnice))
|
Phaseolus aureus
|
mungo fižol
|
|
Fabaceae (Leguminosae) (metuljnice (stročnice))
|
Phaseolus vulgaris
|
pritlikavi fižol, stročji fižol, vrtni fižol
|
|
Fabaceae (Leguminosae) (metuljnice (stročnice))
|
Pisum sativum
|
grah
|
|
Fabaceae (Leguminosae) (metuljnice (stročnice))
|
Trigonella foenum- graecum
|
božja rutica
|
|
metuljnice (stročnice) (Fabaceae (Leguminosae))
|
Lotus corniculatus
|
navadna nokota
|
|
metuljnice (stročnice) (Fabaceae (Leguminosae))
|
Trifolium pratense
|
črna detelja
|
|
metuljnice (stročnice) (Fabaceae (Leguminosae))
|
Vicia sativa
|
grašica
|
|
Linaceae (lanovke)
|
Linum usitatissimum
|
lan
|
|
Polygonaceae (dresnovke)
|
Fagopyrum esculentum
|
ajda
|
|
Solanaceae (razhudnikovke)
|
Solanum lycopersicon
|
paradižnik
|
|
MONOCOTYLEDONAE (ENOKALIČNICE)
|
|
Liliaceae (Amarylladaceae) (lilijevke (narcisovke))
|
Allium cepa
|
čebula
|
|
Poaceae (Gramineae) (trave)
|
Avena sativa
|
oves
|
|
Poaceae (Gramineae) (trave)
|
Hordeum vulgare
|
ječmen
|
|
Poaceae (Gramineae) (trave)
|
Lolium perenne
|
trpežna (angleška) ljuljka
|
|
Poaceae (Gramineae) (trave)
|
Oryza sativa
|
riž
|
|
Poaceae (Gramineae) (trave)
|
Secale cereale
|
rž
|
|
Poaceae (Gramineae) (trave)
|
Sorghum bicolor
|
sirek v zrnju, navadni sirek
|
|
trave (Poaceae (Gramineae))
|
Triticum aestivum
|
pšenica
|
|
Poaceae (Gramineae) (trave)
|
Zea mays
|
koruza
|
Dodatek 3
Seznam potencialnih nekmetijskih rastlin
Potencialne rastline za preskušanje strupenosti rastlin OECD.
Opomba: V naslednji preglednici so informacije o 52 nekmetijskih vrstah (viri so za vsak vnos navedeni v oklepajih). Navedene hitrosti vznika so vzete iz objavljene literature in služijo le kot splošno vodilo. Posamezne izkušnje se lahko razlikujejo glede na vir semena in druge dejavnike.
|
Botanično ime DRUŽINE vrste
(slovensko splošno ime)
|
Življenjska doba (9) in habitat
|
Teža semena
(mg)
|
Obdobje osvetljenosti za kalivost ali rast (10)
|
Globina sejanja
(mm) (11)
|
Čas do kalitve
(dni) (12)
|
Posebna tretiranja (13)
|
Preskus strupenosti (14)
|
Dobavitelji semen (15)
|
Druge reference (16)
|
|
APIACEAE (KOBULNICE)
Torilis japónica
(japonska oklobnica)
|
E, D; prizadeta območja, žive meje, pašniki (16, 19)
|
1,7–1,9 (14, 19)
|
S = T (14)
|
0
(1, 19)
|
5 (50 %) (19)
|
hladna stratifikacija (7, 14, 18, 19), morda je potrebno zorenje (19), tema zavira kalivost (1, 19), brez posebnih tretiranj (5)
|
NAKNADNO (5)
|
|
|
|
ASTERACEAE (NEBINOVKE)
Bellis perennis
(navadna marjetica)
|
T
travišča, orna zemljišča, trate (16, 19)
|
0,09–0,17 (4, 19)
|
S = T (14)
|
0
(4)
|
3 (50 %) (19)
11 (100 %) (18)
|
obsevanost ne vpliva na kalivost (18, 19), brez posebnih tretiranj (4, 14)
|
NAKNADNO (4)
|
A, D, F
|
7
|
|
Centaurea cyanus
(plavica)
|
E
polja, obcestne površine, odprti habitati (16)
|
4,1–4,9 (4, 14)
|
S = T (14)
|
0–3 (2, 4, 14)
|
14–21 (100 %) (14)
|
brez posebnih tretiranj (2, 4)
|
NAKNADNO (2,4)
|
A, D, E, F
|
7
|
|
Centaurea nigra
(črni glavinec)
|
T
polja, obcestne površine, odprti habitati (16, 19)
|
2,4–2,6 (14, 19)
|
S = T (14)
|
0 (19)
|
3 (50 %) (19)
4 (97 %) (18)
|
morda je potrebno zorenje (18, 19), tema zavira kalivost (19), brez posebnih tretiranj (5, 14, 26)
|
NAKNADNO (5, 22, 26)
|
A
|
|
|
Inula helenium
veliki oman
|
T
vlažna, prizadeta mesta
(16)
|
1–1,3 (4, 14, 29)
|
|
0
(4, 29)
|
|
brez posebnih tretiranj (4)
|
NAKNADNO (4)
|
A, F
|
|
|
Leontodon hispidus
(navadni otavčič)
|
T
polja, obcestne površine, prizadeta območja (16, 19)
|
0,85–1,2 (14, 19)
|
S = T (14)
|
0 (19)
|
4 (50 %) (19)
7 (80 %) (18)
|
tema zavira kalivost (17, 18, 19) brez posebnih tretiranj (5, 23)
|
NAKNADNO (5, 22, 23)
|
|
|
|
Rudbeckia hirta
(srhkodlakava rudbekija)
|
D, T prizadeta območja
(16)
|
0,3 (4, 14)
|
S = T (14)
|
0
(4, 33)
|
< 10 (100 %) (33)
|
brez posebnih tretiranj
(4, 14, 33)
|
NAKNADNO (4, 33)
|
C, D, E, F
|
|
|
Solidago canadensis
kanadska zlata rozga
|
T
pašniki, odprta območja (16)
|
0,06–0,08 (4, 14)
|
S = T (11)
|
0
(4)
|
14–21
(11)
|
zmešajte z enakim delom peska in 24 ur namakajte v 500 ppm GA (11), brez posebnih tretiranj (4)
|
NAKNADNO (4)
|
E, F
|
|
|
Xanthium pensylvanicum
(pensilvanski bodič)
|
E
polja, odprti habitati (16)
|
25–61 (14, 29)
|
|
0(1)
5(29)
|
|
tema lahko zavira kalivost (1), namakajte 12 ur v topli vodi (29)
|
PREDHODNO IN NAKNADNO (31)
|
A
|
|
|
Xanthium spinosum
(trnati bodič)
|
E
odprti habitati (16)
|
200 (14)
|
S = T (14)
S > T (6)
|
10
(6)
|
|
opraskanje (14), brez posebnih tretiranj (6)
|
PREDHODNO IN NAKNADNO (6)
|
A
|
|
|
Xanthium strumarium
(navadni bodič)
|
E
polja, odprti habitati (16)
|
67,4 (14)
|
S = T (14)
|
10–20 (6, 21)
|
|
brez posebnih tretiranj
(6, 14, 21)
|
PREDHODNO IN NAKNADNO (6, 21, 28, 31)
|
A
|
|
|
BRASSICACEAE (KRIŽNICE)
Cardamine pratensis
(travniška penuša)
|
T
polja, obcestne površine, trate (16, 19)
|
0,6 (14, 19)
|
S = T (14)
|
0 (19)
|
5 (50 %) (19)
15 (98 %) (18)
|
tema zavira kalivost (18, 19), brez posebnih tretiranj (5, 14, 22)
|
NAKNADNO (5, 22)
|
F
|
|
|
CARYOPHYLLACEAE (KLINČNICE)
Lychnis flos-cuculi
(kukavičja lučca)
|
T
(16)
|
0,21 (14)
|
S = T (14)
|
|
< 14 (100 %) (14, 25)
|
morda je potrebno zorenje (18), brez posebnih tretiranj (5, 14, 15, 22–26)
|
NAKNADNO (5, 15, 22–26)
|
F
|
|
|
CHENOPODIACEAE (METLIKOVKE)
Chenopodium album
(bela metlika)
|
E
robovi polj, prizadeta območja (16, 19)
|
0,7–1,5 (14, 19, 34)
|
S = T (14)
|
0
(1, 19)
|
2 (50 %) (19)
|
tretiranje se razlikuje glede na barvo semena (19), obdobje mirovanja pri shranjevanju na suhem (19), tema zavira kalivost (1, 18, 19), hladna stratifikacija (18), brez posebnih tretiranj (14, 34)
|
PREDHODNO IN NAKNADNO (28, 31, 34)
|
A
|
32
|
|
CLUSIACEAE (KRČNIČEVKE)
Hypericum perforatum
(šentjanževka)
|
T
polja, orna zemljišča, odprti habitati (16, 19)
|
0,1–0,23
(14, 19)
|
S = T
(14)
|
0
(1, 19)
|
3 (19)
11 (90 %) (18)
|
tema zavira kalivost (1, 18, 19),
brez posebnih tretiranj (5, 14, 15, 25, 27)
|
NAKNADNO
(5, 15, 25, 27)
|
A, E, F
|
|
|
CONVOLVULACEAE (SLAKOVKE)
Ipomoea hederacea
(bršljanasti lepi slak)
|
E
obcestne površine, odprti habitati, koruzna polja (16)
|
28,2
(14)
|
S > T
(6, 10)
|
10–20
(6, 10, 21)
|
4 (100 %)
(10)
|
obsevanost ne vpliva na kalivost (1),
brez posebnih tretiranj (6, 21)
|
PREDHODNO IN NAKNADNO
(6, 12, 21, 28)
|
A
|
|
|
CYPERACEAE (OSTRIČEVKE)
Cyperus rotundus
(okrogla ostrica)
|
T
orne površine, pašniki, obcestne površine (16, 30)
|
0,2
(14)
|
S = T
(14)
|
0 (1)
10–20 (6, 10)
|
12 (91 %)
(10)
|
tema zavira kalivost (1),
brez posebnih tretiranj (6, 10, 14)
|
PREDHODNO IN NAKNADNO
(6, 28, 31)
|
B
|
7
|
|
FABACEAE (METULJNICE)
Lotus corniculatus
(navadna nokota)
|
T
travnate površine, obcestne površine, odprti habitati (16, 19)
|
1–1,67
(14, 19)
|
S = T (14)
|
|
1 (50 %)
(19)
|
opraskanje (14, 19),
obsevanost ne vpliva na kalivost (18, 19) brez posebnih tretiranj (23, 25)
|
NAKNADNO
(5, 23, 25)
|
A, D, E, F
|
|
|
Senna obtusifolia
(topolistna sena)
|
E
vlažni gozdovi (16)
|
23–28
(9)
|
S = T (14)
S > T (9)
|
10–20
(6,9)
|
|
semena 24 ur namakajte v vodi (9),
opraskanje (14), viabilnost semena se razlikuje glede na barvo (1), brez posebnih tretiranj (6)
|
NAKNADNO
(6,9)
|
A
|
|
|
Sesbania exaltata
(konoplja)
|
E
aluvialna tla (16)
|
11–13
(9, 14)
|
S > T (9)
|
10-20
(9, 21)
|
|
semena 24 ur namakajte v vodi (9),
obsevanost ne vpliva na kalivost (1), brez posebnih tretiranj (21)
|
PREDHODNO IN NAKNADNO
(9, 21, 28, 31)
|
A
|
|
|
Trifolium pratense
(črna detelja)
|
T
polja, obcestne površine, orna zemljišča (16, 19)
|
1,4–1,7
(14, 19)
|
S = T (14)
|
|
1 (50 %)
(19)
|
opraskanje (14, 18),
morda je potrebno zorenje (19), obsevanost ne vpliva na kalivost (1, 19), brez posebnih tretiranj (5)
|
NAKNADNO
(5)
|
A, E, F
|
|
|
LAMIACEAE (USTNATICE)
Leonurus cardiaca
(deljenolistna srčnica)
|
T
odprta območja (16)
|
0,75–1,0
(4, 14)
|
S = T (14)
|
0
(4)
|
|
brez posebnih tretiranj
(4, 14)
|
NAKNADNO
(4)
|
F
|
|
|
Mentha spicata
(klasasta meta)
|
T
vlažna območja (16)
|
2,21
(4)
|
|
0
(4)
|
|
brez posebnih tretiranj
(4)
|
NAKNADNO
(4)
|
F
|
|
|
Nepeta cataria
(mačja meta)
|
T
prizadeta območja (16)
|
0,54
(4, 14)
|
S = T (14)
|
0
(4)
|
|
brez posebnih tretiranj
(2, 4, 14)
|
NAKNADNO
(2,4)
|
F
|
|
|
Prunella vulgaris
(navadna črnoglavka)
|
T
orna zemljišča, travnata področja, prizadeta mesta (16, 19)
|
0,58–1,2
(4, 14, 19)
|
S = T (14)
|
0
(4, 19)
|
5 (50 %) (19)
7 (91 %) (18)
|
tema zavira kalivost (18, 19),
boljša kalivost z večjimi semeni (1), brez posebnih tretiranj (4, 14, 22)
|
NAKNADNO
(4, 22)
|
A, F
|
|
|
Stachys officinalis
(navadni čistec)
|
T
travišča, robovi polj (19)
|
14–18
(14, 19)
|
S = T (14)
|
|
7 (50 %)
(19)
|
brez posebnih tretiranj
(5, 14, 22)
|
NAKNADNO
(5, 22)
|
F
|
|
|
MALVACEAE (SLEZENOVKE)
Abutilón theophrasti
(baržunasti oslezovec)
|
E
polja, odprti habitati (16)
|
8,8
(14)
|
S = T (14)
|
10–20
(6, 10, 21)
|
4 (84 %)
(10)
|
opraskanje (14),
brez posebnih tretiranj (5, 10, 21)
|
PREDHODNO IN NAKNADNO
(6, 22, 28, 31)
|
A, F
|
|
|
Sida spinosa
(bodičasta sida)
|
E
polja, obcestne površine (16)
|
3,8
(14)
|
S = T (14)
|
10–20
(6, 21)
|
|
opraskanje (14),
obsevanost ne vpliva na kalivost (1), brez posebnih tretiranj (6, 21)
|
PREDHODNO IN NAKNADNO
(6, 21, 28, 31)
|
A, F
|
|
|
PAPAVERACEAE (MAKOVKE)
Papaver rhoeas
(poljski mak)
|
E
polja, orna zemljišča, prizadeta mesta (16, 19)
|
0,1–0,3
(4, 14, 19, 29)
|
S = T (14)
|
0
(4, 29)
|
4 (50 %)
(19)
|
hladna stratifikacija in opraskanje (1, 19, 32),
brez posebnih tretiranj (4, 14, 29)
|
NAKNADNO
(4)
|
A, D, E, F, G
|
|
|
POACEAE (TRAVE)
Agrostis tenuis
(tankolistna šopulja)
|
trate, pašniki (16)
|
0,07 (14)
|
S > T (Ю)
|
20 (10)
|
10 (62 %) (10)
|
tema zavira kalivost (1, 17–19) brez posebnih tretiranj (10)
|
NAKNADNO (10)
|
A, E
|
|
|
Alopecurus myosuroides
(njivski lisičji rep)
|
E
polja, odprti habitati (16)
|
0,9–1,6
(29, 34)
|
S = T (14)
|
2
(29)
|
< 24 (30 %) (34)
|
opraskanje (14), tretiranje s 101 mg/l KNO3 (14), topla stratifikacija (1), tema zavira kalivost (1), brez posebnih tretiranj (34)
|
PREDHODNO IN NAKNADNO
(28, 34)
|
A
|
32
|
|
Avena fatua
(gluhi oves)
|
E
kultivirana območja, odprti habitati (16)
|
7–37,5 (14, 30)
|
S = T (14)
S > T (6)
|
10–20 (6, 10)
|
3 (70 %) (18)
|
opraskanje (7, 32), tema zavira kalitev (1),
hladna stratifikacija (1, 18), brez posebnih tretiranj (6, 10, 14)
|
PREDHODNO IN NAKNADNO (6, 10, 28, 31)
|
A
|
|
|
Bromus tectorum
(strešna stoklasa)
|
E
polja, obcestne površine, orna zemljišča (16)
|
0,45–2,28 (14, 29)
|
S = T (14)
|
3 (29)
|
|
obdobje zorenja (1, 7, 32), svetloba zavira kalivost (1), brez posebnih tretiranj (14)
|
PREDHODNO IN NAKNADNO (28, 31)
|
A
|
|
|
Cynosurus cristatus
(navadni pasji rep)
|
T
polja, obcestne površine, odprti habitati (16, 19)
|
0,5–0,7 (14, 19, 29)
|
S = T (14)
|
0 (29)
|
3 (50 %) (19)
|
obsevanost ne vpliva na kalivost (19), brez posebnih tretiranj (14, 29)
|
NAKNADNO (5)
|
A
|
|
|
Digitaria sanguinalis
(krvavordeča srakonja)
|
E
polja, trate, odprti habitati (16)
|
0,52–0,6 (14, 30)
|
S = T (14)
|
10–20 (21).
|
7 (75 %)
14 (94 %) (7)
|
opraskanje, hladna stratifikacija in zorenje (1, 7, 14, 32), tretiranje s 101 mg/l KNO3 (14), tema zavira kalivost (1), brez posebnih tretiranj (21)
|
PREDHODNO IN NAKNADNO (18, 25, 31)
|
A
|
|
|
Echinochloa crusgalli
(navadna kostreba)
|
E
(16)
|
1,5 (14)
|
S = T (14)
S > T (3)
|
10–20 (7, 21)
|
|
opraskanje (7, 32), obsevanost ne vpliva na kalivost (1), brez posebnih tretiranj (3, 14, 21)
|
PREDHODNO IN NAKNADNO (3, 21, 28, 31)
|
A
|
|
|
Elymus canadensis
(kanadski bored)
|
T
obrežna območja, prizadeta mesta (16)
|
4–5 (14, 30)
|
S = T (11)
|
1
(11)
|
14–28
(11)
|
brez posebnih tretiranj
(2, 11)
|
NAKNADNO (2)
|
C, D, E
|
|
|
Festuca pratensis
(travniška bilnica)
|
T
polja, vlažna območja (16, 19)
|
1,53–2,2 (16, 19)
|
S = T (14)
S > T (10)
|
20 (10)
|
9 (74 %) (10)
2 (50 %) (19)
|
brez posebnih tretiranj
(10, 19)
|
NAKNADNO (10)
|
A
|
7
|
|
Hordeum pusillum
(mali ječmen)
|
E
pašniki, obcestne površine, odprti habitati (16)
|
3,28 (14)
|
|
|
|
topla stratifikacija (1), obsevanost ne vpliva na kalivost (1)
|
PREDHODNO (31)
|
|
7
|
|
Phieum pratense
(travniški mačji rep)
|
T
pašniki, orna polja, prizadeta mesta (16, 19)
|
0,45 (14, 19)
|
S > T (10, 14)
|
0–10 (10, 19)
|
2 (74 %) (10)
8 (50 %) (19)
|
tema zavira kalivost (19), obsevanost ne vpliva na kalivost (17), brez posebnih tretiranj (10, 14, 17, 19)
|
NAKNADNO (10)
|
A, E
|
|
|
POLYGONACEAE (DRESNOVKE)
Polygonum convolvulus
(navadni slakovec)
|
E
odprti habitati, obcestne površine (16)
|
5–8 (4, 14, 29)
|
S = T (20)
|
0–2 (4, 29)
|
|
hladna stratifikacija od 4 do 8 tednov (1, 2, 4, 20, 29), obsevanost ne vpliva na kalivost (1)
|
PREDHODNO IN NAKNADNO (1, 2, 20, 28, 31)
|
A
|
32
|
|
Polygonum lapathifolium
(ščavjelistna dresen)
|
E
vlažna tla (16)
|
1,8–2,5 (14).
|
S > T (6)
|
|
5 (94 %) (18)
|
obsevanost ne vpliva na kalivost (1), tema zavira kalivost (18), hladna stratifikacija (1), brez posebnih tretiranj (5)
|
PREDHODNO IN NAKNADNO (6)
|
A, E
|
|
|
Polygonum pennsylvanicum
(pensilvanska dresen)
|
E
polja, odprti habitati (16)
|
3,6–7 (14, 29)
|
|
2 (29)
|
|
hladna stratifikacija 4 tedne pri 0–5 °C (1, 29), tema zavira kalivost (1)
|
PREDHODNO (31)
|
A, E
|
|
|
Polygonum periscaria
(breskvolistna dresen)
|
E
prizadeta območja, orna zemljišča (16, 19)
|
2,1–2,3 (14, 19)
|
S > T (13)
|
0 (19)
|
< 14 (13)
2 (50 %) (19)
|
opraskanje, hladna stratifikacija, tretiranje z GA (14), hladna stratifikacija, zorenje (17–19), tema zavira kalivost (19), brez posebnih tretiranj (13)
|
NAKNADNO (13)
|
A
|
32
|
|
Rumex crispus
(kodrastolistna kislica)
|
T
orna polja, obcestne površine, odprta območja (16, 19)
|
1,3–1,5 (4, 14, 19)
|
S = T (14, 33)
|
0
(4, 19, 33)
|
3 (50 %) (19)
6 (100 %) (33)
|
obsevanost ne vpliva na kalivost (18, 19), morda je potrebno zorenje (18), brez posebnih tretiranj (4, 14, 33)
|
NAKNADNO (4, 33)
|
A, E
|
32
|
|
PRIMULACEAE (JEGLIČEVKE)
Anagallis arvensis
(navadna kurja češnjica)
|
E
orna polja, odprta območja, prizadeta mesta (16, 19)
|
0,4–0,5 (4, 14, 19)
|
S = T (14)
|
|
1 (50 %) (19)
|
hladna stratifikacija, tretiranje z GA (1, 14, 18, 19, 32), za kalivost je potrebna svetloba (1), brez posebnih tretiranj (2, 4)
|
NAKNADNO (2,4)
|
A, F
|
|
|
RANUNCULACEAE (ZLATIČEVKE)
Ranunculus acris
(ripeča zlatica)
|
T
orna polja, obcestne površine, odprta območja (16, 19)
|
1,5–2 (14, 19, 29)
|
S = T (14)
|
1
(29)
|
41–56 (19, 29)
|
brez posebnih tretiranj
(5, 14, 22, 24–26)
|
NAKNADNO (5, 22, 24–26)
|
|
32
|
|
ROSACEAE (ROŽNICE)
Geum urbanum
(navadna sretena)
|
T
žive meje, vlažna območja
(16, 19)
|
0,8–1,5 (14, 19)
|
S = T (14)
|
0 (19)
|
5 (50 %) (19)
16 (79 %) (18)
|
tema zavira kalivost (18, 19), topla stratifikacija (1), brez posebnih tretiranj (5, 14, 22, 25, 26)
|
NAKNADNO (5, 22, 25, 26)
|
A
|
|
|
RUBIACEAE (BROŠČEVKE)
Galium aparine
(plezajoča lakota)
|
E
orna polja, vlažna območja, prizadeta mesta (16, 19)
|
7–9 (14, 19)
|
S = T (14)
|
|
5 (50 %) (19)
6 (100 %) (18)
|
hladna stratifikacija (1, 18, 19), obsevanost ne vpliva na kalivost (18, 19), svetloba zavira kalivost (1), brez posebnih tretiranj (6, 14)
|
PREDHODNO IN NAKNADNO (6, 28)
|
A
|
32
|
|
Galium mollugo
(navadna lakota)
|
T
žive meje, odprta območja (8)
|
7
(29)
|
S = T (14)
|
2
(29)
|
|
brez posebnih tretiranj
(5, 14, 22, 24, 26, 29)
|
NAKNADNO (5, 22, 24, 26)
|
A
|
|
|
SCROPHULARIACEAE (ČRNOBINOVKE)
Digitalis purpurea
(škrlatni naprstec)
|
D, T žive meje, odprta območja (16, 19)
|
0,1–0,6 (4, 14, 19)
|
S = T (14)
|
0
(4, 19)
|
6 (50 %) (19)
8 (99 %) (18)
|
tema zavira kalivost (1,17–19), brez posebnih tretiranj (4, 22–26)
|
NAKNADNO (4, 22–26)
|
D, G, F
|
|
|
Veronica persica
(perzijski jetičnik)
|
E
orna polja, odprta območja, prizadeta mesta (16, 19)
|
0,5–0,6 (14, 19)
|
S = T (14)
|
0 (19)
|
3(19)
5 (96 %) (18)
|
tema zavira kalivost (18, 19), hladna stratifikacija (18), brez posebnih tretiranj (14)
|
PREDHODNO IN NAKNADNO (28)
|
A
|
32
|
Navedeni dobavitelji semen
|
ID dobavitelja
|
Informacije o dobavitelju
|
|
A
|
|
Herbiseed
|
|
New Farm, Mire Lane, West End, Twyford RG10 0NJ VELIKA BRITANIJA + 44 1189349464
|
|
www.herbiseed.com
|
|
|
B
|
|
Tropilab Inc.
|
|
8240 Ulmerton Road, Largo, FL 33771-3948 ZDA
|
|
+1 7273444050
|
|
www.tropilab.com
|
|
|
C
|
|
Pterophylla – Native Plants & Seeds
|
|
#316 Regional Road 60, RR#1, Walsingham, ON N0E 1X0 KANADA + 1 5195863985
|
|
|
D
|
|
Applewood Seed Co.
|
|
5380 Vivian St., Arvada, CO 80002 ZDA + 1 3034317333
|
|
www.applewoodseed.com
|
|
|
E
|
|
Ernst Conservation Seeds
|
|
9006 Mercer Pike, Meadville, PA 16335 ZDA
|
|
+1 8008733321
|
|
www.ernstseed.com
|
|
|
F
|
|
Chiltern Seeds
|
|
Bortree Stile, Ulverston, Cumbria LA12 7PB VELIKA BRITANIJA
|
|
+44 1229581137
|
|
www.chiltemseeds.co.uk
|
|
|
G
|
|
Thompson & Morgan
|
|
P.O. Box 1051, Fort Erie, ON L2A 6C7 KANADA + 1 8002747333
|
|
www.thompson-morgan.com
|
|
NAVEDENI VIRI
|
(1)
|
Baskin, C. C., in Baskin, J. M. (1998). Seeds. Academic Press, Toronto.
|
|
(2)
|
Blackburn, L. G., in Boutin, C. (2003). Subtle effects of herbicide use in the context of genetically modified crops: a case study with glyphosate (Round-Up®). Ecotoxicology, 12:271–285.
|
|
(3)
|
Boutin, C., Lee, H.-B., Peart, T., Batchelor, P. S., in Maguire, R. J. (2000). Effects of the sulfonylurea herbicide metsulfuron methyl on growth and reproduction of five wetland and terrestrial plant species. Environmental Toxicology & Chemistry, 19(10):2532–2541.
|
|
(4)
|
Boutin, C., Elmegaard, N., in Kjaer, C. (2004). Toxicity testing of fifteen non-crop plant species with six herbicides in a greenhouse experiment: implications for risk assessment. Ecotoxicology, 13:349–369.
|
|
(5)
|
Breeze, V., Thomas, G., in Butler, R. (1992). Use of a model and toxicity data to predict the risks to some wild plant species from drift of four herbicides. Annals of Applied Biology, 121:669–677.
|
|
(6)
|
Brown, R. A., in Farmer, D. (1991). Track-sprayer and glasshouse techniques for terrestrial plant bioassays with pesticides. V: Plants for toxicity assessment: 2. izdaja. ASTM STP 1115, J. W. Gorsuch, W. R. Lower, W. Wang, in M. A. Lewis, ur. American Society for Testing & Materials, Philadelphia. Str. 197–208.
|
|
(7)
|
Buhler, D. D., in Hoffman, M. L. (1999). Anderson's guide to practical methods of propagating weeds and other plants. Weed Science Society of America, Lawrence, K.
|
|
(8)
|
Clapham, A. R., Tutin, T. G., in Warburg, E. F. (1981). Excursion flora of the British Isles, 3. izdaja, Cambridge University Press, Cambridge.
|
|
(9)
|
Clay, P. A., in Griffin, J. L. (2000). Weed seed production and seedling emergence response to late-season glyphosate applications. Weed Science, 48:481–486.
|
|
(10)
|
Cole, J. F. H., in Canning, L. (1993). Rationale for the choice of species in the regulatory testing of the effects of pesticides on terrestrial non-target plants. BCPC – Weeds. str. 151–156.
|
|
(11)
|
Fiely, M. (Ernst Conservation Seeds). (2004). Osebna komunikacija. (www.ernstseed.com).
|
|
(12)
|
Fletcher, J. S., Johnson, F. L., in McFarlane, J. C. (1990). Influence of greenhouse versus field testing and taxonomic differences on plant sensitivity to chemical treatment. Environmental Toxicology & Chemistry, 9:769–776.
|
|
(13)
|
Fletcher, J. S., Pfleeger, T. G., Ratsch, H. C., in Hayes, R. (1996). Potential impact of low levels of chlorsulfuron and other herbicides on growth and yield of nontarget plants. Environmental Toxicology & Chemistry, 15(7):1189–1196.
|
|
(14)
|
Flynn, S., Turner, R. M., in Dickie, J. B. (2004). Seed Information Database (release 6.0, okt. 2004) Royal Botanic Gardens, Kew (www.rbgkew.org.uk/data/sid).
|
|
(15)
|
Franzaring, J., Kempenaar, C., in van der Eerden, L. J. M. (2001). Effects of vapours of chlorpropham and ethofumesate on wild plant species. Environmental Pollution, 114:21–28.
|
|
(16)
|
Gleason, H. A., in Cronquist, A. (1991). Manual of vascular plants of northeastern United States and adjacent Canada, 2. izdaja. New York Botanical Garden, Bronx, NY.
|
|
(17)
|
Grime, J. P. (1981). The role of seed dormancy in vegetation dynamics. Annals of Applied Biology, 98:555–558.
|
|
(18)
|
Grime, J. P., Mason, G., Curtis, A. V., Rodman, J., Band, S. R., Mowforth, M. A. G., Neal, A. M., in Shaw, S. (1981). A comparative study of germination characteristics in a local flora. Journal of Ecology, 69:1017–1059.
|
|
(19)
|
Grime, J. P., Hodgson, J. G., in Hunt, R. 1988. Comparative plant ecology: a functional approach to common British species. Unwin Hyman Ltd., London.
|
|
(20)
|
Kjaer, C. (1994). Sublethal effects of chlorsulfuron on black bindweed (Polygonum convolvulus L.). Weed Research, 34, 453–459.
|
|
(21)
|
Klingaman, T. E., King, C. A., in Oliver, L. R. (1992). Effect of application rate, weed species, and weed stage of growth on imazethapyr activity. Weed Science, 40:227–232.
|
|
(22)
|
Marrs, R. H., Williams, C. T., Frost, A. J., in Plant, R. A. (1989). Assessment of the effects of herbicide spray drift on a range of plant species of conservation interest. Environmental Pollution, 59:71–86.
|
|
(23)
|
Marrs, R. H., Frost, A. J., in Plant, R. A. (1991). Effects of herbicide spray drift on selected species of nature conservation interest: the effects of plant age and surrounding vegetation structure. Environmental Pollution, 69:223–235.
|
|
(24)
|
Marrs, R. H., Frost, A. J., in Plant, R. A. (1991). Effects of mecoprop drift on some plant species of conservation interest when grown in standardized mixtures in microcosms. Environmental Pollution, 73:25–42.
|
|
(25)
|
Marrs, R. H., Frost, A. J., Plant, R. A., in Lunnis, P. (1993). Determination of buffer zones to protect seedlings of non-target plants from the effects of glyphosate spray drift. Agriculture, Ecosystems, & Environment, 45:283–293.
|
|
(26)
|
Marrs, R. H., in Frost, A. J. (1997). A microcosm approach to detection of the effects of herbicide spray drift in plant communities. Journal of Environmental Management, 50:369–388.
|
|
(27)
|
Marshall, E. J. P., in Bernie, J. E. (1985). Herbicide effects on field margin flora. BCPC – Weeds. str. 1021–1028.
|
|
(28)
|
McKelvey, R. A., Wright, J. P., in Honegger, J. L. (2002). A comparison of crop and non-crop plants as sensitive species for regulatory testing. Pest Management Science, 58:1161–1174.
|
|
(29)
|
Morton, S. (Herbiseed). (2004). Osebna komunikacija. (http://www.herbiseed.com).
|
|
(30)
|
USDA, NRCS. 2004. The Plants Database, version 3.5. (http://plants.usda.gov). National Plant Data Centre, Baton Rouge, LA 70874-4490 ZDA.
|
|
(31)
|
USEPA. (1999). One-Liner Database. [U.S. E.P.A./Office of Pesticide Programs/Environmental Fate and Effects Division/Environmental Epidemiology Branch].
|
|
(32)
|
Webster, R. H. (1979). Technical Report No. 56: Growing weeds from seeds and other propagules for experimental purposes. Agricultural Research Council Weed Research Organization, Oxford.
|
|
(33)
|
White, A. L., in Boutin, C. (National Wildlife Research Centre, Environment Canada). 2004. Osebna komunikacija.
|
|
(34)
|
Zwerger, P., in Pestemer, W. (2000). Testing the phytotoxic effects of herbicides on higher terrestrial non-target plants using a plant life-cycle test. Z. PflKrankh. PflSchutz, Sonderh., 17:711–718.
|
Dodatek 4
Primeri ustreznih rastnih pogojev za določene vrste kmetijskih rastlin
Naslednji pogoji so se izkazali za primerne pri 10 vrstah kmetijskih rastlin in jih je mogoče uporabljati kot vodilo tudi pri preskusih z določenimi drugimi vrstami v rastnih komorah:
|
|
Koncentracija ogljikovega dioksida: 350 ± 50 ppm.
|
|
|
Relativna vlažnost: 70 ± 5 % med obdobji osvetljenosti in 90 ± 5 % med obdobji teme.
|
|
|
Temperatura: 25 ± 3 °C podnevi, 20 ± 3 °C ponoči.
|
|
|
Obdobje osvetljenosti: 16 ur osvetljenosti/8 ur teme, pri čemer se predpostavlja, da je povprečna valovna dolžina od 400 do 700 nm.
|
|
|
Osvetljenost: svetlost 350 ± 50 μE/m2/s, merjeno na vrhu rastlinskega pokrova.
|
Vrste kmetijskih rastlin so:
|
—
|
paradižnik (Solanum lycopersicon),
|
|
—
|
navadna kumara (Cucumis sativus),
|
|
—
|
solata (Lactuca sativa),
|
|
—
|
glavnato zelje (Brassica oleracea var. capitata),
|
|
—
|
navadno korenje (Daucus carota),
|
|
—
|
trpežna ljuljka (Lolium perenne),
|
C.32. PRESKUS RAZMNOŽEVANJA ENHITREJEV
UVOD
|
1.
|
Ta preskusna metoda je enakovredna Smernici za preskušanje OECD (TG) 220 (2004). Zasnovana je za uporabo pri ocenjevanju učinkov kemikalij na sposobnost razmnoževanja črva enhitreja, Enchytraeus albidus (Henle, 1873), v tleh. Načeloma temelji na metodi, ki jo je razvila nemška Zvezna agencija za okolje (1) in je bila preskušena s krožnim preskusom (2). Upoštevane so bile tudi druge metode za preskušanje strupenosti kemikalij za enhitreje in deževnike (3)(4)(5)(6)(7)(8).
|
ZAČETNI POMISLEKI
|
2.
|
V tleh živeči kolobarniki iz rodu Enchytraeus so ekološko pomembna vrsta za ekotoksikološko preskušanje. Čeprav je enhitreje pogosto najti v tleh, ki vsebujejo deževnike, pa drži tudi to, da jih je pogosto veliko tudi v tleh, kjer deževnikov ni. Enhitreje je mogoče uporabljati v laboratorijskih preskusih ter v polterenskih in terenskih študijah. S praktičnega vidika je z mnogimi vrstami enhitrejev enostavno ravnati in jih gojiti, njihov generacijski čas pa je znatno krajši od generacijskega časa pri deževnikih. Zato preskus razmnoževanja z enhitreji traja le od 4 do 6 tednov, z deževniki (Eisenia fetida) pa 8 tednov.
|
|
3.
|
Osnovne informacije o ekologiji in ekotoksikologiji enhitrejev v kopenskem okolju je mogoče najti v (9)(10)(11)(12).
|
NAČELO PRESKUSA
|
4.
|
Odrasli črvi enhitrejev so izpostavljeni več koncentracijam preskusne kemikalije, vmešane v umetna tla. Preskus je mogoče razdeliti v dve fazi: (a) če na voljo ni dovolj informacij, preskus za določanje območja delovanja, v katerem je glavna končna točka smrtnost, ocenjena po dveh tednih izpostavljenosti, ter (b) dokončni preskus razmnoževanja, v katerem se oceni skupno število mladičev, ki jih je ustvaril starš, in preživetje staršev. Dokončni preskus traja šest tednov. Po prvih treh tednih se odrasli črvi odstranijo in zabeležijo se morfološke spremembe. Po dodatnih treh tednih se prešteje število potomcev, izleženih iz kokonov, ki so jih proizvedli starši. Sposobnost razmnoževanja živali, izpostavljenih preskusni kemikaliji, se za določitev (i) koncentracije brez opaznega učinka (NOEC) in/ali (ii) ECx (npr. EC10, EC50) z regresijskim modelom, s katerim se oceni koncentracijo, ki bi povzročila x-odstotno zmanjšanje sposobnosti razmnoževanja, primerja s sposobnostjo razmnoževanja pri kontrolah. Preskusne koncentracije morajo oklepati vrednost ECx (npr. EC10, EC50), tako da vrednost ECx nato izvira iz interpolacije in ne iz ekstrapolacije.
|
PODATKI O PRESKUSNI KEMIKALIJI
|
5.
|
Po možnosti morajo biti znani topnost v vodi, vrednost log Kow, porazdelitveni koeficient tla/voda (npr. poglavje C.18 ali C.19 te priloge) in parni tlak preskusne kemikalije. Zaželene so dodatne informacije o usodi preskusne kemikalije v tleh, kot so hitrosti fotolize in hidrolize.
|
|
6.
|
To preskusno metodo je mogoče uporabiti za vodotopne in nevodotopne kemikalije. Vendar se bodo načini nanosa preskusne kemikalije ustrezno razlikovali. Preskusna metoda se ne sme uporabljati pri hlapnih kemikalijah, tj. kemikalijah, za katere je Henryjeva konstanta ali porazdelitveni koeficient zrak/voda večja od ena, ali pri kemikalijah, pri katerih parni tlak pri 25 °C presega 0,0133 Pa.
|
VELJAVNOST PRESKUSA
|
7.
|
Da preskus šteje kot veljaven, morajo kontrolni vzorci izpolnjevati naslednja merila:
|
—
|
smrtnost pri odraslih osebkih na koncu preskusa za določanje območja delovanja in po prvih treh tednih po preskusu razmnoževanja ne sme presegati 20 %,
|
|
—
|
s predpostavko, da je bilo pri pripravi preskusa uporabljenih 10 odraslih osebkov na posodo, mora biti na koncu preskusa povprečno ustvarjenih vsaj 25 mladičev,
|
|
—
|
koeficient variacije okrog povprečnega števila mladičev ob koncu preskusa razmnoževanja ne sme presegati 50 %.
|
Če preskus ne uspe izpolniti zgoraj naštetih meril za veljavnost, mora biti prekinjen, razen če je mogoče podati utemeljitev za nadaljevanje preskusa. Utemeljitev mora biti vključena v poročilo o preskusu.
|
REFERENČNA KEMIKALIJA
|
8.
|
Referenčna kemikalija mora biti preskušana v rednih časovnih razmikih ali pa po možnosti vključena v vsak preskus, da se preveri, ali se odziv preskusnih organizmov v času ni pomembneje spremenil. Primerna referenčna kemikalija je karbendazim, za katerega je dokazano, da vpliva na preživetje in razmnoževanje enhitrejev (13)(14), mogoče pa je uporabiti tudi druge kemikalije, katerih podatki o strupenosti so dobro znani. V krožnem preskusu je bila uporabljena formulacija karbendazima, znana pod trgovskim imenom Derosal™, ki jo dobavlja družba AgrEvo Company (iz Frankfurta v Nemčiji) in ki vsebuje 360 g/l (32,18 %) aktivne sestavine (2). Vrednost EC50 za razmnoževanje, določena v krožnem preskusu, je bila v območju 1,2 ± 0,8 mg aktivne sestavine (a.s.)/kg suhe mase (2). Če je v preskusno serijo vključen pozitivni toksikološki standard, se uporablja ena koncentracija, število ponovitev pa mora biti enako kot v kontrolah. Za karbendazim se priporoča preskušanje 1,2 mg a.s./kg suhe teže (preskušane v obliki tekoče formulacije).
|
OPIS PRESKUSA
Oprema
|
9.
|
Preskusne posode morajo biti izdelane iz stekla ali drugega kemijsko inertnega materiala. Primerni so stekleni kozarci (s prostornino npr. od 0,20 do 0,25 litra; premer: ≈ 6 cm). Posode morajo imeti prozorne pokrove (npr. iz stekla ali polietilena), ki so zasnovani tako, da čim bolj zmanjšajo izhlapevanje vode, pri tem pa omogočajo izmenjavo plinov med tlemi in ozračjem. Pokrovi morajo biti prozorni, da je omogočen prenos svetlobe.
|
|
10.
|
Zahtevana je običajna laboratorijska oprema, zlasti naslednje:
|
—
|
merilnik vrednosti pH in fotometer,
|
|
—
|
ustrezne natančne tehtnice,
|
|
—
|
ustrezna oprema za uravnavanje temperature,
|
|
—
|
ustrezna oprema za uravnavanje vlažnosti (ni nujna, če imajo posode za izpostavljanje pokrove),
|
|
—
|
inkubator ali majhna soba s klimatsko napravo,
|
|
—
|
pincete, kljuke ali zanke,
|
|
—
|
kad za razvijanje fotografij.
|
|
Priprava umetnih tal
|
11.
|
V tem preskusu se uporabljajo umetna tla (5)(7) z naslednjo sestavo (na podlagi suhih tež, posušenih na konstantno težo pri 105 °C):
|
—
|
10 % na zraku posušenega in fino mletega šotnega mahu (sprejemljiva je velikost delcev 2 ± 1 mm); pred uporabo tal, pripravljenih s svežo šaržo šote, v preskusu je priporočljivo preveriti, ali so tla primerna za gojenje črvov,
|
|
—
|
20 % kaolinske gline (po možnosti naj bo vsebnost kaolinita nad 30 %),
|
|
—
|
približno od 0,3 do 1,0 % kalcijevega karbonata (CaCO3, zdrobljenega v prah, analitsko čistega) za doseganje vrednosti pH, ki znaša 6,0 ± 0,5; količina kalcijevega karbonata, ki bo dodana, je lahko odvisna zlasti od kakovosti/značilnosti šote,
|
|
—
|
približno 70 % na zraku posušenega kremenovega peska (odvisno od potrebne količine CaCO3), v glavnem finega peska z več kot 50 % delcev, ki merijo med 50 in 200 mikroni.
|
Pred uporabo tal v dokončnem preskusu je priporočljivo dokazati primernost umetnih tal za gojenje črvov in izpolnjevanje meril za veljavnost preskusa. Tako preverjanje je posebej priporočljivo za to, da se prepreči ogroženost preskusa, če se vsebnost organskega ogljika v umetnih tleh zniža, npr. z znižanjem vsebnosti mahu na vrednost 4–5 % in ustreznim zvišanjem vsebnosti peska. S takim znižanjem vsebnosti organskega ogljika se lahko zmanjšajo možnosti adsorpcije preskusne kemikalije na tla (organski ogljik), razpoložljivost preskusne kemikalije za črve pa se lahko poveča. Dokazano je, da lahko Enchytraeus albidus izpolnjuje merila za veljavnost v zvezi z razmnoževanjem, če se preskus izvaja z naravnimi tlemi z manjšo vsebnostjo organskega ogljika, npr. 2,7 % (15), (omejene) izkušnje pa kažejo, da je to mogoče doseči tudi pri umetnih tleh s 5 % šote.
Opomba: pri uporabi naravnih tal za dodatno preskušanje (na višjih stopnjah) je treba dokazati tudi primernost tal in izpolnjevanje meril za veljavnost preskusa.
|
|
12.
|
Suhe sestavine tal se temeljito premešajo (npr. v velikem laboratorijskem mešalniku). To je treba storiti vsaj en teden pred začetkom preskusa. Zmešana tla je treba hraniti dva dneva, da se kislost uravnoteži/stabilizira. Za določanje vrednosti pH zmesi tal in 1 M kalijevega klorida (KCl) ali 0,01 M kalcijevega klorida (CaCl2) se uporablja raztopina v razmerju 1: 5 (glej (16) in Dodatek 3). Če so tla bolj kisla, kot je določeno z zahtevanim območjem (glej odstavek 11), jih je mogoče prilagoditi z dodajanjem ustrezne količine CaCO3. Če so tla preveč alkalna, jih je mogoče prilagoditi z dodajanjem večje količine zmesi, navedene v odstavku 11, vendar brez CaCO3.
|
|
13.
|
Največja zmogljivost zadrževanja vode (water holding capacity – WHC) umetnih tal je določena v skladu s postopki, opisanimi v Dodatku 2. Dan ali dva pred začetkom preskusa se suha umetna tla predhodno navlažijo z dodajanjem zadostne količine deionizirane vode, da je pridobljena približno polovica končne vsebnosti vode, kar je od 40 do 60 % največje zmogljivosti zadrževanja vode. Na začetku preskusa so predhodno navlažena tla razdeljena na dele, ki ustrezajo številu preskusnih koncentracij (in referenčnih kemikalij, kadar je primerno) ter kontrol, uporabljenih za preskus. Vsebnost vlage se z dodajanjem raztopine preskusne kemikalije in/ali z dodajanjem destilirane ali deionizirane vode prilagodi na 40–60 % največje zmogljivosti zadrževanja vode (glej odstavke 19–21). Vsebnost vlage se določi na začetku in koncu preskusa (s sušenjem na konstantno težo pri 105 °C) in mora biti v optimalnem območju za preživetje črvov. Vsebnost vlage v tleh je mogoče preveriti z rahlim stiskanjem tal v roki; če je vsebnost vlage pravilna, se morajo med prsti pojaviti majhne kapljice vode.
|
Izbira in priprava preskusnih živali
|
14.
|
Priporočena preskusna vrsta je Enchytraeus albidus (Henle, 1837) (enhitrej), član družine Enchytraeidae (red Oligochaeta, deblo Annelida). E. albidus je ena od najobsežnejših vrst kolobarnikov iz družine Enchytraeidae, pri kateri so zabeleženi tudi osebki, dolgi do 35 mm (17)(18). Vrsta E. albidus je razširjena po vsem svetu in jo najdemo v morskih, sladkovodnih in kopenskih habitatih, v glavnem v razkrajajočih se organskih snoveh (algah, kompostu), redko pa na travnikih (9). Njena široka ekološka toleranca in nekatere morfološke variacije kažejo na to, da morda obstaja več podvrst.
|
|
15.
|
Vrsta E. albidus je na trgu na voljo kot hrana za ribe. Treba je preveriti, ali je kultura kontaminirana z drugimi, običajno manjšimi vrstami (1)(19). V primeru kontaminacije je treba vse črve oprati z vodo v petrijevki. Nato se (s stereomikroskopom) izberejo veliki odrasli osebki E. albidus za pripravo nove kulture in izločitev vseh drugih črvov. Vrsto E. albidus je mogoče enostavno gojiti v mnogih organskih snoveh (glej Dodatek 4). Življenjski cikel vrste E. albidus je kratek, ker zrelost doseže v obdobju med 33 dnevi (pri 18 °C) in 74 dnevi (pri 12 °C) (1). Za preskus se uporabijo le kulture, ki so bile brez težav 5 tednov (v času ene generacije) gojene v laboratoriju.
|
|
16.
|
Primerne so tudi druge vrste rodu Enchytraeus, npr. E. buchholzi (Vejdovsky, 1879) ali E. crypticus (Westheide in Graefe, 1992) (glej Dodatek 5). Če se uporabijo druge vrste rodu Enchytraeus, jih je treba jasno identificirati in poročati o razlogih za izbiro.
|
|
17.
|
Živali, uporabljene v preskusih, so odrasli črvi. Na področju kliteluma morajo imeti jajčeca (bele pike) in biti morajo približno enake velikosti (dolgi približno 1 cm). Sinhronizacija gojitvene kulture ni potrebna.
|
|
18.
|
Če se enhitreji ne gojijo v isti vrsti tal in v pogojih (vključno s hranjenjem), uporabljenih za končni preskus, jih je treba aklimatizirati vsaj 24 ur in do tri dni. Na začetku je treba aklimatizirati število odraslih osebkov, ki je večje od števila, potrebnega za izvedbo preskusa, da je omogočena možnost zavrnitve poškodovanih ali kako drugače neprimernih osebkov. Ob koncu obdobja aklimatizacije se za preskus izberejo samo črvi, ki imajo jajčeca in se ne vedejo nenormalno (npr. ne poskušajo uiti iz tal). Črvi se s pinceto, s kljukami ali z zankami skrbno izberejo in namestijo v petrijevko, v kateri je malo sladke vode. V ta namen je primernejša rekonstituirana sladka voda, kot je predlagano v poglavju C.20 te priloge (Preskus razmnoževanja vrste Daphnia magna), saj deionizirana, demineralizirana ali vodovodna voda lahko črve poškoduje. Črvi se pregledajo pod stereomikroskopom in izločijo se vsi, ki nimajo jajčec. Pazljivo se odstranijo in izločijo vse pršice ali vsi skakači, ki so morda kontaminirali kulture. Zdravi črvi, ki se ne uporabijo za preskus, se vrnejo v založno kulturo.
|
Priprava preskusnih koncentracij
Preskusna kemikalija, topna v vodi
|
19.
|
Raztopina preskusne kemikalije se pripravi v deionizirani vodi v količini, ki zadošča za vse ponovitve ene preskusne koncentracije. Priporočljivo je uporabljati zadostno količino vode, da se doseže zahtevana vsebnost vlage, tj. od 40 do 60 % največje vrednosti WHC (glej odstavek 13). Pred vstavljanjem v preskusno posodo se vsaka raztopina preskusne kemikalije temeljito zmeša z eno šaržo predhodno navlaženih tal.
|
Preskusna kemikalija, ki ni topna v vodi
|
20.
|
Pri kemikalijah, ki niso topne v vodi, so pa topne v organskih topilih, se lahko preskusna kemikalija raztopi v najmanjši mogoči količini primernega vehikla (npr. acetona). Uporabijo se lahko le hlapna topila. Vehikel se razprši na majhno količino (npr. 2,5 g) finega kremenovega peska ali pa se z njo zmeša. Vehikel se odstrani tako, da vsaj eno uro izhlapeva v digestoriju. Ta zmes kremenovega peska in preskusne kemikalije se doda predhodno navlaženim tlom in po dodajanju ustrezne količine deionizirane vode temeljito zmeša, da se doseže zahtevana vlaga. Končna mešanica se namesti v preskusne posode.
|
|
21.
|
Pri kemikalijah, ki so slabo topne v vodi in organskih topilih, se ekvivalent 2,5 g fino mletega kremenovega peska na preskusno posodo zmeša z določeno količino preskusne kemikalije, da nastane želena preskusna koncentracija. Ta zmes kremenovega peska in preskusne kemikalije se doda predhodno navlaženim tlom in po dodajanju ustrezne količine deionizirane vode temeljito zmeša, da se doseže zahtevana vsebnost vlage. Končna mešanica se porazdeli v preskusne posode. Postopek se ponovi za vsako preskusno koncentracijo, pripravi pa se tudi ustrezna kontrola.
|
|
22.
|
Kemikalij se običajno ne sme preskušati pri koncentracijah, večjih od 1 000 mg/kg suhe mase tal. Vendar pa je v skladu s cilji določenega preskusa morda potrebno preskušanje pri višjih koncentracijah.
|
IZVEDBA PRESKUSOV
Preskusne in kontrolne skupine
|
23.
|
Za vsako preskusno koncentracijo se količina preskusnih tal, ki ustreza 20 g suhe teže, postavi v preskusno posodo (glej odstavke 19–21). Pripravijo se tudi kontrolni vzorci brez preskusne kemikalije. Vsaki posodi se v skladu s postopki, opisanimi v odstavku 29, doda hrana. V vsako preskusno posodo se naključno razporedi po deset črvov. Črvi se previdno prenesejo v vsako preskusno posodo in na primer s pinceto, kljukami ali zankami namestijo na površino tal. Število ponovitev za preskusne koncentracije in za kontrolne vzorce je odvisno od uporabljenega načrta preskusa (glej odstavek 34). Preskusne posode se naključno namestijo v preskusni inkubator, njihovi položaji pa se naključno menjajo vsak teden.
|
|
24.
|
Če se za nanos preskusne kemikalije uporablja vehikel, je treba poleg preskusne serije izvesti še eno kontrolno serijo, ki vsebuje kremenov pesek, na katerega se razprši ali z njim zmeša topilo. Koncentracija topila ali disperzijskega sredstva mora biti enaka tisti v preskusnih posodah s preskusno kemikalijo. Za kemikalije, ki jih je treba dodajanje v skladu s postopki, opisanimi v odstavku 21, se mora izvesti kontrolna serija, ki vsebuje dodaten kremenov pesek (2,5 g na posodo).
|
Preskusni pogoji
|
25.
|
Preskusna temperatura je 20 ± 2 °C. Za preprečevanje uhajanja črvov iz tal se preskus izvaja v nadzorovanih ciklih svetlobe in teme (po možnosti 16 ur svetlobe in 8 ur teme) pri osvetljenosti od 400 do 800 luksov na območju preskusnih posod.
|
|
26.
|
Za preverjanje vlažnosti tal se posode na začetku preskusa in nato enkrat tedensko stehtajo. Izguba mase se nadomesti z dodajanjem ustrezne količine deionizirane vode. Treba je opozoriti, da je mogoče izgubo vode zmanjšati z vzdrževanjem visoke relativne vlažnosti zraka (> 80 %) v preskusnem inkubatorju.
|
|
27.
|
Vsebnost vlage in vrednost pH je treba meriti ob začetku in koncu preskusa za določanje območja delovanja in dokončnega preskusa. Meritve je treba opraviti v kontrolnih in tretiranih (z vsemi koncentracijami) vzorcih tal, ki so pripravljeni in vzdrževani na enak način kot preskusne kulture, ne vsebujejo pa črvov. Tem vzorcem tal je treba hrano dodati le v začetku preskusa, da se spodbudi mikrobna dejavnost. Količina dodane hrane mora biti enaka količini hrane, dodani preskusnim kulturam. Tem posodam med preskusom ni treba dodajati dodatne hrane.
|
Hranjenje
|
28.
|
Uporablja se hrana, ki lahko vzdržuje populacijo enhitrejev. Kot primerna hrana so se izkazali ovseni kosmiči, po možnosti avtoklavirani pred uporabo, da se prepreči kontaminacija z mikrobi (primerno je tudi gretje).
|
|
29.
|
Najprej se hrana ponudi tako, da se 50 mg grobo mletih ovsenih kosmičev zmeša s tlemi v vsaki posodi, še preden se vanjo namestijo črvi. Nato pa se hrana dobavlja tedensko, vse do 21. dneva. Hranjenje se 28. dne ne izvede, saj so odrasli osebki na tej stopnji odstranjeni, mladi črvi pa po tem potrebujejo relativno malo dodatne hrane. Hranjenje med preskusom obsega 25 mg grobo mletih ovsenih kosmičev na posodo, ki se previdno namestijo na površino tal, da ne poškodujejo črvov. Za zmanjšanje rasti gliv je treba kosmiče ovsa prekriti z majhno količino tal in jih tako zakopati v tla. Če hrana ostane nepoužita, je treba obrok zmanjšati.
|
Načrt za preskus za določanje območja delovanja
|
30.
|
Po potrebi se preskus za določanje območja delovanja izvede na primer s petimi koncentracijami preskusnih kemikalij, ki znašajo 0,1, 1,0, 10, 100 in 1 000 mg/kg (suhe teže tal). Zadošča ena ponovitev za vsak tretirani in kontrolni vzorec.
|
|
31.
|
Preskus za določanje območja delovanja traja dva tedna. Na koncu preskusa se oceni smrtnost črvov. Črv se zabeleži kot mrtev, če se na sprednjem koncu ne odziva na mehanske dražljaje. Pri odločanju o območju koncentracij za uporabo v dokončnem preskusu so poleg informacij o smrtnosti lahko koristne tudi dodatne informacije. Zato je treba zabeležiti tudi spremembe vedenja odraslih osebkov (npr. nezmožnost kopanja v tla, negibno ležanje ob stekleni steni preskusne posode) in morfologijo (npr. prisotnost odprtih ran) ter morebitno prisotnost mladičev. Slednjo je mogoče določiti z metodo barvanja, opisano v Dodatku 6.
|
|
32.
|
Vrednost LC50 je mogoče približno določiti z izračunom geometrijske sredine podatkov o smrtnosti. Pri določanju razpona koncentracij za dokončni preskus se predpostavlja, da so učinki na razmnoževanje nižji od vrednosti LC50 za faktor, ki znaša do 10. Vendar je to razmerje empirično in je v vsakem posameznem primeru lahko drugačno. Dodatna opažanja iz preskusa za določanje območja delovanja, kot je pojav mladičev, lahko pripomorejo k natančnejši določitvi razpona koncentracij preskusne kemikalije, ki bo uporabljen v dokončnem preskusu.
|
|
33.
|
Za natančno določitev vrednosti LC50 je priporočljivo izvajanje preskusa z vsaj štirimi ponovitvami vsake od koncentracij preskusne kemikalije in število koncentracij, ki je zadostno, da pri teh koncentracijah povzroči vsaj štiri različne statistično značilne povprečne odzive. Podobno število koncentracij in ponovitev za kontrole se uporablja, kadar je to primerno.
|
Načrt dokončnega preskusa razmnoževanja
|
34.
|
Na podlagi priporočil, ki izhajajo iz krožnega preskusa, se predlagajo trije načrti (2).
|
—
|
Za določanje vrednosti NOEC je treba preskusiti vsaj pet koncentracij v geometrijski vrsti. Priporočene so štiri ponovitve za vsako preskusno koncentracijo in osem kontrol. Med koncentracijami mora biti razmik, katerega faktor ne sme presegati vrednosti 1,8.
|
|
—
|
Za določitev vrednosti ECx (npr. EC10, EC50) je treba preskusiti vsaj pet koncentracij, da se lahko ECx določi z interpolacijo in ne z ekstrapolacijo pa morajo koncentracije oklepati vrednost ECx. Priporočene so vsaj štiri ponovitve za vsako preskusno koncentracijo in štiri kontrolne ponovitve. Faktor razmika se lahko spreminja, tj. je v pričakovanem območju učinkov lahko manjši ali enak 1,8, pri višjih in nižjih koncentracijah pa je lahko nad 1,8.
|
|
—
|
Kombiniran pristop omogoča določitev vrednosti NOEC in ECx. Treba je uporabiti osem koncentracij za tretiranje v geometrijski vrsti. Priporočene so štiri ponovitve za vsako tretiranje in osem kontrol. Med koncentracijami mora biti razmik, katerega faktor ne sme presegati vrednosti 1,8.
|
|
|
35.
|
Treba je uporabiti deset odraslih črvov na preskusno posodo (glej odstavek 23). V preskusno posodo se hrana doda na začetku preskusa in nato enkrat tedensko (glej odstavek 29) do vključno 21. dneva. Na 21. dan se vzorci tal previdno ročno pregledajo; poiščejo in preštejejo se živi odrasli črvi ter zabeležijo spremembe vedenja (npr. nezmožnost kopanja v tla, negibno ležanje ob stekleni steni preskusne posode) in morfologije (npr. odprte rane). Nato se vsi odrasli črvi odstranijo iz preskusnih posod in preskusnih tal. Preskusna tla, ki vsebujejo morebitne ustvarjene kokone, se inkubirajo dodatne tri tedne pri enakih preskusnih pogojih, razen hranjenja, ki poteka le 35. dan (tj. 25 mg grobo mletih ovsenih kosmičev na posodo).
|
|
36.
|
Po šestih tednih se preštejejo črvi, ki so se na novo izlegli. Priporočljiva je metoda, ki temelji na barvanju z barvilom bengal rdeče (glej Dodatek 6), čeprav so se kot primerne izkazale tudi druge tehnike ekstrakcije z vlago (ne pa tudi s toploto) in flotacije (glej Dodatek 6) (4)(10)(11)(20). Barvanje z barvilom bengal rdeče je priporočljivo, ker ekstrakcijo iz substrata tal z vlago lahko ovira motnost zaradi delcev suspendirane gline.
|
Mejni preskus
|
37.
|
Če pri največji koncentraciji v preskusu za določanje območja delovanja (tj. 1 000 mg/kg) ni opaženih učinkov, je mogoče preskus razmnoževanja s koncentracijo 1 000 mg/kg izvesti kot mejni preskus, da se dokaže, da je vrednost NOEC za razmnoževanje večja od te vrednosti.
|
Povzetek in časovni razpored preskusa
|
38.
|
Faze preskusa je mogoče povzeti na naslednji način:
|
Čas
|
Preskus za določanje območja delovanja
|
Dokončni preskus
|
|
dan – 7 ali prej
|
|
—
|
priprava umetnih tal (mešanje suhih sestavin)
|
|
|
—
|
priprava umetnih tal (mešanje suhih sestavin)
|
|
|
dan – 5
|
|
—
|
preverjanje vrednosti pH umetnih tal
|
|
—
|
merjenje največje vrednosti WHC tal
|
|
|
—
|
preverjanje vrednosti pH umetnih tal
|
|
—
|
merjenje največje vrednosti WHC tal
|
|
|
od dne – 5 do dne – 3
|
|
—
|
razvrščanje črvov za aklimatizacijo
|
|
|
—
|
razvrščanje črvov za aklimatizacijo
|
|
|
od dne – 3 do dne 0
|
|
—
|
aklimatizacija črvov vsaj 24 ur
|
|
|
—
|
aklimatizacija črvov vsaj 24 ur
|
|
|
dan – 1
|
|
—
|
predhodna navlažitev umetnih tal in razdelitev v šarže
|
|
|
—
|
predhodna navlažitev umetnih tal in razdelitev v šarže
|
|
|
dan 0
|
|
—
|
priprava založnih raztopin
|
|
—
|
nanos preskusne kemikalije
|
|
—
|
odtehtanje preskusnega substrata v preskusne posode
|
|
—
|
merjenje vrednosti pH in vsebnosti vlage v tleh
|
|
|
—
|
priprava založnih raztopin
|
|
—
|
nanos preskusne kemikalije
|
|
—
|
odtehtanje preskusnega substrata v preskusne posode
|
|
—
|
merjenje vrednosti pH in vsebnosti vlage v tleh
|
|
|
dan 7
|
|
—
|
preverjanje vsebnosti vlage v tleh
|
|
|
—
|
preverjanje vsebnosti vlage v tleh
|
|
|
dan 14
|
|
—
|
določitev smrtnosti odraslih osebkov
|
|
—
|
merjenje vrednosti pH in vsebnosti vlage v tleh
|
|
|
—
|
preverjanje vsebnosti vlage v tleh
|
|
|
dan 21
|
|
|
—
|
opazovanje vedenja odraslih osebkov
|
|
—
|
odstranjevanje odraslih osebkov
|
|
—
|
določitev smrtnosti odraslih osebkov
|
|
—
|
preverjanje vsebnosti vlage v tleh
|
|
|
dan 28
|
|
|
—
|
preverjanje vsebnosti vlage v tleh
|
|
|
dan 35
|
|
|
—
|
preverjanje vsebnosti vlage v tleh
|
|
|
dan 42
|
|
|
—
|
merjenje vrednosti pH in vsebnosti vlage v tleh
|
|
|
PODATKI IN POROČANJE
Obdelava rezultatov
|
39.
|
Čeprav je v Dodatku 7 podan pregled, v tej preskusni metodi ni podana nobena dokončna statistična smernica za analizo rezultatov preskusa.
|
|
40.
|
V preskusu za določanje območja delovanja je glavna končna točka smrtnost. Vendar je treba zabeležiti tudi spremembe vedenja odraslih osebkov (npr. nezmožnost kopanja v tla, negibno ležanje ob stekleni steni preskusne posode) in morfologije (npr. odprte rane) ter morebitno prisotnost mladičev. Za določanje vrednosti LC50 se običajno uporabi analiza probit (21) ali regresija logit. Vendar pa je mogoče v primerih, pri katerih ta analitska metoda ni primerna (npr. če so na voljo manj kot tri koncentracije z delnimi usmrtitvami), uporabiti alternativne metode. Te metode lahko vključujejo drseča povprečja (22), prilagojeno metodo Spearman-Karber (23) ali enostavno interpolacijo (npr. geometrijsko sredino vrednosti LC0 in LC100, izračunano s kvadratnim korenom zmnožka vrednosti LC0 in LC100).
|
|
41.
|
V dokončnem preskusu je končna točka plodnost (tj. število ustvarjenih mladičev). Vendar je treba v končno poročilo, tako kot pri preskusu za določanje območja delovanja, zabeležiti vse druge znake škodljivega delovanja. Za statistično analizo morata biti izračunana aritmetična sredina in standardni odklon za razmnoževanje pri posamezni tretirani skupini in kontroli.
|
|
42.
|
Če je izvedena analiza variance, je mogoče standardni odklon, s, in stopinje prostosti, df, nadomestiti z oceno skupne variance, pridobljene z analizo variance (ANOVA) oziroma z njenimi stopinjami prostosti, če varianca ni odvisna od koncentracije. V tem primeru uporabite enosmerne analize variance kontrol in tretiranih skupin. Te vrednosti se navadno izračunajo s komercialno programsko opremo za statistiko, pri čemer so rezultati glede na posodo uporabljeni kot ponovitve. Če se zdi, da je združevanje podatkov za negativne kontrole in kontrole s topilom bolj smiselno od preskušanja glede na enega od njih, jih je treba preskusiti, da se preveri, da med njimi ni značilnih razlik (za ustrezne preskuse glej odstavek 45 in Dodatek 7).
|
|
43.
|
Nadaljnje statistično preskušanje in sklepanje je odvisno od tega, ali so vrednosti ponovitev normalno porazdeljene in homogene glede na svojo varianco.
|
Ocena vrednosti NOEC
|
44.
|
Prednost mora imeti uporaba učinkovitih preskusov. Uporabiti je treba informacije npr. iz predhodnih izkušenj s krožnim preskušanjem ali druge podatke iz preteklih študij o tem, ali so podatki približno normalno porazdeljeni. Homogenost variance (homoskedastičnost) je bolj kritična. Izkušnje kažejo, da varianca pogosto narašča z naraščajočo srednjo vrednostjo. V teh primerih transformacija podatkov lahko privede do homoskedastičnosti. Vendar mora taka transformacija temeljiti na izkušnjah s podatki iz preteklih študij in ne na podatkih, ki se proučujejo. Pri homogenih podatkih je treba izvesti več t-preskusov, kot je Williamsov preskus (α = 0,05, enostranski) (24)(25) ali, v nekaterih primerih, Dunnettov preskus (26)(27). Velja pripomniti, da je treba v primeru neenake ponovitve popraviti vrednosti t iz preglednice tako, kot sta predlagala Dunnett in Williams. Včasih se odzivi zaradi velike variacije ne povečajo/zmanjšajo pravilno. V tem primeru velikega odklona od monotonosti je bolj primeren Dunnettov preskus. Če obstajajo odkloni od homoskedastičnosti, je morda smiselno natančneje proučiti možne učinke na variance, da se ugotovi, ali je mogoče uporabiti t-preskuse brez prevelike izgube učinkovitosti (28). Druga možnost je uporaba večkratnega U-preskusa, npr. Bonferronijevega U-preskusa po Holmu (29), ali – če ti podatki kažejo heteroskedastičnost, sicer pa so skladni z osnovnim monotonim razmerjem odmerek-odziv – drugega neparametričnega preskusa (npr. preskusa po Jonckheere-Terpstraju (30)(31) ali Shirleyjevega preskusa (32)(33)); uporaba takšnega preskusa ima v splošnem prednost pred t-preskusi za neenake variance. (Glej tudi shemo v Dodatku 7.)
|
|
45.
|
Če je izveden mejni preskus in so izpolnjeni predpogoji za postopke parametričnih preskusov (normalnost, homogenost), je mogoče uporabiti parni Studentov t-preskus ali, namesto tega, postopek Mann-Whitneyjevega U-preskusa (29).
|
Ocena vrednosti ECx
|
46.
|
Za izračun katere koli vrednosti ECx se po pridobitvi ustrezne funkcije odmerek-odziv za regresijsko analizo (linearno ali nelinearno) uporabijo srednje vrednosti glede na tretirano skupino. Za rast črvov v obliki zveznega odziva je mogoče vrednosti ECx oceniti z ustrezno regresijsko analizo (35). Med primernimi funkcijami za kvantne podatke (smrtnost/preživetje in število ustvarjenih potomcev) so normalna sigmoidna funkcija in logistične ali Weibullove funkcije, ki vsebujejo od dva do štiri parametre, pri čemer nekatere lahko modelirajo tudi odzive v obliki hormeze. Če je bila funkcija odmerek-odziv prilagojena z linearno regresijsko analizo, je treba v regresijski analizi pred ocenjevanjem vrednosti ECx najti značilni r2 (determinacijski koeficient) in/ali naklon, tako da se v enačbo, podano z regresijsko analizo, vstavi vrednost, ki ustreza x % srednje vrednosti kontrole. V skladu s Fiellerjem (navedeno v Finney (21)) ali z drugimi ustreznimi sodobnimi metodami se izračunajo 95-odstotne meje zaupanja.
|
|
47.
|
Namesto tega se odziv lahko modelira kot odstotek ali razmerje parametra modela, ki se razlaga kot srednja vrednost odziva kontrole. V teh primerih je mogoče običajno (logistično, Weibullovo) sigmoidno krivuljo pogosto enostavno prilagoditi rezultatom s postopkom regresije probit (21). V teh primerih je treba utežno funkcijo prilagoditi za odzive metrik, kot je podano v Christensen (36). Če pa je ugotovljena hormeza, mora analizo probit nadomestiti logistična ali Weibullova funkcija s štirimi parametri, prilagojena s postopkom nelinearne regresije (36). Če podatkom ni mogoče prilagoditi primerne funkcije odmerek-odziv, je mogoče za oceno vrednosti ECx in njenih meja zaupanja uporabiti alternativne metode, kot so drseča povprečja po Thompsonu (22) in postopek prilagojene metode Spearman-Karber (23).
|
POROČILO O PRESKUSU
|
48.
|
Poročilo o preskusu mora vsebovati naslednje informacije:
|
|
Preskusna kemikalija:
|
—
|
fizikalno stanje in, kjer je ustrezno, fizikalno-kemijske lastnosti (npr. topnost v vodi, parni tlak),
|
|
—
|
kemijski identifikacijski podatki preskusne kemikalije po nomenklaturi IUPAC, številka CAS, serija, skupina, strukturna formula in čistost,
|
|
—
|
datum izteka roka uporabnosti vzorca.
|
|
|
|
Preskusne vrste:
|
—
|
uporabljene preskusne vrste: vrsta, znanstveno ime, vir organizmov in pogoji gojenja.
|
|
|
|
Preskusni pogoji:
|
—
|
sestavine in priprava umetnih tal,
|
|
—
|
metoda uporabe preskusne kemikalije,
|
|
—
|
opis preskusnih pogojev, vključno s temperaturo, vsebnostjo vlage, vrednostjo pH itd.,
|
|
—
|
celoten opis načrta in postopkov poskusa.
|
|
|
|
Rezultati preskusa:
|
—
|
smrtnost pri odraslih črvih po dveh tednih in število mladičev na koncu preskusa za določanje območja delovanja,
|
|
—
|
smrtnost pri odraslih črvih po treh tednih izpostavljenosti in celoten seznam mladičev na koncu dokončnega preskusa,
|
|
—
|
morebitni opaženi fizični ali patološki simptomi in spremembe vedenja pri preskusnih organizmih,
|
|
—
|
vrednosti LC50, NOEC in/ali ECx (npr. EC50, EC10) za razmnoževanje, če je mogoče nekatere od njih uporabiti znotraj intervalov zaupanja, krivulja prilagojenega modela, uporabljena za njegov izračun, ter vse informacije in opažanja, ki pripomorejo k razlagi rezultatov.
|
|
Odstopanja od postopkov, opisanih v tej preskusni metodi, in morebitni nenavadni dogodki med preskusom.
|
LITERATURA
|
(1)
|
Römbke, J. (1989). Entwicklung eines Reproduktionstests an Bodenorganismen – Enchytraeen. Abschlußbericht des Battelle-Instituts e.V. Frankfurt für das Umweltbundesamt (Berlin), FE-Vorhaben 106 03 051/01.
|
|
(2)
|
Römbke, J., in Moser, T. (1999). Organisation and Performance of an International Ringtest for the Validation of the Enchytraeid Reproduction Test. UBA-Texte 4/99, 150 + 223 str.
|
|
(3)
|
Westheide, W., in Bethge-Beilfuss, D. (1991). The sublethal enchytraeid test system: guidelines and some results, V: Modern Ecology: Basic and Applied Aspects. Uredila Esser, G., in Overdieck, D., str. 497–508. Elsevier, Amsterdam.
|
|
(4)
|
Dirven-Van Breemen, E., Baerselmann, R., in Notenboom, J. (1994). Onderzoek naar de Geschiktheid van de Potwormsoorten Enchytraeus albidus en Enchytraeus crypticus (Oligochaeta, Annelida) in Bodemecotoxicologisch Onderzoek. RIVM Rapport, št. 719102025. 46 str.
|
|
(5)
|
Poglavje C.8 te priloge, Strupenost za deževnike.
|
|
(6)
|
ISO (Mednarodna organizacija za standardizacijo) (1993). Soil Quality – Effects of pollutants on earthworms (Eisenia fetida). Part 1: Determination of acute toxicity using Artificial Soil substrate, št. 11268-1. ISO, Ženeva.
|
|
(7)
|
ISO (Mednarodna organizacija za standardizacijo) (1996). Soil Quality – Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction, No. 11268-2. ISO, Ženeva.
|
|
(8)
|
Rundgren, S., in A. K. Augustsson (1998). Test on the enchytraeid Cognettia sphagnetorum (Vejdovsky 1877). V: Løkke, H. in C. A. M. Van Gestel, Handbook of soil invertebrate toxicity tests. John Wiley and Sons, Chichester, 73–94.
|
|
(9)
|
Kasprzak, K. (1982). Review of enchytraeid community structure and function in agricultural ecosystems. Pedobiologia 23, 217–232.
|
|
(10)
|
Römbke, J. (1995). Enchytraeen (Oligochaeta) als Bioindikator, UWSF – Z. Umweltchem. Ökotox. 7, 246–249.
|
|
(11)
|
Dunger, W., in Fiedler, H. J. (1997). Methoden der Bodenbiologie. G. Fischer Verlag, Stuttgart, New York.
|
|
(12)
|
Didden, W. A. M. (1993). Ecology of terrestrial Enchytraeidae. Pedobiologia 37, 2–29.
|
|
(13)
|
Becker, H. (1991). Bodenorganismen – Prüfungskategorien der Forschung. UWSF – Z. Umweltchem. Ökotox. 3, 19–24.
|
|
(14)
|
Römbke, J., in Federschmidt, A. (1995). Effects of the fungicide Carbendazim on Enchytraeidae in laboratory and field tests, Newsletter on Enchytraeidae 4, 79–96.
|
|
(15)
|
Römbke, J., Riepert, F., in Achazi, R. (2000). Enchytraeen als Testorganismen. V: Toxikologische Beurteilung von Böden. Heiden S., Erb R., Dott W., in Eisentraeger A. (ur.). Spektrum Verl., Heidelberg. 59–81.
|
|
(16)
|
ISO (Mednarodna organizacija za standardizacijo) (1994). Kakovost tal – Določevanje pH, št. 10390. ISO, Ženeva.
|
|
(17)
|
Bell, A. W. (1958). The anatomy of Enchytraeus albidus, with a key to the species of the genus Enchytraeus. Ann. Mus. Novitat. 1902, 1– 13.
|
|
(18)
|
Nielsen, C. O., in Christensen, B. (1959). The Enchytraeidae, critical revision and taxonomy of European species. Natura Jutlandica 8-9, 1– 160.
|
|
(19)
|
Bouguenec, V., in Giani, N. (1987). Deux nouvelles especes d'Enchytraeus (Oligochaeta, Enchytraeidae) et rediscription d'E. bigeminus. Remarques sur le genre Enchytraeus. Ann. Limnol. 23, 9–22.
|
|
(20)
|
Korinkova, J., in Sigmund, J. (1968). The colouring of bottom-fauna samples before sorting, Vestnik Ceskoslovensko Spolecnosti Zoologicke 32, 300–305.
|
|
(21)
|
Finney, D. J. (1971). Probit Analysis (3. izdaja), str. 19–76. Cambridge Univ. Press.
|
|
(22)
|
Finney, D. J. (1978). Statistical Method in Biological Assay. -Charles Griffin & Company Ltd, London.
|
|
(23)
|
Hamilton, M. A., Russo, R. C., in Thurston, R.V. (1977). Trimmed Spearman-Karber Method for estimating median lethal concentrations in toxicity bioassays. Environ. Sci. Technol. 11(7), 714–719; Correction Environ. Sci. Technol. 12(1998), 417.
|
|
(24)
|
Williams, D. A. (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27, 103-117.
|
|
(25)
|
Williams, D. A. (1972). The comparison of several dose levels with a zero dose control. Biometrics 28, 519-531.
|
|
(26)
|
Dunnett, C. W. (1955). A multiple comparison procedure for comparing several treatments with a control. Amer. Statist. Ass. J. 50, 1096-1121.
|
|
(27)
|
Dunnett, C. W. (1964). New tables for multiple comparisons with a control. Biometrics 20, 482-491.
|
|
(28)
|
Hoeven, N. van der (1998). Power analysis for the NOEC: What is the probability of detecting small toxic effects on three different species using the appropriate standardized test protocols? Ecotoxicology 7: 355–361.
|
|
(29)
|
Holm, S. (1979). A simple sequentially rejective multiple test procedure. Scand. J. Statist. 6, 65-70.
|
|
(30)
|
Jonckheere, A. R. (1954). A Distribution-free k-Sample Test Against Ordered Alternatives, Biometrika 41, 133– 145.
|
|
(31)
|
Terpstra, T. J. (1952). The Asymptotic Normality and Consistency of Kendall's Test Against Trend, When Ties are Present in One Ranking, Indagationes Math. 14, 327–333.
|
|
(32)
|
Shirley, E. A. (1979). The comparison of treatment to control group means in toxicology studies, Applied Statistics 28, 144– 151.
|
|
(33)
|
Williams, D. A. (1986). A Note on Shirley's Nonparametric Test for Comparing Several Dose Levels with a Zero-Dose Control, Biometrics 42, 183– 186.
|
|
(34)
|
Sokal, R. R., in F. J. Rohlf. (1981). Biometry. The Principle and practice of statistics in biological research. 2. izdaja. W. H. Freeman and Company. New York.
|
|
(35)
|
Christensen, E. R. (1984). Dose-response functions in aquatic toxicity testing and the Weibull model. Water Research 18, 213–221.
|
|
(36)
|
Van Ewijk, P. H., in Hoekstra, J. A. (1993). Calculation of the EC50 and its confidence interval when sub-toxic stimulus is present. Ecotox, Environ. Safety. 25, 25–32.
|
Dodatek 1
Opredelitve pojmov
Za to preskusno metodo se uporabljajo naslednje opredelitve:
|
|
Kemikalija pomeni snov ali zmes.
|
|
|
ECx
(učinkovita koncentracija za x-odstotni učinek) je koncentracija, ki na preskusnih organizmih v danem obdobju izpostavljenosti v primerjavi s kontrolno učinkuje x-odstotno. V tem preskusu so učinkovite koncentracije izražene kot masa preskusne kemikalije na suho maso preskusnih tal.
|
|
|
LC0
(koncentracija brez smrtnega učinka) je koncentracija preskusne kemikalije, ki v določenem časovnem obdobju ne ubije nobenega od izpostavljenih preskusnih organizmov. V tem preskusu je LC0 izražena kot masa preskusne kemikalije na suho maso preskusnih tal.
|
|
|
LC50
(srednja smrtna koncentracija) je koncentracija preskusne kemikalije, ki v določenem časovnem obdobju ubije 50 % izpostavljenih preskusnih organizmov. V tem preskusu je LC50 izražena kot masa preskusne kemikalije na suho maso preskusnih tal.
|
|
|
LC100
(popolnoma smrtna koncentracija) je koncentracija preskusne kemikalije, ki v določenem časovnem obdobju ubije 100 % izpostavljenih preskusnih organizmov. V tem preskusu je LC100 izražena kot masa preskusne kemikalije na suho maso preskusnih tal.
|
|
|
LOEC (najnižja koncentracija z opaznim učinkom) je najnižja koncentracija preskusne kemikalije, ki ima statistično značilen učinek (p < 0,05). V tem preskusu je vrednost LOEC izražena kot masa preskusne kemikalije na suho maso preskusnih tal. Vse preskusne koncentracije nad vrednostjo LOEC morajo običajno kazati učinek, ki je statistično različen od kontrole. Vsa odstopanja od zgoraj navedenega pri ugotavljanju vrednosti LOEC morajo biti utemeljena v poročilu o preskusu.
|
|
|
NOEC (koncentracija brez opaznega učinka) je najvišja koncentracija preskusne kemikalije tik pod vrednostjo LOEC, pri kateri ni opaznega učinka. V tem preskusu koncentracija, ki ustreza vrednosti NOEC, v danem obdobju izpostavljenosti v primerjavi s kontrolo nima statistično značilnega učinka (p < 0,05).
|
|
|
Hitrost razmnoževanja je srednja vrednost števila mladih črvov, ki jih ustvari določeno število odraslih osebkov v preskusnem obdobju.
|
|
|
Preskusna kemikalija je katera koli snov ali zmes, preskušena s to preskusno metodo.
|
Dodatek 2
Določanje največje zmogljivosti zadrževanja vode
Določanje zmogljivosti zadrževanja vode umetnih tal
Ugotovljeno je bilo, da je primerna naslednja metoda. Opisana je v Prilogi C standarda ISO DIS 11268-2.
S primerno napravo (svedrastim vzorčevalnikom itd.) zberite določeno količino (npr. 5 g) substrata preskusnih tal. Pokrijte dno vzorčevalnika s koščkom filtrirnega papirja in ga po polnjenju z vodo postavite na stojalo v vodno kopel. Vzorčevalnik je treba postopoma potapljati, dokler nivo vode ni nad zgornjim delom tal. Nato ga je treba pustiti v vodi približno tri ure. Ker ni mogoče zadržati vse vode, ki jo absorbirajo talne kapilare, mora biti omogočeno, da se vzorec tal dve uri suši, tako da se vzorčevalnik postavi na ležišče iz zelo mokrega, fino mletega kremenovega peska, ki je nameščen v zaprti posodi (da se ne posuši). Nato je treba vzorec stehtati in pri 105 °C posušiti na konstantno maso. Zmogljivost zadrževanja vode (WHC) je nato mogoče izračunati po naslednjem postopku:

pri čemer je:
|
S
|
=
|
z vodo nasičeni substrat + masa vzorčevalnika + masa filtrirnega papirja,
|
|
T
|
=
|
tara (masa vzorčevalnika + masa filtrirnega papirja),
|
|
D
|
=
|
suha masa substrata.
|
VIR:
ISO (Mednarodna organizacija za standardizacijo) (1996). Soil Quality – Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction, št. 11268-2, ISO, Ženeva.
Dodatek 3
Določanje vrednosti ph tal
Naslednja metoda za določanje vrednosti pH vzorca tal temelji na opisu v ISO 10390 (Kakovost tal – Določevanje pH).
Določena količina tal se pri sobni temperaturi suši vsaj 12 ur. Nato se izdela suspenzija tal (ki vsebuje vsaj 5 gramov tal) v petkratni količini volumna tal z 1 M analitsko čistega kalijevega klorida (KCl) ali 0,01 M raztopine analitsko čistega kalcijevega klorida (CaCl2). Suspenzija se nato pet minut temeljito stresa. Po stresanju se suspenzija vsaj 2 uri in največ 24 ur pusti, da se usede. Vrednost pH tekoče faze se nato meri z merilnikom vrednosti pH, ki je pred vsako meritvijo umerjen z ustreznimi vrstami pufrskih raztopin (npr. pH 4,0 in 7,0).
VIR:
ISO (Mednarodna organizacija za standardizacijo) (1994). Kakovost tal – Določevanje pH, št. 10390. ISO, Ženeva.
Dodatek 4
Pogoji gojenja vrste enchytraeus
Enhitreje vrste Enchytraeus albidus (in drugih vrst Enchytraeus) je mogoče gojiti v velikih plastičnih posodah (npr. 30 × 60 × 10 cm), napolnjenih z zmesjo 1: 1 umetnih tal in naravne, nekontaminirane vrtne prsti. Kompostnemu materialu se je treba izogibati, saj lahko vsebuje strupene kemikalije, kot so težke kovine. Pred uporabo je treba iz tal odstraniti favno (npr. z globokim zamrzovanjem). Substrat, ki ga sestavljajo samo umetna tla, je tudi mogoče uporabiti, vendar je lahko hitrost razmnoževanja nižja od tiste pri substratu z mešanimi tlemi. Vrednost pH substrata, uporabljenega za gojenje, mora znašati 6,0 ± 0,5.
Kultura se hrani v temi pri temperaturi od 15 do 20 °C ± 2 °C. Izogibati se je treba temperaturam, višjim od 23 °C. Tla je treba ohranjati vlažna, ne pa mokra. Da je vsebnost vlage pravilna, kažejo majhne kapljice vode, ki se pojavijo med prsti ob rahlem stiskanju tal. Treba se je izogibati ustvarjanju anoksičnih pogojev, zato je treba poskrbeti, da pokrovi posod, v katerih so kulture, omogočajo zadostno izmenjavo plinov z ozračjem. Vsak teden je treba tla previdno prekopati, da se pospeši zračenje.
Črve je mogoče hraniti z ovsenimi kosmiči. Ovseni kosmiči morajo biti shranjeni v zatesnjenih posodah, pred uporabo pa jih je treba avtoklavirati ali segreti, da se prepreči kontaminacija s pršicami iz moke (npr. vrstami Glyzyphagus, Astigmata, Acarina) ali plenilskimi pršicami (npr. Hypoaspis (Cosmolaelaps) miles, Gamasida, Acarina). Po segrevanju je treba hrano zmleti, tako da jo je mogoče enostavno potresti po površini tal. Občasno se lahko ovsenim kosmičem dodajo vitamini, mleko in ribje olje. Druga primerna vira hrane sta pekovski kvas in ribja hrana ‚Tetramin‘.
Hranjenje poteka približno dvakrat tedensko. Ustrezno količino ovsenih kosmičev se potrese na površino tal ali ob prekopavanju tal za pospeševanje zračenja previdno vmeša v substrat. Absolutna količina ponujene hrane je odvisna od števila črvov v substratu. Če je bila vsa hrana použita v istem dnevu, kot je bila ponujena, je to lahko vodilo, da je treba količino hrane povečati. Obratno pa je treba, če hrana v času drugega hranjenja (en teden kasneje) še vedno ostaja na površini, količino zmanjšati. Hrano, kontaminirano z glivami, je treba odstraniti in zamenjati. Po treh mesecih je treba črve prenesti v sveže pripravljen substrat.
Pogoji gojenja veljajo za zadovoljive, če: (a) črvi ne skušajo zapustiti substrata tal, (b) se črvi skozi tla premikajo hitro, (c) imajo svetlečo zunanjo površino, na katero se ne lepijo delci, (d) so bolj ali manj bele barve, (e) so v kulturah črvi različnih starostnih obdobij, (f) se neprestano razmnožujejo.
Dodatek 5
Izvedba preskusa pri drugih vrstah enchytraeus
Izbira vrst
Razen vrste E. albidus je mogoče uporabiti tudi druge vrste, vendar je treba preskusni postopek in merila za veljavnost ustrezno prilagoditi. Ker je veliko vrst Enchytraeus lahko dostopnih in jih je mogoče zadovoljivo gojiti v laboratoriju, je najpomembnejše merilo za izbiro drugih vrst, ne vrste E. albidus, ekološka pomembnost in, dodatno, primerljiva občutljivost. Lahko obstajajo tudi uradni razlogi za spremembo vrste. V državah, v katerih se npr. vrsta E. albidus ne pojavlja in je ni mogoče uvoziti (npr. zaradi omejitev v zvezi s karanteno), je treba uporabiti drugo vrsto Enchytraeus.
Primeri ustreznih alternativnih vrst
|
—
|
Enchytraeus crypticus (Westheide in Graefe, 1992): v zadnjih letih se ta vrsta pogosto uporablja v ekotoksikoloških študijah, ker jo je preprosto gojiti in preskušati. Vendar je majhna, zato je ravnanje z njo težje v primerjavi z vrsto E. albidus (še posebej v fazah pred uporabo metode barvanja). Ni zagotovo dokazano, da vrsta E. crypticus obstaja na polju, opisana je bila le na podlagi kultur deževnikov. Zato njene ekološke potrebe niso znane.
|
|
—
|
Enchytraeus buchholzi (Vejdovsky, 1879): to ime verjetno zajema skupino vrst v bližnjem sorodstvu, ki jih je morfološko težko ločiti. Ni priporočena za uporabo pri preskušanju, dokler ni ugotovljeno, kateri vrsti pripadajo posamezni osebki, uporabljeni v preskusu. E. buchholzi je navadno mogoče najti na travnikih in prizadetih območjih, kot so obcestne površine.
|
|
—
|
Enchytraeus luxuriosus: ta vrsta je bila prvotno znana kot E.‚minutus‘, a je bila nedavno opisana (1). Prvič jo je odkril U. Graefe (iz Hamburga) na travniku blizu St. Peter-Ordinga (Schleswig-Holstein, Nemčija). E. luxuriosus je približno pol manjša od vrste E. albidus, a je večja od drugih tu opisanih vrst; ta vrsta bi lahko bila dobra alternativa vrsti E. albidus.
|
|
—
|
Enchytraeus bulbosus (Nielsen in Christensen, 1963): doslej so o tej vrsti poročali, da so jo našli v nemških in španskih mineralnih tleh, kjer je pogosta, vendar ne v velikem obsegu. V primerjavi z drugimi vrstami tega rodu jo je relativno enostavno določiti. O njenem vedenju v laboratorijskih preskusih ali njeni občutljivosti na kemikalije ni ničesar znanega. Vendar pa je bilo ugotovljeno, da jo je enostavno gojiti (E. Belotti, osebna komunikacija).
|
Pogoji gojenja
Vse zgoraj omenjene vrste Enchytraeus je mogoče gojiti v enakih substratih, kot se uporabljajo za vrsto E. albidus. Njihova manjša velikost pomeni, da so posode za gojenje lahko manjše in da je mogoče uporabiti enako hrano, vendar pa je treba prilagoditi velikost obroka. Življenjski cikel teh vrst je krajši od življenjskega cikla vrste E albidus, zato mora biti hranjenje pogostejše.
Preskusni pogoji
Preskusni pogoji so v splošnem enaki kot tisti za vrsto E. albidus, razen naslednjega:
|
—
|
velikost preskusne posode je lahko manjša (ni pa nujno),
|
|
—
|
trajanje preskusa razmnoževanja je lahko (ni pa nujno) krajše, tj. štiri namesto šest tednov, vendar trajanja preskusa za določanje območja delovanja ni dovoljeno spremeniti,
|
|
—
|
za štetje je zaradi majhnosti mladih črvov zelo priporočljiva metoda barvanja,
|
|
—
|
merilo za veljavnost, ki se nanaša na ‚število mladičev na preskusno posodo v kontrolnem vzorcu‘, je treba spremeniti v ‚50‘.
|
VIR
|
(1)
|
Schmelz, R. M., in Collado, R. (1999). Enchytraeus luxuriosus sp.nov., a new terrestrial oligochaete species (Enchytraeidae, Clitellata, Annelida). Carolinea 57, 93–100.
|
Dodatek 6
Podroben opis tehnik ekstrakcije
Barvanje z barvilom bengal rdeče
To metodo, ki je bila najprej razvita v ekologiji celinskih voda (1), je za štetje mladih enhitrejev v preskusu razmnoževanja enhitrejev naprej predlagal W. de Coen (z Univerze v Gentu, Belgija). Neodvisno od njega so prilagojeno različico (barvilo bengal rdeče, zmešano s formaldehidom namesto z etanolom) razvili na inštitutu RIVM v Bilthovnu (2)(3).
Ob koncu dokončnega preskusa (tj. po šestih tednih) se tla iz preskusnih posod prenesejo v plitko posodo. Za ta namen je uporabna posoda Bellaplast ali kad za razvijanje fotografij z rebrastim dnom; slednja zato, ker ‚rebra‘ omejujejo premikanje črvov v polju opazovanja. Mladiči se fiksirajo z etanolom (s približno 5 ml na ponovitev). Posode se napolnijo z vodo do višine od 1 do 2 cm. Doda se nekaj kapljic (od 200 do 300 μl) barvila bengal rdeče (1-odstotna raztopina v etanolu) (alternativa je 0,5-odstotno barvilo eozin), obe sestavini pa se previdno zmešata. Po 12 urah bi morali biti črvi obarvani rdečkasto in bi jih moralo biti enostavno prešteti, ker bodo ležali na površini substrata. Zmes substrata/alkohola je namesto tega mogoče pred štetjem črvov sprati tudi prek sita (velikost mreže: 0,250 mm). S tem postopkom se bo nekaj kaolinita, šote in peska izpralo, rdečkasto obarvane črve pa bo laže videti in prešteti. Štetje olajšajo tudi osvetljene leče (leče velikosti vsaj 100 × 75 mm s faktorjem povečave od 2 do 3).
S tehniko barvanja se čas štetja skrajša na nekaj minut na posodo, kot vodilo pa lahko služi podatek, da bi morala ena oseba oceniti vse posode iz enega preskusa v največ dveh dneh.
Ekstrakcija z vlago
Ekstrakcijo z vlago je treba začeti takoj po koncu preskusa. Tla iz vsake preskusne posode se namestijo na plastična sita z velikostjo mreže približno 1 mm. Sita se nato obesijo v plastične sklede, tako da se ne dotikajo tal. Sklede se previdno polnijo z vodo, dokler vzorci v sitih niso popolnoma pod površino vode. Da se zagotovi stopnja izkoristka, ki znaša več kot 90 % prisotnih črvov, je treba uporabiti obdobje ekstrakcije 3 dni pri 20 ± 2 °C. Na koncu obdobja ekstrakcije se sita odstranijo in voda (razen majhne količine) se počasi odlije, pri čemer je treba paziti, da se ne kali usedlina na dnu skled. Plastične sklede se nato rahlo pretresejo, da se suspendira usedlina v vodi nad usedlino. Voda se prenese v petrijevko, ko pa se delci tal usedejo, je s stereomikroskopom in kleščami iz mehkega jekla mogoče določiti, odstraniti in prešteti enhitreje.
Flotacija
Metodo, ki temelji na flotaciji, je v opombi opisal R. Kuperman (4). Po fiksiranju vsebine preskusne posode z etanolom se tla poplavijo z disperzijo Ludox (koloidni kremen AM-30, suspenzija v vodi 30 % mase), ki naj sega od 10 do 15 mm nad površino tal. Po temeljitem mešanju tal s flotacijskim sredstvom od 2 do 3 minute je mogoče mlade črve, ki plavajo na površini, enostavno prešteti.
VIRI
|
(1)
|
Korinkova, J., in Sigmund, J. (1968). The colouring of bottom-fauna samples before sorting, Vestnik Ceskoslovensko Spolecnosti Zoologicke 32, 300–305.
|
|
(2)
|
Dirven-Van Breemen, E., Baerselmann, R., in Notenboom, J. (1994). Onderzoek naar de Geschiktheid van de Potwormsoorten Enchytraeus albidus en Enchytraeus crypticus (Oligochaeta, Annelida) in Bodemecotoxicologisch Onderzoek. RIVM Rapport, št. 719102025. 46 str.
|
|
(3)
|
Posthuma, L., Baerselmann, R., Van Veen, R. P. M., in Dirven-Van Breemen, E. M. (1997). Single and joint toxic effects of copper and zinc on reproduction of Enchytraeus crypticus in relation to sorption of metals in soils. Ecotox. Envir. Safety 38, 108–121.
|
|
(4)
|
Phillips, C. T., Checkai, R. T., in Kuperman, R. G. (1998). An alternative to the O'Connor Method for Extracting Enchytraeids from Soil. SETAC 19th Annual Meeting, Charlotte, ZDA. Abstract Book No. PMP069, str. 157.
|
Dodatek 7
Pregled statistične ocene podatkov (določitev vrednosti noec)

C.33. PRESKUS RAZMNOŽEVANJA DEŽEVNIKOV (EISENIA FETIDA/EISENIA ANDREI)
UVOD
|
1.
|
Ta preskusna metoda je enakovredna Smernici za preskušanje OECD (TG) 222 (2004). Zasnovana je za uporabo pri ocenjevanju učinkov kemikalij v tleh na sposobnost razmnoževanja (in druge subletalne končne točke) vrste deževnikov Eisenia fetida (Savigny, 1826) ali Eisenia andrei (Andre, 1963) (1) (2). Preskus je bil krožno preskušen (3). Obstaja preskusna metoda za preskus akutne strupenosti pri deževnikih (4). Objavljenih je več drugih mednarodnih in nacionalnih smernic za preskuse akutne in kronične strupenosti za deževnike (5)(6)(7)(8).
|
|
2.
|
Vrsta Eisenia fetida/Eisenia andrei velja za eno od predstavnic talne favne in še posebej deževnikov. Na voljo so osnovne informacije o ekologiji deževnikov in njihovi uporabi pri ekotoksikološkem preskušanju (7)(9)(10)(11)(12).
|
NAČELO PRESKUSA
|
3.
|
Odrasli črvi so izpostavljeni več koncentracijam preskusne kemikalije, vmešane v tla ali, v primeru pesticidov, nanesene na tla ali v tla s postopki, skladnimi z vzorcem uporabe kemikalije. Način nanosa je odvisen od namena preskusa. Območje preskusnih koncentracij je izbrano tako, da zajema subletalne in smrtne učinke v obdobju osmih tednov. Smrtnost in učinki na rast odraslih črvov so določeni po 4 tednih izpostavljenosti. Odrasli osebki se nato odstranijo iz tal in po nadaljnjih 4 tednih se s štetjem potomcev ocenijo učinki na razmnoževanje. Sposobnost razmnoževanja živali, izpostavljenih preskusni kemikaliji, se za določitev (i) koncentracije brez opaznega učinka (NOEC) in/ali (ii) ECx (npr. EC10, EC50) z regresijskim modelom, s katerim se oceni koncentracijo, ki bi povzročila x-odstotno zmanjšanje sposobnosti razmnoževanja, primerja s sposobnostjo razmnoževanja pri kontrolah. Preskusne koncentracije morajo oklepati vrednost ECx (npr. EC10, EC50), tako da vrednost ECx nato izvira iz interpolacije in ne iz ekstrapolacije (za opredelitve glej Dodatek 1).
|
PODATKI O PRESKUSNI KEMIKALIJI
|
4.
|
Za pomoč pri zasnovi ustreznih preskusnih postopkov morajo biti na voljo naslednji podatki v zvezi s preskusno kemikalijo:
|
—
|
ter informacije o usodi in vedenju v okolju, kadar je mogoče (npr. hitrost fotolize in hitrost hidrolize, če sta pomembni za vzorce uporabe).
|
|
|
5.
|
To preskusno metodo je mogoče uporabiti pri vseh kemikalijah, ne glede na njihovo topnost v vodi. Preskusna metoda se ne sme uporabljati pri hlapnih kemikalijah, ki so tu opredeljene kot kemikalije, za katere je Henryjeva konstanta ali porazdelitveni koeficient zrak/voda večja od ena, ali pri kemikalijah, pri katerih parni tlak pri 25 °C presega 0,0133 Pa.
|
|
6.
|
V tej preskusni metodi ni upoštevana morebitna razgradnja preskusne kemikalije v obdobju preskusa. Zato ni mogoče predpostavljati, da bodo koncentracije izpostavljenosti med celotnim preskusom ostale na začetnih vrednostih. V tem primeru je priporočena kemijska analiza preskusne kemikalije na začetku in koncu preskusa.
|
REFERENČNA KEMIKALIJA
|
7.
|
Za zagotovitev, da so laboratorijski preskusni pogoji ustrezni, in za potrditev, da se odziv preskusnih organizmov skozi čas statistično ne spreminja, je treba določiti vrednost NOEC in/ali ECx referenčne kemikalije. Referenčno kemikalijo je priporočljivo preskusiti najmanj enkrat letno oz. vzporedno z določanjem strupenosti preskusne snovi, kadar se preskušanja opravljajo redkeje. Karbendazim ali benomil sta primerni referenčni kemikaliji, za kateri je dokazano, da vplivata na reprodukcijo (3). Značilne učinke je treba opaziti med (a) 1 in 5 mg aktivne sestavine (a.s.)/kg suhe mase ali (b) 250–500 g/ha ali 25–50 mg/m2. Če je v preskusno serijo vključen pozitivni toksikološki standard, se uporablja ena koncentracija, število ponovitev pa mora biti enako kot v kontrolah.
|
VELJAVNOST PRESKUSA
|
8.
|
Da rezultat preskusa šteje kot veljaven, morajo kontrolni vzorci izpolnjevati naslednja merila:
|
—
|
vsaka ponovitev (ki vključuje 10 odraslih osebkov) ob koncu preskusa ustvari ≥ 30 mladičev,
|
|
—
|
koeficient variacije razmnoževanja je ≤ 30 %,
|
|
—
|
smrtnost pri odraslih osebkih v začetnih 4 tednih preskusa je ≤ 10 %.
|
Če preskus ne uspe izpolniti zgoraj naštetih meril za veljavnost, mora biti prekinjen, razen če je mogoče podati utemeljitev za nadaljevanje preskusa. Utemeljitev mora biti vključena v poročilo.
|
OPIS PRESKUSA
Oprema
|
9.
|
Uporabiti je treba eno- ali dvolitrske preskusne posode iz stekla ali drugega kemijsko inertnega materiala. Površina prečnega prereza posod mora biti približno 200 cm2, tako da globina vlažnega substrata doseže 5–6 cm, ko je dodanih od 500 do 600 g suhe mase substrata. Zasnova posode mora omogočati izmenjavo plinov med substratom in ozračjem ter dostop svetlobe (npr. s perforiranim prozornim pokrovom), pri tem pa mora črvom preprečevati pobeg. Če je substrata znatno več od 500 do 600 g na preskusno posodo, je treba število črvov sorazmerno povečati.
|
|
10.
|
Zahtevana je običajna laboratorijska oprema, posebej naslednje:
|
—
|
merilnik vrednosti pH in fotometer,
|
|
—
|
ustrezne natančne tehtnice,
|
|
—
|
ustrezna oprema za uravnavanje temperature,
|
|
—
|
ustrezna oprema za uravnavanje vlažnosti (ni nujna, če imajo posode za izpostavljanje pokrove),
|
|
—
|
inkubator ali majhna soba s klimatsko napravo,
|
|
—
|
pincete, kljuke ali zanke,
|
|
Priprava umetnih tal
|
11.
|
V tem preskusu so uporabljena umetna tla (5)(7) z naslednjo sestavo (na podlagi suhih tež, posušenih na konstantno maso pri 105 °C):
|
—
|
10 odstotkov šotnega mahu (z vrednostjo pH, ki je čim bližje vrednostim od 5,5 do 6,0, brez vidnih ostankov rastlin, posušenega na izmerjeno vsebnost vlage),
|
|
—
|
20 odstotkov kaolinske gline (po možnosti naj bo vsebnost kaolinita nad 30 odstotki),
|
|
—
|
od 0,3 do 1,0 % kalcijevega karbonata (CaCO3, zdrobljenega v prah, analitsko čistega) za doseganje začetne vrednosti pH 6,0 ± 0,5,
|
|
—
|
70 % na zraku posušenega kremenovega peska (odvisno od potrebne količine CaCO3), v glavnem finega peska z več kot 50 % delcev, ki merijo med 50 in 200 mikroni.
|
Opomba 1: potrebna količina CaCO3 bo odvisna od sestavin substrata tal, vključno s hrano, in jo je treba določiti z merjenjem podvzorcev tal tik pred preskusom. Vrednost pH je merjena v zmešanem vzorcu v 1 M raztopine kalijevega klorida (KCl) ali 0,01 M raztopine kalcijevega klorida (CaCl2) (13).
Opomba 2: vsebnost organskega ogljika v umetnih tleh je mogoče znižati, npr. z znižanjem vsebnosti šote na vrednost 4–5 % in ustreznim zvišanjem vsebnosti peska. S takim znižanjem vsebnosti organskega ogljika se lahko zmanjšajo možnosti adsorpcije preskusne kemikalije na tla (organski ogljik), razpoložljivost preskusne kemikalije za črve pa se lahko poveča. Dokazano je, da lahko Eisenia fetida izpolnjuje merila za veljavnost v zvezi z razmnoževanjem, če se preskus izvaja z naravnimi tlemi z manjšo vsebnostjo organskega ogljika (npr. 2,7 %) (14), izkušnje pa kažejo, da je to mogoče doseči tudi pri umetnih tleh s 5 % šote. Zato pred uporabo takih tal v dokončnem preskusu ni nujno dokazovati, ali so umetna tla primerna za omogočanje skladnosti preskusa z merili za veljavnost, razen če je vsebnost šote znižana bolj, kot je določeno zgoraj.
Opomba 3: pri uporabi naravnih tal za dodatno preskušanje (na višjih stopnjah) je treba dokazati tudi primernost tal in izpolnjevanje meril za veljavnost preskusa.
|
|
12.
|
Suhe sestavine tal se v dobro prezračenem prostoru temeljito premešajo (npr. v velikem laboratorijskem mešalniku). Pred začetkom preskusa se suha umetna tla navlažijo z dodajanjem zadostne količine deionizirane vode, da je pridobljene približno polovico končne vsebnosti vode, kar je od 40 do 60 % največje zmogljivosti zadrževanja vode (kar ustreza vrednosti 50 ± 10 % suhe mase vlage). S tem je ustvarjen substrat, iz katerega med stiskanjem v roki ne izloči stoječa ali prosto tekoča voda. Največja zmogljivost zadrževanja vode (WHC) umetnih tal je določena v skladu s postopki, opisanimi v Dodatku 2, standardu ISO 11274 (15) ali enakovrednem standardu EU.
|
|
13.
|
Če je preskusna kemikalija nanesena na površino tal ali vmešana v tla brez vode, je mogoče končno količino vode v umetna tla vmešati med pripravo tal. Če se preskusna kemikalija vmeša v tla skupaj z nekaj vode, je mogoče dodatno količino vode dodati skupaj s preskusno kemikalijo (glej odstavek 19).
|
|
14.
|
Vsebnost vlage v tleh je določena ob začetku in koncu preskusa v skladu s standardom ISO 11465 (16) ali enakovrednim standardom EU, vrednost pH tal pa v skladu z Dodatkom 3 ali standardom ISO 10390 (13) ali enakovrednim standardom EU. Te določitve je treba izvesti v vzorcu kontrolnih tal in vzorcih tal s posameznimi preskusnimi koncentracijami. Ob preskušanju kislih ali bazičnih kemikalij vrednosti pH ni dovoljeno prilagajati. Med celotnim preskusom je treba vsebnost vlage spremljati z rednim tehtanjem posod (glej odstavka 26 in 30).
|
Izbira in priprava preskusnih živali
|
15.
|
Vrsta, uporabljena v preskusu, je Eisenia fetida ali Eisenia andrei (1)(2). Za začetek preskusa so potrebni odrasli črvi v starosti od dveh mesecev do enega leta, ki imajo klitelum. Črve je treba izbrati iz sinhronizirane kulture z relativno homogeno starostno strukturo (Dodatek 4). Razlika v starosti posameznih osebkov v preskusni skupini ne sme biti večja od 4 tednov.
|
|
16.
|
Izbrane črve je treba vsaj en dan aklimatizirati v vrsti substrata umetnih tal, ki bo uporabljena v preskusu. V tem obdobju je treba črve hraniti z enako hrano, kot bo uporabljena v preskusu (glej odstavke od 31 do 33).
|
|
17.
|
Na začetku preskusa je treba posamezne skupine 10 črvov stehtati in jih naključno dodeliti preskusnim posodam. Pred tehtanjem se črvi operejo (z deionizirano vodo), odvečna voda pa se odstrani tako, da se črvi za kratek čas položijo na filtrirni papir. Mokra masa posameznih črvov mora znašati med 250 in 600 mg.
|
Priprava preskusnih koncentracij
|
18.
|
Uporabita se lahko dve metodi nanosa preskusne kemikalije: vmešanje preskusne kemikalije v tla (glej odstavke 19–21) ali nanos na površino tal (glej odstavke 22–24). Izbira ustrezne metode je odvisna od namena preskusa. V splošnem se priporoča vmešanje preskusne kemikalije v tla. Vendar so morda potrebni postopki nanosa, ki so skladni z običajno kmetijsko prakso (npr. pršenje tekoče formulacije ali uporaba posebnih formulacij pesticidov, kot so zrnca ali obloge semen). Topila, ki se uporabljajo kot pomoč pri tretiranju tal s preskusno kemikalijo, je treba izbrati na podlagi njihove nizke stopnje strupenosti za deževnike, v načrt preskusa pa je treba vključiti ustrezno kontrolo s topilom (glej odstavek 27).
|
Vmešanje preskusne kemikalije v tla
Preskusna kemikalija, topna v vodi
|
19.
|
Raztopina preskusne kemikalije v deionizirani vodi se pripravi tik pred začetkom preskusa v količini, ki zadošča za vse ponovitve ene preskusne koncentracije. Za lažjo pripravo preskusne raztopine je morda potrebno pomožno topilo. Priročno je pripraviti količino raztopine, ki je potrebna za doseganje končne vsebnosti vlage (od 40 do 60 % največje zmogljivosti zadrževanja vode). Raztopino je treba pred vstavljanjem v preskusno posodo temeljito zmešati s tlemi.
|
Preskusna kemikalija, ki ni topna v vodi
|
20.
|
Preskusna kemikalija se raztopi v majhni količini primernega organskega topila (npr. acetona) in se nato razprši na majhno količino finega kremenovega peska ali pa se vanjo vmeša. Vehikel se nato odstrani tako, da vsaj nekaj minut izhlapeva v digestoriju. Tretirani pesek se nato temeljito zmeša s predhodno navlaženimi umetnimi tlemi. Nato se za doseganje končne vsebnosti vlage, ki mora znašati od 40 do 60 % največje zmogljivosti zadrževanja vode, doda in vmeša deionizirana voda (potrebna količina). Tla so nato pripravljena za namestitev v preskusne posode. Treba je paziti, ker so nekatera topila lahko strupena za deževnike.
|
Preskusna kemikalija, ki ni topna v vodi in organskih topilih
|
21.
|
Pripravi se zmes, ki je sestavljena iz 10 g fino mletega industrijskega kremenovega peska in količine preskusne kemikalije, potrebne za doseganje preskusne koncentracije v tleh. Zmes se nato temeljito zmeša s predhodno navlaženimi umetnimi tlemi. Nato se za doseganje končne vsebnosti vlage, ki mora znašati od 40 do 60 % največje zmogljivosti zadrževanja vode, doda in vmeša deionizirana voda (potrebna količina). Tla so nato pripravljena za vstavljanje v preskusne posode.
|
Nanos preskusne kemikalije na površino tal
|
22.
|
Tla se tretirajo po dodajanju črvov. Najprej se preskusne posode napolnijo z navlaženim substratom tal, stehtani črvi pa se položijo na površino. Zdravi črvi se običajno takoj zakopljejo v substrat, zato so vsi, ki po 15 minutah ostanejo na površini, opredeljeni kot poškodovani in jih je treba zamenjati. Če se črvi zamenjajo, je treba nove in zamenjane črve stehtati, tako da sta na začetku znani skupna živa teža izpostavljene skupine črvov in skupna teža posode s črvi.
|
|
23.
|
Nanese se preskusna kemikalija. Pol ure po namestitvi črvov (ali pa, če so črvi prisotni na površini tal) se preskusne kemikalije ne sme nanašati na tla, da se prepreči neposredna izpostavljenost preskusni kemikaliji prek stika s kožo. Če je preskusna kemikalija pesticid, jo je morda primerno nanesti na površino tal s pršenjem. Preskusno kemikalijo je treba na površino tal nanesti čim bolj enakomerno s primerno laboratorijsko napravo za pršenje, da se posnema pršenje na polju. Pred nanosom je treba odstraniti pokrov preskusne posode in ga nadomestiti z oblogo, ki ščiti stranske stene posode pred pršilom. Oblogo je mogoče izdelati iz preskusne posode z odstranjeno podlogo. Nanos je treba izvesti pri temperaturi v območju variacije 20 ± 2 °C, za vodne raztopine, emulzije ali disperzije pa pri hitrosti nanosa vode med 600 in 800 μl/m2. Hitrost je treba preveriti s primerno tehniko kalibracije. Posebne formulacije, kot so zrnca ali obloge semen, je treba nanesti na način, skladen s kmetijsko uporabo.
|
|
24.
|
Preskusne posode je treba eno uro pustiti nepokrite, da izhlapijo vsa hlapna topila, povezana z nanosom preskusne kemikalije. Treba je paziti, da v tem času noben črv ne pobegne iz preskusnih posod.
|
POSTOPEK
Preskusne in kontrolne skupine
|
25.
|
Priporočljiva je obremenitev z 10 deževniki v 500–600 g suhe mase umetnih tal (tj. 50–60 g tal na črva). Če se uporabljajo velike količine tal, kot v primeru preskušanja pesticidov s posebnimi načini nanosa, npr. oblogami semen, je treba s povečanjem števila črvov vzdrževati obremenitev 50–60 g tal na črva. Za vsako kontrolno posodo in posodo za tretiranje je pripravljenih deset črvov. Črvi se operejo z vodo in obrišejo, nato pa za kratek čas postavijo na vpojni papir, da se odvečna voda odcedi.
|
|
26.
|
Za preprečevanje sistematičnih napak pri razporejanju črvov v preskusne posode je treba s tehtanjem 20 črvov, naključno vzorčenih iz populacije, iz katere bodo odvzeti preskusni črvi, ugotoviti homogenost preskusne populacije. Po zagotovitvi homogenosti se nato skupine črvov izberejo, stehtajo in s postopkom naključnega določanja dodelijo preskusnim posodam. Po dodajanju preskusnih črvov je treba vsako posodo stehtati in tako zagotoviti, da obstaja podatek o začetni teži, ki ga je mogoče uporabiti kot osnovo za spremljanje vsebnosti vlage v tleh med celotnim preskusom, kot je opisano v odstavku 30. Nato se preskusne posode pokrijejo, kot je opisano v odstavku 9, in postavijo v preskusno komoro.
|
|
27.
|
Za vsako od metod nanosa preskusne kemikalije, opisanih v odstavkih od 18 do 24, se pripravijo ustrezne kontrole. Za pripravo kontrol se upoštevajo ustrezni postopki, z izjemo dodajanja preskusne kemikalije. Zato se na kontrole, kjer je primerno, nanesejo organska topila, kremenov pesek ali drugi vehikli v koncentracijah/količinah, skladnih s koncentracijami/količinami, uporabljenimi pri tretiranih skupinah. Če je za dodajanje preskusni kemikaliji uporabljeno topilo ali drug vehikel, je treba zagotoviti, da vehikel ne vpliva na rezultat, zato je treba pripraviti tudi dodatno kontrolo brez vehikla in preskusne kemikalije ter jo preskusiti.
|
Preskusni pogoji
|
28.
|
Preskusna temperatura je 20 ± 2 °C. Preskus se izvaja v nadzorovanih ciklih svetlobe in teme (po možnosti 16 ur svetlobe in 8 ur teme) pri osvetljenosti od 400 do 800 luksov na območju preskusnih posod.
|
|
29.
|
Preskusne posode se med preskusom ne prezračujejo, vendar mora zasnova pokrovov preskusne posode omogočati izmenjavo plinov, pri tem pa omejevati izhlapevanje vlage (glej odstavek 9).
|
|
30.
|
Vsebnost vode v substratu tal v preskusnih posodah se z rednim ponovnim tehtanjem preskusnih posod (razen njihovih pokrovov) vzdržuje med celotnim preskusom. Izgube se po potrebi nadomeščajo z deionizirano vodo. Vsebnost vode se od vsebnosti na začetku preskusa ne sme razlikovati za več kot 10 %.
|
Hranjenje
|
31.
|
Za sprejemljivo velja vsa hrana, katere kakovost je dokazano primerna vsaj za ohranjanje teže črvov med preskusom. Izkušnje so pokazale, da je primerna hrana ovsena kaša ter kravji in konjski gnoj. S preverjanji je treba zagotoviti, da krave ali konji, od katerih je gnoj pridobljen, niso zdravljene ali tretirane s kemikalijami, kot so pospeševalci rasti, nematicidi ali podobni veterinarski proizvodi, ki lahko med preskusom škodljivo vplivajo na črve. Priporočen je samostojno zbrani kravji gnoj, saj so izkušnje pokazale, da lahko na trgu dostopni kravji gnoj, ki se uporablja kot gnojilo za vrt, škodljivo vpliva na črve. Gnoj mora biti pred uporabo posušen na zraku, fino zmlet in pasteriziran.
|
|
32.
|
Preden se vsaka sveža šarža hrane uporabi v preskusu, je treba z njo nahraniti nepreskusno kulturo črvov, da se zagotovi njena primerna kakovost. Rast in proizvajanje kokonov ne smeta biti zmanjšana v primerjavi s črvi v substratu, ki ne vsebuje nove šarže hrane (pogoji, kot so opisani v preskusni metodi C.8(4)).
|
|
33.
|
Hrana se prvič priskrbi en dan po dodajanju črvov in nanosu preskusne kemikalije na tla. Približno 5 g hrane se raztrese na površino tal vsake posode in navlaži z deionizirano vodo (približno 5–6 ml na posodo). Nato se hrana v 4-tedenskem preskusnem obdobju priskrbi enkrat tedensko. Če hrana ostaja nepoužita, je treba obrok zmanjšati, da se prepreči rast gliv ali plesni. Odrasli osebki se odstranijo iz tal 28. dan preskusa. Nato se v vsako preskusno posodo doda 5 g hrane. Hranjenja med preostalimi 4 tedni preskusa ni več.
|
Izbira preskusnih koncentracij
|
34.
|
Predhodno poznavanje strupenosti preskusne kemikalije, npr. iz preskusa akutne strupenosti (4) in/ali iz študij za določanje območja delovanja, bi moralo biti v pomoč pri izbiri ustreznih preskusnih koncentracij. Po potrebi se izvede preskus za določanje območja delovanja z, na primer, petimi preskusnimi koncentracijami, ki znašajo 0,1, 1,0, 10, 100 in 1 000 mg/kg (suhe mase tal). Zadošča ena ponovitev za vsako tretirano skupino in kontrolo. Preskus za določanje območja delovanja traja dva tedna, ob koncu preskusa pa se oceni smrtnost.
|
Načrt poskusa
|
35.
|
Ker za preskus ni mogoče predpisati enega samega statističnega povzetka, ta metoda nudi vse potrebno za določitev vrednosti NOEC in ECx. V predvidljivi prihodnosti bodo regulativni organi verjetno zahtevali vrednost NOEC. V bližnji prihodnosti bo morda zaradi statističnih in ekoloških pomislekov sprejeta bolj razširjena uporaba vrednosti ECx. Zato se na podlagi priporočil, ki izhajajo iz krožnega preskusa preskusne metode razmnoževanja enhitrejev, predlagajo trije načrti (17).
|
|
36.
|
Pri določanju razpona koncentracij se upošteva naslednje:
|
—
|
Za določitev vrednosti NOEC je treba preskusiti vsaj pet/dvanajst koncentracij v geometrijski vrsti. Priporočene so štiri ponovitve za vsako preskusno koncentracijo in osem kontrol. Med koncentracijami mora biti razmik, katerega faktor ne sme presegati vrednosti 2,0.
|
|
—
|
Za določitev vrednosti ECx (npr. EC10, EC50) se priporoča število koncentracij, ki je zadostno, da povzroči vsaj štiri statistično značilne različne povprečne odzive. Priporoča se vsaj dve ponovitvi za vsako preskusno koncentracijo in šest kontrolnih ponovitev. Faktor razmika se lahko spreminja, tj. je v pričakovanem območju učinkov lahko manjši ali enak 1,8, pri višjih in nižjih koncentracijah pa je lahko nad 1,8.
|
|
—
|
Kombiniran pristop omogoča določitev vrednosti NOEC in ECx. Treba je uporabiti osem koncentracij za tretiranje v geometrijski vrsti. Priporočene so štiri ponovitve za vsako tretiranje in osem kontrol. Med koncentracijami mora biti razmik, katerega faktor ne sme presegati vrednosti 1,8.
|
|
Trajanje preskusa in meritve
|
37.
|
Na 28. dan se odrasli črvi pregledajo in preštejejo. Zabeležita se tudi morebitno nenormalno vedenje (npr. nezmožnost kopanja v tla, negibno ležanje) in morebitna nenavadna morfologija (npr. odprte rane). Nato se vse odrasle črve odstrani iz preskusnih posod, prešteje in stehta. Iskanje odraslih osebkov je morda lažje, če so tla, ki vsebujejo črve, pred ocenjevanjem prenesena na čist pladenj. Pred tehtanjem se črvi, vzeti iz tal, operejo (z deionizirano vodo), odvečna voda pa se odstrani tako, da se črvi za kratek čas položijo na filtrirni papir. Vse črve, ki jih v tem trenutku ni mogoče najti, je treba zabeležiti kot mrtve, saj je treba predpostavljati, da so ti črvi pred ocenjevanjem umrli in se razgradili.
|
|
38.
|
Če so bila tla odstranjena iz posod, se nato vrnejo (brez odraslih črvov, vendar z vsemi proizvedenimi kokoni). Nato se tla štiri dodatne tedne inkubirajo pri enakih preskusnih pogojih, razen hranjenja, ki se opravi le enkrat na začetku te faze preskusa (glej odstavek 33).
|
|
39.
|
Ob koncu drugega 4-tedenskega obdobja se s postopki, opisanimi v Dodatku 5, določi število mladičev, izleženih iz kokonov v preskusnih tleh, in število kokonov. V celotnem obdobju preskusa je treba beležiti tudi vse znake poškodb pri črvih ali škodljivih učinkov nanje.
|
Mejni preskus
|
40.
|
Če pri največji koncentraciji v preskusu za določanje območja delovanja (tj. 1 000 mg/kg) ni opaženih učinkov, bo preskus razmnoževanja izveden kot mejni preskus s koncentracijo 1 000 mg/kg. Mejni preskus bo ponudil možnost dokazovanja, da je vrednost NOEC za razmnoževanje večja od mejne koncentracije, pri čemer bo število črvov, uporabljenih v preskusu, kar najmanjše. Za tretirana tla in kontrolo je treba uporabiti osem ponovitev.
|
PODATKI IN POROČANJE
Obdelava rezultatov
|
41.
|
Čeprav je v Dodatku 6 podan pregled, v tej preskusni metodi ni podana nobena dokončna statistična smernica za analizo rezultatov preskusa.
|
|
42.
|
Ena od končnih točk je smrtnost. Vendar je treba zabeležiti tudi spremembe vedenja odraslih osebkov (npr. nezmožnost kopanja v tla, negibno ležanje ob stekleni steni preskusne posode) in morfologije (npr. odprte rane) ter morebitno prisotnost mladičev. Za določanje vrednosti LC50 se običajno uporabi analiza probit (18) ali regresija logit. Vendar pa je mogoče v primerih, pri katerih ta analitska metoda ni primerna (npr. če so na voljo manj kot tri koncentracije z delnimi usmrtitvami), uporabiti alternativne metode. Te metode lahko vključujejo drseča povprečja (19), prilagojeno metodo Spearman-Karber (20) ali enostavno interpolacijo (npr. geometrijsko sredino vrednosti LC0 in LC100, izračunano s kvadratnim korenom zmnožka vrednosti LC0 in LC100).
|
|
43.
|
Druga končna točka je plodnost (tj. število ustvarjenih mladičev). Vendar je treba v končno poročilo, tako kot pri preskusu za določanje območja delovanja, zabeležiti vse druge škodljive znake. Za statistično analizo morata biti izračunani aritmetična sredina

in standardni odklon za razmnoževanje pri posamezni tretirani skupini in kontroli. |
|
44.
|
Če je izvedena analiza variance, je mogoče standardni odklon, s, in stopinje prostosti, df, nadomestiti z oceno skupne variance, pridobljene z analizo variance (ANOVA) oziroma z njenimi stopinjami, če varianca ni odvisna od koncentracije. V tem primeru uporabite enosmerne analize variance kontrol in tretiranih skupin. Te vrednosti se navadno izračunajo s komercialno programsko opremo za statistiko, pri čemer so rezultati glede na posodo uporabljeni kot ponovitve. Če se zdi, da je združevanje podatkov za negativne kontrole in kontrole s topilom bolj smiselno od preskušanja glede na enega od njih, jih je treba preskusiti, da se preveri, da med njimi ni značilnih razlik (za ustrezne preskuse glej odstavek 47 in Dodatek 6).
|
|
45.
|
Nadaljnje statistično preskušanje in sklepanje je odvisno od tega, ali so vrednosti ponovitev normalno porazdeljene in homogene glede na svojo varianco.
|
Ocena vrednosti NOEC
|
46.
|
Prednost mora imeti uporaba učinkovitih preskusov. Uporabiti je treba informacije npr. iz predhodnih izkušenj s krožnim preskušanjem ali druge podatke iz preteklih študij o tem, ali so podatki približno normalno porazdeljeni. Homogenost variance (homoskedastičnost) je bolj kritična. Izkušnje kažejo, da varianca pogosto narašča z naraščajočo srednjo vrednostjo. V teh primerih transformacija podatkov lahko privede do homoskedastičnosti. Vendar mora taka transformacija temeljiti na izkušnjah s podatki iz preteklih študij in ne na podatkih, ki se proučujejo. Pri homogenih podatkih je treba izvesti več t-preskusov, kot je Williamsov preskus (α = 0,05, enostranski) (21)(22) ali, v nekaterih primerih, Dunnettov preskus (23)(24). Velja pripomniti, da je treba v primeru neenake ponovitve popraviti vrednosti t iz preglednice tako, kot sta predlagala Dunnett in Williams. Včasih se odzivi zaradi velike variacije ne povečajo/zmanjšajo pravilno. V tem primeru velikega odklona od monotonosti je bolj primeren Dunnettov preskus. Če obstajajo odkloni od homoskedastičnosti, je morda smiselno natančneje proučiti možne učinke na variance, da se ugotovi, ali je mogoče uporabiti t-preskuse brez prevelike izgube učinkovitosti (25). Druga možnost je uporaba večkratnega U-preskusa, npr. Bonferronijevega U-preskusa po Holmu (26), ali – če ti podatki kažejo heteroskedastičnost, sicer pa so skladni z osnovnim monotonim razmerjem odmerek-odziv – drugega neparametričnega preskusa (npr. preskusa po Jonckheere-Terpstraju (27)(28) ali Shirleyjevega preskusa (29)(30)); uporaba takšnega preskusa ima v splošnem prednost pred t-preskusi za neenake variance. (Glej tudi shemo v Dodatku 6.)
|
|
47.
|
Če je izveden mejni preskus in so izpolnjeni predpogoji za postopke parametričnih preskusov (normalnost, homogenost), je mogoče uporabiti parni Studentov t-preskus ali, namesto tega, postopek Mann-Whitneyjevega U-preskusa (31).
|
Ocena vrednosti ECx
|
48.
|
Za izračun katere koli vrednosti ECx se po pridobitvi ustrezne funkcije odmerek-odziv za regresijsko analizo (linearno ali nelinearno) uporabijo srednje vrednosti glede na tretirano skupino. Za rast črvov v obliki zveznega odziva je mogoče vrednosti ECx oceniti z ustrezno regresijsko analizo (32). Med primernimi funkcijami za kvantne podatke (smrtnost/preživetje) in število ustvarjenih potomcev so normalna sigmoidna funkcija in logistične ali Weibullove funkcije, ki vsebujejo od dva do štiri parametre, pri čemer nekatere lahko modelirajo tudi odzive v obliki hormeze. Če je bila funkcija odmerek-odziv prilagojena z linearno regresijsko analizo, je treba v regresijski analizi pred ocenjevanjem vrednosti ECx najti značilni r2 (determinacijski koeficient) in/ali naklon, tako da se v enačbo, podano z regresijsko analizo, vstavi vrednost, ki ustreza x % srednje vrednosti kontrole. V skladu s Fiellerjem (navedeno v Finney (18)) ali z drugimi ustreznimi sodobnimi metodami se izračunajo 95-odstotne meje zaupanja.
|
|
49.
|
Namesto tega se odziv lahko modelira kot odstotek ali razmerje parametra modela, ki se razlaga kot srednja vrednost odziva kontrole. V teh primerih je mogoče običajno (logistično, Weibullovo) sigmoidno krivuljo pogosto enostavno prilagoditi rezultatom s postopkom regresije probit (18). V teh primerih je treba utežno funkcijo prilagoditi za odzive metrik, kot je podano v Christensen (33). Če pa je ugotovljena hormeza, mora analizo probit nadomestiti logistična ali Weibullova funkcija s štirimi parametri, prilagojena s postopkom nelinearne regresije (34). Če podatkom ni mogoče prilagoditi primerne funkcije odmerek-odziv, je mogoče za oceno vrednosti ECx in njenih meja zaupanja uporabiti alternativne metode, kot so drseča povprečja po Thompsonu (19) in postopek prilagojene metode Spearman-Karber (20).
|
POROČILO O PRESKUSU
|
50.
|
Poročilo o preskusu mora vsebovati naslednje informacije:
|
|
Preskusna kemikalija:
|
—
|
dokončen opis preskusne kemikalije, serija, skupina in številka CAS, čistost,
|
|
—
|
lastnosti preskusne kemikalije (npr. vrednost log Kow, topnost v vodi, parni tlak, Henryjeva konstanta (H) ter informacije o usodi in vedenju).
|
|
|
|
Preskusni organizmi:
|
—
|
uporabljene preskusne živali: vrsta, znanstveno ime, vir organizmov in pogoji gojenja,
|
|
—
|
razpon starosti in velikosti (mase) preskusnih organizmov.
|
|
|
|
Preskusni pogoji
|
—
|
podrobnosti o pripravi preskusnih tal,
|
|
—
|
največja zmogljivost zadrževanja vode v tleh,
|
|
—
|
opis tehnike, uporabljene za nanos preskusne kemikalije na tla,
|
|
—
|
podrobnosti o pomožnih kemikalijah, uporabljenih za dodajanje preskusne kemikalije,
|
|
—
|
podrobnosti o kalibraciji za opremo za pršenje, če je to smiselno,
|
|
—
|
opis načrta in postopkov poskusa,
|
|
—
|
velikost preskusnih posod in količina preskusnih tal,
|
|
—
|
preskusni pogoji: obsevanost, trajanje ciklov svetlobe in teme, temperatura,
|
|
—
|
opis režima hranjenja, vrsta in količina hrane, uporabljene v preskusu, datumi hranjenja,
|
|
—
|
vrednost pH in vsebnost vode v tleh na začetku in koncu preskusa.
|
|
|
|
Rezultati preskusa:
|
—
|
smrtnost pri odraslih osebkih ( %) v vsaki preskusni posodi ob izteku prvih 4 tednov preskusa,
|
|
—
|
skupna masa odraslih osebkov na začetku preskusa v vsaki preskusni posodi,
|
|
—
|
spremembe telesne teže živih odraslih osebkov ( % začetne teže) v vsaki preskusni posodi po prvih štirih tednih preskusa,
|
|
—
|
število mladičev, ustvarjenih v vsaki preskusni posodi ob koncu preskusa,
|
|
—
|
opis očitnih ali patoloških simptomov ali jasnih sprememb vedenja,
|
|
—
|
rezultati, pridobljeni z referenčno preskusno kemikalijo,
|
|
—
|
vrednosti LC50, NOEC in/ali ECx (npr. EC50, EC10) za razmnoževanje, če je mogoče nekatere od njih uporabiti znotraj intervalov zaupanja, krivulja prilagojenega modela, uporabljena za njegov izračun, ter vse informacije in opažanja, ki pripomorejo k razlagi rezultatov,
|
|
—
|
grafični prikaz razmerja med odmerkom in odzivom,
|
|
—
|
rezultati, ki se nanašajo na vsako preskusno posodo.
|
|
Odstopanja od postopkov, opisanih v tej preskusni metodi, in morebitni nenavadni dogodki med preskusom.
|
LITERATURA
|
(1)
|
Jaenicke, J. (1982). ‚Eisenia foetida‘ is two biological species. Megadrilogica 4, 6–8.
|
|
(2)
|
Oien, N., in Stenerson, J. (1984). Esterases of earthworm – III. Electrophoresis reveals that Eisenia foetida (Savigny) is two species. Comp. Biochem. Physiol. 78c (2), 277–282.
|
|
(3)
|
Kula, C. (1996). Development of a test method on sublethal effects of pesticides on the earthworm species Eisenia fetida/Eisenia andrei – comparison of two ringtests. V: Riepert, F., Kula, C. (1996): Development of laboratory methods for testing effects of chemicals and pesticides on collembola and earthworms. Mitt. Biol. Bundesamst. f. Land- Forstwirtsch. Berlin-Dahlem, 320, str. 50–82.
|
|
(4)
|
Poglavje C.8 te priloge, Strupenost za deževnike (preskus).
|
|
(5)
|
ISO (Mednarodna organizacija za standardizacijo) (1996). Soil Quality – Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction, št. 11268-2. ISO, Ženeva.
|
|
(6)
|
ISO (Mednarodna organizacija za standardizacijo) (1993). Soil Quality – Effects of pollutants on earthworms (Eisenia fetida). Part 1: Determination of acute toxicity using Artificial Soil substrate, št. 11268-1. ISO, Ženeva.
|
|
(7)
|
SETAC (1998). Advances in Earthworm Ecotoxicology. Sheppard, S. C., Bembridge, J. D., Holmstrup, M. in L. Posthuma (ur.). SETAC Press, 456 str.
|
|
(8)
|
EPA (1996). Ecological effects test guidelines. Earthworm Subchronic Toxicity Test (850.62.00). United States Environmental Protection Agency. Office of Prevention, Pesticides and Toxic Substances. EPA712-C-96-167, april 1996.
|
|
(9)
|
Bouché, M. B. (1972). Lombriciens de France, Ecologie et systématique. Publication de l'Institut National de la Recherche Agronomique.
|
|
(10)
|
Edwards, C. A. (1983). Development of a standardized laboratory method for assessing the toxicity of chemical substances to earthworms. Report EUR 8714 EN, Commission of European Communities.
|
|
(11)
|
Greig-Smith, P. W., Becker, H., Edwards, P. J., in Heimbach, F. (ur.) (1992). Ecotoxicology of Earthworms. Intercept.
|
|
(12)
|
Edwards, C. A., in Bohlen, J. P. (1996). Biology and ecology of Earthworms, 3. izdaja. Chapman and Hall, London.
|
|
(13)
|
ISO (Mednarodna organizacija za standardizacijo) (1994). Kakovost tal – Določevanje pH, št. 10390. ISO, Ženeva.
|
|
(14)
|
Hund-Rinke, K., Römbke, J., Riepert, F., in Achazi, R. (2000). Beurteilung der Lebensraumfunktion von Böden mit Hilfe von Regenwurmtests. V: Toxikologische Beurteilung von Böden. Heiden S., Erb R., Dott W. in Eisentraeger A. (ur.). Spektrum Verl., Heidelberg. 59–81.
|
|
(15)
|
ISO (Mednarodna organizacija za standardizacijo) (1992). Kakovost tal – Določevanje karakteristik zadrževanja vode – Laboratorijske metode, št. 11274. ISO, Ženeva.
|
|
(16)
|
ISO (Mednarodna organizacija za standardizacijo) (1993). Kakovost tal – Ugotavljanje suhe snovi in vsebnosti vode na osnovi mase – Gravimetrijska metoda, št. 11465. ISO, Ženeva.
|
|
(17)
|
Römbke, J., in Moser, Th. (1999). Organisation and Performance of an International Ringtest for the validation of the Enchytraeid Reproduction Test. UBA-Texte 4/99, 150 + 223 str.
|
|
(18)
|
Finney, D. J. (1971). Probit Analysis (3. izdaja), str. 19–76. Cambridge Univ. Press.
|
|
(19)
|
Finney, D. J. (1978). Statistical Method in Biological Assay. -Charles Griffin & Company Ltd, London.
|
|
(20)
|
Hamilton, M. A., Russo, R. C., in Thurston, R.V. (1977). Trimmed Spearman-Karber Method for estimating median lethal concentrations in toxicity bioassays. Environ. Sci. Technol. 11(7), 714-719; Correction Environ. Sci. Technol. 12(1998), 417.
|
|
(21)
|
Williams, D. A. (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27, 103-117.
|
|
(22)
|
Williams, D. A. (1972). The comparison of several dose levels with a zero dose control. Biometrics 28, 519-531.
|
|
(23)
|
Dunnett, C. W. (1955). A multiple comparison procedure for comparing several treatments with a control. Amer. Statist. Ass. J. 50, 1096-1121.
|
|
(24)
|
Dunnett, C. W. (1964). New tables for multiple comparisons with a control. Biometrics 20, 482-491.
|
|
(25)
|
Hoeven, N. van der (1998). Power analysis for the NOEC: What is the probability of detecting small toxic effects on three different species using the appropriate standardized test protocols? Ecotoxicology 7: 355–361.
|
|
(26)
|
Holm, S. (1979). A simple sequentially rejective multiple test procedure. Scand. J. Statist. 6, 65-70.
|
|
(27)
|
Jonckheere, A. R. (1954). A Distribution-free k-Sample Test Against Ordered Alternatives, Biometrika 41, 133– 145.
|
|
(28)
|
Terpstra, T. J. (1952). The Asymptotic Normality and Consistency of Kendall's Test Against Trend, When Ties are Present in One Ranking, Indagationes Math. 14, 327–333.
|
|
(29)
|
Shirley, E. A. (1979). The comparison of treatment to control group means in toxicology studies, Applied Statistics 28, 144– 151.
|
|
(30)
|
Williams, D. A. (1986). A Note on Shirley's Nonparametric Test for Comparing Several Dose Levels with a Zero-Dose Control, Biometrics 42, 183– 186.
|
|
(31)
|
Sokal, R. R., in Rohlf, F. J. (1981). Biometry. The Principle and practice of statistics in biological research. 2. izdaja. W.H. Freeman and Company. New York.
|
|
(32)
|
Bruce, R. D., in Versteeg, D. J. (1992). A statistical procedure for modelling continuous toxicity data. Environmental Toxicology and Chemistry 11:1485– 1494.
|
|
(33)
|
Christensen, E. R., (1984). Dose-response functions in aquatic toxicity testing and the Weibull model. Water Research 18, 213–221.
|
|
(34)
|
Van Ewijk, P. H., in Hoekstra, J. A. (1993). Calculation of the EC50 and its confidence interval when sub-toxic stimulus is present. Ecotox, Environ. Safety. 25, 25–32.
|
Dodatek 1
Opredelitve pojmov
Pri tej preskusni metodi se uporabljajo naslednje opredelitve:
|
|
Kemikalija pomeni snov ali zmes.
|
|
|
ECx
(učinkovita koncentracija za x-odstotni učinek) je koncentracija, ki na preskusnih organizmih v danem obdobju izpostavljenosti v primerjavi s kontrolo učinkuje x-odstotno. Vrednost EC50 je, na primer, koncentracija, pri kateri je ocenjeno, da na končno točko preskusa učinkuje 50-odstotno glede na izpostavljeno populacijo v določenem obdobju izpostavljenosti. V tem preskusu so učinkovite koncentracije izražene kot masa preskusne kemikalije na suho maso preskusnih tal ali kot masa preskusne kemikalije na enoto površine tal.
|
|
|
LC0
(koncentracija brez smrtnega učinka) je koncentracija preskusne kemikalije, ki v določenem časovnem obdobju ne ubije nobenega od izpostavljenih preskusnih organizmov. V tem preskusu je LC0 izražena kot masa preskusne kemikalije na suho maso preskusnih tal.
|
|
|
LC50
(srednja smrtna koncentracija) je koncentracija preskusne kemikalije, ki v določenem časovnem obdobju ubije 50 % izpostavljenih preskusnih organizmov. V tem preskusu je LC50 izražena kot masa preskusne kemikalije na suho maso preskusnih tal ali kot masa preskusne kemikalije na enoto površine tal.
|
|
|
LC100
(popolnoma smrtna koncentracija) je koncentracija preskusne kemikalije, ki v določenem časovnem obdobju ubije 100 % izpostavljenih preskusnih organizmov. V tem preskusu je LC100 izražena kot masa preskusne kemikalije na suho maso preskusnih tal.
|
|
|
LOEC (najnižja koncentracija z opaznim učinkom) je najnižja koncentracija preskusne kemikalije, ki ima statistično značilen učinek (p < 0,05). V tem preskusu je vrednost LOEC izražena kot masa preskusne kemikalije na suho maso preskusnih tal ali kot masa preskusne kemikalije na enoto površine tal. Vse preskusne koncentracije nad vrednostjo LOEC morajo običajno kazati učinek, ki je statistično različen od kontrole. Vsa odstopanja od zgoraj navedenega morajo biti utemeljena v poročilu o preskusu.
|
|
|
NOEC (koncentracija brez opaznega učinka) je najvišja koncentracija preskusne kemikalije tik pod vrednostjo LOEC, pri kateri ni opaznega učinka. V tem preskusu koncentracija, ki ustreza vrednosti NOEC, v danem obdobju izpostavljenosti v primerjavi s kontrolo nima statistično značilnega učinka (p < 0,05).
|
|
|
Hitrost razmnoževanja: srednja vrednost števila mladih črvov, ki jih ustvari določeno število odraslih osebkov v preskusnem obdobju.
|
|
|
Preskusna kemikalija je snov ali zmes, preskušena s to preskusno metodo.
|
Dodatek 2
Določanje največje zmogljivosti zadrževanja vode
Kot primerna se je izkazala naslednja metoda za določanje največje zmogljivosti zadrževanja vode v tleh. Opisana je v Prilogi C standarda ISO DIS 11268-2 (1).
S primerno napravo za vzorčenje (svedrastim vzorčevalnikom itd.) zberite določeno količino (npr. 5 g) substrata preskusnih tal. Pokrijte dno vzorčevalnika s koščkom filtrirnega papirja, ga napolnite z vodo in ga nato postavite na stojalo v vodno kopel. Vzorčevalnik je treba postopoma potapljati, dokler nivo vode ni nad zgornjim delom tal. Nato ga je treba pustiti v vodi približno tri ure. Ker ni mogoče zadržati vse vode, ki jo absorbirajo talne kapilare, mora biti omogočeno, da se vzorec tal dve uri suši, tako da se vzorčevalnik postavi na ležišče iz zelo mokrega, fino mletega kremenovega peska, ki je nameščen v pokriti posodi (da se ne posuši). Nato je treba vzorec stehtati in pri 105 °C posušiti na konstantno maso. Zmogljivost zadrževanja vode (WHC) je nato mogoče izračunati po naslednjem postopku:
pri čemer je:
|
S
|
=
|
z vodo nasičeni substrat + masa vzorčevalnika + masa filtrirnega papirja,
|
|
T
|
=
|
tara (masa vzorčevalnika + masa filtrirnega papirja),
|
|
D
|
=
|
suha masa substrata.
|
VIR:
|
(1)
|
ISO (Mednarodna organizacija za standardizacijo) (1996). Soil Quality – Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction, št. 11268-2. ISO, Ženeva.
|
Dodatek 3
Določanje vrednosti pH tal
Naslednja metoda za določanje vrednosti pH tal temelji na opisu v ISO 10390: Kakovost tal – Določevanje pH (1).
Določena količina tal se pri sobni temperaturi suši vsaj 12 ur. Nato se izdela suspenzija tal (ki vsebuje vsaj 5 gramov tal) v petkratni količini volumna tal z 1 M analitsko čistega kalijevega klorida (KCl) ali 0,01 M raztopine analitsko čistega kalcijevega klorida (CaCl2). Suspenzija se nato pet minut temeljito stresa ter se nato vsaj 2 uri in največ 24 ur pusti, da se usede. Vrednost pH tekoče faze se nato meri z merilnikom vrednosti pH, ki je pred vsako meritvijo umerjen z ustreznimi vrstami pufrskih raztopin (npr. pH 4,0 in 7,0).
VIR:
|
(1)
|
ISO (Mednarodna organizacija za standardizacijo) (1994). Kakovost tal – Določevanje pH, št. 10390. ISO, Ženeva.
|
Dodatek 4
Gojenje deževnikov vrste Eisenia fetida/Eisenia andrei
Gojenje je po možnosti treba izvajati v klimatizirani komori pri temperaturi 20 °C ± 2 °C. Pri tej temperaturi in ob zadostni količini hrane črvi postanejo zreli po preteku približno 2 do 3 mesecev.
Obe vrsti je mogoče gojiti v zelo različnih živalskih odpadkih. Priporočeno gojišče je mešanica konjskega ali kravjega gnoja in šote v razmerju 50: 50. S preverjanji je treba zagotoviti, da krave ali konji, od katerih je gnoj pridobljen, niso zdravljene ali tretirane s kemikalijami, kot so pospeševalci rasti, nematicidi ali podobni veterinarski proizvodi, ki lahko med preskusom škodljivo vplivajo na črve. Priporočen je samostojno zbrani kravji gnoj iz ‚ekološkega‘ vira, saj so izkušnje pokazale, da lahko na trgu dostopni gnoj, ki se uporablja kot gnojilo za vrt, škodljivo vpliva na črve. Gojišče mora imeti vrednost pH približno 6–7 (uravnavano s kalcijevim karbonatom), majhno ionsko prevodnost (manj kot 6 mS/cm ali manj kot 0,5-odstotno koncentracijo soli) in ne sme biti pretirano kontaminirano z amonijakom ali živalskim urinom. Substrat mora biti vlažen, vendar ne preveč moker. Primerne so škatle za gojenje s prostornino od 10 do 50 litrov.
Za črve standardne starosti in velikosti (mase) je gojenje najbolje začeti s kokoni. Ko je kultura vzpostavljena, se vzdržuje tako, da se odrasli črvi za obdobje 14–28 dni namestijo v škatlo za gojenje s svežim substratom, kar omogoča produkcijo dodatnih kokonov. Nato se odrasli osebki odstranijo, mladiči, ustvarjeni iz kokonov, pa se uporabijo kot osnova za novo kulturo. Črvi se neprekinjeno hranijo z živalskimi odpadki in občasno prenesejo v svež substrat. Izkušnje so pokazale, da je primerna hrana na zraku posušen, fino zmlet kravji ali konjski gnoj ali ovsena kaša. Treba je zagotoviti, da krave ali konji, od katerih je pridobljen gnoj, niso zdravljene s kemikalijami, kot so pospeševalci rasti, ki lahko med dolgotrajnim gojenjem škodljivo vplivajo na črve. Črvi, ki so se izlegli iz kokonov, se uporabijo za preskušanje, ko dosežejo starost med 2 in 12 meseci in veljajo za odrasle.
Velja, da so črvi zdravi, če se premikajo skozi substrat, če ne skušajo zapustiti substrata in če se neprestano razmnožujejo. Izčrpanost substrata se kaže tako, da se črvi premikajo zelo počasi in da je njihov zadnji del rumen. V tem primeru je priporočena dobava novega substrata in/ali zmanjšanje gostote populacije živali.
Dodatek 5
Tehnike štetja mladih črvov, izleženih iz kokonov
Ročno razvrščanje črvov iz substrata tal je časovno zelo potratno. Zato se priporočata dve alternativni metodi:
|
(a)
|
Preskusne posode se postavijo v vodno kopel, pri čemer na začetku temperatura znaša 40 °C, nato pa narašča do 60 °C. Po približno 20 minutah bi se morali mladi črvi pojaviti na površini tal, od koder jih je enostavno odstraniti in prešteti.
|
|
(b)
|
Preskusna tla se lahko izperejo prek sita z metodo, ki so jo razvili van Gestel in drugi (1) pod pogojem, da so bili šota in gnoj ali ovsena kaša, ki so bili dodani tlom, zmleti v fin prah. Dve siti z velikostjo mreže 0,5 mm (in premerom 30 cm) se postavita eno na drugega. Vsebina preskusne posode se opere skozi siti z močnim curkom vodovodne vode, pri čemer mladi črvi in kokoni večinoma ostanejo na zgornjem situ. Pomembno je opozoriti, da mora biti med tem postopkom celotna površina zgornjega sita ves čas mokra, tako da mladi črvi lebdijo na prevleki iz vode, kar preprečuje, da bi spolzeli skozi pore sita. Rezultati so najboljši, če je uporabljena ročka za tuš.
|
Ko je skozi sito opran ves substrat tal, se mladiče in kokone lahko spere z zgornjega sita v posodo. Nato se vsebina posode pusti stati, kar omogoča, da prazni kokoni lebdijo na površini vode, polni kokoni in mladi črvi pa potonejo na dno. Stoječo vodo se nato lahko odlije, mlade črve in kokone pa prenese v petrijevko, v kateri je malo vode. Črvi se za štetje lahko odstranijo z iglo ali pinceto.
Izkušnje so pokazale, da je metoda (a) primernejša za ekstrakcijo mladih črvov, ki jih je mogoče izprati celo skozi 0,5-milimetrsko sito.
Vedno je treba določiti učinkovitost metode, uporabljene za odstranjevanje črvov (in kokonov, če je to primerno) iz substrata tal. Če se črvi zbirajo z ročnim razvrščanjem, je postopek na vseh vzorcih priporočljivo izvesti dvakrat.
VIR:
|
(1)
|
Van Gestel, C. A. M., van Dis, W. A., van Breemen, E. M., Sparenburg, P. M. (1988). Comparison of two methods determining the viability of cocoons produced in earthworm toxicity experiments. Pedobiologia 32:367–371.
|
Dodatek 6
Pregled statistične ocene podatkov (določitev vrednosti NOEC)

C.34. DOLOČANJE ZAVIRANJA DELOVANJA ANAEROBNIH BAKTERIJ – ZMANJŠANJE NASTAJANJA PLINA IZ ANAEROBNO GNIJOČEGA BLATA (IZ ODPLAK)
UVOD
|
1.
|
Ta preskusna metoda je enakovredna Smernici za preskušanje OECD (TG) 224 (2007). Kemikalije, izpuščene v vodno okolje, prehajajo prek aerobnih in anaerobnih območij, kjer lahko razpadejo in/ali zavirajo delovanje bakterij; v nekaterih primerih lahko nemoteno ostajajo v anaerobnih območjih več desetletij in še dlje. Pri čiščenju odpadne vode je prva stopnja, primarni usedalnik, aerobna v tekočini supernatanta in anaerobna v blatu subnatanta. Temu sledi sekundarna stopnja z aerobnim območjem v bazenu za prezračevanje aktivnega blata in anaerobnim območjem v blatu subnatanta v bazenu sekundarnega usedalnika. Blato iz obeh stopenj je po navadi izpostavljeno anaerobnemu čiščenju, pri čemer nastajata metan in ogljikov dioksid, ki se običajno uporabljata za proizvodnjo električne energije. V širšem okolju je verjetno, da bodo kemikalije, ki dosežejo usedline v zalivih, rečnih ustjih in morju, ostale v teh anaerobnih območjih neomejeno dolgo, če niso biorazgradljive. Nekatere kemikalije bodo po možnosti dosegle ta območja v večjih deležih zaradi svojih fizikalnih lastnosti, kot so slaba topnost v vodi, visoka stopnja adsorpcije na suspendirane trdne snovi in nezmožnost aerobne biorazgradljivosti.
|
|
2.
|
Čeprav je zaželeno, da so kemikalije, izpuščene v okolje, biorazgradljive v aerobnih in anaerobnih pogojih, je ključnega pomena, da takšne kemikalije ne zavirajo dejavnosti mikroorganizmov v nobenem od obeh območij. V Združenem kraljestvu je nekaj primerov popolnega zavrtja nastajanja metana, ki ga je povzročil, na primer, pentaklorofenol v industrijskih izpustih, kar je vodilo k dragemu prevozu zavrtega blata iz gnilišč na ‚varna mesta‘ in uvozu zdravo gnijočega blata iz sosednjih naprav. Obstaja pa veliko primerov manj resne prekinitve gnitja zaradi več drugih kemikalij, vključno z alifatskimi halogeniranimi ogljikovodiki (iz kemičnih čistilnic) in detergenti, kar je znatno poslabšalo učinkovitost gnilišča.
|
|
3.
|
Samo ena preskusna metoda, C.11 (1), se ukvarja z zaviranjem delovanja bakterij (dihanja aktivnega blata); ocenjuje učinek preskusnih kemikalij na hitrost privzema kisika v prisotnosti substrata. Metoda se pogosto uporablja za zgodnje opozarjanje o možnih škodljivih učinkih kemikalij na aerobno čiščenje odpadnih vod, pa tudi kot kazalnik neinhibitornih koncentracij preskusnih kemikalij, ki bodo uporabljene v različnih preskusih biorazgradljivosti. Preskusna metoda C.43 (2) omogoča omejeno možnost za določanje strupenosti preskusne kemikalije za plin, ki ga proizvaja anaerobno blato, razredčeno na eno desetino svoje običajne koncentracije trdnih snovi, kar omogoča zahtevano natančnost pri oceni odstotka biorazgradljivosti. Ker je razredčeno blato lahko občutljivejše na inhibitorne kemikalije, se je skupina ISO odločila, da pripravi metodo z uporabo nerazredčenega blata. Pregledana so bila vsaj tri besedila (z Danske, iz Nemčije in iz Združenega kraljestva) in na koncu sta bila pripravljena dva standarda ISO; prvi, ISO 13 641-1 (3), z uporabo nerazredčenega blata, drugi, ISO 13 641-2 (4), pa z uporabo na eno stotino razredčenega blata, kar predstavlja blata in usedline z majhnimi populacijami bakterij. Pri obeh metodah je bil opravljen krožni preskus (5); 1. del je bil potrjen kot sprejemljiv standard, glede 2. dela pa je prišlo do nesoglasja. Predstavniki Združenega kraljestva so menili, da metoda zahteva nadaljnje proučevanje, ker je znaten delež udeležencev poročal o zelo majhnem ali ničnem nastajanju plina, deloma zato, ker je bil prostor za plin v odstotkih prevelik (pri 75 %) za optimalno občutljivost.
|
|
4.
|
Zgodnejše delo v Združenem kraljestvu (6)(7) je opisovalo manometrično metodo z nerazredčenim gnijočim blatom in nepredelanim blatom iz odplak kot substratom v 500-mililitrskih bučkah; naprava je bila nerodna, smrad nepredelanega blata pa neprijeten. Kasneje so Wilson in drugi uspešno uporabili kompaktnejšo in priročnejšo napravo Sheltona in Tiedjeja (8), kot sta jo razvila Battersby in Wilson (9)(10). Kawahara in drugi (11) so v laboratoriju uspešno pripravili več standardnih blat za uporabo v preskusih za anaerobno biorazgradljivost in zaviranje pri več kemikalijah. Poleg tega je bilo pri izvedbi preskusa nepredelano blato kot substrat zamenjano z anaerobnim blatom, razredčenim na eno stotino, ali z blati, usedlinami itd. s šibkim delovanjem bakterij.
|
|
5.
|
S to metodo je mogoče pridobiti informacije, ki so uporabne pri predvidevanju verjetnega učinka preskusne kemikalije na nastajanje plina v anaerobnih gniliščih. Vendar lahko le daljši preskusi, ki natančneje posnemajo delujoča gnilišča, pokažejo, ali lahko pride do prilagoditve mikroorganizmov preskusni kemikaliji in ali se lahko kemikalije, za katere je verjetno, da se bodo absorbirale in adsorbirale na blato, v daljšem časovnem obdobju, kot ga omogoča ta preskus, nakopičijo do koncentracije, ki je strupena.
|
NAČELO PRESKUSA
|
6.
|
Alikvoti zmesi anaerobno gnijočega blata (od 20 g/l do 40 g/l vseh snovi v trdnem stanju) in razgradljiva raztopina substrata se inkubirajo do 3 dni v zatesnjenih posodah posamezno in hkrati z razponom koncentracij preskusne kemikalije. Količina nastalega plina (metana in ogljikovega dioksida) se meri prek povečanja tlaka (Pa) v steklenicah. Odstotek zaviranja nastajanja plina, ki so ga povzročile različne koncentracije preskusne kemikalije, se izračuna iz količin, pridobljenih v zadevnih preskusnih in kontrolnih steklenicah. Vrednost EC50 in druge učinkovite koncentracije se izračunajo iz krivulj odstotka zaviranja v primerjavi s koncentracijo preskusnih kemikalij ali, pogosteje, njenega logaritma.
|
INFORMACIJE O PRESKUSNI KEMIKALIJI
|
7.
|
Preskusne kemikalije je običajno treba uporabljati v najčistejši obliki, ki je lahko dostopna, saj so lahko nečistote v nekaterih kemikalijah, npr. klorofenolih, precej bolj strupene od preskusne kemikalije same. Vendar je treba upoštevati potrebe po preskušanju kemikalij v obliki, v kateri so proizvedene/dane na trg. Uporaba formuliranih produktov običajno ni priporočljiva, pri slabo topnih preskusnih kemikalijah pa je uporaba formuliranega materiala lahko primerna. Lastnosti preskusne kemikalije, ki morajo biti na voljo, vključujejo topnost v vodi in nekaterih organskih topilih, parni tlak, adsorpcijski koeficient, hidrolizo in biorazgradljivost v anaerobnih pogojih.
|
UPORABA METODE
|
8.
|
Preskus se uporablja pri kemikalijah, ki so topne ali netopne v vodi, vključno s hlapnimi kemikalijami. Vendar pa je posebna previdnost potrebna pri materialih z nizko topnostjo v vodi (glej vir (12)) in visoko hlapnostjo. Uporabljajo se lahko tudi inokulumi z drugih anaerobnih mest, npr. blat, nasičenih tal, usedlin. Anaerobne bakterijske sisteme, ki so bili prej izpostavljeni strupenim kemikalijam, je mogoče prilagoditi tako, da ohranijo svojo dejavnost v prisotnosti ksenobiotičnih kemikalij. Inokulumi iz prilagojenih bakterijskih sistemov lahko v primerjavi z inokulumi, pridobljenimi iz neprilagojenih sistemov, kažejo večjo toleranco na preskusne kemikalije.
|
REFERENČNE KEMIKALIJE
|
9.
|
Za preverjanje postopka se referenčna kemikalija preskusi s postavitvijo ustreznih posod vzporedno kot del običajnih potekov preskusa; izkazalo se je, da je 3,5-diklorofenol dosleden zaviralec anaerobnega nastajanja plinov, pa tudi porabe kisika aktivnega blata in drugih biokemičnih reakcij. Dve drugi kemikaliji, metilen bis-tiocianat in pentaklorofenol, sta se izkazali kot močnejša zaviralca nastajanja metana od 3,5-diklorofenola, vendar pa rezultati pri njiju niso potrjeni. Pentaklorofenol se ne priporoča, ker ni lahko dostopen v čisti obliki.
|
OBNOVLJIVOST REZULTATOV
|
10.
|
V mednarodnem krožnem preskusu (5) je bila obnovljivost med 10 sodelujočimi laboratoriji primerna le pri vrednostih EC50 za 3,5-diklorofenol in 2-bromo-etan sulfonsko kislino. (Razpon prve je bil od 32–502 mg/l, slednje pa 220–2 190 mg/l.)
|
Število laboratorijev
|
V mg/l
|
V mg/g blata
|
|
srednja vrednost
|
st. odklon
|
KV (%)
|
srednja vrednost
|
st. odklon
|
KV (%)
|
|
|
3,5-diklorofenol
|
|
10
|
153
|
158
|
103
|
5
|
4,6
|
92
|
|
|
2-bromo-etan sulfonska kislina
|
|
10
|
1 058
|
896
|
85
|
34
|
26
|
76
|
|
Podatki o EC50 iz krožnega preskusa – nerazredčeno blato
|
11.
|
Visoki koeficienti variacije med laboratoriji v veliki meri kažejo na razlike v občutljivosti mikroorganizmov v blatu zaradi predhodne izpostavljenosti ali zaradi predhodne neizpostavljenosti preskusni kemikaliji ali drugim kemično sorodnim kemikalijam. Natančnost, s katero je bila določena vrednost EC50 na osnovi koncentracije blata, je bila komaj kaj boljša od ‚volumetrične‘ vrednosti (mg/l). Trije laboratoriji, ki so poročali o natančnosti svojih vrednosti EC50 za 3,5-diklorofenol, so kazali koeficiente variacije (22, 9 oziroma 18 % za EC50 mg/g), ki so bili precej nižji od koeficientov variacije srednjih vrednosti vseh desetih laboratorijev. Posamezne srednje vrednosti za omenjene tri laboratorije so bile 3,1, 3,2 oziroma 2,8 mg/g. Nižji, sprejemljivi koeficienti variacije znotraj laboratorijev v primerjavi s precej višjimi koeficienti med laboratoriji, namreč 9–22 % v prim. z 92 %, kažejo, da obstajajo značilne razlike med lastnostmi posameznih blat.
|
OPIS METODE
Naprava
|
12.
|
Zahtevani so običajna laboratorijska oprema in naslednje:
|
a)
|
inkubator – biti mora zaščiten pred iskrami in nastavljen na 35 °C ± 2 °C;
|
|
b)
|
na tlak odporne preskusne posode ustrezne nazivne velikosti (17); vsaka mora biti opremljena z zaporko, prevlečeno s plinotesno prevleko, ki lahko prenese tlak približno 2 bar ali 2 × 105 Pa (za prevleko uporabite npr. PTFE = politetrafluoreten). Priporočljive so steklene serumske steklenice nazivne prostornine 125 ml in z dejansko prostornino približno 160 ml, zatesnjene s serumskimi zaporkami (18) in z aluminijastimi zapornimi obročki, vendar pa je mogoče uspešno uporabljati steklenice s skupno prostornino med 0,1 litra in 1 litrom;
|
|
c)
|
natančen merilnik tlaka (19) s priključkom za iglo;
|
|
d)
|
skupno nastajanje plina (metana in ogljikovega dioksida), merjeno z merilnikom tlaka, prilagojenim tako, da omogoča merjenje in odvajanje nastalega plina. Primer ustreznega instrumenta je ročni natančni merilnik tlaka, povezan z injekcijsko iglo; trojni plinotesni petelinček olajša sprostitev odvečnega tlaka (Dodatek 1). Notranjo prostornino cevi in ventila tipala diferenčnega tlaka je treba vzdrževati na čim manjši ravni, tako da so napake, ki nastanejo zaradi zanemarjanja prostornine opreme, nepomembne;
|
|
e)
|
izolirane posode za prevoz gnijočega blata;
|
|
g)
|
sito s kvadratnimi 1-milimetrskimi odprtinami;
|
|
h)
|
rezervoar za gnijoče blato, steklena steklenica ali steklenica iz polietilena visoke gostote s prostornino približno 5 litrov, opremljena z mešalom in opremo za prehod toka dušikovega plina (glej odstavek 13) skozi prostor nad fazno mejo plin-kapljevina;
|
|
i)
|
membranski filtri (0,2 μm) za sterilizacijo substrata;
|
|
j)
|
mikrobrizge za plinotesno povezavo tipala diferenčnega tlaka (glej odstavek 12(c)) s prostorom nad fazno mejo plin-kapljevina v steklenicah (glej odstavek 12(b)); tudi za dodajanje netopnih tekočih preskusnih materialov v steklenice;
|
|
k)
|
komora z rokavicami: neobvezna, a priporočljiva, s rahlo pozitivnim tlakom dušika.
|
|
Reagenti
|
13.
|
Ves čas se uporabljajo analitsko čisti reagenti. Ves čas je treba uporabljati dušikov plin visoke čistosti z vsebnostjo kisika, manjšo od 5 μl/l.
|
Voda
|
14.
|
Če je v kateri koli fazi potrebna razredčitev, uporabite predhodno razplinjeno deionizirano vodo. Analitske kontrole te vode niso potrebne, poskrbite pa za redno vzdrževanje naprave za deionizacijo. Deionizirano vodo uporabite tudi za pripravo založnih raztopin. Pred dodajanjem anaerobnega inokuluma kateri koli raztopini ali razredčitvi preskusnega materiala se prepričajte, da raztopina ali razredčitev ne vsebujeta kisika. To storite z enournim razpihavanjem dušikovega plina skozi vodo za redčenje (ali skozi razredčitve) pred dodajanjem inokuluma, druga možnost pa je, da v ozračju brez kisika vodo za redčenje ogrejete do vrelišča in jo ohladite na sobno temperaturo.
|
Pregnito blato
|
15.
|
Zberite aktivno gnijoče blato iz gnilišča v čistilni napravi za odpadne vode ali, namesto tega, iz laboratorijskega gnilišča, kjer se čisti blato večinoma iz gospodinjskih odplak. Praktične informacije o blatu iz laboratorijskega gnilišča je mogoče najti drugje (11). Če se namerava uporabiti prilagojeni inokulum, je mogoče razmisliti o gnijočem blatu iz čistilne naprave za industrijske odplake. Za zbiranje blata uporabite steklenice s širokim vratom, izdelane iz polietilena visoke gostote ali podobnega materiala, ki se lahko razteza. Steklenice za vzorce napolnite z blatom do približno 1 cm od vrha steklenic, steklenice dobro zatesnite, po možnosti z varnostnim ventilom (odstavek 12(e)), in jih postavite v izolirane posode (odstavek 12(d)), da kar najbolj zmanjšate možnost temperaturnega šoka; v teh posodah naj stojijo do prenosa v inkubator, v katerem se vzdržuje temperatura 35 °C ± 2 °C. Pri odpiranju steklenic poskrbite, da boste sprostili odvečni tlak plina, tako da previdno sprostite tesnilo ali pa uporabite trojni petelinček za sprostitev tlaka (odstavek 12(e)). Po možnosti blato uporabite v nekaj urah po zbiranju, v nasprotnem primeru ga do 3 dni, ko običajno ne pride do velike izgube aktivnosti, hranite pri temperaturi 35 °C ± 2 °C pod prostorom nad fazno mejo dušik-kapljevina, napolnjenim z dušikom.
Opozorilo – Gnijoče blato proizvaja vnetljive pline, ki povzročajo tveganje za požar in eksplozijo. Vsebuje tudi potencialno patogene organizme, zato pri ravnanju z njim upoštevajte ustrezne previdnostne ukrepe. Za zbiranje blata zaradi varnosti ne uporabljajte steklenih posod.
|
Inokulum
|
16.
|
Blato tik pred uporabo rahlo premešajte in ga prek sita z odprtinami velikosti 1 mm2 (odstavek 12(f)) precedite v primerno steklenico (odstavek 12(g)) skozi prostor nad fazno mejo plin-kapljevina, skozi katerega se pomika tok dušika. Oddelite vzorec za merjenje koncentracije celotne količine suhih trdnih snovi (glej npr. ISO 11923 (13) ali enakovredni standard EU). V splošnem uporabljajte blato brez redčenja. Koncentracija trdnih snovi je običajno med 2 % in 4 % (m/v). Preverite vrednost pH in jo po potrebi prilagodite na 7 ± 0,5.
|
Preskusni substrat
|
17.
|
V deionizirani vodi raztopite 10 g hranilnega bujona (npr. bujona Oxoid), 10 g kvasnega ekstrakta in 10 g D-glukoze ter razredčite na 100 ml. Sterilizirajte s filtracijo prek 0,2-mikrometrskega membranskega filtra (odstavek 12(h)) in uporabite takoj ali hranite pri temperaturi 4 °C, vendar največ en dan.
|
Preskusna kemikalija
|
18.
|
Pripravite ločeno založno raztopino za vsako vodotopno preskusno kemikalijo, ki bo vsebovala na primer 10 g/l kemikalije v vodi za redčenje brez kisika (odstavek 14). Za pripravo reakcijskih zmesi, ki vsebujejo po stopnjah razvrščene koncentracije, uporabite ustrezne količine teh založnih raztopin. Namesto tega pripravite razredčeno serijo vsake založne raztopine, tako da bo količina, dodana preskusnim steklenicam, enaka za vsako zahtevano končno koncentracijo. Vrednost pH založnih raztopin mora biti po potrebi prilagojena na 7 ± 0,2.
|
|
19.
|
Za preskusne kemikalije, ki niso zadostno topne v vodi, upoštevajte standard ISO 10 634 (12) ali enakovredni standard EU. Če je treba uporabiti organsko topilo, se izogibajte topilom, kot sta kloroform in ogljikov tetraklorid, za katera je dobro znano, da zavirajo nastajanje metana. V primernem hlapnem topilu, na primer acetonu ali dietil etru, pripravite raztopino ustrezne koncentracije kemikalije, ki ni topna v vodi. Potrebne količine raztopine topila dodajte v prazne preskusne steklenice (odstavek 12(b)), pred dodajanjem blata pa naj topilo izhlapi. Za druge obdelave uporabite standard ISO 10 634 (12) ali enakovredni standard EU, zavedajte pa se, da lahko morebitne površinsko aktivne snovi, uporabljene za pridobivanje emulzij, zavirajo anaerobno nastajanje plina. Če se zdi, da prisotnost organskih topil in emulgatorjev povzroča artefakte, se preskusna kemikalija lahko doda neposredno v preskusno zmes v obliki prahu ali tekočine. Hlapne kemikalije in v vodi netopne tekoče preskusne kemikalije se lahko z mikrobrizgami vbrizgajo v inokulirane serumske steklenice (odstavek 12(i)).
|
|
20.
|
Preskusne kemikalije dodajajte v steklenice tako, da boste dobili geometrijsko vrsto koncentracij, na primer 500 mg/l, 250 mg/l, 125 mg/l, 62,5 mg/l, 31,2 mg/l in 15,6 mg/l. Če območje strupenosti ni znano na podlagi podobnih kemikalij, najprej izvedite predhodni preskus za določanje območja delovanja s koncentracijami 1 000 mg/l, 100 mg/l in 10 mg/l, da določite ustrezno območje.
|
Referenčna kemikalija
|
21.
|
Pripravite vodno raztopino 3,5-diklorofenola (10 g/l), tako da med stresanjem postopno dodajate minimalno količino 5 mol/l raztopine natrijevega hidroksida trdni snovi, dokler se ne raztopi. Nato dodajte deoksigenirano vodo za redčenje (odstavek 14) do zahtevane količine; pri raztapljanju lahko pomaga ultrazvočno razbijanje. Če je v vsaj treh preskusih z različnim inokulumom (različni viri ali različni časi zbiranja) pridobljeno povprečno območje vrednosti EC50, se lahko uporabijo druge referenčne kemikalije.
|
MOTNJE/NAPAKE
|
22.
|
Nekatere sestavine blata bi predvidoma lahko reagirale s potencialnimi zaviralci in zato ne bi bile več na voljo mikroorganizmom, zaviranje pa bi bilo manjše ali pa ga ne bi bilo. Če blato že vsebuje kemikalijo, ki je zaviralna, bi bili rezultati napačni, če bi bila ta kemikalija preskušena. Poleg teh možnosti obstaja več drugih ugotovljenih dejavnikov, ki lahko povzročijo napačne rezultate. Ti so našteti v Dodatku 3, skupaj z metodami odpravljanja napak ali vsaj zmanjševanja števila napak.
|
PRESKUSNI POSTOPEK
|
23.
|
Število potrebnih ponovitev je odvisno od stopnje natančnosti, zahtevane za kazalnike zaviranja. Če so tesnila na steklenicah med trajanjem preskusa dovolj plinotesna, pripravite le eno serijo (vsaj tri ponovitve) preskusnih steklenic pri vsaki zahtevani koncentraciji. Podobno pripravite eno serijo steklenic z referenčno kemikalijo in en niz kontrol. Če pa so tesnila steklenic zanesljiva le pri enem prebadanju ali nekaj prebadanjih, pripravite serijo preskusnih steklenic (npr. tri ponovitve) za vsak časovni razmik (t), za katerega so rezultati zahtevani za vse koncentracije preskusne kemikalije, namenjene preskušanju. Podobno pripravite ‚t‘ serije steklenic za referenčno kemikalijo in kontrole.
|
|
24.
|
Priporočljiva je uporaba komore z rokavicami (odstavek 12(j)). Vsaj 30 minut pred začetkom preskusa skozi komoro z rokavicami, ki vsebuje vso potrebno opremo, zaženite tok dušikovega plina. Poskrbite, da bo med rokovanjem s steklenicami in zatesnjevanjem steklenic temperatura blata v območju 35 °C ± 2 °C.
|
Predhodni preskus
|
25.
|
Če aktivnost blata ni znana, je priporočljivo izvesti predhodni preskus. Pripravite kontrole, da dosežete, na primer, koncentracije trdnih snovi 10 g/l, 20 g/l in 40 g/l, ter substrat, vendar ne uporabite preskusne kemikalije. Pripravite tudi različne količine reakcijske zmesi, da pridobite tri ali štiri razmerja količine prostora nad fazno mejo plin-kapljevina in količine tekočine. Iz rezultatov količin plina, nastalih v različnih časovnih razmikih, se izpeljejo najprimernejši pogoji, ki omogočajo dve dnevni merjenji ustvarjenih znatnih količine plina in eno sprostitev tlaka na dan pri optimalni občutljivosti (20) brez nevarnosti eksplozij.
|
Dodajanje preskusnih kemikalij
|
26.
|
V prazne preskusne steklenice (odstavek 12(b)) dodajte vodotopne preskusne kemikalije v obliki vodnih raztopin (odstavek 18). Uporabite vsaj trojne serije steklenic za vsako območje koncentracij (odstavek 20). Če so preskusne kemikalije netopne ali slabo topne, njihove raztopine v organskih topilih z mikrobrizgo injicirajte v prazne steklenice, da boste pridobili serije ponovitev vsake od petih koncentracij preskusne kemikalije. Prek površine raztopin v preskusnih steklenicah spustite curek dušikovega plina, da bo topilo izhlapelo. Namesto tega lahko dodate netopne trdne kemikalije v obliki tehtanih količin trdnih snovi neposredno v preskusne steklenice.
|
|
27.
|
Če se tekoče preskusne kemikalije, ki niso topne ali so slabo topne v vodi, ne dodajo s topilom, jih v preskusne steklenice dodajte neposredno z mikrobrizgo po dodajanju inokuluma in preskusnega substrata (glej odstavek 30). Na enak način se lahko dodajajo hlapne preskusne kemikalije.
|
Dodajanje inokuluma in substrata
|
28.
|
V 5-litrsko steklenico (odstavek 12(g)) zmešajte ustrezno količino presejanega gnijočega blata (glej odstavek 16), med tem pa skozi prostor nad fazno mejo plin-kapljevina pošiljajte tok dušikovega plina. Preskusne steklenice, ki vsebujejo vodne raztopine ali raztopine preskusnih kemikalij z izhlapelim topilom dve minuti spirajte s tokom dušikovega plina, da odstranite zrak. S pipeto z veliko konico ali z merilnim valjem odmerite alikvote, npr. 100 ml, dobro zmešanega blata v preskusne steklenice. Pipeto morate zaradi lažjega usedanja trdnih snovi iz blata nujno napolniti do točne zahtevane količine blata v enem samem koraku. Če je zajetega več, spraznite pipeto in začnite znova.
|
|
29.
|
Nato dodajte zadostno raztopino substrata (odstavek 17), da bo koncentracija hranilnega bujona, kvasnega ekstrakta in D-glukoze v zmesi znašala po 2 g/l vsakega, pri tem pa mora skozi še vedno teči dušik. Naslednje je primer preskusnih serij.
|
Končna koncentracija preskusne kemikalije v preskusnih steklenicah
(mg/l)
|
Prostornina preskusne kemikalije
(ml)
|
Reagenti in medij
(ml)
|
|
založna raztopina a)10 g/lodstavek 18
|
založna raztopina b)1 g/lodstavek 18
|
voda za redčenje
odstavek 14
|
inokulum
odstavek 16
|
substrat
odstavek 17
|
|
0
|
—
|
0
|
1,0
|
100
|
2
|
|
1
|
—
|
0,1
|
0,9
|
100
|
2
|
|
3,3
|
—
|
0,33
|
0,67
|
100
|
2
|
|
10
|
0,1
|
—
|
0,9
|
100
|
2
|
|
33
|
0,33
|
—
|
0,67
|
100
|
2
|
|
100
|
1,0
|
—
|
0
|
100
|
2
|
|
Celotna prostornina steklenice = 160 ml. Prostornina tekočine = 103 ml
Prostornina plina = 57 ml ali 35,6 % celotne prostornine.
|
|
|
30.
|
Z dušikovim plinom podobno kot prej dobro sperite zadostno število praznih preskusnih steklenic, da odstranite morebitno hlapno in netopno tekočo preskusno kemikalijo (glej odstavek 27).
|
Kontrole in referenčne kemikalije
|
31.
|
Pripravite vsaj trojne serije steklenic, ki naj vsebujejo samo blato in substrat ter bodo služile kot kontrole. Pripravite dodatne steklenice za ponovitve, ki naj vsebujejo blato in substrat ter dovolj založne raztopine referenčne kemikalije, 3,5-diklorofenola (odstavek 21), da bo končna koncentracija znašala 150 mg/l. Ta koncentracija bi morala zavreti nastajanje plina za približno 50 %. Namesto tega lahko pripravite serijo koncentracij referenčne kemikalije. Poleg tega pripravite štiri dodatne steklenice za merjenje pH, ki bodo vsebovale blato, deoksigenirano vodo in substrat. V dve steklenici dodajte preskusno kemikalijo v največji koncentraciji, ki bo preskušana, v preostali dve steklenici pa dodajte deoksigenirano vodo.
|
|
32.
|
Poskrbite, da bodo vse steklenice – s preskusnimi in referenčnimi kemikalijami ter kontrolami – vsebovale enako količino (VR) tekočine; po potrebi za dopolnjevanje količine dodajte deoksigenirano deionizirano vodo (odstavek 14). Velikost prostora nad fazno mejo plin-kapljevina mora biti med 10 % in 40 % prostornine steklenice, dejansko vrednost pa je treba določiti na podlagi podatkov, pridobljenih iz predhodnega preskusa. Po dodajanju vseh sestavin v steklenice odstranite iglo, skozi katero priteka plin, in zatesnite vsako steklenico z zamaškom iz kavčuka in aluminijastim pokrovčkom (odstavek 12(b)), pri tem pa za lažje vstavljanje navlažite zamašek s kapljico deionizirane vode. S stresanjem zmešajte vsebini obeh steklenic.
|
Inkubacija steklenic
|
33.
|
Prenesite steklenice v termostatsko nadzorovan inkubator, po možnosti opremljen s stresalnikom, katerega temperatura je vzdrževana v območju 35 °C ± 2 °C. Steklenice se inkubirajo v temi. Po približno 1 uri izenačite tlak v steklenicah s tlakom ozračja, tako da injekcijsko iglo, pritrjeno na merilnik tlaka (odstavek 12(c)), skozi tesnilo po vrsti vstavite v vsako steklenico, odprete ventil in počakate, da merilnik tlaka prikaže vrednost nič, na koncu pa zaprete ventil. Iglo je treba vstaviti pod kotom približno 45°, da se prepreči uhajanje plina iz steklenic. Če so steklenice inkubirane brez stresalne naprave, jih med inkubacijo vsak dan dvakrat ročno pretresite, da uravnotežite sistem. Steklenice inkubirajte in jih obrnite, da preprečite uhajanje plina skozi zaporko. Vendar pa obračanje v primerih, ko bi se netopne preskusne kemikalije lahko prilepile na dno bučke, ni primerno.
|
Merjenje tlaka
|
34.
|
Ko steklenice dosežejo temperaturo 35 °C ± 2 °C, izmerite in zabeležite vrednost pH vsebine dveh od štirih steklenic, pripravljenih v ta namen, in zavrzite vsebino; preostali steklenici še naprej inkubirajte v temi. Dvakrat na dan v naslednjih 48 do 72 urah izmerite in zabeležite tlak v steklenicah, tako da iglo merilnika tlaka po vrsti vstavljate skozi tesnilo vsake steklenice, med merjenji pa iglo osušite. Med merjenjem, ki ga je treba izvesti čim hitreje, ohranjajte temperaturo vseh delov steklenice pri temperaturi inkubacije. Pustite, da se odčitek tlaka stabilizira, in ga zabeležite. Nato odprite ventil za zračenje in ga zaprite, ko odčitani tlak pade na nič. Običajno preskus nadaljujte 48 ur, merjeno od prvega izenačevanja tlaka, kar je označeno s ‚čas 0‘. Število odčitkov in prezračevanj mora biti za hlapne kemikalije omejeno na ena (ob koncu inkubacije) ali dve, da so izgube preskusne kemikalije kar najmanjše (10).
|
|
35.
|
Če je odčitek tlaka negativen, ventila ne odpirajte. Včasih se v injekcijski igli in ceveh nabere vlaga, kar se odrazi na odčitku tlaka, ki je rahlo negativen. V tem primeru odstranite iglo, pretresite cevi, jih osušite s krpo in namestite novo iglo.
|
Merjenje vrednosti pH
|
36.
|
Po zadnjem merjenju tlaka izmerite in zabeležite vrednost pH vsebine vsake steklenice.
|
PODATKI IN POROČANJE
Prikaz rezultatov
|
37.
|
Izračunajte vsoto in povprečje tlakov, zabeleženih ob vsakem časovnem razmiku za vsako serijo steklenic za ponovitve ter izračunajte srednjo vrednost kumulativne bruto vrednosti tlaka plina ob vsakem časovnem razmiku za vsako serijo ponovitev. Za steklenice s kontrolno, preskusno in referenčno kemikalijo izrišite krivulje srednje vrednosti kumulativne vrednosti nastajanja plina (Pa) v odvisnosti od časa. Na linearnem delu krivulje izberite čas, običajno je to 48 ur, in iz enačbe [1] izračunajte odstotek zaviranja (I) za vsako koncentracijo:
|
I = (1 – Pt/PC) × 100
|
[1],
|
pri čemer so:
|
I
|
odstotek zaviranja v %,
|
|
Pt
|
tlak plina, nastalega s preskusnim materialom v izbranem času v paskalih (Pa),
|
|
Pc
|
tlak plina, nastalega v kontroli v istem času v paskalih (Pa).
|
Priporočljivo je izrisati obe krivulji, tj. krivuljo I v odvisnosti od koncentracije in krivuljo I v odvisnosti od logaritma koncentracije, tako da je mogoče izbrati krivuljo, ki je bolj linearna. Vrednost EC50 (mg/l) ocenite vizualno ali z regresijsko analizo iz krivulje, ki je bolj linearna. Za primerjavo je morda bolj uporabno izraziti koncentracijo kemikalije v mg kemikalije/g celotne količine suhih trdnih snovi. Da pridobite to koncentracijo, delite volumetrično koncentracijo (mg/l) s prostorninsko koncentracijo suhih trdnih snovi v blatu (g/l) (odstavek 16).
|
|
38.
|
Izračunajte odstotek zaviranja, dosežen z eno samo koncentracijo uporabljene referenčne kemikalije, ali vrednost EC50, če je proučenih dovolj koncentracij.
|
|
39.
|
Z upoštevanjem umeritvene krivulje merilnika tlaka (Dodatek 2) pretvorite srednjo vrednost tlaka, pridobljenega v kontroli Pc (Pa), v prostornino in iz tega izračunajte prirast plina, izraženo v obliki prostornine, pridobljeno v 48 urah iz 100 ml nerazredčenega blata pri koncentraciji trdnih snovi od 2 % (20 g/l) do 4 % (40 g/l).
|
Merila za veljavnost
|
40.
|
Rezultati medlaboratorijske primerjave ISO (5) so dokazali, da je referenčna kemikalija (3,5-diklorofenol) povzročila 50-odstotno zaviranje nastajanja plina v območju koncentracij od 32 mg/l do 510 mg/l s srednjo vrednostjo 153 mg/l (odstavek 10). To območje je tako široko, da trdnih meja za zaviranje ni mogoče z gotovostjo določiti kot merilo za veljavnost; to bi moralo postati mogoče, ko bo napredek pokazal, kako proizvesti bolj skladne inokulume. Prostornina nastalega plina v kontrolnih steklenicah v 48 urah se je gibala od 21 ml/g suhe snovi v blatu do 149 ml/g (srednja vrednost je bila 72 ml/g). Med prostornino nastalega plina in ustrezno vrednostjo EC50 ni bilo očitne zveze. Končna vrednost pH se je gibala med 6,1 in 7,5.
|
|
41.
|
Preskus šteje kot veljaven, ko je v referenčni kontroli, ki vsebuje 150 mg/l 3,5-diklorofenola, pridobljeno zaviranje večje od 20 %, ko je v slepi kontroli nastalega več kot 50 ml plina na gram suhe snovi in ko je vrednost pH ob koncu preskusa v območju od 6,2 do 7,5.
|
Poročilo o preskusu
|
42.
|
Poročilo o preskusu mora vsebovati naslednje informacije:
|
|
Preskusna kemikalija
|
—
|
splošno ime, kemijsko ime, številka CAS, strukturna formula in pomembne fizikalno-kemijske lastnosti,
|
|
—
|
čistost (nečistote) preskusne kemikalije.
|
|
|
|
Preskusni pogoji
|
—
|
prostornine tekočih vsebin in prostora nad fazno mejo plin-kapljevina v preskusnih posodah,
|
|
—
|
opisi preskusnih posod in merjenja plina (npr. vrsta merilnika tlaka),
|
|
—
|
uporaba preskusne in referenčne kemikalije v preskusnem sistemu, uporabljene preskusne koncentracije in uporaba kakršnih koli topil,
|
|
—
|
podrobnosti o uporabljenem inokulumu: ime čistilne naprave, opis vira čiščene odpadne vode (npr. obratovalna temperatura, retencijski čas blata, večinoma gospodinjske ali industrijske odplake itd.), koncentracija trdnih snovi, dejavnost nastajanja plina pri anaerobnem gnilišču, predhodna izpostavljenost ali morebitna predhodna prilagoditev strupenim kemikalijam ali mesto zbiranja blata, usedlin itd.,
|
|
—
|
inkubacijska temperatura in območje,
|
|
|
|
Rezultati:
|
—
|
vrednosti pH na koncu preskusa,
|
|
—
|
vsi izmerjeni podatki, zbrani v kontrolnih posodah s preskusno, slepo in referenčno kemikalijo, kot je ustrezno (npr. tlak v Pa ali milibarih), v preglednici,
|
|
—
|
odstotek zaviranja v preskusnih in referenčnih steklenicah ter krivulje zaviranje-koncentracija,
|
|
—
|
izračun vrednosti EC50, izražene v mg/l in mg/g,
|
|
—
|
nastajanje plina na gram blata v 48 urah,
|
|
—
|
razlogi za morebitno zavrnitev rezultatov preskusa,
|
|
—
|
razprava o rezultatih, vključno z morebitnimi odstopanji od postopkov v tej preskusni metodi, in razprava o morebitnih odstopanjih v rezultatih preskusa od tistega, kar bi bilo pričakovano, zaradi motenj in napak,
|
|
—
|
poleg tega pa tudi odgovor na vprašanje, ali je bil namen preskusa merjenje strupenosti za predhodno izpostavljene mikroorganizme ali za predhodno neizpostavljene mikroorganizme.
|
|
|
LITERATURA
|
(1)
|
Poglavje C.11 te priloge: Preskus zaviranja dihanja aktivnega blata.
|
|
(2)
|
Poglavje C.43 te priloge: Anaerobna biološka razgradljivost organskih spojin v pregnitem blatu: metoda z merjenjem nastajanja plina.
|
|
(3)
|
Mednarodna organizacija za standardizacijo (2003). ISO 13641-1 Kakovost vode – Določevanje zaviranja nastanka plina, ki ga proizvedejo anaerobne bakterije – 1. del: Splošen preskus.
|
|
(4)
|
Mednarodna organizacija za standardizacijo (2003). ISO 13641-2 Kakovost vode – Določevanje zaviranja nastanka plina, ki ga proizvedejo anaerobne bakterije – 2. del: Preskus z nizkimi koncentracijami biomase.
|
|
(5)
|
ISO (2000) Ring test of ISO 13 641-1 and ISO 13 641-2. Determination of inhibition of activity of anaerobic bacteria. BL 6958/A. Evans M. R., Painter, H. A. Brixham Environmental Laboratory, AstraZeneca UK Ltd., Brixham, TQ5 8BA, Združeno kraljestvo.
|
|
(6)
|
Swanwick, J. D., Foulkes, M. (1971). Inhibition of anaerobic digestion of sewage sludge by chlorinated hydrocarbons. Wat. Pollut. Control, 70, 58–70.
|
|
(7)
|
HMSO (1986). Determination of the inhibitory effects of chemicals and waste waters on the anaerobic digestion of sewage sludge. ISBN 0 117519 43 X, V: Methods for the Examination of Waters and Associated Materials, Združeno kraljestvo.
|
|
(8)
|
Shelton, D. R., Tiedje, J. M. (1984). General method for determining anaerobic biodegradation potential. Appl. Env. Microbiol. 47 850–857.
|
|
(9)
|
Battersby, N. S., in Wilson, V. (1988). Evaluation of a serum bottle technique for assessing the anaerobic biodegradability of organic compounds under methanogenic conditions. Chemosphere 17, 2441–2460.
|
|
(10)
|
Wilson, V., Painter, H. A., in Battersby, N. S. (1992). A screening method for assessing the inhibition of the anaerobic gas production from sewage sludge. Proc. Int. Symp. on Ecotoxicology. Ecotoxicological Relevance of Test Methods, GSF Forschungzentrum, Neuherberg, Nemčija (1990). Ur. Steinberg C. in Kettrup A., str. 117– 132 (1992).
|
|
(11)
|
Kawahara, K., Yakabe, Y., Chida, T., in Kida, K. (1999). Evaluation of laboratory-made sludge for an anaerobic biodegradability test and its use for assessment of 13 chemicals. Chemosphere, 39 (12), 2007–2018.
|
|
(12)
|
Mednarodna organizacija za standardizacijo (1995). ISO 10634: Kakovost vode – Navodilo za pripravo in obdelavo v vodi slabo topnih organskih spojin za nadaljnje vrednotenje njihove biorazgradljivosti v vodi.
|
|
(13)
|
Mednarodna organizacija za standardizacijo (1997). ISO 11923: Kakovost vode – Določevanje suspendiranih snovi s filtracijo skozi filter iz steklenih vlaken.
|
Dodatek 1
Primer naprave za merjenje nastajanja bioplina s tlakom plina

Legenda:
|
1
|
–
|
merilnik tlaka
|
|
2
|
–
|
trojni plinotesni petelinček
|
|
3
|
–
|
injekcijska igla
|
|
4
|
–
|
plinotesno tesnilo (zaporni pokrovček in zaporka)
|
|
5
|
–
|
prostor nad fazno mejo plin-kapljevina
|
|
6
|
–
|
inokulum pregnitega blata
|
Preskusne posode v okolju s temperaturo 35 °C ± 2 °C.
Dodatek 2
Pretvorba odčitkov merilnika tlaka
Odčitki merilnika tlaka so lahko prek umeritvene krivulje povezani s količinami plina, iz tega pa je mogoče izračunati količino nastalega plina na gram suhega blata v 48 urah. Ta kazalnik dejavnosti se uporablja kot eno od meril, s katerimi se ocenjuje veljavnost rezultatov preskusa. Umeritvena krivulja se ustvari z vbrizganjem znanih količin plina pri temperaturi 35 °C ± 2 °C v serumske steklenice, ki vsebujejo toliko vode, kolikor znaša količina reakcijske zmesi, VR.
|
—
|
V pet serumskih steklenic odmerite VR ml alikvotov vode, hranjene pri temperaturi 35 °C ± 2 °C. Steklenice zatesnite in jih za eno uro postavite v vodno kopel pri temperaturi 35 °C ± 2 °C, da se uravnotežijo.
|
|
—
|
Vklopite merilnik tlaka, pustite ga, da se stabilizira, in ga nastavite na ničlo.
|
|
—
|
Skozi tesnilo ene od steklenic vstavite injekcijsko iglo, odprite ventil in ga pustite odprtega, dokler merilnik tlaka ne pokaže vrednosti nič, nato pa zaprite ventil.
|
|
—
|
Postopek ponovite pri preostalih steklenicah.
|
|
—
|
V vsako steklenico vbrizgajte 1 ml zraka pri temperaturi 35 °C ± 2 °C. Vstavite iglo (na merilniku) v eno od steklenic in pustite, da se odčitek tlaka stabilizira. Zabeležite tlak, odprite ventil in ga pustite odprtega, dokler tlak ne doseže vrednosti nič, nato pa zaprite ventil.
|
|
—
|
Postopek ponovite pri preostalih steklenicah.
|
|
—
|
Celoten postopek ponovite z 2 ml, 3 ml, 4 ml, 5 ml, 6 ml, 8 ml, 10 ml, 12 ml, 16 ml, 20 ml in 50 ml zraka.
|
|
—
|
Izrišite krivuljo pretvorbe tlaka (Pa) v odvisnosti od injicirane prostornine (ml). V območju od 0 Pa do 70 000 Pa in od 0 ml do 50 ml nastajanja plina je odziv instrumenta linearen.
|
Dodatek 3
Ugotovljeni dejavniki, ki lahko povzročijo napačne rezultate
(a) Kakovost pokrovčkov steklenic
Na trgu so na voljo različne vrste zapork za serumske steklenice; med temi jih v pogojih tega preskusa ob prebadanju z iglo veliko izgubi sposobnost tesnjenja, tudi takšne iz butilnega kavčuka. Včasih po prebadanju zaporke z injekcijsko iglo tlak zelo počasi pada. Za preprečevanje puščanja je priporočena uporaba plinotesnih zapork (odstavek 12(b)).
(b) Vlaga v injekcijski igli
V injekcijski igli in ceveh se včasih nakopiči vlaga, kar se odrazi na odčitku tlaka, ki je rahlo negativen. To popravite tako, da odstranite iglo, pretresete cevi, jih osušite s krpo in namestite novo iglo (odstavka 12(c) in 35).
(c) Kontaminacija s kisikom
Anaerobne metode so izpostavljene napakam, do katerih pride zaradi kontaminacije s kisikom, kar lahko oslabi nastajanje plina. Pri tej metodi je treba to možnost kar najbolj zmanjšati z uporabo strogo anaerobnih tehnik, vključno z uporabo komore z rokavicami.
(d) Nepredelani substrati v blatu
Na anaerobno nastajanje plina in občutljivost blata vplivajo substrati, ki so z inokulumom preneseni v preskusne steklenice. Pregnito blato iz anaerobnih gnilišč čistilnih naprav za gospodinjske odplake pogosto še vedno vsebuje prepoznavne snovi, kot so lasje in ostanki rastlin v obliki celuloze, zaradi česar je jemanje reprezentativnih vzorcev lahko oteženo. S presejanjem blata je mogoče nepredelane netopne snovi odstraniti, zato je verjetnost, da bo vzorčenje reprezentativno, večja (odstavek 16).
(e) Hlapne preskusne kemikalije
Hlapne preskusne kemikalije bodo sproščene v prostor v preskusnih steklenicah, ki je nad fazno mejo plin-kapljevina. Pri tem lahko med prezračevanjem po meritvah tlaka pride do izgube nekaj preskusnega materiala iz sistema, kar daje lažno visoke vrednosti EC50. Napako je mogoče zmanjšati s primerno izbiro razmerja med prostornino prostora nad fazno mejo plin-kapljevina in prostornino tekočine ter s tem, da po merjenju tlaka ne zračimo (10).
(f) Nelinearnost nastajanja plina
Če krivulja srednje vrednosti kumulativne vrednosti nastajanja plina v odvisnosti od časa inkubacije v obdobju 48 ur ni približno linearna, se je natančnost preskusa morda zmanjšala. Da ne pride do tega, je morda priporočljiva uporaba gnijočega blata iz drugega vira in/ali dodajanje povečane koncentracije preskusnega substrata/hranilnega bujona, kvasnega ekstrakta in glukoze (odstavek 29).
Dodatek 4
Uporaba pri okoljskih vzorcih z nizko koncentracijo biomase – anaerobnih blatih, usedlinah itd.
UVOD
A.1 V splošnem je specifična mikrobna dejavnost (količina plina, nastalega na gram suhih trdnih snovi) pri naravno nastalih anaerobnih blatih, usedlinah itd. precej nižja od mikrobne dejavnosti pri anaerobnem blatu, pridobljenem iz odplak. Zato je treba pri merjenju zaviralnih učinkov kemikalij na te manj dejavne vzorce spremeniti nekatere pogoje poskusa. Pri teh manj dejavnih vzorcih sta možna dva poteka delovanja:
|
(a)
|
izvedite prilagojen predhodni preskus (odstavek 25) z nerazredčenim vzorcem blata, tal itd. pri temperaturi 35 °C ± 2 °C ali, za natančnejšo simulacijo, pri temperaturi mesta zbiranja vzorcev (kot v 1. delu standarda ISO 13641);
|
|
(b)
|
lahko pa izvedete preskus z razredčenim blatom iz gnilišča (v razmerju 1 proti 100), da posnamete šibko delovanje, pričakovano pri okoljskem vzorcu, vendar temperaturo vzdržujte v območju 35 °C ± 2 °C (kot v 2. delu standarda ISO 13641).
|
A.2 Možnost (a) je mogoče doseči z upoštevanjem tu opisane metode (enakovredne 1. delu standarda ISO 13641), nujno pa je izvesti predhodni preskus (odstavek 25) za določanje optimalnih pogojev, razen če so ti že znani iz prejšnjih preskusov. Vzorec blata ali usedline je treba temeljito zmešati, npr. v mešalniku, in ga po potrebi razredčiti z majhnim delom razplinjene vode za redčenje (odstavek 14), tako da je dovolj tekoč za prenos s široko pipeto ali merilnim valjem. Če se zdi, da bi utegnila manjkati hranila, se vzorec blata lahko centrifugira (v anaerobnih pogojih) in ponovno suspendira v mineralnem mediju, ki vsebuje kvasni ekstrakt (A.11).
A.3 Možnost (b). Ta možnost v razumni meri posnema šibko aktivnost okoljskih vzorcev, vendar ji manjka visoka koncentracija suspendiranih trdnih snovi, ki so prisotne v teh vzorcih. Vloga teh trdnih snovi pri zaviranju ni znana, vendar je mogoče, da bi lahko zaradi reakcije med preskusnimi kemikalijami in sestavinami blata ter adsorpcije preskusnih kemikalij na trdne snovi prišlo do zmanjšanja strupenosti preskusne kemikalije.
A.4 Naslednji pomemben dejavnik je temperatura: za natančno simulacijo je treba preskuse izvesti pri temperaturi mesta zbiranja vzorcev, saj je znano, da različne skupine združb bakterij, ki proizvajajo metan, delujejo v različnih temperaturnih območjih, namreč termofili (~30–35 °C), mezofili (20–25 °C) in psihrofili (< 20 °C), in lahko izkazujejo različne vzorce zaviranja.
A.5 Trajanje. V 1. delu splošnega preskusa z uporabo nerazredčenega blata je bilo nastajanje plina v obdobju 2–4 dni vedno zadostno, v 2. delu z blatom, razredčenim na eno stotino, pa v tem obdobju v krožnem preskusu plin ni nastal ali pa ga ni nastalo dovolj. Pri opisovanju slednjega preskusa Madsen in drugi (1996) pravijo, da mora trajati vsaj 7 dni.
Preskušanje z nizko koncentracijo biomase (možnost b)
Z dodajanjem ali menjavo nekaterih obstoječih odstavkov in pododstavkov v glavnem besedilu je treba izvesti naslednje preureditve in spremembe:
A.6 Dodatek k odstavku 6: Načelo preskusa;
‚To tehniko je mogoče uporabiti z anaerobnim blatom, razredčenim v razmerju 1 proti 100, deloma za posnemanje šibkega delovanja blat in usedlin. Temperatura inkubacije je lahko enaka 35 °C ali pa enaka temperaturi na mestu, na katerem je bil vzorec odvzet. Ker je delovanje bakterij precej šibkejše od tistega v nerazredčenem blatu, je treba obdobje inkubacije podaljšati na vsaj 7 dni.‘
A.7 Dodatek k odstavku 12 (a):
‚inkubator mora biti zmožen delovati tudi pri nižjih temperaturah, in sicer do 15 °C.‘
A.8 Dodatek dodatnega reagenta za odstavkom 13:
‚Fosforna kislina (H3PO4), 85 mas. % v vodi.‘
A.9 Dodatek na koncu odstavka 16:
‚Uporabite končno koncentracijo 0,20 ± 0,05 g/l celotne količine suhih trdnih snovi v preskusu.‘
A.10 Odstavek 17. Preskusni substrat
Ta substrat se ne sme uporabljati, nadomesti ga kvasni ekstrakt (glej odstavke 17; A.11, A.12, A.13).
A.11 Za redčenje anaerobnega blata je potreben mineralni medij, vključno z elementi v sledovih, temu mediju pa je zaradi pripravnosti dodan organski substrat, kvasni ekstrakt.
Dodatek za odstavkom 17:
|
‚(a)
|
Preskusni mineralni medij s kvasnim ekstraktom.
|
Pripravljen je z 10-kratno koncentriranim preskusnim medijem (odstavek 17 (b); A.12) z raztopino elementov v sledovih (odstavek 17(c); A.13). Uporabite sveže dobavljen natrijev sulfid nonahidrat (odstavek 17(b); A.12), če ni svež, pa ga pred uporabo operite in posušite, da mu zagotovite zadostno redukcijsko sposobnost. Če se preskus izvaja brez komore z rokavicami (odstavek 12(j)), je treba koncentracijo natrijevega sulfida v založni raztopini povečati na 2 g/l (z 1 g/l). Natrijev sulfid se lahko za pridobivanje končne koncentracije 0,2 g/l doda tudi iz ustrezne založne raztopine prek zaporke zaprtih preskusnih steklenic, saj se s tem postopkom zmanjša tveganje oksidacije. Namesto tega se lahko uporabi titanov (III) citrat (odstavek 17(b)). Dodajte ga skozi zaporko zaprtih preskusnih steklenic, da dobite koncentracijo od 0,8 mmol/l do 1,0 mmol/l. Titanov (III) citrat je visoko učinkovit reducent z nizko strupenostjo, ki se pripravi, kot je opisano v nadaljevanju: 2,94 g trinatrijevega citrata dihidrata raztopite v 50 ml vode za redčenje brez kisika (odstavek 14) (kar da raztopino 200 mmol/l) in dodajte 5 ml raztopine titanovega (III) klorida (15 g/100 ml vode za redčenje). Z natrijevim karbonatom nevtralizirajte na vrednost pH 7 ± 0,5 in pod tokom dušikovega plina odmerite v ustrezno serumsko steklenico. Koncentracija titanovega (III) citrata v tej založni raztopini je 164 mmol/l. Preskusni medij uporabite takoj ali pa ga največ en dan hranite pri temperaturi 4 °C.
|
A.12
|
(b)
|
Desetkratno koncentrirani preskusni medij, pripravljen z naslednjim:
|
brezvodnim kalijevim dihidrogenfosfatom (KH2PO4)
|
2,7 g
|
|
dinatrijevim hidrogenfosfatom (Na2HPO4)
|
4,4 g
|
|
(ali 11,2 g dodekahidrata)
amonijevim kloridom (NH4Cl)
|
5,3 g
|
|
kalcijevim klorid dihidratom (CaCl2 · 2H2O)
|
0,75 g
|
|
magnezijevim klorid heksahidratom (MgCl2 · 6H2O)
|
1,0 g
|
|
železovim (II) klorid tetrahidratom (FeCl2 · 4H2O)
|
0,2 g
|
|
resazurinom (redoks indikatorjem)
|
0,01 g
|
|
natrijevim sulfid nonahidratom (Na2S · 9H2O)
|
1,0 g
|
|
(ali titanovim (III) citratom) končna koncentracija
|
od 0,8 mmol/l do 1,0 mmol/l
|
|
raztopino elementov v sledovih (glej odstavek 17 (c); A.13)
|
10,0 ml
|
|
kvasnim ekstraktom
|
100 g
|
|
Raztopite v vodi za redčenje (odstavek 14) in dopolnite do:
|
1 000 ml
|
|
|
A.13
|
(c)
|
Raztopina elementov v sledovih, pripravljena z naslednjim:
|
manganovim (II) klorid tetrahidratom (MnCl2 · 4H2O)
|
0,5 g
|
|
ortoborovo kislino (H3BO3)
|
0,05 g
|
|
cinkovim kloridom (ZnCl2)
|
0,05 g
|
|
bakrovim (II) kloridom (CuCl2)
|
0,03 g
|
|
natrijevim molibdat dihidratom (Na2MoO4 · 2H2O)
|
0,01 g
|
|
kobaltovim (II) klorid heksahidratom (CoCl2 · 6H2O)
|
1,0 g
|
|
nikljevim (II) klorid heksahidratom (NiCl2 · 6H2O)
|
0,1 g
|
|
dinatrijevim selenitom (Na2SeO3)
|
0,05 g
|
|
Raztopite v vodi za redčenje (odstavek 14) in dopolnite do:
|
1 000 ml‘
|
|
A.14 Odstavek 25: Predhodni preskus
Nujno mora biti opravljen predhodni preskus, kot je opisan v odstavku 24, razen tega, da mora biti koncentracija trdnih snovi v blatu ena stotina podanih koncentracij, tj. 0,1 g/l, 0,2 g/l in 0,4 g/l. Inkubacija mora trajati najmanj 7 dni.
Opomba: v krožnem preskusu (5) je bil prostor nad fazno mejo plin-kapljevina pri 75 % celotne prostornine precej prevelik; biti mora v priporočenem območju od 10 % do 40 %. Ustrezno merilo je, da mora biti prostornina plina, nastalega pri približno 80-odstotnem zaviranju, merljiva s sprejemljivo natančnostjo (npr. od ± 5 % do ± 10 %).
A.15 Odstavki od 26 do 30: Dodajanje preskusne kemikalije, inokuluma in substrata.
Dodajanje se izvaja na enak način, kot je opisano v teh odstavkih, raztopino substrata (odstavek 17) pa nadomestita preskusni medij in substrat kvasnega ekstrakta (A.11).
Poleg tega je končna koncentracija suhih trdnih snovi v blatu zmanjšana z območja 2–4 g/l na območje 0,2 ± 0,05 g/l (A.9). Dva primera dodajanja sestavin preskusni zmesi sta podana v preglednici A.1, ki nadomesti preglednico v odstavku 29.
A.16 Odstavek 33: Inkubacija steklenic
Zaradi pričakovane manjše hitrosti nastajanja plina se inkubacija izvaja vsaj 7 dni.
A.17 Odstavek 34: Meritve tlaka
Če so zahtevane količine v plinski fazi, se za merjenje tlaka v prostoru steklenic nad fazno mejo plin-kapljevina uporablja enak postopek, kot je opisan v odstavku 34. Če bodo izmerjene celotne količine CO2 in CH4, se vrednost pH tekoče faze z vbrizganjem H3PO4 v vsako ustrezno steklenico in merjenjem tlaka po 30 minutah stresanja pri temperaturi preskusa zmanjša na približno 2. Vendar je mogoče več informacij o kakovosti inokuluma pridobiti z merjenjem tlaka v vsaki steklenici pred zakisljevanjem in po njem. Če je, na primer, hitrost nastajanja CO2 precej višja od hitrosti nastajanja metana, se lahko občutljivost fermentacijskih bakterij spremeni in/ali na metanogene bakterije po možnosti vpliva preskusna kemikalija.
A.18 Odstavek 36: Merjenje vrednosti pH
Če bo uporabljen H3PO4, je treba posebej za merjenje vrednosti pH pripraviti nekaj dodatnih steklenic brez dodanega H3PO4.
VIR:
Madsen, T., Rasmussen, H. B., in Nilsson, L. (1996), Methods for screening anaerobic biodegradability and toxicity of organic chemicals. Projekt št. 336, Inštitut za kakovost vode, Danska agencija za varstvo okolja, Köbenhavn.
Preglednica A.1
Primeri priprave preskusa za serije preskusov
|
Sestavine reakcijske zmesi
|
Primer 1
|
Primer 2
|
Običajni vrstni red dodajanja
|
|
koncentracija pripravljenega inokuluma (g/l)
|
0,42
|
2,1
|
—
|
|
prostornina dodanega inokuluma (ml)
|
45
|
9
|
4
|
|
koncentracija inokuluma v preskusnih steklenicah (g/l)
|
0,20
|
0,20
|
—
|
|
prostornina dodanega preskusnega medija (ml)
|
9
|
9
|
2
|
|
prostornina dodane vode za redčenje (ml)
|
36
|
72
|
3
|
|
koncentracija kvasnega ekstrakta v preskusnih steklenicah (g/l)
|
9,7
|
9,7
|
—
|
|
prostornina založne raztopine preskusne kemikalije (ml)
|
3
|
3
|
1
|
|
celotna prostornina tekočine (ml)
|
93
|
93
|
—
|
Dodatek 5
Opredelitve pojmov
Za to preskusno metodo se uporabljata naslednji opredelitvi:
|
|
Kemikalija pomeni snov ali zmes.
|
|
|
Preskusna kemikalija je snov ali zmes, preskušena s to preskusno metodo.
|
C.35 PRESKUS STRUPENOSTI Z VRSTO LUMBRICULUS V SISTEMU VODE IN USEDLINE Z UPORABO USEDLIN S PRIMEŠANO PRESKUSNO KEMIKALIJO
UVOD
|
1.
|
Ta preskusna metoda je enakovredna Smernici za preskušanje OECD (TG) 225 (2007). Endobentoške živali, ki se hranijo z usedlinami, so lahko zelo izpostavljene kemikalijam, ki se vežejo z usedlinami, zato jih je treba obravnavati prednostno, npr. (1), (2), (3). Med temi uživalci usedlin imajo pomembno vlogo pri usedlinah vodnih sistemov vodni maloščetinci. Z bioturbacijo usedline in s tem, ko služijo kot plen, imajo te živali lahko močan vpliv na biološko razpoložljivost takšnih kemikalij za druge organizme, npr. bentivore vrste rib. V nasprotju z epibentoškimi organizmi se endobentoški vodni maloščetinci (npr. vrsta Lumbriculus variegatus) zakopljejo v usedlino in jedo delce usedline pod površino usedline. S tem je zagotovljena izpostavljenost preskusnih organizmov preskusni kemikaliji prek vseh mogočih načinov privzema (npr. s stikom z kontaminiranimi delci usedline in z zaužitjem teh delcev, pa tudi prek porne vode in vode nad usedlino).
|
|
2.
|
Ta metoda je zasnovana za ocenjevanje učinkov podaljšane izpostavljenosti endobentoških maloščetincev vrste Lumbriculus variegatus (Müller) kemikalijam, povezanim z usedlinami. Temelji na obstoječih protokolih za preskušanje strupenosti usedline in kopičenja v organizmih, npr. (3), (4), (5), (6), (7), (8), (9), (10). Metoda je opisana za statične preskusne pogoje. Scenarij izpostavljenosti, uporabljen v tej preskusni metodi, je primešanje preskusne kemikalije v usedlino. Uporaba usedline s primešano preskusno kemikalijo poskuša posnemati usedlino, kontaminirano s preskusno kemikalijo.
|
|
3.
|
Kemikalije, ki jih je treba preskusiti v zvezi z organizmi, živečimi v usedlinah, se običajno v tem delu obdržijo zelo dolgo. Organizmi, živeči v usedlinah, so lahko izpostavljeni na številne načine. Relativni pomen vsakega načina izpostavljenosti in čas, da ta prispeva k skupnim strupenim učinkom, sta odvisna od fizikalno-kemijskih lastnosti zadevne kemikalije in njene končne usode v živali. Pri kemikalijah, ki se močno adsorbirajo (npr. z log Kow > 5), ali kemikalijah, ki se kovalentno vežejo na usedlino, je lahko zaužitje kontaminirane hrane pomemben način izpostavljenosti. Da ne bi podcenili strupenosti takšnih kemikalij, se usedlini pred nanosom preskusne kemikalije doda hrana, potrebna za razmnoževanje (11). Opisana preskusna metoda je predstavljena dovolj podrobno, da je mogoče izvesti preskus, pri tem pa omogočiti prilagoditve načrta poskusa glede na pogoje v posameznih laboratorijih in različne lastnosti preskusnih kemikalij.
|
|
4.
|
Cilj preskusne metode je določitev učinkov preskusne kemikalije na razmnoževanje in biomaso preskusnih organizmov. Merjena biološka parametra sta celotno število preživelih črvov in biomasa (suha teža) ob koncu izpostavljenosti. Ti podatki se nato za oceno koncentracije, ki bi povzročila x-odstotni učinek (npr. EC50, EC25 in EC10), analizirajo z regresijskim modelom, za določitev koncentracije brez opaznega učinka (NOEC) in najnižje koncentracije z opaznim učinkom (LOEC) pa s preskušanjem statističnih domnev.
|
|
5.
|
V poglavju C.27 te priloge, ‚Preskus strupenosti s trzačami v sistemu vode in usedline z uporabo usedline s primešano preskusno snovjo‘ (6) je veliko ključnih in uporabnih podrobnosti za izvedbo predstavljene metode preskusa strupenosti usedline. Zato ta dokument služi kot osnova, na podlagi katere so bile izdelane spremembe, potrebne za izvajanje preskusov strupenosti z uporabo usedline z vrsto Lumbriculus variegatus. Nadaljnji dokumenti, ki so navedeni, so npr. Standardne smernice ASTM za določanje bioakumulacije z usedlinami povezanih onesnaževal v bentoških nevretenčarjih (3), Metode US EPA za merjenje strupenosti in bioakumulacije z usedlinami povezanih onesnaževal v sladkovodnih nevretenčarjih (7) in Standardne smernice ASTM za zbiranje, shranjevanje, določanje lastnosti in postopke ravnanja z usedlinami za toksikološko preskušanje ter izbiro vzorčevalnikov, uporabljenih za zbiranje bentoških nevretenčarjev (12). Poleg tega so pomembni viri informacij za sestavljanje tega dokumenta tudi praktične izkušnje, pridobljene med krožnim preskušanjem preskusne metode ((13), poročilo o krožnem preskusu), in podrobnosti iz literature.
|
OSNOVNI POGOJI IN NAPOTKI
|
6.
|
Pred začetkom študije je treba pridobiti informacije o preskusni kemikaliji, kot so varnostni ukrepi, ustrezni pogoji shranjevanja in analitske metode. Smernice za preskušanje kemikalij s fizikalno-kemijskimi lastnostmi, zaradi katerih je preskušanje oteženo, so navedene v (14).
|
|
7.
|
Pred izvedbo preskusa morajo biti znane naslednje informacije o preskusni kemikaliji:
|
—
|
splošno ime, kemijsko ime (po možnosti ime IUPAC), strukturna formula, registrska številka CAS, čistost,
|
|
|
8.
|
Pred začetkom preskusa za koristne veljajo tudi naslednje dodatne informacije:
|
—
|
porazdelitveni koeficient oktanol/voda, Kow,
|
|
—
|
porazdelitveni koeficient organski ogljik/voda, izražen z vrednostjo Koc,
|
|
—
|
fototransformacija v vodi,
|
|
|
9.
|
Informacije o določenih lastnostih usedline, ki bodo uporabljene, je treba pridobiti pred začetkom preskusa (7). Za podrobnosti glej odstavke od 22 do 25.
|
NAČELO PRESKUSA
|
10.
|
Črvi v podobnem fiziološkem stanju (sinhronizirani, kot je opisano v Dodatku 5) se izpostavijo seriji koncentracij strupene snovi, nanesene na fazo usedline sistema vode in usedline. Kot medij morata biti uporabljeni umetna usedlina in modelna razredčevalna voda. Kot kontrole služijo preskusne posode brez dodatka preskusne kemikalije. Preskusna kemikalija se primeša v usedlino v celoti za vsako raven koncentracije, da se kar najbolj zmanjša variabilnost med ponovitvami vsake ravni koncentracije, preskusni organizmi pa se nato vnesejo v preskusne posode, v katerih so koncentracije usedline in vode uravnotežene (glej odstavek 29). Preskusne živali se za 28 dni izpostavijo sistemu vode in usedline. Z vidika nizke vsebnosti hranil umetne usedline je treba usedlino dopolniti z virom hrane (glej odstavka 22 in 23 ter Dodatek 4), da se zagotovita rast in razmnoževanje črvov v kontroliranih pogojih. Na ta način je zagotovljeno, da so preskusne živali izpostavljene prek vode in usedline, pa tudi prek hrane.
|
|
11.
|
Najprimernejša končna točka te vrste študije je vrednost ECx (npr. EC50, EC25 in EC10; učinkovita koncentracija, ki vpliva na x % preskusnih organizmov) za razmnoževanje oziroma biomaso v primerjavi s kontrolo. Vendar je treba opozoriti, da vrednost EC50 zaradi visoke negotovosti nizke vrednosti ECx (npr. EC10, EC25) z zelo visokimi 95-odstotnimi mejami zaupanja (npr. (15)) in statistične moči, izračunane med preskušanjem domnev, velja za najbolj robustno končno točko. Poleg tega se lahko izračunata koncentracija brez opaznega učinka (NOEC) in najnižja koncentracije z opaženim učinkom (LOEC) za biomaso in razmnoževanje, če načrt preskusa in podatki podpirajo te izračune (glej odstavke od 34 do 38). Načrt preskusa bo določen z namenom študije, izpeljavo vrednosti EC × ali NOEC.
|
REFERENČNO PRESKUŠANJE
|
12.
|
Pričakovati je, da bo delovanje kontrolnih organizmov v zadostni meri dokazalo sposobnost laboratorija za izvedbo preskusa in, če so na voljo historični podatki, ponovljivost preskusa. Poleg tega se lahko v rednih časovnih razmikih izvedejo referenčni preskusi strupenosti z referenčno strupeno snovjo za oceno občutljivosti preskusnih organizmov. Referenčni preskusi strupenosti, ki trajajo 96 ur in potekajo samo v vodi, lahko zadovoljijo dokažejo občutljivost in stanje preskusnih živali (4)(7). Informacije o strupenosti pentaklorofenola (PCP) v popolnih preskusih (pri 28-dnevni izpostavljenosti usedlini, ki ji je primešana preskusna kemikalija) so vključene v Dodatek 6 in v poročilo o krožnem preskusu preskusne metode (13). Akutna strupenost PCP, ki velja le za vodo, je npr. opisana v (16). Te informacije je mogoče uporabiti za primerjavo občutljivosti preskusnega organizma v referenčnih preskusih s PCP kot referenčno strupeno snovjo. Pri vrsti L. variegatus se kot referenčna strupena snov priporoča kalijev klorid (KCl) ali bakrov sulfat (CuSO4) (4)(7). Doslej je bilo določanje meril kakovosti na osnovi podatkov o strupenosti za KCl težavno zaradi pomanjkanja podatkov o vrsti L. variegatus v literaturi. Informacije o strupenosti bakra za vrsto L. variegatus je mogoče najti v virih od (17) do (21).
|
VELJAVNOST PRESKUSA
|
13.
|
Za veljavnost preskusa morajo biti izpolnjene naslednje zahteve:
|
—
|
krožni preskus (13) je dokazal, da se mora pri vrsti Lumbriculus variegatus povprečno število živih črvov na ponovitev v kontrolah na koncu izpostavljenosti v primerjavi s črvi na ponovitev na začetku izpostavljenosti povečati za faktor, ki znaša vsaj 1,8,
|
|
—
|
vrednost pH vode nad usedlino mora biti ves čas preskusa med 6 in 9,
|
|
—
|
koncentracija kisika v vodi nad usedlino med preskusom ne sme znašati manj kot 30 % nasičenosti zraka (air saturation value – ASV) pri preskusni temperaturi.
|
|
OPIS PRESKUSNE METODE
Preskusni sistem
|
14.
|
Priporočajo se statični sistemi brez obnavljanja vode nad usedlino. Če je razmerje vode in usedline (glej odstavek 15) ustrezno, bo rahlo prezračevanje običajno zadoščalo za vzdrževanje količine vode na sprejemljivi ravni za preskusne organizme (ravni raztopljenega kisika npr. kar najbolj povečajte, kopičenje produktov izločanja pa kar najbolj zmanjšajte). Polstatične ali pretočne sisteme z občasnim ali kontinuiranim obnavljanjem vode nad usedlino je mogoče uporabiti le v izjemnih primerih, saj je pričakovati, da redno obnavljanje vode nad usedlino vpliva na kemijsko ravnotežje (npr. na izgube preskusne kemikalije iz preskusnega sistema).
|
Preskusne posode in naprave
|
15.
|
Izpostavljanje mora potekati v steklenih čašah s prostornino npr. 250 ml in premerom 6 cm. Uporabljajo se lahko tudi druge posode, vendar morajo zagotavljati primerno globino usedline in vode nad njo. Vsaka posoda mora sprejeti plast formulirane usedline, debelo približno 1,5–3 cm. Razmerje med debelino usedline in globino vode nad njo mora biti 1: 4. Posode morajo imeti primerno prostornino, ki ustreza stopnji obremenitve, tj. s številom dodanih preskusnih črvov na enoto usedline (glej tudi odstavek 39).
|
|
16.
|
Preskusne posode in druge naprave, ki bodo prišle v stik s preskusnimi kemikalijami, morajo biti v celoti steklene ali iz drugega kemijsko inertnega materiala. Pri vseh delih opreme se je treba izogibati uporabi materialov, ki se lahko raztopijo, adsorbirajo preskusno kemikalijo ali iz katerih se lahko izlužijo druge kemikalije in ki škodljivo učinkujejo na preskusne živali. Pri vsej opremi, ki ima stik s preskusnim medijem, je treba uporabiti politetrafluoroetilen (PTFE), nerjavno jeklo in/ali steklo. Za organske kemikalije, za katere je znano, da se adsorbirajo na steklo, se lahko zahteva silanizirano steklo. V teh primerih je treba opremo po uporabi zavreči.
|
Preskusne vrste
|
17.
|
Preskusna vrsta, uporabljena v tej vrsti študije, je sladkovodni maloščetinec Lumbriculus variegatus (Müller). Ta vrsta prenese veliko različnih usedlin ter se pogosto uporablja za preskušanje strupenosti usedlin in bioakumulacije (npr. (3), (5), (7), (9), (13), (15), (16), (22), (23), (24), (25), (26), (27), (28), (29), (30), (31), (32), (33), (34), (35)). Treba je poročati o izvoru preskusnih živali, potrditvi identitete vrste (npr. (36)), pa tudi o pogojih gojenja. Če organizmi prihajajo iz internega gojišča, identifikacija vrst pred preskusom ni potrebna.
|
Gojenje preskusnih organizmov
|
18.
|
Za zagotavljanje zadostnega števila črvov za izvajanje preskusov strupenosti usedlin je črve priročno stalno gojiti v laboratoriju. Smernice za metode gojenja vrste Lumbriculus variegatus v laboratoriju in viri začetnih kultur so podani v Dodatku 5. Za podrobnosti o gojenju te vrste glejte vire (3), (7), (27).
|
|
19.
|
Za zagotovitev, da se preskusi izvajajo z živalmi iste vrste, je močno priporočljiva priprava kulture ene same vrste. Poskrbite, da kulture in še posebej črvi, uporabljeni v preskusih, ne bodo imeli vidnih bolezni in anomalij.
|
Voda
|
20.
|
Za uporabo v preskusih je kot voda nad usedlino priporočljiva modelna razredčevalna voda v skladu s poglavjem C.1 te priloge (37); mogoče jo je uporabljati tudi za laboratorijske kulture črvov (za pripravo glej Dodatek 2). Po potrebi je mogoče uporabiti naravno vodo. Izbrana voda mora biti take kakovosti, ki omogoča rast in razmnoževanje preskusnih organizmov med aklimatizacijo in preskušanjem, ne da bi bili pri tem videti nenormalno ali bi se nenormalno vedli. Dokazano je, da vrsta Lumbriculus variegatus v tej vrsti vode preživi, raste in se razmnožuje (30), omogočena pa je tudi kar največja standardizacija preskusnih pogojev in pogojev gojenja. Če se uporablja rekonstituirana voda, je treba poročati o njeni sestavi, pred uporabo pa je treba določiti njene lastnosti, vsaj vrednost pH, vsebnost kisika in trdoto (izraženo v mg CaCO3/l). Uporabne informacije lahko prispeva tudi analiza vode pred uporabo glede na mikro onesnaževala (glej, npr., Dodatek 3).
|
|
21.
|
Vrednost pH vode nad usedlino mora biti v območju od 6,0 do 9,0 (glej odstavek 13). Če je pričakovan povečan razvoj amonijaka, velja za uporabno, da se vrednost pH vzdržuje med 6,0 in 8,0. Za preskušanje npr. šibkih organskih kislin je priporočljivo uravnati vrednost pH z dodajanjem pufra vodi, ki bo uporabljena v preskusu, kot je opisano npr. v (16). Skupna trdota vode, uporabljene v preskusu, mora biti za naravno vodo med 90 in 300 mg CaCO3 na liter. V Dodatku 3 so povzeta dodatna merila za sprejemljivo vodo za redčenje v skladu s Smernico za preskušanje OECD št. 210 (38).
|
Usedlina
|
22.
|
Ker nekontaminirane naravne usedline iz določenega vira niso nujno na voljo vse leto in ker lahko domorodni organizmi in prisotna mikroonesnaževala vplivajo na preskus, je treba po možnosti uporabljati formulirano usedlino (imenovano tudi rekonstituirana, umetna ali sintetična usedlina). Uporaba formulirane usedline kar najbolj zmanjša variabilnost preskusnih pogojev in vnos domorodnih živali. Naslednja formulirana usedlina temelji na umetni usedlini v skladu s (6), (39) in (40). Priporočena je za uporabo v tej vrsti preskusa ((6), (10), (30), (41), (42), (43)):
|
(a)
|
4–5 % šotnega mahu (suha teža); pomembno je uporabiti šoto v obliki prahu, stopnja razpada: ‚srednja‘, fino mleto (velikost delcev ≤ 0,5 mm) in posušeno samo na zraku;
|
|
(b)
|
20 ± 1 % kaolinske gline (suha teža) (vsebnost kaolinita po možnosti nad 30 %);
|
|
(c)
|
75–76 % kremenovega peska (suha teža) (fin pesek, velikost zrn: ≤ 2 mm, vendar mora > 50 % delcev meriti med 50 in 200 μm);
|
|
(d)
|
deionizirana voda, 30–50 % suhe teže usedline poleg sestavnih delov suhe usedline;
|
|
(e)
|
kemijsko čist kalcijev karbonat (CaCO3) za uravnavo vrednosti pH v končni mešanici;
|
|
(f)
|
skupna vsebnost organskega ogljika v končni mešanici mora biti 2 % (± 0,5 %) suhe teže usedline, uravnava pa se z ustreznimi količinami šote in peska v skladu s točkama (a) in (c);
|
|
(g)
|
hrana, npr. uprašeni listi velike koprive (vrsta Urtica, v skladu s farmacevtskimi standardi, za prehrano ljudi) ali zmes uprašenih listov vrste Urtica in alfa celuloze (v razmerju 1: 1), pri 0,4–0,5 % suhe teže usedline poleg sestavnih delov suhe usedline; za podrobnosti glej Dodatek 4.
|
|
|
23.
|
Vir šote, kaolinske gline, hrane in peska mora biti znan. Poleg točke g) je v poglavju C.27 te priloge (6) naštet alternativni rastlinski material, ki bo uporabljen kot vir prehrane: posušeni listi bele murve (Morus alba), plazeče detelje (Trifolium repens), špinače (Spinacia oleracea) ali žitne trave.
|
|
24.
|
Izbrani vir hrane mora biti dodan pred primešanjem preskusne kemikalije usedlini ali med njim. Izbrani vir hrane mora v kontrolah omogočati vsaj še sprejemljivo razmnoževanje. Analiza umetne usedline ali njenih sestavin glede mikro onesnaževal pred uporabo bi lahko dala koristne informacije. Primer priprave formulirane usedline je opisan v Dodatku 4. Sprejemljiva je tudi mešanica suhih sestavin, če se dokaže, da se sestavine usedline po dodatku vode nad usedlino ne začnejo ločevati (da npr. šotni delci ne lebdijo) in da je šota ali usedlina zadostno kondicionirana (glej tudi odstavek 25 in Dodatek 4). Lastnosti umetne usedline morajo biti določene vsaj z virom sestavin, porazdelitvijo zrn glede na velikost (odstotkom peska, mulja in gline), skupno vsebnostjo organskega ogljika, vsebnostjo vode in vrednostjo pH. Merjenje redoks potenciala je neobvezno.
|
|
25.
|
Po potrebi, npr. za posebne namene preskušanja, lahko kot preskusna in/ali gojitvena usedlina služijo tudi naravne usedline z nekontaminiranih mest (3). Vendar pa je treba naravni usedlini, če bo uporabljena, določiti značilnosti vsaj glede izvora (mesta zbiranja), vrednosti pH in amonijaka porne vode, skupne vsebnosti organskega ogljika (TOC) in vsebnosti dušika, porazdelitve delcev glede na velikost (odstotka peska, mulja in gline) in deleža vsebnosti vode (7), biti pa mora tudi nekontaminirana in ne sme vsebovati nobenih drugih organizmov, ki bi lahko tekmovali s preskusnimi ali jih plenili. Meritev redoks potenciala in sposobnosti izmenjave kationov je neobvezna. Prav tako se priporoča, naj se naravna usedlina pred primešanjem preskusne kemikalije sedem dni kondicionira v enakih pogojih, kakršni vladajo v poznejšem preskusu. Ob koncu tega obdobja kondicioniranja je treba vodo nad usedlino odstraniti in zavreči.
|
|
26.
|
Voda, ki bo uporabljena, mora biti take kakovosti, ki omogoča preživetje in razmnoževanje kontrolnih organizmov med obdobjem izpostavljenosti, ne da bi bili pri tem videti nenormalno ali bi se nenormalno vedli. Kontrolni črvi se morajo zakopati v usedlino in jo uživati. Razmnoževanje v kontrolah mora biti vsaj takšno, kot ga določa merilo za veljavnost, opisano v odstavku 13. Prisotnost ali odsotnost iztrebkov na površini usedline, ki kaže, da črvi uživajo usedlino, mora biti zabeležena in lahko pomaga pri razlagi rezultatov preskusa v zvezi s potmi izpostavljenosti. Dodatne informacije o uživanju usedline je mogoče pridobiti z uporabo metod, opisanih v (24), (25), (44) in (45), ki podrobno opisujejo uživanje usedline ali izbiro delcev pri preskusnih organizmih.
|
|
27.
|
Postopki ravnanja z naravnimi usedlinami pred uporabo v laboratoriju so opisani v (3), (7) in (12). Priprava in shranjevanje umetne usedline, priporočene za uporabo v preskusu z vrsto Lumbriculus, je opisana v Dodatku 4.
|
Uporaba preskusne kemikalije
|
28.
|
Preskusna kemikalija se primeša usedlini. Ker se pričakuje, da je večina preskusnih kemikalij slabo topna v vodi, jih je za pripravo založne raztopine treba raztopiti v primernem organskem topilu (npr. acetonu, n-heksanu, cikloheksanu) v čim manjši količini. Založna raztopina mora biti za pripravo preskusnih raztopin razredčena z enakim topilom. Strupenost in hlapnost topila ter topnost preskusne kemikalije v izbranem topilu bi morale biti glavna merila za izbiro primernega sredstva za raztapljanje. Za vsako raven koncentracije mora biti uporabljena enaka količina ustrezne raztopine. Preskusna kemikalija se primeša v usedlino v celoti za vsako raven koncentracije, da se kar najbolj zmanjša variabilnost med ponovitvami vsake ravni koncentracije preskusne kemikalije. Vsaka od preskusnih raztopin se nato zmeša s kremenovim peskom, kot je opisano v odstavku 22 (npr. 10 g kremenovega peska na preskusno posodo). Ugotovljeno je, da količina 0,20–0,25 ml na gram peska zadošča za to, da je kremenov pesek v celoti namočen. Nato morajo topila izhlapeti do suhega stanja. Za kar najmanjše izgube preskusne kemikalije zaradi hkratnega izhlapevanja (npr. odvisnega od parnega tlaka kemikalije) mora biti prevlečeni pesek uporabljen takoj po sušenju. Suhi pesek se zmeša s primerno količino formulirane usedline z ustrezno ravnjo koncentracije. Upoštevati je treba količino peska, prinesenega z mešanico preskusne kemikalije in peska (usedlino je torej treba pripraviti z manj peska). Glavna prednost tega postopka je, da v usedlino ni vnesenega skoraj nič topila (7). Namesto tega se lahko, npr. pri naravni usedlini, preskusna kemikalija doda s primešanjem posušenega in fino zmletega dela usedline, kot je zgoraj opisano za kremenov pesek, ali pa z vmešanjem preskusne kemikalije v vlažno usedlino, pri čemer nato kakršno koli uporabljeno sredstvo za raztapljanje izhlapi. Paziti je treba, da je preskusna kemikalija, dodana usedlini, v njej temeljito in enakomerno razporejena. Po potrebi je mogoče za potrditev ciljnih koncentracij v usedlini in določanje stopnje homogenosti analizirati podvzorce. Za potrditev ciljnih koncentracij v usedlini je lahko uporabna tudi analiza podvzorcev preskusnih raztopin. Ker je za prevlečenje kremenovega peska s preskusno kemikalijo uporabljeno topilo, je treba uporabiti kontrolo s topilom, pripravljeno z enako količino topila, kot je uporabljena pri preskusnih usedlinah. Poročati je treba o metodah, uporabljenih za primešanje, in razlogih za izbiro določenega postopka primešanja, ki ni enak zgoraj opisanemu. Metode primešanja je mogoče prilagoditi fizikalno-kemijskim lastnostim preskusne kemikalije, npr. za preprečevanje izgub zaradi izhlapevanja med primeševanjem ali uravnoteževanjem. Dodatne smernice o postopkih primešanja so podane v Environment Canada (1995) (46).
|
|
29.
|
Ko je usedlina s primešano preskusno kemikalijo pripravljena, porazdeljena v ponovitvene preskusne posode in je vanjo dotočena preskusna voda, je zaželeno, da se omogoči porazdelitev preskusne kemikalije iz usedline v vodno fazo (npr. (3)(7)(9)). To je po možnosti treba storiti v temperaturnih in prezračevalnih pogojih, ki bodo uporabljeni v preskusu. Ustrezen čas za uravnoteženje je odvisen od značilnosti usedline in kemikalije, lahko pa traja od več ur do več dni in v redkih primerih do več tednov (4–5 tednov) (npr. (27)(47)). V tem preskusu se ne čaka na uravnoteženje, temveč se za to priporoča obdobje od 48 ur do 7 dni. Tako bo čas za razgradnjo preskusne kemikalije najkrajši. Usedlino s primešano preskusno kemikalijo je, odvisno od namena študije, npr. če je treba posnemati okoljske pogoje, mogoče uravnoteževati ali starati preko daljšega obdobja.
|
|
30.
|
Ob koncu obdobja za uravnoteženje je treba vzeti vsaj vzorce vode nad usedlino in glavnine usedline za analizo koncentracije preskusne kemikalije ter vsaj pri najvišji koncentraciji in nižji koncentraciji. Te analitske določitve preskusne kemikalije morajo omogočati izračun masne bilance in izražanje rezultatov na podlagi izmerjenih začetnih koncentracij. V splošnem vzorčenje moti ali uniči sistem vode in usedline. Zato navadno ni mogoče uporabiti istih ponovitev za vzorčenje usedlin in črvov. Pripraviti je treba dodatne ‚analitske‘ posode, ki bodo obdelane na enak način (vključno s prisotnostjo preskusnih organizmov), vendar se ne bodo uporabile za biološka opazovanja. Dimenzije posod je treba izbrati tako, da bodo omogočale količine vzorcev, ki jih zahteva analitska metoda. Podrobnosti vzorčenja so navedene v odstavku 53.
|
IZVEDBA PRESKUSA
Predhodni preskus
|
31.
|
Če informacije strupenosti preskusne kemikalije za vrsto Lumbriculus variegatus niso na voljo, je lahko koristna izvedba predhodnega preskusa za določanje območja koncentracij, ki bodo preskušene v dokončnem preskusu, in za optimizacijo preskusnih pogojev dokončnega preskusa. Za ta namen se uporabi niz široko razmaknjenih koncentracij preskusne kemikalije. Črvi so izpostavljeni vsaki koncentraciji preskusne kemikalije v obdobju (npr. 28 dni, kot v dokončnem preskusu), ki omogoča oceno ustreznih preskusnih koncentracij; ponovitve niso zahtevane. Med predhodnim preskusom je treba opazovati in beležiti vedenje črvov, na primer izogibanje usedlini, ki bi ga lahko povzročila preskusna kemikalija in/ali usedlina. V predhodnem preskusu ne smejo biti preskušene koncentracije, višje od 1 000 mg/kg suhe teže usedline.
|
Dokončni preskus
|
32.
|
V dokončnem preskusu mora biti uporabljenih in izbranih vsaj pet koncentracij, npr. na podlagi rezultata predhodnega preskusa za določanje območja delovanja (odstavek 31), in kot je opisano v odstavkih 35, 36, 37 in 38.
|
|
33.
|
Poleg preskusne serije je treba izvesti še kontrolo (za ponovitve glej odstavke 36, 37 in 38), ki vsebuje vse sestavine, razen preskusne kemikalije. Če se za uporabo preskusne kemikalije uporablja kakršno koli sredstvo za raztapljanje, to ne sme imeti pomembnega vpliva na preskusne organizme, kar pokaže dodatna kontrola, v kateri je samo topilo.
|
Načrt preskusa
|
34.
|
Načrt preskusa se nanaša na izbiro števila preskusnih koncentracij in razmikov med njimi, število posod za vsako koncentracijo in število dodanih črvov na posodo. Načrti za oceno vrednosti ECx in NOEC ter izvedbo mejnega preskusa so opisani v odstavkih 35, 36, 37 in 38.
|
|
35.
|
S koncentracijami, vključenimi v preskus, bi morala biti zajeta koncentracija z učinkom (npr. EC50, EC25, EC10) in razpon koncentracije, v katerem je zanimiv vpliv preskusne snovi. Izogibati se je treba ekstrapolaciji veliko pod najnižjo koncentracijo, ki vpliva na preskusne organizme, ali veliko nad najvišjo preskušano koncentracijo. Če je – v izjemnih primerih – takšna ekstrapolacija izvedena, mora biti v poročilu to podrobno pojasnjeno.
|
|
36.
|
Če je treba oceniti vrednost ECx, je treba preskusiti vsaj pet koncentracij in najmanj tri ponovitve za vsako koncentracijo; za kontrolo ali kontrolo s topilom, če se uporablja, se za izboljšanje ocene variabilnosti kontrole priporoča šest ponovitev. Vsekakor je priporočljivo uporabiti dovolj preskusnih koncentracij, da se omogoči dobra ocena modela. Faktor med koncentracijami ne sme biti večji od dve (izjema je dopustna, kadar je naklon krivulje koncentracija-odziv majhen). Število ponovitev na posamezno tretirano skupino se lahko zmanjša, če se poveča število preskusnih koncentracij v razponu 5–95 %. Povečanje števila ponovitev ali zmanjšanje velikosti razmikov med preskusnimi koncentracijami običajno vodi do ožjih intervalov zaupanja za preskus.
|
|
37.
|
Če je treba oceniti vrednosti LOEC/NOEC, je treba uporabiti vsaj pet preskusnih koncentracij z vsaj štirimi ponovitvami (za kontrolo ali kontrolo s topilom, če se uporablja, se za izboljšanje ocene variabilnosti kontrole priporoča šest ponovitev), faktor med koncentracijami pa ne sme biti večji od dve. Nekatere informacije o statistični moči, ugotovljene med preskušanjem domnev v krožnem preskusu preskusne metode so podane v Dodatku 6.
|
|
38.
|
Lahko se opravi mejni preskus (z uporabo ene preskusne koncentracije in kontrol), če do 1 000 mg/kg suhe teže usedline ni pričakovati nobenih učinkov (npr. iz preskusa določanja območja delovanja) ali če bo preskušanje ene same koncentracije dovolj za potrditev zadevne vrednosti NOEC. V slednjem primeru je treba v poročilo o preskusu vključiti podrobno utemeljitev za izbiro mejne koncentracije. Namen mejnega preskusa je izvesti preskus pri dovolj visoki koncentraciji, da lahko nosilci odločanja izključijo mogoče strupene učinke preskusne kemikalije, meja pa je določena pri koncentraciji, za katero ni pričakovati, da bi se pojavila v katerem koli primeru. Priporočenih je 1 000 mg/kg (suhe teže). Običajno je potrebnih vsaj šest ponovitev za tretirane skupine in kontrole. Nekatere informacije o statistični moči, ugotovljene med preskušanjem domnev v krožnem preskusu preskusne metode, so podane v Dodatku 6.
|
Pogoji izpostavljenosti
Preskusni organizmi
|
39.
|
Preskus se izvede z vsaj 10 črvi za vsako ponovitev, uporabljeno za določanje bioloških parametrov. To število črvov ustreza približno 50– 100 mg mokre biomase. S predpostavko, da vsebnost suhe snovi znaša 17,1 % (48), to pomeni približno 9– 17 mg suhe biomase na posodo. V metodah US EPA (2000 (7)) je priporočena uporaba stopnje obremenitve, ki ne presega 1: 50 (suha biomasa: skupni organski ogljik). Za formulirano usedlino, opisano v odstavku 22, to ustreza približno 43 g usedline (suhe teže) na 10 črvov pri vsebnosti skupnega organskega ogljika, ki znaša 2,0 % suhe usedline. V primerih, ko je na posodo uporabljenih več kot 10 črvov, je treba ustrezno prilagoditi količino usedline in vode nad njo.
|
|
40.
|
Vsi črvi, uporabljeni v preskusu, morajo prihajati iz istega vira in biti v enakem fiziološkem stanju (glej Dodatek 5). Izbrati je treba črve podobnih velikosti (glej odstavek 39). Priporočeno je, da se podvzorci serije ali zaloge črvov pred preskusom stehtajo, da se tako oceni srednja teža.
|
|
41.
|
Črvi, ki bodo uporabljeni v preskusu, se odstranijo iz kulture (za podrobnosti glej Dodatek 5). Velike (odrasle) živali, ki ne kažejo znakov nedavne fragmentacije, se prenesejo v steklene posode (npr. petrijevke), ki vsebujejo čisto vodo. Nato se sinhronizirajo, kot je opisano v Dodatku 5. Po obnavljanju, ki traja od 10 do 14 dni, se za preskus uporabijo nepoškodovani, celi črvi podobne velikosti, ki po nežnem mehanskem dražljaju dejavno plavajo ali se plazijo. Če se preskusni pogoji razlikujejo od pogojev gojenja (npr. v temperaturi, režimu osvetljenosti in vodi nad usedlino), bi morala faza aklimatizacije, ki traja npr. 24 ur pri enaki temperaturi, režimu osvetljenosti in vodi nad usedlino, kot so uporabljeni v preskusu, zadoščati za prilagoditev črvov preskusnim pogojem. Prilagojene maloščetince je treba naključno dodeliti preskusnim posodam.
|
Hranjenje
|
42.
|
Ker se hrana usedlini doda pred (ali med) vnosom preskusne kemikalije, se črvi med preskusom ne hrani še dodatno.
|
Svetloba in temperatura
|
43.
|
Obdobje osvetljenosti v kulturi in preskusu običajno traja 16 ur (3), (7). Jakost svetlobe mora ostati nizka (npr. 100–500 lx), da se posnema naravne pogoje na površini usedline, izmeriti pa jo je treba vsaj enkrat med obdobjem izpostavljenosti. Temperatura mora biti ves čas preskusa 20 ± 2 °C. Na določen dani datum merjenja razlika v temperaturi med preskusnimi posodami ne sme presegati ± 1 °C. Preskusne posode je treba postaviti v preskusni inkubator ali preskusno območje naključno, da se npr. kar najbolj zmanjša vpliv mesta posode na razmnoževanje.
|
Prepihovanje
|
44.
|
Vodo nad usedlino v preskusnih posodah je treba rahlo prepihovati (npr. z 2–4 mehurčki na sekundo) prek Pasteurjeve pipete, postavljene približno 2 cm nad površino usedline, da se usedlino čim manj vznemirja. Treba je paziti, da koncentracija raztopljenega kisika ne pade pod 30 % nasičenosti zraka (ASV). Dovod zraka je treba nadzirati in po potrebi vsaj enkrat na dan ob delavnikih prilagoditi.
|
Meritve kakovosti vode
|
45.
|
V vodi nad usedlino je treba meriti naslednje parametre kakovosti:
|
Temperatura:
|
vsaj v eni preskusni posodi vsake ravni koncentracije in eni preskusni posodi kontrol enkrat na teden ter na začetku in koncu obdobja izpostavljenosti; po možnosti se lahko dodatno, npr. v enournih časovnih razmikih, izmeri temperatura okoliškega medija (zraka ali vodne kopeli).
|
|
Koncentracija raztopljenega kisika:
|
vsaj v eni preskusni posodi vsake ravni koncentracije in eni preskusni posodi kontrol enkrat na teden ter na začetku in koncu obdobja izpostavljenosti; izražena v mg/l in % ASV (nasičenosti zraka).
|
|
Dovod zraka:
|
treba ga je nadzirati in ga po potrebi vsaj enkrat na dan ob delavnikih prilagoditi.
|
|
Vrednost pH:
|
vsaj v eni preskusni posodi vsake ravni koncentracije in eni preskusni posodi kontrol enkrat na teden ter na začetku in koncu obdobja izpostavljenosti.
|
|
Skupna trdota vode:
|
vsaj v eni ponovitvi kontrol in eni preskusni posodi pri najvišji koncentraciji na začetku in koncu obdobja izpostavljenosti; izražena v mg/l CaCO3.
|
|
Skupna vsebnost amonijaka:
|
vsaj v eni ponovitvi kontrol in eni preskusni posodi vsake ravni koncentracije na začetku obdobja izpostavljenosti in nato trikrat na teden; izražena v mg/l NH4
+ ali NH3 ali skupnega amonijaka-N.
|
Če je treba zaradi merjenja parametrov kakovosti vode iz posod odstraniti vzorce znatne količine vode, je za merjenje kakovosti vode priporočljivo pripraviti ločene posode, da se razmerje količine vode in usedline ne spremeni.
|
Biološka opazovanja
|
46.
|
Med izpostavljenostjo je treba preskusne posode opazovati, da se vizualno ocenijo morebitne spremembe vedenja pri črvih (npr. izogibanje usedlini, iztrebke, vidne na površini usedline) v primerjavi s kontrolami. Opažanja je treba zabeležiti.
|
|
47.
|
Ob koncu preskusa se vsaka ponovitev pregleda (dodatne posode, namenjene za kemijske analize, se lahko izključijo iz pregleda). Za odstranitev vseh črvov iz preskusne posode je treba uporabiti primerno metodo. Poskrbeti je treba, da so vsi odstranjeni črvi nepoškodovani. Ena možna metoda je presejanje črvov iz usedline. Uporabiti je mogoče mrežo iz nerjavnega jekla s primerno velikostjo odprtin. Večino vode nad usedlino se skrbno odlije, preostalo usedlino in vodo pa se stresa, da nastane blato, ki ga je mogoče presejati skozi sito. Z mrežo velikosti 500 μm večina delcev usedline zelo hitro preide skozi sito, vendar je treba presejanje izvesti hitro, da se črvi ne splazijo v mrežo ali skoznjo. Mreža velikosti 250 μm bo črvom preprečila, da bi se splazili vanjo ali skoznjo, vendar je treba paziti, da na mreži ostane kar najmanj delcev usedline. Presejano blato vsake ponovitvene posode je mogoče drugič presejati, da se zagotovo odstranijo vsi črvi. Alternativna metoda je lahko ogrevanje usedline s postavitvijo preskusnih posod v vodno kopel s temperaturo 50–60 °C; črvi zapustijo usedlino in jih je mogoče z njene površine zbrati z vroče polirano široko pipeto. Druga alternativna metoda je lahko pridobivanje blata usedline in zlivanje tega blata v plitvo ponev primerne velikosti. Iz plitve plasti blata je mogoče črve pobrati z jekleno iglo ali urarsko pinceto (ki se po možnosti uporablja kot vilice in ne kot klešče, da se črvi ne poškodujejo) in jih prenesti v čisto vodo. Po ločitvi črvov iz blata usedline se črvi operejo v preskusnem mediju in preštejejo.
|
|
48.
|
Neodvisno od uporabljene metode morajo laboratoriji dokazati, da je njihovo osebje iz celotne usedline sposobno odstraniti vsaj 90 % organizmov. Določeno število preskusnih organizmov je, na primer, mogoče dodati kontrolni usedlini ali preskusnim usedlinam, stopnjo odstranitve pa je mogoče določiti po eni uri (7).
|
|
49.
|
Zabeležiti in oceniti je treba skupno število živih in mrtvih osebkov na ponovitev. Za mrtve veljajo naslednje skupine črvov:
|
(a)
|
po nežnem mehanskem dražljaju ni nobene reakcije;
|
|
(b)
|
prisotni so znaki razkrajanja (v kombinaciji s točko ‚a‘);
|
Poleg tega je mogoče žive črve dodeliti eni od treh skupin:
|
(a)
|
veliki celi črvi (odrasli osebki) brez obnovljenih predelov telesa;
|
|
(b)
|
celi črvi z obnovljenimi predeli telesa svetlejše barve (tj. z novim zadnjim delom, z novim sprednjim delom ali z novima zadnjim in sprednjim delom);
|
|
(c)
|
neceli črvi (tj. nedavno fragmentirani črvi z neobnovljenimi predeli telesa).
|
Ta dodatna opažanja niso nujna, mogoče pa jih je uporabiti za dodatno razlago bioloških rezultatov (veliko število črvov, dodeljenih skupini c, lahko, na primer, kaže na zamudo pri razmnoževanju ali obnavljanju v danem tretiranju). Poleg tega je treba zabeležiti tudi morebitne opažene razlike v videzu tretiranih in kontrolnih črvov (npr. lezije povrhnjice, zabuhli deli telesa).
|
|
50.
|
Takoj po štetju/oceni se živi črvi, najdeni v vsaki ponovitvi, prenesejo v posušene, predhodno stehtane in označene skodelice tehtnice (eno na ponovitev) ter ubijejo s kapljico etanola na skodelico tehtnice. Skodelice tehtnice se nato postavijo v sušilnik pri 100 ± 5 °C, da se čez noč posušijo, potem pa se po ohlajanju v eksikatorju stehtajo in določi se suha teža črvov (po možnosti v gramih in vsaj na 4 decimalke natančno).
|
|
51.
|
Poleg skupne suhe teže je mogoče določiti suho težo brez pepela, kot je opisano v točki (49), da se upoštevajo anorganske sestavine, ki izvirajo iz zaužite usedline, prisotne v prebavnem traktu črvov.
|
|
52.
|
Biomasa je določena kot skupna biomasa na ponovitev, vključno z odraslimi in mladimi črvi. Pri določanju biomase na ponovitev mrtvi črvi ne smejo biti upoštevani.
|
Preverjanje koncentracij preskusne kemikalije
Vzorčenje
|
53.
|
Vzorci za kemijsko analizo preskusne kemikalije morajo biti odvzeti vsaj za najvišjo koncentracijo in eno nižjo, vsaj na koncu faze uravnoteženja (pred dodajanjem preskusnih organizmov) in na koncu preskusa. Za analizo morata biti vzorčeni vsaj glavnina usedline in voda nad usedlino. Vsak dan vzorčenja je treba vzeti vsaj dva vzorca na matriks in tretiranje. Enega od dveh vzorcev je mogoče shraniti kot rezervo (ki bo analizirana, če bo npr. začetna analiza zunaj razpona ± 20 % nominalne koncentracije). Pri specifičnih kemijskih lastnostih, npr. če je pričakovana hitra razgradnja preskusne kemikalije, se lahko časovni razpored analize na podlagi strokovnega mnenja natančneje določi (npr. s pogostejšim vzorčenjem, analizo več ravni koncentracij). Nato se vzorci lahko vzamejo na vmesne dni vzorčenja (npr. sedmi dan po začetku izpostavljenosti).
|
|
54.
|
Vodo nad usedlino je treba zaradi čim manjšega vznemirjanja usedline vzorčiti tako, da se previdno odlije ali izčrpa. Zabeležiti je treba količino vzorcev.
|
|
55.
|
Po tem, ko je voda nad usedlino odstranjena, se mora usedlina homogenizirati in prenesti v primerno posodo. Zabeleži se teža mokrega vzorca usedline.
|
|
56.
|
Če je dodatno potrebna analiza preskusne kemikalije v porni vodi, je treba homogenizirane in stehtane vzorce centrifugirati, da se pridobi porna voda. Približno 200 ml mokre usedline je, na primer, mogoče natočiti v 250-mililitrske centrifugirne čaše. Nato je treba vzorce centrifugirati brez filtracije, da se loči porna voda, npr. pri 10 000 ± 600 × g 30–60 minut pri temperaturi, ki ne presega v preskusu uporabljene temperature. Po centrifugiranju se supernatant odlije ali nakapa s pipeto, pri čemer je treba paziti, da se prepreči vnos delcev, količina pa se zabeleži. Zabeleži se teža peleta preostale usedline. Če je vsak dan vzorčenja določena suha teža usedline, je ocena masne bilance ali obnove preskusne kemikalije v sistemu vode in usedline lažja. V nekaterih primerih koncentracij v porni vodi zaradi premajhnega vzorca morda ne bo mogoče analizirati.
|
|
57.
|
Če analiza ni takojšnja, je treba vse vzorce shraniti na ustrezen način, npr. pri pogojih shranjevanja, ki so priporočeni za čim manjšo razgradnjo določene preskusne kemikalije (okoljski vzorci se npr. običajno shranjujejo pri – 18 °C v temi). Informacije o pravilnih pogojih shranjevanja za določeno preskusno kemikalijo, na primer trajanju in temperaturi shranjevanja, postopkih ekstrakcije itd., pridobite pred začetkom študije.
|
Analitska metoda
|
58.
|
Ker so za celoten postopek pomembne točnost, natančnost in občutljivost analitske metode, uporabljene za preskusno kemikalijo, se je treba praktično prepričati, da so natančnost in reproduktivnost kemične analize ter ponovna pridobitev preskusne kemikalije iz vzorcev vode in usedline zadovoljive za določeno metodo vsaj pri najnižjih in najvišjih preskusnih koncentracijah. Prepričajte se tudi, da v kontrolnih komorah ni zaznati preskusne kemikalije v koncentracijah, višjih od meje določljivosti. Po potrebi popravite nominalne koncentracije za ponovno pridobivanje primešane preskusne kemikalije za nadzor kakovosti (npr. kjer je stopnja ponovnega pridobivanja zunaj območja 80– 120 % količine, v kateri je bila primešana preskusna kemikalija). V celotnem preskusu je treba z vsemi vzorci ravnati tako, da se kontaminacija in izguba čim bolj zmanjšata (npr. zaradi adsorpcije preskusne kemikalije na napravo za vzorčenje).
|
|
59.
|
Zabeležiti je treba stopnjo ponovnega pridobivanja preskusne kemikalije, mejo zaznavnosti in mejo zaznavnosti v usedlini in vodi ter o njih poročati.
|
PODATKI IN POROČANJE
Obdelava rezultatov
|
60.
|
Glavni obvezni spremenljivki odziva, ki jih je treba v preskusu statistično oceniti, sta biomasa in skupno število črvov na ponovitev. Neobvezno se lahko oceni tudi razmnoževanje (v obliki povečanja števila črvov) in rast (v obliki povečanja suhe biomase). V tem primeru je treba na začetku izpostavljenosti pridobiti oceno suhe teže črvov, npr. z merjenjem suhe teže reprezentativnega podvzorca serije sinhroniziranih črvov, ki bodo uporabljeni v preskusu.
|
|
61.
|
Čeprav smrtnost ni končna točka tega preskusa, je treba smrtnosti oceniti v čim večji meri. Za oceno smrtnosti morajo črvi, ki ne reagirajo na nežen mehanski dražljaj, ali črvi, ki kažejo znake razkrajanja ter pogrešani črvi veljati za mrtve. Smrtnosti je pri razlagi rezultatov treba vsaj zabeležiti in upoštevati.
|
|
62.
|
Učinkovite koncentracije morajo biti izražene v mg/kg suhe teže usedline. Če je rekuperacija preskusne kemikalije, merjene v usedlini ali v usedlini in vodi nad njo ob začetku izpostavljenosti med 80 in 120 % nominalnih koncentracij, je mogoče učinkovite koncentracije (ECx, NOEC, LOEC) izraziti na podlagi nominalnih koncentracij. Če ponovno pridobivanje odstopa od nominalnih koncentracij za več kot ± 20 % vrednosti nominalnih koncentracij, morajo učinkovite koncentracije (ECx, NOEC, LOEC) temeljiti na prvotno izmerjenih koncentracijah na začetku izpostavljenosti, npr. upoštevati morajo masno bilanco preskusne kemikalije v preskusnem sistemu (glej odstavek 30). V teh primerih je mogoče dodatne informacije za potrditev, da so bile preskusne usedline pravilno pripravljene, pridobiti iz analize založnih raztopin in/ali uporabljenih raztopin.
|
ECx
|
63.
|
Vrednosti ECx za parametre, opisane v odstavku 60, se izračunajo z ustreznimi statističnimi metodami (npr. z analizo probit, logistično ali Weibullovo funkcijo, prilagojeno metodo Spearman-Karber ali enostavno interpolacijo). Navodila za statistično ocenjevanje so navedena v (15) in (50). Vrednost ECx je pridobljena tako, da je v navedeno enačbo vstavljena vrednost, ki ustreza x % srednje vrednosti kontrole. Za izračun vrednosti EC50 ali katere koli druge vrednosti ECx je treba srednjo vrednost glede na tretirano skupino (

) analizirati z regresijsko analizo. |
NOEC/LOEC
|
64.
|
Če je statistična analiza namenjena določanju vrednosti NOEC/LOEC, je potrebna statistika glede na posodo (posamezne posode se štejejo za ponovitve). Uporabljene morajo biti ustrezne statistične metode. V splošnem se s pomočjo enostransko zastavljenega (manj obsežnega) preskušanja domnev pri p ≤ 0,05 proučijo škodljivi učinki preskusne snovi v primerjavi s kontrolo. Primeri so podani v naslednjih odstavkih. Navodila za izbiro ustreznih statističnih metod so navedena v (15) in (50).
|
|
65.
|
Normalno porazdelitev podatkov je mogoče preskusiti npr. s preskusom ustreznosti prileganja Kolmogorov-Smirnov, preskusom razmerja med variacijskim razmikom in standardnim odklonom (preskusom R/s) ali Shapiro-Wilkovim preskusom (dvostranskim, p ≤ 0,05). Za preskus homogenosti variance se lahko uporabi Cochranov, Levenov ali Bartlettov preskus (dvostranski, p ≤ 0,05). Če so izpolnjeni predpogoji postopkov parametričnega preskusa (normalnosti, homogenosti variance), je mogoče izvesti enofaktorsko analizo variance (enofaktorsko ANOVA) in nato preskuse večkratne primerjave. Za izračun, ali obstajajo značilne razlike (p ≤ 0,05) med kontrolami in različnimi koncentracijami preskusnih snovi, je mogoče uporabiti parne primerjave (npr. Dunnettov t-preskus) ali regresivne trendnostne preskuse (npr. Williamsov preskus). V nasprotnem primeru je treba za določanje vrednosti NOEC in LOEC uporabiti neparametrične metode (npr. Bonferronijev U-preskus v skladu s trendnostnim preskusom po Holmu ali Jonckheere-Terpstraju).
|
Mejni preskus
|
66.
|
Če je izveden mejni preskus (primerjava kontrole in samo ene tretirane skupine) in če so izpolnjeni predpogoji postopkov parametričnega preskusa (normalnost, homogenost), je mogoče s Studentovim preskusom (t-preskusom) preveriti odzive metrik (skupnega števila črvov in biomase v obliki suhe teže črvov). Če te zahteve niso izpolnjene, je mogoče uporabiti t-preskus za neenake variance (Welchev t-preskus) ali neparametrični preskus, kot je Mann-Whitneyjev U-preskus. Nekatere informacije o statistični moči, ugotovljene med preskušanjem domnev v krožnem preskusu metode, so podane v Dodatku 6.
|
|
67.
|
Za določanje značilnih razlik med kontrolami (kontrolo in kontrolo s topilom) je mogoče ponovitve vsake kontrole preskusiti, kot je opisano za mejni preskus. Če ti preskusi ne zaznajo značilnih razlik, je mogoče vse ponovitve kontrol in kontrol s topilom združiti. V nasprotnem primeru je treba vse tretirane vzorce primerjati s kontrolo s topilom.
|
Razlaga rezultatov
|
68.
|
Če je prišlo do odstopanja od te preskusne metode in kadar se izmerjene koncentracije preskusnih koncentracij pojavljajo na ravneh blizu meje zaznavnosti analitične metode, je treba rezultate razlagati previdno. Morebitna odstopanja od te preskusne metode je treba zabeležiti.
|
Poročilo o preskusu
|
69.
|
Poročilo o preskusu naj vsebuje vsaj naslednje informacije:
|
—
|
Preskusna kemikalija:
|
—
|
kemijski identifikacijski podatki (splošno ime, kemijsko ime, strukturna formula, številka CAS itd.), vključno s čistostjo in analitsko metodo za kvantifikacijo preskusne snovi, virom preskusne kemikalije ter identiteto in koncentracijo vseh uporabljenih topil,
|
|
—
|
vse informacije o fizikalnem stanju in fizikalno-kemijskih lastnostih, kot so bile pridobljene pred začetkom preskusa (npr. topnost v vodi, parni tlak, porazdelitveni koeficient v tleh (ali usedlini, če je na voljo), log Kow, stabilnost v vodi itd.).
|
|
|
—
|
Preskusne vrste:
|
—
|
znanstveno ime, sev, vir, morebitna predhodna obdelava, aklimatizacija, pogoji gojenja itd.
|
|
|
—
|
Preskusni pogoji:
|
—
|
uporabljeni preskusni postopek (npr. statični, polstatični ali pretočni),
|
|
—
|
načrt preskusa (npr. število, material in velikost preskusnih komor, količina vode na posodo (za pretočne ali polstatične postopke: hitrost nadomeščanja količine vode), morebitno prezračevanje, uporabljeno pred preskusom in med njim, število ponovitev, število črvov na ponovitev ob začetku izpostavljenosti, število preskusnih koncentracij, trajanje kondicioniranja, obdobje za uravnoteženje, obdobje izpostavljenosti, pogostost vzorčenja),
|
|
—
|
globina usedline in vode nad njo,
|
|
—
|
metoda predhodne obdelave preskusne kemikalije in njeno primešanje/nanos,
|
|
—
|
nominalne preskusne koncentracije, podrobnosti o vzorčenju za kemijsko analizo in analitske metode, s katerimi so bile pridobljene koncentracije preskusne kemikalije,
|
|
—
|
lastnosti usedline, kot je opisano v odstavkih 24 in 25, in vse druge izvedene meritve, priprava formulirane usedline,
|
|
—
|
priprava preskusne vode (če se uporablja rekonstituirana voda) in lastnosti (koncentracija kisika, vrednost pH, prevodnost, trdota in vse druge izvedene meritve) pred začetkom preskusa,
|
|
—
|
podrobne informacije o hranjenju, vključno z vrsto hrane, pripravo, količino in načinom hranjenja,
|
|
—
|
jakost svetlobe in obdobja osvetljenosti,
|
|
—
|
metode, uporabljene za določanje vseh bioloških parametrov (npr. vzorčenja, pregledovanja, tehtanja preskusnih organizmov) in vseh abiotskih parametrov (npr. parametrov kakovosti vode in usedline),
|
|
—
|
količine in/ali teže vseh vzorcev za kemijsko analizo,
|
|
—
|
podrobne informacije o obdelavi vseh vzorcev za kemijsko analizo, vključno s podrobnostmi o pripravi, shranjevanju, postopkih primešanja preskusne kemikalije, ekstrakciji ter analitskih postopkih (in natančnosti) za preskusno kemikalijo in ponovno pridobivanje preskusne kemikalije.
|
|
|
—
|
Rezultati:
|
—
|
kakovost vode v preskusnih posodah (vrednost pH, temperatura, koncentracija raztopljenega kisika, trdota, koncentracije amonijaka in vse druge izvedene meritve),
|
|
—
|
skupna vsebnost organskega ogljika (TOC), razmerje med suho in mokro težo, vrednost pH usedline in vse druge izvedene meritve,
|
|
—
|
skupno število ter, če je določeno, število celih in necelih črvov v vsaki preskusni komori ob koncu preskusa,
|
|
—
|
suha teža črvov v vsaki preskusni komori ob koncu preskusa in, če je izmerjena, suha teža podvzorca črvov na začetku preskusa,
|
|
—
|
morebitno opaženo nenormalno vedenje v primerjavi s kontrolami (npr. izogibanje usedlini, prisotnost ali odsotnost iztrebkov),
|
|
—
|
morebitne opažene smrtnosti,
|
|
—
|
ocene strupenih končnih točk (npr. ECx, NOEC in/ali LOEC) in statistične metode, uporabljene za njihovo določitev,
|
|
—
|
nominalne preskusne koncentracije, izmerjene preskusne koncentracije in rezultati vseh izvedenih analiz za določitev koncentracije preskusne kemikalije v preskusnih posodah,
|
|
—
|
morebitna odstopanja od meril za veljavnost.
|
|
|
—
|
Vrednotenje rezultatov:
|
—
|
skladnost rezultatov z merili veljavnosti, navedenimi v odstavku 13,
|
|
—
|
obravnava rezultatov, vključno z vsemi vplivi na rezultat preskusa, ki izvirajo iz odstopanj od te preskusne metode.
|
|
|
LITERATURA
|
(1)
|
ES (2003). Tehnični usmeritveni dokument v podporo Direktivi Komisije 93/67/EGS o ocenjevanju tveganj v zvezi z novimi prijavljenimi snovmi, Uredbi Komisije (ES) št. 1488/94 o ocenjevanju tveganja, ki ga predstavljajo obstoječe snovi, in Direktivi 98/8/ES Evropskega parlamenta in Sveta o dajanju biocidnih pripravkov v promet; del I–IV. Urad za publikacije Evropske unije (Evropska komisija), Luksemburg.
|
|
(2)
|
OECD (1992a). Report of the OECD workshop on effects assessment of chemicals in sediment. OECD Monographs, št 60. Organizacija za gospodarsko sodelovanje in razvoj (OECD), Pariz.
|
|
(3)
|
ASTM International (2000). Standard guide for the determination of the bioaccumulation of sediment-associated contaminants by benthic invertebrates, E 1688-00a. V: ASTM International 2004 Annual Book of Standards. Zvezek 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
|
|
(4)
|
ASTM International (2002). Standard Test Method for Measuring the Toxicity of Sediment-Associated Contaminants with Freshwater Invertebrates, E1706-00. V: ASTM International 2004 Annual Book of Standards. Zvezek 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
|
|
(5)
|
Phipps, G. L., Ankley, G. T., Benoit, D. A., in Mattson, V. R. (1993). Use of the aquatic Oligochaete Lumbriculus variegatus for assessing the toxicity and bioaccumulation of sediment-associated contaminants. Environ.Toxicol. Chem. 12, 269–279.
|
|
(6)
|
Poglavje C.27 te priloge: Preskus strupenosti s trzačami v sistemu vode in usedline z uporabo usedline s primešano preskusno snovjo.
|
|
(7)
|
U.S. EPA (2000). Methods for measuring the toxicity and bioaccumulation of sediment-associated contaminants with freshwater invertebrates. Druga izdaja. EPA 600/R-99/064, U.S. Environmental Protection Agency, Duluth, MN, marec 2000.
|
|
(8)
|
Environment Canada (1997). Test for Growth and Survival in Sediment using Larvae of Freshwater Midges (Chironomus tentans or Chironomus riparius). Biological Test Method. Report SPE 1/RM/32. December 1997.
|
|
(9)
|
Hill, I. R., Matthiessen, P., Heimbach, F. (ur.) 1993, Guidance document on Sediment Toxicity Tests and Bioassays for freshwater and Marine Environments, From the SETAC-Europe Workshop On Sediment Toxicity Assessment, 8. – 10. november 1993, Renesse (Nizozemska).
|
|
(10)
|
BBA (1995). Long-term toxicity test with Chironomus riparius: Development and validation of a new test system. Uredila M. Streloke in H. Köpp. Berlin, 1995.
|
|
(11)
|
Riedhammer, C., in Schwarz-Schulz, B. (2001). The Newly Proposed EU Risk Assessment Concept for the Sediment Compartment. J. Soils Sediments 1(2), 105– 110.
|
|
(12)
|
ASTM International (2004). Standard guide for collection, storage, characterisation, and manipulation of sediment for toxicological testing and for selection of samplers used to collect benthic invertebrates. American Society for Testing and Materials, E 1391-03.
|
|
(13)
|
Egeler, Ph., Meller, M., Schallnaß, H. J., in Gilberg, D. (2005). Validation of a sediment toxicity test with the endobenthic aquatic oligochaete Lumbriculus variegatus by an international ring test. V sodelovanju z R. Nagelom in B. Karaoglanom. Poročilo nemški Zvezni agenciji za okolje (Umweltbundesamt Berlin), R&D, št.: 202 67 429.
|
|
(14)
|
OECD (2000). Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. OECD Environment, Health and Safety Publications, Series on Testing and Assessment, št. 23.
|
|
(15)
|
Environment Canada (2003). Guidance Document on Statistical Methods for Environmental Toxicity Tests; peti osnutek, marec 2003; Report EPS 1/RM/___.
|
|
(16)
|
Nikkilä A., Halme A., Kukkonen J. V. K. (2003). Toxicokinetics, toxicity and lethal body residues of two chlorophenols in the oligochaete worm, Lumbriculus variegatus, in different sediments. Chemosphere 51: 35–46.
|
|
(17)
|
Baily, H. C., in Liu, D. H. W. (1980). Lumbriculus variegatus, a Benthic Oligochaete, as a Bioassay Organism. str. 205–215. V: Eaton, J. C., Parrish, P. R., in Hendricks, A. C. (ur.). Aquatic Toxicology, ASTM STP 707. American Society for Testing and Materials.
|
|
(18)
|
Chapman, K. K., Benton, M. J., Brinkhurst, R. O., in Scheuerman, P. R. (1999). Use of the aquatic oligochaetes Lumbriculus variegatus and Tubifex tubifex for assessing the toxicity of copper and cadmium in a spiked-artificial-sediment toxicity test. Environmental Toxicology. 14(2): 271–278.
|
|
(19)
|
Meyer, J. S., Boese, C. J., in Collyard, S. A. (2002). Whole-body accumulation of copper predicts acute toxicity to an aquatic oligochaete (Lumbriculus variegatus) as pH and calcium are varied. Comp. Biochem. Physiol. Del C 133:99– 109.
|
|
(20)
|
Schubauer-Berigan, M. K., Dierkes, J. R., Monson, P. D., in Ankley, G. T. (1993). pH-dependent toxicity of cadmium, copper, nickel, lead and zinc to Ceriodaphnia dubia, Pimephales promelas, Hyalella azteca and Lumbriculus variegatus. Environ. Toxicol. Chem. 12(7):1261– 1266.
|
|
(21)
|
West, C. W., Mattson, V. R., Leonard, E. N., Phipps, G. L., in Ankley, G. T. (1993). Comparison of the relative sensitivity of three benthic invertebrates to copper-contaminated sediments from the Keweenaw Waterway. Hydrobiol. 262:57–63.
|
|
(22)
|
Ingersoll, C. G., Ankley, G. T., Benoit D. A., Brunson, E. L., Burton, G. A., Dwyer, F. J., Hoke, R. A., Landrum, P. F., Norberg-King, T. J., in Winger, P. V. (1995). Toxicity and bioaccumulation of sediment-associated contaminants using freshwater invertebrates: A review of methods and applications. Environ. Toxicol. Chem. 14, 1885-1894.
|
|
(23)
|
Kukkonen, J., in Landrum, P. F. (1994). Toxicokinetics and toxicity of sediment-associated Pyrene to Lumbriculus variegatus (Oligochaeta). Environ. Toxicol. Chem. 13, 1457– 1468.
|
|
(24)
|
Leppänen, M. T., in Kukkonen, J. V. K. (1998a). Relationship between reproduction, sediment type and feeding activity of Lumbriculus variegatus (Müller): Implications for sediment toxicity testing. Environ. Toxicol. Chem. 17: 2196–2202.
|
|
(25)
|
Leppänen, M. T., in Kukkonen, J. V. K. (1998b). Factors affecting feeding rate, reproduction and growth of an oligochaete Lumbriculus variegatus (Müller). Hydrobiologia 377: 183– 194.
|
|
(26)
|
Landrum, P. F., Gedeon, M. L., Burton, G. A., Greenberg. M. S., in Rowland, C. D. (2002). Biological Responses of Lumbriculus variegatus Exposed to Fluoranthene-Spiked Sediment. Arch. Environ. Contam. Toxicol. 42: 292–302.
|
|
(27)
|
Brunson, E. L., Canfield, T. J., Ingersoll, C. J., in Kemble, N. E. (1998). Assessing the bioaccumulation of contaminants from sediments of the Upper Mississippi river using field-collected oligochaetes and laboratory-exposed Lumbriculus variegatus. Arch. Environ. Contam. Toxicol. 35, 191–201.
|
|
(28)
|
Ingersoll, C. G., Brunson, E. L., Wang, N., Dwyer, F. J., Ankley, G. T., Mount, D. R., Huckins J., Petty., J., in Landrum, P. F. (2003). Uptake and depuration of non-ionic organic contaminants from sediment by the oligochaete, Lumbriculus variegatus. Environmental Toxicology and Chemistry 22, 872–885.
|
|
(29)
|
Rodriguez, P., in Reynoldson, T. B. (1999). Laboratory methods and criteria for sediment bioassessment. V: Mudroch, A., Azcue, J. M. in Mudroch, P. (ur.): Manual of Bioassessment of aquatic sediment quality. Lewis Publishers, Boca Raton, CRC Press LLC.
|
|
(30)
|
Liebig, M., Egeler, Ph., Oehlmann, J., in Knacker, Th. (2005). Bioaccumulation of 14C-17α-ethinylestradiol by the oligochaete Lumbriculus variegatus in artificial sediment. Chemosphere 59, 271–280.
|
|
(31)
|
Brust, K., Licht, O., Hultsch, V., Jungmann, D., in Nagel, R. (2001). Effects of Terbutryn on Aufwuchs and Lumbriculus variegatus in Artificial Indoor Streams. Environ. Toxicol. Chemistry, Vol. 20, str. 2000–2007.
|
|
(32)
|
Oetken, M., Ludwichowski, K.-U., in Nagel, R. (2000). Sediment tests with Lumbriculus variegatus and Chironomus riparius and 3,4-dichloroaniline (3,4-DCA) within the scope of EG-AltstoffV. Po naročilu nemške Zvezne agencije za okolje (Umweltbundesamt Berlin), FKZ 360 12 001, marec, 2000.
|
|
(33)
|
Leppänen, M. T., in Kukkonen, J. V. K. (1998). Relative importance of ingested sediment and porewater as bioaccumulation routes for pyrene to oligochaete (Lumbriculus variegatus, Müller). Environ. Sci. Toxicol. 32, 1503– 1508.
|
|
(34)
|
Dermott, R., in Munawar, M. (1992). A simple and sensitive assay for evaluation of sediment toxicity using Lumbriculus variegatus (Müller). Hydrobiologia 235/236: 407–414.
|
|
(35)
|
Drewes, C. D., in Fourtner, C. R. (1990). Morphallaxis in an aquatic oligochaete, Lumbriculus variegatus: Reorganisation of escape reflexes in regenerating body fragments. Develop. Biol. 138: 94– 103.
|
|
(36)
|
Brinkhurst, R. O. (1971). A guide for the identification of British aquatic oligochaeta. Freshw. Biol. Assoc., Sci. Publ. št. 22.
|
|
(37)
|
Poglavje C.1 te priloge, Akutna strupenost za ribe (preskus).
|
|
(38)
|
OECD (1992c). Guidelines for Testing of Chemicals, št. 210. Fish, Early-life Stage Toxicity Test. OECD, Pariz.
|
|
(39)
|
Egeler, Ph., Römbke, J., Meller, M., Knacker, Th., Franke, C., Studinger, G., in Nagel, R. (1997). Bioaccumulation of lindane and hexachlorobenzene by tubificid sludgeworms (Oligochaeta) under standardised laboratory conditions. Chemosphere 35, 835–852.
|
|
(40)
|
Meller, M., Egeler, P., Roembke, J., Schallnass, H., Nagel, R., in Streit, B. (1998). Short-term Toxicity of Lindane, Hexachlorobenzene and Copper Sulphate on Tubificid Sludgeworms (Oligochaeta) in Artificial Media. Ecotox. and Environ. Safety, 39, 10–20.
|
|
(41)
|
Egeler, Ph., Römbke, J., Knacker, Th., Franke, C., in Studinger, G. (1999). Delavnica na temo ‚Bioaccumulation: Sediment test using benthic oligochaetes‘, 26.–27. 4. 1999, Hochheim/Main, Nemčija. Report on the R+D-project No. 298 67 419, Umweltbundesamt, Berlin.
|
|
(42)
|
Suedel, B. C., in Rodgers, J. H. (1993). Development of formulated reference sediments for freshwater and estuarine sediment testing. Environ. Toxicol. Chem. 13, 1163– 1175.
|
|
(43)
|
Naylor, C., in Rodrigues, C. (1995). Development of a test method for Chironomus riparius using a formulated sediment. Chemosphere 31: 3291–3303.
|
|
(44)
|
Kaster, J. L., Klump, J. V., Meyer, J., Krezoski, J., in Smith, M. E. (1984). Comparison of defecation rates of Limnodrilus hoffmeisteri using two different methods. Hydrobiologia 11, 181– 184.
|
|
(45)
|
Martinez-Madrid, M., Rodriguez, P., Perez-Iglesias, J. I., in Navarro, E. (1999). Sediment toxicity bioassays for assessment of contaminated sites in the Nervion river (Northern Spain). 2. Tubifex tubifex (Müller) reproduction sediment bioassay. Ecotoxicology 8, 111– 124.
|
|
(46)
|
Environment Canada (1995). Guidance document on measurement of toxicity test precision using control sediments spiked with a reference toxicant. Environmental Protection Series Report EPS 1/RM/30.
|
|
(47)
|
Landrum, P. F. (1989). Bioavailability and toxicokinetics of polycyclic aromatic hydrocarbons sorbed to sediments for the amphipod Pontoporeia hoyi. Environ. Sci. Technol. 23, 588–595.
|
|
(48)
|
Brooke, L. T., Ankley, G. T., Call, D. J., in Cook, P. M. (1996). Gut content and clearance for three species of freshwater invertebrates. Environ. Toxicol. Chem. 15, 223–228.
|
|
(49)
|
Mount, D. R., Dawson, T. D., in Burkhard, L. P. (1999). Implications of gut purging for tissue residues determined in bioaccumulation testing of sediment with Lumbriculus variegatus. Environ. Toxicol. Chem. 18, 1244– 1249.
|
|
(50)
|
OECD 2006. Current approaches in the statistical analysis of ecotoxicity data: A guidance to application. OECD Series on Testing and Assessment, št. 54, OECD, Pariz, Francija.
|
|
(51)
|
Liebig, M., Meller, M., in Egeler, P. (2004). Sedimenttoxizitätstests mit aquatischen Oligochaeten – Einfluss verschiedener Futterquellen im künstlichen Sediment auf Reproduktion und Biomasse von Lumbriculus variegatus. Proceedings 5/2004: Statusseminar Sedimentkontakttests. 24.–25. marec 2004. BfG (Bundesanstalt für Gewässerkunde), Koblenz, Nemčija, str. 107– 119.
|
Dodatna literatura o statističnih postopkih:
Dunnett, C. W. (1955). A multiple comparison procedure for comparing several treatments with a control. Amer. Statist. Ass. J. 50, 1096– 1121.
Dunnett, C. W. (1964). New tables for multiple comparisons with a control. Biometrics 20, 482–491.
Finney, D. J. (1971). Probit Analysis (3. izdaja), str. 19–76. Cambridge Univ. Press.
Finney, D. J. (1978). Statistical Method in Biological Assay. Charles Griffin & Company Ltd, London.
Hamilton, M. A., Russo, R. C., in Thurston, R. V. (1977). Trimmed Spearman-Karber Method for estimating median lethal concentrations in toxicity bioassays. Environ. Sci. Technol. 11(7), 714–719; Correction: Environ. Sci. Technol. 12 (1998), 417.
Holm, S. (1979). A simple sequentially rejective multiple test procedure. Scand. J. Statist. 6, 65–70.
Sokal, R. R., in Rohlf, F. J. (1981) Biometry. The principles and practice of statistics in biological research. 2. izdaja. W. H. Freeman and Company. New York.
Miller, R. G., Jr. (1986). Beyond ANOVA, basics of applied statistics. John Wiley & Sons. New York.
Shapiro, S. S., in Wilk, M. B. (1965). An analysis of variance test for normality (complete samples). Biometrika 52: 591–611.
Williams, D. A. (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27, 103– 117.
Williams, D. A. (1972). The comparison of several dose levels with a zero dose control. Biometrics 28, 519–531.
Dodatek 1
Opredelitve pojmov
Za to preskusno metodo se uporabljajo naslednje opredelitve:
|
|
Kemikalija pomeni snov ali zmes.
|
|
|
Obdobje kondicioniranja se uporablja za stabiliziranje mikrobne komponente usedline in odstranjevanje npr. amonijaka, ki izvira iz komponent usedline; gre za obdobje pred primešanjem preskusne kemikalije usedlini. Običajno se voda nad usedlino po kondicioniranju zavrže.
|
|
|
Vrednost ECx
je koncentracija preskusne kemikalije v usedlini, ki v navedenem obdobju izpostavljenosti povzroči X-odstotni (npr. 50-odstotni) učinek na biološki parameter.
|
|
|
Obdobje za uravnoteženje se uporablja za porazdelitev preskusne kemikalije med trdno fazo, porno vodo in vodo nad usedlino; gre za obdobje po primešanju preskusne kemikalije usedlini in pred dodajanjem preskusnih organizmov.
|
|
|
Faza izpostavljenosti je čas, v katerem so preskusni organizmi izpostavljeni preskusni kemikaliji.
|
|
|
Formulirana usedlina ali rekonstituirana, umetna ali sintetična usedlina je zmes snovi, uporabljenih za posnemanje fizičnih sestavin naravne usedline.
|
|
|
Najnižja koncentracija z opaznim učinkom (LOEC) je najnižja preskušena koncentracija preskusne kemikalije, pri kateri je bilo opaženo, da ima snov značilen strupen učinek (pri p ≤ 0,05) v primerjavi s kontrolo. Vendar morajo imeti vse koncentracije nad vrednostjo LOEC učinek, ki je enak ali večji od učinka, opaženega pri vrednosti LOEC. Če teh dveh pogojev ni možno izpolniti, je treba podrobno razložiti, kako je bila izbrana vrednost LOEC (in s tem tudi vrednost NOEC).
|
|
|
Koncentracija brez opaznega učinka (NOEC) je preskusna koncentracija tik pod vrednostjo LOEC, ki v danem obdobju izpostavljenosti v primerjavi s kontrolo nima statistično značilnega učinka (p ≤ 0,05).
|
|
|
Porazdelitveni koeficient oktanol/voda (Kow, včasih izražen tudi kot Pow) je uravnoteženo razmerje topnosti kemikalije v n-oktanolu in vodi ter predstavlja lipofilnost kemikalije (poglavje A.24 te priloge). Vrednost Kow ali logaritem Kow (log Kow) se uporablja kot pokazatelj potenciala kemikalije za bioakumulacijo v vodnih organizmih.
|
|
|
Porazdelitveni koeficient organski ogljik/voda (Koc) je razmerje med koncentracijo kemikalije v/na delu usedline z organskim ogljikom in koncentracijo kemikalije v vodi v ravnotežnem stanju.
|
|
|
Voda nad usedlino je voda, ki prekriva usedlino v preskusni posodi.
|
|
|
Porna voda ali intersticijska voda je voda, ki zavzema prostor med delci usedline ali tal.
|
|
|
Usedlina s primešano kemikalijo je usedlina, ki ji je bila dodana kemikalija.
|
|
|
Preskusna kemikalija je snov ali zmes, preskušena s to preskusno metodo.
|
Dodatek 2
Sestava priporočene rekonstituirane vode
(prevzeto iz poglavja C.1 te priloge (1))
|
(a)
|
Raztopina kalcijevega klorida
Raztopite 11,76 g CaCl2 · 2H2O v deionizirani vodi: z deionizirano vodo dopolnite do 1 l.
|
|
(b)
|
Raztopina magnezijevega sulfata
Raztopite 4,93 g MgSO4 · 7H2O v deionizirani vodi: z deionizirano vodo dopolnite do 1 l.
|
|
(c)
|
Raztopina natrijevega bikarbonata
Raztopite 2,59 g NaHCO3 v deionizirani vodi: z deionizirano vodo dopolnite do 1 l.
|
|
(d)
|
Raztopina kalijevega klorida
Raztopite 0,23 g KCl v deionizirani vodi: z deionizirano vodo dopolnite do 1 l.
|
Vse kemikalije morajo biti analitsko čiste.
Prevodnost destilirane ali deionizirane vode ne sme presegati 10 μScm– 1.
25 ml vsake od raztopin v točkah od (a) do (d) je zmešanih z deionizirano vodo, skupna količina pa je s to vodo dopolnjena do 1 l. Vsota kalcijevih in magnezijevih ionov v teh raztopinah je 2,5 mmol/l.
Razmerje ionov Ca in Mg je 4: 1, ionov Na in K pa 10: 1. Alkalnost KS4.3 te raztopine znaša 0,8 mmol/l.
Vodo za redčenje prepihujte, dokler ni dosežena nasičenost s kisikom, nato pa jo pred uporabo shranite za približno dva dni in je ne prepihujte več.
VIR
|
(1)
|
Poglavje C.1 te priloge, Akutna strupenost za ribe (preskus).
|
Dodatek 3
Fizikalno-kemijske lastnosti sprejemljive vode za redčenje
|
Sestavina
|
Koncentracije
|
|
delci
|
< 20 mg/l
|
|
celotni organski ogljik
|
< 2 μg/l
|
|
neionizirani amonijak
|
< 1 μg/l
|
|
ostanek klora
|
< 10 μg/l
|
|
skupni organofosforni pesticidi
|
< 50 ng/l
|
|
skupni organoklorni pesticidi in poliklorirani bifenili
|
< 50 ng/l
|
|
skupni organski klor
|
< 25 ng/l
|
|
(prevzeto iz OECD (1992) (1))
|
VIR
|
(1)
|
OECD (1992). Guidelines for Testing of Chemicals, št. 210. Fish, Early-life Stage Toxicity Test. OECD, Pariz.
|
Dodatek 4
Priporočljiva umetna usedlina – navodila za pripravo in shranjevanje
Sestavine usedline
|
Sestavina
|
Lastnosti
|
% suhe teže usedline
|
|
šota
|
šotni mah, stopnja razpada: ‚srednja‘,sušen na zraku, brez vidnih ostankov rastlin, fino mlet (velikost delcev ≤ 0,5 mm)
|
5 ± 0,5
|
|
kremenov pesek
|
velikost zrn: > 2 mm, vendar mora > 50 % delcev meriti med 50 in 200 μm
|
75–76
|
|
kaolinska glina
|
vsebnost kaolinita ≥ 30 %
|
20 ± 1
|
|
vir hrane
|
npr. prah vrste Urtica (listov koprive), listi vrste Urtica dioica (velike koprive), fino mleti (velikost delcev ≤ 0,5 mm); v skladu s farmacevtskimi standardi, za prehrano ljudi; poleg suhe usedline
|
0,4–0,5 %
|
|
organski ogljik
|
uravnava se z dodatkom šote in peska
|
2 ± 0,5
|
|
kalcijev karbonat
|
CaCO3, zdrobljen v prah, kemijsko čist, poleg suhe usedline
|
0,05–1
|
|
deionizirana voda
|
prevodnost ≤ 10 μS/cm, poleg suhe usedline
|
30–50
|
Opomba: Če so pričakovane povišane koncentracije amonijaka, npr. če je znano, da preskusna kemikalija zavira nitrifikacijo, je lahko koristna zamenjava 50 % koprivnega prahu, bogatega z dušikom, s celulozo (npr. s kemijsko čistim prahom α-celuloze velikosti delcev ≤ 0,5 mm; (1)(2)).
Priprava
Šota se posuši na zraku in zmelje v fin prah. Pripravi se suspenzija potrebne količine šote v prahu v deionizirani vodi, za kar se uporabi visoko zmogljiva naprava za homogenizacijo. Vrednost pH te suspenzije se s CaCO3 uravna na 5,5 ± 0,5. Suspenzija se vsaj dva dneva kondicionira z rahlim mešanjem pri 20 ± 2 °C, da se stabilizira vrednost pH in vzpostavi stabilna mikrobna komponenta. Vrednost pH se znova izmeri in mora biti 6,0 ± 0,5. Šotna suspenzija se nato zmeša z drugimi sestavinami (peskom in kaolinsko glino) in deionizirano vodo, da nastane homogena usedlina z vsebnostjo vode v razponu 30–50 % suhe teže usedline. Vrednost pH končne mešanice se znova izmeri in se po potrebi s CaCO3 uravna na od 6,5 do 7,5. Če pa je pričakovan razvoj amonijaka, je lahko vrednost pH usedline koristno ohranjati pod 7,0 (npr. med 6,0 in 6,5). Vzamejo se vzorci usedline, da se določita suha teža in vsebnost organskega ogljika. Če je pričakovan razvoj amonijaka, se formulirana usedlina lahko kondicionira sedem dni pri enakih pogojih, kakršni vladajo v poznejšem preskusu (razmerje usedline in vode je npr. 1: 4, višina plasti usedline pa enaka tisti v preskusnih posodah), preden ji je primešana preskusna kemikalija, tj. dotočiti je treba vodo, ki jo je treba prepihovati. Ob koncu obdobja kondicioniranja je treba vodo nad usedlino odstraniti in zavreči. Nato se kremenov pesek, ki mu je primešana preskusna kemikalija, za vsako raven tretiranja zmeša z usedlino, usedlino pa se porazdeli med ponovitvene preskusne posode in se ji dotoči preskusno vodo. Nato se posode inkubirajo pri enakih pogojih, kakršni vladajo v poznejšem preskusu. To je začetek obdobja za uravnoteženje. Vodo nad usedlino je treba prepihovati.
Izbrani vir hrane mora biti dodan pred primešanjem preskusne kemikalije usedlini ali med njim. Lahko se najprej zmeša s šotno suspenzijo (glej zgoraj). Vendar se je obsežni razgradnji vira hrane pred dodajanjem preskusnih organizmov – npr. v primeru dolgega obdobja za uravnoteženje – mogoče izogniti s čim krajšim časom med dodajanjem hrane in začetkom izpostavljenosti. Za zagotovitev, da je hrani primešana preskusna kemikalija, je treba vir hrane zmešati z usedlino najkasneje isti dan, ko se preskusna kemikalija primeša usedlini.
Shranjevanje
Suhe sestavine umetne usedline se lahko shranjujejo v suhem in hladnem prostoru pri sobni temperaturi. Pripravljeno usedlino, ki ji je primešana preskusna kemikalija, je treba v preskusu uporabiti takoj. Vzorci usedline s primešano preskusno kemikalijo se lahko nato do analize hranijo v pogojih, priporočenih za zadevno preskusno kemikalijo.
VIRA
|
(1)
|
Egeler, Ph., Meller, M., Schallnaß, H. J., in Gilberg, D. (2005). Validation of a sediment toxicity test with the endobenthic aquatic oligochaete Lumbriculus variegatus by an international ring test. V sodelovanju z R. Nagelom in B. Karaoglanom. Poročilo nemški Zvezni agenciji za okolje (Umweltbundesamt Berlin), R&D, št.: 202 67 429.
|
|
(2)
|
Liebig M., Meller M., in Egeler P. (2004). Sedimenttoxizitätstests mit aquatischen Oligochaeten – Einfluss verschiedener Futterquellen im künstlichen Sediment auf Reproduktion und Biomasse von Lumbriculus variegatus. Proceedings 5/2004: Statusseminar Sedimentkontakttests. 24.–25. marec 2004. BfG (Bundesanstalt für Gewässerkunde), Koblenz, Nemčija, str. 107–119.
|
Dodatek 5
Metode gojenja vrste Lumbriculus variegatus
Vrsta Lumbriculus variegatus (Müller) iz družine Lumbriculidae in reda maloščetincev prebiva v sladkovodnih usedlinah in se pogosto uporablja v ekotoksikološkem preskušanju. V laboratorijskih pogojih jo je enostavno gojiti. Metode gojenja so opisane spodaj.
Metode gojenja
Pogoji gojenja vrste Lumbriculus variegatus so podrobno opisani v Phipps idr. (1993) (1), Brunson idr. (1998) (2), ASTM (2000) (3) in U.S. EPA (2000) (4). Kratek povzetek teh pogojev je opisan spodaj. Glavna prednost vrste L. variegatus je njeno hitro razmnoževanje, zaradi česar se v laboratorijsko gojenih populacijah izjemno hitro povečuje biomasa (npr. (1), (3), (4), (5)).
Črve je mogoče gojiti v velikih akvarijih (57–80 l) pri 23 °C z obdobjem osvetljenosti 16 ur svetlobe in 8 ur teme (100–1 000 lx) in z uporabo dnevno osveževane naravne vode (45–50 l na akvarij). Substrat se pripravi tako, da se nebeljene rjave papirnate brisače razrežejo na trakove, ki jih je nato mogoče za nekaj sekund zmešati z vodo za gojenje, zaradi česar nastanejo majhni deli papirnatega substrata. Ta substrat je nato mogoče takoj uporabiti v akvariju za gojenje vrste Lumbriculus; z njim se prekrije dno posode, lahko pa se tudi zamrzne v deionizirani vodi in tak shrani za kasnejšo uporabo. Svež substrat v posodi bo običajno zdržal približno dva meseca.
Vsaka kultura črvov se začne z od 500 do 1 000 črvi, hranjenimi z 10-mililitrsko suspenzijo, ki pri pogojih obnavljanja vode ali pretočnih pogojih vsebuje 6 g začetne hrane za gojenje trikrat na teden. Hranjenje statičnih in polstatičnih kultur mora biti manj pogosto, da se prepreči rast bakterij ali gliv.
V teh pogojih se število posameznih osebkov v kulturi običajno podvoji v obdobju približno od 10 do 14dni.
Namesto tega je vrsto Lumbriculus variegatus mogoče gojiti tudi v sistemu, ki ga sestavljata plast kremenovega peska, kakršen se uporablja za umetno usedlino (globine 1–2 cm), in rekonstituirana voda. Kot posode za gojenje se lahko uporabijo steklene posode ali posode iz nerjavnega jekla višine od 12 do 20 cm. Vodno telo je treba prek pasteurjeve pipete, nameščene približno 2 cm nad površino usedline, rahlo prepihovati (npr. z 2 mehurčkoma na sekundo). Za preprečevanje kopičenja npr. amonijaka je treba vodo nad usedlino zamenjati prek pretočnega sistema ali, vsaj enkrat na teden, ročno. Maloščetince je mogoče vzdrževati pri sobni temperaturi s 16 urami svetlobe (pri osvetljenosti 100–1 000 lx) in 8 urami teme. V polstatičnih kulturah (z obnavljanjem vode enkrat na teden) se črvi hranijo dvakrat na teden s hrano TetraMin (npr. 0,6–0,8 mg na cm2 površine usedline), ki jo je mogoče vnesti kot suspenzijo 50 mg hrane TetraMin na ml deionizirane vode.
Vrsto Lumbriculus variegatus je mogoče iz kultur odstraniti npr. s prenosom substrata s fino mrežo ali s prenosom organizmov z vroče polirano široko pipeto (premera približno 5 mm) v ločeno čašo. Če je v to čašo hkrati prenesen tudi substrat, se čaša, ki vsebuje črve, in substrat prek noči pustita v pretočnih pogojih, ki bodo iz čaše odstranili substrat, črvi pa bodo ostali na dnu posode. Nato jih je mogoče prenesti v na novo pripravljene gojitvene rezervoarje ali pa nadalje obdelati za preskus, kot je opisano v (3) in (4) ali v nadaljevanju.
Vprašanje, ki ga je pri uporabi vrste L. variegatus v preskusih z usedlino treba kritično obravnavati, je njen način razmnoževanja (z arhitomijo ali morfalakso, npr. (6)). S tem nespolnim razmnoževanjem nastaneta dva fragmenta, ki se določeno obdobje ne hranita, dokler se del glave ali repa ne obnovi (npr. (7), (8)). To pomeni, da izpostavljenost prek zaužitja kontaminirane usedline pri vrsti L. variegatus ne poteka neprekinjeno.
Zato je treba izvesti sinhronizacijo, da se kar najbolj zmanjša nenadzorovano razmnoževanje in regeneracija ter posledična velika variacija pri rezultatih preskusa. Do take variacije lahko pride, če so določeni osebki, ki so fragmentirali in se zato določeno obdobje ne hranijo, izpostavljeni preskusni kemikaliji manj od drugih osebkov, ki med preskusom ne fragmentirajo (9), (10), (11). Črve je treba od 10 do 14 dni pred začetkom izpostavljenosti umetno fragmentirati (sinhronizacija). Za sinhronizacijo je treba izbrati velike (odrasle) črve, ki po možnosti ne kažejo znakov nedavne morfalakse. Te črve je mogoče postaviti na objektno stekelce v kapljico vode za gojenje in jih s skalpelom razdeliti v srednjem delu telesa. Treba je paziti, da so zadnji deli podobne velikosti. Nato je treba zadnje dele pustiti, da v posodah za gojenje, ki vsebujejo enak substrat, kot je bil uporabljen v kulturi, in rekonstituirano vodo, ustvarijo nove glave. Na ustvarjanje novih glav kaže zakopavanje sinhroniziranih črvov v substrat (obnovljene glave je mogoče potrditi s pregledovanjem podvzorca pod binokularnim mikroskopom). Pričakuje se, da bodo preskusni organizmi nato v podobnem fiziološkem stanju. To ob pojavu razmnoževanja sinhroniziranih črvov z morfalakso med preskusom pomeni, da je od skoraj vseh živali pričakovati enako izpostavljenost usedlini, ki ji je primešana preskusna kemikalija. Hranjenje sinhroniziranih črvov se izvede enkrat, takoj ko se črvi začnejo zakopavati v substrat, ali 7 dni po delitvi. Režim hranjenja mora biti primerljiv z rednimi kulturami, priporočljivo pa je, da se sinhronizirani črvi hranijo z enakim virom hrane, kot bo uporabljen v preskusu. Črve je treba vzdrževati pri temperaturi preskusa 20 °C ± 2 °C. Po obnavljanju je treba za preskus uporabiti nepoškodovane, cele črve, ki po nežnem mehanskem dražljaju dejavno plavajo ali se plazijo. Poškodbe ali avtotomijo pri črvih je treba preprečevati; s črvi je treba rokovati npr. s pipetami, ki imajo vroče polirane robove, ali z iglami iz nerjavnega jekla.
Viri začetnih kultur za vrsto Lumbriculus variegatus (naslovi v ZDA so prevzeti iz (4))
|
Evropa
|
|
ECT Oekotoxikologie GmbH
|
|
Böttgerstr. 2-14
|
|
D-65439 Flörsheim/Main
|
|
Nemčija
|
|
|
Bayer Crop Science AG
|
|
Development – Ecotoxicology
|
|
Alfred-Nobel-Str. 50
|
|
D-40789 Monheim
|
|
Nemčija
|
|
|
|
|
|
University of Joensuu
|
|
Laboratory of Aquatic Toxicology
|
|
Dept. of Biology
|
|
Yliopistokatu 7, P.O. Box 111
|
|
FIN-80101 Joensuu
|
|
Finska
|
|
|
Dresden University of Technology
|
|
Institut für Hydrobiologie
|
|
Fakultät für Forst-, Geo- und Hydrowissenschaften
|
|
Mommsenstr. 13
|
|
D-01062 Dresden
|
|
Nemčija
|
|
|
|
|
|
C.N.R.- I.R.S.A.
|
|
Italian National Research Council
|
|
Water Research Institute
|
|
Via Mornera 25
|
|
I-20047 Brugherio MI
|
|
|
|
|
|
|
ZDA
|
|
U.S. Environmental Protection Agency
|
|
Mid-Continent Ecological Division
|
|
6201 Congdon Boulevard
|
|
Duluth, MN 55804
|
|
|
Michigan State University
|
|
Department of Fisheries and Wildlife
|
|
No. 13 Natural Resources Building
|
|
East Lansing, MI 48824-1222
|
|
|
|
|
|
U.S. Environmental Protection Agency
|
|
Environmental Monitoring System Laboratory
|
|
26 W. Martin Luther Dr.
|
|
Cincinnati, OH 45244
|
|
|
Wright State University
|
|
Institute for Environmental Quality
|
|
Dayton, OH 45435
|
|
|
|
|
|
Columbia Environmental Research Center
|
|
U.S. Geological Survey
|
|
4200 New Haven Road
|
|
Columbia, MO 65201
|
|
|
Great Lakes Environmental Research
|
|
Laboratory, NOAA
|
|
2205 Commonwealth Boulevard
|
|
Ann Arbor, MI 48105-1593
|
|
VIRI
|
(1)
|
Phipps, G. L., Ankley, G. T., Benoit, D. A., in Mattson, V. R. (1993). Use of the aquatic Oligochaete Lumbriculus variegatus for assessing the toxicity and bioaccumulation of sediment-associated contaminants. Environ.Toxicol. Chem. 12, 269–279.
|
|
(2)
|
Brunson, E. L., Canfield, T. J., Ingersoll, C. J., in Kemble, N. E. (1998). Assessing the bioaccumulation of contaminants from sediments of the Upper Mississippi river using field-collected oligochaetes and laboratory-exposed Lumbriculus variegatus. Arch. Environ. Contam. Toxicol. 35, 191–201.
|
|
(3)
|
ASTM International (2000). Standard guide for the determination of the bioaccumulation of sediment-associated contaminants by benthic invertebrates, E 1688–00a. V ASTM International 2004 Annual Book of Standards. Vol. 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
|
|
(4)
|
U.S. EPA (2000). Methods for measuring the toxicity and bioaccumulation of sediment-associated contaminants with freshwater invertebrates. Druga izdaja. EPA 600/R-99/064, U.S. Environmental Protection Agency, Duluth, MN, marec 2000.
|
|
(5)
|
Kukkonen, J., in Landrum, P. F. (1994). Toxicokinetics and toxicity of sediment-associated Pyrene to Lumbriculus variegatus (Oligochaeta). Environ. Toxicol. Chem. 13, 1457–1468.
|
|
(6)
|
Drewes C. D., in Fourtner, C. R. (1990). Morphallaxis in an aquatic oligochaete, Lumbriculus variegatus: Reorganisation of escape reflexes in regenerating body fragments. Develop. Biol. 138: 94–103.
|
|
(7)
|
Leppänen, M. T., in Kukkonen, J. V. K. (1998a). Relationship between reproduction, sediment type and feeding activity of Lumbriculus variegatus (Müller): Implications for sediment toxicity testing. Environ. Toxicol. Chem. 17: 2196–2202.
|
|
(8)
|
Leppänen, M. T., in Kukkonen, J. V. K. (1998b). Factors affecting feeding rate, reproduction and growth of an oligochaete Lumbriculus variegatus (Müller). Hydrobiologia 377: 183–194.
|
|
(9)
|
Brust, K., Licht, O., Hultsch, V., Jungmann, D., in Nagel, R. (2001). Effects of Terbutryn on Aufwuchs and Lumbriculus variegatus in Artificial Indoor Streams. Environ. Toxicol. Chemistry, Vol. 20, str. 2000–2007.
|
|
(10)
|
Oetken, M., Ludwichowski, K.-U., in Nagel, R. (2000). Sediment tests with Lumbriculus variegatus and Chironomus riparius and 3,4-dichloroaniline (3,4-DCA) within the scope of EG-AltstoffV. Po naročilu nemške Zvezne agencije za okolje (Umweltbundesamt Berlin), FKZ 360 12 001, marec, 2000.
|
|
(11)
|
Leppänen, M. T., in Kukkonen J. V. K. (1998). Relative importance of ingested sediment and porewater as bioaccumulation routes for pyrene to oligochaete (Lumbriculus variegatus, Müller). Environ. Sci. Toxicol. 32, 1503–1508.
|
Dodatek 6
Povzetek rezultatov krožnega preskusa
‚Preskus strupenosti usedline z vrsto Lumbriculus variegatus‘
Preglednica 1
Rezultati posameznih potekov krožnega preskusa: srednja vrednost števila črvov v kontrolah in kontrolah s topilom na koncu preskusa; SD (standard deviation) = standardni odklon; KV (coefficient of variation) = koeficient variacije.
|
|
Srednja vrednost števila črvov v kontrolah
|
SD
|
KV (%)
|
n
|
Srednja vrednost števila črvov v kontrolah s topilom
|
SD
|
KV (%)
|
n
|
|
|
32,3
|
7,37
|
22,80
|
3
|
39,0
|
3,61
|
9,25
|
3
|
|
|
40,8
|
6,55
|
16,05
|
6
|
36,0
|
5,29
|
14,70
|
3
|
|
|
41,5
|
3,54
|
8,52
|
2
|
38,5
|
7,05
|
18,31
|
4
|
|
|
16,3
|
5,99
|
36,67
|
6
|
30,8
|
6,70
|
21,80
|
4
|
|
|
24,3
|
10,69
|
43,94
|
3
|
26,3
|
3,06
|
11,60
|
3
|
|
|
28,5
|
8,29
|
29,08
|
4
|
30,7
|
1,15
|
3,77
|
3
|
|
|
28,3
|
3,72
|
13,14
|
6
|
28,8
|
2,56
|
8,89
|
6
|
|
|
25,3
|
5,51
|
21,74
|
3
|
27,7
|
1,53
|
5,52
|
3
|
|
|
23,8
|
2,99
|
12,57
|
4
|
21,3
|
1,71
|
8,04
|
4
|
|
|
36,8
|
8,80
|
23,88
|
6
|
35,0
|
4,20
|
11,99
|
6
|
|
|
33,0
|
3,58
|
10,84
|
6
|
33,5
|
1,73
|
5,17
|
4
|
|
|
20,7
|
2,73
|
13,22
|
6
|
15,0
|
6,68
|
44,56
|
4
|
|
|
42,0
|
7,07
|
16,84
|
6
|
43,7
|
0,58
|
1,32
|
3
|
|
|
18,2
|
3,60
|
19,82
|
6
|
21,7
|
4,04
|
18,65
|
3
|
|
|
32,0
|
3,95
|
12,34
|
6
|
31,3
|
4,79
|
15,32
|
4
|
|
Srednja vrednost pri poskusih iz primerjave med laboratoriji
|
29,59
|
|
20,10
|
|
30,61
|
|
13,26
|
|
|
SD
|
8,32
|
|
10,03
|
|
7,57
|
|
10,48
|
|
|
n
|
15
|
|
|
|
15
|
|
|
|
|
najmanj
|
16,3
|
|
|
|
15,0
|
|
|
|
|
največ
|
42,0
|
|
|
|
43,7
|
|
|
|
|
KV (%)
|
28,1
|
|
|
|
24,7
|
|
|
|
Preglednica 2
Rezultati posameznih potekov krožnega preskusa: srednja vrednost skupne suhe teže črvov na ponovitev v kontrolah in kontrolah s topilom na koncu preskusa; SD (standard deviation) = standardni odklon; KV (coefficient of variation) = koeficient variacije.
|
|
Skupna suha teža črvov na ponovitev (kontrole)
|
SD
|
KV (%)
|
n
|
Skupna suha teža črvov na ponovitev (kontrole s topilom)
|
SD
|
KV (%)
|
n
|
|
|
24,72
|
6,31
|
25,51
|
3
|
27,35
|
4,08
|
14,93
|
3
|
|
|
30,17
|
2,04
|
6,75
|
6
|
33,83
|
10,40
|
30,73
|
3
|
|
|
23,65
|
3,61
|
15,25
|
2
|
28,78
|
4,68
|
16,28
|
4
|
|
|
12,92
|
6,83
|
52,91
|
6
|
24,90
|
6,84
|
27,47
|
4
|
|
|
21,31
|
4,17
|
19,57
|
3
|
25,87
|
5,30
|
20,49
|
3
|
|
|
22,99
|
4,86
|
21,16
|
4
|
24,64
|
5,09
|
20,67
|
3
|
|
|
18,91
|
1,91
|
10,09
|
6
|
19,89
|
1,77
|
8,89
|
6
|
|
|
24,13
|
1,63
|
6,75
|
3
|
25,83
|
2,17
|
8,41
|
3
|
|
|
22,15
|
3,18
|
14,34
|
4
|
22,80
|
2,60
|
11,40
|
4
|
|
|
35,20
|
8,12
|
23,07
|
6
|
31,42
|
8,45
|
26,90
|
6
|
|
|
41,28
|
5,79
|
14,02
|
6
|
41,42
|
4,37
|
10,55
|
4
|
|
|
15,17
|
5,78
|
38,09
|
6
|
10,50
|
3,42
|
32,53
|
4
|
|
|
35,69
|
8,55
|
23,94
|
6
|
38,22
|
1,23
|
3,21
|
3
|
|
|
19,57
|
5,21
|
26,65
|
6
|
28,58
|
6,23
|
21,81
|
3
|
|
|
29,40
|
2,16
|
7,34
|
6
|
31,15
|
2,70
|
8,67
|
4
|
|
Srednja vrednost pri poskusih iz primerjave med laboratoriji
|
25,15
|
|
20,36
|
|
27,68
|
|
17,53
|
|
|
SD
|
7,87
|
|
12,56
|
|
7,41
|
|
9,10
|
|
|
n
|
15
|
|
|
|
15
|
|
|
|
|
najmanj
|
12,9
|
|
|
|
10,5
|
|
|
|
|
največ
|
41,3
|
|
|
|
41,4
|
|
|
|
|
KV (%)
|
31,3
|
|
|
|
26,8
|
|
|
|
Preglednica 3
Strupenost PCP: povzetek končnih točk v krožnem preskusu; srednje vrednosti pri poskusih iz primerjave med laboratoriji za EC50, NOEC in LOEC; SD (standard deviation) = standardni odklon; KV (coefficient of variation) = koeficient variacije.
|
Biološki parameter
|
|
Srednja vrednost pri preskusih iz primerjave med laboratoriji (mg/kg)
|
najmanj
|
največ
|
Faktor pri preskusih med laboratoriji
|
SD
|
KV (%)
|
Geometrijska sredina (mg/kg)
|
|
Skupno število črvov
|
EC50
|
23,0
|
4,0
|
37,9
|
9,4
|
10,7
|
46,3
|
19,9
|
|
NOEC
|
9,9
|
2,1
|
22,7
|
10,7
|
7,2
|
72,3
|
7,6
|
|
LOEC
|
27,9
|
4,7
|
66,7
|
14,2
|
19,4
|
69,4
|
20,9
|
|
MDD (%)
|
22,5
|
7,1
|
39,1
|
|
|
|
|
|
Skupna suha teža črvov
|
EC50
|
20,4
|
7,3
|
39,9
|
5,5
|
9,1
|
44,5
|
18,2
|
|
NOEC
|
9,3
|
2,1
|
20,0
|
9,4
|
6,6
|
70,4
|
7,4
|
|
LOEC
|
25,7
|
2,1
|
50,0
|
23,5
|
16,8
|
65,5
|
19,4
|
|
MDD (%)
|
24,8
|
10,9
|
44,7
|
|
|
|
|
|
Smrtnost/preživetje
|
LC50
|
25,3
|
6,5
|
37,2
|
5,7
|
9,4
|
37,4
|
23,1
|
|
NOEC
|
16,5
|
2,1
|
40,0
|
18,8
|
10,3
|
62,4
|
12,8
|
|
LOEC
|
39,1
|
4,7
|
66,7
|
14,2
|
18,1
|
46,2
|
32,6
|
|
Razmnoževanje (povečanje števila črvov na ponovitev)
|
EC50
|
20,0
|
6,7
|
28,9
|
4,3
|
7,6
|
37,9
|
18,3
|
|
NOEC
|
7,9
|
2,1
|
20,0
|
9,4
|
5,2
|
66,0
|
6,4
|
|
LOEC
|
22,5
|
2,1
|
50,0
|
23,5
|
15,4
|
68,6
|
16,0
|
|
MDD (%)
|
29,7
|
13,9
|
47,9
|
|
|
|
|
|
Rast (povečanje biomase na ponovitev)
|
EC50
|
15,3
|
5,7
|
29,9
|
5,2
|
7,1
|
46,5
|
13,7
|
|
NOEC
|
8,7
|
2,1
|
20,0
|
9,4
|
6,0
|
68,1
|
6,9
|
|
LOEC
|
24,0
|
2,1
|
50,0
|
23,5
|
15,7
|
65,5
|
17,3
|
|
MDD (%)
|
32,2
|
13,6
|
65,2
|
|
|
|
|
|
MDD (minimum detectable difference): najmanjša zaznavna razlika v primerjavi s kontrolnimi vrednostmi med preskušanjem domnev, uporabljena kot merilo statistične moči.
|
VIR
Egeler, Ph., Meller, M., Schallnaß, H. J. in Gilberg, D. (2005). Validation of a sediment toxicity test with the endobenthic aquatic oligochaete Lumbriculus variegatus by an international ring test. V sodelovanju z R. Nagelom in B. Karaoglanom. Poročilo nemški Zvezni agenciji za okolje (Umweltbundesamt Berlin), R&D, št.: 202 67 429.
C.36 PRESKUS RAZMNOŽEVANJA PLENILSKE PRŠICE (HYPOASPIS (GEOLAELAPS) ACULEIFER) V TLEH
UVOD
|
1.
|
Ta preskusna metoda je enakovredna Smernici za preskušanje OECD (TG) 226 (2008). Ta preskusna metoda je zasnovana za ocenjevanje učinkov kemikalij v tleh na sposobnost razmnoževanja vrste talne pršice Hypoaspis (Geolaelaps) aculeifer Canestrini (Acari: Laelapidae), zato omogoča oceno zaviranja hitrosti rasti določene populacije (1,2). Sposobnost razmnoževanja pri tem pomeni število mladičev na koncu obdobja preskušanja. Vrsta H. aculeifer predstavlja dodatno trofično raven za vrste, za katere so preskusne metode že na voljo. Za namen te preskusne metode velja, da zadošča preskus razmnoževanja brez razlikovanja in kvantifikacije različnih faz razmnoževalnega cikla. Za kemijske snovi z drugačnim scenarijem izpostavljenosti, ki ne poteka prek tal, so lahko primerni drugi pristopi (3).
|
|
2.
|
Vrsta Hypoaspis (Geolaelaps) aculeifer velja za ustrezno predstavnico talne favne in še posebej plenilskih pršic. Živi po vsem svetu (5) ter jo je enostavno zbirati in gojiti v laboratoriju. Povzetek biologije vrste H. aculeifer je v Dodatku 7. Na voljo so osnovne informacije o ekologiji vrste pršice in njeni uporabi pri ekotoksikološkem preskušanju (4), (5), (6), (7), (8), (9), (10), (11), (12).
|
NAČELO PRESKUSA
|
3.
|
Odrasle samice se izpostavijo razponu koncentracij preskusne kemikalije, vmešane v tla. Preskus se začne z 10 odraslimi samicami na ponovitveno posodo. Samci v preskus niso vneseni, saj izkušnje kažejo, da se samice takoj po tem, ko se izležejo iz faze deutonimfe, parijo, če so prisotni samci. Poleg tega bi vključitev samcev podaljšala preskus tako, da bi bilo potrebno zahtevno razlikovanje starostnih skupin. Zato samo parjenje ni del preskusa. Samice so vnesene v preskus 28–35 dni po začetku obdobja odlaganja jajčec pri sinhronizaciji (glej Dodatek 4), saj samice takrat lahko veljajo za že parjene in so že prešle fazo pred obdobjem odlaganja jajčec. Pri temperaturi 20 °C se preskus konča 14. dan po vnosu samic (dan 0), kar omogoča, da prvi potomci v kontroli dosežejo fazo deutonimfe (glej Dodatek 4). Za glavno merjeno spremenljivko se določi število mladičev na preskusne posode in dodatno še število preživelih samic. Sposobnost razmnoževanja pršic, izpostavljenih preskusni kemikaliji, se primerja s sposobnostjo razmnoževanja v kontrolah, da se določi vrednost ECx (npr. EC10, EC50) ali pa koncentracija brez opaznega učinka (NOEC) (za opredelitve pojmov glej Dodatek 1), odvisno od načrta poskusa (glej odstavek 29). Pregled časovnega načrta preskusa je podan v Dodatku 8.
|
INFORMACIJE O PRESKUSNI KEMIKALIJI
|
4.
|
Po možnosti morajo biti znani topnost v vodi, vrednost log Kow, porazdelitveni koeficient tla/voda in parni tlak preskusne kemikalije. Zaželene so dodatne informacije o usodi preskusne kemikalije v tleh, kot so hitrosti biotske in abiotske razgradnje.
|
|
5.
|
To preskusno metodo je mogoče uporabiti za vodotopne in nevodotopne kemikalije. Vendar se bodo načini nanosa preskusne kemikalije ustrezno razlikovali. Preskusna metoda se ne sme uporabljati pri hlapnih kemikalijah, tj. kemikalijah, za katere je Henryjeva konstanta ali porazdelitveni koeficient zrak/voda večja od ena, ali pri kemikalijah, pri katerih parni tlak presega 0,0133 Pa pri 25 °C.
|
VELJAVNOST PRESKUSA
|
6.
|
Da rezultat preskusa šteje kot veljaven, morajo biti v netretiranih kontrolah izpolnjena naslednja merila:
|
—
|
srednja vrednost smrtnosti odraslih samic na koncu preskusa ne sme presegati 20 %,
|
|
—
|
srednja vrednost števila mladičev na ponovitev (z vnesenimi 10 odraslimi samicami) mora biti ob koncu preskusa vsaj 50,
|
|
—
|
koeficient variacije, izračunan za število mladičev pršic na ponovitev ob koncu dokončnega preskusa, ne sme presegati 30 %.
|
|
REFERENČNA KEMIKALIJA
|
7.
|
Za zagotovitev, da so laboratorijski preskusni pogoji ustrezni, in za potrditev, da se odziv preskusnih organizmov ni spremenil skozi čas, je treba določiti vrednosti ECx in/ali NOEC referenčne kemikalije. Dimetoat (CAS 60-51-5) je primerna referenčna kemikalija, za katero je dokazano, da vpliva na velikost populacije (4). Kot alternativna referenčna kemikalija se lahko uporabi borova kislina (CAS 10043-35-3). S to kemikalijo je pridobljenih manj izkušenj. Obstajata dve možnosti načrta:
|
—
|
referenčno kemikalijo je mogoče preskusiti vzporedno z določanjem strupenosti vsake preskusne kemikalije pri eni koncentraciji, ki mora biti dokazana predhodno v študiji odziva v odvisnosti od odmerka, katere učinek mora biti > 50 % zmanjšanje števila potomcev. V tem primeru mora biti število ponovitev enako številu kontrol (glej odstavek 29),
|
|
—
|
druga možnost je preskušanje referenčne kemikalije enkrat do dvakrat letno v preskusu odziva v odvisnosti od odmerka. Glede na izbrani načrt se število koncentracij in ponovitev ter faktor razmika razlikujejo (glej odstavek 29), vendar mora biti dosežen odziv z 10–90-odstotnim učinkom (faktor razmika 1,8). Vrednost EC50 za dimetoat na podlagi števila mladičev mora biti v območju med 3,0 in 7,0 mg a.s./kg tal (suhe teže). Na podlagi rezultatov, ki so bili z borovo kislino pridobljeni do zdaj, mora biti vrednost EC50 na podlagi števila mladičev v območju med 100 in 500 mg/kg suhe teže tal.
|
|
OPIS PRESKUSA
Preskusne posode in oprema
|
8.
|
Uporabiti je treba preskusne posode premera 3–5 cm (višina zemlje ≥ 1,5 cm), izdelane iz stekla ali drugega kemijsko inertnega materiala, s tesno prilegajočim se pokrovom. Prednost imajo navojni pokrovi in v tem primeru je posode mogoče prezračevati dvakrat tedensko. Druga možnost je uporaba pokrovov, ki omogočajo neposredno izmenjavo plinov med substratom in ozračjem (npr. gaze). Ker je treba med preskusom vzdrževati dovolj visoko vsebnost vlage, je v tem času nujno nadzorovati težo vsake posode za poskus in po potrebi doliti vodo. Če navojni pokrovi niso na voljo, je to lahko še posebej pomembno. Če se uporablja neprozorna posoda, mora biti pokrov iz materiala, ki omogoča dostop svetlobe (npr. s pomočjo perforiranega prozornega pokrova), pri tem pa mora pršicam preprečevati pobeg. Velikost in vrsta posode sta odvisni od metode ekstrakcije (za podrobnosti glej Dodatek 5). Če je ekstrakcija s toploto uporabljena neposredno v preskusni posodi, je na dno mogoče dodati mrežico z ustrezno velikostjo odprtin (do ekstrakcije zatesnjeno), globina tal pa mora biti zadostna, da omogoča nihanje temperature in vlage.
|
|
9.
|
Zahtevana je standardna laboratorijska oprema, posebej naslednje:
|
—
|
po možnosti steklene posode z navojnimi pokrovi,
|
|
—
|
krtače za prenos pršic,
|
|
—
|
merilnik vrednosti pH in merilnik osvetljenosti,
|
|
—
|
ustrezne natančne tehtnice,
|
|
—
|
ustrezna oprema za uravnavanje temperature,
|
|
—
|
ustrezna oprema za uravnavanje vlažnosti zraka (ni nujna, če so posode za izpostavljanje pokrite s pokrovi),
|
|
—
|
inkubator z uravnavanjem temperature ali majhna soba,
|
|
—
|
oprema za ekstrakcijo (glej Dodatek 5) (13),
|
|
—
|
viseči vir svetlobe z možnostjo uravnavanja,
|
|
—
|
kozarci za zbiranje ekstrahiranih pršic.
|
|
Priprava umetnih tal
|
10.
|
Za ta preskus se uporabljajo umetna tla. Umetna tla sestavljajo naslednje sestavine (vse vrednosti temeljijo na suhi masi):
|
—
|
5 % šotnega mahu, posušenega na zraku in fino mletega (sprejemljiva je velikost delcev 2 ± 1 mm),
|
|
—
|
20 % kaolinske gline (po možnosti naj bo vsebnost kaolinita nad 30 %),
|
|
—
|
približno 74 % na zraku posušenega industrijskega peska (odvisno od potrebne količine CaCO3), v glavnem finega peska z več kot 50 % delcev, ki merijo med 50 in 200 mikroni. Natančna količina peska je odvisna od količine CaCO3 (glej spodaj); skupaj morata obe količini znašati do 75 %,
|
|
—
|
< 1,0 % kalcijevega karbonata (CaCO3, zdrobljenega v prah, analitsko čistega) za doseganje vrednosti pH, ki znaša 6,0 ± 0,5; količina kalcijevega karbonata, ki bo dodana, je lahko odvisna zlasti od kakovosti/značilnosti šote (glej opombo 1).
|
Opomba 1: potrebna količina CaCO3 bo odvisna od sestavin substrata tal in jo je treba določiti z merjenjem vrednosti pH podvzorcev tal tik pred preskusom (14).
Opomba 2: vsebnost šote v umetnih tleh odstopa od drugih preskusnih metod za organizme tal, pri katerih je v večini primerov uporabljenih 10 % šote (npr. (15)). Vendar običajna kmetijska tla glede na EPPO (16) ne vsebujejo več kot 5 % organske snovi in znižanje vsebnosti šote zato odraža zmanjšane možnosti naravnih tal za sorpcijo preskusne kemikalije na organski ogljik.
Opomba 3: po potrebi, npr. za posebne namene preskušanja, lahko kot preskusni in/ali gojitveni substrat služijo tudi naravna tla z neonesnaženih mest. Vendar pa je treba naravnim tlom, če bodo uporabljena, določiti značilnosti vsaj glede izvora (mesta zbiranja), vrednosti pH, teksture (porazdelitve delcev glede na velikost) in vsebnosti organske snovi. Če sta na voljo, je treba vključiti vrsto in ime tal glede na razvrstitev tal, tla pa ne smejo biti onesnažena. Če je preskusna kemikalija kovina ali organsko-kovinska spojina, je treba določiti tudi sposobnost izmenjave kationov (CEC) naravnih tal. Posebno pozornost je treba nameniti izpolnjevanju meril za veljavnost, saj osnovnih informacij o naravnih tleh običajno ni veliko.
|
|
11.
|
Suhe sestavine tal se temeljito premešajo (npr. v velikem laboratorijskem mešalniku). Za določanje vrednosti pH se uporablja zmes tal in raztopine 1 M kalijevega klorida (KCl) ali 0,01 M kalcijevega klorida (CaCl2) v razmerju 1: 5 (glej (14) in Dodatek 3). Če so tla bolj kisla, kot je določeno z zahtevanim območjem (glej odstavek 10), jih je mogoče prilagoditi z dodajanjem ustrezne količine CaCO3. Če so tla preveč alkalna, jih je mogoče prilagoditi z dodajanjem večje količine zmesi, sestavljene iz prvih treh sestavin, navedenih v odstavku 10, vendar brez CaCO3.
|
|
12.
|
Največja zmogljivost zadrževanja vode (water holding capacity – WHC) umetnih tal je določena v skladu s postopki, opisanimi v Dodatku 2. Od dva do sedem dni pred začetkom preskusa se suha umetna tla predhodno navlažijo z dodajanjem zadostne količine destilirane ali deionizirane vode, da je pridobljena približno polovica končne vsebnosti vode, kar je od 40 do 60 % največje zmogljivosti zadrževanja vode. Vsebnost vlage se z dodajanjem raztopine preskusne kemikalije in/ali z dodajanjem destilirane ali deionizirane vode prilagodi na 40–60 % največje zmogljivosti zadrževanja vode (glej odstavke 16– 18). Vsebnost vlage v tleh je treba dodatno preveriti z rahlim stiskanjem tal v roki; če je vsebnost vlage pravilna, se morajo med prsti pojaviti majhne kapljice vode.
|
|
13.
|
Vsebnost vlage v tleh se določi ob začetku in koncu preskusa s sušenjem na konstantno težo pri 105 °C v skladu s standardom ISO 11465 (17), vrednost pH tal pa v skladu z Dodatkom 3 ali standardom ISO 10390 (14). Te meritve je treba izvesti v dodatnih vzorcih brez pršic, sestavljenih iz kontrolnih tal in tal s posamezno preskusno koncentracijo. Ob preskušanju kislih ali bazičnih kemikalij vrednosti pH tal ni dovoljeno prilagajati. Med celotnim preskusom je treba z rednim tehtanjem posod nadzorovati vsebnost vlage (glej odstavka 20 in 24).
|
Izbira in priprava preskusnih živali
|
14.
|
Vrsta, uporabljena v preskusu, je Hypoaspis (Geolaelaps) aculeifer (Canestrini, 1883). Za začetek preskusa so potrebne odrasle samice, pridobljene iz sinhronizirane kohorte. Pršice je treba vnesti od 7 do 14 dni po tem, ko odrastejo, 28–35 dni po začetku odlaganja jajčec med sinhronizacijo (glej odstavek 3 in Dodatek 4). Zabeležiti je treba vir pršic ali dobavitelja in vzdrževanje laboratorijske kulture. Če je laboratorijska kultura vzdrževana, je priporočljivo potrjevanje identitete vrste vsaj enkrat na leto. Obrazec s podatki za identifikacijo je priložen v obliki Dodatka 6.
|
Priprava preskusnih koncentracij
|
15.
|
Preskusna kemikalija se vmeša v tla. Organska topila, ki se uporabljajo kot pomoč pri tretiranju tal s preskusno kemikalijo, je treba izbrati na podlagi njihove nizke strupenosti za pršice, v načrt preskusa pa je treba vključiti ustrezno kontrolo s topilom (glej odstavek 29).
|
Preskusna kemikalija, topna v vodi
|
16.
|
Raztopina preskusne kemikalije se pripravi v deionizirani vodi v količini, ki zadošča za vse ponovitve ene preskusne koncentracije. Priporočljivo je uporabljati zadostno količino vode, da se doseže zahtevana vsebnost vlage, tj. od 40 do 60 % največje vrednosti WHC (glej odstavek 12). Pred namestitvijo v preskusno posodo se vsaka raztopina preskusne kemikalije temeljito zmeša z eno šaržo predhodno navlaženih tal.
|
Preskusna kemikalija, ki ni topna v vodi
|
17.
|
Pri kemikalijah, ki niso topne v vodi, so pa topne v organskih topilih, se preskusna kemikalija lahko raztopi v najmanjši mogoči količini primernega vehikla (npr. acetona). Uporabljajo se lahko samo hlapna topila. Pri uporabi takih vehiklov morajo vse preskusne koncentracije in kontrola vsebovati enako najmanjšo količino vehikla. Vehikel se razprši na majhno količino, npr. 10 g, finega kremenovega peska ali pa se z njo zmeša. Skupno vsebnost peska v substratu je treba popraviti glede na to količino. Vehikel se odstrani tako, da vsaj eno uro izhlapeva v digestoriju. Ta zmes kremenovega peska in preskusne kemikalije je dodana predhodno navlaženim tlom in temeljito zmešana z dodajanjem ustrezne količine deionizirane vode, da se doseže zahtevana vlažnost. Končna mešanica se vnese v preskusne posode. Ne pozabite, da so nekatera topila lahko strupena za pršice. Če strupenost topila za pršice ni znana, je zato priporočljiva uporaba dodatne kontrole z vodo brez vehikla. Če je v zadostni meri dokazano, da topilo (v koncentracijah, ki bodo uporabljene) nima učinka, je kontrola z vodo lahko izključena.
|
Preskusna kemikalija, ki je slabo topna v vodi in organskih topilih
|
18.
|
Pri kemikalijah, ki so slabo topne v vodi in organskih topilih, se ekvivalent 2,5 g fino mletega kremenovega peska na preskusno posodo (na primer 10 g finega kremenovega peska za štiri ponovitve) zmeša z določeno količino preskusne kemikalije, da nastane želena preskusna koncentracija. Skupno vsebnost peska v substratu je treba popraviti glede na to količino. Ta zmes kremenovega peska in preskusne kemikalije se doda predhodno navlaženim tlom ter po dodajanju ustrezne količine deionizirane vode temeljito zmeša, da se doseže zahtevana vsebnost vlage. Končna mešanica se porazdeli v preskusne posode. Postopek se ponovi za vsako preskusno koncentracijo, pripravi pa se tudi ustrezna kontrola.
|
POSTOPEK
Preskusne in kontrolne skupine
|
19.
|
Za vsako kontrolno in tretirano posodo se priporoča deset odraslih samic v 20 g suhe mase umetnih tal. Preskusne organizme je treba dodati v dveh urah po pripravi substrata za dokončni preskus (tj. po vnosu preskusne snovi). V posebnih primerih (npr. ko staranje velja za odločilni dejavnik) je mogoče čas med pripravo substrata za dokončni preskus in dodajanjem pršic podaljšati (za podrobnosti takšnega staranja glej (18)). Vendar je treba v takšnih primerih podati znanstveno utemeljitev.
|
|
20.
|
Po dodajanju pršic v tla se pršicam priskrbi hrana, treba pa je tudi izmeriti začetno težo vsake preskusne posode, ki se bo med celotnim preskusom uporabljala kot referenca za nadzor vsebnosti vlage v tleh, kot je opisano v odstavku 24. Nato se preskusne posode pokrijejo, kot je opisano v odstavku 8, in postavijo v preskusno komoro.
|
|
21.
|
Za vsako od metod nanosa preskusne kemikalije, opisanih v odstavkih od 15 do 18, se pripravijo ustrezne kontrole. Za pripravo kontrol se upoštevajo ustrezni postopki, z izjemo dodajanja preskusne kemikalije. Zato se v kontrole, kjer je primerno, vnesejo organska topila, kremenov pesek ali drugi vehikli v koncentracijah/količinah, kot so uporabljene pri tretiranjih. Če je za dodajanje preskusni kemikaliji uporabljeno topilo ali drug vehikel, je treba pripraviti tudi dodatno kontrolo brez vehikla ali preskusne kemikalije in jo preskusiti, če strupenost topila ni znana (glej odstavek 17).
|
Preskusni pogoji
|
22.
|
Preskusna temperatura mora znašati 20 ± 2 °C. Temperaturo je treba vsaj enkrat dnevno zabeležiti in jo po potrebi prilagoditi. Preskus se izvaja v nadzorovanih ciklih svetlobe in teme (po možnosti 16 ur svetlobe in 8 ur teme) pri osvetljenosti od 400 do 800 luksov v bližini preskusnih posod. Zaradi primerljivosti so ti pogoji enaki kot v drugih ekotoksikoloških preskusih (npr. (15)).
|
|
23.
|
Če so uporabljeni navojni pokrovčki, je treba s prezračevanjem preskusnih posod vsaj dvakrat tedensko zagotoviti izmenjavo plinov. Če so uporabljene prevleke iz gaze, je treba posebej paziti na vzdrževanje vsebnosti vlage v tleh (glej odstavka 8 in 24).
|
|
24.
|
Vsebnost vode v talnem substratu v preskusnih posodah se z rednim tehtanjem preskusnih posod (npr. enkrat na teden) in po potrebi z dolivanjem vode v preskusne posode vzdržuje med celotnim preskusom. Izgube se po potrebi nadomeščajo z deionizirano vodo. Vsebnost vlage med preskusom se od začetne vrednosti ne sme razlikovati za več kot 10 %.
|
Hranjenje
|
25.
|
Za primeren vir hrane so se izkazali gniloživi sirojedi (Tyrophagus putrescentiae (Schrank, 1781)). Primerni so lahko tudi majhni skakači (npr. mladiči vrste Folsomia candida Willem, 1902, ali Onychiurus fimatus (19), (20), enhitreji (npr. Enchytraeus crypticus, Westheide in Graefe, 1992) ali nematode (npr. Turbatrix silusiae, de Man, 1913)) (21). Hrano je pred uporabo v preskusu priporočljivo preskusiti. Za izpolnjevanje meril za veljavnost morata biti vrsta in količina hrane takšni, da zagotavljata zadostno število mladičev (odstavek 6). Za izbiro plena je treba upoštevati način delovanja preskusne snovi (akaricid je npr. lahko strupen tudi za prehranske pršice, glej odstavek 26).
|
|
26.
|
Hrano je treba priskrbeti ad libitum (tj. vsakič v majhni količini (konico lopatice)). V ta namen je mogoče uporabiti tudi nizkotlačni sesalnik, kot je predlagano pri preskusu s skakači, ali fin slikarski čopič. Običajno zadošča, če je hrana priskrbljena na začetku preskusa in od dva- do trikrat na teden. Če se zdi, da je preskusna snov za plen strupena, je treba razmisliti o večji pogostosti hranjenja in/ali drugem viru hrane.
|
Izbira preskusnih koncentracij
|
27.
|
Predhodno poznavanje strupenosti preskusne kemikalije, npr. iz študij za določanje območja delovanja, bi moralo biti v pomoč pri izbiri ustreznih preskusnih koncentracij. Po potrebi se izvede preskus za določanje območja delovanja s petimi koncentracijami preskusne kemikalije v razponu 0,1 – 1 000 mg/kg suhih tal z vsaj eno ponovitvijo za tretirane skupine in kontrole. Preskus za določanje območja delovanja traja 14 dni, po tem pa se določita smrtnost odraslih pršic in število mladičev. Razpon koncentracije v dokončnem preskusu mora biti po možnosti izbran tako, da vključuje koncentracije, pri katerih obstaja vpliv na število mladičev, na preživetje generacije mater pa ne. Vendar to ni mogoče pri kemikalijah, ki pri zelo podobnih koncentracijah povzročajo smrtne in subletalne učinke. S koncentracijami, vključenimi v preskus, bi morala biti zajeta koncentracija z učinkom (npr. EC50, EC25, EC10) in razpon koncentracije, v katerem je zanimiv vpliv preskusne snovi. Ekstrapolacija veliko pod najnižjo koncentracijo, ki vpliva na preskusne organizme, ali veliko nad najvišjo preskušano koncentracijo se sme izvesti le v izjemnih primerih, v poročilu pa mora biti to podrobno razloženo.
|
Načrt poskusa
Preskusi odziva v odvisnosti od odmerka
|
28.
|
Zato se na podlagi priporočil, ki izhajajo iz drugega krožnega preskusa (preskusa razmnoževanja enhitrejev (22)), predlagajo trije načrti poskusa. Splošna primernost vseh teh načrtov je bila potrjena z rezultatom validacije vrste H. aculeifer.
|
|
29.
|
Pri določanju razpona koncentracij se upošteva naslednje:
|
—
|
za določanje vrednosti ECx (npr. EC10, EC50), je treba preskusiti dvanajst koncentracij. Priporočene so vsaj dve ponovitvi za vsako preskusno koncentracijo in šest kontrolnih ponovitev. Faktor razmika se lahko spreminja, tj. je v pričakovanem območju učinkov lahko manjši ali enak 1,8, pri višjih in nižjih koncentracijah pa je lahko nad 1,8;
|
|
—
|
za določitev vrednosti NOEC je treba preskusiti vsaj pet koncentracij v geometrijski vrsti. Priporočene so štiri ponovitve za vsako preskusno koncentracijo in osem kontrol. Med koncentracijami mora biti razmik, katerega faktor ne sme presegati vrednosti 2,0;
|
|
—
|
kombiniran pristop omogoča določitev vrednosti NOEC in ECx. Treba je uporabiti osem koncentracij za tretiranje v geometrijski vrsti. Priporočene so štiri ponovitve za vsako tretiranje in osem kontrol. Med koncentracijami mora biti razmik, katerega faktor ne sme presegati vrednosti 1,8.
|
|
Mejni preskus
|
30.
|
Če pri največji koncentraciji v preskusu za določanje območja delovanja (tj. 1 000 mg/kg suhe teže tal) ni opaženih učinkov, se dokončni preskus razmnoževanja lahko izvede kot mejni preskus s koncentracijo 1 000 mg/kg suhe teže tal. Mejni preskus bo ponudil možnost dokazovanja, da je vrednost NOEC EC10 za razmnoževanje večja od mejne koncentracije, pri čemer bo število pršic, uporabljenih v preskusu, čim manjše. Za tretirana tla in kontrolo je treba uporabiti osem ponovitev.
|
Trajanje preskusa in meritve
|
31.
|
Zabeležiti je treba vse opažene razlike med vedenjem in morfologijo pršic v kontrolnih in tretiranih posodah.
|
|
32.
|
Na 14. dan se preživele pršice odstranijo iz tal z ekstrakcijo s toploto/svetlobo ali z drugo ustrezno metodo (glej Dodatek 5). Mladiči (tj. ličinke, protonimfe in deutonimfe) in odrasli osebki se preštejejo ločeno. Vse odrasle pršice, ki jih v tem trenutku ni mogoče najti, je treba zabeležiti kot mrtve, pri čemer se predpostavlja, da so te pršice pred ocenjevanjem umrle in se razkrojile. Učinkovitost ekstrakcije je treba validirati enkrat ali dvakrat na leto z znanimi količinami odraslih osebkov in mladičev. Učinkovitost mora v povprečju znašati več kot 90 %, združeno za vse razvojne faze (glej Dodatek 5). Število odraslih osebkov in število mladičev se ne prilagajata glede na učinkovitost.
|
PODATKI IN POROČANJE
Obdelava rezultatov
|
33.
|
Informacije o statističnih metodah, ki se lahko uporabijo za analizo rezultatov preskusa, so podane v odstavkih od 36 do 41. Poleg tega je treba upoštevati dokument OECD št. 54 z naslovom ‚Sodobni pristopi pri statistični analizi podatkov o ekotoksičnosti: smernice za uporabo‘ (31).
|
|
34.
|
Glavna končna točka preskusa je sposobnost razmnoževanja, v tem primeru število mladičev, ustvarjenih na ponovitveno preskusno posodo (z vnesenimi 10 odraslimi samicami). Statistična analiza za sposobnost razmnoževanja zahteva izračun aritmetične sredine (X) in variance (s2) na tretirano skupino in kontrolo. Vrednosti X in s2 se uporabljata za postopke analize variance, kot so Studentov t-preskus, Dunnettov preskus in Williamsov preskus, ter za izračun 95-odstotnih intervalov zaupanja.
Opomba: ta glavna končna točka je enaka plodnosti, merjeni v obliki števila živečih mladičev, ustvarjenih med preskusom, deljenega s številom starševskih samic, vnesenih na začetku preskusa.
|
|
35.
|
Število preživelih samic v netretiranih kontrolah je glavno merilo za veljavnost in ga je treba dokumentirati. V končno poročilo je treba, tako kot pri preskusu za določanje območja delovanja, zabeležiti tudi vse druge škodljive znake.
|
Vrednost ECx
|
36.
|
Vrednosti ECx, vključno z njihovimi pripadajočimi zgornjimi in spodnjimi 95-odstotnimi mejami zaupanja za parameter, opisanimi v odstavku 34, se izračunajo z ustreznimi statističnimi metodami (npr. z analizo probit, logistično ali Weibullovo funkcijo, prilagojeno metodo Spearman-Karber ali enostavno interpolacijo). Vrednost ECx je pridobljena tako, da je v navedeno enačbo vstavljena vrednost, ki ustreza x % srednje vrednosti kontrole. Za izračun vrednosti EC50 ali katere koli druge vrednosti ECx je treba srednjo vrednost glede na tretirano skupino (X) analizirati z regresijsko analizo.
|
Vrednost NOEC/LOEC
|
37.
|
Če je statistična analiza namenjena določanju vrednosti NOEC/LOEC, je potrebna statistika glede na posodo (posamezne posode se štejejo za ponovitve). Uporabljene morajo biti ustrezne statistične metode (v skladu z dokumentom OECD št. 54 z naslovom ‚Sodobni pristopi pri statistični analizi podatkov o ekotoksičnosti: smernice za uporabo‘. V splošnem se s pomočjo enostransko zastavljenega (manj obsežnega) preskušanja domnev pri p ≤ 0,05 proučijo škodljivi učinki preskusne snovi v primerjavi s kontrolo. Primeri so podani v naslednjih odstavkih.
|
|
38.
|
Normalno porazdelitev podatkov je mogoče preskusiti npr. s preskusom ustreznosti Kolmogorov-Smirnov, preskusom razmerja med variacijskim razmikom in standardnim odklonom (preskusom R/s) ali Shapiro-Wilkovim preskusom (dvostranskim, p ≤ 0,05). Za preskus homogenosti variance se lahko uporabi Cochranov, Levenov ali Bartlettov preskus (dvostranski, p ≤ 0,05). Če so izpolnjeni predpogoji postopkov parametričnega preskusa (normalnosti, homogenosti variance), je mogoče izvesti enofaktorsko analizo variance (enofaktorsko ANOVA) in nato preskuse večkratne primerjave. Za izračun, ali obstajajo značilne razlike (p ≤ 0,05) med kontrolami in različnimi koncentracijami preskusnih snovi (izbira priporočljivega preskusa na podlagi dokumenta OECD št. 54 z naslovom Sodobni pristopi pri statistični analizi podatkov o ekotoksičnosti: smernice za uporabo) je mogoče uporabiti večkratne primerjave (npr. Dunnettov t-preskus) ali regresivne trendnostne preskuse (npr. Williamsov preskus v primeru monotonega razmerja odmerek-odziv). V nasprotnem primeru je treba za določanje vrednosti NOEC in LOEC uporabiti neparametrične metode (npr. Bonferronijev U-preskus v skladu s trendnostnim preskusom po Holmu ali Jonckheere-Terpstraju).
|
Mejni preskus
|
39.
|
Če je izveden mejni preskus (primerjava kontrole in samo ene tretirane skupine) in če so izpolnjeni predpogoji postopkov parametričnega preskusa (normalnost, homogenost), je mogoče s Studentovim preskusom (t-preskusom) preveriti odzive metrik. Če te zahteve niso izpolnjene, je mogoče uporabiti t-preskus za neenake variance (Welchev t-preskus) ali neparametrični preskus, kot je Mann-Whitneyjev U-preskus.
|
|
40.
|
Za določanje značilnih razlik med kontrolami (kontrolo in kontrolo s topilom) je mogoče ponovitve vsake kontrole preskusiti, kot je opisano za mejni preskus. Če ti preskusi ne zaznajo značilnih razlik, je mogoče vse ponovitve kontrol in kontrol s topilom združiti. V nasprotnem primeru je treba vse tretirane vzorce primerjati s kontrolo s topilom.
|
Poročilo o preskusu
|
41.
|
Poročilo o preskusu mora vključevati vsaj naslednje informacije:
|
—
|
Preskusna kemikalija
|
—
|
identiteta preskusne kemikalije, ime, serija, skupina in številka CAS, čistost,
|
|
—
|
fizikalno-kemijske lastnosti preskusne kemikalije (npr. log Kow, topnost v vodi, parni tlak, Henryjevo konstanto (H) in po možnosti informacije o usodi preskusne kemikalije v tleh).
|
|
|
—
|
Preskusni organizmi
|
—
|
identifikacijski podatki in podatki o dobavitelju preskusnih organizmov, opis gojitvenih pogojev,
|
|
—
|
razpon starosti preskusnih organizmov.
|
|
|
—
|
Preskusni pogoji
|
—
|
opis načrta in postopkov poskusa,
|
|
—
|
podrobnosti o pripravi preskusnih tal; podrobno specifikacijo, če so uporabljena naravna tla (izvor, zgodovina, porazdelitev delcev glede na velikost, vrednost pH, vsebnost organske snovi in, če je na voljo, razvrstitev tal),
|
|
—
|
največja zmogljivost zadrževanja vode,
|
|
—
|
opis tehnike, uporabljene za nanos preskusne kemikalije na tla,
|
|
—
|
podrobnosti o pomožnih kemikalijah, uporabljenih za dodajanje preskusne kemikalije,
|
|
—
|
velikost preskusnih posod in suha masa preskusnih tal na posodo,
|
|
—
|
preskusni pogoji: obsevanost, trajanje ciklov svetlobe in teme, temperatura,
|
|
—
|
opis režima hranjenja, vrsta in količina hrane, uporabljene v preskusu, datumi hranjenja,
|
|
—
|
vrednost pH in vsebnost vode v tleh na začetku preskusa in med njim (v kontroli in vsaki tretirani skupini),
|
|
—
|
podroben opis metode ekstrakcije in učinkovitosti ekstrakcije.
|
|
|
—
|
Rezultati preskusa
|
—
|
število mladičev, ugotovljenih v vsaki preskusni posodi ob koncu preskusa,
|
|
—
|
število odraslih samic in smrtnost odraslih osebkov ( %) v vsaki preskusni posodi ob koncu preskusa,
|
|
—
|
opis očitnih simptomov ali jasnih sprememb vedenja,
|
|
—
|
rezultati, pridobljeni z referenčno preskusno kemikalijo,
|
|
—
|
statistični povzetek (vrednost ECx in/ali NOEC), vključno s 95-odstotnimi mejami zaupanja, in opis metode izračuna,
|
|
—
|
grafični prikaz razmerja med koncentracijo in odzivom,
|
|
—
|
odstopanja od postopkov, opisanih v tej preskusni metodi, in morebitni nenavadni dogodki med preskusom.
|
|
|
LITERATURA
|
(1)
|
Casanueva, M. E. (1993). Phylogenetic studies of the free-living and arthropod associated Laelapidae (Acari: Mesostigmata). Gayana Zool. 57, 21–46.
|
|
(2)
|
Tenorio, J. M. (1982). Hypoaspidinae (Acari: Gamasida: Laelapidae) of the Hawaiian Islands. Pacific Insects 24, 259–274.
|
|
(3)
|
Bakker, F. M., Feije, R., Grove, A. J., Hoogendorn, G., Jacobs, G., Loose, E. D., in van Stratum, P. (2003). A laboratory test protocol to evaluate effects of plant protection products on mortality and reproduction of the predatory mite Hypoaspis aculeifer Canestrini (Acari: Laelapidae) in standard soil. JSS – Journal of Soils and Sediments 3, 73–77.
|
|
(4)
|
Karg, W. (1993). Die freilebenden Gamasina (Gamasides), Raubmilben. 2. izdaja. V: Dahl, F. (Hrsg.): Die Tierwelt Deutschlands 59. Teil, G. Fischer, Jena, 523 str.
|
|
(5)
|
Ruf, A. (1991). Do females eat males?: Laboratory studies on the popualation development of Hypoaspis aculeifer (Acari: Parasitiformes). V: Dusbabek,F. in Bukva, V. (ur.): Modern Acarology. Academia Prague & SPD Academic Publishing bv, The Hague, Vol. 2, 487–492.
|
|
(6)
|
Ruf, A. (1995). Sex ratio and clutch size control in the soil inhabiting predatory mite Hypoaspis aculeifer (Canestrini 1883) (Mesostigmata, Dermanyssidae). Proc. 2nd Symp. EURAAC: str. 241–249.
|
|
(7)
|
Ruf, A. (1996). Life-history patterns in soil-inhabiting mesostigmatid mites. Proc. IXth Internat. Congr. Acarol. 1994, Columbus, Ohio: str. 621–628.
|
|
(8)
|
Krogh, P. H., in Axelsen, J. A. (1998). Test on the predatory mite Hypoaspis aculeifer preying on the collembolan Folsomia fimetaria. V: Lokke, H. in van Gestel, C. A. M.: Handbook of soil invertebrate toxicity tests. John Wiley Sons, Chichester, str. 239–251.
|
|
(9)
|
Løkke, H., Janssen, C. R., Lanno, R. P., Römbke, J., Rundgren, S., in Van Straalen, N. M. (2002). Soil Toxicity Tests – Invertebrates. V: Test Methods to Determine Hazards of Sparingly Soluble Metal Compounds in Soils. Fairbrother, A., Glazebrook, P. W., Van Straalen, N. M. in Tarazona, J. V. (ur.). SETAC Press, Pensacola, ZDA. 128 str.
|
|
(10)
|
Schlosser, H.-J., in Riepert, F. (1991/92). Entwicklung eines Prüfverfahrens für Chemikalien an Bodenraubmilben (Gamasina). 1. del: Biologie der Bodenraubmilbe Hypoaspis aculeifer Canestrini, 1883 (Gamasina) unter Laborbedingungen. Zool. Beiträge, 34, 395–433.
|
|
(11)
|
Schlosser, H.-J., in Riepert, F. (1992). Entwicklung eines Prüfverfahrens für Chemikalien an Boden-raubmilben (Gamasina). 2. del: Erste Ergebnisse mit Lindan und Kaliumdichromat in subletaler Dosierung. Zool. Beitr. N. F. 34, 413–433.
|
|
(12)
|
Heckmann, L.-H., Maraldo, K., in Krogh, P. H. (2005). Life stage specific impact of dimethoate on the predatory mite Hypoaspis aculeifer Canestrini (Gamasida: Laelapidae). Environmental Science & Technology 39, 7154–7157.
|
|
(13)
|
Petersen, H. (1978). Some properties of two high-gradient extractors for soil microarthropods, and an attempt to evaluate their extraction efficiency. Natura Jutlandica 20, 95– 122.
|
|
(14)
|
ISO (Mednarodna organizacija za standardizacijo) (1994). Kakovost tal – Določevanje pH, št. 10390. ISO, Ženeva.
|
|
(15)
|
Poglavje C.8 te priloge, Strupenost za deževnike.
|
|
(16)
|
EPPO (2003): EPPO Standards. Environmental risk assessment scheme for plant protection products. Poglavje 8. Soil Organisms and Functions. Bull. OEPP/EPPO Bull. 33, 195–209.
|
|
(17)
|
ISO (Mednarodna organizacija za standardizacijo) (1993). Kakovost tal – Ugotavljanje suhe snovi in vsebnosti vode na osnovi mase – Gravimetrijska metoda, št. 11465. ISO, Ženeva.
|
|
(18)
|
Fairbrother, A., Glazebrock, P. W., Van Straalen, N. M., in Tarazona, J. V. (2002). Test methods to determine hazards of sparingly soluble metal compounds in soils. SETAC Press, Pensacola, FL, ZDA.
|
|
(19)
|
Chi, H. 1981. Die Vermehrungsrate von Hypoaspis aculeifer Canestrini (Acarina, Laelapidae) bei Ernährung mit Onychiurus fimatus Gisin (Collenbola). Ges. allg. angew. Ent. 3:122– 125.
|
|
(20)
|
Schlosser, H. J., in Riepert, F. 1992. Entwicklung eines Prüfverfahrens für Chemikalien an Bodenraubmilden (Gamasina). Zool. Beitr. N. F. 34(3):395–433.
|
|
(21)
|
Heckmann, L.-H., Ruf, A., Nienstedt, K. M., in Krogh, P. H. 2007. Reproductive performance of the generalist predator Hypoaspis aculeifer (Acari: Gamasida) when foraging on different invertebrate prey. Applied Soil Ecology 36, 130– 135.
|
|
(22)
|
Poglavje C.32 te priloge, Preskus razmnoževanja enhitrejev.
|
|
(23)
|
ISO (Mednarodna organizacija za standardizacijo) (1994). Soil Quality – Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction, št. 11268-2. ISO, Ženeva.
|
|
(24)
|
Southwood, T. R. E. (1991). Ecological methods. With particular reference to the study of insect populations. (2. izdaja). Chapman & Hall, London, 524 str.
|
|
(25)
|
Dunger, W., in Fiedler, H. J. (1997). Methoden der Bodenbiologie (2. izdaja). G. Fischer, Jena, 539 str.
|
|
(26)
|
Lesna, I., in Sabelis, M. W. (1999). Diet-dependent female choice for males with ‚good genes‘ in a soil predatory mite. Nature 401, 581–583.
|
|
(27)
|
Ruf, A. (1989). Die Bedeutung von Arrhenotokie und Kannibalismus für die Populationsentwicklung von Hypoaspis aculeifer (Canestrini 1883) (Acari, Gamasina). Mitt. Deut. Ges. Allg. Angew. Ent. 7, 103– 107.
|
|
(28)
|
Ruf, A. (1993). Die morphologische Variabilität und Fortpflanzungsbiologie der Raubmilbe Hypoaspis aculeifer (Canestrini 1883) (Mesostigmata, Dermanyssidae). Dissertation, Universität Bremen.
|
|
(29)
|
Ignatowicz, S. (1974). Observations on the biology and development of Hypoaspis aculeifer Canestrini, 1885 (Acarina, Gamasides). Zoologica Poloniae 24, 11–59.
|
|
(30)
|
Kevan, D. K. McE., in Sharma, G. D. (1964). Observations on the biology of Hypoaspis aculeifer (Canestrini, 1884), apparently new to North America (Acarina: Mesostigmata: Laelaptidae). Acarologia 6, 647–658.
|
|
(31)
|
OECD (2006c). Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. OECD environmental Health and Safety Publications Series on Testing and Assessment, št. 54. ENV/JM/MONO(2006)18.
|
Dodatek 1
Opredelitve pojmov
Pri tej preskusni metodi se uporabljajo naslednje opredelitve (v tem preskusu so vse učinkovite koncentracije izražene kot masa preskusne kemikalije na suho maso preskusnih tal):
|
|
Kemikalija pomeni snov ali zmes.
|
|
|
NOEC (koncentracija brez opaznega učinka) je koncentracija preskusne kemikalije, pri kateri ni opaznega učinka. V tem preskusu koncentracija, ki ustreza vrednosti NOEC, v danem obdobju izpostavljenosti v primerjavi s kontrolo nima statistično značilnega učinka (p < 0,05).
|
|
|
LOEC (najnižja koncentracija z opaznim učinkom) je najnižja koncentracija preskusne kemikalije, ki ima v danem obdobju izpostavljenosti v primerjavi s kontrolo statistično značilen učinek (p < 0,05).
|
|
|
ECx (učinkovita koncentracija za x-odstotni učinek) je koncentracija, ki na preskusnih organizmih v danem obdobju izpostavljenosti v primerjavi s kontrolo učinkuje x-odstotno. Vrednost EC50 je, na primer, koncentracija, pri kateri je ocenjeno, da na končno točko preskusa učinkuje 50-odstotno glede na izpostavljeno populacijo v določenem obdobju izpostavljenosti.
|
|
|
Preskusna kemikalija je snov ali zmes, preskušena s to preskusno metodo.
|
Dodatek 2
Določanje največje zmogljivosti zadrževanja vode
Kot primerna velja naslednja metoda za določanje največje zmogljivosti zadrževanja vode v tleh. Opisana je v Dodatku C standarda ISO DIS 11268-2 (Kakovost tal – Vpliv onesnaževal na deževnike (Eisenia fetida). 2. del: Določevanje vplivov na razmnoževanje (23)).
S primerno napravo za vzorčenje (svedrastim vzorčevalnikom itd.) zberite določeno količino (npr. 5 g) substrata preskusnih tal. Pokrijte dno vzorčevalnika s koščkom filtrirnega papirja, napolnjenega z vodo, in vzorčevalnik nato postavite na stojalo v vodno kopel. Vzorčevalnik je treba postopoma potapljati, dokler nivo vode ni nad zgornjim delom tal. Nato ga je treba pustiti v vodi približno tri ure. Ker ni mogoče zadržati vse vode, ki jo absorbirajo talne kapilare, mora biti omogočeno, da se vzorec tal dve uri suši, tako da se vzorčevalnik postavi na ležišče iz zelo mokrega, fino mletega kremenovega peska, ki je nameščen v pokriti posodi (da se ne posuši). Nato je treba vzorec stehtati in pri 105 °C posušiti na konstantno maso. Zmogljivost zadrževanja vode (WHC) je nato mogoče izračunati po naslednjem postopku:

pri čemer je:
S= z vodo nasičeni substrat + masa vzorčevalnika + masa filtrirnega papirja,
T= tara (masa vzorčevalnika + masa filtrirnega papirja),
D= suha masa substrata.
Dodatek 3
Določanje vrednosti pH tal
Naslednja metoda za določanje vrednosti pH tal temelji na opisu v ISO 10390: Kakovost tal – Določevanje pH (16).
Določena količina tal se pri sobni temperaturi suši vsaj 12 ur. Nato se izdela suspenzija tal (ki vsebuje vsaj 5 gramov tal) v petkratni količini volumna tal z 1 M analitsko čistega kalijevega klorida (KCl) ali 0,01 M raztopine analitsko čistega kalcijevega klorida (CaCl2). Suspenzija se nato pet minut temeljito stresa in se nato vsaj 2 uri in največ 24 ur pusti, da se usede. Vrednost pH tekoče faze se nato meri z merilnikom vrednosti pH, ki je pred vsako meritvijo umerjen z ustreznimi vrstami pufrskih raztopin (npr. pH 4,0 in 7,0).
Dodatek 4
Gojenje vrste Hypoaspis (Geolaelaps) aculeifer, prehranske pršice in sinhronizacija kulture
Gojenje vrste Hypoaspis (Geolaelaps) aculeifer:
Kulture je mogoče hraniti v plastičnih posodah ali steklenih kozarcih, napolnjenih z zmesjo mavca/oglenega prahu (v razmerju 9: 1). Vlažnost mavca je po potrebi mogoče vzdrževati z dodajanjem nekaj kapljic destilirane ali deionizirane vode. Temperature gojenja so optimalne, če so v območju 20 ± 2 °C, režim svetlobe/teme pa za to vrsto ni pomemben. Plen so lahko pršice vrste Typrophagus putrescentiae ali Caloglyphus (s prehranskimi pršicami je treba ravnati previdno, ker lahko pri ljudeh povzročajo alergije), za plen pa so primerni tudi nematode, enhitreji ali skakači. Njihov vir mora biti zabeležen. Razvoj populacije je mogoče začeti z eno samo samico, ker se samci razvijejo iz neoplojenih jajčec. Generacije se večinoma prekrivajo. Samica lahko živi vsaj 100 dni in lahko med svojo življenjsko dobo odloži približno 100 jajčec. Največja hitrost odlaganja jajčec je dosežena med 10. in 40. dnem (po tem, ko samica odraste) in znaša 2,2 jajčeca na samico na dan. Čas razvoja od jajčeca do odrasle samice je približno 20 dni pri temperaturi 20 °C. Predhodno je treba vzdrževati in hraniti več kot eno kulturo.
Gojenje vrste Typrophagus putrescentiae:
Pršice so gojene v stekleni posodi, napolnjeni s finim prahom pivskega kvasa, ki je za preprečevanje pobega nameščen v plastično vedro, napolnjeno z raztopino KNO3. Prehranske pršice se namestijo na vrh tega prahu. Nato se s pomočjo lopatice previdno zmešajo s prahom (ki ga je treba menjati dvakrat na teden).
Sinhronizacija kulture:
Osebki, uporabljeni v preskusu, morajo biti podobne starosti (približno 7 dni po tem, ko dosežejo fazo odraslosti). To se pri temperaturi gojenja 20 °C doseže na naslednji način:
Samice prenesite v čisto posodo za gojenje in dodajte dovolj hrane.
|
—
|
Dopustite od dva do tri dni za odlaganje jajčec, odstranite samice.
|
|
—
|
Odrasle samice med 28. in 35. dnem po tem, ko ste jih začeli nameščati v čiste posode za gojenje, odstranite za preskušanje.
|
Odrasle samice je mogoče zlahka ločiti od samcev in drugih razvojnih faz, ker so večje in bolj nabreknjene oblike ter imajo rjav dorzalni ščit (samci so vitkejši in ploski); barva neodraslih osebkov sega od bele do smetanaste. Razvoj pršic poteka približno po spodaj opisanem vzorcu, ki velja za temperaturo 20 °C (slika): jajčece 5 dni, ličinka 2 dni, protonimfa 5 dni, deutonimfa 7 dni, obdobje pred samičinim odlaganjem jajčec 2 dni. Potem so pršice odrasle.
Slika
Razvoj vrste Hypoaspis (Geolaelaps) aculeifer pri temperaturi 20 °C (odstranitev = samice, uporabljene za preskus).

Odrasle preskusne živali se odstranijo iz sinhronizirane kulture in vnesejo v preskusne posode med 28. in 35. dnem po tem, ko so starševske samice začele odlagati jajčeca (tj. 7–14 dni po tem, ko so postale odrasle). S tem je zagotovljeno, da so preskusne živali že prešle obdobje pred odlaganjem jajčec in so se parile s samci, ki so tudi prisotni v posodi za gojenje. Opažanja pri laboratorijskih kulturah kažejo, da se samice parijo takoj ali kmalu po tem, ko odrastejo, če so prisotni samci (Ruf, Vaninnen, osebno opažanje). Obdobje sedmih dni je določeno zato, da je integracija v laboratorijsko rutino lažja in da je variabilnost razvoja posameznih osebkov med pršicami manjša. Obdobje odlaganja jajčec se mora začeti z vsaj enakim številom samic, ki je sčasoma potrebno za preskus (če je za preskus, na primer, potrebnih 400 samic, je treba dva ali tri dni omogočati odlaganje jajčec vsaj 400 samicam). Začetna točka za sinhronizirano populacijo mora biti vsaj 1 200 jajčec (razmerje med spoloma mora biti približno 0,5, smrtnost približno 0,2). Za preprečitev kanibalizma naj se v eni posodi ne goji več kot 20–30 samic, ki odlagajo jajčeca.
Dodatek 5
Metode ekstrakcije
Ustrezna metoda za ločevanje osebkov iz tal/substrata pri mikropodih je ekstrakcija s toploto (glej spodnjo sliko). Metoda temelji na dejavnosti organizmov, zato je mogoče zabeležiti le mobilne osebke. Načelo ekstrakcije s toploto je postopno poslabševanje pogojev za organizme v vzorcu, tako da bodo zapustili substrat in padli v fiksirno tekočino (npr. etanol). Ključni točki sta trajanje ekstrakcije in poslabševanje pogojev za organizme od dobrih prek srednjih do slabih. Ekstrakcija mora biti pri ekotoksikoloških preskusih čim krajša, saj bi kakršna koli rast populacije med obdobjem ekstrakcije pokvarila rezultate. Po drugi strani morajo biti pogoji glede temperature in vlage v vzorcu vedno v takšnem območju, ki pršicam omogoča gibanje. Ogrevanje vzorca tal izsuši substrat. Če je izsuševanje prehitro, se lahko izsušijo tudi nekatere pršice, še preden uspejo pobegniti.
Zato je predlagan naslednji postopek (24) (25):
|
|
Naprava: Tullgrenovi lijaki ali primerljive metode, kot je npr. McFadyenova (ogrevanje od zgoraj, vzorec je položen nad lijak).
|
|
|
Režim ogrevanja: 25 °C za 12 ur, 35 °C za 12 ur, 45 °C za 24 ur (skupaj 48 ur). Temperaturo je treba meriti v substratu.
|
|
|
Fiksirna tekočina: 70-odstotni etanol
|
|
|
Podrobnosti: vzemite stekleno fiolo, ki je bila uporabljena v preskusu. Odstranite pokrov in okrog odprtine ovijte kos mreže ali tkanine. Velikost očesa na mrežici tkanine mora biti od 1,0 do 1,5 mm. Tkanino pritrdite z elastičnim trakom. Fiolo previdno obrnite okrog in jo postavite v napravo za ekstrakcijo. Tkanina preprečuje, da bi substrat pronical v fiksirno tekočino, pršicam pa omogoča, da lahko zapustijo vzorec. Z režimom ogrevanja začnite po tem, ko so vstavljene vse fiole. Ekstrakcijo končajte po 48 urah. Odstranite fiksirne fiole in s stereomikroskopom preštejte pršice.
|
Učinkovitost ekstrakcije pri izbrani metodi mora biti dokazana enkrat ali dvakrat letno z uporabo posod, ki vsebujejo znano število mladih in odraslih pršic, gojenih v netretiranem preskusnem substratu. Učinkovitost mora v povprečju znašati ≥ 90 %, združeno za vse razvojne faze.
Tullgrenova vrsta naprave za ekstrakcijo

Način priprave preskusne fiole po koncu preskusa, pred ekstrakcijo

Dodatek 6
Identifikacija vrste Hypoaspis (Geolaelaps) aculeifer
|
Podrazred/red/podred:
|
|
Družina:
|
|
Rod/podrod/vrsta:
|
|
Acari/Parasitiformes/Gamasida
|
|
Laelapidae
|
|
Hypoaspis (Geolaelaps) aculeifer
|
|
Avtor in datum:
|
Dr. F. Faraji, (MITOX), 23. januar 2007.
|
|
Uporabljena literatura:
|
Karg, W. (1993). Die freilebenden Gamasina (Gamasides), Raubmilben. Tierwelt Deutschlands 59, druga, revidirana izdaja: 1–523.
Hughes, A. M. (1976). The mites of stored food and houses. Ministry of Agriculture, Fisheries and Food, Technical Bulletin 9: 400 str.
Krantz, G. W. (1978). A manual of Acarology. Oregon State University Book Stores, Inc., 509 str.
|
|
Določevalne lastnosti:
|
Tektum z zaokroženim zobčastim robom; žlebiči hipostome z več kot 6 dentikli; kavdalne dorzalne sete Z4 niso zelo dolge; dlakaste dorzalne sete; normalen genitalni ščit, ni zelo povečan in ne dosega analnega ščita; zadnja polovica dorzalnega ščita brez set, ki nimajo parov; noge II in IV z nekaj gostimi makrosetami; dorzalna seta Z5 približno dvakrat daljša od J5; fiksni člen helicere z 12–14 zobmi in gibljivi člen z 2 zoboma; idiosoma dolga 520–685 μm.
Vrsta Hypoaspis miles se uporablja tudi pri biološkem nadzoru in jo je mogoče zamenjati z vrsto H. aculeifer. Glavna razlika je naslednja:
vrsta H. miles pripada podrodu Cosmolaelaps in ima dorzalne sete v obliki noža, vrsta H. aculeifer pa pripada podrodu Geolaelaps in ima dorzalne sete v obliki ščetin.
|

Dodatek 7
Osnovne informacije o biologiji vrste hypoaspis (geolaelaps) aculeifer
Vrsta Hypoaspis aculeifer pripada družini Lealapidae, redu Acari (pršice), razredu Arachnida, plemenu Arthropoda. Njeni pripadniki živijo v vseh vrstah tal in se hranijo z drugimi pršicami, nematodami, enhitreji in skakači (26). Če je hrane premalo, preidejo na kanibalizem (27). Telo plenilskih pršic je segmentirano na idiosomo in gnatosomo. Manjka jasno razločevanje idiosome v prosomi (glavi) in opistosomi (zadku). Gnatosoma (ščit glave) vsebuje organe za hranjenje, kot so palpi in helicere. Helicere so razcepljene na tri dele in imajo zobe različnih oblik. Razen za zaužitje hrane samci svoje helicere uporabljajo v glavnem za prenos spermatoforov v samice. Dorzalni ščit idiosomo pokriva skoraj v celoti. Velik del idiosome pri samici zavzemajo reproduktivni organi, ki so še posebej razločni tik pred odlaganjem jajčec. Ventralno je mogoče najti dva ščita, sternalnega in genitalnega. Vse noge imajo ščetine in trne. S ščetinami se pršice pri premikanju ali na površini tal zasidrajo. Prvi par nog v glavnem uporabljajo kot antene. Drugi par nog uporabljajo ne le za premikanje, temveč tudi za to, da se pritrdijo na plen. Trni četrtega para nog lahko služijo kot zaščita, pa tudi kot ‚pogon‘ (28). Samci v dolžino merijo 0,55–0,65 mm, tehtajo pa 10–15 μg. Samice v dolžino merijo 0,8–0,9 mm, tehtajo pa 50–60 μg (8)(28) (slika 1).
Slika 1
Samica, samec, protonimfa in ličinka vrste H. aculeifer.

Pri temperaturi 23 °C pršice spolno dozorijo po 16 dneh (samice) oziroma 18 dneh (samci) (6). Samice prenašajo spermije v spolni odprtini, od koder bodo nato preneseni v jajčnik. V jajčniku spermiji zorijo in se shranijo. Do oploditve pride šele, ko spermiji v jajčniku dozorijo. Samice bodo oplojena ali neoplojena jajčeca odložile v grudah ali ločeno, po možnosti v špranje ali odprtine. Pršice, ki so se parile, lahko nosijo mladiče obeh spolov, iz jajčec samic, ki se niso parile, pa se izležejo samo mladiči moškega spola. Pršica v času razvoja do odraslosti preide štiri faze (jajčece – ličinka, ličinka – protonimfa, protonimfa – deutonimfa, deutonimfa – odrasli osebek).
Jajčece je mlečno belo, prosojno, ovalno in dolgo približno 0,37 mm ter ima trdno ovojnico. Glede na (8) ličinke merijo 0,42–0,45 mm. Imajo le tri pare nog. Na področju glave se razvijejo palpi in helicere. Helicere se uporabljajo za izvalitev iz jajčeca, saj imajo nekaj majhnih dentiklov. Po prvi levitvi, 1–2 dni po izvalitvi, se razvijejo protonimfe. Prav tako so bele, merijo 0,45–0,62 mm (8) in imajo štiri pare nog. Prisotni so vsi zobje na helicerah. Pršice v tem stadiju začnejo iskati hrano. V ta namen s helicerami prebodejo kutikulo plena in v plen izbrizgajo izloček za zunajčrevesno prebavo. Nato pršica hrano v obliki kaše lahko posrka. Helicere lahko uporabijo tudi za trganje večjih delov hrane (28). Po še eni levitvi se razvijejo deutonimfe. Merijo 0,60–0,80 mm (8) in so rumene do svetlo rjave barve. V tej fazi jih je mogoče ločiti na samice in samce. Po dodatni levitvi, med katero živali niso dejavne in se razvija rjavi ščit (po približno 14 dneh), pršice postanejo odrasle (28)(29)(30). Pri temperaturi 25 °C je njihova življenjska doba med 48 in 100 dnevi (27).
Dodatek 8
Povzetek in časovni razpored glavnih ukrepov, ki jih je treba izvesti za preskus z vrsto hypoaspis
|
Čas (dnevi)
začetek preskusa = dan 0
|
Dejavnost/opravilo
|
|
Dan od – 35
do – 28
|
Prenesite samice iz založne kulture v čiste posode, da začnete sinhronizacijo.
Dva dni pozneje: odstranitev samic.
Dva- do trikrat na teden: priskrbite dovolj hrane.
|
|
Dan – 5 (± 2)
|
Pripravite umetna tla.
|
|
Dan – 4 (± 2)
|
Določite WHC umetnih tal.
Čez noč posušite.
Naslednji dan: stehtajte vzorce in izračunajte WHC.
|
|
Dan – 4 (± 2)
|
Predhodno navlažite umetna tla, da dosežete 20–30 % WHC.
|
|
Dan 0
|
Začnite preskus: dodajte preskusno kemikalijo umetnim tlom.
V vsako ponovitev vnesite 10 samic.
Stehtajte vsako ponovitev.
Pripravite abiotske kontrole za vsebnost vlage in vrednost pH, 2 ponovitvi za vsako tretiranje.
Čez noč posušite kontrole vlage.
Naslednji dan: stehtajte kontrole vlage.
Naslednji dan: izmerite vrednost pH posušenih abiotskih kontrol.
|
|
Dnevi 3, 6, 9, 12 (pribl.)
|
Vsaki ponovitvi priskrbite zadostno količino organizmov, ki predstavljajo plen.
Vsako ponovitev stehtajte in sčasoma dodajte izhlapelo vodo.
|
|
Dan 14
|
Dokončajte preskus, pripravite ekstrakcijo za vse ponovitve in kontrole učinkovitosti ekstrakcije.
Čez noč posušite kontrole vsebnosti vode.
Naslednji dan: stehtajte kontrole vsebnosti vode.
Naslednji dan: izmerite vrednost pH posušenih kontrol.
|
|
Dan 16
|
Dokončajte ekstrakcijo.
|
|
Dan 16+
|
Zabeležite število odraslih osebkov in mladičev v ekstrahiranem materialu.
O rezultatih poročajte v obliki preglednic.
O postopku preskušanja poročajte na listih za protokol preskusa.
|
C.37 21-DNEVNI PRESKUS RIB: KRATKOTRAJNO PRESEJALNO PRESKUŠANJE ESTROGENEGA IN ANDROGENEGA DELOVANJA TER ZAVIRANJA AROMATAZE
UVOD
|
1.
|
Ta preskusna metoda ustreza Smernici za preskušanje OECD (TG) 230 (2009). Preskus rib, s katerim je mogoče zaznati nekatere kemikalije z endokrinim delovanjem, je treba razviti in validirati zaradi pomislekov, da bi lahko okoljske ravni kemikalij zaradi interakcije teh kemikalij z endokrinim sistemom povzročile škodljive učinke za ljudi in prostoživeče živali. OECD se je leta 1998 začela ukvarjati s prednostno nalogo revidiranja obstoječih smernic ter priprave novih smernic za presejalne preskuse in preskušanje potencialnih povzročiteljev endokrinih motenj. Del naloge je bila priprava smernic za presejalno preskušanje kemikalij, ki so aktivne v endokrinem sistemu ribjih vrst. 21-dnevni presejalni preskus endokrinega delovanja pri ribah je prestal obsežen validacijski program, ki je vključeval medlaboratorijske študije z izbranimi kemikalijami, s katerimi sta bili dokazani ustreznost in zanesljivost preskusa za zaznavanje estrogenih kemikalij in kemikalij, ki zavirajo aromatazo (1) (2) (3) (4) (5), pri treh proučevanih vrstah rib (črnoglavem pisancu, japonski medaki in cebrici); zaznavanje androgenega delovanja je mogoče pri črnoglavem pisancu in medaki, vendar ne pri cebrici. S to preskusno metodo ni mogoče zaznati antiandrogenih kemikalij. Delo v zvezi z validacijo je pregledala skupina strokovnjakov, ki so jih imenovali nacionalni koordinatorji programa smernic za preskušanje (6). Preskus ni namenjen opredelitvi posebnih mehanizmov hormonskih motenj, ker imajo živali nepoškodovano os hipotalamus – hipofiza – spolne žleze (HPG), ki se lahko odziva na kemikalije, ki vplivajo na os HPG na različnih ravneh. Kratkotrajni preskus razmnoževanja rib (OECD TG 229) vključuje plodnost in, kot je primerno, histopatologijo spolnih žlez črnoglavega pisanca ter vse končne točke, ki jih zajema ta preskusna metoda. V OECD TG 229 so zajeti presejalni preskusi kemikalij, ki vplivajo na razmnoževanje prek različnih mehanizmov, vključno z endokrinimi načini. To je treba upoštevati pred izbiro najprimernejše preskusne metode.
|
|
2.
|
V tej preskusni metodi je opisan presejalni preskus in vivo, v katerem se spolno zreli ribji samci in drsteče se ribje samice zadržujejo skupaj ter so izpostavljeni kemikaliji v omejenem delu njihovega življenjskega cikla (21 dni). Ob koncu 21-dnevnega obdobja izpostavljenosti se pri samcih in samicah izmerita ena ali dve, odvisno od uporabljene vrste, končni točki biomarkerja kot kazalnika estrogenega delovanja, zaviranja aromataze ali androgenega delovanja preskusne kemikalije; te končne točke so vitelogenin in sekundarne spolne značilnosti. Vitelogenin se meri pri črnoglavem pisancu, japonski medaki in cebrici, sekundarne spolne značilnosti pa se merijo le pri črnoglavem pisancu in japonski medaki.
|
|
3.
|
Biološki preskus je presejalni preskus in vivo za nekatere endokrine načine delovanja, njegovo uporabo pa je treba obravnavati v okviru temeljnega okvira za preskušanje in oceno kemikalij, ki povzročajo endokrine motnje, ‚OECD Conceptual Framework for the Testing and Assessment of Endocrine Disrupting Chemicals‘ (28).
|
ZAČETNI POMISLEKI IN OMEJITVE
|
4.
|
Vitelogenin običajno proizvajajo jetra samic oviparnih vretenčarjev kot odziv na kroženje endogenega estrogena. Je predhodna sestavina beljakovin jajčnega rumenjaka, ki po nastanku v jetrih potuje po krvnem obtoku do jajčnika, kjer jo absorbirajo in spremenijo razvijajoča se jajčeca. Vitelogenina v plazmi nezrelih ribjih samic in samcev skoraj ni mogoče zaznati, ker nimajo dovolj krožečega estrogena; jetra pa so sposobna sinteze in izločanja vitelogenina kot odziv na spodbujanje eksogenega estrogena.
|
|
5.
|
Meritev vitelogenina je namenjena zaznavanju kemikalij z različnimi estrogenimi načini delovanja. Zaznavanje estrogenih kemikalij je mogoče z meritvijo indukcije vitelogenina pri ribjih samcih in je bilo obsežno dokumentirano v strokovno pregledani znanstveni literaturi (npr. (7)). Indukcija vitelogenina je bila dokazana tudi po izpostavljenosti androgenom, ki se lahko aromatizirajo (8) (9). Zaradi zmanjšanja ravni kroženja estrogena pri samicah, na primer z zaviranjem aromataze, ki spremeni endogeni androgen v naravni estrogen 17β-estradiol, se zmanjša raven vitelogenina, ki se uporablja za zaznavanje kemikalij, ki imajo lastnosti zaviranja aromataze (10) (11). Biološka pomembnost odziva vitelogenina na zaviranje estrogena/aromataze je bila dokazana in obsežno dokumentirana. Vendar je mogoče, da lahko na nastajanje VTG pri samicah vplivajo tudi splošna strupenost in neendokrini strupeni načini delovanja, npr. hepatotoksičnost.
|
|
6.
|
Več merilnih metod je bilo uspešno pripravljenih in standardiziranih za redno uporabo. Med njimi so metode encimskega imunskega testa (ELISA), ki so specifične za posamezne vrste in uporabljajo imunokemijo za kvantifikacijo vitelogenina, nastalega v majhnih vzorcih krvi ali jeter, ki so bili odvzeti pri posameznih ribah (12) (13) (14) (15) (16) (17) (18). Za meritev VTG se vzorčijo kri črnoglavega pisanca, kri ali homogenat glave/repa cebrice in jetra medake. Pri medaki je korelacija med VTG, izmerjenim v krvi, in VTG, izmerjenim v jetrih, dobra (19). V Dodatku 6 so navedeni priporočeni postopki za odvzem vzorcev za analizo vitelogenina. Kompleti za merjenje vitelogenina so lahko dostopni; taki kompleti morajo temeljiti na validirani metodi ELISA, ki je specifična za posamezno vrsto.
|
|
7.
|
Sekundarne spolne značilnosti ribjih samcev nekaterih vrst so izjemno vidne, jih je mogoče kvantificirati in se odzivajo na ravni kroženja endogenih androgenov; to velja za črnoglavega pisanca in medako, vendar ne za cebrico, ki nima sekundarnih spolnih značilnosti, ki jih je mogoče kvantificirati. Samice so sposobne razviti moške sekundarne spolne značilnosti, če so izpostavljene androgenim kemikalijam v vodi. V znanstveni literaturi je na voljo več študij, ki dokumentirajo te vrste odziva pri črnoglavem pisancu (20) in medaki (21). Zmanjšanje sekundarnih spolnih značilnosti pri samcih je treba zaradi majhne statistične moči razlagati previdno, pri čemer mora razlaga temeljiti na strokovni presoji in zanesljivosti dokazov. Ker cebrica nima sekundarnih spolnih značilnosti, ki jih je mogoče kvantificirati in se odzivajo na kemikalije z androgenim delovanjem, je njena uporaba v tem preskusu omejena.
|
|
8.
|
Pri črnoglavem pisancu je glavni kazalnik eksogene androgene izpostavljenosti število drstnih izpuščajev na nosu ribje samice. Pri medaki je glavni označevalec eksogene izpostavljenosti androgenim kemikalijam pri ribjih samicah število bradavičastih podaljškov. V Dodatku 5A in Dodatku 5B so navedeni priporočeni postopki za spremljanje vrednotenja spolnih značilnosti pri črnoglavem pisancu oziroma medaki.
|
|
9.
|
Opredelitve pojmov, uporabljene v tej preskusni metodi, so navedene v Dodatku 1.
|
NAČELO PRESKUSA
|
10.
|
V preskusu so ribji samci in samice v razmnoževalnem stanju skupaj izpostavljeni v preskusnih posodah. Njihovo odraslo in razmnoževalno stanje omogočata jasno razlikovanje po spolu in zato s spolom povezano analizo posamezne končne točke ter zagotavljata njihovo občutljivost na eksogene kemikalije. Ob koncu preskusa se spol potrdi z makroskopskim pregledom spolnih žlez po ventralnem odprtju trebuha s škarjami. Pregled zadevnih pogojev biološkega preskusa je naveden v Dodatku 2. Preskus se običajno začne z ribo, ki je bila vzorčena iz populacije, ki se drsti; starajoče se živali se ne smejo uporabiti. Smernice glede starosti rib in razmnoževalnega stanja so navedene v razdelku Izbira rib. Preskus se izvede s tremi koncentracijami kemikalije za izpostavljanje, kontrolo z vodo in po potrebi kontrolo s topilom. Pri medaki in cebrici se uporabita dve posodi ali ponovitvi na tretiranje (vsaka posoda vsebuje 5 samcev in 5 samic), pri črnoglavem pisancu pa štiri posode ali ponovitve na tretiranje (vsaka posoda vsebuje 2 samca in 4 samice). To je namenjeno prilagoditvi teritorialnega vedenja samcev črnoglavega pisanca ob hkratni ohranitvi ustrezne moči preskusa. Izpostavljenost traja 21 dni, vzorčenje rib pa se izvaja 21. dan izpostavljenosti.
|
|
11.
|
Pri vzorčenju na 21. dan se vse živali humano usmrtijo. Sekundarne spolne značilnosti se merijo pri črnoglavem pisancu in medaki (glej Dodatek 5A in Dodatek 5B); vzorci krvi se za določanje vitelogenina odvzamejo pri cebrici in črnoglavem pisancu, pri čemer se lahko pri cebricah namesto tega za določanje vitelogenina odvzame glava/rep (Dodatek 6), za analizo VTG pri medaki pa se odvzamejo jetra (Dodatek 6).
|
MERILA ZA SPREJEMLJIVOST PRESKUSA
|
12.
|
Za sprejemljivost rezultatov preskusa morajo biti izpolnjeni naslednji pogoji:
|
—
|
smrtnost v kontrolah z vodo (ali topilom) ob koncu obdobja izpostavljenosti ne sme preseči 10 %,
|
|
—
|
koncentracija raztopljenega kisika mora biti v celotnem obdobju izpostavljenosti vsaj 60 % nasičenosti z zrakom (ASV),
|
|
—
|
razlika v temperaturi vode v različnih preskusnih posodah v obdobju izpostavljenosti nikoli ne sme biti večja od ± 1,5 °C in jo je treba vzdrževati v razponu 2 °C znotraj temperaturnih razponov, ki so določeni za preskusno vrsto (Dodatek 2),
|
|
—
|
na voljo morajo biti dokazi, da so se koncentracije preskusne kemikalije v raztopini zadovoljivo vzdrževale v okviru ± 20 % srednjih izmerjenih vrednosti.
|
|
OPIS METODE
Oprema
|
13.
|
Običajna laboratorijska oprema in zlasti naslednje:
|
(a)
|
oksimetri in merilniki pH;
|
|
(b)
|
oprema za določanje trdote in alkalnosti vode;
|
|
(c)
|
ustrezne naprave za nadzor temperature in, po možnosti, stalno spremljanje;
|
|
(d)
|
bazeni, izdelani iz kemijsko inertnih materialov, ter primerne prostornine glede na priporočeno obremenitev in gostoto rib (glej Dodatek 2);
|
|
(e)
|
substrat za drstenje črnoglavega pisanca in cebrice; potrebne podrobnosti so navedene v Dodatku 4;
|
|
(f)
|
primerna točna tehtnica (tj. točna do ± 0,5 mg).
|
|
Voda
|
14.
|
Za preskusno vodo se lahko uporabi katera koli voda, v kateri kaže preskusna vrsta primerno dolgotrajno preživetje in rast. V času preskusa mora biti voda konstantne kakovosti. Vrednost pH vode mora biti med 6,5 in 8,5, v enem preskusu pa mora biti v območju ± 0,5 pH enote. Za zagotovitev, da voda za redčenje ne bi neprimerno vplivala na rezultat preskusa (na primer s kompleksacijo preskusne kemikalije), je treba v časovnih razmikih odvzemati vzorce za analizo. Izvajati je treba meritve težkih kovin (npr. Cu, Pb, Zn, Hg, Cd in Ni), glavnih anionov in kationov (npr. Ca2+, Mg2+, Na+, K+, Cl– in SO4
2–), pesticidov (npr. skupnih organofosfornih in skupnih organoklornih pesticidov), skupnega organskega ogljika in suspendiranih trdnih snovi, na primer vsake tri mesece, kadar se ve, da je voda za redčenje razmeroma konstantne kakovosti. Če se dokaže, da je bila kakovost vode konstantna vsaj eno leto, se lahko meritve izvajajo manj pogosto, časovni razmiki pa se lahko podaljšajo (npr. na vsakih šest mesecev). Nekatere kemijske značilnosti sprejemljive vode za redčenje so navedene v Dodatku 3.
|
Preskusne raztopine
|
15.
|
Preskusne raztopine izbranih koncentracij se pripravijo z redčenjem založne raztopine. Založno raztopino je treba po možnosti pripraviti preprosto z mešanjem ali stresanjem preskusne kemikalije v vodi za redčenje z uporabo mehanskih sredstev (npr. z mešanjem ali ultrazvočnim razbijanjem). Za pridobitev primerno koncentrirane založne raztopine se lahko uporabijo kolone za nasičevanje raztopine. Uporaba topila kot nosilca ni priporočena. Če je topilo potrebno, je treba vzporedno izvajati kontrolo s topilom z enako koncentracijo topila kot pri kemičnih obdelavah. Za kemikalije, ki jih je težko preskusiti, je lahko topilo tehnično najboljša rešitev; upoštevati je treba Smernico OECD za preskušanje strupenosti zahtevnih snovi in zmesi v vodnem okolju (22). Topilo se izbere na podlagi kemijskih lastnosti kemikalije. V Smernici OECD se priporoča največ 100 μl/l, kar je treba upoštevati. Vendar so bili v zadnjem pregledu (23) izraženi dodatni pomisleki glede uporabe topil za preskušanje endokrinega delovanja. Zato se priporoča, da se koncentracije topila po potrebi čim bolj zmanjšajo, kadar koli je to tehnično izvedljivo (odvisno od fizikalno-kemijskih lastnosti preskusne kemikalije).
|
|
16.
|
Uporabil se bo pretočni preskusni sistem. Tak sistem stalno odmerja in redči založno raztopino preskusne kemikalije (npr. merilna črpalka, proporcionalni razredčevalnik in sistem naprav za nasičenje), da dovaja niz koncentracij v preskusne komore. Pretok založnih raztopin in vode za redčenje je treba preverjati v ustreznih časovnih razmikih, po možnosti vsak dan, med preskusom in se ne sme razlikovati za več kot 10 % med celotnim preskusom. Izogibati se je treba uporabi nizkokakovostnega cevnega materiala ali drugih materialov, ki lahko vsebujejo biološko aktivne kemikalije. Pri izbiri materiala za pretočni sistem je treba upoštevati morebitno adsorpcijo preskusne kemikalije v ta material.
|
Vzdrževanje rib
|
17.
|
Preskusne ribe je treba izbrati iz laboratorijske populacije, po možnosti iz enega staleža, ki so se vsaj dva tedna pred preskusom aklimatizirale, kar zadeva kakovost vode in osvetljenost, v pogojih, podobnih tistim, ki se uporabijo v preskusu. Pomembno je, da sta obremenitev in gostota rib (za opredelitvi glej Dodatek 1) primerni za uporabljene preskusne vrste (glej Dodatek 2).
|
|
18.
|
Po 48 urah od naselitve se zabeleži smrtnost, pri čemer se uporabijo naslednja merila:
|
—
|
smrtnost v sedmih dneh je večja od 10 % populacije: celotna serija se zavrne,
|
|
—
|
smrtnost med 5 in 10 % populacije: aklimatizacija sedem dodatnih dni; če je v drugih sedmih dneh smrtnost večja od 5 %, se zavrne celotna serija,
|
|
—
|
smrtnost v sedmih dneh manjša od 5 % populacije: serija se sprejme.
|
|
|
19.
|
Bolezni rib se v obdobju aklimatizacije, obdobju pred izpostavljenostjo ali v obdobju izpostavljenosti ne smejo zdraviti.
|
Predhodna izpostavljenost in izbira rib
|
20.
|
Priporoča se enotedensko obdobje predhodne izpostavljenosti, pri čemer so živali v posodah, podobnim posodam v dejanskem preskusu. Ribe je treba v celotnem obdobju vzdrževanja in med fazo izpostavljenosti hraniti ad libitum. Faza izpostavljenosti se začne s spolno dimorfnimi odraslimi ribami iz laboratorijske zaloge razmnoževalno zrelih živali (npr. z jasno vidnimi sekundarnimi spolnimi značilnostmi pri črnoglavem pisancu in medaki) in aktivnim drstenjem. Na splošno (vendar se to ne sme upoštevati brez opazovanja dejanskega razmnoževalnega stanja zadevne serije rib) morajo biti črnoglavi pisanci stari približno 20 (±2) tednov, če so bili v celotni življenjski dobi gojeni pri 25 ± 2 °C. Japonske medake morajo biti stare približno 16 (±2) tednov, če so bile v celotni življenjski dobi gojene pri 25 ± 2 °C. Cebrice morajo biti stare približno 16 (±2) tednov, če so bile v celotni življenjski dobi gojene pri 26 ± 2 °C.
|
NAČRT PRESKUSA
|
21.
|
Uporabijo se tri koncentracije preskusne kemikalije, ena kontrola (z vodo) in po potrebi ena kontrola s topilom. Podatki se lahko analizirajo, da se določijo statistično značilne razlike med odzivi na tretiranje in odzivi v kontrolah. Te analize bodo pokazale, ali je za kemikalijo potrebno nadaljnje dolgotrajno preskušanje glede škodljivih učinkov (in sicer preživetje, razvoj, rast in razmnoževanje) namesto uporabe za oceno tveganja (24).
|
|
22.
|
Pri cebrici in medaki se na 21. dan poskusa samci in samice iz posameznih stopenj tretiranja (5 samcev in 5 samic v vsaki od dveh ponovitev) ter kontrol vzorčijo za meritev vitelogenina in sekundarnih spolnih značilnosti, če je primerno. Pri črnoglavem pisancu se na 21. dan izpostavljenosti samci in samice iz posameznih ravni tretiranja (2 samca in 4 samice v vsaki od štirih ponovitev) in kontrol vzorčijo za meritev vitelogenina in sekundarnih spolnih značilnosti.
|
Izbira preskusnih koncentracij
|
23.
|
Za namen tega preskusa je treba najvišjo preskusno koncentracijo določiti z najvišjo tolerančno koncentracijo (MTC), ki se določi z napravo za ugotavljanje razpona ali na podlagi drugih podatkov o strupenosti, ali 10 mg/l ali največjo topnostjo v vodi, odvisno od tega, katera vrednost je nižja. MTC je opredeljena kot najvišja preskusna koncentracija kemikalije, ki povzroči manj kot 10-odstotno smrtnost. Pri uporabi tega pristopa se domneva, da obstajajo empirični podatki o akutni strupenosti ali drugi podatki o strupenosti, na podlagi katerih je mogoče oceniti MTC. Ocena MTC je lahko netočna, pri čemer je običajno potrebna strokovna presoja.
|
|
24.
|
Potrebne so tri preskusne koncentracije, ki se med seboj razlikujejo za konstantni faktor, ki ne presega 10, in kontrola z vodo za redčenje (ter po potrebi kontrola s topilom). Priporoča se razpon faktorjev razmika med 3,2 in 10.
|
POSTOPEK
Izbira in tehtanje preskusnih rib
|
25.
|
Pomembno je, da se že na začetku preskusa čim bolj zmanjša variacija teže rib. Primerni razponi velikosti za različne vrste, priporočene za uporabo v tem preskusu, so navedeni v Dodatku 2. Za celotno serijo rib, uporabljenih v preskusu, je treba teže posameznih ribjih samcev in samic na začetku preskusa po možnosti vzdrževati v razponu ± 20 % aritmetične sredine teže istega spola. Priporočljivo je, da se pred preskusom stehta podvzorec staleža rib, da se oceni srednja teža.
|
Pogoji izpostavljenosti
Trajanje
|
26.
|
Preskus traja 21 dni po obdobju predhodne izpostavljenosti. Priporočeno obdobje predhodne izpostavljenosti traja en teden.
|
Hranjenje
|
27.
|
Ribe je treba hraniti ad libitum s primerno hrano (Dodatek 2) dovolj pogosto, da se vzdržuje telesna kondicija. Paziti je treba, da ne pride do rasti mikrobov in kalnosti vode. Kot splošna smernica se lahko dnevni obrok razdeli na dva ali tri enake dele za večkratno krmljenje, pri čemer morajo med posameznimi krmljenji preteči vsaj tri ure. En večji obrok je sprejemljiv zlasti ob vikendih. Hranjenje rib je treba prekiniti 12 ur pred vzorčenjem/nekropsijo.
|
|
28.
|
Ribjo hrano je treba oceniti glede na prisotnost onesnaževal, kot so organoklorni pesticidi, policiklični aromatski ogljikovodiki (PAH) in poliklorirani bifenili (PCB). Izogibati se je treba hrani z višjo ravnjo fitoestrogenov, ki bi lahko ogrozili odziv preskusa na znani agonist estrogena (npr. 17-beta estradiol).
|
|
29.
|
Neprebavljeno hrano in iztrebke je treba odstraniti iz preskusnih posod vsaj dvakrat na teden, npr. s previdnim čiščenjem dna posameznega bazena z uporabo sesalne natege.
|
Svetloba in temperatura
|
30.
|
Obdobje osvetljenosti in temperatura vode morata biti ustrezna za preskusno vrsto (glej Dodatek 2).
|
Pogostost analitskih določitev in meritev
|
31.
|
Pred začetkom obdobja izpostavljenosti je treba zagotoviti ustrezno delovanje sistema za dovajanje kemikalije. Vzpostaviti je treba vse potrebne analitske metode, vključno z zadostnim znanjem o stabilnosti kemikalije v preskusnem sistemu. Med preskusom se koncentracije preskusne kemikalije določijo v rednih časovnih razmikih, kot sledi: pretoke redčila in založne raztopine strupene snovi je treba po možnosti preveriti vsak dan, vendar vsaj dvakrat na teden, pri čemer se ves čas preskusa ne smejo razlikovati za več kot 10 %. Priporoča se, da se dejanske koncentracije preskusne kemikalije izmerijo v vseh posodah na začetku preskusa in nato v tedenskih časovnih razmikih.
|
|
32.
|
Priporoča se, da rezultati temeljijo na merjenih koncentracijah. Če pa se je koncentracija preskusne kemikalije v raztopini zadovoljivo vzdrževala znotraj ± 20 % nominalne koncentracije ves čas preskusa, lahko rezultati temeljijo na nominalnih ali merjenih vrednostih.
|
|
33.
|
Vzorce bo morda treba filtrirati (npr. z uporabo filtra z velikostjo por 0,45 μm) ali centrifugirati. Če je filtracija potrebna, je priporočeni postopek centrifugiranje. Če pa se preskusni material ne adsorbira na filtre, je lahko sprejemljivo tudi filtriranje.
|
|
34.
|
Med preskusom je treba vsaj enkrat na teden v vseh preskusnih posodah izmeriti raztopljeni kisik, temperaturo in pH. Skupno trdoto in alkalnost je treba vsaj enkrat na teden izmeriti v kontrolah in eni posodi pri najvišji koncentraciji. Temperatura se po možnosti stalno spremlja v vsaj eni preskusni posodi.
|
Opažanja
|
35.
|
Med potekom preskusa ali ob prekinitvi preskusa se ocenijo številni splošni (npr. preživetje) in glavni biološki odzivi (npr. ravni vitelogenina). Meritev in vrednotenje teh končnih točk ter njihova uporabnost so opisani v nadaljevanju.
|
Preživetje
|
36.
|
Ribe je treba v obdobju preskusa pregledati vsak dan, vsako smrtnost zabeležiti, mrtve ribe pa čim prej odstraniti. Mrtve ribe se ne smejo nadomestiti niti v kontrolnih posodah niti v tretiranih posodah. Spol rib, ki poginejo med preskusom, je treba določiti z makroskopskim vrednotenjem spolnih žlez.
|
Obnašanje in videz
|
37.
|
Vsako nenormalno obnašanje (glede na kontrole) je treba zabeležiti; to lahko vključuje znake splošne strupenosti, vključno s hiperventilacijo, nekoordiniranim plavanjem, izgubo ravnotežja in netipičnim mirovanjem ali hranjenjem. Zabeležiti je treba tudi zunanje nenormalnosti (kot sta hemoragija in razbarvanje). Take znake strupenosti je treba pri razlagi podatkov previdno obravnavati, ker lahko nakazujejo koncentracije, pri katerih biomarkerji endokrinega delovanja niso zanesljivi. Taka opažanja v zvezi z obnašanjem lahko zagotovijo tudi koristne kvalitativne informacije, ki kažejo mogoče zahteve za prihodnje preskušanje rib. Na primer teritorialna agresivnost normalnih samcev ali maskuliniziranih samic je bila opažena pri črnoglavem pisancu, ki je bil izpostavljen androgenemu delovanju; pri cebrici se značilno obnašanje pri parjenju in drstenju po svitanju zmanjša ali ga ovira izpostavljenost estrogenemu ali antiandrogenemu delovanju.
|
|
38.
|
Ker se lahko nekateri vidiki videza (zlasti barva) pri rokovanju hitro spremenijo, je pomembno, da se kvalitativno opazovanje izvede pred odstranitvijo živali iz preskusnega sistema. Dosedanje izkušnje s črnoglavim pisancem kažejo, da lahko nekatere kemikalije z endokrinim delovanjem na začetku povzročijo spremembe naslednjih zunanjih značilnosti: barvo telesa (svetlo ali temno), vzorce obarvanja (prisotnost navpičnih prog) in obliko telesa (območje glave in prsi). Zato je treba opazovanje fizičnega videza rib izvesti med potekom preskusa in ob koncu študije.
|
Humano ubijanje rib
|
39.
|
Na 21. dan, tj. ob prekinitvi izpostavljenosti, je treba ribe evtanazirati s primernimi količinami trikaina (trikain metan sulfonat, metakain, MS-222 (CAS 886-86-2), 100–500 mg/l, pufran s 300 mg/l NaHCO3 (natrijev bikarbonat, CAS 144-55-8)), da se zmanjša draženje sluznice; kri ali tkivo se nato vzorči za določitev vitelogenina, kot je pojasnjeno v razdelku Vitelogenin.
|
Opazovanje sekundarnih spolnih značilnosti
|
40.
|
Nekatere kemikalije z endokrinim delovanjem lahko povzročijo spremembe pri določenih sekundarnih spolnih značilnostih (število drstnih izpuščajev pri samcu črnoglavega pisanca in bradavičastih podaljškov pri samcu medake). Kemikalije z nekaterimi načini delovanja lahko povzročijo nenormalen pojav sekundarnih spolnih značilnosti pri živalih nasprotnega spola; agonisti androgenega receptorja, kot so trenbolon, metiltestosteron in dihidrotestosteron, lahko na primer pri samici črnoglavega pisanca povzročijo razvoj izrazitih drstnih izpuščajev ali pa pri samici medake razvoj bradavičastih podaljškov (11) (20) (21). Obstajajo tudi poročila, da lahko agonisti estrogenega receptorja zmanjšajo število drstnih izpuščajev in velikost dorzalne strani trupa pred hrbtno plavutjo pri odraslih samcih (25) (26). Taka splošna morfološka opažanja lahko zagotovijo koristne kvalitativne in kvantitativne informacije, ki kažejo mogoče zahteve za prihodnje preskušanje rib. Število in velikost drstnih izpuščajev pri črnoglavem pisancu in bradavičastih podaljškov pri medaki se lahko kvantificira neposredno ali bolj praktično z ohranjenimi vzorci. Priporočeni postopki za vrednotenje sekundarnih spolnih značilnosti pri črnoglavem pisancu in medaki so navedeni v Dodatku 5A oziroma Dodatku 5B.
|
Vitelogenin (VTG)
|
41.
|
Kri se odvzame iz repne arterije/vene s heparinizirano mikrohematokritsko kapilarno cevko ali namesto tega s srčno punkcijo z brizgo. Količine zbrane krvi so odvisne od velikosti ribe ter so običajno v razponu od 5 do 60 μl na posameznega črnoglavega pisanca in od 5 do 15 μl na posamezno cebrico. Plazma se od krvi loči s centrifugiranjem in shrani z inhibitorji protaze pri – 80 °C, dokler se ne analizira glede vitelogenina. Pri medaki pa se kot tkivni vir za določanje vitelogenina uporabijo jetra in pri cebrici homogenat glave/repa (Dodatek 6). Meritev VTG mora temeljiti na validirani homologni metodi ELISA, pri čemer se uporabijo homologni standard VTG in homologna protitelesa. Priporoča se uporaba metode, s katero je mogoče zaznati tako nizke ravni VTG, kot je nekaj ng/ml plazme (ali ng/mg tkiva), kar je raven naravnega ozadja pri neizpostavljenih ribjih samcih.
|
|
42.
|
Nadzor kakovosti analize vitelogenina se zagotovi z uporabo standardov, slepih vzorcev in vsaj dvema analizama. Za vsako metodo ELISA je treba izvesti preskus vpliva matriksa (učinek razredčenja vzorca), da se določi najmanjši faktor razredčenja vzorca. Vsaka plošča ELISA, uporabljena za preskuse VTG, mora vsebovati naslednje vzorce za nadzor kakovosti: vsaj 6 kalibracijskih standardov, ki zajemajo razpon pričakovanih koncentracij vitelogenina, in vsaj en nespecifično vezalni preskus slepega vzorca (analiziran v dveh ponovitvah). Absorpcija teh slepih vzorcev mora biti manj kot 5 % največje absorpcije kalibracijskega standarda. Analizirana bosta vsaj dva alikvota (ponovitvi vdolbinic) posameznega razredčenja vzorca. Ponovitve vdolbinic, ki se razlikujejo za več kot 20 %, je treba ponovno analizirati.
|
|
43.
|
Korelacijski koeficient (R2) za umeritvene krivulje mora biti večji od 0,99. Vendar visoka korelacija ni dovolj za zagotovitev ustrezne napovedi koncentracije v vseh razponih. Poleg dovolj visoke korelacije za umeritveno krivuljo mora biti koncentracija posameznega standarda, kot je izračunana po umeritveni krivulji, med 70 in 120 % nominalne koncentracije. Če se nominalne koncentracije oddaljujejo od regresijske premice kalibracije (npr. pri nižjih koncentracijah), bo morda treba umeritveno krivuljo razdeliti na nizke in visoke razpone ali uporabiti nelinearen model, ki bo ustrezal podatkom o absorpciji. Če se krivulja razdeli, mora biti R2 na obeh delih > 0,99.
|
|
44.
|
Meja zaznavanja (LOD) je opredeljena kot koncentracija najnižjega analitskega standarda, meja določanja (LOQ) pa je opredeljena kot koncentracija najnižjega analitskega standarda, pomnoženega z najnižjim faktorjem razredčenja.
|
|
45.
|
Vsak dan izvedbe preskusa vitelogenina se analizira obogateni vzorec, pripravljen z medpreskusnim referenčnim standardom (Dodatek 7). Razmerje med pričakovano koncentracijo in izmerjeno koncentracijo se sporoči skupaj z rezultati posameznih nizov preskusov, izvedenih isti dan.
|
PODATKI IN POROČANJE
Vrednotenje odziva biomarkerja z analizo variance (ANOVA)
|
46.
|
Za določitev potencialnega endokrinega delovanja kemikalije se z analizo variance (ANOVA) primerjajo odzivi med tretiranji in kontrolnimi skupinami. Kadar se uporabi kontrola s topilom, je treba za vsako končno točko izvesti primeren statistični preskus med vodo za redčenje in kontrolami s topilom. Smernice za obravnavanje podatkov o vodi za redčenje in kontroli s topilom pri nadaljnji statistični analizi so navedene v OECD, 2006c (27). Vse podatke o biološkem odzivu je treba analizirati in sporočiti ločeno po spolu. Če niso izpolnjene zahtevane domneve za parametrske metode – nenormalna porazdelitev (npr. Shapiro-Wilkov preskus) ali heterogena varianca (Bartlettov ali Levenejev preskus), je potreben razmislek o preoblikovanju podatkov, da se poenotijo variance pred izvedbo ANOVA ali pred izvedbo tehtane ANOVA. Za nemonotoni odziv na odmerek se lahko uporabi Dunnettov preskus (parametrski) večkratnih primerjav med pari ali Mann-Whitneyjev preskus z Bonferroni-Holmovo prilagoditvijo (neparametrski). Če je odziv na odmerek približno monoton, se lahko uporabijo drugi statistični preskusi (npr. preskus po Jonckheere-Terpstraju ali Williamsov preskus). V pomoč pri odločitvi glede izbire najprimernejšega statističnega preskusa, ki naj se uporabi, je v Dodatku 8 zagotovljena statistična tabela poteka. Dodatne informacije so navedene v dokumentu OECD o sedanjih pristopih k statistični analizi podatkov o ekotoksičnosti (27).
|
Poročanje o rezultatih preskusa
|
47.
|
Podatki študije morajo obsegati:
|
|
Preskusna infrastruktura:
|
—
|
odgovorno osebje in njihove obveznosti v zvezi s študijo,
|
|
—
|
vsak laboratorij mora s sklopom reprezentativnih kemikalij dokazati usposobljenost.
|
|
|
|
Preskusna kemikalija:
|
—
|
opredelitev preskusne kemikalije,
|
|
—
|
fizikalno stanje in ustrezne fizikalno-kemijske lastnosti,
|
|
—
|
metodo in pogostost priprave preskusnih koncentracij,
|
|
—
|
informacije o stabilnosti in biološki razgradljivosti.
|
|
|
|
Topilo:
|
—
|
opredelitev topila (vrsta, uporabljena koncentracija),
|
|
—
|
utemeljitev izbire topila (če to ni voda).
|
|
|
|
Preskusne živali:
|
—
|
dobavitelja in specifično infrastrukturo dobavitelja,
|
|
—
|
starost rib na začetku preskusa in razmnoževalno stanje/stanje drstenja,
|
|
—
|
podrobnosti o postopku aklimatizacije živali,
|
|
—
|
telesno težo rib na začetku izpostavljenosti (iz podvzorca staleža rib).
|
|
|
|
Preskusni pogoji:
|
—
|
uporabljeni preskusni postopek (vrsta preskusa, stopnja obremenitve, gostota rib itd.),
|
|
—
|
metodo priprave založnih raztopin in pretok,
|
|
—
|
nominalne preskusne koncentracije, tedensko izmerjene koncentracije preskusnih raztopin in uporabljeno analitsko metodo, sredine izmerjenih vrednosti in standardnih odklonov v preskusnih posodah ter dokaze, da se meritve nanašajo na koncentracije preskusne kemikalije v dejanski raztopini,
|
|
—
|
značilnosti vode za redčenje (vključno s pH, trdoto, alkalnostjo, temperaturo, koncentracijo raztopljenega kisika, koncentracijo sledi klora, skupnim organskim ogljikom, suspendiranimi trdnimi snovmi in vsemi ostalimi opravljenimi meritvami),
|
|
—
|
kakovost vode v preskusnih posodah: pH, trdota, temperatura in koncentracija raztopljenega kisika,
|
|
—
|
podrobne informacije o hranjenju (npr. vrsta hrane, vir, dana količina in pogostost dajanja ter analiza zadevnih onesnaževal, če je na voljo (npr. PCB, PAH in organoklorni pesticidi).
|
|
|
|
Rezultati
|
—
|
dokaze, da kontrole izpolnjujejo merila za sprejemljivost preskusa,
|
|
—
|
podatke o smrtnosti za posamezne preskusne koncentracije in kontrole,
|
|
—
|
uporabljene tehnike statistične analize, obdelavo podatkov in utemeljitev uporabljenih tehnik,
|
|
—
|
podatke o bioloških opažanjih splošne morfologije, vključno s sekundarnimi spolnimi značilnostmi in vitelogeninom,
|
|
—
|
rezultate analize podatkov, po možnosti v obliki tabele in grafičnega prikaza,
|
|
—
|
pojav kakršnih koli neobičajnih reakcij rib in kakršnih koli vidnih učinkov, ki jih povzroči preskusna kemikalija.
|
|
|
SMERNICA ZA RAZLAGO IN SPREJEMLJIVOST REZULTATOV PRESKUSA
|
48.
|
V tem razdelku je navedenih nekaj pomislekov, ki jih je treba upoštevati pri razlagi rezultatov preskusa za različne izmerjene končne točke. Rezultate je treba previdno razlagati, kadar se zdi, da preskusna kemikalija povzroča očitno strupenost ali vpliva na splošno stanje preskusne živali.
|
|
49.
|
Pri določanju razpona preskusnih koncentracij je treba paziti, da se ne preseže najvišja tolerančna koncentracija, da bo mogoča smiselna razlaga podatkov. Kadar ni znakov strupenih učinkov, je pomembno, da se izvede vsaj eno tretiranje. Znake bolezni in znake strupenih učinkov je treba temeljito oceniti in o njih poročati. Možno je na primer, da na nastajanje VTG pri samicah vplivajo tudi splošna strupenost in neendokrini strupeni načini delovanja, npr. hepatotoksičnost. Vendar se lahko razlaga učinkov podkrepi z drugimi stopnjami tretiranja, na katere ne vpliva sistemska strupenost.
|
|
50.
|
V zvezi s sprejemljivostjo rezultatov preskusa je treba upoštevati nekaj vidikov. Ravni VTG v kontrolnih skupinah samcev in samic morajo biti kot smernica izrazite ter ločene za približno tri rede velikosti pri črnoglavem pisancu in cebrici ter približno en red velikosti pri medaki. Primeri razpona vrednosti v kontrolnih in tretiranih skupinah so navedene v validacijskih poročilih (1) (2) (3) (4). Visoke vrednosti VTG pri samcih iz kontrol bi lahko ogrozile odzivnost preskusa in njegovo zmožnost za zaznavanje šibkih agonistov estrogena. Nizke vrednosti VTG pri samicah iz kontrol bi lahko ogrozile odzivnost preskusa ter njegovo zmožnost za zaznavanje inhibitorjev aromataze in antagonistov estrogena. Pri pripravi te smernice so bile uporabljene validacijske študije.
|
|
51.
|
Če laboratorij še ni izvedel preskusa ali je prišlo do znatnih sprememb (npr. sprememba seva ali dobavitelja rib), se priporoča izvedba študije tehnične usposobljenosti. Priporočljivo je, da se uporabijo kemikalije, ki zajemajo različne načine delovanja ali vplive na številne preskusne končne točke. V praksi se vsak laboratorij spodbuja k vzpostavitvi lastnih podatkov o kontroli iz preteklih preskusov za samce in samice ter izvedbi pozitivne kontrole za estrogeno delovanje (npr. 17β-estradiol pri100 ng/l ali znan šibek agonist), ki povzroči povečanje VTG pri ribjih samcih, pozitivne kontrole za zaviranje aromataze (npr. fadrozol ali prokloraz pri 300 μg/l), ki povzroči zmanjšanje VTG pri ribjih samicah, in pozitivno kontrolo za androgeno delovanje (npr. 17β-trenbolon pri 5 μg/l), ki povzroči indukcijo sekundarnih spolnih značilnosti pri samicah črnoglavega pisanca in medake. Vsi ti podatki se lahko primerjajo z razpoložljivimi podatki iz validacijskih študij (1) (2) (3), da se zagotovi usposobljenost laboratorija.
|
|
52.
|
Na splošno je treba meritve vitelogenina šteti za pozitivne, če se VTG pri samcih statistično značilno poveča (p < 0,05) ali pri samicah statistično značilno zmanjša (p < 0,05) vsaj pri najvišjem preskušenem odmerku v primerjavi s kontrolno skupino ter ob odsotnosti znakov splošne strupenosti. Pozitiven rezultat je nadalje podprt s prikazom biološko verjetnega razmerja med odmerkom in krivuljo odziva. Kot je bilo navedeno, zmanjšanje vitelogenina morda ni v celoti endokrinega izvora; vendar je treba pozitiven rezultat na splošno razlagati kot dokaz endokrinega delovanja in vivo ter si prizadevati za nadaljnjo pojasnitev.
|
LITERATURA
|
(1)
|
OECD (2006a). Report of the Initial Work Towards the Validation of the 21-Day Fish Screening Assay for the Detection of Endocrine active Substances (Phase 1A). OECD Environmental Health and Safety Publications Series on Testing and Assessment No.60, ENV/JM/MONO(2006)27.
|
|
(2)
|
OECD (2006b). Report of the Initial Work Towards the Validation of the 21-Day Fish Screening Assay for the Detection of Endocrine active Substances (Phase 1B). OECD Environmental Health and Safety Publications Series on Testing and Assessment No.61, ENV/JM/MONO(2006)29.
|
|
(3)
|
OECD (2007). Final report of the Validation of the 21-day Fish Screening Assay for the Detection of Endocrine Active Substances. Phase 2: Testing Negative Substances. OECD Environmental Health and Safety Publications Series on Testing and Assessment No.78, ENV/JM/MONO(2007)25.
|
|
(4)
|
Owens, J. W. (2007). Phase 3 report of the validation of the OECD Fish Screening Assay. CEFIC LRI Project, Endocrine. http://www.cefic-lri.org/index.php?page=projects (dostop 18.9.2008).
|
|
(5)
|
US EPA 2007. Validation of the Fish Short-Term Reproduction Assay: Integrated Summary Report. Unpublished report dated 15 December 2007. US Environmental Protection Agency, Washington, DC. 104 str.
|
|
(6)
|
OECD, 2008. Report of the Validation Peer Review for the 21-Day Fish Endocrine Screening Assay and Agreement of the Working Group of the National Coordinators of the Test Guidelines Programme on the Follow-up of this Report. OECD Environmental Health and Safety Publications Series on Testing and Assessment No.94, ENV/JM/MONO(2008)21.
|
|
(7)
|
Sumpter in Jobling (1995). Vitellogenesis as a biomarker for estrogenic contamination of the aquatic environment. Environmental Health Perspectives;103 Suppl 7: 173–8 Review.
|
|
(8)
|
Pawlowski, S., Sauer, A., Shears, J. A., Tyler, C. R., Braunbeck, T. (2004). Androgenic and estrogenic effects of the synthetic androgen 17alpha-methyltestosterone on sexual development and reproductive performance in the fathead minnow (Pimephales promelas) determined using the gonadal recrudescence assay. Aquatic Toxicology; 68(3): 277–91.
|
|
(9)
|
Andersen, L., Goto-Kazato, R., Trant, J. M., Nash, J. P., Korsgaard, B., Bjerregaard, P. (2006). Short-term exposure to low concentrations of the synthetic androgen methyltestosterone affects vitellogenin and steroid levels in adult male zebrafish (Danio rerio). Aquatic Toxicology; 76(3–4): 343–52.
|
|
(10)
|
Ankley, G. T., Kahl, M. D., Jensen, K. M., Hornung, M. W., Korte, J. J., Makynen, E. A., Leino, R. L. (2002). Evaluation of the aromatase inhibitor fadrozole in a short-term reproduction assay with the fathead minnow (Pimephales promelas). Toxicological Sciences; 67(1): 121–30.
|
|
(11)
|
Panter, G. H., Hutchinson, T. H., Hurd, K. S., Sherren, A., Stanley, R. D., Tyler, C. R. (2004). Successful detection of (anti-)androgenic and aromatase inhibitors in pre-spawning adult fathead minnows (Pimephales promelas) using easily measured endpoints of sexual development. Aquatic Toxicology; 70(1): 11–21.
|
|
(12)
|
Parks, L. G., Cheek, A. O., Denslow, N. D., Heppell, S. A., McLachlan, J. A., LeBlanc, G. A., Sullivan, C. V. (1999). Fathead minnow (Pimephales promelas) vitellogenin: purification, characterization and quantitative immunoassay for the detection of estrogenic compounds. Comparative Biochemistry and Physiology. Part C Pharmacology, toxicology and endocrinology; 123(2): 113–25.
|
|
(13)
|
Panter, G. H., Tyler, C. R., Maddix, S., Campbell, P. M., Hutchinson, T. H., Länge, R., Lye, C., Sumpter, J. P., 1999. Application of an ELISA to quantify vitellogenin concentrations in fathead minnows (Pimephales promelas) exposed to endocrine disrupting chemicals. CEFIC-EMSG research report reference AQ001. CEFIC, Bruselj, Belgija.
|
|
(14)
|
Fenske, M., van Aerle, R. B., Brack, S. C., Tyler, C. R., Segner, H., (2001). Development and validation of a homologous zebrafish (Danio rerio Hamilton- Buchanan) vitellogenin enzyme-linked immunosorbent assay (ELISA) and its application for studies on estrogenic chemicals. Comp. Biochem. Phys. C 129 (3): 217–232.
|
|
(15)
|
Holbech, H., Andersen, L., Petersen, G. I., Korsgaard B., Pedersen, K. L., Bjerregaard, P. (2001). Development of an ELISA for vitellogenin in whole body homogenate of zebrafish (Danio rerio). Comparative Biochemistry and Physiology. Part C Pharmacology, toxicology and endocrinology; 130: 119– 131.
|
|
(16)
|
Rose, J., Holbech, H., Lindholst, C., Noerum, U., Povlsen, A., Korsgaard, B., Bjerregaard, P. 2002. Vitellogenin induction by 17β-estradiol and 17β-ethinylestradiol in male zebrafish (Danio rerio). Comp. Biochem. Physiol. C. 131: 531–539.
|
|
(17)
|
Brion, F., Nilsen, B. M., Eidem, J. K., Goksoyr, A., Porcher, J. M., Development and validation of an enzyme-linked immunosorbent assay to measure vitellogenin in the zebrafish (Danio rerio). Environmental Toxicology and Chemistry; vol 21: 1699– 1708.
|
|
(18)
|
Yokota, H., Morita, H., Nakano, N., Kang, I. J., Tadokoro, H., Oshima, Y., Honjo, T., Kobayashi, K. 2001. Development of an ELISA for determination of the hepatic vitellogenin in Medaka (Oryzias latipes). Jpn J Environ Toxicol 4:87–98.
|
|
(19)
|
Tatarazako, N., Koshio, M., Hori, H., Morita, M., in Iguchi, T., 2004. Validation of an enzyme-linked immunosorbent assay method for vitellogenin in the Medaka. Journal of Health Science 50: 301–308.
|
|
(20)
|
Ankley, G. T., Jensen, K. M., Makynen, E. A., Kahl, M. D., Korte, J. J., Homung, M. W., Henry, T. R., Denny, J. S., Leino, R. L., Wilson, V. S., Cardon, M. C., Hartig, P. C., Gray, L. E. (2003). Effects of the androgenic growth promoter 17-beta-trenbolone on fecundity and reproductive endocrinology of the fathead minnow. Environmental Toxicology and Chemistry; 22(6): 1350–60.
|
|
(21)
|
Seki, M., Yokota, H., Matsubara, H., Maeda, M., Tadokoro, H., Kobayashi, K. (2004). Fish full life-cycle testing for androgen methyltestosterone on medaka (Oryzias latipes). Environmental Toxicology and Chemistry; 23(3): 774–81.
|
|
(22)
|
OECD (2000) Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. Environmental Health and Safety Publications. Series on Testing and Assessment. No. 23. Pariz.
|
|
(23)
|
Hutchinson, T. H., Shillabeer, N., Winter, M. J., Pickford, D. B., 2006a. Acute and chronic effects of carrier solvents in aquatic organisms: A critical review. Review. Aquatic Toxicology, 76; str. 69–92.
|
|
(24)
|
Hutchinson, T. H., Ankley, G. T., Segner, H., Tyler, C. R., 2006b. Screening and testing for endocrine disruption in fish-biomarkers as ‚signposts,‘ not ‚traffic lights,‘ in risk assessment. Environmental Health Perspectives; 114 Suppl 1: 106– 14.
|
|
(25)
|
Miles-Richardson, S. R., Kramer, V. J., Fitzgerald, S. D., Render, J. A., Yamini, B., Barbee, S. J., Giesy, J. P. 1999. Effects of waterborne exposure to 17β-estradiol on secondary sex characteristics and gonads of the fathead minnow (Pimephales promelas). Aquat. Toxicol. 47, 129– 145.
|
|
(26)
|
Martinovic, D., L. S. Blake, E. J. Durhan, K. J. Greene, M. D. Kahl, K. M. Jensen, E. A. Makynen, D. L. Villeneuve in G. T. Ankley. 2008. Characterization of reproductive toxicity of vinclozolin in the fathead minnow and co-treatment with an androgen to confirm an anti-androgenic mode of action. Environ. Toxicol. Chem. 27, 478–488.
|
|
(27)
|
OECD (2006c). Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. OECD environmental Health and Safety Publications Series on Testing and Assessment No.54. ENV/JM/MONO(2006)18.
|
|
(28)
|
OECD (2012) OECD Conceptual Framework for Testing and Assessment of Endocrine Disrupters (revised). Annex I to Draft Guidance Document on Standardised Test Guidelines for Evaluating Chemicals for Endocrine Disruption. Series on Testing and Assessment No 150. ENV/JM/MONO(2012)22.
|
Dodatek 1
Okrajšave in opredelitev pojmov
Kemikalija
: snov ali zmes.
KV
: koeficient variacije.
ELISA
: encimski imunski test.
Stopnja obremenitve
: mokra teža rib na količino vode.
Gostota rib
: število rib na količino vode.
VTG (vitelogenin)
: fosfoglikoprotein in predstopnja rumenjakovih beljakovin, ki se običajno pojavi pri spolno aktivnih samicah vseh oviparnih vrst.
Os HPG
: os hipotalamus – hipofiza – spolne žleze.
MTC
: najvišja tolerančna koncentracija, ki predstavlja približno 10 % LC50.
Preskusna kemikalija
: vsaka snov ali zmes, preskušena z uporabo te preskusne metode.
Dodatek 2
Poskusni pogoji za endokrini presejalni preskus rib
|
|
Črnoglavi pisanec
(Pimephales promelas)
|
Medaka
(Oryzias latipes)
|
Cebrica
(Danio rerio)
|
|
|
pretočni
|
pretočni
|
pretočni
|
|
|
25 ± 2 °C
|
25 ± 2 °C
|
26 ± 2 °C
|
|
4.
|
Kakovost osvetljenosti
|
|
fluorescenčne sijalke (široki spekter)
|
fluorescenčne sijalke (široki spekter)
|
fluorescenčne sijalke (široki spekter)
|
|
|
10–20 μE/m2/s, 540–1 000 luksov ali 50–100 ft-c (ravni v laboratoriju)
|
10–20 μE/m2/s, 540–1 000 luksov ali 50–100 ft-c (ravni v laboratoriju)
|
10–20 μE/m2/s, 540–1 000 luksov ali 50–100 ft-c (ravni v laboratoriju)
|
|
6.
|
Obdobje osvetljenosti (svitanje in mrak sta neobvezna, vendar se ne štejeta za potrebna)
|
|
16 ur svetlobe, 8 ur teme
|
12–16 ur svetlobe, 12-8 ur teme
|
12–16 ur svetlobe, 12-8 ur teme
|
|
|
< 5 g/l
|
< 5 g/l
|
< 5 g/l
|
|
8.
|
Velikost preskusne komore
|
|
10 l (minimum)
|
2 l (minimum)
|
5 l (minimum)
|
|
9.
|
Količina preskusne raztopine
|
|
8 l (minimum)
|
1,5 l (minimum)
|
4 l (minimum)
|
|
10.
|
Zamenjave količin preskusnih raztopin
|
|
vsaj 6 na dan
|
vsaj 5 na dan
|
vsaj 5 na dan
|
|
11.
|
Starost preskusnih organizmov
|
|
glej odstavek 20
|
glej odstavek 20
|
glej odstavek 20
|
|
12.
|
Približna mokra teža odrasle ribe (g)
|
|
samice: 1,5 ± 20 %
samci: 2,5 ± 20 %
|
samice: 0,35 ± 20 %
samci: 0,35 ± 20 %
|
samice: 0,65 ± 20 %
samci: 0,4 ± 20 %
|
|
13.
|
Št. rib na preskusno posodo
|
|
6 (2 samca in 4 samice)
|
10 (5 samcev in 5 samic)
|
10 (5 samcev in 5 samic)
|
|
|
= 3 (plus ustrezno št. kontrol)
|
= 3 (plus ustrezno št. kontrol)
|
= 3 (plus ustrezno št. kontrol)
|
|
15.
|
Št. posod na tretiranje
|
|
najmanj 4
|
najmanj 2
|
najmanj 2
|
|
16.
|
Št. rib na preskusno koncentracijo
|
|
16 odraslih samic in 8 samcev (4 samice in 2 samca v vsaki ponovitveni posodi)
|
10 odraslih samic in 10 samcev (5 samic in 5 samcev v vsaki ponovitveni posodi)
|
10 odraslih samic in 10 samcev (5 samic in 5 samcev v vsaki ponovitveni posodi)
|
|
|
živi ali zamrznjeni odrasli solinski rakci ali njihovi navpliji dvakrat ali trikrat na dan (ad libitum), komercialno dostopna hrana ali kombinacija navedenega
|
navpliji solinskih rakcev dvakrat ali trikrat na dan (ad libitum), komercialno dostopna hrana ali kombinacija navedenega
|
navpliji solinskih rakcev dvakrat ali trikrat na dan (ad libitum), komercialno dostopna hrana ali kombinacija navedenega
|
|
|
brez, razen če koncentracija raztopljenega kisika pade pod 60 % nasičenosti
|
brez, razen če koncentracija raztopljenega kisika pade pod 60 % nasičenosti
|
brez, razen če koncentracija raztopljenega kisika pade pod 60 % nasičenosti
|
|
|
čista površinska voda, voda iz vodnjaka ali modelna razredčevalna voda ali deklorirana vodovodna voda
|
čista površinska voda, voda iz vodnjaka ali modelna razredčevalna voda ali deklorirana vodovodna voda
|
čista površinska voda, voda iz vodnjaka ali modelna razredčevalna voda ali deklorirana vodovodna voda
|
|
20.
|
Obdobje predhodne izpostavljenosti
|
|
priporočeno 7 dni
|
priporočeno 7 dni
|
priporočeno 7 dni
|
|
21.
|
Trajanje izpostavljenosti kemikaliji
|
|
21 dni
|
21 dni
|
21 dni
|
|
22.
|
Biološke končne točke
|
|
preživetje
obnašanje
2y spolne značilnosti
VTG
|
preživetje
obnašanje
2y spolne značilnosti
VTG
|
preživetje
obnašanje
VTG
|
|
23.
|
Sprejemljivost preskusa
|
|
raztopljeni kisik > 60 % nasičenosti; srednja temperatura 25 ± 2 °C; 90-odstotno preživetje rib v kontrolah; izmerjene preskusne koncentracije v razponu 20 % srednjih izmerjenih vrednosti na stopnjo tretiranja
|
raztopljeni kisik > 60 % nasičenosti; srednja temperatura 24 ± 2 °C; 90-odstotno preživetje rib v kontrolah; izmerjene preskusne koncentracije v razponu 20 % srednjih izmerjenih vrednosti na stopnjo tretiranja
|
raztopljeni kisik > 60 % nasičenosti; srednja temperatura 26 ± 2 °C; 90-odstotno preživetje rib v kontrolah; izmerjene preskusne koncentracije v razponu 20 % srednjih izmerjenih vrednosti na stopnjo tretiranja
|
Dodatek 3
Nekatere kemične značilnosti sprejemljive vode za redčenje
|
Sestavina
|
Koncentracije
|
|
delci
|
< 20 mg/l
|
|
skupni organski ogljik
|
< 2 mg/l
|
|
neionizirani amoniak
|
< 1 μg/l
|
|
ostanek klora
|
< 10 μg/l
|
|
skupni organofosforni pesticidi
|
< 50 ng/l
|
|
skupni organoklorni pesticidi in poliklorirani bifenili
|
< 50 ng/l
|
|
skupni organski klor
|
< 25 ng/l
|
Dodatek 4A
Substrat za drstenje cebrice
Drstilni pladenj
: popolnoma steklena laboratorijska posoda, na primer 22 × 15 × 5,5 cm (d × š × g), pokrita z odstranljivo rešetko iz nerjavnega jekla (širina mreže 2 mm). Rešetka mora prekriti odprtino laboratorijske posode pod robom.

Na rešetko je treba pritrditi substrat za drstenje. Zagotoviti mora strukturo, v katero se premaknejo ribe. Primerne so na primer umetne akvarijske rastline iz zelene plastike (opomba: proučiti je treba morebitno adsorpcijo preskusne kemikalije na plastični material). Plastični material je treba dovolj dolgo izpirati v zadostni količini tople vode za zagotovitev, da v preskusno vodo ne bo prešla nobena kemikalija. Pri uporabi steklenih materialov je treba zagotoviti, da se ribe med intenzivnim premikanjem ne poškodujejo niti niso utesnjene.
Razdalja med pladnjem in steklenimi ploščami mora biti vsaj 3 cm, da bi bilo zagotovljeno, da se ribe ne drstijo zunaj pladnja. Ikre, odložene na pladenj, padejo skozi rešetko in se lahko vzorčijo 45–60 minut po začetku osvetljenosti. Prozorne ikre niso sprijete in se lahko enostavno štejejo z uporabo prečne svetlobe. Če je v posodi pet samic, se do 20 iker na dan lahko šteje za nizko število, do 100 iker kot srednje in več kot 100 iker kot visoko število. Drstilni pladenj je treba odstraniti, zbrati ikre in drstilni pladenj ponovno postaviti v preskusno posodo čim pozneje zvečer ali zelo zgodaj zjutraj. Čas do ponovne postavitve rešetke ne sme presegati eno uro, saj bi sicer lahko substrat za drstenje vodil do posameznih parjenj in drstenj ob neobičajnem času. Če je treba zaradi razmer drstilni pladenj vstaviti pozneje, je treba to storiti vsaj 9 ur po začetku osvetljenosti. Drstenje se tako pozno ne začne več.
Dodatek 4B
Substrat za drstenje črnoglavega pisanca
V vsako preskusno komoro se postavijo dve ali tri kombinirane plastične/keramične/steklene plošče ali plošče iz nerjavnega jekla in drstilni pladnji (npr. 80 mm dolg siv polkrožen žleb na pladenj z robovi, dolg 130 mm) (glej sliko). Ustrezno pripravljene plošče iz PVC ali keramike so dokazano primerne za substrat za drstenje (Thorpe idr., 2007).
Priporočeno je, da so plošče pobrušene, da se izboljša oprijem. Pladenj mora biti tudi zaščiten, da se ribam prepreči dostop do iker, ki padejo skozi, razen če je bil za uporabljen substrat za drstenje dokazan učinkovit oprijem.

Podlaga je zasnovana tako, da zadrži vse ikre, ki se ne primejo površine plošče in bi zato padle na dno posode (ali tiste ikre, ki so odložene neposredno na ravno plastično podlago). Vse substrate za drstenje je treba pred uporabo izpirati v vodi za redčenje vsaj 12 ur.
VIRI
Thorpe, K. L., Benstead, R., Hutchinson, T. H., Tyler, C. R., 2007. An optimised experimental test procedure for measuring chemical effects on reproduction in the fathead minnow, Pimephales promelas. Aquatic Toxicology, 81, 90–98.
Dodatek 5A
Ocena sekundarnih spolnih značilnosti pri črnoglavem pisancu za zaznavanje nekaterih kemikalij z endokrinim delovanjem
Pregled
Potencialno pomembne značilnosti fizičnega videza odraslih črnoglavih pisancev pri preskušanju povzročiteljev endokrinih motenj vključujejo barvo telesa (tj. svetlo/temno), vzorce obarvanja (tj. prisotnost navpičnih prog), obliko telesa (tj. oblika glave in območja prsi, napetost trebuha) in posebne sekundarne spolne značilnosti (tj. število in velikost drstnih izpuščajev, velikost dorzalne strani trupa pred hrbtno plavutjo in leglica).
Drstni izpuščaji so na glavi (dorzalna stran trupa pred hrbtno plavutjo) razmnoževalno aktivnih samcev črnoglavega pisanca in so običajno razporejeni v dvostransko simetrični vzorec (Jensen idr., 2001). Pri kontrolnih samicah ter mladih samcih in samicah razvoj izpuščajev ni viden (Jensen idr., 2001). Okoli oči in med nosnicama samcev je lahko do osem posameznih izpuščajev. Največ izpuščajev in največji izpuščaji se nahajajo v dveh vzporednih linijah neposredno pod nosnicama in nad usti. Pri veliko ribah so skupine izpuščajev pod spodnjo čeljustjo; izpuščaji, ki so najbliže ustom, se običajno pojavljajo kot par, medtem ko lahko bolj ventralen sklop sestavljajo največ štirje izpuščaji. Dejansko število izpuščajev je redko večje od 30 (razpon 18–28; Jensen idr., 2001). Prevladujoči izpuščaji (v smislu števila) so prisotni kot posamezne, razmeroma okrogle strukture, katerih višina je približno enaka polmeru. Večina razmnoževalno aktivnih samcev ima tudi vsaj nekaj izpuščajev, ki so večji in izraziti, da jih ni mogoče razlikovati kot posamezne strukture.
Nekatere vrste kemikalij, ki povzročajo endokrine motnje, lahko povzročijo nenormalen pojav nekaterih sekundarnih spolnih značilnosti pri nasprotnem spolu; agonisti androgenih receptorjev, kot je 17β-metiltestosteron ali 17β-trenbolon, lahko pri samicah črnoglavega pisanca povzročijo razvoj drstnih izpuščajev (Smith 1974; Ankley idr., 2001; 2003), medtem ko lahko agonisti estrogenih receptorjev zmanjšajo število ali velikost drstnih izpuščajev pri samcih (Miles-Richardson idr. 1999; Harries idr. 2000).
V nadaljevanju je naveden opis opredelitve drstnih izpuščajev pri črnoglavem pisancu na podlagi postopkov, uporabljenih v laboratoriju Agencije za varstvo okolja ZDA (U. S. Environmental Protection Agency) v Duluthu, Minnesota. Specifični izdelki in/ali oprema se lahko nadomestijo s primerljivimi materiali, ki so na voljo.
Opazovanje je najboljše z uporabo osvetljenega povečevalnega stekla ali trikratno osvetljenega stereomikroskopa. Ribe se opazujejo dorzalno in anteriorno naprej (glava proti opazovalcu).
|
(a)
|
Ribe se postavijo v majhno petrijevko (npr. s premerom 100 mm) anteriorno naprej in ventralno navzdol. Iskalo se usmeri tako, da se omogoči identifikacija izpuščajev. Za identifikacijo območij z izpuščaji se riba nežno in počasi obrne z ene strani na drugo. Izpuščaji se preštejejo in ocenijo.
|
|
(b)
|
Opazovanje se ponovi na ventralni površini glave, tako da se riba v petrijevko postavi dorzalno anteriorno naprej.
|
|
(c)
|
Opazovanje posamezne ribe je treba zaključiti v 2 minutah.
|
Štetje in ocenjevanje izpuščajev
Za ocenjevanje prisotnosti in razvoja izpuščajev pri odraslih črnoglavih pisancih je bilo identificiranih šest posebnih območij. Za določitev lokacije in količine prisotnih izpuščajev je bila pripravljena predloga (glej konec tega Dodatka). Število izpuščajev se zabeleži, njihova velikost pa se lahko za vsak organizem kvantitativno razvrsti kot sledi: 0 – odsoten, 1 – prisoten, 2 – povečan in 3 – izrazit (slika 1).
Ocena 0 – odsotnost izpuščajev. Ocena 1 – prisoten, ta ocena se opredeli kot vsak izpuščaj z eno točko, v kateri je višina skoraj enaka polmeru (premeru). Ocena 2 – povečan, ta ocena se opredeli s tkivom, ki je po videzu podobno zvezdici in ima običajno veliko zvezdasto osnovo z brazdami ali gubami, ki izhajajo in središča. Izpuščaj je v višino pogosto bolj žagast, vendar je lahko občasno nekoliko zaokrožen. Ocena 3 – izrazit, ta ocena običajno pomeni razmeroma velik in zaokrožen izpuščaj z manj definirano strukturo. Ti izpuščaji se občasno nahajajo skupaj in tvorijo eno maso skupaj s posameznimi območji (B, C in D, opisana v nadaljevanju) ali njihovo kombinacijo. Obarvanost in oblika sta podobna oceni 2, vendar sta občasno razmeroma neselektivna. S tem ocenjevalnim sistemom je skupna ocena izpuščajev običajno < 50 pri normalnih kontrolnih samcih s številom izpuščajev od 18 do 20 (Jensen idr., 2001).
Slika 1

Dejansko število izpuščajev pri nekaterih ribah je lahko večje od polj v predlogi (Dodatek A) za določeno območje ocenjevanja. V tem primeru se lahko označijo dodatne ocene, in sicer desno ali levo od polja. Zato ni treba, da je predloga simetrična. Dodatna tehnika označevanja izpuščajev, ki so v parih ali združeni navpično ob vodoravni ravnini ust, se lahko izvede z označevanjem dveh ocen izpuščajev v enem polju.
Območja označevanja:
A– izpuščaji okoli oči. Označeni dorzalno do ventralno okoli anteriornega očesnega obroča. Pri odraslih kontrolnih samcih jih je pogosto več, pri kontrolnih samicah jih ni, na splošno so v parih (en blizu vsakega očesa) ali sami pri samicah, izpostavljenih androgenom.
B– izpuščaji med nosnicama (pore senzornega kanala). Pri kontrolnih samcih so običajno v parih in v razvitejših fazah (2 – povečani ali 3 – izraziti). Niso prisotni pri kontrolnih samicah, pri čemer se pojavljajo in razvijajo pri samicah, izpostavljenih androgenom.
C– izpuščaji neposredno anteriorno na nosni odprtini, vzporedno z usti. Pri odraslih kontrolnih samcih so običajno povečani ali izraziti. Pri manj razvitih samcih ali samicah, tretiranih z androgenom, so prisotni ali povečani.
D– izpuščaji vzporedno z ustno linijo. Pri kontrolnih samcih so običajno ocenjeni kot razviti. Pri kontrolnih samicah niso prisotni, vendar so prisotni pri samicah, izpostavljenih androgenom.
E– izpuščaji na spodnji čeljusti, blizu ust, so običajno majhni in pogosto v parih. Pri kontrolnih ali tretiranih samcih in tretiranih samicah se razlikujejo.
F– izpuščaji ventralno na E. Pogosto so majhni in v parih. Prisotni so pri kontrolnih samcih in samicah, izpostavljenih androgenom.
VIRI
|
(1)
|
Ankley, G. T., Jensen, K. M., Kahl, M. D., Korte, J. J., Makynen, M. E. 2001. Description and evaluation of a short-term reproduction test with the fathead minnow (Pimephales promelas). Environ Toxicol Chem 20: 1276–1290.
|
|
(2)
|
Ankley, G. T., Jensen, K. M., Makynen, E. A., Kahl, M. D., Korte, J. J., Hornung, M. W., Henry, T. R., Denny, J. S., Leino, R. L., Wilson, V. S., Cardon, M. C., Hartig, P. C., Gray, E. L. 2003. Effects of the androgenic growth promoter 17-β trenbolone on fecundity and reproductive endocrinology of the fathead minnow. Environ Toxicol Chem 22: 1350–1360.
|
|
(3)
|
Harries, J. E., Runnalls, T., Hill, E., Harris, C. A., Maddix, S., Sumpter, J. P., Tyler, C. R. 2000. Development of a reproductive performance test for endocrine disrupting chemicals using pair-breeding fathead minnows (Pimephales promelas). Environ Sci Technol 34: 3003–3011.
|
|
(4)
|
Jensen, K. M., Korte, J. J., Kahl, M. D., Pasha, M. S., Ankley, G. T. 2001. Aspects of basic reproductive biology and endocrinology in the fathead minnow (Pimephales promelas). Comp Biochem Physiol C 128: 127–141.
|
|
(5)
|
Kahl, M. D., Jensen, K. M., Korte, J. J., Ankley, G. T. 2001. Effects of handling on endocrinology and reproductive performance of the fathead minnow. J Fish Biol 59: 515–523.
|
|
(6)
|
Miles-Richardson, S.R., Kramer, V. J., Fitzgerald, S. D., Render, J. A., Yamini, B., Barbee, S. J., Giesy, J. P. 1999. Effects of waterborne exposure of 17-estradiol on secondary sex characteristics and gonads of fathead minnows (Pimephales promelas). Aquat Toxicol 47: 129–145.
|
|
(7)
|
Smith, R. J. F. 1974. Effects of 17-methyltestosterone on the dorsal pad and tubercles of fathead minnows (Pimephales promelas). Can J Zool 52: 1031–1038.
|
|
Predloga za izpuščaje
|
Številska ocena
|
|
ID
|
1 – prisoten
|
|
Datum
|
2 – povečan
|
|
Skupna ocena
|
3 – izrazit
|
|
|
C
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
|
|
D
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
Dodatek 5B
Ocena sekundarnih spolnih značilnosti pri medaki za zaznavanje nekaterih kemikalij z endokrinim delovanjem
V nadaljevanju je naveden opis bradavičastih podaljškov (21), ki so sekundarna spolna značilnost pri medaki (Oryzias latipes).
|
(1)
|
Po odstranitvi jeter (Dodatek 6) se telo postavi v koničasto epruveto, ki vsebuje približno 10 ml 10-odstotnega nevtralno pufranega formalina (glava navzgor in rep navzdol). Če so spolne žleze fiksirane v raztopini, ki ni 10-odstotni nevtralno pufran formalin, se z rezilom naredi prečni rez čez telo med anteriornim območjem predrepne plavuti in anusom, pri čemer je treba paziti, da se ne poškodujejo gonopora in same spolne žleze (slika 3). Kranialna stran telesa ribe se vstavi v raztopino fiksativa, da se ohranijo spolne žleze, repna stran telesa ribe pa se vstavi v 10-odstotni nevtralno pufran formalin, kot je opisano zgoraj.
|
|
(2)
|
Ko se telo ribe vstavi v 10-odstotni nevtralno pufran formalin, se anteriorno območje predrepne plavuti prime s pinceto in za približno 30 sekund prepogne, da je predrepna plavut odprta. Pri prijemu predrepne plavuti s pinceto se nekaj plavutnic v anteriornem območju previdno prime, da se bradavičasti podaljški ne opraskajo.
|
|
(3)
|
Ko je predrepna plavut približno 30 sekund odprta, se telo ribe shrani v 10-odstotnem nevtralno pufranem formalinu pri sobni temperaturi do meritve bradavičastih podaljškov (meritev je treba izvesti po vsaj 24-urni fiksaciji).
|
Merjenje
|
(1)
|
Po vsaj 24-urni fiksaciji telesa ribe v 10-odstotnem nevtralnem pufranem formalinu se telo ribe vzame iz koničaste epruvete in formalin obriše s filtrirnim papirjem (ali papirnato brisačo).
|
|
(2)
|
Riba se obrne s trebušno stranjo navzgor. Nato se predrepna plavut previdno odreže z majhnimi secirnimi škarjami (predrepna plavut se po možnosti odreže z nekaj radiji (pterygiophore).
|
|
(3)
|
Anteriorni del odrezane predrepne plavuti se prime s pinceto in položi na objektno stekelce z nekaj kapljicami vode. Nato se predrepna plavut prekrije s krovnim stekelcem. Med prijemanjem predrepne plavuti s pinceto je treba paziti, da se bradavičasti podaljški ne opraskajo.
|
|
(4)
|
S števcem se pod biološkim mikroskopom (pokončni mikroskop ali obrnjeni mikroskop) prešteje število ploščic z bradavičastimi podaljški. Bradavičasti podaljški se prepoznajo, če je na posteriornem robu ploščice vidna majhna tvorba podaljškov. Na delovni list se zapiše število ploščic z bradavičastimi podaljški na vsaki plavutnici (npr. prva plavutnica: 0, druga plavutnica: 10, tretja plavutnica: 12 itd.), vsota teh števil po posameznih ribah pa se vnese v Excelovo preglednico. Po potrebi se predrepna plavut fotografira in na fotografiji prešteje število ploščic z bradavičastimi podaljški.
|
|
(5)
|
Po meritvi se predrepna plavut vstavi v koničasto epruveto, opisano v (1), in shrani.
|
Slika 1
Diagram, na katerem so prikazane razlike v obliki in velikosti predrepne plavuti glede na spol. A, samec; B, samica. Oka, T. B., 1931. On the processes on the fin rays of the male of Oryzias latipes and other sex characters of this fish. J. Fac. Sci., Tokyo Univ., IV, 2: 209–218.

Slika 2
A, podaljški na ploščicah predrepne plavutnice. J.P., ploščica; A.S., aksialni prostor; P., proces. B, distalna okončina plavutnice. Actinotrichia (Act.) so na vrhu. Oka, T. B., 1931. On the processes on the fin rays of the male of Oryzias latipes and other sex characters of this fish. J. Fac. Sci., Tokyo Univ., IV, 2: 209–218.

Slika 3
Fotografija telesa ribe, na kateri je prikazana stran reza, če so spolne žleze fiksirane v raztopini za fiksiranje, ki ni 10-odstotni nevtralno pufran formalin. V tem primeru se preostalo telo z rezilom (rdeča) prereže med anteriornim delom predrepne plavuti in anusom, sprednji del ribe se vstavi v raztopino za fiksiranje spolnih žlez, zadnji del ribe pa se vstavi v 10-odstotni nevtralno pufran formalin.
Dodatek 6
Priporočeni postopki odvzema vzorcev za analizo vitelogenina
Preprečiti je treba navzkrižno onesnaženje med vzorci VTG samcev in samic.
Postopek 1A: Črnoglavi pisanec, odvzem krvi iz repne vene/arterije
Po anesteziji se repno steblo delno prereže z rezilom skalpela, pri čemer se kri odvzame iz repne vene/arterije s heparinizirano mikrohematokritsko kapilarno cevko. Ko je kri odvzeta, se plazma hitro izolira s 3-minutnim centrifugiranjem pri 15 000 g (ali namesto tega 10 minut pri 15 000 g in 4 °C). Po želji se lahko po centrifugiranju določi odstotek hematokrita. Delež plazme se nato odstrani iz mikrohematokritske cevke in shrani v centrifugirki z 0,13 enotami aprotinina (inhibitor protaze) pri – 80 °C, dokler ni mogoče določiti vitelogenina. Odvzete količine plazme so običajno od 5 do 60 mikrolitrov na ribo, odvisno od velikost črnoglavega pisanca (ki je odvisna od spola) (Jensen idr., 2001).
Postopek 1B: Črnoglavi pisanec, odvzem krvi iz srca
Namesto tega se lahko kri odvzame tudi s srčno punkcijo s heparinizirano brizgo (1 000 enot heparina na ml). Kri se prenese v mikroepruvete (shranjene na ledu) in nato centrifugira (5 minut, 7 000 g, sobna temperatura). Plazmo je treba prenesti v čiste mikroepruvete (v alikvotih, če količina plazme to omogoča) in takoj zamrzniti pri – 80 °C, dokler se ne analizira (Panter idr., 1998).
Postopek 2A: Japonska medaka, odstranitev jeter pri medaki
Odstranitev preskusne ribe iz preskusne komore
|
(1)
|
Preskusno ribo je treba iz preskusne komore odstraniti z lovilno mrežico. Paziti je treba, da preskusna riba ne pade v druge preskusne komore.
|
|
(2)
|
Načeloma je treba preskusne ribe odstraniti po naslednjem vrstnem redu: kontrola, kontrola s topilom (če je primerno), najnižja koncentracija, srednja koncentracija, najvišja koncentracija in pozitivna kontrola. Poleg tega je treba odstraniti vse samce iz ene preskusne komore, preden se odstranijo preostale samice.
|
|
(3)
|
Spol posamezne preskusne ribe se določi na podlagi zunanjih spolnih značilnosti (npr. oblike predrepne plavuti).
|
|
(4)
|
Preskusna riba se vstavi v posodo za prenos in prenese na delovno postajo za odstranitev jeter. Preveri se, ali so oznake preskusne komore in posode za prenos točne ter potrdi, da sta število rib, ki so bile odstranjene iz preskusne komore, in število rib, ki ostanejo v preskusni komori, skladni s pričakovanji.
|
|
(5)
|
Če spola ni mogoče določiti na podlagi zunanjega videza rib, se odstranijo vse ribe iz preskusne komore. V tem primeru je treba spol določiti z opazovanjem spolnih žlez ali sekundarnih spolnih značilnosti pod stereomikroskopom.
|
Odstranitev jeter
|
(1)
|
Preskusna riba se iz posode za prenos prenese v raztopino za anestezijo z lovilno mrežico.
|
|
(2)
|
Ko je preskusna riba anestezirana, se prenese na filtrirni papir (ali papirnato brisačo) s pinceto (za splošno rabo). S pinceto se prime glava preskusne ribe, da se prepreči poškodba repa.
|
|
(3)
|
S površine preskusne ribe na filtrirnem papirju (ali papirnati brisači) se obriše voda.
|
|
(4)
|
Riba se obrne s trebušno stranjo navzgor. Nato se z majhnimi secirnimi škarjami naredi majhen prečni rez na sredini med ventralnim delom vratu in srednjim trebušnim delom.
|
|
(5)
|
V majhen rez se vstavijo secirne škarje, s katerimi se zareže v trebuh od točke pod škržnim plaščem do kranialne strani anusa po sredini trebuha. Paziti je treba, da se secirne škarje ne vstavijo pregloboko, s čimer se prepreči poškodba jeter in spolnih žlez.
|
|
(6)
|
Pod stereomikroskopom se izvedejo naslednji postopki.
|
|
(7)
|
Preskusna riba se s trebušno stranjo navzgor postavi na papirnato brisačo (na voljo je tudi petrijevka ali objektno stekelce).
|
|
(8)
|
Stene trebušne votline se razprejo z natančno pinceto, notranji organi pa se eksteriorizirajo. Po potrebi je sprejemljiva tudi eksteriorizacija notranjih organov z odstranitvijo ene strani stene trebušne votline.
|
|
(9)
|
Z drugo natančno pinceto se izpostavijo jetra in žolčnik. Nato se prime žolčni vod in odreže žolčnik. Paziti je treba, da se žolčnik ne poškoduje.
|
|
(10)
|
Na enak način se prime požiralnik in odstrani prebavni trakt. Paziti je treba, da iz prebavnega trakta ne uide vsebina. Odstranita se repni prebavni trakt iz anusa in trakt iz trebušne votline.
|
|
(11)
|
Z obrobja jeter se odrežeta masa maščobe in drugo tkivo. Paziti je treba, da se jetra ne opraskajo.
|
|
(12)
|
Z natančno pinceto se prime jetrno portalno polje, jetra pa se odstranijo iz trebušne votline.
|
|
(13)
|
Jetra se položijo na objektno stekelce. Po potrebi se s površine jeter z natančno pinceto odstranita vsa dodatna maščoba in nepomembno tkivo (npr. notranja plast trebušne votline).
|
|
(14)
|
Teža jeter se izmeri s tarirano 1,5-mililitrsko mikroepruveto z uporabo elektronske analitske tehtnice. Vrednost se zabeleži na delovnem listu (odčitek: 0,1 mg). Potrdijo se identifikacijski podatki na nalepki mikroepruvete.
|
|
(15)
|
Pokrov mikroepruvete z jetri se zapre. Shrani se na rešetki za hlajenje (ali rešetki za zamrzovanje).
|
|
(16)
|
Po odstranitvi enih jeter se instrumenti za seciranje očistijo ali nadomestijo s čistimi.
|
|
(17)
|
Jetra se iz vseh rib v posodi za prenos odstranijo, kot je opisano zgoraj.
|
|
(18)
|
Ko se odstranijo jetra iz vseh rib v posodi za prenos (tj. vseh samcev ali samic v preskusni komori), se vsi vzorci jeter postavijo na rešetko za epruvete z identifikacijsko nalepko in shranijo v zamrzovalniku. Če se jetra donirajo za predhodno tretiranje kmalu po odstranitvi, se vzorci prenesejo na naslednjo delovno postajo na rešetki za hlajenje (ali rešetki za zamrzovanje).
|
Po odstranitvi jeter je telo ribe na voljo za meritev sekundarnih spolnih značilnosti.
Vzorec
Vzorci jeter, odvzeti pri preskusnih ribah, se shranijo pri ≤ –70 °C, če se ne uporabijo za predhodno tretiranje kmalu po odstranitvi.
Slika 1
Rez se s škarjami naredi neposredno anteriorno na prsno plavut.

Slika 2
V srednjo črto trebuha se s škarjami zareže do točke, ki se nahaja približno 2 mm kranialno na anus.

Slika 3
Trebušne stene se razširijo s prijemalkami, da se izpostavijo jetra in drugi notranji organi. (Namesto tega se lahko trebušne stene pripnejo s strani.)
Slika 4
Jetra se neposredno secirajo in odstranijo s prijemalkami.

Slika 5
Črevesje se s prijemalkami nežno umakne.

Slika 6
Oba konca črevesja in vse pritrditve mezenterija se odrežejo s škarjami.
Slika 7 (samica)
Postopek je enak za samico.
Slika 8
Končan postopek.
Postopek 2B: Japonska medaka (Oryzias latipes), predhodno tretiranje jeter za analizo vitelogenina
Iz kompleta za metodo ELISA se vzame steklenica pufra za homogenat in ohladi z zdrobljenim ledom (temperatura raztopine: ≤ 4 °C). Če se uporabi pufer za homogenat iz sistema EnBio ELISA, se raztopina odtaja pri sobni temperaturi, nato pa se steklenica ohladi z zdrobljenim ledom.
Količina pufra za homogenat za jetra se izračuna na podlagi njihove teže (za homogenat se na miligram teže jeter doda 50 μl homogenata). Če jetra tehtajo na primer 4,5 mg, je količina pufra za homogenat za jetra 225 μl. Za vsa jetra se pripravi seznam količin pufra za homogenat.
Priprava jeter za predhodno tretiranje
|
(1)
|
Neposredno pred predhodnim tretiranjem se iz zamrzovalnika vzame 1,5-mililitrska mikroepruveta z jetri.
|
|
(2)
|
Jetra samcev je treba predhodno tretirati pred jetri samic, da se prepreči onesnaženje vitelogenina. Poleg tega je treba preskusne skupine predhodno tretirati po naslednjem vrstnem redu: kontrola, kontrola s topilom (če je primerno), najnižja koncentracija, srednja koncentracija, najvišja koncentracija in pozitivna kontrola.
|
|
(3)
|
Število 1,5-mililitrskih mikroepruvet z vzorci jeter, vzetih iz zamrzovalnika ob danem času, ne sme presegati števila, ki se lahko hkrati centrifugira.
|
|
(4)
|
Na rešetki za zamrzovanje se 1,5-mililitrske mikroepruvete z vzorci jeter razporedijo glede na številko vzorca (jeter ni treba odtajati).
|
Izvedba predhodnega tretiranja
1. Dodajanje homogenizacijskega pufra
|
(1)
|
Na seznamu se preveri količina pufra za homogenat, ki ga je treba uporabiti za posamezen vzorec jeter, mikropipeta pa se nastavi (razpon količine: 100–1 000 μl) na ustrezno količino. Na mikropipeto se namesti čista konica.
|
|
(2)
|
Pufer za homogenat se vzame iz steklenice za reagent in doda v 1,5-mililitrsko mikroepruveto z jetri.
|
|
(3)
|
Pufer za homogenat se v skladu z zgoraj opisanim postopkom doda v vse 1,5-mililitrske mikroepruvete z jetri. Konice mikropipete ni treba zamenjati z novo. Če je konica onesnažena ali bi lahko bila onesnažena, jo je treba zamenjati.
|
2. Homogenizacija jeter
|
(1)
|
Na homogenizator mikroepruvete se namesti novo pestilo.
|
|
(2)
|
Pestilo se vstavi v 1,5-mililitrsko mikroepruveto. Homogenizator mikroepruvete se drži tako, da stisne jetra med površino pestila in notranjo steno 1,5-mililitrske mikroepruvete.
|
|
(3)
|
Homogenizator mikroepruvete mora delovati od 10 do 20 sekund. Med delovanjem se 1,5-mililitrska mikroepruveta ohlaja z zdrobljenim ledom.
|
|
(4)
|
Pestilo se dvigne iz 1,5-mililitrske mikroepruvete in približno 10 sekund pusti počivati. Nato se izvede vizualni pregled stanja suspenzije.
|
|
(5)
|
Če se v suspenziji opazijo deli jeter, se ponovita koraka (3) in (4), da se pripravi zadovoljiv homogenat jeter.
|
|
(6)
|
Suspendirani homogenat jeter se do centrifugiranja hladi na rešetki za zamrzovanje.
|
|
(7)
|
Za vsak homogenat se pestilo zamenja z novim.
|
|
(8)
|
Vsa jetra se homogenizirajo s pufrom za homogenat v skladu z zgoraj opisanim postopkom.
|
3. Centrifugiranje suspendiranega homogenata jeter
|
(1)
|
Temperatura ohlajene komore za centrifugiranje se potrdi pri ≤ 5 °C.
|
|
(2)
|
V ohlajeno centrifugo se vstavijo 1,5-mililitrske mikroepruvete s suspendiranim homogenatom jeter (po potrebi se prilagodi ravnotežje).
|
|
(3)
|
Suspendirani homogenat jeter se 10 minut centrifugira pri 13 000 g in ≤ 5 °C. Če pa so supernatanti ustrezno ločeni, se lahko sila in čas centrifugiranja po potrebi prilagodita.
|
|
(4)
|
Po centrifugiranju se preveri, ali so supernatanti ustrezno ločeni (vrhnja plast: lipid, srednja plast: supernatant, spodnja plast: jetrno tkivo). Če ločitev ni ustrezna, se suspenzija ponovno centrifugira v enakih pogojih.
|
|
(5)
|
Vsi vzorci se odstranijo iz ohlajene centrifuge in na rešetki za zamrzovanje razvrstijo po številki vzorca. Paziti je treba, da se ločene plasti po centrifugiranju ne suspendirajo ponovno.
|
4. Odvzemanje supernatanta
|
(1)
|
Štiri 0,5-mililitrske mikroepruvete se za shranjevanje supernatanta položijo na rešetko za epruvete.
|
|
(2)
|
Z mikropipeto se odvzame 30 μl vsakega supernatanta (ločenega kot srednja plast) in prenese v eno 0,5-mililitrsko mikroepruveto. Paziti je treba, da se ne odvzame lipid z vrhnje plasti ali jetrno tkivo s spodnje plasti.
|
|
(3)
|
Supernatant se odvzame in prenese v dve drugi 0,5-mililitrski mikroepruveti na enak način, kot je opisano zgoraj.
|
|
(4)
|
Z mikropipeto se odvzame preostali supernatant (če je mogoče: ≥ 100 μl). Nato se supernatant prenese v preostali 0,5-mililitrski mikroepruveti. Paziti je treba, da se ne odvzame lipid z vrhnje plasti ali jetrno tkivo s spodnje plasti.
|
|
(5)
|
Pokrov 0,5-mililitrske mikroepruvete se zapre in na nalepko zapiše količina supernatanta. Takoj zatem se mikroepruvete ohladijo na rešetki za zamrzovanje.
|
|
(6)
|
Za vsak supernatant se konica mikropipete zamenja z novo. Če se na konico prime veliko lipida, se takoj zamenja z novo, da se prepreči onesnaženje ekstrakta jeter z maščobo.
|
|
(7)
|
Ves centrifugirani supernatant se prenese v štiri 0,5-mililitrske mikroepruvete v skladu z zgoraj opisanim postopkom.
|
|
(8)
|
Ko se supernatant prenese v 0,5-mililitrske mikroepruvete, se te postavijo na rešetko za epruvete z identifikacijskimi nalepkami in takoj nato zamrznejo v zamrzovalniku. Če se koncentracije VTG merijo takoj po predhodnem tretiranju, se ena 0,5-mililitrska mikroepruveta (ki vsebuje 30 μl supernatanta) ohrani hladna na rešetki za epruvete in prenese na delovno postajo, kjer se izvaja preskus ELISA. V takem primeru se preostale mikroepruvete postavijo na rešetke za epruvete in zamrznejo v zamrzovalniku.
|
|
(9)
|
Po odvzemu supernatanta se ostanki primerno zavržejo.
|
Shranjevanje vzorca
Dokler se 0,5-mililitrske mikroperuvete s supernatantom homogenata jeter ne uporabijo za ELISA, se shranijo pri ≤ – 70 °C.
Postopek 3A: Cebrica, odvzem krvi iz repne vene/arterije
Takoj po anesteziji se repno steblo prečno prereže, pri čemer se kri iz repne arterije/vene odvzame s heparinizirano mikrohematokritsko kapilarno cevko. Količine krvi so v razponu od 5 do 15 μl in so odvisne od velikosti ribe. V mikrokapilarno cevko se doda enaka količina pufra aprotinina (6 μgml v PBS), plazma pa se od krvi loči s centrifugiranjem (5 minut pri 600 g). Plazma se zbere v preskusnih epruvetah in shrani pri – 20 °C, dokler se ne analizira glede vitelogenina ali drugih zadevnih beljakovin.
Postopek 3B: Cebrica, odvzem krvi s srčno punkcijo
Da se prepreči koagulacija krvi in razgradnja beljakovin, se vzorci odvzamejo v fosfatnem pufru s soljo (PBS), ki vsebuje heparin (1 000 enot/ml) in aprotinin, ki zavira proteazo (2 TIU/ml). Za sestavine pufra se priporočajo heparin, amonijeva sol in liofilizirani aprotinin. Za vzorčenje krvi se priporoča brizga (1 ml) s pritrjeno tanko iglo (npr. Braun Omnikan-F). Brizga mora biti predhodno napolnjena s pufrom (približno 100 μl), da se iz vseh rib v celoti eluirajo majhne količine krvi. Vzorci krvi se odvzamejo s srčno punkcijo. Najprej je treba ribe anestezirati z MS-222 (100 mg/l). Ustrezna stopnja anestezije uporabniku omogoča, da loči srčni utrip cebric. Med punkcijo srca naj bo bat brizge pod rahlo napetostjo. Odvzeta količina krvi je v razponu med 20 in 40 mikrolitri. Po srčni punkciji je treba zmes krvi/pufra prenesti v preskusno epruveto. Plazma se od krvi loči s centrifugiranjem (20 minut, 5 000 g) in jo je treba shraniti pri – 80 °C, dokler se ne potrebuje za analizo.
Postopek 3C Standardni delovni postopek: cebrica, homogenizacija glave in repa
|
(1)
|
Ribe se anestezirajo in evtanazirajo v skladu z opisom preskusa.
|
|
(2)
|
Glava in rep ribe se odrežeta v skladu s sliko 1.
|
Pomembno: med ravnanji s posameznimi ribami je treba vse instrumente za seciranje in rezalno desko sprati in ustrezno očistiti (npr. s 96-odstotnim etanolom), da se prepreči ‚vitelogeninsko onesnaženje‘ neinduciranih samcev zaradi samic ali induciranih samcev.
Slika 1

|
(3)
|
Teža zbranih glav in repov posameznih rib se izmeri na najbližji miligram.
|
|
(4)
|
Po tehtanju se deli vnesejo v ustrezne epruvete (npr. 1,5-mililitrske mikroepruvete) in zamrznejo pri – 80 °C do homogenizacije oz. dokler se neposredno ne homogenizirajo na ledu z dvema plastičnima pestiloma. (Druge metode se lahko uporabijo, če se izvajajo na ledu in zagotovijo homogeno maso.) Pomembno: epruvete je treba ustrezno oštevilčiti, da se lahko glava in rep ribe povežeta z ustreznim delom telesa, uporabljenim za histologijo spolnih žlez.
|
|
(5)
|
Ko dobimo homogeno maso, se ji doda 4-kratna teža tkiva ledeno mrzlega homogenizacijskega pufra (22). Delo s pestiloma je treba nadaljevati, dokler zmes ni homogena. Pomembno opozorilo: za vsako ribo se uporabita dve novi pestili.
|
|
(6)
|
Vzorci se postavijo na led do začetka centrifugiranja pri 4 °C in 50 000 × g za 30 minut.
|
|
(7)
|
S pipeto se supernatant odmeri na dele po 20 μl v vsaj dve epruveti, tako da se konica pipete potopi pod plast maščobe na površini in supernatant previdno izsesa brez delcev maščobe ali peletov.
|
|
(8)
|
Epruvete se do uporabe shranijo pri – 80 °C.
|
Dodatek 7
Obogateni vzorci vitelogenina in medpreskusni referenčni standard
Vsak dan izvedbe preskusov vitelogenina se analizira obogateni vzorec, pripravljen z medpreskusnim referenčnim standardom. Vitelogenin, uporabljen za pripravo medpreskusnega referenčnega standarda, je iz serije, ki se razlikuje od serije, uporabljene za pripravo kalibracijskih standardov za preskus, ki se izvaja.
Obogateni vzorec se pripravi z dodajanjem znane količine medpreskusnega standarda vzorcu plazme kontrolnih samcev. Vzorec se obogati, da se doseže koncentracija vitelogenina, ki je med 10- in 100-krat večja od pričakovane koncentracije vitelogenina pri kontrolnih ribjih samcih. Vzorec plazme kontrolnih samcev, ki se obogati, lahko izvira iz ene ribe ali pa je sestavljen iz več rib.
Podvzorec neobogatene plazme kontrolnih samcev se analizira v vsaj dveh ponovitvenih vdolbinicah. Tudi obogateni vzorec se analizira v vsaj dveh ponovitvenih vdolbinicah. Srednja količina vitelogenina v dveh neobogatenih vzorcih plazme kontrolnih samcev se doda izračunani količini vitelogenina, dodanega obogatenim vzorcem, da se določi pričakovana koncentracija. Razmerje med pričakovano koncentracijo in izmerjeno koncentracijo se sporoči skupaj z rezultati posameznih nizov preskusov, izvedenih isti dan.
Dodatek 8
Tabela poteka za statistično analizo

C.38 PRESKUS PREOBRAZBE DVOŽIVK
UVOD
|
1.
|
Ta preskusna metoda ustreza Smernici za preskušanje OECD (TG) 231 (2009). Preskus, s katerim se lahko zaznajo kemikalije, ki so aktivne v ščitničnem sistemu vretenčarjev, je treba razviti in validirati zaradi pomislekov, da bi lahko okoljske ravni kemikalij povzročile škodljive učinke za ljudi in prostoživeče živali. OECD se je leta 1998 začela ukvarjati s prednostno nalogo revidiranja obstoječih smernic za preskušanje ter priprave novih smernic za presejalne preskuse in preskušanje potencialnih povzročiteljev endokrinih motenj. Del naloge je bila priprava smernic za preskušanje za presejalno preskušanje kemikalij, ki so aktivne v ščitničnem sistemu vretenčarjev. Predlagana sta bila 28-dnevna študija oralne strupenosti s ponavljajočimi se odmerki na glodavcih (poglavje B.7 te priloge) in preskus preobrazbe dvoživk (AMA). Izboljšana preskusna metoda B.7 je prestala validacijo, objavljena pa je bila revidirana preskusna metoda. Preskus preobrazbe dvoživk (AMA) je prestal validacijski program, ki je vključeval laboratorijske in medlaboratorijske študije, s katerimi sta bili dokazani ustreznost in zanesljivost preskusa (1) (2). Nato je validacijo preskusa strokovno pregledala skupina neodvisnih strokovnjakov (3). Ta preskusna metoda je rezultat izkušenj, pridobljenih med validacijskimi študijami za zaznavo kemikalij, ki vplivajo na ščitnico, in dela, opravljenega v državah članicah OECD.
|
NAČELO PRESKUSA
|
2.
|
Preskus preobrazbe dvoživk (AMA) je presejalni preskus za empirično identifikacijo kemikalij, ki bi lahko vplivale na normalno funkcijo osi hipotalamus – hipofiza – ščitnica (HPT). AMA predstavlja posplošen model vretenčarja, saj temelji na ohranjenih strukturah in funkcijah osi HPT. Gre za pomemben preskus, ker je preobrazba dvoživk dobro proučen proces, odvisen od ščitnice, ki se odziva na kemikalije, aktivne v osi HPT, in je edini obstoječi preskus, s katerim se lahko zazna aktivnost ščitnice v živali, ki se morfološko razvija.
|
|
3.
|
Splošni načrt poskusa zajema 21-dnevno izpostavljenost paglavcev Xenopus laevis v 51. fazi najmanj trem različnim koncentracijam preskusne kemikalije in kontroli z vodo za redčenje. Vsak preskusni tretirani vzorec ima štiri ponovitve. Gostota ličink na začetku preskusa je 20 paglavcev na preskusno posodo v vsaki tretirani skupini. Opazovane končne točke so dolžina zadnjega kraka, dolžina od ust do zadnjične odprtine (SVL), razvojna faza, mokra teža, histologija ščitnice in dnevna opazovanja smrtnosti.
|
OPIS METODE
Preskusna vrsta
|
4.
|
Xenopus laevis se rutinsko goji v laboratorijih po vsem svetu in se lahko enostavno pridobi prek komercialnih dobaviteljev. Razmnoževanje se lahko pri tej vrsti skozi celo leto enostavno doseže z uporabo injekcij humanega horionskega gonadotropina (HCG), pri čemer se lahko nastale ličinke v velikem številu rutinsko gojijo do izbranih razvojnih faz, zaradi česar je mogoča uporaba protokolov preskusa, specifičnih za razvojno fazo. Za uporabo v preskusu so primernejše ličinke odraslih osebkov iz laboratorija. Čeprav to ni prednostni postopek, se lahko namesto tega jajčeca ali embrii pošljejo v laboratorij, ki izvaja preskus, in aklimatizirajo; pošiljanje v stadiju ličink za uporabo v preskusu ni sprejemljivo.
|
Oprema in potrebščine
|
5.
|
Za izvedbo tega preskusa so potrebne naslednja oprema in potrebščine:
|
a)
|
sistem za izpostavljanje (glej opis v nadaljevanju);
|
|
b)
|
akvarij iz stekla ali nerjavnega jekla (glej opis v nadaljevanju);
|
|
d)
|
naprave za nadzor temperature (npr. grelniki ali hladilniki (prilagodljivi do 22 °C ± 1 °C));
|
|
f)
|
binokularni stereomikroskop;
|
|
g)
|
digitalni fotoaparat z ločljivostjo vsaj 4 milijone slikovnih točk in funkcijo mikro;
|
|
h)
|
programska oprema za digitalizacijo slik;
|
|
i)
|
petrijevka (npr. 100 × 15 mm) ali prosojna plastična posodica primerljive velikosti;
|
|
j)
|
analitska tehtnica, s katero je mogoče meriti na 3 decimalna mesta natančno (mg);
|
|
k)
|
merilnik raztopljenega kisika;
|
|
l)
|
merilnik vrednosti pH;
|
|
m)
|
merilnik jakosti svetlobe, s katerim je mogoče meriti v luksih;
|
|
n)
|
različna laboratorijska steklena posoda in pripomočki;
|
|
o)
|
prilagodljive pipete (10 do 5 000 μl) ali različne pipete ustreznih velikosti;
|
|
p)
|
preskusna kemikalija v zadostnih količinah za izvedbo študije, po možnosti iz ene serije;
|
|
q)
|
analitski instrumenti, primerni za preskušano kemikalijo, ali pogodbene analitske storitve.
|
|
Kemijska preverljivost
|
6.
|
AMA temelji na protokolu vodne izpostavljenosti, pri katerem se preskusna kemikalija uvaja v preskusne komore prek pretočnega sistema. Vendar pretočne metode omejujejo vrste kemikalij, ki se lahko preskusijo, kot določajo fizikalno-kemijske lastnosti kemikalije. Zato je treba pred uporabo tega protokola pridobiti osnovne informacije o kemikaliji, ki so pomembne za določitev preverljivosti, pri čemer je treba upoštevati Smernico OECD za preskušanje strupenosti zahtevnih snovi in zmesi v vodnem okolju (4). Značilnosti, ki kažejo, da bi lahko bilo kemikalijo težko preskusiti v vodnih sistemih, vključujejo: visok porazdelitveni koeficient oktanol/voda (log Kow), visoko hlapnost, občutljivost za hidrolizo in občutljivost za fotolizo v laboratorijskih svetlobnih pogojih. Za določanje preverljivosti so lahko pomembni tudi drugi dejavniki, ki jih je treba določiti na podlagi posameznega primera. Če ni mogoč uspešen preskus kemikalije z uporabo pretočnega preskusnega sistema, se lahko uporabi sistem s statičnim obnavljanjem. Če noben sistem ne more sprejeti preskusne kemikalije, se ne preskuša z uporabo tega protokola.
|
Sistem izpostavljenosti
|
7.
|
Kadar je mogoče, ima pretočni sistem za redčenje prednost pred sistemom s statičnim obnavljanjem. Če fizikalnih in/ali kemijskih lastnosti katere koli preskusne kemikalije ni mogoče podrediti pretočnemu sistemu za redčenje, se lahko uporabi nadomestni sistem izpostavljenosti (npr. s statičnim obnavljanjem). Sestavni deli sistema, ki pridejo v stik z vodo, morajo biti iz stekla, nerjavnega jekla in/ali politetrafluoroetilena. Vendar se lahko uporabi tudi ustrezna plastika, če ne vpliva na študijo. Posode za izpostavljanje morajo biti akvariji iz stekla ali nerjavnega jekla, opremljeni z dvižnimi cevmi, pri čemer mora biti približna prostornina posode med 4,0 in 10,0 l, najmanjša globina vode pa med 10 do 15 cm. Sistem mora podpirati vse koncentracije izpostavljenosti in kontrolo s štirimi ponovitvami na tretiranje. Pretok v posamezni posodi mora biti konstanten zaradi vzdrževanja bioloških pogojev in izpostavljenosti kemikaliji (npr. 25 ml/min). Tretirane posode je treba naključno dodeliti na položaj v sistemu izpostavljenosti, da se zmanjšajo potencialni učinki zaradi položaja, vključno z majhnimi razlikami v temperaturi, jakosti svetlobe itd. Fluorescenčno osvetlitev je treba uporabiti za zagotovitev obdobja osvetljenosti 12 ur svetlobe: 12 ur teme pri jakosti od 600 do 2 000 luksov (lumnov/m2) na vodni gladini. Temperaturo vode je treba vzdrževati pri 22 °C ± 1 °C, pH med 6,5 in 8,5, koncentracijo raztopljenega kisika (DO) pa > 3,5 mg/l (> 40 % nasičenosti z zrakom) v posamezni preskusni posodi. Najnižjo temperaturo vode, pH in koncentracijo raztopljenega kisika je treba meriti vsak teden; temperaturo je po možnosti treba stalno meriti v vsaj eni preskusni posodi. V Dodatku 1 so opisani poskusni pogoji, v katerih je treba izvesti protokol. Za več informacij o vzpostavitvi pretočnega sistema izpostavljenosti in/ali sistemov s statičnim obnavljanjem glej Standardne smernice ASTM za izvajanje preskusov akutne strupenosti na preskusnih materialih z ribami, velikimi vretenčarji in dvoživkami (5) ter splošne preskuse vodne toksikologije.
|
Kakovost vode
|
8.
|
Uporabi se lahko vsaka lokalno razpoložljiva voda (npr. izvirska voda ali vodovodna voda, prečiščena z ogljem), ki omogoča normalno rast in razvoj paglavcev X. laevis. Ker se lahko kakovost lokalne vode med posameznimi območji bistveno razlikuje, je treba izvesti analizo kakovosti vode, zlasti če niso na voljo historični podatki o uporabi vode za gojenje Xenopus. Posebno pozornost je treba nameniti zlasti zagotavljanju, da v vodi ni bakra, klora in kloraminov, ki so strupeni za žabe in paglavce. Priporoča se tudi analiza ravni naravnega ozadja fluorida, perklorata in klorata (stranski produkti dezinfekcije pitne vode) v vodi, ker so vsi ti anioni substrati prenašalca joda v ščitnični žlezi, pri čemer lahko višje ravni posameznega aniona kot moteči dejavniki vplivajo na rezultat študije. Analizo je treba izvesti pred začetkom preskušanja, v preskusni vodi pa običajno ne sme biti teh anionov.
|
Koncentracija jodida v preskusni vodi
|
9.
|
Da lahko ščitnična žleza sintetizira ščitnični hormon, mora imeti ličinka na voljo dovolj jodida v vodi in hrani. Zdaj ni empiričnih smernic za najmanjše koncentracije jodida. Vendar lahko razpoložljivost jodida vpliva na odzivnost ščitničnega sistema na snovi, ki vplivajo na ščitnico, in spremeni bazalno aktivnost ščitnične žleze, tj. vidik, ki ga je treba upoštevati pri razlagi rezultatov histopatologije ščitnice. Zato je treba sporočiti izmerjene koncentracije jodida v preskusni vodi. Na podlagi razpoložljivih podatkov iz validacijskih študij je bilo dokazano, da je protokol uspešen, če so koncentracije jodida (I–) v preskusni vodi med 0,5 in 10 μg/l. Najprimernejša najmanjša koncentracija jodida v preskusni vodi mora biti 0,5 μg/l. Če je preskusna voda modelna razredčevalna voda iz deionizirane vode, je treba dodati najmanjšo koncentracija joda, tj. 0,5 μg/l. Vsako dodajanje jodovih ali drugih soli v vodo je treba navesti v poročilu.
|
Vzdrževanje živali
Oskrba odraslih osebkov in razmnoževanje
|
10.
|
Oskrba odraslih osebkov in razmnoževanje potekata v skladu s standardnimi smernicami, podrobnejše informacije pa so navedene v standardnih smernicah za izvajanje preskusa teratogeneze embriov žab (FETAX) (6). Take standardne smernice zagotavljajo primer ustreznih metod oskrbe in parjenja, vendar jih ni treba strogo upoštevati. Za začetek razmnoževanja se v pare (3–5) odraslih samic in samcev injicira humani horionski gonadotropin (HCG). V samice in samce se injicira približno 800 IU – 1 000 IU oz. 600 IU–800 IU HCG, raztopljenega v 0,6–0,9-odstotni solni raztopini. Pari, ki se razmnožujejo, so v velikih posodah, v okolju, ki jih ne ovira, in v statičnih pogojih, da se spodbuja ampleksus. Dno vsake posode za razmnoževanje mora imeti navidezno dno iz mreže iz nerjavnega jekla ali plastike, ki omogoča prehajanje jajčnih legel na dno posode. Žabe, ki so injicirane pozno popoldne, običajno odložijo večino jajčec do sredine naslednjega jutra. Ko je odloženih in oplojenih dovolj jajčec, je treba odrasle osebke odstraniti iz posod za razmnoževanje.
|
Oskrba in izbira ličink
|
11.
|
Ko so odrasli osebki odstranjeni iz posod za razmnoževanje, se jajčeca zberejo, pri čemer se njihova sposobnost preživetja oceni z reprezentativno podskupino embriov iz vseh posod za razmnoževanje. Najboljše posamezne mreste (za oceno kakovosti mrestov se priporočajo 2–3) je treba ohraniti na podlagi sposobnosti preživetja embriov in prisotnosti ustreznega števila (najmanj 1 500) embriov. Vsi organizmi, ki se uporabijo v študiji, morajo izhajati iz enega mresta (tj. mresti se ne smejo mešati). Embrii se prenesejo v veliko ploščato skodelico ali posodo, vsa očitno mrtva ali nenormalna jajčeca (glej opredelitev iz točke (5)) pa se odstranijo s pipeto ali kapalko. Zdravi embrii iz vsakega od treh mrestov se prenesejo v tri ločene posode za izvalitev. Štiri dni po namestitvi v posode za izvalitev se na podlagi sposobnosti preživetja in uspešne izvalitve izbere najboljši mrest, ličinke pa se prenesejo v ustrezno število posod za gojenje pri temperaturi 22 °C ± 1 °C. Poleg tega se v dodatne posode prenese nekaj dodatnih ličink, ki se bodo uporabile kot zamenjava v primeru smrti v posodah za gojenje v prvem tednu. S tem postopkom se ohranja stalna gostota organizmov, s čimer se zmanjša razvojna divergenca v kohorti enega mresta. Vse posode za gojenje je treba vsak dan očistiti z izčrpanjem. Kot previdnostni ukrep se namesto rokavic iz lateksa priporoča uporaba rokavic iz vinila ali nitrila. Poginule ličinke je treba vsakodnevno odstranjevati in dodajati nadomestne, da se ohranja gostota organizmov v prvem tednu. Hranjenje mora potekati vsaj dvakrat na dan.
|
|
12.
|
V fazi pred izpostavljenostjo se paglavci prilagodijo pogojem iz faze dejanske izpostavljenosti, vključno z vrsto hrane, temperaturo, ciklom svetlobe in teme ter gojiščem. Zato se priporoča, da se v fazi pred izpostavljenostjo in v fazi izpostavljenosti uporabi enaka voda za gojenje/redčenje. Če se za vzdrževanje paglavcev v fazi pred izpostavljenostjo uporablja statični gojitveni sistem, je treba gojišče zamenjati v celoti vsaj dvakrat na teden. Natrpanost, ki je posledica velike gostote ličink v obdobju pred izpostavljenostjo, je treba preprečiti, ker bi lahko pomembno vplivala na razvoj paglavcev v naslednji fazi preskušanja. Zato gostota gojenja ne sme presegati približno štirih paglavcev/l gojišča (statični sistem izpostavljenosti) oz. 10 paglavcev/l gojišča (npr. pri pretoku 50 ml/min v sistemu pred izpostavljenostjo ali gojitvenem sistemu). V teh pogojih se morajo paglavci v 12 dneh razviti od 45./46. faze do 51. faze. Pri reprezentativnih paglavcih iz populacije tega staleža je treba vsak dan pregledati razvojno fazo, da se oceni ustrezno časovno obdobje za začetek izpostavljenosti. Skrbno je treba čim bolj zmanjšati stres in travmo za paglavce, zlasti med seljenjem, čiščenjem akvarija in ravnanjem z ličinkami. Preprečiti je treba stresne razmere/dejavnosti, kot so glasen in nenehen hrup, trkanje po akvariju, tresljaji v akvariju, čezmerna dejavnost v laboratoriju in hitre spremembe v okolju (razpoložljivost svetlobe, temperatura, pH, raztopljeni kisik, pretok vode itd.). Če se paglavci v 17 dneh po oploditvi ne razvijejo do 51. faze, je treba kot potencialnega krivca obravnavati čezmeren stres.
|
Gojenje in hranjenje ličink
|
13.
|
Paglavce se v celotnem obdobju pred izpostavljenostjo (po Nieuwkoopovi in Faberjevi (NF) 45./46. fazi (8)) in v celotnem 21-dnevnem preskusnem obdobju hrani s t. i. komercialno krmo za paglavce, uporabljeno v validacijskih študijah (glej tudi Dodatek 1), ali z drugo hrano, ki dokazano omogoča enako uspešnost preskusa preobrazbe dvoživk. Način hranjenja v obdobju pred izpostavljenostjo je treba skrbno prilagoditi, da se izpolnijo potrebe razvijajočih se paglavcev. To pomeni, da je treba novo izvaljenim paglavcem večkrat na dan (vsaj dvakrat) dati manjši obrok hrane. Dovajanje čezmernih količin hrane je treba preprečiti, da i) se ohrani kakovost vode in ii) prepreči zamašitev filtrirnega aparata z delci in ostanki hrane. Pri krmi za paglavce, uporabljeni v validacijskih študijah, je treba dnevne obroke hrane malo pred začetkom preskusa povečati glede na rast paglavcev na približno 30 mg/žival/dan. V validacijskih študijah je bilo dokazano, da ta komercialno dostopna krma podpira ustrezno rast in razvoj paglavcev X. laevis in je v drobnih delcih, ki se v vodnem stolpcu dlje časa ne raztopijo in jih odplakne tok. Zato je treba skupno dnevno količino hrane razdeliti na manjše obroke in jo dovajati vsaj dvakrat na dan. Način hranjenja s to krmo je naveden v tabeli 1. Stopnje hranjenja je treba zabeležiti. Dovaja se lahko suha ali kot založna raztopina, pripravljena v vodi za redčenje. Tako založno raztopino je treba sveže pripraviti vsak drugi dan in jo hraniti pri 4 °C, kadar se ne uporablja.
Tabela 1
Način hranjenja s komercialno krmo za paglavce, uporabljeno v validacijskih študijah za paglavce X. laevis, v delu preskusa preobrazbe dvoživk z živimi živalmi v pretočnih pogojih
|
Dan študije
|
Obrok hrane (mg krme/žival/dan)
|
|
0–4
|
30
|
|
5–7
|
40
|
|
8–10
|
50
|
|
11–14
|
70
|
|
15–21
|
80
|
|
Analitična kemija
|
14.
|
Pred izvedbo študije je treba oceniti stabilnost preskusne kemikalije na podlagi informacij o njeni topnosti, razgradljivosti in hlapnosti. Preskusne raztopine iz vsake ponovitvene posode pri posamezni koncentraciji je treba vzorčiti za analize analitične kemije na začetku preskusa (dan 0) in vsak teden med preskusom za najmanj štiri vzorce. Priporočeno je tudi, da se vsaka preskusna koncentracija analizira med pripravo sistema, pred začetkom preskusa, da se preveri učinkovitost sistema. Poleg tega se priporoča, da se založne raztopine analizirajo, ko se zamenjajo, zlasti če prostornina založne raztopine ne zagotavlja zadostnih količin kemikalije, ki bi pokrivale trajanje rutinskih obdobij vzorčenja. V primeru kemikalij, ki jih pri nekaterih ali vseh koncentracijah, uporabljenih v preskusu, ni mogoče zaznati, je treba izmeriti založno raztopino in zabeležiti pretok sistema, da se izračunajo nominalne koncentracije.
|
Dodajanje kemikalije
|
15.
|
Metoda, ki se uporablja za uvajanje preskusne kemikalije v sistem, se lahko razlikuje glede na njene fizikalno-kemijske lastnosti. Vodotopne kemikalije se lahko raztopijo v alikvotih preskusne vode pri koncentraciji, ki omogoča dodajanje pri ciljni preskusni koncentraciji v pretočnem sistemu. Kemikalije, ki so pri sobni temperaturi tekoče in težko topne v vodi, se lahko uvajajo z metodami saturacijske kolone za izmenjavo med tekočinama. Kemikalije, ki so pri sobni temperaturi trdne in težko topne v vodi, se lahko uvajajo s saturacijskimi kolonami iz steklene volne (7). Priporoča se uporaba preskusnega sistema brez nosilca, vendar imajo različne preskusne kemikalije različne fizikalno-kemijske lastnosti, zaradi katerih bodo verjetno potrebni različni pristopi za pripravo vode za izpostavljenost kemikalijam. Če je mogoče, se ne uporabijo topila ali nosilci, ker: i) lahko nekatera topila povzročijo strupenost in/ali neželene ali nepričakovane endokrinološke odzive, ii) lahko preskušanje kemikalij nad njihovo vodotopnostjo (kar se lahko pogosto zgodi pri uporabi topil) privede do netočnih določitev učinkovitih koncentracij in iii) lahko uporaba topil v dolgotrajnejših preskusih privede do znatne stopnje razvoja biofilma, povezanega z mikrobno dejavnostjo. Za kemikalije, ki jih je težko preskusiti, se lahko kot zadnja rešitev uporabi topilo, pri čemer je treba za določitev najboljše metode upoštevati Smernico OECD za preskušanje strupenosti zahtevnih snovi in zmesi v vodnem okolju (4). Topilo se izbere na podlagi kemijskih lastnosti kemikalije. Topila, za katera je bilo ugotovljeno, da so učinkovita za preskušanje strupenosti v vodnem okolju, vključujejo aceton, etanol, metanol, dimetil formamid in trietilen glikol. Če se uporabi topilo kot nosilec, morajo biti koncentracije topila nižje od kronične koncentracije brez opaznega učinka (NOEC); v skladu s Smernico OECD se priporoča največ 100 μl/l; v skladu z nedavnim pregledom se priporoča uporaba tako nizkih koncentracij topil, kot je 20 μl/l vode za redčenje (12). Če se uporabijo topila kot nosilci, je treba poleg kontrol brez topila (čista voda) oceniti ustrezne kontrole s topilom. Če kemikalije ni mogoče dodati prek vode zaradi fizikalno-kemijskih lastnosti (slaba topnost) ali omejene razpoložljivosti kemikalije, se lahko prouči uvajanje s prehrano. V zvezi s prehransko izpostavljenostjo je bilo opravljeno predhodno delo, vendar se ta način izpostavljenosti ne uporablja pogosto. Izbiro metode je treba dokumentirati in analitsko preveriti.
|
Izbira preskusnih koncentracij
Vzpostavitev visoke preskusne koncentracije
|
16.
|
Za namen tega preskusa je treba visoko preskusno koncentracijo določiti z mejo topnosti preskusne kemikalije, najvišjo tolerančno koncentracijo (MTC) za akutno strupene kemikalije ali 100 mg/l (kar koli je najnižje).
|
|
17.
|
MTC je opredeljena kot najvišja preskusna koncentracija kemikalije, ki povzroči manj kot 10-odstotno akutno smrtnost. Pri uporabi tega pristopa se domneva, da obstajajo empirični podatki o akutni smrtnosti, na podlagi katerih je mogoče oceniti MTC. Ocena MTC je lahko netočna, pri čemer je običajno potrebna strokovna presoja. Čeprav je lahko uporaba regresijskih modelov tehnično najzanesljivejši pristop za oceno MTC, se lahko uporaben približek MTC izpelje iz obstoječih akutnih podatkov z uporabo 1/3 vrednosti akutne LC50. Vendar podatki o akutni strupenosti za vrste, ki se preskušajo, niso nujno na voljo. Če podatki o akutni strupenosti, specifični za vrsto, niso na voljo, se lahko pri paglavcih, ki so reprezentativni (tj. so enake faze) za paglavce v preskusu AMA, opravi 96-urni preskus LC50. Če so na voljo podatki za druge vodne vrste (npr. študije LC50 pri ribah ali drugih dvoživkah), se lahko verjetna MTC oceni s strokovno presojo na podlagi ekstrapolacije med vrstami.
|
|
18.
|
Če kemikalija ni akutno strupena in je topna pri koncentraciji, višji od 100 mg/l, pa je treba šteti za najvišjo preskusno koncentracijo (HTC) 100 mg/l, ker se ta koncentracija običajno šteje za ‚praktično nestrupeno‘.
|
|
19.
|
Čeprav metode statičnega obnavljanja niso priporočeni postopek, se lahko uporabljajo, kadar pretočne metode niso ustrezne za doseganje MTC. Če se uporabijo metode statičnega obnavljanja, je treba dokumentirati stabilnost koncentracije preskusne kemikalije, pri čemer mora stabilnost ostati v mejah izvedbenih meril. Priporočajo se 24-urna obdobja obnavljanja. Obdobja obnavljanja, ki presegajo 72 ur, niso sprejemljiva. Ob koncu vsakega obdobja obnavljanja, neposredno pred obnavljanjem, je treba izmeriti parametre kakovosti vode (npr. raztopljeni kisik, temperaturo, pH itd.).
|
Razpon preskusnih koncentracij
|
20.
|
Uporabiti je treba vsaj tri preskusne koncentracije in kontrole s čisto vodo (ter po potrebi kontrole z vehiklom). Najmanjša razlika med najnižjo in najvišjo preskusno koncentracijo mora biti približno en red velikosti. Največja ločitev odmerka je 0,1 in najmanjša 0,33.
|
POSTOPEK
Začetek in izvedba preskusa
Dan 0
|
21.
|
Izpostavljanje je treba začeti, ko zadostno število paglavcev iz založne populacije pred izpostavljenostjo doseže 51. razvojno fazo po Nieuwkoopu in Faberju (8), pri čemer so glede na oploditev stari manj ali točno 17 dni. Za izbiro preskusnih živali je treba zdrave paglavce iz založne populacije, ki so videti normalni, združiti v eni posodi, ki vsebuje primerno prostornino vode za redčenje. Za določanje razvojne faze je treba posamezne paglavce odstraniti iz skupne posode z majhno mrežo ali cedilom in jih prenesti v prozorno merilno komoro (npr. 100-milimetrsko petrijevko) z vodo za redčenje. Priporočljivo je, da se za določanje faze ne uporablja anestezija, vendar se lahko za anestezijo paglavcev uporabi 100 mg/l trikain metan sulfonata (npr. MS-222), ki je pred uporabo ustrezno pufran z natrijevim karbonatom (pH 7.0). Če se za anestezijo uporabi npr. MS-222, je treba metodologijo za njegovo ustrezno uporabo pridobiti v izkušenih laboratorijih in jo sporočiti skupaj z rezultati preskusa. Med prenosom je treba z živalmi ravnati zelo previdno, da se čim bolj zmanjša stres zaradi prenosa in se preprečijo poškodbe.
|
|
22.
|
Razvojna faza živali se določi z binokularnim stereomikroskopom. Da se zmanjša končna variabilnost v razvojni fazi, je pomembno, da se faza določi čim bolj natančno. Po Nieuwkoopu in Faberju (8) je glavni razvojni znak za določitev 51. faze pri organizmih morfologija zadnjega kraka. Morfološke značilnosti zadnjega kraka je treba pregledati pod mikroskopom. Čeprav se je treba za določanje razvojne faze paglavcev seznaniti z Nieuwkoopovimi in Faberjevimi (8) smernicami v celoti, se lahko faza zanesljivo določi na podlagi izrazitih morfoloških znakov. Naslednja tabela se lahko uporabi za poenostavitev in standardizacijo postopka določanja faze skozi celotno študijo, tako da se določijo izraziti morfološki znaki, ki so povezani z različnimi fazami, pri čemer se predvideva, da je razvoj normalen.
Tabela 2
Izraziti morfološki znaki za določanje faze na podlagi smernic Nieuwkoopa in Faberja
|
Izraziti morfološki znaki
|
Razvojna faza
|
|
51
|
52
|
53
|
54
|
55
|
56
|
57
|
58
|
59
|
60
|
61
|
62
|
63
|
64
|
65
|
66
|
|
zadnji krak
|
X
|
X
|
X
|
X
|
X
|
X
|
X
|
|
|
|
|
|
|
|
|
|
|
sprednji krak
|
|
|
|
|
|
X
|
X
|
X
|
X
|
X
|
|
|
|
|
|
|
|
kraniofacialna struktura
|
|
|
|
|
|
|
|
|
|
X
|
X
|
X
|
X
|
|
|
|
|
morfologija vohalnega živca
|
|
|
|
|
|
|
|
|
|
|
X
|
X
|
X
|
|
|
|
|
dolžina repa
|
|
|
|
|
|
|
|
|
|
|
|
|
X
|
X
|
X
|
X
|
|
|
23.
|
Za začetek preskusa morajo biti vsi paglavci v 51. fazi. Najizrazitejši morfološki znak za določanje navedene faze je morfologija zadnjega kraka, ki je prikazana na sliki 1.
Slika 1
Morfologija zadnjega kraka pri paglavcu X. laevis v 51. fazi.

|
|
24.
|
Poleg izbire razvojne faze se lahko uporabi neobvezna izbira velikosti poskusnih živali. Za ta namen je treba na dan 0 izmeriti dolžino celega telesa (ne SVL) na podvzorcu približno 20 paglavcev v 51. fazi po Nieuwkoopu in Faberju. Po izračunu srednje dolžine celega telesa te skupine živali se lahko določijo največje in najmanjše mejne dolžine celotnega telesa poskusnih živali, pri čemer je dovoljeni razpon srednje vrednosti ± 3 mm (srednje vrednosti razpona dolžin celotnega telesa med 24,0 in 28,1 mm za paglavce v 51. fazi). Vendar je določanje razvojne faze glavni parameter za ugotavljanje pripravljenosti posamezne preskusne živali. Paglavci, ki kažejo zelo vidne deformnosti ali poškodbe, je treba izključiti iz preskusa.
|
|
25.
|
Paglavci, ki izpolnjujejo merila za fazo, opisana zgoraj, se zadržijo v posodi s čisto vodo za gojenje, dokler ni postopek določanja faze končan. Ko je določanje faze končano, se ličinke naključno razporedijo v tretirane posode za izpostavljenost, dokler ni v vsaki posodi po 20 ličink. V vsaki tretirani posodi se nato pregleda, ali so v njej živali, ki so videti nenormalno (npr. poškodbe, nenormalen način plavanja itd.). Očitno nezdrave paglavce je treba odstraniti iz tretiranih posod in jih nadomestiti z ličinkami, ki se na novo izberejo iz skupne posode.
|
Opažanja
|
26.
|
Za bolj poglobljene informacije o postopkih prekinitve preskusa in obdelavi paglavcev glej Smernico OECD za histologijo ščitnice pri dvoživkah (9).
|
Meritve na 7. dan
|
27.
|
Na 7. dan se iz vsake preskusne posode odstrani pet naključno izbranih paglavcev na ponovitev. Z uporabljenim naključnim postopkom je treba vsakemu organizmu, ki se preskuša, zagotoviti enako verjetnost izbire. To je mogoče doseči z uporabo katere koli metode naključnega vzorca, vendar je pri tem treba ujeti vsakega paglavca. Neizbrani paglavci se vrnejo v posodo, iz katere so bili zajeti, izbrani paglavci pa se humano evtanazirajo v npr. 150 do 200 mg/l MS-222 in ustrezno pufrajo z natrijevim karbonatom, da se doseže pH 7,0. Evtanazirani paglavci se sperejo v vodi in posušijo, nato pa se njihova telesna teža določi na najbližji miligram. Določijo se dolžina zadnjega kraka, dolžina od ust do zadnjične odprtine in razvojna faza (z binokularnim stereomikroskopom) vsakega paglavca.
|
Meritve na 21. dan (prekinitev preskusa)
|
28.
|
Ob prekinitvi preskusa (21. dan) se preostali paglavci odstranijo iz preskusnih posod in humano evtanazirajo v npr. 150 do 200 mg/l MS-222 ter ustrezno pufrajo z natrijevim bikarbonatom, kot je navedeno zgoraj. Paglavci se sperejo v vodi in posušijo, nato pa se njihova telesna teža določi na najbližji miligram. Izmerijo se razvojna faza, SVL in dolžina zadnjega kraka vsakega paglavca.
|
|
29.
|
Vse ličinke se za 48 do 72 ur prestavijo v Davidsonovo fiksirno raztopino kot vzorci celotnega telesa ali kot vzorci obrezanega tkiva glave, ki vključujejo spodnjo čeljust za histološko oceno. Za histopatologijo je treba vzorčiti skupaj pet paglavcev iz vsake ponovitvene posode. Ker je višina folikularnih celic odvisna od faze (10), je najustreznejši pristop vzorčenja za histološke analize uporaba osebkov iste faze, kadar koli je mogoče. Za izbiro osebkov iste faze je treba fazo vseh ličink prvič določiti pred izbiro ter nadaljnjo obdelavo za zbiranje podatkov in shranjevanje. To je potrebno, ker bo zaradi divergence pri razvoju prišlo do različnih porazdelitev faz v posameznih ponovitvenih posodah.
|
|
30.
|
Živali, izbrane za histopatologijo (n = 5 iz vsake ponovitve), je treba uskladiti s srednjo fazo kontrol (združene ponovitve), kadar koli je mogoče. Če je v ponovitvenih posodah več kot pet ličink ustrezne faze, se pet ličink naključno izbere.
|
|
31.
|
Če je v ponovitvenih posodah manj kot pet ličink ustrezne faze, je treba vzorčiti naključno izbrane osebke naslednje nižje ali višje razvojne faze, da se doseže skupna velikost vzorca petih ličink na ponovitev. Priporoča se, da se odločitev o vzorčenju dodatnih ličink iz naslednje nižje ali višje razvojne stopnje sprejme na podlagi splošne ocene porazdelitve faz v kontrolah in skupinah za kemične obdelave. To pomeni, da je treba vzorčiti dodatne ličinke iz naslednje nižje faze, če je kemična obdelava povezana z razvojno zaostalostjo. Če je kemična obdelava povezana s pospešitvijo razvoja, pa je treba vzorčiti dodatne ličinke iz naslednje višje faze.
|
|
32.
|
V primerih resnih sprememb razvoja paglavcev zaradi tretiranja s preskusno kemikalijo se porazdelitev faz v skupinah za kemično obdelavo morda ne bo prekrivala z izračunano srednjo razvojno fazo kontrole. Samo v teh primerih je treba postopek izbire spremeniti z uporabo faze, ki se razlikuje od srednje faze kontrole, da se doseže vzorčenje ličink enake faze za histopatologijo ščitnice. Če so faze nedoločljive (tj. asinhronost), je treba za histološko analizo naključno izbrati 5 paglavcev iz vsake ponovitve. Vzorčenje katere koli ličinke, ki ni v fazi, enakovredni srednji razvojni fazi kontrole, je treba utemeljiti.
|
Določanje bioloških končnih točk
|
33.
|
V 21-dnevni fazi izpostavljenosti se 7. in 21. dan izvede meritev primarnih končnih točk, vendar je treba preskusne živali opazovati vsak dan. V tabeli 3 je naveden pregled končnih točk meritev in ustreznih časovnih točk opazovanja. Podrobnejše informacije za tehnične postopke meritve zgornjih končnih točk in histološke ocene so navedene v smernicah OECD (9).
Tabela 3
Časovne točke opazovanja za primarne končne točke pri AMA
|
Zgornje končne točke
|
Vsak dan
|
7. dan
|
21. dan
|
|
|
ߦ
|
|
|
|
|
|
ߦ
|
ߦ
|
|
|
|
ߦ
|
ߦ
|
|
—
|
dolžina od ust do zadnjične odprtine
|
|
|
ߦ
|
ߦ
|
|
|
|
ߦ
|
ߦ
|
|
—
|
histologija ščitnične žleze
|
|
|
|
ߦ
|
|
Zgornje končne točke
|
34.
|
Razvojna faza, dolžina zadnjega kraka, SVL in mokra teža so zgornje končne točke AMA, pri čemer je vsaka na kratko obravnavana v nadaljevanju. Dodatne tehnične informacije za zbiranje teh podatkov, vključno s postopki za računalniško podprte analize, katerih uporaba se priporoča, so navedene v smernicah, na katere so navedeni sklici.
|
Razvojna faza
|
35.
|
Razvojna faza paglavcev X. laevis se določi z merili za določanje faze po Nieuwkoopu in Faberju (8). Podatki o razvojni fazi se uporabijo pri ugotavljanju, ali je razvoj pospešen, asinhron, zakasnjen ali nespremenjen. Pospešen ali zakasnjen razvoj se določi s primerjavo med srednjo fazo, ki jo dosežejo kontrolne in tretirane skupine. Asinhroni razvoj je ugotovljen, če pregledana tkiva niso deformirana ali nenormalna, vendar je relativen čas morfogeneze ali razvoja različnih tkiv moten pri enem paglavcu.
|
Dolžina zadnjega kraka
|
36.
|
Diferenciacijo in rast zadnjih krakov nadzorujejo hormoni ščitnice in so pomemben razvojni znak, ki se že uporablja za določanje razvojne faze. Razvoj zadnjega kraka se pri določanju razvojne stopnje uporablja kvalitativno, vendar se tukaj obravnava kot kvantitativna končna točka. Zato se dolžina zadnjega kraka meri kot končna točka za ugotavljanje učinkov na ščitnično os (slika 2). Zaradi doslednosti se dolžina zadnjega kraka meri na zadnjem levem kraku. Dolžina zadnjega kraka se oceni 7. dan in 21. dan preskusa. Na 7. dan je merjenje dolžine zadnjega kraka enostavno, kot je prikazano na sliki 2. Merjenje dolžine zadnjega kraka na 21. dan pa je bolj zapleteno zaradi ukrivljenosti kraka. Zato se mora meritev dolžine zadnjega kraka na 21. dan začeti pri telesni steni in nadaljevati po sredinski črti kraka prek vseh kotov odstopanja. Spremembe dolžine zadnjega kraka na 7. dan se štejejo za pomembne za potencialno aktivnost ščitnice, čeprav na 21. dan niso očitne. Meritve dolžin se pridobijo na podlagi digitalnih fotografij z uporabo programske opreme za analizo slik, kot je opisano v Smernici OECD za histologijo ščitnice pri dvoživkah (9).
|
Dolžina telesa in teža mokrega telesa
|
37.
|
Določanje dolžine od ust do zadnjične odprtine (SVL) (slika 2) in mokre teže je v protokol preskusa vključeno, da se ocenijo možni učinki preskusne kemikalije na hitrost rasti paglavcev v primerjavi s kontrolno skupino, in je koristno pri ugotavljanju posplošene strupenosti za preskusno kemikalijo. Ker se lahko zaradi odstranitve adherentne vode za določanje teže ustvarijo stresni pogoji za paglavce in se lahko poškoduje njihova koža, se te meritve izvajajo na 7. dan pri paglavcih iz podvzorca, pri vseh ostalih paglavcih pa ob prekinitvi preskusa (21. dan). Zaradi doslednosti je treba kot repno mejo za meritev upoštevati kranialno stran zadnjične odprtine.
|
|
38.
|
Dolžina od ust do zadnjične odprtine (SVL) se uporabi za oceno rasti paglavca, kot je prikazano na sliki 2.
Slika 2
(A) Vrste meritev dolžine telesa in (B) meritve zadnjega kraka pri paglavcih X. laevis (1)

|
Histologija ščitnične žleze
|
39.
|
Čeprav sta razvojna faza in dolžina zadnjega kraka pomembni končni točki za oceno sprememb pri metamorfnem razvoju, povezanih z izpostavljenostjo, se zakasnjeni razvoj sam po sebi ne more šteti za diagnostični kazalnik protiščitničnega delovanja. Nekatere spremembe so lahko opazne le z rutinsko histopatološko analizo. Diagnostična merila vključujejo hipertrofijo/atrofijo ščitnične žleze, hipertrofijo folikularnih celic, hiperplazijo folikularnih celic, dodatna kvalitativna merila pa območje svetline folikla, kakovost koloida in velikost/obliko folikularne celice. Poročati je treba o razvrstitvi resnosti (4 stopnje). Informacije o odvzemu in obdelavi vzorcev za histopatološko analizo in izvedbo histopatoloških analiz na vzorcih tkiva so na voljo v dokumentih ‚Preskus metamorfoze dvoživk: Del 1 – Tehnične smernice za morfološko vzorčenje in histološko pripravo‘ in ‚Preskus metamorfoze dvoživk: Del 2 – Pristop k branju študij, diagnostičnim merilom, razvrstitvi resnosti in atlasu‘ (9). Laboratoriji, ki preskus izvajajo prvič, se morajo pred izvedbo histološke analize in oceno ščitnične žleze zaradi usposabljanja posvetovati z izkušenimi patologi. Zaradi očitnih in znatnih sprememb zgornjih končnih točk, ki kažejo pospešen razvoj ali asinhronost, morda ne bo potrebna histopatološka analiza ščitnične žleze. Zaradi odsotnosti očitnih morfoloških sprememb ali dokazov o zakasnjenem razvoju pa so histološke analize upravičene.
|
Smrtnost
|
40.
|
Vsak dan je treba pregledati, ali so v preskusnih posodah mrtvi paglavci, in zabeležiti številke za posamezne posode. Za vsak primer smrtnosti je treba zabeležiti datum, koncentracijo in številko posode. Mrtve živali je treba takoj po ugotovitvi smrtnosti odstraniti iz preskusnih posod. Stopnje smrtnosti, ki presegajo 10 %, lahko kažejo neustrezne preskusne pogoje ali strupene učinke preskusne kemikalije.
|
Dodatna opažanja
|
41.
|
Primere nenormalnega obnašanja ter zelo vidne deformnosti in lezije je treba zabeležiti. Za vsako opaženo nenormalno obnašanje, velike deformnosti ali lezije je treba zabeležiti datum, koncentracijo in številko posode. Za normalno obnašanje je značilno, da paglavci v vodnem stolpcu z repom nad glavo redno ritmično udarjajo z repno plavutjo, redno prihajajo na površino, premikajo škržni poklopec in se odzivajo na dražljaje. Nenormalno obnašanje bi na primer vključevalo lebdenje na gladini, ležanje na dnu posode, obrnjen ali nepravilen način plavanja, odsotnost površinske aktivnosti in neodzivanje na dražljaje. Zabeležiti je treba tudi velike razlike pri porabi hrane med tretiranji. Velike deformnosti in lezije lahko med drugim vključujejo morfološke nenormalnosti (npr. deformacije krakov), hemoragične lezije, bakterijske ali glivične okužbe. Te ugotovitve so kvalitativne, pri čemer jih je treba obravnavati podobno kot klinične znake bolezni/stresa in jih primerjati s kontrolnimi živalmi. Če je pojavnost ali stopnja pojavnosti v izpostavljenih posodah večja kot v kontrolnih posodah, jo je treba obravnavati kot dokaz očitne strupenosti.
|
PODATKI IN POROČANJE
Zbiranje podatkov
|
42.
|
Vse podatke je treba zbrati z elektronskimi ali ročnimi sistemi, ki upoštevajo dobro laboratorijsko prakso (GLP). Podatki študije morajo obsegati:
|
|
Preskusna kemikalija:
|
—
|
opis preskusne kemikalije: fizikalno-kemijske lastnosti, informacije o stabilnosti in biološki razgradljivosti,
|
|
—
|
informacije in podatke o kemikaliji: metodo in pogostost priprave razredčin. Informacije o preskusni kemikaliji vključujejo aktualne in nominalne koncentracije preskusne kemikalije ter v nekaterih primerih nematične kemikalije, kot je ustrezno. Za založne raztopine in preskusne raztopine bodo morda potrebne meritve preskusne kemikalije,
|
|
—
|
topilo (če ni voda): utemeljitev izbire topila in opis topila (vrsta, uporabljena koncentracija).
|
|
|
|
Preskusni pogoji:
|
—
|
operativne evidence: zajemajo opažanja v zvezi z delovanjem preskusnega sistema ter podpornega okolja in infrastrukture. Običajne evidence vključujejo: sobno temperaturo, preskusno temperaturo, obdobje osvetljenosti, stanje kritičnih delov sistema izpostavljenosti (npr. črpalke, števci ciklov, tlaki), pretoke, vodostaj, spremembe standardne steklenice in evidence prehranjevanja. Parametri splošne kakovosti vode vključujejo: pH, raztopljeni kisik, prevodnost, skupni jod, alkalnost in trdoto,
|
|
—
|
odstopanja od preskusne metode: te informacije morajo vključevati vse informacije ali pripovedne opise odstopanj od preskusne metode.
|
|
|
|
Rezultati:
|
—
|
biološka opažanja in podatki: ti vključujejo dnevna opažanja smrtnosti, porabe hrane, nenormalnega načina plavanja, letargije, izgube ravnotežja, deformnosti, lezij itd. Opažanja in podatki, zbrani v vnaprej določenih časovnih razmikih, vključujejo: razvojno fazo, dolžino zadnjega kraka, dolžino od ust do zadnjične odprtine in mokro težo,
|
|
—
|
tehnike statistične analize in utemeljitev uporabljenih tehnik, rezultati statistične analize, po možnosti v tabeli,
|
|
—
|
histološki podatki: ti vključujejo pripovedne opise ter razvrščeno resnost in pogostnost specifičnih opažanj, kot je navedeno v smernici za histopatologijo,
|
|
—
|
ad-hoc opažanja: ta opažanja morajo vključevati pripovedne opise študije, ki jih ni mogoče razvrstiti v zgoraj opisane kategorije.
|
|
|
Poročanje podatkov
|
43.
|
Dodatek 2 vsebuje razpredelnice za dnevno zbiranje podatkov, ki se lahko uporabijo kot smernica za vnos neobdelanih podatkov in izračune statističnega povzetka. Navedene so tudi tabele za poročanje, ki so uporabne za sporočanje povzetkov podatkov o končnih točkah. Tabele za poročanje za histološke ocene so navedene v Dodatku 2.
|
Izvedbena merila in sprejemljivost/veljavnost preskusa
|
44.
|
Na splošno bodo posledica velikih odstopanj od preskusne metode podatki, nesprejemljivi za razlago ali poročanje. Zato so bila naslednja merila iz tabele 4 pripravljena kot smernica za določanje kakovosti izvedenega preskusa, splošne uspešnosti kontrolnih organizmov.
Tabela 4
Izvedbena merila za AMA
|
Merilo
|
Sprejemljive meje
|
|
Preskusne koncentracije
|
V 21-dnevnem preskusu se ohranjajo pri ≤ 20 % KV (variabilnost izmerjenih preskusnih koncentracij).
|
|
Smrtnost v kontrolah
|
≤ 10 % – smrtnost v nobeni ponovitvi v kontrolah ne sme preseči 2 paglavcev.
|
|
Najnižja srednja razvojna faza kontrol na koncu preskusa
|
57
|
|
Razpon razvojnih stopenj v kontrolni skupini
|
Deseti in 90. centil porazdelitve razvojnih faz se ne smeta razlikovati za več kot 4 faze.
|
|
Raztopljeni kisik
|
≥ 40 % nasičenosti z zrakom (23)
|
|
pH
|
pH je treba vzdrževati med 6,5 in 8,5. Razlike med ponovitvami/tretiranji ne smejo presegati 0,5.
|
|
Temperatura vode
|
22 °C ± 1 °C – razlike med ponovitvami/tretiranji ne smejo presegati 0,5 °C.
|
|
Preskusne koncentracije brez očitne strupenosti
|
≥ 2
|
|
Uspešnost ponovitev
|
Ogrozita se lahko ≤ 2 ponovitvi v celotnem preskusu.
|
|
Posebni pogoji za uporabo topila
|
Če se uporabi topilo kot nosilec, je treba uporabiti kontrolo s topilom in kontrolo s čisto vodo ter poročati o rezultatih.
|
|
Statistično značilne razlike med kontrolno skupino s topilom in kontrolno skupino z vodo se obravnavajo posebej. Več informacij je navedenih v nadaljevanju.
|
|
Posebni pogoji za sistem s statičnim obnavljanjem
|
Poročati je treba o reprezentativnih kemijskih analizah pred obnavljanjem in po njem.
|
|
Ravni amoniaka je treba izmeriti neposredno pred obnavljanjem.
|
|
Vse parametre kakovosti vode iz tabele 1 iz Dodatka 1 je treba izmeriti neposredno pred obnavljanjem.
|
|
Obdobje obnavljanja ne sme biti daljše od 72 ur.
|
|
Ustrezen časovni razpored hranjenja (50 % dnevnega obroka komercialne krme za paglavce)
|
|
Veljavnost preskusa
|
45.
|
Da se preskus šteje za sprejemljiv/veljaven, morajo biti izpolnjene naslednje zahteve:
|
|
veljaven poskus v zvezi z negativnim preskusom za aktivnost ščitnice:
|
(1)
|
smrtnost v nobenem tretiranem vzorcu (vključno s kontrolami) ne sme preseči 10 %. Smrtnost pri nobeni ponovitvi ne sme preseči treh paglavcev, sicer se ponovitev šteje za ogroženo;
|
|
(2)
|
za analizo morata biti na voljo vsaj dve stopnji tretiranja, pri čemer so vse štiri ponovitve neogrožene;
|
|
(3)
|
za analizo morata biti na voljo vsaj dve stopnji tretiranja brez očitne strupenosti;
|
|
|
|
veljaven poskus v zvezi s pozitivnim preskusom za aktivnost ščitnice:
|
(1)
|
v kontrolni skupini sta lahko največ dva smrtna primera paglavcev na ponovitev.
|
|
|
Način odločanja za izvedbo AMA
|
46.
|
Način odločanja za AMA je bil pripravljen za zagotovitev smiselne pomoči pri izvedbi in razlagi rezultatov biološkega preskusa (glej tabelo poteka na sliki 3). Način odločanja v bistvu obravnava končne točke v navedenem naprednem razvoju, asinhroni razvoj in histopatologija ščitnice se obravnavata podrobno, zakasneli razvoj, dolžina od ust do zadnjične odprtine, teža mokrega telesa in parametri, na katere bi lahko vplivala splošna strupenost, pa se obravnavajo manj podrobno.
Slika 3
Način odločanja za izvedbo AMA
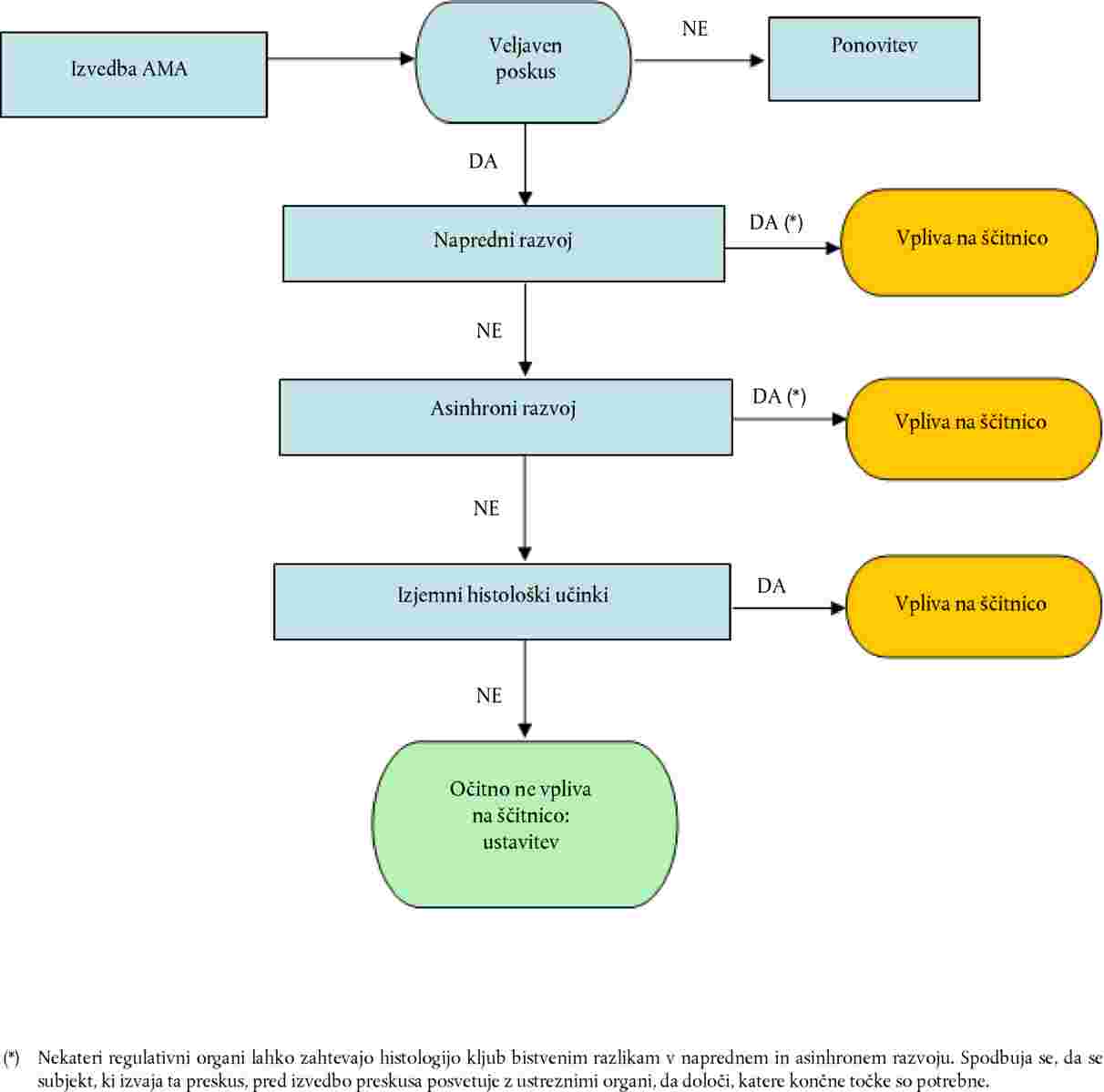
|
Napredni razvoj (določen z uporabo razvojne faze, SVL in HLL)
|
47.
|
Znano je le, da se napredni razvoj pojavi zaradi učinkov, ki so povezani s ščitničnim hormonom. To so lahko učinki perifernega tkiva, kot je neposredna interakcija z receptorjem ščitničnega hormona (kot je s T4) ali učinki, ki spreminjajo ravni kroženja ščitničnega hormona. V vsakem primeru se to šteje za ustrezen dokaz, da je kemikalija povezana z aktivnostjo ščitnice. Napredni razvoj se oceni na enega od dveh načinov. Prvič, splošna faza razvoja se lahko oceni s standardiziranim pristopom, kot sta ga opisala Nieuwkoop in Faber (8). Drugič, kvantificirajo se lahko specifične morfološke značilnosti, kot je dolžina zadnjega kraka na 7. in 21. dan, kar je pozitivno povezano z agonističnimi učinki na receptor ščitničnega hormona. Če se pojavi statistično značilen napredek pri razvoju ali dolžini zadnjega kraka, preskus kaže, da kemikalija vpliva na ščitnico.
|
|
48.
|
Ocenjevanje prisotnosti pospešenega razvoja pri preskusnih živalih glede na kontrolno populacijo bo temeljilo na rezultatih statističnih analiz, izvedenih za naslednje štiri končne točke:
|
—
|
dolžina zadnjega kraka (normalizirana s SVL) na 7. dan študije,
|
|
—
|
dolžina zadnjega kraka (normalizirana s SVL) na 21. dan študije,
|
|
—
|
razvojna faza na 7. dan študije,
|
|
—
|
razvojna faza na 21. dan študije.
|
|
|
49.
|
Statistične analize dolžine zadnjega kraka je treba izvesti na podlagi meritev dolžine zadnjega levega kraka. Dolžina zadnjega kraka se normalizira z razmerjem med dolžino zadnjega kraka in dolžino od ust do zadnjične odprtine posameznega osebka. Nato se primerja sredina normaliziranih vrednosti posamezne stopnje tretiranja. Pospešen razvoj se nato kaže z znatnim povečanjem srednje dolžine zadnjega kraka (normalizirane) v kemično obdelani skupini v primerjavi s kontrolno skupino na 7. dan študije in/ali 21. dan študije (glej Dodatek 3).
|
|
50.
|
Statistične analize razvojne faze je treba izvesti na podlagi določitve razvojne faze v skladu z morfološkimi merili, ki sta jih opisala Nieuwkoop in Faber (8). Pospešen razvoj se kaže, če se na 7. in/ali 21. dan študije v primerjavi s kontrolno skupino z večkvantno analizo zazna znatno povečanje vrednosti, povezanih z razvojno fazo, v kemično obdelani skupini.
|
|
51.
|
Pri preskusni metodi AMA se znaten učinek na katero koli od navedenih štirih končnih točk šteje kot ustrezen za zaznavo pospešenega razvoja. To pomeni, da znatnih učinkov na dolžino zadnjega kraka ob določeni časovni točki ni treba potrditi z znatnimi učinki na dolžino zadnjega kraka ob drugem času ali z znatnimi učinki na razvojno fazo ob tej določeni časovni točki. Znatnih učinkov na razvojno fazo ob določeni časovni točki pa ni treba potrditi z znatnimi učinki na razvojno fazo ob drugem času ali z znatnimi učinki na dolžino zadnjega kraka ob tej določeni časovni točki. Pomen dokazov pospešenega razvoja se bo kljub temu povečal, če bodo znatni učinki zaznani pri več kot eni končni točki.
|
Asinhroni razvoj (določen z merili za razvojno fazo)
|
52.
|
Za asinhroni razvoj je značilna motnja relativnega časa morfogeneze ali razvoja različnih tkiv pri enem paglavcu. Nezmožnost jasne določitve razvojne faze organizma s skupino morfoloških končnih točk, ki se štejejo kot značilne za katero koli fazo, kaže, da se tkiva pri preobrazbi razvijajo asinhrono. Asinhroni razvoj je kazalnik aktivnosti ščitnice. Edini znani načini delovanja, ki povzročajo asinhroni razvoj, so učinki kemikalij na periferno delovanje ščitničnega hormona in/ali metabolizem ščitničnega hormona pri razvijajočih se tkivih, kot je ugotovljen pri inhibitorjih dejodaze.
|
|
53.
|
Ocenjevanje prisotnosti asinhronega razvoja pri preskusnih živalih glede na kontrolno populacijo bo temeljil na splošni morfološki oceni preskusnih živali na 7. in 21. dan študije.
|
|
54.
|
Opis normalnega razvoja Xenopus laevis, ki sta ga pripravila Nieuwkoop in Faber (8), zagotavlja okvir za opredelitev zaporedja normalnega preoblikovanja tkiva. Izraz ‚asinhroni razvoj‘ se nanaša izrecno na tista odstopanja v splošnem morfološkem razvoju paglavcev, ki preprečujejo dokončno določitev razvojne faze v skladu z Nieuwkoopovimi in Faberjevimi merili (8), ker ključni morfološki znaki kažejo značilnosti različnih faz.
|
|
55.
|
Kot nakazuje izraz ‚asinhroni razvoj‘, je treba obravnavati le primere, ki kažejo odstopanja v napredovanju preoblikovanja posebnih tkiv glede na napredovanje preoblikovanja drugih tkiv. Nekateri klasični fenotipi vključujejo zakasnitev ali odsotnost razvoja sprednjega kraka kljub normalnemu ali naprednemu razvoju zadnjih krakov ali repnih tkiv ali zgodnjo resorpcijo škrg glede na fazo morfogeneze zadnjih krakov in resorpcije repa. Da žival kaže asinhroni razvoj, se zabeleži, če ji ni mogoče dodeliti faze, ker ne izpolnjujejo večine pomembnih razvojnih meril za dano fazo po Nieuwkoopu in Faberju (8) ali če obstaja izjemna zakasnitev ali pospešitev ene ali več ključnih značilnosti (npr. popolna resorpcija repa, ko še ni sprednjih krakov). Ta ocena se izvede kvalitativno in mora zajemati pregled vseh pomembnih značilnosti, ki sta jih navedla Nieuwkoop in Faber (8). Pri tem pa ni treba zabeležiti stanja razvoja različnih pomembnih značilnosti opazovanih živali. Živalim, pri katerih je zabeleženo, da kažejo asinhroni razvoj, se ne dodeli razvojna faza po Nieuwkoopu in Faberju (8).
|
|
56.
|
Zato je glavno merilo, da se primeri nenormalnega morfološkega razvoja označijo kot ‚asinhroni razvoj‘, motnja relativnega časa preoblikovanja tkiva in morfogeneze tkiva, medtem ko morfologija prizadetih tkiv ni očitno nenormalna. Primer prikaza razlage splošnih morfoloških nenormalnosti je, da bo zadržana morfogeneza zadnjega kraka glede na razvoj drugih tkiv izpolnila merilo ‚asinhronega razvoja‘, medtem ko se primeri manjkajočih zadnjih krakov, nenormalnih števil (npr. ektrodaktilija in polidaktilija) ali drugih očitnih deformnosti krakov ne smejo šteti za ‚asinhroni razvoj‘.
|
|
57.
|
V zvezi s tem morajo pomembni morfološki znaki, katerih usklajen metamorfni napredek je treba oceniti, vključevati morfogenezo zadnjih krakov, morfogenezo sprednjih krakov, pojav sprednjih krakov, fazo resorpcije repa (zlasti resorpcijo repne plavuti) in morfologijo glave (npr. velikost škrg, fazo resorpcije škrg, morfologijo spodnje čeljusti in protruzijo Mecklovega hrustanca).
|
|
58.
|
Glede na različne načine kemijskega delovanja se lahko pojavijo različni splošni morfološki fenotipi. Nekateri klasični fenotipi vključujejo zakasnitev ali odsotnost razvoja sprednjega kraka kljub normalnemu ali naprednemu razvoju zadnjih krakov ali repnih tkiv, zgodnji resorpciji škrg glede na zadnje krake in preoblikovanju repa.
|
Histopatologija
|
59.
|
Če kemikalija ne povzroča očitne strupenosti in ne pospešuje razvoja ali povzroča asinhronega razvoja, se histopatologija ščitnične žleze oceni na podlagi ustrezne smernice (9). Razvojna zaostalost, kadar ni strupenosti, je pomemben kazalnik protiščitničnega delovanja, vendar je analiza razvojne faze manj občutljiva in manj diagnostična kot histopatološka analiza ščitnične žleze. Zato je v tem primeru treba izvajati histopatološke analize ščitničnih žlez. V odsotnosti razvojnih učinkov so bili dokazani učinki na histologijo ščitnične žleze. Če se histopatologija ščitnice spremeni, se šteje, da kemikalija vpliva na ščitnico. Če v ščitničnih žlezah ni ugotovljen zakasnjeni razvoj ali histološke lezije, se šteje, da kemikalija ne vpliva na ščitnico. Ta odločitev se utemelji s tem, da na ščitnično žlezo vpliva TSH, pri čemer bodo vse kemikalije, ki kroženje ščitničnega hormona spremenijo dovolj, da se spremeni sekrecija TSH, povzročile histopatološke spremembe ščitničnih žlez. Kroženje ščitničnega hormona se lahko spremeni zaradi različnih načinov in mehanizmov delovanja. Čeprav raven ščitničnega hormona kaže na učinek, ki je povezan s ščitnico, to ni dovolj za določitev, kateri način ali mehanizem delovanja je povezan z odzivom.
|
|
60.
|
Ker ta končna točka ni primerna za osnovne statistične pristope, je treba učinek, povezan z izpostavljenostjo kemikaliji, določiti s strokovnim mnenjem patologa.
|
Zakasneli razvoj (določen z uporabo razvojne faze, HLL, BW in SVL)
|
61.
|
Zakasneli razvoj lahko povzročijo protiščitnični mehanizmi in posredna strupenost. Verjetno je, da zmeren zakasneli razvoj in očitni znaki strupenosti kažejo nespecifičen strupeni učinek. Ocenjevanje neščitnične strupenosti je bistven del preskusa, da se zmanjša verjetnost lažno pozitivnih rezultatov. Čezmerna smrtnost je jasen znak, da se pojavljajo drugi strupeni mehanizmi. Zmerna zmanjšanja rasti, kot so določena z mokro težo in/ali dolžino od ust do zadnjične odprtine, podobno kažejo neščitnično strupenost. Očitna povečanja rasti se pogosto ugotovijo pri kemikalijah, ki negativno vplivajo na normalen razvoj. Zato prisotnost večjih živali še ne pomeni neščitnične strupenosti. Vendar se pri določanju ščitnične strupenosti ne sme nikoli zanašati izključno na rast. Za določanje delovanja ščitnice je treba uporabiti rast skupaj z razvojno fazo in histopatologijo ščitnice. Pri določanju očitne strupenosti je treba obravnavati tudi druge končne točke, vključno z edemi, hemoragičnimi lezijami, letargijo, manjšo porabo hrane, neenakomernim/spremenjenim načinom plavanja itd. Če vse preskusne koncentracije kažejo znake očitne strupenosti, je treba preskusno kemikalijo ponovno oceniti pri nižjih preskusnih koncentracijah, preden se določi, ali bi lahko vplivala na ščitnico ali ne.
|
|
62.
|
Statistično značilen zakasneli razvoj, kadar ni drugih znakov očitne strupenosti, kaže, da kemikalija vpliva na ščitnico (antagonistično). Kadar ni pomembnih statističnih odzivov, se lahko ta rezultat popravi z rezultati histopatologije ščitnice.
|
Statistične analize
|
63.
|
Priporoča se, da se pri statističnih analizah podatkov upoštevajo postopki, opisani v dokumentu Sedanji pristopi k statistični analizi podatkov o ekotoksičnosti: smernica za uporabo (11). Za vse stalne kvantitativne končne točke (HLL, SVL, mokra teža), skladne z monotonim odzivom na odmerek, je treba za vzpostavitev znatnega učinka tretiranja na regresiven način uporabiti preskus po Jonckheere-Terpstraju.
|
|
64.
|
Za stalne končne točke, ki niso skladne z monotonim odzivom na odmerek, je treba pri podatkih oceniti normalnost (priporoča se uporaba Shapiro-Wilkovega ali Anderson-Darlingovega preskusa) in homogenost varianc (priporoča se uporaba Levenejevega preskusa). Oba preskusa se izvedeta na ostankih iz analize variance. Namesto formalnih preskusov za normalnost in homogenost varianc se lahko uporabi strokovna presoja, čeprav se priporoča uporaba formalnih preskusov. Če je ugotovljena nenormalnost ali heterogenost varianc, je treba poiskati normalizacijsko pretvorbo, ki stabilizira variance. Če so podatki (morda po pretvorbi) normalno porazdeljeni s homogenostjo varianc, se znaten učinek tretiranja določi na podlagi Dunnettovega preskusa. Če so podatki (morda po pretvorbi) normalno porazdeljeni s heterogenostjo varianc, se znaten učinek tretiranja določi na podlagi Tamhane-Dunnettovega preskusa, preskusa T3 ali Mann-Whitney-Wilcoxonovega U-preskusa. Kadar ni mogoče najti normalizacijske pretvorbe, se znaten učinek tretiranja določi na podlagi Mann-Whitney-Wilcoxonovega U-preskusa in Bonferroni-Holmove prilagoditve vrednostim p. Dunnettov preskus se uporablja neodvisno od katerega koli F-preskusa analize variance, Mann-Whitneyjev preskus pa se uporablja neodvisno od katerega koli Kruskall-Wallisovega preskusa.
|
|
65.
|
Visoka smrtnost ni pričakovana, vendar jo je treba oceniti na podlagi regresivnega Cochran-Armitageovega preskusa, kadar so podatki skladni z monotonostjo odziva na odmerek, sicer pa na podlagi Fisherjevega eksaktnega preskusa z Bonferroni-Holmovo prilagoditvijo.
|
|
66.
|
Znaten učinek tretiranja za razvojno stopnjo se določi na podlagi regresivne uporabe preskusa po Jonckheere-Terpstraju, ki se uporablja za mediane ponovitev. Namesto tega je treba za določitev učinka uporabiti večkvantni Jonckheerov preskus od 20. do 80. centila, kar je tudi priporočljivo, ker upošteva spremembe profila porazdelitve.
|
|
67.
|
Ustrezna enota analize je ponovitev, da podatke sestavljajo mediane ponovitev, če se uporablja preskus po Jonckheere-Terpstraju ali Mann-Whitneyjev U-preskus, ali ponovljena srednja vrednost, če se uporablja Dunnettov preskus. Monotonost odziva na odmerek se lahko oceni vizualno na podlagi ponovitve in sredin tretiranj ali na podlagi formalnih preskusov, kot so opisani zgoraj (11). Pri manj kot petih ponovitvah na tretirani vzorec ali kontrolo je treba uporabiti točne različice permutacije preskusa po Jonckheere-Terpstraju in Mann-Whitneyevega preskusa, če so na voljo. Statistična značilnost vseh navedenih preskusov je ocenjena na raven značilnosti 0,05.
|
|
68.
|
Slika 4 je diagram poteka za izvedbo statističnih preskusov stalnih podatkov.
Slika 4
Diagram poteka za statistične pristope za podatke o zveznem odzivu.
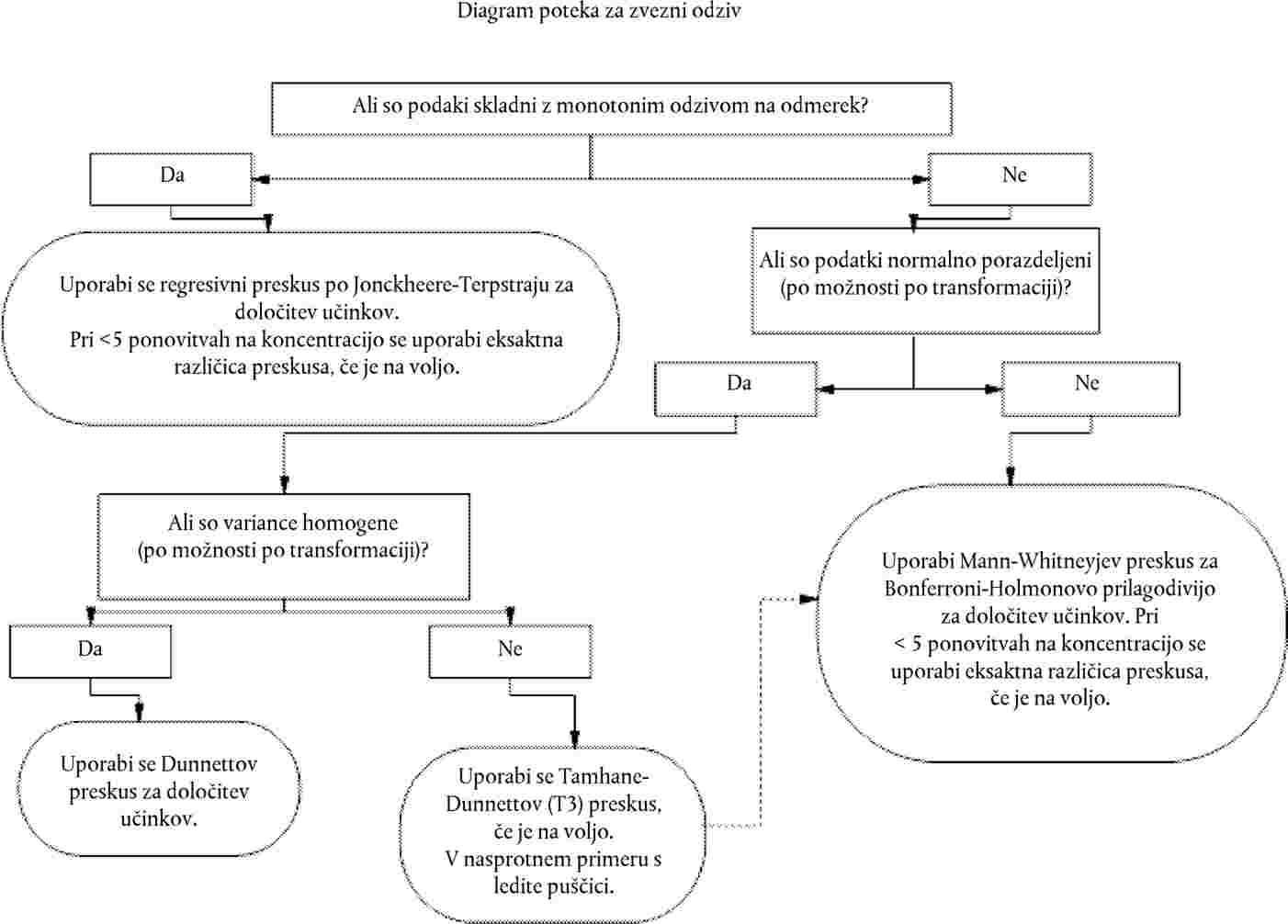
|
Posebni pomisleki o analizi podatkov
Uporaba ogroženih stopenj tretiranja
|
69.
|
Pri določanju, ali se očitna strupenost kaže s ponovitvijo ali celotnim tretiranjem, se obravnava več dejavnikov, ki jih je treba izključiti iz analize. Očitna strupenost je opredeljena kot več kot dva smrtna primera v kateri koli ponovitvi, ki ju je mogoče pojasniti le s strupenostjo in ne s tehnično napako. Drugi znaki očitne strupenosti vključujejo hemoragijo, nenormalno obnašanje, nenormalne načine plavanja, anoreksijo in vse druge klinične znake bolezni. Za subletalne znake strupenosti bodo lahko potrebne kvalitativne ocene, ki jih je vedno treba izvesti za kontrolno skupino s čisto vodo.
|
Kontrole s topilom
|
70.
|
Uporabo topila je treba obravnavati le kot zadnjo možnost, ko so bile obravnavane že vse druge možnosti dovajanja kemikalije. Če se uporabi topilo, je treba skladno izvesti kontrolo s čisto vodo. Ob koncu preskusa je treba izvesti oceno potencialnih učinkov topila. Ocena se izvede s statistično primerjavo kontrolne skupine s topilom in kontrolne skupine s čisto vodo. Najpomembnejše končne točke, ki jih je v tej analizi treba obravnavati, so razvojna faza, dolžina od ust do zadnjične odprtine in mokra teža, ker lahko nanje vpliva strupenost, ki ne vpliva na ščitnico. Če se pri teh končnih točkah ugotovijo statistično značilne razlike med kontrolno skupino s čisto vodo in kontrolno skupino s topilom, je treba končne točke študije za merila odziva določiti s kontrolo s čisto vodo. Če za nobeno izmerjeno spremenljivko odziva ni statistično značilne razlike med kontrolo s čisto vodo in kontrolo s topilom, je treba končne točke študije za merila odziva določiti z združenimi kontrolami z vodo za redčenje in topilom.
|
Tretirane skupine, ki dosežejo 60. razvojno fazo ali več
|
71.
|
Po 60. fazi se velikost in teža paglavcev zmanjšata zaradi resorpcije in zmanjšanja absolutne vsebnosti vode. Zato meritev mokre teže in dolžine od ust do zadnjične odprtine v statističnih analizah ni mogoče ustrezno uporabiti za razlike v hitrostih rasti. Podatke o mokri teži in dolžini organizmov, ki so presegli 60. fazo po Nieuwkoopu in Faberju, je treba izključiti in se jih ne sme uporabiti pri analizah sredin ponovitev ali median ponovitev. Za analizo teh parametrov, povezanih z rastjo, se lahko uporabita dva različna pristopa.
|
|
72.
|
Prvi pristop je, da se za statistično analizo mokre teže in/ali dolžine od ust do zadnjične odprtine obravnavajo le paglavci, katerih razvojna faza je nižja ali enaka 60. fazi. S tem pristopom naj bi se zagotovile ustrezno zanesljive informacije o resnosti možnih učinkov na rast, če se iz analiz umakne le majhen del preskusnih živali (≤ 20 %). Če večje število paglavcev v eni ali več nominalnih koncentracijah kaže razvojno fazo, višjo od 60. (≥ 20 %), je treba pri vseh paglavcih opraviti dvofaktorsko analizo variance in ugnezdeno strukturo variance, da se ocenijo učinki na rast zaradi kemične obdelave, pri čemer se upošteva učinek pozne razvojne faze na rast. V Dodatku 3 so navedene smernice za analizo teže in dolžine z dvofaktorsko analizo variance.
|
LITERATURA
|
(1)
|
OECD (2004). Report of the Validation of the Amphibian Metamorphosis Assay for the detection of thyroid active substances: Phase 1 – Optimisation of the Test Protocol. Environmental Health and Safety Publications. Series on Testing and Assessment. No. 77, Pariz.
|
|
(2)
|
OECD (2007). Final Report of the Validation of the Amphibian Metamorphosis Assay: Phase 2 – Multi-chemical Interlaboratory Study. Environmental Health and Safety Publications. Series on Testing and Assessment. No. 76. Pariz.
|
|
(3)
|
OECD (2008). Report of the Validation Peer Review for the Amphibian Metamorphosis Assay and Agreement of the Working Group of the National Coordinators of the Test Guidelines Programme on the Follow-up of this Report. Environmental Health and Safety Publications. Series on Testing and Assessment. No. 92. Pariz.
|
|
(4)
|
OECD (2000). Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. Environmental Health and Safety Publications. Series on Testing and Assessment. No. 23. Pariz.
|
|
(5)
|
ASTM (2002). Standard Guide for Conducting Acute Toxicity Tests on Test Materials with Fishes, Macroinvertebrates, and Amphibians. American Society for Testing and Materials, ASTM E729–96(2002), Filadelfija, PA.
|
|
(6)
|
ASTM (2004). Standard Guide for Conducting the Frog Embryo Teratogenesis Assay – Xenopus (FETAX). E 1439–98.
|
|
(7)
|
Kahl, M. D., Russom, C. L., DeFoe, D. L., in Hammermeister, D. E. (1999). Saturation units for use in aquatic bioassays. Chemosphere 39, str. 539–551.
|
|
(8)
|
Nieuwkoop, P. D., in Faber, J. (1994). Normal Table of Xenopus laevis. Garland Publishing, New York.
|
|
(9)
|
OECD (2007). Guidance Document on Amphibian Thyroid Histology. Environmental Health and Safety Publications. Series on Testing and Assessment. No. 82. Pariz.
|
|
(10)
|
Dodd, M. H. I., in Dodd, J. M. (1976). Physiology of Amphibia. Lofts, B. (ur.), Academic Press, New York, str. 467–599.
|
|
(11)
|
OECD (2006). Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. Environmental Health and Safety Publications. Series on Testing and Assessment, No. 54. Pariz.
|
|
(12)
|
Hutchinson, T. H., Shillabeer, N., Winter, M. J., Pickford, D. B. (2006). Acute and chronic effects of carrier solvents in aquatic organisms: A critical review. Review. Aquatic Toxicology, 76; str. 69–92.
|
Dodatek 1
Tabela 1
Poskusni pogoji za 21-dnevni preskus preobrazbe dvoživk
|
Preskusna žival
|
Ličinka Xenopus laevis
|
|
Začetna faza ličinke
|
51. faza po Nieuwkoopu in Faberju
|
|
Obdobje izpostavljenosti
|
21 dni
|
|
Merila za izbiro ličink
|
razvojna faza in celotna dolžina (neobvezno)
|
|
Preskusne koncentracije
|
najmanj 3 koncentracije v približno enem redu velikosti
|
|
Režim izpostavljenosti
|
pretočni (priporočen) in/ali s statičnim obnavljanjem
|
|
Pretok preskusnega sistema
|
25 ml/min (prostornina se v celoti zamenja približno vsake 2,7 ure)
|
|
Primarne končne točke/dnevi določitve
|
smrtnost
|
vsak dan
|
|
razvojna faza
|
7. in 21. dan
|
|
dolžina zadnjega kraka
|
7. in 21. dan
|
|
dolžina od ust do zadnjične odprtine
|
7. in 21. dan
|
|
teža mokrega telesa
|
7. in 21. dan
|
|
histologija ščitnice
|
21. dan
|
|
Voda za redčenje/laboratorijska kontrola
|
deklorirana vodovodna voda (prečiščena z ogljem) ali enakovreden laboratorijski vir
|
|
Gostota ličink
|
20 ličink/preskusno posodo (5/l)
|
|
Preskusna raztopina/preskusna posoda
|
4–10 l (najmanj 10–15 cm vode)/stekleno preskusno posodo ali preskusno posodo iz nerjavnega jekla (npr. 22,5 cm × 14 cm × 16,5 cm)
|
|
Ponovitev
|
4 ponovitvene preskusne posode/preskusno koncentracijo in kontrolo
|
|
Sprejemljiva stopnja smrtnosti v kontrolah
|
≤ 10 % na ponovitveno preskusno posodo
|
|
Fiksiranje žleze
|
Število fiksiranih
|
vsi paglavci (najprej se jih oceni 5/ponovitev)
|
|
Regija
|
glava ali celo telo
|
|
Fiksacijska tekočina
|
Davidsonov fiksativ
|
|
Hranjenje
|
Hrana
|
Sera Micron® ali enakovredna
|
|
Količina/pogostost
|
za način hranjenja s Sera Micron® glej tabelo 1
|
|
Osvetlitev
|
Obdobje osvetljenosti
|
12 h svetlobe: 12 h teme:
|
|
Jakost
|
600 do 2 000 luksov (izmerjeno na vodni gladini)
|
|
Temperatura vode
|
22 °C ± 1 °C
|
|
pH
|
6,5–8,5
|
|
Koncentracija raztopljenega kisika (DO)
|
> 3,5 mg/l (> 40 % nasičenosti z zrakom)
|
|
Časovni razpored vzorčenja za analitično kemijo
|
enkrat/teden (4 vzorčenja/preskus)
|
Dodatek 2
Tabele za poročanje za neobdelane podatke in povzete podatke
Tabela 1
Splošne informacije o preskusni kemikaliji
|
Kemijske informacije
|
|
|
Vnesite preskusno kemikalijo, enote koncentracije in tretiranja
|
|
|
Preskusna kemikalija:
|
|
|
|
|
Enote koncentracije:
|
|
|
|
|
Tretiranje 1
|
|
|
|
|
Tretiranje 2
|
|
|
|
|
Tretiranje 3
|
|
|
|
|
Tretiranje 4
|
|
|
|
|
|
|
|
|
|
Datum (dan 0):
|
|
Vnesite datum (mm/dd/ll)
|
|
|
Datum (7. dan):
|
|
Vnesite datum (mm/dd/ll)
|
|
|
Datum (21. dan):
|
|
Vnesite datum (mm/dd/ll)
|
Tabela 2
Zbirni listi za neobdelane podatke za 7. in 21. dan
|
DAN X
DATUM 00/00/00
|
|
|
Koncentracija
|
Številka tretiranja
|
Številka ponovitve
|
Številka osebka
|
Označba osebka
|
Razvojna faza
|
Dolžina SVL (mm)
|
Dolžina zadnjega kraka (mm)
|
Mokra teža celotnega organizma (mg)
|
|
VRSTICA
|
TRET.
|
ŠT: TRET.
|
PON.
|
ŠT. OS.
|
OZN. OS.
|
FAZA
|
BL
|
HLL
|
TEŽA
|
|
1
|
0,00
|
1
|
|
|
|
|
|
|
|
|
2
|
0,00
|
1
|
|
|
|
|
|
|
|
|
3
|
0,00
|
1
|
|
|
|
|
|
|
|
|
4
|
0,00
|
1
|
|
|
|
|
|
|
|
|
5
|
0,00
|
1
|
|
|
|
|
|
|
|
|
6
|
0,00
|
1
|
|
|
|
|
|
|
|
|
7
|
0,00
|
1
|
|
|
|
|
|
|
|
|
8
|
0,00
|
1
|
|
|
|
|
|
|
|
|
9
|
0,00
|
1
|
|
|
|
|
|
|
|
|
10
|
0,00
|
1
|
|
|
|
|
|
|
|
|
11
|
0,00
|
1
|
|
|
|
|
|
|
|
|
12
|
0,00
|
1
|
|
|
|
|
|
|
|
|
13
|
0,00
|
1
|
|
|
|
|
|
|
|
|
14
|
0,00
|
1
|
|
|
|
|
|
|
|
|
15
|
0,00
|
1
|
|
|
|
|
|
|
|
|
16
|
0,00
|
1
|
|
|
|
|
|
|
|
|
17
|
0,00
|
1
|
|
|
|
|
|
|
|
|
18
|
0,00
|
1
|
|
|
|
|
|
|
|
|
19
|
0,00
|
1
|
|
|
|
|
|
|
|
|
20
|
0,00
|
1
|
|
|
|
|
|
|
|
|
21
|
0,00
|
2
|
|
|
|
|
|
|
|
|
22
|
0,00
|
2
|
|
|
|
|
|
|
|
|
23
|
0,00
|
2
|
|
|
|
|
|
|
|
|
24
|
0,00
|
2
|
|
|
|
|
|
|
|
|
25
|
0,00
|
2
|
|
|
|
|
|
|
|
|
26
|
0,00
|
2
|
|
|
|
|
|
|
|
|
27
|
0,00
|
2
|
|
|
|
|
|
|
|
|
28
|
0,00
|
2
|
|
|
|
|
|
|
|
|
29
|
0,00
|
2
|
|
|
|
|
|
|
|
|
30
|
0,00
|
2
|
|
|
|
|
|
|
|
|
31
|
0,00
|
2
|
|
|
|
|
|
|
|
|
32
|
0,00
|
2
|
|
|
|
|
|
|
|
|
33
|
0,00
|
2
|
|
|
|
|
|
|
|
|
34
|
0,00
|
2
|
|
|
|
|
|
|
|
|
35
|
0,00
|
2
|
|
|
|
|
|
|
|
|
36
|
0,00
|
2
|
|
|
|
|
|
|
|
|
37
|
0,00
|
2
|
|
|
|
|
|
|
|
|
38
|
0,00
|
2
|
|
|
|
|
|
|
|
|
39
|
0,00
|
2
|
|
|
|
|
|
|
|
|
40
|
0,00
|
2
|
|
|
|
|
|
|
|
|
41
|
0,00
|
3
|
|
|
|
|
|
|
|
|
42
|
0,00
|
3
|
|
|
|
|
|
|
|
|
43
|
0,00
|
3
|
|
|
|
|
|
|
|
|
44
|
0,00
|
3
|
|
|
|
|
|
|
|
|
45
|
0,00
|
3
|
|
|
|
|
|
|
|
|
46
|
0,00
|
3
|
|
|
|
|
|
|
|
|
47
|
0,00
|
3
|
|
|
|
|
|
|
|
|
48
|
0,00
|
3
|
|
|
|
|
|
|
|
|
49
|
0,00
|
3
|
|
|
|
|
|
|
|
|
50
|
0,00
|
3
|
|
|
|
|
|
|
|
|
51
|
0,00
|
3
|
|
|
|
|
|
|
|
|
52
|
0,00
|
3
|
|
|
|
|
|
|
|
|
53
|
0,00
|
3
|
|
|
|
|
|
|
|
|
54
|
0,00
|
3
|
|
|
|
|
|
|
|
|
55
|
0,00
|
3
|
|
|
|
|
|
|
|
|
56
|
0,00
|
3
|
|
|
|
|
|
|
|
|
57
|
0,00
|
3
|
|
|
|
|
|
|
|
|
58
|
0,00
|
3
|
|
|
|
|
|
|
|
|
59
|
0,00
|
3
|
|
|
|
|
|
|
|
|
60
|
0,00
|
3
|
|
|
|
|
|
|
|
|
61
|
0,00
|
4
|
|
|
|
|
|
|
|
|
62
|
0,00
|
4
|
|
|
|
|
|
|
|
|
63
|
0,00
|
4
|
|
|
|
|
|
|
|
|
64
|
0,00
|
4
|
|
|
|
|
|
|
|
|
65
|
0,00
|
4
|
|
|
|
|
|
|
|
|
66
|
0,00
|
4
|
|
|
|
|
|
|
|
|
67
|
0,00
|
4
|
|
|
|
|
|
|
|
|
68
|
0,00
|
4
|
|
|
|
|
|
|
|
|
69
|
0,00
|
4
|
|
|
|
|
|
|
|
|
70
|
0,00
|
4
|
|
|
|
|
|
|
|
|
71
|
0,00
|
4
|
|
|
|
|
|
|
|
|
72
|
0,00
|
4
|
|
|
|
|
|
|
|
|
73
|
0,00
|
4
|
|
|
|
|
|
|
|
|
74
|
0,00
|
4
|
|
|
|
|
|
|
|
|
75
|
0,00
|
4
|
|
|
|
|
|
|
|
|
76
|
0,00
|
4
|
|
|
|
|
|
|
|
|
77
|
0,00
|
4
|
|
|
|
|
|
|
|
|
78
|
0,00
|
4
|
|
|
|
|
|
|
|
|
79
|
0,00
|
4
|
|
|
|
|
|
|
|
|
80
|
0,00
|
4
|
|
|
|
|
|
|
|
Tabela 3
Izračunani povzeti podatki o končnih točkah za 7. in 21. dan
|
|
|
Razvojna faza
|
SVL (mm)
|
Dolžina zadnjega kraka (mm)
|
Teža (mg)
|
|
TRET.
|
PON.
|
MIN
|
MEDIANA
|
MAKS
|
SREDINA
|
ST. ODKL.
|
SREDINA
|
ST. ODKL.
|
SREDINA
|
ST. ODKL.
|
|
1
|
1
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
1
|
2
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
1
|
3
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
1
|
4
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
2
|
1
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
2
|
2
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
2
|
3
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
2
|
4
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
3
|
1
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
3
|
2
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
3
|
3
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
3
|
4
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
4
|
1
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
4
|
2
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
4
|
3
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
4
|
4
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
Opomba: Izračuni v celicah so povezani z vnesenimi podatki iz tabele 2.
|
Tabela 4
Podatki o dnevni smrtnosti
|
Dan preskusa
|
Datum
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
|
0
|
00/00/00
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
11
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
12
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
13
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
14
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
15
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
16
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
17
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
18
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
19
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
20
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
21
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Število ponovitev
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
|
Število tretiranj
|
0
|
|
|
|
0
|
|
|
|
0
|
|
|
|
0
|
|
|
|
|
Opomba: Izračuni v celicah so povezani z vnesenimi podatki iz tabele 1.
|
Tabela 5
Merila kakovosti vode
Sistem izpostavljenosti (pretočni/s statičnim obnavljanjem)
Temperatura:
Jakost svetlobe:
Cikel svetlobe in teme:
Hrana:
Stopnja hranjenja:
pH vode:
Koncentracija jodida v preskusni vodi:
Tabela 6
Povzetek kemičnih podatkov
|
Kemijsko ime:
|
|
Številka CAS:
|
|
Dan preskusa
|
Datum
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
|
0
|
00/00/00
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
11
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
12
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
13
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
14
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
15
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
16
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
17
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
18
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
19
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
20
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
21
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Opomba: Izračuni v celicah so povezani z vnesenimi podatki iz tabele 1.
|
Tabela 7
Tabele za histopatološko poročanje za glavna merila
|
Datum:
|
Kemikalija:
|
|
|
Patolog:
|
|
|
Hipertrofija ščitnične žleze
|
Atrofija ščitnične žleze
|
Hipertrofija folikularnih celic
|
Hiperplazija folikularnih celic
|
|
Hipertrofija ščitnične žleze
|
Atrofija ščitnične žleze
|
Hipertrofija folikularnih celic
|
Hiperplazija folikularnih celic
|
|
Oznaka kontrolne živali – ponovitev 1
|
|
|
|
|
|
Oznaka preskusne živali – ponovitev 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Oznaka kontrolne živali – ponovitev 2
|
|
|
|
|
|
Oznaka preskusne živali – ponovitev 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Skupaj:
|
|
|
|
|
Skupaj:
|
|
|
|
|
|
|
Hipertrofija ščitnične žleze
|
Atrofija ščitnične žleze
|
Hipertrofija folikularnih celic
|
Hiperplazija folikularnih celic
|
|
|
Hipertrofija ščitnične žleze
|
Atrofija ščitnične žleze
|
Hipertrofija folikularnih celic
|
Hiperplazija folikularnih celic
|
|
Oznaka preskusne živali – ponovitev 1
|
|
|
|
|
|
Oznaka preskusne živali – ponovitev 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Oznaka preskusne živali – ponovitev 2
|
|
|
|
|
|
Oznaka preskusne živali – ponovitev 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Skupaj:
|
|
|
|
|
Skupaj:
|
|
|
|
|
Tabela 8
Dodatna histopatološka merila
|
Datum:
|
Kemikalija:
|
|
|
Patolog:
|
|
|
|
|
|
|
|
|
Povečanje območja svetline folikla
|
Zmanjšanje območja svetline folikla
|
Povečanje območja svetline folikla
|
Zmanjšanje območja svetline folikla
|
|
Oznaka kontrolne živali – ponovitev 1
|
|
|
|
Oznaka preskusne živali – ponovitev 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Oznaka kontrolne živali – ponovitev 2
|
|
|
|
Oznaka preskusne živali – ponovitev 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Skupaj:
|
|
|
Skupaj:
|
|
|
|
|
Povečanje območja svetline folikla
|
Zmanjšanje območja svetline folikla
|
|
|
Povečanje območja svetline folikla
|
Zmanjšanje območja svetline folikla
|
|
Oznaka preskusne živali – ponovitev 1
|
|
|
|
Oznaka preskusne živali – ponovitev 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Oznaka preskusne živali – ponovitev 2
|
|
|
|
Oznaka preskusne živali – ponovitev 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Skupaj:
|
|
|
Skupaj:
|
|
|
Tabela 9
Pripovedni opisi histopatoloških ugotovitev
|
Datum:
|
|
Kemikalija:
|
|
Patolog:
|
|
|
Pripovedni opis
|
|
Oznaka kontrolne živali – ponovitev 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Oznaka kontrolne živali – ponovitev 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Oznaka preskusne živali – ponovitev 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Oznaka preskusne živali – ponovitev 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Oznaka preskusne živali – ponovitev 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Oznaka preskusne živali – ponovitev 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Oznaka preskusne živali – ponovitev 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Oznaka preskusne živali – ponovitev 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Tabela 10
Predloga tabele za poročanje za povzetke za dan x (7. ali 21. dan) AMA
|
|
|
Kontrola
|
Odmerek 1
|
Odmerek 2
|
Odmerek 3
|
|
Končna točka
|
Ponovitev
|
Sredina
|
SO
|
KV
|
Š
|
Sredina
|
SO
|
KV
|
Š
|
Vrednost p
|
Sredina
|
SO
|
KV
|
Š
|
Vrednost p
|
Sredina
|
SO
|
KV
|
Š
|
Vrednost p
|
|
Zadnji krak Dolžina
(mm)
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Sredina:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
SVL
(mm)
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Sredina:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Mokra teža
(mg)
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Sredina:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Tabela 11
Tabela za poročanje za povzetke za dan × (7. ali 21. dan) AMA
|
|
|
Kontrola
|
Odmerek 1
|
Odmerek 2
|
Odmerek 3
|
|
|
Ponovitev
|
Mediana
|
Min.
|
Maks.
|
Š
|
Mediana
|
Min.
|
Maks.
|
Š
|
Vrednost p
|
Mediana
|
Min.
|
Maks.
|
Š
|
Vrednost p
|
Mediana
|
Min.
|
Maks.
|
Mediana
|
Vrednost p
|
|
Razvojna faza
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Sredina:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Dodatek 3
Alternativna analiza teže in dolžine, kadar je razvojna faza pozna pri več kot 20 % paglavcev v eni koncentraciji ali več
Če večje število paglavcev v eni ali več nominalnih koncentracijah kaže razvojno fazo, višjo od 60. (≥ 20 %), je treba pri vseh paglavcih opraviti dvofaktorsko analizo variance in ugnezdeno strukturo variance, da se ocenijo učinki na rast zaradi kemične obdelave, pri čemer se upošteva učinek pozne razvojne faze na rast.
Priporoča se uporaba vseh podatkov, vendar je treba upoštevati učinek pozne razvojne faze. To omogoča dvofaktorska analiza variance z ugnezdeno strukturo variance. Če je razvojna faza živali 61. ali višja, je treba za pozno fazo izbrati „da“ (LateStage = „Yes“). V nasprotnem primeru je treba izbrati „ne“ (LateStage = „No“). Nato se lahko izvede dvofaktorska analiza variance s koncentracijo in LateStage ter njuno povezanostjo, pri čemer je Rep(Conc) naključni faktor, Tadpole(Rep) pa še en naključni učinek. Ponovitev se še vedno obravnava kot enota analize in zagotavlja v glavnem enake rezultate kot tehtana analiza sredin rep*latestage, tehtana s številom živali na sredino. Če podatki ne upoštevajo zahtev analize variance glede normalnosti ali homogenosti varianc, se lahko izvede pretvorba normalizirane porazdelitve, v čimer se odstrani navedena ovira.
Poleg standardnih F-preskusov analize variance za učinke Conc, LateStage in njihovih povezanosti se lahko interakcijski F-preskus razdeli na dva dodatna F-preskusa analize variance, pri čemer se en uporablja za srednje odzive pri koncentracijah za LateStage=„No“, drugi pa za srednje odzive pri koncentracijah za LateStage = „Yes“. Dodatne primerjave sredin tretiranj glede na kontrolo se izvedejo v vsaki fazi LateStage. Izvedejo se lahko analize trenda z ustreznimi nasprotji ali enostavne primerjave parov, če obstajajo dokazi nemonotonega odziva na odmerek v okviru ene stopnje spremenljivke LateStage. Bonferroni-Holmova prilagoditev vrednostim p se izvede le, če ustrezen F-del ni pomemben. To se lahko naredi v SAS in predvidoma v drugih statističnih programskih paketih. Zapleti se lahko pojavijo, če v nekaterih koncentracijah ni živali v pozni fazi, vendar se lahko ti primeri rešijo neposredno.
Dodatek 4
Opredelitve
Kemikalija
: snov ali zmes.
Preskusna kemikalija
: vsaka snov ali zmes, preskušena z uporabo te preskusne metode.
C.39 PRESKUS RAZMNOŽEVANJA SKAKAČEV V TLEH
UVOD
|
1.
|
Ta preskusna metoda ustreza Smernici za preskušanje OECD (TG) 232 (2009). Zasnovana je za ocenjevanje učinkov kemikalij na sposobnost razmnoževanja skakačev v tleh. Temelji na obstoječih postopkih (1) (2). Partenogenetska Folsomia candida in Folsomia fimetaria, ki se razmnožujeta spolno, sta dve najbolj razširjeni vrsti skakačev, ki sta primerni za gojenje in komercialno dostopni. Kadar je treba oceniti posebne habitate, kjer ni teh vrst, se lahko postopek razširi tudi na druge vrste skakačev, če lahko izpolnijo merila za veljavnost preskusa.
|
|
2.
|
Talni skakači so ekološko pomembna vrsta za ekotoksikološko preskušanje. Skakači so šesteronožci s tankim zunanjim skeletom, ki je zelo prepusten za zrak in vodo, ter predstavljajo vrsto členonožcev z drugačnim načinom in stopnjo izpostavljenosti kot deževniki in enhitreji.
|
|
3.
|
Gostote populacije skakačev običajno dosežejo 105 m– 2 v tleh in plasteh preperelega listja v več kopenskih ekosistemih (3) (4). Odrasli običajno merijo 0,5–5 mm, njihov prispevek k skupni živalski biomasi in dihanju tal pa je nizek in ocenjen na 1–5 % (5). Njihova najpomembnejša vloga bi zato lahko bila potencialno reguliranje procesov z mikrobivorizmom in plenjenjem mikrofavne. Skakači so plen za številne endogeične in epigeične nevretenčarje, kot so pršice, strige, pajki, krešiči in kratkokrilci. Skakači prispevajo k procesom razpadanja v kislih tleh, kjer bi lahko bili najpomembnejši talni nevretenčarji poleg enhitrejev, ker tam običajno ni deževnikov in dvojnonog.
|
|
4.
|
F. fimetaria se nahaja po vsem svetu in je pogosto v različnih vrstah tal od peščenih do ilovnatih in od humusa do trhline. Je skakač, ki nima oči in pigmenta. Najden je bil v kmetijskih tleh po vsej Evropi (6). Je vsejed in se med drugim prehranjuje z mikroorganizmi fungus hypha, bakterijami, praživalmi in odpadki. Njegova interakcija poteka prek paše z infekcijami patogenih gliv (7) in lahko vpliva na mikorizo, kot je znano za F. candida. Tako kot večina vrst skakačev se razmnožuje spolno, pri čemer morajo biti samci stalno prisotni zaradi oploditve jajčec.
|
|
5.
|
Tudi F. candida se nahaja povsod po svetu. Čeprav običajno ni prisotna v večini naravnih tal, se v večjem številu pogosto nahaja v tleh, bogatih s humusom. Je skakač, ki nima oči in pigmenta. Ima dobro razvito furko (skakalni organ), se aktivno premika s tekom in takoj skoči, če je ogrožen. Ekološka vloga F. candida je podobna vlogi F. fimetaria, vendar so njen habitat organsko bogatejša tla. Razmnožuje se partenogenetsko. Samcev je manj kot eden na tisoč.
|
NAČELO PRESKUSA
|
6.
|
Sinhroni odrasli (F. fimetaria) ali mladi (F. candida) skakači so izpostavljeni različnim koncentracijam preskusne kemikalije, premešane v spremenjena umetna tla (8) s 5-odstotno vsebnostjo organske snovi (ali alternativna tla). Potek preskusa se lahko razdeli na dva koraka:
|
—
|
preskus za določanje območja delovanja, če ni na voljo ustreznih informacij o strupenosti, v katerem sta smrtnost in razmnoževanje glavni končni točki, ki se ocenjujeta po dveh tednih za F. fimetaria in treh tednih za F. candida,
|
|
—
|
končni preskus razmnoževanja, v katerem se ocenjujeta skupno število mladičev, ki so jih ustvarili starši, in preživetje staršev. Ta končni preskus traja tri tedne za F. fimetaria ali štiri tedne za F. candida.
|
Strupeni učinek preskusne kemikalije na smrtnost odraslih in njihovo sposobnost razmnoževanja se izrazi kot LCx in ECx s prilagajanjem podatkov ustreznemu modelu z nelinearno regresijo, da se oceni koncentracija, ki bi povzročila x-odstotno smrtnost ali manjšo sposobnost razmnoževanja, ali pa kot vrednost NOEC/LOEC (9).
|
INFORMACIJE O PRESKUSNI KEMIKALIJI
|
7.
|
Priporočljivo je, da so znane fizikalne lastnosti, topnost v vodi, log Kow, porazdelitveni koeficient tla/voda in parni tlak preskusne kemikalije. Zaželene so dodatne informacije o končnem stanju preskusne kemikalije v tleh, kot so stopnje fotolize in hidrolize ter biotska razgradnja. Kadar so na voljo kemijska identifikacija preskusne kemikalije v skladu z nomenklaturo IUPAC, številka CAS, serija, skupina, strukturna formula in čistost, jih je treba dokumentirati.
|
|
8.
|
Ta preskusna metoda se lahko uporabi za kemikalije, ki so v vodi topne ali netopne. Vendar se bo način uporabe preskusne kemikalije ustrezno razlikoval. Preskusna metoda se ne uporablja za hlapne kemikalije, tj. kemikalije, katerih Henryjeva konstanta ali porazdelitveni koeficient zrak/voda je večji od ena, ali kemikalije, katerih parni tlak presega 0,0133 Pa pri 25 °C.
|
VELJAVNOST PRESKUSA
|
9.
|
Da se rezultati preskusa štejejo za veljavne, morajo biti v netretiranih kontrolah izpolnjena naslednja merila:
|
—
|
srednja smrtnost pri odraslih na koncu preskusa ne sme presegati 20 %,
|
|
—
|
povprečno število mladičev na posodo mora biti na koncu preskusa vsaj 100,
|
|
—
|
koeficient variacije, izračunan za število mladičev, mora biti na koncu končnega preskusa manj kot 30 %.
|
|
REFERENČNA KEMIKALIJA
|
10.
|
Referenčno kemikalijo je treba preskusiti pri koncentraciji EC50 za izbrano vrsto preskusnih tal v rednih časovnih razmikih ali jo po možnosti vključiti v vsak preskusni vzorec, da se preveri, ali je raven odziva preskusnih organizmov v preskusnem sistemu normalna. Ustrezna referenčna kemikalija je borova kemikalija, ki mora razmnoževanje zmanjšati za 50 % (10) (11) pri približno 100 mg/kg suhe teže tal za obe vrsti.
|
OPIS PRESKUSA
Preskusne posode in oprema
|
11.
|
Ustrezne preskusne posode so posode, ki lahko zadržujejo 30 g vlažne prsti. Izdelane morajo biti iz stekla ali inertne plastike (nestrupene). Vendar se je treba uporabi plastičnih posod izogibati, če se izpostavljenost preskusni kemikaliji zmanjša zaradi sorpcije. Preskusna posoda mora imeti presečno območje, ki omogoča dejansko globino tal v preskusni posodi od 2 do 4 cm. Posode morajo imeti pokrove (npr. iz stekla ali polietilena), ki so zasnovani za zmanjšanje izhlapevanja vode, medtem ko omogočajo izmenjavo plinov med tlemi in atmosfero. Posoda mora biti vsaj delno prozorna, da omogoča prenos svetlobe.
|
|
12.
|
Potrebna je normalna laboratorijska oprema, zlasti:
|
—
|
merilnik vrednosti pH in merilnik osvetljenosti,
|
|
—
|
ustrezne natančne tehtnice,
|
|
—
|
ustrezna oprema za uravnavanje temperature,
|
|
—
|
ustrezna oprema za uravnavanje vlažnosti zraka (ni nujna, če so posode za izpostavljanje pokrite s pokrovi),
|
|
—
|
inkubator z uravnavanjem temperature ali majhen prostor,
|
|
—
|
prijemalke ali nizkotlačni sesalnik.
|
|
Priprava preskusnih tal
|
13.
|
Uporabijo se spremenjena umetna tla (8) s 5-odstotno vsebnostjo organske snovi. Če umetna tla niso podobna naravnim, se lahko uporabijo tudi naravna tla. Priporočena sestava umetnih tal je naslednja (na podlagi suhih tež, posušenih na konstantno težo pri 105 °C):
|
—
|
5 % šotnega maha, posušenega na zraku in fino mletega (sprejemljiva je velikost delcev 2 ± 1 mm),
|
|
—
|
20 % kaolinske gline (vsebnost kaolinita po možnosti nad 30 %),
|
|
—
|
približno 74 % industrijskega peska, posušenega na zraku (odvisno od potrebne količine CaCO3), pretežno finega peska z več kot 50 % delcev med 50 in 200 mikronov. Točna količina peska je odvisna od količine CaCO3 (glej v nadaljevanju), pri čemer morata skupaj predstavljati 75 %,
|
|
—
|
1,0 % kalcijevega karbonata (CaCO3, zdrobljen v prah, analitsko čisti) za zagotovitev pH 6,0 ± 0,5; količina kalcijevega karbonata, ki ga je treba dodati, je lahko odvisna pretežno od kakovosti/vrste šote (glej opombo 1).
|
Opomba 1: Količina CaCO3, ki je potrebna, bo odvisna od sestavin substrata tal in jo je treba določiti z merjenjem pH predinkubiranih podvzorcev vlažnih tal neposredno pred preskusom.
Opomba 2: Priporoča se merjenje pH ter po možnosti razmerja C/N, kationske izmenjalne kapacitete (CEC) in vsebnosti organske snovi v tleh, da se omogočita poznejša normalizacija in boljša razlaga rezultatov.
Opomba 3: Po potrebi se lahko npr. za namene posebnega preskušanja kot preskusni in/ali kulturni substrat uporabijo tudi naravna tla z neonesnaženih območij. Če se uporabijo naravna tla, pa je treba določiti vsaj njihov izvor (mesto odvzema), pH, teksturo (porazdelitev delcev glede na velikost), kationsko izmenjalno kapaciteto in vsebnost organske snovi, pri čemer ne smejo biti onesnažena. Preden se tla uporabijo pri končnem preskusu, je priporočljivo dokazati ustreznost naravnih tal za preskus in izpolnjevanje meril za veljavnost preskusa.
|
|
14.
|
Suhe sestavine tal se temeljito premešajo (npr. v velikem laboratorijskem mešalniku). Največja zmogljivost zadrževanja vode (WHC) umetnih tal se določi v skladu s postopki iz Dodatka 5. Odstotek vlage v tleh za preskušanje je treba optimirati, da se zagotovi porozna struktura tal, ki skakačem omogoča vstop skozi pore. To je običajno 40–60 % največje zmogljivosti zadrževanja vode.
|
|
15.
|
Suha umetna tla se predhodno navlažijo z dodajanjem dovolj deionizirane vode, da se zagotovi približno pol končne vsebnosti vode 2–7 dni pred začetkom preskusa, kar omogoča vzpostavitev ravnotežja/stabilizacijo kislosti. Za določitev pH se uporabi zmes tal in raztopine 1 M kalijevega klorida (KCl) ali 0,01 M kalcijevega klorida (CaCl2) v razmerju 1: 5 (v skladu z Dodatkom 6). Če so tla bolj kisla, kot je potrebno, se lahko prilagodijo z dodajanjem ustrezne količine CaCO3. Če so tla preveč alkalna, se lahko prilagodijo z dodajanjem anorganske kisline, ki ni škodljiva za skakače.
|
|
16.
|
Predhodno navlažena tla se razdelijo na dele, ki ustrezajo številu preskusnih koncentracij (in referenčne kemikalije, kadar je primerno) ter kontrol, uporabljenih v preskusu. Dodajanje preskusnih kemikalij in uravnavanje vsebnosti vode potekata v skladu z odstavkom 24.
|
Izbira in priprava preskusnih živali
|
17.
|
Priporočena vrsta je partenogena F. candida, ker je v krožnem preskusu preskusne metode (11) pogosteje izpolnjevala merila za veljavnost glede preživetja kot F. fimetaria. Če se uporabi alternativna vrsta, mora izpolnjevati merila za veljavnost iz odstavka 9. Na začetku preskusa morajo biti živali dobro nahranjene in stare 23–26 dni (F. fimetaria) oz. 9– 12 dni (F. candida). Pri vsaki ponovitvi je treba uporabiti 10 samcev in 10 samic za F. fimetaria ter 10 samic za F. candida (glej Dodatek 2 in Dodatek 3). Sinhrone živali se izberejo naključno iz posod, za vsako serijo, ki se doda ponovitvi, pa se preverita njihovo zdravje in fizično stanje. Vsaka skupina 10/20 osebkov se doda v naključno izbrano preskusno posodo, pri čemer se velike samice F. fimetaria izberejo, da se zagotovi razlikovanje od samcev F. fimetaria.
|
Priprava preskusnih koncentracij
|
18.
|
Uporabijo se lahko štiri metode dodajanja preskusne kemikalije: 1) mešanje preskusne kemikalije v tla z vodo kot nosilcem, 2) mešanje preskusne kemikalije v tla z organskim topilom kot nosilcem, 3) mešanje preskusne kemikalije v tla s peskom kot nosilcem ali 4) dodajanje preskusne kemikalije na površino tal. Izbira ustrezne metode je odvisna od značilnosti kemikalije in namena preskusa. Na splošno se priporoča umešanje preskusne kemikalije v tla. Vendar bodo morda potrebni postopki dodajanja, ki so skladni s praktično uporabo preskusne kemikalije (npr. pršenje tekočega pripravka ali uporaba posebnih pesticidnih pripravkov, kot so zrnca ali obloge semen). Tla se tretirajo, preden se vanje vnesejo skakači, razen kadar se preskusna kemikalija doda na površino tal, pri čemer je treba skakačem omogočiti, da vstopijo v tla.
|
Preskusne kemikalija, ki je topna v vodi
|
19.
|
Raztopina preskusne kemikalije se pripravi v deionizirani vodi v dovolj veliki količini za vse ponovitve ene preskusne koncentracije. Vsaka raztopina preskusne kemikalije se temeljito premeša z eno serijo predhodno namočenih tal, preden se doda v preskusno posodo.
|
Preskusna kemikalija, ki ni topna v vodi
|
20.
|
Preskusna kemikalija, ki ni topna v vodi, vendar je topna v organskih topilih, se lahko raztopi v čim manjši prostornini ustreznega topila (npr. acetona), ki še zagotavlja ustrezno mešanje kemikalije v tleh, in zmeša z delom potrebnega kremenovega peska. Uporabijo se lahko le hlapna topila. Če se uporabi organsko topilo, morajo vse preskusne koncentracije in dodatna negativna kontrola s topilom vsebovati enako čim manjšo količino topila. Posode za dodajanje je treba pustiti odkrite dovolj dolgo, da topilo za dodajanje preskusne kemikalije izhlapi, s čimer se prepreči razgradnja preskusne kemikalije v tem času.
|
Preskusna kemikalija, ki je v vodi in organskih topilih slabo topna
|
21.
|
Pri kemikalijah, ki so v vodi in organskih topilih slabo topne, se kremenov pesek, ki mora biti del vsega peska, dodanega tlom, zmeša s količino preskusne kemikalije, ki zagotovi potrebno preskusno koncentracijo. Ta mešanica kremenovega peska in preskusne kemikalije se doda predhodno navlaženim tlom in temeljito zmeša po dodajanju ustrezne količine deionizirane vode, da se zagotovi potreben odstotek vlage. Končna mešanica se razdeli v preskusne posode. Postopek se ponovi za vsako preskusno koncentracijo, pri čemer se pripravi tudi ustrezna kontrola.
|
Dodajanje preskusne kemikalije na površino tal
|
22.
|
Če je preskusna kemikalija pesticid, je lahko ustrezno dodajanje na površino tal s pršenjem. Tla se tretirajo, ko se vanje dodajo skakači. Preskusne posode se najprej napolnijo z navlaženim substratom tal, dodajo se živali in nato se preskusne posode stehtajo. Da se prepreči neposredna izpostavljenost živali preskusni kemikaliji z neposrednim stikom, se preskusna kemikalija doda vsaj pol ure po vnosu skakačev. Preskusno kemikalijo je treba dodati na površino tal čim bolj enakomerno s primerno laboratorijsko napravo za pršenje, da se simulira pršenje na terenu. Dodajanje mora potekati pri temperaturi v razponu ± 2 °C, za vodne raztopine, emulzije ali disperzije pa pri stopnji nanosa v skladu s priporočili iz ocene tveganja. Stopnjo je treba preveriti z ustrezno kalibracijo. Posebne formulacije, kot so zrnca ali obloge semen, se lahko dodajajo, kot je skladno z uporabo v kmetijstvu. Hrana se doda po pršenju.
|
POSTOPEK
Preskusni pogoji
|
23.
|
Srednja temperatura preskusa mora biti 20 °C ± 1 °C s temperaturnim razponom 20 °C ± 2 °C. Preskus se izvede pri nadzorovanih ciklih svetlobe in teme (po možnosti 12 ur svetlobe in 12 ur teme) z osvetljenostjo od 400 do 800 luksov na območju preskusnih posod.
|
|
24.
|
Da se preveri vlažnost tal, se posode tehtajo na začetku preskusa, sredi preskusa in na koncu preskusa. Izguba vode > 2 % se nadomesti z dodajanjem deionizirane vode. Opozoriti je treba, da se lahko izguba vode zmanjša z vzdrževanjem visoke vlažnosti zraka (> 80 %) v preskusnem inkubatorju.
|
|
25.
|
pH je treba izmeriti na začetku in koncu preskusa za določanje območja delovanja in končnega preskusa. Meritve je treba izvesti v enem dodatnem kontrolnem vzorcu in enem dodatnem vzorcu vzorcev tretiranih tal (vse koncentracije), ki se pripravi in vzdržuje enako kot preskusne kulture, vendar brez dodajanja skakačev.
|
Preskusni postopek in meritve
|
26.
|
Za vsako koncentracijo se v preskusno posodo doda količina preskusnih tal, ki ustreza 30 g sveže teže. Pripravijo se tudi kontrole z vodo brez preskusne kemikalije. Če se za dodajanje preskusne kemikalije uporablja vehikel, je treba poleg preskusnih serij izvesti tudi kontrolne serije, ki vsebujejo samo vehikel. Koncentracija topila ali disperzijskega sredstva mora biti enaka kot koncentracija v preskusnih posodah s preskusno kemikalijo.
|
|
27.
|
Posamezni skakači se previdno prenesejo v posamezno preskusno posodo (naključno porazdeljeni v preskusne posode) in položijo na površino tal. Za učinkovit prenos živali se lahko uporabi nizkotlačni sesalnik. Število ponovitev za preskusne koncentracije in kontrole je odvisno od uporabljenega načrta preskusa. Preskusne posode se naključno razporedijo po preskusnem inkubatorju in nato vsak teden naključno prerazporedijo.
|
|
28.
|
Za preskus s F. fimetaria je treba uporabiti 20 odraslih osebkov, od tega 10 samcev in 10 samic, starih 23–26 dni. Na 21. dan se skakači ekstrahirajo iz tal in preštejejo. Pri F. fimetaria se spol loči po velikosti v seriji sinhronih živali, uporabljeni za preskus. Samice so značilno večje od samcev (glej Dodatek 3).
|
|
29.
|
Za preskus s F. candida je treba uporabiti deset 9– 12 dni starih mladičev na preskusno posodo. Na 28. dan se skakači ekstrahirajo iz tal in preštejejo.
|
|
30.
|
Kot primeren vir hrane se na začetku preskusa in po približno dveh tednih v vsako posodo doda ustrezna količina, npr. 2– 10 mg, zrnastega suhega pekovskega kvasa, ki je komercialno dostopen za uporabo v gospodinjstvu.
|
|
31.
|
Na koncu preskusa se ocenita smrtnost in razmnoževanje. Po treh (F. fimetaria) ali štirih tednih (F. candida) se skakači ekstrahirajo iz preskusnih tal (glej Dodatek 4) in preštejejo (12). Skakač se šteje za mrtvega, če pri štetju ni prisoten. Metodi ekstrakcije in štetja morata biti validirani. Validacija vključuje učinkovitost ekstrakcije mladičev, ki je večja od 95 %, npr. z dodajanjem znanega števila v tla.
|
|
32.
|
Praktični povzetek in časovni razpored preskusnega postopka sta opisana v Dodatku 2.
|
Načrt preskusa
Preskus za določanje območja delovanja
|
33.
|
Po potrebi se preskus za določanje območja delovanja izvede na primer s petimi koncentracijami preskusne kemikalije, in sicer 0,1, 1,0, 10, 100 in 1 000 mg/kg suhe teže tal ter dvema ponovitvama za vsako tretiranje in kontrolo. Pri določanju območja koncentracij, ki jih je treba uporabiti pri preskusu za določanje območja delovanja, so lahko uporabne tudi dodatne informacije o smrtnosti in razmnoževanju skakačev, ki izhajajo iz preskusov s podobnimi kemikalijami ali iz literature.
|
|
34.
|
Preskus za določanje območja delovanja traja dva tedna pri F. fimetaria in tri tedne pri F. candida, da se dobi eno leglo mladičev. Na koncu preskusa se ocenita smrtnost in razmnoževanje skakačev. Zabeležiti je treba število odraslih in pojav mladičev.
|
Končni preskus
|
35.
|
Za določitev ECx (npr. EC10, EC50) je treba uporabiti dvanajst koncentracij. Priporočata se vsaj dve ponovitvi za vsako tretiranje s preskusno koncentracijo in šest kontrolnih ponovitev. Faktor oddaljenosti se lahko razlikuje glede na vzorec odziva na odmerek.
|
|
36.
|
Za določitev NOEC/LOEC je treba preskusiti vsaj pet koncentracij v geometrijskem zaporedju. Priporočajo se vsaj štiri ponovitve za vsako tretiranje s preskusno koncentracijo in osem kontrol. Razmik med koncentracijami je treba določiti s faktorjem, ki ne presega 1,8.
|
|
37.
|
Združen pristop omogoča določitev NOEC/LOEN in ECx. Pri tem združenem pristopu je treba uporabiti osem koncentracij za tretiranje v geometrijskem zaporedju. Priporočajo se vsaj štiri ponovitve za vsako tretiranje in osem kontrol. Razmik med koncentracijami je treba določiti s faktorjem, ki ne presega 1,8.
|
|
38.
|
Če se pri preskusu za določanje območja delovanja ne opazijo učinki pri najvišji koncentraciji (tj. 1 000 mg/kg), se lahko kot mejni preskus izvede preskus razmnoževanja, pri čemer se uporabita preskusna koncentracija 1 000 mg/kg in kontrola. Z mejnim preskusom se zagotovi priložnost za dokaz, da pri mejni koncentraciji ni statistično značilnega učinka. Osem ponovitev je treba uporabiti tako za tretirana tla kot kontrolo.
|
PODATKI IN POROČANJE
Obdelava rezultatov
|
39.
|
Sposobnost razmnoževanja je glavna končna točka (npr. število ustvarjenih mladičev na preskusno posodo). S statistično analizo, npr. postopki analize variance, se primerjajo tretiranja s t-preskusom, Dunnettovim preskusom ali Williamsovim preskusom. Za sredine posameznih tretiranj se izračunajo 95-odstotni intervali zaupanja.
|
|
40.
|
Število preživelih odraslih v netretiranih kontrolah je pomembno merilo za veljavnost in ga je treba dokumentirati. Tako kot pri preskusu za določanje območja delovanja je treba v končnem poročilu navesti tudi vse druge škodljive znake.
|
LCx in ECx
|
41.
|
Vrednosti ECx, vključno s spodnjimi in zgornjimi 95-odstotnimi mejami zaupanja za parameter, povezanimi z njimi, se izračunajo po ustreznih statističnih metodah (npr. logistična ali Weibullova funkcija, spremenjena metoda Spearman-Karber ali linearna interpolacija). ECx se pridobi tako, da se v postavljeno enačbo vstavi vrednost, ki ustreza x % sredine kontrole. Za izračun EC50 ali katere koli druge vrednosti ECx je treba za celoten niz podatkov opraviti regresijsko analizo. LC50 se običajno oceni z analizo probit ali podobno analizo, ki upošteva binomsko porazdeljene podatke o smrtnosti.
|
NOEC/LOEC
|
42.
|
Če se bo NOEC/LOEC določala s statistično analizo, so potrebni statistični podatki (posamezne posode se štejejo za ponovitve) po posodah. Uporabiti je treba ustrezne statistične metode v skladu z dokumentom OECD št. 54 o sedanjih pristopih k statistični analizi podatkov o ekotoksičnosti: smernica za uporabo (9). Na splošno se škodljivi učinki preskusne kemikalije v primerjavi s kontrolo proučujejo s preskušanjem enostransko zastavljene hipoteze pri p ≤ 0,05.
|
|
43.
|
Normalna porazdelitev in homogenost varianc se lahko preskusita z ustreznim statističnim preskusom, npr. Shapiro-Wilkovim preskusom oz. Levenejevim preskusom (p ≤ 0,05). Izvedejo se lahko enofaktorska analiza variance (ANOVA) in nadaljnje metode večkratne primerjave. Metode večkratne primerjave (npr. Dunnettov preskus) ali regresivni preskusi trenda (npr. Williamsov preskus) se lahko uporabijo za izračun, ali obstajajo znatne razlike (p ≤ 0,05) med kontrolami in različnimi koncentracijami preskusne kemikalije (izbira priporočenega preskusa v skladu s dokumentom OECD št. 54 (9)). V nasprotnem primeru se lahko za določitev NOEC in LOEC uporabijo neparametrične metode (npr. Bonferronijev U-preskus v skladu s preskusom trenda po Holmu ali Jonckheere-Terpstraju).
|
Mejni preskus
|
44.
|
Če je bil mejni preskus (primerjava kontrol in izključeno enega tretiranja) izveden in so izpolnjeni predpogoji za postopke parametričnega preskusa (normalnost, homogenost), se lahko odzivi metrik ocenijo s t-preskusom. Če te zahteve niso izpolnjene, se lahko uporabi t-preskus za neenake variance (Welchev t-preskus) ali neparametrični preskus, kot je Mann-Whitneyjev U-preskus.
|
|
45.
|
Za določanje znatnih razlik med kontrolami (kontrola in kontrola s topilom) se lahko ponovitve posameznih kontrol preskusijo, kot je opisano za mejni preskus. Če se znatne razlike s temi preskusi ne zaznajo, se lahko vse kontrolne ponovitve in kontrolne ponovitve s topilom združijo. V nasprotnem primeru je treba vsa tretiranja primerjati s kontrolo s topilom.
|
Poročilo o preskusu
|
46.
|
V poročilu o preskusu morajo biti vsaj naslednje informacije:
|
|
Preskusna kemikalija
|
—
|
identiteta preskusne kemikalije, serija, skupina in številka CAS, čistoča,
|
|
—
|
fizikalno-kemijske lastnosti preskusne kemikalije (npr. Kow, topnost v vodi, parni tlak, Henryjeva konstanta (H) in po možnosti informacije o končnem stanju preskusne kemikalije v tleh), če so na voljo,
|
|
—
|
formulacija preskusne kemikalije in navedba dodatkov, če se ne preskuša čista kemikalija.
|
|
|
|
Preskusni organizmi
|
—
|
identifikacija vrste in dobavitelja preskusnih organizmov, opis pogojev razmnoževanja in starostni razpon preskusnih organizmov.
|
|
|
|
Preskusni pogoji
|
—
|
opis načrta poskusa in postopkov,
|
|
—
|
podrobnosti o pripravi preskusnih tal, natančna specifikacija, če se uporabijo naravna tla (izvor, zgodovina, porazdelitev delcev glede na velikost, pH, vsebnost organske snovi),
|
|
—
|
zmogljivost tal za zadrževanje vode,
|
|
—
|
opis tehnike, uporabljene za dodajanje preskusne kemikalije v tla,
|
|
—
|
preskusni pogoji: jakost svetlobe, trajanje ciklov svetlobe in teme, temperatura,
|
|
—
|
opis načina hranjenja, vrsta in količina hrane, uporabljene v preskusu, datumi hranjenja,
|
|
—
|
pH in vsebnost vode v tleh na začetku in koncu preskusa (kontrola in posamezno tretiranje),
|
|
—
|
natančen opis metode ekstrakcije in učinkovitosti ekstrakcije.
|
|
|
|
Rezultati preskusa
|
—
|
število mladičev, določeno v posamezni preskusni posodi na koncu preskusa,
|
|
—
|
število odraslih in njihova smrtnost ( %) v posamezni preskusni posodi na koncu preskusa,
|
|
—
|
opis očitnih fizioloških ali patoloških simptomov ali izrazitih sprememb v obnašanju,
|
|
—
|
rezultati, pridobljeni z referenčno preskusno kemikalijo,
|
|
—
|
vrednosti NOEC/LOEC, LCx za smrtnost in ECx za razmnoževanje (zlasti LC50, LC10, EC50, in EC10) skupaj s 95-odstotnimi intervali zaupanja. Graf prilagojenega modela, uporabljenega za izračun, enačba njegove funkcije in njegovi parametri (glej (9)),
|
|
—
|
vse informacije in opažanja, koristni za razlago rezultatov,
|
|
—
|
vrednost dejanskega preskusa, če se izvede preskušanje domnev (9),
|
|
—
|
odstopanja od postopkov, opisanih v tej preskusni metodi, in vsi nenavadni pojavi med preskusom,
|
|
—
|
če se oceni NOEC, najmanjša zaznavna razlika.
|
|
|
LITERATURA
|
(1)
|
Wiles, J. A., in Krogh, P. H. (1998). Testing with the collembolans I. viridis, F. candida and F. fimetaria. V: Handbook of soil invertebrate toxicity tests (ur. H Løkke in CAM Van Gestel), str. 131– 156. John Wiley & Sons, Ltd., Chichester.
|
|
(2)
|
ISO (1999) Soil Quality – Effects of soil pollutants on Collembola (Folsomia candida): Method for determination of effects on reproduction. No. 11267. Mednarodna organizacija za standardizacijo, Ženeva.
|
|
(3)
|
Burges, A., in Raw, F. (ur.) (1967). Soil Biology. Academic Press. London.
|
|
(4)
|
Petersen, H., in Luxton, M. (1982). A comparative analysis of soil fauna populations and their role in decomposition processes. Oikos 39: 287–388.
|
|
(5)
|
Petersen, H. (1994). A review of collembolan ecology in ecosystem context. Acta Zoologica Fennica 195: 111– 118.
|
|
(6)
|
Hopkin, S. P. (1997). Biology of the Springtails (Insecta: Collembola). Oxford University Press. 330 str. (ISBN 0-19-854084-1).
|
|
(7)
|
Ulber, B. (1983). Einfluss von Onychirurus fimatus Gisin (Collembola, Onychiuridae) und Folsomia fimetaria L. (Collembola, Isotomidae) auf Pythium ultimum Trow. einen Erreger des Wurzelbrandes der Zuckerrübe. V: New trends in soil Biology (Lebrun, Ph., André, H. M., De Medts, A., Grégoire-Wibo, Wauthy, G. (ur.), Proceedings of the VI. international colloquium on soil zoology, Louvain-la-neuve (Belgija), od 30. avgusta do 2. septembra 1982, I Dieu-Brichart, Ottignies-Louvain-la-Neuve, str. 261–268.
|
|
(8)
|
Poglavje C.36 te priloge, Preskus razmnoževanja plenilske pršice (Hypoaspis (Geolaelaps) aculeifer) v tleh.
|
|
(9)
|
OECD (2006). Current approaches in the statistical analysis of ecotoxicity data: a guidance to application. OECD series on testing and assessment Number 54, ENV/JM/MONO(2006)18, OECD Pariz.
|
|
(10)
|
Scott-Fordsmand, J. J., in Krogh, P. H. (2005). Background report on prevalidation of an OECD springtail test guideline. Environmental Project Nr. 986. Miljøstyrelsen 61 str. Dansko ministrstvo za okolje.
|
|
(11)
|
Krogh, P. H. (2009). Toxicity testing with the collembolans Folsomia fimetaria and Folsomia candida and the results of a ringtest. Danska agencija za varstvo okolja, okoljski projekt št. 1256, str. 66.
|
|
(12)
|
Krogh, P. H., Johansen, K., in Holmstrup, M. (1998). Automatic counting of collembolans for laboratory experiments. Appl. Soil Ecol. 7, 201–205.
|
|
(13)
|
Fjellberg, A. (1980). Identification keys to Norwegian collembolans. Norsk Entomologisk Forening.
|
|
(14)
|
Edwards, C. A. (1955). Simple techniques for rearing Collembola, Symphyla and other small soil inhabiting arthropods. V: Soil Zoology (Kevan D. K. McE., ur.). Butterworths, London, str. 412–416.
|
|
(15)
|
Goto, H. E. (1960). Simple techniques for the rearing of Collembola and a not on the use of a fungistatic substance in the cultures. Entomologists' Monthly Magazine 96: 138– 140.
|
Dodatek 1
Opredelitve
Za to preskusno metodo se uporabljajo naslednje opredelitve (v tem preskusu so vse učinkovite koncentracije izražene kor masa preskusne kemikalije na suho maso preskusnih tal):
|
|
Kemikalija je snov ali zmes.
|
|
|
NOEC (koncentracija brez opaznega učinka) je koncentracija preskusne kemikalije, pri kateri se učinki ne opazijo. V tem preskusu koncentracija, ki ustreza NOEC, v primerjavi s kontrolo nima statistično značilnega učinka (p < 0,05) v določenem obdobju izpostavljenosti.
|
|
|
LOEC (najnižja koncentracija z opaznim učinkom) je najnižja koncentracija preskusne kemikalije, ki ima v primerjavi s kontrolo statistično značilen učinek (p < 0,05) v določenem obdobju izpostavljenosti.
|
|
|
ECx (koncentracija z učinkom za x-odstotni učinek) je koncentracija, ki v primerjavi s kontrolo povzroči x-odstotni učinek na preskusni organizem v določenem obdobju izpostavljenosti. EC50 je na primer koncentracija, za katero se oceni, da bo imela v določenem obdobju izpostavljenosti učinek na končno točko preskusa pri 50 % izpostavljene populacije.
|
|
|
Preskusna kemikalija je vsaka snov ali zmes, preskušena z uporabo te preskusne metode.
|
Dodatek 2
Glavni ukrepi in časovni razpored za izvedbo preskusa pri skakačih
Koraki preskusa so naslednji:
|
Čas (dan)
|
Ukrep
|
|
– 23 do – 26
|
priprava sinhrone kultureF. Fimetaria;
|
|
– 14
|
priprava umetnih tal (mešanje suhih sestavin);
preverjanje pH umetnih tal in ustrezna prilagoditev;
meritev največje zmogljivosti tal za zadrževanje vode;
|
|
– 9 do – 12
|
priprava sinhrone kultureF. Candida;
|
|
– 2 do – 7
|
predhodna navlažitev tal;
|
|
– 1
|
razporeditev mladičev v skupine;
priprava založnih raztopin in dodajanje preskusne kemikalije, če je potrebno topilo;
|
|
0
|
priprava založne raztopine in dodajanje preskusne kemikalije, če je potrebna uporaba trdne kemikalije, vodotopne kemikalije ali dodajanja na površino;
meritev pH tal in tehtanje posod;
dodajanje hrane. Vnos skakačev;
|
|
14
|
preskus za določanje območja delovanja za F. fimetaria: prekinitev preskusa, ekstrakcija živali, meritev pH tal in izgube vode (teža);
končni preskusi: meritev odstotka vlage, nadomestitev vode in dodajanje 2–10 mg kvasa;
|
|
21
|
končni preskus za F. fimetaria: prekinitev preskusa, ekstrakcija živali, merjenje pH tal in izgube vode (teža);
preskus za določanje območja delovanja za F. candida: prekinitev preskusa, ekstrakcija živali, meritev pH tal in izgube vode (teža);
|
|
28
|
končni preskus za F. candida: prekinitev preskusa, ekstrakcija živali, meritev pH tal in izgube vode (teža).
|
Dodatek 3
Smernica za gojenje in sinhronizacijo F. fimetaria in F. candida
Čas in trajanja iz te smernice je treba preveriti pri vsakem posameznem sevu skakačev za zagotovitev, da bo časovni razpored omogočal ustrezno sinhronizirane mladiče. Pojav odlaganja jajčec po prenosu odraslih osebkov v svež substrat in izvalitev iz jajčec določata ustrezen dan za zbiranje jajčec in sinhronih mladičev.
Priporoča se, da stalna založna kultura zajema npr. 50 posod/petrijevk. Prehranjevalne pogoje založne kulture je treba dobro vzdrževati s tedenskim hranjenjem, dodajanjem vode ter odstranjevanjem stare hrane in trupel. Premalo skakačev na substratu lahko privede do zaviranja zaradi večje rasti plesni. Če se založna kultura prepogosto uporablja za proizvajanje jajčec, se lahko kultura utrudi. Znaki utrujenosti so mrtvi odrasli in plesen na substratu. Jajčeca, ki ostanejo pri pridobivanju sinhronih živali, se lahko uporabijo za pomlajevanje kulture.
V sinhroni kulturi F. fimetaria se samci ločijo od samic zlasti po velikosti. Samci so očitno manjši od samic in hodijo hitreje od samic. Za pravilno izbiro spola je potrebne nekaj prakse in se lahko potrdi z mikroskopskim pregledom genitalnega dela (13).
1. Gojenje
1.a Priprava gojiščnega substrata
Gojiščni substrat je mavec (kalcijev sulfat) z aktivnim ogljem. To zagotavlja vlažen substrat, pri čemer je funkcija oglja absorpcija odpadnih plinov in iztrebkov (14) (15). Za lažje opazovanje skakačev se lahko uporabijo različne oblike oglja. Za F. candida in F. fimetaria se na primer uporablja oglje v prahu (zagotavlja črn/siv mavec):
Sestavine substrata:
|
—
|
200 ml destilirane vode,
|
ali
|
—
|
50 g aktivnega oglja v prahu,
|
|
—
|
260–300 ml destilirane vode,
|
Zmes substrata se pred uporabo strdi.
1.b Razmnoževanje
Skakači so v posodah, kot so petrijevke (90 mm × 13 mm), katerih dno je prekrito z 0,5 cm debelo plastjo substrata iz mavca/oglja. Gojijo se pri 20 °C ± 1 °C ter ciklu 12 ur svetlobe in 12 ur teme (400–800 luksov). Posode so vedno vlažne, kar zagotavlja, da je relativna vlažnost zraka v njih 100-odstotna. To se lahko zagotovi s prisotnostjo proste vode v poroznem mavcu, vendar je treba preprečiti nastanek vodnega filma na površini mavca. Izguba vode se lahko prepreči z zagotavljanjem vlažnega zraka prostora. Vse mrtve živali in plesnivo hrano je treba odstraniti iz posod. Za spodbujanje proizvajanja jajčec je treba odrasle živali prenesti v petrijevke z novo pripravljenim substratom iz mavca/oglja.
1.c Vir hrane
Kot edini vir hrane za F. candida in F fimetaria se uporablja zrnasti suhi pekovski kvas. Sveža hrana se dodaja enkrat ali dvakrat na teden, da se prepreči nastajanje plesni. V majhnem kupu se položi neposredno na mavec. Količino dodanega pekovskega kvasa je treba prilagoditi velikosti populacije skakačev, vendar na splošno ustreza 2–15 mg.
2. Sinhronizacija
Preskus je treba izvesti s sinhroniziranimi živalmi, da se zagotovijo homogene preskusne živali enakega stadija in velikosti. Sinhronizacija omogoča tudi ločevanje samcev in samic F. fimetaria, ko so stari tri tedne, na podlagi spolnega dimorfizma, tj. razlik v velikosti. Spodnji postopek je predlog za pridobivanje sinhroniziranih živali (praktični koraki niso obvezni).
2.a Sinhronizacija
|
—
|
Pripravijo se posode z 0,5 cm debelo plastjo substrata iz mavca/oglja.
|
|
—
|
Za odlaganje jajčec se 150–200 odraslih osebkov F. fimetaria in 50–100 F. candida iz najboljših 15–20 posod z založno kulturo s 4–8 tednov starim substratom prenese v posode, kjer se jih hrani s 15 mg pekovskega kvasa. Izogniti se je treba prenosu mladičev skupaj z odraslimi, saj lahko prisotnost mladičev zavira proizvajanje jajčec.
|
|
—
|
Kultura se vzdržuje pri 20 °C ± 1 °C (sredina mora biti 20 °C) ter ciklu 12 ur svetlobe in 12 ur teme (400–800 luksov). Zagotovita se razpoložljivost sveže hrane in nasičenost zraka z vodo. Zaradi pomanjkanja hrane se lahko živali iztrebljajo na jajčeca, kar povzroča rast plesni na njih, F. candida pa lahko poje lastna jajčeca. Po 10 dneh se jajčeca skrbno zberejo z iglo in lopatico ter prenesejo na ‚papir za jajčeca‘ (majhni kosi filtrirnega papirja, pomočeni v kašo iz mavca/oglja), ki se položi v posodo s svežim substratom iz mavca/oglja Substratu se doda nekaj zrn kvasa, ki spodbujajo mladiče, da zapustijo papir za jajčeca. Pomembno je, da sta papir za jajčeca in substrat vlažna, sicer lahko jajčeca dehidrirajo. Namesto tega se lahko odrasle živali odstranijo iz gojiščnih posod za sinhronizacijo, ko 2 ali 3 dni proizvajajo jajčeca.
|
|
—
|
Po treh dneh se bo večina jajčec na papirju za jajčeca izlegla, pri čemer se lahko nekateri mladiči nahajajo pod papirjem za jajčeca.
|
|
—
|
Za zagotovitev enako starih mladičev se papir za jajčeca, na katerem so neizvaljena jajčeca, odstrani iz petrijevke s prijemalkami. Mladiči, zdaj stari 0–3 dni, ostanejo v posodi in se hranijo s pekovskim kvasom. Neizvaljena jajčeca se zavržejo.
|
|
—
|
Jajčeca in izvaljeni mladiči se gojijo enako kot odrasli. Zlasti za F. fimetaria je treba sprejeti naslednje ukrepe: zagotovitev ustrezne sveže hrane, odstranjevanje stare in plesnive hrane in razdelitev mladičev v nove petrijevke po enem tednu, če je gostota večja od 200.
|
2.b Ravnanje s skakači ob začetku preskusa
|
—
|
Devet do dvanajsti dni stari osebki F. candida ali 23–26 dni stari osebki F. fimetaria se zberejo, npr. s sesanjem, in spustijo v majhno posodo z vlažnim substratom iz mavca/oglja, pod binokularnim mikroskopom pa se pregleda njihovo fizično stanje (poškodovane živali se zavržejo). Vse korake je treba izvesti medtem, ko so skakači v vlažni atmosferi, da se prepreči stres zaradi pomanjkanja vode, npr. z uporabo namočenih površin itd.
|
|
—
|
Posoda se obrne navzdol, pri čemer se potrka nanjo, da se skakači prenesejo v tla. Statično elektriko je treba nevtralizirati, sicer lahko živali poletijo v zrak ali se prilepijo na stran preskusne posode in izsušijo. Za nevtralizacijo se lahko uporabi ionizator ali vlažna krpa pod posodo.
|
|
—
|
Hrano je treba razporediti po vsej površini tal in ne le v enem kupu.
|
|
—
|
Med prenosom in preskušanjem se ne sme udarjati po preskusnih posodah ali jih drugače fizično motiti, saj bi to lahko povečalo stiskanje tal in oviralo interakcijo med skakači.
|
3. Alternativne vrste skakačev
Za preskušanje po tej preskusni metodi se lahko izberejo druge vrste skakačev, kot so Proisotoma minuta, Isotoma viridis, Isotoma anglicana, Orchesella cincta, Sinella curviseta, Paronychiurus kimi, Orthonychiurus folsomi in Mesaphorura macrochaeta. Pred uporabo alternativnih vrst morajo biti izpolnjeni številni predpogoji:
|
—
|
biti morajo nedvoumno identificirane,
|
|
—
|
izbiro vrste je treba utemeljiti,
|
|
—
|
zagotoviti je treba, da je v fazo preskušanja vključena reproduktivna biologija, da bo to med izpostavljenostjo potencialen cilj,
|
|
—
|
znana mora biti zgodovina življenja: starost pri zrelosti, trajanje razvoja jajčec in stadiji, v katerih poteka izpostavljenost,
|
|
—
|
s preskusnim substratom in virom hrane je treba zagotoviti optimalne pogoje za rast in razmnoževanje,
|
|
—
|
variabilnost mora biti ustrezno nizka za natančno in točno oceno strupenosti.
|
Dodatek 4
Ekstrakcija in štetje živali
1. Ekstrakcija se lahko izvede na dva načina.
|
1.a
|
Prvi način: uporabi se lahko ekstraktor z nadzorovanim padanjem temperature, ki temelji na MacFadyenovih načelih (1). Toplota prihaja iz grelnega elementa na vrhu ekstrakcijske posode (uravnava se s termistorjem na površini vzorca tal). Temperatura v ohlajeni tekočini, ki obdaja zbiralno posodo, se uravnava s termistorjem na površini zbiralne posode (pod jedrom tal). Termistorja sta povezana s krmilno enoto, ki se lahko programira in poveča temperaturo glede na predhodno nastavljen urnik. Živali se zberejo v ohlajeni zbiralni posodi (2 °C) s spodnjo plastjo mavca/oglja. Ekstrakcija se začne pri 25 °C, pri čemer se temperatura vsakih 12 ur samodejno poveča za 5 °C, skupaj pa traja 48 ur. Ekstrakcija je končana po 12 urah pri 40 °C.
|
|
1.b
|
Drugi način: po inkubacijski dobi po poskusu se število mladičev skakačev oceni s flotacijo. Za ta namen se preskus izvede v posodah s prostornino približno 250 ml. Na koncu preskusa se doda približno 200 ml vode. Tla se nežno premešajo s finim čopičem, kar skakačem omogoči lebdenje na vodni gladini. Vodi se lahko doda majhna količina, približno 0,5 ml, črne fotografske barve Kentmere, s čimer se zaradi večjega kontrasta med vodo in belimi skakači olajša štetje. Barva za skakače ni strupena.
|
2. Štetje:
Šteje se lahko s prostim očesom ali pod svetlobnim mikroskopom z mrežo nad posodo za flotacijo ali s fotografiranjem površine posamezne posode in poznejšim štetjem skakačev na povečanih slikah ali projiciranih diapozitivih. Štetje se lahko izvede tudi s tehnikami digitalne obdelave slik (12). Vse tehnike morajo biti validirane.
Dodatek 5
Določitev največje zmogljivosti tal za zadrževanje vode
Ugotovljeno je bilo, da je naslednja metoda za določanje največje zmogljivosti tal za zadrževanje vode (WHC) ustrezna. Opisana je v Prilogi C k ISO DIS 11268-2 (Kakovost tal – Vpliv onesnaževal na deževnike (Eisenia fetida). Del 2: Določitev vpliva na razmnoževanje).
Z ustrezno napravo na vzorčenje (npr. svedrasti vzorčevalnik) se zbere določena količina (npr. 5. g) substrata preskusnih tal. Dno vzorčevalnika se pokrije s kosom mokrega filtrirnega papirja, nato pa se postavi na podstavek v vodni kopeli. Vzorčevalnik je treba postopno potopiti, dokler ni nivo vode nad vrhom tal. Nato ga je treba pustiti v vodi približno tri ure. Ker ni mogoče ohraniti vse vode, ki so jo absorbirale kapilare v tleh, se mora vzorec tal odtekati dve uri, tako da se vzorčevalnik položi na podlago iz zelo mokrega fino drobljenega kremenovega peska v pokriti posodi (da se prepreči izsušitev). Nato je treba vzorec stehtati in sušiti do konstantne mase pri 105 °C. Zmogljivost zadrževanja vode (WHC) je treba izračunati, kot sledi:

pri čemer je:
|
S
|
=
|
substrat, prepojen z vodo + masa cevi + masa filtrirnega papirja,
|
|
T
|
=
|
tara (masa cevi + masa filtrirnega papirja),
|
|
D
|
=
|
suha masa substrata.
|
Dodatek 6
Določanje pH tal
Naslednja metoda za določanje pH tal temelji na opisu iz ISO DIS 10390: Kakovost tal – Določanje pH.
Določena količina tal se suši pri sobni temperaturi vsaj 12 ur. Suspenzija tal (ki vsebuje vsaj 5 g tal) se nato naredi v petkratni prostornini tal z 1 M raztopine analitsko čistega kalijevega klorida (KCl) ali 0,01 M raztopine analitsko čistega kalcijevega klorida (CaCl2). Suspenzija se temeljito pretresa pet minut in nato počiva vsaj dve uri, vendar ne dlje kot 24 ur. Nato se pH tekoče faze izmeri z merilnikom vrednosti pH, ki je pred vsakim merjenjem kalibriran z ustrezno serijo puferskih raztopin (npr. pH 4,0 in 7,0).
C.40 PRESKUS STRUPENOSTI ŽIVLJENJSKEGA CIKLA S TRZAČAMI V SISTEMU VODE IN USEDLINE Z UPORABO VODE S PRIMEŠANO PRESKUSNO SNOVJO ALI USEDLINE S PRIMEŠANO PRESKUSNO SNOVJO
UVOD
|
1.
|
Ta preskusna metoda ustreza Smernici za preskušanje OECD (TG) 233 (2010). Zasnovana je za ocenjevanje učinkov vseživljenjske izpostavljenosti sladkovodnega dvokrilca Chironomus sp. kemikalijam ter v celoti zajema prvo generacijo (generacija P) in zgodnji del druge generacije (generacija F1). Je razširitev obstoječih preskusnih metod C.28 (1) in C.27 (15) z uporabo scenarija izpostavljenosti vodi s primešano preskusno snovjo oziroma usedlini s primešano preskusno snovjo. Upošteva obstoječe protokole za preskušanje strupenosti za Chironomus riparius in Chironomus dilutus (ki sta se prej imenovala C. tentans (2)), ki so bili pripravljeni v Evropi in Severni Ameriki (3) (4) (5) (6) (7) (8) (9) ter nato krožno preskušeni (1) (7) (10) (11) (12). Uporabijo se lahko tudi druge dobro dokumentirane vrste trzače, npr. Chironomus yoshimatsui (13) (14). Celotna izpostavljenost traja približno 44 dni za C. riparius in C. yoshimatsui ter približno 100 dni za C. dilutus.
|
|
2.
|
V tej preskusni metodi je opisan tako scenarij izpostavljenosti vodi kot scenarij izpostavljenosti usedlini. Izbira ustreznega scenarija izpostavljenosti je odvisna od namena uporabe preskusa. Scenarij izpostavljenosti, ki vključuje primešanje preskusne snovi v vodni stolpec, je namenjen simulaciji pojava zanašanja pesticidov in zajema začetno najvišjo koncentracijo v površinskih vodah. Primešanje preskusne snovi v vodo je uporabno tudi za druge vrste izpostavljenosti (vključno z razlitji kemikalij), vendar ne za procese kopičenja v usedlini, ki trajajo dlje od preskusnega obdobja. V tem primeru in če je odtekanje glavni način vnosa pesticidov v vodna telesa, je lahko primernejši načrt z usedlino s primešano preskusno snovjo. Če so drugi scenariji izpostavljenosti aktualni, se lahko načrt preskusa enostavno prilagodi. Če razporeditev preskusne kemikalije med vodno fazo in usedlino na primer ni aktualna in je treba čim bolj zmanjšati adsorpcijo v usedlino, se lahko predvidi uporaba nadomestne umetne usedline (npr. kremenovega peska).
|
|
3.
|
Kemikalije, za katere je treba preskusiti organizme, živeče v usedlini, se lahko v usedlini ohranijo zelo dolgo. Organizmi, živeči v usedlinah, so lahko izpostavljeni na številne načine. Relativni pomen vsakega načina izpostavljenosti in čas, da ta prispeva k skupnim strupenim učinkom, sta odvisna od fizikalno-kemijskih lastnosti kemikalije. Pri kemikalijah, ki se močno adsorbirajo, ali kemikalijah, ki se kovalentno vežejo na usedlino, je lahko zaužitje onesnažene hrane pomemben način izpostavljenosti. Da ne bi podcenili strupenosti visoko lipofilnih kemikalij, se lahko predvidi uporaba hrane, dodane usedlini pred uporabo preskusne kemikalije (glej odstavek 31). Zato se lahko vključijo vsi načini izpostavljenosti in vsi življenjske faze.
|
|
4.
|
Izmerjene končne točke so skupno število odraslih preobraženih osebkov (za prvo in drugo generacijo), hitrost razvoja (za prvo in drugo generacijo), razmerje med spoloma pri živih odraslih, v celoti preobraženih osebkih (za prvo in drugo generacijo), število nizov jajčec na samice (samo prva generacija) in fertilnost nizov jajčec (samo prva generacija).
|
|
5.
|
Zelo se zelo priporoča formulirana usedlina. Ta ima pred naravnimi usedlinami več prednosti:
|
—
|
variabilnost pri poskusih je manjša, saj formulirana usedlina pomeni obnovljivi ‚standardizirani matriks‘, poleg tega ni več treba iskati virov neonesnaženih in čistih usedlin,
|
|
—
|
preskusi se lahko začnejo kadar koli, ne da bi se bilo treba ukvarjati s sezonsko variabilnostjo v preskusni usedlini, poleg tega usedline ni treba predhodno tretirati, da bi se odstranila domorodna favna,
|
|
—
|
nižji stroški v primerjavi z odvzemom zadostne količine usedline na terenu, potrebne za rutinsko preskušanje,
|
|
—
|
formulirana usedlina omogoča primerjave strupenosti in ustrezno razvrstitev kemikalije (3).
|
|
|
6.
|
Uporabljene opredelitve pojmov so navedene v Dodatku 1.
|
NAČELO PRESKUSA
|
7.
|
Ličinke trzače prvega stadija so izpostavljene razponu koncentracije preskusne kemikalije v sistemu vode in usedline. Preskus se začne z vnosom ličink prvega stadija (prva generacija) v preskusne čaše, ki vsebujejo usedlino s primešano preskusno snovjo, ali pa se preskusna kemikalija primeša v vodo po vnosu ličink. Ocenijo se preobrazba trzače, čas do preobrazbe in razmerje med spoloma pri živih odraslih, v celoti preobraženih trzačah. Preobraženi odrasli se prenesejo v kletke za razmnoževanje, da se olajšajo rojenje, parjenje in odlaganje jajčec. Ocenita se število odloženih nizov jajčec in njihova fertilnost. Iz teh nizov jajčec se pridobijo ličinke prvega stadija druge generacije. Te ličinke se prenesejo v sveže pripravljene preskusne čase (postopek primešanja preskusne snovi kot pri prvi generaciji), da se določi sposobnost preživetja druge generacije z oceno njihove preobrazbe, časa do preobrazbe in razmerja med spoloma pri v celoti preobraženih, živih trzačah (shematska predstavitev preskusa življenjskega cikla je navedena v Dodatku 5). Vsi podatki se analizirajo z regresivnim modelom, da se oceni koncentracija, ki bi povzročila x-odstotno zmanjšanje v zvezi z zadevno končno točko, ali s preskušanjem domnev, da se določi koncentracija brez opaznega učinka (NOEC). Pri slednjem je potrebna primerjava odzivov na tretiranje z ustreznimi odzivi na kontrolo s statističnimi preskusi. Opozoriti je treba, da so lahko pri scenariju z vodo s primešano preskusno snovjo v primeru kemikalij, ki se hitro razgradijo, ličinke v poznejši življenjski fazi posamezne generacije (npr. faza bube) izpostavljene znatno manjši ravni koncentracije v vodi nad usedlino kot ličinke prvega stadija. Če je to zadržek in je potrebna primerljiva stopnja izpostavljenosti za posamezno življenjsko fazo, se lahko predvidita naslednji spremembi preskusne metode:
|
—
|
vzporedni preskusi s primešanjem preskusne snovi v različnih življenjskih fazah ali
|
|
—
|
ponavljajoče se primešanje preskusne snovi (ali obnovitev vode nad usedlino) v preskusnem sistemu med obema preskusnima fazama (prva in druga generacija), pri čemer je treba razmike med primešanjem (obnovo) prilagoditi končnim značilnostim preskusne kemikalije.
|
Takšne spremembe so izvedljive le pri scenariju z vodo s primešano preskusno snovjo, vendar ne pri scenariju z usedlino s primešano preskusno snovjo.
|
INFORMACIJE O PRESKUSNI KEMIKALIJI
|
8.
|
Znani morajo biti topnost preskusne kemikalije v vodi, njen parni tlak in log K
ow, izmerjeni ali izračunani porazdelitveni koeficient v usedlini ter stabilnost v vodi in usedlini. Za kvantifikacijo preskusne kemikalije v vodi nad usedlino, porni vodi in usedlini mora biti na voljo zanesljiva analitska metoda z znano in izpričano natančnostjo ter mejo zaznavnosti. Koristni informaciji sta tudi strukturna formula in čistost preskusne kemikalije. Prav tako je koristno poznati obnašanje preskusne snovi v okolju (npr. disipacija, abiotska in biotska razgradnja itd.). Dodatne smernice za preskušanje kemikalij s fizikalno-kemijskimi lastnostmi, zaradi katerih je preskušanje oteženo, so navedene v (16).
|
REFERENČNE KEMIKALIJE
|
9.
|
Referenčne kemikalije se lahko redno preskušajo kot sredstvo za zagotavljanje, da se občutljivost laboratorijske populacije ni spremenila. Tako kot pri vodnih bolhah je dovolj izvedba 48-urnega akutnega preskusa (v skladu s 17). Dokler ni na voljo validirana smernica za akutno preskušanje, se lahko predvidi kronični preskus v skladu s poglavjem C.28 te priloge. Primeri referenčnih strupenih snovi, ki so bile uspešno uporabljene v krožnih preskusih in validacijskih študijah, so: lindan, trifluralin, pentaklorofenol, kadmijev klorid in kalijev klorid (1) (3) (6) (7) (18).
|
VELJAVNOST PRESKUSA
|
10.
|
Za veljavnost preskusa morajo biti izpolnjeni naslednji pogoji:
|
—
|
srednja preobrazba v kontrolnem tretiranju mora biti na koncu obdobja izpostavljenosti pri obeh generacijah vsaj 70-odstotna (1) (7),
|
|
—
|
pri C. riparius in C. yoshimatsui se mora 85 % vseh trzač, preobraženih v odrasle osebke, iz kontrolnega tretiranja v obeh generacijah pojaviti med 12. in 23. dnem po vnosu ličink prvega stadija v posode; pri C. dilutus je sprejemljivo obdobje od 20 do 65 dni,
|
|
—
|
srednje razmerje med spoloma pri živih odraslih, v celoti preobraženih osebkih (kot ženski ali moški del) v kontrolnem tretiranju obeh generacij mora biti vsaj 0,4, vendar ne več kot 0,6,
|
|
—
|
v vsaki kletki za razmnoževanje mora biti število nizov jajčec v kontrolah za prvo generacijo vsaj 0,6 na samico, dodano v kletko za razmnoževanje,
|
|
—
|
delež fertilnih nizov jajčec v posamezni kletki za razmnoževanje kontrol prve generacije mora biti vsaj 0,6,
|
|
—
|
na koncu obdobja izpostavljenosti je treba za obe generaciji v vsaki posodi izmeriti pH in koncentracijo raztopljenega kisika. Koncentracija kisika mora biti vsaj 60 % nasičenosti z zrakom (ASV (24)), pH vode nad usedlino pa mora biti v vseh posodah med 6 in 9,
|
|
—
|
temperatura vode se ne sme razlikovati za več kot ± 1,0 °C.
|
|
OPIS METODE
Preskusne posode in kletke za razmnoževanje
|
11.
|
Ličinke se izpostavijo v 600-mililitrskih steklenih čašah s premerom približno 8,5 cm (glej Dodatek 5). Primerne so tudi druge posode, vendar morajo zagotavljati primerno debelino usedline in vode nad njo. Površina usedline mora biti dovolj velika, da zagotavlja 2 do 3 cm2 na ličinko. Razmerje med debelino usedline in globino vode nad njo mora biti približno 1: 4. Uporabiti je treba kletke za razmnoževanje (vsaka od treh mer mora biti najmanj 30 cm), ki imajo na vrhu in vsaj eni stranici gazo (velikost mreže je približno 1 mm) (glej Dodatek 5). V vsako kletko se za odlaganje jajčec postavi 2-litrska kristalizirka s preskusno vodo in usedlino. Tudi pri kristalizirki mora biti razmerje med debelino usedline in globino vode nad njo približno 1: 4. Ko se nizi jajčec poberejo iz kristalizirke, se prestavijo v 12-mestno mikrotitersko ploščo (en niz na vdolbinico, ki vsebuje vsaj 2,5 ml vode iz kristalizirke s primešano preskusno snovjo) in nato se plošče prekrijejo s pokrovom, da se prepreči znatno izhlapevanje. Uporabijo se lahko tudi druge posode, primerne za vzdrževanje nizov jajčec. Vse preskusne posode in druge naprave, ki bodo prišle v stik s preskusnim sistemom, razen mikrotiterskih plošč, morajo biti v celoti iz stekla ali drugega kemijsko inertnega materiala (npr. politetrafluoroetilena).
|
Izbira vrst
|
12.
|
Če je mogoče, naj se v preskusu uporabi vrsta Chironomus riparius. Uporabi se lahko tudi C. yoshimatsui. C. dilutus je prav tako primerna, vendar je z njo težje delati in zahteva daljše preskusno obdobje. Podrobnosti metod gojenja C. riparius so navedene v Dodatku 2. Informacije o pogojih gojenja do na voljo tudi za C. dilutus (5) in C. yoshimatsui (14). Identifikacijo vrst je treba potrditi pred preskušanjem, ni pa to potrebno pred vsakim preskusom, če organizmi prihajajo iz internega gojišča.
|
Usedlina
|
13.
|
Če je mogoče, je treba uporabiti formulirano usedlino (imenovano tudi rekonstituirana, umetna ali sintetična usedlina). Če se uporabi naravna usedlina, je treba določiti njene značilnosti (vsaj pH in vsebnost organskega ogljika, priporoča se tudi določitev drugih parametrov, kot sta razmerje C/N in granulometrija), poleg tega ne sme biti onesnažena in ne sme vsebovati drugih organizmov, ki bi lahko tekmovali z ličinkami trzač ali jih požrli. Priporoča se tudi, da se usedline pred preskušanjem sedem dni kondicionirajo v preskusnih pogojih. Priporoča se naslednja formulirana usedlina, kot je opisana v (1), (1) (20) (21):
|
a.
|
4–5 % (suha teža) šote: čim bližje pH od 5,5 do 6,0; pomembno je uporabiti fino mleto šoto v prahu (velikost delcev ≤ 1 mm), sušeno le na zraku;
|
|
b.
|
20 % (suhe teže) kaolinske gline (vsebnost kaolinita po možnosti nad 30 %);
|
|
c.
|
75–76 % (suhe teže) kremenovega peska (prevladovati mora fini pesek, pri katerem je več kot 50 % delcev velikih od 50 do 200 μm);
|
|
d.
|
doda se deionizirana voda, tako da je v končni mešanici vlaga 30–50-odstotna;
|
|
e.
|
doda se kemijsko čist kalcijev karbonat (CaCO3), da se pH v končni mešanici usedline uravna na 7,0 ± 0,5;
|
|
f.
|
vsebnost organskega ogljika v končni mešanici mora biti 2 % (±0,5 %), uravnava pa se z ustreznimi količinami šote in peska v skladu s točkama (a) in (c).
|
|
|
14.
|
Vir šote, kaolinske gline in peska mora biti znan. Preveriti je treba, da sestavine usedline niso kemično onesnažene (npr. da ne vsebujejo težkih kovin, organoklornih spojin, in organofosfornih spojin). Primer priprave formulirane usedline je opisan v Dodatku 3. Sprejemljiva je tudi mešanica suhih sestavin, če se dokaže, da se sestavine usedline po dodatku vode nad usedlino ne začnejo ločevati (npr. lebdenje šotnih delcev) in da je šota ali usedlina zadostno kondicionirana.
|
Voda
|
15.
|
Za preskusno vodo je primerna vsaka voda, ki ustreza kemijskim značilnostim sprejemljive vode za redčenje, ki so navedene v dodatkih 2 in 4. Za gojiščno vodo in preskusno vodo je sprejemljiva vsaka primerna voda, naravna voda (površinska ali podzemna voda), modelna razredčevalna voda (glej Dodatek 2) ali deklorirana vodovodna voda, če trzače čas gojenja in preskušanja v njej preživijo brez znakov stresa. Na začetku preskusa mora biti pH preskusne vode med 6 in 9, skupna trdota pa ne sme biti večja od 400 mg/l kot CaCO3. Če se domneva, da bo prišlo do interakcije med ioni, ki povzročajo trdoto vode, in preskusno kemikalijo, je treba uporabiti vodo z manjšo trdoto (v takem primeru se torej ne sme uporabiti medij Elendt M4). Ves čas študije je treba uporabljati isto vrsto vode. Značilnosti vode, navedene v Dodatku 4, je treba izmeriti vsaj dvakrat na leto ali kadar se sumi, da so se morda te značilnosti bistveno spremenile.
|
Založne raztopine – voda s primešano preskusno snovjo
|
16.a.
|
Preskusne koncentracije se izračunajo na podlagi koncentracij v vodnem stolpcu, tj. vodi nad usedlino. Preskusne raztopine izbranih koncentracij se običajno pripravijo z redčenjem založne raztopine. Založne raztopine je po možnosti treba pripraviti tako, da se preskusna snov raztopi v preskusni vodi. V nekaterih primerih bo morda treba uporabiti topila ali disperzijska sredstva, da se pripravi primerno koncentrirana založna raztopina. Primerna topila so na primer aceton, etilen glikol monoetil eter, etilen glikol dimetil eter, dimetil formamid in trietilen glikol. Disperzijska sredstva, ki se lahko uporabijo, so Cremaphor RH40, Tween 80, metil celuloza 0,01 % in HCO-40. Koncentracija sredstva za raztapljanje v končnem preskusnem mediju mora biti minimalna (tj. ≤ 0,1 ml/l) in enaka v vseh posodah s preskusno kemikalijo. Če se uporabi sredstvo za raztapljanje, to ne sme bistveno vplivati na preživetje, kar se kaže s kontrolo s topilom, ki se primerja z negativno kontrolo (z vodo). Vendar si je treba čim bolj prizadevati, da se taki materiali ne uporabijo.
|
Založne raztopine – usedlina s primešano preskusno snovjo
|
16. b.
|
Usedline s primešano preskusno snovjo izbrane koncentracije se običajno pripravijo z dodajanjem raztopine preskusne kemikalije neposredno v usedlino. Založna raztopina preskusne kemikalije, raztopljene v deionizirani vodi, se zmeša s formulirano usedlino z valjčnim mlinom, mešalnikom za krmo ali ročno. Če je preskusna kemikalija slabo topna v vodi, se lahko raztopi v čim manjši prostornini ustreznega organskega topila (npr. heksana, acetona ali kloroforma). Ta raztopina se nato zmeša z 10 g finega kremenovega peska za vsako preskusno posodo. Topilo lahko izhlapi in ga je treba v celoti odstraniti iz peska. Pesek se nato zmeša z ustrezno količino usedline. Za raztapljanje, razpršitev ali emulgiranje preskusne kemikalije se lahko uporabijo samo tista sredstva, ki hitro izhlapijo. Ne smemo pozabiti, da je treba pri pripravi usedline upoštevati količino peska, vnesenega z mešanico preskusne kemikalije in peska (tj. usedlino je torej treba pripraviti z manj peska). Paziti je treba, da je preskusna kemikalija, dodana usedlini, v njej temeljito in enakomerno razporejena. Po potrebi se lahko podvzorci analizirajo, da se ugotovi stopnja homogenosti.
|
NAČRT PRESKUSA
|
17.
|
Načrt preskusa se nanaša na izbiro števila preskusnih koncentracij in razmikov med njimi, število posod za vsako koncentracijo, število ličink na posodo ter število kristalizirk in kletk za razmnoževanje. Načrti za ECx, NOEC in mejni preskus so opisani v nadaljevanju.
|
Načrt za regresijsko analizo
|
18.
|
S preskusom je treba zajeti učinkovito koncentracijo (ECx,) in razpon koncentracije, v katerem je učinek preskusne kemikalije aktualen, da se končna točka ne ekstrapolira zunaj meja dobljenih podatkov. Izogibati se je treba ekstrapolaciji veliko pod najnižjo ali nad najvišjo koncentracijo. Predhoden preskus za določanje območja delovanja v skladu s preskusnima metodama C.27 in C.28 je lahko uporaben za izbiro primernega razpona preskusnih koncentracij.
|
|
19.
|
Pri pristopu ECx je za vsako koncentracijo potrebnih vsaj pet koncentracij in osem ponovitev. Za vsako koncentracijo je treba uporabiti dve kletki za razmnoževanje (A in B). Osem ponovitev se razdeli v dve skupini po štiri ponovitve za posamezno kletko za razmnoževanje. Ta združitev ponovitev je potrebna zaradi števila trzač, ki mora biti v kletki za zanesljivo oceno razmnoževanja. Vendar ima druga generacija ponovno osem ponovitev, ki se začnejo z izpostavljenimi populacijami v kletkah za razmnoževanje. Faktor med koncentracijami ne sme biti večji od 2 (izjema je dopustna, kadar naklon krivulje odmerek-učinek ni strm). Število ponovitev na posamezno posodo s preskusno kemikalijo se lahko zmanjša na šest (tri za vsako posodo za gojenje), če se poveča število preskusnih koncentracij z različnimi učinki. Povečanje števila ponovitev ali zmanjšanje velikosti razmikov med preskusnimi koncentracijami običajno vodi do ožjih intervalov zaupanja okrog ECX.
|
Načrt za oceno NOEC
|
20.
|
Pri pristopu NOEC je treba uporabiti pet preskusnih koncentracij z vsaj osmimi ponovitvami (štiri za vsako kletko za razmnoževanje, A in B), faktor med koncentracijami pa ne sme biti večji od 2. Število ponovitev mora zadostovati, da se zagotovi ustrezna statistična moč za ugotovitev 20-odstotne razlike v primerjavi s kontrolo pri 5-odstotni stopnji značilnosti (α = 0,05). Za hitrost razvoja, plodnost in fertilnost je običajno ustrezna analiza variance (ANOVA), ki ji sledi Dunnettov ali Williamsov preskus (22–25). Za koeficient preobrazbe in razmerje med spoloma je lahko ustrezen Cochran-Armitageev preskus, Fisherjev eksaktni preskus (z Bonferronijevim popravkom) ali Mantel-Haenszelov preskus.
|
Mejni preskus
|
21.
|
Mejni preskus se lahko izvede (ena preskusna koncentracija in kontrola(-e)), če v neobveznem predhodnem preskusu za določanje območja delovanja do največje koncentracije ni bilo opaženih učinkov. Namen mejnega preskusa je pokazati, da se vsi strupeni učinki preskusne kemikalije opazijo pri količinah, ki so večje od preskušene mejne koncentracije. Za vodo se predlaga 100 mg/l, za usedlino pa 1 000 mg/kg (suha teža). Običajno je potrebnih vsaj osem ponovitev za tretirane in kontrolne posode. Izkazati je treba ustrezno statistično moč za ugotovitev 20-odstotne razlike v primerjavi s kontrolo pri 5-odstotni stopnji značilnosti (α = 0,05). Pri odzivih metrik (npr. hitrost razvoja) je t-preskus primerna statistična metoda, če podatki izpolnjujejo zahteve tega preskusa (normalnost, homogenost varianc). Če te zahteve niso izpolnjene, se lahko uporabi t-preskus za neenake variance ali neparametrični preskus, kot je Wilcoxon-Mann-Whitneyjev preskus. Pri koeficientu preobrazbe je primeren Fisherjev eksaktni preskus.
|
POSTOPEK
Pogoji izpostavljenosti
Priprava sistema vode in usedline (primešanje preskusne snovi v vodo)
|
22.a.
|
Formulirana usedlina (glej odstavka 13– 14 in Dodatek 3) se doda v vse preskusne posode in v kristalizirko, da nastane plast usedline, debela vsaj 1,5 cm (v kristalizirki je lahko nekoliko tanjša), vendar ne debelejša od 3 cm. Doda se voda (glej odstavek 15), da razmerje med debelino usedline in globino vode ne presega 1: 4. Po pripravi preskusnih posod je treba sistem vode in usedline približno sedem dni prezračevati, preden se dodajo ličinke prvega stadija prve ali druge generacije (glej odstavek 14 in Dodatek 3). Sistem vode in usedline v kristalizirkah se med preskusom ne prezračuje, ker jim ni treba podpirati preživetja (nizi jajčec so zbrani že pred izvalitvijo). Da se preprečita ločevanje sestavin usedline in ponovna suspenzija finega materiala med dodajanjem preskusne vode v vodni stolpec, se lahko usedlina med točenjem vode prekrije s plastičnim pokrovom. Pokrov se nato takoj odstrani. Primerna so lahko tudi druga sredstva.
|
Priprava sistema vode in usedline (usedlina s primešano preskusno snovjo)
|
22. b.
|
Usedline s primešano preskusno snovjo, pripravljene v skladu z odstavkom 16b, se vnesejo v posode, nad usedlino pa se doda voda, da je razmerje med prostornino usedline in vode 1: 4. Plast usedline mora biti debela od 1,5 do 3 cm (v kristalizirki je lahko nekoliko tanjša). Da se prepreči ločevanje sestavin usedline in ponovna suspenzija finega materiala med dodajanjem preskusne vode v vodni stolpec, se lahko usedlina med točenjem vode prekrije s plastičnim pokrovom, ki se takoj nato odstrani. Primerna so lahko tudi druga sredstva. Ko je usedlina s primešano preskusno snovjo in vodo nad njo pripravljena, je zaželeno, da se omogoči razdelitev preskusne kemikalije iz usedline v vodno fazo (4) (5) (7) (18). To je po možnosti treba storiti v temperaturnih in prezračevalnih pogojih, ki bodo uporabljeni v preskusu. Ustrezen čas za uravnoteženje je odvisen od usedline in kemikalije, lahko pa traja od več ur do več dni in v redkih primerih do pet tednov. Ker bi bil tako na voljo čas za razgradnjo številnih kemikalij, se na uravnoteženje ne sme čakati, ampak se za to priporoča 48-urno obdobje. Vendar se lahko čas za uravnoteženje podaljša, če je znano, da je razpolovna doba razgradnje kemikalije v usedlini dolga (glej odstavek 8). Po koncu tega dodatnega obdobja za uravnoteženje je treba izmeriti koncentracijo preskusne kemikalije v vodi nad usedlino, porni vodi in usedlini vsaj pri najvišji in nižji koncentraciji (glej odstavek 38). Te analitske določitve preskusne kemikalije omogočajo izračun masne bilance in izražanje rezultatov na podlagi izmerjenih koncentracij.
|
|
23.
|
Preskusne posode je treba pokriti (npr. s steklenimi ploščami). Po potrebi se lahko med študijo voda dotoči do prvotne prostornine, da se nadomesti izhlapevanje. Za to je treba uporabiti destilirano ali deionizirano vodo, da se prepreči kopičenje soli. Kristalizirke v kletkah za razmnoževanje niso pokrite in se lahko, vendar ni nujno, prilagodijo, da se nadomesti izguba vode v preskusnem obdobju, saj so nizi jajčec v stiku z vodo samo približno en dan, kristalizirke pa se uporabljajo le v kratki fazi preskusa.
|
Dodajanje preskusnih organizmov
|
24.
|
Štiri do pet dni pred dodajanjem ličink prvega stadija za prvo generacijo je treba jajčna legla vzeti iz kulture in jih vstaviti v majhne posode v gojišču. Uporabi se lahko starejši medij iz založne kulture ali sveže pripravljeni medij. V vsakem primeru je treba v gojišče dodati majhno količino hrane, npr. nekaj kapljic filtrata iz fino mlete suspenzije ribje hrane v kosmičih (glej Dodatek 2). Uporabiti je treba samo sveže odložena jajčna legla. Ličinke se običajno izvalijo nekaj dni po tem, ko so bila jajčeca odločena (2 do 3 dni za C. riparius pri 20 °C ter 1 do 4 dni za C. dilutus pri 23 °C in C. yoshimatsui pri 25 °C), rast ličink pa poteka v štirih stadijih, od katerih vsak traja 4–8 dni. V preskusu je treba uporabiti ličinke prvega stadija (največ 48 ur po tem, ko se izvalijo). Stadij ličink bi se morda lahko preveril z merjenjem širine glave (7).
|
|
25.
|
Dvajset ličink prvega stadija za prvo generacijo se s topo pipeto naključno vnese v vsako preskusno posodo, ki vsebuje sistem z vodo in usedlino. Med dodajanjem ličink v preskusne posode se ustavi prezračevanje vode, ki se ne sme izvajati še 24 ur potem, ko so bile ličinke dodane (glej odstavek 32). Glede na uporabljeni načrt preskusa (glej odstavka 19 in 20) je število uporabljenih ličink na koncentracijo vsaj 120 (6 ponovitev na koncentracijo) za pristop ECX in 160 za pristop NOEC (8 ponovitev na koncentracijo). Pri načrtu z usedlino s primešano preskusno snovjo se izpostavljenost začne z vnosom ličink.
|
Primešanje preskusne snovi v vodo nad usedlino
|
26.
|
Štiriindvajset ur po vnosu ličink prvega stadija za prvo generacijo se preskusna kemikalija primeša v vodni stolpec nad usedlino, pri čemer se ponovno zagotovi rahlo prezračevanje (za mogoče spremembe načrta preskusa glej odstavek 7). Pod vodno gladino se s pipeto vnesejo majhne prostornine založnih raztopin preskusne kemikalije. Vodo nad usedlino je nato treba premešati, pri čemer je treba paziti, da se ne premeša še usedlina. Pri načrtu z vodo s primešano preskusno snovjo se izpostavljenost začne s primešanjem preskusne snovi v vodo (tj. en dan po vnosu ličink).
|
Zbiranje preobraženih odraslih osebkov
|
27.
|
Preobražene trzače prve generacije se iz preskusnih posod zberejo vsaj enkrat, bolje pa dvakrat na dan (glej točko 36) z aspiratorjem, sesalnikom ali podobno napravo (glej Dodatek 5). Paziti je treba, da se odrasli osebki na poškodujejo. Zbrane trzače iz štirih preskusnih posod v okviru enega tretiranja se vnesejo v kletke za razmnoževanje, ki so jim bile predhodno dodeljene. Na dan prve preobrazbe (samca) se v kristalizirke pod vodno gladino s pipeto primeša majhna prostornina založne raztopine preskusne kemikalije (načrt z vodo s primešano preskusno snovjo). Vodo nad usedlino je nato treba premešati, pri čemer je treba paziti, da se ne premeša še usedlina. Koncentracija preskusne kemikalije v kristalizirki je običajno enaka kot v posodah za tretiranje, ki so dodeljene določeni kletki za razmnoževanje. Pri načrtu z usedlino s primešano preskusno snovjo se kristalizirke pripravijo približno 11. dan po začetku izpostavljenosti (tj. vnosu ličink prve generacije), da se lahko ravnotežje vzpostavi približno 48 ur pred prvim odlaganjem nizov jajčec.
|
|
28.
|
Nizi jajčec se zberejo iz kristalizirke v kletki za razmnoževanje s pinceto ali topo pipeto. Vsak niz jajčec se vnese v posodo z gojiščem iz kristalizirke, iz katere je bil odvzet (npr. iz vdolbinice 12-mestne mikroplošče skupaj z vsaj 2,5 ml medija). Posode z nizi jajčec so pokrite s pokrovom, da se prepreči znatno izhlapevanje. Nizi jajčec se opazujejo vsaj šest dni po tem, ko so nastali, da se lahko razvrstijo kot fertilni ali nefertilni.
Za začetek druge generacije se iz vsake kletke za razmnoževanje izberejo trije ali bolje šest fertilnih nizov jajčec skupaj z nekaj hrane, ki omogoča izvalitev. Ti nizi jajčec bi morali nastati na vrhuncu obdobja odlaganja jajčec, ki se v kontrolah običajno pojavi okrog 19. dne preskusa. V idealnih pogojih se druga generacija vseh tretiranj začne na isti dan, vendar zaradi učinkov na razvoj ličink, povezanih s kemikalijami, to ni vedno mogoče. V takem primeru se lahko v višjih koncentracijah začne pozneje kot v tretiranjih z nižjimi koncentracijami in v kontroli (s topilom).
|
|
29. a.
|
Pri načrtu z vodo s primešano preskusno snovjo se sistem z vodo in usedlino za drugo generacijo pripravi s primešanjem preskusne kemikalije v vodni stolpec nad usedlino približno 1 uro pred vnosom ličink prvega stadija v preskusne posode. Pod vodno gladino se s pipeto vnesejo majhne prostornine raztopin preskusne kemikalije. Vodo nad usedlino je nato treba premešati, pri čemer je treba paziti, da se ne premeša tudi usedlina. Po primešanju preskusne snovi se zagotovi rahlo prezračevanje.
|
|
29. b.
|
Pri načrtu z usedlino s primešano preskusno snovjo se posode za izpostavljanje, ki vsebujejo sistem vode in usedline, za drugo generacijo pripravijo enako kot za prvo generacijo.
|
|
30.
|
Dvajset ličink prvega stadija (največ 48 ur po tem, ko se izvalijo) druge generacije se s topo pipeto naključno vnese v vsako preskusno posodo, ki vsebuje sistem z vodo in usedlino s primešano preskusno snovjo. Med dodajanjem ličink prvega stadija v preskuse posode se ustavi prezračevanje vode, ki se ne sme izvajati še 24 ur potem, ko so bile ličinke dodane. Glede na uporabljeni načrt preskusa (glej odstavka 19 in 20) je število uporabljenih ličink na koncentracijo vsaj 120 (6 ponovitev na koncentracijo) za pristop ECX in 160 za pristop NOEC (8 ponovitev na koncentracijo).
|
Hrana
|
31.
|
Ličinke v preskusnih posodah je treba hraniti po možnosti vsak dan ali vsaj trikrat na teden. Ustrezna količina hrane za mlade ličinke v prvih 10 dneh njihovega razvoja je 0,25–0,5 mg (0,35–0,5 mg za C. yoshimatsui) ribje hrane (suspenzija v vodi ali fino mleta hrana, npr. Tetra-Min ali Tetra-Phyll; glej podrobnosti v Dodatku 2) na ličinko na dan. Starejše ličinke lahko potrebujejo nekoliko več hrane: 0,5– 1,0 mg na ličinko na dan mora biti dovolj za preostanek preskusa. Obrok hrane je treba zmanjšati v vseh tretiranih vzorcih in kontrolah, če se opazi rast plesni ali smrtnost v kontrolah. Če razvoja plesni ni mogoče ustaviti, je treba preskus ponoviti.
Toksikološki pomen izpostavljenosti z zaužitjem je običajno večji pri kemikalijah z visoko afiniteto do organskega ogljika ali kemikalij, ki se kovalentno vežejo na usedlino. Zato se lahko pri preskušanju kemikalij s takimi lastnostmi količina hrane, potrebna za zagotovitev preživetja in naravno rast ličink, doda formulirani usedlini pred obdobjem stabilizacije, kar je odvisno od regulativnih zahtev. Da se prepreči poslabšanje kakovosti vode, je treba namesto ribje hrane uporabiti rastlinski material, npr. dodajanje 0,5 % (suhe teže) fino mletega listja velike koprive (Urtica dioica), bele murve (Morus alba), plazeče detelje (Trifolium repens), špinače (Spinacia oleracea) ali drugega rastlinskega materiala (Cerophyl ali α-celuloza). Dodajanje celotnega obroka vira organske hrane v usedlino pred primešanjem preskusne snovi ni niti nepomembno glede na kakovost vode in biološko učinkovitost (21) niti standardizirana metoda, vendar so nedavne študije dokazale, da ta metoda deluje (19) (26). Odraslih trzač v kletki za razmnoževanje običajno ni treba hraniti, vendar se plodnost in fertilnost povečata, če se jim kot vir hrane za odrasle preobražene osebke zagotovi vatna blazinica, namočena v nasičeno raztopino saharoze (34).
|
Pogoji inkubacije
|
32.
|
Rahlo prezračevanje vode nad usedlino v preskusnih posodah se zagotavlja 24 ur po vnosu ličink prvega stadija obeh generacij in se izvaja ves čas preskusa (paziti je treba, da koncentracija raztopljenega kisika ne pade pod 60 % ASV). Prezračevanje se zagotavlja prek steklene pasteurjeve pipete, katere izhod je pritrjen 2 do 3 cm nad plastjo usedline in ki ustvarja nekaj mehurčkov na sekundo. Pri preskušanju hlapnih kemikalij je treba upoštevati, da se sistem z vodo in usedlino ne prezračuje, medtem ko je treba hkrati izpolniti merilo za veljavnost najmanj 60 % ASV (odstavek 10). Več smernic je na voljo v (16).
|
|
33.
|
Preskus s C. riparius se izvaja pri konstantni temperaturi 20 °C (± 2 °C). Za C. dilutus in C. yoshimatsui sta priporočeni temperaturi 23 °C oziroma 25 °C (± 2 °C). Uporablja se 16-urno obdobje osvetljenosti, jakost svetlobe pa mora biti od 500 do 1 000 luksov. Pri kletkah za razmnoževanje se lahko doda ena ura faze svitanja in mraka.
|
Trajanje izpostavljenosti
|
34.
|
Načrt z vodo s primešano preskusno snovjo: obdobje izpostavljenosti se pri prvi generaciji začne, ko se preskusna kemikalija primeša v vodo nad usedlino v preskusni posodi (to je en dan po vnosu ličink; za mogoče spremembe načrta izpostavljenosti glej odstavek 7). Izpostavljenost druge generacije ličink se začne takoj, ker se vnesejo v sistem z vodo in usedlino, v katerega je bila preskusna snov že primešana. Najdaljše trajanje izpostavljenosti pri C. riparius in C. yoshimatui je za prvo generacijo 27 dni, za drugo generacijo pa 28 dni (ličinke prve generacije preživijo en dan v posodah brez izpostavljenosti). Glede na prekrivanje celoten preskus traja približno 44 dni. Pri C. dilutus je najdaljše trajanje izpostavljenosti 64 dni za prvo generacijo oziroma 65 dni za drugo generacijo. Preskus traja skupaj približno 100 dni.
Načrt z usedlino s primešano preskusno snovjo: izpostavljenost se začne z vnosom ličink in traja najdlje 28 dni za obe generaciji pri C. riparius in C. yoshimatsui ter največ 65 dni za obe generaciji pri C. dilutus.
|
Opažanja
Preobrazba
|
35.
|
Določita se čas razvoja ter skupno število v celoti preobraženih in živih samcev in samic trzače za obe generaciji. Samce je mogoče preprosto prepoznati po pahljačastih tipalkah in drži vitkega telesa.
|
|
36.
|
Preskusne posode obeh generacij je treba opazovati vsaj trikrat na teden, da se vizualno oceni kakršno koli neobičajno obnašanje (npr. zapuščanje usedline, nenavadno plavanje) v primerjavi s kontrolo. V obdobju preobrazbe, ki se pri C. riparius in C. yoshimatsui začne približno 12 dni po vnosu ličink (20 dni po vnosu pri C. dilutus) se preobražene trzače preštejejo in opredelijo po spolu vsaj enkrat na dan, priporočljivo pa je dvakrat na dan (zgodaj zjutraj in pozno popoldne). Po identifikaciji se trzače prve generacije previdno odstranijo iz posod in prenesejo v kletko za razmnoževanje. Trzače druge generacije se odstranijo in po identifikaciji usmrtijo. Vse nize jajčec, odložene v preskusnih posodah prve generacije, je treba zbrati posamezno in jih prenesti z vsaj 2,5 ml naravne vode v 12-mestne mikroplošče (ali druge primerne posode), ki so pokrite s pokrovom, da se prepreči znatno izhlapevanje. Zabeležiti je treba tudi število mrtvih ličink in vidnih bub, ki se niso preobrazile. Primeri kletke za razmnoževanje, preskusne posode in sesalnika so navedeni v Dodatku 5.
|
Razmnoževanje
|
37.
|
Učinki na razmnoževanje se ocenijo s številom nizov jajčec, ki jih odložijo trzače prve generacije, ter njihovo fertilnostjo. Nizi jajčec se enkrat na dan zberejo iz kristalizirke, ki je v vsaki posodi za gojenje. Nize jajčec je treba zbrati in prenesti z vsaj 2,5 ml naravne vode v 12-mestne mikroplošče (en niz jajčec v eno vdolbinico) ali druge primerne posode, ki so pokrite s pokrovom, da se prepreči znatno izhlapevanje. Za vsak niz jajčec se dokumentirajo naslednje lastnosti: dan odlaganja, velikost (normalna, tj. 1,0 ± 0,3 cm, ali majhna, običajno ≤ 0,5 cm) in struktura (običajna = oblika banane s spiralnim nizom jajčec ali nenormalna, npr. niz jajčec, ki ni v obliki spirale) ter fertilnost (fertilen ali nefertilen). Fertilnost niza jajčec se oceni v šestih dneh po tem, ko je bil odložen. Niz jajčec se šteje za fertilen, če se izvali vsaj ena tretjina jajčec. Skupno število samic, dodanih v kletko za razmnoževanje, se uporabi za izračun števila nizov jajčec na samico in število fertilnih nizov jajčec na samico. Po potrebi se lahko število jajčec v nizu jajčec oceni nedestruktivno z uporabo metode krožnega štetja (podrobno opisana v 32 in 33).
|
Analitske meritve
Koncentracija preskusne kemikalije
|
38.
|
Na začetku (v primeru primešanja preskusne snovi v vodo po možnosti eno uro po vnosu preskusne snovi) in koncu preskusa je treba analizirati vsaj vzorce vode nad usedlino, porne vode in usedline, in sicer pri najvišji in nižji koncentraciji. To velja za posode iz obeh generacij. Iz kristalizirk v kletki za razmnoževanje se analizira samo voda nad usedlino, ker pridejo v stik z njo nizi jajčec (pri načrtu z usedlino s primešano preskusno snovjo se lahko predvidi analitska potrditev koncentracije usedline). Po potrebi se lahko med preskusom izvedejo nadaljnje meritve usedline, porne vode ali vode nad usedlino. Te določitve koncentracije preskusne snovi pokažejo obnašanje/porazdelitev preskusne kemikalije v sistemu vode in usedline. Za vzorčenje usedline in porne vode na začetku preskusa in med njim (glej odstavek 39) so potrebne dodatne preskusne posode za izvedbo analitskega določanja. Meritve usedline pri načrtu z vodo s primešano preskusno snovjo morda ne bodo potrebne, če je bila porazdelitev preskusne kemikalije med vodo in usedlino jasno določena v študiji vode/usedline v primerljivih pogojih (npr. razmerje med usedlino in vodo, vrsta vnosa, vsebnost organskega ogljika v usedlini) ali če je bilo dokazano, da izmerjene koncentracije v vodi nas usedlino ostajajo v razponu od 80 do 120 % nominalnih ali izmerjenih začetnih koncentracij.
|
|
39.
|
Kadar se izvajajo vmesne meritve (npr. 7. in/ali 14. dan) in če so za analize potrebni veliki vzorci, ki jih ni mogoče odvzeti iz preskusnih posod, ne da bi to vplivalo na preskusni sistem, je treba analitske določitve izvesti na vzorcih iz dodatnih preskusnih posod, ki se tretirajo enako (vključno s prisotnostjo preskusnih organizmov), vendar se za biološka opažanja ne uporabljajo.
|
|
40.
|
Za izolacijo intersticijske (= porne) vode se priporoča 30-minutno centrifugiranje pri npr. 10 000 g in 4 °C. Če pa se za preskusno kemikalijo izkaže, da se ne adsorbira na filtre, je sprejemljivo tudi filtriranje. V nekaterih primerih morda koncentracij v porni vodi zaradi premajhne prostornine v vzorcu ne bo mogoče analizirati.
|
Fizikalno-kemijski parametri
|
41.
|
Ustrezno je treba izmeriti pH, raztopljeni kisik v preskusni vodi ter temperaturo vode v preskusnih posodah in kristalizirkah (glej odstavek 10). Na začetku in koncu preskusa je treba v kontrolah ter eni preskusni posodi in kristalizirki izmeriti trdoto in amoniak pri najvišji koncentraciji.
|
PODATKI IN POROČANJE
Obdelava rezultatov
|
42.
|
Namen tega preskusa življenjskega cikla je določiti učinek preskusne kemikalije na razmnoževanje ter hitrost razvoja in skupno število v celoti preobraženih in živih samcev in samic trzače za dve generaciji. Za podatke o koeficientu preobrazbe je treba združiti samce in samice. Če ni statistično znatnih razlik med občutljivostjo obeh spolov v zvezi s hitrostjo razvoja, se lahko rezultati za samce in samice združijo za statistično analizo.
|
|
43.
|
Učinkovite koncentracije, izražene kot koncentracije v vodi nad usedlino (za vodo s primešano preskusno snovjo) ali v usedlini (za usedlino s primešano preskusno snovjo), se običajno izračunajo na podlagi koncentracij, izmerjenih na začetku izpostavljenosti (glej odstavek 38). Za vodo s primešano preskusno snovjo se zato za vsako tretiranje izračuna povprečna vrednost koncentracij, običajno izmerjenih na začetku izpostavljenosti v vodi nad usedlino v posodah za obe generaciji in v kristalizirkah. Za usedlino s primešano preskusno snovjo se zato za vsako tretiranje izračuna povprečna vrednost koncentracij, običajno izmerjenih na začetku izpostavljenosti v posodah za obe generaciji (in neobvezno v kristalizirkah).
|
|
44.
|
Za izračun točkovne ocene, tj. ECx, se lahko statistični podatki po posodah in kletkah za razmnoževanje uporabijo kot dejanske ponovitve. Pri izračunu intervala zaupanja za ECx je treba upoštevati variabilnost med posodami ali pa dokazati, da je ta zanemarljiva. Če se model prilega po metodi najmanjših kvadratov, je treba statistične podatke po posameznih posodah transformirati, da se izboljša homogenost variance. Vendar je treba vrednosti ECx izračunati po tem, ko so bili rezultati transformirani nazaj na prvotno vrednost (31).
|
|
45.
|
Kadar je namen statistične analize določiti NOEC s preskušanjem domnev, je treba upoštevati variabilnost med posodami, kar se zagotovi z uporabo metod analize variance (npr. postopki Williamsovega in Dunnettovega preskusa). Williamsov preskus bi bil ustrezen, če se v teoriji pričakuje monotono razmerje odmerek-učinek, Dunnettov preskus pa bi bil ustrezen, kadar domneva o monotonosti ne drži. Namesto tega se lahko uporabijo robustnejši preskusi (27), kadar so običajne predpostavke analize variance kršene (31).
|
Koeficient preobrazbe
|
46.
|
Koeficienti preobrazbe so kvantni podatki in se lahko analizirajo s Cochran-Armitageovim preskusom, uporabljenim regresivno (step-down), kadar se pričakuje monotono razmerje med odmerek-učinek in so ti podatki v skladu s tem pričakovanjem. Če niso, se lahko uporabi Fisherjev eksaktni preskus ali Mantel-Haenszelov preskus z Bonferroni-Holmovimi popravljenimi vrednostmi p. Če se izkaže, da je variabilnost med ponovitvami v okviru iste koncentracije večja, kot bi kazala binomska porazdelitev (pogosto imenovana ‚ekstra-binomska‘ variacija), potem je treba uporabiti robustni Cochran-Armitageev preskus ali Fisherjev eksaktni preskus, kot je predlagano v (27).
Vsota preobraženih živih trzač (samcev in samic) na posodo, ne
, se določi in deli s številom vnesenih ličink, na
:

pri čemer je:
|
ER
|
=
|
koeficient preobrazbe,
|
|
ne
|
=
|
število preobraženih živih trzač na posodo,
|
|
na
|
=
|
število vnesenih ličink na posodo (običajno 20).
|
Če je ne
večje kot na
(tj. če je bilo nenamerno vnesenih več ličink, kot je bilo predvideno), je treba na
izenačiti z ne
.
|
|
47.
|
Alternativen pristop v primeru ekstra-binomske variacije, ki je ustreznejši za večje vzorce, je obravnavanje koeficienta preobrazbe kot zveznega odziva in uporaba postopkov, ki so skladni s temi podatki o ER. Velik vzorec je tu opredeljen kot število preobraženih osebkov in število nepreobraženih osebkov po posameznih ponovitvah (posodah), pri čemer je obojih več kot pet.
|
|
48.
|
Za uporabo metod analize variance je treba vrednosti ER najprej transformirati z arkus sinus-korensko transformacijo ali Tukey-Freemanovo transformacijo, da se dobi približna normalna porazdelitev in da se variance izenačijo. Cochran-Armitageev preskus, Fisherjev eksaktni preskus (Bonferroni) ali Mantel-Haenszelov preskus se lahko uporabi, kadar se uporabljajo absolutne pogostosti. Pri arkus sinus-korenski transformaciji se izračuna arkus sinus (sin– 1) kvadratnega korena ER.
|
|
49.
|
Za koeficiente preobrazbe se vrednosti ECx izračunajo z regresijsko analizo (npr. probit, logit ali Weibullov model (28)). Če regresijska analiza ni uspešna (npr. kadar sta manj kot dva delna odgovora), se lahko uporabijo druge neparametrične metode, kot sta drseče povprečje ali linearna interpolacija.
|
Hitrost razvoja
|
50.
|
Srednji čas razvoja predstavlja srednji časovni razpon med vnosom ličink (dan 0 preskusa) in pojavom eksperimentalne kohorte trzač (za izračun dejanskega časa razvoja je treba upoštevati starost ličink ob vnosu). Hitrost razvoja (enota: (1/dan) je obratna času razvoja in predstavlja tisti delež razvoja ličink, ki se zgodi na dan. Za oceno teh raziskav strupenosti v usedlini je primernejša hitrost razvoja, saj je njena varianca manjša, poleg tega je bolj homogena in bližje normalni porazdelitvi v primerjavi s časom razvoja. Zato se lahko namesto časa razvoja za hitrost razvoja uporabijo učinkovitejši postopki parametričnega preskusa. Če se hitrost razvoja obravnava kot zvezni odziv, se lahko vrednosti ECx ocenijo z regresijsko analizo (npr. (29) (30)). NOEC za srednjo hitrost razvoja se lahko določi z metodami analize variance, npr. Williamsovim ali Dunnettovim preskusom. Ker se samci preobrazijo hitreje od samic, tj. njihova hitrost razvoja je večja, je smiselno poleg hitrosti razvoja vseh trzač skupaj izračunati tudi hitrost razvoja za vsak spol ločeno.
|
|
51.
|
Za statistično preskušanje se za število trzač, opaženih na dan opazovanja x, domneva, da so se preobrazile na sredini časovnega intervala med dnevom x in dnevom x – l (l = dolžina intervala opazovanja, običajno 1 dan). Srednja hitrost razvoja na posodo (

) se izračuna z enačbo:

pri čemer je:
|

|
:
|
srednja hitrost razvoja za posodo,
|
|
i
|
:
|
indeks intervala opazovanja,
|
|
m
|
:
|
največje število intervalov opazovanja,
|
|
fi
|
:
|
število trzač, preobraženih v intervalu opazovanja i,
|
|
ne
|
:
|
skupno število preobraženih trzač ob koncu poskusa (Σfi
),
|
|
xi
|
:
|
hitrost razvoja trzač, preobraženih v intervalu i,
|

pri čemer je:
|
dayi
|
:
|
dan opazovanja (dnevi od vnosa ličink),
|
|
li
|
:
|
dolžina intervala opazovanja i (dnevi, običajno 1 dan).
|
|
Razmerje med spoloma
|
52.
|
Razmerja med spoloma so kvantni podatki in jih je zato treba oceniti s Ficherjevim eksaktnim preskusom ali drugimi ustreznimi metodami. Naravno razmerje med spoloma pri C. riparius je ena, tj. samci in samice so enako pogosti. Podatke o razmerju med spoloma je treba obravnavati enako za obe generaciji. Ker je največje število trzač na posodo (tj. 20) premajhno za smiselno statistično analizo, se sešteje skupno število v celoti preobraženih in živih trzač za posamezen spol v vseh posodah enega tretiranja. Ti netransformirani podatki se preskusijo glede na podatke iz kontrole (s topilom) ali združene kontrole v kontingenčni tabeli 2 × 2.
|
Razmnoževanje
|
53.
|
Razmnoževanje se tako kot plodnost izračuna kot število nizov jajčec na samico. To natančneje pomeni, da se skupno število nizov jajčec, odloženih v kletki za razmnoževanje, deli s skupnim številom živih in nepoškodovanih samic, dodanih v navedeno kletko. NOEC za plodnost se lahko določi z metodami analize variance, npr. Williamsovim ali Dunnettovim preskusom.
|
|
54.
|
Fertilnost nizov jajčec se uporabi za kvantifikacijo števila fertilnih nizov jajčec na samico. Skupno število nizov jajčec, odloženih v kletki za razmnoževanje, se deli s skupnim številom živih in nepoškodovanih samic, dodanih v navedeno kletko. NOEC za fertilnost se lahko določi z metodami analize variance, npr. Williamsovim ali Dunnettovim preskusom.
|
Poročilo o preskusu
|
55.
|
V poročilu o preskusu morajo biti naslednje informacije:
|
|
Preskusna kemikalija:
|
—
|
fizikalno stanje in fizikalno-kemijske lastnosti (topnost v vodi, parni tlak, log K
ow, porazdelitveni koeficient v tleh (ali v usedlini, če je na voljo), stabilnost v vodi in usedlini itd.),
|
|
—
|
kemijski identifikacijski podatki (splošno ime, kemijsko ime, strukturna formula, številka CAS itd.), vključno s čistostjo in analitsko metodo za kvantifikacijo preskusne kemikalije.
|
|
|
|
Preskusne vrste:
|
—
|
uporabljeni preskusni organizmi: vrsta, znanstveno ime, vir organizmov in pogoji razmnoževanja,
|
|
—
|
informacije o ravnanju z jajčnimi legli in ličinkami,
|
|
—
|
informacije o ravnanju s preobraženimi odraslimi osebki prve generacije s pomočjo sesalnika itd. (glej Dodatek 5),
|
|
—
|
starost preskusnih organizmov ob vnosu v preskusne posode za prvo in drugo generacijo.
|
|
|
|
Preskusni pogoji:
|
—
|
uporabljena usedlina, tj. naravna ali formulirana (umetna),
|
|
—
|
naravna usedlina: lokacija in opis mesta vzorčenja usedline, vključno, če je mogoče, s preteklim onesnaženjem; značilnosti usedline: pH, vsebnost organskega ogljika, razmerje C/N in granulometrija (če je ustrezno),
|
|
—
|
formulirana usedlina: priprava, sestavine in značilnosti (vsebnost organskega ogljika, pH, vlaga itd., izmerjeni na začetku preskusa),
|
|
—
|
priprava preskusne vode (če se uporablja modelna razredčevalna voda) in značilnosti (koncentracija kisika, pH, trdota itd., izmerjeni na začetku preskusa),
|
|
—
|
globina usedline in vode nad njo v preskusnih posodah in kristalizirkah,
|
|
—
|
prostornina vode nad usedlino in porne vode; teža mokre usedline s porno vodo in brez nje v preskusnih posodah in kristalizirkah,
|
|
—
|
preskusne posode (material in velikost),
|
|
—
|
kristalizirke (material in velikost),
|
|
—
|
kletke za razmnoževanje (material in velikost),
|
|
—
|
način priprave založnih raztopin in preskusnih koncentracij za preskusne posode in kristalizirke,
|
|
—
|
vnos preskusne kemikalije v preskusne posode in kristalizirke: preskusne koncentracije, število ponovitev in topil, če so potrebna,
|
|
—
|
pogoji inkubacije za preskusne posode: temperatura, svetlobni cikel in jakost, prezračevanje (mehurčki na sekundo),
|
|
—
|
pogoji inkubacije za kletke za razmnoževanje in kristalizirke: temperatura, svetlobni cikel in jakost svetlobe,
|
|
—
|
pogoji inkubacije za nize jajčec v mikroploščah (ali drugih posodah): temperatura, svetlobni cikel in jakost svetlobe,
|
|
—
|
podrobne informacije o hranjenju, vključno z vrsto hrane, pripravo, količino in načinom.
|
|
|
|
Rezultati:
|
—
|
nazivne preskusne koncentracije, izmerjene preskusne koncentracije in rezultati vseh analiz za določitev koncentracije preskusne kemikalije v preskusnih posodah in kristalizirkah,
|
|
—
|
kakovost vode v preskusnih posodah in kristalizirkah, tj. pH, temperatura, raztopljeni kisik, trdota in amoniak,
|
|
—
|
morebitna nadomestitev izhlapele preskusne vode v preskusnih posodah,
|
|
—
|
število preobraženih samcev in samic trzače na posodo ter na dan za prvo in drugo generacijo,
|
|
—
|
razmerje med spoloma pri v celoti preobraženih in živih trzačah na tretiranje za prvo in drugo generacijo,
|
|
—
|
število ličink, ki se niso preobrazile v trzače, na posodo za prvo in drugo generacijo,
|
|
—
|
odstotek/delež preobrazbe na ponovitev in preskusno koncentracijo (združeni samci in samice trzače) za prvo in drugo generacijo,
|
|
—
|
srednja hitrost razvoja v celoti preobraženih in živih trzač na ponovitev in stopnjo koncentracije (združeni samci in samice trzače) za prvo in drugo generacijo,
|
|
—
|
število nizov jajčec, odloženih v kristalizirkah, na kletko za razmnoževanje in dan,
|
|
—
|
lastnosti posameznega niza jajčec (velikost, oblika in fertilnost),
|
|
—
|
plodnost – skupno število nizov jajčec na skupno število samic, dodanih v kletko za razmnoževanje,
|
|
—
|
fertilnost – skupno število fertilnih nizov jajčec na skupno število samic, dodanih v kletko za razmnoževanje,
|
|
—
|
ocene strupenih končnih točk, npr. ECx (in s tem povezani intervali zaupanja), NOEC ter statistične metode, uporabljene za njihovo določitev,
|
|
—
|
razprava o rezultatih, vključno z vsemi vplivi na rezultat preskusa, ki izvirajo iz odstopanj od te preskusne metode.
|
|
|
LITERATURA
|
(1)
|
Poglavje C.28 te priloge, Preskus strupenost s trzačami v sistemu vode in usedline z uporabo vode s primešano preskusno snovjo.
|
|
(2)
|
Shobanov, N. A., Kiknadze, I. I., in Butler, M. G. (1999). Palearctic and Nearctic Chironomus (Camptochironomus) tentans Fabricius are different species (Diptera: Chironomidae). Entomologica Scandinavica, 30: 311–322.
|
|
(3)
|
Fleming, R., idr. (1994). Sediment Toxicity Tests for Poorly Water-Soluble Substances, Final Report to the European Commission, Report No: EC 3738. Avgust 1994. WRc, Združeno kraljestvo.
|
|
(4)
|
SETAC (1993). Guidance Document on Sediment toxicity Tests and Bioassays for Freshwater and Marine Environments, z delavnice WOSTA, ki je potekala na Nizozemskem.
|
|
(5)
|
ASTM International (2009). E1706-05E01: Test Method for Measuring the Toxicity of Sediment-Associated Contaminants with Freshwater Invertebrates. V: Annual Book of ASTM Standards, Zvezek 11.06, Biological Effects and Environmental Fate; Biotechnology. ASTM International, West Conshohocken, PA.
|
|
(6)
|
Environment Canada (1997). Test for Growth and Survival in Sediment using Larvae of Freshwater Midges (Chironomus tentans or Chironomus riparius), Biological Test Method, Report SPE 1/RM/32, december 1997.
|
|
(7)
|
US-EPA (2000). Methods for Measuring the Toxicity and Bioaccumulation of Sediment-associated Contaminants with Freshwater Invertebrates, druga izdaja, EPA 600/R-99/064, marec 2000, sprememba prve izdaje iz junija 1994.
|
|
(8)
|
US-EPA/OPPTS 850.1735 (1996). Whole Sediment Acute Toxicity Invertebrates.
|
|
(9)
|
US-EPA/OPPTS 850.1790 (1996). Chironomid Sediment toxicity Test.
|
|
(10)
|
Milani, D., Day, K. E., McLeay, D. J., in Kirby, R. S. (1996). Recent intra- and inter-laboratory studies related to the development and standardisation of Environment Canada's biological test methods for measuring sediment toxicity using freshwater amphipods (Hyalella azteca) and midge larvae (Chironomus riparius), Technical Report, Environment Canada, National Water Research Institute, Burlington, Ontario, Kanada.
|
|
(11)
|
Norberg-King, T. J., Sibley, P. K., Burton, G. A., Ingersoll, C. G., Kemble, N. E., Ireland, S., Mount, D. R., in Rowland, C. D. (2006). Interlaboratory evaluation of Hyalella azteca and Chironomus tentans short-term and long-term sediment toxicity tests, Environ. Toxicol. Chem., 25: 2662–2674.
|
|
(12)
|
Taenzler, V., Bruns, E., Dorgerloh, M., Pfeifle, V., in Weltje, L. (2007). Chironomids: suitable test organisms for risk assessment investigations on the potential endocrine-disrupting properties of pesticides, Ecotoxicology, 16: 221–230.
|
|
(13)
|
Sugaya, Y. (1997). Intra-specific variations of the susceptibility of insecticides in Chironomus yoshimatsui, Jp. J. Sanit. Zool., 48: 345–350.
|
|
(14)
|
Kawai, K. (1986). Fundamental studies on chironomid allergy, I. Culture methods of some Japanese chironomids (Chironomidae, Diptera), Jp. J. Sanit. Zool., 37: 47–57.
|
|
(15)
|
Poglavje C.27 te priloge, Preskus strupenosti s trzačami v sistemu vode in usedline z uporabo usedline s primešano preskusno snovjo.
|
|
(16)
|
OECD (2000). Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures, Environment, Health and Safety Publications, Series on Testing and Assessment No. 23, ENV/JM/MONO(2000)6, OECD, Pariz.
|
|
(17)
|
Weltje, L., Rufli, H., Heimbach, F., Wheeler, J., Vervliet-Scheebaum, M., in Hamer, M. (2010). The chironomid acute toxicity test: development of a new test system, Integr. Environ. Assess. Management.
|
|
(18)
|
Environment Canada. (1995). Guidance Document on Measurement of Toxicity Test Precision Using Control Sediments Spiked with a Reference Toxicant, Report EPS 1/RM/30, september 1995.
|
|
(19)
|
Oetken, M., Nentwig, G., Löffler, D., Ternes, T., in Oehlmann, J. (2005). Effects of pharmaceuticals on aquatic invertebrates, Part I, The antiepileptic drug carbamazepine, Arch. Environ. Contam. Toxicol., 49: 353–361.
|
|
(20)
|
Suedel, B. C., in Rodgers, J. H. (1994). Development of formulated reference sediments for freshwater and estuarine sediment testing, Environ. Toxicol. Chem., 13: 1163– 1175.
|
|
(21)
|
Naylor, C., in Rodrigues, C. (1995), Development of a test method for Chironomus riparius using a formulated sediment, Chemosphere, 31: 3291–3303.
|
|
(22)
|
Dunnett, C. W. (1964). A multiple comparisons procedure for comparing several treatments with a control. J. Amer. Statis. Assoc., 50: 1096– 1121.
|
|
(23)
|
Dunnett, C. W. (1964). New tables for multiple comparisons with a control, Biometrics, 20: 482–491.
|
|
(24)
|
Williams, D. A. (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics, 27: 103– 117.
|
|
(25)
|
Williams, D. A. (1972). The comparison of several dose levels with a zero dose control. Biometrics, 28: 510–531.
|
|
(26)
|
Jungmann, D., Bandow, C., Gildemeister, T., Nagel, R., Preuss, T. G., Ratte, H. T., Shinn, C., Weltje, L., in Maes, H. M. (2009). Chronic toxicity of fenoxycarb to the midge Chironomus riparius after exposure in sediments of different composition. J Soils Sediments, 9: 94– 102.
|
|
(27)
|
Rao, J. N. K., in Scott, A. J. (1992). A simple method for the analysis of clustered binary data. Biometrics, 48: 577–585.
|
|
(28)
|
Christensen, E. R. (1984), Dose-response functions in aquatic toxicity testing and the Weibull model, Water Res., 18: 213–221.
|
|
(29)
|
Bruce, R. D., in Versteeg, D. J. (1992). A statistical procedure for modelling continuous toxicity data, Environ. Toxicol. Chem., 11: 1485– 1494.
|
|
(30)
|
Slob, W. (2002). Dose-response modelling of continuous endpoints. Toxicol. Sci., 66: 298–312.
|
|
(31)
|
OECD (2006). Current Approaches in the Statistical Analysis of Ecotoxicity Data: a Guidance to Application, OECD Series on Testing and Assessment No. 54, 146 str., ENV/JM/MONO(2006)18, OECD, Pariz.
|
|
(32)
|
Benoit, D. A., Sibley, P. K., Juenemann, J. L., in Ankley, G. T. (1997). Chironomus tentans life-cycle test: design and evaluation for use in assessing toxicity of contaminated sediments, Environ. Toxicol. Chem., 16: 1165– 1176.
|
|
(33)
|
Vogt, C., Belz, D., Galluba, S., Nowak, C., Oetken, M. in Oehlmann, J. (2007). Effects of cadmium and tributyltin on development and reproduction of the non-biting midge Chironomus riparius (Diptera) – baseline experiments for future multi-generation studies, J. Environ. Sci. Health Part A, 42: 1–9.
|
|
(34)
|
OECD (2010). Validation report of the Chironomid full life-cycle toxicity test, Forthcoming publication in the Series on Testing and Assessment, OECD, Pariz.
|
Dodatek 1
Opredelitve
Za to preskusno metodo se uporabljajo naslednje opredelitve pojmov:
|
|
Kemikalija je snov ali zmes.
|
|
|
Formulirana usedlina ali rekonstituirana, umetna ali sintetična usedlina je zmes snovi, uporabljenih za posnemanje fizičnih sestavin naravne usedline.
|
|
|
Voda nad usedlino je voda, ki se nalije nad usedlino v preskusni posodi.
|
|
|
Intersticijska voda ali porna voda je voda, ki zavzema prostor med delci usedline in tal.
|
|
|
Voda s primešano preskusno snovjo je preskusna voda, ki ji je bila dodana preskusna kemikalija.
|
|
|
Preskusna kemikalija je vsaka snov ali zmes, preskušena z uporabo te preskusne metode.
|
Dodatek 2
Priporočila za gojenje Chironomus riparius
|
1.
|
Ličinke Chironomus se lahko gojijo v kristalizirkah ali večjih posodah. Na dno posode se nanese tanka plast finega kremenovega peska (debela približno od 5 do 10 mm). Za primeren substrat se je izkazal tudi kieselgur (npr. Merck, Art 8117) (zadošča tanjša plast, debela samo nekaj mm). Nato se doda primerna voda do globine več cm. Vodo je treba po potrebi dotočiti, da se nadomestijo izgube zaradi izhlapevanja in prepreči izsušitev. Voda se po potrebi lahko zamenja. Zagotoviti je treba rahlo prezračevanje. Posode, v katerih se gojijo ličinke, morajo biti v primerni kletki, ki bo preprečila pobeg odraslih preobraženih osebkov. Kletka mora biti dovolj velika, da lahko preobraženi odrasli osebki rojijo, sicer se lahko zgodi, da ne bo parjenja (najmanjša velikost je približno 30 × 30 × 30 cm).
|
|
2.
|
Kletke morajo biti v prostoru s sobno temperaturo ali prostoru s konstantnim ozračjem pri 20 ± 2 °C s 16-urnim obdobjem osvetljenosti (jakost približno 1 000 luksov) in 8 urami teme. Po poročilih lahko manj kot 60-odstotna relativna vlažnost zraka ovira razmnoževanje.
|
Voda za redčenje
|
3.
|
Uporabi se lahko vsaka primerna naravna ali sintetična voda. Običajno se uporabljajo voda iz vodnjaka, deklorirana vodovodna voda in umetni mediji (npr. medij Elendt ‚M4‘ ali ‚M7‘, glej v nadaljevanju). Vodo je treba pred uporabo prezračevati. Voda za gojenje se lahko po potrebi obnovi, tako da se uporabljena voda iz posod za gojenje skrbno pretoči ali izsesa, ne da bi se pri tem uničil ovoj ličink.
|
Hranjenje ličink
|
4.
|
Ličinke Chironomus je treba hraniti s približno 250 mg ribje hrane v kosmičih (Tetra Min®, Tetra Phyll® ali druga podobna zaščitena znamka ribje hrane) na posodo na dan. Hrana se lahko daje v obliki suhega mletega prahu ali kot suspenzija v vodi: 1,0 g hrane v kosmičih se doda 20 ml vode za redčenje in zmeša, da nastane homogena mešanica. Ta pripravek se lahko daje v količini približno 5 ml na posodo na dan (pred uporabo ga je treba pretresti). Starejše ličinke lahko dobijo več hrane.
|
|
5.
|
Hranjenje se prilagaja kakovosti vode. Če gojišče postane ‚moteno‘, je treba hranjenje zmanjšati. Dodajanje hrane je treba skrbno spremljati. Premalo hrane bo povzročilo selitev ličink v vodni stolpec, preveč hrane pa povečano mikrobno dejavnost in zmanjšane koncentracije kisika. Oboje lahko privede do počasnejše rasti.
|
|
6.
|
Ko se pripravijo nove posode za gojenje, se lahko dodajo tudi celice nekaterih zelenih alg (npr. Scenedesmus subspicatus, Chlorella vulgaris).
|
Hranjenje preobraženih odraslih osebkov
|
7.
|
Nekateri raziskovalci so predlagali, da se lahko kot hrana za odrasle preobražene osebke uporabi vatna blazinica, namočena v nasičeno raztopino saharoze.
|
Preobrazba
|
8.
|
Pri 20 ± 2 °C se bo preobrazba v odrasle osebke iz posod za gojenje ličink začela po približno 13 do 15 dneh. Samce je mogoče preprosto razlikovati po pahljačastih tipalkah in suhem telesu.
|
Jajčna legla
|
9.
|
Ko so v kletki za razmnoževanje odrasli osebki, je treba vse posode za gojenje ličink trikrat na teden preveriti glede morebitnih odloženih želatinastih jajčnih legel. Če so prisotna, jih je treba previdno odstraniti. Prenesti jih je treba v majhno posodo, ki vsebuje vzorec vode za razmnoževanje. Jajčna legla se uporabijo za pripravo nove posode za gojenje (npr. 2 do 4 jajčna legla/posodo) ali za preskuse strupenosti.
|
|
10.
|
Ličinke prvega stadija bi se morale izvaliti po 2 ali 3 dneh.
|
Priprava novih posod za gojenje
|
11.
|
Ko so gojišča vzpostavljena, bi moralo biti mogoče novo posodo za gojenje za ličinke pripraviti vsak teden ali manj pogosto, odvisno od zahtev preskušanja, stare posode pa odstraniti, ko se ličinke preobrazijo v odrasle osebke. S takim sistemom bo najpreprosteje zagotovljena redna oskrba z odraslimi osebki.
|
Končne koncentracije v preskusnih raztopinah ‚M4‘ in ‚M7‘
|
12.
|
Elendt (1990) je opisal medij ‚M4‘. Medij ‚M7‘ se pripravi kot medij ‚M4‘, razen za snovi, navedene v tabeli 1, za katere so koncentracije pri ‚M7‘ štirikrat nižje kot pri ‚M4‘. Preskusna raztopina se ne sme pripraviti po Elendt in Bias (1990), saj koncentracije NaSiO3 · 5H2O, NaNO3, KH2PO4 in K2HPO4, navedene za pripravo založnih raztopin, niso ustrezne.
|
Priprava medija ‚M7‘
|
13.
|
Vsaka založna raztopina (I) se pripravi posebej, sestavljena založna raztopina (II) pa se pripravi iz teh založnih raztopin (I) (glej tabelo 1). V 50 ml sestavljene založne raztopine (II), ki ji je dodana količina vsake založne raztopine makrohranilnih snovi, navedena v tabeli 2, se dolije deionizirana voda do 1 litra, da se pripravi medij ‚M7‘. Založna raztopina vitaminov se pripravi tako, da se trije vitamini dodajo v deionizirano vodo, kot je navedeno v tabeli 3, 0,1 ml sestavljene založne raztopine vitaminov pa se doda končnemu mediju ‚M7‘ malo pred uporabo. Založna raztopina vitaminov se hrani zamrznjena v majhnih alikvotih. Medij se prezračuje in stabilizira.
|
Tabela 1
Založne raztopine elementov v sledeh za medija M4 in M7
|
Založne raztopine (I)
|
Količina (mg) za pripravo 1 litra z deionizirano vodo
|
Za pripravo sestavljene založne raztopine (II): zmešajo se naslednje količine (ml) založnih raztopin (I) in dopolnijo do 1 litra z deionizirano vodo
|
Končne koncentracije v preskusnih raztopinah (mg/l)
|
|
M4
|
M7
|
M4
|
M7
|
|
H3BO3
(25)
|
57 190
|
1,0
|
0,25
|
2,86
|
0,715
|
|
MnCl2 · 4H2O (25)
|
7 210
|
1,0
|
0,25
|
0,361
|
0,090
|
|
LiCl (25)
|
6 120
|
1,0
|
0,25
|
0,306
|
0,077
|
|
RbCl (25)
|
1 420
|
1,0
|
0,25
|
0,071
|
0,018
|
|
SrCl2 · 6H2O (25)
|
3 040
|
1,0
|
0,25
|
0,152
|
0,038
|
|
NaBr (25)
|
320
|
1,0
|
0,25
|
0,016
|
0,004
|
|
Na2MoO4 · 2H2O (25)
|
1 260
|
1,0
|
0,25
|
0,063
|
0,016
|
|
CuCl2 · 2H2O (25)
|
335
|
1,0
|
0,25
|
0,017
|
0,004
|
|
ZnCl2
|
260
|
1,0
|
1,0
|
0,013
|
0,013
|
|
CaCl2 · 6H2O
|
200
|
1,0
|
1,0
|
0,010
|
0,010
|
|
KI
|
65
|
1,0
|
1,0
|
0,0033
|
0,0033
|
|
Na2SeO3
|
43,8
|
1,0
|
1,0
|
0,0022
|
0,0022
|
|
NH4VO3
|
11,5
|
1,0
|
1,0
|
0,00058
|
0,00058
|
|
Na2EDTA · 2H2O (25)
(26)
|
5 000
|
20,0
|
5,0
|
2,5
|
0,625
|
|
FeSO4 · 7H2O (25)
(26)
|
1 991
|
20,0
|
5,0
|
1,0
|
0,249
|
Tabela 2
Založne raztopine makrohranilnih snovi za medija M4 in M7
|
|
Količina za pripravo 1 litra z deionizirano vodo
(mg)
|
Količina založnih raztopin makrohranilnih snovi za pripravo medijev M4 in M7
(ml/l)
|
Končne koncentracije v preskusnih raztopinah M4 in M7
(mg/l)
|
|
CaCl2 · 2H2O
|
293 800
|
1,0
|
293,8
|
|
MgSO4 · 7H2O
|
246 600
|
0,5
|
123,3
|
|
KCl
|
58 000
|
0,1
|
5,8
|
|
NaHCO3
|
64 800
|
1,0
|
64,8
|
|
NaSiO3 · 9H2O
|
50 000
|
0,2
|
10,0
|
|
NaNO3
|
2 740
|
0,1
|
0,274
|
|
KH2PO4
|
1 430
|
0,1
|
0,143
|
|
K2HPO4
|
1 840
|
0,1
|
0,184
|
Tabela 3
Založna raztopina vitaminov za medija M4 in M7
Vse tri raztopine vitaminov so združene v eno.
|
|
Količina za pripravo 1 litra z deionizirano vodo
(mg)
|
Količina dodane založne raztopine vitaminov za pripravo medijev M4 in M7
(ml/l)
|
Končne koncentracije v preskusnih raztopinah M4 in M7
(mg/l)
|
|
Tiamin hidroklorid
|
750
|
0,1
|
0,075
|
|
Cianokobalamin (B12)
|
10
|
0,1
|
0,0010
|
|
Biotin
|
7,5
|
0,1
|
0,00075
|
VIRI
BBA (1995). Long-term toxicity test with Chironomus riparius: Development and validation of a new test system, uredila M. Streloke in H. Köpp. Berlin.
Elendt, B. P. (1990). Selenium deficiency in Crustacea, Protoplasma, 154: 25–33.
Elendt, B. P., in W.-R. Bias (1990). Trace nutrient deficiency in Daphnia magna cultured in standard medium for toxicity testing, Effects on the optimisation of culture conditions on life history parameters of D. magna, Water Research, 24: 1157–1167.
Dodatek 3
Priprava formulirane usedline
SESTAVA USEDLINE
Sestava formulirane usedline mora biti naslednja:
|
Sestavina
|
Značilnosti
|
Delež suhe teže usedline v %
|
|
šota
|
šotni mah, čim bližje pH 5,5–6,0, brez vidnih ostankov rastlin, fino mlet (velikost delcev ≤ 1 mm) in sušen na zraku
|
4–5
|
|
kremenov pesek
|
velikost zrn: > 50 % delcev mora biti velikih 50–200 μm
|
75–76
|
|
kaolinska glina
|
vsebnost kaolinita ≥ 30 %
|
20
|
|
organski ogljik
|
uravnava se z dodatkom šote in peska.
|
2 (± 0,5)
|
|
kalcijev karbonat
|
CaCO3, zdrobljen v prah, kemijsko čist.
|
0,05–0,1
|
|
voda
|
prevodnost ≤ 10 μS/cm
|
30–50
|
PRIPRAVA
Šota se posuši na zraku in zmelje v fin prah. Pripravi se suspenzija potrebne količine šote v prahu v deionizirani vodi, za kar se uporabi visoko zmogljiva naprava za homogenizacijo. Vrednost pH te suspenzije se s CaCO3 uravna na 5,5 ± 0,5. Suspenzija se vsaj dva dni kondicionira z rahlim mešanjem pri 20 ± 2 °C, da se stabilizira pH in vzpostavi stabilna mikrobna komponenta. Vrednost pH se znova izmeri in mora biti 6,0 ± 0,5. Šotna suspenzija se nato zmeša z drugimi sestavinami (peskom in kaolinsko glino) in deionizirano vodo, da nastane homogena usedlina z vsebnostjo vode v razponu 30 – 50 % suhe teže usedline. pH končne mešanice se znova izmeri in po potrebi uravna na 6,5 do 7,5 s CaCO3. Odvzamejo se vzorci usedline, da se določita suha teža in vsebnost organskega ogljika. Priporoča se, da se formulirana usedlina pred uporabo v preskusu strupenosti s trzačami sedem dni kondicionira v enakih pogojih, kot vladajo v poznejšem preskusu.
SHRANJEVANJE
Suhe sestavine za pripravo umetne usedline se lahko shranjujejo v suhem in hladnem prostoru pri sobni temperaturi. Formulirana (mokra) usedlina se pred uporabo v preskusu ne sme shranjevati. Uporabiti jo je treba takoj po 7-dnevnem obdobju kondicioniranja, s katerim se njena priprava konča.
VIRI
OECD (1984). Earthworm, Acute Toxicity Test, Test Guideline No. 207, Guidelines for the Testing of Chemicals, OECD, Pariz.
Meller, M., Egeler, P., Roembke, J., Schallnass, H., Nagel, R., in B. Streit (1998). Short-term toxicity of lindane, hexachlorobenzene and copper sulfate on tubificid sludgeworms (Oligochaeta) in artificial media, Ecotox. Environ. Safety, 39: 10–20.
Dodatek 4
Kemijske značilnosti sprejemljive vode za redčenje
|
SESTAVINA
|
KONCENTRACIJE
|
|
delci
|
< 20 mg/l
|
|
skupni organski ogljik
|
< 2 mg/l
|
|
neionizirani amoniak
|
< 1 μg/l
|
|
trdota kot CaCO3
|
< 400 mg/l (27)
|
|
ostanek klora
|
< 10 μg/l
|
|
skupni organofosforni pesticidi
|
< 50 ng/l
|
|
skupni organoklorni pesticidi in poliklorirani bifenili
|
< 50 ng/l
|
|
skupni organski klor
|
< 25 ng/l
|
Dodatek 5
Smernica za izvedbo preskusa
Primer kletke za razmnoževanje:

|
A
|
:
|
gaza na vrhu in vsaj eni stranici kletke (velikost mreže je približno 1 mm);
|
|
B
|
:
|
odprtina za vnos preobraženih odraslih osebkov v kletko za razmnoževanje in odstranjevanje odloženih nizov jajčec iz kristalizirk (na sliki niso prikazane);
|
|
C
|
:
|
kletka za razmnoževanje, dolga najmanj 30 cm, visoka najmanj 30 cm in široka najmanj 30 cm.
|
Primer preskusne posode:

|
A
|
:
|
pasteurjeva pipeta za dovajanje zraka v vodo nad usedlino;
|
|
B
|
:
|
stekleni pokrov za preprečevanje pobega preobraženih trzač;
|
|
C
|
:
|
gladina vode;
|
|
D
|
:
|
preskusna posoda (steklena časa s prostornino najmanj 600 ml);
|
|
E
|
:
|
plast usedline.
|
Primer sesalnika za zajetje odraslih trzač (puščici označujeta smer zračnega toka):

|
A
|
:
|
steklena cev (notranji premer približno 5 mm), priključena na samosesalno črpalko;
|
|
B
|
:
|
zamašek iz gume, preluknjan s stekleno cevjo (A). Znotraj je odprtina steklene cevi (A) prekrita z bombažem in gazo (velikost mreže je približno 1 mm), da se preprečijo poškodbe trzač, ko jih sesalnik posesa;
|
|
C
|
:
|
prozoren vsebnik (plastičen ali steklen, dolg približno 15 cm) za ujete trzače;
|
|
D
|
:
|
zamašek iz gume, preluknjan s cevjo (E). Zamašek D se odstrani z vsebnika C, da se trzače spustijo v kletko za razmnoževanje;
|
|
E
|
:
|
cev (plastična ali steklena, notranji premer približno 8 mm) za zbiranje odraslih trzač iz posode.
|
Shematski prikaz preskusa življenjskega cikla:
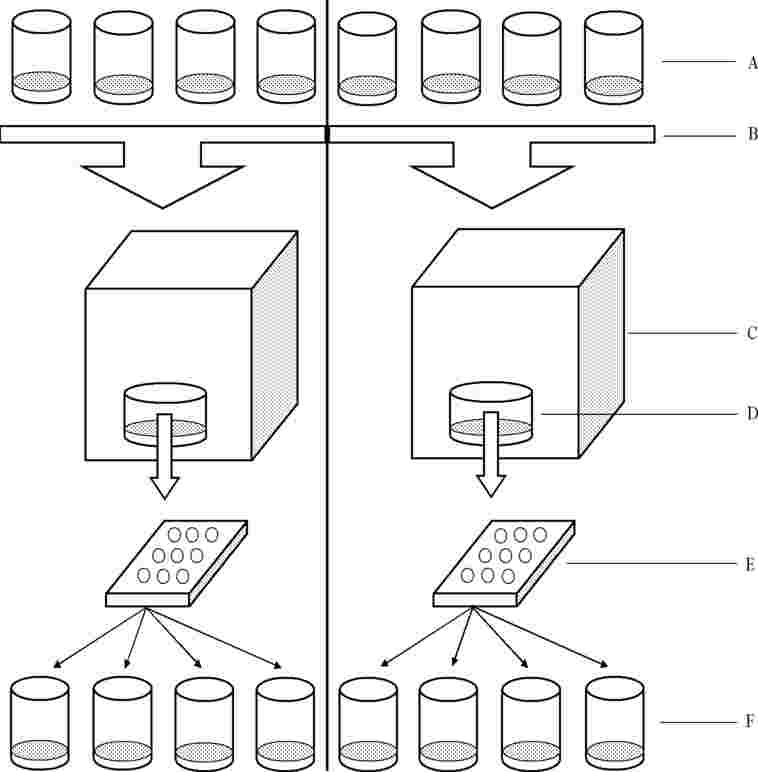
|
A
|
:
|
prva generacija – preskusne posode, ki vsebujejo sistem z vodo in usedlino, osem ponovitev, 20 ličink prvega stadija na posodo;
|
|
B
|
:
|
štiri preskusne posode za vsako kletko za razmnoževanje, A in B;
|
|
C
|
:
|
kletki za razmnoževanje (A in B) za rojenje, parjenje in odlaganje jajčec;
|
|
D
|
:
|
kristalizirki za odlaganje nizov jajčec;
|
|
E
|
:
|
mikroplošči, ena vdolbinica za vsak niz jajčec;
|
|
F
|
:
|
druga generacija – preskusne posode, ki vsebujejo sistem z vodo in usedlino, osem ponovitev, 20 ličink prvega stadija na posodo.
|
C.41 PRESKUS SPOLNEGA RAZVOJA RIB
UVOD
|
1.
|
Ta preskusna metoda ustreza Smernici za preskušanje OECD (TG) 234 (2011). Temelji na sklepu iz leta 1998, da se pripravijo nove ali posodobijo obstoječe preskusne metode za spremljanje in preskušanje potencialnih povzročiteljev endokrinih motenj. Preskus spolnega razvoja rib (FSDT) je bil opredeljen kot obetavna preskusna metoda, ki zajema občutljivo življenjsko fazo rib, ki se odzivajo na kemikalije, podobne estrogenu in androgenu. Med letoma 2006 in 2010 se je izvajala medlaboratorijska validacija preskusne metode, pri čemer so bile validirane japonska medaka (Oryzias latipes), cebrica (Danio rerio) in zet (Gasterosteus aculeatus), črnoglavi pisanec (Pimephales promelas) pa je bil delno validiran (41) (42) (43). Ta protokol vključuje japonsko medako, zeta in cebrico. Protokol je načeloma razširitev OECD TG 210 Ribe, preskus strupenosti v zgodnji življenjski fazi (1), kjer se izpostavljenost nadaljuje, dokler niso ribe spolno diferencirane, tj. približno 60 dni po tem, ko se izvalijo (DPH), pri japonski medaki, zetu in cebrici (obdobje izpostavljenosti je lahko pri drugih vrstah, ki še bodo validirane, krajše ali daljše), pri čemer se dodajo endokrine občutljive končne točke. S preskusom spolnega razvoja rib se ocenjujejo učinki v zgodnji življenjski fazi in možne škodljive posledice kemikalij, ki domnevno povzročajo endokrine motnje (npr. inhibitorji estrogenov, androgenov in steroidogeneze) spolnega razvoja. Kombinacija dveh glavnih endokrinih končnih točk, koncentracija vitelogenina (VTG) in fenotipsko razmerje med spoloma omogočajo, da se s preskusom nakaže način delovanja preskusne kemikalije. Zaradi spremembe fenotipskega razmerja med spoloma, ki je pomembna za populacijo, se lahko preskus spolnega razvoja rib uporablja za oceno nevarnosti in tveganja. Če se preskus uporabi za oceno nevarnosti ali tveganja, pa se zet ne sme uporabiti, ker validacijski podatki, ki so do zdaj na voljo, kažejo, da so pri tej vrsti spremembe fenotipskega razmerja med spoloma, ki jih povzroči preskusna kemikalija, neobičajne.
|
|
2.
|
Protokol temelji na ribah, ki so kemikalijam izpostavljene prek vode v spolno nestabilnem obdobju, v katerem naj bi bile ribe najbolj občutljive na učinke kemikalij, ki povzročajo endokrine motnje, ki ovirajo spolni razvoj. Glavni končni točki se izmerita kot kazalnika razvojnih kromosomskih aberacij, povezanih z endokrinim sistemom, koncentracije VTG in razmerja med spoloma (deleža po spolu), določena s histologijo spolnih žlez. Histopatologija spolnih žlez (ocena in določanje faze oocitov in spermatogenih celic) ni obvezna. Poleg tega se določi genetski spol, kadar koli je mogoče (npr. pri japonski medaki in zetu). Prisotnost označevalca genetskega spola je pomembna prednost, ker poveča moč statističnih podatkov o razmerju med spoloma in omogoči zaznavanje posamezne spremembe fenotipičnega spola. Druge zgornje končne točke, ki jih je treba izmeriti, vključujejo hitrost izvalitve, preživetje, dolžino in telesno težo. Preskusna metoda bi se lahko prilagodila drugim vrstam, ki niso omenjene zgoraj, če bi prestale enako validacijo, kot so jo japonska medaka, zet in cebrica, če so ribe iz kontrole ob koncu preskusa spolno diferencirane, če so ravni VTG dovolj visoke za zaznavanje pomembnih variacij, povezanih s kemikalijo, in če se z referenčnimi kemikalijami z endokrinim delovanjem ((anti-)estrogeni, (anti-)androgeni, inhibitorji aromataze itd.) vzpostavi občutljivost preskusnega sistema. Poleg tega mora OECD pregledati vsa validacijska poročila, ki se nanašajo na podatke o preskusu spolnega razvoja rib z uporabo drugih vrst, rezultat validacije pa se mora šteti za zadovoljivega.
|
Začetni pomisleki in omejitve
|
3.
|
VTG običajno proizvajajo jetra samic oviparnih vretenčarjev kot odziv na kroženje endogenega estrogena (2). Je predhodna sestavina beljakovin jajčnega rumenjaka, ki po nastanku v jetrih potuje po krvnem obtoku do jajčnika, kjer jo absorbirajo in spremenijo razvijajoča se jajčeca. Sinteza VTG je pri nezrelih ribah in odraslih samcih rib zelo omejena, ker nimajo dovolj krožečega estrogena, čeprav zaznavna. Vendar so jetra sposobna sinteze in izločanja VTG kot odziv na spodbujanje eksogenega estrogena (3) (4) (5).
|
|
4.
|
Meritev VTG je namenjena zaznavanju kemikalij z estrogenimi, antiestrogenimi in androgenimi načini delovanja ter kemikalijam, ki vplivajo na steroidogenezo, kot so na primer inhibitorji aromataze. Zaznavanje estrogenih kemikalij je mogoča z meritvijo indukcije VTG pri samcih in je bila obsežno dokumentirana v strokovno pregledani znanstveni literaturi. Indukcija VTG je bila dokazana tudi po izpostavljenosti androgenom, ki se lahko aromatizirajo (6) (7). Zaradi zmanjšanja ravni kroženja estrogena pri samicah, na primer z zaviranjem aromataze, ki spremeni endogeni androgen v naravni estrogen 17β-estradiol, se zmanjša koncentracija VTG, ki se uporablja za zaznavanje kemikalij, ki imajo lastnosti zaviranja aromataze, ali širše inhibitorjev steroidogeneze (33). Biološka pomembnost odziva VTG na zaviranje estrogena/aromataze je bila dokazana in obsežno dokumentirana (8) (9). Vendar je mogoče, da lahko na nastajanje VTG pri samicah vplivajo tudi splošna strupenost in neendokrini strupeni načini delovanja.
|
|
5.
|
Za redno uporabo za kvantifikacijo VTG v krvi, jetrih, celotnem telesu ali odvzetih vzorcih homogenata glave/repa posameznih rib je bilo uspešno razvitih in standardiziranih več merilnih metod. Tako je pri cebrici, zetu in japonski medaki ter tudi pri delno validirani vrsti črnoglavega pisanca; na voljo so metode encimskega imunskega testa (ELISA), ki so specifične za posamezne vrste in uporabljajo imunokemijo za kvantifikacijo VTG (5) (10) (11) (12) (13) (14) (15) (16). Pri japonski medaki in cebrici je dobra povezava med VTG, izmerjenim v krvni plazmi, jetrih in vzorcih homogenata, čeprav bi lahko homogenati kazali nekoliko manjše vrednosti kot plazma (17) (18) (19). V Dodatku 5 so navedeni priporočeni postopki za odvzem vzorcev za analizo VTG.
|
|
6.
|
Sprememba fenotipskega razmerja med spoloma (deleži po spolu) so končna točka, ki izraža spremembo spola. Načeloma lahko estrogeni, antiestrogeni, androgeni, antiandrogeni in kemikalije, ki zavirajo steroidogenezo, vplivajo na razmerje med spoloma pri ribah, ki se razvijajo (20). Dokazano je bilo, da je sprememba spola pri cebricah delno spremenljiva (21) po izpostavljenosti kemikaliji, ki je podobna estrogenu, pri čemer je sprememba spola po izpostavljenosti kemikaliji, ki je podobna androgenu, stalna (30). Spol se določi kot ženski, moški, dvospolni (v eni spolni žlezi so oociti in spermatogene celice) ali nediferenciran ter se pri posameznih ribah določi s histološkim pregledom spolnih žlez. Smernice so navedene v Dodatku 7 in Smernici OECD za določitev histopatologije, povezane z endokrinim sistemom, spolnih žlez pri ribah (22).
|
|
7.
|
Genetski spol se pregleda prek genetskih označevalcev, kadar obstajajo pri dani vrsti rib. Pri japonski medaki se lahko ženski geni XX ali moški geni XY določijo z verižno reakcijo s polimerazo (PCR) ali z analizo na kromosom Y vezanega gena z domeno DM (prisotnost ali odsotnost domene DM), kot je opisano v (23) (24). Za zeta obstaja enakovredna metoda PCR za določitev genetskega spola, ki je opisana v Dodatku 10. Če se lahko posamezni genetski spol poveže s fenotipičnim spolom, se vrednost preskusa izboljša, pri čemer je zato treba genetski spol določiti pri vrstah z dokumentiranimi označevalci genetskega spola.
|
|
8.
|
Glavni endokrini končni točki, tj. VTG in razmerje med spoloma, lahko skupaj dokažeta endokrini način delovanja (MOA) kemikalije (tabela 1). Razmerje med spoloma je biomarker, pomemben za populacijo (25) (26), za nekatere dobro opredeljene načine delovanja pa se lahko rezultati preskusa spolnega razvoja rib uporabijo za namene ocene nevarnosti in tveganja, če regulativna agencija meni, da je to ustrezno. Ti načini delovanja so zdaj estrogeni, androgeni in inhibitorji steroidogeneze.
Tabela 1
Odziv endokrinih končnih točk na različne načine delovanja kemikalij:
↑= povečevanje, ↓= zmanjševanje, – = se ne proučuje
|
MOA
|
VTG ♂
|
VTG ♀
|
Razmerje med spoloma
|
Viri
|
|
šibek agonist estrogena
|
↑
|
↑
|
↑ ♀ ali ↑ nedif.
|
(27) (40)
|
|
močan agonist estrogena
|
↑
|
↑
|
↑ ♀ ali ↑ nedif., ne ♂
|
(28) (40)
|
|
antagonist estrogena
|
—
|
—
|
↓ ♀, ↑ nedif.
|
(29)
|
|
agonist androgena
|
↓ ali –
|
↓ ali –
|
↑ ♂, ne ♀
|
(28) (30)
|
|
antagonist androgena
|
—
|
—
|
↑ ♀
↑ dvospolni
|
(31)
|
|
inhibitor aromataze
|
↓
|
↓
|
↓ ♀
|
(33)
|
|
|
9.
|
Preskus spolnega razvoja rib ne zajema razmnoževalne življenjske faze rib, zato je treba kemikalije, ki domnevno vplivajo na razmnoževanje pri nižjih koncentracijah kot na spolni razvoj, proučiti s preskusom, ki zajema razmnoževanje.
|
|
10.
|
Opredelitve pojmov za namen te preskusne metode so navedene v Dodatku 1.
|
|
11.
|
Cilj preskusa spolnega razvoja rib in vivo je določitev kemikalij z androgenimi in estrogenimi lastnostmi ter antiandrogenimi lastnostmi, antiestrogenimi lastnostmi in lastnostmi, ki zavirajo steroidogenezo. Fazi validacije preskusa spolnega razvoja rib (1 in 2) sta zajeli estrogene in androgene kemikalije ter kemikalije, ki zavirajo steroidogenezo. Učinki na antagoniste estrogena in androgena v preskusu spolnega razvoja rib so navedeni v tabeli 1, vendar so ti načini delovanja zdaj manj dokumentirani.
|
NAČELO PRESKUSA
|
12.
|
V preskusu so ribe od novo oplojene ikre do konca spolne diferenciacije izpostavljene vsaj trem koncentracijam preskusne kemikalije, raztopljene v vodi. Preskusni pogoji morajo biti pretočni, razen če niso mogoči zaradi razpoložljivosti ali narave (npr. omejena topnost) preskusne kemikalije. Preskus se začne z vnosom novo oplojenih iker (pred brazdanjem blastodiska) v preskusne komore. Vnos posameznih vrst v komore je opisan v odstavku 27. Pri validiranih vrstah, tj. japonski medaki, zetu in cebrici, se preskus konča 60 dni po izvalitvi. Po koncu preskusa se vse ribe humano evtanazirajo. Za analizo VTG se odvzamejo biološki vzorci (krvna plazma, jetra ali homogenat glave/repa) posameznih rib, preostali del pa se fiksira za histološko oceno spolnih žlez, da se določi fenotipični spol; neobvezno se lahko opravi histopatologija (npr. določanje faze spolnih žlez, stopnja dvospolnosti). Pri vrstah, ki imajo ustrezne označevalce, se odvzame biološki vzorec (predrepna ali hrbtna plavut) za določitev genetskega spola (dodatka 9 in 10).
|
|
13.
|
Pregled zadevnih preskusnih pogojev, specifičnih za validirane vrste, tj. japonsko medako, zeta in cebrico, je naveden v Dodatku 2.
|
INFORMACIJE O PRESKUSNI KEMIKALIJI
|
14.
|
Na voljo morajo biti rezultati preskusa akutne strupenosti ali drugega kratkoročnega preskusa strupenosti [npr. preskusna metoda C.14 (34) in OECD TG 210 (1)], po možnosti izvedenega z vrstami, izbranimi za ta preskus. To pomeni, da sta znana topnost preskusne kemikalije v vodi in parni tlak preskusne kemikalije ter da je na voljo zanesljiva analitska metoda za kvantifikacijo kemikalije v preskusnih komorah z znano in izpričano točnostjo ter mejo zaznavnosti.
|
|
15.
|
Druge uporabne informacije so strukturna formula, čistost kemikalije, stabilnost v vodi ali na svetlobi, Pow in rezultati preskusa za lahko biološko razgradljivost (metoda C.4) (35).
|
Merila za sprejemljivost preskusa
|
16.
|
Za sprejemljivost rezultatov preskusa morajo biti izpolnjeni naslednji pogoji:
|
—
|
koncentracija raztopljenega kisika mora biti ves čas preskusa vsaj 60 % nasičenosti z zrakom (ASV),
|
|
—
|
razlika v temperaturi vode v različnih preskusnih komorah med obdobjem izpostavljenosti nikoli ne sme biti večja od ± 1,5 °C in jo je treba vzdrževati znotraj temperaturnih razponov, ki so določeni za preskusno vrsto (Dodatek 2),
|
|
—
|
na voljo mora biti validirana metoda za analizo kemikalije za izpostavljenost z mejo zaznavnosti, ki je znatno nižja od najnižje nominalne koncentracije, zbrati pa je treba dokaze, da so bile koncentracije preskusne kemikalije v raztopini zadovoljivo ohranjene v razponu ± 20 % srednjih izmerjenih vrednosti,
|
|
—
|
število vseh preživelih oplojenih iker v kontrolah in, kadar je primerno, v kontrolah s topilom mora biti večje ali enako mejnim vrednostim iz Dodatka 2,
|
|
—
|
merila sprejemljivosti, povezana z rastjo in lastnostmi spola ob koncu preskusa, temeljijo na podatkih iz kontrolnih skupin (združene kontrole s topilom in vodo, če pa se zelo razlikujejo, samo s topilom):
|
|
Japonska medaka
|
Cebrica
|
Zet
|
|
Rast
|
Mokra teža ribe (osušene s pivnikom)
|
> 150 mg
|
> 75 mg
|
> 120 mg
|
|
Dolžina (standardna dolžina)
|
> 20 mm
|
> 14 mm
|
> 20 mm
|
|
Razmerje med spoloma (% samcev ali samic)
|
30–70 %
|
30–70 %
|
30–70 %
|
|
|
—
|
Če se uporabi topilo, ne sme imeti statistično značilnega učinka na preživetje in ne sme povzročati učinkov endokrinih motilcev ali drugih škodljivih učinkov na zgodnje življenjske faze, kar se pokaže s kontrolo s topilom.
|
Če se opazi odstopanje od meril za sprejemljivost preskusa, je treba posledice obravnavati glede na zanesljivost podatkov o preskusu in te pomisleke vključiti v poročanje.
|
OPIS PRESKUSNE METODE
Preskusne komore
|
17.
|
Uporabijo se lahko kakršne koli steklene, nerjavne ali druge kemijsko inertne komore. Komore morajo biti dovolj velike, da omogočajo skladnost s stopnjo obremenitve, navedeno v nadaljevanju. Priporočljivo je, da se preskusno komore naključno postavijo v preskusno območje. Bolj kot povsem naključni načrt se priporoča načrt naključne razdelitve v bloke, pri kateri so v vsakem bloku prisotne vse koncentracije. Preskusne komore morajo biti zaščitene pred neželenimi motnjami.
|
Izbira vrst
|
18.
|
Priporočene vrste rib so navedene v Dodatku 2. Postopki za vključitev novih vrst so navedeni v odstavku 2.
|
Vzdrževanje starševskih rib
|
19.
|
Podrobnosti o vzdrževanju starševskih rib v zadovoljivih pogojih so navedene v OECD TG 210 (1). Starševske ribe je treba enkrat ali dvakrat na dan hraniti z ustrezno hrano.
|
Ravnanje z embrii in ličinkami
|
20.
|
Embrii in ličinke se lahko na začetku izpostavijo v glavni komori v manjših steklenih ali nerjavnih komorah, ki imajo mrežaste stranice ali konce, da se lahko skozi komoro pretaka preskusna kemikalija. Neturbulentni tok skozi te majhne komore se lahko doseže tako, da se komore obesijo na držalo, nameščeno tako, da premika posodo gor in dol, vendar tako, da so organizmi ves čas potopljeni.
|
|
21.
|
Kadar se za zadrževanje iker v glavni preskusni komori uporabljajo posodice, rešetke ali mreže za ikre, je treba te priprave odstraniti, ko se ličinke izvalijo, obdržijo se le mreže, da ribe ne pobegnejo. Če je treba ličinke prenesti, se te ne smejo izpostaviti zraku in pri spuščanju rib iz posod za ikre se ne smejo uporabljati lovilne mrežice. Čas prenosa je različen, odvisno od vrste, in tudi ni vselej potreben.
|
Voda
|
22.
|
Vsaka voda, v kateri je preživetje preskusne vrste v kontroli vsaj tako dobro kot v vodi, opisani v Dodatku 3, je primerna kot preskusna voda. Voda mora biti ves čas trajanja preskusa konstantne kakovosti. Za zagotovitev, da voda za redčenje ne bi neprimerno vplivala na rezultat preskusa (na primer z odzivom na preskusno kemikalijo) ali škodljivo učinkovala na produktivnost plemenskih rib, je treba v časovnih razmikih odvzemati vzorce za analizo. Skupni organski ogljik, prevodnost, pH in suspendirane trdne snovi je treba izmeriti na primer vsake tri mesece, če je znano, da je kakovost vode za redčenje razmeroma konstantna. Če je kakovost vode vprašljiva, je treba izvajati meritve težkih kovin (npr. Cu, Pb, Zn, Hg, Cd, Ni), glavnih anionov in kationov (npr. Ca2+, Mg2+, Na+, K+, Cl–, SO4
2–) ter pesticidov. Podrobnosti o kemijski analizi in odvzemu vode so navedene v odstavku 34.
|
Preskusne raztopine
|
23.
|
Če je izvedljivo, je treba uporabiti pretočni sistem. Za pretočne preskuse je potreben sistem, ki stalno odmerja in redči založno raztopino preskusne kemikalije (npr. merilna črpalka, proporcionalni razredčevalnik in sistem naprav za nasičenje), da dovaja niz koncentracij v preskusne komore. Pretok založnih raztopin in vode za redčenje je treba med preskusom preverjati v časovnih razmikih in se ne sme razlikovati za več kot 10 % med celotnim preskusom. Ugotovljeno je bilo, da je primeren pretok enak prostornini vsaj petih preskusnih komor na 24 ur (1). Izogibati se je treba uporabi cevnega materiala ali drugih materialov, ki lahko vsebujejo biološko aktivne kemikalije ali adsorbirajo preskusno kemikalijo.
|
|
24.
|
Založno raztopino je treba po možnosti pripraviti brez uporabe topil preprosto z mešanjem ali stresanjem preskusne kemikalije v vodi za redčenje z uporabo mehanskih sredstev (npr. z mešanjem ali ultrazvočnim razbijanjem). Če se preskusna kemikalija v vodi težko raztopi, je treba upoštevati postopke, opisane v Smernici OECD za preskušanje strupenosti zahtevnih snovi in zmesi v vodnem okolju (36). Uporabi topil se je treba izogniti, vendar bo v nekaterih primerih morda potrebna, da se pripravi primerno koncentrirana založna raztopina. Primeri ustreznih topil so navedeni v (36).
|
|
25.
|
Polstatičnim preskusnim pogojem se je treba izogibati, razen če so utemeljeni s trdnimi razlogi, povezanimi s preskusno kemikalijo (npr. stabilnost, omejena razpoložljivost, visoki stroški ali nevarnost). Za polstatično tehniko se lahko uporabita dva različna postopka obnove; bodisi se pripravijo nove preskusne raztopine v čistih posodah ter se preživele ikre in ličinke nežno prenesejo v nove posode bodisi preskusni organizmi ostanejo v preskusnih komorah, medtem ko se vsak dan zamenja del (vsaj dve tretjini) preskusne vode.
|
POSTOPEK
Pogoji izpostavljenosti
Odvzem iker in trajanje
|
26.
|
Da bi preprečili genetsko nagnjenost, se ikre odvzamejo pri vsaj treh parih ali skupinah, ki se parijo, premešajo in naključno izberejo za začetek preskusa. Opis umetne oploditve pri zetu je opisan v Dodatku 11. Preskus se mora začeti čim prej po tem, ko se ikre oplodijo, pri čemer se embrii po možnosti potopijo v preskusne raztopine pred začetkom brazdanja blastodiska ali čim prej po tej fazi in ne pozneje kot 12 ur po oploditvi. Preskus se mora izvajati do konca spolne diferenciacije v kontrolni skupini (pri japonski medaki, zetu in cebrici 60 dni po tem, ko se izležejo).
|
Obremenitev
|
27.
|
Na začetku preskusa mora biti na eno koncentracijo vsaj 120 oplojenih iker, razdeljenih med vsaj 4 ponovitve (sprejemljiva je razporeditev v kontrole na podlagi kvadratnega korena). Ikre je treba naključno porazdeliti (z uporabo statističnih tabel za naključno razporeditev) med tretiranja. Stopnja obremenitve (za opredelitev glej Dodatek 1) mora biti dovolj nizka za vzdrževanje koncentracije raztopljenega kisika na vsaj 60 % nasičenosti z zrakom brez neposrednega prezračevanja komor. Za pretočne preskuse je priporočena stopnja obremenitve, ki nikoli ne presega 0,5 g/l na 24 ur in ne presega 5 g/l raztopine. Najpozneje 28 dni po oploditvi je treba število rib na ponovitev prerazporediti, da je v vsaki ponovitvi čim bolj enako število rib. Če se pojavi smrtnost, povezana z izpostavljenostjo, je treba število ponovitev ustrezno zmanjšati, da se ohrani čim bolj enaka gostota rib med stopnjami tretiranja.
|
Svetloba in temperatura
|
28.
|
Obdobje osvetljenosti in temperatura vode morata biti ustrezna za preskusno vrsto (za poskuse pogoje za preskus spolnega razvoja rib glej Dodatek 2).
|
Hranjenje
|
29.
|
Hrana in hranjenje sta ključna, zato je bistveno, da se pravilna hrana za posamezno fazo dovaja v ustreznih časovnih razmikih in v količini, ki je ustrezna za podporo normalne rasti. Hranjenje mora biti ad libitum, pri čemer je treba čim bolj zmanjšati presežek. Za zagotovitev ustrezne hitrosti rasti je treba ribe hraniti vsaj dvakrat na dan (ob vikendih je sprejemljivo enkrat na dan), med posameznimi krmljenji pa morajo preteči vsaj tri ure. Ostanke hrane in iztrebke je treba odstraniti, da se prepreči kopičenje odpadkov. S pridobljenimi izkušnjami se hrana in načini hranjenja stalno izpopolnjujejo, da se izboljšata preživetje in rast. Zato si je treba prizadevati za potrditev predlaganega načina pri priznanih strokovnjakih. Hranjenje je treba prekiniti 24 ur pred koncem preskusa. Primeri ustrezne hrane so navedeni v Dodatku 2 (glej tudi okvir OECD za preskušanje rib (39)).
|
Preskusne koncentracije
|
30.
|
Preskusne kemikalije morajo biti razporejene, kot je opisano v Dodatku 4. Uporabiti je treba vsaj tri preskusne koncentracije v vsaj štirih ponovitvah. Pri izbiri obsega preskusnih koncentracij je treba upoštevati krivuljo odvisnosti LC50 od časa izpostavljenosti pri akutnih študijah. Če se bodo podatki uporabiti za oceno tveganja, se priporoča pet preskusnih koncentracij.
|
|
31.
|
Koncentracij kemikalije, ki so višje od 10 % LC50 pri akutnem odraslem osebku ali 10 mg/l, katera koli je nižja, ni treba preskusiti. Najvišja preskusna koncentracija mora biti 10 % LC50 v življenjski fazi ličinke/mladiča.
|
Kontrole
|
32.
|
Poleg preskusnih koncentracij je treba izvesti tudi kontrolo z vodo za redčenje (≥ 4 ponovitve) in, če je ustrezno, kontrolo s topilom (≥ 4 ponovitve). V preskusu se lahko uporabijo le topila, za katera je bilo dokazano, da nimajo statistično značilnega učinka na končne točke preskusa.
|
|
33.
|
Če se uporabi topilo, njegova končna koncentracija ne sme biti večja od 0,1 ml/l (36) in mora biti enaka v vseh preskusnih komorah, razen v kontroli z vodo za redčenje. Vendar si je treba čim bolj prizadevati, da se taka topila ne uporabijo ali da so koncentracije topil čim nižje.
|
Pogostost analitskih določitev in meritev
|
34.
|
Kemijsko analizo koncentracije preskusne kemikalije je treba izvesti pred začetkom preskusa, da se preveri skladnost z merili sprejemljivosti. Vse ponovitve je treba ločeno analizirati na začetku in koncu preskusa. Med preskusom je treba vsaj enkrat na teden analizirati eno ponovitev na preskusno koncentracijo, pri čemer se ponovitve sistematično zamenjujejo (1, 2, 3, 4, 1, 2 …). Če se vzorci shranijo za poznejšo analizo, je treba metodo shranjevanja vzorcev predhodno validirati. Vzorce je treba filtrirati (npr. skozi 0,45 μm velike pore) ali centrifugirati, da se zagotovijo določitve kemikalij v dejanski raztopini.
|
|
35.
|
Med preskusom je treba meriti raztopljeni kisik, pH, skupno trdoto, prevodnost, slanost (če je ustrezno) in temperaturo v vseh preskusnih komorah. Raztopljeni kisik, slanost (če je ustrezno) in temperaturo je treba meriti vsaj enkrat na teden, pH, prevodnost in trdoto pa na začetku in koncu preskusa. Temperaturo je treba po možnosti stalno spremljati v vsaj eni preskusni komori.
|
|
36.
|
Rezultati morajo temeljiti na merjenih koncentracijah. Če pa se je koncentracija preskusne kemikalije v raztopini zadovoljivo vzdrževala znotraj ± 20 % nominalne koncentracije ves čas preskusa, lahko rezultati temeljijo na nominalnih ali merjenih vrednostih.
|
Opažanja in meritve
Faze razvoja embria
|
37.
|
Izpostavljenost se mora začeti čim prej po oploditvi in pred začetkom brazdanja blastodiska, vendar ne pozneje kot 12 ur po oploditvi, da se zagotovi izpostavljenost med zgodnjo fazo embrionalnega razvoja.
|
Izvalitev in preživetje
|
38.
|
Vsaj enkrat na dan je treba opazovati izvalitev in preživetje ter to zapisati. Mrtve zarodke, ličinke in mladiče je treba odstraniti čim prej po tem, ko se opazijo, ker se lahko hitro razkrojijo in razpadejo zaradi delovanja drugih rib. Izjemna pazljivost je potrebna pri odstranjevanju posameznih mrtvih osebkov, da ne udarimo ali fizično poškodujemo sosednjih iker/ličink, saj so te izjemno nežne in občutljive. Merila za smrt so različna glede na življenjsko fazo:
|
—
|
za ikre: zlasti v zgodnjih fazah opazna izguba prosojnosti in sprememba barve, ki jo povzroči koagulacija in/ali obarjanje beljakovin, ki povzročajo bel moten videz,
|
|
—
|
za ličinke in mladiče: negibnost in/ali odsotnost dihalnega gibanja in/ali odsotnost srčnega utripa in/ali bela motna obarvanost osrednjega živčnega sistema in/ali pomanjkanje odzivanja na mehanske dražljaje.
|
|
Nenormalen videz
|
39.
|
Zabeležiti je treba število ličink ali rib, pri katerih se kaže nenormalna oblika telesa, pri čemer je treba opisati videz in naravo nenormalnosti. Opozoriti je treba, da so nenormalni embrii in ličinke lahko naraven pojav, in jih je v kontrolah pri nekaterih vrstah lahko več odstotkov. Nenormalne živali je treba odstraniti iz preskusnih komor, ko poginejo. Vendar je treba v skladu z Direktivo 2010/63/EU Evropskega parlamenta in Sveta z dne 22. septembra 2010 o zaščiti živali, ki se uporabljajo v znanstvene namene, živali anestezirati in evtanazirati v skladu z opisom iz odstavka 44 ter jih za analizo podatkov obravnavati kot smrtne primere, če nenormalnosti povzročajo bolečino, trpljenje in stisko ali je mogoče zanesljivo predvideti trajne poškodbe in pogin.
|
Nenormalno obnašanje
|
40.
|
Nenormalnosti, npr. hiperventilacijo, nekoordinirano plavanje, netipično mirovanje in netipično obnašanje pri hranjenju, je treba zapisati, ko je pojavijo.
|
Teža
|
41.
|
Na koncu preskusa je treba vse preživele ribe evtanazirati (anestezirati, če je treba vzeti vzorce krvi) ter izmeriti mokro težo (osušeno s pivnikom) posameznih osebkov.
|
Dolžina
|
42.
|
Na koncu preskusa je treba izmeriti dolžine (standardna dolžina) posameznih osebkov.
|
|
43.
|
Na podlagi teh opažanj bodo za poročanje na voljo vsi ali nekateri podatki, navedeni v nadaljevanju:
|
—
|
število zdravih rib na koncu preskusa,
|
|
—
|
čas začetka in konca izvalitve,
|
|
—
|
dolžina in teža preživelih živali,
|
|
—
|
število deformiranih živali,
|
|
—
|
število rib, ki kažejo nenormalno obnašanje.
|
|
Vzorčenje rib
|
44.
|
Ribe se vzorčijo ob zaključku preskusa. Vzorčene ribe je treba evtanazirati npr. z MS-222 (100–500 mg/l, pufran z 200 mg NaHCO3/l) ali FA-100 (4-alil-2-metoksifenol: evgenol) ter jih ločeno izmeriti in stehtati kot mokro težo (osušeno s pivnikom) ali anestezirati, če je treba vzeti vzorec krvi (glej odstavek 49).
|
Vzorčenje za analizo VTG in določitev spola s histološko oceno
|
45.
|
Vse ribe je treba vzorčiti in pripraviti za analizo spola in VTG. Vse ribe je treba histološko analizirati, da se določi spol. Za meritve VTG je sprejemljivo podvzorčenje vsaj 16 rib iz vsake ponovitve. Za VTG je treba analizirati več rib, če se izkaže, da rezultati podvzorčenja niso jasni.
|
|
46.
|
Postopek vzorčenja za VTG in določitev spola je odvisen od metode analize VTG.
|
Metoda homogenata glave/repa za analizo VTG
|
47.
|
Riba se evtanazira. Glava in rep vsake ribe se ločita od njenega telesa z rezi s skalpelom neposredno za prsnimi plavutmi in neposredno za hrbtno plavutjo (glej sliko 1). Glave in repi rib se združijo, stehtajo ter ločeno oštevilčijo, zamrznejo v tekočem dušiku in shranijo pri – 70 °C ali manj za analizo VTG. Telo ribe se oštevilči in fiksira v ustreznem fiksativu za histološko oceno (22). Z uporabo te metode se VTG in histopatologija ocenita pri vsakem posameznem osebku, zato se lahko morebitna sprememba ravni VTG poveže s fenotipičnim spolom ribe ali genetskim spolom (japonska medaka in zet) ribe. Dodatne informacije so navedene v smernici za homogenizacijo (Dodatek 5) in smernici za kvantifikacijo VTG (Dodatek 6).
|
Metoda živega homogenata za analizo VTG
|
48.
|
Riba se evtanazira. Jetra se secirajo in shranijo pri – 70 °C ali nižji temperaturi. Priporočeni postopki za odstranitev jeter in predhodno tretiranje so navedeni v OECD TG 229 (37) ali v poglavju C.37 te priloge (38). Jetra se nato ločeno homogenizirajo, kot je opisano v OECD TG 229 ali poglavju C.37 te priloge. Zbrani supernatant se uporabi za merjenje VTG s homogeno tehniko ELISA (glej Dodatek 6 za primer kvantifikacije pri cebrici ali OECD TG 229 (37) pri japonski medaki). Na podlagi tega pristopa se lahko pridobijo tudi podatki o VTG in histologiji spolnih žlez pri posameznih ribah.
|
Metoda krvne plazme za analizo VTG
|
49.
|
Za pridobitev plazme se kri odvzame iz anestezirane ribe s srčno punkcijo, iz repne vede ali z rezom repa in centrifugira pri 4 °C. Plazma se do uporabe hrani pri – 70 °C ali nižji temperaturi. Za histologijo se cela riba evtanazira in fiksira. Vzorci plazme in ribe se ločeno oštevilčijo, da se ravni VTG povežejo s spolom ribe.
Slika 1
Rezanje ribe za meritev VTG v homogenatu glava/rep in histološko oceno srednje rezine

|
Določitev genetskega spola
|
50.
|
Pri vrstah, ki imajo ustrezne označevalce, se za določitev genetskega spola odvzame biološki vzorec posamezne ribe. Pri japonski medaki se odvzame iz predrepne ali hrbtne plavuti. Podroben opis, vključno z vzorčenjem tkiva in določanjem spola z metodo PCR, je naveden v Dodatku 9. Enako je za zeta opis vzorčenja tkiva in metode PCR za določanje spola naveden v Dodatku 10.
|
Meritev VTG
|
51.
|
Meritev VTG mora temeljiti na kvantitativno in analitsko validirani metodi. Na voljo morajo biti informacije o variabilnosti metode pri preskusu in med preskusi, uporabljene v zadevnem laboratoriju. Vir laboratorijske in medlaboratorijske variabilnosti (najverjetneje) temelji na različnih razvojnih fazah populacije rib. Glede na variabilnost meritev VTG je treba NOEC, ki temeljijo le na tej končni točki, obravnavati zelo previdno. Na voljo so različne metode za oceno nastajanja VTG pri vrstah rib, obravnavanih v tem preskusu. Merilna tehnika, ki je razmeroma občutljiva in specifična, je določitev koncentracij proteinov z encimskim imunskim testom (ELISA). Uporabiti je treba homologna protitelesa (proti VTG iste vrste) in najpomembnejše homologne raztopine.
|
Določanje spola
|
52.
|
Glede na postopek vzorčenja VTG se cela riba ali preostali srednji del vsake ribe vstavi v predhodno označeno kaseto za obdelavo in fiksira v ustreznem fiksativu za histološko določitev spola (neobvezno tudi za oceno določanja faze spolnih žlez). Smernice za fiksiranje in vstavljanje so navedene v Dodatku 7 in Smernici OECD za določitev histopatologije, povezane z endokrinim sistemom, spolnih žlez pri ribah (22). Ribe se po obdelavi vstavijo v parafinske bloke. Osebki se v parafinski blok vstavijo vzdolžno. Pri vsakem osebku se odvzame vsaj šest vzdolžnih rezin (debeline 3–5 μm) s sprednje ravnine, vključno s spolnim tkivom obeh spolnih žlez. Razmik med temi rezinami mora biti približno 50 μm pri samcih in 250 μm pri samicah. Ker pa vsak blok pogosto vsebuje samce in samice (če je v vsak blok vstavljen več kot en osebek), mora biti razmik med rezinami iz teh blokov približno 50 μm, dokler se ne pridobi vsaj šest rezin spolnih žlez od vsakega samca. Zato se lahko razmik med rezinami poveča na približno 250 μm pri samicah. Rezine se pobarvajo s hematoksilinom in eozinom ter pregledajo pod svetlobnim mikroskopom, pri čemer se osredotoči na spol (samec, samica, dvospolnik ali nediferencirani osebek). Dvospolnost je opredeljena kot prisotnost več kot enega oocita v testisu na šest analiziranih rezin ali spermatogenih celic (da/ne) v jajčnikih. Histopatologija ter določanje faze jajčnikov in testisov nista obvezna, če pa se izvedeta, je treba rezultate sistematično analizirati in o njih poročati. Opozoriti je treba, da je za nekatere vrste rib običajna nepopolna razvitost para spolnih žlez, pri čemer je lahko prisotna le ena spolna žleza (npr. japonska medaka in občasno cebrica). Vsa taka opažanja je treba zabeležiti.
|
|
53.
|
Določitev genetskega spola pri posameznih osebkih japonske medake temelji na prisotnosti ali odsotnosti gena za določitev moškega spola, DMY, ki se nahaja na kromosomu Y. Genotipski spol medake se lahko določi s sekvenciranjem gena DMY iz DNA, ekstrahirane na primer iz kosa predrepne ali hrbtne plavuti. Prisotnost DMY kaže posameznika (samca) z geni XY ne glede na fenotip, medtem ko odsotnost DMY kaže posameznika (samico) z geni XX ne glede na fenotip (23). Smernice za pripravo tkiva in metodo PCR so navedene v Dodatku 9. Genetski spol se pri posameznih zetih določa tudi z metodo PCR, ki je opisana v Dodatku 10.
|
|
54.
|
O pojavu dvospolnosti (za opredelitev glej Dodatek 1) je treba poročati.
|
Sekundarne spolne značilnosti
|
55.
|
Sekundarne spolne značilnosti so pri vrstah, kot je japonska medaka, endokrino nadzorovane, zato je treba po možnosti opazovanje fizičnega videza rib izvesti na koncu izpostavljenosti. Pri japonski medaki je oblikovanje papil na zadnjem delu predrepne plavuti pri samicah občutljivo na androgen. V poglavju C.37 te priloge (38) so zadevne fotografije sekundarnih spolnih značilnosti pri samcih in androgeniziranih samic.
|
PODATKI IN POROČANJE
Obdelava rezultatov
|
56.
|
Pomembno je, da se končna točka določi z najmočnejšim statističnim preskusom. Dvojnik je poskusna enota, vendar je treba v statistično preskušanje vključiti variabilnost v ponovitvah. V Dodatku 8 je na voljo diagram poteka za odločitev o uporabi najprimernejšega statističnega preskusa na podlagi značilnosti podatkov, pridobljenih s preskusom. Raven statistične značilnosti za vse vključene končne točke je 0,05.
|
Deleži spola in genetskega spola
|
57.
|
Če obstaja monotoni odziv na odmerek, je treba deleže spola za znatne učinke (pristop NOEC/LOEC) izpostavljenosti analizirati s preskusom po Jonckheere-Terpstraju (preskus trenda). Če je ugotovljena nemonotonost, je treba uporabiti preskus med pari: Dunnettov preskus se uporabi, če se lahko pridobita normalnost in homogenost varianc. Tamhane-Dunnetov preskus se uporabi, če je prisotna homogenost varianc. Sicer se uporabi Mann-Whitneyjev preskus z Bonferroni-Holmovo prilagoditvijo. V Dodatku 8 je diagram poteka, v kateri so navedeni statistični podatki o deležih spola. Deleže spola je treba v tabelah predstaviti kot koncentracijski delež ± standardni odklon samcev, samic, dvospolnikov in nediferenciranih osebkov. Statistično značilnost je treba poudariti. Primeri so navedeni v validacijskem poročilu faze 2 preskusa spolnega razvoja rib (42). Genetski spol je treba sporočiti kot delež sprememb fenotipičnega spola samic, samcev, dvospolnikov in nediferenciranih osebkov.
|
Koncentracije VTG
|
58.
|
Analizirati je treba pomemben učinek (pristop NOEC/LOEC) izpostavljenosti koncentracijam VTG. Bolj zaželen kot t-preskus z Bonferronijevim popravkom je Dunnettov preskus. Če se uporabi Bonferronijev popravek, je bolj zaželen Bonferroni-Holmov popravek. Dovoliti je treba logaritmično transformacijo VTG, da se dosežeta normalnost in homogenost varianc. Če je odziv na koncentracijo skladen z monotonostjo, ima preskus po Jonckheere-Terpstraju prednost pred vsemi navedenimi preskusi. Če se uporabi t-preskus ali Dunnettov preskus, za nadaljevanje ni potreben F-preskus pomembnosti analize variance. Podrobnosti so navedene v tabeli poteka v Dodatku 8. Rezultate je treba predstaviti v tabelah kot koncentracijske sredine ± standardni odklon samcev, samic, dvospolnikov in nediferenciranih osebkov. Poudariti je treba statistično značilnost za fenotipične samice in fenotipične samce. Primeri so navedeni v validacijskem poročilu faze 2 preskusa spolnega razvoja rib (42).
|
Dejanske koncentracije preskusne kemikalije
|
59.
|
Dejanske koncentracije preskusne kemikalije v komorah je treba analizirati tako pogosto, kot je opisano v odstavku 34. Rezultate je treba sporočiti v tabelah kot srednjo koncentracijo ± standardni odklon na podlagi ponovitev in na podlagi koncentracij skupaj s poudarjenimi informacijami o številu vzorcev in izjemami pri srednji koncentraciji za tretiranje ± 20 %. Primeri so navedeni v validacijskem poročilu faze 2 preskusa spolnega razvoja rib (42).
|
Razlaga rezultatov
|
60.
|
Rezultate preskusa je treba razlagati previdno, kadar so merjene koncentracije preskusne kemikalije v preskusnih raztopinah blizu meje zaznavnosti analitske metode.
|
Poročilo o preskusu
|
61.
|
V poročilu o preskusu morajo biti naslednje informacije:
|
|
Preskusna kemikalija
|
—
|
zadevne fizikalno-kemijske lastnosti, identifikacijski podatki kemikalije vključno s čistostjo in analitsko metodo za kvantifikacijo preskusne kemikalije.
|
|
|
|
Preskusni pogoji
|
—
|
Uporabljeni postopek (npr. pretočni semi-statični/obnavljajoči; načrt preskusa, vključno s preskusnimi koncentracijami, metodo priprave založnih raztopin (v prilogi), pogostostjo obnavljanja (navesti je treba sredstvo za raztapljanje in njegovo koncentracijo, če se uporabi),
|
|
—
|
nominalne preskusne koncentracije, srednje vrednosti izmerjenih vrednosti in njihovi standardni odkloni v preskusnih komorah in metoda, s katero so bile te dobljene (uporabljeno analitsko metodo je treba predstaviti v prilogi), ter dokazi, da se meritve nanašajo na koncentracije preskusne kemikalije v pravi raztopini,
|
|
—
|
kakovost vode v preskusnih komorah, pH, trdota, temperatura in koncentracija raztopljenega kisika,
|
|
—
|
podrobne informacije o hranjenju (npr. vrsta hrane, vir, dana količina in pogostost dajanja ter analiza onesnaževal (npr. PCB, PAH in organoklorni pesticidi), če je ustrezno.
|
|
|
|
Rezultati
|
—
|
Dokazi, da so kontrole izpolnjevale merila za veljavnost: podatke o hitrosti izvalitve je treba predstaviti v tabelah kot delež na ponovitev in na koncentracijo. Poudariti je treba izjeme pri merilih sprejemljivosti (v kontrolah). Preživetje je treba predstaviti kot delež na ponovitev in na koncentracijo. Poudariti je treba izjeme pri merilih za veljavnost (v kontrolah),
|
|
—
|
jasna navedba rezultatov, pridobljenih na različnih opazovanih končnih točkah: preživetje embriov in uspešna izvalitev; zunanje nenormalnosti, dolžina in teža; meritve VTG (ng/g homogenata, ng/ml plazme ali ng/mg jeter); histologija spolnih žlez, razmerje med spoloma, podatki o genetskem spolu, pojav katerih koli nenavadnih odzivov rib in vidnih učinkov zaradi preskusne kemikalije.
|
|
|
|
62.
|
Rezultate preskusa je treba predstaviti kot srednje vrednosti ± standardni odklon (SD) ali standardno napako (SE). Statistične podatke je treba sporočiti vsaj kot NOEC in LOEC ter intervale zaupanja. Upoštevati je treba statistično tabelo poteka (Dodatek 8).
|
LITERATURA
|
(1)
|
OECD (1992), Fish, Early Life Stage Toxicity Test, Test Guideline No. 210, Guidelines for the Testing of Chemicals, OECD, Pariz.
|
|
(2)
|
Jobling, S., Sheahan, D., Osborne, J. A., Matthiessen, P., in Sumpter, J. P. (1996). ‚Inhibition of testicular growth in rainbow trout (Oncorhynchus mykiss) exposed to estrogenic alkylphenolic chemicals‘, Environmental Toxicology and Chemistry 15, str. 194–202.
|
|
(3)
|
Sumpter, J. P., in Jobling, S. (1995). ‚Vitellogenesis As A Biomarker for Estrogenic Contamination of the Aquatic Environment‘, Environmental Health Perspectives 103, str. 173– 178.
|
|
(4)
|
Tyler, C. R., van Aerle, R., Hutchinson, T. H., Maddix, S. in Trip, H. (1999). ‚An in vivo testing system for endocrine disruptors in fish early life stages using induction of vitellogenin‘, Environmental Toxicology and Chemistry 18, str. 337–347.
|
|
(5)
|
Holbech, H., Andersen, L., Petersen, G. I., Korsgaard, B., Pedersen, K. L. in Bjerregaard, P. (2001a). ‚Development of an ELISA for vitellogenin in whole body homogenate of zebrafish (Danio rerio)‘, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 130, str. 119– 131.
|
|
(6)
|
Andersen, L., Bjerregaard, P., in B. Korsgaard (2003). ‚Vitellogenin induction and brain aromatase activity in adult male and female zebrafish exposed to endocrine disrupters‘, Fish Physiology and Biochemistry 28, str. 319–321.
|
|
(7)
|
Orn, S., Holbech, H., Madsen, T. H., Norrgren, L., in Petersen, G. I. (2003). ‚Gonad development and vitellogenin production in zebrafish (Danio rerio) exposed to ethinylestradiol and methyltestosterone‘, Aquatic Toxicology 65, str. 397–411.
|
|
(8)
|
Panter, G. H., Hutchinson, T. H., Lange, R., Lye, C. M., Sumpter, J. P., Zerulla, M., in Tyler, C. R. (2002). ‚Utility of a juvenile fathead minnow screening assay for detecting (anti-)estrogenic substances‘, Environmental Toxicology and Chemistry 21, str. 319–326.
|
|
(9)
|
Sun, L. W., Zha, J. M., Spear, P. A., in Wang, Z. J. (2007). ‚Toxicity of the aromatase inhibitor letrozole to Japanese medaka (Oryzias latipes) eggs, larvae and breeding adults‘, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 145, str. 533–541.
|
|
(10)
|
Parks, L. G., Cheek, A. O., Denslow, N. D., Heppell, S. A., McLachlan, J. A., LeBlanc, G. A., in Sullivan, C. V. (1999). ‚Fathead minnow (Pimephales promelas) vitellogenin: purification, characterization and quantitative immunoassay for the detection of estrogenic compounds‘, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 123, str. 113– 125.
|
|
(11)
|
Brion, F., Nilsen, B. M., Eidem, J. K., Goksoyr, A., in Porcher, J. M. (2002). ‚Development and validation of an enzyme-linked immunosorbent assay to measure vitellogenin in the zebrafish (Danio rerio)‘, Environmental Toxicology and Chemistry 21, str. 1699– 1708.
|
|
(12)
|
Nishi, K., Chikae, M., Hatano, Y., Mizukami, H., Yamashita, M., Sakakibara, R., in Tamiya, E. (2002). ‚Development and application of a monoclonal antibody-based sandwich ELISA for quantification of Japanese medaka (Oryzias latipes) vitellogenin‘, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 132, str. 161– 169.
|
|
(13)
|
Hahlbeck, E., Katsiadaki, I., Mayer, I., Adolfsson-Erici, M., James, J., in Bengtsson, B. E. (2004). ‚The juvenile three-spined stickleback (Gasterosteus aculeatus L.) as a model organism for endocrine disruption – II – kidney hypertrophy, vitellogenin and spiggin induction‘, Aquatic Toxicology 70, str. 311–326.
|
|
(14)
|
Tatarazako, N., Koshio, M., Hori, H., Morita, M.. in Iguchi, T. (2004). ‚Validation of an enzyme-linked immunosorbent assay method for vitellogenin in the medaka‘, Journal of Health Science 50, str. 301–308.
|
|
(15)
|
Eidem, J. K., Kleivdal, H., Kroll, K., Denslow, N., van Aerle, R., Tyler, C., Panter, G., Hutchinson, T., in Goksoyr, A. (2006). ‚Development and validation of a direct homologous quantitative sandwich ELISA for fathead minnow (Pimephales promelas) vitellogenin. Aquatic Toxicology‘, 78, str. 202–206.
|
|
(16)
|
Jensen, K. M., in Ankley, G. T. (2006). ‚Evaluation of a commercial kit for measuring vitellogenin in the fathead minnow (Pimephales promelas)‘, Ecotoxicology and Environmental Safety 64, str. 101– 105.
|
|
(17)
|
Holbech, H., Petersen, G. I., Norman, A., Örn, S., Norrgren, L., in Bjerregaard, P. (2001b). ‚Suitability of zebrafish as test organism for detection of endocrine disrupting chemicals. Comparison of vitellogenin in plasma and whole body homogenate from zebrafish (Danio rerio) and rainbow trout (Oncorhynchus mykiss)‘, Nordic Council of Ministers, TemaNord 2001:597, str. 48–51.
|
|
(18)
|
Nilsen, B. M., Berg, K., Eidem, J. K., Kristiansen, S. I., Brion, F., Porcher, J. M. in Goksoyr, A. (2004). ‚Development of quantitative vitellogenin-ELISAs for fish test species used in endocrine disruptor screening‘, Analytical and Bioanalytical Chemistry 378, str. 621–633.
|
|
(19)
|
Orn, S., Yamani, S. in Norrgren, L. (2006). ‚Comparison of vitellogenin induction, sex ratio, and gonad morphology between zebrafish and Japanese medaka after exposure to 17 alpha-ethinylestradiol and 17 beta-trenbolone‘, Archives of Environmental Contamination and Toxicology 51, str. 237–243.
|
|
(20)
|
Scholz, S., in Kluver, N. (2009). ‚Effects of Endocrine Disrupters on Sexual, Gonadal Development in Fish, Sexual Development‘ 3, str. 136– 151.
|
|
(21)
|
Fenske, M., Maack, G., Schafers, C. in Segner, H. (2005). ‚An environmentally relevant concentration of estrogen induces arrest of male gonad development in zebrafish, Danio rerio‘, Environmental Toxicology and Chemistry 24, str. 1088– 1098.
|
|
(22)
|
OECD (2010), Guidance Document on the Diagnosis of Endocrine-related Histopathology in Fish Gonads, Series on Testing and Assessment No. 123, ENV/JM/MONO(2010)14, OECD, Pariz.
|
|
(23)
|
Kobayashi, T., Matsuda, M., Kajiura-Kobayashi, H., Suzuki, A., Saito, N., Nakamoto, M., Shibata, N., in Nagahama, Y. (2004). ‚Two DM domain genes, DMY and DMRT1, involved in testicular differentiation and development in the medaka, Oryzias latipes‘, Developmental Dynamics 231, str. 518–526.
|
|
(24)
|
Shinomiya, A., Otake, H., Togashi, K., Hamaguchi, S., in Sakaizumi M. (2004), ‚Field survey of sex-reversals in the medaka, Oryzias latipes: genotypic sexing of wild populations‘, Zoological Science 21, str. 613–619.
|
|
(25)
|
Kidd, K. A., Blanchfield, P. J., Mills, K. H., Palace, V. P., Evans, R. E., Lazorchak, J. M., in Flick, R. W. (2007). ‚Collapse of a fish population after exposure to a synthetic estrogen‘, Proceedings of the National Academy of Sciences of the United States of America 104, str. 8897–8901.
|
|
(26)
|
Palace,V. P., Evans, R. E., Wautier, K. G., Mills, K. H., Blanchfield, P. J., Park, B. J., Baron, C. L., in Kidd, K. A. (2009). ‚Interspecies differences in biochemical, histopathological, and population responses in four wild fish species exposed to ethynylestradiol added to a whole lake‘, Canadian Journal of Fisheries and Aquatic Sciences 66, str. 1920– 1935.
|
|
(27)
|
Panter, G. H., Hutchinson, T. H., Hurd, K. S., Bamforth, J., Stanley, R. D., Duffell, S., Hargreaves, A., Gimeno, S., in Tyler, C. R. (2006). ‚Development of chronic tests for endocrine active chemicals – Part 1. An extended fish early-life stage test for oestrogenic active chemicals in the fathead minnow (Pimephales promelas)‘, Aquatic Toxicology 77, str. 279–290.
|
|
(28)
|
Holbech, H., Kinnberg, K., Petersen, G. I., Jackson, P., Hylland, K., Norrgren, L., in Bjerregaard, P. (2006). ‚Detection of endocrine disrupters: Evaluation of a Fish Sexual Development Test (FSDT)‘, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 144, str. 57–66.
|
|
(29)
|
Andersen, L., Kinnberg, K., Holbech, H., Korsgaard, B., in Bjerregaard, P. (2004). ‚Evaluation of a 40 day assay for testing endocrine disrupters: Effects of an anti-estrogen and an aromatase inhibitor on sex ratio and vitellogenin concentrations in juvenile zebrafish (Danio rerio)‘, Fish Physiology and Biochemistry 30, str. 257–266.
|
|
(30)
|
Morthorst, J. E., Holbech, H., in Bjerregaard, P. (2010). ‚Trenbolone causes irreversible masculinization of zebrafish at environmentally relevant concentrations‘, Aquatic Toxicology 98, str. 336–343.
|
|
(31)
|
Kiparissis,Y., Metcalfe, T. L., Balch, G. C. in Metcalf, C. D. (2003). ‚Effects of the antiandrogens, vinclozolin and cyproterone acetate on gonadal development in the Japanese medaka (Oryzias latipes)‘, Aquatic Toxicology 63, str. 391–403.
|
|
(32)
|
Panter, G. H., Hutchinson, T. H., Hurd, K. S., Sherren, A., Stanley, R. D., in Tyler, C. R. (2004). ‚Successful detection of (anti-) androgenic and aromatase inhibitors in pre-spawning adult fathead minnows (Pimephales promelas) using easily measured endpoints of sexual development‘, Aquatic Toxicology 70, str. 11–21.
|
|
(33)
|
Kinnberg, K., Holbech, H., Petersen, G. I., in Bjerregaard, P. (2007). ‚Effects of the fungicide prochloraz on the sexual development of zebrafish (Danio rerio)‘, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 145, str. 165– 170.
|
|
(34)
|
Poglavje C.14 te priloge, Preskus rasti ribjih mladic.
|
|
(35)
|
Poglavje C.4 te priloge, Razgradnja – biokemijska potreba po kisiku.
|
|
(36)
|
OECD (2000). Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures, Series on Testing and Assessment No. 23, OECD, Pariz.
|
|
(37)
|
OECD (2009). Fish Short Term Reproduction Assay, Test Guideline No. 229, Guidelines for the Testing of Chemicals, OECD, Pariz.
|
|
(38)
|
Poglavje C.37 te priloge, 21-dnevni preskus rib: kratkotrajno presejalno preskušanje estrogenega in androgenega delovanja ter zaviranja aromataze.
|
|
(39)
|
OECD (2012). Fish Toxicity Testing Framework, Series on Testing and Assessment No. 171, OECD, Pariz.
|
|
(40)
|
Schäfers, C., Teigeler, M., Wenzel, A., Maack, G., Fenske, M., Segner, H. (2007). ‚Concentration- and time-dependent effects of the synthetic estrogen, 17 alpha-ethinylestradiol, on reproductive capabilities of the zebrafish, Danio rerio‘, Journal of Toxicology and Environmental Health-Part A, 70, 9– 10 str. 768–779.
|
|
(41)
|
OECD (2011), Validation Report (Phase 1) for the Fish Sexual Development Test, Series on Testing and Assessment No 141, ENV/JM/MONO(2011)22, OECD, Pariz.
|
|
(42)
|
OECD (2011), Validation Report (Phase 2) for the Fish Sexual Development Test, Series on Testing and Assessment No 142, ENV/JM/MONO(2011)23, OECD, Pariz.
|
|
(43)
|
OECD (2011), Peer Review Report of the validation of the Fish Sexual Development Test, Series on Testing and Assessment No 143, ENV/JM/MONO(2011)24, OECD, Pariz.
|
|
(44)
|
Direktiva 2010/63/EU Evropskega parlamenta in Sveta z dne 22. septembra 2010 o varstvu živali, ki se uporabljajo za znanstvene namene. UL L 276, 20.10.2010, str. 33.
|
Dodatek 1
Okrajšave in opredelitev pojmov
Zgornja končna točka
: povzroča učinke na ravni populacije.
ASV
: nasičenost z zrakom (air saturation value).
Biomarker
: povzroča učinke na ravni posameznega osebka.
Kemikalija
: snov ali zmes.
Dph
: dnevi po izvalitvi (days post hatch).
DMY
: na kromosom Y vezan gen z domeno DM, ki je potreben za razvoj samcev medak.
ELISA
: encimski imunski test.
Teža ribe
: mokra teža ribe (osušene s pivnikom).
FSDT
: preskus spolnega razvoja rib.
Os HPG
: os hipotalamus – hipofiza – spolne žleze.
Dvospolne ribe
: ribe z več kot enim oocitom v testisu na 6 analiziranih delov ali spermatogenimi celicami v jajčnikih (da/ne).
Stopnja obremenitve
: mokra teža rib na prostornino vode.
MOA
: način delovanja.
RT-PCR
: verižna reakcija s polimerazo z reverzno transkriptazo.
Preskusna kemikalija
: vsaka snov ali zmes, preskušena z uporabo te preskusne metode.
Nediferencirane ribe
: ribe s spolnimi žlezami, ki ne kažejo zaznavnih zarodnih celic.
VTG
: vitelogenin.
Dodatek 2
Poskusni pogoji za preskus spolnega razvoja rib (sladkovodne vrste)
|
|
japonska medaka (Oryzias latipes)
|
cebrica (Danio rerio)
|
zet (Gasterostreus aculeatus)
|
|
|
pretočni ali polstatični
|
pretočni ali polstatični
|
pretočni ali polstatični
|
|
|
25 ± 2 °C
|
27 ± 2 °C
|
20 ± 2 °C
|
|
4.
|
Kakovost osvetljenosti
|
|
fluorescenčne sijalke (široki spekter)
|
fluorescenčne sijalke (široki spekter)
|
fluorescenčne sijalke (široki spekter)
|
|
|
10–20 μE/m2/s, 540–1 080 luksov ali 50–100 ft-c (ravni v laboratoriju)
|
10–20 μE/m2/s, 540–1 080 luksov ali 50–100 ft-c (ravni v laboratoriju)
|
10–20 μE/m2/s, 540–1 080 luksov ali 50–100 ft-c (ravni v laboratoriju)
|
|
|
12–16 ur svetlobe, 8–12 ur teme
|
12–16 ur svetlobe, 8–12 ur teme
|
16 ur svetlobe, 8 ur teme
|
|
7.
|
Najmanjša velikost komore
|
|
posamezne komore morajo vsebovati vsaj 7 l vode
|
posamezne komore morajo vsebovati vsaj 7 l vode
|
posamezne komore morajo vsebovati vsaj 7 l vode
|
|
8.
|
Zamenjave prostornin preskusnih raztopin
|
|
vsaj 5 na dan
|
vsaj 5 na dan
|
vsaj 5 na dan
|
|
9.
|
Starost preskusnih organizmov ob začetku izpostavljenosti
|
|
novo oplojene ikre (zgodnji stadij blastule)
|
novo oplojene ikre (zgodnji stadij blastule)
|
novo oplojene ikre
|
|
10.
|
Št. iker na tretiranje
|
|
najmanj 120
|
najmanj 120
|
najmanj 120
|
|
|
najmanj 3 (plus ustrezno št. kontrol)
|
najmanj 3 (plus ustrezno št. kontrol)
|
najmanj 3 (plus ustrezno št. kontrol)
|
|
12.
|
Št. ponovitev na tretiranje
|
|
najmanj 4 (razen v primeru razporeditve v kontrole na podlagi kvadratnega korena)
|
najmanj 4 (razen v primeru razporeditve v kontrole na podlagi kvadratnega korena)
|
najmanj 4 (razen v primeru razporeditve v kontrole na podlagi kvadratnega korena)
|
|
|
živa Artemia, zamrznjeni odrasli morski rakci, hrana v kosmičih itd.; priporočeno je hranjenje dvakrat na dan
|
posebna hrana za zarod, živa Artemia, zamrznjeni odrasli morski rakci, hrana v kosmičih itd.; priporočeno je hranjenje dvakrat na dan
|
živa Artemia, zamrznjeni odrasli morski rakci, hrana v kosmičih itd.; priporočeno je hranjenje dvakrat na dan
|
|
|
brez, razen če koncentracija raztopljenega kisika pade pod 60 % nasičenosti
|
brez, razen če koncentracija raztopljenega kisika pade pod 60 % nasičenosti
|
brez, razen če koncentracija raztopljenega kisika pade pod 70 % nasičenosti
|
|
|
čista površinska voda, vodovodna voda ali modelna razredčevalna voda
|
čista površinska voda, vodovodna voda ali modelna razredčevalna voda
|
čista površinska voda, vodovodna voda ali modelna razredčevalna voda
|
|
16.
|
Trajanje izpostavljenosti preskusni kemikaliji
|
|
60 dph
|
60 dph
|
60 dph
|
|
17.
|
Biološke končne točke
|
|
uspešnost izvalitve, preživetje, morfologija velikih organov, VTG histologija spolnih žlez, genetski spol razmerje med spoloma
|
uspešnost izvalitve, preživetje morfologija velikih organov, VTG histologija spolnih žlez, razmerje med spoloma
|
uspešnost izvalitve, preživetje morfologija velikih organov, VTG histologija spolnih žlez, razmerje med spoloma
|
|
18.
|
Merila sprejemljivosti preskusa za združene ponovitve kontrol
|
|
uspešna izvalitev > 80 %
|
uspešna izvalitev > 80 %
|
uspešna izvalitev > 80 %
|
|
preživetje po izvalitvi ≥ 70 %
|
preživetje po izvalitvi ≥ 70 %
|
preživetje po izvalitvi ≥ 70 %
|
|
rast (mokra teža ribe, osušena s pivnikom) > 150 mg
|
rast (mokra teža ribe, osušena s pivnikom) > 75 mg
|
rast (mokra teža ribe, osušena s pivnikom) > 120 mg
|
|
dolžina (standardna dolžina) > 20 mm
|
dolžina (standardna dolžina) > 14 mm
|
dolžina (standardna dolžina) > 20 mm
|
|
razmerje med spoloma (% samcev ali samic)
30 %–70 %
|
razmerje med spoloma (% samcev ali samic) 30 %–70 %
|
razmerje med spoloma (% samcev ali samic) 30 %–70 %
|
Dodatek 3
Kemijske značilnosti sprejmljive vode za redčenje
|
SESTAVINA
|
KONCENTRACIJA
|
|
delci
|
< 20 mg/l
|
|
skupni organski ogljik
|
< 2 mg/l
|
|
neionizirani amoniak
|
< 1 μg /l
|
|
ostanek klora
|
< 10 μg /l
|
|
skupni organofosforni pesticidi
|
< 50 ng/l
|
|
skupni organoklorni pesticidi in poliklorirani bifenili
|
< 50 ng/l
|
|
skupni organski klor
|
< 25 ng/l
|
Dodatek 4
Iz preskusne metode C.14/Smernica za preskusne koncentracije
|
Stolpec (število koncentracij med 100 in 10 ali med 10 in 1) (28)
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
|
100
|
100
|
100
|
100
|
100
|
100
|
100
|
|
32
|
46
|
56
|
63
|
68
|
72
|
75
|
|
10
|
22
|
32
|
40
|
46
|
52
|
56
|
|
3,2
|
10
|
18
|
25
|
32
|
37
|
42
|
|
1,0
|
4,6
|
10
|
16
|
22
|
27
|
32
|
|
|
2,2
|
5,6
|
10
|
15
|
19
|
24
|
|
|
1,0
|
3,2
|
6,3
|
10
|
14
|
18
|
|
|
|
1,8
|
4,0
|
6,8
|
10
|
13
|
|
|
|
1,0
|
2,5
|
4,6
|
7,2
|
10
|
|
|
|
|
1,6
|
3,2
|
5,2
|
7,5
|
|
|
|
|
1,0
|
2,2
|
3,7
|
5,6
|
|
|
|
|
|
1,5
|
2,7
|
4,2
|
|
|
|
|
|
1,0
|
1,9
|
3,2
|
|
|
|
|
|
|
1,4
|
2,4
|
|
|
|
|
|
|
1,0
|
1,8
|
|
|
|
|
|
|
|
1,3
|
|
|
|
|
|
|
|
1,0
|
Dodatek 5
Smernica za homogenizacijo glave in repa mladic cebrice, črnoglavega pisanca, zeta in japonske medake
Namen tega razdelka je opisati postopke, ki se izvedejo pred kvantifikacijo koncentracije VTG. Uporabijo se lahko tudi drugi postopki, katerih rezultat je primerljiva kvantifikacija VTG. Koncentracija VTG se lahko namesto v homogenatu glave/repa določi v krvni plazmi ali jetrih.
Postopek
|
1.
|
Ribe se anestezirajo in evtanazirajo v skladu z opisom preskusa.
|
|
2.
|
Glava in rep ribe se odrežeta v skladu z opisom preskusa. Opozorilo: med ravnanji s posameznimi ribami je treba vse instrumente za seciranje in rezalno desko sprati in ustrezno očistiti (npr. s 96-odstotnim etanolom), da se prepreči ‚onesnaženje‘ neinduciranih samcev z VTG samic ali induciranih samcev.
|
|
3.
|
Teža zbranih glav in repov posameznih rib se izmeri na najbližji miligram.
|
|
4.
|
Po tehtanju se deli vnesejo v ustrezne epruvete (npr. 1,5-mililitrske epruvete) in zamrznejo pri – 80 °C do homogenizacije oz. dokler se neposredno ne homogenizirajo na ledu z dvema plastičnima pestiloma. (Druge metode se lahko uporabijo, če se izvajajo na ledu in zagotovijo homogeno maso.) Opozorilo: epruvete je treba ustrezno oštevilčiti, da se lahko glava in rep ribe povežeta z ustreznim delom telesa, uporabljenim za histologijo spolnih žlez.
|
|
5.
|
Ko dobimo homogeno maso, se ji doda 4–10-kratna teža tkiva ledeno mrzlega homogenizacijskega pufra
(29) (paziti je treba na raztopino). Delo s pestiloma je treba nadaljevati, dokler zmes ni homogena. Pomembno opozorilo: za vsako ribo se uporabita dve novi pestili.
|
|
6.
|
Vzorci se postavijo na led do začetka centrifugiranja pri 4 °C in 50 000 g za 30 minut.
|
|
7.
|
S pipeto se supernatant odmeri na dele po 20 do 50 μl (paziti je treba na količino) v vsaj dve epruveti, tako da se konica pipete potopi pod plast maščobe na površini in supernatant previdno izsesa brez delcev maščobe ali peletov.
|
|
8.
|
Epruvete se do uporabe hranijo pri – 80 °C.
|
Opomba: homogenizacijski pufer je treba uporabiti na dan priprave. Med uporabo ga je treba postaviti na led.
Dodatek 6
Smernica za kvantifikacijo vitelogenina v homogenatu glave in repa pri cebricah (Danio rerio) (spremenjen na podlagi Holbch idr., 2001). uporabijo se lahko drugi postopki, pri katerih se uporabljajo homologna antitelesa in raztopine
|
1.
|
Mikrotiterske plošče (potrjena Maxisorp F96, Nunc, Roskilde, Danska), predhodno premazane s 5 μg/ml lipovitelin-IgG proti cebricam, se odtajajo in trikrat sperejo s pufrom za spiranje (*).
|
|
2.
|
Prečiščena raztopina vitelogenina (30) pri cebricah se serijsko razredči na 0,2, 0,5, 1, 2, 5, 10 in 20 ng/ml v pufru za redčenje (**), vzorci pa se razredčijo vsaj 200-krat (da se prepreči vpliv matriksa) v pufru za redčenje in vnesejo na plošče. Kontrola preskusa se ponovi dvakrat. V vsako vdolbinico se doda 150 μl. Raztopine se dodajo v ponovitev in vzorce v treh ponovitvah. Čez noč se na stresalniku inkubirajo pri 4 °C.
|
|
3.
|
Plošče se petkrat sperejo s pufrom za spiranje (*).
|
|
4.
|
Hrenova peroksidaza (HRP), spojena z dekstranovo verigo (npr. AMDEX A/S, Danska), in konjugirana protitelesa se razredčijo v pufru za spiranje; dejanska raztopina se razlikuje po seriji in starosti. V vsako vdolbinico se doda 150 μl, plošče pa se eno uro inkubirajo na stresalniku pri sobni temperaturi.
|
|
5.
|
Plošče se petkrat sperejo s pufrom za spiranje (*), dno plošč pa se skrbno očisti z etanolom.
|
|
6.
|
V vsako vdolbinico se doda 150 μl TMB plus (***). Ploščo je treba pred svetlobo zaščititi z aluminijasto folijo ter opazovati razvoj barv na stresalniku.
|
|
7.
|
Ko je umeritvena krivulja popolnoma razvita, se aktivnost encimov ustavi z vnosom 150 μl 0,2 M H2SO4 v vsako vdolbinico.
|
|
8.
|
Absorpcija se meri pri 450 nm (npr. na čitalniku plošč Molecular Devices Thermomax). Podatki se analizirajo s povezano programsko opremo (npr. Softmax).
|
|
(*)
|
Pufer za spiranje:
|
založni PBS (****)
|
500,0
|
ml
|
|
BSA
|
5,0
|
g
|
|
Tween 20
|
5,0
|
ml
|
|
Uravnati pH na 7,3 in napolniti do 5 l z Millipore H2O. Hraniti pri 4 °C.
|
|
|
(**)
|
Pufer za redčenje:
|
založni PBS (****)
|
100,0
|
ml
|
|
BSA
|
3,0
|
g
|
|
Tween 20
|
1,0
|
ml
|
|
Uravnati pH na 7,3 in napolniti do 1 l z Millipore H2O. Hraniti pri 4 °C.
|
|
|
(***)
|
TMB plus je substrat, pripravljen za uporabo, ki ga proizvaja KemEnTec (Danska). Občutljiv je na svetlobo. Hraniti pri 4 °C.
|
|
(****)
|
Založni PBS
|
NaCl
|
160,0
|
g
|
|
KH2PO4
|
4,0
|
g
|
|
Na2HPO4 2H2O
|
26,6
|
g
|
|
KCl
|
4,0
|
g
|
|
Uravnati pH na 6,8 in napolniti do 2 l z Millipore H2O. Hraniti pri sobni temperaturi.
|
|
Dodatek 7
Smernica za pripravo tkivnih rezin za določanje spola in faze spolnih žlez
Cilj tega razdelka je opisati postopke, ki se izvedejo pred oceno histoloških rezin. Uporabijo se lahko drugi postopki, katerih rezultat je podobna določitev spola in faze spolnih žlez.
Ti postopki so z nekaj izjemami podobni za japonsko medako (JMD) in cebrico (ZF).
Evtanazija, nekropsija in fiksacija tkiva
Cilji:
|
1.
|
zagotoviti humano žrtvovanje ribe;
|
|
2.
|
pridobiti potrebne teže telesa in meritve;
|
|
3.
|
oceniti sekundarne spolne značilnosti;
|
|
4.
|
secirati tkivo za analizo VTG;
|
|
5.
|
fiksirati spolne žleze.
|
Postopki:
|
1.
|
ribo je treba žrtvovati neposredno pred nekropsijo. Če ni na voljo več obducentov, se zato ne sme usmrtiti več rib hkrati;
|
|
2.
|
riba se z majhnim sakom odstrani iz preskusne komore in prenese na območje za nekropsijo v posodi za prenos;
|
|
3.
|
riba se vnese v raztopino za evtanazijo, riba se iz raztopine odstrani, ko neha dihati in se ne odziva na zunanje dražljaje;
|
|
4.
|
določi se mokra teža ribe;
|
|
5.
|
Za pripravo tkiv za analizo VTG se lahko riba postavi na plutovinasto ploščo na mizico stereomikroskopa;
|
(a)
|
pri cebrici se glava odreže neposredno za prsno plavutjo, rep pa neposredno za hrbtno plavutjo;
|
|
(b)
|
pri japonski medaki se trebuh odpre z natančnim prerezom ob ventralni sredinski črti od prsnega obroča do točke, kranialne na anus. Jetra se previdno odstranijo z majhno prijemalko in škarjicami;
|
|
|
6.
|
vzorci za analizo VTG se vstavijo v mikroepruvete in takoj zamrznejo v tekočem dušiku;
|
|
7.
|
trup, vključno s spolnimi žlezami, se vstavi v predhodno označene plastične kasete za tkivo, ki se prenesejo v Davidsonov ali Bouinov fiksativ. Fiksativa mora biti vsaj desetkrat več od približne prostornine tkiv. Posoda s fiksativom se pet sekund nežno pretresa, da se zračni mehurčki odstranijo iz kasete;
|
|
8.
|
|
(a)
|
vsa tkiva ostanejo v Davidsonovem fiksativu čez noč, naslednji dan pa se prenesejo v posamezne posode z 10-odstotnim nevtralno pufranim formalinom. Posode s kasetami se 5 sekund nežno stresajo, da se zagotovi ustrezna penetracija formalina v kasete;
|
|
(b)
|
tkiva ostanejo v Bouinovem fiksativu 24 ur, sledi pa prenos v 70-odstotni etanol.
|
|
Obdelava tkiva
Cilji:
|
1.
|
dehidracija tkiva za ustrezno penetracijo parafina;
|
|
2.
|
impregnacija tkiva s parafinom, da se ohrani neokrnjenost tkiva in ustvari trdna podlaga za mikrotomijo;
|
Postopki:
|
3.
|
označene kasete s tkivom se odstranijo iz hrambe s formalinom/etanolom in postavijo v košare za obdelavo, košara za obdelavo se obremeni v napravi za obdelavo tkiva;
|
|
4.
|
izbere se časovni načrt obdelave;
|
|
5.
|
ko naprava za obdelavo tkiva konča obdelovalni cikel, se lahko košare prenesejo v napravo za vstavljanje.
|
Vstavljanje
Cilj:
ustrezna usmeritev vzorca v strjeni parafin za mikrotomijo.
Postopki:
|
1.
|
košare s kasetami se odstranijo iz naprave za obdelavo in potopijo v s parafinom napolnjeno prednjo komoro grelne naprave za vstavljanje ali pa se kasete prestavijo v ločen parafinski grelnik;
|
|
2.
|
prva kaseta, ki se bo vstavila, se odstrani iz prednje komore grelne konzole ali parafinskega grelnika. Pokrov kasete se odstrani in zavrže, na oznaki kasete pa se preverijo zabeležke o živali, da se pred vstavljanjem odpravijo morebitne neskladnosti;
|
|
3.
|
izbere se ustrezno velik kalup za vstavljanje;
|
|
4.
|
kalup se drži pod cevko dozirne konzole in napolni s tekočim parafinom;
|
|
5.
|
vzorec se odstrani iz kasete in vstavi v stopljeni parafin v kalupu. To se ponovi pri 4–8 vzorcih za vsak kalup s parafinom. Mesto posamezne ribe se označi tako, da se prva riba položi pod kotom 180 stopinj glede na ribo 2–4/8;
|
|
6.
|
vzorec se prekrije z dodajanjem dodatnega parafina;
|
|
7.
|
kalup s podlago kasete se postavi na hladilno ploščo kriogene posode;
|
|
8.
|
ko se parafin strdi, se blok (tj. strjeni parafin s tkivi in podlago kasete) odstrani iz kalupa.
|
Mikrotomija
Cilj:
rezanje in pritrditev histoloških rezin za barvanje.
Postopki:
|
1.
|
začetna faza mikrotomije, ki se imenuje ‚seznanitev‘, se izvede po naslednjih korakih:
|
(a)
|
parafinski blok se vstavi v vpenjalo mikrotoma;
|
|
(b)
|
vpenjalo se z vrtenjem kolesa mikrotoma pomika naprej, s parafinske površine bloka pa se režejo debele rezine, dokler nož ne doseže vstavljenih tkiv;
|
|
(c)
|
debelina rezine se na mikrotomu nastavi na 3–5 mikronov. Vpenjalo se pomika naprej in z bloka se odreže več rezin, da se odstranijo vsi artefakti, ki so med grobimi rezi nastali na rezalni površini tkiva;
|
|
(d)
|
blok se lahko odstrani iz vpenjala in s srednjo stranjo naprej položi na led, da se tkivo zmoči;
|
|
|
2.
|
naslednja faza mikrotomije je končno rezanje rezin in pritrditev tkivnih rezin na mikroskopske preparate. Ti postopki se izvedejo, kot sledi:
|
(a)
|
če je bil blok postavljen na led, se odstrani z njega in vstavi v vpenjalo mikrotoma;
|
|
(b)
|
vpenjalo se pri debelini rezine, nastavljene na 3–5 mikronov na mikrotomu, pomika naprej z vrtenjem kolesa mikrotoma, rezine se režejo z bloka, dokler ne dobimo ‚traka‘, ki vsebuje vsaj eno sprejemljivo rezino s spolnimi žlezami (če je med rezanjem potrebno, se lahko blok odstrani iz vpenjala, postavi na led, da se tkivo zmoči, in vstavi nazaj v vpenjalo);
|
|
(c)
|
rezine se plosko položijo na vodno gladino v vodni kopeli. Poskusi se obdržati vsaj eno rezino brez gub in zračnih mehurčkov, ujetih pod njo;
|
|
(d)
|
mikroskopsko objektno stekelce se potopi pod najboljšo rezino, ki se s stekelcem dvigne iz vode. Ta postopek se imenuje ‚pritrditev‘ rezine na preparat;
|
|
(e)
|
za sklop rib se pripravijo tri rezine. Druga in tretja rezina se odrežeta v razmiku 50 mikronov za prvo rezino. Če ribe niso vstavljene s spolnimi žlezami v isti rezalni ravnini, je treba narediti več rezin, da se zagotovi vsaj šest rezin s spolnimi žlezami za vsako ribo;
|
|
(f)
|
s pisalom za označevanje preparatov se na preparatu označi številka bloka, iz katerega je bil preparat ustvarjen;
|
|
(g)
|
preparat se položi na podstavek za barvanje;
|
|
(h)
|
blok se odstrani iz vpenjala in shrani s sprednjim delom naprej.
|
|
Barvanje, namestitev krovnega stekelca in označevanje preparatov
Cilji:
|
—
|
obarvanje rezin za histopatološko preiskavo;
|
|
—
|
trajno zatesnjeno pritrjena in obarvana tkiva;
|
|
—
|
trajno identificirane obarvane rezine, ki omogočajo popolno sledljivost;
|
Postopki:
|
1.
|
barvanje:
|
(a)
|
preparati se pred barvanjem čez noč sušijo na zraku;
|
|
(b)
|
rezine se barvajo s hematoksilin-eozinom;
|
|
|
2.
|
namestitev krovnega stekelca:
|
(a)
|
krovna stekelca se lahko namestijo ročno ali samodejno;
|
|
(b)
|
preparat se pomoči v ksilen ali TissueClear, odvečni ksilen/TissueClear pa se nežno odstrani s preparata;
|
|
(c)
|
v bližino konca preparata nasproti zamrznjenega konca ali na krovno stekelce se nanese približno 0,1 ml pritrditvenega medija;
|
|
(d)
|
krovno stekelce se med nameščanjem na preparat nagne pod majhnim kotom;
|
|
|
3.
|
označevanje:
|
(a)
|
vsaka oznaka preparata mora vsebovati naslednje informacije:
|
(iii)
|
št. vzorca/št. Preparata;
|
|
(iv)
|
kemikalijo/skupino tretiranja;
|
|
|
Dodatek 8
Statistični diagram poteka za analizo vitelogenina
statisTični diagram poteka za analizo razmerja med spoloma

Dodatek 9
Smernice za vzorčenje tkiva za določitev genetskega spola in določitev genetskega spola z metodo PCR
Vzorčenje tkiva, priprava in shranjevanje pred določanjem genetskega spola z metodo PCR pri medaki (pripravil laboratorij za vodne organizme družbe Bayer CropScience AG)
|
1.
|
Pri vsaki ribi se z natančnimi škarjami odrežeta predrepna in hrbtna plavut in vstavita v epruveto s 100 μl ekstrakcijskega pufra 1 (podrobnosti o pripravi pufra so navedene v nadaljevanju). Po rezanju vsake ribe se škarje očistijo v čaši z destilirano H2O in osušijo s papirnato brisačo.
|
|
2.
|
Tkiva plavuti se za lizo celic homogenizirajo s teflonskim pestičem mikroepruvete. Za vsako epruveto se uporabi novo pestilo, da se prepreči onesnaženje. Pestila se čez noč pustijo v 0,5 M NaOH, 5 minut spirajo v destilirani H2O ter do uporabe shranijo v etanolu ali sterilizirajo po avtoklaviranju.
|
|
3.
|
Tkivo plavuti se lahko shrani tudi brez ekstrakcijskega pufra 1 na suhem ledu in nato v zamrzovalniku pri – 80 °C, da se prepreči degeneracija DNA. Vendar ekstrakcija poteka bolje, če se DNA ekstrahira hkrati (za ravnanje glej zgoraj; vzorce je treba odtajati na ledu po shranjevanju pri – 80 °C, preden se v epruvete doda pufer).
|
|
4.
|
Po homogenizaciji se vse epruvete postavijo v vodno kopel, kjer 15 minut vrejo pri 100 °C.
|
|
5.
|
Nato se s pipeto v vsako epruveto doda 100 μl ekstrakcijskega pufra 2 (podrobnosti o pripravi pufra so navedene v nadaljevanju). Vzorci se pri sobni temperaturi hranijo 15 minut in se pri tem občasno nežno ročno pretresejo.
|
|
6.
|
Po tem se vse epruvete ponovno postavijo v vodno kopel, kjer še 15 minut vrejo pri 100 °C.
|
|
7.
|
Epruvete se do nadaljnje analize zamrznejo pri – 20 °C.
|
Priprava pufra
Pufer PCR 1:
|
|
500 mg N-lavroilsarkozina (npr. Merck KGaA, Darmstadt, GE)
|
Pufer PCR 2:
|
|
20 g Chelex (npr. Biorad, Munich, GE)
|
|
|
nabrekne v 100 ml destilirane H2O
|
Določanje genetskega spola (z metodo PCR) pri medaki (pripravila laboratorij za vodne organizme družbe Bayer CropScience AG in Universität Würzburg Biozentrum)
Pripravljene in zamrznjene epruvete (opisano v zgornjem oddelku) se odtajajo na ledu. Nato se centrifugirajo v mikrocentrifugirki (30 sekund pri največji hitrosti in sobni temperaturi). Za PCR se uporabi čisti supernatant iz oborine. Preprečiti je treba vsak prenos sledi Chelexa (lokaliziranega v oborini) v reakcijo PCR, saj bi to vplivalo na aktivnost Taq-polimeraze. Supernatant se uporabi neposredno ali pa se zamrzne (pri – 20 °C) in odtaja v več ciklih brez negativnega učinka na DNA za poznejše analize.
1. Priprava ‚reakcijske zmesi‘ (25 μl na vzorec):
|
|
Prostornina
|
Končna koncentracija
|
|
Matrična DNA
|
0,5 μl–2 μl
|
|
|
10 × pufer PCR z MgCl2
|
2,5 μl
|
1x
|
|
Nukleotidi (vsi dATP, dCTP, dGTP, dTTP)
|
4 μl (5 mM)
|
200 μM
|
|
Smerni začetni oligonukleotid (10 μM) (glej v nadaljevanju 3–5)
|
0,5 μl
|
200 nM
|
|
Protismerni začetni oligonukleotid (10 μM) (glej v nadaljevanju 3–5)
|
0,5 μl
|
200 nM
|
|
DMSO
|
1,25 μl
|
5 %
|
|
Voda (stopnje PCR)
|
do 25 μl
|
|
|
Taq E-polimeraza
|
0,3 μl
|
1,5 U
|
|
10 × pufer PCR z MgCl2: 670 mM Tris/HCl (pH 8,8 pri 25 °C), 160 mM (NH4)2SO4, 25 mM MgCl2, 0,1 % Tween 20
|
Za vsako PCR (glej v nadaljevanju 3–5) je potreben poseben začetni oligonukleotid kot nova kombinacija ‚reakcijske zmesi‘ in ustrezne količine matrične DNA, ki je potrebna za vsak vzorec (glej zgoraj). Ustrezne prostornine se s pipetami prenesejo v nove epruvete. Po tem se vse epruvete zaprejo, mešajo (približno 10 sekund) in centrifugirajo (10 sekund pri sobni temperaturi). Nato se lahko začnejo ustrezni programi PCR. V vsakem programu PCR se uporabita še pozitivna kontrola (reprezentativen vzorec DNA z znano aktivnostjo in jasnimi rezultati) in negativna kontrola (1 μl destiliranega H2O).
2. Priprava agaroznega gela (1 %) – med potekom programov PCR
|
—
|
3 g agaroze se raztopijo v 300 ml pufra 1 × TAE (1-odstotni agarozni gel);
|
|
—
|
raztopina mora vreti v mikrovalovni pečici (približno 2–3 minute);
|
|
—
|
vročo raztopino je treba preliti v model za vlivanje, ki stoji na ledu;
|
|
—
|
po približno 20 minutah je agarozni gel pripravljen za uporabo;
|
|
—
|
agarozni gel se do konca programov PCR shrani v pufru 1 × TAE.
|
3. Program PCR za aktin:
namen te reakcije PCR je dokazati, da se DNA v vzorcu ne poškoduje.
|
—
|
Poseben začetni oligonukleotid:
|
—
|
‚Mact1(zgornji/smerni)‘ → TTC AAC AGC CCT GCC ATG TA
|
|
—
|
‚Mact2(spodnji/protismerni)‘ → GCA GCT CAT AGC TCT TCT CCA GGG AG
|
|
|
—
|
Program:
|
—
|
Cikel (35-krat):
|
Denaturacija
|
→ 45 sekund pri 95 °C
|
|
Prileganje
|
→ 45 sekund pri 56 °C
|
|
Podaljševanje
|
→ 1 minuta pri 68 °C
|
|
|
4. Program PCR za gena X in Y:
v tem programu PCR za odkrivanje genov X in Y se uporabijo vzorci neokrnjene DNA. Pri moški DNA morata biti vidni dve progi, pri ženski DNA pa ena proga (po barvanju in gelski elektroforezi). V to izvajanje programa je treba vključiti eno pozitivno kontrolo za moške (vzorec XY) in eno za ženske (vzorec XX).
|
—
|
Poseben začetni oligonukleotid:
|
—
|
‚PG 17,5‘ (zgornji/smerni) → CCG GGT GCC CAA GTG CTC CCG CTG
|
|
—
|
‚PG 17,6‘ (spodnji/protismerni) → GAT CGT CCC TCC ACA GAG AAG AGA
|
|
|
—
|
Program:
|
—
|
Cikel (40-krat):
|
Denaturacija
|
→ 45 sekund pri 95 °C
|
|
Prileganje
|
→ 45 sekund pri 55 °C
|
|
Podaljševanje
|
→ 1 minuta 30 sekund pri 68 °C
|
|
|
5. Program PCR za gen Y kot ‚kontrola‘ za program PCR za gena X in Y:
ta program PCR preverja rezultate ‚programa PCR za gena X in Y‘. Pri ‚moških vzorcih‘ mora biti vidna ena proga, pri ‚ženskih vzorcih‘ pa proge ne smejo biti vidne (po barvanju in gelski elektroforezi).
|
—
|
Poseben začetni oligonukleotid:
|
—
|
‚DMTYa (zgornji/smerni)‘ → GGC CGG GTC CCC GGG TG
|
|
—
|
‚DMTYd (spodnji/protismerni)‘ → TTT GGG TGA ACT CAC ATG G
|
|
|
—
|
Program:
|
—
|
Cikel (40-krat):
|
Denaturacija
|
→ 45 sekund pri 95 °C
|
|
Prileganje
|
→ 45 sekund pri 56 °C
|
|
Podaljševanje
|
→ 1 minuta pri 68 °C
|
|
|
6. Barvanje vzorcev PCR
Raztopine za barvanje
|
|
0,25-odstotno bromofenolno modro
|
|
|
0,25-odstotni ksilenksianol
|
V vsako epruveto se s pipeto doda 1 μl raztopine za barvanje.
7. Začetek gelske elektroforeze:
|
—
|
pripravljeni 1-odstotni agarozni gel se prenese v komoro za gelsko elektroforezo, napolnjeno s pufrom 1 × TAE;
|
|
—
|
v utor na agaroznem gelu se s pipeto vnese 10–15 μl obarvanega vzorca PCR;
|
|
—
|
v ločen utor se s pipeto vnese tudi 5–15 μl Invitrogena (lestvica 1 kb);
|
|
—
|
elektroforezo je treba začeti z 200 V;
|
|
—
|
končati jo je treba po 30–45 minutah.
|
8. Določanje prog:
|
—
|
agarozni gel je treba očistiti v destilirani H2O;
|
|
—
|
nato je treba agarozni gel za 15–30 minut prenesti v etidijev bromid;
|
|
—
|
po tem je treba v UV-svetlobni škatli posneti sliko agaroznega gela;
|
|
—
|
na koncu se vzorci analizirajo glede na pozitivno kontrolno progo (ali proge) in lestvico.
|
Dodatek 10
Smernica za vzorčenje tkiva za določitev genetskega spola z metodo PCR pri zetu
Vzorčenje tkiva in ekstrakcija DNA
DNA se lahko ekstrahira z različnimi komercialno dostopnimi reagenti ter ročnimi in samodejnimi ekstrakcijskimi sistemi. V nadaljevanju je opisan protokol, ki se uporablja v laboratoriju Cefas Weymouth, kjer je potrebno, pa so bili dodani alternativni pristopi.
|
1.
|
Z vsake posamezne ribe se z natančnimi škarjami odstrani majhen kos tkiva (10–20 mg) z dorzolateralnega območja (ko se odstranita glava in rep za analizo VTG). Tkivo se vnese v epruveto in postavi neposredno na tekoči dušik (za shranjevanje pri – 80 °C) ali napolni s 70-odstotnim etanolom (za prenos in naknadno shranjevanje pri 4 °C). Škarje se po uporabi za posamezno ribo očistijo v 70-odstotnem etanolu in nato v destilirani vodi ter osušijo s papirnato brisačo.
|
|
2.
|
Etanol (če je bil uporabljen) se odstrani z aspiracijo, tkivo pa se čez noč razkroji s proteinazo K v 400 μl pufra ATL (Qiagen). Alikvot (200 μl) produkta razkroja se prenese v 96-mestni S-blok (Qiagen), DNA pa se ekstrahira v 96-mestnem formatu s sistemom Qiagen Universal BioRobot in priborom QIamp Investigator BioRobot. DNA se eluira v 50 μl proste vode DNaze in RNaze. Če se za ekstrakcijo DNA uporabljajo trda tkiva (kot je bodica ali prsna plavut), bo morda treba vzorec homogenizirati v liznem pufru s sistemom za lizo tkiva FastPrep® ali enakovrednim sistemom za razkroj tkiva.
Ali pa:
|
(a)
|
tkivo se čez noč razkraja s proteinazo K v 400 μl liznega pufra G2 (Qiagen), DNA pa se ekstrahira iz 200 μl produkta razkroja z enostavnim priborom EZ-1 DNA Tissue Kit in EZ-1 BioRobot ali enostavnim priborom DNA Mini Kit. DNA se eluira v 50 μl zmesi;
|
|
(b)
|
tkiva se obdelajo z reagentom DNAzol. Vzorci tkiv se v 1,5-mililitrski mikrocentrifugirki 10 minut razkrajajo v 1 ml DNAzola in nato 5 minut centrifugirajo pri 13 000 o/min, da se odstranijo vsi delci. Vzorec, ki je prestal lizo, se prenese v novo 1,5-mililitrsko mikrocentrifugirko s 500 μl 100-odstotnega molekularno čistega etanola in nato 10 minut centrifugira pri 13 000 o/min, da se DNA obori. Etanol se odstrani in nadomesti s 400 μl 70-odstotnega etanola molekulske stopnje, 5 minut centrifugira pri 13 000 o/min, kosi DNA pa se raztapljajo v 50 μl proste vode molekulske DNaze in RNaze. Če se uporabljajo trda tkiva (prsna plavut), bo morda treba vzorec pred ekstrakcijo DNA homogenizirati v liznem pufru s sistemom za lizo tkiva FastPrep® ali enakovrednim sistemom za razkroj tkiva.
|
|
|
3.
|
DNA se shranjuje pri – 20 °C, dokler se ne potrebuje.
|
Pomembno opozorilo: med postopki je treba nositi rokavice.
Analiza verižne reakcije s polimerazo (PCR)
Amplifikacije so se izvedle z 2,5 μl ekstrakta DNA v 50 μl reakcijske zmesi z začetnimi oligonukleotidi lokusov (kot je opisano v Peichel idr., 2004. Current Biology 1:1416-1424):
|
smerni začetni oligonukleotid
|
5′ GGG ACG AGC AAG ATT TAT TGG 3′;
|
|
protismerni začetni oligonukleotid
|
5′ TAT AGT TAG CCA GGA GAT GG 3′.
|
Reagente PCR dobavljajo številni dobavitelji. V nadaljevanju opisana metoda se trenutno uporablja v laboratoriju Cefas Weymouth.
1. Priprava ‚reakcijske zmesi‘ (50 μl na vzorec):
Izhodiščna zmes se pripravi, kot sledi. Pripravi se lahko vnaprej in se do uporabe shrani zamrznjena pri – 20 °C. Pripraviti je treba zadostno izhodiščno zmes za negativno kontrolo (samo voda stopnje molekularne biologije).
|
|
Prostornina (založna koncentracija)/vzorec
|
Končna koncentracija
|
|
Reakcijski pufer 5xGoTaq®
|
10 μl
|
1x
|
|
MgCl2
|
5 μl (25 mM)
|
2,5 mM
|
|
Nukleotidi (dATP, dCTP, dGTP, dTTP)
|
0,5 μl (25 mM vsak)
|
250 μM vsak
|
|
Smerni začetni oligonukleotid
|
0,5 μl (0,1 nmol/μl)
|
2,0 μM
|
|
Protismerni začetni oligonukleotid
|
0,5 μl (0,1 nmol/μl)
|
2,0 μM
|
|
Voda stopnje molekularne biologije
|
30,75 μl
|
|
|
Polimeraza GoTaq
|
0,25 μl
|
1,25 U
|
|
—
|
V označeno 0,5-mililitrsko epruveto za PCR s tankimi stenami se odmeri 47,5 μl.
|
|
—
|
V ustrezno označeno epruveto se doda 2,5 μl čiste DNA. Postopek se ponovi za vse vzorce in negativno kontrolo.
|
|
—
|
Prekrije se z dvema kapljicama mineralnega olja. Namesto tega se lahko uporabi ciklični termostat z ogrevanim pokrovom.
|
|
—
|
Vzorci so se 5 minut denaturirali v cikličnem termostatu PTC-225 pri 94 ± 2 °C, temu pa je sledilo 39 enominutnih ciklov pri 94 ± 2 °C, 55 ± 2 °C in 72 ± 2 °C ter na koncu desetminutno podaljševanje pri 72 ± 2 °C.
|
2. Priprava agaroznega gela (2 %):
Proizvodi PCR se običajno razgradijo na 20-odstotnem agaroznem gelu, ki vsebuje etidijev bromid.
Uporabi se lahko tudi kapilarni sistem elektroforeze.
|
—
|
Dva grama agaroze se odtehtata v 100 ml pufra 1 × TAE.
|
|
—
|
Pogreje se v mikrovalovni pečici (približno 2–3 minute), da se agaroza raztopi.
|
|
—
|
Dodata se 2 kapljici končne koncentracije etidijevega bromida 0,5 μg/ml.
|
|
—
|
Vroča raztopina se prenese v opremo za ulitje gela.
|
3. Gelska elektroforeza:
|
—
|
Agarozni gel se prenese v opremo za elektroforezo in potopi v pufer 1 × TAE.
|
|
—
|
V ločene vdolbinice se vnese 20 μl vsakega vzorca, pri čemer se v prosto vdolbinico doda molekulski velikostni standard (lestvica DNA 100 bp, Promega).
|
|
—
|
Elektroforeza se 30–45 minut izvaja pri 120 V.
|
4. Vizualizacija proizvodov amplifikacije
Če je bil v agarozni gel vključen etidijev bromid, kot je opisano zgoraj, se proizvodi DNA vizualizirajo pod virom UV. V nasprotnem primeru se agarozni gel obarva tako, da se gel pred vizualizacijo za 30 minut prekrije z razredčeno raztopino etidijevega bromida (0,5 μg/ml v vodi).
Dodatek 11
Smernica za postopek umetne oploditve pri zetu
Namen tega razdelka je opisati postopke za pridobitev oplojenih iker zeta za uporabo v preskusu spolnega razvoja rib.
Postopki
Pridobivanje semenčic samcev
|
1.
|
Evtanazira se dobro obarvan samec želene populacije.
|
|
2.
|
Moda se odrežejo z obeh strani ribe. Moda so običajno močno pigmentirane paličaste strukture, ki so že vidne ob lateralni sredinski črti telesa. Uporabi se lahko katera koli od naslednjih metod.
|
|
3.
|
Z natančnimi škarjami se naredi 1–1,5-centimetrski rez z enim prerezom pod kotom približno 45 stopinj, ki se začne pri kloaki.
|
|
4.
|
S skalpelom se naredi majhen rez na boku ribe nekoliko posteriorno na medenico in ventralno na lateralne ploščice.
|
|
5.
|
Moda se odstranijo s finimi kleščami in vstavijo v petrijevko.
|
|
6.
|
Vsako modo se prekrije s 100 μl sveže narejene Hankove končne raztopine
(31).
|
|
7.
|
Moda se fino narežejo na kocke z britvico ali skalpelom. Pri tem se sprostijo semenčice, ki dajo Hankovi raztopini mlečen videz.
|
|
8.
|
Tekočina s semenčicami se vnese v epruveto, pri čemer se pazi, da se s pipetiranjem vanjo ne vnesejo deli mod.
|
|
9.
|
V epruveto se doda 800 μl Hankove končne raztopine in dobro premeša.
|
|
10.
|
Po potrebi se lahko samec konzervira s fiksiranjem v 100-odstotnem etanolu ali drugem želenem fiksativu. To je zlasti pomembno, če se v okviru študije določa izvor potomstva glede na starše.
|
Pomembno opozorilo: čeprav se lahko večina potrebnih založnih raztopin pripravi vnaprej, je treba zalogo 5 in zato končno raztopino pripraviti svežo na dan uporabe.
|
Zaloga 1
|
|
NaCl
|
8,00 g
|
|
KCl
|
0,40 g
|
|
Destilirana voda
|
100 ml
|
|
Zaloga 2
|
|
Na2HPO4 (brezvodni)
|
0,358 g
|
|
KH2PO4
|
0,60 g
|
|
Destilirana voda
|
100 ml
|
|
Zaloga 3
|
|
CaCl2
|
0,72 g
|
|
Destilirana voda
|
50 ml
|
|
Zaloga 4
|
|
MgSO4 7H2O
|
1,23 g
|
|
Destilirana voda
|
50 ml
|
|
Zaloga 5 (sveže pripravljena)
|
|
NaHCO3
|
0,35 g
|
|
Destilirana voda
|
10 ml
|
Opomba: če že imate nekatere od navedenih soli, vendar z drugačno vsebnostjo vode (tj. 2H2O namesto brezvodne), jih lahko uporabite, vendar najprej prilagodite maso na podlagi molekulske mase.
Za Hankovo končno raztopino se po naslednjem vrstnem redu združijo:
|
zaloga 1
|
1,0 ml
|
|
zaloga 2
|
0,1 ml
|
|
zaloga 3
|
0,1 ml
|
|
destilirana voda
|
8,6 ml
|
|
zaloga 4
|
0,1 ml
|
|
zaloga 5
|
0,1 ml
|
Pred uporabo dobro premešajte.
Oploditev
|
1.
|
V želeni populaciji se določijo velike in gravidne samice; samice so pripravljene na stiskanje šele, ko se vidijo ikre, ki izstopajo iz kloake. Za pripravljene samice je značilna ‚pokončna‘ drža.
|
|
2.
|
S prstom oz. palcem se nežno premika po boku ribe do repa, da se spodbudi izločitev vrečke z ikrami v svežo petrijevko. Postopek se ponovi na drugi strani in riba vrne v posodo.
|
|
3.
|
Ikre se lahko razporedijo (tvorijo enoslojno plast) s finim čopičem. Pomembno je, da se poskusi čim več iker izpostaviti semenčicam, k čemur pripomore čim večja površina iker. Pomembno opozorilo: ikre morajo biti vlažne, zato se obložijo z vlažnim robcem (pomembno je, da se ikre ne dotikajo vode neposredno, saj bi lahko horij, ki preprečuje oploditev, prehitro otrdel). Samice se zelo razlikujejo po številu iker, ki ga lahko proizvedejo, vendar bi moralo biti v povprečju iz ene gravidne samice enostavno pridobiti približno 150 iker.
|
|
4.
|
Po celotni površini iker se s čopičem enakomerno porazdeli 25μl semenčic v Hankovi zmesi. Ko se oplojevanje začne, bodo ikre hitro otrdele in spremenile barvo (v minuti). Če se oceni, da je iker več kot 150, se postopek ponovi. Če ikre ne otrdijo v minuti, se doda nekaj semenčic. Pomembno opozorilo: z dodajanjem semenčic se stopnja oplojenosti morda ne bo izboljšala.
|
|
5.
|
Ikre in raztopina s semenčicami morajo biti v stiku vsaj 15 minut, oplojene ikre pa je treba vstaviti v akvarij za izpostavljanje v uri in pol po oploditvi.
|
|
6.
|
Postopek se ponovi z drugo samico, dokler ni zbrano želeno število iker.
|
|
7.
|
Nekaj iker zadnje serije se prihrani in fiksira v 10-odstotni ocetni kislini.
|
Štetje in razporeditev iker v preskusnem akvariju
|
1.
|
Ikre je treba enakomerno porazdeliti med vsako stopnjo tretiranja, da se prepreči genetska nagnjenost. Vsako serijo oplojenih iker je treba razporediti v enako velike skupine (toliko, kot je stopenj tretiranja) s topim instrumentom (npr. s širokimi entomološkimi kleščami ali inokulacijsko zanko). Če so cilj štiri ponovitve na tretiranje, pri čemer je v vsaki 20 iker, je treba razdeliti 80 iker na akvarij za izpostavljanje. Pomembno opozorilo: priporočljivo je dodati dodatnih 20 % (tj. 96 iker na stopnjo tretiranja), dokler se ne zagotovi 100-odstotna oploditev.
|
|
2.
|
Ikre zeta so zelo nagnjenje h glivičnim okužbam izven gnezdišč, ki jih varujejo samci. Zato je ključnega pomena, da se vse ikre prvih pet dni preskusa tretirajo z metilensko modrim. Založna raztopina metilensko modrega se pripravi z 1 mg/ml in doda v akvarij za izpostavljanje, kjer je največja končna koncentracija 2,125 mg/l. Pomembno opozorilo: zeti se ne smejo izpostaviti metilensko modremu, ko se izvalijo, zato v sistemu za ublažitev do šestega dne ne sme biti več metilensko modrega.
|
|
3.
|
Ikre se vsak dan pregledajo, pri čemer je treba dokumentirati vse mrtve ali neoplojene ikre. Pomembno opozorilo: dokler se ikre ne izvalijo, ne smejo zapustiti vode niti za krajši čas.
|
C.42 BIOLOŠKA RAZGRADLJIVOST V MORSKI VODI
SPLOŠNI UVOD
|
1.
|
Ta preskusna metoda ustreza Smernici za preskušanje OECD (TG) 306 (1992). Ko so bile pripravljene izvirne preskusne metode, ni bilo znano, v kakšnem obsegu bi se lahko rezultati presejalnih preskusov lahke biološke razgradljivosti z uporabo sladke vode in komunalne odplake ali aktivnega blata kot inokuluma, uporabili za morsko okolje. V zvezi s tem so bili sporočeni različni rezultati (npr. (1)).
|
|
2.
|
Veliko industrijskih odpadnih voda, ki vsebujejo različne kemikalije, doseže morje z neposrednim izpustom ali prek rečnih ustij in rek, v katerih so zadrževalni časi kratki v primerjavi z obdobjem, ki je potrebno za popolno biološko razgradnjo številnih prisotnih kemikalij. Zaradi vedno večje ozaveščenosti o potrebi, da je treba morsko okolje zaščititi pred vedno večjo obremenitvijo s kemikalijami in oceniti verjetno koncentracijo kemikalij v morju, so bile razvite preskusne metode za biološko razgradljivost v morski vodi.
|
|
3.
|
Pri metodah, opisanih v tem poglavju, se naravna morska voda uporablja kot vodna faza in vir mikroorganizmov. V okviru prizadevanj za skladnost z metodami za lahko biološko razgradljivost v sladki vodi sta se proučevali uporaba ultrafiltrirane in centrifugirane morske vode ter uporaba morskih usedlin kot inokulumov. Ta proučevanja niso bila uspešna. Preskusni medij je zato naravna morska voda, predhodno tretirana, da se odstranijo grobi delci.
|
|
4.
|
Da bi se lahko končna biološka razgradljivost ocenila z metodo stresanja bučke, je treba zaradi slabe občutljivosti analitske metode za raztopljeni organski ogljik (DOC) uporabiti razmeroma visoke koncentracije preskusne snovi. Zato je treba dodajati morsko vodo z mineralnimi hranilnimi snovmi (N in P), saj bi njihove nizke koncentracije sicer omejile odstranitev raztopljenega organskega ogljika. Pri metodi stresanja bučke je treba zaradi koncentracije dodane preskusne snovi dodati tudi hranilne snovi.
|
|
5.
|
Zato metode niso preskusi za lahko biološko razgradljivost, ker se mikroorganizmom, ki so že prisotni v morski vodi, ne doda inokulum. Preskusi tudi niso simulacija morskega okolja, saj se dodajo hranilne snovi, koncentracija preskusne snovi pa je veliko višja, kot bi bila prisotna v morju. Zato se metode predlagajo v novem podrazdelku ‚Biološka razgradljivost v morski vodi‘.
|
UPORABA
|
6.
|
Rezultati preskusa, ki bi se uporabili, ker sta vzorec uporabe in odstranjevanje zadevne snovi pokazala pot do morja, dajejo prvi vtis o biološki razgradljivosti v morski vodi. Če je rezultat pozitiven (> 70 % odstranjenega raztopljenega organskega ogljika; > 60 % teoretične potrebe po kisiku (TPK)), se lahko ugotovi, da je biološka razgradnja v morskem okolju mogoča. Vendar negativen rezultat ne izključuje takega potenciala, ampak kaže, da je potrebna nadaljnja študija, na primer z uporabo čim nižje koncentracije preskusne snovi.
|
|
7.
|
Če je potrebna bolj končna vrednost hitrosti ali stopnje biološke razgradnje v morski vodi na določenem mestu, je v vsakem primeru treba uporabiti zahtevnejše, bolj prefinjene in zato dražje metode. Simulacijski preskus bi se na primer lahko uporabil s koncentracijo preskusne snovi, ki je bliže verjetni koncentraciji v okolju. Uporabila bi se lahko tudi neobogatena morska voda, ki ni predhodno tretirana, iz aktualne lokacije, primarna biološka razgradnja pa bi se lahko spremljala s specifično kemijsko analizo. Za končno biološko razgradljivost bi bile potrebne snovi, označene s 14C, da bi se lahko izmerile hitrosti izginjanja topnega organskega 14C in nastajanje 14CO2 pri pogojih, ki so realni za okolje.
|
IZBIRA METOD
|
8.
|
Izbira metode, ki se bo uporabila, je odvisna od številnih dejavnikov. Naslednja tabela bo pripomogla k izbiri. Čeprav snovi, ki so topne v vodi pod ekvivalentom približno 5 mg C/l, z metodo stresanja bučke ni mogoče preskusiti, se lahko z njo načeloma preskusijo vsaj slabo topne snovi.
Tabela
Prednosti in slabosti metode stresanja bučke ter preskusa v zaprti steklenici
|
METODA
|
PREDNOSTI
|
SLABOSTI
|
|
STRESANJE BUČKE
|
|
—
|
enostavna oprema, razen analizatorja za C,
|
|
—
|
trajanje 60 dni ni težava,
|
|
—
|
ni motenj zaradi nitrifikacije,
|
|
—
|
lahko se prilagodi hlapnim snovem,
|
|
|
—
|
potreben je analizator za C,
|
|
—
|
uporabi se 5–40 mg DOC/l, lahko ima inhibitorni učinek,
|
|
—
|
določitev DOC je zahtevna pri nizkih koncentracijah v morski vodi (učinek klora),
|
|
—
|
DOC je v morski vodi občasno visoka,
|
|
|
ZAPRTA STEKLENICA
|
|
—
|
enostavna določitev konca,
|
|
—
|
uporablja se nizka koncentracija preskusne snovi (2 mg/l), zato je manjša verjetnost zaviranja,
|
|
—
|
enostavna prilagoditev hlapnim snovem,
|
|
|
—
|
morda je težko ohranjati nepredušnost steklenic,
|
|
—
|
zaradi rasti bakterij po stenah so lahko rezultati napačni,
|
|
—
|
slepe vrednosti absorpcije O2 so lahko visoke zlasti po 28 dneh; lahko se preprečijo s staranjem morske vode,
|
|
—
|
mogoče motnje absorpcije O2 zaradi nitrifikacije
|
|
|
METODA STRESANJA BUČKE
UVOD
|
1.
|
Ta metoda je različica prilagojenega presejalnega preskusa OECD, opisanega v poglavju C.4B te priloge (2). Končna različica je bila pripravljena kot rezultat krožnega preskusa, ki ga je za Evropsko komisijo pripravil danski inštitut za kakovost vode (3).
|
|
2.
|
Tako kot pri spremljajočem preskusu v zaprti steklenici se rezultati tega preskusa ne smejo obravnavati kot kazalniki lahke biološke razgradljivosti, ampak se morajo uporabiti izrecno za pridobivanje informacij o biološki razgradljivosti snovi v morskih okoljih.
|
NAČELO METODE
|
3.
|
Predhodno določena količina preskusne snovi se raztopi v preskusnem mediju, da nastane koncentracija 540 mg raztopljenega organskega ogljika (DOC)/l. Če se meje občutljivosti analiz organskega ogljika izboljšajo, lahko ima prednost uporaba nižjih koncentracij preskusne snovi, zlasti za inhibitorne snovi. Raztopina preskusne snovi v preskusnem mediju se inkubira z mešanjem v temi ali difuzni svetlobi v aerobnih pogojih pri stalni temperaturi (vzdrževani v razponu ± 2 °C), ki je običajno v obsegu 15–20 °C. Kadar je cilj študije simulacija okoljskih razmer, se lahko preskusi izvedejo izven običajnega temperaturnega razpona. Priporoča se, da preskus ne traja dlje kot približno 60 dni. Razgradnja sledi meritvam raztopljenega organskega ogljika (končna razgradnja) in v nekaterih primerih specifični analizi (primarna razgradnja).
|
INFORMACIJE O PRESKUSNI SNOVI
|
4.
|
Da bi vedeli, ali se lahko preskus uporabi za določeno snov, morajo biti znane nekatere njene lastnosti. Določiti je treba vsebnost organskega ogljika v snovi, njena hlapnost ne sme povzročati bistvenih izgub med potekom preskusa, njena topnost v vodi pa mora biti večja ali enaka 2 540 mg C/l. Poleg tega se preskusna snov ne sme znatno adsorbirati na steklene površine. Za razlago dobljenih rezultatov so potrebne informacije o čistosti ali relativnih deležih glavnih sestavin preskusne snovi, zlasti kadar so rezultati mejni.
|
|
5.
|
Informacije o strupenosti preskusne snovi za bakterije, kot se na primer meri v kratkotrajnih preskusih stopnje respiracije (4), so lahko koristne pri izbiri primernih preskusnih koncentracij in so lahko bistvene za pravilno razlago nizkih vrednosti biološke razgradnje. Vendar take informacije niso vedno zadostne za razlago rezultatov, dobljenih v preskusu biološke razgradnje, pri čemer je ustreznejši postopek, ki je opisan v odstavku 18.
|
REFERENČNE SNOVI
|
6.
|
Da se preveri mikrobna dejavnost vzorca morske vode, je treba uporabiti ustrezne referenčne snovi. Primeri snovi, ki se lahko uporabijo v ta namen, so natrijev benzoat, natrijev acetat in anilin. Referenčne snovi se morajo razgraditi v razumnem času, sicer se priporoča, da se preskus ponovi z drugim vzorcem morske vode.
|
|
7.
|
Pri krožnem preskusu za Evropsko komisijo, kjer so bili vzorci morske vode odvzeti na različnih lokacijah in v različnih časovnih obdobjih (3), sta bila lag faza (tL) in čas do 50-odstotne razgradnje (t50), ki ne vključuje lag faze, od 1 do 4 dni oziroma od 1 do 7 dni za natrijev benzoat. Za anilin je bil tL od 0 do 10dni, t50 pa od 1 do 10 dni.
|
OBNOVLJIVOST IN OBČUTLJIVOST METODE
|
8.
|
Obnovljivost metode je bila določena s krožnim preskusom (3). Najnižjo koncentracijo preskusne snovi, za katero se lahko ta metoda uporabi z analizo raztopljenega organskega ogljika, v veliki meri določata meja zaznavnosti analize organskega ogljika (približno 0,5 mg C/l) in koncentracija raztopljenega organskega ogljika v uporabljeni morski vodi (običajno 35 mg/l za vodo iz odprtega morja). Osnovna koncentracija raztopljenega organskega ogljika ne sme preseči približno 20 % skupne koncentracije raztopljenega organskega ogljika po dodajanju preskusne snovi. Če to ni izvedljivo, se lahko osnovna koncentracija raztopljenega organskega ogljika občasno zniža s staranjem morske vode pred preskušanjem. Če se metoda uporabi le s specifično kemijsko analizo (s katero se meri primarna razgradnja), mora raziskovalec z zagotavljanjem dodatnih informacij dokumentirati, ali se lahko pričakuje končna razgradljivost. Dodatne informacije lahko vključujejo rezultate drugih preskusov za lahko ali inherentno biološko razgradljivost.
|
OPIS METODE
Oprema
|
9.
|
Običajna laboratorijska oprema in:
|
a.
|
stresalnik, primeren za erlenmajerice prostornine 0,52 litra, bodisi z avtomatskim uravnavanjem temperature bodisi v prostoru s konstantno temperaturo 15–20 °C, ki se vzdržuje v razponu ± 2 °C;
|
|
b.
|
erlenmajerice z ozkim grlom, prostornine 0,52 litra;
|
|
c.
|
naprava za membransko filtracijo ali centrifuga;
|
|
d.
|
membranski filtri, 0,2–0,45 μm;
|
|
f.
|
oprema za specifično analizo (neobvezno).
|
|
Morska voda
|
10.
|
V temeljito očiščeno posodo se odvzem vzorec morske vode in prenese v laboratorij, po možnosti v enem ali dveh dneh po odvzemu. Zagotovi se, da temperatura vzorca med prevozom ne bo znatno presegla temperature, ki bo uporabljena v preskusu. Natančno se opredeli lokacija vzorčenja in opiše njegovo stanje v zvezi z onesnaženostjo in hranilnimi snovmi. V opredelitev se zlasti pri obalnih vodah vključita število heterotrofnih mikrobnih kolonij ter določitev koncentracij raztopljenega nitrata, amoniaka in fosfata.
|
|
11.
|
Za vzorec morske vode se navedejo naslednje informacije:
|
—
|
videz vzorca – moten itd.,
|
|
—
|
temperatura v času odvzema,
|
|
—
|
raztopljeni organski ogljik,
|
|
—
|
čas od odvzema do uporabe v preskusu.
|
|
|
12.
|
Če se ugotovi, da je vsebnost raztopljenega organskega ogljika v vzorcu morske vode previsoka (odstavek 8), je priporočeno, da se morska voda pred uporabo stara približno en teden. Staranje poteka v aerobnih pogojih pri preskusni temperaturi in v temi ali pri difuzni svetlobi. Po potrebi je treba aerobne pogoje vzdrževati z rahlim prezračevanjem. Med staranjem se vsebnost lahko razgradljive organske snovi zmanjša. Krožni preskus (3) ni pokazal razlike med možnostjo razgradnje staranih in sveže odvzetih vzorcev morske vode. Morska voda se pred uporabo tretira tako, da se odstranijo grobi delci, npr. s filtriranjem skozi najlonski filter ali filter papir (ne membranski filter ali filter GF/C) ali s sedimentacijo in odlivanjem. Uporabljeni postopek je treba navesti. Če se izvede staranje, se po njem izvede predhodno tretiranje.
|
Založne raztopine za mineralne hranilne snovi
|
13.
|
Iz analitsko čistih reagentov se pripravijo naslednje založne raztopine.
|
(a)
|
Kalijev dihidrogen ortofosfat, KH2PO4
|
8,50 g
|
|
Dikalijev hidrogen ortofosfat, K2HPO4
|
21,75 g
|
|
Dinatrijev hidrogen ortofosfat dihidrat, Na2HPO4 · 2H2O
|
33,30 g
|
|
Amonijev klorid, NH4Cl
|
0,50 g
|
|
Raztopiti in dopolniti do 1 litra z destilirano vodo.
|
|
|
(b)
|
Kalcijev klorid, CaCl2
|
27,50 g
|
|
Raztopiti in dopolniti do 1 litra z destilirano vodo.
|
|
|
(c)
|
Magnezijev sulfat heptahidrat, MgSO4 · 7H2O
|
22,50 g
|
|
Raztopiti in dopolniti do 1 litra z destilirano vodo.
|
|
|
(d)
|
Železov (III) klorid heksahidrat, FeCl3 · 6H2O
|
0,25 g
|
|
Raztopiti in dopolniti do 1 litra z destilirano vodo.
|
|
Obarjanje v raztopini (d) bi se lahko preprečilo z dodajanjem ene kapljice koncentrirane HCl ali 0,4 g etilendiamintetraocetne kisline (EDTA, dinatrijeva sol) na liter. Če se obarjenje pojavi v založni raztopini, se nadomesti s svežo raztopino.
|
Priprava preskusnega medija
|
14.
|
Doda se 1 ml vsake od zgornjih založnih raztopin na liter predhodno tretirane morske vode.
|
Inokulum
|
15.
|
Mikroorganizmom, ki so že prisotni v morski vodi, se ne doda poseben inokulum. Število heterotrofov, ki v preskusnem mediju morske vode tvorijo kolonije (in po možnosti tudi v izvirnih vzorcih morske vode), se (neobvezno) določi npr. s štetjem kolonij na ploščah, za kar se uporabi morski agar. To je zlasti zaželeno za vzorce iz obalnih ali onesnaženih mest. Heterotrofna mikrobna dejavnost v morski vodi se preveri s preskusom z referenčno snovjo.
|
Priprava bučk
|
16.
|
Zagotovi se, da bo vsa steklena posoda temeljito očiščena, vendar ne nujno sterilna (npr. z alkoholno klorovodikovo kislino), sprana in posušena pred uporabo, da se prepreči onesnaženje z ostanki iz prejšnjih preskusov. Bučke je treba očistiti tudi pred prvo uporabo.
|
|
17.
|
Preskusne snovi v dveh bučkah se ocenijo hkrati, skupaj z bučko za referenčno snov. V dveh ponovitvah se izvede slepi preskus brez preskusne ali referenčne snovi za določanje analitskih slepih vzorcev. Preskusne snovi, ki se lahko ustrezno dodajo prek koncentrirane založne raztopine, se raztopijo v preskusnem mediju, da se zagotovijo želene začetne koncentracije, ki so običajno 540 mg DOC/l. Referenčna snov se normalno preskusi pri začetni koncentraciji, ki ustreza 20 mg DOC/l. Če se uporabijo založne raztopine preskusnih in/ali referenčnih sovi, se zagotovite, da se slanost medija morske vode ne spremeni bistveno.
|
|
18.
|
Če se lahko pričakujejo strupeni učinki ali jih ni mogoče izključiti, je v načrt preskusa priporočljivo vključiti dve ponovitvi preskusa zaviranja. Preskusna in referenčna snov se dodata v isto posodo, pri čemer naj bo zaradi primerjave koncentracija referenčne snovi običajno enaka kot pri kontrolnem preskusu (tj. 20 mg DOC/l).
|
|
19.
|
V erlenmajerice se odmerijo primerne prostornine preskusnih raztopin (primerna količina ne presega polovice prostornine erlenmajeric), nato pa se vse erlenmajerice ohlapno pokrijejo (npr. z aluminijasto folijo), tako da bo mogoča izmenjava plinov med bučko in okoliškim zrakom. (Če se uporablja analiza raztopljenega organskega ogljika, vata ni primerna.) Posode se postavijo na stresalnik in se ves čas preskusa neprekinjeno stresajo pri zmernih obratih (npr. 100 o/min). Temperatura (15–20 °C v razponu ± 2 °C) se nadzoruje in posode se zaščitijo pred svetlobo, da se prepreči rast alg. Zagotovi se, da v zraku ni strupenih snovi.
|
Fizikalno-kemijski kontrolni preskus (neobvezno)
|
20.
|
Če obstaja sum abiotske razgradnje ali mehanizma izgub, kot je hidroliza (težava le pri specifični analizi), izhlapevanje ali adsorpcija, je priporočljivo izvesti fizikalno-kemijski kontrolni preskus. Izvede se lahko z vnosom živosrebrovega (II) klorida (HgCl2) (32) (50– 100 mg/l) v posode s preskusno snovjo, da se ustavi mikrobna dejavnost. Znatno zmanjšanje raztopljenega organskega ogljika ali koncentracije specifične snovi v fizikalno-kemijskem kontrolnem preskusu kaže abiotske mehanizme odstranjevanja. (Če se uporabi živosrebrov klorid, je treba pri analizi raztopljenega organskega ogljika paziti na motnje ali zastrupitev katalizatorja.)
|
Število bučk
|
21.
|
V značilnem poteku preskusa se uporabijo naslednje bučke:
|
bučki 1 in 2
|
–
|
vsebujeta preskusno snov (preskusno suspenzijo),
|
|
bučki 3 in 4
|
–
|
vsebujeta le morsko vodo (slepi),
|
|
bučka 5
|
–
|
vsebuje referenčno snov (kontrola postopka),
|
|
bučka 6
|
–
|
vsebuje preskusno in referenčno snov (kontrola strupenosti) – neobvezna,
|
|
bučka 7
|
–
|
vsebuje preskusno snov in sterilizacijsko sredstvo (abiotska sterilna kontrola) – neobvezna.
|
|
Analiza raztopljenega organskega ogljika
|
22.
|
Med potekom preskusa se v ustreznih razmikih odvzamejo vzorci za analizo raztopljenega organskega ogljika (Dodatek 1). Vzorci se vedno odvzamejo na začetku preskusa (dan 0) in 60. dan. Za opis časovnega poteka razgradnje je skupaj potrebnih vsaj pet vzorcev. Fiksnega časovnega razporeda vzorčenja ni mogoče določiti, ker se hitrost biološke razgradnje razlikuje. Za vsak vzorec se določi raztopljeni organski ogljik v dveh ponovitvah.
|
Vzorčenje
|
23.
|
Potrebna prostornina vzorcev je odvisna od analitske metode (specifična analiza), uporabljenega analizatorja ogljika in postopka (membranska filtracija ali centrifugiranje), izbranega za tretiranje vzorca pred določanjem ogljika (odstavka 25 in 26). Pred vzorčenjem je treba zagotoviti, da je preskusni medij dobro premešan in da se material, prilepljen na steno bučke, raztopi ali suspendira.
|
|
24.
|
Membransko filtracijo ali centrifugiranje je treba izvesti takoj po vzorčenju. Po potrebi se filtrirani ali centrifugirani vzorci shranijo pri 2–4 °C za največ 48 ur ali pod – 18 °C za daljša obdobja (vzorec se pred shranjevanjem zakisa na pH 2, če je znano, da to ne bo vplivalo na snov).
|
|
25.
|
Membranski filtri (0,2–0,45 μm) so primerni le, če je zagotovljeno, da med filtriranjem ne izpuščajo ogljika in ne adsorbirajo snovi; npr. polikarbonski membranski filtri. Nekateri membranski filtri so impregnirani s površinsko aktivnimi snovmi za hidrofilizacijo in lahko sprostijo velike količine raztopljenega ogljika. Takšne filtre je treba pripraviti z vrenjem v deionizirani vodi tri zaporedna obdobja, pri čemer eno traja eno uro. Po vrenju je treba filtre shraniti v deionizirani vodi. Prvih 20 ml filtrata se zavrže.
|
|
26.
|
Namesto membranske filtracije se lahko izbere centrifugiranje vzorcev. Centrifugira se 15 minut pri 40 000 m.s– 2 (~ 4 000 g), po možnosti v ohlajeni centrifugi.
Opomba: zdi se, da razlikovanje skupnega organskega ogljika (TOC) od raztopljenega organskega ogljika (TOC/DOC) s centrifugiranjem pri zelo nizkih koncentracijah ni mogoče, saj se bodisi ne odstranijo vse bakterije bodisi se ogljik kot del bakterijske plazme ponovno raztopi. Pri višjih preskusnih koncentracijah (> 10 mg C na liter) se zdi napaka pri centrifugiranju primerljivo majhna.
|
Pogostost vzorčenja
|
27.
|
Če se analize izvajajo takoj po vzorčenju, se naslednji čas vzorčenja oceni ob upoštevanju rezultata analitskega določanja.
|
|
28.
|
Če se vzorci ohranijo (odstavek 24) za poznejšo analizo, je treba odvzeti več kor pet vzorcev, kolikor je potrebno najmanjše število. Zadnji vzorec se analizira najprej, pri čemer je mogoče s postopno ‚vzvratno‘ izbiro ustreznih vzorcev pridobiti dober opis krivulje biološke razgradnje z razmeroma majhnim številom analitskih določitev. Če do konca preskusa ne pride do razgradnje, ni treba analizirati dodatnih vzorcev, pri čemer se lahko v takem primeru z ‚vzvratno‘ strategijo prihrani veliko analitskih stroškov.
|
|
29.
|
Če se na krivulji razgradnje pred 60. dnem opazi ravnotežje, je treba preskus končati. Če je očitno, da se je razgradnja začela pred 60. dnem, vendar ni dosegla ravnotežja, se preskus podaljša za dodatno obdobje.
|
PODATKI IN POROČANJE
Obdelava rezultatov
|
30.
|
Rezultati analize se zabeležijo na priloženi podatkovni list (Dodatek 2), vrednosti biološke razgradnje za preskusno in referenčno snov pa se izračunajo po naslednji enačbi:
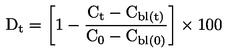
pri čemer je:
|
Dt
|
=
|
razgradnja v odstotku raztopljenega organskega ogljika ali odstranitev specifične snovi ob času t,
|
|
Co
|
=
|
začetna koncentracija raztopljenega organskega ogljika ali specifične snovi v preskusnem mediju,
|
|
Ct
|
=
|
koncentracija raztopljenega organskega ogljika ali specifične snovi v preskusnem mediju ob času t,
|
|
Cbl(0)
|
=
|
začetna koncentracija raztopljenega organskega ogljika ali specifične snovi v slepem vzorcu,
|
|
Cbl(t)
|
=
|
koncentracija raztopljenega organskega ogljika ali specifične snovi v slepem vzorcu ob času t.
|
|
|
31.
|
Razgradnja se navede kot odstotek odstranitve raztopljenega organskega ogljika (končna razgradnja) ali odstranitve specifične snovi (primarna razgradnja) ob času t. Koncentracije raztopljenega organskega ogljika se izračunajo na najbližji 0,1 mg na liter, srednje vrednosti Dt pa se zaokrožijo na najbližji celi odstotek.
|
|
32.
|
Potek razgradnje se grafično prikaže na diagramu, kot je prikazano na sliki ‚Veljavnost in razlaga rezultatov‘. Če je na voljo dovolj podatkov, se iz krivulje izračunata lag faza (tL) in čas do 50-odstotne odstranitve od konca lag faze (t50).
|
Poročilo o preskusu
|
33.
|
V poročilu o preskusu morajo biti naslednje informacije:
|
|
Preskusna snov:
|
—
|
fizikalna narava in, kadar je to primerno, fizikalno-kemijske lastnosti,
|
|
—
|
identifikacijski podatki.
|
|
|
|
Preskusni pogoji:
|
—
|
lokacija in opis mesta vzorčenja, stanje v zvezi z onesnaženostjo in hranilnimi snovmi (število kolonij, amoniak, fosfat, če je primerno),
|
|
—
|
značilnosti vzorca (datum vzorčenja, globina, videz, temperatura, slanost, raztopljeni organski ogljik (neobvezno), čas med odvzemom in uporabo v preskusu),
|
|
—
|
metoda staranja morske vode, če je bila uporabljena,
|
|
—
|
uporabljena metoda za predhodno tretiranje (filtracija/sedimentacija) morske vode,
|
|
—
|
uporabljena metoda za določitev raztopljenega organskega ogljika,
|
|
—
|
uporabljena metoda za specifično analizo (neobvezno),
|
|
—
|
uporabljena metoda za določitev števila heterotrofov v morski vodi (metoda štetja kolonij na ploščah ali alternativni postopek) (neobvezno),
|
|
—
|
druge metode (neobvezno), uporabljene za opis značilnosti morske vode (merjenje ATP itd.).
|
|
|
|
Rezultati:
|
—
|
analitski podatki, navedeni na podatkovnem listu (Dodatek 2),
|
|
—
|
potek preskusa razgradnje se grafično prikaže na diagramu, ki kaže lag fazo (tL), naklon in čas (z začetkom ob koncu lag faze) do 50-odstotne odstranitve (t50). Lag faza se lahko grafično oceni, kot je prikazano na sliki v razdelku ‚Veljavnost in razlaga rezultatov‘, ali se ustrezno šteje kot čas, potreben za 10-odstotno razgradnjo,
|
|
—
|
odstotek razgradnje, izmerjen po 60 dneh ali ob koncu preskusa.
|
|
|
Veljavnost in razlaga rezultatov
|
34.
|
Rezultati, pridobljeni z referenčnimi snovmi, npr. natrijevim benzoatom, natrijevim acetatom ali anilinom, morajo biti primerljivi z rezultati, pridobljenimi s krožnim preskusom (3) (glej razdelek ‚Referenčne snovi‘, odstavek 7). Če so rezultati, pridobljenimi z referenčnimi snovmi, netipični, je treba preskus ponoviti z drugim vzorcem morske vode. Čeprav rezultatov preskusov zaviranja zaradi prispevka raztopljenega organskega ogljika, ki ga zagotovi preskusna snov, ni vedno mogoče enostavno razlagati, je znatno zmanjšanje stopnje odstranitve skupnega raztopljenega organskega ogljika v primerjavi s stopnjo iz kontrole pozitiven znak za strupene učinke.
|
|
35.
|
Zaradi uporabljenih razmeroma visokih preskusnih koncentracij v primerjavi z večino naravnih sistemov (in zato neugodnim razmerjem med koncentracijami preskusnih snovi in drugih virov ogljika) se metoda šteje za predhodni preskus, ki se lahko uporabi za ugotovitev, ali je snov lahko biološko razgradljiva. V skladu s tem nizek rezultat ne pomeni nujno, da preskusna snov v morskem okolju ni biološko razgradljiva, ampak kaže, da bo za to ugotovitev potrebnega več dela.
Na spodnji sliki je prikazan teoretičen poskus razgradnje, ki kaže izvedljiv način ocene vrednosti tL (dolžina lag faze) in t50 (časovno obdobje, ki se začne pri tL), potrebnih za 50-odstotno odstranitev.

|
METODA Z ZAPRTO STEKLENICO
UVOD
|
1.
|
Ta metoda je različica preskusa v zaprti steklenici (5) za morsko vodo, katere končna različica je bila pripravljena kot rezultat krožnega preskusa, ki ga je za Evropsko komisijo pripravil danski inštitut za kakovost vode (3).
|
|
2.
|
Tako kot pri spremljajoči metodi stresanja bučke se rezultati tega preskusa ne smejo obravnavati kot kazalniki lahke biološke razgradljivosti, ampak se morajo uporabiti izrecno za pridobivanje informacij o biološki razgradljivosti snovi v morskih okoljih.
|
NAČELO METODE
|
3.
|
Predhodno določena količina preskusne snovi se raztopi v preskusnem mediju v koncentraciji, ki je običajno 2– 10 mg preskusne snovi na liter (uporabi se lahko ena koncentracija ali več). Raztopina se v polni zaprti steklenici hrani v temi v kopeli ali posodi s konstantno temperaturo, ki se vzdržuje na ± 1 °C v razponu 15–20 °C. Kadar je cilj študije simulacija okoljskih razmer, se lahko preskusi izvedejo izven običajnega temperaturnega razpona, če se nadzor temperature ustrezno prilagodi. Razgradnji sledijo analize kisika v 28-dnevnem obdobju.
|
|
4.
|
Krožni preskus je pokazal, da v večini primerov zaradi resnih motenj ne bi bilo mogoče zbrati koristnih informacij, če bi se preskus podaljšal na več kot 28 dni. Slepe vrednosti biokemijske potrebe po kisiku (BPK) so bile verjetno pretirano visoke zaradi rasti po stenah, ki jo povzroča pomanjkanje mešanja, in nitrifikacije. Zato je priporočeno trajanje preskusa 28 dni, če pa slepe vrednosti biokemijske potrebe po kisiku ostanejo v okviru 30-odstotne meje (odstavka 15 in 40), se lahko preskus podaljša.
|
INFORMACIJE O PRESKUSNI SNOVI
|
5.
|
Da bi vedeli, ali se lahko preskus uporabi za določeno snov, morajo biti znane nekatere njene lastnosti. Empirična formula je potrebna, da se lahko izračuna teoretična potreba po kisiku (TPK) (glej dodatek 3); v nasprotnem primeru je treba določiti kemijsko potrebo snovi po kisiku (KPK), ki se šteje za referenčno vrednost. Uporaba kemijske potrebe po kisiku je manj zadovoljiva, ker nekatere snovi v preskusu kemijske potrebe po kisiku ne oksidirajo popolnoma.
|
|
6.
|
Topnost snovi mora biti vsaj 2 mg/l, čeprav se načeloma lahko preskusijo tudi manj topne snovi (npr. z ultrazvočnim razbijanjem) in hlapne snovi. Za razlago dobljenih rezultatov so potrebne informacije o čistosti ali relativnih deležih glavnih sestavin preskusne snovi, zlasti kadar so rezultati mejni.
|
|
7.
|
Informacije o strupenosti snovi za bakterije, kot se na primer meri v kratkotrajnih preskusih respiracije (4), so lahko zelo koristne pri izbiri primernih preskusnih koncentracij in so lahko bistvene za pravilno razlago nizkih vrednosti biološke razgradnje. Vendar take informacije niso vedno zadostne za razlago rezultatov, dobljenih v preskusu biološke razgradnje, pri čemer je ustreznejši postopek, ki je opisan v odstavku 27.
|
REFERENČNE SNOVI
|
8.
|
Da se preveri mikrobna dejavnost vzorca morske vode, je treba uporabiti ustrezne referenčne snovi. Za ta namen se lahko uporabi (na primer) anilin, natrijev acetat ali natrijev benzoat. Pri teh snoveh se mora v razumnem času pojaviti vsaj 60-odstotna razgradnja (njihove teoretične potrebe po kisiku), sicer se priporoča, da se preskus ponovi z drugim vzorcem morske vode.
|
|
9.
|
Pri krožnem preskusu za Evropsko komisijo, kjer so bili vzorci morske vode odvzeti na različnih lokacijah in v različnih časovnih obdobjih, sta bila lag faza (tL) in čas do 50-odstotne razgradnje (t50), ki ne vključuje lag faze, od 0 do 2 dni oziroma od 1 do 4 dni za natrijev benzoat. Za anilin sta bili vrednosti tL in t50 od 0 do 7 dni oziroma od 2 do 12 dni.
|
OBNOVLJIVOST
|
10.
|
Obnovljivost metod je bila določena s krožnim preskusom za Evropsko komisijo (3).
|
OPIS METODE
Oprema
|
11.
|
Običajna laboratorijska oprema in:
|
(a)
|
uporabijo se lahko BPK-steklenice s steklenimi zamaški in prostornino 250–300 ml ali steklenice z ozkim grlom in prostornino 250 ml;
|
|
(b)
|
več dvo-, tri- ali štirilitrskih steklenic z oznakami za litre za pripravo preskusa in polnjenje BPK-steklenic;
|
|
(c)
|
vodna kopel ali prostor s konstantno temperaturo za shranjevanje steklenic pri konstantni temperaturi (± 1 °C), kjer ni svetlobe;
|
|
(d)
|
oprema za analizo raztopljenega kisika;
|
|
(e)
|
membranski filtri, 0,2–0,45 μm (neobvezno);
|
|
(f)
|
oprema za specifično analizo (neobvezno).
|
|
Morska voda
|
12.
|
V temeljito očiščeno posodo se odvzame vzorec morske vode in prenesite v laboratorij, po možnosti v enem ali dveh dneh po odvzemu. Zagotovi se, da temperatura vzorca med prevozom ne bo znatno presegla temperature, ki bo uporabljena v preskusu.
|
|
13.
|
Natančno se opredeli lokacija vzorčenja in opiše njeno stanje v zvezi z onesnaženostjo in hranilnimi snovmi. V opredelitev se zlasti pri obalnih ali onesnaženih vodah vključita število heterotrofnih mikrobnih kolonij ter določitev koncentracij raztopljenega nitrata, amoniaka in fosfata.
|
|
14.
|
Za vzorec morske vode se navedejo naslednje informacije:
|
—
|
videz vzorca – moten itd.,
|
|
—
|
temperatura v času odvzema,
|
|
—
|
raztopljeni organski ogljik (DOC),
|
|
—
|
čas od odvzema do uporabe v preskusu.
|
|
|
15.
|
Če se ugotovi, da je vsebnost raztopljenega organskega ogljika v vzorcu visoka ali če se zdi, da bi bila slepa biokemijska potreba po kisiku po 28 dneh več kot 30 % potrebe referenčne snovi, se priporoča, da se morska voda pred uporabo stara približno en teden.
|
|
16.
|
Staranje vzorca poteka v aerobnih pogojih pri preskusni temperaturi in v temi ali difuzni svetlobi. Po potrebi je treba aerobne pogoje vzdrževati z rahlim prezračevanjem. Med staranjem se vsebnost lahko razgradljive organske snovi zmanjša. Krožni preskus (3) ni pokazal razlike med možnostjo razgradnje staranih in sveže odvzetih vzorcev morske vode.
|
|
17.
|
Morska voda se pred uporabo tretira tako, da se odstranijo grobi delci, npr. s filtriranjem skozi najlonski filter ali filter papir (ne membranski filter ali filter GF/C) ali s sedimentacijo in odlivanjem. Uporabljeni postopek je treba navesti. Če se izvede staranje, je treba izvesti tudi predhodno tretiranje.
|
Založne raztopine za mineralne hranilne snovi
|
18.
|
Iz analitsko čistih reagentov se pripravijo naslednje založne raztopine.
|
(a)
|
Kalijev dihidrogen ortofosfat, KH2PO4
|
8,50 g
|
|
Dikalijev hidrogen ortofosfat, K2HPO4
|
21,75 g
|
|
Dinatrijev hidrogen ortofosfat dihidrat, Na2HPO4 · 2H2O
|
33,30 g
|
|
Amonijev klorid, NH4Cl
|
0,50 g
|
|
Raztopiti in dopolniti do 1 litra z destilirano vodo.
|
|
|
(b)
|
Kalcijev klorid, CaCl2
|
27,50 g
|
|
Raztopiti in dopolniti do 1 litra z destilirano vodo.
|
|
|
(c)
|
Magnezijev sulfat heptahidrat, MgSO4 · 7H2O
|
22,50 g
|
|
Raztopiti in dopolniti do 1 litra z destilirano vodo.
|
|
|
(d)
|
Železov (III) klorid heksahidrat, FeCl3 · 6H2O
|
0,25 g
|
|
Raztopiti in dopolniti do 1 litra z destilirano vodo.
|
|
Obarjanje v raztopini (d) bi se lahko preprečilo z dodajanjem ene kapljice koncentrirane HCl ali 0,4 g etilendiamintetraocetne kisline (EDTA, dinatrijeva sol) na liter. Če se obarjenje pojavi v založni raztopini, se nadomesti s svežo raztopino.
|
Priprava preskusnega medija
|
19.
|
Na liter predhodno tretirane morske vode se doda 1 ml vsake od zgornjih založnih raztopin. Preskusni medij se nasiči z zrakom pri preskusni temperaturi, tako da se 20 minut prezračuje s čistim stisnjenim zrakom. Za namene kontrole se določi koncentracija raztopljenega kisika. Nasičena koncentracija raztopljenega kisika kot funkcija slanosti in temperature se lahko odčita iz nomograma, priloženega tej preskusni metodi (Dodatek 4).
|
Inokulum
|
20.
|
Mikroorganizmom, ki so že prisotni v morski vodi, se ne doda poseben inokulum. Število heterotrofov, ki v preskusnem mediju morske vode tvorijo kolonije (in po možnosti tudi v izvirnem vzorcu morske vode), se (neobvezno) določi npr. s štetjem kolonij na ploščah, za kar se uporabi morski agar. To je zlasti zaželeno za vzorce iz obalnih ali onesnaženih mest. Heterotrofna mikrobna dejavnost v morski vodi se preveri s preskusom z referenčno snovjo.
|
Priprava preskusnih steklenic
|
21.
|
Izvedejo se vsi potrebne priprave, vključno s staranjem in predhodno tretiranje morske vode pri izbrani preskusni temperaturi med 15 in 20 °C, ter zagotovi čistost, vendar ne sterilnost steklene posode.
|
|
22.
|
Pripravijo se skupine BPK-steklenic za določanje biokemijske potrebe po kisiku preskusne in referenčne snovi v sočasnih preskusnih nizih. Vse analize se izvedejo na dveh steklenicah (slepi vzorci, referenčna in preskusna snov), tj. za vsako določanje se pripravita dve steklenici. Analize se izvajajo vsaj na dan 0 ter 5., 15. in 28. dan (štiri določitve). Pri analizah kisika je za štiri določitve skupaj potrebnih 3 × 2 × 4 = 24 steklenic (slepi vzorec, referenčna in preskusna snov) in zato približno 8 litrov preskusnega medija (za eno koncentracijo preskusne snovi).
|
|
23.
|
V ustrezno velikih steklenicah (odstavek 11) se pripravijo ločene raztopine preskusne in referenčne snovi, tako da se v delno napolnjene velike steklenice najprej neposredno ali s koncentrirano založno raztopino dodata preskusna in založna snov. Preskusni medij se dodaja, dokler ne nastanejo končne želene koncentracije. Če se uporabijo založne raztopine preskusnih in/ali referenčnih sovi, je treba zagotoviti, da se slanost medija morske vode ne spremeni bistveno.
|
|
24.
|
Koncentracije preskusne in referenčne snovi se izberejo ob upoštevanju:
|
(a)
|
topnosti raztopljenega kisika v morski vodi pri prevladujoči preskusni temperaturi in slanosti (glej priloženi nomogram v Dodatku 4);
|
|
(b)
|
slepe biokemijske potrebe morske vode po kisiku in
|
|
(c)
|
pričakovane biološke razgradljivosti preskusne snovi.
|
|
|
25.
|
Topnost raztopljenega kisika je pri 15 °C in 20 °C ter slanosti 32 delov na tisoč (oceanska voda) približno 8,1 oziroma 7,4 mg/l. Poraba kisika morske vode same (respiracija v slepem vzorcu) je lahko 2 mg O2/l ali več, če morska voda ni starana. Zato se za zagotovitev ostanka znatne koncentracije kisika po oksidaciji preskusne snovi za snovi, ki bi se morale v preskusnih pogojih popolnoma razgraditi (kot so referenčne snovi), uporabi začetna koncentracija preskusne snovi, ki je približno 23 mg/l (odvisno od teoretične potrebe po kisiku). Manj razgradljive snovi se preskusijo pri nižjih koncentracijah, tj. do 10 mg/l, če se ne pojavijo strupeni učinki. Prednost lahko ima izvedba vzporednih preskusov z nizko (približno 2 mg/l) in visoko (približno 10 mg/l) koncentracijo preskusne snovi.
|
|
26.
|
Vzporedno je treba določiti slepi kisik v steklenicah, ki ne vsebujejo niti preskusne niti referenčne snovi.
|
|
27.
|
Če je treba določiti zaviralne učinke, se v ločenih velikih steklenicah (odstavek 13) pripravijo naslednji nizi raztopin:
|
(a)
|
2 mg/l lahko razgradljive snovi, npr. katere koli navedene referenčne snovi;
|
|
(b)
|
x mg/l preskusne snovi (x je običajno 2);
|
|
(c)
|
2 mg/l lahko razgradljive snovi plus x mg/l preskusne snovi.
|
|
Fizikalno-kemijski kontrolni preskus (neobvezno)
|
28.
|
Če se izkoristi možnost uporabe specifičnih analiz, se lahko izvede fizikalno-kemijski poskus za preverjanje, ali se je preskusna snov odstranila z abiotskimi mehanizmi, kot je hidroliza ali adsorpcija. Fizikalno-kemijski kontrolni preskus se lahko izvede z vnosom živosrebrovega (II) klorida (HgCl2) (33) (50– 100 mg/l) v dve bučki s preskusno snovjo, da se ustavi mikrobna dejavnost. Znatno zmanjšanje koncentracije specifične snovi med preskusom kaže abiotske mehanizme odstranjevanja.
|
Število BPK-steklenic pri značilnem poteku preskusa
|
29.
|
Pri značilnem poteku preskusa se uporabijo naslednje steklenice:
|
—
|
vsaj 8 steklenic s preskusno snovjo,
|
|
—
|
vsaj 8 steklenic izključno z morsko vodo, ki je okrepljena s hranilnimi snovmi,
|
|
—
|
vsaj 8 steklenic z referenčno snovjo in po potrebi,
|
|
—
|
6 steklenic s preskusno in referenčno snovjo (kontrola strupenosti).
|
|
POSTOPEK
|
30.
|
Takoj po pripravi je treba vsako raztopino izčrpati iz spodnje četrtine (ne z dna) ustrezno velike steklenice in z njo napolniti ustrezno skupino BPK-steklenic. V kontrolah nič (čas nič) se takoj analizira raztopljeni kisik (odstavek 33) ali pa se shranijo za poznejšo kemijsko analizo z obarjanjem z MnCl2 (manganov (II) klorid) in NaOH (natrijev hidroksid).
|
|
31.
|
Preostale vzporedne BPK-steklenice se inkubirajo pri preskusni temperaturi (15–20 °C), shranijo v temi in umaknejo z inkubacijskega območja v ustreznih časovnih razmikih (npr. vsaj po 5, 15 in 28 dneh), pri čemer se v njih analizira raztopljeni kisik (odstavek 33).
|
|
32.
|
Vzorci za specifično analizo se 15 minut membransko filtrirajo (0,2–0,45 μm) ali centrifugirajo (neobvezno). Če se ne analizirajo takoj, se hranijo pri 2–4 °C za največ 48 ur oz. pri – 18 °C za daljša obdobja (vzorec se pred shranjevanjem zakisa na pH 2, če je znano, da to ne bo vplivalo na snov).
|
Določanje raztopljenega kisika
|
33.
|
Koncentracija raztopljenega kisika se določi s kemijsko ali elektrokemijsko metodo, ki je nacionalno ali mednarodno priznana.
|
PODATKI IN POROČANJE
Obdelava rezultatov
|
34.
|
Na priložene podatkovne liste se zabeležijo analitski rezultati (Dodatek 5).
|
|
35.
|
Biokemijska potreba po kisiku se izračuna kot razlika porabe kisika med slepim vzorcem in raztopino preskusne snovi v preskusnih pogojih. Neto poraba kisika se deli s koncentracijo (m/v) snovi, da se biokemijska potreba po kisiku izrazi kot BPK/mg preskusne snovi. Razgradnja je opredeljena kot razmerje med biokemijsko potrebo po kisiku in po možnosti teoretično potrebo po kisiku (TPK) ali kemijsko potrebo po kisiku (KPK) ter izražena v odstotkih (glej odstavek 36).
|
|
36.
|
Za vsak čas vzorčenja se za preskusno in referenčno snov izračunajo vrednosti biološke razgradnje z eno od naslednjih enačb:
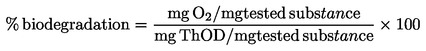

pri čemer je:
|
TPK
|
=
|
teoretična potreba po kisiku (izračun, Dodatek 3),
|
|
KPK
|
=
|
kemijska potreba po kisiku, določena s poskusom.
|
Opomba: občasno načina izračuna (odstotek teoretične potrebe po kisiku ali odstotek kemijske potrebe po kisiku) ne zagotovita enakih rezultatov; priporoča se uporaba teoretične potrebe po kisiku, ker v preskusu kemijske potrebe po kisiku nekatere snovi ne oksidirajo popolnoma.
|
|
37.
|
Potek preskusa razgradnje se grafično prikaže na diagramu (glej primer v razdelku ‚Veljavnost in razlaga rezultatov‘). Če je na voljo dovolj podatkov, se iz krivulje biološke razgradnje izračunata lag faza (tL) in čas (t50) do 50-odstotne odstranitve od konca lag faze.
|
|
38.
|
Če se uporabi specifična analiza (neobvezno), se odstotek primarne razgradnje navede kot odstotek odstranitve specifične snovi v preskusnem obdobju (popravljen za analitske slepe vzorce).
|
Poročilo o preskusu
|
39.
|
Poročilo o preskusu mora vsebovati naslednje informacije:
|
|
Preskusna snov:
|
—
|
fizikalna narava in, kadar je to primerno, fizikalno-kemijske lastnosti,
|
|
—
|
identifikacijski podatki.
|
|
|
|
Preskusni pogoji:
|
—
|
lokacija in opis mesta vzorčenja: stanje v zvezi z onesnaženostjo in hranilnimi snovmi (število kolonij, nitrat, amoniak, fosfat, če je ustrezno),
|
|
—
|
značilnosti vzorca (datum vzorčenja, globina, videz, temperatura, slanost, raztopljeni organski ogljik (neobvezno), čas med odvzemom in uporabo v preskusu),
|
|
—
|
metoda staranja morske vode, če je bila uporabljena,
|
|
—
|
uporabljena metoda za predhodno tretiranje (filtracija/sedimentacija) morske vode,
|
|
—
|
uporabljena metoda za določanje kemijske potrebe po kisiku (če se je izvedlo),
|
|
—
|
uporabljena metoda za meritve kisika,
|
|
—
|
postopek disperzije za snovi, ki so v preskusnih pogojih slabo topne,
|
|
—
|
uporabljena metoda za določitev števila heterotrofov v morski vodi (metoda štetja kolonij na ploščah ali alternativni postopek),
|
|
—
|
uporabljena metoda za določanje raztopljenega organskega ogljika v morski vodi (neobvezno),
|
|
—
|
uporabljena metoda za specifično analizo (neobvezno),
|
|
—
|
druge neobvezne metode, uporabljene za opis značilnosti morske vode (merjenje ATP itd.).
|
|
|
|
Rezultati:
|
—
|
analitski podatki, navedeni na podatkovnem listu (kot je priložen, Dodatek 5),
|
|
—
|
potek preskusa razgradnje, grafično prikazan na diagramu, ki kaže lag fazo (tL), naklon in čas (z začetkom ob koncu lag faze) do 50-odstotne odstranitve končne porabe kisika zaradi oksidacije preskusne snovi (t50). Lag faza se lahko grafično oceni, kot je prikazano na priloženi sliki, ali se ustrezno šteje kot čas, potreben za 10-odstotno razgradnjo,
|
|
—
|
odstotek razgradnje, izmerjen po 28 dneh.
|
|
|
Veljavnost in razlaga rezultatov
|
40.
|
Respiracija v slepem vzorcu ne sme preseči 30 % kisika v preskusni steklenici. Če tega merila ni mogoče izpolniti s sveže odvzeto morsko vodo, je treba morsko vodo pred uporabo starati (stabilizirati).
|
|
41.
|
Upoštevati je treba možnost, da lahko snovi, ki vsebujejo dušik, vplivajo na rezultate.
|
|
42.
|
Rezultati, pridobljeni z referenčnima snovema benzoatom in anilinom, morajo biti primerljivi z rezultati, pridobljenimi s krožnim preskusom (3) (odstavek 9). Če so rezultati, pridobljenimi z referenčnimi snovmi, netipični, je treba preskus ponoviti z drugim vzorcem morske vode.
|
|
43.
|
Preskusna snov se lahko šteje za zaviralno za bakterije (pri uporabljeni koncentraciji), če je biokemijska potreba zmesi referenčne in preskusne snovi po kisiku manjša od vsote biokemijske potrebe ločenih raztopin obeh snovi po kisiku.
|
|
44.
|
Zaradi razmeroma visokih preskusnih koncentracij v primerjavi z večino naravnih sistemov in zato neugodnim razmerjem med koncentracijami preskusne snovi in drugih virov ogljika se metoda šteje za predhodni preskus, ki se lahko uporabi za ugotovitev, ali je snov lahko biološko razgradljiva. V skladu s tem nizek rezultat ne pomeni nujno, da preskusna snov v morskem okolju ni biološko razgradljiva, ampak kaže, da bo za to ugotovitev potrebnega več dela.
Na spodnji sliki je prikazan teoretičen poskus razgradnje, ki kaže izvedljiv način ocene vrednosti tL (dolžina lag faze) in t50, časovnega obdobja (ki se začne pri tL), potrebnega za 50-odstotno končno porabo kisika zaradi oksidacije preskusne snovi.

|
LITERATURA
|
(1)
|
de Kreuk, J. F., in Hanstveit, A. O. (1981). Determination of the biodegradability of the organic fraction of chemical wastes. Chemosphere, 10 (6); 561-573.
|
|
(2)
|
Poglavje C.4-B te priloge: Določanje ‚dobre‘ biorazgradljivosti – Del III: Prilagojeni presejalni preskus OECD.
|
|
(3)
|
Nyholm, N., in Kristensen, P. (1987). Screening Test Methods for Assessment of Biodegradability of Chemical Substances in Seawater. Final Report of the ring test programme 1984– 1985, marec 1987, Komisija Evropskih skupnosti.
|
|
(4)
|
Poglavje C.11 te priloge: Biorazgradnja – preskus zaviranja dihanja aktivnega blata
|
|
(5)
|
Poglavje C.4-E te priloge: Določanje ‚dobre‘ biorazgradljivosti – Del VI: Preskus z zaprto steklenico.
|
Dodatek 1
Določanje organskega ogljika v morski vodi
METODA STRESANJA BUČKE
Za določanje organskega ogljika v vzorcu vode organske spojine v vzorcu oksidirajo v ogljikov dioksid običajno z eno od naslednjih treh tehnik:
|
—
|
mokra oksidacija s persulfatom/ultravijoličnim obsevanjem,
|
|
—
|
mokra oksidacija s persulfatom/zvišano temperaturo (116–130 °C),
|
Sproščeni CO2 se kvantificira z uporabo infrardeče spektrometrije ali titrimetrije. Druga možnost je redukcija CO2 na metan, ki se kvantificira s plamensko ionizacijskim detektorjem (FID).
Metoda s persulfatom/ultravijoličnim obsevanjem se običajno uporablja za analizo ‚čiste‘ vode z nizko vsebnostjo delcev. Zadnji metodi se lahko uporabljata za večino vzorcev vode, pri čemer je metoda s persulfatom/zvišano temperaturo najprimernejša za vzorce nizke stopnje, sežigalna tehnika pa za vzorce z vsebnostjo nehlapnega organskega ogljika (NVOC) veliko nad 1 mg C/l.
Motnje
Vse tri metode so odvisne od izločevanja ali izravnave anorganskega ogljika, ki je prisoten v vzorcu. Najpogosteje uporabljena metoda za izločevanje anorganskega ogljika je spiranje CO2 iz zakisanega vzorca, čeprav se s tem izgubijo tudi hlapne organske spojine (1). Za vsako matriko vzorčenja je treba zagotoviti popolno izločitev ali izravnavo anorganskega ogljika, glede na vrsto vzorca pa je treba poleg nehlapnega organskega ogljika določiti hlapni organski ogljik (VOC).
Visoke koncentracije klorida so razlog za manjšo učinkovitost oksidacije z uporabo metode s persulfatom/ultravijoličnim obsevanjem (2). Vendar se lahko ta motnja prepreči z uporabo oksidacijskega reagenta, spremenjenega z dodajanjem živosrebrovega (II) nitrata. Priporoča se, da se za oceno posamezne vrste vzorca, ki vsebuje klorid, uporabi največja dovoljena prostornina vzorca. Visoke koncentracije soli v vzorcu, analiziranem z metodo sežiganja, lahko povzročijo prekritje katalizatorja s soljo in čezmerno korozijo sežigalne cevi. V skladu z navodili proizvajalca je treba izvajati varnostne ukrepe.
Zelo motni vzorci in vzorci, ki vsebujejo delce, pri uporabi metode s persulfatom/ultravijoličnim obsedanjem morda ne bodo popolnoma oksidirali.
Primer ustrezne metode
Nehlapen organski ogljik se določi z oksidacijo s persulfatom/ultravijoličnim obsevanjem in nato kvantifikacijo sproščenega CO2, pri čemer se uporabi nedisperzivna infrardeča spektrometrija.
Oksidacijski reagent se prilagodi v skladu s predlogi iz (2), kot je opisano v navodilih proizvajalca:
|
(a)
|
8,2 g HgCl2 in 9 6 g Hg(NO3)2 · H2O se raztopi v več sto mililitrih vode z reagentom z nizko koncentracijo ogljika;
|
|
(b)
|
20 g K2S2O8 se raztopi v raztopini živosrebrove soli;
|
|
(c)
|
zmesi se doda 5 ml HNO3 (koncentracija);
|
|
(d)
|
reagent se razredči na 1 000 ml.
|
Motnja, ki jo povzroči klorid, se prepreči s 40 μl vzorca za 10-odstotni klorid in 200 μl vzorca za 1,9-odstotni klorid. Vzorci visokih koncentracij klorida in/ali večje prostornine vzorcev se lahko analizirajo v skladu s to metodo, če se prepreči kopičenje klorida v oksidacijski posodi. Če je ustrezno, se nato lahko za zadevno vrsto vzorca določi hlapen organski ogljik.
LITERATURA
|
(1)
|
ISO, Kakovost vode – Navodila za določanje skupnega organskega ogljika (TOC). Osnutek mednarodnega standarda ISO/DIS 8245, 16. januar, 1986.
|
|
(2)
|
American Public Health Association, Standard Methods for the Estimation of Water and Wastewater. American Water Works Association & Water Pollution Control Federation, 16. izdaja, 1985.
Tudi aktualno (vsebuje opis sistema avtoanalize):
|
|
(3)
|
Schreurs, W. (1978). An automated colorimetric method for the determination of dissolved organic carbon in seawater by UV destruction. Hydrobiological Bulletin 12, 137–142.
|
Dodatek 2
Biološka razgradnja v morski vodi
METODA STRESANJA BUČKE
PODATKOVNI LIST
|
2.
|
DATUM ZAČETKA PRESKUSA:
|
|
3.
|
PRESKUSNA SNOV:
Naziv:
|
Koncentracija založne raztopine:
|
mg/l kot snov
|
|
Začetna koncentracija v mediju, to:
|
mg/l kot snov
|
|
:
|
mg DOC/l
|
|
|
4.
|
MORSKA VODA:
Vir:
Datum odvzema:
Globina odvzema:
Videz ob odvzemu (npr. moten itd.):
|
Slanost ob odvzemu:
|
‰
|
|
Temperatura ob odvzemu:
|
°C
|
|
DOC ‚x‘ ur po odvzemu:
|
mg/l
|
Tretiranje pred preskusom (npr. filtriranje, sedimentacija, staranje itd.):
|
Število mikrobnih kolonij
|
|
kolonije/ml
|
|
|
|
kolonije/ml
|
|
Druge značilnosti:
|
|
|
|
|
5.
|
DOLOČITVE OGLJIKA:
Analizator ogljika:
|
|
Št. bučke
|
|
DOC po n dneh (mg/l)
|
|
0
|
n1
|
n2
|
n3
|
nx
|
|
Preskus: morska voda s preskusno snovjo, okrepljena s hranilnimi snovmi
|
1
|
a1
|
|
|
|
|
|
|
a2
|
|
|
|
|
|
|
sredina, Ca(t)
|
|
|
|
|
|
|
2
|
b1
|
|
|
|
|
|
|
b2
|
|
|
|
|
|
|
sredina, Cb(t)
|
|
|
|
|
|
|
Slepi vzorec: morska voda brez preskusne snovi, okrepljena s hranilnimi snovmi
|
1
|
c1
|
|
|
|
|
|
|
c2
|
|
|
|
|
|
|
sredina, Cc(t)
|
|
|
|
|
|
|
2
|
d1
|
|
|
|
|
|
|
d2
|
|
|
|
|
|
|
sredina, Cd(t)
|
|
|
|
|
|
| sredina,
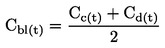
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6.
|
VREDNOTENJE NEOBDELANIH PODATKOV:
|
Št. bučke
|
Izračun rezultatov
|
% razgradnje po n dneh
|
|
0
|
n1
|
n2
|
n3
|
nx
|
|
1
|
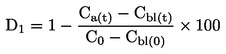
|
0
|
|
|
|
|
|
2
|

|
0
|
|
|
|
|
|
Sredina (34)
|

|
0
|
|
|
|
|
|
Opomba:
|
Podobne oblike se lahko uporabijo, če razgradnji sledi specifična analiza ter za referenčne snovi in kontrole strupenosti.
|
|
|
7.
|
ABIOTSKA RAZGRADNJA (neobvezno)
|
|
Čas (dni)
|
|
0
|
t
|
|
Koncentracija DOC (mg/l) v sterilnih kontrolah
|
Cs(o)
|
Cs(t)
|
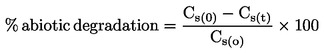
|
Dodatek 3
Izračun teoretične biokemijske potrebe po kisiku
METODA Z ZAPRTO STEKLENICO
Teoretična biokemijska potreba po kisiku snovi CcHhClclNnNanaOoPpSs molekulske mase MW se izračuna glede na:

Ta izračun pomeni, da se C mineralizira v CO2, H v H2O, P v P2O5 in Na v Na2O. Halogen se izloči kot vodikov halid in dušik kot amoniak.
Primer:
glukoza C6H12O6, MW = 180
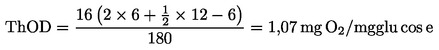
Molekulske mase soli, razen soli alkalnih kovin, se izračunajo ob predpostavki, da so bile soli hidrolizirane.
Predpostavlja se, da je žveplo oksidiralo na stopnjo + 6.
Primer:
natrijev n-dodecilbenzensulfonatC18H29SO3Na, MW = 348

V primeru snovi, ki vsebujejo dušik, se lahko dušik izloči kot amoniak, nitrit ali nitrat, ki ustreza različnim teoretičnim potrebam po kisiku.

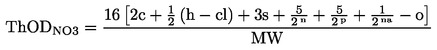
Če je bila v primeru sekundarnega amina z analizo opažena popolna tvorba nitrata:
(C12H25)2 NH, MW = 353

Dodatek 4

Dodatek 5
Biološka razgradnja v morski vodi
METODA Z ZAPRTO STEKLENICO
PODATKOVNI LIST
|
2.
|
DATUM ZAČETKA PRESKUSA:
|
|
3.
|
PRESKUSNA SNOV:
Naziv:
|
Koncentracija založne raztopine:
|
mg/l
|
|
Začetna koncentracija v mediju morske vode:
|
mg/l
|
|
TPK ali KPK:
|
mg O2/mg preskusne snovi
|
|
|
4.
|
MORSKA VODA:
Vir:
Datum odvzema:
Globina odvzema:
Videz ob odvzemu (npr. moten itd.):
|
Slanost ob odvzemu:
|
‰
|
|
Temperatura ob odvzemu:
|
°C
|
|
DOC ‚x‘ ur po odvzemu:
|
mg/l
|
Tretiranje pred preskušanjem (npr. filtriranje, sedimentacija, staranje itd.):
|
Število mikrobnih kolonij
|
|
kolonije/ml
|
|
|
|
kolonije/ml
|
|
Druge značilnosti:
|
|
|
|
|
5.
|
PRESKUSNI MEDIJ:
|
Temperatura po prezračevanju:
|
°C
|
|
Koncentracija O2 po prezračevanju in stanje pred začetkom preskusa:
|
mg O2/l
|
|
|
6.
|
DOLOČANJE RAZTOPLJENEGA KISIKA:
Metoda: Winkler/elektroda
|
|
Št. bučke
|
|
mg O2/l po n dneh
|
|
0
|
5
|
15
|
28
|
|
Preskus: morska voda, okrepljena s hranilnimi snovmi, s preskusno snovjo
|
1
|
a1
|
|
|
|
|
|
2
|
a2
|
|
|
|
|
|
sredina preskusnega vzorca
|
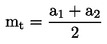
|
|
|
|
|
|
Slepi vzorec: morska voda, okrepljena s hranilnimi snovmi, brez preskusne snovi
|
1
|
c1
|
|
|
|
|
|
2
|
c2
|
|
|
|
|
|
sredina slepega vzorca
|

|
|
|
|
|
Opomba: za referenčno snov in kontrolo strupenosti se lahko uporabi podobna oblika.
|
|
7.
|
PORABA RAZTOPLJENEGA KISIKA: % RAZGRADNJE (% D):
|
|
Razgradnja DO po n dneh
|
|
5
|
15
|
28
|
|
(mb
– mt
) (35)
|
|
|
|
|

|
|
|
|
|
C.43 ANAEROBNA BIOLOŠKA RAZGRADLJIVOST ORGANSKIH SNOVI V PREGNITEM BLATU: Z MERJENJEM NASTAJANJA PLINA
UVOD
|
1.
|
Ta preskusna metoda ustreza Smernici za preskušanje OECD (TG) 311 (2006). Obstajajo številni presejalni preskusi za ocenjevanje aerobne biološke razgradljivosti organskih snovi (preskusne metode C.4, C.9, C.10 in C.11 (1) ter OECD TG 302C (2)), rezultati njihove uporabe pa so se uspešno uporabljali za napovedovanje končnega stanja snovi v aerobnem okolju, zlasti v aerobnih fazah čiščenja odpadne vode. Aerobno se obravnavajo tudi različni deli snovi, ki niso topne v vodi, ter snovi, ki se adsorbirajo na trdne delce odplak, ker so prisotni v usedenih odplakah. Vendar se večji kosi teh snovi vežejo na primarno usedene odplake, ki se ločijo od neobdelanih odplak v usedalniku, preden se usedene odplake ali odplake, zbrane na površju, aerobno očistijo. Odplake, ki v intersticijski vodi vsebujejo nekatere topne snovi, se nato prenesejo v ogrevana gnilišča za anaerobno čiščenje. Ker v tem sklopu še ni preskusov za ocenjevanje anaerobne biološke razgradljivosti v anaerobnih gniliščih in je ta preskus namenjen zapolnitvi te vrzeli, morda ni uporaben za druge anoksične ekosisteme.
|
|
2.
|
Respirometrične tehnike za merjenje količin nastalega plina, zlasti metana (CH4) in ogljikovega dioksida (CO2), v anaerobnih pogojih, so se uspešno uporabljale za ocenjevanje anaerobne biološke razgradljivosti. Birch idr. (3) so pregledali te postopke in sklenili, da je delo Sheltona in Tiedjea (4), ki temelji na zgodnjih študijah (5) (6) (7), najpodrobnejše. Metoda (4), ki so jo naprej razvili drugi (8) in je postala ameriški standard (9) (10), ni rešila težav v zvezi z različno topnostjo CO2 in CH4 v preskusnem mediju ter izračunom teoretičnega nastanka plina preskusne snovi. V poročilu ECETOC (3) je bila priporočena dodatna meritev vsebnosti raztopljenega anorganskega ogljika (DIC) v supernatantu, zaradi česar je tehnika postala širše uporabna. Metoda ECETOC je bila mednarodno kalibrirana (oz. krožno preskušena) in je postala standard ISO 11734 (11).
|
|
3.
|
Ta preskusna metoda, ki temelji na ISO 11734 (11), opisuje presejalno metodo za vrednotenje možne anaerobne biološke razgradljivosti organskih snovi v specifičnih pogojih (tj. v anaerobnem gnilišču v danem času in razponu koncentracije mikroorganizmov). Ker se razredčeno blato uporablja z razmeroma visoko koncentracijo preskusne snovi in preskus običajno traja dlje od retencijskega časa v anaerobnih gniliščih, preskusni pogoji morda niti ne ustrezajo pogojem v anaerobnih gniliščih niti niso uporabni za ocenjevanje anaerobne biološke razgradljivosti organskih snovi v različnih okoljskih pogojih. Blato je preskusni snovi izpostavljeno največ 60 dni, kar je dlje od običajnega retencijskega časa blata (25 do 30 dni) v anaerobnih gniliščih, čeprav so lahko retencijski časi na industrijskih lokacijah veliko daljši. Predvidevanja na podlagi rezultatov tega preskusa niso tako prepričljiva kot predvidevanja v primeru aerobne biološke razgradnje, ker so dokazi, pridobljeni o obnašanju preskusne snovi pri ‚lahkih‘ aerobnih preskusih in simulacijskih preskusih ter v aerobnem okolju, dovolj prepričljivi, da obstaja povezava; za anaerobno okolje obstaja malo podobnih dokazov. Pojav popolne anaerobne biološke razgradnje se lahko predvidi, če se doseže 75–80 % teoretičnega nastanka plina. Velika razmerja snovi glede na biomaso, uporabljena v teh preskusih, pomenijo, da se bo snov, ki prehaja, verjetneje razgradila v anaerobnem gnilišču. Poleg tega se snovi, ki se v preskusu ne spremenijo v plin, morda ne bodo ohranile v okoljsko bolj realnih razmerjih med snovjo in biomaso. Pojavljajo se tudi druge anaerobne reakcije, s katerimi se lahko snovi vsaj delno razgradijo, npr. z dekloriranjem, vendar ta preskus ne zazna takih reakcij. Izginjanje preskusne snovi pa se lahko spremlja z uporabo specifičnih analitskih metod za njeno določanje (glej odstavke 6, 30, 44 in 53).
|
NAČELO PRESKUSA
|
4.
|
Sprano pregnito blato (36), ki vsebuje nizke (< 10 mg/l) koncentracije anorganskega ogljika, se približno desetkrat razredči, da je koncentracija vseh snovi v trdnem stanju od 1 g/l do 3 g/l, in približno 60 dni inkubira pri 35 °C ± 2 °C v zatesnjenih posodah s preskusno snovjo pri 20 do 100 mg C/l. Aktivnost blata se meri z vzporedno slepo kontrolo z inokulumom blata v mediju in brez preskusne snovi.
|
|
5.
|
Izmeri se naraščanje tlaka v prostoru v zaprti posodi nad fazno mejo plin-kapljevina zaradi nastajanja ogljikovega dioksida in metana. Večina nastalega CO2 se bo v preskusnih pogojih raztopila v tekoči fazi ali spremenila v karbonat ali vodikov karbonat. Ta anorganski ogljik se izmeri na koncu preskusa.
|
|
6.
|
Količina ogljika (anorganskega in metana), ki nastane zaradi biološke razgradnje preskusne snovi, se izračuna iz neto nastalega plina in neto tvorbe anorganskega ogljika v tekoči fazi nad vrednostmi slepe kontrole. Obseg biološke razgradnje se izračuna iz skupnega anorganskega ogljika in nastalega metana-C kot odstotek izmerjene ali izračunane količine ogljika, dodanega preskusni snovi. Potek biološke razgradnje se lahko sledi zgolj z vmesnimi meritvami nastajanja plina. Primarna biološka razgradnja se lahko določi še s specifično analizo na začetku in koncu preskusa.
|
INFORMACIJE O PRESKUSNI SNOVI
|
7.
|
Za pravilno razlago rezultatov morajo biti znani čistost, vodotopnost, hlapnost in adsorpcijske lastnosti preskusne snovi. Vsebnost organskega ogljika ( % m/m) preskusne snovi je treba določiti na podlagi njene kemijske strukture ali z meritvami. Pri hlapnih preskusnih snoveh k odločitvi o uporabnosti preskusa prispeva izmerjena ali izračunana Henryjeva konstanta. Informacije o strupenosti preskusne snovi za anaerobne bakterije so koristne pri izbiri ustrezne preskusne koncentracije in pri razlagi rezultatov, ki kažejo slabo biološko razgradljivost. Priporoča se vključitev nadzora zaviranja, razen če je znano, da preskusna snov ne zavira anaerobnih mikrobnih dejavnosti (glej odstavek 21 in ISO 13641-1 (12)).
|
UPORABNOST PRESKUSNE METODE
|
8.
|
Preskusna metoda se lahko uporablja za vodotopne snovi; uporabi se lahko tudi za slabo topne in netopne snovi, če se uporabi metoda natančnega odmerjanja, npr. glej ISO 10634 (13). Na splošno je pri hlapnih snoveh potrebno odločanje na podlagi posameznega primera. Morda bo potrebno sprejeti posebne ukrepe, na primer zadrževanje plina med preskusom.
|
REFERENČNE SNOVI
|
9.
|
Da se postopek preveri, se referenčna snov preskusi z določitvijo vzporednih ustreznih posod kot del običajnega poteka preskusa. Primeri so fenol, natrijev benzoat in polietilen glikol 400, pri čemer se pričakuje, da se bo v 60 dneh teoretični nastanek plina zmanjšal za več kot 60 % (npr. metan in anorganski ogljik) (3) (14).
|
OBNOVLJIVOST REZULTATOV PRESKUSA
|
10.
|
Mednarodni krožni preskus (14) je dosegel dobro obnovljivost meritev tlaka plina med tremi posodami. Relativni standardni odklon (koeficient variacije, COV) je bil večinoma nižji od 20 %, čeprav se je ta vrednost ob prisotnosti strupenih snovi ali prosti koncu 60-dnevnega inkubacijskega obdobja pogosto povečala na > 20 %. Večji odkloni so bili ugotovljeni tudi v posodah s prostornino < 150 ml. Končne vrednosti pH preskusnega medija so bile v razponu 6,5–7,0.
|
|
11.
|
S krožnim preskusom so bili pridobljeni naslednji rezultati.
|
Preskusna snov
|
Skupni podatki
n1
|
Srednja razgradnja
(skupni podatki)
(%)
|
Relativni standardni odklon
(skupnih podatkov)
(%)
|
Veljavni podatki
n2
|
Srednja razgradnja
(veljavni podatki)
(%)
|
Relativni standardni odklon
(veljavni podatki)
(%)
|
Podatki > 60 % razgradnja pri veljavnih preskusih
n3
|
|
Palmitinska kislina
|
36
|
68,7 ± 30,7
|
45
|
27
|
72,2 ± 18,8
|
26
|
19 = 70 % (37)
|
|
Polietilen Glikol 400
|
38
|
79,8 ± 28,0
|
35
|
29
|
77,7 ± 17,8
|
23
|
24 = 83 % (37)
|
|
|
12.
|
Koeficienti variacije sredine vseh vrednosti, pridobljenih s palmitinsko kislino in polietilen glikolom 400, so bili 45 % (n = 36) oziroma 35 % (n = 38). Ko so se vrednosti < 40 % in > 100 % izpustile (prve domnevno zaradi neoptimalnih pogojev, druge iz neznanih razlogov), so se koeficienti variacije zmanjšali na 26 % oziroma 23 %. Deleža ‚veljavnih‘ vrednosti, ki so zagotovile vsaj 60 odstotno razgradnjo, sta bila 70 % za palmitinsko kislino in 83 % za polietilen glikol 400. Deleži odstotka biološke razgradnje, izpeljani iz meritev raztopljenega anorganskega ogljika, so bili razmeroma majhni, vendar različni. Za palmitinsko kislino sta bila razpon 0–35 % in sredina 12 % s koeficientom variacije 92 %, za polietilen glikol 400 pa razpon 0–40 % in sredina 24 % s koeficientom variacije 54 %.
|
OPIS PRESKUSNE METODE
Oprema
|
13.
|
Potrebna je običajna laboratorijska oprema in naslednje:
|
a.
|
inkubator – zaščiten pred iskrami in z vzdrževano temperaturo 35 °C ± 2 °C,
|
|
b.
|
steklene preskusne posode, odporne proti tlaku, ustrezne nominalne velikosti (38), opremljene s plinotesnimi septumi, ki lahko vzdržijo približno 2 bara. Prostornina prostora v zaprti posodi nad fazno mejo plin-kapljevina mora biti približno od 10 % do 30 % celotne prostornine. Če se bioplin redno sprošča, je ustrezna približno 10-odstotna prostornina prostora v zaprti posodi nad fazno mejo plin-kapljevina, če pa se plin sprošča samo na koncu preskusa, je ustrezna 30-odstotna prostornina. Če se tlak sprošča ob vsakem vzorčenju, se priporočajo steklene serumske steklenice z nominalno prostornino 125 ml, skupno prostornino približno 160 ml, zatesnjene s serumskimi septumi (39) in aluminijastimi zapornimi obročki,
|
|
c.
|
naprava za merjenje tlaka (40), prilagojena tako, da omogoča meritve in izpuščanje nastalega plina, na primer natančni ročni merilnik tlaka, povezan s primerno injekcijsko iglo; trojni plinotesni petelinček olajša sproščanje prevelikega tlaka (Dodatek 1). Notranjo prostornino cevi in ventila pretvornika tlaka je treba ohranjati čim manjšo, da so napake zaradi zanemarjanja prostornine opreme neznatne,
Opomba: meritve tlaka se uporabijo neposredno za izračun količine ogljika, nastalega v prostoru v zaprti posodi nad fazno mejo plin-kapljevina (odstavki 42 do 44). Odčitki tlaka se lahko z grafom za pretvorbo pretvorijo tudi v prostornine (pri 35 °C in atmosferskem tlaku) nastalega plina. Ta graf sestavljajo podatki, ki se pridobijo z injiciranjem znanih prostornin dušikovega plina v niz preskusnih posod (npr. serumskih steklenic) pri 35 °C ± 2 °C in beleženjem posledičnih odčitkov stabiliziranega tlaka (glej Dodatek 2). Izračun je prikazan v opombi pri odstavku 44.
Opozorilo: pri uporabi mikrobrizg je treba paziti, da ne pride do poškodb z iglami.
|
|
d.
|
analizator ogljika, primeren za neposredno določitev anorganskega ogljika v razponu od 1 mg/l do 200 mg/l,
|
|
e.
|
zelo natančne brizge za plinaste in tekoče vzorce,
|
|
f.
|
magnetna mešala in sledilniki (neobvezno),
|
|
g.
|
komora, v katero posegamo z rokavicami (priporočeno).
|
|
Reagenti
|
14.
|
Ves čas se uporabljajo analitsko čisti reagenti.
|
Voda
|
15.
|
Destilirana ali deionizirana voda (deoksigenirana s prezračevanjem z dušikovim plinom, ki vsebuje manj kot 5 μl/l kisika), ki vsebuje manj kot 2 mg/l raztopljenega organskega ogljika (DOC).
|
Preskusni medij
|
16.
|
Medij za redčenje se pripravi tako, da vsebuje naslednje sestavine v navedenih količinah:
|
Brezvodni kalijev dihidrogen fosfat (KH2PO4)
|
0,27 g
|
|
Dinatrijev hidrogen fosfat dodekahidrat (Na2HPO4 · 12H2O))
|
1,12 g
|
|
Amonijev klorid (NH4Cl)
|
0,53 g
|
|
Kalcijev klorid dihidrat (CaCl2 · 2H2O)
|
0,075 g
|
|
Magnezijev klorid heksahidrat (MgCl2 · 6H2O)
|
0,10 g
|
|
Železov (II) klorid tetrahidrat (FeCl2 · 4H2O)
|
0,02 g
|
|
Resazurin (kazalnik kisika)
|
0,001 g
|
|
Natrijev sulfid nonahidrat (Na2S · 9H2O)
|
0,10 g
|
|
Založna raztopina elementov v sledovih (neobvezno, odstavek 18)
|
10 ml
|
|
Doda se deoksigenirana voda (odstavek 15)
|
do 1 litra
|
Opomba: uporabiti je treba svež natrijev sulfid ali pa ga je treba pred uporabo sprati in posušiti, da se zagotovi zadostna sposobnost redukcije. Preskus bi se lahko izvedel brez uporabe komore, v katero posegamo z rokavicami (glej odstavek 26). V tem primeru je treba končno koncentracijo natrijevega sulfida v mediju povečati na 0,20 g Na2S · 9H2O na liter. Natrijev sulfid se lahko doda tudi iz primerne anaerobne založne raztopine prek septuma zaprtih preskusnih posod, saj se s tem postopkom zmanjša tveganje oksidacije. Natrijev sulfid se lahko zamenja s titanovim (III) citratom, ki se doda skozi septum zaprtih preskusnih posod pri končni koncentraciji 0,8 do 1,0 mmol/l. Titanov (III) citrat je zelo učinkovit reducent nizke strupenosti, ki se pripravi, kot sledi: v 50 ml deoksigenirane vode se raztopi 2,94 g trinatrijevega citrata dihidrata (da dobimo raztopino 200 mmol/l) in doda 5 ml 15-odstotne (m/v) raztopine titanovega (III) klorida). Z mineralno alkalijo se nevtralizira do pH 7 ± 0,2 in odmeri v ustrezno posodo pod tokom dušika. Koncentracija titanovega (III) citrata v tej založni raztopini je 164 mmol/l.
|
|
17.
|
Sestavine preskusnega medija, razen reducenta (natrijev sulfid titanov citrat), se premešajo, raztopina pa neposredno pred uporabo približno 20 minut prezračuje z dušikovim plinom, da se odstrani kisik. Nato se neposredno pred uporabo medija doda primerna prostornina sveže pripravljene raztopine reducenta (pripravljene v deoksigenirani vodi). Po potrebi se pH medija prilagodi z razredčeno mineralno kislino ali bazo na pH 7 ± 0,2.
|
Založna raztopina elementov v sledovih
|
18.
|
Da se izboljšajo procesi anaerobne razgradnje, zlasti če se uporabljajo nizke koncentracije (npr. 1 g/l) inokuluma, se priporoča, da preskusni medij vsebuje naslednje elemente v sledovih (11).
|
Manganov klorid tetrahidrat (MnCl2 · 4H2O)
|
50 mg
|
|
Borova kislina (H3BO3)
|
5 mg
|
|
Cinkov klorid (ZnCl2)
|
5 mg
|
|
Bakrov (II) klorid (CuCl2)
|
3 mg
|
|
Dinatrijev molibdat dihidrat (Na2MoO4 · 2H2O)
|
1 mg
|
|
Kobaltov klorid heksahidrat (CoCl2 · 6H2O)
|
100 mg
|
|
Nikljev klorid heksahidrat (NiCl2 · 6H2O)
|
10 mg
|
|
Dinatrijev selenit (Na2SeO3)
|
5 mg
|
|
Doda se deoksigenirana voda (odstavek 15)
|
do 1 litra
|
|
Preskusna snov
|
19.
|
Preskusna snov se doda kot založna raztopina, suspenzija, emulzija ali neposredno kot trdna snov ali tekočina ali kot absorbirana na filter iz steklenih vlaken, da se dobi koncentracija največ 100 mg/l organskega ogljika. Če se uporabijo založne raztopine, se pripravi primerna raztopina z vodo (odstavek 15) (predhodno deoksigenirana s prezračevanjem z dušikovim plinom) take moči, da je dodana prostornina manj kot 5 % skupne prostornine reakcijske zmesi. Po potrebi se pH založne raztopine prilagodi na pH 7 ± 0,2. Za preskusne snovi, ki v vodi niso dovolj topne, glej ISO 10634 (13). V primeru uporabe topila se pripravi dodatna kontrola, pri čemer se topilo doda le v inokulirani medij. Izogibati se je treba organskim topilom, za katera je znano, da zavirajo nastajanje metana, kot sta kloroform in ogljikov tetraklorid.
Opozorilo: s strupenimi preskusnimi snovmi in snovmi, katerih lastnosti niso znane, je treba ravnati previdno.
|
Referenčne snovi
|
20.
|
Referenčne snovi, kot so natrijev benzoat, fenol in polietilen glikol 400, so se uspešno uporabljale za preverjanje postopka, pri čemer so se v 60 dneh več kot 60-odstotno razgradile. Založna raztopina (v deoksigenirani vodi) izbrane referenčne snovi se pripravi enako kot za preskusno snov, njen pH pa se po potrebi uravna na 7 ± 0,2.
|
Kontrola zaviranja (pogojno)
|
21.
|
Za pridobivanje informacij o strupenosti preskusne snovi za anaerobne mikroorganizme, da se ugotovi najprimernejša preskusna koncentracija, se preskusna snov in referenčna snov vneseta v posodo s preskusnim medijem (glej odstavek 16), in sicer vsaka v enaki koncentraciji, kot je bila dodana (glej odstavka 19 in 20 ter ISO 13641-1 (12)).
|
Pregnito blato
|
22.
|
Pregnito blato se odvzame iz gnilišča v čistilni napravi odpadnih vod, ki čisti predvsem gospodinjske odplake. Opisati je treba vse značilnosti blata in sporočiti informacije o njegovem ozadju (glej odstavek 54). Če naj bi se uporabil prilagojeni inokulum, se lahko prouči uporaba pregnitega blata iz industrijske čistilne naprave. Za odvzem pregnitega blata se uporabijo plastenke s širokim grlom iz polietilena visoke gostote ali podobnega materiala, ki se lahko razširi. Plastenke se napolnijo z blatom do 1 cm pod vrhom in zatesnijo, po možnosti z varnostnim ventilom. Odvzeto blato se lahko po prevozu v laboratorij uporabi neposredno ali pa se postavi v laboratorijsko gnilišče. Odvečni bioplin se sprosti s previdnim odpiranjem plastenk z blatom. Kot vir inokuluma se lahko uporabi tudi laboratorijsko pridelano anaerobno blato, vendar je lahko njegov razpon delovanja zmanjšan.
Opozorilo: pregnito blato proizvaja vnetljive pline, ki predstavljajo tveganje požara ali eksplozije; vsebuje tudi potencialno patogene organizme, zato je treba pri ravnanju z njim upoštevati ustrezne varnostne ukrepe. Iz varnostnih razlogov se za odvzem blata ne uporabljajo steklene posode.
|
|
23.
|
Da se zmanjšata nastajanje plina v ozadju in vpliv slepih kontrol, se lahko prouči predhodno gnitje blata. Če je predhodno gnitje potrebno, se mora blatu omogočiti gnitje brez dodajanja hranilnih snovi ali substratov pri 35 °C ± 2 °C do 7 dni. Ugotovljeno je bilo, da se s približno petdnevnim predhodnim gnitjem običajno optimalno zmanjša nastajanje plina v slepih vzorcih, ne da bi se nesprejemljivo povečala lag faza ali inkubacijsko obdobje v preskusni fazi ali ne da bi prišlo do nedejavnosti majhnega števila preskušanih snovi.
|
|
24.
|
Za preskusne snovi, ki so slabo biološko razgradljive ali so domnevno slabo biološko razgradljive, se prouči predhodna izpostavljenost blata preskusni snovi, da se pridobi inokulum, ki je bolje prilagojen. V takem primeru se preskusna snov doda pregnitemu blatu v koncentraciji organskega ogljika, ki je od 5 mg/l do 20 mg/l, in inkubira največ dva tedna. Predhodno izpostavljena snov se pred uporabo previdno spere (glej odstavek 25), v poročilu o preskusu pa se navedejo pogoji predhodne izpostavljenosti.
|
Inokulum
|
25.
|
Blato se spere (glej odstavke 22 do 24) neposredno pred uporabo, da se koncentracija anorganskega ogljika v končni preskusni suspenziji zmanjša na manj kot 10 mg/l. Blato se centrifugira v zatesnjenih centrifugirnih epruvetah (npr. 3 000 g 5 minut) in izpusti supernatant. Dobljeni peleti se suspendirajo v deoksigeniranem mediju (odstavka 16 in 17), suspenzija se ponovno centrifugira, supernatant pa se izpusti. Če se količina anorganskega ogljika ni dovolj zmanjšala, se lahko postopek spiranja blata ponovi največ dvakrat. To naj ne bi škodljivo vplivalo na mikroorganizme. Na koncu se pelet suspendira v potrebni prostornini preskusnega medija in določi koncentracija vseh snovi v trdnem stanju [npr. ISO 11923 (15)]. Končna koncentracija vseh snovi v trdnem stanju v preskusnih posodah mora biti v razponu od 1 g/l do 3 g/l (ali približno 10 % koncentracije v nerazredčenem pregnitem blatu). Zgornji postopki se izvedejo tako, da je blato v čim manjšem stiku s kisikom (uporabi se na primer dušikova atmosfera).
|
PRESKUSNI POSTOPEK
|
26.
|
Naslednji začetni postopki se izvedejo s tehnikami, ki vzdržujejo čim manjši stik med pregnitim blatom in kisikom, npr. morda bo potrebno delo v komori, v katero posegamo z rokavicami, v dušikovi atmosferi in/ali s spiranjem plastenk z dušikom (4).
|
Priprava preskusa s preskusnim vzorcem in kontrolo
|
27.
|
Pripravijo se vsaj tri preskusne posode (glej odstavek 13-b) za preskusno snov, slepe kontrole, referenčne snovi, kontrole zaviranja (pogojno) in komore za kontrolo tlaka (neobvezen postopek) (glej odstavke 7 in 19–21). Pripravijo se lahko tudi dodatne posode za ocenjevanje primarne biološke razgradnje s specifičnimi analizami preskusne snovi. Isti niz slepih kontrol se lahko uporabi za več preskusnih snovi v istem preskusu, če so prostornine prostora v zaprti posodi nad fazno mejo plin-kapljevina skladne.
|
|
28.
|
Razredčeni inokulum se pred vnosom v posode pripravi npr. s široko pipeto. Alikvoti dobro premešanega inokuluma (odstavek 25) se dodajo tako, da je koncentracija vseh snovi v trdnem stanju enaka v vseh posodah (med 1 g/l in 3 g/l). Po potrebi se založne raztopine preskusne in referenčne snovi dodajo po uravnavanju pH na 7 ± 0,2. Preskusno snov in referenčno snov je treba dodati na najprimernejši način (odstavek 19).
|
|
29.
|
Preskusna koncentracija organskega ogljika mora biti običajno med 20 in 100 mg/l (odstavek 4). Če je preskusna snov strupena, je treba preskusno koncentracijo zmanjšati na 20 mg C/l ali celo manj, če je treba izmeriti le primarno biološko razgradnjo s specifičnimi analizami. Opozoriti je treba, da se variabilnost rezultatov preskusa poveča pri nižjih preskusnih koncentracijah.
|
|
30.
|
V posode s slepimi vzorci se doda enaka količina nosilca, kot se uporabi za odmerjanje preskusne snovi, namesto založne raztopine, suspenzije ali emulzije. Če je bila preskusna snov dodana s filtri iz steklenih vlaken ali organskimi topili, se v slepe vzorce doda filter ali toliko topila, kot ga je izhlapelo. Za merjene vrednosti pH se pripravi dodatna ponovitev s preskusno snovjo. Po potrebi se pH uravna na 7 ± 0,2 z majhnimi količinami razredčene mineralne kisline ali baze. V vse preskusne posode je treba dodati enake količine nevtralizacijskega sredstva. Sredstva ni treba dodati, če je bila vrednost pH založnih raztopin preskusne snovi in referenčne snovi že prilagojena (glej odstavka 19 in 20). Če je treba izmeriti primarno biološko razgradnjo, je treba iz posode za kontrolo pH ali iz dodatne preskusne posode odvzeti primeren vzorec, koncentracijo preskusne snovi pa je treba izmeriti s specifičnimi analizami. Če je treba reakcijske zmesi premešati, se lahko v posode dodajo prekriti magneti.
|
|
31.
|
Zagotoviti je treba, da sta skupna prostornina tekočine V1 in prostornina prostora v zaprti posodi nad fazno mejo plin-kapljevina Vh enaki v vseh posodah. Vrednosti V1 in Vh se zabeležita. Vse posode je treba zatesniti s plinskim septumom in jih iz komore, v katero posegamo z rokavicami (glej odstavek 26), prenesti v inkubator (glej odstavek 13-a).
|
Netopne preskusne snovi
|
32.
|
Stehtane količine snovi, ki so slabo topne v vodi, se dodajo neposredno v pripravljene posode. Če je uporaba topila potrebna (glej odstavek 19), se raztopina preskusne snovi ali suspenzije prenese v prazno posodo. Če je mogoče, naj topilo izhlapi s prehajanjem dušikovega plina skozi posode, nato pa se dodajo druge sestavine, tj. razredčeno blato (odstavek 25) in deoksigenirana voda, kot je potrebno. Pripraviti je treba tudi dodatno kontrolo s topilom (glej odstavek 19). Druge metode dodajanja netopnih snovi so opisane v ISO 10634 (13). Tekoče preskusne snovi se lahko z brizgo odmerijo v popolnoma pripravljene zatesnjene posode, če se pričakuje, da začetni pH ne bo presegel 7 ± 1, sicer pa se odmerijo, kot je opisano zgoraj (glej odstavek 19).
|
Inkubacije in meritve tlaka plina
|
33.
|
Pripravljene posode se približno eno uro inkubirajo pri 35 °C ± 2 °C, da se omogoči uravnoteženje in sproščanje odvečnega plina v atmosfero, na primer s stresanjem posamezne posode, vstavitvijo igle merilnika tlaka (odstavek 13-c) skozi tesnilo in odpiranjem ventila, dokler se na merilniku tlaka ne prikaže vrednost nič. Če je v tej fazi ali ob vmesnih meritvah tlak prostora v zaprti posodi nad fazno mejo plin-kapljevina manjši od atmosferskega, je treba z dušikovim plinov ponovno vzpostaviti atmosferski tlak. Ventil se zapre (glej odstavek 13-c), inkubacija pa se nadaljuje v temi, pri čemer se zagotovi, da se vsi deli posode ohranjajo pri temperaturi za gnitje. Posode se po inkubaciji opazujejo od 24 do 48 ur. Če je supernatant v posodah izrazito rožnato obarvan, se zavržejo, tj. če je resazurin (glej odstavek 16) spremenil barvo, kar kaže na prisotnost kisika (glej odstavek 50). Čeprav lahko sistem majhne količine kisika zanemari, lahko višje koncentracije resno zavirajo potek anaerobne biološke razgradnje. Občasna zavrnitev posamezne posode iz niza treh je lahko sprejemljiva, vendar je treba pri večjem številu napak uvesti preiskavo eksperimentalnih postopkov in preskus ponoviti.
|
|
34.
|
Vsebina vseh posod se previdno zmeša z nekajminutnim mešanjem ali stresanjem vsaj dvakrat ali trikrat na teden in neposredno pred vsakim merjenjem tlaka. S stresanjem se inokulum ponovno suspendira, pri čemer se zagotovi plinsko ravnotežje. Vse meritve tlaka je treba izvesti hitro, saj bi se lahko temperatura v preskusnih posodah znižala, kar bi povzročilo napačne meritve. Med merjenjem tlaka je treba v preskusnih posodah, vključno s prostorom v zaprti posodi nad fazno mejo plin-kapljevina, vzdrževati temperaturo za gnitje. Tlak plina se izmeri na primer tako, da se skozi septum vstavi injekcijska igla (odstavek 13-c), priključena na merilnik za spremljanje tlaka. Paziti je treba, da voda ne vstopi v injekcijsko iglo. Če se to zgodi, je treba mokre dele osušiti in namestiti novo iglo. Tlak je treba meriti v milibarih (glej odstavek 42). Tlak plina v posodah se lahko izmeri v rednih časovnih presledkih, na primer vsak teden, odvečni plin pa se lahko sprosti v atmosfero. Namesto tega se lahko tlak izmeri le na koncu preskusa, da se določi količina nastalega bioplina.
|
|
35.
|
Priporoča se, da se izvedejo vmesne meritve tlaka, saj se na podlagi povečanega tlaka določi, kdaj se lahko preskus prekine, pri čemer se lahko upošteva tudi kinetika (glej odstavek 6).
|
|
36.
|
Običajno se preskus konča po 60-dnevnem inkubacijskem obdobju, razen če krivulja biološke razgradnje, dobljena na podlagi meritev tlaka, prej doseže ravnotežje, tj. fazo, v kateri je bila dosežena največja razgradnja, krivulja biološke razgradnje pa se je zravnala. Če je vrednost ravnotežja manj kot 60 %, je razlaga otežena, ker kaže, da se je mineraliziral le del molekule ali da je prišlo do napake. Če ob koncu običajnega inkubacijskega obdobja plin nastaja, vendar ravnotežje očitno ni doseženo, je treba proučiti podaljšanje preskusa, da se preveri, ali bo ravnotežje (> 60 %) doseženo.
|
Merjenje anorganskega ogljika
|
37.
|
Ob koncu preskusa po zadnji meritvi tlaka plina naj se blato usede. Posamezne posode se zaporedno odprejo in iz njih se nemudoma odvzame vzorec za določitev koncentracije (mg/l) anorganskega ogljika v supernatantu. Za supernatant se ne uporabi niti centrifugiranje niti filtriranje, ker bi prišlo do nesprejemljive izgube raztopljenega ogljikovega dioksida. Če supernatanta po vzorčenju ni mogoče analizirati, se za največ 2 dni shrani v zatesnjeni fioli brez prostora v zaprti posodi nad fazno mejo plin-kapljevina in ohlajen na približno 4 °C. Po merjenju anorganskega ogljika se izmeri in zabeleži vrednost pH.
|
|
38.
|
Namesto tega se lahko anorganski ogljik v supernatantu določi posredno s sproščanjem raztopljenega anorganskega ogljika kot ogljikovega dioksida, ki se lahko izmeri v prostoru v zaprti posodi nad fazno mejo plin-kapljevina. Po zadnjem merjenju tlaka plina se tlak v vseh posodah uravna na atmosferski tlak. Vsebina posod se zakisa na približno pH 1, tako da se skozi septum zatesnjenih posod doda koncentrirana mineralna kislina (npr. H2SO4). Pretresene posode se približno 24 ur inkubirajo pri 35 °C ± 2 °C, tlak plina, ki nastane iz sproščenega ogljikovega dioksida, pa se izmeri z merilnikom tlaka.
|
|
39.
|
Podobne meritve se izvedejo za ustrezne slepe vzorce, referenčne snovi in posode za kontrolo zaviranja, če so vključene (glej odstavek 21).
|
|
40.
|
V nekaterih primerih, zlasti če se iste kontrolne posode uporabijo za več preskusnih snovi, je treba proučiti meritve vmesnih koncentracij anorganskega ogljika v preskusnih in kontrolnih posodah, kot je primerno. V tem primeru je treba pripraviti dovolj posod za vse vmesne meritve. Ta postopek ima prednost pred odvzemom vzorcev zgolj iz ene posode. Slednje se lahko izvede le, če se zdi, da potrebna prostornina za analizo raztopljenega anorganskega ogljika ni prevelika. Meritev raztopljenega anorganskega ogljika je treba izvesti po meritvi tlaka plina brez sproščanja odvečnega plina, kot je opisano v nadaljevanju:
|
—
|
skozi septum se brez odpiranja posod z brizgo odvzame čim manjša prostornina vzorcev supernatanta, pri čemer se določi anorganski ogljik v vzorcu,
|
|
—
|
po odvzemu vzorca se odvečni plin sprosti ali ne,
|
|
—
|
upoštevati je treba, da lahko še tako majhno zmanjšanje prostornine supernatanta (npr. približno 1 %) pomeni znatno povečanje prostornine plina v prostoru v zaprti posodi nad fazno mejo plin-kapljevina (Vh),
|
|
—
|
enačbe (glej odstavek 44) se popravijo z vstavitvijo Vh v enačbo 3, kot je potrebno.
|
|
Specifične analize
|
41.
|
Če je treba določiti primarno anaerobno razgradnjo (glej odstavek 30), se iz posod, ki vsebujejo preskusno snov, na začetku in na koncu preskusa odvzame primerna prostornina vzorca za specifične analize. Če se to izvede, je treba pri izračunu rezultatov nastajanja plina upoštevati, da se bosta prostornini prostora v zaprti posodi nad fazno mejo plin-kapljevina (Vh) in tekočine (Vl) spremenili. Namesto tega se lahko vzorci za specifične analize odvzamejo iz dodatnih zmesi, ki so bile predhodno določene za ta namen (odstavek 30).
|
PODATKI IN POROČANJE
Obdelava rezultatov
|
42.
|
Iz praktičnih razlogov se tlak plina meri v milibarih (1 mbar = 1h Pa = 102 Pa, 1 Pa = 1 N/m2), prostornina v litrih in temperatura v stopinjah Celzija.
|
Ogljik v prostoru v zaprti posodi nad fazno mejo plin-kapljevina
|
43.
|
Ker tako 1 mol metana kot 1 mol ogljikovega dioksida vsebuje 12 g ogljika, se lahko masa ogljika v dani prostornini sproščenega plina izrazi kot:
|
m= 12 × 103×n
|
enačba [1],
|
pri čemer je:
|
m
|
=
|
masa ogljika (mg) v dani prostornini sproščenega plina,
|
|
12
|
=
|
relativna atomska masa ogljika,
|
|
n
|
=
|
število molov plina v dani prostornini.
|
Če plin, ki ni metan ali ogljikov dioksid (npr. N2O), nastane v znatnih količinah, je treba enačbo [1] spremeniti, da opisuje možnost učinkov nastalih plinov.
|
|
44.
|
Na podlagi zakona plina se lahko n izrazi kot:
|

|
enačba [2]
|
pri čemer je:
|
p
|
=
|
tlak plina (paskali),
|
|
V
|
=
|
prostornina plina (m3),
|
|
R
|
=
|
plinska konstanta [8 314 J/(mol K)],
|
|
T
|
=
|
inkubacijska temperatura (kelvini).
|
S kombinacijo enačb [1] in [2] ter racionalizacijo za omogočanje nastajanja plina v slepih kontrolah.
|

|
enačba [3]
|
pri čemer je:
|
mh
|
=
|
masa neto ogljika, ki nastane kot plin v prostoru v zaprti posodi nad fazno mejo plin-kapljevina (mg),
|
|
Dp
|
=
|
sredina razlike med začetnim in končnim tlakom v preskusni posodi, od katere se odšteje ustrezna sredina v slepih posodah (milibari),
|
|
Vh
|
=
|
prostornina prostora v zaprti posodi nad fazno mejo plin-kapljevina v posodi (l),
|
|
0,1
|
=
|
pretvorba za newtone/m2 v milibare in m3 v litre.
|
Enačbo [4] je treba uporabiti za normalno inkubacijsko temperaturo, ki je 35 °C (308 K):
|
mh
= 0,468(Δp·Vh
)
|
enačba [4]
|
Opomba: nadomestni izračun prostornine. Odčitki merilnika tlaka se pretvorijo v ml nastalega plina z umeritveno krivuljo, dobljeno z grafičnim prikazom injicirane prostornine (ml) glede na odčitke merilnika (Dodatek 2). Število molov (n) plina v prostoru v zaprti posodi nad fazno mejo plin-kapljevina se izračuna z deljenjem skupne količine nastalega plina (ml) s 25 286 ml/mol, kar je prostornina, ki jo zasede en mol plina pri 35 °C in standardnem atmosferskem tlaku. Ker tako 1 mol CH4 kot 1 mol CO2 vsebuje 12 g ogljika, se količina ogljika (mg) v prostoru v zaprti posodi nad fazno mejo plin-kapljevina (mh
) izračuna z enačbo [5]:
|
mh
= 12 × 103×n
|
enačba [5]
|
Racionalizacija za omogočanje nastajanja plina v slepih kontrolah:
|

|
enačba [6]
|
pri čemer je:
|
mh
|
=
|
masa neto ogljika, ki nastane kot plin v prostoru v zaprti posodi nad fazno mejo plin-kapljevina (mg),
|
|
DV
|
=
|
sredina razlike med prostornino nastalega plina v prostoru v zaprti posodi nad fazno mejo plin-kapljevina v preskusnih posodah in posodah s slepimi kontrolami,
|
|
25 286
|
=
|
prostornina, ki jo zasede 1 mol plina pri 35 °C in 1 atmosferi.
|
|
|
45.
|
Potek biološke razgradnje se lahko sledi z grafičnim prikazom povečanja skupnega tlaka Dp (milibari) v odvisnosti od časa, če je primerno. Na podlagi te krivulje se določi in zabeleži lag faza (dnevi). Lag faza je čas od začetka preskusa do začetka znatne razgradnje (glej na primer Dodatek 3). Če so bili odvzeti in analizirani vmesni vzorci supernatanta (glej odstavke 40, 46 in 47), se lahko namesto kumulativnega tlaka grafično prikaže skupni nastali ogljik (v plinu in tekočini).
|
Ogljik v tekočini
|
46.
|
Količina metana v tekočini se zanemari, ker je znano, da je zelo slabo topen v vodi. Masa anorganskega ogljika v tekočini preskusne posode se izračuna z enačbo [7]:
pri čemer je:
|
ml
|
=
|
masa anorganskega ogljika v tekočini (mg),
|
|
Cnet
|
=
|
koncentracija anorganskega ogljika v preskusnih posodah, od katere se odšteje koncentracija v kontrolnih posodah na koncu preskusa (mg/l),
|
|
Vl
|
=
|
prostornina tekočine v posodi (l).
|
|
Skupni uplinjeni ogljik
|
47.
|
Skupna masa uplinjenega ogljika v posodi se izračuna z enačbo [8]:
pri čemer je:
|
|
mt
= skupna masa uplinjenega ogljika (mg),
|
|
|
mh
in ml
sta enaka zgornjim opredelitvam.
|
|
Ogljik preskusne snovi
|
48.
|
Masa ogljika v preskusnih posodah, ki izhaja iz dodane preskusne snovi, se izračuna z enačbo [9]:
pri čemer je:
|
mv
|
=
|
masa ogljika preskusne snovi (mg),
|
|
Cc
|
=
|
koncentracija ogljika preskusne snovi v preskusni posodi (mg/l),
|
|
Vl
|
=
|
prostornina tekočine v preskusni posodi (l).
|
|
Obseg biološke razgradnje
|
49.
|
Odstotek biološke razgradnje se iz plina v prostoru v zaprti posodi nad fazno mejo plin-kapljevina izračuna z enačbo [10], skupni odstotek biološke razgradnje pa z enačbo [11]:
|
Dh
= (mh
/mv
) × 100
|
enačba [10]
|
|
Dt
= (mt
/mv
) × 100
|
enačba [11]
|
pri čemer je:
|
|
Dh
= biološka razgradnja iz plina v prostoru v zaprti posodi nad fazno mejo plin-kapljevina ( %),
|
|
|
Dt
= skupna biološka razgradnja ( %),
|
|
|
mh mv
in mt
so enaki zgornjim opredelitvam.
|
Stopnja primarne biološke razgradnje se izračuna iz (neobveznih) meritev koncentracije preskusne snovi na začetku in koncu inkubacije z enačbo [12]:
|
Dp
= (1 –Se
/Si
) × 100
|
enačba [12]
|
pri čemer je:
|
Dp
|
=
|
primarna razgradnja preskusne snovi ( %),
|
|
Si
|
=
|
začetna koncentracija preskusne snovi (mg/l),
|
|
Se
|
=
|
koncentracija preskusne snovi na koncu (mg/l).
|
Če metoda analize kaže znatne koncentracije preskusne snovi v neprilagojenem inokulumu anaerobnega blata, se uporabi enačba [13]:
|
Dp
1
= [1 – (Se
–Seb
)/(Si
–Sib
)] × 100
|
enačba [13]
|
pri čemer je:
|
Dp
1
|
=
|
popravljena primarna razgradnja preskusne snovi ( %),
|
|
Sib
|
=
|
začetna ‚očitna‘ koncentracija preskusne snovi v slepih kontrolah (mg/l),
|
|
Seb
|
=
|
‚očitna‘ koncentracija preskusne snovi v slepih kontrolah na koncu (mg/l).
|
|
Veljavnost rezultatov
|
50.
|
Uporabijo se lahko samo odčitki tlaka v posodah, ki ne kažejo rožnate obarvanosti (glej odstavek 33). Onesnaženje s kisikom se najbolj zmanjša z uporabo ustreznih tehnik za anaerobno ravnanje.
|
|
51.
|
Upoštevati je treba, da je preskus veljaven, če referenčna snov doseže ravnotežje, ki predstavlja več kot 60-odstotno biološko razgradnjo (41).
|
|
52.
|
Če pH na koncu preskusa preseže razpon 7 ± 1 in biološka razgradnja ni zadostna, se preskus ponovi z večjo puferno kapaciteto medija.
|
Zaviranje razgradnje
|
53.
|
Nastajanje plina v posodah, ki vsebujejo preskusno snov in referenčno snov, mora biti vsaj enako nastajanju plina v posodah, ki vsebujejo samo referenčno snov, v nasprotnem primeru se kaže zaviranje nastajanja plina. V nekaterih primerih bo v posodah, ki vsebujejo preskusno snov brez referenčne snovi, nastalo manj plina kot v slepih kontrolah, kar kaže, da preskusna snov deluje kot inhibitor.
|
Poročilo o preskusu
|
54.
|
V poročilo o preskusu se vključijo naslednje informacije:
|
|
Preskusna snov:
|
—
|
splošno ime, kemijsko ime, številka CAS, strukturna formula in pomembne fizikalno-kemijske lastnosti,
|
|
—
|
čistost (nečistoče) preskusne snovi.
|
|
|
|
Preskusni pogoji:
|
—
|
prostornine razredčene tekočine gnilišča (Vl
) in prostora v zaprti posodi nad fazno mejo plin-kapljevina v posodi,
|
|
—
|
opis preskusnih posod, glavne značilnosti meritve bioplina (npr. vrsta merilnika tlaka) in analizatorja anorganskega ogljika,
|
|
—
|
vnos preskusne snovi in referenčne snovi v preskusni sistem: uporabljena preskusna koncentracija in uporaba topil,
|
|
—
|
podrobnosti o uporabljenem inokulumu: naziv čistilne naprave, opis vira prečiščene odpadne vode (npr. obratovalna temperatura, retencijski čas blata, predvsem gospodinjski itd.), koncentracija, vse informacije, potrebne za utemeljitev tega, in informacije o vseh predhodnih tretiranjih inokuluma (npr. predhodno gnitje, predhodna izpostavljenost),
|
|
—
|
inkubacijska temperatura,
|
|
|
|
Rezultati:
|
—
|
vrednosti pH in anorganskega ogljika na koncu preskusa,
|
|
—
|
koncentracija preskusne snovi na začetku in koncu preskusa, če je bila izvedena specifična meritev,
|
|
—
|
vsi izmerjeni podatki, zbrani v preskusu, slepe posode, posode z referenčno snovjo in posode za kontrolo zaviranja, kot je ustrezno (npr. tlak v milibarih, koncentracija anorganskega ogljika (mg/l) v obliki tabele (izmerjene podatke za prostor v zaprti posodi nad fazno mejo plin-kapljevina in tekočino je treba sporočiti ločeno),
|
|
—
|
statistična obdelava podatkov, trajanje preskusa ter diagram biološke razgradnje preskusne snovi, referenčne snovi in kontrole strupenosti,
|
|
—
|
odstotek biološke razgradnje preskusne snovi in referenčne snovi,
|
|
—
|
razlogi za morebitno zavrnitev rezultatov preskusa,
|
|
|
LITERATURA
|
(1)
|
Naslednja poglavja te priloge:
|
|
C.4 Določanje ‚dobre‘ biorazgradljivosti;
|
|
|
C.9 Biorazgradnja – Zahn-Wellensev preskus;
|
|
|
C.10 Simulacijski preskus za aerobno čiščenje odpadne vode:
A: Enote z aktivnim blatom, B: Biofilmi;
|
|
|
C.11 Biorazgradnja – preskus zaviranja dihanja aktivnega blata.
|
|
|
(2)
|
OECD (2009) Inherent Biodegradability: Modified MITI Test (II), OECD Guideline for Testing of Chemicals, No. 302C, OECD, Pariz.
|
|
(3)
|
Birch, R. R., Biver, C., Campagna, R., Gledhill, W. E., Pagga, U., Steber, J., Reust, H., in Bontinck, W. J. (1989). Screening of chemicals for anaerobic biodegradation. Chemosphere 19, 1527– 1550. (Objavljeno tudi kot ECETOC Technical Report No. 28, junij 1988).
|
|
(4)
|
Shelton D. R., in Tiedje, J. M. (1984). General method for determining anaerobic biodegradation potential. Appl. Environ. Mircobiology, 47, 850–857.
|
|
(5)
|
Owen, W. F., Stuckey, DC., Healy J. B., Jr, Young L. Y., in McCarty, P. L. (1979). Bioassay for monitoring biochemical methane potential and anaerobic toxicity. Water Res. 13, 485–492.
|
|
(6)
|
Healy, J. B. Jr., in Young, L. Y. (1979). Anaerobic biodegradation of eleven aromatic compounds to methane. Appl. Environ. Microbiol. 38, 84–89.
|
|
(7)
|
Gledhill, W. E. (1979). Proposed standard practice for the determination of the anaerobic biodegradation of organic chemicals. Working document. Draft 2 no.35.24. American Society for Testing Materials, Filadelfija.
|
|
(8)
|
Battersby, N. S., in Wilson, V. (1988). Evaluation of a serum bottle technique for assessing the anaerobic biodegradability of organic chemicals under methanogenic conditions. Chemosphere, 17, 2441–2460.
|
|
(9)
|
E1192-92. Standard Test Method for Determining the Anaerobic Biodegradation Potential of Organic Chemicals. ASTM, Filadelfija.
|
|
(10)
|
US-EPA (1998) Fate, Transport and Transformation Test Guidelines OPPTS 835.3400 Anaerobic Biodegradability of Organic Chemicals.
|
|
(11)
|
Mednarodna organizacija za standardizacijo (1995) ISO 11 734 Kakovost vode – Vrednotenje ‚končne‘ anaerobne biorazgradljivosti organskih spojin v presnovljenem blatu – Metoda z merjenjem nastalega bioplina.
|
|
(12)
|
Mednarodna organizacija za standardizacijo (2003) ISO 13 641-1 Kakovost vode – Določevanje zaviranja nastanka plina, ki ga proizvedejo anaerobne bakterije – 1. del: Splošen preskus.
|
|
(13)
|
Mednarodna organizacija za standardizacijo (1995) ISO 10 634 Kakovost vode – Navodilo za pripravo in obdelavo v vodi slabo topnih organskih spojin za nadaljnje vrednotenje njihove biorazgradljivosti v vodi.
|
|
(14)
|
Pagga, U., in Beimborn, D. B., (1993). Anaerobic biodegradation test for organic compounds. Chemosphere, 27, 1499– 1509.
|
|
(15)
|
Mednarodna organizacija za standardizacijo (1997) ISO 11 923 Kakovost vode – Določevanje suspendiranih snovi s filtracijo skozi filter iz steklenih vlaken.
|
Dodatek 1
Primer opreme za merjenje nastajanja bioplina s tlakom plina

Legenda:
|
1
|
–
|
Merilnik tlaka
|
|
2
|
–
|
Trojni plinotesni petelinček
|
|
3
|
–
|
Injekcijska igla
|
|
4
|
–
|
Plinotesno tesnilo (zaporni pokrovček in septum)
|
|
5
|
–
|
Prostor v zaprti posodi nad fazno mejo plin-kapljevina (Vh
)
|
|
6
|
–
|
Inokulum pregnitega blata (Vl
)
|
Preskusne posode v okolju s 35 °C ± 2 °C
Dodatek 2
Pretvorba odčitkov merilnika tlaka
Odčitki merilnika tlaka so lahko povezani s prostorninami plina z umeritveno krivuljo, ki nastane z injiciranjem znanih prostornin zraka pri 35 °C ± 2 °C v serumske steklenice, ki vsebujejo toliko vode kot reakcijska zmes, V
R:
|
—
|
odmeri se V
R ml alikvotov vode in hrani v petih serumskih steklenicah pri 35 °C ± 2 °C. Steklenice se zatesnijo in za eno uro postavijo v vodno kopel pri 35 °C, da se vzpostavi ravnotežje,
|
|
—
|
merilnik tlaka se vklopi, pusti, da se stabilizira, in nastavi na nič,
|
|
—
|
injekcijska igla se vstavi skozi tesnilo ene od steklenic, ventil se odpre, dokler se na merilniku tlaka ne prikaže vrednost nič, in nato zapre,
|
|
—
|
postopek se ponovi pri ostalih steklenicah,
|
|
—
|
v vsako steklenico se injicira 1 ml zraka pri 35 °C ± 2 °C. Igla (merilnika) se vstavi skozi tesnilo eno od steklenic in pusti, da se meritve tlaka stabilizirajo. Tlak se zabeleži, ventil pa se odpre, dokler se na merilniku tlaka ne prikaže vrednost nič, in nato zapre,
|
|
—
|
postopek se ponovi pri ostalih steklenicah,
|
|
—
|
zgornji postopek se v celoti ponovi z 2 ml, 3 ml, 4 ml, 5 ml, 6 ml, 8 ml, 10 ml, 12 ml, 16 ml, 20 ml in 50 ml zraka,
|
|
—
|
grafično se prikaže krivulja pretvorbe tlaka (Pa) v odvisnosti od injicirane prostornine plina Vb (ml). Odziv instrumenta je linearen v razponu od 0 Pa do 70 000 Pa in od 0 ml do 50 ml nastalega plina.
|
Dodatek 3
Primer krivulje razgradnje (skupno neto povečanje tlaka)
Dodatek 4
Primer podatkovnih listov za preskus anaerobne biološke razgradnje – podatkovni list za preskusno snov
|
Laboratorij: …
|
Preskusna snov: …
|
Preskus št. …
|
|
Preskusna temperatura: (°C): …
|
Prostornina prostora v zaprti posodi nad fazno mejo plin-kapljevina (V
h): …(l)
|
Prostornina tekočine (V
l): …(l)
|
|
Ogljik v preskusni snovi C
c,v: …(mg/l)
|
mv
(42): …(mg)
|
|
|
Dan
|
p1
(preskus)
(milibari)
|
p2
(preskus)
(milibari)
|
p3
(preskus)
(milibari)
|
p (preskus)
sredina
(milibari)
|
p4
(slepi)
(milibari)
|
p5
(slepi)
(milibari)
|
p6
(slepi)
(milibari)
|
p (slepi)
sredina
(milibari)
|
p (neto)
preskus – slepi
sredina (milibari)
|
Δp (neto)
skupaj
(milibari)
|
mh
prostor v zaprti posodi nad fazno mejo plin-kapljevina C
(43)
(mg)
|
Dh
biološka razgradnja (44)
(%)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C
IC, 1
preskus
(mg)
|
C
IC, 2
preskus
(mg)
|
C
IC, 3
preskus
(mg)
|
C
IC
sredina – preskus
(mg)
|
C
IC, 4
slepi
(mg)
|
C
IC, 5
slepi
(mg)
|
C
IC, 6
slepi
(mg)
|
C
IC
sredina – slepi
(mg)
|
C
IC, net
preskus – slepi
sredina
(mg)
|
m
l
tekočina C (45)
(mg)
|
m
t
skupaj C (46)
(mg)
|
D
t
biološka razgradnja (47)
(%)
|
|
Anorganski ogljik (konec)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
pH (konec)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Laboratorij: …
|
Referenčna snov: …
|
Preskus št. …
|
|
Preskusna temperatura: (°C): …
|
Prostornina prostora v zaprti posodi nad fazno mejo plin-kapljevina (V
h): …(l)
|
Prostornina tekočine (V
l) (litri): …
|
|
Ogljik v referenčni snovi C
c,v (mg/l): …
|
mv
(48) …(mg):
|
|
|
Dan
|
p
1 (ref.)
(milibari)
|
p
2 (ref.)
(milibari)
|
p
3 (ref.)
(milibari)
|
p (ref.)
sredina
(milibari)
|
p
4 (inhib.)
(milibari)
|
p
5 (inhib.)
(milibari)
|
p
6 (inhib.)
(milibari)
|
p (inhib.)
sredina
(milibari)
|
p (ref.)
ref. – slepi
(milibari)
|
Δ
p (ref.)
skupaj
(milibari)
|
m
h
prostor v zaprti posodi nad fazno mejo plin-kapljevina C
(49)
(mg)
|
D
h
Biološka razgradnja (50)
(%)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C
IC, 1
ref.
(mg)
|
C
IC, 2
ref.
(mg)
|
C
IC, 3
ref.
(mg)
|
C
IC
ref. – sredina
(mg)
|
C
IC, 4
inhib.
(mg)
|
C
IC, 5
inhib.
(mg)
|
C
IC, 6
inhib.
(mg)
|
C
IC
inhib. – sredina
(mg)
|
C
IC, net
ref. – inhib.
(mg)
|
m
l
tekočina C (51)
(mg)
|
m
t
skupaj C (52)
(mg)
|
D
t
biološka razgradnja (53)
(%)
|
|
Anorganski ogljik (konec)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
pH (konec)
|
|
|
|
|
|
|
|
|
|
|
|
|
C.44 IZPIRANJE V TALNIH KOLONAH
UVOD
|
1.
|
Ta preskusna metoda ustreza Smernici za preskušanje OECD (TG) 312 (2004). Umetne kemikalije lahko tla dosežejo neposredno z namerno uporabo (npr. agrokemikalije) ali po posrednih poteh (npr. odpadna voda → odpadno blato → tla ali zrak → mokro/suho odlaganje). Za oceno tveganja teh kemikalij je treba oceniti njihov potencial za transformacijo v tleh in premik (izpiranje) v globlje plasti tal ter postopno v podtalnico.
|
|
2.
|
Na voljo je več metod za merjenje potenciala izpiranja kemikalij v tla v nadzorovanih laboratorijskih pogojih, tj. tankoplastna kromatografija tal, debeloplastna kromatografija tal, kolonska kromatografija tal ter meritve adsorpcije in desorpcije (1) (2). Pri neioniziranih kemikalijah porazdelitveni koeficient n-oktanol/voda (Pow) omogoča zgodnjo oceno njihovega potenciala adsorpcije in izpiranja (3) (4) (5).
|
|
3.
|
Metoda, opisana v tej preskusni metodi, temelji na kolonski kromatografiji tal v oviranih tleh (za opredelitev glej Dodatek 1). Za določitev (i) potenciala izpiranja preskusne kemikalije in (ii) potenciala izpiranja produktov transformacije (študija s starimi ostanki) v tleh v nadzorovanih laboratorijskih pogojih se izvajata dve vrsti poskusov (54). Ta preskusna metoda temelji na obstoječih smernicah (6) (7) (8) (9) (10) (11).
|
|
4.
|
Na delavnici OECD o izbiri tal/usedline, ki je bila leta 1995 v Belgiratu v Italiji (12), je bil dosežen dogovor o številu in vrstah tal za uporabo pri tej preskusni metodi. Sprejeta so bila tudi priporočila glede odvzemanja, obravnavanja in shranjevanja vzorcev tal za poskuse v zvezi z izpiranjem.
|
NAČELO PRESKUSNE METODE
|
5.
|
Kolone iz ustrezno inertnega materiala (npr. stekla, nerjavnega jekla, aluminija, teflona, PVC itd.) so napolnjene s tlemi, nasičene in uravnotežene z raztopino ‚umetnega dežja‘ (za opredelitev glej Dodatek 1) ter nato osušene. Nato se površina vsake talne kolone tretira s preskusno kemikalijo in/ali starimi ostanki preskusne kemikalije. Umetni dež se nato vnese v talne kolone, izcedna voda pa se odvzame. Po izpiranju se tla odstranijo iz kolon in razdelijo na ustrezno število delov, odvisno od informacij, ki jih mora zagotoviti študija. V vseh delih tal in izcedni vodi se nato analizira preskusna kemikalija in, če je primerno, produkti transformacije ali druge aktualne kemikalije.
|
UPORABNOST PRESKUSNE METODE
|
6.
|
Preskusna metoda se uporablja za preskusne kemikalije (neoznačene ali radioaktivno označene, npr.14C), za katere je na voljo dovolj natančna in občutljiva analitska metoda. Preskusna metoda se ne sme uporabljati za kemikalije, ki so hlapne v tleh in vodi ter zato ne ostanejo v tleh in/ali izcedni vodi v poskusnih pogojih te preskusne metode.
|
INFORMACIJE O PRESKUSNI KEMIKALIJI
|
7.
|
Preskusne kemikalije brez oznake ali z radioaktivno oznako se lahko uporabijo za merjenje obnašanja izpiranja v talnih kolonah. Radioaktivno označene snovi so potrebne za proučevanje izpiranja produktov transformacije (stari ostanki preskusne kemikalije) in določitve masne bilance. Priporoča se oznaka14C, vendar so lahko koristni tudi drugi izotopi, kot so13C,15N,3H in 32P. Če je mogoče, se označi(-jo) najbolj stabilen(-lni) del(-i) molekule. Čistost preskusne kemikalije mora biti najmanj 95-odstotna.
|
|
8.
|
Večino kemikalij je treba uporabiti kot eno snov. Vendar se lahko pri aktivnih snoveh v izdelkih za zaščito rastlin za proučevanje izpiranja matične preskusne snovi uporabljajo formulirani produkti, vendar je njihovo preskušanje potrebno zlasti, kadar bo zmes verjetno vplivala na hitrost sproščanja (npr. zrnaste formulacije ali formulacije z nadzorovanim sproščanjem). V zvezi s specifičnimi zahtevami za načrt preskusa zmesi bi lahko bilo koristno posvetovanje z regulativnim organom pred izvedbo preskusa. Za študije izpiranja starih ostankov je treba uporabiti čisto matično preskusno snov.
|
|
9.
|
Pred izvajanjem preskusov izpiranja v talnih kolonah naj bi bile na voljo naslednje informacije o preskusni kemikaliji:
|
(1)
|
topnost v vodi [preskusna metoda A.6] (13);
|
|
(2)
|
topnost v organskih topilih;
|
|
(3)
|
parni tlak [preskusna metoda A.4] (13) in/ali Henryjeva konstanta;
|
|
(4)
|
porazdelitveni koeficient n-oktanol/voda [preskusni metodi A.8 in A.24] (13);
|
|
(5)
|
adsorpcijski koeficient (Kd, Kf ali KOC) [preskusni metodi C.18 in/ali C.19 ] (13);
|
|
(6)
|
hidroliza [preskusna metoda C.7] (13);
|
|
(7)
|
konstanta disociacije ((pKa) [OECD TG 112] (25);
|
|
(8)
|
aerobna in anaerobna transformacija v tleh [preskusna metoda C.23] (13).
|
Opomba: V ustreznih poročilih o preskusu je treba poročati o temperaturi, pri kateri so bile opravljene te meritve.
|
|
10.
|
Količina preskusne kemikalije, vnesene v talne kolone, mora biti zadostna za zaznavo vsaj 0,5 % uporabljenega odmerka v katerem koli posameznem delu. Pri aktivnih kemikalijah v izdelkih za zaščito rastlin lahko količina uporabljene preskusne kemikalije ustrezna največji priporočeni stopnji uporabe (ena uporaba).
|
|
11.
|
Na voljo mora biti primerna analitska metoda znane točnosti, natančnosti in občutljivosti za kvantifikacijo preskusne kemikalije in, če je ustrezno, njenih produktov transformacije v tleh in izcedni vodi. Znana mora biti tudi analitska meja zaznavnosti preskusne kemikalije in njenih pomembnih produktov transformacije (običajno vsaj vseh produktov transformacije ≥ 10 % uporabljenega odmerka, opaženega v študijah poteka transformacij, vendar raje katerih koli zadevnih produktov transformacije) (glej odstavek 17).
|
REFERENČNE KEMIKALIJE
|
12.
|
Za oceno relativne mobilnosti preskusne kemikalije v tleh je treba uporabiti referenčne kemikalije z znanim obnašanjem pri izpiranju, kot je atrazin ali monuron, ki se lahko štejejo za snovi z zmernim izpiranjem (1) (8) (11). Za potrditev hidrodinamičnih lastnosti talne kolone je lahko koristna tudi nesorpcijska in nerazgradljiva polarna referenčna kemikalija (npr. tritij, bromid, fluoroscein, eozin) za sledenje gibanja vode v koloni.
|
|
13.
|
Kemikalije analitskega standarda so lahko koristne tudi za določitev značilnosti in/ali opredelitev produktov transformacije, najdenih v delih tal in izcednih vodah s kromatografsko, spektroskopsko ali drugo ustrezno metodo.
|
OPREDELITVE IN ENOTE
MERILA KAKOVOSTI
Izkoristek
|
15.
|
Vsota deležev preskusne kemikalije, najdenih v delih tal in izcedni vodi kolone po izpiranju, je izkoristek poskusa izpiranja. Izkoristki morajo biti v razponu od 90 % do 110 % pri radioaktivno označenih kemikalijah (11) in od 70 % do 110 % pri neoznačenih kemikalijah (8).
|
Ponovljivost in občutljivost analitske metode
|
16.
|
Ponovljivost analitske metode za kvantifikacijo preskusne kemikalije in produktov transformacije se lahko preveri s ponovljeno analizo istega ekstrakta dela tal ali izcedne vode (glej odstavek 11).
|
|
17.
|
Meja zaznavnosti analitske metode za preskusno kemikalijo in produkte transformacije mora biti najmanj 0,01 mg · kg– 1 v vsakem delu tal ali izcedni vodi (kot preskusna snov) ali 0,5 % uporabljenega odmerka v katerem koli posameznem delu, kar je manj. Opredeliti je treba tudi mejo določanja.
|
OPIS PRESKUSNE METODE
Preskusni sistem
|
18.
|
Za preskus se uporabljajo kolone za izpiranje (deljive ali nedeljive) iz ustrezno inertnega materiala (npr. stekla, nerjavnega jekla, aluminija, teflona, PVC itd.) z notranjim premerom vsaj 4 cm in najmanjšo višino 35 cm. Preskusi se potencialno medsebojno delovanje materiala kolone in preskusne kemikalije in/ali njenih produktov transformacije. Primeri ustreznih deljivih in nedeljivih kolon so prikazani v Dodatku 2.
|
|
19.
|
Za polnjenje talnih kolon se uporabljajo žlica, potisni bat in vibracijska oprema.
|
|
20.
|
Za vnos umetnega dežja v talne kolone se lahko uporabljajo vlečni bat ali peristaltična črpalka, ročke za prho, steklenice za zagotavljanje stalne hitrosti pretoka ali enostavni liji kapalniki.
|
Laboratorijska oprema in kemikalije
|
21.
|
Potrebna je standardna laboratorijska oprema, zlasti:
|
(1)
|
instrumenti za analizo, na primer oprema GLC, HPLC, TLC, vključno z ustreznimi sistemi zaznavanja za analiziranje označenih ali neoznačenih kemikalij ali inverzno metodo izotopskega redčenja;
|
|
(2)
|
instrumenti za identifikacijo (npr. MS, GC-MS, HPLC-MS, NMR itd.);
|
|
(3)
|
tekočinski scintilacijski števec za radioaktivno označeno preskusno kemikalijo;
|
|
(4)
|
oksidacijsko sredstvo za izgorevanje označenih snovi;
|
|
(5)
|
naprave za ekstrakcijo (na primer centrifugirke za hladno ekstrakcijo in naprava Soxhlet za kontinuirano ekstrakcijo pod refluksom);
|
|
(6)
|
instrumenti za koncentracijo raztopin in ekstraktov (npr. rotacijski evaporator).
|
|
|
22.
|
Uporabljene kemikalije vključujejo: analitsko čista organska topila, kot so aceton, metanol itd., scintilacijsko tekočino, raztopino 0,01 M CaCl2 v destilirani ali deionizirani vodi (= umetni dež).
|
Preskusna kemikalija
|
23.
|
Preskusno kemikalijo je treba za vnos v talno kolono raztopiti v vodi (deionizirani ali destilirani). Če je preskusna kemikalija v vodi slabo topna, se lahko vnese kot formuliran produkt (po potrebi po suspendiranju ali emulgiranju v vodi) ali v katerem koli organskem topilu. Če se uporabi organsko topilo, ga je treba uporabiti čim manj in mora pred začetkom procesa izpiranja izhlapeti s površine talne kolone. Trdne formulacije, kot so zrnca, je treba vnesti v trdni obliki brez vode; za boljšo razporeditev po površini talne kolone se lahko formulirani produkt pred uporabo zmeša z majhno količino kremenovega peska (npr. 1 g).
|
|
24.
|
Količina preskusne kemikalije, vnesene v talne kolone, mora biti zadostna za zaznavo vsaj 0,5 % uporabljenega odmerka v katerem koli posameznem delu. Pri aktivnih kemikalijah v izdelkih za zaščito rastlin lahko temelji na največji priporočeni stopnji uporabe (stopnja enega nanosa), pri čemer mora biti pri matičnem spiranju in spiranju starih ostankov povezana s površino uporabljene talne kolone (55).
|
Referenčna kemikalija
|
25.
|
Pri poskusih izpiranja je treba uporabiti referenčno kemikalijo (glej odstavek 12). Na površino talne kolone jo je treba nanesti podobno kot preskusno kemikalijo z ustrezno hitrostjo, ki omogoča primerno zaznavanje kot notranji standard skupaj s preskusno kemikalijo v isti talni koloni ali samostojno kot ločena talna kolona. Obe kemikaliji naj bi se uporabili v isti talni koloni, razen če sta obe kemikaliji podobno označeni.
|
Tla
Izbira tal
|
26.
|
Za študije izpiranja z matično preskusno kemikalijo je treba uporabiti 3 do 4 tla z različnim pH, vsebnostjo organskega ogljika in teksturo (12) Smernice za izbiranje tal za poskuse izpiranja so navedene v tabeli 1. Pri preskusnih kemikalijah, ki jih je mogoče ionizirati, morajo izbrana tla zajeti širok razpon pH, da se oceni mobilnost kemikalije v njeni ionizirani in neionizirani obliki; vsaj troje tal mora imeti pH, pri katerem je preskusna kemikalija v mobilni obliki.
Tabela 1
Smernice za izbiro tal za študije izpiranja
|
Tla št.
|
Vrednost pH
|
Organski ogljik
%
|
Vsebnost gline
%
|
Tekstura (56)
|
|
1
|
> 7,5
|
3,5–5,0
|
20–40
|
glinasta ilovica
|
|
2
|
5,5–7,0
|
1,5–3,0
|
15–25
|
muljasta ilovica
|
|
3
|
4,0–5,5
|
3,0–4,0
|
15–30
|
ilovica
|
|
4
|
< 4,0–6,0 (57)
|
< 0,5–1,5 (57)
(58)
|
< 10–15 (57)
|
ilovnat pesek
|
|
5
|
< 4,5
|
> 10 (59)
|
< 10
|
ilovnat pesek/pesek
|
|
|
27.
|
Občasno so lahko potrebne druge vrste tal, ki predstavljajo hladnejša, zmerna in tropska območja. Če se da prednost drugim vrstam tal, jih je zato treba opredeliti z istimi parametri in morajo imeti podobne razlike v lastnostih kot tiste, opisane v smernicah za izbiro tal za študije izpiranja (glej tabelo 1 zgoraj), čeprav niso popolnoma skladne z merili.
|
|
28.
|
Za študije izpiranja s ‚starimi ostanki‘ je treba uporabiti ena tla (12). Vsebnost peska v njih mora biti > 70 % in vsebnost organskega ogljika med 0,5 in 1,5 % (npr. tla št. 4 v tabeli 1). Uporaba več vrst tal je lahko potrebna, če so podatki o produktih transformacije pomembni.
|
|
29.
|
Vse vrste tal je treba opredeliti vsaj glede teksture [ % peska, % mulja, % gline v skladu s sistemi FAO in USDA za razvrščanje (14)], pH, kationske izmenjalne kapacitete, vsebnosti organskega ogljika, gostote v razsutem stanju (za ovirana tla) in zmogljivosti zadrževanja vode. Meritev mikrobne biomase je potrebna le za tla, ki se uporabljajo med staranjem/inkubacijo, izvedeno pred poskusom izpiranja s starimi odpadki. Informacije o dodatnih lastnostih tal (npr. razvrstitev tal, mineralogija gline, specifična površina) so lahko koristne pri razlagi rezultatov te študije. Za določitev značilnosti tal se lahko uporabijo metode, priporočene v virih (15) (16) (17) (18) (19).
|
Odvzemanje in shranjevanje tal
|
30.
|
Tla je treba odvzeti z zgornje plasti (horizont A) do globine največ 20 cm. Ostanke vegetacije, makrofavne in kamnov je treba odstraniti. Tla (razen tal, ki se uporabljajo za staranje preskusne kemikalije) se sušijo na zraku pri sobni temperaturi (najbolje med 20 in 25 °C. Desagregacija (razdruževanje) se mora izvesti s čim manjšo silo, tako da se prvotna tekstura tal čim manj spremeni. Tla se presejejo skozi sito z luknjicami < 2 mm. Priporočena je previdna homogenizacija, saj se s tem poveča obnovljivost rezultatov. Tla se lahko pred uporabo shranijo pri sobni temperaturi in posušena na zraku (12). Nobena omejitev časa shranjevanja ni priporočena, vendar je treba tla, ki se shranjujejo več kot tri leta, pred uporabo ponovno analizirati glede na njihovo vsebnost organskega ogljika in pH.
|
|
31.
|
Na voljo morajo biti podrobne informacije o preteklosti mesta vzorčenja, kjer se odvzemajo tla za preskus. Podrobnosti vključujejo točno lokacijo [natančno definirano z UTM (Universal Transversal Mercator-Projection/European Horizontal Datum) ali zemljepisnimi koordinatami], pokritost z vegetacijo, uporabo kemikalij za zaščito pridelka, uporabo organskih in anorganskih gnojil, dodatke bioloških materialov ali naključno onesnaženje (12). Če so bila tla v predhodnih štirih letih tretirana s preskusno kemikalijo ali analognimi strukturami, se ne smejo uporabiti v študijah izpiranja.
|
Preskusni pogoji
|
32.
|
V obdobju preskušanja je treba kolone za izpiranje hraniti v temi pri sobni temperaturi, dokler se ta temperatura vzdržuje v razponu ± 2 °C. Priporočajo se temperature med 18 in 25 °C.
|
|
33.
|
Umetni dež (0,01 M CaCl2) je treba neprekinjeno nanašati na površino talnih kolon s hitrostjo 200 mm v obdobju 48 ur (60); ta hitrost je enaka nanosu 251 ml za kolono z notranjim premerom 4 cm. Če je to potrebno za preskus, se lahko uporabijo tudi druge hitrosti umetnih padavin in daljše trajanje.
|
Izvajanje preskusa
Izpiranje z matično preskusno kemikalijo
|
34.
|
Vsaj ponovitve kolon za izpiranje se napolnijo z netretiranimi, na zraku sušenimi in presejanimi tlemi (< 2 mm) do višine približno 30 cm. Za zagotovitev enotnega polnjenja se tla vnesejo v kolone v majhnih delih z žlico in s potisnim batom stisnejo s hkratnim nežnim vibriranjem tal, dokler se vrh talne kolone ne pogrezne. Enotno polnjenje je potrebno, da se v kolonah za izpiranje zagotovijo obnovljivi rezultati. Za podrobnosti o tehnikah polnjenja kolon glej vire (20) (21) in (22). Za nadzor obnovljivosti postopka polnjenja se določi skupna teža tal v kolonah (61), teže ponovitvenih kolon morajo biti podobne.
|
|
35.
|
Ko so talne kolone napolnjene, se zmočijo z umetnim dežjem (0,01 M CaCl2) od spodaj navzgor, da voda izpodrine zrak iz por v tleh. Nato se v talnih kolonah vzpostavi ravnotežje, odvečna voda pa odteče zaradi težnosti. Metode za nasičevanje kolon so opisane v viru (23).
|
|
36.
|
Nato se v talne kolone vnese preskusna kemikalija in/ali referenčna kemikalija (glej odstavke 23–25). Za homogeno razporeditev raztopin je treba suspenzije ali emulzije preskusne in/ali referenčne kemikalije enakomerno nanesti na površino talnih kolon. Če se za vnos preskusne kemikalije priporoča vključitev v tla, jo je treba zmešati z majhno količino (npr. 20 g) tal in nanesti na površino talne kolone.
|
|
37.
|
Površine talnih kolon se nato prekrijejo s steklenim sintranim diskom, steklenimi kroglicami, filtri iz steklenih vlaken ali okroglim filtrirnim papirjem, da se umetni dež enakomerno razporedi po celotni površini in preprečijo motnje površine tal zaradi dežnih kapljic. Večji kot je premer kolone, bolj je treba paziti pri dodajanju umetnega dežja v talne kolone, da se zagotovi enakomerna porazdelitev umetnega dežja po celotni površini tal. Nato se umetni dež doda v talne kolone po kapljicah s pomočjo vlečnega bata ali peristaltične črpalke ali lija kapalnika. Po možnosti je treba izcedne vode zbrati v delih, njihove prostornine pa se zabeležijo (62).
|
|
38.
|
Po izpiranju in odtekanju iz kolon se talne kolone razdelijo na ustrezno število delov, odvisno od informacij, ki jih mora zagotoviti študija, deli se ekstrahirajo z ustreznimi topili ali zmesmi topil, v njih pa se analizirajo preskusna kemikalija ter, kadar je ustrezno, produkti transformacije, skupna radioaktivnost in referenčna kemikalija. Izcedne vode ali deli izcednih vod se analizirajo neposredno ali po ekstrakciji za iste produkte. Če se uporabi preskusna kemikalija z radioaktivno oznako, je treba opredeliti vse dele, ki vsebujejo ≥ 10 % uporabljene radioaktivnosti.
|
Izpiranje s starimi ostanki
|
39.
|
Sveža tla (ki niso bila predhodno sušena na zraku) se tretirajo s hitrostjo, ki ustreza površini talnih kolon (glej odstavek 24), z radioaktivno označeno preskusno kemikalijo in inkubirajo v aerobnih pogojih v skladu s preskusno metodo C.23 (13). Inkubacijsko obdobje (staranje) mora biti dovolj dolgo, da nastanejo znatne količine produktov transformacije; priporoča se obdobje staranja, ki traja polovico starosti preskusne kemikalije (63), vendar ne sme presegati 120 dni. Starana tla se pred izpiranjem analizirajo glede preskusne kemikalije in njenih produktov transformacije.
|
|
40.
|
Kolone za izpiranje se do višine 28 cm napolnijo z istimi tlemi (vendar sušenimi na zraku), kot so bila uporabljena pri poskusu staranja, kot je opisano v odstavku 34, pri čemer se določi tudi skupna teža napolnjenih talnih kolon. Talne kolone se nato predhodno zmočijo, kot je opisano v odstavku 35.
|
|
41.
|
Nato se preskusna kemikalija in njeni produkti transformacije nanesejo na površino talnih kolon v obliki starih ostankov tal (glej odstavek 39) kot 2 cm debel del tal. Skupna višina talnih kolon (netretirana tla + starana tla) naj ne bi presegla 30 cm (glej odstavek 34).
|
|
42.
|
Izpiranje se izvede, kot je opisano v odstavku 37.
|
|
43.
|
Po izpiranju se deli tal in izcedne vode analizirajo glede preskusne kemikalije, njenih produktov transformacije in neekstrahirane radioaktivnosti, kot je navedeno v odstavku 38. Za določitev količine starih odpadkov, ki se ohrani v zgornji dvocentimetrski plasti po izpiranju, je treba ta del analizirati ločeno.
|
PODATKI IN POROČANJE
Obdelava rezultatov
|
44.
|
Količine preskusne kemikalije, produktov transformacije, snovi, ki jih ni mogoče ekstrahirati, in referenčne kemikalije, če je vključena, je treba navesti v % uporabljenega začetnega odmerka za vsak del tal v delu izcedne vode. Za vsako kolono je treba zagotoviti grafični prikaz deležev, ugotovljenih kot funkcija globin tal.
|
|
45.
|
Če je v te študije izpiranja v kolonah vključena referenčna kemikalija, se lahko izpiranje kemikalije oceni na relativni lestvici z uporabo faktorjev relativne mobilnosti (RMF; za opredelitev glej Dodatek 3) (1) (11), ki omogoča primerjavo podatkov o izpiranju različnih kemikalij, pridobljenih pri različnih vrstah tal. Primeri vrednosti RMF za različne kemikalije za zaščito pridelka so navedeni v Dodatku 3.
|
|
46.
|
Ocene Koc (adsorpcijski koeficient, normiran na organski ogljik) in Kom (porazdelitveni koeficient, normiran na organsko snov) se lahko pridobi tudi na podlagi rezultatov izpiranja v kolonah z uporabo povprečne razdalje izpiranja ali določenih povezav med RMF in Kom oziroma Koc (4) ali z uporabo enostavne kromatografske teorije (24). Vendar je treba slednjo metodo uporabljati previdno, zlasti ob upoštevanju, da proces izpiranja ne vključuje izključno nasičenih pogojev toka, ampak pogosto nenasičene sisteme.
|
Razlaga rezultatov
|
47.
|
Študije izpiranja v kolonah, opisane v tej metodi, omogočajo določanje potenciala izpiranja ali mobilnosti preskusne kemikalije (v študiji matičnega izpiranja) in/ali njenih produktov transformacije (v študiji izpiranja starih ostankov) v tleh. Ti preskusi ne predvidevajo količinsko obnašanja pri izpiranju v terenskih pogojih, vendar se lahko uporabijo za primerjavo ‚sposobnosti izpiranja‘ ene kemikalije z drugimi, katerih obnašanje pri izpiranju je morda znano (24). Podobno ne merijo količinsko deleža uporabljene kemikalije, ki bi lahko dosegel podtalnico (11). Vendar lahko rezultati študij izpiranja v kolonah pomagajo pri odločanju, ali je treba izvesti dodatno polterensko ali terensko preskušanje za kemikalije, ki v laboratorijskih preskusih kažejo velik potencial mobilnosti.
|
Poročilo o preskusu
|
48.
|
Poročilo mora vsebovati:
|
|
Preskusna kemikalija in referenčna kemikalija (če se uporabi):
|
—
|
splošno ime, kemijsko ime (nomenklatura IUPAC in CAS), številko CAS, kemijsko strukturo (z navedbo položaja oznak, kadar se uporabi radioaktivno označena snov) in ustrezne fizikalno-kemijske lastnosti,
|
|
—
|
čistoče (nečistoče) preskusne kemikalije,
|
|
—
|
radiokemijsko čistost označene kemikalije in specifično aktivnost (kadar je primerno).
|
|
|
|
Preskusna tla:
|
—
|
podrobnosti o mestu odvzema,
|
|
—
|
lastnosti tal, kot so pH, vsebnost organskega ogljika in gline, tekstura in gostota v razsutem stanju (za ovirana tla),
|
|
—
|
mikrobno dejavnost tal (le za tla, uporabljena za staranje preskusne kemikalije),
|
|
—
|
dolžino shranjevanja tal in razmere shranjevanja.
|
|
|
|
Preskusni pogoji:
|
—
|
datume izvajanja študij,
|
|
—
|
dolžino in premer kolon za izpiranje,
|
|
—
|
skupno težo tal v talnih kolonah,
|
|
—
|
količino uporabljene preskusne kemikalije in, če je primerno, referenčne kemikalije,
|
|
—
|
količino, pogostost in trajanje nanašanja dodajanja umetnega dežja,
|
|
—
|
temperaturo poskusnega okolja,
|
|
—
|
število ponovitev (vsaj dve),
|
|
—
|
metode za analizo preskusne kemikalije, produktov transformacije in, kadar je primerno, referenčne kemikalije v različnih delih tal in izcednih vod,
|
|
—
|
metode za opis značilnosti in opredelitev produktov transformacije v delih tal in izcednih vod.
|
|
|
|
Rezultati preskusa:
|
—
|
tabele z rezultati, izraženimi kot koncentracije in kot % uporabljenega odmerka za dele tal in izcednih vod,
|
|
—
|
masno bilanco, če je primerno,
|
|
—
|
prostornine izcednih vod,
|
|
—
|
razdalje izpiranja in, kadar je primerno, faktorje relativne mobilnosti,
|
|
—
|
grafični prikaz %, ugotovljenega v delih tal glede na globino dela tal,
|
|
—
|
razpravo o rezultatih in razlago rezultatov.
|
|
|
LITERATURA
|
(1)
|
Guth, J. A., Burkhard, N., in Eberle, D. O. (1976). Experimental Models for Studying the Persistence of Pesticides in Soil. Proc. BCPC Symposium: Persistence of Insecticides and Herbicides.
|
|
(2)
|
Russel, M. H. (1995). Recommended approaches to assess pesticide mobility in soil. In progress in Pesticide Biochemistry and Toxicology, Vol. 9 (Environmental Behaviour of Agrochemicals – T. R. Roberts in P. C. Kearney, ur.). J. Wiley & Sons.
|
|
(3)
|
Briggs, G. G. (1981). Theoretical and experimental relationships between soil adsorption, octanol-water partition coefficient, water solubilities, bioconcentration factors, and the parachor. J.Agric. Food Chem. 29, 1050– 1059.
|
|
(4)
|
Chiou, C. T., Porter, P. E., in Schmedding, D. W. (1983). Partition equilibria of non-ionic organic compounds between soil organic matter and water. Environ. Sci. Technol. 17, 227–231.
|
|
(5)
|
Guth, J. A. (1983). Untersuchungen zum Verhalten von Pflanzenschutzmitteln im Boden. Bull. Bodenkundliche Gesellschaft Schweiz 7, 26–33.
|
|
(6)
|
US-Environmental Protection Agency (1982). Pesticide Assessment Guidelines, Subdivision N. Chemistry: Environmental Fate.
|
|
(7)
|
Agriculture Canada (1987). Environmental Chemistry and Fate Guidelines for registration of pesticides in Canada.
|
|
(8)
|
Priloga I k Direktivi Komisije 95/36/ES z dne 14. julija 1995 o spremembi Direktive Sveta 91/414/EGS o dajanju fitofarmacevtskih sredstev v promet, UL L 172, 22.7.1995, str. 8.
|
|
(9)
|
Dutch Commission for Registration of Pesticides (1991). Application for registration of a pesticide. Section G: Behaviour of the product and its metabolites in soil, water and air.
|
|
(10)
|
BBA (1986). Richtlinie für die amtliche Prüfung von Pflanzenschutzmitteln, Teil IV, 4–2. Versickerungsverhalten von Pflanzenschutzmitteln.
|
|
(11)
|
SETAC (1995). Procedures for Assessing the Environmental Fate and Ecotoxicity of Pesticides. Mark R. Lynch, ur.
|
|
(12)
|
OECD (1995). Final Report of the OECD Workshop on Selection of Soils/Sediments. Belgirate, Italija, 18.–20. januar 1995.
|
|
(13)
|
Naslednja poglavja te priloge:
|
|
Poglavje A.4, Parni tlak,
|
|
|
Poglavje A.6, Topnost v vodi,
|
|
|
Poglavje A.8, Porazdelitveni koeficient, metoda stresanja bučke,
|
|
|
Poglavje A.24, Porazdelitveni koeficient, metoda tekočinske kromatografije visoke ločljivosti (HPLC),
|
|
|
Poglavje C.7, Razgradnja – Abiotska razgradnja: hidroliza kot funkcija pH,
|
|
|
Poglavje C.18, Adsorpcija/desorpcija z uporabo metode šaržnih preskusov ravnotežja,
|
|
|
Poglavje C.23, Aerobna in anaerobna transformacija v tleh.
|
|
|
(14)
|
Soil Texture Classification (US and FAO systems). Weed Science, 33, Suppl. 1 (1985) and Soil Sci. Soc. Amer. Proc. 26, 305 (1962).
|
|
(15)
|
Methods of Soil Analysis (1986). Part 1, Physical and Mineralogical Methods (A. Klute, ur.). Agronomy Series No. 9, druga izdaja.
|
|
(16)
|
Methods of Soil Analysis (1982). Part 2, Chemical and Microbiological Properties (A. L. Page, R. H. Miller in D. R. Kelney, ur.). Agronomy Series No. 9, druga izdaja.
|
|
(17)
|
ISO Standard Compendium Environment (1994). Soil Quality – General aspects; chemical and physical methods of analysis; biological methods of analysis. Prva izdaja.
|
|
(18)
|
Mückenhausen, E. (1975). Die Bodenkunde und ihre geologischen, geomorphologischen, mineralogischen und petrologischen Grundlagen. DLG-Verlag, Frankfurt na Majni.
|
|
(19)
|
Scheffer, F., in Schachtschabel, P. (1998). Lehrbuch der Bodenkunde. F. Enke Verlag, Stuttgart.
|
|
(20)
|
Weber, J. B., in Peeper, T. F. (1977). In Research Methods in Weed Science, druga izdaja (B. Truelove, ur.). Soc. Weed Sci., Auburn, Alabama, 73–78.
|
|
(21)
|
Weber, J. B., Swain, L. R., Strek, H. J., in Sartori, J. L. (1986). In Research Methods in Weed Science, tretja izdaja (N.D. Camper, ur.). Soc. Weed Sci., Champaign, IL, 190–200.
|
|
(22)
|
Oliveira idr. (1996). Packing of sands for the production of homogeneous porous media. Soil Sci. Soc. Amer. J. 60(1): 49–53.
|
|
(23)
|
Shackelford, C. D. (1991). Laboratory diffusion testing for waste disposal. – A review. J. Contam. Hydrol. 7, 177–217.
|
|
(24)
|
Hamaker, J. W. (1975). Interpretation of soil leaching experiments. V: Environmental Dynamics of Pesticides (R. Haque, V. H. Freed, ur.), 115– 133. Plenum Press, New York.
|
|
(25)
|
OECD (1981). Dissociation constants in water. OECD Guideline for Testing of Chemicals, No. 4112, OECD, Pariz.
|
Dodatek 1
Opredelitev pojmov in enote
Starani ostanki tal
: preskusna kemikalija in produkti transformacije, prisotni v tleh po vnosu in dovolj dolgem obdobju, ki omogoča procese prenosa, adsorpcije, metabolizma in disipacije za spremembo porazdelitve in osnovnih kemijskih značilnosti nekaterih uporabljenih kemikalij (1).
Umetni dež
: raztopina 0,01 M CaCl2 v destilirani ali deionizirani vodi.
Povprečna razdalja izpiranja
: dno dela tal, kjer je kumulativna izkoriščena kemikalija 50 % skupne izkoriščene preskusne kemikalije [poskus normalnega izpiranja] ali (dno dela tal, kjer je kumulativna izkoriščena kemikalija 50 % skupne izkoriščene preskusne kemikalije) – ((debelina staranih ostankov tal)/2) [študija izpiranja starih ostankov].
Kemikalija
: snov ali zmes.
Izcedna voda
: vodna faza, ki kaplja skozi talni profil ali talno kolono (1).
Izpiranje
: proces, s katerim se kemikalija premakne navzdol po talnem profilu ali talni koloni (1).
Razdalja izpiranja
: najgloblji del tal, v katerem je bilo po procesu izpiranja najdenih ≥ 0,5 % uporabljene preskusne kemikalije ali starih ostankov (enakovredna globini penetracije).
Meja zaznavnosti (LOD) in meja določanja (LOQ)
: meja zaznavnosti (LOD) je koncentracija kemikalije, pod katero identitete kemikalije ni mogoče razlikovati od analitičnih artefaktov. Meja določanja (LOQ) je koncentracija kemikalije, pod katero koncentracije ni mogoče določiti s sprejemljivo natančnostjo.
Faktor relativne mobilnosti (RMF)
: (razdalja izpiranja preskusne kemikalije (cm))/(razdalja izpiranja referenčne kemikalije (cm)).
Preskusna kemikalija
: vsaka snov ali zmes, preskušena z uporabo te preskusne metode.
Produkt transformacije
: vse kemikalije, ki so posledica biotskih ali abiotskih transformacijskih reakcij preskusne kemikalije, vključno s CO2 in produkti, ki so vezani v ostankih.
Tla
: mešanica mineralnih in organskih kemičnih sestavin, slednje vsebujejo spojine z visoko vsebnostjo ogljika in dušika in z veliko molsko maso, ki jih poseljujejo majhni (večinoma mikro-) organizmi. Tla se lahko obdelujejo v dveh stanjih:
|
—
|
v neoviranem, kakor so se razvila s časom, z značilnimi plastmi različnih vrst tal;
|
|
—
|
oviranem, kakor jih navadno najdemo na ornih zemljiščih ali kakor se pojavljajo, kadar se vzorci jemljejo s kopanjem in se uporablja ta preskusna metoda (2).
|
|
(1)
|
Holland, P. T. (1996). Glossary of Terms Relating to Pesticides. IUPAC Reports on Pesticide (36). Pure & Appl. Chem. 68, 1167–1193.
|
|
(2)
|
OECD Test Guideline 304 A: Inherent Biodegradability in Soil (sprejeto 12. maja 1981).
|
Dodatek 2
Slika 1
Primer nedeljivih kolon za izpiranje iz stekla
z dolžino 35 cm in notranjim premerom 5 cm (1)

|
(1)
|
Drescher, N. (1985). Moderner Acker- und Pflanzenbau aus Sicht der Pflanzenschutzmittelindustrie. In Unser Boden – 70 Jahre Agrarforschung der BASF AG, 225–236. Verlag Wissenschaft und Politik, Köln.
|
Slika 2
Primer deljive kovinske kolone z notranjim premerom 4 cm (1)

|
(1)
|
Burkhard, N., Eberle D. O., in Guth, J. A. (1975). Model systems for studying the environmental behaviour of pesticides. Environmental Quality and Safety, Suppl. Vol. III, 203–213.
|
Dodatek 3
Primeri faktorjev relativne mobilnosti
(64)
(RMF) za različne kemikalije za zaščito pridelka (1) (2) in ustrezni razredi mobilnosti
(66)
|
Razpon RMF
|
Kemikalija (RMF)
|
Razred mobilnosti
|
|
≤ 0,15
|
paration (< 0,15), flurodifen (0,15)
|
I
nemobilen
|
|
0,15–0,8
|
profenofos (0,18), propikonazol (0.23), diazinon (0,28), diuron (0,38), terbutilazin (0,52), metidation (0,56), prometrin (0,59), propazin (0,64), alaklor (0,66), metolaklor (0,68)
|
II
nekoliko mobilen
|
|
0,8–1,3
|
monuron (65) (1,00), atrazin (1,03), simazin (1,04), fluometuron (1,18)
|
III
zmerno mobilen
|
|
1,3–2,5
|
prometon (1,67), cianazin (1,85), bromacil (1,91), karbutilat (1,98)
|
IV
precej mobilen
|
|
2,5–5,0
|
karbofuran (3,00), dioksakarb (4,33)
|
V
mobilen
|
|
> 5,0
|
monokrotofos (> 5,0), mikrotofos (> 5,0)
|
VI
zelo mobilen
|
|
(1)
|
Guth, J. A. (1985). Adsorption/desorption. V Joint International Symposium ‚Physicochemical Properties and their Role in Environmental Hazard Assessment.‘ Canterbury, Združeno kraljestvo, 1.–3. julij 1985.
|
|
(2)
|
Guth, J. A., in Hörmann, W. D. (1987). Problematik und Relevanz von Pflanzenschutzmittel-Spuren im Grund (Trink-) Wasser. Schr.Reihe Verein WaBoLu, 68, 91–106.
|
|
(3)
|
Harris, C. I. (1967). Movement of herbicides in soil. Weeds 15, 214–216.
|
|
(4)
|
Helling, C. S. (1971). Pesticide mobility in soils. Soil Sci. Soc. Am. Proc. 35, 743–748.
|
|
(5)
|
McCall, P. J., Laskowski, D. A., Swann, R. L., in Dishburger, H. J. (1981). Measurements of sorption coefficients of organic chemicals and their use in environmental fate analysis. In Test Protocols for Environmental Fate and Movement of Toxicants. Proceedings of AOAC Symposium, AOAC, Washington D.C.
|
|
(6)
|
Hollis, J. M. (1991). Mapping the vulnerability of aquifers and surface waters to pesticide contamination at the national/regional scale. BCPC Monograph No. 47 Pesticides in Soil and Water, 165–174.
|
C.45 OCENA EMISIJ IZ LESA, TRETIRANEGA S SREDSTVI ZA ZAŠČITO LESA, V OKOLJE: LABORATORIJSKA METODA ZA LESNE PROIZVODE, KI NISO PREKRITI IN SO V STIKU S SLADKO VODO ALI MORSKO VODO
UVOD
|
1.
|
Ta preskusna metoda ustreza Smernici za preskušanje OECD (TG) 313 (2007). Emisije iz lesa, tretiranega s sredstvi za zaščito lesa, v okolje je treba kvantificirati, da se omogoči ocena okoljskega tveganja tretiranega lesa. Preskusna metoda opisuje laboratorijsko metodo za oceno emisij iz lesa, tretiranega s sredstvi za zaščito lesa, v dveh primerih, kjer bi lahko emisije vstopile v okolje:
|
—
|
emisije iz tretiranega lesa v stiku s sladko vodo. Emisije s površine tretiranega lesa bi lahko vstopile v vodo;
|
|
—
|
emisije iz tretiranega lesa v stiku z morsko vodo. Emisije s površine tretiranega lesa bi lahko vstopile v vodo.
|
|
|
2.
|
Ta preskusna metoda je namenjena preskušanju emisij iz lesa in lesnih proizvodov, ki niso prekriti in so v stiku s sladko vodo ali morsko vodo. Razredi uporabe se uporabljajo mednarodno in kategorizirajo biološko nevarnost, ki ji bodo izpostavljeni tretirani proizvodi. Razredi uporabe opredeljujejo tudi razmere, v katerih se tretirani proizvodi uporabljajo, in določajo ekosisteme (zrak, voda, tla), ki bi lahko bili izpostavljeni tveganju zaradi lesa, tretiranega s sredstvi za zaščito lesa.
|
|
3.
|
Preskusna metoda je laboratorijski postopek za odvzem vzorcev (emisatov) iz vode, ki se uporablja za potapljanje tretiranega lesa, v vedno večjih časovnih razmikih po izpostavljenosti. Količina emisij v emisatu je povezana s površino lesa in trajanjem izpostavljenosti, da se oceni pretok v mg/m2/dan. Zato se lahko oceni pretok (hitrost izpiranja) po vedno daljših obdobjih izpostavljenosti.
|
|
4.
|
Količina emisij se lahko uporabi pri oceni okoljskega tveganja tretiranega lesa.
|
ZAČETNI POMISLEKI
|
5.
|
Mehanizem izpiranja s sladko vodo na površini lesa se ne šteje za enakega vrsti in resnosti izpiranja s površine lesa z morsko vodo. Zato je za sredstva ali zmesi za zaščito lesa, ki se uporabljajo za tretiranje lesa, uporabljenega v okoljih z morsko vodo, potrebna študija izpiranja lesa z morsko vodo.
|
|
6.
|
Les mora v primeru lesa, tretiranega s sredstvom za zaščito lesa, predstavljati komercialno uporabljen les. Tretirati ga je treba v skladu z navodili proizvajalca sredstva za zaščito lesa ter v skladu z ustreznimi standardi in specifikacijami. Pred začetkom preskusa je treba navesti parametre za kondicioniranje lesa po tretiranju.
|
|
7.
|
Vzorci lesa, ki se uporabijo, morajo predstavljati uporabljene lesne proizvode (npr. glede vrste, gostote in drugih lastnosti).
|
|
8.
|
Preskus se lahko uporablja za les s postopkom penetracije ali površinskega nanosa ali za tretiran les, ki je dodatno obvezno površinsko tretiran (npr. z barvo, ki se nanese kot zahteva za komercialno uporabo).
|
|
9.
|
Za določanje količine, vsebnosti in vrste emisij iz lesa so pomembni sestava, količina, pH in agregatno stanje vode.
|
NAČELO PRESKUSNE METODE
|
10.
|
Preskusni vzorci lesa, tretiranega s sredstvi za zaščito lesa, se potopijo v vodo. Voda (emisat) se odvzame in kemijsko analizira večkrat v obdobju izpostavljenosti, ki je dovolj dolgo za izvedbo statističnih izračunov. Na podlagi analitskih rezultatov se izračunajo ravni emisije v mg/m2/dan. Navesti je treba obdobja vzorčenja. Preskusi z netretiranimi vzorci se lahko prekinejo, če se v prvih treh podatkovnih točkah ne zazna naravno ozadje.
|
|
11.
|
Vključitev netretiranih vzorcev lesa omogoča določitev ravni naravnega ozadja emisatov iz lesa, ki niso uporabljena sredstva za zaščito lesa.
|
MERILA KAKOVOSTI
Točnost
|
12.
|
Točnost preskusne metode za oceno emisij je odvisna od preskusnih vzorcev, ki predstavljajo komercialno tretiran les, kako voda predstavlja dejansko vodo in kako režim izpostavljenosti predstavlja naravne pogoje.
|
|
13.
|
Točnost, natančnost in ponovljivost analitske metode je treba določiti pred izvedbo preskusa.
|
Obnovljivost
|
14.
|
Odvzamejo in analizirajo se trije vzorci vode, srednja vrednost pa se šteje za vrednost emisije. Obnovljivost rezultatov v enem laboratoriju in med različnimi laboratoriji je odvisna od režima potopitve in lesa, uporabljenega kot preskusni vzorec.
|
Sprejemljiv razpon rezultatov
|
15.
|
Sprejemljiv je razpon rezultatov tega preskusa, kjer se zgornje in spodnje vrednosti razlikujejo za manj kot en red velikosti.
|
PRESKUSNI POGOJI
Voda
|
16.
|
Scenariji izpiranja s sladko vodo: za uporabo v preskusu izpiranja, če se ocenjuje les, izpostavljen sladki vodi, se priporoča deionizirana voda (npr. ASTM D 1193, tip II). Temperatura vode mora biti 20 °C ± 2 °C, izmerjeni pH in temperaturo vode pa je treba vključiti v poročilo o preskusu. Analiza vzorcev uporabljene vode, odvzetih pred potopitvijo tretiranih vzorcev, omogoča oceno analiziranih kemikalij v vodi. To je kontrola za določitev ravni naravnega ozadja kemikalij, ki se nato kemijsko analizirajo.
|
|
17.
|
Scenariji izpiranja z morsko vodo: za uporabo v preskusu izpiranja, če se ocenjuje les, izpostavljen morski vodi, se priporoča sintetična morska voda (npr. ASTM D 1141, nadomestna oceanska voda brez težkih kovin). Temperatura vode mora biti 20 °C ± 2 °C, izmerjeni pH in temperaturo vode pa je treba vključiti v poročilo o preskusu. Analiza vzorcev uporabljene vode, odvzetih pred potopitvijo tretiranih vzorcev, omogoča oceno analiziranih kemikalij v vodi. To je kontrola za analizo ravni naravnega ozadja pomembnih kemikalij.
|
Preskusni vzorci lesa
|
18.
|
Vrste lesa morajo biti značilne za vrste lesa, uporabljene za preskušanje učinkovitosti sredstev za zaščito lesa. Priporočene vrste so Pinus sylvestris L. (rdeči bor), Pinus resinosa Ait. (ameriški rdeči bor) ali Pinus spp (južni bor). Z drugimi vrstami se lahko izvedejo dodatni preskusi.
|
|
19.
|
Uporabiti je treba les s premim potekom aksialnih elementov brez grč. Izogibati se je treba materialu smolnatega videza. Les mora predstavljati les, ki je komercialno dostopen. Zabeležiti je treba vir, gostoto in število letnic na 10 mm.
|
|
20.
|
Preskusni vzorci lesa naj bi bili v skladu z velikostjo blokov iz EN 113(mere 25 mm × 50 mm × 15 mm) v sklopih po pet, pri čemer so vzdolžni profili vzporedni z aksialnimi elementi, čeprav se lahko uporabijo tudi druge mere, kot je 50 mm × 150 mm × 10 mm. Preskusni vzorec je treba v celoti potopiti v vodo. Preskusni vzorci morajo zajemati 100 % beljave. Vsak vzorec se edinstveno označi, da se lahko identificira kadar koli med preskusom.
|
|
21.
|
Vsi vzorci morajo biti skobljani ali žagani tangentno na letnice, površine pa ne smejo biti obrušene.
|
|
22.
|
Za analizo se uporabi vsaj pet sklopov preskusnih vzorcev lesa: trije sklopi vzorcev se tretirajo s sredstvom za zaščito lesa, en sklop vzorcev je netretiran, en sklop vzorcev pa se uporabi za oceno odstotka vlage po sušenju preskusnih vzorcev pred tretiranjem. Pripravi se dovolj preskusnih vzorcev za izbiro treh sklopov vzorcev, ki so v obsegu 5 % srednje vrednosti retencij sredstva za zaščito lesa vseh preskusnih vzorcev.
|
|
23.
|
Vsi preskusni vzorci so na prečnem prerezu lesa zaščiteni s kemikalijo, ki preprečuje penetracijo sredstva za zaščito lesa v prečni prerez lesa vzorcev ali preprečuje izpiranje iz vzorcev prek prečnega prereza. Ločevati je treba med vzorci, ki se uporabljajo za površinski nanos, in postopki penetracije za nanos tesnilnega sredstva za prečni prerez lesa. Tesnilno sredstvo za prečni prerez lesa je treba nanesti pred tretiranjem le v primeru površinskega nanosa.
|
|
24.
|
Prečni prerez lesa mora biti prost za tretiranje s postopki penetracije. Zato je treba prečni prerez lesa vzorcev zaščititi na koncu obdobja kondicioniranja. Emisijo je treba oceniti le za vzdolžno površino. Tesnilna sredstva je treba pregledati in po potrebi ponovno nanesti pred začetkom izpiranja, pri čemer se jih ne sme ponovno nanesti, ko se je izpiranje že začelo.
|
Posoda za potopitev
|
25.
|
Posoda je izdelana iz inertnega materiala in je dovolj velika, da lahko sprejme pet vzorcev lesa v skladu z EN 113 v 500 ml vode, pri čemer je razmerje med površino in prostornino vode 0,4 cm2/ml.
|
Oprema za preskusne vzorce
|
26.
|
Preskuse vzorce podpira oprema, ki zagotavlja, da so vse izpostavljene površine vzorca v stiku z vodo.
|
POSTOPEK TRETIRANJA S SREDSTVOM ZA ZAŠČITO LESA
Priprava tretiranih preskusnih vzorcev
|
27.
|
Preskusni vzorec lesa, ki ga je treba tretirati s sredstvom za zaščito lesa, ki se preskuša, se tretira po metodi, določeni za sredstvo za zaščito lesa, kar je lahko s postopkom tretiranja s penetriranjem ali postopkom površinskega nanosa, ki je lahko potopitev, zanašanje ali premazovanje.
|
Sredstva za zaščito lesa, ki se nanašajo s postopki tretiranja s penetracijo
|
28.
|
Pripraviti je treba raztopino sredstva za zaščito lesa, ki bo zagotovila določeno absorpcijo ali retencijo, kadar se nanaša s postopki tretiranja s penetracijo. Izmerijo se teža in mere preskusnega vzorca lesa. Postopek tretiranja s penetracijo mora biti takšen, kot je določen za nanos sredstev za zaščito na les, ki se uporablja kot razred uporabe 4 ali 5. Vzorec se po tretiranju ponovno stehta, retencija sredstva za zaščito lesa (kg/m3) pa se izračuna po enačbi:

|
|
29.
|
Opozoriti je treba, da se lahko v tem preskusu uporabi les, tretiran v industrijskem obratu za obdelavo (npr. z vakuumsko impregnacijo). Uporabljene postopke je treba zabeležiti, retencijo materiala, ki je bil tretiran po teh postopkih, pa je treba analizirati in zabeležiti.
|
Sredstva za zaščito lesa, ki se nanašajo s postopki površinskega nanosa
|
30.
|
Postopki površinskega nanosa vključujejo potopitev, zanašanje ali premazovanje preskusnih vzorcev lesa. Postopek in stopnja nanosa (npr. litri/m2) morata biti takšna, kot je določeno za površinski nanos sredstva za zaščito lesa.
|
|
31.
|
V tem primeru je treba tudi opozoriti, da se lahko v tem preskusu uporablja tudi les, tretiran v industrijskem obratu za obdelavo. Uporabljene postopke je treba zabeležiti, retencijo materiala, ki je bil tretiran po teh postopkih, pa je treba analizirati in zabeležiti.
|
Kondicioniranje preskusnih vzorcev po tretiranju
|
32.
|
Tretirane preskusne vzorce je treba po tretiranju kondicionirati v skladu s priporočili dobavitelja preskusnega sredstva za zaščito glede na zahteve za označevanje sredstva za zaščito lesa ali kot v skladu s praksami komercialnega tretiranja ali v skladu s standardom EN 252.
|
Priprava in izbira preskusnih vzorcev
|
33.
|
Po kondicioniranju po tretiranju se izračuna srednja retencija skupine preskusnih izračunov, za meritve izpiranja pa se naključno izberejo trije reprezentativni sklopi vzorcev z retencijo v razponu 5 % sredine skupine.
|
POSTOPEK ZA MERITVE EMISIJE SREDSTVA ZA ZAŠČITO LESA
Metoda potopitve
|
34.
|
Preskusni vzorci se stehtajo in nato v celoti potopijo v vodo, pri čemer se zabeležita datum in čas. Posoda se prekrije, da se zmanjša izhlapevanje.
|
|
35.
|
Voda se menjuje v naslednjih razmikih: 6 ur, 1 dan, 2 dni, 4 dni, 8 dni, 15 dni, 22 dni, 29 dni (opomba: to so skupni časi, ne časi razmikov). Zabeležiti je treba čas in datum menjave vode ter maso vode, odvzete in posode.
|
|
36.
|
Po vsaki menjavi vode se vzorec vode, v kateri je bil potopljen sklop preskusnih vzorcev, zadrži za poznejšo kemijsko analizo.
|
|
37.
|
Postopek vzorčenja omogoča izračun profila količine emisij v odvisnosti od časa. Vzorce je treba shraniti v pogojih, v katerih se analit ohrani, npr. v hladilniku v temi, da se zmanjša mikrobna rast v vzorcih pred analizo.
|
MERITVE EMISIJ
Tretirani vzorci
|
38.
|
V odvzeti vodi se kemijsko analizirajo aktivna snov in/ali zadevni produkti razgradnje/transformacije, če je primerno.
|
Netretirani vzorci
|
39.
|
Odvzem vode (emisata) v tem sistemu in poznejša analiza kemikalij, ki so bile izprane iz netretiranih vzorcev lesa, omogočata oceno mogoče ravni emisije sredstva za zaščito lesa iz netretiranega lesa. Odvzem in analiza emisata po podaljšanjih obdobjih izpostavljenosti omogočata oceno hitrosti spremembe ravni emisije glede na čas. Ta analiza je kontrolni postopek za določitev ravni naravnega ozadja preskusne kemikalije v netretiranem lesu za potrditev, da les, uporabljen kot vir vzorcev, ni bil predhodno tretiran s sredstvom za zaščito lesa.
|
PODATKI IN POROČANJE
Kemijske analize
|
40.
|
Odvzeta voda se kemijsko analizira, pri čemer se rezultat analize vode izrazi v ustreznih enotah, npr. μg/l.
|
Sporočanje podatkov
|
41.
|
Vsi rezultati se zabeležijo. V Dodatku sta navedena primer predlaganega obrazca za beleženje za en sklop tretiranih preskusnih vzorcev in zbirna tabela za izračun srednjih vrednosti emisije v posameznih razmikih vzorčenja.
|
|
42.
|
Dnevni pretok emisije v mg/m2/dan se izračuna tako, da se sredina treh meritev pri treh ponovitvah deli s številom dni potopitve.
|
Poročilo o preskusu
|
43.
|
V poročilo o preskusu je treba navesti vsaj naslednje informacije:
|
—
|
naziv dobavitelja sredstva za zaščito lesa, ki se preskuša,
|
|
—
|
določeno edinstveno ime ali oznako preskušanega sredstva za zaščito lesa,
|
|
—
|
trgovsko ali splošno ime aktivnih snovi z generičnim opisom dodatkov (npr. pomožno topilo, smola) in sestavo v % m/m sestavin,
|
|
—
|
zadevno retencijo ali obremenitev (v kg/m3 oziroma l/m2), določeno za les, ki se uporabi v stiku z vodo,
|
|
—
|
vrste uporabljenega lesa z gostoto in hitrostjo rasti v letnicah na 10 mm,
|
|
—
|
obremenitev ali retencijo preskušenega sredstva za zaščito lesa in enačbo, ki se uporabi za izračun retencije, izražene kot l/m2 ali kg/m3,
|
|
—
|
metodo nanosa sredstva za zaščito lesa, pri čemer se navede uporabljen časovni razpored za postopek penetracije, in metodo nanosa, če se je uporabilo površinsko tretiranje,
|
|
—
|
datum nanosa sredstva za zaščito lesa in oceno odstotka vlage v preskusnih vzorcih, izraženo v odstotkih,
|
|
—
|
uporabljene postopke kondicioniranja, pri čemer se navedejo tip, pogoji in trajanje,
|
|
—
|
specifikacijo tesnilnega sredstva za prečni prerez lesa in število nanosov,
|
|
—
|
specifikacijo vseh poznejših tretiranj lesa, npr. specifikacijo dobavitelja, vrsto, značilnosti in obremenitev barve,
|
|
—
|
čas in datum posamezne potopitve, količino vode, uporabljene za posamezno potopitev preskusnih vzorcev, in količino vode, ki jo med potopitvijo absorbira les,
|
|
—
|
vsa odstopanja od opisane metode in vse dejavnike, ki bi lahko vplivali na rezultate.
|
|
LITERATURA
|
(1)
|
Evropski standard EN 84:1997: Zaščitna sredstva za les – Pospešeno staranje zaščitenega lesa pred biološkim preskušanjem – Postopek izpiranja.
|
|
(2)
|
Evropski standard EN 113/A1:2004: Zaščitna sredstva za les – Preskusna metoda za ugotavljanje preventivne učinkovitosti zaščitnih sredstev proti glivam odprtotrosnicam – Ugotavljanje toksičnih vrednosti.
|
|
(3)
|
Evropski standard EN 252:1989: Terenska preskusna metoda za ugotavljanje relativne preventivne učinkovitosti zaščitnega sredstva za les v stiku z zemljo.
|
|
(4)
|
Evropski standard EN 335 – Del 1: 2006. Trajnost lesa in lesnih materialov – Definicije razredov uporabe – Del 1: Splošno.
|
|
(5)
|
American Society for Testing and Materials Standards, ASTM D 1141– 1998. Standard Practice for the Preparation of Substitute Ocean Water, Without Heavy Metals. Annual Book of ASTM Standards, zvezek 11.02.
|
|
(6)
|
American Society for Testing and Materials Standards, ASTM D 1193–77 Type II – 1983. Specifications for Reagent Water. Annual Book of ASTM Standards, zvezek 11.01.
|
Dodatek 1
Obrazec za beleženje za preskusno metodo
Ocena emisij iz lesa, tretiranega s sredstvi za zaščito lesa, v okolje: laboratorijska metoda za lesne proizvode, ki niso prekriti in so v stiku s sladko vodo ali morsko vodo
|
Preskusni laboratorij
|
|
|
Sredstvo za zaščito lesa
|
|
Dobavitelj zaščitnega sredstva za les
|
|
|
Določeno edinstveno ime ali oznaka zaščitnega sredstva za les
|
|
|
Trgovinsko ali splošno ime zaščitnega sredstva za les
|
|
|
Dodatki
|
|
|
Ustrezna retencija za les, ki se uporabi v stiku z vodo
|
|
|
Nanos
|
|
Metoda nanosa
|
|
|
Datum nanosa
|
|
|
Enačba, uporabljena za izračun retencije:
|
|
|
Postopek kondicioniranja
|
|
|
Trajanje kondicioniranja
|
|
|
Tesnilno sredstvo za prečni prerez lesa/število nanosov
|
|
|
Poznejše tretiranje
|
če je primerno
|
|
Preskusni vzorci
|
|
Vrste lesa
|
|
|
Gostota lesa
|
(minimum … srednja vrednost … maksimum)
|
|
Hitrost rasti (letnice na 10 mm)
|
(minimum … srednja vrednost … maksimum)
|
|
Odstotek vlage
|
|
|
Obseg preskusa
(67)
|
Retencija (npr. kg/m3)
|
|
Tretiran ‚x‘
|
srednja vrednost in standardni odklon ali razpon za 5 vzorcev
|
|
Tretiran ‚y‘
|
srednja vrednost in standardni odklon ali razpon za 5 vzorcev
|
|
Tretiran ‚z‘
|
srednja vrednost in standardni odklon ali razpon za 5 vzorcev
|
|
Netretiran
|
|
|
Variacija parametrov preskusne metode
|
npr. kakovost vode, mere preskusnih vzorcev itd.
|
|
Čas
|
Menjava vode
|
Masa vzorca
|
Absorpcija vode
|
Vzorec vode
|
|
Tretiran (sredina)
|
Netretiran
|
Tretiran (sredina)
|
Netretiran
|
|
Preskusna voda
|
x
|
y
|
z
|
|
|
Datum
|
g
|
g
|
g
|
g
|
št.
|
pH
|
pH
|
pH
|
pH
|
|
začetek
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6 ur
|
|
|
|
|
|
1
|
|
|
|
|
|
24 ur
|
|
|
|
|
|
2
|
|
|
|
|
|
2 dni
|
|
|
|
|
|
3
|
|
|
|
|
|
4 dni
|
|
|
|
|
|
4
|
|
|
|
|
|
8 dni
|
|
|
|
|
|
5
|
|
|
|
|
|
15 dni
|
|
|
|
|
|
6
|
|
|
|
|
|
22 dni
|
|
|
|
|
|
7
|
|
|
|
|
|
29 dni
|
|
|
|
|
|
8
|
|
|
|
|
|
|
|
Za vsako aktivno snov je treba pripraviti ločene tabele.
|
Čas
|
Menjava vode
|
Rezultati analize
|
|
Netretirani vzorci
|
Tretirani vzorci
|
|
Koncentracija aktivne sestavine v vodi
mg/l
|
Izpuščena količina
mg/m2
|
Raven emisije
mg/m2/dan
|
Koncentracija aktivne sestavine v vodi
|
Izpuščena količina
|
Raven emisije
|
|
x
|
y
|
z
|
Sredina
|
x
|
y
|
z
|
Sredina
|
x
|
y
|
z
|
Sredina
|
|
|
Datum
|
mg/l
|
mg/l
|
mg/l
|
mg/l
|
mg/m2
|
mg/m2
|
mg/m2
|
mg/m2
|
mg/m2/dan
|
mg/m2/dan
|
mg/m2/dan
|
mg/m2/dan
|
|
6 ur
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
24 ur
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 dni
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 dni
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8 dni
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
15 dni
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
22 dni
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
29 dni
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Opomba: Ker bi se lahko rezultati netretiranih vzorcev uporabili za popravljanje ravni emisije iz tretiranih vzorcev, morajo biti prvi rezultati netretiranih vzorcev, vse vrednosti tretiranih vzorcev pa so ‚popravljene vrednosti‘. Popravi se lahko tudi začetna analiza vode.
Dodatek 2
Opredelitve
Kemikalija
: snov ali zmes.
Preskusna kemikalija
: vsaka snov ali zmes, preskušena z uporabo te preskusne metode.
C.46 BIOAKUMULACIJA V BENTOŠKIH MALOŠČETINCIH, KI ŽIVIJO V USEDLINAH
UVOD
|
1.
|
Ta preskusna metoda ustreza Smernici za preskušanje OECD (TG) 315 (2008). Endobentoške živali, ki jedo usedline, so lahko izpostavljene snovem v usedlinah (1). Med navedenimi živalmi, ki jedo usedline, imajo vodni maloščetinci pomembno vlogo v tleh vodnih sistemov. Živijo v usedlinah in so pogosto najpogostejše vrste, zlasti v habitatih z okoljskimi razmerami, ki so škodljive za druge živali. Z bioturbacijo usedlin in kot plen lahko te živali močno vplivajo na biološko razpoložljivost takih snovi za druge organizme, npr. bentivore vrste rib. V nasprotju z epibentoškimi organizmi se endobentoški vodni maloščetinci zarijejo v usedlino in jedo delce usedlin pod njihovo površino. Zato so ti organizmi izpostavljeni snovem prek številnih načinov absorpcije, vključno z neposrednim stikom, zaužitjem onesnaženih delcev usedline, porno vodo in vodo nad usedlino. Nekatere vrste bentoških maloščetincev, ki se trenutno uporabljajo pri ekotoksikološkem preskušanju, so opisane v Dodatku 6.
|
|
2.
|
Med parametri, ki so značilni za bioakumulacijo snovi, so zlasti bioakumulacijski faktor (BAF), konstanta hitrosti absorpcije usedline (ks) in konstanta hitrosti izločanja (ke). Podrobnejše opredelitve navedenih parametrov so navedene v Dodatku 1.
|
|
3.
|
Za oceno bioakumulacijskega potenciala snovi na splošno in proučitev bioakumulacije snovi, ki bi se lahko porazdelile v usedlini ali na njej, je potrebna preskusna metoda za posamezna področja (1) (2) (3) (4).
|
|
4.
|
Ta preskusna metoda je zasnovana za oceno bioakumulacije snovi v usedlinah v endobentoških črvih maloščetincih. Preskusna snov se primeša v usedlino. Uporaba usedline s primešano preskusno snovjo naj bi simulirala onesnaženo usedlino.
|
|
5.
|
Ta metoda temelji na obstoječih preskusnih metodah za strupenost usedlin in bioakumulacijo (1) (4) (5) (6) (7) (8) (9). Drugi koristni dokumenti so: razprave in rezultati mednarodne delavnice (11) ter rezultat mednarodnega krožnega preskusa (12).
|
|
6.
|
Ta preskus se uporablja za stabilne, nevtralne organske snovi, ki se lahko združijo z usedlinami. S to metodo se lahko meri tudi bioakumulacija stabilnih kovinoorganskih spojin v usedlini (12). Ne uporablja se za kovine in druge elemente v sledovih (11), če se načrt preskusa ne spremeni glede na prostornine substrata in vode ter po možnosti glede na velikost vzorca tkiva.
|
PREDPOGOJ IN INFORMACIJE O PRESKUSNI SNOVI
|
7.
|
Obstaja le nekaj dobro uveljavljenih kvantitativnih razmerij med strukturo in aktivnostjo (QSAR) za procese bioakumulacije, ki so trenutno na voljo (14). Najpogosteje uporabljeno razmerje je korelacija med bioakumulacijo in biokoncentracijo stabilnih organskih snovi ter njihovo lipofilnostjo (izražena kot logaritem porazdelitvenega koeficienta oktanol/voda (log Kow); za opredelitev glej Dodatek 1), ki je bil razvit za opis porazdelitve snovi med vodo in ribe. Na podlagi tega razmerja so bile vzpostavljene tudi korelacije za področje usedlin (15) (16) (17) (18). Korelacija Kow-log BCF je lahko kot pomembnejše kvantitativno razmerje med strukturo in aktivnostjo koristno za prvo predhodno oceno bioakumulacijskega potenciala snovi v usedlinah. Vendar lahko na BAF vpliva vsebnost lipidov preskusnega organizma in vsebnost organskega ogljika v usedlini. Zato se lahko tudi porazdelitveni koeficient organski ogljik/voda (Koc) uporabi kot pomembnejša determinanta bioakumulacije organskih snovi v usedlini.
|
|
8.
|
Ta preskus se uporablja za:
|
—
|
stabilne organske snovi z vrednostmi log Kow med 3,0 in 6,0 (5) (19) ter superlipofilne snovi, ki kažejo log Kow več kot 6,0 (5),
|
|
—
|
snovi, ki se uvrščajo v razred organskih snovi, znanih po svojem bioakumulacijskem potencialu v živih organizmih, npr. površinsko aktivne snovi ali zelo adsorpcijske snovi (npr. visok Koc).
|
|
|
9.
|
Pred začetkom študije je treba pridobiti informacije o preskusni snovi, kot so varnostni ukrepi, ustrezni pogoji shranjevanja, stabilnost in analitske metode. Navodila za preskušanje snovi, ki jih je težko preskušati zaradi fizikalno-kemijskih lastnosti, so na voljo v (20) in (21). Pred izvajanjem preskusa bioakumulacije z vodnimi maloščetinci morajo biti znane naslednje informacije o preskusni snovi:
|
—
|
splošno ime, kemijsko ime (najbolje ime IUPAC), strukturna formula, registrska številka CAS, čistost,
|
|
—
|
topnost v vodi [preskusna metoda A.6 (22)],
|
|
—
|
porazdelitveni koeficient oktanol/voda, Kow [preskusni metodi A.8 in A.24 (22)],
|
|
—
|
porazdelitveni koeficient usedlina/voda, izražen kot Kd ali Koc [preskusna metoda C.19 (22)],
|
|
—
|
hidroliza [preskusna metoda C.7 (22)],
|
|
—
|
fototransformacija v vodi (23),
|
|
—
|
parni tlak [preskusna metoda A.4 (22)],
|
|
—
|
lahka biološka razgradljivost [preskusni metodi C.4 in C.29 (22)],
|
|
—
|
površinska napetost [preskusna metoda A.5 (22)],
|
|
—
|
kritična micelna koncentracija (24).
|
Poleg navedenega bi bile pomembne naslednje informacije, kadar so na voljo:
|
—
|
biološka razgradnja v vodnem okolju [preskusni metodi C.24 in C.25 (22)],
|
|
|
10.
|
Radioaktivno označene preskusne snovi lahko pospešijo analizo vodnih vzorcev, vzorcev usedlin in bioloških vzorcev ter se lahko uporabijo pri odločitvi, ali je treba identificirati in kvantificirati produkte razgradnje. Opisana metoda je bila validirana z mednarodnim krožnim preskusom (12) za snovi z oznako 14C. Če se merijo skupni radioaktivni ostanki, bioakumulacijski faktor (BAF) temelji na matični snovi, vključno z vsemi ohranjenimi produkti razgradnje. Študija metabolizma se lahko združi tudi s študijo bioakumulacije z analizo in kvantifikacijo deleža matične snovi in njenih produktov razgradnje v vzorcih, odvzetih na koncu absorpcijske faze ali na vrhuncu bioakumulacije. V vsakem primeru je priporočljivo, da izračun BAF temelji na koncentraciji matične snovi v organizmih in ne le na skupnih radioaktivnih ostankih.
|
|
11.
|
Informacije, ki se zahtevajo poleg lastnosti preskusne snovi, so strupenost za vrsto maloščetincev, ki se uporabi v preskusu, kot je srednja smrtna koncentracija (LC50) v času, potrebnem za absorpcijsko fazo, da se zagotovi, da so izbrane koncentracije izpostavljenosti veliko nižje od ravni strupenosti. Prednost je treba dati vrednostim strupenosti, ki izhajajo iz dolgotrajnih raziskav subletalnih končnih točk (EC50), če so na voljo. Če taki podatki niso na voljo, se lahko koristne informacije zagotovijo s preskusom akutne strupenosti v pogojih, ki so enaki pogojem za preskus bioakumulacije, ali podatki o strupenosti za druge nadomestne vrste.
|
|
12.
|
Na voljo mora biti ustrezna analitska metoda znane točnosti, natančnosti in občutljivosti za kvantifikacijo snovi v preskusnih raztopinah, usedlinah in biološkem materialu, pa tudi podrobnosti o pripravi in shranjevanju vzorcev ter varnostni listi za snov. Prav tako morajo biti znane analitske meje zaznavnosti preskusne snovi v vodi, usedlini in črvjem tkivu. Če se uporabi radioaktivno označena preskusna snov, morajo biti znani tudi specifična radioaktivnost (tj. Bq mol– 1), položaj radioaktivno označenega atoma in odstotek radioaktivnosti, povezan z nečistočami. Specifična radioaktivnost preskusne snovi mora biti čim večja, da se zaznajo čim nižje preskusne koncentracije (11).
|
|
13.
|
Na voljo morajo biti informacije o značilnostih usedline, ki se uporabi (npr. izvor usedline ali njenih sestavin, pH in koncentracija amoniaka v porni vodi (naravne usedline), vsebnost organskega ogljika (TOC), porazdelitev delcev glede na velikost (odstotek peska, mulja in gline) in odstotek suhe teže) (6).
|
NAČELO PRESKUSA
|
14.
|
Preskus obsega dve fazi: fazo absorpcije (izpostavljenost) in fazo izločanja (po izpostavljenosti). V fazi absorpcije so črvi izpostavljeni usedlini, ki ji je primešana preskusna snov, ter prekriti z modelno razredčevalno vodo in uravnoteženi, kot je primerno (11). Kontrolna skupna črvov se nahaja v enakih pogojih brez preskusne snovi.
|
|
15.
|
Za fazo izločanja se črvi prenesejo v sistem usedline in vode brez preskusne snovi. Faza izločanja je potrebna za zbiranje informacij o hitrosti, s katero preskusni organizmi izločajo preskusno snov (19) (25). Faza izločanja je potrebna vedno, razen če je bila absorpcija preskusne snovi v fazi izpostavljenosti nepomembna (npr. ni statistične razlike med koncentracijo preskusne snovi v preskusnih in kontrolnih črvih). Če v fazi absorpcije ni bilo doseženo stabilno stanje, se lahko kinetika – BAFk, konstanti hitrosti absorpcije in izločanja – določi z rezultati iz faze izločanja. Sprememba koncentracija preskusne snovi v črvih ali na njih se spremlja ves čas trajanja obeh faz preskusa.
|
|
16.
|
V fazi absorpcije se meritve izvajajo, dokler BAF ne doseže ravnotežja ali stabilnega stanja. Faza absorpcije bi običajno morala trajati 28 dni. Praktične izkušnje kažejo, da je 12- do 14-dnevna faza absorpcije dovolj, da več stabilnih nevtralnih organskih snovi doseže stabilno stanje (6) (8) (9).
|
|
17.
|
Če pa stabilno stanje ni doseženo v 28 dneh, se faza izločanja začne s prenosom izpostavljenih maloščetincev v posode, ki vsebujejo enak medij brez preskusne snovi. Faza izločanja se prekine, ko se doseže 10-odstotna raven koncentracije, izmerjene v črvih na 28. dan faze absorpcije, ali po največ 10 dneh. Raven ostankov v črvih na koncu faze izločanja se zabeleži kot dodatna končna točka, npr. kot neizločeni ostanki (NER). Najbolje je, da se bioakumulacijski faktor (BAFss) izračuna kot razmerje koncentracije v črvih (Ca) in v usedlini (Cs) pri očitnem stabilnem stanju ter kot kinetični bioakumulacijski faktor, BAFK, kot razmerje med konstanto hitrosti absorpcije iz usedline (ks) in konstanto hitrosti izločanja (ke) ob predpostavki kinetike prvega reda. Če stabilno stanje ni doseženo v 28 dneh, se BAFK izračuna iz konstante hitrosti absorpcije in konstante hitrosti izločanja. Za izračun glej Dodatek 2. Če se kinetika prvega reda ne upošteva, je treba uporabiti bolj zapletene modele (Dodatek 2 in vir (25)).
|
|
18.
|
Če stabilno stanje ni doseženo v 28 dneh, se lahko faza absorpcije podaljša, pri čemer se skupine izpostavljenih črvov, če so na voljo, izpostavijo nadaljnjim meritvam, dokler ni doseženo stabilno stanje; vzporedno se mora kljub temu na 28. dan faze absorpcije začeti faza izločanja.
|
|
19.
|
Konstanta hitrosti absorpcije, konstanta hitrosti izločanja (ali konstante pri uporabi zapletenejših modelov), kinetični bioakumulacijski faktor (BAFK), in kjer je mogoče, meje zaupanja za vse te parametre se izračunajo po računalniških modelnih enačbah (za modele glej Dodatek 2). Ustreznost prileganja modela je mogoče ugotoviti na podlagi korelacijskega koeficienta ali determinacijskega koeficienta (koeficienti blizu ena pomenijo dobro prileganje).
|
|
20.
|
Za zmanjšanje variabilnosti rezultatov preskusa za organske snovi z visoko lipofilnostjo je treba izraziti tudi bioakumulacijske faktorje glede na vsebnost lipidov v preskusnih organizmih in vsebnost organskega ogljika (TOC) v usedlini (faktor akumulacije v organizmih glede na usedlino ali BSAF v kg TOC usedline kg– 1 vsebnosti lipidov v črvih). Ta pristop temelji na izkušnjah in teoretskih korelacijah za vodno področje, kjer za nekatere kemijske razrede velja jasna povezava med potencialom snovi za bioakumulacijo in njeno lipofilnostjo, ki je bila dobro uveljavljena za ribe kot modelne organizme (14) (25) (27). Obstaja tudi povezava med vsebnostjo lipidov v preskusnih ribah in zaznano bioakumulacijo takih snovi. Podobne korelacije so bile ugotovljene tudi pri bentoških organizmih (15) (16) (17) (18). Če je na voljo dovolj črvjega tkiva, se lahko vsebnost lipidov v preskusnih živalih določi z uporabo istega biološkega materiala kot za določanje koncentracije preskusne snovi. Vendar je praktično uporabiti aklimatizirane kontrolne živali vsaj na začetku ali bolje na koncu faze absorpcije za meritev vsebnosti lipidov, ki se lahko nato uporabi za normaliziranje vrednosti BAF.
|
VELJAVNOST PRESKUSA
|
21.
|
Za veljavnost preskusa veljata naslednja pogoja:
|
—
|
Skupna smrtnost črvov (v kontrolah in tretiranih vzorcih) do konca preskusa ne sme preseči 20 % začetnega števila.
|
|
—
|
Dokazati je treba tudi, da se črvi zarijejo v usedlino, kar omogoča čim večjo izpostavljenost. Za podrobnosti glej odstavek 28.
|
|
OPIS METODE
Preskusne vrste
|
22.
|
V preskusu se lahko uporabi več vrst vodnih maloščetincev. Najpogosteje uporabljene vrste so navedene v Dodatku 6.
|
|
23.
|
Da se dokaže zdravstveno stanje preskusnih živali (1) (6), je treba preskuse strupenosti (96 ur, samo v vodi) izvajati v rednih časovnih razmikih (npr. vsak mesec) z referenčno strupeno snovjo, kot je kalijev klorid (KCl) ali bakrov sulfat (CuSO4) (1). Če se referenčni preskusi strupenosti ne izvajajo v rednih časovnih razmikih, je treba serijo organizmov, ki se uporabijo v preskusu bioakumulacije v usedlini, preveriti z referenčno strupeno snovjo. Z meritvijo vsebnosti lipidov se lahko zagotovijo tudi koristne informacije o stanju živali.
|
Gojenje preskusnih organizmov
|
24.
|
Da se zagotovi zadostno število črvov za izvajanje preskusov bioakumulacije, bo morda treba črve gojiti v stalni laboratorijski kulturi za posamezno vrsto. Metode laboratorijskega gojenja za izbrane preskusne vrste so povzete v Dodatku 6. Za podrobnosti glej vire (8) (9) (10) (18) (28) (29) (30) (31) (32).
|
Oprema
|
25.
|
Pri vseh delih opreme se je treba izogibati uporabi materialov, ki se lahko raztopijo, adsorbirajo preskusne snovi ali iz katerih se lahko izperejo druge snovi in ki škodljivo učinkujejo na preskusne živali. Uporabiti je mogoče standardne pravokotne ali valjaste komore iz kemijsko inertnega materiala in s primerno prostornino, ki ustrezajo stopnji obremenitve, tj. številu preskusnih črvov. Pri dodajanju vode ali zraka se je treba izogibati uporabi mehkih plastičnih epruvet. Za vso opremo, ki je v stiku s preskusnim medijem, je treba uporabiti politetrafluoroetilen, nerjavno jeklo in/ali steklo. Pri snoveh z visokimi adsorpcijskimi koeficienti, kot so sintetični piretroidi, bo morda potrebno silanizirano steklo. V teh primerih je treba opremo po uporabi zavreči (5). Pri radioaktivno označenih preskusnih snoveh in hlapnih snoveh je potrebno pazljivo ravnanje, da se preprečita odstranitev in uhajanje odstranjene preskusne snovi. Uporabiti je treba lovilnike (npr. steklene plinske izpiralke), ki vsebujejo ustrezne absorbente za zadrževanje morebitnih ostankov, ki izparijo iz preskusnih komor (11).
|
Voda
|
26.
|
Kakovost vode nad usedlino mora biti taka, da preskusni vrsti omogoča preživetje ves čas trajanja aklimatizacije in preskušanja, ne da bi pokazala kakršen koli neobičajen videz ali obnašanje. Priporoča se, da se v preskusih in laboratorijskih kulturah črvov kot voda nad usedlino uporabi modelna razredčevalna voda v skladu s preskusno metodo C.1 (25). Dokazano je bilo, da lahko v tej vodi preživi, raste in se razmnožuje več vrst (8), pri čemer se zagotovi čim večja standardizacija preskusnih pogojev in pogojev gojenja. Vodo je treba opredeliti vsaj glede pH, prevodnosti in trdote. Analiza vode, kar zadeva mikro onesnaževala, pred uporabo bi morala dati koristne informacije (Dodatek 4).
|
|
27.
|
Voda mora biti ves čas preskusa enake kakovosti. pH vode nad usedlino mora biti med 6 in 9. Skupna trdota mora biti na začetku preskusa med 90 in 400 mg CaCO3 na liter (7). Razponi za pH in trdoto v navedeni modelni razredčevalni vodi so navedeni v preskusni metodi C.1 (25). Če obstaja sum interakcije med ioni, ki povzročajo trdoto vode, in preskusno snovjo, je treba uporabiti vodo z manjšo trdoto. V Dodatku 4 so povzeta dodatna merila za sprejemljivo vodo za redčenje v skladu z OECD TG 210 (34).
|
Usedlina
|
28.
|
Usedlina mora biti take kakovosti, ki omogoča preživetje in po možnosti razmnoževanje preskusnih organizmov med aklimatizacijo in preskušanjem, ne da bi bili pri tem videti nenormalno ali bi se nenormalno obnašali. Črvi se morajo zariti v usedlino. Obnašanje pri zarivanju lahko vpliva na izpostavljenost in zato za BAF. Zato je treba izogibanje usedlini ali obnašanje pri zarivanju zabeležiti, kadar motnost vode nad usedlino omogoča taka opazovanja. Črvi (v kontrolah in tretiranih vzorcih) se morajo v usedlino zariti v 24 urah po vnosu v preskusne posode. Če se ne zarijejo ali se opazi izogibanje usedlini (npr. več kot 20 % v več kot polovici faze absorpcije), to pomeni, da preskusni pogoji niso ustrezni, da preskusni organizmi niso zdravi ali da to obnašanje sproža koncentracija preskusne snovi. V takem primeru je treba preskus ustaviti in ponoviti v boljših pogojih. Dodatne informacije o zaužitju usedline se lahko dobijo z metodami, opisanimi v (35) (36), ki določajo zaužitje usedline ali izbiro delcev v preskusnih organizmih. Če je vsaj prisotnost iztrebkov ali njihova odsotnost na površini usedline opazna, kar kaže, da so črvi usedlino zaužili, jo je treba zabeležiti in obravnavati pri razlagi rezultatov preskusa glede na načine izpostavljenosti.
|
|
29.
|
V preskusih in laboratorijskih kulturah črvov se priporoča uporaba umetne usedline, ki temelji na umetnih tleh, opisanih v preskusni metodi C.8 (40) (Dodatek 5), saj naravne usedline primerne kakovosti morda niso na voljo celo leto. Poleg tega lahko domorodni organizmi in možna prisotnost mikro onesnaževal v naravnih usedlinah vplivajo na preskus. V umetni usedlini lahko preživi, raste in se razmnožuje več vrst (8).
|
|
30.
|
Umetno usedlino je treba opredeliti vsaj glede izvora sestavin, porazdelitve velikosti zrn (delež peska, mulja in gline) vsebnosti organskega ogljika (TOC), vsebnosti vode in pH. Meritev redoks potenciala je neobvezna. Vendar se lahko kot preskusne usedline in/ali usedline za gojenje uporabijo naravne usedline z neonesnaženih mest (1). Naravne usedline je treba opredeliti vsaj glede izvora (mesto odvzema), pH in amoniaka porne vode, vsebnosti organskega ogljika (TOC), porazdelitve delcev glede na velikost (delež peska, mulja in gline) ter deleža vsebnosti vode (6). Če se pričakuje razvoj amoniaka, se priporoča, da se naravna usedlina pred primešanjem preskusne snovi sedem dni kondicionira v enakih pogojih, kot vladajo v poznejšem preskusu. Na koncu tega obdobja kondicioniranja je treba vodo nad usedlino odstraniti in zavreči. Analiza usedline ali njenih sestavin, kar zadeva mikro onesnaževala, pred uporabo bi lahko dala koristne informacije.
|
Priprava
|
31.
|
Ravnanje z naravnimi usedlinami pred uporabo v laboratoriju je opisano v (1) (6) (44). Priprava umetne usedline je opisana v Dodatku 5.
|
Shranjevanje
|
32.
|
Naravne usedline je treba v laboratoriju shranjevati čim manj časa. Po priporočilu U.S. EPA (6) je najdaljše obdobje shranjevanja 8 tednov v temi pri 4 ± 2 °C. V posodah za shranjevanje nad usedlino ne sme biti prostora v zaprti posodi nad fazno mejo plin-kapljevina. Priporočila za shranjevanje umetne usedline so navedena v Dodatku 5.
|
Aplikacija preskusne snovi
|
33.
|
Usedlini se primeša preskusna snov. Postopek primešanja preskusne snovi vključuje prekritje ene ali več sestavin usedline s preskusno snovjo. Na primer kremenov pesek ali del njega (npr. 10 g kremenovega peska na preskusno posodo) se lahko namoči z raztopino preskusne snovi v ustreznem topilu, ki nato počasi izhlapi do suhega stanja. Prekriti del se lahko nato vmeša v vlažno usedlino. Pri pripravi usedline je treba upoštevati količino peska, prinesenega z mešanico preskusne snovi in peska, tj. usedlino je torej treba pripraviti z manj peska (6).
|
|
34.
|
Pri naravni usedlini se lahko preskusna snov doda s primešanjem preskusne snovi v suhi del usedline, kot je opisano zgoraj za umetno usedlino, ali z vmešanjem preskusne snovi v mokro usedlino, pri čemer nato vsa uporabljena sredstva za raztapljanje izhlapijo. Primerna topila za primešanje preskusne snovi v usedlino so etanol, metanol, etilen glikol monometil eter, etilen glikol dimetil eter, dimetilformamid in trietilen glikol (5) (34). Strupenost in hlapnost topila ter topnost preskusne snovi v izbranem topilu morajo biti glavna merila za izbiro primernega sredstva za raztapljanje. Dodatna navodila glede postopkov primešanja preskusne snovi so navedena v Environment Canada (1995) (41). Paziti je treba, da je preskusna snov, dodana usedlini, v njej temeljito in enakomerno razporejena. Ponovitvene podvzorce usedline s primešano preskusno snovjo je treba analizirati, da se preveri koncentracija preskusne snovi v usedlini in da se določi stopnja homogenosti razporeditve preskusne snovi.
|
|
35.
|
Ko je usedlina s primešano preskusno snovjo in vodo nad usedlino pripravljena, je zaželeno, da se omogoči porazdelitev preskusne snovi med usedlino in vodno fazo. To je po možnosti treba storiti v temperaturnih in prezračevalnih pogojih, ki bodo uporabljeni v preskusu. Ustrezen čas za uravnoteženje je odvisen od usedline in snovi, lahko pa traja od več ur do več dni in v redkih primerih do več tednov (4 do 5 tednov) (28) (42). V tem preskusu se na uravnoteženje ne čaka, ampak se za to priporoča obdobje od 48 ur do 7 dni. Odvisno od namena študije, npr. kdaj je treba posnemati okoljske razmere, se lahko usedlina s primešano preskusno snovjo uravnoteži ali stara dlje (11).
|
IZVEDBA PRESKUSA
Predhodni preskus
|
36.
|
Da se izboljšajo preskusni pogoji končno veljavnega preskusa, npr. izbira koncentracije preskusnih snovi, trajanje faze absorpcije in izločanja, bi bilo koristno izvesti predhodni poskus. Med predhodnim preskusom je treba opazovati in zabeležiti obnašanje črvov, na primer izogibanje usedlini, tj. kadar črvi pobegnejo iz usedline, kar bi lahko povzročila preskusna snov in/ali sama usedlina. Izogibanje usedlini se lahko uporabi tudi kot subletalni parameter v predhodnem preskusu za oceno koncentracij preskusne snovi, ki se uporabijo v preskusu bioakumulacije.
|
Pogoji izpostavljenosti
Trajanje faze absorpcije
|
37.
|
Preskusni organizmi so preskusni snovi izpostavljeni v fazi absorpcije. Prvi vzorec je treba odvzeti od 4 do 24 ur po začetku faze absorpcije. Fazo absorpcije je treba izvajati največ 28 dni (1) (6) (11), razen če se lahko dokaže, da je bilo ravnovesje doseženo že prej. Stabilno stanje je doseženo, ko: (i) je grafični prikaz bioakumulacijskih faktorjev v vseh obdobjih vzorčenja v odvisnosti od časa vzporeden s časovno osjo, (ii) se tri zaporedne analize BAF na vzorcih, odvzetih v razmiku najmanj dveh dni, druga od druge ne razlikujejo za več kot 20 % in (iii) ni statistično značilnih razlik med tremi obdobji vzorčenja (na podlagi statističnih primerjav, npr. analize variance in regresijske analize). Če stabilno stanje ni doseženo v 28 dneh, se lahko faza absorpcije konča z začetkom faze izločanja, pri čemer se lahko BAFK izračuna iz konstant hitrosti absorpcije in izločanja (glej tudi odstavke 16 do 18).
|
Trajanje faze izločanja
|
38.
|
Prvi vzorec je treba odvzeti od 4 do 24 ur po začetku faze izločanja, ker se lahko v začetnem obdobju pojavijo hitre spremembe v ostankih tkiva. Prekinitev faze izločanja se priporoča, če je koncentracija preskusne snovi nižja od 10 % koncentracije v stabilnem stanju ali po najdaljšem trajanju, tj. 10 dneh. Raven ostankov v črvih na koncu faze izločanja se sporoči kot sekundarna končna točka. Na to obdobje pa lahko vendarle vpliva obdobje, v katerem koncentracija preskusne snovi v črvih ostaja nad analitsko mejo zaznavnosti.
|
Preskusni organizmi
Število preskusnih črvov
|
39.
|
Število črvov na vzorec mora zagotavljati takšno maso črvjega tkiva, da je masa preskusne snovi na vzorec na začetku faze absorpcije oziroma na koncu faze izločanja znatno večja od meje zaznavnosti preskusne snovi v biološkem materialu. V navedenih delih faze absorpcije in faze izločanja je koncentracija v preskusnih živalih običajno razmeroma nizka (6) (8) (18). Ker je teža posameznih živali v več vrstah vodnih maloščetincev zelo majhna (5– 10 mg mokre teže na posamezno žival pri Lumbriculus variegatus in Tubifex tubifex), se lahko črvi zadevne ponovitvene preskusne komore združijo za tehtanje in analizo preskusne kemikalije. Pri preskusnih vrstah z večjo težo posameznih živali (npr. Branchiura sowerbyi) se lahko uporabijo ponovitve, ki vsebujejo en osebek, vendar je treba v takih primerih število ponovitev povečati za pet za vsako točko vzorčenja (11) Opozoriti pa je treba, da vrsta B. sowerbyi ni bila vključena v krožni preskus (12), zato se ne priporoča kot prednostna vrsta v preskusu.
|
|
40.
|
Uporabiti je treba črve podobne velikosti (za L. variegatus glej Dodatek 6). Prihajati morajo iz istega vira in biti odrasle ali velike živali istega starostnega razreda (glej Dodatek 6). Teža in starost živali bi lahko znatno vplivali na vrednosti BAF (npr. zaradi različne vsebnosti lipidov in/ali prisotnosti jajc); te parametre je treba točno zabeležiti. Za meritev srednje mokre in suhe teže je treba pred začetkom preskusa stehtati suho težo podvzorca.
|
|
41.
|
Pri Tubifex tubifex in Lumbriculus variegatus se v obdobju preskušanja pričakuje razmnoževanje. Odsotnost razmnoževanja v preskusu bioakumulacije je treba zabeležiti in upoštevati pri razlagi rezultatov preskusa.
|
Obremenitev
|
42.
|
Uporabiti je treba visoka razmerja med usedlino in črvi ter vodo in črvi, da se čim bolj zmanjša koncentracija preskusne snovi v usedlini med fazo absorpcije in preprečijo zmanjševanja koncentracije raztopljenega kisika. Izbrana stopnja obremenitve mora ustrezati tudi naravnim gostotam populacije izbrane vrste (43). Za Tubifex tubifex se priporoča na primer stopnja obremenitve 1–4 mg črvjega tkiva (mokra teža) na gram mokre usedline (8) (11). V virih (1) in (6) se za L. variegatus priporoča stopnja obremenitve ≤ 1 g suhe teže črvjega tkiva na 50 g organskega ogljika v usedlini.
|
|
43.
|
Črvi, ki se bodo uporabili v preskusu, se odstranijo iz kulture s presejanjem usedline za kulturo. Živali (odrasli ali veliki črvi brez znakov nedavne fragmentacije) se prenesejo v steklene posode (npr. petrijevke), ki vsebujejo čisto vodo. Če se preskusni pogoji razlikujejo od pogojev gojenja, mora biti dovolj 24-urna faza aklimatizacije. Pred tehtanjem se iz črvov odstrani odvečna voda. To se lahko izvede s previdnim prenosom črvov na predhodno navlaženo papirnato brisačo. Za sušenje črvov se ne priporoča uporaba absorpcijskega papirja, saj bi ta lahko povzročil stres pri črvih ali jih poškodoval. Brunson in drugi (1998) priporočajo uporabo 1,33-kratne količine neosušenih črvov glede na ciljno biomaso. Teh dodatnih 33 % ustreza razliki med osušenimi in neosušenimi črvi (28).
|
|
44.
|
Na začetku faze absorpcije (dan 0 preskusa) se preskusni organizmi odstranijo iz komore za aklimatizacijo in naključno razporedijo v posode (npr. petrijevke), ki vsebujejo modelno razredčevalno vodo, tako da se v vsako posodo dodajajo skupine dveh črvov, dokler ni v vsaki posodi deset črvov. Vsaka od teh skupin črvov se lahko naključno prenese v ločene preskusne posode, npr. z mehkimi kleščami iz plavljenega jekla. Preskusne posode se nato inkubirajo v preskusnih pogojih.
|
Hranjenje
|
45.
|
Ker je vsebnosti hranilnih snovi v umetni usedlini majhna, je treba usedlino izboljšati z virom hrane. Da se izpostavljenost preskusnih organizmov ne bi podcenila, npr. s selektivnim hranjenjem z neonesnaženo hrano, je treba usedlini pred vnosom preskusne snovi dodati hrano, ki je potrebna za razmnoževanje in rast preskusnih organizmov (glej Dodatek 5).
|
Razmerje med usedlino in vodo
|
46.
|
Priporočeno razmerje med usedlino in vodo je 1: 4 (45). To razmerje se šteje za primerno za ohranjanje koncentracij kisika na ustreznih ravneh in preprečevanje kopičenja amoniaka v vodi na usedlino. Vsebnost kisika v vodi nad usedlino je treba ohranjati pri nasičenosti ≥ 40 %. Vodo nad usedlino je treba nežno prezračevati (npr. 2–4 mehurčki na sekundo) s pasteurjevo pipeto, nastavljene približno 2 cm nad površino usedline, da se čim bolj zmanjšajo motnje usedline.
|
Svetloba in temperatura
|
47.
|
Obdobje osvetljenosti v kulturi in preskusu traja 16 ur (1) (6). Jakost svetlobe na območju preskusa mora biti približno 500 – 1 000 luksov. Temperatura mora biti ves čas preskusa 20 ± 2 °C.
|
Preskusne koncentracije
|
48.
|
Za določanje kinetike absorpcije se uporabi ena koncentracija (čim nižja), vendar se lahko uporabi tudi druga (višja) koncentracija (npr. (46)). V tem primeru se vzorci odvzamejo in analizirajo v stabilnem stanju ali po 28 dneh, da se potrdi BAF, izmerjen pri nižji koncentraciji (11). Višjo koncentracijo je treba izbrati, da se izključijo škodljivi učinki (npr. z izbiro približno 1 % najnižje znane kronične učinkovite koncentracije ECx, kot je izpeljana iz zadevnih študij kronične strupenosti). Nižje preskusne koncentracije morajo biti znatno višje od meje zaznavnosti v vzorcih usedline in bioloških vzorcih z uporabljeno analitsko metodo. Če je učinkovita koncentracija preskusne snovi blizu analitski meji zaznavnosti, se priporoča uporaba radioaktivno označene preskusne snovi z visoko specifično radioaktivnostjo.
|
Tretirane in kontrolne ponovitve
|
49.
|
Najmanjše število tretiranih ponovitev za kinetične meritve mora biti tri na točko vzorčenja (11) v celotni fazi absorpcije in izločanja. Dodatne ponovitve je treba uporabiti npr. za neobvezne dodatne datume vzorčenja. Za fazo izločanja se pripravi ujemajoče se število ponovitev z usedlino brez primešane preskusne snovi v vodi nad usedlino, da se lahko tretirani črvi na koncu faze absorpcije prenesejo iz določenih tretiranih posod v netretirane posode. Skupno število tretiranih ponovitev mora biti zadostno za fazo absorpcije in fazo izločanja.
|
|
50.
|
Namesto tega se lahko črvi, namenjeni vzorčenju v fazi izločanja, izpostavijo v veliki posodi, ki vsebuje usedlino s primešano preskusno snovjo iste serije, kot je bila uporabljena za kinetiko absorpcije. Dokazati je treba, da so preskusni pogoji (npr. debelina usedline, razmerje med usedlino in vodo, obremenitev, temperatura, kakovost vode) primerljivi s ponovitvami, namenjenimi za fazo absorpcije. Na koncu faze absorpcije je treba iz te posode za analizo odvzeti vzorce vode, usedline in črvov, zadostno število velikih črvov, ki ne kažejo znakov nedavne fragmentacije pa je treba previdno odstraniti in prenesti v ponovitve, pripravljene za fazo izločanja (npr. deset organizmov na ponovitveno posodo).
|
|
51.
|
Če se poleg vode ne uporabi nobeno drugo topilo, je treba za biološko analizo in analizo naravnega ozadja zagotoviti vsaj 9 ponovitev negativne kontrole (vsaj 3 vzorci na začetku, 3 na koncu absorpcije in 3 na koncu izločanja). Če se za nanos preskusne snovi uporabi sredstvo za raztapljanje, je treba izvesti kontrolo s topilom (na začetku je treba vzorčiti vsaj 3 ponovitve, 3 na koncu faze absorpcije in 3 na koncu faze izločanja). V tem primeru je treba za vzorčenje na koncu faze absorpcije zagotoviti vsaj 4 ponovitve negativne kontrole (brez topila). Te ponovitve je mogoče biološko primerjati s kontrolo s topilom, da se pridobijo informacije o morebitnem vplivu topila na preskusne organizme. Podrobnosti so navedene v Dodatku 3.
|
Pogostost meritev kakovosti vode
|
52.
|
V fazi absorpcije in izločanja je treba v vodi nad usedlino izmeriti vsaj naslednje parametre kakovosti vode:
|
Temperatura
|
v eni posodi vsake stopnje tretiranja na datum vzorčenja in v eni kontrolni posodi enkrat na teden ter na začetku in koncu obdobja absorpcije in izločanja; zabeleži se lahko tudi temperatura v okoliškem mediju (zrak prostora ali vodna kopel) ali v eni reprezentativni preskusni posodi, npr. ves čas ali v urnih razmikih,
|
|
Vsebnost raztopljenega kisika
|
v eni posodi vsake stopnje tretiranja in v eni kontrolni posodi na datum vzorčenja; izrazi se v mg/L in % ASV (vrednost nasičenosti zraka),
|
|
Dovod zraka
|
nadzoruje se vsaj enkrat na dan (delavniki) in po potrebi prilagodi,
|
|
pH
|
v eni tretirani posodi vsake stopnje tretiranja na datum vzorčenja in v eni kontrolni posodi enkrat na teden ter na začetku in koncu obdobja absorpcije in izločanja,
|
|
Skupna trdota vode
|
vsaj v eni tretirani posodi in eni kontrolni preskusni posodi na začetku in koncu obdobja absorpcije in izločanja, izražena v mg/l CaCO3,
|
|
Skupna vsebnost amoniaka
|
vsaj v eni tretirani posodi in eni kontrolni preskusni posodi na začetku in koncu obdobja absorpcije in izločanja; izražena v mg/l NH4
+ ali NH3 ali skupnega amonijskega dušika.
|
|
Vzorčenje in analiza črvov, usedline in vode
Časovni razpored vzorčenja
|
53.
|
Primeri časovnih razporedov vzorčenja za 28-dnevno fazo absorpcije in 10-dnevno fazo izločanja so navedeni v Dodatku 3.
|
|
54.
|
Vzorci vode in usedline se odvzamejo iz preskusnih komor za določitev koncentracije preskusne snovi pred vnosom črvov ter v fazah absorpcije in izločanja. Med preskusom se koncentracije preskusne snovi določijo v črvih, usedlini in vodi, da se spremlja razporeditev preskusne snovi v delih preskusnega sistema.
|
|
55.
|
V fazi absorpcije in v fazi izločanja se črvi, usedlina in voda vzorčijo vsaj šestkrat.
|
|
56.
|
Vzorčenje se nadaljuje, dokler se ne doseže ravnotežje (stabilno stanje) (glej Dodatek 1) ali 28 dni. Če se ravnotežje ne doseže v 28 dneh, naj se začne faza izločanja. Ko se začne faza izločanja, se določeni črvi prenesejo v ponovitvene komore, ki vsebujejo netretirano usedlino in vodo (glej odstavka 17 in 18).
|
Vzorčenje in priprava vzorcev
|
57.
|
Vzorci vode se pridobijo z odlivanjem, izsesavanjem ali pipetiranjem prostornine, ki zadostuje za meritev količine preskuse snovi v vzorcu.
|
|
58.
|
Preostala voda nad usedlino se previdno odlije ali izsesa iz preskusnih komor. Vzorce usedline je treba odvzeti previdno, da se črvi čim manj motijo.
|
|
59.
|
V času vzorčenja se vsi črvi odstranijo iz ponovitve preskusa, npr. s suspendiranjem usedline z vodo nad usedlino in porazdelitvijo vsebine posameznih ponovitev na plitev pladenj ter pobiranjem črvov s prijemalkami iz plavljenega jekla. Na plitvem steklenem ali jeklenem pladnju se hitro sperejo z vodo. Odvečna voda se odstrani. Črvi se previdno prenesejo v predhodno stehtano posodo in stehtajo. Črvi se žrtvujejo z zamrzovanjem (npr. ≤ – 18 °C). Zabeležiti je treba prisotnost in število kokonov in/ali mladičev.
|
|
60.
|
Na splošno je treba črve stehtati in žrtvovati takoj po vzorčenju brez faze čiščenja prebavil, da se pridobi konzervativen BAF, ki vključuje vsebino onesnaženih prebavil in preprečijo izgube telesnih ostankov v katerem koli obdobju čiščenja prebavil izključno v vodi (8). Pričakuje se, da se snovi z log Kow nad 5 v obdobju čiščenja prebavil izključno v vodi ne bodo znatno izločevale, medtem ko bi se lahko snovi z log Kow, nižjim od 4, lahko izgubile v znatnih količinah (47).
|
|
61.
|
V fazi izločanja črvi čistijo svoja prebavila v čisto usedlino. To pomeni, da meritve, izvedene neposredno pred fazo izločanja, vključujejo usedlino prebavil, medtem ko se šteje, da se po prvih 4–24 urah faze izločanja večina vsebnosti onesnaženih prebavil nadomesti s čisto usedlino (11) (47). Koncentracija v črvih iz tega vzorca se lahko nato šteje za koncentracijo tkiva po čiščenju prebavil. Da bi upoštevali razredčenje koncentracije preskusne snovi z neonesnaženo usedlino v fazi izločanja, je mogoče oceniti težo vsebnosti prebavil iz razmerja med mokro težo črvov in težo pepela črvov ali razmerja med suho težo črvov in težo pepela črvov.
|
|
62.
|
Če je namen specifične študije merjenje biološke razpoložljivosti in dejanskih ostankov tkiva v preskusnih organizmih, je treba stehtati, 6 ur čistiti v čisti vodi (47) in pred analizo ponovno stehtati vsaj podvzorec tretiranih živali (npr. iz treh dodatnih ponovitvenih posod), po možnosti vzorčenih v stabilnem stanju. Podatki o teži črvov in telesni koncentraciji tega podvzorca se lahko nato primerjajo z vrednostmi, pridobljenimi iz neočiščenih črvov. Črvi, namenjeni meritvi izločanja, se ne smejo čistiti pred prenosom v čisto usedlino, da se čim bolj zmanjša dodatni stres za živali.
|
|
63.
|
Zaželeno je, da se vzorci vode, usedline in črvov analizirajo takoj (tj. 1–2 dni) po odstranitvi, da se prepreči razgradnja ali druge izgube ter da se v teku preskusa izračunata približni hitrosti absorpcije in izločanja. S takojšnjo analizo se izognemo tudi zamudam pri ugotavljanju, kdaj je bilo doseženo ravnotežje.
|
|
64.
|
Če se analiza ne izvede takoj, je treba vzorce shraniti v ustreznih pogojih. Pred začetkom študije se pridobijo informacije o stabilnosti in ustreznih pogojih shranjevanja za določeno preskusno snov (npr. trajanje in temperatura shranjevanja, postopki ekstrakcije itd.). Če take informacije niso na voljo in se oceni, da so nujne, se lahko za določitev stabilnosti pri shranjevanju hkrati izvedejo kontrole tkiv s primešano preskusno snovjo.
|
Kakovost analitske metode
|
65.
|
Ker je za celoten postopek pomembna točnost, natančnost in občutljivost analitske metode, uporabljene za preskusno snov, je treba praktično preveriti, da sta natančnost in obnovljivost kemijske analize, kakor tudi rekuperacija preskusne snovi iz vzorcev vode, usedline in črvov, zadovoljivi za določeno metodo. Zagotoviti je treba tudi, da se preskusna snov v kontrolnih komorah ne zazna v koncentracijah, ki so višje od naravnega ozadja. Po potrebi se vrednosti Cw, Cs in Ca popravijo za rekuperacije in vrednosti naravnega ozadja kontrol. Med celotnim preskusom je treba vse vzorce obravnavati tako, da se čim bolj zmanjšata onesnaženje in izguba (npr. zaradi adsorpcije preskusne snovi na napravi za vzorčenje).
|
|
66.
|
Zabeležiti in sporočiti je treba skupno rekuperacijo in rekuperacijo preskusne snovi v črvih, usedlini, vodi in lovilnikih, če se uporabijo, ki vsebujejo absorbente za zadrževanje izhlapele preskusne snovi.
|
|
67.
|
Ker se priporoča uporaba radioaktivno označenih snovi, je mogoče analizirati skupno radioaktivnosti (npr. matičnih snovi in produktov razgradnje). Če pa je analitsko izvedljivo, lahko kvantifikacija matične snovi in produktov razgradnje v stabilnem stanju ali na koncu faze absorpcije zagotovi pomembne informacije. Če se take meritve nameravajo izvesti, je treba vzorce izpostaviti ustreznim postopkom ekstrakcije, da se lahko matična snov ločeno kvantificira. Kadar zaznani produkt razgradnje predstavlja znaten delež (npr. > 10 %) radioaktivnosti, izmerjene v preskusnih organizmih v stabilnem stanju ali na koncu faze absorpcije, se priporoča identifikacija takih produktov razgradnje (5).
|
|
68.
|
Zaradi nizke biomase osebkov pogosto ni mogoče določiti koncentracije preskusne snovi v posameznih črvih, razen če se kot preskusna vrsta uporabi Branchiura sowerbyi (40–50 mg mokre teže na črva) (11). Zato je združevanje osebkov, vzorčenih iz dane preskusne posode, sprejemljivo, vendar omejuje statistične postopke, ki se lahko uporabijo za podatke. Če sta določen statistični postopek in moč pomembna faktorja, je treba v preskus vključiti ustrezno število preskusnih živali in/ali ponovitvenih preskusnih komor, da se prilagodi zaželenemu združevanju, postopku in moči.
|
|
69.
|
Priporoča se, da se BAF izrazi kot funkcija skupne mokre teže, skupne suhe teže ter po potrebi (npr. pri zelo lipofilnih snoveh) kot funkcija vsebnosti lipida in vsebnosti organskega ogljika usedline. Za določanje vsebnosti lipida je treba uporabiti ustrezne metode (48) (49). Kot standardna metoda (48) se lahko priporoči tehnika z ekstrakcijo kloroforma/metanola (50). Da bi se izognili uporabi kloriranih topil, pa se lahko uporabi prilagojena krožno preskušena metoda Bligha in Dyerja (50), kot je opisana v (51). Ker različne metode ne dajo enakih vrednosti (48), je pomembno navesti podrobnosti o uporabljeni metodi. Kadar je to mogoče, tj. če je na voljo dovolj črvjega tkiva, se vsebnost lipidov izmeri na istem vzorcu ali ekstraktu, kot je bil pripravljen za analizo preskusne snovi, ker je treba lipide pogosto odstraniti iz ekstrakta, preden se analizira s kromatografijo (5). Vendar je praktično uporabiti aklimatizirane kontrolne živali vsaj na začetku ali bolje na koncu faze absorpcije za meritev vsebnosti lipidov, npr. v treh vzorcih.
|
PODATKI IN POROČANJE
Obdelava rezultatov
|
70.
|
Krivulja absorpcije preskusne snovi se dobi z grafičnim prikazom koncentracije preskusne snovi v črvih ali na njih v fazi absorpcije v odvisnosti od časa na aritmetični lestvici. Če je krivulja dosegla ravnotežje, se izračuna BAFss v stabilnem stanju:

|
|
71.
|
Kinetični bioakumulacijski faktor (BAFK) se določi kot razmerje med ks in ke. Konstanta izločanja (ke) se običajno določi na podlagi krivulje izločanja (tj. grafičnega prikaza koncentracije preskusne snovi v črvih v fazi izločanja). Konstanta hitrosti absorpcije ne nato izračuna na podlagi kinetike krivulje absorpcije. Za izračun BAFK ter konstant hitrosti ks in ke je najbolje uporabiti računalniške metode za ocenjevanje nelinearnih parametrov (glej Dodatek 2). Če izločanje očitno ni prvega reda, je treba uporabiti kompleksnejše modele (25) (27) (52).
|
|
72.
|
Faktor akumulacije v organizmih glede na usedlino (BSAF) se določi z normalizacijo BAFK za vsebnost lipidov v črvih in skupno vsebnost organskega ogljika v usedlini.
|
Razlaga rezultatov
|
73.
|
Rezultate je treba razlagati previdno, kadar se izmerjene koncentracije preskusnih koncentracij pojavljajo na ravneh blizu meje zaznavnosti uporabljene analitske metode.
|
|
74.
|
Jasno določeni krivulji absorpcije in izločanja sta pokazateljici kakovostnih podatkov o bioakumulaciji. Meje zaupanja za vrednosti BAF na podlagi dobro zasnovanih študij na splošno ne smejo presegati 25 % (5).
|
Poročilo o preskusu
|
75.
|
Poročilo o preskusu mora vsebovati naslednje informacije:
|
|
Preskusna snov
|
—
|
fizikalno stanje in fizikalno-kemijske lastnosti, npr. log Kow, topnost v vodi,
|
|
—
|
kemijske identifikacijske podatke; vir preskusne snovi, identiteto in koncentracijo vseh uporabljenih topil,
|
|
—
|
če gre za radioaktivno označeno snov, točen položaj radioaktivnih atomov, specifično radioaktivnost in odstotek radioaktivnosti, združene z nečistočami.
|
|
|
|
Preskusne vrste
|
—
|
znanstveno ime, sev, vir, morebitno predhodno tretiranje, aklimatizacijo, starost, red velikosti itd.
|
|
|
|
Preskusni pogoji
|
—
|
uporabljeni preskusni postopek (npr. statični, polstatični ali pretočni),
|
|
—
|
vrsto in značilnosti uporabljene osvetljenosti in obdobja osvetljenosti,
|
|
—
|
načrt preskusa (npr. število, material in velikost preskusnih komor, prostornina vode, masa in prostornina usedline,stopnja nadomeščene vodne prostornine (za pretočne ali polstatične postopke), vsako prezračevanje pred preskusom in med njim, število ponovitev, število črvov na ponovitev, število preskusnih koncentracij, trajanje faz absorpcije in izločanja, pogostost vzorčenja),
|
|
—
|
metodo priprave preskusne snovi in dodajanja preskusne snovi ter razloge za izbiro metode,
|
|
—
|
nominalne preskusne koncentracije,
|
|
—
|
vir sestavin umetne vode in usedline ali, če se uporabijo naravni mediji, vir vode in usedline, opis vsakega predhodnega tretiranja, rezultate vseh dokazovanj sposobnosti preskusnih živali za življenje in/ali razmnoževanje v uporabljenih medijih, značilnosti usedline (pH, amoniak v porni vodi (naravne usedline) vsebnost organskega ogljika (TOC), porazdelitev delcev glede na velikost (delež peska, mulja in gline), delež vsebnosti vode in vse druge izvedene meritve) ter značilnosti vode (pH, trdota, prevodnost, temperatura, koncentracija raztopljenega kisika, koncentracija sledi klora (če so bile merjene) in vse druge izvedene meritve),
|
|
—
|
nominalno in izmerjeno suho težo v % mokre teže (ali razmerje med suho težo in mokro težo) umetne usedline, izmerjeno suho težo v % mokre teže (ali razmerje med suho težo in mokro težo) za naravne usedline,
|
|
—
|
kakovost vode v preskusnih komorah, kot jo določajo temperatura, pH, amoniak, skupna trdota in koncentracija raztopljenega kisika,
|
|
—
|
podrobne informacije o tretiranju vzorcev vode, usedline in črvov, vključno s podrobnostmi o pripravi, shranjevanju, postopkih primešanja preskusne snovi, ekstrakciji in analitskih postopkih (in natančnosti) za preskusno snov ter o vsebnosti lipidov in rekuperaciji preskusne snovi.
|
|
|
|
Rezultati
|
—
|
smrtnost kontrolnih črvov in črvov v posamezni preskusni komori ter vse zaznane subletalne učinke, vključno z nenormalnim obnašanjem (npr. izogibanje usedlini, prisotnost ali odsotnost iztrebkov, odsotnost razmnoževanja),
|
|
—
|
izmerjeno suho težo v % mokre teže (ali razmerje med suho težo in mokro težo) usedline in preskusnih organizmov (koristno za normalizacijo),
|
|
—
|
vsebnost lipidov v črvih,
|
|
—
|
krivulje, ki prikazujejo kinetiko absorpcije in izločanja preskusne snovi pri črvih ter čas do vzpostavitve stabilnega stanja,
|
|
—
|
Ca, Cs in Cw (s standardnim odklonom in razponom, če je primerno) za vse čase vzorčenja (Ca izražen v g kg– 1 mokre in suhe teže celega telesa, Cs izražen v g kg– 1 mokre in suhe teže usedline in Cw v mg l– 1). Če je potreben faktor akumulacije v organizmih glede na usedlino (BSAF, za opredelitev glej Dodatek 1) (npr. za primerjavo rezultatov dveh ali več preskusov, opravljenih z živalmi z različno vsebnostjo lipidov), je treba Ca dodatno izraziti v g kg– 1 vsebnosti lipidov v organizmu, Cs pa je treba izraziti v g kg– 1 organskega ogljika (OC) v usedlini,
|
|
—
|
BAF (izražen v kg mokre usedline kg– 1 mokrih črvov), konstanto hitrosti absorpcije usedline ks (izražen v g mokre usedline kg– 1 mokrih črvov d– 1) in konstanto hitrosti izločanja ke (izražena v d– 1); dodatno se lahko sporoči BSAF (izražen v kg organskega ogljika v usedlini kg– 1 vsebnosti lipidov v črvih),
|
|
—
|
neizločene ostanke (NER) na koncu faze izločanja,
|
|
—
|
če se izmerijo: deleže matične snovi, produktov razgradnje in vezanih ostankov (tj. delež preskusne snovi, ki ga ni mogoče ekstrahirati z običajnimi metodami ekstrakcije), zaznane v preskusnih živalih,
|
|
—
|
metode, uporabljene za statistične analize podatkov.
|
|
|
|
Vrednotenje rezultatov
|
—
|
skladnost rezultatov z merili za veljavnost, navedenimi v odstavku 21,
|
|
—
|
nepričakovane ali nenavadne rezultate, npr. nepopolno izločanje preskusne snovi iz preskusnih živali; v takih primerih se lahko koristne informacije zagotovijo na podlagi predhodnih študij.
|
|
|
Dodatek 1
Opredelitve in enote
|
|
Umetna usedlina ali formulirana ali rekonstituirana ali sintetična usedlina je zmes snovi, uporabljenih za posnemanje fizičnih sestavin naravne usedline.
|
|
|
Bioakumulacija je povečanje koncentracije preskusne snovi v organizmu ali na njem glede na koncentracijo preskusne snovi v okoliškem mediju. Izhaja iz procesov biokoncentracije in biomagnifikacije (glej v nadaljevanju).
|
|
|
Bioakumulacijski faktor (BAF) kadar koli med fazo absorpcije tega preskusa bioakumulacije je koncentracija preskusne snovi v preskusnem organizmu ali na njem (Ca v g kg– 1 mokre ali suhe teže), deljena s koncentracijo snovi v okoliškem mediju (Cs kot g kg– 1 mokre ali suhe teže usedline). Za sklicevanje na enoti Ca in Cs ima BAF enoto kg usedline kg– 1 črvov (15).
|
|
|
Bioakumulacijski faktorji, izračunani neposredno iz razmerja med konstanto hitrosti absorpcije usedline, ki se deli s konstanto hitrosti izločanja (ks oziroma ke, glej v nadaljevanju), se imenujejo kinetični bioakumulacijski faktor (BAFK).
|
|
|
Biokoncentracija je povečanje koncentracije preskusne snovi v organizmu ali na njem izključno zaradi absorpcije prek telesne površine, ki je odvisno od koncentracije preskusne snovi v okoliškem mediju.
|
|
|
Biomagnifikacija je povečanje koncentracije preskusne snovi v organizmu ali na njem predvsem zaradi absorpcije iz onesnažene hrane ali plena, ki je odvisno od koncentracije preskusne snovi v hrani ali plenu. Biomagnifikacija lahko vodi do prenosa ali kopičenja preskusne snovi v prehranjevalnem spletu.
|
|
|
Faktor akumulacije v organizmih glede na usedlino (BSAF) je na lipide normalizirana koncentracija preskusne snovi v/na preskusnem organizmu v stabilnem stanju, deljena s koncentracijo snovi v usedlini v stabilnem stanju, normalizirano na organski ogljik. Ca se nato izrazi v g kg– 1 vsebnosti lipidov v organizmu, Cs pa v g kg– 1 vsebnosti organskih snovi usedline.
|
|
|
Obdobje kondicioniranja se uporablja za stabilizacijo mikrobne komponente usedline in za odstranitev npr. amoniaka, ki izhaja iz sestavin usedline; poteka pred primešanjem preskusne snovi v usedlino. Voda nad usedlino se po kondicioniranju običajno zavrže.
|
|
|
Izločanje preskusne snovi je odstranitev te snovi iz tkiva preskusnega organizma z aktivnimi ali pasivnimi procesi, ki se pojavijo neodvisno od prisotnosti ali odsotnosti preskusne snovi v okoliškem mediju.
|
|
|
Faza izločanja je čas po prenosu preskusnih organizmov iz onesnaženega medija v medij brez preskusne snovi, v kateri se proučuje izločanje (ali neto izguba) snovi iz preskusnih organizmov.
|
|
|
Konstanta hitrosti izločanja (ke) je numerična vrednost, ki opredeljuje stopnjo znižanja koncentracije preskusne snovi v/na preskusnih organizmih po prenosu preskusnih organizmov iz medija s preskusno snovjo v medij brez kemikalije; ke se izrazi v d– 1.
|
|
|
Obdobje za uravnoteženje se uporablja za porazdelitev preskusne snovi med trdno fazo, porno vodo in vodo nad usedlino; poteka po primešanju preskusne snovi v usedlino in pred vnosom preskusnih organizmov.
|
|
|
Porazdelitveni koeficient oktanol/voda (Kow) je uravnoteženo razmerje topnosti snovi v n-oktanolu in vodi, včasih izraženo tudi kot Pow. Logaritem Kow (log Kow) se uporablja kot kazalnik potenciala kemikalije za bioakumulacijo.
|
|
|
Porazdelitveni koeficient organski ogljik/voda (Koc) je uravnoteženo razmerje med koncentracijo snovi v/na delu usedline z organskim ogljikom in koncentracijo snovi v vodi.
|
|
|
Voda nad usedlino je voda nad usedlino v preskusni posodi.
|
|
|
Ravnotežje ali stabilno stanje je opredeljeno kot ravnotežje med procesoma absorpcije in izločanja, ki potekata hkrati v fazi izpostavljenosti. Stabilno stanje je v grafičnem prikazu BAF v odvisnosti od časa v vsakem obdobju vzorčenja doseženo, ko krivulja postane vzporedna s časovno osjo in se tri zaporedne analize BAF na vzorcih, odvzetih v razmiku najmanj dveh dni, druga od druge ne razlikuje za več kot 20 % ter ni statistično značilnih razlik med tremi obdobji vzorčenja. Za preskusne snovi, ki se počasi absorbirajo, so primernejši sedemdnevni razmiki (5).
|
|
|
Porna voda ali intersticijska voda je voda, ki zavzema prostor med delci usedline ali tal.
|
|
|
Konstanta hitrosti absorpcije usedline (ks) je numerična vrednost, ki opredeljuje stopnjo povišanja koncentracije preskusne snovi v/na preskusnem organizmu zaradi absorpcije iz faze usedline. ks se izrazi v g usedline kg– 1 črvov d– 1.
|
|
|
Usedlina s primešano preskusno snovjo je usedlina, ki ji je bila dodana preskusna snov.
|
|
|
Bioakumulacijski faktor stabilnega stanja (BAFss) je BAF v stabilnem stanju in se ne spreminja znatno v daljšem časovnem obdobju, saj je koncentracija preskusne snovi v okoliškem mediju (Cs v g·kg– 1 mokre ali suhe teže usedline) v tem obdobju konstantna.
|
|
|
Faza absorpcije ali izpostavitve je čas, v katerem so preskusni organizmi izpostavljeni preskusni snovi.
|
Dodatek 2
Izračun parametrov absorpcije in izločanja
Glavni cilj preskusa bioakumulacije je določitev bioakumulacijskega faktorja BAF. Izmerjeni BAF se lahko izračuna tako, da se koncentracija preskusne snovi v preskusnem organizmu, Ca, deli s koncentracijo preskusne snovi v usedlini, Cs, v stabilnem stanju. Če se stabilno stanje v fazi absorpcije ne doseže, se BAF izračuna enako kot za 28. dan. Vendar je treba navesti, ali BAF temelji na koncentracijah v stabilnem stanju ali ne.
Za izračun kinetičnega bioakumulacijskega faktorja (BAFK), konstante hitrosti absorpcije usedline (ks) in konstante hitrosti izločanja (ke) je najbolje uporabiti računalniške metode za ocenjevanje nelinearnih parametrov. Glede na časovne vrste povprečnih akumulacijskih faktorjev (Ca, srednje vrednosti vseh datumov vzorčenja/Cs, srednje vrednosti vseh datumov vzorčenja = AF) faze absorpcije na podlagi mokre teže črvov in usedline ter modelne enačbe
|
AF(t) = BAF × (1 – eke × t)
|
[enačba 1]
|
pri čemer je AF(t) razmerje med koncentracijo preskusne snovi v črvih in njene koncentracije v usedlini ob kateri koli dani časovni točki (t) faze absorpcije, ti računalniški programi izračunajo vrednosti za BAFK, ks in ke.
Ko se v fazi absorpcije doseže stabilno stanje (tj. t = ∞), se lahko enačba 1 poenostavi na
|
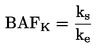
|
[enačba 2]
|
pri čemer je
|
ks
|
=
|
konstanta hitrosti absorpcije v tkivu [g usedline kg– 1 črvov d– 1],
|
|
ke
|
=
|
konstanta hitrosti izločanja [d– 1].
|
Nato je ks/ke × Cs pristop za ugotavljanje koncentracije preskusne snovi v črvjem tkivu v stabilnem stanju (Ca,ss).
Faktor akumulacije v organizmih glede na usedlino (BSAF) je treba izračunati na naslednji način:
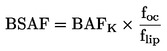
pri čemer je foc del organskega ogljika v usedlini in flip del lipidov v črvih, pri čemer oba temeljita na suhi teži ali mokri teži.
Glede na časovne vrste koncentracijskih vrednosti se lahko kinetika izločanja modelira z naslednjimi modelnimi enačbami in računalniškim izračunom na podlagi metode za ocenjevanje nelinearnih parametrov.
Srednji izmerjeni telesni ostanki na koncu faze absorpcije se priporočajo kot privzeta začetna točka. Vrednost, modelirana/ocenjena na podlagi faze absorpcije, se lahko uporabi le, če npr. izmerjena vrednost znatno odstopa od modeliranih telesnih ostankov. Za alternativno predhodno izpostavljenost črvov, namenjenih za izločanje, glej tudi odstavek 50; pri tem pristopu se šteje, da vzorci teh predhodno izpostavljenih črvov na dan 0 faze izločanja zagotavljajo realne telesne ostanke za začetek kinetike izločanja.
Če podatkovne točke, grafično prikazane v odvisnosti od časa, kažejo konstantno eksponentno padanje koncentracije preskusne snovi v živalih, je mogoče za opis časovnega poteka izločanja uporabiti enodelni model (enačba 4).
|
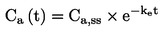
|
[enačba 3]
|
Procesi izločanja so včasih videti dvofazni, pri čemer v zgodnjih fazah Ca hitro upada, kar se v poznejših fazah izločanja spremeni v počasnejšo izgubo preskusnih snovi (8) (19) (25). Ti dve fazi je mogoče razložiti s predpostavko, da sta v organizmu dva različna dela, iz katerih se preskusna snov izloča z različno hitrostjo. V takih primerih je treba proučiti posebne vire (15) (16) (17) (25).
Dvodelno izločanje se opiše npr. z naslednjo enačbo (25):
|

|
[enačba 4]
|
A in B predstavljata velikost delov (v odstotku skupnih ostankov tkiva), pri čemer je A del s hitrim izločanjem snovi in B del s počasnih izločanjem preskusne snovi. Vsota A in B je 100 % celotne prostornine dela živali v stabilnem stanju. ka in kb predstavljata ustrezni konstanti izločanja [d– 1]. Če je dvodelni model prilagojen podatkom o očiščenju, se lahko konstanta hitrosti absorpcije ks določi, kot sledi (53) (54):
|

|
[enačba 5]
|
Kljub temu je treba te modelne enačbe uporabljati previdno, zlasti kadar se med preskusom spremeni biološka razpoložljivost preskusne snovi (42).
Namesto z zgoraj opisanimi modelnimi enačbami se lahko kinetika (ks in ke) izračuna tudi naenkrat z modelom kinetike prvega reda za vse podatke iz faz absorpcije in izločanja skupaj. Opis metode, ki lahko omogoča tak združeni izračun konstant hitrosti absorpcije in izločanja, je naveden v virih (55), (56) in (57).
Neizločene ostanke (NER) je treba izračunati kot sekundarno končno točko, tako da se razmerje med povprečno koncentracijo v črvih (Ca) na 10. dan faze izločanja in povprečno koncentracijo v črvih (Ca) v stabilnem stanju (28. dan faze absorpcije) pomnoži s 100:

Dodatek 3
Primer časovnega razporeda vzorčenja za 28-dnevni preskus bioakumulacije
(a) Faza absorpcije (vključno s 4-dnevno fazo uravnoteženja)
|
Dan
|
Dejavnosti
|
|
– 6
|
priprava šotne suspenzije za usedlino; 48-urno kondicioniranje suspenzije
|
|
– 4
|
primešanje preskusne snovi v usedlino ali del usedline; mešanje vseh sestavin usedline; odstranitev vzorcev usedline iz tretiranih vzorcev in usedline iz kontrole s topilom za določitev koncentracije preskusne snovi; dodajanje vode nad usedlino; inkubacija pri preskusnih pogojih (faza uravnoteženja)
|
|
– 3/– 2
|
ločitev preskusnih organizmov od kulture za aklimatizacijo
|
|
0
|
meritev kakovosti vode (glej odstavek 52); odstranjevanje ponovitev za odvzem vzorcev vode in usedline za določitev koncentracije preskusne snovi; naključna razporeditev črvov v preskusne komore, zadržanje dovolj podvzorcev črvov za določitev analitskih vrednosti naravnega ozadja; nadzor dovajanja zraka, če se uporabi zaprti preskusni sistem
|
|
1
|
odstranitev ponovitev za vzorčenje, nadzor dovajanja zraka, obnašanja črvov in kakovosti vode (glej odstavek 56), odvzem vzorcev vode, usedline in črvov za določitev koncentracije preskusne snovi
|
|
2
|
nadzor dovajanja zraka, obnašanja črvov in temperature
|
|
3
|
enako kot 1. dan
|
|
4–6
|
enako kot 2. dan
|
|
7
|
enako kot 1. dan; po potrebi nadomestitev izhlapele vode
|
|
8–13
|
enako kot 2. dan
|
|
14
|
enako kot 1. dan; po potrebi nadomestitev izhlapele vode
|
|
15–20
|
enako kot 2. dan
|
|
21
|
enako kot 1. dan; po potrebi nadomestitev izhlapele vode
|
|
22–27
|
enako kot 2. dan
|
|
28
|
enako kot 1. dan; meritev kakovosti vode (glej odstavek 52); konec faze absorpcije, zadržanje dovolj podvzorcev črvov za določitev analitskih vrednosti naravnega ozadja, mokre in suhe teže ter vsebnosti lipidov; prenos črvov iz preostalih izpostavljenih ponovitev v posode s čisto usedlino za fazo izločanja (brez čiščenja prebavil; vzorčenje vode, usedline in črvov iz kontrol s topilom; vzorčenje raztopin za lovljenje, če so bile uporabljene
|
|
|
Dejavnosti pred izpostavljenostjo (faza uravnoteženja) je treba časovno načrtovati ob upoštevanju lastnosti preskusne snovi. Če je potrebno, 7-dnevno kondicioniranje pripravljene usedline v vodi nad usedlino pri 20 ± 2 °C; v tem primeru zgodnja priprava usedline!
|
|
|
Dejavnosti, opisane za 2. dan, je treba izvajati vsak dan (vsaj ob delavnikih).
|
(b) Faza izločanja
|
Dan
|
Dejavnosti
|
|
– 6
|
priprava šotne suspenzije za usedlino; 48-urno kondicioniranje suspenzije
|
|
– 4
|
premešanje vseh sestavin usedline; odstranitev vzorcev usedline iz tretiranih vzorcev in usedline iz kontrole s topilom za določitev koncentracije preskusne snovi; dodajanje vode nad usedlino; inkubacija pri preskusnih pogojih
|
|
0 (28. dan faze absorpcije)
|
meritev kakovosti vode (glej odstavek 52); prenos črvov in preostalih izpostavljenih ponovitev v posode s čisto usedlino; po 4–6 urah odstranitev ponovitev za odvzem vzorcev vode, usedline in črvov za določitev koncentracije preskusne snovi, naključna razporeditev črvov v preskusne komore
|
|
1
|
odstranitev ponovitev za vzorčenje, nadzor dovajanja zraka, obnašanja črvov in kakovosti vode (glej odstavek 52), odvzem vzorcev vode, usedline in črvov za določitev koncentracije preskusne snovi
|
|
2
|
nadzor dovajanja zraka, obnašanja črvov in temperature
|
|
3
|
enako kot 1. dan
|
|
4
|
enako kot 2. dan
|
|
5
|
enako kot 1. dan
|
|
6
|
enako kot 2. dan
|
|
7
|
enako kot 1. dan; po potrebi nadomestitev izhlapele vode
|
|
8–9
|
enako kot 2. dan
|
|
10
|
enako kot 1. dan; konec faze izločanja; meritev kakovosti vode (glej odstotek 52), vzorčenje vode, usedline in črvov iz kontrol s topilom; vzorčenje raztopin za lovljenje, če so bile uporabljene
|
|
|
Usedlino pred začetkom faze izločanja je treba pripraviti enako kot pred fazo absorpcije.
|
|
|
Dejavnosti, opisane za 2. dan, je treba izvajati vsak dan (vsaj ob delavnikih).
|
Dodatek 4
Nekatere fizikalno-kemijske lastnosti sprejemljive vode za redčenje
|
SESTAVINA
|
KONCENTRACIJE
|
|
delci
|
< 20 mg/l
|
|
skupni organski ogljik
|
< 2 μg/l
|
|
neionizirani amoniak
|
< 1 μg/l
|
|
ostanek klora
|
< 10 μg/l
|
|
skupni organofosforni pesticidi
|
< 50 ng/l
|
|
skupni organoklorni pesticidi in poliklorirani bifenili
|
< 50 ng/l
|
|
skupni organski klor
|
< 25 ng/l
|
SESTAVA PRIPOROČENE MODELNE RAZREDČEVALNE VODE
|
(a)
|
Raztopina kalcijevega klorida
V deionizirani vodi se raztopi 11,76 g CaCl2 2H2O; deionizirana voda se dolije do 1 litra.
|
|
(b)
|
Raztopina magnezijevega sulfata
V deionizirani vodi se raztopi 4,93 g MgSO4 7H2O; deionizirana voda se dolije do 1 litra.
|
|
(c)
|
Raztopina natrijevega bikarbonata
V deionizirani vodi se raztopi 2,59 g NaHCO3; deionizirana voda se dolije do 1 litra.
|
|
(d)
|
Raztopina kalijevega klorida
V deionizirani vodi se raztopi 0,23 g KCl; deionizirana voda se dolije do 1 litra.
|
Vse kemikalije morajo biti analitsko čiste.
Prevodnost destilirane ali deionizirane vode ne sme preseči 10 μScm– 1.
Zmeša se 25 ml vsake raztopine od (a) do (d), deionizirana voda pa se dolije do skupne prostornine 1 l. Vsota kalcijevih in magnezijevih ionov v tej raztopini je 2,5 mmol/l.
Razmerje ionov Ca in Mg je 4: 1 ter ionov Na in K 10: 1. Kislinska zmogljivost KS4,3 te raztopine je 0,8 mmol/l.
Voda za redčenje se prezračuje, dokler se ne doseže nasičenost s kisikom, nato se za približno dva dni shrani brez dodatnega prezračevanja pred uporabo.
pH sprejemljive vode za redčenje mora biti v razponu 6–9.
Dodatek 5
Umetna usedlina – priporočila za pripravo in shranjevanje
V nasprotju z zahtevami iz preskusne metode C.8 (40) je priporočena vsebnost šote v umetni usedlini 2 % namesto 10 % suhe teže, da ustreza nizki do zmerni vsebnosti organskih snovi naravnih usedlin (58).
Delež suhih sestavin umetne usedline:
|
Sestavina
|
Značilnosti
|
% suhe usedline
|
|
šota
|
šotni mah, stopnja razgradnje: ‚srednja‘, sušen na zraku, brez vidnih ostankov rastlin, fino drobljen (velikost delcev ≤ 0,5 mm)
|
2 ± 0,5
|
|
kremenov pesek
|
velikost zrn: ≤ 2 mm, vendar mora biti > 50 % delcev v razponu 50–200 μm
|
76
|
|
kaolinska glina
|
vsebnost kaolinita ≥ 30 %
|
22 ± 1
|
|
vir hrane
|
Folia urticae, listje Urtica sp. (velika kopriva) v prahu, fino mleto (velikost delcev ≤ 0,5 mm), ali zmes listja Urtica sp. v prahu z alfa celulozo (1: 1); v skladu s farmacevtskimi standardi, za prehrano ljudi; poleg suhe usedline
|
0,4–0,5 %
|
|
kalcijev karbonat
|
CaCO3, zdrobljen v prah, kemijsko čist, poleg suhe usedline
|
0,05–1
|
|
deionizirana voda
|
prevodnost ≤ 10 μS/cm, poleg suhe usedline
|
30–50
|
Če se pričakujejo višje koncentracije amoniaka, npr. če je znano, da preskusna koncentracija zavira nitrifikacijo, bo morda koristno 50 % koprive v prahu nadomestiti s celulozo (npr. s kemijsko čistim prahom α-celuloze z velikostjo delcev ≤ 0,5 mm).
Priprava
Šota se posuši na zraku in zmelje v fin prah (velikost delcev ≤ 0,5 mm, ni vidnih ostankov rastlin). Suspenzija potrebne količine šote v prahu se pripravi z delom deionizirane vode, ki se doda suhi usedlini (za nastanek šotnega molja, ki ga je mogoče mešati, se je kot koristna prostornina vode izkazala 11,5-kratna suha teža šote (8)) s pomočjo visoko zmogljive naprave za homogenizacijo.
pH te suspenzije se s CaCO3 uravna na 5,5 ± 0,5. Suspenzija se vsaj dva dni kondicionira z rahlim mešanjem pri 20 ± 2 °C, da se stabilizira pH in vzpostavi stabilna mikrobna komponenta. pH se znova izmeri in po potrebi s CaCO3 uravna na 6,0 ± 0,5. Nato se vsa suspenzija umeša z drugimi suhimi sestavinami, pri čemer se upoštevajo vsi deli, uporabljeni za primešanje preskusne snovi. Preostala deionizirana voda se doda, da se dobi homogena usedlina. pH se znova izmeri in po potrebi s CaCO3 uravna na 6,5 do 7,5. Če pa se pričakuje razvoj amoniaka, je lahko koristno ohraniti pH usedline pod 7,0 (npr. med 6,0 in 6,5). Odvzamejo se vzorci usedline, da se določita suha teža in vsebnost organskega ogljika. Če se pričakuje razvoj amoniaka, se lahko umetna usedlina 7 dni kondicionira v enakih pogojih, kot vladajo v poznejšem preskusu (npr. razmerje med usedlino in vodo je 1: 4, višina plasti usedline kot v preskusnih posodah), preden se ji primeša preskusna snov, tj. prekriti jo je treba z vodo, ki mora biti prezračevana. Na koncu obdobja kondicioniranja je treba vodo nad usedlino odstraniti in zavreči. Odvzamejo se vzorci usedline, da se določita suha teža in skupna vsebnost organskega ogljika (npr. 3 vzorci).
Nato se kremenov pesek s primešano preskusno snovjo zmeša z usedlino za vsako stopnjo tretiranja, usedlina se razporedi v ponovitvene preskusne posode in prekrije s preskusno vodo (npr. razmerje med usedlino in vodo je 1: 4, višina plasti usedline v ko preskusnih posodah). Posode se nato inkubirajo v enakih pogojih kot vladajo v poznejšem preskusu. Tukaj se začne obdobje za uravnoteženje. Vodo nad usedlino je treba prezračevati.
Izbrani vir hrane je treba dodati pred primešanjem preskusne snovi v usedlino ali med njim. Na začetku se lahko zmeša s šotno suspenzijo (glej zgoraj). Čezmerna razgradnja vira hrane pred vnosom preskusnih organizmov, npr. v primeru dolgega obdobja za uravnoteženje, se lahko prepreči z ohranjanjem čim krajšega časa med dodajanjem hrane in začetkom izpostavljenosti. Da se zagotovi ustrezen stik hrane s preskusno snovjo, je treba vir hrane zmešati z usedlino najpozneje na dan primešanja preskusne snovi v usedlino. Izjeme so dovoljene, kadar dolžina obdobja za uravnoteženje povzroča mikrobno razgradnjo hrane pred vnosom preskusnih organizmov. Odvzamejo se vzorci usedline, da se določita suha teža in skupni organski ogljik (npr. 3 vzorci usedline s primešano preskusno snovjo ali kontrolne usedline).
Suho težo sestavin (šote, peska, kaolina) je treba sporočiti v gramih in deležu skupne suhe teže.
Tudi prostornino vode, ki jo je treba med pripravo usedline dodati suhim sestavinam, je treba sporočiti v deležu skupne suhe teže (npr. 100 % suhe teže + 46 % vode pomeni, da 1 000 g suhe teže sprejme skupaj 460 ml vode, kar je 1 460 g mokre usedline).
Shranjevanje
Suhe sestavine za umetno usedlino se lahko shranjujejo v suhem in hladnem prostoru pri sobni temperaturi. Pripravljena mokra usedlina se lahko za 2–4 tedne od dneva priprave hrani (le za nadaljnjo uporabo v gojišču) v temi pri 4 ± 2 °C (8).
Usedlino s primešano preskusno snovjo je treba uporabiti takoj, razen če obstajajo informacije o tem, da je mogoče določeno usedlino shranjevati, ne da bi to vplivalo na strupenost in biološko razpoložljivost preskusne snovi. Vzorci usedline s primešano preskusno snovjo se lahko do analize hranijo v pogojih, priporočenih za zadevno preskusno snov.
Dodatek 6
Vrste maloščetincev, priporočene za preskušanje bioakumulacije
Tubifex tubifex (MÜLLER), Tubificidae, Oligochaeta
Maloščetinski tubifeks (Tubificidae, Oligochaeta) Tubifex tubifex (Müller) živi v sladkovodnih usedlinah v cevkah, ki so prevlečene s sluzjo. Črvi v teh cevkah živijo z glavo navzdol in se prehranjujejo z delci usedline, pri čemer izkoriščajo povezane mikro organizme in organske odpadke. Zadnji del običajno valovi v vodi nad usedlino zaradi dihanja. Čeprav ta vrsta naseljuje številne vrste usedlin po celotni severni polobli, ima Tubifex tubifex najraje razmeroma fine delce (59). Primernost te vrste za ekotoksikološko preskušanje je opisana na primer v (8) (29) (31) (39) (60) (62) (63).
Metode gojenja
Da se zagotovi zadostno število osebkov Tubifex tubifex za izvajanje preskusov bioakumulacije, bo morda treba črve gojiti v stalni laboratorijski kulturi. Za gojenje T. tubifex se priporoča sistem, ki zajema umetno usedlino na podlagi umetnih tal v skladu s preskusno metodo C.8 (40) in modelno razredčevalno vodo v skladu s preskusno metodo C.1 (8).
Kot posode za gojenje se lahko uporabijo posode iz stekla ali nerjavnega jekla višine od 12 do 20 cm. V vsaki posodi za gojenje je plast mokre umetne usedline, pripravljene, kot je opisano v Dodatku 5. Debelina plasti usedline mora omogočati naravno obnašanje črvov pri zarivanju (vsaj 2 cm debela plast za T. tubifex). V sistem se doda modelna razredčevalna voda. Pri tem je treba paziti, da se usedlina čim manj moti. Vodno telo se nežno prezračuje (npr. 2 mehurčka na sekundo z zrakom, filtriranim na 0,45 μm) s pasteurjevo pipeto, ki je nastavljena 2 cm nad površino usedline. Priporočena temperatura za gojenje je 20 ± 2 °C.
Črvi se v sistem za gojenje vnesejo z največjo obremenitvijo 20 000 osebkov/m2 površine usedline. Večja obremenitev bi lahko povzročila manjše hitrosti rasti in razmnoževanja (43).
Pri gojenju v umetnih usedlinah je treba črve hraniti. Prehrana, ki zajema fino mleto ribjo hrano, npr. TetraMin®, lahko služi kot dodatna hranilna snov (8); Klerks 1994, osebno sporočilo. Stopnje hranjenja morajo omogočati zadostno rast in razmnoževanje ter ohranjati kopičenje amoniaka in rast plesni v gojišču na čim nižji ravni. Hrana se lahko daje dvakrat na teden (npr. 0,6–0,8 mg/cm2 površine usedline). Praktične izkušnje so pokazale, da lahko uporaba hrane, ki je suspendirana in homogenizirana v deionizirani vodi, olajša homogeno razporeditev hrane po površini usedline v posodah za gojenje.
Da se prepreči kopičenje amoniaka, je treba vodo nad usedlino zamenjati s pretočnim sistemom ali ročno vsaj enkrat na teden. V založnih kulturah je treba usedlino zamenjati vsake tri mesece.
Vzorčenje črvov iz gojišča se lahko izvede s presejanjem gojitvene usedline skozi sito z luknjicami velikosti 1 mm, če so potrebni le odrasli osebki. Za zadržanje kokonov je primerna mreža z luknjicami velikosti 0,5 mm, za črvje mladiče pa sito z luknjicami velikosti 0,25 mm. Ko se usedlina preseje skozi sita, se ta lahko postavijo v modelno razredčevalno vodo. Črvi zapustijo mrežo in se lahko nato iz vode poberejo s prijemalkami iz plavljenega jekla ali pipeto z vroče poliranimi robovi.
Za začetek preskusa ali novih kultur se uporabijo samo nepoškodovani in jasno identificirani primerki Tubifex tubifex (npr. (64)). Bolne ali poškodovane črve in kokone, na katerih so se namnožili mikroorganizmi fungus hypha, je treba zavreči.
S sinhrono kulturo se lahko v primernih razmikih zagotovijo črvi določene starosti, ko so potrebni. Nove posode za gojenje se pripravijo v izbranih razmikih (npr. vsaka dva tedna), pri čemer se začnejo z živalmi določene starosti (npr. kokoni). V pogojih gojenja, opisanih tukaj, črvi odrastejo po 8–10 tednih. Kulture se lahko spravijo, ko črvi odložijo nove kokone, npr. po desetih tednih. Vzorčeni odrasli osebki se lahko uporabijo za preskuse, s kokoni pa se lahko začnejo nove kulture.
Lumbriculus variegatus (MÜLLER), Lumbriculidae, Oligochaeta
Lumbriculus variegatus (Lumbriculidae, Oligochaeta) prav tako živi v sladkovodnih usedlinah po vsem svetu in se pogosto uporablja v ekotoksikološkem preskušanju. Informacije o biologiji, pogojih gojenja in občutljivosti vrste so navedene v (1) (6) (9) (36). Lumbriculus variegatus se lahko z nekaj omejitvami gojijo tudi v umetni usedlini, ki se v skladu z (8) priporoča za T. tubifex. Ker ima L. variegatus v naravi raje bolj grobe usedline kot T. tubifex (59), lahko laboratorijske kulture v umetnih usedlinah, ki se uporabljajo za T. tubifex, poginejo po 4 do 6 mesecih. Praktične izkušnje so pokazale, da je lahko L. variegatus v peščenem substratu (npr. kremenov pesek, fini prod) v pretočnem sistemu, v katerem se ribja hrana uporablja kot vir hranilnih snovi več let brez obnovitve substrata. Velika prednost L. variegatus pred drugimi vrstami vodnih maloščetincev je hitro razmnoževanje, zaradi katerega se biomasa v laboratorijsko gojenih populacijah hitro poveča (1) (6) (9) (10).
Metode gojenja
Pogoji gojenja za Lumbriculus variegatus so podrobno opisani v Phipps in drugi (1993) (10), Brunson in drugi (1998) (28), ASTM (2000) (1) in U.S. EPA (2000) (6). V nadaljevanju je naveden kratek povzetek teh pogojev.
Črvi se lahko gojijo v velikih akvarijih (57–80 l) pri 23 °C z obdobjem osvetljenosti (100–1 000 luksov), ki obsega 16 ur svetlobe in 8 ur teme, ter vsakodnevno obnovljeno naravno vodo (45–50 l na akvarij). Substrat se pripravi z rezanjem nebeljenih brisač iz rjavega papirja na trakove, ki se lahko nato nekaj sekund meša z vodo za gojenje, da nastanejo majhni kosi papirnega substrata. Ta substrat se lahko nato neposredno uporabi v akvariju s kulturo Lumbriculus, tako da se prekrije dno posode, ali pa se za poznejšo uporabo shrani zamrznjen v deionizirani vodi. Nov substrat v posodi bo na splošno zdržal približno dva meseca.
Vsaka kultura črvov se začne s 500–1 000 črvi in se trikrat na teden hrani z 10 ml suspenzije, ki vsebuje 6 g začetne hrane za postrvi, v pogojih za obnovitev ali pretočnih pogojih. Statičnim ali polstatičnim kulturam se morajo zagotoviti manjše stopnje hranjenja, da se prepreči rast bakterij in plesni. Hrano in papirni substrat je treba analizirati glede snovi, ki jih je treba uporabiti v preskusih bioakumulacije.
V teh pogojih se število osebkov v kulturi običajno podvoji v približno 10 do 14 dneh.
Lumbriculus variegatus se lahko odstrani iz gojišč npr. s prenosom substrata s fino mrežo ali organizmov z vroče polirano široko (premer približno 5 mm) stekleno pipeto v ločeno čašo. Če se v to čašo prenese tudi substrat, se čaša s črvi in substratom čez noč pusti v pretočnih pogojih, v katerih se bo substrat odstranil iz čase, medtem ko bodo črvi ostali na dnu posode. Nato se lahko vnesejo v novo pripravljene posode za gojenje ali dodatno obdelajo za preskus, kot je opisano v (1) in (6). Poškodbe ali avtotomijo pri črvih je treba preprečiti npr. z uporabo pipet z vroče poliranimi robovi ali nerjavnimi pincetami za ravnanje s temi črvi.
Pri uporabi L. variegatus v preskusih bioakumulacije v usedlinah je treba kritično obravnavati njihov način razmnoževanja (arhitomija, ki ji sledi morfalaksa). S tem nespolnim razmnoževanjem nastaneta dva fragmenta, ki se določeno časovno obdobje ne prehranjujeta, dokler se glava ali del repa ne obnovi (npr. (36) (37)). To pomeni, da je pri L. variegatus absorpcija usedline in onesnaževala z zaužitjem morda ne odvijata hkrati, kot pri tubificidih, ki se ne razmnožujejo s fragmentacijo.
Zato je treba izvesti sinhronizacijo, da se čim bolj zmanjšata nenadzorovano razmnoževanje in obnavljanje ter s tem velike razlike v rezultatih preskusov. Do takih razlik lahko pride, če so nekateri osebki, ki so se fragmentirali in se zato določeno časovno obdobje niso prehranjevali, manj izpostavljeni preskusni snovi kot drugi osebki, ki se med preskusom ne fragmentirajo, npr. (38). Črve je treba 10 do 14 dni pred začetkom izpostavljenosti umetno fragmentirati (sinhronizacija) (65). Uporabiti je treba velike črve, ki po možnosti ne kažejo znakov nedavne fragmentacije. Ti črvi se lahko postavijo na objektno stekelce v kapljico vode za gojenje in s skalpelom secirajo po sredini telesa. Pri tem je treba paziti, da so zadnji deli podobne velikosti. Nato je treba zadnje dele do začetka izpostavljenosti pustiti v posodah za gojenje z istim substratom, kot je bil uporabljen v vodi za gojenje in modelni razredčevalni vodi, kjer se regenerirajo nove glave. Regeneracija novih glav se kaže, ko se sinhronizirani črvi zarijejo v substrat (prisotnost regeneriranih glav se lahko potrdi s pregledom reprezentativnega podvzorca pod binokularnim mikroskopom). Preskusni organizmi se nato pregledajo, da so v podobnem fiziološkem stanju. To pomeni, da se pričakuje, da bodo vse živali enako izpostavljene usedlini s primešano preskusno snovjo, ko se med preskusom pri sinhroniziranih črvih pojavi regeneracija z morfalakso. Sinhronizirane črve je treba hraniti takoj, ko se začnejo zarivati v substrat, ali 7 dni po seciranju. Način hranjenja mora biti primerljiv z navadnimi kulturami, vendar bi se lahko sinhronizirani črvi hranili z enakim virom hrane kot se uporabi v preskusu. Črve je treba shranjevati pri preskusni temperaturi, tj. 20 ± 2 °C. Po regeneraciji je treba za preskus uporabiti nepoškodovane in popolne črve podobne velikosti, ki aktivno plavajo ali se plazijo po nežnih mehanskih dražljajih. Poškodbe ali avtotomijo pri črvih je treba preprečiti npr. z uporabo pipet z vroče poliranimi robovi ali nerjavnimi pincetami za ravnanje s temi črvi.
Kadar se v preskusu uporabi Lumbriculus variegatus, se mora zaradi specifičnega načina razmnoževanja te vrste število črvov med preskusom povečati, če so pogoji ustrezni (6). Odsotnost razmnoževanja v preskusu bioakumulacije z L. variegatus je treba zabeležiti in upoštevati pri razlagi rezultatov preskusa.
Branchiura sowerbyi (BEDDARD), Tubificidae, Oligochaeta (vrsta ni validirana s krožnim preskusom)
Branchiura sowerbyi naseljujejo različne vrste usedlin v zajetjih, jezerih, ribnikih in rekah, avtohtono v tropskih območjih. Nahajajo se lahko tudi v toplih vodnih telesih severne poloble. Vendar so pogostejši v blatnih glinenih usedlinah z visoko vsebnostjo organske snovi. Črvi živijo v plasti usedline. Običajno je zarit tudi zadnji del črvov. Ta vrsta se enostavno identificira po škržnih lističih na zadnjem delu. Odrasli osebki lahko v dolžino dosežejo 9–11 cm, njihova mokra teža pa je 40–50 mg. Črvi se hitro razmnožujejo, pri čemer se njihovo število v temperaturnih pogojih in pogojih prehranjevanja, opisanih v nadaljevanju, podvoji v manj kot 2 tednih (Aston in drugi, 1982, (65)). B. sowerbyi se uporablja tako v študijah strupenosti kot v študijah bioakumulacije (Marchese in Brinkhurst 1996 (31), Roghair in drugi 1996 (67)).
Metode gojenja
V nadaljevanju so povzeti pogoji gojenja Branchiura sowerbyi (po Mercedes R. Marchese, INALI, Argentina in Carla J. Roghair, RIVM, Nizozemska).
Za gojenje preskusnih organizmov se ne zahteva enotna tehnika. Organizmi se lahko gojijo v neonesnaženi naravni usedlini (31). Praktične izkušnje so pokazale, da se z gojiščem iz naravne usedline in peska izboljša stanje črvov v primerjavi s čisto naravno usedlino (32) (67). Za to kulturo se lahko uporabijo čaše s prostornino 3 l, v katerih je 1 500 ml gojišča iz usedline in vode, ki vsebuje 375 ml naravne neonesnažene usedline (približno 10 % skupnega organskega ogljika, približno 17 % delcev ≤ 63 μm), 375 ml čistega peska (M32) in 750 ml modelne razredčevalne vode ali deklorirane vodovodne vode (31) (32) (67). Kot substrat za gojenje se lahko uporabijo tudi papirnate brisače, vendar je rast populacije manjša kot v naravni usedlini. V polstatičnih sistemih se vodna plast počasi prezračuje, vodo nad usedlino pa je treba obnoviti vsak teden.
V vsaki čaši je na začetku 25 mladih črvov. Po dveh mesecih se veliki črvi s pinceto poberejo iz usedline in vnesejo v novo čašo s sveže pripravljenim gojiščem iz usedline in vode. V stari čaši so tudi kokoni in mladi črvi. Tako se lahko spravi do 400 mladih črvov na čašo. Odrasli črvi se lahko vsaj eno leto uporabljajo za razmnoževanje.
Kulture je treba vzdrževati pri temperaturi 21 do 25 °C. Temperatura ne sme nihati za več kot ± 2 °C. Čas, potreben za razvoj embria od odložitve jajčeca do mladiča, ki zapusti kokon, je približno tri tedne pri 25 °C. Ugotovljeno je bilo, da je pri B. sowerbyi en preživeli črv v blatu pri 25 °C proizvede od 6,36 (31) do 11,2 (30) jajčec na preživelega črva. Število jajčec na kokon je od 1,8 do 2,8 (66) (69) ali do 8 (68).
Vsak teden je treba izmeriti raztopljeni kisik, trdoto vode, temperaturo in pH. Ribja hrana (npr. TetraMin®) se lahko doda kot suspenzija dvakrat ali trikrat na teden ad libitum. Črvi se lahko ad libitum hranijo tudi z odtajano zeleno solato.
Pomembna prednost te vrste je velika biomasa osebkov (do 40–50 mg mokre teže na osebek). Zato se lahko ta vrsta uporablja za preskušanje bioakumulacije neradioaktivno označenih preskusnih snovi. Izpostavi se lahko v sistemih, ki se uporabljajo za T. tubifex ali L. variegatus, z enim osebkom na ponovitev (11). Vendar je nato treba ponovitev povečati, razen če se uporabijo večje preskusne komore (11). Za to vrsto je treba prilagoditi tudi merilo za veljavnost v zvezi z obnašanjem med zarivanjem.
LITERATURA
|
(1)
|
ASTM International (2000). Standard guide for the determination of the bioaccumulation of sediment-associated contaminants by benthic invertebrates, E 1688-00a. V: ASTM International 2004 Annual Book of Standards. Zvezek 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
|
|
(2)
|
European Commission (EC) (2003). Technical Guidance Document on Risk Assessment in support of Commission Directive 93/67/EEC on Risk Assessment for new notified substances, Commission Regulation (EC) No 1488/94 on Risk Assessment for existing substances and Directive 98/8/EC of the European Parliament and of the Council concerning the placing of biocidal products on the market; Part I – IV. Urad za publikacije Evropskih skupnosti, Luksemburg.
|
|
(3)
|
OECD (1992a). Report of the OECD workshop on effects assessment of chemicals in sediment. OECD Monographs No. 60. Organizacija za gospodarsko sodelovanje in razvoj (OECD), Pariz.
|
|
(4)
|
Ingersoll, C. G., Ankley, G. T., Benoit D. A., Brunson, E. L., Burton, G. A., Dwyer, F. J., Hoke, R. A., Landrum, P. F., Norberg-King, T. J., in Winger, P.V. (1995). Toxicity and bioaccumulation of sediment-associated contaminants using freshwater invertebrates: A review of methods and applications. Environ. Toxicol. Chem. 14, 1885–1894.
|
|
(5)
|
Poglavje C.13 te priloge, Biokoncentracija: pretočni preskus na ribah.
|
|
(6)
|
U.S. EPA (2000). Methods for measuring the toxicity and bioaccumulation of sediment-associated contaminants with freshwater invertebrates. Druga izdaja. EPA 600/R-99/064, U.S. Environmental Protection Agency, Duluth, MN, marec 2000.
|
|
(7)
|
Poglavje C.27 te priloge, Preskus strupenosti s trzačami v sistemu vode in usedline z uporabo usedline s primešano preskusno snovjo.
|
|
(8)
|
Egeler, Ph., Römbke, J., Meller, M., Knacker, Th., Franke, C., Studinger, G., in Nagel, R. (1997). Bioaccumulation of lindane and hexachlorobenzene by tubificid sludgeworms (Oligochaeta) under standardised laboratory conditions. Chemosphere 35, 835–852.
|
|
(9)
|
Ingersoll, C. G., Brunson, E. L., Wang N., Dwyer, F. J., Ankley, G. T., Mount D. R., Huckins J., Petty. J., in Landrum, P. F. (2003). Uptake and depuration of nonionic organic contaminants from sediment by the oligochaete, Lumbriculus variegatus. Environmental Toxicology and Chemistry 22, 872–885.
|
|
(10)
|
Phipps, G. L., Ankley, G. T., Benoit, D. A., in Mattson, V. R. (1993). Use of the aquatic Oligochaete Lumbriculus variegatus for assessing the toxicity and bioaccumulation of sediment-associated contaminants. Environ.Toxicol. Chem. 12, 269–279.
|
|
(11)
|
Egeler, Ph., Römbke, J., Knacker, Th., Franke, C., in Studinger, G. (1999). Delavnica o ‚Bioaccumulation: Sediment test using benthic oligochaetes‘, 26.–27.april 1999, Hochheim am Main, Nemčija. Report on the R+D-project No. 298 67 419, Umweltbundesamt, Berlin.
|
|
(12)
|
Egeler, Ph., Meller, M., Schallnaß, H. J., in Gilberg, D. (2006). Validation of a sediment bioaccumulation test with endobenthic aquatic oligochaetes by an international ring test. Report to the Federal Environmental Agency (Umweltbundesamt Dessau), R&D No.: 202 67 437.
|
|
(13)
|
Kelly, J. R., Levine, S. N., Buttel, L. A., Kelly, A. C., Rudnick, D. T., in Morton, R. D. (1990). Effects of tributyltin within a Thalassia seagrass ecosystem. Estuaries 13, 301–310.
|
|
(14)
|
Nendza, M. (1991). QSARs of bioaccumulation: Validity assessment of log Kow/log BCF correlations. V: R. Nagel in R. Loskill (ur.): Bioaccumulation in aquatic systems. Contributions to the assessment. Proceedings of an international workshop, Berlin 1990. VCH, Weinheim.
|
|
(15)
|
Landrum, P. F., Lee II, H., in Lydy, M. J. (1992). Toxicokinetics in aquatic systems: Model comparisons and use in hazard assessment. Environ. Toxicol. Chem. 11, 1709–1725.
|
|
(16)
|
Markwell, R. D., Connell, D. W., in Gabric, A. J. (1989). Bioaccumulation of lipophilic compounds from sediments by oligochaetes. Wat. Res. 23, 1443–1450.
|
|
(17)
|
Gabric, A. J., Connell, D. W., in Bell, P. R. F. (1990). A kinetic model for bioconcentration of lipophilic compounds by oligochaetes. Wat. Res. 24, 1225–1231.
|
|
(18)
|
Kukkonen, J., in Landrum, P. F. (1994). Toxicokinetics and toxicity of sediment-associated Pyrene to Lumbriculus variegatus (Oligochaeta). Environ. Toxicol. Chem. 13, 1457–1468.
|
|
(19)
|
Franke, C., Studinger, G., Berger, G., Böhling, S., Bruckmann, U., Cohors-Fresenborg, D., in Jöhncke, U. (1994). The assessment of bioaccumulation. Chemosphere 29, 1501–1514.
|
|
(20)
|
OECD (2000). Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. OECD Environment, Health and Safety Publications, Series on Testing and Assessment No. 23.
|
|
(21)
|
U.S. EPA (1996). Special Considerations for Conducting Aquatic Laboratory Studies. Ecological Effects Test Guidelines. OPPTS 850.1000. Public Draft. EPA 712-C-96-113. U.S. Environmental Protection Agency.
|
|
(22)
|
Naslednja poglavja te priloge:
|
|
Poglavje A.4, Parni tlak,
|
|
|
Poglavje A.5, Površinska napetost,
|
|
|
Poglavje A.6, Topnost v vodi,
|
|
|
Poglavje A.8, Porazdelitveni koeficient, metoda stresanja bučke,
|
|
|
Poglavje A.24, Porazdelitveni koeficient, metoda tekočinske kromatografije visoke ločljivosti (HPLC),
|
|
|
Poglavje C.7, Razgradnja – Abiotska razgradnja: hidroliza kot funkcija pH,
|
|
|
Poglavje C.4 A–F, Določanje ‚dobre‘ biorazgradljivosti,
|
|
|
Poglavje C.19, Ocenjevanje adsorpcijskega koeficienta (Koc ) tal in odpadnega blata (blata iz čistilnih naprav) s tekočinsko kromatografijo visoke ločljivosti (HPLC),
|
|
|
Poglavje C.29, Dobra biorazgradljivost – CO2 v zaprtih posodah.
|
|
|
(23)
|
OECD (1996). Direct phototransformation of chemicals in water. Environmental Health and Safety Guidance Document Series on Testing and Assessment of Chemicals No. 3. OECD, Pariz.
|
|
(24)
|
Antoine, M. D., Dewanathan, S., in Patonay, G. (1991). Determination of critical micelles concentration of surfactants using a near-infrared hydrophobicity probe. Microchem. J. 43, 165–172.
|
|
(25)
|
Beek, B., Boehling, S., Bruckmann, U., Franke, C., Joehncke, U., in Studinger, G. (2000). The assessment of bioaccumulation. V: Hutzinger, O. (ur.), The Handbook of Environmental Chemistry, Vol. 2 Part J (ur. zvezka: B. Beek): Bioaccumulation – New Aspects and Developments. Springer-Verlag Berlin Heidelberg: 235–276.
|
|
(26)
|
Spacie, A., in Hamelink, J. L. (1982). Alternative models for describing the bioconcentration of organics in fish. Environ. Toxicol. Chem. 1, 309–320.
|
|
(27)
|
Hawker, D. W., in Connell, D. W. (1988). Influence of partition coefficient of lipophilic compounds on bioconcentration kinetics with fish. Wat. Res. 22, 701–707.
|
|
(28)
|
Brunson, E. L., Canfield, T. J., Ingersoll, C. J., in Kemble, N. E. (1998). Assessing the bioaccumulation of contaminants from sediments of the Upper Mississippi river using field-collected oligochaetes and laboratory-exposed Lumbriculus variegatus. Arch. Environ. Contam. Toxicol. 35, 191–201.
|
|
(29)
|
Reynoldson, T. B., Thompson, S. P., in Bamsey, J. L. (1991). A sediment bioassay using the tubificid oligochaete worm Tubifex tubifex. Environ. Toxicol. Chem. 10, 1061–1072.
|
|
(30)
|
Aston, R. J., in Milner, A. G. P. (1981). Conditions for the culture of Branchiura sowerbyi (Oligochaeta: Tubificidae) in activated sludge. Aquaculture 26, 155–160.
|
|
(31)
|
Marchese, M. R., in Brinkhurst, R. O. (1996). A comparison of two tubificid species as candidates for sublethal bioassay tests relevant to subtropical and tropical regions. Hydrobiologia 334, 163–168.
|
|
(32)
|
Roghair, C. J., in Buijze, A. (1994). Development of sediment toxicity tests. IV. A bioassay to determine the toxicity of field sediments to the oligochaete worm Branchiura sowerbyi. RIVM Report 719102027.
|
|
(33)
|
Poglavje C.1 te priloge, Akutna strupenost za ribe.
|
|
(34)
|
OECD (1992c). Guidelines for Testing of Chemicals No. 210. Fish, Early-life Stage Toxicity Test. OECD, Pariz.
|
|
(35)
|
Kaster, J. L., Klump, J. V., Meyer, J., Krezoski, J., in Smith, M. E. (1984). Comparison of defecation rates of Limnodrilus hoffmeisteri using two different methods. Hydrobiologia 11, 181–184.
|
|
(36)
|
Leppänen, M. T., in Kukkonen, J. V. K. (1998). Factors affecting feeding rate, reproduction and growth of an oligochaete Lumbriculus variegatus (Müller). Hydrobiologia 377: 183–194.
|
|
(37)
|
Leppänen, M. T., in Kukkonen, J. V. K. (1998). Relationship between reproduction, sediment type and feeding activity of Lumbriculus variegatus (Müller): Implications for sediment toxicity testing. Environ. Toxicol. Chem. 17: 2196–2202.
|
|
(38)
|
Leppänen M. T., in Kukkonen J. V. K. (1998). Relative importance of ingested sediment and porewater as bioaccumulation routes for pyrene to oligochaete (Lumbriculus variegatus, Müller). Environ. Sci. Toxicol. 32, 1503–1508.
|
|
(39)
|
Martinez-Madrid, M., Rodriguez, P., Perez-Iglesias, J. I., in Navarro, E. (1999). Sediment toxicity bioassays for assessment of contaminated sites in the Nervion river (Northern Spain). 2. Tubifex tubifex (Müller) reproduction sediment bioassay. Ecotoxicology 8, 111–124.
|
|
(40)
|
Poglavje C.8 te priloge, Strupenost za deževnike.
|
|
(41)
|
Environment Canada (1995). Guidance document on measurement of toxicity test precision using control sediments spiked with a reference toxicant. Environmental Protection Series Report EPS 1/RM/30.
|
|
(42)
|
Landrum, P. F. (1989). Bioavailability and toxicokinetics of polycyclic aromatic hydrocarbons sorbed to sediments for the amphipod Pontoporeia hoyi. Environ. Sci. Toxicol. 23, 588–595.
|
|
(43)
|
Poddubnaya, T. L. (1980). Life cycles of mass species of Tubificidae (Oligochaeta). V: R. O. Brinkhurst in D. G. Cook (ur.): Aquatic Oligochaeta Biology, 175–184. Plenum Press, New York.
|
|
(44)
|
ASTM (1998). Standard guide for collection, storage, characterisation, and manipulation of sediment for toxicological testing. American Society for Testing and Materials, E 1391–94.
|
|
(45)
|
Hooftman, R. N., van de Guchte, K., in Roghair, C. J. (1993). Development of ecotoxicological test systems to assess contaminated sediments. Joint report no. 1: Acute and (sub)chronic tests with the model compound chlorpyrifos. RIVM-719102022.
|
|
(46)
|
Franke, C. (1996). How meaningful is the bioconcentration factor for risk assessment?. Chemosphere 32, 1897–1905.
|
|
(47)
|
Mount, D. R., Dawson, T. D., in Burkhard, L. P. (1999). Implications of gut purging for tissue residues determined in bioaccumulation testing of sediment with Lumbriculus variegatus. Environ. Toxicol. Chem. 18, 1244–1249.
|
|
(48)
|
Randall, R. C., Lee II, H., Ozretich, R. J., Lake, J. L., in Pruell, R. J. (1991). Evaluation of selected lipid methods for normalising pollutant bioaccumulation. Environ.Toxicol. Chem. 10, 1431–1436.
|
|
(49)
|
Gardner, W. S., Frez, W. A., Cichocki, E. A., in Parrish, C. C. (1985). Micromethods for lipids in aquatic invertebrates. Limnology and Oceanography, 30, 1099–1105.
|
|
(50)
|
Bligh, E. G., in Dyer, W. J. (1959). A rapid method of total lipid extraction and purification. Can. J. Biochem. Physiol. 37, 911–917.
|
|
(51)
|
De Boer, J., Smedes, F., Wells, D., in Allan, A. (1999). Report on the QUASH interlaboratory study on the determination of total-lipid in fish and shellfish. Round 1 SBT-2. Exercise 1000. EU, Standards, Measurement and Testing Programme.
|
|
(52)
|
Kristensen, P. (1991). Bioconcentration in fish: comparison of bioconcentration factors derived from OECD and ASTM testing methods; influence of particulate matter to the bioavailability of chemicals. Water Quality Institute, Danska.
|
|
(53)
|
Zok, S., Görge, G., Kalsch, W., in Nagel, R. (1991). Bioconcentration, metabolism and toxicity of substituted anilines in the zebrafish (Brachydanio rerio). Sci. Total Environment 109/110, 411–421
|
|
(54)
|
Nagel, R. (1988). Umweltchemikalien und Fische – Beiträge zu einer Bewertung. Habilitationsschrift, Johannes Gutenberg-Universität Mainz, Nemčija.
|
|
(55)
|
Janssen, M. P. M., Bruins, A., De Vries, T. H., in Van Straalen, N. M. (1991). Comparison of cadmium kinetics in four soil arthropod species. Arch. Environ. Contam. Toxicol. 20: 305–312.
|
|
(56)
|
Van Brummelen, T. C., in Van Straalen, N. M. (1996). Uptake and elimination of benzo(a)pyrene in the terrestrial isopod Porcellio scaber. Arch. Environ. Contam. Toxicol. 31: 277–285.
|
|
(57)
|
Sterenborg, I., Vork, N. A., Verkade, S. K., Van Gestel, C. A. M., in Van Straalen, N. M. (2003). Dietary zinc reduces uptake but not metallothionein binding and elimination of cadmium in the springtail Orchesella cincta. Environ. Toxicol. Chemistry 22: 1167–1171.
|
|
(58)
|
Suedel, B. C., in Rodgers, J. H. (1993). Development of formulated reference sediments for freshwater and estuarine sediment testing. Environ. Toxicol. Chem. 13, 1163–1175.
|
|
(59)
|
Wachs, B. (1967). Die Oligochaeten-Fauna der Fließgewässer unter besonderer Berücksichtigung der Beziehung zwischen der Tubificiden-Besiedlung und dem Substrat. Arch. Hydr. 63, 310–386.
|
|
(60)
|
Oliver, B. G. (1987). Biouptake of chlorinated hydrocarbons from laboratory-spiked and field sediments by oligochaete worms. Environ. Sci. Technol. 21, 785–790.
|
|
(61)
|
Chapman, P. M., Farrell, M. A., in Brinkhurst, R. O. (1982a). Relative tolerances of selected aquatic oligochaetes to individual pollutants and environmental factors. Aquatic Toxicology 2, 47–67.
|
|
(62)
|
Chapman, P. M., Farrell, M. A., in Brinkhurst, R. O. (1982b). Relative tolerances of selected aquatic oligochaetes to combinations of pollutants and environmental factors. Aquatic Toxicology 2, 69–78.
|
|
(63)
|
Rodriguez, P., in Reynoldson, T. B. (1999). Laboratory methods and criteria for sediment bioassessment. V: A. Mudroch, J. M. Azcue, in P. Mudroch (ur.): Manual of Bioassessment of aquatic sediment quality. Lewis Publishers, Boca Raton, CRC Press LLC.
|
|
(64)
|
Brinkhurst, R. O. (1971). A guide for the identification of British aquatic oligochaeta. Freshw. Biol. Assoc., Sci. Publ. No. 22.
|
|
(65)
|
Egeler, Ph., Meller, M., Schallnaß, H. J., in Gilberg, D. (2005). Validation of a sediment toxicity test with the endobenthic aquatic oligochaete Lumbriculus variegatus by an international ring test. In co-operation with R. Nagel and B. Karaoglan. Report to the Federal Environmental Agency (Umweltbundesamt Berlin), R&D No.: 202 67 429.
|
|
(66)
|
Aston, R. J., Sadler, K., in Milner, A. G. P. (1982). The effect of temperature on the culture of Branchiura sowerbyi (Oligochaeta: Tubificidae) on activated sludge. Aquaculture 29, 137–145.
|
|
(67)
|
Roghair, C. J., Buijze, A., Huys, M. P. A., Wolters-Balk, M. A. H., Yedema, E. S. E., in Hermens, J. L. M. (1996). Toxicity and toxicokinetics for benthic organisms; II: QSAR for base-line toxicity to the midge Chironomus riparius and the tubificid oligochaete worm Branchiura sowerbyi. RIVM Report 719101026.
|
|
(68)
|
Aston, R. J. (1984). The culture of Branchiura sowerbyi (Tubificidae, Oligochaeta) using cellulose substrate. Aquaculture 40, 89–94.
|
|
(69)
|
Bonacina, C., Pasteris, A., Bonomi, G., in Marzuoli, D. (1994). Quantitative observations on the population ecology of Branchiura sowerbyi (Oligochaeta, Tubificidae). Hydrobiologia, 278, 267–274
|
“ |

 In force
In force