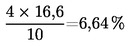EUR-Lex Access to European Union law

This document is an excerpt from the EUR-Lex website
Document 32009R0152
Commission Regulation (EC) No 152/2009 of 27 January 2009 laying down the methods of sampling and analysis for the official control of feed (Text with EEA relevance)
Uredba Komisije (ES) št. 152/2009 z dne 27. januarja 2009 o določitvi metod vzorčenja in analitskih metod za uradni nadzor krme (Besedilo velja za EGP)
Uredba Komisije (ES) št. 152/2009 z dne 27. januarja 2009 o določitvi metod vzorčenja in analitskih metod za uradni nadzor krme (Besedilo velja za EGP)
OJ L 54, 26.2.2009, p. 1–130
(BG, ES, CS, DA, DE, ET, EL, EN, FR, IT, LV, LT, HU, MT, NL, PL, PT, RO, SK, SL, FI, SV)
Special edition in Croatian: Chapter 03 Volume 006 P. 3 - 132
 In force: This act has been changed. Current consolidated version: 04/04/2024
In force: This act has been changed. Current consolidated version: 04/04/2024
|
26.2.2009 |
SL |
Uradni list Evropske unije |
L 54/1 |
UREDBA KOMISIJE (ES) št. 152/2009
z dne 27. januarja 2009
o določitvi metod vzorčenja in analitskih metod za uradni nadzor krme
(Besedilo velja za EGP)
KOMISIJA EVROPSKIH SKUPNOSTI JE –
ob upoštevanju Pogodbe o ustanovitvi Evropske skupnosti,
ob upoštevanju Uredbe (ES) št. 882/2004 Evropskega parlamenta in Sveta z dne 29. aprila 2004 o izvajanju uradnega nadzora, da se zagotovi preverjanje skladnosti z zakonodajo o krmi in živilih ter s pravili o zdravstvenem varstvu živali in zaščiti živali (1), ter zlasti člena 11(4)(a), (b) in (c) Uredbe,
ob upoštevanju naslednjega:
|
(1) |
Naslednji akti so bili sprejeti za izvajanje Direktive 70/373/EGS in ostanejo veljavni v skladu s členom 61(2) Uredbe (ES) št. 882/2004:
|
|
(2) |
Ker je Uredba (ES) št. 882/2004 nadomestila Direktivo 70/373/EGS, je primerno nadomestiti izvedbene akte k navedeni direktivi z eno uredbo. Hkrati je treba prilagoditi metode glede na znanstvene in tehnološke dosežke. Črtati je treba metode, ki ne veljajo več za njihovo nameravano uporabo. Čeprav je predvidena pravočasna posodobitev določb o vzorčenju, da se upoštevajo zadnji dosežki pri proizvodnji, shranjevanju, prevozu in trženju krme, je za zdaj ustrezno ohraniti obstoječe določbe o vzorčenju. |
|
(3) |
Zato je treba razveljaviti direktive 71/250/EGS, 71/393/EGS, 72/199/EGS, 73/46/EGS, 76/371/EGS, 76/372/EGS, 78/633/EGS, 81/715/EGS, 84/425/EGS, 86/174/EGS, 93/70/EGS, 93/117/ES, 98/64/ES, 1999/27/ES, 1999/76/ES, 2000/45/ES, 2002/70/ES in 2003/126/ES. |
|
(4) |
Ukrepi, predvideni s to uredbo, so v skladu z mnenjem Stalnega odbora za prehranjevalno verigo in zdravje živali – |
SPREJELA NASLEDNJO UREDBO:
Člen 1
Vzorčenje za uradni nadzor krme v zvezi z določanjem sestavin, dodatkov in nezaželenih snovi, razen ostankov pesticidov in mikroorganizmov, se izvaja v skladu z metodami iz Priloge I.
Člen 2
Priprava vzorcev za analizo in prikaz rezultatov se izvajata v skladu z metodami iz Priloge II.
Člen 3
Analiza za uradni nadzor krme se izvaja z uporabo metod iz Priloge III (Analitske metode za nadzor sestave posamičnih krmil in krmnih mešanic), Priloge IV (Analitske metode za nadzor ravni dovoljenih krmnih dodatkov), Priloge V (Analitske metode za nadzor nezaželenih snovi v krmi) in Priloge VI (Analitske metode za določitev sestavin živalskega izvora za uradni nadzor krme).
Člen 4
Energijska vrednost krmnih mešanic za perutnino se izračuna v skladu s Prilogo VII.
Člen 5
Za potrditev se uporabljajo analitske metode za nadzor nedovoljenih krmnih dodatkov iz Priloge VIII.
Člen 6
Direktive 71/250/EGS, 71/393/EGS, 72/199/EGS, 73/46/EGS, 76/371/EGS, 76/372/EGS, 78/633/EGS, 81/715/EGS, 84/425/EGS, 86/174/EGS, 93/70/EGS, 93/117/ES, 98/64/ES, 1999/27/ES, 1999/76/ES, 2000/45/ES, 2002/70/ES in 2003/126/ES se razveljavijo.
Sklici na razveljavljene direktive se upoštevajo kot sklici na to uredbo in se berejo v skladu s korelacijsko tabelo iz Priloge IX.
Člen 7
Ta uredba začne veljati dvajseti dan po objavi v Uradnem listu Evropske unije.
Uporablja se od 26. avgusta 2009
Ta uredba je v celoti zavezujoča in se neposredno uporablja v vseh državah članicah.
V Bruslju, 27. januarja 2009
Za Komisijo
Androulla VASSILIOU
Članica Komisije
(1) UL L 165, 30.4.2004, str. 1.
(2) UL L 155, 12.7.1971, str. 13.
(3) UL L 279, 20.12.1971, str. 7.
(4) UL L 123, 29.5.1972, str. 6.
(5) UL L 83, 30.3.1973, str. 21.
(6) UL L 102, 15.4.1976, str. 1.
(7) UL L 102, 15.4.1976, str. 8.
(8) UL L 206, 29.7.1978, str. 43.
(9) UL L 257, 10.9.1981, str. 38.
(10) UL L 238, 6.9.1984, str. 34.
(11) UL L 130, 16.5.1986, str. 53.
(12) UL L 234, 17.9.1993, str. 17.
(13) UL L 329, 30.12.1993, str. 54.
(14) UL L 257, 19.9.1998, str. 14.
(15) UL L 118, 6.5.1999, str. 36.
(16) UL L 207, 6.8.1999, str. 13.
(17) UL L 174, 13.7.2000, str. 32.
(18) UL L 209, 6.8.2002, str. 15.
(19) UL L 339, 24.12.2003, str. 78.
PRILOGA I
METODE VZORČENJA
1. NAMEN IN PODROČJE UPORABE
Vzorci za uradni nadzor krme se jemljejo v skladu s spodaj opisanimi metodami. Tako dobljeni vzorci se obravnavajo kot reprezentativni za vzorčene deleže.
2. OSEBJE, KI JEMLJE VZORCE
Vzorce jemljejo osebe, ki jih za to pooblastijo države članice.
3. OPREDELITEV POJMOV
Vzorčeni delež: količina proizvoda, ki predstavlja enoto in ima značilnosti, ki se obravnavajo kot enotne.
Posamični vzorec: količina, ki se vzame iz ene točke vzorčenega deleža.
Skupni vzorec: skupek posamičnih vzorcev, vzetih iz istega vzorčenega deleža.
Zmanjšan skupni vzorec: reprezentativni del skupnega vzorca, dobljen iz slednjega s postopkom redukcije.
Končni vzorec: del zmanjšanega skupnega vzorca ali homogeniziranega skupnega vzorca.
4. OPREMA
|
4.1 |
Oprema za vzorčenje mora biti izdelana iz snovi, ki ne morejo onesnažiti proizvodov, katerih vzorci se jemljejo. Takšno opremo lahko države članice uradno odobrijo. |
4.2 Priporočena oprema za vzorčenje trdne krme
4.2.1 Ročno vzorčenje
|
4.2.1.1 |
Lopatka z ravnim dnom in navpičnimi stranicami. |
|
4.2.1.2 |
Sonda za vzorčenje z dolgo režo ali razdelki. Dimenzije sonde za vzorčenje morajo ustrezati značilnostim vzorčenega deleža (globina posode, velikost vreče itd.) in velikosti delcev krme. |
4.2.2 Mehansko vzorčenje
Za vzorčenje premikajoče se krme se lahko uporablja odobrena mehanska oprema.
4.2.3 Razdelilnik
Naprava, namenjena za delitev vzorca na približno enake dele, ki se lahko uporablja za jemanje posamičnih vzorcev ter za pripravo zmanjšanih skupnih in končnih vzorcev.
5. KOLIČINSKE ZAHTEVE
|
5.A |
Pri nadzoru snovi ali proizvodov, ki so enakomerno porazdeljeni po krmi. |
|
|
5.A.1 |
Vzorčeni delež Velikost vzorčenega deleža mora biti takšna, da se lahko vzorči vsak njegov sestavni del. |
|
|
5.A.2 |
Posamični vzorci |
|
|
5.A.2.1 |
Razsuta krma: |
Najmanjše število posamičnih vzorcev: |
|
5.A.2.1.1 |
vzorčeni deleži, ki ne presegajo 2,5 tone |
7 |
|
5.A.2.1.2 |
vzorčeni deleži, ki presegajo 2,5 tone |
√ 20-kratnik teže vzorčenega deleža (1) v tonah, do največ 40 posamičnih vzorcev |
|
5.A.2.2 |
Pakirana krma: |
Najmanjše število paketov za vzorčenje (2): |
|
5.A.2.2.1 |
Paketi, težji od 1 kg: |
|
|
5.A.2.2.1.1 |
vzorčeni deleži iz 1 do 4 paketov |
vsi paketi |
|
5.A.2.2.1.2 |
vzorčeni deleži iz 5 do 16 paketov |
4 |
|
5.A.2.2.1.3 |
vzorčeni deleži iz več kot 16 paketov |
√ število paketov, ki sestavljajo vzorčeni delež (1), do največ 20 paketov |
|
5.A.2.2.2 |
Paketi, težki do 1 kg |
4 |
|
5.A.2.3 |
Tekoča ali poltekoča krma: |
Najmanjše število posod za vzorčenje (2): |
|
5.A.2.3.1 |
posode s prostornino več kot 1 liter: |
|
|
5.A.2.3.1.1 |
vzorčeni deleži iz 1 do 4 posod |
vse posode |
|
5.A.2.3.1.2 |
vzorčeni deleži iz 5 do 16 posod |
4 |
|
5.A.2.3.1.3 |
vzorčeni deleži iz več kot 16 posod |
√ število posod, ki sestavljajo vzorčeni delež (1), do največ 20 posod |
|
5.A.2.3.2 |
Posode s prostornino do 1 litra |
4 |
|
5.A.2.4 |
Krmni bloki in mineralni lizalni kamni |
Najmanjše število blokov ali lizalnih kamnov za vzorčenje (2): 1 blok ali lizalni kamen na vzorčeni delež s 25 enotami, do največ 4 bloki ali lizalni kamni |
|
5.A.3 |
Skupni vzorec: zahtevan je en skupni vzorec na vzorčeni delež. Skupno število posamičnih vzorcev, ki sestavljajo skupni vzorec, ne sme biti manjše kot: |
|
|
5.A.3.1 |
razsuta krma |
4 kg |
|
5.A.3.2 |
pakirana krma: |
|
|
5.A.3.2.1 |
paketi, težji od 1 kg |
4 kg |
|
5.A.3.2.2 |
paketi, težki do 1 kg |
teža vsebine 4 izvirnih paketov |
|
5.A.3.3 |
Tekoča ali poltekoča krma: |
|
|
5.A.3.3.1 |
posode s prostornino več kot 1 liter |
4 litre |
|
5.A.3.3.2 |
posode s prostornino do 1 litra |
količina vsebine 4 izvirnih paketov |
|
5.A.3.4 |
Krmni bloki ali mineralni lizalni kamni: |
|
|
5.A.3.4.1 |
teže več kot 1 kg po kosu |
4 kg |
|
5.A.3.4.2 |
teže do 1 kg po kosu |
teža štirih izvirnih blokov ali lizalnih kamnov |
|
5.A.4 |
Končni vzorci Iz skupnega vzorca se po potrebi po redukciji oblikuje končni vzorec. Zahtevana je analiza vsaj enega končnega vzorca. Količina končnega vzorca za analizo ne sme biti manjša od: |
|
|
|
trdna krma |
500 g |
|
|
tekoča ali poltekoča krma |
500 ml |
|
5.B |
Pri nadzoru nezaželenih snovi ali proizvodov, za katere obstaja verjetnost, da bodo neenakomerno porazdeljeni po krmi, kot so aflatoksini, rženi rožički, ricinus in krotalarija v posamičnih krmilih (3) |
|
|
5.B.1 |
Vzorčeni delež: glej 5.A.1 |
|
|
5.B.2 |
Posamični vzorci |
|
|
5.B.2.1 |
Razsuta krma: glej 5.A.2.1 |
|
|
5.B.2.2 |
Pakirana krma: |
Najmanjše število paketov za vzorčenje: |
|
5.B.2.2.1 |
vzorčeni deleži iz 1 do 4 paketov |
vsi paketi |
|
5.B.2.2.2 |
vzorčeni deleži iz 5 do 16 paketov |
4 |
|
5.B.2.2.3 |
vzorčeni deleži iz več kot 16 paketov |
√ število paketov, ki sestavljajo vzorčeni delež (1), do največ 40 paketov |
|
5.B.3 |
Skupni vzorci Število skupnih vzorcev je odvisno od velikosti vzorčenega deleža. Najmanjše število skupnih vzorcev na vzorčeni delež je navedeno spodaj. Skupna teža posamičnih vzorcev, ki sestavljajo vsak skupni vzorec, ne sme biti manjša od 4 kg: |
|
|
5.B.3.1 |
Razsuta krma |
|
|
|
Teža vzorčenega deleža v tonah: |
Najmanjše število skupnih vzorcev na vzorčen delež: |
|
|
do vključno 1 |
1 |
|
|
več kot 1 in do vključno 10 |
2 |
|
|
več kot 10 in do vključno 40 |
3 |
|
|
več kot 40 |
4 |
|
5.B.3.2 |
Pakirana krma |
|
|
|
Število paketov vzorčenega deleža: |
Najmanjše število skupnih vzorcev na vzorčen delež: |
|
|
1 do 16 |
1 |
|
|
17 do 200 |
2 |
|
|
201 do 800 |
3 |
|
|
več kot 800 |
4 |
|
5.B.4 |
Končni vzorci Iz vsakega skupnega vzorca se po zmanjšanju oblikuje končni vzorec. Zahteva se analiza vsaj enega končnega vzorca na vzorčeni delež. Teža končnega vzorca za analizo ne sme biti manjša od 500 g. |
|
6. NAVODILA ZA JEMANJE, PRIPRAVO IN PAKIRANJE VZORCEV
6.1 Splošno
Vzorci se morajo jemati in pripravljati v najkrajšem možnem času, pri tem pa se morajo upoštevati vsi potrebni previdnostni ukrepi za preprečitev spremembe ali onesnaženja proizvoda. Instrumenti ter površine in posode, namenjeni za sprejem vzorcev, morajo biti čisti in suhi.
6.2 Posamični vzorci
6.2.A Pri nadzoru snovi ali proizvodov, ki so enakomerno porazdeljeni po krmi
Posamični vzorci morajo biti vzeti naključno iz celega vzorčenega deleža in morajo biti približno enako veliki.
6.2.A.1
Vzorčeni delež se razdeli na približno enake namišljene dele. Število delov, ki ustreza zahtevanemu številu posamičnih vzorcev v skladu s točko 5.A.2, se izbere naključno in iz vsakega od njih se vzame vsaj en vzorec.
Po potrebi se lahko vzorčenje opravi med premikanjem (nakladanjem ali razkladanjem) vzorčenega deleža.
6.2.A.2
Po izbiri zahtevanega števila paketov za vzorčenje, kot je navedeno v točki 5.A.2, se del vsebine vsakega paketa odstrani s sondo ali lopatko. Po potrebi se paketi izpraznijo ločeno in šele nato vzamejo vzorci. V vsakem posameznem skupnem vzorcu se kakršne koli grude razbijejo po potrebi z ločevanjem in vrnitvijo v vzorec.
6.2.A.3
Po izbiri zahtevanega števila posod za vzorčenje iz točke 5.A.2 se vsebina po potrebi homogenizira in iz vsake posode se vzame določena količina.
Posamični vzorci se lahko vzamejo, ko se posoda izprazni.
6.2.A.4
Po izbiri zahtevanega števila posod za jemanje vzorcev iz točke 5.A.2 se vzorci vzamejo z različnih ravni.
Vzorci se lahko vzamejo tudi, ko se posoda izprazni, vendar se prvi deli zavržejo.
Vsa odvzeta količina v nobenem primeru ne sme biti manjša od 10 litrov.
6.2.A.5
Po izbiri zahtevanega števila blokov ali lizalnih kamnov za vzorčenje iz točke 5.A.2 se vzame del vsakega bloka ali lizalnega kamna.
6.2.B Pri nadzoru nezaželenih snovi ali proizvodov, za katere obstaja verjetnost, da bodo neenakomerno porazdeljeni po krmi, kot so aflatoksini, rženi rožički, ricinus in krotalarija v posamičnih krmilih
Vzorčeni delež se razdeli na približno enake namišljene dele, ki ustrezajo številu skupnih vzorcev iz točke 5.B.3. Če je to število višje od ena, se skupno število posamičnih vzorcev iz točke 5.B.2 približno enakomerno razdeli po različnih delih. Nato se vzamejo približno enako veliki vzorci (4), ki morajo biti takšni, da skupna količina v vzorcih iz vsakega dela ni manjša od najmanj 4 kg, kolikor se zahteva za vsak skupni vzorec. Posamični vzorci, odvzeti iz različnih delov, se ne združijo v skupni vzorec.
6.3 Priprava skupnih vzorcev
6.3.A Pri nadzoru snovi ali proizvodov, ki so enakomerno porazdeljeni po krmi
Posamični vzorci se zmešajo, da sestavljajo skupni vzorec.
6.3.B Pri nadzoru nezaželenih snovi ali proizvodov, za katere obstaja verjetnost, da bodo neenakomerno porazdeljeni po krmi, kot so aflatoksini, rženi rožički, ricinus in krotalarija v posamičnih krmilih
Posamični vzorci iz vsakega dela vzorčenega deleža se zmešajo in pripravi se število skupnih vzorcev iz točke 5.B.3, pri čemer je treba zabeležiti izvor vsakega skupnega vzorca.
6.4 Priprava končnih vzorcev
Material v vsakem skupnem vzorcu se previdno zmeša, da nastane homogeniziran vzorec (5). Po potrebi se skupni vzorec najprej zmanjša na najmanj 2 kg ali 2 litra (zmanjšan skupni vzorec), in sicer z uporabo mehanskega ali avtomatskega razdelilnika ali razdelitvijo na četrtine.
Nato se pripravijo vsaj trije končni vzorci, ki so približno enako veliki in ustrezajo količinskim zahtevam iz točke 5.A.4 ali 5.B.4. Vsak vzorec se shrani v ustrezno posodo. Sprejeti je treba vse potrebne previdnostne ukrepe, da se med prevozom ali shranjevanjem prepreči kakršna koli sprememba sestave vzorca, onesnaženje ali mešanje.
6.5 Pakiranje končnih vzorcev
Posode ali paketi se zapečatijo in označijo z etiketami (celotna etiketa mora biti vključena v pečat) tako, da jih ni mogoče odpreti, ne da bi se pri tem poškodoval pečat.
7. EVIDENTIRANJE VZORČENJA
Vsako vzorčenje je treba evidentirati, tako da se lahko vsak vzorčeni delež nedvoumno prepozna.
8. POŠILJANJE VZORCEV
Za vsak skupni vzorec se v pooblaščeni laboratorij za analizo v najkrajšem možnem času pošlje najmanj en končni vzorec skupaj z vsemi informacijami, ki jih potrebuje oseba, ki izvaja analizo.
(1) Kadar število ni celo število, se zaokroži navzgor na naslednje celo število.
(2) Za pakete ali posode, katerih vsebina ne presega 1 kg ali 1 litra, ter za bloke ali lizalne kamne, ki posamično ne tehtajo več kot 1 kg, je vsebina posamičnega vzorca en izvirni paket ali izvirna posoda, en blok ali en kamen.
(3) Metode iz 5.A se uporabljajo za nadzor aflatoksinov, rženih rožičkov, ricinusa in krotalarije pri popolnih in dopolnilnih krmnih mešanicah.
(4) Pri pakirani krmi se po ločeni izpraznitvi paketov vsebina paketov za vzorčenje po potrebi odstrani s sondo ali lopatko.
(5) V vsakem posameznem skupnem vzorcu se kakršne koli grude razbijejo (po potrebi z ločevanjem in vrnitvijo v vzorec).
PRILOGA II
SPLOŠNE DOLOČBE O ANALITSKIH METODAH ZA KRMO
A. PRIPRAVA VZORCEV ZA ANALIZO
1. Namen
Spodaj navedeni postopki opisujejo pripravo končnih vzorcev za analizo, ki se pošljejo nadzornim laboratorijem po vzorčenju v skladu z določbami iz Priloge I.
Ti vzorci se morajo pripraviti tako, da so natehtane količine, določene za analitske metode, homogene in reprezentativne za končne vzorce.
2. Previdnostni ukrepi
Postopek za pripravo vzorca je odvisen od uporabljene analitske metode. Zato je zelo pomembno zagotoviti, da je postopek za pripravo vzorca primeren za uporabljeno analitsko metodo.
Vse potrebne operacije se morajo izvesti tako, da se čim bolj prepreči onesnaženje vzorca in sprememba njegove sestave.
Drobljenje, mešanje in sejanje se izvedejo na najhitrejši možni način, tako da je vzorec čim manj izpostavljen zraku in svetlobi. Mlini in drobilci, ki verjetno znatno segrejejo vzorec, se ne uporabljajo.
Krmo, ki je posebej občutljiva na toploto, je priporočljivo drobiti ročno. Pri delu z opremo se zagotovi, da ni vir onesnaženja z elementi v sledovih.
Če pri pripravi ni možno preprečiti bistvene spremembe vsebnosti vlage v vzorcu, je treba v skladu z metodo iz dela A Priloge III določiti vsebnost vlage pred in po pripravi.
3. Postopek
Vzorec se z ustreznimi tehnikami delitve, kot sta izmenično odvzemanje vzorca z zajemalko ali odvzemanje vzorca ob stacionarnem ali rotacijskem mešanju, razdeli na ustrezne manjše vzorce za analizo in za referenčne vzorce. Stožčasta delitev vzorca ali delitev vzorca v četrtine nista priporočljivi, ker se lahko pojavijo hude napake v cepitvi podvzorcev. Referenčni vzorec je treba hraniti v primerno čisti in suhi posodi z neprepustnim zamaškom, manjše dele, ki tehtajo vsaj 100 g, pa je treba pripraviti za analizo, kakor je navedeno v nadaljnjem besedilu.
3.1 Krma, ki jo je mogoče drobiti kot tako
Če v analitski metodi ni navedeno drugače, se po drobljenju celoten vzorec po potrebi preseje s sitom s kvadratnimi odprtinami 1 mm (v skladu s priporočilom ISO R565). Izogibati se je treba prekomernemu drobljenju.
Presejani vzorec se premeša in zbere v primerno čisto in suho posodo z neprepustnim zamaškom. Tik preden se natehta količina za analizo, se vzorec še enkrat premeša.
3.2 Krma, ki jo je mogoče drobiti po sušenju
Če v analitski metodi ni navedeno drugače, se vzorec v skladu s postopkom za predhodno sušenje iz točke 4.3 metode za določanje vsebnosti vlage iz dela A Priloge III suši toliko časa, da se vsebnost vlage zniža na 8–12 %. Nato se nadaljuje, kakor je navedeno v oddelku 3.1.
3.3 Tekoča ali poltekoča krma
Vzorec se zbere v primerno čisto in suho posodo z neprepustnim zamaškom. Tik preden se natehta količina za analizo, se vzorec še enkrat dobro premeša.
3.4 Druga krma
Vzorci, ki se ne morejo pripraviti v skladu z enim izmed zgoraj navedenih postopkov, se obdelajo po katerem koli drugem postopku, ki zagotavlja, da bo količina vzorca, natehtana za analizo, homogena in reprezentativna za končne vzorce.
4. Shranjevanje vzorcev
Vzorci se morajo hraniti pri temperaturi, ki ne bo spremenila njihove sestave. Vzorci, namenjeni za analizo vitaminov ali snovi, ki so posebno občutljive na svetlobo, se hranijo v posodah iz rjavega stekla.
B. DOLOČBE O REAGENTIH IN OPREMI, KI SE UPORABLJAJO PRI ANALITSKIH METODAH
|
1. |
Če v analitskih metodah ni posebej določeno, morajo biti vsi reagenti za analizo analitsko čisti (a.č.). Pri analiziranju sledov se mora čistost reagentov preveriti s slepim preskusom. Glede na dobljene rezultate je morda potrebno dodatno čiščenje reagentov. |
|
2. |
Pri vseh postopkih analitskih metod, ki vključujejo pripravo raztopin, razredčevanje, spiranje ali izpiranje in pri katerih vrsta uporabljenega topila ali razredčila ni navedena, se mora uporabiti voda. Praviloma je voda demineralizirana ali destilirana. V posameznih primerih, ki so posebej navedeni v analitskih metodah, jo je treba prečistiti s posebnimi postopki. |
|
3. |
Ob upoštevanju opreme, ki je ponavadi prisotna v kontrolnih laboratorijih, so pri analitskih metodah navedeni le posebni instrumenti in naprave ali tisti, ki zahtevajo posebno uporabo. Biti morajo čisti, zlasti pri določanju zelo nizkih količin snovi. |
C. UPORABA ANALITSKIH METOD IN PRIKAZ REZULTATOV
1. Postopek ekstrakcije
Pri številnih metodah je določen poseben postopek ekstrakcije. Praviloma se lahko uporabijo postopki ekstrakcije, ki se razlikujejo od postopka iz metode, če je za uporabljeni postopek učinkovitost ekstrakcije za analizirano matrico dokazano enakovredna postopku iz metode.
2. Postopek čiščenja
Pri številnih metodah je določen poseben postopek čiščenja. Praviloma se lahko uporabijo drugi postopki čiščenja, ki se razlikujejo od postopka iz metode, če je za uporabljeni postopek analitska učinkovitost čiščenja za analizirano matrico dokazano enakovredna postopku iz metode.
3. Poročanje o uporabljeni analitski metodi
Na splošno je za določanje vsake snovi v krmi določena ena sama metoda. Kadar je določenih več metod, mora kontrolni laboratorij v poročilu o analizi navesti, katero metodo je uporabil.
4. Število določanj
Rezultat, naveden v poročilu o analizi, je srednja vrednost vsaj dveh določanj z zadovoljivo ponovljivostjo, izvedenih na ločenih vzorčenih deležih.
Vendar pri analizi nezaželenih snovi, če je rezultat prvega določanja bistveno (> 50 %) nižji od specifikacije, ki se nadzira, dodatna določanja niso potrebna, če so bili uporabljeni ustrezni kakovostni postopki.
Pri nadzoru navedene vsebnosti snovi ali sestavine, če rezultat prvega določanja potrdi navedeno vsebnost, tj. rezultat analize je znotraj sprejemljivih meja odstopanja navedene vsebnosti, dodatna določanja niso potrebna, če so bili uporabljeni ustrezni kakovostni postopki.
V nekaterih primerih je ta sprejemljiva meja odstopanja opredeljena v zakonodaji, kot je Direktiva Sveta 79/373/EGS (1).
5. Poročanje o rezultatih analize
Rezultat analize se prikaže tako, kakor je navedeno v analitski metodi, na primerno število decimalk, in se po potrebi popravi glede na vsebnost vlage v končnem vzorcu pred pripravo.
6. Nezanesljivost meritve in popravek za izkoristek pri analizi nezaželenih snovi
V zvezi z nezaželenimi snovmi po Direktivi 2002/32/ES, vključno z dioksini in dioksinom podobnimi PCB, se proizvod, namenjen za živalsko krmo, šteje za neskladnega z določeno najvišjo vsebnostjo, če rezultat analize presega najvišjo vsebnost ob upoštevanju razširjene nezanesljivosti meritve in popravka za izkoristek. Za oceno skladnosti se uporabi analizirana koncentracija s popravkom za izkoristek, od katere se odšteje razširjena nezanesljivost meritve. Ta postopek se uporabi le v primerih, kadar analitska metoda omogoča oceno nezanesljivosti meritve in popravka za izkoristek (tj. ni možna na primer v primeru mikroskopske analize).
O rezultatu analize se poroča (če uporabljena analitska metoda omogoča oceno nezanesljivosti meritve in popravka za izkoristek) na naslednji način:
|
(a) |
s popravkom za izkoristek, pri čemer se navede raven popravka. Popravek za izkoristek ni potrebno uporabiti, če je 90–110-odstoten; |
|
(b) |
kot „x +/– U“, pri čemer je x rezultat analize in U razširjena nezanesljivost meritve, ob uporabi faktorja za zajetje 2, zaradi katerega je stopnja zanesljivosti približno 95 %. |
Vendar če je rezultat analize bistveno (> 50 %) nižji od specifikacije, ki se določa, in je bil uporabljen ustrezni kakovostni postopek ter je namen analize le preverjanje skladnosti z zakonodajnimi določbami, se lahko rezultat analize poroča brez popravka za izkoristek, popravek za izkoristek in nezanesljivost meritve pa se lahko v teh primerih izpustita.
PRILOGA III
ANALITSKE METODE ZA NADZOR SESTAVE POSAMIČNIH KRMIL IN KRMNIH MEŠANIC
A. DOLOČANJE VLAGE
1. Namen in področje uporabe
Ta metoda omogoča določanje vsebnosti vlage v krmi. Kadar krma vsebuje hlapne snovi, kot so organske kisline, je treba upoštevati, da se pri določanju vlage zajame tudi bistvena količina hlapnih snovi.
Ta metoda ne zajema analizo mlečnih izdelkov kot posamičnih krmil, analizo mineralnih snovi, analizo mineralnih mešanic, sestavljenih predvsem iz mineralnih snovi, analizo živalskih in rastlinskih maščob in olj ali analizo oljnih semen in oljnatega sadja.
2. Načelo
Vzorec se osuši pri določenih pogojih, ki se spreminjajo glede na vrsto krme. Izguba mase se določi s tehtanjem. Pri trdni krmi z visoko vsebnostjo vlage je treba izvesti predhodno sušenje.
3. Oprema
|
3.1 |
Drobilec iz materiala, ki ne absorbira vlage, in se lahko enostavno čisti, omogoča hitro in enakomerno drobljenje brez pregretja, v največji možni meri preprečuje stik z zunanjim zrakom ter ustreza zahtevam iz 4.1.1 in 4.1.2 (npr. udarni ali vodno hlajeni mikrodrobilci, konusni mlini, počasni drobilniki ali drobilniki na zobata kolesa). |
|
3.2 |
Analitska tehtnica, natančna na 1 mg |
|
3.3 |
Suhe posode iz nerjaveče kovine ali stekla s pokrovi, ki omogočajo zapiranje, neprepustno za zrak; delovna površina, ki omogoča razprostrtje vzorca na približno 0,3 g/cm2. |
|
3.4 |
Električno ogrevan izotermičen sušilnik (± 2 oC) s primerno ventilacijo in ki zagotavlja hitro uravnavanje temperature (1). |
|
3.5 |
Nastavljiv električni vakuumski sušilnik, opremljen z oljno črpalko in mehanizmom za dovajanje suhega vročega zraka ali s sušilnim sredstvom (npr. kalcijevim oksidom). |
|
3.6 |
Eksikator z debelo kovinsko ali porcelansko perforirano ploščo, ki vsebuje učinkovito sušilno sredstvo. |
4. Postopek
|
Opomba |
: |
Postopki, opisani v tem oddelku, se morajo izvajati takoj po odprtju posod z vzorci. Analiza se mora izvesti najmanj v dveh vzporednih določitvah. |
4.1 Priprava
4.1.1
Vzame se najmanj 50 g vzorca. Po potrebi se zdrobi ali razdeli tako, da se prepreči sprememba vsebnosti vlage (glej točko 6).
4.1.2
Vzame se najmanj 50 g vzorca. Zdrobi se tako, da najmanj 50 % delcev preide skozi sito z odprtinami velikosti 0,5 mm in jih na situ z okroglimi odprtinami velikosti 1 mm ostane največ 10 %.
4.1.3
Približno 25 g vzorca se natehta na 10 mg natančno, doda se primerna količina brezvodnega peska, stehtanega na 10 mg natančno, in se meša do nastanka homogene mase.
4.2 Sušenje
4.2.1
Posoda (3.3) s pokrovom se stehta na 1 mg natančno. V stehtano posodo se natehta 5 g vzorca na 1 mg natančno, ki se enakomerno porazdeli. Posoda brez pokrova se postavi v sušilnik, segret na 103 oC. Posoda se postavi v sušilnik v najkrajšem možnem času, da se prepreči prevelik padec temperature. Sušenje traja štiri ure od trenutka, ko je temperatura v sušilniku ponovno 103 oC. Posoda se pokrije s pokrovom, vzame iz sušilnika, pusti v eksikatorju (3.6) 30 do 45 minut, da se ohladi, in stehta na 1 mg natančno.
Krma, sestavljena zlasti iz olj in maščob, se suši v sušilniku nadaljnjih 30 minut pri 130 oC. Razlika med obema tehtanjema ne sme presegati 0,1 % vlage.
4.2.2
Posoda (3.3) s pokrovom se stehta na 0,5 mg natančno. V stehtano posodo se natehta približno 5 g zdrobljenega vzorca na 1 mg natančno, ki se enakomerno porazdeli. Posoda brez pokrova se postavi v sušilnik, segret na 130 oC. Posoda se postavi v sušilnik v najkrajšem možnem času, da se prepreči prevelik padec temperature. Sušenje traja 2 uri od trenutka, ko je temperatura v sušilniku ponovno 130 oC. Posoda se pokrije s pokrovom, vzame iz sušilnika, pusti v eksikatorju (3.6) 30 do 45 minut, da se ohladi, in stehta na 1 mg natančno.
|
4.2.3 |
Krmne mešanice, ki vsebujejo več kot 4 % saharoze ali laktoze: posamična krmila, kot so rožiči, hidrolizirani žitni proizvodi, fermentirana semena, posušena mleta pesa, ribe in raztopine sladkorja; krmne mešanice, ki vsebujejo več kot 25 % mineralnih soli, vključno s kristalno vodo. Posoda (3.3) s pokrovom se stehta na 0,5 mg natančno. V stehtano posodo se natehta približno 5 g vzorca na 1 mg natančno, ki se enakomerno porazdeli. Posoda brez pokrova se postavi v vakuumski sušilnik (3.5), segret na 80–85 oC. Posoda se postavi v sušilnik v najkrajšem možnem času, da se prepreči prevelik padec temperature. Počaka se, da tlak naraste do 100 torov in pri tem tlaku sušenje traja štiri ure na vročem suhem zraku ali s sušilnim sredstvom (približno 300 g za 20 vzorcev). V zadnjem primeru se vakuumska črpalka izklopi, ko je želeni tlak dosežen. Čas sušenja se računa od trenutka, ko je temperatura v sušilniku ponovno 80–85 oC. Tlak v sušilniku se previdno izenači z atmosferskim. Sušilnik se odpre, posoda se takoj pokrije s pokrovom in vzame iz peči, pusti se 30 do 45 minut v eksikatorju (3.6), da se ohladi, in stehta na 1 mg natančno. Suši se nadaljnjih 30 minut v vakuumskem sušilniku pri 80–85 oC in ponovno stehta. Razlika med obema tehtanjema ne sme presegati 0,1 % vlage. |
4.3 Predhodno sušenje
4.3.1
Trdna krma z visoko vsebnostjo vlage, ki jo je težko drobiti, mora biti predhodno sušena na naslednji način:
v primerno posodo (npr. aluminijast krožnik velikosti 20 × 12 cm in z robom 0,5 cm) se natehta 50 g nezdrobljenega vzorca na 10 mg natančno (stisnjeno ali zgoščeno krmo se lahko po potrebi na grobo razdeli). V sušilniku se suši pri 60–70 oC, dokler se vsebnost vlage ne zniža na 8–12 %. Posoda se vzame iz sušilnika in eno uro ohlaja v laboratoriju brez pokrova, nato pa stehta na 10 mg natančno. Krma se takoj zdrobi, kakor je navedeno v točki 4.1.1, in osuši, kakor je navedeno v točki 4.2.1 ali 4.2.3 glede na vrsto krme.
4.3.2
Zrna z vsebnostjo vlage nad 17 % morajo biti predhodno sušena na naslednji način:
v primerno posodo (npr. aluminijast krožnik velikosti 20 × 12 cm in z robom 0,5 cm) se natehta 50 g nezdrobljenega zrna na 10 mg natančno. Suši se 5 do 7 minut v sušilniku pri 130 oC. Posoda se vzame iz sušilnika in 2 uri ohlaja v laboratoriju brez pokrova ter nato stehta na 10 mg natančno. Krma se takoj zmelje, kakor je navedeno v točki 4.1.2, in osuši, kakor je navedeno v točki 4.2.2.
5. Izračun rezultatov
Vsebnost vlage (X), izražena kot masni delež vzorca, se izračuna po naslednji formuli:
5.1 Sušenje brez predhodnega sušenja

pri čemer je:
|
m |
= |
začetna masa vzorčenega deleža v gramih; |
|
m0 |
= |
masa suhega vzorčenega deleža v gramih. |
5.2 Sušenje s predhodnim sušenjem
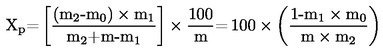
pri čemer je:
|
m |
= |
začetna masa vzorčenega deleža v gramih; |
|
m1 |
= |
masa vzorčenega deleža po predhodnem sušenju v gramih; |
|
m2 |
= |
masa vzorčenega deleža po drobljenju ali mletju v gramih; |
|
m0 |
= |
masa suhega vzorčenega deleža v gramih. |
5.3 Ponovljivost
Razlika med rezultatoma dveh vzporednih določanj, izvedenih na istem vzorcu, ne presega 0,2 % absolutne vrednosti vlage.
6. Opomba
Če se izkaže, da je potrebno drobljenje, in če se izkaže, da se pri tem spremeni vsebnost vlage v proizvodu, se morajo rezultati analize sestavin krme popraviti glede na vsebnost vlage v vzorcu v prvotnem stanju.
B. DOLOČANJE VLAGE V MAŠČOBAH IN OLJIH ŽIVALSKEGA IN RASTLINSKEGA IZVORA
1. Namen in področje uporabe
Ta metoda se uporablja za določanje vsebnosti vode in hlapnih snovi v maščobah in oljih živalskega in rastlinskega izvora.
2. Načelo
Vzorec se posuši do konstantne mase (izguba mase med dvema zaporednima tehtanjema ne sme presegati 1 mg) pri 103 oC. Izguba mase se določi s tehtanjem.
3. Oprema
|
3.1 |
Posoda z ravnim dnom iz nerjavečega materiala s premerom 8 do 9 cm in višino približno 3 cm |
|
3.2 |
Termometer z utrjeno bučko in podaljškom na zgornjem delu, s skalo od približno 80 oC do vsaj 110 oC in dolžino približno 10 cm |
|
3.3 |
Peščena kopel ali električna plošča |
|
3.4 |
Eksikator, ki vključuje učinkovito sušilo |
|
3.5 |
Analitska tehtnica |
4. Postopek
Približno 20 g homogeniziranega vzorca se natehta na 1 mg natančno in prenese v suho, stehtano posodo (3.1), v kateri je termometer (3.2). Ob nenehnem mešanju s termometrom se segreva na peščeni kopeli ali vroči plošči (3.3) tako, da temperatura doseže 90 oC v približno 7 minutah.
Temperatura se zniža, pri čemer se opazuje pogostost dviganja mehurčkov z dna posode. Temperatura ne sme preseči 105 oC. Nadaljuje se z mešanjem in pri tem se drgne dno posode, dokler mehurčki ne prenehajo izhajati.
Da se zagotovi popolna odstranitev vlage, se večkrat segreje na 103 ± 2 oC ob ohlajevanju na 93 oC med zaporednimi segrevanji. Nato se pusti, da se vzorec v eksikatorju (3.4) ohladi na sobno temperaturo, in se stehta. Postopek se ponavlja, dokler izguba mase med dvema zaporednima tehtanjema ni manjša od 2 mg.
|
Opomba |
: |
Povečanje mase vzorca po ponovljenem segrevanju kaže na oksidacijo maščobe, v tem primeru je treba upoštevati rezultat tehtanja, izvedenega neposredno pred začetkom povečevanja mase. |
5. Izračun rezultatov
Masni delež vlage (X) v vzorcu se izračuna po naslednji formuli:

pri čemer je:
|
m |
= |
masa vzorčenega deleža v gramih; |
|
m1 |
= |
masa posode z vsebino pred segrevanjem v gramih; |
|
m2 |
= |
masa posode z vsebino po segrevanju v gramih. |
Rezultati, nižji od 0,05 %, se navedejo kot „manj kot 0,05 %“.
Ponovljivost
Razlika med rezultatoma dveh vzporednih določanj, izvedenih na istem vzorcu, ne sme presegati 0,05 % absolutne vrednosti.
C. DOLOČANJE VSEBNOSTI SUROVIH BELJAKOVIN
1. Namen in področje uporabe
Ta metoda se uporablja za določanje vsebnosti surovih beljakovin v krmi na podlagi vsebnosti dušika, določenega po Kjeldahlovi metodi.
2. Načelo
Vzorec se razkroji z žveplovo kislino v prisotnosti katalizatorja. Raztopina natrijevega hidroksida se doda kisli raztopini, da postane bazična. Amonijak se destilira in zbere v odmerjeno količino žveplove kisline, katere presežek se titrira s standardno raztopino natrijevega hidroksida.
Sproščeni amonijak se lahko destilira v presežek raztopine borove kisline ter nato titrira z raztopino klorovodikove ali žveplove kisline.
3. Reagenti
|
3.1 |
Kalijev sulfat |
|
3.2 |
Katalizator: bakrov (II) oksid CuO ali bakrov (II) sulfat pentahidrat, CuSO4 5H2O |
|
3.3 |
Cink v zrncih |
|
3.4 |
Žveplova kislina, ρ20 = 1,84 g/ml |
|
3.5 |
Žveplova kislina, standardna volumetrična raztopina, c(H2SO4) = 0,25 mol/l |
|
3.6 |
Žveplova kislina, standardna volumetrična raztopina, c(H2SO4) = 0,10 mol/l |
|
3.7 |
Žveplova kislina, standardna volumetrična raztopina, c(H2SO4) = 0,05 mol/l |
|
3.8 |
Indikator metil rdeče; 300 mg metil rdečega se raztopi v 100 ml etanola, σ = 95–96 % (v/v) |
|
3.9 |
Raztopina natrijevega hidroksida (lahko tehnična) β = 40 g/100 ml (m/v: 40 %) |
|
3.10 |
Žveplova kislina, standardna volumetrična raztopina, c(NaOH) = 0,25 mol/l |
|
3.11 |
Žveplova kislina, standardna volumetrična raztopina, c(NaOH) = 0,10 mol/l |
|
3.12 |
Zdrobljen plovec, opran v klorovodikovi kislini in prežaren |
|
3.13 |
Acetanilid (tališče = 114 oC, N-vsebnost = 10,36 %) |
|
3.14 |
Saharoza (brez dušika) |
|
3.15 |
Borova kislina (H3BO3) |
|
3.16 |
Raztopina indikatorja metil rdeče: 100 mg metil rdečega se raztopi v 100 ml etanola ali metanola. |
|
3.17 |
Raztopina bromokrezol zelenega: 100 mg bromokrezol zelenega se raztopi v 100 ml etanola ali metanola. |
|
3.18 |
Raztopina borove kisline (10–40 g/l glede na uporabljeno opremo) Pri določanju s kolorimetrično ekvivalentno točko se morata raztopinam borove kisline dodati indikatorja metil rdeče in bromokrezol. Pri pripravi 1 litra raztopine borove kisline se pred uravnavanjem volumna doda 7 ml raztopine indikatorja metil rdeče (3.16) in 10 ml raztopine bromokrezol zelenega (3.17). Glede na uporabljeno vodo se lahko pH raztopine borove kisline med serijami razlikuje. Pogosto je za doseganje pozitivnega slepega vzorca treba dodati majhen volumen baze.
|
|
3.19 |
Klorovodikova kislina, standardna volumetrična raztopina, c(HCl) = 0,10 mol/l
|
4. Oprema
Naprava, primerna za izvajanje razklopa, destilacije in titracije po Kjeldahlovi metodi.
5. Postopek
5.1 Razklop
1 g vzorca se natehta na 0,001 g natančno in se prenese v bučko naprave za razklop. Doda se 15 g kalijevega sulfata (3.1), ustrezna količina katalizatorja (3.2) (0,3–0,4 g bakrovega (II) oksida ali 0,9–1,2 g bakrovega (II) sulfat pentahidrata), 25 ml žveplove (VI) kisline (3.4) in po potrebi nekaj zrnc plovca (3.12) ter vse skupaj premeša.
Bučka se najprej zmerno segreva in po potrebi občasno obrne, dokler masa ne zogleni in pena ne izgine; nato se močneje segreva do enakomernega vretja tekočine. Segrevanje je ustrezno, če se vrela kislina kondenzira na stenah bučke. Paziti je treba, da se stene bučke ne pregrejejo in da se organski delci ne sprimejo nanje.
Ko se raztopina zbistri in obarva rahlo zeleno, se pusti vreti še 2 uri, nato pa pusti, da se ohladi.
5.2 Destilacija
Previdno se doda toliko vode, da se sulfati povsem raztopijo. Pusti se, da se ohladi, nato pa se po potrebi doda nekaj zrnc cinka (3.3). Nadaljuje se v skladu s točko 5.2.1 ali 5.2.2.
5.2.1
V zbirno bučko naprave za destilacijo se doda natančno 25 ml žveplove kisline (3.5) ali (3.7) glede na pričakovano vsebnost dušika. Doda se nekaj kapljic indikatorja metil rdeče (3.8).
Bučka za razklop se poveže s kondenzatorjem naprave za destilacijo in konica kondenzatorja se potopi v tekočino v zbirni bučki vsaj do globine 1 cm (glej opombo 8.3). V bučko za razklop se počasi vlije 100 ml raztopine natrijevega hidroksida (3.9) tako, da ne pride do izgube amonijaka (glej opombo 8.1). Bučka se segreva do popolne destilacije amonijaka.
5.2.2.
Pri ročni titraciji amonijaka iz destilata se uporablja spodaj navedeni postopek. Kadar je destilacijska enota v celoti avtomatizirana in vključuje titracijo amonijaka iz destilata, se upoštevajo navodila proizvajalca za upravljanje z destilacijsko enoto.
Zbirna bučka s 25–30 ml raztopine borove kisline (3.18) se postavi pod izhodno odprtino kondenzatorja tako, da je dovodna cev pod površino presežka raztopine borove kisline. Destilacijska enota se nastavi tako, da se dovaja 50 ml raztopine natrijevega hidroksida (3.9). Destilacijska enota se upravlja v skladu z navodili proizvajalca, sproščeni amonijak pa se destilira z raztopino natrijevega hidroksida. Destilat se zbere v raztopino borove kisline. Na količino destilata (čas parne destilacije) vpliva količina dušika v vzorcu. Upoštevati je treba navodila proizvajalca.
|
Opomba |
: |
V polavtomatski destilacijski enoti sta dodajanje presežka natrijevega hidroksida in parna destilacija avtomatizirana postopka. |
5.3 Titracija
Nadaljuje se v skladu s točko 5.3.1 ali 5.3.2.
5.3.1
Presežek žveplove kisline v zbirni bučki se titrira do ekvivalentne točke z raztopino natrijevega hidroksida (3.10 ali 3.11) glede na koncentracijo uporabljene žveplove kisline.
5.3.2
Vsebina zbirne bučke se titrira s standardno volumetrično raztopino klorovodikove kisline (3.19) ali standardno volumetrično raztopino žveplove kisline (3.6), pri čemer se uporabi bireta in odčita količina uporabljene titracijske snovi.
Pri določanju s kolorimetrično ekvivalentno točko je ekvivalentna točka dosežena pri prvem znaku rožnatega obarvanja vsebine. Volumen birete se odčita na 0,05 ml natančno. Magnetna mešalna plošča z osvetlitvijo ali fotometrični detektor lahko pripomoreta k določanju ekvivalentne točke.
Parni destilator z avtomatično titracijo lahko to opravi avtomatično.
Upoštevati je treba navodila proizvajalca za upravljanje specifičnega destilatorja ali destilatorja/titratorja.
|
Opomba |
: |
Pri avtomatičnem sistemu titriranja se titracija začne takoj po začetku destilacije, uporabi pa se 1-odstotna raztopina borove kisline (3.18). Pri popolnoma avtomatizirani destilacijski enoti se lahko izvaja avtomatična titracija amonijaka, ekvivalentna točka pa se lahko določa s potenciometričnim pH sistemom. V tem primeru se uporablja avtomatični titrator s pH metrom. Ta pH meter se ustrezno umeri med pH 4 in pH 7 z običajnimi laboratorijskimi postopki za umerjanje pH. Ekvivalentna točka pH pri titraciji je dosežena pri pH 4,6, ko je naklon titracijske krivulje največji (točka pregiba). |
5.4 Slepi preskus
Slepi preskus (razklop, destilacija in titracija), v katerem se namesto vzorca uporabi 1 g saharoze (3.14), se izvede za potrditev, da reagenti ne vsebujejo dušika.
6. Izračun rezultatov
Izračuni se izvedejo v skladu s točko 6.1 ali 6.2.
6.1 Izračun za titracijo v skladu s točko 5.3.1
Vsebnost surovih beljakovin, izražena kot masni delež, se izračuna po naslednji formuli:
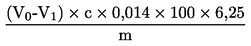
pri čemer je:
|
Vo |
= |
volumen (ml) NaOH (3.10 ali 3.11), uporabljen pri slepem preskusu; |
|
V1 |
= |
volumen (ml) NaOH (3.10 ali 3.11), uporabljen pri titraciji vzorca; |
|
c |
= |
koncentracija (mol/l) natrijevega hidroksida (3.10 ali 3.11); |
|
m |
= |
masa (g) vzorca. |
6.2 Izračun za titracijo v skladu s točko 5.3.2
6.2.1
Vsebnost surovih beljakovin, izražena kot masni delež, se izračuna po naslednji formuli:

pri čemer je:
|
m |
= |
masa (g) vzorčenega deleža; |
|
c |
= |
koncentracija (mol/l) standardne volumetrične raztopine klorovodikove kisline (3.19); |
|
V0 |
= |
volumen (ml) klorovodikove kisline, uporabljen pri slepem preskusu; |
|
V1 |
= |
volumen (ml) klorovodikove kisline, uporabljen v vzorčenem deležu. |
6.2.2
Vsebnost surovih beljakovin, izražena kot masni delež, se izračuna po naslednji formuli:

pri čemer je:
|
m |
= |
masa (g) vzorčenega deleža; |
|
c |
= |
koncentracija (mol/l) standardne volumetrične raztopine žveplove kisline (3.6); |
|
V0 |
= |
volumen (ml) žveplove kisline (3.6), uporabljen v slepem preskusu; |
|
V1 |
= |
volumen (ml) žveplove kisline (3.6), uporabljen v vzorčenem deležu. |
7. Preverjanje metode
7.1 Ponovljivost
Razlika med rezultatoma dveh vzporednih določanj, izvedenih na istem vzorcu, ne sme presegati:
|
— |
0,2 % absolutne vrednosti za vsebnosti surovih beljakovin pod 20 %, |
|
— |
1,0 % višje vrednosti za vsebnosti surovih beljakovin 20–40 %, |
|
— |
0,4 % absolutne vrednosti za vsebnosti surovih beljakovin nad 40 %. |
7.2 Točnost
Za analizo (razklop, destilacija, titracija) se uporabi 1,5 do 2,0 g acetanilida (3.13) ob navzočnosti 1 g saharoze (3.14); za 1 g acetanilida se porabi 14,80 ml žveplove kisline (3.5). Izkoristek mora biti najmanj 99-odstoten.
8. Opombe
|
8.1 |
Naprava je lahko ročna, polavtomatska ali avtomatska. Če je pri napravi med razklopom in destilacijo potreben prenos, se ta prenos mora izvesti brez kakršne koli izgube. Če bučka naprave za destilacijo ni opremljena s kapalnim lijakom, se natrijev hidroksid doda tik pred povezavo bučke s kondenzatorjem, pri čemer se tekočina vliva počasi ob steni bučke. |
|
8.2 |
Če se vsebina bučke strjuje, se določanje začne znova, vendar z večjo količino žveplove kisline (3.4), kakor je navedeno zgoraj. |
|
8.3 |
Pri proizvodih z nizko vsebnostjo dušika se lahko volumen žveplove kisline (3.7), ki se doda v zbirno bučko, po potrebi zmanjša na 10 ali 15 ml, bučka pa se dopolni do 25 ml z vodo. |
|
8.4 |
Pri redni analizi se lahko za določanje surovih beljakovin uporabi nadomestna analitska metoda, vendar je Kjeldahlova metoda, opisana v tem delu C, referenčna metoda. Za vsako matrico posebej je treba dokazati, da so rezultati, pridobljeni z nadomestno metodo (npr. DUMAS), enakovredni rezultatom, pridobljenim z referenčno metodo. V poročilu o analizi je treba navesti analitsko metodo, uporabljeno za določanje surovih beljakovin, saj lahko rezultati, pridobljeni z nadomestno metodo, kljub potrditvi enakovrednosti, odstopajo od rezultatov, pridobljenih z referenčno metodo. |
D. DOLOČANJE SEČNINE
1. Namen in področje uporabe
Ta metoda omogoča določanje ravni sečnine v krmi.
2. Načelo
Vzorec se suspendira v vodi s snovjo za zbistritev. Suspenzija se filtrira. Doda se 4-dimetilaminobenzaldehid (4-DMAB), nato pa se določi vsebnost sečnine v filtratu z merjenjem optične gostote pri valovni dolžini 420 nm.
3. Reagenti
|
3.1 |
Raztopina 4-dimetilaminobenzaldehida: 1,6 g 4-DMAB se raztopi v 100 ml 96-odstotnega etanola in doda 10 ml klorovodikove kisline (ρ201,19 g/ml). Reagent se lahko hrani največ dva tedna. |
|
3.2 |
Raztopina Carrez I: 21,9 g cinkovega acetata Zn(CH3COO)2 2H2O in 3 g ledoceta se raztopi v vodi. Dopolni se z vodo do 100 ml. |
|
3.3 |
Raztopina Carrez II: 10,6 g kalijevega ferocianida K4 Fe (CN)6 3H2O se raztopi v vodi. Dopolni se z vodo do 100 ml. |
|
3.4 |
Aktivno oglje, ki ne absorbira sečnine (treba je preveriti). |
|
3.5 |
Sečnina, 0,1-odstotna raztopina (m/v) |
4. Oprema
|
4.1 |
Mešalnik: približno 35 do 40 obr./min. |
|
4.2 |
Epruvete: 160 × 16 mm z brušenimi zamaški |
|
4.3 |
Spektrofotometer |
5. Postopek
5.1 Analiza vzorca
2 g vzorca se natehta na 1 mg natančno in skupaj z 1 g aktivnega oglja (3.4) prenese v 500-mililitrsko merilno bučko. Doda se 400 ml vode in 5 ml raztopine Carrez I (3.2), meša se približno 30 sekund in doda 5 ml raztopine Carrez II (3.3). Meša se 30 minut v mešalniku. Dopolni se z vodo do oznake, pretrese in filtrira.
5 ml prozornega brezbarvnega filtrata se odstrani in prenese v epruvete z brušenimi zamaški, doda se 5 ml raztopine 4-DMAB (3.1) ter premeša. Epruvete se postavijo v kopel z vodo pri 20 oC (+/- 4 oC). Po 15 minutah se izmeri optična gostota raztopine vzorca s spektrofotometrom pri 420 nm. Rezultat se primerja z raztopino reagentov iz slepega preskusa.
5.2 Umeritvena krivulja
V 100-mililitrske merilne bučke se prenese 1, 2, 4, 5 in 10 ml raztopine sečnine (3.5), ki se dopolnijo z vodo do oznake. Od vsake raztopine se odpipetira 5 ml, vsaki se doda 5 ml raztopine 4-DMAB (3.1), homogenizira se in izmeri optična gostota, kakor je opisano zgoraj s primerjavo s kontrolno raztopino, ki vsebuje 5 ml 4-DMAB in 5 ml vode brez sečnine. Pripravi se umeritvena krivulja.
6. Izračun rezultatov
Količina sečnine v vzorcu se določi iz umeritvene krivulje.
Rezultat se izrazi kot masni delež vzorca.
7. Opombe
|
7.1 |
Če vsebnost sečnine presega 3 %, se vzorec zmanjša na 1 g ali se prvotna raztopina razredči, tako da v 500 ml ni več kot 50 mg sečnine. |
|
7.2 |
Če je vsebnost sečnine nizka, se vzorec poveča, dokler je filtrat še prozoren in brezbarven. |
|
7.3 |
Če vzorec vsebuje preproste dušikove spojine, kot so aminokisline, se optična gostota meri pri 435 nm. |
E. DOLOČANJE HLAPNIH DUŠIKOVIH BAZ
I. Z MIKRODIFUZIJO
1. Namen in področje uporabe
Ta metoda se uporablja za določanje vsebnosti hlapnih dušikovih baz v krmi, izraženih kot amonijak.
2. Načelo
Vzorec se ekstrahira z vodo, raztopina pa zbistri in filtrira. Hlapne dušikove baze se ločijo z mikrodifuzijo z uporabo raztopine kalijevega karbonata, zberejo v raztopino borove kisline in titrirajo z žveplovo kislino.
3. Reagenti
|
3.1 |
Trikloroocetna kislina, 20-odstotna raztopina (m/v) |
|
3.2 |
Indikator: 33 mg bromokrezol zelenega in 65 mg metil rdečega se raztopi v 100 ml 95–96-odstotnega (v/v) etanola. |
|
3.3 |
Raztopina borove kisline: v litrski merilni bučki se v 200 ml 95–96-odstotnega (v/v) etanola in 700 ml vode raztopi 10 g borove kisline. Doda se 10 ml indikatorja (3.2). Premeša se, po potrebi pa se barva raztopine spremeni v svetlo rdečo z dodajanjem raztopine natrijevega hidroksida. 1 ml te raztopine ustreza največ 300 μg NH3. |
|
3.4 |
Nasičena raztopina kalijevega karbonata: v 100 ml vrele vode se raztopi 100 g kalijevega karbonata. Pusti se, da se ohladi, ter nato filtrira. |
|
3.5 |
Žveplova kislina, 0,01 mol/l |
4. Oprema
|
4.1 |
Mešalec: približno 35 do 40 obr./min. |
|
4.2 |
Steklene ali plastične Conwayeve celice (glej diagram) |
|
4.3 |
Mikrobirete z označenim merilom 1/100 ml |
5. Postopek
10 g vzorca se natehta na 1 mg natančno in se s 100 ml vode prenese v 200-mililitrsko merilno bučko. V mešalcu se meša ali stresa 30 minut. Doda se 50 ml raztopine trikloroocetne kisline (3.1), dopolni z vodo do oznake, močno pretrese in filtrira skozi nagubani filter.
S pipeto se doda 1 ml raztopine borove kisline (3.3) v srednji del Conwayeve celice in 1 ml filtrata vzorca v zgornji del celice. Delno se pokrije z namaščenim pokrovom. V zgornji del celice se hitro nakapa 1 ml nasičene raztopine kalijevega karbonata (3.4), nato se neprepustno zapre. Celica se pazljivo obrača v vodoravni ravnini, da se reagenta premešata. Pusti se najmanj štiri ure pri sobni temperaturi ali eno uro pri temperaturi 40 oC.
Z mikrobireto (4.3) se hlapne baze v raztopini borove kisline titrirajo z žveplovo kislino (3.5).
Slepi preskus se izvede po istem postopku, vendar brez vzorca, ki se analizira.
6. Izračun rezultatov
1 ml H2SO40,01 mol/l ustreza 0,34 mg amonijaka.
Rezultat se izrazi kot masni delež vzorca.
Ponovljivost
Razlika med rezultatoma dveh vzporednih določanj, izvedenih na istem vzorcu, ne presega:
|
— |
10 % relativne vrednosti, če je vsebnost amonijaka nižja od 1,0 %, |
|
— |
0,1 % absolutne vrednosti, če je vsebnost amonijaka 1,0 % ali več. |
7. Opomba
Če vsebnost amonijaka v vzorcu presega 0,6 %, se začetni filtrat razredči.

II. Z DESTILACIJO
1. Namen in področje uporabe
Ta metoda se uporablja za določanje vsebnosti hlapnih dušikovih baz, izraženih kot amonijak, v ribji moki, ki praktično ne vsebuje sečnine. Uporablja se le za vsebnost amonijaka, ki je nižja od 0,25 %.
2. Načelo
Vzorec se ekstrahira z vodo, raztopina pa zbistri in filtrira. Hlapne dušikove baze se izločijo pri temperaturi vrelišča z dodatkom magnezijevega oksida in zberejo v določeno količino žveplove kisline, katere presežek se titrira z raztopino natrijevega hidroksida.
3. Reagenti
|
3.1 |
Trikloroocetna kislina, 20-odstotna raztopina (m/v) |
|
3.2 |
Magnezijev oksid |
|
3.3 |
Emulzija proti penjenju (npr. silikon) |
|
3.4 |
Žveplova kislina, 0,05 mol/l |
|
3.5 |
Raztopina natrijevega hidroksida, 0,1 mol/l |
|
3.6 |
0,3-odstotna raztopina metil rdečega v 95–96-odstotnem (v/v) etanola |
4. Oprema
|
4.1 |
Mešalec: približno 35 do 40 obr./min. |
|
4.2 |
Naprava za destilacijo po Kjeldahlu |
5. Postopek
10 g vzorca se natehta na 1 mg natančno in s 100 ml vode prenese v 200-mililitrsko merilno bučko. V mešalcu se meša ali stresa 30 minut. Doda se 50 ml raztopine trikloroocetne kisline (3.1), dopolni z vodo do oznake, močno pretrese in filtrira skozi nagubani filter.
Odpipetira se volumen bistrega filtrata, ki ustreza pričakovani vsebnosti hlapnih dušikovih baz (ponavadi zadošča 100 ml). Razredči se na 200 ml, doda se 2 g magnezijevega oksida (3.2) in nekaj kapljic emulzije proti penjenju (3.3). Raztopina mora biti alkalna pri preskusu z lakmusovim papirjem, če ni, se doda magnezijev oksid (3.2). Nadaljevati je treba v skladu s točkama 5.2 in 5.3 dela C te priloge, tj. Analitske metode za določanje vsebnosti surovih beljakovin.
Slepi preskus se izvede po istem postopku, vendar brez vzorca, ki se analizira.
6. Izračun rezultatov
1 ml H2SO40,05 mol/l ustreza 1,7 mg amonijaka.
Rezultat se izrazi kot masni delež vzorca.
Ponovljivost
Relativna razlika med rezultatoma dveh vzporednih določitev, izvedenih na istem vzorcu, ne presega 10 % amonijaka.
F. DOLOČANJE AMINOKISLIN (RAZEN TRIPTOFANA)
1. Namen in področje uporabe
Ta metoda se uporablja za določanje prostih (sintetičnih in naravnih) in celotnih (vezanih s peptidi in prostih) aminokislin v krmi z uporabo analizatorja aminokislin. Uporablja se za naslednje aminokisline: cist(e)in, metionin, lizin, treonin, alanin, arginin, aspartat, glutaminsko kislino, glicin, histidin, izolevcin, levcin, fenilalanin, prolin, serin, tirozin in valin.
S metodo ni možno ločiti soli aminokislin ter D in L oblik aminokislin. Ne uporablja se za določanje triptofana ali hidroksi-analogov aminokislin.
2. Načelo
2.1 Proste aminokisline
Proste aminokisline se ekstrahirajo z razredčeno klorovodikovo kislino. Soekstrahirane dušikove makromolekule se oborijo s sulfosalicilno kislino in odstranijo s filtriranjem. pH filtrirane raztopine se uravna na 2,20. Aminokisline se ločijo z ionsko izmenjevalno kromatografijo in določijo z reakcijo z ninhidrinom s fotometrično detekcijo pri 570 nm.
2.2 Celotne aminokisline
Postopek se izbere glede na preiskovane aminokisline. Cist(e)in in metionin se morata pred hidrolizo oksidirati v cisteinsko kislino in metionin-sulfon. Tirozin se mora določiti v hidrolizatih neoksidiranih vzorcev. Vse druge aminokisline, navedene v točki 1, se lahko določajo v oksidiranem ali neoksidiranem vzorcu.
Oksidacija se izvede pri 0 oC z mešanico peroksimravljične kisline in fenola. Presežek oksidacijskega reagenta se razgradi z natrijevim disulfitom. Oksidiran ali neoksidiran vzorec se 23 ur hidrolizira s klorovodikovo kislino (3.20). pH hidrolizata se uravna na 2,20. Aminokisline se ločijo z ionsko izmenjevalno kromatografijo in določijo z reakcijo z ninhidrinom s fotometrično detekcijo pri 570 nm (440 nm za prolin).
3. Reagenti
Uporabiti je treba dvojno destilirano vodo ali vodo enakovredne kakovosti (prevodnost < 10 μS)
|
3.1 |
Vodikov peroksid, m (m/m) = 30 % |
|
3.2 |
Mravljična kislina, m (m/m) = 98–100 % |
|
3.3 |
Fenol |
|
3.4 |
Natrijev disulfit |
|
3.5 |
Natrijev hidroksid |
|
3.6 |
5-sulfosalicilat dihidrat |
|
3.7 |
Klorovodikova kislina, približno 1,18 g/ml |
|
3.8 |
Tri-natrijev citrat dihidrat |
|
3.9 |
2,2'-tiodietanol (tiodiglikol) |
|
3.10 |
Natrijev klorid |
|
3.11 |
Ninhidrin |
|
3.12 |
Petroleter, vrelišče 40–60 oC |
|
3.13 |
Norlevcin ali druga spojina, primerna za uporabo kot notranji standard |
|
3.14 |
Plinasti dušik (< 10 ppm kisika) |
|
3.15 |
1-oktanol |
|
3.16 |
Aminokisline |
|
3.16.1 |
Standardne snovi iz točke 1. Čiste spojine, ki ne vsebujejo kristalne vode. Pred uporabo se suši 1 teden pod vakuumom s P2O5 ali H2SO4. |
|
3.16.2 |
Cisteinska kislina |
|
3.16.3 |
Metionin-sulfon |
|
3.17 |
Raztopina natrijevega hidroksida, c = 7,5 mol/l: 300 g NaOH (3.5) se raztopi v vodi in dopolni z vodo do 1 litra. |
|
3.18 |
Raztopina natrijevega hidroksida, c = 1 mol/l: 40 g NaOH (3.5) se raztopi v vodi in dopolni z vodo do 1 litra. |
|
3.19 |
Mravljična kislina – raztopina fenola: 889 g mravljične kisline (3.2) se zmeša s 111 g vode ter se doda 4,73 g fenola (3.3). |
|
3.20 |
Hidrolizna mešanica, c = 6 mol HCl/l, ki vsebuje 1 g fenola/l: 1 g fenola (3.3) se doda k 492 ml HCl (3.7) in dopolni z vodo do 1 litra. |
|
3.21 |
Mešanica ekstrakcije, c = 0,1 mol HCl/l, ki vsebuje 2 % tiodiglikola: 8,2 ml HCl (3.7) se razredči s približno 900 ml vode, doda se 20 ml tiodiglikola (3.9) in dopolni z vodo do 1 litra (3.7 in 3.9 se ne smeta zmešati neposredno). |
|
3.22 |
5-sulfosalicilna kislina, ß = 6 %: 60 g 5-sulfosalicilne kisline (3.6) se raztopi v vodi in dopolni z vodo do 1 litra. |
|
3.23 |
Oksidacijska mešanica (peroksimravljična kislina – fenol): 0,5 ml vodikovega peroksida (3.1) se zmeša s 4,5 ml raztopine mravljične kisline in fenola (3.19) v majhni čaši. Inkubira se 1 uro pri 20–30 oC, da nastane peroksimravljična kislina, nato se ohladi v ledeni kopeli (15 min), preden se doda vzorcu. Opozorilo: Izogibati se je treba stiku s kožo in nositi je treba zaščitna oblačila. |
|
3.24 |
Citratni pufer, c = 0,2 mol Na+/l, pH 2,20: v približno 800 ml vode se raztopi 19,61 g natrijevega citrata (3.8), 5 ml tiodiglikola (3.9), 1 g fenola (3.3) in 16,50 ml HCl (3.7). pH se uravna na 2,20. Dopolni se z vodo do 1 litra. |
|
3.25 |
Pufri za eluiranje, pripravljeni v skladu z navodili za uporabljeni analizator (4.9) |
|
3.26 |
Reagent ninhidrin, pripravljen v skladu z navodili za uporabljeni analizator (4.9) |
|
3.27 |
Standardne raztopine aminokislin. Te raztopine se hranijo pri temperaturi do 5 oC. |
|
3.27.1 |
Osnovna standardna raztopina aminokislin (3.16.1). c = 2,5 μmol/ml za vsako v klorovodikovi kislini. Lahko se priskrbi iz proste prodaje. |
|
3.27.2 |
Osnovna standardna raztopina cisteinske kisline in metionin-sulfona, c = 1,25 μmol/ml. V litrski merilni bučki se raztopi 0,2115 g cisteinske kisline (3.16.2) in 0,2265 g metionin-sulfona (3.16.3) v citratnem pufru (3.24) ter dopolni s citratnim pufrom do oznake. Hrani se največ 12 mesecev pri temperaturi do 5 oC. Ta raztopina se ne uporablja, če osnovna standardna raztopina (3.27.1) vsebuje cisteinsko kislino in metionin-sulfon. |
|
3.27.3 |
Osnovna standardna raztopina notranjega standarda, npr. norlevcina, c = 20 μmol/ml. V merilni bučki se raztopi 0,6560 g norlevcina (3.13) v citratnem pufru (3.24) in dopolni s citratnim pufrom do 250 ml. Hrani se največ 6 mesecev pri temperaturi do 5 oC. |
|
3.27.4 |
Raztopina za umerjanje standardnih aminokislin, ki se uporablja s hidrolizati, c = 5 nmol/50 μl za cisteinsko kislino in metionin-sulfon ter c = 10 nmol/50 μl za druge aminokisline. V 100-mililitrski čaši se raztopi 2,2 g natrijevega klorida (3.10) s 30 ml citratnega pufra (3.24). Dodajo se 4,00 ml osnovne standardne raztopine aminokisline (3.27.1), 4,00 ml osnovne standardne raztopine cisteinske kisline in metionin-sulfona (3.27.2) ter 0,50 ml osnovne standardne raztopine notranjega standarda (3.27.3), če se uporablja. pH se uravna na 2,20 z natrijevim hidroksidom (3.18). Vsebina se prenese v 50-mililitrsko merilno bučko, dopolni se s citratnim pufrom (3.24) do oznake in premeša. Hrani se največ 3 mesece pri temperaturi do 5 oC. Glej tudi opombo 9.1. |
|
3.27.5 |
Raztopina za umerjanje standardnih aminokislin, ki se uporablja s hidrolizati, se pripravi v skladu s točko 5.3.3.1, za ekstrakte pa v skladu s točko 5.2. Raztopina za umerjanje se pripravi v skladu s točko 3.27.4, vendar brez natrijevega klorida. Hrani se največ 3 mesece pri temperaturi do 5 oC. |
4. Oprema
|
4.1 |
100- ali 250-mililitrska bučka z okroglim dnom in kondenzatorjem povratnega toka |
|
4.2 |
100-mililitrska borosilikatna steklena posoda z zamaškom z navojem in ovita v gumo/teflon (npr. Duran, Schott) za uporabo v sušilniku |
|
4.3 |
Sušilnik s prezračevanjem z umetnim dotokom zraka in regulatorjem temperature z natančnostjo, boljšo od ± 2 oC |
|
4.4 |
pH meter (na tri decimalke) |
|
4.5 |
Membranski filter (0,22 μm) |
|
4.6 |
Centrifuga |
|
4.7 |
Rotacijski vakuumski uparjalnik |
|
4.8 |
Mehanski stresalnik ali magnetno mešalo |
|
4.9 |
Aminokislinski analizator ali oprema za HPLC s kolono z ionskim izmenjevalcem, pripravo za ninhidrin, derivatizacijo po koloni in fotometričnim detektorjem Kolona se napolni s smolo sulfoniranega polistirena, ki lahko loči aminokisline med seboj in od drugih materialov, ki vsebujejo ninhidrin. Črpalki s stabilnim tokom ±0,5 % zagotavljata tok v pufrski in ninhidrinski črti pri standardnem umerjanju in analizi vzorca. Za nekatere aminokisline se lahko uporabi hidroliza v analizatorju, pri čemer je koncentracija natrija v hidrolizatu c = 0,8 mol/l in v hidrolizatu je vsa mravljična kislina, ki nastane pri oksidaciji. Druge metode ne zagotavljajo zadovoljive ločitve nekaterih aminokislin, če je v hidrolizatu preveč mravljične kisline in/ali visoka koncentracija natrijevih ionov. V tem primeru se volumen kisline po hidrolizi in pred uravnavanjem pH zmanjša z uparevanjem na približno 5 ml. Uparevanje se izvede pod vakuumom pri največ 40 oC. |
5. Postopek
5.1 Priprava vzorca
Vzorec se zdrobi, tako da preide skozi 0,5 mm sito. Vzorci z visoko vlago se morajo pred drobljenjem osušiti na zraku pri temperaturi, ki ne presega 50 oC, ali osušiti z zmrzovanjem. Vzorci z visoko vsebnostjo maščobe se pred drobljenjem ekstrahirajo s petroletrom (3.12).
5.2 Določanje prostih aminokislin v krmi in premiksih
Primerna količina (1–5 g) pripravljenega vzorca (5.1) se natehta na 0,2 mg natančno in prenese v erlenmajerico, temu pa se doda 100,0 ml mešanice ekstrakcije (3.21). Z mehanskim stresalnikom ali magnetnim mešalom (4.8) se mešanica stresa 60 minut. Pusti se, da se usedlina usede na dno, in odpipetira 10,0 ml supernatanta v 100-mililitrsko čašo.
Med mešanjem se doda 5,0 ml raztopine sulfosalicilne kisline (3.22) in 5 minut nadaljuje z mešanjem s pomočjo magnetnega mešala. Supernatant se filtrira ali centrifugira, da se odstrani ves precipitat. 10,0 ml te raztopine se prenese v 100-mililitrsko čašo in pH uravnava na 2,20 z raztopino natrijevega hidroksida (3.18), s citratnim pufrom (3.24) se prenese v merilno bučko ustreznega volumna in dopolni z raztopino pufra (3.24) do oznake.
Če se uporablja notranji standard, se za vsakih 100 ml končne raztopine doda 1,00 ml notranjega standarda (3.27.3) ter dopolni z raztopino pufra (3.24) do oznake.
Nadaljuje se s kromatografijo v skladu s točko 5.4.
Če se ekstrakti ne pregledajo isti dan, se morajo hraniti pri temperaturi do 5 oC.
5.3 Določanje celotnih aminokislin
5.3.1
0,1–1 g pripravljenega vzorca (5.1) se natehta na 0,2 mg natančno in prenese v:
|
— |
100-mililitrsko bučko z okroglim dnom (4.1) (za odprto hidrolizo 5.3.2.3) ali |
|
— |
250-mililitrsko bučko z okroglim dnom (4.1), če je zahtevana nizka koncentracija natrija (5.3.3.1), ali |
|
— |
100-mililitrsko steklenico z zamaškom z navojem (4.2) (za zaprto hidrolizo 5.3.2.4). |
V natehtanem vzorčenem deležu mora biti vsebnost dušika približno 10 mg, vsebnost vlage pa ne sme preseči 100 mg.
Bučka/steklenica se postavi v ledeno kopel in ohladi na 0 oC, doda se 5 ml oksidacijske mešanice (3.23) in meša s stekleno lopatico z ukrivljeno konico. Bučka/steklenica z lopatico se nepredušno zapre s filmom, ledena kopel, ki vsebuje nepredušno zaprto posodo, pa se postavi v hladilnik s temperaturo 0 oC in pusti 16 ur. Po 16 urah se posoda vzame iz hladilnika, presežni oksidacijski reagent pa se razgradi z dodatkom 0,84 g natrijevega disulfita (3.4).
Nadaljuje se s točko 5.3.2.1.
5.3.2
5.3.2.1
Oksidiranemu vzorcu, pripravljenemu v skladu s točko 5.3.1, se doda 25 ml hidrolizne mešanice (3.20), pri čemer je treba pazljivo sprati kakršne koli ostanke vzorca s stene posode in lopatice.
Nadaljuje se v skladu s točko 5.3.2.3 ali 5.3.2.4 odvisno od uporabljenega postopka hidrolize.
5.3.2.2
V 100- ali 250-mililitrsko bučko z okroglim dnom (4.1) ali 100-mililitrsko steklenico z zamaškom z navojem (4.2) se natehta 0,1–1 g pripravljenega vzorca (5.1) na 0,2 mg natančno. V natehtanem vzorčenem deležu mora biti vsebnost dušika približno 10 mg. Pazljivo se doda 25 ml hidrolizne mešanice (3.20) in zmeša z vzorcem. Nadaljuje se v skladu s točko 5.3.2.3 ali 5.3.2.4.
5.3.2.3
Mešanici v bučki (pripravljeni v skladu s točko 5.3.2.1 ali 5.3.2.2) se dodajo 3 steklene kroglice, nato se pusti vreti z neprestanim mehurčenjem pri povratnem toku 23 ur. Po zaključku hidrolize se kondenzator spere s 5 ml citratnega pufra (3.24). Bučka se odstrani in ohladi v ledeni kopeli.
Nadaljuje se v skladu s točko 5.3.3.
5.3.2.4
Steklenica, ki vsebuje mešanico, pripravljeno v skladu s točko 5.3.2.1 ali 5.3.2.2, se postavi v sušilnik (4.3) pri 110 oC. V prvi uri se za preprečitev povečanja tlaka (zaradi nastanka plinastih snovi) in eksplozije zamašek z navojem postavi čez vrh steklenice. Steklenica se ne sme zapreti z zamaškom. Po eni uri se steklenica zapre z zamaškom in pusti v sušilniku (4.3) 23 ur. Po zaključku hidrolize se steklenica odstrani iz sušilnika, zamašek steklenice se pazljivo odpre, steklenica pa položi v ledeno kopel. Pusti se, da se ohladi.
Odvisno od postopka za uravnavanje pH (5.3.3) se vsebina steklenice z uporabo citratnega pufra (3.24) prenese v 250-mililitrsko čašo ali 250-mililitrsko bučko z okroglim dnom.
Nadaljuje se v skladu s točko 5.3.3.
5.3.3
Glede na odstopanje analizatorja aminokislin (4.9) za natrij se za uravnavanje pH nadaljuje v skladu točko 5.3.3.1 ali 5.3.3.2.
5.3.3.1
Ko se uporabljajo analizatorji aminokislin, pri katerih je zahtevana nizka koncentracija natrija (ko je treba zmanjšati volumen kisline), je priporočljivo uporabiti raztopino notranjega osnovnega standarda (3.27.3).
V tem primeru se hidrolizatu pred uparevanjem dodata 2,00 ml raztopine notranjega osnovnega standarda (3.27.3).
Hidrolizatu, pridobljenemu v skladu s točko 5.3.2.3 ali 5.3.2.4, se dodata 2 kaplji 1-oktanola (3.15).
Z rotacijskim uparilnikom (4.7) se pod vakuumom pri 40 oC volumen zmanjša na 5–10 ml. Če se volumen nenamerno zmanjša na manj kot 5 ml, se mora hidrolizat izločiti in analiza začeti znova.
pH se uravna na 2,20 z raztopino natrijevega hidroksida (3.18), nato pa se nadaljuje v skladu s točko 5.3.4.
5.3.3.2
Hidrolizati, pridobljeni v skladu s točko 5.3.2.3 ali 5.3.2.4, se delno nevtralizirajo, tako da se med mešanjem pazljivo doda 17 ml raztopine natrijevega hidroksida (3.17), pri čemer se mora ohranjati temperatura pod 40 oC.
Pri sobni temperaturi se pH uravna na 2,20 z raztopino natrijevega hidroksida (3.17) in nato raztopino natrijevega hidroksida (3.18). Nadaljuje se v skladu s točko 5.3.4.
5.3.4
Hidrolizat (5.3.3.1 ali 5.3.3.2), uravnan na pH, se s citratnim pufrom (3.24) prenese v 200-mililitrsko merilno bučko in dopolni s pufrom (3.24) do oznake.
Če notranji standard še ni bil uporabljen, se dodata 2,00 ml notranjega standarda (3.27.3), nato pa se dopolni s citratnim pufrom (3.24) do oznake. Temeljito se premeša.
Nadaljuje se s kromatografijo (5.4).
Če se raztopine vzorca ne pregledajo še isti dan, se morajo shraniti pri temperaturi pod 5 oC.
5.4 Kromatografija
Pred kromatografijo mora biti temperatura ekstrakta (5.2) ali hidrolizata (5.3.4) enaka sobni temperaturi. Mešanica se stresa, primerna količina pa se filtrira skozi membranski filter 0,22 μm (4.5). S to bistro raztopino se opravi ionska izmenjevalna kromatografija z analizatorjem aminokislin (4.9).
Vbrizgavanje je lahko ročno ali avtomatično. Pomembno je, da se ista količina raztopine (±0,5 %) doda koloni za analizo standardov in vzorcev, razen ko se uporablja notranji standard, ter da je razmerje med natrijem in aminokislino v raztopinah standarda in vzorca takšno, kot se uporablja ponavadi.
Na splošno je pogostost umerjanja odvisna od stabilnosti reagenta ninhidrina in analitskega sistema. Standard ali vzorec se razredči s citratnim pufrom (3.24), da se doseže površina vrha standarda, ki je 30–200 % površine vrha aminokislin v vzorcu.
Kromatografija aminokislin se nekoliko razlikuje glede na vrsto uporabljenega analizatorja in smole. Izbrani sistem mora imeti možnost ločitve aminokisline med seboj in od materialov, ki vsebujejo ninhidrin. V delovnem območju se mora kromatografski sistem odzivati linearno na spremembe količin aminokislin, dodanih koloni.
Pri kromatografiji se uporabljajo spodaj navedena razmerja med najnižjimi in najvišjimi vrednostmi, ko se analizira istomolarna raztopina (aminokislin, ki se določajo). Istomolarna raztopina mora vsebovati vsaj 30 % največje vsebnosti vsake aminokisline, ki se lahko natančno izmeri s sistemom za analizo aminokislin (4.9).
Za ločevanje treonina od serina razmerje med najnižjo in najvišjo vrednostjo za aminokislino z nižjo vrednostjo izmed dveh prekrivajočih se aminokislin ne sme presegati 2:10. (Če se določajo le cistein, metionin, treonin in lizin, bo neustrezna ločitev od sosednjih vrhov negativno vplivala na določanje.) Za vse druge aminokisline mora biti ločevanje boljše od 1:10.
Sistem mora zagotavljati, da se lizin loči od „lizinskih artefaktov“ in ornitina.
6. Izračun rezultatov
Za vsako posamezno aminokislino se izračuna površina vzorca in najvišje vrednosti standarda ter količina (X), izražena v g aminokislin na kg vzorca.

Če se uporablja notranji standard, se pomnoži z: 
|
A |
= |
površina vrha hidrolizata ali ekstrakta; |
|
B |
= |
površina vrha standardne raztopine za umerjanje; |
|
C |
= |
površina vrha hidrolizata ali ekstrakta kot notranjega standarda; |
|
D |
= |
površina vrha standardne raztopine za umerjanje kot notranjega standarda; |
|
M |
= |
molska masa aminokisline, ki se določa; |
|
c |
= |
koncentracija standarda v μmol/ml; |
|
m |
= |
masa vzorca v gramih (popravljena na prvotno maso, če je vzorec posušen ali razmaščen); |
|
V |
= |
ml celotnega hidrolizata (5.3.4) ali izračunani celotni volumen razredčitve ekstrakta (6.1) v ml. |
Cistin in cistein se določata kot cisteinska kislina v hidrolizatih oksidiranega vzorca, vendar se izračunata kot cistin (C6H12N2O4S2, M 240,30 g/mol) z uporabo molske mase 120,15 g/mol (= 0,5 x 240,30 g/mol).
Metionin se določa kot metionin-sulfon v hidrolizatih oksidiranega vzorca, vendar se izračuna kot metionin, pri čemer se uporabi molska masa metionina: 149,21 g/mol.
Dodani prosti metionin se določa po ekstrakciji kot metionin, za izračun pa se uporabi ista molska masa.
|
6.1 |
Celotni volumen razredčitve ekstraktov (F) za določanje prostih aminokislin (5.2) se izračuna po naslednji formuli: 
|
7. Ocena metode
Metoda je bila preskušena v mednarodni medlaboratorijski primerjavi, ki je bila izvedena leta 1990 s štirimi različnimi vrstami krme (mešana prašičja krma, mešanica za pitovne piščance, beljakovinski koncentrat, premiks). Rezultati, brez izjem, s srednjimi vrednostmi in standardnimi odmiki so prikazani v preglednici v tej točki:
Srednje vrednosti v g/kg
|
Referenčni material |
Aminokislina |
||||||
|
Treonin |
Cist(e)in |
Metionin |
Lizin |
||||
|
Mešana prašičja krma |
6,94 n = 15 |
3,01 n = 17 |
3,27 n = 17 |
9,55 n = 13 |
|||
|
Mešanica za pitovne piščance |
9,31 n = 16 |
3,92 n = 18 |
5,08 n = 18 |
13,93 n = 16 |
|||
|
Beljakovinski koncentrat |
22,32 n = 16 |
5,06 n = 17 |
12,01 n = 17 |
47,74 n = 15 |
|||
|
Premiks |
58,42 n = 16 |
— |
90,21 n = 16 |
98,03 n = 16 |
|||
|
|||||||
7.1 Ponovljivost
Ponovljivost zgoraj navedene primerjave, izražena kot „standardni odmik v laboratoriju“, je prikazana v spodnji preglednici:
Standardni odmik (Sr) v laboratoriju, izražen v g/kg
|
Referenčni material |
Aminokislina |
||||||
|
Treonin |
Cist(e)in |
Metionin |
Lizin |
||||
|
Mešana prašičja krma |
0,13 n = 15 |
0,10 n = 17 |
0,11 n = 17 |
0,26 n = 13 |
|||
|
Mešanica za pitovne piščance |
0,20 n = 16 |
0,11 n = 18 |
0,16 n = 18 |
0,28 n = 16 |
|||
|
Beljakovinski koncentrat |
0,48 n = 16 |
0,13 n = 17 |
0,27 n = 17 |
0,99 n = 15 |
|||
|
Premiks |
1,30 n = 16 |
— |
2,19 n = 16 |
2,06 n = 16 |
|||
|
|||||||
Koeficient variacije (%) standardnega odmika (Sr) v laboratoriju
|
Referenčni material |
Aminokislina |
||||||
|
Treonin |
Cist(e)in |
Metionin |
Lizin |
||||
|
Mešana prašičja krma |
1,9 n = 15 |
3,3 n = 17 |
3,4 n = 17 |
2,8 n = 13 |
|||
|
Mešanica za pitovne piščance |
2,1 n = 16 |
2,8 n = 18 |
3,1 n = 18 |
2,1 n = 16 |
|||
|
Beljakovinski koncentrat |
2,7 n = 16 |
2,6 n = 17 |
2,2 n = 17 |
2,4 n = 15 |
|||
|
Premiks |
2,2 n= 16 |
— |
2,4 n = 16 |
2,1 n = 16 |
|||
|
|||||||
7.2 Obnovljivost
Rezultati zgoraj navedene primerjave, izraženi kot standardni odmik med laboratoriji, so prikazani v spodnji preglednici:
Standardni odmik (SR) med laboratoriji, izražen v g/kg
|
Referenčni material |
Aminokislina |
||||||
|
Treonin |
Cist(e)in |
Metionin |
Lizin |
||||
|
Mešana prašičja krma |
0,28 n = 15 |
0,30 n = 17 |
0,23 n = 17 |
0,30 n = 13 |
|||
|
Mešanica za pitovne piščance |
0,48 n = 16 |
0,34 n = 18 |
0,55 n = 18 |
0,75 n = 16 |
|||
|
Beljakovinski koncentrat |
0,85 n = 16 |
0,62 n = 17 |
1,57 n = 17 |
1,24 n = 15 |
|||
|
Premiks |
2,49 n = 16 |
— |
6,20 n = 16 |
6,62 n = 16 |
|||
|
|||||||
Koeficient variacije (%) standardnega odmika (SR) med laboratoriji
|
Referečni material |
Amino Acid |
||||||
|
Treonin |
Cist(e)in |
Metionin |
Lizin |
||||
|
Mešana prašičja krma |
4,1 n = 15 |
9,9 n = 17 |
7,0 n = 17 |
3,2 n = 13 |
|||
|
Mešanica za pitovne piščance |
5,2 n = 16 |
8,8 n = 18 |
10,9 n = 18 |
5,4 n = 16 |
|||
|
Beljakovinski koncentrat |
3,8 n = 16 |
12,3 n = 17 |
13,0 n = 17 |
3,0 n = 15 |
|||
|
Premiks |
4,3 n = 16 |
— |
6,9 n = 16 |
6,7 n = 16 |
|||
|
|||||||
8. Uporaba referenčnih materialov
Pravilna uporaba metode se preveri s ponovljenimi merjenji na potrjenih referenčnih materialih, kadar so na voljo. Priporočeno je umerjanje s potrjeno raztopino za umerjanje aminokislin.
9. Opombe
|
9.1 |
Zaradi razlik med analizatorji aminokislin se kot smernica obravnavajo končne koncentracije raztopin standardnih aminokislin za umerjanje (glej 3.27.4 in 3.27.5) in hidrolizata (glej 5.3.4). Za vse aminokisline je treba preveriti območje naprave, v katerem je odziv linearen. Standardna raztopina se razredči s citratnim pufrom, da je površina vrha na sredini tega območja. |
|
9.2 |
Kadar se za analizo hidrolizatov uporablja oprema za tekočinsko kromatografijo visoke ločljivosti, se morajo eksperimentalni pogoji optimizirati v skladu s priporočili proizvajalca. |
|
9.3 |
Pri uporabi metode za krmo, ki vsebuje več kot 1 % klorida (koncentrat, mineralna krma, nadomestna krma), se lahko pojavi prenizka vrednost vsebnosti metionina in je zato potrebna posebna obdelava. |
G. DOLOČANJE TRIPTOFANA
1. Namen in področje uporabe
Ta metoda omogoča določanje celotnega in prostega triptofana v krmi. Ne omogoča pa ločevanja med oblikama D in L.
2. Načelo
Za določanje celotnega triptofana se vzorec hidrolizira pri bazičnih pogojih z nasičeno raztopino barijevega hidroksida in 20 ur segreva do 110 oC. Po hidrolizi se doda notranji standard.
Za določanje prostega triptofana se vzorec ekstrahira pri rahlo kislih pogojih v prisotnosti notranjega standarda.
Triptofan in notranji standard v hidrolizatu ali ekstraktu se določata s HPLC s fluorescenčno detekcijo.
3. Reagenti
|
3.1 |
Uporabljati je treba dvakrat destilirano vodo ali vodo enake kakovosti (prevodnost < 10 μS/cm). |
|
3.2 |
Standardna snov: triptofan (čistoča/vsebnost ≥ 99 %), osušen pod vakuumom nad fosforjevim pentoksidom |
|
3.3 |
Snov, ki je notranji standard: α-metil-triptofan (čistoča/vsebnost ≥ 99 %), osušen pod vakuumom nad fosforjevim pentoksidom. |
|
3.4 |
Barijev hidroksid oktahidrat (paziti je treba, da Ba(OH)2 .8 H2O ni pretirano izpostavljen zraku, da se ne bi tvoril BaCO3, ki lahko moti določanje) (glej opombo 9.3). |
|
3.5 |
Natrijev hidroksid |
|
3.6 |
Ortofosforna kislina, m (m/m) = 85 % |
|
3.7 |
Klorovodikova kislina, ρ201,19 g/ml |
|
3.8 |
Metanol, za HPLC |
|
3.9 |
Petroleter, vrelišče 40–60 oC |
|
3.10 |
Raztopina natrijevega hidroksida, c = 1 mol/l: 40,0 g NaOH (3.5) se raztopi v vodi in dopolni z vodo do 1 litra (3.1). |
|
3.11 |
Klorovodikova kislina, c = 6 mol/l: 492 ml HCl (3.7) se dopolni z vodo do 1 litra. |
|
3.12 |
Klorovodikova kislina, c = 1 mol/l: 82 ml HCl (3.7) se dopolni z vodo do 1 litra. |
|
3.13 |
Klorovodikova kislina, c = 0,1 mol/l: 8,2 ml HCl (3.7) se dopolni z vodo do 1 litra. |
|
3.14 |
Ortofosforna kislina, c = 0,5 mol/l: 34 ml ortofosforne kisline (3.6) se dopolni z vodo (3.1) do 1 litra. |
|
3.15 |
Koncentrirana raztopina triptofana (3.2), c = 2,50 μmol/ml: v 500-mililitrski merilni bučki se raztopi 0,2553 g triptofana (3.2) v klorovodikovi kislini (3.13) in dopolni s klorovodikovo kislino (3.13) do oznake. Hrani se največ 4 tedne pri –18 oC. |
|
3.16 |
Koncentrirana raztopina notranjega standarda, c = 2,50 μmol/ml: v 500-mililitrski merilni bučki se raztopi 0,2728 g α-metil-triptofana (3.3) v klorovodikovi kislini (3.13) in dopolni se s klorovodikovo kislino (3.13) do oznake. Pri –18 oC se shrani največ 4 tedne. |
|
3.17 |
Standardna raztopina triptofana in notranjega standarda za umerjanje: pripravi se 2,00 ml koncentrirane raztopine triptofana (3.15) in 2,00 ml koncentrirane raztopine notranjega standarda (α-metil-triptofan) (3.16). Razredči se z vodo (3.1) in metanolom (3.8) na približno enak volumen in približno enako koncentracijo metanola (10–30 %) kot pri končnem hidrolizatu. Ta raztopina se mora pripraviti sveža pred uporabo. Med pripravo jo je treba zaščititi pred neposredno sončno svetlobo. |
|
3.18 |
Ocetna kislina |
|
3.19 |
1,1,1-trikloro-2-metil-2-propanol |
|
3.20 |
Etanolamin, m (m/m) > 98 % |
|
3.21 |
1 g 1,1,1-trikloro-2-metil-2-propanola (3.19) se raztopi v 100 ml metanola (3.8). |
|
3.22 |
Mobilna faza za HPLC: 3,00 g ocetne kisline (3.18) + 900 ml vode (3.1) +50,0 ml raztopine (3.21) 1,1,1-trikloro-2-metil-2-propanola (3.19) v metanolu (3.8) (1 g/100 ml). pH se uravna na 5,00 z etanolaminom (3.20). Dopolni se z vodo do 1 000 ml (3.1). |
4. Oprema
|
4.1 |
Oprema HPLC s spektrofluorometričnim detektorjem |
|
4.2 |
Kolona za tekočinsko kromatografijo, 125 mm x 4 mm C18, polnitev 3 μm ali enakovredna |
|
4.3 |
pH meter |
|
4.4 |
Bučka iz polipropilena, volumna 125 ml, s širokim vratom in zamaškom z navojem |
|
4.5 |
Membranski filter, 0,45 μm |
|
4.6 |
Avtoklav, 110 (± 2) oC, 1,4 (±0,1) bar |
|
4.7 |
Mehanski stresalnik ali magnetno mešalo |
|
4.8 |
Vorteks mešalnik |
5. Postopek
5.1 Priprava vzorcev
Vzorec se zdrobi, tako da preide skozi 0,5 mm sito. Vzorce z visoko vsebnostjo vlage je treba pred drobljenjem osušiti na zraku pri temperaturi do 50 oC ali pa osušiti z zmrzovanjem. Vzorci z visoko vsebnostjo maščobe se pred drobljenjem ekstrahirajo s petroletrom (3.9).
5.2 Določanje prostega triptofana (ekstrakt)
Primerna količina (1–5 g) pripravljenega vzorca (5.1) se natehta na 1 mg natančno in prenese v erlenmajerico. Doda se 100,0 ml klorovodikove kisline (3.13) in 5,00 ml koncentrirane raztopine notranjega standarda (3.16). Z mehanskim stresalnikom ali magnetnim mešalom (4.7) se stresa ali meša 60 minut. Pusti se, da se usedlina usede na dno, nato pa se odpipetira 10,0 ml supernatanta v čašo. Doda se 5 ml ortofosforne kisline (3.14). pH raztopine se z natrijevim hidroksidom (3.10) uravna na 3. Doda se dovolj metanola (3.8), da je v končnem volumnu koncentracija metanola 10–30 %. Prenese se v merilno bučko primernega volumna in razredči z vodo na volumen, potreben za kromatografijo (približno enak volumen kot pri standardni raztopini za umerjanje (3.17)).
Pred vbrizganjem na HPLC kolono se nekaj ml raztopine prefiltrira skozi 0,45 μm membranski filter (4.5). Nadaljuje se s kromatografijo v skladu s točko 5.4.
Standardna raztopina in ekstrakti se zaščitijo pred neposredno sončno svetlobo. Če ni možno analizirati ekstraktov istega dne, se lahko hranijo največ 3 dni pri 5 oC.
5.3 Določanje celotnega triptofana (hidrolizat)
0,1–1 g pripravljenega vzorca (5.1) se natehta na 0,2 mg natančno in prenese v bučko iz polipropilena (4.4). Vsebnost dušika v natehtanem delu vzorca je približno 10 mg. Doda se 8,4 mg barijevega hidroksid oktahidrata (3.4) in 10 ml vode. Meša se na vorteks mešalniku (4.8) ali z magnetnim mešalom (4.7). S teflonom prevlečeni magnet se pusti v mešanici. Stene posode se sperejo s 4 ml vode. Zapre se z zamaškom z navojem, bučka pa se rahlo zapre. Prenese se v avtoklav (4.6), kjer je vrela voda, in pusti v pari 30–60 minut. Zapre se avtoklav in 20 ur avtoklavira pri 110 (± 2) oC.
Preden se avtoklav odpre, se temperatura zmanjša nekoliko pod 100 oC. Da se prepreči kristalizacija Ba(OH)2 ×8 H2O, se topli mešanici doda 30 ml vode sobne temperature. Rahlo se pretresa ali meša. Doda se 2,00 ml koncentrirane raztopine notranjega standarda (α-metil-triptofana) (3.16). Posode se 15 minut hladijo na vodni/ledeni kopeli.
Nato se doda 5 ml ortofosforne kisline (3.14). Posoda se zadrži v hladilni kopeli, med mešanjem nevtralizira s HCl (3.11), pH pa se s HCl (3.12) uravna na 3,0. Doda se dovolj metanola, da je koncentracija metanola v končnem volumnu 10–30 %. Prenese se v merilno bučko primernega volumna in razredči z vodo do volumna, potrebnega za kromatografijo (na primer 100 ml). Dodatek metanola ne povzroči obarjanja.
Pred vbrizganjem na HPLC kolono se nekaj ml raztopine prefiltrira skozi 0,45 μm membranski filter (4.5). Nadaljuje se s kromatografijo v skladu s točko 5.4.
Standardna raztopina in hidrolizati se zaščitijo pred neposredno sončno svetlobo. Če ni možno analizirati ekstraktov istega dne, se lahko hranijo največ 3 dni pri 5 oC.
5.4 Določanje s HPLC
Za izokratsko eluiranje se lahko kot smernica uporabljajo naslednji pogoji; lahko se uporabljajo tudi drugi pogoji, če zagotavljajo enakovredne rezultate (glej tudi opombi 9.1 in 9.2).
|
Kolona za tekočinsko kromatografijo (4.2): |
125 mm × 4 mm, C18, polnitev 3 μm ali enakovredna |
|
Temperatura kolone: |
sobna temperatura |
|
Mobilna faza (3.22): |
3,00 g ocetne kisline (3.18) + 900 ml vode (3.1) +50,0 ml raztopine (3.21) 1,1,1-trikloro-2-metil-2-propanola (3.19) v metanolu (3.8) (1 g/100 ml). pH raztopine se z etanolaminom (3.20) uravna na 5,00. Dopolni se z vodo (3.1) do 1 000 ml. |
|
Hitrost pretoka: |
1 ml/min |
|
Skupni čas izvedbe: |
približno 34 min |
|
Detekcijska valovna dolžina: |
ekscitacija: 280 nm, emisija: 356 nm. |
|
Volumen, ki se vbrizga: |
20 μl |
6. Izračun rezultatov
Količina triptofana (X), izražena v g na 100 g vzorca, se izračuna po naslednji formuli:
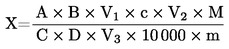
|
A |
= |
površina vrha notranjega standarda, standardne raztopina za umerjanje (3.17); |
|
B |
= |
površina vrha triptofana, ekstrakta (5.2) ali hidrolizata (5.3); |
|
V1 |
= |
volumen, v ml (2 ml), koncentrirane raztopine triptofana (3.15), dodane raztopini za umerjanje (3.17); |
|
c |
= |
koncentracija, v μmol/ml (= 2,50), koncentrirane raztopine triptofana (3.15), dodane raztopini za umerjanje (3.17); |
|
V2 |
= |
volumen, v ml, koncentrirane raztopine notranjega standarda (3.16), dodane pri ekstrakciji (5.2) (= 5,00 ml) ali hidrolizatu (5.3) (= 2,00 ml); |
|
C |
= |
površina vrha notranjega standarda, ekstrakta (5.2) ali hidrolizata (5.3); |
|
D |
= |
površina vrha triptofana, standardne raztopine za umerjanje (3.17); |
|
V3 |
= |
volumen, v ml (= 2,00 ml), koncentrirane raztopine notranjega standarda (3.16), dodane standardni raztopini za umerjanje (3.17); |
|
m |
= |
masa vzorca v g (popravljena na prvotno maso, če je vzorec posušen in/ali razmaščen); |
|
M |
= |
molska masa triptofana (= 204,23 g/mol). |
7. Ponovljivost
Razlika med rezultatoma dveh vzporednih določanj, izvedenih na istem vzorcu, ne sme presegati 10 % najvišjega rezultata.
8. Rezultati medlaboratorijske študije
Organizirana je bila medlaboratorijska študija ES (četrta medlaboratorijska primerjava), pri kateri je 12 laboratorijev analiziralo 3 vzorce, da se potrdi metoda za hidrolizo. Vsak vzorec je bil analiziran petkrat. Rezultati so prikazani v spodnji preglednici:
|
|
Vzorec 1 Prašičja krma |
Vzorec 2 Prašičja krma z dodanim L-triptofanom |
Vzorec 3 Koncentrat prašičje krme |
|
L |
12 |
12 |
12 |
|
n |
50 |
55 |
50 |
|
Srednja vrednost [g/kg] |
2,42 |
3,40 |
4,22 |
|
Sr [g/kg] |
0,05 |
0,05 |
0,08 |
|
r [g/kg] |
0,14 |
0,14 |
0,22 |
|
CVr [ %] |
1,9 |
1,6 |
1,9 |
|
SR [g/kg] |
0,15 |
0,20 |
0,09 |
|
R [g/kg] |
0,42 |
0,56 |
0,25 |
|
CVR [ %] |
6,3 |
6,0 |
2,2 |
|
L |
= |
število laboratorijev, ki so predložili rezultate; |
|
n |
= |
število uporabljenih posameznih rezultatov, razen izjem (identificiranih s testom za izjeme po Cochranu in Dixonu); |
|
Sr |
= |
standardni odmik ponovljivosti; |
|
SR |
= |
standardni odmik obnovljivosti; |
|
r |
= |
ponovljivost; |
|
R |
= |
obnovljivost; |
|
CVr |
= |
koeficient variacije ponovljivosti v %; |
|
CVR |
= |
koeficient variacije obnovljivosti v %. |
Organizirana je bila še ena medlaboratorijska študija ES (tretja medlaboratorijska primerjava), v kateri je 13 laboratorijev analiziralo 2 vzorca, da se potrdi metoda za ekstrakcijo prostega triptofana. Vsak vzorec je bil analiziran petkrat. Rezultati so prikazani v spodnji preglednici:
|
|
Vzorec 4 Mešanica pšenice in soje |
Vzorec 5 Mešanica pšenice in soje (= vzorec 4) z dodanim triptofanom (0,457 g/kg1) |
|
L |
12 |
12 |
|
n |
55 |
60 |
|
Srednja vrednost [g/kg] |
0,391 |
0,931 |
|
Sr [g/kg] |
0,005 |
0,012 |
|
r [g/kg] |
0,014 |
0,034 |
|
CVr [ %] |
1,34 |
1,34 |
|
SR [g/kg] |
0,018 |
0,048 |
|
R [g/kg] |
0,050 |
0,134 |
|
CVR [ %] |
4,71 |
5,11 |
|
L |
= |
število laboratorijev, ki so predložili rezultate; |
|
n |
= |
število uporabljenih posameznih rezultatov, razen izjem (identificiranih s testom za izjeme po Cochranu in Dixonu); |
|
Sr |
= |
standardni odmik ponovljivosti; |
|
SR |
= |
standardni odmik obnovljivosti; |
|
r |
= |
ponovljivost; |
|
R |
= |
obnovljivost; |
|
CVr |
= |
koeficient variacije ponovljivosti v %; |
|
CVR |
= |
koeficient variacije obnovljivosti v %. |
Organizirana je bila še ena medlaboratorijska študija ES, v kateri je do 7 laboratorijev analiziralo 4 vzorce, da se potrdi metoda za hidrolizo triptofana. Rezultati so prikazani spodaj. Vsak vzorec je bil analiziran petkrat.
|
|
Vzorec 1 Mešana prašičja krma (CRM 117) |
Vzorec 2 Ribja moka z nizko vsebnostjo maščob (CRM 118) |
Vzorec 3 Sojina moka (CRM 119) |
Vzorec 4 Posneto mleko v prahu (CRM 120) |
|
L |
7 |
7 |
7 |
7 |
|
n |
25 |
30 |
30 |
30 |
|
Srednja vrednost [g/kg] |
2,064 |
8,801 |
6,882 |
5,236 |
|
Sr [g/kg] |
0,021 |
0,101 |
0,089 |
0,040 |
|
r [g/kg] |
0,059 |
0,283 |
0,249 |
0,112 |
|
CVr [ %] |
1,04 |
1,15 |
1,30 |
0,76 |
|
SR [g/kg] |
0,031 |
0,413 |
0,283 |
0,221 |
|
R [g/kg] |
0,087 |
1,156 |
0,792 |
0,619 |
|
CVR [ %] |
1,48 |
4,69 |
4,11 |
4,22 |
|
L |
= |
število laboratorijev, ki so predložili rezultate; |
|
n |
= |
število uporabljenih posameznih rezultatov, po izločitvi izjem (identificiranih s testom za izjeme po Cochranu in Dixonu); |
|
Sr |
= |
standardni odmik ponovljivosti; |
|
SR |
= |
standardni odmik obnovljivosti; |
|
r |
= |
ponovljivost; |
|
R |
= |
obnovljivost; |
|
CVr |
= |
koeficient variacije ponovljivosti v %; |
|
CVR |
= |
koeficient variacije obnovljivosti v %. |
9. Opombe
|
9.1 |
Ločevanje triptofana in α-metil-triptofana lahko izboljšajo naslednji posebni kromatografski pogoji. Izokratsko eluiranje, ki mu sledi gradientno čiščenje kolone:
|
||||||||||||||||||||||||||||||||||||||||||||
|
9.2 |
Kromatografija se spreminja glede na vrsto HPLC in uporabljeni material za polnitev kolone. Izbrani sistem mora zagotavljati ločevanje bazne linije triptofana in notranjega standarda. Poleg tega je pomembno, da se produkti razgradnje dobro ločijo od triptofana in notranjega standarda. Izvede se postopek s hidrolizatom brez notranjega standarda, da se preveri bazna linija notranjega standarda za nečistoče. Pomembno je, da je čas izvedbe dovolj dolg, da se eluirajo vsi produkti razgradnje, sicer lahko zapozneli vrhovi eluiranja motijo nadaljnje kromatografiranje. Kromatografski sistem se v delovnem območju odziva linearno. Linearni odziv se izmeri s konstantno (običajno) koncentracijo notranjega standarda in različnimi koncentracijami triptofana. Zelo pomembno je, da so velikosti vrhov triptofana in notranjega standarda v linearnem območju HPLC/fluorescenčnega sistema. Če so vrhovi triptofana in/ali notranjega standarda prenizki ali previsoki, se analiza ponovi z drugačno količino vzorca in/ali drugačnim končnim volumnom. |
|
9.3 |
Barijev hidroksid
Topnost barijevega hidroksida se s staranjem zmanjša. Posledica tega je motna raztopina za določitev HPLC, kar lahko povzroči nizke rezultate za triptofan. |
H. DOLOČANJE SUROVIH OLJ IN MAŠČOB
1. Namen in področje uporabe
Ta metoda omogoča določanje vsebnosti surovih olj in maščob v krmi. Ne omogoča analize oljnih semen in oljnatega sadja.
Vrsta in sestava krme ter namena izvajanja analize vplivata na uporabo spodaj opisanih postopkov.
1.1 Postopek A – Surova olja in maščobe, ki se ekstrahirajo neposredno
Ta metoda se uporablja za krmo rastlinskega izvora, razen tiste, ki je zajeta v področju uporabe postopka B.
1.2 Postopek B – Celotna surova olja in maščobe
Ta metoda se uporablja za krmo živalskega izvora in za vse krmne mešanice. Uporablja se za vso krmo, iz katere ni mogoče povsem ekstrahirati olj in maščob brez predhodne hidrolize (npr. gluteni, kvas, krompirjeve beljakovine in izdelki, pri katerih se izvaja izrivanje, kosmičenje in segrevanje).
1.3 Razlaga rezultatov
Vedno kadar je rezultat pri postopku B višji od rezultata pri postopku A, se kot prava vrednost sprejme rezultat, dobljen pri postopku B.
2. Načelo
2.1 Postopek A
Vzorec se ekstrahira s petroletrom. Topilo se oddestilira, ostanek pa osuši in stehta.
2.2 Postopek B
Vzorec se med segrevanjem obdela s klorovodikovo kislino. Mešanica se ohladi in filtrira. Ostanek se spere in osuši, nato pa se izvede določanje v skladu s postopkom A.
3. Reagenti
|
3.1 |
Petroleter, vrelišče 40–60 oC. Bromno število mora biti nižje od 1 in ostanek pri uparevanju nižji od 2 mg/100 ml. |
|
3.2 |
Natrijev sulfat, brezvodni |
|
3.3 |
Klorovodikova kislina, c = 3 mol/l |
|
3.4 |
Filtracijsko sredstvo, npr. Kieselguhr, Hyflo-supercel |
4. Oprema
|
4.1 |
Naprava za ekstrakcijo. Če je opremljena s sifonom (naprava Soxhlet), je hitrost povratnega toka približno 10 ciklov na uro; če ni opremljena s sifonom, je hitrost povratnega toka približno 10 ml na minuto. |
|
4.2 |
Kartuše za ekstrakcijo, ki ne vsebujejo materialov, topnih v petroletru, in s poroznostjo, ki je v skladu z zahtevami iz točke 4.1. |
|
4.3 |
Sušilnik, vakuumski, nastavljen na 75 oC ± 3 oC, ali zračni, nastavljen na 100 oC ± 3 oC. |
5. Postopek
5.1 Postopek A (glej točko 8.1)
5 g vzorca se natehta na 1 mg natančno, prenese v kartušo za ekstrakcijo (4.2) in pokrije s čepkom iz vate, ki ne vsebuje maščobe.
Kartuša se postavi v ekstraktor (4.1) in šest ur ekstrahira s petroletrom (3.1). Ekstrakt petroletra se zbere v suho stehtano bučko, v kateri so delci plovca (2).
Topilo se oddestilira. Ostanek se osuši tako, da se bučka za uro in pol postavi v sušilnik (4.3). Pusti se, da se ohladi v eksikatorju, in stehta. Ponovno se suši 30 minut, da se zagotovi ohranitev konstantne mase olj in maščob (izguba mase med dvema zaporednima tehtanjema ne sme presegati 1 mg).
5.2 Postopek B
2,5 g vzorca se natehta na 1 mg natančno (glej točko 8.2), prenese v 400-mililitrsko čašo ali 300-mililitrsko erlenmajerico in ter doda 100 ml klorovodikove kisline (3.3) in delci plovca. Čaša se pokrije z urnim steklom ali pa se erlenmajerica spoji s kondenzatorjem povratnega toka. Pri nizkem plamenu ali na električnem kuhalniku se mešanica počasi zavre in se pusti rahlo vreti eno uro. Paziti je treba, da se vzorec ne oprijema sten posode.
Ohladi se in doda toliko filtracijskega sredstva (3.4), da med filtracijo ne pride do izgub olja in maščob. Filtrira se skozi navlažen, dvojni filtrirni papir, ki ne vsebuje maščob. Ostanek se spere s hladno vodo, dokler filtrat ni nevtralen. Prepričati se je treba, da filtrat ne vsebuje nobenih olj ali maščob. Njihova prisotnost pomeni, da se mora vzorec pred hidrolizo ekstrahirati s petroletrom po postopku A.
Dvojni filtrirni papir, na katerem je ostanek, se prenese na urno steklo in se uro in pol suši v sušilniku (4.3) pri 100 oC ± 3 oC.
Dvojni filtrirni papir s suhim ostankom se prenese v kartušo za ekstrahiranje (4.2) in pokrije s čepkom iz vate, ki ne vsebuje maščob. Kartuša se postavi v ekstraktor (4.1), nato pa se nadaljuje, kakor je navedeno v drugem in tretjem odstavku točke 5.1.
6. Prikaz rezultatov
Masa ostanka se izrazi kot masni delež vzorca.
7. Ponovljivost
Razlika med rezultatoma dveh vzporednih določanj, ki jih na istem vzorcu izvaja isti analitik, ne presega:
|
— |
0,2 % absolutne vrednosti za vsebnosti surovih olj in maščobe, nižje od 5 %, |
|
— |
4,0 % višjega rezultata za vsebnosti 5–10 %, |
|
— |
0,4 % absolutne vrednosti za vsebnosti nad 10 %. |
8. Opombe
|
8.1 |
Pri proizvodih z visoko vsebnostjo olj in maščob, ki jih je težko zdrobiti ali so neprimerni za pripravo homogenega zmanjšanega skupnega preskusnega vzorca, se uporabi naslednji postopek. 20 g vzorca se natehta na 1 mg natančno in zmeša z 10 g ali več brezvodnega natrijevega sulfata (3.2). Ekstrahira se s petroletrom (3.1), kakor je navedeno v točki 5.1. Ekstrakt se dopolni s petroletrom do 500 ml (3.1) in premeša. 50 ml raztopine se prenese v majhno suho stehtano bučko, v kateri so delci plovca. Oddestilira se topilo, se osuši, nato pa se nadaljuje, kakor je določeno v zadnjem odstavku točke 5.1. Iz ostanka po ekstrakciji v kartuši se odstrani topilo, ostanek se zdrobi do velikosti delcev 1 mm, vrne v kartušo za ekstrakcijo (natrijev sulfat se ne doda), nato pa se nadaljuje, kakor je določeno v drugem in tretjem odstavku točke 5.1. Vsebnost olj in maščob kot masni delež vzorca se izračuna po naslednji formuli: (10m1 + m2) × 5 pri čemer je:
|
|
8.2 |
Pri proizvodih z nizko vsebnostjo olj in maščob se lahko preskusni vzorec poveča na 5 g. |
|
8.3 |
Hrano za hišne živali, ki vsebuje veliko vode, je treba včasih pred hidrolizo in ekstrakcijo po postopku B zmešati z brezvodnim natrijevim sulfatom. |
|
8.4 |
Pri točki 5.2 je za spiranje ostanka po filtraciji morda učinkoviteje uporabiti vročo vodo namesto hladne. |
|
8.5 |
Pri nekateri krmi je morda treba podaljšati čas sušenja na več kot uro in pol. Odvečnemu sušenju se izogiba, saj lahko povzroči nizke rezultate. Uporabi se lahko tudi mikrovalovna pečica. |
|
8.6 |
Če je vsebnost surovih olj/maščob višja od 15 %, se pred hidrolizo po postopku A priporoča predhodna ekstrakcija, pri postopku B pa ponovna ekstrakcija. Do določene mere je to odvisno od vrste krme ter vrste olj in maščob v krmi. |
I. DOLOČANJE SUROVIH VLAKEN
1. Namen in področje uporabe
Ta metoda omogoča določanje nemastnih organskih snovi v krmi, ki so netopne v kislih in baznih medijih ter so ponavadi poimenovane surova vlakna.
2. Načelo
Vzorec se po potrebi razmasti in zaporedno obdela s specificiranimi koncentracijami vrelih raztopin žveplove kisline in kalijevega hidroksida. Ostanek se loči s filtracijo skozi filter iz sintranega stekla, spere, posuši, stehta in upepeli pri 475–500 oC. Izguba teže pri upepeljevanju ustreza vsebnosti surovih vlaken v preskusnem vzorcu.
3. Reagenti
|
3.1 |
Žveplova kislina, c = 0,13 mol/l |
|
3.2 |
Sredstvo proti penjenju (npr. n-oktanol) |
|
3.3 |
Filtrirno sredstvo (Celite 545 ali enakovredno), segreto na 500 oC za štiri ure (8.6) |
|
3.4 |
Aceton |
|
3.5 |
Petroleter, vrelišče 40–60 oC |
|
3.6 |
Klorovodikova kislina, c = 0,5 mol/l |
|
3.7 |
Raztopina kalijevega hidroksida, c = 0,23 mol/l |
4. Oprema
|
4.1 |
Enota za segrevanje za razklop z žveplovo kislino in raztopino kalijevega hidroksida, opremljena z dodatkom za filtrirni lonček (4.2) in odtočno cevjo, ki je preko zamaška priklopljena na tekočino in vakuum, po možnosti s stisnjenim zrakom. Pred vsako uporabo se enota pet minut segreva z vrelo vodo. |
|
4.2 |
Stekleni filtrirni lonček z nameščeno filtrirno ploščo iz sintranega stekla in velikosti por 40–90 μm. Pred prvo uporabo ga je treba za nekaj minut segreti na 500 oC in ohladiti (8.6). |
|
4.3 |
Valj, volumna vsaj 270 ml, s kondenzatorjem povratnega toka, primernim za vretje |
|
4.4 |
Sušilnik s termostatom |
|
4.5 |
Žarilna peč s termostatom |
|
4.6 |
Enota za ekstrakcijo, sestavljena iz podporne plošče za filtrirni lonček (4.2) in odtočne cevi, ki je preko zamaška priklopljena na vakuum in tekočino. |
|
4.7 |
Obročki, ki povežejo enoto za segrevanje (4.1), lonček (4.2) in valj (4.3) ter enoto za hladno ekstrakcijo (4.6) in lonček. |
5. Postopek
1 g pripravljenega vzorca se natehta na 1 mg natančno in prenese v lonček (4.2) (glej opombe 8.1, 8.2 in 8.3), čemur se doda 1 g filtrirnega sredstva (3.3).
Najprej se povežeta enota za segrevanje (4.1) in filtrirni lonček (4.2), nato pa valj (4.3) in lonček. V povezana valj in lonček se nalije 150 ml vrele žveplove kisline (3.1) in po potrebi nekaj kapljic sredstva proti penjenju (3.2).
Tekočina se zavre v 5 ± 2 minutah ter pusti močno vreti natančno 30 minut.
Odpre se zamašek na odtočni cevi (4.1), žveplova kislina se pod vakuumom filtrira skozi filtrirni lonček, ostanek pa se trikrat spere s po 30 ml vrele vode, da je filtrirni ostanek po vsakem spiranju suh.
Odtočni zamašek se zapre, v povezana valj in lonček se nalije 150 ml vrele raztopine kalijevega hidroksida (3.7), nato pa se doda nekaj kapljic sredstva proti penjenju (3.2). Tekočina se zavre v 5 ± 2 minutah ter pusti močno vreti natančno 30 minut. To se filtrira, postopek spiranja pa se ponovi, kakor je bil uporabljen za žveplovo kislino.
Po končnem spiranju in sušenju se lonček z vsebino odklopi in priklopi na enoto za hladno ekstrakcijo (4.6). Ostanek v lončku se pod vakuumom trikrat spere s po 25 ml acetona (3.4), da je filtrirni ostanek po vsakem spiranju suh.
Lonček se suši v sušilniku pri 130 oC do konstantne teže. Po vsakem sušenju se ohladi v eksikatorju in hitro stehta. Lonček se postavi v žarilno peč in pri 475–500 oC žari najmanj 30 minut do konstantne teže (izguba teže med dvema zaporednima tehtanjema ne sme presegati 2 mg).
Po vsakem segrevanju in pred merjenjem se lonček najprej ohladi v peči, nato pa še v eksikatorju.
Slepi preskus se izvede brez vzorca. Izguba teže pri žarjenju ne sme presegati 4 mg.
6. Izračun rezultatov
Vsebnost surovih vlaken, izražena kot masni delež vzorca, se izračuna po naslednji formuli:

pri čemer je:
|
m |
= |
masa vzorca v gramih; |
|
m0 |
= |
izguba mase po žarjenju pri določanju v gramih; |
|
m1 |
= |
izguba mase po žarjenju pri slepem preskusu v gramih. |
7. Ponovljivost
Razlika med rezultatoma dveh vzporednih določanj, izvedenih na istem vzorcu, ne sme presegati:
|
— |
0,6 % absolutne vrednosti za vsebnosti surovih vlaken, manjše od 10 %, |
|
— |
6 % višje vrednosti za vsebnosti surovih vlaken 10 % ali več. |
8. Opombe
|
8.1 |
Krmo, ki vsebuje več kakor 10 % surovih maščob, je treba pred analizo razmastiti s petroletrom (3.5). Filtrirni lonček (4.2) z vsebino se poveže z enoto za hladno ekstrakcijo (4.6), ostanek pa se pod vakuumom trikrat spere s po 30 ml petroletra, da je ostanek suh. Lonček z vsebino se poveže z enoto za segrevanje (4.1), nadaljuje pa se v skladu s točko 5. |
|
8.2 |
Krmo, ki vsebuje maščobe, ki se ne morejo neposredno ekstrahirati s petroletrom (3.5), je treba razmastiti, kakor je navedeno v točki 8.1, in ponovno razmastiti po vretju s kislino. Po vretju s kislino in nadaljnjim spiranjem se lonček z vsebino poveže z enoto za hladno ekstrakcijo (4.6) ter trikrat spere s po 30 ml acetona in trikrat s po 30 ml petroletra. Filtrira se pod vakuumom do suhega stanja, nadaljuje pa se, kakor je navedeno v točki 5, pri čemer se začne z dodajanjem kalijevega hidroksida. |
|
8.3 |
Če krma vsebuje več kot 5 % karbonatov, izraženih kot kalcijev karbonat, se lonček (4.2) z natehtanim vzorcem poveže z enoto za segrevanje (4.1). Vzorec se trikrat spere s po 30 ml klorovodikove kisline (3.6). Po vsakem dodajanju je treba vzorec pustiti stati približno eno minuto, preden se filtrira. Ponovno se spere s 30 ml vode, nato pa se nadaljuje, kakor je navedeno v točki 5. |
|
8.4 |
Če se uporablja naprava v obliki stojala (številni lončki, povezani na isto enoto za segrevanje), se v isti seriji ne smeta opraviti posamezni določanji na istem vzorcu za analizo. |
|
8.5 |
Če je po vretju težko filtrirati kisle in bazične raztopine, se uporabi stisnjen zrak skozi odtočno cev enote za segrevanje in se nato nadaljuje s filtriranjem. |
|
8.6 |
Temperatura žarjenja ne presega 500 oC, da se podaljša obstojnost steklenih filtrirnih lončkov. Potrebna je previdnost, da se preprečijo odvečni toplotni šoki med segrevanjem ali hlajenjem. |
J. DOLOČANJE SLADKORJA
1. Namen in področje uporabe
Ta metoda omogoča določanje količine reducirajočih sladkorjev in celotnih sladkorjev po inverziji, izraženih kot glukoza ali, kadar je to primerno, saharoza s faktorjem preračunavanja 0,95. Uporablja se za krmne mešanice. Za drugo krmo se uporabljajo posebne metode. Kadar je primerno, se laktoza izmeri ločeno in upošteva pri izračunu rezultata.
2. Načelo
Sladkorji se ekstrahirajo z razredčenim etanolom in raztopina se zbistri z raztopinama Carrez I in II. Po odstranitvi etanola se določijo količine pred inverzijo in po njej po Luff-Schoorlovi metodi.
3. Reagenti
|
3.1 |
Etanol, 40-odstotna raztopina (v/v), gostota: 0,948 g/ml pri 20 oC, nevtraliziran proti fenolftaleinu |
|
3.2 |
Raztopina Carrez I: 21,9 g cinkovega acetata Zn (CH3COO)2 × 2H2O in 3 g ledoceta se raztopijo v vodi. Dopolni se z vodo do 100 ml. |
|
3.3 |
Raztopina Carrez II: 10,6 g kalijevega ferocianida K4 Fe (CN)6 × 3H2O se raztopi v vodi. Dopolni se z vodo do 100 ml. |
|
3.4 |
Metiloranž 0,1-odstotna raztopina (m/v) |
|
3.5 |
Klorovodikova kislina, 4 mol/l |
|
3.6 |
Klorovodikova kislina, 0,1 mol/l |
|
3.7 |
Raztopina natrijevega hidroksida, 0,1 mol/l |
|
3.8 |
Luff-Schoorlov reagent: Med previdnim mešanjem se v raztopimo natrijevega karbonata (3.8.3) vlije raztopina citronske kisline (3.8.2). Doda se raztopina bakrovega sulfata (3.8.1), nato pa se dopolni z vodo do 1 litra. Pusti se čez noč in nato filtrira. Preveri se koncentracija tako dobljenega reagenta (Cu 0,05 mol/l; Na2 CO3 1 mol/l), glej zadnji odstavek točke 5.4. pH raztopine je približno 9,4. |
|
3.8.1 |
Raztopina bakrovega sulfata: v 100 ml vode se raztopi 25 g bakrovega sulfata (Cu SO4 5H2O), ki ne vsebuje železa. |
|
3.8.2 |
Raztopina citronske kisline: v 50 ml vode se raztopi 50 g citronske kisline (C6H8O7.H2O). |
|
3.8.3 |
Raztopina natrijevega karbonata: v približno 300 ml tople vode se raztopi 143,8 g brezvodnega natrijevega karbonata. Pusti se, da se ohladi. |
|
3.9 |
Raztopina natrijevega tiosulfata, 0,1 mol/l. |
|
3.10 |
Raztopina škroba: v liter vrele vode se doda suspenzija 5 g topnega škroba v 30 ml vode. Pusti se vreti 3 minute, nato se ohladi in po potrebi doda 10 mg živosrebrovega jodida kot konzervansa. |
|
3.11 |
Žveplova kislina, 3 mol/l |
|
3.12 |
Kalijev jodid, 30-odstotna raztopina (m/v) |
|
3.13 |
Zdrobljen plovec, prevret v klorovodikovi kislini, opran z vodo in osušen |
|
3.14 |
3-metilbutan-l-ol |
4. Oprema
Mešalnik: približno 35 do 40 obr./min.
5. Postopek
5.1 Ekstrakcija vzorca
2,5 g vzorca se natehta na 1 mg natančno in prenese v 250-mililitrsko merilno bučko. Doda se 200 ml etanola (3.1) in v mešalniku meša 1 uro. Doda se 5 ml raztopine Carrez I (3.2) in meša približno 30 sekund. Doda se 5 ml raztopine Carrez II (3.3) in ponovno meša 1 minuto. Dopolni se z etanolom (3.1) do oznake, homogenizira in filtrira. Odstrani se 200 ml filtrata in upari približno do polovice, da se odstrani skoraj ves etanol. Ostanek po uparevanju se s toplo vodo prenese v 200-mililitrsko merilno bučko, ohladi se, dopolni z vodo do oznake, homogenizira in po potrebi filtrira. Ta raztopina se uporabi za določanje količine reducirajočih sladkorjev, po inverziji pa celotnih sladkorjev.
5.2 Določanje reducirajočih sladkorjev
Odpipetira se največ 25 ml raztopine, ki vsebuje manj kot 60 mg reducirajočih sladkorjev, izraženih kot glukoza. Po potrebi se dopolni z destilirano vodo do 25 ml in določi vsebnost reducirajočih sladkorjev po Luff-Schoorlovi metodi. Rezultat se izrazi kot masni delež glukoze v vzorcu.
5.3 Določanje celotnih sladkorjev po inverziji
50 ml raztopine se odpipetira v 100-mililitrsko merilno bučko. Doda se nekaj kapljic raztopine metiloranža (3.4), nato pa se previdno in ob neprestanem mešanju doda klorovodikova kislina (3.5), dokler tekočina na postane močno rdeča. Doda se 15 ml klorovodikove kisline (3.6), bučka se potopi v skoraj vrelo vodno kopel in v njej pusti 30 minut. Hitro se ohladi na približno 20 oC, nato pa se doda 15 ml raztopine natrijevega hidroksida (3.7). Dopolni se z vodo do 100 ml in homogenizira. Odpipetira se največ 25 ml raztopine, ki vsebuje manj kot 60 mg reducirajočih sladkorjev, izraženih kot glukoza. Po potrebi se dopolni z destilirano vodo do 25 ml in določi vsebnost reducirajočih sladkorjev po Luff-Schoorlovi metodi. Rezultat se izrazi kot masni delež glukoze ali, kadar je to primerno, saharoze tako, da se pomnoži s faktorjem 0,95.
5.4 Titracija po Luff-Schoorlovi metodi
25 ml Luff-Schoorlovega reagenta (3.8) se odpipetira v 300-mililitrsko erlenmajerico; doda se natančno 25 ml zbistrene raztopine sladkorja. Dodata se 2 zrni plovca (3.13) in med ročnim mešanjem se segreva nad prostim plamenom srednje višine tako, da raztopina zavre v približno dveh minutah. Erlenmajerica se takoj postavi na žično mrežico, prevlečeno z azbestom, ki ima odprtino s premerom 6 cm, pod katero je prižgan plamen. Plamen se naravna tako, da se segreva le dno erlenmajerice. Na erlenmajerico se namesti kondenzator povratnega toka. Pusti se vreti natančno 10 minut. Takoj se ohladi v mrzli vodi in čez približno pet minut titrira na naslednji način:
doda se 10 ml raztopine kalijevega jodida (3.12) in takoj nato (previdno zaradi možnosti močnega penjenja) 25 ml žveplove kisline (3.11). Z raztopino natrijevega tiosulfata (3.9) se titrira do svetlorumene barve, doda se indikator škrob (3.10), nato pa se titracija zaključi.
Enaka titracija se izvede brez vretja z natančno izmerjeno mešanico 25 ml Luff-Schoorlovega reagenta (3.8) in 25 ml vode, potem ko se ji doda 10 ml raztopine kalijevega jodida (3.12) in 25 ml žveplove kisline (3.11).
6. Izračun rezultatov
S pomočjo preglednice se določi količina glukoze v mg, ki ustreza razliki med vrednostma obeh titracij, izraženi v mg natrijevega tiosulfata 0,1 mol/l. Rezultat se izrazi kot masni delež vzorca.
7. Posebni postopki
|
7.1 |
Pri krmi, ki vsebuje veliko melase, in drugi krmi, ki ni zelo homogena, se natehta 20 g vzorca in s 500 ml vode prenese v litrsko merilno bučko. V mešalniku se meša 1 uro. Raztopina se zbistri z uporabo reagentov Carrez I (3.2) in II (3.3), kakor je opisano v točki 5.1, vendar se uporabi štirikratna količina vsakega reagenta. Bučka se dopolni z 80-odstotnim etanolom (v/v) do oznake. Homogenizira se in filtrira. Etanol se odstrani, kakor je opisano v točki 5.1. Če ni dekstriniranega škroba, se dopolni do oznake z destilirano vodo. |
|
7.2 |
V primeru melas in posamične krme, ki vsebujejo veliko sladkorja in so skoraj brez škroba (rožiči, posušene rezine pese itd.), se natehta 5 g in prenese v 250-mililitrsko merilno bučko, doda se 200 ml destilirane vode in eno uro ali po potrebi več meša v mešalniku. Raztopina se zbistri z uporabo reagentov Carrez I (3.2) in II (3.3), kakor je opisano v točki 5.1. Dopolni se z mrzlo vodo do oznake, homogenizira in filtrira. Za določanje količine celotnih sladkorjev se nadaljuje, kakor je opisano v točki 5.3. |
8. Opombe
|
8.1 |
Za preprečevanje penjenja je priporočljivo, da se pred vretjem z Luff-Schoorlovim reagentom doda (ne glede na volumen) približno 1 ml 3-metilbutan-l-ola (3.14). |
|
8.2 |
Razlika med vsebnostjo celotnih sladkorjev po inverziji, izraženih kot glukoza, in vsebnostjo reducirajočih sladkorjev, izraženih kot glukoza, pomnoženo z 0,95, je masni deleži saharoze. |
|
8.3 |
Za določanje vsebnosti reducirajočih sladkorjev, razen laktoze, se lahko uporabljata dve metodi: |
|
8.3.1 |
za približen izračun se vsebnost laktoze, določena z drugo analitsko metodo, pomnoži z 0,675, dobljeni rezultat pa se odšteje od vsebnosti reducirajočih sladkorjev; |
|
8.3.2 |
za natančen izračun reducirajočih sladkorjev, razen laktoze, je treba za končno določitev uporabiti isti vzorec. Ena od analiz se izvede na delu raztopine, ki nastane pri postopku iz točke 5.1, druga pa na delu raztopine, ki nastane pri določanju laktoze z metodo, določeno za navedeni namen (po fermentiranju drugih vrst sladkorja in zbistritve). V obeh primerih se količina sladkorja določi z Luff-Schoorlovo metodo in izračuna v mg glukoze. Ena vrednost se odšteje od druge in razlika se izrazi kot masni delež vzorca. Primer: Za vsako določanje oba uporabljena volumna ustrezata 250 mg vzorca. V prvem primeru se porabi 17 ml raztopine natrijevega tiosulfata 0,1 mol/l, kar ustreza 44,2 mg glukoze, v drugem pa 11 ml, kar ustreza 27,6 mg glukoze. Razlika je 16,6 mg glukoze. Vsebnost reducirajočih sladkorjev (razen laktoze), izračunana kot glukoza, je zato:
|
Preglednica vrednosti za 25 ml Luff-Schoorlovega reagenta
ml Na2 S2 O30,1 mol/l, 2 minuti segrevanja, 10 minut vretja
|
Na2S2O3 0,1 mol/l |
Glukoza, fruktoza, sladkorji po inveriziji C6H12O6 |
Laktoza C12H22O11 |
Maltoza C12H22O11 |
Na2S2O3 0,1 mol/l |
|||
|
ml |
mg |
razlika |
mg |
razlika |
mg |
razlika |
ml |
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 |
2,4 4,8 7,2 9,7 12,2 14,7 17,2 19,8 22,4 25,0 27,6 30,3 33,0 35,7 38,5 41,3 44,2 47,1 50,0 53,0 56,0 59,1 62,2 |
2,4 2,4 2,5 2,5 2,5 2,5 2,6 2,6 2,6 2,6 2,7 2,7 2,7 2,8 2,8 2,9 2,9 2,9 3,0 3,0 3,1 3,1 |
3,6 7,3 11,0 14,7 18,4 22,1 25,8 29,5 33,2 37,0 40,8 44,6 48,4 52,2 56,0 59,9 63,8 67,7 71,7 75,7 79,8 83,9 88,0 |
3,7 3,7 3,7 3,7 3,7 3,7 3,7 3,7 3,8 3,8 3,8 3,8 3,8 3,8 3,9 3,9 3,9 4,0 4,0 4,1 4,1 4,1 |
3,9 7,8 11,7 15,6 19,6 23,5 27,5 31,5 35,5 39,5 43,5 47,5 51,6 55,7 59,8 63,9 68,0 72,2 76,5 80,9 85,4 90,0 94,6 |
3,9 3,9 3,9 4,0 3,9 4,0 4,0 4,0 4,0 4,0 4,0 4,1 4,1 4,1 4,1 4,1 4,2 4,3 4,4 4,5 4,6 4,6 |
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 |
K. DOLOČANJE LAKTOZE
1. Namen in področje uporabe
Ta metoda omogoča določanje ravni laktoze v krmi, ki vsebuje več kot 0,5 % laktoze.
2. Načelo
Sladkorji se raztopijo v vodi. Raztopina se fermentira s kvasovkami vrste Saccharomyces cerevisiae, ki ne spreminjajo laktoze. Po zbistritvi in filtriranju se vsebnost laktoze v filtratu določi po Luff-Schoorlovi metodi.
3. Reagenti
|
3.1 |
Suspenzija kvasovk vrste Saccharomyces cerevisiae: 25 g svežih kvasovk se raztopi v 100 ml vode. Suspenzija je ob hranjenju v hladilniku uporabna največ en teden. |
|
3.2 |
Raztopina Carrez I: 21,9 g cinkovega acetata Zn (CH3 COO)2 2H2O in 3 g ledoceta se raztopijo v vodi. Dopolni se z vodo do 100 ml. |
|
3.3 |
Raztopina Carrez II: 10,6 g kalijevega ferocianida K4 Fe (CN)6 3H2O se raztopi v vodi. Dopolni se z vodo do 100 ml. |
|
3.4 |
Luff-Schoorlov reagent: med previdnim mešanjem se v raztopino natrijevega karbonata (3.4.3) vlije raztopina citronske kisline (3.4.2). Doda se raztopina bakrovega sulfata (3.4.1), nato pa se dopolni z vodo do 1 litra. Pusti se čez noč in nato filtrira. Preveri se koncentracija tako dobljenega reagenta (Cu 0,05 mol/l, Na2 CO3 1 mol/l). pH raztopine je približno 9,4. |
|
3.4.1 |
Raztopina bakrovega sulfata: v 100 ml vode se raztopi 25 g bakrovega sulfata (Cu SO4 × 5H2O), ki ne vsebuje železa. |
|
3.4.2 |
Raztopina citronske kisline: v 50 ml vode se raztopi 50 g citronske kisline (C6H8O7×H2O). |
|
3.4.3 |
Raztopina natrijevega karbonata: v približno 300 ml tople vode se raztopi 143,8 g brezvodnega natrijevega karbonata. Pusti se, da se ohladi. |
|
3.5 |
Zdrobljen plovec, prevret v klorovodikovi kislini, opran z vodo in osušen |
|
3.6 |
Kalijev jodid, 30-odstotna raztopina (m/v) |
|
3.7 |
Žveplova kislina, 3 mol/l |
|
3.8 |
Raztopina natrijevega tiosulfata, 0,1 mol/l |
|
3.9 |
Raztopina škroba: v liter vrele vode se doda suspenzija 5 g topnega škroba v 30 ml vode. Pusti se vreti 3 minute, nato pa se ohladi in po potrebi doda 10 mg živosrebrovega jodida kot konzervansa. |
4. Oprema
Vodna kopel s termostatom, nastavljenim na 38–40 oC
5. Postopek
1 g vzorca se natehta na 1 mg natančno in prenese v 100-mililitrsko merilno bučko. Doda se 25–30 ml vode. Bučka se za 30 minut postavi v vrelo vodno kopel, nato ohladi na približno 35 oC. Doda se 5 ml suspenzije kvasovk (3.1) in homogenizira. Bučka se pusti 2 uri v vodni kopeli pri temperaturi 38–40 oC. Ohladi se na približno 20 oC.
Doda se 2,5 ml raztopine Carrez I (3.2) in meša 30 sekund, nato se doda 2,5 ml raztopine Carrez II (3.3) in ponovno meša 30 sekund. Dopolni se z vodo do 100 ml, premeša in filtrira. Del filtrata, ki ne presega 25 ml in ki priporočljivo vsebuje 40 do 80 mg laktoze, se odpipetira in prenese v 300-mililitrsko erlenmajerico. Po potrebi se dopolni z vodo do 25 ml.
Slepi preskus s 5 ml suspenzije kvasovk (3.1) se izvede pri enakih pogojih. Vsebnost laktoze se določi po Luff-Schoorlovi metodi na naslednji način: doda se natančno 25 ml Luff-Schoorlovega reagenta (3.4) in 2 zrni plovca (3.5). Med ročnim mešanjem se segreva nad prostim plamenom srednje jakosti tako, da tekočina zavre v približno 2 minutah. Erlenmajerica se takoj postavi na žično mrežico, prevlečeno z azbestom, ki ima odprtino s premerom 6 cm, pod katero je prižgan plamen. Plamen se naravna tako, da se segreva le dno erlenmajerice. Na erlenmajerico se namesti kondenzator povratnega toka. Pusti se vreti natančno 10 minut. Takoj se ohladi v mrzli vodi in čez približno 5 minut titrira na naslednji način:
doda se 10 ml raztopine kalijevega jodida (3.6) in takoj nato (previdno zaradi možnosti močnega penjenja) 25 ml žveplove kisline (3.7). Z raztopino natrijevega tiosulfata (3.8) se titrira do svetlorumene barve, doda se indikator škrob (3.9), nato pa se titracija zaključi.
Enaka titracija se izvede brez vretja z natančno izmerjeno mešanico 25 ml Luff-Schoorlovega reagenta (3.4) in 25 ml vode, potem ko se ji doda 10 ml raztopine kalijevega jodida (3.6) in 25 ml žveplove kisline (3.7).
6. Izračun rezultatov
S pomočjo priložene preglednice se določi količina laktoze v mg, ki ustreza razliki med rezultatoma dveh titracij, izraženih v ml natrijevega tiosulfata 0,1 mol/l.
Rezultat se izrazi kot masni delež brezvodne laktoze v vzorcu.
7. Opomba
Pri proizvodih, ki vsebujejo več kot 40 % fermentiranega sladkorja, se uporabi več kot 5 ml suspenzije kvasovk (3.1).
Preglednica vrednosti za 25 ml Luff-Schoorlovega reagenta
ml Na2 S2 O30,1 mol/l, 2 minuti segrevanja, 10 minut vretja
|
Na2S2O3 0,1 mol/l |
Glukoza, fruktoza, sladkorji po inveriziji C6H12O6 |
Laktoza C12H22O11 |
Maltoza C12H22O11 |
Na2S2O3 0,1 mol/l |
|||
|
ml |
mg |
razlika |
mg |
razlika |
mg |
razlike |
ml |
|
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 |
2,4 4,8 7,2 9,7 12,2 14,7 17,2 19,8 22,4 25,0 27,6 30,3 33,0 35,7 38,5 41,3 44,2 47,1 50,0 53,0 56,0 59,1 62,2 |
2,4 2,4 2,5 2,5 2,5 2,5 2,6 2,6 2,6 2,6 2,7 2,7 2,7 2,8 2,8 2,9 2,9 2,9 3,0 3,0 3,1 3,1 |
3,6 7,3 11,0 14,7 18,4 22,1 25,8 29,5 33,2 37,0 40,8 44,6 48,4 52,2 56,0 59,9 63,8 67,7 71,7 75,7 79,8 83,9 88,0 |
3,7 3,7 3,7 3,7 3,7 3,7 3,7 3,7 3,8 3,8 3,8 3,8 3,8 3,8 3,9 3,9 3,9 4,0 4,0 4,1 4,1 4,1 |
3,9 7,8 11,7 15,6 19,6 23,5 27,5 31,5 35,5 39,5 43,5 47,5 51,6 55,7 59,8 63,9 68,0 72,2 76,5 80,9 85,4 90,0 94,6 |
3,9 3,9 3,9 4,0 3,9 4,0 4,0 4,0 4,0 4,0 4,0 4,1 4,1 4,1 4,1 4,1 4,2 4,3 4,4 4,5 4,6 4,6 |
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 |
L. DOLOČANJE ŠKROBA
POLARIMETRIČNA METODA
1. Namen in področje uporabe
Ta metoda omogoča določanje ravni škroba in visokomolekularnih produktov razgradnje škroba v krmi za preverjanje skladnosti z označeno energijsko vrednostjo (določbe iz Priloge VII) in Direktivo Sveta 96/25/ES (3).
2. Načelo
Metoda vključuje dve določanji. Pri prvi se vzorec obdela z razredčeno klorovodikovo kislino. Po zbistritvi in filtriranju se izmeri optična rotacija raztopine s polarimetrijo.
Pri drugi se vzorec ekstrahira s 40-odstotnim etanolom. Po nakisanju filtrata s klorovodikovo kislino ter zbistritvi in filtriranju se izmeri optična rotacija tako kot pri prvem določanju.
Razlika med dvema meritvama, pomnožena z znanim faktorjem, je vsebnost škroba v vzorcu.
3. Reagenti
|
3.1 |
Klorovodikova kislina, 25-odstotna raztopina (m/v), gostota: 1,126 g/ml |
|
3.2 |
Trikloroocetna kislina, 1,13-raztopina raztopina (m/v) Koncentracija se mora preveriti s titracijo z 0,1 mol/l raztopino natrijevega hidroksida v prisotnosti 0,1-odstotnega (m/v) metil rdečega v 94-odstotnem (v/v) etanolu. Za nevtralizacijo 10 ml je potrebno 30,94 ml NaOH 0,1 mol/l. |
|
3.3 |
Raztopina Carrez I: 21,9 g cinkovega acetata Zn(CH3COO)2 2H2O in 3 g ledoceta se raztopi v vodi. Dopolni se z vodo do 100 ml. |
|
3.4 |
Raztopina Carrez II: 10,6 g kalijevega ferocianida K4(Fe(CN)6 3H2O se raztopi v vodi. Dopolni se z vodo do 100 ml. |
|
3.5 |
Etanol, 40-odstotna raztopina (v/v), gostota: 0,948 g/ml pri 20 oC |
4. Oprema
|
4.1 |
250-mililitrska erlenmajerica s standardnim brušenim vratom in kondenzatorjem povratnega toka |
|
4.2 |
Polarimeter ali saharometer |
5. Postopek
5.1 Priprava vzorca
Vzorec se zdrobi tako, da vsi delci preidejo skozi sito z okroglimi luknjicami premera 0,5 mm.
5.2 Določanje celotne optične rotacije (P ali S) (glej opombo 7.1)
2,5 g zdrobljenega vzorca se natehta na 1 mg natančno in prenese v 100-mililitrsko merilno bučko. Doda se 25 ml klorovodikove kisline (3.2), pretrese se, da nastane enakomerna porazdelitev preskusnega vzorca, nato pa se doda nadaljnjih 25 ml klorovodikove kisline (3.2). Bučka se potopi v vrelo vodno kopel in prve 3 minute močno in enakomerno stresa, da se prepreči nastanek aglomeratov. V vodni kopeli mora biti toliko vode, da kopel ostane na točki vrelišča, ko se vanjo potopi bučka. Bučke se med stresanjem ne sme odstraniti iz kopeli. Po natanko 15 minutah se bučka odstrani iz kopeli, doda se 30 ml hladne vode, nato pa se takoj ohladi na 20 oC.
Doda se 5 ml Raztopine Carrez I (3.3) in stresa približno 30 sekund. Nato se doda 5 ml raztopine Carrez II (3.4) in ponovno stresa 30 sekund. Dopolni se z vodo do oznake, premeša in filtrira. Če filtrat ni popolnoma bister (kar je redko), se ponovi določanje z uporabo večje količine raztopin Carrez I in II, na primer 10 ml.
Optična rotacija raztopine v 200-milimetrski epruveti se izmeri s polarimetrom ali saharimetrom.
5.3 Določanje optične rotacije (P' ali S') snovi, ki so topne v 40-odstotnem etanolu
5 g vzorca se natehta na 1 mg natančno, prenese v 100-mililitrsko merilno bučko in doda se približno 80 ml etanola (3.5) (glej opombo 7.2). Bučka se pusti stati 1 uro na sobni temperaturi; v tem času se šestkrat močno pretrese, da se preskusni vzorec temeljito premeša z etanolom. Dopolni se z etanolom (3.5) do oznake, premeša in filtrira.
50 ml filtrata (kar ustreza 2,5 g vzorca) se odpipetira v 250-mililitrsko erlenmajerico, doda se 2,1 ml klorovodikove kisline (3.1) in močno pretrese. Erlenmajerica se spoji s kondenzatorjem povratnega toka in potopi v vrelo vodno kopel. Po natanko 15 minutah se erlenmajerica odstrani iz kopeli, vsebina se prenese v 100-mililitrsko merilno bučko, spere se z malo hladne vode in ohladi na 20 oC.
Za zbistritev se uporabita raztopini Carrez I (3.3.) in II (3.4), dopolni se z vodo do oznake, premeša in filtrira, nato pa se izmeri optična rotacija, kakor je navedeno v drugem in tretjem odstavku točke 5.2.
6. Izračun rezultatov
Vsebnost škroba (%) se izračuna na naslednji način:
6.1 meritve s polarimetrom

|
P |
= |
celotna optična rotacija v kotnih stopinjah; |
||||||||||||||
|
P' |
= |
optična rotacija snovi, ki so topne v 40-odstotnem (V/V) etanolu, v kotnih stopinjah; |
||||||||||||||
|
|
= |
specifična optična rotacija čistega škroba. Vrednosti, D ki se ponavadi uporabljajo za ta faktor, so:
|
6.2 meritve s saharimetrom
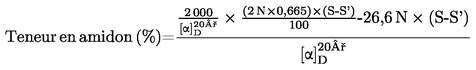
|
S |
= |
celotna optična rotacija v stopinjah saharimetra; |
|
S' |
= |
optična rotacija snovi, ki so topne v 40-odstotnem (v/v) etanolu, v stopinjah saharimetra; |
|
N |
= |
masa (g) saharoze v 100 ml vode, pri kateri je optična rotacija 100 saharimetrskih stopinj, kadar se meri z uporabo 200-milimetrske epruvete; 16,29 g za francoske saharimetre; 26,00 g za nemške saharimetre; 20,00 g za mešane saharimetre; |
|
|
= |
specifična optična rotacija čistega škroba (glej 6.1). |
6.3 Ponovljivost
Razlika med rezultatoma dveh vzporednih določanj, izvedenih na istem vzorcu, ne sme presegati 0,4 absolutne vrednosti za vsebnost škroba, ki je nižja od 40 %, in 1 % relativne vrednosti za vsebnost škroba, ki je enaka ali višja od 40 %.
7. Opombe
|
7.1 |
Če vzorec vsebuje več kot 6 % karbonatov, izračunanih v obliki kalcijevega karbonata, se jih mora pred določanjem celotne optične rotacije razkrojiti z obdelavo z natančno primerno količino razredčene žveplove kisline. |
|
7.2 |
V primeru proizvodov, ki imajo visoko vsebnost laktoze, kot je serum mleka v prahu ali posneto mleko v prahu, se po dodatku 80 ml etanola (3.5) izvaja naslednje: bučka se spoji s kondenzatorjem povratnega toka in se za 30 minut potopi v vodno kopel pri 50 oC. Pusti se, da se ohladi, in nadaljuje z analizo, kakor je navedeno v točki 5.3. |
|
7.3 |
Naslednja posamična krmila, kadar so prisotna v znatni količini v krmi, povzročajo motnje pri določanju vsebnosti škroba s polarimetrično metodo, zaradi česar so lahko rezultati nepravilni:
|
M. DOLOČANJE SUROVEGA PEPELA
1. Namen in področje uporabe
Ta metoda omogoča določanje vsebnosti surovega pepela v krmi.
2. Načelo
Vzorec se upepeli pri 550 oC; ostanek se stehta.
3. Reagenti
Amonijev nitrat, 20-odstotna raztopina (m/v)
4. Oprema
|
4.1 |
Grelna plošča |
|
4.2 |
Električna žarilna peč s termostatom |
|
4.3 |
Žarilni lončki za upepeljevanje iz kremena, porcelana ali platine, pravokotni (približno 60 × 40 × 25 mm) ali okrogli (premer: 60 do 75 mm, višina: 20 do 40 mm) |
5. Postopek
Približno 5 g vzorca se natehta na 1 mg natančno (2,5 g pri proizvodih, ki lahko nabreknejo) in prenese v žarilni lonček za upepelitev, ki se predhodno segreje na 550 oC, ohladi in tarira. Lonček se postavi na grelno ploščo in postopoma segreva, da snov zogleni. Upepeli se v skladu s točko 5.1 ali 5.2.
|
5.1 |
Lonček se postavi v žarilno peč, segreto na 550 oC. Pri tej temperaturi se pusti, dokler ne nastane bel, svetlosiv ali rdečkast pepel, ki je videti, da ne vsebuje ogljikovih delcev. Lonček se postavi v eksikator, pusti se, da se ohladi, in takoj stehta. |
|
5.2 |
Lonček se postavi v žarilno peč, segreto na 550 oC. V peči se pusti 3 ure. Lonček se postavi v eksikator, pusti se, da se ohladi, in takoj stehta. Ponovno se postavi v žarilno peč za 30 minut, pri čemer mora biti masa pepela konstantna (izguba mase med dvema zaporednima tehtanjema ne sme presegati 1 mg). |
6. Izračun rezultatov
Masa ostanka se izračuna tako, da se odšteje tara.
Rezultat se izrazi kot masni delež vzorca.
7. Opombe
|
7.1 |
Snovi, ki se težko upepelijo, je treba najprej najmanj tri ure upepeljevati, nato ohladiti in jim dodati nekaj kapljic 20-odstotne raztopine amonijevega nitrata ali vode (pazljivo, da se pepel ne razprši ali da ne nastanejo grude). Po sušenju v sušilniku se nadaljuje z žarjenjem. Postopek se po potrebi ponovi, dokler upepelitev ni popolna. |
|
7.2 |
Pri snoveh, ki so odporne na obdelavo iz točke 7.1, se nadaljuje na naslednji način: po triurni upepelitvi se pepel prenese v vročo vodo in filtrira skozi majhen filter brez pepela. Filter in njegova vsebina se upepelita v istem lončku. Filtrat se prenese v ohlajen lonček, upari do suhega, upepeli in stehta. |
|
7.3 |
Pri oljih in maščobah se 25 g vzorca natančno natehta v lonček primerne velikosti. Upepeli se tako, da se snov zažge s trakom iz filtrirnega papirja brez pepela. Po sežigu se navlaži s čim manj vode. Osuši in upepeli se, kakor je opisano v točki 5. |
N. DOLOČANJE PEPELA, NETOPNEGA V KLOROVODIKOVI KISLINI
1. Namen in področje uporabe
Ta metoda omogoča določanje ravni mineralnih snovi v krmi, netopnih v klorovodikovi kislini. Glede na naravo vzorca se lahko uporabljata dve metodi.
|
1.1 |
Metoda A: uporablja se za organska posamična krmila in za večino krmnih mešanic; |
|
1.2 |
Metoda B: uporablja se za mineralne krmne mešanice in krmne mešanice, ki vsebujejo več kot 1 % snovi, netopnih v klorovodikovi kislini in določenih po metodi A. |
2. Načelo
|
2.1 |
Metoda A: vzorec se upepeli, pepel se raztopi v vreli klorovodikovi kislini, netopni ostanek pa filtrira in stehta. |
|
2.2 |
Metoda B: vzorec se obdela s klorovodikovo kislino. Raztopina se filtrira, ostanek se upepeli, tako dobljeni pepel pa se obdela v skladu z metodo A. |
3. Reagenti
|
3.1 |
Klorovodikova kislina, 3 mol/l |
|
3.2 |
Trikloroocetna kislina, 20-odstotna raztopina (m/v) |
|
3.3 |
Trikloroocetna kislina, 1-odstotna raztopina (m/v) |
4. Oprema
|
4.1 |
Grelna plošča |
|
4.2 |
Električna žarilna peč s termostatom |
|
4.3 |
Žarilni lončki za upepeljevanje iz kremena, porcelana ali platine, pravokotni (približno 60 × 40 × 25 mm) ali okrogli (premer: 60 do 75 mm, višina: 20 do 40 mm) |
5. Postopek
5.1 Metoda A
Vzorec se upepeli po metodi za določanje surovega pepela. Lahko se uporabi pepel, dobljen pri navedeni analizi.
Pepel se prenese v 250- do 400-mililitrsko čašo s 75 ml klorovodikove kisline (3.1). Počasi se segreje do vretja in pusti rahlo vreti petnajst minut. Topla raztopina se filtrira skozi filtrirni papir brez pepela, ostanek pa se spira s toplo vodo, dokler kisla reakcija ne preneha. Filter z ostankom in pepelom se posuši v tariranem žarilnem lončku pri 550–700 oC. Ohladi se v eksikatorju in stehta.
5.2 Metoda B
5 g vzorca se natehta na 1 mg natančno in prenese v 250- do 400-mililitrsko čašo. Doda se 25 ml vode in nato 25 ml klorovodikove kisline (3.1), premeša se, nato pa se počaka, da se reakcija umiri. Doda se še 50 ml klorovodikove kisline (3.1). Počaka se, da se preneha izločati plin, nato pa se čaša postavi v vrelo vodno kopel za 30 minut ali po potrebi dlje, da se popolnoma hidrolizira kakršen koli škrob, ki je lahko prisoten. Vsebina, ki je še topla, se filtrira skozi filter brez pepela, filter pa se spere s 50 ml tople vode (glej opombo 7). Filter, ki vsebuje ostanek, se prenese v žarilni lonček, posuši in upepeli pri 550–700 oC. Pepel se prenese v 250- do 400-mililitrsko čašo s 75 ml klorovodikove kisline (3.1); nadaljuje se, kakor je opisano v drugem pododstavku točke 5.1.
6. Izračun rezultatov
Masa ostanka se izračuna tako, da se odšteje tara. Rezultat se izrazi kot masni delež vzorca.
7. Opomba
Če pri filtriranju nastopijo težave, se analiza ponovi, pri čemer se 50 ml klorovodikove kisline (3.1) nadomesti s 50 ml 20-odstotne trikloroocetne kisline (3.2), filter pa se spere s toplo raztopino 1-odstotne trikloroocetne kisline (3.3).
O. DOLOČANJE KARBONATOV
1. Namen in področje uporabe
Ta metoda omogoča določanje količine karbonatov v večini krme, ponavadi izraženih kot kalcijev karbonat.
Vendar je treba v nekaterih primerih (na primer pri železovem karbonatu) uporabiti posebna metoda.
2. Načelo
Karbonati se razkrojijo s klorovodikovo kislino; sproščeni ogljikov dioksid se zbere v bireto, nastala prostornina pa se primerja s prostornino, ki se pod istimi pogoji sprosti iz znane količine kalcijevega karbonata.
3. Reagenti
|
3.1 |
Klorovodikova kislina, gostota 1,10 g/ml |
|
3.2 |
Kalcijev karbonat |
|
3.3 |
Žveplova kislina, približno 0,05 mol/l, obarvana z metil rdečim |
4. Oprema
Scheibler-Dietrichova naprava (glej sliko) ali ustrezna druga naprava
5. Postopek
Glede na vsebnost karbonata v vzorcu se natehta del vzorca, kakor je navedeno spodaj:
|
— |
0,5 g pri proizvodih, ki vsebujejo 50–100 % karbonatov, izraženih kot kalcijev karbonat, |
|
— |
1 g pri proizvodih, ki vsebujejo 40–50 % karbonatov, izraženih kot kalcijev karbonat, |
|
— |
2 do 3 g za druge proizvode. |
Natehtani del vzorca se prenese v posebno bučko (4) naprave, povezano z majhno epruveto iz nezdrobljivega materiala, ki vsebuje 10 ml klorovodikove kisline (3.1), bučka pa se poveže z napravo. Trojni petelinček (5) se obrne tako, da je bireta (1) odprta navzven. S pomočjo pomične cevi (2), napolnjene z obarvano žveplovo kislino (3.3) in povezane z bireto (1), se nivo tekočine uravna na oznako nič. Petelinček (5) se obrne tako, da se bireta (1) in cev (3) povežeta, nato pa se preveri, ali je raven na oznaki nič.
Z nagibanjem bučke (4) se klorovodikova kislina (3.1) počasi spušča prek vzorca. Tlaka se izenačita tako, da se cev (2) spušča. Bučka (4) se stresa, dokler se ogljikov dioksid popolnoma ne preneha izločati.
Tlaka se izenačita tako, da se izenačita ravni tekočin v bireti (1) in cevi (2). Rezultat se odčita po nekaj minutah, ko se volumen plina ustali.
Pod enakimi pogoji se izvede kontrolni preskus z 0,5 g kalcijevega karbonata (3.2).
6. Izračun rezultatov
Vsebnost karbonatov, izraženih kot kalcijev karbonat, se izračuna po naslednji formuli:
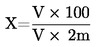
pri čemer je:
|
X |
= |
% (m/m) karbonatov v vzorcu, izraženih kot kalcijev karbonat; |
|
V |
= |
ml sproščenega CO2 iz dela vzorca; |
|
V1 |
= |
ml sproščenega CO2 iz 0,5 g CaCO3; |
|
m |
= |
masa dela vzorca v gramih. |
7. Opombe
|
7.1 |
Ko je masa dela vzorca večja od 2 g, se najprej v bučko (4) nalije 15 ml destilirane vode in se pred začetkom preskusa premeša. Enaka količina vode se uporabi za kontrolni preskus. |
|
7.2 |
Če se volumen naprave, ki se uporablja, razlikuje od volumna Scheibler-Dietrichove naprave, je treba ustrezno prilagoditi količino dela vzorca in kontrolne snovi ter izračun rezultata.
|
P. DOLOČANJE CELOTNEGA FOSFORJA
FOTOMETRIČNA METODA
1. Namen in področje uporabe
Ta metoda omogoča določanje celotne vsebnosti fosforja v krmi. Zlasti primerna je za analizo proizvodov z nizko vsebnostjo fosforja. V nekaterih primerih (pri proizvodih, ki vsebujejo veliko fosforja) se lahko uporabi gravimetrična metoda.
2. Načelo
Vzorec se mineralizira s suhim sežigom (pri organski krmi) ali z raztapljanjem s kislino (pri mineralnih mešanicah in tekoči krmi) ter prenese v kislo raztopino. Raztopini se doda molibdovanadatni reagent. Optična gostota rumene raztopine, ki pri tem nastane, se meri s spektrofotometrom pri 430 nm.
3. Reagenti
|
3.1 |
Kalcijev karbonat |
|
3.2 |
Klorovodikova kislina, ρ20 = 1,10 g/ml (približno 6 mol/l) |
|
3.3 |
Dušikova kislina, ρ20 = 1,045 g/ml |
|
3.4 |
Dušikova kislina, ρ20 = 1,38 do 1,42 g/ml |
|
3.5 |
Žveplova kislina, ρ20 = 1,84 g/ml |
|
3.6 |
Molibdovanadatni reagent: v litrski merilni bučki se zmeša 200 ml raztopine amonijevega heptamolibdata (3.6.1), 200 ml raztopine amonijevega monovanadata (3.6.2) in 134 ml dušikove kisline (3.4). Dopolni se z vodo do oznake. |
|
3.6.1 |
Raztopina amonijevega heptamolibdata: v vroči vodi se raztopi 100 g amonijevega heptamolibdata ((NH4) 6Mo7O24×4H2O). Doda se 10 ml amonijaka (gostota 0,91 g/ml) in dopolni z vodo do 1 litra. |
|
3.6.2 |
Raztopina amonijevega monovanadata: v 400 ml vroče vode se raztopi 2,35 g amonijevega monovanadata (NH4VO3). Med neprestanim mešanjem se počasi doda 20 ml razredčene dušikove kisline (7 ml HNO3 (3.4) + 13 ml H2O) in dopolni z vodo do 1 litra. |
|
3.7 |
Standardna raztopina 1 mg fosforja na ml: v vodi se raztopi 4,387 g kalijevega dihidrogen fosfata (KH2PO4). Dopolni se z vodo do 1 litra. |
4. Oprema
|
4.1 |
Žarilni lončki iz kremena, porcelana ali platine |
|
4.2 |
Električna žarilna peč s termostatom, nastavljenim na 550 oC |
|
4.3 |
250-mililitrska Kjeldahlova bučka |
|
4.4 |
Merilne bučke in precizijske pipete |
|
4.5 |
Spektrofotometer |
|
4.6 |
Epruvete premera približno 16 mm, z brušenimi zamaški premera 14,5 mm, volumna 25–30 ml |
5. Postopek
5.1 Priprava raztopine
Glede na naravo vzorca se raztopina pripravi, kakor je navedeno v točki 5.1.1 ali 5.1.2.
5.1.1
1 g vzorca ali več se natehta na 1 mg natančno. Vzorec se prenese v Kjeldahlovo bučko, doda se 20 ml žveplove kisline (3.5), pretrese se, da se vzorec popolnoma prepoji s kislino in da se ne sprijema sten bučke, nato se segreje in pusti vreti 10 minut. Pusti se, da se nekoliko ohladi, dodata se 2 ml dušikove kisline (3.4), zmerno se segreje, pusti se, da se nekoliko ohladi, doda se še nekaj dušikove kisline (3.4) in ponovno segreje do vretja. Postopek se ponavlja do nastanka brezbarvne raztopine. Ohladi se, doda nekaj vode, tekočina se prelije v 500-mililitrsko merilno bučko, Kjeldahlova bučka pa se spere z vročo vodo. Pusti se, da se ohladi, dopolni se z vodo do oznake, homogenizira in filtrira.
5.1.2
V žarilni lonček se natehta približno 2,5 g vzorca na 1 mg natančno. Doda se 1 g kalcijevega karbonata (3.1) in meša, da se snovi popolnoma premešata. Žari se v pečici pri 550 oC, da nastane bel ali siv pepel (majhna količina oglja ni problematična). Pepel se prenese v 250-mililitrsko čašo. Doda se 20 ml vode, nato pa se dodaja klorovodikova kislina (3.2), dokler ne prenehajo izhajati mehurčki. Doda se nadaljnjih 10 ml klorovodikove kisline (3.2). Čaša se postavi na peščeno kopel in pusti uparevati do suhega, da kremen postane netopen. Ostanek se raztopi v 10 ml dušikove kisline (3.3) in se na peščeni kopeli ali vroči plošči pusti vreti 5 minut, raztopina pa ne sme upariti v celoti. Tekočina se prelije v 500-mililitrsko merilno bučko, čaša pa se večkrat spere z vročo vodo. Pusti se, da se ohladi, dopolni se z vodo do oznake, homogenizira in filtrira.
5.2 Nastanek barve in merjenje optične gostote
Alikvot filtrata iz točke 5.1.1 ali 5.1.2 se razredči do koncentracije fosforja največ 40 μg/ml. 10 ml te raztopine se prenese v epruveto (4.6) in doda 10 ml molibdovanadatnega reagenta (3.6). Homogenizira se in pusti stati najmanj 10 minut pri 20 oC. Izmeri se optična gostota s spektrofotometrom pri 430 nm raztopine, ki se dobi z dodajanjem 10 ml molibdovanadatnega reagenta (3.6) v 10 ml vode.
5.3 Umeritvena krivulja
Iz standardne raztopine (3.7) se pripravijo raztopine, ki vsebujejo 5, 10, 20, 30 in 40 μg fosforja na ml. V 10 ml vsake izmed teh raztopin se doda 10 ml molibdovanadatnega reagenta (3.6). Homogenizira se in pusti stati najmanj 10 minut pri 20 oC. Izmeri se optična gostota, kakor je navedeno v točki 5.2. Umeritvena krivulja se pripravi tako, da se v diagram vnesejo izmerjene optične gostote ustreznih količin fosforja. Za koncentracije 0–40 μg/ml bo krivulja linearna.
6. Izračun rezultatov
Količina fosforja v preskusnem vzorcu se določi iz umeritvene krivulje.
Rezultat se izrazi kot masni delež vzorca.
Ponovljivost
Razlika med rezultatoma dveh vzporednih določanj, izvedenih na istem vzorcu, ne presega:
|
— |
3 % višjega rezultata, če je vsebnost fosforja nižja od 5 %, |
|
— |
0,15 % absolutne vrednosti, če je vsebnost fosforja 5 % ali več. |
Q. DOLOČANJE KLORA IZ KLORIDOV
1. Namen in področje uporabe
Ta metoda omogoča določanja količine klora v kloridih, topnih v vodi, ki so ponavadi izraženi kot natrijev klorid. Uporablja se za vso krmo.
2. Načelo
Kloridi se raztopijo v vodi. Če proizvod vsebuje organske snovi, se zbistri. Raztopina se rahlo nakisa z dušikovo kislino in kloridi se oborijo v obliki srebrovega klorida z raztopino srebrovega nitrata. Presežek srebrovega nitrata se titrira z raztopino amonijevega tiocianata po Volhardovi metodi.
3. Reagenti
|
3.1 |
Raztopina amonijevega tiocianata, 0,1 mol/liter |
|
3.2 |
Raztopina srebrovega nitrata, 0,1 mol/l |
|
3.3 |
Nasičena raztopina amonij-železovega sulfata (NH4)Fe(SO4)2 |
|
3.4 |
Dušikova kislina, gostota: 1,38 g/ml |
|
3.5 |
Dietileter |
|
3.6 |
Aceton |
|
3.7 |
Raztopina Carrez I: 21,9 g cinkovega acetata Zn (CH3COO)2·2H2O in 3 g ledoceta se raztopijo v vodi. Dopolni se z vodo do 100 ml. |
|
3.8 |
Raztopina Carrez II: 10,6 g kalijevega ferocianida K4Fe(CN)6·3H2O se raztopi v vodi. Dopolni se z vodo do 100 ml. |
|
3.9 |
Aktivno oglje, ki ne vsebuje kloridov in jih ne absorbira. |
4. Oprema
Mešalnik: približno 35 do 40 obr./min.
5. Postopek
5.1 Priprava raztopine
Glede na naravo vzorca se raztopina pripravi, kakor je navedeno v točki 5.1.1, 5.1.2 ali 5.1.3.
Hkrati se opravi slepi preskus brez vzorca, ki se analizira.
5.1.1
Največ 10 g vzorca, ki vsebuje največ 3 g klora v obliki kloridov, se natehta na 1 mg natančno. S 400 ml vode se prenese v 500-mililitrsko merilno bučko pri približno 20 oC. V mešalniku se meša 30 minut, dopolni do oznake, homogenizira in filtrira.
5.1.2
Približno 5 g vzorca se natehta na 1 mg natančno in se skupaj z 1 g aktivnega oglja prenese v 500-mililitrsko merilno bučko. Doda se 400 ml vode s temperaturo približno 20 oC in 5 ml raztopine Carrez I (3.7), meša se 30 sekund in nato doda 5 ml raztopine Carrez II (3.8). V mešalniku se meša 30 minut, dopolni do oznake, homogenizira in filtrira.
5.1.3
Raztopina se pripravi, kakor je opisano v točki 5.1.2, vendar se ne filtrira. Dekantira se (po potrebi centrifugira), 100 ml supernatanta pa se odstrani in prenese v 200-mililitrsko merilno bučko. Zmeša se z acetonom (3.6) in z njim dopolni do oznake, homogenizira in filtrira.
5.2 Titracija
S pipeto se v erlenmajerico prenese 25–100 ml filtrata (glede na pričakovano vsebnost klora), ki nastane pri postopku iz točke 5.1.1, 5.1.2 ali 5.1.3. Alikvot ne sme vsebovati več kot 150 mg klora (Cl). Po potrebi se z vodo razredči na najmanj 50 ml, doda se 5 ml dušikove kisline (3.4), 20 ml nasičene raztopine amonij-železovega sulfata (3.3) in 2 kapljici raztopine amonijevega tiocianata (3.1), ki se doda iz birete, napolnjene do oznake nič. Z bireto se doda raztopina srebrovega nitrata (3.2), tako da nastane 5 ml presežka. Doda se 5 ml dietiletra (3.5) in dobro se pretrese, da oborina koagulira. Presežek srebrovega nitrata se titrira z raztopino amonijevega tiocianata (3.1), dokler ne nastane rdečkastorjavi odtenek, ki je obstojen 1 minuto.
6. Izračun rezultatov
Količina klora (X), izražena kot masni delež natrijevega klorida, se izračuna po naslednji formuli:
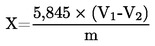
pri čemer je:
|
V1 |
= |
ml dodane raztopine srebrovega nitrata 0,1 mol/l; |
|
V2 |
= |
ml za titracijo uporabljene raztopine amonijevega tiocianata 0,1 mol/l; |
|
m |
= |
masa vzorca. |
Če je pri slepem preskusu uporabljen srebrov nitrat 0,1 mol/l, se ta vrednost odšteje od volumna (V1 – V2).
7. Opombe
|
7.1 |
Titracija se lahko izvede tudi s potenciometrom. |
|
7.2 |
Proizvodi, ki vsebujejo veliko olj in maščob, se najprej razmastijo z dietiletrom ali petroletrom. |
|
7.3 |
Pri ribji moki se titracija lahko izvede z Mohrovo metodo. |
(1) Za sušenje žita, moke, drobljencev in zdroba mora imeti sušilnik takšno toplotno kapaciteto, da se bo, ko je predhodno nastavljen na 131 oC, vrnil na to temperaturo v manj kot 45 minutah, potem ko je bilo vanj za sušenje hkrati postavljeno največje možno število vzorcev. Ventilacija mora biti takšna, da se, ko se v sušilniku dve uri suši največje možno število vzorcev pšenice, rezultati razlikujejo za manj kot 0,15 % od tistih, ki so bili sušeni 4 ure.
(2) Kadar je treba kakovost olja ali maščob naknadno še preskušati, se delci plovca zamenjajo s steklenimi kroglicami.
PRILOGA IV
ANALITSKE METODE ZA NADZOR RAVNI DOVOLJENIH KRMNIH DODATKOV
A. DOLOČANJE VITAMINA A
1. Namen in področje uporabe
Ta metoda omogoča določanje ravni vitamina A (retinola) v krmi in premiksih. Vitamin A vključuje celoten trans-retinil alkohol in njegove cis izomere, ki se določajo s to metodo. Vsebnost vitamina A se izrazi v mednarodnih enotah (IU) na kg. Ena IU ustreza aktivnosti 0,300 μg celotnega trans-vitamin A alkohola ali 0,344 μg acetata celotnega trans-vitamina A ali 0,550 μg palmitata celotnega trans-vitamina A.
Meja kvantifikacije je 2 000 IU vitamina A/kg.
2. Načelo
Vzorec se hidrolizira z raztopino etanolnega kalijevega hidroksida, vitamin A pa se ekstrahira v petroleter. Topilo se odstrani z uparevanjem, ostanek pa raztopi v metanolu in po potrebi razredči do zahtevane koncentracije. Vsebnost vitamina A se določi s plinsko kromatografijo visoke ločljivosti z reverzno fazo (RP–HPLC) z uporabo UV- ali fluorescenčnega detektorja. Kromatografski parametri se izberejo tako, da se celoten trans-vitamin A alkohol in njegovi cis izomeri ne ločijo.
3. Reagenti
|
3.1 |
Etanol, σ = 96 % |
|
3.2 |
Petroleter, vrelišče 40–60 oC |
|
3.3 |
Metanol |
|
3.4 |
Raztopina kalijevega hidroksida, c = 50 g/100 ml |
|
3.5 |
Raztopina natrijevega askorbata, c = 10 g/100 ml (glej opombo 7.7) |
|
3.6 |
Natrijev sulfid, Na2S· x H2O (x = 7–9) |
|
3.6.1 |
Raztopina natrijevega sulfida, c = 0,5 mol/l v glicerolu, ß = 120 g/l (za x = 9) (glej opombo 7.8) |
|
3.7 |
Raztopina fenolftaleina, c = 2 g/100 ml v etanolu (3.1) |
|
3.8 |
2-propanol |
|
3.9 |
Mobilna faza za HPLC: mešanica metanola (3,3) in vode, npr. 980 + 20 (v + v). Točno razmerje bo določeno glede na značilnosti uporabljene kolone. |
|
3.10 |
Dušik, brez kisika |
|
3.11 |
Acetat celotnega trans-vitamina A, posebne čistosti, certificirane aktivnosti, npr. 2,80 × 106 IU/g |
|
3.11.1 |
Osnovna raztopina acetata celotnega trans-vitamina A: 50 mg acetata vitamina A (3.11) se natehta na 0,1 mg natančno in prenese v 100-mililitrsko merilno bučko. Raztopi se v 2-propanolu (3.8) in dopolni do oznake z istim topilom. Nominalna koncentracija te raztopine je 1 400 IU vitamina A na ml. Točno vsebnost je treba določiti v skladu s točko 5.6.3.1. |
|
3.12 |
Palmitat celotnega trans-vitamina A, posebne čistosti, certificirane aktivnosti, npr. 1,80 × 106 IU/g |
|
3.12.1 |
Osnovna raztopina palmitata celotnega trans-vitamina A: 80 mg palmitata vitamina A (3.12) se natehta na 0,1 mg natančno in prenese v 100-mililitrsko merilno bučko. Raztopi se v 2-propanolu (3.8) in dopolni do oznake z istim topilom. Nominalna koncentracija te raztopine je 1 400 IU vitamina A na ml. Točno vsebnost je treba določiti v skladu s točko 5.6.3.2. |
|
3.13 |
2,6-Di-tert-butil-4-metilfenol (BHT) (glej opombo 7.5) |
4. Oprema
|
4.1 |
Rotacijski vakuumski uparjalnik |
|
4.2 |
Temna steklovina |
|
4.2.1 |
Bučke z ravnim dnom ali erlenmajerice, 500-mililitrske, z brušenim vratom |
|
4.2.2 |
Merilne bučke z zamaški iz brušenega stekla, z ozkim vratom, 10, 25, 100 in 500-mililitrske |
|
4.2.3 |
Liji ločniki, konusni, 1 000-mililitrski, z zamaški iz brušenega stekla |
|
4.2.4 |
Hruškaste bučke, 250-mililitrske, z zamaški iz brušenega stekla |
|
4.3 |
Allihnov kondenzator, z dolžino obroča 300 mm s spojem iz brušenega stekla in z nastavkom za dovodno cev plina |
|
4.4 |
Naguban filtrirni papir za ločevanje faz, premera 185 mm (npr. Schleicher & Schuell 597 HY 1/2) |
|
4.5 |
Oprema HPLC s sistemom vbrizgavanja |
|
4.5.1 |
Kolona za tekočinsko kromatografijo, 250 mm x 4 mm, C18, polnitev 5 ali 10 μm ali enakovredna (kriterij za zmogljivost: samo en vrh za vse izomere retinola pod pogoji kromatografije HPLC) |
|
4.5.2 |
UV- ali fluorescenčni detektor s spremenljivo nastavitvijo valovne dolžine |
|
4.6 |
Spektrofotometer z 10 mm kvarcnimi kivetami |
|
4.7 |
Vodna kopel z magnetnim mešalnikom |
|
4.8 |
Naprava za ekstrakcijo (glej sliko 1), sestavljena iz: |
|
4.8.1 |
steklenega valja z volumnom l litra, vratom iz brušenega stekla in zamaškom; |
|
4.8.2 |
vložka iz brušenega stekla s stransko ročico in nastavljivo cevjo, ki gre skozi središče. Nastavljiva cev ima spodnji del v obliki črke U in vbrizg na nasprotnem koncu, tako da vrhnja plast tekočine v valju lahko preide v lij ločnik. |
5. Postopek
|
Opomba |
: |
Vitamin A je občutljiv na (UV) svetlobo in oksidacijo. Vsi postopki se izvajajo brez svetlobe (z uporabo temne steklovine ali steklene posode, zaščitene v aluminijasto folijo) in kisika (spiranje z dušikom). Med ekstrakcijo se zrak nad tekočino zamenja z dušikom (previsokemu tlaku se izogne z občasnim popuščanjem zamaška). |
5.1 Priprava vzorca
Vzorec se zdrobi tako, da preide skozi 1 mm sito, pri čemer se je treba izogibati nastanku toplote. Drobljenje se mora izvesti neposredno pred tehtanjem in umiljenjem, drugače lahko pride do izgube vitamina A.
5.2 Umiljenje
Glede na vsebnost vitamina A se natehta 2–25 g vzorca na 1 mg natančno in prenese v 500-mililitrsko bučko z ravnim dnom ali erlenmajerico (4.2.1). Med obračanjem se postopoma dodajo 130 ml etanola (3.1), približno 100 mg BHT (3.13), 2 ml raztopine natrijevega askorbata (3.5) in 2 ml raztopine natrijevega sulfida (3.6). Na bučko se namesti kondenzator (4.3), bučka pa se potopi v vodno kopel z magnetnim mešalnikom (4.7). Segreje se do vretja in 5 minut pusti pod kondenzatorjem povratnega toka. Nato se skozi kondenzator doda 25 ml raztopine kalijevega hidroksida (3.4) in pusti pod kondenzatorjem (4.3) povratnega toka nadaljnjih 25 minut, z mešanjem pod rahlim pretokom dušika. Nato se kondenzator spere s približno 20 ml vode, vsebina bučke pa ohladi na sobno temperaturo.
5.3 Ekstrakcija
Z dekantiranjem se raztopina za umiljenje kvantitativno prenese v 1 000-mililitrski lij ločnik (4.2.3) ali napravo za ekstrakcijo (4.8), tako da se spere s skupno 250 ml vode. Nato se bučka za umiljenje spere s 25 ml etanola (3.1) in 100 ml petroletra (3.2), raztopine za spiranje pa se prenesejo v lij ločnik ali napravo za ekstrakcijo. Razmerje vode in etanola v združenih raztopinah mora biti približno 2:1. 2 minuti se močno stresa in nato 2 minuti pusti, da se umiri.
5.3.1
Ko so plasti ločene (glej opombo 7.3), se plast petroletra prenese v drug lij ločnik (4.2.3). Ekstrakcija se ponovi dvakrat s 100 ml petroletra (3.2) in dvakrat s 50 ml petroletra (3.2).
Združene ekstrakte v liju ločniku se med rahlim pretresanjem (da se prepreči nastanek emulzij) dvakrat spere s po 100 ml vode in nato s ponavljajočim se stresanjem ponovno s po 100 ml vode, dokler voda pri dodajanju raztopine fenolftaleina (3.7) ne ostane brezbarvna (navadno zadošča štirikratno spiranje). Sprani ekstrakt se filtrira skozi suh naguban filter za ločevanje faz (4.4) v 500-mililitrsko merilno bučko (4.2.2), da se odstrani suspendirana voda. Lij ločnik in filter se spereta s 50 ml petroletra (3.2), dopolni se do oznake s petroletrom (3.2) in dobro premeša.
5.3.2
Ko se plasti ločijo (glej opombo 7.3), se zamašek steklenega valja (4.8.1) zamenja z vložkom iz brušenega stekla (4.8.2), spodnji del nastavljive cevi pa se namesti v obliki črke U tik nad raven vmesnika. S tlakom, ki ga tvori dušik v stranski ročici, se zgornja plast petroletra prenese v 1 000-mililitrski lij ločnik (4.2.3). V stekleni valj se doda 100 ml petroletra (3.2), zamaši in dobro pretrese. Počaka se, da se plasti ločijo, zgornja plast pa se prenese v lij ločnik tako kot prej. Postopek ekstrakcije se ponovi s 100 ml petroletra (3.2), nato dvakrat s po 50 ml petroletra (3.2), plasti petroletra pa se dodajo v lij ločnik.
Združeni ekstrakti petroletra se sperejo, kakor je opisano v točki 5.3.1, nato pa se nadaljuje, kakor je navedeno v navedeni točki.
5.4 Priprava raztopine vzorca za HPLC
Alikvot raztopine petroletra (iz 5.3.1 ali 5.3.2) se odpipetira v 250-mililitrsko hruškasto bučko (4.2.4). Topilo se upari skoraj do suhega v rotacijskem uparjalniku (4.1) pri znižanem tlaku in temperaturi kopeli do 40 oC. Atmosferski tlak se vzpostavi z dovajanjem dušika (3.10), bučka pa se odstrani iz rotacijskega uparjalnika. Preostalo topilo se odstrani v toku dušika (3.10), ostanek pa se takoj raztopi v znanem volumnu (10–100 ml) metanola (3.3) (koncentracija vitamina A mora biti 5–30 IU/ml).
5.5 Določanje s HPLC
Vitamin A se loči na koloni C18 z reverzno fazo (4.5.1), koncentracija pa se izmeri z UV-detektorjem (325 nm) ali fluorescenčnim detektorjem (ekscitacija: 325 nm, emisija: 475 nm) (4.5.2).
Vbrizga se alikvot (npr. 20 μl) raztopine metanola, ki nastane pri točki 5.4, in eluira z mobilno fazo (3.9). Izračuna se srednja vrednost višine (površine) vrhov za več vbrizgov iste raztopine vzorca in srednje vrednosti višin (površin) vrhov za več vbrizgov raztopin za umerjanje (5.6.2).
Naslednji pogoji se lahko uporabljajo kot smernica; lahko se uporabljajo tudi drugi pogoji, če zagotavljajo enakovredne rezultate.
|
Kolona za tekočinsko kromatografijo (4.5.1): |
250 mm × 4 mm, C18, polnitev 5 ali 10 μm ali enakovredna |
|
Mobilna faza (3.9): |
Mešanica metanol (3.3) in vode, npr. 980 + 20 (v + v) |
|
Hitrost pretoka: |
1–2 ml/min |
|
Detektor (4.5.2): |
UV-detektor (325 nm) ali fluorescenčni detektor (ekscitacija: 325 nm/emisija: 475 nm) |
5.6 Umerjanje
5.6.1
20 ml osnovne raztopine acetata vitamina A (3.11.1) ali 20 ml osnovne raztopine palmitata vitamina A (3.12.1) se odpipetira v 500-mililitrsko bučko z ravnim dnom ali erlenmajerico (4.2.1) ter hidrolizira, kakor je navedeno v točki 5.2, vendar brez dodatka BHT. Nato se ekstrahira s petroletrom (3.2) v skladu s točko 5.3 in dopolni do 500 ml s petroletrom (3.2). 100 ml tega ekstrakta se upari v rotacijskem uparjalniku (glej 5.4) skoraj do suhega, odstrani se preostalo topilo s tokom dušika (3.10), ostanek pa se ponovno raztopi v 10,0 ml metanola (3.3). Nominalna koncentracija te raztopine je 560 IU vitamina A na ml. Točno vsebnost je treba določiti v skladu s točko 5.6.3.3. Delovno standardno raztopino je treba sveže pripraviti pred uporabo.
2,0 ml te delovne standardne raztopine se odpipetira v 20-mililitrsko merilno bučko, dopolni se z metanolom (3.3) do oznake in premeša. Nominalna koncentracija te razredčene delovne standardne raztopine je 56 IU vitamina A na ml.
5.6.2
1,0, 2,0, 5,0 in 10,0 ml razredčene delovne standardne raztopine se prenese v serijo 20-mililitrskih merilnih bučk, dopolni se z metanolom (3.3) do oznake in premeša. Nominalne koncentracije teh raztopin so 2,8, 5,6, 14,0 in 28,0 IU vitamina A na ml.
Večkrat se vbrizga 20 μl vsake od raztopin za umerjanje in določijo se srednje vrednosti višin (površin) vrhov. Iz srednjih vrednosti višin (površin) vrhov se pripravi umeritvena krivulja ob upoštevanju rezultatov UV-kontrole (5.6.3.3).
5.6.3
5.6.3.1
2,0 ml osnovne raztopine acetata vitamina A (3.11.1) se odpipetira v 50 ml merilno bučko (4.2.2) in dopolni z 2-propanolom (3.8) do oznake. Nominalna koncentracija te raztopine je 56 IU vitamina A na ml. 3,0 ml te razredčene raztopine acetata vitamina A se odpipetira v 25-mililitrsko merilno bučko in dopolni z 2-propanolom (3.8) do oznake. Nominalna koncentracija te raztopine je 6,72 IU vitamina A na ml. Izmeri se UV-spekter te raztopine proti 2-propanolu (3.8) v spektrofotometru (4.6) med 300 in 400 nm. Maksimalna ekstinkcija mora biti med 325 in 327 nm.
Izračun vsebnosti vitamina A:
IU vitamina A/ml = E326 × 19,0
( za acetat vitamina A = 1 530 pri 326 nm v 2-propanolu)
za acetat vitamina A = 1 530 pri 326 nm v 2-propanolu)
5.6.3.2
2,0 ml osnovne raztopine palmitata vitamina A (3.12.1) se odpipetira v 50-mililitrsko merilno bučko (4.2.2) in dopolni z 2-propanolom (3.8) do oznake . Nominalna koncentracija te raztopine je 56 IU vitamina A na ml. 3,0 ml te razredčene raztopine palmitata vitamina A se odpipetira v 25-mililitrsko merilno bučko in dopolni z 2-propanolom (3.8) do oznake. Nominalna koncentracija te raztopine je 6,72 IU vitamina A na ml. Izmeri se UV-spekter te raztopine proti 2-propanolu (3.8) v spektrofotometru (4.6) med 300 in 400 nm. Maksimalna ekstinkcija mora biti med 325 in 327 nm.
Izračun vsebnosti vitamina A:
IU vitamina A/ml = E326 × 19,0
( za palmitat vitamina A = 957 pri 326 nm v 2-propanolu)
za palmitat vitamina A = 957 pri 326 nm v 2-propanolu)
5.6.3.3
3,0 ml nerazredčene delovne standardne raztopine vitamina A, pripravljene v skladu s točko 5.6.1, se odpipetira v 50-mililitrsko merilno bučko (4.2.2) in dopolni z 2-propanolom (3.8) do oznake. 5,0 ml te raztopine se odpipetira v 25-mililitrsko merilno bučko in dopolni z 2-propanolom (3.8) do oznake . Nominalna koncentracija te raztopine je 6,72 IU vitamina A na ml. Izmeri se UV-spekter te raztopine proti 2-propanolu (3.8) v spektrofotometru (4.6) med 300 in 400 nm. Maksimalna ekstinkcija mora biti med 325 in 327 nm.
Izračun vsebnosti vitamina A:
IU vitamina A/ml = E325 × 18,3
( za vitamin A alkohol = 1 821 pri 325 nm v 2-propanolu)
za vitamin A alkohol = 1 821 pri 325 nm v 2-propanolu)
6. Izračun rezultatov
Iz srednje vrednosti višin (površin) vrhov vitamina A iz raztopine vzorca se s pomočjo umeritvene krivulje (5.6.2) določi koncentracija raztopine vzorca v IU/ml.
Vsebnost vitamina A (w) v vzorcu, izražena v IU/kg, se izračuna po naslednji formuli:
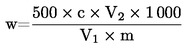 [IU/kg]
[IU/kg]
pri čemer je:
|
c |
= |
koncentracija vitamina A (5.4) v IU/ml v raztopini vzorca; |
|
V1 |
= |
volumen raztopine vzorca (5.4) v ml; |
|
V2 |
= |
volumen alikvota, uporabljenega pri točki 5.4, v ml; |
|
m |
= |
masa preskusnega vzorca v gramih. |
7. Opombe
|
7.1 |
Pri vzorcih z nizko koncentracijo vitamina A se ekstrakte petroletra iz dveh umilitvenih šarž (natehtana količina: 25 g) lahko združi v eno raztopino vzorca za določanje s HPLC. |
|
7.2 |
Masa vzorca za analizo ne vsebuje več kot 2 g maščobe. |
|
7.3 |
Če se fazi ne ločita, se doda približno 10 ml etanola (3.1) za razbitje emulzije. |
|
7.4 |
Pri ribjem olju in drugih čistih maščobah se čas umiljenja podaljša na 45–60 minut. |
|
7.5 |
Namesto BHT se lahko uporablja hidrokinon. |
|
7.6 |
Z običajno fazno kolono je možno ločiti izomere retinola. Vendar je pri tem treba za izračune zabeležiti vse višine (površine) vrhov vseh cis in trans izomerov. |
|
7.7 |
Namesto raztopine natrijevega askorbata se lahko uporabi približno 150 mg askorbinske kisline. |
|
7.8 |
Namesto raztopine natrijevega sulfida se lahko uporabi približno 50 mg EDTA. |
|
7.9 |
Pri analizi vitamina A v mlečnih nadomestkih je treba paziti:
Da se preveri, ali uporabljena analitska metoda zagotavlja zanesljive rezultate glede te specifične matrice (mlečni nadomestek), je treba na dodatnem preskusnem vzorcu izvesti preskus izkoristka. Če je izkoristek nižji od 80 %, se pri analitskem rezultatu uporabi popravek za izkoristek. |
8. Ponovljivost
Razlika med rezultatoma dveh vzporednih določanj, izvedenih na istem vzorcu, ne sme presegati 15 % najvišjega rezultata.
9. Rezultati medlaboratorijske študije (1)
|
|
Premiks |
Krma in premiksi |
Mineralni koncentrat |
Beljakovinska krma |
Krma za prašiče |
|
L |
13 |
12 |
13 |
12 |
13 |
|
n |
48 |
45 |
47 |
46 |
49 |
|
Srednja vrednost [IU/kg] |
17,02 x 106 |
1,21 x 106 |
537 100 |
151 800 |
18 070 |
|
Sr [IU/kg] |
0,51 x 106 |
0,039 x 106 |
22 080 |
12 280 |
682 |
|
r [IU/kg] |
1,43 x 106 |
0,109 x 106 |
61 824 |
34 384 |
1 910 |
|
CVr [ %] |
3,0 |
3,5 |
4,1 |
8,1 |
3,8 |
|
SR [IU/kg] |
1,36 x 106 |
0,069 x 106 |
46 300 |
23 060 |
3 614 |
|
R [IU/kg] |
3,81 x 106 |
0,193 x 106 |
129 640 |
64 568 |
10 119 |
|
CVR [ %] |
8,0 |
6,2 |
8,6 |
15 |
20 |
|
L |
: |
število laboratorijev; |
|
n |
: |
število posameznih vrednosti; |
|
Sr |
: |
standardni odmik ponovljivosti; |
|
SR |
: |
standardni odmik obnovljivosti; |
|
r |
: |
ponovljivost; |
|
R |
: |
obnovljivost; |
|
CVr |
: |
koeficient variacije ponovljivosti; |
|
CVR |
: |
koeficient variacije obnovljivosti; |
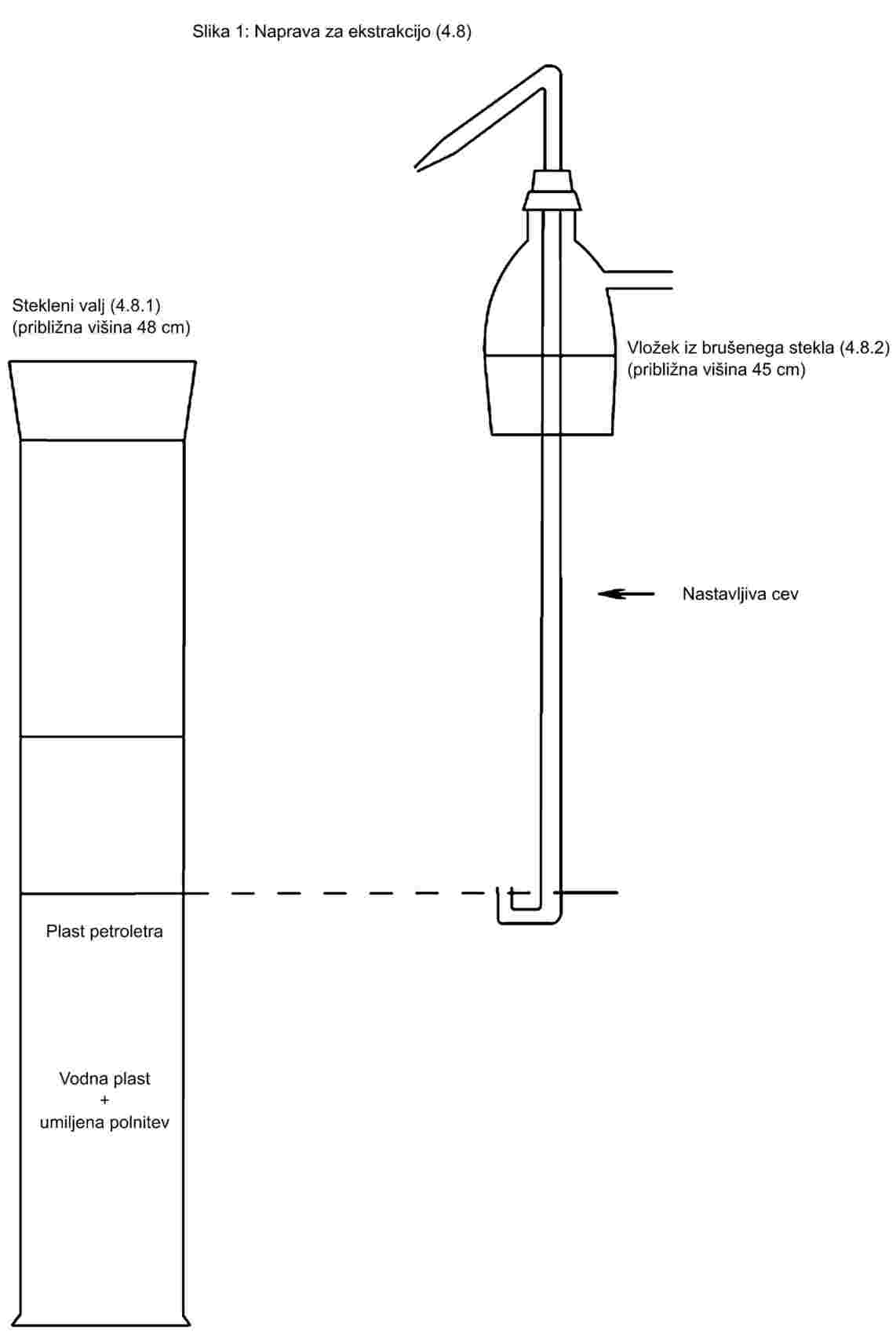
B. DOLOČANJE VITAMINA E
1. Namen in področje uporabe
Ta metoda omogoča določanje ravni vitamina E v krmi in premiksih. Vsebnost vitamina E se izrazi v mg acetata DL-α-tokoferola na kg. 1 mg acetata DL-α-tokoferola ustreza 0,91 mg DL-α-tokoferola (vitamina E).
Meja kvantifikacije je 2 mg vitamina E/kg. Ta meja kvantifikacije se lahko doseže le s fluorescenčnim detektorjem. Meja kvantifikacije za UV-detektor je 10 mg/kg.
2. Načelo
Vzorec se hidrolizira z raztopino etanolnega kalijevega hidroksida, vitamin E pa se ekstrahira v petroleter. Topilo se odstrani z uparevanjem, ostanek pa raztopi v metanolu in po potrebi razredči do zahtevane koncentracije. Vsebnost vitamina E se določi s tekočinsko kromatografijo visoke ločljivosti z reverzno fazo (RP–HPLC) z uporabo UV- ali fluorescenčnega detektorja.
3. Reagenti
|
3.1 |
Etanol, σ = 96 % |
|
3.2 |
Petroleter, vrelišče 40–60 oC |
|
3.3 |
Metanol |
|
3.4 |
Raztopina kalijevega hidroksida, c = 50 g/100 ml |
|
3.5 |
Raztopina natrijevega askorbata, c = 10 g/100 ml (glej opombo 7.7) |
|
3.6 |
Natrijev sulfid, Na2S· x H2O (x = 7–9) |
|
3.6.1 |
Raztopina natrijevega sulfida, c = 0,5 mol/l v glicerolu, β = 120 g/l (za x = 9) (glej opombo 7.8) |
|
3.7 |
Raztopina fenolftaleina, c = 2 g/100 ml v etanolu (3.1) |
|
3.8 |
Mobilna faza za HPLC: mešanica metanola (3.3) in vode, npr. 980 + 20 (v + v). Točno razmerje bo določeno glede na značilnosti uporabljene kolone. |
|
3.9 |
Dušik, brez kisika |
|
3.10 |
Acetat DL-α-tokoferola, posebne čistosti, certificirane aktivnosti |
|
3.10.1 |
Osnovna raztopina acetata DL-α-tokoferola: 100 mg acetata DL-α-tokoferola (3.10) se natehta na 0,1 mg natančno in prenese v 100-mililitrsko merilno bučko. Raztopi se v etanolu (3.1) in dopolni z istim topilom do oznake. 1 ml te raztopine vsebuje 1 mg acetata DL-α-tokoferola. (Za UV-kontrolo glej točko 5.6.1.3, za stabilizacijo pa opombo 7.4.) |
|
3.11 |
DL-α-tokoferol, posebne čistosti, certificirane aktivnosti |
|
3.11.1 |
Osnovna raztopina acetata DL-α-tokoferola: 100 mg DL-α-tokoferola (3.10) se natehta na 0,1 mg natančno in prenese v 100-mililitrsko merilno bučko. Raztopi se v etanolu (3.1) in dopolni z istim topilom do oznake. 1 ml te raztopine vsebuje 1 mg DL-α-tokoferola. (Za UV-kontrolo glej točko 5.6.2.3, za stabilizacijo pa opombo 7.4.) |
|
3.12 |
2,6-Di-tert-butil-4-metilfenol (BHT) (glej opombo 7.5) |
4. Oprema
|
4.1 |
Rotacijski uparjalnik |
|
4.2 |
Temna steklovina |
|
4.2.1 |
Bučke z ravnim dnom ali erlenmajerice, 500-mililitrske, z brušenim vratom |
|
4.2.2 |
Merilne bučke z zamaški iz brušenega stekla, z ozkim vratom, 10-, 25-, 100- in 500-mililitrske |
|
4.2.3 |
Liji ločniki, konusni, 1 000-mililitrski, z zamaški iz brušenega stekla |
|
4.2.4 |
Hruškaste bučke, 250-mililitrske, z zamaški iz brušenega stekla |
|
4.3 |
Allihnov kondenzator, dolžina obroča 300 mm, s spojem iz brušenega stekla in nastavkom za dovodno cev plina |
|
4.4 |
Naguban filtrirni papir za ločevanje faz, premera 185 mm (npr. Schleicher & Schuell 597 HY 1/2) |
|
4.5 |
Oprema za kromatografijo HPLC s sistemom vbrizgavanja |
|
4.5.1 |
Kolona za tekočinsko kromatografijo, 250 mm x 4 mm C18, polnitev 5 ali 10 μm ali enakovredna |
|
4.5.2 |
Fluorescenčni ali UV-detektor, s spremenljivo nastavitvijo valovne dolžine |
|
4.6 |
Spektrofotometer z 10 mm kvarcnimi kivetami |
|
4.7 |
Vodna kopel z magnetnim mešalnikom |
|
4.8 |
Naprava za ekstrakcijo (glej sliko 1), sestavljena iz: |
|
4.8.1 |
steklenega valja z volumnom l litra, vratom iz brušenega stekla in zamaškom; |
|
4.8.2 |
vložka iz brušenega stekla s stransko ročico in nastavljivo cevjo, ki gre skozi središče. Nastavljiva cev ima spodnji del v obliki črke U in vbrizg na nasprotnem koncu, tako da vrhnja plast tekočine v valju lahko preide v lij ločnik. |
5. Postopek
|
Opomba |
: |
Vitamin E je občutljiv na (UV) svetlobo in oksidacijo. Vsi postopki se izvajajo brez svetlobe (z uporabo temne steklovine ali steklene posode, zaščitene v aluminijasto folijo) in kisika (spiranje z dušikom). Med ekstrakcijo se zrak nad tekočino zamenja z dušikom (previsokemu tlaku se izogne z občasnim rahljanjem zamaška). |
5.1 Priprava vzorca
Vzorec se zdrobi tako, da preide skozi 1 mm sito, pri čemer se je treba izogibati nastanku toplote. Drobljenje se mora izvesti neposredno pred tehtanjem in umiljenjem, drugače lahko pride do izgube vitamina E.
5.2 Umiljenje
Glede na vsebnost vitamina E se natehta 2–25 g vzorca na 0,01 g natančno in prenese v 500-mililitrsko bučko z ravnim dnom ali erlenmajerico (4.2.1). Med obračanjem se postopoma dodajo 130 ml etanola (3.1), približno 100 mg BHT (3.12), 2 ml raztopine natrijevega askorbata (3.5) in 2 ml raztopine natrijevega sulfida (3.6). Na bučko se namesti kondenzator (4.3), bučka pa se potopi v vodno kopel z magnetnim mešalnikom (4.7). Segreje se do vretja in 5 minut pusti pod kondenzatorjem povratnega toka. Nato se skozi kondenzator (4.3) doda 25 ml raztopine kalijevega hidroksida (3.4) in z mešanjem pod rahlim pretokom dušika pusti pod kondenzatorjem povratnega toka nadaljnjih 25 minut. Nato se kondenzator spere s približno 20 ml vode, vsebina bučke pa ohladi na sobno temperaturo.
5.3 Ekstrakcija
Z dekantiranjem se raztopina za umiljenje kvantitativno prenese v 1 000-mililitrski lij ločnik (4.2.3) ali napravo za ekstrakcijo (4.8), tako da se spere s skupno 250 ml vode. Nato se bučka za umiljenje spere s 25 ml etanola (3.1) in 100 ml petroletra (3.2), raztopine za spiranje pa se prenesejo v lij ločnik ali napravo za ekstrakcijo. Razmerje vode in etanola v združenih raztopinah mora biti približno 2:1. 2 minuti se močno stresa in nato 2 minuti pusti, da se umiri.
5.3.1
Ko so plasti ločene (glej opombo 7.3), se plast petroletra prenese v drug lij ločnik (4.2.3). Ekstrakcija se ponovi dvakrat s 100 ml petroletra (3.2) in dvakrat s 50 ml petroletra (3.2).
Združene ekstrakte v liju ločniku se med rahlim pretresanjem (da se prepreči nastanek emulzij) dvakrat spere s po 100 ml vode in nato s ponavljajočim se stresanjem ponovno s po 100 ml vode, dokler voda pri dodajanju raztopine fenolftaleina (3.7) ne ostane brezbarvna (navadno zadošča štirikratno spiranje). Sprani ekstrakt se filtrira skozi suh naguban filter za ločevanje faz (4.4) v 500-mililitrsko merilno bučko (4.2.2), da se odstrani suspendirana voda. Lij ločnik in filter se spereta s 50 ml petroletra (3.2), dopolni se do oznake s petroletrom (3.2) in dobro premeša.
5.3.2
Ko se plasti ločijo (glej opombo 7.3), se zamašek steklenega valja (4.8.1) zamenja z vložkom iz brušenega stekla (4.8.2), spodnji del nastavljive cevi pa se namesti v obliki črke U tik nad raven vmesnika. S tlakom, ki ga tvori dušik v stranski ročici, se zgornja plast petroletra prenese v 1 000-mililitrski lij ločnik (4.2.3). V stekleni valj se doda 100 ml petroletra (3.2), zamaši se in dobro pretrese. Počaka se, da se plasti ločijo, zgornja plast pa se prenese v lij ločnik tako kot prej. Postopek ekstrakcije se ponovi s 100 ml petroletra (3.2), nato dvakrat s po 50 ml petroletra (3.2), plasti petroletra pa se dodajo v lij ločnik.
Združeni ekstrakti petroletra se sperejo, kakor je opisano v točki 5.3.1, nato pa se nadaljuje, kakor je navedeno v navedeni točki.
5.4 Priprava raztopine vzorca za HPLC
Alikvot raztopine petroletra (iz točke 5.3.1 ali 5.3.2) se odpipetira v 250-mililitrsko hruškasto bučko (4.2.4). Topilo se upari skoraj do suhega v rotacijskem uparjalniku (4.1) pri znižanem tlaku in temperaturi kopeli do 40 oC. Atmosferski tlak se vzpostavi z dovajanjem dušika (3.9), bučka pa se odstrani iz rotacijskega uparjalnika. Preostalo topilo se odstrani v toku dušika (3.9), ostanek pa se takoj raztopi v znanem volumnu (10–100 ml) metanola (3.3) (koncentracija DL-α-tokoferola mora biti 5–30 μg/ml).
5.5 Določanje s HPLC
Vitamin E se loči na koloni C18 z reverzno fazo (4.5.1), koncentracija pa se izmeri s fluorescenčnim detektorjem (ekscitacija: 295 nm, emisija: 330 nm) ali UV-detektorjem (292 nm) (4.5.2).
Vbrizga se alikvot (npr. 20 μl) raztopine metanola, ki nastane pri točki 5.4, in eluira se z mobilno fazo (3.8). Izračunajo se srednje vrednosti višin (površin) vrhov za več vbrizgov iste raztopine vzorca in srednje vrednosti višin (površin) vrhov za več vbrizgov raztopin za umerjanje (5.6.2).
Naslednji pogoji se lahko uporabljajo kot smernica; lahko se uporabljajo tudi drugi pogoji, če zagotavljajo enakovredne rezultate.
|
Kolona za tekočinsko kromatografijo (4.5.1): |
250 mm × 4 mm, C18, polnitev 5 ali 10 μm ali enakovredna |
|
Mobilna faza (3.8): |
Mešanica metanola (3.3) in vode, npr. 980 + 20 (v + v). |
|
Hitrost pretoka: |
1–2 ml/min |
|
Detektor (4.5.2): |
Fluorescečni detektor: (ekscitacija: 295 nm/emisija: 330 nm) ali UV-detektor (292 nm) |
5.6 Umerjanje (acetat DL-α-tokoferola ali DL-α-tokoferol)
5.6.1
5.6.1.1
25 ml osnovne raztopine acetata DL-α-tokoferola (3.10.1) se odpipetira v 500-mililitrsko bučko z ravnim dnom ali erlenmajerico (4.2.1) in hidrolizira, kakor je opisano v točki 5.2. Nato se ekstrahira s petroletrom (3.2) v skladu s točko 5.3 in dopolni do 500 ml s petroletrom. 25 ml tega ekstrakta se upari v rotacijskem uparjalniku (glej 5.4) skoraj do suhega, odstrani se preostalo topilo s tokom dušika (3.9), ostanek pa se ponovno raztopi v 25,0 ml metanola (3.3). Nominalna koncentracija te raztopine je 45,5 μg DL-α-tokoferola na ml, kar je enakovredno 50 μg acetata DL-α-tokoferola na ml. Delovno standardno raztopino je treba pripraviti svežo pred uporabo.
5.6.1.2
1,0, 2,0, 4,0 in 10,0 ml delovne standardne raztopine se prenese v serijo 20-mililitrskih merilnih bučk, dopolni se z metanolom (3.3) do oznake in premeša. Nominalne koncentracije teh raztopin so 2,5, 5,0, 10,0 in 25,0 μg/ml acetata DL-α-tokoferola, tj. 2,28, 4,55, 9,10 in 22,8 μg/ml DL-α-tokoferola.
Večkrat se vbrizga 20 μl vsake raztopine za umerjanje, nato pa se določijo srednje vrednosti višin (površin) vrhov. Iz srednjih vrednosti višin (površin) vrhov se pripravi umeritvena krivulja.
5.6.1.3
5,0 ml osnovne raztopine acetata DL-α-tokoferola (3.10.1) se razredči na 25,0 ml z etanolom, UV-spekter te raztopine pa se izmeri proti etanolu (3.1) v spektrofotometru (4.6) med 250 in 320 nm.
Maksimalna absorpcija je pri 284 nm:
 = 43,6 pri 284 nm v etanolu
= 43,6 pri 284 nm v etanolu
Pri tem razredčenju mora biti vrednost ekstinkcije 0,84 do 0,88.
5.6.2
5.6.2.1
2 ml osnovne raztopine DL-α-tokoferola (3.11.1) se odpipetira v 50-mililitrsko merilno bučko, raztopi v metanolu (3.3) in dopolni z metanolom do oznake. Nominalna koncentracija te raztopine je 40 μg DL-α-tokoferola na ml, kar je enakovredno 44,0 μg acetata DL-α-tokoferola na ml. Delovno standardno raztopino je treba pripraviti svežo pred uporabo.
5.6.2.2
1,0, 2,0, 4,0 in 10,0 ml delovne standardne raztopine se prenese v serijo 20-mililitrskih merilnih bučk, dopolni se do oznake z metanolom (3.3) in premeša. Nominalne koncentracije teh raztopin so 2,0, 4,0, 8,0 in 20,0 μg/ml DL-α-tokoferola, tj. 2,20, 4,40, 8,79 in 22,0 μg/ml acetata DL-α-tokoferola.
Večkrat se vbrizga 20 μl vsake raztopine za umerjanje, nato pa se določijo srednje vrednosti višin (površin) vrhov. Iz srednjih vrednosti višin (površin) vrhov se pripravi umeritvena krivulja.
5.6.2.3
2,0 ml osnovne raztopine DL-α-tokoferola (3.11.1) se razredči na 25,0 ml z etanolom, UV-spekter te raztopine pa se izmeri proti etanolu (3.1) v spektrofotometru (4.6) med 250 in 320 nm. Maksimalna absorpcija je pri 292 nm:
 = 75,8 pri 292 nm v etanolu
= 75,8 pri 292 nm v etanolu
Pri tem razredčenju mora biti vrednost ekstinkcije 0,6.
6. Izračun rezultatov
Iz srednje vrednosti višine (površine) vrhov vitamina E iz raztopine vzorca se s pomočjo umeritvene krivulje (5.6.1.2 ali 5.6.2.2) določi koncentracija raztopine vzorca v μg/ml (izračunana kot acetat DL-α-tokoferola).
Vsebnost vitamina E (w) v mg/kg v vzorcu se izračuna po naslednji formuli:
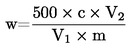 [mg/kg]
[mg/kg]
pri čemer je:
|
c |
= |
koncentracija vitamina E (kot acetata α-tokoferola) v raztopini vzorca (5.4) v μg/ml; |
|
V1 |
= |
volumen raztopine vzorca (5.4) v ml; |
|
V2 |
= |
volumen alikvota, uporabljenega pri točki 5.4, v ml; |
|
m |
= |
masa preskusnega vzorca v gramih. |
7. Opombe
|
7.1 |
Pri vzorcih z nizko koncentracijo vitamina E se ekstrakti petroletra iz dveh umilitvenih šarž (natehtana množina: 25 g) združijo v eno raztopino vzorca za določanje s HPLC. |
|
7.2 |
Masa vzorca za analizo ne vsebuje več kot 2 g maščobe. |
|
7.3 |
Če se fazi ne ločita, se doda približno 10 ml etanola (3.1) za razbitje emulzije. |
|
7.4 |
Po spektrofotometrični meritvi raztopine acetata DL-α-tokoferola ali raztopine DL-α-tokoferola v skladu s točko 5.6.1.3 ali pa 5.6.2.3 se doda približno 10 mg BHT (3.12) v raztopino (3.10.1 ali 3.10.2), raztopina pa se hrani v hladilniku (hrani se lahko največ 4 tedne). |
|
7.5 |
Namesto BHT se lahko uporablja hidrokinon. |
|
7.6 |
Z običajno fazno kolono je možno ločiti α-, β-, γ- in δ-tokoferol. |
|
7.7 |
Namesto raztopine natrijevega askorbata se lahko uporabi približno 150 mg askorbinske kisline. |
|
7.8 |
Namesto raztopine natrijevega sulfida se lahko uporabi približno 50 mg EDTA. |
|
7.9 |
Acetat vitamina E se v bazičnih pogojih hidrolizira zelo hitro, zato je zelo občutljiv na oksidacijo, zlasti v navzočnosti elementov v sledovih, kot sta železo in baker. Če raven vitamina E v premiksih presega 5 000 mg/kg, se vitamin E pri določanju lahko razgradi. Zato je za potrditev priporočena metoda HPLC z encimsko razgradnjo strukture vitamina E brez bazičnega umiljenja. |
8. Ponovljivost
Razlika med rezultatoma dveh vzporednih določanj, izvedenih na istem vzorcu, ne sme presegati 15 % najvišjega rezultata.
9. Rezultati medlaboratorijske študije (2)
|
|
Premiks |
Krma in premiksi |
Mineralni koncentrat |
Beljakovinska krma |
Krma za prašiče |
|
L |
12 |
12 |
12 |
12 |
12 |
|
n |
48 |
48 |
48 |
48 |
48 |
|
Srednja vrednost [mg/kg] |
17 380 |
1 187 |
926 |
315 |
61,3 |
|
Sr [mg/kg] |
384 |
45,3 |
25,2 |
13,0 |
2,3 |
|
r [mg/kg] |
1 075 |
126,8 |
70,6 |
36,4 |
6,4 |
|
CVr [ %] |
2,2 |
3,8 |
2,7 |
4,1 |
3,8 |
|
SR mg/kg] |
830 |
65,0 |
55,5 |
18,9 |
7,8 |
|
R [mg/kg] |
2 324 |
182,0 |
155,4 |
52,9 |
21,8 |
|
CVR [ %] |
4,8 |
5,5 |
6,0 |
6,0 |
12,7 |
|
L |
: |
število laboratorijev; |
|
n |
: |
število posameznih vrednosti; |
|
Sr |
: |
standardni odmik ponovljivosti; |
|
SR |
: |
standardni odmik obnovljivosti; |
|
r |
: |
ponovljivost; |
|
R |
: |
obnovljivost; |
|
CVr |
: |
koeficient variacije ponovljivosti; |
|
CVR |
: |
koeficient variacije obnovljivosti. |

C. DOLOČANJE ŽELEZA, BAKRA, MANGANA IN CINKA V SLEDOVIH
1. Namen in področje uporabe
Ta metoda omogoča določanje železa, bakra, mangana in cinka v sledovih v krmi. Meje za določanje so:
|
— |
železo (Fe): 20 mg/kg, |
|
— |
baker (Cu): 10 mg/kg, |
|
— |
mangan (Mn): 20 mg/kg, |
|
— |
cink (Zn): 20 mg/kg. |
2. Načelo
Po razkroju morebitnih organskih snovi se vzorec raztopi v klorovodikovi kislini. Po primernem razredčenju se z atomsko absorpcijsko spektrometrijo določijo železo, baker, mangan in cink.
3. Reagenti
Uvodne opombe
Za pripravo reagentov in raztopin za analizo se uporabi voda brez kationov, ki jih je treba določiti, ki se pripravi z dvojnim destiliranjem vode v destilatorju iz borosilikatnega ali kremenovega stekla ali z dvojno ionsko izmenjavo.
Reagenti morajo biti najmanj analitske čistoče. Odsotnost elementa, ki se določa, se preveri s slepim preskusom. Po potrebi se morajo reagenti dodatno prečistiti.
Namesto spodaj navedenih standardnih raztopin se lahko uporabijo komercialne standardne raztopine, če imajo jamstvo in so bile pred uporabo preverjene.
|
3.1 |
Klorovodikova kislina (g: 1,19 g/ml) |
|
3.2 |
Klorovodikova kislina (6 mol/l) |
|
3.3 |
Klorovodikova kislina (0,5 mol/l) |
|
3.4 |
38–40-odstotna (v/v) klorovodikova kislina z vsebnostjo železa (Fe) manj kot 1 mg/l in z manj kot 10 mg/l ostanka (v obliki sulfata) po uparevanju |
|
3.5 |
Žveplova kislina (g: 1,84 g/ml) |
|
3.6 |
Vodikov peroksid a.č. (približno 100 volumnov kisika (30 % po masi)) |
|
3.7 |
Standardna raztopina železa (1 000 μg Fe/ml), pripravljena na naslednji način, ali enakovredna komercialno dostopna raztopina: 1 g železne žice se raztopi v 200 ml klorovodikove kisline 6 mol/l (3.2), doda se 16 ml vodikovega peroksida (3.6) in dopolni z vodo do 1 litra. |
|
3.7.1 |
Standardna delovna raztopina železa (100 μg Fe/ml), pripravljena z redčenjem 1 dela standardne raztopine (3.7) z 9 deli vode. |
|
3.8 |
Standardna raztopina bakra (1 000 μg Cu/ml), pripravljena na naslednji način, ali enakovredna komercialno dostopna raztopina:
|
|
3.8.1 |
Standardna delovna raztopina bakra (10 μg Cu/ml), pripravljena z redčenjem 1 dela standardne raztopine (3.8) z 9 deli vode, nato pa z redčenjem 1 dela te raztopine z 9 deli vode. |
|
3.9 |
Standardna raztopina mangana (1 000 μg Mn/ml), pripravljena na naslednji način, ali enakovredna komercialno dostopna raztopina:
|
|
3.9.1 |
Standardna delovna raztopina mangana (10 μg Mn/ml), pripravljena z redčenjem 1 dela standardne raztopine (3.9) z 9 deli vode, nato pa z redčenjem 1 dela te raztopine z 9 deli vode. |
|
3.10 |
Standardna raztopina cinka (1 000 μg Zn/ml), pripravljena na naslednji način, ali enakovredna komercialno dostopna raztopina:
|
|
3.10.1 |
Standardna delovna raztopina cinka (10 μg Zn/ml), pripravljena z redčenjem 1 dela standardne raztopine (3.10) z 9 deli vode, nato pa z redčenjem 1 dela te raztopine z 9 deli vode. |
|
3.11 |
Raztopina lantanovega klorida: 12 g lantanovega klorida se raztopi v 150 ml vode, doda se 100 ml klorovodikove kisline 6 mol/l (3.2) in dopolni z vodo do 1 litra. |
4. Oprema
|
4.1 |
Žarilna peč z regulacijo temperature in po možnosti rekorderjem |
|
4.2 |
Stekleni deli morajo biti iz odpornega borosilikata, priporočljiva pa je uporaba opreme, ki je namenjena izključno določanju elementov v sledovih. |
|
4.3 |
Atomski absorpcijski spektrofotometer, ki ustreza zahtevam metode glede občutljivosti in natančnosti zahtevanega območja. |
5. Postopek (3)
5.1 Vzorci, ki vsebujejo organske snovi
5.1.1 (4)
|
5.1.1.1 |
5–10 g vzorca se natehta na 0,2 mg natančno in prenese v žarilni lonček iz kvarca ali platine (glej opombo (b)), osuši v sušilniku pri 105 oC in postavi v hladno žarilno peč (4.1). Peč se zapre (glej opombo (c)), temperatura pa se približno 90 minut postopoma viša na 450–475 oC. Ta temperatura se ohranja 4–16 ur (npr. čez noč), da se odstranijo zoglenele snovi, nato pa se peč odpre in ohladi (glej opombo (d)). Pepel se navlaži z vodo in prenese v 250-mililitrsko čašo. Lonček se spere s skupaj približno 5 ml klorovodikove kisline (3.1), vsebina pa se počasi in previdno prenese v čašo (lahko pride do burne reakcije zaradi nastanka CO2). Po kapljicah se dodaja klorovodikova kislina (3.1), meša pa se, dokler penjenje ne poneha. Upareva se do suhega, pri čemer se občasno premeša s stekleno palčko. Nato se ostanku doda 15 ml klorovodikove kisline 6 mol/l (3.2) in približno 120 ml vode. Premeša se s stekleno paličico, ki se pusti v čaši, čaša pa se pokrije z urnim steklom. Počasi se segreva do vretja in pusti vreti do popolne raztopitve pepela. Skozi filter, ki ne vsebuje pepela, se filtrira v 250-mililitrsko merilno bučko. Čaša in filter se spereta s 5 ml vroče klorovodikove kisline 6 mol/l (3.2) in dvakrat z vrelo vodo. Merilna bučka se napolni z vodo do oznake (koncentracija HCl približno 0,5 mol/l). |
|
5.1.1.2 |
Če je ostanek na filtru videti črn (ogljik), se ponovno postavi v peč in upepeli pri 450–475 oC. Ta upepelitev, ki zahteva le nekaj ur (približno 3–5 ur), je končana, ko je pepel videti bel ali skoraj bel. Ostanek se raztopi s približno 2 ml klorovodikove kisline (3.1), upari do suhega in doda 5 ml klorovodikove kisline 6 mol/l (3.2). Segreje se, raztopina se filtrira v merilno bučko in dopolni z vodo do oznake (koncentracija HCl približno 0,5 mol/l). Opombe:
|
5.1.2
5.1.2.1
Za vsak element, ki se določa, se iz standardnih delovnih raztopin iz točk 3.7.1, 3.8.1, 3.9.1 in 3.10.1 pripravi serija raztopin za umerjanje, pri čemer je koncentracija HCl v vsaki približno 0,5 mol/l (in (pri železu, manganu in cinku) koncentracija lantanovega klorida, ki ustreza 0,1 % La (m/v)).
Izbrane koncentracije elementov v sledovih morajo ustrezati območju občutljivosti uporabljenega spektrofotometra. V spodnjih preglednicah so kot primer navedena tipična območja raztopin za umerjanje glede na vrsto in občutljivost uporabljenega spektrofotometra, zato je morda treba izbrati drugačne koncentracije.
Železo
|
μg Fe/ml |
0 |
0,5 |
1 |
2 |
3 |
4 |
5 |
|
ml delovne standardne raztopine (3.7.1) (1 ml = 100 μg Fe) |
0 |
0,5 |
1 |
2 |
3 |
4 |
5 |
|
ml HCl (3.2) |
7 |
7 |
7 |
7 |
7 |
7 |
7 |
|
+ 10 ml raztopine lantanovega klorida (3.11) in dopolniti z vodo do 100 ml |
|||||||
Baker
|
μg Cu/ml |
0 |
0,1 |
0,2 |
0,4 |
0,6 |
0,8 |
1,0 |
|
ml delovne standardne raztopine (3.8.1) (1 ml = 10 μg Cu) |
0 |
1 |
2 |
4 |
6 |
8 |
10 |
|
ml HCl (3.2) |
8 |
8 |
8 |
8 |
8 |
8 |
8 |
Mangan
|
μg Mn/ml |
0 |
0,1 |
0,2 |
0,4 |
0,6 |
0,8 |
1,0 |
|
ml delovne standardne raztopine (3.9.1) (1 ml = 10 μg Mn) |
0 |
1 |
2 |
4 |
6 |
8 |
10 |
|
ml HCl (3.2) |
7 |
7 |
7 |
7 |
7 |
7 |
7 |
|
+ 10 ml raztopine lantanovega klorida (3.11) in dopolniti z vodo do 100 ml |
|||||||
Cink
|
μg Zn/ml |
0 |
0,05 |
0,1 |
0,2 |
0,4 |
0,6 |
0,8 |
|
ml delovne standardne raztopine (3.10.1) (1 ml = 10 μg Zn) |
0 |
0,5 |
1 |
2 |
4 |
6 |
8 |
|
ml HCl (3.2) |
7 |
7 |
7 |
7 |
7 |
7 |
7 |
|
+ 10 ml raztopine lantanovega klorida (3.11) in dopolniti z vodo do 100 ml |
|||||||
5.1.2.2
Za določanje bakra se lahko raztopina, pripravljena v skladu s točko 5.1.1, ponavadi uporabi neposredno. Če je treba koncentracijo prilagoditi območju umeritve, se ustrezen alikvot odpipetira v 100-mililitrsko merilno bučko in dopolni s klorovodikovo kislino 0,5 mol/l (3.3) do oznake.
Za določanje železa, mangana in cinka se odpipetira ustrezen alikvot raztopine, pripravljene v skladu s točko 5.1.1, v 100-mililitrsko merilno bučko, doda se 10 ml raztopine lantanovega klorida (3.11) in dopolni do oznake s klorovodikovo kislino 0,5 mol/l (3.3) (glej tudi točko 8 „Opomba“).
5.1.2.3
Slepi preskus mora vključevati vse predpisane korake postopka, le da se izpusti vzorec. Raztopina za umerjanje „0“ se ne sme uporabljati kot slepa raztopina.
5.1.2.4
Atomska absorpcija raztopin za umerjanje in raztopine, ki se analizira, se izmeri z uporabo oksidnega plamena zrak-acetilen pri naslednjih valovnih dolžinah:
|
|
Fe: 248,3 nm |
|
|
Cu: 324,8 nm |
|
|
Mn: 279,5 nm |
|
|
Zn: 213,8 nm |
Vsako merjenje se izvede štirikrat.
5.2 Mineralna krma
Če vzorec ne vsebuje organskih snovi, predhodno upepeljevanje ni potrebno. Nadaljuje se v skladu z drugim odstavkom točke 5.1.1.1. Uparevanje s klorovodikovo kislino se lahko izpusti.
6. Izračun rezultatov
Koncentracija elementa v sledovih v raztopini, ki se analizira, se izračuna s pomočjo umeritvene krivulje, rezultat pa se izrazi v miligramih elementa v sledovih na kilogram vzorca (ppm).
7. Ponovljivost
Razlika med rezultatoma dveh vzporednih določanj, ki jih na istem vzorcu izvaja isti analitik, ne presega:
|
— |
5 mg/kg absolutne vrednosti za vsebnosti zadevnega elementa v sledovih do 50 mg/kg, |
|
— |
10 % višjega rezultata za vsebnosti zadevnega elementa v sledovih 50–100 mg/kg, |
|
— |
10 mg/kg absolutne vrednosti za vsebnosti zadevnega elementa v sledovih 100–200 mg/kg, |
|
— |
5 % višjega rezultata za vsebnosti zadevnega elementa v sledovih nad 200 mg/kg. |
8. Opomba
Če je količina prisotnih fosfatov visoka, lahko moti določanje železa, mangana in cinka. To se mora popraviti z dodajanjem raztopine lantanovega klorida (3.11). Če pa je masno razmerju v vzorcu (Ca + Mg/P) > 2, se lahko izpusti dodajanje raztopine lantanovega klorida (3.11) raztopini za analizo in raztopinam za umerjanje.
D. DOLOČANJE HALOFUGINONA
DL-trans-7-bromo-6-kloro-3-[3-(3-hidroksi-2-piperidil)acetonil]-kvinazolin-4-(3H)-ena hidrobromid
1. Namen in področje uporabe
Ta metoda omogoča določanje ravni halofuginona v krmi. Meja kvantifikacije je 1 mg/kg.
2. Načelo
Po obdelavi z vročo vodo se halofuginon ekstrahira v obliki proste baze v etilni acetat in se nato kot hidroklorid loči v vodno raztopino kisline. Ekstrakt se prečisti z ionsko izmenjevalno kromatografijo. Vsebnost halofuginona se določi s tekočinsko kromatografijo visoke ločljivosti (HPLC) z reverzno fazo in z UV-detektorjem.
3. Reagenti
|
3.1 |
Acetonitril, za HPLC |
|
3.2 |
Izmenjevalec Amberlite XAD-2 |
|
3.3 |
Amonijev acetat |
|
3.4 |
Etilni acetat |
|
3.5 |
Ledocetna kislina |
|
3.6 |
Standardna snov halofuginon (DL-trans-7-bromo-6-kloro-3-[3-hidroksi-2-piperidil)acetonil]-kvinazolin-4-(3H)-ena hidrobromid, E 764) |
|
3.6.1 |
50 mg halofuginona (3.6) se natehta na 0,1 mg natančno in prenese v 500-mililitrsko merilno bučko ter raztopi v pufrski raztopini amonijevega acetata (3.18), dopolni se s pufrsko raztopino do oznake in premeša. Ta raztopina je stabilna tri tedne pri 5 oC, če se hrani na temnem. |
|
3.6.2 |
V serijo 100-mililitrskih merilnih bučk se prenese 1,0, 2,0, 3,0, 4,0 in 6,0 ml osnovne standardne raztopine (3.6.1). Dopolni se z mobilno fazo (3.21) do oznake in premeša. V teh raztopinah je koncentracija halofuginona 1,0, 2,0, 3,0, 4,0 in 6,0 μg/ml. Te raztopine je treba pripraviti sveže pred uporabo. |
|
3.7 |
Klorovodikova kislina, (ρ20 približno 1,16 g/ml) |
|
3.8 |
Metanol |
|
3.9 |
Srebrov nitrat |
|
3.10 |
Natrijev askorbat |
|
3.11 |
Natrijev karbonat |
|
3.12 |
Natrijev klorid |
|
3.13 |
EDTA (etilendiamintetraocetna kislina, dinatrijeva sol) |
|
3.14 |
Voda, za HPLC |
|
3.15 |
Raztopina natrijevega karbonata, c = 10 g/100 ml |
|
3.16 |
Raztopina natrijevega klorida in nasičenega natrijevega karbonata, c = 5 g/100 ml 50 g natrijevega karbonata (3.11) se raztopi v vodi, razredči do 1 litra, nato pa se doda natrijev klorid (3.12), dokler raztopina ni nasičena. |
|
3.17 |
Klorovodikova kislina, približno 0,1 mol/l 10 ml HCl (3.7) se razredči z vodo do 1 litra. |
|
3.18 |
Pufrska raztopina amonijevega acetata, približno 0,25 mol/l 19,3 g amonijevega acetata (3.3) in 30 ml ocetne kisline (3.5) se raztopi v vodi (3.14) ter razredči do 1 litra. |
|
3.19 |
Priprava izmenjevalca Amberlite XAD-2 Ustrezna količina Amberlita (3.2) se spira z vodo, dokler niso odstranjeni vsi kloridni ioni, kar dokazuje preskus s srebrovim nitratom (3.20) v zavrženi vodni fazi. Nato se izmenjevalec spere s 50 ml metanola (3.8), metanol se zavrže, izmenjevalec pa hrani v svežem metanolu. |
|
3.20 |
Raztopina srebrovega nitrata, približno 0,1 mol/l 0,17 g srebrovega nitrata (3.9) se raztopi v 10 ml vode. |
|
3.21 |
Mobilna faza HPLC 500 ml acetonitrila (3.1) se zmeša s 300 ml pufrske raztopine amonijevega acetata (3.18) in 1 200 ml vode (3.14). pH se uravna na 4,3 z ocetno kislino (3.5). Filtrira se skozi filter 0,22 μm (4.8) in raztopina se razplini (npr. 10 minut v ultrazvočni kopeli). Ta raztopina je stabilna en mesec, če se hrani na temnem v zaprti posodi. |
4. Oprema
|
4.1 |
Ultrazvočna kopel |
|
4.2 |
Rotacijski uparjalnik |
|
4.3 |
Centrifuga |
|
4.4 |
HPLC-oprema z ultravijoličnim detektorjem z nastavljivo valovno dolžino ali detektorjem s serijo diod |
|
4.4.1 |
Kolona za tekočinsko kromatografijo, 300 mm × 4 mm, C18, polnitev 10 μm ali enakovredna kolona |
|
4.5 |
Steklena kolona (300 mm × 10 mm) s filtrom iz sintranega stekla in petelinčkom |
|
4.6 |
Filtri iz steklenih vlaken, premera 150 mm |
|
4.7 |
Membranski filtri, 0,45 μm |
|
4.8 |
Membranski filtri, 0,22 μm |
5. Postopek
|
Opomba |
: |
Halofuginon kot prosta baza je nestabilen v bazičnih in etilacetatnih raztopinah. V etilacetatu se ne pusti več kot 30 minut. |
5.1 Splošno
|
5.1.1 |
Z analizo slepe krme se preveri, da niso prisotni niti halofuginon niti moteče snovi. |
|
5.1.2 |
Preskus izkoristka se izvede z analizo slepe krme, ki se ji doda količina halofuginona, podobna količini v vzorcu. Za koncentracijo 3 mg/kg se k 10 g slepe krme doda 300 μl osnovne standardne raztopine (3.6.1), premeša se in počaka 10 minut, preden se začne postopek ekstrakcije (5.2).
|
5.2 Ekstrakcija
10 g pripravljenega vzorca se natehta na 0,1 g natančno in prenese v 200-mililitrsko centrifugirno epruveto, doda se 0,5 g natrijevega askorbata (3.10), 0,5 g EDTA (3.13) in 20 ml vode ter premeša. Epruveta se postavi za 5 min v vodno kopel (80 oC). Po ohladitvi na sobno temperaturo se doda 20 ml raztopine natrijevega karbonata (3.15) in premeša. Takoj se doda 100 ml etilacetata (3.4) in 15 sekund ročno močno stresa. Nato se epruveta postavi za 3 minute v ultrazvočno kopel (4.1), zamašek pa zrahlja. Centrifugira se 2 minuti, faza etilacetata pa se oddekantira skozi filter iz steklenih vlaken (4.6) v 500-mililitrski lij ločnik. Ekstrakcija vzorca se ponovi z nadaljnjimi 100 ml etilacetata. Sestavljeni ekstrakti se spirajo 1 minuto s 50 ml raztopine nasičenega natrijevega klorida-natrijevega karbonata (3.16), vodna plast pa se zavrže.
Organska plast se ekstrahira 1 minuto s 50 ml klorovodikove kisline (3.17). Spodnja kislinska plast se prenese v 250-mililitrski lij ločnik. Organska plast se ponovno ekstrahira 1,5 minute z nadaljnjimi 50 ml klorovodikove kisline, ekstrakt pa se združi s prvim ekstraktom. Združena ekstrakta se približno 10 sekund spirata z 10 ml etilacetata (3.4) z vrtenjem.
Vodna plast se prenese v 250-mililitrsko bučko z okroglim dnom, organska faza pa se zavrže. Ves preostali etilacetat iz kisle raztopine se upari v rotacijskem uparjalniku (4.2). Temperatura vodne kopeli ne sme preseči 40 oC. Ves preostali etilacetat se odstrani v 5 minutah v vakuumu pri približno 25 milibarih in 38 oC.
5.3 Čiščenje
5.3.1
Kolona XAD-2 se pripravi za vsak ekstrakt vzorca. 10 g pripravljenega Amberlita (3.19) se z metanolom (3.8) prenese v stekleno kolono (4.5). Na vrh posteljice izmenjevalca se položi majhen zamašek iz steklene volne. Metanol se izpusti iz kolone, izmenjevalec pa se spere s 100 ml vode tako, da se tok vode ustavi, ko vrh posteljice doseže izmenjevalec. Pred uporabo se pusti 10 minut, da se kolona uravnoteži. Kolona se ne sme nikoli izsušiti.
5.3.2
Ekstrakt (5.2) se prenese na vrh pripravljene kolone z Amberlitom (5.3.1) in eluira, eluat pa se zavrže. Hitrost eluiranja ne sme biti večja od 20 ml/min. Bučka z okroglim dnom se spere z 20 ml klorovodikove kisline (3.17) in vsebina se uporabi za spiranje izmenjalne kolone. Kakršna koli preostala raztopina kisline se prepiha z zrakom. Ostanek po izpiranju se zavrže. V kolono se doda 100 ml metanola (3.8), 5–10 ml se eluira, eluat pa se zbere v 250-mililitrsko bučko z okroglim dnom. Preostali metanol se pusti 10 minut, da se uravnoteži z izmenjevalcem, eluiranje se nadaljuje s hitrostjo, ki ne presega 20 ml/min, eluat pa se zbira v isto bučko z okroglim dnom. Metanol se upari na rotacijskem uparjalniku (4.2), pri čemer temperatura vodne kopeli ne sme preseči 40 oC. Ostanek se z mobilno fazo (3.21) prenese v 10-mililitrsko merilno bučko. Dopolni se z mobilno fazo do oznake in premeša. Alikvot se prefiltrira skozi membranski filter (4.7). Raztopina se shrani za določanje s HPLC (5.4).
5.4 Določanje s HPLC
5.4.1
Naslednji pogoji se lahko uporabljajo kot smernice, lahko pa se uporabljajo drugi pogoji, če zagotavljajo enakovredne rezultate.
Kolona za tekočinsko kromatografijo (4.4.1)
Mobilna faza HPLC (3.21)
Hitrost pretoka: 1,5–2 ml/min
Detekcijska valovna dolžina: 243 nm
Volumen, ki se vbrizga: 40 do 100 μl
Stabilnost kromatografskega sistema se preveri z večkratnim vbrizgavanjem raztopine za umerjanje s koncentracijo 3,0 μg/ml (3.6.2), dokler niso dosežene konstantne višine (ali površine) vrhov in konstantni retencijski časi.
5.4.2
Vsaka raztopina za umerjanje (3.6.2) se vbrizga večkrat, za vsako koncentracijo pa se izmerijo srednje vrednosti višin (površin) vrhov. Umeritvena krivulja se pripravi tako, da se na ordinato nanesejo srednje vrednosti višin ali površin vrhov raztopin za umerjanje, na absciso pa ustrezne koncentracije v μg/ml.
5.4.3
Ekstrakt vzorca (5.3.2) se vbrizga večkrat, pri čemer se uporabijo enaki volumni kot za raztopino za umerjanje, nato pa se določi srednja vrednost višin (površin) vrhov halofuginona.
6. Izračun rezultatov
Koncentracija raztopine v μg/ml se določi iz srednjih vrednosti višin (površin) vrhov halofuginona v raztopini vzorca iz umeritvene krivulje (5.4.2).
Vsebnost halofuginona (w) (mg/kg) v vzorcu se izračuna po naslednji formuli:

pri čemer je:
|
c |
: |
koncentracija halofuginona v raztopini vzorca v μg/ml; |
|
m |
: |
masa preskušanega vzorca v gramih. |
7. Potrditev rezultatov
7.1 Identiteta
Identiteta analita se lahko potrdi z dodatno kromatografijo ali z detektorjem s serijo diod, s katerim se primerjata spekter ekstrakta vzorca in spekter raztopine za umerjanje (3.6.2) s koncentracijo 6,0 μg/ml.
7.1.1
Ekstraktu vzorca se doda ustrezna količina raztopine za umerjanje (3.6.2). Količina dodanega halofuginona mora biti podobna ocenjeni količini halofuginona v ekstraktu vzorca.
Povišan je le vrh halofuginona ob upoštevanju dodane količine in razredčitve ekstrakta. Širina vrha na polovici maksimalne višine mora biti znotraj ± 10 % prvotne širine.
7.1.2
Rezultati se ocenijo glede na naslednja merila:
|
(a) |
valovni dolžini maksimalne absorpcije spektra vzorca in spektra standarda, zabeleženi na najvišji točki vrha kromatograma, morata biti isti znotraj meja, določenih z ločljivostjo sistema za detekcijo. Za detekcijo s serijo diodo je to ponavadi znotraj ± 2 nm; |
|
(b) |
med 225 in 300 nm se spekter vzorca in spekter standarda, zabeležena na najvišji točki kromatografskega vrha, za navedene dele spektra ne smeta razlikovati znotraj območja 10–100 % relativne absorbance. To merilo je izpolnjeno, ko so prisotne iste najvišje vrednosti in ko odmik med dvema spektroma na nobeni opazovani točki ne preseže 15 % absorbance standardnega analita; |
|
(c) |
med 225 in 300 nm se spektri naraščanja, najvišje točke vrha in padanja vrha, pridobljeni iz ekstrakta vzorca, za navedene dele spektra ne smejo razlikovati znotraj območja 10–100 % relativne absorbance. To merilo je izpolnjeno, ko so prisotne iste najvišje točke in ko odmik med spektri na nobeni od opazovanih točk ne preseže 15 % absorbance spektra najvišje točke. |
Če eno od teh meril ni izpolnjeno, prisotnost analita ni potrjena.
7.2 Ponovljivost
Razlika med rezultatoma dveh vzporednih določanj, izvedenih na istem vzorcu, ne sme presegati 0,5 mg/kg za vsebnost halofuginona do 3 mg/kg.
7.3 Izkoristek
Za slepi vzorec z dodatkom je izkoristek najmanj 80 %.
8. Rezultati medlaboratorijske študije
Organizirana je bila medlaboratorijska študija (5), v kateri je osem laboratorijev analiziralo tri vzorce.
Rezultati
|
|
Vzorec A (slepi) ob prejemu |
Vzorec B (v prahu) |
Vzorec C (v briketih) |
||
|
|
|
ob prejemu |
po 2 mesecih |
ob prejemu |
po 2 mesecih |
|
Srednja vrednost [mg/kg] |
ND |
2,80 |
2,42 |
2,89 |
2,45 |
|
SR [mg/kg] |
— |
0,45 |
0,43 |
0,40 |
0,42 |
|
CVR [ %] |
— |
16 |
18 |
14 |
17 |
|
Rec. [ %] |
|
86 |
74 |
88 |
75 |
|
ND |
= |
ni zaznano; |
|
SR |
= |
standardni odmik obnovljivosti; |
|
CVR |
= |
koeficient variacije obnovljivosti (%); |
|
Rec. |
= |
izkoristek (%). |
E. DOLOČANJE ROBENIDINA
1,3-bis [(4-klorobenziliden)amino]gvanidin – hidroklorid
1. Namen in področje uporabe
Ta metoda omogoča določanje ravni robenidina v krmi. Meja kvantifikacije je 5 mg/kg.
2. Načelo
Vzorec se ekstrahira z nakisanim metanolom. Ekstrakt se osuši in alikvot se prečisti na koloni iz aluminijevega oksida. Robenidin se eluira s kolone z metanolom, koncentrira in dopolni z mobilno fazo do ustreznega volumna. Vsebnost robenidina se določi s tekočinsko kromatografijo visoke ločljivosti (HPLC) z reverzno fazo in UV-detektorjem.
3. Reagenti
|
3.1 |
Metanol |
|
3.2 |
Nakisani metanol 4,0 ml klorovodikove kisline (ρ20 = 1,18 g/ml) se prenese v 500-mililitrsko merilno bučko, dopolni se do oznake z metanolom (3.1) in premeša. Ta raztopina se pred vsako uporabo sveže pripravi. |
|
3.3 |
Acetonitril, za HPLC |
|
3.4 |
Molekularno sito Tip 3A, kroglice 8 do 12 meš (kroglice, premera 1,6 – 2,5 mm, kristalinični aluminijev silikat, premer por 0,3 mm) |
|
3.5 |
Stopnja kislinske aktivnosti I aluminijevega oksida, za kolonsko kromatografijo V primerno posodo se prenese 100 g aluminijevega oksida in doda 2,0 ml vode. Zamaši se in stresa približno 20 minut. Hrani se v dobro zaprti posodi. |
|
3.6 |
Raztopina kalijevega dihidrogenfosfata, c = 0,025 mol/l 3,40 g kalijevega dihidrogenfosfata se raztopi v vodi (za HPLC) v 1 000-mililitrski merilni bučki, dopolni se do oznake in premeša. |
|
3.7 |
Raztopina dinatrijevega hidrogenfosfata, c = 0,025 mol/l 3,55 g brezvodnega dinatrijevega hidrogenfosfata (ali 4,45 g dihidrata ali 8,95 g dodekahidrata) se raztopi v vodi (za HPLC) v 1 000-mililitrski merilni bučki, dopolni se do oznake in premeša. |
|
3.8 |
HPLC-mobilna faza Zmešajo se naslednji reagenti:
Filtrira se skozi filter 0,22 μm (4,6), raztopina pa se nato razplini (npr. 10 minut v ultrazvočni kopeli). |
|
3.9 |
Standardna snov Čisti robenidin: 1,3-bis[4-klorobenziliden)amino] gvanidin hidroklorid |
|
3.9.1 |
30 mg standardnega robenidina (3.9) se natehta na 0,1 mg natančno. Raztopi se v nakisanem metanolu (3.2) v 100-mililitrski merilni bučki, dopolni se z istim topilom do oznake in premeša. Bučka se ovije v aluminijasto folijo in hrani v temi. |
|
3.9.2 |
10,0 ml osnovne standardne raztopine robenidina (3.9.1) se prenese v 250-mililitrsko merilno bučko, dopolni se z mobilno fazo (3.8) do oznake in premeša. Bučka se ovije v aluminijasto folijo in hrani v temi. |
|
3.9.3 |
V serijo 50-mililitrskih merilnih bučk se prenese 5,0, 10,0, 15,0, 20,0 in 25,0 ml vmesne standardne raztopine (3.9.2). Dopolni se z mobilno fazo (3.8) do oznake in premeša. Te raztopine ustrezajo koncentracijam robenidina 1,2, 2,4, 3,6, 4,8 in 6,0 μg/ml. Te raztopine je treba pripraviti sveže pred uporabo. |
|
3.10 |
Voda za HPLC |
4. Oprema
|
4.1 |
Steklena kolona Iz temnega stekla, s petelinčkom in rezervoarjem z volumnom približno 150 ml, notranjega premera 10–15 mm, dolžine 250 mm |
|
4.2 |
Mehanski stresalnik ali magnetno mešalo |
|
4.3 |
Rotacijski uparjalnik |
|
4.4 |
Oprema za HPLC z ultravijoličnim detektorjem ali detektorjem s serijo diod, z nastavljivo valovno dolžino v območju 250–400 nm. |
|
4.4.1 |
Kolona za tekočinsko kromatografijo: 300 mm × 4 mm, C18, polnitev 10 μm ali enakovredna |
|
4.5 |
Filtrski papir iz steklenih vlaken (Whatman GF/A ali enakovreden) |
|
4.6 |
Membranski filtri, 0,22 μm |
|
4.7 |
Membranski filtri, 0,45 μm |
5. Postopek
|
Opomba |
: |
Robenidin je občutljiv na svetlobo. Pri vseh postopkih se uporablja temna steklovina. |
5.1 Splošno
|
5.1.1 |
Z analizo slepe krme se zagotovi, da niso prisotni niti robenidin niti moteče snovi. |
|
5.1.2 |
Preskus izkoristka se izvede z analizo slepe krme (5.1.1), ki se ji doda količina amproliuma, podobna količini v vzorcu. Za koncentracijo 60 mg/kg se 3,0 ml osnovne standardne raztopine (3.9.1) prenese v 250-mililitrsko erlenmajerico. Raztopina se upari v toku dušika do približno 0,5 ml. Doda se 15 g slepe krme, premeša, pusti 10 minut in nadaljuje z ekstrakcijo (5.2).
|
5.2 Ekstrakcija
Približno 15 g vzorca se natehta na 0,01 g natančno. Prenese se v 250-mililitrsko erlenmajerico, doda se 100,0 ml nakisanega metanola (3.2), zamaši se in stresa eno uro v stresalniku (4.2). Raztopina se filtrira skozi filtrirni papir iz steklenih vlaken (4.5) v 150-mililitrsko erlenmajerico. Doda se 7,5 g molekularnega sita (3.4), zamaši se in stresa pet minut. Takoj se filtrira skozi filtrirni papir iz steklenih vlaken. Ta raztopina se shrani za fazo čiščenja (5.3).
5.3 Čiščenje
5.3.1
V spodnji del steklene kolone se vstavi majhen zamašek iz steklene volne (4.1), ki se potlači s stekleno palčko. 11,0 g pripravljenega aluminijevega oksida (3.5) se natehta in prenese v kolono. Pazi se, da je pri tem postopku izpostavljenost zraku čim manjša. Rahlo se udarja po spodnjem delu polne kolone, da se aluminijev oksid sesede.
5.3.2
Na kolono se s pipeto prenese 5,0 ml ekstrakta vzorca, pripravljenega v (5.2). Pipeta se nasloni na steno kolone, nato pa se pusti, da se raztopina absorbira na aluminijev oksid. Robenidin se eluira iz kolone s 100 ml metanola (3.1) s hitrostjo pretoka 2–3 ml/min, eluat pa se zbere v 250-mililitrsko bučko z okroglim dnom. Raztopina metanola se upari do suhega pri znižanem tlaku in pri 40 oC v rotacijskem uparjalniku (4.3). Ostanek se raztopi v 3–4 ml mobilne faze (3.8) in prenese v 10-mililitrsko merilno bučko. Bučka se nekajkrat spere z 1–2 ml mobilne faze, izpirki pa se prenesejo v merilno bučko. Dopolni se do oznake z istim topilom in premeša. Alikvot se prefiltrira skozi membranski filter 0,45 μm (4.7). Ta raztopina se shrani za določanje s HPLC (5.4).
5.4 Določanje s HPLC
5.4.1
Naslednji pogoji se lahko uporabljajo kot smernice, lahko pa se uporabljajo drugi pogoji, če zagotavljajo enakovredne rezultate:
kolona za tekočinsko kromatografijo (4.4.1),
mobilna faza HPLC (3.8),
hitrost pretoka: 1,5–2 ml/min,
valovna dolžina detekcije: 317 nm,
volumen, ki se vbrizga: 20–50 μl.
Stabilnost kromatografskega sistema se preveri z večkratnim vbrizgavanjem raztopine za umerjanje (3.9.3) s koncentracijo 3,6 μg/ml, dokler se ne dosežejo konstantne višine vrhov in konstantni retencijski časi.
5.4.2
Vsaka raztopina za umerjanje (3.9.3) se večkrat vbrizga, za vsako koncentracijo pa se izmerijo višine (površine) vrhov. Umeritvena krivulja se pripravi tako, da se na ordinato nanesejo srednje vrednosti višin ali površin vrhov raztopin za umerjanje, na absciso pa ustrezne koncentracije v μg/ml.
5.4.3
Večkrat se vbrizga ekstrakt vzorca (5.3.2) z enakimi volumni, kakor se uporabljajo pri raztopini za umerjanje, nato pa se določijo srednje vrednosti višin (površin) vrhov robenidina.
6. Izračun rezultatov
Koncentracija raztopine vzorca v μg/ml se določi iz srednje vrednosti višin (površin) vrhov robenidina iz umeritvene krivulje (5.4.2).
Vsebnost robenidina (w) (mg/kg) v vzorcu se izračuna po naslednji formuli:

pri čemer je:
|
c |
= |
koncentracija robenidina v raztopini vzorca v μg/ml; |
|
m |
= |
masa preskušanega vzorca v gramih. |
7. Potrditev rezultatov
7.1 Identiteta
Identiteta analita se lahko potrdi z dodatno kromatografijo ali z detektorjem s serijo diod, s katerim se primerjata spekter ekstrakta vzorca in spekter raztopine za umerjanje (3.9.3) s koncentracijo 6,0 μg/ml.
7.1.1
Ekstraktu vzorca se doda primerna količina raztopine za umerjanje (3.9.3). Količina dodanega robenidina mora biti podobna ocenjeni količini robenidina v ekstraktu vzorca.
Povišan je le vrh robenidina ob upoštevanju dodane količine in razredčitve ekstrakta. Širina vrha na polovici njegove največje višine mora biti v mejah približno 10 % prvotne širine.
7.1.2
Rezultati se ocenijo glede na naslednja merila:
|
(a) |
valovni dolžini maksimalne absorpcije spektra vzorca in spektra standarda, zabeleženi na najvišji točki vrha kromatograma, morata biti isti znotraj meja, določenih z ločljivostjo sistema za detekcijo. Za detekcijo s serijo diod je to ponavadi v območju približno 2 nm; |
|
(b) |
med 250 in 400 nm se spekter vzorca in spekter standarda na najvišji točki kromatografskega vrha za navedene dele spektra ne smeta razlikovati znotraj območja 10–100 % relativne absorbance. To merilo je izpolnjeno, ko so prisotne iste najvišje vrednosti in ko odmik med dvema spektroma na nobeni opazovani točki ne preseže 15 % absorbance standardnega analita; |
|
(c) |
med 250 in 400 nm se spektri naraščanja, najvišje točke vrha in padanja vrha, pridobljeni iz ekstrakta vzorca, za navedene dele spektra ne smejo razlikovati znotraj območja 10–100 % relativne absorbance. To merilo je izpolnjeno, ko so prisotne iste najvišje točke in ko odmik med spektri na nobeni od opazovanih točk ne preseže 15 % absorbance spektra najvišje točke. |
Če eno od teh meril ni izpolnjeno, prisotnost analita ni potrjena.
7.2 Ponovljivost
Razlika med rezultatoma dveh vzporednih določanj, izvedenih na istem vzorcu, ne sme presegati 10 % višjega rezultata za vsebnost robenidina nad 15 mg/kg.
7.3 Izkoristek
Za slepi vzorec z dodatkom je izkoristek najmanj 85 %.
8. Rezultati medlaboratorijske študije
ES je organizirala medlaboratorijsko študijo, pri kateri je 12 laboratorijev analiziralo štiri vzorce perutninske in kunčje krme v prahu in briketih. Vsak vzorec je bil analiziran dvakrat. Rezultati so zbrani v spodnji preglednici:
|
|
Perutninska krma |
Kunčja krma |
||
|
|
v prahu |
v briketih |
v prahu |
v briketih |
|
Srednja vrednost [mg/kg] |
27,00 |
27,99 |
43,6 |
40,1 |
|
Sr [mg/kg] |
1,46 |
1,26 |
1,44 |
1,66 |
|
CVr [ %] |
5,4 |
4,5 |
3,3 |
4,1 |
|
SR [mg/kg] |
4,36 |
3,36 |
4,61 |
3,91 |
|
CVR [ %] |
16,1 |
12,0 |
10,6 |
9,7 |
|
Recovery [ %] |
90,0 |
93,3 |
87,2 |
80,2 |
|
Sr |
= |
standardni odmik ponovljivosti; |
|
CVr |
= |
koeficient variacije ponovljivosti v %; |
|
SR |
= |
standardni odmik obnovljivosti; |
|
CVR |
= |
koeficient variacije obnovljivosti v %. |
F. DOLOČANJE DIKLAZURILA
(+)-4-klorfenil [2,6-dikloro-4-(2,3,4,5-tetrahidro-3,5-diokso-1,2,4-triazin-2-il) fenil] acetonitril
1. Namen in področje uporabe
Ta metoda omogoča določanje ravni diklazurila v krmi in premiksih. Meja določanja je 0,1 mg/kg, meja kvantifikacije pa 0,5 mg/kg.
2. Načelo
Po dodatku notranjega standarda se vzorec ekstrahira z nakisanim metanolom. Pri krmi se alikvot ekstrakta prečisti na kartuši C18 za ekstrakcijo v trdni fazi. Diklazuril se eluira iz kartuše z mešanico nakisanega metanola in vode. Po uparevanju se ostanek raztopi v raztopini DMF in vode. Pri premiksih se ekstrakt upari in nato se ostanek raztopi v raztopini DMF in vode. Vsebnost diklazurila se določi s tekočinsko kromatografijo visoke ločljivosti (HPLC) z reverzno fazo s ternarnim gradientom, z uporabo UV-detektorja.
3. Reagenti
|
3.1 |
Voda, za HPLC |
|
3.2 |
Amonijev acetat |
|
3.3 |
Tetrabutilamonijev hidrogen sulfat (TBHS) |
|
3.4 |
Acetonitril, za HPLC |
|
3.5 |
Metanol, za HPLC |
|
3.6 |
N, N-dimetilformamid (DMF) |
|
3.7 |
Klorovodikova kislina, ρ20 = 1,19 g/ml |
|
3.8 |
Standardna snov: diklazuril II-24: (+)-4-klorfenil [2,6-diklor-4-(2,3,4,5-tetrahidro-3,5-diokso-1,2,4-triazin-2-il) fenil] acetonitril, zajamčene čistosti, E771. |
|
3.8.1 |
25 mg standardne snovi diklazurila (3.8) se natehta na 0,1 mg natančno in prenese v 50-mililitrsko merilno bučko. Raztopi se v DMF (3.6), bučka se dopolni z DMF (3.6) do oznake in premeša. Bučka se ovije v aluminijasto folijo ali pa se uporabi rjava bučka ter shrani v hladilniku. Pri temperaturi ≤ 4 oC je raztopina stabilna 1 mesec. |
|
3.8.2 |
5,00 ml osnovne standardne raztopine (3.8.1) se prenese v 50-mililitrsko merilno bučko, dopolni se z DMF (3.6) do oznake in premeša. Bučka se ovije v aluminijasto folijo ali pa se uporabi rjava bučka ter shrani v hladilniku. Pri temperaturi ≤ 4 oC je raztopina stabilna 1 mesec. |
|
3.9 |
Snov, ki je notranji standard: 2,6 dikloro-α-(4-klorofenil)-4-(4,5 dihidro-3,5-diokso-1,2,4-triazin-2 (3H) – il) α-metilbenzen-acetonitril. |
|
3.9.1 |
25 mg notranjega standarda (3.9) se natehta na 0,1 mg natančno in prenese v 50-mililitrsko merilno bučko. Raztopi se v DMF (3.6), bučka se dopolni z DMF (3.6) do oznake in premeša. Bučka se ovije v aluminijasto folijo ali se pa uporabi rjava bučka ter shrani v hladilniku. Pri temperaturi ≤ 4 oC je raztopina stabilna 1 mesec. |
|
3.9.2 |
5,00 ml osnovne raztopine notranjega standarda (3.9.1) se prenese v 50-mililitrsko merilno bučko, dopolni se z DMF (3.6) do oznake in premeša. Bučka se ovije v aluminijasto folijo ali pa se uporabi rjava bučka ter shrani v hladilniku. Pri temperaturi ≤ 4 oC je raztopina stabilna 1 mesec. |
|
3.9.3 |
(p = nominalna vsebnost diklazurila v mg/kg v premiksu) p/10 mg notranjega standarda se natehta na 0,1 mg natančno in prenese v 100-mililitrsko merilno bučko, raztopi se v DMF (3.6) v ultrazvočni kopeli (4.6), dopolni se z DMF do oznake in premeša. Bučka se ovije v aluminijasto folijo ali pa se uporabi rjava bučka ter shrani v hladilniku. Pri temperaturi ≤ 4 oC je raztopina stabilna 1 mesec. |
|
3.10 |
Raztopina za umerjanje, 2 μg/ml 2,00 ml standardne raztopine diklazurila (3.8.2) in 2,00 ml raztopine notranjega standarda (3.9.2) se odpipetira v 50-mililitrsko merilno bučko. Doda se 16 ml DMF (3.6), bučka se dopolni z vodo do oznake in premeša. To raztopino je treba pripraviti svežo pred uporabo. |
|
3.11 |
Ekstrakcijska kartuša za trdno fazo C18, npr. Bond Elut, velikost: 1 cc, masa absorbenta: 100 mg |
|
3.12 |
Ekstrakcijsko topilo: nakisani metanol 5,0 ml klorovodikove kisline (3.7) se odpipetira v 1 000 ml metanola (3.5) in premeša. |
|
3.13 |
Mobilna faza za HPLC |
|
3.13.1 |
Eluent A: raztopina amonijevega acetata in tetrabutilamonijevega hidrogen sulfata 5 g amonijevega acetata (3.2) in 3,4 g TBHS (3.3) se raztopi v 1 000 ml vode (3.1) ter premeša. |
|
3.13.2 |
Eluent B: acetonitril (3.4) |
|
3.13.3 |
Eluent C: metanol (3.5) |
4. Oprema
|
4.1 |
Mehanski stresalnik |
|
4.2 |
Oprema za HPLC s terciarnim gradientom |
|
4.2.1 |
Kolona za tekočinsko kromatografsko kolono, Hypersil ODS, polnitev 3 μm, 100 mm x 4,6 mm ali enakovredna |
|
4.2.2 |
UV-detektor z nastavljivo valovno dolžino ali detektor s serijo diod. |
|
4.3 |
Rotacijski uparjalnik |
|
4.4 |
Membranski filter, 0,45 μm |
|
4.5 |
Vakuumski ventil |
|
4.6 |
Ultrazvočna kopel |
5. Postopek
5.1 Splošno
5.1.1
Z analizo slepe krme se zagotovi, da niso prisotni niti diklazuril niti moteče snovi. Vrsta slepe krme je podobna vrsti vzorca in z analizo se dokaže odsotnost diklazurila ali motečih substanc.
5.1.2
Preskus izkoristka se izvede tako, da se analizira slepa krma, ki se ji doda toliko diklazurila, kolikor ga je v vzorcu. Za koncentracijo l mg/kg se doda 0,1 ml osnovne standardne raztopine (3.8.1) v 50 g slepe krme, dobro se premeša in pusti 10 minut, pred nadaljevanjem (5.2) pa se večkrat ponovno premeša.
Če pa vrsta slepe krme, podobna vrsti vzorca, ni na voljo (glej 5.1.1), se lahko preskus izkoristka izvede po metodi standardnega dodatka. V tem primeru se vzorcu za analizo doda količina diklazurila, podobna tisti v vzorcu. Ta vzorec se analizira skupaj z vzorcem brez dodanega diklazurila, izkoristek pa se izračuna z odštevanjem.
5.2 Ekstrakcija
5.2.1
Približno 50 g vzorca se natehta na 0,01 g natančno. Prenese se v 500-mililitrsko erlenmajerico, doda se 1,00 ml raztopine notranjega standarda (3.9.2) in 200 ml ekstrakcijskega topila (3.12), nato pa se erlenmajerica zamaši. Mešanica se prek noči stresa v stresalniku (4.1). Pusti se 10 minut, da se usede. 20-mililitrski alikvot supernatanta se prenese v primerno stekleno posodo in razredči z 20 ml vode. Ta raztopina se prenese na ekstrakcijsko kartušo (3.11), skoznjo pa se spusti z vakuumom (4.5). Kartuša se spere s 25 ml mešanice ekstrakcijskega topila (3.12) in vode, 65 + 35 (V + V). Zbrane frakcije se zavržejo, spojine pa se eluirajo s 25 ml mešanice ekstrakcijskega topila (3.12) in vode, 80 + 20 (V + V). Ta frakcija se upari v rotacijskem uparjalniku (4.3) pri 60 oC do prve sušine. Ostanek se raztopi v 1,0 ml DMF (3.6), doda se 1,5 ml vode (3.1) in premeša. Filtrira se skozi membranski filter (4.4). Nadaljuje se z določanjem s HPLC (5.3).
5.2.2
Približno 1 g vzorca se natehta na 0,001 g natančno. Prenese se v 500-mililitrsko erlenmajerico, doda se 1,00 ml raztopine notranjega standarda (3.9.3) in 200 ml ekstrakcijskega topila (3.12), nato pa se erlenmajerica zamaši. Mešanica se prek noči stresa v stresalniku (4.1). Pusti se 10 minut, da se usede. Alikvot (10 000/p ml, p = nominalna vsebnost diklazurila v mg/kg v premiksu) supernatanta se prenese v primerno veliko bučko z okroglim dnom. Do prve sušine se upari pri znižanem tlaku in 60 oC v rotacijskem uparjalniku (4.3). Ostanek se ponovno raztopi v 10,0 ml DMF (3.6), doda se 15,0 ml vode (3.1) in premeša. Nadaljuje se z določanjem s HPLC (5.3).
5.3 Določanje s HPLC
5.3.1
Naslednji pogoji se lahko uporabljajo kot smernice, lahko pa se uporabljajo drugi pogoji, če zagotavljajo enakovredne rezultate.
|
Kolona za tekočinsko kromatografijo (4.2.1): |
100 mm × 4,6 mm, Hypersil ODS, polnitev 3 μm ali enakovredna |
|
||||||
|
Mobilna faza: |
Eluent A (3.13.1): |
vodna raztopina amonijevega acetata in tetrabutil amonijevega hidrogen sulfata |
||||||
|
|
Eluent B (3.13.2): |
acetonitril |
||||||
|
|
Eluent C (3.13.3): |
metanol |
||||||
|
Način eluiranja: |
V 10 minutah se spere z B. |
|||||||
|
Hitrost pretoka: |
1,5–2 ml/min |
|
||||||
|
Volumen, ki se vbrizga: |
20 μl |
|
||||||
|
Valovna dolžina detekcije: |
280 nm |
|
||||||
Stabilnost kromatografskega sistema se preveri z večkratnim vbrizgavanjem raztopine za umerjanje s koncentracijo 2 μg/ml (3.10), dokler se ne dosežejo konstantne višine vrhov in konstantni retencijski časi.
5.3.2
Večkrat se vbrizga 20 μl raztopine za umerjanje (3.10) ter določi srednja vrednost višine (površine) vrhov diklazurila in vrhov raztopine notranjega standarda.
5.3.3
Večkrat se vbrizga 20 μl raztopine vzorca (5.2.1 ali 5.2.2) ter določi srednja vrednost višine (površine) vrha diklazurila in raztopine notranjega standarda.
6. Izračun rezultatov
6.1 Krma
Vsebnost diklazurila (w) (mg/kg) v vzorcu se izračuna po naslednji formuli:
 [mg/kg]
[mg/kg]
pri čemer je:
|
hd, s |
= |
višina (površina) vrha diklazurila v raztopini vzorca (5.2.1); |
|
hi, s |
= |
višina (površina) vrha notranjega standarda v raztopini vzorca (5.2.1); |
|
hd, c |
= |
višina (površina) vrha diklazurila v raztopini za umerjanje (3.10); |
|
hi, c |
= |
višina (površina) vrha notranjega standarda v raztopini za umerjanje (3.10); |
|
cd, c |
= |
koncentracija diklazurila v raztopini za umerjanje v μg/ml (3.10); |
|
m |
= |
masa preskusnega vzorca v gramih; |
|
V |
= |
volumen ekstrakta vzorca v skladu s točko 5.2.1 (tj. 2,5 ml). |
6.2 Premiksi
Vsebnost diklazurila (w) (mg/kg) v vzorcu se izračuna po naslednji formuli:
 [mg/kg]
[mg/kg]
pri čemer je:
|
hd, c |
= |
višina (površina) vrha diklazurila v raztopini za umerjanje (3.10); |
|
hi, c |
= |
višina (površina) vrha notranjega standarda v raztopini za umerjanje (3.10); |
|
hd, s |
= |
višina (površina) vrha diklazurila v raztopini vzorca (5.2.2); |
|
hi, s |
= |
višina (površina) vrha notranjega standarda v raztopini vzorca (5.2.2); |
|
cd, c |
= |
koncentracija diklazurila v raztopini za umerjanje v μg/ml (3.10); |
|
m |
= |
masa preskusnega vzorca v gramih; |
|
V |
= |
volumen ekstrakta vzorca v skladu s točko 5.2.2 (tj. 25 ml); |
|
p |
= |
nominalna vsebnost diklazurila v mg/kg v premiksu. |
7. Potrditev rezultatov
7.1 Identiteta
Identiteta analita se lahko potrdi z dodatno kromatografijo ali z detektorjem s serijo diod, s katerim se primerjata spekter ekstrakta vzorca (5.2.1 ali 5.2.2) in spekter raztopine za umerjanje (3.10).
7.1.1
Ekstraktu vzorca (5.2.1 ali 5.2.2) se doda primerna količina raztopine za umerjanje (3.10). Količina dodanega diklazurila mora biti podobna količini diklazurila v ekstraktu vzorca.
Povišana sta le vrh diklazurila in vrh notranjega standarda ob upoštevanju dodane količine in razredčitve ekstrakta. Širina vrha na polovici višine mora biti znotraj ± 10 % prvotne širine vrha diklazurila ali notranjega standardnega vrha v vzorcu, ki mu diklazuril ni bil dodan.
7.1.2
Rezultati se ocenijo glede na naslednja merila:
|
(a) |
valovni dolžini maksimalne absorpcije spektra vzorca in spektra standarda, zabeleženi na najvišji točki vrha na kromatogramu, morata biti isti znotraj meja, določenih z ločljivostjo sistema za detekcijo. Pri detekciji s serijo diod je to ponavadi ± 2 nm; |
|
(b) |
med 230 in 320 nm se spekter vzorca in spekter standarda, zabeležena na najvišji točki vrha na kromatogramu, za navedene dele spektra ne smeta razlikovati v območju 10–100 % relativne absorbance. To merilo je izpolnjeno, ko so prisotne iste najvišje vrednosti in ko odmik med dvema spektroma na nobeni opazovani točki ne preseže 15 % absorbance standardnega analita; |
|
(c) |
med 230 in 320 nm se spektri naraščanja, najvišje točke vrha in padanja vrha, pridobljeni iz ekstrakta vzorca, za navedene dele spektra ne smejo razlikovati v območju 10–100 % relativne absorbance. To merilo je izpolnjeno, ko so prisotne iste najvišje točke in ko odmik med spektri na nobeni od opazovanih točk ne preseže 15 % absorbance spektra najvišje točke. |
Če eno od teh meril ni izpolnjeno, prisotnost analita ni potrjena.
7.2 Ponovljivost
Razlika med rezultatoma dveh vzporednih določanj, izvedenih na istem vzorcu, ne sme presegati:
|
— |
30 % višje vrednosti za vsebnosti diklazurila 0,5–2,5 mg/kg, |
|
— |
0,75 mg/kg za vsebnosti diklazurila 2,5–5 mg/kg, |
|
— |
15 % višje vrednosti za vsebnosti diklazurila nad 5 mg/kg. |
7.3 Izkoristek
Pri vzorcu z dodatkom (slepem vzorcu) je izkoristek najmanj 80 %.
8. Rezultati medlaboratorijske študije
Organizirana je bila medlaboratorijska študija, pri kateri je 11 laboratorijev analiziralo 5 vzorcev. Te vzorce sta sestavljala dva premiksa; eden je bil mešan z organsko matrico (O 100), drug pa z anorgansko matrico (A 100). Teoretična vsebnost je 100 mg diklazurila na kg. Trije različni proizvajalci (NL) (L1/Z1/K1) so proizvedli 3 mešane perutninske krme. Teoretična vsebnost je 1 mg diklazurila na kg. Laboratorijem je bilo naročeno, naj vsak vzorec analizirajo enkrat ali dvakrat. (Podrobnejše informacije o navedeni medlaboratorijski študiji so v Journal of AOAC International, knjiga 77, št. 6, 1994, str. 1359–1361). Rezultati so navedeni v spodnji preglednici.
|
|
Vzorec 1 A 100 |
Vzorec 2 O 100 |
Vzorec 3 L1 |
Vzorec 4 Z1 |
Vzorec 5 K1 |
|
L |
11 |
11 |
11 |
11 |
6 |
|
n |
19 |
18 |
19 |
19 |
12 |
|
Srednja vrednost |
100,8 |
103,5 |
0,89 |
1,15 |
0,89 |
|
Sr (mg/kg) |
5,88 |
7,64 |
0,15 |
0,02 |
0,03 |
|
CVr (%) |
5,83 |
7,38 |
17,32 |
1,92 |
3,34 |
|
SR (mg/kg) |
7,59 |
7,64 |
0,17 |
0,11 |
0,12 |
|
CVR (%) |
7,53 |
7,38 |
18,61 |
9,67 |
13,65 |
|
Nominalna vsebnost (mg/kg) |
100 |
100 |
1 |
1 |
1 |
|
L |
= |
število laboratorijev; |
|
n |
= |
število posameznih vrednosti; |
|
Sr |
= |
standardni odmik ponovljivosti; |
|
CVr |
= |
koeficient variacije ponovljivosti; |
|
SR |
= |
standardni odmik obnovljivosti; |
|
CVR |
= |
koeficient variacije obnovljivosti. |
9. Opomba
Predhodno je treba dokazati, da je odziv diklazurila linearen v območju koncentracij, ki se merijo.
G. DOLOČANJE LASALOCID NATRIJA
Natrijeva sol polieter monokarboksilne kisline, proizvedena s Streptomyces lasaliensis
1. Namen in področje uporabe
Ta metoda omogoča določanje ravni lasalocid natrija v krmi in premiksih. Meja določanja je 5 mg/kg, meja kvantifikacije pa 10 mg/kg.
2. Načelo
Lasalocid natrij se ekstrahira iz vzorca v nakisani metanol in določi s tekočinsko kromatografijo visoke ločljivosti (HPLC) z reverzno fazo z uporabo spektrofluorimetričnega detektorja.
3. Reagenti
|
3.1 |
Kalijev dihidrogen fosfat (KH2PO4) |
|
3.2 |
Ortofosforna kislina, m (m/m) = 85 % |
|
3.3 |
Raztopina ortofosforne kisline, c = 20 % 23,5 ml ortofosforne kisline (3.2) se razredči s 100 ml vode. |
|
3.4 |
6-metil-2-heptilamin (1,5-dimetilheksilamin), m (m/m) = 99 % |
|
3.5 |
Metanol, za HPLC |
|
3.6 |
Klorovodikova kislina, gostota = 1,19 g/ml |
|
3.7 |
Raztopina fosfatnega pufra, c = 0,01 mol/l 1,36 g KH2PO4 (3.1) se raztopi v 500 ml vode (3.11), doda se 3,5 ml ortofosforne kisline (3.2) in 10,0 ml 6-metil-2-heptilamina (3.4). pH se uravna na 4,0 z raztopino ortofosforne kisline (3.3) in razredči z vodo (3.11) do 1 000 ml. |
|
3.8 |
Nakisani metanol 5,0 ml klorovodikove kisline (3.6) se prenese v litrsko merilno bučko, dopolni se z metanolom (3.5) do oznake in premeša. To raztopino je treba pripraviti svežo pred uporabo. |
|
3.9 |
Mobilna faza za tekočinsko kromatografijo visoke ločljivosti (HPLC), raztopina fosfatnega pufra in metanola 5 + 95 (V + V) 5 ml raztopine fosfatnega pufra (3.7) se zmeša s 95 ml metanola (3.5). |
|
3.10 |
Lasalocid natrij standardna snov, zajamčene čistosti, C34H53O8Na (natrijeva sol polieter monokarboksilne kisline, proizvedena s Streptomyces lasaliensis), E763 |
|
3.10.1 |
50 mg lasalocid natrija (3.10) se natehta na 0,1 mg natančno in prenese v 100-mililitrsko merilno bučko, raztopi se v nakisanem metanolu (3.8) ter z istim topilom dopolni do oznake in premeša. To raztopino je treba pripraviti svežo pred uporabo. |
|
3.10.2 |
10,0 ml osnovne standardne raztopine (3.10.1) se odpipetira v 100-mililitrsko merilno bučko, z nakisanim metanolom (3.8) se dopolni do oznake in premeša. Ta raztopina se mora pripraviti sveža pred uporabo. |
|
3.10.3 |
V serijo 50-mililitrskih merilnih bučk se prenese 1,0, 2,0, 4,0, 5,0 in 10,0 ml vmesne standardne raztopine (3.10.2). Z nakisanim metanolom se dopolni do oznake (3.8) in premeša. Te raztopine ustrezajo 1,0, 2,0, 4,0, 5,0 in 10,0 μg lasalocid natrija na ml. Te raztopine se morajo pripraviti sveže pred uporabo. |
|
3.11 |
Voda, za HPLC |
4. Oprema
|
4.1 |
Ultrazvočna kopel (ali stresalna vodna kopel) z nadzorom temperature |
|
4.2 |
Membranski filtri, 0,45 μm |
|
4.3 |
Oprema za tekočinsko kromatografijo visoke ločljivosti (HPLC) s sistemom za vbrizgavanje, primernim za vbrizgavanje volumnov 20 μl |
|
4.3.1 |
Kolona za tekočinsko kromatografijo 125 mm x 4 mm, reverzna faza C18, polnitev 5 μm ali enakovredna |
|
4.3.2 |
Spektrofluorimeter s spremenljivo nastavitvijo valovnih dolžin ekscitacije in emisije |
5. Postopek
5.1 Splošno
5.1.1
Za učinkovitost preskusa izkoristka (5.1.2) se z analizo slepe krme zagotovi, da niso prisotni niti lasalocid natrij niti moteče snovi. Slepa krma je podobne vrste kot vzorec in dokaže se odsotnost lasalocid natrija ali motečih snovi.
5.1.2
Preskus izkoristka se izvede z analiziranjem slepe krme, ki se ji doda količina lasalocid natrija, podobna količini v vzorcu. Za koncentracijo 100 mg/kg se 10,0 ml osnovnega standarda (3.10.1) prenese v 250-mililitrsko erlenmajerico, raztopina pa se upari do približno 0,5 ml. Doda se 50 g slepe krme, dobro se premeša in pusti 10 minut, preden se nadaljuje s postopkom ekstrakcije (5.2) pa se nekajkrat ponovno premeša.
Če pa vrsta slepe krme, podobna vrsti vzorca, ni na voljo (glej točko 5.1.1), se lahko preskus izkoristka izvede po metodi standardnega dodatka. V tem primeru se vzorcu za analizo doda količina lasalocid natrija, podobna tisti v vzorcu. Ta vzorec se analizira skupaj z vzorcem brez dodanega lasalocid natrija, izkoristek pa se izračuna z odštevanjem.
5.2 Ekstrakcija
5.2.1
5–10 g vzorca se natehta na 0,01 g natančno in prenese v 250-mililitrsko erlenmajerico z zamaškom. S pipeto se doda 100,0 ml nakisanega metanola (3.8). Zamašek se rahlo zapre, erlenmajerica pa se zavrti, da se delci razpršijo. Erlenmajerica se postavi v ultrazvočno kopel (4.1) pri približno 40 oC za 20 minut, nato se odstrani iz kopeli in ohladi na sobno temperaturo. Pusti se stati približno 1 uro, dokler se suspenzija ne usede, nato pa se alikvot filtrira skozi 0,45 μm membranski filter (4.2) v primerno posodo. Nadaljuje se z določanjem s HPLC (5.3).
5.2.2
Približno 2 g nezmletega premiksa se natehta na 0,001 g natančno in prenese v 250-mililitrsko merilno bučko. Doda se 100,0 ml nakisanega metanola (3.8) in bučka se zavrti, da se delci razbijejo. Erlenmajerica z vsebino se postavi v ultrazvočno kopel (4.1) pri približno 40 oC za 20 minut, nato se odstrani iz kopeli in ohladi na sobno temperaturo. Z nakisanim metanolom (3.8) se razredči do oznake in dobro premeša. Pusti se stati 1 uro, dokler se suspenzija ne obori, nato se alikvot filtrira skozi 0,45 μm membranski filter (4.2). Primeren volumen čistega filtrata se razredči z nakisanim metanolom (3.8), da nastane končna preskusna raztopina s koncentracijo približno 4 μg/ml lasalocid natrija. Nadaljuje se z določanjem s HPLC (5.3).
5.3 Določanje s HPLC
5.3.1
Naslednji pogoji se lahko uporabljajo kot smernice; lahko se uporabljajo tudi drugi pogoji, če zagotavljajo enakovredne rezultate:
|
Kolona za tekočinsko kromatografijo (4.3.1): |
125 mm × 4 mm, reverzna faza C18, polnitev 5 μm ali enakovredna |
|
Mobilna faza (3.9): |
Mešanica raztopine fosfatnega pufra (3.7) in metanola (3.5), 5+95 (V+V) |
|
Hitrost pretoka: |
1,2 ml/min |
|
Detekcijska valovna dolžina: |
|
|
ekscitacija: |
310 nm |
|
emisija |
419 nm |
|
Volumen, ki se vbrizga: |
20 μl |
Stabilnost kromatografskega sistema se preveri z večkratnim vbrizgavanjem raztopine za umerjanja s koncentracijo 4,0 μg/ml (3.10.3), dokler niso dosežene konstantne višine (ali površine) vrhov in konstantni retencijski časi.
5.3.2
Vsaka raztopina za umerjanje (3.10.3) se večkrat vbrizga in za vsako koncentracijo se določijo srednje vrednosti višin (površin) vrhov. Umeritvena krivulja se pripravi tako, da se na ordinato nanesejo srednje vrednosti višin (površin) vrhov, na absciso pa ustrezne koncentracije v μg/ml.
5.3.3
Večkrat se vbrizgajo ekstrakti vzorca, ki nastanejo pri točki 5.2.1 ali 5.2.2, pri čemer se uporabijo enaki volumni kot pri raztopinah za umerjanje ter določijo srednje vrednosti višin (površin) vrhov lasalocid natrija.
6. Izračun rezultatov
Iz srednjih vrednosti višin (površin) vrhov, ki so nastali z vbrizganjem raztopine vzorca (5.3.3), se določi koncentracija lasalocid natrija (μg/ml) iz umeritvene krivulje.
6.1 Krma
Vsebnost lasalocid natrija (w) (mg/kg) v vzorcu se izračuna po naslednji formuli:
 [mg/kg]
[mg/kg]
pri čemer je:
|
c |
= |
koncentracija lasalocid natrija v raztopini vzorca (5.2.1) v μg/ml; |
|
V1 |
= |
volumen ekstrakta vzorca v skladu s točko 5.2.1 v ml (tj. 100); |
|
m |
= |
masa preskusnega vzorca v gramih. |
6.2 Premiksi
Vsebnost lasalocid natrija (w) (mg/kg) v vzorcu se izračuna po naslednji formuli:
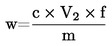 [mg/kg]
[mg/kg]
pri čemer je:
|
c |
= |
koncentracija lasalocid natrija v raztopini vzorca (5.2.2) v μg/ml; |
|
V2 |
= |
volumen ekstrakta vzorca v skladu s točko 5.2.2 v ml (tj. 250); |
|
f |
= |
faktor razredčitve v skladu s 5.2.2; |
|
m |
= |
masa preskusnega vzorca v gramih. |
7. Potrditev rezultatov
7.1 Identiteta
Metode, ki temeljijo na spektrofluorometriji, so manj izpostavljene motnjam kot metode, pri katerih se uporablja UV-detekcija. Identiteta analita se lahko potrdi z dodatno kromatografijo.
7.1.1
Ekstraktu vzorca (5.2.1 ali 5.2.2) se doda ustrezna količina raztopine za umerjanje (3.10.3). Količina dodanega lasalocid natrija mora biti podobna količini lasalocid natrija v ekstraktu vzorca. Le vrh lasalocid natrija je povišan ob upoštevanju količine dodanega lasalocid natrija in razredčitve ekstrakta. Širina vrha na polovici višine mora biti znotraj ± 10 % prvotne širine vrha, ki nastane pri ekstraktu vzorca brez dodanega lasalocid natrija.
7.2 Ponovljivost
Razlika med rezultatoma dveh vzporednih določanj, izvedenih na istem vzorcu, ne sme presegati:
|
— |
15 % višje vrednosti za vsebnosti lasalocid natrija 30–100 mg/kg, |
|
— |
15 mg/kg za vsebnosti lasalocid natrija 100–200 mg/kg, |
|
— |
7,5 % višje vrednosti za vsebnosti lasalocid natrija več kot 200 mg/kg. |
7.3 Izkoristek
Za krmo z dodatkom (slepo krmo) je izkoristek najmanj 80 %. Za vzorce premiksov z dodatkom je izkoristek najmanj 90 %.
8. Rezultati medlaboratorijske študije
Organizirana je bila medlaboratorijska študija (6), v kateri je 12 laboratorijev analiziralo 2 premiksa (vzorca 1 in 2) in 5 vzorcev krme (vzorci 3–7). Vsak vzorec je bil analiziran dvakrat. Rezultati so navedeni v spodnji preglednici:
|
|
Vzorec 1 Premiks za piščance |
Vzorec 2 Premiks za purane |
Vzorec 3 Briketi za purane |
Vzorec 4 Drobtine za piščance |
Vzorec 5 Krma za purane |
Vzorec 6 Krma za perutnino A |
Vzorec 7 Krma za perutnino B |
|
L |
12 |
12 |
12 |
12 |
12 |
12 |
12 |
|
n |
23 |
23 |
23 |
23 |
23 |
23 |
23 |
|
Srednja vrednost [mg/kg] |
5 050 |
16 200 |
76,5 |
78,4 |
92,9 |
48,3 |
32,6 |
|
Sr [mg/kg] |
107 |
408 |
1,71 |
2,23 |
2,27 |
1,93 |
1,75 |
|
CVr [ %] |
2,12 |
2,52 |
2,24 |
2,84 |
2,44 |
4,00 |
5,37 |
|
SR [mg/kg] |
286 |
883 |
3,85 |
7,32 |
5,29 |
3,47 |
3,49 |
|
CVR [ %] |
5,66 |
5,45 |
5,03 |
9,34 |
5,69 |
7,18 |
10,70 |
|
Nominalna vsebnosti [mg/kg] |
5 000 (7) |
16 000 (7) |
80 (7) |
105 (7) |
120 (7) |
50 (8) |
35 (8) |
|
L |
= |
število laboratorijev; |
|
n |
= |
število posameznih vrednosti; |
|
Sr |
= |
standardni odmik ponovljivosti; |
|
SR |
= |
standardni odmik obnovljivosti; |
|
CVr |
= |
koeficient variacije ponovljivosti v %; |
|
CVR |
= |
koeficient variacije obnovljivosti v %; |
(1) Izvedla delovna skupina za krmo Verband Deutscher Landwirtschaftlicher Untersuchungs- und Forschungsanstalten (VDLUFA).
(2) Izvedla delovna skupina za krmo Verband Deutscher Landwirtschaftlicher Untersuchungs- und Forschungsanstalten (VDLUFA).
(3) Lahko se uporabljajo druge metode za razklop, če dokazano zagotavljajo podobne rezultate (kot je npr. mikrovalovni razklop).
(4) V zeleni krmi (sveži ali posušeni) je lahko velika količina kremena rastlinskega izvora, v katerem so lahko elementi v sledovih in ga je treba odstraniti. Pri vzorcih takšne krme je treba izvajati naslednji spremenjeni postopek. Postopki iz točke 5.1.1.1 se izvedejo do filtracije. Filtrirni papir, ki vsebuje netopen ostanek, se dvakrat spere z vrelo vodo in prenese v žarilni lonček iz kvarca ali platine. Prežari se v žarilni peči (4.1) pri temperaturi pod 550 oC, dokler ves zogleneli material popolnoma ne izgine. Pusti se ohladiti, doda se nekaj kapljic vode in 10–15 ml klorovodikove kisline (3.4), nato pa se upari do suhega pri približno 150 oC. Če v ostanku ostane kremen, se ponovno raztopi v nekaj mililitrih klorovodikove kisline (3.4) in upari do suhega. Doda se pet kapljic žveplove kisline (3.5) in segreva do prenehanja izhajanja belih hlapov. Po dodatku 5 ml klorovodikove kisline 6 mol/l (3.2) in približno 30 ml vode se segreva, raztopina se filtrira v 250-mililitrsko merilno bučko ter dopolni z vodo do oznake (koncentracija HCl približno 0,5 mol/l). Nadaljuje se z določanjem v skladu s točko 5.1.2.
(5) The Analyst 108, 1983, str. 1252–1256.
(6) Analyst, 1995, 120, 2175-2180;
(7) Vsebnost, ki jo navede proizvajalec;
(8) Krma, pripravljena v laboratoriju.
PRILOGA V
ANALITSKE METODE ZA NADZOR NEZAŽELENIH SNOVI V KRMI
A. DOLOČANJE PROSTEGA IN CELOTNEGA GOSIPOLA
1. Namen in področje uporabe
Ta metoda omogoča določanje ravni prostega in celotnega gosipola ter kemijsko sorodnih snovi v semenu, moki in tropinah bombaževca ter v krmnih mešanicah, ki vsebujejo ta posamična krmila, kadar je koncentracija prostega in celotnega gosipola ter kemijsko sorodnih snovi višja od 20 mg/kg.
2. Načelo
Gosipol se pri določanju prostega gosipola ekstrahira v navzočnosti 3-aminopropan-1-ola z mešanico propan-2-ola in heksana, pri določanju celotnega gosipola pa v navzočnosti dimetilformamida. Gosipol se z anilinom pretvori v gosipol-dianilin, katerega optična gostota se izmeri pri 440 nm.
3. Reagenti
|
3.1 |
Mešanica propan-2-ola in heksana: 60 volumskih delov propan-2-ola se zmeša s 40 volumskimi deli n-heksana. |
|
3.2 |
Topilo A: v litrsko merilno bučko se doda 500 ml mešanice propan-2-ola in heksana (3.1), 2 ml 3-aminopropan-1-ola, 8 ml of ledocetne kisline in 50 ml vode. Z mešanico propan-2-ola in heksana (3.1) se dopolni do oznake. Ta reagent je obstojen en teden. |
|
3.3 |
Topilo B: v 100-mililitrsko merilno bučko se odpipetira 2 ml 3-aminopropan-1-ola in 10 ml ledocetne kisline. Ohladi se na sobno temperaturo in dopolni z N, N-dimetilformamidom do oznake. Ta reagent je obstojen en teden. |
|
3.4 |
Anilin: če optična gostota v slepem preskusu presega 0,022, se anilin destilira prek cinka v prahu, pri čemer se zavrže prvih in zadnjih 10 % destilata. Če se reagent hrani v hladilniku v rjavi, zaprti stekleni posodi, je obstojen več mesecev. |
|
3.5 |
Standardna raztopina gosipola A: v 250-mililitrsko merilno bučko se da 27,9 mg gosipol acetata. Raztopi se in dopolni s topilom A (3.2) do oznake. 50 ml te raztopine se odpipetira v 250-mililitrsko merilno bučko in dopolni s topilom A do oznake. Koncentracija gosipola v tej raztopini je 0,02 mg/ml. Pred uporabo se raztopina pusti eno uro na sobni temperaturi. |
|
3.6 |
Standardna raztopina gosipola B: v 50-mililitrsko merilno bučko se da 27,9 mg gosipol acetata. Raztopi se in dopolni s topilom B (3.3) do oznake. Koncentracija gosipola v tej raztopini je 0,5 mg/ml. Če se standardni raztopini gosipola A in B zaščitita pred svetlobo, sta obstojni 24 ur. |
4. Oprema
|
4.1 |
Mešalnik: približno 35 obr./min. |
|
4.2 |
Spektrofotometer |
5. Postopek
5.1 Preskusni vzorec
Količina uporabljenega preskusnega vzorca je odvisna od pričakovane vsebnosti gosipola v vzorcu. Primerneje je uporabiti majhen preskusni vzorec in relativno velik alikvot filtrata, da nastane dovolj gosipola za natančne fotometrične meritve. Pri določanju prostega gosipola v semenu, moki in tropinah bombaževca količina preskusnega vzorca ne presega 1 g; za krmno mešanica pa je količina lahko do 5 g. 10-mililitrski alikvot filtrata je primeren v večini primerov; vsebuje 50–100 μg gosipola. Pri določanju celotnega gosipola je količina preskusnega vzorca 0,5–5 g, zato da 2-mililitrski alikvot filtrata vsebuje 40–200 μg gosipola.
Analiza se izvede pri sobni temperaturi približno 20 oC.
5.2 Določanje prostega gosipola
Preskusni vzorec se prenese v 250-mililitrski bučko z brušenim vratom, katere dno je prekrito z drobci stekla. S pipeto se doda 50 ml topila A (3.2), bučka se zamaši, nato pa se z mešalnikom meša eno uro. Filtrira se skozi suhi filter v majhno bučko z brušenim vratom. Med filtriranjem se lijak prekrije z urnim steklom.
V vsako od dveh 25-mililitrskih merilnih bučk (A in B) se odpipetirajo enaki alikvoti filtrata, ki vsebujejo 50–100 μg gosipola. Po potrebi se s topilom A (3.2) dopolni do 10 ml. Z mešanico propan-2-ola in heksana (3.1) se bučka (A) dopolni do oznake. Ta raztopina se uporabi kot referenčna raztopina za merjenje raztopine vzorca.
V vsako od dveh 25-mililitrskih merilni bučk (C in D) se odpipetira 10 ml topila A (3.2). Z mešanico propan-2-ola in heksana (3.1) se bučka (C) dopolni do oznake. Ta raztopina se uporabi kot referenčna raztopina za merjenje raztopine vzorca.
V bučki (D) in (B) se doda 2 ml anilina (3.4). 30 minut se segrevata nad vrelo vodno kopeljo, da se obarvata. Ohladita se na sobno temperaturo, dopolnita z mešanico propan-2-ola in heksana (3.1) do oznake, homogenizirata in pustita stati eno uro.
V spektrofotometru se pri 440 nm in z 1-centimetrsko kiveto določi optična gostota raztopine iz slepega preskusa (D) tako, da se primerja z referenčno raztopino (C), optična gostota raztopine vzorca (B) pa se primerja z referenčno raztopino (A).
Optična gostota raztopine iz slepega preskusa se odšteje od optične gostote raztopine vzorca (= popravljena optična gostota). Vsebnost prostega gosipola se s pomočjo te vrednosti izračuna, kakor je navedeno v točki 6.
5.3 Določanje celotnega gosipola
Preskusni vzorec z 1–5 mg gosipola se prenese v 50-mililitrsko merilno bučko ter doda 10 ml topila B (3.3). Hkrati se pripravi slepi preskus, tako da se v drugo 50-mililitrsko merilno bučko prenese 10 ml topila B (3.3). Obe bučki se segrevata 30 minut nad vrelo vodno kopeljo. Ohladita se na sobno temperaturo, obe bučki pa se dopolnita z mešanico propan-2-ola in heksana (3.1) do oznake. Homogenizira se in pusti 10–15 minut, da se usede, nato se filtrira v bučko z brušenim vratom.
V dve 25-mililitrski merilni bučki se odpipetira po 2 ml filtrata vzorca, v drugi dve 25-mililitrski merilni bučki pa po 2 ml filtrata slepega preskusa. Ena bučka iz vsake serije se dopolni do 25 ml z mešanico propan-2-ola in heksana (3.1). Te raztopine se uporabijo kot referenčne raztopine.
V vsako od drugih dveh bučk se dodata 2 ml anilina (3.4). 30 minut se segrevata nad vrelo vodno kopeljo, da se obarvata. Ohladita se na sobno temperaturo, dopolnita z mešanico propan-2-ola in heksana (3.1) do 25 ml, homogenizirata in pustita stati eno uro.
Optična gostota prostega gosipola se določi, kakor je opisano v točki 5.2. Vsebnost celotnega gosipola se s pomočjo te vrednosti izračuna, kakor je navedeno v točki 6.
6. Izračun rezultatov
Rezultati se lahko izračunajo s pomočjo specifične optične gostote (6.1) ali iz umeritvene krivulje (6.2).
6.1 S specifično optično gostoto
Specifične optične gostote, pri opisanih pogojih, so naslednje:
|
Prosti gosipol |
|
|
Celotni gosipol |
|
Vsebina prostega ali celotnega gosipola v vzorcu se izračuna po naslednji formuli:
pri čemer je:
|
E |
= |
popravljena optična gostota, ki se določi v skladu s točko 5.2; |
|
p |
= |
masa preskusnega vzorca v gramih; |
|
a |
= |
alikvot filtrata v mililitrih. |
6.2 Iz umeritvene krivulje
6.2.1
Pripravita se 2 seriji petih 25-mililitrskih merilnih bučk. V vsako serijo bučk se odpipetirajo 2,0, 4,0, 6,0, 8,0 in 10,0-mililitrski alikvoti standardne raztopine gosipola A (3.5). S topilom A (3.2) se dopolni do 10 ml. Zadnja 25-mililitrska merilna bučka v vsaki seriji vsebuje le 10 ml topila A (3.2) (slepi preskus).
Bučke iz prve serije (vključno z bučko za slepi preskus) se dopolnijo do 25 ml z mešanico propan-2-ola in heksana (3.1) (referenčna serija).
V vsako bučko iz druge serije (vključno z bučko za slepi preskus) se dodata 2 ml anilina (3.4). 30 minut se segrevajo nad vrelo vodno kopeljo, da se obarvajo. Ohladijo se na sobno temperaturo, dopolnijo z mešanico propan-2-ola in heksana (3.1) do oznake, homogenizirajo in pustijo stati eno uro (standardna serija).
Optična gostota raztopin iz standardne serije in ustreznih raztopin iz referenčne serije se določi, kakor je navedeno v točki 5.2. Umeritvena krivulja se pripravi tako, da se v diagram vnesejo izmerjene optične gostote glede na količine gosipola (v μg).
6.2.2
Pripravi se šest 50-mililitrskih merilnih bučk. V prvo bučko se prenese 10 ml topila B (3.3), v druge pa 2,0, 4,0, 6,0, 8,0 in 10,0 ml standardne raztopine gosipola B (3.6). Vsaka bučka se dopolni do 10 ml s topilom B (3.3). Segrevajo se 30 minut nad vrelo vodno kopeljo. Ohladijo se na sobno temperaturo, dopolnijo z mešanico propan-2-ola in heksana (3.1) do oznake in homogenizirajo.
2,0 ml vsake od teh raztopin se prenese v vsako od dveh serij šestih 25-mililitrskih merilnih bučk. Bučke iz prve serije se dopolnijo do 25 ml z mešanico propan-2-ola in heksana (3.1) (referenčna serija).
V vsako bučko iz druge serije se dodata 2 ml anilina (3.4). Segrevajo se 30 minut nad vrelo vodno kopeljo. Ohladijo se na sobno temperaturo, dopolnijo z mešanico propan-2-ola in heksana (3.1) do oznake, homogenizirajo in pustijo stati eno uro (standardna serija).
Optična gostota raztopin iz standardne serije in ustreznih raztopin iz referenčne serije se določi, kakor je navedeno v točki 5.2. Umeritvena krivulja se pripravi tako, da se v diagram vnesejo izmerjene optične gostote glede na količine gosipola (v μg).
6.3 Ponovljivost
Razlika med rezultatoma dveh vzporednih določanj, izvedenih na istem vzorcu, ne sme presegati:
|
— |
15 % višje vrednosti za vsebnosti gosipola, nižje od 500 ppm, |
|
— |
75 ppm absolutno za vsebnosti gosipola 500–750 ppm, |
|
— |
10 % višje vrednosti za vsebnosti gosipola, višje od 750 ppm. |
B. DOLOČANJE RAVNI DIOKSINOV (PCDD/PCDF) IN DIOKSINOM PODOBNIH PCB
I. METODE VZORČENJA IN RAZLAGA REZULTATOV ANALIZE
1. Namen in področje uporabe
Vzorci za uradni nadzor ravni dioksinov (polikloriranih dibenzo-p-dioksinov (PCDD)) in polikloriranih dibenzofuranov (PCDF) ter dioksinom podobnih polikloriranih bifenilov (PCB) (1) v krmi se odvzamejo v skladu z določbami iz Priloge I. Upoštevati je treba količinske zahteve za nadzor snovi ali proizvodov, enakomerno razporejenih po krmi, kakor so določene v točki 5.A Priloge I. Tako dobljeni sestavljeni vzorci se obravnavajo kot reprezentativni za serije in podserije, iz katerih so odvzeti. Skladnost z mejnimi vrednostmi iz Direktive 2002/32/ES Evropskega parlamenta in Sveta (2) se ugotavlja na podlagi ravni, določenih v laboratorijskih vzorcih.
2. Skladnost serije ali podserije s specifikacijo
Serija je sprejeta, če rezultat posamezne analize ne presega zadevne mejne vrednosti iz Direktive 2002/32/ES ob upoštevanju nezanesljivosti meritve.
Serija ni v skladu z mejno vrednostjo iz Direktive 2002/32/ES, če navzgor zaokroženi rezultat analize (3), potrjen z dvakratno analizo (4), ob upoštevanju nezanesljivosti meritve nedvomno presega mejno vrednost.
Nezanesljivost meritve se lahko upošteva v skladu z enim od naslednjih pristopov:
|
— |
z izračunom razširjene nezanesljivosti ob uporabi faktorja za zajetje 2, ki zagotavlja 95 % stopnjo zaupanja. Serija ni skladna, če je izmerjena vrednost minus U nad mejno vrednostjo. v primeru ločenih določanj dioksinov in dioksinom podobnih PCB je treba vsoto ocenjene razširjene nezanesljivosti ločenih rezultatov analiz dioksinov in dioksinom podobnih PCB uporabiti za vsoto dioksinov in dioksinom podobnih PCB; |
|
— |
z določitvijo odločitvene meje (CCα) v skladu z Odločbo Komisije 2002/657/ES (5) (točka 3.1.2.5 Priloge – v primeru snovi z določeno dovoljeno mejo). Serija ni skladna, če je izmerjena vrednost enaka ali večja od CCα. |
Sedanja pravila razlage se uporabljajo za rezultat analize vzorca za uradni nadzor. Ne vplivajo na pravico držav članic, da uporabljajo nacionalna pravila za analize za varovalne ali referenčne namene.
II. PRIPRAVA VZORCA IN ZAHTEVE ZA ANALITSKE METODE PRI URADNEM NADZORU RAVNI DIOKSINOV (PCDD/PCDF) IN DIOKSINOM PODOBNIH PCB
1. Cilj in področje uporabe
Te zahteve se uporabljajo, kadar se posamična krmila in krma analizirajo za določanje dioksinov (polikloriranih dibenzo-p-dioksinov (PCDD) in polikloriranih dibenzofuranov (PCDF)) ter dioksinom podobnih polikloriranih bifenilov (PCB).
Spremljanje prisotnosti dioksinov v krmi se lahko izvaja s presejalno metodo, da se izberejo tisti vzorci, katerih ravni dioksinov ali dioksinom podobnih PBC so nižje od 25 % ali so nad predpisano ravnjo. Kadar je koncentracija dioksinov v navedenih vzorcih povišana, jo je treba določiti/potrditi s potrditveno metodo.
Presejalne metode so metode, ki se uporabljajo za ugotavljanje prisotnosti dioksinov in dioksinom podobnih PCB pri predpisani ravni. Pri teh metodah je prepustnost vzorcev visoka in uporabljajo se za ločevanje številnih vzorcev na morebitne vzorce s pozitivnim rezultatom. So posebej oblikovane, da se preprečijo lažno negativni rezultati.
Potrditvene metode so metode, ki zagotavljajo celovite ali dopolnilne informacije ter natančno količinsko določitev dioksinov in dioksinom podobnih PCB pri predpisani ravni.
2. Ozadje
Ker okoljski in biološki vzorci (vključno z vzorci posamičnih krmil/krme) na splošno vsebujejo kompleksne mešanice različnih dioksinov iste vrste, se je razvila zasnova dejavnikov ekvivalence toksičnosti (TEF), da se olajša ocena tveganja. Ti TEF-i so bili oblikovani za izražanje koncentracij mešanic 2,3,7,8-substituiranih PCDD in PCDF ter nekaterih ne-orto in mono-orto s klorom substituiranih PCB, ki imajo dioksinom podobne aktivnosti v ekvivalentih toksičnosti (TEQ) 2,3,7,8-TCDD. Koncentracije posameznih snovi v danem vzorcu se pomnožijo z ustreznim TEF in nato seštejejo, da se izračuna celotna koncentracija dioksinom podobnih spojin, izraženih v ekvivalentih toksičnosti.
Samo v tej uredbi je sprejemljiva specifična meja določljivosti posameznega pripadnika iste vrste tista koncentracija analita v ekstraktu vzorca, ki sproži instrumentalni odziv na dva različna iona, ki se spremljata z razmerjem S/Š (signal/šum) 3:1 za manj občutljiv signal, in izpolnjuje osnovne zahteve, npr. retencijski čas in razmerje izotopov v skladu s postopkom določanja, kakor je opisan v metodi EPA 1613, revizija B.
3. Zahteve za zagotavljanje kakovosti, ki jih treba izpolnjevati pri pripravi vzorca
Uporabljajo se splošne določbe za pripravo vzorcev za analizo iz Priloge II.
Poleg tega je treba izpolnjevati naslednje pogoje:
|
— |
vzorce je treba hraniti in prevažati v steklenih, aluminijastih, polipropilenskih ali polietilenskih posodah. Iz posode za vzorce je treba odstraniti sledi papirnega prahu. Steklena posoda se spere s topili, ki se predhodno preverijo zaradi prisotnosti dioksinov; |
|
— |
slepi preskus se izvede tako, da se izvede celotni analitski postopek brez vzorca; |
|
— |
masa vzorca, ki se uporablja za ekstrakcijo, mora zadoščati za izpolnitev zahtev glede občutljivosti. |
4. Zahteve za laboratorije
|
— |
Laboratoriji dokažejo zmogljivost metode v območju predpisane vrednosti, tj. 0,5-kratna, 1-kratna in 2-kratna predpisana vrednost s sprejemljivim koeficientom variacije za ponovljene analize. Za podrobnosti o merilih sprejemljivosti glej točko 5. |
|
— |
Meja kvantifikacije za potrditveno metodo je v območju približno ene petine predpisane vrednosti, s čimer se zagotovi, da so v območju predpisanih vrednosti sprejemljivi koeficienti variacije. |
|
— |
Redne slepe kontrole in preskusi z dodatkom ali analize kontrolnih vzorcev (zaželen je certificiran referenčni material, če je na voljo) se izvajajo kot ukrepi za notranji nadzor kakovosti. |
|
— |
Uspešno sodelovanje v medlaboratorijskih študijah, ki ocenjujejo uspešnost laboratorijev, je najboljši način za dokazovanje usposobljenosti za posebne analize. Vendar pa uspešno sodelovanje v medlaboratorijskih študijah, npr. za vzorce tal ali odplak, ne dokazuje nujno tudi usposobljenosti na področju vzorcev živil ali krme, ki predstavljajo nižje ravni onesnaženja. Zato je stalno sodelovanje v medlaboratorijskih študijah za določanje dioksinov in dioksinom podobnih PCB v ustreznih krmnih/živilskih matricah obvezna. |
|
— |
Laboratorije akreditirajo priznani organi, ki delujejo v skladu z ISO Guide 58, kar zagotovlja, da uporabljajo analitsko zagotavljanje kakovosti. Laboratoriji se akreditirajo v skladu s standardom ISO/IEC/17025. |
5. Zahteve za analitske postopke za dioksine in dioksinom podobne PCB
Osnovne zahteve za sprejetje analitskih postopkov:
|
— |
visoka občutljivost in nizke meje zaznavnosti. Za PCDD in PCDF morajo biti zaznavne količine v območju pikograma TEQ (10-12 g) zaradi visoke toksičnosti nekaterih od teh spojin. Za PCB je znano, da so njihove ravni višje od ravni PCDD in PCDF. Za večino PCB pripadnikov iste vrste je občutljivost v območju nanograma (10-9 g) že zadostna. Pri merjenju bolj toksičnih dioksinom podobnih PCB pripadnikov iste vrste (zlasti ne-orto substituiranih pripadnikov iste vrste) je treba doseči enako občutljivost kot za PCDD in PCDF; |
|
— |
visoka selektivnost (specifičnost). Razlikovati je treba med PCDD, PCDF in dioksinom podobnimi PCB ter med številnimi drugimi, sočasno ekstrahiranimi spojinami ter po možnosti spojinami, ki motijo analizo in so prisotne v koncentracijah, ki so do več velikostnih razredov večje od koncentracij zadevnih analitov. Pri metodi plinske kromatografije/masne spektrometrije (GC/MS) je treba razlikovati med različnimi pripadniki iste vrste, na primer med toksičnimi (npr. sedemnajstimi 2,3,7,8-substituiranimi PCDD in PCDF ter dioksinom podobnimi PCB) in pripadniki iste vrste. Biološki preskusi morajo biti sposobni selektivno določiti vrednosti TEQ kot vsoto PCDD, PCDF in dioksinom podobnih PCB; |
|
— |
visoka točnost (pravilnost in natančnost). Določanje zagotovlja veljavne in zanesljive ocene pravih koncentracij v vzorcu. Visoka točnost (točnost meritve: ujemanje merilnega rezultata s pravo ali dogovorjeno vrednostjo merilne veličine) je potrebna, da se prepreči zavrnitev rezultata analize vzorca na podlagi slabe zanesljivosti ocene TEQ. Točnost se izrazi kot pravilnost (razlika med srednjo vrednostjo izmerjenega analita v certificiranem materialu, in njegovo certificirano vrednostjo, izraženo kot odstotek te vrednosti) in natančnost (RSDR, relativni standardni odmik od rezultatov, pridobljenih pri pogojih, ki jih je možno obnoviti). |
Presejalne metode lahko obsegajo biološke preskuse in metode GC/MS; potrditvene metode so visoko ločljive plinske kromatografske/visoko ločljive masne spektrometrične (HRGC/HRMS) metode.
Pri skupni vrednosti TEQ morajo biti izpolnjena naslednja merila:
|
|
Presejalne metode |
Potrditvene metode |
|
Delež lažno negativnih rezultatov |
< 1 % |
|
|
Pravilnost |
|
- 20 % do + 20 % |
|
Natančnost RSDR |
< 30 % |
< 15 % |
6. Posebne zahteve, ki jih morajo za presejanje ali potrditev izpolnjevati metode GC/MS
|
— |
Dodajanje s 13C-označenih 2,3,7,8-klor substituiranih notranjih PCDD/F standardov in s 13C-označenih notranjih standardov za dioksinom podobne PCB je treba izvesti na samem začetku analitske metode, npr. pred ekstrakcijo, da se potrdi analitski postopek. Dodati je treba vsaj enega pripadnika iste vrste za vsako od tetra- do okta-kloriranih homolognih skupin za PCDD/F in vsaj enega pripadnika iste vrste za vsako od homolognih skupin za dioksinom podobne PCB (lahko pa se doda vsaj en pripadnik iste vrste za vsak spektrometrično izbran ion s funkcijo evidentiranja, ki se uporablja za spremljanje PCDD/F in dioksinom podobnih PCB). Prednost ima, še zlasti v primeru potrditvenih metod, uporaba vseh 17 s 13C-označenih 2,3,7,8-klor substituiranih notranjih PCDD/F standardov in vseh 12 s 13C-označenih notranjih standardov za dioksinom podobne PCB. |
|
— |
Prav tako se z uporabo ustreznih raztopin za umerjanje določijo relativni faktorji odzivnosti za tiste pripadnike iste vrste, katerim ni dodan s 13C označen analog. |
|
— |
Za krmo rastlinskega in živalskega izvora, ki vsebuje manj kot 10 % maščob, je obvezen dodatek notranjih standardov pred ekstrakcijo. Za krmo živalskega izvora, ki vsebuje več kot 10 % maščob, se notranji standardi lahko dodajo pred ekstrakcijo ali po ekstrakciji maščobe. Izvede se ustrezna potrditev učinkovitosti ekstrakcije, ki je odvisna od stopnje, na kateri se dodajo notranji standardi, in od tega, ali se o rezultatih poroča na podlagi proizvoda ali maščob. |
|
— |
Pred analizo GC/MS je treba dodati 1 ali 2 (nadomestna) standarda za izračun izkoristka. |
|
— |
Potreben je nadzor izkoristka. Za potrditvene metode morajo biti izkoristki posameznih notranjih standardov 60–120-odstotni. Nižji ali višji izkoristki za posamezne pripadnike iste vrste, zlasti za nekatere hepta- in okta-klorirane dibenzodioksine in dibenzofurane, so sprejemljivi, če njihov prispevek k vrednosti TEQ ne presega 10 % celotne vrednosti TEQ (temelji na vsoti PCDD/F in dioksinom podobnih PCB). Pri presejalnih metodah morajo biti izkoristki 30–140 %. |
|
— |
Ločevanje dioksinov od motečih kloriranih spojin, kot so dioksinom nepodobni PCB-ji in klorirani difenil etri, se izvede z ustreznimi kromatografskimi tehnikami (prednost imajo kolona s florizilom, kolona z aluminijevim oksidom in/ali kolona z ogljikom). |
|
— |
Plinsko kromatografsko ločevanje izomerov je zadostno (< 25 % vrh do vrha med 1,2,3,4,7,8-HxCDF in 1,2,3,6,7,8-HxCDF). |
|
— |
Določanje se izvede v skladu z metodo EPA, revizija 1613 B: tetra- do okta-klorirani dioksini in furani z redčenjem izotopov HRGC/HRMS ali drugi z enakovrednimi merili zmogljivosti. |
|
— |
Razlika med vrednostjo, zaokroženo navzgor, in vrednostjo, zaokroženo navzdol, ne sme presegati 20 % pri krmi, onesnaženi z dioksini v območju najvišje vrednosti ali nad njo. Pri krmi z ravnjo onesnaženosti bistveno pod najvišjo vrednostjo je lahko razlika 25–40-odstotna. |
7. Presejalne analitske metode
7.1 Uvod
Pri presejalni metodi se lahko uporabita različna analitska pristopa: čisti presejalni pristop in kvantitativni pristop.
Odziv vzorcev se primerja z odzivom referenčnega vzorca pri predpisani vrednosti. Vzorci z odzivom, ki je manjši od odziva referenčnega vzorca, so negativni, vzorci z višjim odzivom pa so verjetno pozitivni. Zahteve:
|
— |
v vsako serijo preskusov je treba vključiti slepe in referenčne vzorce, ki se ekstrahirajo in preskušajo sočasno in pod enakimi pogoji. Pri referenčnem vzorcu mora biti odziv jasno povišan glede na slepega; |
|
— |
vključijo se dodatni referenčni vzorci z 0,5-kratno in 2-kratno predpisano vrednostjo, da se dokaže primerna zmogljivost preskusa v območju predpisane vrednosti; |
|
— |
ko se preskušajo druge matrice, je treba dokazati ustreznost referenčnih vzorcev, priporočljivo z vključitvijo vzorcev, pri katerih je HRGC/HRMS pokazala, da vsebujejo raven TEQ, ki je približna ravni TEQ referenčnega vzorca, ali drugače s slepim vzorcem, ki je obogaten pri tej ravni; |
|
— |
ker se pri bioloških preskusih ne sme uporabljati notranjih standardov, so preskusi ponovljivosti zelo pomembni za pridobitev informacij o standardnem odmiku znotraj ene serije preskusov. Koeficient variacije mora biti pod 30 %; |
|
— |
za biološke preskuse se opredelijo ciljne spojine, možne motnje in najvišje sprejemljive ravni slepega preskusa. |
Kvantitativni pristop zahteva standardne serije redčenja, dvojno ali trojno čiščenje, merjenje ter kontrolo slepega vzorca in izkoristka. Rezultat se lahko izrazi kot TEQ, pri čemer se domneva, da spojine, ki tvorijo signal, ustrezajo načelu TEQ. To se lahko izvaja z uporabo TCDD (ali standardne mešanice dioksinov/furanov/dioksinom podobnih PCB), s katero se pripravi umeritvena krivulja za izračun vrednosti TEQ v ekstraktu in s tem v vzorcu. Ta se nato popravi za raven TEQ, izračunano za slepi vzorec (da se upošteva nečistost uporabljenih topil in kemikalij) in izkoristek (izračunan iz ravni TEQ v vzorcu za nadzor kakovosti v bližini predpisane meje). Bistveno je upoštevati, da se del vidne izgube pri izkoristku lahko pripiše učinkom matrice in/ali razlikam med vrednostmi TEF v bioloških preskusih in uradnimi vrednostmi TEF, ki jih je določila Svetovna zdravstvena organizacija.
7.2 Zahteve za analitske metode, ki se uporabljajo za presejanje
|
— |
Za presejanje se lahko uporabijo analitske metode GC/MS in biološki preskusi. Za metode GC/MS se uporabljajo zahteve iz točke 6. Posebne zahteve za biološke preskuse na celični osnovi so določene v točki 7.3, za biološke preskuse na podlagi pribora pa v točki 7.4. |
|
— |
Potrebne so informacije o številu lažno pozitivnih in lažno negativnih rezultatov velike skupine vzorcev pod in nad zgornjo ravnjo ali ravnjo dejavnosti, v primerjavi z vsebnostjo TEQ, kakor jo določa kvantitativna analitska metoda. Stopnja dejansko lažno negativnih rezultatov mora biti pod 1 %. Stopnja lažno pozitivnih vzorcev je dovolj nizka, da je uporaba presejalnega orodja koristna. |
|
— |
Pozitivne rezultate je vedno treba potrditi s potrditveno analitsko metodo (HRGC/HRMS). Poleg tega se vzorci iz širokega območja TEQ potrdijo z HRGC/HRMS (približno 2–10 % negativnih vzorcev). Na voljo so informacije o ujemanju med biološkim preskusom in rezultati analize HRGC/HRMS. |
7.3 Posebne zahteve za biološke preskuse na celični osnovi
|
— |
Pri izvajanju biološkega preskusa vsaka serija preskusov zahteva serijo referenčnih koncentracij TCDD ali mešanice dioksina/furana (celotna krivulja odmerek/odziv z R2 > 0,95). Vendar pa se za namene presejanja za analizo vzorcev nizkih ravni lahko uporabi razširjena krivulja nizkih ravni. |
|
— |
Za izid biološkega preskusa v konstantnem časovnem obdobju se na seznamu nadzora kakovosti uporabi referenčna koncentracija TCDD (približno 3-kratna meja določanja). Druga možnost je lahko relativni odziv referenčnega vzorca v primerjavi z umeritveno premico TCDD, ker lahko na odziv celic vplivajo številni dejavniki. |
|
— |
Za vsak tip referenčne snovi se evidentirajo in preverjajo preglednice nadzora kakovosti, da se zagotovi izid v skladu s predpisanimi smernicami. |
|
— |
Zlasti za kvantitativne izračune mora biti začetek redčenja vzorca znotraj linearnega dela krivulje odziva. Vzorce nad linearnim delom krivulje odziva je treba razredčiti in ponovno preskusiti. Zato je priporočljivo, da se hkrati preskušajo najmanj 3 razredčitve ali več. |
|
— |
Standardni odmik v odstotkih ni nad 15 % pri trikratnem določanju za vsako razredčitev vzorca in ni nad 30 % pri treh neodvisnih poskusih. |
|
— |
Meja določanja se lahko določi kot 3-kratni standardni odmik slepega topila ali odziva ozadja. Drugi pristop je uporaba odziva, ki je nad ozadjem (uporabljeni faktor je 5-kratno slepo topilo), izračunan iz umeritvene krivulje za tisti dan. Meja kvantifikacije se lahko določi kot 5-kratni ali 6-kratni standardni odmik slepega topila ali odziva ozadja ali pa se uporabi odziv, ki je razločno nad ozadjem (uporabljeni faktor je 10-kratno slepo topilo), izračunan iz umeritvene krivulje za tisti dan. |
7.4 Posebne zahteve za biološke preskuse s priborom
|
— |
Zagotovi se, da je biološki preskus s priborom dovolj občutljiv in zanesljiv za uporabo pri krmi. |
|
— |
Pri pripravi in analizi vzorca je treba slediti navodilom proizvajalca. |
|
— |
Kompleti za preskušanje se ne uporabljajo po preteku roka uporabnosti. |
|
— |
Snovi ali komponente, ki se uporabljajo z drugimi kompleti, se ne uporabljajo. |
|
— |
Kompleti za preskuse se hranijo pri natančno določeni temperaturi in uporabljajo pri natančno določeni delovni temperaturi. |
|
— |
Meja določanja za imunoanalize se določi kot vsota srednje vrednosti in 3-kratnega standardnega odmika, ki temeljita na 10 ponovitvah analize slepega vzorca, ta vsota pa se deli z naklonom linearne regresijske enačbe. |
|
— |
Za preskuse v laboratoriju se uporabljajo referenčni standardi, da se zagotovi odzivnost na standard znotraj sprejemljivega območja. |
8. Poročanje o rezultatih
Če uporabljeni analitski postopki to omogočajo, analitski rezultati vključujejo ravni posameznih PCDD/F in PCB pripadnikov iste vrste, predložiti pa jih je treba zaokrožene navzdol, navzgor ali proti sredini, da se v poročilo o rezultatih vključi kar največ informacij in tako omogoči razlaga rezultatov glede na posebne zahteve.
Poročilo vključuje tudi vsebnost lipidov v vzorcu ter metodo, uporabljeno za ekstrakcijo maščob.
Izkoristki posameznih notranjih standardov morajo biti na voljo, kadar so izkoristki izven območja, navedenega v točki 6, kadar je presežena najvišja vrednost in na zahtevo tudi v drugih primerih.
Ker je treba pri odločanju o skladnosti vzorca upoštevati nezanesljivost meritve, je na voljo tudi ta parameter. Rezultat analize se zato izrazi kot x +/- U, pri čemer je x rezultat analize, U pa razširjena nezanesljivost meritve, kar pri količniku zajetja 2 pomeni približno 95-odstotno stopnjo zaupanja. V primeru ločenih določanj dioksinov in dioksinom podobnih PCB je treba vsoto ocenjene razširjene nezanesljivosti ločenih rezultatov analize dioksinov in dioksinom podobnih PCB uporabiti za vsoto dioksinov in dioksinom podobnih PCB.
Če se pri nezanesljivosti meritve upošteva CCα (kot je opisan v I.2 tega dela B), se navede ta parameter.
(1) Preglednica s TEF (= dejavniki ekvivalence točnosti) za dioksine, furane in dioksinom podobne PCB:
|
Pripadnik iste vrste |
Vrednost TEF |
Pripadnik iste vrste |
Vrednost TEF |
|
Dibenzo-p-dioksini („PCDD“) |
|
Dioksinom podobni PCB: |
|
|
2,3,7,8-TCDD |
1 |
|
|
|
1,2,3,7,8-PeCDD |
1 |
Ne-orto PCB |
|
|
1,2,3,4,7,8-HxCDD |
0,1 |
PCB 77 |
0,0001 |
|
1,2,3,6,7,8-HxCDD |
0,1 |
PCB 81 |
0,0001 |
|
1,2,3,7,8,9-HxCDD |
0,1 |
PCB 126 |
0,1 |
|
1,2,3,4,6,7,8-HpCDD |
0,01 |
PCB 169 |
0,01 |
|
OCDD |
0,0001 |
Mono-orto PCB |
|
|
|
|
PCB 105 |
0,0001 |
|
Dibenzofurani („PCDF“) |
|
PCB 114 |
0,0005 |
|
2,3,7,8-TCDF |
0,1 |
PCB 118 |
0,0001 |
|
1,2,3,7,8-PeCDF |
0,05 |
PCB 123 |
0,0001 |
|
2,3,4,7,8-PeCDF |
0,5 |
PCB 156 |
0,0005 |
|
1,2,3,4,7,8-HxCDF |
0,1 |
PCB 157 |
0,0005 |
|
1,2,3,6,7,8-HxCDF |
0,1 |
PCB 167 |
0,00001 |
|
1,2,3,7,8,9-HxCDF |
0,1 |
PCB 189 |
0,0001 |
|
2,3,4,6,7,8-HxCDF |
0,1 |
|
|
|
1,2,3,4,6,7,8-HpCDF |
0,01 |
|
|
|
1,2,3,4,7,8,9-HpCDF |
0,01 |
|
|
|
OCDF |
0,0001 |
|
|
|
Uporabljene okrajšave: „T“ = tetra; „Pe“ = penta; „Hx“ = heksa; „Hp““= hepta; „O“ = okta; „CDD“ = klorodibenzo-p-dioksin; „CDF“ = klorodibenzofuran; „CB“ = klorobifenil. |
|||
(2) UL L 140, 30.5.2002, str. 10.
(3) Pojem „zaokroženo navzgor“ zahteva uporabo meje kvantifikacije za prispevek vsakega nekvantificiranega pripadnika iste vrste k ekvivalentu toksičnosti (TEQ).
Pojem „zaokroženo navzdol“ zahteva uporabo ničle za prispevek vsakega nekvantificiranega pripadnika iste vrste k ekvivalentu toksičnosti (TEQ).
Pojem „zaokroženo proti sredini“ zahteva uporabo polovice meje kvantifikacije za izračun prispevka vsakega nekvantificiranega pripadnika iste vrste k ekvivalentu toksičnosti (TEQ).
(4) Dvakratna analiza je potrebna, da se izključi možnost notranjega navzkrižnega onesnaženja ali naključne zamenjave vzorcev. Prva analiza se ob upoštevanju nezanesljivosti meritve uporablja za potrditev skladnosti.
Če se analiza izvaja zaradi onesnaženja z dioksinom, se lahko potrditev z dvakratno analizo izpusti, kadar so vzorci, ki se analizirajo, prek sledljivosti povezani z onesnaženjem z dioksinom.
PRILOGA VI
ANALITSKE METODE ZA DOLOČANJE SESTAVIN ŽIVALSKEGA IZVORA ZA URADNI NADZOR KRME
Zahteve za mikroskopsko določanje, identifikacijo ali oceno sestavin živalskega izvora v krmi
1. Cilj in področje uporabe
Te zahteve se uporabljajo, ko se določanje sestavin živalskega izvora (opredeljenih kot proizvodov iz predelave teles in telesnih delov sesalcev, perutnine in rib) v krmi izvaja z mikroskopskimi preiskavami v okviru usklajenega programa nadzora na področju prehrane živali v skladu z Uredbo Evropskega parlamenta in Sveta (ES) št. 882/2004 (1). Če se metode v tej prilogi uporabljajo pri vseh uradnih preskusih, se lahko izvedejo tudi dodatni preskusi, ki temeljijo na nekoliko spremenjeni ali drugi metodi, da se izboljša določanje nekaterih vrst sestavin živalskega izvora ali da se nadalje podrobneje opredeli izvor sestavin živalskega izvora. Pole tega se pri pregledovanju nekaterih posebnih sestavin živalskega izvora, kot so plazma ali kosti v loju (glej tudi točko 9), lahko uporabi spremenjeni protokol, če so te analize opravljene poleg analiz, ki so predvidene v usklajenem programu nadzora.
2. Občutljivost
V krmi se lahko glede na vrsto sestavine živalskega izvora določajo zelo majhne količine (< 0,1 %).
3. Načelo
Za identifikacijo se uporablja reprezentativni vzorec, ki je bil odvzet v skladu z določbami iz Priloge I in ustrezno pripravljen. Za obdelavo krme z nizko vsebnostjo vlage je ustrezen naslednji protokol. Krma s vsebnostjo vlage več kot 14 % se pred obdelavo osuši (kondenzira). Posebno krmo ali posamična krmila (npr. maščobe, olja) je treba namensko obdelati (glej točko 9). Sestavine živalskega izvora se opredelijo na podlagi tipičnih, mikroskopsko prepoznavnih značilnosti (tj. mišičnih vlaken in drugih mesnih delcev, hrustanca, kosti, roževine, ščetin, krvi, perja, jajčnih lupin, ribjih kosti, luskin). Opredelitev se mora izvesti na presejani frakciji (6.1) in koncentrirani usedlini (6.2) vzorca.
4. Reagenti
4.1 Sredstvo za pripravo preparatov
|
4.1.1 |
Kloralhidrat (vodni, 60 % m/v) |
|
4.1.2 |
Lug (NaOH 2,5 % m/v ali KOH 2,5 % m/v) za presejane frakcije |
|
4.1.3 |
Parafinsko olje ali glicerol (viskoznost: 68–81) za mikroskopska opazovanja v usedlini |
4.2 Sredstva za izpiranje
|
4.2.1 |
Alkohol, 96-odstotni |
|
4.2.2 |
Aceton |
4.3 Sredstvo za koncentriranje
|
4.3.1 |
Tetrakloroetilen (gostota 1,62) |
4.4 Reagenti za obarvanje
|
4.4.1 |
Raztopina joda/kalijevega jodida (2 g kalijevega jodida se raztopi v 100 ml vode in med pogostim stresanjem doda 1 g joda.) |
|
4.4.2 |
Rdeči alizarin (2,5 ml 1M klorovodikove kisline se raztopi v 100 ml vode in tej raztopini se doda 200 mg rdečega alizarina.) |
|
4.4.3 |
Cistinski reagent (2 g svinčevega acetata, 10 g NaOH/100 ml H2O) |
|
4.4.4 |
Raztopina joda/kalijevega jodida (raztopljeno v 70-odstotnem etanolu) |
4.5 Reagent za beljenje
|
4.5.1 |
Komercialna raztopina natrijevega hipoklorita (9,6 % aktivnega klora) |
5. Oprema in pripomočki
|
5.1 |
Analitska tehtnica (natančnost 0,01 g, razen za koncentrirano usedlino: 0,001 g) |
|
5.2 |
Pribor za mletje (drobilni mlin ali terilnica, posebej za krmo, ki ob analizi vsebuje > 15 % maščobe) |
|
5.3 |
Sito z mrežico s kvadratnimi odprtinami širine največ 0,50 mm |
|
5.4 |
Lij ločnik ali konična čaša za usedlino |
|
5.5 |
Stereomikroskop (najmanj 40-kratna povečava) |
|
5.6 |
Sestavljeni mikroskop (najmanj 400-kratna povečava), prepustna svetloba ali polarizirana svetloba |
|
5.7 |
Standardna laboratorijska steklovina Vsa oprema se temeljito očisti. Liji ločniki in steklovina se morajo oprati v pomivalnem stroju. Sita se morajo očistiti z uporabo krtače s trdimi ščetinami. |
6. Postopek
Krma v briketih se lahko predhodno preseje, če se obe frakciji analizirata kot ločena vzorca.
Obdela se najmanj 50 g vzorca (previdno se zdrobi s primerno opremo za drobljenje (5.2), če je potrebno, da se dobi ustrezna struktura). Iz zmletega materiala se vzameta dva reprezentativna dela, eden za presejano frakcijo (najmanj 5 g) (6.1) in eden za koncentrirano usedlino (najmanj 5 g) (6.2). Za identifikacijo se dodatno lahko uporabi barvanje z reagenti za barvanje (6.3).
Za opredelitev narave živalskih beljakovin in izvora delcev se lahko uporabi sistem podpore pri določanju, kot je ARIES, in dokumentirajo referenčni vzorci.
6.1 Identifikacija sestavin živalskega izvora v presejanih frakcijah
Najmanj 5 g vzorca se preseje skozi sito (5.3) v dve frakciji.
Presejane frakcije z velikimi delci (ali reprezentativni del frakcije) se v tankem sloju nanesejo na primerno podlago ter se pri različnih povečavah sistematično pregledajo pod stereomikroskopom (5.5), da se ugotovijo sestavine živalskega izvora.
Mikroskopski preparati iz presejanih frakcij z drobnimi delci se sistematično pregledajo pod sestavljenim mikroskopom (5.6) pri različnih povečavah, da se ugotovijo sestavine živalskega izvora.
6.2 Opredelitev sestavin živalskega izvora v koncentrirani usedlini
V lij ločnik ali konično čašo za usedlino se prenese najmanj 5 g (na 0,01 g natančno) vzorca, ki se obdela z najmanj 50 ml tetrakloroetilena (4.3.1). Mešanica se večkrat pretrese ali premeša.
|
— |
Če se uporabi zaprt lij ločnik, se usedlina pusti stati tako dolgo (najmanj 3 minute), dokler se ne loči. Usedlina se ponovno pretrese in ponovno pusti stati najmanj 3 minute. Usedlina se ponovno loči. |
|
— |
Če se uporabi odprta čaša, se usedlina pusti stati vsaj 5 minut, dokler se ne loči. |
Celotna usedlina se osuši in nato stehta (na 0,001 g natančno). Tehtanje je potrebno le, če se zahteva ocena. Če usedlina vsebuje mnogo velikih delcev, se lahko skozi sito (5.3) preseje v dve frakciji. Posušena usedlina se pregleda pod stereomikroskopom (5.5) in sestavljenim mikroskopom (5.6), da se ugotovijo kostne sestavine.
6.3 Uporaba sredstev za pripravo preparatov in reagentov za obarvanje
Mikroskopska identifikacija sestavin živalskega izvora se lahko izboljša tudi s pomočjo posebnih sredstev za pripravo preparatov in reagentov za obarvanje.
Kloralhidrat (4.1.1): Ob previdnem segrevanju so lahko celične strukture jasnejše vidne, ker se škrobne verige želatinizirajo, nezaželene celične sestavine pa odstranijo.
Lug (4.1.2): krmni material se očisti z natrijevim hidroksidom ali kalijevim hidroksidom, kar olajša določanje mišičnih vlaken, ščetin in drugih keratinskih struktur.
Parafinsko olje in glicerol (4.1.3): Kostne sestavine se lahko dobro identificirajo v tem sredstvu za pripravo preparatov, ker je v večini kostnih votlinic (lacunae) še vedno zrak in so zato vidne kot črne luknje, velikosti približno 5–15 μm.
Raztopina joda/kalijevega jodida (4.4.1): uporablja se za določanje škroba (modrovijolična barva) in beljakovin (rumenooranžna barva). Raztopine se lahko po potrebi razredčijo.
Raztopina rdečega alizarina (4.4.2): rdečerožnato obarvanje kosti, ribjih kosti in luskin. Pred sušenjem sedimenta (glej točko 6.2) se celotni sediment prenese v stekleno epruveto in dvakrat spere s približno 5 ml alkohola (4.2.1) (pri vsaki uporabi vorteks mešalnika se topilo pusti stati približno 1 minuto ter se nato odtoči). Pred uporabo tega reagenta za obarvanje se sediment pobeli z dodatkom najmanj 1 ml raztopine natrijevega hipoklorita (4.5.1). Čas reakcije je 10 minut. Epruveta se napolni z vodo, usedlina se pusti stati 2–3 minute, voda in raztopljeni delci pa se odtočijo. Usedlina se dvakrat spere z 10 ml vode (uporabi se vorteks mešalnik, pusti se stati in vsakič se odtoči voda). Doda se 2–10 ali več kapljic (glede na količino ostanka) raztopine rdečega alizarina. Mešanica se stresa, reakcija pa poteka nekaj sekund. Obarvana usedlina se dvakrat spere s približno 5 ml alkohola (4.2.1), nato pa enkrat z acetonom (4.2.2) (vsakič ko se uporabi vorteks mešalnik, se topilo pusti stati približno 1 minuto ter se nato odtoči). Usedlina je takrat pripravljena za sušenje.
Cistinski reagent (4.4.3): Pri previdnem segrevanju se sestavine, ki vsebujejo cistin (ščetine, perje itd.), obarvajo črnorjavo.
6.4 Pregled krme zaradi morebitne vsebnosti ribje moke
Pod sestavljenim mikroskopom se pregleda najmanj en mikroskopski preparat iz drobno presejane frakcije in drobne frakcije usedline (glej točki 6.1 in 6.2).
Kadar oznaka navaja, da sestavine vsebujejo ribjo moko, ali kadar obstaja sum na vsebnost ribje moke ali kadar se odkrije vsebnost ribje moke že pri začetni preiskavi, se iz izvirnega vzorca pregledata najmanj dva dodatna mikroskopska preparata iz drobno presejane frakcije ter frakcije celotne usedline.
7. Izračun in ocena
Države članice zagotovijo, da se postopki, opisani v tej točki, uporabljajo pri izvajanju uradne analize, da se oceni količina (in ne zgolj vsebnost) sestavin živalskega izvora.
Izračun je možno narediti le, če sestavine živalskega izvora vsebujejo delce kosti.
Delci kosti toplokrvnih kopenskih vrst (tj. sesalcev in ptic) se lahko v mikroskopskih preparatih ločijo od različnih vrst ribjih kosti na podlagi tipičnih kostnih votlinic (lacunae). Delež sestavin živalskega izvora se v vzorčenem materialu oceni glede na:
|
— |
ocenjeni delež (masni %) kostnih delcev v koncentrirani usedlini in |
|
— |
delež (masni %) kosti v sestavinah živalskega izvora. |
Ocena mora temeljiti na najmanj treh mikroskopskih preparatih (če je možno) in na najmanj petih poljih na preparat. Koncentrirana usedlina v krmnih mešanicah praviloma ne vsebuje samo delcev kosti kopenskih živali in rib, ampak tudi druge delce z visoko specifično maso, npr. minerale, pesek, delce olesenelih rastlin in podobno.
7.1 Ocenjena vrednost odstotnega deleža delcev kosti
% delcev kosti kopenskih živali = (S × c)/W
% delcev ribjih kosti in luskin = (S × d)/W
|
(S = |
masa usedline (mg), c = korekcijski faktor (%) za ocenjeni delež kosti kopenskih živali v usedlini, d = korekcijski faktor (%) za ocenjeni delež delcev ribjih kosti in luskin v usedlini, W = masa materiala vzorca za sedimentacijo (mg)). |
7.2 Ocenjena vrednost sestavin živalskega izvora
Delež kosti se v živalskih proizvodih lahko močno razlikuje. (Delež kosti pri kostni moki je 50–60 %, pri mesni moki pa 20–30 %; pri ribji moki se vsebnost kosti in luskin razlikuje glede na kategorijo in izvor ribje moke, ponavadi pa je 10–20 %).
Če je znana vrsta živalske moke, prisotne v vzorcu, je možno oceniti vsebnost:
ocenjena vsebnost sestavin proizvodov kopenskih živali (%) = (S × c)/(W × f) × 100;
ocenjena vsebnost sestavin ribjih proizvodov (%) = (S × d)/(W × f) × 100
|
(S = |
masa usedline (mg), c = korekcijski faktor (%) za ocenjeni delež kostnih sestavin kopenskih živali v usedlini, d = korekcijski faktor (%) za ocenjeni delež delcev ribjih kosti in luskin v usedlini, f = korekcijski faktor za delež kosti v sestavinah živalskega izvora v pregledanem vzorcu, W = masa materiala vzorca za sedimentacijo (mg)). |
8. Prikaz rezultatov preiskave
Poročilo vsebuje vsaj informacije o prisotnosti sestavin iz kopenskih živali in ribje moke. O različnih primerih se poroča na naslednji način:
|
8.1 |
za prisotnost sestavin iz kopenskih živali:
|
|
8.2 |
za prisotnost ribje moke:
V primeru ugotovljenih sestavin ribjega izvora ali izvora kopenskih živali se lahko v poročilu o rezultatih pregleda, če se zahteva, nadalje navede ocena količine ugotovljenih sestavin (x %, < 0,1 %, 0,1–0,5 %, 0,5–5 % ali > 5 %), podrobno opredeli vrsta kopenske živali, če je možno, in ugotovi živalske sestavine (mišična vlakna, hrustanec, kosti, roževina, ščetine, perje, kri, jajčne lupine, ribje kosti, luskine). Kadar se ocenjuje količina sestavin živalskega izvora, se navede uporabljeni korekcijski faktor f. Kadar se identificirajo kostne sestavine kopenskih živali, poročilo vsebuje dodatni stavek: „Možnost, da so bile zgornje sestavine pridobljene iz sesalcev, ne more biti izključena.“ Ta dodatni stavek ni potreben, kadar so delci kosti kopenskih živali opredeljeni kot delci kosti perutnine ali sesalcev. |
9. Izbirni protokol za analizo maščobe ali olja
Za analizo maščobe ali olja se lahko uporabi naslednji protokol:
|
— |
če je maščoba trdna, se segreva v na primer mikrovalovni pečici, dokler ne postane tekoča, |
|
— |
40 ml maščobe z dna vzorca se odpipetira v centrifugirko, |
|
— |
centrifugira se 10 minut pri 4 000 obr./min., |
|
— |
če je maščoba trdna po centrifugiranju, se ponovno segreva v pečici, dokler ne postane tekoča. Ponovno se centrifugira 5 minut pri 4 000 obr./min., |
|
— |
z majhno žličko ali lopatico se polovica dekantirane nečistoče prenese v majhno petrijevko ali na mikroskopsko stekelce za mikroskopsko identifikacijo morebitne vsebnosti sestavin živalskega izvora (mesnih vlaken, perja, delcev kosti itd.). Kot sredstvo za pripravo preparatov za mikroskopijo se priporoča parafinsko olje ali glicerol, |
|
— |
ostanki nečistoče se uporabijo za usedlino, kakor je opisano v točki 6.2. |
PRILOGA VII
METODA IZRAČUNA ENERGIJSKE VREDNOSTI KRME ZA PERUTNINO
1. Metoda izračuna in prikaza energijske vrednosti
Energijska vrednost krme za perutnino mora biti izračunana v skladu s formulo, določeno v nadaljnjem besedilu na podlagi odstotkov nekaterih analitskih sestavin krme. Ta vrednost se izrazi v megajoulih (MJ) presnovne energije (ME), popravljeno za dušik, na kilogram krmne mešanice:
MJ/kg ME = 0,1551 × % surovih beljakovin +0,3431 × % surovih maščob +0,1669 × % škroba +0,1301 × % celotnega sladkorja (izraženega kot saharoza).
2. Odstopanja, ki se uporabljajo za označene vrednosti
Če se v okviru uradnega pregleda odkrije razlika (povečana ali zmanjšana energijska vrednost krme) med rezultatom pregleda in označeno energijsko vrednostjo, je dovoljeno minimalno odstopanje 0,4 MJ/kg ME.
3. Prikaz rezultatov
Po uporabi zgoraj navedene formule je treba dobljeni rezultat izraziti z eno decimalko.
4. Metode vzorčenja in analitske metode
Vzorčenje krmnih mešanic in določanje vsebnosti analitskih sestavin, navedenih v metodi izračuna, je treba izvesti v skladu z metodami Skupnosti za vzorčenje ali analitskimi metodami Skupnosti za uradni pregled krme.
Uporablja se naslednje:
|
— |
za določanje vsebnosti surove maščobe: postopek B metode za določanje surovih olj in maščob iz dela H Priloge III, |
|
— |
za določanje vsebnosti škroba: polarimetrična metoda iz dela L Priloge III. |
PRILOGA VIII
ANALITSKE METODE ZA NADZOR KRMNIH DODATKOV, KI NISO VEČ DOVOLJENI
Pomembno obvestilo:Za določanje krmnih dodatkov, ki niso več dovoljeni, se lahko uporabljajo analitske metode, ki so občutljivejše od analitskih metod, navedenih v tej prilogi.Za potrditev se uporabljajo analitske metode iz te priloge.
A. DOLOČANJE METIL BENZOKVATA
7-benziloksi-6-butil-3-metoksikarbonil-4-kinolon
1. Namen in področje uporabe
Ta metoda omogoča določanje ravni metil benzokvata v krmi. Meja kvantifikacije je 1 mg/kg.
2. Načelo
Metil benzokvat se ekstrahira iz vzorca z raztopino metanol metansulfonske kisline. Ekstrakt se prečisti z diklorometanom z ionsko izmenjevalno kromatografijo in nato ponovno z diklorometanom. Vsebnost metil benzokvata se določi s tekočinsko kromatografijo visoke ločljivosti (HPLC) z reverzno fazo in UV-detektorjem.
3. Reagenti
|
3.1 |
Diklorometan |
|
3.2 |
Metanol, za HPLC |
|
3.3 |
Mobilna faza HPLC mešanica metanola (3.2) in vode (za HPLC) 75 + 25 (v + v) Filtrira se skozi filter 0,22 μm (4,5), raztopina pa se nato razplini (npr. 10 minut v ultrazvočni kopeli). |
|
3.4 |
Raztopina metansulfonske kisline, c = 2 % 20,0 ml metansulfonske kisline se razredči z metanolom (3.2) do 1 000 ml. |
|
3.5 |
Raztopina klorovodikove kisline, c = 10 % 100 ml klorovodikove kisline (ρ201,18 g/ml) se razredči z vodo do 1 000 ml. |
|
3.6 |
Kationsko izmenjevalna smola Amberlite CG-120 (Na), 100 do 200 meš Smola se pred uporabo obdela. 100 g smole se suspendira v 500 ml raztopine klorovodikove kisline (3.5) in se med neprestanim mešanjem segreva na vroči plošči do vretja. Ohladi se in kislina se oddekantira. Filtrira se skozi papirni filter pod vakuumom. Smola se dvakrat spere s po 500 ml vode, nato pa še z 250 ml metanola (3.2). Nato se še enkrat spere s 250 ml metanola in osuši z zrakom, ki prehaja skozi filtrirano pogačo. Suha smola se hrani v zaprti steklenici. |
|
3.7 |
Standardna snov: čisti metil benzokvat (7-benziloksi-6-butil-3-metoksikarbonil-4-kinolon) |
|
3.7.1 |
50 mg standardne snovi (3.7) se natehta na 0,1 mg natančno in raztopi v raztopini metansulfonske kisline (3.4) v 100-mililitrski merilni bučki, dopolni se do oznake in premeša. |
|
3.7.2 |
5,0 ml osnovne standardne raztopine metil benzokvata (3.7.1) se prenese v 50-mililitrsko merilno bučko, dopolni do oznake z metanolom (3.2) in premeša. |
|
3.7.3 |
V serijo 25-mililitrskih merilnih bučk se prenese 1,0, 2,0, 3,0, 4,0 in 5,0 ml vmesne standardne raztopine metil benzokvata (3.7.2). Dopolni se do oznake z mobilno fazo (3.3) in premeša. Koncentracija metil benzokvata v teh raztopinah je 2,0, 4,0, 6,0, 8,0 in 10,0 μg/ml. Te raztopine je treba pripraviti sveže pred uporabo. |
4. Oprema
|
4.1 |
Laboratorijski stresalnik |
|
4.2 |
Rotacijski uparjalnik |
|
4.3 |
Steklena kolona (250 mm × 15 mm) s petelinčkom in kapaciteto rezervoarja približno 200 ml |
|
4.4 |
Oprema za HPLC z ultravijoličnim detektorjem z nastavljivo valovno dolžino ali detektorjem s serijo diod |
|
4.4.1 |
Kolona za tekočinsko kromatografijo: 300 mm × 4 mm, C18, polnitev 10 μm ali enakovredna |
|
4.5 |
Membranski filtri, 0,22 μm |
|
4.6 |
Membranski filtri, 0,45 μm |
5. Postopek
5.1 Splošno
|
5.1.1 |
Z analizo slepe krme se zagotovi, da niso prisotni niti metil benzokvat niti moteče snovi. |
|
5.1.2 |
Preskus izkoristka se izvede z analizo slepe krme, ki se ji doda količina metil benzokvata, podobna količini v vzorcu. Za koncentracijo 15 mg/kg se k 20 g slepe krme doda 600 μl osnovne standardne raztopine (3.7.1), premeša se in počaka 10 minut, preden se začne postopek ekstrakcije (5.2). Opomba: Pri tej metodi je vrsta slepe krme podobna vrsti vzorca in pri analizi se dokaže odsotnost metil benzikvata. |
5.2 Ekstrakcija
Približno 20 g pripravljenega vzorca se natehta na 0,01 g natančno in prenese v 250-mililitrsko erlenmajerico. Doda se 100,0 ml raztopine metansulfonske kisline (3.4) in mehansko stresa (4.1) 30 minut. Raztopina se filtrira skozi papirni filter, filtrat pa se shrani za postopek ločevanja tekočina-tekočina (5.3).
5.3 Ločevanje tekočina-tekočina
V 500-mililitrski lij ločnik, v katerem je 100 ml raztopine klorovodikove kisline (3.5), se prenese 25,0 ml filtrata, ki nastane pri postopku iz točke 5.2. V lij se doda 100 ml diklorometana (3.1) in stresa eno minuto. Počaka se, da se plasti ločijo, spodnja (diklorometanska) plast pa se odlije v 500-mililitrsko bučko z okroglim dnom. Ekstrakcija vodne faze se dvakrat ponovi s po 40 ml diklorometana, ki se priključijo prvemu ekstraktu v bučki z okroglim dnom. Ekstrakt diklorometana se upari do suhega v rotacijskem uparjalniku (4.2) pri znižanem tlaku in 40 oC. Ostanek se raztopi v 20–25 ml metanola (3.2), bučka se zamaši, celotni ekstrakt pa se shrani za ionsko izmenjevalno kromatografijo (5.4).
5.4 Ionska izmenjevalna kromatografija
5.4.1
V spodnji del steklene kolone (4.3) se vstavi zamašek iz steklene volne. Pripravi se suspenzija s 5,0 g obdelane kationske izmenjevalne smole (3.6) in 50 ml klorovodikove kisline (3.5), nato pa se vlije v stekleno kolono in počaka, da se usede. Presežek kisline se odstrani do višine tik nad površino smole, nato pa se kolona spira z vodo do nevtralne reakcije eluata na lakmusov papir. 50 ml metanola (3.2) se prenese v kolono in pusti, da prodre na površino smole.
5.4.2
Nastali ekstrakt (5.3) se pazljivo odpipetira na kolono. Bučka z okroglim dnom se dvakrat spere s po 5–10 ml metanola (3.2), izpirka pa se preneseta na kolono. Ekstrakt se spusti do površine smole, kolona pa se spere s 50 ml metanola, pri čemer hitrost pretoka ne sme preseči 5 ml na minuto. Eluat se zavrže. Metil benzokvat se iz kolone eluira s 150 ml raztopine metansulfonske kisline (3.4), eluat s kolone pa se zbere v 250-mililitrsko erlenmajerico.
5.5 Ločevanje tekočina-tekočina
Eluat, ki nastane pri postopku iz točke 5.4.2, se prenese v litrski lij ločnik. Erlenmajerica se spere s 5–10 ml metanola (3.2), izpirek pa se združi z vsebino v liju ločniku. Doda se 300 ml raztopine klorovodikove kisline (3.5) in 130 ml diklorometana (3.1). Stresa se 1 minuto in pusti, da se fazi ločita. Spodnja (diklorometanska) plast se odtoči v 500-mililitrsko bučko z okroglim dnom. Ekstrakcija vodne faze se dvakrat ponovi s po 70 ml diklorometana, oba ekstrakta pa se združita s prvim v bučki z okroglim dnom.
Ekstrakt diklorometana se upari do suhega v rotacijskem uparjalniku (4.2) pod znižanim tlakom ter pri 40 oC. Ostanek v bučki se raztopi v približno 5 ml metanola (3.2), raztopina pa se prenese v 10-mililitrsko merilno bučko. Bučka z okroglim dnom se dvakrat spere s po 1–2 ml metanola, izpirka pa se preneseta v merilno bučko. Dopolni se z metanolom do oznake in premeša. Alikvot se filtrira skozi membranski filter (4.6). Ta raztopina se shrani za določanje s HPLC (5.6).
5.6 Določanje s HPLC
5.6.1
Naslednji pogoji se lahko uporabljajo kot smernica, lahko pa se uporabljajo drugi pogoji, če zagotavljajo enakovredne rezultate:
|
— |
kolona za tekočinsko kromatografijo (4.4.1), |
|
— |
HPLC-mobilna faza: mešanica metanola in vode (3.3), |
|
— |
hitrost pretoka: 1–1,5 ml/min, |
|
— |
valovna dolžina detekcije: 265 nm, |
|
— |
volumen, ki se vbrizga: 20–50 μl. |
Stabilnost kromatografskega sistema se preveri z večkratnim vbrizganjem raztopine za umerjanje (3.7.3) s koncentracijo 4 μg/ml, dokler se ne dosežejo konstantne višine (ali površine) vrhov in konstantni retencijski časi.
5.6.2
Vsaka raztopina za umerjanje (3.7.3) se večkrat vbrizga in za vsako koncentracijo se izmerijo višine (površine) vrhov. Umeritvena krivulja se pripravi tako, da se na ordinato nanesejo srednje vrednosti višin ali površin vrhov raztopin za umerjanje, na absciso pa ustrezne koncentracije v μg/ml.
5.6.3
Ekstrakt vzorca (5.5) se večkrat vbrizga, pri tem se uporabijo enaki volumni kakor pri raztopini za umerjanje, ter določijo srednje vrednosti višin (površin) vrhov metil benzokvata.
6. Izračun rezultatov
Koncentracija raztopine vzorca v μg/ml se določi iz srednjih vrednosti vrhov (površin) metil benzokvata iz umeritvene krivulje (5.6.2).
Vsebnost metil benzokvata (w) (mg/kg) v vzorcu se izračuna po naslednji formuli:

pri čemer je:
|
c |
= |
koncentracija metil benzokvata v raztopini vzorca v μg/ml; |
|
m |
= |
masa preskušanega vzorca v gramih. |
7. Potrditev rezultatov
7.1 Identiteta
Identiteta analita se lahko potrdi z dodatno kromatografijo ali z detektorjem s serijo diod, s katerim se primerjata spekter ekstrakta vzorca in spekter raztopine za umerjanje (3.7.3) s koncentracijo 10 μg/ml.
7.1.1
Ekstraktu vzorca se doda ustrezna količina vmesne standardne raztopine (3.7.2). Količina dodanega metil benzokvata mora biti podobna ocenjeni količini metil benzokvata v ekstraktu vzorca.
Povišan je le vrh metil benzokvata ob upoštevanju dodane količine in razredčitve ekstrakta. Širina vrha na polovici njegove največje višine mora biti v mejah približno 10 % prvotne širine.
7.1.2
Rezultati se ocenijo glede na naslednja merila:
|
(a) |
valovni dolžini maksimalne absorpcije spektra vzorca in spektra standarda, zabeleženi na najvišji točki vrha kromatograma, morata biti enaki znotraj meja, določenih z ločljivostjo sistema za detekcijo. Za detekcijo s serijo diod je to ponavadi v območju približno 2 nm; |
|
(b) |
med 220 in 350 nm se spekter vzorca in spekter standarda na najvišji točki kromatografskega vrha za navedene dele spektra ne smeta razlikovati znotraj območja od 10 do 100 % relativne absorbance. To merilo je izpolnjeno, ko so prisotne iste najvišje vrednosti in ko odmik med dvema spektroma na nobeni opazovani točki ne preseže 15 % absorbance standardnega analita; |
|
(c) |
med 220 in 350 nm se spektri naraščanja, najvišje točke vrha in padanja vrha, pridobljeni iz ekstrakta vzorca, za navedene dele spektra ne smejo razlikovati med seboj v območju 10 do 100 % relativne absorbance. To merilo je izpolnjeno, ko so prisotne iste najvišje točke in ko odmik med spektri na nobeni od opazovanih točk ne preseže 15 % absorbance spektra najvišje točke. |
Če eno od teh meril ni izpolnjeno, prisotnost analita ni potrjena.
7.2 Ponovljivost
Razlika med rezultatoma dveh vzporednih določanj, izvedenih na istem vzorcu, ne sme presegati 10 % višjega rezultata za vsebnosti metil benzokvata 4–20 mg/kg.
7.3 Izkoristek
Za slepi vzorec z dodatkom je izkoristek najmanj 90-odstoten.
8. Rezultati medlaboratorijske študije
10 laboratorijev je analiziralo 5 vzorcev. Vsak vzorec je bil analiziran dvakrat.
|
|
Slepi preskus |
Obrok 1 |
Briketi 1 |
Obrok 2 |
Briketi 2 |
|
Srednja vrednost [mg/kg] |
ND |
4,50 |
4,50 |
8,90 |
8,70 |
|
Sr [mg/kg] |
— |
0,30 |
0,20 |
0,60 |
0,50 |
|
CVr [ %] |
— |
6,70 |
4,40 |
6,70 |
5,70 |
|
SR [mg/kg] |
— |
0,40 |
0,50 |
0,90 |
1,00 |
|
CVR [ %] |
— |
8,90 |
11,10 |
10,10 |
11,50 |
|
Izkoristek [ %] |
— |
92,00 |
93,00 |
92,00 |
89,00 |
|
ND |
= |
ni bilo ugotovljeno; |
|
Sr |
= |
standardni odmik ponovljivosti; |
|
CVr |
= |
koeficient variacije ponovljivosti v %; |
|
SR |
= |
standardni odmik obnovljivosti; |
|
CVR |
= |
koeficient variacije obnovljivosti v %. |
B. DOLOČANJE OLAKVINDOKSA
2-[N-2'-(hidroksietil)karbamoil]-3-metilkvinoksalin-N1,N4-dioksid
1. Namen in področje uporabe
Ta metoda omogoča določanje ravni olakvindoksa v krmi. Meja kvantifikacije je 5 mg/kg.
2. Načelo
Vzorec se ekstrahira z mešanico vode in metanola. Vsebnost olakvindoksa se določi s tekočinsko kromatografijo visoke ločljivosti (HPLC) z reverzno fazo z uporabo UV-detektorja.
3. Reagenti
|
3.1 |
Metanol |
|
3.2 |
Metanol, za HPLC |
|
3.3 |
Voda, za HPLC |
|
3.4 |
Mobilna faza za HPLC Mešanica vode (3.3) in metanola (3.2), 900 + 100 (V + V) |
|
3.5 |
Standardna snov: čisti olakvindoks 2-[N-2'-(hidroksietil)karbamoil]-3-metilkvinoksalin-N1,N4-dioksid, E 851 |
|
3.5.1 |
50 mg olakvindoksa (3.5) se natehta na 0,1 mg natančno in prenese v 200-mililitrsko merilno bučko, nato pa se doda približno 190 ml vode. Bučka se nato postavi za 20 minut v ultrazvočno kopel (4.1). Po ultrazvočni obdelavi se raztopina segreje na sobno temperaturo, dopolni z vodo do oznake in premeša. Bučka se ovije v aluminijasto folijo in shrani v hladilniku. To raztopino je treba pripraviti svežo vsak mesec. |
|
3.5.2 |
10,0 ml osnovne standardne raztopine (3.5.1) se prenese v 100-mililitrsko merilno bučko, dopolni z mobilno fazo (3.4) do oznake in premeša. Bučka se ovije v aluminijasto folijo in shrani v hladilniku. To raztopino je treba pripraviti svežo vsak dan. |
|
3.5.3 |
V serijo 50-mililitrskih merilnih bučk se prenese 1,0, 2,0, 5,0, 10,0, 15,0 in 20,0 ml vmesne standardne raztopine (3.5.2). Dopolni se z mobilno fazo (3.4) do oznake in premeša. Bučke se ovije v aluminijasto folijo. Te raztopine ustrezajo 0,5, 1,0, 2,5, 5,0, 7,5 in 10,0 μg olakvindoksa na ml. Te raztopine je treba pripraviti sveže vsak dan. |
4. Oprema
|
4.1 |
Ultrazvočna kopel |
|
4.2 |
Mehanski stresalnik |
|
4.3 |
Oprema za HPLC z detektorjem ultravijolične svetlobe z nastavljivo valovno dolžino ali detektorjem s serijo diod |
|
4.3.1 |
Kolona za tekočinsko kromatografijo, 250 mm × 4 mm C18, 10 μm polnitev ali enakovredna |
|
4.4 |
Membranski filtri, 0,45 μm |
5. Postopek
|
Opomba: |
Olakvindoks je občutljiv na svetlobo. Vsi postopki se izvajajo v temnem prostoru ali pa se uporabijo posode iz rjavega stekla. |
5.1 Splošno
|
5.1.1 |
Z analizo slepe krme se zagotovi, da niso prisotni niti olakvindoks niti moteče snovi. |
|
5.1.2 |
Preskus izkoristka se izvede z analizo slepe krme, ki se ji doda količina olakvindoksa, podobna količini v vzorcu. Za koncentracijo 50 mg/kg se 10,0 ml osnovne standardne raztopine (3.5.1) prenese v 250-mililitrsko erlenmajerico, raztopina pa se upari do približno 0,5 ml. Doda se 50 g slepe krme, dobro se premeša in pusti 10 minut ter vmes nekajkrat ponovno premeša, nato pa se nadaljuje s postopkom ekstrakcije (5.2).
|
5.2 Ekstrakcija
Približno 50 g vzorca se natehta na 0,01 g natančno. Prenese se v 1 000-mililitrsko erlenmajerico, doda se 100 ml metanola (3.1), erlenmajerica pa se postavi za 5 minut v ultrazvočno kopel (4.1). Doda se 410 ml vode in se pusti še 15 minut v ultrazvočni kopeli. Bučka se odstrani iz ultrazvočne kopeli, 30 minut se stresa s stresalnikom (4.2), nato pa se filtrira skozi naguban filter. 10,0 ml filtrata se prenese v 20-mililitrsko merilno bučko, dopolni se z vodo do oznake in premeša. Alikvot se filtrira skozi membranski filter (4.4) (glej točko 9 Opomba). Nadaljuje se z določanjem s HPLC (5.3).
5.3 Določanje s HPLC
5.3.1
Naslednji pogoji se lahko uporabljajo kot smernice, lahko pa se uporabljajo drugi pogoji, če zagotavljajo enakovredne rezultate.
|
Analitska kolona (4.3.1) |
|
|
Mobilna faza (3.4): |
mešanica vode (3.3) in metanola (3.2), 900 + 100 (V + V) |
|
Hitrost pretoka: |
1,5–2 ml/min |
|
Detekcijska valovna dolžina: |
380 nm |
|
Volumen, ki se vbrizga: |
20–100 μl |
Stabilnost kromatografskega sistema se preveri z večkratnim vbrizgavanjem raztopine za umerjanje (3.5.3) s koncentracijo 2,5 μg/ml, dokler se ne dosežejo konstantne višine vrhov in konstantni retencijski časi.
5.3.2
Za vsako koncentracijo se vsaka raztopina za umerjanje (3.5.3) večkrat vbrizga, nato pa se določijo se srednje vrednosti višin (površin) vrhov. Umeritvena krivulja se pripravi tako, da se na ordinato nanesejo srednje vrednosti višin (površin) vrhov raztopin za umerjanje, na absciso pa ustrezne koncentracije v μg/ml.
5.3.3
Ekstrakt vzorca (5.2) se vbrizga večkrat, pri čemer se uporabijo enaki volumni kakor pri raztopini za umerjanje, nato pa se določijo srednje vrednosti višin (površin) vrhov olakvindoksa.
6. Izračun rezultatov
Koncentracija raztopine vzorca v μg/ml se določi iz srednje vrednosti višin (površin) vrhov olakvindoksa iz umeritvene krivulje (5.3.2).
Vsebnost olakvindoksa v vzorcu (w) v mg/kg se izračuna po naslednji formuli:

pri čemer je:
|
c |
= |
koncentracija olakvindoksa v ekstraktu vzorca (5.2) v μg/ml; |
|
m |
= |
masa preskusnega vzorca v g (5.2). |
7. Potrditev rezultatov
7.1 Identiteta
Identiteta analita se lahko potrdi z dodatno kromatografijo ali z detektorjem s serijo diod, s katerim se primerjata spekter ekstrakta vzorca (5.2) in spekter raztopine za umerjanje (3.5.3) s koncentracijo 5,0 μg/ml.
7.1.1
Ekstraktu vzorca (5.2) se doda ustrezna količina raztopine za umerjanje (3.5.3). Količina dodanega olakvindoksa mora biti podobna količini olakvindoksa v ekstraktu vzorca.
Povišan je le vrh olakvindoksa ob upoštevanju dodane količine in razredčitve ekstrakta. Širina vrha na polovici maksimalne višine mora biti znotraj ± 10 % prvotne širine vrha, ki nastane pri ekstraktu vzorca brez dodanega olakvindoksa.
7.1.2
Rezultati se ocenijo glede na naslednja merila:
|
(a) |
valovni dolžini maksimalne absorpcije spektra vzorca in spektra standarda, zabeleženi na najvišji točki vrha na kromatogramu, morata biti znotraj meja, določenih z ločljivostjo sistema za detekcijo. Pri detekciji s serijo diod je to ponavadi ± 2 nm; |
|
(b) |
med 220 in 400 nm se spekter vzorca in spekter standarda, zabeležena na najvišji točki vrha na kromatogramu, za navedene dele spektra ne smeta razlikovati v območju 10–100 % relativne absorbance. To merilo je izpolnjeno, ko so prisotne iste najvišje vrednosti in ko odmik med dvema spektroma na nobeni opazovani točki ne preseže 15 % absorbance standardnega analita; |
|
(c) |
med 220 in 400 nm se spektri naraščanja, najvišje točke vrha in padanja vrha, pridobljeni iz ekstrakta vzorca, za navedene dele spektra ne smejo razlikovati med seboj v območju 10–100 % relativne absorbance. To merilo je izpolnjeno, ko so prisotne iste najvišje točke in ko odmik med spektri na nobeni od opazovanih točk ne preseže 15 % absorbance spektra najvišje točke. |
Če eno od teh meril ni izpolnjeno, prisotnost analita ni potrjena.
7.2 Ponovljivost
Razlika med rezultatoma dveh vzporednih določanj, izvedenih na istem vzorcu, ne sme presegati 15 % višjega rezultata za vsebnosti olakvindoksa 10–200 mg/kg.
7.3 Izkoristek
Za slepi vzorec z dodatkom je izkoristek najmanj 90-odstoten.
8. Rezultati medlaboratorijske študije
Organizirana je bila medlaboratorijska študija, pri kateri je 13 laboratorijev analiziralo 4 vzorce krme v briketih, vključno z enim slepim vzorcem. Rezultati so prikazani v spodnji preglednici:
|
|
Vzorec 1 |
Vzorec 2 |
Vzorec 3 |
Vzorec 4 |
|
L |
13 |
10 |
11 |
11 |
|
n |
40 |
40 |
44 |
44 |
|
Srednja vrednost [mg/kg] |
— |
14,6 |
48,0 |
95,4 |
|
Sr [mg/kg] |
— |
0,82 |
2,05 |
6,36 |
|
SR [mg/kg] |
— |
1,62 |
4,28 |
8,42 |
|
CVr [ %] |
— |
5,6 |
4,3 |
6,7 |
|
CVR [ %] |
— |
11,1 |
8,9 |
8,8 |
|
Nominalna vsebnost |
|
|
|
|
|
[mg/kg] |
— |
15 |
50 |
100 |
|
Izkoristek % |
— |
97,3 |
96,0 |
95,4 |
|
L |
: |
število laboratorijev; |
|
n |
: |
število posameznih vrednosti; |
|
Sr |
: |
standardni odmik ponovljivosti; |
|
SR |
: |
standardni odmik obnovljivosti; |
|
CVr |
: |
koeficient variacije ponovljivosti; |
|
CVR |
: |
koeficient variacije obnovljivosti. |
9. Opomba
Čeprav metoda ni potrjena za krmo, ki vsebuje več kot 100 mg/kg olakvindoksa, je mogoče dobiti zadovoljive rezultate tako, da se uporabi manjša masa vzorca in/ali razredčitev ekstrakta (5.2), da se doseže koncentracija v območju umeritvene krivulje (5.3.2).
C. DOLOČANJE AMPROLIUMA
1-[(4-amino-2-propilpirimidin-5-il)metil]-2-metil-piridin klorid hidroklorid
1. Namen in področje uporabe
Ta metoda omogoča določanje ravni amproliuma v krmi in premiksih. Meja določanja je 1 mg/kg, meja kvantifikacije pa 5 mg/kg.
2. Načelo
Vzorec se ekstrahira z mešanico metanola in vode. Po redčenju z mobilno fazo in membranski filtraciji se vsebnost amproliuma določi s kationsko izmenjevalno tekočinsko kromatografijo visoke ločljivosti (HPLC) z uporabo UV-detektorja.
3. Reagenti
|
3.1 |
Metanol |
|
3.2 |
Acetonitril, za HPLC |
|
3.3 |
Voda, za HPLC |
|
3.4 |
Raztopina natrijevega dihidrogen fosfata, c = 0,1 mol/l V 1 000-mililitrski merilni bučki se v vodi (3.3) raztopi 13,80 g natrijevega dihidrogen fosfat monohidrata, dopolni se z vodo (3.3) do oznake in premeša. |
|
3.5 |
Raztopina natrijevega perklorata, c = 1,6 mol/l V 1 000-mililitrski merilni bučki se v vodi (3.3) raztopi 224,74 g natrijevega perklorat monohidrata, dopolni se z vodo (3.3) do oznake in premeša. |
|
3.6 |
Mobilna faza za HPLC (glej opombo 9.1). Mešanica acetonitrila (3.2), raztopine natrijevega dihidrogen fosfata (3.4) in raztopine natrijevega perklorata (3.5), 450+450+100 (v+v+v). Pred uporabo se filtrira z membranskim filtrom 0,22 μm (4.3), raztopina pa se razplini (npr. najmanj 15 minut v ultrazvočni kopeli (4.4)). |
|
3.7 |
Standardna snov: čisti amprolium, l-[(4-amino-2-propilpirimidin-5-il)metil]-2-metil-piridin klorid hidroklorid, E 750 (glej opombo 9.2) |
|
3.7.1 |
50 mg amproliuma (3.7) se natehta na 0,1 mg natančno in prenese v 100-mililitrsko merilno bučko ter raztopi v 80 ml metanola (3.1), bučka pa se za 10 minut postavi v ultrazvočno kopel (4.4). Po ultrazvočni obdelavi se raztopina segreje na sobno temperaturo, dopolni se z vodo do oznake in premeša. Pri temperaturi ≤ 4 oC je raztopina stabilna 1 mesec. |
|
3.7.2 |
5,0 ml osnovne standardne raztopine (3.7.1) se odpipetira v 50-mililitrsko merilno bučko, dopolni se z ekstrakcijskim topilom (3.8) do oznake in premeša. Pri temperaturi ≤ 4 oC je raztopina stabilna 1 mesec. |
|
3.7.3 |
V serijo 50-mililitrskih merilnih bučk se prenese 0,5, 1,0, in 2,0 ml vmesne standardne raztopine (3.7.2). Dopolni se z mobilno fazo (3.6) do oznake in premeša. Te raztopine ustrezajo 0,5, 1,0 in 2,0 μg amproliuma na ml. Te raztopine je treba pripraviti sveže pred uporabo. |
|
3.8 |
Ekstrakcijsko topilo Mešanica metanola (3.1) in vode 2+1 (v+v) |
4. Oprema
|
4.1 |
Oprema za HPLC s sistemom za vbrizgavanje, primernim za vbrizgavanje volumnov 100 μl |
|
4.1.1 |
Kolona za tekočinsko kromatografijo, 125 mm × 4 mm, kationski izmenjevalec Nucleosil 10 SA, polnitev 5 ali 10 μm ali enakovredna |
|
4.1.2 |
UV-detektor z nastavljivo valovno dolžino ali detektor s serijo diod |
|
4.2 |
Membranski filter, material PTFE, 0,45 μm |
|
4.3 |
Membranski filter, 0,22 μm |
|
4.4 |
Ultrazvočna kopel |
|
4.5 |
Mehanski stresalnik ali magnetno mešalo |
5. Postopek
5.1 Splošno
5.1.1
Za učinkovitost preskusa izkoristka (5.1.2) se z analizo slepe krme zagotovi, da niso prisotni niti amprolium niti moteče snovi. Vrsta slepe krme je podobna vrsti vzorca in dokaže se odsotnost amproliuma ali motečih snovi.
5.1.2
Preskus izkoristka se izvede z analizo slepe krme, ki se ji doda količina amproliuma, podobna količini v vzorcu. Za koncentracijo 100 mg/kg se 10,0 ml osnovne standardne raztopine (3.7.1) prenese v 250-mililitrsko erlenmajerico, raztopina pa se upari do približno 0,5 ml. Doda se 50 g slepe krme, dobro se premeša in pusti 10 minut ter vmes nekajkrat ponovno premeša, nato pa se nadaljuje s postopkom ekstrakcije (5.2).
Če pa vrsta slepe krme, podobna vrsti vzorca, ni na voljo (glej točko 5.1.1), se lahko preskus izkoristka izvede po metodi standardnega dodatka. V tem primeru se vzorcu za analizo doda toliko amproliuma, kolikor ga je v vzorcu. Ta vzorec se analizira skupaj z vzorcem brez dodanega amproliuma, izkoristek pa se izračuna z odštevanjem.
5.2 Ekstrakcija
5.2.1
V 500-mililitrsko erlenmajerico se natehta na 0,01 g natančno 5–40 g vzorca, odvisno od vsebnosti amproliuma, in doda 200 ml ekstrakcijskega topila (3.8). Erlenmajerica se postavi v ultrazvočno kopel (4.4) in se pusti 15 minut. Odstrani se iz ultrazvočne kopeli in 1 uro stresa s stresalnikom ali meša z magnetnim mešalom (4.5). Alikvot ekstrakta se razredči z mobilno fazo (3.6), da nastane vsebnost amproliuma 0,5–2 μg/ml, ter premeša (glej opombo 9.3). 5–10 ml tako razredčene raztopine se filtrira skozi membranski filter (4.2). Nadaljuje se z določanjem s HPLC (5.3).
5.2.2
V 500-mililitrsko erlenmajerico se na 0,001 g natančno natehta 1–4 g premiksa, odvisno od vsebnosti amproliuma, in doda 200 ml ekstrakcijskega topila (3.8). Erlenmajerica se postavi v ultrazvočno kopel (4.4) in se pusti 15 minut. Odstrani se iz ultrazvočne kopeli in 1 uro stresa s stresalnikom ali meša z magnetnim mešalom (4.5). Alikvot ekstrakta se razredči z mobilno fazo (3.6), da nastane vsebnost amproliuma 0,5–2 μg/ml, ter premeša. 5–10 ml tako razredčene raztopine se filtrira skozi membranski filter (4.2). Nadaljuje se z določanjem s HPLC (5.3).
5.3 Določanje s HPLC
5.3.1
Naslednji pogoji se lahko uporabljajo kot smernice, lahko pa se uporabljajo drugi pogoji, če zagotavljajo enakovredne rezultate.
|
Kolona za tekočinsko |
|
|
kromatografijo (4.1.1): |
125 mm × 4 mm, kationski izmenjevalec Nucleosil 10 SA, polnitev 5 ali 10 μm ali enakovredna |
|
Mobilna faza (3.6): |
Mešanica acetonitrila (3.2), raztopine natrijevega dihidrogen fosfata (3.4) in raztopine natrijevega perklorata (3.5), 450+450+100 (v+v+v) |
|
Hitrost pretoka: |
0,7–1 ml/min |
|
Detekcijska valovna dolžina: |
264 nm |
|
Volumen, ki se vbrizga: |
100 μl |
Stabilnost kromatografskega sistema se preveri z večkratnim vbrizgavanjem raztopine za umerjanje (3.7.3) s koncentracijo 1,0 μg/ml, dokler se ne dosežejo konstantne višine vrhov in konstantni retencijski časi.
5.3.2
Za vsako koncentracijo se vsaka raztopina za umerjanje (3.7.3) vbrizga večkrat, nato pa se določijo srednje vrednosti višin (površin) vrhov. Umeritvena krivulja se pripravi tako, da se na ordinato nanesejo srednje vrednosti višin (površin) vrhov raztopin za umerjanje, na absciso pa ustrezne koncentracije v μg/ml.
5.3.3
Ekstrakt vzorca (5.2) se večkrat vbrizga, pri čemer se uporabijo enaki volumni kakor pri raztopini za umerjanje, nato pa se določijo srednje vrednosti višin (površin) vrhov amproliuma.
6. Izračun rezultatov
Koncentracija raztopine vzorca v μg/ml se določi iz srednje vrednosti višin (površin) vrhov amproliuma iz umeritvene krivulje (5.3.2).
Vsebnost amproliuma (w) v mg/kg vzorca se izračuna po naslednji formuli:
 [mg/kg]
[mg/kg]
pri čemer je:
|
V |
= |
volumen ekstrakcijskega topila (3.8) v ml v skladu s točko 5.2 (tj. 200 ml); |
|
c |
= |
koncentracija amproliuma v ekstraktu vzorca (5.2) v μg/ml; |
|
f |
= |
faktor razredčitve v skladu s točko 5.2; |
|
m |
= |
masa preskusnega vzorca v gramih. |
7. Potrditev rezultatov
7.1 Identiteta
Identiteta analita se lahko potrdi z dodatno kromatografijo ali z detektorjem s serijo diod, s katerim se primerjata spekter ekstrakta vzorca (5.2) in spekter raztopine za umerjanje (3.7.3) s koncentracijo 2,0 μg/ml.
7.1.1
Ekstraktu vzorca (5.2) se doda primerna količina raztopine za umerjanje (3.7.3). Količina dodanega amproliuma mora biti podobna količini amproliuma v ekstraktu vzorca.
Povišan je le vrh amproliuma ob upoštevanju dodane količine in razredčitve ekstrakta. Širina vrha na polovici maksimalne višine mora biti znotraj ± 10 % prvotne širine vrha, ki nastane pri ekstraktu vzorca brez dodanega amproliuma.
7.1.2
Rezultati se ocenijo glede na naslednja merila:
|
(a) |
valovni dolžini maksimalne absorpcije spektra vzorca in spektra standarda, zabeleženi na najvišji točki vrha na kromatogramu, morata biti znotraj meja, določenih z ločljivostjo sistema za detekcijo. Pri določanju s serijo diod je to ponavadi ± 2 nm; |
|
(b) |
med 210 in 320 nm se spekter vzorca in spekter standarda, zabeležena na najvišji točki vrha na kromatogramu, za navedene dele spektra ne smeta razlikovati v območju 10–100 % relativne absorbance. To merilo je izpolnjeno, ko so prisotne iste najvišje vrednosti in ko odmik med dvema spektroma na nobeni opazovani točki ne preseže 15 % absorbance standardnega analita; |
|
(c) |
med 210 in 320 nm se spektri naraščanja, najvišje točke vrha in padanja vrha, pridobljeni iz ekstrakta vzorca, za navedene dele spektra ne smejo razlikovati med seboj v območju 10–100 % relativne absorbance. To merilo je izpolnjeno, ko so prisotne iste najvišje točke in ko odmik med spektri na nobeni od opazovanih točk ne preseže 15 % absorbance spektra najvišje točke. |
Če eno izmed teh meril ni izpolnjeno, prisotnost analita ni potrjena.
7.2 Ponovljivost
Razlika med rezultatoma dveh vzporednih določitev na istem vzorcu ne sme presegati:
|
— |
15 % višje vrednosti za vsebnosti amproliuma 25–500 mg/kg, |
|
— |
75 mg/kg za vsebnosti amproliuma 500–1 000 mg/kg, |
|
— |
7,5 % višje vrednosti za vsebnosti amproliuma nad 1 000 mg/kg. |
7.3 Izkoristek
Pri vzorcu z dodatkom (slepem vzorcu) je izkoristek najmanj 90-odstoten.
8. Rezultati medlaboratorijske študije
Organizirana je bila medlaboratorijska študija, pri kateri so bili analizirani trije vzorci perutninske krme (vzorci 1–3), en vzorec mineralne krme (vzorec 4) in en vzorec premiksa (vzorec 5). Rezultati so navedeni v spodnji preglednici:
|
|
Vzorec 1 (slepa krma) |
Vzorec 2 |
Vzorec 3 |
Vzorec 4 |
Vzorec 5 |
|
L |
14 |
14 |
14 |
14 |
15 |
|
n |
56 |
56 |
56 |
56 |
60 |
|
Srednja vrednost [mg/kg] |
— |
45,5 |
188 |
5 129 |
25 140 |
|
Sr [mg/kg] |
— |
2,26 |
3,57 |
178 |
550 |
|
CVr [ %] |
— |
4,95 |
1,90 |
3,46 |
2,20 |
|
SR [mg/kg] |
— |
2,95 |
11,8 |
266 |
760 |
|
CVR [ %] |
— |
6,47 |
6,27 |
5,19 |
3,00 |
|
Nominalna vsebnost [mg/kg] |
— |
50 |
200 |
5 000 |
25 000 |
|
L |
: |
število laboratorijev; |
|
n |
: |
število posameznih vrednosti; |
|
Sr |
: |
standardni odmik ponovljivosti; |
|
CVr |
: |
koeficient variacije ponovljivosti; |
|
SR |
: |
standardni odmik obnovljivosti; |
|
CVR |
: |
koeficient variacije obnovljivosti. |
9. Opombe
|
9.1 |
Če vzorec vsebuje tiamin, se vrh tiamina v kromatogramu pojavi malo pred vrhom amproliuma. Pri tej metodi se morata amprolium in tiamin ločiti. Če se amprolium in tiamin ne ločita s kolono (4.1.1), ki se uporablja pri tej metodi, se do 50 % acetonitrila v mobilni fazi (3.6) zamenja z metanolom. |
|
9.2 |
Po britanski farmakopeji sta najvišji točki spektra raztopine amproliuma (c = 0,02 mol/l) v klorovodikovi kislini (c = 0,1 mol/l) pri 246 nm in 262 nm. Absorbanca znaša 0,84 pri 246 nm in 0,80 pri 262 nm. |
|
9.3 |
Ekstrakt se mora vedno razredčiti z mobilno fazo, ker se sicer retencijski čas vrha amproliuma bistveno premakne zaradi sprememb v ionski moči. |
D. DOLOČANJE KARBADOKSA
Metil 3-(2-kvinoksalinilmetilen)karbazat N 1 ,N 4 -dioksid
1. Namen in področje uporabe
Ta metoda omogoča določanje ravni karbadoksa v krmi, premiksih in pripravkih. Meja določanja je 1 mg/kg, meja kvantifikacije pa 5 mg/kg.
2. Načelo
Vzorec se uravnoteži z vodo in ekstrahira z metanol-acetonitrilom. Pri krmi se alikvot filtriranega ekstrakta prečisti na koloni iz aluminijevega oksida. Pri premiksih in pripravkih se alikvot filtriranega ekstrakta z vodo, metanolom in acetonitrilom razredči do primerne koncentracije. Vsebnost karbadoksa se določi s tekočinsko kromatografijo visoke ločljivosti (HPLC) z reverzno fazo z uporabo UV-detektorja.
3. Reagenti
|
3.1 |
Metanol |
|
3.2 |
Acetonitril, za HPLC |
|
3.3 |
Ocetna kislina, m = 100 % |
|
3.4 |
Aluminijev oksid: nevtralni, stopnja aktivnosti I |
|
3.5 |
Metanol-acetonitril 1 + 1 (v + v) 500 ml metanola (3.1) se zmeša s 500 ml acetonitrila (3.2). |
|
3.6 |
Ocetna kislina, σ = 10 % 10 ml ocetne kisline (3.3) se razredči z vodo do 100 ml. |
|
3.7 |
Natrijev acetat |
|
3.8 |
Voda, za HPLC |
|
3.9 |
Raztopina acetatnega pufra, c = 0,01 mol/l, pH = 6,0 0,82 g natrijevega acetata (3.7) se raztopi v 700 ml vode (3.8), pH pa se z ocetno kislino (3.6) uravna na 6,0. Prenese se v 1 000-mililitrsko merilno bučko, dopolni se z vodo (3.8) do oznake in premeša. |
|
3.10 |
Mobilna faza za HPLC 825 ml raztopine acetatnega pufra (3.9) se zmeša s 175 ml acetonitrila (3.2). Filtrira se skozi filter 0,22 μm (4.5), raztopina pa se razplini (npr. 10 minut v ultrazvočni kopeli). |
|
3.11 |
Standardna snov Čisti karbadoks: metil 3-(2-kvinoksalinilmetilen)karbazat N1,N4-dioksid, E 850 |
|
3.11.1 |
Osnovna standardna raztopina karbadoksa, 100 μg/ml (glej točko 5 Postopek): 25 mg standardne snovi karbadoksa (3.11) se natehta na 0,1 mg natančno in prenese v 250-mililitrsko merilno bučko. V ultrazvočni kopeli (4.7) se raztopi v metanol-acetonitrilu (3.5). Po ultrazvočni obdelavi se raztopina segreje na sobno temperaturo, dopolni se z metanol-acetonitrilom (3.5) do oznake in premeša. Bučka se ovije v aluminijasto folijo ali pa se uporabi rjava bučka ter shrani v hladilniku. Pri temperaturi ≤ 4 oC je raztopina stabilna 1 mesec. |
|
3.11.2 |
2,0, 5,0, 10,0 in 20,0 ml osnovne standardne raztopine (3.11.1) se prenese v serijo 100-mililitrskih merilnih bučk. Doda se 30 ml vode, dopolni se z metanol-acetonitrilom (3.5) do oznake in premeša. Bučke se ovijejo v aluminijasto folijo. Te raztopine ustrezajo koncentracijam karbadoksa 2,0, 5,0, 10,0, in 20,0 μg/ml. Raztopine za umerjanje je treba pripraviti sveže pred uporabo.
|
|
3.12 |
Mešanica voda-[metanol-acetonitril] (3.5), 300 + 700 (v + v) 300 ml vode se zmeša s 700 ml mešanice metanola in acetonitrila (3.5). |
4. Oprema
|
4.1 |
Laboratorijski stresalnik ali magnetno mešalo |
|
4.2 |
Filtrski papir iz steklenih vlaken (Whatman GF/A ali enakovreden) |
|
4.3 |
Steklena kolona (dolžina 300 do 400 mm, notranji premer približno 10 mm) s sintrano stekleno frito in odtočnim ventilom
|
|
4.4 |
Oprema za HPLC s sistemom za vbrizgavanje, primernim za vbrizgavanje volumnov 20 μl |
|
4.4.1 |
Kolona za tekočinsko kromatografijo: 300 mm x 4 mm, C18, polnitev 10 μm ali enakovredna |
|
4.4.2 |
UV-detektor z nastavljivo valovno dolžino ali detektor s serijo diod v območju 225 do 400 nm |
|
4.5 |
Membranski filter, 0,22 μm |
|
4.6 |
Membranski filter, 0,45 μm |
|
4.7 |
Ultrazvočna kopel |
5. Postopek
|
Opomba: |
Karbadoks je občutljiv na svetlobo. Vsi postopki se izvajajo pri zmanjšani svetlobi ali pa se uporabi posoda iz rjavega stekla ali se bučka ovije v aluminijasto folijo. |
5.1 Splošno
5.1.1
Za učinkovitost preskusa izkoristka (5.1.2) se z analizo slepe krme zagotovi odsotnost karbadoksa in motečih snovi. Vrsta slepe krme je podobna vrsti vzorca in pri analizi se dokaže odsotnost karbadoksa ali motečih snovi.
5.1.2
Preskus izkoristka se izvede z analizo slepe krme (5.1.1) z dodatkom količine karbadoksa, podobne količini v vzorcu. Za koncentracijo 50 mg/kg se 5,0 ml osnovne standardne raztopine (3.11.1) prenese v 200-mililitrsko erlenmajerico. Raztopina se upari na približno 0,5 ml v toku dušika. Doda se 10 g slepe krme, premeša se in pusti 10 minut, nato pa se nadaljuje z ekstrakcijo (5.2).
Če pa vrsta slepe krme, podobna vrsti vzorca, ni na voljo (glej točko 5.1.1), se lahko preskus izkoristka izvede po metodi standardnega dodatka. V tem primeru se vzorcu za analizo doda količina karbadoksa, podobna količini v vzorcu. Ta vzorec se analizira skupaj z vzorcem brez dodanega karbadoksa, izkoristek pa se izračuna z odštevanjem.
5.2 Ekstrakcija
5.2.1
10 g vzorca se natehta na 0,01 g natančno in prenese v 200-mililitrsko erlenmajerico. Doda se 15,0 ml vode, premeša se in pusti 5 minut, da se uravnoteži. Doda se 35,0 ml metanol-acetonitrila (3.5), zamaši se in stresa 30 minut na stresalniku ali meša z magnetnim mešalnikom (4.1). Raztopina se filtrira skozi filtrirni papir iz steklenih vlaken (4.2). Ta raztopina se shrani za fazo čiščenja (5.3).
5.2.2
1 g nezdrobljenega vzorca se natehta na 0,001 g natančno in prenese v 200-mililitrsko erlenmajerico. Doda se 15,0 ml vode, premeša se in pusti 5 minut, da se uravnoteži. Doda se 35,0 ml metanol-acetonitrila (3.5), zamaši se in stresa 30 minut na stresalniku ali meša z magnetnim mešalnikom (4.1). Raztopina se filtrira skozi filtrirni papir iz steklenih vlaken (4.2).
Alikvot filtrata se odpipetira v 50-mililitrsko merilno bučko. Doda se 15,0 ml vode, dopolni se z metanol-acetonitrilom (3.5) do oznake in premeša. Koncentracija karbadoksa v končni raztopini je približno 10 μg/ml. Alikvot se filtrira skozi filter 0,45 μm (4.6).
Nadaljuje se z določanjem s HPLC (5.4).
5.2.3
0,2 g nezdrobljenega vzorca se natehta na 0,001 g natančno in prenese v 250-mililitrsko erlenmajerico. Doda se 45,0 ml vode, premeša se in pusti 5 minut, da se uravnoteži. Doda se 105,0 ml metanol-acetonitrila (3.5), zamaši se in homogenizira. Vzorec se pusti v ultrazvočni kopeli (4.7) 15 minut, nato pa se 15 minut stresa ali meša (4.1). Raztopina se filtrira skozi filtrirni papir iz steklenih vlaken (4.2).
Alikvot filtrata se razredči z mešanico vode, metanola in acetonitrila (3.12), da je končna koncentracija karbadoksa 10–15 μg/ml (za 10-odstotni preparat je faktor razredčitve 10). Alikvot se filtrira skozi filter 0,45 μm (4.6).
Nadaljuje se z določanjem s HPLC (5.4).
5.3 Čiščenje
5.3.1
Natehta se 4 g aluminijevega oksida (3.4) in prenese v stekleno kolono (4.3).
5.3.2
15 ml filtriranega ekstrakta (5.2.1) se nanese na kolono iz aluminijevega oksida, prva 2 ml eluata pa se zavržeta. Zbere se naslednjih 5 ml, alikvot pa se filtrira skozi filter 0,45 μm (4.6).
Nadaljuje se z določanjem s HPLC (5.4).
5.4 Določanje s HPLC
5.4.1
Naslednji pogoji se lahko uporabljajo kot smernice, lahko pa se uporabljajo drugi pogoji, če zagotavljajo enakovredne rezultate:
|
Kolona za tekočinsko |
|
|
kromatografijo (4.4.1): |
300 mm × 4 mm, C18, polnitev 10 μm ali enakovredna |
|
Mobilna faza (3.10): |
Mešanica raztopine acetatnega pufra (3.9) in acetonitrila (3.2), 825 + 175 (v+v) |
|
Hitrost pretoka: |
1,5–2 ml/min |
|
Detekcijska valovna dolžina: |
365 nm |
|
Volumen, ki se vbrizga: |
20 μl |
Stabilnost kromatografskega sistema se preveri z večkratnim vbrizgavanjem raztopine za umerjanje (3.11.2) s koncentracijo 5,0 μg/ml, dokler se ne dosežejo konstantne višine vrhov (površin) in konstantni retencijski časi.
5.4.2
Vsaka raztopina za umerjanje (3.11.2) se večkrat vbrizga in za vsako koncentracijo se določijo srednje vrednosti višin (površin) vrhov. Umeritvena krivulja se pripravi tako, da se na ordinato nanesejo srednje vrednosti višin ali površin vrhov raztopin za umerjanje, na absciso pa ustrezne koncentracije v μg/ml.
5.4.3
Ekstrakt vzorca [(5.3.2) za krmo, (5.2.2) za premikse in (5.2.3) za pripravke] se vbrizga večkrat, nato pa se določijo srednje vrednosti višin (površin) vrhov karbadoksa.
6. Izračun rezultatov
Koncentracija karbadoksa v raztopini vzorca v μg/ml se določi iz srednje vrednosti višin (površin) vrhov karbadoksa iz umeritvene krivulje (5.4.2).
6.1 Krma
Vsebnost karbadoksa (w) (mg/kg) v vzorcu se izračuna po naslednji formuli:
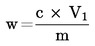 [mg/kg]
[mg/kg]
pri čemer je:
|
c |
= |
koncentracija karbadoksa v ekstraktu vzorca (5.3.2) v μg/ml; |
|
V1 |
= |
volumen ekstrakta v ml (tj. 50); |
|
m |
= |
masa preskusnega vzorca v gramih. |
6.2 Premiksi in pripravki
Vsebnost karbadoksa (w) (mg/kg) v vzorcu se izračuna po naslednji formuli:
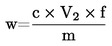 [mg/kg]
[mg/kg]
pri čemer je:
|
c |
= |
koncentracija karbadoksa v ekstraktu vzorca (5.2.2 ali 5.2.3) v μg/ml; |
|
V2 |
= |
volumen ekstrakta v ml (tj. 50 za premikse; 150 za pripravke); |
|
f |
= |
faktor razredčitve v skladu s točko 5.2.2 (premiksi) ali 5.2.3 (pripravki); |
|
m |
= |
masa preskusnega vzorca v gramih. |
7. Potrditev rezultatov
7.1 Identiteta
Identiteta analita se lahko potrdi z dodatno kromatografijo ali detektorjem s serijo diod, s katerim se primerjata spekter ekstrakta vzorca in spekter raztopine za umerjanje (3.11.2) s koncentracijo 10,0 μg/ml.
7.1.1
Ekstraktu vzorca se doda primerna količina raztopine za umerjanje (3.11.2). Količina dodanega karbadoksa mora biti podobna ocenjeni količini karbadoksa v ekstraktu vzorca.
Povišan je le vrh karbadoksa ob upoštevanju dodane količine in razredčitve ekstrakta. Širina vrha na polovici njegove največje višine mora biti v mejah približno 10 % prvotne širine.
7.1.2
Rezultati se ocenijo glede na naslednja merila:
|
(a) |
valovni dolžini maksimalne absorpcije spektra vzorca in spektra standarda, zabeleženi na najvišji točki vrha na kromatogramu, morata biti znotraj meja, določenih z ločljivostjo sistema za detekcijo. Za detekcijo s serijo diod je to ponavadi znotraj ± 2 nm; |
|
(b) |
med 225 in 400 nm se spekter vzorca in spekter standarda na najvišji točki kromatografskega vrha za navedene dele spektra ne smeta razlikovati znotraj območja 10–100 % relativne absorbance. To merilo je izpolnjeno, ko so prisotne iste najvišje vrednosti in ko odmik med dvema spektroma na nobeni opazovani točki ne preseže 15 % absorbance standardnega analita; |
|
(c) |
med 225 in 400 nm se spektri naraščanja, najvišje točke vrha in padanja vrha, pridobljeni iz ekstrakta vzorca, za navedene dele spektra ne smejo razlikovati med seboj v območju 10–100 % relativne absorbance. To merilo je izpolnjeno, ko so prisotni iste najvišje točke in ko odmik med spektri na nobeni od opazovanih točk ne preseže 15 % absorbance spektra najvišje točke. |
Če eno od teh meril ni izpolnjeno, prisotnost analita ni potrjena.
7.2 Ponovljivost
Razlika med rezultatoma dveh vzporednih določanj, izvedenih na istem vzorcu, za vsebnosti 10 mg/kg in več ne sme presegati 15 % višjega rezultata.
7.3 Izkoristek
Pri vzorcu z dodatkom (slepem vzorcu) je izkoristek najmanj 90-odstoten.
8. Rezultati medlaboratorijske študije
Organizirana je bila medlaboratorijska študija, pri kateri je 8 laboratorijev analiziralo 6 vzorcev krme, 4 vzorce premiksov in 3 vzorce pripravkov. Vsak vzorec je bil analiziran dvakrat. (Za natančnejše informacije o medlaboratorijski študiji glej Journal of AOAC, knjiga 71, št. 1988, 484, str. 484–490.) Rezultati (razen izjem) so prikazani v spodnji preglednici:
Preglednica 1.
Rezultati medlaboratorijske študije za krmo
|
|
Vzorec 1 |
Vzorec 2 |
Vzorec 3 |
Vzorec 4 |
Vzorec 5 |
Vzorec 6 |
|
L |
8 |
8 |
8 |
8 |
8 |
8 |
|
n |
15 |
14 |
15 |
15 |
15 |
15 |
|
Srednja vrednost (mg/kg) |
50,0 |
47,6 |
48,2 |
49,7 |
46,9 |
49,7 |
|
Sr (mg/kg) |
2,90 |
2,69 |
1,38 |
1,55 |
1,52 |
2,12 |
|
CVr (%) |
5,8 |
5,6 |
2,9 |
3,1 |
3,2 |
4,3 |
|
SR (mg/kg) |
3,92 |
4,13 |
2,23 |
2,58 |
2,26 |
2,44 |
|
CVR (%) |
7,8 |
8,7 |
4,6 |
5,2 |
4,8 |
4,9 |
|
Nominalna vsebnost (mg/kg) |
50,0 |
50,0 |
50,0 |
50,0 |
50,0 |
50,0 |
Preglednica 2.
Rezultati medlaboratorijske študije za premikse in pripravke
|
|
Premiksi |
Pripravki |
|||||
|
A |
B |
C |
D |
A |
B |
C |
|
|
L |
7 |
7 |
7 |
7 |
8 |
8 |
8 |
|
n |
14 |
14 |
14 |
14 |
16 |
16 |
16 |
|
Srednja vrednost (g/kg) |
8,89 |
9,29 |
9,21 |
8,76 |
94,6 |
98,1 |
104 |
|
Sr (g/kg) |
0,37 |
0,28 |
0,28 |
0,44 |
4,1 |
5,1 |
7,7 |
|
CVr (%) |
4,2 |
3,0 |
3,0 |
5,0 |
4,3 |
5,2 |
7,4 |
|
SR (g/kg) |
0,37 |
0,28 |
0,40 |
0,55 |
5,4 |
6,4 |
7,7 |
|
CVR (%) |
4,2 |
3,0 |
4,3 |
6,3 |
5,7 |
6,5 |
7,4 |
|
Nominalna vsebnost (g/kg) |
10,0 |
10,0 |
10,0 |
10,0 |
100 |
100 |
100 |
|
L |
: |
število laboratorijev; |
|
n |
: |
število posameznih vrednosti; |
|
Sr |
: |
standardni odmik ponovljivosti; |
|
CVr |
: |
koeficient variacije ponovljivosti; |
|
SR |
: |
standardni odmik obnovljivosti; |
|
CVR |
: |
koeficient variacije obnovljivosti. |
PRILOGA IX
KORELACIJSKE TABELE IZ ČLENA 6
1. Direktiva 71/250/EGS
|
Direktiva 71/250/EGS |
Ta uredba |
|
Člen 1, prvi pododstavek |
Člen 3 |
|
Člen 1, drugi pododstavek |
Člen 2 |
|
Člen 2 |
— |
|
Člen 3 |
— |
|
Priloga, del 1 |
Priloga II |
|
Priloga, del 2 |
— |
|
Priloga, del 3 |
— |
|
Priloga, del 4 |
Priloga III, del O |
|
Priloga, del 5 |
Priloga III, del M |
|
Priloga, del 6 |
Priloga III, del N |
|
Priloga, del 7 |
Priloga III, del Q |
|
Priloga, del 9 |
Priloga III, del K |
|
Priloga, del 10 |
— |
|
Priloga, del 11 |
— |
|
Priloga, del 12 |
Priloga III, del J |
|
Priloga, del 14 |
Priloga III, del D |
|
Priloga, del 16 |
— |
2. Direktiva 71/393/EGS
|
Direktiva 71/393/EGS |
Ta uredba |
|
Člen 1 |
Člen 3 |
|
Člen 2 |
— |
|
Člen 3 |
— |
|
Priloga, del I |
Priloga III, del A |
|
Priloga, del II |
Priloga III, del E |
|
Priloga, del III |
Priloga III, del P |
|
Priloga, del IV |
Priloga III, del H |
3. Direktiva 72/199/EGS
|
Direktiva 72/199/EGS |
Ta uredba |
|
Člen 1 |
Člen 3 |
|
Člen 2 |
— |
|
Člen 3 |
— |
|
Člen 4 |
— |
|
Priloga I, del 1 |
Priloga III, del L |
|
Priloga I, del 2 |
Priloga III, del C |
|
Priloga I, del 3 |
— |
|
Priloga I, del 4 |
— |
|
Priloga I, del 5 |
Priloga V, del A |
|
Priloga II |
— |
4. Direktiva 73/46/EGS
|
Direktiva 73/46/EGS |
Ta uredba |
|
Člen 1 |
Člen 3 |
|
Člen 3 |
— |
|
Člen 4 |
— |
|
Priloga I, del 1 |
Priloga III, del B |
|
Priloga I, del 2 |
— |
|
Priloga I, del 3 |
Priloga III, del I |
5. Direktiva 76/371/EGS
|
Direktiva 76/371/EGS |
Ta uredba |
|
Člen 1 |
Člen 1 |
|
Člen 2 |
— |
|
Člen 3 |
— |
|
Priloga |
Priloga I |
6. Direktiva 76/372/EGS
|
Direktiva 76/372/EGS |
Ta uredba |
|
Člen 1 |
— |
|
Člen 2 |
— |
|
Člen 3 |
— |
|
Priloga |
— |
7. Direktiva 78/633/EGS
|
Direktiva 78/633/EGS |
Ta uredba |
|
Člen 1 |
Člen 3 |
|
Člen 2 |
— |
|
Člen 3 |
— |
|
Priloga, del 1 |
— |
|
Priloga, del 2 |
— |
|
Priloga, del 3 |
Priloga IV, del C |
8. Direktiva 81/715/EGS
|
Direktiva 81/715/EGS |
Ta uredba |
|
Člen 1 |
— |
|
Člen 2 |
— |
|
Člen 3 |
— |
|
Priloga |
— |
9. Direktiva 84/425/EGS
|
Direktiva 84/425/EGS |
Ta uredba |
|
Člen 1 |
— |
|
Člen 2 |
— |
|
Člen 3 |
— |
|
Priloga |
— |
10. Direktiva 86/174/EGS
|
Direktiva 86/174/EGS |
Ta uredba |
|
Člen 1 |
Člen 4 |
|
Člen 2 |
— |
|
Člen 3 |
— |
|
Priloga |
Priloga VII |
11. Direktiva 93/70/EGS
|
Direktiva 93/70/EGS |
Ta uredba |
|
Člen 1 |
Člen 3 |
|
Člen 2 |
— |
|
Člen 3 |
— |
|
Priloga |
Priloga IV, del D |
12. Direktiva 93/117/ES
|
Direktiva 93/117/ES |
Ta uredba |
|
Člen 1 |
Člena 3 in 5 |
|
Člen 2 |
— |
|
Člen 3 |
— |
|
Priloga, del 1 |
Priloga IV, del E |
|
Priloga, del 2 |
Priloga VIII, del A |
13. Direktiva 98/64/ES
|
Direktiva 98/64/ES |
Ta uredba |
|
Člen 1 |
Člena 3 in 5 |
|
Člen 2 |
— |
|
Člen 3 |
— |
|
Člen 4 |
— |
|
Priloga, del A |
Priloga III, del F |
|
Priloga, del C |
Priloga VIII, del B |
14. Direktiva 1999/27/ES
|
Direktiva 1999/27/ES |
Ta uredba |
|
Člen 1 |
Člena 3 in 5 |
|
Člen 2 |
— |
|
Člen 3 |
— |
|
Člen 4 |
— |
|
Člen 5 |
— |
|
Člen 6 |
— |
|
Člen 7 |
— |
|
Priloga, del A |
Priloga VIII, del C |
|
Priloga, del B |
Priloga IV, del F |
|
Priloga, del C |
Priloga VIII, del D |
15. Direktiva 1999/76/ES
|
Direktiva 1999/76/ES |
Ta uredba |
|
Člen 1 |
Člen 3 |
|
Člen 2 |
— |
|
Člen 3 |
— |
|
Člen 4 |
— |
|
Priloga |
Priloga IV, del G |
16. Direktiva 2000/45/ES
|
Direktiva 2000/45/ES |
Ta uredba |
|
Člen 1 |
Člen 3 |
|
Člen 2 |
— |
|
Člen 3 |
— |
|
Člen 4 |
— |
|
Priloga, del A |
Priloga IV, del A |
|
Priloga, del B |
Priloga IV, del B |
|
Priloga, del C |
Priloga III, del G |
17. Direktiva 2002/70/ES
|
Direktiva 2002/70/ES |
Ta uredba |
|
Člen 1 |
Člen 1 |
|
Člen 2 |
Člena 2 in 3 |
|
Člen 3 |
— |
|
Člen 4 |
— |
|
Člen 5 |
— |
|
Priloga I |
Priloga I in Priloga V, del B (I) |
|
Priloga II |
Priloga II in Priloga V, del B (II) |
18. Direktiva 2003/126/ES
|
Direktiva 2003/126/ES |
Ta uredba |
|
Člen 1 |
Člen 3 |
|
Člen 2 |
— |
|
Člen 3 |
— |
|
Člen 4 |
— |
|
Člen 5 |
— |
|
Člen 6 |
— |
|
Priloga |
Priloga VI |