ISSN 1725-5147
doi:10.3000/17255147.L_2009.220.slo
Úradný vestník
Európskej únie
L 220

Slovenské vydanie
Právne predpisy
Zväzok 52
24. augusta 2009
|
ISSN 1725-5147 doi:10.3000/17255147.L_2009.220.slo |
||
|
Úradný vestník Európskej únie |
L 220 |
|

|
||
|
Slovenské vydanie |
Právne predpisy |
Zväzok 52 |
|
Obsah |
|
I Akty prijaté podľa Zmluvy o ES/Zmluvy o Euratome, ktorých uverejnenie je povinné |
Strana |
|
|
|
NARIADENIA |
|
|
|
* |
Nariadenie Komisie (ES) č. 761/2009 z 23. júla 2009, ktorým sa na účely prispôsobenia technickému pokroku mení a dopĺňa nariadenie Európskeho parlamentu a Rady (ES) č. 440/2008, ktorým sa ustanovujú testovacie metódy podľa nariadenia Európskeho parlamentu a Rady (ES) č. 1907/2006 o registrácii, hodnotení, autorizácii a obmedzovaní chemických látok (REACH) ( 1 ) |
|
|
|
|
|
(1) Text s významom pre EHP |
|
SK |
Akty, ktoré sú vytlačené obyčajným písmom, sa týkajú každodennej organizácie poľnohospodárskych záležitostí a sú spravidla platné len obmedzenú dobu. Názvy všetkých ostatných aktov sú vytlačené tučným písmom a je pred nimi hviezdička. |
I Akty prijaté podľa Zmluvy o ES/Zmluvy o Euratome, ktorých uverejnenie je povinné
NARIADENIA
|
24.8.2009 |
SK |
Úradný vestník Európskej únie |
L 220/1 |
NARIADENIE KOMISIE (ES) č. 761/2009
z 23. júla 2009,
ktorým sa na účely prispôsobenia technickému pokroku mení a dopĺňa nariadenie Európskeho parlamentu a Rady (ES) č. 440/2008, ktorým sa ustanovujú testovacie metódy podľa nariadenia Európskeho parlamentu a Rady (ES) č. 1907/2006 o registrácii, hodnotení, autorizácii a obmedzovaní chemických látok (REACH)
(Text s významom pre EHP)
KOMISIA EURÓPSKYCH SPOLOČENSTIEV,
so zreteľom na Zmluvu o založení Európskeho spoločenstva,
so zreteľom na nariadenie Európskeho parlamentu a Rady (ES) č. 1907/2006 z 18. decembra 2006 o registrácii, hodnotení, autorizácii a obmedzovaní chemických látok (REACH) a o zriadení Európskej chemickej agentúry, o zmene a doplnení smernice 1999/45/ES a o zrušení nariadenia Rady (EHS) č. 793/93 a nariadenia Komisie (ES) č. 1488/94, smernice Rady 76/769/EHS a smerníc Komisie 91/155/EHS, 93/67/EHS, 93/105/ES a 2000/21/ES (1), a najmä na jeho článok 13 ods. 3,
keďže:
|
(1) |
Nariadenie Komisie (ES) č. 440/2008 (2) obsahuje testovacie metódy na určovanie fyzikálno-chemických vlastností, toxicity a ekotoxicity látok, ktoré sa majú používať na účely nariadenia (ES) č. 1907/2006. |
|
(2) |
Je potrebné aktualizovať nariadenie (ES) č. 440/2008 s cieľom zmeniť niektoré testovacie metódy a pridať niekoľko nových testovacích metód, ktoré prijala OECD. Tento návrh bol prekonzultovaný so zainteresovanými stranami. Predmetné zmeny a doplnenia majú za cieľ prispôsobiť metódy vedeckému a technickému pokroku. |
|
(3) |
Mali by sa zrevidovať ustanovenia týkajúce sa tlaku pár s cieľom pridať novú metódu efúzie. |
|
(4) |
Je potrebné pridať novú metódu merania dĺžky váženého geometrického stredného priemeru vláken. |
|
(5) |
Je vhodné aktualizovať nariadenie (ES) č. 440/2008 s cieľom prioritne pridať novú in vitro testovaciu metódu podráždenia kože s cieľom dosiahnuť zníženie počtu zvierat používaných na pokusné účely v súlade so smernicou Rady 86/609/EHS z 24. novembra 1986 o aproximácii zákonov, iných právnych predpisov a správnych opatrení členských štátov týkajúcich sa ochrany zvierat používaných na pokusné a iné vedecké účely (3). Hoci o návrhu in vitro testovacej metódy podráždenia kože sa v rámci OECD ešte stále diskutuje, je v tomto výnimočnom prípade vhodné začleniť metódu B 46 do tohto nariadenia. Metóda B 46 by sa mala aktualizovať čo najskôr po dosiahnutí dohody v rámci OECD alebo po sprístupnení informácií odôvodňujúcich takúto revíziu. |
|
(6) |
Je potrebné zrevidovať ustanovenia týkajúce sa inhibičného testu rias s cieľom pridať ďalšie druhy a splniť požiadavky týkajúce sa hodnotenia nebezpečnosti a klasifikácie chemických látok. |
|
(7) |
Je potrebné pridať test simulovanej biodegradácie ako novú metódu merania aeróbnej mineralizácie povrchových vôd, ako aj test inhibície rastu ako novú metódu hodnotenia toxicity pre rod Lemna. |
|
(8) |
Nariadenie (ES) č. 440/2008 by sa preto malo zodpovedajúcim spôsobom zmeniť a doplniť. |
|
(9) |
Opatrenia stanovené v tomto nariadení sú v súlade so stanoviskom výboru zriadeného podľa článku 133 nariadenia (ES) č. 1907/2006, |
PRIJALA TOTO NARIADENIE:
Článok 1
Príloha k nariadeniu (ES) č. 440/2008 sa mení a dopĺňa takto:
|
1. |
Časť A sa mení a dopĺňa takto:
|
|
2. |
Časť B sa mení a dopĺňa takto: Dopĺňa sa kapitola B.46 uvedená v prílohe III k tomuto nariadeniu. |
|
3. |
Časť C sa mení a dopĺňa takto:
|
Článok 2
Toto nariadenie nadobúda účinnosť tretím dňom po jeho uverejnení v Úradnom vestníku Európskej únie.
Toto nariadenie je záväzné v celom rozsahu a priamo uplatniteľné vo všetkých členských štátoch
V Bruseli 23. júla 2009
Za Komisiu
Stavros DIMAS
člen Komisie
(1) Ú. v. EÚ L 396, 30.12.2006, s. 1.
(2) Ú. v. EÚ L 142, 31.5.2008, s. 1.
(3) Ú. v. ES L 358, 18.12.1986, s. 1.
PRÍLOHA I
|
A.4. |
Tlak pary |
1. METÓDA
Táto metóda je rovnocenná s OECD TG 104 (2004).
1.1. ÚVOD
Táto revidovaná verzia metódy A.4(1) obsahuje dodatočnú metódu, výtokovú metódu: izotermálnu termogravimetriu určenú pre látky s veľmi nízkym tlakom (až do 10–10 Pa). Vzhľadom na potreby postupov, najmä pokiaľ ide o získanie tlaku pary v prípade látok s nízkym tlakom pary, sa prehodnotili iné postupy tejto metódy pri zohľadnení rozmedzí použiteľnosti.
Pri termodynamickej rovnováhe je tlak pary čistej látky výlučne funkciou teploty. Základné princípy sú uvedené v odkazoch (2) (3).
Neexistuje jediný postup merania, ktorý by sa dal aplikovať na celé rozmedzie tlakov pary od menej ako 10–10 Pa do 105 Pa. V tejto metóde sa uvádza osem metód na meranie tlaku pary, ktoré sa môžu použiť v rôznych rozmedziach tlakov pary. Porovnávajú sa rôzne metódy, pokiaľ ide o uplatnenie a rozsah merania v tabuľke 1. Metódy sa môžu použiť výlučne na zlúčeniny, ktoré sa v podmienkach testu nerozkladajú. V prípadoch, keď sa z technických dôvodov nemôžu uplatniť experimentálne metódy, možno tiež tlak pary odhadnúť a odporúčaná metóda odhadu je uvedená v dodatku.
1.2. POJMY A JEDNOTKY
Tlak pary látky je definovaný ako tlak nasýtenej pary nad tuhou alebo kvapalnou látkou.
Pre tlak sa používa jednotka SI pascal (Pa). Ďalej sa uvádzajú iné jednotky, ktoré sa používali v minulosti, spolu s ich prepočítavacími koeficientmi:
|
1 Torr |
= |
1 mm Hg |
= |
1,333 × 102 Pa |
|
1 atmosféra |
= |
1,013 × 105 Pa |
|
|
|
1 bar |
= |
105 Pa |
|
|
Jednotkou teploty v rámci sústavy SI je kelvin (K). Stupne Celzia sa prepočítavajú na kelviny podľa vzorca:
T = t + 273,15
kde T je kelvin alebo termodynamická teplota a t je teplota v stupňoch Celzia.
Tabuľka 1
|
Metóda merania |
Látky |
Odhadovaná opakovateľnosť |
Odhadovaná reprodukovateľnosť |
Odporúčaný rozsah |
|
|
Tuhá |
Kvapalná |
||||
|
Dynamická metóda |
s nízkou teplotou tavenia |
áno |
do 25 % 1 až 5 % |
do 25 % 1 až 5 % |
103 Pa až 2 × 103 Pa 2 × 103 Pa až 105 Pa |
|
Statická metóda |
áno |
áno |
5 až 10 % |
5 až 10 % |
10 Pa až 105 Pa 10–2 Pa až 105 Pa (1) |
|
Metóda s s použitím izoteniskopu |
áno |
áno |
5 až 10 % |
5 až 10 % |
102 Pa až 105 Pa |
|
Výtoková metóda: váhy na meranie tlaku pary |
áno |
áno |
5 až 20 % |
do 50 % |
10–3 až 1 Pa |
|
Výtoková metóda: Knudsenova komôrka |
áno |
áno |
10 až 30 % |
— |
10–10 až 1 Pa |
|
Výtoková metóda: izotermálna termogravimetria |
áno |
áno |
5 až 30 % |
do 50 % |
10–10 až 1 Pa |
|
Metóda plynovej saturácie |
áno |
áno |
10 až 30 % |
do 50 % |
10–10 až 103 Pa |
|
Metóda rotujúcej guľôčky |
áno |
áno |
10 až 20 % |
— |
10–4 až 0,5 Pa |
1.3. PRINCÍP TESTU
Vo všeobecnosti sa tlak pary stanovuje pri rozličných teplotách. V limitovanom teplotnom rozmedzí je logaritmus tlaku pary čistej látky lineárnou funkciou inverzie termodynamickej teploty podľa zjednodušenej Clapeyronovej-Clausiusovej rovnice:

kde:
|
p |
= |
tlak pary látky vyjadrený v pascaloch |
|
ΔHv |
= |
teplota vyparovania v J mol–1 |
|
R |
= |
všeobecná plynová konštanta, 8,314 J mol–1 K–1 |
|
T |
= |
teplota v K (v kelvinoch). |
1.4. REFERENČNÉ LÁTKY
Referenčné látky sa nemusia použiť. V prvom rade slúžia na občasnú kontrolu účinnosti metódy a na umožnenie porovnania výsledkov dosiahnutých pri použití rozličných metód.
1.5. OPIS METÓDY
1.5.1. Dynamická metóda (Cottrellova metóda)
1.5.1.1. Princíp
Tlak pary sa meria stanovením teploty varu látky pri rôznych špecifikovaných tlakoch v rozmedzí približne 103 a 105 Pa. Táto metóda sa odporúča aj na stanovenie teploty varu. Na tento účel sa dá použiť až do teploty 600 K. Teploty varu kvapalných látok sú približne o 0,1 °C vyššie v hĺbke 3 až 4 cm ako na povrchu kvôli hydrostatickému tlaku stĺpca kvapaliny. V Cottrellovej metóde (4) sa teplomer umiestni do pary nad povrch kvapaliny a vriaca kvapalina sa kontinuálne vyzdvihne nad guľôčku teplomeru. Tenká vrstva kvapaliny, ktorá je v rovnováhe s parou pri atmosférickom tlaku, pokryje guľôčku. Teplomer takto odmeria skutočný bod varu bez chýb kvôli prehriatiu alebo hydrostatickému tlaku. Pumpa, ktorú skonštruoval Cottrell, je znázornená na obrázku 1. Trubica A obsahuje vriacu kvapalinu. Platinový drôt B zatavený do dna umožňuje rovnomerný var. Bočná trubica C vedie k chladiču a plášť D zabraňuje, aby sa studený kondenzát dostal k teplomeru E. Keď kvapalina v A vrie, bubliny a kvapalina zachytená v lieviku sa vlejú cez dve ramená pumpy F nad guľôčku teplomeru.
|
Obrázok 1
|
Obrázok 2
|
Cottrellova pumpa (4)
|
A: |
Termočlánok |
|
B: |
Objem na vyrovnávanie vákua |
|
C: |
Manometer |
|
D: |
Vákuum |
|
E: |
Miesto merania |
|
F: |
Ohrievací článok približne 150 W |
1.5.1.2. Prístroje
Veľmi presný prístroj využívajúci Cottrellovu metódu je znázornený na obrázku 2. Pozostáva z trubice s varnou časťou v spodnej časti, chladiča v strednej časti a výstupom a prírubou v hornej časti. Cottrellova pumpa je umiestnená vo varnej časti, ktorú zohrieva elektrický patrónový ohrievač. Teplota sa meria pomocou plášťového termočlánku alebo odporového teplomera zasunutím cez prírubu na vrchu. Výstup je pripojený k zariadeniu na reguláciu tlaku. Zariadenie na reguláciu tlaku pozostáva z vákuovej pumpy, objemu na vyrovnávanie, manostatu na dávkovanie dusíka na reguláciu tlaku a manometra.
1.5.1.3. Postup
Látka sa umiestni do varnej časti. S problémami sa možno stretnúť v prípade tuhých látok, ktoré nie sú vo forme prášku, ale tieto problémy sa môžu v niektorých prípadoch vyriešiť zahriatím chladiaceho plášťa. Po naplnení nádoby sa prístroj tesne uzavrie v prírube a testovaná látka sa odplyní. Použitie tejto metódy nie je vhodné pre peniace látky.
Ďalej sa nastaví najnižší požadovaný tlak a zapne sa ohrievanie. Zároveň sa snímač teploty pripojí na registračný prístroj.
Rovnováha sa dosiahne vtedy, keď sa zaregistruje konštantná teplota varu pri konštantnom tlaku. Treba dávať pozor najmä na to, aby sa zabránilo prudkému varu. Okrem toho sa musí v chladiči dosiahnuť úplná kondenzácia. Keď sa stanovuje tlak pary tuhých látok s nízkou teplotou topenia, je potrebné dbať na to, aby sa zabránilo zablokovaniu chladiča.
Po zaregistrovaní tohto rovnovážneho bodu sa nastaví vyšší tlak. Postup pokračuje rovnakým spôsobom až po dosiahnutie tlaku 105 Pa (spolu je to približne 5 až 10 meraní). V rámci kontroly sa musia rovnovážne body opakovať a merať pri klesajúcich tlakoch.
1.5.2. Statická metóda
1.5.2.1. Princíp
V statickej metóde (5) sa pri termodynamickej rovnováhe stanovuje tlak pary pri špecifikovanej teplote. Táto metóda je vhodná pre látky a viaczložkové kvapaliny a tuhé látky v rozmedzí od 10–1 do 105 Pa a za predpokladu, že sa bude postupovať opatrne, aj v rozmedzí 1 až 10 Pa.
1.5.2.2. Prístroje
Prístroj pozostáva z kúpeľa s konštantnou teplotou (presnosť ±0,2 K), nádoby na testovanú vzorku pripojenej k podtlakovej rúrke, manometra a systému na reguláciu tlaku. Komora na vzorky (obrázok 3a) je pripojená k podtlakovej rúrke cez ventil a diferenciálny manometer (trubica v tvare U obsahuje vhodnú manometrovú kvapalinu), ktorá slúži ako nulový indikátor. Pre diferenčný manometer možno použiť ortuť, silikóny a ftaláty v závislosti od tlakového rozmedzia a chemických vlastností testovanej látky. Pokiaľ možno, malo by sa z ekologických dôvodov vyhnúť používaniu ortuti. Testovaná látka sa nesmie vo výraznejšej miere rozpúšťať v kvapaline nachádzajúcej sa v trubici v tvare U alebo s ňou reagovať. Namiesto trubice v tvare U možno použiť manometer (obrázok 3b). Pre manometer možno v rozsahu normálneho atmosférického tlaku do 102 Pa použiť ortuť, zatiaľ čo silikóny a ftaláty sú vhodné na použitie pri tlakoch nižších ako 102 Pa až po 10 Pa. Existujú aj iné manometre, ktoré možno použiť pri tlakoch nižších ako 102 Pa a pri tlakoch nižších ako 10–1 Pa sa môžu dokonca použiť kapacitné manometre so zahrievateľnou membránou. Teplota sa meria na vonkajšej stene nádoby obsahujúcej vzorku alebo v samotnej nádobe.
1.5.2.3. Postup
Ak sa použije prístroj opísaný na obrázku 3a, naplňte trubicu v tvare U zvolenou kvapalinou, ktorá musí byť pred odčítaním nameraných hodnôt odplynená pri zvýšenej teplote. Testovaná látka sa umiestni do prístroja a odplyní pri zníženej teplote. V prípade viaczložkovej vzorky by mala byť teplota dostatočne nízka, aby sa zabezpečilo, že sa nezmení zloženie materiálu. Rovnováhu možno rýchlejšie dosiahnuť miešaním. Vzorka sa môže chladiť kvapalným dusíkom alebo suchým ľadom, pričom treba dbať na to, aby sa zabránilo kondenzácii vzduchu alebo nasatiu kvapaliny. Pri otvorenej polohe ventilu nad nádobou sa po niekoľkých minútach odsávaním odstráni vzduch. Ak je to potrebné, musí sa postup odplynenia opakovať niekoľkokrát.
|
Obrázok 3a
|
Obrázok 3b
|
Keď sa vzorka pri uzatvorenom ventile zahreje, tlak pary narastá. Toto zmení rovnováhu kvapaliny v trubici v tvare U. Na kompenzovanie tohto javu sa do prístroja cez ventil vpúšťa dusík alebo vzduch dovtedy, kým sa diferenciálny indikátor tlaku opäť neustáli na nulovej hodnote. Tlak, ktorý je na to potrebný, sa môže odčítať z manometra alebo z presného prístroja. Tento tlak zodpovedá tlaku pary testovanej látky pri teplote merania. Ak sa použije prístroj opísaný na obrázku 3b, tlak pary sa odčítava priamo.
Teplotná závislosť tlaku pary sa stanovuje v primerane krátkych intervaloch (spolu približne 5 až 10 meracích bodov) až po požadované maximum teploty.
Odčítania nízkych teplôt sa musia opakovať ako kontrola. Ak sa hodnoty získané z opakovaných odčítaní nezhodujú s krivkou získanou pre stúpajúcu teplotu, môže to byť následkom jednej z uvedených skutočností:
|
i) |
testovaná vzorka ešte obsahuje vzduch (napríklad materiály s vysokou viskozitou) alebo nízkovriace látky, ktorý sa uvoľňuje alebo ktoré sa uvoľňujú počas zahrievania; |
|
ii) |
testovaná látka podlieha chemickej reakcii v skúmanom teplotnom rozmedzí (napr. rozklad alebo polymerizácia). |
1.5.3. Metóda s s použitím izoteniskopu
1.5.3.1. Princíp
Izoteniskop (6) je založený na princípe statickej metódy. Pri tejto metóde sa vzorka umiestni do banky, ktorá sa udržiava pri konštantnom tlaku a je pripojená k manometru a vákuovej pumpe. Nečistoty prchavejšie ako testovaná látka sa odstránia odplynením pri zníženom tlaku. Tlak pary vzorky pri zvolených teplotách sa vyrovnáva známym tlakom inertného plynu. Izoteniskop bol vyvinutý na meranie tlaku pary určitých kvapalných uhľovodíkov, ale je vhodný aj na skúmanie tuhých látok. Metóda obvykle nie je vhodná pre viaczložkové systémy. Výsledky sú ovplyvnené len malými chybami v prípade vzoriek, ktoré obsahujú neprchavé nečistoty. Odporúčané rozmedzie je 102 až 105 Pa.
1.5.3.2. Prístroje
Príklad meracieho prístroja je znázornený na obrázku 4. Úplný opis možno nájsť v ASTM D 2879 – 86 (6).
1.5.3.3. Postup
V prípade kvapalín samotná testovaná látka slúži ako kvapalina v diferenciálnom manometri. Množstvo kvapaliny, ktoré je dostatočné na zaplnenie banky a krátkeho ramena manometra, sa umiestni do izoteniskopu. Izoteniskop sa napojí na vákuový systém a vákuuje, potom sa naplní dusíkom. Vákuovanie a prečistenie systému sa opakuje dvakrát, aby sa odstránil reziduálny kyslík. Naplnený izoteniskop sa umiestni v horizontálnej polohe tak, aby sa testovaná vzorka rozšírila v tenkej vrstve vo vzorkovej banke a manometri. Tlak systému sa redukuje na 133 Pa a vzorka sa mierne zahrieva, až kým nezačne vrieť (odstránenie rozpustených plynov). Izoteniskop sa potom umiestni tak, aby sa vzorka opäť vrátila do banky a naplnila krátke rameno manometra. Tlak sa udržiava na 133 Pa. Vytiahnutý hrot banky so vzorkou sa zohrieva malým plameňom dovtedy, kým sa uvoľnená para zo vzorky nerozšíri v dostatočnej miere na to, aby vytlačila časť vzorky z hornej časti banky a ramena manometra do manometra, vytvoriac tak plynom naplnený priestor bez prítomnosti dusíka. Izoteniskop sa potom umiestni do kúpeľa s konštantnou teplotou a tlak dusíka sa nastaví tak, aby sa rovnal tlaku vzorky. V rovnovážnom stave sa tlak dusíka rovná tlaku pary testovanej látky.
Obrázok 4

V prípade tuhých látok a v závislosti od tlakového a teplotného rozmedzia sa použijú manometrové kvapaliny, napr. silikónové kvapaliny alebo ftaláty. Odplynená manometrová kvapalina sa naleje do vydutiny na dlhom ramene izoteniskopu. Potom sa tuhá látka určená na skúmanie umiestni do banky a odplyní sa pri zvýšenej teplote. Po tomto úkone sa izoteniskop nakloní tak, aby tlakomerová kvapalina mohla natiecť do trubice v tvare U.
1.5.4. Výtoková metóda: váhy na meranie tlaku pary (7)
1.5.4.1. Princíp
Vzorka testovanej látky sa zahrieva v malej piecke a umiestni do vákuového zvonu. Piecka je prikrytá vekom s malými otvormi známych priemerov. Para testovanej látky, ktorá uniká z jedného z otvorov, sa nasmeruje na misku citlivých váh, ktoré sa tiež nachádzajú vo vákuovom zvone. V niektorých modeloch môže byť miska váh obklopená chladiacou nádobou zabezpečujúcou odvádzanie tepla smerom von prenosom tepla a chladená sálaním tak, aby sa unikajúca para na nej kondenzovala. Impulz prúdu pary pôsobí na váhy ako sila. Tlak pary možno odvodiť dvomi spôsobmi: priamo zo sily pôsobiacej na misku váh a tiež z rýchlosti odparovania s použitím Hertzovej-Knudsenovej rovnice (2):
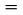
kde:
|
G |
= |
rýchlosť odparovania (kg s–1 m–2) |
|
M |
= |
mólová hmotnosť (g mol–1) |
|
T |
= |
teplota (K) |
|
R |
= |
všeobecná plynová konštanta (J mol–1 K–1) |
|
P |
= |
tlak pary (Pa) |
Odporúčané rozmedzie je 10–3 až 1 Pa.
1.5.4.2. Prístroje
Všeobecný princíp prístroja je znázornený na obrázku 5.
Obrázok 5

|
A: |
Podložka |
F: |
Chladiaci box a chladiaca tyč |
|
B: |
Pohyblivá cievka |
G: |
Odparovacia piecka |
|
C: |
Vákuový zvon |
H: |
Dewarova nádoba s tekutým dusíkom |
|
D: |
Váhy s miskou |
I: |
Meranie teploty vzorky |
|
E: |
Vákuový merací prístroj |
J: |
Testovaná látka |
1.5.5. Výtoková metóda: Knudsenova komôrka
1.5.5.1. Princíp
Táto metóda je založená na odhade hmotnosti testovanej látky, ktorá za jednotku času unikla z Knudsenovej komôrky (8) vo forme pary cez mikrootvor v ultravákuových podmienkach. Hmotnosť výtokovej uniknutej pary sa dá zistiť buď stanovením úbytku hmotnosti komôrky, alebo kondenzáciou pary pri nízkej teplote a stanovením množstva vyprchanej látky využitím chromatografie. Tlak pary sa vypočíta s použitím Hertzovej-Knudsenovej rovnice (pozri oddiel 1.5.4.1) s korekčnými koeficientmi, ktoré závisia od parametrov prístroja (9). Odporúčané rozmedzie je 10–10 až 1 Pa (10) (11) (12) (13) (14).
1.5.5.2. Prístroje
Všeobecný princíp prístroja je znázornený na obrázku 6.
Obrázok 6

|
1: |
Pripojenie na vákuum |
7: |
Veko so závitom |
|
2: |
Dutina na zasunutie platinového odporového teplomera alebo na meranie a reguláciu teploty |
8: |
Krídlové matice |
|
3: |
Veko vákuovej nádoby |
9: |
Svorníky |
|
4: |
Tesniaci O-krúžok |
10: |
Efúzne komôrky z nehrdzavejúcej ocele |
|
5: |
Hliníková vákuová nádoba |
11: |
Ohrievacie teleso |
|
6: |
Zariadenie na inštalovanie a vyberanie efúznych komôr |
|
|
1.5.6. Výtoková metóda: izotermálna termogravimetria
1.5.6.1. Princíp
Metóda je založená na stanovení zvýšených rýchlostí odparovania v prípade testovanej látky pri zvýšených teplotách a tlaku okolitého prostredia s použitím termogravimetrie (10) (15) (16) (17) (18) (19) (20). Rýchlosti odparovania vT vznikajú na základe vystavenia zvolenej zlúčeniny pomalému prúdu inertného plynu a sledovania úbytku hmotnosti pri určených izotermických teplotách T v kelvinoch počas príslušných časových období. Tlaky pary pT sa vypočítajú z hodnôt vT s použitím lineárneho vzťahu medzi logaritmom tlaku pary a logaritmom rýchlosti odparovania. V prípade potreby sa môže urobiť extrapolácia na teploty 20 °C a 25 °C regresnou analýzou log pT proti 1/T. Táto metóda je vhodná pre látky, ktoré majú tlak pár rovnako nízky ako 10–10 Pa (10–12 mbar) a stupeň čistoty čo možno najbližšie k 100 %, aby sa zabránilo chybnej interpretácii nameraných úbytkov hmotnosti.
1.5.6.2. Prístroje
Všeobecný princíp experimentálnej zostavy je znázornený na obrázku 7.
Obrázok 7

Nosná doštička so vzorkou, ktorá visí na mikrováhach v komore s regulovanou teplotou, sa umiestni do prúdu suchého dusíka, ktorý unáša odparené molekuly testovanej látky. Po opustení komory sa prúd plynu prečistí na sorpčnej jednotke.
1.5.6.3. Postup
Testovaná látka sa aplikuje na povrch zdrsnenej sklenej doštičky v homogénnej vrstve. V prípade tuhých látok sa doštička rovnomerne navlhčí roztokom testovanej látky vo vhodnom rozpúšťadle a vysuší v inertnej atmosfére. Na meranie sa pokrytá doštička umiestni do termogravimetrického analyzátora a následne sa kontinuálne meria úbytok hmotnosti ako funkcia času.
Rýchlosť odparovania vT sa pri stanovenej teplote vypočíta z úbytku hmotnosti Δm doštičky so vzorkou na základe

kde F je povrchová plocha nanesených testovaných látok, obvykle povrchová plocha doštičky so vzorkou, a t je čas úbytku hmotnosti Δm.
Tlak pary pT sa vypočíta na základe toho, že je funkciou rýchlosti odparovania vT:
Log pT = C + D log vT
kde C a D sú konštanty špecifické pre používané experimentálne usporiadanie závislé od priemeru komory, kde sa uskutočňuje meranie, a od prietokovej rýchlosti plynu. Tieto konštanty sa musia stanoviť vopred tak, že sa odmeria súbor zlúčenín so známym tlakom pary a regresiou log pT proti log vT (11) (21) (22).
Vzťah medzi tlakom pary pT a teplotou T v kelvinoch je daný vzorcom
Log pT = A + B 1/T
kde A a B sú konštanty získané regresiou log pT proti 1/T. Na základe tejto rovnice sa extrapoláciou môže tlak pary vypočítať pre akúkoľvek inú teplotu.
1.5.7. Metóda plynovej saturácie (23)
1.5.7.1. Princíp
Prúd inertného nosného plynu sa prepúšťa cez vzorku testovanej látky alebo nad ňou dostatočne pomaly, aby sa plyn nasýtil parou testovanej látky. Dosiahnutie nasýtenia v plynnej fáze je mimoriadne dôležité. Transportovaná látka sa zachytí obvykle s použitím sorbentu a zmeria sa jej množstvo. Ako alternatíva k zachyteniu pary a následnej analýze sa môžu použiť analytické techniky typu „in-train“ ako plynová chromatografia na stanovenie množstva transportovanej látky. Tlak pary sa vypočíta na základe predpokladu, že je dodržaný zákon ideálneho plynu a že celkový tlak zmesi plynov sa rovná sume tlakov plynov tvoriacich zmes. Parciálny tlak testovanej látky, t. j. tlak pary, sa vypočíta na základe známeho objemu celkového plynu a hmotnosti transportovaného materiálu.
Postup plynovej saturácie možno použiť na tuhé alebo kvapalné látky. Môže sa použiť pre tlaky pár až do 10–10 Pa (10) (11) (12) (13) (14). Metóda je najspoľahlivejšia pre tlaky pár nižšie ako 103 Pa. Pre vyššie tlaky pár ako 103 Pa sú obvykle nadhodnotené pravdepodobne kvôli vytváraniu aerosólu. Keďže merania tlaku pary sa uskutočňujú pri teplote miestnosti, nie je potrebná extrapolácia údajov z vysokých teplôt a vyhne sa tak extrapolácii vysokej teploty, ktorá môže často spôsobovať vážne chyby.
1.5.7.2. Prístroje
Postup vyžaduje, aby sa použila nádoba s konštantnou teplotou. Na obrázku 8 je znázornená nádoba, v ktorej sa nachádzajú držiaky na tri tuhé a tri kvapalné vzorky, ktoré umožňujú trojnásobnú analýzu buď tuhej, alebo kvapalnej vzorky. Teplota je regulovaná v rozmedzí ±0,5 °C alebo viac.
Obrázok 8

Vo všeobecnosti sa ako inertný nosný plyn používa dusík, ale príležitostne sa môže vyžadovať aj použitie iného plynu (24). Nosný plyn musí byť suchý. Prúd plynu sa rozdelí do 6 prúdov regulovaných ihlovými ventilmi (otvor približne 0,79 mm) a prúdi do nádoby cez medenú trubicu s vnútorným priemerom 3,8 mm. Po vyrovnaní teploty plyn prúdi cez vzorku a zachytávač so sorbentom a opúšťa nádobu.
Tuhé vzorky sa vložia do sklenej rúrky s vnútorným priemerom 5 mm medzi zátky zo sklenej vaty (pozri obrázok 9). Na obrázku 10 je znázornený držiak kvapalnej vzorky a sorpčný systém. Najlepšie reprodukovateľnou metódou na meranie tlaku pary kvapalín je naniesť kvapalinu na sklené guľôčky alebo na inertný sorbent, ako napr. kremeň, a naplniť držiak týmito guľôčkami. Alternatívne sa môže prúdenie nosného plynu nastaviť tak, aby prechádzal cez hrubú fritu a prebublal cez kolónu testovanej kvapalnej látky.
|
Obrázok 9
|
Obrázok 10
|
Sorpčný systém sa skladá z vrchnej a spodnej sorpčnej časti. Pri veľmi nízkych tlakoch pary sa na sorbente zachytia len veľmi malé množstvá a adsorpcia na sklenej vate a sklenej trubici medzi vzorkou a sorbentom môže spôsobiť vážny problém.
Ďalším účinným spôsobom na získanie odpareného materiálu sú zachytávače chladené tuhým CO2. Nespôsobujú žiadny protitlak na saturátorovú kolónu a zachytený materiál sa tiež veľmi jednoducho kvantitatívne uvoľňuje.
1.5.7.3. Postup
Prietoková rýchlosť unikajúceho nosného plynu sa meria pri izbovej teplote. Prietoková rýchlosť sa počas experimentu často kontroluje, aby sa zabezpečila správna hodnota pre celkový objem nosného plynu. Uprednostňuje sa priebežné sledovanie hmotnostným prietokomerom. Nasýtenie plynnej fázy môže vyžadovať značný čas kontaktu, a preto aj pomerne nízke prietokové rýchlosti plynu (25).
Na konci experimentu sa obidve časti sorbentu, vrchná a spodná, analyzujú samostatne. Zlúčenina v každej časti sa pridaním rozpúšťadla desorbuje. Výsledné roztoky sa kvantitatívne analyzujú na stanovenie hmotnosti desorbovanej z každej časti. Výber analytickej metódy (aj výber sorbentu a rozpúšťadla na desorpciu) je určený vlastnosťami testovaného materiálu. Účinnosť desorpcie sa stanoví vstreknutím známeho množstva vzorky na sorbent, jej desorpciou a analýzou získaného množstva. Je dôležité skontrolovať účinnosť desorpcie a koncentráciu, ktorá je rovnaká alebo približná ako koncentrácia vzorky, pri podmienkach testu.
Na zabezpečenie toho, aby sa nosný plyn nasýtil testovanou látkou, sa používajú tri rozdielne prietokové rýchlosti. Ak vypočítaný tlak pary nevykazuje žiadnu závislosť od prietokovej rýchlosti, predpokladá sa, že plyn je nasýtený.
Tlak pary sa vypočíta na základe rovnice:

kde:
|
p |
= |
tlak pary (Pa) |
|
W |
= |
hmotnosť odparenej testovanej látky (g) |
|
V |
= |
objem nasýteného plynu (m3) |
|
R |
= |
všeobecná plynová konštanta 8,314 (J mol–1 K–1) |
|
T |
= |
teplota (K) |
|
M |
= |
mólová hmotnosť testovanej látky (g mol–1). |
Namerané objemy musia byť opravené z hľadiska tlakových a teplotných rozdielov medzi prietokomerom a saturátorom.
1.5.8. Rotujúca guľôčka
1.5.8.1. Princíp
Táto metóda využíva meradlo viskozity rotujúceho rotora, v ktorom je meracím prvkom malá oceľová guľôčka, ktorá je zavesená do magnetického poľa, v ktorom rotuje (26) (27) (28). Snímacie cievky umožňujú meranie jej rýchlosti otáčania. Ak guľôčka dosiahla danú rotačnú rýchlosť, približne 400 otáčok za sekundu, ďalšie budenie sa zastaví a následkom trenia plynu dochádza k spomaľovaniu. Pokles rýchlosti otáčania sa meria ako funkcia času. Tlak pary sa odvodí zo spomalenia oceľovej guľôčky, ktoré je závislé od tlaku. Odporúčané rozmedzie je 10–4 až 0,5 Pa.
1.5.8.2. Prístroje
Schematický nákres pokusného systému je zobrazený na obrázku 11. Meracia hlava je umiestnená v termostaticky upravovanom uzavretom priestore s presnosťou regulácie na 0,1 °C. Nádoba so vzorkou je umiestnená v termostaticky upravovanom uzavretom priestore tiež s presnosťou regulácie na 0,1 °C. Všetky ostatné časti zostavy sa udržiavajú pri vyššej teplote, aby sa zabránilo kondenzácii. Celý prístroj je napojený na vysokovákuový systém.
Obrázok 11

2. Údaje a správy
2.1. ÚDAJE
Tlak pary zo všetkých predchádzajúcich metód sa musí stanoviť aspoň pre dve teploty. V rozmedzí od 0 °C do 50 °C sa odporúčajú tri alebo viacej teplôt, aby sa dala skontrolovať lineárnosť krivky tlaku plynu. V prípade výtokovej metódy (Knudsenova komôrka a izotermická termogravimetria) a metód plynovej saturácie sa pre stanovenie teplotného rozmedzia odporúča 120 °C až 150 °C namiesto 0 °C až 50 °C.
2.2. SPRÁVA O TESTE
Správa o teste musí obsahovať tieto informácie:
|
— |
použitú metódu, |
|
— |
presnú špecifikáciu látky (identitu a prímesi) a opatrenia v rámci predbežnej purifikácie testovanej látky, ak sa uskutočnili, |
|
— |
minimálne dve tlakové a teplotné hodnoty a prednostne tri alebo viac sa vyžadujú v rozmedzí od 0 °C do 50 °C (alebo 120 °C až 150 °C), |
|
— |
aspoň jedna teplota musí byť pod 25 °C, ak je to technicky možné na základe zvolenej metódy, |
|
— |
všetky pôvodné údaje, |
|
— |
log p verzus 1/T krivka, |
|
— |
odhad tlaku pary pri 20 °C alebo 25 °C. |
Ak sa pozoruje premena (zmena skupenstva, rozklad), treba uviesť nasledujúce informácie:
|
— |
charakter zmeny, |
|
— |
teplotu, pri ktorej sa zmena prejavuje pri atmosférickom tlaku, |
|
— |
tlak pary pri 10 °C a 20 °C pod teplotou premeny a 10 °C a 20 °C nad touto teplotou (s výnimkou premeny z tuhej látky na plyn). |
V správe z testu musia byť uvedené všetky informácie a poznámky, ktoré sú dôležité pre interpretáciu výsledkov testu, najmä týkajúce sa nečistôt a fyzikálneho stavu (skupenstva) testovanej látky.
3. POUŽITÁ LITERATÚRA
|
1. |
Úradný vestník Európskych spoločenstiev L 383A, s. 26 – 47 (1992). |
|
2. |
Ambrose, D. (1975). Experimental Thermodynamics, Vol. II, Le Neindre, B., and Vodar, B., Eds., Butterworths, London. |
|
3. |
Weissberger R., ed. (1959). Technique of Organic Chemistry, Physical Methods of Organic Chemistry, 3rd ed., Vol. I, Part I. Chapter IX, Interscience Publ., New York. |
|
4. |
Glasstone, S. (1946). Textbook of Physical Chemistry, 2nd ed., Van Nostrand Company, New York. |
|
5. |
NF T 20 – 048 AFNOR (September 1985). Chemical products for industrial use – Determination of vapour pressure of solids and liquids within a range from 10–1 to 105 Pa – Static method. |
|
6. |
ASTM D 2879 – 86, Standard test method for vapour pressure – temperature relationship and initial decomposition temperature of liquids by isoteniscope. |
|
7. |
NF T 20 – 047 AFNOR (September 1985). Chemical products for industrial use –Determination of vapour pressure of solids and liquids within range from 10–3 to 1 Pa – Vapour pressure balance method. |
|
8. |
Knudsen, M. (1909). Ann. Phys. Lpz., 29, 1979; (1911), 34, 593. |
|
9. |
Ambrose, D., Lawrenson, I.J., Sprake, C.H.S. (1975). J. Chem. Thermodynamics 7, 1173. |
|
10. |
Schmuckler, M.E., Barefoot, A.C., Kleier, D.A., Cobranchi, D.P. (2000), Vapor pressures of sulfonylurea herbicides; Pest Management Science 56, 521 – 532. |
|
11. |
Tomlin, C.D.S. (ed.), The Pesticide Manual, Twelfth Edition (2000). |
|
12. |
Friedrich, K., Stammbach, K., Gas chromatographic determination of small vapour pressures determination of the vapour pressures of some triazine herbicides. J. Chromatog. 16 (1964), 22 – 28. |
|
13. |
Grayson, B.T., Fosbraey, L.A., Pesticide Science 16 (1982), 269 – 278. |
|
14. |
Rordorf, B.F., Prediction of vapor pressures, boiling points and enthalpies of fusion for twenty-nine halogenated dibenzo-p-dioxins, Thermochimia Acta 112 Issue 1 (1987), 117 – 122. |
|
15. |
Gückel, W., Synnatschke, G., Ritttig, R., A Method for Determining the Volatility of Active Ingredients Used in Plant Protection; Pesticide Science 4 (1973), 137 – 147. |
|
16. |
Gückel, W., Synnatschke, G., Ritttig, R., A Method for Determining the Volatility of Active Ingredients Used in Plant Protection II. Application to Formulated Products; Pesticide Science 5 (1974), 393 – 400. |
|
17. |
Gückel, W., Kaestel, R., Lewerenz, J., Synnatschke, G., A Method for Determining the Volatility of Active Ingredients Used in Plant Protection. Part III: The Temperature Relationship between Vapour Pressure and Evaporation Rate; Pesticide Science 13 (1982), 161 – 168. |
|
18. |
Gückel, W., Kaestel, R., Kroehl, T., Parg, A., Methods for Determining the Vapour Pressure of Active Ingredients Used in Crop Protection. Part IV: An Improved Thermogravimetric Determination Based on Evaporation Rate; Pesticide Science 45 (1995), 27 – 31. |
|
19. |
Kroehl, T., Kaestel, R., Koenig, W., Ziegler, H., Koehle, H., Parg, A., Methods for Determining the Vapour Pressure of Active Ingredients Used in Crop Protection. Part V: Thermogravimetry Combined with Solid Phase MicroExtraction (SPME); Pesticide Science, 53 (1998), 300 – 310. |
|
20. |
Tesconi, M., Yalkowsky, S.H., A Novel Thermogravimetric Method for Estimating the Saturated Vapor Pressure of Low-Volatility Compounds; Journal of Pharmaceutical Science 87(12) (1998), 1512 – 20. |
|
21. |
Lide, D.R. (ed.), CRC Handbook of Chemistry and Physics, 81th ed.(2000), Vapour Pressure in the Range –25 °C to 150 °C. |
|
22. |
Meister, R.T. (ed.), Farm Chemicals Handbook, Vol. 88 (2002). |
|
23. |
40 CFR, 796 (1993), pp 148 – 153, Office of the Federal Register, Washington DC. |
|
24. |
Rordorf B.F. (1985). Thermochimica Acta 85, 435. |
|
25. |
Westcott et al. (1981). Environ. Sci. Technol. 15, 1375. |
|
26. |
Messer G., Röhl, P., Grosse G., and Jitschin W. (1987). J. Vac. Sci. Technol. (A), 5(4), 2440. |
|
27. |
Comsa G., Fremerey J.K., and Lindenau, B. (1980). J. Vac. Sci. Technol. 17(2), 642. |
|
28. |
Fremerey, J.K. (1985). J. Vac. Sci. Technol. (A), 3(3), 1715. |
(1) Pri použití kapacitného manometra.
Dodatok
Metóda odhadu
ÚVOD
Predbežne vypočítané hodnoty tlaku pary sa môžu použiť na:
|
— |
rozhodnutie, ktorá z existujúcich pokusných metód je najvhodnejšia, |
|
— |
poskytnutie odhadu alebo medznej hodnoty v prípadoch, keď sa pokusná metóda z technických príčin nemôže uplatniť. |
METÓDA ODHADU
Tlak pary kvapalín a tuhých látok sa môže odhadnúť s s použitím modifikovanej Watsonovej korelácie (a). Jediným potrebným pokusným údajom je normálna teplota varu. Táto metóda sa dá použiť v celom rozmedzí tlaku od 105 Pa do 10–5 Pa.
Podrobné informácie o tejto metóde sú uvedené v príručke Handbook of Chemical Property Estimation Methods (Príručka metód na odhadovanie vlastností) (b). Pozri aj OECD Environmental Monograph (Monografia OECD o životnom prostredí), č. 67 písm. c).
POSTUP VÝPOČTU
Tlak pary sa vypočíta takto:

kde:
|
T |
= |
daná teplota |
|
Tb |
= |
normálny bod varu |
|
PVP |
= |
tlak pary pri teplote T |
|
ΔHVb |
= |
výparné teplo |
|
ΔZb |
= |
koeficient stlačiteľnosti (odhadovaný pri 0,97) |
|
m |
= |
empirický koeficient závislý od fyzikálneho skupenstva pri danej teplote T. |
Ďalej
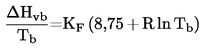
kde KF je empirický koeficient zohľadňujúci polaritu testovanej látky. Pre viaceré typy zlúčenín sú koeficienty KF uvedené v odkazoch pod písmenom b).
Často sú k dispozícii údaje, ktoré uvádzajú teplotu varu pri zníženom tlaku. V takom prípade sa tlak pary vypočíta takto:
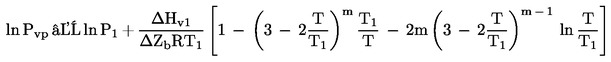
kde T1 je bod varu pri zníženom tlaku P1.
SPRÁVA
Ak sa použije metóda odhadu, správa o teste musí obsahovať úplnú dokumentáciu výpočtov.
POUŽITÁ LITERATÚRA
|
(a) |
Watson, K.M. (1943). Ind. Eng. Chem, 35, 398. |
|
(b) |
Lyman, W.J., Reehl, W.F., Rosenblatt, D.H. (1982). Handbook of Chemical Property Estimation Methods, McGraw-Hill. |
|
(c) |
OECD Environmental Monograph No.67. Application of Structure-Activity Relationships to the Estimation of Properties Important in Exposure Assessment (1993). |
PRÍLOHA II
|
A.22. |
DĹŽKOVÁ HODNOTA GEOMETRICKÉHO VYJADRENIA PRIEMERU VLÁKEN |
1. METÓDA
1.1. ÚVOD
Táto metóda opisuje postup merania dĺžkovej hodnoty geometrického vyjadrenia priemeru (Length Weighted Geometric Mean Diameter – LWGMD) objemu umelých minerálnych vláken (Man Made Mineral Fibres – MMMF). Keďže hodnota LWGMD štatistického súboru sa bude s 95 % pravdepodobnosťou nachádzať medzi 95 % hladinami spoľahlivosti vzorky (t. j. LWGMD ±2 štandardné chyby), vykazovaná hodnota (testovacia hodnota) bude na nižšej úrovni 95 % hladiny spoľahlivosti (napríklad LWGMD – dve štandardné chyby). Metóda je založená na aktualizácii (jún 1994) návrhu postupu HSE (Health and Safty Executive – Výkonný výbor pre zdravie a bezpečnosť), ktorý bol prijatý 26. septembra 1993 na stretnutí medzi ECFIA (European Ceramic Fibres Industry Association – Európska asociácia odvetví priemyselných vláken) a HSE v Chesteri a bol vyvinutý pri druhej medzilaboratórnej skúške (1,2). Táto metóda merania sa môže používať na určenie priemeru vlákna látok výrobkov obsahujúcich MMMF vrátane ohňovzdorných keramických vláken (RCF), umelých sklovitých vláken (MMVF), kryštalických a polykryštalických vláken.
Dĺžková hmotnosť vyjadruje nahradenie vplyvu rozloženia na priemer v dôsledku porušenia dlhých vláken počas odoberania, prípadne narábania s materiálom. Geometrická štatistika (geometrická hodnota) sa používa na meranie miery rozloženia MMMF priemerov, pretože tieto priemery mávajú zvyčajne veľkosť rozloženia, ktorá sa približuje k normálnej polohe.
Meranie dĺžky, ako aj priemeru je zdĺhavé a zároveň časovo náročné, ale ak sa merajú len tie vlákna, ktoré sa plynulo dotýkajú tenkou čiarou poľa SEM pohľadu, potom je pravdepodobnosť výberu daného vlákna pomerná k jeho dĺžke. Takto sa určí dĺžka pri výpočtoch dĺžkových hodnôt, pričom jedinou požadovanou hodnotou je veľkosť priemeru, a LWGMD-2SE sa môže vypočítať, ako bolo uvedené.
1.2. POJMY
Zrno: predmet s pomerom dĺžky k šírke menej ako 3:1.
Vlákno: Predmet s pomerom dĺžky k šírke (pomer strán) menej ako 3:1.
1.3. ROZSAH A OBMEDZENIA
Metóda sa zameriava na zobrazenie rozloženia priemeru, ktorý má strednú hodnotu od 0,5 μm do 6 μm. Väčšie priemery sa môžu zmerať s použitím menšieho zvýšenia SEM, ale táto metóda bude značne obmedzená pri jemnejšom rozložení vlákna a meranie pomocou TEM (mikroskop prenosu elektrónov) sa odporúča v prípade, ak je stredná hodnota priemeru nižšia ako 0,5 μm.
1.4. PRINCÍP TESTOVACEJ METÓDY
Určité množstvo reprezentatívnej vzorky sa odoberie z vlákninovej zóny alebo voľne uloženého vlákna. Voľné vlákna sa skrátia s použitím postupu drvenia a reprezentatívna časť vzorky sa rozptýli vo vode. Hmota sa potom oddelí a prefiltruje polykarbonátovým filtrom cez sito s okami veľkosti 0,2 μm a pripraví na skúšku s použitím techniky skenovacieho elektrónového mikroskopu (SEM). Priemer vláken sa odmeria na 10 000-násobne zväčšenej obrazovke, prípadne väčšom zväčšení (1) s použitím metódy priesečníka, ktorá poskytne nestranný odhad strednej hodnoty priemeru. Vypočíta sa spodná hodnota 95 % intervalu spoľahlivosti (na základe jednostranného testu) a stanoví sa odhad najnižšej hodnoty geometrického vyjadrenia priemeru vláken materiálu.
1.5. OPIS TESTOVACEJ METÓDY
1.5.1. Bezpečnostné opatrenia
Priamy kontakt s jemnými vláknami sa musí obmedziť na minimum a pri narábaní so suchými vláknami je nutné používať digestor alebo odkladaciu skrinku. Pravidelné monitorovanie kontaktu s látkami sa vykonáva na účel stanovenia efektívnosti kontrolných metód. Pri narábaní s MMMF je nevyhnutné používať rukavice na jednorazové použitie, aby sa predišlo podráždeniu pokožky a zabránilo krížovej kontaminácii (nakazeniu).
1.5.2. Prístroje/zariadenia
|
— |
lis a farbivo (schopný vyprodukovať tlak 10 Mpa), |
|
— |
polykarbonátové kapilárne pórovité filtre s veľkosťou pórov 0,2 μm (priemer 25 mm), |
|
— |
membránový celulózový filter s veľkosťou pórov 5 μm, určený ako pomocný filter, |
|
— |
sklený filtračný prístroj (alebo jednorazové filtračné systémy) umožňujúce požitie filtrov s priemerom 25 mm (napríklad milipórová sklená mikroanalýzová sada, typ č. XX10 025 00), |
|
— |
čistá destilovaná voda získaná prefiltrovaním cez filter s veľkosťou pórov 0,2 μm na účely odstránenia mikroorganizmov, |
|
— |
katódový rozprašovač s anódou zo zlata, prípadne zo zlata či paládia, |
|
— |
skenovací (rastrovací) elektrónový mikroskop s rozlišovacou schopnosťou do 10 nm a pracujúci s 10 000-násobným zväčšením, |
|
— |
rôzne: stierky, skalpel s čepeľou typu 24, klieštičky, SEM tubusy, karbónové lepidlo alebo karbónová lepiaca páska, strieborný skalpel, |
|
— |
ultrazvuková sonda alebo ultrazvuková vanička na doske laboratórneho stola, |
|
— |
odoberač vzorky sedimentov alebo korkovrt na odoberanie vzoriek z pokrývky MMMF. |
1.5.3. Postup pri teste
1.5.3.1. Odber vzoriek
Pri vrchných vrstvách sa na odoberanie vzoriek profilu použije 25 mm odoberač vzorky sedimentov alebo korkovrt. Mali by byť rovnomerne rozmiestnené po šírke z kratšej strany vrstvy alebo v prípade, že sú k dispozícii dlhé dĺžky vrstiev, sa odoberú z náhodných častí. Rovnaké zariadenie možno použiť na náhodné odoberanie vzoriek z uvoľnených vláken. Malo by sa odobrať šesť vzoriek, aby sa zohľadnili priestorové odchýlky objemu materiálu.
Šesť vzoriek jadra sa pod tlakom 10 Mpa rozdrví v lisovadle s priemerom 50 mm. Materiál sa rozmieša pomocou stierky a znovu sa lisuje pod tlakom 10 Mpa. Potom sa materiál odoberie z lisovadla a uskladní v hermeticky uzatvorenej sklenej fľaši.
1.5.3.2. Príprava vzorky
V nutnom prípade sa organický tmel odstráni umiestnením vlákna dovnútra pece pri teplote 450 °C počas približne jednej hodiny.
Vytvarujte vzorku do kužeľa a rozštvrťte ju (vykonáva sa vnútri prachovej skrinky).
S použitím stierky pridajte malé množstvo (< 0,5 g) vzorky do 100 ml čerstvo destilovanej vody, ktorá bola prefiltrovaná pomocou membránového filtra veľkosti 0,2 µm (ak sa použitie ukáže opodstatnené, možno použiť náhradný zdroj ultračistej vody). Dôkladne rozmiešajte s použitím ultrazvukovej sondy poháňanej 100 W zdrojom a nastavenej tak, aby sa vytvorila kavitácia. (V prípade, že sonda nie je k dispozícii, použite nasledujúcu metódu: 30 sekúnd ju treba opakovane triasť a obracať; nechať 5 minút pôsobiť pod ultrazvukom umiestnením v stolnej ultrazvukovej vaničke; potom opakovane triasť a obracať počas ďalších 30 sekúnd.)
Okamžite po rozptýlení vlákna je potrebné odobrať niekoľko častíc (napríklad tri pomerné časti 3,6 a 10 ml) pomocou širokootvorovej pipety (s objemom 2 – 5 ml).
Prefiltrujte každú časť cez polykarbonátový filter veľkosti otvorov 0,2 μm s pomocou MEC filtru veľkosti pórov 5 µm s použitím 25 ml skleného filtrovacieho lievika s valcovitým zásobníkom. Približne 5 ml prefiltrovanej destilovanej vody by sa malo umiestniť do lievika a častica sa pomaly prekvapkáva do vody, držiac konček pipety pod ohybom. Pipeta a zásobník sa po prekvapkávaní musia riadne prepláchnuť z toho dôvodu, že vlákna sa zvyčajne nachádzajú viac na povrchu.
Opatrne odoberte filter a pred umiestnením do sušiacej nádoby ho oddeľte od podporného filtra.
Kmitavým pohybom narežte štvrtinu alebo polovicu z prefiltrovanej hmoty s použitím skalpovacej čepele typu 24. Opatrne pripevnite oddelenú časť k bloku SEM s s použitím lepiaceho uhlíkového štítka alebo uhlíkového lepidla. Použite strieborný skalpel najmenej v troch polohách tak, aby sa zlepšil elektrický kontakt okrajov filtra a ústrižku. Keď lepidlo/strieborný skalpel oschne, obaľte katódu vrstvou 50 nm zlata, prípadne zmesou zlata/paládia na povrchu usadeniny.
1.5.3.3. SEM kalibrácia a postup
1.5.3.3.1. Kalibrácia
SEM kalibráciu je potrebné skontrolovať najmenej raz do týždňa (najlepšie každodenne) s použitím certifikovanej kalibračnej mriežky. Kalibráciu je nutné porovnať s certifikovanou normou a v prípade, ak meraná hodnota (SEM) nie je v rozpätí ±2 % certifikovanej hodnoty, musí sa kalibrácia SEM upraviť a znovu skontrolovať.
SEM by malo byť schopné rozpustiť prinajmenšom viditeľný priemer 0,2 µm s použitím absolútnej vzorkovej matrice pri 2 000-násobnom zväčšení.
1.5.3.3.2. Pracovný postup
Proces SEM sa vykonáva pri 10 000-násobnom zväčšení (2) za podmienok, ktoré umožňujú dobrú rozlíšiteľnosť prostredníctvom obrazu pri nízkych hodnotách skenovania, napríklad 5 sekúnd na snímku. Napriek tomu, že pracovné podmienky pri rôznych SEM sa môžu odlišovať, všeobecne platí, že na získanie najlepšej viditeľnosti a rozlíšenia je pri použití relatívne malého objemu hmoty atómov potrebné použiť zvyšujúce sa napätie od 5 – 10 keV pomocou malého bodového nastavenia a krátkej prevádzkovej vzdialenosti. Pri realizácii lineárneho priečneho pohybu sa musí použiť 0o sklon na účely minimalizovania opätovného zaostrenia alebo ak sa SEM nachádza v eucentrickej polohe, použije sa eucentrická prevádzková vzdialenosť. Menšie zväčšenie možno použiť v prípade, ak materiál neobsahuje vlákna s malým priemerom, a pre vlákna s väčším priemerom (> 5 µm).
1.5.3.4. Meranie veľkosti
1.5.3.4.1. Zhodnotenie vzorky preskúšaním pri malom zväčšení
Najskôr sa vzorka preskúša pri malom zväčšení, aby sa zistil zhluk väčších vláken a ich hustota. V prípade nadmerného zhlukovania vláken sa odporúča pripraviť novú vzorku.
Štatistická presnosť si vyžaduje meranie minimálneho počtu vláken, pričom vysoká hustota vláken je výhodnejšia, pretože preskúšavanie prázdnych polí je časovo náročné a nepredstavuje prínos k celkovej analýze. Ak je filter preplnený, meranie všetkých merateľných vláken sa stáva náročným a malé vlákna môžu byť vynechané, lebo sú prekryté väčšími.
Ku skresleniu výsledkov nadhodnotením LWGMD môže dôjsť, ak je hustota vláken väčšia ako 150 vláken na milimeter lineárneho priečneho posunu. Na druhej strane nízka koncentrácia vláken zvyšuje čas analýzy a často je efektívnejšie pripraviť vzorku s hustotou vláken bližšou optimálnej hodnote, ako sa spoliehať na vlákna s nízkou koncentráciou. Optimálna hustota vláken sa určuje na základe priemeru jedného alebo dvoch počítateľných vláken na polia zo záberu pri 5 000-násobnom zväčšení. Napriek tomu optimálna hustota závisí od veľkosti (priemeru) vláken, takže laborant pri rozhodovaní, či hustota vlákna je blízko k optimálnej hodnote, alebo nie, musí použiť vlastný odborný úsudok.
1.5.3.4.2. Meranie dĺžky priemeru vláken
Počítajú sa iba tie vlákna, ktoré sa dotýkajú (alebo prečnievajú) tenkej (plynulej) čiary naznačenej na obrazovke SEM. Na tento účel sa nakreslí horizontálna (alebo vertikálna) čiara idúca stredom obrazovky.
Alternatívou sa ukazuje byť možnosť umiestnenia jednotlivého bodu do stredu obrazovky s plynulým skenovaním jedným smerom krížom cez celý filter. Každé vlákno s koeficientom s priemerom 3:1, ktoré sa dotýka tohto bodu alebo ho presahuje, sa potom zmeria a zaznamená.
1.5.3.4.3. Triedenie vláken
Odporúča sa odmerať minimálne 300 vláken. Každé vlákno sa odmeria iba raz v priesečníku s čiarou alebo bodom nakresleným na obraze (alebo blízko k priesečníku, ak sú okraje vlákna prekryté). Ak sa objavia vlákna, ktoré majú nerovnomerné priečne rezy, je potrebné použiť rozmer reprezentujúci priemernú hodnotu priemeru vlákna. Opatrne treba určiť presný okraj a odmerať najkratšiu vzdialenosť medzi okrajmi vlákna. Triedenie možno realizovať online alebo offline s použitím uložených obrázkov alebo fotografií. Vzhľadom na úsporu času a zamedzenie chýb pri prepise, ako aj kvôli zautomatizovaniu samotného výpočtu sa odporúča použiť poloautomatizovaný snímkovací systém merania, ktorý je schopný stiahnuť údaje priamo do tabuľkovej formy.
Konce dlhých vláken je potrebné preveriť pri nízkej hodnote zväčšenia, aby sa zamedzilo ich opätovnému zvlneniu do zorného poľa merania a zabezpečilo, že sa odmerajú iba raz.
2. ÚDAJE
2.1. SPRACOVANIE VÝSLEDKOV
Priemery vláken zvyčajne nemajú normálne rozloženie. Napriek tomu možno získať pri logaritmickej transformácii rozloženie, ktoré sa približuje k normálnemu stavu.
Výpočet aritmetickej hodnoty (stredná hodnota lnD) a štandardnej odchýlky (SDlnD) od prenosu základne hodnôt e (lnD) z priemerov vláken (D).
|
|
(1) |
|
|
(2) |
Štandardná odchýlka sa vydelí druhou odmocninou počtu meraní (n), čím vyrátame štandardnú chybu (SElnD).
|
|
(3) |
Odpočítajte dvakrát štandardnú chybu od hodnoty a vypočítajte exponenciál tejto hodnoty (stredná hodnota mínus dve štandardné chyby) a dostanete strednú geometrickú hodnotu mínus dve štandardné chyby.
|
|
(4) |
3. NAHLASOVANIE SPRÁV
PROTOKOL O TESTE
Protokol o teste musí obsahovať aspoň nasledujúcu informáciu:
|
— |
hodnotu LWGMD-2SE, |
|
— |
všetky odchýlky a zvlášť tie, ktoré môžu mať vplyv na presnosť a správnosť výsledkov s patričným zdôvodnením. |
4. LITERATÚRA
|
1. |
B. Tylee SOP MF 240. Health and Safety Executive. February 1999. |
|
2. |
G. Burdett and G. Revell. Development of a standard method to measure the length-weigthed geometric mean fibre diameter: Results of the Second inter-laboratory exchange. IR/L/MF/94/07. Project R42.75 HPD. Health and Safety Executive. Research and Laboratory Services Division, 1994. |
(1) Táto hodnota zväčšenia sa uvádza pre vlákna s priemerom 3 μm, pre vlákna s priemerom 6 μm je vhodnejšie 5 000-násobné zväčšenie.
(2) Pri vláknach 3 μm pozri predchádzajúcu poznámku.
PRÍLOHA III
|
B.46. |
PODRÁŽDENIE KOŽE IN VITRO: TEST NA MODELI REKONŠTRUOVANEJ ĽUDSKEJ POKOŽKY |
1. METÓDA
1.1. ÚVOD
Podráždením kože sa rozumie reverzibilné poškodenie kože po aplikácii testovacej látky maximálne na štyri hodiny [v znení definície podľa globálneho harmonizovaného systému klasifikácie a označovania chemických látok a zmesí (GHS) Organizácie Spojených národov (OSN)] (1). Touto testovacou metódou sa zabezpečuje postup in vitro, ktorý v závislosti od požiadaviek na informácie umožňuje určiť podráždenie pokožky látkami ako nezávislý náhradný test v rámci testovacej stratégie, ktorá vychádza z posúdenia závažnosti dôkazov (weight of evidence) (2).
Posudzovanie podráždenia kože sa zvyčajne vykonávalo na laboratórnych zvieratách (pozri metódu B.4) (3). Pokiaľ ide o obavy o životné podmienky zvierat, metóda B.4 umožňuje určiť poleptanie/podráždenie kože pomocou stratégie sekvenčného testovania, s použitím overených metód in vitro a ex vivo, vďaka čomu sa vylúči bolesť a utrpenie zvierat. Tri overené testovacie metódy in vitro alebo usmernenia k testovaniu, B.40, B.40a a TG 435 (4, 5, 6), sú užitočné pri tej časti stratégie sekvenčného testovania B.4, ktorá sa týka poleptania.
Táto testovacia metóda je založená na modeloch rekonštruovanej ľudskej pokožky, ktoré svojím celkovým usporiadaním (použitie keratinocytov získaných z ľudskej pokožky ako zdroja buniek, reprezentatívneho tkaniva a cytoarchitektúry) presne napodobňujú biochemické a fyziologické vlastnosti vrchnej časti ľudskej kože, t. j. epidermy. Postup opísaný v tejto testovacej metóde umožňuje určenie nebezpečenstva dráždivých látok v súlade s kategóriou 2 GHS OSN. Táto testovacia metóda takisto zahŕňa súbor noriem výkonnosti na posudzovanie podobných a upravených testovacích metód založených na rekonštruovanej ľudskej pokožke (7).
Prevalidačné, optimalizačné a validačné štúdie sa ukončili pre dve testovacie metódy in vitro (8, 9, 10, 11, 12, 13, 14, 15, 16, 17) a sú komerčne dostupné ako EpiSkin™ a EpiDerm™, pričom používajú modely rekonštruovanej ľudskej pokožky. Tieto referencie vychádzali z R 38. Niektoré aspekty prepočítania na účely GHS sa uvádzajú v referencii 25. Metódy, ktoré vykazujú výkonnosť ekvivalentnú EpiSkin™ (overená referenčná metóda 1), sa odporúčajú ako nezávislá testovacia metóda, ktorá slúži ako náhrada za testy králikov in vivo na klasifikáciu dráždivých látok kategórie 2 GHS. Metódy, ktoré vykazujú výkonnosť ekvivalentnú EpiDerm™ (overená referenčná metóda 2), sa odporúčajú len ako skríningová testovacia metóda alebo ako časť stratégie sekvenčného testovania v závislosti od posúdenia závažnosti dôkazov na klasifikáciu dráždivých látok kategórie 2 GHS. Skôr ako sa na účely regulácie môže použiť navrhovaný test na modeli rekonštruovanej ľudskej pokožky in vitro, mala by sa stanoviť jeho spoľahlivosť, relevantnosť (presnosť) a obmedzenia jeho navrhovaného používania, aby sa zabezpečila jeho porovnateľnosť s overenou referenčnou metódou 1 v súlade s normami výkonnosti stanovenými v tejto testovacej metóde (doplnok).
V súlade s požiadavkami tejto testovacej metódy boli overené ďalšie dve testovacie metódy na modeli rekonštruovanej ľudskej pokožky in vitro, ktoré vykazujú podobné výsledky ako overená referenčná metóda 1 (18). Ide o upravenú testovaciu metódu EpiDerm™ (metóda „me-too“ 1) a testovaciu metódu SkinEthic RHE™ (upravená referenčná metóda 1).
1.2. VYMEDZENIE POJMOV
V rámci tejto testovacej metódy sa vymedzujú tieto pojmy:
Presnosť: Miera zhody výsledkov testovacej metódy s prijatými referenčnými hodnotami. Ide o opatrenie výkonnosti testovacej metódy a jeden z aspektov relevantnosti. Tento pojem sa často používa zameniteľne s pojmom „zhoda“ a označuje podiel správnych výsledkov testovacej metódy.
Dávkovaná kontrolná látka: Referenčná látka, ktorá v tkanivách vyvoláva odozvu bunkovej životaschopnosti stredného rozsahu.
Životaschopnosť buniek: Parameter na meranie celkovej aktivity bunkovej populácie, ako napríklad schopnosť bunkových mitochondriálnych dehydrogenáz redukovať vitálne farbivo MTT [3 – (4,5-dimetyltiazol-2-yl)-2,5-difenyltetrazólium bromid, tiazolylová modrá)], ktorý v závislosti od posledného meraného cieľového bodu a od použitej koncepcie testu zodpovedá celkovému počtu a/alebo vitalite živých buniek.
ET50 : Expozičný čas potrebný na zníženie životaschopnosti buniek o 50 % pri použití markerovej látky v špecifikovanej pevnej koncentrácii, pozri takisto IC50.
Miera nesprávnej negativity: Podiel všetkých pozitívnych látok, ktoré sú testovacou metódou nesprávne identifikované ako negatívne. Je to jeden z ukazovateľov výkonnosti testovacej metódy.
Miera nesprávnej pozitivity: Podiel všetkých negatívnych (neaktívnych) látok, ktoré sú nesprávne identifikované ako pozitívne. Je to jeden z ukazovateľov výkonnosti testovacej metódy.
Nekonečná dávka: Množstvo testovanej látky aplikovanej na kožu, ktoré prekračuje množstvo potrebné na úplné a rovnomerné pokrytie povrchu kože.
GHS (globálny harmonizovaný systém klasifikácie a označovania chemických látok): Systém navrhovania klasifikácie látok a zmesí podľa štandardizovaných typov a stupňov fyzických, zdravotných a environmentálnych rizík a označovania pomocou príslušných komunikačných prvkov, ako sú piktogramy, signalizačné slová, upozornenia na nebezpečnosť, bezpečnostné upozornenia a karty bezpečnostných údajov, ktoré obsahujú informácie o ich nežiaducich účinkoch z hľadiska ochrany ľudí (vrátane zamestnancov, pracujúcich, prepravcov, spotrebiteľov a osoby zodpovedné za riešenie havárií) a životného prostredia (1); v rámci EÚ bol implementovaný nariadením (ES) č. 1272/2008.
IC50 : Koncentrácia, pri ktorej markerová látka znižuje životaschopnosť tkanív o 50 % (IC50) po stanovenom expozičnom čase, pozri takisto ET50.
Normy výkonnosti: Normy založené na overenej referenčnej metóde, ktoré slúžia ako základňa na hodnotenie porovnateľnosti navrhovanej testovacej metódy, ktorá je mechanicky a funkčne podobná. Patria sem: I. nevyhnutné zložky testovacej metódy; II. minimálny zoznam referenčných látok vybraných spomedzi látok používaných na preukázanie prijateľnej výkonnosti overenej referenčnej metódy a III. porovnateľné úrovne presnosti a spoľahlivosti založené na tom, čo sa získalo pre overenú referenčnú metódu, ktorú by navrhovaná testovacia metóda mala preukázať pri hodnotení pomocou minimálneho zoznamu referenčných látok.
Spoľahlivosť: Meria rozsah, v rámci ktorého sa môže testovacia metóda počas istého časového obdobia opakovane vykonávať v rámci laboratórií a medzi nimi navzájom, pričom sa používa ten istý protokol. Posudzuje sa vypočítaním vnútrolaboratórnej a medzilaboratórnej reprodukovateľnosti.
Citlivosť: Podiel všetkých pozitívnych/aktívnych látok, ktoré sa testom správne klasifikovali. Je to miera presnosti testovacej metódy, ktorá poskytuje kategorizačné výsledky, a ide o dôležité hľadisko pri hodnotení relevantnosti testovacej metódy.
Špecifickosť: Podiel všetkých negatívnych/neaktívnych látok, ktoré sa testom správne klasifikovali. Je to miera presnosti testovacej metódy, ktorá poskytuje kategorizačné výsledky, a ide o dôležité hľadisko pri hodnotení relevantnosti testovacej metódy.
Podráždenie kože: Vytvorenie reverzibilného poškodenia kože po aplikácii testovanej látky v trvaní do štyroch hodín. Podráždenie kože je lokálne vzniknutá, neimunogenetická reakcia, ktorá sa objaví krátko po stimulácii (24). Jeho charakteristickou vlastnosťou je reverzibilný proces, ku ktorému patria zápalové reakcie a väčšina klinických prejavov podráždenia charakteristických pre zápalový proces (erytém, edém, svrbenie a bolesť).
1.3. ROZSAH A OBMEDZENIA
Obmedzením testov rekonštruovanej ľudskej pokožky, ktoré patria do tejto testovacej metódy, je to, že klasifikujú len látky dráždivé pre kožu podľa kategórie 2 GHS OSN. Keďže neumožňujú klasifikáciu látok do nepovinnej kategórie 3 v zmysle GHS OSN, všetky zostávajúce látky nebudú klasifikované (žiadna kategória). V závislosti od regulačných potrieb a možného budúceho začlenenia nových koncových bodov, zlepšení alebo rozvoja nových testov „me-too“ bude možno nutné túto testovaciu metódu revidovať.
Táto testovacia metóda umožňuje určenie nebezpečenstva dráždivých jednozložkových látok (19), ale neposkytuje adekvátne informácie o poleptaní kože. Plyny a aerosóly nemožno testovať, kým nedošlo k hodnoteniu zmesí vo validačnej štúdii.
1.4. PRINCÍP TESTU
Testovacia látka sa lokálne aplikuje na trojrozmerný model rekonštruovanej ľudskej pokožky pozostávajúci z normálnych keratinocytov získaných z ľudskej pokožky, ktoré sa vykultivovali, aby vytvorili viacvrstvový, vysoko diferencovaný model ľudskej pokožky. Pozostáva z organizovanej bazálnej vrstvy, vrstvy ostnitých buniek a vrstvy zrnitých buniek a viacvrstvovej rohovitej vrstvy (stratum corneum) obsahujúcej medzibunkové lipidové lamelové vrstvy usporiadané vo vzoroch, ktoré sú analogické vrstvám nachádzajúcim sa in vivo.
Princíp testu na modeli rekonštruovanej ľudskej pokožky je založený na predpoklade, že dráždivé látky dokážu prejsť cez rohovitú vrstvu pokožky vďaka difúzii, pričom sú cytotoxické pre hlbšie ležiace vrstvy buniek. Životaschopnosť buniek sa meria premenou dehydrogenázy vitálneho farbiva MTT [3 – (4,5-dimetyltiazol-2-yl)-2,5-difenyltetrazólium-bromid, tiazolylová modrá; EINECS číslo 206 – 069 – 5, CAS číslo 298 – 93 – 1)] na modrú formazánovú soľ, ktorá sa kvantitatívne meria po extrakcii z tkanív (20). Dráždivé látky sa identifikujú na základe ich schopnosti spôsobiť pokles životaschopnosti buniek pod vymedzenú prahovú úroveň (t. j. ≤ 50 % pre dráždivé látky kategórie 2 GHS OSN). Látky, ktoré spôsobujú pokles životaschopnosti buniek nad vymedzenú prahovú úroveň, sa neklasifikujú (t. j. > 50 %, žiadna kategória).
Systémy modelu rekonštruovanej ľudskej pokožky sa môžu použiť na testovanie pevných látok, kvapalín, polotuhých látok a voskov. Kvapaliny môžu byť vodné alebo nevodné, pevné látky môžu byť rozpustné alebo nerozpustné vo vode. Ak je to možné, pevné látky by sa mali vždy testovať vo forme jemného prášku. Keďže do overovania systémov testu na modeli rekonštruovanej ľudskej pokožky sa zaradilo 58 starostlivo vybratých látok zastupujúcich široké spektrum chemických tried, očakáva sa, že tieto metódy budú všeobecne platné pre všetky chemické triedy (16). Validácia zahŕňa 13 dráždivých látok kategórie 2 GHS. Je potrebné upozorniť na to, že nežieravé kyseliny, zásady, soli a iné anorganické dráždivé látky neboli zahrnuté do validácie a niektoré známe triedy organických dráždivých látok, ako napríklad hydroperoxidy, fenoly a surfaktanty, neboli zahrnuté alebo boli zahrnuté len v obmedzenej miere.
1.5. PREUKÁZANIE SPÔSOBILOSTI
Predtým ako sa začne bežne používať overená metóda, ktorá vyhovuje požiadavkám tejto testovacej metódy, laboratóriá môžu prejaviť želanie preukázať technickú spôsobilosť pomocou desiatich látok odporúčaných v tabuľke 1. V rámci tejto testovacej metódy sa nepovinná kategória 3 GHS OSN nepovažuje za žiadnu kategóriu. Pri nových podobných testovacích metódach („me-too“) vyvinutých v rámci tejto testovacej metódy, ktoré sú štrukturálne a funkčne podobné overeným referenčným metódam alebo pri úprave overených metód, by sa mali použiť normy výkonnosti opísané v dodatku k tejto testovacej metóde na preukázanie porovnateľnej spoľahlivosti a presnosti novej testovacej metódy predtým, ako sa začne používať na regulačné testovanie.
Tabuľka 1
Látky na preukázanie spôsobilosti, ktoré patria do podskupiny referenčných látok uvedených v dodatku
|
Látka |
CAS číslo |
Hodnota in vivo |
Fyzikálny stav |
Kategória GHS |
|
kyselina 1-naftyloctová |
86 – 87 – 3 |
0 |
pevná látka |
žiadna kat. |
|
propán-2-ol |
67 – 63 – 0 |
0,3 |
kvapalina |
žiadna kat. |
|
metyl-stearát |
112 – 61 – 8 |
1 |
pevná látka |
žiadna kat. |
|
heptyl-butyrát |
5870 – 93 – 9 |
1,7 |
kvapalina |
nepovinná kat. 3 |
|
hexyl-2-hydroxybenzoát |
6259 – 76 – 3 |
2 |
kvapalina |
nepovinná kat. 3 |
|
3-p-kumenyl-2-metylpropanál |
103 – 95 – 7 |
2,3 |
kvapalina |
kat. 2 |
|
1-brómhexán |
111 – 25 – 1 |
2,7 |
kvapalina |
kat. 2 |
|
butyl-metakrylát |
97 – 88 – 1 |
3 |
kvapalina |
kat. 2 |
|
1-metyl-3-fenyl-1-piperazín |
5271 – 27 – 2 |
3,3 |
pevná látka |
kat. 2 |
|
heptanál |
111 – 71 – 7 |
4 |
kvapalina |
kat. 2 |
1.6. OPIS METÓDY
Nasleduje opis zložiek a postupov testu na modeli rekonštruovanej ľudskej pokožky na posúdenie podráždenia kože. Model rekonštruovanej ľudskej pokožky sa môže vytvoriť, pripraviť alebo získať komerčne (napr. EpiSkin™, EpiDerm™ a SkinEthic RHE™). Štandardné protokoly testovacej metódy pre EpiSkin™, EpiDerm™ a SkinEthic RHE™ možno nájsť na [http://ecvam.jrc.ec.europa.eu] (21, 22, 23). Testovanie by sa malo vykonať takto:
1.6.1. Zložky modelu rekonštruovanej ľudskej pokožky
1.6.1.1. Všeobecné podmienky modelu
Na zostavenie epitelu by sa mali použiť normálne ľudské keratinocyty. Pod funkčnou rohovitou vrstvou sa musí nachádzať viac vrstiev životaschopných epitelových buniek (bazálna vrstva, vrstva ostnitých buniek, vrstva zrnitých buniek). Rohovitá vrstva by mala byť viacvrstvová a obsahovať potrebný profil lipidov, aby sa vytvorila silná funkčná bariéra, ktorá odolá rýchlemu prenikaniu cytotoxických markerových látok, ku ktorým patrí napr. dodecylsulfát sodný (SDS) alebo Triton X-100. Bariérová funkcia sa môže posudzovať buď určením koncentrácie, pri ktorej markerová látka znižuje životaschopnosť tkanív o 50 % (IC50) po stanovenom expozičnom čase, alebo určením expozičného času, ktorý je potrebný na zníženie životaschopnosti buniek o 50 % (ET50) pri používaní markerovej látky v určitej pevne stanovenej koncentrácii. Izolačné vlastnosti modelu by mali zabrániť prieniku materiálu okolo rohovitej vrstvy do životaschopného tkaniva, čo by viedlo k chybnému modelovaniu vystavenia kože. Model kože by nemal byť kontaminovaný baktériami, vírusmi, mykoplazmami ani hubami.
1.6.1.2. Podmienky funkčného modelu
1.6.1.2.1. Životaschopnosť
Uprednostňovanou analýzou na určenie stupňa životaschopnosti je MTT (20). Optická hustota (optical density – OD) farbiva extrahovaného (rozpusteného) z tkaniva získaného z negatívnej kontroly (negative control – NC) by mala byť aspoň 20-násobne vyššia ako OD samotného extrakčného rozpúšťadla. Malo by sa zdokumentovať, že tkanivo získané z negatívnej kontroly je stabilné v kultúre (zabezpečuje podobné výsledky merania životaschopnosti) počas expozičného času testu.
1.6.1.2.2. Bariérová funkcia
Rohovitá vrstva a zloženie jej lipidov musia byť schopné zabrániť rýchlemu prieniku cytotoxických markerových látok, ku ktorým patrí napr. SDS alebo Triton X-100, podľa odhadu pomocou IC50 alebo ET50.
1.6.1.2.3. Morfológia
Rekonštruovanú kožu/pokožku by mal histologicky preskúmať riadne kvalifikovaný personál, ktorý musí preukázať, že model rekonštruovanej kože/pokožky má štruktúru podobnú ľudskej koži/pokožke (vrátane viacvrstvovej rohovitej vrstvy).
1.6.1.2.4. Reprodukovateľnosť
Výsledky metódy používajúcej špecifický model by mali preukázať reprodukovateľnosť v čase, najlepšie prostredníctvom príslušnej dávkovanej kontrolnej látky (referenčnej hodnoty) (pozri dodatok).
1.6.1.2.5. Kontroly kvality modelu (QC)
Každá dávka epidermálneho modelu by mala spĺňať stanovené kritériá na uvoľnenie do obehu, v rámci ktorých sú najvýznamnejšie kritériá životaschopnosti (bod 1.6.1.2.1) a bariérovej funkcie (bod 1.6.1.2.2). Rozsah prijateľnosti (horná a dolná hranica) pre IC50 alebo ET50 by mal stanoviť poskytovateľ modelu kože (alebo overovateľ v prípade použitia interného modelu). Bariérové vlastnosti tkanív by sa mali overiť v laboratóriu po prijatí tkanív. Na spoľahlivú prognózu účinkov podráždenia sú prijateľné len výsledky získané pomocou kvalifikovaných tkanív. Ako príklad sa nižšie uvádzajú rozpätia prijateľnosti pre overené referenčné metódy.
Tabuľka 2
Príklady kritérií kontroly kvality na uvoľnenie dávok do obehu
|
|
Dolná hranica prijateľnosti |
Stredná hodnota rozpätia prijateľnosti |
Horná hranica prijateľnosti |
|
Overená referenčná metóda 1 (18-hodinové ošetrenie SDS) |
IC50 = 1,0 mg/ml |
IC50 = 2,32 mg/ml |
IC50 = 3,0 mg/ml |
|
Overená referenčná hodnota 2 (1 % Triton X100) |
ET50 = 4,8 hod. |
ET50 = 6,7 hod. |
ET50 = 8,7 hod. |
1.6.1.3. Aplikácia testovacích a kontrolných látok
Pri každom ošetrení a kontrole by sa mal použiť dostatočný počet replík tkaniva (minimálne tri repliky na jeden pokus). V prípade kvapalných a pevných látok je potrebné na celý povrch kože rovnomerne naniesť dostatočné množstvo testovacej látky, pričom je nutné sa vyhýbať nekonečnej dávke (pozri 1.2. Vymedzenie pojmov), t. j. malo by sa použiť minimálne 25 μL/cm2 alebo 25 mg/cm2. V prípade pevných látok by sa mal pred aplikáciou povrch pokožky zvlhčiť deionizovanou alebo destilovanou vodou, aby sa tak zabezpečil dobrý kontakt s kožou. Ak je to možné, pevné látky by sa mali vždy testovať vo forme jemného prášku. Na konci expozičného času sa testovacia látka musí dôkladne zmyť z povrchu kože vodným pufrom alebo 0,9 % roztokom NaCl. V závislosti od použitého modelu rekonštruovanej ľudskej pokožky sa expozičný čas môže pohybovať v rozmedzí od 15 do 60 minút a inkubačná teplota v rozmedzí 20 °C a 37 °C. Ďalšie informácie sa nachádzajú v štandardných pracovných postupoch pre dané tri metódy (21, 22, 23).
Pre každú štúdiu by sa mali súbežne vykonať negatívne a pozitívne kontroly, aby sa preukázalo, že životaschopnosť (NC), bariérová funkcia a výsledná tkanivová citlivosť tkanív (PC) sú v rámci stanoveného historického rozpätia prijateľnosti. Navrhovaná látka na pozitívnu kontrolu je 5 % vodný SDS. Navrhované látky na negatívnu kontrolu sú voda alebo fosfátom pufrovaný fyziologický roztok (PBS).
1.6.1.4. Merania bunkovej životaschopnosti
Najdôležitejším prvkom testovacieho postupu je to, že merania životaschopnosti sa nevykonávajú hneď po expozícii testovacím látkam, ale až po dostatočne dlhom inkubačnom čase po ošetrení opláchnutých tkanív v čerstvom médiu. Tento čas umožňuje regeneráciu po slabo dráždivých účinkoch, ako aj výskyt jasných cytotoxických účinkov. Počas fázy optimalizácie testu (9, 10, 11, 12, 13) sa ako optimálny ukázal byť 42-hodinový inkubačný čas po ošetrení, a preto sa používal pri overovaní referenčných testovacích metód.
Analýza premeny MTT je overená kvantitatívna metóda, ktorá by sa mala používať na meranie životaschopnosti buniek. Je vhodná na použitie v trojrozmernom modeli tkaniva. Vzorka kože sa na 3 hodiny vloží do roztoku MTT s vhodnou koncentráciou (napr. 0,3 – 1 mg/mL). Pomocou rozpúšťadla (napr. izopropanol, kyslý izopropanol) sa potom z tkaniva extrahuje vyzrážaný modrý formazánový produkt, pričom koncentrácia formazánu sa odmeria stanovením OD pri 570 nm pomocou priepustného pásma maximálne ±30 nm.
Optické vlastnosti testovacej látky alebo jej chemický účinok na MTT môžu interferovať s analýzou, čo vedie k nesprávnemu odhadu životaschopnosti (keďže testovacia látka môže zabraňovať procesu tvorby farby alebo ho zvrátiť, ale rovnako ho môže aj spôsobovať). K tomu môže dôjsť, keď sa špecifická testovacia látka úplne neodstráni z kože pri oplachovaní alebo keď prenikne cez pokožku. Ak testovacia látka pôsobí priamo na MTT, je prirodzene zafarbená alebo sa zafarbí pri ošetrovaní tkaniva, musia sa použiť ďalšie kontroly, aby sa zistilo, či nedochádza k interferencii testovacej látky s technikou merania životaschopnosti, a aby sa táto prípadná interferencia skorigovala. Podrobný opis testovania priamej redukcie MTT sa nachádza v protokole testovacej metódy pre overené referenčné metódy (21, 22, 23). Nešpecifická farba (NSC) spôsobená týmito zásahmi by nemala presahovať 30 % negatívnej kontroly (pre korekcie). Ak NSC > 30 %, testovacia látka sa považuje za nezlučiteľnú s testom.
1.6.1.5. Kritériá prijateľnosti analýzy
Pri každej analýze používajúcej platné dávkovanie (pozri odsek 1.6.1.2.5) by tkanivá spracované negatívnou kontrolou mali vykázať OD, čím by sa prejavila kvalita tkanív po všetkých krokoch zaslania a prijatia a celom procese protokolu podráždenia. Hodnoty OD z kontrol by nemali byť nižšie ako historicky stanovené dolné hranice. Podobne by tkanivá ošetrené pozitívnou kontrolou, t. j. 5 % vodným SDS, mali reflektovať citlivosť, ktorú si tkanivá uchovali, a ich schopnosť reagovať na dráždivú látku v podmienkach každej jednotlivej analýzy (napr. životaschopnosť 40 % pre overenú referenčnú metódu 1 a 20 % pre overenú referenčnú metódu 2). Mali by sa stanoviť súvisiace a vhodné merania variability medzi replikami tkaniva (napr. ak sa použije štandardná odchýlka, mali by byť < 18 %).
2. ÚDAJE
2.1. ÚDAJE
Pre každé ošetrenie je potrebné do tabuľky zaznamenať údaje z jednotlivých testovacích vzoriek replikátu (napr. hodnoty OD a vypočítaný percentuálny podiel životaschopnosti buniek pre každú testovaciu látku vrátane klasifikácie) vrátane údajov o duplicitných alebo opakovaných experimentoch. Okrem toho by sa mali pre každý pokus uvádzať aj stredné hodnoty ± štandardnej odchýlky. Pozorované interakcie s reagentom MTT a zafarbenými testovacími látkami by sa mali oznamovať pre každú testovaciu látku.
2.2. INTERPRETÁCIA VÝSLEDKOV
Hodnoty OD namerané pre každú testovaciu vzorku sa môžu použiť na výpočet percenta životaschopnosti v porovnaní s negatívnou kontrolou, ktorá je stanovená na 100 %. Je potrebné jasne definovať, dokumentovať a v prípade potreby preukázať hraničnú percentuálnu hodnotu životaschopnosti buniek odlišujúcu od seba dráždivé látky a nezatriedené testovacie látky a štatistické postupy použité pri hodnotení výsledkov a identifikácii dráždivých látok. Hraničné hodnoty prognózy podráždenia v rámci overených referenčných metód sa uvádzajú nižšie:
Testovacia látka sa pokladá za dráždivú pre kožu v súlade s kategóriou 2 GHS OSN:
|
i) |
ak životaschopnosť tkaniva po expozičnom a pozorovacom inkubačnom čase je menšia alebo sa rovná (≤) 50 %. |
Testovacia látka nepatrí do žiadnej kategórie:
|
ii) |
ak životaschopnosť tkaniva po expozičnom a pozorovacom inkubačnom čase je väčšia (>) ako 50 %. |
3. PODÁVANIE SPRÁV
3.1. SPRÁVA O TESTE
Správa o teste by mala obsahovať tieto informácie:
Testovacie a kontrolné látky:
|
— |
chemický názov (chemické názvy), ako napríklad názov podľa IUPAC alebo CAS a číslo CAS, ak je známe, |
|
— |
čistota a zloženie látky (v hmotnostných percentách), |
|
— |
fyzikálno-chemické vlastnosti relevantné na vykonanie štúdie (napr. fyzikálny stav, stabilita a nestabilita, pH, rozpustnosť vo vode, ak je známa), |
|
— |
prípadná úprava testovacích/kontrolných látok pred testovaním (napr. zahriatie, rozomletie), |
|
— |
podmienky skladovania. |
Zdôvodnenie modelu kože a použitého protokolu.
Podmienky testovania:
|
— |
použitý bunkový systém, |
|
— |
údaje o kalibrácii zariadenia a priepustnom pásme použitom na meranie životaschopnosti buniek (napr. spektrofotometer), |
|
— |
úplné podkladové údaje o použitom osobitnom modeli kože vrátane jeho výkonnosti. K nim by mala patriť predovšetkým:
|
|
— |
podrobné informácie o použitom postupe testovania, |
|
— |
testovacie dávky, trvanie expozície a pozorovacieho inkubačného času, |
|
— |
opis všetkých modifikácií testovacieho postupu, |
|
— |
odkaz na historické údaje o modeli. K nim by mali patriť predovšetkým:
|
|
— |
opis použitých hodnotiacich kritérií vrátane zdôvodnenia výberu hraničných bodov pre model prognózy. |
Výsledky:
|
— |
údaje z individuálnych testovacích vzoriek spracované v podobe tabuľky, |
|
— |
opis ďalších pozorovaných účinkov. |
Rozbor výsledkov.
Závery.
4. ODKAZY
|
1. |
United Nations (UN) (2007). Globally Harmonized System of Classification and Labelling of Chemicals (GHS), druhé prepracované vydanie, UN New York a Ženeva 2007. Dostupné na internete: http://www.unece.org/trans/danger/publi/ghs/ghs_rev02/02files_e.html. |
|
2. |
REACH: Guidance on Information Requirements and Chemical Safety Assessment. Dostupné na internete: http://guidance.echa.europa.eu/docs/guidance_document/information_requirements_en.htm?time=1232447649. |
|
3. |
Testovacia metóda B.4. ACUTE TOXICITY; AKÚTNE PODRÁŽDENIE/POLEPTANIE KOŽE. |
|
4. |
Testovacia metóda B.40. POLEPTANIE KOŽE IN VITRO: TEST TRANSKUTÁNNEHO ELEKTRICKÉHO ODPORU TER. |
|
5. |
Testovacia metóda B.40A. POLEPTANIE KOŽE IN VITRO: TEST NA MODELI ĽUDSKEJ KOŽE. |
|
6. |
OECD (2006). Testovacie usmernenie 435. OECD Guideline for the Testing of Chemicals. In Vitro Membrane Barrier Test Method. Prijaté 19. júla 2006. Dostupné na internete: http://www.oecd.org/document/22/0,2340,en_2649_34377_1916054_1_1_1_1,00.html. |
|
7. |
ECVAM (2009) Performance Standards for applying human skin models to in vitro skin irritation. Dostupné na internete pod Download Study Documents: http://ecvam.jrc.ec.europa.eu. |
|
8. |
Fentem, J.H., Briggs, D., Chesné, C., Elliot, G.R., Harbell, J.W., Heylings, J.R., Portes, P., Roguet, R., van de Sandt, J.J.M. & Botham, P. (2001). A prevalidation study on in vitro tests for acute skin irritation. Results and evaluation by the Management Team. Toxicology in vitro 15, 57 – 93. |
|
9. |
Portes, P., Grandidier, M.H., Cohen, C. & Roguet, R. (2002). Refinement of the EPISKIN protocol for the assessment of acute skin irritation of chemicals: follow-up to the ECVAM prevalidation study. Toxicology in vitro 16, 765 – 770. |
|
10. |
Kandárová, H., Liebsch, M., Genschow, E., Gerner, I., Traue, D., Slawik, B. & Spielmann, H. (2004). Optimisation of the EpiDerm test protocol for the upcoming ECVAM validation study on in vitro skin irritation tests. ALTEX 21, 107 – 114. |
|
11. |
Kandárová, H., Liebsch, M., Gerner, I., Schmidt, E., Genschow, E., Traue, D. & Spielmann H. (2005) The EpiDerm Test Protocol fort the Upcoming ECVAM Validation Study on In Vitro Skin Irritation Tests – An Assessment of the Performance of the Optimised Test. ATLA 33, 351 – 367. |
|
12. |
Cotovio, J., Grandidier, M. – H., Portes, P., Roguet, R. & G. Rubinsteen. (2005). The In Vitro Acute Skin Irritation of Chemicals: Optimisation of the EPISKIN Prediction Model within the Framework of the ECVAM Validation Process. ATLA 33, 329 – 349. |
|
13. |
Zuang, V., Balls, M., Botham, P.A., Coquette, A., Corsini, E., Curren, R.D., Elliot, G.R., Fentem, J.H., Heylings, J.R., Liebsch, M., Medina, J., Roguet, R., van De Sandt, J.J.M., Wiemann, C. & Worth, A. (2002). Follow-up to the ECVAM prevalidation study on in vitro tests for acute skin irritation. ECVAM Skin Irritation Task Force Report 2. ATLA 30,109 – 129. |
|
14. |
Spielmann, H., Hoffmann, S., Liebsch, M., Botham, P., Fentem, J., Eskes, C., Roguet, R., Cotovió, J., Cole, T., Worth, A., Heylings, J., Jones, P., Robles, C., Kandárová, H., Gamer, A., Remmele, M., Curren, R., Raabe, H., Cockshott, A., Gerner, I. and Zuang, V. (2007) The ECVAM International Validation Study on In Vitro Tests for Acute Skin Irritation: Report on the Validity of the EPISKIN and EpiDerm Assays and on the Skin Integrity Function Test. ATLA 35, 559 – 601. |
|
15. |
Hoffmann, S. (2006). ECVAM Skin Irritation Validation Study Phase II: Analysis of the Primary Endpoint MTT and the Secondary Endpoint IL1-α. 135 pp. + annexes. Dostupné na internete pod Download Study Documents: http://ecvam.jrc.ec.europa.eu. |
|
16. |
Eskes, C., Cole, T., Hoffmann, S., Worth, A., Cockshott, A., Gerner, I. & Zuang. V (2007) ECVAM International Validation Study on In Vitro Tests for Acute Skin Irritation: Selection of Test Chemicals. ATLA 35, 603 – 619. |
|
17. |
J. Cotovio, M. – H. Grandidier, D. Lelièvre, R. Roguet, E. Tinois-Tessonneaud, J. Leclaire (2007). In vitro acute skin irritancy of chemicals using the validated EPISKIN model in a tiered strategy – Results and performances with 184 cosmetic ingredients, AATEX, Special Issue-proceedings from WC6. Vol.14, 351 – 358. |
|
18. |
Vyhlásenie ESAC o aktualizovanej analýze EpiDerm a podobných analýzach SkinEthic. 5. november 2008. |
|
19. |
ES (2006). Nariadenie Európskeho parlamentu a Rady (ES) č. 1907/2006 z 18. decembra 2006 o registrácii, hodnotení, autorizácii a obmedzovaní chemických látok (REACH) a o zriadení Európskej chemickej agentúry, o zmene a doplnení smernice 1999/45/ES a o zrušení nariadenia Rady (EHS) č. 793/93 a nariadenia Komisie (ES) č. 1488/94, smernice Rady 76/769/EHS a smerníc Komisie 91/155/EHS, 93/67/EHS, 93/105/ES a 2000/21/ES. Úradný vestník Európskej únie L 396/1, 30.12.2006. OPOCE, Luxemburg. |
|
20. |
Mosman, T. (1983) Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. Journal of Immunological Methods 65, 55 – 63. |
|
21. |
EpiSkin™ SOP, Version 1.6 (január 2005). Validation of the EpiSkin Skin Irritation Test – 42 Hours Assay For The Prediction of Acute Skin Irritation of Chemicals. Dostupné na internete pod Download Study Documents: http://ecvam.jrc.ec.europa.eu. |
|
22. |
EpiDerm™ SOP, Version 5.0 (október 2004). Draft Standard Operating Procedure. In Vitro Skin Irritation Test: Human Skin Model. Model: EpiDerm™- 200. Dostupné na internete pod Download Study Documents: http://ecvam.jrc.ec.europa.eu. |
|
23. |
SkinEthic RHE™ SOP. Bude dostupné na internete pod Download Study Documents: http://ecvam.jrc.ec.europa.eu. |
|
24. |
Harvell, J.D., Lammintausta, K., Maibach H.I. (1995) Irritant contact dermatitis IN: Guin J.D. Practical Contact Dermatitis Mc Graw-Hill New York, s. 7 – 18. |
|
25. |
Griesinger C, Barroso J & Zuang V: ECVAM background document on the recent adaptations of the ECVAM performance standards for in vitro skin irritation testing in the context of the drafting process of an EU test method and an OECD draft test guideline. Ispra 13. november 2008. |
Dodatok
Hodnotenie výkonnostných charakteristík navrhovaných modelov rekonštruovanej ľudskej pokožky in vitro pri podráždení pokožky
ÚVOD
Postupy navrhované v rámci tejto testovacej metódy by sa mali hodnotiť, aby sa určila ich spoľahlivosť a presnosť pomocou látok, ktoré zastupujú celý rozsah výsledkov dráždivosti Draizovho testu. Pri hodnotení a použití 20 odporúčaných referenčných látok (tabuľka 1) by navrhované postupy mali mať hodnoty spoľahlivosti a presnosti, ktoré sú porovnateľné s hodnotami overených referenčných metód 1 (tabuľka 3) (1). Normy pre presnosť a spoľahlivosť, ktoré by sa mali dosiahnuť, sa uvádzajú v bode II a III. Zaraďujú sa sem neklasifikované aj klasifikované látky (kategória 2 GHS OSN), ktoré predstavujú relevantné chemické triedy, aby sa spoľahlivosť a výkonnosť (citlivosť, špecifickosť, miera nesprávneho negatívu a miera nesprávneho pozitívu a presnosť) navrhovanej testovacej metódy mohli porovnať s hodnotami overenej referenčnej metódy 1. Spoľahlivosť testovacej metódy, ako aj jej schopnosť správne identifikovať dráždivé látky kategórie 2 GHS OSN by sa mali stanoviť pred jej s použitím pri testovaní nových látok.
NORMY VÝKONNOSTI
Normy výkonnosti zahŕňajú tieto tri zložky: I. nevyhnutné zložky testovacej metódy; II. referenčné látky a III. vymedzené hodnoty spoľahlivosti a presnosti (2). Tieto normy výkonnosti sú založené na normách výkonnosti po dokončení validačnej štúdie ECVAM o podráždení kože (3).
I. Nevyhnutné zložky testovacej metódy
Všeobecné podmienky modelu
Na zostavenie epitelu by sa mali použiť normálne ľudské keratinocyty. Pod funkčnou rohovitou vrstvou sa musí nachádzať viac vrstiev životaschopných epitelových buniek (bazálna vrstva, vrstva ostnitých buniek, vrstva zrnitých buniek). Rohovitá vrstva by mala byť viacvrstvová a obsahovať potrebný profil lipidov, aby sa vytvorila silná funkčná bariéra, ktorá odolá rýchlemu prenikaniu cytotoxických markerových látok, ku ktorým patrí napr. dodecylsulfát sodný (SDS) alebo Triton X-100. Bariérová funkcia sa môže posudzovať buď určením koncentrácie, pri ktorej markerová látka znižuje životaschopnosť tkanív o 50 % (IC50) po stanovenom expozičnom čase, alebo určením expozičného času, ktorý je potrebný na zníženie životaschopnosti buniek o 50 % (ET50) pri používaní markerovej látky v určitej pevne stanovenej koncentrácii. Izolačné vlastnosti modelu by mali zabrániť prieniku materiálu okolo rohovitej vrstvy do životaschopného tkaniva, čo by viedlo k chybnému modelovaniu vystavenia kože. Model kože by nemal byť kontaminovaný baktériami, vírusmi, mykoplazmami ani hubami.
Podmienky funkčného modelu
Životaschopnosť
Uprednostňovanou analýzou na určenie stupňa životaschopnosti je MTT (4). Optická hustota (OD) farbiva extrahovaného (rozpusteného) z tkaniva získaného z negatívnej kontroly (NC) by mala byť aspoň 20-násobne vyššia ako OD samotného extrakčného rozpúšťadla. Malo by sa zdokumentovať, že tkanivo získané z negatívnej kontroly je stabilné v kultúre (zabezpečuje podobné výsledky merania životaschopnosti) počas expozičného času testu.
Bariérová funkcia
Rohovitá vrstva a zloženie jej lipidov musia byť schopné zabrániť rýchlemu prieniku cytotoxických markerových látok, ku ktorým patrí napr. SDS alebo Triton X-100, podľa odhadu pomocou IC50 alebo ET50.
Morfológia
Rekonštruovanú kožu/pokožku by mal histologicky preskúmať riadne kvalifikovaný personál, ktorý musí preukázať, že model rekonštruovanej kože/pokožky má štruktúru podobnú ľudskej koži/pokožke (vrátane viacvrstvovej rohovitej vrstvy).
Reprodukovateľnosť
Výsledky metódy používajúcej špecifický model by mali preukázať reprodukovateľnosť v čase, najlepšie prostredníctvom príslušnej dávkovanej kontrolnej látky (referenčnej hodnoty) (pozri vymedzenie pojmov v bode 1.2).
Kontroly kvality modelu (QC)
Každá dávka epidermálneho modelu by mala spĺňať stanovené kritériá na uvoľnenie do obehu, v rámci ktorých sú najvýznamnejšie kritériá životaschopnosti a bariérovej funkcie. Rozsah prijateľnosti (horná a dolná hranica) pre IC50 alebo ET50 by mal stanoviť poskytovateľ modelu kože (alebo overovateľ v prípade použitia interného modelu). Bariérové vlastnosti tkanív by sa mali overiť v laboratóriu po prijatí tkanív. Na spoľahlivú prognózu účinkov podráždenia sú prijateľné len výsledky získané pomocou kvalifikovaných tkanív. Ako príklad sa nižšie uvádzajú rozpätia prijateľnosti pre overené referenčné metódy.
Tabuľka 1
Príklady kritérií kontroly kvality na uvoľnenie dávok do obehu
|
|
Dolná hranica prijateľnosti |
Stredná hodnota rozpätia prijateľnosti |
Horná hranica prijateľnosti |
|
Overená referenčná metóda 1 (18-hodinové ošetrenie SDS) |
IC50 = 1,0 mg/ml |
IC50 = 2,32 mg/ml |
IC50 = 3,0 mg/ml |
|
Overená referenčná hodnota 2 (1 % Triton X100) |
ET50 = 4,8 hod. |
ET50 = 6,7 hod. |
ET50 = 8,7 hod. |
II. Referenčné látky
Referenčné látky sa používajú na určenie toho, či spoľahlivosť a presnosť navrhovanej novej testovacej metódy rekonštruovanej ľudskej pokožky in vitro, ktorá sa ukázala byť štrukturálne a funkčne dostatočne podobná overeným referenčným metódam alebo predstavuje menšiu úpravu overenej referenčnej metódy, je z hľadiska výkonnosti porovnateľná s overenou referenčnou metódou 1 (1). K 20 referenčným látkam uvedeným v tabuľke 2 patria látky predstavujúce rozličné dôležité chemické triedy, ako aj látky kategórie 2 GHS OSN. K látkam uvedeným v tomto zozname patrí 10 látok kategórie 2 GHS OSN, 3 látky nepovinnej kategórie 3 GHS OSN a 7 nezatriedených látok. V rámci tejto testovacej metódy sa nepovinná kategória 3 nepovažuje za žiadnu kategóriu. Tieto referenčné látky predstavujú minimálny počet látok, ktoré by sa mali použiť na hodnotenie presnosti a spoľahlivosti navrhovanej testovacej metódy rekonštruovanej ľudskej pokožky pri podráždení kože. V situácii, keď nie je uvedená látka k dispozícii, môžu sa použiť iné látky, pre ktoré sú dostupné adekvátne referenčné údaje in vivo. Ak je to žiaduce, môžu sa do minimálneho zoznamu referenčných látok pridať ďalšie látky, ktoré predstavujú ostatné chemické triedy a pre ktoré sú dostupné referenčné údaje, aby sa tak mohla ohodnotiť presnosť navrhovanej testovacej metódy.
Tabuľka 2
Referenčné látky na určenie hodnôt presnosti a spoľahlivosti modelov rekonštruovanej ľudskej pokožky pri podráždení kože
|
Látka (1) |
CAS číslo |
EINECS číslo |
Fyzikálny stav |
Hodnota in vivo |
GHS kat. in vitro |
GHS kat. in vivo |
|
1-bróm-4-chlórbután |
6940-78-9 |
230-089-3 |
kvapalina |
0 |
kat. 2 |
žiadna kat. |
|
dietylftalát |
84-66-2 |
201-550-6 |
kvapalina |
0 |
žiadna kat. |
žiadna kat. |
|
kyselina 1-naftyloctová |
86-87-3 |
201-705-8 |
pevná látka |
0 |
žiadna kat. |
žiadna kat. |
|
alyl-fenoxyacetát |
7493-74-5 |
231-335-2 |
kvapalina |
0,3 |
žiadna kat. |
žiadna kat. |
|
propán-2-ol |
67-63-0 |
200-661-7 |
kvapalina |
0,3 |
žiadna kat. |
žiadna kat. |
|
4-(metylsulfanyl)benzaldehyd |
3446-89-7 |
222-365-7 |
kvapalina |
1 |
kat. 2 |
žiadna kat. |
|
metyl-stearát |
112-61-8 |
203-990-4 |
pevná látka |
1 |
žiadna kat. |
žiadna kat. |
|
heptyl-butyrát |
5870-93-9 |
227-526-5 |
kvapalina |
1,7 |
žiadna kat. |
nepovinná kateg. kat. 3 |
|
hexyl-2-hydroxybenzoát |
6259-76-3 |
228-408-6 |
kvapalina |
2 |
žiadna kat. |
nepovinná kat. 3 |
|
triizobutyl-fosfát |
126-71-6 |
204-798-3 |
kvapalina |
2 |
kat. 2 |
nepovinná kat. 3 |
|
dekán-1-ol |
112-30-1 |
203-956-9 |
kvapalina |
2,3 |
kat. 2 |
kat. 2 |
|
3-p-kumenyl-2-metylpropanál |
103-95-7 |
203-161-7 |
kvapalina |
2,3 |
kat. 2 |
kat. 2 |
|
1-brómhexán |
111-25-1 |
203-850-2 |
kvapalina |
2,7 |
kat. 2 |
kat. 2 |
|
2-chlór metyl-3,5-dimetyl-4-metoxypyridín hydrochlorid |
86604-75-3 |
434-680-9 |
pevná látka |
2,7 |
kat. 2 |
kat. 2 |
|
2-(4-metylcyklohex-3-enyl)propán-2-ol |
98-55-5 |
202-680-6 |
kvapalina |
2,7 |
kat. 2 |
kat. 2 |
|
dipropyldisulfán |
629-19-6 |
211-079-8 |
kvapalina |
3 |
žiadna kat. |
kat. 2 |
|
butyl-metakrylát |
97-88-1 |
202-615-1 |
kvapalina |
3 |
kat. 2 |
kat. 2 |
|
benzénetiol, 5-(1,1 dimetyletyl)-2-metyl |
7340-90-1 |
438-520-9 |
kvapalina |
3,3 |
kat. 2 |
kat. 2 |
|
1-metyl-3-fenyl-1-piperazín |
5271-27-2 |
431-180-2 |
pevná látka |
3,3 |
kat. 2 |
kat. 2 |
|
heptanál |
111-71-7 |
203-898-4 |
kvapalina |
4 |
kat. 2 |
kat. 2 |
Látky uvedené v tabuľke 2 poskytujú reprezentatívne rozdelenie 58 látok, ktoré sa použili pri medzinárodnej validačnej štúdii ECVAM o podráždení kože (1). Ich výber sa zakladá na týchto kritériách:
|
— |
látky sú komerčne dostupné, |
|
— |
reprezentujú celý rad výsledkov dráždivosti Draizovho testu (od nedráždiacich až po silne dráždiace), |
|
— |
majú dobre definovanú chemickú štruktúru, |
|
— |
reprezentujú reprodukovateľnosť a schopnosť prognózy overenej metódy, ako je stanovené vo validačnej štúdii ECVAM, |
|
— |
reprezentujú chemickú funkčnosť použitú pri validačnom procese, |
|
— |
nesúvisia s extrémne toxickým profilom (napr. karcinogénnym alebo toxickým pre reprodukčný systém) a nesúvisia s obmedzujúcimi nákladmi na odstránenie. |
III. Vymedzené hodnoty presnosti a spoľahlivosti
Výkonnosť (citlivosť, špecifickosť, miera nesprávneho negatívu a miera nesprávneho pozitívu a presnosť) navrhovanej testovacej metódy by mala byť porovnateľná s hodnotami overenej referenčnej metódy 1 (tabuľka 3), t. j. citlivosť by mala byť vyššia alebo sa rovnať (≥) 80 %, špecifickosť by mala byť vyššia alebo sa rovnať (≥) 70 % a presnosť by mala byť vyššia alebo sa rovnať (≥) 75 %. Vypočítanie výkonnosti by sa malo vykonať pomocou všetkých klasifikácií získaných pre 20 látok v rozličných zúčastnených laboratóriách. Klasifikácia pre každú látku v každom laboratóriu by sa mala získať s použitím strednej hodnoty životaschopnosti za rozličné vykonané pokusy (minimálne tri platné pokusy).
Tabuľka 3
Výkonnosť overenej referenčnej metódy 1 (2)
|
Testovacia metóda |
Počet látok |
Citlivosť |
Špecifickosť |
Miera nesprávneho negatívu |
Miera nesprávneho pozitívu |
Presnosť |
|
Overená referenčná metóda 1 (3) |
58 |
87,2 % (4) |
71,1 % (5) |
12,8 % |
29,9 % |
74,7 % |
|
Overená referenčná metóda 1 (3) |
20 |
90 % |
73,3 % |
10 % |
26,7 % |
81,7 % |
Spoľahlivosť navrhovanej testovacej metódy by mala byť porovnateľná so spoľahlivosťou overených referenčných metód.
Vnútrolaboratórna reprodukovateľnosť
Hodnotenie vnútrolaboratórnej variability by malo dokázať súlad s klasifikáciami (kategória 2/žiadna kategória) získanými pri iných, nezávislých pokusoch 20 referenčných látok v rámci jedného laboratória, ktorý je vyšší ako alebo sa rovná (≥) 90 %.
Medzilaboratórna reprodukovateľnosť
Hodnotenie medzilaboratórnej reprodukovateľnosti nie je nevyhnutné, ak sa navrhovaná testovacia metóda používa len v jednom laboratóriu. Pre metódy, ktoré by sa mali prenášať medzi laboratóriami, by mal byť súlad s klasifikáciami (kategória 2/žiadna kategória) získanými pri iných, nezávislých pokusoch 20 referenčných látok najlepšie medzi minimálne tromi laboratóriami vyšší ako alebo sa rovnať (≥) 80 %.
ODKAZY
|
1. |
Spielmann, H., Hoffmann, S., Liebsch, M., Botham, P., Fentem, J., Eskes, C., Roguet, R., Cotovió, J., Cole, T., Worth, A., Heylings, J., Jones, P., Robles, C., Kandárová, H., Gamer, A., Remmele, M., Curren, R., Raabe, H., Cockshott, A., Gerner, I. and Zuang, V. (2007) The ECVAM International Validation Study on In Vitro Tests for Acute Skin Irritation: Report on the Validity of the EPISKIN and EpiDerm Assays and on the Skin Integrity Function Test. ATLA 35, 559- 601. |
|
2. |
OECD (2005) Guidance Document No. 34 on the validation and international acceptance of new or updated test methods for hazard assessment. OECD, Paris. |
|
3. |
ECVAM (2007) Performance Standards for applying human skin models to in vitro skin irritation. Dostupné na internete pod Download Study Documents: http://ecvam.jrc.ec.europa.eu (cit. 27. októbra 2008). |
|
4. |
Mosman, T. (1983) Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. Journal of Immunological Methods 65, 55- 63. |
|
5. |
Eskes, C., Cole, T., Hoffmann, S., Worth, A., Cockshott, A., Gerner, I. & Zuang. V (2007) ECVAM International Validation Study on In Vitro Tests for Acute Skin Irritation: Selection of Test Chemicals. ATLA 35, 603- 619. |
(1) 20 referenčných látok predstavuje reprezentatívny výber z 58 látok, ktoré sa pôvodne používali na overenie referenčnej metódy 1 (EpiSkin™). Kompletný zoznam testovacích látok a kritériá ich výberu sú k dispozícii (5).
(2) Tabuľka 3 poskytuje výkonnosť overenej referenčnej metódy 1 s ohľadom na jej schopnosť správne identifikovať dráždivé látky (kategória 2 GHS OSN) a neklasifikované látky (žiadna kategória vrátane nepovinnej kategórie 3) pre 58 a 20 referenčných látok (tabuľka 2).
(3) EpiSkin™.
(4) Na základe 13 dráždivých látok kategórie 2 GHS.
(5) Na základe 45 dráždivých látok kategórie 3 GHS alebo chemických látok, ktoré podľa GHS nepatria do žiadnej kategórie.
PRÍLOHA IV
|
C.3. |
SLADKOVODNÉ RIASY A SINICE, TEST INHIBÍCIE RASTU |
1. METÓDA
Táto metóda je rovnocenná s OECD TG 201 (2006) (1).
1.1. ÚVOD
Testovacie metódy sa pravidelne revidujú a aktualizujú vzhľadom na vedecký pokrok. Bolo potrebné revidovať testovaciu metódu C.3 tak, aby zahŕňala ďalšie druhy a spĺňala požiadavky posudzovania rizika a aby bola uvedená klasifikácia chemických látok. Revízia sa uskutočnila na základe rozsiahlych praktických skúseností, vedeckého pokroku v oblasti štúdií toxicity rias a rozsiahleho regulačného využitia, ktoré od pôvodného prijatia metódy nastali.
1.2. VYMEDZENIE POJMOV
Na účely tejto testovacej metódy sa používajú tieto pojmy a skratky:
Biomasa: je suchá hmotnosť živej hmoty nachádzajúcej sa v populácii, vyjadrená ako daný objem, napr. mg rias/liter testovaného roztoku. „Biomasa“ je obvykle definovaná ako hmotnosť, ale v tomto teste sa toto slovo používa na vyjadrenie hmotnosti na objem. V tomto teste biomasu vyjadruje napr. aj počet buniek, fluorescencia atď., ktoré sa bežne merajú, a teda používanie pojmu „biomasa“ sa vzťahuje aj na tieto náhradné kritériá.
Koeficient odchýlky: je bezrozmerná hodnota premenlivosti parametra definovaná ako pomer štandardnej odchýlky k strednej hodnote. Môže sa vyjadriť aj ako percentuálna hodnota. Stredný koeficient odchýlky priemernej špecifickej rýchlosti rastu sa v paralelných kontrolných kultúrach vypočíta takto:
|
1. |
Vypočítajte % KO priemerného špecifického rastu na základe každodenných rýchlostí rastu/rýchlostí rastu po častiach pre príslušné paralelky. |
|
2. |
Vypočítajte strednú hodnotu zo všetkých hodnôt vypočítaných v bode 1 na získanie stredného koeficientu zmeny špecifickej dennej rýchlosti rastu/špecifickej rýchlosti rastu po častiach v paralelných kontrolných kultúrach. |
ECx : je koncentrácia testovanej látky rozpustená v testovacom médiu, ktorej následkom je x % (napr. 50 %) zníženie rastu testovaného organizmu v rámci stanoveného času expozície (je potrebné výslovne uviesť, ak sa odchyľuje od celkovej alebo obvyklej dĺžky testu). Na jednoznačné zaznamenanie hodnoty EC odvodenej od rýchlosti rastu sa používa symbol „ErC“ alebo symbol „EyC“ na zaznamenanie hodnoty z výťažku.
Rastové médium: je kompletné syntetické kultivačné médium, v ktorom testovaná riasa rastie v prítomnosti testovanej látky (expozícii, ktorej je vystavená). Testovaná látka sa za normálnych podmienok rozpustí v testovanom médiu.
Rýchlosť rastu (priemerná špecifická rýchlosť rastu): je logaritmickým nárastom biomasy počas času expozície testovanou látkou.
Najnižšia koncentrácia s pozorovateľnými účinkami (LOEC): je najnižšia testovaná koncentrácia, pri ktorej sa pozoruje, že látka má štatisticky významný účinok na zníženie rastu (pri p < 0,05) v porovnaní s kontrolou v rámci daného času expozície. Škodlivý účinok všetkých testovaných koncentrácií nad LOEC sa však vždy rovná alebo je väčší ako účinky pozorované pri LOEC. Ak nie sú splnené tieto dve podmienky, je potrebné poskytnúť úplné vysvetlenie, akým spôsobom sa zvolila LOEC (a teda aj NOEC).
Koncentrácia bez pozorovaného účinku (NOEC): je testovaná koncentrácia bezprostredne pod LOEC.
Hodnota reakcie: je premenná hodnota na odhad toxicity odvodená z akýchkoľvek stanovených parametrov opisujúcich biomasu rôznymi metódami výpočtu. V prípade tejto metódy sú rýchlosti rastu a výťažok hodnotami reakcie odvodenými priamo z merania biomasy alebo uvedených náhradných parametrov.
Špecifická rýchlosť rastu: je hodnota premennej reakcie definovaná ako kvocient rozdielu prirodzených logaritmov parametra pozorovania (v tejto testovacej metóde biomasy) a príslušného časového intervalu.
Výťažok: je hodnota meranej premennej na konci času expozície mínus hodnota meranej premennej na začiatku času expozície na vyjadrenie nárastu biomasy počas testu.
1.3. POUŽITEĽNOSŤ TESTU
Táto testovacia metóda sa dá najľahšie použiť pre látky rozpustné vo vode, pri ktorých sa predpokladá, že za podmienok testu zostávajú vo vode. V prípade testovania látok, ktoré sú prchavé, silne sa adsorbujú, sú sfarbené, s nízkou rozpustnosťou vo vode, alebo látky, ktoré môžu ovplyvniť dostupnosť živín alebo minerálnych látok v testovacom médiu, môžu byť potrebné určité modifikácie uvedeného postupu (napr. uzatvorený systém, úprava testovacích nádob). Usmernenia k niektorým vhodným úpravám sú uvedené v (2) (3) a (4).
1.4. PRINCÍP TESTU
Cieľom tohto testu je stanoviť účinky látky na rast sladkovodných mikrorias a/alebo siníc. Exponenciálne rastúce testované organizmy sú vystavené testovanej látke v jednorazových kultúrach obvykle počas 72 hodín. Napriek pomerne krátkej dĺžke testu sa môžu hodnotiť účinky na niekoľkých generáciách.
Reakciou systému je zníženie rastu v sérii kultúr rias (testované jednotky) vystavených rôznym koncentráciám testovanej látky. Reakcia sa hodnotila ako funkcia expozičnej koncentrácie v porovnaní s priemerným rastom paralelných, nevystavených kontrolných kultúr. Na preukázanie úplnej reakcie systému na toxické účinky (optimálna citlivosť) sa kultúram umožní neobmedzený exponenciálny rast v podmienkach s vhodnými živinami a nepretržité svetlo počas času postačujúceho na meranie zníženia špecifickej rýchlosti rastu.
Rast a inhibícia rastu sa kvantifikujú stanovením biomasy rias ako funkcie času. Biomasa rias je definovaná ako suchá hmotnosť na objem, napr. mg rias/liter testovaného roztoku. Suchá hmotnosť sa však zložito stanovuje, a preto sa používajú náhradné parametre. Z týchto náhradných parametrov sa najčastejšie používa počet buniek. Iné náhradné parametre zahŕňajú objem buniek, fluorescenciu, optickú hustotu atď. Je potrebné poznať prepočítavací koeficient medzi meraným náhradným parametrom a biomasou.
Konečným bodom testu je inhibícia rastu vyjadrená ako logaritmický nárast biomasy (priemerná špecifická rýchlosť rastu) počas času expozície. Z priemerných špecifických rýchlostí rastu zaznamenaných v sérii testovaných roztokov sa stanoví koncentrácia, ktorá spôsobuje špecifickú x % inhibíciu rýchlosti rastu (napr. 50 %), a vyjadrí sa ako ErCx (napr. ErC50).
Na uplatnenie tejto metódy v regulačnom rámci EÚ by sa mal výpočet výsledkov opierať o priemernú špecifickú rýchlosť rastu z dôvodov uvedených v odseku 2.2. Ďalšou hodnotou reakcie použitou v tejto testovacej metóde je výťažok, ktorý sa v niektorých krajinách vyžaduje na splnenie špecifických regulačných požiadaviek. Definovaný je ako biomasa na konci času expozície mínus biomasa na začiatku času expozície. Z výťažkov zaznamenaných v sérii testovaných roztokov sa stanoví koncentrácia, ktorá spôsobuje špecifickú x % inhibíciu výťažku (napr. 50 %), a vypočíta sa a vyjadrí ako EyCx (napr. EyC50).
Okrem toho možno štatisticky stanoviť najnižšiu koncentráciu s pozorovateľnými účinkami (LOEC) a koncentráciu bez pozorovaného účinku (NOEC).
1.5. INFORMÁCIE O TESTOVANEJ LÁTKE
Informácie o testovanej látke, ktoré môžu byť užitočné pri stanovovaní testovacích podmienok, zahŕňajú štrukturálny vzorec, čistotu, svetelnú stálosť, stabilitu pri skúšobných podmienkach, vlastnosti týkajúce sa absorpcie svetla, pKa a výsledky štúdií transformácie vrátane biologickej odbúrateľnosti vo vode.
Rozpustnosť vo vode, rozdeľovací koeficient oktanol-voda (Pow) a tlak pary testovanej látky musia byť známe a musí byť k dispozícii validovaná metóda na kvantifikáciu látky v testovaných roztokoch so zaznamenanou výťažnosťou a detekčný limit.
1.6. REFERENČNÁ LÁTKA
Referenčná(-é) látka(-y), ako napr. 3,5-dichlórfenol, používané v medzinárodnej kruhovej skúške (4) sa môže(-u) testovať ako prostriedok kontroly postupu testu. Pre zelené riasy sa môže použiť ako referenčná látka aj dvojchroman draselný. Referenčnú látku je potrebné testovať aspoň dvakrát do roka.
1.7. PLATNOSŤ TESTU
Test je platný, ak sú splnené tieto kritériá:
|
— |
Biomasa v kontrolných kultúrach sa musí exponenciálne zvýšiť aspoň o faktor 16 počas 72-hodinového času testu. To je v súlade so špecifickou rýchlosťou rastu 0,92 deň–1. Rýchlosť rastu je obvykle podstatne vyššia pre najčastejšie používané druhy (pozri dodatok 1). Toto kritérium sa nemusí splniť, ak sa používajú druhy, ktoré rastú pomalšie ako druhy, ktoré sú uvedené v dodatku 1. V tomto prípade sa čas testu predĺži, aby sa dosiahol aspoň 16-násobný rast v kontrolných kultúrach, pričom počas trvania testu musí byť rast exponenciálny. Trvanie testu sa môže skrátiť najmenej na 48 hod., aby sa zachoval neobmedzený exponenciálny rast počas testu, pokiaľ sa dosiahol minimálny multiplikačný faktor 16. |
|
— |
Priemerný koeficient odchýlky pre špecifické rýchlosti rastu po častiach (dni 0 – 1, 1 – 2 a 2 – 3 pre 72-hodinové testy) v kontrolných kultúrach (pozri oddiel 1.2 pod nápisom „koeficient odchýlky“) nesmie byť väčší ako 35 %. Pozri druhý odsek v oddiele 2.2.1 na výpočet špecifických rýchlostí rastu po častiach. Toto kritérium platí na strednú hodnotu koeficientov odchýlky vypočítanú pre paralelné kontrolné kultúry. |
|
— |
Koeficient odchýlky priemerných špecifických rýchlostí rastu počas celého času testu v paralelných kontrolných kultúrach nesmie byť väčší ako 7 % v testoch s Pseudokirchneriella subcapitata a Desmodesmus subspicatus. Pre iné, menej často testované druhy nesmie hodnota presiahnuť 10 %. |
1.8. OPIS METÓDY
1.8.1. Prístroje
Testovacie nádoby a iné prístroje, ktoré prichádzajú do styku s testovanými roztokmi, musia byť celé zo skla alebo iného chemicky inertného materiálu. Predmety sa musia dôkladne umyť, aby sa zabezpečilo, že žiadne organické ani anorganické kontaminanty neovplyvnia rast rias ani zloženie testovaných roztokov.
Testovacími nádobami sú zvyčajne sklené banky s rozmermi, ktoré umožnia dostačujúci objem kultúry pre merania počas testu a prenos dostatočného množstva CO2 z atmosféry (pozri druhý odsek v oddiele 1.8.9). Pamätajte, že objem kvapaliny musí byť postačujúci pre analytické stanovenia (pozri piaty odsek v oddiele 1.8.11).
Okrem toho budú potrebné niektoré z týchto zariadení:
|
— |
prístroj na kultiváciu: miestnosť alebo priestor, v ktorom sa môže udržiavať inkubačná teplota v rozmedzí ±2 °C; |
|
— |
prístroje na meranie svetla: je dôležité pripomenúť, že metóda merania intenzity svetla, a najmä typ receptora (kolektora) ovplyvní hodnotu merania. Merania by sa mali prednostne uskutočniť s použitím guľových (4 π) receptorov (ktoré reagujú na priame a odrazené svetlo zo všetkých uhlov nad a pod rovinou merania) alebo 2 π receptora (ktorý reaguje na svetlo zo všetkých uhlov nad rovinou merania); |
|
— |
prístroj na stanovenie biomasy rias. Počet buniek, ktorý je najčastejšie používaným náhradným parametrom za biomasu rias, sa môže vypočítať s použitím elektronického počítadla častíc, mikroskopu s počítacou komôrkou alebo prietokovým cytometrom. Iné náhradné parametre za biomasu možno zmerať s použitím prietokového cytometra, fluorimetra, spektrofotometra alebo kolorimetra. Na výpočet je potrebný prepočítavací faktor vzťahujúci sa na počet buniek na suchú hmotnosť. Na zabezpečenie potrebných meraní pri nízkych koncentráciách biomasy s použitím spektrofotometra môže byť potrebné použiť kyvety s dráhou svetla aspoň 4 cm. |
1.8.2. Testovacie organizmy
Môžu sa použiť viaceré druhy voľne rastúcich mikrorias a siníc. Ukázalo sa, že kmene uvedené v dodatku 1 sú vhodné pre postup testu uvedený v tejto testovacej metóde.
V prípade použitia iných kmeňov je potrebné uviesť v správe o teste kmeň/alebo pôvod. Musí byť potvrdené, že sa môže zachovať exponenciálny rast zvolenej testovanej riasy počas času testu za obvyklých podmienok.
1.8.3. Rastové médium
Odporúčajú sa dve alternatívne rastové médiá, OECD a AAP médium. Zloženie týchto médií je uvedené v dodatku 2. Pamätajte, že počiatočná hodnota pH a kapacita tlmenia (regulujúca nárast pH) oboch médií je rozdielna. Z tohto dôvodu môžu byť výsledky testov odlišné v závislosti od použitého média, najmä ak sa testujú ionizujúce látky.
Na určité účely môže byť potrebné modifikovať rastové médium, napr. keď sa testujú kovy a chelatačné činidlá, alebo pri testovaní pri rôznych hodnotách pH. Použitie modifikovaného média sa musí podrobne opísať a odôvodniť (3) (4).
1.8.4. Počiatočná koncentrácia biomasy
Počiatočná biomasa v testovaných kultúrach musí byť rovnaká vo všetkých testovaných kultúrach a dostatočne nízka, aby umožnila exponenciálny rast počas inkubačného času bez rizika vyčerpania živín. Počiatočná biomasa by nemala byť vyššia ako 0,5 mg/l, vyjadrená ako sušina. Odporúčajú sa tieto počiatočné koncentrácie buniek:
|
Pseudokirchneriella subcapitata |
5 × 103 – 104 |
bunky/ml |
|
Desmodesmus subspicatus |
2 – 5 × 103 |
bunky/ml |
|
Navicula pelliculosa |
104 |
bunky/ml |
|
Anabaena flos-aquae |
104 |
bunky/ml |
|
Synechococcus leopoliensis |
5 × 104 – 105 |
bunky/ml |
1.8.5. Koncentrácie testovanej látky
Rozsah koncentrácií, v ktorých sa môžu účinky prejaviť, sa môže stanoviť na základe výsledkov testov na zistenie rozsahu. Pre konečný definitívny test sa zvolí aspoň päť koncentrácií usporiadaných v geometrickom rade s faktorom maximálne 3,2. Pre testované látky vykazujúce plochú krivku reakcie na koncentráciu sa môže zvoliť vyšší faktor. Séria koncentrácií musí prednostne pokrývať rozmedzie 5 % – 75 % inhibície rýchlosti rastu rias.
1.8.6. Paralelky a kontroly
Test sa uskutoční s tromi paralelkami pri každej testovanej koncentrácii. Ak sa nevyžaduje stanovenie NOEC, môže sa test pozmeniť a zvýšiť počet koncentrácií a znížiť počet paraleliek na koncentráciu. Musia byť aspoň 3 kontrolné paralelky a teoreticky by sa mal použiť dvojnásobný počet paraleliek pre každú testovanú koncentráciu.
Môže sa pripraviť oddelený súbor testovacích roztokov na analytické stanovenie testovanej látky (pozri štvrtý a šiesty odsek v oddiele 1.8.11).
Ak sa na rozpustenie testovanej látky používa rozpúšťadlo, musia sa v teste použiť ďalšie kontroly obsahujúce rozpúšťadlo v rovnakej koncentrácii, ako sa používa v testovaných kultúrach.
1.8.7. Príprava inokula
Na prispôsobenie testovaných rias testovacím podmienkam a zabezpečenie, aby sa riasy nachádzali v exponenciálnej fáze rastu, keď sa používajú na inokuláciu testovacích roztokov, sa pripraví inokulum v testovacom médiu 2 – 4 dni pred začiatkom testu. Biomasa rias sa musí upraviť, aby sa v inokule umožnil exponenciálny rast do začiatku testu. Inokulum sa inkubuje za rovnakých podmienok ako testované kultúry. V inokule sa meria nárast biomasy, aby sa zabezpečilo, že rast je v obvyklom rozsahu ako v prípade testovaného kmeňa za podmienok kultivácie. Príklad postupu na kultiváciu rias je opísaný v dodatku 3. Aby sa zabránilo súčasnému rozdeleniu buniek počas testu, môže byť potrebné uskutočniť druhý krok na rozmnoženie inokula.
1.8.8. Príprava testovacích roztokov
Všetky testovacie roztoky musia obsahovať rovnaké koncentrácie rastového média a počiatočnej biomasy testovanej riasy. Testovacie roztoky zvolených koncentrácií sa pripravujú obvykle zmiešaním zásobného roztoku testovanej látky s rastovým médiom a inokulom. Zásobné roztoky sa pripravujú obvykle rozpustením látky v testovacom médiu.
Rozpúšťadlá, napr. acetón, t-butyl alkohol a dimetylformamid, sa môžu použiť ako nosiče na pridávanie do testovacieho média látok s nízkou rozpustnosťou vo vode (2) (3). Koncentrácia rozpúšťadla nesmie byť vyššia ako 100 µl/l a rovnaká koncentrácia rozpúšťadla sa musí pridať do všetkých kultúr (vrátane kontrol) v testovanej sérii.
1.8.9. Inkubácia
Uzavrite testovacie nádoby zátkami prepúšťajúcimi vzduch. Nádoby sa pretrepú a umiestnia do kultivačného prístroja. Počas testu je potrebné ponechať riasy v suspenzii a umožniť prenos CO2. Preto je potrebné neustále trepanie alebo miešanie. Kultúry sa musia uchovávať pri teplote v rozmedzí 21 °C až 24 °C s presnosťou ±2 °C. Pre iné druhy, ako sú uvedené v dodatku 1, napr. pre tropické druhy, môžu byť vhodné vyššie teploty pod podmienkou, že budú splnené kritériá platnosti. Odporúča sa umiestniť banky náhodne a denne ich v inkubátore premiestňovať.
Počas testu by sa pH kontrolného média nemalo zvýšiť o viac ako 1,5. Pre kovy a zlúčeniny, ktoré sa čiastočne ionizujú pri pH okolo testovacieho pH, môže byť potrebné limitovať kolísanie pH, aby sa získali reprodukovateľné a presné výsledky. Odchýlka < 0,5 pH je technicky možná a dá sa dosiahnuť zabezpečením prísunu dostatočného množstva CO2 z okolitého vzduchu do testovacieho roztoku, napr. zvýšením rýchlosti trepania. Inou možnosťou je znížiť spotrebu CO2 znížením počiatočnej biomasy alebo dĺžky testu.
Priestor, kde sa kultúry inkubujú, musí byť kontinuálne osvetlený rovnomerným fluorescenčným osvetlením, napr. studeným bielym svetlom alebo denným svetlom. Kmene rias a sinice sa odlišujú, pokiaľ ide o požiadavky na svetlo. Je potrebné zvoliť takú intenzitu, ktorá vyhovuje použitému testovanému organizmu. Pre odporúčané druhy zelených rias sa zvolí intenzita svetla na úrovni testovacích roztokov z rozsahu 60 – 120 µE·m–2·s–1 pri meraní vo fotosynteticky účinnom rozsahu vlnovej dĺžky 400 – 700 nm s použitím vhodného receptora. Niektoré druhy, najmä Anabaena flos-aquae, rastú dobre pri nižšej intenzite svetla a pri vyššej intenzite sa môžu poškodiť. Pre takéto druhy je potrebné zvoliť priemernú intenzitu svetla v rozmedzí 40 – 60 µE·m–2·s–1. (Pre prístroje na meranie svetla kalibrované v luxoch príslušné rozmedzie 4 440 – 8 880 luxov pre studené biele svetlo zodpovedá približne odporúčanej intenzite svetla 60 – 120 µE·m–2·s–1.) Počas inkubácie nesmie intenzita svetla kolísať viac ako ±15 % priemernej intenzity svetla.
1.8.10. Dĺžka testu
Dĺžka testu je obvykle 72 hodín. Dĺžka testu sa však môže skrátiť alebo predĺžiť pod podmienkou, že budú splnené všetky kritériá platnosti v oddiele 1.7.
1.8.11. Merania a analytické stanovenia
Počas trvania testu sa v každej banke stanovuje množstvo biomasy minimálne jedenkrát za deň. Ak sa merania uskutočňujú s malými objemami odobratými z testovacieho roztoku pipetou, netreba ich nahradiť.
Meranie biomasy sa uskutočňuje manuálne počítaním buniek pomocou mikroskopu alebo elektronickým počítadlom častíc (ako počet buniek a/alebo biologický objem). Môžu sa použiť alternatívne techniky, napr. prietoková cytometria, in vitro alebo in vivo chlorofylová fluorescencia (6) (7), alebo optická hustota, a uspokojivú koreláciu s biomasou možno preukázať množstvom biomasy vyskytujúcim sa v teste.
pH roztokov sa meria na začiatku a na konci testu.
Ak je dostupný analytický postup na stanovenie testovanej látky v použitom rozsahu koncentrácie, musia sa testovacie roztoky analyzovať, aby sa skontrolovali počiatočné koncentrácie a či sa počas testu zachovávajú expozičné koncentrácie.
Analýza koncentrácie testovanej látky na začiatku a na konci testu nízkej a vysokej testovanej koncentrácie a koncentrácie okolo predpokladaného EC50 môže byť dostačujúca, ak je pravdepodobnosť, že expozičné koncentrácie sa budú odlišovať o menej ako 20 % nominálnych hodnôt počas testu. Odporúča sa analýza všetkých testovaných koncentrácií na začiatku a na konci testu, ak nie je pravdepodobné, že koncentrácie budú v rozmedzí 80 % – 120 % nominálnych hodnôt. Pre prchavé, nestabilné alebo silne sa adsorbujúce testované látky sa odporúča ďalší odber vzoriek na analýzu v 24-hodinových intervaloch počas expozičného času, aby sa lepšie stanovil úbytok testovanej látky. Pre tieto látky budú potrebné ďalšie paralelky. Vo všetkých prípadoch je potrebné stanoviť koncentrácie testovanej látky iba v jednej paralelnej nádobe na každú testovanú koncentráciu (alebo na obsahy nádob rozdelené do paraleliek).
S testovacím médiom pripraveným osobitne na analýzu expozičných koncentrácií počas testu sa musí zaobchádzať rovnako ako s tými, ktoré sa používajú na testovanie, t. j. musia sa inokulovať riasami a inkubovať za rovnakých podmienok. Ak sa vyžaduje analýza rozpustenej testovanej látky, môže byť potrebné separovať riasy od média. Na separáciu sa prednostne použije centrifugácia pri nízkom g, dostatočnom na usadenie rias.
Ak je dokázané, že koncentrácia látky, ktorá sa má testovať, je v uspokojivej miere zachovaná v rozmedzí ±20 % nominálnej hodnoty alebo nameranej počiatočnej koncentrácie počas testu, analýza výsledkov môže byť založená na nominálnych hodnotách alebo nameraných počiatočných hodnotách. Ak je odchýlka od nominálnej alebo nameranej počiatočnej koncentrácie väčšia ako ±20 %, analýza výsledkov musí byť založená na geometrickej strednej koncentrácii počas expozície alebo na modeloch opisujúcich pokles koncentrácie testovanej látky (3) (8).
Inhibičný test rias je dynamickejším testovacím systémom ako väčšina iných krátkodobých testov toxicity pre vodné prostredie. V dôsledku toho môže byť zložité stanoviť skutočné expozičné koncentrácie, najmä pre adsorbujúce sa látky testované pri nízkych koncentráciách. V takýchto prípadoch úbytok látky z roztoku na základe adsorpcie s narastajúcim množstvom biomasy rias neznamená, že sa z testovacieho systému stratil. Pri analýze výsledku testu by sa malo skontrolovať, či zníženie koncentrácie testovanej látky v priebehu testu sprevádza zníženie inhibície rastu. Ak áno, môže sa zvážiť vhodný model, ktorý opisuje pokles koncentrácie testovanej látky (8). Ak nie, môže sa vyžadovať, aby bola analýza výsledkov založená na počiatočných (nominálnych alebo nameraných) koncentráciách.
1.8.12. Iné pozorovania
Musí sa uskutočniť mikroskopické pozorovanie na overenie normálneho a zdravého vzhľadu inokula a na zistenie akéhokoľvek neobvyklého vzhľadu rias (čo môže byť zapríčinené expozíciou testovanej látky) na konci testu.
1.8.13. Limitný test
V určitých situáciách, napr. keď z predbežného testu vyplýva, že testovaná látka nemá žiadne toxické účinky pri koncentráciách do 100 mg·l–1 alebo do jej limitu rozpustnosti v testovacom médiu (podľa toho, ktorá hodnota je nižšia), sa môže uskutočniť limitný test umožňujúci porovnanie reakcií v kontrolnej skupine a jednej ošetrenej skupine (100 mg·l–1 alebo koncentrácia rovnaká ako limit rozpustnosti). Dôrazne sa odporúča, aby to bolo založené na analýze expozičnej koncentrácie. Na limitný test platia všetky už uvedené testovacie podmienky a kritériá platnosti s výnimkou, že musí byť aspoň šesť ošetrených paraleliek. Hodnoty reakcie v kontrolnej a ošetrenej skupine sa môžu analyzovať s použitím štatistického testu na porovnanie stredných hodnôt, napr. Študentov t-test. Ak variancie v oboch skupinách nie sú rovnaké, je potrebné uskutočniť t-test upravený na nerovnaké variancie.
1.8.14. Modifikácia pre silno sfarbené látky
Ožarovanie (intenzita svetla) by malo byť na najvyššom konci rozsahu predpísanom v tejto testovacej metóde: 120µE m-2 s-1 alebo vyššie.
Dráha svetla by sa mala skrátiť zmenšením obsahu testovacích roztokov (v rozpätí 5 – 25 ml).
Na dosiahnutie vysokej frekvencie vystavenia rias veľkému ožiareniu na povrchu kultúry je potrebné dostatočné pretrepanie (napríklad miernym zatrasením).
2. ÚDAJE
2.1. VYTVORENIE RASTOVÝCH KRIVIEK
Biomasa v testovacej nádobe môže byť vyjadrená v jednotkách náhradného parametra použitého na meranie (napr. počet buniek, svietivosť).
Na vytvorenie rastových kriviek usporiadajte do tabuľky stanovené koncentrácie biomasy v testovaných kultúrach a kontrolách spolu s koncentráciami testovaného materiálu a časmi merania zaznamenanými s rozlíšením aspoň na celé hodiny. V tomto prvom štádiu môžu byť užitočné obe stupnice, logaritmická aj lineárna, ale logaritmická stupnica je povinná a obvykle lepšie vyjadruje parametre charakterizujúce rast počas trvania testu. Pamätajte, že exponenciálny rast je vyjadrený priamkou, ak sa vytvorí na logaritmickej stupnici, a že sklon čiary (zošikmenie) označuje špecifickú rýchlosť rastu.
Grafické znázornenie slúži na kontrolu, či kontrolné kultúry počas testu rastú exponenciálne pri predpokladanej rýchlosti rastu. Kriticky preskúmajte všetky experimentálne body a podobu grafov a skontrolujte prvotné údaje a postupy v prípade možných chýb. Skontrolujte najmä všetky experimentálne údaje, pri ktorých sa predpokladá, že sa odchyľujú v dôsledku systematickej chyby. Ak je zrejmé, že sa chyby v postupe dajú zistiť a/alebo sa pokladajú za vysoko pravdepodobné, konkrétny experimentálny údaj sa označí ako extrémna hodnota a nezahrnie sa do následnej štatistickej analýzy. (Nulová koncentrácia rias v jednej z dvoch alebo troch paralelných nádob môže naznačovať, že nádoba nebola správne inokulovaná alebo nebola riadne vyčistená.) V správe o teste sa musia jasne uviesť dôvody na vyradenie experimentálneho údaju ako extrémnej hodnoty. Prípustnými dôvodmi sú iba (zriedkavo) chyby v postupe a nie nepresnosť. Štatistické postupy v prípade identifikácie extrémnych hodnôt majú obmedzené použitie pre tento typ problému a nemôžu nahradiť odborné posúdenie. Extrémne hodnoty (takto označené) sa musia prednostne ponechať medzi experimentálnymi údajmi uvedenými v každej ďalšej grafickej alebo tabuľkovej prezentácii údajov.
2.2. HODNOTY REAKCIE
Cieľom testu je stanoviť účinky testovanej látky na rast rias. Táto testovacia metóda opisuje dve hodnoty reakcie, keďže členské krajiny majú rozdielne preferencie a regulačné požiadavky. Aby boli výsledky testu prijateľné vo všetkých členských krajinách, musia sa vyhodnotiť účinky s použitím oboch hodnôt reakcie a) a b), ktoré sú uvedené nižšie:
|
a) |
Priemerná špecifická rýchlosť rastu: táto hodnota reakcie sa vypočíta na základe logaritmického nárastu biomasy počas času testu vyjadreného za deň. |
|
b) |
Výťažok: touto hodnotou reakcie je množstvo biomasy na konci testu bez počiatočného množstva biomasy. |
Na uplatnenie tejto metódy v regulačnom rámci EÚ by sa mal výpočet výsledkov opierať o priemernú špecifickú rýchlosť rastu z ďalej uvedených dôvodov. Je potrebné pripomenúť, že hodnoty toxicity vypočítané s použitím týchto dvoch hodnôt reakcie nie sú porovnateľné a tento rozdiel sa musí zohľadniť pri použití výsledkov testu. ECx hodnoty založené na priemernej špecifickej rýchlosti rastu (ErCx) budú obvykle vyššie ako výsledky založené na výťažku (EyCx) pri dodržaní testovacích podmienok tejto testovacej metódy pre matematický základ príslušných metód. Neznamená to rozdiel v citlivosti medzi oboma hodnotami reakcie, ale jednoducho to znamená, že hodnoty sa matematicky odlišujú. Pojem priemerná špecifická rýchlosť rastu je založená na všeobecnom exponenciálnom modele rastu rias v nelimitovaných kultúrach, kde sa toxicita stanovuje na základe účinkov na rýchlosť rastu, bez závislosti od absolútnej úrovne špecifickej rýchlosti rastu kontroly, od klesania krivky reakcie na koncentráciu alebo dĺžky testu. Naopak je to v prípade výsledkov založených na výťažku ako hodnote reakcie, ktoré sú závislé od všetkých týchto ďalších premenných. EyCx je závislé od špecifickej rýchlosti rastu druhov rias, ktoré sa používajú v každom teste a od maximálnej špecifickej rýchlosti rastu, ktorá sa môže meniť medzi druhmi a dokonca medzi rozdielnymi kmeňmi rias. Táto hodnota reakcie sa nesmie použiť na porovnanie citlivosti na toxické látky medzi druhmi rias alebo dokonca odlišnými kmeňmi. Zatiaľ čo sa z vedeckého hľadiska na stanovenie toxicity uprednostňuje použitie priemernej špecifickej rýchlosti rastu, aby sa vyhovelo súčasným regulačným požiadavkám v niektorých krajinách, do tejto testovacej metódy sa zahrnulo aj stanovenie toxicity založené na výťažku.
2.2.1. Priemerná rýchlosť rastu
Priemerná špecifická rýchlosť rastu pre konkrétny čas sa vypočíta ako logaritmus nárastu biomasy z rovnice pre každú jednotlivú kontrolnú a ošetrenú nádobu:
 (deň–1)
(deň–1)
kde:
|
µ i – j |
je priemerná špecifická rýchlosť rastu od času i do j |
|
X i |
je biomasa v čase i |
|
X j |
je biomasa v čase j. |
Pre každú ošetrenú a kontrolnú skupinu vypočítajte strednú hodnotu pre rýchlosť rastu spolu s odhadmi variancie.
Vypočítajte priemernú špecifickú rýchlosť rastu počas celej dĺžky testu (obvykle dni 0 – 3) radšej s použitím ako počiatočnej hodnoty nominálne inokulovanej biomasy ako nameranej počiatočnej hodnoty, pretože sa týmto spôsobom obvykle dosahuje väčšia presnosť. Ak použité zariadenie na meranie biomasy umožňuje dostatočne presné stanovenie malého množstva inokula biomasy (napr. prietokový cytometer), potom sa môže použiť nameraná počiatočná koncentrácia biomasy. Tiež stanovte rýchlosti rastu po častiach vypočítané ako špecifické rýchlosti rastu pre každý deň počas priebehu testu (dni 0 – 1, 1 – 2 a 2 – 3) a skontrolujte, či je kontrolná rýchlosť rastu naďalej konštantná (pozri kritériá platnosti, oddiel 1.7). Významne nižšia špecifická rýchlosť rastu v deň jeden ako celková priemerná špecifická rýchlosť rastu môže indikovať lag fázu. Zatiaľ čo lag fázu možno minimalizovať a prakticky eliminovať v kontrolných kultúrach vhodným namnožením prípravnej kultúry, lag fáza v exponovaných kultúrach môže indikovať regeneráciu po pôvodnom toxickom strese alebo zníženú expozíciu pre úbytok testovanej látky (vrátane sorpcie na biomasu rias) po počiatočnej expozícii. Môže sa teda stanoviť rýchlosť rastu po častiach na vyhodnotenie účinkov testovanej látky, ktoré sa vyskytnú počas času expozície. Značné rozdiely medzi rýchlosťou rastu po častiach a priemernou rýchlosťou rastu indikujú odchýlku od konštantného exponenciálneho rastu, a to, že dôkladné preskúmanie rastových kriviek je zabezpečené.
Vypočítajte inhibíciu rýchlosti rastu v percentách pre každú ošetrenú paralelku s pomocou rovnice:
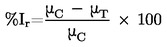
kde:
|
%Ir: |
percentuálna inhibícia priemernej špecifickej rýchlosti rastu |
|
µC: |
stredná hodnota priemernej špecifickej rýchlosti rastu (µ) v kontrolnej skupine |
|
µT: |
priemerná špecifická rýchlosť rastu pre ošetrenú paralelku. |
Ak sa použijú rozpúšťadlá na prípravu testovacích roztokov, použijú sa vo výpočte percentuálnej inhibície skôr kontroly s rozpúšťadlom ako kontroly bez rozpúšťadiel.
2.2.2. Výťažok
Výťažok sa vypočíta ako množstvo biomasy na konci testu mínus počiatočné množstvo biomasy pre každú jednotlivú kontrolnú a ošetrenú nádobu. Pre každú testovanú koncentráciu a kontrolu vypočítajte strednú hodnotu výťažku spolu s odhadmi variancie. Percentuálna inhibícia výťažku (%Iy) sa môže vypočítať pre každú ošetrenú paralelku takto:

kde:
|
% Iy: |
percentuálna inhibícia výťažku |
|
YC: |
stredná hodnota výťažku v kontrolnej skupine |
|
YT: |
hodnota výťažku pre ošetrenú paralelku. |
2.3. VYTVORENIE KRIVKY REAKCIE NA KONCENTRÁCIU
Zaznamenajte do grafu percento inhibície proti logaritmu koncentrácie testovanej látky a pozorne graf skontrolujte a nezohľadnite žiadny experimentálny údaj, ktorý bol vylúčený v prvej fáze ako extrémna hodnota. Plynulou čiarou spojte body voľne alebo počítačovou interpoláciou na stanovenie prvých výsledkov o vzťahu medzi koncentráciou a reakciou, potom postupujte presnejšou metódou, prednostne výpočtovou štatistickou metódou. V závislosti od plánovaného využitia údajov, kvality (presnosti) a množstva údajov, ako aj dostupnosti nástrojov na analýzu sa môže rozhodnúť (a niekedy odôvodniť) zastaviť v tomto štádiu analýzu údajov a jednoducho odčítať kľúčové hodnoty EC50 a EC10 (a/alebo EC20) z krivky spojenej voľne (pozri aj nižšie uvedenú časť o stimulačných účinkoch). Platné dôvody na nepoužitie štatistickej metódy môžu zahŕňať toto:
|
— |
Údaje nie sú vhodné pre výpočtové metódy, aby poskytli spoľahlivejšie výsledky, ako sa dajú získať odborným posúdením – za takýchto okolností niektoré počítačové programy môžu dokonca poskytnúť nesprávne riešenie (iterácie nesmú konvergovať atď.). |
|
— |
Reakcie stimulovaného rastu nemožno náležite spracovať s použitím dostupných počítačových programov (pozri nižšie). |
2.4. ŠTATISTICKÉ POSTUPY
Cieľom je získať kvantitatívny vzťah medzi koncentráciou a reakciou regresnou analýzou. Možno použiť váženú lineárnu regresiu po uskutočnení linearizovanej transformácie reakčných údajov – napríklad na probitové alebo logitové, alebo Weibullove jednotky (9), alebo sa uprednostňujú techniky nelineárnej regresie, ktorými sa lepšie spracujú nepresnosti údajov, ktorým sa nedá zabrániť, a odchýlky od hladkých rozdelení. Priblížením buď k nulovej, alebo k úplnej inhibícii sa takéto nepresnosti môžu transformáciou zväčšiť a ovplyvniť analýzu (9). Je potrebné pripomenúť, že štandardné metódy analýzy s použitím probitovej, logitovej alebo Weibullovej transformácie sa plánujú na použitie na kvantálne (napr. mortalita alebo prežitie) údaje a musia sa modifikovať, aby sa prispôsobili údajom o raste alebo biomase. Osobitné postupy na stanovenie hodnôt ECx zo spojitých údajov možno nájsť v (10) (11) a (12). Použitie nelineárnej regresnej analýzy je uvedené ďalej v dodatku 4.
Pre každú hodnotu reakcie, ktorá sa má analyzovať, použite vzťah medzi koncentráciou a reakciou na výpočet bodových odhadov hodnôt ECx. Ak je to možné, je potrebné stanoviť 95 % hranice spoľahlivosti pre každý odhad. Vhodnosť reakčných údajov na regresný model je potrebné vyhodnotiť buď graficky, alebo štatisticky. Regresná analýza sa musí uskutočniť s použitím jednotlivých reakcií paraleliek, nie stredných hodnôt ošetrenej skupiny. Ak je však zostrojenie nelineárnej krivky zložité alebo nemožné pre príliš veľký rozptyl údajov, problému sa dá vyhnúť uskutočnením regresie na skupinovom základe ako praktický spôsob zníženia vplyvu podozrivých extrémnych hodnôt. Použitie tejto možnosti sa musí uviesť v správe z testu ako odchýlka od obvyklého postupu, pretože krivky zostrojené s jednotlivými paralelkami nepriniesli dobrý výsledok.
EC50 odhady a hranice spoľahlivosti sa môžu získať aj s použitím lineárnej interpolácie bootstrappingom (13), ak dostupné regresné modely/metódy sú nevhodné pre údaje.
Pre odhad LOEC aj NOEC v prípade účinkov testovanej látky na rýchlosť rastu je potrebné porovnať stredné hodnoty ošetrenej skupiny s použitím techník pre analýzu variancie (ANOVA). Stredná hodnota pre každú koncentráciu sa musí potom porovnať s kontrolnou strednou hodnotou s použitím príslušného viacnásobného porovnania alebo testovacej metódy trendu. Môže sa použiť Dunnettov alebo Williamsov test (14) (15) (16) (17) (18). Je potrebné stanoviť, či je dodržaný ANOVA predpoklad homogenity variancie. Toto stanovenie sa môže uskutočniť graficky alebo oficiálnym testom (18). Vhodný je Levenov alebo Bartlettov test. Nesplnenie predpokladu homogenity variancie sa môže niekedy upraviť logaritmickou transformáciou údajov. Ak je heterogenita variancie extrémna a nedá sa korigovať transformáciou, je potrebné posúdiť analýzu metódami, ako sú napr. „step-down Jonkheere“ testy trendu. Ďalšie informácie o stanovení NOEC možno nájsť v (12).
Najnovší vedecký vývoj vedie k odporúčaniu, aby sa upustilo od koncepcie NOEC a nahradila sa regresiou založenou na bodovom odhade ECx. Príslušná hodnota pre x pre tento test na riasach nebola stanovená. Rozsah 10 % až 20 % sa zdá byť vhodný (v závislosti od zvolenej hodnoty reakcie) a prednostne sa musí zaznamenať EC10 a EC20.
2.5. STIMULÁCIA RASTU
Niekedy sa pri nízkych koncentráciách pozoruje stimulácia rastu (negatívna inhibícia). Môže to byť v dôsledku hormézy („toxickej stimulácie“) alebo pridania stimulujúcich rastových faktorov s testovaným materiálom do použitého minimálneho média. Pamätajte, že pridanie anorganických živín by nemalo mať žiadny priamy účinok, pretože testovacie médium by malo počas testu zachovávať nadbytok živín. Stimuláciu pri nízkych dávkach možno ignorovať pri výpočtoch EC50, pokiaľ nie je extrémna. Ak je však extrémna alebo sa má vypočítať hodnota ECx pre nízke x, môžu sa vyžadovať osobitné postupy. Malo by sa zabrániť vypusteniu stimulačných reakcií z analýzy údajov, ak je to možné, a ak dostupný softvér na vytvorenie krivky nemôže prijať malú stimuláciu, môže sa použiť lineárna interpolácia bootstrappingom. Ak je stimulácia extrémna, môže sa zvážiť model hormézy (19).
2.6. NETOXICKÁ INHIBÍCIA RASTU
Testovacie materiály absorbujúce svetlo môžu spôsobiť zníženie rýchlosti rastu, pretože tienenie znižuje množstvo dostupného svetla. Takéto fyzikálne typy účinkov je potrebné oddeliť od toxických účinkov modifikáciou podmienok testu, a to je potrebné osobitne uviesť v správe. Informácie možno nájsť v (2) a (3).
3. SPRÁVA
3.1. SPRÁVA O TESTE
Správa o teste musí obsahovať tieto informácie:
Testovaná látka:
|
— |
fyzikálny charakter a príslušné fyzikálno-chemické vlastnosti vrátane limitu rozpustnosti vo vode, |
|
— |
chemické identifikačné údaje vrátane čistoty. |
Testované druhy:
|
— |
kmeň, dodávateľ alebo zdroj a použité podmienky kultivácie. |
Testovacie podmienky:
|
— |
dátum začiatku testu a jeho dĺžka, |
|
— |
opis testu: testovacie nádoby, objemy kultúr, hustota biomasy na začiatku testu, |
|
— |
zloženie média, |
|
— |
testované koncentrácie a paralelky (napr. počet paraleliek, počet testovaných koncentrácií a použitý geometrický rad), |
|
— |
opis prípravy testovaných roztokov vrátane použitia rozpúšťadiel atď. |
|
— |
prístroj na kultiváciu, |
|
— |
intenzita svetla a kvalita (zdroj, homogenita), |
|
— |
teplota, |
|
— |
testované koncentrácie: nominálne testované koncentrácie a všetky výsledky analýz na stanovenie koncentrácie testovanej látky v testovacích nádobách. V správe sa musí uviesť výťažnosť a limit kvantifikácie v testovacom matrixe, |
|
— |
všetky odchýlky od tejto testovacej metódy, |
|
— |
metódy na stanovenie biomasy a dôkaz vzťahu medzi stanoveným parametrom a sušinou. |
Výsledky:
|
— |
pH hodnoty na začiatku a na konci testu pri všetkých ošetreniach, |
|
— |
množstvo biomasy v každej banke v každom meranom bode a metóda merania biomasy, |
|
— |
rastové krivky (graf množstva biomasy proti času), |
|
— |
vypočítané hodnoty reakcie pre každú ošetrenú paralelku so strednými hodnotami a variančným koeficientom v prípade paraleliek, |
|
— |
grafické znázornenie vzťahu koncentrácie a účinku, |
|
— |
odhady toxicity pre hodnoty reakcie, napr. EC50, EC10, EC20, a sprievodné intervaly spoľahlivosti. Ak sa vypočítavajú, LOEC a NOEC a štatistické metódy použité na ich stanovenie, |
|
— |
ak sa používa ANOVA, veľkosť účinku, ktorý sa stanovil (napr. najmenej významný rozdiel), |
|
— |
každá stimulácia rastu zistená v každom ošetrení, |
|
— |
všetky iné pozorované účinky, napr. morfologické zmeny rias, |
|
— |
diskusia k výsledkom vrátane každého vplyvu na záver z testu vyplývajúceho z odchýliek od tejto testovacej metódy. |
4. POUŽITÁ LITERATÚRA
|
(1) |
OECD TG 201 (2006) Freshwater Alga and Cyanobacteria, Growth Inhibition Test. |
|
(2) |
ISO 1998: Water quality – Guidance for algal growth inhibition tests with poorly soluble materials, volatile compounds, metals and waster water. ISO/DIS 14442. |
|
(3) |
OECD 2000: Guidance Document on Aquatic Toxicity Testing of Difficult Substances and mixtures. Environmental Health and Safety Publications. Series on Testing and Assessment, no. 23. |
|
(4) |
ISO 1998: Water quality – Sampling – Part 16: General Guidance for Biotesting. ISO 5667 – 16. |
|
(5) |
ISO 1993: Water quality – Algal growth inhibition test. ISO 8692. |
|
(6) |
Mayer, P., Cuhel, R. and Nyholm, N. (1997). A simple in vitro fluorescence method for biomass measurements in algal growth inhibition tests. Water Research 31: 2525 – 2531. |
|
(7) |
Slovacey, R.E. and Hanna, P.J. In vivo fluorescence determinations of phytoplancton chlorophyll, Limnology & Oceanography 22,5 (1977), pp. 919 – 925. |
|
(8) |
Simpson, S.L., Roland, M.G.E., Stauber, J.L. and Batley, G.E. (2003) Effect of declining toxicant concentrations on algal bioassay endpoints. Environ. Toxicol. Chem 22, 2073 – 2079. |
|
(9) |
Christensen, E.R., Nyholm, N. (1984): Ecotoxicological Assays with Algae: Weibull Dose-Response Curves. Env. Sci. Technol. 19, 713 – 718. |
|
(10) |
Nyholm, N. Sørensen, P.S., Kusk, K.O. and Christensen, E.R. (1992): Statistical treatment of data from microbial toxicity tests. Environ. Toxicol. Chem. 11, 157 – 167. |
|
(11) |
Bruce, R.D., and Versteeg, D.J. (1992). A statistical procedure for modelling continuous toxicity data. Env. Toxicol. Chem. 11: 1485 – 1494. |
|
(12) |
OECD. (2004). Guidance Document on Statistical Analysis of Ecotoxicity Data. |
|
(13) |
Norberg-King T.J. (1988) An interpolation estimate for chronic toxicity: The ICp approach. National Effluent Toxicity Assessment Center Technical Report 05 – 88. USEPA, Duluth, MN. |
|
(14) |
Dunnett, C.W. (1955) A multiple comparisons procedure for comparing several treatments with a control. J. Amer. Statist. Assoc. 50: 1096 – 1121. |
|
(15) |
Dunnett, C.W. (1964) New tables for multiple comparisons with a control. Biometrics 20: 482 – 491. |
|
(16) |
Williams, D.A. (1971) A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27: 103 – 117. |
|
(17) |
Williams, D.A. (1972) The comparison of several dose levels with a zero dose control. Biometrics 28: 510 – 531. |
|
(18) |
Draper, N.R. and Smith, H. (1981). Applied Regression Analysis, second edition. Wiley, New York. |
|
(19) |
Brain P. and Cousens R. (1989). An equation to describe dose-responses where there is stimulation of growth at low doses. Weed Research, 29, 93 – 96. |
Dodatok 1
Kmene, ktoré sa ukázali ako vhodné na účely testu
Zelené riasy
|
— |
Pseudokirchneriella subcapitata (predtým známa pod názvom Selenastrum capricornutum), ATCC 22662, CCAP 278/4, 61.81 SAG, |
|
— |
Desmodesmus subspicatus (predtým známa ako Scenedesmus subspicatus), 86.81 SAG. |
Rozsievky
|
— |
Navicula pelliculosa, UTEX 664. |
Sinice
|
— |
Anabaena flos-aquae, UTEX 1444, ATCC 29413, CCAP 1403/13A, |
|
— |
Synechococcus leopoliensis, UTEX 625, CCAP 1405/1. |
Zdroje kmeňov
Odporúčané kmene sú dostupné z kultúr s jedným druhom rias z týchto zbierok (v abecednom poradí):
|
|
|
|
|
|
|
|
|
|
|
|
Vzhľad a charakteristika odporúčaných druhov
|
|
P. subcapitata |
D. subspicatus |
N. pelliculosa |
A. flos-aquae |
S. leopoliensis |
|
Vzhľad |
zakrivené, skrútené samostatné bunky |
oválne, väčšinou samostatné bunky |
tyčinky |
reťazce oválnych buniek |
tyčinky |
|
Veľkosť (dl. × š.) µm |
8 – 14 × 2 – 3 |
7 – 15 × 3 – 12 |
7,1 × 3,7 |
4,5 × 3 |
6 × 1 |
|
Objem buniek (µm3/bunku) |
40 – 60 (1) |
60 – 80 (1) |
40 – 50 (1) |
30 – 40 (1) |
2,5 (2) |
|
Sušina buniek (mg/bunku) |
2 – 3 × 10–8 |
3 – 4 × 10–8 |
3 – 4 × 10–8 |
1 – 2 × 10–8 |
2 – 3 × 10–9 |
|
Rýchlosť rastu (3) (deň–1) |
1,5 – 1,7 |
1,2 – 1,5 |
1,4 |
1,1 – 1,4 |
2,0 – 2,4 |
Osobitné odporúčania pre kultiváciu a zaobchádzanie s odporúčanými testovanými druhmi
Pseudokirchneriella subcapitata a Desmodesmus subspicatus
Tieto zelené riasy sa obvykle ľahko uchovávajú v rôznych kultivačných médiách. Informácie týkajúce sa vhodných médií sú dostupné zo zbierok kultúr. Bunky sú obvykle samostatné, bunková hustota sa stanovuje jednoducho s použitím elektronického počítadla častíc alebo mikroskopu.
Anabaena flos-aquae
Na uchovávanie zásobnej kultúry sa môžu použiť rôzne rastové médiá. Je mimoriadne dôležité, aby sa pri obnovovaní zabránilo jednorazovej kultúre prekročiť log fázy rastu, v tomto bode je obnova zložitá.
Anabaena flos-aquae vytvára zhluky spletených reťazcov buniek. Veľkosť týchto zhlukov sa môže meniť podľa podmienok kultivácie. Môže byť potrebné rozdeliť tieto zhluky pri počítaní pomocou mikroskopu alebo elektronického počítadla častíc, ktoré sa použije na stanovenie množstva biomasy.
Môže sa použiť sonifikácia častí vzoriek na rozbitie reťazcov, aby sa znížila variabilita počtu buniek. Dlhšia sonifikácia, ako sa vyžaduje na rozbitie reťazcov na kratšie úseky, môže poškodiť bunky. Intenzita sonifikácie a jej trvanie musia byť rovnaké pri každom spracovaní.
Spočítajte dostatočné množstvo políčok na hemocytometri (minimálne 400 buniek) na elimináciu variability. Tým sa zlepší spoľahlivosť mikroskopického stanovenia hustoty.
Elektronické počítadlo častíc sa môže použiť na stanovenie celkového objemu buniek druhu Anabaena po rozbití reťazcov buniek opatrnou sonifikáciou. Je potrebné prispôsobiť silu sonifikácie, aby sa zabránilo rozbitiu buniek.
Použite vortexový mixér alebo podobnú vhodnú metódu na zabezpečenie toho, že suspenzia rias, ktorá sa použije na inokuláciu testovacích nádob je dobre premiešaná a homogénna.
Testovacie nádoby sa musia umiestniť na orbitálnu trepačku s platformou približne pri 150 otáčkach za minútu. Alternatívne sa môže použiť občasné miešanie na zníženie tvorby zhlukov druhu Anabaena. Ak sa vyskytne zhlukovanie, je potrebné venovať pozornosť tomu, aby sa dosiahli reprezentatívne vzorky na stanovenie množstva biomasy. Môže byť potrebné prudké premiešanie pred odberom vzoriek, aby sa rozbili zhluky rias.
Synechococcus leopoliensis
Na uchovávanie zásobnej kultúry sa môžu použiť rôzne rastové médiá. Informácie týkajúce sa vhodných médií sú dostupné zo zbierok kultúr.
Synechococcus leopoliensis rastie vo forme samostatných tyčinkovitých buniek. Bunky sú veľmi malé, čo sťažuje použitie počítania pomocou mikroskopu pri stanovovaní množstva biomasy. Užitočné sú elektronické počítadlá častíc vybavené na počítanie menších častíc až veľkosti približne 1 µm. Vhodné sú tiež fluorometrické merania in vitro.
Navicula pelliculosa
Na uchovávanie zásobnej kultúry sa môžu použiť rôzne rastové médiá. Informácie týkajúce sa vhodných médií sú dostupné zo zbierok kultúr. Pamätajte, že do média je potrebné pridať kremičitan.
Navicula pelliculosa môže za určitých rastových podmienok tvoriť zhluky. Kvôli produkcii lipidov majú bunky rias niekedy tendenciu akumulovať vo forme povrchového filmu. Za týchto okolností je potrebné prijať osobitné opatrenia pri odoberaní čiastočných vzoriek na stanovenie množstva biomasy, aby bolo možné získať reprezentatívne vzorky. Môže byť potrebné prudké premiešanie, napr. s použitím vortexového mixéra.
(1) Stanovené elektronickým počítadlom častíc.
(2) Vypočítané z veľkosti.
(3) Najčastejšie pozorovaná rýchlosť rastu v OECD médiu s intenzitou svetla približne 70 µE·m–2·s–1 a 21 °C.
Dodatok 2
Rastové médiá
Môže sa použiť jedno z týchto rastových médií:
MédiumOECD: Pôvodné médium OECD TG 201, tiež podľa ISO 8692.
US EPA médium AAP, tiež podľa ASTM.
Pri príprave týchto médií sa musí použiť činidlo alebo chemické látky analytickej kvality a deionizovaná voda.
Zloženie média AAP (US. EPA) a média OECD TG 201.
|
Zložka |
EPA |
OECD |
||
|
|
mg/l |
mM |
mg/l |
mM |
|
NaHCO3 |
15,0 |
0,179 |
50,0 |
0,595 |
|
NaNO3 |
25,5 |
0,300 |
|
|
|
NH4Cl |
|
|
15,0 |
0,280 |
|
MgCl2·6(H2O) |
12,16 |
0,0598 |
12,0 |
0,0590 |
|
CaCl2·2(H2O) |
4,41 |
0,0300 |
18,0 |
0,122 |
|
MgSO4·7(H2O) |
14,6 |
0,0592 |
15,0 |
0,0609 |
|
K2HPO4 |
1,044 |
0,00599 |
|
|
|
KH2PO4 |
|
|
1,60 |
0,00919 |
|
FeCl3·6(H2O) |
0,160 |
0,000591 |
0,0640 |
0,000237 |
|
Na2EDTA·2(H2O) |
0,300 |
0,000806 |
0,100 |
0,000269 (1) |
|
H3BO3 |
0,186 |
0,00300 |
0,185 |
0,00299 |
|
MnCl2·4(H2O) |
0,415 |
0,00201 |
0,415 |
0,00210 |
|
ZnCl2 |
0,00327 |
0,000024 |
0,00300 |
0,0000220 |
|
CoCl2·6(H2O) |
0,00143 |
0,000006 |
0,00150 |
0,00000630 |
|
Na2MoO4·2(H2O) |
0,00726 |
0,000030 |
0,00700 |
0,0000289 |
|
CuCl2.2(H2O) |
0,000012 |
0,00000007 |
0,00001 |
0,00000006 |
|
pH |
7,5 |
8,1 |
||
V teste s rozsievkou Navicula pelliculosa sa musí k obidvom médiám pridať Na2SiO3·9H20, aby sa dosiahla koncentrácia 1,4 mg Si/l.
pH média sa dosiahne rovnováhou medzi uhličitanovým systémom média a parciálnym tlakom CO2 v okolitom vzduchu. Približný vzťah medzi pH pri 25 °C a molárnou koncentráciou hydrogenuhličitanu je:
PHeq = 11,30 + log [HCO3]
15 mg/l NaHCO3, pHeq = 7,5 (U.S. EPA médium) alebo 50 mg NaHCO3/l, pHeq = 8.1 (médium OECD).
Zloženie prvkov v testovacom médiu
|
Prvok |
EPA |
OECD |
|
|
mg/l |
mg/l |
|
C |
2,144 |
7,148 |
|
N |
4,202 |
3,927 |
|
P |
0,186 |
0,285 |
|
K |
0,469 |
0,459 |
|
Na |
11,044 |
13,704 |
|
Ca |
1,202 |
4,905 |
|
Mg |
2,909 |
2,913 |
|
Fe |
0,033 |
0,017 |
|
Mn |
0,115 |
0,115 |
Príprava média OECD
|
Živina |
Koncentrácia v zásobnom roztoku |
|
Zásobný roztok 1: makroživiny |
|
|
NH4Cl MgCl2·6H2O CaCl2·2H2O MgSO4·7H2O KH2PO4 |
1,5 g·l–1 1,2 g·l–1 1,8 g·l–1 1,5 g·l–1 0,16 g·l–1 |
|
Zásobný roztok 2: železo |
|
|
FeCl3·6H2O Na2EDTA·2H2O |
64 mg·l–1 100 mg·l–1 |
|
Zásobný roztok 3: stopové prvky |
|
|
H3BO3 MnCl2·4H2O ZnCl2 CoCl2·6H2O CuCl2·2H2O Na2MoO4·2H2O |
185 mg·l–1 415 mg·l–1 3 mg·l–1 1,5 mg·l–1 0,01 mg·l–1 7 mg·l–1 |
|
Zásobný roztok 4: hydrogenuhličitan |
|
|
NaHCO3 |
50 g·l–1 |
|
Na2SiO3·9H20 |
|
Zásobné roztoky sterilizujte membránovou filtráciou (stredný priemer pórov 0,2 µm) alebo autoklávovaním (120 °C, 15 min). Skladujte roztoky v tme pri 4 °C.
Zásobné roztoky 2 a 4 neautoklávujte, ale sterilizujte ich membránovou filtráciou.
Pripravte rastové médium pridaním príslušného objemu zásobných roztokov 1 – 4 do vody:
Pridajte do 500 ml sterilizovanej vody:
|
— |
10 ml zásobného roztoku 1 |
|
— |
1 ml zásobného roztoku 2 |
|
— |
1 ml zásobného roztoku 3 |
|
— |
1 ml zásobného roztoku 4. |
Doplňte do 1 000 ml sterilizovanou vodou.
Poskytnite dostatočný čas na vyrovnanie média s atmosférickým CO2, v prípade potreby prebublaním sterilným filtrovaným vzduchom niekoľko hodín.
Príprava média AAP
|
A1.1. |
Pridajte 1 ml každého zásobného roztoku v A1.2.1 – A1.2.7 do približne 900 ml deionizovanej alebo destilovanej vody a potom zrieďte na 1 l. |
|
A1.2. |
Zásobné roztoky makroživín sa pripravujú rozpustením týchto látok v 500 ml deionizovanej alebo destilovanej vody. Činidlá A1.2.1, A1.2.2, A1.2.3, a A1.2.4 možno spojiť do jedného zásobného roztoku. |
|
A1.2.1. |
NaNO3 – 12,750 g. |
|
A1.2.2. |
MgCl2 ·6H2O – 6,082 g. |
|
A1.2.3. |
CaCl2 ·2H2O – 2,205 g. |
|
A1.2.4. |
Zásobný roztok mikroživín – (pozri A1.3). |
|
A1.2.5. |
MgSO4·7H2O – 7,350 g. |
|
A1.2.6. |
K2HPO4 – 0,522 g. |
|
A1.2.7. |
NaHCO3 – 7,500 g. |
|
A1.2.8. |
Na2SiO3·9H2O – pozri poznámku A1.1. Poznámka A1.1. – Používajte iba pre testovacie druhy rozsievok. Môže sa pridať priamo (202,4 mg) alebo prostredníctvom zásobného roztoku, aby sa dosiahla konečná koncentrácia Si v médiu 20 mg/l. |
|
A1.3. |
Zásobný roztok mikroživín sa pripravuje rozpustením týchto látok v 500 ml deionizovanej alebo destilovanej vody: |
|
A1.3.1. |
H3BO3 – 92,760 mg. |
|
A1.3.2. |
MnCl2·4H2O – 207,690 mg. |
|
A1.3.3. |
ZnCl2 – 1,635 mg. |
|
A1.3.4. |
FeCl3·6H2O – 79,880 mg. |
|
A1.3.5. |
CoCl2·6H2O – 0,714 mg. |
|
A1.3.6. |
Na2MoO4·2H2O – 3,630 mg. |
|
A1.3.7. |
CuCl2·2H2O – 0,006 mg. |
|
A1.3.8. |
Na2EDTA·2H2O – 150,000 mg. [dinátrium (etyléndinitrilo) tetraacetát]. |
|
A1.3.9. |
Na2SeO4·5H2O – 0,005 mg. Pozri poznámku A1.2. Poznámka A1.2. – Používajte iba v médiu pre zásobné roztoky kultúry druhov rozsievok. |
|
A1.4. |
Upravte pH na 7,5 ± 0,1 pridaním 0,1 N alebo 1,0 N NaOH, alebo HCl. |
|
A1.5. |
Prefiltrujte médium do sterilnej nádoby cez 0,22-μm membránový filter, ak sa má používať počítač častíc, alebo cez 0,45-μm filter v prípade, že sa počítač častíc nepoužíva. |
|
A1.6. |
Uchovávajte médium až do použitia v tme pri teplote približne 4 °C. |
(1) Molárny pomer EDTA a železa je mierne vyšší ako jeden. Zabraňuje to vyzrážaniu železa a zároveň sa minimalizuje chelácia ťažkých kovov.
Dodatok 3
Vzor postupu kultivácie rias
Všeobecné pozorovania
Účelom kultivácie podľa tohto postupu je získať kultúry rias na testovanie toxicity.
Musia sa použiť vhodné metódy na zabezpečenie, aby kultúry rias neboli infikované baktériami. Axenické kultúry môžu byť vhodné, ale sú potrebné kultúry s jedným druhom rias.
Všetky činnosti by sa mali vykonávať pri sterilných podmienkach, aby sa zamedzilo kontaminácii baktériami a inými riasami.
Prístroje a materiály
Pozri v časti Testovacia metóda: Prístroje.
Postupy na získanie kultúr rias
Príprava živných roztokov (médií):
Všetky živné soli média sa pripravia ako koncentrované zásobné roztoky a skladujú sa v tme a chlade. Tieto roztoky sa sterilizujú filtráciou alebo autoklávovaním.
Médium sa pripraví pridaním správneho množstva zásobného roztoku do sterilnej destilovanej vody, pozorne, aby sa zabránilo infekcii. V prípade tuhého média sa pridá 0,8 % agaru.
Zásobná kultúra:
Zásobné kultúry sú malé kultúry rias, ktoré sa pravidelne prenášajú do čerstvého média, aby sa použili ako počiatočný testovací materiál. Ak sa kultúry nepoužívajú pravidelne, naočkujú sa do skúmaviek na šikmý agar. Potom sa aspoň raz za dva mesiace prenesú do čerstvého média.
Zásobné kultúry sa kultivujú v kónických bankách obsahujúcich vhodné médium (objem okolo 100 ml). Ak sa riasy inkubujú pri 20 °C pri kontinuálnom osvetlení, je potrebný prenos raz týždenne.
Prenesie sa také množstvo „starej“ kultúry sterilnou pipetou do banky s čerstvým médiom, aby počiatočná koncentrácia rýchlo rastúceho druhu bola asi 100-násobne menšia ako v starej kultúre.
Stupeň rastu druhu sa môže stanoviť z rastovej krivky. Ak je toto známe, možno určiť hustotu, pri ktorej by sa mala kultúra preniesť do nového média. To sa musí vykonať skôr, ako kultúra dosiahne stacionárnu fázu rastu.
Prípravná kultúra:
Prípravná kultúra je určená na to, aby poskytla potrebné množstvo rias na inokuláciu testovaných kultúr. Prípravná kultúra sa inkubuje pri testovacích podmienkach a použije sa, pokiaľ je ešte v exponenciálnom raste, normálne po inkubačnom čase 2 až 4 dni. Kultúry rias obsahujúce deformované alebo abnormálne bunky sa musia odstrániť.
Dodatok 4
Analýza údajov nelineárnou regresiou
Všeobecné aspekty
Reakcia v testoch na riasach a iných testoch mikrobiálneho rastu – rast biomasy je svojím charakterom kontinuálna alebo metrická premenná – rýchlosť procesu, ak sa použije rýchlosť rastu, a jeho časový integrál, ak sa zvolí biomasa. Obidva sa vzťahujú na zodpovedajúcu strednú hodnotu reakcie paralelných neexponovaných kontrol, ktoré vykazujú maximálnu reakciu za podmienok, ktorým sú vystavené, pričom svetlo a teplota sú v teste na riasach primárnymi určujúcim faktormi. Systém je distribuovaný alebo homogénny a na biomasu sa môže nahliadať ako na kontinuum, pričom sa nezohľadňujú jednotlivé bunky. Rozdelenie variancie typu odpovede v prípade takéhoto systému sa vzťahuje iba na experimentálne faktory (obvykle opísané ako logaritmickonormálne alebo normálne rozdelenia chyby). Čo je opakom typických reakcií pri biologických skúškach s kvantálnymi údajmi, pre ktoré sa tolerancia (typicky binomicky rozdelená) jednotlivých organizmov často pokladá za dominantný variančný komponent. Reakcie kontrol tu majú hodnotu nula alebo hodnotu pozadia.
V podmienkach bez výskytu komplikácií normalizovaná alebo relatívna reakcia r monotónne klesá z 1 (nulová inhibícia) k 0 (100 % inhibícia). Pamätajte, že so všetkými reakciami sa spája chyba a že zjavné negatívne inhibície možno vypočítať iba ako výsledok náhodnej chyby.
Regresná analýza
Modely
Regresná analýza sa zameriava na kvantitatívny opis krivky reakcie na koncentráciu vo forme matematickej regresnej funkcie Y = f (C) alebo častejšie F (Z) kde Z = log C. Inverzné použitie C = f–1 (Y) umožňuje výpočet hodnôt ECx vrátane EC50, EC10 a EC20 a ich 95 % limity spoľahlivosti. Niektoré jednoduché matematické formy funkcií dokážu úspešne opísať vzťahy medzi koncentráciou a reakciou získané na základe testov inhibície rastu rias. Funkcie zahŕňajú napríklad logaritmickú rovnicu, nesymetrickú Weibullovu rovnicu a logaritmickonormálnu rozdeľovaciu funkciu, z ktorých všetky tvoria sigmoidné krivky asymptoticky sa približujúce k jednej pre C → 0 a nule pre C → nekonečno.
Použitie kontinuálnych modelov prahových funkcií (napr. Koymanov model „pre inhibíciu populačného rastu“, Kooijman a kol., 1996) je najnovším návrhom alebo alternatívou asymptotických modelov. Pri tomto modeli sa nepredpokladajú účinky pri koncentráciách pod určitou prahovou hodnotou, EC0+, ktorá sa odhadne pomocou extrapolácie vzťahu reakcie na koncentráciu, aby preťala os koncentrácie s použitím jednoduchej kontinuálnej funkcie, ktorá v počiatočnom bode nie je diferenciovateľná.
Pamätajte, že analýza môže byť jednoduchou minimalizáciou súčtov reziduálnych štvorcov (za predpokladu konštantnej variancie) alebo vážených štvorcov, ak je heterogenita variancie kompenzovaná.
Postup
Možno uviesť nasledujúci postup: zvoľte príslušnú rovnicu funkcie Y = f (C) a aproximujte ju na údaje nelineárnou regresiou. Uprednostnite využitie meraní z každej jednotlivej banky skôr ako stredné hodnoty paraleliek, aby sa z údajov získalo čo najviac informácií. Ak je variancia vysoká, na druhej strane z praktických skúseností vyplýva, že stredné hodnoty paraleliek môžu poskytnúť lepší matematický odhad, menej ovplyvnený náhodnými chybami v údajoch, ako v prípade každého jednotlivého experimentálneho bodu.
Zaznamenajte aproximovanú krivku a namerané údaje a skontrolujte, či je preloženie krivky správne. Analýza rezíduí môže byť obzvlášť užitočným nástrojom na tento účel. Ak zvolený funkčný vzťah použitý na reakciu na koncentráciu neopisuje dobre celú krivku alebo niektorú jej dôležitú časť, ako napr. reakcie pri nízkych koncentráciách, zvoľte inú možnosť aproximácie krivky – napr. nesymetrickú krivku ako Weibullovu funkciu namiesto symetrickej krivky. Negatívne inhibície môžu byť problémom napríklad pre log-normálnu rozdeľovaciu funkciu, ktorá takisto vyžaduje alternatívnu regresnú funkciu. Neodporúča sa priradiť nulu ani malú kladnú hodnotu k takýmto záporným hodnotám, pretože to skresľuje rozdelenie chýb. Môže byť vhodné vyhotoviť samostatné aproximácie krivky na častiach krivky, ako napr. časť nízkej inhibície na odhad hodnôt EClow x. Vypočítajte z použitej rovnice [„inverzným odhadom“, C = f–1 (Y), charakteristické bodové odhady ECx] a zaznamenajte ako minimálne EC50 a jeden alebo dva odhady EClow x. Zo skúseností z praktického testovania vyplýva, že presnosť testu na riasach obvykle umožňuje primerane presný odhad pri 10 % úrovni inhibície, ak je dostatok experimentálnych bodov – pokiaľ sa nevyskytne stimulácia pri nízkych koncentráciách ako faktor spôsobujúci zmätok. Presnosť odhadu EC20 je často podstatne lepšia ako EC10, pretože EC20 je obvykle umiestnené na približne lineárnej časti centrálnej krivky reakcie na koncentráciu. Niekedy môže byť ťažké interpretovať EC10 pre stimuláciu rastu. Preto sa odporúča, aj keď sa EC10 dá normálne získať s dostatočnou presnosťou, zaznamenať vždy aj EC20.
Váhové faktory
Experimentálna variancia nie je spravidla konštantná a obvykle zahŕňa proporcionálnu zložku, preto je výhodné bežne vykonávať váženú regresiu. Vážené faktory pre takúto analýzu sa zvyčajne pokladajú za inverzne proporcionálne k variancii:
Wi = 1/Var(ri)
Mnohé regresné programy povoľujú možnosť analýzy váženou regresiou s váženými faktormi uvedenými v tabuľke. Obvykle sa musia vážené faktory normalizovať tak, že sa vynásobia n/Σ wi (n je počet experimentálnych údajov) tak, aby sa ich súčet rovnal jednej.
Normalizované reakcie
Normalizovanie strednou hodnotou reakcie kontroly skrýva niektoré zásadné problémy a spôsobuje pomerne komplikovanú štruktúru variancie. Vydelením reakcií strednou hodnotou reakcie kontroly, aby sa získala percentuálna hodnota inhibície, sa zavádza ďalšia chyba zapríčinená chybou strednej hodnoty. Pokiaľ táto chyba nie je zanedbateľne malá, musia sa opraviť váhové faktory v regresii a musia sa opraviť hranice spoľahlivosti na kovarianciu s kontrolou (17). Pamätajte, že vysoká presnosť odhadovanej strednej hodnoty reakcie kontroly je dôležitá, aby sa minimalizovala celková variancia pre relatívnu reakciu. Táto variancia je takáto:
index i sa vzťahuje na úroveň koncentrácie i a index 0 na kontroly:
Yi = relatívna reakcia = ri/r0 = 1 – I = f (Ci)
s varianciou:
Var (Yi) = Var (ri/r0) ≅ (∂Yi / ∂ ri)2·Var(ri) + (∂ Yi/ ∂ r0)2·Var (r0),
a pretože
(∂ Yi/ ∂ ri) = 1/r0 a (∂ Yi / ∂ r0) = ri/r0 2
s normálne rozdelenými údajmi a paralelami mi a m0:
Var(ri) = σ2/mi
celková variancia relatívnej reakcie, Yi je teda:
Var(Yi) = σ2/(r0 2 mi) + ri 2·σ2/r0 4 m0
Chyba strednej hodnoty kontroly je inverzne proporcionálna k druhej odmocnine počtu paralelných kontrol spriemerovaných a niekedy môže byť opodstatnené zahrnúť predchádzajúce údaje a týmto spôsobom vo veľkej miere znížiť chybu. Alternatívny postup je nenormalizovať údaje a aproximovať absolútne reakcie vrátane údajov o reakcii kontroly, ale zavedením hodnoty reakcie kontroly ako ďalšieho parametra na použitie nelineárnou regresiou. Regresná rovnica má obvykle 2 parametre, táto metóda vyžaduje 3 parametre, a preto je potrebných viac experimentálnych údajov ako nelineárna regresia na údaje, ktoré sú normalizované pri použití vopred nastavenej reakcie kontroly.
Intervaly inverznej spoľahlivosti
Výpočet intervalov spoľahlivosti nelineárnej regresie inverzným odhadom je pomerne zložitý a nie je dostupnou štandardnou voľbou v bežných počítačových štatistických programových balíkoch. Približné limity spoľahlivosti sa môžu získať so štandardnými programami nelineárnej regresie s reparametrizáciou (Bruce a Versteeg, 1992), ktorá zahŕňa prepísanie matematickej rovnice požadovanými bodovými odhadmi, napr. EC10 a EC50 ako parametre, ktoré sa majú odhadnúť. [Ponechajte funkciu I = f (α, β, koncentrácia) a použite definičné vzťahy f (α, β, EC10) = 0,1 a f (α, β, EC50) = 0,5 na nahradenie f (α, β koncentrácia) ekvivalentnou funkciou g (EC10, EC50, koncentrácia.]
Priamejší výpočet (Andersen a kol., 1998) sa uskutoční ponechaním pôvodnej rovnice s použitím Taylorovho rozvoja okolo stredných hodnôt ri a r0.
V poslednom čase sú obľúbené „metódy boot strap“. Tieto metódy používajú stanovené údaje a generátor náhodných čísel riadeného častého opätovného odberu vzoriek na odhad empirického rozdelenia variancie.
Použitá literatúra
Kooijman, S.A.L.M.; Hanstveit, A.O.; Nyholm, N. (1996): No-effect concentrations in algal growth inhibition tests. Water Research, 30, 1625 – 1632.
Bruce, R.D. and Versteeg, D.J.(1992) A Statistical Procedure for Modelling Continuous Ecotoxicity Data. Env. Toxicol. Chem.11, 1485 – 1494.
Andersen, J.S., Holst, H., Spliid, H., Andersen, H., Baun, A. & Nyholm, N. (1998): Continuous ecotoxicological data evaluated relative to a control response. Journal of Agricultural, Biological and Environmental Statistics, 3, 405 – 420.
PRÍLOHA V
|
C.25. |
AERÓBNA MINERALIZÁCIA V POVRCHOVEJ VODE – SIMULAČNÝ TEST BIODEGRADÁCIE |
1. METÓDA
Táto metóda je rovnocenná s OECD TG 309 (2004) (1).
1.1. ÚVOD
Cieľom tohto testu je stanoviť časový priebeh biodegradácie testovanej látky pri nízkej koncentrácii v aeróbnej prírodnej vode a kvantifikovať zistenia formou vyjadrenia kinetických rýchlostí. Tento simulačný test je laboratórny dávkový test trepačkovej banky na stanovenie rýchlostí aeróbnej biodegradácie organických látok vo vzorkách prírodnej povrchovej vody (sladkej, poloslanej alebo morskej). Je založený na ISO/DIS 14592 – 1 (2) a obsahuje aj prvky z testovacích metód C.23 a C.24 (3) (4). Voliteľne sa môže v prípade dlhodobých testov nahradiť dávkový postup semikontinuálnym postupom, aby sa zabránilo degenerácii testovaného mikrokozmu. Základným cieľom simulačného testu je stanoviť mineralizáciu testovanej látky v povrchovej vode a mineralizácia tvorí základ vyjadrenia kinetiky degradácie. Voliteľný druhý cieľ testu však slúži na získanie informácií o primárnej degradácii a vzniku hlavných transformačných produktov. Identifikácia transformačných produktov a prípadne kvantifikácia ich koncentrácií sú osobitne dôležité v prípade veľmi pomaly mineralizujúcich látok (napr. s polčasmi pre celkový zvyškový 14C presahujúcimi 60 dní). Na identifikáciu a kvantifikáciu hlavných produktov transformácie sa musia kvôli analytickým obmedzeniam obvykle používať vyššie koncentrácie testovanej látky (napr. > 100 μg/l).
Nízka koncentrácia v tomto teste znamená koncentráciu (napr. menej ako 1 μg/l až 100 μg/l), ktorá je dostatočne nízka na zabezpečenie toho, aby kinetika biodegradácie získaná z testu odrážala koncentrácie predpokladané v prostredí. V porovnaní s celkovým množstvom biologicky odbúrateľných uhlíkových substrátov dostupných v prírodnej vode použitej v teste bude testovaná látka prítomná v nízkej koncentrácii slúžiť ako sekundárny substrát. Z toho vyplýva, že predpokladaná kinetika biodegradácie je prvého poriadku („nerastová“ kinetika) a že testovaná látka sa môže dať odbúrať „kometabolizmom“. Z kinetiky prvého poriadku vyplýva, že rýchlosť degradácie (mg/L/day) je úmerná koncentrácii látky, ktorá sa časom znižuje. V prípade pravej kinetiky prvého poriadku špecifická degradačná rýchlostná konštanta k nie je závislá od času a koncentrácie. Znamená to, že k významne nemení svoju hodnotu počas pokusu a pridávanou koncentráciou medzi pokusmi sa nemení. Podľa definície sa špecifická degradačná rýchlostná konštanta rovná relatívnej zmene koncentrácie za čas: k = (1/C) · (dC/dt). Aj keď sa obvykle predpokladá kinetika prvého poriadku za predpísaných podmienok, za určitých okolností môžu byť vhodnejšie iné kinetiky. Odchýlky od kinetiky prvého poriadku sa môžu pozorovať napríklad vtedy, ak jav prenosu hmoty, ako napr. rýchlosť difúzie, obmedzuje skôr rýchlosť biotransformácie ako rýchlosť biologickej reakcie. Údaje sa dajú takmer vždy opísať kinetikou pseudoprvého poriadku pri akceptácii závislosti rýchlostnej konštanty od koncentrácie.
Informácie o biologickej odbúrateľnosti testovanej látky pri vyšších koncentráciách (napr. zo štandardných skríningových testov), ako aj informácie o abiotickej odbúrateľnosti, produktoch transformácie a príslušných fyzikálnochemických vlastnostiach musia byť pred testom k dispozícii ako pomôcka pri plánovaní pokusu a interpretácii výsledkov. Použitie testovaných látok označených 14C a stanovenie fázového rozdelenia 14C na konci testu umožní stanoviť konečnú biologickú odbúrateľnosť. Ak sa použije neoznačená testovaná látka, možno odhadnúť iba konečnú biodegradáciu, ak sa testuje vyššia koncentrácia a všetky známe produkty transformácie sú známe.
1.2. VYMEDZENIE POJMOV
Primárna biodegradácia: Štrukturálna zmena (transformácia) chemickej látky mikroorganizmami, ktorá má za následok stratu chemickej identity.
Funkčná biodegradácia: Štrukturálna zmena (transformácia) chemickej látky mikroorganizmami, ktorá má za následok stratu špecifickej vlastnosti.
Konečná aeróbna biodegradácia: Rozloženie chemickej látky mikroorganizmami v prítomnosti kyslíka na oxid uhličitý, vodu a minerálne soli všetkých ostatných prítomných prvkov (mineralizácia) a vznik novej biomasy a organických mikrobiálnych produktov biosyntézy.
Mineralizácia: Rozloženie chemickej látky alebo organického materiálu mikroorganizmami v prítomnosti kyslíka na oxid uhličitý, vodu a minerálne soli všetkých ostatných prítomných prvkov.
Lag fáza: Dosiahnutý čas od začiatku testu do prispôsobenia degradujúcich mikroorganizmov a do zvýšenia stupňa biodegradácie chemickej látky alebo organického materiálu na úroveň stanoviteľnosti (napr. 10 % maximálnej teoretickej biodegradácie alebo menej v závislosti od presnosti meracej techniky).
Maximálna úroveň biodegradácie: Stupeň biodegradácie chemickej látky alebo organickej hmoty v teste zaznamenaný v percentách, po ktorom sa už žiadna ďalšia biodegradácia neuskutoční.
Primárny substrát: Súbor prírodných zdrojov uhlíka a energie, ktoré zabezpečujú rast a udržiavanie mikrobiálnej biomasy.
Sekundárny substrát: Zložka substrátu prítomná v takej nízkej koncentrácii, že jej degradáciou by sa príslušným mikroorganizmom dodali iba nepatrné množstvá uhlíka a energie v porovnaní s uhlíkom a energiou dodanými degradáciou hlavných zložiek substrátu (primárne substráty).
Degradačná rýchlostná konštanta: Rýchlostná konštanta prvého poriadku alebo pseudoprvého poriadku k (d–1), ktorá vyjadruje rýchlosť procesov degradácie. Pre dávkový pokus sa k odhadne zo začiatočnej časti degradačnej krivky získanej po ukončení lag fázy.
Polčas, t1/2 (d): Termín používaný na charakterizáciu rýchlosti reakcie prvého poriadku. Je to časový interval, ktorý zodpovedá poklesu koncentrácie o faktor 2. Polčas a degradačná rýchlostná konštanta sú vo vzťahu vyjadrenom rovnicou t1/2 = ln2/k.
Polčas degradácie, DT50 (d): Termín používaný na kvantifikáciu výsledku biodegradačných testov. Je to časový interval vrátane lag fázy, potrebný na dosiahnutie hodnoty 50 % biodegradácie.
Detekčný limit (LOD) a kvantifikačný limit (LOQ): Detekčný limit (LOD) je koncentrácia látky, pod ktorou nemožno odlíšiť identitu látky od analytických údajov. Kvantifikačný limit (LOQ) je koncentrácia látky, pod ktorou nemožno stanoviť koncentráciu s prípustnou presnosťou.
Rozpustený organický uhlík (DOC): Tá časť organického uhlíka vo vzorke vody, ktorá sa nedá odstrániť špecifickým oddelením fáz, napríklad centrifugáciou 15 minút pri 40 000 ms–2 alebo membránovou filtráciou s použitím membrán s pórmi s priemerom 0,2 μm –0,45 μm.
Celková aktivita organického 14C (TOA): Celková aktivita 14C spojená s organickým uhlíkom.
Aktivita rozpusteného organického 14C (DOA): Celková aktivita 14C spojená s rozpustených organickým uhlíkom.
Aktivita časticového organického 14C (POA): Celková aktivita 14C spojená s organickým uhlíkom v časticiach.
1.3. POUŽITEĽNOSŤ TESTU
Tento simulačný test sa dá použiť na neprchavé alebo mierne prchavé organické látky testované pri nízkych koncentráciách. Pri použití baniek, ktoré umožňujú prístup vzduchu (napr. s vatovými zátkami), sa môžu látky s Henryho konštantami menšími ako približne 1 Pa·m3/mol (pribl. 10–5 atm·m3/mol) v podstate pokladať za neprchavé. Pri použití uzavretých baniek s plynnou fázou možno testovať mierne prchavé látky (s Henryho konštantami < 100 Pa·m3/mol alebo < 10–3 atm·m3/mol) bez strát z testovacieho systému. Ak sa pri odstraňovaní CO2 nevykonajú príslušné opatrenia, môže sa vyskytnúť strata látok označených 14C. Za takýchto okolností môže byť potrebné, aby sa CO2 zachytil v internom absorbéri s alkalickým hydroxidom alebo aby sa použil externý absorpčný systém na CO2 (priame stanovenie 14CO2, pozri dodatok 3). Na stanovenie kinetiky biodegradácie musia byť koncentrácie testovanej látky nižšie ako jej rozpustnosť vo vode. Je však potrebné pripomenúť, že hodnoty rozpustnosti vo vode z literatúry môžu byť značne vyššie ako rozpustnosť testovanej látky v prírodných vodách. Prípadne sa môže rozpustnosť testovacích látok, ktoré sú mimoriadne zle rozpustné vo vode, stanoviť tak, že sa použijú testované prírodné vody.
Môže sa použiť metóda na simuláciu biodegradácie v povrchovej vode bez hrubých častíc („pelagický test“) alebo v kalnej povrchovej vode, ktorá sa môže vyskytovať napr. v blízkosti rozhrania voda/sediment („test suspendovaného sedimentu“).
1.4. PRINCÍP TESTU
Test sa uskutočňuje v dávkach tak, že sa inkubuje testovaná látka buď iba s povrchovou vodou („pelagický test“), alebo s povrchovou vodou doplnenou o suspendované tuhé látky/sediment 0,01 až 1 g/L sušiny („test suspendovaného sedimentu“) na simuláciu vodného toku so suspendovanými tuhými látkami alebo resuspendovaným sedimentom. Koncentrácia suspendovaných tuhých látok/sedimentu v spodnom rozsahu tohto intervalu je typická pre väčšinu povrchových vôd. Testovacie banky sa inkubujú v tme pri teplote prostredia za aeróbnych podmienok a miešania. Na účely stanovenia kinetiky degradácie sa musia použiť minimálne dve rozdielne koncentrácie testovanej látky. Koncentrácie sa musia navzájom odlišovať o faktor 5 až 10 a mali by predstavovať predpokladaný rozsah koncentrácií v prostredí. Maximálna koncentrácia testovanej látky nesmie byť vyššia ako 100 µg/L, ale uprednostňujú sa maximálne testované koncentrácie nižšie ako 10 µg/L alebo menej, aby sa zabezpečilo, že biodegradácia prebieha podľa kinetiky prvého poriadku. Najnižšia koncentrácia nesmie byť vyššia ako 10 µg/L, ale uprednostňujú sa najnižšie testované koncentrácie 1 – 2 μg/L alebo menej ako 1 μg/L. S použitím obchodne dostupných látok označených 14C možno uskutočniť náležitú analýzu takejto nízkej koncentrácie. Pre analytické obmedzenia často nemožno stanoviť koncentráciu testovanej látky s potrebnou presnosťou, ak sa použije testovaná látka pri koncentrácii ≤ 100 µg/L (pozri druhý odsek v oddiele 1.7.2). Môžu sa použiť vyššie koncentrácie testovanej látky (> 100 µg/L a niekedy > 1 mg/L) na identifikáciu a kvantifikáciu hlavných produktov transformácie alebo vtedy, ak nie je dostupná špecifická analytická metóda s nízkym detekčným limitom. Ak sa testujú vysoké koncentrácie testovanej látky, môže sa stať, že sa nebudú dať použiť výsledky na stanovenie degradačnej konštanty prvého poriadku a polčas, keďže degradácia pravdepodobne nebude prebiehať podľa kinetiky prvého poriadku.
Ak sa použije špecifická chemická analýza, sleduje sa degradácia v príslušných časových intervaloch a meria sa buď zvyškový 14C, alebo zvyšková koncentrácia testovanej látky. Označenie najstabilnejšej časti molekuly 14C zabezpečuje stanovenie celkovej mineralizácie, zatiaľ čo označenie 14C najmenej stabilnej časti molekuly, ako aj použitie špecifickej analýzy umožňuje iba vyhodnotenie primárnej biodegradácie. Najstabilnejšia časť však nemusí zahŕňať relevantnú funkčnú časť molekuly (ktorá môže súvisieť so špecifickou vlastnosťou, ako napr. toxicita, bioakumulácia atď.). V tomto prípade môže byť potrebné otestovať látku označenú 14C vo funkčnej časti na sledovanie eliminácie špecifickej vlastnosti.
1.5. INFORMÁCIE O TESTOVANEJ LÁTKE
V tomto teste sa môžu použiť radioaktívne označené aj neoznačené testované látky. Odporúča sa technika označenia 14C a označenie musí byť spravidla na najstabilnejšej časti(-iach) molekuly (pozri aj oddiel 1.4). Pre látky obsahujúce viac ako jeden aromatický kruh sa prednostne označí 14C jeden alebo viac uhlíkov v každom kruhu. Okrem toho sa označí 14C jeden alebo viac uhlíkov na oboch stranách ľahko degradovateľných väzieb. Chemická a/alebo rádiochemická čistota testovanej látky musí byť > 95 %. V prípade rádioaktívne označených látok sa uprednostňuje špecifická aktivita v hodnote približne 50 μCi/mg (1,85 MBq) alebo viac, aby sa umožnili merania 14C v testoch s nízkymi začiatočnými koncentráciami. Musia byť dostupné tieto informácie o testovanej látke:
|
— |
rozpustnosť vo vode [metóda A.6], |
|
— |
rozpustnosť v organickom(-ých) rozpúšťadle(-ách) (látky použité s rozpúšťadlom alebo s nízkou rozpustnosťou vo vode), |
|
— |
disociačná konštanta (pKa), ak je látka náchylná na protonizáciu alebo deprotonizáciu [OECD TG 112] (5), |
|
— |
tlak pár [metóda A.4] a Henryho konštanta, |
|
— |
chemická stabilita vo vode a v tme (hydrolýza) [metóda C.7]. |
Ak sa testujú vo vode málo rozpustné látky v morskej vode, môže byť takisto osožné poznať vysoľovací koeficient (alebo „Sečenovovov koeficient“) Ks, ktorý je definovaný výrazom: log (S/S’) = Ks Cm, kde S je rozpustnosť látky v čerstvej vode a S’ je rozpustnosť látky v morskej vode a Cm je molárna koncentrácia soli.
Ak sa test vykonáva ako „test suspendovaného sedimentu“, musia byť k dispozícii aj tieto informácie:
|
— |
rozdeľovací koeficient n-oktanol/voda [metóda A.8], |
|
— |
adsorpčný koeficient [metóda C.18]. |
Ostatné osožné informácie môžu zahŕňať:
|
— |
environmentálnu koncentráciu, ak je známa alebo odhadnutá, |
|
— |
toxicitu testovanej látky pre mikroorganizmy [metóda C.11], |
|
— |
ľahkú a/alebo prirodzenú biodegradovateľnosť [metódy C.4 A – F, C.12, C.9, OECD TG 302 (5)], |
|
— |
aeróbnu alebo anaeróbnu biodegradovateľnosť v štúdiách transformácie v pôde a systémoch sediment/voda [metódy C.23, C.24]. |
1.6. REFERENČNÁ LÁTKA
Ako referenčnú látku je potrebné použiť látku, ktorá sa za aeróbnych podmienok bežne ľahko odbúrava (napr. anilín alebo benzoát sodný). Predpokladaný časový interval pre degradáciu anilínu a benzoátu sodného je obvykle menej ako 2 týždne. Účelom referenčných látok je zabezpečiť, aby mikrobiálna aktivita testovanej vody bola v určitých hraniciach, t. j. aby voda obsahovala aktívnu mikrobiálnu populáciu.
1.7. KRITÉRIÁ KVALITY
1.7.1. Výťažnosť
Hneď po pridaní testovanej látky sa musí každá počiatočná koncentrácia preveriť stanovením aktivity 14C alebo chemickou analýzou v prípade neoznačených látok minimálne s jednou paralelnou vzorkou. Poskytnú sa tým informácie o použiteľnosti a opakovateľnosti analytickej metódy a o homogenite rozdelenia testovanej látky. Obvykle sa v následnej analýze údajov skôr používa nameraná počiatočná aktivita 14C alebo koncentrácia testovanej látky ako nominálna koncentrácia, keďže sa tým kompenzujú straty kvôli adsorpcii a chybám pri dávkovaní. Pre testovanú látku 14C je úroveň výťažnosti na konci pokusu daná hmotnostnou bilanciou (pozri posledný odsek v oddiele 1.8.9.4). V ideálnom prípade by mala byť radioaktívne označená hmotnostná bilancia v rozsahu od 90 % do 110 %, zatiaľ čo analytická presnosť v prípade neoznačených testovaných látok by mala viesť k počiatočnej výťažnosti medzi 70 % a 110 %. Tieto rozsahy je potrebné interpretovať ako ciele a nemali by sa používať ako kritériá pre prípustnosť testu. Voliteľne sa pre testovanú látku a pre hlavné produkty transformácie môže analytická presnosť stanoviť pri nižšej koncentrácii ako počiatočná koncentrácia.
1.7.2. Opakovateľnosť a citlivosť analytickej metódy
Opakovateľnosť analytickej metódy (vrátane účinnosti počiatočnej extrakcie) na kvantifikáciu testovanej látky a produktov transformácie sa v prípade potreby musí preveriť piatimi paralelnými analýzami jednotlivých extraktov povrchovej vody.
Detekčný limit (LOD) analytickej metódy pre testovanú látku a pre produkty transformácie musí byť aspoň 1 % z počiatočného množstva aplikovaného na testovací systém, ak je to možné. Limit kvantifikácie (LOQ) musí byť rovný alebo menší ako 10 % použitej koncentrácie. Chemická analýza mnohých organických látok a ich produktov transformácie často vyžaduje, aby sa testovaná látka použila v pomerne vysokej koncentrácii, t. j. > 100 μg/L.
1.8. OPIS TESTOVACEJ METÓDY
1.8.1. Zariadenie
Test sa môže vykonávať v Erlenmeyerových alebo valcovitých bankách vhodnej kapacity (napr. 0,5 alebo 1,0 litra) uzatvorených silikónovými alebo gumovými zátkami, alebo v sérových bankách s uzávermi neprepúšťajúcimi CO2 (napr. s butylkaučukovou zátkou). Ďalšia možnosť je vykonať test s použitím viacerých baniek a zužitkovať celé banky aspoň v dvoch paralelkách v každom časovom intervale (pozri posledný odsek v oddiele 1.8.9.1). Pre neprchavé testované látky, ktoré nie sú rádioaktívne označené, nie sú potrebné plynotesné zátky ani uzávery, vhodné sú voľné vatové zátky, ktoré zabraňujú kontaminácii z ovzdušia (pozri druhý odsek v oddiele 1.8.9.1). Mierne prchavé látky sa musia testovať v systéme biometrického typu jemným premiešavaním vodného povrchu. Na zabránenie bakteriálnej kontaminácii sa nádoby môžu prípadne pred použitím sterilizovať zahriatím alebo autoklávovaním. Okrem toho sa môže použiť toto štandardné laboratórne zariadenie:
|
— |
trepačka alebo magnetické miešadlá na nepretržité miešanie testovacích baniek, |
|
— |
centrifúga, |
|
— |
pH meter, |
|
— |
turbidimeter na nefelometrické merania zákalu, |
|
— |
pec alebo mikrovlnná pec na stanovenia sušiny, |
|
— |
prístroj na membránovú filtráciu, |
|
— |
autokláv alebo pec na tepelnú sterilizáciu sklených nádob, |
|
— |
zariadenia na manipuláciu s látkami označenými 14C, |
|
— |
zariadenie na kvantifikáciu aktivity 14C vo vzorkách z roztokov na zachytávanie CO2 a v prípade potreby zo vzoriek sedimentu, |
|
— |
analytické zariadenie na stanovenie testovanej (a referenčnej) látky, ak sa používa špecifická chemická analýza (napr. plynová chromatografia, vysokotlaková kvapalinová chromatografia). |
1.8.2. Zásobné roztoky testovanej látky
Na prípravu zásobných roztokov testovaných a referenčných látok sa používa deionizovaná voda (pozri prvý odsek v oddiele 1.8.7). Deionizovaná voda musí byť zbavená látok, ktoré môžu byť toxické pre mikroorganizmy, a rozpustený organický uhlík (DOC) nesmie tvoriť viac ako 1 mg/L (6).
1.8.3. Odber a preprava povrchovej vody
Miesto odberu povrchovej vody sa zvolí v súlade s cieľom testu v danej situácii. Pri výbere miest odberu sa musia posúdiť predchádzajúce možné vstupy z poľnohospodárstva, priemyslu alebo domácností. Ak je známe, že vodné prostredie bolo kontaminované testovanou látkou alebo jej štrukturálnymi analógmi v priebehu predchádzajúcich štyroch rokov, nesmie sa použiť na odber testovanej vody, pokiaľ preskúmanie rýchlostí degradácie v miestach, ktoré už boli vystavené pôsobeniu, nie je výslovným cieľom výskumného pracovníka. V mieste odberu sa zmeria pH a teplota vody. Ďalej je potrebné zaznamenať hĺbku odberu vzorky a vzhľad vzorky vody (napr. farbu a zakalenie) (pozri oddiel 3). Stanoví sa koncentrácia kyslíka a/alebo redoxný potenciál vo vode a v povrchovej vrstve sedimentu na dôkaz aeróbnych podmienok, pokiaľ to nie je zrejmé z posúdenia vzhľadu a predchádzajúcich skúseností s týmto miestom. Povrchová voda sa prepravuje v dôkladne vyčistenej nádobe. Počas prepravy nesmie teplota vzorky výrazne prekročiť teplotu používanú v teste. Odporúča sa chladenie pri 4 °C, ak preprava trvá viac ako 2 až 3 hodiny. Vzorka vody nesmie byť zamrznutá.
1.8.4. Skladovanie a príprava povrchovej vody
Test je potrebné prednostne začať do nasledujúceho dňa po odbere vzorky. Skladovanie vody je v prípade potreby nevyhnutné minimalizovať a nesmie v žiadnom prípade prekročiť maximálne 4 týždne. Vzorka vody sa do použitia udržiava pri 4 °C za prístupu vzduchu. Pred použitím sa odstránia hrubé častice, napr. filtráciou cez nylonový filter približne s 100 μm veľkosťou ôk alebo cez hrubý papierový filter, alebo sedimentáciou.
1.8.5. Príprava vody doplnenej o sediment (voliteľné)
Pre test suspendovaného sedimentu sa pridá povrchový sediment do baniek obsahujúcich prírodnú vodu (filtrovanú na účely odstránenia hrubých častíc, ako je uvedené v oddiele 1.8.4), aby sa získala suspenzia; koncentrácia suspendovaných tuhých látok musí byť medzi 0,01 a 1 g/L. Povrchový sediment musí pochádzať z rovnakého miesta, z ktorého bola odobratá vzorka vody. V závislosti od konkrétneho vodného prostredia môže byť povrchový sediment charakterizovaný buď vysokým obsahom organického uhlíka (2,5 % –7,5 %) a jemnou textúrou, alebo nízkym obsahom organického uhlíka (0,5 % –2,5 %) a hrubou textúrou (2). Povrchový sediment sa môže pripraviť takto: extrahujte niekoľko jadier sedimentov s použitím skúmavky z priesvitného plastu, odrežte vrchné aeróbne vrstvy (z povrchu do hĺbky max. 5 mm) hneď po odbere vzorky a spojte ich dohromady. Výsledná vzorka sedimentu sa musí prepravovať v nádobe s veľkou plynnou fázou, aby sa sediment udržiaval v aeróbnych podmienkach (ochlaďte na 4 °C, ak preprava trvá viac ako 2 až 3 hodiny). Vzorka sedimentu sa suspenduje v testovanej vode v pomere 1: 10 a do použitia sa udržiava pri 4 °C za prístupu vzduchu. Skladovanie sedimentu je v prípade potreby nevyhnutné minimalizovať a nesmie v žiadnom prípade prekročiť maximálne 4 týždne.
1.8.6. Semikontinuálny postup (voliteľné)
Môže byť potrebné predĺžiť inkubáciu (niekoľko mesiacov), ak sa vyskytuje dlhá lag fáza predtým, ako možno stanoviť významnú degradáciu testovanej látky. Ak je toto známe z predchádzajúceho testovania látky, test možno začať s použitím semikontinuálneho postupu, ktorý umožňuje pravidelné obnovovanie časti testovanej vody alebo suspenzie (pozri dodatok 2). Alternatívne sa môže bežný dávkový test zmeniť na semikontinuálny test, ak sa nedosiahne žiadna degradácia testovanej látky počas približne 60 dní testovania s použitím dávkového postupu (pozri druhý odsek v oddiele 1.8.8.3).
1.8.7. Pridávanie testovanej (alebo referenčnej) látky
Pre látky s vysokou rozpustnosťou vo vode (> 1 mg/L) a nízkou prchavosťou (Henryho konštanty < 1 Pa·m3/mol alebo < 10–5 atm·m3/mol) sa môže pripraviť zásobný roztok v deionizovanej vode (pozri oddiel 1.8.2); do testovacích nádob sa pridá príslušný objem zásobného roztoku, aby sa dosiahla požadovaná koncentrácia. Je potrebné, aby bol objem každého pridaného zásobného roztoku čo možno najmenší (< 10 % konečného objemu kvapaliny, ak je to možné). Ďalší postup je rozpustiť testovanú látku vo väčšom objeme testovanej vody, ktorá môže byť alternatívou použitia organických rozpúšťadiel.
Ak je to nevyhnutné, pripravia sa zásobné roztoky neprchavých látok s nízkou rozpustnosťou vo vode s použitím prchavého organického rozpúšťadla, ale množstvo pridaného rozpúšťadla do testovacieho systému nesmie byť vyššie ako 1 objemové % a nesmie mať škodlivé účinky na mikrobiálnu aktivitu. Rozpúšťadlo nesmie ovplyvniť stabilitu testovanej látky vo vode. Rozpúšťadlo sa musí odstrániť až do extrémne malého množstva tak, aby významne nezvýšilo koncentráciu DOC testovanej vody alebo suspenzie. Je to potrebné skontrolovať špecifickou analýzou pre látku alebo ak je možné, analýzou DOC (6). Je potrebné venovať pozornosť tomu, aby sa množstvo preneseného rozpúšťadla obmedzilo na čo najnižšiu potrebnú mieru, a zabezpečiť, aby sa množstvo testovanej látky dalo rozpustiť v konečnom objeme testovanej vody. Môžu sa použiť iné techniky na pridávanie testovanej látky do testovacích nádob, ako je uvedené v (7) a (8). Ak sa používa organické rozpúšťadlo na aplikáciu testovanej látky, s kontrolami s rozpúšťadlom obsahujúcimi testovanú vodu (bez žiadnych prídavných látok) a testovanú vodu s pridanou referenčnou látkou sa musí zaobchádzať rovnako ako s aktívnymi testovacími nádobami doplnenými o testovanú látku v nosiči, ktorým je rozpúšťadlo. Účelom kontrol s rozpúšťadlom je preskúmať prípadné škodlivé účinky na mikrobiálnu populáciu spôsobené rozpúšťadlom, ako naznačuje degradácia referenčnej látky.
1.8.8. Testovacie podmienky
1.8.8.1. Teplota pri teste
Inkubácia sa musí vykonávať v tme (prednostne) alebo v difúznom svetle pri regulovanej teplote (± 2 °C), čo môže byť teplota terénu alebo štandardná teplota 20 °C – 25 °C. Teplota terénu môže byť buď aktuálna teplota vzorky v čase odberu vzorky, alebo priemerná teplota terénu v mieste odberu.
1.8.8.2. Miešanie
Musí sa zabezpečiť miešanie nepretržitým trepaním alebo miešaním, aby sa zachovala suspenzia častíc a mikroorganizmov. Miešanie tiež uľahčuje prenos kyslíka z plynnej fázy do kvapaliny tak, že možno náležite zachovať aeróbne podmienky. Umiestnite banky na trepačku (trepanie približne pri 100 rpm) alebo použite magnetické miešanie. Miešanie musí byť nepretržité. Trepanie alebo miešanie musí byť čo najmiernejšie, avšak také, aby sa neustále zachovala homogénna suspenzia.
1.8.8.3. Dĺžka testu
Dĺžka testu obvykle nemá presiahnuť 60 dní, pokiaľ sa nepoužíva semikontinuálny postup s pravidelným obnovovaním testovanej suspenzie (pozri oddiel 1.8.6 a dodatok 2). Čas testu v prípade dávkového testu sa môže predĺžiť maximálne na 90 dní, ak sa degradácia testovanej látky začala počas prvých 60 dní. Degradácia sa monitoruje v príslušných časových intervaloch stanovením zvyškovej aktivity 14C alebo uvoľneného 14CO2 (pozri oddiel 1.8.9.4) a/alebo chemickou analýzou (oddiel 1.8.9.5). Inkubačný čas musí byť dostatočne dlhý na vyhodnotenie degradačného procesu. Prednostne by miera degradácie mala byť vyššia ako 50 %; pre pomaly degradovateľné látky miera degradácie musí byť dostatočná (obvykle vyššia ako 20 % degradácia) na zabezpečenie stanovenia kinetickej degradačnej rýchlostnej konštanty.
V testovacom systéme sa musia vykonávať pravidelné merania koncentrácie pH a kyslíka, pokiaľ z predchádzajúcich skúseností z podobných testov so vzorkami vôd a sedimentu odobratých z rovnakého miesta nevyplýva zbytočnosť takýchto meraní. Za určitých podmienok by metabolizmus primárnych substrátov pri oveľa vyšších koncentráciách vo vode alebo sedimente mohol mať za následok dostatočné uvoľnenie CO2 a vyčerpanie kyslíka, ktoré významne zmenia experimentálne podmienky počas testu.
1.8.9. Postup
1.8.9.1. Príprava baniek na pelagický test
Preneste príslušný objem testovanej vody do testovacích baniek, do približne jednej tretiny objemu banky a najmenej okolo 100 ml. Ak sa používajú viaceré banky (aby sa umožnilo zužitkovanie celých baniek v každom čase odberu vzoriek), je vhodný objem testovanej vody tiež približne 100 ml, keďže malé objemy vzoriek môžu ovplyvňovať dĺžku lag fázy. Testovaná látka sa pridáva zo zásobného roztoku, ako je uvedené v oddieloch 1.8.2 a 1.8.7. Je potrebné použiť minimálne dve rozdielne koncentrácie testovanej látky odlišujúce sa o faktor 5 až 10 na stanovenie kinetiky degradácie a výpočet kinetickej degradačnej rýchlostnej konštanty. Obe zvolené koncentrácie musia byť menšie ako 100 µg/L a prednostne v rozmedzí < 1 – 10 µg/L.
Uzavrite banky zátkami alebo uzávermi neprepúšťajúcimi vzduch a CO2. Pre neprchavé testované chemické látky, neoznačené 14C, sú vhodné voľné vatové zátky, ktoré zabraňujú kontaminácii z ovzdušia (pozri oddiel 1.8.1), za predpokladu, že všetky hlavné produkty degradácie sú známe ako neprchavé a ak sa používa nepriame stanovenie CO2 (pozri dodatok 3).
Inkubujte banky pri zvolenej teplote (pozri oddiel 1.8.8.1). Na začiatku testu odoberte vzorky na chemickú analýzu alebo stanovenia 14C (t. j. predtým ako sa začne biodegradácia; pozri oddiel 1.7.1) a potom v príslušných časových intervaloch v priebehu testu. Odber vzoriek sa môže vykonať odoberaním čiastočných vzoriek (napr. 5 ml alikvóty) z každej paralelky alebo zužitkovať celé banky v každom čase odberu vzoriek. Mineralizácia testovanej látky sa môže stanoviť buď nepriamo, alebo priamo (pozri dodatok 3). Obvykle je potrebných minimálne päť odberov počas degradačnej fázy (t. j. po ukončení lag fázy) na stanovenie spoľahlivej rýchlostnej konštanty, pokiaľ sa nedá odôvodniť, že pre rýchlo degradujúce látky sú postačujúce tri odbery. Pre látky, ktoré sa počas degradačnej fázy nedegradujú rýchlo, možno ľahko uskutočniť viac meraní, a preto sa na stanovenie k musí použiť viac experimentálnych bodov. Nedá sa stanoviť pevný harmonogram pre odber vzoriek, lebo rýchlosť biodegradácie je premenlivá, ale odporúča sa, ak je degradácia pomalá, odoberať vzorky raz do týždňa. Ak je testovaná látka rýchlo degradovateľná, odber vzoriek sa musí uskutočniť jedenkrát za deň počas prvých troch dní a potom každý druhý alebo tretí deň. Za určitých okolností, ako napr. v prípade veľmi rýchlo hydrolyzujúcich látok, môže byť potrebné odoberať vzorky v hodinových intervaloch. Odporúča sa, aby sa uskutočnila predbežná štúdia pred testom na stanovenie vhodných intervalov odberov vzoriek. Ak musia byť vzorky k dispozícii pre ďalšie špecifické analýzy, odporúča sa odobrať viac vzoriek a potom vybrať tie, ktoré sa budú analyzovať na konci pokusu na základe obrátenej stratégie, t. j. posledné vzorky sa analyzujú prvé (pozri druhý odsek v oddiele 1.8.9.5 pre pokyny o stabilite vzoriek počas skladovania).
1.8.9.2. Počet baniek a vzoriek
Pripravte dostatočný počet testovacích baniek, aby ste mali k dispozícii:
|
— |
testovacie banky; minimálne dve banky pre každú koncentráciu testovanej látky (prednostne minimálne 3) alebo viac testovaných baniek pre každú koncentráciu, ak sa zužitkujú celé banky v každom čase odberu (označené ako FT), |
|
— |
testovacie banky pre výpočet hmotnostnej bilancie; minimálne dve banky pre každú koncentráciu testovanej látky (označené ako FM), |
|
— |
slepú kontrolu, bez testovanej látky; minimálne jedna čistá testovacia banka obsahujúca iba testovanú vodu (označené ako FB), |
|
— |
referenčnú kontrolu; dve paralelné banky s referenčnou látkou (napr. anilín alebo benzoát sodný s koncentráciou 10 µg/l) (označené ako FC). Účelom referenčnej kontroly je potvrdiť minimálnu mikrobiálnu aktivitu. Ak je to vhodné, môže sa použiť radioaktívne označená referenčná látka aj vtedy, keď sa degradácia testovanej látky sleduje chemickou analýzou, |
|
— |
sterilnú kontrolu; jedna alebo dve banky obsahujúce sterilizovanú testovanú vodu na preskúmanie prípadnej abiotickej degradácie alebo inej nebiologickej eliminácie testovanej látky (označené ako FS). Biologickú aktivitu možno zastaviť autoklávovaním (121 °C; 20 min) testovanej vody alebo pridaním toxickej látky (napr. azid sodný (NaN3) v množstve 10 – 20 g/l, chlorid ortuťnatý (HgCl2) v množstve 100 mg/l alebo formalín v množstve 100 mg/l) alebo gamma žiarením. Ak sa použije HgCl2, musí sa zneškodňovať ako toxický odpad. V prípade vody s veľkým množstvom pridaného sedimentu nie je jednoduché dosiahnuť sterilné podmienky; v takomto prípade sa odporúča opakované autoklávovanie (napr. trikrát). Je potrebné zohľadniť, že sa môžu počas autoklávovania zmeniť sorpčné vlastnosti sedimentu, |
|
— |
kontroly rozpúšťadla obsahujúce testovanú vodu a testovanú vodu s referenčnou látkou; dve paralelné banky s rovnakým množstvom rozpúšťadla a s použitím rovnakého postupu, ako sa používa pri aplikácii testovanej látky. Účelom je preskúmať možné škodlivé účinky rozpúšťadla stanovením degradácie referenčnej látky. |
Pri zostavovaní testu by výskumný pracovník mal zohľadniť relatívnu dôležitosť väčšieho počtu paraleliek v pokuse v porovnaní so zvýšeným počtom časov odberu. Presné číslo baniek bude závisieť od použitej metódy na stanovenie degradácie (pozri tretí odsek v oddiele 1.8.9.1, odsek 1.8.9.4 a dodatok 3).
V každom čase odberu sa musia odobrať z každej testovanej banky dve čiastočné vzorky (napr. 5 ml alikvóty). Ak sa použije viac baniek, aby sa umožnilo zbieranie celých baniek, musia sa obetovať minimálne dve banky v každom čase odberu (pozri prvý odsek v oddiele 1.8.9.1).
1.8.9.3. Príprava baniek na test suspendovaného sedimentu [voliteľné]
Pridajte potrebné objemy testovanej vody a sedimentu, ak je potrebné, do testovacích nádob (pozri oddiel 1.8.5). Príprava baniek pre test suspendovaného sedimentu je rovnaká ako pre pelagický test (pozri oddiely 1.8.9.1 a 1.8.9.2). Použite prednostne sérové fľašky alebo banky podobného tvaru. Umiestnite uzatvorené banky na trepačku horizontálne. Otvorené banky pre neprchavé látky a neoznačené 14C je potrebné umiestniť vo zvislej polohe; v tomto prípade sa odporúča magnetické miešanie s použitím magnetických miešadielok pokrytých sklom. V prípade potreby fľašky prevzdušnite, aby boli zachované správne aeróbne podmienky.
1.8.9.4. Rádiochemické stanovenia
Uvoľnený 14CO2 sa stanovuje nepriamo a priamo (pozri dodatok 3). 14CO2 sa stanovuje nepriamo na základe rozdielu medzi počiatočnou aktivitou 14C v testovanej vode alebo suspenzii a celkovou zvyškovou aktivitou v čase odberu vzorky meranej po okyslení vzorky na pH 2 – 3 a odstránení CO2. Anorganický uhlík sa tým odstráni a meraná zvyšková aktivita pochádza z organického materiálu. Nepriame stanovenie 14CO2 sa nesmie použiť, ak počas transformácie testovanej látky vznikajú prchavé hlavné produkty transformácie (pozri dodatok 3). Ak je to možné, je potrebné merať uvoľnenie 14CO2 priamo (pozri dodatok 3) v každom čase odberu vzoriek aspoň v jednej testovacej banke; tento postup umožňuje kontrolu hmotnostnej bilancie aj procesu biodegradácie, ale je obmedzený na testy uskutočnené s uzatvorenými bankami.
Ak sa stanovuje uvoľnený 14CO2 priamo počas testu, musí sa na tento účel na začiatku testu pripraviť viac baniek. Odporúča sa priame stanovenie 14CO2, ak počas transformácie testovanej látky vznikajú prchavé hlavné produkty transformácie. V každom bode merania sa okyslia ďalšie testovacie banky na pH 2 – 3 a 14CO2 sa zhromaždí v internom alebo externom absorbéri (pozri dodatok 3).
Prípadne sa koncentrácie testovanej látky označenej 14C a hlavné produkty transformácie môžu stanoviť s použitím rádiochromatografie (napr. chromatografia na tenkej vrstve, RAD-TLC) alebo HPLC s rádiochemickou detekciou.
Prípadne sa môže stanoviť fázové rozdelenie zvyškovej rádioaktivity (pozri dodatok 1) a zvyšnej testovanej látky a môžu sa stanoviť produkty transformácie.
Na konci testu sa musí stanoviť hmotnostná bilancia priamym meraním 14CO2 s použitím oddelených testovacích baniek, z ktorých sa počas testu neodoberú žiadne vzorky (pozri dodatok 3).
1.8.9.5. Špecifická chemická analýza
Ak je k dispozícii citlivá špecifická analytická metóda, primárna biodegradácia sa môže namiesto použitia techník rádioaktívneho označovania vyhodnotiť meraním celkovej zvyškovej koncentrácie testovanej látky. Ak sa používa rádioaktívne označená testovaná látka (na meranie celkovej mineralizácie), môže sa paralelne uskutočniť špecifická chemická analýza, aby poskytla ďalšie užitočné informácie, a na kontrolu postupu. Špecifická chemická analýza sa môže tiež použiť na meranie transformácie produktov, ktoré sa tvoria počas degradácie testovanej látky, a to sa odporúča pre látky, ktoré sa mineralizujú, s polčasmi viac ako 60 dní. Koncentrácia testovanej látky a produktov transformácie pri každom odbere sa stanoví a zaznamená (ako koncentrácia a ako percentuálny podiel použitého množstva). Vo všeobecnosti sa produkty transformácie stanovené pri ≥ 10 % použitej koncentrácie v ktoromkoľvek čase odberu vzoriek musia identifikovať, pokiaľ neexistuje iný riadne odôvodnený postup. Produkty transformácie, pre ktoré sa koncentrácie trvale zvyšujú počas štúdie, sa tiež posúdia na účely identifikácie, aj keď ich koncentrácie nepresahujú vyššie uvedené limity, lebo to môže byť dôkazom perzistencie. Je potrebné zvážiť analýzu produktov transformácie v sterilných kontrolkách, ak sa usudzuje, že by bola možná rýchla abiotická transformácia testovanej látky (napr. hydrolýza). Podľa jednotlivých prípadov je potrebné uvážiť potrebu kvantifikácie a identifikácie a v správe sa uvedú odôvodnenia. Extrakčné techniky s organickým rozpúšťadlom sa musia použiť podľa pokynov v príslušnom analytickom postupe.
Všetky vzorky sa musia skladovať pri 2 °C až 4 °C a bez prístupu vzduchu, ak sa analýza uskutoční do 24 hodín (prednostne). V prípade dlhšieho skladovania sa vzorky zmrazia pod –18 °C alebo sa chemicky zakonzervujú. Acidifikácia ako metóda na konzerváciu vzoriek sa neodporúča, pretože acidifikované vzorky môžu byť nestabilné. Ak sa vzorky neanalyzujú do 24 hodín a skladujú sa dlhšie, je potrebné uskutočniť štúdiu stability počas skladovania, aby sa dokázala stabilita chemických látok, pri skladovaní pod –18 °C alebo v podmienkach konzervácie. Ak analytická metóda obsahuje buď extrakciu rozpúšťadla, alebo extrakciu tuhej fázy (ETF), extrakcia sa musí uskutočniť hneď po odbere vzoriek alebo po uskladnení vzoriek v chladničke maximálne 24 hodín.
V závislosti od citlivosti analytickej metódy môžu byť potrebné väčšie objemy vzoriek, ako sú uvedené v odseku 16. Test sa môže jednoducho vykonať s jednolitrovými testovanými objemami v 2 – 3-litrových bankách, ktoré umožňujú odber približne 100 ml vzoriek.
2. ÚDAJE A SPRÁVY
2.1. SPRACOVANIE VÝSLEDKOV
2.1.1. Grafické zaznamenanie údajov
Zaokrúhlite časy odberu na celé hodiny (pokiaľ sa látka podstatne nedegraduje za niekoľko minút až hodín), ale nie na celé dni. Graficky zaznamenajte odhady zvyškovej aktivity testovanej látky (pre látky označené 14C) alebo zvyškovú koncentráciu (pre neoznačené látky) proti času v lineárnom aj v semilogaritmickom grafe (pozri obrázky 1a, 1b). Ak prebieha degradácia, porovnajte výsledky z baniek FT s výsledkami z baniek FS. Ak sa stredné hodnoty výsledkov z baniek s testovanou látkou (FT) a sterilných baniek (FS) odchyľujú o menej ako 10 %, dá sa predpokladať, že pozorovaná degradácia je hlavne abiotická. Ak je degradácia v bankách FS nižšia, môžu sa použiť čísla na korekciu čísel získaných z baniek FT (odpočítaním) na odhad miery biodegradácie. Ak sa uskutočnia voliteľné analýzy pre hlavné produkty transformácie, je potrebné okrem grafu rozkladu testovanej látky poskytnúť grafy znázorňujúce ich tvorbu a rozklad.
Stanovte dĺžku lag fázy tL z degradačnej krivky (semilogaritmický graf) extrapoláciou jej lineárnej časti na nulovú degradáciu alebo alternatívne stanovením času pre približne 10 % degradáciu (pozri obrázky 1a a 1b). Zo semilogaritmického grafu stanovte rýchlostnú konštantu prvého poriadku k a jej štandardnú chybu lineárnou regresiou ln (zvyškovej aktivity 14C alebo koncentrácie testovanej látky) proti času. Pomocou predovšetkým meraní 14C použite iba údaje prislúchajúce počiatočnej lineárnej časti krivky po ukončenej lag fáze a uprednostnite skôr výber menšieho množstva údajov, ktoré sú reprezentatívne, pred výberom väčšieho množstva nespoľahlivejších údajov. Nespoľahlivosť sa v tomto prípade týka chýb súvisiacich s odporúčaným priamym použitím nameraných zvyškových aktivít 14C (pozri nižšie). Niekedy môže byť potrebné vypočítať dve odlišné rýchlostné konštanty, ak degradácia prebieha podľa bifázického modelu. Na tento účel sa definujú dve odlišné fázy degradačnej krivky. Pre každú jednu paralelnú banku sa musia urobiť výpočty rýchlostnej konštanty k a polčasu t½ = ln2/k, ak sa odoberajú čiastočné vzorky z rovnakej banky, alebo s použitím priemerných hodnôt, ak sa zužitkujú celé banky v každom čase odberu (pozri posledný odsek v oddiele 1.8.9.2). Ak sa použije prvý uvedený postup, je potrebné uviesť v správe rýchlostnú konštantu a polčas pre každú jednu paralelnú banku ako priemernú hodnotu so štandardnou chybou. Ak sa použili vysoké koncentrácie testovanej látky, degradačná krivka sa môže značne odchýliť od rovnej čiary (semilogaritmický graf) a kinetika prvého poriadku nemusí platiť. Preto nemá zmysel definovať polčas. V prípade obmedzeného rozsahu údajov sa však môže použiť kinetika pseudoprvého poriadku a stanoviť polčas degradácie DT50 (čas dosiahnutia 50 % degradácie). Je potrebné však pamätať na to, že časový priebeh degradácie mimo zvoleného rozsahu údajov sa nedá predpovedať s použitím DT50, ktorý je iba deskriptorom daného súboru údajov. Analytické nástroje na uľahčenie štatistických výpočtov a na zostrojenie krivky sú ľahko dostupné a odporúča sa používať tento druh softvéru.
Ak sa vykonáva špecifická chemická analýza, stanovte rýchlostné konštanty a polčasy pre primárnu degradáciu, ako je uvedené vyššie pre celkovú mineralizáciu. Ak primárna degradácia je ohraničeným procesom, môžu sa použiť experimentálne údaje z celého priebehu degradácie. Je to preto, že merania sú na rozdiel od meraní aktivity 14C priame.
Ak sa použijú látky označené 14C, aspoň na konci testu sa musí vyjadriť hmotnostná bilancia ako percento použitej začiatočnej koncentrácie.
2.1.2. Zvyšková aktivita
Ak sa biologicky degraduje časť organickej látky označená 14C, hlavná časť 14C sa premení na 14CO2, zatiaľ čo ďalšia časť sa využije na rast biomasy a/alebo syntézu mimobunkových metabolitov. Z tohto dôvodu úplná „konečná“ biodegradácia látky nemá za následok 100 % konverziu uhlíka na 14CO2. 14C zabudovaný do produktov vytvorených biosyntézou sa následne pomaly uvoľňuje ako 14CO2 pre „sekundárnu mineralizáciu“. Z týchto dôvodov sa v grafických znázorneniach zvyškovej organickej aktivity 14C (meranej po uvoľnení CO2) alebo 14CO2 proti času po ukončení degradácie ukazuje „chvostovanie“. To sťažuje kinetickú interpretáciu údajov a z tohto dôvodu by sa na stanovenie degradačnej rýchlostnej konštanty mala obvykle použiť iba začiatočná časť krivky (po ukončení lag fázy a predtým, ako sa dosiahne približne 50 % degradácie). Ak sa degraduje testovaná látka, celková zvyšková aktivita organického 14C je vždy vyššia ako aktivita 14C spojená so zvyšnou intaktnou testovanou látkou. Ak sa testovaná látka degraduje reakciou prvého poriadku a konštantná časť α sa mineralizuje na CO2, počiatočný sklon krivky úbytku 14C (celkový organický 14C proti času) bude α časy sklonu príslušnej krivky pre koncentráciu testovanej látky (alebo aby sme boli presní, časť testovanej látky označenej 14C). Na základe meraní celkovej nekorigovanej aktivity organického 14C bude preto vypočítaná degradačná rýchlostná konštanta konzervatívna. Postupy na stanovenie koncentrácií testovanej látky z nameraných rádiochemických aktivít, založené na rôznych zjednodušujúcich predpokladoch, sú uvedené v odkazoch (2) (9) (10) (11). Takéto postupy sa najjednoduchšie používajú pre rýchlo degradovateľné látky.
2.2. INTERPRETÁCIA VÝSLEDKOV
Ak sa zistí, že k je nezávislá od pridanej koncentrácie (t. j. ak vypočítané k je približne rovnaké ako pri rôznych koncentráciách testovanej látky), dá sa predpokladať, že rýchlostná konštanta prvého poriadku je reprezentatívna pre použité testovacie podmienky, t. j. testovanú látku, vzorku vody a teplotu pri teste. To, do akej miery sa dajú výsledky zovšeobecniť alebo extrapolovať na iné systémy, sa musí odborne posúdiť. Ak sa použije vysoká koncentrácia testovanej látky a degradácia preto neprebieha podľa kinetiky prvého poriadku, údaje sa nedajú použiť na priame stanovenie rýchlostnej konštanty prvého poriadku alebo príslušný polčas. Údaje odvodené z testu s použitím vysokej koncentrácie testovanej látky sa môžu ešte stále použiť na stanovenie stupňa celkovej mineralizácie a/alebo na detekciu a kvantifikáciu produktov transformácie.
Ak sú známe rýchlosti iných procesov úbytku ako biodegradácia (napr. hydrolýza alebo prchavosť), môžu sa odpočítať od čistej rýchlosti úbytku zistenej počas testu na stanovenie približného odhadu rýchlosti biodegradácie. Údaje pre hydrolýzu sa môžu získať napr. zo sterilnej kontroly alebo z paralelného testovania s použitím vyššej koncentrácie testovanej látky.
Nepriame a priame stanovenie 14CO2 (oddiel 1.8.9.4 a dodatok 3) možno použiť iba na meranie miery mineralizácie testovanej látky na CO2. Rádiochromatografia (RAD-TLC) alebo HPLC sa môžu použiť na analyzovanie koncentrácií testovanej látky označenej 14C a vzniku hlavných produktov transformácie (tretí odsek v oddiele 1.8.9.4). Na umožnenie priameho stanovenia polčasu je potrebné, aby neboli prítomné žiadne hlavné produkty transformácie (definované ako ≥ 10 % použitého množstva testovanej látky). Ak sú prítomné hlavné produkty transformácie, ako sa tu definuje, je potrebné podrobné vyhodnotenie údajov. Toto môže zahŕňať opakované testovanie a/alebo identifikáciu produktov transformácie (pozri prvý odsek v oddiele 1.8.9.5), pokiaľ osud produktov transformácie nemožno logicky vyhodnotiť na základe skúseností (napr. informácie o ceste degradácie). Keďže sa pomer uhlíka testovanej látky premenenej na CO2 mení (v závislosti zväčša od koncentrácie testovanej látky a iných dostupných substrátov, testovacích podmienok a mikrobiálneho spoločenstva), tento test neumožňuje priame stanovenie konečnej biodegradácie ako v DOC die-away teste, ale výsledok je podobný výsledku získanému respirometrickým testom. Stupeň mineralizácie bude teda nižší alebo rovnajúci sa minimálnej úrovni konečnej biodegradácie. Na získanie úplnejšieho obrazu konečnej biodegradácie (mineralizácie a zabudovania do biomasy) sa na konci testu musí vykonať analýza fázového rozdelenia 14C (pozri dodatok 1). 14C v podiele častíc bude pozostávať z 14C zabudovaného do bakteriálnej biomasy a 14C adsorbovaného na organické častice.
2.3. PLATNOSŤ TESTU
Ak sa referenčná látka nedegraduje v predpokladom časovom intervale (pre anilín a benzoát sodný obvykle menej ako dva týždne), platnosť testu je spochybnená a musí sa ďalej preveriť alebo sa alternatívne test musí zopakovať s novou vzorkou vody. V kruhovom teste ISO metódy, na ktorom sa zúčastnilo sedem laboratórií z Európy, prevzali degradačné rýchlostné konštanty pre anilín v rozmedzí 0,3 až 1,7 deň–1 s priemerom 0,8 d–1 pri 20 oC a štandardnou chybou ±0,4 d–1 (t½ = 0,9 dňa). Typické lag fázy boli 1 až 7 dní. Uviedlo sa, že skúmané vody mali bakteriálnu biomasu zodpovedajúcu 103 -104 jednotkám tvoriacim kolónie (CFU) na ml. Degradačné rýchlosti v stredoeurópskych vodách bohatých na živiny boli vyššie ako v severských oligotrofických vodách, čo môže byť kvôli odlišnému trofickému stavu alebo prechádzajúcemu vystaveniu chemickým látkam.
Celková výťažnosť (hmotnostná bilancia) na konci pokusu musí byť medzi 90 % a 110 % pre radioaktívne označené látky, pričom počiatočná výťažnosť na začiatku pokusu musí byť medzi 70 % a 110 % pre neoznačené látky. Uvedené rozsahy je však potrebné interpretovať len ako ciele a nemali by sa používať ako kritériá pre akceptáciu testu.
3. SPRÁVA O TESTE
Typ štúdie, t. j. pelagický alebo test suspendovaného sedimentu, sa musia jasne stanoviť v správe z testu, ktorá musí obsahovať minimálne tieto informácie:
Testovaná látka a referenčná látka(y):
|
— |
všeobecné názvy, chemické názvy (odporúčané názvy IUPAC a/alebo názvy CAS), čísla CAS, štrukturálne vzorce (uvádzajúce pozíciu označenia 14C, ak sa používa rádioaktívne označená látka) a príslušné fyzikálno-chemické vlastnosti testu a referenčnej látky (pozri oddiely 1.5 a 1.6), |
|
— |
všeobecné názvy, čísla CAS, štrukturálne vzorce (uvádzajúce pozíciu označenia 14C, ak sa používa rádioaktívne označená látka) a príslušné fyzikálno-chemické vlastnosti látok použitých ako štandardy na identifikáciu produktov transformácie, |
|
— |
čistota (nečistoty) testovaných a referenčných látok, |
|
— |
rádiochemická čistota označenej chemickej látky a špecifická aktivita (v prípade potreby). |
Povrchová voda:
Musia sa poskytnúť minimálne tieto informácie pre odobratú vzorku vody:
|
— |
umiestnenie a opis miesta odberu vzoriek vrátane predchádzajúcej kontaminácie, ak je to možné, |
|
— |
dátum a miesto odberu vzoriek, |
|
— |
živiny (celkový N, amónne ióny, dusitany, dusičnany, celkový P, rozpustené ortofosfáty), |
|
— |
hĺbka odberu, |
|
— |
vzhľad vzorky (napr. farba a zákal), |
|
— |
DOC a TOC, |
|
— |
BSK, |
|
— |
teplota a pH v mieste a čase odberu, |
|
— |
kyslík alebo redoxný potenciál (povinné iba vtedy, ak nie sú zrejmé aeróbne podmienky), |
|
— |
slanosť alebo vodivosť (v prípade morskej vody a poloslanej vody), |
|
— |
suspendované tuhé látky (v prípade zakalenej vzorky), |
|
— |
prípadne ďalšie informácie o mieste odberu v čase odberu (napr. aktuálne alebo predchádzajúce údaje o rýchlosti toku riek alebo morských prúdov, hlavné vypúšťania v blízkosti a typ vypúšťaní, poveternostné podmienky pred časom odberu) |
a prípadne:
|
— |
mikrobiálna biomasa (napr. priame stanovenie metódou farbenia akridínovou oranžovou alebo jednotky tvoriace kolónie), |
|
— |
anorganický uhlík, |
|
— |
koncentrácia chlorofylu-a ako špecifické stanovenie biomasy rias. |
Okrem toho sa poskytnú tieto informácie o sedimente, ak sa uskutočňuje test suspendovaného sedimentu:
|
— |
hĺbka odberu sedimentu, |
|
— |
vzhľad sedimentu (napr. sfarbený, bahnitý, prachový alebo pieskový), |
|
— |
textúra (napr. % hrubého piesku, jemného piesku, siltu a ílu), |
|
— |
sušina v g/l suspendovaných tuhých látok, koncentrácia TOC alebo úbytok hmotnosti žíhaním ako kritérium obsahu organickej látky, |
|
— |
pH, |
|
— |
kyslík alebo redoxný potenciál (povinné iba, ak nie sú zrejmé aeróbne podmienky). |
Testovacie podmienky:
|
— |
čas medzi odberom a s použitím v laboratórnom teste, skladovanie vzoriek a predpríprava vzorky, dátumy uskutočnenia štúdií, |
|
— |
množstvo použitej testovanej látky, testovaná koncentrácia a referenčná látka, |
|
— |
metóda aplikácie testovanej látky vrátane každého použitia rozpúšťadiel, |
|
— |
objem použitej povrchovej vody a sedimentu (ak sa používa) a odobratý objem v každom intervale na analýzu, |
|
— |
opis použitého testovacieho systému, |
ak sa nemôžu dodržať podmienky uchovávania v tme, informácie o podmienkach „difúzneho svetla“,
|
— |
informácie o metóde(-ach) použitých na zabezpečenie sterilných podmienok (napr. teplota, čas a počet autoklávovaní), |
|
— |
inkubačná teplota, |
|
— |
informácie o analytických technikách a metóde(-ach) použitých na rádiochemické merania a na kontrolu hmotnostnej bilancie a stanovenia fázového rozdelenia (ak sa vykonáva), |
|
— |
počet paraleliek. |
Výsledky:
|
— |
výťažnosť v percentách (pozri oddiel 1.7.1), |
|
— |
opakovateľnosť a citlivosť použitých analytických metód vrátane detekčného limitu (LOD) a limitu kvantifikácie (LOQ) (pozri oddiel 1.7.2), |
|
— |
všetky namerané údaje (vrátane časov odberu) a vypočítané hodnoty v tabuľkovej forme a degradačné krivky pre každú testovanú koncentráciu a pre každú paralelnú banku; zaznamenajte lineárny korelačný koeficient pre sklon logaritmického grafu, stanovenú lag fázu a rýchlostnú konštantu prvého poriadku alebo pseudoprvého poriadku (ak je to možné) a príslušný polčas degradácie (alebo polčas, t50), |
|
— |
zaznamenajte príslušné hodnoty ako priemery výsledkov zistených v jednotlivých paralelkách, napr. dĺžku lag fázy, degradačnú rýchlostnú konštantu a polčas degradácie (alebo t50), |
|
— |
kategorizujte systém ako neadaptovaný alebo adaptovaný na základe vzhľadu degradačnej krivky a prípadného vplyvu testovanej koncentrácie, |
|
— |
výsledky konečnej kontroly hmotnostnej bilancie a výsledky stanovení fázového rozdelenia (ak sa uskutočnili), |
|
— |
frakcia mineralizovaného 14C a v prípade použitia špecifickej analýzy konečná úroveň primárnej degradácie, |
|
— |
identifikácia, molárna koncentrácia a percento použitých a hlavných produktov transformácie (pozri prvý odsek v oddiele 1.8.9.5) v prípade potreby, |
|
— |
navrhovaná cesta transformácie v prípade potreby, |
|
— |
diskusia o výsledkoch. |
4. POUŽITÁ LITERATÚRA
|
1. |
OECD TG 309 (2004) Aerobic Mineralisation in surface water – Simulation Biodegradation Test. |
|
2. |
ISO/DIS 14592 – 1 (1999) Water quality – Evaluation of the aerobic biodegradability of organic compounds at low concentrations – Part 1: Shake flask batch test with surface water or surface water/sediment suspensions. |
|
3. |
Testing Method C.23. Aerobic and anaerobic transformation in soil. |
|
4. |
Testing Method C.24. Aerobic and anaerobic transformation in aquatic sediments. |
|
5. |
OECD (1993). Guidelines for the Testing of Chemicals. OECD, Paris. |
|
6. |
ISO 8245 (1999). Water quality – Guidelines on the determination of total organic carbon (TOC) and dissolved organic carbon (DOC). |
|
7. |
ISO 10634 (1995). Water quality – Guidance for the preparation and treatment of poorly water-soluble organic compounds for the subsequent evaluation of their biodegradability in an aqueous medium. |
|
8. |
OECD draft (2000). Guidance Document on aquatic toxicity testing of difficult substances and mixtures. Environmental Health and Safety Publications. Series on Testing and Assessment. No 22 (to be published summer 2000). |
|
9. |
Simkins, S. and Alexander, M. (1984). Models for mineralization kinetics with the variables of substrate concentration and population density. Appl. Environ. Microbiol.47, 394 – 401. |
|
10. |
Ingerslev, F. and N. Nyholm. (2000). Shake-flask test for determination of biodegradation rates of 14C-labeled chemicals at low concentrations in surface water systems. Ecotoxicol. Environ. Saf. 45, 274 – 283. |
|
11. |
ISO/CD 14592 – 1 (1999). Ring test report: Water Quality – Evaluation of the aerobic biodegradability of organic compounds at low concentrations part 1 – report of 1998/1999 ring-test. Shake flask batch test with surface water or surface water/sediment suspensions. |
Dodatok 1
Fázové rozdelenie 14C
Na kontrolu postupu sa musí bežné stanovenie celkovej zvyškovej organickej aktivity 14C (TOA) doplniť meraniami hmotnostnej bilancie zahŕňajúcej priame stanovenie uvoľneného 14CO2 po zachytení na absorbéri (pozri dodatok 3). Pozitívny vznik 14CO2 je sám osebe priamym dôkazom biodegradácie na rozdiel od abiotickej degradácie alebo iných mechanizmov úbytku, ako napr. prchavosť a sorpcia. Ďalšie užitočné informácie charakterizujúce priebeh biodegradovateľnosti možno získať z meraní distribúcie TOA medzi rozpusteným stavom (aktivita rozpusteného organického 14C, DOA) a časticovým stavom (časticová aktivita organického 14C, POA) po oddelení častíc membránovou filtráciou alebo odstredením. POA pozostáva z testovanej látky naadsorbovanej na mikrobiálnu biomasu a na iné častice testovanej látky okrem uhlíka, ktorý sa použil na syntézu nového bunkového materiálu a tak zabudoval do časticovej frakcie biomasy. Vznik rozpusteného 14C organického materiálu sa dá stanoviť ako DOA na konci biodegradácie (plató na krivke degradácie proti času).
Stanovenie fázového rozdelenia zvyškového 14C vo vybratých vzorkách filtrovaním vzoriek na 0,22 μm alebo 0,45 μm membránovom filtri z materiálu, ktorý neadsorbuje významné množstvá testovanej látky (môžu byť vhodné polykarbonátové filtre). Ak je adsorpcia testovanej látky na filter príliš veľká na to, aby sa nemusela zohľadniť (je to potrebné skontrolovať pred pokusom), môže sa použiť namiesto filtrácie centrifugácia pri vysokej rýchlosti (2 000 g; 10 min.).
Pokračujte s filtrátom alebo s odstredenou zložkou, ako je uvedené v dodatku 3 pre nefiltrované vzorky. Rozpustite membránové filtre vo vhodnej scintilačnej kvapaline a merajte ako obvykle, bežne len pomerovou metódou s externým štandardom na korekciu zhášania, alebo použite okysličovadlo vzoriek. Ak sa použila centrifugácia, resuspendujte pelet vzniknutý z frakcie častíc v 1 – 2 ml destilovanej vody a preneste do scintilačnej fľaštičky. Potom s použitím 1 ml destilovanej vody dvakrát premyte a preneste premývaciu vodu do fľaštičky. V prípade potreby sa suspenzia môže zaliať do gélu na meranie kvapalinovým scintilačným počítačom.
Dodatok 2
PoloKontinuálny postup
Môže byť potrebné predĺžiť inkubáciu na niekoľko mesiacov na dosiahnutie dostatočnej degradácie látok, ktoré sa ťažko odbúravajú. Dĺžka testu nesmie byť obvykle dlhšia ako 60 dní, pokiaľ nie sú zachované vlastnosti pôvodnej vzorky vody obnovením testovanej suspenzie. Čas testu sa však môže predĺžiť maximálne na 90 dní bez obnovenia testovanej suspenzie, ak sa degradácia testovanej látky začala počas prvých 60 dní.
Počas dlhodobej inkubácie sa diverzita mikrobiálneho spoločenstva môže obmedziť kvôli mechanizmom úbytku a kvôli prípadnému úbytku základných živín a primárnych uhlíkových substrátov vo vzorke vody. Preto sa odporúča, aby sa použil semikontinuálny test na príslušné stanovenie rýchlosti degradácie látok, ktoré sa pomaly degradujú. Test je potrebné začať s použitím semikontinuálneho postupu, ak sa na základe predchádzajúcich skúseností predpokladá, že na dosiahnutie 20 % degradácie látky bude potrebný inkubačný čas tri mesiace. Alternatívne sa môže bežný dávkový test zmeniť na semikontinuálny test, ak sa nedosiahne žiadna degradácia testovanej látky počas približne 60 dní testovania s použitím dávkového postupu. Semikontinuálny postup sa môže zastaviť a test pokračuje ako dávkový pokus, keď sa zaznamená významná degradácia (napr. > 20 %).
V polokontinuálnom teste sa každé dva týždne nahradí približne jedna tretina objemu testovanej suspenzie čerstvo odobratou vodou s testovanou látkou, ktorá sa pridá do počiatočnej koncentrácie. Ak sa vykonáva test suspendovaného sedimentu, podobne sa do vody pridá sediment na nahradenie do počiatočnej koncentrácie (medzi 0,01 a 1 g/l). Pri uskutočňovaní testu so suspendovanými tuhými látkami je dôležité, aby sa zachoval plne suspendovaný systém aj počas obnovenia vody a aby bol rezidenčný čas rovnaký pre tuhé látky a vodu, lebo v opačnom prípade sa môže stratiť plánovaná podobnosť s homogénnym vodným systémom bez ustálených fáz. Z týchto dôvodov sa uprednostňuje počiatočná koncentrácia suspendovaných sedimentov v spodnom rozsahu špecifikovaného intervalu, ak sa používa semikontinuálny postup.
Predpísané pridanie testovanej látky znamená, že sa počiatočná koncentrácia testovanej látky čiastočným obnovením testovanej suspenzie neprekročí, a teda sa zabráni adaptácii, ktorá sa často pozoruje pri vysokých koncentráciách testovanej látky. Keďže postup zahŕňa reinokuláciu aj nahradenie vyčerpaných živín a primárnych substrátov, pôvodná mikrobiálna diverzita sa obnoví a trvanie testu sa môže v podstate predlžovať až do nekonečna. Ak sa používa semikontinuálny postup, je dôležité pripomenúť, že sa zvyšková koncentrácia testovanej látky musí korigovať o množstvá pridanej a odstránenej testovanej látky pri každom obnovení. Pre látky, ktoré sa zle adsorbujú, sa môže používať celková koncentrácia alebo koncentrácia rozpustenej testovanej látky. Adsorpcia je minimálna (< 5 %) za špecifických podmienok (0,1 – 1 g tuhých látok/l) pre látky s log Kow < 3 (platí pre neutrálne, lipofilné zlúčeniny). Toto je vyjadrené v nasledujúcom príklade výpočtu: 0,1 g/l tuhých látok približne zodpovedá 10 mg uhlíka na liter (frakcia uhlíka, fC = 0,01). Za predpokladu, že
Log Kow (testovanej látky) = 3
Koc = 0,42 × Kow
rozdeľovací koeficient, Kd = fC × Koc,
potom rozpustená frakcia celkovej koncentrácie (C-voda (Cw)/C-celková (Ct) je:
Cw/Ct = 1/(1 + Kd × SS) = 1(1 + Koc × fC × SS) = 1/(1 + 0,42 × 103 × 0,01 × 0,1 × 10–3) = 0,999
Dodatok 3
Stanovenie 14CO2
Nepriame stanovenie 14CO2
Pre bežné merania je nepriama metóda obvykle najmenej časovo náročnou a najpresnejšou metódou, ak je testovaná látka neprchavá a netransformuje sa na prchavé produkty transformácie. Preneste jednoducho nefiltrované vzorky, napr. veľkosti 5 ml, do scintilačných fľaštičiek. Na začiatku je vhodná aktivita vo vzorkách 5 000 dpm – 10 000 dpm (80 – 170 Bq) a minimálna počiatočná aktivita je okolo 1 000 dpm. CO2 sa musí odstrániť po okyslení na pH 2 – 3 1 – 2 kvapkami koncentrovanej H3PO4 alebo HCl. Odstránenie CO2 možno uskutočniť prebublávaním vzduchom počas približne ½ – 1 hodiny. Alternatívne sa môžu fľaštičky prudko trepať 1 – 2 hodiny (napríklad na mikrotrepačke) alebo za miernejšieho trepania cez noc. Účinnosť postupu odstraňovania CO2 sa musí skontrolovať (predĺžením času prevzdušňovania alebo trepania). Potom sa musí pridať scintilačná kvapalina vhodná na meranie vodných vzoriek, vzorka sa homogenizuje vo vírivom mixéri a rádioaktivita sa stanoví meraním kvapalinovým scintilačným počítačom a odpočítaním aktivity pozadia zistenej v slepých vzorkách (FB). Pokiaľ nie je testovaná voda príliš sfarbená alebo neobsahuje vysokú koncentráciu častíc, vykazujú vzorky obvykle rovnaké zhášanie a bude postačujúce uskutočniť korekcie zhášania s použitím externého štandardu. Ak je testovaná voda veľmi sfarbená, môže byť potrebná korekcia zhášania pridaním vnútorného štandardu. Ak je vysoká koncentrácia častíc, nemusí sa dať dosiahnuť homogénny roztok alebo gél alebo môžu sa vyskytnúť veľké odchýlky medzi vzorkami v zhášaní. V tomto prípade sa môže použiť metóda merania opísaná nižšie pre testované suspenzie. Ak sa test vykonáva ako test suspendovaného sedimentu, meranie 14CO2 by sa mohlo uskutočniť nepriamo odobratím homogénnej 10 ml vzorky testovanej vody/suspenzie a oddelením fáz centrifugáciou pri vhodnej rýchlosti (napr. 15 min. pri 40 000 m/s2). Vodná fáza sa potom spracuje, ako je uvedené vyššie. Aktivita 14C vo fáze častíc (POA) sa stanoví resuspendovaním sedimentu do malého objemu destilovanej vody, prenosom do scintilačných fľaštičiek a pridaním scintilačnej kvapaliny na vytvorenie gélu (na tento účel sú dostupné špeciálne scintilačné kvapaliny). V závislosti od charakteru častíc (napr. aký majú obsah organického materiálu), môže byť vhodné natráviť vzorku cez noc solubilizérom tkanív a potom pred pridaním scintilačnej kvapaliny homogenizovať vo vírivom mixéri. Alternatívne sa môže stanoviť POA spaľovaním v nadbytku kyslíka s použitím okysličovadla vzoriek. Pri meraní sa musia vždy pridať vnútorné štandardy a môže byť potrebné uskutočniť korekcie zhášania pridaním vnútorného štandardu pre každú jednu vzorku.
Priame stanovenie 14CO2
Na priame stanovenie uvoľneného 14CO2 sa na začiatku testu pripraví viac baniek, zužitkovanie testovacích baniek sa v každom bode stanovenia vykoná tak, že sa testovacie banky okyslia na pH 2 – 3 a 14CO2 sa zhromaždí vo vnútornom (umiestnenom v každej testovacej banke na začiatku testu) alebo externom absorbéri. Ako absorbčné médium sa môže použiť buď alkalická zásada (napr. 1 N roztok NaOH alebo granule NaOH), etanolamín alebo komerčne dostupné absorbéry založené na etanolamíne. Na priame stanovenie 14CO2 musia byť banky uzatvorené, napr. butylkaučukovou zátkou.
Obrázok 1a
Príklad aritmetického grafického zaznamenania údajov (zvyšková aktivita proti času)

Obrázok 1b
Vzor semilogaritmického grafického zaznamenania údajov (ln zvyškovej aktivity proti času)

PRÍLOHA VI
|
C.26. |
LEMNA SP. TEST INHIBÍCIE RASTU |
1. METÓDA
Táto metóda je rovnocenná s OECD TG 221 (2006) (1). Orgány EÚ dospeli k širokému konsenzu, že pri silne zafarbených látkach sú testy s rodom Lemna vhodnou alternatívou k testu s riasami (2) (3).
1.1. ÚVOD
Táto testovacia metóda je určená na hodnotenie toxicity látok pre sladkovodné rastliny rodu Lemna (žaburinka). Je založená na existujúcich usmerneniach (4) (5) (6) (7) (8) (9), ale obsahuje modifikácie týchto metód zohľadňujúce najnovší výskum a konzultácie týkajúce sa množstva kľúčových aspektov. Navrhovaná metóda bola validovaná medzinárodným kruhovým testom (10).
Táto testovacia metóda opisuje testovanie toxicity pri použití Lemna gibba a Lemna minor, obidvoch druhov, ktoré sa študujú vo veľkej miere a podliehajú uvedeným normám. Taxonómia Lemna spp. je zložitá, komplikuje ju výskyt veľkého množstva fenotypov. Aj keď sa môže vyskytnúť genetická variabilita pri reakcii na toxické látky v prípade rodu Lemna, v súčasnosti neexistujú dostatočné údaje o tomto zdroji variability, aby sa mohol odporučiť konkrétny klon na použitie v tejto testovacej metóde. Je potrebné pripomenúť, že test sa nevykonáva axenicky, ale jednotlivé kroky počas postupu testu sa uskutočňujú v etapách, aby sa minimalizovala kontaminácia inými organizmami.
Uvádzajú sa informácie o testovaní pri obnove (semistatické a prietokové) a bez obnovy (statické) testovacieho roztoku. V závislosti od cieľov testu a od regulačných požiadaviek sa odporúča posúdiť semistatické a prietokové metódy, napr. pre látky, ktoré z roztoku rýchlo unikajú v dôsledku odparovania, fotodegradácie, precipitácie alebo biodegradácie. Ďalšie informácie sú uvedené v (11).
1.2. VYMEDZENIE POJMOV
Na účely tejto testovacej metódy sa používajú tieto pojmy a skratky:
Biomasa: je sušina živej hmoty nachádzajúcej sa v populácii. V tomto teste biomasu nahrádza napr. počet lístkov alebo plocha lístkov, ktoré sa bežne merajú, a používanie pojmu „biomasa“ sa teda vzťahuje aj na tieto náhradné kritériá.
Chloróza: je žltnutie tkaniva lístkov.
Klon: je organizmus alebo bunka, ktorá vznikla z jedného jedinca nepohlavným rozmnožovaním. Jedince z rovnakého klonu sú preto geneticky identické.
Kolónia: znamená zhluk navzájom spojených materských a dcérskych lístkov (obvykle 2 až 4). Niekedy sa uvádza ako rastlina.
ECx : je koncentrácia testovanej látky rozpustená v testovacom médiu, ktorá má za následok x % (napr. 50 %) zníženie rastu rodu Lemna v rámci stanoveného času expozície (je potrebné výslovne uviesť v prípade odchýlky od celkovej alebo obvyklej dĺžky testu). Na jednoznačné zaznamenanie hodnoty EC odvodenej z rýchlosti rastu alebo výťažku sa používa symbol „ErC“ pre rýchlosť rastu a symbol „EyC“ sa používa pre výťažok, po ktorom nasleduje použitá meraná premenná, napr. ErC (počet lístkov).
Prietoková metóda: je test, v ktorom sa testovacie roztoky kontinuálne nahrádzajú.
Lístok: je individuálna/samostatná „lístkovitá“ štruktúra žaburinky. Je to najmenšia jednotka, t. j. jednotlivec schopný rozmnožovania.
Gibozita: znamená lístky, ktoré majú vypuklý alebo napuchnutý vzhľad.
Rast: je nárast meranej premennej, napr. počtu lístkov, sušiny, hmotnosti vo vlhkom stave alebo plochy lístkov, počas testu.
Rýchlosť rastu (priemerná špecifická rýchlosť rastu): je logaritmickým nárastom biomasy počas expozície testovanou látkou.
Najnižšia koncentrácia s pozorovateľnými účinkami (LOEC): je najnižšia testovaná koncentrácia, pri ktorej sa pozoruje, že látka má štatisticky významný účinok na zníženie rastu (pri p < 0,05) pri porovnaní s kontrolou v rámci daného času expozície. Škodlivý účinok všetkých testovaných koncentrácií nad LOEC však musí byť vždy rovnaký alebo väčší ako účinky pozorované pri LOEC. Ak nie sú splnené tieto dve podmienky, je potrebné poskytnúť úplné vysvetlenie, akým spôsobom sa zvolila LOEC (a teda aj NOEC).
Merané premenné: sú všetky typy premenných, ktoré sa merajú na vyjadrenie konečného bodu testu s použitím jedného alebo viacerých hodnôt reakcie. V tejto metóde počet lístkov, plocha lístkov, hmotnosť v čerstvom stave a sušina sú meranými premennými.
Monokultúra: je kultúra s jedným druhom rastliny.
Nekróza: je odumreté (t. j. biele alebo rozmočené) tkanivo lístkov.
Koncentrácia bez pozorovaného účinku (NOEC): je testovaná koncentrácia bezprostredne pod LOEC.
Fenotyp: je viditeľná charakteristika organizmu určená interakciou jeho génov s jeho prostredím.
Premenná hodnota reakcie: je premenná na odhad toxicity odvodená z akýchkoľvek stanovených premenných opisujúcich biomasu rôznymi metódami výpočtu. Pre túto metódu sú rýchlosti rastu a výťažok hodnoty reakcie odvodené z meraných premenných, ako počet lístkov, plocha lístkov, hmotnosť v čerstvom stave alebo sušina.
Semistatický (obnovovací) test: je test, v ktorom sa testovací roztok počas testu pravidelne nahrádza v konkrétnych intervaloch.
Statický test: je testovacia metóda bez obnovy testovacieho roztoku počas testu.
Konečný bod testu: opisuje všeobecný faktor, ktorý sa zmení testovanou chemickou látkou v porovnaní s kontrolou ako cieľ testu. V tejto metóde je konečným bodom inhibícia rastu, ktorá môže byť vyjadrená rôznymi hodnotami reakcie, založenými na jednej alebo viacerých meraných premenných.
Testovacie médium: je kompletné syntetické kultivačné médium, v ktorom testované rastliny rastú v podmienkach expozície testovanou látkou. Testovaná látka sa pri normálnych podmienkach rozpustí v testovanom médiu.
Výťažok: je hodnota meranej premennej na vyjadrenie množstva biomasy na konci času expozície mínus meraná premenná na začiatku času expozície.
1.3. PRINCÍP TESTU
Umožní sa exponenciálny rast rastlinných kultúr rodu Lemna vo forme monokultúr v odlišných koncentráciách testovanej látky počas siedmich dní. Účelom testu je kvantifikovať účinky vo vzťahu k testovanej látke na vegetatívny rast počas tohto času založené na hodnotení zvolených meraných premenných. Počet lístkov je najdôležitejšou meranou premennou. Meria sa ešte aspoň jedna ďalšia meraná premenná (celková plocha lístkov, sušina alebo hmotnosť v čerstvom stave), lebo niektoré látky môžu oveľa viac ovplyvniť iné merané premenné ako počet lístkov. Na kvantifikovanie účinkov vzťahujúcich sa na testovanú látku sa rast v testovacích roztokoch porovnáva rastom v kontrolách a koncentrácia spôsobujúca špecifickú x % inhibíciu rastu (napr. 50 %) sa určí a vyjadrí ako ECx (napr. EC50).
Konečným bodom testu je inhibícia rastu vyjadrená ako logaritmický nárast meranej premennej (priemerná špecifická rýchlosť rastu) počas expozície. Z priemerných špecifických rýchlostí rastu zaznamenaných v sérii testovaných roztokov sa koncentrácia, ktorá spôsobuje špecifickú x % inhibíciu rýchlosti rastu (napr. 50 %), stanoví a vyjadrí ako ErCx (napr. ErC50).
Ďalšou hodnotou reakcie použitou v tejto testovacej metóde je výťažok, ktorý sa v niektorých krajinách vyžaduje na splnenie špecifických regulačných požiadaviek. Je definovaný ako merané premenné na konci času expozície mínus merané premenné na začiatku času expozície. Z výťažku zaznamenaného v sérii testovaných roztokov sa koncentrácia, ktorá spôsobuje špecifickú x % inhibíciu výťažku (napr. 50 %), vypočíta a vyjadrí ako EyCx (napr. EyC50).
Okrem toho možno štatisticky stanoviť najnižšiu koncentráciu s pozorovateľnými účinkami (LOEC) a koncentráciu bez pozorovaného účinku (NOEC).
1.4. INFORMÁCIE O TESTOVANEJ LÁTKE
Musí byť k dispozícii analytická metóda s vhodnou citlivosťou na kvantifikáciu látky v testovacom médiu.
Informácie o testovanej látke, ktoré môžu byť osožné pri stanovovaní testovacích podmienok, obsahujú štrukturálny vzorec, čistotu, rozpustnosť vo vode, stabilitu vo vode a svetle, pKa, Kow, tlak pary a biologickú odbúrateľnosť. Rozpustnosť vo vode a tlak pary sa dajú použiť na výpočet Henryho konštanty, ktorá bude indikovať, či sú pravdepodobné značné úbytky testovanej látky. To pomôže pri indikácii, či je potrebné prijať konkrétne kroky na kontrolu takýchto úbytkov. Ak sú informácie o rozpustnosti a stabilite testovanej látky neurčité, odporúča sa, aby sa tieto informácie hodnotili za podmienok testu, t. j. rastové médium, teplota, režim osvetľovania používané v teste.
Ak je kontrola pH testovacieho média obzvlášť dôležitá, napr. pri testovaní kovov alebo látok, ktoré sú hydrolyticky nestabilné, odporúča sa pridať do rastového média tlmivý roztok (pozri prvý odsek v oddiele 1.7.4). Ďalšie informácie pre testované látky s fyzikálno-chemickými vlastnosťami, ktoré sťažujú ich testovanie, sú uvedené v (11).
1.5. REFERENČNÁ LÁTKA
Referenčná(-é) látka(-y), ako napr. 3,5-dichlórfenol, používaná(-é) v medzinárodnom kruhovom teste (10), sa môže(-u) testovať ako prostriedok kontroly postupu testu. Odporúča sa testovať referenčnú látku aspoň dvakrát do roka, alebo ak sa testovanie vykonáva menej často, súbežne so stanovením toxicity testovanej látky.
1.6. PLATNOSŤ TESTU
Tento test je platný, iba ak čas zdvojenia počtu lístkov v kontrole je menej ako 2,5 dní (60 h), čo zodpovedá približne sedemnásobnému zvýšeniu za sedem dní a priemernej špecifickej rýchlosti rastu 0,275 d–1. Pri použití média a za podmienok testu uvedených v tejto testovacej metóde môže sa toto kritérium splniť, ak sa použije statický test (8). Rovnako sa predpokladá, že toto kritérium sa bude dať dosiahnuť aj za podmienok semistatického a prietokového testu. Výpočet času zdvojenia je uvedený v oddiele 2.1.
1.7. OPIS METÓDY
1.7.1. Prístroje
Všetky zariadenia, ktoré prichádzajú do styku s testovacím médiom, musia byť vyrobené zo skla alebo iného chemicky inertného materiálu. Sklené nádoby, ktoré sa používajú na kultiváciu a na testovanie, sa musia vyčistiť od chemických kontaminantov, ktoré by sa mohli rozpúšťať v testovacom médiu, a musia byť sterilné. Testovacie nádoby musia byť dostatočne široké, aby lístky rôznych kolónií v kontrolných nádobách mohli rásť bez prekrývania na konci testu. Neprekáža, ak sa korienky dotýkajú dna testovacích nádob, ale odporúča sa minimálna hĺbka 20 mm a minimálny objem 100 ml v každej testovacej nádobe. Výber testovacích nádob nie je rozhodujúci, pokiaľ sa tieto požiadavky dodržia. Vhodné sú všetky druhy sklených kadičiek, kryštalizačných misiek alebo sklených Petriho misiek vhodných rozmerov. Testovacie nádoby musia byť zakryté, aby sa minimalizovalo vyparovanie a náhodná kontaminácia, pričom sa musí umožniť potrebná výmena vzduchu. Vhodné testovacie nádoby, a predovšetkým veká nesmú spôsobovať tienenie alebo zmeny spektrálnych charakteristík svetla.
Kultúry a testovacie nádoby sa nesmú uchovávať spoločne. To sa dá najlepšie dosiahnuť s použitím oddelených environmentálnych rastových komôr, inkubátorov alebo miestností. Osvetlenie a teplota sa musia byť nastavovateľné a udržiavané na konštantnej úrovni (pozri oddiel 1.7.8).
1.7.2. Testované organizmy
Organizmus používaný pre tento test je buď Lemna gibba, alebo Lemna minor. Krátka charakteristika druhov žaburinky, ktoré sa používajú na testovanie toxicity, je uvedená v dodatku 1. Rastlinný materiál možno získať zo zbierky kultúr, iného laboratória alebo z terénu. Ak je získaný z terénu, je potrebné minimálne osem týždňov pred použitím uchovávať rastliny v kultúre v rovnakom médiu, ako sa používa na testovanie. Miesta v teréne použité na zbieranie počiatočných kultúr musia byť bez zrejmých zdrojov kontaminácie. Ak sa získa z iného laboratória alebo zbierky kultúr, mali by sa podobne uchovávať minimálne tri týždne. Vždy je potrebné uviesť v správe zdroj rastlinného materiálu a druh a klon (ak je známy) použitý na testovanie.
Musia sa používať monokultúry, ktoré sú viditeľne bez kontaminácie inými organizmami, ako napr. riasy a prvoky. Zdravé rastliny L. minor sa skladajú z kolónií obsahujúcich dva až päť lístkov, pričom zdravé kolónie L. gibba môžu obsahovať až sedem lístkov.
Kvalita a uniformita rastlín, ktoré sa používajú na test, budú mať značný vplyv na výsledok testu, a preto by sa mali starostlivo vyberať. Musia sa použiť mladé, rýchlo rastúce rastliny bez viditeľných lézií alebo straty farby (chloróza). Kvalitné kultúry sa prejavujú vysokým výskytom kolónií, ktoré pozostávajú aspoň z dvoch lístkov. Veľký počet jediných lístkov značí environmentálny stres, napr. obmedzený prísun živín, a rastlinný materiál z takýchto kultúr sa nesmie použiť na testovanie.
1.7.3. Kultivácia
Na zníženie frekvencie uchovávania kultúr (napr. v čase, keď sa neplánujú žiadne testy s rodom Lemna) sa kultúry môžu uchovávať pri obmedzenom osvetlení a teplote (4 °C – 10 °C). Informácie o kultivovaní sú uvedené v dodatku 2. Zrejmé znaky kontaminácie riasami alebo inými organizmami budú vyžadovať povrchovú sterilizáciu čiastočnej vzorky lístkov rodu Lemna, ktorá sa potom prenesie do čerstvého média (pozri dodatok 2). V tomto prípade sa zvyšná kontaminovaná kultúra vyradí.
Aspoň sedem dní pred uskutočnením testu sa dostatočný počet kolónií prenesie sterilne do čerstvého sterilného média a kultivuje 7 – 10 dní za podmienok testu.
1.7.4. Testovacie médium
Odporúčajú sa rôzne médiá pre Lemna minor a Lemna gibba, ako sa uvádza nižšie. Je potrebné starostlivo posúdiť pridanie pH tlmivého roztoku do testovacieho roztoku [MOPS (kyselina 3-morfolinopropánsulfónová, č. CAS: 1132 – 61 – 2; č. EINECS: 214 – 478 – 5) v médiu pre L. minor a NaHCO3 v médiu pre L. gibba], ak sa očakáva, že by mohli reagovať s testovanou látkou a ovplyvniť vyjadrenie jej toxicity. Steinbergovo médium (12) je tiež prijateľné, pokiaľ sú splnené kritériá platnosti.
Odporúča sa modifikácia švédskej normy (SIS) rastového média pre Lemna na kultiváciu a testovanie L. minor. Zloženie tohto média je uvedené v dodatku 3.
Na kultiváciu a testovanie L. gibba sa odporúča rastové médium 20X – AAP, ako je uvedené v dodatku 3.
Steinbergovo médium, ako je uvedené v dodatku 3, je vhodné aj pre L. minor, ale sa môže použiť aj pre L. gibba, pokiaľ sú splnené kritériá platnosti.
1.7.5. Testovacie roztoky
Testovacie roztoky sa pripravujú obvykle zriedením zásobného roztoku. Zásobné roztoky testovacieho roztoku sa pripravujú obvykle rozpustením látky v rastovom médiu.
Najvyššia testovacia koncentrácia testovanej látky nesmie byť spravidla vyššia ako rozpustnosť látky vo vody za podmienok testu. Je potrebné však pripomenúť, že Lemna spp. plávajú na povrchu a môžu byť vystavené látkam, ktoré sa zhromažďujú na rozhraní voda-vzduch (napr. látky, ktoré sú vo vode zle rozpustné alebo hydrofóbne látky, alebo povrchovoaktívne látky). Za takýchto podmienok bude expozícia pochádzať z iného materiálu, ako sa nachádza v roztoku, a testovacie koncentrácie môžu v závislosti od vlastností testovanej látky byť vyššie ako rozpustnosť vo vode. Pre testované látky s nízkou rozpustnosťou vo vode môže byť potrebné pripraviť koncentrovaný zásobný roztok alebo disperziu látky s použitím organického rozpúšťadla alebo disperzantu, aby sa umožnilo pridanie príslušných množstiev testovanej látky do testovacieho média a napomohlo jej rozptýlenie a rozpustenie. Treba vyvinúť všetko úsilie na to, aby sa zabránilo použitiu takýchto materiálov. Nesmie sa vyskytovať žiadna fytotoxicita v dôsledku použitia pomocných rozpúšťadiel alebo disperzantov. Napríklad k bežne používaným rozpúšťadlám, ktoré nespôsobujú fytotoxicitu pri koncentráciách do 100 μl·l–1, patrí acetón a dimetylformamid. Ak sa používa rozpúšťadlo alebo disperzant, jeho konečná koncentrácia sa musí zaznamenať a udržiavať na minime (≤ 100 μ·l–1) a všetky ošetrené vzorky a kontroly musia obsahovať rovnakú koncentráciu rozpúšťadla alebo disperzantu. Ďalšie informácie o použití disperzantov sú uvedené v (11).
1.7.6. Testované a kontrolné skupiny
Predchádzajúce poznatky o toxicite testovanej látky pre rod Lemna, napr. z testov na zistenie rozmedzia, napomôžu pri voľbe vhodných testovaných koncentrácií. V konečnom teste toxicity musí byť aspoň päť testovaných koncentrácií zoradených v geometrických radoch. Prednostne nesmie byť rozdeľovací koeficient medzi testovanými koncentráciami vyšší ako 3,2, ale môže sa použiť vyššia hodnota, ak je krivka reakcie na koncentráciu plochá. Je potrebné uviesť zdôvodnenie, ak sa použije menej ako päť koncentrácií. Na každú testovanú koncentráciu sa musia použiť aspoň tri paralelky.
Pri stanovení rozsahu testovaných koncentrácií (v prípade testov na zistenie rozsahu a/alebo konečnom teste toxicity) je potrebné zvážiť toto:
|
— |
Na stanovenie ECx musia testované koncentrácie obklopovať hodnotu ECx, aby sa zabezpečila primeraná úroveň spoľahlivosti. Napríklad ak sa odhaduje EC50, najvyššia testovaná koncentrácia musí byť vyššia ako hodnota EC50. Ak hodnota EC50 leží mimo rozsahu testovaných koncentrácií, asociované intervaly spoľahlivosti budú väčšie a môže sa stať, že sa vhodnosť modelu pre štatistické spracovanie nebude dať správne posúdiť. |
|
— |
Ak je cieľom odhad LOEC/NOEC, najnižšia testovaná koncentrácia musí byť dostatočne nízka na to, aby rast nebol významne nižší ako v kontrole. A ďalej najvyššia testovaná koncentrácia musí byť dostatočne vysoká na to, aby bol rast významne nižší ako v kontrole. Ak to tak nie je, test sa bude musieť opakovať s použitím rôznych rozsahov koncentrácií (pokiaľ najvyššia koncentrácia nie je limitnou hodnotou rozpustnosti alebo maximálnou povolenou limitnou hodnotou koncentrácie, napr. 100 mg·l–1). |
Každý test musí zahŕňať kontroly pozostávajúce z rovnakého živného média, počtu lístkov a kolónií, environmentálnych podmienok a postupov ako v prípade testovacích nádob, ale bez testovanej látky. Ak sa používa pomocné rozpúšťadlo alebo disperzant, musí sa zahrnúť ďalšia kontrola s rozpúšťadlom/disperzantom v rovnakej koncentrácii, ako sa nachádza v nádobách s testovanou látkou. Počet paralelných kontrolných nádob (a v prípade potreby nádob s rozpúšťadlom) musí byť minimálne rovnaký alebo v ideálnom prípade dvojnásobný ako počet nádob použitý pre každú testovanú koncentráciu.
Ak sa nevyžaduje stanovenie NOEC, môže sa test pozmeniť a zvýšiť počet koncentrácií a znížiť počet paraleliek na koncentráciu. Musia byť však aspoň tri paralelky kontroly.
1.7.7. Expozícia
Kolónie pozostávajúce z 2 až 4 viditeľných lístkov sa prenesú do kultúry inokula a náhodne sa rozdelia do testovacích nádob za sterilných podmienok. Každá testovacia nádoba musí obsahovať celkove 9 až 12 lístkov. Počet lístkov a kolónií musí byť rovnaký v každej testovacej nádobe. Zo skúseností pri použití tejto metódy a údajov kruhového testu vyplýva, že tri paralelky na jedno ošetrenie, pričom každá paralelka obsahuje na začiatku 9 až 12 lístkov, sú dostatočné na detekciu rozdielov v raste približne v rozmedzí 4 % až 7 % inhibície vypočítanej na základe rýchlosti rastu (10 % až 15 % vypočítanej podľa výťažku) medzi ošetreniami (10).
Je potrebné, aby sa testovacie nádoby v inkubátore umiestňovali náhodne, aby sa minimalizoval vplyv priestorových rozdielov v intenzite svetla alebo teplote. Takisto je potrebné blokové usporiadanie alebo náhodné premiestňovanie nádob pri uskutočňovaní pozorovaní (alebo častejšie premiestňovanie).
Ak z predbežného testu stability vyplýva, že sa nedá zachovať koncentrácia testovanej látky (t. j. meraná koncentrácia poklesne pod 80 % meranej počiatočnej koncentrácie) počas trvania testu (7 dní), odporúča sa uskutočniť semistatický test. V tomto prípade sa kolónie musia exponovať čerstvo pripraveným testovacím a kontrolným roztokom aspoň dvakrát počas testu (napr. dni 3 a 5). Frekvencia expozície čerstvého média bude závisieť od stability testovanej látky; môže byť potrebná vyššia frekvencia na zachovanie približne konštantných koncentrácií veľmi nestabilných alebo prchavých látok. V niektorých prípadoch môže byť potrebné použiť prietokový postup (11) (13).
Spôsob expozície aplikáciou na listy (sprej) sa nenachádza v tejto testovacej metóde, namiesto toho pozri (14).
1.7.8. Podmienky inkubácie
Použije sa kontinuálne teplé alebo studené biele fluorescenčné osvetlenie na zabezpečenie zvolenej intenzity svetla medzi 85 – 135 μE·m–2·s–1 pri meraní vo fotosynteticky aktívnom žiarení (400 – 700 nm) v bodoch v rovnakej vzdialenosti od zdroja svetla ako lístky rastliny rodu Lemna (rovnocenné 6 500 – 10 000 lux). Žiadna odlišnosť od zvolenej intenzity svetla nad plochou, kde sa uskutočňuje test, nesmú presiahnuť ± 15 %. Metóda detekcie svetla a merania, najmä typ senzora, ovplyvní meranú hodnotu. Guľové senzory (ktoré reagujú na svetlo zo všetkých uhlov nad a pod rovinou merania) a „kosínusové“ senzory (ktoré reagujú na svetlo zo všetkých uhlov nad rovinou merania) sa uprednostňujú pred jednosmernými senzormi a poskytnú presnejšie snímanie v prípade viacbodového svetelného zdroja takého typu, aký sa uvádza v tejto metóde.
Teplota v testovaných nádobách musí byť 24 °C ± 2 °C. pH kontrolného média sa nesmie zvýšiť počas testu o viac ako 1,5 jednotiek. Odchýlka o viac ako 1,5 jednotiek by však nemala spôsobiť neplatnosť testu, ak sa dokáže, že sú splnené kritériá platnosti. V určitých prípadoch je potrebné venovať dodatočnú pozornosť kolísaniu pH, ako napr. pri testovaní nestabilných látok alebo kovov. Ďalšie informácie sú uvedené v (11).
1.7.9. Trvanie
Test sa ukončí 7 dní po premiestnení rastlín do testovacích nádob.
1.7.10. Merania a analytické stanovenia
Na začiatku testu sa spočíta a zaznamená počet lístkov v testovacích nádobách, pričom je potrebné venovať pozornosť tomu, aby sa spočítali vystupujúce, zreteľne viditeľné lístky. Počet lístkov, ktoré majú normálny alebo abnormálny vzhľad, je potrebné stanoviť na začiatku testu, minimálne každé 3 dni počas expozície (t. j. aspoň 2-krát počas 7 dní) a po ukončení testu. Je potrebné si všimnúť zmeny vo vývoji rastliny, napr. vo veľkosti lístkov, vzhľade, známky nekrózy, chlorózy a gibozity, rozpad kolónií alebo stratu schopnosti plávať na hladine a v dĺžke korienkov a vzhľade. Je potrebné si všimnúť aj významné znaky testovacieho média (napr. prítomnosť nerozpusteného materiálu, rast rias v testovacej nádobe).
Okrem stanovení počtu lístkov počas testu sa posudzujú aj účinky testovanej látky na jednu (alebo viac) z týchto meraných premenných:
|
i) |
celková plocha lístkov; |
|
ii) |
sušina; |
|
iii) |
hmotnosť v čerstvom stave. |
Celková plocha lístkov je výhodná, lebo sa dá stanoviť pre každý test a kontrolnú nádobu na začiatku, počas a na konci testu. Sušinu alebo hmotnosť v čerstvom stave je potrebné stanoviť na začiatku testu zo vzorky kultúry inokula, ktorá predstavuje kultúru použitú na začiatku testu a na konci testu, s rastlinným materiálom z každého testu a kontrolnej nádoby. Ak sa plocha lístkov nemeria, uprednostňuje sa sušina pred hmotnosťou v čerstvom stave.
Celková plocha lístkov, sušina a hmotnosť v čerstvom stave sa môže stanoviť takto:
|
i) |
Celková plocha lístkov: Celková plocha lístkov všetkých kolónií sa môže stanoviť analýzou obrazu. Siluetu testovacej nádoby a rastlín možno zachytiť prostredníctvom videokamery (t. j. umiestnením nádoby na svetelný box) a výsledný obraz sa digitalizuje. Kalibráciou plochých tvarov známej plochy sa potom môže stanoviť celková plocha lístkov v testovacej nádobe. Je potrebné venovať pozornosť tomu, aby sa vylúčila interferencia spôsobená okrajom testovacej nádoby. Alternatívnym, ale prácnejším prístupom je urobiť fotokópiu testovacej nádoby a rastlín, vystrihnúť výslednú siluetu kolónií a stanoviť ich plochu s použitím analyzátora plochy lístkov alebo milimetrového papiera. Môžu byť vhodné aj iné techniky (napr. pomer hmotnosti papiera medzi plochou siluety kolónii a jednotkou plochy). |
|
ii) |
Sušina: Všetky kolónie sa zozbierajú z každej testovacej nádoby a opláchnu destilovanou alebo deionizovanou vodou. Osušia sa, aby sa odstránila nadbytočná voda a potom sa sušia pri 60 °C do konštantnej hmotnosti. Musia obsahovať všetky úlomky korienkov. Sušina sa musí vyjadriť s presnosťou minimálne 0,1 mg. |
|
iii) |
Hmotnosť v čerstvom stave: Všetky kolónie sa prenesú do predvážených polystyrénových (alebo iný inertný materiál) skúmaviek s malými (1 mm) otvormi v zaoblených dnách. Skúmavky sa potom 10 minút centrifugujú pri 3 000 rpm pri teplote miestnosti. Skúmavky obsahujúce už vysušené kolónie sa opätovne prevážia a hmotnosť v čerstvom stave sa vypočíta odpočítaním hmotnosti prázdnej skúmavky. |
1.7.10.1. Frekvencia meraní a analytické stanovenia
Ak sa použije statický test, na začiatku a na konci testu sa musí zmerať pH každej ošetrenej vzorky. Ak sa použije semistatický test, pH sa musí zmerať v každej dávke „čerstvého“ testovacieho roztoku pred každým obnovením a aj v zodpovedajúcich „spotrebovaných“ roztokoch.
Intenzita svetla sa musí merať v rastovej komore, inkubátore alebo miestnosti v bodoch v rovnakej vzdialenosti od zdroja svetla ako lístky Lemna. Merania sa musia uskutočniť minimálne jedenkrát počas testu. Teplota média v náhradnej nádobe udržiavanej v rovnakých podmienkach v rastovej komore, inkubátore alebo miestnosti sa musí zaznamenať minimálne jedenkrát za deň.
Počas testu sa v príslušných intervaloch stanovia koncentrácie testovanej látky. V statických testoch je minimálne potrebné stanoviť koncentrácie na začiatku a na konci testu.
V semistatických testoch, kde sa očakáva, že koncentrácie testovanej látky nebudú v rozmedzí ± 20 % nominálnej koncentrácie, je potrebné analyzovať všetky čerstvo pripravené testovacie roztoky a rovnaké roztoky pri každom obnovení (pozri tretí odsek v oddiele 1.7.7). V prípade tých testov, kde však nameraná počiatočná koncentrácia testovanej látky nie je v rozmedzí ± 20 % nominálnej hodnoty, ale kde sa dajú poskytnúť dostačujúce dôkazy na preukázanie, že počiatočné koncentrácie sú reprodukovateľné a stabilné (t. j. v rozmedzí 80 % – 20 % počiatočnej koncentrácie), sa môžu chemické stanovenia vykonať iba s najvyššími a najnižšími testovanými koncentráciami. Vo všetkých prípadoch je potrebné stanoviť koncentrácie testovanej látky pred obnovením iba v jednej paralelnej nádobe na každú testovanú koncentráciu (alebo obsahy nádob rozdelených do paraleliek).
Ak sa použije prietokový test, je vhodný podobný systém odberu vzoriek, ako je uvedený pre semistatické testy, vrátane analýzy na začiatku, v polovici a na konci testu, ale meranie „spotrebovaných“ roztokov v tomto prípade nie je vhodné. Pri tomto type sa musí prietoková rýchlosť riedidla a testovaná látka alebo zásobný roztok testovanej látky denne kontrolovať.
Ak je dokázané, že koncentrácia látky, ktorá sa testuje, je počas testu dostatočnej miere udržiavaná v rozmedzí ± 20 % nominálnej hodnoty alebo nameranej počiatočnej koncentrácie, analýza výsledkov sa môže zakladať na nominálnych hodnotách alebo nameraných počiatočných hodnotách. Ak je odchýlka od nominálnej alebo nameranej počiatočnej koncentrácie väčšia ako ± 20 %, analýza výsledkov sa musí zakladať na geometrickej strednej koncentrácii počas expozície alebo modeloch opisujúcich pokles koncentrácie testovanej látky (11).
1.7.11. Limitný test
Za niektorých okolností, napr. ak z predbežného testu vyplýva, že testovaná látka nemá žiadne toxické účinky pri koncentráciách do 100 mg·l–1 alebo do jej limitu rozpustnosti v testovacom médiu (podľa toho, ktorá hodnota je nižšia), môže sa uskutočniť limitný test umožňujúci porovnanie reakcií v kontrolnej skupine a jednej ošetrenej skupine (100 mg·l–1 alebo koncentrácia rovnaká ako limit rozpustnosti). Dôrazne sa odporúča, aby sa toto zakladalo na analýze expozičnej koncentrácie. Na limitný test platia všetky už uvedené testovacie podmienky a kritériá validity s výnimkou, že musí byť aspoň šesť ošetrených paraleliek. Rast v kontrolnej a ošetrenej skupine sa môže analyzovať s použitím štatistického testu na porovnanie prostriedkov, napr. Študentov t-test.
2. ÚDAJE A SPRÁVY
2.1. ČAS ZDVOJENIA
Na stanovenie času zdvojenia (Td) počtu lístkov a pri dodržaní tohto kritéria platnosti podľa štúdie (oddiel 1.6) sa použije tento vzorec s údajmi, ktoré sa získali z kontrolných nádob:
Td = ln 2/μ
kde μ je priemerná špecifická rýchlosť rastu stanovená a opísaná v prvom a druhom odseku oddielu 2.2.1.
2.2. HODNOTY REAKCIE
Cieľom testu je stanoviť účinky testovanej látky na vegetatívny rast rastlín rodu Lemna. Táto testovacia metóda opisuje dve premenné hodnoty reakcie, keďže členské krajiny majú rozdielne preferencie a regulačné požiadavky. Aby boli výsledky testu prijateľné vo všetkých členských krajinách, účinky sa musia vyhodnotiť s použitím oboch premenných hodnôt reakcie a) a b), ktoré sú uvedené nižšie.
|
a) |
Priemerná špecifická rýchlosť rastu: táto premenná hodnota reakcie sa vypočíta na základe zmien logaritmu počtu lístkov a okrem toho na základe zmien logaritmu iného parametra merania (celková plocha lístkov, sušina alebo hmotnosť v čerstvom stave) v kontrolách a v každej ošetrenej skupine až do ukončenia testu. Niekedy sa uvádza ako relatívna rýchlosť rastu (15). |
|
b) |
Výťažok: táto premenná hodnota reakcie sa vypočíta na základe zmien počtu lístkov a okrem toho na základe zmien iného parametra merania (celková plocha lístkov, sušina alebo hmotnosť v čerstvom stave) v kontrolách a v každej ošetrenej skupine až do ukončenia testu. |
Je potrebné pripomenúť, že hodnoty toxicity vypočítané s použitím týchto dvoch premenných hodnôt reakcie nie sú porovnateľné a tento rozdiel sa musí zohľadniť pri použití výsledkov testu. ECx hodnoty založené na priemernej špecifickej rýchlosti rastu (ErCx) budú obvykle vyššie ako výsledky založené na výťažku (EyCx) pri dodržaní testovacích podmienok tejto testovacej metódy kvôli matematickému základu príslušných metód. Neznamená to rozdiel v citlivosti medzi oboma premennými hodnotami reakcie, ale jednoducho to znamená, že hodnoty sa odlišujú matematicky. Pojem priemerná špecifická rýchlosť rastu sa zakladá na všeobecnom exponenciálnom modele rastu rias v nelimitovaných kultúrach, kde sa toxicita stanovuje na základe účinkov na rýchlosť rastu, bez závislosti od absolútnej úrovne špecifickej rýchlosti rastu kontroly, od klesania krivky reakcie na koncentráciu alebo od dĺžky testu. Naopak je to v prípade výsledkov založených na výťažku ako premennej hodnote reakcie, ktoré sú závislé od všetkých týchto ďalších premenných. EyCx je závislé od špecifickej rýchlosti rastu druhov žaburiniek, ktoré sa používajú v každom teste, a od maximálnej špecifickej rýchlosti rastu, ktorá sa môže meniť medzi druhmi a dokonca medzi rozdielnymi klonmi. Táto premenná hodnota reakcie sa nesmie použiť na porovnanie citlivosti na toxické látky medzi druhmi žaburinky alebo dokonca odlišnými klonmi. Zatiaľ čo sa z vedeckého hľadiska uprednostňuje použitie priemernej špecifickej rýchlosti rastu, na odhady toxicity, aby sa vyhovelo súčasným regulačným požiadavkám v niektorých krajinách, do tejto testovacej metódy sa zahrnulo aj stanovenie toxicity založené na výťažku.
Odhady toxicity sa musia zakladať na počte lístkov a na jednej ďalšej meranej premennej (celková plocha lístkov, suchá hmotnosť alebo čerstvá hmotnosť), pretože niektoré látky môžu ovplyvniť iné merané premenné oveľa viac ako počet lístkov. Tento účinok by sa nemal stanovovať iba na základe počítania počtu lístkov.
Počet lístkov, ako aj každá iná zaznamenaná meraná premenná, t. j celková plocha lístkov, sušina alebo hmotnosť v čerstvom stave, sa zapíše do tabuľky spolu s koncentráciami testovanej látky pri každom meraní. Následná analýza údajov, napr. na odhad LOEC, NOEC alebo ECx, sa musí zakladať na hodnotách pre jednotlivé paralelné vzorky a nie na vypočítaných stredných hodnotách pre každú ošetrenú skupinu.
2.2.1. Priemerná špecifická rýchlosť rastu
Priemerná špecifická rýchlosť rastu za konkrétny čas sa vypočíta ako logaritmus nárastu premenných rastu – počtu lístkov a jednej ďalšej meranej premennej (celková plocha lístkov, sušina alebo hmotnosť v čerstvom stave) – s použitím uvedeného vzorca pre každú paralelnú vzorku kontroly a ošetrených vzoriek:

kde:
|
— |
μi – j: |
priemerná špecifická rýchlosť rastu od času i do j |
|
— |
Ni: |
meraná premenná v testovacej alebo kontrolnej nádobe v čase i |
|
— |
Nj: |
meraná premenná v testovacej alebo kontrolnej nádobe v čase j |
|
— |
t: |
čas od i do j. |
Pre každú ošetrenú a kontrolnú skupinu vypočítajte strednú hodnotu pre rýchlosť rastu spolu s odhadmi variancie.
Priemerná špecifická rýchlosť rastu sa vypočíta pre celý čas testu (čas „i“ v uvedenom vzorci je začiatok testu a čas „j“ je koniec testu). Pre každú testovanú koncentráciu a kontrolu vypočítajte strednú hodnotu špecifickej rýchlosti rastu spolu s odhadmi variancie. Okrem toho sa môže stanoviť rýchlosť rastu po častiach, aby sa vyhodnotili účinky testovanej látky, ktoré sa vyskytnú počas expozície (napr. skontrolovaním logaritmicky transformovaných rastových kriviek). Značné rozdiely medzi rýchlosťou rastu po častiach a priemernou rýchlosťou rastu indikujú odchýlku od konštantného exponenciálneho rastu, a to, že je zaručené dôkladné preskúmanie rastových kriviek. V tomto prípade by bolo konzervatívnym prístupom porovnávanie špecifických rýchlostí rastu ošetrených kultúr počas času maximálnej inhibície so špecifickými rýchlosťami rastu kontrol počas rovnakého času.
Percento inhibície rýchlosti rastu (Ir) sa môže potom vypočítať pre každú testovanú koncentráciu (ošetrenú skupinu) podľa tohto vzorca:
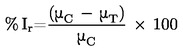
kde:
|
— |
% Ir: |
percento inhibície priemernej špecifickej rýchlosti rastu |
|
— |
μC: |
stredná hodnota pre μ v kontrole |
|
— |
μT: |
stredná hodnota pre μ v ošetrenej skupine. |
2.2.2. Výťažok
Účinky na výťažok sa stanovia na základe dvoch meraných premenných, počtu lístkov a jednej ďalšej meranej premennej (celkového počtu lístkov, suchej hmotnosti alebo čerstvej hmotnosti) nachádzajúcej sa v každej testovacej nádobe na začiatku a na konci testu. Pre sušinu alebo hmotnosť v čerstvom stave sa počiatočné množstvo biomasy stanoví na základe vzorky lístkov odobratých z rovnakej dávky použitej na inokuláciu testovacích nádob (pozri druhý odsek v oddiele 1.7.3). Pre každú testovanú koncentráciu a kontrolu vypočítajte strednú hodnotu výťažku spolu s odhadmi variancie. Stredné percento inhibície výťažku (%Iy) sa môže vypočítať pre každú ošetrenú paralelnú vzorku takto:

kde:
|
— |
% Iy: |
percento zníženia výťažku |
|
— |
bC: |
konečné množstvo biomasy mínus počiatočné množstvo biomasy pre kontrolnú skupinu |
|
— |
bT: |
konečné množstvo biomasy mínus počiatočné množstvo biomasy v ošetrenej skupine. |
2.2.3. Zostrojenie kriviek reakcie na koncentráciu
Krivky reakcie na koncentráciu vzťahujúce sa na stredné percento inhibície hodnoty reakcie (Ir, alebo Iy vypočítané, ako je uvedené v poslednom odseku oddielu 2.2.1 alebo v oddiele 2.2.2), a logaritmus koncentrácie testovanej látky sa graficky zaznamenajú.
2.2.4. Odhad ECx
Odhady ECx (napr. EC50) sa musia zakladať na priemernej rýchlosti rastu (ErCx) a aj na výťažku (EyCx), z ktorých sa každý musí zasa zakladať na počte lístkov a jednej ďalšej meranej premennej (celkový počet lístkov, sušina alebo hmotnosť v čerstvom stave). Je to preto, že existujú testované látky, ktoré rozdielne vplývajú na počet lístkov, a iné merané premenné. Požadovanými parametrami toxicity sú preto štyri hodnoty ECx pre každú vypočítanú úroveň inhibície x: ErCx (počet lístkov), ErCx (celková plocha lístkov, sušina alebo hmotnosť v čerstvom stave), EyCx (počet lístkov) a EyCx (celková plocha lístkov, sušina alebo hmotnosť v čerstvom stave).
2.3. ŠTATISTICKÉ POSTUPY
Cieľom je získať kvantitatívny vzťah medzi koncentráciou a reakciou regresnou analýzou. Možno použiť váženú lineárnu regresiu po uskutočnení linearizovanej transformácie reakčných údajov – napríklad na probitové alebo logitové alebo Weibullove jednotky (16), alebo sa uprednostňujú techniky nelineárnej regresie, ktorými sa lepšie spracujú nepresnosti údajov, ktorým sa nedá zabrániť, a odchýlky od hladkých rozdelení. Priblížením buď k nulovej, alebo úplnej inhibícii sa takéto nepresnosti môžu transformáciou zväčšiť a ovplyvniť analýzu (16). Je potrebné pripomenúť, že štandardné metódy analýzy s použitím probitových, logitových alebo Weibullových transformácií sa plánujú na použitie na kvantálne (napr. mortalita alebo prežitie) údaje a musia sa modifikovať, aby sa prispôsobili údajom o rýchlosti rastu alebo biomasy. Osobitné postupy na stanovenie hodnôt ECx zo spojitých údajov možno nájsť v (17) (18) a (19).
Pre každú hodnotu reakcie, ktorá sa má analyzovať, použite vzťah medzi koncentráciou a reakciou na výpočet bodových odhadov hodnôt ECx. Ak je to možné, je potrebné stanoviť 95 % hranice spoľahlivosti pre každý odhad. Vhodnosť reakčných údajov pre regresný model je potrebné vyhodnotiť buď graficky, alebo štatisticky. Regresná analýza sa musí uskutočniť s použitím jednotlivých reakcií paralelných vzoriek, nie stredných hodnôt ošetrenej skupiny.
Odhady EC50 a hranice spoľahlivosti sa môžu získať aj s použitím lineárnej interpolácie bootstrappingom (20), ak dostupné regresné modely/metódy sú pre údaje nevhodné.
Na odhad LOEC aj NOEC je potrebné porovnať stredné hodnoty ošetrenej skupiny s použitím techník pre analýzu variancie (ANOVA). Stredná hodnota pre každú koncentráciu sa musí potom porovnať s kontrolnou strednou hodnotou s použitím príslušného viacnásobného porovnania alebo testovacej metódy trendu. Môže sa použiť Dunnettov alebo Williamsov test (21) (22) (23) (24). Je potrebné stanoviť, či je dodržaný ANOVA predpoklad homogenity variancie. Toto stanovenie sa môže uskutočniť graficky alebo oficiálnym testom (25). Vhodný je Levenov alebo Bartlettov test. Nesplnenie predpokladu homogenity variancie sa môže niekedy korigovať logaritmickou transformáciou údajov. Ak je heterogenita variancie extrémna a nedá sa korigovať transformáciou, je potrebné posúdiť analýzu metódami, ako sú napr. „step-down Jonkheere“ testy trendu. Ďalšie informácie o stanovení NOEC možno nájsť v (19).
Najnovší vývoj vo vede vedie k odporúčaniu, aby sa upustilo od koncepcie NOEC a aby sa nahradila regresiou založenou na bodovom odhade ECx. Príslušná hodnota pre x nebola stanovená pre tento test na rastlinách rodu Lemna. Rozsah 10 % až 20 % sa však zdá byť vhodný (v závislosti od zvolenej hodnoty reakcie) a prednostne sa musí zaznamenať EC10 a EC20.
3. SPRÁVA
3.1. SPRÁVA Z TESTU
Správa z testu musí obsahovať tieto informácie:
Testovaná látka:
|
— |
fyzikálny charakter a príslušné fyzikálno-chemické vlastnosti vrátane limitu rozpustnosti vo vode, |
|
— |
chemické identifikačné údaje (napr. číslo CAS) vrátane čistoty. |
Testované druhy:
|
— |
vedecký názov, klon (ak je známy) a zdroj. |
Testovacie podmienky:
|
— |
použitý postup testovania (statický, semistatický alebo prietokový), |
|
— |
dátum začiatku testu a jeho dĺžka, |
|
— |
testovacie médium, |
|
— |
opis priebehu experimentu: testovacie nádoby a veká, objemy roztokov, počet kolónií a lístkov na testovaciu nádobu na začiatku testu, |
|
— |
testované koncentrácie (nominálne a merané podľa potreby) a počet paralelných vzoriek na koncentráciu, |
|
— |
metódy prípravy zásobných roztokov vrátane všetkých použitých rozpúšťadiel alebo disperzantov, |
|
— |
teplota počas testu, |
|
— |
zdroj svetla, intenzita a homogenita, |
|
— |
hodnoty pH testovacieho a kontrolného média, |
|
— |
koncentrácie testovaných látok a metóda analýzy s príslušným posúdením kvality údajov (validačné štúdie, štandardné odchýlky alebo hranice spoľahlivosti analýzy), |
|
— |
metódy stanovenia počtu lístkov a iné merané premenné, napr. sušina, hmotnosť v čerstvom stave alebo počet lístkov, |
|
— |
všetky odchýlky od tejto testovacej metódy. |
Výsledky:
|
— |
nespracované údaje: počet lístkov a iné merané premenné v každej testovacej a kontrolnej nádobe pri každom pozorovaní a analýze, |
|
— |
stredné hodnoty a štandardné odchýlky pre každú meranú premennú, |
|
— |
rastové krivky pre každú koncentráciu (odporúčané s logaritmicky transformovanou meranou premennou, pozri druhý odsek v oddiele 2.2.1), |
|
— |
čas zdvojenia/rýchlosť rastu v kontrole založené na počte lístkov, |
|
— |
vypočítané hodnoty reakcie pre každú ošetrenú paralelnú vzorku so strednými hodnotami a variančným koeficientom pre paralelky, |
|
— |
grafické znázornenie vzťahu koncentrácie/účinku, |
|
— |
odhady toxických konečných bodov pre hodnoty reakcie, napr. EC50, EC10, EC20, a príslušné intervaly spoľahlivosti. Ak sa vypočítava, LOEC a NOEC a štatistické metódy použité na ich stanovenie, |
|
— |
ak sa používa ANOVA, veľkosť účinku, ktorý sa stanovil (napr. najmenej významný rozdiel), |
|
— |
každá stimulácia rastu zistená v každom ošetrení, |
|
— |
všetky viditeľné znaky fytotoxicity, ako aj pozorovania testovacích roztokov, |
|
— |
diskusia k výsledkom vrátane každého vplyvu na záver z testu vyplývajúceho z odchýlok od tejto testovacej metódy. |
4. POUŽITÁ LITERATÚRA
|
(1) |
OECD TG 221 (2006) Lemna Sp. Growth Inhibition Test. |
|
(2) |
The use of Lemna studies for coloured substances is detailed in Section 13.5.3 of the EU Manual of Decisions dated July 2006, at http://ecb.jrc.ec.europa.eu/new-chemicals. |
|
(3) |
Guidance on information requirements and chemical safety assessment – Chapter R.7b: Endpoint specific guidance; Table 7.8.3 Summary of difficult substance testing issues, dostupné na adrese: http://guidance.echa.europa.eu/docs/guidance_document/information_requirements_en.htm?time=1234958685# |
|
(4) |
ASTM International. (2003). Standard Guide for Conducting Static Toxicity Test With Lemna gibba G3. E 1415 – 91 (Reapproved 1998). pp. 733 – 742. In, Annual Book of ASTM Standards, Vol. 11.05 Biological Effects and Environmental Fate; Biotechnology; Pesticides, ASTM, West Conshohocken, PA. |
|
(5) |
USEPA – United States Environmental Protection Agency. (1996). OPPTS 850.4400 Aquatic Plant Toxicity Test Using Lemna spp., „Public draft“. EPA 712-C-96 – 156. 8 pp. |
|
(6) |
AFNOR – Association Française de Normalisation. (1996). XP T 90 – 337: Détermination de l’inhibition de la croissance de Lemna minor. 10 pp. |
|
(7) |
SSI – Swedish Standards Institute. (1995). Water quality – Determination of growth inhibition (7-d) Lemna minor, duckweed. SS 02 82 13. 15pp. (v švédčine). |
|
(8) |
Environment Canada. (1999). Biological Test Method: Test for Measuring the Inhibition of Growth Using the Freshwater Macrophyte, Lemna minor. EPS 1/RM/37 – 120 pp. |
|
(9) |
Environment Canada. (1993) Proposed Guidelines for Registration of Chemical Pesticides: Non-Target Plant Testing and Evaluation. Canadian Wildlife Service, Technical Report Series No. 145. |
|
(10) |
Sims I., Whitehouse P., and Lacey R. (1999) The OECD Lemna Growth Inhibition Test. Development and Ring-testing of draft OECD Test Guideline. R&D Technical Report EMA 003. WRc plc – Environment Agency. |
|
(11) |
OECD (2000). Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. OECD Environmental Health and Safety Publications, Series on Testing and Assessment No. 23. |
|
(12) |
ISO DIS 20079. Water Quality – Determination of the Toxic Effect of Water Constituents and Waste Water to Duckweed (Lemna minor) – Duckweed Growth Inhibition Test. |
|
(13) |
Walbridge C. T. (1977). A flow-through testing procedure with duckweed (Lemna minor L.). Environmental Research Laboratory – Duluth, Minnesota 55804. US EPA Report No. EPA-600/3 – 77 108. September 1977. |
|
(14) |
Lockhart W. L., Billeck B. N. and Baron C. L. (1989). Bioassays with a floating plant (Lemna minor) for effects of sprayed and dissolved glyphosate. Hydrobiologia, 118/119, 353 – 359. |
|
(15) |
Huebert, D.B. and Shay J.M. (1993) Considerations in the assessment of toxicity using duckweeds. Environmental Toxicology and Chemistry, 12, 481 – 483. |
|
(16) |
Christensen, E.R., Nyholm, N. (1984): Ecotoxicological Assays with Algae: Weibull Dose-Response Curves. Env. Sci. Technol. 19, 713 – 718. |
|
(17) |
Nyholm, N. Sørensen, P.S., Kusk, K.O. and Christensen, E.R. (1992): Statistical treatment of data from microbial toxicity tests. Environ. Toxicol. Chem. 11, 157 – 167. |
|
(18) |
Bruce R.D. and Versteeg D.J. (1992) A statistical procedure for modelling continuous toxicity data. Environmental Toxicology and Chemistry, 11, 1485 – 1494. |
|
(19) |
OECD. (2004). Guidance Document on Statistical Analysis of Ecotoxicity Data. |
|
(20) |
Norberg-King T.J. (1988) An interpolation estimate for chronic toxicity: The ICp approach. National Effluent Toxicity Assessment Center Technical Report 05 – 88. USEPA, Duluth, MN. |
|
(21) |
Dunnett, C.W. (1955) A multiple comparisons procedure for comparing several treatments with a control. J. Amer. Statist. Assoc., 50, 1096 – 1121. |
|
(22) |
Dunnett, C.W. (1964) New tables for multiple comparisons with a control. Biometrics, 20, 482 – 491. |
|
(23) |
Williams, D.A. (1971) A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics, 27: 103 – 117. |
|
(24) |
Williams, D.A. (1972) The comparison of several dose levels with a zero dose control. Biometrics, 28: 510 – 531. |
|
(25) |
Brain P. and Cousens R. (1989). An equation to describe dose-responses where there is stimulation of growth at low doses. Weed Research, 29, 93 – 96. |
Dodatok 1
Opis Lemna spp.
Vodná rastlina bežne nazývaná žaburinka, Lemna spp., patrí do čeľade Lemnaceae, ktorá má množstvo druhov rozšírených po celom svete v štyroch rodoch. Ich odlišný vzhľad a taxonómia sú dôkladne opísané (1) (2). Lemna gibba a L. minor sú druhy zastúpené v miernych pásmach a bežne sa používajú na testy toxicity. Obidva druhy majú plávajúcu alebo ponorenú byľ v tvare disku (lístok) a veľmi tenký koreň vychádzajúci z centra spodnej plochy každého lístka. Lemna spp. zriedkavo vytvárajú kvety a rastliny sa rozmnožujú vegetatívne vytváraním nových lístkov (3). V porovnaní so staršími rastlinami bývajú bledšie, majú kratšie korene a skladajú sa z dvoch až troch lístkov rôznych veľkostí. Malá veľkosť rastliny Lemna, jej jednoduchá štruktúra, nepohlavné rozmnožovanie a krátky čas vývoja umožňujú, že rastliny tohto rodu sú veľmi vhodné na laboratórne testovanie (4) (5).
Vzhľadom na pravdepodobné odchýlky medzi druhmi sú platné iba porovnania citlivosti v rámci jedného druhu.
Príklady druhov Lemna, ktoré sa používajú na testovanie: Odkazy týkajúce sa druhov
Lemna aequinoctialis: Eklund, B. (1996). The use of the red alga Ceramium strictum and the duckweed Lemna aequinoctialis in aquatic ecotoxicological bioassays. Licentiate in Philosophy Thesis 1996:2. Dep. of Systems Ecology, Stockholm University.
Lemna major: Clark, N. A. (1925). The rate of reproduction of Lemna major as a function of intensity and duration of light. J. phys. Chem., 29: 935 – 941.
Lemna minor: United States Environmental Protection Agency (USEPA). (1996). OPPTS 850.4400 Aquatic Plant Toxicity Test Using Lemna spp., „Public draft“. EPA 712-C-96 – 156. 8 pp.
Association Française de Normalisation (AFNOR). (1996). XP T 90 – 337: Détermination de l’inhibition de la croissance de Lemna minor. 10 pp.
Swedish Standards Institute (SIS). (1995). Water quality – Determination of growth inhibition (7-d) Lemna minor, duckweed. SS 02 82 13. 15 pp. (v švédčine).
Lemna gibba: ASTM International. (2003). Standard Guide for Conducting Static Toxicity Test With Lemna gibba G3. E 1415 – 91 (Reapproved 1998). pp. 733 – 742.
United States Environmental Protection Agency (USEPA). (1996). OPPTS 850.4400 Aquatic Plant Toxicity Test Using Lemna spp., „Public draft“. EPA 712-C-96 – 156. 8 pp.
Lemna paucicostata: Nasu, Y., Kugimoto, M. (1981). Lemna (duckweed) as an indicator of water pollution. I. The sensitivity of Lemna paucicostata to heavy metals. Arch. Environ. Contam. Toxicol., 10:1959 – 1969.
Lemna perpusilla: Clark, J. R. et al. (1981). Accumulation and depuration of metals by duckweed (Lemna perpusilla). Ecotoxicol. Environ. Saf., 5:87 – 96.
Lemna trisulca: Huebert, D. B., Shay, J. M. (1993). Considerations in the assessment of toxicity using duckweeds. Environ. Toxicol. and Chem., 12:481 – 483.
Lemna valdiviana: Hutchinson, T.C., Czyrska, H. (1975). Heavy metal toxicity and synergism to floating aquatic weeds. Verh.-Int. Ver. Limnol., 19:2102 – 2111.
Zdroje druhov Lemna
|
University of Toronto Culture Collection of Algae and Cyanobacteria |
|
Department of Botany, University of Toronto |
|
Toronto, Ontario, Canada, M5S 3 B2 |
|
Tel. +1 4169783641 |
|
Fax +1 4169785878 |
|
e-mail: jacreman@botany.utoronto.ca |
|
http://www.botany.utoronto.ca/utcc |
|
North Carolina State University |
|
Forestry Dept |
|
Duckweed Culture Collection |
|
Campus Box 8002 |
|
Raleigh, NC 27695 – 8002 |
|
United States |
|
Tel. 1 9195157572 |
|
astomp@unity.ncsu.edu |
|
Institute of Applied Environmental Research (ITM) Stockholm University |
|
SE-106 91 STOCKHOLM |
|
SWEDEN |
|
Tel. +46 86747240 |
|
Fax +46 86747636 |
|
Federal Environmental Agency (UBA) |
|
FG III 3.4 |
|
Schichauweg 58 |
|
12307 Berlin |
|
GERMANY |
|
e-mail: lemna@uba.de |
|
http://www.umweltbundesamt.de/contact.htm |
Použitá literatúra
|
(1) |
Hillman, W.S. (1961). The Lemnaceae or duckweeds: A review of the descriptive and experimental literature. The Botanical Review, 27:221 – 287. |
|
(2) |
Landolt, E. (1986). Biosystematic investigations in the family of duckweed (Lemnaceae). Vol. 2. Geobotanischen Inst. ETH, Stiftung Rubel, Zürich, Switzerland. |
|
(3) |
Björndahl, G. (1982). Growth performance, nutrient uptake and human utilization of duckweeds (Lemnaceae family). ISBN 82 – 991150 – 0 – 0. The Agricultural Research Council of Norway, University of Oslo. |
|
(4) |
Wang, W. (1986). Toxicity tests of aquatic pollutants by using common duckweed. Environmental Pollution, Ser B, 11:1 – 14. |
|
(5) |
Wang, W. (1990). Literature review on duckweed toxicity testing. Environmental Research, 52:7 – 22. |
Dodatok 2
Uchovávanie zásobnej kultúry
Zásobné kultúry sa môžu dlhší čas uchovávať pri nízkych teplotách (4 °C – 10 °C) bez toho, aby ich bolo potrebné opätovne pripraviť. Rastové médium pre rastliny rodu Lemna môže byť rovnaké, ako sa používa na testovanie, ale pre zásobné kultúry sa môžu použiť iné médiá bohaté na živiny.
Pravidelne sa pomocou sterilných nástrojov premiestni množstvo mladých svetlozelených rastlín do nových kultivačných nádob obsahujúcich čerstvé médium. Pri chladnejšej teplote navrhnutej v tomto materiáli sa môže čiastočná kultivácia vykonávať v intervaloch až tri mesiace.
Musia sa používať chemicky čisté (umyté v kyseline) a sterilné sklenené kultivačné nádoby a sterilné postupy. V prípade kontaminácie zásobnej kultúry, napr. riasami alebo plesňami, je potrebné prijať opatrenia na odstránenie kontaminujúcich organizmov. V prípade rias a väčšiny iných kontaminujúcich organizmov sa to dá docieliť povrchovou sterilizáciou. Vzorka kontaminovaného rastlinného materiálu sa odoberie a korienky sa odstrihnú. Potom sa materiál prudko pretrepe v čistej vode, následne sa ponorí do 0,5 % (v/v) roztoku chlórnanu sodného na 30 sekúnd až 5 minút. Rastlinný materiál sa potom opláchne sterilnou vodou a prenesie v niekoľkých dávkach do kultivačných nádob obsahujúcich čerstvé rastové médium. V dôsledku tohto postupu veľa lístkov uhynie, najmä ak sa použijú dlhšie expozičné časy, ale tie, ktoré prežijú, sú obvykle nekontaminované. Tieto sa môžu potom použiť na opätovné naočkovanie nových kultúr.
Dodatok 3
Médiá
Odporúčajú sa rôzne rastové médiá pre L. minor a L. gibba. Pre L. minor sa odporúča modifikované médium podľa švédskej normy (SIS), zatiaľ čo pre L. gibba sa odporúča médium 20X AAP. Zloženia oboch médií sú uvedené nižšie. Pri príprave týchto médií sa musia použiť reagencie alebo chemikálie analytickej kvality a deionizovaná voda.
Rastové médium podľa švédskej normy (SIS) pre rastliny rodu Lemna
|
— |
Zásobné roztoky I – V sa sterilizujú v autokláve (120 °C, 15 minút) alebo membránovou filtráciou (veľkosť pórov približne 0,2 μm). |
|
— |
Zásobný roztok VI (a voliteľne VII) sa sterilizuje iba membránovou filtráciou, nie je potrebné ho autoklávovať. |
|
— |
Sterilné zásobné roztoky sa skladujú v chlade a tme. Zásobné roztoky I – V sa musia vyradiť po šiestich mesiacoch, zatiaľ čo zásobný roztok VI (a voliteľne VII) má čas použiteľnosti jeden mesiac.
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
— |
Na prípravu jedného litra média SIS sa pridá do 900 ml deionizovanej vody:
Poznámka: Ďalší zásobný roztok VII (tlmivý roztok MOPS) môže byť potrebný pre určité testované látky (pozri posledný odsek v oddiele 1.4). |
|
— |
pH sa nastaví na 6,5 ± 0,2 buď 0,1, alebo 1 mol HCl, alebo NaOH a objem sa doplní do jedného litra deionizovanou vodou. |
Rastové médium 20X AAP
Zásobné roztoky sa pripravia v sterilnej destilovanej alebo deionizovanej vode.
Sterilné zásobné roztoky sa skladujú v chlade a tme. V týchto podmienkach budú mať zásobné roztoky čas trvanlivosti minimálne 6 – 8 týždňov.
Pre médium 20X – AAP sa pripraví päť živných zásobných roztokov (A1, A2, A3, B a C) a použijú sa chemikálie reagenčnej kvality. Na prípravu rastového média sa pridá 20 ml každého živného zásobného roztoku do približne 850 ml deionizovanej vody. pH sa nastaví na 7,5 ± 0,1 buď 0,1, alebo 1 mol HCl, alebo NaOH a objem sa doplní do jedného litra deionizovanou vodou. Médium sa potom prefiltruje do sterilnej nádoby cez 0,2 μm (približne) membránový filter.
Rastové médium určené na testovanie sa musí pripraviť 1 – 2 dni pred použitím, aby sa stabilizovalo pH. Pred použitím sa skontroluje pH rastového média a v prípade potreby sa znovu upraví pridaním 0,1 alebo 1 M NaOH, alebo HCl, ako sa uvádza vyššie.
|
Zásobný roztok č. |
Látka |
Koncentrácia v zásobnom roztoku (g·l–1) (1) |
Koncentrácia v pripravenom médiu(mg·l–1) (1) |
Pripravené médium |
|
|
Prvok |
Koncentrácia (mg·l–1) (1) |
||||
|
A1 |
NaNO3 MgCl2·6H2O CaCl2·2H2O |
26 12 4,4 |
510 240 90 |
Na; N Mg Ca |
190; 84 58,08 24,04 |
|
A2 |
MgSO4·7H2O |
15 |
290 |
S |
38,22 |
|
A3 |
K2HPO4·3H2O |
1,4 |
30 |
K; P |
9,4;3,7 |
|
B |
H3BO3 MnCl2·4H2O FeCl3·6H2O Na2EDTA·2H2O ZnCl2 CoCl2·6H2O Na2MoO4·2H2O CuCl2·2H2O |
0,19 0,42 0,16 0,30 3,3 mg·l–1 1,4 mg·l–1 7,3 mg·l–1 0,012 mg·l–1 |
3,7 8,3 3,2 6,0 66 μg·l–1 29 μg·l–1 145 μg·l–1 0,24 μg·l–1 |
B Mn Fe — Zn Co Mo Cu |
0,65 2,3 0,66 — 31 μg·l–1 7,1 μg·l–1 58 μg·l–1 0,080 μg·l–1 |
|
C |
NaHCO3 |
15 |
300 |
Na; C |
220; 43 |
Poznámka: Teoreticky vhodná konečná koncentrácia hydrogenuhličitanu (ktorým by sa zabránilo značnému upravovaniu pH) je 15 mg/l, a nie 300 mg/l. Používanie 20X AAP média v minulosti vrátane kruhového testu pre túto metódu je založené na 300 mg/l [I. Sims, P. Whitehouse and R. Lacey. (1999) The OECD Lemna Growth Inhibition Test. Development and Ring-testing of draft OECD Test Guideline. R&D Technical Report EMA 003. WRc plc – Environment Agency].
STEINBERGOVO médium (podľa ISO 20079)
Koncentrácie a zásobné roztoky
|
— |
Modifikované Steinbergovo médium sa používa v ISO 20079 pre samotné Lemna minor (lebo iba Lemna minor je v tomto prípade povolená), ale z testov vyplýva, že dobré výsledky sa dajú dosiahnuť aj s Lemna gibba. |
|
— |
Pri príprave média sa musia použiť reagencie alebo chemické látky reagenčnej alebo analytickej kvality a deionizovaná voda. |
|
— |
Príprava živného média zo zásobných roztokov alebo 10-krát koncentrovaného média, ktoré umožňuje maximálnu koncentráciu média bez vyzrážania. |
Tabuľka 1
pH-stabilizované STEINBERGOVO médium (modifikované podľa Altenburgera)
|
Látka |
Živné médium |
||
|
Makroprvky |
mol. hmotnosť |
mg/l |
mmol/l |
|
KNO3 |
101,12 |
350,00 |
3,46 |
|
Ca(NO3)2 · 4H2O |
236,15 |
295,00 |
1,25 |
|
KH2PO4 |
136,09 |
90,00 |
0,66 |
|
K2HPO4 |
174,18 |
12,60 |
0,072 |
|
MgSO4 · 7H2O |
246,37 |
100,00 |
0,41 |
|
Mikroprvky |
mol. hmotnosť |
µg/l |
µmol/l |
|
H3BO3 |
61,83 |
120,00 |
1,94 |
|
ZnSO4 · 7H2O |
287,43 |
180,00 |
0,63 |
|
Na2MoO4 · 2H2O |
241,92 |
44,00 |
0,18 |
|
MnCl2 · 4H2O |
197,84 |
180,00 |
0,91 |
|
FeCl3 · 6H2O |
270,21 |
760,00 |
2,81 |
|
EDTA dinátrium-dihydrát |
372,24 |
1 500,00 |
4,03 |
Tabuľka 2
Zásobné roztoky (Makroprvky)
|
g/l |
||
|
Zásobný roztok 1: |
|||
|
KNO3 |
17,50 |
||
|
KH2PO4 |
4,5 |
||
|
K2HPO4 |
0,63 |
||
|
Zásobný roztok 2: |
|||
|
MgSO4 · 7H2O |
5,00 |
||
|
Zásobný roztok 3: |
|||
|
Ca(NO3)2 · 4H2O |
14,75 |
||
Tabuľka 3
Zásobné roztoky (Mikroprvky)
|
mg/l |
||
|
Zásobný roztok 4: |
|||
|
H3BO3 |
120,0 |
||
|
Zásobný roztok 5: |
|||
|
ZnSO4 · 7H2O |
180,0 |
||
|
Zásobný roztok 6: |
|||
|
Na2MoO4 · 2H2O |
44,0 |
||
|
Zásobný roztok 7: |
|||
|
MnCl2 · 4H2O |
180,0 |
||
|
Zásobný roztok 8: |
|||
|
FeCl3 · 6H2O |
760,00 |
||
|
EDTA dinátrium-dihydrát |
1 500,00 |
||
|
— |
Môžu sa použiť zásobné roztoky 2 a 3 a samostatne 4 až 7 (pri zohľadnení požadovaných koncentrácií). |
|
— |
Na dlhší čas trvanlivosti sterilizujte zásobné roztoky v autokláve pri 121 °C 20 min. alebo alternatívne sterilne prefiltrujte (0,2 µm). Pre zásobný roztok 8 sa dôrazne odporúča sterilná filtrácia (0,2 µm). |
Príprava konečnej koncentrácie STEINBERGOVHO média (modifikované)
|
— |
Pridajte 20 ml zásobných roztokov 1, 2 a 3 (pozri tabuľku 2) do približne 900 ml deionizovanej vody, aby ste zabránili vyzrážaniu. |
|
— |
Pridajte 1,0 ml zásobných roztokov 4, 5, 6, 7 a 8 (pozri tabuľku 3). |
|
— |
pH musí byť 5,5 ± 0,2 (upravte pridaním minimálneho objemu roztoku NaOH alebo HCl). |
|
— |
Doplňte vodou do 1 000 ml. |
|
— |
Ak sú roztoky sterilné a používa sa vhodná voda, ďalšia sterilizácia nie je potrebná. Ak sa sterilizuje konečné médium, zásobný roztok 8 sa musí pridať po autoklávovaní (20 min. pri 121 °C). |
Príprava 10-krát koncentrovaného STEINBERGOVHO média (modifikovaného) na dočasné skladovanie
|
— |
Pridajte 20 ml zo zásobných roztokov 1, 2 a 3 (pozri tabuľku 2) približne do 30 ml vody, aby ste zabránili vyzrážaniu. |
|
— |
Pridajte 1,0 ml zo zásobných roztokov 4, 5, 6, 7 a 8 (pozri tabuľku 3). Doplňte vodou do 100 ml. |
|
— |
Ak sú roztoky sterilné a používa sa vhodná voda, ďalšia sterilizácia nie je potrebná. Ak sa sterilizuje konečné médium, zásobný roztok 8 sa musí pridať po autoklávovaní (20 min. pri 121 °C). |
|
— |
pH média (konečná koncentrácia) musí byť 5,5 ± 0,2. |
(1) Pokiaľ nie je známa.