|
10.
|
Dopĺňajú sa kapitoly C.27, C.28, C.29 a C.30:
„C.27 TEST TOXICITY CHIRONOMIDAE V SYSTÉME SEDIMENT – VODA ZA POUŽITIA OBOHATENÉHO SEDIMENTU
ÚVOD
|
1.
|
Táto testovacia metóda je rovnocenná s Usmerneniami OECD na vykonávanie testov (TG) 218 (2004). Táto testovacia metóda bola vypracovaná s cieľom hodnotiť účinky predĺženého pôsobenia chemikálií na vodné larvy dvojkrídlovcov rodu Chironomus žijúce v sedimente. Vychádza z existujúcich protokolov o testoch toxicity pri druhoch Chironomus riparius a Chironomus tentans, ktoré boli vypracované v Európe (1) (2) (3) a Severnej Amerike (4) (5) (6) (7) (8) a boli podrobené kruhovým testom (1) (6) (9). Môžu sa použiť aj iné dobre zdokumentované druhy pakomárov, napr. Chironomus yoshimatsui (10) (11).
|
|
2.
|
Expozičný scenár použitý v tejto testovacej metóde je obohacovanie sedimentu testovanou látkou. Výber vhodného expozičného scenára závisí od plánovaného použitia testu. Scenár obohacovania sedimentu je určený na simuláciu akumulovaných úrovní chemikálií pretrvávajúcich v sedimente. Tento expozičný systém zahŕňa obohacovanie sedimentu v testovacom systéme sediment – voda.
|
|
3.
|
Látky, ktoré je potrebné testovať na organizmoch žijúcich v sedimente, zvyčajne pretrvajú v tomto kompartmente dlhý čas. Organizmy žijúce v sedimente môžu byť exponované viacerými spôsobmi. Relatívny význam každého spôsobu expozície a časové obdobie, v ktorom sa každý z nich podieľa na celkových toxických účinkoch, závisí od fyzikálno-chemických vlastností danej chemikálie. V prípade silno adsorbujúcich látok (napr. s log Kow > 5) alebo látok, ktoré sa kovalentne viažu na sediment, môže byť významným spôsobom expozície prijímanie kontaminovanej potravy. S cieľom zabrániť podhodnoteniu toxicity vysokolipofilných látok možno zvážiť použitie potravy pridanej do sedimentu pred aplikáciou testovanej látky. S cieľom zohľadniť všetky potenciálne spôsoby expozície sa táto testovacia metóda zameriava na dlhodobú expozíciu. Trvanie testu je v rozsahu 20 – 28 dní v prípade druhov C. riparius a C. yoshimatsui a 28 – 65 dní pri C. tentans. Ak sú na špecifické účely potrebné krátkodobé údaje, napríklad s cieľom skúmať účinky nestabilnej chemikálie, môžu sa po desiatich dňoch odstrániť ďalšie replikáty.
|
|
4.
|
Meranými parametrami sú celkový počet vykuklených dospelých jedincov a čas do vykuklenia. Ak sú potrebné ďalšie krátkodobé údaje, odporúča sa vykonať merania prežitia a rastu lariev až po desiatich dňoch s použitím ďalších replikátov podľa potreby.
|
|
5.
|
Odporúča sa použiť umelo pripravený sediment. Umelo pripravený sediment má oproti prírodným sedimentom niekoľko výhod:
|
—
|
zníži sa variabilita testu, lebo umelo pripravený sediment vytvára reprodukovateľnú ‚štandardizovanú matricu‘, a odstráni sa potreba nájsť nekontaminované a čisté zdroje sedimentu,
|
|
—
|
testy je možné začať kedykoľvek bez problému sezónnej variability v testovanom sedimente a nie je potrebné sediment predpripraviť, aby sa odstránila pôvodná fauna. Použitie umelo pripraveného sedimentu takisto znižuje náklady spojené s odberom dostatočných množstiev sedimentu v teréne na rutinné testovanie,
|
|
—
|
použitie umelo pripraveného sedimentu umožňuje porovnanie toxicity a následné zatriedenie látok.
|
|
|
6.
|
Vymedzenie pojmov je uvedené v dodatku 1.
|
PRINCÍP TESTU
|
7.
|
Larvy pakomárov v prvom instare sú exponované rozsahu koncentrácií testovanej chemikálie v systémoch sediment – voda. Sediment sa obohatí testovanou látkou a následne sa larvy prvého instaru zavedú do testovacích kadičiek, v ktorých sa stabilizovali koncentrácie sedimentu a vody. Na konci testu sa meria vykuklenie pakomárov a vývojový pomer. Podľa potreby sa môže po desiatich dňoch merať aj prežitie a hmotnosť lariev (pomocou ďalších replikátov podľa potreby). Tieto údaje sa analyzujú buď prostredníctvom regresného modelu na odhadnutie koncentrácie, ktorá by spôsobila × % pokles vo vykuklení, prežívaní lariev alebo raste (napr. EC15, EC50 atď.), alebo prostredníctvom testovania štatistickej hypotézy na stanovenie koncentrácie NOEC/LOEC. Pri druhom spôsobe je potrebné pomocou štatistických testov porovnať hodnoty účinkov s kontrolnými hodnotami.
|
INFORMÁCIE O TESTOVANEJ LÁTKE
|
8.
|
Je potrebné poznať rozpustnosť testovanej látky vo vode, jej tlak pary, namerané alebo vypočítané delenie na sediment a stabilitu vo vode a v sedimente. Mala by byť k dispozícii spoľahlivá analytická metóda so známou a zdokumentovanou presnosťou a detekčným limitom na kvantifikáciu testovanej látky v nadložnej vode, pórovej vode a sedimente. Medzi užitočné informácie patrí štrukturálny vzorec a čistota testovanej látky. Užitočnou informáciou je aj chemický osud testovanej chemikálie (napr. rozptýlenie, abiotická a biotická degradácia atď.). Ďalšie informácie pre testované látky s fyzikálno-chemickými vlastnosťami, ktoré sťažujú ich testovanie, sú uvedené v odkaze (12).
|
REFERENČNÉ CHEMIKÁLIE
|
9.
|
Referenčné chemikálie sa môžu testovať pravidelne ako prostriedok na zabezpečenie spoľahlivosti testovacieho protokolu a testovacích podmienok. Príkladmi referenčných toxických látok, ktoré sa úspešne používajú v kruhových testoch a overovacích štúdiách, sú: lindán, trifluralín, pentachlórfenol, chlorid kademnatý a chlorid draselný (1) (2) (5) (6) (13).
|
PLATNOSŤ TESTU
|
10.
|
Pre platnosť testu je potrebné uplatňovať tieto podmienky:
|
—
|
vykuklenie v kontrolných skupinách musí byť na konci testu na úrovni minimálne 70 % (1) (6),
|
|
—
|
vykuklenie druhov C. riparius a C. yoshimatsui na dospelé jedince z kontrolných nádob by malo nastať 12 – 23 dní po ich vložení do nádob. V prípade druhu C. tentans je potrebné obdobie 20 – 65 dní,
|
|
—
|
na konci testu je potrebné zmerať v každej nádobe pH a koncentráciu rozpusteného kyslíka. Koncentrácia kyslíka by pri použitej teplote mala predstavovať najmenej 60 % saturačnej hodnoty vzduchom (ASV) a hodnota pH nadložnej vody by vo všetkých testovacích nádobách mala byť v rozmedzí 6 – 9,
|
|
—
|
teplota vody by sa nemala líšiť o viac ako ± 1,0 °C. Teplotu vody je možné kontrolovať pomocou izotermickej komory a v tom prípade je potrebné v primeranom časovom intervale potvrdiť teplotu v komore.
|
|
OPIS METÓDY
Testovacie nádoby
|
11.
|
Štúdia sa vykonáva v sklenených kadičkách s objemom 600 ml a s priemerom 8 cm. Sú vhodné aj iné nádoby, ale musia zaručiť vhodnú hĺbku nadložnej vody a sedimentu. Povrch sedimentu by mal byť dostatočne veľký, aby poskytoval 2 – 3 cm2 priestoru na larvu. Pomer hĺbky vrstvy sedimentu k hĺbke nadložnej vody by mal byť 1: 4. Testovacie nádoby a iné prístroje, ktoré prichádzajú do styku s testovacím systémom, by mali byť vyrobené výlučne zo skla alebo iného chemicky inertného materiálu (napr. teflónu).
|
Výber druhov
|
12.
|
Uprednostňovaným druhom na použitie v teste je Chironomus riparius. Chironomus tentans je takisto vhodný, ale je náročnejší na starostlivosť a vyžaduje si dlhšie trvanie testu. Možno použiť aj Chironomus yoshimatsui. Podrobné informácie o kultivačných metódach v prípade druhu Chironomus riparius sú uvedené v dodatku 2. Informácie o kultivačných podmienkach sú k dispozícii aj pre iné druhy, t. j. Chironomus tentans (4) a Chironomus yoshimatsui (11). Identifikácia druhov musí byť pred testovaním potvrdená, ale nevyžaduje sa pred každým testom, ak organizmy pochádzajú z internej kultúry.
|
Sediment
|
13.
|
Uprednostňuje sa použitie umelo pripraveného sedimentu (známeho aj pod názvom rekonštituovaný, umelý alebo syntetický sediment). Ak sa však použije prírodný sediment, je potrebné ho charakterizovať (aspoň pH, obsah organického uhlíka, odporúča sa takisto stanovenie ostatných parametrov ako pomer C/N a granulometria) a nemal by obsahovať žiadne kontaminanty ani iné organizmy, ktoré by mohli s pakomármi súperiť alebo ich požierať. Takisto sa odporúča, aby bol prírodný sediment pred použitím v teste toxicity pri pakomároch na sedem dní uvedený do podmienok, ktoré budú prevládať v nasledujúcom teste. V tomto teste (1) (15) (16) sa odporúča použiť nasledujúci umelo pripravený sediment založený na umelej pôde použitej v testovacej metóde C.8 (14):
|
a)
|
4 – 5 % (suchá hmotnosť) rašeliny: čo najbližšie k pH 5,5 – 6,0. Je dôležité použiť rašelinu v práškovej forme, jemne rozomletú (veľkosť častíc ≤ 1 mm) a sušenú iba vzduchom;
|
|
b)
|
20 % (suchá hmotnosť) kaolínu (obsah kaolinitu podľa možnosti nad 30 %);
|
|
c)
|
75 – 76 % (suchá hmotnosť) kremenného piesku (mal by prevládať jemný piesok s viac ako 50 % častíc s veľkosťou od 50 do 200 μm);
|
|
d)
|
deionizovaná voda sa pridá, aby sa dosiahla vlhkosť konečnej zmesi v rozsahu 30 - 50 %;
|
|
e)
|
uhličitan vápenatý chemicky čistej kvality (CaCO3) sa pridá, aby sa pH konečnej zmesi sedimentu upravila na 7,0 ± 0,5; obsah organického uhlíka v konečnej zmesi by mal byť 2 % (± 0,5 %) a je potrebné ho upraviť pomocou primeraného množstva rašeliny a piesku podľa písmen a) a c).
|
|
|
14.
|
Zdroj rašeliny, kaolínu a piesku by mal byť známy. Je potrebné skontrolovať, či zložky sedimentu neobsahujú chemické kontaminanty (napr. ťažké kovy, organochlórové zlúčeniny, organofosforové zlúčeniny atď.). Príklad prípravy umelo pripraveného sedimentu je uvedený v dodatku 3. Miešanie suchých zložiek je takisto prípustné, ak sa preukáže, že po pridaní nadložnej vody nedochádza k separácii zložiek sedimentu (napr. k vyplaveniu častíc rašeliny) a že rašelina alebo sediment sú v dostatočnej miere uvedené do podmienok.
|
Voda
|
15.
|
Každá voda, ktorá vyhovuje chemickým charakteristikám prijateľnej riediacej vody podľa zoznamu uvedeného v dodatkoch 2 a 4, je vhodná ako testovacia voda. Každá vhodná voda, prírodná voda (povrchová alebo podzemná voda), rekonštituovaná voda (pozri dodatok 2) alebo odchlórovaná voda z vodovodu sú prijateľné ako voda na kultiváciu a testovacia voda, ak v nej pakomáre prežijú počas celej kultivácie a testovania bez príznakov stresu. Na začiatku testu by pH testovacej vody mala mať hodnotu medzi 6 a 9 a celková tvrdosť by nemala byť vyššia ako 400 mg/l pre CaCO3. Ak však existuje podozrenie na interakciu medzi iónmi tvrdosti a testovanou látkou, mala by sa použiť voda s nižšou tvrdosťou (a v takom prípade sa teda nesmie použiť Elendtovo médium M4). Počas celej štúdie by sa mal používať rovnaký druh vody. Charakteristiky kvality vody uvedené v dodatku 4 by sa mali merať najmenej dvakrát za rok alebo ak existuje podozrenie, že sa tieto charakteristiky mohli významne zmeniť.
|
Zásobné roztoky – obohatené sedimenty
|
16.
|
Obohatené sedimenty vybratej koncentrácie sa zvyčajne pripravujú pridaním roztoku testovanej látky priamo do sedimentu. Zásobný roztok testovanej látky rozpustenej v deionizovanej vode sa zmieša s umelo pripraveným sedimentom pomocou valcovne, stroja na miešanie krmív alebo ručným miešaním. Ak je testovaná látka slabo rozpustná vo vode, možno ju rozpustiť v čo najmenšom objeme vhodného organického rozpúšťadla (napr. hexán, acetón alebo chloroform). Tento roztok sa následne zmieša s 10 g jemného kremenného piesku na jednu testovaciu nádobu. Počká sa, kým sa rozpúšťadlo odparí, pričom sa musí z piesku celkom odstrániť. Piesok sa potom zmieša s vhodným množstvom sedimentu na testovaciu kadičku. Na zvýšenie rozpustnosti, na disperziu alebo na emulziu testovanej látky možno použiť iba látky, ktoré sú ľahko prchavé. Treba mať na pamäti, že pri príprave sedimentu je nutné zohľadniť piesok, ktorý pochádza z testovanej látky a pieskovej zmesi (t. j. sediment by sa teda mal pripraviť s menším množstvom piesku). Je nutné zabezpečiť, aby sa testovaná látka pridávaná do sedimentu v sedimente dôkladne a rovnomerne distribuovala. V prípade potreby možno na účely stanovenia stupňa homogenity analyzovať podvzorky.
|
KONCEPCIA TESTU
|
17.
|
Koncepcia testu sa vzťahuje na výber počtu a odstup testovaných koncentrácií, počet nádob pri každej koncentrácii a počet lariev v každej nádobe. Sú tu opísané koncepcie na odhadnutie bodu EC, na odhadnutie koncentrácie NOEC a na vykonanie limitného testu.
|
Koncepcia regresnej analýzy
|
18.
|
Účinná koncentrácia (napr. EC15, EC50) a koncentračný rozsah, v ktorom sa skúmajú účinky testovanej látky, sa merajú koncentráciami zahrnutými do testu. Vo všeobecnosti sú presnosť a najmä platnosť, s ktorou možno odhadovať účinné koncentrácie (ECx), lepšie, ak je účinná koncentrácia v rozsahu testovaných koncentrácií. Je potrebné vyhýbať sa extrapolácii hlboko pod najnižšou pozitívnou koncentráciou alebo nad najvyššou koncentráciou. Pri výbere rozsahu koncentrácií, ktoré sa použijú, je užitočný predbežný test na zistenie rozsahu (pozri odsek 27).
|
|
19.
|
Ak je potrebné odhadnúť ECx, malo by sa testovať najmenej päť koncentrácií a tri replikáty pre každú koncentráciu. V každom prípade sa odporúča použiť dostatočné testovacie koncentrácie, ktoré umožnia dobrý modelový odhad. Faktor medzi koncentráciami by nemal byť väčší ako dva (v prípadoch, keď má krivka závislosti reakcie od dávky plytký sklon, možno urobiť výnimku). Počet replikátov pri každej aplikácii sa môže znížiť, ak sa zvýši počet testovacích koncentrácií s rozdielnymi reakciami. Zvýšenie počtu replikátov alebo skrátenie dĺžky intervalov testovacích koncentrácií zvyčajne vedie k nižším intervalom spoľahlivosti testu. Ak sa odhaduje desaťdňové prežívanie a rast lariev, sú potrebné ďalšie replikáty.
|
Koncepcia odhadu NOEC/LOEC
|
20.
|
Ak sa odhadujú koncentrácie LOEC alebo NOEC, použije sa päť testovacích koncentrácií s najmenej štyrmi replikátmi a faktor medzi koncentráciami by nemal byť vyšší ako 2. Počet replikátov by mal byť dostatočný, aby sa zabezpečila primeraná štatistická výpovedná hodnota na zistenie rozdielu 20 % pri kontrole pri úrovni významnosti 5 % (p = 0,05). V prípade vývojového pomeru je zvyčajne vhodná analýza rozptylu (ANOVA), ako napríklad Dunnettov test a Williamsov test (17) (18) (19) (20). Pri pomere vykuklenia možno použiť Cochranov-Armitageho test, Fisherov exaktný test (s Bonferroniho korekciou) alebo Mantelov-Haenszelov test.
|
Limitný test
|
21.
|
Môže sa vykonať limitný test (jedna testovaná koncentrácia a kontrola), ak v predbežnom teste na zistenie rozsahu neboli pozorované žiadne účinky. Účelom limitného testu je vykonať test pri dostatočne vysokej koncentrácii, ktorá umožní subjektom zodpovedným za rozhodovanie vylúčiť možné toxické účinky testovanej látky a stanoviť limit pri koncentrácii, ktorá sa neočakáva v žiadnej situácii. Odporúča sa úroveň 1 000 mg/kg (suchá hmotnosť). Zvyčajne je na aplikáciu aj kontrolu potrebných najmenej šesť replikátov. Je nutné preukázať primeranú štatistickú výpovednú hodnotu na zistenie rozdielu 20 % pri kontrole pri úrovni významnosti 5 % (p = 0,05). V prípade metrickej reakcie (vývojový pomer a hmotnosť) je vhodnou štatistickou metódou t-test, pokiaľ údaje spĺňajú požiadavky tohto testu (normalita, homogénne rozptyly). Ak tieto požiadavky nie sú splnené, môže sa použiť t-test nerovnomerných rozptylov alebo neparametrický test ako napríklad Wilcoxonov-Mannov-Whitheyho test. Pri pomere vykuklenia je vhodný Fisherov exaktný test.
|
POSTUP
Podmienky expozície
Príprava systému obohatený sediment – voda
|
22.
|
Postup obohacovania opísaný v testovacej metóde C.8: Toxicita pre dážďovky je odporúčaným postupom na aplikáciu testovanej látky (14). Obohatené sedimenty sa umiestnia do nádob, do ktorých sa pridá nadložná voda, aby sa vytvoril objemový pomer sediment – voda 1: 4 (pozri odseky 11 a 15). Výška vrstvy sedimentu by mala byť v rozsahu 1,5 - 3 cm. S cieľom zabrániť separácii zložiek sedimentu a resuspendovaniu jemného materiálu počas pridávania testovacej vody do vodného stĺpca môže byť sediment v čase, keď sa naň nalieva voda, prikrytý umelohmotným kotúčom, ktorý sa hneď potom odstráni. Môže byť vhodné aj použitie iných prístrojov.
|
|
23.
|
Testovacie nádoby sa zakryjú (napr. sklenenými platňami). V prípade potreby sa počas štúdie dopĺňajú hladiny vody na pôvodný objem s cieľom kompenzovať vyparovanie vody. Na tento účel sa použije destilovaná alebo deionizovaná voda, aby sa predišlo hromadeniu solí.
|
Stabilizácia
|
24.
|
Keď je obohatený sediment s nadložnou vodou pripravený, je vhodné umožniť delenie testovanej látky z vodnej fázy do sedimentu (3) (4) (6) (13). To by sa podľa možnosti malo vykonať za rovnakých teplotných a prevzdušňovacích podmienok, aké sa použijú v teste. Primeraný čas vyvažovania závisí od konkrétneho sedimentu a chemikálie a môže trvať niekoľko hodín až dní a v zriedkavých prípadoch až niekoľko týždňov (štyri až päť týždňov). Keďže tým by sa poskytol čas na degradáciu mnohých chemikálií, na rovnovážny stav sa nečaká, ale odporúča sa vyvažovacie obdobie v trvaní 48 hodín. Na konci tohto ďalšieho vyvažovacieho obdobia sa odmeria koncentrácia testovanej látky v nadložnej vode, pórovej vode a sedimente aspoň pri najvyššej koncentrácii a pri jednej nižšej koncentrácii (pozri odsek 38). Tieto analytické skúmania testovanej látky umožňujú výpočet hmotnostnej bilancie a vyjadrenie výsledkov na základe meraných koncentrácií.
|
Pridanie testovacích organizmov
|
25.
|
Štyri až päť dní pred pridaním testovacích organizmov do testovacích nádob sa z kultúr odoberú vajíčkové masy a umiestnia sa do malých nádob s kultivačných médiom. Môže sa použiť staršie médium zo zásobnej kultúry alebo čerstvo pripravené médium. Ak sa použije čerstvo pripravené kultivačné médium, je potrebné doň pridať malé množstvo potravy, napr. zelené riasy a/alebo niekoľko kvapiek filtrátu z jemne rozomletej suspenzie vločkového krmiva pre ryby (pozri dodatok 2). Použijú sa iba čerstvo nakladené vajíčkové masy. Larvy sa zvyčajne začnú liahnuť niekoľko dní po nakladení vajíčok (dva až tri dni v prípade druhu Chironomus riparius pri teplote 20 °C a jeden až štyri dni v prípade Chironomus tentans pri teplote 23 °C a Chironomus yoshimatsui pri teplote 25 °C) a rast lariev prebieha v štyroch instaroch, z ktorých každý trvá štyri až osem dní. V teste sa použijú larvy prvého instaru (dva až tri alebo jeden až štyri dni po vyliahnutí). Instar pakomárov je možné skontrolovať podľa šírky hlavového segmentu (6).
|
|
26.
|
Larvy 21. instaru sa pomocou tupej pipety náhodne rozdelia do jednotlivých testovacích nádob obsahujúcich obohatený sediment a vodu. Prevzdušňovanie vody je nutné počas pridávania lariev do testovacích nádob prerušiť a musí byť pozastavené počas ďalších 24 hodín po pridaní lariev (pozri odseky 25 a 32). Podľa použitej koncepcie testu (pozri odseky 19 a 20) je počet lariev použitých pri každej koncentrácii najmenej 60 na odhad bodu EC a 80 na stanovenie koncentrácie NOEC.
|
Testovacie koncentrácie
|
27.
|
Pri určovaní rozsahu koncentrácií pre konečný test môže byť užitočný test na zistenie rozsahu. Na tento účel sa použije súbor koncentrácií testovanej látky s veľkými odstupmi. S cieľom zabezpečiť rovnakú hustotu povrchu na pakomára, ktorá sa použije pri konečnom teste, sú pakomáre vystavené každej koncentrácii testovanej látky na obdobie, ktoré umožňuje odhad vhodných testovacích koncentrácií, pričom nie sú potrebné žiadne replikáty.
|
|
28.
|
Testovacie koncentrácie pre konečný test sa vyberú na základe výsledkov testu na zistenie rozsahu. Je potrebné použiť a vybrať najmenej päť koncentrácií, ako sa uvádza v odsekoch 18 – 20.
|
Kontroly
|
29.
|
Súčasťou testu sú kontrolné nádoby bez prítomnosti testovanej látky, ktoré však obsahujú sediment, a primeraný počet replikátov (pozri odseky 19 – 20). Ak sa pri aplikácii testovanej látky použije rozpúšťadlo (pozri odsek 16), je potrebné pridať kontrolu rozpúšťadla v sedimente.
|
Testovací systém
|
30.
|
Použijú sa statické systémy. Vo výnimočných prípadoch sa môžu použiť semistatické alebo prietokové systémy s prerušovaným alebo nepretržitým obmieňaním nadložnej vody, napríklad ak sú špecifikácie kvality vody nevhodné pre testovacie organizmy alebo ak ovplyvňujú chemickú rovnováhu (napr. úrovne rozpusteného kyslíka príliš klesnú, koncentrácia vylučovaných produktov príliš stúpne alebo sa zo sedimentu lúhujú minerály, čo má vplyv na pH a/alebo tvrdosť vody). Zvyčajne však postačujú a uprednostňujú sa iné metódy zlepšenia kvality nadložnej vody, ako napríklad prevzdušňovanie.
|
Potrava
|
31.
|
Je nevyhnutné larvy kŕmiť podľa možnosti každý deň alebo najmenej trikrát do týždňa. V prvých desiatich dňoch je pre mladé larvy podľa všetkého vhodné krmivo pre ryby (suspenzia vo vode alebo jemne rozomletá potrava, napr. Tetra-Min alebo Tetra-Phyll, bližšie informácie pozri v dodatku 2) v dennom množstve 0,25 – 0,5 mg (0,35 – 0,5 mg pre druh C. yoshimatsui) na jednu larvu. Pre staršie larvy môže byť potrebné o niečo väčšie množstvo potravy: denné množstvo 0,5 – 1 mg na jednu larvu by malo po zvyšok testu postačovať. Ak sa pozoruje rast hubovitých organizmov alebo ak sa v kontrolných nádobách pozoruje mortalita, prídel potravy by sa mal vo všetkých testovacích nádobách znížiť a mal by sa kontrolovať. Ak nie je možné vznik hubovitých organizmov zastaviť, test je nutné opakovať. Pri testovaní silno adsorbujúcich látok (napr. s log Kow > 5) alebo látok, ktoré sa kovalentne viažu na sediment, sa môže do umelo pripraveného sedimentu pred stabilizačným obdobím pridať množstvo potravy potrebné na zabezpečenie prežitia a prirodzeného rastu organizmov. Na tento účel sa namiesto krmiva pre ryby musí použiť rastlinný materiál, napr. sa môže pridať 0,5 % (suchá hmotnosť) jemne rozomletých listov napr. pŕhľavy dvojdomej (Urtica dioica), moruše (Morus alba), ďateliny plazivej (Trifolium repens), špenátu (Spinacia oleracea) alebo iného rastlinného materiálu (Cerophyl alebo alfa celulóza).
|
Podmienky inkubácie
|
32.
|
Najlepšie po 24 hodinách od pridania lariev sa zabezpečí jemné prevzdušňovanie nadložnej vody v testovacích nádobách a pokračuje v ňom počas celého testu (treba dbať na to, aby koncentrácia rozpusteného kyslíka neklesla pod 60 % ASV). Prevzdušňovanie sa zabezpečí pomocou sklenenej Pasteurovej pipety upevnenej 2 – 3 cm nad vrstvou sedimentu (t. j. jedna alebo niekoľko bublín za sekundu). Ak sa testujú prchavé chemikálie, možno zvážiť, že systém sediment – voda sa nebude prevzdušňovať.
|
|
33.
|
Test sa vykonáva pri konštantnej teplote 20 °C (± 2 °C). V prípade druhu C. tentans sa odporúča teplota 23 °C a v prípade C. yoshimatsui 25 °C (± 2 °C). Použije sa 16-hodinová svetlá fáza, pričom intenzita svetla by mala byť 500 – 1 000 luxov.
|
Trvanie expozície
|
34.
|
Expozícia sa začne pridaním lariev do obohatených a kontrolných nádob. Maximálna dĺžka expozície je 28 dní v prípade druhov C. riparius a C. yoshimatsui a 65 dní v prípade C. tentans. Ak sa pakomáre vykuklia skôr, test sa môže ukončiť najskôr po piatich dňoch po vykuklení posledného dospelého jedinca v kontrolnej skupine.
|
Pozorovania
Vykuklenie
|
35.
|
Určí sa čas vývoja a celkový počet úplne vykuklených samčích a samičích pakomárov. Samčeky sa ľahko identifikujú podľa obrvených tykadiel.
|
|
36.
|
Testovacie nádoby je potrebné pozorovať najmenej trikrát do týždňa s cieľom vizuálne zhodnotiť každé abnormálne správanie (napr. opúšťanie sedimentu, nezvyčajné plávanie) v porovnaní s kontrolnou skupinou. Počas obdobia očakávaného vykuklenia je nevyhnutné každý deň spočítať vykuklené pakomáre. Pohlavie a počet úplne vykuklených pakomárov sa zaznamenáva denne. Po identifikácii sa pakomáre vyberú z nádob. Všetky vajíčkové masy nakladené pred ukončením testu sa zaznamenajú a následne odstránia, aby sa predišlo opätovnému zavedeniu lariev do sedimentu. Takisto sa zaznamená počet viditeľných kukiel, ktoré sa nevykuklili. Usmernenie k meraniu vykuklenia je uvedené v dodatku 5.
|
Rast a prežívanie
|
37.
|
Ak je potrebné získať údaje o desaťdňovom prežívaní a raste lariev, na začiatku sa pripravia ďalšie testovacie nádoby tak, aby sa mohli následne použiť. Sediment z týchto ďalších nádob sa precedí pomocou cedidla s hrúbkou 250 μm, aby sa zachytili larvy. Kritérium na stanovenie smrti je nehybnosť alebo absencia reakcie na mechanický podnet. Stratené larvy sa takisto počítajú medzi mŕtve (larvy, ktoré uhynuli na začiatku testu, sa mohli rozložiť pôsobením mikróbov). Určí sa suchá hmotnosť (bez popola) lariev, ktoré prežili v každej testovacej nádobe, a vypočíta sa stredná suchá hmotnosť jedincov na jednu nádobu. Je užitočné určiť, do ktorého instaru patria larvy, ktoré prežili. Na toto meranie sa môže použiť šírka hlavového segmentu každého jedinca.
|
Analytické merania
Koncentrácia testovanej látky
|
38.
|
Pred začiatkom testu (t. j. pred pridaním lariev) sa pri každom ošetrení z najmenej jednej nádoby odstránia súhrnné vzorky sedimentu na účely analytického stanovenia koncentrácie testovanej látky v sedimente. Odporúča sa, aby sa vzorky nadložnej vody, pórovej vody a sedimentu analyzovali minimálne na začiatku (pozri odsek 24) a na konci testu pri najvyššej koncentrácii a pri jednej nižšej koncentrácii. Tieto skúmania testovanej látky poskytujú informácie o správaní/delení testovanej látky v systéme voda – sediment.
|
|
39.
|
Ak sa vykonajú prostredné merania (napr. v deň 7) a ak sú na analýzu potrebné veľké vzorky, ktoré nemožno odobrať z testovacích nádob bez ovplyvnenia testovacieho systému, analytické vyšetrenia je potrebné vykonať na vzorkách z ďalších testovacích nádob, s ktorými sa zaobchádzalo rovnakým spôsobom (vrátane prítomnosti testovacích organizmov), ale ktoré sa nepoužijú na biologické pozorovania.
|
|
40.
|
Na izolovanie intersticiálnej vody je odporúčaným postupom odstredenie napr. pri 10 000 g a 4 °C počas 30 minút. Ak sa však preukáže, že testovaná látka sa na filtroch neadsorbuje, môže byť prijateľná aj filtrácia. V niektorých prípadoch nemusí byť možné analyzovať koncentrácie v pórovej vode, lebo vzorka je príliš malá.
|
Fyzikálno-chemické parametre
|
41.
|
Je potrebné vhodným spôsobom odmerať pH a teplotu v testovacích nádobách (pozri odsek 10). Tvrdosť a amoniak sa merajú v kontrolných nádobách a v jednej testovacej nádobe pri najvyššej koncentrácii na začiatku a na konci testu.
|
ÚDAJE A PODÁVANIE SPRÁV
Spracovanie výsledkov
|
42.
|
Účelom tohto testu je určiť vplyv testovanej látky na vývojový pomer a celkový počet úplne vykuklených samčích a samičích pakomárov, alebo v prípade desaťdňového testu účinky na prežívanie a hmotnosť lariev. Ak nič nepoukazuje na štatisticky rozdielnu vnímavosť medzi pohlaviami, výsledky pre samčeky a samičky možno na účely štatistických analýz zhrnúť spoločne. Rozdiely vnímavosti medzi pohlaviami sa môžu štatisticky posúdiť napr. tabuľkovým testom χ2 – r × 2. Prežívanie lariev a stredná suchá hmotnosť jedincov na jednu nádobu sa podľa potreby musí určiť po desiatich dňoch.
|
|
43.
|
Účinné koncentrácie vyjadrené a vychádzajúce zo suchej hmotnosti sa podľa možnosti vypočítajú na základe koncentrácií nameraných v sedimente na začiatku testu (pozri odsek 38).
|
|
44.
|
Na vyčíslenie odhadu bodu EC50 alebo akejkoľvek inej hodnoty ECx sa ako pravé replikáty môže použiť štatistika na jednu nádobu. Pri výpočte intervalu spoľahlivosti pre každú hodnotu ECx je potrebné zohľadniť variabilitu medzi nádobami alebo je nutné preukázať, že táto variabilita je taká malá, že je možné ju ignorovať. Ak sa model upraví metódou najmenších štvorcov, v štatistike na jednu nádobu je potrebné aplikovať transformáciu, aby sa zlepšila homogénnosť rozptylu. Hodnoty ECx by sa však mali vypočítať po tom, ako sa reakcia transformuje naspäť na pôvodnú hodnotu.
|
|
45.
|
Ak je cieľom štatistickej analýzy určenie koncentrácie NOEC/LOEC prostredníctvom testovania hypotézy, je potrebné zohľadniť variabilitu medzi nádobami, napr. pomocou hierarchickej analýzy ANOVA. Alternatívne môžu byť vhodné podrobnejšie testy (21) v prípadoch, keď dochádza k nedodržaniu zvyčajných predpokladov analýzy ANOVA.
|
Pomer vykuklenia
|
46.
|
Pomery vykuklenia sú kvantové údaje a môžu sa analyzovať pomocou Cochranovho-Armitageho testu aplikovaného zostupne v prípadoch, keď sa očakáva monotónna reakcia na dávku a tieto údaje zodpovedajú tomuto očakávaniu. Ak to tak nie je, možno použiť Fisherov exaktný test alebo Mantzelov-Haentzalov test s Bonferroniho-Holmovou úpravou hodnôt p. Ak sa medzi replikátmi pri rovnakej koncentrácii preukáže väčšia variabilita, než akú by indikovala binomická distribúcia (často sa uvádza ako ‚extra-binomická‘ variácia), potom by sa mal použiť podrobný Cochranov-Armitageho test alebo Fisherov exaktný test, ako sa navrhuje v bode (21).
Určí sa súčet pakomárov vykuklených na jednu nádobu, ne, a vydelí sa počtom zavedených lariev, na:

kde:
|
ER
|
=
|
pomer vykuklenia,
|
|
ne
|
=
|
počet pakomárov vykuklených na nádobu,
|
|
na
|
=
|
počet zavedených lariev na nádobu.
|
|
|
47.
|
Najvhodnejšou alternatívou pri veľkých vzorkách v prípadoch extra binomickej variácie je brať pomer vykuklenia (ER) ako nepretržitú reakciu a použiť postupy, ako je napríklad Williamsov test, ak sa očakáva monotónna reakcia na dávku, ktorá je konzistentná s týmito údajmi o ER. Ak reakcia nie je monotónna, je vhodný Dunnettov test. Za veľkú vzorku sa pokladá vzorka, v ktorej je počet vykuklených aj počet nevykuklených jedincov v každom replikáte (nádobe) vyšší ako päť.
|
|
48.
|
Pri aplikovaní metód ANOVA je potrebné najskôr transformovať hodnoty ER pomocou arkussínusovej transformácie druhej odmocniny alebo Freemanovej-Tukeyho transformácie s cieľom získať približnú normálnu distribúciu a vyrovnať rozptyly. Cochranov-Armitageho test, Fisherov exaktný (Bonferroniho) test alebo Mantelov-Haenszelov test možno aplikovať, ak sa použijú absolútne frekvencie. Arkussínusová transformácia druhej odmocniny sa aplikuje pomocou prevrátenej hodnoty sínusu (sin–1) druhej odmocniny ER.
|
|
49.
|
Pri pomeroch vykuklenia sa hodnoty ECx vypočítajú pomocou regresnej analýzy (alebo napr. pomocou modelov probit (22), logit, Weibull, vhodného komerčného softvéru atď.). Ak je regresná analýza neúspešná (napr. ak sú k dispozícii menej ako dve čiastkové reakcie), použijú sa iné neparametrické metódy, ako je metóda pohyblivého priemeru alebo jednoduchá interpolácia.
|
Vývojový pomer
|
50.
|
Stredný vývojový čas predstavuje stredné časové rozpätie medzi zavedením lariev (deň 0 testu) a vykuklením pokusnej kohorty pakomárov. (Pri výpočte reálneho vývojového času sa zohľadní vek lariev v čase zavedenia). Vývojový pomer je prevrátená hodnota vývojového času (jednotka: 1/deň) a predstavuje časť vývinu lariev, ktorá prebieha za deň. Pri hodnotení týchto štúdií toxicity v sedimente sa uprednostňuje vývojový pomer, lebo jeho rozptyl je nižší a v porovnaní s vývojovým časom je homogénnejší a bližší normálnej distribúcii. Výkonné parametrické testovacie postupy teda možno lepšie použiť s vývojovým pomerom ako s vývojovým časom. Pre vývojový pomer ako nepretržitú reakciu možno hodnoty ECx odhadnúť pomocou regresnej analýzy [napr. (23), (24)].
|
|
51.
|
Pri nasledujúcich štatistických testoch sa predpokladá, že počet pakomárov pozorovaných v kontrolnom dni × sa vykuklil v strednom časovom intervale medzi dňom × a dňom x - l (l = dĺžka kontrolného intervalu, zvyčajne jeden deň). Stredný vývojový pomer na nádobu sa vypočíta podľa tejto rovnice:

kde:
|
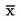
|
:
|
stredný vývojový pomer na nádobu,
|
|
i
|
:
|
index kontrolného intervalu,
|
|
m
|
:
|
maximálny počet kontrolných intervalov,
|
|

|
:
|
počet pakomárov vykuklených v kontrolnom intervale i,
|
|
ne
|
:
|
celkový počet pakomárov vykuklených na konci pokusu, (=  ), ),
|
|
xi
|
:
|
vývojový pomer pakomárov vykuklených v intervale i;
|

kde:
|
deňi
|
:
|
kontrolný deň (dni od aplikácie),
|
|
li
|
:
|
dĺžka kontrolného intervalu i (dni, zvyčajne jeden deň).
|
|
Správa o teste
|
52.
|
Správa o teste musí obsahovať aspoň tieto informácie:
|
|
Testovaná látka:
|
—
|
fyzikálny charakter a významné fyzikálno-chemické vlastnosti (rozpustnosť vo vode, tlak pary, rozdeľovací koeficient v pôde (alebo v sedimente, ak je k dispozícii), stabilita vo vode atď.),
|
|
—
|
chemické identifikačné údaje (bežný názov, chemický názov, štrukturálny vzorec, číslo CAS atď.) vrátane čistoty a analytickej metódy kvantifikácie testovanej látky.
|
|
|
|
Testovacie druhy:
|
—
|
použité testovacie zvieratá: druh, vedecký názov, zdroj organizmov a podmienky chovu,
|
|
—
|
informácie o manipulácii s vajíčkovými masami a larvami,
|
|
—
|
vek testovacích zvierat pri umiestnení do testovacích nádob.
|
|
|
|
Podmienky testovania:
|
—
|
použitý sediment, t. j. prírodný alebo umelo pripravený sediment,
|
|
—
|
v prípade prírodného sedimentu poloha a opis miesta odobratia vzoriek vrátane histórie kontaminácie, ak je to možné, charakteristiky: pH, obsah organického uhlíka, pomer C/N a granulometria (podľa potreby),
|
|
—
|
príprava umelo pripraveného sedimentu: zložky a charakteristiky (obsah organického uhlíka, pH, vlhkosť atď. na začiatku testu),
|
|
—
|
príprava testovacej vody (ak sa použije rekonštituovaná voda) a charakteristiky (koncentrácia kyslíka, pH, vodivosť, tvrdosť atď. na začiatku testu),
|
|
—
|
výška sedimentu a nadložnej vody,
|
|
—
|
objem nadložnej a pórovej vody, hmotnosť mokrého sedimentu s pórovou vodou a bez nej,
|
|
—
|
testovacie nádoby (materiál a veľkosť),
|
|
—
|
metóda obohatenia sedimentu: použité testovacie koncentrácie, počet replikátov a prípadné použitie rozpúšťadiel,
|
|
—
|
rovnovážna fáza stabilizácie systému obohatený sediment – voda: trvanie a podmienky,
|
|
—
|
inkubačné podmienky: teplota, svetelný cyklus a intenzita, prevdzušňovanie (frekvencia a intenzita),
|
|
—
|
podrobné informácie o kŕmení vrátane druhu potravy, prípravy, množstva a kŕmneho režimu.
|
|
|
|
Výsledky:
|
—
|
nominálne testovacie koncentrácie, namerané testovacie koncentrácie a výsledky všetkých analýz na stanovenie koncentrácie testovanej látky v testovacej nádobe,
|
|
—
|
kvalita vody v testovacích nádobách, t. j. pH, teplota, rozpustený kyslík, tvrdosť a amoniak,
|
|
—
|
kompenzácia prípadnej vyparenej testovacej vody,
|
|
—
|
počet vykuklených samčích a samičích pakomárov na nádobu na deň,
|
|
—
|
počet lariev na nádobu, ktoré sa nevykuklili,
|
|
—
|
stredná suchá hmotnosť jednotlivých lariev na nádobu a na instar podľa potreby,
|
|
—
|
percentuálne vykuklenie na replikát a testovaciu koncentráciu (samčie a samičie pakomáre spolu),
|
|
—
|
stredný vývojový pomer úplne vykuklených pakomárov na replikát a miera ošetrenia (samčie a samičie pakomáre spolu),
|
|
—
|
odhady toxických parametrov, napr. ECx (a súvisiace intervaly spoľahlivosti), NOEC a/alebo LOEC a štatistické metódy použité na ich stanovenie,
|
|
—
|
rozbor výsledkov vrátane každého vplyvu na výsledok testu vyplývajúceho z odchýlok od tejto testovacej metódy.
|
|
|
LITERATÚRA
|
1.
|
BBA (1995). Long-term toxicity test with Chironomus riparius: Development and validation of a new test system. Upravili M. Streloke a H.Köpp. Berlín 1995.
|
|
2.
|
Fleming, R. a kol. (1994). Sediment Toxicity Tests for Poorly Water-Soluble Substances. Záverečná správa pre Európsku komisiu. Správa č.: EK, 3738. August 1994. WRc, UK.
|
|
3.
|
SETAC (1993). Guidance Document on Sediment toxicity Tests and Bioassays for Freshwater and Marine Environments. Zo seminára WOSTA, ktorý sa uskutočnil v Holandsku.
|
|
4.
|
ASTM International/E1706-00 (2002). Test Method for Measuring the Toxicity of Sediment-Associated Contaminants with Freshwater Invertebrates. s. 1125 – 1241. In ASTM International 2002 Annual Book of Standards. Volume 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM. International, West Conshohocken, PA.
|
|
5.
|
Environment Canada (1997). Test for Growth and Survival in Sediment using Larvae of Freshwater Midges (Chironomus tentans or Chironomus riparius). Biological Test Method. Report SPE 1/RM/32. December 1997.
|
|
6.
|
US-EPA (2000). Methods for Measuring the Toxicity and Bioaccumulation of Sediment-associated Contaminants with Freshwater Invertebrates. Druhé vydanie. EPA 600/R-99/064. Marec 2000. Revízia prvého vydania z júna 1994.
|
|
7.
|
US-EPA/OPPTS 850.1735. (1996): Whole Sediment Acute Toxicity Invertebrates.
|
|
8.
|
US-EPA/OPPTS 850.1790. (1996): Chironomid Sediment toxicity Test.
|
|
9.
|
Milani, D., Day, K. E., McLeay, D. J., a Kirby, R. S. (1996). Recent intra- and inter-laboratory studies related to the development and standardisation of Environment Canada’s biological test methods for measuring sediment toxicity using freshwater amphipods (Hyalella azteca) and midge larvae (Chironomus riparius). Technical Report. Environment Canada. National Water Research Institute. Burlington, Ontario, Kanada.
|
|
10.
|
Sugaya, Y. (1997). Intra-specific variations of the susceptibility of insecticides in Chironomus yoshimatsui. Jp. J. Sanit. Zool. 48 (4): 345 – 350.
|
|
11.
|
Kawai, K. (1986). Fundamental studies on Chironomid allergy. I. Culture methods of some Japanese Chironomids (Chironomidae, Diptera). Jp. J. Sanit. Zool. 37(1): 47 – 57.
|
|
12.
|
OECD (2000). Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. OECD Environment, Health and Safety Publications, Series on Testing and Assessment No. 23.
|
|
13.
|
Environment Canada (1995). Guidance Document on Measurement of Toxicity Test Precision Using Control Sediments Spiked with a Reference Toxicant. Report EPS 1/RM/30. September 1995.
|
|
14.
|
Testovacia metóda C.8 tejto prílohy, Toxicita pre dážďovky.
|
|
15.
|
Suedel, B. C., a Rodgers, J. H. (1994). Development of formulated reference sediments for freshwater and estuarine sediment testing. Environ. Toxicol. Chem. 13: 1163 – 1175.
|
|
16.
|
Naylor, C., a Rodrigues, C. (1995). Development of a test method for Chironomus riparius using a formulated sediment. Chemosphere 31: 3291 – 3303.
|
|
17.
|
Dunnett, C. W. (1964). A multiple comparisons procedure for comparing several treatments with a control. J. Amer. Statis. Assoc., 50: 1096 – 1121.
|
|
18.
|
Dunnett, C. W. (1964). New tables for multiple comparisons with a control. Biometrics, 20: 482 – 491.
|
|
19.
|
Williams, D. A. (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics, 27: 103 – 117.
|
|
20.
|
Williams, D. A. (1972). The comparison of several dose levels with a zero dose control. Biometrics, 28: 510 – 531.
|
|
21.
|
Rao, J. N. K., a Scott, A. J. (1992). A simple method for the analysis of clustered binary data. Biometrics 48: 577 – 585.
|
|
22.
|
Christensen, E. R. (1984). Dose-response functions in aquatic toxicity testing and the Weibull model. Water Research 18: 213 – 221.
|
|
23.
|
Bruce a Versteeg (1992). A statistical procedure for modelling continuous toxicity data. Environmental Toxicology and Chemistry 11: 1485 – 1494.
|
|
24.
|
Slob, W. (2002). Dose-response modelling of continuous endpoints. Toxicol. Sci. 66: 298-312.
|
Dodatok 1
VYMEDZENIE POJMOV
Na účely tejto testovacej metódy sa používajú tieto vymedzenia pojmov:
|
|
Umelo pripravený sediment alebo rekonštituovaný, umelý alebo syntetický sediment, je zmes materiálov použitých na napodobnenie fyzických zložiek prírodného sedimentu.
|
|
|
Nadložná voda je voda umiestnená v testovacej nádobe nad sedimentom.
|
|
|
Intersticiálna voda alebo pórová voda je voda nachádzajúca sa v priestore medzi časticami sedimentu a pôdy.
|
|
|
Obohatený sediment je sediment, do ktorého bola pridaná testovaná látka.
|
|
|
Testovaná chemikália: akákoľvek látka alebo zmes testovaná pomocou tejto testovacej metódy.
|
Dodatok 2
Odporúčania ku kultúre Chironomus riparius
|
1.
|
Larvy rodu Chironomus sa môžu chovať v kryštalizačných miskách alebo vo väčších nádobách. Na dno nádoby sa nanesie tenká vrstva jemného kremenného piesku vo výške 5 – 10 mm. Je preukázané, že vhodným substrátom je aj diatomit (napr. Merck, článok 8117) (postačuje tenšia vrstva do výšky len niekoľkých milimetrov). Potom sa pridá vhodná voda do výšky niekoľkých centimetrov. Hladiny vody by sa mali podľa potreby dopĺňať, aby sa kompenzovala strata vyparením a aby sa predišlo vysychaniu. Vodu je možné v prípade potreby vymeniť. Je potrebné zabezpečiť jemné prevzdušňovanie. Misky na chov lariev by mali byť umiestnené vo vhodnej klietke, ktorá zabráni úniku vykuklených dospelých jedincov. Klietka by mala byť dostatočne veľká, aby umožňovala rojenie vykuklených dospelých jedincov, v opačnom prípade by nemuselo dôjsť ku kopulácii (minimálna veľkosť je asi 30 × 30 × 30 cm).
|
|
2.
|
Klietky je potrebné udržiavať pri izbovej teplote alebo v miestnosti so stálym prostredím pri teplote 20 ± 2 °C so svetlou fázou v trvaní 16 hodín (intenzita asi 1 000 luxov) a fázou tmy v trvaní 8 hodín. Je preukázané, že vlhkosť vzduchu nižšia ako 60 % RH môže brániť reprodukcii.
|
Riediaca voda
|
3.
|
Možno použiť akúkoľvek vhodnú prírodnú alebo syntetickú vodu. Bežne sa používa studňová voda, odchlórovaná voda z vodovodu a umelé médiá (napr. Elendtovo médium ‚M4‘ alebo ‚M7‘, pozri ďalej). Pred použitím je potrebné vodu prevzdušniť. V prípade potreby možno kultivačnú vodu obnoviť opatrným odliatím alebo odčerpaním použitej vody z kultivačných nádob bez toho, aby sa poškodili trubice lariev.
|
Kŕmenie lariev
|
4.
|
Larvy rodu Chironomus sa kŕmia vločkovým krmivom pre ryby [Tetra Min®, Tetra Phyll® alebo iná podobná značka patentovaného krmiva pre ryby] približným množstvom 250 mg na nádobu na deň. Krmivo sa môže podávať ako suchý rozomletý prášok alebo ako suspenzia vo vode: 1,0 g vločkového krmiva sa pridá do 20 ml riediacej vody a premieša sa, aby sa získala homogénna zmes. Tento prípravok sa môže podávať v množstve približne 5 ml na nádobu na deň (pred použitím pretrepať). Staršie larvy môžu dostávať viac.
|
|
5.
|
Kŕmenie sa upraví podľa kvality vody. Ak sa kultivačné médium zakalí, kŕmenie je potrebné obmedziť. Prídavky do krmiva sa musia starostlivo monitorovať. Nedostatok potravy spôsobí, že larvy sa budú presúvať k vodnému stĺpcu, a prebytok potravy spôsobí zvýšenie činnosti mikróbov a zníženie koncentrácií kyslíka. V obidvoch prípadoch môže dôjsť k zníženiu rastových pomerov.
|
|
6.
|
Pri založení nových kultivačných nádob sa môžu pridať aj bunky niektorých zelených rias (napr. Scenedesmus subspicatus, Chlorella vulgaris).
|
Kŕmenie vykuklených dospelých jedincov
|
7.
|
Z niektorých pokusov vyplýva, že ako potrava pre vykuklené dospelé jedince môže slúžiť vatový tampón napustený nasýteným sacharózovým roztokom.
|
Vykuklenie
|
8.
|
Pri teplote 20 ± 2 °C sa dospelé jedince začnú kukliť z nádoby na chov lariev po približne 13 – 15 dňoch. Samčeky sa ľahko rozlíšia podľa obrvených tykadiel.
|
Vajíčkové masy
|
9.
|
Keď sú v chovnej klietke prítomné dospelé jedince, vo všetkých nádobách na chov lariev je potrebné trikrát do týždňa kontrolovať kladenie želatínových vajíčkových más. Ak sú vajíčkové masy prítomné, opatrne sa odoberú. Mali by sa preniesť na malú misku so vzorkou kultivačnej vody. Vajíčkové masy sa použijú na založenie nových kultivačných nádob (napr. dve až štyri vajíčkové masy na nádobu) alebo sa použijú v testoch toxicity.
|
|
10.
|
Larvy prvého instaru by sa mali vyliahnuť po dvoch až troch dňoch.
|
Založenie nových kultivačných nádob
|
11.
|
Po vytvorení kultúr by malo byť možné založiť novú nádobu na kultiváciu lariev každý týždeň alebo menej často v závislosti od testovacích požiadaviek, pričom staršie nádoby sa po vykuklení dospelých pakomárov odstránia. Týmto spôsobom sa pri minimálnom riadení zabezpečí pravidelné dopĺňanie dospelých jedincov.
|
Príprava testovacích roztokov ‚M4‘ a ‚M7‘
|
12.
|
Elendt (1990) opísal médium ‚M4‘. Médium ‚M7‘ sa pripravuje ako médium ‚M4‘ s výnimkou látok označených v tabuľke 1, pre ktoré sú koncentrácie v médiu ‚M7‘ štyrikrát nižšie ako v médiu ‚M4‘. Publikácia o médiu ‚M7‘ je v štádiu prípravy (Elendt, osobná komunikácia). Testovací roztok by sa nemal pripraviť podľa Elendta a Biasa (1990), lebo koncentrácie NaSiO3 5 H2O, NaNO3, KH2PO4 a K2HPO4 uvedené pre prípravu zásobných roztokov nie sú vhodné.
|
Príprava média ‚M7‘
|
13.
|
Každý zásobný roztok (I) sa pripraví jednotlivo a kombinovaný zásobný roztok (II) sa pripraví z týchto zásobných roztokov (I) (pozri tabuľku 1). Na prípravu média ‚M7‘ sa 50 ml z kombinovaného zásobného roztoku (II) a množstvá každého makronutričného zásobného roztoku uvedené v tabuľke 2 doplnia do jedného litra deionizovanej vody. Vitamínový zásobný roztok sa pripraví pridaním troch vitamínov do deionizovanej vody, ako je uvedené v tabuľke 3, a krátko pred použitím sa do konečného média ‚M7‘ pridá 0,1 ml kombinovaného vitamínového zásobného roztoku. (Vitamínový zásobný roztok sa skladuje zmrazený v malých alikvotných častiach.) Médium sa prevzdušňuje a stabilizuje.
|
LITERATÚRA
BBA (1995). Long-term toxicity test with Chironomus riparius: Development and validation of a new test system. Upravili M. Streloke a H.Köpp. Berlín 1995.
Tabuľka 1
Zásobné roztoky stopových prvkov pre médiá M4 a M7
|
Zásobné roztoky (I)
|
Množstvo (mg) doplnené do jedného litra deionizovanej vody
|
Na prípravu kombinovaného zásobného roztoku (II) sa zmiešajú tieto množstvá (ml) zásobných roztokov (I) a doplnia sa do jedného litra deionizovanej vody
|
Konečné koncentrácie v testovacích roztokoch (mg/l)
|
|
M4
|
M7
|
M4
|
M7
|
|
H3BO3
(15)
|
57 190
|
1,0
|
0,25
|
2,86
|
0,715
|
|
MnCl2 · 4 H2O (15)
|
7 210
|
1,0
|
0,25
|
0,361
|
0,090
|
|
LiCl (15)
|
6 120
|
1,0
|
0,25
|
0,306
|
0,077
|
|
RbCl (15)
|
1 420
|
1,0
|
0,25
|
0,071
|
0,018
|
|
SrCl2 · 6 H2O (15)
|
3 040
|
1,0
|
0,25
|
0,152
|
0,038
|
|
NaBr (15)
|
320
|
1,0
|
0,25
|
0,016
|
0,004
|
|
Na2MoO4 · 2 H2O (15)
|
1 260
|
1,0
|
0,25
|
0,063
|
0,016
|
|
CuCl2 · 2 H2O (15)
|
335
|
1,0
|
0,25
|
0,017
|
0,004
|
|
ZnCl2
|
260
|
1,0
|
1,0
|
0,013
|
0,013
|
|
CaCl2 · 6 H2O
|
200
|
1,0
|
1,0
|
0,010
|
0,010
|
|
KI
|
65
|
1,0
|
1,0
|
0,0033
|
0,0033
|
|
Na2SeO3
|
43,8
|
1,0
|
1,0
|
0,0022
|
0,0022
|
|
NH4VO3
|
11,5
|
1,0
|
1,0
|
0,00058
|
0,00058
|
|
Na2EDTA · 2 H2O (15)
(16)
|
5 000
|
20,0
|
5,0
|
2,5
|
0,625
|
|
FeSO4 · 7 H2O (15)
(16)
|
1 991
|
20,0
|
5,0
|
1,0
|
0,249
|
Tabuľka 2
Makronutričné zásobné roztoky pre médiá M4 a M7
|
|
Množstvo doplnené do jedného litra deionizovanej vody
(mg)
|
Množstvo pridaných makronutričných zásobných roztokov pri príprave médií M4 a M7
(ml/l)
|
Konečné koncentrácie v testovacích roztokoch M4 a M7
(mg/l)
|
|
CaCl2 · 2 H2O
|
293 800
|
1,0
|
293,8
|
|
MgSO4 · 7 H2O
|
246 600
|
0,5
|
123,3
|
|
KCl
|
58 000
|
0,1
|
5,8
|
|
NaHCO3
|
64 800
|
1,0
|
64,8
|
|
NaSiO3 · 9 H2O
|
50 000
|
0,2
|
10,0
|
|
NaNO3
|
2 740
|
0,1
|
0,274
|
|
KH2PO4
|
1 430
|
0,1
|
0,143
|
|
K2HPO4
|
1 840
|
0,1
|
0,184
|
Tabuľka 3
Vitamínový zásobný roztok pre médiá M4 a M7. Všetky tri vitamínové roztoky sa skombinujú, aby sa vytvoril jeden vitamínový zásobný roztok.
|
|
Množstvo doplnené do jedného litra deionizovanej vody
(mg)
|
Množstvo pridaného vitamínového zásobného roztoku pri príprave médií M4 a M7
(ml/l)
|
Konečné koncentrácie v testovacích roztokoch M4 a M7
(mg/l)
|
|
Tiamín hydrochlorid
|
750
|
0,1
|
0,075
|
|
Kyanokobalamín (B12)
|
10
|
0,1
|
0,0010
|
|
Biotín
|
7,5
|
0,1
|
0,00075
|
LITERATÚRA
Elendt, B. P. (1990). Selenium Deficiency in Crustacean. Protoplasma 154: 25 – 33.
Elendt, B. P., a Bias, W.-R. (1990). Trace Nutrient Deficiency in Daphnia magna Cultured in Standard Medium for Toxicity Testing. Effects on the Optimization of Culture Conditions on Life History Parameters of D. magna. Water Research 24 (9): 1157 – 1167.
Dodatok 3
PRÍPRAVA UMELO PRIPRAVENÉHO SEDIMENTU
Zloženie sedimentu
Zloženie umelo pripraveného sedimentu by malo byť takéto:
|
Zložka
|
Charakteristika
|
% suchej hmotnosti
sedimentu
|
|
Rašelina
|
Rašelinníková rašelina, pH čo najbližšie k 5,5 – 6,0, bez viditeľných zvyškov rastlín, jemne rozomletá (veľkosť častíc ≤ 1 mm) a usušená vzduchom
|
4 – 5
|
|
Kremenný piesok
|
Veľkosť zrniek: > 50 % častíc by malo mať veľkosť v rozsahu 50 – 200 μm
|
75 – 76
|
|
Kaolín
|
Obsah kaolinitu ≥ 30 %
|
20
|
|
Organický uhlík
|
Upravený pridaním rašeliny a piesku
|
2 (± 0,5)
|
|
Uhličitan vápenatý
|
CaCO3, rozomletý na prach, chemicky čistý
|
0,05 - 0,1
|
|
Voda
|
Vodivosť ≤ 10 μS/cm
|
30 - 50
|
Príprava
Rašelina sa usuší vzduchom a rozomelie na jemný prášok. V deionizovanej vode sa pomocou vysokovýkonného homogenizačného prístroja pripraví suspenzia požadovaného množstva rašelinového prášku. Hodnota pH tejto suspenzie sa upraví na 5,5 ± 0,5 pomocou CaCO3. Suspenzia sa aspoň na dva dni uvedie do podmienok jemným premiešavaním pri teplote 20 ± 2 °C, aby sa stabilizovala hodnota pH a vytvorila stabilná mikrobiálna zložka. Opäť sa zmeria pH, ktoré by malo byť na úrovni 6,0 ± 0,5. Rašelinová suspenzia sa následne zmieša s ostatnými zložkami (piesok a kaolín) a s deionizovanou vodou, aby sa získal homogénny sediment s obsahom vody v rozsahu 30 - 50 percent suchej hmotnosti sedimentu. Znova sa zmeria hodnota pH konečnej zmesi a podľa potreby sa pomocou CaCO3 upraví na 6,5 – 7,5. Odoberú sa vzorky sedimentu, aby sa určila suchá hmotnosť a obsah organického uhlíka. Následne sa odporúča, aby sa pred použitím v teste toxicity pri pakomároch umelo pripravený sediment uviedol na sedem dní do rovnakých podmienok, aké budú prevládať v nasledujúcom teste.
Skladovanie
Suché zložky na prípravu umelého sedimentu sa môžu skladovať na suchom a chladnom mieste pri izbovej teplote. Umelo pripravený (mokrý) sediment by sa pred použitím v teste nemal skladovať. Mal by sa použiť hneď po sedemdňovom období uvádzania do podmienok, ktorým sa končí jeho príprava.
LITERATÚRA
Kapitola C.8 tejto prílohy. Toxicita pre dážďovky.
Meller M., Egeler P., Rombke J., Schallnass H., Nagel R., Streit B. (1998). Short-term Toxicity of Lindane, Hexachlorobenzene and Copper Sulfate on Tubificid Sludgeworms (Oligochaeta) in Artificial Media. Ecotox. and Environ. Safety 39: 10 – 20.
Dodatok 4
Chemické charakteristiky prijateľnej riediacej vody
|
Látka
|
Koncentrácie
|
|
Pevné častice
|
< 20 mg/l
|
|
Celkový organický uhlík
|
< 2 mg/l
|
|
Neionizovaný amoniak
|
< 1 μg/l
|
|
Tvrdosť ako CaCO3
|
< 400 mg/l (17)
|
|
Zostatkový chlór
|
< 10 μg/l
|
|
Celkové organofosfátové pesticídy
|
< 50 ng/l
|
|
Celkové organochlórované pesticídy plus polychlórované bifenyly
|
< 50 ng/l
|
|
Celkový organický chlór
|
< 25 ng/l
|
Dodatok 5
Usmernenie k monitorovaniu vykuklenia lariev pakomárov
Na testovacie kadičky sa umiestnia pasce na vykuklené jedince. Tieto pasce sú potrebné odo dňa 20 do skončenia testu. Ďalej je znázornený príklad použitej pasce.

A: nylonová sieťka
B: prevrátené umelohmotné misky
C: expozičná kadička bez okraja
D: sieťované otvory na výmenu vody
E: voda
F: sediment
C. 28. TEST TOXICITY CHIRONOMIDAE V SYSTÉME SEDIMENT – VODA ZA POUŽITIA OBOHATENEJ VODY
ÚVOD
|
1.
|
Táto testovacia metóda je rovnocenná s OECD TG 219 (2004). Táto testovacia metóda bola vypracovaná s cieľom hodnotiť účinky predĺženého pôsobenia chemikálií na vodné larvy dvojkrídlovcov rodu Chironomus žijúce v sedimente. Vychádza najmä z usmernenia BBA, ktoré používa testovací systém sediment – voda s umelou pôdou a expozičným scenárom vo vodnom stĺpci (1). Zohľadňuje aj existujúce protokoly o testoch toxicity na Chironomus riparius a Chironomus tentans, ktoré boli vypracované v Európe a Severnej Amerike (2) (3) (4) (5) (6) (7) (8) a boli podrobené kruhovým testom (1) (6) (9). Môžu sa použiť aj iné dobre zdokumentované druhy pakomárov, napr. Chironomus yoshimatsui (10) (11).
|
|
2.
|
Expozičný scenár použitý v tejto testovacej metóde je obohacovanie vody. Výber vhodného expozičného scenára závisí od plánovaného použitia testu. Vodný expozičný scenár zahŕňajúci obohatenie vodného stĺpca je určený na simuláciu prípadu pesticídneho postreku a zahŕňa počiatočné maximálne koncentrácie v pórovej vode. Je užitočný aj pri iných druhoch expozície (vrátane chemických únikov) s výnimkou akumulačných procesov, ktoré trvajú dlhšie ako testovacie obdobie.
|
|
3.
|
Látky, ktoré je potrebné testovať na organizmoch žijúcich v sedimente, zvyčajne pretrvajú v tomto kompartmente dlhý čas. Organizmy žijúce v sedimente môžu byť exponované viacerými spôsobmi. Relatívny význam každého spôsobu expozície a časové obdobie, v ktorom sa každý z nich podieľa na celkových toxických účinkoch, závisí od fyzikálno-chemických vlastností danej chemikálie. V prípade silno adsorbujúcich látok (napr. s log Kow > 5) alebo látok, ktoré sa kovalentne viažu na sediment, môže byť významným spôsobom expozície prijímanie kontaminovanej potravy. S cieľom vyhnúť sa podhodnoteniu toxicity vysokolipofilných látok možno zvážiť použitie potravy pridanej do sedimentu pred aplikáciou testovanej látky. S cieľom zohľadniť všetky potenciálne spôsoby expozície sa táto testovacia metóda zameriava na dlhodobú expozíciu. Trvanie testu je v rozsahu 20 – 28 dní v prípade druhov C. riparius a C. yoshimatsui a 28 – 65 dní pri C. tentans. Ak sú na špecifické účely potrebné krátkodobé údaje, napríklad s cieľom skúmať účinky nestabilných chemikálií, môžu sa po desiatich dňoch odstrániť ďalšie replikáty.
|
|
4.
|
Meranými parametrami sú celkový počet vykuklených dospelých jedincov a čas do vykuklenia. Ak sú potrebné ďalšie krátkodobé údaje, odporúča sa vykonať merania prežitia a rastu lariev až po desiatich dňoch s použitím ďalších replikátov podľa potreby.
|
|
5.
|
Odporúča sa použiť umelo pripravený sediment. Umelo pripravený sediment má oproti prírodným sedimentom niekoľko výhod:
|
—
|
zníži sa variabilita testu, lebo umelo pripravený sediment vytvára reprodukovateľnú ‚štandardizovanú matricu‘, a odstráni sa potreba nájsť nekontaminované a čisté zdroje sedimentu,
|
|
—
|
testy je možné začať kedykoľvek bez problému sezónnej variability v testovanom sedimente a nie je potrebné sediment predpripraviť, aby sa odstránila pôvodná fauna. Použitie umelo pripraveného sedimentu takisto znižuje náklady spojené s odberom dostatočných množstiev sedimentu v teréne na rutinné testovanie,
|
|
—
|
použitie umelo pripraveného sedimentu umožňuje porovnanie toxicity a následné zatriedenie látok: údaje o toxicite z testov s prírodnými a umelými sedimentmi boli v prípade viacerých chemikálií porovnateľné (2).
|
|
|
6.
|
Vymedzenie pojmov je uvedené v dodatku 1.
|
PRINCÍP TESTU
|
7.
|
Larvy pakomárov v prvom instare sú exponované rozsahu koncentrácií testovanej látky v systémoch sediment – voda. Test sa začne umiestnením lariev v prvom instare do testovacích kadičiek obsahujúcich systém sediment – voda a následne obohatením vody testovanou látkou. Na konci testu sa meria vykuklenie pakomárov a vývojový pomer. Podľa potreby sa môže po desiatich dňoch merať aj prežitie a hmotnosť lariev (pomocou ďalších replikátov podľa potreby). Tieto údaje sa analyzujú buď prostredníctvom regresného modelu na odhadnutie koncentrácie, ktorá by spôsobila x % pokles vo vykuklení, prežívaní lariev alebo raste (napr. EC15, EC50 atď.), alebo prostredníctvom testovania štatistickej hypotézy na stanovenie koncentrácie NOEC/LOEC. Pri druhom spôsobe je potrebné pomocou štatistických testov porovnať hodnoty účinkov s kontrolnými hodnotami.
|
INFORMÁCIE O TESTOVANEJ LÁTKE
|
8.
|
Je potrebné poznať rozpustnosť testovanej látky vo vode, jej tlak pary, namerané alebo vypočítané delenie na sediment a stabilitu vo vode a v sedimente. Mala by byť k dispozícii spoľahlivá analytická metóda so známou a zdokumentovanou presnosťou a detekčným limitom na kvantifikáciu testovanej látky v nadložnej vode, pórovej vode a sedimente. Medzi užitočné informácie patrí štrukturálny vzorec a čistota testovanej látky. Užitočnou informáciou je aj chemický osud testovanej chemikálie (napr. rozptýlenie, abiotická a biotická degradácia atď.). Ďalšie informácie pre testované látky s fyzikálno-chemickými vlastnosťami, ktoré sťažujú ich testovanie, sú uvedené v odkaze (12).
|
REFERENČNÉ CHEMIKÁLIE
|
9.
|
Referenčné chemikálie sa môžu testovať pravidelne ako prostriedok na zabezpečenie spoľahlivosti testovacieho protokolu a testovacích podmienok. Príkladmi referenčných toxických látok, ktoré sa úspešne používajú v kruhových testoch a overovacích štúdiách, sú: lindán, trifluralín, pentachlórfenol, chlorid kademnatý a chlorid draselný (1) (2) (5) (6) (13).
|
PLATNOSŤ TESTU
|
10.
|
Aby bol test platný, musí spĺňať tieto podmienky:
|
—
|
vykuklenie v kontrolných skupinách musí byť na konci testu na úrovni minimálne 70 % (1) (6),
|
|
—
|
vykuklenie druhov C. riparius a C. yoshimatsui na dospelé jedince z kontrolných nádob by malo nastať 12 – 23 dní po ich vložení do nádob. V prípade druhu C. tentans je potrebné obdobie 20 – 65 dní,
|
|
—
|
na konci testu je potrebné zmerať v každej nádobe pH a koncentráciu rozpusteného kyslíka. Koncentrácia kyslíka by pri použitej teplote mala predstavovať najmenej 60 % saturačnej hodnoty vzduchom (ASV) a hodnota pH nadložnej vody by vo všetkých testovacích nádobách mala byť v rozmedzí 6 – 9,
|
|
—
|
teplota vody by sa nemala líšiť o viac ako ± 1,0 °C. Teplotu vody je možné kontrolovať pomocou izotermickej komory a v tom prípade je potrebné v primeraných časových intervaloch potvrdiť teplotu v komore.
|
|
OPIS METÓDY
Testovacie nádoby
|
11.
|
Štúdia sa vykonáva v sklenených kadičkách s objemom 600 ml a s priemerom 8 cm. Sú vhodné aj iné nádoby, ale musia zaručiť vhodnú hĺbku nadložnej vody a sedimentu. Povrch sedimentu by mal byť dostatočne veľký, aby poskytoval 2 – 3 cm2 priestoru na larvu. Pomer hĺbky vrstvy sedimentu k hĺbke nadložnej vody by mal byť 1: 4. Testovacie nádoby a iné prístroje, ktoré prichádzajú do styku s testovacím systémom, by mali byť vyrobené výlučne zo skla alebo iného chemicky inertného materiálu (napr. teflónu).
|
Výber druhov
|
12.
|
Uprednostňovaným druhom na použitie v teste je Chironomus riparius. Chironomus tentans je takisto vhodný, ale je náročnejší na starostlivosť a vyžaduje si dlhšie trvanie testu. Možno použiť aj Chironomus yoshimatsui. Podrobné informácie o kultivačných metódach v prípade druhu Chironomus riparius sú uvedené v dodatku 2. Informácie o kultivačných podmienkach sú k dispozícii aj pre iné druhy, t. j. Chironomus tentans (4) a Chironomus yoshimatsui (11). Identifikácia druhov musí byť pred testovaním potvrdená, ale nevyžaduje sa pred každým testom, ak organizmy pochádzajú z internej kultúry.
|
Sediment
|
13.
|
Uprednostňuje sa použitie umelo pripraveného sedimentu (známeho aj pod názvom rekonštituovaný, umelý alebo syntetický sediment). Ak sa však použije prírodný sediment, je potrebné ho charakterizovať (aspoň pH, obsah organického uhlíka, odporúča sa aj stanovenie ostatných parametrov ako pomer C/N a granulometria) a nemal by obsahovať žiadne kontaminanty ani iné organizmy, ktoré by mohli s pakomármi súperiť alebo ich požierať. Takisto sa odporúča, aby bol prírodný sediment pred použitím v teste toxicity pri pakomároch na sedem dní uvedený do podmienok, ktoré budú prevládať v nasledujúcom teste. V tomto teste (1) (15) (16) sa odporúča použiť nasledujúci umelo pripravený sediment založený na umelej pôde použitej v testovacej metóde C.8 (14):
|
a)
|
4 – 5 % (suchá hmotnosť) rašeliny: čo najbližšie k pH 5,5 – 6,0. Je dôležité použiť rašelinu v práškovej forme, jemne rozomletú (veľkosť častíc ≤ 1 mm) a sušenú iba vzduchom;
|
|
b)
|
20 % (suchá hmotnosť) kaolínu (obsah kaolinitu podľa možnosti nad 30 %);
|
|
c)
|
75 – 76 % (suchá hmotnosť) kremenného piesku (mal by prevládať jemný piesok s viac ako 50 % častíc s veľkosťou od 50 do 200 μm);
|
|
d)
|
deionizovaná voda sa pridá, aby sa dosiahla vlhkosť konečnej zmesi v rozsahu 30 – 50 %;
|
|
e)
|
uhličitan vápenatý chemicky čistej kvality (CaCO3) sa pridá, aby sa pH konečnej zmesi sedimentu upravila na 7,0 ± 0,5;
|
|
f)
|
obsah organického uhlíka v konečnej zmesi by mal byť 2 % (± 0,5 %) a je potrebné ho upraviť pomocou primeraného množstva rašeliny a piesku podľa písmen a) a c).
|
|
|
14.
|
Zdroj rašeliny, kaolínu a piesku by mal byť známy. Je potrebné skontrolovať, či zložky sedimentu neobsahujú chemické kontaminanty (napr. ťažké kovy, organochlórové zlúčeniny, organofosforové zlúčeniny atď.). Príklad prípravy umelo pripraveného sedimentu je uvedený v dodatku 3. Miešanie suchých zložiek je takisto prípustné, ak sa preukáže, že po pridaní nadložnej vody nedochádza k separácii zložiek sedimentu (napr. k vyplaveniu častíc rašeliny) a že rašelina alebo sediment sú v dostatočnej miere uvedené do podmienok.
|
Voda
|
15.
|
Každá voda, ktorá vyhovuje chemickým charakteristikám prijateľnej riediacej vody podľa zoznamu uvedeného v dodatkoch 2 a 4, je vhodná ako testovacia voda. Každá vhodná voda, prírodná voda (povrchová alebo podzemná voda), rekonštituovaná voda (pozri dodatok 2) alebo odchlórovaná voda z vodovodu sú prijateľné ako voda na kultiváciu a testovacia voda, ak v nej pakomáre prežijú počas celej kultivácie a testovania bez príznakov stresu. Na začiatku testu by pH testovacej vody mala mať hodnotu medzi 6 a 9 a celková tvrdosť by nemala byť vyššia ako 400 mg/l pre CaCO3. Ak však existuje podozrenie na interakciu medzi iónmi tvrdosti a testovanou látkou, mala by sa použiť voda s nižšou tvrdosťou (a v takom prípade sa teda nesmie použiť Elendtovo médium M4). Počas celej štúdie by sa mal používať rovnaký druh vody. Charakteristiky kvality vody uvedené v dodatku 4 by sa mali merať najmenej dvakrát za rok, alebo ak existuje podozrenie, že sa tieto charakteristiky mohli významne zmeniť.
|
Zásobné roztoky – obohatená voda
|
16.
|
Testovacie koncentrácie sa vypočítajú na základe koncentrácií vo vodnom stĺpci, t. j. vody nad sedimentom. Testovacie roztoky vybratých koncentrácií sa zvyčajne pripravujú zriedením zásobného roztoku. Zásobné roztoky sa podľa možnosti pripravujú rozpustením testovanej látky v testovacom médiu. V niektorých prípadoch môže byť na vytvorenie vhodne koncentrovaného zásobného roztoku potrebné použiť rozpúšťadlá alebo disperzné činidlá. Príkladmi vhodných rozpúšťadiel sú acetón, etanol, metanol, etylénglykolmonoetyléter, etylénglykoldimetyléter, dimetylformamid a trietylénglykol. Ako disperzné činidlá možno použiť Cremophor RH40, Tween 80, 0,01 % metylcelulózu a HCO-40. Koncentrácia látky zvyšujúcej rozpustnosť v konečnom testovacom médiu by mala byť minimálna (t. j. ≤ 0,1 ml/l) a mala by byť vo všetkých pokusoch rovnaká. Ak sa použije látka zvyšujúca rozpustnosť, nesmie mať žiadne signifikantné účinky na prežívanie ani žiaden viditeľný škodlivý účinok na larvy pakomárov, aké sa preukázali pri kontrole s rozpúšťadlom. Je však potrebné vynaložiť maximálne úsilie, aby sa predišlo použitiu týchto materiálov.
|
KONCEPCIA TESTU
|
17.
|
Koncepcia testu sa vzťahuje na výber počtu a odstup testovaných koncentrácií, počet nádob pri každej koncentrácii a počet lariev v každej nádobe. Sú tu opísané koncepcie na odhadnutie bodu EC, na odhadnutie koncentrácie NOEC a na vykonanie limitného testu. Uprednostňuje sa regresná analýza pred testovaním hypotéz.
|
Koncepcia regresnej analýzy
|
18.
|
Účinná koncentrácia (napr. EC15, EC50) a koncentračný rozsah, v ktorom sa skúmajú účinky testovanej látky, sa merajú koncentráciami zahrnutými do testu. Vo všeobecnosti sú presnosť a najmä platnosť, s ktorou možno odhadovať účinné koncentrácie (ECx), lepšie, ak je účinná koncentrácia v rozsahu testovaných koncentrácií. Je potrebné vyhýbať sa extrapolácii hlboko pod najnižšou pozitívnou koncentráciou alebo nad najvyššou koncentráciou. Pri výbere rozsahu koncentrácií, ktoré sa použijú, je užitočný predbežný test na zistenie rozsahu (pozri odsek 27).
|
|
19.
|
Ak je potrebné odhadnúť ECx, malo by sa testovať najmenej päť koncentrácií a tri replikáty pre každú koncentráciu. V každom prípade je vhodné použiť dostatočné testovacie koncentrácie, ktoré umožnia dobrý modelový odhad. Faktor medzi koncentráciami by nemal byť väčší ako 2 (v prípadoch, keď má krivka závislosti reakcie od dávky plytký sklon, možno urobiť výnimku). Počet replikátov pri každej aplikácii sa môže znížiť, ak sa zvýši počet testovacích koncentrácií s rozdielnymi reakciami. Zvýšenie počtu replikátov alebo skrátenie dĺžky intervalov testovacích koncentrácií zvyčajne vedie k nižším intervalom spoľahlivosti testu. Ak sa odhaduje desaťdňové prežívanie a rast lariev, sú potrebné ďalšie replikáty.
|
Koncepcia odhadu NOEC/LOEC
|
20.
|
Ak sa odhadujú koncentrácie NOEC/LOEC, použije sa päť testovacích koncentrácií s najmenej štyrmi replikátmi a faktor medzi koncentráciami by nemal byť vyšší ako dva. Počet replikátov by mal byť dostatočný, aby sa zabezpečila primeraná štatistická výpovedná hodnota na zistenie rozdielu 20 % pri kontrole pri úrovni významnosti 5 % (p = 0,05). V prípade vývojového pomeru je zvyčajne vhodná analýza rozptylu (ANOVA), ako napríklad Dunnettov test a Williamsov test (17) (18) (19) (20). Pri pomere vykuklenia možno použiť Cochranov-Armitageho, Fisherov exaktný (s Bonferroniho korekciou) alebo Mantelov-Haenszelov test.
|
Limitný test
|
21.
|
Môže sa vykonať limitný test (jedna testovaná koncentrácia a kontrola), ak v predbežnom teste na zistenie rozsahu neboli pozorované žiadne účinky. Účelom limitného testu je ukázať, že toxická hodnota testovanej látky je väčšia ako testovaná limitná koncentrácia. V tejto testovacej metóde nemožno navrhnúť odporúčanú koncentráciu. Toto rozhodnutie je na posúdení regulačného orgánu. Zvyčajne je na aplikáciu aj kontrolu potrebných najmenej šesť replikátov. Je nutné preukázať primeranú štatistickú výpovednú hodnotu na zistenie rozdielu 20 % pri kontrole pri úrovni významnosti 5 % (p = 0,05). V prípade metrickej reakcie (vývojový pomer a hmotnosť) je vhodnou štatistickou metódou t-test, pokiaľ údaje spĺňajú požiadavky tohto testu (normalita, homogénne rozptyly). Ak tieto požiadavky nie sú splnené, môže sa použiť t-test nerovnomerných rozptylov alebo neparametrický test, ako napríklad Wilcoxonov-Mannov-Whitheyho test. Pri pomere vykuklenia je vhodný Fisherov exaktný test.
|
POSTUP
Podmienky expozície
Príprava systému obohatená voda – sediment
|
22.
|
Do testovacích nádob sa pridajú primerané množstvá umelo pripraveného sedimentu (pozri odseky 13 – 14 a dodatok 3), aby sa vytvorila vrstva hrubá najmenej 1,5 cm. Voda sa pridá do výšky 6 cm (pozri odsek 15). Pomer výšky vrstvy sedimentu a výšky vody by nemal presiahnuť 1: 4, pričom vrstva sedimentu by nemala byť hrubšia ako 3 cm. Systém sediment – voda by sa mal pred pridaním testovacích organizmov nechať jemne prevzdušňovať počas siedmich dní (pozri odsek 14 a dodatok 3). S cieľom zabrániť separácii zložiek sedimentu a resuspendovaniu jemného materiálu počas pridávania testovacej vody do vodného stĺpca môže byť sediment v čase, keď sa naň nalieva voda, prikrytý umelohmotným kotúčom, ktorý sa hneď potom odstráni. Môže byť vhodné aj použitie iných prístrojov.
|
|
23.
|
Testovacie nádoby sa zakryjú (napr. sklenenými platňami). V prípade potreby sa počas štúdie dopĺňajú hladiny vody na pôvodný objem s cieľom kompenzovať vyparovanie vody. Na tento účel sa použije destilovaná alebo deionizovaná voda, aby sa predišlo hromadeniu solí.
|
Pridanie testovacích organizmov
|
24.
|
Štyri až päť dní pred pridaním testovacích organizmov do testovacích nádob sa z kultúr odoberú vajíčkové masy a umiestnia sa do malých nádob s kultivačných médiom. Môže sa použiť staršie médium zo zásobnej kultúry alebo čerstvo pripravené médium. Ak sa použije čerstvo pripravené kultivačné médium, je potrebné doň pridať malé množstvo potravy, napr. zelené riasy a/alebo pár kvapiek filtrátu z jemne rozomletej suspenzie vločkového krmiva pre ryby (pozri dodatok 2). Použijú sa iba čerstvo nakladené vajíčkové masy. Larvy sa zvyčajne začnú liahnuť niekoľko dní po nakladení vajíčok (dva až tri dni v prípade druhu Chironomus riparius pri teplote 20 °C a jeden až štyri dni v prípade Chironomus tentans pri teplote 23 °C a Chironomus yoshimatsui pri teplote 25 °C) a rast lariev prebieha v štyroch instaroch, z ktorých každý trvá štyri až osem dní. V teste sa použijú larvy prvého instaru (dva až tri alebo jeden až štyri dni po vyliahnutí). Instar pakomárov je možné skontrolovať podľa šírky hlavového segmentu (6).
|
|
25.
|
Larvy 21. instaru sa pomocou tupej pipety náhodne rozdelia do jednotlivých testovacích nádob obsahujúcich obohatený sediment a vodu. Prevzdušňovanie vody je nutné počas pridávania lariev do testovacích nádob prerušiť a musí byť pozastavené počas ďalších 24 hodín po pridaní lariev (pozri odseky 24 a 32). Podľa použitej koncepcie testu (pozri odseky 19 a 20) je počet lariev použitých pri každej koncentrácii najmenej 60 na odhad bodu EC a 80 na stanovenie koncentrácie NOEC.
|
|
26.
|
Dvadsaťštyri hodín po pridaní lariev sa do nadložného vodného stĺpca pridá testovaná látka a opäť sa začne s jemným prevzdušňovaním. Pod povrch vody sa pomocou pipety aplikujú malé množstvá roztokov testovanej látky. Nadložná voda sa potom opatrne premieša, aby sa nenarušil sediment.
|
Testovacie koncentrácie
|
27.
|
Pri určovaní rozsahu koncentrácií pre konečný test môže byť užitočný test na zistenie rozsahu. Na tento účel sa použije súbor koncentrácií testovanej látky s veľkými odstupmi. S cieľom zabezpečiť rovnakú hustotu povrchu na pakomára, ktorá sa použije pri konečnom teste, sú pakomáre vystavené každej koncentrácii testovanej látky na obdobie, ktoré umožňuje odhad vhodných testovacích koncentrácií, pričom nie sú potrebné žiadne replikáty.
|
|
28.
|
Testovacie koncentrácie pre konečný test sa vyberú na základe výsledkov testu na zistenie rozsahu. Je potrebné použiť a vybrať najmenej päť koncentrácií, ako sa uvádza v odsekoch 18 – 20.
|
Kontroly
|
29.
|
Súčasťou testu sú kontrolné nádoby bez prítomnosti testovanej látky, ktoré však obsahujú sediment, a primeraný počet replikátov (pozri odseky 19 – 20). Ak sa pri aplikácii testovanej látky použije rozpúšťadlo (pozri odsek 16), je potrebné pridať kontrolu rozpúšťadla v sedimente.
|
Testovací systém
|
30.
|
Použijú sa statické systémy. Vo výnimočných prípadoch sa môžu použiť semistatické alebo prietokové systémy s prerušovaným alebo nepretržitým obmieňaním nadložnej vody, napríklad ak sú špecifikácie kvality vody nevhodné pre testovacie organizmy alebo ak ovplyvňujú chemickú rovnováhu (napr. úrovne rozpusteného kyslíka príliš klesnú, koncentrácia vylučovaných produktov príliš stúpne alebo sa zo sedimentu lúhujú minerály, čo má vplyv na pH a/alebo tvrdosť vody). Zvyčajne však postačujú a uprednostňujú sa iné metódy zlepšenia kvality nadložnej vody, ako napríklad prevzdušňovanie.
|
Potrava
|
31.
|
Je nevyhnutné larvy kŕmiť podľa možnosti každý deň alebo najmenej trikrát do týždňa. V prvých desiatich dňoch je pre mladé larvy podľa všetkého vhodné krmivo pre ryby (suspenzia vo vode alebo jemne rozomletá potrava, napr. Tetra-Min alebo Tetra-Phyll, bližšie informácie pozri v dodatku 2) v dennom množstve 0,25 – 0,5 mg (0,35 – 0,5 mg pre druh C. yoshimatsui) na jednu larvu. Pre staršie larvy môže byť potrebné o niečo väčšie množstvo potravy: denné množstvo 0,5 – 1 mg na jednu larvu by malo po zvyšok testu postačovať. Ak sa pozoruje rast hubovitých organizmov alebo ak sa v kontrolných nádobách pozoruje mortalita, prídel potravy by sa mal vo všetkých testovacích a kontrolných nádobách znížiť. Ak nie je možné vznik hubovitých organizmov zastaviť, test je nutné opakovať. Pri testovaní silno adsorbujúcich látok (napr. s log Kow > 5) alebo látok, ktoré sa kovalentne viažu na sediment, sa môže do umelo pripraveného sedimentu pred stabilizačným obdobím pridať množstvo potravy potrebné na zabezpečenie prežitia a prirodzeného rastu organizmov. Na tento účel sa namiesto krmiva pre ryby musí použiť rastlinný materiál, napr. sa môže pridať 0,5 % (suchá hmotnosť) jemne rozomletých listov napr. pŕhľavy dvojdomej (Urtica dioica), moruše (Morus alba), ďateliny plazivej (Trifolium repens), špenátu (Spinacia oleracea) alebo iného rastlinného materiálu (Cerophyl alebo alfa celulóza).
|
Podmienky inkubácie
|
32.
|
Najlepšie po 24 hodinách od pridania lariev sa zabezpečí jemné prevzdušňovanie nadložnej vody v testovacích nádobách a pokračuje v ňom počas celého testu (treba dbať na to, aby koncentrácia rozpusteného kyslíka neklesla pod 60 % ASV). Prevzdušňovanie sa zabezpečí pomocou sklenenej Pasteurovej pipety upevnenej 2 – 3 cm nad vrstvou sedimentu (t. j. jedna alebo niekoľko bublín za sekundu). Ak sa testujú prchavé chemikálie, možno zvážiť, že systém sediment – voda sa nebude prevzdušňovať.
|
|
33.
|
Test sa vykonáva pri konštantnej teplote 20 °C (± 2 °C). V prípade druhu C. tentans sa odporúča teplota 23 °C a v prípade C. yoshimatsui 25 °C (± 2 °C). Použije sa 16-hodinová svetlá fáza, pričom intenzita svetla by mala byť 500 – 1 000 luxov.
|
Trvanie expozície
|
34.
|
Expozícia sa začne pridaním lariev do obohatených a kontrolných nádob. Maximálna dĺžka expozície je 28 dní v prípade druhov C. riparius a C. yoshimatsui a 65 dní v prípade C. tentans. Ak sa pakomáre vykuklia skôr, test sa môže ukončiť najskôr päť dní po vykuklení posledného dospelého jedinca v kontrolnej skupine.
|
POZOROVANIA
Vykuklenie
|
35.
|
Určí sa čas vývoja a celkový počet úplne vykuklených samčích a samičích pakomárov. Samčeky sa ľahko identifikujú podľa obrvených tykadiel.
|
|
36.
|
Testovacie nádoby je potrebné pozorovať najmenej trikrát do týždňa s cieľom vizuálne zhodnotiť každé abnormálne správanie (napr. opúšťanie sedimentu, nezvyčajné plávanie) v porovnaní s kontrolnou skupinou. Počas obdobia očakávaného vykuklenia je nevyhnutné každý deň spočítať vykuklené pakomáre. Pohlavie a počet úplne vykuklených pakomárov sa zaznamenáva denne. Po identifikácii sa pakomáre vyberú z nádob. Všetky vajíčkové masy nakladené pred ukončením testu sa zaznamenajú a následne odstránia, aby sa predišlo opätovnému zavedeniu lariev do sedimentu. Takisto sa zaznamená počet viditeľných kukiel, ktoré sa nevykuklili. Usmernenie k meraniu vykuklenia je uvedené v dodatku 5.
|
Rast a prežívanie
|
37.
|
Ak je potrebné získať údaje o desaťdňovom prežívaní a raste lariev, na začiatku sa pripravia ďalšie testovacie nádoby tak, aby sa mohli následne použiť. Sediment z týchto ďalších nádob sa precedí pomocou cedidla s hrúbkou 250 μm, aby sa zachytili larvy. Kritériami na stanovenie smrti sú nehybnosť alebo chýbajúca reakcia na mechanický podnet. Stratené larvy sa takisto počítajú medzi mŕtve (larvy, ktoré uhynuli na začiatku testu, sa mohli rozložiť pôsobením mikróbov). Určí sa suchá hmotnosť (bez popola) lariev, ktoré prežili v každej testovacej nádobe, a vypočíta sa stredná suchá hmotnosť jedincov na jednu nádobu. Je užitočné určiť, do ktorého instaru patria larvy, ktoré prežili. Na toto meranie sa môže použiť šírka hlavového segmentu každého jedinca.
|
Analytické merania
Koncentrácia testovanej látky
|
38.
|
Vzorky nadložnej vody, pórovej vody a sedimentu sa musia analyzovať minimálne na začiatku (najlepšie jednu hodinu po aplikácii testovanej látky) a na konci testu pri najvyššej koncentrácii a pri jednej nižšej koncentrácii. Tieto skúmania koncentrácie testovanej látky poskytujú informácie o správaní/delení testovanej látky v systéme voda – sediment. Odoberanie vzoriek na začiatku testu môže ovplyvniť testovací systém (napr. odstránenie testovaných lariev), preto je potrebné použiť ďalšie testovacie nádoby, aby bolo podľa potreby možné vykonať analytické vyšetrenia na začiatku a počas testu (pozri odsek 39). Merania v sedimente nemusia byť potrebné, ak sa delenie testovanej látky medzi vodu a sediment jednoznačne určilo v štúdii voda/sediment pri porovnateľných podmienkach (napr. pomer sedimentu k vode, druh aplikácie, obsah organického uhlíka v sedimente).
|
|
39.
|
Ak sa vykonajú prostredné merania (napr. v deň 7) a ak sú na analýzu potrebné veľké vzorky, ktoré nemožno odobrať z testovacích nádob bez ovplyvnenia testovacieho systému, analytické vyšetrenia je potrebné vykonať na vzorkách z ďalších testovacích nádob, s ktorými sa zaobchádzalo rovnakým spôsobom (vrátane prítomnosti testovacích organizmov), ale ktoré sa nepoužijú na biologické pozorovania.
|
|
40.
|
Na izolovanie intersticiálnej vody je odporúčaným postupom odstredenie napr. pri 10 000 g a 4 °C počas 30 minút. Ak sa však preukáže, že testovaná látka sa na filtroch neadsorbuje, môže byť prijateľná aj filtrácia. V niektorých prípadoch nemusí byť možné analyzovať koncentrácie v pórovej vode, lebo vzorka je príliš malá.
|
Fyzikálno-chemické parametre
|
41.
|
Je potrebné vhodným spôsobom odmerať pH, rozpustený kyslík v testovacej vode a teplotu v testovacích nádobách (pozri odsek 10). Tvrdosť a amoniak sa merajú v kontrolných nádobách a v jednej testovacej nádobe pri najvyššej koncentrácii na začiatku a na konci testu.
|
ÚDAJE A PODÁVANIE SPRÁV
Spracovanie výsledkov
|
42.
|
Účelom tohto testu je určiť účinok testovanej látky na vývojový pomer a celkový počet úplne vykuklených samčích a samičích pakomárov, alebo v prípade desaťdňového testu účinky na prežívanie a hmotnosť lariev. Ak nič nepoukazuje na štatisticky rozdielnu vnímavosť medzi pohlaviami, výsledky pre samčeky a samičky možno na účely štatistických analýz zhrnúť spoločne. Rozdiely vnímavosti medzi pohlaviami sa môžu štatisticky posúdiť, napr. tabuľkovým testom χ2 – r × 2. Prežívanie lariev a stredná suchá hmotnosť jedincov na jednu nádobu sa podľa potreby musí určiť po desiatich dňoch.
|
|
43.
|
Účinné koncentrácie vyjadrené ako koncentrácie v nadložnej vode sa podľa možnosti vypočítajú na základe nameraných koncentrácií na začiatku testu (pozri odsek 38).
|
|
44.
|
Na vyčíslenie odhadu bodu EC50 alebo akejkoľvek inej hodnoty ECx sa ako pravé replikáty môže použiť štatistika na jednu nádobu. Pri výpočte intervalu spoľahlivosti pre každú hodnotu ECx je potrebné zohľadniť variabilitu medzi nádobami alebo je nutné preukázať, že táto variabilita je taká malá, že je možné ju ignorovať. Ak sa model upraví metódou najmenších štvorcov, v štatistike na jednu nádobu je potrebné aplikovať transformáciu, aby sa zlepšila homogénnosť rozptylu. Hodnoty ECx by sa však mali vypočítať po tom, ako sa reakcia transformuje naspäť na pôvodnú hodnotu.
|
|
45.
|
Ak je cieľom štatistickej analýzy určenie koncentrácie NOEC/LOEC prostredníctvom testovania hypotézy, je potrebné zohľadniť variabilitu medzi nádobami, napr. pomocou hierarchickej analýzy ANOVA. Alternatívne môžu byť vhodné podrobnejšie testy (21) v prípadoch, keď dochádza k nedodržaniu zvyčajných predpokladov analýzy ANOVA.
|
Pomer vykuklenia
|
46.
|
Pomery vykuklenia sú kvantové údaje a môžu sa analyzovať pomocou Cochranovho-Armitageho testu aplikovaného zostupne v prípadoch, keď sa očakáva monotónna reakcia na dávku a tieto údaje zodpovedajú tomuto očakávaniu. Ak tomu tak nie je, možno použiť Fisherov exaktný test alebo Mantzelov-Haentzalov test s Bonferroniho-Holmovou úpravou hodnôt p. Ak sa medzi replikátmi pri rovnakej koncentrácii preukáže väčšia variabilita, než akú by indikovala binomická distribúcia (často sa uvádza ako ‚extra-binomická‘ variácia), potom by sa mal použiť podrobný Cochranov-Armitageho test alebo Fisherov exaktný test, ako sa navrhuje v bode (21).
|
|
47.
|
Určí sa súčet pakomárov vykuklených na jednu nádobu, ne, a vydelí sa počtom zavedených lariev, na:

kde:
|
ER
|
=
|
pomer vykuklenia,
|
|
ne
|
=
|
počet pakomárov vykuklených na nádobu,
|
|
na
|
=
|
počet zavedených lariev na nádobu.
|
|
|
48.
|
Najvhodnejšou alternatívou pri veľkých vzorkách v prípadoch extra binomickej variácie je brať pomer vykuklenia (ER) ako nepretržitú reakciu a použiť postupy, ako je napríklad Williamsov test, ak sa očakáva monotónna reakcia na dávku, ktorá je konzistentná s týmito údajmi o ER. Ak reakcia nie je monotónna, je vhodný Dunnettov test. Za veľkú vzorku sa pokladá vzorka, v ktorej je počet vykuklených aj počet nevykuklených jedincov v každom replikáte (nádobe) vyšší ako päť.
|
|
49.
|
Pri aplikovaní metód ANOVA je potrebné najskôr transformovať hodnoty ER pomocou arkussínusovej transformácie druhej odmocniny alebo Freemanovej-Tukeyho transformácie s cieľom získať približnú normálnu distribúciu a vyrovnať rozptyly. Cochranov-Armitageho test, Fisherov exaktný (Bonferroniho) test alebo Mantelov-Haenszelov test možno aplikovať, ak sa použijú absolútne frekvencie. Arkussínusová transformácia druhej odmocniny sa aplikuje pomocou prevrátenej hodnoty sínusu (sin–1) druhej odmocniny ER.
|
|
50.
|
Pri pomeroch vykuklenia sa hodnoty ECx vypočítajú pomocou regresnej analýzy (alebo napr. pomocou modelov probit (22), logit, Weibull, vhodného komerčného softvéru atď.). Ak je regresná analýza neúspešná (napr. ak sú k dispozícii menej ako dve čiastkové reakcie), použijú sa iné neparametrické metódy, ako je metóda pohyblivého priemeru alebo jednoduchá interpolácia.
|
Vývojový pomer
|
51.
|
Stredný vývojový čas predstavuje stredné časové rozpätie medzi zavedením lariev (deň 0 testu) a vykuklením pokusnej kohorty pakomárov. (Pri výpočte reálneho vývojového času sa zohľadní vek lariev v čase zavedenia). Vývojový pomer je prevrátená hodnota vývojového času (jednotka: 1/deň) a predstavuje časť vývinu lariev, ktorá prebieha za deň. Pri hodnotení týchto štúdií toxicity v sedimente sa uprednostňuje vývojový pomer, lebo jeho rozptyl je nižší a v porovnaní s vývojovým časom je homogénnejší a bližší normálnej distribúcii. Výkonné parametrické testovacie postupy teda možno lepšie použiť s vývojovým pomerom ako s vývojovým časom. Pre vývojový pomer ako nepretržitú reakciu možno hodnoty ECx odhadnúť pomocou regresnej analýzy [napr. (23) (24)].
|
|
52.
|
Pri nasledujúcich štatistických testoch sa predpokladá, že počet pakomárov pozorovaných v kontrolnom dni × sa vykuklil v strednom časovom intervale medzi dňom × a dňom x - l (l = dĺžka kontrolného intervalu, zvyčajne jeden deň). Stredný vývojový pomer na nádobu x) sa vypočíta podľa tejto rovnice:
kde:
|

|
:
|
stredný vývojový pomer na nádobu,
|
|
i
|
:
|
index kontrolného intervalu,
|
|
m
|
:
|
maximálny počet kontrolných intervalov,
|
|
|
:
|
počet pakomárov vykuklených v kontrolnom intervale i,
|
|
ne
|
:
|
celkový počet pakomárov vykuklených na konci pokusu (=  ), ),
|
|
xi
|
:
|
vývojový pomer pakomárov vykuklených v intervale i;
|

kde:
|
deňi
|
:
|
kontrolný deň (dni od aplikácie),
|
|
li
|
:
|
dĺžka kontrolného intervalu i (dni, zvyčajne jeden deň).
|
|
Správa o teste
|
53.
|
Správa o teste musí obsahovať aspoň tieto informácie:
|
|
Testovaná látka:
|
—
|
fyzikálny charakter a, ak je to relevantné, fyzikálno-chemické vlastnosti (rozpustnosť vo vode, tlak pary, rozdeľovací koeficient v pôde (alebo v sedimente, ak je k dispozícii), stabilita vo vode atď.),
|
|
—
|
chemické identifikačné údaje (bežný názov, chemický názov, štrukturálny vzorec, číslo CAS atď.) vrátane čistoty a analytickej metódy kvantifikácie testovanej látky.
|
|
|
|
Testovacie druhy:
|
—
|
použité testovacie zvieratá: druh, vedecký názov, zdroj organizmov a podmienky chovu,
|
|
—
|
informácie o manipulácii s vajíčkovými masami a larvami,
|
|
—
|
vek testovacích zvierat pri umiestnení do testovacích nádob.
|
|
|
|
Podmienky testovania:
|
—
|
použitý sediment, t. j. prírodný alebo umelo pripravený sediment,
|
|
—
|
v prípade prírodného sedimentu poloha a opis miesta odobratia vzoriek sedimentu vrátane histórie kontaminácie, ak je to možné, charakteristiky: pH, obsah organického uhlíka, pomer C/N a granulometria (podľa potreby),
|
|
—
|
príprava umelo pripraveného sedimentu: zložky a charakteristiky (obsah organického uhlíka, pH, vlhkosť atď. na začiatku testu),
|
|
—
|
príprava testovacej vody (ak sa použije rekonštituovaná voda) a charakteristiky (koncentrácia kyslíka, pH, vodivosť, tvrdosť atď. na začiatku testu),
|
|
—
|
výška sedimentu a nadložnej vody,
|
|
—
|
objem nadložnej a pórovej vody, hmotnosť mokrého sedimentu s pórovou vodou a bez nej,
|
|
—
|
testovacie nádoby (materiál a veľkosť),
|
|
—
|
metóda prípravy zásobných roztokov a testovacích koncentrácií,
|
|
—
|
aplikácia testovanej látky: použité testovacie koncentrácie, počet replikátov a prípadné použitie rozpúšťadiel,
|
|
—
|
inkubačné podmienky: teplota, svetelný cyklus a intenzita, prevdzušňovanie (frekvencia a intenzita),
|
|
—
|
podrobné informácie o kŕmení vrátane druhu potravy, prípravy, množstva a kŕmneho režimu.
|
|
|
|
Výsledky:
|
—
|
nominálne testovacie koncentrácie, namerané testovacie koncentrácie a výsledky všetkých analýz na stanovenie koncentrácie testovanej látky v testovacej nádobe,
|
|
—
|
kvalita vody v testovacích nádobách, t. j. pH, teplota, rozpustený kyslík, tvrdosť a amoniak,
|
|
—
|
kompenzácia prípadnej vyparenej testovacej vody,
|
|
—
|
počet vykuklených samčích a samičích pakomárov na nádobu na deň,
|
|
—
|
počet lariev na nádobu, ktoré sa nevykuklili,
|
|
—
|
stredná suchá hmotnosť jednotlivých lariev na nádobu a na instar podľa potreby,
|
|
—
|
percentuálne vykuklenie na replikát a testovaciu koncentráciu (samčie a samičie pakomáre spolu),
|
|
—
|
stredný vývojový pomer úplne vykuklených pakomárov na replikát a miera ošetrenia (samčie a samičie pakomáre spolu),
|
|
—
|
odhady toxických parametrov, napr. ECx (a súvisiace intervaly spoľahlivosti), NOEC a/alebo LOEC a štatistické metódy použité na ich stanovenie,
|
|
—
|
rozbor výsledkov vrátane každého vplyvu na výsledok testu vyplývajúceho z odchýlok od tejto testovacej metódy.
|
|
|
LITERATÚRA
|
1.
|
BBA (1995). Long-term toxicity test with Chironomus riparius: Development and validation of a new test system. Upravili M. Streloke a H. Köpp. Berlín 1995.
|
|
2.
|
Fleming, R. a kol. (1994). Sediment Toxicity Tests for Poorly Water-Soluble Substances. Záverečná správa pre Európsku komisiu. Správa č.: EK, 3738. August 1994. WRc, UK.
|
|
3.
|
SETAC (1993). Guidance Document on Sediment toxicity Tests and Bioassays for Freshwater and Marine Environments. Zo seminára WOSTA, ktorý sa uskutočnil v Holandsku.
|
|
4.
|
ASTM International/E1706-00 (2002). Test Method for Measuring the Toxicity of Sediment-Associated Contaminants with Freshwater Invertebrates, s. 1125 – 1241. In ASTM International 2002 Annual Book of Standards. Volume 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
|
|
5.
|
Environment Canada (1997). Test for Growth and Survival in Sediment using Larvae of Freshwater Midges (Chironomus tentans or Chironomus riparius). Biological Test Method. Report SPE 1/RM/32. December 1997.
|
|
6.
|
US-EPA (2000). Methods for Measuring the Toxicity and Bioaccumulation of Sediment-associated Contaminants with Freshwater Invertebrates. Druhé vydanie. EPA 600/R-99/064. Marec 2000. Revízia prvého vydania z júna 1994.
|
|
7.
|
US-EPA/OPPTS 850.1735. (1996): Whole Sediment Acute Toxicity Invertebrates.
|
|
8.
|
US-EPA/OPPTS 850.1790. (1996): Chironomid Sediment toxicity Test.
|
|
9.
|
Milani, D., Day, K. E., McLeay, D. J., Kirby, R. S. (1996). Recent intra- and inter-laboratory studies related to the development and standardisation of Environment Canada’s biological test methods for measuring sediment toxicity using freshwater amphipods (Hyalella azteca) and midge larvae (Chironomus riparius). Technical Report. Environment Canada. National Water Research Institute. Burlington, Ontario, Kanada.
|
|
10.
|
Sugaya, Y. (1997). Intra-specific variations of the susceptibility of insecticides in Chironomus yoshimatsui. Jp. J. Sanit. Zool. 48 (4): 345 – 350.
|
|
11.
|
Kawai, K. (1986). Fundamental studies on Chironomid allergy. I. Culture methods of some Japanese Chironomids (Chironomidae, Diptera). Jp. J. Sanit. Zool. 37(1): 47 – 57.
|
|
12.
|
OECD (2000). Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. OECD Environment, Health and Safety Publications, Series on Testing and Assessment No. 23.
|
|
13.
|
Environment Canada (1995). Guidance Document on Measurement of Toxicity Test Precision Using Control Sediments Spiked with a Reference Toxicant. Report EPS 1/RM/30. September 1995.
|
|
14.
|
Kapitola C.8 tejto prílohy, Toxicita pre dážďovky.
|
|
15.
|
Suedel, B. C., a Rodgers, J. H. (1994). Development of formulated reference sediments for freshwater and estuarine sediment testing. Environ. Toxicol. Chem. 13: 1163 – 1175.
|
|
16.
|
Naylor, C., a Rodrigues, C. (1995). Development of a test method for Chironomus riparius using a formulated sediment. Chemosphere 31: 3291 – 3303.
|
|
17.
|
Dunnett, C. W. (1964). A multiple comparisons procedure for comparing several treatments with a control. J. Amer. Statis. Assoc. 50: 1096 – 1121.
|
|
18.
|
Dunnett, C. W. (1964). New tables for multiple comparisons with a control. Biometrics 20: 482 – 491.
|
|
19.
|
Williams, D. A. (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27: 103 – 117.
|
|
20.
|
Williams, D. A. (1972). The comparison of several dose levels with a zero dose control. Biometrics 28: 510 – 531.
|
|
21.
|
Rao, J. N. K., a Scott, A. J. (1992). A simple method for the analysis of clustered binary data. Biometrics 48: 577 – 585.
|
|
22.
|
Christensen, E. R. (1984). Dose-response functions in aquatic toxicity testing and the Weibull model. Water Research 18: 213 – 221.
|
|
23.
|
Bruce a Versteeg (1992). A statistical procedure for modelling continuous toxicity data. Environmental Toxicology and Chemistry 11: 1485 – 1494.
|
|
24.
|
Slob, W. (2002). Dose-response modelling of continuous endpoints. Toxicol. Sci. 66: 298 – 312.
|
Dodatok 1
VYMEDZENIE POJMOV
Na účely tejto metódy sa používajú tieto vymedzenia pojmov:
|
|
Umelo pripravený sediment alebo rekonštituovaný, umelý alebo syntetický sediment je zmes materiálov použitých na napodobnenie fyzických zložiek prírodného sedimentu.
|
|
|
Nadložná voda je voda umiestnená v testovacej nádobe nad sedimentom.
|
|
|
Intersticiálna voda alebo pórová voda je voda nachádzajúca sa v priestore medzi časticami sedimentu a pôdy.
|
|
|
Obohatená voda je voda, do ktorej bola pridaná testovaná látka.
|
|
|
Testovaná chemikália: akákoľvek látka alebo zmes testovaná pomocou tejto testovacej metódy.
|
Dodatok 2
Odporúčania ku kultúre Chironomus riparius
|
1.
|
Larvy rodu Chironomus sa môžu chovať v kryštalizačných miskách alebo vo väčších nádobách. Na dno nádoby sa nanesie tenká vrstva jemného kremenného piesku vo výške 5 – 10 mm. Je preukázané, že vhodným substrátom je aj diatomit (napr. Merck, článok 8117) (postačuje tenšia vrstva do výšky len niekoľkých milimetrov). Potom sa pridá vhodná voda do výšky niekoľkých centimetrov. Hladiny vody by sa mali podľa potreby dopĺňať, aby sa kompenzovala strata vyparením a aby sa predišlo vysychaniu. Vodu je možné v prípade potreby vymeniť. Je potrebné zabezpečiť jemné prevzdušňovanie. Misky na chov lariev by mali byť umiestnené vo vhodnej klietke, ktorá zabráni úniku vykuklených dospelých jedincov. Klietka by mala byť dostatočne veľká, aby umožňovala rojenie vykuklených dospelých jedincov, v opačnom prípade by nemuselo dôjsť ku kopulácii (minimálna veľkosť je asi 30 × 30 × 30 cm).
|
|
2.
|
Klietky je potrebné udržiavať pri izbovej teplote alebo v miestnosti so stálym prostredím pri teplote 20 ± 2 °C so svetlou fázou v trvaní 16 hodín (intenzita asi 1 000 luxov) a fázou tmy v trvaní osem hodín. Je preukázané, že vlhkosť vzduchu nižšia ako 60 % RH môže brániť reprodukcii.
|
Riediaca voda
|
3.
|
Možno použiť akúkoľvek vhodnú prírodnú alebo syntetickú vodu. Bežne sa používa studňová voda, odchlórovaná voda z vodovodu a umelé médiá (napr. Elendtovo médium ‚M4‘ alebo ‚M7‘, pozri ďalej). Pred použitím je potrebné vodu prevzdušniť. V prípade potreby možno kultivačnú vodu obnoviť opatrným odliatím alebo odčerpaním použitej vody z kultivačných nádob bez toho, aby sa poškodili trubice lariev.
|
Kŕmenie lariev
|
4.
|
Larvy rodu Chironomus sa kŕmia vločkovým krmivom pre ryby [Tetra Min®, Tetra Phyll® alebo inou podobnou značkou patentovaného krmiva pre ryby] približným množstvom 250 mg na nádobu na deň. Krmivo sa môže podávať ako suchý rozomletý prášok alebo ako suspenzia vo vode: 1,0 g vločkového krmiva sa pridá do 20 ml riediacej vody a premieša sa, aby sa získala homogénna zmes. Tento prípravok sa môže podávať v množstve približne 5ml na nádobu na deň (pred použitím pretrepať). Staršie larvy môžu dostávať viac.
|
|
5.
|
Kŕmenie sa upraví podľa kvality vody. Ak sa kultivačné médium zakalí, kŕmenie je potrebné obmedziť. Prídavky do krmiva sa musia starostlivo monitorovať. Nedostatok potravy spôsobí, že larvy sa budú presúvať k vodnému stĺpcu, a prebytok potravy spôsobí zvýšenie činnosti mikróbov a zníženie koncentrácií kyslíka. V obidvoch prípadoch môže dôjsť k zníženiu rastových pomerov.
|
|
6.
|
Pri založení nových kultivačných nádob sa môžu pridať aj bunky niektorých zelených rias (napr. Scenedesmus subspicatus, Chlorella vulgaris).
|
Kŕmenie vykuklených dospelých jedincov
|
7.
|
Z niektorých pokusov vyplýva, že ako potrava pre vykuklené dospelé jedince môže slúžiť vatový tampón napustený nasýteným sacharózovým roztokom.
|
Vykuklenie
|
8.
|
Pri teplote 20 ± 2 °C sa dospelé jedince začnú kukliť z nádoby na chov lariev po približne 13 – 15 dňoch. Samčeky sa ľahko rozlíšia podľa obrvených tykadiel.
|
Vajíčkové masy
|
9.
|
Keď sú v chovnej klietke prítomné dospelé jedince, vo všetkých nádobách na chov lariev je potrebné trikrát do týždňa kontrolovať kladenie želatínových vajíčkových más. Ak sú vajíčkové masy prítomné, opatrne sa odoberú. Mali by sa preniesť na malú misku so vzorkou kultivačnej vody. Vajíčkové masy sa použijú na založenie nových kultivačných nádob (napr. dve až štyri vajíčkové masy na nádobu) alebo sa použijú v testoch toxicity.
|
|
10.
|
Larvy prvého instaru by sa mali vyliahnuť po dvoch až troch dňoch.
|
Založenie nových kultivačných nádob
|
11.
|
Po vytvorení kultúr by malo byť možné založiť novú nádobu na kultiváciu lariev každý týždeň alebo menej často v závislosti od testovacích požiadaviek, pričom staršie nádoby sa po vykuklení dospelých pakomárov odstránia. Týmto spôsobom sa pri minimálnom riadení zabezpečí pravidelné dopĺňanie dospelých jedincov.
|
Príprava testovacích roztokov ‚M4‘ a ‚M7‘
|
12.
|
Elendt (1990) opísal médium ‚M4‘. Médium ‚M7‘ sa pripravuje ako médium ‚M4‘ s výnimkou látok označených v tabuľke 1, pre ktoré sú koncentrácie v médiu ‚M7‘ štyrikrát nižšie ako v médiu ‚M4‘. Publikácia o médiu ‚M7‘ je v štádiu prípravy (Elendt, osobná komunikácia). Testovací roztok by sa nemal pripraviť podľa Elendta a Biasa (1990), lebo koncentrácie NaSiO3.5H2O, NaNO3, KH2PO4 a K2HPO4 uvedené pre prípravu zásobných roztokov nie sú vhodné.
|
Príprava média ‚M7‘
|
13.
|
Každý zásobný roztok (I) sa pripraví jednotlivo a kombinovaný zásobný roztok (II) sa pripraví z týchto zásobných roztokov (I) (pozri tabuľku 1). Na prípravu média ‚M7‘ sa 50 ml z kombinovaného zásobného roztoku (II) a množstvá každého makronutričného zásobného roztoku uvedené v tabuľke 2 doplnia do 1 l deionizovanej vody. Vitamínový zásobný roztok sa pripraví pridaním troch vitamínov do deionizovanej vody, ako je uvedené v tabuľke 3, a krátko pred použitím sa do konečného média ‚M7‘ pridá 0,1 ml kombinovaného vitamínového zásobného roztoku. (Vitamínový zásobný roztok sa skladuje zmrazený v malých alikvotných častiach). Médium sa prevzdušňuje a stabilizuje.
Tabuľka 1
Zásobné roztoky stopových prvkov pre médiá M4 a M7
|
Zásobné roztoky (I)
|
Množstvo (mg) doplnené do jedného litra deionizovanej vody
|
Na prípravu kombinovaného zásobného roztoku (II) sa zmiešajú tieto množstvá (ml) zásobných roztokov (I) a doplnia sa do jedného litra deionizovanej vody
|
Konečné koncentrácie v testovacích roztokoch (mg/l)
|
|
M4
|
M7
|
M4
|
M7
|
|
H3BO3
(18)
|
57 190
|
1,0
|
0,25
|
2,86
|
0,715
|
|
MnCl2 • 4 H2O (18)
|
7 210
|
1,0
|
0,25
|
0,361
|
0,090
|
|
LiCl (18)
|
6 120
|
1,0
|
0,25
|
0,306
|
0,077
|
|
RbCl (18)
|
1 420
|
1,0
|
0,25
|
0,071
|
0,018
|
|
SrCl2 • 6 H2O (18)
|
3 040
|
1,0
|
0,25
|
0,152
|
0,038
|
|
NaBr (18)
|
320
|
1,0
|
0,25
|
0,016
|
0,004
|
|
Na2MoO4 • 2 H2O (18)
|
1 260
|
1,0
|
0,25
|
0,063
|
0,016
|
|
CuCl2 • 2 H2O (18)
|
335
|
1,0
|
0,25
|
0,017
|
0,004
|
|
ZnCl2
|
260
|
1,0
|
1,0
|
0,013
|
0,013
|
|
CaCl2 • 6 H2O
|
200
|
1,0
|
1,0
|
0,010
|
0,010
|
|
KI
|
65
|
1,0
|
1,0
|
0,0033
|
0,0033
|
|
Na2SeO3
|
43,8
|
1,0
|
1,0
|
0,0022
|
0,0022
|
|
NH4VO3
|
11,5
|
1,0
|
1,0
|
0,00058
|
0,00058
|
|
Na2EDTA • 2 H2O (18)
(19)
|
5 000
|
20,0
|
5,0
|
2,5
|
0,625
|
|
FeSO4 • 7 H2O (18)
(19)
|
1 991
|
20,0
|
5,0
|
1,0
|
0,249
|
Tabuľka 2
Makronutričné zásobné roztoky pre médiá M4 a M7
|
|
Množstvo doplnené do jedného litra deionizovanej vody
(mg)
|
Množstvo pridaných makronutričných zásobných roztokov pri príprave médií M4 a M7
(ml/l)
|
Konečné koncentrácie v testovacích roztokoch M4 a M7
(mg/l)
|
|
CaCl2 • 2 H2O
|
293 800
|
1,0
|
293,8
|
|
MgSO4 • 7 H2O
|
246 600
|
0,5
|
123,3
|
|
KCl
|
58 000
|
0,1
|
5,8
|
|
NaHCO3
|
64 800
|
1,0
|
64,8
|
|
NaSiO3 • 9 H2O
|
50 000
|
0,2
|
10,0
|
|
NaNO3
|
2 740
|
0,1
|
0,274
|
|
KH2PO4
|
1 430
|
0,1
|
0,143
|
|
K2HPO4
|
1 840
|
0,1
|
0,184
|
Tabuľka 3
Vitamínový zásobný roztok pre médiá M4 a M7
Všetky tri vitamínové roztoky sa skombinujú, aby sa vytvoril jeden vitamínový zásobný roztok.
|
|
Množstvo doplnené do jedného litra deionizovanej vody
(mg)
|
Množstvo pridaného vitamínového zásobného roztoku pri príprave médií M4 a M7
(ml/l)
|
Konečné koncentrácie v testovacích roztokoch M4 a M7
(mg/l)
|
|
Tiamín hydrochlorid
|
750
|
0,1
|
0,075
|
|
Kyanokobalamín (B12)
|
10
|
0,1
|
0,0010
|
|
Biotín
|
7,5
|
0,1
|
0,00075
|
|
LITERATÚRA
BBA (1995). Long-term toxicity test with Chironomus riparius: Development and validation of a new test system. Upravili M. Streloke a H.Köpp. Berlín 1995.
Elendt, B. P. (1990). Selenium Deficiency in Crustacean. Protoplasma 154: 25 – 33.
Elendt, B. P., a Bias, W.-R. (1990). Trace Nutrient Deficiency in Daphnia magna Cultured in Standard Medium for Toxicity Testing. Effects on the Optimization of Culture Conditions on Life History Parameters of D. magna. Water Research 24 (9): 1157 – 1167.
Dodatok 3
PRÍPRAVA UMELO PRIPRAVENÉHO SEDIMENTU
Zloženie sedimentu
Zloženie umelo pripraveného sedimentu by malo byť takéto:
|
Zložka
|
Charakteristika
|
% suchej hmotnosti
sedimentu
|
|
Rašelina
|
Rašelinníková rašelina, pH čo najbližšie k 5,5 – 6,0, bez viditeľných zvyškov rastlín, jemne rozomletá (veľkosť častíc ≤ 1 mm) a usušená vzduchom
|
4 – 5
|
|
Kremenný piesok
|
Veľkosť zrniek: > 50 % častíc by malo mať veľkosť v rozsahu 50 – 200 μm
|
75 – 76
|
|
Kaolín
|
Obsah kaolinitu ≥ 30 %
|
20
|
|
Organický uhlík
|
Upravený pridaním rašeliny a piesku
|
2 (± 0,5)
|
|
Uhličitan vápenatý
|
CaCO3, rozomletý na prach, chemicky čistý
|
0,05 – 0,1
|
|
Voda
|
Vodivosť ≤ 10 μS/cm
|
30 – 50
|
Príprava
Rašelina sa usuší vzduchom a rozomelie na jemný prášok. V deionizovanej vode sa pomocou vysokovýkonného homogenizačného prístroja pripraví suspenzia požadovaného množstva rašelinového prášku. Hodnota pH tejto suspenzie sa upraví na 5,5 ± 0,5 pomocou CaCO3. Suspenzia sa aspoň na dva dni uvedie do podmienok jemným premiešavaním pri teplote 20 ± 2 °C, aby sa stabilizovala hodnota pH a vytvorila stabilná mikrobiálna zložka. Opäť sa zmeria pH, ktoré by malo byť na úrovni 6,0 ± 0,5. Rašelinová suspenzia sa následne zmieša s ostatnými zložkami (piesok a kaolín) a s deionizovanou vodou, aby sa získal homogénny sediment s obsahom vody v rozsahu 30 – 50 percent suchej hmotnosti sedimentu. Znova sa zmeria hodnota pH konečnej zmesi a podľa potreby sa pomocou CaCO3 upraví na 6,5 – 7,5. Odoberú sa vzorky sedimentu, aby sa určila suchá hmotnosť a obsah organického uhlíka. Následne sa odporúča, aby sa pred použitím v teste toxicity pri pakomároch umelo pripravený sediment uviedol na sedem dní do rovnakých podmienok, aké budú prevládať v nasledujúcom teste.
Skladovanie
Suché zložky na prípravu umelého sedimentu sa môžu skladovať na suchom a chladnom mieste pri izbovej teplote. Umelo pripravený (mokrý) sediment by sa pred použitím v teste nemal skladovať. Mal by sa použiť hneď po sedemdňovom období uvádzania do podmienok, ktorým sa končí jeho príprava.
LITERATÚRA:
Kapitola C.8 tejto prílohy. Toxicita pre dážďovky.
Meller M., Egeler P., Rombke J., Schallnass H., Nagel R., Streit B. (1998). Short-term Toxicity of Lindane, Hexachlorobenzene and Copper Sulfate on Tubificid Sludgeworms (Oligochaeta) in Artificial Media. Ecotox. and Environ. Safety 39: 10 – 20.
Dodatok 4
Chemické charakteristiky prijateľnej riediacej vody
|
Látka
|
Koncentrácie
|
|
Pevné častice
|
< 20 mg/l
|
|
Celkový organický uhlík
|
< 2 mg/l
|
|
Neionizovaný amoniak
|
< 1 μg/l
|
|
Tvrdosť ako CaCO3
|
< 400 mg/l (20)
|
|
Zostatkový chlór
|
< 10 μg/l
|
|
Celkové organofosfátové pesticídy
|
< 50 ng/l
|
|
Celkové organochlórované pesticídy plus polychlórované bifenyly
|
< 50 ng/l
|
|
Celkový organický chlór
|
< 25 ng/l
|
Dodatok 5
Usmernenie k monitorovaniu vykuklenia lariev pakomárov
Na testovacie kadičky sa umiestnia pasce na vykuklené jedince. Tieto pasce sú potrebné odo dňa 20 do skončenia testu. Ďalej je znázornený príklad použitej pasce.
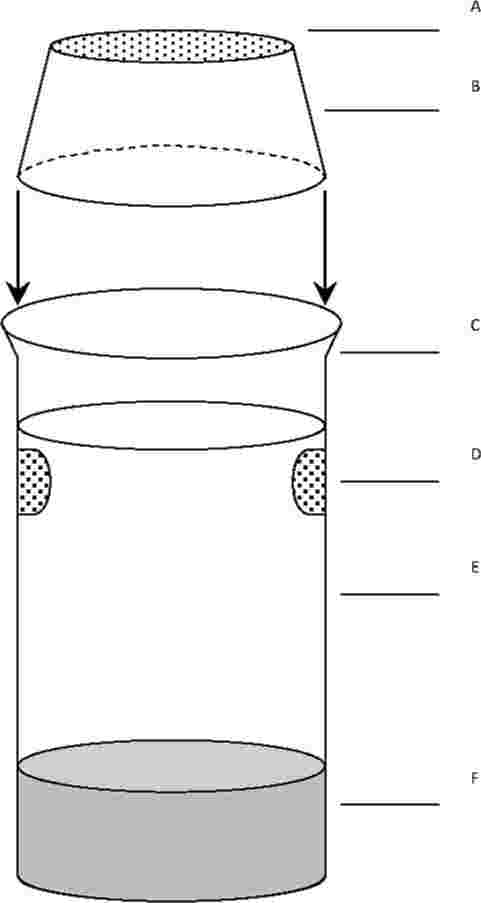
|
A
|
:
|
nylonová sieťka
|
|
B
|
:
|
prevrátené umelohmotné misky
|
|
C
|
:
|
expozičná kadička bez okraja
|
|
D
|
:
|
sieťované otvory na výmenu vody
|
|
E
|
:
|
voda
|
|
F
|
:
|
sediment
|
C.29. ĽAHKÁ BIODEGRADOVATEĽNOSŤ – CO2 V HERMETICKY UZAVRETÝCH NÁDOBÁCH (TEST V UZAVRETOM PRIESTORE NAD KVAPALINOU)
ÚVOD
|
1.
|
Táto testovacia metóda je rovnocenná s Usmerneniami OECD na vykonávanie testov (TG) 310 (2003). Táto testovacia metóda je skríningovou metódou na hodnotenie ľahkej biodegradovateľnosti chemikálií a poskytuje podobné informácie ako šesť testovacích metód opísaných v kapitole C.4 tejto prílohy A až F. Chemikáliu, pri ktorej sa v tejto testovacej metóde preukážu pozitívne výsledky, možno preto považovať za ľahko biodegradovateľnú, a teda za rýchlo degradovateľnú v životnom prostredí.
|
|
2.
|
Zvyčajne bola prvou voľbou na testovanie slabo rozpustných chemikálií a chemikálií, ktoré silne adsorbujú, osvedčená metóda (1) oxidu uhličitého (CO2) založená na Sturmovom pôvodnom teste (2) na hodnotenie biodegradovateľnosti organických chemikálií meraním oxidu uhličitého vytváraného mikrobiálnym pôsobením. Vyberá sa aj v prípade rozpustných (ale nie prchavých) chemikálií, lebo uvoľňovanie oxidu uhličitého mnohí považujú za jediný jednoznačný dôkaz mikrobiálnej činnosti. Rozpustený organický uhlík možno odstrániť fyzikálno-chemickými procesmi (adsorpciou, vyparením, zrážaním, hydrolýzou), ako aj mikrobiálnym pôsobením, pričom mnohé nebiologické reakcie spotrebúvajú kyslík. V zriedkavých prípadoch sa CO2 z organických chemikálií tvorí abioticky. V pôvodnom a modifikovanom Sturmovom teste (1) (2) sa CO2 odstráni z tekutej fázy do absorbujúcich nádob čerením (t. j. bublajúcim vzduchom aplikovaným s cieľom odstrániť CO2 cez tekuté médium), zatiaľ čo v Larsonovej verzii (3) (4) sa CO2 prevedie z reakčnej nádoby do absorbérov púšťaním vzduchu bez obsahu CO2 cez uzavretý priestor nad kvapalinou a ďalej nepretržitým pretrepávaním testovacej nádoby. Reakčná nádoba sa pretrepáva iba v Larsonovej modifikácii. Premiešavanie je v ISO 9439 (5) a v pôvodnej americkej verzii (6) špecifikované iba pre nerozpustné látky, pričom obe normy špecifikujú skôr čerenie namiesto výmeny uzavretého priestoru nad kvapalinou. V ďalšej oficiálnej metóde USA EPA (7) založenej na Gledhillovej metóde (8) sa pretrepávaná reakčná nádoba uzavrie pred ovzduším a vyprodukované CO2 sa hromadí vo vnútornom alkalickom zachytávači priamo z plynnej fázy podobne ako v prípade klasických Warburgových/Barcroftových respirometrických baniek.
|
|
3.
|
Ukázalo sa však, že počas aplikácie štandardného modifikovaného Sturmovho testu na viaceré chemikálie sa v médiu hromadí anorganický uhlík (IC) (9). Počas degradácie 20 mg C/l anilínu bola zistená koncentrácia IC až 8 mg/l. Hromadenie CO2 v alkalických zachytávačoch preto nezodpovedalo reálnemu množstvu mikrobiologicky vyprodukovaného CO2 v medzičasoch počas degradácie. Špecifikácia, podľa ktorej na to, aby sa testovaná chemikália klasifikovala ako ľahko biodegradovaná, sa musí počas ‚desaťdňového okna‘ (desať dní nasledujúcich ihneď po dosiahnutí 10 % biodegradácie) nahromadiť > 60 % teoretickej maximálnej produkcie CO2 (ThCO2), nebude splnená v prípade niektorých chemikálií, ktoré by takto boli klasifikované po použití eliminácie rozpusteného organického uhlíka (DOC).
|
|
4.
|
Ak je percentuálna degradácia nižšia, ako sa očakáva, je možné, že IC sa akumuloval v testovacom roztoku. Degradovateľnosť sa potom môže hodnotiť pomocou iných testov ľahkej biodegradovateľnosti.
|
|
5.
|
Ďalšie nedostatky Sturmovej metodiky (náročnosť vykonania, náročnosť na čas, náchylnosť k chybám pri pokusoch a nemožnosť použitia v prípade prchavých chemikálií) dali podnet k skúmaniu metódy uzavretej nádoby, ktorá by bola iná ako Gledhillova a ktorá by nahradila prúdenie plynu (10) (11). Boatman a kolektív (12) vyhodnotili predchádzajúce metódy a zaviedli systém uzavretého priestoru nad kvapalinou, v ktorom sa CO2 na konci inkubácie uvoľňoval do priestoru nad kvapalinou prostredníctvom okysľovania média. CO2 sa meral plynovou chromatografiou (GC)/analýzou IC vo vzorkách automaticky odoberaných z priestoru nad kvapalinou, ale nezohľadňoval sa rozpustený anorganický uhlík (DIC) v tekutej fáze. Takisto použité nádoby boli veľmi malé (20 ml) a obsahovali iba 10 ml média, čo spôsobovalo problémy napr. pri pridávaní nevyhnutne veľmi malých množstiev nerozpustných testovaných chemikálií a/alebo problém s mikroorganizmami schopnými degradovať testovanú chemikáliu, ktoré mohli byť v inokulovanom médiu prítomné v nedostatočnom množstve alebo vôbec.
|
|
6.
|
Tieto problémy prekonali nezávislé štúdie Struijsa a Stoltenkampa (13) a Bircha a Fletchera (14), pričom druhých menovaných inšpirovali ich skúsenosti so zariadením používaným v teste anaeróbnej biodegradácie (15). V prvej metóde (13) sa CO2 meria v priestore nad kvapalinou po acidifikácii a vyrovnaní, zatiaľ čo v druhej metóde (14) sa meria DIC v plynnej aj tekutej fáze bez ošetrenia. Vyše 90 % vytvoreného IC sa vyskytovalo v tekutej fáze. Obidve metódy majú oproti Sturmovmu testu výhody v tom, že testovací systém je kompaktnejší a ovládateľnejší, môžu sa testovať prchavé chemikálie a predišlo sa možnosti oneskorenia v meraní vyprodukovaného CO2.
|
|
7.
|
Tieto dva prístupy boli skombinované do normy ISO o CO2 v uzavretom priestore nad kvapalinou (16), ktorá bola podrobená kruhovým testom (17), a práve táto norma predstavuje základ uvedenej testovacej metódy. Tieto dva prístupy sa podobne využili v metóde USA EPA (18). Odporúčajú sa dve metódy merania CO2, konkrétne CO2 v uzavretom priestore nad kvapalinou po acidifikácii (13) a IC v tekutej fáze po pridaní prebytočných alkálií. Druhú uvedenú metódu predstavil Peterson počas kruhového testu CONCAWE (19) tejto metódy uzavretého priestoru nad kvapalinou, ktorá bola modifikovaná na meranie inherentnej biodegradovateľnosti. Zmeny vykonané pri revízii metód z roku 1992 (20) v kapitole C.4 tejto prílohy týkajúce sa ľahkej biodegradovateľnosti boli začlenené do tejto testovacej metódy tak, aby podmienky (médium, trvanie atď.) boli inak rovnaké ako podmienky v revidovanom Sturmovom teste (20). Birch a Fletcher (14) preukázali, že pri tomto teste uzavretého priestoru nad kvapalinou sa dosiahli veľmi podobné výsledky, aké sa s rovnakými chemikáliami dosiahli v kruhovom teste OECD (21) revidovaných testovacích metód.
|
PRINCÍP TESTU
|
8.
|
Testovaná chemikália, zvyčajne v koncentrácii 20 mg C/l, sa ako jediný zdroj uhlíka a energie inkubuje v tlmivom médiu s obsahom minerálnych solí, ktoré bolo inokulované zmiešanou populáciou mikroorganizmov. Test prebieha v hermeticky uzavretých fľašiach s priestorom nad kvapalinou obsahujúcim vzduch, ktorý predstavuje rezervoár kyslíka pre aeróbnu biodegradáciu. Uvoľňovanie CO2, ktoré je dôsledkom úplnej aeróbnej biodegradácie testovanej chemikálie, sa stanoví meraním množstva IC vyprodukovaného v testovacích fľašiach, ktoré presahuje množstvo IC vyprodukované v slepých kontrolných nádobách obsahujúcich iba inokulované médium. Rozsah biodegradácie je vyjadrený ako percento teoretickej maximálnej produkcie IC (ThIC) založené na množstve testovanej chemikálie (ako organického uhlíka) pridanej na začiatku testu.
|
|
9.
|
Takisto možno odmerať aj elimináciu DOC a/alebo rozsah primárnej biodegradácie testovanej chemikálie (20).
|
INFORMÁCIE O TESTOVANEJ CHEMIKÁLII
|
10.
|
Je potrebné poznať obsah organického uhlíka (hmotnostné percento) v testovanej chemikálii buď z jej chemickej štruktúry, alebo na základe merania, aby bolo možné vypočítať percentuálnu degradáciu. V prípade prchavých testovaných chemikálií je na stanovenie vhodného pomeru priestoru nad kvapalinou k objemu kvapaliny užitočná nameraná alebo vypočítaná Henryho konštanta. Pri výbere vhodnej testovacej koncentrácie a pri interpretácii výsledkov poukazujúcich na slabú biodegradovateľnosť sú užitočné informácie o toxicite testovanej chemikálie na mikroorganizmy: pokiaľ nie je známe, že testovaná chemikália nemá na mikrobiálnu činnosť inhibičné účinky, odporúča sa zahrnúť kontrolu inhibície (pozri odsek 24).
|
POUŽITEĽNOSŤ METÓDY
|
11.
|
Test možno použiť na testované chemikálie rozpustné vo vode a na nerozpustné testované chemikálie, je však potrebné zabezpečiť dobrú disperziu testovanej chemikálie. Pri použití odporúčaného pomeru priestoru nad kvapalinou k objemu kvapaliny 1: 2 možno testovať prchavé chemikálie s Henryho konštantou do 50 Pa.m3.mol–1, lebo podiel testovanej chemikálie v uzavretom priestore nad kvapalinou nepresiahne 1 % (13). Pri testovaní prchavejších chemikálií možno použiť menší objem priestoru nad kvapalinou, ale ich biodostupnosť môže byť obmedzujúca, najmä ak sú slabo rozpustné vo vode. Používatelia však musia zabezpečiť, aby pomer priestoru nad kvapalinou k objemu kvapaliny a koncentrácia testovanej chemikálie boli také, aby bol k dispozícii dostatok kyslíka, ktorý umožňuje úplnú aeróbnu biodegradáciu (napr. sa treba vyhnúť používaniu vysokej koncentrácie substrátu a malého objemu priestoru nad kvapalinou). Usmernenia k tejto téme sú uvedené v bodoch (13) (23).
|
REFERENČNÉ CHEMIKÁLIE
|
12.
|
Na kontrolu postupu testovania sa súbežne testuje referenčná chemikália so známou biodegradovateľnosťou. Na tento účel možno pri testovaní chemikálií rozpustných vo vode použiť anilín, benzoan sodný alebo etylénglykol a pri testovaní slabo rozpustných chemikálií 1-oktanol (13). Biodegradácia týchto chemikálií musí v priebehu 14 dní dosiahnuť úroveň > 60 % ThIC.
|
REPRODUKOVATEĽNOSŤ
|
13.
|
V ISO kruhovom teste metódy (17) sa pri použití odporúčaných podmienok vrátane 20 mg C testovanej chemikálie/l získali tieto výsledky.
|
Testovaná chemikália
|
Stredná percentuálna biodegradácia
(28 d)
|
Variačný koeficient
(%)
|
Počet laboratórií
|
|
Anilín
|
90
|
16
|
17
|
|
1-oktanol
|
85
|
12
|
14
|
Variabilita v rámci testu (replikovateľnosť) pri použití anilínu bola takmer vo všetkých uskutočnených testoch v prípade variačných koeficientov nepresahujúcich 5 % nízka. V dvoch prípadoch, v ktorých bola replikovateľnosť horšia, bola väčšia variabilita pravdepodobne spôsobená vysokou produkciou IC v slepých kontrolných nádobách. Replikovateľnosť bola horšia v prípade 1-oktanolu, ale stále bola v 79 % uskutočnených testov pod úrovňou 10 %. Táto väčšia variabilita v rámci testu mohla byť spôsobená chybami v dávkovaní, lebo do hermeticky uzavretých testovacích fliaš sa musel vstreknúť malý objem (3 – 4 μl) 1-oktanolu. Pri použití nižších koncentrácií testovanej chemikálie by výsledné variačné koeficienty boli vyššie, a to najmä pri koncentráciách nižších ako 10 mg C/l. Čiastočne možno tento problém vyriešiť znížením koncentrácie celkového anorganického uhlíka (TIC) v inokule.
|
|
14.
|
Kruhový test EÚ (24) piatich povrchovo aktívnych činidiel pridávaných v koncentrácii 10 mg C/l priniesol tieto výsledky:
|
Testovaná chemikália
|
Stredná percentuálna biodegradácia
(28 d)
|
Variačný koeficient
(%)
|
Počet laboratórií
|
|
Tetrapropylén
Benzénsulfonát
|
17
|
45
|
10
|
|
Di-izo-oktylsulfo-sukcinát
(aniónový)
|
72
|
22
|
9
|
|
Hexadecyltrimetyl- (21)
amónium chlorid
(katiónový)
|
75
|
13
|
10
|
|
Izo-nonylfenol-(etoxylát)9
(neiónový)
|
41
|
32
|
10
|
|
Koko-amid-propyl
dimetylhydroxy
sulfobetaín
(amfotérny)
|
60
|
23
|
11
|
Z výsledkov vyplýva, že vo všeobecnosti bola variabilita vyššia v prípade horšie degradovaných povrchovo aktívnych činidiel. Variabilita v rámci testu bola nižšia ako 15 % vo vyše 90 % prípadov, pričom najvyššia úroveň dosiahla 30 – 40 %.
|
Poznámka:
|
Väčšina povrchovo aktívnych činidiel nie sú jednomolekulové substancie, ale zmesi izomérov, homológov atď., ktoré degradujú po rôznych charakteristických lag obdobiach a pri rôznych kinetických rýchlostiach, čo vedie k ‚nejasným‘ podhodnoteným krivkám, takže hodnota úspešnosti 60 % sa v rámci ‚desaťdňového okna‘ nemusí dosiahnuť, ani v prípade, že by každá individuálna molekulárna substancia pri samostatnom testovaní za desať dní dosiahla úroveň > 60 %. Tento jav možno pozorovať aj pri iných komplexných zmesiach.
|
|
OPIS METÓDY
Zariadenie
|
15.
|
Bežné laboratórne zariadenie a:
|
a)
|
sklenené sérové fľaše hermeticky uzavreté butylovými gumenými zátkami a tesniacimi hliníkovými uzávermi. Odporúčaná veľkosť je 125 ml, pričom celkový objem je približne 160 ml (v tomto prípade by mal známy objem každej fľaše byť 160 ± 1 ml). Menšie nádoby možno použiť, ak výsledky spĺňajú podmienky uvedené v odsekoch 66 a 67;
|
|
b)
|
uhlíkový analyzátor alebo iný prístroj (napr. plynový chromatograf) na meranie anorganického uhlíka;
|
|
c)
|
striekačky s vysokou presnosťou na plynné a kvapalné vzorky;
|
|
d)
|
orbitálna trepačka v prostredí s kontrolovanou teplotou;
|
|
e)
|
prívod vzduchu bez obsahu CO2 – môže sa pripraviť púšťaním vzduchu cez granule nátronového vápna alebo použitím plynnej zmesi 80 % N2/20 % 02 (nepovinné) (pozri odsek 28);
|
|
f)
|
membránové filtračné zariadenie s pórovitosťou 0,20 – 0,45 μm (nepovinné);
|
|
g)
|
analyzátor organického uhlíka (nepovinné).
|
|
Činidlá
|
16.
|
Vždy sa používajú analyticky čisté činidlá.
|
Voda
|
17.
|
Používa sa destilovaná alebo deionizovaná voda s obsahom celkového organického uhlíka ≤ 1 mg/l. Táto hodnota predstavuje ≤ 5 % počiatočného obsahu organického uhlíka pridaného v odporúčanej dávke testovanej chemikálie.
|
Zásobné roztoky pre médium s obsahom minerálnych solí
|
18.
|
Zásobné roztoky a médium s obsahom minerálnych solí sú podobné tým, ktoré sú špecifikované v norme ISO 14593 (16) a v testoch ‚ľahkej biodegradovateľnosti‘ v kapitole C.4 (20). Použitie vyššej koncentrácie chloridu amónneho (2,0 g/l namiesto 0,5 g/l) je nutné iba vo výnimočných prípadoch, napr. ak je koncentrácia testovanej chemikálie > 40 mg C/l. Zásobné roztoky sú uskladnené v chlade a mali by sa zlikvidovať po šiestich mesiacoch alebo skôr, ak vykazujú známky zrážania alebo mikrobiálneho rastu. Pripravia sa tieto zásobné roztoky:
|
a)
|
dihydrogénfosforečnan draselný (KH2PO4) 8,50 g,
hydrogénfosforečnan draselný (K2HPO4) 21,75 g,
dihydrát hydrogénfosforečnanu disodného (Na2HPO4.2H2O) 33,40 g,
chlorid amónny (NH4Cl) 0,50 g.
Rozpustí sa vo vode a doplní na jeden liter. Hodnota pH tohto roztoku by mala byť 7,4 (± 0,2). Ak tomu tak nie je, pripraví sa nový roztok;
|
|
b)
|
dihydrát chloridu vápenátého (CaCl2.2H2O) 36,40 g.
Rozpustí sa vo vode a doplní na jeden liter;
|
|
c)
|
heptahydrát síranu horečnatého (MgSO4.7H2O) 22,50 g.
Rozpustí sa vo vode a doplní na jeden liter;
|
|
d)
|
chlorid železitý hexahydrát (FeCl3.6H20) 0,25 g.
Rozpustí sa vo vode a doplní na jeden liter, pričom sa pridá jedna kvapka koncentrovaného roztoku.
|
|
Príprava minerálneho média
|
19.
|
Zmieša sa 10 ml roztoku v písmene a) s približne 800 ml vody (odsek 17), potom sa pridá 1 ml roztokov v písmenách b), c) a d) a doplní vodou (odsek 17) na jeden liter.
|
Iné činidlá
|
20.
|
Koncentrovaná kyselina trihydrogénfosforečná (H3PO4) (> 85 % hmotnosti na objem).
|
Roztok hydroxidu sodného 7 M
|
21.
|
V jednom litri vody sa rozpustí 280 g hydroxidu sodného (NaOH) (odsek 17). Určí sa koncentrácia DIC tohto roztoku a táto hodnota sa zohľadní pri výpočte výsledkov testu (pozri odseky 55 a 61), najmä v súvislosti s kritériom platnosti podľa odseku 66 písm. b). Ak je koncentrácia DIC príliš vysoká, pripraví sa nový roztok.
|
Testovaná chemikália
|
22.
|
Vo vode (odsek 17) alebo v testovacom médiu (odsek 19) sa pripraví zásobný roztok testovanej chemikálie, ktorá je dostatočne rozpustná vo vode, s koncentráciou pokiaľ možno stokrát vyššou, ako je konečná koncentrácia, ktorá sa použije v teste. Môže byť potrebné upraviť pH zásobného roztoku. Zásobný roztok sa pridá do minerálneho média, aby sa dosiahla konečná koncentrácia organického uhlíka medzi 2 a 40 mg C/l, ideálne 20 mg C/l. Použitie nižších ako uvedených koncentrácií môže mať za následok nižšiu presnosť. Rozpustné a nerozpustné kvapalné chemikálie možno do nádob pridávať priamo pomocou striekačiek s vysokou presnosťou. Slabo rozpustné a nerozpustné testované chemikálie môžu vyžadovať osobitné postupy (25). Možnosti sú tieto:
|
a)
|
priame pridanie známych odvážených množstiev;
|
|
b)
|
ultrazvuková disperzia pred pridaním;
|
|
c)
|
disperzia pomocou emulgujúcich činidiel potrebná na zistenie inhibičných alebo stimulačných účinkov na mikrobiálnu činnosť pred pridaním;
|
|
d)
|
adsorpcia kvapalnej testovanej chemikálie alebo roztoku vo vhodnom prchavom rozpúšťadle, na inertnom médiu alebo nosnom materiáli (napr. filter zo sklenených vlákien), po ktorej nasleduje odparenie rozpúšťadla, ak sa použilo, a priame pridanie známych množstiev;
|
|
e)
|
pridanie známeho objemu roztoku testovanej chemikálie vo vysokoprchavom rozpúšťadle do prázdnej testovacej nádoby a následné odparenie rozpúšťadla.
|
Činidlá alebo rozpúšťadlá použité v písmenách c), d) a e) je potrebné testovať na zistenie akýchkoľvek stimulačných alebo inhibičných účinkov na mikrobiálnu činnosť [pozri odsek 42 písm. b)].
|
Referenčná chemikália
|
23.
|
Vo vode sa pripraví zásobný roztok (rozpustnej) referenčnej chemikálie (odsek 17), s koncentráciou, pokiaľ možno stokrát vyššou, ako je konečná koncentrácia, ktorá sa použije (20 mg C/l) v teste.
|
Kontrola inhibície
|
24.
|
Testované chemikálie v podmienkach použitých pri hodnotení ľahkej biodegradácie často nevykazujú významnú degradáciu. Jednou z možných príčin je skutočnosť, že testovaná chemikália v koncentrácii, v ktorej sa aplikuje v teste, má na inokulum inhibičné účinky. Do koncepcie testu sa môže zahrnúť kontrola inhibície s cieľom umožniť identifikáciu (pri spätnom pohľade) inhibície ako možnej príčiny alebo prispievajúceho faktora. Kontrolou inhibície možno prípadne takéto interferencie vylúčiť a preukázať, že nulovú alebo nepatrnú degradáciu možno pripísať výhradne rezistencii voči mikrobiálnemu napadnutiu v podmienkach testu. Na účely získania informácií o toxických účinkoch testovanej chemikálie na (aeróbne) mikroorganizmy sa pripraví roztok v testovacom médiu obsahujúci testovanú chemikáliu a referenčnú chemikáliu (odsek 19), každý v rovnakej koncentrácii, v akej sa pridáva (pozri odsek 22 a 23).
|
Inokulum
|
25.
|
Inokulum možno získať z rôznych zdrojov: aktivovaný kal, výtok splaškových vôd (nechlórovaný), povrchové vody a pôdy alebo zmes uvedeného (20). Biodegradačnú činnosť zdroja treba skontrolovať pomocou referenčnej chemikálie. Ak sa daný postup použije ako test ľahkej biodegradovateľnosti, bez ohľadu na zdroj by sa nemali použiť mikroorganizmy, ktoré boli predtým exponované testovanej chemikálii.
|
Upozornenie:
|
Aktivovaný kal, splaškové vody a výtok splaškových vôd obsahujú choroboplodné organizmy a je nutné s nimi zaobchádzať opatrne.
|
|
|
26.
|
Na základe skúseností je optimálny objem inokula taký, ktorý:
|
—
|
je dostatočný na zabezpečenie primeranej biodegradačnej činnosti,
|
|
—
|
degraduje referenčnú chemikáliu o stanovené percento (pozri odsek 66),
|
|
—
|
poskytuje 102 – 105 jednotiek tvoriacich kolónie na mililiter v konečnej zmesi,
|
|
—
|
zvyčajne poskytuje koncentráciu 4 mg/l suspendovaných tuhých látok v konečnej zmesi pri použití aktivovaného kalu; môžu sa použiť koncentrácie do 30 mg/l, ale tie môžu významne zvýšiť produkciu CO2 v slepých kontrolných nádobách (26),
|
|
—
|
predstavuje menej ako 10 % počiatočnej koncentrácie organického uhlíka zavedeného testovanou chemikáliou,
|
|
—
|
predstavuje vo všeobecnosti 1 – 10 ml inokula na jeden liter testovacieho roztoku.
|
|
Aktivovaný kal
|
27.
|
Odoberie sa čerstvá vzorka aktivovaného kalu z prevzdušňovacej nádrže čističky odpadových vôd alebo z laboratórnej jednotky, ktoré spracúvajú prevažne domáce splaškové vody. V prípade potreby sa cedením odstránia hrubé častice (napr. pomocou cedidla, ktorého oká majú veľkosť 1 mm2) a kal sa až do použitia uskladňuje v aeróbnych podmienkach.
|
|
28.
|
Po odstránení hrubých častíc sa prípadne nechá sedimentovať alebo sa odstredí (napr. 1 100 × g na 10 minút). Supernatantová kvapalina sa zleje. Kal sa môže premyť v minerálnom roztoku. Koncentrovaný kal sa suspenduje v minerálnom médiu s cieľom získať koncentráciu 3 – 5 g suspendovaných tuhých látok/l. Následne sa prevzdušňuje podľa potreby.
|
|
29.
|
Kal sa odoberie zo správne pracujúcej čističky. Ak sa musí kal odobrať z vysokostupňovej čističky alebo je možné, že obsahuje inhibítory, mal by sa premyť. Po dôkladnom premiešaní sa sedimentuje alebo odstredí resuspendovaný kal, odstráni sa supernatantová kvapalina a premytý kal znovu suspenduje v ďalšom objeme minerálneho média. Tento postup sa opakuje, kým sa z kalu neodstráni nadbytočný substrát alebo inhibítor.
|
|
30.
|
Z úplne resuspendovaného alebo neošetreného kalu sa odoberie vzorka tesne pred použitím na stanovenie suchej hmotnosti suspendovaných tuhých látok.
|
|
31.
|
Ďalšou alternatívou je homogenizácia aktivovaného kalu (3 – 5 g suspendovaných tuhých látok/l). Kal sa prevzdušňuje v mixéri Waring dve minúty pri strednej rýchlosti. Zmiešaný kal sa nechá sedimentovať 30 minút, alebo ak je to potrebné, aj dlhšie, a dekantuje sa kvapalinou na nižšie použitie ako inokulum v množstve 10 mg/l minerálneho média.
|
|
32.
|
Ďalšie zníženie uvoľňovania čistého CO2 možno dosiahnuť prevzdušňovaním kalu počas noci vzduchom bez obsahu CO2. Ako inokulum sa v tomto teste použije koncentrácia 4 mg/l tuhých látok aktivovaného kalu (13).
|
Sekundárny výtok splaškových vôd
|
33.
|
Inokulum možno prípadne získať zo sekundárneho výtoku čističky alebo z laboratórnej jednotky, ktoré prevažne spracúvajú domáce splaškové vody. Vzorka sa udržiava v aeróbnych podmienkach a použije sa v deň odberu alebo sa podľa potreby aklimatizujte. Výtok sa prefiltruje cez hrubý filter, aby sa odstránili hrubé pevné častice, a odmeria sa hodnota pH.
|
|
34.
|
Filtrát sa s cieľom zníženia obsahu IC počas jednej hodiny čerí vzduchom bez obsahu CO2 [odsek 15 písm. e)], pričom hodnota pH sa udržiava na úrovni 6,5 pomocou kyseliny trihydrogénfosforečnej (odsek 20). Hodnota pH sa zmení na pôvodnú úroveň pomocou hydroxidu sodného (odsek 21) a po približne hodinovej sedimentácii sa odoberie vhodné množstvo supernatantu na inokuláciu. Týmto postupom čerenia sa znižuje obsah IC v inokule. Napríklad ak sa ako inokulum použil maximálny odporúčaný objem filtrovaného čereného výtoku (100 ml) na liter, množstvo IC prítomné v slepých kontrolných nádobách bolo v rozsahu 0,4 – 1,3 mg/l (14), čo predstavuje 2 – 6,5 % C testovanej chemikálie pri 20 mg C/l a 4 – 13 % pri 10 mg C/l.
|
Povrchové vody
|
35.
|
Z vhodnej povrchovej vody sa odoberie vzorka. Mala by sa udržiavať v aeróbnych podmienkach a použiť v deň odberu. Vzorka sa podľa potreby koncentruje filtráciou alebo odstredením. Objem inokula, ktoré sa použije v každej testovacej nádobe, by mal spĺňať kritériá uvedené v odseku 26.
|
Pôda
|
36.
|
Z maximálnej hĺbky 20 cm pod pôdnym povrchom sa odoberie vzorka vhodnej pôdy. Skôr než sa vzorka pôdy preoseje cez sito s veľkosťou ôk 2 mm, odstránia sa z nej kamene, zvyšky rastlín a bezstavovcov (ak je vzorka príliš mokrá a nie je možné ju ihneď preosiať, čiastočne sa usuší vzduchom, aby sa uľahčilo preosievanie). Vzorka sa udržiava v aeróbnych podmienkach a použije sa v deň odberu. (Ak sa vzorka prenáša vo voľne uviazanom čiernom polyetylénovom vreci, možno ju v tomto vreci skladovať pri teplote 2 – 4 °C až jeden mesiac).
|
Aklimatizácia inokula
|
37.
|
Inokulum sa môže aklimatizovať na experimentálne podmienky, ale nie predadaptovať na testovanú chemikáliu. Aklimatizáciou možno znížiť uvoľňovanie čistého CO2. Aklimatizácia pozostáva z prevzdušňovania aktivovaného kalu po zriedení v testovacom médiu na úroveň 30 mg/l pomocou vlhkého vzduchu bez obsahu CO2 v trvaní päť až sedem dní pri testovacej teplote.
|
POSTUP TESTOVANIA
Počet fliaš
|
38.
|
Počet fliaš [odsek 15 písm. a)] potrebný na test bude závisieť od frekvencie analýz a trvania testu.
|
|
39.
|
Odporúča sa analyzovať trojice fliaš po dostatočnom počte časových intervalov, aby sa mohlo určiť desaťdňové okno. Na konci testu sa takisto analyzuje najmenej päť testovacích fliaš [odsek 15 písm. a)] zo súborov fliaš v písmenách a), b) a c) (pozri odsek 42) s cieľom umožniť výpočet 95 % intervalov spoľahlivosti pre strednú hodnotu percentuálnej biodegradácie.
|
Inokulované médium
|
40.
|
Inokulum sa použije pri koncentrácii 4 mg/l suchých tuhých látok v aktivovanom kale. Tesne pred použitím sa pripraví dostatočne inokulované médium pridaním napríklad 2 ml vhodne upraveného aktivovaného kalu (odseky 27 – 32) s koncentráciou 2 000 mg/l do jedného litra média s obsahom minerálnych solí (odsek 19). Ak sa použije sekundárny výtok splaškových vôd, maximálne 100 ml výtoku (odsek 33) sa pridá do 900 ml média s obsahom minerálnych solí (odsek 19) a zriedi sa médiom na jeden liter.
|
Príprava fliaš
|
41.
|
Alikvotné časti inokulovaného média sa rozdelia do paralelných fliaš tak, aby bol pomer priestoru nad kvapalinou ku kvapaline 1: 2 (napr. sa pridá 107 ml do fliaš s kapacitou 160 ml). Možno použiť aj iné pomery, ale treba venovať pozornosť varovaniu uvedenému v odseku 11. Bez ohľadu na použité inokulum je nutné sa uistiť, že inokulované médium je dostatočne premiešané, aby sa zabezpečila jeho rovnomerná distribúcia do fliaš.
|
|
42.
|
Pripravia sa súbory fliaš [odsek 15 písm. a)], ktoré obsahujú:
|
a)
|
testovacie nádoby (označené FT) obsahujúce testovanú chemikáliu;
|
|
b)
|
slepé kontrolné nádoby (označené FB) obsahujúce iba testovacie médium a inokulum; takisto sa musia pridať všetky chemikálie, rozpúšťadlá, činidlá alebo filtre zo sklenených vlákien, ktoré sa použili na zavedenie testovanej chemikálie do testovacích nádob;
|
|
c)
|
nádoby (označené FC) na kontrolu postupu obsahujúce referenčnú chemikáliu;
|
|
d)
|
v prípade potreby nádoby (označené FI) na kontrolu možných inhibičných účinkov testovanej chemikálie obsahujúce testovanú chemikáliu aj referenčnú chemikáliu v rovnakých koncentráciách (odsek 24) ako vo fľašiach FT a FC;
|
|
e)
|
nádoby (označené FS) na kontrolu možnej abiotickej degradácie ako v písmene a) plus 50 mg/l HgCl2 alebo sterilizované inými prostriedkami (napr. v autokláve).
|
|
|
43.
|
Vo vode rozpustné testované chemikálie a referenčné chemikálie sa pridajú ako vodné zásobné roztoky (odseky 22, 23 a 24), aby sa dosiahla koncentrácia 10 – 20 mg C/l.
|
|
44.
|
Nerozpustné testované chemikálie a nerozpustné referenčné chemikálie sa pridajú do fliaš rôznymi spôsobmi [pozri odsek 22 písm. a) – e)] podľa charakteru testovanej chemikálie pred alebo po pridaní inokulovaného média v závislosti od metódy aplikácie testovanej chemikálie. Ak sa použije jeden z postupov uvedených v odseku 22 písm. a) – e), potom by sa so slepými fľašami FB [odsek 42 písm. b)] malo naložiť podobným spôsobom, ale s vylúčením testovanej chemikálie alebo referenčnej chemikálie.
|
|
45.
|
Prchavé testované chemikálie sa pomocou mikrostriekačky vstreknú do hermeticky uzavretých fliaš (odsek 47). Dávka sa vypočíta zo vstreknutého objemu a hustoty testovanej chemikálie.
|
|
46.
|
Podľa potreby sa do nádob pridá voda, aby bol v každej nádobe rovnaký objem kvapaliny. Treba zabezpečiť, aby pomer priestoru nad kvapalinou ku kvapaline (zvyčajne 1: 2) a koncentrácia testovanej chemikálie boli nastavené tak, aby bol k dispozícii dostatok kyslíka, ktorý umožní úplnú biodegradáciu.
|
|
47.
|
Všetky fľaše sa potom hermeticky uzatvoria napríklad butylovými gumenými priehradkami a hliníkovými uzávermi. Prchavé testované chemikálie je potrebné pridať v tejto fáze (odsek 45). Na účely monitorovania poklesu koncentrácie DOC testovanej chemikálie a analýz, ktoré sa vykonávajú v nulovom čase pri počiatočnej koncentrácii IC [sterilné kontroly, odsek 42 písm. e)], alebo iných determinantov sa z testovacej nádoby odoberie primeraná vzorka. Testovacia nádoba a jej obsah sa následne zlikviduje.
|
|
48.
|
Hermeticky uzavreté fľaše sa umiestnia na rotačnú trepačku [odsek 15 písm. d)] s rýchlosťou pretrepávania, ktorá je dostatočná na to, aby obsahy fliaš ostali dobre premiešané a v suspenzii (napr. 150 – 200 rpm), a následne sa inkubujú v tme pri teplote 20 °C a skladujú pri tejto teplote v rozmedzí ± 1 °C.
|
Odber vzoriek
|
49.
|
Systém odberu vzoriek bude závisieť od lag fázy a kinetickej rýchlosti biodegradácie testovanej chemikálie. V deň odberu vzoriek sa fľaše zlikvidujú na účely analýzy, čo by sa malo vykonávať najmenej raz do týždňa alebo častejšie (napr. dvakrát do týždňa), ak sa požaduje úplná krivka degradácie. Z trepačky sa odoberie požadovaný počet paralelných fliaš predstavujúcich FT, FB a FC a, ak sa použili, FI a FS (pozri odsek 42). Test zvyčajne trvá 28 dní. Ak z biodegradačnej krivky vyplýva, že sa dosiahol rovnovážny stav pred uplynutím 28 dní, test môže byť ukončený skôr. Z piatich fliaš vyhradených na 28. deň testu sa odoberú vzorky na analýzu a výsledky sa použijú na výpočet limitov spoľahlivosti alebo variačného koeficientu percentuálnej biodegradácie. Z fliaš, ktoré slúžia ako kontroly inhibície a abiotickej degradácie, nie je potrebné odoberať vzorky tak často ako z ostatných fliaš; postačuje deň 1 a deň 28.
|
Analýza anorganického uhlíka (IC)
|
50.
|
Produkcia CO2 vo fľašiach sa zistí tak, že sa odmeria zvýšenie koncentrácie anorganického uhlíka (IC) počas inkubácie. Na meranie množstva IC vyprodukovaného v teste sú k dispozícii dve odporúčané metódy, ktoré sú opísané ďalej. Keďže výsledky týchto metód sa môžu mierne líšiť, v priebehu testu by sa mala použiť iba jedna.
|
|
51.
|
Metóda a) sa odporúča, ak médium pravdepodobne obsahuje napríklad zvyšky papiera zo skleneného filtra a/alebo nerozpustnej testovanej chemikálie. Ak nie je k dispozícii uhlíkový analyzátor, možno túto analýzu možno vykonať pomocou plynového chromatografu. Je dôležité, aby mali fľaše počas analýzy plynu v uzavretom priestore nad kvapalinou teplotu, ktorá je rovnaká alebo sa blíži k testovacej teplote. Metóda b) môže byť jednoduchšia pre laboratóriá, ktoré na meranie IC používajú uhlíkový analyzátor. Je dôležité, aby bol roztok hydroxidu sodného (odsek 21), ktorý sa použije na premenu CO2 na uhličitan, čerstvo pripravený alebo aby bol známy jeho obsah IC, takže bude možné ho zohľadniť pri výpočte výsledkov testu [pozri odsek 66 písm. b)].
|
Metóda a): acidifikácia na pH < 3
|
52.
|
Pred každou várkou analýz sa IC analyzátor nakalibruje pomocou vhodného štandardu IC (napr. 1 % hmotnostného CO2 v N2). Koncentrovaná kyselina trihydrogénfosforečná (odsek 20) sa vstrekne cez priehradku každej fľaše, z ktorej sa odoberá vzorka, s cieľom znížiť pH média na úroveň < 3 (napr. sa pridá 1 ml do 107 ml testovacieho média). Fľaše sa umiestnia späť do trepačky. Po jednohodinovom pretrepávaní pri testovacej teplote sa fľaše vyberú z trepačky, odoberú sa alikvotné časti (napr. 1 ml) plynu z uzavretého priestoru nad kvapalinou každej fľaše a vstreknú sa do IC analyzátora. Namerané koncentrácie IC sa zaznamenajú v jednotkách mg C/l.
|
|
53.
|
Princípom tejto metódy je, že po acidifikácii na pH < 3 a vyvážení pri teplote 20 °C je rovnovážna konštanta pre distribúciu CO2 medzi kvapalnou a plynnou fázou v testovacích fľašiach 1,0 v prípade, že sa meria ako koncentrácia (13). Tento fakt je potrebné pre testovací systém aspoň raz preukázať týmto spôsobom:
Založia sa fľaše obsahujúce 5 a 10 mg/l IC s využitím roztoku bezvodého uhličitanu sodného (Na2CO3) vo vode bez obsahu CO2, ktorý sa pripraví tak, že voda sa pomocou koncentrovanej kyseliny trihydrogénfosforečnej okyslí na pH 6,5 (odsek 20), počas noci sa čerí pomocou vzduchu bez obsahu CO2 a pomocou alkálie sa jeho pH zvýši na neutrálnu úroveň. Je potrebné zabezpečiť, aby bol pomer objemu uzavretého priestoru nad kvapalinou k objemu kvapaliny rovnaký ako v testoch (napr. 1 : 2). Obsah fliaš sa okyslí a vyváži podľa opisu v odseku 52 a odmeria sa koncentrácia IC v uzavretom priestore nad kvapalinou, ako aj v kvapalnej fáze. Skontroluje sa, či sú tieto dve koncentrácie v rozsahu pokusnej chyby rovnaké. Ak nie sú, pracovník by mal skontrolovať postupy. Túto kontrolu distribúcie IC medzi kvapalnou a plynnou fázou nie je potrebné vykonať počas každého testu. Pravdepodobne ju bude možné vykonať počas kalibrácie.
|
|
54.
|
Ak sa meria eliminácia DOC (iba testované chemikálie rozpustné vo vode), vzorky z kvapalnej fázy sa odoberú zo samostatných (neokyslených) fliaš, prefiltrujú sa cez membránu a vstreknú sa do analyzátora DOC. Tieto fľaše možno v prípade potreby použiť pri iných analýzach na meranie primárnej biodegradácie.
|
Metóda b): premena CO2 na uhličitan
|
55.
|
Pred každou várkou analýz sa IC analyzátor nakalibruje pomocou vhodného štandardu, ako je napríklad roztok hydrogénuhličitanu sodného (NaHCO3) vo vode bez obsahu CO2 (pozri odsek 53) v rozsahu 0 – 20 mg/l ako IC. Roztok hydroxidu sodného (7M, odsek 21) (napr. 1 ml do 107 ml média) sa vstrekne cez priehradku každej fľaše, z ktorej sa odoberajú vzorky, a fľaše sa nechajú pretrepávať pri testovacej teplote jednu hodinu. V prípade všetkých fliaš zlikvidovaných v daný deň sa použije rovnaký roztok NaOH, ale nemusí sa nevyhnutne použiť pri každom odbere vzoriek počas testu. Ak sa v čase každého odberu vzoriek požadujú absolútne hodnoty IC v slepých pokusoch, bude potrebné stanoviť IC roztoku NaOH pri každom použití. Fľaše sa vyberú z trepačky a nechajú sa sedimentovať. Striekačkou sa z každej nádoby odoberú vhodné objemy (napr. 50 – 1 000 μl) kvapalnej fázy. Vzorky sa vstreknú do IC analyzátora a zaznamenajú sa koncentrácie IC. Je potrebné zabezpečiť, aby bol použitý analyzátor správne vybavený na spracovanie zásaditých vzoriek produkovaných pri tejto metóde.
|
|
56.
|
Princípom tejto metódy je, že po pridaní alkálie a pretrepaní je koncentrácia IC v uzavretom priestore nad kvapalinou zanedbateľná. Tento fakt je pre testovací systém nutné aspoň raz skontrolovať pomocou štandardov IC, pridaním alkálie, vyvážením a odmeraním koncentrácie IC v uzavretom priestore nad kvapalinou, ako aj v kvapalnej fáze (pozri odsek 53). Koncentrácia v uzavretom priestore nad kvapalinou by sa mala blížiť nule. Túto kontrolu prakticky úplnej absorpcie CO2 nie je potrebné vykonávať pri každom teste.
|
|
57.
|
Ak sa meria eliminácia DOC (iba testované chemikálie rozpustné vo vode), vzorky z kvapalnej fázy sa odoberú zo samostatných fliaš (neobsahujúcich žiadne pridané alkálie), prefiltrujú sa cez membránu a vstreknú sa do analyzátora DOC. Tieto fľaše možno v prípade potreby použiť pri iných analýzach na meranie primárnej biodegradovateľnosti.
|
ÚDAJE A PODÁVANIE SPRÁV
Výpočet výsledkov
|
58.
|
Pri predpoklade stopercentnej mineralizácie testovanej chemikálie na CO2 sa nadbytočný ThIC vyprodukovaný v slepých kontrolných testoch rovná TOC pridanému do každej testovacej fľaše na začiatku testu, teda:

Celková hmotnosť (mg) anorganického uhlíka (TIC) v každej fľaši je:
|

|
rovnica [1]
|
kde:
|
VL
|
=
|
objem kvapaliny vo fľaši (litre),
|
|
CL
|
=
|
koncentrácia IC v kvapaline (mg/l ako uhlík),
|
|
VH
|
=
|
objem uzavretého priestoru nad kvapalinou (litre),
|
|
CH
|
=
|
koncentrácia IC v uzavretom priestore nad kvapalinou (mg/l ako uhlík).
|
Výpočty TIC pre dve analytické metódy použité na meranie IC v tomto teste sú opísané ďalej v odsekoch 60 a 61. Percentuálna biodegradácia (% D) sa v jednotlivých prípadoch vypočíta podľa vzorca:
|

|
rovnica [2]
|
kde:
|
TICt
|
=
|
mg TIC v testovacej fľaši v čase t,
|
|
TICb
|
=
|
stredná mg TIC v slepých kontrolných fľašiach v čase t,
|
|
TOC
|
=
|
mg TOC pridaná do testovacej nádoby na začiatku.
|
Z príslušných množstiev TIC vyprodukovaných do časov odberu sa vypočíta percentuálna biodegradácia, % D, pre testovacie (FT), referenčné (FC) a, ak sú zahrnuté, kontrolné (FI) fľaše na monitorovanie inhibície.
|
|
59.
|
Ak v priebehu testovacieho obdobia došlo k výraznému zvýšeniu obsahu TIC sterilných kontrolných fliaš (FS), potom možno vyvodiť záver, že došlo k abiotickej degradácii testovanej chemikálie, ktorú treba zohľadniť pri výpočte D v rovnici [2].
|
Acidifikácia na pH < 3
|
60.
|
Keďže acidifikácia na pH < 3 a vyvažovanie vedie k vyrovnaniu koncentrácie TIC v kvapalnej a plynnej fáze, stačí odmerať iba koncentráciu IC v plynnej fáze. Teda z rovnice [1]
, kde VB = objem sérovej fľaše. |
Premena CO2 na uhličitan
|
61.
|
Pri tejto metóde sú výpočty rovnaké ako v rovnici [1], ale zanedbateľné množstvo IC v plynnej fáze sa ignoruje, čiže

a

. |
Vyjadrenie výsledkov
|
62.
|
Krivka biodegradácie sa získa tak, že sa zakreslí percentuálna biodegradácia, D, v závislosti od času inkubácie a podľa možnosti sa naznačí lag fáza, biodegradačná fáza, desaťdňové okno a rovnovážna fáza, teda fáza, v ktorej sa dosiahla maximálna degradácia a krivka biodegradácie sa vyrovnala. Ak sa pre súbežné testovacie nádoby získajú porovnateľné výsledky FT (< 20 % rozdiel), zakreslí sa stredná krivka (pozri dodatok 2, obrázok 1), ak nie, krivky sa zakreslia pre každú nádobu. Stanoví sa stredná hodnota percentuálnej biodegradácie v rovnovážnej fáze alebo sa posúdi najvyššia hodnota (napr. keď krivka v rovnovážnej fáze klesá), ale je dôležité zvážiť, či v druhom prípade nejde o odľahlú hodnotu. Táto maximálna úroveň biodegradácie sa v správe o teste uvedie ako ‚stupeň biodegradácie testovanej chemikálie‘. Ak počet testovacích nádob nebol na naznačenie rovnovážnej fázy dostatočný, na výpočet strednej hodnoty sa použijú údaje namerané v posledný deň testu. Táto posledná hodnota, priemer piatich replikátov, slúži na určenie presnosti, s ktorou bola stanovená percentuálna biodegradácia. Do správy sa uvedie aj hodnota získaná na konci desaťdňového okna.
|
|
63.
|
Rovnakým spôsobom sa zakreslí krivka pre referenčnú chemikáliu, FC, a, ak je zahrnutá, pre abiotickú kontrolu eliminácie, FS, a kontrolu inhibície, FI.
|
|
64.
|
Zaznamenajú sa množstvá TIC prítomné v slepých kontrolných nádobách (FB), rovnako ako množstvá v bankách FS (abiotická kontrola), ak takéto nádoby boli zahrnuté do testu.
|
|
65.
|
Vypočíta sa D pre nádoby FI podľa teoretického nárastu IC očakávaného iba v dôsledku referenčnej zložky zmesi. Ak v deň 28 [(DFC
(22) – DFI
(23))/DFC] × 100 > 25 %, možno predpokladať, že testovaná chemikália potlačila činnosť inokula, čo mohlo viesť k nízkym hodnotám DFT získaným v podmienkach testu. V takom prípade možno test opakovať s využitím nižšej testovacej koncentrácie a podľa možnosti znížením DIC v inokule a TIC vytvorenej v slepých kontrolných nádobách, lebo nižšia koncentrácia bude mať inak za následok menšiu presnosť metódy. Prípadne možno použiť iné inokulum. Ak je vo fľaši FS (abiotická) pozorované výrazné zvýšenie (> 10 %) množstva TIC, mohlo dôjsť k abiotickým degradačným procesom.
|
Platnosť výsledkov
|
66.
|
Test sa považuje za platný, ak:
|
a)
|
stredná percentuálna degradácia v nádobách FC obsahujúcich referenčnú chemikáliu je > 60 % do 14. dňa inkubácie a
|
|
b)
|
stredné množstvo TIC prítomnej v slepých kontrolných nádobách FB na konci testu je > 3 mg C/l.
|
Ak tieto limity nie sú splnené, test by sa mal zopakovať s využitím inokula z iného zdroja a/alebo je potrebné preveriť použité postupy. Napríklad ak je problémom vysoká produkcia IC v slepých kontrolných nádobách, treba sa riadiť postupom uvedeným v odsekoch 27 – 32.
|
|
67.
|
Ak testovaná chemikália nedosiahne 60 % ThIC a preukáže sa, že nemá inhibičné účinky (odsek 65), test možno zopakovať pri vyššej koncentrácii inokula (až do 30 mg/l aktivovaného kalu a 100 ml výtoku/l) alebo s využitím inokúl z iných zdrojov, najmä ak bola degradácia v rozsahu 20 – 60 %.
|
Interpretácia výsledkov
|
68.
|
Biodegradácia > 60 % ThIC počas desaťdňového okna v tomto teste preukazuje, že testovaná chemikália ja ľahko biodegradovateľná v aeróbnych podmienkach.
|
|
69.
|
Ak sa nedosiahne hraničná hodnota 60 % ThIC, stanoví sa hodnota pH v médiách vo fľašiach, ktoré sa neacidifikovali ani nealkalizovali. Hodnota pod 6,5 môže znamenať, že došlo nitrifikácii. V takom prípade je potrebné test zopakovať s tlmivým roztokom vyššej koncentrácie.
|
Správa o teste
|
70.
|
Pre každý deň, v ktorom sa odoberali vzorky, sa zostaví tabuľka % D pre každú testovaciu (FT), referenčnú (FC) a, ak bola zahrnutá, inhibičnú kontrolnú fľašu (FI). Ak sa v prípade paralelných fliaš získajú porovnateľné výsledky, zakreslí sa krivka strednej hodnoty % D v závislosti od času. Zaznamená sa množstvo TIC v slepých kontrolných (FB) a v sterilných kontrolných nádobách (FS), DOC a/alebo ostatných determinantov a ich percentuálna eliminácia.
|
|
71.
|
Stanoví sa stredná hodnota % D v rovnovážnej fáze alebo v prípade, že biodegradačná krivka v rovnovážnej fáze klesá, sa použije najvyššia hodnota a táto hodnota sa v správe uvedie ako ‚stupeň biodegradácie testovanej chemikálie‘. Je dôležité zabezpečiť, aby v druhom prípade najvyššia hodnota nebola odľahlá.
|
|
72.
|
Správa o teste musí obsahovať tieto informácie:
|
|
Testovaná chemikália:
|
—
|
bežný názov, chemický názov, číslo CAS, štrukturálny vzorec a významné fyzikálno-chemické vlastnosti,
|
|
—
|
čistota (nečistoty) testovanej chemikálie.
|
|
|
|
Podmienky testovania:
|
—
|
odkaz na túto testovaciu metódu,
|
|
—
|
opis použitého testovacieho systému (napr. objem nádoby, pomer uzavretého priestoru nad kvapalinou a kvapaliny, metóda miešania atď.),
|
|
—
|
aplikácia testovanej chemikálie a referenčnej chemikálie v testovacom systéme: použitá testovacia koncentrácia a množstvo uhlíka dávkované do každej testovacej fľaše, použitie akýchkoľvek rozpúšťadiel,
|
|
—
|
údaje o použitom inokule, akomkoľvek predchádzajúcom ošetrení a aklimatizácii,
|
|
—
|
overenie princípu analýzy IC,
|
|
—
|
hlavné charakteristiky použitého IC analyzátora (a všetkých ostatných použitých analytických metód),
|
|
|
|
Výsledky:
|
—
|
nespracované údaje a vypočítané hodnoty biodegradovateľnosti v tabuľkovej forme,
|
|
—
|
graf percentuálnej degradácie v závislosti od času pre testovanú a referenčnú chemikáliu, lag fáza, fáza degradácie, desaťdňové okno a sklon,
|
|
—
|
percentuálna eliminácia v rovnováhe, na konci testu a po desaťdňovom okne,
|
|
—
|
dôvody pre akékoľvek odmietnutie testovacích výsledkov,
|
|
—
|
akékoľvek ďalšie skutočnosti, ktoré majú význam pre použitý postup,
|
|
|
LITERATÚRA
|
1.
|
Kapitola C.4 tejto prílohy, Stanovenie ‚ľahkej‘ biodegradovateľnosti – test uvoľňovania CO2 (metóda C.4-C).
|
|
2.
|
Sturm, R. N. (1973). Biodegradability of Nonionic surfactants: screening test for predicting rate and ultimate biodegradation. J.A,.Oil Chem Soc. 50: 159 – 167.
|
|
3.
|
Larson, R. J. (1979). Estimation of biodegradation potential of xenobiotic organic chemicals. Appl Env. Microbiol. 38: 1153 – 1161.
|
|
4.
|
Larson, R. J., Hansmann, M. A., a Bookland, E. A. (1996). Carbon dioxide recovery in ready biodegradability tests: mass transfer and kinetic constants, Chemosphere 33: 1195 – 1210.
|
|
5.
|
ISO 9439 (1990; revidované 1999). Kvalita vody. Hodnotenie úplnej aeróbnej biodegradability organických látok vo vodnom prostredí. Skúška tvorby oxidu uhličitého (Sturm)
|
|
6.
|
US EPA (1996). Fate, Transport and Transformation Test Guideline. 835. 3110 Carbon dioxide evolution test. Office, Prevention Pesticides and Toxic Substances Washington, DC.
|
|
7.
|
US EPA (1996). Fate, Transport and Transformation Test Guideline. 835. 3100. Aerobic aquatic biodegradation. Office, Prevention Pesticides and Toxic Substances Washington, DC.
|
|
8.
|
Gledhill, W. E. (1975). Screening test for assessment of biodegradability: Linear alkyl benzene sulfonate. Appl Microbiol. 30: 922 – 929.
|
|
9.
|
Weytjens, D., Van Ginneken, I., a Painter, H. A. (1994). The recovery of carbon dioxide in the Sturm test for ready biodegradability. Chemosphere 28: 801 – 812.
|
|
10.
|
Ennis, D. M., a Kramer, A. (1975). A rapid microtechnique for testing biodegradability of nylons and polyamides. J. Food Sci. 40: 181 – 185.
|
|
11.
|
Ennis, D. M., Kramer, A., Jameson, C. W., Mazzoccki, P. H., a Bailey, P. H. (1978). Appl. Env. Microbiol. 35: 51 – 53.
|
|
12.
|
Boatman, R. J., Cunningham, S. L., a Ziegler, D. A. (1986). A method for measuring the biodegradation of organic chemicals, Env. Toxicol. Chem. 5: 233 – 243.
|
|
13.
|
Struijs, J., a Stoltenkamp, J. (1990). Head space determination of evolved carbon dioxide in a biodegradability screening test. Ecotox. Env. Safety 19: 204 – 211.
|
|
14.
|
Birch, R. R., a Fletcher, R. J. (1991). The application of dissolved inorganic carbon measurements to the study of aerobic biodegradability. Chemosphere 23: 507 – 524.
|
|
15.
|
Birch, R. R., Biver, C., Campagna, R., Gledhill, W. E., Pagga, U., Steber, J., Reust, H., a Bontinck, W. J. (1989). Screening of chemicals for anaerobic biodegradation. Chemosphere 19: 1527 – 1550.
|
|
16.
|
ISO 14593, (1999) Kvalita vody. Hodnotenie úplnej aeróbnej biodegradability organických látok vo vodnom prostredí. Metóda analýzy uvoľneného anorganického uhlíka v uzavretých nádobách (skúška CO2 headspace)
|
|
17.
|
Battersby, N. S. (1997). The ISO headspace C02 biodegradation test, Chemosphere 34: 1813 – 1822.
|
|
18.
|
US EPA (1996). Fate, Transport and Transportation. 835.3120. Sealed vessel carbon dioxide production test. Office, Prevention Pesticides and Toxic Substance, Washington, DC.
|
|
19.
|
Battersby, N. S., Ciccognani, D., Evans, M. R., King, D., Painter, H. A., Peterson, D. R., a Starkey, M. (1999). An ‚inherent‘ biodegradability test for oil products: description and results of an international ring test. Chemosphere 38: 3219 – 3235.
|
|
20.
|
Kapitola C.4 tejto prílohy, Stanovenie ‚ľahkej‘ biodegradovateľnosti.
|
|
21.
|
OECD (1988). OECD Ring-test of methods for determining ready biodegradability: Správa predsedu (M. Hashimoto; MITI) a záverečná správa (M. Kitano a M. Takatsuki; CITI). Paríž.
|
|
22.
|
Kapitola C.11 tejto prílohy, Respiračno-inhibičný test aktivovaného kalu.
|
|
23.
|
Struijs, J., Stoltenkamp-Wouterse, M. J., a Dekkers, A. L. M. (1995). A rationale for the appropriate amount of inoculum in ready biodegradability tests. Biodegradation 6: 319 – 327.
|
|
24.
|
EÚ (1999). Ring-test of the ISO Headspace CO2 method: application to surfactants: Surfactant Ring Test-1, Report EU4697, Water Research Centre, máj 1999, Medmenham, SL7 2HD, Spojené kráľovstvo.
|
|
25.
|
ISO 10634 (1996) Kvalita vody. Pokyny na prípravu a spracovanie organických látok málo rozpustných vo vode na následné hodnotenie ich biodegradability vo vodnom prostredí.
|
Dodatok 1
SKRATKY A VYMEDZENIE POJMOV
IC: anorganický uhlík.
ThCO2: teoretický oxid uhličitý (mg) je vypočítané množstvo oxidu uhličitého, ktoré sa vytvorí zo známeho alebo odmeraného obsahu uhlíka v testovanej chemikálii, keď je kompletne mineralizovaná. Je vyjadrený aj ako mg oxidu uhličitého uvoľneného z mg testovanej chemikálie.
DOC: rozpustený organický uhlík je organický uhlík prítomný v roztoku alebo ten, ktorý prechádza cez 0,45-mikrometrový filter alebo ostáva v supernatante po odstredení pri cca. 4 000 g (približne 40 000 m s-2) počas 15 minút.
DIC: rozpustený anorganický uhlík.
ThIC: teoretický anorganický uhlík.
TIC: celkový anorganický uhlík.
Ľahko biodegradovateľné: dohodnutá klasifikácia chemikálií, ktoré prešli cez určité špecifické skríningové testy na úplnú biodegradovateľnosť. Tieto testy sú také prísne, že sa predpokladá, že takéto chemikálie sa budú rýchlo a úplne biodegradovať vo vodnom prostredí v aeróbnych podmienkach.
Desaťdňové okno: desať dní nasledujúcich ihneď po dosiahnutí 10 % degradácie.
Inherentná biodegradovateľnosť: klasifikácia chemikálií, pre ktoré existuje jednoznačný dôkaz ich biodegradácie (primárnej alebo úplnej) v každom teste na biodegradovateľnosť.
Úplná aeróbna biodegradácia: úroveň degradácie, ktorá sa dosiahne, keď testovanú chemikáliu úplne spotrebujú mikroorganizmy, čoho výsledkom je tvorba oxidu uhličitého, vody, minerálnych solí a nových mikrobiálnych bunkových zložiek (biomasy).
Mineralizácia: mineralizácia je úplná degradácia organickej chemikálie na CO2 a H2O v aeróbnych podmienkach a na CH4, CO2 a H2O v anaeróbnych podmienkach.
Lag fáza: dosiahnutý čas od začiatku testu do aklimatizácie a/alebo prispôsobenia degradujúcich mikroorganizmov a do zvýšenia stupňa biodegradácie testovanej chemikálie alebo organického materiálu na úroveň stanoviteľnosti (napr. 10 % maximálnej teoretickej biodegradácie alebo menej v závislosti od presnosti meracej techniky).
Fáza degradácie: čas od konca lag fázy až po čas, keď sa dosiahne 90 % maximálnej úrovne degradácie.
Rovnovážna fáza: rovnovážna fáza je fáza, v ktorej sa dosiahla maximálna degradácia a v ktorej je krivka biodegradácie vyrovnaná.
Testovaná chemikália: akákoľvek látka alebo zmes testovaná pomocou tejto testovacej metódy.
Dodatok 2
Príklad krivky biodegradácie
Obrázok 1
Biodegradácia 1-oktanolu v teste CO2 v uzavretom priestore nad kvapalinou

Glosár
Biodegradácia:
Fáza degradácie:
Maximálna úroveň biodegradácie:
Rovnovážna fáza:
Desaťdňové okno:
Čas testovania (dni):
C. 30. BIOAKUMULÁCIA PRI SUCHOZEMSKÝCH MÁLOŠTETINAVCOCH
ÚVOD
|
1.
|
Táto testovacia metóda je rovnocenná s Usmerneniami OECD na vykonávanie testov (TG) 317 (2010). Pokiaľ ide o testovacie metódy týkajúce sa environmentálneho osudu, Biokoncentrácia: prietokový rybí test [kapitola C.13 tejto prílohy (49)] bola uverejnená v roku 1996 a Bioakumulácia pri bentických máloštetinavcoch žijúcich v sedimente [kapitola C.51 tejto prílohy (53)] bola uverejnená v roku 2008. Extrapolácia údajov o vodnej bioakumulácii na suchozemské organizmy, ako sú dážďovky, je zložitá, resp. nemožná. Modelové výpočty založené na lipofilite testovanej chemikálie, napr. (14) (37), sa v súčasnosti využívajú na hodnotenie bioakumulácie chemikálií v pôde, ako napríklad v technickom usmerňovacom dokumente EÚ (19). Potrebe testovacej metódy špecifickej pre kompartmenty už bola venovaná pozornosť, napr. (55). Takáto metóda je dôležitá najmä pre hodnotenie sekundárnej otravy v suchozemských potravinových reťazcoch (4). Problému bioakumulácie v organizmoch iných ako ryby sa venuje niekoľko testovacích metód na vnútroštátnej úrovni, napr. (2) a (72). Metódu merania bioakumulácie pri dážďovkách a červoch čeľade Enchytraeidae (Eisenia fetida, Savigny) z kontaminovanej pôdy vypracovala Americká spoločnosť pre testovanie a materiály (American Society for Testing and Materials) (3). Medzinárodne uznávaná metóda na stanovenie bioakumulácie v obohatenej pôde prispeje k lepšiemu hodnoteniu rizík chemikálií v suchozemských ekosystémoch, napr. (25) (29).
|
|
2.
|
Bezstavovce požívajúce pôdu sú vystavené účinkom chemikálií naviazaných na pôdu. Medzi týmito zvieratami zohrávajú suchozemské máloštetinavce významnú úlohu v štruktúre a funkcii pôdy (15) (20). Suchozemské máloštetinavce žijú v pôde a čiastočne na pôdnom povrchu (najmä v nadložnom horizonte). Často predstavujú najhojnejšie zastúpený živočíšny druh v biomase (54). Tieto zvieratá vzhľadom na bioturbáciu pôdy a skutočnosť, že bývajú častou korisťou, významne ovplyvňujú biodostupnosť chemikálií pre iné organizmy, ako sú dravce patriace do skupiny bezstavovcov [napr. dravé roztoče a chrobáky, napr. (64)] alebo stavovcov (napr. líšky a čajky) (18) (62). Niektoré druhy suchozemských máloštetinavcov, ktoré sa v súčasnosti využívajú v ekotoxikologickom testovaní, sú opísané v dodatku 5.
|
|
3.
|
V štandardnej príručke ASTM na vykonávanie laboratórnych testov pôdnej toxicity alebo bioakumulácie pri dážďovkách druhu Eisenia fetida a červov čeľade Enchytraeidae druhu Enchytraeus albidus (3) sa uvádza mnoho základných a užitočných informácií týkajúcich sa postupu tejto testovacej metódy bioakumulácie v pôde. Medzi ďalšie dokumenty, ktoré sú uvedené v tejto testovacej metóde, patrí kapitola C.13 tejto prílohy, Biokoncentrácia: prietokový rybí test (49) a kapitola C.51 tejto prílohy: Bioakumulácia pri bentických máloštetinavcoch žijúcich v sedimente (53). Ďalší významný zdroj informácií o tejto testovacej metóde predstavujú aj praktické skúsenosti so štúdiami bioakumulácie v pôde a publikácie uvedené v literatúre, napr. (1) (5) (11) (12) (28) (40) (43) (45) (57) (59) (76) (78) (79).
|
|
4.
|
Túto testovaciu metódu možno použiť najmä v prípade stabilných, neutrálnych organických chemikálií, ktoré sa zvyčajne adsorbujú na pôde. Pomocou tejto testovacej metódy možno testovať bioakumuláciu stabilných organokovových zlúčenín, ktoré sa viažu na pôdu. Možno ju použiť aj na kovy a iné stopové prvky.
|
PREDPOKLADANÉ PODMIENKY
|
5.
|
Testy na meranie bioakumulácie chemikálie pri suchozemských máloštetinavcoch boli vykonané s ťažkými kovmi [pozri napr. (63)] a perzistentnými, organickými chemikáliami s hodnotami log Kow od 3,0 do 6,0, napr. (40). Takéto testy sa vzťahujú aj na:
|
—
|
chemikálie, ktoré vykazujú nízky log Kow vyšší ako 6,0 (superhydrofóbne chemikálie),
|
|
—
|
chemikálie patriace do triedy organických chemikálií, o ktorých je známe, že majú potenciál sa bioakumulovať v živých organizmoch, napr. povrchovo aktívne alebo vysokoadsorpčné chemikálie,
|
|
—
|
chemikálie, ktoré vykazujú potenciál bioakumulácie vzhľadom na štruktúrne charakteristiky, napr. analógy chemikálií, pri ktorých je známy potenciál bioakumulácie, a
|
|
|
6.
|
Informácie o testovanej chemikálii, ako je bežný názov, chemický názov (podľa možnosti názov IUPAC), štrukturálny vzorec, registračné číslo CAS, čistota, bezpečnostné opatrenia, vhodné podmienky skladovania a analytické metódy, je potrebné získať pred začiatkom štúdie. Okrem toho je nutné poznať tieto informácie:
|
b)
|
rozdeľovací koeficient oktanol – voda, Kow;
|
|
c)
|
rozdeľovací koeficient pôda – voda, vyjadrený ako Koc;
|
|
e)
|
degradovateľnosť (napr. v pôde, vo vode);
|
|
|
7.
|
Možno použiť rádiooznačené testované chemikálie alebo chemikálie bez rádiooznačenia. Na uľahčenie analýzy sa však odporúča použiť rádiooznačenú testovanú chemikáliu. Rozhodnutie bude závisieť od detekčných limitov alebo od požiadavky na meranie materskej testovanej chemikálie a metabolitov. Ak sa použije rádiooznačená testovaná chemikália a merajú sa celkové rádioaktívne rezíduá, je dôležité, aby sa rádiooznačené rezíduá v pôde aj v testovacích organizmoch charakterizovali prostredníctvom určenia percenta materskej testovanej chemikálie a percenta označenej nematerskej chemikálie, napr. vo vzorkách odobratých v rovnovážnom stave alebo na konci fázy absorpcie, aby bolo možné vypočítať bioakumulačný faktor (BAF) pre danú materskú testovanú chemikáliu a pre metabolity v pôde (pozri odsek 50). Metódu, ktorá je tu opísaná, možno modifikovať, napr. na účely zabezpečenia dostatočnej biomasy, na meranie organickej testovanej chemikálie bez rádiooznačenia alebo v prípade kovov. Ak sa merajú celkové rádioaktívne rezíduá (prostredníctvom kvapalinovej scintilačnej spektroskopie nasledujúcej po extrakcii, horení alebo stabilizácii tkaniva), bioakumulačný faktor je založený na materskej testovanej chemikálii a metabolitoch. Výpočet BAF by podľa možnosti mal vychádzať z koncentrácie materskej testovanej chemikálie v organizmoch a celkových rádioaktívnych rezíduí. Následne sa na účely porovnateľnosti medzi výsledkami rôznych testov bioakumulácie na základe BAF vypočíta akumulačný faktor bioty k pôde (BSAF) normalizovaný na obsah lipidov v červoch a obsah organického uhlíka (OC) v pôde.
|
|
8.
|
Toxicita testovanej chemikálie pre živočíšny druh použitý v teste by mala byť známa, napr. účinná koncentrácia (ECx) alebo letálna koncentrácia (LCx) počas fázy absorpcie [napr. (19)]. Vybratá koncentrácia testovanej chemikálie by podľa možnosti mala predstavovať približne 1 % jej akútnej asymptotickej LC50 a mala by byť najmenej desaťkrát vyššia ako jej detekčný limit v pôde pri použitej analytickej metóde. Prednostne by sa mali použiť hodnoty toxicity získané z dlhodobých štúdií o subletálnych parametroch, pokiaľ sú k dispozícii (51) (52). Ak takéto údaje nie sú dostupné, užitočné informácie prinesie test akútnej toxicity [pozri napr. (23)].
|
|
9.
|
Mala by byť k dispozícii vhodná analytická metóda známej správnosti, presnosti a citlivosti na kvantifikáciu chemikálie v testovacích roztokoch, v pôde a v biologickom materiáli, ako aj údaje o príprave a skladovaní vzoriek a karty bezpečnostných údajov o materiáli. Treba poznať aj analytické detekčné limity testovanej látky v pôde a v tkanivách červov. Ak sa použije testovaná chemikália označená 14C, je nutné poznať špecifickú rádioaktivitu (t. j. Bq mol–1) a percento rádioaktivity spojenej s nečistotami. Špecifická rádioaktivita testovanej chemikálie by mala byť dostatočne vysoká, aby umožnila analýzu, a použité testovacie koncentrácie by nemali vyvolávať toxické účinky.
|
|
10.
|
Test možno vykonať s využitím umelej alebo prírodnej pôdy. Informácie o charakteristikách použitej prírodnej pôdy, napr. pôvod pôdy alebo jej zložiek, pH, obsah organického uhlíka, rozdelenie veľkosti častíc (percento piesku, siltu a hliny), a retenčná kapacita vody (WHC) by mali byť známe pred začiatkom testu (3) (48).
|
PRINCÍP TESTU
|
11.
|
Medzi parametre, ktoré charakterizujú bioakumuláciu testovanej chemikálie, patrí bioakumulačný faktor (BAF), konštanta rýchlosti absorpcie (ks) a konštanta rýchlosti eliminácie (ke). Vymedzenie pojmov je uvedené v dodatku 1.
|
|
12.
|
Test pozostáva z dvoch fáz: fázy absorpcie (expozícia) a fázy eliminácie (po expozícii). Počas fázy absorpcie sa paralelné skupiny červov vystavia pôsobeniu pôdy, ktorá bola obohatená testovanou chemikáliou. Okrem testovacích zvierat sa za tých istých podmienok bez testovanej chemikálie chovajú skupiny kontrolných červov. Odmeria sa suchá hmotnosť a obsah lipidov v testovacích organizmoch. Na toto meranie možno použiť červy z kontrolnej skupiny. Analytické hodnoty pozadia (slepý test) možno získať analýzou vzoriek kontrolných červov a pôdy. Vo fáze eliminácie sa červy prenesú do pôdy, ktorá neobsahuje testovanú chemikáliu. Fáza eliminácie je nutná vždy okrem prípadu, keď je absorpcia testovanej chemikálie počas fázy expozície bezvýznamná. Fáza eliminácie poskytuje informácie o rýchlosti, ktorou testovacie organizmy vylučujú testovanú chemikáliu [napr. (27)]. Ak sa v priebehu fázy absorpcie nedosiahol rovnovážny stav, stanovenie kinetických parametrov – kinetického bioakumulačného faktora BAFk, konštánt rýchlosti absorpcie a eliminácie – by podľa možnosti malo byť založené na súbežnej úprave výsledkov z fáz absorpcie a eliminácie. Koncentrácia testovanej chemikálie v/na červoch sa monitoruje v priebehu oboch fáz testu.
|
|
13.
|
Počas fázy absorpcie sa vykonávajú merania v časoch odberov vzoriek počas až 14 dní (čeľaď Enchytraeidae) alebo 21 dní (dážďovky), až kým sa nedosiahne rovnovážny stav (11) (12) (67). Rovnovážny stav nastáva vtedy, keď je krivka závislosti koncentrácie pri červoch od času paralelná s časovou osou a ak sa tri po sebe nasledujúce analýzy vzoriek odobratých v intervaloch najmenej dvoch dní navzájom nelíšia o viac ako ± 20 % na základe štatistických porovnaní (napr. analýza rozptylu, regresná analýza).
|
|
14.
|
Fáza eliminácie pozostáva z prenosu testovacích organizmov do nádob obsahujúcich rovnaký substrát bez testovanej chemikálie. Počas fázy eliminácie sa merania vykonávajú v časoch odberov vzoriek počas 14 dní (čeľaď Enchytraeidae) alebo 21 dní (dážďovky), pokiaľ skoršie analytické skúmanie nepreukázalo 90-percentné zníženie rezíduí testovanej chemikálie pri červoch. Koncentrácia testovanej chemikálie pri červoch na konci fázy eliminácie sa do správy uvedie ako neeliminované rezíduá. Rovnovážny bioakumulačný faktor (BAFss) sa podľa možnosti vypočíta ako pomer koncentrácie pri červoch (Ca) a v pôde (Cs) pri zrejmom rovnovážnom stave, a ako kinetický bioakumulačný faktor, BAFK, ako pomer konštanty rýchlosti absorpcie z pôdy (ks) a konštanty rýchlosti eliminácie (ke) (pre vymedzenie pojmov pozri dodatok 1) pri predpoklade kinetiky prvého rádu (pre výpočty pozri dodatok 2). Ak je zrejmé, že nie je možné použiť kinetiku prvého rádu, mali by sa použiť iné modely.
|
|
15.
|
Konštanta rýchlosti absorpcie, konštanta rýchlosti eliminácie (alebo konštanty, ak boli použité ďalšie modely), kinetický bioakumulačný faktor (BAFK) a podľa možnosti limity spoľahlivosti každého z týchto parametrov sa vypočítajú pomocou počítačových modelových rovníc (pre ďalšie usmernenia pozri dodatok 2). Správnosť odhadu každého modelu možno stanoviť napr. na základe korelačného koeficientu alebo koeficientu určenia (koeficienty blízke hodnote jeden indikujú vysokú mieru zhody) alebo na základe chí-kvadrátu. Takisto veľkosť štandardnej chyby alebo limit spoľahlivosti blízko odhadovaných parametrov môžu indikovať správnosť odhadu modelu.
|
|
16.
|
Na zníženie variability výsledkov testu v prípade testovaných chemikálií s vysokou lipofilitou by bioakumulačné faktory mali byť vyjadrené vo vzťahu k obsahu lipidov a k obsahu organického uhlíka (kg organického uhlíka (OC) kg–1 obsahu lipidov pri červoch). Tento prístup je založený na skutočnosti, že v prípade iektorých chemických tried existuje zrejmá závislosť medzi potenciálom bioakumulácie a lipofilitou, ktorá bola zistená pri rybách (47). Medzi obsahom lipidov pri rybách a bioakumuláciou takýchto chemikálií existuje vzťah. V prípade bentických organizmov boli zistené podobné korelácie, napr. (30) (44). Podobne sa táto korelácia preukázala v prípade suchozemských máloštetinavcov, napr. (5) (6) (7) (14). Ak je k dispozícii dostatok ntkaniva z červov, obsah lipidov v testovacích zvieratách možno určiť na rovnakom biologickom materiáli, aký bol použitý na určenie koncentrácie testovanej chemikálie. Na meranie obsahu lipidov možno prípadne použiť kontrolné zvieratá.
|
PLATNOSŤ TESTU
|
17.
|
Ak má byť test platný, musia byť splnené tieto kritériá v prípade kontrolných zvierat, ako aj v prípade ošetrených zvierat:
|
—
|
na konci testu by celková mortalita počas fázy absorpcie a eliminácie nemala presahovať 10 % (dážďovky) alebo 20 % (červy čeľade Enchytraeidae) celkového počtu zavedených červov,
|
|
—
|
pri druhoch Eisenia fetida a Eisenia andrei by strata strednej hmotnosti nameraná na konci fázy absorpcie a na konci fázy eliminácie nemala presahovať 20 % v porovnaní s počiatočnou čerstvou hmotnosťou (f.w.) na začiatku jednotlivých fáz.
|
|
OPIS METÓDY
Testovacie druhy
|
18.
|
Na testovanie bioakumulácie sa odporúča niekoľko druhov suchozemských máloštetinavcov. Najbežnejšie používané druhy Eisenia fetida alebo Eisenia andrei (čeľaď Lumbricidae), alebo Enchytraeus albidus, Enchytraeus crypticus alebo Enchytraeus luxuriosus (čeľaď Enchytraeidae) sú opísané v dodatku 5.
|
Zariadenie
|
19.
|
V prípade všetkých častí zariadenia treba dbať na to, aby sa predišlo používaniu materiálov, ktoré môžu rozpustiť, adsorbovať testovanú chemikáliu alebo vylúhovať iné chemikálie a mať škodlivé účinky na testovacie zvieratá. Možno použiť štandardné nádoby pravouhlého alebo valcovitého tvaru vyrobené z chemicky inertného materiálu a s primeranou kapacitou, ktorá zodpovedá veľkosti násady, t. j. počtu testovacích červov. Na každé zariadenie, ktoré prichádza do kontaktu s testovacími médiami, možno použiť nerezovú oceľ, umelú hmotu alebo sklo. Testovacie nádoby by mali byť vhodne prikryté, aby sa zabránilo úniku červov, ale zároveň bol zabezpečený dostatočný prívod vzduchu. V prípade chemikálií s vysokým adsorpčným koeficientom, ako sú syntetické pyretroidy, môže byť potrebné posilanizované sklo. V takýchto prípadoch je potrebné zariadenia po skončení pokusu zlikvidovať (49). Je nutné zabrániť úniku rádiooznačených testovaných látok a prchavých chemikálií. Na zachytenie všetkých rezíduí odparených z testovacích nádob by sa mali použiť zachytávače (napr. sklenené fľaše na premývanie plynu) obsahujúce vhodné absorbenty.
|
Pôda
|
20.
|
Testovacia pôda by mala mať takú kvalitu, aby umožnila prežívanie a podľa možnosti reprodukciu testovacích organizmov počas celého obdobia aklimatizácie a testovania bez toho, aby sa pri týchto organizmoch prejavil nezvyčajný vzhľad alebo správanie. Červy by sa mali zahrabať do pôdy.
|
|
21.
|
Ako substrát v týchto testoch sa odporúča použiť umelú pôdu opísanú v kapitole C.8 tejto prílohy (48). Príprava umelej pôdy pre testy bioakumulácie a odporúčania týkajúce sa skladovania umelej pôdy sú uvedené v dodatku 4. Umelú pôdu vysušenú vzduchom možno až do použitia skladovať pri izbovej teplote.
|
|
22.
|
Ako testovacia a/alebo kultivačná pôda však môže slúžiť prírodná pôda z neznečistených miest. V prípade prírodnej pôdy je nutné uviesť aspoň pôvod (miesto odberu), pH, obsah organického uhlíka, rozdelenie veľkosti častíc (percento piesku, siltu a hliny), maximálnu retenčnú kapacitu vody (WHCmax) a percentuálny obsah vody (3). Analýzou pôdy alebo jej zložiek pred použitím možno získať užitočné informácie o znečisťujúcich mikrolátkach. Ak sa použije pôda z poľnohospodárskeho poľa, nemala by byť ošetrovaná výrobkami na ochranu plodín ani hnojivom z ošetrovaných zvierat, ako sú umelé hnojivá, najmenej jeden rok a v prípade organických hnojív najmenej šesť mesiacov pred odberom vzoriek (50). Postupy manipulácie s prírodnou pôdou pred jej použitím v ekotoxikologických testoch s máloštetinavcami v laboratóriu sú opísané v odseku (3). Čas skladovania prírodnej pôdy v laboratóriu by mal byť čo najkratší.
|
Aplikácia testovanej chemikálie
|
23.
|
Testovaná chemikália sa pridá do pôdy. Je potrebné zohľadniť fyzikálno-chemické vlastnosti testovanej chemikálie. Testovaná chemikália rozpustná vo vode by sa mala pred tým, ako sa zmieša s pôdou, vo vode úplne rozpustiť. Odporúčaný postup obohacovania v prípade testovanej chemikálie, ktorá je slabo rozpustná vo vode, zahŕňa nanesenie testovanej chemikálie na jednu alebo viacero (umelých zložiek) pôdy. Napríklad kremenný piesok alebo jeho časť možno napustiť roztokom testovanej chemikálie vo vhodnom organickom rozpúšťadle, ktorý sa následne odparí do sucha. a Časť s nánosom možno potom zamiešať do mokrej pôdy. Hlavnou výhodou tohto postupu je fakt, že do pôdy sa nedostane žiadne rozpúšťadlo. Ak sa použije prírodná pôda, testovanú chemikáliu možno pridať obohatením časti pôdy vysušenej vzduchom, ako je opísané v prípade umelej pôdy, alebo zamiešaním testovanej chemikálie do mokrej pôdy, pričom ďalším krokom bude odparenie v prípade, že sa použilo činidlo zvyšujúce rozpustnosť. Vo všeobecnosti treba v čo najväčšej možnej miere zabrániť kontaktu mokrej pôdy s rozpúšťadlami. Je možné uvažovať o nasledujúcich možnostiach (3):
|
—
|
ak sa použije iné rozpúšťadlo ako voda, malo by byť miešateľné s vodou a/alebo by malo byť možné ho odstrániť (napríklad odparením), v dôsledku čoho by v pôde zostala iba testovaná chemikália,
|
|
—
|
ak sa použije kontrola rozpúšťadla, negatívna kontrola nie je nutná. Kontrola rozpúšťadla by mala obsahovať najvyššiu koncentráciu rozpúšťadla pridaného do pôdy a malo by sa pri nej použiť rozpúšťadlo z tej istej dávky, aká bola použitá na prípravu zásobného roztoku. Toxicita a prchavosť rozpúšťadla a rozpustnosť testovanej chemikálie vo vybratom rozpúšťadle by mali byť hlavnými kritériami pri výbere vhodného činidla zvyšujúceho rozpustnosť.
|
|
|
24.
|
V prípade chemikálií, ktoré sú slabo rozpustné vo vode a v organických rozpúšťadlách, možno na dosiahnutie želanej testovacej koncentrácie zmiešať 2,0 – 2,5 g jemného kremenného piesku na testovaciu nádobu s určitým množstvom testovanej chemikálie, napr. pomocou trecej misky a paličky. Táto zmes kremenného piesku a testovanej chemikálie sa pridá do predvlhčenej pôdy a dôkladne sa zmieša s primeraným množstvom deionizovanej vody, aby sa získal požadovaný obsah vlhkosti. Konečná zmes sa rozdelí do testovacích nádob. Postup sa opakuje pri každej testovacej koncentrácii a pripraví sa aj vhodná kontrola s 2,0 – 2,5 g jemne zomletého kremenného piesku na testovaciu nádobu.
|
|
25.
|
Koncentrácia testovanej chemikálie v pôde sa stanoví po obohatení. Pred zavedením testovacích organizmov je potrebné overiť homogénnu distribúciu testovanej chemikálie do pôdy. Metóda použitá na obohatenie a dôvody pre výber konkrétneho postupu obohacovania sa uvedú do správy (24).
|
|
26.
|
Rovnováha medzi pôdnou fázou a fázou pórovej vody by sa podľa možnosti mala stanoviť ešte pred pridaním organizmov. Odporúča sa použiť obdobie štyroch dní pri teplote 20 °C. V prípade mnohých organických chemikálií slabo rozpustných vo vode sa čas potrebný na dosiahnutie skutočnej rovnováhy medzi adsorbovanými a rozpustenými časťami môže počítať na dni alebo mesiace. V závislosti od účelu štúdie, napríklad ak sa napodobňujú podmienky životného prostredia, sa obohatená pôda môže nechať ‚zrieť‘ dlhšie, napr. v prípade kovov počas troch týždňov pri teplote 20 °C (22).
|
Kultivácia testovacích organizmov
|
27.
|
Červy sa podľa možnosti chovajú v stálej laboratórnej kultúre. Usmernenia o metódach laboratórnej kultivácie v prípade druhov Eisenia fetida a Eisenia andrei a druhov čeľade Enchytraeidae sú uvedené v dodatku 5 [pozri aj (48) (51) (52)].
|
|
28.
|
Červy použité v testoch by nemali mať žiadne badateľné choroby, abnormality a parazity.
|
VYKONANIE TESTU
|
29.
|
Testovacie organizmy sú počas fázy absorpcie vystavené pôsobeniu testovanej chemikálie. Fáza absorpcie by mala trvať 14 dní (Enchytraeidae) alebo 21 dní (dážďovky), pokiaľ sa nepreukáže, že bol dosiahnutý rovnovážny stav.
|
|
30.
|
Vo fáze eliminácie sa červy prenesú do pôdy, ktorá neobsahuje testovanú chemikáliu. Prvá vzorka sa odoberie po 4 – 24 hodinách od začiatku fázy eliminácie. Príklady harmonogramu odberov vzoriek v prípade 21-dňovej fázy absorpcie a 21-dňovej fázy eliminácie sú uvedené v dodatku 3.
|
Testovacie organizmy
|
31.
|
V prípade mnohých druhov suchozemských červov čeľade Enchytraeidae je individuálna hmotnosť veľmi nízka (napr. 5 – 10 mg čerstvej hmotnosti na jedinca v prípade druhu Enchytraeus albidus a ešte menej v prípade druhu Enchytraeus crypticus alebo Enchytraeus luxuriosus). Na vykonanie meraní hmotnosti a chemickú analýzu môže byť potrebné zozbierať červy z paralelných testovacích nádob (t. j. na získanie jedného analytického výsledku z tkaniva sa použijú všetky červy z paralelnej nádoby). Do každého replikátu sa pridá 20 jedincov Enchytraeidae, pričom sa použijú najmenej tri replikáty. Ak je analytický detekčný limit testovanej chemikálie vysoký, môže byť potrebných viac červov. V prípade testovacích druhov s vyššou individuálnou hmotnosťou (Eisenia fetida a Eisenia andrei) možno použiť paralelné nádoby obsahujúce jedného jedinca.
|
|
32.
|
Dážďovky použité v teste by mali mať podobnú hmotnosť (napr. individuálna hmotnosť Eisenia fetida a Eisenia andrei by mala byť v rozmedzí 250 – 600 mg). Červy čeľade Enchytraeidae (napr. Enchytraeus albidus) by mali mať dĺžku približne 1 cm. Všetky červy použité v konkrétnom teste by mali pochádzať z rovnakého zdroja a malo by ísť o dospelé zvieratá s klitelom (pozri dodatok 5). Keďže hmotnosť a vek zvieraťa môže mať vplyv na hodnoty BAF (napr. v dôsledku meniaceho sa obsahu lipidov a/alebo prítomnosti vajíčok), tieto parametre je nutné presne zaznamenať a zohľadniť pri interpretácii výsledkov. Okrem toho počas obdobia expozície môže dôjsť k nakladeniu kokónov, čo bude mať takisto vplyv na hodnoty BAF. Pred testom sa odporúča odvážiť podvzorku testovacích červov na odhadnutie strednej čerstvej a suchej hmotnosti.
|
|
33.
|
Používa sa vysoký pomer pôdy k červom, aby sa minimalizovalo znižovanie koncentrácie testovanej chemikálie v pôde počas fázy absorpcie. V prípade druhov Eisenia fetida a Eisenia andrei je minimálne odporúčané množstvo 50 g suchej hmotnosti (d.w.) pôdy na červa a v prípade červov čeľade Enchytraeidae minimálne 10 – 20 g d.w. pôdy na testovaciu nádobu. Nádoby by mali obsahovať vrstvu pôdy hrubú 2 – 3 cm (Enchytraeidae) alebo 4 – 5 cm (dážďovky).
|
|
34.
|
Červy použité v teste sa odoberú z kultúry (napr. červy Enchytraeidae pomocou pinzety). Dospelé zvieratá sa prenesú do neošetrenej testovacej pôdy, aby sa aklimatizovali, a kŕmia sa (pozri odsek 36). Ak sa podmienky testovania líšia od podmienok kultivácie, fáza aklimatizácie v trvaní 24 – 72 hodín by mala postačovať, aby sa červy adaptovali na podmienky testovania. Po aklimatizácii sa dážďovky prepláchnu tak, že sa prenesú do sklenených misiek (napr. Petriho misiek) obsahujúcich čistú vodu a následne sa odvážia pred tým, ako sa vložia do testovacej pôdy. Pred vážením treba z červov odstrániť nadbytočnú vodu jemným dotykom o hranu misky alebo opatrným osušením mierne navlhčenou papierovou vreckovkou.
|
|
35.
|
Zahrabávanie testovacích organizmov sa pozoruje a zaznamená. V testoch s dážďovkami sa zvieratá (kontrolné a ošetrené) zvyčajne zahrabú do pôdy za niekoľko hodín, čo treba najneskôr do 24 hodín po pridaní červov do testovacích nádob skontrolovať. Ak sa dážďovky nezahrabú do pôdy (napr. viac ako 10 % v priebehu vyše polovice fázy absorpcie), znamená to buď, že podmienky testovania nie sú vhodné, alebo že testovacie organizmy nie sú zdravé. V takom prípade je potrebné test pozastaviť a zopakovať. Červy Enchytraeidae žijú najmä v intersticiálnych póroch pôdy a ich integument môže byť často v kontakte s okolitým substrátom iba čiastočne. Predpokladá sa, že expozícia zahrabávajúcich sa a nezahrabávajúcich sa červov Enchytraeidae je rovnaká a v prípade, že sa červy nezahrabú, nie je nevyhnutne potrebné test opakovať.
|
Kŕmenie
|
36.
|
Ak sa použije pôda s nízkym celkovým obsahom organického uhlíka, je potrebné naplánovať kŕmenie. Ak sa použije umelá pôda, odporúčaná týždenná dávka krmiva (t. j. červy sa kŕmia raz týždenne) je 7 mg sušeného hnoja na g suchej hmotnosti pôdy v prípade dážďoviek a 2 – 2,5 mg zomletých ovsených vločiek na g suchej hmotnosti pôdy v prípade červov Enchytraeidae (11). Prvá dávka potravy sa zmieša s pôdou tesne pred pridaním testovacích organizmov. Podľa možnosti sa použije rovnaký druh potravy, aký sa použil v kultúrach (pozri dodatok 5).
|
Svetlo a teplota
|
37.
|
Testy sa vykonávajú v kontrolovaných 16/8-hodinových cykloch svetla/tmy, podľa možnosti s intenzitou 400 – 800 lx v priestore testovacích nádob (3). Testovacia teplota by počas celého testu mala byť 20 ± 2 °C.
|
Testovacie koncentrácie
|
38.
|
Použije sa jedna koncentrácia. Prípady, keď je potrebná ďalšia koncentrácia (koncentrácie), treba odôvodniť. Ak sa toxicita (ECx) testovanej chemikálie blíži k analytickému detekčnému limitu, na testovanie sa odporúča sa použiť rádiooznačenú chemikáliu s vysokou špecifickou rádioaktivitou. V prípade kovov by koncentrácia mala byť vyššia ako úroveň pozadia v tkanive a pôde.
|
Replikáty
|
39.
|
Na kinetické merania (fáza absorpcie a eliminácie) sa pri každom odbere vzorky použijú minimálne tri ošetrené paralelné nádoby. Celkový počet pripravených replikátov by mal byť dostatočný na pokrytie všetkých časov odberu vzoriek vo fáze absorpcie a eliminácie.
|
|
40.
|
Na účely biologických pozorovaní a meraní (napr. pomer suchej a čerstvej hmotnosti, obsahu lipidov) a na analýzu koncentrácií v pozadí pri červoch a v pôde musí byť v prípade, že sa nepoužilo iné rozpúšťadlo ako voda, k dispozícii najmenej 12 paralelných nádob negatívnej kontroly (zo štyroch sa vzorka odoberie na začiatku, zo štyroch na konci fázy absorpcie a zo štyroch na konci fázy eliminácie). Ak sa pri aplikácii testovanej chemikálie použije činidlo zvyšujúce rozpustnosť, okrem ošetrených replikátov treba vykonať kontrolu rozpúšťadla (zo štyroch paralelných nádob sa vzorka odoberie na začiatku, zo štyroch na konci fázy absorpcie a zo štyroch na konci fázy eliminácie) obsahujúcu všetky zložky okrem testovanej látky. V tomto prípade možno na nepovinný odber vzorky na konci fázy absorpcie použiť ďalšie štyri paralelné nádoby na negatívnu kontrolu (bez rozpúšťadla). Tieto replikáty možno biologicky porovnať s kontrolou rozpúšťadla s cieľom získať informácie o možnom vplyve rozpúšťadla na testovacie organizmy. Odporúča sa založenie dostatočného počtu ďalších rezervných paralelných nádob (napr. osem) na aplikáciu látky a kontrolu.
|
Frekvencia merania kvality pôdy
|
41.
|
Hodnota pH pôdy, obsah vlhkosti pôdy a teplota (nepretržitá) v testovacej miestnosti sa odmerajú na začiatku a na konci fázy absorpcie a eliminácie. Raz týždenne sa obsah vlhkosti pôdy skontroluje odvážením testovacích nádob a porovnaním skutočných hmotností s počiatočnými hmotnosťami na začiatku testu. Straty vody treba kompenzovať pridávaním deionizovanej vody.
|
Odber vzoriek a analýza červov a pôdy
|
42.
|
Príklad harmonogramu fázy absorpcie a fázy eliminácie v testoch bioakumulácie pri dážďovkách a Enchytraeidae je uvedený v dodatku 3.
|
|
43.
|
Vzorky pôdy sa z testovacích nádob na účely stanovenia koncentrácie testovanej chemikálie odoberú pred pridaním červov a počas fázy absorpcie a fázy eliminácie. V priebehu testu sa stanovia koncentrácie testovanej chemikálie v červoch a v pôde. Vo všeobecnosti sa merajú celkové koncentrácie pôdy. Nepovinne možno odmerať koncentrácie v pórovej vode. V takom prípade je nutné pred začiatkom štúdie uviesť odôvodnenie a príslušné metódy a zahrnúť ich do správy.
|
|
44.
|
Vzorky červov a pôdy sa počas fázy absorpcie a fázy eliminácie odoberú najmenej šesťkrát. Ak sa preukáže stabilita testovanej chemikálie, počet analýz pôdy možno znížiť. Odporúča sa analyzovať najmenej tri replikáty na začiatku a na konci fázy absorpcie. Ak sa koncentrácia v pôde nameraná na konci fázy absorpcie líši od počiatočnej koncentrácie o viac ako 30 %, treba analyzovať aj vzorky pôdy odobraté v iné dni.
|
|
45.
|
Červy z daného replikátu sa z pôdy pri každom čase odberu vzorky vyberú (napr. sa na plytkú misku rozotrie pôda z replikátu a červy sa povyberajú pomocou jemnej pinzety) a rýchlo sa prepláchnu vodou v plytkom pohári alebo oceľovej miske. Nadbytočná voda sa odstráni (pozri odsek 34). Červy sa opatrne prenesú do predváženej nádoby a okamžite sa odvážia vrátane obsahu tráviaceho traktu.
|
|
46.
|
V prípade dážďoviek (druh Eisenia) sa počká jednu noc na vyprázdnenie tráviaceho traktu červov, napr. sa umiestnia na vlhký filtračný papier do prikrytej Petriho misky (pozri odsek 34). Po vyprázdnení sa stanoví hmotnosť červov, aby sa posúdilo možné zníženie biomasy počas testu (pozri kritériá platnosti v odseku 17). Váženie a analýza tkaniva sa v prípade Enchytraeidae vykonáva bez vyprázdňovania, lebo je to vzhľadom na malú veľkosť týchto červov technicky náročné. Po stanovení konečnej hmotnosti sa červy okamžite najvhodnejšou metódou usmrtia (napr. pomocou tekutého dusíka alebo zmrazením pri teplotách pod – 18 °C).
|
|
47.
|
Vo fáze eliminácie červy nahradia kontaminovaný obsah tráviaceho traktu čistou pôdou. To znamená, že merania pri nevyprázdnených červoch (v tomto kontexte Enchytraeidae), z ktorých sa vzorky odoberali tesne pred fázou eliminácie, obsahujú kontaminovanú pôdu v tráviacom trakte. Pri vodných máloštetinavcoch sa predpokladá, že po prvých 4 – 24 hodinách fázy eliminácie sa väčšina kontaminovaného obsahu tráviaceho traktu nahradí čistým sedimentom, napr. (46). Podobné zistenia boli zaznamenané aj pri dážďovkách v štúdiách akumulácie rádiooznačeného kadmia a zinku (78). Pri nevyprázdnených Enchytraeidae možno koncentráciu tejto prvej vzorky fázy eliminácie považovať za koncentráciu v tkanive po vyprázdnení tráviaceho traktu. Na zohľadnenie zriedenia koncentrácie testovanej látky nekontaminovanou pôdou počas fázy eliminácie možno hmotnosť obsahu tráviaceho traktu odhadnúť na základe pomeru čerstvej hmotnosti a hmotnosti popola alebo pomeru suchej hmotnosti a hmotnosti popola pri červoch.
|
|
48.
|
Vzorky pôdy a červov by sa podľa možnosti mali analyzovať ihneď po odobratí (t. j. do jedného až dvoch dní), aby sa predišlo degradácii alebo iným stratám, pričom sa odporúča vypočítať približnú rýchlosť absorpcie a rýchlosť eliminácie v priebehu testu. Ak sa analýza odloží, vzorky by sa mali vhodnou metódou uskladniť, napr. hlbokým zmrazením (≤ – 18 °C).
|
|
49.
|
Treba skontrolovať, či presnosť a reprodukovateľnosť chemickej analýzy, ako aj výťažnosť testovanej chemikálie zo vzoriek pôdy a červov vyhovujú danej metóde. V správe sa uvedie extrakčná účinnosť, detekčný limit (LOD) a kvantifikačný limit (LOQ). Podobne treba skontrolovať, či testovaná chemikália nie je prítomná v kontrolných nádobách vo vyšších koncentráciách, ako je koncentrácia v pozadí. Ak je koncentrácia testovanej chemikálie v testovacom organizme Ca pri kontrolných červoch > 0, treba túto skutočnosť pri výpočte kinetických parametrov zohľadniť (pozri dodatok 2). So všetkými vzorkami by sa počas celého testu malo zaobchádzať tak, aby sa minimalizovala kontaminácia a strata (napr. v dôsledku adsorpcie testovanej chemikálie na zariadenie na odber vzoriek).
|
|
50.
|
Pri práci s rádiooznačenými testovanými chemikáliami sa môže analyzovať materská chemikália a metabolity. Kvantifikáciou materskej testovanej chemikálie a metabolitov v rovnovážnom stave alebo na konci fázy absorpcie sa získajú dôležité informácie. Vzorky by sa následne mali vyčistiť, aby bolo možné kvantifikovať materskú testovanú chemikáliu samostatne. Ak v analyzovanej vzorke (vzorkách) samotné metabolity presahujú 10 % celkovej rádioaktivity, odporúča sa identifikovať tieto metabolity.
|
|
51.
|
Celková výťažnosť a výťažnosť testovanej chemikálie v červoch, v pôde a, ak sa použijú, v zachytávačoch obsahujúcich absorbenty na zadržanie odparenej testovanej chemikálie sa zaznamená a uvedie do správy.
|
|
52.
|
Spájanie vzoriek jedincov odobratých z danej testovacej nádoby je prípustné v prípade červov Enchytraeidae, ktoré sú menšie ako dážďovky. Ak spájanie vzoriek vedie k zníženiu počtu replikátov, štatistické postupy, ktoré možno použiť pri spracúvaní údajov, budú obmedzenejšie. Ak sa vyžaduje špecifický štatistický postup a významnosť, potom je potrebné do testu zahrnúť primeraný počet paralelných testovacích nádob, aby sa zabezpečilo želané spájanie vzoriek, postup a významnosť.
|
|
53.
|
Odporúča sa vyjadriť BAF ako funkciu celkovej suchej hmotnosti a v prípade potreby (t. j. v prípade vysokohydrofóbnych chemikálií) aj ako funkciu obsahu lipidov. Na stanovenie obsahu lipidov sa použijú vhodné metódy (niektoré existujúce metódy – napr. (31) (58) – je potrebné na tento účel upraviť). Tieto metódy využívajú extrakciu zmesou chloroformu a metanolu. S cieľom predísť použitiu chlórovaných rozpúšťadiel by sa mala použiť upravená metóda podľa Bligha a Dyera (9) uvedená v odkaze (17). Keďže rôznymi metódami sa nemusí dospieť k identickým hodnotám, je dôležité uviesť podrobné informácie o použitej metóde. Ak je to možné, t. j. ak je k dispozícii dostatočné množstvo tkaniva z červov, analýza lipidov by sa podľa možnosti mala vykonať na rovnakej vzorke alebo extrakte, aké boli použité na analýzu testovanej chemikálie, lebo lipidy je často nutné z extraktu odstrániť, skôr než ich možno chromatograficky analyzovať (49). Prípadne možno použiť kontrolné zvieratá na meranie obsahu lipidov, ktorý sa následne môže použiť na normalizáciu hodnôt BAF. Pri druhom prístupe je kontaminácia zariadenia testovanou chemikáliou nižšia.
|
ÚDAJE A PODÁVANIE SPRÁV
Spracovanie výsledkov
|
54.
|
Krivka absorpcie testovanej chemikálie sa získa tak, že sa na aritmetické osi zakreslí jej koncentrácia v/na červoch počas fázy absorpcie v závislosti od času. Ak krivka dosiahne rovnováhu alebo rovnovážny stav (pozri vymedzenie pojmov v dodatku 1), rovnovážny bioakumulačný faktor BAFss sa vypočíta podľa tohto vzorca:

Ca je koncentrácia testovanej chemikálie v testovacom organizme,
Cs je koncentrácia testovanej chemikálie v pôde.
|
|
55.
|
Ak sa nedosiahne rovnovážny stav, namiesto BAFss sa na základe konštánt rýchlosti určí BAFK týmto spôsobom:
|
—
|
určí sa akumulačný faktor (BAFK) ako pomer ks/ke,
|
|
—
|
rýchlosti absorpcie a eliminácie sa podľa možnosti vypočítajú súbežne (pozri rovnicu 11 v dodatku 2),
|
|
—
|
konštanta rýchlosti eliminácie (ke) sa zvyčajne stanoví podľa krivky eliminácie (t. j. znázornenia koncentrácie testovanej látky v červoch počas fázy eliminácie). Konštanta rýchlosti absorpcie ks sa potom vypočíta podľa ke a hodnoty Ca, ktorá je odvodená z krivky absorpcie (opis týchto metód je uvedený v dodatku 2). Prednostným spôsobom stanovovania BAFK a oboch rýchlostných konštánt ks a ke sú nelineárne metódy odhadovania parametrov pomocou počítača. Ak je zrejmé, že eliminácia nie je prvého rádu, potom je potrebné použiť komplexnejšie modely.
|
|
Správa o teste
|
56.
|
Správa o teste musí obsahovať tieto informácie:
|
|
Testovaná chemikália:
|
—
|
všetky dostupné informácie o akútnej alebo dlhodobej toxicite (napr. ECx, LCx, NOEC) testovanej chemikálie pre máloštetinavce žijúce v pôde,
|
|
—
|
čistota, fyzický charakter a fyzikálno-chemické vlastnosti, napr. log Kow, rozpustnosť vo vode,
|
|
—
|
chemické identifikačné údaje; zdroj testovanej látky, identita a koncentrácia akéhokoľvek použitého rozpúšťadla,
|
|
—
|
ak sa použije rádiooznačená testovaná chemikália, presná poloha označených atómov, špecifická rádioaktivita a rádiochemická čistota.
|
|
|
|
Testovacie druhy:
|
—
|
vedecký názov, kmeň, pôvod, všetky zásahy uskutočnené pred pokusom, aklimatizácia, vek, rozsah hmotností atď.
|
|
|
|
Podmienky testovania:
|
—
|
použitý postup testovania,
|
|
—
|
typ a charakteristiky osvetlenia a dĺžka svetlej fázy (svetlých fáz),
|
|
—
|
koncepcia testu (napr. počet a veľkosť testovacích nádob, hmotnosť pôdy a výška vrstvy pôdy, počet replikátov, počet červov v jednom replikáte, počet testovacích koncentrácií, trvanie fázy absorpcie a fázy eliminácie, frekvencia odberov vzoriek),
|
|
—
|
odôvodnenie výberu materiálu testovacej nádoby,
|
|
—
|
metóda prípravy a aplikácie testovanej látky, ako aj dôvody pre výber špecifickej metódy,
|
|
—
|
nominálne testovacie koncentrácie, priemery hodnôt nameraných v testovacích nádobách a ich smerodajné odchýlky a spôsob, akým sa vypočítali,
|
|
—
|
zdroj zložiek umelej pôdy alebo – ak boli použité prírodné médiá – pôvod pôdy, opis všetkých zásahov uskutočnených pred pokusom, výsledky kontrol (prežívanie, tvorba biomasy, reprodukcia), charakteristiky pôdy (pH, celkový obsah organického uhlíka, rozdelenie veľkosti častíc (percento piesku, siltu a hliny), WHCmax, percentuálny obsah vody na začiatku a na konci testu a akékoľvek iné uskutočnené merania),
|
|
—
|
podrobné informácie o manipulácii so vzorkami pôdy a červov vrátane údajov o príprave, skladovaní, postupoch obohacovania, extrakcii a analytických postupoch (a presnosti) testovanej látky v červoch a v pôde, obsahu lipidov (ak sa meral) a výťažnosti testovanej látky.
|
|
|
|
Výsledky:
|
—
|
mortalita kontrolných červov a červov v jednotlivých testovacích nádobách a akékoľvek pozorované nezvyčajné správanie (napr. vyhýbanie sa pôde, chýbajúca reprodukcia v teste bioakumulácie pri Enchytraeidae),
|
|
—
|
pomer suchej hmotnosti k čerstvej hmotnosti pôdy a testovacích organizmov (užitočné na účely normalizácie),
|
|
—
|
čerstvé hmotnosti červov v každom čase odberu vzorky; v prípade dážďoviek, čerstvé hmotnosti na začiatku testu a v každom čase odberu vzorky pred a po vyprázdnení tráviaceho traktu,
|
|
—
|
obsah lipidov v testovacích organizmoch (ak bol stanovený),
|
|
—
|
krivky znázorňujúce absorpčnú a eliminačnú kinetiku testovanej chemikálie pri červoch a v čase rovnovážneho stavu,
|
|
—
|
Ca a Cs (so smerodajnou odchýlkou a rozsahom, ak je to vhodné) pre všetky časy odberov vzoriek (Ca vyjadrené v g kg–1 čerstvej a suchej hmotnosti celého tela, Cs vyjadrená v g kg–1 čerstvej a suchej hmotnosti pôdy). Ak sa požaduje akumulačný faktor bioty k pôde (BSAF) (napr. na porovnanie výsledkov z dvoch alebo viacerých testov vykonaných so zvieratami s odlišným obsahom lipidov), Ca možno dodatočne vyjadriť ako g kg–1 obsahu lipidov v organizme a Cs možno vyjadriť ako g kg–1 organického uhlíka (OC) v pôde,
|
|
—
|
BAF (vyjadrený v kg pôdy·kg–1 červov), konštanta rýchlosti absorpcie pôdy ks (vyjadrená v g pôdy kg–1 červov deň–1) a konštanta rýchlosti eliminácie ke (vyjadrená v deň–1), BSAF (vyjadrený v kg pôdy OC kg–1 obsahu lipidov pri červoch) možno do správy uviesť dodatočne,
|
|
—
|
ak sa merajú: percentá materskej chemikálie, metabolitov a viazaných rezíduí (t. j. percento testovanej chemikálie, ktoré nemožno extrahovať pomocou bežných metód extrakcie) zistené v pôde a testovacích zvieratách,
|
|
—
|
metódy použité na štatistické analýzy údajov.
|
|
|
|
Hodnotenie výsledkov:
|
—
|
súlad výsledkov s kritériami platnosti uvedenými v odseku 17,
|
|
—
|
neočakávané alebo nezvyčajné výsledky, napr. neúplná eliminácia testovanej chemikálie z testovacích zvierat.
|
|
|
LITERATÚRA
|
1.
|
Amorim, M. (2000). Chronic and toxicokinetic behavior of Lindane (γ-HCH) in the Enchytraeid Enchytraeus albidus. Diplomová práca, Univerzita Coimbra.
|
|
2.
|
ASTM (2000). Standard guide for the determination of the bioaccumulation of sediment-associated contaminants by benthic invertebrates. American Society for Testing and Materials, E 1688-00a.
|
|
3.
|
ASTM International (2004). Standard guide for conducting laboratory soil toxicity or bioaccumulation tests with the Lumbricid earthworm Eisenia fetida and the Enchytraeid potworm Enchytraeus albidus. ASTM International, E1676-04: 26 s.
|
|
4.
|
Beek, B., Boehling, S., Bruckmann, U., Franke, C., Joehncke, U., Studinger, G. (2000). The assessment of bioaccumulation. In Hutzinger, O. (editor), The Handbook of Environmental Chemistry, Vol. 2 Part J (Vol. editor: B. Beek): Bioaccumulation – New Aspects and Developments. Springer-Verlag Berlin Heidelberg: 235 – 276.
|
|
5.
|
Belfroid, A., Sikkenk, M., Seinen, W., Van Gestel, C., Hermens, J. (1994). The toxicokinetic behavior of chlorobenzenes in earthworms (Eisenia andrei): Experiments in soil. Environ. Toxicol. Chem. 13: 93 – 99.
|
|
6.
|
Belfroid, A., Van Wezel, A., Sikkenk, M., Van Gestel, C., Seinen, W., a Hermens, J. (1993). The toxicokinetic behavior of chlorobenzenes in earthworms (Eisenia andrei): Experiments in water. Ecotox. Environ. Safety 25: 154 – 165.
|
|
7.
|
Belfroid, A., Meiling, J., Drenth, H., Hermens, J., Seinen, W., Van Gestel, C. (1995). Dietary uptake of superlipophilic compounds by earthworms (Eisenia andrei). Ecotox. Environ. Safety 31: 185 – 191.
|
|
8.
|
Bell, A. W. (1958). The anatomy of Enchytraeus albidus, with a key to the species of the genus Enchytraeus. Ann. Mus. Novitat. 1902: 1 – 13.
|
|
9.
|
Bligh, E. G., a Dyer, W. J. (1959). A rapid method of total lipid extraction and purification. Can. J. Biochem. Pysiol. 37: 911 – 917.
|
|
10.
|
Bouche, M. (1972). Lombriciens de France. Ecologie et Systematique. INRA, Annales de Zoologie-Ecologie animale, Paríž, 671 s
|
|
11.
|
Bruns, E., Egeler, Ph., Moser, T., Römbke, J., Scheffczyk, A., Spörlein, P. (2001a). Standardisierung und Validierung eines Bioakkumulationstests mit terrestrischen Oligochaeten. Report to the German Federal Environmental Agency (Umweltbundesamt Berlin), R&D No.: 298 64 416.
|
|
12.
|
Bruns, E., Egeler, Ph., Römbke, J., Scheffczyk, A., Spörlein, P. (2001b). Bioaccumulation of lindane and hexachlorobenzene by the oligochaetes Enchytraeus luxuriosus and Enchytraeus albidus (Enchytraeidae, Oligochaeta, Annelida). Hydrobiologia 463: 185 – 196.
|
|
13.
|
Conder, J. M., a Lanno, R. P. (2003). Lethal critical body residues as measures of Cd, Pb, and Zn bioavailability and toxicity in the earthworm Eisenia fetida. J. Soils Sediments 3: 13 – 20.
|
|
14.
|
Connell, D. W., a Markwell, R. D. (1990). Bioaccumulation in the Soil to Earthworm System. Chemosphere 20: 91 – 100.
|
|
15.
|
Didden, W. A. M. (1993). Ecology of Terrestrial Enchytraeidae. Pedobiologia 37: 2 – 29.
|
|
16.
|
Didden, W. (2003). Oligochaeta, In: Bioindicators and biomonitors. Markert, B.A., Breure, A.M. & Zechmeister, H.G. (eds.). Elsevier Science Ltd., Holandsko, s. 555 – 576.
|
|
17.
|
De Boer, J., Smedes, F., Wells, D., Allan, A. (1999). Report on the QUASH interlaboratory study on the determination of total-lipid in fish and shellfish. Round 1 SBT-2, Exercise 1000, EU, Standards, Measurement and Testing Programme.
|
|
18.
|
Dietrich, D. R., Schmid, P., Zweifel, U., Schlatter, C., Jenni-Eiermann, S., Bachmann, H., Bühler, U., Zbinden, N. (1995). Mortality of birds of prey following field application of granular carbofuran: A Case Study. Arch. Environ. Contam. Toxicol. 29: 140 – 145.
|
|
19.
|
Nariadenie Európskeho parlamentu a Rady (ES) č. 1907/2006 z 18. decembra 2006 o registrácii, hodnotení, autorizácii a obmedzovaní chemických látok (REACH) a o zriadení Európskej chemickej agentúry, o zmene a doplnení smernice 1999/45/ES a o zrušení nariadenia Rady (EHS) č. 793/93 a nariadenia Komisie (ES) č. 1488/94, smernice Rady 76/769/EHS a smerníc Komisie 91/155/EHS, 93/67/EHS, 93/105/ES a 2000/21/ES (Ú. v. EÚ L 396, 30.12.2006, s. 1).
|
|
20.
|
Edwards, C. A., a Bohlen, P. J. (1996). Biology and ecology of earthworms. Tretie vydanie, Chapman & Hall, Londýn, 426 s
|
|
21.
|
Kapitola C.51 tejto prílohy, Bioakumulácia pri bentických máloštetinavcoch žijúcich v sedimente.
|
|
22.
|
Egeler, Ph., Gilberg, D., Scheffczyk, A., Moser, Th., a Römbke, J. (2009). Validation of a Soil Bioaccumulation Test with Terrestrial Oligochaetes by an International Ring Test (Validierung einer Methode zur standardisierten Messung der Bioakkumulation mit terrestrischen Oligochaeten). Report to the Federal Environmental Agency (Umweltbundesamt Dessau-Rosslau), R&D No.: 204 67 458: 149 s Dostupné na prevzatie na: http://www.oecd.org/dataoecd/12/20/42552727.pdf.
|
|
23.
|
Elmegaard, N., a Jagers op Akkerhuis GAJM (2000). Safety factors in pesticide risk assessment, Differences in species sensitivity and acute-chronic relations. National Environmental Research Institute, NERI Technical Report 325: 57 s.
|
|
24.
|
Environment Canada (1995). Guidance document on measurement of toxicity test precision using control sediments spiked with a reference toxicant. Environmental Protection Series Report EPS 1/RM/30.
|
|
25.
|
EPPO (2003). Environmental Risk Assessment scheme for plant protection products. Soil organisms and functions, EPPO (European Plant Protection Organization) Standards, Bull, OEPP/EPPO 33: 195 – 208.
|
|
26.
|
Franke, C. (1996). How meaningful is the bioconcentration factor for risk assessment? Chemosphere 32: 1897-1905.
|
|
27.
|
Franke, C., Studinger, G., Berger, G., Böhling, S., Bruckmann, U., Cohors-Fresenborg, D., Jöhncke, U. (1994). The assessment of bioaccumulation. Chemosphere 29: 1501 – 1514.
|
|
28.
|
Füll, C. (1996). Bioakkumulation und Metabolismus von -1,2,3,4,5,6-Hexachlorcyclohexan (Lindan) und 2-(2,4-Dichlorphenoxy)-propionsäure (Dichlorprop) beim Regenwurm Lumbricus rubellus (Oligochaeta, Lumbricidae). Dizertačná práca, Univerzita Mainz, 156 s.
|
|
29.
|
Füll, C., Schulte, C., Kula, C. (2003). Bewertung der Auswirkungen von Pflanzenschutzmitteln auf Regenwürmer. UWSF – Z. Umweltchem, Ökotox. 15: 78 – 84.
|
|
30.
|
Gabric, A. J., Connell, D. W., Bell, P. R. F. (1990). A kinetic model for bioconcentration of lipophilic compounds by oligochaetes. Wat. Res. 24: 1225 – 1231.
|
|
31.
|
Gardner, W. S., Frez, W. A., Cichocki, E. A., Parrish, C. C. (1985). Micromethods for lipids in aquatic invertebrates. Limnology and Oceanography 30: 1099 – 1105.
|
|
32.
|
Hawker, D. W., a Connell, D. W. (1988). Influence of partition coefficient of lipophilic compounds on bioconcentration kinetics with fish. Wat. Res. 22: 701 – 707.
|
|
33.
|
Hund-Rinke, K., a Wiechering, H. (2000). Earthworm avoidance test for soil assessments: An alternative for acute and reproduction tests. J. Soils Sediments 1: 15 – 20.
|
|
34.
|
Hund-Rinke, K., Römbke, J., Riepert, F., Achazi, R. (2000). Beurteilung der Lebensraumfunktion von Böden mit Hilfe von Regenwurmtests. V: Toxikologische Beurteilung von Böden. Heiden, S., Erb, R., Dott, W. & Eisentraeger, A. (eds.), Spektrum Verl., Heidelberg, 59 – 81.
|
|
35.
|
ISO 11268-2 (1998) Kvalita pôdy – účinky znečisťujúcich látok na dážďovky (Eisenia fetida). Časť 2: Stanovenie účinkov na reprodukciu.
|
|
36.
|
Jaenike, J. (1982). ‚Eisenia foetida‘ is two biological species. Megadrilogica 4: 6 – 8.
|
|
37.
|
Jager, T. (1998). Mechanistic approach for estimating bioconcentration of organic chemicals in earthworms (Oligochaeta). Environ. Toxicol. Chem. 17: 2080 – 2090.
|
|
38.
|
Jager, T., Sanchez, P. A., Muijs, B., van der Welde, E., Posthuma, L. (2000). Toxicokinetics of polycyclic aromatic hydrocarbons in Eisenia andrei (Oligochaeta) using spiked soil. Environ. Toxicol. Chem. 19: 953 – 961.
|
|
39.
|
Jager, T., Baerselman, R., Dijkman, E., De Groot, A. C., Hogendoorn, E. A., DeJong, A., Kruitbosch, J. A. W., Peijnenburg, W. J. G. M. (2003a). Availability of polycyclic aromatic hydrocarbons to earthworms (Eisenia andrei, Oligochaeta) in field-polluted soils and soil-sediment mixtures. Environ. Toxicol. Chem. 22: 767 – 775.
|
|
40.
|
Jager, T., Fleuren, R. L. J., Hoogendoorn, E., de Korte, G. (2003b). Elucidating the routes of exposure for organic chemicals in the earthworm, Eisenia andrei (Oligochaeta). Environ. Sci. Technol. 37: 3399 – 3404.
|
|
41.
|
Janssen, M. P. M., Bruins, A., De Vries, T. H., Van Straalen, N. M. (1991). Comparison of cadmium kinetics in four soil arthropod species. Arch. Environ. Contam. Toxicol. 20: 305 – 312.
|
|
42.
|
Kasprzak, K. (1982). Review of enchytraeid community structure and function in agricultural ecosystems. Pedobiologia 23: 217 – 232.
|
|
43.
|
Khalil, A. M. (1990). Aufnahme und Metabolismus von 14C-Hexachlorbenzol und 14C-Pentachlornitrobenzol in Regenwürmern. Dizertačná práca, Univerzita Mníchov, 137 s.
|
|
44.
|
Landrum, P. F. (1989). Bioavailability and toxicokinetics of polycyclic aromatic hydrocarbons sorbed to sediments for the amphipod Pontoporeia hoyi. Environ. Sci. Toxicol. 23: 588 – 595.
|
|
45.
|
Marinussen, M. P. J. C., Van der Zee, S. E. A. T. M., De Haan, F. A. M. (1997). Cu accumulation in Lumbricus rubellus under laboratory conditions compared with accumulation under field conditions. Ecotox. Environ. Safety 36: 17 – 26.
|
|
46.
|
Mount, D. R., Dawson, T. D., Burkhard, L. P. (1999). Implications of gut purging for tissue residues determined in bioaccumulation testing of sediment with Lumbriculus variegates. Environ. Toxicol. Chem. 18: 1244 – 1249.
|
|
47.
|
Nendza, M. (1991). QSARs of bioaccumulation: Validity assessment of log Kow/log BCF correlations, In: R. Nagel and R. Loskill (eds.): Bioaccumulation in aquatic systems, Contributions to the assessment, Proceedings of an international workshop, Berlín 1990, VCH, Weinheim.
|
|
48.
|
Kapitola C.8 tejto prílohy, Toxicita pre dážďovky.
|
|
49.
|
Kapitola C.13 tejto prílohy, Biokoncentrácia: prietokový rybí test.
|
|
50.
|
Kapitola C.21 tejto prílohy, Pôdne mikroorganizmy: test dusíkovej premeny.
|
|
51.
|
Kapitola C.35 tejto prílohy, Test reprodukcie pri Enchytraeidae.
|
|
52.
|
Kapitola C.36 tejto prílohy, Test reprodukcie pri dážďovkách
|
|
53.
|
Kapitola C.51 tejto prílohy: Bioakumulácia pri bentických máloštetinavcoch žijúcich v sedimente.
|
|
54.
|
Petersen, H., a Luxton, M. (1982). A comparative analysis of soil fauna populations and their role in decomposition processes. Oikos 39: 287 – 388.
|
|
55.
|
Phillips, D. J. H. (1993). Bioaccumulation. In: Handbook of Ecotoxicology Vol. 1. Calow P. (ed.). Blackwell Scientific Publ., Oxford. 378 – 396.
|
|
56.
|
Pflugmacher, J. (1992). Struktur-Aktivitätsbestimmungen (QSAR) zwischen der Konzentration von Pflanzenschutzmitteln und dem Octanol-Wasser-Koeffzienten UWSF- Z. Umweltchem. Ökotox. 4: 77 – 81.
|
|
57.
|
Posthuma, L., Weltje, L., Anton-Sanchez, F. A. (1996). Joint toxic effects of cadmium and pyrene on reproduction and growth of the earthworm Eisenia fetida. RIVM Report No. 607506001, Bilthoven.
|
|
58.
|
Randall, R. C., Lee, II H., Ozretich, R. J., Lake, J. L., Pruell, R. J. (1991). Evaluation of selected lipid methods for normalising pollutant bioaccumulation. Environ.Toxicol. Chem. 10: 1431 – 1436.
|
|
59.
|
Römbke, J., Egele, P., Füll, C. (1998). Literaturstudie über Bioakkumulationstests mit Oligochaeten im terrestrischen Medium. UBA-Texte 28/98, 84 s
|
|
60.
|
Römbke, J., a Moser, Th. (1999). Organisation and performance of an international ring-test for the validation of the Enchytraeid reproduction test. UBA-Texte 4/99: 373 s
|
|
61.
|
Römbke, J., Riepert, F., Achazi, R. (2000). Enchytraeen als Testorganismen, In: Toxikologische Beurteilung von Böden. Heiden, S., Erb, R., Dott, W. & Eisentraeger, A. (eds.). Spektrum Verl., Heidelberg. 105 – 129.
|
|
62.
|
Romijn, C. A. F. M., Luttik, R., Van De Meent, D., Slooff, W.,Canton, J. H. (1993). Presentation of a General Algorithm to Include Effect Assessment on Secondary Poisoning in the Derivation of Environmental Quality Criteria, Part 2: Terrestrial food chains. Ecotox. Envir. Safety 27: 107 – 127.
|
|
63.
|
Sample, B. E., Suter, D. W., Beauchamp, J. J., Efroymson, R. A. (1999). Literature-derived bioaccumulation models for earthworms: Development and validation. Environ. Toxicol. Chem. 18: 2110 – 2120.
|
|
64.
|
Schlosser, H.-J., a Riepert, F. (1992). Entwicklung eines Prüfverfahrens für Chemikalien an Bodenraubmilben (Gamasina), Teil 2: Erste Ergebnisse mit Lindan und Kaliumdichromat in subletaler Dosierung. Zool. Beitr. NF 34: 413 – 433.
|
|
65.
|
Schmelz, R., a Collado, R. (1999). Enchytraeus luxuriosus sp. nov., a new terrestrial oligochaete species (Enchytraeide, Clitellata, Annelida). Carolinea 57: 93 – 100.
|
|
66.
|
Sims, R. W., a Gerard, B. M. (1985). Earthworms, In: Kermack, D. M. & Barnes, R. S. K. (Hrsg.): Synopses of the British Fauna (New Series) No. 31. 171 S. Londýn: E. J. Brill/Dr. W. Backhuys.
|
|
67.
|
Sousa, J. P., Loureiro, S., Pieper, S., Frost, M., Kratz, W., Nogueira, A. J. A., Soares, A. M. V. M. (2000). Soil and plant diet exposure routes and toxicokinetics of lindane in a terrestrial isopod. Environ. Toxicol. Chem. 19: 2557 – 2563.
|
|
68.
|
Spacie, A., a Hamelink, J. L. (1982). Alternative models for describing the bioconcentration of organics in fish. Environ. Toxicol. Chem. 1, 309 – 320.
|
|
69.
|
Stephenson, G. L., Kaushik, A., Kaushik, N. K., Solomon, K. R., Steele, T., Scroggins, R. P. (1998). Use of an avoidance-response test to assess the toxicity of contaminated soils to earthworms. In: Advances in earthworm ecotoxicology. S. Sheppard, J. Bembridge, M. Holmstrup, L. Posthuma (eds.). Setac Press, Pensacola, 67 – 81.
|
|
70.
|
Sterenborg, I., Vork, N. A., Verkade, S. K., Van Gestel, C. A. M., Van Straalen, N. M. (2003). Dietary zinc reduces uptake but not metallothionein binding and elimination of cadmium in the springtail Orchesella cincta. Environ. Toxicol. Chemistry 22: 1167 – 1171.
|
|
71.
|
UBA (Umweltbundesamt) (1991). Bioakkumulation – Bewertungskonzept und Strategien im Gesetzesvollzug. UBA-Texte 42/91. Berlín.
|
|
72.
|
US EPA (2000). Methods for measuring the toxicity and bioaccumulation of sediment-associated contaminants with freshwater invertebrates. Druhé vydanie, EPA 600/R-99/064, US, Environmental Protection Agency, Duluth, MN, marec 2000.
|
|
73.
|
Van Brummelen, T. C., a Van Straalen, N. M. (1996). Uptake and elimination of benzoa)pyrene in the terrestrial isopod Porcellio scaber. Arch. Environ. Contam. Toxicol. 31: 277 – 285.
|
|
74.
|
Van Gestel, C. A. M. (1992). The influence of soil characteristics on the toxicity of chemicals for earthworms; a review, In: Ecotoxicology of Earthworms (Ed. Becker, H., Edwards, P. J., Greig-Smith, P. W., a Heimbach, F.). Intercept Press, Andover (GB).
|
|
75.
|
Van Gestel, C. A., a Ma, W.-C. (1990). An approach to quantitative structure-activity relationships (QSARs) in earthworm toxicity studies. Chemosphere 21: 1023 – 1033.
|
|
76.
|
Van Straalen, N. M., Donker, M. H., Vijver, M. G., van Gestel, C. A. M. (2005). Bioavailability of contaminants estimated from uptake rates into soil invertebrates. Environmental Pollution 136: 409 – 417.
|
|
77.
|
Venter, J. M., a Reinecke, A. J. (1988). The life-cycle of the compost-worm Eisenia fetida (Oligochaeta). South African J. Zool. 23: 161 – 165.
|
|
78.
|
Vijver, M. G., Vink, J. P. M., Jager, T., Wolterbeek, H. T., van Straalen, N. M., van Gestel, C. A. M. (2005). Biphasic elimination and uptake kinetics of Zn and Cd in the earthworm Lumbricus rubellus exposed to contaminated floodplain soil. Soil Biol, Biochem. 37: 1843 – 1851.
|
|
79.
|
Widianarko, B., a Van Straalen, N. M. (1996). Toxicokinetics-based survival analysis in bioassays using nonpersistent chemicals, Environ. Toxicol. Chem. 15: 402 – 406.
|
Dodatok 1
VYMEDZENIE POJMOV
|
|
Bioakumulácia je zvyšovanie koncentrácie testovanej chemikálie v alebo na organizme vzhľadom na koncentráciu testovanej chemikálie v okolitom médiu. Bioakumulácia je dôsledkom procesov biokoncentrácie a biomagnifikácie (pozri ďalej).
|
|
|
Biokoncentrácia je zvyšovanie koncentrácie testovanej chemikálie v alebo na organizme, ktoré je dôsledkom absorpcie chemikálie výlučne z okolitého média (t. j. prostredníctvom povrchu tela a požitej pôdy), vzhľadom na koncentráciu testovanej chemikálie v okolitom médiu.
|
|
|
Biomagnifikácia je zvyšovanie koncentrácie testovanej chemikálie v alebo na organizme, ktoré je dôsledkom hlavne absorpcie z kontaminovanej potravy alebo koristi, vzhľadom na koncentráciu testovanej chemikálie v potrave alebo koristi. Biomagnifikácia môže viesť k prenosu alebo akumulácii testovanej látky v rámci potravinového reťazca.
|
|
|
Eliminácia testovanej chemikálie je strata tejto chemikálie z tkaniva testovacieho organizmu aktívnymi alebo pasívnymi procesmi, ku ktorým dochádza bez ohľadu na prítomnosť alebo neprítomnosť testovanej látky v okolitom médiu.
|
|
|
Bioakumulačný faktor (BAF) v akomkoľvek čase počas fázy absorpcie tohto testu bioakumulácie je koncentrácia testovanej chemikálie v/na testovacom organizme (Ca v g·kg–1 suchej hmotnosti červov) vydelená koncentráciou chemikálie v okolitom médiu (Cs ako g·kg–1 suchej hmotnosti pôdy); jednotkou BAF je kg pôdy·kg–1 červov.
|
|
|
Rovnovážny bioakumulačný faktor (BAFss) je BAF v rovnovážnom stave a v priebehu dlhšieho obdobia sa výrazne nemení, pričom koncentrácia testovanej chemikálie v okolitom médiu (Cs ako g kg–1 suchej hmotnosti pôdy) je počas tohto obdobia konštantná.
|
|
|
Bioakumulačné faktory vypočítané priamo na základe pomeru konštanty rýchlosti absorpcie pôdy a konštanty rýchlosti eliminácie (ks a ke, pozri ďalej) sa označujú ako kinetický bioakumulačný faktor (BAFK).
|
|
|
Akumulačný faktor bioty k pôde (BSAF) je koncentrácia testovanej chemikálie v/na testovacom organizme normalizovaná na lipidy vydelená koncentráciou testovanej chemikálie v pôde v rovnovážnom stave normalizovanou na organický uhlík. Ca je potom vyjadrená ako g·kg–1 obsahu lipidov v organizme a Cs ako g·kg–1 organického obsahu pôdy; jednotkou BSAF je kg OC·kg–1 lipidov.
|
|
|
Rovnováha alebo rovnovážny stav sa vymedzuje ako rovnováha medzi procesmi absorpcie a eliminácie, ku ktorým dochádza súčasne počas fázy expozície. Rovnovážny stav nastáva pri grafickom znázornení závislosti BAF od času vtedy, keď sa priebeh krivky stáva paralelný s časovou osou a tri po sebe idúce analýzy BAF uskutočnené na vzorkách odobratých minimálne v dvojdňových intervaloch sa od seba neodlišujú o viac ako 20 % a ak medzi týmito tromi obdobiami odberu vzoriek neexistujú štatisticky významné rozdiely. V prípade testovaných chemikálie, ktoré sa vstrebávajú pomalšie, sú vhodnejšie intervaly v trvaní sedem dní (49).
|
|
|
Rozdeľovací koeficient organický uhlík – voda (Koc) je pomer koncentrácie chemikálie v/na zlomku pôdy tvorenom organickým uhlíkom a koncentrácie chemikálie vo vode v rovnováhe.
|
|
|
Rozdeľovací koeficient oktanol – voda (Kow) je pomer rozpustnosti chemikálie v n-oktanole a vo vode v rovnováhe, niekedy vyjadrený aj ako Pow. Dekadický logaritmus Kow (log Kow) sa používa na vyjadrenie potenciálu chemikálie na bioakumuláciu vo vodných živočíchoch.
|
|
|
Fáza absorpcie alebo expozície je čas, počas ktorého sú testovacie organizmy vystavené pôsobeniu testovanej chemikálie.
|
|
|
Konštanta rýchlosti absorpcie pôdy (ks) je číselná hodnota vyjadrujúca rýchlosť zvyšovania koncentrácie testovanej látky v/na testovacom organizme v dôsledku absorpcie z pôdnej fázy; ks je vyjadrená v g pôdy kg–1 červov d–1.
|
|
|
Fáza eliminácie je čas nasledujúci po prenose testovacích organizmov z kontaminovaného média do média bez obsahu testovanej látky, počas ktorého sa skúma eliminácia (alebo čistá strata) chemikálie z testovacích organizmov.
|
|
|
Konštanta rýchlosti eliminácie (ke) je číselná hodnota vyjadrujúca rýchlosť znižovania koncentrácie testovanej látky v/na testovacom organizme po prenose testovacích organizmov z média obsahujúceho testovanú látku do média bez obsahu testovanej látky; ke je vyjadrená v d–1.
|
|
|
Testovaná chemikália: akákoľvek látka alebo zmes testovaná pomocou tejto testovacej metódy.
|
Dodatok 2
Výpočet parametrov absorpcie a eliminácie
Hlavným parametrom testu bioakumulácie je bioakumulačný faktor, BAF. Meraný BAF možno vypočítať tak, že koncentrácia v testovacom organizme, Ca, sa vydelí koncentráciou v pôde, Cs, v rovnovážnom stave. Ak sa počas fázy absorpcie nedosiahne rovnovážny stav, BAFK sa vypočíta z konštánt rýchlosti, nie z BAFss. Treba však uviesť, či je BAF založený na koncentráciách v rovnovážnom stave alebo nie.
Zvyčajným prostriedkom stanovovania kinetického bioakumulačného faktora (BAFK), konštanty rýchlosti absorpcie pôdy (ks) a konštanty rýchlosti eliminácie (ke) je použitie nelineárnych metód odhadovania parametrov na počítači, napr. na základe modelov opísaných v odkaze (68). Vzhľadom na súbor sekvenčných údajov o koncentrácii v závislosti od času a modelové rovnice:
|

|
0 < t < tc
|
[rovnica 1]
|
alebo
|

|
t > tc
|
[rovnica 2]
|
kde
|
Ca
|
=
|
koncentrácia chemikálie v červoch [g kg–1 čerstvej alebo suchej hmotnosti],
|
|
ks
|
=
|
konštanta rýchlosti absorpcie v tkanivách [g pôdy kg–1 červov d–1],
|
|
Cs
|
=
|
koncentrácia chemikálie v pôde [g kg–1 čerstvej alebo suchej hmotnosti],
|
|
ke
|
=
|
konštanta rýchlosti eliminácie [d–1],
|
|
tc
|
=
|
čas na konci fázy absorpcie,
|
tieto počítačové programy počítajú hodnoty BAFK, ks a ke.
Ak sa koncentrácia v pozadí pri neexponovaných červoch, napr. v deň 0, výrazne líši od nuly (to môže nastať napr. v prípade kovov), daná koncentrácia v pozadí (Ca,0) by sa mala zahrnúť do týchto rovníc, ktoré budú mať takúto podobu:
|

|
0 < t < tc
|
[rovnica 3]
|
a
|

|
t > tc
|
[rovnica 4]
|
V prípadoch, keď je pozorovaný výrazný priebežný pokles koncentrácie testovacej chemikálie v pôde počas fázy absorpcie, možno použiť tieto modely, napr. (67) (79):
|

|
[rovnica 5]
|
kde
|
Cs
|
=
|
koncentrácia chemikálie v pôde [g kg–1 čerstvej alebo suchej hmotnosti],
|
|
k0
|
=
|
konštanta rýchlosti degradácie v pôde [d–1],
|
|
C0
|
=
|
počiatočná koncentrácia chemikálie v pôde [g kg–1 čerstvej alebo suchej hmotnosti],
|
|

|
0 < t < tc
|
[rovnica 6]
|
|
|
t > tc
|
[rovnica 7]
|
kde
|
Ca
|
=
|
koncentrácia chemikálie v červoch [g kg–1 čerstvej alebo suchej hmotnosti],
|
|
ks
|
=
|
konštanta rýchlosti absorpcie v tkanivách [g pôdy kg–1 červov d–1],
|
|
k0
|
=
|
konštanta rýchlosti degradácie v pôde [d–1],
|
|
ke
|
=
|
konštanta rýchlosti eliminácie [d–1],
|
|
tc
|
=
|
čas na konci fázy absorpcie.
|
Ak sa počas fázy absorpcie dosiahne rovnovážny stav (t. j. t = ∞), rovnicu 1
|

|
0 < t < tc
|
[rovnica 1]
|
možno zredukovať na:

alebo
|

|
[rovnica 8]
|
Potom ks/ke x Cs je prístup ku koncentrácii testovanej látky v tkanivách červov v rovnovážnom stave (Ca,ss).
Akumulačný faktor bioty k pôde (BSAF) možno vypočítať takto:
|

|
[rovnica 9]
|
kde foc je frakcia pôdneho organického uhlíka a flip je frakcia lipidov z červov, podľa možnosti obe stanovené zo vzoriek odobratých počas testu a na základe suchej hmotnosti alebo čerstvej hmotnosti.
Kinetiku eliminácie možno modelovať na základe údajov z fázy eliminácie a s využitím tejto modelovej rovnice a počítačovej metódy odhadovania nelineárnych parametrov. Ak dátové body zakreslené v závislosti od času poukazujú na konštantný exponenciálny pokles koncentrácie testovanej látky pri zvieratách, na opísanie časového priebehu eliminácie možno použiť jednokompartmentový model (rovnica 9).
|

|
[rovnica 10]
|
Procesy eliminácie sa niekedy javia ako dvojfázové, pričom počas počiatočných fáz vykazujú rýchly pokles Ca, ktorý prechádza v pomalšiu stratu testovaných látok v neskorších fázach eliminácie, napr. (27) (68). Dve fázy možno interpretovať s využitím predpokladu, že v organizme, z ktorého sa testovaná látka stráca rôznymi rýchlosťami, existujú dva rôzne kompartmenty. V týchto prípadoch je potrebné si preštudovať konkrétnu literatúru, napr. (38) (39) (40) (78).
Pomocou uvedených modelových rovníc možno kinetické parametre (ks a ke) vypočítať aj v jednom kole použitím modelu kinetiky prvého rádu na všetky údaje z fázy absorpcie aj eliminácie súčasne. Opis metódy, ktorá umožňuje takýto kombinovaný výpočet konštánt rýchlostí absorpcie a eliminácie, možno nájsť v odkazoch 41, 73 a 70.
|

|
[rovnica 11]
|
|
Poznámka:
|
Ak sa parametre absorpcie a eliminácie odhadujú súčasne z kombinovaných údajov o absorpcii a eliminácii, premenná ‚m‘ uvedená v rovnici 11 je deskriptor, ktorý umožňuje počítačovému programu priradiť podpojmy rovnice k súborom údajov z príslušnej fázy a vykonať správne hodnotenie (m = 1 pre fázu absorpcie; m = 2 pre fázu eliminácie).
|
Tieto modelové rovnice by sa však mali používať opatrne, najmä ak počas testu dôjde k zmenám v biodostupnosti alebo (bio)degradácie testovanej chemikálie [pozri napr. (79)].
Dodatok 3
PRÍKLADY HARMONOGRAMOV TESTOV BIOAKUMULÁCIE V PÔDE
Test s dážďovkami
|
a)
|
Fáza absorpcie s použitím ôsmich dní odberu vzoriek na výpočet kinetiky
|
Deň
|
Činnosť
|
|
– 6
|
aklimatizácia pripravenej pôdy počas 48 h;
|
|
– 4
|
obohatenie pôdnej frakcie s roztokom testovanej chemikálie; odparenie akéhokoľvek rozpúšťadla; miešanie pôdnych zložiek; rozdelenie pôdy do testovacích nádob; vyvažovanie v testovacích podmienkach počas štyroch dní (troch týždňov v prípade pôdy obohatenej kovmi);
|
|
– 3 až – 1
|
separácia testovacích organizmov z kultúry na aklimatizáciu; príprava a zvlhčovanie pôdnych zložiek;
|
|
0
|
meranie teploty a pH pôdy; odstránenie pôdnych vzoriek z ošetrených nádob a kontrol rozpúšťadla na stanovenie koncentrácie testovanej chemikálie; pridanie prídelu potravy; váženie a náhodné rozdelenie červov do testovacích nádob; zachovanie dostatočných podvzoriek červov na stanovenie analytických hodnôt pozadia, čerstvej a suchej hmotnosti a obsahu lipidov; váženie všetkých testovacích nádob na kontrolu vlhkosti pôdy; kontrola prívodu vzduchu, ak sa používa uzavretý testovací systém;
|
|
1
|
kontrola prívodu vzduchu, zaznamenanie správania červov a teploty; odber vzoriek pôdy a červov na stanovenie koncentrácie testovanej látky;
|
|
2
|
rovnako ako deň 1;
|
|
3
|
kontrola prívodu vzduchu, správania červov a teploty;
|
|
4
|
rovnako ako deň 1;
|
|
5 – 6
|
rovnako ako deň 3;
|
|
7
|
rovnako ako deň 1; pridanie prídelu potravy; kontrola vlhkosti pôdy opätovným odvážením testovacích nádob a kompenzáciou odparenej vody;
|
|
8 – 9
|
rovnako ako deň 3;
|
|
10
|
rovnako ako deň 1;
|
|
11 – 13
|
rovnako ako deň 3;
|
|
14
|
rovnako ako deň 1; pridanie prídelu potravy; kontrola vlhkosti pôdy opätovným odvážením testovacích nádob a kompenzáciou odparenej vody;
|
|
15 – 16
|
rovnako ako deň 3;
|
|
17
|
rovnako ako deň 1;
|
|
18 – 20
|
rovnako ako deň 3;
|
|
21
|
rovnako ako deň 1; meranie teploty a pH pôdy; kontrola vlhkosti pôdy opätovným odvážením testovacích nádob; koniec fázy absorpcie; prenos červov zo zvyšných exponovaných replikátov do nádob obsahujúcich čistú pôdu pre fázu eliminácie (bez vyprázdnenia tráviaceho traktu); odber vzoriek pôdy a červov z kontrol rozpúšťadla.
|
|
|
Činnosti pred expozíciou (fáza vyvažovania) by sa mali naplánovať tak, aby boli zohľadnené vlastnosti testovanej chemikálie.
|
|
|
Činnosti opísané pre deň 3 by sa mali vykonávať denne (aspoň cez pracovné dni).
|
|
|
b)
|
Fáza eliminácie
|
Deň
|
Činnosť
|
|
– 6
|
príprava a zvlhčovanie pôdnych zložiek; aklimatizácia pripravenej pôdy počas 48 h;
|
|
– 4
|
miešanie pôdnych zložiek; rozdelenie pôdy do testovacích nádob; inkubácia v testovacích podmienkach počas štyroch dní;
|
|
0 (koniec fázy absorpcie)
|
meranie teploty a pH pôdy; váženie a náhodné rozdelenie červov do testovacích nádob; pridanie prídelu potravy; prenos červov zo zvyšných exponovaných replikátov do nádob obsahujúcich čistú pôdu; odber vzoriek pôdy a červov po 4 – 6 h na stanovenie koncentrácie testovanej chemikálie;
|
|
1
|
kontrola prívodu vzduchu, zaznamenanie správania červov a teploty; odber vzoriek pôdy a červov na stanovenie koncentrácie testovanej chemikálie;
|
|
2
|
rovnako ako deň 1;
|
|
3
|
kontrola prívodu vzduchu, správania červov a teploty;
|
|
4
|
rovnako ako deň 1;
|
|
5 – 6
|
rovnako ako deň 3;
|
|
7
|
rovnako ako deň 1; pridanie prídelu potravy; kontrola vlhkosti pôdy opätovným odvážením testovacích nádob a kompenzáciou odparenej vody;
|
|
8 – 9
|
rovnako ako deň 3;
|
|
10
|
rovnako ako deň 1;
|
|
11 – 13
|
rovnako ako deň 3;
|
|
14
|
rovnako ako deň 1; pridanie prídelu potravy; kontrola vlhkosti pôdy opätovným odvážením testovacích nádob a kompenzáciou odparenej vody;
|
|
15 – 16
|
rovnako ako deň 3;
|
|
17
|
rovnako ako deň 1;
|
|
18 – 20
|
rovnako ako deň 3;
|
|
21
|
rovnako ako deň 1; meranie teploty a pH pôdy; kontrola vlhkosti pôdy opätovným odvážením testovacích nádob; odber vzoriek pôdy a červov z kontrol rozpúšťadla.
|
|
|
Príprava pôdy pred začiatkom fázy eliminácie by mala byť rovnaká ako pred fázou absorpcie.
|
|
|
Činnosti opísané pre deň 3 by sa mali vykonávať denne (aspoň cez pracovné dni).
|
|
Test s Enchytraeidae
|
a)
|
Fáza absorpcie s použitím ôsmich dní odberu vzoriek na výpočet kinetiky
|
Deň
|
Činnosť
|
|
– 6
|
aklimatizácia pripravenej pôdy počas 48 h;
|
|
– 4
|
obohatenie pôdnej frakcie s roztokom testovanej chemikálie; odparenie akéhokoľvek rozpúšťadla; miešanie pôdnych zložiek; rozdelenie pôdy do testovacích nádob; vyvažovanie v testovacích podmienkach počas štyroch dní (troch týždňov v prípade pôdy obohatenej kovmi);
|
|
– 3 až – 1
|
separácia testovacích organizmov z kultúry na aklimatizáciu; príprava a zvlhčovanie pôdnych zložiek;
|
|
0
|
meranie teploty a pH pôdy; odstránenie pôdnych vzoriek z ošetrených nádob a kontrol rozpúšťadla na stanovenie koncentrácie testovanej chemikálie; pridanie prídelu potravy do pôdy; váženie a náhodné rozdelenie červov do testovacích nádob; zachovanie dostatočných podvzoriek červov na stanovenie analytických hodnôt pozadia, čerstvej a suchej hmotnosti a obsahu lipidov; váženie všetkých testovacích nádob na kontrolu vlhkosti pôdy; kontrola prívodu vzduchu, ak sa používa uzavretý testovací systém;
|
|
1
|
kontrola prívodu vzduchu, zaznamenanie správania červov a teploty; odber vzoriek pôdy a červov na stanovenie koncentrácie testovanej látky;
|
|
2
|
rovnako ako deň 1;
|
|
3
|
kontrola prívodu vzduchu, správania červov a teploty;
|
|
4
|
rovnako ako deň 1;
|
|
5 – 6
|
rovnako ako deň 3;
|
|
7
|
rovnako ako deň 1; pridanie prídelu potravy do pôdy; kontrola vlhkosti pôdy opätovným odvážením testovacích nádob a kompenzáciou odparenej vody;
|
|
9
|
rovnako ako deň 1;
|
|
10
|
rovnako ako deň 3;
|
|
11
|
rovnako ako deň 1;
|
|
12 – 13
|
rovnako ako deň 3;
|
|
14
|
rovnako ako deň 1; pridanie prídelu potravy do pôdy; meranie teploty a pH pôdy; kontrola vlhkosti pôdy opätovným odvážením testovacích nádob; koniec fázy absorpcie; prenos červov zo zvyšných exponovaných replikátov do nádob obsahujúcich čistú pôdu pre fázu eliminácie (bez vyprázdnenia tráviaceho traktu); odber vzoriek pôdy a červov z kontrol rozpúšťadla.
|
|
|
Činnosti pred expozíciou (fáza vyvažovania) by sa mali naplánovať tak, aby boli zohľadnené vlastnosti testovanej chemikálie.
|
|
|
Činnosti opísané pre deň 3 by sa mali vykonávať denne (aspoň cez pracovné dni).
|
|
Dodatok 4
Umelá pôda – odporúčania týkajúce sa prípravy a skladovania
Keďže prírodné pôdy z konkrétneho zdroja nemusia byť k dispozícii po celý rok a autochtónne organizmy, ako aj prítomnosť znečisťujúcich mikrolátok môže ovplyvniť test, v tomto teste sa odporúča použiť umelý substrát, umelú pôdu podľa kapitoly C.8 tejto prílohy, Toxicita pre dážďovky (48). V takejto pôde môžu prežiť, rásť a rozmnožovať sa viaceré testovacie druhy a je zabezpečená maximálna štandardizácia, ako aj intra- a interlaboratórna porovnateľnosť testovacích a kultivačných podmienok.
Pôdne zložky
|
Rašelina:
|
10 %
|
Rašelinníková rašelina, podľa usmernenia OECD 207 (48)
|
|
Kremenný piesok:
|
70 %
|
Priemyselný kremenný piesok (vysušený vzduchom); veľkosť častíc: viac ako 50 % častíc by malo mať veľkosť v rozsahu 50 – 200 μm, ale všetky častice by mali byť ≤ 2 mm
|
|
Kaolín:
|
20 %
|
Obsah kaolinitu ≥ 30 %
|
|
Uhličitan vápenatý:
|
≤ 1 %
|
CaCO3, rozomletý na prach, chemicky čistý
|
Obsah organického uhlíka v umelej pôde možno prípadne znížiť, napr. znížením obsahu rašeliny na 4 – 5 % suchej pôdy a zodpovedajúcim zvýšením obsahu piesku. V dôsledku takéhoto zníženia obsahu organického uhlíka sa môžu znížiť možnosti adsorpcie testovanej chemikálie na pôde (organický uhlík) a dostupnosť testovanej chemikálie pre červy sa môže zvýšiť (74). Preukázalo sa, že druhy Enchytraeus albidus a Eisenia fetida môžu splniť kritéria platnosti týkajúce sa reprodukcie, ak sa testujú v poľných pôdach s nižším obsahom organického uhlíka, napr. 2,7 % (33), 61, a na základe skúseností možno tento výsledok dosiahnuť aj v umelej pôde, ktorá obsahuje 5 % rašeliny.
Príprava
Suché zložky pôdy sa dôkladne zmiešajú (napr. vo veľkokapacitnom laboratórnom miešači). Zložky sa zmiešajú približne týždeň pred začiatkom testu. Zmiešané suché pôdne zložky sa zvlhčia deionizovanou vodou najmenej 48 hodín pred aplikáciou testovanej látky, aby sa vyvážila/stabilizovala kyslosť. Na stanovenie pH zmesi pôdy sa používa roztok 1 M KCl v pomere 1: 5. Ak hodnota pH nie je v požadovanom rozmedzí (6,0 ± 0,5), do pôdy sa pridá dostatočné množstvo CaCO3 alebo sa pripraví nová várka pôdy.
Maximálna retenčná kapacita vody (WHC) umelej pôdy sa určí podľa ISO 11268-2 (35). Najmenej dva dni pred začiatkom testu sa suchá umelá pôda zvlhčí pridaním dostatočného množstva deionizovanej alebo rekonštituovanej vody, aby sa získala približne polovica konečného obsahu vody. Konečný obsah vody by mal predstavovať 40 – 60 % maximálnej WHC. Na začiatku testu sa predvlhčená pôda rozdelí na toľko várok, koľko je testovacích koncentrácií a kontrol použitých v teste, a obsah vlhkosti sa pomocou roztoku testovanej látky a/alebo pridaním deionizovanej alebo rekonštituovanej vody upraví na 40 – 60 % WHCmax. Obsah vlhkosti sa stanoví na začiatku a na konci testu (pri teplote 105 °C). Mal by optimálne zodpovedať požiadavkám jednotlivých druhov (obsah vlhkosti možno skontrolovať aj takto: keď sa pôda jemne stlačí v ruke, medzi prstami by sa mali objaviť malé kvapky vody).
Skladovanie
Suché zložky umelej pôdy možno až do použitia skladovať pri izbovej teplote. Pripravená predvlhčená pôda sa pred obohatením môže skladovať na chladnom mieste počas až troch dní. Je potrebné dbať na to, aby sa minimalizovalo odparovanie vody. Pôda obohatená o testovanú látku by sa mala ihneď použiť, pokiaľ nie sú k dispozícii informácie, podľa ktorých možno konkrétnu pôdu skladovať bez toho, aby to malo vplyv na toxicitu a biodostupnosť testovanej látky. Vzorky obohatenej pôdy sa môžu do analýzy uskladniť v podmienkach odporúčaných pre konkrétnu testovanú látku.
Dodatok 5
Odporúčané druhy suchozemských máloštetinavcov na testovanie bioakumulácie z pôdy
Dážďovky
Odporúčaný testovací druh je Eisenia fetida (Savigny 1826) patriaci do čeľade Lumbricidae. Od roku 1972 sa delí na dva poddruhy [Eisenia fetida a Eisenia andrei (10)]. Podľa Jaenikeho (36) ide v skutočnosti o dva samostatné druhy. Eisenia fetida sa ľahko rozpozná podľa svetlých intersegmentálnych žltých pásikov, zatiaľ čo Eisenia andrei má jednotné tmavočervené zafarbenie. Tieto druhy pravdepodobne pochádzajú z oblasti Čierneho mora a v súčasnosti sú rozšírené na celom svete, najmä v antropogénne modifikovaných biotopoch, ako sú haldy kompostu. Oba druhy možno použiť na ekotoxikologické aj bioakumulačné testy.
Eisenia fetida a Eisenia andrei sú komerčne dostupné, napr. ako návnady na ryby. V porovnaní s inými dážďovkovitými červami majú krátky životný cyklus, pričom dospelosť dosahujú približne v dvoch až troch mesiacoch (pri izbovej teplote). Ich optimálna teplota je približne 20 – 24 °C. Majú radšej pomerne vlhké substráty s takmer neutrálnym pH a vysokým obsahom organického materiálu. Keďže tieto druhy sa vo veľkej miere využívajú v štandardizovaných ekotoxikologických testoch približne 25 rokov, ich kultivácia je zaužívaná (48) (77).
Oba druhy možno chovať v širokej škále živočíšnych odpadov. Chovné médium, ktoré sa odporúča podľa ISO (35), je zmes konského alebo dobytčieho hnoja a rašeliny v pomere 50: 50. Médium by malo mať hodnotu pH 6 – 7 (regulovaná pomocou uhličitanu vápenatého), nízku iónovú vodivosť (menej ako 6 mS/cm alebo menej ako 0,5 % koncentrácie soli) a nemalo by byť nadmerne kontaminované amoniakom alebo zvieracím močom. Možno použiť aj komerčnú záhradnú pôdu bez prísad alebo umelú pôdu podľa OECD (48) alebo zmes oboch pôd v pomere 50: 50. Substrát by mal byť vlhký, ale nie príliš mokrý. Vhodné sú chovné boxy s objemom 10 – 50 litrov.
Na získanie červov štandardného veku a hmotnosti je najlepšie začať kultiváciou kokónov. Dospelé červy sa preto pridajú do chovného boxu obsahujúceho čerstvý substrát na tvorbu kokónov. Praktické skúsenosti preukázali, že hustota populácie približne 100 dospelých červov na kg substrátu (čerstvá hmotnosť) zabezpečuje dobrú mieru reprodukcie. Po 28 dňoch sa dospelé červy odoberú. Dážďovky vyliahnuté z kokónov sa použijú na testovanie, keď dosiahnu dospelosť, aspoň po dvoch mesiacoch, ale pred uplynutím 12 mesiacov.
Červy opísaných druhov možno považovať za zdravé, keď sa pohybujú v substráte, nesnažia sa opustiť substrát a priebežne sa rozmnožujú. Veľmi pomalý pohyb alebo žltá zadná časť (v prípade Eisenia fetida) znamená vyčerpanie substrátu. V takom prípade sa odporúča čerstvý substrát a/alebo nižší počet zvierat v boxe.
Ďalšie vybraté odkazy
Gerard, B. M. (1964). Synopsis of the British fauna. No. 6 Lumbricidae. Linnean Soc. Londýn, 6: 1 – 58.
Graff, O. (1953). Die Regenwürmer Deutschlands. Schr. Forsch. Anst. Landwirtsch. 7: 1 – 81.
Römbke, J., Egeler, P., Füll, C. (1997). Literaturstudie über Bioakkumulationstests mit Oligochaeten im terrestrischen Medium. Bericht für das UBA F + E 206 03 909, 86 s
Rundgren, S. (1977). Seasonality of emergence in lumbricids in southern Sweden. Oikos 28: 49 – 55.
Satchell, J. E. (1955). Some aspects of earthworm ecology. Soil Zoology (Kevan): 180 – 201.
Sims, R. W., a Gerard, B. M. (1985). A synopsis of the earthworms. Linnean Soc. Londýn 31: 1 – 171.
Tomlin, A. D. (1984). The earthworm bait market in North America. In: Earthworm Ecology – from Darwin to vermiculture. Satchell, J.E. (ed.), Chapman & Hall, Londýn. 331 – 338 s.
Enchytraeidae
Odporúčaný testovací druh je Enchytraeus albidus Henle 1837 (mrlica biela). Enchytraeus albidus je jeden z najväčších (až 15mm) druhov obrúčkavých máloštetinavcov čeľade Enchytraeidae a vyskytuje sa na celom svete, napr. (8). Enchytraeus albidus sa vyskytuje v morských, sladkovodných a suchozemských biotopoch, najmä v rozkladajúcej sa organickej hmote (morské riasy, kompost) a vzácne na lúkach (42). Táto široká ekologická tolerancia a niektoré morfologické variácie poukazujú na skutočnosť, že môže existovať niekoľko rás tohto druhu.
Enchytraeus albidus je komerčne dostupný, predáva sa ako potrava pre ryby. Treba skontrolovať, či kultúra nie je kontaminovaná inými, zvyčajne menšími druhmi (60). Ak dôjde ku kontaminácii, všetky červy by sa mali premyť vodou v Petriho miske. Veľké dospelé jedince druhu Enchytraeus albidus sa následne vyberú (pomocou stereomikroskopu) na založenie novej kultúry. Všetky ostatné červy sa zlikvidujú. Životný cyklus tohto druhu je krátky, keďže dospieva od 33 dní (pri teplote 18 °C) do 74 dní (pri teplote 12 °C). V teste možno použiť iba kultúry, ktoré sa udržiavali v laboratóriu bez problémov počas najmenej piatich týždňov (jedna generácia).
Iné druhy rodu Enchytraeus sú takisto vhodné, najmä Enchytraeus luxuriosus. Tento druh sa fyziologicky vyskytuje v pôde a najnovšie bol opísaný v odkaze (65). Ak sa použijú iné druhy rodu Enchytraeus, musia byť jednoznačne identifikované a do správy sa musí uviesť odôvodnenie výberu daného druhu.
Enchytraeus crypticus (Westheide a Graefe 1992) je druh, ktorý patrí do tej istej skupiny ako Enchytraeus luxuriosus. Nebolo s istotou zistené, či sa tento druh vyskytuje v poli, a opísaný bol iba z kultúr dážďoviek a háld kompostu (Römbke 2003). Jeho pôvodné ekologické potreby preto nie sú známe. Najnovšie laboratórne štúdie v rôznych poľných pôdach však potvrdili, že tento druh má vysokú toleranciu voči vlastnostiam pôdy, ako je pH a štruktúra (Jänsch a kol. 2005). V posledných rokoch sa tento druh často používa v ekotoxikologických štúdiách pre jednoduchosť chovu a testovania, napr. Kuperman a kol. 2003). Je však malý (3 – 12 mm; 7 mm v priemere (Westheide a Müller 1996), v dôsledku čoho je manipulácia problematickejšia ako v prípade druhu Enchytraeus albidus. Ak sa tento druh použije namiesto Enchytraeus albidus, veľkosť testovacej nádoby môže, ale nemusí byť menšia. Okrem toho je potrebné zohľadniť, že tento druh sa veľmi rýchlo rozmnožuje, a generačný čas pri teplote 20 ± 2 °C je menej ako 20 dní (Achazi a kol. 1999) alebo pri vyšších teplotách ešte menej.
Enchytraeidae druhu Enchytraeus albidus (ako aj iné druhy rodu Enchytraeus) možno chovať vo veľkých umelohmotných boxoch (napr. 30 × 60 × 10 cm alebo 20 × 12 × 8 cm, ktorý je vhodný pre kultúry malých červov) naplnených zmesou umelej pôdy a komerčne dostupnej nekontaminovanej záhradnej pôdy bez prísad. Kompostový materiál by sa nemal používať, lebo môže obsahovať toxické chemikálie, ako sú ťažké kovy. Faunu je potrebné z chovnej pôdy pred použitím odstrániť prostredníctvom hlbokého zmrazenia, ktoré sa vykoná trikrát. Možno použiť aj čistú umelú pôdu, ale miera reprodukcie môže byť pomalšia v porovnaní s mierou, ktorá sa dosiahne pomocou zmiešaných substrátov. Hodnota pH substrátu by mala byť 6,0 ± 0,5. Kultúra je uložená v inkubátore pri teplote 15 ± 2 °C bez svetla. V každom prípade treba zabrániť tomu, aby bola teplota vyššia ako 23 °C. Umelá/prírodná pôda by mala byť vlhká, ale nie mokrá. Keď sa pôda jemne stlačí v ruke, mali by sa objaviť iba malé kvapky vody. V každom prípade treba predchádzať anoxickým podmienkam (napr. ak sa použije veko, počet dier vo veku by mal byť dostatočne vysoký, aby zabezpečoval dostatočnú výmenu vzduchu). Chovná pôda by sa mala raz týždenne prevzdušniť dôkladným miešaním.
Červy by sa mali kŕmiť najmenej raz týždenne ad libitum ovsenými otrubami, ktoré sa vložia do dutiny na povrchu pôdy a prikryjú pôdou. Ak v nádobe ostala potrava z posledného dňa kŕmenia, množstvo podávanej potravy by sa malo zodpovedajúco upraviť. Ak na zvyšnej potrave rastú huby, mala by sa nahradiť novým množstvom ovsených vločiek. Na stimuláciu reprodukcie možno ovsené vločky každé dva týždne doplniť komerčne dostupným bielkovinovým práškom s vitamínmi. Po troch mesiacoch sa zvieratá prenesú do čerstvo pripravenej kultúry alebo chovného substrátu. Ovsené otruby, ktoré musia byť uskladnené v hermeticky uzavretých nádobách, sa pred použitím autoklávujú alebo zohrejú, aby sa zabránilo infekciám v dôsledku múčnych roztočov (napr. druh Glyzyphagus, Astigmata, Acarina) alebo dravých roztočov (napr. Hypoaspis (Cosmolaelaps) miles, Gamasida, Acarina). Po dezinfekcii sa potrava zomelie, aby ju bolo možné ľahko rozsypať po povrchu pôdy. Ďalším možným zdrojom potravy sú pekárske kvasnice alebo potrava pre ryby TetraMin®.
Vo všeobecnosti sú kultivačné podmienky dostatočné, ak sa červy nesnažia opustiť substrát, v pôde sa pohybujú rýchlo, majú lesklý vonkajší povrch bez prilepených častíc pôdy a sú viac-menej do biela zafarbené a ak možno pozorovať červy rôzneho veku. Červy možno v skutočnosti považovať za zdravé, ak sa priebežne rozmnožujú.
Ďalšie vybraté odkazy
Achazi, R. K., Fröhlich, E., Henneken, M., Pilz, C. (1999). The effect of soil from former irrigation fields and of sewage sludge on dispersal activity and colonizing success of the annelid Enchytraeus crypticus (Enchytraeidae, Oligochaeta). Newsletter on Enchytraeidae 6: 117 – 126.
Jänsch, S., Amorim, M. J. B., Römbke, J. (2005). Identification of the ecological requirements of important terrestrial ecotoxicological test species. Environ. Reviews 13: 51 – 83.
Kuperman, R. G., Checkai, R. T., Simini, M., Phillips, C. T., Kolakowski, J. E., Kurnas, C. W., Sunahara, G. I. (2003). Survival and reproduction of Enchytraeus crypticus (Oligochaeta, Enchytraeidae) in a natural sandy loam soil amended with the nitro-heterocyclic explosives RDX and HMX. Pedobiologia 47: 651 – 656.
Römbke, J. (2003). Ecotoxicological laboratory tests with enchytraeids: A review. Pedobiologia 47: 607 – 616.
Westheide, W., a Graefe, U. (1992). Two new terrestrial Enchytraeus species (Oligochaeta, Annelida). J. Nat. Hist. 26: 479 – 488.
Westheide, W., a Müller, M. C. (1996). Cinematographic documentation of enchytraeid morphology and reproductive biology. Hydrobiologia 334: 263 – 267.“
“ |
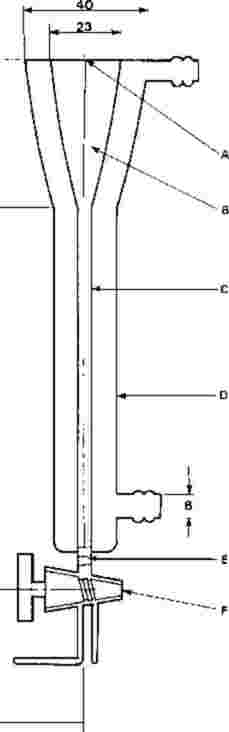

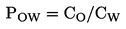

 (v molarite),
(v molarite),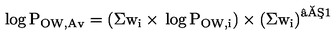
 .
.

 . V prípade nižších koncentrácií sa vyžadujú väčšie objemy.
. V prípade nižších koncentrácií sa vyžadujú väčšie objemy.




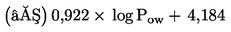

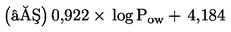
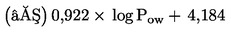

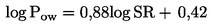


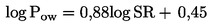
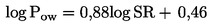
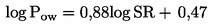





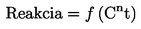














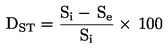








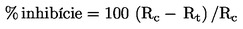
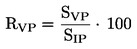




















 ),
),


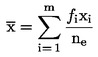

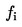
 ),
),