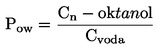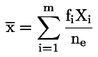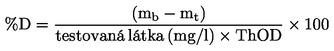|
6.
|
Dopĺňajú sa kapitoly C.31 až C.46: „C.31. TEST SUCHOZEMSKÝCH RASTLÍN: TEST VZCHÁDZANIA SEMIEN A RASTU SADENÍC
ÚVOD
|
1.
|
Táto testovacia metóda je rovnocenná s usmernením OECD na vykonávanie testov (TG) 208 (2006). Testovacie metódy sa pravidelne revidujú vzhľadom na vedecký pokrok a použiteľnosť na regulačné účely. Táto aktualizovaná testovacia metóda je určená na hodnotenie možných účinkov chemikálií na vzchádzanie semien a rast sadeníc. Nevzťahuje sa na chronické účinky alebo účinky na reprodukciu (t. j. prípravu osiva, tvorbu kvetov, dozrievanie plodov). Posúdiť sa musia podmienky expozície a vlastnosti chemikálie, ktorá sa má testovať, aby sa zabezpečilo použitie vhodných testovacích metód (napr. pri testovaní kovov/kovových zlúčenín by sa mali posúdiť účinky pH a súvisiacich iónov s opačnými nábojmi) (1). Táto testovacia metóda sa nevzťahuje na rastliny vystavené pôsobeniu pár chemikálií. Použiteľná je na testovanie všeobecných chemikálií, biocídov a výrobkov na ochranu plodín (známych aj ako prípravky na ochranu rastlín alebo pesticídy). Metóda bola vyvinutá na základe existujúcich metód uvedených v literatúre pod číslami (2) (3) (4) (5) (6) (7). Uvádzajú sa aj ďalšie odkazy týkajúce sa testovania rastlín pod číslami (8) (9) (10). Vymedzenie použitých pojmov je uvedené v dodatku 1.
|
PRINCÍP TESTU
|
2.
|
Týmto testom sa hodnotia účinky na rast sadeníc a skorý rast vyšších rastlín po expozícii testovanej chemikálii v pôde (alebo inej vhodnej pôdnej matrici). Semená sa vystavia styku s pôdou s aplikovanou testovanou chemikáliou a hodnotia sa účinky po uplynutí zvyčajne 14 – 21 dní po vzídení sadenice v kontrolnej skupine o 50 %. Meranými konečnými parametrami sú vizuálne posúdenie vzchádzania sadeníc, suchá hmotnosť výhonkov (prípadne čerstvá hmotnosť výhonkov) a v niektorých prípadoch výška výhonku, ako aj posúdenie viditeľných škodlivých účinkov na rôzne časti rastliny. Tieto merania a pozorovania sa porovnávajú s meraniami a pozorovaniami kontrolných rastlín bez aplikovanej chemikálie.
|
|
3.
|
V závislosti od očakávaného spôsobu expozície sa testovaná chemikália pridá do pôdy (prípadne do matrice s umelo pripravenou pôdou) alebo sa aplikuje na povrch pôdy, čo primerane reprezentuje potenciálny spôsob expozície chemikálie. Pri pridávaní do pôdy sa chemikália aplikuje do určitého objemu voľnej pôdy. Po aplikácii sa pôda prenesie do nádob a následne sa semená daného rastlinného druhu vysadia do pôdy. Povrchové aplikácie sa robia na pôdu v nádobách, do ktorej boli semená už vysadené. Testovacie jednotky (kontrolné vzorky, vzorky pôdy s aplikovanou chemikáliou a semená) sa následne umiestnia do vhodných podmienok na podporu klíčenia/rastu rastlín.
|
|
4.
|
Podľa zámeru štúdie sa test môže vykonať s cieľom zostrojiť krivku závislosti odozvy od dávky, alebo ako limitný test jednej koncentrácie/dávky. Ak výsledky testu jednej koncentrácie/dávky prekročia určitú úroveň toxicity (napr. ak boli zaznamenané väčšie účinky než x %), vykoná sa test na vyhľadávanie rozsahu, ktorým sa stanoví horné a dolné hranice toxicity, a následne sa vykoná viacnásobný test koncentrácie/dávky na vytvorenie krivky závislosti odozvy od dávky. Na získanie hodnôt účinnej koncentrácie ECx alebo účinnej aplikačnej dávky ERx (napr. EC25, ER25, EC50, ER50) pre najcitlivejšie sledovaný parameter, resp. parametre sa používa vhodná štatistická analýza. V rámci tohto testu sa môžu vypočítať aj hodnoty koncentrácie bez pozorovaného účinku (NOEC) a najnižšej koncentrácie s pozorovaným účinkom (LOEC).
|
INFORMÁCIE O TESTOVANEJ CHEMIKÁLII
|
5.
|
Pri identifikácii očakávaného spôsobu expozície chemikálie a pri navrhovaní testu sú užitočné tieto informácie: štrukturálny vzorec, čistota, rozpustnosť vo vode, rozpustnosť v organických rozpúšťadlách, rozdeľovacia konštanta 1-oktanol/voda, sorpčné vlastnosti pôdy, tlak pary, chemická stabilita vo vode a na svetle a biodegradovateľnosť.
|
PLATNOSŤ TESTU
|
6.
|
Na to, aby bol test platný, je potrebné v kontrolných vzorkách splniť tieto kritériá:
|
—
|
vzchádzanie semien (sadeníc) dosahuje najmenej 70 %,
|
|
—
|
sadenice nevykazujú viditeľné fytotoxické účinky (napr. chlorózu, nekrózu, vädnutie, deformácie listov a stoniek) a rastliny vykazujú len rozdiely v raste a morfológii bežné pre daný druh,
|
|
—
|
stredná miera prežitia vzídených kontrolných sadeníc počas celej štúdie je najmenej 90 %,
|
|
—
|
environmentálne podmienky pre jednotlivé druhy sú rovnaké a rastové médiá obsahujú rovnaké množstvo pôdnej matrice, podporných médií alebo substrátu z rovnakého zdroja.
|
|
REFERENČNÁ CHEMIKÁLIA
|
7.
|
Referenčná chemikália sa môže testovať v pravidelných intervaloch s cieľom overiť, či sa vykonanie testu, reakcia príslušných testovacích rastlín a podmienky testu postupom času výrazne nezmenili. Alternatívne by sa staršie merania množstva biomasy alebo rastu kontrolných vzoriek mohli použiť na hodnotenie výkonnosti testovacieho systému v konkrétnych laboratóriách a môžu slúžiť ako prostriedok kontroly kvality v rámci jednotlivých laboratórií.
|
OPIS METÓDY
Prirodzená pôda – umelý substrát
|
8.
|
Rastliny sa môžu pestovať v nádobách v pieskovohlinitej pôde, hlinitopieskovej pôde alebo pieskovoílovitej hline, ktorá obsahuje až 1,5 % organického uhlíka (približne 3 % organickej hmoty). Použiť sa môže aj komerčná záhradkárska zemina alebo syntetická pôdna zmes s obsahom do 1,5 % organického uhlíka. Ílovité pôdy by sa nemali používať, ak je testovaná chemikália známa vysokou afinitou k ílom. Pôda z poľa by sa mala preosiať na veľkosť častíc 2 mm s cieľom zhomogenizovať ju a odstrániť z nej veľké častice. Zaznamenať by sa mal typ a štruktúra konečnej pripravenej pôdy, jej percentuálny obsah organického uhlíka, pH a obsah soli ako parameter elektrónovej vodivosti. Pôda by sa mala klasifikovať podľa štandardnej klasifikačnej schémy (11). Pôda by sa mohla pasterizovať alebo tepelne ošetriť s cieľom znížiť vplyv pôdnych patogénov.
|
|
9.
|
Prírodná pôda môže skomplikovať interpretáciu výsledkov a zvýšiť ich premenlivosť v dôsledku premenlivých fyzikálnych/chemických vlastností a mikrobiálnych populácií. Tieto premenné následne menia schopnosť zadržiavania vlhkosti, schopnosť vytvárania chemických väzieb, prevdzušňovanie a obsah živín a stopových prvkov. Okrem premenlivosti týchto fyzikálnych faktorov sa vyskytnú aj zmeny v chemických vlastnostiach, ako je napríklad pH a oxidačno-redukčný potenciál, ktoré môžu ovplyvniť biodostupnosť testovanej chemikálie (12) (13) (14).
|
|
10.
|
Umelé substráty sa spravidla nepoužívajú na testovanie výrobkov na ochranu plodín, ale môžu sa použiť na testovanie všeobecných chemikálií, alebo ak je žiaduce, aby sa minimalizovala premenlivosť prírodnej pôdy a zvýšila porovnateľnosť výsledkov testu. Použité substráty by mali byť zložené z inertných materiálov, ktoré minimalizujú interakciu s testovanou chemikáliou, nosným rozpúšťadlom alebo obidvoma. Kyselinou premytý kremenný piesok, minerálna vlna a sklené guľôčky (s priemerom napríklad 0,35 – 0,85 mm) sú vhodné inertné materiály, ktoré minimálne absorbujú testovanú chemikáliu (15), aby sa zabezpečilo, že chemikália bude maximálne dostupná sadenici prostredníctvom koreňa. Medzi nevhodné substráty patria vermikulit, perlit alebo iné vysokoabsorpčné materiály. Na to, aby rastliny netrpeli nedostatkom výživy, mali by sa im dodávať živiny potrebné na ich rast. Ak je to možné, potreba živín by sa mala posúdiť prostredníctvom chemickej analýzy alebo vizuálnym hodnotením kontrolných rastlín.
|
Kritériá pre výber testovaných druhov
|
11.
|
Výber druhov by mal byť dostatočne široký, napríklad vzhľadom na ich taxonomickú diverzitu v rastlinnej ríši, ich rozdelenie, hojnosť, osobitné charakteristiky životného cyklu druhov a región prirodzeného výskytu, aby vznikol dostatočne široký rozsah reakcií (8) (10) (16) (17) (18) (19) (20). Pri výbere by sa mali zohľadniť tieto charakteristiky možných testovacích druhov:
|
—
|
použité druhy majú jednotné semená, ktoré sú ľahko dostupné zo spoľahlivých štandardných zdrojov osiva, ich klíčenie je konzistentné, spoľahlivé a rovnomerné a rast sadeníc je tiež rovnomerný,
|
|
—
|
rastlinu je možné testovať v laboratóriu a môže poskytnúť spoľahlivé a reprodukovateľné výsledky v rámci rôznych testovacích zariadení,
|
|
—
|
citlivosť testovacích druhov by mala byť v súlade s reakciami rastlín vystavených účinkom chemikálie v prírodnom prostredí,
|
|
—
|
do určitej miery sa využívali v predchádzajúcich testoch toxicity a ich použitie, napríklad v rámci biologických testov herbicídov, skríningových testov ťažkých kovov, stresových testov slanosti alebo minerálov alebo štúdií alelopatie, ukazuje citlivosť na širokú škálu stresových faktorov,
|
|
—
|
sú zlučiteľné s rastovými podmienkami testovacej metódy,
|
|
—
|
spĺňajú kritériá platnosti testu.
|
Niektoré v minulosti použité testovacie druhy sú uvedené v dodatku 2 a potenciálne druhy iné ako plodiny v dodatku 3.
|
|
12.
|
Počet druhov, ktoré sa majú testovať, závisí od príslušných regulačných požiadaviek, preto nie je uvedený v tejto testovacej metóde.
|
Aplikácia testovanej chemikálie
|
13.
|
Chemikália by sa mala aplikovať vo vhodnom nosiči (napr. voda, acetón, etanol, polyetylénglykol, arabská guma, piesok). Testovať sa môžu aj zmesi (pripravené výrobky alebo prípravky), ktoré obsahujú účinné zložky a rozličné pomocné látky.
|
Pridávanie do pôdy/do umelého substrátu
|
14.
|
Chemikálie, ktoré sú rozpustné vo vode alebo suspendované vo vode, sa môžu pridať do vody a potom sa roztok zmieša s pôdou pomocou vhodného miešacieho zariadenia. Tento typ testu môže byť vhodný, ak k expozícii chemikálie dochádza cez pôdu alebo cez vodu, ktorá sa nachádza v pôdnych póroch, pričom existujú obavy o prenos koreňmi. Pridaním testovanej chemikálie by sa nemala prekročiť pôdna kapacita retencie vody. Objem pridanej vody by mal byť rovnaký pre každú testovanú koncentráciu, ale mal by byť obmedzený tak, aby nedochádzalo k vytváraniu zhlukov v pôde.
|
|
15.
|
Chemikálie s nízkou rozpustnosťou vo vode by sa mali rozpustiť vo vhodnom prchavom rozpúšťadle (napr. acetón, etanol) a zmiešať s pieskom. Rozpúšťadlo sa potom môže z piesku odstrániť pomocou prúdu vzduchu za nepretržitého premiešavania piesku. Piesok s aplikovanou chemikáliou sa zmieša s experimentálnou pôdou. Vytvorí sa druhá kontrolná vzorka, do ktorej sa pridá iba piesok a rozpúšťadlo. Do vzoriek s aplikovanou chemikáliou všetkých koncentrácií a do druhej kontrolnej vzorky sa pridá rovnaké množstvo piesku so zamiešaným a následne odstráneným rozpúšťadlom. V prípade tuhých, nerozpustných testovaných chemikálií sa vo vhodnom miešacom zariadení zmieša suchá pôda s chemikáliou. Pôda sa potom pridá do nádob a okamžite sa zasadia semená.
|
|
16.
|
Ak sa namiesto pôdy používa umelý substrát, chemikálie, ktoré sú rozpustné vo vode, sa môžu rozpustiť v živnom roztoku tesne pred začiatkom testu. Chemikálie, ktoré nie sú rozpustné vo vode, ale je možné ich suspendovať vo vode pomocou nosiča, ktorým je rozpúšťadlo, by sa mali pridať do živného roztoku s nosičom. Chemikálie, ktoré nie sú rozpustné vo vode a pre ktoré nie je k dispozícii netoxický nosič rozpustný vo vode, by sa mali rozpustiť vo vhodnom prchavom rozpúšťadle. Roztok sa zmieša s pieskom alebo sklenými guľôčkami, vloží do rotačného vákuového zariadenia a odparí, pričom vznikne rovnomerný nános chemikálie na piesku alebo guľôčkach. Pred naplnením nádob by sa mala odvážená časť guľôčok extrahovať rovnakým organickým rozpúšťadlom a testovanou chemikáliou.
|
Povrchová aplikácia
|
17.
|
V prípade výrobkov na ochranu plodín sa pri aplikácii testovanej chemikálie často používa striekanie testovacieho roztoku na povrch pôdy. Všetko vybavenie, ktoré sa používa na vykonávanie testov, vrátane zariadenia používaného na prípravu a podávanie testovanej chemikálie, by malo mať takú konštrukciu a kapacitu, aby bolo možné testy s týmto vybavením vykonať presne a s reprodukovateľným pokrytím. Pokrytie by malo byť jednotné na celej ploche pôdy. Je potrebné dbať na to, aby sa zabránilo možnosti adsorbovania chemikálií alebo ich reagovania v styku so zariadením (napr. plastovými rúrkami a lipofilnými chemikáliami alebo oceľovými časťami a prvkami). Testovaná chemikália sa rozstrieka na povrch pôdy tak, aby sa simulovala typická aplikácia postrekom z cisterny. Vo všeobecnosti by sa mal objem rozstriekanej chemikálie pohybovať v rozsahu normálnej poľnohospodárskej praxe a používaných objemov (množstvo vody atď. by sa malo zaznamenať). Typ dýzy by sa mal zvoliť tak, aby sa zabezpečilo rovnomerné pokrytie povrchu pôdy. Ak sa používajú rozpúšťadlá a nosiče, mala by sa vytvoriť druhá skupina kontrolných rastlín, pri ktorých by sa použilo iba rozpúšťadlo/nosič. To nie je potrebné v prípade výrobkov na ochranu plodín, ktoré sa testujú ako prípravky.
|
Overovanie koncentrácie/dávky testovanej chemikálie
|
18.
|
Hodnoty koncentrácií/dávok aplikácie sa musia potvrdiť príslušným analytickým overovaním. V prípade rozpustných chemikálií sa všetky testovacie koncentrácie/dávky môžu potvrdiť analýzou najvyššej koncentrácie testovacieho roztoku použitého na test, s dokumentáciou o následnom riedení a o používaní kalibrovaného aplikačného zariadenia (napr. kalibrovaného analytického skla, kalibrovaného postrekovacieho aplikačného zariadenia). V prípade nerozpustných chemikálií sa na overovanie materiálu zlúčeniny musia použiť hmotnosti testovanej chemikálie pridané do pôdy. Ak sa vyžaduje preukázanie homogénnosti, môže byť potrebná analýza pôdy.
|
POSTUP
Koncepcia testu
|
19.
|
Semená toho istého druhu sa pestujú v príslušných nádobách. Počet semien zasadených do každej nádoby bude závisieť od druhu rastliny, veľkosti nádoby a trvania testu. Počet rastlín v nádobe by mal zabezpečiť vhodné podmienky na rast a zabrániť preplneniu nádoby v priebehu testu. Maximálna hustota výsadby je približne 3 až 10 semien na 100 cm2 v závislosti od veľkosti semien. Napríklad do nádoby s priemerom 15 cm sa odporúča zasadiť jednu až dve rastliny kukurice, sóje, rajčiaku, uhorky alebo cukrovej repy, tri rastliny repky alebo hrachu a 5 až 10 semien cibule, pšenice alebo iných malých semien. Počet semien a paralelných nádob (replikát sa vymedzuje ako paralelná nádoba, takže rastliny v rámci tej istej nádoby netvoria replikát) by mal byť primeraný pre optimálnu štatistickú analýzu (21). Je potrebné si uvedomiť, že variabilita bude vyššia v prípade testovaných druhov, v prípade ktorých sa v každej nádobe (replikáte) použije menší počet veľkých semien v porovnaní s testovacím druhom, pri ktorom sa v každej nádobe môže použiť väčší počet malých semien. Zasadením rovnakého počtu semien do každej nádoby sa táto variabilita môže minimalizovať.
|
|
20.
|
Kontrolné skupiny sa používajú s cieľom zabezpečiť, aby pozorované účinky boli spájané len s expozíciou testovanej chemikálie alebo sa expozícii testovanej chemikálie pripisovali. Vhodná kontrolná skupina by mala byť v každom ohľade identická s testovacou skupinou, okrem expozície účinkom testovanej chemikálie. V rámci daného testu by všetky testovacie rastliny vrátane kontrolných mali pochádzať z toho istého zdroja. S cieľom predísť ovplyvňovaniu je potrebné náhodné zaraďovanie testovacích a kontrolných nádob.
|
|
21.
|
Používať by sa nemali semená obaľované insekticídom alebo herbicídom (t. j. upravené semená). Použitie určitých nesystémových kontaktných fungicídov (napr. kaptánu, tirámu) však niektoré regulačné orgány povoľujú (22). Ak existuje možnosť výskytu patogénov prenášaných semenami, semená sa môžu nakrátko namočiť do slabého, 5 % roztoku chlórnanu, potom sa dôkladne opláchnu v tečúcej vode a vysušia. Žiadne ošetrenie iným výrobkom na ochranu plodín nie je povolené.
|
Podmienky testu
|
22.
|
Podmienky testu by sa mali približovať podmienkam potrebným na normálny rast testovacích druhov a odrôd (príklady podmienok testu sú uvedené v dodatku 4). Klíčiace rastliny by sa mali udržiavať správnymi záhradníckymi postupmi v kontrolovanom prostredí komôr, fytotrónov alebo skleníkov. Pri použití rastových zariadení tieto postupy zvyčajne zahŕňajú kontrolu a primerane časté (napr. denné) zaznamenávanie teploty, vlhkosti, koncentrácie oxidu uhličitého, svetla (intenzity, vlnovej dĺžky, fotosynteticky aktívneho žiarenia) a času osvetlenia, spôsobu zavlažovania atď., s cieľom zabezpečiť správny rast rastlín v porovnaní s kontrolnými rastlinami vybratých druhov. Teplota v skleníku by sa mala regulovať prostredníctvom systémov vetrania, vykurovania a/alebo chladenia. Na testovanie v skleníkoch sa vo všeobecnosti odporúčajú tieto podmienky:
|
—
|
teplota: 22 °C ± 10 °C,
|
|
—
|
fotoperióda: minimálne 16 hodín svetla,
|
|
—
|
svietivosť: 350 ± 50 μE/m2/s. Môže byť potrebné doplnkové osvetlenie, ak intenzita klesne pod hodnotu 200 μE/m2/s pri vlnových dĺžkach 400 – 700 nm, s výnimkou určitých druhov, ktorých požiadavky na svetlo sú nižšie.
|
Podmienky prostredia by sa mali v priebehu štúdie monitorovať a zaznamenávať. Rastliny by sa mali pestovať v nepórovitých plastových alebo glazovaných nádobách s podložkou alebo miskou pod nádobou. Nádoby sa môžu pravidelne premiestňovať s cieľom minimalizovať variabilitu v raste rastlín (vzhľadom na rozdiely v podmienkach testu v rámci rastových zariadení). Nádoby musia byť dostatočne veľké, aby umožnili normálny rast.
|
|
23.
|
Pôdne živiny sa môžu podľa potreby dopĺňať, aby sa zachovala vysoká životaschopnosť rastlín. Potreba a časovanie ďalších živín je možné posúdiť pozorovaním kontrolných rastlín. Odporúča sa spodné dopĺňanie vody do testovacích nádob (napr. pomocou knôtov zo sklenených vlákien). Počiatočné vrchné zavlažovanie sa však môže využiť na stimuláciu klíčenia semena a v prípade aplikácie na povrchu pôdy uľahčuje pohyb chemikálie do pôdy.
|
|
24.
|
Osobitné podmienky rastu by mali byť vhodné pre skúmaný testovací druh a testovanú chemikáliu. Kontrolné rastliny a rastliny s aplikovanou chemikáliou sa musia uchovávať v rovnakých podmienkach prostredia, mali by sa však prijať primerané opatrenia, aby sa zabránilo krížovej expozícii (napr. prchavých chemikálií) medzi jednotlivými rastlinami s aplikovanou chemikáliou a kontrolných rastlín testovacím chemikáliám.
|
Testovanie s jednou koncentráciou/dávkou
|
25.
|
Pri určovaní vhodnej koncentrácie/dávky chemikálie na vykonanie testu s jednou koncentráciou alebo dávkou (kontrolný/limitný test) je potrebné zvážiť viaceré faktory. V prípade všeobecných chemikálií to zahŕňa fyzikálne/chemické vlastnosti danej chemikálie. V prípade výrobkov na ochranu plodín je potrebné zvážiť fyzikálne/chemické vlastnosti a spôsob použitia testovanej chemikálie, jej maximálnu koncentráciu alebo aplikačnú dávku, počet aplikácií za sezónu a/alebo perzistenciu testovanej chemikálie. Na zistenie, či všeobecná chemikália má fytotoxické vlastnosti, môže byť vhodné vykonať test pri maximálnej hladine 1 000 mg/kg suchej pôdy.
|
Test na vyhľadávanie rozsahu
|
26.
|
V prípade potreby sa môže vykonať test na vyhľadávanie rozsahu, poskytujúci usmernenie týkajúce sa koncentrácií/dávok, ktoré sa majú testovať v rámci konečnej štúdie odozvy na dávku. Pri teste na vyhľadávanie rozsahu by hodnoty testovacích koncentrácií/dávok mali mať veľké rozstupy (napr. 0,1, 1, 10, 100 a 1 000 mg/kg suchej pôdy). V prípade výrobkov na ochranu plodín by sa hodnoty koncentrácií/dávok mohli zakladať na odporúčaných alebo maximálnych hodnotách koncentrácie alebo aplikačnej dávky, napríklad 1/100, 1/10, 1/1 odporúčanej/maximálnej koncentrácie alebo aplikačnej dávky.
|
Testovanie s viacerými koncentráciami/dávkami
|
27.
|
Účelom testu s viacerými koncentráciami/dávkami je určiť vzťah dávky a účinku a stanoviť hodnotu ECx alebo ERx pre vzchádzanie, biomasu a/alebo vizuálne účinky v porovnaní s kontrolnými rastlinami bez expozície tak, ako to vyžadujú regulačné orgány.
|
|
28.
|
Počet a rozstup hodnôt koncentrácie alebo dávky by mal byť dostatočný na vytvorenie spoľahlivého vzťahu dávky a účinku a príslušnej regresnej rovnice, ako aj na stanovenie odhadu hodnoty ECx alebo ERx. Zvolené koncentrácie/dávky by mali zahŕňať hodnoty ECx alebo ERx, ktoré treba určiť. Napríklad, ak sa požaduje hodnota koncentrácie EC50, bolo by žiaduce vykonať test s dávkami, ktoré vytvárajú účinok 20 – 80 %. Na dosiahnutie tohto cieľa sa odporúča použiť najmenej päť testovacích koncentrácií/dávok v geometrickom rade, spolu s kontrolnými vzorkami bez aplikovanej chemikálie, pričom faktor rozstupu medzi hodnotami by nemal presahovať tri. Počet replikátov pre každú skupinu s aplikovanou chemikáliou a kontrolnú skupinu by mal byť najmenej štyri a celkový počet semien by mal byť najmenej 20. V prípade väčšieho počtu replikátov určitých rastlín s nízkou rýchlosťou klíčenia alebo variabilnými spôsobmi rastu môže byť potrebné zvýšiť štatistickú významnosť testu. Ak sa použije väčší počet testovacích koncentrácií/dávok, počet replikátov sa môže znížiť. Ak sa má odhadnúť hodnota koncentrácie NOEC, na dosiahnutie želanej štatistickej významnosti môže byť potrebných viac replikátov (23).
|
Pozorovania
|
29.
|
Počas sledovaného obdobia, t. j. 14 až 21 dní od vyklíčenia 50 % kontrolných rastlín (prípadne aj kontrol s aplikáciou rozpúšťadla), sa rastliny často pozorujú (najmenej raz týždenne, a ak je to možné, denne), pričom sa sleduje klíčenie a vizuálna fytotoxicita a mortalita. Na konci testu by sa mali zaznamenať výsledky merania percentuálnych hodnôt vzchádzania a množstva biomasy rastlín, ktoré prežili, ako aj viditeľné škodlivé účinky na rôzne časti rastliny. Medzi viditeľné škodlivé účinky patria abnormality vo vzhľade vzídených sadeníc, zastavený rast, chloróza, úbytok farby, mortalita a účinky na vývoj rastliny. Konečné množstvo biomasy je možné merať pomocou konečnej priemernej sušiny vo výhonkoch rastlín, ktoré prežili. Výhonky na povrchu pôdy na zozbierajú a vysušia na konštantnú hmotnosť pri teplote 60 °C. Alternatívne sa konečné množstvo biomasy môže merať pomocou hmotnosti výhonkov v čerstvom stave. Ďalším konečným parametrom môže byť výška výhonku, ak to vyžadujú regulačné orgány. Na hodnotenie pozorovateľných toxických reakcií by sa mal použiť jednotný systém hodnotenia viditeľného poškodenia. Príklady kvalitatívneho a kvantitatívneho vizuálneho hodnotenia sú uvedené v literatúre pod číslami (23) (24).
|
ÚDAJE A PODÁVANIE SPRÁV
Štatistická analýza
Test s jednou koncentráciou/dávkou
|
30.
|
Údaje pre každý rastlinný druh by sa mali analyzovať s použitím vhodnej štatistickej metódy (21). V správe by sa mala uviesť úroveň účinku pri testovanej koncentrácii/dávke alebo skutočnosť, že sa pri testovanej koncentrácii/dávke daný účinok nedosiahol (napr. účinok < x % pozorovaný pri koncentrácii alebo dávke y).
|
Test s viacerými koncentráciami/dávkami
|
31.
|
Vzťah medzi dávkou a reakciou sa stanoví regresným výpočtom. Použiť sa môžu rôzne modely: napríklad na odhad hodnôt ECx alebo ERx (napr. EC25, ER25, EC50, ER50) a ich hraníc spoľahlivosti pre vzchádzanie ako kvantálny údaj by mohli byť vhodné metódy ako probitová, logitová, Weibullova, Spearman-Karberova, upravená Spearman-Karberova atď. Pre priebežné parametre rastu sadeníc (hmotnosť a výšku) sa hodnoty ECx alebo ERx a ich hranice spoľahlivosti môžu odhadnúť pomocou vhodnej regresnej analýzy [napríklad Bruceova-Versteegova nelineárna regresná analýza (25)]. Vždy, keď je to možné, hodnota R2 pre najcitlivejšie druhy by mala byť 0,7 alebo vyššia a účinky použitých testovacích koncentrácií/dávok by mali byť v rozsahu 20 až 80 %. Ak sa má odhadnúť hodnota koncentrácie NOEC, uprednostniť by sa malo použitie výkonných štatistických testov a tie by sa mali vyberať na základe rozdelenia údajov (21) (26).
|
Protokol o skúške
|
32.
|
V protokole o skúške by sa mali predložiť výsledky štúdie, ako aj podrobný opis podmienok testu, dôkladný rozbor výsledkov, analýza údajov a závery vyplývajúce z analýzy. Poskytnúť by sa malo zhrnutie vo forme tabuliek a prehľad výsledkov. Protokol musí obsahovať tieto informácie:
|
|
Testovaná chemikália:
|
—
|
identifikačné údaje chemikálie, dôležité vlastnosti testovanej chemikálie (napr. hodnota log Pow, rozpustnosť vo vode, tlak pary a informácie o osude a správaní látky v životnom prostredí, ak sú k dispozícii),
|
|
—
|
podrobné údaje o testovacom roztoku a overovaní testovaných koncentrácií tak, ako sa uvádza v bode 18.
|
|
|
|
Testované druhy:
|
—
|
podrobné údaje o testovacom organizme: druh/odroda, čeľaď rastliny, vedecké a bežné názvy, čo najpodrobnejšie informácie o zdroji a histórii osiva (t. j. názov dodávateľa, percentuálna klíčivosť, trieda veľkosti semena, číslo dávky alebo šarže, rok vysemenenia alebo sezóna rastu, dátum hodnotenia klíčivosti), životaschopnosť atď.,
|
|
—
|
počet jedno- a dvojklíčnolistových testovacích druhov,
|
|
—
|
odôvodnenie výberu druhov,
|
|
—
|
opis skladovania, ošetrovania a udržiavania osiva.
|
|
|
|
Podmienky testu:
|
—
|
testovacie zariadenie (napr. rastová komora, fytotrón a skleník),
|
|
—
|
opis testovacieho systému (napr. rozmery nádob, materiál nádob a množstvá pôdy),
|
|
—
|
vlastnosti pôdy (textúra alebo typ pôdy: rozdelenie a klasifikácia častíc pôdy, fyzikálne a a chemické vlastnosti vrátane percentuálneho podielu organickej hmoty, percentuálneho podielu organického uhlíka a pH),
|
|
—
|
príprava pôdy/substrátu (napr. pôdy, umelo pripravenej pôdy, piesku a pod.) pred testom,
|
|
—
|
opis média obsahujúceho živiny, ak sa použilo,
|
|
—
|
aplikácia testovanej chemikálie: opis metódy aplikácie, opis vybavenia, miera a objem expozície vrátane verifikácie chemikálie, opisu kalibračnej metódy a opisu podmienok prostredia počas aplikácie,
|
|
—
|
podmienky rastu: svietivosť (napr. fotosynteticky aktívneho žiarenia), fotoperióda, maximálne a minimálne teploty, rozpis a metóda zavlažovania, hnojenie,
|
|
—
|
počet semien v každej nádobe, počet rastlín na dávku, počet replikátov (paralelných nádob) na mieru expozície,
|
|
—
|
typ a počet kontrolných vzoriek (negatívne a/alebo pozitívne kontrolné vzorky, kontrolné vzorky s rozpúšťadlom, ak sa použili),
|
|
|
|
Výsledky:
|
—
|
tabuľka všetkých parametrov pre každý replikát, testovaná koncentrácia/dávka a druh rastliny,
|
|
—
|
počet a percento vyklíčených sadeníc a vzchádzania v porovnaní s kontrolnými vzorkami,
|
|
—
|
meranie množstva biomasy rastlín (suchej hmotnosti výhonkov alebo hmotnosti výhonkov v čerstvom stave) ako percentuálneho podielu kontrolných rastlín,
|
|
—
|
výška výhonkov rastlín ako percentuálny podiel kontrolných rastlín, ak sa meria,
|
|
—
|
percentuálna miera viditeľného poškodenia a kvalitatívny a kvantitatívny opis viditeľného poškodenia (chloróza, nekróza, vädnutie, deformácia listov a stonky, ako aj neprítomnosť účinkov) spôsobeného testovanou chemikáliou v porovnaní s kontrolnými rastlinami,
|
|
—
|
opis hodnotiacej škály používanej na posúdenie viditeľného poškodenia, ak sa vizuálne hodnotenie vykonáva,
|
|
—
|
v prípade štúdií s jednou dávkou aj percentuálna miera poškodenia,
|
|
—
|
hodnoty ECx alebo ERx (napr. EC50, ER50, EC25, ER25) a súvisiace hranice spoľahlivosti; ak sa vykonáva regresná analýza, uvedie sa štandardná chyba pre regresný výpočet a štandardná chyba pre odhad jednotlivých parametrov (napr. sklon, úsek),
|
|
—
|
hodnota koncentrácie NOEC (a LOEC), ak sa vypočítava,
|
|
—
|
opis použitých štatistických postupov a predpokladov,
|
|
—
|
grafické zobrazenie týchto údajov a vzťahu dávky a účinku testovacích druhov.
|
|
Uvedú sa odchýlky od postupov opísaných v tejto testovacej metóde a všetky nezvyčajné udalosti počas testu.
|
LITERATÚRA
|
1.
|
Schrader G., Metge K., and Bahadir M. (1998). Importance of salt ions in ecotoxicological tests with soil arthropods. Applied Soil Ecology, 7, 189-193.
|
|
2.
|
International Organisation of Standards. (1993). ISO 11269-1. Soil Quality -- Determination of the Effects of Pollutants on Soil Flora – Part 1: Method for the Measurement of Inhibition of Root Growth.
|
|
3.
|
International Organisation of Standards. (1995). ISO 11269-2. Soil Quality -- Determination of the Effects of Pollutants on Soil Flora – Part 2: Effects of Chemicals on the Emergence and Growth of Higher Plants.
|
|
4.
|
American Standard for Testing Material (ASTM). (2002). E 1963-98. Standard Guide for Conducting Terrestrial Plant Toxicity Tests.
|
|
5.
|
U.S. EPA. (1982). FIFRA, 40CFR, Part 158.540. Subdivision J, Parts 122-1 and 123-1.
|
|
6.
|
US EPA. (1996). OPPTS Harmonized Test Guidelines, Series 850. Ecological Effects Test Guidelines:
|
—
|
850.4000: Background – Non-target Plant Testing;
|
|
—
|
850.4025: Target Area Phytotoxicity;
|
|
—
|
850.4100: Terrestrial Plant Toxicity, Tier I (Seedling Emergence);
|
|
—
|
850.4200: Seed Germination/Root Elongation Toxicity Test;
|
|
—
|
850.4225: Seedling Emergence, Tier II;
|
|
—
|
850.4230: Early Seedling Growth Toxicity Test.
|
|
|
7.
|
AFNOR, X31-201. (1982). Essai d'inhibition de la germination de semences par une substance. AFNOR X31-203/ISO 11269-1. (1993) Determination des effets des polluants sur la flore du sol: Méthode de mesurage de l'inhibition de la croissance des racines.
|
|
8.
|
Boutin, C., Freemark, K.E. and Keddy, C.J. (1993). Proposed guidelines for registration of chemical pesticides: Non-target plant testing and evaluation. Technical Report Series No.145. Canadian Wildlife Service (Headquarters), Environment Canada, Hull, Québec, Canada.
|
|
9.
|
Forster, R., Heimbach, U., Kula, C., and Zwerger, P. (1997). Effects of Plant Protection Products on Non-Target Organisms – A contribution to the Discussion of Risk Assessment and Risk Mitigation for Terrestrial Non-Target Organisms (Flora and Fauna). Nachrichtenbl. Deut. Pflanzenschutzd. No 48.
|
|
10.
|
Hale, B., Hall, J.C., Solomon, K., and Stephenson, G. (1994). A Critical Review of the Proposed Guidelines for Registration of Chemical Pesticides; Non-Target Plant Testing and Evaluation, Centre for Toxicology, University of Guelph, Ontario Canada.
|
|
11.
|
Soil Texture Classification (US and FAO systems): Weed Science, 33, Suppl. 1 (1985) and Soil Sc. Soc. Amer. Proc. 26:305 (1962).
|
|
12.
|
Audus, L.J. (1964). Herbicide behaviour in the soil. In: Audus, L.J. ed. The Physiology and biochemistry of Herbicides, London, New York, Academic Press, NY, Chapter 5, pp. 163-206.
|
|
13.
|
Beall, M.L., Jr. and Nash, R.G. (1969). Crop seedling uptake of DDT, dieldrin, endrin, and heptachlor from soil, J. Agro. 61:571-575.
|
|
14.
|
Beetsman, G.D., Kenney, D.R. and Chesters, G. (1969). Dieldrin uptake by corn as affected by soil properties, J. Agro. 61:247-250.
|
|
15.
|
U.S. Food and Drug Administration (FDA). (1987). Environmental Assessment Technical Handbook. Environmental Assessment Technical Assistance Document 4.07, Seedling Growth, 14 pp., FDA, Washington, DC.
|
|
16.
|
McKelvey, R.A., Wright, J.P., Honegger, J.L. and Warren, L.W. (2002). A Comparison of Crop and Non-crop Plants as Sensitive Indicator Species for Regulatory Testing. Pest Management Science vol. 58:1161-1174
|
|
17.
|
Boutin, C.; Elmegaard, N. and Kjær, C. (2004). Toxicity testing of fifteen non-crop plant species with six herbicides in a greenhouse experiment: Implications for risk assessment. Ecotoxicology vol. 13(4): 349-369.
|
|
18.
|
Boutin, C., and Rogers, C.A. (2000). Patterns of sensitivity of plant species to various herbicides – An analysis with two databases. Ecotoxicology vol.9(4):255-271.
|
|
19.
|
Boutin, C. and Harper, J.L. (1991). A comparative study of the population dynamics of five species of Veronica in natural habitats. J. Ecol. 9:155-271.
|
|
20.
|
Boutin, C., Lee, H.-B., Peart, T.E., Batchelor, S.P. and Maguire, R.J.. (2000). Effects of the sulfonylurea herbicide metsulfuron methyl on growth and reproduction of five wetland and terrestrial plant species. Envir. Toxicol. Chem. 19 (10): 2532-2541.
|
|
21.
|
OECD (2006). Guidance Document, Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. Series on Testing and Assessment No 54, Organisation for Economic Co-operation and Development, Paris.
|
|
22.
|
Hatzios, K.K. and Penner, D. (1985). Interactions of herbicides with other agrochemicals in higher plants. Rev. Weed Sci. 1:1-63.
|
|
23.
|
Hamill, P.B., Marriage, P.B. and G. Friesen. (1977). A method for assessing herbicide performance in small plot experiments. Weed Science 25:386-389.
|
|
24.
|
Frans, R.E. and Talbert, R.E. (1992). Design of field experiments and the measurement and analysis of plant response. In: B. Truelove (Ed.) Research Methods in Weed Science, 2nd ed. Southern weed Science Society, Auburn, 15-23.
|
|
25.
|
Bruce, R.D. and Versteeg, D. J.(1992). A Statistical Procedure for Modelling Continuous Toxicity Data. Environmental Toxicology and Chemistry 11, 1485-1492.
|
|
26.
|
Chapter C.33 of this Annex: Earthworm Reproduction Test (Eisenia fetida/Eisenia andrei).
|
Dodatok 1
Vymedzenie pojmov
|
|
Účinná zložka (alebo účinná látka) je materiál určený na vyvolanie osobitného biologického účinku (napr. na reguláciu hmyzu, reguláciu chorôb rastlín, reguláciu buriny v oblasti, kde sa aplikuje testovaná chemikália), známy aj ako technická účinná zložka, účinná látka.
|
|
|
Chemikália je látka alebo zmes.
|
|
|
Výrobky na ochranu plodín alebo prípravky na ochranu rastlín alebo pesticídy sú materiály so špecifickou biologickou aktivitou, ktoré sa úmyselne používajú na ochranu plodín pred škodcami (napr. plesňovými ochoreniami, hmyzom a konkurenčnými rastlinami).
|
|
|
Účinná koncentrácia x % (ECx) alebo účinná dávka x % (ERx) je koncentrácia alebo dávka, ktorá má za následok nežiaducu zmenu alebo modifikáciu konečného parametra testu o x % pri meraní vo vzťahu ku kontrolnej vzorke (napr. redukciu vzchádzania semien, hmotnosti výhonkov, konečného počtu prítomných rastlín alebo nárast viditeľného poškodenia o 25 % alebo 50 % by predstavovalo hodnoty EC25/ER25 alebo EC50/ER50).
|
|
|
Vzchádzanie je objavenie sa časti klíčka (koleoptily alebo kotyledónu) nad povrchom pôdy.
|
|
|
Prípravok je komerčne pripravený výrobok s obsahom účinnej látky (účinnej zložky), známy aj ako konečný prípravok (8) alebo typický výrobok na konečné použitie.
|
|
|
LOEC (najnižšia koncentrácia s pozorovaným účinkom) je najnižšia koncentrácia testovanej chemikálie, pri ktorej bol pozorovaný daný účinok. Pokiaľ ide o tento test, koncentrácia zodpovedajúca hodnote LOEC má štatisticky významný účinok (p < 0,05) v rámci daného expozičného času v porovnaní s kontrolnou vzorkou, a je vyššia ako hodnota NOEC.
|
|
|
Necieľové rastliny: ide o rastliny, ktoré sa nachádzajú mimo cieľovej oblasti. V prípade výrobkov na ochranu plodín sa to zvyčajne týka rastlín mimo oblasti s aplikovanou chemikáliou.
|
|
|
NOEC (koncentrácia bez pozorovaného účinku) je najvyššia koncentrácia testovanej chemikálie, pri ktorej nebol pozorovaný žiadny účinok. V tomto teste koncentrácia zodpovedajúca hodnote NOEC nemá žiadny štatisticky významný účinok (p < 0,05) v rámci daného expozičného času v porovnaní s kontrolnou vzorkou.
|
|
|
Fytotoxicita je súbor negatívnych odchýlok (na základe merania a vizuálneho hodnotenia) od obvyklého vzhľadu a rastu rastlín v reakcii na danú chemikáliu.
|
|
|
Replikát je experimentálna jednotka, ktorá predstavuje kontrolnú skupinu a/alebo skupinu s aplikovanou chemikáliou. V rámci týchto štúdií sa za replikát považuje paralelná nádoba.
|
|
|
Vizuálne hodnotenie je hodnotenie viditeľného poškodenia na základe pozorovaní rastlinného porastu, vitality, malformácie, chlorózy, nekrózy a celkového vzhľadu v porovnaní s kontrolnou vzorkou.
|
|
|
Testovaná chemikália je akákoľvek látka alebo zmes, ktorá sa testuje pomocou tejto testovacej metódy.
|
Dodatok 2
Zoznam druhov v minulosti používaných na testovanie rastlín
|
Čeľaď
|
Druh
|
Slovenský názov
|
|
DICOTYLEDONAE
|
|
Apiaceae (Umbelliferae)
|
Daucus carota
|
mrkva obyčajná
|
|
Asteraceae (Compositae)
|
Helianthus annuus
|
slnečnica ročná
|
|
Asteraceae (Compositae)
|
Lactuca sativa
|
šalát siaty
|
|
Brassicaceae (Cruciferae)
|
Sinapis alba
|
horčica biela
|
|
Brassicaceae (Cruciferae)
|
Brassica campestris var. chinensis
|
kapusta poľná čínska
|
|
Brassicaceae (Cruciferae)
|
Brassica napus
|
kapusta repková
|
|
Brassicaceae (Cruciferae)
|
Brassica oleracea var. capitata
|
kapusta obyčajná hlávková
|
|
Brassicaceae (Cruciferae)
|
Brassica rapa
|
kapusta poľná
|
|
Brassicaceae (Cruciferae)
|
Lepidium sativum
|
žerucha siata
|
|
Brassicaceae (Cruciferae)
|
Raphanus sativus
|
reďkev siata
|
|
Chenopodiaceae
|
Beta vulgaris
|
repa obyčajná
|
|
Cucurbitaceae
|
Cucumis sativus
|
uhorka siata
|
|
Fabaceae (Leguminosae)
|
Glycine max (G. soja)
|
sója fazuľová
|
|
Fabaceae (Leguminosae)
|
Phaseolus aureus
|
fazuľa zlatá (mungo)
|
|
Fabaceae (Leguminosae)
|
Phaseolus vulgaris
|
fazuľa obyčajná fazuľa záhradná
|
|
Fabaceae (Leguminosae)
|
Pisum sativum
|
hrach siaty
|
|
Fabaceae (Leguminosae)
|
Trigonella foenum-graecum
|
senovka grécka
|
|
Fabaceae (Leguminosae)
|
Lotus corniculatus
|
ľadenec rožkatý
|
|
Fabaceae (Leguminosae)
|
Trifolium pratense
|
ďatelina lúčna
|
|
Fabaceae (Leguminosae)
|
Vicia sativa
|
vika siata
|
|
Linaceae
|
Linum usitatissimum
|
ľan siaty
|
|
Polygonaceae
|
Fagopyrum esculentum
|
pohánka jedlá
|
|
Solanaceae
|
Solanum lycopersicon
|
rajčiak jedlý
|
|
MONOCOTYLEDONAE
|
|
Liliaceae (Amarylladaceae)
|
Allium cepa
|
cesnak cibuľový
|
|
Poaceae (Gramineae)
|
Avena sativa
|
ovos siaty
|
|
Poaceae (Gramineae)
|
Hordeum vulgare
|
jačmeň siaty
|
|
Poaceae (Gramineae)
|
Lolium perenne
|
mätonoh trváci
|
|
Poaceae (Gramineae)
|
Oryza sativa
|
ryža siata
|
|
Poaceae (Gramineae)
|
Secale cereale
|
raž siata
|
|
Poaceae (Gramineae)
|
Sorghum bicolor
|
cirok dvojfarebný
|
|
Poaceae (Gramineae)
|
Triticum aestivum
|
pšenica letná
|
|
Poaceae (Gramineae)
|
Zea mays
|
kukurica siata
|
Dodatok 3
Zoznam potenciálnych nepoľnohospodárskych druhov
Potenciálne druhy na testovanie toxicity rastlín podľa OECD
Poznámka: Táto tabuľka poskytuje informácie o 52 nepoľnohospodárskych druhoch (odkazy na literatúru sú uvedené v zátvorkách pri každom zápise). Údaje o klíčivosti sú prevzaté z publikovanej literatúry a slúžia len na všeobecné usmernenie. Individuálne skúsenosti sa môžu líšiť v závislosti od zdroja osiva a iných faktorov.
|
ČEĽAĎ Botanický názov druhu
(slovenský názov)
|
Životnosť (9) a biotop
|
Hmotnosť osiva
(mg)
|
Fotoperióda na klíčenie alebo rast (10)
|
Hĺbka sadenia
(mm) (11)
|
Čas na klíčenie
(počet dní) (12)
|
Osobitné postupy (13)
|
Test toxicity (14)
|
Dodávatelia osív (15)
|
Ďalšie odkazy (16)
|
|
APIACEAE
Torilis japónica
(torica japonská)
|
А, В narušené oblasti, živé ploty, pastviny (16, 19)
|
1,7 – 1,9 (14, 19)
|
L = D (14)
|
0
(1, 19)
|
5 (50 %) (19)
|
studená stratifikácia (7, 14, 18, 19) môže byť potrebné dozrievanie (19) klíčenie brzdí tma (1, 19) žiadne osobitné postupy (5)
|
PO (5)
|
|
|
|
ASTERACEAE
Bellis perennis
(sedmokráska obyčajná)
|
Ρ
lúky, orná pôda, rašeliny (16, 19)
|
0,09 – 0,17 (4, 19)
|
L = D (14)
|
0
(4)
|
3 (50 %) (19)
11 (100 %) (18)
|
klíčenie neovplyvňuje intenzita ožiarenia (18, 19) žiadne osobitné postupy (4, 14)
|
PO (4)
|
A, D, F
|
7
|
|
Centaurea cyanus
(nevädza poľná)
|
A
polia, blízkosť ciest, otvorené biotopy (16)
|
4,1 – 4,9 (4, 14)
|
L = D (14)
|
0-3 (2, 4, 14)
|
14 – 21 (100 %) (14)
|
žiadne osobitné postupy (2, 4)
|
PO (2,4)
|
A, D, E, F
|
7
|
|
Centaurea nigra
(nevädzovec frygický pravý)
|
Ρ
polia, blízkosť ciest, otvorené biotopy (16, 19)
|
2,4 – 4,9 (14, 19)
|
L = D (14)
|
0 (19)
|
3 (50 %) (19)
4 (97 %) (18)
|
môže byť potrebné dozrievanie (18, 19) klíčenie brzdí tma (19) žiadne osobitné postupy (5, 14, 26)
|
PO (5, 22, 26)
|
A
|
|
|
Inula helenium
(oman pravý)
|
Ρ
vlhké, narušené oblasti
(16)
|
1 – 1,3 (4, 14, 29)
|
|
0
(4, 29)
|
|
žiadne osobitné postupy (4)
|
PO (4)
|
A, F
|
|
|
Leontodon hispidus
(púpavec srstnatý)
|
Ρ
polia, blízkosť ciest, narušené oblasti (16, 19)
|
0,85 – 1,2 (14, 19)
|
L = D (14)
|
0 (19)
|
4 (50 %) (19)
7 (80 %) (18)
|
klíčenie brzdí tma (17, 18, 19) žiadne osobitné postupy (5, 23)
|
PO (5, 22, 23)
|
|
|
|
Rudbeckia hirta
(rudbekia srstnatá)
|
Β, Ρ narušené oblasti
(16)
|
0,3 (4, 14)
|
L = D (14)
|
0
(4, 33)
|
< 10 (100 %) (33)
|
žiadne osobitné postupy
(4, 14, 33)
|
PO (4, 33)
|
C, D, E, F
|
|
|
Solidago canadensis
(zlatobyľ kanadská)
|
Ρ
pasienky, otvorené priestranstvá (16)
|
0,06 – 0,08 (4, 14)
|
L = D (11)
|
0
(4)
|
14 – 21
(11)
|
zmiešať s rovnakým dielom piesku a namočiť do 500 ppm GA na 24 hodín (11) žiadne osobitné postupy (4)
|
PO (4)
|
E, F
|
|
|
Xanthium pensylvanicum
(voškovník)
|
A
polia, otvorené biotopy (16)
|
25 – 61 (14, 29)
|
|
0(1)
5(29)
|
|
klíčenie môže brzdiť tma (1) namočiť do teplej vody na 12 hodín (29)
|
PRED a PO (31)
|
A
|
|
|
Xanthium spinosum
(voškovník tŕnitý)
|
A
otvorené biotopy (16)
|
200 (14)
|
L = D (14)
L > D (6)
|
10
(6)
|
|
skarifikácia (14) žiadne osobitné postupy (6)
|
PRED a PO (6)
|
A
|
|
|
Xanthium strumarium
(voškovník obyčajný)
|
A
polia, otvorené biotopy (16)
|
67,4 (14)
|
L = D (14)
|
10 – 20 (6, 21)
|
|
žiadne osobitné postupy
(6, 14, 21)
|
PRED a PO (6, 21, 28, 31)
|
A
|
|
|
BRASSICACEAE
Cardamine pratensis
(žerušnica lúčna)
|
Ρ
polia, blízkosť ciest, rašeliny (16, 19)
|
0,6 (14, 19)
|
L = D (14)
|
0 (19)
|
5 (50 %) (19)
15 (98 %) (18)
|
klíčenie brzdí tma (18, 19) žiadne osobitné postupy (5, 14, 22)
|
PO (5, 22)
|
F
|
|
|
CARYOPHYLLACEAE
Lychnis flos-cuculi
(kukučka lúčna)
|
Ρ
(16)
|
0,21 (14)
|
L = D (14)
|
|
< 14 (100 %) (14, 25)
|
môže byť potrebné dozrievanie (18) žiadne osobitné postupy (5, 14, 15, 22 – 26)
|
PO (5, 15, 22-26)
|
F
|
|
|
CHENOPODIACEAE
Chenopodium album
(mrlík biely)
|
A
medze, narušené oblasti (16, 19)
|
0,7 – 1,5 (14, 19, 34)
|
L = D (14)
|
0
(1, 19)
|
2 (50 %) (19)
|
postup sa odlišuje v závislosti od farby osiva (19) dormancia skladovaním v suchu (19) klíčenie brzdí tma (1, 18, 19) studená stratifikácia (18) žiadne osobitné postupy (14, 34)
|
PRED a PO (28, 31, 34)
|
A
|
32
|
|
CLUSIACEAE
Hypericum perforatum
(ľubovník bodkovaný)
|
Ρ
polia, orná pôda, otvorené biotopy (16, 19)
|
0,1 – 0,23
(14, 19)
|
L = D
(14)
|
0
(1, 19)
|
3 (19)
11 (90 %) (18)
|
klíčenie brzdí tma (1, 18, 19)
žiadne osobitné postupy (5, 14, 15, 25, 27)
|
PO
(5, 15, 25, 27)
|
A, E, F
|
|
|
CONVOLVULACEAE
Ipomoea hederacea
(povojník)
|
A
blízkosť ciest, otvorené biotopy, obilné polia (16)
|
28,2
(14)
|
L > D
(6, 10)
|
10-20
(6, 10, 21)
|
4 (100 %)
(10)
|
klíčenie neovplyvňuje intenzita ožiarenia (1)
žiadne osobitné postupy (6, 21)
|
PRED a PO
(6, 12, 21, 28)
|
A
|
|
|
CYPERACEAE
Cyperus rotundus
(šachor)
|
Ρ
orná pôda, pasienky, blízkosť ciest (16, 30)
|
0,2
(14)
|
L = D
(14)
|
0 (1)
10 – 20 (6, 10)
|
12 (91 %)
(10)
|
klíčenie brzdí tma (1)
žiadne osobitné postupy (6, 10, 14)
|
PRED a PO
(6, 28, 31)
|
B
|
7
|
|
FABACEAE
Lotus corniculatus
ľadenec rožkatý
|
Ρ
trávnaté plochy, blízkosť ciest, otvorené biotopy (16, 19)
|
1 – 1,67
(14, 19)
|
L = D (14)
|
|
1 (50 %)
(19)
|
skarifikácia (14, 19)
klíčenie neovplyvňuje intenzita ožiarenia (18, 19) žiadne osobitné postupy (23, 25)
|
PO
(5, 23, 25)
|
A, D, E, F
|
|
|
Senna obtusifolia
(kasia sennová)
|
A
vlhké lesy (16)
|
23-28
(9)
|
L = D (14)
L > D (9)
|
10 – 20
(6,9)
|
|
namočiť semená do vody na 24 hodín (9)
skarifikácia (14) životaschopnosť osiva sa odlišuje v závislosti od farby (1) žiadne osobitné postupy (6)
|
PO
(6,9)
|
A
|
|
|
Sesbania exaltata
(konope)
|
A
aluviálne pôdy (16)
|
11 – 13
(9, 14)
|
L > D (9)
|
10 – 20
(9, 21)
|
|
namočiť semená do vody na 24 hodín (9)
klíčenie neovplyvňuje intenzita ožiarenia (1) žiadne osobitné postupy (21, 14)
|
PRED a PO
(9, 21, 28, 31)
|
A
|
|
|
Trifolium pratense
ďatelina lúčna
|
Ρ
polia, blízkosť ciest, orná pôda (16, 19)
|
1,4 – 1,7
(14, 19)
|
L = D (14)
|
|
1 (50 %)
(19)
|
skarifikácia (14, 18)
môže byť potrebné dozrievanie (19) klíčenie neovplyvňuje intenzita ožiarenia (1, 19) žiadne osobitné postupy (5)
|
PO
(5)
|
A, E, F
|
|
|
LAMIACEAE
Leonurus cardiaca
(srdcovník obyčajný)
|
Ρ
otvorené priestranstvá (16)
|
0,75 – 1,0
(4, 14)
|
L = D (14)
|
0
(4)
|
|
žiadne osobitné postupy
(4, 14)
|
PO
(4)
|
F
|
|
|
Mentha spicata
(mäta klasnatá)
|
Ρ
vlhké oblasti (16)
|
2,21
(4)
|
|
0
(4)
|
|
žiadne osobitné postupy
(4)
|
PO
(4)
|
F
|
|
|
Nepeta cataria
(kocúrnik obyčajný)
|
Ρ
narušené oblasti (16)
|
0,54
(4, 14)
|
L = D (14)
|
0
(4)
|
|
žiadne osobitné postupy
(2, 4, 14)
|
PO
(2,4)
|
F
|
|
|
Prunella vulgaris
(čiernohlávok obyčajný)
|
Ρ
orná pôda, trávnaté plochy, narušené oblasti (16, 19)
|
0,58 – 1,2
(4, 14, 19)
|
L = D (14)
|
0
(4, 19)
|
5 (50 %) (19)
7 (91 %) (18)
|
klíčenie brzdí tma (18, 19)
väčšie klíčenie pri väčších semenách (1 ) žiadne osobitné postupy (4, 14, 22)
|
PO
(4, 22)
|
A, F
|
|
|
Stachys officinalis
(betonika lekárska)
|
Ρ
lúky, medze (19)
|
14 – 18
(14, 19)
|
L = D (14)
|
|
7 (50 %)
(19)
|
žiadne osobitné postupy
(5, 14, 22)
|
PO
(5, 22)
|
F
|
|
|
MALVACEAE
Abutilón theophrasti
(abutilon)
|
A
polia, otvorené biotopy (16)
|
8,8
(14)
|
L = D (14)
|
10 – 20
(6, 10, 21)
|
4 (84 %)
(10)
|
skarifikácia (14)
žiadne osobitné postupy (5, 10, 21)
|
PRED a PO
(6, 22, 28, 31)
|
A, F
|
|
|
Sida spinosa
(podlsnečník)
|
A
polia, blízkosť ciest (16)
|
3,8
(14)
|
L = D (14)
|
10 – 20
(6, 21)
|
|
skarifikácia (14)
klíčenie neovplyvňuje intenzita ožiarenia (1) žiadne osobitné postupy (6, 21)
|
PRED a PO
(6, 21, 28, 31)
|
A, F
|
|
|
PAPAVERACEAE
Papaver rhoeas
(mak vlčí)
|
A
polia, orná pôda, narušené oblasti (16, 19)
|
0,1 – 0,3
(4, 14, 19, 29)
|
L = D (14)
|
0
(4, 29)
|
4 (50 %)
(19)
|
studená stratifikácia a skarifikácia (1, 19, 32)
žiadne osobitné postupy (4, 14, 29)
|
PO
(4)
|
A, D, E, F, G
|
|
|
POACEAE
Agrostis tenuis
(psinček tenký)
|
trávniky, pasienky (16)
|
0,07 (14)
|
L > D (Ю)
|
20 (10)
|
10 (62 %) (10)
|
klíčenie brzdí tma (1, 17 – 19) žiadne osobitné postupy (10)
|
PO (10)
|
A, E
|
|
|
Alopecurus myosuroides
(psiarka roľná)
|
A
polia, otvorené biotopy (16)
|
0,9 – 1,6
(29, 34)
|
L = D (14)
|
2
(29)
|
< 24 (30 %) (34)
|
skarifikácia (14) ošetriť 101 mg/l KNO3 (14) teplá stratifikácia (1) klíčenie brzdí tma (1) žiadne osobitné postupy (34)
|
PRED a PO
(28, 34)
|
A
|
32
|
|
Avena fatua
(ovos hluchý)
|
A
obrábané plochy, otvorené biotopy (16)
|
7 – 7,5 (14, 30)
|
L = D (14)
L > D (6)
|
10 – 20 (6, 10)
|
3 (70 %) (18)
|
skarifikácia (7, 32) klíčenie brzdí tma (1)
studená stratifikácia (1, 18) žiadne osobitné postupy (6, 10, 14)
|
PRED a PO (6, 10, 28, 31)
|
A
|
|
|
Bromus tectorum
(stoklas strechový)
|
A
polia, blízkosť ciest, orná pôda (16)
|
0,45 – 2,28 (14, 29)
|
L = D (14)
|
3 (29)
|
|
obdobie dozrievania (1, 7, 32) klíčenie brzdí svetlo (1) žiadne osobitné postupy (14)
|
PRED a PO (28, 31)
|
A
|
|
|
Cynosurus cristatus
(hrebienka obyčajná)
|
P
polia, blízkosť ciest, otvorené biotopy (16, 19)
|
0,5 – 0,7 (14, 19, 29)
|
L = D (14)
|
0 (29)
|
3 (50 %) (19)
|
klíčenie neovplyvňuje intenzita ožiarenia (19) žiadne osobitné postupy (14, 29)
|
PO (5)
|
A
|
|
|
Digitaria sanguinalis
(rosička krvavá)
|
A
polia, rašeliny, otvorené biotopy (16)
|
0,52 – 0,6 (14, 30)
|
L = D (14)
|
10 – 20 (21)
|
7 (75 %)
14 (94 %) (7)
|
skarifikácia, studená stratifikácia a dozrievanie (1, 7, 14, 32) ošetriť 101 mg/l KNO3 (14) klíčenie brzdí tma (1) žiadne osobitné postupy (21)
|
PRED a PO (18, 25, 31)
|
A
|
|
|
Echinochloa crusgalli
(ježatka kuria)
|
A
(16)
|
1,5 (14)
|
L = D (14)
L > D (3)
|
10 – 20 (7, 21)
|
|
skarifikácia (7, 32) klíčenie neovplyvňuje intenzita ožiarenia (1) žiadne osobitné postupy (3, 14, 21)
|
PRED a PO (3, 21, 28, 31)
|
A
|
|
|
Elymus canadensis
(pýrovník kanadský)
|
P
pobrežné územia, narušené oblasti (16)
|
4 – 5 (14, 30)
|
L = D (11)
|
1
(11)
|
14 – 28
(11)
|
žiadne osobitné postupy
(2, 11)
|
PO (2)
|
C, D, E
|
|
|
Festuca pratensis
(kostrava lúčna)
|
P
polia, vlhké oblasti (16, 19)
|
1,53 – 2,2 (16, 19)
|
L = D (14)
L > D (10)
|
20 (10)
|
9 (74 %) (10)
2 (50 %) (19)
|
žiadne osobitné postupy
(10, 19)
|
PO (10)
|
A
|
7
|
|
Hordeum pusillum
(jačmeň)
|
A
pasienky, blízkosť ciest, otvorené biotopy (16)
|
3,28 (14)
|
|
|
|
teplá stratifikácia (1) klíčenie neovplyvňuje intenzita ožiarenia (1)
|
PRED (31)
|
|
7
|
|
Phieum pratense
(timotejka lúčna)
|
P
pasienky, orná pôda, narušené oblasti (16, 19)
|
0,45 (14, 19)
|
L > D (10, 14)
|
0 – 10 (10, 19)
|
2 (74 %) (10)
8 (50 %) (19)
|
klíčenie brzdí tma (19) klíčenie neovplyvňuje intenzita ožiarenia (17) žiadne osobitné postupy (10, 14, 17, 19)
|
PO (10)
|
A, E
|
|
|
POLYGONACEAE
Polygonum convolvulus
(pohánkovec ovíjavý)
|
A
otvorené biotopy, blízkosť ciest (16)
|
5 – 8 (4, 14, 29)
|
L = D (20)
|
0 – 2 (4, 29)
|
|
studená stratifikácia 4 – 8 týždňov (1, 2, 4, 20, 29) klíčenie neovplyvňuje intenzita ožiarenia (1)
|
PRED a PO 1, 2, 20, 28, 31
|
A
|
32
|
|
Polygonum lapathifolium
(horčiak štiavolistý)
|
A
vlhká pôda (16)
|
1,8 – 2,5 (14)
|
L > D (6)
|
|
5 (94 %) (18)
|
klíčenie neovplyvňuje intenzita ožiarenia (1) klíčenie brzdí tma (18) studená stratifikácia (1) žiadne osobitné postupy (5)
|
PRED a PO (6)
|
A, E
|
|
|
Polygonum pennsylvanicum
(horčiak)
|
A
polia, otvorené biotopy (16)
|
3,6 – 7 (14, 29)
|
|
2 (29)
|
|
studená stratifikácia 4 týždne pri teplote 0 – 5 °C (1, 29) klíčenie brzdí tma (1)
|
PRED (31)
|
A, E
|
|
|
Polygonum periscaria
(horčiak broskyňolistý)
|
A
narušené oblasti, orná pôda (16, 19)
|
2,1 – 2,3 (14, 19)
|
L > D (13)
|
0 (19)
|
< 14 (13)
2 (50 %) (19)
|
skarifikácia, studená stratifikácia, ošetrenie GA (14) studená stratifikácia, dozrievanie (17 – 19) klíčenie brzdí tma (19) žiadne osobitné postupy (13)
|
PO (13)
|
A
|
32
|
|
Rumex crispus
(štiavec kučeravý)
|
P
orná pôda, blízkosť ciest, otvorené priestranstvá (16, 19)
|
1,3 – 1,5 (4, 14, 19)
|
L = D (14, 33)
|
0
(4, 19, 33)
|
3 (50 %) (19)
6 (100 %) (33)
|
klíčenie brzdí tma (18, 19) môže byť potrebné dozrievanie (18) žiadne osobitné postupy (4, 14, 33)
|
PO (4, 33)
|
A, E
|
32
|
|
PRIMULACEAE
Anagallis arvensis
(drchnička roľná)
|
A
orná pôda, otvorené priestranstvá, narušené oblasti (16, 19)
|
0,4 – 0,5 (4, 14, 19)
|
L = D (14)
|
|
1 (50 %) (19)
|
studená stratifikácia, ošetrenie GA (1,14, 18, 19, 32) na klíčenie je potrebné svetlo (1) žiadne osobitné postupy (2, 4)
|
PO (2,4)
|
A, F
|
|
|
RANUNCULACEAE
Ranunculus acris
(iskerník prudký)
|
Ρ
orná pôda, blízkosť ciest, otvorené priestranstvá (16, 19)
|
1,5 – 2 (14, 19, 29)
|
L = D (14)
|
1
(29)
|
41 – 56 (19, 29)
|
žiadne osobitné postupy
(5, 14, 22, 24 – 26)
|
PO (5, 22, 24 – 26)
|
|
32
|
|
ROSACEAE
Geum urbanum
(kuklík mestský)
|
Ρ
živé ploty, vlhké oblasti
(16, 19)
|
0,8 – 1,5 (14, 19)
|
L = D (14)
|
0 (19)
|
5 (50 %) (19)
16 (79 %) (18)
|
klíčenie brzdí tma (18, 19) teplá stratifikácia (1) žiadne osobitné postupy (5, 14, 22, 25, 26)
|
PO (5, 22, 25, 26)
|
A
|
|
|
RUBIACEAE
Galium aparine
(lipkavec obyčajný)
|
A
orná pôda, vlhké oblasti, narušené oblasti (16, 19)
|
7 – 9 (14, 19)
|
L = D (14)
|
|
5 (50 %) (19)
6 (100 %) (18)
|
studená stratifikácia (1, 18, 19) klíčenie neovplyvňuje intenzita ožiarenia (18, 19) klíčenie brzdí svetlo (1) žiadne osobitné postupy (6, 14)
|
PRED a PO (6, 28)
|
A
|
32
|
|
Galium mollugo
(lipkavec mäkký)
|
Ρ
okraje živých plotov, otvorené priestranstvá (8)
|
7
(29)
|
L = D (14)
|
2
(29)
|
|
žiadne osobitné postupy
(5, 14, 22, 24, 26, 29)
|
PO (5, 22, 24, 26)
|
A
|
|
|
SCROPHULARIACEAE
Digitalis purpurea
(náprstník červený)
|
B, P živé ploty, otvorené priestranstvá (16, 19)
|
0,1 – 0,6 (4, 14, 19)
|
L = D (14)
|
0
(4, 19)
|
6 (50 %) (19)
8 (99 %) (18)
|
klíčenie brzdí tma (1, 17 – 19) žiadne osobitné postupy (4, 22 – 26)
|
PO (4, 22 – 26)
|
D, G, F
|
|
|
Veronica persica
(veronika perzská)
|
A
orná pôda, otvorené priestranstvá, narušené oblasti (16, 19)
|
0,5 – 0,6 (14, 19)
|
L = D (14)
|
0 (19)
|
3 (19)
5 (96 %) (18)
|
klíčenie brzdí tma (18, 19) studená stratifikácia (18) žiadne osobitné postupy (14)
|
PRED a PO (28)
|
A
|
32
|
Uvádzaní dodávatelia semien
|
Označenie dodávateľa
|
Informácie o dodávateľovi
|
|
A
|
|
Herbiseed
|
|
New Farm, Mire Lane, West End, Twyford RG10 0NJ ENGLAND +44 (0) 1189 349 464
|
|
www.herbiseed.com
|
|
|
B
|
|
Tropilab Inc.
|
|
8240 Ulmerton Road, Largo, FL 33771-3948 USA
|
|
(727) 344 – 4050
|
|
www.tropilab.com
|
|
|
C
|
|
Pterophylla – Native Plants & Seeds
|
|
#316 Regional Road 60, RR#1, Walsingham, ON N0E 1X0 CANADA (519) 586 – 3985
|
|
|
D
|
|
Applewood Seed Co.
|
|
5380 Vivian St., Arvada, CO 80002 USA (303) 431 – 7333
|
|
www.applewoodseed.com
|
|
|
E
|
|
Ernst Conservation Seeds
|
|
9006 Mercer Pike, Meadville, PA 16335 USA
|
|
(800) 873 – 3321
|
|
www.ernstseed.com
|
|
|
F
|
|
Chiltern Seeds
|
|
Bortree Stile, Ulverston, Cumbria LA12 7PB ENGLAND
|
|
+44 1229 581137
|
|
www.chiltemseeds.co.uk
|
|
|
G
|
|
Thompson & Morgan
|
|
P.O. Box 1051, Fort Erie, ON L2A 6C7 CANADA (800) 274 – 7333
|
|
www.thompson-morgan.com
|
|
UVÁDZANÁ LITERATÚRA
|
1.
|
Baskin, C.C. & Baskin, J.M. 1998. Seeds. Academic Press, Toronto
|
|
2.
|
Blackburn, L.G. & Boutin, C. 2003. Subtle effects of herbicide use in the context of genetically modified crops: a case study with glyphosate (Round-Up®). Ecotoxicology, 12:271-285.
|
|
3.
|
Boutin, C., Lee, H-B., Peart, T., Batchelor, P.S., & Maguire, R.J. 2000. Effects of the sulfonylurea herbicide metsulfuron methyl on growth and reproduction of five wetland and terrestrial plant species. Environmental Toxicology & Chemistry, 19(10):2532-2541.
|
|
4.
|
Boutin, C., Elmegaard, N., & Kjaer, C. 2004. Toxicity testing of fifteen non-crop plant species with six herbicides in a greenhouse experiment: implications for risk assessment. Ecotoxicology, 13:349-369.
|
|
5.
|
Breeze, V., Thomas, G., & Butler, R. 1992. Use of a model and toxicity data to predict the risks to some wild plant species from drift of four herbicides. Annals of Applied Biology, 121:669-677.
|
|
6.
|
Brown, R.A., & Farmer, D. 1991. Track-sprayer and glasshouse techniques for terrestrial plant bioassays with pesticides. In: Plants for toxicity assessment: 2nd volume. ASTM STP 1115, J.W. Gorsuch, W.R. Lower, W.Wang, & M.A. Lewis, eds. American Society for Testing & Materials, Philadelphia. pp 197 – 208.
|
|
7.
|
Buhler, D.D. & Hoffman, M.L. 1999. Anderson's guide to practical methods of propagating weeds and other plants. Weed Science Society of America, Lawrence, K.
|
|
8.
|
Clapham, A.R., Tutin, T.G., & Warburg, E.F. 1981. Excursion flora of the British Isles, 3rd ed. Cambridge University Press, Cambridge
|
|
9.
|
Clay, P.A. & Griffin, J.L. 2000. Weed seed production and seedling emergence response to late-season glyphosate applications. Weed Science, 48:481-486.
|
|
10.
|
Cole, J.F.H. & Canning, L. 1993. Rationale for the choice of species in the regulatory testing of the effects of pesticides on terrestrial non-target plants. BCPC – Weeds. pp. 151 – 156.
|
|
11.
|
Fiely, M. (Ernst Conservation Seeds). 2004. Personal communication. (www.ernstseed.com)
|
|
12.
|
Fletcher, J.S., Johnson, F.L., & McFarlane, J.C. 1990. Influence of greenhouse versus field testing and taxonomic differences on plant sensitivity to chemical treatment. Environmental Toxicology & Chemistry, 9:769-776.
|
|
13.
|
Fletcher, J.S., Pfleeger, T.G., Ratsch, H.C., & Hayes, R. 1996. Potential impact of low levels of chlorsulfuron and other herbicides on growth and yield of nontarget plants. Environmental Toxicology & Chemistry, 15(7):1189-1196.
|
|
14.
|
Flynn, S., Turner, R.M., and Dickie, J.B. 2004. Seed Information Database (release 6.0, Oct 2004) Royal Botanic Gardens, Kew (www.rbgkew.org.uk/data/sid)
|
|
15.
|
Franzaring, J., Kempenaar, C., & van der Eerden, L.J.M. 2001. Effects of vapours of chlorpropham and ethofumesate on wild plant species. Environmental Pollution, 114:21-28.
|
|
16.
|
Gleason, H.A. & Cronquist, A. 1991. Manual of vascular plants of northeastern United States and adjacent Canada, 2nd ed. New York Botanical Garden, Bronx, NY
|
|
17.
|
Grime, J.P. 1981. The role of seed dormancy in vegetation dynamics. Annals of Applied Biology, 98:555-558.
|
|
18.
|
Grime, J.P., Mason, G., Curtis, A.V., Rodman, J., Band, S.R., Mowforth, M.A.G., Neal, A.M., & Shaw, S. 1981. A comparative study of germination characteristics in a local flora. Journal of Ecology, 69:1017-1059.
|
|
19.
|
Grime, J.P., Hodgson, J.G., & Hunt, R. 1988. Comparative plant ecology: a functional approach to common British species. Unwin Hyman Ltd., London
|
|
20.
|
Kjaer, C. 1994. Sublethal effects of chlorsulfuron on black bindweed (Polygonum convolvulus L.). Weed Research, 34:453-459.
|
|
21.
|
Klingaman, T.E., King, C.A., & Oliver, L.R. 1992. Effect of application rate, weed species, and weed stage of growth on imazethapyr activity. Weed Science, 40:227-232.
|
|
22.
|
Marrs, R.H., Williams, C.T., Frost, A.J., & Plant, R.A. 1989. Assessment of the effects of herbicide spray drift on a range of plant species of conservation interest. Environmental Pollution, 59:71-86.
|
|
23.
|
Marrs, R.H., Frost, A.J., & Plant, R.A. 1991. Effects of herbicide spray drift on selected species of nature conservation interest: the effects of plant age and surrounding vegetation structure. Environmental Pollution, 69:223-235.
|
|
24.
|
Marrs, R.H., Frost, A.J., & Plant, R.A. 1991. Effects of mecoprop drift on some plant species of conservation interest when grown in standardized mixtures in microcosms. Environmental Pollution, 73:25-42.
|
|
25.
|
Marrs, R.H., Frost, A.J., Plant, R.A., & Lunnis, P. 1993. Determination of buffer zones to protect seedlings of non-target plants from the effects of glyphosate spray drift. Agriculture, Ecosystems, & Environment, 45:283-293.
|
|
26.
|
Marrs, R.H. & Frost, A.J. 1997. A microcosm approach to detection of the effects of herbicide spray drift in plant communities. Journal of Environmental Management, 50:369-388.
|
|
27.
|
Marshall, E.J.P. & Bernie, J.E. 1985. Herbicide effects on field margin flora. BCPC – Weeds. pp. 1021-1028.
|
|
28.
|
McKelvey, R.A., Wright, J.P., & Honegger, J.L. 2002. A comparison of crop and non-crop plants as sensitive species for regulatory testing. Pest Management Science, 58:1161-1174.
|
|
29.
|
Morton, S. (Herbiseed). 2004. Personal communication. (http://www.herbiseed.com)
|
|
30.
|
USDA, NRCS. 2004. The Plants Database, version 3.5. (http://plants.usda.gov). National Plant Data Centre, Baton Rouge, LA 70874-4490 USA
|
|
31.
|
USEPA. 1999. One-Liner Database. [U.S. E.P.A./Office of Pesticide Programs/Environmental Fate and Effects Division/Environmental Epidemiology Branch].
|
|
32.
|
Webster, R.H. 1979. Technical Report No. 56: Growing weeds from seeds and other propagules for experimental purposes. Agricultural Research Council Weed Research Organization, Oxford.
|
|
33.
|
White, A. L. & Boutin, C. (National Wildlife Research Centre, Environment Canada). 2004. Personal communication.
|
|
34.
|
Zwerger, P. & Pestemer, W. 2000. Testing the phytotoxic effects of herbicides on higher terrestrial non-target plants using a plant life-cycle test. Z. PflKrankh. PflSchutz, Sonderh., 17:711-718.
|
Dodatok 4
Príklady vhodných rastových podmienok pre určité druhy plodín
Tieto podmienky sa považujú za vhodné pre desať druhov plodín a môžu sa použiť aj ako usmernenie pre testy v rastových komorách s určitými inými druhmi plodín:
|
|
koncentrácia oxidu uhličitého: 350 ppm ± 50 ppm,
|
|
|
relatívna vlhkosť: 70 % ± 5 % počas obdobia svetla a 90 % ± 5 % počas obdobia tmy,
|
|
|
teplota: 25 ± 3 °C počas dňa, 20 ± 3 °C počas noci,
|
|
|
fotoperióda: 16 hodín svetla/8 hodín tmy, za predpokladu priemernej vlnovej dĺžky v rozsahu 400 – 700 nm,
|
|
|
svetlo: svietivosť 350 ± 50 μE/m2/s, meraná vo vrchnej časti veka.
|
Druhy plodín:
|
—
|
rajčiak jedlý (Solanum lycopersicon),
|
|
—
|
uhorka siata (Cucumis sativus),
|
|
—
|
šalát hlávkový (Lactuca sativa),
|
|
—
|
sója fazuľová (Glycine max),
|
|
—
|
kapusta obyčajná hlávková (Brassica oleracea var. capitata),
|
|
—
|
mrkva obyčajná (Daucus carota),
|
|
—
|
ovos siaty (Avena sativa),
|
|
—
|
mätonoh trváci (Lolium perenne),
|
|
—
|
kukurica siata (Zea mays),
|
|
—
|
cesnak cibuľový (Allium cepa).
|
C.32. REPRODUKČNÝ TEST S ČERVAMI ČEĽADE ENCHYTRAEIDAE
ÚVOD
|
1.
|
Táto testovacia metóda je rovnocenná s usmernením OECD na vykonávanie testov (TG) 220 (2004). Je určená na posúdenie účinkov chemikálií na reprodukčný výstup červov čeľade Enchytraeidae (Enchytraeus albidus Henle 1873) v pôde. Založená je predovšetkým na metóde, ktorú vyvinula Spolková agentúra pre životné prostredie (Umweltbundesamt) v Nemecku (1) a ktorá bola podrobená kruhovým testom (2). Do úvahy sa brali aj iné metódy testovania toxicity chemikálií pre červy čeľade Enchytraeidae a pre dážďovky (3) (4) (5) (6) (7) (8).
|
ÚVODNÉ ÚVAHY
|
2.
|
Pôdne červy rodu Enchytraeus sú ekologicky vhodné druhy na ekotoxikologické testovanie. Aj keď červy čeľade Enchytraeidae sa často nachádzajú v pôdach obsahujúcich dážďovky, je tiež pravda, že často sú na ne bohaté aj mnohé pôdy, v ktorých sa dážďovky nevyskytujú. Červy čeľade Enchytraeidae je možné použiť pri laboratórnych testoch, ako aj v rámci polopoľných a poľných štúdií. Z praktického hľadiska sú mnohé druhy rodu Enchytraeus vhodné vzhľadom na jednoduchú manipuláciu a rozmnožovanie a na generačný čas, ktorý je omnoho kratší ako v prípade dážďoviek. Reprodukčný test s červami Enchytraeidae preto trvá iba štyri až šesť týždňov, zatiaľ čo s dážďovkami (Eisenia fetida) je to osem týždňov.
|
|
3.
|
Základné informácie o ekológii a ekotoxikológii čeľade Enchytraeidae v suchozemskom životnom prostredí je možné nájsť v literatúre pod číslami (9), (10), (11), (12).
|
PRINCÍP TESTU
|
4.
|
Dospelé červy Enchytraeidae sa vystavia účinkom rôznych koncentrácií testovanej chemikálie zamiešanej do umelo pripravenej pôdy. Test je možné rozdeliť na dve fázy: a) test na vyhľadávanie rozsahu v prípade, ak nie sú k dispozícii dostatočné informácie, v rámci ktorého je hlavným parametrom mortalita hodnotená po dvoch týždňoch expozície a b) konečný reprodukčný test, v rámci ktorého sa hodnotí celkový počet juvenilných jedincov vyprodukovaných rodičovským živočíchom a prežitie rodičovských živočíchov. Konečný test trvá šesť týždňov. Po prvých troch týždňoch sa dospelé červy odoberú a zaznamenajú sa morfologické zmeny. Po ďalších troch týždňoch sa spočíta potomstvo vyliahnuté z kokónov, ktoré vyprodukovali dospelé červy. Výstup reprodukcie živočíchov exponovaných testovanej chemikálii sa porovnáva s reprodukčným výstupom kontrolných vzoriek s cieľom stanoviť hodnoty i) koncentrácie bez pozorovaného účinku (NOEC) a/alebo ii) koncentrácie ECx (napr. EC10, EC50) pomocou regresného modelu na odhad koncentrácie, ktorá by spôsobila zníženie reprodukčného výstupu o x %. Koncentrácia ECx (napr. EC10, EC50) by mala byť v rozsahu testovacích koncentrácií, aby sa potom hodnota ECx určila interpoláciou namiesto extrapolácie.
|
INFORMÁCIE O TESTOVANEJ CHEMIKÁLII
|
5.
|
Predovšetkým by mala byť známa rozpustnosť vo vode, hodnota log Kow, rozdeľovacia konštanta pôdnej vody (napr. kapitola C.18 alebo C.19 tejto prílohy) a tlak pary testovanej chemikálie. Žiaduce sú aj doplnkové informácie o osude testovanej chemikálie v pôde, napríklad rýchlosť fotolýzy a hydrolýzy.
|
|
6.
|
Táto testovacia metóda sa môže použiť na chemikálie rozpustné alebo nerozpustné vo vode. Spôsob aplikácie testovanej chemikálie sa však bude zodpovedajúcim spôsobom líšiť. Testovacia metóda nie je použiteľná v prípade prchavých chemikálií, t. j. chemikálií, pre ktoré je hodnota Henryho konštanty alebo rozdeľovacej konštanty vzduch/voda vyššia ako jeden, alebo chemikálií, pre ktoré tlak pár pri teplote 25 °C presahuje hodnotu 0,0133 Pa.
|
PLATNOSŤ TESTU
|
7.
|
Na to, aby bol test platný, by kontrolné vzorky mali spĺňať tieto kritériá:
|
—
|
mortalita dospelých jedincov by nemala presahovať hodnotu 20 % na konci testu na vyhľadávanie rozsahu a po prvých troch týždňoch reprodukčného testu,
|
|
—
|
za predpokladu, že na začiatku testu bolo použitých 10 dospelých jedincov na nádobu, na konci testu by malo byť vyprodukovaných v priemere najmenej 25 juvenilných jedincov na nádobu,
|
|
—
|
variačný koeficient okolo stredného počtu juvenilných jedincov na konci reprodukčného testu by nemal byť vyšší ako 50 %.
|
Ak test nespĺňa uvedené kritériá platnosti, jeho vykonávanie by sa malo ukončiť, pokiaľ nie je možné predložiť odôvodnenie pokračovania testu. Toto odôvodnenie by malo byť zahrnuté do správy o teste.
|
REFERENČNÁ CHEMIKÁLIA
|
8.
|
Referenčná chemikália by sa mala testovať v pravidelných intervaloch alebo prípadne zahrnúť do každého testu s cieľom overiť, že reakcia testovaných organizmov sa postupom času výrazne nezmenila. Vhodnou referenčnou chemikáliou je karbendazim, pri ktorom sa preukázalo, že ovplyvňuje prežívanie a reprodukciu červov čeľade Enchytraeidae (13) (14), alebo by sa mohli používať aj iné chemikálie, ktorých údaje o toxicite sú dobre známe. V kruhovom teste (2) sa použil karbendazim vo forme prípravku známeho pod obchodným názvom Derosal™, ktorý dodáva spoločnosť AgrEvo (Frankfurt, Nemecko) a ktorý obsahuje 360 g/l (32,18 %) účinnej zložky. Koncentrácia EC50 pre reprodukciu stanovená v rámci kruhového testu dosahovala hodnoty v rozsahu 1,2 mg ± 0,8 mg účinnej zložky/kg suchej hmotnosti (2). Ak sa do série testov zahrnie pozitívny štandard toxicity, použije sa jedna koncentrácia a počet replikátov by mal byť rovnaký ako pri kontrolných vzorkách. V prípade karbendazimu sa na testovanie odporúča 1,2 mg účinnej zložky/kg suchej hmotnosti (testuje sa ako kvapalný prípravok).
|
OPIS TESTU
Zariadenia
|
9.
|
Testovacie nádoby by mali byť vyrobené zo skla alebo iného chemicky inertného materiálu. Vhodné sú sklené poháre (napr. s objemom 0,2 – 0,25 litra a priemerom ≈ 6 cm). Nádoby by mali mať priesvitné veká (napr. zo skla alebo polyetylénu) navrhnuté tak, aby znížili vyparovanie vody, ale zároveň umožnili výmenu plynov medzi pôdou a atmosférou. Veká by mala byť priesvitné, aby umožňovali prechod svetla.
|
|
10.
|
Potrebné je bežné laboratórne vybavenie, konkrétne toto:
|
—
|
primerané zariadenie na regulovanie teploty,
|
|
—
|
primerané zariadenie na regulovanie vlhkosti (nie je to nevyhnutné, ak nádoby s exponovanými vzorkami majú veká),
|
|
—
|
inkubátor alebo malá miestnosť s klimatizačným zariadením,
|
|
—
|
pinzety, háčiky alebo slučky,
|
|
Príprava umelej pôdy
|
11.
|
V tomto teste sa používa umelo prirpavená pôda (5) (7) s týmto zložením (na základe sušiny vysušenej na konštantnú hmotnosť pri teplote 105 °C):
|
—
|
10 % rašeliny, vysušenej vzduchom a jemne drvenej (prijateľné sú častice veľkosti 2 mm ± 1 mm); odporúča sa pred použitím na test skontrolovať, či je pôda pripravená s čerstvou dávkou rašeliny vhodná na kultiváciu červov,
|
|
—
|
20 % kaolínovej hliny (obsah kaolinitu podľa možnosti nad 30 %),
|
|
—
|
približne 0,3 – 1 % uhličitanu vápenatého (CaCO3, práškový, analytickej čistoty) na dosiahnutie hodnoty pH 6,0 ± 0,5; pridávané množstvo uhličitanu vápenatého môže do značnej miery závisieť od kvality/vlastností rašeliny,
|
|
—
|
približne 70 % vzduchom vysušeného kremenného piesku (v závislosti od potrebného množstva CaCO3), prevažne jemný piesok s viac ako 50 % častíc s veľkosťou od 50 do 200 mikrónov.
|
Odporúča sa pred použitím na konečný test preukázať vhodnosť umelej pôdy na kultiváciu červov a na splnenie kritérií platnosti testu. Osobitne sa odporúča, aby sa takouto kontrolou zabezpečilo, že priebeh testu nebude ohrozený, ak obsah organického uhlíka v umelej pôde klesne, napríklad znížením obsahu rašeliny na 4 – 5 % a zodpovedajúcim zvýšením obsahu piesku. V dôsledku takéhoto poklesu obsahu organického uhlíka sa môžu znížiť možnosti adsorpcie testovanej chemikálie na pôdu (organický uhlík) a dostupnosť testovanej chemikálie pre červy sa môže zvýšiť. Preukázalo sa, že červy druhu Enchytraeus albidus môžu splniť kritériá platnosti, pokiaľ ide o reprodukciu, keď sa testy vykonávajú v poľných pôdach s nižším obsahom organického uhlíka, než bolo uvedené (napr. 2,7 %) (15), a existujú skúsenosti, hoci obmedzené, že toto je možné dosiahnuť aj v umelo pripravenej pôde s 5 % rašeliny.
Poznámka: Vhodnosť pôdy a splnenie kritérií platnosti testu by sa mali preukázať aj v prípade použitia prírodnej pôdy v ďalšom testovaní (napr. vyššieho stupňa).
|
|
12.
|
Suché zložky pôdy sa dôkladne zmiešajú (napr. vo veľkokapacitnom laboratórnom miešači). Malo by sa tak urobiť prinajmenšom týždeň pred začiatkom testu. Zmiešaná pôda by sa mala skladovať dva dni, aby sa vyvážila/stabilizovala jej kyslosť. Na stanovenie pH sa používa zmes pôdy a roztoku 1 M chloridu draselného (KCl) alebo 0,01 M chloridu vápenatého (CaCl2) v pomere 1: 5 (pozri literatúru (16) a dodatok 3). Ak je pôda kyslejšia než požadovaný rozsah (pozri bod 11), môže sa upraviť pridaním príslušného množstva CaCO3. Ak je pôda príliš alkalická, môže sa upraviť pridaním väčšieho množstva zmesi, uvedenej v bode 11, ale s vylúčením CaCO3.
|
|
13.
|
Maximálna kapacita zadržiavania vody umelej pôdy sa stanoví v súlade s postupmi opísanými v dodatku 2. Jeden alebo dva dni pred začiatkom testu sa suchá umelá pôda predvlhčí pridaním dostatočného množstva deionizovanej vody, aby sa dosiahla približne polovica konečného obsahu vody, čo je 40 – 60 % maximálnej kapacity zadržiavania vody. Na začiatku testu sa predvlhčená pôda rozdelí na časti zodpovedajúce počtu testovacích koncentrácií (a v prípade potreby počtu vzoriek referenčnej chemikálie) a kontrolných vzoriek používaných na test. Obsah vlhkosti sa upraví na 40 – 60 % maximálnej kapacity zadržiavania vody pridaním roztoku testovanej chemikálie a/alebo pridaním destilovanej alebo deionizovanej vody (pozri body 19 – 21). Obsah vlhkosti sa stanoví na začiatku a na konci testu (vysušením na konštantnú hmotnosť pri teplote 105 °C) a jeho hodnota by mala byť v optimálnom rozsahu pre prežitie červov. Hrubú kontrolu obsahu vlhkosti v pôde je možné vykonať jemným stláčaním pôdy v ruke. Ak je obsah vlhkosti správny, medzi prstami by sa mali objaviť malé kvapky vody.
|
Výber a príprava testovacích živočíchov
|
14.
|
Odporúčaný testovací druh je Enchytraeus albidus Henle 1837 (mrlica biela), patriaci do čeľade Enchytraeidae (trieda Oligochaeta, kmeň Annelida). E. albidus je jeden z najväčších druhov čeľade Enchytraeidae, so zaznamenanými exemplármi dĺžky až 35 mm (17) (18). E. albidus sa vyskytuje na celom svete v morských, sladkovodných a suchozemských biotopoch, najmä v rozkladajúcej sa organickej hmote (morské riasy, kompost) a iba zriedka na lúkach (9). Jeho široká ekologická tolerancia a niektoré morfologické odchýlky by mohli poukazovať na existenciu viacerých línií.
|
|
15.
|
E. albidus je komerčne dostupný ako krmivo pre ryby. Je potrebné skontrolovať, či kultúra nie je kontaminovaná inými, zvyčajne menšími druhmi (1) (19). Ak sa zistí kontaminácia, všetky červy by sa mali premyť vodou v Petriho miske. Potom by sa mali vybrať (pomocou stereomikroskopu) veľké dospelé exempláre E. albidus s cieľom začať novú kultúru, pričom všetky ostatné červy sa odstránia. E. albidus je možné jednoducho pestovať v širokej škále organických materiálov (pozri dodatok 4). Životný cyklus E. albidus je krátky, keďže dospievanie červa trvá od 33 dní (pri teplote 18 °C) do 74 dní (pri teplote 12 °C) (1). Na test sa použijú iba kultúry, ktoré sa bez problémov udržiavali v laboratóriu najmenej päť týždňov (jedna generácia).
|
|
16.
|
Iné druhy rodu Enchytraeus sú tiež vhodné, napríklad E. buchholzi Vejdovsky 1879 alebo E. crypticus Westheide a Graefe 1992 (pozri dodatok 5). Ak sa použijú iné druhy rodu Enchytraeus, musia byť jednoznačne identifikované a do správy by sa malo uviesť odôvodnenie výberu daného druhu.
|
|
17.
|
Živočíchy použité na testy sú dospelé červy. Mali by mať vajíčka (biele škvrny) v oblasti klitella a mali by byť približne rovnakej veľkosti (asi 1 cm dlhé). Synchronizácia chovu kultúry nie je potrebná.
|
|
18.
|
Ak sa červy nechovajú v tom istom druhu pôdy a za podmienok (vrátane kŕmenia) používaných pre záverečný test, musia sa aklimatizovať najmenej 24 hodín, prípadne až tri dni. Spočiatku by sa mal aklimatizovať väčší počet dospelých jedincov, než je potrebný na vykonanie testu, aby bol priestor na zamietnutie poškodených alebo inak nevhodných exemplárov. Na konci obdobia aklimatizácie sa na testy vyberú len červy, ktoré obsahujú vajíčka a nevykazujú žiadne poruchy správania (napr. pokusy uniknúť z pôdy). Červy sa opatrne vyberú pomocou klenotníckych pinziet, háčikov alebo slučiek a umiestnia sa do Petriho misky obsahujúcej malé množstvo sladkej vody. Na tento účel sa uprednostňuje rekonštituovaná sladká voda, ako sa navrhuje v kapitole C.20 tejto prílohy (reprodukčný test na Daphnia magna), keďže deionizovaná voda, demineralizovaná voda alebo voda z vodovodu by mohla byť pre červov škodlivá. Červy sa kontrolujú pod stereomikroskopom a každý, ktorý neobsahuje vajíčka, sa vyradí. Dbá sa na vybratie a odstránenie všetkých roztočov alebo chvostoskokov, ktoré môžu infikovať kultúry. Zdravé červy, ktoré sa nepoužijú na test, sa vrátia do zásobnej kultúry.
|
Príprava testovacích koncentrácií
Testovaná chemikália rozpustná vo vode
|
19.
|
Roztok testovanej chemikálie sa pripravuje s deionizovanou vodou v množstve dostatočnom pre všetky replikáty jednej testovacej koncentrácie. Odporúča sa použitie primeraného množstva vody, aby sa dosiahol požadovaný obsah vlhkosti, t. j. 40 – 60 % maximálnej kapacity zadržiavania vody (pozri bod 13). Každý roztok testovanej chemikálie sa pred vložením do testovacej nádoby dôkladne premieša s jednou šaržou predvlhčenej pôdy.
|
Testovaná chemikália nerozpustná vo vode
|
20.
|
V prípade chemikálií nerozpustných vo vode, ale rozpustných v organických rozpúšťadlách, sa testovaná chemikália môže rozpustiť v čo najmenšom objeme vhodného nosiča (napr. acetónu). Používať by sa mali iba prchavé rozpúšťadlá. Nosič sa nastrieka na malé množstvo, napríklad 2,5 g, jemného kremenného piesku, alebo sa s ním zmieša. Nosič sa odstráni najmenej hodinovým odparovaním pod digestorom. Táto zmes kremenného piesku a testovanej chemikálie sa pridá do predvlhčenej pôdy a po pridaní primeraného množstva deionizovanej vody, aby sa dosiahol požadovaný obsah vlhkosti, sa dôkladne premieša. Konečná zmes sa vloží do testovacích nádob.
|
|
21.
|
V prípade chemikálií, ktoré sú slabo rozpustné vo vode a v organických rozpúšťadlách, sa ekvivalent 2,5 g jemne drveného kremenného piesku na testovaciu nádobu zmieša s príslušným množstvom testovanej chemikálie na dosiahnutie požadovanej testovacej koncentrácie. Táto zmes kremenného piesku a testovanej chemikálie sa pridá do predvlhčenej pôdy a dôkladne zmieša s primeraným množstvom deionizovanej vody, aby sa dosiahol požadovaný obsah vlhkosti. Konečná zmes sa rozdelí medzi testovacie nádoby. Tento postup sa opakuje pre každú testovaciu koncentráciu a pripravia sa aj primerané kontrolné vzorky.
|
|
22.
|
Chemikálie by sa spravidla nemali testovať pri koncentráciách vyšších ako 1 000 mg/kg suchej hmotnosti pôdy. Testovanie pri vyšších koncentráciách sa však môže vyžadovať v súlade s cieľmi osobitného testu.
|
VYKONANIE TESTOV
Testovacie skupiny a kontrolné vzorky
|
23.
|
Pre každú testovaciu koncentráciu sa množstvo testovacej pôdy zodpovedajúce 20 g sušiny umiestni do testovacej nádoby (pozri body 19 – 21). Pripravia sa tiež kontrolné vzorky bez testovanej chemikálie. Do každej nádoby sa pridá potrava v súlade s postupmi opísanými v bode 29. Do každej testovacej nádoby sa náhodným výberom umiestni desať červov. Červy sa opatrne prenesú do každej testovacej nádoby a umiestnia na povrch pôdy, napríklad pomocou klenotníckych pinziet, háčikov alebo slučiek. Počet replikátov pre testovacie koncentrácie a kontrolné vzorky závisí od použitej koncepcie testu (pozri bod 34). Testovacie nádoby sa náhodne umiestnia v testovacom inkubátore a tieto pozície sa raz týždenne náhodne zmenia.
|
|
24.
|
Ak sa na aplikáciu testovanej chemikálie použije nosič, mala by sa okrem testovacej série pripraviť jedna kontrolná séria obsahujúca kremenný piesok s nastriekaným alebo zamiešaným rozpúšťadlom. Koncentrácia rozpúšťadla alebo dispergantu by mala byť rovnaká, aká sa používa v testovacích nádobách obsahujúcich testovanú chemikáliu. V prípade chemikálií, ktoré si vyžadujú aplikáciu v súlade s postupmi uvedenými v bode 21, by sa mala pripraviť kontrolná séria obsahujúca doplnkový kremenný piesok (2,5 g na nádobu).
|
Podmienky testu
|
25.
|
Testovacia teplota je 20 °C ± 2 °C. S cieľom zabrániť úniku červov z pôdy sa test vykonáva v kontrolovaných cykloch svetla a tmy (podľa možnosti 16 hodín svetla a 8 hodín tmy) s intenzitou osvetlenia 400 až 800 luxov v okolí testovacích nádob.
|
|
26.
|
S cieľom kontrolovať vlhkosť pôdy sa nádoby odvážia na začiatku testu a potom raz týždenne. Úbytok hmotnosti sa dopĺňa pridaním primeraného množstva deionizovanej vody. Je potrebné si uvedomiť, že strata vody sa môže znížiť udržiavaním vysokej vlhkosti vzduchu (> 80 %) v testovacom inkubátore.
|
|
27.
|
Obsah vlhkosti a hodnota pH by sa mali merať na začiatku a na konci testu na vyhľadávanie rozsahu aj konečného testu. Merania by sa mali robiť v kontrolných vzorkách pôdy, ako aj vo vzorkách s aplikovanou chemikáliou (všetky koncentrácie), ktoré boli pripravené a udržiavané rovnakým spôsobom ako testovacie kultúry, ale bez červov. Potrava by sa mala pridávať do vzoriek pôdy len na začiatku testu na uľahčenie mikrobiálnej aktivity. Množstvo pridanej potravy by malo byť rovnaké, aké sa pridáva do testovaných kultúr. Počas testu nie je potrebné pridávať do týchto nádob ďalšiu potravu.
|
Kŕmenie
|
28.
|
Používať sa môže potrava, ktorá je schopná udržiavať populáciu červov čeľade Enchytraeidae. Zistilo sa, že vhodným kŕmnym materiálom sú ovsené otruby, ktoré sa podľa možnosti pred použitím autoklávujú, aby sa predišlo mikrobiálnej kontaminácii (vhodné je aj zohrievanie).
|
|
29.
|
Potrava sa najskôr pripraví zmiešaním 50 mg mletých ovsených otrúb s pôdou v každej nádobe pred vložením červov. Potom sa potrava dodáva týždenne, až do 21. dňa. Kŕmenie sa nevykoná v 28. deň, keďže dospelé jedince boli v tejto fáze premiestnené a mladé červy odvtedy potrebujú pomerne málo doplnkovej potravy. Kŕmenie počas testu pozostáva z 25 mg mletých ovsených otrúb na nádobu, ktoré sa opatrne uložia na povrch pôdy tak, aby sa predišlo poraneniu červov. V záujme obmedzenia tvorby plesní by sa uložené ovsené vločky mali prekryť malým množstvom pôdy. Ak potrava zostáva neskonzumovaná, dávka by sa mala znížiť.
|
Koncepcia testu na vyhľadávanie rozsahu
|
30.
|
V prípade potreby sa vykoná test na vyhľadávanie rozsahu, napríklad s piatimi koncentráciami testovanej chemikálie: 0,1, 1,0, 10, 100 a 1 000 mg/kg (suchej hmotnosti pôdy). Postačuje jeden replikát pre každú vzorku s aplikovanou chemikáliou a kontrolnú vzorku.
|
|
31.
|
Test na vyhľadávanie rozsahu trvá dva týždne. Na konci testu sa posudzuje mortalita červov. Červ sa považuje za mŕtveho, keď nereaguje na mechanický podnet v prednej časti tela. Doplnkové informácie o mortalite môžu byť užitočné aj pri rozhodovaní o rozsahu koncentrácií, ktoré sa použijú v konečnom teste. Preto by sa mali zaznamenať aj zmeny v správaní (napr. neschopnosť zavŕtať sa do pôdy, ležanie bez pohybu pri sklenej stene testovacej nádoby) a morfológii (napr. prítomnosť otvorených rán) dospelých jedincov, ako aj existencia každého juvenilného jedinca. Prírastok juvenilných jedincov je možné určovať pomocou metódy farebného označovania opísanej v dodatku 6.
|
|
32.
|
Hodnotu koncentrácie LC50 je možné približne určiť výpočtom geometrickej strednej hodnoty údajov o mortalite. Pri stanovení koncentračného rozsahu pre konečný test sa predpokladá, že účinky na reprodukciu sú nižšie ako hodnota LC50, s faktorom až do 10. To je však empirický vzťah a v každom konkrétnom prípade môže byť iný. Ďalšie pozorovania v rámci testu na vyhľadávanie rozsahu, ako je výskyt juvenilných jedincov, môžu pomôcť spresniť rozsah koncentrácie testovanej chemikálie, ktorý sa použije pri konečnom teste.
|
|
33.
|
Na presné stanovenie hodnoty LC50 sa odporúča vykonanie testu s použitím najmenej štyroch replikátov každej koncentrácie testovanej chemikálie a primeraným počtom koncentrácií, ktoré vyvolajú aspoň štyri odlišné štatisticky významné stredné reakcie na tieto koncentrácie. V prípade potreby sa používa podobný počet koncentrácií a replikátov pre kontrolné vzorky.
|
Koncepcia konečného reprodukčného testu
|
34.
|
Na základe odporúčaní vyplývajúcich z kruhového testu sa navrhujú tri koncepcie (2):
|
—
|
Na stanovenie hodnoty NOEC by sa malo testovať aspoň päť koncentrácií v geometrickej sérii. Odporúčajú sa štyri replikáty pre každú testovaciu koncentráciu a osem kontrolných vzoriek. Faktor rozstupu medzi hodnotami koncentrácie by nemal presahovať 1,8.
|
|
—
|
Na stanovenie hodnoty ECx (napr. EC10, EC50) by sa malo testovať aspoň päť koncentrácií, pričom hodnota ECx by mala byť v rozsahu týchto koncentrácií, aby sa mohla určiť interpoláciou namiesto extrapolácie. Odporúčajú sa najmenej štyri replikáty pre každú testovaciu koncentráciu a štyri kontrolné replikáty. Faktor rozstupu sa môže meniť, t. j. môže mať hodnotu najviac 1,8 v očakávanom rozsahu účinkov a viac ako 1,8 pri vyšších a nižších koncentráciách.
|
|
—
|
Kombinovaný prístup umožňuje určenie obidvoch koncentrácií, NOEC aj ECx. Použiť by sa malo osem koncentrácií aplikovanej chemikálie v geometrickom rade. Odporúčajú sa štyri replikáty pre každú aplikáciu chemikálie a osem kontrolných vzoriek. Faktor rozstupu medzi hodnotami koncentrácie by nemal presahovať 1,8.
|
|
|
35.
|
Použiť by sa malo desať dospelých červov na testovaciu nádobu (pozri bod 23). Potrava sa pridáva do testovacích nádob na začiatku testu a potom raz týždenne (pozri bod 29), až do 21. dňa vrátane. V 21. deň sa vzorky pôdy pozorne ručne prehľadajú, nájdu a spočítajú sa žijúce dospelé červy a zaznamenajú sa zmeny v ich správaní (napr. neschopnosť zavŕtať sa do pôdy, ležanie bez pohybu pri sklenej stene testovacej nádoby) a morfológii (napr. otvorené rany). Všetky dospelé červy sa potom vyberú z testovacích nádob a testovacej pôdy. Testovacia pôda, ktorá obsahuje akékoľvek vzniknuté kokóny, sa inkubuje ďalšie tri týždne za tých istých podmienok testu, s výnimkou toho, že kŕmenie sa vykonáva len v 35. deň (25 mg mletých ovsených vločiek na nádobu).
|
|
36.
|
Po šiestich týždňoch sa počítajú čerstvo vyliahnuté červy. Odporúča sa metóda založená na farebnom označovaní bengálskym červeným farbivom (pozri dodatok 6), hoci aj iné mokré (ale nie tepelné) techniky extrakcie a vyplavovania (pozri dodatok 6) sa ukázali ako vhodné (4) (10) (11) (20). Farebné označovanie bengálskou červeňou sa odporúča, lebo mokrej extrakcii z pôdneho substrátu môže brániť turbidite spôsobenej suspendovanými časticami ílu.
|
Limitný test
|
37.
|
Ak sa v rámci testu na vyhľadávanie rozsahu nepozorujú žiadne účinky ani pri najvyššej koncentrácii (t. j. 1 000 mg/kg), reprodukčný test sa môže vykonať ako limitný test s použitím koncentrácie 1 000 mg/kg s cieľom dokázať, že hodnota NOEC z hľadiska reprodukcie je vyššia ako uvedená hodnota.
|
Zhrnutie a harmonogram testu
|
38.
|
Jednotlivé kroky testu je možné zhrnúť takto:
|
Čas
|
Test na vyhľadávanie rozsahu
|
Konečný test
|
|
–7. deň alebo skôr
|
|
—
|
príprava umelej pôdy (miešanie suchých zložiek)
|
|
|
—
|
príprava umelej pôdy (miešanie suchých zložiek)
|
|
|
–5. deň
|
|
—
|
kontrola pH umelej pôdy
|
|
—
|
meranie maximálnej kapacity zadržiavania vody v pôde
|
|
|
—
|
kontrola pH umelej pôdy
|
|
—
|
meranie maximálnej kapacity zadržiavania vody v pôde
|
|
|
–5. deň až –3. deň
|
|
—
|
roztriedenie červov na aklimatizáciu
|
|
|
—
|
roztriedenie červov na aklimatizáciu
|
|
|
– 3. až 0. deň
|
|
—
|
aklimatizácia červov najmenej 24 hodín
|
|
|
—
|
aklimatizácia červov najmenej 24 hodín
|
|
|
–1. deň
|
|
—
|
predvlhčenie umelo pripravenej pôdy a rozdelenie do dávok
|
|
|
—
|
predvlhčenie umelo pripravenej pôdy a rozdelenie do dávok
|
|
|
0. deň
|
|
—
|
príprava zásobných roztokov
|
|
—
|
aplikácia testovanej chemikálie
|
|
—
|
váženie testovacieho substrátu do testovacích nádob
|
|
—
|
meranie pH pôdy a obsahu vlhkosti v pôde
|
|
|
—
|
príprava zásobných roztokov
|
|
—
|
aplikácia testovanej chemikálie
|
|
—
|
váženie testovacieho substrátu do testovacích nádob
|
|
—
|
meranie pH pôdy a obsahu vlhkosti v pôde
|
|
|
7. deň
|
|
|
|
14. deň
|
|
—
|
stanovenie mortality dospelých jedincov
|
|
—
|
odhad počtu juvenilných jedincov
|
|
—
|
meranie pH pôdy a obsahu vlhkosti v pôde
|
|
|
|
21. deň
|
|
|
—
|
pozorovanie správania dospelých jedincov
|
|
—
|
premiestnenie dospelých jedincov
|
|
—
|
stanovenie mortality dospelých jedincov
|
|
|
28. deň
|
|
|
|
35. deň
|
|
|
|
42. deň
|
|
|
—
|
počítanie juvenilných červov
|
|
—
|
meranie pH pôdy a obsahu vlhkosti v pôde
|
|
|
ÚDAJE A PODÁVANIE SPRÁV
Spracovanie výsledkov
|
39.
|
Hoci v dodatku 7 je uvedený prehľad, žiadne definitívne štatistické usmernenia na analýzu výsledkov testu táto testovacia metóda neposkytuje.
|
|
40.
|
V rámci testu na vyhľadávanie rozsahu je hlavným parametrom mortalita. Preto by sa mali zaznamenať aj zmeny v správaní (napr. neschopnosť zavŕtať sa do pôdy, ležanie bez pohybu pri sklenej stene testovacej nádoby) a morfológii (napr. prítomnosť otvorených rán) dospelých jedincov, ako aj existencia každého juvenilného jedinca. Na stanovenie koncentrácie LC50 by sa mala spravidla používať probitová analýza (21) alebo logaritmická regresia. Napriek tomu v prípadoch, keď je táto metóda analýzy nevhodná (napr. ak sú k dispozícii menej ako tri koncentrácie čiastočne spôsobujúce usmrtenie), je možné použiť alternatívne metódy. Tieto metódy môžu zahŕňať pohyblivé priemery (22), upravenú Spearman-Karberovu metódu (23) alebo jednoduchú interpoláciu (napr. geometrickú strednú hodnotu LC0 a LC100, vypočítanú ako súčin druhej odmocniny LC0 a hodnoty LC100).
|
|
41.
|
V rámci konečného testu je hlavným parametrom plodnosť (t. j. počet narodených juvenilných jedincov). Pokiaľ však ide o test na vyhľadávanie rozsahu, všetky ostatné škodlivé príznaky by sa mali uviesť v záverečnej správe. Štatistická analýza si vyžaduje výpočet aritmetickej strednej hodnoty a štandardnej odchýlky vo vzťahu k reprodukcii pre vzorky s aplikovanou chemikáliou a kontrolné vzorky.
|
|
42.
|
Ak sa vykonáva analýza variancie, štandardnú odchýlku (s) a stupne voľnosti (df) môže nahradiť odhad výberovej variancie, získaný postupom ANOVA, a jej stupne voľnosti, za predpokladu, že variancia nezávisí od koncentrácie. V tomto prípade sa použije jedna hodnota variancií pre kontrolné vzorky a pre vzorky s aplikovanou chemikáliou. Tieto hodnoty sa zvyčajne vypočítajú pomocou komerčného štatistického softvéru s využitím výsledkov pre jednotlivé nádoby ako replikátov. Ak sa spájanie údajov pre negatívne kontrolné vzorky a kontrolné vzorky s rozpúšťadlom zdá byť primeranejšie než porovnávanie s jednou z týchto skupín v rámci testu, malo by sa testovaním zistiť, či nie sú výrazne odlišné (vhodné testy sú uvedené v bode 45 a dodatku 7).
|
|
43.
|
Ďalšie štatistické testovanie a odvodzovanie závisí od toho, či majú hodnoty pre replikáty normálne rozdelenie a sú homogénne, pokiaľ ide o ich varianciu.
|
Odhad koncentrácie NOEC
|
44.
|
Uprednostniť by sa malo použitie výkonných testov. Mali by sa využívať informácie napríklad z predchádzajúcich skúseností s kruhovým testovaním alebo iné historické údaje o tom, či sú údaje približne normálne rozdelené. Homogénnosť variancie (homoskedasticita) je kritickejšia. Zo skúseností vyplýva, že variancia sa často zvyšuje s rastúcou strednou hodnotou. V týchto prípadoch by transformácia údajov mohla viesť k homoskedasticite. Taká transformácia by však mala byť založená na skúsenostiach s historickými údajmi, a nie na údajoch, ktoré sú predmetom prešetrovania. S homogénnymi údajmi by sa mali vykonať viaceré t-testy, ako napríklad Williamsov test (α = 0,05, jednostranný) (24) (25), alebo v určitých prípadoch Dunnettov test (26) (27). Je potrebné si uvedomiť, že v prípade nerovnakej replikácie sa tabuľkové t-hodnoty musia upraviť, ako navrhujú Dunnett a Williams. Niekedy sa reakcie nezvyšujú/neznižujú pravidelne v dôsledku veľkých odchýlok. V prípade výraznej odchýlky od monotónnosti je Dunnettov test vhodnejší. Ak sa vyskytujú odchýlky od homoskedasticity, môže byť vhodné podrobnejšie preskúmať možné účinky na variancie s cieľom rozhodnúť, či sa t-testy môžu použiť bez výraznejšej straty výkonnosti (28). Alternatívne sa môžu použiť viacnásobné U-testy, napríklad Bonferroniho U-test podľa Holma (29), alebo v prípade, keď tieto údaje vykazujú heteroscedasticitu, ale inak sú v súlade so základným monotónnym priebehom krivky závislosti dávka-odpoveď, môže sa použiť iný neparametrický test [napr. Jonckheereho-Terpstrov (30) (31) alebo Shirleyho (32) (33)], pričom vo všeobecnosti sú tieto testy uprednostňované pred t-testami s nerovnakou varianciou (pozri tiež náčrt v dodatku 7).
|
|
45.
|
Ak sa vykonáva limitný test a sú splnené podmienky postupov parametrického testu (normalita, homogenita), môže sa použiť Studentov párový t-test, alebo inak Mannov-Whitneyho postup U-testu (29).
|
Odhad koncentrácie ECx
|
46.
|
Pri výpočte ktorejkoľvek hodnoty ECx sa na regresnú analýzu (lineárnu alebo nelineárnu) používajú stredné hodnoty pre jednotlivé vzorky s aplikovanou chemikáliou, a to po získaní vhodnej funkcie závislosti dávky a reakcie. Pre rast červov ako nepretržitú reakciu sa hodnoty ECx môžu odhadnúť použitím vhodnej regresnej analýzy (35). Medzi vhodné funkcie pre kvantálne údaje (mortalita/prežitie a počet vyprodukovaných potomkov) patria bežný sigmoid, logistická alebo Weibullova funkcia s dvomi až štyrmi parametrami, pričom niektoré z týchto funkcií môžu modelovať aj hormetické reakcie. Ak sa lineárnou regresnou analýzou určila funkcia závislosti dávky a reakcie, mal by sa pred odhadom hodnoty ECx nájsť regresnou analýzou významný koeficient determinácie (r2) a/alebo sklon zadaním hodnoty zodpovedajúcej x % strednej hodnoty pre kontrolnú vzorku do rovnice získanej regresnou analýzou. Hranice spoľahlivosti 95 % sa vypočítajú podľa Fiellera [citovaný v práci Finneyho (21)] alebo inými modernými vhodnými metódami.
|
|
47.
|
Alternatívne sa reakcia modeluje ako percentuálna časť alebo podiel modelového parametra, ktorý sa interpretuje ako stredná hodnota reakcie kontrolnej vzorky. V týchto prípadoch sa výsledky často môžu ľahko znázorniť normálnou (logistickou, Weibullovou) sigmoidnou krivkou s použitím postupu probitovej regresie (21). V týchto prípadoch sa váhová funkcia musí upraviť na metrické reakcie, ako uvádza Christensen (36). Ak sa však pozoruje horméza, probitovú analýzu by mala nahradiť logistická alebo Weibullova funkcia so štyrmi parametrami, určená postupom nelineárnej regresie (36). Ak z údajov nie je možné určiť vhodnú funkciu závislosti dávky a reakcie, môžu sa na odhad hodnoty ECx a jej hraníc spoľahlivosti použiť alternatívne metódy, ako sú pohyblivé priemery podľa Thompsona (22) a upravený Spearman-Karberov postup (23).
|
PROTOKOL O SKÚŠKE
|
48.
|
Protokol o skúške musí obsahovať tieto informácie:
|
|
Testovaná chemikália:
|
—
|
fyzikálny charakter, a ak je to relevantné, fyzikálno-chemické vlastnosti (napr. rozpustnosť vo vode, tlak pary),
|
|
—
|
chemická identifikácia testovanej chemikálie podľa názvoslovia IUPAC, číslo CAS, číslo šarže, dávky, štrukturálny vzorec a čistota,
|
|
—
|
dátum expirácie vzorky.
|
|
|
|
Testované druhy:
|
—
|
použité testované živočíchy: druh, vedecký názov, zdroj organizmov a podmienky chovu,
|
|
|
|
Podmienky testu:
|
—
|
zložky a príprava umelej pôdy,
|
|
—
|
metóda aplikácie testovanej chemikálie,
|
|
—
|
opis testovacích podmienok vrátane teploty, obsahu vlhkosti, pH atď.,
|
|
—
|
úplný opis koncepcie experimentu a postupov.
|
|
|
|
Výsledky testu:
|
—
|
mortalita dospelých červov po dvoch týždňoch a počet juvenilných jedincov na konci testu na vyhľadávanie rozsahu,
|
|
—
|
mortalita dospelých červov po troch týždňoch expozície a celý záznam o juvenilných jedincoch na konci konečného testu,
|
|
—
|
akékoľvek pozorované fyzikálne alebo patologické príznaky a zmeny v správaní testovaných organizmov,
|
|
—
|
hodnoty LC50, NOEC a/alebo ECx (napr. EC50, EC10) pre reprodukciu, ak sú niektoré z nich použiteľné, spolu s intervalmi spoľahlivosti a grafom, ktorý znázorňuje model ich výpočtu, ako aj všetky informácie a pozorovania, ktoré môžu byť nápomocné pri interpretácii výsledkov,
|
|
Uvedú sa odchýlky od postupov opísaných v tejto testovacej metóde a všetky nezvyčajné udalosti počas testu.
|
LITERATÚRA
|
1.
|
Römbke, J. (1989). Entwicklung eines Reproduktionstests an Bodenorganismen – Enchytraeen. Abschlußbericht des Battelle-Instituts e.V. Frankfurt für das Umweltbundesamt (Berlin), FE-Vorhaben 106 03 051/01.
|
|
2.
|
Römbke, J. and Moser, T. (1999). Organisation and Performance of an International Ringtest for the Validation of the Enchytraeid Reproduction Test. UBA-Texte 4/99, 150 + 223 pp.
|
|
3.
|
Westheide, W. and Bethge-Beilfuss, D. (1991). The sublethal enchytraeid test system: guidelines and some results, In: Modern Ecology: Basic and Applied Aspects. Ed. by Esser, G. and Overdieck, D. pp 497-508. Elsevier, Amsterdam,
|
|
4.
|
Dirven-Van Breemen, E., Baerselmann, R. and Notenboom, J. (1994). Onderzoek naar de Geschiktheid van de Potwormsoorten Enchytraeus albidus en Enchytraeus crypticus (Oligochaeta, Annelida) in Bodemecotoxicologisch Onderzoek. RIVM Rapport Nr. 719102025. 46 pp.
|
|
5.
|
Chapter C.8 of this Annex, Toxicity for Earthworms.
|
|
6.
|
ISO (International Organization for Standardization) (1993). Soil Quality – Effects of pollutants on earthworms (Eisenia fetida). Part 1: Determination of acute toxicity using Artificial Soil substrate, No. 11268-1. ISO, Geneve.
|
|
7.
|
ISO (International Organization for Standardization) (1996). Soil Quality – Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction, No. 11268-2. ISO, Geneve.
|
|
8.
|
Rundgren, S. and A.K. Augustsson (1998). Test on the enchytraeid Cognettia sphagnetorum (Vejdovsky 1877). In: Løkke, H. and C.A.M. Van Gestel, Handbook of soil invertebrate toxicity tests. John Wiley and Sons, Chichester, 73-94.
|
|
9.
|
Kasprzak, K. (1982). Review of enchytraeid community structure and function in agricultural ecosystems. Pedobiologia 23, 217-232.
|
|
10.
|
Römbke, J. (1995). Enchytraeen (Oligochaeta) als Bioindikator, UWSF – Z. Umweltchem. Ökotox. 7, 246-249.
|
|
11.
|
Dunger, W. and Fiedler, H.J. (1997). Methoden der Bodenbiologie. G. Fischer Verlag, Stuttgart, New York.
|
|
12.
|
Didden, W.A.M. (1993). Ecology of terrestrial Enchytraeidae. Pedobiologia 37, 2-29.
|
|
13.
|
Becker, H. (1991). Bodenorganismen – Prüfungskategorien der Forschung. UWSF – Z. Umweltchem. Ökotox. 3, 19-24.
|
|
14.
|
Römbke, J. and Federschmidt, A. (1995). Effects of the fungicide Carbendazim on Enchytraeidae in laboratory and field tests, Newsletter on Enchytraeidae 4, 79-96.
|
|
15.
|
Römbke, J., Riepert, F. & Achazi R. (2000): Enchytraeen als Testorganismen. In: Toxikologische Beurteilung von Böden. Heiden, S., Erb, R., Dott, W. & Eisentraeger, A. (eds.). Spektrum Verl., Heidelberg. 59-81.
|
|
16.
|
ISO (International Organization for Standardization) (1994). Soil Quality – Determination of pH, No. 10390. ISO, Geneve.
|
|
17.
|
Bell, A.W. (1958). The anatomy of Enchytraeus albidus, with a key to the species of the genus Enchytraeus. Ann. Mus. Novitat. 1902, 1-13.
|
|
18.
|
Nielsen, C.O. and Christensen, B. (1959). The Enchytraeidae, critical revision and taxonomy of European species. Natura Jutlandica 8-9, 1-160.
|
|
19.
|
Bouguenec, V. and Giani, N. (1987). Deux nouvelles especes d'Enchytraeus (Oligochaeta, Enchytraeidae) et rediscription d'E. bigeminus. Remarques sur le genre Enchytraeus. Ann. Limnol. 23, 9-22.
|
|
20.
|
Korinkova, J. and Sigmund, J. (1968). The colouring of bottom-fauna samples before sorting, Vestnik Ceskoslovensko Spolecnosti Zoologicke 32, 300-305.
|
|
21.
|
Finney, D.J. (1971). Probit Analysis (3rd ed.), pp. 19-76. Cambridge Univ. Press.
|
|
22.
|
Finney, D.J. (1978). Statistical Method in Biological Assay. – Charles Griffin & Company Ltd, London.
|
|
23.
|
Hamilton, M.A., R.C. Russo and R.V. Thurston. (1977). Trimmed Spearman-Karber Method for estimating median lethal concentrations in toxicity bioassays. Environ. Sci. Technol. 11(7), 714-719; Correction Environ. Sci. Technol. 12(1998), 417.
|
|
24.
|
Williams, D.A., (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27, 103-117.
|
|
25.
|
Williams, D.A., (1972). The comparison of several dose levels with a zero dose control. Biometrics 28, 519-531.
|
|
26.
|
Dunnett, C.W., (1955). A multiple comparison procedure for comparing several treatments with a control. Amer. Statist. Ass. J. 50, 1096-1121.
|
|
27.
|
Dunnett, C.W., (1964) New tables for multiple comparisons with a control. Biometrics 20, 482-491.
|
|
28.
|
Hoeven, N. van der, (1998). Power analysis for the NOEC: What is the probability of detecting small toxic effects on three different species using the appropriate standardized test protocols? Ecotoxicology 7: 355-361
|
|
29.
|
Holm, S., (1979): A simple sequentially rejective multiple test procedure. Scand. J. Statist. 6, 65-70.
|
|
30.
|
Jonckheere, A. R. (1954); A Distribution-free k-Sample Test Against Ordered Alternatives, Biometrika 41, 133-145.
|
|
31.
|
Terpstra, T. J. (1952); The Asymptotic Normality and Consistency of Kendall's Test Against Trend, When Ties are Present in One Ranking, Indagationes Math. 14, 327-333.
|
|
32.
|
Shirley, E. A. (1979); The comparison of treatment to control group means in toxicology studies, Applied Statistics 28, 144-151.
|
|
33.
|
Williams, D.A. (1986); A Note on Shirley's Nonparametric Test for Comparing Several Dose Levels with a Zero-Dose Control, Biometrics 42, 183-186.
|
|
34.
|
Sokal, R.R. and F.J. Rohlf. (1981). Biometry. The Principle and practice of statistics in biological research. 2nd edition. W.H. Freeman and Company. New York.
|
|
35.
|
Christensen, E.R., (1984). Dose-response functions in aquatic toxicity testing and the Weibull model. Water Research 18, 213-221.
|
|
36.
|
Van Ewijk, P.H. and J.A. Hoekstra. (1993). Calculation of the EC50 and its confidence interval when sub-toxic stimulus is present. Ecotox, Environ. Safety. 25, 25-32.
|
Dodatok 1
Vymedzenie pojmov
Na účely tejto testovacej metódy sa používajú tieto vymedzenia pojmov:
|
|
Chemikália je látka alebo zmes.
|
|
|
ECx
(účinná koncentrácia x %) je koncentrácia, ktorá v rámci stanoveného času expozície vyvolá účinok x % na testované organizmy v porovnaní s kontrolnou vzorkou. V rámci tohto testu sa účinné koncentrácie vyjadrujú ako hmotnosť testovanej chemikálie na suchú hmotnosť testovacej pôdy.
|
|
|
LC0
(nulová letálna koncentrácia) je koncentrácia testovanej chemikálie, ktorá v danom časovom úseku nespôsobí usmrtenie testovaných organizmov vystavených jej pôsobeniu. V rámci tohto testu sa LC0 vyjadruje ako hmotnosť testovanej chemikálie na suchú hmotnosť testovanej pôdy.
|
|
|
LC50
(stredná letálna koncentrácia) je koncentrácia testovanej chemikálie, ktorá v danom časovom úseku spôsobí usmrtenie 50 % testovaných organizmov vystavených jej pôsobeniu. V rámci tohto testu sa LC50 vyjadruje ako hmotnosť testovanej chemikálie na suchú hmotnosť testovanej pôdy.
|
|
|
LC100
(absolútna letálna koncentrácia) je koncentrácia testovanej chemikálie, ktorá v danom časovom úseku spôsobí usmrtenie 100 % testovaných organizmov vystavených jej pôsobeniu. V rámci tohto testu sa LC100 vyjadruje ako hmotnosť testovanej chemikálie na suchú hmotnosť testovanej pôdy.
|
|
|
LOEC (najnižšia koncentrácia s pozorovaným účinkom) je najnižšia koncentrácia testovanej chemikálie, ktorá má štatisticky významný účinok (p < 0,05). V rámci tohto testu sa LOEC vyjadruje ako hmotnosť testovanej chemikálie na suchú hmotnosť testovacej pôdy. Všetky testovacie koncentrácie vyššie ako LOEC by za normálnych okolností mali vyvolať účinok, ktorý je štatisticky odlišný od kontrolných vzoriek. Akékoľvek odchýlky od uvedeného pri určovaní LOEC musia byť odôvodnené v správe o teste.
|
|
|
NOEC (koncentrácia bez pozorovaného účinku) je najvyššia koncentrácia testovanej chemikálie, bezprostredne pod koncentráciou LOEC, pri ktorej sa nepozoruje žiadny účinok. V tomto teste koncentrácia zodpovedajúca hodnote NOEC nemá žiadny štatisticky významný účinok (p < 0,05) v rámci daného expozičného času v porovnaní s kontrolnou vzorkou.
|
|
|
Miera reprodukcie je stredná hodnota počtu narodených juvenilných červov na počet dospelých červov počas testu.
|
|
|
Testovaná chemikália je akákoľvek látka alebo zmes, ktorá sa testuje pomocou tejto testovacej metódy.
|
Dodatok 2
Stanovenie maximálnej kapacity zadržiavania vody
Stanovenie kapacity zadržiavania vody umelej pôdy
Táto metóda sa považuje za vhodnú. Opísaná je v prílohe C normy ISO DIS 11268-2.
Pomocou vhodného zariadenia (špirálová trubica atď.) sa odoberie určené množstvo (napr. 5 g) testovacieho pôdneho substrátu. Spodná časť trubice sa zakryje kúskom filtračného papiera a po naplnení vodou sa umiestni na stojan vo vodnom kúpeli. Trubica by sa mala postupne ponárať do vody, až kým vodná hladina nestúpne nad vrchnú vrstvu pôdy. Potom by sa mala nechať vo vode približne tri hodiny. Keďže nie všetka voda, ktorú absorbujú kapiláry pôdy, sa môže zachovať, vzorke pôdy by sa malo umožniť odvodnenie počas dvoch hodín tak, že sa trubica uloží na vrstvu veľmi mokrého jemne drveného kremenného piesku v uzavretej nádobe (aby sa zabránilo vysúšaniu). Vzorka by sa potom mala odvážiť a vysušiť na konštantnú hmotnosť pri teplote 105 °C. Kapacitu zadržiavania vody (WHC) je možné vypočítať takto:

kde:
|
S
|
=
|
vodou saturovaný substrát + hmotnosť trubice + hmotnosť filtračného papiera,
|
|
T
|
=
|
hmotnosť obalu (hmotnosť trubice + hmotnosť filtračného papiera),
|
|
D
|
=
|
suchá hmotnosť substrátu.
|
LITERATÚRA:
ISO (International Organization for Standardization) (1996). Soil Quality -Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction, No. 11268-2. ISO, Geneve.
Dodatok 3
Stanovenie ph pôdy
Táto metóda stanovenia pH vzorky pôdy je založená na opise uvedenom v norme ISO 10390 (Kvalita pôdy – stanovenie pH).
Určené množstvo pôdy sa suší pri teplote miestnosti najmenej 12 hodín. Potom sa vytvorí suspenzia pôdy (obsahujúca najmenej 5 g pôdy) s päťnásobným objemom 1 M chloridu draselného (KCl) analytickej čistoty alebo 0,01 M roztoku chloridu vápenatého (CaCl2) analytickej čistoty. Suspenzia sa potom päť minút dôkladne pretrepáva. Po pretrepaní sa suspenzia nechá stáť najmenej 2 hodiny, ale nie dlhšie ako 24 hodín. Hodnota pH kvapalnej fázy sa potom meria pH-metrom, ktorý sa pred každým meraním kalibruje pomocou vhodnej série tlmivých roztokov (napr. s pH 4,0 a 7,0).
LITERATÚRA:
ISO (International Organization for Standardization) (1994). Soil Quality – Determination of pH, No. 10390. ISO, Geneve.
Dodatok 4
Kultivačné podmienky rodu Enchytraeus
Červy druhu Enchytraeus albidus (ako aj iné druhy rodu Enchytraeus) z čeľade Enchytraeidae je možné kultivovať vo veľkých plastových boxoch (napr. s rozmermi 30 × 60 × 10 cm) naplnených zmesou 1:1 umelo pripravenej pôdy a prírodnej nekontaminovanej záhradnej pôdy. Kompostový materiál sa nesmie používať, lebo by mohol obsahovať toxické chemikálie, ako sú ťažké kovy. Faunu je potrebné z pôdy pred použitím odstrániť (napr. hlbokým zmrazením). Použiť sa môže aj substrát tvorený len umelou pôdou, ale miera reprodukcie môže byť nižšia, než sa dosiahne pomocou zmiešaného pôdneho substrátu. Substrát, ktorý sa používa na kultiváciu, by mal mať hodnotu pH 6,0 ± 0,5.
Kultúra sa uchováva v tme pri teplote 15 – 20 °C ± 2 °C. Je potrebné zabrániť stúpnutiu teploty nad 23 °C. Pôda sa musí udržiavať vlhká, ale nie mokrá. Správny obsah vlhkosti v pôde sa prejaví malými kvapkami vody medzi prstami pri jemnom stláčaní pôdy. Musí sa predchádzať vzniku anoxických podmienok tým, že sa zabezpečí, aby veká kultivačných nádob umožňovali primeranú výmenu plynov s atmosférou. Pôda by sa mala každý týždeň opatrne rozrušiť, aby sa uľahčilo prevzdušňovanie.
Červy sa môžu kŕmiť ovsenými vločkami. Vločky by sa mali skladovať v hermeticky uzavretých nádobách a pred použitím by sa mali autoklávovať alebo zahriať, aby sa zabránilo zamoreniu múčnymi roztočmi (napr. rod Glyzyphagus, Astigmata, Acarina) alebo dravými roztočmi [napríklad Hypoaspis (Cosmolaelaps) miles, Gamasida, Acarina]. Po tepelnom ošetrení by sa mala potrava rozomlieť, aby ju bolo možné ľahko rozsypať na povrch pôdy. Z času na čas sa ovsené otruby môžu doplniť pridaním vitamínov, mlieka a oleja z tresčej pečene. Inými vhodnými zdrojmi potravy sú pekárske kvasnice a krmivo pre ryby TetraMin.
Kŕmenie prebieha približne dvakrát týždenne. Primerané množstvo ovsených otrúb sa rozsype na povrch pôdy alebo sa opatrne zamieša do substrátu pri rozrušovaní pôdy na uľahčenie prevzdušňovania. Absolútne množstvo poskytnutej potravy závisí od počtu červov prítomných v substráte. Ako usmernenie platí, že množstvo potravy by sa malo zvýšiť, ak sa všetka spotrebuje počas dňa, keď bola poskytnutá. Naopak, ak potrava zostáva na povrchu aj v čase druhého kŕmenia (o týždeň neskôr), jej množstvo by sa malo znížiť. Potrava kontaminovaná rastom plesní by sa mala odstrániť a nahradiť. Po troch mesiacoch by sa červy mali presunúť do čerstvo pripraveného substrátu.
Kultivačné podmienky sa považujú za vyhovujúce, ak sa červy: a) nepokúšajú opustiť pôdny substrát, b) rýchlo pohybujú v pôde, c) majú lesklý vonkajší povrch bez prichytených častíc pôdy, d) majú viac-menej belavú farbu, e) vykazujú v kultúrach rozličné vekové kategórie a f) sústavne sa reprodukujú.
Dodatok 5
Vykonanie testu s inými druhmi rodu Enchytraeus
Výber druhov
Použiť sa môžu aj iné druhy než E. albidus, ale zodpovedajúcim spôsobom by sa mal upraviť postup testovania a kritériá platnosti. Keďže mnohé druhy rodu Enchytraeus sú ľahko dostupné a je možné ich uspokojivo udržiavať v laboratóriu, najdôležitejším kritériom pri výbere iných druhov ako E. albidus je ekologický význam, ako aj ich porovnateľná citlivosť. Na zmenu druhov môžu byť aj formálne dôvody. Napríklad v krajinách, kde sa druh E. albidus nevyskytuje a nie je možné ho dovážať (napr. v dôsledku karanténnych obmedzení), bude potrebné použiť iný druh rodu Enchytraeus.
Príklady vhodných alternatívnych druhov
|
—
|
Enchytraeus crypticus (Westheide a Graefe 1992): v posledných rokoch sa tento druh často používa v ekotoxikologických štúdiách pre jednoduchosť chovu a testovania. Je však malý, a preto je manipulácia s ním zložitejšia v porovnaní s druhom E. albidus (najmä v štádiách pred použitím metódy farebného označovania). V prípade druhu E. crypticus nebolo s istotou zistené, či sa vyskytuje na poliach, a opísaný bol iba z kultúr dážďoviek. Jeho ekologické potreby preto nie sú známe.
|
|
—
|
Enchytraeus buchholzi (Vejdovsky 1879): názov pravdepodobne zahŕňa skupinu blízko príbuzných druhov, ktoré sú morfologicky ťažko rozlíšiteľné. Jeho použitie na testovanie sa neodporúča, pokiaľ jedince, ktoré by sa mali použiť v rámci testu, nie je možné druhovo identifikovať. Červy druhu E. buchholzi sa zvyčajne vyskytujú na lúkach a v narušených oblastiach, ako je okolie ciest.
|
|
—
|
Enchytraeus luxuriosus: tento druh bol pôvodne známy ako E. minutus, a bol opísaný až nedávno (1). Prvýkrát ho objavil U. Graefe (Hamburg) na lúke v blízkosti St. Peter-Ording (spolková krajina Šlezvicko-Holštajnsko, Nemecko). Červy druhu E. luxuriosus majú približne polovičnú veľkosť v porovnaní s druhom E. albidus, ale sú väčšie v porovnaní s ostatnými uvádzanými druhmi, čo by z nich mohlo robiť dobrú alternatívu druhu E. albidus.
|
|
—
|
Enchytraeus bulbosus (Nielsen a Christensen 1963): tento druh bol doteraz hlásený z Nemecka a Španielska, kde žije v minerálnych pôdach a jeho výskyt je bežný, ale obvykle nie veľmi hojný. V porovnaní s inými malými druhmi tohto rodu je pomerne ľahko identifikovateľný. Nič nie je známe o jeho správaní v rámci laboratórnych testov ani o jeho citlivosti na chemikálie. Zistilo sa však, že sa ľahko kultivuje (E. Belotti, osobná komunikácia).
|
Chovné podmienky
Všetky uvedené druhy rodu Enchytraeus je možné kultivovať v rovnakých substrátoch, aké sa používajú v prípade druhu E. albidus. Ich menšia veľkosť znamená, že kultivačné nádoby môžu byť menšie a že sa síce môže používať rovnaká potrava, ale musí sa upraviť veľkosť dávky. Životný cyklus týchto druhov je kratší ako v prípade druhu E. albidus, preto by sa kŕmenie malo vykonávať častejšie.
Podmienky testu
Podmienky testu sú vo všeobecnosti rovnaké ako tie, ktoré sa vzťahujú na druh E. albidus, okrem toho, že
|
—
|
veľkosť testovacej nádoby môže (ale nemusí) byť menšia,
|
|
—
|
čas trvania reprodukčného testu môže (ale nemusí) byť kratší, t. j. štyri namiesto šiestich týždňov, pričom čas trvania testu na vyhľadávanie rozsahu by sa nemal meniť,
|
|
—
|
vzhľadom na malé rozmery juvenilných červov sa dôrazne odporúča použiť pri počítaní metódu farebného označovania;
|
|
—
|
kritérium platnosti vzťahujúce sa na počet juvenilných jedincov na testovaciu nádobu v kontrolnej vzorke by sa malo zmeniť na ‚50‘.
|
LITERATÚRA
|
(1)
|
Schmelz, R.M. and Collado, R. (1999). Enchytraeus luxuriosus sp.nov., a new terrestrial oligochaete species (Enchytraeidae, Clitellata, Annelida). Carolinea 57, 93-100.
|
Dodatok 6
Podrobný opis techník extrakcie
Farebné označovanie bengálskou červeňou
Použitie tejto metódy, pôvodne vyvinutej pre sladkovodné životné prostredie (1), na počítanie juvenilných jedincov čeľade Enchytraeidae prvýkrát navrhol W. De Coen (Univerzita Gent, Belgicko) v rámci reprodukčného testu čeľade Enchytraeidae. Upravenú verziu (bengálska červeň zmiešaná s formaldehydom namiesto etanolu) nezávisle vypracoval inštitút RIVM v Bilthovene (2) (3).
Na konci konečného testu (t. j. po šiestich týždňoch) sa pôda z testovacích nádob prenesie do plytkej nádoby. Vhodná na tento účel je bellaplastová nádoba alebo fotografická miska s rebrovaným dnom, lebo ‚rebrá‘ obmedzujú pohyb červov v oblasti pozorovania. Mladé jedince sú fixované etanolom (približne 5 ml na replikát). Do nádob sa potom naleje voda tak, aby tvorila vrstvu 1 – 2 cm. Pridá sa niekoľko kvapiek (200 – 300 μl) bengálskej červene (1 % roztok v etanole) (alternatívou je 0,5 % eozín) a obidve zložky sa dôkladne premiešajú. Po 12 hodinách by mali byť červy červenkasto sfarbené a malo by byť možné ich ľahko spočítať, lebo budú ležať na povrchu substrátu. Alternatívne sa môže zmes substrátu a alkoholu pred spočítaním červov preprať cez sito (veľkosť ôk: 0,25 mm). Použitím tohto postupu sa kaolinit, rašelina a časť piesku vymyjú a červenkasté červy sa budú jednoduchšie vyhľadávať a počítať. Počítanie uľahčí aj použitie šošoviek s osvetlením (šošovky s veľkosťou najmenej 100 × 75 mm a s dvojnásobným až trojnásobným faktorom zväčšenia).
Technika farebného označovania skracuje čas počítania na niekoľko minút na nádobu a ako usmernenie platí, že by malo byť možné, aby jedna osoba bola schopná posúdiť všetky nádoby z jedného testu v priebehu maximálne dvoch dní.
Mokrá extrakcia
Mokrá extrakcia by sa mala začať okamžite po skončení testu. Pôda z každej testovacej nádoby sa umiestni do plastových sít s veľkosťou ôk približne 1 mm. Sitá sa potom zavesia do plastových misiek bez dotyku s dnom. Misky sa opatrne naplnia vodou tak, aby vzorky v sitách boli úplne pod vodnou hladinou. S cieľom zabezpečiť výťažnosť viac ako 90 % prítomných červov by extrakcia mala prebiehať tri dni pri teplote 20 °C ± 2 °C. Po skončení extrakcie sa sitá vyberú a voda (s výnimkou malého množstva) sa pomaly vyleje, pričom sa dbá na to, aby sa nenarušil sediment na dne misiek. Plastové misky sa potom mierne pretrepú, aby suspendoval sediment vo vrstve vody. Voda sa preleje do Petriho misky a po usadení častíc pôdy sa môžu červy čeľade Enchytraeidae identifikovať, premiestniť a spočítať s použitím stereomikroskopu a jemnej oceľovej pinzety.
Flotácia
Metódu založenú na flotácii opísal vo svojej práci R. Kuperman (4). Po fixovaní obsahu testovacej nádoby etanolom sa pôda zaleje prípravkom Ludox (koloidný silikát AM-30, 30 hm. % suspenzia vo vode) do výšky 10 – 15 mm nad povrch pôdy. Po dôkladnom premiešaní pôdy s flotačným činidlom v trvaní 2 – 3 minút plávajú juvenilné červy na povrchu a je možné ich ľahko spočítať.
LITERATÚRA
|
1.
|
Kořínková, J. and Sigmund, J. (1968). The colouring of bottom-fauna samples before sorting, Vestník Československé Společnosti Zoologické 32, 300-305.
|
|
2.
|
Dirven-Van Breemen, E., Baerselmann, R. and Notenboom, J. (1994). Onderzoek naar de Geschiktheid van de Potwormsoorten Enchytraeus albidus en Enchytraeus crypticus (Oligochaeta, Annelida) in Bodemecotoxicologisch Onderzoek. RIVM Rapport Nr. 719102025. 46 pp.
|
|
3.
|
Posthuma, L., Baerselmann, R., Van Veen, R.P.M. and Dirven-Van Breemen, E.M. (1997). Single and joint toxic effects of copper and zinc on reproduction of Enchytraeus crypticus in relation to sorption of metals in soils. Ecotox. Envir. Safety 38, 108-121.
|
|
4.
|
Phillips, C.T., Checkai, R.T. and Kuperman, R.G. (1998). An alternative to the O'Connor Method for Extracting Enchytraeids from Soil. SETAC 19th Annual Meeting, Charlotte, USA. Abstract Book No. PMP069, p. 157.
|
Dodatok 7
Prehľad štatistického posúdenia údajov (stanovenie hodnoty NOEC)

C.33. REPRODUKČNÝ TEST S DÁŽĎOVKAMI (EISENIA FETIDA/EISENIA ANDREI)
ÚVOD
|
1.
|
Táto testovacia metóda je rovnocenná s usmernením OECD na vykonávanie testov (TG) 222 (2004). Je určená na posúdenie účinkov chemikálií v pôde na reprodukčný výstup (a ďalších subletálnych parametrov) dážďoviek druhu Eisenia fetida (Savigny 1826) alebo Eisenia andrei (Andre 1963) (1) (2). Metóda bola podrobená kruhovému testu (3). Existuje testovacia metóda pre test akútnej toxicity pre dážďovky (4). Uverejnené boli viaceré iné medzinárodné a vnútroštátne usmernenia pre akútne a chronické testy s dážďovkami (5) (6) (7) (8).
|
|
2.
|
Druhy Eisenia fetida a Eisenia andrei sa považujú za jedných zo zástupcov pôdnej fauny a predovšetkým dážďoviek. Základné informácie o ekológii dážďoviek a ich používaní v ekotoxikologickom testovaní sú k dispozícii v literatúre (7) (9) (10) (11) (12).
|
PRINCÍP TESTU
|
3.
|
Dospelé červy sú vystavené účinkom rôznych koncentrácií testovanej chemikálie, buď zamiešanej do pôdy, alebo, v prípade pesticídov, aplikovanej na povrch alebo do pôdy s použitím postupov, ktoré sú v súlade so spôsobom používania chemikálie. Metóda aplikácie je špecifická na účely testu. Rozsah testovacích koncentrácií sa vyberá tak, aby zahŕňal tie, ktoré môžu počas ôsmich týždňov spôsobiť subletálne i letálne účinky. Účinky na mortalitu a rast dospelých červov sa stanovia po štyroch týždňoch expozície. Dospelé jedince sa potom vyberú z pôdy a účinky na reprodukciu sa posudzujú po ďalších štyroch týždňoch sčítaním počtu potomstva prítomného v pôde. Výstup reprodukcie červov vystavených testovanej chemikálii sa porovnáva s reprodukčným výstupom kontrolných vzoriek s cieľom stanoviť hodnoty i) koncentrácie bez pozorovaného účinku (NOEC) a/alebo ii) koncentrácie ECx (napr. EC10, EC50) pomocou regresného modelu na odhad koncentrácie, ktorá by spôsobila zníženie reprodukčného výstupu o x %. Koncentrácia ECx (napr. EC10, EC50) by mala byť v rozsahu testovacích koncentrácií, aby sa potom hodnota ECx určila interpoláciou namiesto extrapolácie (pozri vymedzenie pojmov v dodatku 1).
|
INFORMÁCIE O TESTOVANEJ CHEMIKÁLII
|
4.
|
Na pomoc pri vypracovaní vhodných postupov testovania by mali byť k dispozícii tieto informácie týkajúce sa testovanej chemikálie:
|
—
|
a ak je to možné, informácie o osude a správaní testovanej chemikálie v životnom prostredí (napr. rýchlosť fotolýzy a hydrolýzy, pokiaľ je to dôležité z hľadiska spôsobov aplikácie).
|
|
|
5.
|
Táto testovacia metóda sa môže použiť na všetky chemikálie bez ohľadu na ich rozpustnosť vo vode. Testovacia metóda nie je použiteľná v prípade prchavých chemikálií, vymedzených na tento účel ako chemikálie, pre ktoré je hodnota Henryho konštanty alebo rozdeľovacej konštanty vzduch/voda vyššia ako jeden, alebo chemikálie, pre ktoré tlak pary pri teplote 25 °C presahuje hodnotu 0,0133 Pa.
|
|
6.
|
V rámci tejto testovacej metódy neexistuje žiadna povolená odchýlka, pokiaľ ide o možnú degradáciu testovanej chemikálie počas celého trvania testu. Následne nie je možné predpokladať, že expozičné koncentrácie sa počas celého testu budú udržiavať na počiatočných hodnotách. V tom prípade sa odporúča vykonať chemickú analýzu testovanej chemikálie na začiatku a na konci testu.
|
REFERENČNÁ CHEMIKÁLIA
|
7.
|
S cieľom zabezpečiť, aby boli laboratórne podmienky testu primerané, a overiť, či sa reakcia testovaných organizmov postupom času štatisticky výrazne nezmenila, sa musia stanoviť hodnoty NOEC a/alebo ECx referenčnej chemikálie. Odporúča sa testovať referenčnú chemikáliu najmenej raz ročne, alebo ak sa testovanie vykonáva zriedkavejšie, súbežne so stanovením toxicity testovanej chemikálie. Vhodnými referenčnými chemikáliami sú karbendazim a benomyl, pri ktorých sa preukázalo, že ovplyvňujú reprodukciu (3). Výrazné účinky by sa mali pozorovať pri hodnotách a) 1 – 5 mg účinnej zložky/kg suchej hmotnosti alebo b) 250 – 500 g/ha alebo 25 – 50 mg/m2. Ak sa do série testov zahrnie pozitívny štandard toxicity, použije sa jedna koncentrácia a počet replikátov by mal byť rovnaký ako pri kontrolných vzorkách.
|
PLATNOSŤ TESTU
|
8.
|
Na to, aby sa výsledok testu považoval za platný, by kontrolné vzorky mali spĺňať tieto kritériá:
|
—
|
v každom replikáte (obsahujúcom 10 dospelých jedincov) by malo byť do konca testu vyprodukovaných ≥ 30 juvenilných jedincov,
|
|
—
|
variačný koeficient reprodukcie by mal byť ≤ 30 %,
|
|
—
|
mortalita dospelých jedincov počas počiatočných 4 týždňov testu by mala byť ≤ 10 %.
|
Ak test nespĺňa uvedené kritériá platnosti, jeho vykonávanie by sa malo ukončiť, pokiaľ nie je možné predložiť odôvodnenie pokračovania testu. Toto odôvodnenie by malo byť zahrnuté do protokolu o skúške.
|
OPIS TESTU
Zariadenia
|
9.
|
Používať by sa mali testovacie nádoby vyrobené zo skla alebo iného chemicky inertného materiálu s objemom približne jeden až dva litre. Nádoby by mali mať v priereze plochu približne 200 cm2, aby sa dosiahla hĺbka vlhkého substrátu okolo 5 – 6 cm, keď sa pridá 500 – 600 g sušiny substrátu. Konštrukcia veka nádoby by mala umožniť výmenu plynov medzi substrátom a atmosférou a prístup svetla (napr. perforované priesvitné veko) a zároveň zabrániť úniku červov. Ak je množstvo používaného testovacieho substrátu podstatne väčšie než 500 – 600 g na jednu testovaciu nádobu, počet červov by sa mal úmerne zvýšiť.
|
|
10.
|
Potrebné je bežné laboratórne vybavenie, konkrétne toto:
|
—
|
primerané zariadenie na regulovanie teploty,
|
|
—
|
primerané zariadenie na regulovanie vlhkosti (nie je to nevyhnutné, ak nádoby s exponovanými vzorkami majú veká),
|
|
—
|
inkubátor alebo malá miestnosť s klimatizačným zariadením,
|
|
—
|
pinzety, háčiky alebo slučky,
|
|
Príprava umelej pôdy
|
11.
|
V tomto teste sa používa umelo pripravená pôda (5) (7) s týmto zložením (na základe sušiny vysušenej na konštantnú hmotnosť pri teplote 105 °C):
|
—
|
10 percent rašeliny (pH čo najbližšie k hodnotám 5,5 – 6,0, bez viditeľných rastlinných zvyškov, jemne mletá, vysušená na meraný obsah vlhkosti),
|
|
—
|
20 percent kaolínovej hliny (obsah kaolinitu podľa možnosti nad 30 percent),
|
|
—
|
0,3 – 1 % uhličitanu vápenatého (CaCO3, práškový, analytickej čistoty) na dosiahnutie počiatočnej hodnoty pH 6,0 ± 0,5,
|
|
—
|
70 % vzduchom vysušeného kremenného piesku (v závislosti od potrebného množstva CaCO3), prevažne jemný piesok s viac ako 50 % častíc s veľkosťou od 50 do 200 mikrónov.
|
Poznámka 1: potrebné množstvo CaCO3 bude závisieť od zložiek pôdneho substrátu vrátane potravy a malo by sa stanoviť meraním čiastkových vzoriek pôdy tesne pred testom; hodnota pH sa meria v zmiešanej vzorke roztoku 1 M chloridu draselného (KCl) alebo 0,01 M roztoku chloridu vápenatého (CaCl2) (13).
Poznámka 2: Obsah organického uhlíka v umelo pripravenej pôde môže klesnúť, napríklad znížením obsahu rašeliny na 4 – 5 % a zodpovedajúcim zvýšením obsahu piesku. V dôsledku takéhoto poklesu obsahu organického uhlíka sa môžu znížiť možnosti adsorpcie testovanej chemikálie na pôdu (organický uhlík) a dostupnosť testovanej chemikálie pre červy sa môže zvýšiť. Preukázalo sa, že červy druhu Eisenia fetida môžu spĺňať kritériá platnosti reprodukcie v prípade, keď sa testy vykonávajú v poľných pôdach s nižším obsahom organického uhlíka (napr. 2,7 %) (14), a existujú praktické skúsenosti potvrdzujúce, že toto je možné dosiahnuť aj v umelo pripravenej pôde s 5 % rašeliny. Preto nie je potrebné pred použitím takejto pôdy na konečný test preukazovať, že umelo pripravená pôda je vhodná na dosiahnutie súladu s kritériami platnosti testu, pokiaľ obsah rašeliny neklesne viac, ako bolo uvedené.
Poznámka 3: Vhodnosť pôdy a splnenie kritérií platnosti testu by sa mali preukázať aj v prípade použitia prírodnej pôdy v ďalšom testovaní (napr. vyššieho stupňa).
|
|
12.
|
Suché zložky pôdy sa dôkladne zmiešajú (napr. vo veľkokapacitnom laboratórnom miešači) v dobre vetranom priestore. Pred začiatkom testu sa suchá umelo pripravená pôda zvlhčí pridaním dostatočného množstva deionizovanej vody, aby sa dosiahla približne polovica konečného obsahu vody, čo je 40 – 60 % maximálnej kapacity zadržiavania vody (čo zodpovedá 50 % ± 10 % vlhkosti sušiny). Tým vznikne substrát, v ktorom sa pri stláčaní rukou neobjaví stojaca ani voľná voda. Maximálna kapacita zadržiavania vody umelej pôdy sa stanoví v súlade s postupmi uvedenými v dodatku 2 k norme ISO 11274 (15) alebo v rovnocennej norme EÚ.
|
|
13.
|
Ak sa testovaná chemikália aplikuje na povrch pôdy alebo sa zamieša do pôdy bez vody, konečné množstvo vody sa môže zamiešať do umelo pripravnej pôdy počas prípravy pôdy. Ak sa testovaná chemikália zamieša do pôdy spolu s určitým množstvom vody, ďalšia voda sa môže pridať spolu s testovanou chemikáliou (pozri bod 19).
|
|
14.
|
Obsah vlhkosti v pôde sa stanoví na začiatku a na konci testu v súlade s normou ISO 11465 (16) alebo rovnocennou normou EÚ a hodnota pH pôdy sa stanoví v súlade s dodatkom 3 alebo normou ISO 10390 (13) alebo rovnocennou normou EÚ. Tieto hodnoty by sa mali stanoviť z kontrolnej vzorky pôdy a zo vzorky pôdy s každou testovanou koncentráciou. Hodnota pH pôdy by sa pri testovaní kyslých alebo zásaditých chemikálií nemala upravovať. Obsah vlhkosti by sa mal monitorovať počas celého testu pravidelným vážením nádob (pozri body 26 a 30).
|
Výber a príprava testovacích živočíchov
|
15.
|
Živočíšne druhy použité v teste sú Eisenia fetida alebo Eisenia andrei (1) (2). Na začiatok testu sú potrebné dospelé červy vo veku dva mesiace až jeden rok a s vyvinutým opaskom (clitellum). Červy by sa mali vybrať zo synchronizovanej kultúry s relatívne homogénnou vekovou štruktúrou (dodatok 4). Jedinci v rámci skupiny by sa nemali líšiť vo veku o viac ako 4 týždne.
|
|
16.
|
Vybraté červy by sa mali aklimatizovať najmenej jeden deň s typom umelého pôdneho substrátu, ktorý sa má použiť v rámci testu. Počas tohto obdobia by sa červy mali kŕmiť tou istou potravou, ktorá sa má použiť v rámci testu (pozri body 31 – 33).
|
|
17.
|
Na začiatku testu by sa mali skupiny 10 červov jednotlivo vážiť a náhodne zaraďovať do testovacích nádob. Červy sa pred vážením umyjú (deionizovanou vodou) a prebytočná voda sa odstráni tak, že sa červy nakrátko položia na filtračný papier. Čerstvá hmotnosť jednotlivých červov by mala dosahovať hodnotu od 250 do 600 mg.
|
Príprava testovaných koncentrácií
|
18.
|
Použiť sa môžu dve metódy aplikácie testovanej chemikálie: miešanie testovanej chemikálie do pôdy (pozri body 19 – 21) alebo aplikácia na povrchu pôdy (pozri body 22 – 24). Výber vhodnej metódy závisí od účelu testu. Vo všeobecnosti sa odporúča miešanie testovanej chemikálie do pôdy. Môžu však byť potrebné postupy aplikácie, ktoré sú v súlade s bežnou poľnohospodárskou praxou (napr. nástrek kvapalného prípravku alebo použitie špeciálnych prípravkov na ochranu rastlín, ako sú granuly alebo moridlá osiva). Rozpúšťadlá používané na pomoc pri aplikovaní testovanej chemikálie do pôdy by sa mali vyberať na základe ich nízkej toxicity pre dážďovky a do koncepcie testu musí byť zahrnutá primeraná kontrola rozpúšťadla (pozri bod 27).
|
Miešanie testovanej chemikálie do pôdy
Testovaná chemikália rozpustná vo vode
|
19.
|
Roztok testovanej chemikálie v deionizovanej vode sa pripravuje tesne pred začiatkom testu v množstve dostatočnom pre všetky replikáty jednej koncentrácie. Na uľahčenie prípravy testovacieho roztoku môže byť potrebné pomocné rozpúšťadlo. Je vhodné pripraviť také množstvo roztoku, aké je potrebné na dosiahnutie konečného obsahu vlhkosti (40 – 60 % maximálnej kapacity zadržiavania vody). Roztok sa pred vložením do testovacej nádoby dôkladne premieša s pôdnym substrátom.
|
Testovaná chemikália nerozpustná vo vode
|
20.
|
Testovaná chemikália sa rozpustí v malom objeme vhodného organického rozpúšťadla (napr. acetónu) a potom sa nastrieka na malé množstvo jemného kremenného piesku, alebo sa s ním zmieša. Rozpúšťadlo sa potom odstráni aspoň niekoľkominútovým odparovaním pod digestorom. Piesok s aplikovanou chemikáliou sa následne dôkladne zmieša s predvlhčenou umelo pripravenou pôdou. Potom sa pridá a zamieša deionizovaná voda (potrebné množstvo), aby sa dosiahol konečný obsah vlhkosti 40 – 60 % maximálnej kapacity zadržiavania vody. Pôda je tým pripravená na vloženie do testovacích nádob. Je potrebné dbať na to, že niektoré rozpúšťadlá môžu byť toxické pre dážďovky.
|
Testovaná chemikália rozpustná vo vode a v organických rozpúšťadlách
|
21.
|
Pripraví sa zmes zložená z 10 g jemne drveného priemyselného kremenného piesku a testovanej chemikálie v množstve potrebnom na dosiahnutie testovanej koncentrácie v pôde. Zmes sa potom dôkladne premieša s predvlhčenou umelo pripravenou pôdou. Potom sa pridá a zamieša deionizovaná voda (potrebné množstvo), aby sa dosiahol konečný obsah vlhkosti 40 – 60 % maximálnej kapacity zadržiavania vody. Pôda je tým pripravená na vloženie do testovacích nádob.
|
Aplikácia testovanej chemikálie na povrch pôdy
|
22.
|
Testovaná chemikália sa aplikuje do pôdy až po vložení červov. Testovacie nádoby sa najskôr naplnia navlhčeným pôdnym substrátom a na povrch sa uložia odvážené červy. Zdravé červy sa spravidla okamžite zahrabú do substrátu a následne sa všetky, ktoré zostanú na povrchu aj po 15 minútach, označia za poškodené a musia sa vymeniť. Ak sa červy vymenia, tie nové aj tie nahradené by sa mali odvážiť, aby bola známa celková živá hmotnosť skupiny červov vystavených pôsobeniu chemikálie a celková hmotnosť nádoby s červami na začiatku testu.
|
|
23.
|
Aplikuje sa testovaná chemikália. Nemala by sa pridávať do pôdy skôr ako pol hodiny po vložení červov (alebo kým sa červy nachádzajú na povrchu pôdy), aby sa tak predišlo akejkoľvek priamej expozícii testovanej chemikálie pri styku s povrchom tela. Ak je testovanou chemikáliou pesticíd, môže byť vhodné aplikovať ho na povrch pôdy striekaním. Testovaná chemikália by sa mala aplikovať na povrch pôdy čo najrovnomernejšie použitím vhodného laboratórneho striekacieho zariadenia, aby sa simulovala aplikácia pri postreku na poli. Pred aplikáciou by sa malo odobrať veko testovacej nádoby a nahradiť vložkou, ktorá chráni bočné steny nádoby pred postrekom. Vložka sa môže vyrobiť z testovacej nádoby s odstráneným podstavcom. Aplikácia by sa mala vykonať pri teplote v rozsahu 20 °C ± 2 °C a v prípade vodných roztokov, emulzií alebo disperzií pri aplikačnej dávke vody 600 – 800 μl/m2. Veľkosť dávky by sa mala overiť pomocou vhodnej kalibračnej metódy. Osobitné prípravky ako granuly alebo moridlá osiva by sa mali používať spôsobom, ktorý je v súlade s poľnohospodárskym použitím.
|
|
24.
|
Testovacie nádoby by sa mali hodinu nechať odkryté, aby sa mohlo odpariť prchavé rozpúšťadlo použité pri aplikácii testovanej chemikálie. Treba dbať na to, aby žiadny červ v priebehu tohto času neunikol z testovacích nádob.
|
POSTUP
Testované skupiny a kontrolné vzorky
|
25.
|
Odporúča sa vložiť 10 dážďoviek do 500 – 600 g sušiny umelo pripravenej pôdy (t. j. 50 – 60 g pôdy na červa). Ak sa použijú väčšie množstvá pôdy, čo by mohol byť prípad testovania pesticídov s osobitnými spôsobmi aplikácie, napríklad pomocou moridla osiva, mal by sa pri vkladaní zachovať pomer 50 – 60 g pôdy na jedného červa, a to zvýšením počtu červov. Pre každú nádobu s kontrolnou vzorkou a so vzorkou s aplikovanou chemikáliou sa pripraví desať červov. Červy sa umyjú vodou, otrú a potom sa nakrátko uložia na absorpčný papier, čo umožní, aby odtiekla prebytočná voda.
|
|
26.
|
S cieľom predísť systematickým chybám v rozdelení červov do testovacích nádob by sa mala určiť homogenita testovanej populácie individuálnym vážením 20 červov náhodne vybratých z populácie, z ktorej sa majú vybrať testované červy. Po zabezpečení homogenity sa vyberú šarže červov, odvážia sa a metódou náhodného výberu sa zaradia do testovacích nádob. Po vložení testovacích červov by sa mala odmerať hmotnosť každej testovacej nádoby, aby sa zabezpečil údaj o počiatočnej hmotnosti, ktorý sa môže použiť ako základ na monitorovanie obsahu vlhkosti v pôde pomocou testu uvedeného v bode 30. Testovacie nádoby sa potom uzavrú, ako je opísané v bode 9, a uložia do testovacej komory.
|
|
27.
|
Pre každú z metód aplikácie testovanej chemikálie opísaných v bodoch 18 – 24 sa pripraví vhodná kontrolná vzorka. Pri príprave kontrolných vzoriek sa dodržiavajú príslušné uvedené postupy, s výnimkou toho, že sa nepridá testovaná chemikália. Preto ak je to potrebné, do kontrolných vzoriek sa pridávajú organické rozpúšťadlá, kremenný piesok alebo iné nosiče v koncentráciách/množstvách, ktoré sú v súlade s rovnakými parametrami používanými pri vzorkách s aplikovanou chemikáliou. Ak sa na pridávanie testovanej chemikálie používa rozpúšťadlo alebo iný nosič, mala by sa pripraviť a otestovať aj doplnková kontrolná vzorka bez nosiča alebo testovanej chemikálie, aby sa zabezpečilo, že nosič nemá vplyv na výsledok.
|
Podmienky testu
|
28.
|
Testovacia teplota je 20 °C ± 2 °C. Test sa vykonáva za kontrolovaných cyklov svetla a tmy (podľa možnosti 16 hodín svetla a 8 hodín tmy) s intenzitou osvetlenia 400 – 800 luxov v okolí testovacích nádob.
|
|
29.
|
Testovacie nádoby sa počas testu neprevzdušňujú, ale konštrukcia veka testovacej nádoby by mala umožniť výmenu plynov a zároveň obmedziť odparovanie vlhkosti (pozri bod 9).
|
|
30.
|
Obsah vody v pôdnom substráte v testovacích nádobách sa počas celého testu udržiava opakovaným vážením testovacích nádob (bez ich viek). Straty sa podľa potreby dopĺňajú deionizovanou vodou. Obsah vody by sa od začiatku testu nemal meniť o viac ako 10 %.
|
Kŕmenie
|
31.
|
Akákoľvek potrava, ktorá je vhodná prinajmenšom na udržanie hmotnosti červa počas testu, sa považuje za prijateľnú. Zo skúseností vyplynulo, že vhodnou potravou je ovsená múka, kravský alebo konský hnoj. Kontroly by mali zabezpečiť, že kravy alebo kone, od ktorých sa hnoj získava, nepodstupujú liečbu alebo ošetrovanie chemickými látkami, ako sú rastové stimulátory, nematicídy alebo podobné veterinárne produkty, ktoré by mohli mať počas testu nepriaznivý vplyv na červy. Odporúča sa kravský hnoj získaný z vlastných zdrojov, lebo zo skúseností vyplynulo, že komerčne dostupný kravský hnoj, používaný ako záhradné hnojivo, môže mať nepriaznivé účinky na červy. Hnoj by sa mal pred použitím vysušiť vzduchom, jemne zomlieť a pasterizovať.
|
|
32.
|
Každá čerstvá šarža potravy by sa pred použitím v rámci testu mala najskôr poskytnúť kultúre červov, ktorá sa na teste nepodieľa, aby sa zabezpečilo, že má dostatočnú kvalitu. Rast a produkcia kokónov by sa nemali znížiť v porovnaní s červami chovanými v substráte, ktorý neobsahuje potravu z novej šarže [podmienky, ako sú uvedené v testovacej metóde C.8 (4)].
|
|
33.
|
Potrava sa prvýkrát poskytne jeden deň po pridaní červov a aplikácii testovanej chemikálie do pôdy. Približne 5 g potravy sa rozloží na povrch pôdy v každej nádobe a zvlhčí deionizovanou vodou (približne 5 – 6 ml na nádobu). Potom sa potrava poskytuje raz týždenne počas 4 týždňov trvania testu. Ak potrava zostáva neskonzumovaná, dávka by sa mala znížiť, aby sa zabránilo rastu a vytváraniu plesní. V 28. deň testu sa dospelé jedince vyberú z pôdy. Do každej testovacej nádoby sa potom podá ďalších 5 gramov potravy. V priebehu zostávajúcich 4 týždňov testu už žiadne ďalšie kŕmenie neprebieha.
|
Výber testovaných koncentrácií
|
34.
|
Predchádzajúce poznatky o toxicite testovanej chemikálie by mali pomôcť pri výbere vhodných testovaných koncentrácií, napríklad z testu akútnej toxicity (4) a/alebo zo štúdií týkajúcich sa vyhľadávania rozsahu. V prípade potreby sa vykoná test na vyhľadávanie rozsahu, napríklad s piatimi testovanými koncentráciami: 0,1, 1,0, 10, 100 a 1 000 mg/kg (pôdnej sušiny). Na každú vzorku s aplikovanou chemikáliou a kontrolnú vzorku stačí jeden replikát. Test na vyhľadávanie rozsahu trvá dva týždne a na konci testu sa posudzuje mortalita.
|
Koncepcia experimentu
|
35.
|
Keďže testu nei je možné predpísať jediný súhrnný štatistický údaj, táto testovacia metóda umožňuje stanovenie hodnôt NOEC a ECx. Je pravdepodobné, že regulačné orgány budú v dohľadnej budúcnosti vyžadovať hodnotu koncentrácie NOEC. Je tiež možné, že v blízkej budúcnosti sa zavedie širšie využívanie hodnoty ECx, vyplývajúce zo štatistických a ekologických aspektov. Preto sa na základe odporúčaní vychádzajúcich z kruhového testu metódy testovania reprodukcie čeľade Enchytraeidae navrhujú tri koncepcie (17).
|
|
36.
|
Pri stanovení rozsahu koncentrácií je treba mať na zreteli:
|
—
|
na stanovenie hodnoty NOEC by sa malo testovať aspoň päť/dvanásť koncentrácií v geometrickej sérii. Odporúčajú sa štyri replikáty na každú testovanú koncentráciu a osem kontrolných vzoriek. Faktor rozstupu medzi hodnotami koncentrácie by nemal presahovať 2,0.
|
|
—
|
Na stanovenie hodnoty ECx (napr. EC10, EC50) sa odporúča testovať primeraný počet koncentrácií, ktoré vyvolajú aspoň štyri štatisticky významne odlišné stredné reakcie na tieto koncentrácie. Odporúčajú sa najmenej dva replikáty pre každú testovanú koncentráciu a šesť kontrolných replikátov. Faktor rozstupu sa môže meniť, t. j. môže mať hodnotu najviac 1,8 v očakávanom rozsahu účinkov a viac ako 1,8 pri vyšších a nižších koncentráciách.
|
|
—
|
Kombinovaný prístup umožňuje určenie obidvoch koncentrácií, NOEC aj ECx. Použiť by sa malo osem koncentrácií aplikovanej chemikálie v geometrickom rade. Odporúčajú sa štyri replikáty pre každú aplikáciu chemikálie a osem kontrolných vzoriek. Faktor rozstupu medzi hodnotami koncentrácie by nemal presahovať 1,8.
|
|
Trvanie testu a merania
|
37.
|
V 28. deň sa skontrolujú a spočítajú žijúce dospelé červy. Zaznamenať by sa mali aj zmeny v správaní (napr. neschopnosť zavŕtať sa do pôdy, ležanie bez pohybu) a v morfológii (napr. prítomnosť otvorených rán). Všetky dospelé červy sa potom vyberú z testovacích nádob, spočítajú a zvážia. Vyhľadávanie dospelých jedincov môže uľahčiť presun pôdy obsahujúcej červy na čistú podložku pred hodnotením. Červy vybraté z pôdy by sa mali pred vážením umyť (deionizovanou vodou) a prebytočná voda by sa mala odstrániť tak, že sa červy nakrátko umiestnia na filtračný papier. Červy, ktoré sa v danej chvíli nenájdu, sa zaznamenajú ako mŕtve, lebo je možné predpokladať, že takéto červy pred hodnotením uhynuli a rozložili sa.
|
|
38.
|
Ak bola pôda z nádob odstránená, následne sa vráti späť (bez dospelých červov, ale obsahujúca všetky kokóny, ktoré sa vyprodukovali). Pôda sa potom inkubuje ďalšie štyri týždne za tých istých podmienok testu, s výnimkou toho, že kŕmenie sa vykoná len raz na začiatku tejto fázy testu (pozri bod 33).
|
|
39.
|
Na konci druhého 4-týždňového obdobia sa postupmi opísanými v dodatku 5 stanoví počet juvenilných jedincov vyliahnutých z kokónov v testovacej pôde a počet kokónov. Počas celého testu by sa mali tiež zaznamenávať všetky príznaky zranenia alebo poškodenia červov.
|
Limitný test
|
40.
|
Ak sa v rámci testu na vyhľadávanie rozsahu nepozorujú žiadne účinky ani pri najvyššej koncentrácii (t. j. 1 000 mg/kg), reprodukčný test sa vykoná ako limitný test s použitím koncentrácie 1 000 mg/kg. Limitný test umožní preukázať, či je hodnota NOEC z hľadiska reprodukcie vyššia ako limitná koncentrácia, a zároveň sa minimalizuje počet červov použitých v rámci testu. Pre vzorky pôdy s aplikovanou chemikáliou aj pre kontrolné vzorky by sa malo použiť osem replikátov.
|
ÚDAJE A PODÁVANIE SPRÁV
Spracovanie výsledkov
|
41.
|
Hoci v dodatku 6 je uvedený prehľad, žiadne definitívne štatistické usmernenia na analýzu výsledkov testu táto testovacia metóda neposkytuje.
|
|
42.
|
Jedným z parametrov je mortalita. Preto by sa mali zaznamenať aj zmeny v správaní (napr. neschopnosť zavŕtať sa do pôdy, ležanie bez pohybu pri sklenej stene testovacej nádoby) a v morfológii (napr. prítomnosť otvorených rán) dospelých jedincov, ako aj existencia každého juvenilného jedinca. Na stanovenie koncentrácie LC50 by sa mala spravidla používať probitová analýza (18) alebo logaritmická regresia. V prípadoch, keď je táto metóda analýzy nevhodná (napr. ak sú k dispozícii menej ako tri koncentrácie čiastočne spôsobujúce usmrtenie), je však možné použiť alternatívne metódy. Tieto metódy môžu zahŕňať pohyblivé priemery (19), upravenú Spearman-Karberovu metódu (20) alebo jednoduchú interpoláciu (napr. geometrickú strednú hodnotu LC0 a LC100 vypočítanú ako súčin druhej odmocniny LC0 a hodnoty LC100).
|
|
43.
|
Ďalším parametrom je plodnosť (t. j. počet vyprodukovaných mladých jedincov). Pokiaľ však ide o test na vyhľadávanie rozsahu, všetky ostatné škodlivé príznaky by sa mali uviesť v záverečnej správe. Štatistická analýza si vyžaduje výpočet aritmetickej strednej hodnoty

a štandardnej odchýlky vo vzťahu k reprodukcii pre vzorky s aplikovanou chemikáliou a kontrolné vzorky. |
|
44.
|
Ak sa vykonáva analýza rozptylu, štandardnú odchýlku (s) a stupne voľnosti (df) môže nahradiť odhad výberového rozptylu získaný postupom ANOVA a stupne jeho voľnosti za predpokladu, že rozptyl nezávisí od koncentrácie. V tomto prípade sa použije jedna hodnota rozptylu pre kontrolné vzorky a pre vzorky s aplikovanou chemikáliou. Tieto hodnoty sa zvyčajne vypočítajú pomocou komerčného štatistického softvéru s využitím výsledkov pre jednotlivé nádoby ako replikátov. Ak sa spájanie údajov pre negatívne kontrolné vzorky a kontrolné vzorky s rozpúšťadlom zdá byť primeranejšie než porovnávanie s jednou z týchto skupín v rámci testu, malo by sa testovaním zistiť, či nie sú výrazne odlišné (vhodné testy sú uvedené v bode 47 a dodatku 6).
|
|
45.
|
Ďalšie štatistické testovanie a odvodzovanie závisí od toho, či majú hodnoty pre replikáty normálne rozdelenie a sú homogénne, pokiaľ ide o ich rozptyl.
|
Odhad koncentrácie NOEC
|
46.
|
Uprednostniť by sa malo použitie výkonných testov. Mali by sa využívať informácie napríklad z predchádzajúcich skúseností z medzilaboratórnych porovnávacích skúšok, prípadne iné historické údaje o tom, či sú údaje približne normálne rozdelené. Homogénnosť rozptylu (homoskedasticita) je kritickejšia. Zo skúseností vyplýva, že rozptyl sa často zvyšuje s rastúcou strednou hodnotou. V týchto prípadoch by transformácia údajov mohla viesť k homoskedasticite. Taká transformácia by však mala byť založená na skúsenostiach s historickými údajmi, a nie na údajoch, ktoré sú predmetom prešetrovania. S homogénnymi údajmi by sa mali vykonať viaceré t-testy, ako napríklad Williamsov test (α = 0,05, jednostranný) (21) (22), alebo v určitých prípadoch Dunnettov test (23) (24). Je potrebné si uvedomiť, že v prípade nerovnakej replikácie sa tabuľkové t-hodnoty musia upraviť tak, ako navrhujú Dunnett a Williams. Niekedy sa reakcie nezvyšujú/neznižujú pravidelne v dôsledku veľkých odchýlok. V prípade výraznej odchýlky od monotónnosti je Dunnettov test vhodnejší. Ak sa vyskytnú odchýlky od homoskedasticity, môže byť vhodné podrobnejšie preskúmať možné účinky na rozptyly s cieľom rozhodnúť, či sa t-testy môžu použiť bez výraznejšej straty výkonnosti (25). Alternatívne sa môžu použiť viacnásobné U-testy, napríklad Bonferroniho U-test podľa Holma (26), alebo v prípade, keď tieto údaje vykazujú heteroskedasticitu, ale inak sú v súlade so základným monotónnym priebehom krivky závislosti dávka-odpoveď, môže sa použiť iný neparametrický test [napr. Jonckheereho-Terpstrov (27) (28) alebo Shirleyho (29) (30)], pričom vo všeobecnosti sú tieto testy uprednostňované pred t-testami s nerovnakým rozptylom (pozri tiež náčrt v dodatku 6).
|
|
47.
|
Ak sa vykonáva limitný test a sú splnené podmienky postupov parametrického testu (normalita, homogenita), môže sa použiť Studentov párový t-test, v opačnom prípade Mannov-Whitneyho postup U-testu (31).
|
Odhad koncentrácie ECx
|
48.
|
Pri výpočte ktorejkoľvek hodnoty ECx sa na regresnú analýzu (lineárnu alebo nelineárnu) používajú stredné hodnoty pre jednotlivé vzorky s aplikovanou chemikáliou, a to po získaní vhodnej funkcie závislosti dávky a reakcie. Pre rast červov ako nepretržitú reakciu sa hodnoty ECx môžu odhadnúť použitím vhodnej regresnej analýzy (32). Medzi vhodné funkcie pre kvantálne údaje (mortalita/prežitie) a počet vyprodukovaných potomkov patria bežný sigmoid, logistická alebo Weibullova funkcia s dvomi až štyrmi parametrami, pričom niektoré z týchto funkcií môžu modelovať aj hormetické reakcie. Ak sa lineárnou regresnou analýzou určila funkcia závislosti dávky a reakcie, mal by sa pred odhadom hodnoty ECx nájsť regresnou analýzou významný koeficient determinácie (r2) a/alebo sklon zadaním hodnoty zodpovedajúcej x % strednej hodnoty pre kontrolnú vzorku do rovnice získanej regresnou analýzou. Hranice spoľahlivosti 95 % sa vypočítajú podľa Fiellera [citovaný v práci Finneyho (18)] alebo inými modernými vhodnými metódami.
|
|
49.
|
Alternatívne sa reakcia modeluje ako percentuálna časť alebo podiel modelového parametra, ktorý sa interpretuje ako stredná hodnota reakcie kontrolnej vzorky. V týchto prípadoch sa výsledky často môžu ľahko znázorniť normálnou (logistickou, Weibullovou) sigmoidnou krivkou s použitím postupu probitovej regresie (18). V týchto prípadoch sa váhová funkcia musí upraviť na metrické reakcie, ako uvádza Christensen (33). Ak sa však pozoruje horméza, probitovú analýzu by mala nahradiť logistická alebo Weibullova funkcia so štyrmi parametrami, určená postupom nelineárnej regresie (34). Ak z údajov nie je možné určiť vhodnú funkciu závislosti dávky a reakcie, môžu sa na odhad hodnoty ECx a jej hraníc spoľahlivosti použiť alternatívne metódy, ako sú pohyblivé priemery podľa Thompsona (19) a upravený Spearman-Karberov postup (20).
|
PROTOKOL O SKÚŠKE
|
50.
|
Protokol o skúške musí obsahovať tieto informácie:
|
|
Testovaná chemikália:
|
—
|
úplný opis testovanej chemikálie, číslo šarže, číslo dávky a číslo CAS, čistota,
|
|
—
|
vlastnosti testovanej chemikálie [napr. log Kow, rozpustnosť vo vode, tlak pary, Henryho konštanta (H) a informácie o jej osude a správaní].
|
|
|
|
Testované organizmy:
|
—
|
použité testované živočíchy: druh, vedecký názov, zdroj organizmov a podmienky chovu,
|
|
—
|
vek, veľkosť (hmotnosť) testovaných organizmov.
|
|
|
|
Podmienky testu
|
—
|
podrobnosti o príprave testovacej pôdy,
|
|
—
|
maximálna kapacita zadržiavania vody v pôde,
|
|
—
|
opis metódy, ktorá sa použila na aplikáciu testovanej chemikálie do pôdy,
|
|
—
|
údaje o pomocných chemikáliách použitých na podávanie testovanej chemikálie,
|
|
—
|
kalibračné údaje o rozstrekovacích zariadeniach, ak je to potrebné,
|
|
—
|
opis koncepcie experimentu a postupu,
|
|
—
|
veľkosť testovacích nádob a objem testovacej pôdy,
|
|
—
|
podmienky testu: intenzita svetla, trvanie cyklov svetla a tmy, teplota,
|
|
—
|
opis kŕmneho režimu, druh a množstvo potravy, ktorá sa používala v rámci testu, dátumy kŕmenia,
|
|
—
|
hodnoty pH a obsahu vody v pôde na začiatku a na konci testu.
|
|
|
|
Výsledky testu:
|
—
|
mortalita dospelých jedincov ( %) v každej testovacej nádobe na konci prvých 4 týždňov testu,
|
|
—
|
celková hmotnosť dospelých jedincov na začiatku testu v každej testovacej nádobe,
|
|
—
|
zmeny telesnej hmotnosti živých dospelých jedincov ( % počiatočnej hmotnosti) v každej testovacej nádobe po prvých štyroch týždňoch testu,
|
|
—
|
počet juvenilných jedincov vyprodukovaných v každej testovacej nádobe na konci testu,
|
|
—
|
opis zjavných alebo patologických príznakov alebo výrazných zmien v správaní,
|
|
—
|
výsledky získané s referenčnými vzorkami testovanej chemikálie,
|
|
—
|
hodnoty LC50, NOEC a/alebo ECx (napr. EC50, EC10) pre reprodukciu, ak sú niektoré z nich použiteľné, spolu s intervalmi spoľahlivosti a grafom, ktorý znázorňuje model ich výpočtu, ako aj všetky informácie a pozorovania, ktoré môžu byť nápomocné pri interpretácii výsledkov,
|
|
—
|
diagram vzťahu dávky a účinku,
|
|
—
|
výsledky uplatniteľné na každú testovaciu nádobu.
|
|
Uvedú sa odchýlky od postupov opísaných v tejto testovacej metóde a všetky nezvyčajné udalosti počas testu.
|
LITERATÚRA
|
1.
|
Jaenicke, J. (1982). ‚Eisenia foetida‘ is two biological species. Megadrilogica 4, 6-8.
|
|
2.
|
Oien, N. and J. Stenerson (1984). Esterases of earthworm – III. Electrophoresis reveals that Eisenia foetida (Savigny) is two species. Comp. Biochem. Physiol. 78c (2), 277 – 282.
|
|
3.
|
Kula, C. (1996). Development of a test method on sublethal effects of pesticides on the earthworm species Eisenia fetida/Eisenia andrei – comparison of two ringtests. In: Riepert, F., Kula, C. (1996): Development of laboratory methods for testing effects of chemicals and pesticides on collembola and earthworms. Mitt. Biol. Bundesamst. f. Land- Forstwirtsch. Berlin-Dahlem, 320, p. 50-82.
|
|
4.
|
Chapter C.8 of this Annex, Earthworm acute toxicity test.
|
|
5.
|
ISO (International Organization for Standardization) (1996). Soil Quality – Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction, No.11268-2. ISO, Geneve.
|
|
6.
|
ISO (International Organization for Standardization) (1993). Soil Quality – Effects of pollutants on earthworms (Eisenia fetida). Part 1: Determination of acute toxicity using artificial soil substrate, No.11268-1. ISO, Geneve.
|
|
7.
|
SETAC (1998). Advances in Earthworm Ecotoxicology. Sheppard, S.C., Bembridge, J.D., Holmstrup, M., and L. Posthuma, (eds). SETAC Press, 456 pp.
|
|
8.
|
EPA (1996). Ecological effects test guidelines. Earthworm Subchronic Toxicity Test (850.62.00). United States Environmental Protection Agency. Office of Prevention, Pesticides and Toxic Substances. EPA712-C-96-167, April 1996.
|
|
9.
|
Bouché, M.B. (1972). Lombriciens de France, Ecologie et systématique. Publication de l'Institut National de la Recherche Agronomique.
|
|
10.
|
Edwards, C.A. (1983). Development of a standardized laboratory method for assessing the toxicity of chemical substances to earthworms. Report EUR 8714 EN, Commission of European Communities.
|
|
11.
|
Greig-Smith, P.W., H. Becker, P.J. Edwards and F. Heimbach (eds.) (1992). Ecotoxicology of Earthworms. Intercept.
|
|
12.
|
Edwards, C.A. and J. P. Bohlen, (1996). Biology and ecology of Earthworms, 3rd Edition. Chapman and Hall, London.
|
|
13.
|
(ISO (International Organization for Standardization) (1994). Soil Quality – Determination of pH, No. 10390. ISO, Geneve.
|
|
14.
|
Hund-Rinke, K, Römbke, J., Riepert, F. & Achazi R. (2000): Beurteilung der Lebensraumfunktion von Böden mit Hilfe von Regenwurmtests. In: Toxikologische Beurteilung von Böden. Heiden, S., Erb, R., Dott, W. & Eisentraeger, A. (eds.). Spektrum Verl., Heidelberg. 59-81.
|
|
15.
|
ISO (International Organization for Standardization) (1992). Soil Quality –Determination of water retention characteristics –Laboratory methods, No. 11274. ISO, Geneve.
|
|
16.
|
ISO (International Organization for Standardization) (1993). Soil Quality –Determination of dry matter and water content on a mass basis – Gravimetric method, No. 11465. ISO, Geneve.
|
|
17.
|
Römbke, J. and Th. Moser (1999). Organisation and Performance of an International Ringtest for the validation of the Enchytraeid Reproduction Test. UBA-Texte 4/99, 150+ 223 pp.
|
|
18.
|
Finney, D.J. (1971). Probit Analysis (3rd ed.), pp. 19-76. Cambridge Univ. Press.
|
|
19.
|
Finney, D.J. (1978). Statistical Method in Biological Assay. – Charles Griffin & Company Ltd, London.
|
|
20.
|
Hamilton, M.A., R.C. Russo and R.V. Thurston. (1977). Trimmed Spearman-Karber Method for estimating median lethal concentrations in toxicity bioassays. Environ. Sci. Technol. 11(7), 714-719; Correction Environ. Sci. Technol. 12(1998), 417.
|
|
21.
|
Williams, D.A., (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27, 103-117.
|
|
22.
|
Williams, D.A., (1972). The comparison of several dose levels with a zero dose control. Biometrics 28, 519-531.
|
|
23.
|
Dunnett, C.W., (1955). A multiple comparison procedure for comparing several treatments with a control. Amer. Statist. Ass. J. 50, 1096-1121.
|
|
24.
|
Dunnett, C.W., (1964) New tables for multiple comparisons with a control. Biometrics 20, 482-491.
|
|
25.
|
Hoeven, N. van der, (1998). Power analysis for the NOEC: What is the probability of detecting small toxic effects on three different species using the appropriate standardized test protocols? Ecotoxicology 7: 355-361
|
|
26.
|
Holm, S., (1979): A simple sequentially rejective multiple test procedure. Scand. J. Statist. 6, 65-70.
|
|
27.
|
Jonckheere, A. R. (1954); A Distribution-free k-Sample Test Against Ordered Alternatives, Biometrika 41, 133-145.
|
|
28.
|
Terpstra, T. J. (1952); The Asymptotic Normality and Consistency of Kendall's Test Against Trend, When Ties are Present in One Ranking, Indagationes Math. 14, 327-333.
|
|
29.
|
Shirley, E. A. (1979); The comparison of treatment to control group means in toxicology studies, Applied Statistics 28, 144-151.
|
|
30.
|
Williams, D.A. (1986); A Note on Shirley's Nonparametric Test for Comparing Several Dose Levels with a Zero-Dose Control, Biometrics 42, 183-186.
|
|
31.
|
Sokal, R.R. and F.J. Rohlf. (1981). Biometry. The Principle and practice of statistics in biological research. 2nd edition. W.H. Freeman and Company. New York.
|
|
32.
|
Bruce R.D. and Versteeg D.J. (1992) A statistical procedure for modelling continuous toxicity data. Environmental Toxicology and Chemistry 11:1485-1494
|
|
33.
|
Christensen, E.R., (1984). Dose-response functions in aquatic toxicity testing and the Weibull model. Water Research 18, 213-221.
|
|
34.
|
Van Ewijk, P.H. and J.A. Hoekstra. (1993). Calculation of the EC50 and its confidence interval when sub-toxic stimulus is present. Ecotox, Environ. Safety. 25, 25-32.
|
Dodatok 1
Vymedzenie pojmov
Na účely tejto testovacej metódy sa používajú tieto vymedzenia pojmov:
|
|
Chemikália je látka alebo zmes.
|
|
|
ECx
(účinná koncentrácia x %) je koncentrácia, ktorá v rámci stanoveného času expozície vyvolá účinok x % na testované organizmy v porovnaní s kontrolnou vzorkou. Napríklad EC50 je koncentrácia, pri ktorej sa odhaduje, že v stanovenom čase expozície vyvolá účinok na výsledok testu pri 50 % exponovanej populácie. V rámci tohto testu sa účinné koncentrácie vyjadrujú ako hmotnosť testovanej chemikálie na suchú hmotnosť testovacej pôdy alebo ako hmotnosť testovanej chemikálie na jednotku plochy pôdy.
|
|
|
LC0
(nulová letálna koncentrácia) je koncentrácia testovanej chemikálie, ktorá v danom časovom úseku nespôsobí usmrtenie testovaných organizmov vystavených jej pôsobeniu. V rámci tohto testu sa LC0 vyjadruje ako hmotnosť testovanej chemikálie na suchú hmotnosť testovanej pôdy.
|
|
|
LC50
(stredná letálna koncentrácia) je koncentrácia testovanej chemikálie, ktorá v danom časovom úseku spôsobí usmrtenie 50 % testovaných organizmov vystavených jej pôsobeniu. V rámci tohto testu sa LC50 vyjadruje ako hmotnosť testovanej chemikálie na suchú hmotnosť testovacej pôdy alebo ako hmotnosť testovanej chemikálie na jednotku plochy pôdy.
|
|
|
LC100
(absolútna letálna koncentrácia) je koncentrácia testovanej chemikálie, ktorá v danom časovom úseku spôsobí usmrtenie 100 % testovaných organizmov vystavených jej pôsobeniu. V rámci tohto testu sa LC100 vyjadruje ako hmotnosť testovanej chemikálie na suchú hmotnosť testovanej pôdy.
|
|
|
LOEC (najnižšia koncentrácia s pozorovaným účinkom) je najnižšia koncentrácia testovanej chemikálie, ktorá má štatisticky významný účinok (p < 0,05). V rámci tohto testu sa LOEC vyjadruje ako hmotnosť testovanej chemikálie na suchú hmotnosť testovacej pôdy alebo ako hmotnosť testovanej chemikálie na jednotku plochy pôdy. Všetky testovacie koncentrácie vyššie ako LOEC by za normálnych okolností mali vyvolať účinok, ktorý je štatisticky odlišný od kontrolných vzoriek. Akékoľvek odchýlky od uvedeného musia byť odôvodnené v správe o teste.
|
|
|
NOEC (koncentrácia bez pozorovaného účinku) je najvyššia koncentrácia testovanej chemikálie, bezprostredne pod koncentráciou LOEC, pri ktorej sa nepozoruje žiadny účinok. V tomto teste koncentrácia zodpovedajúca hodnote NOEC nemá žiadny štatisticky významný účinok (p < 0,05) v rámci daného expozičného času v porovnaní s kontrolnou vzorkou.
|
|
|
Miera reprodukcie je stredná hodnota počtu narodených juvenilných červov na počet dospelých červov počas testu.
|
|
|
Testovaná chemikália je akákoľvek látka alebo zmes, ktorá sa testuje pomocou tejto testovacej metódy.
|
Dodatok 2
Stanovenie kapacity zadržiavania vody umelej pôdy
Táto metóda sa považuje za vhodnú. Opísaná je v prílohe C normy ISO DIS 11268-2.
Pomocou vhodného zariadenia (špirálová trubica atď.) sa odoberie určené množstvo (napr. 5 g) testovacieho pôdneho substrátu. Spodná časť trubice sa zakryje kúskom filtračného papiera a po naplnení vodou sa umiestni na stojan vo vodnom kúpeli. Trubica by sa mala postupne ponárať do vody, až kým vodná hladina nestúpne nad vrchnú vrstvu pôdy. Potom by sa mala nechať vo vode približne tri hodiny. Keďže nie všetka voda, ktorú absorbujú kapiláry pôdy, sa môže zachovať, vzorke pôdy by sa malo umožniť odvodnenie počas dvoch hodín tak, že sa trubica uloží na vrstvu veľmi mokrého jemne drveného kremenného piesku v uzavretej nádobe (aby sa zabránilo vysúšaniu). Vzorka by sa potom mala odvážiť a vysušiť na konštantnú hmotnosť pri teplote 105 °C. Kapacitu zadržiavania vody (WHC) je možné vypočítať takto:

kde:
|
S
|
=
|
vodou saturovaný substrát + hmotnosť trubice + hmotnosť filtračného papiera,
|
|
T
|
=
|
hmotnosť obalu (hmotnosť trubice + hmotnosť filtračného papiera),
|
|
D
|
=
|
suchá hmotnosť substrátu.
|
LITERATÚRA:
|
1.
|
ISO (International Organization for Standardization) (1996). Soil Quality -Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction, No. 11268-2. ISO, Geneve.
|
Dodatok 3
Stanovenie pH pôdy
Táto metóda stanovenia pH pôdy je založená na opise uvedenom v norme ISO DIS 10390: Kvalita pôdy – stanovenie pH (1).
Určené množstvo pôdy sa suší pri teplote miestnosti najmenej 12 hodín. Potom sa vytvorí suspenzia pôdy (obsahujúca najmenej 5 g pôdy) s päťnásobným objemom 1 M roztoku chloridu draselného (KCl) analytickej čistoty alebo 0,01 M roztoku chloridu vápenatého (CaCl2) analytickej čistoty. Suspenzia sa následne päť minút dôkladne pretrepáva a potom sa nechá stáť najmenej 2 hodiny, ale nie dlhšie ako 24 hodín. Hodnota pH kvapalnej fázy sa potom meria pH metrom, ktorý sa pred každým meraním kalibruje pomocou vhodnej série tlmivých roztokov (napr. s pH 4,0 a 7,0).
LITERATÚRA:
|
(1)
|
ISO (International Organization for Standardization) (1994). Soil Quality – Determination of pH, No. 10390. ISO, Geneve.
|
Dodatok 4
Kultivácia druhov Eisenia fetida/Eisenia andrei
Chov by mal prednostne prebiehať v klimatickej komore pri teplote 20 °C ± 2 °C. Pri tejto teplote a zabezpečení dostatku potravy červy dospejú približne po dvoch až troch mesiacoch.
Oba druhy je možné kultivovať v širokej škále živočíšnych odpadov. Odporúčané chovné médium je zmes konského alebo kravského hnoja a rašeliny v pomere 50: 50. Kontroly by mali zabezpečiť, že kravy alebo kone, od ktorých sa hnoj získava, nepodstupujú liečbu alebo ošetrovanie chemickými látkami, ako sú rastové stimulátory, nematicídy alebo podobné veterinárne produkty, ktoré by mohli mať počas testu nepriaznivý vplyv na červy. Odporúča sa hnoj získaný z ‚organických‘ zdrojov, lebo zo skúseností vyplynulo, že komerčne dostupný hnoj, používaný ako záhradné hnojivo, môže mať nepriaznivé účinky na červy. Médium by malo mať hodnotu pH približne 6 – 7 (upravenú pomocou uhličitanu vápenatého), nízku iónovú vodivosť (menej ako 6 mS/cm alebo 0,5 % koncentrácie soli) a nemalo by byť nadmerne kontaminované amoniakom alebo živočíšnym močom. Substrát by mal byť vlhký, ale nie príliš mokrý. Vhodné sú chovné nádoby s objemom 10 – 50 litrov.
Na získanie červov štandardného veku a veľkosti (hmotnosti) je najlepšie začať kultiváciou kokónov. Kultúra sa po vytvorení udržiava umiestnením dospelých červov do chovnej nádoby s čerstvým substrátom na 14 až 28 dní s cieľom umožniť produkciu ďalších kokónov. Dospelé jedince sa potom premiestnia a juvenilné jedince vyliahnuté z kokónov sa použijú ako základ pre ďalšiu kultúru. Červy sa kŕmia nepretržite živočíšnym odpadom a z času na čas sa presúvajú do čerstvého substrátu. Zo skúseností vyplynulo, že vhodnou potravou je vzduchom sušený, jemne mletý kravský alebo konský hnoj alebo ovsená múka. Je potrebné zabezpečiť, aby kravy alebo kone, od ktorých sa hnoj získava, neboli liečené chemickými látkami, ako sú rastové stimulátory, ktoré by mohli mať negatívny vplyv na červy počas dlhodobej kultivácie. Červy vyliahnuté z kokónov sa používajú na testovanie, keď majú 2 – 12 mesiacov a považujú sa za dospelé jedince.
Červy je možné považovať za zdravé, ak sa pohybujú v substráte, nesnažia sa opustiť substrát a priebežne sa rozmnožujú. Vyčerpanie substrátu sa prejavuje tým, že červy sa pohybujú veľmi pomaly a zadnú časť tela majú žltú. V tomto prípade sa odporúča zabezpečiť čerstvý substrát a/alebo znížiť hustotu chovu.
Dodatok 5
Techniky na počítanie juvenilných červov vyliahnutých z kokónov
Ručné triedenie červov v pôdnom substráte je veľmi časovo náročné. Preto sa odporúčajú dve alternatívne metódy:
|
a)
|
Testovacie nádoby sa umiestnia do vodného kúpeľa s počiatočnou teplotou 40 °C, ktorá sa však zvýši na 60 °C. Po približne 20 minútach by sa na povrchu pôdy mali objaviť juvenilné červy, odkiaľ je možné ich ľahko vybrať a spočítať.
|
|
b)
|
Testovacia pôda sa môže premyť cez sito pomocou metódy, ktorú vypracovali van Gestel a kol. (1), za predpokladu, že rašelina a hnoj alebo ovsená múka, pridávané do pôdy, boli pomleté na jemný prášok. Dve sitá s veľkosťou ôk 0,5 mm (priemer 30 cm) sa uložia na seba. Obsah skúšobnej nádoby sa premyje cez sitá silným prúdom vody z vodovodu, pričom juvenilné červy a kokóny sa zachytia prevažne na vrchnom site. Je dôležité si uvedomiť, že celý povrch vrchného sita by mal počas tejto operácie zostať mokrý, aby sa mladé červy vznášali na vrstve vody, a tak sa im zabránilo v preliezaní okami sita. Najlepšie výsledky sa dosahujú, ak sa používa sprchová hlavica.
|
Keď sa všetok pôdny substrát premyje cez sitá, juvenilné jedince a kokóny sa môžu spláchnuť z vrchného sita do misy. Obsah misy sa potom nechá odstáť, pričom prázdne kokóny vyplávajú na hladinu vody a plné kokóny a mladé červy sa potopia na dno. Odstáta voda sa potom môže vyliať a mladé červy a kokóny sa presunú do Petriho misky s malým množstvom vody. Červy je možné povyberať na počítanie pomocou ihly alebo pinzety.
Zo skúseností vyplynulo, že metóda a) je vhodnejšia na vyberanie juvenilných červov, ktoré sa môžu spláchnuť aj cez sito s veľkosťou ôk 0,5 mm.
Zakaždým by sa mala stanoviť účinnosť metódy použitej na vyberanie červov (a prípadne kokónov) z pôdneho substrátu. Ak sa juvenilné jedince vyberajú technikou ručného triedenia, odporúča sa vykonať túto operáciu dvakrát na všetkých vzorkách.
LITERATÚRA:
|
(1)
|
Van Gestel, C.A.M., W.A. van Dis, E.M. van Breemen, P.M. Sparenburg (1988). Comparison of two methods determining the viability of cocoons produced in earthworm toxicity experiments. Pedobiologia 32:367-371.
|
Dodatok 6
Prehľad štatistického posúdenia údajov (stanovenie hodnoty NOEC)

C.34. STANOVENIE INHIBÍCIE ČINNOSTI ANAERÓBNYCH BAKTÉRIÍ – ZNÍŽENIE PRODUKCIE PLYNU Z ANAERÓBNE VYHNÍVAJÚCEHO (ČISTIARENSKÉHO) KALU
ÚVOD
|
1.
|
Táto testovacia metóda je rovnocenná s usmernením OECD na vykonávanie testov (TG) 224 (2007). Chemikálie vypúšťané do vodného prostredia prechádzajú aeróbnymi aj anaeróbnymi zónami, kde môžu degradovať a/alebo inhibovať činnosť baktérií. V niektorých prípadoch môžu nerušene zostať v anaeróbnych zónach celé desaťročia alebo aj dlhšie. Pri čistení odpadových vôd je prvá fáza – primárne usadzovanie – v kvapalnom supernatante aeróbne a v kalovom subnatante anaeróbne. Ďalej sa v druhej fáze aeróbna zóna nachádza v aktivovanom kale v prevzdušňovacej nádrži a anaeróbna zóna v kalovom subnatante v sekundárnej usadzovacej nádrži. Kal z obidvoch týchto fáz zvyčajne prechádza anaeróbnou úpravou, pričom vzniká metán a oxid uhličitý, ktoré sa spravidla používajú na výrobu elektrickej energie. V širšom prostredí chemikálie prenikajúce do sedimentov v zálivoch, ústiach riek a v mori pravdepodobne zostanú v týchto anaeróbnych zónach natrvalo, ak nie sú biodegradovateľné. Určité chemikálie preniknú do týchto zón vo väčšom množstve najmä vďaka svojim fyzikálnym vlastnostiam, ako je nízka rozpustnosť vo vode, vysoká adsorpcia na suspendované tuhé látky, ako aj neschopnosť aeróbnej biodegradácie.
|
|
2.
|
Je žiaduce, aby chemické látky vypúšťané do životného prostredia boli biodegradovateľné v aeróbnych aj anaeróbnych podmienkach, zároveň je však potrebné, aby takéto chemikálie neinhibovali činnosť mikroorganizmov v žiadnej z uvedených zón. V Spojenom kráľovstve sa vyskytlo niekoľko prípadov úplnej inhibície tvorby metánu, spôsobenej napríklad pentachlórfenolom vo vypúšťaných priemyselných odpadových vodách, čo viedlo k veľmi nákladnej preprave inhibovaného kalu z vyhnívacích nádrží na ‚bezpečné‘ skládky a dovozu zdravo vyhnívajúceho kalu zo susedných zariadení. Vyskytli sa však mnohé prípady menej závažného narušenia vyhnívania viacerými ďalšími chemikáliami vrátane alifatických halogénovaných uhľovodíkov (chemické čistenie) a detergentov, čo viedlo k výraznému zníženiu účinnosti vyhnívacej nádrže.
|
|
3.
|
Iba jedna testovacia metóda, C.11 (1), sa zaoberá inhibíciou činnosti baktérií (respirácia aktivovaného kalu), keď posudzuje účinok testovanej látky na mieru spotreby kyslíka v prítomnosti substrátu. Metóda sa vo veľkej miere využíva na včasné varovanie pred možnými škodlivými účinkami chemikálií na aeróbnu úpravu odpadových vôd, ako aj pri určovaní neinhibičných koncentrácií testovaných chemikálií, ktoré sa majú používať v rôznych testoch biodegradovateľnosti. Testovacia metóda C.43 (2) poskytuje obmedzené možnosti na stanovenie toxicity testovanej chemikálie pre produkciu plynu v anaeróbnom kale, zriedenom na jednu desatinu bežnej koncentrácie tuhých látok s cieľom umožniť požadovanú presnosť pri posudzovaní percentuálnej hodnoty biodegradácie. Keďže zriedený kal by mohol byť citlivejší na inhibičné chemikálie, skupina ISO sa rozhodla vypracovať metódu, pri ktorej sa používa nezriedený kal. Preskúmali sa najmenej tri texty (z Dánska, Nemecka a Spojeného kráľovstva) a nakoniec boli vypracované dve normy ISO, jedna s použitím nezriedeného kalu – ISO 13 641-1 (3) a druhá s použitím kalu zriedeného na jednu stotinu – ISO 13 641-2 (4), ktoré predstavujú kaly a sedimenty s malým množstvom bakteriálnych kultúr. Obe metódy boli podrobené medzilaboratórnej porovnávacej skúške (5): časť 1 bola potvrdená ako prijateľná norma, no časť 2 vyvolala nesúhlas. Zástupcovia Spojeného kráľovstva sa domnievali, že metóda si vyžaduje ďalšie preskúmanie, keďže veľká časť účastníkov uvádzala veľmi nízku alebo žiadnu produkciu plynu, čiastočne z toho dôvodu, že podiel priestoru pre plyn bol príliš vysoký (75 %) na optimálnu citlivosť.
|
|
4.
|
V starších prácach uverejnených v Spojenom kráľovstve (6) (7) bola opísaná manometrická metóda, pri ktorej sa používal nezriedený vyhnívajúci kal a surový čistiarenský kal ako substrát v 500 ml bankách. Zariadenie bolo neskladné a zápach surového kalu nepríjemný. Neskôr Wilson a kol. (10) úspešne používali kompaktnejšie a vhodnejšie prístroje Sheltona a Tiedjeho (8), ktoré zdokonalili Battersby a Wilson (9). Kawahara a kol. (11) v laboratóriu úspešne pripravili štandardnejšie kaly na použitie v rámci testov anaeróbnej biodegradovateľnosti a inhibície pre množstvo chemikálií. Okrem toho bol surový kal ako substrát nahradený a test sa vykonáva s použitím anaeróbneho kalu zriedeného na jednu stotinu alebo s kalmi, sedimentmi atď. s malou bakteriálnou činnosťou.
|
|
5.
|
Táto metóda môže poskytnúť informácie, ktoré sú užitočné pri predpovedaní pravdepodobného účinku testovanej chemikálie na produkciu plynu v anaeróbnych vyhnívacích nádržiach. Iba dlhšie testy, ktoré dôslednejšie simulujú fungujúce vyhnívacie nádrže, však môžu ukázať, či môže dôjsť k adaptácii mikroorganizmov na testovanú chemikáliu, alebo či chemikálie, ktoré pravdepodobne kal absorbuje alebo adsorbuje, môžu vytvoriť toxickú koncentráciu na dlhšie obdobie, než umožňuje tento test.
|
PRINCÍP TESTU
|
6.
|
Alikvotné časti zmesi anaeróbne vyhnívajúceho kalu (20 – 40 g/l celkových tuhých látok) a degradovateľného substrátového roztoku sa inkubujú samostatne a súčasne s rôznymi koncentráciami testovanej chemikálie v utesnených nádobách najviac tri dni. Množstvo vyprodukovaného plynu (metán a oxid uhličitý) sa zisťuje meraním nárastu tlaku (v Pa) vo fľašiach. Percentuálna hodnota inhibície produkcie plynu v dôsledku rôznych koncentrácií testovanej chemikálie sa vypočíta na základe množstiev vyprodukovaných v príslušných testovacích a kontrolných fľašiach. Hodnota EC50 a iné účinné koncentrácie sa vypočítajú z diagramov závislosti percentuálnej inhibície od koncentrácie testovaných chemikálií, alebo, čo je zvyčajnejšie, jej logaritmu.
|
INFORMÁCIE O TESTOVANEJ CHEMIKÁLII
|
7.
|
Testované chemikálie by sa mali spravidla používať v najčistejšej bežne dostupnej forme, keďže nečistoty v niektorých chemikáliách, napríklad v chlórfenoloch, môžu byť oveľa toxickejšie než samotná testovaná chemikália. Je však potrebné tiež zvážiť potrebu, aby sa chemikálie testovali vo forme, v ktorej sa vyrábajú/komerčne sprístupňujú. Použitie pripravených výrobkov sa bežne neodporúča, ale v prípade slabo rozpustných testovaných látok môže byť použitie pripraveného materiálu vhodné. Vlastnosti testovanej chemikálie, ktoré by mali byť k dispozícii, zahŕňajú rozpustnosť vo vode a v niektorých organických rozpúšťadlách, tlak pary, adsorpčný koeficient, hydrolýzu a biodegradovateľnosť v anaeróbnych podmienkach.
|
POUŽITEĽNOSŤ METÓDY
|
8.
|
Tento test je možné použiť na chemikálie, ktoré sú rozpustné alebo nerozpustné vo vode vrátane prchavých chemikálií. Osobitnú pozornosť je však potrebné venovať materiálom s nízkou rozpustnosťou vo vode [pozri literatúru (12)] a vysokou prchavosťou. Použiť sa môžu aj inokulá z anaeróbnych miest, ako sú napríklad kaly, nasýtené pôdy, sedimenty. Anaeróbne bakteriálne systémy, ktoré už boli vystavené pôsobeniu toxických chemikálií, môžu byť prispôsobené na zachovanie svojej činnosti v prítomnosti xenobiotických chemikálií. Inokulá z prispôsobených bakteriálnych systémov môžu prejavovať vyššiu toleranciu voči testovaným chemikáliám v porovnaní s inokulami získanými z neprispôsobených systémov.
|
REFERENČNÉ CHEMIKÁLIE
|
9.
|
S cieľom kontrolovať postup sa testuje referenčná chemikália vo vhodných nádobách, paralelne, ako súčasť bežného testu. Ako konzistentný inhibítor produkcie anaeróbneho plynu, ako aj spotreby kyslíka aktivovaným kalom a iných biochemických reakcií sa ukázal 3,5-dichlórfenol. Dve ďalšie chemikálie sa ukázali byť viac inhibujúce vo vzťahu k metánu než 3,5-dichlórfenol, konkrétne metylén bis(tiokyanát) a pentachlórfenol, ale výsledky s nimi neboli validované. Pentachlórfenol sa neodporúča, lebo nie je ľahko dostupný v čistej forme.
|
REPRODUKOVATEĽNOSŤ VÝSLEDKOV
|
10.
|
V medzinárodnej porovnávacej skúške (5) sa medzi desiatimi zúčastnenými laboratóriami ukázala ako dostatočná iba reprodukovateľnosť hodnôt EC50 pre 3,5-dichlórfenol a kyselinu 2-brómetán-sulfónovú. (Rozsah pre 3,5-dichlórfenol bol 32 – 502 mg/l a pre kyselinu 2-brómetán-sulfónovú 220 – 2 190 mg/l).
|
Počet laboratórií
|
mg/l
|
mg/g kalu
|
|
stredná hodnota
|
s.d.
|
cv(%)
|
stredná hodnota
|
s.d.
|
cv(%)
|
|
|
3,5-dichlórfenol
|
|
10
|
153
|
158
|
103
|
5
|
4,6
|
92
|
|
|
kyselina 2-brómetán-sulfónová
|
|
10
|
1 058
|
896
|
85
|
34
|
26
|
76
|
|
Údaje EC50 z medzilaboratórnej porovnávacej skúšky – neriedený kal
|
11.
|
Vysoké variačné koeficienty medzi laboratóriami do veľkej miery odrážajú rozdiely v citlivosti mikroorganizmov v kale spôsobené skutočnosťou, že v minulosti buď boli vystavené, alebo neboli vystavené pôsobeniu testovanej chemikálie alebo iných chemicky príbuzných chemikálií. Presnosť, s akou sa stanovila hodnota EC50 na základe koncentrácie kalu, bola sotva vyššia než v prípade hodnoty stanovenej na základe objemu (mg/l). Tri laboratóriá, ktoré uviedli presnosť svojich hodnôt EC50 pre 3,5-dichlórfenol, vykázali oveľa nižšie variačné koeficienty (22, 9 a 18 % pre EC50 v mg/g), než boli variačné koeficienty stredných hodnôt všetkých desiatich laboratórií. Jednotlivé stredné hodnoty pre tri laboratóriá boli 3,1, 3,2 a 2,8 mg/g. Nižšie, prijateľné variačné koeficienty v rámci jednotlivých laboratórií v porovnaní s oveľa vyššími koeficientmi medzi rôznymi laboratóriami, t. j. 9 – 22 %, resp. 92 %, naznačujú, že existujú výrazné rozdiely vo vlastnostiach jednotlivých kalov.
|
OPIS METÓDY
Zariadenie
|
12.
|
Potrebné je bežné laboratórne vybavenie a tieto zariadenia:
|
a)
|
inkubátor – odolný proti iskrám a s udržiavanou teplotou 35 °C ± 2 °C;
|
|
b)
|
tlaku odolné sklené testovacie nádoby primeraných menovitých rozmerov (17), z ktorých každá je vybavená plynotesnými poťahovanými priehradkami, schopnými odolávať tlaku približne 2 bary alebo 2 × 105 Pa (ako poťah sa používa napríklad PTFE = polytetrafluóretylén). Odporúčajú sa sklené fľaše na sérum s menovitým objemom 125 ml, so skutočným objemom približne 160 ml, utesnené sérovou priehradkou (18) a drážkovanými hliníkovými prstencami. Vhodné sú však aj fľaše s celkovým objemom 0,1 – 1 liter;
|
|
c)
|
presný tlakomer (19) a ihlový nástavec;
celková produkcia plynu (metán a oxid uhličitý) sa meria pomocou tlakomera prispôsobeného na meranie a odvádzanie vyprodukovaného plynu. Príkladom vhodného prístroja je ručný presný tlakomer s pripojenou injekčnou ihlou a trojcestným plynotesným ventilom, ktorý umožňuje uvoľnenie nadmerného tlaku (dodatok 1). Vnútorný objem rúrky a ventilu snímača tlaku by mal byť čo najmenší, aby boli chyby, ktoré vznikajú zanedbaním objemu zariadenia, zanedbateľné;
|
|
d)
|
izolované nádoby na prepravu vyhnívajúceho kalu;
|
|
e)
|
trojcestné tlakové ventily;
|
|
f)
|
sito so štvorcovými okami so stranou 1 mm;
|
|
g)
|
zásobník na vyhnívajúci kal – fľaša zo skla alebo z polyetylénu s vysokou hustotou, s objemom približne 5 litrov, vybavená miešadlom a zariadením na prúdenie plynného dusíka (pozri bod 13) cez voľný priestor nad kalom;
|
|
h)
|
membránové filtre (0,2 μm) na sterilizáciu substrátu;
|
|
i)
|
mikrostriekačky na plynotesné pripojenie snímača tlaku [pozri bod 12 c)] k voľnému priestoru vo fľašiach [pozri bod 12 b)] a tiež na pridávanie nerozpustných kvapalných testovacích materiálov do fliaš;
|
|
j)
|
odkladacia schránka, nepovinná, ale odporúčaná, s mierne pozitívnym tlakom dusíka.
|
|
Reagenty
|
13.
|
Používajú sa výlučne reagenty analytickej čistoty. Vždy by sa mal používať plynný dusík vysokej čistoty s obsahom menej ako 5 μl/l kyslíka.
|
Voda
|
14.
|
Ak je v ktoromkoľvek štádiu potrebné zriedenie, používa sa deionizovaná, vopred odvzdušnená voda. Analytické kontroly tejto vody nie sú potrebné, ale treba zabezpečiť, aby sa pravidelne vykonávala údržba deionizačného prístroja. Deionizovaná voda sa používa aj na prípravu zásobných roztokov. Pred pridaním anaeróbneho inokula do akéhokoľvek roztoku alebo pred zriedením testovaného materiálu je potrebné sa ubezpečiť, že neobsahujú kyslík. To sa vykoná buď vháňaním plynného dusíka do vody (alebo do roztokov) počas 1 hodiny pred pridaním inokula, alebo prípadne zahriatím vody na teplotu varu a ochladením na teplotu miestnosti v atmosfére bez obsahu kyslíka.
|
Vyhnívajúci kal
|
15.
|
Vyhnívajúci kal sa aktívne zbiera z vyhnívacích nádrží v čistiarňach odpadových vôd, alebo alternatívne z laboratórnych vyhnívacích nádrží, kde sa spracováva kal prevažne z odpadových vôd z domácností. Praktické informácie týkajúce sa kalu z laboratórnych vyhnívacích nádrží je možné nájsť v literatúre pod číslom (11). Ak sa má používať upravené inokulum, je možné uvažovať o vyhnívajúcom kale z čistiarní priemyselných odpadových vôd. Na zbieranie kalu by sa mali používať fľaše so širokým hrdlom vyrobené z polyetylénu s vysokou hustotou alebo podobného materiálu, ktorý môže expandovať. Kal sa naloží do fliaš na vzorky až do výšky 1 cm od vrchu fľaše, fľaše sa pevne uzavrú, najlepšie bezpečnostným ventilom [bod 12 písm. e)], a uložia sa do izolovaných nádob [bod 12 písm. d)], aby sa minimalizoval teplotný šok, až kým sa nepremiestnia do inkubátora s udržiavanou teplotou 35 °C ± 2 °C. Pri otváraní fliaš je potrebné zabezpečiť uvoľnenie nadmerného tlaku plynu buď opatrným otvorením uzáveru, alebo pomocou trojcestného ventilu na uvoľňovanie tlaku [bod 12 písm. e)]. Kal by sa mal prednostne použiť do niekoľkých hodín od odberu, inak je potrebné ho uskladniť pri teplote 35 °C ± 2 °C pod vrstvou dusíka najviac na tri dni, kým spravidla dochádza k malým stratám činnosti.
Upozornenie – Vyhnívajúci kal vytvára horľavé plyny, ktoré predstavujú riziko vzniku požiaru a výbuchu a obsahuje aj potenciálne patogénne organizmy. Preto je potrebné pri manipulácii s kalom prijať primerané opatrenia. Z bezpečnostných dôvodov sa na zber kalu nepoužívajú sklené nádoby.
|
Inokulum
|
16.
|
Bezprostredne pred použitím sa kal jemne premieša a preleje cez sito s rozmermi ôk 1 mm2 [bod 12 písm. f)] do vhodnej fľaše [bod 12 písm. g)] cez priestor, ktorým prechádza prúd dusíka. Vytvorí sa vzorka na meranie koncentrácie celkovej sušiny [pozri napríklad normu ISO 11 923 (13) alebo rovnocennú normu EÚ]. Vo všeobecnosti sa kal používa bez riedenia. Koncentrácia tuhých látok je zvyčajne 2 – 4 hm. %. Skontrolujú sa hodnoty pH kalu a v prípade potreby sa upravia na hodnotu 7 ± 0,5.
|
Testovací substrát
|
17.
|
V deionizovanej vode sa rozpustí 10 g živín (napr. Oxoid), 10 g kvasnicového extraktu a 10 g D-glukózy a zriedi sa na 100 ml. Substrát sa sterilizuje filtráciou cez membránový filter 0,2 μm [bod 12 písm. h)] a okamžite sa použije, alebo sa uskladní pri teplote 4 °C najviac na jeden deň.
|
Testovaná chemikália
|
18.
|
Pripraví sa samostatný zásobný roztok pre každú testovanú chemikáliu rozpustnú vo vode, ktorý obsahuje napríklad 10 g/l chemikálie vo vode bez kyslíka (bod 14). Vhodné objemy týchto zásobných roztokov sa použijú pri príprave reakčných zmesí obsahujúcich odstupňované koncentrácie. Alternatívne sa pripraví séria zriedení každého zásobného roztoku tak, aby bol objem pridaný do testovacích fliaš rovnaký pre každú požadovanú konečnú koncentráciu. Hodnota pH zásobných roztokov by sa mala v prípade potreby upraviť na 7 ± 0,2.
|
|
19.
|
Informácie týkajúce sa testovaných chemikálií, ktoré sú nedostatočne rozpustné vo vode, sú uvedené v norme ISO 10 634 (12) alebo rovnocennej norme EÚ. Ak je potrebné použiť organické rozpúšťadlo, treba sa vyhnúť rozpúšťadlám, ako je chloroform a chlorid uhličitý, ktoré sú známe ako silné inhibítory produkcie metánu. Pripraví sa roztok príslušnej koncentrácie chemikálie nerozpustnej vo vode vo vhodnom prchavom rozpúšťadle, napríklad v acetóne alebo dietyléteri. Do prázdnych testovacích fliaš sa nalejú potrebné objemy roztoku s rozpúšťadlom [bod 12 písm. b)] a pred pridaním kalu sa rozpúšťadlo odparí. V prípade iných foriem aplikácie chemikálie sa treba riadiť normou ISO 10 634 (12) alebo rovnocennou normou EÚ, ale je potrebné si uvedomiť, že všetky povrchovo aktívne látky používané na prípravu emulzií môžu byť inhibítormi anaeróbnej produkcie plynu. Ak sa predpokladá, že prítomnosť organických rozpúšťadiel a emulgačných činidiel spôsobuje vznik artefaktov, testovanú chemikáliu je možné pridať priamo do testovacej zmesi vo forme prášku alebo tekutiny. Prchavé chemikálie a vo vode nerozpustné kvapalné testované chemikálie sa môžu vstreknúť do sérových fliaš s inokulom mikrostriekačkou [bod 12 písm. i)].
|
|
20.
|
Testované chemikálie sa pridávajú do fliaš tak, aby vznikol geometrický rad koncentrácií, napríklad 500 mg/l, 250 mg/l, 125 mg/l, 62,5 mg/l, 31,2 mg/l a 15,6 mg/l. Ak rozsah toxicity nie je známy z údajov o podobných látkach, najskôr sa vykoná predbežná skúška na vyhľadávanie rozsahu s koncentráciou 1 000 mg/l, 100 mg/l a 10 mg/l s cieľom stanoviť primeraný rozsah.
|
Referenčná chemikália
|
21.
|
Vodný roztok 3,5-dichlórfenolu (10 g/l) sa pripraví postupným pridávaním minimálneho množstva 5 mol/l roztoku hydroxidu sodného k pevnej látke a pretrepávaním až do rozpustenia. Potom sa riedi odkysličenou vodou (bod 14) až do požadovaného objemu, pričom rozpúšťaniu môže pomôcť použitie ultrazvuku. Použiť sa môžu aj iné referenčné chemikálie, ak sa dosiahol priemerný rozsah koncentrácie EC50 v rámci najmenej troch testov s rôznymi inokulami (rôzne zdroje alebo rôzne časy odberu).
|
INTERFERENCIA/CHYBY
|
22.
|
Niektoré zložky kalov by pravdepodobne mohli reagovať s potenciálnymi inhibítormi a zabrániť ich prístupu k mikroorganizom, a tým znížiť alebo znemožniť inhibíciu. Aj v prípade, že kal už obsahuje chemikáliu, ktorá je inhibičná, môže sa dospieť k chybným výsledkom, ak bola daná chemikália podrobená testu. Okrem uvedených možností existuje viacero identifikovaných faktorov, ktoré môžu viesť k nesprávnym výsledkom. Tie sú uvedené v dodatku 3 spolu s metódami eliminovania alebo aspoň zredukovania chýb.
|
POSTUP SKÚŠKY
|
23.
|
Počet potrebných replikátov závisí od stupňa presnosti požadovaného pre indexy inhibície. Ak sú uzávery fliaš počas trvania testu dostatočne plynotesné, pripraví sa len jedna séria (najmenej troch) testovacích fliaš na každú požadovanú koncentráciu. Podobne sa pripraví len jedna séria fliaš s referenčnou chemikáliou a jeden súbor kontrolných vzoriek. Ak je však tesnosť uzáverov fliaš spoľahlivá iba pre jedno alebo niekoľko prepichnutí, je potrebné pripraviť sériu (napr. troch) testovacích fliaš pre každý interval (t), pre ktorý sa požadujú výsledky pre všetky koncentrácie testovanej chemikálie, ktoré sa majú testovať. Podobne sa pripravia série ‚t‘ fliaš pre referenčné chemikálie a pre kontrolné vzorky.
|
|
24.
|
Odporúča sa používať odkladaciu schránku [bod 12 písm. j)]. Najmenej 30 minút pred začiatkom testu treba spustiť prietok plynného dusíka cez odkladaciu schránku obsahujúcu celé potrebné vybavenie. Je potrebné zabezpečiť, aby počas manipulácie s fľašami a ich uzatváraní teplota kalu dosahovala hodnotu 35 °C ± 2 °C.
|
Predbežná skúška
|
25.
|
Ak činnosť kalu nie je známa, odporúča sa vykonať predbežnú skúšku. Pripravia sa kontrolné vzorky, napríklad s koncentráciou tuhých látok 10 g/l, 20 g/l a 40 g/l a so substrátom, ale bez testovanej chemikálie. Používajú sa tiež rozdielne objemy reakčnej zmesi s cieľom dosiahnuť tri alebo štyri hodnoty pomeru objemu uzavretého priestoru nad kvapalinou k objemu kvapaliny. Z výsledkov objemu plynu vyprodukovaného v rôznych časových intervaloch je možné stanoviť najvhodnejšie podmienky, ktoré umožňujú dve merania denne, každodenné získavanie značných objemov plynu a uvoľňovanie tlaku pri optimálnej citlivosti (20) bez strachu z výbuchov.
|
Pridanie testovaných chemikálií
|
26.
|
Testované chemikálie rozpustné vo vode sa pridajú do prázdnych testovacích fliaš [bod 12 písm. b)] ako vodné roztoky (bod 18). Používajú sa najmenej tri série fliaš pre každý rozsah koncentrácií (bod 20). Nerozpustné a slabo rozpustné testované chemikálie sa vo forme roztokov v organických rozpúšťadlách vstreknú do prázdnych fliaš pomocou mikrostriekačky tak, aby vznikli série replikátov všetkých piatich koncentrácií testovanej chemikálie. Rozpúšťadlo sa odparí prúdom plynného dusíka po povrchu roztoku v testovacích fľašiach. Alternatívne je možné pridať nerozpustné tuhé chemikálie ako odvážené množstvá tuhej látky priamo do testovacích fliaš.
|
|
27.
|
Ak sa vo vode nerozpustné alebo slabo rozpustné kvapalné testované chemikálie nepridávajú pomocou rozpúšťadla, pridajú sa priamo mikrostriekačkou do testovacích fliaš po vložení inokula a testovacieho substrátu (pozri bod 30). Prchavé testované chemikálie sa môžu pridávať rovnakým spôsobom.
|
Pridanie inokula a substrátu
|
28.
|
Do 5 litrovej fľaši [bod 12 písm. g)], do ktorej prúdi plynný dusík, sa zamieša primeraný objem preosiateho vyhnívajúceho kalu (pozri bod 16). Testovacími fľašami obsahujúcimi vodné roztoky alebo odparené roztoky testovaných chemikálií s rozpúšťadlami sa nechá prúdiť plynný dusík približne dve minúty, aby sa odstránil prítomný vzduch. Alikvotné množstvo, napríklad 100 ml, dobre premiešaného kalu sa vloží do testovacích fliaš pomocou pipety so širokým hrotom alebo do odmerného valca. Je nevyhnutné naplniť pipetu naraz presným požadovaným objemom kalu, vzhľadom na ľahké usadzovanie tuhých látok v kale. Ak sa naberie viac, je potrebné vyprázdniť pipetu a začať odznova.
|
|
29.
|
Následne sa do zmesi pridá dostatočné množstvo substrátového roztoku (bod 17), aby sa získala koncentrácia 2 g/l jednotlivých živín, výťažok z kvasníc a D-glukóza, pričom dusík naďalej prúdi. Toto je príklad testovacej série.
|
Konečná hmotnostná koncentrácia testovanej chemikálie v testovacích fľašiach
(mg/l)
|
Objem testovanej chemikálie
(ml)
|
Reagenty a médiá
(ml)
|
|
Zásobný roztok a)10 g/lbod 18
|
Zásobný roztok b)1 g/lbod 18
|
Riedenie vodou
bod 14
|
Inokulum
bod 16
|
Substrát
bod 17
|
|
0
|
—
|
0
|
1,0
|
100
|
2
|
|
1
|
—
|
0,1
|
0,9
|
100
|
2
|
|
3,3
|
—
|
0,33
|
0,67
|
100
|
2
|
|
10
|
0,1
|
—
|
0,9
|
100
|
2
|
|
33
|
0,33
|
—
|
0,67
|
100
|
2
|
|
100
|
1,0
|
—
|
0
|
100
|
2
|
|
Celkový objem fľaše = 160 ml. Objem kvapaliny = 103 ml.
Objemu plynu = 57 ml alebo 35,6 % celkového objemu.
|
|
|
30.
|
Podobne aj v prípade akejkoľvek prchavej a nerozpustnej kvapalnej testovanej chemikálie (pozri bod 27) sa dostatok prázdnych testovacích fliaš ošetrí prúdiacim plynným dusíkom.
|
Kontrolné vzorky a referenčná chemikália
|
31.
|
Pripravia sa najmenej tri súbory fliaš obsahujúcich iba kal a substrát, ktoré slúžia ako kontrolné vzorky. Pripravia sa aj ďalšie paralelné fľaše obsahujúce kal a substrát a tiež dostatočné množstvo zásobného roztoku referenčnej chemikálie, 3,5-dichlórfenolu (bod 21), aby bola výsledkom konečná koncentrácia 150 mg/l. Táto koncentrácia by mala inhibovať produkciu plynu približne o 50 %. Alternatívne sa pripraví séria koncentrácií referenčnej chemikálie. Okrem toho sa pripravia štyri osobitné fľaše na meranie pH, ktoré obsahujú kal, odkysličenú vodu a substrát. Do dvoch fliaš sa pridá testovaná chemikália s najvyššou koncentráciou, aká sa testuje, a do zostávajúcich dvoch fliaš sa pridá odkysličená voda.
|
|
32.
|
Je potrebné zabezpečiť, aby všetky fľaše, s testovanou a referenčnou chemikáliou, ako aj s kontrolnými vzorkami, obsahovali rovnaký objem (VR) kvapaliny. V prípade potreby sa na dosiahnutie tohto objemu do fľaše pridá odkysličená deionizovaná voda (bod 14). Uzavretý priestor nad kvapalinou by mal predstavovať 10 – 40 % objemu fľaše, pričom jeho skutočná hodnota sa vyberie z údajov získaných v rámci predbežného testu. Po pridaní všetkých zložiek do fliaš sa odstráni ihla, cez ktorú sa dodával plyn, a každá fľaša sa utesní gumovou zátkou a hliníkovým uzáverom [bod 12 písm. b)], pričom zátka sa zvlhčí kvapkou deionizovanej vody. Obsah každej fľaše sa premieša pretrepaním.
|
Inkubácia fliaš
|
33.
|
Fľaše sa presunú do termostaticky regulovaného inkubátora, podľa možnosti vybaveného trepacím zariadením, s udržiavanou teplotou 35 °C ± 2 °C. Fľaše sa nechajú inkubovať v tme. Po približne jednej hodine sa vyrovná tlak vo fľašiach s atmosférickým tlakom tak, že sa injekčnou ihlou pripojenou k tlakomeru [bod 12 písm. c)] prepichne zátka každej fľaše, otvorí sa ventil, až kým tlakomer neukazuje nulu, a napokon sa ventil uzavrie. Ihla by sa mala zapichnúť pod uhlom približne 45°, aby sa zabránilo úniku plynu z fliaš. Ak sú fľaše inkubované v inkubátore bez trepacieho zariadenia, je potrebné ich ručne pretrepať dvakrát za deň počas celého inkubačného času na vyváženie systému. Obsah fliaš sa potom odstráni a zostávajúce fľaše sa ďalej inkubujú v tme. Prevrátenie však nie je vhodné v prípadoch, keď nerozpustné testované chemikálie môžu priľnúť ku dnu banky.
|
Meranie tlaku
|
34.
|
Keď fľaše dosiahnu teplotu 35 °C ± 2 °C, odmeria a zaznamená sa pH obsahu dvoch zo štyroch fliaš pripravených na tento účel. Obsah fliaš sa potom odstráni a zostávajúce fľaše sa ďalej inkubujú v tme. Počas nasledujúcich 48 – 72 hodín sa dvakrát denne odmeria a zaznamená tlak vo fľašiach tak, že sa ihlou tlakomeru prepichne zátka každej fľaše, pričom ihla sa medzi meraniami vysuší. Všetky časti fľaše treba počas merania udržiavať na inkubačnej teplote a meranie by sa malo vykonať čo najrýchlejšie. Meranú hodnotu tlaku je potrebné nechať stabilizovať a potom ju zaznamenať. Následne sa otvorí ventil a opäť uzavrie, keď hodnota tlaku klesne na nulu. Test pokračuje zvyčajne 48 hodín od okamihu prvého vyrovnávania tlaku, ktorý sa označuje ako ‚čas 0‘. Počet meraní a vyrovnávaní tlaku v prípade prchavých chemikálií by mal byť obmedzený na jedno (na konci inkubácie) alebo dve, aby sa minimalizovali straty testovanej chemikálie (10).
|
|
35.
|
Ak je nameraná hodnota tlaku záporná, ventil sa neotvorí. V injekčnej ihle a hadičke sa niekedy hromadí vlhkosť, čo sa prejaví nízkou zápornou hodnotou tlaku. V takom prípade sa odoberie ihla, hadička sa potrasie a vysuší utierkou a nasadí sa nová ihla.
|
Meranie pH
|
36.
|
Po záverečnom meraní tlaku sa odmeria a zaznamená hodnota pH obsahu každej fľaše.
|
ÚDAJE A PODÁVANIE SPRÁV
Interpretácia výsledkov
|
37.
|
Vypočíta sa suma a priemer zaznamenaných hodnôt tlaku v každom časovom intervale pre každý súbor paralelných fliaš a vypočíta sa stredná kumulovaná hrubá hodnota tlaku plynu v každom časovom intervale pre každý súbor replikátov. Zostroja sa krivky časovej závislosti strednej kumulatívnej produkcie plynu (v Pa) pre kontrolné, testovacie a referenčné fľaše. Na lineárnej časti krivky sa vyberie čas, zvyčajne 48 hodín, a pre každú koncentráciu sa vypočíta percentuálna hodnota inhibície (I) z rovnice [1]:
|
I = (1 – Pt/PC) × 100
|
[1],
|
kde
|
I
|
percentuálna inhibícia v %,
|
|
Pt
|
tlak plynu vyprodukovaného s testovaným materiálom za zvolený čas v pascaloch (Pa),
|
|
Pc
|
tlak plynu vyprodukovaného v kontrolnej vzorke za rovnaký čas v pascaloch (Pa).
|
Bolo by vhodné vypracovať obidva diagramy, t. j. diagram závislosti inhibície (I) od koncentrácie, ako aj od logaritmu koncentrácie tak, aby bolo možné vybrať krivku, ktorá má bližšie k linearite. Hodnota EC50 (mg/l) sa stanoví vizuálne alebo pomocou regresnej analýzy z krivky, ktorá má bližšie k linearite. Na porovnávacie účely môže byť užitočnejšie vyjadriť koncentráciu chemikálie v mg chemikálie/g celkovej sušiny. Táto koncentrácia sa vypočíta ako podiel objemovej koncentrácie (mg/l) a objemovej koncentrácie tuhých častíc sušiny kalu (g/l) (bod 16).
|
|
38.
|
Vypočíta sa buď percentuálna hodnota inhibície dosiahnutá jednou koncentráciou použitej referenčnej chemikálie, alebo hodnota EC50, ak sa skúmal dostatočný počet koncentrácií.
|
|
39.
|
Stredná hodnota tlaku plynu vyprodukovaného v kontrolnej vzorke Pc (Pa) sa prevedie na objem na základe kalibračnej krivky tlakomeru (dodatok 2) a z toho sa vypočíta výťažok plynu, vyjadrený ako objem vyprodukovaný v priebehu 48 hodín zo 100 ml nezriedeného kalu pri koncentrácii tuhých látok 2 % (20 g/l) až 4 % (40 g/l).
|
Kritériá platnosti
|
40.
|
Z výsledkov medzilaboratórnej skúšky ISO (5) vyplynulo, že referenčná chemikália (3,5-dichlórfenol) spôsobila 50 % inhibíciu produkcie plynu v rozsahu koncentrácií 32 – 510 mg/l, pričom stredná hodnota je 153 mg/l (bod 10). Tento rozsah je taký široký, že nie je možné spoľahlivo určiť pevné hranice inhibície ako kritériá platnosti. To by bolo možné, ak by ďalší vývoj ukázal, ako vyprodukovať konzistentnejšie inokulum. Objemy plynu vyprodukovaného v kontrolných fľašiach v priebehu 48 hodín sa pohybovali od 21 ml/g sušiny kalu do 149 ml/g sušiny kalu (stredná hodnota 72 ml/g). Neexistuje žiadny zjavný vzťah medzi objemom vyprodukovaného plynu a zodpovedajúcou hodnotou EC50. Konečná hodnota pH sa pohybovala od 6,1 do 7,5.
|
|
41.
|
Test sa považuje za platný, ak sa dosiahne inhibícia vyššia ako 20 % v referenčnej kontrolnej vzorke obsahujúcej 150 mg/l 3,5-dichlórfenolu, v kontrolnej slepej vzorke sa vyprodukuje viac ako 50 ml plynu na gram sušiny a hodnota pH na konci testu je v rozsahu 6,2 – 7,5.
|
Protokol o skúške
|
42.
|
Protokol o skúške musí obsahovať tieto informácie:
|
|
Testovaná chemikália
|
—
|
bežný názov, chemický názov, číslo CAS, štrukturálny vzorec a príslušné fyzikálno-chemické vlastnosti,
|
|
—
|
čistota (nečistoty) testovanej chemikálie.
|
|
|
|
Podmienky testu
|
—
|
objem kvapalného obsahu a uzavretého priestoru nad kvapalinou v testovacích nádobách,
|
|
—
|
opis testovacích nádob a merania plynu (napr. typ tlakomeru),
|
|
—
|
aplikácia testovanej chemikálie a referenčnej chemikálie do testovacieho systému, použité testovacie koncentrácie a použitie akýchkoľvek rozpúšťadiel,
|
|
—
|
údaje o použitom inokule: názov čistiarne odpadových vôd, opis zdroja čistenej odpadovej vody (napr. prevádzková teplota, retenčný čas kalu, informácia, či prevažujú odpadové vody z domácností alebo priemyselné odpadové vody atď.), koncentrácia tuhých látok, činnosť produkcie plynu v anaeróbnej vyhnívacej nádrži, predchádzajúca expozícia alebo možná predbežná adaptácia na toxické chemikálie, alebo miesto odberu kalu, sedimentu atď.,
|
|
—
|
teplota a rozsah inkubácie,
|
|
|
|
Výsledky
|
—
|
hodnoty pH na konci testu,
|
|
—
|
všetky zhromaždené namerané údaje z testovacích nádob, slepých kontrolných nádob a kontrolných nádob s referenčnou chemikáliou, v prípade potreby v tabuľkovej forme (napr. tlak v Pa alebo milibaroch),
|
|
—
|
percentuálna inhibícia v testovacích a referenčných fľašiach a krivky závislosti inhibície od koncentrácie,
|
|
—
|
vypočítané hodnoty EC50, vyjadrené v mg/l a mg/g,
|
|
—
|
produkcia plynu na gram kalu za 48 hodín,
|
|
—
|
dôvody na akékoľvek odmietnutie výsledkov testu,
|
|
—
|
diskusia o výsledkoch vrátane odchýlok od postupov v rámci tejto testovacej metódy a diskusia o akýchkoľvek odchýlkach od očakávaných výsledkov testu v dôsledku interferencií a chýb;
|
|
—
|
uvedie sa tiež, či účelom testu bolo meranie toxicity na mikroorganizmy, ktoré už boli vystavené alebo ktoré ešte neboli vystavené pôsobeniu testovanej chemikálie.
|
|
|
LITERATÚRA
|
1.
|
Chapter C.11 of this Annex: Activated Sludge, Respiration Inhibition Test.
|
|
2.
|
Chapter C.43 of this Annex: Anaerobic biodegradability of organic compounds in digested sludge: method by measurement of gas production.
|
|
3.
|
International Organisation for Standardisation (2003) ISO 13 641-1 Water Quality – Determination of inhibition of gas production of anaerobic bacteria – Part 1: General Test.
|
|
4.
|
International Organisation for Standardisation (2003) ISO 13 641-2 Water Quality – Determination of inhibition of gas production of anaerobic bacteria – Part 2: Test for low biomass concentrations.
|
|
5.
|
ISO (2000) Ring test of ISO 13 641-1 and ISO 13 641-2. Determination of inhibition of activity of anaerobic bacteria. BL 6958/A. Evans MR, Painter HA. Brixham Environmental Laboratory, AstraZeneca UK Ltd., Brixham, TQ5 8BA UK.
|
|
6.
|
Swanwick JD, Foulkes M (1971). Inhibition of anaerobic digestion of sewage sludge by chlorinated hydrocarbons. Wat. Pollut. Control, 70, 58-70.
|
|
7.
|
HMSO (1986) Determination of the inhibitory effects of chemicals and waste waters on the anaerobic digestion of sewage sludge. ISBN 0 117519 43 X, In: Methods for the Examination of Waters and Associated Materials UK.
|
|
8.
|
Shelton DR, Tiedje JM (1984). General method for determining anaerobic biodegradation potential. Appl. Env. Microbiol. 47 850-857.
|
|
9.
|
Battersby NS and Wilson V (1988). Evaluation of a serum bottle technique for assessing the anaerobic biodegradability of organic compounds under methanogenic conditions. Chemosphere 17, 2441-2460.
|
|
10.
|
Wilson V, Painter HA and Battersby NS (1992). A screening method for assessing the inhibition of the anaerobic gas production from sewage sludge. Proc. Int. Symp. on Ecotoxicology. Ecotoxicological Relevance of Test Methods, GSF Forschungzentrum, Neuherberg, Germany (1990). Eds. Steinberg C and Kettrup A, pp117-132 (1992).
|
|
11.
|
Kawahara K, Yakabe Y, Chida T, and Kida K (1999). Evaluation of laboratory-made sludge for an anaerobic biodegradability test and its use for assessment of 13 chemicals. Chemosphere, 39 (12), 2007-2018.
|
|
12.
|
International Organization for Standardization (1995) ISO 10 634 Water Quality – Guidance for the preparation and treatment of poorly water-soluble organic compounds for the subsequent evaluation of their biodegradability in an aqueous medium.
|
|
13.
|
International Organization for Standardization (1997) ISO 11 923 Water Quality – Determination of suspended solids by filtration through glass-fibre filters.
|
Dodatok 1
Príklad zariadenia na meranie produkcie bioplynu podľa tlaku plynu
Legenda:
|
1
|
–
|
tlakomer
|
|
2
|
–
|
plynotesný trojcestný ventil
|
|
3
|
–
|
injekčná ihla
|
|
4
|
–
|
plynotesný uzáver (tesniaci uzáver a priehradka)
|
|
5
|
–
|
uzavretý priestor nad kvapalinou
|
|
6
|
–
|
inokulum vyhnívajúceho kalu
|
Testovacie nádoby v prostredí s teplotou 35 °C ± 2 °C.
Dodatok 2
Konverzia tlakomera
Údaje tlakomeru sa môžu pomocou štandardnej krivky dať do vzťahu s objemom plynu a z toho sa môže vypočítať objem vyprodukovaného plynu na gram sušiny kalu za 48 hodín. Tento index aktivity sa použije ako jedno z kritérií, ktorými sa zhodnotí platnosť výsledkov testu. Kalibračná krivka sa vypracuje vstreknutím známeho množstva plynu pri teplote 35 °C ± 2 °C do sérových fliaš, ktoré obsahujú rovnaký objem vody, ako je objem reakčnej zmesi (VR).
|
—
|
Alikvotné množstvo vody VR (ml) udržiavanej pri teplote 35 °C ± 2 °C sa rozdelí do piatich sérových fliaš. Fľaše sa pevne uzavrú a na 1 hodinu umiestnia do vodného kúpeľa s teplotou 35 °C ± 2 °C, aby sa systém dostal do rovnováhy.
|
|
—
|
Zapne sa tlakomer, nechá sa stabilizovať a nastaví sa na nulu.
|
|
—
|
Injekčnou ihlou sa prepichne zátka jednej z fliaš, otvorí sa ventil, až kým tlakomer neukáže nulovú hodnotu, potom sa ventil uzavrie.
|
|
—
|
Postup sa opakuje so zostávajúcimi fľašami.
|
|
—
|
Do každej fľaše sa vstrekne 1 ml vzduchu s teplotou 35 °C ± 2 °C. Ihlou (tlakomera) sa prepichne zátka jednej z fliaš a nechá sa stabilizovať meraná hodnota tlaku. Hodnota tlaku sa zaznamená, otvorí sa ventil, až kým tlakomer neukáže nulovú hodnotu, potom sa ventil uzavrie.
|
|
—
|
Postup sa opakuje so zostávajúcimi fľašami.
|
|
—
|
Celý postup sa opakuje s použitím 2 ml, 3 ml, 4 ml, 5 ml, 6 ml, 8 ml, 10 ml, 12 ml, 16 ml, 20 ml a 50 ml vzduchu.
|
|
—
|
Zostrojí sa konverzná krivka závislosti tlaku (Pa) od objemu vstreknutého plynu (ml). Reakcia zariadenia je lineárna v rozsahu 0 – 70 000 Pa a 0 – 50 ml vyprodukovaného plynu.
|
Dodatok 3
Známe faktory, ktoré môžu viesť k nesprávnym výsledkom
a) Kvalita uzáverov fliaš
Rozličné typy priehradiek pre sérové fľaše sú komerčne dostupné, mnohé z nich vrátane butylkaučukových však strácajú tesnosť, keď sa prepichnú ihlou podľa podmienok testu. Niekedy dochádza po prepichnutí priehradky injekčnou ihlou k veľmi pomalému poklesu tlaku. S cieľom predísť únikom plynu sa odporúča používať plynotesné priehradky [bod 12 písm. b)].
b) Vlhkosť v injekčnej ihle
V injekčnej ihle a hadičke sa niekedy hromadí vlhkosť, čo sa prejaví nízkou zápornou hodnotou tlaku. Napraví sa to tak, že sa odoberie ihla, hadička sa potrasie a vysuší utierkou a nasadí sa nová ihla [body 12 písm. c) a 35].
c) Kontaminácia kyslíkom
Anaeróbne metódy sú náchylné na chyby spôsobené kontamináciou kyslíkom, čo môže spôsobiť nižšiu produkciu plynu. V rámci tejto metódy by sa takáto možnosť mala minimalizovať pomocou prísne anaeróbnych techník vrátane používania odkladacej schránky.
d) Hrubé substráty v kale
Anaeróbnu produkciu plynu a citlivosť kalu ovplyvňujú substráty, ktoré sa prenášajú s inokulom do testovacích fliaš. Vyhnívajúci kal z domových anaeróbnych vyhnívacích nádrží často obsahuje rozpoznateľný materiál ako chlpy a celulózové zvyšky rastlín, ktoré majú tendenciu sťažovať získavanie reprezentatívnych vzoriek. Preosiatím kalu je možné odstrániť hrubé nerozpustné látky, čo zvyšuje pravdepodobnosť odberu reprezentatívnych vzoriek (bod 16).
e) Prchavé testované chemikálie
Prchavé testované chemikálie sa uvoľnia do uzavretého priestoru nad kvapalinou v testovacích fľašiach. To môže viesť k určitej strate testovaného materiálu zo systému počas ventilácie po meraniach tlaku, čím by sa získali nepravdivo vysoké hodnoty koncentrácie EC50. Chybu je možné znížiť vhodným výberom pomeru objemu uzavretého priestoru nad kvapalinou k objemu kvapaliny a vynechaním ventilácie po vykonaní merania tlaku (10).
f) Nelinearita produkcie plynu
Ak krivka závislosti strednej kumulatívnej produkcie plynu od času inkubácie nie je za 48-hodinové obdobie približne lineárna, presnosť testovania sa môže znížiť. Na prekonanie tejto skutočnosti sa odporúča použiť vyhnívajúci kal z iného zdroja a/alebo zvýšiť koncentráciu testovacieho substrátu živín, výťažku z kvasníc a glukózy (bod 29).
Dodatok 4
Aplikácia na environmentálne vzorky s nízkou koncentráciou biomasy – anaeróbnych kalov, sedimentov atď.
ÚVOD
A.1 Vo všeobecnosti je špecifická mikrobiálna aktivita (objem plynu vyprodukovaného na gram sušiny) prirodzene sa vyskytujúcich anaeróbnych kalov, sedimentov, pôd atď. oveľa nižšia ako aktivita anaeróbneho kalu získaného z odpadových vôd. Z tohto dôvodu, ak sa majú merať inhibičné účinky chemikálií na tieto menej aktívne vzorky, musia sa upraviť niektoré experimentálne podmienky. V prípade týchto menej aktívnych vzoriek sú možné dva všeobecné postupy:
|
a)
|
vykoná sa upravená predbežná skúška (bod 25) s nezriedenou vzorkou kalu, pôdy atď. pri teplote 35 °C ± 2 °C alebo pri teplote, aká bola na mieste odberu vzorky, čím sa dosiahne presnejšia simulácia (ako v časti 1 normy ISO 13 641);
|
|
b)
|
alebo sa vykoná test so zriedeným (1: 100) kalom z vyhnívacej nádrže, čím sa simuluje nízka aktivita, ktorá sa očakáva od environmentálnej vzorky, pričom teplota sa udržiava na hodnote 35 °C ± 2 °C (ako v časti 2 normy ISO 13 641).
|
A.2 Možnosť a) je možné realizovať pomocou tu opísanej metódy (rovnocennej s metódou uvedenou v časti 1 normy ISO 13 641), ale je nevyhnutné vykonať predbežnú skúšku (bod 25), aby sa zabezpečili optimálne podmienky, pokiaľ už nie sú známe z predchádzajúceho testovania. Vzorka kalu alebo sedimentu by sa mala dôkladne premiešať, napríklad v miešadle, a v prípade potreby zriediť malým množstvom odvzdušnenej vody (bod 14) tak, aby bola dostatočne mobilná na premiestnenie pomocou pipety so širokým hrotom alebo odmerného valca. Ak sa množstvo živín považuje za nedostatočné, vzorka sa môže odstrediť (za anaeróbnych podmienok) a opätovne suspendovať v minerálnom médiu, ktoré obsahuje výťažok z kvasníc (A.11).
A.3 Možnosť b) primerane imituje nízku aktivitu environmentálnych vzoriek, ale koncentrácia suspendovaných tuhých látok prítomných v týchto vzorkách nie je vysoká. Úloha týchto tuhých látok v inhibícii nie je známa, ale je možné, že výsledkom reakcie testovaných chemikálií a zložiek kalu, ako aj adsorpcie testovaných chemikálií na tuhé látky, by mohlo byť zníženie toxicity testovanej chemikálie.
A.4 Ďalším dôležitým faktorom je teplota: v rámci prísnej simulácie by sa testy mali vykonávať pri teplote, aká bola na mieste odberu vzorky, keďže o rôznych skupinách baktérií produkujúcich metán je známe, že sú aktívne v rozličných teplotných rozsahoch, konkrétne termofily (~ 30 – 35 °C), mezofily (20 – 25 °C) a psychrofily (< 20 °C), ktoré môžu vykazovať rôzne inhibičné vlastnosti.
A.5 Trvanie: v rámci všeobecného testu bola v časti 1, s použitím nezriedeného kalu, produkcia plynu v trvaní 2 až 4 dni vždy dostatočná, zatiaľ čo v časti 2 s použitím stokrát zriedeného kalu sa za tento čas v rámci medzilaboratórnej porovnávacej skúšky nevyprodukoval dostatok plynu, ak vôbec nejaký. Madsen a kol. (1996) pri opise tohto druhého testu uvádzajú, že k dispozícii by malo byť najmenej sedem dní.
Testovanie s nízkou koncentráciou biomasy (možnosť b)
Vykonať by sa mali tieto zmeny, ktorými sa dopĺňajú alebo nahrádzajú niektoré existujúce body a podbody hlavného textu.
A.6 K bodu 6 sa dopĺňa: Princíp skúšky:
‚Táto technika sa môže používať s anaeróbnym kalom zriedeným v pomere 1: 100, čiastočne na simuláciu nízkej aktivity kalov a sedimentov. Inkubačná teplota môže byť buď 35 °C, alebo rovnaká, aká bola na mieste odberu vzorky. Keďže bakteriálna aktivita je oveľa nižšia ako v nezriedenom kale, inkubačný čas by sa mal predĺžiť najmenej na sedem dní.‘
A.7 K bodu 12 a) sa dopĺňa:
‚inkubátor by mal byť schopný prevádzky až do teploty 15 °C.‘
A.8 Za bod 13 sa dopĺňa ďalší reagent:
‚kyselina fosforečná (H3PO4) 85 % hmotnosti vo vode.‘
A.9 Na koniec bodu 16 sa dopĺňa:
‚V rámci testu sa použije konečná koncentrácia 0,20 g/l ± 0,05 g/l celkovej sušiny.‘
A.10 Bod 17: Testovací substrát
Tento substrát sa nepoužije, ale nahradí sa výťažkom z kvasníc (pozri body 17, A.11, A.12, A.13).
A.11 Na zriedenie anaeróbneho kalu je potrebné minerálne médium vrátane stopových prvkov a na zjednodušenie sa do tohto média pridá organický substrát, výťažok z kvasníc.
Za bod 17 sa dopĺňa:
|
‚a)
|
Testovacie minerálne médium s výťažkom z kvasníc
|
Pripravuje sa z desaťnásobne koncentrovaného testovacieho média [bod 17 písm. b), A.12], s roztokom stopového prvku [bod 17 písm. c), A.13]. Použije sa čerstvo dodaný nonahydrát sulfidu sodného [bod 17 písm. b), A.12], alebo sa pred použitím prepláchne a vysuší, aby sa zabezpečilo, že bude mať dostatočnú redukčnú kapacitu. Ak sa test vykonáva bez použitia odkladacej schránky [bod 17 písm. j)], koncentrácia sulfidu sodného v zásobnom roztoku by sa mala zvýšiť na 2 g/l (z hodnoty 1 g/l). Sulfid sodný sa môže pridávať aj z vhodného zásobného roztoku cez priehradku uzavretých testovacích fliaš, keďže tento postup znižuje riziko oxidácie, až do dosiahnutia konečnej koncentrácie 0,2 g/l. Alternatívne sa môže použiť titánium-citrát [bod 17 písm. b)]. Pridáva sa cez priehradku uzavretých testovacích fliaš, aby sa dosiahla koncentrácia 0,8 – 1,0 mmol/l. Titánium-citrát je vysokoúčinné a málo toxické redukčné činidlo, ktoré sa pripraví takto: rozpustí sa 2,94 g dihydrátu citrátu trisodného v 50 ml odkysličenej vody (bod 14) (čoho výsledkom je roztok 200 mmol/l) a pridá sa 5 ml roztoku titánium-chlorátu (15 g/100 ml vody). Činidlo sa pomocou uhličitanu sodného neutralizuje na pH 7 ± 0,5 a do vhodnej sérovej fľaše sa naleje v prúde plynného dusíka. Koncentrácia titánium-citrátu v tomto zásobnom roztoku je 164 mmol/l. Testovacie médium sa má použiť okamžite alebo skladovať pri teplote 4 °C najdlhšie 1 deň.
|
A.12
|
b)
|
Desaťnásobne koncentrované testovacie médium sa pripraví z týchto zložiek:
|
bezvodý dihydrogénfosforečnan draselný (KH2PO4)
|
2,7 g
|
|
hydrogénfosforečnan disodný (Na2HPO4)
|
4,4 g
|
|
(alebo 11,2 g dodekahydrátu)
chlorid amónny (NH4Cl)
|
5,3 g
|
|
dihydrát chloridu vápenatého (CaC12 2H2O)
|
0,75 g
|
|
hexahydrát chloridu horečnatého (MgCl2 6H2O)
|
1,0 g
|
|
tetrahydrát chloridu železnatého (FeCl2 4H2O)
|
0,2 g
|
|
resazurín (oxidačno-redukčný indikátor)
|
0,01 g
|
|
nonahydrát sulfidu sodného (Na2S 9H2O)
|
1,0 g
|
|
(alebo titánium-citrát) konečná koncentrácia
|
0.8 mmol/l až 1.0 mmol/l
|
|
roztok stopových prvkov [pozri bod 17 písm. c), A.13]
|
10,0 ml
|
|
výťažok z kvasníc
|
100 g
|
|
rozpustí sa vo vode (bod 14) a doplní sa do:
|
1 000 ml
|
|
|
A.13
|
c)
|
Roztok stopových prvkov sa pripraví z týchto zložiek:
|
tetrahydrát chloridu mangánatého (MnCl2 · 4H2O)
|
0,5 g
|
|
kyselina boritá (H3BO3)
|
0,05 g
|
|
chlorid zinočnatý (ZnCl2)
|
0,05 g
|
|
chlorid meďnatý (CuCl2)
|
0,03 g
|
|
dihydrát molybdénanu sodného (Na2MoO4 · 2H2O)
|
0,01 g
|
|
hexahydrát chloridu kobaltnatého (CoCl2 · 6H2O)
|
1,0 g
|
|
hexahydrát chloridu nikelnatého (NiCl2 · 6H2O)
|
0,1 g
|
|
seleničitan sodný (Na2SeO3)
|
0,05 g
|
|
rozpustí sa vo vode (bod 14) a doplní sa do:
|
1 000 ml‘
|
|
A.14 Bod 25: Predbežná skúška
Je dôležité, aby sa predbežná skúška vykonala tak, ako je opísané v bode 24, s výnimkou toho, že koncentrácia tuhých látok v kale by mala predstavovať jednu stotinu uvedenej hodnoty, teda 0,1 g/l, 0,2 g/l a 0,4 g/l. Inkubácia by mala trvať najmenej 7 dní.
Poznámka: V rámci medzilaboratórnej porovnávacej skúšky (5) bol objem uzavretého priestoru nad kvapalinou príliš veľký – až 75 % celkového objemu. Táto hodnota by mala byť v odporúčanom rozsahu od 10 do 40 %. Dôležitým kritériom je, že objem plynu vyprodukovaného pri inhibícii približne 80 % by mal byť merateľný s prijateľnou presnosťou (napr. ± 5 % až ± 10 %).
A.15 Body 26 až 30: Pridanie testovanej chemikálie, inokula a substrátu
Pridávanie prebieha tým istým spôsobom, ako je uvedené v daných bodoch, ale substrátový roztok (bod 17) sa nahradí substrátom testovacieho média a výťažku z kvasníc (A.11).
Okrem toho sa konečná koncentrácia sušiny kalu znížila z 2 – 4 g/l na 0,2 g/l ± 0,05 g/l (A.9). Dva príklady pridávania zložiek testovacej zmesi sú uvedené v tabuľke A.1, ktorá nahrádza tabuľku uvedenú v bode 29.
A.16 Bod 33: Inkubácia fliaš
Vzhľadom na očakávanú nižšiu mieru produkcie plynu sa inkubácia vykonáva najmenej 7 dní.
A.17 Bod 34: Meranie tlaku
Na meranie tlaku v uzavretom priestore nad kvapalinou vo fľašiach sa používa rovnaký postup, ako je opísané v bode 34, ak je potrebné zistiť množstvá v plynnej fáze. Ak sa má merať celkové množstvo CO2 a CH4, pH kvapalnej fázy sa zníži približne na hodnotu 2 vstreknutím H3PO4 do každej príslušnej fľaše, pričom sa tlak meria po 30-minútovom pretrepávaní pri testovacej teplote. Viac informácií o kvalite inokula je však možné získať meraním tlaku v každej fľaši pred okyslením a po ňom. Napríklad ak je miera produkcie CO2 oveľa vyššia ako miera produkcie metánu, citlivosť fermentatívnych baktérií sa môže zmeniť a/alebo testovaná chemikália v prvom rade ovplyvní metanogénne baktérie.
A.18 Bod 36: Meranie pH
Ak sa má použiť H3PO4, je potrebné pripraviť ďalšie fľaše, do ktorých sa H3PO4 nepridá, zvlášť ak sa má merať pH.
LITERATÚRA:
Madsen, T, Rasmussen, HB; and Nilsson, L (1996), Methods for screening anaerobic biodegradability and toxicity of organic chemicals. Project No.336, Water Quality Institute, Danish Environment Protection Agency, Copenhagen.
Tabuľka A.1.
Príklady nastavenia pre testovacie dávky
|
Zložky reakčnej zmesi
|
Príklad 1
|
Príklad 2
|
Bežné poradie pridávania
|
|
Koncentrácia pripraveného inokula (g/l)
|
0,42
|
2,1
|
—
|
|
Objem pridaného inokula (ml)
|
45
|
9
|
4
|
|
Koncentrácia inokula v testovacích fľašiach (g/l)
|
0,20
|
0,20
|
—
|
|
Objem pridaného testovacieho média (ml)
|
9
|
9
|
2
|
|
Objem vody pridanej na riedenie (ml)
|
36
|
72
|
3
|
|
Koncentrácia výťažku z kvasníc v testovacích fľašiach (g/l)
|
9,7
|
9,7
|
—
|
|
Objem zásobného roztoku testovanej chemikálie (ml)
|
3
|
3
|
1
|
|
Celkový objem kvapaliny (ml)
|
93
|
93
|
—
|
Dodatok 5
Vymedzenie pojmov
Na účely tejto testovacej metódy sa používa toto vymedzenie pojmov:
|
|
Chemikália je látka alebo zmes.
|
|
|
Testovaná chemikália je akákoľvek látka alebo zmes, ktorá sa testuje pomocou tejto testovacej metódy.
|
C.35 TEST TOXICITY PRE ČERVY RODU LUMBRICULUS V SYSTÉME SEDIMENT – VODA ZA POUŽITIA OBOHATENÉHO SEDIMENTU
ÚVOD
|
1.
|
Táto testovacia metóda je rovnocenná s usmernením OECD na vykonávanie testov (TG) 225 (2007). Endobentózne organizmy, ktoré sa živia sedimentmi, sú potenciálne vystavené silnému pôsobeniu chemikálií naviazaných na sedimenty, a preto by sa im mala venovať zvýšená pozornosť, napr. (1), (2), (3). Medzi takýmito živočíchmi zohrávajú dôležitú úlohu vodné máloštetinavce (trieda Oligochaeta) v sedimentoch vodných systémov. Tieto živočíchy svojou bioturbáciou sedimentu a tým, že slúžia ako korisť, môžu mať silný vplyv na biologickú dostupnosť takýchto chemikálií pre iné organizmy, napr. ryby, ktoré sa živia bentosom. Na rozdiel od epibentóznych organizmov sa endobentózne vodné máloštetinavce (napr. dážďovička pestrá, Lumbriculus variegatus) zahrabávajú do sedimentu a živia sa časticami sedimentu pod jeho povrchom. Tým je zabezpečené, že testované organizmy sú vystavené pôsobeniu testovaných chemikálií všetkými možnými spôsobmi (napr. dotykom s kontaminovanými časticami usadenín a ich požitím, ale aj prostredníctvom vody v póroch sedimentov a nadložnej vody).
|
|
2.
|
Táto testovacia metóda bola vypracovaná s cieľom posúdiť účinky dlhodobého pôsobenia chemikálií naviazaných na sedimenty na endobentózne máloštetinavce druhu Lumbriculus variegatus (Müller). Vychádza z existujúcich protokolov testu toxicity a bioakumulácie v sedimente, napr. (3), (4), (5), (6), (7), (8), (9), (10). Metóda je opísaná pre statické podmienky testu. Expozičným scenárom použitým v rámci tejto testovacej metódy je obohacovanie sedimentu testovanou chemikáliou. Použitie obohateného sedimentu je určené na simuláciu prípadu sedimentu kontaminovaného testovanou chemikáliou.
|
|
3.
|
Chemikálie, ktoré je potrebné testovať na organizmoch žijúcich v sedimente, zvyčajne pretrvajú v tomto prostredí dlhý čas. Organizmy žijúce v sedimente môžu byť exponované viacerými spôsobmi. Relatívny význam každého spôsobu expozície a časové obdobie, v ktorom sa každý z nich podieľa na celkových toxických účinkoch, závisí od fyzikálno-chemických vlastností danej chemikálie a jej konečného osudu v tele živočícha. V prípade silno adsorbujúcich chemikálií (napr. s hodnotou log Kow > 5) alebo chemikálií, ktoré sa kovalentne viažu na sediment, môže byť významným spôsobom expozície prijímanie kontaminovanej potravy. S cieľom vyhnúť sa podhodnoteniu toxicity takých chemikálií sa potrava potrebná na reprodukciu a rast testovaných organizmov pridá do sedimentu pred aplikáciou testovanej chemikálie (11). Opísaná testovacia metóda je dostatočne podrobná, aby test bolo možné vykonať s možnosťou úprav experimentálnej koncepcie v závislosti od podmienok v jednotlivých laboratóriách a od rôznych vlastností testovaných chemikálií.
|
|
4.
|
Testovacia metóda je zameraná na stanovenie účinkov testovanej chemikálie na reprodukciu a biomasu testovaných organizmov. Meranými biologickými parametrami sú celkový počet prežívajúcich červov a množstvo biomasy (suchá hmotnosť) na konci expozície. Tieto údaje sa analyzujú buď prostredníctvom regresného modelu na odhadnutie koncentrácie, ktorá by spôsobila účinok x % (napr. EC50, EC25 a EC10), alebo prostredníctvom testovania štatistickej hypotézy na stanovenie koncentrácie bez pozorovaného účinku (NOEC) a najnižšej koncentrácie s pozorovaným účinkom (LOEC).
|
|
5.
|
V kapitole C.27 tejto prílohy, ‚Test toxicity Chironomidae v systéme sediment – voda za použitia obohateného sedimentu‘ (6), je uvedených mnoho základných a užitočných informácií týkajúcich sa postupu metódy testovania toxicity v sedimente. Tento dokument teda slúži ako základ pre vypracované úpravy potrebné na vykonávanie testov toxicity v sedimente s máloštetinavcami druhu Lumbriculus variegatus. Medzi ďalšie použité dokumenty patria napríklad štandardná príručka ASTM na stanovenie bioakumulácie kontaminantov naviazaných na sedimenty bentóznymi bezstavovcami (3), metódy US EPA na meranie toxicity a bioakumulácie kontaminantov naviazaných na sedimenty sladkovodnými bezstavovcami (7) a štandardná príručka ASTM na zber, uchovávanie, charakterizáciu a manipuláciu sedimentov na toxikologické testovanie a na výber vzoriek pri zbere bentóznych bezstavovcov (12). Okrem toho sú dôležitým zdrojom informácií na vypracovanie tohto dokumentu praktické skúsenosti získané počas medzilaboratórnej porovnávacej skúške testovacej metódy [(13), protokol o medzilaboratórnej porovnávacej skúške] a údaje z literatúry.
|
ZÁKLADNÉ A USMERŇUJÚCE INFORMÁCIE
|
6.
|
Informácie o testovanej chemikálii, ako sú bezpečnostné opatrenia, vhodné podmienky skladovania a analytické metódy, je potrebné získať pred začiatkom štúdie. Usmernenia týkajúce sa fyzikálno-chemických vlastností testovaných chemikálií, ktoré sťažujú ich testovanie, sú uvedené v literatúre pod číslom (14).
|
|
7.
|
Pred vykonaním testu by mali byť známe tieto informácie o testovanej chemikálii:
|
—
|
bežný názov, chemický názov (podľa možnosti názov IUPAC), štrukturálny vzorec, registračné číslo CAS, čistota,
|
|
|
8.
|
Za užitočné pred začiatkom testu sa považujú tieto doplňujúce informácie:
|
—
|
rozdeľovacia konštanta oktanol – voda, Kow,
|
|
—
|
rozdeľovacia konštanta organický uhlík – voda, vyjadrený ako Koc,
|
|
—
|
fototransformácia vo vode,
|
|
|
9.
|
Pred začiatkom testu by sa mali získať informácie o určitých vlastnostiach sedimentu (7). Podrobnosti sú uvedené v bodoch 22 až 25.
|
PRINCÍP TESTU
|
10.
|
Červy v podobnom fyziologickom stave (synchronizované, ako je opísané v dodatku 5), sa vystavia pôsobeniu série koncentrácií toxickej chemikálie, aplikovanej na fázu sedimentu v systéme sediment – voda. Ako médium by sa mal použiť umelý sediment a rekonštituovaná voda. Testovacie nádoby bez pridania testovacej chemikálie slúžia ako kontrolné vzorky. Sediment sa obohatí o testovanú chemikáliu hromadne pre každú úroveň koncentrácie s cieľom minimalizovať variabilitu medzi replikátmi každej úrovne koncentrácie. Následne sa testované organizmy umiestnia do testovacích nádob, v ktorých sú koncentrácie sedimentu a vody vyvážené (pozri bod 29). Testované živočíchy sú vystavené pôsobeniu systémov sediment – voda 28 dní. Vzhľadom na nízky obsah živín v umelom sedimente by sa mal sediment upraviť zdrojom potravy (pozri body 22 a 23 a dodatok 4), aby sa zabezpečilo, že červy budú rásť a rozmnožovať sa v rámci podmienok regulácie. Týmto spôsobom sa zabezpečí, aby boli testované živočíchy exponované účinkom vody a sedimentu, ako aj ich potravy.
|
|
11.
|
Uprednostňovaným parametrom v rámci tohto typu štúdie je koncentrácia ECx (napr. EC50, EC25 a EC10, účinná koncentrácia, ovplyvňujúca x % testovaných organizmov) pre reprodukciu a množstvo biomasy, v porovnaní s kontrolnými vzorkami. Je však potrebné si uvedomiť, že vzhľadom na veľkú neistotu nízkej hodnoty ECx (napr. EC10, EC25) s extrémne vysokými hranicami spoľahlivosti (95 %) [napr. (15)] a štatistickú významnosť vypočítanú počas testovania hypotézy sa za najpevnejší konečný parameter považuje koncentrácia EC50. Okrem toho sa pre množstvo biomasy a reprodukciu môže vypočítať koncentrácia bez pozorovaného účinku (NOEC) a najnižšia koncentrácia s pozorovaným účinkom (LOEC), ak koncepcia a údaje testu podporujú tieto výpočty (pozri body 34 až 38). Účel štúdie, odvodenie koncentrácií ECx alebo NOEC, bude závisieť od koncepcie testu.
|
REFERENČNÉ TESTY
|
12.
|
Očakáva sa, že výsledky s kontrolnými organizmami dostatočne preukážu schopnosť laboratória vykonať test, a ak sú k dispozícii historické údaje, aj opakovateľnosť testu. Okrem toho sa môžu v pravidelných intervaloch vykonávať referenčné testy toxicity s použitím referenčnej toxickej chemikálie na posúdenie citlivosti testovaných organizmov. Citlivosť a stav testovaných živočíchov môžu uspokojivo preukázať referenčné testy toxicity iba vo vode, v trvaní 96 hodín (4) (7). Informácie o toxicite pentachlórfenolu (PCP) v úplných testoch (28-dňová expozícia v obohatenom sedimente) sú uvedené v dodatku 6 a v protokole o medzilaboratórnej porovnávacej skúške testovacej metódy (13). Akútna toxicita PCP iba vo vode je opísaná v literatúre, napr. (16). Tieto informácie sa môžu použiť na porovnanie citlivosti testovacieho organizmu v referenčných testoch s PCP ako referenčnou toxickou chemikáliou. Ako referenčné toxické chemikálie pre druh L. variegatus sa odporúčajú chlorid draselný (KCl) alebo síran meďnatý (CuSO4) (4) (7). V súčasnosti je stanovenie kvalitatívnych kritérií založených na údajoch o toxicite pre KCl zložité z dôvodu nedostatku údajov v literatúre pre druh L. variegatus. Informácie o toxicite medi voči druhu L. variegatus je možné nájsť v bodoch (17) až (21).
|
PLATNOSŤ TESTU
|
13.
|
Ak má byť test platný, mali by byť splnené tieto požiadavky:
|
—
|
medzilaboratórna porovnávacia skúška (13) ukázala, že pre druh Lumbriculus variegatus by mal priemerný počet žijúcich červov v jednom replikáte kontrolnej vzorky vzrásť najmenej o faktor 1,8 na konci expozície v porovnaní s počtom červov v jednom replikáte na jej začiatku,
|
|
—
|
hodnota pH nadložnej vody by mala byť počas testu 6 až 9,
|
|
—
|
koncentrácia kyslíka v nadložnej vode by počas testu nemala byť nižšia ako 30 % hodnoty rozpustnosti vzdušného kyslíka pri testovacej teplote.
|
|
OPIS TESTOVACEJ METÓDY
Testovací systém
|
14.
|
Odporúčajú sa statické systémy bez obnovy nadložnej vody. Ak je pomer sedimentu a vody (pozri bod 15) vhodný, jemné prevzdušňovanie bude spravidla stačiť na udržanie kvality vody na prijateľnej úrovni pre testované organizmy (napr. na maximalizáciu hladiny rozpusteného kyslíka, minimalizáciu vzniku produktov vylučovania). Semistatické alebo prietokové systémy s prerušovaným alebo sústavným obnovovaním nadložnej vody by sa mali využívať len vo výnimočných prípadoch, keďže pravidelné obnovovanie nadložnej vody môže ovplyvniť chemickú rovnováhu (napr. straty testovanej chemikálie z testovacieho systému).
|
Testovacie nádoby a zariadenie
|
15.
|
Expozícia by mala prebiehať v sklených kadičkách, napr. s objemom 250 ml a priemerom 6 cm. Použiť sa môžu aj iné vhodné sklené nádoby, ale mali by zaručiť primeranú hĺbku nadložnej vody a sedimentu. Do každej nádoby by sa mala vložiť vrstva 1,5 – 3 cm umelo pripraveného sedimentu. Pomer hĺbky vrstvy sedimentu a hĺbky nadložnej vody by mal byť 1: 4. Nádoby by mali mať vhodnú veľkosť, ktorá zodpovedá veľkosti náplne, t. j. počtu vložených testovaných červov pripadajúcich na jednotku hmotnosti sedimentu (pozri tiež bod 39).
|
|
16.
|
Testovacie nádoby a ďalšie zariadenia, ktoré prídu do styku s testovacími chemikáliami, by mali byť vyrobené výlučne zo skla alebo z iného chemicky inertného materiálu. Treba dbať na to, aby sa pri všetkých častiach zariadenia predišlo používaniu materiálov, ktoré sa môžu rozpúšťať, môžu absorbovať testované chemikálie alebo vylúhovať iné chemikálie a mať škodlivé účinky na testované živočíchy. Všetko zariadenie, ktoré prichádza do styku s testovacími médiami, by malo byť vyrobené z polytetrafluóretylénu, nehrdzavejúcej ocele a/alebo zo skla. V prípade organických chemikálií, o ktorých je známa ich adsorpcia na sklo, môže byť potrebné použiť posilanizované sklo. V takýchto prípadoch je potrebné zariadenia po skončení pokusu zlikvidovať.
|
Testované druhy
|
17.
|
Testovaný druh používaný pri takomto type štúdií predstavujú sladkovodné máloštetinavce Lumbriculus variegatus (Müller). Tento druh je tolerantný voči širokej škále typov sedimentov a vo veľkej miere sa využíva na testovanie toxicity a bioakumulácie v sedimente [napr. (3), (5), (7), (9), (13), (15), (16), (22), (23), (24), (25), (26), (27), (28), (29), (30), (31), (32), (33), (34), (35)]. Uvádzať by sa mal pôvod testovaných živočíchov, potvrdenie identity druhu [napr. (36)], ako aj podmienky kultúry. Identifikácia druhu sa nevyžaduje pred každým testom, ak organizmy pochádzajú z internej kultúry.
|
Kultivácia testovaných organizmov
|
18.
|
S cieľom mať dostatočný počet červov na vykonávanie testov toxicity v sedimente je vhodné uchovávať ich v stálej laboratórnej kultúre. Usmernenie pre metódy laboratórnej kultúry druhu Lumbriculus variegatus a zdroje štartovacích kultúr sú uvedené v dodatku 5. Podrobné informácie o kultivovaní tohto druhu sú uvedené v literatúre (3), (7), (27).
|
|
19.
|
Na zabezpečenie toho, aby sa testy vykonávali so živočíchmi toho istého druhu, sa dôrazne odporúča vytvorenie kultúr jedného druhu. Je potrebné tiež zabezpečiť, aby kultúry a najmä červy použité v testoch boli bez zjavných chorôb a abnormalít.
|
Voda
|
20.
|
Ako nadložnú vodu v testoch sa odporúča používať vodu rekonštituovanú podľa kapitoly C.1 tejto prílohy (37). Tá sa môže používať aj pre laboratórne kultúry červov (príprava je opísaná v dodatku 2). Ak je to potrebné, môže sa používať aj prírodná voda. Zvolená voda musí mať takú kvalitu, aby umožnila rast a reprodukciu testovaného druhu počas celého obdobia aklimatizácie a testovania bez toho, že by sa prejavil nezvyčajný vzhľad alebo správanie. Druh Lumbriculus variegatus preukázal schopnosť prežiť, rásť a rozmnožovať sa v tomto type vody (30) a umožňuje maximálnu štandardizáciu testovacích a kultivačných podmienok. Ak sa použije rekonštituovaná voda, je potrebné uviesť jej zloženie a pred použitím by mali byť známe prinajmenšom údaje o jej hodnote pH, obsahu kyslíka a tvrdosti (vyjadrenej v mg CaCO3/l). Užitočné informácie by mohla poskytnúť analýza vody na mikropolutanty pred jej použitím (pozri napr. dodatok 3).
|
|
21.
|
Hodnota pH nadložnej vody by mala byť v rozsahu 6,0 – 9,0 (pozri bod 13). Ak sa očakáva zvýšená produkcia amoniaku, považuje sa za užitočné udržiavať hodnotu pH v rozsahu 6,0 – 8,0. Na testovanie napríklad slabých organických kyselín je vhodné upraviť pufrovaním hodnotu pH vody, ktorá sa má používať v rámci testu, ako sa uvádza v literatúre, napr. pod číslom (16). V prípade prírodnej vody, ktorá sa má používať v rámci testu, by jej celková tvrdosť mala byť v rozsahu 90 – 300 mg CaCO3 na liter. V dodatku 3 sú zhrnuté ďalšie kritériá pre vhodnú vodu na riedenie podľa usmernenia OECD č. 210 (38).
|
Sediment
|
22.
|
Keďže nekontaminované prírodné sedimenty z konkrétneho zdroja nemusia byť k dispozícii po celý rok a autochtónne organizmy, ako aj prítomnosť mikropolutantov môžu ovplyvniť test, prednostne by sa mal používať umelo pripravený sediment (známy aj pod názvom rekonštituovaný, umelý alebo syntetický sediment). Použitie umelo pripraveného sedimentu minimalizuje variabilitu testovacích podmienok, ako aj zavedenie autochtónnej fauny. Uvedený umelo pripravený sediment je založený na umelom sedimente podľa literatúry (6), (39) a (40). Odporúča sa na typ testov podľa literatúry (6), (10), (30), (41), (42), (43):
|
a)
|
4 – 5 % (suchá hmotnosť) rašeliny; dôležité je používať rašelinu vo forme prášku, stupeň rozkladu: ‚stredný‘, jemne drvenú (veľkosť častíc ≤ 0,5 mm) a sušenú iba vzduchom;
|
|
b)
|
20 % ± 1 % (suchá hmotnosť) kaolínovej hliny (obsah kaolinitu podľa možnosti nad 30 %);
|
|
c)
|
75 – 76 % (suchá hmotnosť) kremenného piesku (jemný piesok, veľkosť zrniek: ≤ 2 mm, ale > 50 % častíc by malo mať veľkosť v rozsahu 50 – 200 μm);
|
|
d)
|
deionizovaná voda, 30 – 50 % suchej hmotnosti sedimentu, okrem zložiek suchého sedimentu;
|
|
e)
|
uhličitan vápenatý chemicky čistej kvality (CaCO3) sa pridáva, aby sa upravila hodnota pH konečnej zmesi sedimentu;
|
|
f)
|
celkový obsah organického uhlíka (TOC) v konečnej zmesi by mal byť 2 % (± 0,5 %) suchej hmotnosti sedimentu a mal by sa upraviť pomocou primeraného množstva rašeliny a piesku podľa písmen a) a c);
|
|
g)
|
potrava, napríklad sušené listy pŕhľavy dvojdomej (rod Urtica, v súlade s farmaceutickými normami, na ľudskú spotrebu), alebo zmes sušených listov rodu Urtica s alfa celulózou (1: 1), pri 0,4 – 0,5 % suchej hmotnosti sedimentu, okrem zložiek suchého sedimentu; podrobnosti sú uvedené v dodatku 4.
|
|
|
23.
|
Zdroj rašeliny, kaolínovej hliny, potravy a piesku by mal byť známy. Okrem písmena g) sa aj v kapitole C.27 tejto prílohy (6) uvádzajú alternatívne rastlinné materiály, ktoré sa majú použiť ako zdroj výživy: dehydrované listy moruše (Morus alba), ďateliny plazivej (Trifolium repens), špenátu (Spinacia oleracea) alebo obilných tráv.
|
|
24.
|
Zvolený zdroj potravy by sa mal pridať pred obohacovaním sedimentu testovanou chemikáliou alebo počas neho. Zvolený zdroj potravy by mal umožniť prinajmenšom prijateľnú reprodukciu v kontrolnej vzorke. Analýza umelého sedimentu alebo jeho zložiek na mikropolutanty by mohla pred použitím poskytnúť užitočné informácie. Príklad prípravy umelo pripraveného sedimentu je opísaný v dodatku 4. Prijateľné je tiež zmiešanie suchých zložiek, ak sa preukáže, že po pridaní nadložnej vody nedochádza k oddeleniu zložiek sedimentu (napr. vyplavením častíc rašeliny) a že rašelina alebo sediment prejde dostatočným kondicionovaním (pozri tiež bod 25 a dodatok 4). V prípade umelého sedimentu by mal byť známy prinajmenšom pôvod zložiek, rozdelenie veľkosti častíc (percento piesku, siltu a hliny), celkový obsah organického uhlíka, obsah vody a hodnota pH. Meranie oxidačno-redukčného potenciálu je nepovinné.
|
|
25.
|
V prípade potreby, napríklad na špecifické testovacie účely, môžu slúžiť na testovanie a/alebo kultivovanie sedimentu aj prírodné sedimenty z neznečistených lokalít (3). Ak sa však použije prírodný sediment, mal by byť známy prinajmenšom jeho pôvod (miesto odberu), hodnota pH a obsah amoniaku vo vode obsiahnutej v póroch, celkový obsah organického uhlíka a obsah dusíka, rozdelenie veľkosti častíc (percento piesku, siltu a hliny) a percentuálny obsah vody (7), a nemal by obsahovať žiadne kontaminanty ani iné organizmy, ktoré by mohli súperiť s testovanými organizmami alebo na nich koristiť. Meranie oxidačno-redukčného potenciálu a kapacity výmeny katiónov je nepovinné. Odporúča sa tiež, aby bol prírodný sediment pred obohatením testovanou chemikáliou na sedem dní uvedený do podmienok, ktoré budú prevládať v nasledujúcom teste. Na konci tohto obdobia kondicionovania by sa mala nadložná voda odobrať a odstrániť.
|
|
26.
|
Sediment, ktorý sa má použiť, musí mať takú kvalitu, aby umožnil prežívanie a reprodukciu organizmov v kontrolných vzorkách počas trvania expozície bez toho, že by sa prejavil ich nezvyčajný vzhľad alebo správanie. Červy v kontrolných vzorkách by sa mali zahrabať do sedimentu a mali by sediment požívať. Reprodukcia v kontrolných vzorkách by mala dosahovať prinajmenšom hodnoty podľa kritérií platnosti opísaných v bode 13. Prítomnosť alebo neprítomnosť fekálnych peliet na povrchu sedimentu, ktorá je ukazovateľom požívania sedimentu červami, je potrebné zaznamenať a môže pomôcť pri interpretácii výsledkov testu vo vzťahu k spôsobom expozície. Doplnkové informácie o požívaní sedimentu je možné získať použitím metód opísaných v literatúre (24), (25), (44) a (45), ktoré špecifikujú požívanie sedimentu alebo výber častíc v testovaných organizmoch.
|
|
27.
|
Postupy manipulácie s prírodnými sedimentmi ešte pred ich použitím v laboratóriu sú opísané v literatúre (3), (7), (12). Príprava a skladovanie umelého sedimentu, ktorého použitie sa odporúča v prípade testu s červami rodu Lumbriculus, sú opísané v dodatku 4.
|
Aplikácia testovanej chemikálie
|
28.
|
Testovaná chemikália sa pridá do sedimentu. Keďže v prípade väčšiny testovaných chemikálií sa predpokladá nízka rozpustnosť vo vode, pri príprave zásobného roztoku by sa mali rozpustiť vo vhodnom organickom rozpúšťadle (napr. v acetóne, n-hexáne, cyklohexáne) s čo najmenším objemom. Zo zásobného roztoku by sa mali pripraviť testovacie roztoky zriedením s rovnakým rozpúšťadlom. Toxicita a prchavosť rozpúšťadla, ako aj rozpustnosť testovanej chemikálie vo vybratom rozpúšťadle by mali byť hlavnými kritériami pri výbere vhodného činidla zvyšujúceho rozpustnosť. Pre každú úroveň koncentrácie by sa mal použiť rovnaký objem príslušného roztoku. Sediment by sa mal obohatiť hromadne pre každú úroveň koncentrácie s cieľom minimalizovať variabilitu medzi replikátmi každej úrovne koncentrácie testovanej chemikálie. Každý testovací roztok sa následne zmieša s kremenným pieskom, ako je opísané v bode 22 (napr. 10 g kremenného piesku na jednu testovaciu nádobu). Na to, aby kremenný piesok úplne nasiakol, postačuje objem 0,20 – 0,25 ml roztoku/g piesku. Rozpúšťadlo sa musí následne odpariť do sucha. S cieľom minimalizovať straty testovanej chemikálie pri odparovaní (napr. v závislosti od tlaku pár chemikálie) by sa pokrytý piesok mal použiť ihneď po vysušení. Suchý piesok sa zmieša s vhodným množstvom umelo pripraveného sedimentu zodpovedajúcej úrovne koncentrácie. Množstvo piesku použitého pri príprave zmesi s testovanou chemikáliou sa musí brať do úvahy pri príprave sedimentu (t. j. sediment by sa mal pripraviť s menším množstvom piesku). Hlavnou výhodou tohto postupu je skutočnosť, že do sedimentu sa nedostane prakticky žiadne rozpúšťadlo (7). Alternatívne, napríklad pre pôdny sediment, je možné testovanú chemikáliu pridať obohatením vysušenej a jemne pomletej vzorky sedimentu, ako bolo opísané v prípade kremenného piesku, alebo zamiešaním testovanej chemikálie do mokrého sedimentu a následným odparením všetkého použitého činidla zvyšujúceho rozpustnosť. Je potrebné zabezpečiť, aby sa testovaná chemikália pridávaná do sedimentu dôkladne a rovnomerne distribuovala v sedimente. V prípade potreby je možné analyzovať čiastkové vzorky na potvrdenie cieľovej koncentrácie v sedimente a stanovenie stupňa homogenity. Na potvrdenie cieľovej koncentrácie v sedimente môže byť tiež užitočné analyzovať čiastkové vzorky testovacích roztokov. Keďže na nanášanie testovanej chemikálie na kremenný piesok sa použije rozpúšťadlo, pripraviť by sa mala kontrolná vzorka s rovnakým množstvom rozpúšťadla a testovacích sedimentov. Je potrebné zaznamenať metódu použitú na obohatenie a dôvody na výber konkrétneho postupu obohacovania, ak je iný než uvedené postupy. Metóda obohatenia sa môže prispôsobiť fyzikálno-chemickým vlastnostiam testovanej chemikálie, napríklad aby sa zabránilo stratám spôsobeným odparovaním počas obohacovania alebo vyvažovania. Ďalšie usmernenia o postupoch obohacovania sa uvádzajú v dokumente Environment Canada (1995) (46).
|
|
29.
|
Keď je obohatený sediment pripravený, rozmiestnený do paralelných testovacích nádob a prekrytý testovacou vodou, je vhodné umožniť rozdelenie testovanej chemikálie zo sedimentu do vodnej fázy [napr. (3), (7), (9)]. To by sa podľa možnosti malo vykonať za rovnakých teplotných a prevzdušňovacích podmienok, aké sa použijú v teste. Primeraný čas vyvažovania závisí od konkrétneho sedimentu a chemikálie a môže trvať niekoľko hodín až dní a v zriedkavých prípadoch až niekoľko týždňov (štyri až päť týždňov) [napr. (27) (47)]. V rámci tohto testu sa na rovnovážny stav nečaká, ale odporúča sa vyvažovacie obdobie 48 hodín až sedem dní. Preto sa bude minimalizovať čas na degradáciu testovanej chemikálie. V závislosti od účelu štúdie, napríklad keď sa napodobňujú podmienky životného prostredia, obohatený sediment sa môže nechať vyvažovať alebo zrieť aj dlhší čas.
|
|
30.
|
Na konci tohto vyvažovacieho obdobia, by sa mali odobrať vzorky na analýzu koncentrácie testovanej chemikálie, prinajmenšom z nadložnej vody a sedimentu, aspoň pri najvyššej koncentrácii a jednej nižšej koncentrácii. Toto analytické skúmanie testovanej látky by malo umožniť výpočet hmotnostnej bilancie a vyjadrenie výsledkov na základe meraných počiatočných koncentrácií. Odoberanie vzoriek vo všeobecnosti narúša alebo ničí systém sedimentu a vody. Preto zvyčajne nie je možné použiť rovnaké replikáty na odber vzoriek sedimentu a červov. Je potrebné pripraviť doplnkové ‚analytické‘ nádoby vhodných rozmerov, s ktorými sa zaobchádza rovnakým spôsobom (vrátane prítomnosti testovaných organizmov), ale ktoré sa nepoužijú na biologické pozorovania. Rozmery nádob by sa mali zvoliť tak, aby umožňovali vytvorenie vzoriek dostatočne veľkých pre potreby analytickej metódy. Podrobné informácie o odbere vzoriek sú uvedené v bode 53.
|
VYKONANIE TESTU
Predbežná skúška
|
31.
|
Ak nie sú dostupné žiadne informácie o toxicite testovanej chemikálie voči druhu Lumbriculus variegatus, môže byť užitočné vykonať predbežnú skúšku s cieľom určiť rozsah koncentrácií, ktoré sa majú testovať v rámci konečného testu, a optimalizovať podmienky konečného testu. Na tento účel sa použije súbor koncentrácií testovanej látky s veľkými rozstupmi. Červy sú vystavené každej koncentrácii testovanej chemikálie na určité obdobie (napr. 28 dní ako v rámci konečného testu), ktoré umožňuje odhad vhodných testovacích koncentrácií, pričom sa nevyžadujú žiadne replikáty. Počas predbežného testu je potrebné pozorovať a zaznamenávať správanie červov, napríklad vyhýbanie sa sedimentu, čo môže byť spôsobené testovanou chemikáliou a/alebo sedimentom. Koncentrácie vyššie ako 1 000 mg/kg suchej hmotnosti sedimentu by sa nemali testovať v rámci predbežného testu.
|
Konečný test
|
32.
|
V rámci konečného testu by sa malo použiť najmenej päť koncentrácií, ktoré sa zvolia napríklad na základe výsledkov predbežnej skúšky na vyhľadávanie rozsahu (bod 31), ako je uvedené v bodoch 35, 36, 37 a 38.
|
|
33.
|
Okrem testovacích sérií sa pripravujú kontrolné vzorky (používanie replikátov je opísané v bodoch 36, 37 a 38), ktoré obsahujú všetky zložky okrem testovanej chemikálie. Ak sa pri aplikácii testovanej chemikálie použije činidlo zvyšujúce rozpustnosť, nemalo by mať žiadny významný vplyv na testované organizmy, čo preukážu doplnkové kontrolné vzorky iba s rozpúšťadlom.
|
Koncepcia testu
|
34.
|
Koncepcia testu sa vzťahuje na výber počtu a rozstupu testovacích koncentrácií, počtu nádob pre každú koncentráciu a počtu červov vložených do každej nádoby. Koncepcie odhadu koncentrácií ECx, NOEC a vykonania limitného testu sú opísané v bodoch 35, 36, 37 a 38.
|
|
35.
|
Účinná koncentrácia (napr. EC50, EC25, EC10) a rozsah koncentrácií, v ktorom sa skúmajú účinky testovanej chemikálie, by mali byť v rozsahu koncentrácií použitých v rámci testu. Je potrebné sa vyhnúť extrapolácii hlboko pod najnižšou koncentráciou, ktorá ovplyvňuje testovaný organizmus, alebo nad najvyššou testovacou koncentráciou. Ak sa vo výnimočných prípadoch takáto extrapolácia vykoná, musí sa v správe uviesť úplné vysvetlenie.
|
|
36.
|
Ak sa má odhadnúť koncentrácia ECx, malo by sa testovať najmenej päť koncentrácií a minimálne tri replikáty na každú koncentráciu. Pre kontrolné vzorky a kontrolné vzorky s rozpúšťadlom, ak sa použijú, sa odporúča šesť replikátov s cieľom zlepšiť odhad variability kontrolných vzoriek. V každom prípade je vhodné použiť dostatočné testovacie koncentrácie, ktoré umožnia dobrý modelový odhad. Faktor rozstupu medzi koncentráciami by nemal byť vyšší ako dva (v prípadoch, keď má krivka závislosti reakcie od koncentrácie plytký sklon, je možné urobiť výnimku). Počet replikátov pri každej aplikácii testovanej chemikálie sa môže znížiť, ak sa zvýši počet testovacích koncentrácií s reakciou v rozsahu 5 – 95 %. Zvýšenie počtu replikátov alebo zúženie intervalov testovacích koncentrácií zvyčajne vedie k užším intervalom spoľahlivosti testu.
|
|
37.
|
Ak sa majú odhadnúť hodnoty koncentrácie LOEC/NOEC, malo by sa použiť najmenej päť testovacích koncentrácií s minimálne štyrmi replikátmi (pre kontrolné vzorky a kontrolné vzorky s rozpúšťadlom, ak sa použijú, sa odporúča šesť replikátov s cieľom zlepšiť odhad variability kontrolných vzoriek) a faktor rozstupu medzi koncentráciami by nemal byť vyšší ako dva. Niektoré informácie o štatistickej významnosti, zistené počas testovania hypotézy v rámci kruhového testu testovacej metódy, sú uvedené v dodatku 6.
|
|
38.
|
Môže sa vykonať limitný test (s použitím jednej testovacej koncentrácie a kontrolnej vzorky), ak sa neočakávajú žiadne účinky až do koncentrácie 1 000 mg/kg suchej hmotnosti sedimentu (napr. na základe predbežnej skúšky na vyhľadávanie rozsahu), alebo ak testovanie s jednou koncentráciou bude dostatočné na potvrdenie zisťovanej hodnoty NOEC. V druhom uvedenom prípade by sa do protokolu o skúške malo uviesť podrobné zdôvodnenie výberu hraničnej koncentrácie. Účelom limitného testu je vykonať test pri dostatočne vysokej koncentrácii, ktorá umožní subjektom zodpovedným za rozhodovanie vylúčiť možné toxické účinky testovanej chemikálie a stanoviť hraničnú hodnotu koncentrácie, ktorej výskyt sa neočakáva v žiadnej situácii. Odporúča sa hodnota 1 000 mg/kg (suchej hmotnosti). Zvyčajne je pre vzorky s aplikovanou chemikáliou aj pre kontrolné vzorky potrebných najmenej šesť replikátov. Niektoré informácie o štatistickej významnosti, zistené počas testovania hypotézy v rámci kruhového testu testovacej metódy, sú uvedené v dodatku 6.
|
Podmienky expozície
Testované organizmy
|
39.
|
Test sa vykonáva s počtom minimálne desať červov na každý replikát používaný na stanovenie biologických parametrov. Tento počet červov zodpovedá približne 50 – 100 mg čerstvej biomasy. Za predpokladu obsahu sušiny 17,1 % (48) to znamená približne 9 – 17 mg suchej biomasy na jednu nádobu. V norme U.S. EPA (2000) (7) sa odporúča používať veľkosť náplne nepresahujúcu pomer 1: 50 (suchá biomasa: TOC). V prípade umelo pripraveného sedimentu, opísaného v bode 22, to zodpovedá približne 43 g sedimentu (suchá hmotnosť) na 10 červov pri celkovom obsahu TOC 2,0 % suchého sedimentu. V prípadoch, keď sa používa viac ako desať červov na jednu nádobu, by sa malo zodpovedajúcim spôsobom upraviť množstvo sedimentu a nadložnej vody.
|
|
40.
|
Červy použité v teste by mali pochádzať z toho istého zdroja a mali by to byť živočíchy v podobnom fyziologickom stave (pozri dodatok 5). Vyberať by sa mali červy podobnej veľkosti (pozri bod 39). Odporúča sa pred testom odvážiť čiastkovú vzorku dávky alebo zásoby červov s cieľom odhadnúť ich strednú hmotnosť.
|
|
41.
|
Červy použité v teste sa odoberú z kultúry (podrobnosti sú uvedené v dodatku 5). Veľké (dospelé) živočíchy, ktoré nejavia príznaky nedávnej fragmentácie, sa presunú do sklenených misiek (napr. Petriho misiek) obsahujúcich čistú vodu. Následne sa synchronizujú, ako je opísané v dodatku 5. Po regenerácii v trvaní 10 – 14 dní by sa neporušené úplné červy podobnej veľkosti, ktoré po jemných mechanických podnetoch aktívne plávajú alebo lezú, mali použiť na testovanie. Ak sa podmienky testu líšia od podmienok kultivácie (napr. teplotou, svetelným režimom a nadložnou vodou), fáza aklimatizácie napríklad 24 hodín pri teplote, svetelnom režime a použití rovnakej nadložnej vody ako v rámci testu by mala postačovať, aby sa červy adaptovali na podmienky testu. Adaptované máloštetinavce by sa mali náhodne rozdeliť do testovacích nádob.
|
Kŕmenie
|
42.
|
Keďže potrava sa pridáva do sedimentu pred aplikáciou testovanej chemikálie (alebo počas nej), červy sa počas testu ďalej nekŕmia.
|
Svetlo a teplota
|
43.
|
Dĺžka fotoperiódy v kultúre a v rámci testu je zvyčajne 16 hodín (3), (7). Intenzita svetla by sa mala udržiavať na nízkej úrovni (napr. 100 – 500 lux), aby sa na povrchu sedimentu napodobňovali prírodné podmienky, a merať by sa mala najmenej raz počas trvania expozície. Teplota by mala byť počas celého testu 20 °C ± 2 °C. Počas jedného daného termínu merania by rozdiel v teplote medzi testovacími nádobami nemal byť vyšší ako ± 1 °C. Testovacie nádoby by mali byť náhodne umiestnené v testovacom inkubátore alebo testovacom priestore, napríklad s cieľom minimalizovať skreslenie reprodukcie v dôsledku umiestnenia nádoby.
|
Prevzdušňovanie
|
44.
|
Nadložná voda v testovacích nádobách by sa mala jemne prevzdušňovať (napr. 2 až 4 bubliny za sekundu) prostredníctvom Pasteurovej pipety umiestnenej približne 2 cm nad povrchom sedimentu tak, aby sa minimalizovalo narušenie sedimentu. Treba dbať na to, aby koncentrácia rozpusteného kyslíka neklesla pod 30 % hodnoty rozpustnosti vzdušného kyslíka. Prívod vzduchu by sa mal kontrolovať a v prípade potreby upraviť najmenej raz denne v pracovné dni.
|
Meranie kvality vody
|
45.
|
V nadložnej vode by sa mali merať tieto parametre kvality vody:
|
Teplota:
|
najmenej v jednej testovacej nádobe na každú úroveň koncentrácie a v jednej testovacej nádobe s kontrolnou vzorkou, raz týždenne a na začiatku a na konci expozície; ak je to možné, doplnkovo sa môže zaznamenať teplota v okolitom médiu (okolitý vzduch alebo vodný kúpeľ), napríklad v hodinových intervaloch
|
|
Obsah rozpusteného kyslíka:
|
najmenej v jednej testovacej nádobe na každú úroveň koncentrácie a v jednej testovacej nádobe s kontrolnou vzorkou, raz týždenne a na začiatku a na konci expozície; vyjadrený v mg/l a % rozpustnosti vzdušného kyslíka (ASV)
|
|
Prívod vzduchu:
|
mal by sa kontrolovať najmenej raz denne v pracovné dni a v prípade potreby upraviť
|
|
pH:
|
najmenej v jednej testovacej nádobe na každú úroveň koncentrácie a v jednej testovacej nádobe s kontrolnou vzorkou, raz týždenne a na začiatku a na konci expozície
|
|
Celková tvrdosť vody:
|
najmenej v jednom replikáte kontrolnej vzorky a v jednej testovacej nádobe s najvyššou koncentráciou, na začiatku a na konci expozície; vyjadrený v mg/l CaCO3
|
|
Celkový obsah amoniaku:
|
najmenej v jednom replikáte kontrolnej vzorky a v jednej testovacej nádobe na každú úroveň koncentrácie, na začiatku a na konci expozície a následne trikrát týždenne; vyjadrený v mg/l NH4
+ alebo NH3 alebo ako celkový amoniak.
|
Ak si meranie parametrov kvality vody vyžaduje odobratie významných vzoriek vody z nádob, môže byť vhodné vytvoriť samostatné nádoby na meranie kvality vody, aby sa nemenil objemový pomer vody a sedimentu.
|
Biologické pozorovania
|
46.
|
Počas expozície by sa mali testovacie nádoby pozorovať s cieľom vizuálne posúdiť akékoľvek rozdiely v správaní červov (napr. vyhýbanie sa sedimentu, fekálne pelety viditeľné na povrch sedimentu) v porovnaní s kontrolnými vzorkami. Pozorovania je potrebné zaznamenať.
|
|
47.
|
Na konci testu sa preskúma každý replikát (doplnkové nádoby určené na chemické analýzy môžu byť z preskúmania vylúčené). Vhodná metóda by sa mala použiť na vybratie všetkých červov z testovacej nádoby. Treba dbať na to, aby sa všetky červy vybrali nezranené. Jednou z možných metód je získanie červov zo sedimentu preosiatím. Použiť sa môže sito z nehrdzavejúcej ocele s vhodnou veľkosťou ôk. Väčšina nadložnej vody sa opatrne vyleje a zvyšný sediment s vodou sa pretrepe, aby vznikol kal, ktorý je možné preosiať cez sito. Ak sa použije sito s otvormi 500 μm, väčšina častíc sedimentu prejde sitom veľmi rýchlo. Celé preosiatie by sa však malo urobiť rýchlo, aby sa zabránilo červom vliezť do ôk sita, alebo cez ne preliezť. Ak sa použije sito s otvormi 250 μm, zabráni to červom vliezť do ôk sita, alebo cez ne preliezť. Je však potrebné dbať na to, aby na site zostalo čo najmenej častíc sedimentu. Preosiaty kal z každej nádoby replikátu sa môže preosiať druhýkrát, aby sa zabezpečilo vybratie všetkých červov. Alternatívnou metódou by mohlo byť zahriatie sedimentu uložením testovacích nádob do vodného kúpeľa s teplotou 50 – 60 °C. Červy opustia sediment a je možné ich vyzbierať z povrchu sedimentu pomocou hladkej pipety so širokým hrotom. Inou alternatívnou metódou by mohlo byť vytvoriť kal zo sedimentu a naliať ho na plytkú misku vhodnej veľkosti. Z plytkej vrstvy kalu sa červy môžu pozbierať pomocou oceľovej ihly alebo hodinárskej pinzety (použije sa skôr ako vidlička než ako kliešte, aby sa zabránilo poraneniu červov) a preniesť do čistej vody. Červy sa po oddelení z kalu sedimentu opláchnu v testovacom médiu a spočítajú.
|
|
48.
|
Nezávisle od použitej metódy by laboratóriá mali preukázať, že ich zamestnanci sú schopní získať priemerne najmenej 90 % organizmov z celého sedimentu. Napríklad určitý počet testovaných organizmov by sa mohol vložiť do sedimentu kontrolnej vzorky alebo testovacej vzorky a po 1 hodine by sa mohli vybrať a bolo by možné posúdiť mieru ich opätovného získania (7).
|
|
49.
|
Celkový počet žijúcich a mŕtvych jedincov na jeden replikát by sa mal zaznamenať a zhodnotiť. Za mŕtve sa považujú tieto skupiny červov:
|
a)
|
nereagujú na jemný mechanický podnet;
|
|
b)
|
objavujú sa známky rozkladu (v kombinácii s písm. a);
|
|
c)
|
počet chýbajúcich červov.
|
Okrem toho sa živé červy môžu zaradiť do jednej z troch skupín:
|
a)
|
veľké úplné červy (dospelé) bez regenerovaných častí tela;
|
|
b)
|
úplné červy s regenerovanými svetlejšie sfarbenými časťami tela (t. j. novou zadnou časťou, novou prednou časťou alebo s novou prednou aj zadnou časťou);
|
|
c)
|
neúplné červy (t. j. nedávno fragmentované červy s neregenerovanými časťami tela).
|
Tieto doplnkové pozorovania nie sú povinné, ale môžu sa použiť na doplňujúcu interpretáciu biologických výsledkov (napr. vysoký počet červov zaradených do skupiny c môže poukazovať na meškanie reprodukcie alebo regenerácie v danej vzorke s aplikovanou chemikáliou). Okrem toho, ak sa pozorujú rozdiely vo výzore (napr. poškodenia povrchu tela, edémové časti tela) medzi červami zo vzorky s aplikovanou chemikáliou a červami z kontrolnej vzorky, je potrebné ich zaznamenať.
|
|
50.
|
Hneď po spočítaní/zhodnotení sa živé červy nájdené v každom replikáte preložia na suché, vopred zvážené a označené misky váh (jedna na každý replikát) a usmrtia sa pomocou kvapky etanolu na každú misku. Misky sa umiestnia do sušiacej piecky a pri teplote 100 °C ± 5 °C sa sušia celú noc, potom sa po ochladení v exsikátore odvážia a stanoví sa suchá hmotnosť červov (podľa možnosti v gramoch, najmenej na 4 desatinné miesta).
|
|
51.
|
Okrem celkovej suchej hmotnosti sa môže stanoviť suchá hmotnosť bez popola, podľa opisu v literatúre (49), aby sa zohľadnili anorganické zložky pochádzajúce z požitého sedimentu a prítomné v tráviacom trakte červov
|
|
52.
|
Množstvo biomasy sa určí ako celkové množstvo biomasy na jeden replikát vrátane dospelých a juvenilných červov. Pri stanovení množstva biomasy na replikát by sa nemali brať do úvahy mŕtve červy.
|
Overovanie koncentrácie testovanej chemikálie
Odber vzoriek
|
53.
|
Vzorky na chemickú analýzu testovanej chemikálie by sa mali odobrať aspoň pri najvyššej koncentrácii a jednej nižšej koncentrácii, prinajmenšom na konci fázy vyvažovania (pred pridaním testovaných organizmov) a na konci testu. Na analýzu by sa mali odobrať prinajmenšom vzorky časti sedimentu a nadložnej vody. V rámci každého termínu odberu vzoriek by sa mali odobrať najmenej dve vzorky na matricu a na vzorku s aplikovanou chemikáliou. Jeden duplikát vzorky sa môže uložiť ako rezerva (ktorá sa bude analyzovať napríklad v prípade, že výsledok počiatočnej analýzy neleží v rozsahu ± 20 % od nominálnej koncentrácie). V prípade osobitných chemických vlastností, napríklad ak sa očakáva rýchla degradácia testovanej chemikálie, sa na základe odborného posúdenia môže spresniť analytický harmonogram (napr. častejšie odbery vzoriek, analýza viacerých úrovní koncentrácie). Vzorky sa môžu odobrať v strednom termíne (napr. v 7. deň po začatí expozície).
|
|
54.
|
Vzorka nadložnej vody by sa mala opatrne odobrať odliatím alebo odčerpaním tak, aby sa minimalizovalo narušenie sedimentu. Objem vzorky je potrebné zaznamenať.
|
|
55.
|
Po odliatí nadložnej vody by sa mal sediment homogenizovať a preložiť do vhodnej nádoby. Hmotnosť vzorky mokrého sedimentu sa zaznamená.
|
|
56.
|
Ak sa dodatočne požaduje analýza testovanej chemikálie v pórovej vode, je potrebné homogenizované a odvážené vzorky sedimentu odstrediť, aby sa získala pórová voda. Napríklad približne 200 ml mokrého sedimentu sa môže uložiť do odstreďovacej kadičky s objemom 250 ml. Potom by sa vzorky mali odstreďovať bez filtrácie, s cieľom izolovať pórovú vodu, napríklad 30 – 60 minút pri odstredivom zrýchlení 10 000 ± 600 × g a pri teplote nepresahujúcej teplotu používanú v rámci testu. Po odstredení sa supernatant opatrne vyleje alebo vyberie pipetou tak, aby v ňom nezostala žiadna častica sedimentu, a objem sa zaznamená. Zaznamená sa aj hmotnosť zostávajúcich peliet sedimentu. Tento údaj môže uľahčiť odhad hmotnostnej bilancie alebo výťažnosti testovanej chemikálie v systéme voda – sediment, ak sa suchá hmotnosť sedimentu určuje v každom termíne odberu vzorky. V niektorých prípadoch nemusí byť možné analyzovať koncentrácie v pórovej vode, lebo vzorka je príliš malá.
|
|
57.
|
Ak sa analýza neurobí okamžite, všetky vzorky by sa mali skladovať vhodnou metódou, napríklad podľa podmienok skladovania odporúčaných na dosiahnutie minimálnej degradácie danej testovanej chemikálie (napr. environmentálne vzorky sa bežne skladujú v tme pri teplote – 18 °C). Pred začiatkom štúdie je potrebné získať informácie o vhodných podmienkach skladovania danej testovanej chemikálie – napríklad o trvaní a teplote skladovania, postupoch extrakcie atď.
|
Analytická metóda
|
58.
|
Celý postup v zásade závisí od presnosti a citlivosti analytickej metódy použitej v prípade testovanej chemikálie, preto je potrebné experimentálne overiť, či sú presnosť a reprodukovateľnosť chemickej analýzy, ako aj výťažnosť testovanej chemikálie zo vzoriek sedimentu a vody pre danú metódu uspokojivé, aspoň pre najnižšiu a najvyššiu testovanú koncentráciu. Treba tiež overiť, či testovaná chemikália nie je prítomná v kontrolných komorách vo vyšších koncentráciách, ako je kvantifikačný limit. Ak je to potrebné, opraví sa hodnota nominálnej koncentrácie pre výťažnosť obohatených vzoriek na kontrolu kvality (napr. ak je výťažnosť mimo rozsahu 80 – 120 % obohateného množstva). So všetkými vzorkami by sa počas celého testu malo zaobchádzať tak, aby sa minimalizovala kontaminácia a strata (napr. v dôsledku adsorpcie testovanej chemikálie na zariadenie na odber vzoriek).
|
|
59.
|
Výťažnosť testovanej chemikálie, kvantifikačný limit a limit detekcie v sedimente a vode by sa mali zaznamenať a uviesť v správe.
|
ÚDAJE A PODÁVANIE SPRÁV
Spracovanie výsledkov
|
60.
|
Hlavné povinné premenné hodnoty reakcie v rámci testu, ktoré sa majú štatisticky hodnotiť, sú množstvo biomasy a celkový počet červov v jednom replikáte. Voliteľne by sa mohli hodnotiť aj reprodukcia (ako zvýšenie počtu červov) a rast (ako zvýšenie množstva suchej biomasy). V tomto prípade by sa mal získať odhad suchej hmotnosti červov na začiatku expozície, napríklad meraním suchej hmotnosti reprezentatívnej čiastkovej vzorky z dávky synchronizovaných červov, ktoré sa majú použiť v rámci testu.
|
|
61.
|
Hoci mortalita nie je parametrom tohto testu, mala by sa hodnotiť v najväčšej možnej miere. Pri odhadovaní mortality by sa za mŕtve mali považovať červy, ktoré nereagujú na jemný mechanický podnet alebo javia príznaky rozkladu, ako aj chýbajúce červy. Mortalita by sa mala zaznamenať a brať do úvahy pri interpretácii výsledkov testu.
|
|
62.
|
Účinné koncentrácie by mali byť vyjadrené v mg/kg suchej hmotnosti sedimentu. Ak je výťažnosť testovanej chemikálie nameraná na začiatku expozície v sedimente alebo v sedimente a nadložnej vode 80 – 120 % nominálnej koncentrácie, účinné koncentrácie (ECx, LOEC, NOEC) sa môžu vyjadriť na základe nominálnej koncentrácie. Ak sa výťažnosť odchyľuje od nominálnej koncentrácie o viac ako ± 20 % nominálnej koncentrácie, účinné koncentrácie (ECx, LOEC, NOEC) by mali byť založené na koncentráciách pôvodne nameraných na začiatku expozície, napríklad pri zohľadnení hmotnostnej bilancie testovanej chemikálie v testovacom systéme (pozri bod 30). V takýchto prípadoch je možné získať doplnkové informácie z analýzy zásobných roztokov a/alebo aplikačných roztokov s cieľom potvrdiť, že testovacie sedimenty boli pripravené správne.
|
ECx
|
63.
|
Hodnoty ECx pre parametre uvedené v bode 60 sa vypočítajú pomocou vhodných štatistických metód (napr. probitová analýza, logistická alebo Weibullova funkcia, upravená Spearman-Karberova metóda alebo jednoduchá interpolácia). Usmernenia o štatistickom hodnotení sú uvedené v literatúre (15) a (50). Koncentrácia ECx sa získa zadaním hodnoty, ktorá zodpovedá x % strednej hodnoty nameranej v kontrolnej vzorke, do príslušnej rovnice. Pri výpočte EC50 alebo akejkoľvek inej hodnoty ECx by sa mali stredné hodnoty pre každú vzorku s aplikovanou chemikáliou (

) podrobiť regresnej analýze. |
NOEC/LOEC
|
64.
|
Ak je cieľom štatistickej analýzy stanovenie koncentrácie NOEC/LOEC, potrebné sú štatistické údaje pre každú nádobu (jednotlivé nádoby sa považujú za replikáty). Používať by sa mali vhodné štatistické metódy. Vo všeobecnosti sa nepriaznivé účinky testovanej chemikálie v porovnaní s kontrolnými vzorkami skúmajú pomocou jednostranného (obmedzeného) testovania hypotéz pri hodnote p ≤ 0,05. Príklady sú uvedené v ďalších bodoch. Usmernenia k výberu vhodných štatistických metód sú uvedené v literatúre (15) a (50).
|
|
65.
|
Normálne rozloženie údajov sa môže testovať napríklad Kolmogorovovým-Smirnovovým testom dobrej zhody, testom pomeru rozsahu k štandardnej odchýlke (R/s test) alebo Shapiro-Wilkovým testom (dvojstranný, p ≤ 0,05). Na testovanie homogenity variancie sa môže použiť Cochranov test, Levenov test alebo Barlettov test (dvojstranný, p ≤ 0,05). Ak sú splnené požiadavky postupov parametrických testov (normalita, homogenita variancie), môže sa vykonať jednostranná analýza variancie (ANOVA) a následné testy viacnásobného porovnania. Párové porovnania (napr. Dunnettov t-test) alebo testy zmiernenia trendu (napr. Williamsov test) sa môžu použiť na výpočet, či existujú výrazné rozdiely (p ≤ 0,05) medzi kontrolnými vzorkami a vzorkami s rôznymi koncentráciami testovanej chemikálie. Inak by sa na stanovenie koncentrácií NOEC a LOEC mali použiť neparametrické metódy (napr. Bonferroniho U-test podľa Holma alebo Jonckheereho-Terpstrov test trendu).
|
Limitný test
|
66.
|
Ak sa vykonal limitný test (porovnanie kontrolnej vzorky a len jednej vzorky s aplikovanou chemikáliou) a ak sú splnené požiadavky postupov parametrických testov (normalita, homogenita), metrické reakcie (celkový počet červov a množstvo biomasy ako suchá hmotnosť červov) je možné hodnotiť pomocou Studentovho testu (t-test). Ak tieto požiadavky nie sú splnené, je možné použiť t-test nerovnakej variancie (Welchov t-test) alebo neparametrický test, ako napríklad Mannov-Whitneyho U-test. Niektoré informácie o štatistickej významnosti, zistené počas testovania hypotézy v rámci medzilaboratórnej porovnávacej skúšky testovacej metódy, sú uvedené v dodatku 6.
|
|
67.
|
S cieľom určiť významné rozdiely medzi kontrolnými vzorkami (kontrolné vzorky a kontrolné vzorky s rozpúšťadlom) sa môžu replikáty každej kontrolnej vzorky testovať tak, ako je uvedené pre limitný test. V prípade, že sa týmito testami nezistia významné rozdiely, všetky replikáty kontrolných vzoriek a kontrolných vzoriek s rozpúšťadlom sa môžu spojiť. Inak by sa mali všetky vzorky s aplikovanou chemikáliou porovnať s kontrolnými vzorkami s rozpúšťadlom.
|
Interpretácia výsledkov
|
68.
|
Výsledky by sa mali interpretovať opatrne, ak sa vyskytli odchýlky od tejto testovacej metódy, a v prípadoch, keď namerané hodnoty testovacích koncentrácií dosahujú úrovne blízke detekčným limitom použitej analytickej metódy. Všetky odchýlky od tejto testovacej metódy sa musia zaznamenať.
|
Protokol o skúške
|
69.
|
Protokol o skúške by mal obsahovať prinajmenšom tieto informácie:
|
—
|
Testovaná chemikália:
|
—
|
identifikačné údaje chemikálie (bežný názov, chemický názov, štrukturálny vzorec, číslo CAS atď.) vrátane čistoty a analytickej metódy na kvantifikáciu testovanej chemikálie; zdroj testovanej chemikálie, identita a koncentrácia akéhokoľvek použitého rozpúšťadla,
|
|
—
|
akékoľvek dostupné informácie o fyzikálnom charaktere a fyzikálno-chemických vlastnostiach, získané pred začiatkom testu (napr. rozpustnosť vo vode, tlak pary, rozdeľovacia konštanta v pôde (alebo v sedimente, ak je k dispozícii), log Kow, stabilita vo vode atď.).
|
|
|
—
|
Testované druhy:
|
—
|
vedecký názov, pôvod, všetky zásahy uskutočnené pred testom, aklimatizácia, kultivačné podmienky atď.
|
|
|
—
|
Podmienky testu:
|
—
|
použitý postup testovania (napr. statický, semistatický alebo prietokový),
|
|
—
|
koncepcia testu (napr. počet, materiál a veľkosť testovacích komôr, objem vody na jednu nádobu, hmotnosť a objem sedimentu na jednu nádobu, (pre prietokový alebo semistatický postup: rýchlosť výmeny celého objemu vody), akékoľvek prevzdušňovanie používané pred testom a počas neho, počet replikátov, počet červov v jednom replikáte na začiatku expozície, počet testovacích koncentrácií, dĺžka obdobia kondicionovania, vyvažovania a expozície, frekvencia odberov vzoriek),
|
|
—
|
hĺbka sedimentu a nadložnej vody,
|
|
—
|
metóda úpravy testovanej chemikálie pred testom a metóda obohatenia/aplikácie testovanej chemikálie,
|
|
—
|
nominálne testovacie koncentrácie, podrobnosti týkajúce sa odberu vzoriek na chemickú analýzu a analytické metódy, ktorými sa získali hodnoty koncentrácie testovanej chemikálie,
|
|
—
|
vlastnosti sedimentu, ako sú opísané v bodoch 24 a 25, a akékoľvek ďalšie vykonané merania, príprava umelo pripraveného sedimentu,
|
|
—
|
príprava vody použitej na testovanie (ak sa použije rekonštituovaná voda) a jej vlastnosti (koncentrácia kyslíka, pH, vodivosť, tvrdosť a výsledky iných vykonaných meraní) pred začatím testu,
|
|
—
|
podrobné informácie o kŕmení vrátane druhu potravy, prípravy, množstva a kŕmneho režimu,
|
|
—
|
intenzita svetla a dĺžka fotoperiódy, resp. fotoperiód,
|
|
—
|
metódy použité na stanovenie všetkých biologických parametrov (napr. odber vzoriek, inšpekcie, váženie testovaných organizmov) a všetky abiotické parametre (napr. parametre kvality vody a sedimentu),
|
|
—
|
objem a/alebo hmotnosť všetkých vzoriek na chemickú analýzu
|
|
—
|
podrobné informácie o príprave všetkých vzoriek na chemickú analýzu vrátane údajov o príprave, skladovaní, postupoch obohacovania, extrakcii a analytických postupoch (a presnosti) testovanej chemikálie a výťažnosti testovanej chemikálie.
|
|
|
—
|
Výsledky:
|
—
|
kvalita vody v testovacích nádobách (pH, teplota, koncentrácia rozpusteného kyslíka, tvrdosť, koncentrácia amoniaku a výsledky iných vykonaných meraní),
|
|
—
|
celkový obsah organického uhlíka (TOC), pomer suchej hmotnosti k čerstvej hmotnosti, pH sedimentu a výsledky iných vykonaných meraní,
|
|
—
|
celkový počet červov a počet úplných a neúplných červov, ak je stanovený, v každej skúšobnej komore na konci testu,
|
|
—
|
suchá hmotnosť červov v každej skúšobnej komore na konci testu a suchá hmotnosť čiastkovej vzorky červov na začiatku testu, ak sa meria,
|
|
—
|
akékoľvek pozorované nenormálne správanie v porovnaní s kontrolnými vzorkami (napr. vyhýbanie sa sedimentu, prítomnosť alebo neprítomnosť fekálnych peliet),
|
|
—
|
celková pozorovaná mortalita,
|
|
—
|
odhady toxických konečných parametrov (napr. ECx, NOEC a/alebo LOEC) a štatistické metódy použité na ich stanovenie,
|
|
—
|
nominálne testovacie koncentrácie, namerané testovacie koncentrácie a výsledky všetkých analýz na stanovenie koncentrácie testovanej chemikálie v testovacích nádobách,
|
|
—
|
akékoľvek odchýlky od kritéria platnosti.
|
|
|
—
|
Hodnotenie výsledkov:
|
—
|
súlad výsledkov s kritériami platnosti uvedenými v bode 13,
|
|
—
|
rozbor výsledkov vrátane každého vplyvu na výsledok testu vyplývajúceho z odchýlok od tejto testovacej metódy.
|
|
|
LITERATÚRA
|
1.
|
EC (2003). Technical Guidance Document in support of Commission Directive 93/67/EEC on Risk Assessment for new notified substances, Commission Regulation (EC) No 1488/94 on Risk Assessment for existing substances and Directive 98/8/EC of the European Parliament and of the Council concerning the placing of biocidal products on the market; Part I – IV. Office for Official Publications of the EC (European Commission), Luxembourg.
|
|
2.
|
OECD (1992a). Report of the OECD workshop on effects assessment of chemicals in sediment. OECD Monographs No. 60. Organisation for Economic Co-operation and Development (OECD), Paris.
|
|
3.
|
ASTM International (2000). Standard guide for the determination of the bioaccumulation of sediment-associated contaminants by benthic invertebrates, E 1688-00a. In ASTM International 2004 Annual Book of Standards. Volume 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
|
|
4.
|
ASTM International (2002). Standard Test Method for Measuring the Toxicity of Sediment-Associated Contaminants with Freshwater Invertebrates, E1706-00. In ASTM International 2004 Annual Book of Standards. Volume 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
|
|
5.
|
Phipps, G.L., Ankley, G.T., Benoit, D.A. and Mattson, V.R. (1993). Use of the aquatic Oligochaete Lumbriculus variegatus for assessing the toxicity and bioaccumulation of sediment-associated contaminants. Environ.Toxicol. Chem. 12, 269-279.
|
|
6.
|
Chapter C.27 of this Annex, ‚Sediment-water chironomid toxicity test using spiked sediment‘.
|
|
7.
|
U.S. EPA (2000). Methods for measuring the toxicity and bioaccumulation of sediment-associated contaminants with freshwater invertebrates. Second Edition. EPA 600/R-99/064, U.S. Environmental Protection Agency, Duluth, MN, March 2000.
|
|
8.
|
Environment Canada (1997). Test for Growth and Survival in Sediment using Larvae of Freshwater Midges (Chironomus tentans or Chironomus riparius). Biological Test Method. Report SPE 1/RM/32. December 1997.
|
|
9.
|
Hill, I.R., Matthiessen, P., Heimbach, F. (eds), 1993, Guidance document on Sediment Toxicity Tests and Bioassays for freshwater and Marine Environments, From the SETAC-Europe Workshop On Sediment Toxicity Assessment, 8-10 November 1993, Renesse (NL).
|
|
10.
|
BBA (1995). Long-term toxicity test with Chironomus riparius: Development and validation of a new test system. Edited by M. Streloke and H.Köpp. Berlin 1995.
|
|
11.
|
Riedhammer C. & B. Schwarz-Schulz (2001). The Newly Proposed EU Risk Assessment Concept for the Sediment Compartment. J. Soils Sediments 1(2), 105-110.
|
|
12.
|
ASTM International (2004). Standard guide for collection, storage, characterisation, and manipulation of sediment for toxicological testing and for selection of samplers used to collect benthic invertebrates. American Society for Testing and Materials, E 1391-03.
|
|
13.
|
Egeler, Ph., Meller, M., Schallnaß, H.J. & Gilberg, D. (2005). Validation of a sediment toxicity test with the endobenthic aquatic oligochaete Lumbriculus variegatus by an international ring test. In co-operation with R. Nagel and B. Karaoglan. Report to the Federal Environmental Agency (Umweltbundesamt Berlin), R&D No.: 202 67 429.
|
|
14.
|
OECD (2000). Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. OECD Environment, Health and Safety Publications, Series on Testing and Assessment No. 23.
|
|
15.
|
Environment Canada (2003). Guidance Document on Statistical Methods for Environmental Toxicity Tests; fifth draft, March 2003; Report EPS 1/RM/___
|
|
16.
|
Nikkilä A., Halme A., Kukkonen J.V.K. (2003). Toxicokinetics, toxicity and lethal body residues of two chlorophenols in the oligochaete worm, Lumbriculus variegatus, in different sediments. Chemosphere 51: 35-46.
|
|
17.
|
Baily H.C., & Liu D.H.W. (1980). Lumbriculus variegatus, a Benthic Oligochaete, as a Bioassay Organism. p. 205-215. In J.C. Eaton, P.R. Parrish, and A.C. Hendricks (eds). Aquatic Toxicology, ASTM STP 707. American Society for Testing and Materials.
|
|
18.
|
Chapman K. K., Benton M. J., Brinkhurst R. O. & Scheuerman P. R. (1999). Use of the aquatic oligochaetes Lumbriculus variegatus and Tubifex tubifex for assessing the toxicity of copper and cadmium in a spiked-artificial-sediment toxicity test. Environmental Toxicology. 14(2): 271-278.
|
|
19.
|
Meyer J.S., Boese C.J. & Collyard S.A. (2002). Whole-body accumulation of copper predicts acute toxicity to an aquatic oligochaete (Lumbriculus variegatus) as pH and calcium are varied. Comp. Biochem. Physiol. Part C 133:99-109.
|
|
20.
|
Schubauer-Berigan M.K., Dierkes J.R., Monson P.D. & Ankley G.T. (1993). pH-dependent toxicity of cadmium, copper, nickel, lead and zinc to Ceriodaphnia dubia, Pimephales promelas, Hyalella azteca and Lumbriculus variegatus. Environ. Toxciol. Chem. 12(7):1261-1266.
|
|
21.
|
West, C.W., V.R. Mattson, E.N. Leonard, G.L. Phipps & G.T. Ankley (1993). Comparison of the relative sensitivity of three benthic invertebrates to copper-contaminated sediments from the Keweenaw Waterway. Hydrobiol. 262:57-63.
|
|
22.
|
Ingersoll, C.G., Ankley, G.T., Benoit D.A., Brunson, E.L., Burton, G.A., Dwyer, F.J., Hoke, R.A., Landrum, P. F., Norberg-King, T. J. and Winger, P.V. (1995). Toxicity and bioaccumulation of sediment-associated contaminants using freshwater invertebrates: A review of methods and applications. Environ. Toxicol. Chem. 14, 1885-1894.
|
|
23.
|
Kukkonen, J. and Landrum, P.F. (1994). Toxicokinetics and toxicity of sediment-associated Pyrene to Lumbriculus variegatus (Oligochaeta). Environ. Toxicol. Chem. 13, 1457-1468.
|
|
24.
|
Leppänen, M.T. & Kukkonen, J.V.K. (1998a). Relationship between reproduction, sediment type and feeding activity of Lumbriculus variegatus (Müller): Implications for sediment toxicity testing. Environ. Toxicol. Chem. 17: 2196-2202.
|
|
25.
|
Leppänen, M.T. & Kukkonen, J.V.K. (1998b). Factors affecting feeding rate, reproduction and growth of an oligochaete Lumbriculus variegatus (Müller). Hydrobiologia 377: 183-194.
|
|
26.
|
Landrum, P.F., Gedeon, M.L., Burton, G.A., Greenberg. M.S., & Rowland, C.D. (2002). Biological Responses of Lumbriculus variegatus Exposed to Fluoranthene-Spiked Sediment. Arch. Environ. Contam. Toxicol. 42: 292-302.
|
|
27.
|
Brunson, E.L., Canfield, T.J., Ingersoll, C.J. & Kemble, N.E. (1998). Assessing the bioaccumulation of contaminants from sediments of the Upper Mississippi river using field-collected oligochaetes and laboratory-exposed Lumbriculus variegatus. Arch. Environ. Contam. Toxicol. 35, 191-201.
|
|
28.
|
Ingersoll, C.G., Brunson, E.L., Wang N., Dwyer, F.J., Ankley, G.T., Mount D.R., Huckins J., Petty. J. and Landrum, P. F. (2003). Uptake and depuration of non-ionic organic contaminants from sediment by the oligochaete, Lumbriculus variegatus. Environmental Toxicology and Chemistry 22, 872-885.
|
|
29.
|
Rodriguez, P. & Reynoldson, T.B. (1999). Laboratory methods and criteria for sediment bioassessment. In: A. Mudroch, J.M. Azcue & P. Mudroch (eds.): Manual of Bioassessment of aquatic sediment quality. Lewis Publishers, Boca Raton, CRC Press LLC.
|
|
30.
|
Liebig, M., Egeler, Ph. Oehlmann, J., & Knacker, Th. (2005). Bioaccumulation of14 C-17α-ethinylestradiol by the oligochaete Lumbriculus variegatus in artificial sediment. Chemosphere 59, 271-280.
|
|
31.
|
Brust, K., O. Licht, V. Hultsch, D. Jungmann & R. Nagel (2001). Effects of Terbutryn on Aufwuchs and Lumbriculus variegatus in Artificial Indoor Streams. Environ. Toxicol. Chemistry, Vol. 20, pp. 2000–2007.
|
|
32.
|
Oetken, M., K.-U. Ludwichowski & R. Nagel (2000). Sediment tests with Lumbriculus variegatus and Chironomus riparius and 3,4-dichloroaniline (3,4-DCA) within the scope of EG-AltstoffV. By order of the Federal Environmental Agency (Umweltbundesamt Berlin), FKZ 360 12 001, March 2000.
|
|
33.
|
Leppänen M.T. & Kukkonen J.V.K. (1998). Relative importance of ingested sediment and porewater as bioaccumulation routes for pyrene to oligochaete (Lumbriculus variegatus, Müller). Environ. Sci. Toxicol. 32, 1503-1508.
|
|
34.
|
Dermott R. & Munawar M. (1992). A simple and sensitive assay for evaluation of sediment toxicity using Lumbriculus variegatus (Müller). Hydrobiologia 235/236: 407-414.
|
|
35.
|
Drewes C.D. & Fourtner C.R. (1990). Morphallaxis in an aquatic oligochaete, Lumbriculus variegatus: Reorganisation of escape reflexes in regenerating body fragments. Develop. Biol. 138: 94-103.
|
|
36.
|
Brinkhurst, R.O. (1971). A guide for the identification of British aquatic oligochaeta. Freshw. Biol. Assoc., Sci. Publ. No. 22.
|
|
37.
|
Chapter C.1 of this Annex, Fish, Acute Toxicity Test.
|
|
38.
|
OECD (1992c). Guidelines for Testing of Chemicals No. 210. Fish, Early-life Stage Toxicity Test. OECD, Paris.
|
|
39.
|
Egeler, Ph., Römbke, J., Meller, M., Knacker, Th., Franke, C., Studinger, G. & Nagel, R. (1997). Bioaccumulation of lindane and hexachlorobenzene by tubificid sludgeworms (Oligochaeta) under standardised laboratory conditions. Chemosphere 35, 835-852.
|
|
40.
|
Meller, M., P. Egeler, J. Roembke, H. Schallnass, R. Nagel and B. Streit. (1998). Short-term Toxicity of Lindane, Hexachlorobenzene and Copper Sulphate on Tubificid Sludgeworms (Oligochaeta) in Artificial Media. Ecotox. and Environ. Safety, 39, 10-20.
|
|
41.
|
Egeler, Ph., Römbke, J., Knacker, Th., Franke, C. & Studinger, G. (1999). Workshop on ‚Bioaccumulation: Sediment test using benthic oligochaetes‘, 26.-27.4.1999, Hochheim/Main, Germany. Report on the R+D-project No. 298 67 419, Umweltbundesamt, Berlin.
|
|
42.
|
Suedel, B.C. and Rodgers, J.H. (1993). Development of formulated reference sediments for freshwater and estuarine sediment testing. Environ. Toxicol. Chem. 13, 1163-1175.
|
|
43.
|
Naylor, C. and C. Rodrigues. (1995). Development of a test method for Chironomus riparius using a formulated sediment. Chemosphere 31: 3291-3303.
|
|
44.
|
Kaster, J.L., Klump, J.V., Meyer, J., Krezoski, J. & Smith, M.E. (1984). Comparison of defecation rates of Limnodrilus hoffmeisteri using two different methods. Hydrobiologia 11, 181-184.
|
|
45.
|
Martinez-Madrid, M., Rodriguez, P., Perez-Iglesias, J.I. & Navarro, E. (1999). Sediment toxicity bioassays for assessment of contaminated sites in the Nervion river (Northern Spain). 2. Tubifex tubifex (Müller) reproduction sediment bioassay. Ecotoxicology 8, 111-124.
|
|
46.
|
Environment Canada (1995). Guidance document on measurement of toxicity test precision using control sediments spiked with a reference toxicant. Environmental Protection Series Report EPS 1/RM/30.
|
|
47.
|
Landrum, P.F. (1989). Bioavailability and toxicokinetics of polycyclic aromatic hydrocarbons sorbed to sediments for the amphipod Pontoporeia hoyi. Environ. Sci. Technol. 23, 588-595.
|
|
48.
|
Brooke, L.T., Ankley, G.T., Call, D.J. & Cook, P.M. (1996). Gut content and clearance for three species of freshwater invertebrates. Environ. Toxicol. Chem. 15, 223-228.
|
|
49.
|
Mount, D.R., Dawson, T.D. & Burkhard, L.P. (1999). Implications of gut purging for tissue residues determined in bioaccumulation testing of sediment with Lumbriculus variegatus. Environ. Toxicol. Chem. 18, 1244-1249.
|
|
50.
|
OECD 2006. Current approaches in the statistical analysis of ecotoxicity data: A guidance to application. OECD Series on Testing and Assessment No. 54, OECD, Paris, France.
|
|
51.
|
Liebig M., Meller M. & Egeler P. (2004). Sedimenttoxizitätstests mit aquatischen Oligochaeten – Einfluss verschiedener Futterquellen im künstlichen Sediment auf Reproduktion und Biomasse von Lumbriculus variegatus. Proceedings 5/2004: Statusseminar Sedimentkontakttests. March 24-25, 2004. BfG (Bundesanstalt für Gewässerkunde), Koblenz, Germany. pp. 107-119.
|
Doplnková literatúra týkajúca sa štatistických postupov:
Dunnett, C.W. (1955). A multiple comparison procedure for comparing several treatments with a control. Amer. Statist. Ass. J. 50, 1096-1121.
Dunnett, C.W. (1964). New tables for multiple comparisons with a control. Biometrics 20, 482-491.
Finney, D.J. (1971). Probit Analysis (3rd ed.), pp. 19-76. Cambridge Univ. Press.
Finney, D.J. (1978). Statistical Method in Biological Assay. Charles Griffin & Company Ltd, London.
Hamilton, M.A., R.C. Russo and R.V. Thurston. (1977). Trimmed Spearman-Karber Method for estimating median lethal concentrations in toxicity bioassays. Environ. Sci. Technol. 11(7), 714-719; Correction: Environ. Sci. Technol. 12 (1998), 417.
Holm, S. (1979). A simple sequentially rejective multiple test procedure. Scand. J. Statist. 6, 65-70.
Sokal, R.R. and F.J. Rohlf. (1981) Biometry. The principles and practice of statistics in biological research. 2nd edition. W.H. Freeman and Company. New York.
Miller, R.G., Jr. (1986). Beyond ANOVA, basics of applied statistics. John Wiley & Sons. New York.
Shapiro S.S. & Wilk M.B (1965). An analysis of variance test for normality (complete samples). Biometrika 52: 591-611.
Williams, D.A. (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27, 103-117.
Williams, D.A. (1972). The comparison of several dose levels with a zero dose control. Biometrics 28, 519 531.
Dodatok 1
Vymedzenie pojmov
Na účely tejto testovacej metódy sa používa toto vymedzenie pojmov:
|
|
Chemikália je látka alebo zmes.
|
|
|
Obdobie kondicionovania sa využíva na stabilizovanie mikrobiálnej zložky sedimentu a na odstránenie napríklad amoniaku pochádzajúceho zo zložiek sedimentu; predchádza obohacovaniu sedimentu testovanou chemikáliou. Po kondicionovaní sa nadložná voda zvyčajne odstráni.
|
|
|
ECx
je koncentrácia testovanej chemikálie v sedimente, ktorá v rámci stanoveného času expozície vyvolá účinok x % (napr. 50 %) na biologický parameter.
|
|
|
Obdobie vyvažovania umožňuje rozdelenie testovanej chemikálie medzi tuhú fázu, vodu nachádzajúcu sa v interstíciu sedimentu a nadložnú vodu; prebieha po obohatení sedimentu testovanou chemikáliou a pred pridaním testovaných organizmov.
|
|
|
Fáza expozície je čas, v priebehu ktorého sú testované organizmy vystavené pôsobeniu testovanej chemikálie.
|
|
|
Umelo pripravený sediment alebo rekonštituovaný, umelý či syntetický sediment je zmes materiálov použitých na napodobnenie fyzických zložiek prírodného sedimentu.
|
|
|
Najnižšia koncentrácia s pozorovaným účinkom (LOEC) je najnižšia testovacia koncentrácia testovanej chemikálie, pri ktorej sa pozoruje, že chemikália má významný toxický účinok (pri p ≤ 0,05) v porovnaní s kontrolnou vzorkou. Škodlivý účinok všetkých testovacích koncentrácií nad LOEC však musí byť rovnaký alebo väčší ako účinky pozorované pri LOEC. Ak nie sú splnené tieto dve podmienky, je potrebné poskytnúť úplné vysvetlenie, akým spôsobom sa zvolila koncentrácia LOEC (a teda aj koncentrácia NOEC).
|
|
|
Koncentrácia bez pozorovaného účinku (NOEC) je testovacia koncentrácia bezprostredne pod koncentráciou LOEC, ktorá v porovnaní s kontrolnou vzorkou nemá žiadny štatisticky významný účinok (p ≤ 0,05) v rámci daného času expozície.
|
|
|
Rozdeľovacia konštanta oktanol – voda (Kow, niekedy označovaný aj Pow) je pomer rozpustnosti chemikálie v n-oktanole a vo vode v rovnovážnom stave a predstavuje lipofilitu chemikálie (kapitola A.24 tejto prílohy). Parameter Kow alebo logaritmus Kow (log Kow) sa používa na vyjadrenie potenciálu chemikálie na bioakumuláciu vo vodných organizmoch.
|
|
|
Rozdeľovacia konštanta organický uhlík – voda (Koc) je pomer koncentrácie chemikálie vo/na frakcii sedimentu tvorenej organickým uhlíkom a koncentrácie chemikálie vo vode v rovnovážnom stave.
|
|
|
Nadložná voda je voda umiestnená v testovacej nádobe nad sedimentom.
|
|
|
Pórová voda alebo intersticiálna voda je voda nachádzajúca sa v póroch sedimentu alebo pôdy.
|
|
|
Obohatený sediment je sediment, do ktorého bola pridaná testovaná chemikália.
|
|
|
Testovaná chemikália je akákoľvek látka alebo zmes, ktorá sa testuje pomocou tejto testovacej metódy.
|
Dodatok 2
Zloženie odporúčanej rekonštituovanej vody
(prevzaté z kapitoly C.1 tejto prílohy 1)
|
a)
|
Roztok chloridu vápenatého
Rozpustite 11,76 g CaCl2 × 2H2O v deionizovanej vode; doplňte deionizovanou vodou na 1 liter.
|
|
b)
|
Roztok síranu horečnatého
Rozpustite 4,93 g MgSO4 × 2H7O v deionizovanej vode; doplňte deionizovanou vodou na 1 liter.
|
|
c)
|
Roztok hydrouhličitanu sodného
Rozpustite 2,59 g NaHCO3 v deionizovanej vode; doplňte deionizovanou vodou na 1 liter.
|
|
d)
|
Roztok chloridu draselného
Rozpustite 0,23 g KCl v deionizovanej vode; doplňte deionizovanou vodou na 1 liter.
|
Všetky chemikálie musia byť analytickej čistoty.
Vodivosť destilovanej alebo deionizovanej vody nesmie prekročiť hodnotu 10 μScm– 1.
Zmieša sa 25 ml každého z roztokov a) až d) a doplní sa deionizovanou vodou na celkový objem 1 liter. Celkové množstvo iónov vápnika a horčíka v tomto roztoku je 2,5 mmol/l.
Pomer iónov Ca: Mg je 4: 1 a pomer iónov Na: K je 10: 1. Kyselinová kapacita KS4.3 tohto roztoku je 0,8 mmol/l.
Rozpúšťacia voda sa prevzdušňuje, pokiaľ sa nedosiahne nasýtenie kyslíkom, potom sa pred použitím uskladní približne na dva dni bez ďalšieho prevzdušňovania.
LITERATÚRA
|
(1)
|
Chapter C.1 of this Annex, Fish Acute Toxicity Test.
|
Dodatok 3
Fyzikálno-chemické vlastnosti vody vhodnej na riedenie
|
Zložka
|
Koncentrácie
|
|
Tuhé častice
|
< 20 mg/l
|
|
Celkový organický uhlík
|
< 2 μg/l
|
|
Neionizovaný amoniak
|
< 1 μg/l
|
|
Zvyškový chlór
|
< 10 μg/l
|
|
Celkové pesticídy na báze organofosfátov
|
< 50 ng/l
|
|
Celkové organochlórované pesticídy plus polychlórované bifenyly
|
< 50 ng/l
|
|
Celkový organický chlór
|
< 25 ng/l
|
|
[prevzaté z OECD (1992) (1)]
|
LITERATÚRA
|
1.
|
OECD (1992). Guidelines for Testing of Chemicals No. 210. Fish, Early-life Stage Toxicity Test. OECD, Paris.
|
Dodatok 4
Odporúčaný umelý sediment – usmernenia na prípravu a skladovanie
Zložky sedimentu
|
Zložka
|
Charakteristika
|
% sušiny v sedimente
|
|
Rašelina
|
rašelina s machom z rašelinníka, stupeň rozkladu: ‚stredný‘, sušená vzduchom, žiadne viditeľné zvyšky rastlín, jemne rozomletá (veľkosť častíc ≤0,5 mm)
|
5 ± 0,5
|
|
Kremenný piesok
|
veľkosť zrniek: ≤ 2 mm, ale > 50 % častíc by malo mať veľkosť v rozsahu 50 – 200 μm);
|
75 – 76
|
|
Kaolínová hlina
|
obsah kaolinitu ≥ 30 %
|
20 ± 1
|
|
Zdroj potravy
|
napr. rozomleté listy žihľavy obyčajnej (Folia urticae), listy pŕhľavy dvojdomej (Urtica dioica), jemne rozomleté (veľkosť častíc ≤0,5 mm); v súlade s farmaceutickými normami, na ľudskú spotrebu; navyše k suchému sedimentu
|
0,4 – 0,5 %
|
|
Organický uhlík
|
upravený pridaním rašeliny a piesku
|
2 ± 0,5
|
|
Uhličitan vápenatý
|
CaCO3, práškový, chemicky čistý, navyše k suchému sedimentu
|
0,05 – 1
|
|
Deionizovaná voda
|
vodivosť ≤ 10 μS/cm, navyše k suchému sedimentu
|
30 – 50
|
Poznámka: Ak sa predpokladá výskyt zvýšených koncentrácií amoniaku, napríklad ak je testovaná chemikália známym inhibítorom nitrifikácie, môže byť užitočné nahradiť 50 % prášku žihľavy, bohatej na dusík, celulózou [napr. prášková α-celulóza, chemicky čistá, veľkosť častíc ≤ 0,5 mm (1) (2)].
Príprava
Rašelina sa usuší vzduchom a rozomelie na jemný prášok. V deionizovanej vode sa pomocou vysokovýkonného homogenizačného prístroja pripraví suspenzia požadovaného množstva rašelinového prášku. Hodnota pH tejto suspenzie sa pomocou CaCO3 upraví na 5,5 ± 0,5. Suspenzia sa najmenej dva dni nechá kondicionovať s jemným premiešavaním pri teplote 20 ± 2 °C, aby sa stabilizovala hodnota pH a vytvorila stabilná mikrobiálna zložka. Opäť sa zmeria hodnota pH, ktorá by mala byť na úrovni 6,0 ± 0,5. Rašelinová suspenzia sa následne zmieša s ostatnými zložkami (piesok a kaolínová hlina) a s deionizovanou vodou, aby sa získal homogénny sediment s obsahom vody v rozsahu 30 – 50 percent sušiny v sedimente. Znova sa zmeria hodnota pH konečnej zmesi a podľa potreby sa pomocou CaCO3 upraví na 6,5 – 7,5. Ak sa však očakáva vyvíjanie amoniaku, môže byť užitočné udržiavať hodnotu pH sedimentu pod 7,0 (napr. medzi 6,0 a 6,5). Odoberú sa vzorky sedimentu, aby sa stanovila suchá hmotnosť a obsah organického uhlíka. Ak sa však očakáva vyvíjanie amoniaku, umelo pripravený sediment sa môže kondicionovať sedem dní za rovnakých podmienok, aké budú prevládať v následnom teste (napr. pomer sediment – voda 1: 4, výška vrstvy sedimentu ako v testovacích nádobách), pred tým, ako bude obohatený testovanou chemikáliou, t. j. mal by sa prekryť vrstvou vody, ktorá sa bude prevzdušňovať. Na konci obdobia kondicionovania by sa mala nadložná voda odobrať a odstrániť. Následne sa obohatený kremenný piesok zmieša so sedimentom pre každú úroveň aplikovanej chemikálie, sediment sa rozdelí do paralelných testovacích nádob a prekryje testovacou vodou. Nádoby sa potom inkubujú za rovnakých podmienok, aké budú prevládať v následnom teste. Tu sa začína obdobie vyvažovania. Nadložná voda by sa mala prevzdušňovať.
Zvolený zdroj potravy by sa mal pridať pred obohacovaním sedimentu testovanou chemikáliou alebo počas neho. Na začiatku sa môže zmiešať s rašelinovou suspenziou (pozri vyššie). Nadmernému rozkladu zdroja potravy ešte pred pridaním testovaných organizmov, napríklad v prípade dlhého obdobia vyvažovania, je možné predísť tým, že obdobie medzi pridaním potravy a začiatkom expozície bude čo najkratšie. S cieľom zabezpečiť, aby bola potrava obohatená testovanou chemikáliou, by sa zdroj potravy mal zmiešať so sedimentom najneskôr v deň, keď sa sediment obohatí testovanou chemikáliou.
Skladovanie
Suché zložky umelého sedimentu sa môžu skladovať na suchom, chladnom mieste alebo pri teplote miestnosti. Umelo pripravený sediment obohatený testovanou chemikáliou by sa mal použiť v rámci testu okamžite. Vzorky obohateného sedimentu sa môžu skladovať v podmienkach odporúčaných pre konkrétnu testovanú chemikáliu až do analýzy.
LITERATÚRA
|
1.
|
Egeler, Ph., Meller, M., Schallnaß, H.J. & Gilberg, D. (2005). Validation of a sediment toxicity test with the endobenthic aquatic oligochaete Lumbriculus variegatus by an international ring test. In co-operation with R. Nagel and B. Karaoglan. Report to the Federal Environmental Agency (Umweltbundesamt Berlin), R&D No.: 202 67 429.
|
|
2.
|
Liebig M., Meller M. & Egeler P. (2004). Sedimenttoxizitätstests mit aquatischen Oligochaeten – Einfluss verschiedener Futterquellen im künstlichen Sediment auf Reproduktion und Biomasse von Lumbriculus variegatus. Proceedings 5/2004: Statusseminar Sedimentkontakttests. March 24-25, 2004. BfG (Bundesanstalt für Gewässerkunde), Koblenz, Germany. pp. 107-119.
|
Dodatok 5
Metódy kultivácie druhu Lumbriculus variegatus
Červ druhu Lumbriculus variegatus (MÜLLER), čeľade Lumbriculidae, triedy Oligochaeta je obyvateľom sladkovodných sedimentov a široko sa využíva v ekotoxikologickom testovaní. Ľahko sa kultivuje v laboratórnych podmienkach. V nasledujúcom texte je uvedený prehľad metód kultivácie.
Metódy kultivácie
Kultivačné podmienky pre druh Lumbriculus variegatus sú podrobne vysvetlené v prácach Phipps a kol. (1993) (1), Brunson a kol. (1998) (2), ASTM (2000) (3), U.S. EPA (2000) (4). Stručné zhrnutie týchto podmienok je uvedené nižšie. Hlavnou výhodou druhu L. variegatus je jeho rýchla reprodukcia, čo vedie k rýchlemu nárastu množstva biomasy populácií kultivovaných v laboratóriu [napr. (1), (3), (4), (5)].
Červy je možné kultivovať vo veľkých akváriách (57 – 80 l), pri teplote 23 °C, s fotoperiódou 16 h svetla: 8 h tmy (pri intenzite osvetlenia 100 – 1 000 luxov), s použitím denne obnovovanej prírodnej vody (45 – 50 l na akvárium). Substrát sa pripraví postrihaním nebielených hnedých papierových utierok na pásiky, ktoré sa potom môžu na niekoľko sekúnd zmiešať s kultivačnou vodou, aby vznikol substrát malých kúskov papiera. Tento substrát sa potom môže priamo použiť v akváriu určenom na kultivovanie dážďovičiek Lumbriculus tak, že sa ním pokryje dno nádrže, alebo sa uskladní zmrazený v deionizovanej vode na neskoršie použitie. Nový substrát vo všeobecnosti vydrží v nádrži približne dva mesiace.
Každá kultivácia červov sa začína s 500 – 1 000 červami, ktoré sa kŕmia 10 ml suspenzie obsahujúcej 6 g pstruhov ako štartovaciu potravu, trikrát týždenne v podmienkach obnovy alebo prietokového systému. Statické alebo semistatické kultúry by sa mali kŕmiť menšími dávkami, aby sa predišlo rastu baktérií a húb.
Za týchto podmienok sa počet jedincov v rámci kultúry vo všeobecnosti zdvojnásobí počas približne 10 až 14 dní.
Alternatívne sa druh Lumbriculus variegatus môže kultivovať aj v systéme pozostávajúcom z vrstvy kremenného piesku, ktorý sa používa ako umelý sediment (hĺbka 1 – 2 cm) a rekonštituovanej vody. Ako kultivačné nádoby sa môžu použiť nádoby zo skla alebo z nerezovej ocele, s výškou 12 – 20 cm. Vrstva vody by sa mala jemne prevzdušňovať (napr. dve bubliny za sekundu) prostredníctvom Pasteurovej pipety umiestnenej približne 2 cm nad povrchom sedimentu. S cieľom zabrániť nahromadeniu napríklad amoniaku by sa nadložná voda mala vymieňať pomocou prietokového systému, alebo aspoň raz za týždeň ručne. Máloštetinavce je možné držať pri teplote miestnosti s fotoperiódou 16 hodín svetla (s intenzitou osvetlenia 100 – 1 000 lx) a 8 hodín tmy. V semistatickej kultúre (obnova vody raz za týždeň) sa červy kŕmia dvakrát týždenne potravou pre ryby TetraMin (napr. 0,6 – 0,8 mg/cm2 povrchu sedimentu), ktorá sa môže aplikovať ako suspenzia 50 mg TetraMin na každý ml deionizovanej vody.
Červy druhu Lumbriculus variegatus sa môžu z kultúr vyberať napríklad prenosom substrátu pomocou jemného sita alebo organizmov pomocou sklenej hladkej pipety so širokým hrotom (s priemerom približne 5 mm), do oddelenej kadičky. Ak sa do tejto kadičky prenáša aj substrát, kadička obsahujúca červov a substrát sa cez noc nechá v prietokových podmienkach, čím sa odstráni z kadičky substrát, zatiaľ čo červy zostanú na dne nádoby. Tie sa potom môžu vložiť do novopripravených kultivačných nádrží, alebo ďalej spracúvať na test, ako je uvedené v literatúre (3) a (4), alebo v ďalšom texte.
Otázka, ktorú treba kriticky zvažovať pri použití druhu L. variegatus v rámci testovania v sedimentoch, je jeho spôsob reprodukcie [architómia alebo morfalaxia, napr. (6)]. Toto nepohlavné rozmnožovanie vedie ku vzniku dvoch fragmentov, ktoré počas určitého obdobia neprijímajú potravu, až kým sa hlavová alebo chvostová časť nezregeneruje [napr. (7), (8)]. To znamená, že v prípade druhu L. variegatus nedochádza k expozícii prostredníctvom požitia kontaminovaného sedimentu nepretržite.
Preto by sa mala vykonávať synchronizácia s cieľom minimalizovať nekontrolovanú reprodukciu a regeneráciu a následne veľké rozdiely vo výsledkoch testov. Takéto rozdiely môžu vzniknúť, ak viacerí jedinci, ktorí sú fragmentovaní, a preto počas určitého obdobia neprijímajú potravu, sú menej vystavení pôsobeniu testovanej chemikálie ako ostatní jedinci, ktorí počas testu neprejdú fragmentáciou (9), (10), (11). Červy by sa mali umelo fragmentovať 10 – 14 dní pred začiatkom expozície (synchronizácia). Na synchronizáciu by sa mali prednostne vyberať veľké (dospelé) červy, ktoré nevykazujú príznaky nedávnej morfalaxie. Tieto červy sa môžu umiestniť na podložné sklíčko do kvapky kultivačnej vody a skalpelom rozdeliť v strednej časti tela. Treba dbať na to, aby zadné časti mali podobnú veľkosť. Zadné časti by sa potom mali do začiatku expozície nechať v kultivačných nádobách obsahujúcich rovnaký substrát, aký sa používa v kultúre, a rekonštituovanú vodu, na regeneráciu nových hlavových častí. Príznakom regenerácie nových hlavových častí je, keď sa synchronizované červy zahrabávajú do substrátu (prítomnosť regenerovaných hláv sa môže potvrdiť preskúmaním reprezentatívnej čiastkovej vzorky binokulárnym mikroskopom). Očakáva sa, že testované organizmy budú potom v podobnom fyziologickom stave. To znamená, že keď počas testu dôjde pri synchronizovaných červoch k reprodukcii morfalaxiou, predpokladá sa, že prakticky všetky živočíchy by mali byť rovnako vystavené pôsobeniu obohateného sedimentu. Kŕmenie synchronizovaných červov by sa malo vykonať raz, hneď po tom, ako sa červy začnú zahrabávať do substrátu, alebo sedem dní po rozdelení. Režim kŕmenia by mal byť porovnateľný s riadnymi kultúrami, ale môže byť vhodné kŕmiť synchronizované červy tým istým zdrojom potravy, aký sa bude používať v rámci testu. Červy by sa mali držať pri testovacej teplote 20 °C ± 2 °C. Po regenerácii by sa na test mali použiť neporušené úplné červy podobnej veľkosti, ktoré po jemných mechanických podnetoch aktívne plávajú alebo lezú. Predchádzať by sa malo zraneniam alebo autotómii červov, napríklad používaním pipety s hladkými okrajmi alebo dentálnej pinzety z nehrdzavejúcej ocele na manipuláciu s týmito červami.
Zdroje štartovacích kultúr druhu Lumbriculus variegatus [adresy v USA sú prevzaté z literatúry (4)]
|
Európa
|
|
ECT Oekotoxikologie GmbH
|
|
Böttgerstr. 2-14
|
|
D-65439 Flörsheim/Main
|
|
Germany
|
|
|
Bayer Crop Science AG
|
|
Development – Ecotoxicology
|
|
Alfred-Nobel-Str. 50
|
|
D-40789 Monheim
|
|
Germany
|
|
|
|
|
|
University of Joensuu
|
|
Laboratory of Aquatic Toxicology
|
|
Dept. of Biology
|
|
Yliopistokatu 7, P.O. Box 111
|
|
FIN-80101 Joensuu
|
|
Finland
|
|
|
Dresden University of Technology
|
|
Institut für Hydrobiologie
|
|
Fakultät für Forst-, Geo- und Hydrowissenschaften
|
|
Mommsenstr. 13
|
|
D-01062 Dresden
|
|
Germany
|
|
|
|
|
|
C.N.R.- I.R.S.A.
|
|
Italian National Research Council
|
|
Water Research Institute
|
|
Via Mornera 25
|
|
I-20047 Brugherio MI
|
|
|
|
|
|
|
USA
|
|
U.S. Environmental Protection Agency
|
|
Mid-Continent Ecological Division
|
|
6201 Congdon Boulevard
|
|
Duluth, MN 55804
|
|
|
Michigan State University
|
|
Department of Fisheries and Wildlife
|
|
No. 13 Natural Resources Building
|
|
East Lansing, MI 48824-1222
|
|
|
|
|
|
U.S. Environmental Protection Agency
|
|
Environmental Monitoring System Laboratory
|
|
26 W. Martin Luther Dr.
|
|
Cincinnati, OH 45244
|
|
|
Wright State University
|
|
Institute for Environmental Quality
|
|
Dayton, OH 45435
|
|
|
|
|
|
Columbia Environmental Research Center
|
|
U.S. Geological Survey
|
|
4200 New Haven Road
|
|
Columbia, MO 65201
|
|
|
Great Lakes Environmental Research
|
|
Laboratory, NOAA
|
|
2205 Commonwealth Boulevard
|
|
Ann Arbor, MI 48105-1593
|
|
REFERENCES
|
1.
|
Phipps, G.L., Ankley, G.T., Benoit, D.A. and Mattson, V.R. (1993). Use of the aquatic Oligochaete Lumbriculus variegatus for assessing the toxicity and bioaccumulation of sediment-associated contaminants. Environ.Toxicol. Chem. 12, 269-279.
|
|
2.
|
Brunson, E.L., Canfield, T.J., Ingersoll, C.J. & Kemble, N.E. (1998). Assessing the bioaccumulation of contaminants from sediments of the Upper Mississippi river using field-collected oligochaetes and laboratory-exposed Lumbriculus variegatus. Arch. Environ. Contam. Toxicol. 35, 191-201.
|
|
3.
|
ASTM International (2000). Standard guide for the determination of the bioaccumulation of sediment-associated contaminants by benthic invertebrates, E 1688-00a. In ASTM International 2004 Annual Book of Standards. Volume 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
|
|
4.
|
U.S. EPA (2000). Methods for measuring the toxicity and bioaccumulation of sediment-associated contaminants with freshwater invertebrates. Second Edition. EPA 600/R-99/064, U.S. Environmental Protection Agency, Duluth, MN, March 2000.
|
|
5.
|
Kukkonen, J. and Landrum, P.F. (1994). Toxicokinetics and toxicity of sediment-associated Pyrene to Lumbriculus variegatus (Oligochaeta). Environ. Toxicol. Chem. 13, 1457-1468.
|
|
6.
|
Drewes C.D. & Fourtner C.R. (1990). Morphallaxis in an aquatic oligochaete, Lumbriculus variegatus: Reorganisation of escape reflexes in regenerating body fragments. Develop. Biol. 138: 94-103.
|
|
7.
|
Leppänen, M.T. & Kukkonen, J.V.K. (1998a). Relationship between reproduction, sediment type and feeding activity of Lumbriculus variegatus (Müller): Implications for sediment toxicity testing. Environ. Toxicol. Chem. 17: 2196-2202.
|
|
8.
|
Leppänen, M.T. & Kukkonen, J.V.K. (1998b). Factors affecting feeding rate, reproduction and growth of an oligochaete Lumbriculus variegatus (Müller). Hydrobiologia 377: 183-194.
|
|
9.
|
Brust, K., O. Licht, V. Hultsch, D. Jungmann & R. Nagel (2001). Effects of Terbutryn on Aufwuchs and Lumbriculus variegatus in Artificial Indoor Streams. Environ. Toxicol. Chemistry, Vol. 20, pp. 2000–2007.
|
|
10.
|
Oetken, M., K.-U. Ludwichowski & R. Nagel (2000). Sediment tests with Lumbriculus variegatus and Chironomus riparius and 3,4-dichloroaniline (3,4-DCA) within the scope of EG-AltstoffV. By order of the Federal Environmental Agency (Umweltbundesamt Berlin), FKZ 360 12 001, March 2000.
|
|
11.
|
Leppänen M.T. & Kukkonen J.V.K. (1998). Relative importance of ingested sediment and porewater as bioaccumulation routes for pyrene to oligochaete (Lumbriculus variegatus, Müller). Environ. Sci. Toxicol. 32, 1503-1508.
|
Dodatok 6
Súhrn výsledkov medzilaboratórnej porovnávacej skúšky
‚Test toxicity sedimentu s druhom Lumbriculus variegatus‘
Tabuľka 1
Výsledky jednotlivých častí medzilaboratórnej porovnávacej skúšky: stredný počet červov v kontrolných vzorkách a v kontrolných vzorkách ošetrených rozpúšťadlom na konci testu. SD = štandardná odchýlka, CV = variačný koeficient
|
|
Stredný počet červov v kontrolných vzorkách
|
SD
|
CV (%)
|
n
|
Stredný počet červov vo vzorkách ošetrených rozpúšťadlom
|
SD
|
CV (%)
|
n
|
|
|
32,3
|
7,37
|
22,80
|
3
|
39,0
|
3,61
|
9,25
|
3
|
|
|
40,8
|
6,55
|
16,05
|
6
|
36,0
|
5,29
|
14,70
|
3
|
|
|
41,5
|
3,54
|
8,52
|
2
|
38,5
|
7,05
|
18,31
|
4
|
|
|
16,3
|
5,99
|
36,67
|
6
|
30,8
|
6,70
|
21,80
|
4
|
|
|
24,3
|
10,69
|
43,94
|
3
|
26,3
|
3,06
|
11,60
|
3
|
|
|
28,5
|
8,29
|
29,08
|
4
|
30,7
|
1,15
|
3,77
|
3
|
|
|
28,3
|
3,72
|
13,14
|
6
|
28,8
|
2,56
|
8,89
|
6
|
|
|
25,3
|
5,51
|
21,74
|
3
|
27,7
|
1,53
|
5,52
|
3
|
|
|
23,8
|
2,99
|
12,57
|
4
|
21,3
|
1,71
|
8,04
|
4
|
|
|
36,8
|
8,80
|
23,88
|
6
|
35,0
|
4,20
|
11,99
|
6
|
|
|
33,0
|
3,58
|
10,84
|
6
|
33,5
|
1,73
|
5,17
|
4
|
|
|
20,7
|
2,73
|
13,22
|
6
|
15,0
|
6,68
|
44,56
|
4
|
|
|
42,0
|
7,07
|
16,84
|
6
|
43,7
|
0,58
|
1,32
|
3
|
|
|
18,2
|
3,60
|
19,82
|
6
|
21,7
|
4,04
|
18,65
|
3
|
|
|
32,0
|
3,95
|
12,34
|
6
|
31,3
|
4,79
|
15,32
|
4
|
|
Medzilaboratórna stredná hodnota
|
29,59
|
|
20,10
|
|
30,61
|
|
13,26
|
|
|
SD
|
8,32
|
|
10,03
|
|
7,57
|
|
10,48
|
|
|
n
|
15
|
|
|
|
15
|
|
|
|
|
min.
|
16,3
|
|
|
|
15,0
|
|
|
|
|
max.
|
42,0
|
|
|
|
43,7
|
|
|
|
|
CV (%)
|
28,1
|
|
|
|
24,7
|
|
|
|
Tabuľka 2
Výsledky jednotlivých častí medzilaboratórnej porovnávacej skúšky: stredná celková suchá hmotnosť červov na jeden replikát v kontrolných vzorkách a v kontrolných vzorkách ošterených rozpúšťadlom na konci testu. SD = štandardná odchýlka, CV = variačný koeficient
|
|
Celková suchá hmotnosť červov na replikát (kontrolné vzorky)
|
SD
|
CV (%)
|
n
|
Celková suchá hmotnosť červov na replikát (kontrolné vzorky ošetrené rozpúšťadlom)
|
SD
|
CV (%)
|
n
|
|
|
24,72
|
6,31
|
25,51
|
3
|
27,35
|
4,08
|
14,93
|
3
|
|
|
30,17
|
2,04
|
6,75
|
6
|
33,83
|
10,40
|
30,73
|
3
|
|
|
23,65
|
3,61
|
15,25
|
2
|
28,78
|
4,68
|
16,28
|
4
|
|
|
12,92
|
6,83
|
52,91
|
6
|
24,90
|
6,84
|
27,47
|
4
|
|
|
21,31
|
4,17
|
19,57
|
3
|
25,87
|
5,30
|
20,49
|
3
|
|
|
22,99
|
4,86
|
21,16
|
4
|
24,64
|
5,09
|
20,67
|
3
|
|
|
18,91
|
1,91
|
10,09
|
6
|
19,89
|
1,77
|
8,89
|
6
|
|
|
24,13
|
1,63
|
6,75
|
3
|
25,83
|
2,17
|
8,41
|
3
|
|
|
22,15
|
3,18
|
14,34
|
4
|
22,80
|
2,60
|
11,40
|
4
|
|
|
35,20
|
8,12
|
23,07
|
6
|
31,42
|
8,45
|
26,90
|
6
|
|
|
41,28
|
5,79
|
14,02
|
6
|
41,42
|
4,37
|
10,55
|
4
|
|
|
15,17
|
5,78
|
38,09
|
6
|
10,50
|
3,42
|
32,53
|
4
|
|
|
35,69
|
8,55
|
23,94
|
6
|
38,22
|
1,23
|
3,21
|
3
|
|
|
19,57
|
5,21
|
26,65
|
6
|
28,58
|
6,23
|
21,81
|
3
|
|
|
29,40
|
2,16
|
7,34
|
6
|
31,15
|
2,70
|
8,67
|
4
|
|
Medzilaboratórna stredná hodnota
|
25,15
|
|
20,36
|
|
27,68
|
|
17,53
|
|
|
SD
|
7,87
|
|
12,56
|
|
7,41
|
|
9,10
|
|
|
n
|
15
|
|
|
|
15
|
|
|
|
|
min.
|
12,9
|
|
|
|
10,5
|
|
|
|
|
max.
|
41,3
|
|
|
|
41,4
|
|
|
|
|
CV (%)
|
31,3
|
|
|
|
26,8
|
|
|
|
Tabuľka 3
Toxicita PCP: súhrn konečných parametrov v medzilaboratórnej porovnávacej skúške; medzilaboratórne stredné hodnoty EC50, NOEC a LOEC. SD = štandardná odchýlka, CV = variačný koeficient
|
Biologický parameter
|
|
Medzilaboratórna stredná hodnota
|
min.
|
max.
|
Medzilaboratórny faktor
|
SD
|
CV (%)
|
geometrický priemer (mg/kg)
|
|
celkový počet červov
|
EC50
|
23,0
|
4,0
|
37,9
|
9,4
|
10,7
|
46,3
|
19,9
|
|
NOEC
|
9,9
|
2,1
|
22,7
|
10,7
|
7,2
|
72,3
|
7,6
|
|
LOEC
|
27,9
|
4,7
|
66,7
|
14,2
|
19,4
|
69,4
|
20,9
|
|
MDD (%)
|
22,5
|
7,1
|
39,1
|
|
|
|
|
|
Celková suchá hmotnosť červov
|
EC50
|
20,4
|
7,3
|
39,9
|
5,5
|
9,1
|
44,5
|
18,2
|
|
NOEC
|
9,3
|
2,1
|
20,0
|
9,4
|
6,6
|
70,4
|
7,4
|
|
LOEC
|
25,7
|
2,1
|
50,0
|
23,5
|
16,8
|
65,5
|
19,4
|
|
MDD (%)
|
24,8
|
10,9
|
44,7
|
|
|
|
|
|
Mortalita/prežitie
|
LC50
|
25,3
|
6,5
|
37,2
|
5,7
|
9,4
|
37,4
|
23,1
|
|
NOEC
|
16,5
|
2,1
|
40,0
|
18,8
|
10,3
|
62,4
|
12,8
|
|
LOEC
|
39,1
|
4,7
|
66,7
|
14,2
|
18,1
|
46,2
|
32,6
|
|
Reprodukcia (zvýšenie počtu červov na replikát)
|
EC50
|
20,0
|
6,7
|
28,9
|
4,3
|
7,6
|
37,9
|
18,3
|
|
NOEC
|
7,9
|
2,1
|
20,0
|
9,4
|
5,2
|
66,0
|
6,4
|
|
LOEC
|
22,5
|
2,1
|
50,0
|
23,5
|
15,4
|
68,6
|
16,0
|
|
MDD (%)
|
29,7
|
13,9
|
47,9
|
|
|
|
|
|
Rast (zvýšenie množstva biomasy na replikát)
|
EC50
|
15,3
|
5,7
|
29,9
|
5,2
|
7,1
|
46,5
|
13,7
|
|
NOEC
|
8,7
|
2,1
|
20,0
|
9,4
|
6,0
|
68,1
|
6,9
|
|
LOEC
|
24,0
|
2,1
|
50,0
|
23,5
|
15,7
|
65,5
|
17,3
|
|
MDD (%)
|
32,2
|
13,6
|
65,2
|
|
|
|
|
|
MDD: minimálny zistiteľný rozdiel oproti hodnotám kontrolných vzoriek pri testovaní hypotézy; používa sa na meranie štatistickej významnosti.
|
LITERATÚRA
Egeler, Ph., Meller, M., Schallnaß, H.J. & Gilberg, D. (2005). Validation of a sediment toxicity test with the endobenthic aquatic oligochaete Lumbriculus variegatus by an international ring test. In co-operation with R. Nagel and B. Karaoglan. Report to the Federal Environmental Agency (Umweltbundesamt Berlin), R&D No.: 202 67 429.
C.36 REPRODUKČNÝ TEST S DRAVÝMI ROZTOČMI [HYPOASPIS ACULEIFER (GEOLAELAPS)] V PÔDE
ÚVOD
|
1.
|
Táto testovacia metóda je rovnocenná s usmernením OECD na vykonávanie testov (TG) 226 (2008). Táto testovacia metóda je určená na odhadnutie účinkov chemikálií v pôde na reprodukčný výstup pôdnych dravých roztočov Hypoaspis aculeifer (Geolaelaps) Canestrini (Acari: čeľaď Laelapidae), a teda umožňuje odhad inhibície špecifickej rýchlosti rastu populácie (1), (2). Reprodukčný výstup tu znamená počet juvenilných jedincov na konci testovacieho obdobia. Roztoče druhu H. aculeifer predstavujú doplnok tropickej úrovne k druhom, pre ktoré sú testovacie metódy už k dispozícii. Reprodukčný test bez diskriminácie a kvantifikácie rôznych fáz reprodukčného cyklu sa považuje za primeraný na účely tejto testovacej metódy. Pre chemické látky s iným expozičným scenárom, ako je expozícia prostredníctvom pôdy, by mohli byť vhodné iné prístupy (3).
|
|
2.
|
Druh Hypoaspis (Geolaelaps) aculeifer sa považuje za relevantného predstaviteľa pôdnej fauny a najmä dravých roztočov. Je zastúpený na celom svete (5) a je možné ho ľahko zhromažďovať a chovať v laboratóriu. Súhrn venovaný biológii druhu H. aculeifer je uvedený v dodatku 7. Základné informácie o ekológii jednotlivých druhov roztočov a ich použití v ekotoxikologickom testovaní sú k dispozícii v literatúre (4), (5), (6), (7), (8), (9), (10), (11), (12).
|
PRINCÍP SKÚŠKY
|
3.
|
Dospelé samičky sú vystavené účinkom rôznych koncentrácií testovanej chemikálie zamiešanej do pôdy. Test sa začína s desiatimi dospelými samičkami na jednu paralelnú nádobu. Samčekovia nie sú v teste zahrnutí, lebo zo skúseností vyplynulo, že ak sú samčekovia prítomní, samičky sa pária ihneď alebo krátko po ukončení štádia deutonymfy. Okrem toho, začlenenie samčekov by predĺžilo test natoľko, že by bola potrebná namáhavá diskriminácia podľa štádií veku. Samotné párenie teda nie je súčasťou testu. Samičky sa synchronizovane zapoja do testu 28 – 35 dní po začiatku obdobia kladenia vajíčok (pozri dodatok 4), lebo vtedy je možné predpokladať, že samičky sú už spárené a že prešli štádiom predchádzajúcim kladeniu vajíčok. Pri teplote 20 °C sa test skončí v 14. deň po zapojení samičiek (0. deň), čo umožňuje prvej kontrolnej skupine potomkov dosiahnuť štádium deutonymfy (pozri dodatok 4). Ako hlavná meraná premenná hodnota sa stanoví počet juvenilných jedincov na jednu testovaciu nádobu a okrem toho počet samičiek, ktoré prežili. Reprodukčný výstup roztočov vystavených pôsobeniu testovanej chemikálie sa porovnáva s výsledkami kontrolných vzoriek s cieľom stanoviť hodnotu ECx (napr. EC10, EC50) alebo koncentráciu bez pozorovaného účinku (NOEC) (pozri vymedzenie pojmov v dodatku 1), v závislosti od použitej koncepcie experimentu (pozri bod 29). Prehľad harmonogramu testu je uvedený v doplnku 8.
|
INFORMÁCIE O TESTOVANEJ CHEMIKÁLII
|
4.
|
Predovšetkým by mala byť známa rozpustnosť vo vode, hodnota log Kow, rozdeľovacia konštanta pôdnej vody a tlak pary testovanej chemikálie. Žiaduce sú tiež doplnkové informácie o osude testovanej chemikálie v pôde, napríklad rýchlosť biotickej a abiotickej degradácie.
|
|
5.
|
Táto testovacia metóda sa môže použiť na chemikálie rozpustné alebo nerozpustné vo vode. Spôsob aplikácie testovanej chemikálie sa však bude zodpovedajúcim spôsobom líšiť. Testovacia metóda nie je použiteľná v prípade prchavých chemikálií, t. j. chemikálií, pre ktoré je hodnota Henryho konštanty alebo rozdeľovacej konštanty vzduch/voda vyššia ako jeden, alebo chemikálií, pre ktoré tlak pár pri teplote 25 °C presahuje hodnotu 0,0133 Pa.
|
PLATNOSŤ TESTU
|
6.
|
Na to, aby sa výsledok testu považoval za platný, by v kontrolných vzorkách bez aplikovanej chemikálie mali byť splnené tieto kritériá:
|
—
|
stredná mortalita dospelých samičiek by nemala presiahnuť 20 % na konci testu,
|
|
—
|
stredný počet juvenilných jedincov v každom replikáte (desať dospelých samičiek) by mala byť najmenej 50 na konci testu,
|
|
—
|
variačný koeficient vypočítaný pre počet mladých roztočov v replikáte by nemal byť vyšší ako 30 % na konci konečného testu.
|
|
REFERENČNÁ CHEMIKÁLIA
|
7.
|
Musia sa stanoviť hodnoty koncentrácií ECx a/alebo NOEC referenčnej chemikálie, aby sa zabezpečilo, že laboratórne podmienky testu sú primerané, a aby sa overilo, že reakcia testovaných organizmov sa postupom času výrazne nezmenila. Vhodnou referenčnou chemikáliou je dimetoát (CAS 60-51-5), pri ktorom sa preukázalo, že ovplyvňuje veľkosť populácie (4). Ako alternatívna referenčná chemikália sa môže použiť kyselina boritá (CAS 10043-35-3). S touto chemikáliou sa zatiaľ získalo menej skúseností. Možné sú dve alternatívne koncepcie:
|
—
|
Referenčná chemikália sa môže testovať súbežne so stanovením toxicity každej testovanej chemikálie s jednou koncentráciou, ktorá sa musí vopred preukázať v štúdii odozvy na dávku s výsledkom zníženia počtu potomstva o > 50 %. V tomto prípade by mal byť počet replikátov rovnaký ako pri kontrolných vzorkách (pozri bod 29).
|
|
—
|
Alternatívne sa referenčná chemikália testuje jeden až dvakrát ročne v rámci testu odozvy na dávku. V závislosti od zvolenej koncepcie sa líši počet koncentrácií a replikátov, ako aj faktor rozstupu (pozri bod 29), ale dosiahnuť by sa mala reakcia zodpovedajúca účinku 10 – 90 % (faktor rozstupu 1,8). Hodnota EC50 pre dimetoát, na základe počtu juvenilných jedincov, by mala byť v rozsahu 3,0 – 7,0 mg účinnej látky/kg pôdy (suchá hmotnosť). Podľa výsledkov získaných doteraz s kyselinou boritou by hodnota EC50 na základe počtu juvenilných jedincov mala byť v rozsahu 100 – 500 mg/kg /kg suchej hmotnosti pôdy.
|
|
OPIS TESTU
Testovacie nádoby a vybavenie
|
8.
|
Používať by sa mali testovacie nádoby s priemerom 3 – 5 cm (výška pôdy ≥ 1,5 cm), vyrobené zo skla alebo iného chemicky inertného materiálu a s priliehavým vekom. Uprednostňujú sa skrutkovacie uzávery a v tom prípade by sa nádoby mohli prevzdušňovať dvakrát týždenne. Alternatívne sa môžu používať uzávery, ktoré umožňujú priamu výmenu plynov medzi substrátom a atmosférou (napr. gáza). Keďže obsah vlhkosti musí byť počas testu dostatočne vysoký, je dôležité počas testu kontrolovať hmotnosť každej testovacej nádoby a v prípade potreby doplniť vodu. Toto môže byť mimoriadne dôležité, ak nie sú k dispozícii žiadne skrutkovacie uzávery. Ak sa používa nepriesvitná testovacia nádoba, uzáver by mal byť vyrobený z materiálu, ktorý umožňuje prístup svetla (napr. perforovaný priesvitný uzáver), ale zároveň zabraňuje roztočom v úniku. Veľkosť a druh testovacej nádoby závisí od metódy extrakcie (podrobnosti sú uvedené v dodatku 5). Ak sa tepelná extrakcia deje priamo v testovacej nádobe, mohlo by sa pridať spodné sito s vhodnou veľkosťou ôk (utesnené až do extrakcie) a hĺbka pôdy by mala byť dostatočná na to, aby sa dosiahol gradient teploty a vlhkosti.
|
|
9.
|
Potrebné je bežné laboratórne vybavenie, konkrétne:
|
—
|
prednostne sklené nádoby so skrutkovacími uzávermi,
|
|
—
|
kefy na prenos roztočov,
|
|
—
|
vhodné zariadenie na regulovanie teploty,
|
|
—
|
vhodné zariadenia na regulovanie vlhkosti vzduchu (nie je to nevyhnutné, ak nádoby s exponovanými vzorkami majú veká),
|
|
—
|
inkubátor alebo malá miestnosť s reguláciou teploty,
|
|
—
|
zariadenie na extrakciu (pozri dodatok 5) (13),
|
|
—
|
vrchný osvetľovací panel s reguláciou osvetlenia,
|
|
—
|
nádoby na zbieranie vybratých roztočov.
|
|
Príprava umelej pôdy
|
10.
|
Pri tomto teste sa použije umelo pripravená pôda. Umelo pripravená pôda sa skladá z týchto zložiek (všetky hodnoty sú založené na suchej hmotnosti):
|
—
|
5 % rašeliny, vysušenej vzduchom a jemne drvenej (prijateľné sú častice veľkosti 2 mm ± 1 mm);
|
|
—
|
20 % kaolínovej hliny (obsah kaolinitu podľa možnosti nad 30 %),
|
|
—
|
približne 74 % vzduchom vysušeného kremenného piesku (v závislosti od potrebného množstva CaCO3), prevažne jemný piesok s viac ako 50 % častíc s veľkosťou od 50 do 200 mikrónov. Presné množstvo piesku závisí od množstva CaCO3 (pozri nižšie), pričom spoločne by mali predstavovať až 75 %,
|
|
—
|
< 1 % uhličitanu vápenatého (CaCO3, práškový, analytickej čistoty) na dosiahnutie hodnoty pH 6,0 ± 0,5; pridávané množstvo uhličitanu vápenatého môže do značnej miery závisieť od kvality/vlastností rašeliny (pozri poznámku 1).
|
Poznámka 1: potrebné množstvo CaCO3 bude závisieť od zložiek pôdneho substrátu a malo by sa stanoviť na základe merania hodnoty pH čiastkových vzoriek pôdy bezprostredne pred testom (14).
Poznámka 2: obsah rašeliny v umelej pôde sa líši od iných testovacích metód s pôdnymi organizmami, kde sa vo väčšine prípadov používa 10 % rašeliny [napr. (15)]. Podľa organizácie EPPO (16) však typická poľnohospodárska pôda neobsahuje viac ako 5 % organickej hmoty, a tak zníženie obsahu rašeliny odráža zníženú možnosť sorpcie testovanej chemikálie na organický uhlík v prírodnej pôde.
Poznámka 3: ak je to potrebné, napríklad na konkrétne účely testovania, prírodná pôda z neznečistených miest môže slúžiť aj ako testovací a/alebo kultivačný substrát. Ak sa však použije prírodná pôda, mali by sa uviesť prinajmenšom údaje o pôvode (mieste odberu), pH, textúre (rozdelení veľkosti častíc) a obsahu organických látok. Zahrnutý by mal byť aj druh a názov pôdy podľa klasifikácie pôdy, ak je k dispozícii, a pôda by nemala byť ničím kontaminovaná. V prípade, že testovanou chemikáliou je kov alebo organokovová zlúčenina, mala by sa určiť aj kapacita katiónovej výmeny prírodnej pôdy. Osobitnú pozornosť je potrebné venovať plneniu kritérií platnosti, keďže základné informácie o prírodných pôdach sú spravidla zriedkavé.
|
|
11.
|
Suché zložky pôdy sa dôkladne zmiešajú (napr. vo veľkokapacitnom laboratórnom miešači). Na stanovenie pH sa používa zmes pôdy a roztoku 1 M chloridu draselného (KCl) alebo 0,01 M roztoku chloridu vápenatého (CaCl2) v pomere 1: 5 (pozri literatúru (14) a dodatok 3). Ak je pôda kyslejšia než požadovaný rozsah (pozri bod 10), môže sa upraviť pridaním príslušného množstva CaCO3. Ak je pôda príliš alkalická, môže sa upraviť pridaním väčšieho množstva zmesi obsahujúcej prvé tri zložky uvedené v bode 10, no bez CaCO3.
|
|
12.
|
Maximálna kapacita zadržiavania vody umelej pôdy sa stanoví v súlade s postupmi opísanými v dodatku 2. Dva až sedem dní pred začiatkom testu sa suchá umelá pôda predvlhčí pridaním dostatočného množstva destilovanej alebo deionizovanej vody, aby sa dosiahla približne polovica konečného obsahu vody, čo je 40 – 60 % maximálnej kapacity zadržiavania vody. Obsah vlhkosti sa upraví na 40 – 60 % maximálnej kapacity zadržiavania vody pridaním roztoku testovanej chemikálie a/alebo pridaním destilovanej alebo deionizovanej vody (pozri body 16 až 18). Hrubú kontrolu obsahu vlhkosti v pôde je možné vykonať jemným stláčaním pôdy v ruke. Ak je obsah vlhkosti správny, medzi prstami by sa mali objaviť malé kvapky vody.
|
|
13.
|
Obsah vlhkosti v pôde sa stanoví na začiatku a na konci testu vysušením na konštantnú hmotnosť pri teplote 105 °C v súlade s normou ISO 11465 (17) a hodnota pH pôdy sa stanoví v súlade s dodatkom 3 alebo normou ISO 10390 (14). Tieto merania by sa mali vykonať v doplnkových vzorkách bez roztočov, z kontrolnej vzorky pôdy aj zo vzorky pôdy s každou testovacou koncentráciou. Hodnota pH pôdy by sa pri testovaní kyslých alebo zásaditých chemikálií nemala upravovať. Obsah vlhkosti by sa mal monitorovať počas celého testu pravidelným vážením nádob (pozri body 20 a 24).
|
Výber a príprava testovaných živočíchov
|
14.
|
V rámci testu sa používa druh Hypoaspis (Geolaelaps) aculeifer (Canestrini, 1883). Na začiatku testu sú potrebné dospelé samičky roztočov, získané zo synchronizovanej populácie. Roztoče by sa mali vložiť do nádob približne 7 – 14 dní pred dosiahnutím dospelosti, 28 – 35 dní po začiatku kladenia vajíčok v rámci synchronizácie (pozri bod 3 a dodatok 4). Zdroj roztočov alebo dodávateľ a udržiavateľ laboratórnej kultúry by sa mali zaznamenať. Ak sa laboratórna kultúra uchováva, odporúča sa potvrdiť identitu daného druhu najmenej raz do roka. Identifikačný list je uvedený v dodatku 6.
|
Príprava testovaných koncentrácií
|
15.
|
Testovaná chemikália sa zamieša do pôdy. Organické rozpúšťadlá používané na pomoc pri aplikovaní testovanej chemikálie do pôdy by sa mali vyberať na základe ich nízkej toxicity pre roztoče a do koncepcie testu musí byť zahrnutá primeraná kontrola rozpúšťadla (pozri bod 29).
|
Testovaná chemikália rozpustná vo vode
|
16.
|
Roztok testovanej chemikálie sa pripravuje s deionizovanou vodou v množstve dostatočnom pre všetky replikáty jednej testovacej koncentrácie. Odporúča sa použitie primeraného množstva vody, aby sa dosiahol požadovaný obsah vlhkosti, t. j. 40 – 60 % maximálnej kapacity zadržiavania vody (pozri bod 12). Každý roztok testovanej chemikálie sa pred vložením do testovacej nádoby dôkladne premieša s jednou šaržou predvlhčenej pôdy.
|
Testovaná chemikália nerozpustná vo vode
|
17.
|
V prípade chemikálií nerozpustných vo vode, ale rozpustných v organických rozpúšťadlách, sa testovaná chemikália môže rozpustiť v čo najmenšom objeme vhodného nosiča (napr. acetónu). Používať by sa mali iba prchavé rozpúšťadlá. Keď sa použijú takéto nosiče, všetky testovacie koncentrácie a kontrolné vzorky by mali obsahovať rovnaké minimálne množstvo nosiča. Nosič sa nastrieka na malé množstvo, napríklad 10 g, jemného kremenného piesku, alebo sa s ním zmieša. Celkový obsah piesku v substráte by sa mal upraviť na toto množstvo. Nosič sa odstráni najmenej hodinovým odparovaním pod digestorom. Táto zmes kremenného piesku a testovanej chemikálie sa pridá do predvlhčenej pôdy a po pridaní primeraného množstva deionizovanej vody, aby sa dosiahol požadovaný obsah vlhkosti, sa dôkladne premieša. Konečná zmes sa vloží do testovacích nádob. Treba si uvedomiť, že niektoré rozpúšťadlá môžu byť pre roztoče toxické. Preto sa odporúča použiť doplnkové kontrolné vzorky vody bez nosiča, ak toxicita rozpúšťadla pre roztoče nie je známa. Ak sa náležite preukáže, že rozpúšťadlo (v koncentráciách, ktoré sa majú použiť) nemá žiadne účinky, kontrolné vzorky vody sa môžu vylúčiť.
|
Testovaná chemikália slabo rozpustná vo vode a v organických rozpúšťadlách
|
18.
|
V prípade chemikálií, ktoré sú slabo rozpustné vo vode a v organických rozpúšťadlách, sa ekvivalent 2,5 g jemne drveného kremenného piesku na jednu testovaciu nádobu (napr. 10 g jemného kremenného piesku na štyri replikáty) zmieša s príslušným množstvom testovanej chemikálie na dosiahnutie požadovanej testovacej koncentrácie. Celkový obsah piesku v substráte by sa mal upraviť na toto množstvo. Táto zmes kremenného piesku a testovanej chemikálie sa pridá do predvlhčenej pôdy a po pridaní primeraného množstva deionizovanej vody, aby sa dosiahol požadovaný obsah vlhkosti, sa dôkladne premieša. Konečná zmes sa rozdelí do testovacích nádob. Tento postup sa opakuje pre každú testovaciu koncentráciu a pripraví sa vhodná kontrolná vzorka.
|
POSTUP
Testované skupiny a kontrolné vzorky
|
19.
|
Odporúča sa vložiť do každej nádoby s kontrolnou vzorkou a nádoby s aplikovanou chemikáliou desať dospelých samičiek v 20 g suchej hmotnosti umelej pôdy. Testované organizmy by sa mali pridať do dvoch hodín po príprave konečného testovacieho substrátu (t. j. po aplikácii testovanej chemikálie). V osobitných prípadoch (napr. ak sa starnutie považuje za rozhodujúci faktor) je možné predĺžiť čas medzi prípravou záverečného testovacieho substrátu a vložením roztočov [podrobnosti týkajúce sa takého starnutia sú uvedené v literatúre pod číslom (18)]. V takýchto prípadoch sa však musí poskytnúť vedecké zdôvodnenie.
|
|
20.
|
Po vložení do pôdy sa roztočom poskytne potrava a mala by sa odmerať počiatočná hmotnosť každej testovacej nádoby. Tento údaj sa použije ako referenčná hodnota pre monitorovanie obsahu vlhkosti v pôde počas testu, ako je uvedené v bode 24. Testovacie nádoby sa potom uzavrú, ako je opísané v bode 8, a uložia do testovacej komory.
|
|
21.
|
Pre každú z metód aplikácie testovanej chemikálie opísaných v bodoch 15 – 18 sa pripraví vhodná kontrolná vzorka. Pri príprave kontrolných vzoriek sa dodržiavajú príslušné uvedené postupy, s výnimkou toho, že sa nepridá testovaná chemikália. Preto, ak je to vhodné, do kontrolných vzoriek sa pridávajú organické rozpúšťadlá, kremenný piesok alebo iné nosiče v rovnakých koncentráciách/množstvách ako do vzoriek s aplikovanou chemikáliou. Ak sa na pridávanie testovanej chemikálie používa rozpúšťadlo alebo iný nosič, mali by sa pripraviť a otestovať aj doplnkové kontrolné vzorky bez nosiča alebo testovanej chemikálie, ak toxicita rozpúšťadla nie je známa (pozri bod 17).
|
Podmienky testu
|
22.
|
Testovacia teplota by mala byť 20 °C ± 2 °C. Teplota by sa mala zaznamenať minimálne jedenkrát za deň a v prípade potreby upraviť. Test sa vykonáva v kontrolovaných cykloch svetla a tmy (podľa možnosti 16 hodín svetla a 8 hodín tmy) s intenzitou osvetlenia 400 – 800 luxov v okolí testovacích nádob. Z dôvodu porovnateľnosti sú tieto podmienky rovnaké ako pri iných pôdnych ekotoxikologických testoch [napr. (15)].
|
|
23.
|
V prípade použitia skrutkovacích uzáverov by sa mala zabezpečiť výmena plynov prevzdušňovaním testovacích nádob najmenej dvakrát týždenne. Ak sa použijú gázové veká, osobitnú pozornosť treba venovať udržiavaniu obsahu vlhkosti v pôde (pozri body 8 a 24).
|
|
24.
|
Obsah vody v pôdnom substráte v testovacích nádobách sa počas celého testu udržiava pravidelným vážením testovacích nádob a v prípade potreby dopĺňaním vody (napr. raz týždenne). Straty sa podľa potreby dopĺňajú deionizovanou vodou. Obsah vlhkosti by sa počas testu nemal líšiť od počiatočnej hodnoty o viac ako 10 %.
|
Kŕmenie
|
25.
|
Ako vhodný zdroj potravy sa ukázali syrové roztoče [Tyrophagus putrescentiae (Schrank, 1781)]. Vhodné môžu byť aj malé chvostoskoky (napr. mladé jedince druhu Folsomia candida Willem, 1902 alebo Onychiurus fimatus) (19), (20), červy čeľade Enchytraeidae (napr. Enchytraeus crypticus Westheide a Graefe, 1992) alebo hlístovce (napr. Turbatrix silusiae de Man, 1913) (21). Odporúča sa kontrolovať potravu pred použitím v rámci testu. Druhom a množstvom potravy by sa mal zabezpečiť dostatočný počet juvenilných jedincov v záujme splnenia kritérií platnosti (bod 6). Pri výbere koristi by sa mal zvážiť spôsob pôsobenia testovanej chemikálie (napr. akaricídny prostriedok môže byť toxický aj pre potravinové roztoče, pozri bod 26).
|
|
26.
|
Potrava by sa mala poskytovať ad libitum [t. j. zakaždým v malom množstve (na špičku lopatky)]. Na tento účel sa môže tiež použiť odsávač s miernym saním, ako sa navrhuje v teste s chvostoskokmi, alebo jemný štetec. Dodanie potravy na začiatku testu a potom dva- až trikrát týždenne obvykle postačuje. Ak sa testovaná chemikália zdá byť toxická pre korisť, je potrebné zvážiť zintenzívnenie kŕmenia a/alebo alternatívny zdroj potravy.
|
Výber testovaných koncentrácií
|
27.
|
Predchádzajúce poznatky o toxicite testovanej chemikálie by mali pomôcť pri výbere vhodných testovaných koncentrácií, napríklad zo štúdií týkajúcich sa vyhľadávania rozsahu. V prípade potreby sa vykoná test na vyhľadávanie rozsahu s piatimi koncentráciami testovanej chemikálie v rozsahu 0,1 – 1 000 mg/kg suchej pôdy, najmenej s jedným replikátom pre každú vzorku s aplikovanou chemikáliou a kontrolnú vzorku. Test na vyhľadávanie rozsahu trvá 14 dní a na konci testu sa posudzuje mortalita dospelých roztočov a počet juvenilných jedincov. Rozsah koncentrácií v konečnom teste by sa mal podľa možnosti zvoliť tak, aby zahŕňal koncentrácie, ktoré ovplyvňujú počty juvenilných jedincov, ale neovplyvňujú prežívanie materskej generácie. To však nemusí byť možné pre chemikálie, ktoré spôsobujú letálne a subletálne účinky pri takmer rovnakých koncentráciách. Účinná koncentrácia (napr. EC50, EC25, EC10) a rozsah koncentrácií, v ktorom sa skúmajú účinky testovanej chemikálie, by mali byť v rozsahu koncentrácií použitých v rámci testu. Iba vo výnimočných prípadoch by sa mala robiť extrapolácia hlboko pod najnižšou koncentráciou, ktorá ovplyvňuje testovaný organizmus, alebo nad najvyššou testovacou koncentráciou. V takých prípadoch by sa malo v protokole uviesť úplné vysvetlenie.
|
Koncepcia experimentu
Testy závislosti reakcie od dávky
|
28.
|
Na základe odporúčaní vyplývajúcich z ďalšej medzilaboratórnej porovnávacej skúšky sa navrhujú tri koncepcie testu [skúška reprodukcie bielych červov (Enchytraeid) (22)]. Všeobecnú vhodnosť všetkých týchto koncepcií potvrdil výsledok validácie druhu H. aculeifer.
|
|
29.
|
Pri stanovení rozsahu koncentrácií treba mať na zreteli tieto skutočnosti:
|
—
|
na stanovenie hodnoty ECx (napr. EC10, EC50) by sa malo testovať dvanásť koncentrácií. Odporúčajú sa najmenej dva replikáty pre každú testovanú koncentráciu a šesť kontrolných replikátov. Faktor rozstupu sa môže meniť, t. j. môže mať hodnotu najviac 1,8 v očakávanom rozsahu účinkov a viac ako 1,8 pri vyšších a nižších koncentráciách.
|
|
—
|
Na stanovenie hodnoty NOEC by sa malo testovať aspoň päť koncentrácií v geometrickej sérii. Odporúčajú sa štyri replikáty na každú testovanú koncentráciu a osem kontrolných vzoriek. Faktor rozstupu medzi hodnotami koncentrácie by nemal presahovať 2,0.
|
|
—
|
Kombinovaný prístup umožňuje určenie obidvoch koncentrácií, NOEC aj ECx. Použiť by sa malo osem koncentrácií aplikovanej chemikálie v geometrickom rade. Odporúčajú sa štyri replikáty pre každú aplikáciu chemikálie a osem kontrolných vzoriek. Faktor rozstupu medzi hodnotami koncentrácie by nemal presahovať 1,8.
|
|
Limitný test
|
30.
|
Ak sa v rámci testu na vyhľadávanie rozsahu nepozorujú žiadne účinky ani pri najvyššej koncentrácii (t. j. 1 000 mg/kg suchej hmotnosti pôdy), konečný reprodukčný test sa môže vykonať ako limitný test s použitím testovacej koncentrácie 1 000 mg/kg suchej hmotnosti pôdy. Limitný test umožní dokázať, že hodnota NOEC alebo EC10 z hľadiska reprodukcie je vyššia ako limitná koncentrácia, a zároveň sa minimalizuje počet roztočov použitých v rámci testu. Pre vzorky pôdy s aplikovanou chemikáliou aj pre kontrolné vzorky by sa malo použiť osem replikátov.
|
Trvanie testu a merania
|
31.
|
Mali by sa zaznamenať všetky zistené rozdiely medzi správaním a morfológiou roztočov v kontrolných nádobách a v nádobách s aplikovanou chemikáliou.
|
|
32.
|
Na 14. deň sa roztoče, ktoré prežili, vyberú z pôdy extrakciou pomocou tepla/svetla alebo inou vhodnou metódou (pozri dodatok 5). Osobitne sa spočítajú juvenilné jedince (t. j. larvy, protonymfy a deutonymfy) a dospelé jedince. Všetky dospelé roztoče, ktoré sa v tomto čase nenájdu, sa zaznamenajú ako mŕtve, lebo je možné predpokladať, že takéto roztoče pred hodnotením uhynuli a rozložili sa. Účinnosť extrakcie sa musí overovať raz alebo dvakrát ročne v kontrolných vzorkách so známym počtom dospelých a juvenilných jedincov. Účinnosť by mala v priemere presahovať hodnotu 90 %, kombinovane pre všetky vývojové štádiá (pozri dodatok 5). Počty dospelých a juvenilných jedincov sa neupravujú z hľadiska účinnosti.
|
ÚDAJE A PODÁVANIE SPRÁV
Spracovanie výsledkov
|
33.
|
Informácie o štatistických metódach, ktoré sa môžu použiť na analýzu výsledkov testu, sú uvedené v bodoch 36 až 41. Okrem toho je potrebné používať dokument OECD 54 ‚Súčasné prístupy k štatistickej analýze údajov o ekotoxicite: návod na uplatňovanie‘ (31).
|
|
34.
|
Hlavným parametrom testu je reprodukčný výstup, v tomto prípade počet juvenilných jedincov vyprodukovaných na jednu paralelnú testovaciu nádobu (s desiatimi vloženými dospelými samičkami). Štatistická analýza si vyžaduje aritmetický priemer (x) a rozptyl (s2) reprodukčného výstupu, ktorý sa vypočíta na jednu vzorku s aplikovanou chemikáliou a na jednu kontrolnú vzorku. Hodnoty x a s2 sa používajú v rámci postupov ANOVA, ako je napríklad Studentov t-test, Dunnettov test alebo Williamsov test, ako aj na výpočet 95 % intervalov spoľahlivosti.
Poznámka: Tento hlavný parameter je rovnocenný s parametrom plodnosti, ktorá sa určuje ako podiel počtu žijúcich juvenilných jedincov vyprodukovaných počas testu a počtu rodičovských samičiek použitých na začiatku testu.
|
|
35.
|
Počet samičiek, ktoré prežili v kontrolných vzorkách bez aplikovanej chemikálie, je hlavným kritériom platnosti a musí sa zdokumentovať. Podobne ako v rámci testu na vyhľadávanie rozsahu by sa aj všetky škodlivé príznaky mali uviesť v záverečnej správe.
|
ECx
|
36.
|
Hodnoty ECx vrátane ich príslušných spodných a vrchných 95 % hraníc spoľahlivosti pre parameter uvedený v bode 34 sa vypočítajú pomocou vhodných štatistických metód (napr. probitová analýza, logistická alebo Weibullova funkcia, upravená Spearman-Karberova metóda alebo jednoduchá interpolácia). Koncentrácia ECx sa získa zadaním hodnoty, ktorá zodpovedá x % strednej hodnoty nameranej v kontrolnej vzorke, do príslušnej rovnice. Pri výpočte EC50 alebo akejkoľvek inej hodnoty ECx by sa mali stredné hodnoty pre každú vzorku s aplikovanou chemikáliou (x) podrobiť regresnej analýze.
|
NOEC/LOEC
|
37.
|
Ak je cieľom štatistickej analýzy stanovenie koncentrácie NOEC/LOEC, potrebné sú štatistické údaje pre každú nádobu (jednotlivé nádoby sa považujú za replikáty). Používať by sa mali vhodné štatistické metódy (podľa dokumentu OECD 54 ‚Súčasné prístupy k štatistickej analýze údajov o ekotoxicite: návod na uplatňovanie‘). Vo všeobecnosti sa nepriaznivé účinky testovanej chemikálie v porovnaní s kontrolnými vzorkami skúmajú pomocou jednostranného (obmedzeného) testovania hypotéz pri hodnote p ≤ 0,05. Príklady sú uvedené v ďalších bodoch.
|
|
38.
|
Normálne rozloženie údajov sa môže testovať napríklad Kolmogorovovým-Smirnovovým testom dobrej zhody, testom pomeru rozsahu k štandardnej odchýlke (R/s test) alebo Shapiro-Wilkovým testom (dvojstranný, p ≤ 0,05). Na testovanie homogenity variancie sa môže použiť Cochranov test, Levenov test alebo Barlettov test (dvojstranný, p ≤ 0,05). Ak sú splnené požiadavky postupov parametrických testov (normalita, homogenita variancie), môže sa vykonať jednostranná analýza variancie (ANOVA) a následné testy viacnásobného porovnania. Viacnásobné porovnania (napr. Dunnettov t-test) alebo testy zmiernenia trendu (napr. Williamsov test v prípade monotónneho vzťahu dávky a reakcie) sa môžu použiť na výpočet, či existujú výrazné rozdiely (p ≤ 0,05) medzi kontrolnými vzorkami a vzorkami s rôznymi koncentráciami testovanej chemikálie (výber odporúčaných testov podľa dokumentu OECD 54 ‚Súčasné prístupy k štatistickej analýze údajov o ekotoxicite: návod na uplatňovanie‘). Inak by sa na stanovenie koncentrácií NOEC a LOEC mali použiť neparametrické metódy (napr. Bonferroniho U-test podľa Holma alebo Jonckheereho-Terpstrov test trendu).
|
Limitný test
|
39.
|
Ak sa vykonal limitný test (porovnanie kontrolnej vzorky a len jednej vzorky s aplikovanou chemikáliou) a ak sú splnené požiadavky postupov parametrických testov (normalita, homogenita), metrické reakcie je možné hodnotiť pomocou Studentovho testu (t-test). Ak tieto požiadavky nie sú splnené, je možné použiť t-test nerovnakej variancie (Welchov t-test) alebo neparametrický test, ako napríklad Mannov-Whitneyho U-test.
|
|
40.
|
S cieľom určiť významné rozdiely medzi kontrolnými vzorkami (kontrolné vzorky a kontrolné vzorky s rozpúšťadlom) sa môžu replikáty každej kontrolnej vzorky testovať tak, ako je uvedené pre limitný test. V prípade, že sa týmito testami nezistia významné rozdiely, všetky replikáty kontrolných vzoriek a kontrolných vzoriek s rozpúšťadlom sa môžu spojiť. Inak by sa mali všetky vzorky s aplikovanou chemikáliou porovnať s kontrolnými vzorkami s rozpúšťadlom.
|
Protokol o skúške
|
41.
|
Protokol o skúške by mal obsahovať prinajmenšom tieto informácie:
|
—
|
Testovaná chemikália
|
—
|
identita testovanej chemikálie, názov, číslo šarže, číslo dávky a číslo CAS, čistota,
|
|
—
|
fyzikálno-chemické vlastnosti testovanej chemikálie (napr. log Kow, rozpustnosť vo vode, tlak pary, Henryho konštanta (H), a pokiaľ možno, informácie o osude testovanej chemikálie v pôde).
|
|
|
—
|
Testované organizmy
|
—
|
identifikácia a dodávateľ testovaných organizmov, opis podmienok kultivácie,
|
|
—
|
vekový rozsah testovaných organizmov.
|
|
|
—
|
Podmienky testu
|
—
|
opis koncepcie experimentu a postupu,
|
|
—
|
podrobnosti o príprave testovacej pôdy, podrobnosti o príprave testovacej pôdy; podrobné špecifikácie, ak sa použila prírodná pôda (pôvod, história, rozdelenie veľkosti častíc, pH, obsah organickej hmoty a klasifikácia pôdy, ak je k dispozícii),
|
|
—
|
maximálna kapacita zadržiavania vody v pôde,
|
|
—
|
opis metódy, ktorá sa použila na aplikáciu testovanej chemikálie do pôdy,
|
|
—
|
údaje o pomocných chemikáliách použitých na podávanie testovanej chemikálie,
|
|
—
|
veľkosť testovacích nádob a suchá hmotnosť testovacej pôdy na jednu nádobu,
|
|
—
|
podmienky testu: intenzita svetla, trvanie cyklov svetla a tmy, teplota,
|
|
—
|
opis kŕmneho režimu, druh a množstvo potravy, ktorá sa používala v rámci testu, dátumy kŕmenia,
|
|
—
|
hodnoty pH a obsah vody v pôde na začiatku a počas testu (kontrolné vzorky a každá vzorka s aplikovanou chemikáliou),
|
|
—
|
podrobný opis metódy extrakcie a účinnosti extrakcie.
|
|
|
—
|
Výsledky testu
|
—
|
počet juvenilných jedincov stanovený v každej testovacej nádobe na konci testu,
|
|
—
|
počet dospelých samičiek a mortalita dospelých jedincov ( %) v každej testovacej nádobe na konci testu,
|
|
—
|
opis zjavných príznakov alebo výrazných zmien v správaní,
|
|
—
|
výsledky získané s referenčnými vzorkami testovanej chemikálie,
|
|
—
|
súhrnné štatistické údaje (ECx a/alebo NOEC) vrátane 95 % hranice spoľahlivosti a opis metódy výpočtu,
|
|
—
|
krivka závislosti veličiny od koncentrácie.
|
|
—
|
Uvedú sa odchýlky od postupov opísaných v tejto testovacej metóde a všetky nezvyčajné udalosti počas testu.
|
|
|
LITERATÚRA
|
1.
|
Casanueva, M.E. (1993). Phylogenetic studies of the free-living and arthropod associated Laelapidae (Acari: Mesostigmata). Gayana Zool. 57, 21-46.
|
|
2.
|
Tenorio, J. M. (1982). Hypoaspidinae (Acari: Gamasida: Laelapidae) of the Hawaiian Islands. Pacific Insects 24, 259-274.
|
|
3.
|
Bakker, F.M., Feije, R., Grove, A. J., Hoogendorn, G., Jacobs, G., Loose, E.D. and van Stratum, P. (2003). A laboratory test protocol to evaluate effects of plant protection products on mortality and reproduction of the predatory mite Hypoaspis aculeifer Canestrini (Acari: Laelapidae) in standard soil. JSS – Journal of Soils and Sediments 3, 73-77.
|
|
4.
|
Karg, W. (1993). Die freilebenden Gamasina (Gamasides), Raubmilben. 2nd edition In: Dahl, F. (Hrsg.): Die Tierwelt Deutschlands 59. Teil, G. Fischer, Jena, 523 pp.
|
|
5.
|
Ruf, A. (1991). Do females eat males?: Laboratory studies on the popualation development of Hypoaspis aculeifer (Acari: Parasitiformes). In: F. Dusbabek & V. Bukva (eds.): Modern Acarology. Academia Prague & SPD Academic Publishing bv, The Hague, Vol. 2, 487-492
|
|
6.
|
Ruf, A. (1995). Sex ratio and clutch size control in the soil inhabiting predatory mite Hypoaspis aculeifer (Canestrini 1883) (Mesostigmata, Dermanyssidae). Proc. 2nd Symp. EURAAC: p 241-249.
|
|
7.
|
Ruf, A. (1996). Life-history patterns in soil-inhabiting mesostigmatid mites. Proc. IXth Internat. Congr. Acarol. 1994, Columbus, Ohio: p 621-628.
|
|
8.
|
Krogh, P.H. and Axelsen, J.A. (1998). Test on the predatory mite Hypoaspis aculeifer preying on the collembolan Folsomia fimetaria. In: Lokke, H. and van Gestel, C.A.M.: Handbook of soil invertebrate toxicity tests. John Wiley Sons, Chichester, p 239-251.
|
|
9.
|
Løkke, H., Janssen, C.R., Lanno, R.P., Römbke, J., Rundgren, S. and Van Straalen, N.M. (2002). Soil Toxicity Tests – Invertebrates. In: Test Methods to Determine Hazards of Sparingly Soluble Metal Compounds in Soils. Fairbrother, A., Glazebrook, P.W., Van Straalen, N.M. and Tarazona, J.V. (eds.). SETAC Press, Pensacola, USA. 128 pp.
|
|
10.
|
Schlosser, H.-J. and Riepert, F. (1991/92). Entwicklung eines Prüfverfahrens für Chemikalien an Bodenraubmilben (Gamasina). Teil 1: Biologie der Bodenraubmilbe Hypoaspis aculeifer Canestrini, 1883 (Gamasina) unter Laborbedingungen. Zool. Beiträge, 34, 395-433.
|
|
11.
|
Schlosser, H.-J. and Riepert, F. (1992). Entwicklung eines Prüfverfahrens für Chemikalien an Boden-raubmilben (Gamasina). Teil 2: Erste Ergebnisse mit Lindan und Kaliumdichromat in subletaler Dosierung. Zool. Beitr. N.F. 34, 413-433.
|
|
12.
|
Heckmann, L.-H., Maraldo, K. and Krogh, P. H. (2005). Life stage specific impact of dimethoate on the predatory mite Hypoaspis aculeifer Canestrini (Gamasida: Laelapidae). Environmental Science & Technology 39, 7154-7157.
|
|
13.
|
Petersen, H. (1978). Some properties of two high-gradient extractors for soil microarthropods, and an attempt to evaluate their extraction efficiency. Natura Jutlandica 20, 95-122.
|
|
14.
|
ISO (International Organization for Standardization) (1994). Soil Quality – Determination of pH, No. 10390. ISO, Geneve.
|
|
15.
|
Chapter C.8 of this Annex -. Toxicity for Earthworms..
|
|
16.
|
EPPO (2003): EPPO Standards. Environmental risk assessment scheme for plant protection products. Chapter 8. Soil Organisms and Functions. Bull. OEPP/EPPO Bull. 33, 195-209.
|
|
17.
|
ISO (International Organization for Standardization) (1993). Soil Quality –Determination of dry matter and water content on a mass basis – Gravimetric method, No. 11465. ISO, Geneve.
|
|
18.
|
Fairbrother, A., Glazebrock, P.W., Van Straalen, N.M. and Tarazona, J.V. 2002. Test methods to determine hazards of sparingly soluble metal compounds in soils. SETAC Press, Pensacola, FL, USA.
|
|
19.
|
Chi, H. 1981. Die Vermehrungsrate von Hypoaspis aculeifer Canestrini (Acarina, Laelapidae) bei Ernährung mit Onychiurus fimatus Gisin (Collenbola). Ges.allg..angew. Ent. 3:122-125.
|
|
20.
|
Schlosser, H.J., und Riepert, F. 1992. Entwicklung eines Prüfverfahrens für Chemikalien an Bodenraubmilden (Gamasina). Zool.Beitr. N.F. 34(3):395-433.
|
|
21.
|
Heckmann, L.-H., Ruf, A., Nienstedt, K. M. and Krogh, P. H. 2007. Reproductive performance of the generalist predator Hypoaspis aculeifer (Acari: Gamasida) when foraging on different invertebrate prey. Applied Soil Ecology 36, 130-135.
|
|
22.
|
Chapter C.32 of this Annex- Enchytraeid reproduction test.
|
|
23.
|
ISO (International Organization for Standardization) (1994). Soil Quality – Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction, No. 11268-2. ISO, Geneve.
|
|
24.
|
Southwood, T.R.E. (1991). Ecological methods. With particular reference to the study of insect populations. (2nd ed.). Chapman & Hall, London, 524 pp.
|
|
25.
|
Dunger, W. and Fiedler, H.J. (1997). Methoden der Bodenbiologie (2nd ed.). G. Fischer, Jena, 539 pp.
|
|
26.
|
Lesna, I. and Sabelis, M.W. (1999). Diet-dependent female choice for males with ‚good genes‘ in a soil predatory mite. Nature 401, 581-583.
|
|
27.
|
Ruf, A. (1989). Die Bedeutung von Arrhenotokie und Kannibalismus für die Populationsentwicklung von Hypoaspis aculeifer (Canestrini 1883) (Acari, Gamasina). Mitt. Deut. Ges. Allg. Angew. Ent. 7, 103-107.
|
|
28.
|
Ruf, A. (1993). Die morphologische Variabilität und Fortpflanzungsbiologie der Raubmilbe Hypoaspis aculeifer (Canestrini 1883) (Mesostigmata, Dermanyssidae). Dissertation, Universität Bremen.
|
|
29.
|
Ignatowicz, S. (1974). Observations on the biology and development of Hypoaspis aculeifer Canestrini, 1885 (Acarina, Gamasides). Zoologica Poloniae 24, 11-59.
|
|
30.
|
Kevan, D.K. McE. and Sharma, G.D. (1964). Observations on the biology of Hypoaspis aculeifer (Canestrini, 1884), apparently new to North America (Acarina: Mesostigmata: Laelaptidae). Acarologia 6, 647-658.
|
|
31.
|
OECD (2006). Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. OECD environmental Health and Safety Publications Series on Testing and Assessment No.54. ENV/JM/MONO(2006)18
|
Dodatok 1
Vymedzenie pojmov
Na účely tejto testovacej metódy sa používajú tieto vymedzenia pojmov (v rámci tohto testu sa všetky účinné koncentrácie vyjadrujú ako hmotnosť testovanej chemikálie na suchú hmotnosť testovacej pôdy):
|
|
Chemikália je látka alebo zmes.
|
|
|
NOEC (koncentrácia bez pozorovaného účinku) je koncentrácia testovanej chemikálie, pri ktorej sa nepozoruje žiadny účinok. V tomto teste koncentrácia zodpovedajúca hodnote NOEC nemá žiadny štatisticky významný účinok (p < 0,05) v rámci daného expozičného času v porovnaní s kontrolnou vzorkou.
|
|
|
LOEC (najnižšia koncentrácia s pozorovaným účinkom) je najnižšia koncentrácia testovanej chemikálie, ktorá má štatisticky významný účinok (p < 0,05) v rámci daného času expozície v porovnaní s kontrolnou vzorkou.
|
|
|
ECx
(účinná koncentrácia x %) je koncentrácia, ktorá v rámci stanoveného času expozície vyvolá účinok x % na testované organizmy v porovnaní s kontrolnou vzorkou. Napríklad EC50 je koncentrácia, pri ktorej sa odhaduje, že v stanovenom čase expozície vyvolá účinok na výsledok testu pri 50 % exponovanej populácie.
|
|
|
Testovaná chemikália je akákoľvek látka alebo zmes, ktorá sa testuje pomocou tejto testovacej metódy.
|
Dodatok 2
Stanovenie maximálnej kapacity zadržiavania vody v pôde
Táto metóda stanovenia maximálnej kapacity zadržiavania vody v pôde sa považuje za vhodnú. Opísaná je v prílohe C normy ISO DIS 11268-2 [Kvalita pôdy – účinky znečisťujúcich látok na dážďovky (Eisenia fetida), časť 2: Part 2: Stanovenie účinkov na reprodukciu (23)].
Pomocou vhodného zariadenia na odber vzoriek (špirálová trubica atď.) sa odoberie určené množstvo (napr. 5 g) testovacieho pôdneho substrátu. Spodná časť trubice sa zakryje kúskom filtračného papiera a po naplnení vodou sa umiestni na stojan vo vodnom kúpeli. Trubica by sa mala postupne ponárať do vody, až kým vodná hladina nestúpne nad vrchnú vrstvu pôdy. Potom by sa mala nechať vo vode približne tri hodiny. Keďže nie všetka voda, ktorú absorbujú kapiláry pôdy, sa môže zachovať, vzorke pôdy by sa malo umožniť odvodnenie počas dvoch hodín tak, že sa trubica uloží na vrstvu veľmi mokrého jemne drveného kremenného piesku v uzavretej nádobe (aby sa zabránilo vysúšaniu). Vzorka by sa potom mala odvážiť a vysušiť na konštantnú hmotnosť pri teplote 105 °C. Kapacitu zadržiavania vody (WHC) je možné vypočítať takto:

kde:
S= vodou saturovaný substrát + hmotnosť trubice + hmotnosť filtračného papiera,
T= hmotnosť obalu (hmotnosť trubice + hmotnosť filtračného papiera),
D= suchá hmotnosť substrátu.
Dodatok 3
Stanovenie pH pôdy
Táto metóda stanovenia pH pôdy je založená na opise uvedenom v norme ISO DIS 10390: Kvalita pôdy – stanovenie pH (16).
Určené množstvo pôdy sa suší pri teplote miestnosti najmenej 12 hodín. Potom sa vytvorí suspenzia pôdy (obsahujúca najmenej 5 g pôdy) s päťnásobným objemom 1 M roztoku chloridu draselného (KCl) analytickej čistoty alebo 0,01 M roztoku chloridu vápenatého (CaCl2) analytickej čistoty. Suspenzia sa následne päť minút dôkladne pretrepáva a potom sa nechá stáť najmenej 2 hodiny, ale nie dlhšie ako 24 hodín. Hodnota pH kvapalnej fázy sa potom meria pH metrom, ktorý sa pred každým meraním kalibruje pomocou vhodnej série tlmivých roztokov (napr. s pH 4,0 a 7,0).
Dodatok 4
Chov druhu Hypoaspis (Geolaelaps) aculeifer, potravinové roztoče a synchronizácia kultúry
Chov druhu Hypoaspis (Geolaelaps) aculeifer:
Kultúry sa môžu uchovávať v plastových nádobách alebo sklených pohároch naplnených zmesou sadry a prášku z dreveného uhlia (9: 1). Sadra sa môže udržiavať vo vlhkom stave pridaním niekoľkých kvapiek destilovanej alebo deionizovanej vody, ak je to potrebné. Optimálna teplota na chov je 20 °C ± 2 °C, režim svetla a tmy nie je pre tento druh dôležitý. Korisťou môžu byť roztoče druhu Typrophagus putrescentiae alebo Caloglyphus sp. (s potravinovými roztočmi by sa malo zaobchádzať opatrne, lebo môžu spôsobovať alergie u ľudí), ale ako korisť sú vhodné aj háďatká, červy čeľade Enchytraeidae a chvostoskoky. Ich zdroje by sa mali zaznamenať. Vývoj populácie sa môže začať s jednou samičkou, lebo samčekovia sa vyvíjajú v neoplodnených vajíčkach. Generácie sa do značnej miery prekrývajú. Samička môže žiť najmenej 100 dní a môže počas svojho života naklásť približne 100 vajíčok. Najvyššiu mieru kladenia vajíčok dosahujú samičky v období 10 – 40 dní (odkedy dospejú) a dosahuje hodnotu až 2,2 vajíčka na samičku– 1 a deň– 1. Čas vývoja od vajíčka po dospelú samičku je približne 20 dní pri teplote 20 °C. Pred začiatkom tohto vývoja by sa malo založiť a udržiavať viac kultúr.
Chov druhu Typrophagus putrescentiae:
Roztoče sa uchovávajú v sklenej nádobe naplnenej jemným práškovým pivovarníckym droždím, ktorá sa vloží do plastového vedra naplneného roztokom KNO3 s cieľom zabrániť úniku. Potravinové roztoče sa umiestnia na vrch tohto prášku. Potom sa pomocou lopatky opatrne zmiešajú s práškom (ktorý sa má vymeniť dvakrát týždenne).
Synchronizácia kultúry:
Exempláre, ktoré sa používajú v rámci testu, by mali približne rovnako staré (asi sedem dní po dosiahnutí štádia dospelosti). Pri teplote chovu 20 °C sa to dosiahne týmto postupom:
Samičky sa presunú do čistej chovnej nádoby a poskytne sa im dostatočné množstvo potravy.
|
—
|
Poskytnú sa im dva až tri dni na kladenie vajíčok, potom sa samičky premiestnia.
|
|
—
|
Dospelé samičky sa použijú na testovanie medzi 28. a 35. dňom od začiatku ich umiestňovania do čistých chovných nádob.
|
Dospelé samičky je možné ľahko odlíšiť od samčekov aj od ostatných vývojových štádií podľa ich väčších rozmerov, oblejšieho tvaru a hnedého chrbtového štítu (samčekovia sú štíhlejší a plochí, nedospelé jedince sú bielej až krémovej farby). Vývoj roztočov prebieha pri teplote 20 °C približne podľa uvedenej schémy (obrázok): vajíčko päť dní, larva dva dni, protonymfa päť dní, deutonymfa sedem dní, obdobie samičky pred kladením vajíčok dva dni. Potom sú roztoče dospelé.
Obrázok
vývoj roztočov druhu Hypoaspis aculeifer (Geolaelaps) pri teplote 20 °C. [premiestnenie = samičky sa použijú na test]

Dospelé testované živočíchy sa premiestnia zo synchronizovanej kultúry do testovacích nádob medzi 28. a 35. dňom od okamihu, keď rodičovské samičky začali klásť vajíčka (t. j. 7 – 14 dní po dosiahnutí štádia dospelosti). Tým sa zabezpečí, že testované živočíchy už prešli obdobím pred kladením vajíčok a spárili sa so samčekmi, ktoré sú takisto prítomné v kultivačnej nádobe. Pozorovania laboratórnych kultúr naznačujú, že samičky sa pária ihneď alebo krátko po dosiahnutí štádia dospelosti, ak sú prítomní samčekovia (Ruf, Vaninnen, osobné pozorovania). Obdobie siedmich dní bolo stanovené s cieľom uľahčiť zapojenie do laboratórnej rutiny a utlmiť individuálne vývojové rozdiely medzi roztočmi. Kladenie vajíčok by sa malo začať prinajmenšom s rovnakým počtom samičiek, aký je prípadne potrebný na test (ak je na test potrebných napr. 400 samičiek, najmenej 400 samičkám by sa malo umožniť klásť vajíčka dva až tri dni). Počiatočnou hranicou pre synchronizovanú populáciu by malo byť najmenej 1 200 vajíčok (pomer pohlaví približne 0,5, mortalita približne 0,2). Na prevenciu kanibalizmu je prijateľnejšie ponechať v jednej nádobe najviac 20 – 30 samičiek kladúcich vajíčka.
Dodatok 5
Metódy extrakcie
V prípade mikroskopických článkonožcov je vhodnou metódou na oddelenie exemplárov od pôdy/substrátu tepelná extrakcia (pozri obrázok). Táto metóda je založená na aktivite organizmov, takže len mobilné exempláre budú mať šancu byť zaznamenané. Princípom tepelnej extrakcie je vytvoriť pre organizmy postupne sa zhoršujúce podmienky vo vzorke, takže opustia substrát a spadnú do fixačnej kvapaliny (napr. etanolu). Kľúčovými bodmi sú trvanie extrakcie a gradient prechodu od dobrých cez stredné až po zlé podmienky pre organizmy. Trvanie extrakcie na ekotoxikologické testy musí byť čo najkratšie, lebo akýkoľvek rast populácie počas extrakcie by skreslil výsledky. Na druhej strane podmienky teploty a vlhkosti vo vzorke musia byť vždy v rozsahu, ktorý umožňuje roztočom pohybovať sa. Zahrievanie vzorky pôdy vedie k vysychaniu substrátu. Ak je vysychanie príliš rýchle, niektoré roztoče môžu tiež vyschnúť skôr, ako sa im podarí uniknúť.
Preto sa navrhuje tento postup (24), (25):
|
|
Zariadenie: Tullgrenov lievik alebo porovnateľné metódy, ako napríklad McFadyenova (zahrievanie zhora, vzorka sa dáva nad lievik).
|
|
|
Režim zahrievania: 25 °C počas 12 hodín, 35 °C počas 12 hodín, 45 °C počas 24 hodín (spolu 48 hodín). Teplota by sa mala merať v substráte.
|
|
|
Fixačná kvapalina: 70 % etanol.
|
|
|
Postup: Zoberie sa sklená nádobka, ktorá sa používala v rámci testu. Odoberie sa uzáver a okolo otvoru sa omotá kus sieťky alebo tkaniny. Tkanina by mala mať veľkosť ôk 1,0 – 1,5 mm. Tkanina sa upevní elastickou páskou. Nádobka sa opatrne otočí hore dnom a vloží do extrakčného zariadenia. Tkanina bráni substrátu, aby vytiekol do fixačnej kvapaliny, ale umožňuje roztočom opustiť vzorku. Po vložení všetkých nádobiek sa začne režim zahrievania. Extrakcia sa skončí po 48 hodinách. Fixačné nádobky sa vyberú zo zariadenia a roztoče sa spočítajú pomocou preparačného mikroskopu.
|
Účinnosť zvolenej metódy extrakcie sa musí overovať raz alebo dvakrát ročne s použitím nádob obsahujúcich známy počet juvenilných a dospelých roztočov v testovacom substráte bez aplikovanej chemikálie. Účinnosť extrakcie by mala byť v priemere ≥ 90 % kombinovane pre všetky vývojové štádiá.
Tullgrenovo extrakčné zariadenie

Ako sa pripraví testovacia nádobka po skončení testu, pred extrakciou.
Dodatok 6
Identifikácia druhu Hypoaspis (Geolaelaps) aculeifer
|
Podtrieda/rad/podrad:
|
|
Čeľaď:
|
|
Rod/podrod/druh:
|
|
Acari/Parasitiformes/Gamasida
|
|
Laelapidae
|
|
Hypoaspis (Geolaelaps) aculeifer
|
|
Autor a dárum:
|
F. Faraji, Ph.D. (MITOX), 23. január 2007
|
|
Použitá literatúra:
|
Karg, W. (1993). Die freilebenden Gamasina (Gamasides), Raubmilben. Tierwelt Deutschlands 59, 2nd revised edition: 1-523.
Hughes, A. M. (1976). The mites of stored food and houses. Ministry of Agriculture, Fisheries and Food, Technical Bulletin 9: 400pp.
Krantz, G.W. (1978). A manual of Acarology. Oregon State University Book Stores, Inc., 509 pp.
|
|
Deterministické vlastnosti:
|
tektum so zaobleným zúbkovaným okrajom, ryhovaný hypostom s viac ako 6 zúbkami, nie veľmi dlhé zadné chrbtové štetiny Z4, chrbtové štetiny, nie veľmi zväčšený normálny genitálny štít, ktorý nesiaha po análny štít, zadná polovica chrbtového štítu bez nespárovaných štetín, nohy II a IV s hrubými makroskopickými štetinami, chrbtové štetiny Z5 približne dvakrát dlhšie než J5, pevné články klepietok s 12 – 14 zubami a pohyblivé články s 2 zubami, zadná časť tela dlhá 520 – 685 μm.
Druh Hypoaspis miles sa tiež používa v oblasti biologickej kontroly a mohlo by dôjsť k jeho zámene s druhom H. aculeifer. Hlavný rozdiel:
H. miles patrí k podrodu Cosmolaelaps a má nožovité chrbtové štetiny, zatiaľ čo H. aculeifer patrí k podrodu Geolaelaps a má chĺpkovité chrbtové štetiny.
|
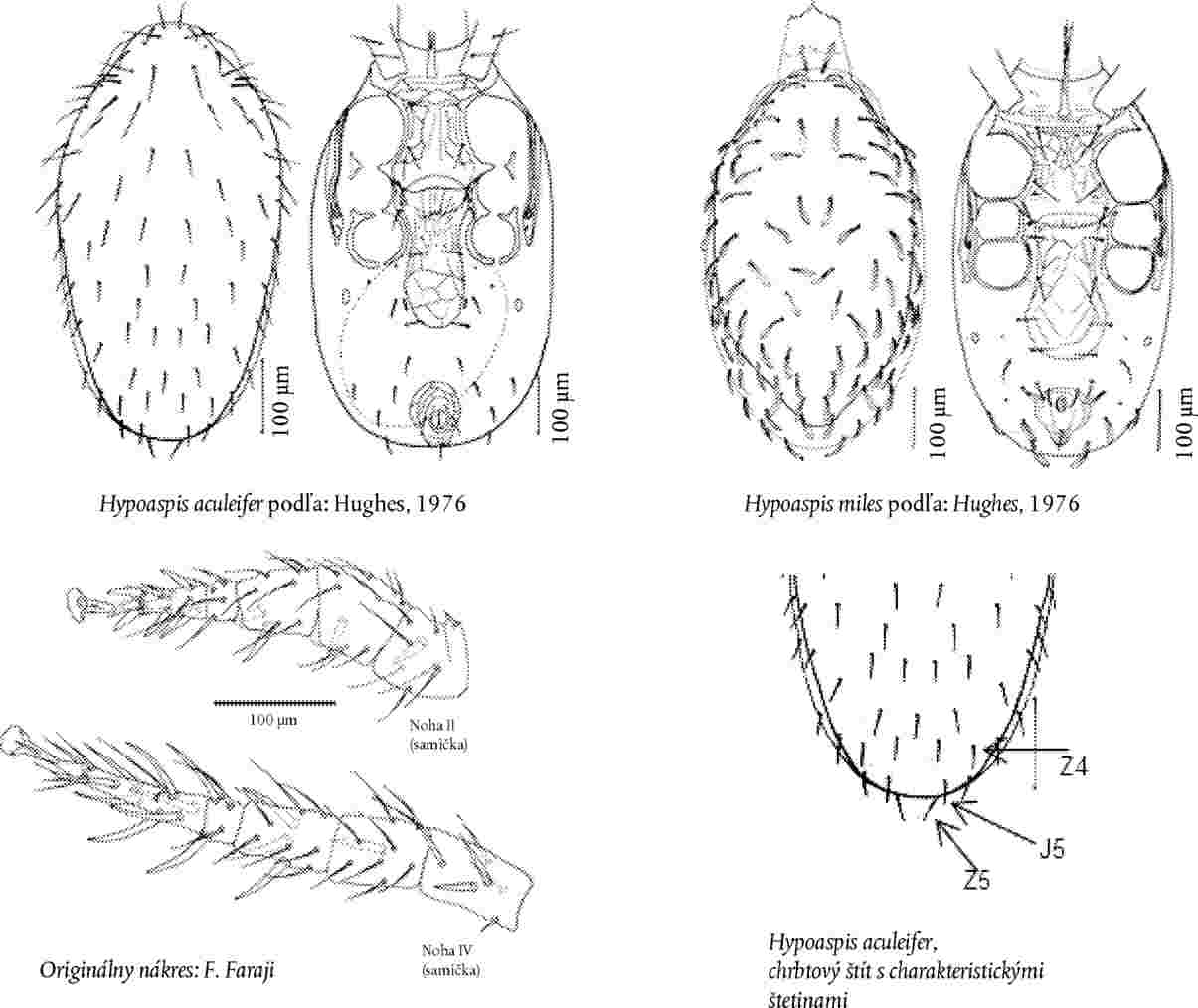
Dodatok 7
Základné informácie o biológii druhu Hypoaspis (Geolaelaps) aculeifer
Druh Hypoaspis aculeifer patrí do čeľade Lealapidae, podtriedy Acari (roztoče), triedy Arachnida, kmeňa Arthropoda. Roztoče žijú vo všetkých druhoch pôdy a živia sa inými roztočmi, háďatkami a chvostoskokmi (26). V prípade nedostatku potravy prejdú na kanibalizmus (27). Telo predátorských roztočov sa delí na dve časti, idiosoma (zadná časť tela) a gnathosoma (predná časť tela). Jasné rozdelenie idiosomy na prosoma (hlavohruď) a opisthosoma (brucho) chýba. Gnathosoma obsahuje nástroje na kŕmenie, ako napríklad tykadlá (palps) a klepietka (chelicery). Klepietka sa delia na tri časti a sú vybavené ostňami rôznych tvarov. Samčekovia využívajú klepietka okrem požívania potravy najmä na prenos svojich spermatických váčkov na samičky. Chrbtový štít pokrýva takmer úplne idiosoma. Veľkú časť idiosoma pri samičkách zaberajú rozmnožovacie orgány, ktoré sú obzvlášť zreteľné krátko pred ukladaním vajíčka. V brušnej časti sa nachádzajú dva štíty, hrudný a genitálny. Všetky nohy sú vybavené štetinami a ostňami. Štetiny sa používajú na uchytenie pri pohybe v pôde alebo na nej. Prvý pár nôh sa používa predovšetkým ako anténa. Druhý pár nôh sa používa nielen na pohyb, ale aj na zovretie koristi. Ostne na štvrtom páre nôh môžu slúžiť na obranu, a tiež ako pohon (28). Samčekovia sú dlhí 0,55 – 0,65 mm a majú hmotnosť 10 – 15 μg. Samičky sú dlhé 0,8 – 0,9 mm a vážia 50 – 60 μg (8) (28) (obr. 1).
Obrázok 1
Samička, samček, protonymfa a larva druhu H. aculeifer.

Pri teplote 23 °C roztoče pohlavne dozrievajú po 16 dňoch (samičky) a po 18 dňoch (samčekovia) (6). Samičky prenesú spermie pomocou solenostoma, odkiaľ sa presunú k vajíčku. Vo vajíčku spermie dozrejú a uchovajú sa tam. K oplodneniu dochádza, až keď spermie vo vajíčku dozrejú. Oplodnené alebo neoplodnené vajíčka budú uložené pri samičkách v zhlukoch alebo oddelene, prevažne v prasklinách alebo otvoroch. Samičky môžu po párení nosiť juvenilných jedincov oboch pohlaví, zatiaľ čo z vajíčok samičiek, ktoré sa nepárili, sa môžu vyliahnuť výlučne samčí juvenilní jedinci. Počas vývoja k dospelosti prechádzajú roztoče štyrmi vývojovými fázami (vajíčko – larva, larva – protonymfa, protonymfa – deutonymfa, deutonymfa – dospelosť).
Vajíčko je mliečne biele, sklovité, elipsovité a približne 0,37 mm dlhé, s pevným plášťom. Podľa literatúry (8) majú larvy veľkosť 0,42 – 0,45 mm. Majú len tri páry nôh. V oblasti hlavy sa vyvíjajú tykadlá a klepietka. Na klepietkach je niekoľko malých zúbkov, ktoré sa používajú na liahnutia z vajíčka. Po prvom lienení, jeden až dva dni po vyliahnutí, sa vyvinie protonymfa. Tiež sú biele, majú veľkosť 0,45 – 0,62 mm (8) a štyri páry nôh. Zuby na klepietkach sú už úplne vyvinuté. Začínajúc týmto štádiom roztoče začínajú zháňať potravu. Z tohto dôvodu roztoč klepietkom prepichne kutikulu koristi a vstrekne do nej sekréty na trávenie. Vzniknutú kašu potom môže roztoč vysať. Klepietka sa môžu použiť aj na odtrhnutie väčších častíc z hrudiek potravy (28). Po jednom ďalšom lienení sa vyvinú deutonymfy. Sú 0,60 – 0,80 mm (8) veľké a majú žltú až svetlohnedú farbu. Od tejto fázy je možné ich rozdeliť na samičky a samčekov. Po ďalšom zvlečení, keď sú živočíchy neaktívne a vyvíja sa im hnedý štít (približne po 14 dňoch), sú roztoče dospelé (28) (29) (30). Ich životnosť je medzi 48 a 100 dní pri teplote 25 °C (27).
Dodatok 8
Zhrnutie a harmonogram hlavných opatrení, ktoré sa majú prijať s cieľom vykonať test s rodom Hypoaspis
|
Čas (dni)
začiatok testu = 0. deň
|
Činnosť/úloha
|
|
– 35. deň
až – 28. deň
|
Samičky sa premiestnia zo zásobnej kultúry do čistých nádob, aby sa začala synchronizácia
o 2 dni neskôr: premiestnenie samičiek
dvakrát alebo trikrát do týždňa: poskytovať dostatok potravy
|
|
– 5. deň (+/- 2)
|
príprava umelej pôdy
|
|
– 4. deň (+/- 2)
|
stanovenie kapacity zadržiavania vody (WHC) umelo pripravenej pôdy
sušenie počas noci
nasledujúci deň: odvážia sa vzorky a vypočíta WHC
|
|
– 4. deň (+/- 2)
|
umelo pripravená pôda sa predvlhčí, aby sa dosiahla vlhkosť 20 – 30 % WHC
|
|
0. deň
|
začiatok testu: do umelo pripravenej pôdy sa pridá testovaná chemikália
do každého replikátu sa vloží desať samičiek
každý replikát sa odváži
pripravia sa abiotické kontrolné vzorky na obsah vlhkosti a pH, 2 replikáty pre každú vzorku s aplikovanou chemikáliou
vlhké kontrolné vzorky sa počas noci vysušia
nasledujúci deň: odvážia sa vlhké kontrolné vzorky
nasledujúci deň: odmeria sa pH vysušených abiotických kontrolných vzoriek
|
|
3., 6., 9., 12. deň (približne)
|
do každého replikátu sa pridá dostatočné množstvo organizmov ako koristi
každý replikát sa odváži, prípadne sa doplní odparená voda
|
|
14. deň
|
ukončí sa test, začne sa extrakcia všetkých replikátov a kontrola účinnosti extrakcie
počas noci sa vysuší obsah vody kontrolných vzoriek
nasledujúci deň: odváži sa obsah vody v kontrolných vzorkách
nasledujúci deň: odmeria sa pH vysušených kontrolných vzoriek
|
|
16. deň
|
ukončí sa extrakcia
|
|
po 16. dni
|
zaznamená sa počet dospelých a juvenilných jedincov vo vybratom materiáli
výsledky sa uvedú do vzorovej tabuľky
do hárkov protokolu o skúške sa zapíše postup testovania
|
C.37. 21-DŇOVÝ TEST NA RYBÁCH: KRÁTKODOBÝ SKRÍNING ESTROGÉNNEHO A ANDROGÉNNEHO PÔSOBENIA A INHIBÍCIA AROMATÁZY
ÚVOD
|
1.
|
Táto testovacia metóda je rovnocenná s usmernením OECD na vykonávanie testov (TG) 230 (2009). Potreba vypracovať a validovať test na rybách, schopný odhaliť určité chemikálie s účinkom na endokrinný systém, vychádza z obavy, že úroveň týchto chemikálií v životnom prostredí môže mať škodlivé účinky na ľudí aj na voľne žijúce živočíchy v dôsledku pôsobenia týchto chemikálií na endokrinný systém. Organizácia OECD v roku 1998 iniciovala činnosť s vysokou prioritou s cieľom zrevidovať existujúce usmernenia a vypracovať nové usmernenia na vykonávanie skríningu a testov potenciálnych endokrinných disruptorov. Jednou zložkou tejto aktivity bolo vypracovať usmernenie na vykonávanie testov pre skríning chemikálií s účinkom na endokrinný systém určitých druhov rýb. Tento 21-dňový skríningový test endokrinného systému rýb bol podrobený rozsiahlemu programu validácie, ktorý pozostával z medzilaboratórnych štúdií s vybratými chemikáliami s cieľom preukázať význam a spoľahlivosť testu na zisťovanie chemikálií s estrogénnym pôsobením a spôsobujúcich inhibíciu aromatázy (1, 2, 3, 4, 5) na troch druhoch skúmaných rýb (čerebľa potočná, medaka japonská a dánio pruhované). Androgénne pôsobenie je možné zisťovať pri čerebli potočnej a medake japonskej, ale nie pri dániu pruhovanom. Táto testovacia metóda neumožňuje zisťovanie anti-androgénnych chemikálií. Postup validácie bol podrobený partnerskému preskúmaniu skupinou odborníkov nominovaných národnými koordinátormi programu usmernení na vykonávanie testov (6). Tento test nie je určený na identifikáciu špecifických mechanizmov hormonálneho narušenia, lebo testovacie živočíchy majú intaktnú os hypotalamus – hypofýza – gonády (HHG), ktorá môže reagovať na ovplyvňujúce chemikálie na rôznych úrovniach. Krátkodobý reprodukčný test na rybách (OECD TG 229) zahŕňa fekunditu a v prípade potreby histopatológiu gonád čereble potočnej, ako aj všetky parametre uvedené v tejto testovacej metóde. Usmernenie OECD TG 229 umožňuje skríning chemikálií, ktoré ovplyvňujú reprodukciu prostredníctvom rôznych mechanizmov vrátane endokrinných modalít. Toto by sa malo zvážiť pred výberom najvhodnejšej testovacej metódy.
|
|
2.
|
Táto testovacia metóda opisuje skríningový test in vivo, v rámci ktorého sa pohlavne dospelí samčekovia a neresiace sa samičky rýb držia spolu a vystavia sa pôsobeniu chemikálie počas obmedzenej etapy ich životného cyklu (21 dní). Po ukončení 21-dňovej expozície sa pri samčekoch a samičkách merajú v závislosti od použitého druhu jeden alebo dva biomarkerové parametre ako indikátory estrogénneho alebo androgénneho pôsobenia a inhibície aromatázy testovanej chemikálie. Týmito parametrami sú vitelogenín a sekundárne pohlavné znaky. Vitelogenín sa meria pri čerebli potočnej, medake japonskej a dániu pruhovanom, zatiaľ čo sekundárne pohlavné znaky iba pri čerebli potočnej a medake japonskej.
|
|
3.
|
Tento biologický test slúži ako skríningový test in vivo pre určité endokrinné mechanizmy pôsobenia a jeho použitie je potrebné posudzovať v kontexte ‚Koncepčného rámca OECD na testovanie a hodnotenie chemikálií ako endokrinných disruptorov‘ (28).
|
ÚVODNÉ ÚVAHY A OBMEDZENIA
|
4.
|
Vitelogenín sa spravidla vytvára v pečeni samičiek vajcorodých stavovcov ako reakcia na cirkulujúci endogénny estrogén. Je to prekurzor proteínov vaječného žĺtka a po vzniku v pečeni sa krvným obehom dostáva k vaječníkom, ktoré ho prijmú a modifikujú v procese tvorby vajíčok. Vitelogenín takmer nie je možné zistiť v plazme nedospelých samičiek a samčekov rýb, pretože nemajú dostatok cirkulujúceho estrogénu. Ich pečeň je však schopná syntetizovať a vylučovať vitelogenín v reakcii na stimuláciu exogénnym estrogénom.
|
|
5.
|
Meranie vitelogenínu slúži na zisťovanie chemikálií s rôznymi estrogénnymi mechanizmami pôsobenia. Estrogénne chemikálie je možné zisťovať prostredníctvom merania indukcie vitelogenínu v telách samčekov rýb, čo bolo veľakrát zdokumentované v partnersky preskúmanej vedeckej literatúre [napr. (7)]. Indukcia vitelogenínu sa preukázala aj po vystavení pôsobeniu aromatizovateľných androgénov (8), (9). Zníženie úrovne cirkulácie estrogénu v telách samičiek, napríklad v dôsledku inhibície aromatázy konverziou endogénneho androgénu na prírodný estrogén 17β-estradiol, spôsobuje pokles úrovne vitelogenínu, ktorý sa používa na zisťovanie chemikálií s vlastnosťami inhibície aromatázy (10), (11). Biologický význam reakcie vitelogenínu na estrogénne pôsobenie a inhibíciu aromatázy je vo veľkej miere zdokumentovaný. Je však možné, že tvorbu vitelogenínu v telách samičiek môže ovplyvňovať aj všeobecná toxicita a iné ako endokrinné toxické mechanizmy pôsobenia, napríklad hepatotoxicita.
|
|
6.
|
Viaceré metódy merania boli úspešne vyvinuté a štandardizované na bežné použitie. Ide o druhovo špecifické metódy enzýmového imunosorbentového stanovenia (ELISA) používajúce imunochémiu na kvantifikáciu vitelogenínu produkovaného v malých vzorkách krvi alebo pečene odobratých z jednotlivých rýb (12), (13), (14), (15), (16), (17), (18). Na meranie vitelogenínu sa odoberajú vzorky krvi čereble potočnej, krvi alebo homogenátu z hlavy/chvosta dánia pruhovaného a pečene medaky japonskej. V prípade medaky japonskej existuje dobrá korelácia medzi vitelogenínom meraným z krvi a z pečene (19). V dodatku 6 sú uvedené odporúčané postupy pre odber vzoriek na analýzu vitelogenínu. Súpravy na meranie vitelogenínu sú bežne dostupné, pričom by tieto súpravy mali byť založené na validovanej druhovo špecifickej metóde ELISA.
|
|
7.
|
Sekundárne pohlavné znaky samčekov niektorých druhov rýb sú zvonku viditeľné, kvantifikovateľné a citlivé na cirkulujúce úrovne endogénnych androgénov. Týka sa to čereble potočnej a medaky japonskej, ale nie dánia pruhovaného, ktorý nemá kvantifikovateľné sekundárne pohlavné znaky. Samičky si udržiavajú schopnosť vývoja samčích sekundárnych pohlavných znakov, ak sú vystavené pôsobeniu androgénnych chemikálií vo vode. Vo vedeckej literatúre sú k dispozícii viaceré štúdie dokumentujúce tento typ reakcie pri jedincoch druhu čereble potočnej (20) a medaky japonskej (21). Interpretácia úbytku sekundárnych pohlavných znakov pri samčekoch by mala byť opatrná vzhľadom na nízku štatistickú významnosť a mala by byť založená na odbornom posudku a závažnosti dôkazov. Použitie dánia pruhovaného v rámci tohto testu je obmedzené, keďže nemá kvantifikovateľné sekundárne pohlavné znaky citlivé na androgénne účinky chemikálií.
|
|
8.
|
V prípade čereble potočnej je hlavným ukazovateľom pôsobenia exogénneho estrogénu počet výrastkov (tuberkulov) nachádzajúcich sa na ústach samičiek rýb. V prípade medaky japonskej predstavuje hlavný marker exogénneho pôsobenia androgénnych chemikálií na samičky rýb počet papilárnych procesov. V dodatkoch 5A a 5B sú uvedené odporúčané postupy, ktoré treba dodržiavať v prípade hodnotenia pohlavných znakov čereble potočnej, resp. medaky japonskej.
|
|
9.
|
Vymedzenie pojmov použité v rámci tejto testovacej metódy je uvedené v dodatku 1.
|
PRINCÍP TESTU
|
10.
|
V rámci testu sa samčekovia a samičky rýb v reprodukčnom stave spoločne vystavia pôsobeniu chemikálie v testovacích nádobách. Ich stav dospelosti a reprodukčný stav umožňuje jasné rozlíšenie obidvoch pohlaví, a teda analýzu každého parametra s ohľadom na pohlavie, a zabezpečuje ich citlivosť na exogénne chemikálie. Po ukončení testu sa pohlavie potvrdí makroskopickým skúmaním gonád po ventrálnom otvorení brušnej dutiny nožnicami. Prehľad príslušných podmienok biologického testu je uvedený v dodatku 2. Test sa spravidla začína výberom vzorky rýb z populácie, ktorá je v stave neresenia, pričom by sa nemali používať senescentné živočíchy. Usmernenie týkajúce sa veku rýb a ich reprodukčného stavu sa uvádza v časti o výbere rýb. Test sa vykonáva s použitím troch expozičných koncentrácií chemikálie, ako aj s kontrolnou vzorkou vody, a ak je to potrebné, s kontrolnou vzorkou obsahujúcou rozpúšťadlo. V prípade medaky japonskej a dánia pruhovaného sa používajú dve nádoby alebo dva replikáty na jednu vzorku s aplikovanou chemikáliou (každá nádoba obsahuje päť samčekov a päť samičiek), zatiaľ čo v prípade čereble potočnej sa používajú štyri nádoby alebo replikáty na jednu vzorku s aplikovanou chemikáliou (každá nádoba obsahuje dvoch samčekov a štyri samičky). Ide o zohľadnenie teritoriálneho správania samčekov čereble potočnej pri súčasnom zachovaní dostatočnej významnosti testu. Expozícia trvá 21 dní a odber vzoriek rýb sa vykoná v 21. deň expozície.
|
|
11.
|
Pre odber vzoriek v 21. deň sa všetky živočíchy usmrtia humánnym spôsobom. Druhotné pohlavné znaky sa zisťujú pri čerebli potočnej a medake japonskej (pozri dodatok 5A a dodatok 5B). Na stanovenie vitelogenínu v tele dánia pruhovaného a čereble potočnej sa odoberú vzorky krvi, pričom alternatívne sa na stanovenie vitelogenínu v tele dánia pruhovaného môžu odobrať hlavy/chvosty (dodatok 6). Na analýzu vitelogenínu v tele medaky japonskej sa odoberie pečeň (dodatok 6).
|
KRITÉRIÁ PRIJATEĽNOSTI TESTU
|
12.
|
Na to, aby boli výsledky testu prijateľné, musia byť splnené tieto podmienky:
|
—
|
úmrtnosť v kontrolných vzorkách s vodou (alebo s rozpúšťadlom) na konci obdobia expozície by nemala prekročiť hodnotu 10 %,
|
|
—
|
koncentrácia rozpusteného kyslíka by mala počas expozície dosahovať najmenej 60 % hodnoty rozpustnosti vzdušného kyslíka,
|
|
—
|
teplota vody by sa v žiadnom okamihu počas expozície nemala líšiť o viac ako ± 1,5 °C medzi testovacími nádobami a mala by sa udržiavať v rozsahu 2 °C v rámci teplotných rozsahov špecifikovaných pre daný testovací druh (dodatok 2),
|
|
—
|
malo by byť preukázateľné, že koncentrácia testovanej chemikálie v roztoku bola uspokojivo udržiavaná v rozsahu ± 20 % stredných nameraných hodnôt.
|
|
OPIS METÓDY
Zariadenie
|
13.
|
Obvyklé laboratórne vybavenie a najmä tieto zariadenia:
|
a)
|
zariadenie na meranie kyslíka a pH meter;
|
|
b)
|
zariadenie na stanovenie tvrdosti a alkality vody;
|
|
c)
|
vhodné zariadenie na reguláciu teploty a podľa možnosti na kontinuálne monitorovanie;
|
|
d)
|
nádrže z chemicky inertného materiálu a s vhodným objemom v súvislosti s odporúčanou veľkosťou násady a chovnou hustotou (pozri dodatok 2);
|
|
e)
|
substrát na neresenie pre čerebľu potočnú a dánio pruhované (potrebné údaje sú uvedené v dodatku 4);
|
|
f)
|
vhodné presné váhy (t. j. s presnosťou do ± 0,5 mg).
|
|
Voda
|
14.
|
Použiteľná voda na testovvanie je každá voda, v ktorej testovací druh vykazuje vhodné dlhotrvajúce prežívanie a rast. Mala by mať konštantnú kvalitu počas celého testu. Hodnota pH vody by mala byť v rozsahu 6,5 – 8,5, ale počas daného testu by mala byť v rozsahu ± 0,5 jednotky pH. S cieľom zabezpečiť, aby riediaca voda nemala prílišný vplyv na výsledok testu (napr. tvorbou komplexu testovanej chemikálie), by sa vzorky mali odoberať v intervaloch počas analýzy. Ak je známe, že riediaca voda bude mať pomerne konštantnú kvalitu, zisťovanie ťažkých kovov (napr. Cu, Pb, Zn, Hg, Cd a Ni), hlavných aniónov a katiónov (napr. Ca2+, Mg2+, Na+, K+, Cl– a SO42–), pesticídov (napr. celkového obsahu organofosforečných a organochlórových pesticídov), celkového organického uhlíka a suspendovaných tuhých látok by sa malo vykonávať napríklad každé tri mesiace. Ak sa preukázalo, že kvalita vody je stabilná najmenej počas jedného roka, merania sa môžu vykonávať menej často a časové intervaly medzi nimi sa môžu predĺžiť (napr. každých šesť mesiacov). Niektoré chemické vlastnosti vody vhodnej na riedenie sú uvedené v zozname v dodatku 3.
|
Testovacie roztoky
|
15.
|
Testovacie roztoky vybratých koncentrácií sa pripravujú riedením zásobných roztokov. Zásobný roztok by sa mal podľa možností pripraviť jednoduchým miešaním alebo trepaním testovanej chemikálie v riediacej vode mechanickým prostriedkom (napr. miešadlom alebo ultrazvukom). Na dosiahnutie vhodne koncentrovaných zásobných roztokov sa môžu použiť saturačné kolóny (rozpúšťacie kolóny). Použitie rozpúšťadla ako nosiča sa neodporúča. Ak je však rozpúšťadlo potrebné, mali by sa súbežne pripraviť kontrolné vzorky s rozpúšťadlom, s rovnakou koncentráciou rozpúšťadla, aká je vo vzorkách s aplikovanou chemikáliou. V prípade zložitých testovaných chemikálií môže byť rozpúšťadlo technicky najlepším riešením, je však potrebné riadiť sa usmerňovacím dokumentom OECD o testovaní toxicity zložitých látok a zmesí vo vodnom prostredí (22). Výber rozpúšťadla bude daný chemickými vlastnosťami chemikálie. V usmerňovacom dokumente OECD sa odporúča maximálna hodnota 100 μl/l, ktorá by sa mala dodržiavať. Nedávny prieskum (23) však poukázal na ďalšie problémy pri používaní rozpúšťadiel v rámci testovania endokrinného pôsobenia. Preto sa v prípadoch, keď je použitie rozpúšťadla potrebné, odporúča minimalizovať jeho koncentráciu všade tam, kde je to technicky možné (v závislosti od fyzikálno-chemických vlastností testovanej chemikálie).
|
|
16.
|
Používať sa bude prietokový testovací systém. Takýmto systémom sa kontinuálne rozdeľuje a riedi zásobný roztok testovanej chemikálie (napr. dávkovacími meracími čerpadlami, proporcionálnym zrieďovačom, saturačným systémom) s cieľom dodať rad koncentrácií do testovacích komôr. Prietoky zásobných roztokov a riediacej vody by sa mali počas testu kontrolovať v intervaloch, najlepšie denne, a ich hodnoty by sa nemali v priebehu celého testu meniť o viac ako 10 %. Pozornosť by sa mala venovať tomu, aby sa nepoužívali potrubia z plastov s nízkym stupňom kvality alebo z iných materiálov, ktoré môžu obsahovať biologicky aktívne chemikálie. Pri výbere materiálu na prietokový systém by sa mala zvážiť možná adsorpcia testovanej chemikálie na tento materiál.
|
Uchovávanie rýb
|
17.
|
Testovacie ryby by sa mali vyberať z laboratórnej populácie, podľa možnosti z jednej zásoby, ktorá sa aklimatizovala najmenej dva týždne pred testom v podobných podmienkach, pokiaľ ide o kvalitu vody a osvetlenie, aké sa použijú v rámci testu. Je dôležité, aby veľkosť násady a chovná hustota (vymedzenie pojmov je uvedené v dodatku 1) boli vhodné pre použitý testovací druh (pozri dodatok 2).
|
|
18.
|
Po 48-hodinovej privykacej (adaptačnej) fáze sa zaznamená mortalita a uplatnia sa tieto kritériá:
|
—
|
úmrtnosť za sedem dní prevyšuje 10 % populácie: celá násada sa vyradí,
|
|
—
|
úmrtnosť je 5 – 10 % populácie: aklimatizovať ďalších sedem dní; ak je úmrtnosť počas ďalších siedmich dní vyššia ako 5 %, celá násada sa vyradí,
|
|
—
|
úmrtnosť za sedem dní je nižšia ako 5 % populácie: násada sa akceptuje.
|
|
|
19.
|
Ryby by nemali byť podrobené liečeniu chorôb počas aklimatizácie, v období pred expozíciou, ani počas expozície.
|
Obdobie pred expozíciou a výber rýb
|
20.
|
Odporúča sa, aby sa živočíchy umiestnili do nádob podobných tým, ktoré sa použijú v rámci skutočného testu, na obdobie jedného týždňa pred expozíciou. Ryby by sa mali kŕmiť ad libitum počas celého obdobia uchovávania a počas fázy expozície. Fáza expozície sa začína s pohlavne dimorfnými dospelými rybami z laboratórnej zásoby reprodukčne zrelých živočíchov (napr. s jasne viditeľnými sekundárnymi pohlavnými znakmi v prípade čereble potočnej a medaky japonskej) vo fáze aktívneho neresenia.Tieto údaje slúžia iba ako všeobecné usmernenie (a nemali by sa brať do úvahy izolovane od pozorovania skutočného reprodukčného stavu danej násady rýb). Čereble potočné by mali byť približne v 20. (± 2) týždni života, za predpokladu, že počas celého života boli kultivované pri teplote 25 ± 2 °C. Medaky japonské by mali byť približne v 16. (± 2) týždni života, za predpokladu, že počas celého života boli kultivované pri teplote 25 ± 2 °C. Medaky japonské by mali byť približne v 16. (± 2) týždni života, za predpokladu, že počas celého života boli kultivované pri teplote 26 ± 2 °C.
|
KONCEPCIA TESTU
|
21.
|
Používajú sa tri koncentrácie testovanej chemikálie, jedna kontrolná vzorka (voda), a ak je to potrebné, jedna kontrolná vzorka s rozpúšťadlom. Údaje je možné analyzovať s cieľom určiť štatisticky významné rozdiely medzi reakciami vo vzorkách s aplikovanou chemikáliou a v kontrolných vzorkách. Tieto analýzy poskytnú informáciu, či je potrebné ďalšie dlhodobejšie testovanie nepriaznivých účinkov (najmä na prežitie, rozvoj, rast a reprodukciu) skôr pre chemikáliu, než na účely hodnotenia rizika (24).
|
|
22.
|
V prípade dánia pruhovaného a medaky japonskej sa v 21. deň testu z tiel samčekov a samičiek na každej úrovni aplikácie chemikálie (päť samčekov a päť samičiek v každom z dvoch replikátov) a v kontrolných skupinách odoberú vzorky na meranie vitelogenínu a sekundárnych pohlavných znakov, podľa potreby. V prípade čereble potočnej sa v 21. deň expozície z tiel samčekov a samičiek (dvaja samčekovia a štyri samičky v každom zo štyroch replikátov) a v kontrolných skupinách odoberú vzorky na stanovenie vitelogenínu a sekundárnych pohlavných znakov.
|
Výber testovacích koncentrácií
|
23.
|
Na účely tohto testu by sa mala stanoviť najvyššia testovacia koncentrácia vo výške maximálnej tolerovanej koncentrácie (MTC), ktorá sa určí pomocou testu na zistenie rozsahu alebo z iných údajov o toxicite, alebo vo výške 10 mg/l, alebo na základe maximálnej rozpustnosti vo vode, podľa toho, ktorá hodnota je najnižšia. MTC sa vymedzuje ako najvyššia testovacia koncentrácia chemikálie, ktorá spôsobuje úmrtnosť nižšiu ako 10 %. Pri tomto prístupe sa predpokladá, že existujú empirické údaje o akútnej toxicite alebo iné údaje o toxicite, na základe ktorých je možné odhadnúť hodnotu MTC. Odhad hodnoty MTC môže byť nepresný a spravidla sa vyžaduje určitý odborný posudok.
|
|
24.
|
Potrebné sú tri testovacie koncentrácie s konštantným faktorom rozstupu nepresahujúcim hodnotu 10 a kontrolná vzorka s riediacou vodou (v prípade potreby aj kontrolná vzorka s rozpúšťadlom). Odporúča sa celá škála faktorov rozstupu s hodnotami od 3,2 do 10.
|
POSTUP
Výber a váženie testovacích rýb
|
25.
|
Je dôležité hneď na začiatku testu minimalizovať odchýlky v hmotnosti rýb. Vhodné rozsahy veľkosti rýb na použitie v rámci tohto testu pre rôzne druhy sú uvedené v dodatku 2. Pre celú násadu rýb použitých v rámci testu platí, že rozsah individuálnych hmotností samčekov a samičiek na začiatku testu by sa mal udržiavať podľa možnosti v rozsahu ± 20 % aritmetickej strednej hodnoty hmotnosti jedincov rovnakého pohlavia. Odporúča sa odvážiť aj čiastkovú vzorku zásoby rýb pred testom, aby bolo možné odhadnúť strednú hmotnosť.
|
Podmienky expozície
Trvanie
|
26.
|
Test trvá 21 dní nasledujúcich po období pred expozíciou. Odporúčané obdobie pred expozíciou je jeden týždeň.
|
Kŕmenie
|
27.
|
Ryby by sa mali kŕmiť ad libitum vhodnou potravou (dodatok 2) v dostatočnom množstve, aby sa udržiaval ich telesný stav. Treba dbať na to, aby sa predišlo rastu mikroorganizmov a zákalu vody. Ako všeobecné usmernenie platí, že denná dávka môže byť rozdelená do dvoch alebo troch rovnakých porcií podávaných vo viacerých kŕmeniach za deň, oddelene, najmenej s trojhodinovými prestávkami. Jedna väčšia porcia je prijateľná najmä počas víkendov. Ryby sa nekŕmia počas 12 hodín pred odberom vzoriek/pitvou.
|
|
28.
|
Potrava pre ryby by sa mala hodnotiť z hľadiska prítomnosti kontaminantov, ako sú organochlórové pesticídy, polycyklické aromatické uhľovodíky, polychlórované bifenyly. Vylúčiť by sa mala potrava so zvýšenou úrovňou fytoestrogénov, ktorá by ovplyvnila reakciu pri teste na známe agonisty estrogénu (napr. 17-beta estradiol).
|
|
29.
|
Nezožratá potrava a fekálny materiál by sa mali odstraňovať z testovacích nádob najmenej dvakrát týždenne, napríklad dôkladným vyčistením dna každej nádrže pomocou odsávania.
|
Svetlo a teplota
|
30.
|
Fotoperióda a teplota vody by mali byť vhodné pre dané testovacie druhy (dodatok 2).
|
Frekvencia analytických stanovení a meraní
|
31.
|
Pred začiatkom času expozície je potrebné zabezpečiť riadne fungovanie systému prísunu chemikálie. Pripraviť by sa mali všetky potrebné analytické metódy vrátane dostatočných vedomostí o chemickej stabilite v testovacom systéme. Počas testu sa koncentrácie testovanej chemikálie určujú v pravidelných časových intervaloch takto: prietoky riedidla a zásobného roztoku toxickej látky by sa mali kontrolovať podľa možnosti denne, ale minimálne dvakrát za týždeň, a nemali by sa počas celého testu meniť viac ako o 10 %. Odporúča sa merať skutočné koncentrácie testovanej chemikálie vo všetkých nádobách na začiatku testu a potom v týždenných intervaloch.
|
|
32.
|
Odporúča sa, aby výsledky vychádzali z nameraných koncentrácií. V prípade, že koncentrácia testovanej chemikálie v roztoku bola uspokojivo udržiavaná v rozsahu ± 20 % nominálnej koncentrácie počas celého testu, výsledky môžu vychádzať buď z nominálnych, alebo z nameraných hodnôt.
|
|
33.
|
Vzorky môže byť potrebné filtrovať (napr. pomocou filtra s veľkosťou pórov 0,45 μm) alebo odstreďovať. V prípade potreby je odstreďovanie odporúčaným postupom. Ak sa však testovaný materiál neabsorbuje na filtri, aj filtrácia je prijateľná.
|
|
34.
|
Počas testu by sa najmenej raz za týždeň mala merať koncentrácia rozpusteného kyslíka, teplota a hodnota pH vo všetkých testovacích nádobách. Najmenej raz za týždeň by sa mala merať celková tvrdosť vody a alkalita v kontrolných nádobách a v jednej nádobe s najvyššou koncentráciou. Teplota by sa mala podľa možnosti monitorovať kontinuálne aspoň v jednej testovacej nádobe.
|
Pozorovania
|
35.
|
V priebehu alebo na konci testu sa posudzujú viaceré všeobecné reakcie (napr. prežitie) a základné biologické reakcie (napr. úroveň vitelogenínu). Meranie a hodnotenie týchto parametrov a ich využitie sú opísané v ďalších bodoch.
|
Prežitie
|
36.
|
Ryby by sa mali počas testovacieho obdobia denne kontrolovať, každý úhyn by sa mal zaznamenať a uhynutá ryba čo najskôr odstrániť. Mŕtve ryby by sa nemali nahrádzať ani v kontrolných nádobách, ani v nádobách s aplikovanou chemikáliou. Pohlavie rýb, ktoré uhynuli počas testu, by sa malo určiť makroskopickým hodnotením gonád.
|
Správanie a vzhľad
|
37.
|
Akékoľvek abnormálne správanie (v porovnaní s kontrolnými vzorkami) by sa malo zaznamenať. Môže ísť o príznaky všeobecnej toxicity vrátane hyperventilácie, nekoordinovaného plávania, straty rovnováhy a atypickej nehybnosti alebo kŕmenia. Okrem toho by sa mali zaznamenať aj vonkajšie abnormality (ako napríklad krvácanie, strata farby). Takéto príznaky toxicity by sa mali starostlivo zvážiť pri interpretácii údajov, lebo môžu naznačovať existenciu koncentrácií, pri ktorých biomarkery endokrinného pôsobenia nie sú spoľahlivé. Takéto pozorovania správania môžu poskytovať aj užitočné kvalitatívne informácie na vypracovanie potenciálnych budúcich požiadaviek na vykonávanie testov s rybami. Napríklad v prípade normálnych samčekov a maskulinizovaných samičiek čereble potočnej, vystavených androgénnemu pôsobeniu, bola pozorovaná teritoriálna agresivita. V prípade dánia pruhovaného sa po vystavení estrogénnemu alebo anti-androgénnemu pôsobeniu znižuje alebo spomaľuje charakteristická aktivita pri párení a neresení.
|
|
38.
|
Keďže niektoré aspekty vzhľadu (predovšetkým farba) sa môžu rýchlo zmeniť pri manipulácii, je dôležité, aby sa kvalitatívne pozorovania vykonávali pred odstránením živočíchov z testovacieho systému. Doterajšie skúsenosti s druhom čereble potočnej naznačujú, že niektoré chemikálie s účinkom na endokrinný systém môžu najskôr vyvolať zmeny týchto vonkajších znakov: farba tela (svetlá alebo tmavá), vzorované sfarbenie (prítomnosť zvislých pruhov) a tvar tela (hlavová a prsná oblasť). Pozorovania fyzického vzhľadu rýb by sa preto mali vykonávať v priebehu celého testu a na záver štúdie.
|
Humánne usmrcovanie rýb
|
39.
|
V 21. deň, t. j. po ukončení expozície, by sa ryby mali usmrtiť primeraným množstvom trikaínu [trikaín metán sulfonát, Metacain, MS-222 (CAS 886-86-2)], 100 – 500 mg/l, tlmeného pridaním 300 mg/l NaHCO3 (bikarbonát sodný, CAS 144-55-8) na zníženie podráždenia slizníc. Potom sa odoberú vzorky krvi alebo tkaniva na stanovenie vitelogenínu, ako je vysvetlené v príslušnej časti.
|
Pozorovanie sekundárnych pohlavných znakov
|
40.
|
Niektoré chemikálie s účinkom na endokrinný systém môžu vyvolávať zmeny špecializovaných sekundárnych pohlavných znakov (počet tuberkulov pri samčekoch čereble potočnej, papilárnych procesov pri samčekoch medaky). Najmä chemikálie s určitými mechanizmami pôsobenia môžu vyvolávať abnormálny výskyt sekundárnych pohlavných znakov pri živočíchoch opačného pohlavia, napríklad agonisty androgénových receptorov, ako sú trenbolón, metyltestosterón a dihydrotestosterón, môžu spôsobovať vyvinutie výrazných tuberkulov pri samičkách čereble potočnej alebo papilárnych procesov pri samičkách medaky (11), (20), (21). Uvádza sa tiež, že agonisty estrogénových receptorov môžu znížiť počet tuberkulov a veľkosť záhlavnej časti chrbta pri dospelých samčekoch (25), (26). Takéto celkové morfologické pozorovania môžu poskytovať užitočné kvalitatívne a kvantitatívne informácie na vypracovanie potenciálnych budúcich požiadaviek na vykonávanie testov s rybami. Počet a veľkosť tuberkulov pri čerebli potočnej a papilárnych procesov pri medake je možné kvantifikovať priamo alebo praktickejšie na konzervovaných exemplároch. V dodatkoch 5A a 5B sú uvedené odporúčané postupy na hodnotenie sekundárnych pohlavných znakov čereble potočnej, resp. medaky.
|
Vitelogenín (VTG)
|
41.
|
Krv sa odoberá z chvostovej tepny/žily pomocou heparinizovanej mikrohematokritovej kapilárnej kanyly, alebo alternatívne srdcovou punkciou pomocou striekačky. V závislosti od veľkosti rýb sa objem krvi, ktorú je možné odobrať, vo všeobecnosti pohybuje v rozmedzí 5 – 60 μl na jeden exemplár čereble potočnej a 5 – 15 μl na jeden exemplár dánia pruhovaného. Plazma sa oddelí od krvi odstredením a uchová sa s inhibítorom proteázy pri teplote – 80 °C, pokým nebude analyzovaná na prítomnosť vitelogenínu. Alternatívne sa ako zdroj tkaniva na stanovenie vitelogenínu použije pečeň v prípade medaky a homogenát z hlavy/chvosta v prípade dánia pruhovaného (dodatok 6). Meranie vitelogenínu by malo byť založené na validovanej homologickej metóde ELISA, s použitím homologického štandardu vitelogenínu a homologických protilátok. Odporúča sa použiť metódu, pomocou ktorej je možné zistiť množstvo vitelogenínu na úrovni niekoľkých ng/ml plazmy (alebo ng/mg tkaniva), čo je úroveň pozadia v tele samčekov rýb bez aplikovanej chemikálie.
|
|
42.
|
Kontrola kvality analýzy vitelogenínu sa vykoná s použitím štandardov, slepých vzoriek a aspoň dvojitej analýzy. Pre každú metódu ELISA by sa mal pri určovaní minimálneho faktora riedenia vzorky vykonať test na matricový efekt (efekt zriedenia vzorky). Každá platnička ELISA používaná v rámci testov na zistenie vitelogenínu by mala obsahovať tieto vzorky na kontrolu kvality: najmenej šesť kalibračných štandardov zahŕňajúcich rozsah očakávaných koncentrácií vitelogenínu a najmenej jednu nešpecifickú viazanú testovaciu slepú vzorku (analyzuje sa duplicitne). Absorbancia týchto slepých vzoriek by mala byť nižšia ako 5 % maximálnej absorbancie kalibračného štandardu. Analyzovať sa budú najmenej dve alikvotné časti (paralelné) každého zriedenia vzorky. Paralelné vzorky, ktoré sa líšia o viac ako 20 %, by sa mali opätovne analyzovať.
|
|
43.
|
Korelačný koeficient (R2) pre kalibračné krivky by mal byť väčší ako 0,99. Vysoká korelácia však nie je dostatočná na to, aby sa zaručilo primerané predvídanie koncentrácie vo všetkých rozsahoch. Okrem dostatočne vysokej korelácie pre kalibračnú krivku by koncentrácia každého štandardu, ktorá sa vypočíta z kalibračnej krivky, mala ležať v rozsahu 70 – 120 % nominálnej koncentrácie. Ak sa nominálne koncentrácie odkláňajú od kalibračnej regresnej priamky (napr. pri nižších koncentráciách), môže byť nevyhnutné rozdeliť kalibračnú krivku na nízky a vysoký rozsah, alebo použiť nelineárny model, ktorý primerane zodpovedá údajom o absorbancii. Ak sa krivka rozdelí, obidve jej časti by mali mať R2 > 0,99.
|
|
44.
|
Detekčný limit (LOD) je vymedzený ako koncentrácia najnižšieho analytického štandardu a limit kvantifikácie (LOQ) je vymedzený ako súčin koncentrácie najnižšieho analytického štandardu a najnižšieho faktora riedenia.
|
|
45.
|
Každý deň, keď sa vykonávajú testy na zistenie vitelogenínu, sa budú analyzovať obohatené vzorky s použitím referenčnej látky-štandard (dodatok 7). Spolu s výsledkami z každého súboru testov vykonaných v tento deň sa uvádza pomer očakávanej koncentrácie a nameranej koncentrácie.
|
ÚDAJE A PODÁVANIE SPRÁV
Vyhodnocovanie reakcií biomarkerov pomocou analýzy rozptylu (ANOVA)
|
46.
|
Na zistenie potenciálneho endokrinného pôsobenia chemikálie sa porovnávajú reakcie v skupinách s aplikovanou chemikáliou a reakcie v kontrolných skupinách pomocou analýzy rozptylu (ANOVA). Ak sa použije kontrolná vzorka s rozpúšťadlom, mali by sa pre každý parameter vykonať vhodné štatistické testy na porovnanie kontrolných vzoriek s riediacou vodou a kontrolných vzoriek s rozpúšťadlom. Usmernenia k spôsobu použitia údajov z kontrolných vzoriek s riediacou vodou a kontrolných vzoriek s rozpúšťadlom v následnej štatistickej analýze je možné nájsť v dokumente OECD 2006c (27). Všetky údaje o biologických reakciách by sa mali analyzovať a uvádzať osobitne podľa pohlavia. Ak sa nesplnia požadované predpoklady parametrických metód – iné ako normálne rozdelenie (napr. Shapiro-Wilkov test) alebo heterogénny rozptyl (Barlettov test), je potrebné zvážiť transformovanie údajov pred vykonaním analýzy ANOVA tak, aby sa dosiahli homogénne rozptyly, alebo vykonanie váženej ANOVA. V prípade nemonotónnej závislosti reakcie od dávky sa môže použiť Dunnettov test (parametrický) na viacnásobné párové porovnávanie alebo Mannov-Whitneyho test s Bonferroniho úpravou (neparametrický). Ak je závislosť reakcie od dávky približne monotónna, môžu sa použiť iné štatistické testy (napr. Jonckheereho-Terpstrov test alebo Williamsov test). V dodatku 8 je uvedený štatistický diagram, ktorý má pomôcť pri rozhodovaní o najvhodnejšom štatistickom teste na použitie. Doplnkové informácie je možné získať aj z dokumentu OECD o súčasných prístupoch v štatistickej analýze údajov o ekotoxicite (27).
|
Podávanie správ o výsledkoch testu
|
47.
|
Údaje štúdie by mali zahŕňať:
|
|
Testovacie zariadenie:
|
—
|
zodpovední pracovníci a ich úlohy v rámci štúdie,
|
|
—
|
každé laboratórium preukáže odbornosť v používaní škály reprezentatívnych chemikálií.
|
|
|
|
Testovaná chemikália:
|
—
|
charakteristika testovanej chemikálie,
|
|
—
|
fyzikálny charakter a dôležité fyzikálno-chemické vlastnosti,
|
|
—
|
metóda a frekvencia prípravy testovacích koncentrácií,
|
|
—
|
informácie o stabilite a biodegradovateľnosti.
|
|
|
|
Rozpúšťadlo:
|
—
|
charakteristika rozpúšťadla (povaha, použitá koncentrácia),
|
|
—
|
odôvodnenie výberu rozpúšťadla (ak je iné ako voda).
|
|
|
|
Testovacie živočíchy:
|
—
|
dodávateľ a konkrétne zariadenie dodávateľa,
|
|
—
|
vek rýb na začiatku testu a stav reprodukcie/neresenia,
|
|
—
|
údaje o postupe aklimatizácie živočíchov,
|
|
—
|
telesná hmotnosť rýb na začiatku expozície (z podvzorky populácie rýb).
|
|
|
|
Podmienky testu:
|
—
|
použitý postup testovania (druh testu, stupeň zaťaženia, chovná hustota atď.),
|
|
—
|
metóda prípravy zásobných roztokov a prietok,
|
|
—
|
nominálne testovacie koncentrácie, týždenne merané koncentrácie testovacích roztokov a použitá analytická metóda, stredné namerané hodnoty a štandardné odchýlky v testovacích nádobách a dôkaz o tom, že merania zodpovedajú koncentráciám testovanej chemikálie v skutočnom roztoku,
|
|
—
|
charakteristiky riediacej vody (vrátane pH, tvrdosti, alkality, teploty, koncentrácie rozpusteného kyslíka, úrovne reziduálneho chlóru, celkového organického uhlíka, suspendovaných tuhých látok a výsledkov akýchkoľvek iných vykonaných meraní),
|
|
—
|
kvalita vody v testovacích nádobách: pH, tvrdosť, teplota a koncentrácia rozpusteného kyslíka,
|
|
—
|
podrobné informácie o kŕmení [napr. druh potravy, zdroj, dávkované množstvo a frekvencia a analýza príslušných kontaminantov (napr. polychlórované bifenyly, polycyklické aromatické uhľovodíky a organochlórové pesticídy), ak je k dispozícii].
|
|
|
|
Výsledky
|
—
|
dôkaz, že kontrolné vzorky splnili kritériá prijateľnosti testu,
|
|
—
|
údaje o úmrtnosti vyskytujúcej sa pri každej z testovacích koncentrácií a v kontrolnej vzorke,
|
|
—
|
používané štatistické analytické techniky, spracovanie údajov a odôvodnenie použitia daných techník,
|
|
—
|
údaje o biologických pozorovaniach celkovej morfológie vrátane sekundárnych pohlavných znakov a vitelogenínu,
|
|
—
|
výsledky analýz údajov, najlepšie v tabuľkovej a grafickej forme,
|
|
—
|
výskyt akýchkoľvek neobvyklých reakcií rýb a akýchkoľvek viditeľných účinkov vyvolaných testovanou chemikáliou.
|
|
|
USMERNENIE PRE INTERPRETÁCIU A AKCEPTÁCIU VÝSLEDKOV TESTU
|
48.
|
Táto časť obsahuje niekoľko aspektov, ktoré treba brať do úvahy pri interpretácii výsledkov testu pre jednotlivé merané parametre. Výsledky by sa mali interpretovať opatrne, ak sa zdá, že testovaná chemikália má zjavné toxické účinky alebo ovplyvňuje celkový stav testovacieho živočícha.
|
|
49.
|
S cieľom umožniť zmysluplnú interpretáciu údajov je potrebné pri stanovení rozsahu testovacích koncentrácií dbať na to, aby sa neprekročila maximálna tolerovaná koncentrácia. Je dôležité mať najmenej jednu vzorku s aplikovanou chemikáliou, v ktorej nie sú žiadne príznaky toxických účinkov. Príznaky choroby a príznaky toxických účinkov by sa mali dôkladne vyhodnotiť a zaznamenať. Je napríklad možné, že produkciu vitelogenínu v telách samičiek môže ovplyvňovať aj všeobecná toxicita a neendokrinné toxické mechanizmy pôsobenia, napríklad hepatotoxicita. Interpretáciu účinkov však môžu podporiť iné množstvá aplikovanej chemikálie, ktoré nie je možné si pomýliť so systémovou toxicitou.
|
|
50.
|
Existuje niekoľko aspektov, ktoré treba brať do úvahy pri akceptácii výsledkov testu. Ako usmernenie platí, že úrovne vitelogenínu v kontrolných skupinách samčekov a samičiek by mali byť odlišné a líšiť by sa mali približne o tri rádové hodnoty v prípade čereble potočnej a dánia pruhovaného a približne o jeden rád v prípade medaky. Príklady rozsahu hodnôt, ktoré sa vyskytli v kontrolných skupinách a v skupinách s aplikovanou chemikáliou, sú k dispozícii vo validačných správach (1), (2), (3), (4). Vysoké hodnoty vitelogenínu pri samčekoch v kontrolných skupinách by mohli ohroziť citlivosť testu a jeho schopnosť odhaliť slabé agonisty estrogénu. Nízke hodnoty vitelogenínu pri samičkách v kontrolných skupinách by mohli ohroziť citlivosť testu a jeho schopnosť odhaliť inhibítory aromatázy a antagonisty estrogénu. Na vypracovanie tohto usmernenia sa použili validačné štúdie.
|
|
51.
|
Ak laboratórium predtým nevykonávalo tento test alebo nastali podstatné zmeny (napr. zmena kmeňa rýb alebo dodávateľa), je vhodné realizovať štúdiu technickej spôsobilosti. Odporúča sa použitie chemikálií, ktoré zahŕňajú rôzne mechanizmy pôsobenia alebo vplyvu na viaceré parametre testu. V praxi sa každému laboratóriu odporúča, aby si budovalo svoju vlastnú databázu historických kontrolných údajov pre samčekov a samičky a aby používalo pozitívnu kontrolnú chemikáliu na estrogénne pôsobenie (napr. 17β-estradiol, 100 ng/l, alebo známe slabé agonisty), ktoré vedie k zvýšeniu množstva vitelogenínu v telách samčekov rýb, pozitívnu kontrolnú chemikáliu na inhibíciu aromatázy (napr. fadrozol alebo prochloraz, 300 μg/l), ktorá vedie k zníženiu množstva vitelogenínu v telách samičiek rýb, a pozitívnu kontrolnú chemikáliu na androgénne pôsobenie (napr. 17β-trenbolón, 5 μg/l), ktoré vedie k vzniku sekundárnych pohlavných znakov pri samičkách čereble potočnej a medaky. Všetky tieto údaje je možné porovnať s dostupnými údajmi z validačných štúdií (1), (2), (3), aby sa zabezpečila odbornosť laboratória.
|
|
52.
|
Vo všeobecnosti by sa malo meranie vitelogenínu považovať za pozitívne, ak existuje štatisticky významné zvýšenie množstva vitelogenínu v telách samčekov (p < 0,05) alebo štatisticky významný pokles v telách samičiek (p < 0,05) v porovnaní s kontrolnou skupinou, aspoň pri najvyššej testovacej dávke, a ak sa nevyskytnú príznaky všeobecnej toxicity. Pozitívny výsledok ďalej podporí preukázanie biologicky hodnoverného vzťahu medzi dávkou a reakciou. Ako už bolo uvedené, pokles množstva vitelogenínu nemusí mať výlučne endokrinný pôvod. Pozitívny výsledok by sa však mal vo všeobecnosti interpretovať ako dôkaz endokrinného pôsobenia in vivo a mal by spravidla viesť k opatreniam na ďalšie objasnenie.
|
LITERATÚRA
|
1.
|
OECD (2006a). Report of the Initial Work Towards the Validation of the 21-Day Fish Screening Assay for the Detection of Endocrine active Substances (Phase 1A). OECD Environmental Health and Safety Publications Series on Testing and Assessment No.60, ENV/JM/MONO(2006)27.
|
|
2.
|
OECD (2006b). Report of the Initial Work Towards the Validation of the 21-Day Fish Screening Assay for the Detection of Endocrine active Substances (Phase 1B). OECD Environmental Health and Safety Publications Series on Testing and Assessment No.61, ENV/JM/MONO(2006)29.
|
|
3.
|
OECD (2007). Final report of the Validation of the 21-day Fish Screening Assay for the Detection of Endocrine Active Substances. Phase 2: Testing Negative Substances. OECD Environmental Health and Safety Publications Series on Testing and Assessment No.78, ENV/JM/MONO(2007)25.
|
|
4.
|
Owens JW (2007). Phase 3 report of the validation of the OECD Fish Screening Assay. CEFIC LRI Project, Endocrine. http://www.cefic-lri.org/index.php?page=projects (accessed 18/09/08).
|
|
5.
|
US EPA 2007. Validation of the Fish Short-Term Reproduction Assay: Integrated Summary Report. Unpublished report dated 15 December 2007. US Environmental Protection Agency, Washington, DC. s. 104.
|
|
6.
|
OECD, 2008. Report of the Validation Peer Review for the 21-Day Fish Endocrine Screening Assay and Agreement of the Working Group of the National Coordinators of the Test Guidelines Programme on the Follow-up of this Report. OECD Environmental Health and Safety Publications Series on Testing and Assessment No.94, ENV/JM/MONO(2008)21.
|
|
7.
|
Sumpter a Jobling (1995). Vitellogenesis as a biomarker for estrogenic contamination of the aquatic environment. Environmental Health Perspectives;103 Suppl 7:173 – 8 Review.
|
|
8.
|
Pawlowski S, Sauer A, Shears JA, Tyler CR, Braunbeck T (2004). Androgenic and estrogenic effects of the synthetic androgen 17alpha-methyltestosterone on sexual development and reproductive performance in the fathead minnow (Pimephales promelas) determined using the gonadal recrudescence assay. Aquatic Toxicology; 68(3):277 – 91.
|
|
9.
|
Andersen L, Goto-Kazato R, Trant JM, Nash JP, Korsgaard B, Bjerregaard P (2006). Short-term exposure to low concentrations of the synthetic androgen methyltestosterone affects vitellogenin and steroid levels in adult male zebrafish (Danio rerio). Aquatic Toxicology; 76(3-4):343 – 52.
|
|
10.
|
Ankley GT, Kahl MD, Jensen KM, Hornung MW, Korte JJ, Makynen EA, Leino RL (2002). Evaluation of the aromatase inhibitor fadrozole in a short-term reproduction assay with the fathead minnow (Pimephales promelas). Toxicological Sciences;67(1):121 – 30.
|
|
11.
|
Panter GH, Hutchinson TH, Hurd KS, Sherren A, Stanley RD, Tyler CR (2004). Successful detection of (anti-)androgenic and aromatase inhibitors in pre-spawning adult fathead minnows (Pimephales promelas) using easily measured endpoints of sexual development. Aquatic Toxicology; 70(1):11 – 21.
|
|
12.
|
Parks LG, Cheek AO, Denslow ND, Heppell SA, McLachlan JA, LeBlanc GA, Sullivan CV (1999). Fathead minnow (Pimephales promelas) vitellogenin: purification, characterization and quantitative immunoassay for the detection of estrogenic compounds. Comparative Biochemistry and Physiology. Part C Pharmacology, toxicology and endocrinology; 123(2):113 – 25.
|
|
13.
|
Panter GH, Tyler CR, Maddix S, Campbell PM, Hutchinson TH, Länge R, Lye C, Sumpter JP, 1999. Application of an ELISA to quantify vitellogenin concentrations in fathead minnows (Pimephales promelas) exposed to endocrine disrupting chemicals. CEFIC-EMSG research report reference AQ001. CEFIC, Brusel, Belgicko.
|
|
14.
|
Fenske M., van Aerle, R.B., Brack, S.C., Tyler, C.R., Segner, H., (2001). Development and validation of a homologous zebrafish (Danio rerio Hamilton- Buchanan) vitellogenin enzyme-linked immunosorbent assay (ELISA) and its application for studies on estrogenic chemicals. Comp. Biochem. Phys. C 129 (3): 217 – 232.
|
|
15.
|
Holbech H, Andersen L, Petersen GI, Korsgaard B, Pedersen KL, Bjerregaard P. (2001). Development of an ELISA for vitellogenin in whole body homogenate of zebrafish (Danio rerio). Comparative Biochemistry and Physiology. Part C Pharmacology, toxicology and endocrinology; 130: 119 – 131.
|
|
16.
|
Rose J, Holbech H, Lindholst C, Noerum U, Povlsen A, Korsgaard B, Bjerregaard P. 2002. Vitellogenin induction by 17ß-estradiol and 17ß-ethinylestradiol in male zebrafish (Danio rerio). Comp. Biochem. Physiol. C. 131: 531 – 539.
|
|
17.
|
Brion F, Nilsen BM, Eidem JK, Goksoyr A, Porcher JM, Development and validation of an enzyme-linked immunosorbent assay to measure vitellogenin in the zebrafish (Danio rerio). Environmental Toxicology and Chemistry; vol 21: 1699 – 1708.
|
|
18.
|
Yokota H, Morita H, Nakano N, Kang IJ, Tadokoro H, Oshima Y, Honjo T, Kobayashi K. 2001. Development of an ELISA for determination of the hepatic vitellogenin in Medaka (Oryzias latipes). Jpn J Environ Toxicol 4:87 – 98.
|
|
19.
|
Tatarazako N, Koshio M, Hori H, Morita M a Iguchi T., 2004. Validation of an enzyme-linked immunosorbent assay method for vitellogenin in the Medaka. Journal of Health Science 50:301 – 308.
|
|
20.
|
Ankley GT, Jensen KM, Makynen EA, Kahl MD, Korte JJ, Homung MW, Henry TR, Denny JS, Leino RL, Wilson VS, Cardon MC, Hartig PC, Gray LE (2003). Effects of the androgenic growth promoter 17-beta-trenbolone on fecundity and reproductive endocrinology of the fathead minnow. Environmental Toxicology and Chemistry; 22(6): 1350 – 60.
|
|
21.
|
Seki M, Yokota H, Matsubara H, Maeda M, Tadokoro H, Kobayashi K (2004). Fish full life-cycle testing for androgen methyltestosterone on medaka (Oryzias latipes). Environmental Toxicology and Chemistry; 23(3):774 – 81.
|
|
22.
|
OECD (2000) Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. Environmental Health and Safety Publications. Series on Testing and Assessment. No. 23. Paríž.
|
|
23.
|
Hutchinson TH, Shillabeer N, Winter MJ, Pickford DB, 2006a. Acute and chronic effects of carrier solvents in aquatic organisms: A critical review. Review. Aquatic Toxicology, 76; s. 69 – 92.
|
|
24.
|
Hutchinson TH, Ankley GT, Segner H, Tyler CR, 2006b. Screening and testing for endocrine disruption in fish-biomarkers as ‚signposts,‘ not ‚traffic lights,‘ in risk assessment. Environmental Health Perspectives;114 Suppl 1:106 – 14.
|
|
25.
|
Miles-Richardson, SR, Kramer VJ, Fitzgerald SD, Render JA, Yamini B, Barbee SJ, Giesy JP. 1999. Effects of waterborne exposure to 17β-estradiol on secondary sex characteristics and gonads of the fathead minnow (Pimephales promelas). Aquat. Toxicol. 47, 129 – 145.
|
|
26.
|
Martinovic, D., L.S. Blake, E.J. Durhan, K.J. Greene, M.D. Kahl, K.M., Jensen, E.A. Makynen, D.L. Villeneuve a G.T. Ankley. 2008. Characterization of reproductive toxicity of vinclozolin in the fathead minnow and co-treatment with an androgen to confirm an anti-androgenic mode of action. Environ. Toxicol. Chem. 27, 478 – 488.
|
|
27.
|
OECD (2006c). Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. OECD environmental Health and Safety Publications Series on Testing and Assessment No.54. ENV/JM/MONO(2006)18.
|
|
28.
|
OECD (2012) OECD Conceptual Framework for Testing and Assessment of Endocrine Disrupters (revised). Annex I to Draft Guidance Document on Standardised Test Guidelines for Evaluating Chemicals for Endocrine Disruption. Series on Testing and Assessment No 150. ENV/JM/MONO(2012)22.
|
Dodatok 1
Skratky a vymedzenie pojmov
Chemikália
: látka alebo zmes.
CV
: variačný koeficient.
ELISA
: enzýmové imunosorbentové stanovenie.
Stupeň zaťaženia
: čerstvá hmotnosť rýb na objem vody.
Chovná hustota
: počet rýb na objem vody.
Vitelogenín (VTG)
: fosfolipoglykoproteín, slúžiaci ako prekurzor proteínov vaječného žĺtka, ktorý sa normálne vyskytuje v telách pohlavne aktívnych samičiek všetkých vajcorodých druhov.
Os HHG (HPG)
: os hypothalamus – hypofýza – gonády (hypothalamic-pituitary-gonadal).
MTC (maximum tolerated concentration)
: maximálna tolerovaná koncentrácia, ktorá predstavuje približne 10 % hodnoty LC50.
Testovaná chemikália
: je akákoľvek látka alebo zmes, ktorá sa testuje pomocou tejto testovacej metódy.
Dodatok 2
Experimentálne podmienky skríningového testu na endokrinnom systéme rýb
|
|
Čerebľa potočná
(Pimephales promelas)
|
Medaka
(Oryzias latipes)
|
Dánio pruhované
(Danio rerio)
|
|
|
prietokový
|
prietokový
|
prietokový
|
|
|
25 ± 2°C
|
25 ± 2°C
|
26 ± 2°C
|
|
|
Žiarivky (široké spektrum)
|
Žiarivky (široké spektrum)
|
Žiarivky (široké spektrum)
|
|
|
10 – 20 μE/m2/s, 540 – 1 000 luxov alebo 50 – 100 ft-c (úrovne v laboratórnom prostredí)
|
10 – 20 μE/m2/s, 540 – 1 000 luxov alebo 50 – 100 ft-c (úrovne v laboratórnom prostredí)
|
10 – 20 μE/m2/s, 540 – 1 000 luxov alebo 50 – 100 ft-c (úrovne v laboratórnom prostredí)
|
|
6.
|
Fotoperióda (možné sú prechody svitania/súmraku, ale nepovažujú sa za nutné)
|
|
16 hodín svetla a 8 hodín tmy
|
12 – 16 hodín svetla a 12 – 8 hodín tmy
|
12 – 16 hodín svetla a 12 – 8 hodín tmy
|
|
|
< 5 g/l
|
< 5 g/l
|
< 5 g/l
|
|
8.
|
Veľkosť skúšobnej komory
|
|
10 l (minimálne)
|
2 l (minimálne)
|
5 l (minimálne)
|
|
9.
|
Objem testovacieho roztoku
|
|
8 l (minimálne)
|
1,5 l (minimálne)
|
4 l (minimálne)
|
|
10.
|
Výmeny objemu testovacích roztokov
|
|
minimálne 6 denne
|
minimálne 5 denne
|
minimálne 5 denne
|
|
11.
|
Vek testovacích organizmov
|
|
pozri bod 20
|
pozri bod 20
|
pozri bod 20
|
|
12.
|
Približná mokrá hmotnosť dospelých rýb (g)
|
|
samičky: 1,5 ± 20 %
samčekovia: 2,5 ± 20 %
|
samičky: 0,35 ± 20 %
samčekovia: 0,35 ± 20 %
|
samičky: 0,65 ± 20 %
samčekovia: 0,4 ± 20 %
|
|
13.
|
Počet rýb v každej testovacej nádobe
|
|
6 (2 samčekovia a 4 samičky)
|
10 (5 samčekov a 5 samičiek)
|
10 (5 samčekov a 5 samičiek)
|
|
14.
|
Počet vzoriek s aplikovanou chemikáliou
|
|
= 3 (plus primerané kontrolné vzorky)
|
= 3 (plus primerané kontrolné vzorky)
|
= 3 (plus primerané kontrolné vzorky)
|
|
15.
|
Počet nádob na každú aplikáciu chemikálie
|
|
minimálne 4
|
minimálne 2
|
minimálne 2
|
|
16.
|
Počet rýb na každú testovanú koncentráciu
|
|
16 dospelých samičiek a 8 samčekov (4 samičky a 2 samčekovia v každej replikačnej nádobe)
|
10 dospelých samičiek a 10 samčekov (5 samičiek a 5 samčekov v každej replikačnej nádobe)
|
10 dospelých samičiek a 10 samčekov (5 samičiek a 5 samčekov v každej replikačnej nádobe)
|
|
|
živé alebo mrazené dospelé jedince alebo larvy žiabronôžky soľnej, dva- alebo trikrát denne (ad libitum), komerčne dostupná potrava, alebo kombinácia uvedeného
|
larvy žiabronôžky soľnej, dva- alebo trikrát denne (ad libitum), komerčne dostupná potrava, alebo kombinácia uvedeného
|
larvy žiabronôžky soľnej, dva- alebo trikrát denne (ad libitum), komerčne dostupná potrava, alebo kombinácia uvedeného
|
|
|
žiadne, pokiaľ koncentrácia rozpusteného kyslíka neklesne pod 60 % hodnoty saturácie vzduchom
|
žiadne, pokiaľ koncentrácia rozpusteného kyslíka neklesne pod 60 % hodnoty saturácie vzduchom
|
žiadne, pokiaľ koncentrácia rozpusteného kyslíka neklesne pod 60 % hodnoty saturácie vzduchom
|
|
|
s čistým povrchom, studňová alebo rekonštituovaná voda alebo odchlórovaná voda z vodovodu
|
s čistým povrchom, studňová alebo rekonštituovaná voda alebo odchlórovaná voda z vodovodu
|
s čistým povrchom, studňová alebo rekonštituovaná voda alebo odchlórovaná voda z vodovodu
|
|
20.
|
Obdobie pred expozíciou
|
|
odporúča sa 7 dní
|
odporúča sa 7 dní
|
odporúča sa 7 dní
|
|
21.
|
Trvanie expozície chemikálii
|
|
21 dní
|
21 dní
|
21 dní
|
|
|
prežitie
správanie
sekundárne pohlavné znaky
vitelogenín
|
prežitie
správanie
sekundárne pohlavné znaky
vitelogenín
|
prežitie
správanie
vitelogenín
|
|
|
rozpustený kyslík > 60 % saturácie; stredná teplota 25 °C ± 2 °C; prežitie rýb v kontrolných vzorkách 90 %; merané testovacie koncentrácie v rozsahu 20 % strednej meranej hodnoty pre každú úroveň aplikácie chemikálie
|
rozpustený kyslík > 60 % saturácie; stredná teplota 24 °C ± 2 °C; prežitie rýb v kontrolných vzorkách 90 %; merané testovacie koncentrácie v rozsahu 20 % strednej meranej hodnoty pre každú úroveň aplikácie chemikálie
|
rozpustený kyslík > 60 % saturácie; stredná teplota 26 °C ± 2 °C; prežitie rýb v kontrolných vzorkách 90 %; merané testovacie koncentrácie v rozsahu 20 % stredných meraných hodnôt pre každú úroveň aplikácie chemikálie
|
Dodatok 3
Niektoré chemické vlastnosti prijateľnej riediacej vody
|
Zložka
|
Koncentrácie
|
|
Tuhé častice
|
< 20 mg/l
|
|
Celkový organický uhlík
|
< 2 mg/l
|
|
Neionizovaný amoniak
|
< 1 μg/l
|
|
Zostatkový chlór
|
< 10 μg/l
|
|
Celkové organofosfátové pesticídy
|
< 50 ng/l
|
|
Celkové organochlórované pesticídy a polychlórované bifenyly
|
< 50 ng/l
|
|
Celkový organický chlór
|
< 25 ng/l
|
Dodatok 4A
Substrát na neresenie pre dánio pruhované
Nádoba na neresenie
: celosklená nádoba s rozmermi napríklad 22 × 15 × 5,5 cm (dĺžka × šírka × výška) pokrytá odnímateľnou drôtenou mriežkou z nehrdzavejúcej ocele (so šírkou otvorov 2 mm). Mriežka by mala pokrývať otvor nádoby v rovine položenej nižšie, ako je okraj nádoby.

Na mriežku by sa mal upevniť substrát na neresenie. Rybám by mal poskytovať štruktúru, do ktorej môžu preniknúť. Vhodné sú napríklad umelé akváriové rastliny vyrobené zo zeleného plastového materiálu (poznámka: je potrebné zobrať do úvahy možnú adsorpciu testovanej chemikálie na plastový materiál). Plastový materiál by sa mal dostatočne dlho lúhovať v dostatočnom objeme teplej vody, aby sa zabezpečilo, že do vody použitej na testovanie sa neprenesú žiadne chemikálie. V prípade použitia sklených materiálov by sa malo zabezpečiť, aby sa ryby pri intenzívnom pohybe nezranili ani neochromili.
Vzdialenosť medzi nádobou a sklenými stenami by mala byť najmenej 3 cm, aby sa zabezpečilo, že neresenie sa nevykonáva mimo nádoby. Vajíčka vzniknuté neresením v nádobe prepadávajú cez mriežku a môžu byť odobraté ako vzorky 45 – 60 minút po začiatku osvetlenia. Priesvitné vajíčka sú nepriľnavé a ľahko sa počítajú pomocou transverzálneho svetla. Pri použití piatich samičiek na nádobu sa denný počet vajíčok do 20 môže považovať za nízky, od 20 do 100 za stredný a nad 100 za vysoký. Nádoba na neresenie by sa mala vybrať, vajíčka zozbierať a nádobu na neresenie vložiť späť do testovacej nádoby, buď čo najneskôr večer, alebo veľmi skoro ráno. Čas, ktorý uplynie do opätovného vloženia, by nemal presiahnuť jednu hodinu, lebo inak stopa substrátu na neresenie môže vyvolať individuálne párenie a neresenie v nezvyčajnom čase. Ak si situácia vyžaduje neskoršie vloženie nádoby na neresenie, malo by sa to urobiť najmenej 9 hodín po začiatku osvetlenia. V tomto pokročilom dennom čase sa už neresenie nevyvoláva.
Dodatok 4B
Substrát na neresenie pre čerebľu potočnú
Do každej skúšobnej komory sa umiestnia dva alebo tri kombinované plastové/keramické/sklené alebo nerezové oblúkové kryty s podložkami na neresenie (napr. 80 mm dlhý sivý polkruhový žľab uložený na podložke so zvýšeným okrajom a s dĺžkou 130 mm) (pozri obrázok). Riadne vyzreté kryty z PVC alebo keramiky sa ukázali ako vhodné miesto pre substrát na neresenie (Thorpe et al, 2007).
Odporúča sa kryty obrúsiť, aby sa zvýšila ich adhézia. Podložka by mala byť prekrytá sieťkou tak, aby sa zabránilo rybám v prístupe k padajúcim vajíčkam, pokiaľ nebola preukázaná účinná priľnavosť k substrátu na neresenie.

Dno je konštruované tak, aby obsahovalo všetky vajíčka, ktoré nepriľnú k povrchu krytu a spadnú na dno nádoby (alebo vajíčka, ktoré sa uložia priamo na plochú plastovú spodnú časť). Všetky substráty na neresenie by sa mali pred použitím minimálne 12 hodín lúhovať v riediacej vode.
LITERATÚRA
Thorpe KL, Benstead R, Hutchinson TH, Tyler CR, 2007. An optimised experimental test procedure for measuring chemical effects on reproduction in the fathead minnow, Pimephales promelas. Aquatic Toxicology, 81, 90 – 98.
Dodatok 5A
Posúdenie sekundárnych pohlavných znakov čereble potočnej na zistenie určitých chemikálií s účinkom na endokrinný systém
Prehľad
Medzi potenciálne dôležité znaky fyzického vzhľadu dospelých jedincov čereble potočnej pri testovaní endokrinných disruptorov patrí farba tela (t. j. svetlá/tmavá), vzorované sfarbenie (t. j. prítomnosť alebo neprítomnosť zvislých pruhov), tvar tela (t. j. tvar hlavovej a prsnej oblasti, brušná distenzia) a špecializované sekundárne pohlavné znaky (t. j. počet a veľkosť tuberkulov, veľkosť záhlavnej časti chrbta a kladielka).
Tuberkuly sa nachádzajú na hlave (záhlavná časť chrbta) reprodukčne aktívnych samčekov čereble potočnej a ich usporiadanie je obvykle dvojstranne symetrické (Jensen et al., 2001). Kontrolné vzorky samičiek a mladých samčekov a samičiek nevykazujú vznik žiadnych tuberkulov (Jensen et al., 2001). Až osem jednotlivých tuberkulov sa môže nachádzať okolo očí a medzi nozdrami samčekov. Najväčší počet tuberkulov s najväčšou veľkosťou je umiestnený v dvoch rovnobežných líniách bezprostredne pod nozdrami a nad ústami. prípade mnohých rýb sa skupiny tuberkulov vyskytujú pod dolnou čeľusťou, pričom najbližšie k ústam sa spravidla vyskytujú v pároch, zatiaľ čo bližšie k brušnej časti vznikajú ako skupiny až štyroch tuberkulov. Celkový počet tuberkulov je zriedkavo vyšší ako 30 (rozsah 18 – 28; Jensen et al. 2001). Prevládajú (z hľadiska počtu) tuberkuly, ktoré tvoria samostatnú, relatívne okrúhlu štruktúru s výškou približne rovnou polomeru. Väčšina reprodukčne aktívnych samčekov má tiež prinajmenšom niekoľko tuberkulov, ktoré sú zväčšené a výrazné natoľko, že sú nerozoznateľné ako jednotlivé štruktúry.
Niektoré druhy chemikálií narušujúcich endokrinný systém môžu vyvolávať abnormálny výskyt určitých sekundárnych pohlavných znakov pri živočíchoch opačného pohlavia. Napríklad agonisty androgénových receptorov, ako sú 17β-metyltestosterón alebo 17β-trenbolón, môžu spôsobovať vyvinutie tuberkulov pri samičkách čereble potočnej (Smith, 1974; Ankley et al. 2001; 2003), zatiaľ čo agonisty estrogénových receptorov môžu znížiť počet alebo veľkosť tuberkulov pri samčekoch (Miles – Richardson et al., 1999; Harries et al. 2000).
V ďalšej časti sa uvádza opis charakteristiky tuberkulov čereble potočnej na základe postupov používaných Agentúrou na ochranu životného prostredia Spojených štátov amerických v meste Duluth v štáte Minnesota. Špecifické produkty a/alebo zariadenia sa môžu nahradiť porovnateľnými materiálmi, ktoré sú k dispozícii.
Prehliadanie sa najlepšie vykonáva pomocou osvetlenej lupy alebo trikrát osvetleného stereoskopického mikroskopu. Ryba sa prehliada zo strany chrbta, natočená prednou časťou dopredu (hlavou k prehliadačovi).
|
a)
|
Ryba sa uloží do malej Petriho misky (napr. s priemerom 100 mm), prednou časť dopredu a brušnou nadol. Hľadáčik sa zameria tak, aby bola možná identifikácia tuberkulov. Ryba sa jemne a pomaly otáča zo strany na stranu a identifikujú sa oblasti tuberkulov. Tuberkuly sa spočítajú a zaznamenajú.
|
|
b)
|
Ryba sa v Petriho miske uloží chrbtovou časťou nadol, prednou dopredu, a vykoná sa prehliadka povrchu brušnej časti hlavy.
|
|
c)
|
Pozorovania každej ryby by sa mali ukončiť do dvoch minút.
|
Počítanie a klasifikácia tuberkulov
Určených bolo šesť osobitných oblastí hodnotenia prítomnosti a vývoja tuberkulov pri dospelých jedincoch čereble potočnej. Vypracoval sa vzor, ako mapovať umiestnenie a množstvo prítomných tuberkulov (pozri koniec tohto dodatku). Počet tuberkulov sa zaznamenáva a ich veľkosť môže byť pre každý organizmus kvantitatívne klasifikovaná ako: 0 – neprítomný, 1 – prítomný, 2 – zväčšený a 3 – výrazný (obrázok 1).
Kategória 0 – neprítomný nijaký tuberkul. Kategória 1 – prítomný, identifikovaný akýkoľvek jednotlivý tuberkul, ktorého výška sa približne rovná jeho polomeru (priemeru).Kategória 2 – zväčšený, identifikovaný na základe tkaniva, ktoré vzhľadom pripomína hviezdičku, zvyčajne s veľkou radiálnou základňou s drážkami alebo so žliabkami vychádzajúcimi zo stredu. Vrchná časť tuberkula je často viac vrúbkovaná, ale niekedy môže byť čiastočne zaoblená. Kategória 3 – výrazný, zvyčajne pomerne veľký a zaoblený, s menej rozlíšenou štruktúrou. Tieto tuberkuly niekedy spoločne vytvárajú jednotnú masu v jednej oblasti alebo v kombinácii oblastí (B, C a D, ako je opísané v ďalšej časti). Sfarbenie a tvar sú podobné ako v rámci klasifikácie 2, ale niekedy sú dosť málo rozlíšiteľné. Použitie tohto systému klasifikácie vo všeobecnosti povedie k celkovej hodnote < 50 pri bežnom samčekovi z kontrolnej vzorky, s počtom tuberkulov 18 – 20 (Jensen et al., 2001).
Obrázok 1

Skutočný počet tuberkulov na tele niektorých rýb môže byť väčší ako počet políčok v šablóne (dodatok A) pre určitú klasifikovanú oblasť. V takom prípade je možné vyznačiť ďalšie čísla klasifikácie vpravo alebo vľavo od príslušného políčka. Zobrazenie šablóny preto nemusí byť symetrické. Ďalšou technikou mapovania tuberkulov, ktoré sú spojené v pároch alebo vertikálne pozdĺž horizontálnej roviny úst, by mohlo byť dvojité značenie dvoch bodov klasifikácie tuberkulov v jednom políčku.
Mapovacie oblasti:
A– tuberkuly nachádzajúce sa okolo očí. Mapujú sa od chrbtovej časti po brušnú časť okolo predného okraja očí. Na telách zrelých samčekov v kontrolných vzorkách ich je spravidla väčší počet, na telách samičiek v kontrolných vzorkách nie sú prítomné, na telách samičiek vystavených pôsobeniu androgénov sa vo všeobecnosti nachádzajú dva (jeden pri každom oku) alebo jeden osamotený.
B– tuberkuly nachádzajúce sa medzi nozdrami (otvormi zmyslových kanálov). Na telách zrelých samčekov v kontrolných vzorkách sa spravidla vyskytujú v pároch, na vyšších úrovniach vývoja (2 – zväčšené alebo 3 – výrazné). Na telách samičiek v kontrolných vzorkách nie sú prítomné, pričom určitý výskyt a vývoj sa zaznamenal na telách samičiek vystavených pôsobeniu androgénov.
C– tuberkuly nachádzajúce sa bezprostredne pred nozdrami, rovnobežne s ústami. Na telách zrelých samčekov v kontrolných vzorkách sú vo všeobecnosti zväčšené alebo výrazné. Na telách menej vyvinutých samčekov alebo samičiek vystavených pôsobeniu androgénov sú prítomné alebo zväčšené.
D– tuberkuly nachádzajúce sa rovnobežne pozdĺž línie úst. Na telách zrelých samčekov v kontrolných vzorkách sa vyvíjajú všeobecne podľa klasifikácie. Na telách samičiek v kontrolných vzorkách nie sú prítomné, ale na telách samičiek vystavených pôsobeniu androgénov sú prítomné.
E– tuberkuly nachádzajúce sa na dolnej čeľusti, v blízkosti úst, zvyčajne malé a spravidla v pároch. Výskyt je rôzny v prípade samčekov v kontrolných vzorkách alebo vo vzorkách s aplikovanou chemikáliou a v prípade samičiek vo vzorkách s aplikovanou chemikáliou.
F– tuberkuly nachádzajúce sa v brušnej časti priľahlej k oblasti E. Spravidla sú malé a vyskytujú sa v pároch. Prítomné sú na telách samčekov v kontrolných vzorkách a na telách samičiek vystavených pôsobeniu androgénov.
ODKAZY
|
1.
|
Ankley GT, Jensen KM, Kahl MD, Korte JJ, Makynen ME. 2001. Description and evaluation of a short-term reproduction test with the fathead minnow (Pimephales promelas). Environ Toxicol Chem 20:1276 – 1290.
|
|
2.
|
Ankley GT, Jensen KM, Makynen EA, Kahl MD, Korte JJ, Hornung MW, Henry TR, Denny JS, Leino RL, Wilson VS, Cardon MC, Hartig PC, Gray EL. 2003. Effects of the androgenic growth promoter 17-β trenbolone on fecundity and reproductive endocrinology of the fathead minnow. Environ Toxicol Chem 22:1350 – 1360.
|
|
3.
|
Harries JE, Runnalls T, Hill E, Harris CA,Maddix S, Sumpter JP, Tyler CR. 2000. Development of a reproductive performance test for endocrine disrupting chemicals using pair-breeding fathead minnows (Pimephales promelas). Environ Sci Technol 34:3003 – 3011.
|
|
4.
|
Jensen KM, Korte JJ, Kahl MD, Pasha MS, Ankley GT. 2001. Aspects of basic reproductive biology and endocrinology in the fathead minnow (Pimephales promelas). Comp Biochem Physiol C 128:127-141.
|
|
5.
|
Kahl MD, Jensen KM, Korte JJ, Ankley GT. 2001. Effects of handling on endocrinology and reproductive performance of the fathead minnow. J Fish Biol 59:515 – 523.
|
|
6.
|
Miles-Richardson SR, Kramer VJ, Fitzgerald SD, Render JA, Yamini B, Barbee SJ, Giesy JP. 1999. Effects of waterborne exposure of 17-estradiol on secondary sex characteristics and gonads of fathead minnows (Pimephales promelas). Aquat Toxicol 47:129 – 145.
|
|
7.
|
Smith RJF. 1974. Effects of 17-methyltestosterone on the dorsal pad and tubercles of fathead minnows (Pimephales promelas). Can J Zool 52:1031 – 1038.
|
|
Šablóna pre tuberkuly
|
Číselná klasifikácia
|
|
Identifikácia
|
1 – prítomný
|
|
Dátum
|
2 – zväčšený
|
|
Celková hodnota
|
3 – výrazný
|
|
|
C
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
|
|
D
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
Dodatok 5B
Posúdenie sekundárnych pohlavných znakov medaky pri zisťovaní určitých chemikálií s účinkom na endokrinný systém
Nasleduje opis merania papilárnych procesov (21), ktoré sú sekundárnymi pohlavnými znakmi medaky (Oryzias latipes).
|
1.
|
Po vyrezaní pečene (dodatok 6) sa mŕtve telo vloží do kužeľovej banky, ktorá obsahuje približne 10 ml 10 % neutrálneho tlmeného formalínu (smerom hore: hlava, smerom dolu: chvost). Ak sa gonáda fixuje inak než v 10 % neutrálnym tlmeným formalínom, je potrebné mŕtve telo rozrezať priečnym rezom medzi prednou časťou análnej plutvy a análnym otvorom pomocou žiletky, pričom treba dbať, aby sa nenarušil gonopór ani samotná gonáda (obrázok 3). Kraniálna strana tela ryby sa vloží do fixačného roztoku na konzervovanie gonád a chvostová strana tela ryby do 10 % neutrálneho tlmeného formalínu, ako už bolo opísané.
|
|
2.
|
Po vložení tela ryby do 10 % neutrálneho tlmeného formalínu sa uchopí predná časť análnej plutvy pomocou pinzety a ohne sa približne na 30 sekúnd, aby sa plutva roztiahla. Pri uchopení análnej plutvy pomocou pinzety uchopte opatrne niekoľko lúčov plutvy v prednej časti, aby sa nepoškodili papilárne procesy.
|
|
3.
|
Po roztiahnutí análnej plutvy približne na 30 sekúnd sa telo ryby uloží do 10 % neutrálneho tlmeného formalínu pri izbovej teplote, až do začiatku merania papilárnych procesov (meranie by sa malo vykonať po fixovaní v dĺžke najmenej 24 hodín).
|
Meranie
|
1.
|
Po fixovaní tela ryby v 10 % neutrálnom tlmenom formalíne najmenej 24 hodín sa mŕtve telo ryby vyberie z kužeľovej banky a formalín sa otrie filtračným papierom (alebo papierovou utierkou).
|
|
2.
|
Ryba sa položí brušnou stranou nahor. Potom sa pomocou malých pitevných nožníc opatrne odreže análna plutva (odporúča sa odrezať análnu plutvu aj s malou časťou opornej kosti pterygiophore).
|
|
3.
|
Oddelená análna plutva sa pinzetou uchopí za prednú časť a položí sa na podložné sklíčko s niekoľkými kvapkami vody. Potom sa plutva zakryje krycím sklíčkom. Pri uchopení análnej plutvy pomocou pinzety je potrebné dávať pozor, aby sa nepoškodili papilárne procesy.
|
|
4.
|
Pomocou počítadla pod biologickým mikroskopom (stojanovým alebo inverzným) sa určí počet spojených platničiek s papilárnymi procesmi. Papilárne procesy sa vykazujú, keď je na zadnom okraji spojenej platničky viditeľné malé zoskupenie výrastkov. Do pracovného hárku sa zapíše počet spojených platničiek s papilárnymi procesmi na každom lúči plutvy (napr. prvý lúč plutvy: 0, druhý lúč plutvy: 10, tretí lúč plutvy: 12 atď.) a v tabuľke programu Excel sa uvedie súčet týchto počtov pre jednotlivé ryby. V prípade potreby sa urobí fotografia análnej plutvy a počet spojených platničiek s papilárnymi procesmi sa určí z tejto fotografie.
|
|
5.
|
Po meraní sa análna plutva vloží do kužeľovej banky opísanej v bode 1 a odloží sa.
|
Obr. 1.
Obrázok znázorňujúci rozdiely medzi pohlaviami, pokiaľ ide o tvar a veľkosť análnej plutvy. A: samček, B:samička. Oka, T. B., 1931: On the processes on the fin rays of the male of Oryzias latipes and other sex characters of this fish. J. Fac. Sci., Tokyo Univ., IV, 2: 209 – 218.

Obr. 2.
A, Procesy na spojených platničkách lúča análnej plutvy. J.P.: spojená platnička, A.S.: axiálny priestor, P.: proces B, Distálny koniec lúča plutvy. Na úplnom konci sú lúče plutvy actinotrichia (Act.). Oka, T. B., 1931: On the processes on the fin rays of the male of Oryzias latipes and other sex characters of this fish. J. Fac. Sci., Tokyo Univ., IV, 2: 209 – 218.

Obr. 3.
Fotografia tela ryby, ktorá znázorňuje miesto rezu v prípade, že sa gonáda fixuje v inom fixačnom roztoku, než je 10 % neutrálny tlmený formalín. V takom prípade sa telo rozreže medzi prednou časťou análnej plutvy a análnym otvorom pomocou žiletky (červená čiara), hlavová strana tela ryby sa vloží do fixačného roztoku na konzervovanie gonád a chvostová strana tela ryby sa vloží do 10 % neutrálneho tlmeného formalínu.

Dodatok 6
Odporúčané postupy odberu vzoriek na analýzu vitelogenínu
Je potrebné dbať na to, aby sa zabránilo krížovej kontaminácii medzi vzorkami vitelogenínu samčekov a samičiek.
Postup 1A: Čerebľa potočná, odber krvi z chvostovej žily/tepny
Po anestetizovaní sa čepeľou skalpela nareže chvostový pedunkulus a pomocou heparinizovanej mikrohematokritovej kapilárnej kanyly sa odoberie krv z chvostovej tepny/žily. Po odobratí krvi sa rýchlo izoluje plazma odstreďovaním počas troch minút pri 15 000 g (alebo alternatívne počas desiatich minút pri 15 000 g a teplote 4 ° C). Ak sa to vyžaduje, po odstreďovaní je možné stanoviť percentuálnu hodnotu hematokritu. Časť plazmy sa odoberie z mikrohematokritovej kanyly, vloží sa do odstreďovacej skúmavky spolu s 0,13 jednotky aprotinínu (inhibítor proteázy) a uchová sa pri teplote – 80 ° C, pokým nebude možné stanoviť vitelogenín. V závislosti od veľkosti čereble potočnej (závisí od pohlavia) sa objem plazmy, ktorú je možné odobrať, vo všeobecnosti pohybuje v rozmedzí 5 – 60 μl na jednu rybu (Jensen et al., 2001).
Postup 1B: Čerebľa potočná, odber krvi zo srdca
Alternatívne sa krv môže odobrať srdcovou punkciou pomocou heparinizovanej striekačky (1 000 jednotiek heparínu na ml). Krv sa preloží do Eppendorfových skúmaviek (uložených na ľade) a potom sa odstredí (5 minút, 7 000 g, izbová teplota). Plazma by sa mala presunúť do čistých Eppendorfových skúmaviek (v alikvotných množstvách, ak to objem plazmy umožňuje) a rýchlo zmraziť na – 80 °C, pokým sa nevykoná analýza (Panter et al., 1998).
Postup 2A: Medaka japonská, vyrezanie pečene
Vybratie testovacej ryby zo skúšobnej komory
|
1.
|
Testovacia ryba by sa mala vybrať zo skúšobnej komory pomocou malého podberáka. Je potrebné dávať pozor, aby testovacia ryba nespadla do inej skúšobnej komory.
|
|
2.
|
Testovacie ryby by sa mali v zásade vyberať v tomto poradí: kontrolná vzorka, kontrolná vzorka s rozpúšťadlom (ak je to vhodné), najnižšia koncentrácia, stredná koncentrácia, najvyššia koncentrácia a pozitívna kontrolná vzorka. Okrem toho by sa mali z každej skúšobnej komory najskôr vybrať všetci samčekovia, až potom zostávajúce samičky.
|
|
3.
|
Pohlavie každej testovacej ryby sa určí na základe vonkajších sekundárnych pohlavných znakov (napr. tvaru análnej plutvy).
|
|
4.
|
Testovacia ryba sa vloží do prepravného kontajnera a premiestni na pracovisko určené na vyrezanie pečene. Je potrebné skontrolovať správnosť údajov na štítkoch na skúšobnej komore a prepravnom kontajneri, aby sa potvrdilo, že počet rýb, ktoré sa vybrali zo skúšobnej komory, a počet rýb, ktoré v skúšobnej komore zostali, je v súlade s očakávaním.
|
|
5.
|
Ak nie je možné určiť pohlavie rýb na základe ich vonkajšieho vzhľadu, vyberú sa všetky ryby zo skúšobnej komory. V tom prípade by sa pohlavie malo určiť na základe pozorovania gonád alebo sekundárnych pohlavných znakov stereoskopickým mikroskopom.
|
Vyrezanie pečene
|
1.
|
Testovacia ryba sa preloží z prepravného kontajnera do anestetického roztoku pomocou malého podberáka.
|
|
2.
|
Po anestetizovaní sa testovacia ryba pomocou pinzety (spotrebného druhu) uloží na filtračný papier (alebo na papierovú utierku). Rybu je potrebné uchopiť pinzetou za boky hlavy, aby sa zabránilo zlomeniu chvosta.
|
|
3.
|
Voda z povrchu testovacej ryby sa utrie filtračným papierom (alebo papierovou utierkou).
|
|
4.
|
Ryba sa položí brušnou stranou nahor. Potom sa pomocou pitevných nožníc urobí malý priečny zárez medzi časťou brucha v blízkosti hlavy a strednou časťou brucha.
|
|
5.
|
Pitevné nožnice sa vložia do malého rezu a brucho sa rozstrihne pozdĺž stredovej línie od zadného bodu žiabrového krytu po kraniálnu stranu análneho otvoru. Je potrebné dávať pozor, aby sa pitevné nožnice nevložili príliš hlboko a nedošlo k poškodeniu pečene a gonád.
|
|
6.
|
Ďalšie operácie je potrebné vykonať pomocou stereoskopického mikroskopu.
|
|
7.
|
Testovacia ryba sa položí brušnou stranou nahor na papierovú utierku (použiť sa môže aj sklená Petriho miska alebo podložné sklíčko).
|
|
8.
|
Pomocou presnej pinzety sa rozšíria steny brušnej dutiny a vyberú sa z nej vnútorné orgány. Je tiež prípustné, aby sa v prípade potreby vnútorné orgány vybrali odstránením jednej bočnej steny brušnej dutiny.
|
|
9.
|
Pomocou ďalšej presnej pinzety sa odhalí spojená časť pečene a žlčníka. Potom sa uchopí žlčovod a žlčník sa odreže. Je potrebné dávať pozor, aby sa žlčník nepoškodil.
|
|
10.
|
Uchopí sa pažerák a rovnakým spôsobom sa od pečene oddelí tráviaci trakt. Je potrebné dávať pozor, aby nedošlo k úniku obsahu tráviaceho traktu. Kaudálny tráviaci trakt sa oddelí od análneho otvoru a odstráni z brušnej dutiny.
|
|
11.
|
Z okrajových častí pečene sa odreže tuková hmota a iné tkanivá. Je potrebné dávať pozor, aby sa pečeň nepoškodila.
|
|
12.
|
Pečeň sa uchopí presnou pinzetou za oblasť brány a vyberie sa z brušnej dutiny.
|
|
13.
|
Pečeň sa uloží na podložné sklíčko. V prípade potreby sa pomocou presnej pinzety odstráni z povrchu pečene akýkoľvek ďalší tuk a cudzie tkanivo (napr. výstelka brucha).
|
|
14.
|
Hmotnosť pečene sa meria pomocou elektronických analytických váh s mikroskúmavkou 1,5 ml predstavujúcou hmotnosť obalu. Hodnota sa zaznamená do pracovného hárku (napr.: 0,1 mg). Je potrebné potvrdiť identifikačné údaje na štítku mikroskúmavky.
|
|
15.
|
Mikroskúmavka obsahujúca pečeň sa uzavrie a uloží do chladiaceho boxu (alebo mraziaceho boxu).
|
|
16.
|
Po vyrezaní jednej pečene je potrebné pitevné nástroje vyčistiť, alebo ich nahradiť čistými.
|
|
17.
|
Pečeň sa odoberie z tiel všetkých rýb v prepravnom kontajneri, ako už bolo uvedené.
|
|
18.
|
Po vyrezaní pečene z tiel všetkých rýb v prepravnom kontajneri (t. j. všetkých samčekov alebo samičiek v skúšobnej komore) sa všetky vzorky pečene uložia v skúmavkách do stojana s identifikačnými štítkami a vložia sa do mraziaceho boxu. Ak sa pečeň krátko po vyrezaní venuje na predúpravu, vzorky sa na nasledujúce pracovisko prenášajú v chladiacom boxe (alebo mraziacom boxe).
|
Po vyrezaní pečene je mŕtve telo ryby k dispozícii na meranie sekundárnych pohlavných znakov.
Vzorka
Ak sa vzorky pečene nepoužijú na predúpravu krátko po vyrezaní z tela testovacej ryby, musia sa skladovať pri teplote ≤ – 70 °C.
Obrázok 1
Nožnicami sa urobí rez tesne pred prsnými plutvami.

Obrázok 2
Stredová línia brucha sa nožnicami rozstrihne k bodu približne 2 mm od kraniálnej strany análneho otvoru.

Obrázok 3
Pomocou pinzety sa rozšíria steny brušnej dutiny a odhalí sa pečeň a ďalšie vnútorné orgány. (Alternatívne sa steny brušnej dutiny môžu zboku pripevniť).
Obrázok 4
Pečeň sa vyberie a vyreže priamo pomocou pinziet.

Obrázok 5
Črevá sa jemne odtiahnu pomocou pinzety.

Obrázok 6
Obidva konce čriev a akékoľvek mezenteriálne pripojenia sa oddelia pomocou nožníc.

Obrázok 7 (samička)
Postup v prípade samičiek je rovnaký.
Obrázok 8
Postup je ukončený.

Postup 2 B: Medaka japonská (Oryzias latipes), predbežná úprava pečene na analýzu vitelogenínu
Zo súpravy ELISA sa vyberie fľaša tlmivého roztoku homogenátu a ochladí sa rozdrveným ľadom (teplota roztoku: ≤ 4 °C). Ak sa použije tlmivý roztok homogenátu zo systému EnBio ELISA, nechá sa rozmraziť pri izbovej teplote a potom sa fľaša ochladí rozdrveným ľadom.
Vypočíta sa objem tlmivého roztoku homogenátu pre pečeň na základe jej hmotnosti (pre homogenát sa pridá 50 μl tlmivého roztoku homogenátu na 1 mg hmotnosti pečene). Napríklad ak je hmotnosť pečene 4,5 mg, objem tlmivého roztoku homogenátu pre pečeň je 225 μl. Je potrebné vypracovať zoznam objemu tlmivého roztoku homogenátu pre všetky pečene.
Príprava pečene na predúpravu
|
1.
|
Tesne pred predúpravou sa z mraziaceho boxu vyberie 1,5 ml mikroskúmavka obsahujúca pečeň.
|
|
2.
|
Predúprava pečene samčekov by sa mala vykonať pred úpravou pečene samičiek, aby sa zabránilo kontaminácii vitelogenínu. Okrem toho, predúprava pre testovacie skupiny by sa mala vykonať v tomto poradí: kontrolná vzorka, kontrolná vzorka s rozpúšťadlom (ak je to vhodné), najnižšia koncentrácia, stredná koncentrácia, najvyššia koncentrácia a pozitívna kontrolná vzorka.
|
|
3.
|
Počet 1,5 ml mikroskúmaviek so vzorkami pečene, ktoré sa v danom čase vyberú z mraziaceho boxu, by nemal prekročiť počet 1,5 ml mikroskúmaviek, ktoré sa môžu v danom čase odstreďovať.
|
|
4.
|
1,5 ml mikroskúmavky so vzorkami pečene sa uložia v poradí podľa čísel vzoriek v mraziacom boxe (nie je potrebné pečeň rozmrazovať).
|
Postup predúpravy
1. Pridanie homogenizačného tlmivého roztoku
|
1.
|
Podľa zoznamu sa zistí objem tlmivého roztoku homogenátu, ktorý sa má použiť pre konkrétnu vzorku pečene, a mikropipeta sa nastaví na príslušný objem (rozsah objemu: 100 – 1 000 μl). Na mikropipetu sa nasadí čistý hrot.
|
|
2.
|
Tlmivý roztok homogenátu sa odoberie z fľaše reaktantu a pridá sa do 1,5 ml mikroskúmavky obsahujúcej pečeň.
|
|
3.
|
Uvedeným postupom sa tlmivý roztok homogenátu pridá do všetkých 1,5 ml mikroskúmaviek obsahujúcich pečeň. Nie je potrebné meniť hrot mikropipety za nový. Ak je však hrot kontaminovaný, alebo by mohol byť kontaminovaný, mal by sa vymeniť.
|
2. Homogenizácia pečene
|
1.
|
Na homogenizátor mikroskúmaviek sa nasadí nové miešadlo na homogenizáciu.
|
|
2.
|
Do 1,5 ml mikroskúmavky sa vloží miešadlo. Homogenizátor sa drží tak, aby bola pečeň pritlačená medzi povrch miešadla a vnútornú stenu mikroskúmavky.
|
|
3.
|
Homogenizátor sa uvedie do prevádzky na 10 – 20 sekúnd. Počas prevádzky je potrebné chladiť mikroskúmavku rozdrveným ľadom.
|
|
4.
|
Miešadlo sa vytiahne z 1,5 ml mikroskúmavky a nechá sa v pokoji približne 10 sekúnd. Potom sa vykoná vizuálna kontrola stavu suspenzie.
|
|
5.
|
Ak sa v suspenzii pozorujú kúsky pečene, je potrebné opakovať operácie 3 a 4, aby sa pripravil uspokojivý homogenát pečene.
|
|
6.
|
Suspendovaný homogenát pečene sa chladí v mraziacom boxe až do odstredenia.
|
|
7.
|
Pre každý homogenát je potrebné vymeniť miešadlo za nové.
|
|
8.
|
Uvedeným postupom sa zhomogenizujú všetky pečene s tlmivým roztokom homogenátu.
|
3. Odstreďovanie suspendovaného homogenátu pečene
|
1.
|
Je potrebné overiť, či je teplota v chladenej komore centrifúgy ≤ 5 °C.
|
|
2.
|
Do chladenej centrifúgy sa vložia 1,5 ml mikroskúmavky obsahujúce suspendovaný homogenát pečene (v prípade potreby sa upraví rovnováha).
|
|
3.
|
Suspendovaný homogenát pečene sa odstreďuje 10 minút pri 13 000 g a teplote ≤ 5 °C. Ak sú však supernatanty dostatočne oddelené, sila a čas odstreďovania sa môžu upraviť podľa potreby.
|
|
4.
|
Po odstredení je potrebné skontrolovať, či sú supernatanty primerane oddelené (povrchová vrstva: tuk, stredná vrstva: supernatant, spodná vrstva: tkanivo pečene). Ak oddelenie nie je primerané, suspenzia sa opäť odstredí za tých istých podmienok.
|
|
5.
|
Všetky vzorky sa vyberú z chladenej centrifúgy a uložia v poradí podľa čísel vzoriek v mraziacom boxe. Je potrebné dať pozor, aby sa znovu nesuspendovali vrstvy oddelené po odstreďovaní.
|
4. Odber supernatantu
|
1.
|
Do stojana na skúmavky sa vložia štyri 0,5 ml mikroskúmavky na uloženie supernatantu.
|
|
2.
|
Z každého supernatantu (oddeleného ako stredná vrstva) sa pomocou mikropipety odoberie 30 μl a vloží sa do jednej 0,5 ml mikroskúmavky. Je potrebné dať pozor, aby sa neodobral tuk z povrchovej vrstvy alebo tkanivo pečene zo spodnej vrstvy.
|
|
3.
|
Supernatant sa odoberie a rozdelí do dvoch ďalších 0,5 ml mikroskúmaviek rovnakým spôsobom, ako už bolo uvedené.
|
|
4.
|
Zvyšok supernatantu sa odoberie pomocou mikropipety (ak je to možné: ≥ 100 μl). Vloží sa do poslednej 0,5 ml mikroskúmavky. Je potrebné dať pozor, aby sa neodobral tuk z povrchovej vrstvy alebo tkanivo pečene zo spodnej vrstvy.
|
|
5.
|
0,5 ml mikroskúmavka sa uzavrie a na štítok sa napíše objem supernatantu. Hneď potom sa mikroskúmavky ochladia v mraziacom boxe.
|
|
6.
|
Hrot mikropipety sa vymení za nový pre každý supernatant. Ak sa na hrote usadí veľké množstvo tuku, je potrebné ho ihneď vymeniť, aby sa zabránilo kontaminácii pečeňového extraktu tukom.
|
|
7.
|
Všetky odstredené supernatanty sa uvedeným postupom vložia do štyroch 0,5 ml mikroskúmaviek.
|
|
8.
|
Všetky 0,5 ml mikroskúmavky sa po vložení supernatantu uložia do stojana s identifikačnými štítkami a potom sa okamžite zmrazia v mraziacom boxe. Ak sa koncentrácie vitelogenínu merajú ihneď po predúprave, jedna 0,5 ml mikroskúmavka (obsahujúca 30 μl supernatantu) sa drží v chladenom stojane a potom sa premiestni na pracovisko, kde sa vykonáva test ELISA. V takom prípade sa zostávajúce mikroskúmavky uložia do stojanov a zmrazia v mraziacom boxe.
|
|
9.
|
Po odbere supernatantu sa zvyšok primerane zlikviduje.
|
Uskladnenie vzoriek
0,5 ml mikroskúmavky obsahujúce supernatant homogenátu pečene sa udržiavajú pri teplote ≤ – 70 °C, až kým sa nepoužijú na test ELISA.
Postup 3A: Dánio pruhované, odber krvi z chvostovej žily/tepny
Bezprostredne po anestéze sa priečne nareže chvostový pedunkulus a pomocou heparinizovanej mikrohematokritovej kapilárnej kanyly sa odstráni krv z chvostovej tepny/žily. Objemy krvi sa pohybujú v rozmedzí od 5 do 15 μl v závislosti od veľkosti rýb. Rovnaký objem tlmivého roztoku aprotinínu (6 μgml vo fosfátovom tlmivom fyziologickom roztoku) sa pridá do mikrokapilárnej skúmavky a z krvi sa odstreďovaním oddelí plazma (5 minút pri 600 g). Plazma sa odoberie do testovacích skúmaviek a udržiava sa pri teplote – 20 °C, až kým sa nezačne analyzovať na prítomnosť vitelogenínu alebo iných skúmaných proteínov.
Postup 3B: Dánio pruhované, odber krvi srdcovou punkciou
S cieľom zabrániť zrážaniu krvi a degradácii proteínov sa vzorky odoberajú vo fosfátovom tlmivom fyziologickom roztoku (PBS) obsahujúcom heparín (1 000 jednotiek/ml) a inhibítor proteázy aprotinín (2 TIU/ml). Ako prísady do tlmivého roztoku sa odporúčajú heparín amóniová soľ a lyofilizovaný aprotinín. Na odber vzoriek krvi sa odporúča striekačka (1 ml) s pevnou tenkou ihlou (napr. Braun Omnikan-F). Striekačka by sa mala vopred naplniť tlmivým roztokom (približne 100 μl), aby sa úplne eluovali malé objemy krvi z každej ryby. Vzorky krvi sa odoberajú srdcovou punkciou. Ryba by sa mala najskôr anestetizovať s MS-222 (100 mg/l). Správna hladina anestézie umožňuje používateľovi rozpoznať tlkot srdca dánia pruhovaného. Pri punkcii srdca je potrebné držať piest striekačky pod miernym tlakom. Objem krvi, ktorú je možné odobrať, sa pohybuje v rozsahu 20 – 40 mikrolitrov. Po srdcovej punkcii by sa mala testovacia skúmavka naplniť zmesou krvi a tlmivého roztoku. Plazma sa z krvi oddelí odstreďovaním (20 min, 5 000 g) a mala by sa udržiavať pri teplote – 80 °C, až kým sa nezačne analyzovať.
Postup 3C:Štandardný operačný postup: Dánio pruhované, homogenizácia hlavy a chvosta
|
1.
|
Ryba sa anestetizuje a usmrtí v súlade s opisom testu.
|
|
2.
|
Hlava a chvost sa odrežú z tela ryby podľa obrázka 1.
|
Upozornenie: Všetky pitevné nástroje a doska na rezanie by sa mali medzi spracovávaním jednotlivých rýb riadne opláchnuť a vyčistiť (napr. 96 % etanolom), aby sa zabránilo ‚vitelogenínovému znečisteniu‘ neindukovaných samčekov od samičiek alebo indukovaných samčekov.
Obrázok 1

|
3.
|
Celková hmotnosť hlavy a chvosta z každej ryby sa meria s presnosťou na miligramy.
|
|
4.
|
Po odvážení sa jednotlivé časti vložia do príslušných skúmaviek (napr. 1,5 ml Eppendorfovej) a zmrazia sa pri teplote – 80 °C až do homogenizácie, alebo sa homogenizujú priamo na ľade pomocou dvoch plastových miešadiel. (Môžu sa použiť aj iné metódy, ak sa vykonávajú na ľade a výsledkom je homogénna hmota). Upozornenie: Skúmavky by mali byť riadne očíslované tak, aby bolo možné hlavu a chvost ryby priradiť k časti tela, ktorá sa používa na histológiu gonád.
|
|
5.
|
Keď sa dosiahne homogénna hmota, pridá sa ľadový homogenizačný tlmivý roztok (22) predstavujúci štvornásobok hmotnosti tkaniva. Zmes sa ďalej spracováva miešadlami, kým nie je homogénna. Dôležitá poznámka: Pre každú jednotlivú rybu sa používajú nové miešadlá.
|
|
6.
|
Vzorky sú uložené na ľade až do začiatku 30-minútového odstreďovania pri teplote 4 °C a 50 000 × g.
|
|
7.
|
Na vloženie dávok 20 μl supernatantu do najmenej dvoch skúmaviek sa použije pipeta. Hrot pipety sa prestrčí pod vrstvu tuku na povrchu a opatrne sa odsaje supernatant bez tukových alebo tuhých frakcií.
|
|
8.
|
Skúmavky sa pred použitím skladujú pri teplote – 80 °C.
|
Dodatok 7
Obohatené vzorky vitelogenínu a referenčná látka-štandard
Každý deň, keď sa vykonávajú testy na zistenie vitelogenínu, sa budú analyzovať obohatené vzorky pripravené na základe referenčnej látky-štandard. Vitelogenín použitý na prípravu referenčnej látky-štandard musí pochádzať z inej dávky než vitelogenín použitý na prípravu kalibračných štandardov pre vykonávaný test.
Obohatená vzorka sa pripraví pridaním známeho množstva štandardu do kontrolnej vzorky plazmy samčekov. Vzorka sa obohatí tak, aby sa dosiahla koncentrácia vitelogenínu 10- až 100-násobná oproti očakávanej koncentrácii v kontrolnej vzorke samčekov rýb. Kontrolná vzorka plazmy samčekov, ktorá sa obohatí, môže pochádzať od jednej ryby alebo môže byť zmesou od viacerých rýb.
Čiastková vzorka neobohatenej vzorky plazmy samčekov sa bude analyzovať najmenej v dvoch duplicitných súboroch. Obohatená vzorka sa tiež bude analyzovať najmenej v dvoch duplicitných súboroch. Stredné množstvo vitelogenínu v dvoch neobohatených kontrolných vzorkách plazmy samčekov sa pridá k vypočítanému množstvu vitelogenínu pridanému na obohatenie vzoriek s cieľom stanoviť očakávanú koncentráciu. Spolu s výsledkami z každého súboru testov vykonaných v daný deň sa uvádza pomer tejto očakávanej koncentrácie a nameranej koncentrácie.
Dodatok 8
Schéma rozhodovania pre štatistickú analýzu

C.38. SKÚŠKA METAMORFÓZY OBOJŽIVELNÍKOV
ÚVOD
|
1.
|
Táto testovacia metóda je rovnocenná s usmernením OECD na vykonávanie testov (TG) 231 (2009). Potreba vyvinúť a validovať skúšku schopnú zistiť chemikálie pôsobiace v systéme štítnej žľazy stavovcov vyplýva z obavy, že úrovne chemikálií v životnom prostredí môžu spôsobiť nepriaznivé účinky u ľudí aj voľne žijúcich živočíchov. Organizácia OECD v roku 1998 iniciovala činnosť s vysokou prioritou s cieľom vykonať revíziu existujúcich usmernení a vypracovať nové usmernenia na skríning a testovanie potenciálnych endokrinných disruptorov. Jednou zložkou tejto činnosti bolo vytvoriť usmernenie na skríning chemikálií pôsobiacich na systém štítnej žľazy stavovcov. Navrhlo sa rozšírenie 28-dňovej štúdie orálnej toxicity po opakovanom podaní pri hlodavcoch (kapitola B.7 tejto prílohy) a skúška metamorfózy obojživelníkov (AMA). Rozšírená testovacia metóda B.7 prešla validáciou a bola vydaná revidovaná testovacia metóda. Skúška metamorfózy obojživelníkov (AMA) prešla rozsiahlym programom validácie, ktorého súčasťou boli vnútrolaboratórne a medzilaboratórne štúdie, ktoré preukázali význam a spoľahlivosť skúšky (1, 2). Validácia skúšky bola následne predmetom partnerského preskúmania panelom nezávislých odborníkov (3). Táto testovacia metóda je výsledkom skúseností získaných počas validačných štúdií zameraných na zisťovanie chemikálií pôsobiacich v štítnej žľaze a práce vykonanej v členských krajinách OECD.
|
PRINCÍP TESTU
|
2.
|
Skúška metamorfózy obojživelníkov (AMA) je skríningová skúška určená na empirickú identifikáciu chemikálií, ktoré môžu narúšať normálnu funkciu osi hypotalamus – hypofýza – štítna žľaza (HPT). AMA predstavuje všeobecný model pre stavovce, lebo je založená na zachovaných štruktúrach a funkciách osi HPT. Je to dôležitá skúška, lebo metamorfóza obojživelníkov predstavuje dobre preskúmaný proces závislý od štítnej žľazy, ktorý reaguje na chemikálie pôsobiace v rámci osi HPT. Ide o jedinú existujúcu skúšku, ktorou sa zisťuje pôsobenie na štítnu žľazu pri živočíchovi prechádzajúcom morfologickým vývinom.
|
|
3.
|
Všeobecná koncepcia pokusu zahŕňa expozíciu žubrienok druhu Xenopus laevis v štádiu 51 minimálne trom rôznym koncentráciám testovanej chemikálie a kontrolnej riediacej vode počas 21 dní. Každá testovaná koncentrácia sa testuje v štyroch replikátoch. Hustota lariev na začiatku testu je 20 žubrienok na testovaciu nádrž pre všetky skupiny s aplikovanou chemikáliou. Pozorovacie sledované parametre sú dĺžka zadných končatín, dĺžka od pysku po kloaku (SVL), vývinové štádium, mokrá hmotnosť, histológia štítnej žľazy a každodenné pozorovania úmrtnosti.
|
OPIS METÓDY
Testovací druh
|
4.
|
Xenopus laevis sa bežne kultivuje v laboratóriách na celom svete a je ľahko dostupný prostredníctvom komerčných dodávateľov. Pri tomto druhu sa po celý rok ľahko vyvoláva rozmnožovanie pomocou injekcií ľudského chorionického gonadotropínu (hCG) a výsledné larvy sa rutinne vo veľkom počte chovajú až po vybraté vývinové štádiá, čo umožňuje použitie testovacích protokolov špecifických pre dané štádium. Najvhodnejšie je na skúšku použiť larvy pochádzajúce z interných dospelých jedincov. Alternatívne si laboratórium vykonávajúce test môže objednať vajíčka alebo embryá, ktorým musí umožniť aklimatizáciu, tento postup však nie je najvhodnejší. Použitie dodaných larválnych štádií v teste je neprijateľné.
|
Vybavenie a spotrebný materiál
|
5.
|
Na vykonanie tejto skúšky je potrebné toto vybavenie a spotrebný materiál:
|
a)
|
expozičný systém (pozri opis ďalej);
|
|
b)
|
akváriá zo skla alebo nehrdzavejúcej ocele (pozri opis ďalej);
|
|
d)
|
prístroje na reguláciu teploty [napr. ohrievače alebo chladiče (nastaviteľné na teplotu 22 °C ± 1 °C)];
|
|
f)
|
binokulárny disekčný mikroskop;
|
|
g)
|
digitálna kamera s rozlíšením aspoň 4 megapixle a s funkciou mikro;
|
|
h)
|
softvér na digitalizáciu obrazu;
|
|
i)
|
Petriho miska (napr. 100 × 15 mm) alebo priehľadná plastová komora porovnateľnej veľkosti;
|
|
j)
|
analytické váhy schopné merať na tri desatinné miesta (mg);
|
|
k)
|
prístroj na meranie rozpusteného kyslíka;
|
|
m)
|
prístroj na meranie intenzity svetla schopný merať v luxoch;
|
|
n)
|
rôzne laboratórne sklo a nástroje;
|
|
o)
|
nastaviteľné pipety (10 – 5 000 μl) alebo rôzne pipety zodpovedajúcich veľkostí;
|
|
p)
|
testovaná chemikália v dostatočnom množstve na vykonanie štúdie, podľa možnosti z jednej šarže;
|
|
q)
|
analytické prístroje vhodné pre testovanú chemikáliu alebo zmluvné analytické služby.
|
|
Chemická testovateľnosť
|
6.
|
Skúška AMA je založená na protokole vodnej expozície, podľa ktorého sa testovaná chemikália privádza do testovacích komôr pomocou prietokového systému. Prietoková metóda však znamená obmedzenie druhov chemikálií, ktoré možno testovať, na základe fyzikálno-chemických vlastností chemikálie. Pred použitím tohto protokolu by sa preto mali získať základné informácie o chemikálii potrebné na určenie testovateľnosti a mal by sa prečítať usmerňovací dokument OECD o testovaní vodnej toxicity ťažkých látok a zmesí (4). Medzi vlastnosti, ktoré naznačujú, že chemikáliu môže byť ťažké testovať vo vodných systémoch, patria: vysoká rozdeľovacia konštanta oktanol/voda (log Kow), vysoká prchavosť, náchylnosť na hydrolýzu a náchylnosť na fotolýzu v laboratórnych podmienkach osvetlenia. Z hľadiska určenia testovateľnosti môžu mať význam aj iné faktory, ktoré by sa mali stanoviť pre každý jednotlivý prípad. Ak nie je možné úspešne otestovať danú chemikáliu pomocou prietokového testovacieho systému, možno použiť statický obnovovací systém. Ak ani jeden z týchto systémov nie je vhodný pre testovanú chemikáliu, štandardným postupom je netestovať ju pomocou tohto protokolu.
|
Expozičný systém
|
7.
|
Podľa možnosti sa uprednostňuje prietokový zrieďovací systém pred statickým obnovovacím systémom. Ak fyzikálne a/alebo chemické vlastnosti niektorej z testovaných chemikálií nevyhovujú použitiu prietokového zrieďovacieho systému, možno použiť alternatívny expozičný (napr. statický obnovovací) systém. Komponenty systému, ktoré prichádzajú do kontaktu s vodou, by mali byť zo skla, nehrdzavejúcej ocele a/alebo polytetrafluóretylénu. Možno však použiť aj vhodné plasty, ak to nenaruší štúdiu. Expozičné nádrže by mali byť akváriá zo skla alebo nehrdzavejúcej ocele vybavené zvislými trubicami s približným objemom nádrže 4,0 – 10,0 l a minimálnou hĺbkou vody 10 – 15 cm. Systém by mal byť schopný podporovať všetky expozičné koncentrácie a kontrolu, a to v štyroch replikátoch na testovanú koncentráciu. Prietok v každej nádrži má byť konštantný, aby sa zachovali stabilné biologické podmienky a expozícia chemikálii (napr. 25 ml/min.). Testovacie nádrže by sa mali náhodne prideliť na určitú pozíciu v expozičnom systéme, aby sa minimalizovali prípadné vplyvy pozície vrátane miernych odchýlok v teplote, intenzite svetla atď. Malo by sa použiť žiarivkové osvetlenie na zabezpečenie fotoperiódy 12 hodín svetla: 12 hodín tmy pri intenzite v rozsahu 600 – 2 000 luxov (lumen/m2) na povrchu vody. Voda by sa mala udržiavať pri teplote 22 °C ± 1 °C, pH medzi 6,5 – 8,5 a koncentrácia rozpusteného kyslíka > 3,5 mg/l (> 40 % rozpustnosť vzdušného kyslíka) v každej testovacej nádrži. Keďže minimálna teplota vody, pH a rozpustený kyslík by sa mali merať raz za týždeň, ideálne by sa aspoň v jednej testovacej nádobe mala teplota merať nepretržite. V dodatku 1 sa uvádzajú podmienky pokusu, za ktorých by sa protokol mal vykonať. Ďalšie informácie o inštalácii prietokových expozičných systémov a/alebo statických obnovovacích systémov sa nachádzajú v štandardnom usmernení ASTM na vykonávanie testov akútnej toxicity na testovaných materiáloch pre ryby, makrobezstavovce a obojživelníky (5) a vo všeobecných vodných toxikologických testoch.
|
Kvalita vody
|
8.
|
Možno použiť akúkoľvek na mieste dostupnú vodu (napr. pramenistú vodu alebo vodu z vodovodu filtrovanú pomocou drevného uhlia), ktorá umožňuje normálny rast a vývin žubrienok X. laevis. Keďže kvalita miestnej vody sa môže medzi jednotlivými oblasťami výrazne líšiť, mala by sa vykonať analýza kvality vody, najmä ak nie sú dostupné historické údaje o použiteľnosti vody na chov rodu Xenopus. Osobitná pozornosť by sa mala venovať tomu, aby voda neobsahovala meď, chlór a chloramíny, ktoré sú toxické pre žaby a žubrienky. Ďalej sa odporúča vykonať analýzu vody z hľadiska hodnoty pozadia pre fluorid, perchlorát a chlorát (vedľajší produkt dezinfekcie pitnej vody), pretože všetky tieto anióny sú substráty jódového transportéra štítnej žľazy a ich zvýšená hladina môže narušiť výsledok štúdie. Analýza by sa mala vykonať pred začatím testovania a testovacia voda by za normálnych okolností nemala obsahovať tieto anióny.
|
Koncentrácia jodidu v testovacej vode
|
9.
|
Na to, aby štítna žľaza mohla tvoriť hormón štítnej žľazy, larvy musia mať k dispozícii dostatok jodidu z kombinácie vodných a potravných zdrojov. V súčasnosti neexistujú empiricky odvodené usmernenia pre minimálne koncentrácie jodidu. Dostupnosť jodidu však môže ovplyvniť schopnosť systému štítnej žľazy reagovať na látky pôsobiace v štítnej žľaze a je známe, že jodid reguluje základnú činnosť štítnej žľazy, čo je aspekt, ktorý si zaslúži pozornosť pri interpretácii výsledkov histopatologického vyšetrenia štítnej žľazy. Preto je nutné v správe uviesť namerané koncentrácie jodidu v testovacej vode. Na základe dostupných údajov z validačných štúdií protokol preukázateľne dobre funguje pri koncentrácii jodidu (I–) v testovacej vode medzi 0,5 a 10 μg/l. V ideálnom prípade by minimálna koncentrácia jodidu v testovacej vode mala byť 0,5 μg/l. Ak sa testovacia voda rekonštituuje z deionizovanej vody, mal by sa pridať jód na dosiahnutie minimálnej koncentrácie 0,5 μg/l. Každé ďalšie pridanie jódu alebo iných solí do testovacej vody by sa malo zaznamenať do správy.
|
Chov živočíchov
Párenie dospelých jedincov a starostlivosť o ne
|
10.
|
Párenie dospelých jedincov a starostlivosť o ne sa vykonávajú v súlade so štandardnými usmerneniami. Podrobnejšie informácie sa nachádzajú v štandardných usmerneniach na vykonanie skúšky teratogenézy žabích embryí (FETAX) (6). Tieto štandardné usmernenia sú príkladom vhodných metód starostlivosti a párenia, ale nevyžaduje sa ich prísne dodržiavanie. Na vyvolanie párenia sa párom (3 – 5) dospelých samičiek a samčekov vstrekne ľudský chorionický gonadotropín (hCG). Samičkám sa vstrekne približne 800 – 1 000 IU a samčekom približne 600 – 800 IU hCG rozpusteného v 0,6 – 0,9 % fyziologickom roztoku. Páriace sa páry sa držia vo veľkých nádržiach nerušené a za statických podmienok, aby sa podporil amplexus. Na spodku každej rozmnožovacej nádrže by malo byť falošné dno vytvorené zo siete z nehrdzavejúcej ocele alebo plastu, ktoré umožňuje padanie vajíčkových más na spodok nádrže. Žaby, ktoré dostali injekciu neskoro popoludní, zvyčajne nakladú väčšinu vajíčok v polovici dopoludnia nasledujúceho dňa. Po uvoľnení a oplodnení dostatočného množstva vajíčok je potrebné vybrať dospelých jedincov z rozmnožovacích nádrží.
|
Starostlivosť o larvy a ich výber
|
11.
|
Po vybratí dospelých jedincov z rozmnožovacích nádrží sa vajíčka pozbierajú a vyhodnotia z hľadiska životaschopnosti pomocou reprezentatívnej podvzorky embryí zo všetkých rozmnožovacích nádrží. Najlepšie jednotlivé znášky (odporúčajú sa dve až tri na vyhodnotenie kvality znášok) na základe životaschopnosti embryí a prítomnosti dostatočného počtu (najmenej 1 500) embryí sa zachovajú. Všetky organizmy použité v štúdii by mali pochádzať z jednej znášky (t. j. znášky by sa nemali miešať dohromady). Embryá sa prenesú na veľkú plochú podložku alebo misku a všetky zjavne mŕtve alebo abnormálne vajíčka [pozri vymedzenie v literatúre (5)] sa odstránia pomocou pipety alebo očného kvapkadla. Kvalitné embryá z každej z troch znášok sa prenesú do troch samostatných nádrží na liahnutie. Štyri dni po umiestnení do nádrží na liahnutie sa na základe životaschopnosti a úspešného vyliahnutia vyberie najlepšia znáška a larvy sa prenesú do primeraného počtu chovných nádrží s teplotou 22 °C ± 1 °C. Okrem toho sa niekoľko ďalších lariev prenesie do iných nádrží na použitie ako náhrady v prípade, že v chovných nádržiach dôjde počas prvého týždňa k úmrtnosti. Týmto postupom sa zachová stabilná hustota organizmov, čím sa znížia rozdiely vo vývine v kohorte z jednej znášky. Všetky chovné nádrže sa musia každý deň dočista vysať. Ako preventívne opatrenie sa namiesto latexových rukavíc odporúča použiť vinylové alebo nitrilové rukavice. Uhynuté larvy sa odstraňujú každý deň a následne sa dopĺňajú náhradné larvy, aby sa počas prvého týždňa zachovala hustota organizmov. Kŕmenie by sa malo vykonávať aspoň dvakrát denne.
|
|
12.
|
Počas predexpozičnej fázy sa žubrienky aklimatizujú na podmienky expozičnej fázy vrátane druhu potravy, teploty, cyklu svetla a tmy a kultivačného média. Preto sa odporúča použiť v predexpozičnej i expozičnej fáze rovnakú kultivačnú/riediacu vodu. Ak sa na chov žubrienok v predexpozičnej fáze používa statický kultivačný systém, kultivačné médium by sa malo vymieňať kompletne aspoň dvakrát týždenne. Je potrebné vyhnúť sa nadmernej hustote žubrienok spôsobenej vysokou hustotou lariev v období pred expozíciou, pretože môže zásadne ovplyvniť vývin žubrienok počas nasledujúcej testovacej fázy. Hustota počas chovu by preto nemala presiahnuť približne štyri žubrienky/l kultivačného média (statický expozičný systém) alebo desať žubrienok/l kultivačného média (s prietokom v predexpozičnom alebo kultivačnom systéme napr. 50 ml/min.). Za týchto podmienok by sa žubrienky mali vyvinúť zo štádií 45/46 do štádia 51 do 12 dní. Reprezentatívne žubrienky z tejto zásobnej populácie by sa mali každý deň kontrolovať z hľadiska vývinového štádia s cieľom odhadnúť vhodný časový bod na začatie expozície. Pozornosť by sa mala venovať minimalizovaniu stresu a traumy žubrienok, a to najmä počas presunov, čistenia akvárií a manipulácie s larvami. Je potrebné vyhýbať sa stresujúcim podmienkam/činnostiam, ako je silný a/alebo nepretržitý hluk, búchanie na akváriá, vibrácie v akváriách, nadmerná činnosť v laboratóriu a náhle zmeny okolitého prostredia (dostupnosti svetla, teploty, pH, rozpusteného kyslíka, prietoku vody atď.). Ak vývin žubrienok nepokročí do štádia 51 do 17 dní od oplodnenia, za potenciálnu príčinu možno považovať nadmerný stres.
|
Kultivácia a kŕmenie lariev
|
13.
|
Žubrienky sa počas celého obdobia pred expozíciou [po Nieuwkoopovej a Faberovej (NF) fáze 45/46 (8)] a počas celého testovacieho obdobia 21 dní kŕmia napríklad komerčným krmivom pre žubrienky používaným vo validačných štúdiách (pozri tiež dodatok 1) alebo inou potravou, použitím ktorej sa preukazne dosahujú rovnaké výsledky v skúške metamorfózy obojživelníkov. Kŕmny režim počas obdobia pred expozíciou sa musí starostlivo upraviť tak, aby zodpovedal požiadavkám vyvíjajúcich sa žubrienok. To znamená, že čerstvo vyliahnutým žubrienkam by sa niekoľkokrát denne (aspoň dvakrát) mali podávať malé dávky potravy. Nemá sa podávať nadmerné množstvo potravy, aby sa i) zachovala kvalita vody a ii) zabránilo upchatiu žiabrových filtrov časticami a zvyškami potravy. V prípade krmiva pre žubrienky použitého vo validačných štúdiách by sa denný prídel potravy mal zvyšovať spolu s rastom žubrienky na približne 30 mg/živočích/deň krátko pred začatím testu. Vo validačných štúdiách sa preukázalo, že toto komerčne dostupné krmivo podporuje správny rast a vývin žubrienok X. laevis. Skladá sa z jemných častíc, ktoré zostanú dlho suspendované vo vodnom stĺpci a odstraňujú sa prúdom vody. Preto by sa celkové denné množstvo potravy malo rozdeliť na menšie dávky a podávať aspoň dvakrát denne. Kŕmny režim pre toto krmivo je uvedený v tabuľke 1. Dávky krmiva by sa mali zaznamenávať. Môže sa podávať suché alebo ako zásobný roztok pripravený v riediacej vode. Tento zásobný roztok sa má čerstvo pripravovať každý druhý deň a, keď sa nepoužíva, má sa skladovať pri teplote 4 C.
Tabuľka 1
Kŕmny režim pre komerčne dostupné krmivo pre žubrienky použité vo validačných štúdiách so žubrienkami X. laevis počas časti skúšky AMA so živými živočíchmi v podmienkach prietoku
|
Deň štúdie
|
Prídel potravy (mg krmiva/živočích/deň)
|
|
0. – 4.
|
30
|
|
5. – 7.
|
40
|
|
8. – 10.
|
50
|
|
11. – 14.
|
70
|
|
15. – 21.
|
80
|
|
Analytická chémia
|
14.
|
Pred vykonaním štúdie by sa mala vyhodnotiť stabilita testovanej chemikálie s využitím dostupných informácií o jej rozpustnosti, degradovateľnosti a prchavosti. Z testovacích roztokov zo všetkých nádrží s replikátom pre každú koncentráciu by sa mali odobrať vzorky na analytické chemické analýzy na začiatku testu (0. deň) a každý týždeň počas testu, spolu minimálne štyri vzorky. Takisto sa odporúča, aby sa každá testovaná koncentrácia analyzovala aj počas prípravy systému pred začiatkom testu na overenie výkonnosti systému. Okrem toho sa odporúča, aby sa analyzovali aj zásobné roztoky, keď sa menia, najmä ak objem zásobného roztoku neposkytuje dostatočné množstvo chemikálie na analýzy počas celého bežného obdobia odberu vzoriek. V prípade chemikálií, ktoré nemožno zistiť pri niektorých alebo všetkých koncentráciách použitých v teste, by sa mali odmerať zásobné roztoky a mali by sa zaznamenať prietoky systému, aby bolo možné vypočítať nominálne koncentrácie.
|
Aplikovanie chemikálie
|
15.
|
Metódy používané na aplikovanie testovanej chemikálie do systému sa môžu líšiť v závislosti od jej fyzikálno-chemických vlastností. Chemikálie rozpustné vo vode možno rozpustiť v alikvotných častiach testovacej vody v koncentrácii, ktorá umožňuje aplikovanie pri cieľovej testovanej koncentrácii v prietokovom systéme. Chemikálie, ktoré sú kvapalné pri izbovej teplote a slabo rozpustné vo vode, možno aplikovať pomocou metód saturátora kvapalina: kvapalina. Chemikálie, ktoré sú pevné pri izbovej teplote a slabo rozpustné vo vode, možno aplikovať pomocou saturačných kolón so sklenou vatou (7). Odporúča sa použiť testovací systém bez nosiča. Rôzne testované chemikálie však budú mať odlišné fyzikálno-chemické vlastnosti, ktoré si pravdepodobne budú vyžadovať rôzne prístupy k príprave vody na expozíciu chemikálii. Odporúča sa urobiť všetko pre to, aby nebolo nutné použiť rozpúšťadlá alebo nosiče, pretože: i) niektoré rozpúšťadlá samotné môžu mať za následok toxicitu a/alebo nežiaduce alebo neočakávané endokrinologické odozvy, ii) testované chemikálie vo vyššom množstve ako ich rozpustnosť vo vode (k čomu často dochádza pri použití rozpúšťadiel) môžu viesť k nepresnému stanoveniu účinných koncentrácií a iii) použitie rozpúšťadiel v dlhodobých testoch môže mať za následok tvorbu značného ‚biofilmu‘ spojeného s mikrobiálnou aktivitou. V prípade ťažko testovateľných chemikálií možno rozpúšťadlo použiť ako poslednú možnosť, pričom na stanovenie najlepšej metódy je potrebné prečítať si usmerňovací dokument OECD o testovaní vodnej toxicity ťažkých látok a zmesí (4). Výber rozpúšťadla sa stanoví na základe chemických vlastností chemikálie. Medzi rozpúšťadlá, ktoré sa považujú za účinné na testovanie vodnej toxicity, patrí acetón, etanol, metanol, dimetylformamid a trietylénglykol. V prípade použitia rozpúšťadla ako nosiča by koncentrácie rozpúšťadla mali byť nižšie ako chronická koncentrácia, pri ktorej sa nepozorujú účinky (NOEC). V usmerňovacom dokumente OECD sa odporúča maximálne 100 μl/l, pričom v nedávnom preskúmaní sa odporúča použiť koncentráciu rozpúšťadla len 20 μl/l riediacej vody (12). Ak sa používajú rozpúšťadlá ako nosiče, okrem kontrolných skupín bez rozpúšťadla by sa mali vyhodnotiť aj vhodné kontrolné skupiny s rozpúšťadlom (čistá voda). Ak nie je možné aplikovať chemikáliu prostredníctvom vody z dôvodu fyzikálno-chemických vlastností (nízkej rozpustnosti) alebo obmedzenej chemickej dostupnosti, možno uvažovať o jej aplikovaní v potrave. Uskutočnil sa predbežný výskum expozície v prípade aplikovania v potrave, ale tento spôsob expozície sa bežne nepoužíva. Výber metódy by sa mal zdokumentovať a analyticky overiť.
|
Výber testovaných koncentrácií
Stanovenie vysokej testovanej koncentrácie
|
16.
|
Na účely tohto testu sa vysoká testovaná koncentrácia má stanoviť podľa limitu rozpustnosti testovanej chemikálie, maximálnej tolerovanej koncentrácie (MTC) pre akútne toxické chemikálie alebo na 100 mg/l, podľa toho, ktorá hodnota je najnižšia.
|
|
17.
|
MTC sa vymedzuje ako najvyššia testovaná koncentrácia chemikálie, ktorá vedie k menšej ako 10 % akútnej úmrtnosti. Tento prístup predpokladá, že existujú empirické údaje o akútnej úmrtnosti, na základe ktorých možno odhadnúť MTC. Odhad MTC môže byť nepresný a zvyčajne si vyžaduje určitý odborný posudok. Hoci používanie regresných modelov môže byť z technického hľadiska najvhodnejším prístupom k odhadu MTC, užitočnú aproximáciu MTC možno odvodiť aj z existujúcich údajov o akútnej toxicite ako 1/3 hodnoty akútnej LC50. Údaje o akútnej toxicite testovacieho druhu však nemusia byť k dispozícii. Ak údaje o akútnej toxicite konkrétneho druhu nie sú k dispozícii, možno uskutočniť 96-hodinový test LC50 so žubrienkami, ktoré sú reprezentatívne (t. j. v rovnakom štádiu) pre žubrienky testované v skúške AMA. Prípadne ak sú k dispozícii údaje o iných vodných druhoch (napr. štúdie LC50 pri rybách alebo iných druhoch obojživelníkov), možno na základe odborného posudku odhadnúť pravdepodobnú hodnotu MTC pomocou medzidruhovej extrapolácie.
|
|
18.
|
Alternatívne ak chemikália nie je akútne toxická a je rozpustná pri koncentrácii nad 100 mg/l, potom sa za najvyššiu testovanú koncentráciu (HTC) má považovať 100 mg/l, pretože táto koncentrácia sa zvyčajne považuje za ‚prakticky netoxickú‘.
|
|
19.
|
Hoci statické obnovovacie metódy nie sú odporúčaným postupom, môžu sa použiť, keď prietokové metódy nie sú dostatočné na dosiahnutie MTC. Ak sa použijú statické obnovovacie metódy, je potrebné zdokumentovať stabilitu koncentrácie testovanej chemikálie, ktorá by mala zostať v rámci hraníc kritérií účinnosti. Odporúčajú sa 24-hodinové obdobia obnovovania. Obdobia obnovovania dlhšie ako 72 hodín nie sú prijateľné. Okrem toho sa na konci každého obdobia obnovovania bezprostredne pred obnovením majú odmerať parametre kvality vody (napr. rozpustný kyslík, teplota, pH atď.).
|
Rozsah testovanej koncentrácie
|
20.
|
Požadované minimum predstavujú tri testované koncentrácie a kontrolná skupina s čistou vodou (a kontrolná skupina, ktorej bolo aplikované vehikulum, ak to je potrebné). Minimálny rozdiel medzi najvyššou a najnižšou testovanou koncentráciou by mal byť približne jedna rádová hodnota. Maximálny rozstup medzi dávkami je 0,1 a minimálny 0,33.
|
POSTUP
Začiatok a vykonanie testu
0. deň
|
21.
|
Expozícia by sa mala začať vtedy, keď dostatočný počet žubrienok z predexpozičnej zásobnej populácie dosiahne vývinové štádium 51 podľa Nieuwkoopa a Fabera (8), pričom musia mať vek 17 dní alebo menej od oplodnenia. Na účely výberu testovacích živočíchov sa zdravé a normálne vyzerajúce žubrienky zo zásobnej populácie majú spoločne vložiť do jednej nádoby s vhodným objemom riediacej vody. Na stanovenie vývinového štádia sa žubrienky majú po jednej vyberať zo spoločnej nádrže pomocou malej siete alebo cedidla a preniesť do priehľadnej meracej komory (napr. 100 mm Petriho misky) s riediacou vodou. Pri stanovovaní štádia nie je vhodné použiť anestéziu, individuálne však možno žubrienky pred manipuláciou uspať s použitím 100 mg/l trikaín metánsulfonátu (napr. MS-222) vhodne tlmeného hydrogénuhličitanom sodným (pH 7,0). Ak sa použije, metodika správneho použitia napr. MS-222 na anestéziu sa má získať od skúsených laboratórií a uviesť v správe spolu s výsledkami testu. So živočíchmi sa počas tohto prenosu musí manipulovať opatrne, aby sa minimalizoval stres pri manipulácii a aby nedošlo k poraneniu.
|
|
22.
|
Vývinové štádium živočíchov sa stanovuje pomocou binokulárneho disekčného mikroskopu. V záujme zníženia základnej variability vo vývinovom štádiu je dôležité, aby sa toto stanovenie vykonalo čo najpresnejšie. Podľa Nieuwkoopa a Fabera (8) je hlavným vývinovým znakom pri výbere organizmov v štádiu 51 morfológia zadných končatín. Morfologické vlastnosti zadných končatín by sa mali preskúmať pod mikroskopom. Kým na získanie komplexných informácií o stanovovaní štádií žubrienok je nutné prečítať si celé usmernenie od Nieuwkoopa a Fabera (8), vývinové štádium možno spoľahlivo určiť aj pomocou nápadných morfologických znakov. Nasledujúcu tabuľku možno použiť na zjednodušenie a štandardizovanie procesu stanovovania štádia v priebehu štúdie prostredníctvom identifikovania nápadných morfologických znakov spojených s rôznymi štádiami za predpokladu, že vývin je normálny.
Tabuľka 2
Nápadné morfologické znaky jednotlivých štádií podľa usmernenia Nieuwkoopa a Fabera
|
Nápadné morfologické znaky
|
Vývinové štádium
|
|
51
|
52
|
53
|
54
|
55
|
56
|
57
|
58
|
59
|
60
|
61
|
62
|
63
|
64
|
65
|
66
|
|
Zadné končatiny
|
X
|
X
|
X
|
X
|
X
|
X
|
X
|
|
|
|
|
|
|
|
|
|
|
Predné končatiny
|
|
|
|
|
|
X
|
X
|
X
|
X
|
X
|
|
|
|
|
|
|
|
Kraniofaciálna štruktúra
|
|
|
|
|
|
|
|
|
|
X
|
X
|
X
|
X
|
|
|
|
|
Morfológia čuchového nervu
|
|
|
|
|
|
|
|
|
|
|
X
|
X
|
X
|
|
|
|
|
Dĺžka chvosta
|
|
|
|
|
|
|
|
|
|
|
|
|
X
|
X
|
X
|
X
|
|
|
23.
|
Na to, aby bolo možné začať test, musia byť všetky žubrienky v štádiu 51. Najnápadnejší morfologický znak tohto štádia je morfológia zadných končatín, čo potvrdzuje obrázok 1.
Obrázok 1
Morfológia zadných končatín žubrienky X. laevis v štádiu 51

|
|
24.
|
Okrem výberu pokusných živočíchov podľa vývinového štádia možno voliteľne použiť aj výber podľa veľkosti. Na tieto účely je potrebné odmerať dĺžku celého tela (nie SVL) v 0. deň na podvzorke približne 20 žubrienok v štádiu 51 podľa NF. Po výpočte priemernej dĺžky celého tela tejto skupiny živočíchov možno stanoviť minimálne a maximálne hranice pre dĺžku celého tela pokusných živočíchov s rozsahom priemernej hodnoty ± 3 mm (priemeru hodnôt dĺžky celého tela je v rozsahu 24,0 – 28,1 mm pre žubrienky v štádiu 51). Primárnym parametrom na stanovenie pripravenosti každého testovaného živočícha je však stanovenie vývinového štádia. Žubrienky s výrazne viditeľnými malformáciami alebo poraneniami by sa mali zo skúšky vylúčiť.
|
|
25.
|
Žubrienky, ktoré spĺňajú uvedené kritériá štádia, sa držia v nádrži s čistou kultivačnou vodou až do skončenia procesu stanovovania štádia. Po stanovení štádia sa larvy náhodne rozdelia do expozičných testovacích nádrží tak, aby každá nádrž obsahovala 20 lariev. Živočíchy v každej testovacej nádrži sa potom skontrolujú, či nemajú abnormálny vzhľad (napr. poranenia abnormálne plávanie atď.). Zjavne nezdravo vyzerajúce žubrienky sa majú z testovacích nádrží odstrániť a nahradiť novými larvami zo spoločnej nádrže.
|
Pozorovania
|
26.
|
Podrobnejšie informácie o postupoch ukončenia testu a spracovaní žubrienok sa nachádzajú v usmerňovacom dokumente OECD o histológii štítnej žľazy obojživelníkov (9).
|
Merania v 7. deň
|
27.
|
V 7. deň sa z každej testovacej nádrže vyberie päť náhodne vybratých žubrienok na replikát. Musí sa použiť taký náhodný postup, aby mal každý testovaný organizmus rovnakú pravdepodobnosť, že bude vybratý. To možno dosiahnuť použitím akejkoľvek randomizačnej metódy, ale vyžaduje sa, aby sa každá žubrienka vybrala sieťkou. Žubrienky, ktoré neboli vybraté, sa vrátia do pôvodnej nádrže a vybraté žubrienky sa humánnym spôsobom usmrtia v 150 – 200 mg/l príslušnej látky, napr. MS-222, primerane tlmenej hydrogénuhličitanom sodným na pH 7,0. Usmrtené žubrienky sa opláchnu vodou a osušia. Následne sa odmeria ich telesná hmotnosť s presnosťou na miligram. Každej žubrienke sa odmeria dĺžka zadných končatín, dĺžka od pysku po kloaku a stanoví sa vývinové štádium (pomocou binokulárneho disekčného mikroskopu).
|
Merania v 21. deň (ukončenie testu)
|
28.
|
V deň ukončenia testu (21. deň) sa zostávajúce žubrienky vyberú z testovacích nádrží a humánne usmrtia v 150 – 200 mg/l príslušnej látky, napr. MS-222, primerane tlmenej hydrogénuhličitanom sodným, ako je opísané vyššie. Žubrienky sa opláchnu vodou a osušia. Následne sa odmeria ich telesná hmotnosť s presnosťou na miligram. Pre každú žubrienku sa stanoví vývinové štádium a odmeria SVL a dĺžka zadných končatín.
|
|
29.
|
Všetky larvy sa na 48 – 72 hodín umiestnia do Davidsonovho fixačného prostriedku buď ako vzorky celého tela alebo ako narezané vzorky tkaniva hlavy obsahujúce dolnú čeľusť na účely histologických vyšetrení. Na účely histopatologického vyšetrenia sa z každej nádrže s replikátom odoberie vzorka piatich žubrienok. Keďže výška folikulárnych buniek závisí od štádia (10), najvhodnejším prístupom k odberu vzoriek na histologické analýzy je použitie jedincov v rovnakom štádiu, pokiaľ to je možné. Na účely výberu jedincov v rovnakom štádiu sa má pred výberom a následným spracovaním na účely získania údajov a zakonzervovania stanoviť štádium všetkých lariev. To je potrebné preto, lebo normálne rozdiely vo vývine budú viesť k rozdielnej distribúcii štádií v jednotlivých nádržiach s replikátom.
|
|
30.
|
Živočíchy vybraté na histopatologické vyšetrenie (n = 5 z každého replikátu) by mali zodpovedať mediánovému štádiu kontrolných živočíchov (spojených replikátov), pokiaľ to je možné. Ak je v niektorých nádržiach s replikátom viac ako päť lariev vo vhodnom štádiu, náhodne sa vyberie päť lariev.
|
|
31.
|
Ak je v niektorých nádržiach s replikátom menej ako päť lariev vo vhodnom štádiu, náhodne sa vyberú jedince z nasledujúceho nižšieho alebo vyššieho vývinového štádia tak, aby sa dosiahla celková veľkosť vzorky päť lariev na replikát. Rozhodnutie o použití doplnkových lariev z nasledujúceho nižšieho alebo vyššieho vývinového štádia by podľa možnosti malo byť založené na celkovom vyhodnotení distribúcie štádií v kontrolnej skupine a skupinách s aplikovanou chemikáliou. To znamená, že ak je aplikovanie chemikálie spojené s oneskorením vývinu, doplnkové larvy by sa mali odobrať z nasledujúceho nižšieho štádia. Naopak ak je aplikovanie chemikálie spojené s urýchlením vývinu, doplnkové larvy by sa mali odobrať z nasledujúceho vyššieho štádia.
|
|
32.
|
V prípade závažných zmien vo vývine žubrienok v dôsledku aplikovania testovanej chemikálie sa môže stať, že distribúcia štádií v skupine s aplikovanou chemikáliou sa nebude prekrývať s vypočítaným mediánovým vývinovým štádiom v kontrolnej skupine. Len v týchto prípadoch sa má výberový proces upraviť tak, že sa použije štádium odlišné od mediánového štádia v kontrolnej skupine, aby bolo možné vykonať histopatologické vyšetrenie štítnej žľazy s použitím vzoriek v rovnakom štádiu. Okrem toho ak štádiá nemožno určiť (t. j. asynchrónia), na histologickú analýzu sa náhodne vyberie päť žubrienok z každého replikátu. Vždy je nutné uviesť odôvodnenie výberu vzoriek lariev, ktoré nie sú v štádiu zodpovedajúcom mediánovému vývinovému štádiu kontrolnej skupiny.
|
Stanovenie biologických sledovaných parametrov
|
33.
|
Počas 21-dňovej expozičnej fázy sa meranie základných sledovaných parametrov vykonáva v 7. a 21. deň, testované živočíchy sa však musia pozorovať každý deň. Tabuľka 3 obsahuje prehľad sledovaných parametrov merania a príslušné časové body pozorovania. Podrobnejšie informácie o technických postupoch merania vrcholových sledovaných parametrov a histologických hodnotení sa nachádzajú v usmerňovacích dokumentoch OECD (9).
Tabuľka 3
Časové body pozorovania pre základné sledované parametre skúšky AMA
|
Vrcholové sledované parametre
|
denne
|
7. deň
|
21. deň
|
|
|
ߦ
|
|
|
|
|
|
ߦ
|
ߦ
|
|
|
|
ߦ
|
ߦ
|
|
—
|
dĺžka od pysku po kloaku
|
|
|
ߦ
|
ߦ
|
|
|
|
ߦ
|
ߦ
|
|
—
|
histológia štítnej žľazy
|
|
|
|
ߦ
|
|
Vrcholové sledované parametre
|
34.
|
Vrcholové sledované parametre skúšky AMA sú vývinové štádium, dĺžka zadných končatín, SVL a mokrá hmotnosť. Každý z nich je stručne opísaný ďalej. Ďalšie technické informácie o zbere týchto údajov vrátane odporúčaných postupov počítačovej analýzy sú k dispozícii v uvedených usmerňovacích dokumentoch.
|
Vývinové štádium
|
35.
|
Vývinové štádium žubrienok X. laevis sa stanovuje pomocou kritérií stanovenia štádia podľa Nieuwkoopa a Fabera (8). Údaje o vývinovom štádiu slúžia na určenie toho, či je vývin urýchlený asynchrónny, oneskorený alebo nedotknutý. Urýchlenie alebo oneskorenie vývinu sa určuje porovnaním mediánového štádia dosiahnutého v kontrolnej a testovanej skupine. Asynchrónny vývin sa uvádza vtedy, keď skúmané tkanivá nie sú malformované ani abnormálne, ale keď je pri konkrétnej žubrienke narušené relatívne načasovanie morfogenézy alebo vývinu rôznych tkanív.
|
Dĺžka zadných končatín
|
36.
|
Diferenciáciu a rast zadných končatín, ktoré sú hlavnými vývinovými znakmi už použitými na stanovenie vývinového štádia, regulujú hormóny štítnej žľazy. Vývin zadných končatín sa používa kvalitatívne na stanovenie vývinového štádia, ale tu sa považuje za kvantitatívny sledovaný parameter. Dĺžka zadných končatín sa preto meria ako sledovaný parameter na zistenie účinkov na os štítnej žľazy (obrázok 2). V záujme jednotnosti sa dĺžka zadných končatín meria na ľavej zadnej končatine. Dĺžka zadných končatín sa vyhodnotí v 7. deň aj 21. deň testu. V 7. deň je meranie dĺžky zadnej končatiny jednoduché ako to vidieť na obrázku 2. V 21. deň je to už zložitejšie z dôvodu ohybov končatiny. Merania dĺžky zadných končatín v 21. deň by preto mali začínať od steny tela a sledovať stredovú čiaru končatiny cez prípadné uhlové odchýlky. Zmeny v dĺžke zadných končatín v 7. deň aj keď nie sú zrejmé v 21. deň, sa stále považujú za významné z hľadiska potenciálneho pôsobenia na štítnu žľazu. Merania dĺžky sa získavajú z digitálnych fotografií pomocou softvéru na analýzu obrazu ako sa uvádza v usmerňovacom dokumente OECD o histológii štítnej žľazy obojživelníkov (9).
|
Dĺžka tela a mokrá hmotnosť
|
37.
|
Spôsoby stanovenia dĺžky od pysku po kloaku (SVL) (obrázok 2) a mokrej hmotnosti sú uvedené v protokole testu na posúdenie možných účinkov testovaných chemikálií na rýchlosť rastu žubrienok v porovnaní s kontrolnou skupinou a sú užitočné pri detekcii celkovej toxicity na testovanú chemikáliu. Keďže odstránenie priľnutej vody na účely stanovenia hmotnosti môže žubrienke spôsobiť stres a poškodenie kože, tieto merania sa vykonávajú na žubrienkach odobratých ako podvzorky v 7. deň a na všetkých ostatných žubrienkach po ukončení testu (21. deň). V záujme jednotnosti použite kraniálny okraj kloaky ako kaudálny limit merania.
|
|
38.
|
Dĺžka od pysku po kloaku (SVL) sa používa na posúdenie rastu žubrienky, ako je znázornené na obrázku 2.
Obrázok 2
(A) Druhy meraní dĺžky tela a (B) meranie dĺžky zadných končatín žubrienok X. laevis (1).
|
Histológia štítnej žľazy
|
39.
|
Zatiaľ čo vývinové štádium a dĺžka zadných končatín sú významné sledované parametre na hodnotenie zmien vo vývoji metamorfózy súvisiacich s expozíciou, oneskorený vývin sa sám osebe nemôže považovať za diagnostický ukazovateľ pôsobenia proti štítnej žľaze. Niektoré zmeny možno zistiť len bežnou histopatologickou analýzou. Diagnostické kritériá zahŕňajú hypertrofiu/atrofiu štítnej žľazy, hypertrofiu folikulárnych buniek, hyperpláziu folikulárnych buniek a ďalšie kvalitatívne kritériá: plochu folikulárnej dutiny, kvalitu koloidu a výšku/tvar folikulárnych buniek. Je potrebné uviesť stupeň závažnosti (štyri stupne). Informácie o získaní a spracovaní vzoriek na histologickú analýzu a o vykonávaní histologickej analýzy vzoriek tkaniva sú k dispozícii v dokumentoch ‚Skúška metamorfózy obojživelníkov: časť 1 – Technické usmernenia na odber morfologických vzoriek a histologickú prípravu‘ a ‚Skúška metamorfózy obojživelníkov: časť 2 – Prístup k čítaniu štúdií, diagnostických kritérií, stupňov závažnosti a atlasu‘ (9). Laboratóriá, ktoré vykonávajú skúšku prvýkrát, by pred uskutočnením histologickej analýzy a vyhodnotením štítnej žľazy mali požiadať o radu skúsených patológov na účely zaškolenia. V prípade zreteľných a podstatných zmien vo vrcholových sledovaných parametroch, ktoré nasvedčujú urýchlenému alebo asynchrónnemu vývinu, nemusí byť nutné vykonať histopatologickú analýzu štítnej žľazy. Ak však zreteľné morfologické zmeny alebo dôkazy o oneskorení vývinu neexistujú, histologické analýzy sú potrebné.
|
Úmrtnosť
|
40.
|
Všetky testovacie nádrže sa musia každý deň kontrolovať, či v nich nie sú mŕtve žubrienky. Ak sú, ich počet v každej nádrži sa musí zaznamenať. Pre každý úhyn je potrebné zaznamenať dátum, koncentráciu a číslo nádrže. Mŕtve živočíchy sa musia z nádrže odstrániť ihneď po zistení úhynu. Úmrtnosť presahujúca 10 % môže znamenať nevhodné testovacie podmienky alebo toxické účinky testovanej chemikálie.
|
Ďalšie pozorovania
|
41.
|
Je nutné zaznamenať prípady abnormálneho správania a zreteľne viditeľných malformácií a lézií. Pre každé abnormálne správanie, zreteľnú malformáciu alebo léziu je potrebné zaznamenať dátum, koncentráciu a číslo nádrže. Normálne správanie sa vyznačuje rozptýlením žubrienok vo vodnom stĺpci s chvostom vztýčeným nad hlavou, pravidelným rytmickým búchaním chvostovou plutvou, pravidelným vychádzaním na hladinu, vytvorením žiabrových viečok a reagovaním na podnety. Abnormálne správanie zahŕňa napríklad plávanie na povrchu, ležanie na spodku nádrže, obrátené alebo nepravidelné plávanie, nevychádzanie na hladinu a nereagovanie na podnety. Okrem toho je nutné zaznamenať aj výrazné rozdiely v konzumácii potravy medzi vzorkami s aplikovanou chemikáliou. Zreteľné malformácie a lézie môžu okrem iného zahŕňať morfologické abnormality (napr. deformácie končatín), krvavé lézie, bakteriálne alebo plesňové infekcie. Tieto stanovenia sú kvalitatívne a mali by sa považovať za podobné klinickým príznakom ochorenia/stresu a porovnať s kontrolnými živočíchmi. Ak je výskyt alebo miera výskytu v exponovaných nádržiach vyššia ako v kontrolných nádržiach, malo by sa to považovať za dôkaz zjavnej toxicity.
|
ÚDAJE A PODÁVANIE SPRÁV
Zber údajov
|
42.
|
Všetky údaje by sa mali zbierať pomocou elektronických alebo manuálnych systémov, ktoré sú v súlade so správnou laboratórnou praxou (SLP). Údaje zo štúdie by mali zahŕňať:
|
|
Testovaná chemikália:
|
—
|
charakterizácia testovanej chemikálie: fyzikálno-chemické vlastnosti, údaje o stálosti a biodegradovateľnosti,
|
|
—
|
chemické informácie a údaje: spôsob a frekvencia prípravy roztokov. Informácie o testovanej chemikálii zahŕňajú skutočné a nominálne koncentrácie testovanej chemikálie a v niektorých prípadoch podľa potreby nepôvodnej chemikálie. Merania testovanej chemikálie sa môžu vyžadovať pre zásobné roztoky i testované roztoky,
|
|
—
|
rozpúšťadlo (ak je iné ako voda): odôvodnenie výberu rozpúšťadla a charakterizáciu rozpúšťadla (druh, použitá koncentrácia).
|
|
|
|
Podmienky testu:
|
—
|
prevádzkové záznamy: skladajú sa z pozorovaní týkajúcich sa fungovania testovacieho systému a podporného prostredia a infraštruktúry. Typické záznamy zahŕňajú: teplotu okolia, testovaciu teplotu, fotoperiódu, stav kritických prvkov expozičného systému (napr. čerpadiel, počítadiel cyklov, tlakov), prietoky, hladiny vody, zmeny v zásobnej fľaši a záznamy o kŕmení. Všeobecné parametre kvality vody zahŕňajú: pH, rozpustený kyslík, vodivosť, celkový jód, zásaditosť a tvrdosť,
|
|
—
|
odchýlky od testovacej metódy: táto informácia by mala zahŕňať všetky informácie o odchýlkach od testovacej metódy alebo ich slovné opisy.
|
|
|
|
Výsledky:
|
—
|
biologické pozorovania a údaje: patria sem každodenné pozorovania úmrtnosti, spotreby potravy abnormálneho plávania, letargie, straty rovnováhy, malformácií, lézií atď. Pozorovania a údaje zozbierané vo vopred určených intervaloch zahŕňajú: vývinové štádium, dĺžku zadných končatín, dĺžku od pysku po kloaku a mokrú hmotnosť,
|
|
—
|
štatistické analytické metódy a odôvodnenie použitých metód, výsledky štatistickej analýzy, najlepšie v tabuľkovej forme,
|
|
—
|
histologické údaje: zahŕňajú slovné opisy ako aj stupeň závažnosti a skóre výskytu osobitných pozorovaní v súlade s usmerňovacím dokumentom o histopatológii,
|
|
—
|
pozorovania ad hoc: tieto pozorovania by mali zahŕňať slovné opisy štúdie, ktoré nepatria do uvedených kategórií.
|
|
|
Oznamovanie údajov
|
43.
|
Dodatok 2 obsahuje hárky na každodenné zaznamenávanie získaných údajov, ktoré možno použiť ako usmernenie na zapisovanie nespracovaných údajov a výpočty súhrnných štatistík. Okrem toho sú k dispozícii oznamovacie tabuľky vhodné na sprostredkovanie zhrnutí údajov o sledovaných parametroch. Oznamovacie tabuľky pre histologické hodnotenia sa nachádzajú v dodatku 2.
|
Kritériá účinnosti a test prípustnosti/validity
|
44.
|
Výrazné odchýlky od testovacej metódy budú mať vo všeobecnosti za následok neprijateľné údaje na účely interpretácie alebo podávania správ. Preto sa vypracovali kritériá uvedené v tabuľke 4 ako usmernenie na určenie kvality vykonaného testu, teda všeobecného stavu kontrolných organizmov.
Tabuľka 4
Kritériá účinnosti pre skúšku AMA
|
Kritérium
|
Prípustné limity
|
|
Testované koncentrácie
|
Udržiavané na úrovni ≤ 20 % CV (variabilita nameranej testovanej koncentrácie) počas 21-dňového testu.
|
|
Úmrtnosť v kontrolných skupinách
|
≤ 10 % – úmrtnosť v každom jednom replikáte v kontrolných skupinách by nemala prekročiť dve žubrienky.
|
|
Minimálne mediánové vývinové štádium kontrolných organizmov na konci testu
|
57
|
|
Rozptyl vývinových štádií v kontrolnej skupine
|
10. a 90. percentil distribúcie vývinových štádií by sa nemal líšiť o viac ako štyri štádiá.
|
|
Rozpustený kyslík
|
≥ 40 % rozpustnosť vzdušného kyslíka (23)
|
|
pH
|
pH by sa malo udržiavať v rozmedzí 6,5 – 8,5. Rozdiely medzi replikátmi/koncentráciami chemikálie by nemali byť väčšie ako 0,5.
|
|
Teplota vody
|
22° ± 1 °C – rozdiely medzi replikátmi/koncentráciami chemikálie by nemali byť väčšie ako 0,5 °C.
|
|
Testované koncentrácie bez zjavnej toxicity
|
≥ 2
|
|
Stav replikátov
|
≤ 2 replikáty v rámci testu môžu byť narušené.
|
|
Osobitné podmienky na použitie rozpúšťadla
|
Ak sa použije rozpúšťadlo ako nosič, je nutné použiť kontrolnú skupinu s rozpúšťadlom i kontrolnú skupinu s čistou vodou a uviesť výsledky.
|
|
Štatisticky významné rozdiely medzi kontrolnými skupinami s rozpúšťadlom a kontrolnými skupinami s vodou treba riešiť osobitne. Viac informácií sa nachádza ďalej.
|
|
Osobitné podmienky pre statický obnovovací systém
|
V správe je potrebné uviesť reprezentatívne chemické analýzy vykonané pred obnovením a po ňom.
|
|
Bezprostredne pred obnovením sa musí odmerať hladina amoniaku.
|
|
Bezprostredne pred obnovením sa musia odmerať všetky parametre kvality vody uvedené v tabuľke 1 dodatku 1.
|
|
Obdobie obnovenia by nemalo presiahnuť 72 hodín.
|
|
Vhodný harmonogram kŕmenia (50 % denného prídelu komerčného krmiva pre žubrienky).
|
|
Validita testu
|
45.
|
Tieto požiadavky by sa mali splniť na to, aby sa test mohol považovať za prípustný/platný:
|
|
Platný pokus pre test stanovený ako negatívny na pôsobenie na štítnu žľazu:
|
1.
|
Pre každé aplikovanie chemikálie (vrátane kontrolných skupín) nesmie úmrtnosť presiahnuť 10 %. Pre každý replikát nesmie úmrtnosť presiahnuť tri žubrienky, inak sa replikát považuje za narušený.
|
|
2.
|
Na analýzu musia byť k dispozícii aspoň dve úrovne koncentrácie chemikálie so všetkými štyrmi nenarušenými replikátmi.
|
|
3.
|
Na analýzu musia byť k dispozícii aspoň dve úrovne koncentrácie chemikálie bez zjavnej toxicity.
|
|
|
|
Platný pokus pre test stanovený ako pozitívny na pôsobenie na štítnu žľazu:
|
1.
|
Môže sa vyskytnúť úmrtnosť nie viac ako dve žubrienky/replikát v kontrolnej skupine.
|
|
|
Logická schéma rozhodovania pri vykonávaní skúšky AMA
|
46.
|
Pre skúšku AMA sa vytvorila logická schéma rozhodovania ako logická pomôcka pri vykonávaní biologickej skúšky a interpretácii jej výsledkov (pozri vývojový diagram na obrázku 3). Podľa tejto logickej schémy rozhodovania sa v podstate vážia sledované parametre tak, že urýchlený vývin asynchrónny vývin a histopatológia štítnej žľazy majú veľkú váhu, kým oneskorený vývin, dĺžka od pysku po kloaku a mokrá telesná hmotnosť, teda parametre, ktoré môžu byť potenciálne ovplyvnené všeobecnou toxicitou, majú menšiu váhu.
Obrázok 3
Logická schéma rozhodovania pri vykonávaní skúšky AMA
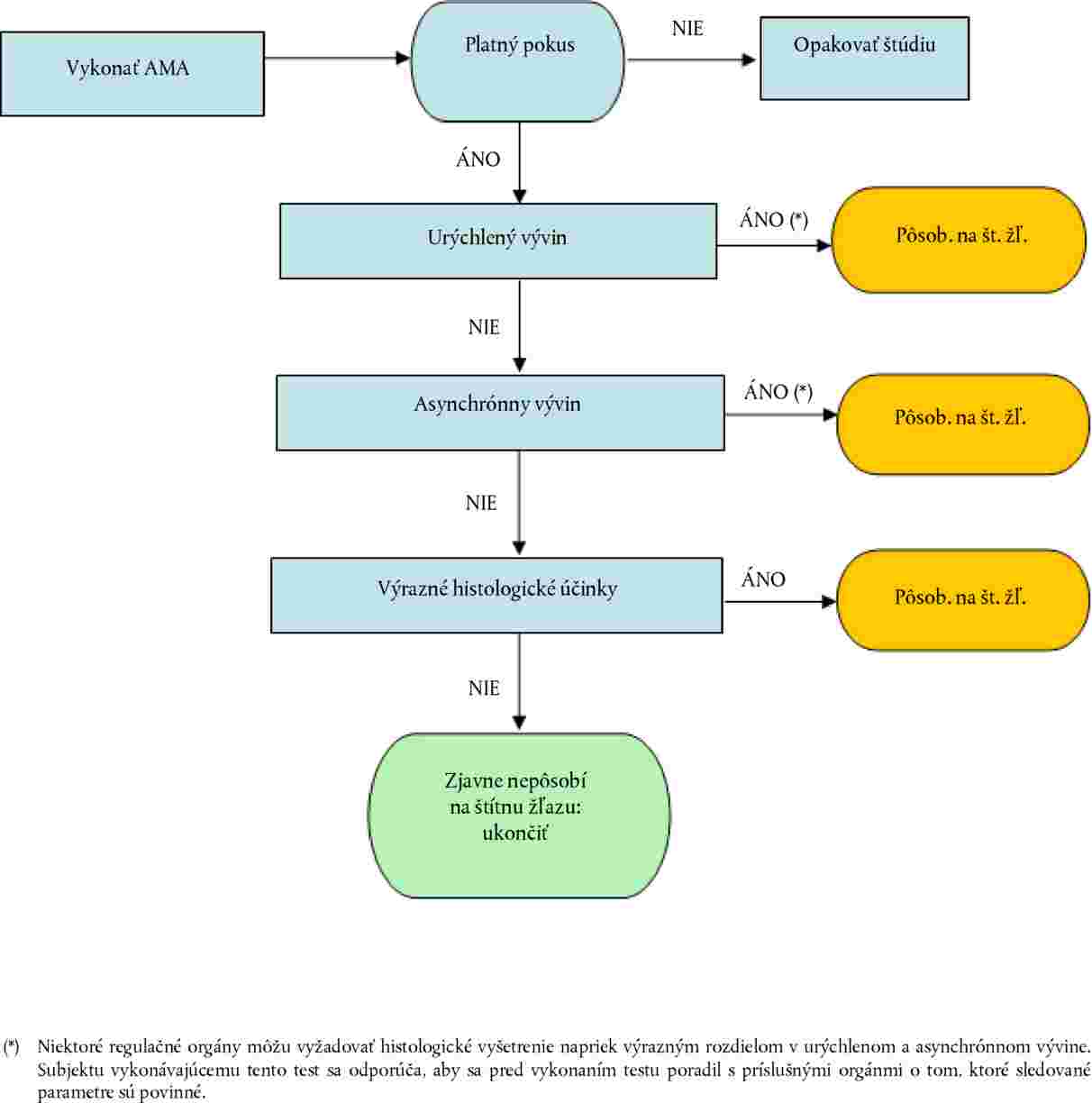
|
Urýchlený vývin (stanovený podľa vývinovej fázy, SVL a HLL)
|
47.
|
Je známe, že urýchlený vývin sa vyskytuje len prostredníctvom účinkov, ktoré súvisia s hormónom štítnej žľazy. Môže ísť o účinky na periférne tkanivá, ako je priama interakcia s receptorom hormónu štítnej žľazy (napr. T4) alebo účinky, ktoré menia hladinu hormónu štítnej žľazy v krvnom obehu. V obidvoch prípadoch sa to považuje za dostatočný dôkaz pôsobenia chemikálie na štítnu žľazu. Urýchlený vývin sa vyhodnocuje jedným z dvoch spôsobov. Po prvé, všeobecné vývinové štádium možno vyhodnotiť s použitím štandardizovaného prístupu podľa Nieuwkoopa a Fabera (8). Po druhé, v 7. aj 21. dni možno kvantifikovať konkrétne morfologické znaky, napríklad dĺžku zadných končatín, ktoré jasne súvisia s agonistickými účinkami na receptor hormónu štítnej žľazy. Ak sa zistí štatisticky významný urýchlený vývin alebo väčšia dĺžka zadných končatín, potom z testu vyplýva, že chemikália pôsobí na štítnu žľazu.
|
|
48.
|
Vyhodnotenie testovaných živočíchov z hľadiska prítomnosti urýchleného vývinu v porovnaní s kontrolnou populáciou bude založené na výsledkoch štatistických analýz uskutočnených pre tieto štyri sledované parametre:
|
—
|
dĺžka zadných končatín (normalizovaná vzhľadom na SVL) v 7. deň štúdie,
|
|
—
|
dĺžka zadných končatín (normalizovaná vzhľadom na SVL) v 21. deň štúdie,
|
|
—
|
vývinové štádium v 7. deň štúdie,
|
|
—
|
vývinové štádium v 21. deň štúdie.
|
|
|
49.
|
Štatistické analýzy dĺžky zadných končatín by sa mali vykonať na základe meraní dĺžky ľavej zadnej končatiny. Dĺžka zadných končatín sa normalizuje podľa pomeru dĺžky zadných končatín a dĺžky od pysku po kloaku jedinca. Následne sa porovnajú priemery normalizovaných hodnôt pre každú úroveň koncentrácie chemikálie. Urýchlenie vývinu sa potom udáva ako významný nárast priemernej dĺžky zadných končatín (normalizovanej) v skupine s aplikovanou chemikáliou v porovnaní s kontrolnou skupinou v 7. deň a/alebo 21. deň štúdie (pozri dodatok 3).
|
|
50.
|
Štatistické analýzy vývinového štádia by sa mali vykonať na základe stanovenia vývinových štádií podľa morfologických kritérií opísaných Nieuwkoopom a Faberom (8). K urýchlenému vývinu došlo vtedy, keď sa v multikvantovej analýze zistí významný nárast hodnôt vývinového štádia v skupine s aplikovanou chemikáliou v porovnaní s kontrolnou skupinou v 7. deň a/alebo 21. deň štúdie.
|
|
51.
|
V testovacej metóde skúšky AMA sa významný vplyv na ktorýkoľvek zo štyroch uvedených sledovaných parametrov považuje za dostatočný na jednoznačné stanovenie urýchleného vývinu. To znamená, že významný vplyv na dĺžku zadných končatín v určitom časovom bode si nevyžaduje potvrdenie významným vplyvom na dĺžku zadných končatín v inom časovom bode ani významným vplyvom na vývinové štádium v tomto konkrétnom časovom bode. A ďalej, významný vplyv na vývinové štádium v určitom časovom bode si nevyžaduje potvrdenie významným vplyvom na vývinové štádium v inom časovom bode ani významným vplyvom na dĺžku zadných končatín v tomto konkrétnom časovom bode. Váha dôkazov o urýchlenom vývine sa však zvýši ak sa významný vplyv zistí pre viacero sledovaných parametrov.
|
Asynchrónny vývin (stanovený podľa kritérií vývinového štádia)
|
52.
|
Asynchrónny vývin je charakterizovaný narušením relatívneho načasovania morfogenézy alebo vývinu rôznych tkanív konkrétnej žubrienky. Nemožnosť jasne stanoviť vývinové štádium organizmu pomocou súboru morfologických sledovaných parametrov považovaných za typické pre príslušné štádium naznačuje, že tkanivá sa počas metamorfózy vyvíjajú asynchrónne. Asynchrónny vývin je ukazovateľom pôsobenia na štítnu žľazu. Jediné známe spôsoby účinku vyvolávajúce asynchrónny vývin sú prostredníctvom pôsobenia chemikálií na periférnu činnosť hormónu štítnej žľazy a/alebo metabolizmus hormónu štítnej žľazy vo vyvíjajúcich sa tkanivách ako sa to zaznamenalo v prípade inhibítorov dejodinázy.
|
|
53.
|
Hodnotenie testovacích živočíchov z hľadiska prítomnosti asynchrónneho vývinu v porovnaní s kontrolnou populáciou bude založené na hodnotení výrazných morfologických znakov testovacích živočíchov v 7. a 21. deň štúdie.
|
|
54.
|
Opis normálneho vývinu Xenopus laevis od Nieuwkoopa a Fabera (8) poskytuje rámec na identifikáciu poradia normálnej remodelácie tkaniva. Pojem ‚asynchrónny vývin‘ sa osobitne vzťahuje na odchýlky vo vývine výrazných morfologických znakov žubrienok, ktoré znemožňujú konečné stanovenie vývinového štádia podľa kritérií Nieuwkoopa a Fabera (8), lebo hlavné morfologické znaky majú charakteristiky rôznych štádií.
|
|
55.
|
Ako napovedá pojem ‚asynchrónny vývin‘, do úvahy sa majú brať len prípady odchýlok v pokroku remodelácie konkrétnych tkanív v porovnaní s pokrokom remodelácie iných tkanív. Niektoré klasické fenotypy zahŕňajú oneskorenie alebo neprítomnosť vzniku predných končatín napriek normálnemu alebo urýchlenému vývinu zadných končatín a tkanív chvosta alebo predčasnú resorpciu žiabier vzhľadom na štádium morfogenézy zadných končatín a resorpcie chvosta. Živočích sa zaznamená ako vyvíjajúci sa asynchrónne ak ho nemožno zaradiť do žiadneho štádia, lebo nespĺňa väčšinu zásadných vývinových kritérií pre dané štádium podľa Niewkoopa a Fabera (8) alebo ak došlo k mimoriadnemu oneskoreniu alebo urýchleniu vývinu jedného alebo viacerých kľúčových znakov (napr. chvost sa úplne resorboval, ale nevytvorili sa predné končatiny). Toto posúdenie sa vykonáva kvalitatívne a malo by vychádzať z preskúmania celého súboru znakov uvádzaných Nieuwkoopom a Faberom (8). Nie je však potrebné zaznamenať vývinové štádium rôznych zásadných znakov pozorovaných živočíchov. Živočíchy zaznamenané ako vyvíjajúce sa asynchrónne sa nezaradia do žiadneho vývinového štádia podľa Nieuwkoopa a Fabera (8).
|
|
56.
|
Hlavným kritériom na stanovenie prípadov abnormálneho morfologického vývinu ako ‚asynchrónneho vývinu‘ je teda to, že relatívne načasovanie remodelácie tkaniva a morfogenézy tkaniva sú narušené, zatiaľ čo morfológia postihnutých tkanív nie je zjavne abnormálna. Jedným príkladom na ilustráciu tejto interpretácie výrazných morfologických abnormalít je skutočnosť, že oneskorená morfogenéza zadných končatín vzhľadom na vývin iných tkanív bude spĺňať kritérium ‚asynchrónneho vývinu‘, kým prípady chýbajúcich zadných končatín abnormálnych prstov (napr. ektrodaktýlie, polydaktýlie) alebo iných zjavných malformácií končatín by sa nemali považovať za ‚asynchrónny vývin‘.
|
|
57.
|
Hlavné morfologické znaky, ktoré by sa mali hodnotiť z hľadiska koordinovaného vývinu počas metamorfózy, by preto mali zahŕňať morfogenézu zadných končatín, morfogenézu predných končatín, vznik predných končatín, štádium resorpcie chvosta (najmä resorpcie chvostovej plutvy) a morfológiu hlavy (napr. veľkosť žiabier a štádium resorpcie žiabier, morfológiu dolnej čeľuste, vyčnievanie Meckelovej chrupky).
|
|
58.
|
V závislosti od spôsobu účinku chemikálie sa môžu objaviť rôzne výrazné morfologické fenotypy. Niektoré klasické fenotypy zahŕňajú oneskorenie alebo neprítomnosť vzniku predných končatín napriek normálnemu alebo urýchlenému vývinu zadných končatín a tkanív chvosta a predčasnú resorpciu žiabier vzhľadom na remodeláciu zadných končatín a chvosta.
|
Histopatológia
|
59.
|
Ak chemikália nespôsobuje zjavnú toxicitu a neurýchľuje vývin ani nespôsobuje asynchrónny vývin, vyhodnotí sa histopatológia štítnej žľazy podľa príslušného usmerňovacieho dokumentu (9). Oneskorenie vývinu je v neprítomnosti toxicity významným ukazovateľom pôsobenia proti štítnej žľaze, ale analýza vývinového štádia je menej citlivá a menej diagnostická ako histopatologická analýza štítnej žľazy. Preto sa v tomto prípade vyžaduje vykonanie histopatologických analýz štítnych žliaz. Vplyv na histológiu štítnej žľazy sa preukázal aj v neprítomnosti vplyvu na vývin. Ak sa zistia zmeny v histopatológii štítnej žľazy, chemikália sa považuje za pôsobiacu na štítnu žľazu. Ak sa nepozorujú žiadne oneskorenia vývinu ani histologické lézie štítnych žliaz, chemikália sa považuje za nepôsobiacu na štítnu žľazu. Odôvodnenie tohto rozhodnutia spočíva v tom, že štítna žľaza je pod vplyvom TSH a každá chemikália, ktorá zmení hladinu hormónu štítnej žľazy v krvnom obehu dostatočne na to, aby zmenila sekréciu TSH, bude mať za následok histopatologické zmeny v štítnej žľaze. Hladinu hormónu štítnej žľazy v krvnom obehu môžu zmeniť rôzne spôsoby a mechanizmy účinku. To znamená, že hoci hladina hormónu štítnej žľazy svedčí o vplyve na štítnu žľazu, nestačí to na určenie, ktorý spôsob alebo mechanizmus účinku je príčinou odozvy.
|
|
60.
|
Keďže tento sledovaný parameter nemožno určiť s použitím základných štatistických prístupov, stanovenie vplyvu spojeného s expozíciou chemikálii vykoná patológ odborným posudkom.
|
Oneskorený vývin (stanovený podľa vývinovej fázy, HLL, BW, SVL)
|
61.
|
Oneskorený vývin môže byť spôsobený mechanizmami pôsobenia proti štítnej žľaze a prostredníctvom nepriamej toxicity. Mierne oneskorenia vývinu spojené so zjavnými známkami toxicity pravdepodobne nasvedčujú nešpecifickému toxickému účinku. Hodnotenie netyreoideálnej toxicity je základným prvkom testu v záujme zníženia pravdepodobnosti falošných pozitívnych výsledkov. Nadmerná úmrtnosť je evidentnou známkou výskytu iných toxických mechanizmov. Podobne aj mierne spomalenie rastu stanovené na základe mokrej hmotnosti a/alebo SVL nasvedčuje netyreoideálnej toxicite. Zjavné zrýchlenie rastu sa bežne pozoruje v prípade chemikálií, ktoré negatívne ovplyvňujú normálny vývin. Prítomnosť väčších živočíchov preto nevyhnutne neznamená netyreoideálnú toxicitu. Pri stanovení tyreoideálnej toxicity sa však nikdy nemožno spoliehať len na rast. Rast v spojení s vývinovým štádiom a histopatológiou štítnej žľazy by sa mal použiť skôr na stanovenie pôsobenia na štítnu žľazu. Pri stanovovaní zjavnej toxicity by sa mali zvážiť aj ďalšie sledované parametre vrátane edému, krvavých lézií, letargie, zníženej spotreby potravy, nesprávneho/zmeneného plávania atď. Ak sa pri všetkých testovaných koncentráciách vyskytnú známky zjavnej toxicity, testovaná chemikália by sa mala znova vyhodnotiť pri nižších testovaných koncentráciách predtým, než sa určí, či chemikália potenciálne pôsobí alebo nepôsobí na štítnu žľazu.
|
|
62.
|
Štatisticky významné oneskorenia vývinu v neprítomnosti iných známok zjavnej toxicity nasvedčujú tomu, že chemikália pôsobí na štítnu žľazu (antagonisticky). V neprítomnosti významných štatistických odoziev môžu tento výsledok podporiť výsledky histopatologického vyšetrenia štítnej žľazy.
|
Štatistické analýzy
|
63.
|
Štatistické analýzy údajov by podľa možnosti mali vychádzať z postupov uvedených v dokumente Súčasné prístupy k štatistickej analýze údajov o ekotoxicite: návod na používanie (11). Na všetky spojité kvantitatívne sledované parametre (HLL, SVL, mokrá hmotnosť) zodpovedajúce monotónnemu priebehu krivky závislosti dávka-odpoveď sa má použiť Jonckheereho-Terpstrov test aplikovaný zostupne na stanovenie významného účinku chemikálie.
|
|
64.
|
V prípade spojitých sledovaných parametrov, ktoré nezodpovedajú monotónnemu priebehu krivky závislosti dávka-odpoveď, sa má vyhodnotiť normalita údajov (podľa možnosti pomocou Shapirovho-Wilkovho testu alebo Andersonovho-Darlingovho testu) a homogenita rozptylu (podľa možnosti pomocou Leveneho testu). Obidva testy sa vykonávajú na rezíduách z analýzy ANOVA. Namiesto týchto formálnych testov normality a homogenity rozptylu možno použiť odborný posudok, ale uprednostňujú sa formálne testy. Ak sa zistí nenormalita alebo heterogenita rozptylu, je potrebné vykonať normalizačnú transformáciu na stabilizáciu rozptylu. Ak majú údaje (možno po transformácii) normálnu distribúciu s homogénnym rozptylom, významný vplyv chemikálie sa stanoví pomocou Dunnettovho testu. Ak majú údaje (možno po transformácii) normálnu distribúciu s heterogénnym rozptylom, významný vplyv chemikálie sa stanoví pomocou Tamhaneho-Dunnettovho alebo T3 testu alebo pomocou Mann-Whitneyho-Wilcoxonovho U testu. Ak nie je možné použiť žiadnu normalizačnú transformáciu, významný vplyv chemikálie sa stanoví pomocou Mann-Whitneyho-Wilcoxonovho U testu s použitím Bonferroniho-Holmovej úpravy hodnôt p. Dunnettov test sa uplatňuje nezávisle od akéhokoľvek F-testu analýzy ANOVA a Mann-Whitneyho test sa uplatňuje nezávisle od celkového Kruskallovho-Wallisovho testu.
|
|
65.
|
Významná úmrtnosť sa neočakáva, ale treba ju vyhodnotiť pomocou zostupného Cochranovho-Armitageovho testu ak údaje zodpovedajú monotónnosti odozva na dávku a v ostatných prípadoch pomocou Fisherovho exaktného testu s Bonferroniho-Holmovou úpravou.
|
|
66.
|
Významný vplyv chemikálie na vývinové štádium sa stanovuje pomocou zostupnej aplikácie Jonckheereho-Terpstrovho testu na mediány replikátov. Na stanovenie vplyvu sa odporúča použiť aj multikvantový Jonckheereho test od 20. do 80. percentilu, lebo zohľadňuje zmeny v distribučnom profile.
|
|
67.
|
Vhodnou jednotkou analýzy je replikát, aby údaje predstavovali mediány pre replikáty ak sa používa Jonckheereho-Terpstrov alebo Mann-Whitneyho U test alebo priemery pre replikáty ak sa používa Dunnettov test. Monotónnosť odozvy na dávku možno posúdiť vizuálne na základe priemerov alebo mediánov pre replikáty alebo koncentrácie chemikálie alebo pomocou už opísaných formálnych testov (11).V prípade menej ako piatich replikátov na koncentráciu chemikálie alebo kontrolnú skupinu by sa podľa možnosti mali použiť verzie s presnou permutáciou Jonckheereho-Terpstrovho testu a Mann-Whitneyho testu. Štatistická významnosť všetkých uvedených testov sa posudzuje na hladine významnosti 0,05.
|
|
68.
|
Obrázok 4 predstavuje vývojový diagram vykonávania štatistických testov na spojitých údajoch.
Obrázok 4
Vývojový diagram štatistických prístupov v prípade údajov o spojitej odozve
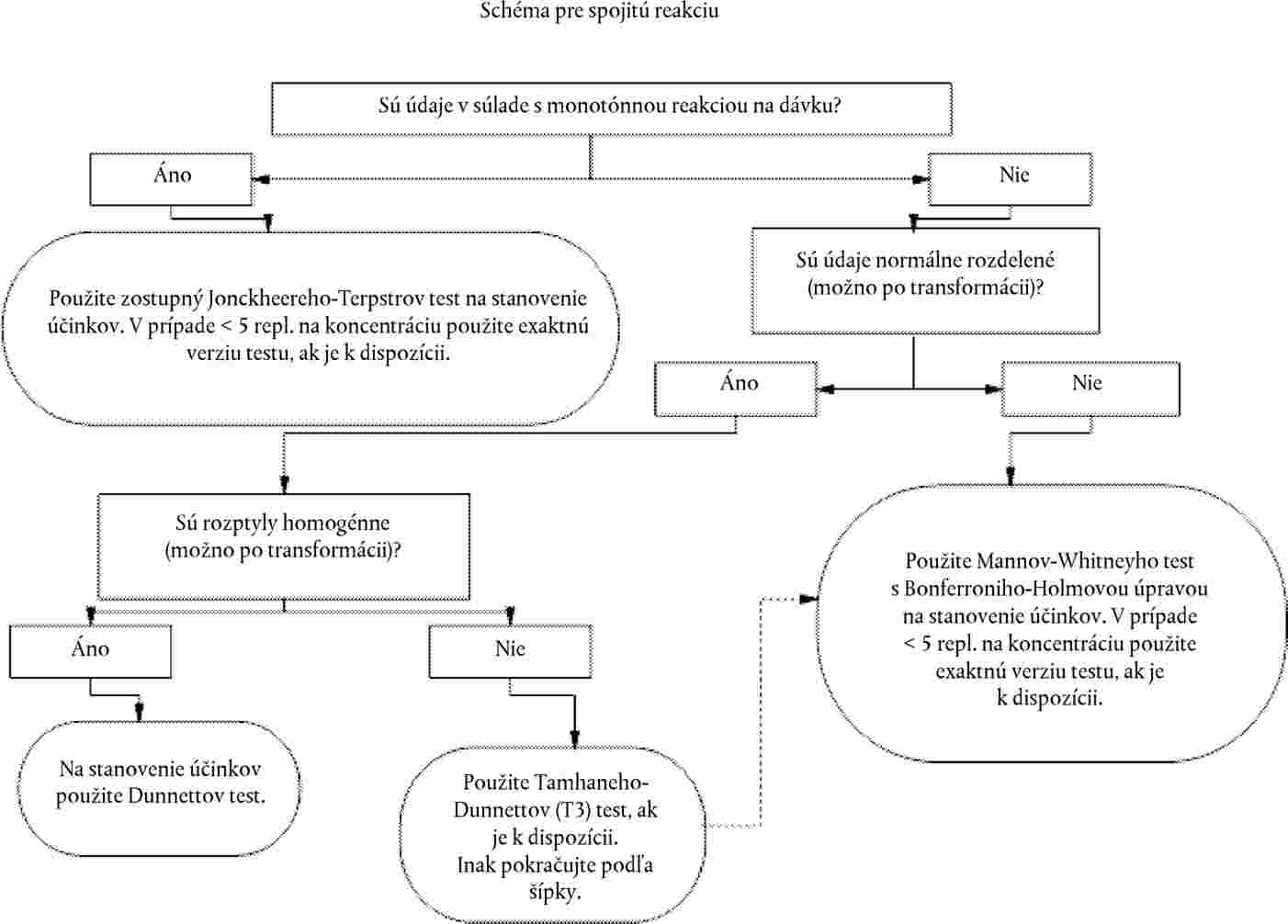
|
Osobitné aspekty analýzy údajov
Používanie úrovní narušenia skupiny s určitou koncentráciou chemikálie
|
69.
|
Pri rozhodovaní, či replikát alebo celá skupina s určitou koncentráciou chemikálie vykazuje zjavnú toxicitu a mala by sa vylúčiť z analýzy, sa zohľadňuje viacero faktorov. Zjavná toxicita je vymedzená > 2 úhynmi v ktoromkoľvek z replikátov, ktoré možno vysvetliť iba toxicitou a nie technickou chybou. Iné známky zjavnej toxicity zahŕňajú krvácanie abnormálne správanie abnormálne vzory plávania anorexiu a akékoľvek iné klinické známky choroby. V prípade subletálnych známok toxicity môžu byť potrebné kvalitatívne hodnotenia, ktoré by sa vždy mali vykonať porovnaním s kontrolnou skupinou s čistou vodou.
|
Kontrolné skupiny s rozpúšťadlom
|
70.
|
O použití rozpúšťadla by sa malo uvažovať až ako o poslednej možnosti ak sa zvážili všetky ostatné možnosti aplikovania chemikálie. Ak sa použije rozpúšťadlo, mala by sa zároveň vykonať analýza kontrolnej skupiny s čistou vodou. Po skončení testu by sa malo vykonať hodnotenie potenciálneho vplyvu rozpúšťadla. To sa dosiahne štatistickým porovnaním kontrolnej skupiny s rozpúšťadlom a kontrolnej skupiny s čistou vodou. Najdôležitejšie sledované parametre, ktoré treba zohľadniť v tejto analýze, sú vývinové štádium, SVL a mokrá hmotnosť, lebo môžu byť ovplyvnené netyreoideálnou toxicitou. Ak sa zistia štatisticky významné rozdiely v týchto sledovaných parametroch medzi kontrolnou skupinou s čistou vodou a kontrolnou skupinou s rozpúšťadlom, stanovte sledované parametre štúdie pre merania odozvy s použitím kontrolnej skupiny s čistou vodou. Ak sa nezistí štatisticky významný rozdiel medzi kontrolnou skupinou s čistou vodou a kontrolnou skupinou s rozpúšťadlom v žiadnej z nameraných závisle premenných, stanovte sledované parametre štúdie pre merania odozvy s použitím spojenej kontrolnej skupiny s riediacou vodou a rozpúšťadlom.
|
Skupiny s aplikovanou chemikáliou, ktoré dosiahli vývinové štádium 60 a vyššie
|
71.
|
Po štádiu 60 sa pri žubrienkach prejaví zníženie veľkosti a hmotnosti v dôsledku resorpcie tkaniva a zníženia celkového obsahu vody. Merania mokrej hmotnosti a SVL preto nemožno primerane použiť na štatistické analýzy na zistenie rozdielov v rýchlostiach rastu. Údaje o mokrej hmotnosti a dĺžke organizmov v štádiu > NF60 by sa preto mali cenzurovať a nemožno ich použiť na analýzy priemerov alebo mediánov pre replikáty. Na analýzu týchto parametrov rastu možno použiť dva rozdielne prístupy.
|
|
72.
|
Jedným prístupom je použiť na štatistické analýzy mokrej hmotnosti a/alebo SVL len žubrienky s vývinovým štádiom 60 alebo nižším. Predpokladá sa, že tento prístup poskytuje dostatočne spoľahlivé informácie o závažnosti možných vplyvov na rast, pokiaľ sa z analýz odstráni iba malá časť testovacích živočíchov (≤ 20 %). Ak sa vývin po štádiu 60 zistí pri zvýšenom počte žubrienok (≥ 20 %) v prípade jednej alebo viacerých nominálnych koncentrácií, mala by sa na všetkých žubrienkach vykonať dvojfaktorová ANOVA s hierarchickou štruktúrou rozptylu na vyhodnotenie vplyvu na rast v dôsledku aplikovania chemikálie so zohľadnením vplyvu vývinu po neskoré štádium na rast. Dodatok 3 obsahuje usmernenie o dvojfaktorovej analýze ANOVA hmotnosti a dĺžky.
|
LITERATÚRA
|
1.
|
OECD (2004) Report of the Validation of the Amphibian Metamorphosis Assay for the detection of thyroid active substances: Phase 1 – Optimisation of the Test Protocol. Environmental Health and Safety Publications. Series on Testing and Assessment. No. 77, Paríž.
|
|
2.
|
OECD (2007) Final Report of the Validation of the Amphibian Metamorphosis Assay: Phase 2 – Multi-chemical Interlaboratory Study. Environmental Health and Safety Publications. Series on Testing and Assessment. No. 76. Paríž.
|
|
3.
|
OECD (2008) Report of the Validation Peer Review for the Amphibian Metamorphosis Assay and Agreement of the Working Group of the National Coordinators of the Test Guidelines Programme on the Follow-up of this Report. Environmental Health and Safety Publications. Series on Testing and Assessment. No. 92. Paríž.
|
|
4.
|
OECD (2000) Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. Environmental Health and Safety Publications. Series on Testing and Assessment. No. 23. Paríž.
|
|
5.
|
ASTM (2002) Standard Guide for Conducting Acute Toxicity Tests on Test Materials with Fishes, Macroinvertebrates and Amphibians. American Society for Testing and Materials aSTM E729-96(2002), Philadelpia, PA.
|
|
6.
|
ASTM (2004) Standard Guide for Conducting the Frog Embryo Teratogenesis Assay – Xenopus (FETAX). E 1439-98.
|
|
7.
|
Kahl,M.D., Russom,C.L., DeFoe,D.L. a Hammermeister,D.E. (1999) Saturation units for use in aquatic bioassays. Chemosphere 39, s. 539 – 551.
|
|
8.
|
Nieuwkoop,P.D. a Faber,J. (1994) Normal Table of Xenopus laevis. Garland Publishing, New York.
|
|
9.
|
OECD (2007) Guidance Document on Amphibian Thyroid Histology. Environmental Health and Safety Publications. Series on Testing and Assessment. No. 82. Paríž.
|
|
10.
|
Dodd,M.H.I. a Dodd,J.M. (1976) Physiology of Amphibia. Lofts,B. (ed.) academic Press, New York, s. 467 – 599.
|
|
11.
|
OECD (2006) Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. Environmental Health and Safety Publications. Series on Testing and Assessment, No. 54. Paríž.
|
|
12.
|
Hutchinson TH, Shillabeer N, Winter MJ, Pickford DB, 2006. Acute and chronic effects of carrier solvents in aquatic organisms: A critical review. Review. Aquatic Toxicology, 76; s. 69 – 92.
|
Dodatok 1
Tabuľka 1
Podmienky pokusu pre 21-dňovú skúšku metamorfózy obojživelníkov
|
Testovací živočích
|
Larvy Xenopus laevis
|
|
Počiatočné larválne štádium
|
Štádium 51 podľa Nieuwkoopa a Fabera
|
|
Obdobie expozície
|
21 dní
|
|
Kritériá výberu lariev
|
Vývinové štádium a celková dĺžka (voliteľné)
|
|
Testované koncentrácie
|
Minimálne tri koncentrácie s rozsahom približne jednej rádovej hodnoty
|
|
Režim expozície
|
Prietokový (prednostne) a/alebo statický obnovovací
|
|
Prietok testovacieho systému
|
25 ml/min. (výmena celého objemu približne každých 2,7 hod.)
|
|
Základné sledované parametre/dni stanovenia
|
Úmrtnosť
|
Denne
|
|
Vývinové štádium
|
7. a 21. deň
|
|
Dĺžka zadných končatín
|
7. a 21. deň
|
|
Dĺžka od pysku po kloaku
|
7. a 21. deň
|
|
Mokrá telesná hmotnosť
|
7. a 21. deň
|
|
Histológia štítnej žľazy
|
21. deň
|
|
Riediaca voda/laboratórna kontrola
|
Odchlórovaná voda z vodovodu (filtrovaná pomocou drevného uhlia) alebo rovnocenný laboratórny zdroj
|
|
Hustota lariev
|
20 lariev/testovaciu nádobu (5/l)
|
|
Testovací roztok/testovacia nádoba
|
4 – 10 l (minimálna hĺbka vody 10 – 15 cm)/testovacia nádoba zo skla alebo nehrdzavejúcej ocele (napr. 22,5 cm × 14 cm × 16,5 cm)
|
|
Opakovanie
|
4 testovacie nádoby s replikátmi/testovanú koncentráciu a kontrolnú skupinu
|
|
Prípustná úmrtnosť v kontrolných skupinách
|
≤ 10 % na testovaciu nádobu s replikátom
|
|
Fixácia štítnej žľazy
|
Počet fixovaných jedincov
|
Všetky žubrienky (5/replikát sa vyhodnotí na začiatku)
|
|
Oblasť
|
Hlava alebo celé telo
|
|
Fixačná kvapalina
|
Davidsonov fixačný prostriedok
|
|
Kŕmenie
|
Potrava
|
Sera Micron® alebo rovnocenná
|
|
Množstvo/frekvencia
|
Kŕmny režim pre potravu Sera Micron® sa nachádzajú v tabuľke 1.
|
|
Osvetlenie
|
Fotoperióda
|
12 hod. svetlo: 12 hod. tma
|
|
Intenzita
|
600 – 2 000 luxov (merané na povrchu vody)
|
|
Teplota vody
|
22° ± 1 °C
|
|
pH
|
6,5 – 8,5
|
|
Koncentrácia rozpusteného kyslíka
|
> 3,5 mg/l (> 40 % rozpustnosť vzdušného kyslíka)
|
|
Harmonogram odoberania vzoriek na chemickú analýzu
|
Raz za týždeň (4 odobratia vzorky/test)
|
Dodatok 2
Oznamovacie tabuľky pre nespracované údaje a súhrnné údaje
Tabuľka 1
Všeobecné informácie o testovanej chemikálii
|
Informácie o chemikálii
|
|
|
Uveďte testovanú chemikáliu, jednotky koncentrácie a testované koncentrácie
|
|
|
Testovaná chemikália:
|
|
|
|
|
Jednotky koncentrácie:
|
|
|
|
|
Testovaná koncentrácia 1
|
|
|
|
|
Testovaná koncentrácia 2
|
|
|
|
|
Testovaná koncentrácia 3
|
|
|
|
|
Testovaná koncentrácia 4
|
|
|
|
|
|
|
|
|
|
Dátum (0. deň):
|
|
Uveďte dátum (mm/dd/rr)
|
|
|
Dátum (7. deň):
|
|
Uveďte dátum (mm/dd/rr)
|
|
|
Dátum (21. deň):
|
|
Uveďte dátum (mm/dd/rr)
|
Tabuľka 2
Hárky na zaznamenanie nespracovaných údajov v 7. a 21. deň
|
DEŇ X
DÁTUM 00/00/00
|
|
|
Koncentrácia
|
Číslo koncentrácie
|
Číslo replikátu
|
Číslo jedinca
|
Identifikátor jedinca
|
Vývinové štádium
|
Dĺžka SVL (mm)
|
Dĺžka zadných končatín (mm)
|
Mokrá hmotnosť celého organizmu (mg)
|
|
RIADOK
|
TRT
|
TRT#
|
REP
|
IND
|
ID#
|
ŠTÁDIUM
|
BL
|
HLL
|
HMOTNOSŤ
|
|
1
|
0,00
|
1
|
|
|
|
|
|
|
|
|
2
|
0,00
|
1
|
|
|
|
|
|
|
|
|
3
|
0,00
|
1
|
|
|
|
|
|
|
|
|
4
|
0,00
|
1
|
|
|
|
|
|
|
|
|
5
|
0,00
|
1
|
|
|
|
|
|
|
|
|
6
|
0,00
|
1
|
|
|
|
|
|
|
|
|
7
|
0,00
|
1
|
|
|
|
|
|
|
|
|
8
|
0,00
|
1
|
|
|
|
|
|
|
|
|
9
|
0,00
|
1
|
|
|
|
|
|
|
|
|
10
|
0,00
|
1
|
|
|
|
|
|
|
|
|
11
|
0,00
|
1
|
|
|
|
|
|
|
|
|
12
|
0,00
|
1
|
|
|
|
|
|
|
|
|
13
|
0,00
|
1
|
|
|
|
|
|
|
|
|
14
|
0,00
|
1
|
|
|
|
|
|
|
|
|
15
|
0,00
|
1
|
|
|
|
|
|
|
|
|
16
|
0,00
|
1
|
|
|
|
|
|
|
|
|
17
|
0,00
|
1
|
|
|
|
|
|
|
|
|
18
|
0,00
|
1
|
|
|
|
|
|
|
|
|
19
|
0,00
|
1
|
|
|
|
|
|
|
|
|
20
|
0,00
|
1
|
|
|
|
|
|
|
|
|
21
|
0,00
|
2
|
|
|
|
|
|
|
|
|
22
|
0,00
|
2
|
|
|
|
|
|
|
|
|
23
|
0,00
|
2
|
|
|
|
|
|
|
|
|
24
|
0,00
|
2
|
|
|
|
|
|
|
|
|
25
|
0,00
|
2
|
|
|
|
|
|
|
|
|
26
|
0,00
|
2
|
|
|
|
|
|
|
|
|
27
|
0,00
|
2
|
|
|
|
|
|
|
|
|
28
|
0,00
|
2
|
|
|
|
|
|
|
|
|
29
|
0,00
|
2
|
|
|
|
|
|
|
|
|
30
|
0,00
|
2
|
|
|
|
|
|
|
|
|
31
|
0,00
|
2
|
|
|
|
|
|
|
|
|
32
|
0,00
|
2
|
|
|
|
|
|
|
|
|
33
|
0,00
|
2
|
|
|
|
|
|
|
|
|
34
|
0,00
|
2
|
|
|
|
|
|
|
|
|
35
|
0,00
|
2
|
|
|
|
|
|
|
|
|
36
|
0,00
|
2
|
|
|
|
|
|
|
|
|
37
|
0,00
|
2
|
|
|
|
|
|
|
|
|
38
|
0,00
|
2
|
|
|
|
|
|
|
|
|
39
|
0,00
|
2
|
|
|
|
|
|
|
|
|
40
|
0,00
|
2
|
|
|
|
|
|
|
|
|
41
|
0,00
|
3
|
|
|
|
|
|
|
|
|
42
|
0,00
|
3
|
|
|
|
|
|
|
|
|
43
|
0,00
|
3
|
|
|
|
|
|
|
|
|
44
|
0,00
|
3
|
|
|
|
|
|
|
|
|
45
|
0,00
|
3
|
|
|
|
|
|
|
|
|
46
|
0,00
|
3
|
|
|
|
|
|
|
|
|
47
|
0,00
|
3
|
|
|
|
|
|
|
|
|
48
|
0,00
|
3
|
|
|
|
|
|
|
|
|
49
|
0,00
|
3
|
|
|
|
|
|
|
|
|
50
|
0,00
|
3
|
|
|
|
|
|
|
|
|
51
|
0,00
|
3
|
|
|
|
|
|
|
|
|
52
|
0,00
|
3
|
|
|
|
|
|
|
|
|
53
|
0,00
|
3
|
|
|
|
|
|
|
|
|
54
|
0,00
|
3
|
|
|
|
|
|
|
|
|
55
|
0,00
|
3
|
|
|
|
|
|
|
|
|
56
|
0,00
|
3
|
|
|
|
|
|
|
|
|
57
|
0,00
|
3
|
|
|
|
|
|
|
|
|
58
|
0,00
|
3
|
|
|
|
|
|
|
|
|
59
|
0,00
|
3
|
|
|
|
|
|
|
|
|
60
|
0,00
|
3
|
|
|
|
|
|
|
|
|
61
|
0,00
|
4
|
|
|
|
|
|
|
|
|
62
|
0,00
|
4
|
|
|
|
|
|
|
|
|
63
|
0,00
|
4
|
|
|
|
|
|
|
|
|
64
|
0,00
|
4
|
|
|
|
|
|
|
|
|
65
|
0,00
|
4
|
|
|
|
|
|
|
|
|
66
|
0,00
|
4
|
|
|
|
|
|
|
|
|
67
|
0,00
|
4
|
|
|
|
|
|
|
|
|
68
|
0,00
|
4
|
|
|
|
|
|
|
|
|
69
|
0,00
|
4
|
|
|
|
|
|
|
|
|
70
|
0,00
|
4
|
|
|
|
|
|
|
|
|
71
|
0,00
|
4
|
|
|
|
|
|
|
|
|
72
|
0,00
|
4
|
|
|
|
|
|
|
|
|
73
|
0,00
|
4
|
|
|
|
|
|
|
|
|
74
|
0,00
|
4
|
|
|
|
|
|
|
|
|
75
|
0,00
|
4
|
|
|
|
|
|
|
|
|
76
|
0,00
|
4
|
|
|
|
|
|
|
|
|
77
|
0,00
|
4
|
|
|
|
|
|
|
|
|
78
|
0,00
|
4
|
|
|
|
|
|
|
|
|
79
|
0,00
|
4
|
|
|
|
|
|
|
|
|
80
|
0,00
|
4
|
|
|
|
|
|
|
|
Tabuľka 3
Vypočítané zhrnutia údajov o sledovaných parametroch zo 7. a 21. dňa
|
|
|
Vývinové štádium
|
SVL (mm)
|
Dĺžka zadných končatín (mm)
|
Hmotnosť (mg)
|
|
TRT
|
REP
|
MIN.
|
MEDIÁN
|
MAX.
|
PRIEMER
|
ŠTD. ODCH.
|
PRIEMER
|
ŠTD. ODCH.
|
PRIEMER
|
ŠTD. ODCH.
|
|
1
|
1
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
1
|
2
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
1
|
3
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
1
|
4
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
2
|
1
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
2
|
2
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
2
|
3
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
2
|
4
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
3
|
1
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
3
|
2
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
3
|
3
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
3
|
4
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
4
|
1
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
4
|
2
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
4
|
3
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
4
|
4
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
Poznámka: Výpočty hodnôt v bunkách sú prepojené s údajmi v tabuľke 2.
|
Tabuľka 4
Údaje o dennej úmrtnosti
|
Deň testu
|
Dátum
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
|
0
|
00/00/00
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
11
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
12
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
13
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
14
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
15
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
16
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
17
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
18
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
19
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
20
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
21
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Počet replikátov
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
|
Počet aplikovaní chemikálie
|
0
|
|
|
|
0
|
|
|
|
0
|
|
|
|
0
|
|
|
|
|
Poznámka: Výpočty hodnôt v bunkách sú prepojené s údajmi v tabuľke 1.
|
Tabuľka 5
Kritériá kvality vody
Expozičný systém (prietokový/statický obnovovací):
Teplota:
Intenzita svetla:
Cyklus svetla a tmy:
Potrava:
Dávka krmiva:
pH vody:
Koncentrácia jódu v testovacej vode:
Tabuľka 6
Súhrnné chemické údaje
|
Názov chemikálie:
|
|
Č. CAS:
|
|
Deň testu
|
Dátum
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
|
0
|
00/00/00
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
11
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
12
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
13
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
14
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
15
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
16
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
17
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
18
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
19
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
20
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
21
|
#Value!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Poznámka: Výpočty hodnôt v bunkách sú prepojené s údajmi v tabuľke 1.
|
Tabuľka 7
Histopatologické oznamovacie tabuľky pre hlavné kritériá
|
Dátum:
|
Chemikália:
|
|
|
Patológ:
|
|
|
Hypertrofia štítnej žľazy
|
Atrofia štítnej žľazy
|
Hypertrofia folikulárnych buniek
|
Hyperplázia folikulárnych buniek
|
|
Hypertrofia štítnej žľazy
|
Atrofia štítnej žľazy
|
Hypertrofia folikulárnych buniek
|
Hyperplázia folikulárnych buniek
|
|
ID kontrolného živočícha – replikát 1
|
|
|
|
|
|
ID živočícha dostávajúceho dávku – replikát 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ID kontrolného živočícha – replikát 2
|
|
|
|
|
|
ID živočícha dostávajúceho dávku – replikát 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Spolu:
|
|
|
|
|
Spolu:
|
|
|
|
|
|
|
Hypertrofia štítnej žľazy
|
Atrofia štítnej žľazy
|
Hypertrofia folikulárnych buniek
|
Hyperplázia folikulárnych buniek
|
|
|
Hypertrofia štítnej žľazy
|
Atrofia štítnej žľazy
|
Hypertrofia folikulárnych buniek
|
Hyperplázia folikulárnych buniek
|
|
ID živočícha dostávajúceho dávku – replikát 1
|
|
|
|
|
|
ID živočícha dostávajúceho dávku – replikát 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ID živočícha dostávajúceho dávku – replikát 2
|
|
|
|
|
|
ID živočícha dostávajúceho dávku – replikát 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Spolu:
|
|
|
|
|
Spolu:
|
|
|
|
|
Tabuľka 8
Ďalšie histopatologické kritériá
|
Dátum:
|
Chemikália:
|
|
|
Patológ:
|
|
|
|
|
|
|
|
|
Zväčšenie plochy folikulárnej dutiny
|
Zmenšenie plochy folikulárnej dutiny
|
Zväčšenie plochy folikulárnej dutiny
|
Zmenšenie plochy folikulárnej dutiny
|
|
ID kontrolného živočícha – replikát 1
|
|
|
|
ID živočícha dostávajúceho dávku – replikát 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ID kontrolného živočícha – replikát 2
|
|
|
|
ID živočícha dostávajúceho dávku – replikát 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Spolu:
|
|
|
Spolu:
|
|
|
|
|
Zväčšenie plochy folikulárnej dutiny
|
Zmenšenie plochy folikulárnej dutiny
|
|
|
Zväčšenie plochy folikulárnej dutiny
|
Zmenšenie plochy folikulárnej dutiny
|
|
ID živočícha dostávajúceho dávku – replikát 1
|
|
|
|
ID živočícha dostávajúceho dávku – replikát 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ID živočícha dostávajúceho dávku – replikát 2
|
|
|
|
ID živočícha dostávajúceho dávku – replikát 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Spolu:
|
|
|
Spolu:
|
|
|
Tabuľka 9
Slovné opisy histopatologických nálezov
|
Dátum:
|
|
Chemikália:
|
|
Patológ:
|
|
|
Slovný opis
|
|
ID kontrolného živočícha – replikát 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ID kontrolného živočícha – replikát 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ID živočícha dostávajúceho dávku – replikát 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ID živočícha dostávajúceho dávku – replikát 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ID živočícha dostávajúceho dávku – replikát 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ID živočícha dostávajúceho dávku – replikát 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ID živočícha dostávajúceho dávku – replikát 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ID živočícha dostávajúceho dávku – replikát 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Tabuľka 10
Vzor súhrnnej oznamovacej tabuľky pre deň × (7. alebo 21.) skúšky AMA
|
|
|
Kontrola
|
Dávka 1
|
Dávka 2
|
Dávka 3
|
|
Sledovaný parameter
|
Replikát
|
Priemer
|
SD
|
CV
|
N
|
Priemer
|
SD
|
CV
|
N
|
Hodnota p
|
Priemer
|
SD
|
CV
|
N
|
Hodnota p
|
Priemer
|
SD
|
CV
|
N
|
Hodnota p
|
|
Dĺžka zadných končatín
(mm)
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Priemer:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
SVL
(mm)
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Priemer:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Mokrá hmotnosť
(mg)
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Priemer:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Tabuľka 11
Vzor súhrnnej oznamovacej tabuľky pre údaje o vývinovom štádiu v deň × (7. alebo 21.) skúšky AMA
|
|
|
Kontrola
|
Dávka 1
|
Dávka 2
|
Dávka 3
|
|
|
Replikát
|
Medián
|
Min.
|
Max.
|
N
|
Medián
|
Min.
|
Max.
|
N
|
Hodnota p
|
Medián
|
Min.
|
Max.
|
N
|
Hodnota p
|
Medián
|
Min.
|
Max.
|
Medián
|
Hodnota p
|
|
Vývinové štádium
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Priemer:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Dodatok 3
Alternatívna analýza hmotnosti a dĺžky v prípade vývinu po neskoré štádium u viac ako 20 % žubrienok pri jednej alebo viacerých koncentráciách
Ak sa vývin po štádiu 60 zistí pri zvýšenom počte žubrienok (≥ 20 %) v prípade jednej alebo viacerých nominálnych koncentrácií, mala by sa na všetkých žubrienkach vykonať dvojfaktorová ANOVA s hierarchickou štruktúrou rozptylu na vyhodnotenie vplyvu na rast v dôsledku aplikovania chemikálie so zohľadnením vplyvu vývinu po neskoré štádium na rast.
Navrhuje sa použiť všetky údaje, ale zohľadniť vplyv vývinu po neskoré štádium. Možno to urobiť pomocou dvojfaktorovej analýzy ANOVA s hierarchickou štruktúrou rozptylu. Definujte parameter LateStage = ‚Yes‘ pre živočícha vo vývinovom štádiu 61 alebo neskoršom. Inak definujte parameter LateStage = ‚No‘. Potom možno vykonať dvojfaktorovú analýzu ANOVA s koncentráciou a premennou LateStage a ich interakciou, pričom Rep(Conc) sa použije ako náhodný faktor a Tadpole(Rep) ako ďalší náhodný vplyv. Parameter rep sa tak stále bude považovať za jednotku analýzy, pričom výsledky budú v zásade rovnaké ako v prípade analýzy priemerov rep*latestage vážených podľa počtu živočíchov na priemer. Ak údaje porušujú požiadavky analýzy ANOVA na normalitu alebo homogenitu rozptylu, na odstránenie tejto prekážky možno použiť normalizovanú transformáciu na poradia.
Okrem štandardných F-testov analýzy ANOVA na vyhodnotenie vplyvu premenných Conc, LateStage a ich vzájomných interakcií možno interakčný F-test ‚rozrezať‘ na dva ďalšie F-testy analýzy ANOVA: jeden pre priemerné reakcie naprieč koncentráciami pre LateStage = ‚No‘ a druhý pre priemerné reakcie naprieč koncentráciami pre LateStage = ‚Yes‘. Ďalšie porovnania priemerov pre jednotlivé aplikované koncentrácie chemikálie s kontrolnými skupinami sa vykonajú pre každú úroveň premennej LateStage. Možno vykonať trendovú analýzu pomocou vhodných kontrastov alebo jednoduché párové porovnania ak existuje dôkaz o nemonotónnom priebehu krivky závislosti dávka-odpoveď na určitej úrovni premennej LateStage. Bonferroniho-Holmova úprava hodnôt p sa robí iba vtedy, keď zodpovedajúci F-rez nie je významný. Možno to urobiť v SAS a pravdepodobne aj v iných štatistických softvérových balíkoch. Komplikácie môžu nastať v prípade, že pri niektorých koncentráciách nie sú žiadne živočíchy v neskoršom štádiu, ale tieto situácie možno vyriešiť jednoduchým spôsobom.
Dodatok 4
Vymedzenie pojmov
Chemikália:
: látka alebo zmes.
Testovaná chemikália:
: akákoľvek látka alebo zmes, ktorá sa testuje pomocou tejto testovacej metódy.
C.39. TEST ROZMNOŽOVANIA CHVOSTOSKOKOV V PÔDE
ÚVOD
|
1.
|
Táto testovacia metóda je rovnocenná s usmernením OECD na vykonávanie testov (TG) 232 (2009). Táto testovacia metóda je určená na posúdenie účinkov chemikálií na výstup reprodukcie chvostoskokov v pôde. Je založená na jestvujúcich postupoch (1) (2). Partenogenetický druh Folsomia candida a pohlavne sa rozmnožujúci druh Folsomia fimetaria sú dva z najprístupnejších druhov chvostoskokov (Collembola), možno ich kultivovať a sú komerčne dostupné. Ak je nutné posudzovať osobitné biotopy, na ktorých tieto dva druhy nežijú, postup je možné rozšíriť aj na iné druhy chvostoskokov ak spĺňajú kritériá validity testu.
|
|
2.
|
Pôdne chvostoskoky sú ekologicky významné druhy z hľadiska ekotoxikologického testovania. Chvostoskoky sú šesťnožce s tenkým exoskeletom vysokopriepustným pre vzduch a vodu a predstavujú druhy článkonožcov s odlišným spôsobom a mierou expozície v porovnaní s dážďovkami a druhmi čeľade Enchytraeidae.
|
|
3.
|
Hustota populácií chvostoskokov v pôde a vrstvách opadaných listov v mnohých suchozemských ekosystémoch zvyčajne dosahuje 105 m– 2 (3) (4). Dospelé jedince zvyčajne merajú 0,5 – 5 mm, pričom ich podiel na celkovej živočíšnej biomase a respirácii v pôde je nízky – odhaduje sa na 1 – 5 % (5). Ich najvýznamnejšou úlohou teda môže byť potenciálna regulácia procesov prostredníctvom predácie mikroorganizmov a mikrofauny. Chvostoskoky sú korisťou širokej škály endogeických a epigeických bezstavovcov ako sú roztoče, stonožky, pavúky, druhy čeľade Carabidae a drobčíky. Chvostoskoky sa podieľajú na procesoch rozkladu v kyslých pôdach, kde môžu byť najdôležitejšími pôdnymi bezstavovcami okrem čeľade Enchytraeidae, keďže dážďovky a mnohonôžky tu zvyčajne chýbajú.
|
|
4.
|
F. fimetaria má celosvetové rozšírenie a je bežný vo viacerých druhoch pôdy od piesočnatých po hlinu a od pravého (dokonale rozloženého a premiešaného s pevnou fázou pôdy) po surový (nerozložený) humus. Je to bezoký nepigmentovaný chvostoskok. Bol zaznamenaný v poľnohospodárskych pôdach v celej Európe (6). Je všežravý, pričom súčasť jeho potravy tvoria hubové hýfy, baktérie, prvoky a detrit. Prostredníctvom spásania interaguje s infekciami húb rastlín spôsobenými patogénnymi hubami (7) a môže ovplyvňovať mykorízu ako to je známe v prípade F. candida. Tak ako väčšina druhov chvostoskokov, rozmnožuje sa pohlavne, pričom si vyžaduje nepretržitú prítomnosť samčekov, ktorí oplodňujú vajíčka.
|
|
5.
|
F. candida je takisto rozšírený na celom svete. Hoci vo väčšine prírodných pôd nie je bežný, často sa vyskytuje vo veľmi vysokom počte na miestach bohatých na humus. Je to bezoký nepigmentovaný chvostoskok. Má dobre vyvinutú furku aktívne behá a pri vyrušení pohotovo skáče. Ekologická úloha F. candida je podobná úlohe F. fimetaria, ale biotopmi sú pôdy bohatšie na organické látky. Rozmnožuje sa partenogeneticky. Samčekovia sa môžu vyskytovať v počte menej než jeden na tisíc jedincov.
|
PRINCÍP TESTU
|
6.
|
Synchrónne dospelé (F. fimetaria) alebo mladé (F. candida) chvostoskoky sú vystavené účinkom rôznych koncentrácií testovanej chemikálie zamiešanej do modifikovanej umelo pripravenej pôdy (8) s použitím 5 % obsahu organickej hmoty (alebo alternatívnej pôdy). Vykonávanie testu možno rozdeliť na dva kroky:
|
—
|
test na vyhľadávanie rozsahu v prípade, že nie sú k dispozícii dostatočné informácie o toxicite – v tomto teste sú hlavnými sledovanými parametrami úmrtnosť a rozmnožovanie, ktoré sa hodnotia po dvoch týždňoch v prípade F. fimetaria a po troch týždňoch v prípade F. candida,
|
|
—
|
hlavný reprodukčný test, v ktorom sa hodnotí celkový počet mladých jedincov vyprodukovaných rodičovskými živočíchmi a prežitie rodičovských živočíchov. Tento definitívny test trvá tri týždne v prípade F. fimetaria alebo štyri týždne v prípade F. candida.
|
Toxické účinky testovanej chemikálie na úmrtnosť a výstup reprodukcie dospelých jedincov sú vyjadrené ako LCx a ECx, pričom na základe nelineárnej regresie sa stanoví vhodný model pre údaje s cieľom odhadnúť koncentráciu, ktorá by spôsobila x % úmrtnosť, resp. zníženie výstupu reprodukcie alebo alternatívne ako hodnota NOEC/LOEC (9).
|
INFORMÁCIE O TESTOVANEJ CHEMIKÁLII
|
7.
|
Je vhodné, aby boli známe fyzikálne vlastnosti, rozpustnosť vo vode, hodnota log Kow, rozdeľovacia konštanta pôda – voda a tlak pary testovanej chemikálie. Potrebné sú aj ďalšie informácie o osude testovanej chemikálie v pôde, napríklad miera fotolýzy a hydrolýzy a biotická degradácia. Je potrebné uviesť aj chemickú identifikáciu testovanej chemikálie podľa názvoslovia IUPAC, číslo CAS, šaržu, dávku, štrukturálny vzorec a čistotu ak sú k dispozícii.
|
|
8.
|
Táto testovacia metóda sa môže použiť na chemikálie rozpustné alebo nerozpustné vo vode. Spôsob aplikácie testovanej chemikálie sa však podľa toho bude líšiť. Testovacia metóda nie je použiteľná v prípade prchavých chemikálií, t. j. chemikálií, ktorých Henryho konštanta alebo rozdeľovacia konštanta vzduch – voda je vyššia, ako jeden alebo chemikálií, ktorých tlak pary je vyšší ako 0,0133 Pa pri 25 °C.
|
VALIDITA TESTU
|
9.
|
Na to, aby sa výsledky testu mohli považovať za platné, musia kontrolné skupiny bez aplikovanej chemikálie spĺňať tieto kritériá:
|
—
|
priemerná úmrtnosť dospelých jedincov nesmie presiahnuť 20 % na konci testu,
|
|
—
|
priemerný počet mladých jedincov na nádobu by mal byť aspoň 100 na konci testu,
|
|
—
|
variačný koeficient vypočítaný pre počet mladých jedincov by mal byť nižší ako 30 % na konci hlavného testu.
|
|
REFERENČNÁ CHEMIKÁLIA
|
10.
|
Referenčná chemikália by sa mala testovať pri koncentrácii EC50 pre vybratý druh testovacej pôdy buď v pravidelných intervaloch alebo podľa možnosti v rámci každého testovacieho kola na overenie, že odozva testovacích organizmov v testovacom systéme je na normálnej úrovni. Vhodnou referenčnou chemikáliou je kyselina boritá, ktorá by mala znížiť rozmnožovanie o 50 % (10) (11) pri približne 100 mg/kg suchej hmotnosti pôdy pre obidva druhy.
|
OPIS TESTU
Testovacie nádoby a vybavenie
|
11.
|
Vhodnými testovacími nádobami sú nádoby s kapacitou na umiestnenie 30 g vlhkej pôdy. Mali by byť zo skla alebo inertného plastu (netoxického). Použitiu plastových nádob sa však treba vyhnúť ak je expozícia testovanej chemikálii znížená v dôsledku sorpcie. Testovacie nádoby by mali mať prierez umožňujúci, aby bola skutočná hĺbka pôdy v testovacej nádobe 2 – 4 cm. Nádoby by mali mať viečka (napr. zo skla alebo z polyetylénu) navrhnuté tak, aby sa znížilo odparovanie vody a zároveň sa umožnila výmena plynov medzi pôdou a atmosférou. Nádoba by mala byť aspoň čiastočne priehľadná, aby umožňovala prenos svetla.
|
|
12.
|
Vyžaduje sa bežné laboratórne vybavenie, konkrétne:
|
—
|
vhodné vybavenie na reguláciu teploty,
|
|
—
|
vhodné vybavenie na reguláciu vlhkosti vzduchu (nie je to nevyhnutné ak sú expozičné nádoby zakryté viečkami),
|
|
—
|
inkubátor alebo malá miestnosť s regulovanou teplotou,
|
|
—
|
pinzety alebo zariadenie s nízkym sacím prietokom vzduchu.
|
|
Príprava testovacej pôdy
|
13.
|
Používa sa umelo pripravená pôda (8) s obsahom organickej hmoty 5 %. Alternatívne možno použiť prírodnú pôdu, keďže umelo pripravená pôda sa nepodobá prírodnej pôde. Odporúčané zloženie umelo pripravenej pôdy (na základe suchej hmotnosti vysušenej na konštantnú hmotnosť pri teplote 105 °C) je takéto:
|
—
|
5 % rašeliny vysušenej vzduchom a jemne rozomletej (prijateľná je veľkosť častíc 2 mm ± 1 mm),
|
|
—
|
20 % kaolínu (obsah kaolinitu podľa možnosti nad 30 %),
|
|
—
|
približne 74 % priemyselného piesku vysušeného vzduchom (v závislosti od množstva potrebného CaCO3), prevažne jemný piesok s viac ako 50 % častíc s veľkosťou od 50 do 200 mikrónov – presné množstvo piesku závisí od množstva CaCO3 (pozri ďalej), pričom spolu by mali predstavovať až 75 %,
|
|
—
|
1,0 % uhličitanu vápenatého (CaCO3, rozomletého na prach analyticky čistého) na dosiahnutie pH 6,0 ± 0,5, pričom množstvo pridaného uhličitanu vápenatého môže závisieť najmä od kvality/charakteru rašeliny (pozri poznámku 1).
|
Poznámka 1: Potrebné množstvo CaCO3 bude závisieť od zložiek pôdneho substrátu a malo by sa určiť meraním pH podvzoriek vopred inkubovanej vlhkej pôdy bezprostredne pred testom.
Poznámka 2: Odporúča sa odmerať pH a prípadne aj pomer C/N, kapacitu katiónovej výmeny (CEC) a obsah organickej hmoty v pôde, aby v neskoršej fáze bolo možné vykonať normalizáciu a lepšie interpretovať výsledky.
Poznámka 3: Ak to je potrebné, napríklad na osobitné testovacie účely ako testovací a/alebo kultivačný substrát sa môžu použiť aj prírodné pôdy z neznečistených miest. Ak sa však použije prírodná pôda, je nutné uviesť aspoň jej pôvod (miesto odberu), pH, textúru (distribúciu veľkosti častíc), CEC a obsah organickej hmoty a pôda nesmie byť kontaminovaná. V prípade prírodnej pôdy sa odporúča pred jej použitím v hlavnom teste preukázať jej vhodnosť na test a na splnenie kritérií validity testu.
|
|
14.
|
Suché zložky pôdy sa dôkladne zmiešajú (napr. vo veľkokapacitnom laboratórnom miešači). Maximálna kapacita zadržiavania vody (WHC) umelo pripravenej pôdy sa určí v súlade s postupmi opísanými v dodatku 5. Obsah vlhkosti testovacej pôdy by sa mal optimalizovať tak, aby sa dosiahla kyprá priepustná štruktúra pôdy umožňujúca chvostoskokom vstupovať do pórov. Zvyčajne to je 40 – 60 % maximálnej WHC.
|
|
15.
|
Suchá umelo pripravená pôda sa vopred zvlhčí pridaním dostatočného množstva deionizovanej vody na získanie približne polovice konečného obsahu vody dva až sedem dní pred začiatkom testu, aby sa vyvážila/stabilizovala kyslosť. Na stanovenie pH sa použije zmes pôdy a 1 M roztoku chloridu draselného (KCl) alebo 0,01 M roztoku chloridu vápenatého (CaCl2) v pomere 1:5 (podľa dodatku 6). Ak je pôda kyslejšia ako požadovaný rozsah, možno ju upraviť pridaním príslušného množstva CaCO3. Ak je pôda príliš zásaditá, možno ju upraviť pridaním anorganickej kyseliny neškodnej pre chvostoskoky.
|
|
16.
|
Vopred zvlhčená pôda sa rozdelí na časti zodpovedajúce počtu testovaných koncentrácií (a podľa potreby referenčnej chemikálii) a kontrolných skupín použitých v teste. Pridajú sa testované chemikálie a obsah vody sa reguluje podľa bodu 24.
|
Výber a príprava testovacích živočíchov
|
17.
|
Odporúčaný druh je partenogenetický F. candida, lebo v medzilaboratórnej porovnávacej skúške testovacej metódy (11) tento druh splnil kritériá validity pre prežívanie častejšie ako F. fimetaria. Ak sa použije alternatívny druh, musí spĺňať kritériá validity uvedené v bode 9. Na začiatku testu majú byť živočíchy dobre kŕmené a majú byť vo veku 23 – 26 dní v prípade F. fimetaria a 9 – 12 dní v prípade F. candida. Pre každý replikát by počet jedincov F. fimetaria mal byť desať samčekov a desať samičiek. V prípade F. candida sa má použiť desať samičiek (pozri dodatok 2 a dodatok 3). Synchrónne živočíchy sa náhodne odoberú z misiek a skontroluje sa ich zdravotný a fyzický stav pre každú dávku pridanú do replikátu. Každá skupina 10/20 jedincov sa pridá do náhodne vybratej testovacej nádoby a vyberú sa veľké samičky F. fimetaria, aby sa ľahko odlíšili od samčekov F. fimetaria.
|
Príprava testovaných koncentrácií
|
18.
|
Možno použiť štyri metódy aplikácie testovanej chemikálie: 1. zamiešanie testovanej chemikálie do pôdy s vodou ako nosičom, 2. zamiešanie testovanej chemikálie do pôdy s organickým rozpúšťadlom ako nosičom, 3. zamiešanie testovanej chemikálie do pôdy s pieskom ako nosičom alebo 4. aplikovanie testovanej chemikálie na povrch pôdy. Výber vhodnej metódy závisí od vlastností chemikálie a účelu testu. Vo všeobecnosti sa odporúča zamiešať testovanú chemikáliu do pôdy. Môže však byť potrebné použiť postupy, ktoré sú v súlade s praktickým použitím testovanej chemikálie (napr. nastriekanie kvapalnej formy alebo použitie špeciálnych pesticídových prípravkov ako sú granuly alebo moridlá osiva). Pôda sa takto pripraví pred pridaním chvostoskokov okrem prípadov, keď sa testovaná chemikália pridáva na povrch pôdy – vtedy sa má najskôr chvostoskokom umožniť vstúpiť do pôdy.
|
Testovaná chemikália rozpustná vo vode
|
19.
|
Roztok testovanej chemikálie sa pripraví v deionizovanej vode v dostatočnom množstve pre všetky replikáty jednej testovanej koncentrácie. Každý roztok testovanej chemikálie sa pred pridaním do testovacej nádoby dôkladne premieša s jednou dávkou vopred zvlhčenej pôdy.
|
Testovaná chemikália nerozpustná vo vode
|
20.
|
V prípade chemikálií nerozpustných vo vode, ale rozpustných v organických rozpúšťadlách, sa testovaná chemikália môže rozpustiť v čo najmenšom možnom objeme vhodného rozpúšťadla (napr. acetónu), ktorý zabezpečí riadne zamiešanie chemikálie do pôdy a jej zmiešanie s požadovanou časťou kremenného piesku. Mali by sa používať iba prchavé rozpúšťadlá. Ak sa použije organické rozpúšťadlo, všetky testované koncentrácie a doplnkový negatívny kontrolný roztok rozpúšťadla by mali obsahovať rovnaké minimálne množstvo rozpúšťadla. Aplikačné nádoby by mali určitý čas zostať nezakryté, aby sa rozpúšťadlo použité na aplikovanie testovanej chemikálie mohlo odpariť, aby tak v tom čase nedošlo k rozptylu toxickej chemikálie.
|
Testovaná chemikália slabo rozpustná vo vode a v organických rozpúšťadlách
|
21.
|
V prípade chemikálií, ktoré sú slabo rozpustné vo vode a v organických rozpúšťadlách, sa kremenný piesok, ktorý by mal byť súčasťou celkového množstva piesku pridaného do pôdy, zmieša s množstvom testovanej chemikálie potrebnej na dosiahnutie požadovanej testovanej koncentrácie. Táto zmes kremenného piesku a testovanej chemikálie sa pridá do vopred zvlhčenej pôdy, potom sa pridá primerané množstvo deionizovanej vody, aby sa získal požadovaný obsah vlhkosti a všetko sa dôkladne premieša. Konečná zmes sa rozdelí medzi testovacie nádoby. Postup sa zopakuje pre každú testovanú koncentráciu a pripraví sa aj vhodný kontrolný roztok.
|
Aplikácia testovanej chemikálie na povrch pôdy
|
22.
|
Ak je testovaná chemikália pesticíd, môže byť vhodné aplikovať ju na povrch pôdy nastriekaním. Urobí sa to až po pridaní chvostoskokov. Testovacie nádoby sa najskôr naplnia zvlhčeným pôdnym substrátom, pridajú sa živočíchy a potom sa testovacie nádoby odvážia. S cieľom predísť priamej expozícii živočíchov testovanej chemikálii priamym kontaktom, testovaná chemikália sa aplikuje najskôr polhodinu po pridaní chvostoskokov. Testovaná chemikália by sa mala aplikovať na povrch pôdy čo najrovnomernejšie pomocou vhodného laboratórneho striekacieho zariadenia, aby sa simuloval postrek v teréne. Aplikovanie by sa malo uskutočniť pri teplote s odchýlkou ± 2 °C a v prípade vodných roztokov, emulzií alebo disperzií s rýchlosťou aplikovania vody v súlade s odporúčaniami na posúdenie rizika. Rýchlosť sa má overiť s použitím vhodnej kalibračnej metódy. Špeciálne prípravky ako granuly alebo moridlá osiva sa môžu aplikovať spôsobom, ktorý je v súlade s poľnohospodárskym použitím. Po nastriekaní sa pridá potrava.
|
POSTUP
Podmienky testu
|
23.
|
Priemerná teplota pri teste by mala byť 20 °C ± 1 °C s rozsahom teplôt 20 °C ± 2 °C. Test sa vykonáva za regulovaných cyklov svetla a tmy (podľa možnosti 12 hodín svetla a 12 hodín tmy) pri osvetlení 400 – 800 luxov v priestore testovacích nádob.
|
|
24.
|
Na účely kontroly vlhkosti pôdy sa nádoby odvážia na začiatku, v strede a na konci testu. Úbytok hmotnosti > 2 % sa dopĺňa pridaním deionizovanej vody. Je potrebné poznamenať, že úbytok vody možno znížiť udržiavaním vysokej vlhkosti vzduchu (> 80 %) v testovacom inkubátore.
|
|
25.
|
Hodnota pH by sa mala odmerať na začiatku a konci testu na vyhľadávanie rozsahu i hlavného testu. Merania by sa mali vykonať aj na jednej dodatočnej kontrolnej vzorke a jednej dodatočnej vzorke z pôdnych vzoriek s aplikovanou chemikáliou (všetky koncentrácie), ktorá sa pripravila a udržiavala rovnakým spôsobom ako testovacie kultúry, ale bez pridania chvostoskokov.
|
Postup testu a merania
|
26.
|
Pre každú testovanú koncentráciu sa množstvo testovacej pôdy zodpovedajúce 30 g hmotnosti v natívnom stave umiestni do testovacej nádoby. Pripravia sa aj vodné kontrolné vzorky bez testovanej chemikálie. Ak sa na aplikáciu testovanej látky používa vehikulum, okrem testovacej série sa má vykonať jedna kontrolná séria obsahujúca len vehikulum. Koncentrácia rozpúšťadla alebo dispergantu musí byť rovnaká ako koncentrácia použitá v testovacích nádobách obsahujúcich testovanú chemikáliu.
|
|
27.
|
Jednotlivé chvostoskoky sa opatrne prenesú do každej testovacej nádoby (pridelia sa náhodne) a umiestnia na povrch pôdy. Na účinný prenos živočíchov sa môže použiť zariadenie s nízkym sacím prietokom vzduchu. Počet replikátov pre testované koncentrácie a kontrolné skupiny závisí od použitej koncepcie testu. Testovacie nádoby sa náhodne umiestnia do testovacieho inkubátora a tieto pozície sa raz týždenne znova opätovne randomizujú.
|
|
28.
|
V teste F. fimetaria sa má použiť 20 dospelých jedincov (desať samčekov a desať samičiek) vo veku 23 – 26 dní na testovaciu nádobu. V 21. deň sa chvostoskoky extrahujú z pôdy a spočítajú. V dávke synchronizovaných jedincov F. fimetaria použitej v teste sa pohlavia rozlíšia podľa veľkosti. Samičky sú zreteľne väčšie ako samčekovia (pozri dodatok 3).
|
|
29.
|
V teste F. candida sa má použiť desať mladých jedincov vo veku 9 – 12 dní na testovaciu nádobu. V 28. deň sa chvostoskoky extrahujú z pôdy a spočítajú.
|
|
30.
|
Ako vhodný zdroj potravy sa na začiatku testu a po približne dvoch týždňoch do každej nádoby pridá dostatočné množstvo, napr. 2 – 10 mg, granulovaného sušeného pekárskeho droždia komerčne dostupného na použitie v domácnosti.
|
|
31.
|
Na konci testu sa hodnotí úmrtnosť a rozmnožovanie. Po troch týždňoch (F. fimetaria) alebo štyroch týždňoch (F. candida) sa chvostoskoky extrahujú z testovacej pôdy (pozri dodatok 4) a spočítajú (12). Chvostoskok, ktorého sa nepodarí extrahovať, sa zaznamená ako mŕtvy. Metódy extrakcie a počítania by mali byť validované. Validita zahŕňa účinnosť extrakcie mladých jedincov vyššiu ako 95 %, napr. pridaním známeho počtu do pôdy.
|
|
32.
|
Praktické zhrnutie a harmonogram postupu testu sú uvedené v dodatku 2.
|
Koncepcia testu
Test na vyhľadávanie rozsahu
|
33.
|
V prípade potreby sa vykoná test na vyhľadávanie rozsahu napríklad s piatimi koncentráciami testovanej chemikálie 0,1; 1,0; 10; 100 a 1 000 mg/kg suchej hmotnosti pôdy v dvoch replikátoch pre každú testovanú koncentráciu a kontrolnú skupinu. Pri rozhodovaní o rozsahu koncentrácií, ktoré sa použijú na test na vyhľadávanie rozsahu, môžu byť užitočné aj dodatočné informácie o úmrtnosti alebo rozmnožovaní chvostoskokov z testov s podobnými chemikáliami alebo z literatúry.
|
|
34.
|
Test na vyhľadávanie rozsahu trvá dva týždne pre F. fimetaria a tri týždne pre F. candida, aby sa zabezpečila produkcia jednej znášky mladých jedincov. Na konci testu sa vyhodnotí úmrtnosť a rozmnožovanie chvostoskokov. Je potrebné zaznamenať počet dospelých jedincov a objavenie sa mladých jedincov.
|
Hlavný test
|
35.
|
Na stanovenie hodnoty ECx (napr. EC10, EC50) by sa malo otestovať dvanásť koncentrácií. Odporúča sa použiť aspoň dva replikáty na každú testovanú koncentráciu chemikálie a šesť kontrolných replikátov. Faktor odstupu sa môže meniť v závislosti od charakteru odozvy na dávku.
|
|
36.
|
Na stanovenie hodnoty NOEC/LOEC je potrebné otestovať aspoň päť koncentrácií v geometrickom rade. Odporúčajú sa štyri replikáty na každú testovanú koncentráciu chemikálie plus osem kontrolných skupín. Koncentrácie by mali mať faktor odstupu nepresahujúci 1,8.
|
|
37.
|
Kombinovaný prístup umožňuje stanovenie hodnôt NOEC/LOEC i ECx. V rámci tohto kombinovaného prístupu sa má použiť osem koncentrácií chemikálie v geometrickom rade. Odporúčajú sa štyri replikáty na každú koncentráciu chemikálie plus osem kontrolných skupín. Koncentrácie by mali mať faktor odstupu nepresahujúci 1,8.
|
|
38.
|
Ak sa v teste na vyhľadávanie rozsahu nezistia žiadne účinky pri najvyššej koncentrácii (t. j. 1 000 mg/kg), možno reprodukčný test vykonať ako limitný test s použitím testovanej koncentrácie 1 000 mg/kg a kontrolnej skupiny. Limitný test poskytne príležitosť preukázať, že neexistuje štatisticky významný účinok pri limitnej koncentrácii. Má sa použiť osem replikátov pre pôdu s aplikovanou chemikáliou ako aj pre kontrolnú skupinu.
|
ÚDAJE A PODÁVANIE SPRÁV
Spracovanie výsledkov
|
39.
|
Hlavným sledovaným parametrom je výstup reprodukcie (napr. počet mladých jedincov vyprodukovaný na testovaciu nádobu). V štatistickej analýze, napr. v postupoch analýzy ANOVA, sa porovnajú populácie s aplikovanou chemikáliou pomocou Studentovho t-testu, Dunnettovho testu alebo Williamsovho testu. Pre priemery jednotlivých populácií sa vypočítajú 95 % intervaly spoľahlivosti.
|
|
40.
|
Hlavným kritériom validity, ktoré by sa malo zdokumentovať, je počet prežívajúcich dospelých jedincov v kontrolných skupinách bez aplikovanej chemikálie. Tak ako v prípade testu na vyhľadávanie rozsahu sa do záverečnej správy majú uviesť aj všetky ostatné škodlivé známky.
|
LCx a ECx
|
41.
|
Hodnoty ECx vrátane príslušných dolných a horných 95 % hraníc spoľahlivosti pre daný parameter sa vypočítajú pomocou vhodných štatistických metód (napr. logistickej alebo Weibullovej funkcie, Spearman-Karberovej metódy s orezanými údajmi alebo jednoduchej interpolácie). Hodnota ECx sa získa vložením hodnoty zodpovedajúcej x % priemeru kontrolnej skupiny do zistenej rovnice. Na účely výpočtu hodnoty EC50 alebo akejkoľvek inej hodnoty ECx sa na úplnom súbore údajov vykoná regresná analýza. Hodnota LC50 sa zvyčajne odhaduje probitovou analýzou alebo podobnou analýzou zohľadňujúcou binomicky distribuované údaje o úmrtnosti.
|
NOEC/LOEC
|
42.
|
Ak je cieľom štatistickej analýzy určiť hodnotu NOEC/LOEC, vyžadujú sa štatistiky pre jednotlivé nádoby (ktoré sa považujú za replikáty). Mali by sa použiť vhodné štatistické metódy podľa dokumentu OECD 54 o súčasných prístupoch k štatistickej analýze údajov o ekotoxicite: návodu na používanie (9). Vo všeobecnosti sa nepriaznivé účinky testovanej chemikálie v porovnaní s kontrolnou skupinou analyzujú pomocou jednostranného testu hypotézy s p ≤ 0,05.
|
|
43.
|
Normálnu distribúciu a homogenitu rozptylu možno otestovať pomocou vhodného štatistického testu, napr. Shapiro-Wilkovho testu, resp. Leveneho testu (p ≤ 0,05). Možno vykonať jednosmernú analýzu rozptylu (ANOVA) a následné viacnásobné porovnávacie testy. Viacnásobné porovnávania (napr. Dunnettov test) alebo zostupné trendové testy (napr. Williamsov test) sa môžu použiť na vypočítanie, či existujú významné rozdiely (p ≤ 0,05) medzi kontrolnými skupinami a rôznymi koncentráciami testovanej chemikálie [výber odporúčaného testu podľa dokumentu OECD 54 (9)]. Na stanovenie hodnôt NOEC a LOEC možno použiť aj iné neparametrické metódy (napr. Bonferroniho U-test podľa Holma alebo Jonckheereho-Terpstrov trendový test).
|
Limitný test
|
44.
|
Ak sa vykonal limitný test (porovnanie kontrolnej skupiny a len jednej koncentrácie chemikálie) a boli splnené predpoklady parametrických testovacích postupov (normalita, homogenita), metrické reakcie možno vyhodnotiť pomocou Studentovho testu (t-testu). Ak tieto podmienky neboli splnené, možno použiť t-test s nerovnomerným rozptylom (Welchov t-test) alebo neparametrický test, napríklad Mann-Whitneyho U-test.
|
|
45.
|
Na stanovenie významných rozdielov medzi kontrolnými skupinami (kontrolná skupina a kontrolná skupina s rozpúšťadlom) možno replikáty z každej kontrolnej skupiny otestovať podľa opisu pre limitný test. Ak sa v týchto testoch nezistia významné rozdiely, všetky replikáty kontrolnej skupiny a kontrolnej skupiny s rozpúšťadlom možno spojiť. V opačnom prípade sa všetky koncentrácie chemikálie majú porovnať s kontrolnou skupinou s rozpúšťadlom.
|
Protokol o skúške
|
46.
|
Protokol o skúške musí obsahovať aspoň tieto informácie:
|
|
Testovaná chemikália:
|
—
|
totožnosť testovanej chemikálie, šaržu, dávku a číslo CAS, čistotu,
|
|
—
|
fyzikálno-chemické vlastnosti testovanej chemikálie [napr. log Kow, rozpustnosť vo vode, tlak pary, Henryho konštantu (H) a podľa možnosti informácie o osude testovanej chemikálie v pôde] ak sú k dispozícii,
|
|
—
|
ak sa netestuje čistá chemikália, je potrebné uviesť zloženie testovanej chemikálie a prídavné látky.
|
|
|
|
Testovacie organizmy
|
—
|
identifikácia druhu a dodávateľa testovacích organizmov, opis podmienok chovu a rozsah veku testovacích organizmov.
|
|
|
|
Podmienky testu
|
—
|
opis návrhu a postupu experimentu,
|
|
—
|
údaje o príprave testovacej pôdy, podrobné špecifikácie ak sa použije prírodná pôda (pôvod, história, distribúcia veľkosti častíc, pH, obsah organickej hmoty),
|
|
—
|
kapacita pôdy zadržiavať vodu,
|
|
—
|
opis metódy použitej na aplikáciu testovanej chemikálie do pôdy,
|
|
—
|
podmienky testu: intenzita svetla, trvanie cyklov svetla a tmy, teplota,
|
|
—
|
opis kŕmneho režimu, druh a množstvo potravy použitej v teste, dátumy kŕmenia,
|
|
—
|
pH a obsah vody v pôde na začiatku a konci testu (kontrolná skupina a každá koncentrácia chemikálie),
|
|
—
|
podrobný opis metódy extrakcie a účinnosť extrakcie.
|
|
|
|
Výsledky testu
|
—
|
počet mladých jedincov zistený v každej testovacej nádobe na konci testu,
|
|
—
|
počet dospelých jedincov a ich úmrtnosť ( %) v každej testovacej nádobe na konci testu,
|
|
—
|
opis zjavných fyziologických alebo patologických príznakov alebo výrazných zmien v správaní,
|
|
—
|
výsledky získané s referenčnou testovanou chemikáliou,
|
|
—
|
hodnoty NOEC/LOEC, LCx pre úmrtnosť a ECx pre rozmnožovanie (väčšinou LC50, LC10, EC50 a EC10) s 95 % intervalmi spoľahlivosti, graf vhodného modelu použitého na výpočet, rovnica jeho funkcie a jeho parametre [pozri (9)],
|
|
—
|
všetky informácie a pozorovania, ktoré môžu pomôcť pri interpretácii výsledkov,
|
|
—
|
spoľahlivosť testu ak sa vykonáva testovanie hypotéz (9),
|
|
—
|
odchýlky od postupov opísaných v tejto testovacej metóde a všetky nezvyčajné udalosti počas testu,
|
|
—
|
ak sa odhaduje hodnota NOEC, minimálny zistiteľný rozdiel.
|
|
|
LITERATÚRA
|
1.
|
Wiles JA a Krogh PH (1998) Testing with the collembolans I. viridis, F. candida and F. fimetaria. V Handbook of soil invertebrate toxicity tests (ed. H Løkke and CAM Van Gestel), s. 131 – 156. John Wiley a Sons, Ltd., Chichester.
|
|
2.
|
ISO (1999) Soil Quality – Effects of soil pollutants on Collembola (Folsomia candida): Method for determination of effects on reproduction. No. 11267. Medzinárodná organizácia pre normalizáciu, Ženeva.
|
|
3.
|
Burges A a Raw F (Eds) (1967) Soil Biology. Academic Press. Londýn.
|
|
4.
|
Petersen H a Luxton M (1982) A comparative analysis of soil fauna populations and their role in decomposition processes. Oikos 39: 287 – 388.
|
|
5.
|
Petersen H (1994) A review of collembolan ecology in ecosystem context. Acta Zoologica Fennica 195: 111 – 118.
|
|
6.
|
Hopkin SP (1997). Biology of the Springtails (Insecta: Collembola). Oxford University Press. 330 s. (ISBN 0-19-854084-1).
|
|
7.
|
Ulber B (1983) Einfluss von Onychirurus fimatus Gisin (Collembola, Onychiuridae) und Folsomia fimetaria L. (Collembola, Isotomidae) auf Pythium ultimum Trow. einen Erreger des Wurzelbrandes der Zuckerrübe. V New trends in soil Biology (Lebrun Ph andré HM, De Medts A, Grégoire-Wibo, Wauthy G (Eds), Proceedings of the VI. international colloquium on soil zoology, Louvain-la-neuve (Belgium), 30. august – 2. september 1982, I Dieu-Brichart, Ottignies-Louvain-la-Neuve, s. 261 – 268.
|
|
8.
|
kapitola C.36 tejto prílohy, Predatory mite (Hypoaspis (Geolaelaps) aculeifer) reproduction test in soil.
|
|
9.
|
OECD (2006), Current approaches in the statistical analysis of ecotoxicity data: a guidance to application. OECD series on testing and assessment Number 54, ENV/JM/MONO(2006)18, OECD Paríž
|
|
10.
|
Scott-Fordsmand JJ a Krogh PH (2005) Background report on prevalidation of an OECD springtail test guideline. Environmental Project Nr. 986. Miljøstyrelsen 61 s. Danish Ministry for the Environment.
|
|
11.
|
Krogh, P.H., 2009. Toxicity testing with the collembolans Folsomia fimetaria and Folsomia candida and the results of a ringtest. Danish Environmental Protection Agency, Environmental Project No. 1256, s. 66.
|
|
12.
|
Krogh PH, Johansen K and Holmstrup M (1998) Automatic counting of collembolans for laboratory experiments. Appl. Soil Ecol. 7, 201 – 205
|
|
13.
|
Fjellberg A (1980) Identification keys to Norwegian collembolans. Norsk Entomologisk Forening.
|
|
14.
|
Edwards C.A. (1955) Simple techniques for rearing Collembola, Symphyla and other small soil inhabiting arthropods. V Soil Zoology (Kevan D.K. McE., Ed). Butterworths, Londýn, s. 412 – 416
|
|
15.
|
Goto HE (1960) Simple techniques for the rearing of Collembola and a not on the use of a fungistatic substance in the cultures. Entomologists' Monthly Magazine 96: 138 – 140.
|
Dodatok 1
Vymedzenie pojmov
Na túto testovaciu metódu sa vzťahujú tieto vymedzenia pojmov (v tomto teste sú všetky účinné koncentrácie vyjadrené ako hmotnosť testovanej chemikálie na suchú hmotnosť testovacej pôdy):
|
|
Chemikália je látka alebo zmes.
|
|
|
NOEC (koncentrácia bez pozorovaného účinku) je koncentrácia testovanej chemikálie, pri ktorej sa nepozoruje žiadny účinok. V tomto teste koncentrácia zodpovedajúca hodnote NOEC nemá žiadny štatisticky významný účinok (p < 0,05) v rámci daného času expozície v porovnaní s kontrolnou vzorkou.
|
|
|
LOEC (najnižšia koncentrácia s pozorovaným účinkom) je najnižšia koncentrácia testovanej chemikálie, ktorá má štatisticky významný účinok (p < 0,05) v rámci daného času expozície v porovnaní s kontrolnou vzorkou.
|
|
|
ECx (účinná koncentrácia pre účinok x %) je koncentrácia, ktorá v rámci daného času expozície vyvolá x % účinok na testovacie organizmy v porovnaní s kontrolnou vzorkou. Napríklad EC50 je koncentrácia, pri ktorej sa odhaduje, že v stanovenom čase expozície vyvolá účinok na sledovaný parameter testu v 50 % exponovanej populácie.
|
|
|
Testovaná chemikália je akákoľvek látka alebo zmes, ktorá sa testuje pomocou tejto testovacej metódy.
|
Dodatok 2
Hlavné úkony a harmonogram na vykonanie testu chvostoskokov
Kroky testu možno zhrnúť takto:
|
Čas (deň)
|
Úkon
|
|
– 23. až – 26.
|
Príprava synchrónnej kultúry F. fimetaria
|
|
–14.
|
Príprava umelo pripravenej pôdy (zmiešanie suchých zložiek)
Kontrola pH umelo pripravenej pôdy a úprava podľa potreby
Odmeranie maximálnej WHC pôdy
|
|
– 9. až – 12.
|
Príprava synchrónnej kultúry F. candida
|
|
– 2. až – 7.
|
Predbežné zvlhčenie pôdy
|
|
– 1.
|
Rozdelenie mladých jedincov do dávok
Príprava zásobných roztokov a aplikovanie testovanej chemikálie ak je potrebné rozpúšťadlo
|
|
0.
|
Príprava zásobných roztokov a aplikovanie testovanej chemikálie ak ide o pevnú chemikáliu, chemikáliu rozpustnú vo vode alebo ak sa vyžaduje povrchová aplikácia
Odmeranie pH pôdy a hmotnosti nádob
Pridanie potravy. Pridanie chvostoskokov.
|
|
14.
|
Test na vyhľadávanie rozsahu pre F. fimetaria: ukončenie testu, extrakcia živočíchov, odmeranie pH pôdy a straty vody (hmotnosť)
Hlavné testy: odmeranie obsahu vlhkosti, doplnenie vody a pridanie 2 – 10 mg droždia
|
|
21.
|
Hlavný test pre F. fimetaria: ukončenie testu, extrakcia živočíchov, odmeranie pH pôdy a straty vody (hmotnosť)
Test na vyhľadávanie rozsahu pre F. candida: ukončenie testu, extrakcia živočíchov, odmeranie pH pôdy a straty vody (hmotnosť)
|
|
28.
|
Hlavný test pre F. candida: ukončenie testu, extrakcia živočíchov, odmeranie pH pôdy a straty vody (hmotnosť)
|
Dodatok 3
Usmernenia na chov a synchronizáciu F. fimetaria a F. candida
Pre každý konkrétny kmeň chvostoskokov je potrebné overiť, či časy a trvania uvedené v tomto usmernení umožňujú dostatočnú synchronizáciu mladých jedincov. Výskyt kladenia vajíčok po prenose dospelých jedincov do čerstvého substrátu a liahnutia vajíčok v zásade určujú vhodný deň na zber vajíčok a synchrónnych mláďat.
Odporúča sa mať trvalú zásobnú kultúru skladajúcu sa napr. z 50 nádob/Petriho misiek. Zásobná kultúra by sa mala udržiavať v dobrom stave výživy kŕmením raz za týždeň, pridávaním vody a odstraňovaním starej potravy a uhynutých jedincov. Príliš málo chvostoskokov na substráte môže mať za následok inhibíciu v dôsledku intenzívnejšieho rastu plesní. Ak sa zásobná kultúra používa na produkciu vajíčok príliš často, môže sa unaviť. Známky únavy sú mŕtve dospelé jedince a pleseň na substráte. Zvyšné vajíčka z produkcie synchrónnych živočíchov možno použiť na oživenie kultúry.
V synchrónnej kultúre F. fimetaria sa samčekovia a samičky predovšetkým rozlišujú podľa veľkosti. Samčekovia sú výrazne menší než samičky a pohybujú sa rýchlejšie než samičky. Správny výber pohlavia si vyžaduje malú prax a možno ho potvrdiť mikroskopickou kontrolou pohlavnej oblasti (13).
1. Chov
1.a. Príprava kultivačného substrátu
Kultivačný substrát je sadra (síran vápenatý) s aktívnym uhlím. Takto sa zabezpečí vlhkosť substrátu, pričom funkciou uhlia je absorbovať odpadové plyny a exkrementy (14) (15). Na uľahčenie pozorovania chvostoskokov možno použiť rôzne formy uhlia. Napríklad v prípade F. candida a F. fimetaria sa používa práškové uhlie (použitím ktorého sa vytvára čierna/sivá sadra).
Zložky substrátu:
|
—
|
200 ml destilovanej vody,
|
alebo
|
—
|
50 g aktívneho práškového uhlia,
|
|
—
|
260 – 300 ml destilovanej vody,
|
Zmes substrátu sa pred použitím nechá sadnúť.
1.b. Rozmnožovanie
Chvostoskoky sa držia v nádobách, napr. v Petriho miskách (90 mm × 13 mm), s dnom pokrytým 0,5 cm vrstvou substrátu zo sadry/uhlia. Kultivujú sa pri teplote 20 ± °1 °C a pri cykle svetla a tmy 12: 12 hodín (400 – 800 luxov). Nádoby sa nepretržite udržiavajú vlhké, aby bola relatívna vlhkosť vzduchu v nádobách 100 %. Možno to dosiahnuť prítomnosťou voľnej vody v poréznej sadre, ale bez vytvorenia vodného filmu na povrchu sadry. Strate vody je možné zabrániť vytvorením vlhkého okolitého vzduchu. Všetky mŕtve jedince ako aj plesnivá potrava, sa majú z nádob odstrániť. Na stimuláciu produkcie vajíčok je potrebné preniesť dospelé živočíchy do Petriho misiek s čerstvo pripraveným substrátom zo sadry/uhlia.
1.c. Zdroj potravy
Ako jediný zdroj potravy pre F. candida a F. fimetaria sa používa granulované sušené pekárske droždie. Čerstvá potrava sa poskytuje raz alebo dvakrát za týždeň, aby sa zabránilo vzniku plesní. Ukladá sa priamo na sadru v malej kôpke. Hmotnosť pridávaného pekárskeho droždia by sa mala prispôsobiť veľkosti populácie chvostoskokov, vo všeobecnosti však stačí 2 – 15 mg.
2. Synchronizácia
Test by sa mal vykonať so synchronizovanými živočíchmi, aby sa získali homogénne testované živočíchy toho istého instaru a veľkosti. Synchronizácia okrem toho umožňuje odlíšiť samčekov a samičky F. fimetaria vo veku tri týždne a staršie na základe pohlavného dimorfizmu, t. j. rozdielov vo veľkosti. Postup uvedený ďalej je odporúčaním ako získať synchronizované živočíchy (praktické kroky sú voliteľné).
2.a. Synchronizácia
|
—
|
Pripravte nádoby s 0,5 cm vrstvou substrátu zo sadry/uhlia.
|
|
—
|
Na účely znesenia vajíčok preneste 150 – 200 dospelých jedincov F. fimetaria a 50 – 100 jedincov F. candida z najlepších 15 – 20 nádob so zásobnou kultúrou so substrátom starým štyri až osem týždňov do nádob a živočíchy nakŕmte 15 mg pekárskeho droždia. Nedávajte spolu mladé a dospelé jedince, lebo prítomnosť mladých jedincov môže inhibovať produkciu vajec.
|
|
—
|
Kultúru uchovávajte pri teplote 20 ± 1 °C (priemer by mal byť 20 ± °C) a cykle svetla a tmy 12 : 12 hodín (400 – 800 luxov). Zabezpečte prísun čerstvej potravy a saturáciu vzduchu vodou. Nedostatok potravy môže mať za následok, že živočíchy sa budú vyprázdňovať na vajíčka, čo môže spôsobiť rast plesní na vajíčkach, prípadne F. candida môže požierať vlastné vajíčka. Po desiatich dňoch sa vajíčka starostlivo zozbierajú ihlou a špachtľou a prenesú do ‚vajíčkového papiera‘ (malé kusy filtračného papiera ponorené do kaše zo sadry/uhlia), ktorý sa vloží do nádoby s čerstvým substrátom zo sadry/uhlia. Do substrátu sa pridá niekoľko zrniečok droždia na prilákanie mladých jedincov, aby opustili vajíčkový papier. Je dôležité, aby boli vajíčkový papier a substrát vlhké, inak sa vajíčka dehydrujú. Alternatívne je možné dospelé živočíchy po nakladení vajíčok vybrať zo synchronizačných kultivačných nádob na dva alebo tri dni.
|
|
—
|
Po troch dňoch bude väčšina vajíčok na vajíčkovom papieri vyliahnutá, pričom niektoré mladé jedince sa môžu nachádzať pod vajíčkovým papierom.
|
|
—
|
Ak chceme získať mladé jedince rovnakého veku, vajíčkový papier s nevyliahnutými vajíčkami vyberieme pinzetou z Petriho misky. Mláďatá, ktoré sú teraz vo veku 0 – 3 dni, zostanú v miske a kŕmia sa pekárskym droždím. Nevyliahnuté vajíčka sa vyradia z testu.
|
|
—
|
Vajíčka a vyliahnuté mladé jedince sa kultivujú rovnakým spôsobom ako dospelé jedince. Konkrétne v prípade F. fimetaria by sa mali prijať tieto opatrenia: zabezpečiť dostatok čerstvej potravy, odstraňovať starú plesnivú potravu, po týždni mláďatá rozdeliť do nových Petriho misiek ak hustota prekračuje 200.
|
2.b. Manipulácia s chvostoskokmi na začiatku testu
|
—
|
Jedince F. candida vo veku 9 – 12 dní alebo F. fimetaria vo veku 23 – 26 dní sa pozbierajú, napr. nasatím a vypustia do malej nádoby s vlhkým substrátom zo sadry/uhlia. Pomocou binokulárneho mikroskopu sa skontroluje ich fyzický stav (zranené a poškodené živočíchy sa odstránia). Všetky kroky by sa mali vykonať tak, aby boli chvostoskoky stále vo vlhkom prostredí, napr. na mokrom povrchu atď., aby sa predišlo stresu zo sucha.
|
|
—
|
Otočte nádobu dnom nahor a poklepte na ňu, aby sa chvostoskoky presunuli do pôdy. Je potrebné neutralizovať statickú elektrinu, inak sa môže stať, že živočíchy budú lietať vo vzduchu alebo sa prilepia na stenu testovacej nádoby a vyschnú. Na neutralizáciu možno použiť ionizátor alebo vlhkú handru umiestnenú pod nádobou.
|
|
—
|
Potrava by sa mala rozložiť po celom povrchu pôdy, nemala by zostať len v jednej hrudke.
|
|
—
|
Počas prenosu a testovacieho obdobia by sa nemalo klopať na testovacie nádoby ani ich inak fyzicky narúšať, lebo by to mohlo zvýšiť zhutňovanie pôdy a obmedziť interakcie medzi chvostoskokmi.
|
3. Alternatívne druhy chvostoskokov
Na testovanie pomocou tejto testovacej metódy možno použiť aj iné druhy chvostoskokov, napríklad Proisotoma minuta, Isotoma viridis, Isotoma anglicana, Orchesella cincta, Sinella curviseta, Paronychiurus kimi, Orthonychiurus folsomi, Mesaphorura macrochaeta. Pred použitím alternatívnych druhov je nutné splniť niekoľko predpokladov:
|
—
|
majú byť jednoznačne určené,
|
|
—
|
treba uviesť dôvody na ich výber,
|
|
—
|
je potrebné zabezpečiť, aby bola do testovacej fázy zahrnutá reprodukčná biológia, aby bola potenciálnym cieľom počas expozície,
|
|
—
|
je potrebné poznať históriu života: vek dosiahnutia dospelosti, trvanie vývinu vajíčok a instary, ktoré sú podrobené expozícii,
|
|
—
|
testovací substrát a poskytovaná potrava musia poskytovať optimálne podmienky na rast a rozmnožovanie,
|
|
—
|
variabilita musí byť dostatočne nízka na precízny a presný odhad toxicity.
|
Dodatok 4
Extrakcia a počítanie živočíchov
1. Možno použiť dve metódy extrakcie.
|
1.a.
|
Prvá metóda: Možno použiť extraktor s kontrolovaným teplotným gradientom založený na zásadách MacFadyena (1). Teplo pochádza z vykurovacieho telesa na vrchu extrakčnej skrinky (regulovaného prostredníctvom termistora umiestneného na povrchu vzorky pôdy). Teplota v chladenej kvapaline okolo zbernej nádoby sa reguluje prostredníctvom termistora umiestneného na povrchu zbernej skrinky (umiestnenej pod povrchom pôdy). Termistory sú spojené s programovateľnou ovládacou jednotkou, ktorá zvyšuje teplotu podľa vopred naprogramovaného harmonogramu. Živočíchy sa zbierajú do chladenej zbernej skrinky (2 °C) so spodnou vrstvou zo sadry/uhlia. Extrakcia sa začína pri teplote 25 °C a teplota sa automaticky zvyšuje každých 12 hodín o 5 °C a celkovo trvá 48 hodín. Po 12 hodinách pri 40 °C sa extrakcia končí.
|
|
1.b.
|
Druhá metóda: Po pokusnom inkubačnom období sa počet prítomných mladých chvostoskokov stanoví s použitím flotácie. Na tieto účely sa test vykoná v nádobách s objemom približne 250 ml. Na konci testu sa pridá približne 200 ml destilovanej vody. Pôda sa jemne premieša jemným štetcom, aby chvostoskoky stúpali k hladine vody. Do vody sa môže pridať malé množstvo, približne 0,5 ml, čierneho farbiva na tlač fotografií značky Kentmere na uľahčenie počítania zvýšením kontrastu medzi vodou a bielymi chvostoskokmi. Farbivo nie je pre chvostoskoky toxické.
|
2. Počítanie:
Počítanie možno vykonať voľným okom alebo pod svetelným mikroskopom s použitím mriežky umiestnenej na flotačnej nádobe alebo odfotografovaním povrchu každej nádoby a následným spočítaním chvostoskokov na zväčšených alebo premietaných snímkach. Počítanie možno vykonať aj s použitím digitálnych metód spracovania obrazu (12). Všetky postupy je potrebné validovať.
Dodatok 5
Určenie maximálnej hodnoty WHC pôdy
Táto metóda na určenie maximálnej kapacity zadržiavania vody (WHC) pôdy sa považuje za vhodnú. Je opísaná v prílohe C normy ISO DIS 11268-2 [Kvalita pôdy. Účinky znečisťujúcich látok na dážďovky (Eisenia fetida). Časť 2: Stanovenie účinkov na rozmnožovanie].
Odoberte stanovené množstvo (napr. 5 g) testovacieho pôdneho substrátu pomocou vhodného zariadenia na odber vzoriek (špirálového vzorkovača atď.). Zakryte spodnú časť rúrky kúskom mokrého filtračného papiera a potom ju umiestnite na stojan vo vodnom kúpeli. Rúrku treba postupne ponoriť, kým hladina vody nebude nad povrchom pôdy. Potom sa nechá vo vode približne tri hodiny. Keďže nie je možné zadržať všetku vodu absorbovanú pôdnymi kapilárami, vzorku pôdy treba nechať dve hodiny odvodniť tak, že rúrka sa umiestni na vrstvu veľmi mokrého jemného kremenného piesku v zakrytej nádobe (aby sa zabránilo vysušeniu). Vzorka sa potom odváži vysušená na konštantnú hmotnosť pri teplote 105 °C. Kapacita zadržiavania vody (WHC) sa vypočíta takto:

Kde:
|
S
|
=
|
substrát saturovaný vodou + hmotnosť rúrky + hmotnosť filtračného papiera,
|
|
T
|
=
|
hmotnosť obalu (hmotnosť rúrky + hmotnosť filtračného papiera),
|
|
D
|
=
|
suchá hmotnosť substrátu.
|
Dodatok 6
Stanovenie pH pôdy
Táto metóda stanovenia pH pôdy je založená na opise uvedenom v norme ISO DIS 10390: Kvalita pôdy – Stanovenie pH.
Stanovené množstvo pôdy sa suší pri izbovej teplote aspoň 12 hodín. Potom sa pripraví suspenzia pôdy (obsahujúca aspoň 5 g pôdy) v 1 M roztoku chloridu draselného (KCl) analytickej triedy čistoty alebo 0,01 M roztoku chloridu vápenatého (CaCl2) analytickej triedy čistoty, ktorých objem zodpovedá päťnásobku objemu pôdy. Suspenzia sa potom dôkladne pretrepáva päť minút a potom sa nechá usadnúť aspoň na 2 hodiny, ale nie dlhšie ako 24 hodín. Hodnota pH kvapalnej fázy sa potom odmeria pomocou pH-metra, ktorý sa pred každým meraním kalibruje pomocou vhodnej série tlmivých roztokov (napr. pH 4,0 a 7,0).
C.40. TEST TOXICITY ŽIVOTNÉHO CYKLU CHIRONOMIDAE V SYSTÉME SEDIMENT – VODA ZA POUŽITIA OBOHATENEJ VODY ALEBO OBOHATENÉHO SEDIMENTU
ÚVOD
|
1.
|
Táto testovacia metóda je rovnocenná s usmernením OECD na vykonávanie testov (TG) 233 (2010). Je určená na posúdenie účinkov celoživotnej expozície sladkovodných dvojkrídlovcov Chironomus sp. chemikáliám s úplným pokrytím 1. generácie (generácie P) a začiatku 2. generácie (generácie F1). Je rozšírením existujúcich testovacích metód C.28 (1) a C.27 (15) za použitia expozičného scenára s obohatenou vodou, resp. s obohateným sedimentom. Zohľadňuje existujúce protokoly o testoch toxicity Chironomus riparius a Chironomus dilutus [predchádzajúci názov C. tentans (2)], ktoré boli vypracované v Európe a Severnej Amerike (3) (4) (5) (6) (7) (8) (9) a následne podrobené kruhovým testom (1) (7) (10) (11) (12). Môžu sa použiť aj iné dobre zdokumentované druhy pakomárov, napr. Chironomus yoshimatsui (13) (14). Celkové trvanie expozície je približne 44 dní v prípade C. riparius a C. yoshimatsui a približne 100 dní v prípade C. dilutus.
|
|
2.
|
V tejto testovacej metóde je opísaný vodný i sedimentový expozičný scenár. Výber vhodného expozičného scenára závisí od plánovaného použitia testu. Vodný expozičný scenár zahŕňajúci obohatenie vodného stĺpca je určený na simuláciu prípadu postreku pesticídmi a zahŕňa počiatočnú maximálnu koncentráciu v povrchovej vode. Obohacovanie vody je užitočné aj pri iných druhoch expozície (vrátane chemických únikov), ale nie pri akumulačných procesoch v sedimente, ktoré trvajú dlhšie ako testovacie obdobie. V takom prípade a tiež vtedy, keď hlavným spôsobom vstupu pesticídov do vodných útvarov je odtok, môže byť vhodnejšou koncepcia s použitím obohateného sedimentu. V prípade záujmu o iné expozičné scenáre je možné test ľahko prispôsobiť. Ak je napríklad potrebné vyhnúť sa distribúcii testovanej chemikálie medzi vodnú fázu a vrstvu sedimentu a musí sa minimalizovať adsorpcia do sedimentu, možno zvážiť použitie náhradného umelého sedimentu (napr. kremenného piesku).
|
|
3.
|
Chemikálie, ktoré si vyžadujú testovanie organizmov žijúcich v sedimente, môžu v sedimentoch dlho pretrvávať. Organizmy žijúce v sedimente môžu byť exponované viacerými spôsobmi. Relatívny význam každého spôsobu expozície a časové obdobie, v ktorom sa každý z nich podieľa na celkových toxických účinkoch, závisia od fyzikálno-chemických vlastností danej chemikálie. V prípade silno adsorbujúcich chemikálií alebo chemikálií, ktoré sa kovalentne viažu na sediment, môže byť významným spôsobom expozície prijímanie kontaminovanej potravy. S cieľom nepodceniť toxicitu vysokolipofilných chemikálií možno zvážiť použitie potravy pridanej do sedimentu pred aplikáciou testovanej chemikálie (pozri bod 31). Je teda možné zahrnúť všetky spôsoby expozície a všetky štádiá života.
|
|
4.
|
Merané sledované parametre sú celkový počet vykuklených dospelých jedincov (pre 1. a 2. generáciu), miera vývinu (pre 1. a 2. generáciu), pomer pohlaví úplne vykuklených a živých dospelých jedincov (pre 1. a 2. generáciu), počet šnúr vajíčok na samičku (len pre 1. generáciu) a fertilita šnúr vajíčok (len pre 1. generáciu).
|
|
5.
|
Dôrazne sa odporúča použiť umelo pripravený sediment. Umelo pripravený sediment má oproti prírodným sedimentom viaceré výhody:
|
—
|
zníži sa variabilita pokusu, lebo umelo pripravený sediment vytvára reprodukovateľnú ‚štandardizovanú matricu‘ a odstráni sa potreba získať nekontaminovaný čistý sediment,
|
|
—
|
testy je možné začať kedykoľvek bez problému sezónnej variability v testovanom sedimente a nie je potrebné sediment vopred upraviť, aby sa odstránila pôvodná fauna,
|
|
—
|
nižšie náklady v porovnaní s terénnym zberom dostatočného množstva potrebného na bežné testovanie,
|
|
—
|
umelo pripravený sediment umožňuje porovnanie toxicity naprieč štúdiami a následné klasifikovať chemikálie (3).
|
|
|
6.
|
Vymedzenie pojmov je uvedené v dodatku 1.
|
PRINCÍP TESTU
|
7.
|
Larvy pakomárov v prvom instare sa exponujú rozsahu koncentrácií testovanej látky v systéme sediment – voda. Test sa začína umiestnením lariev v prvom instare (1. generácia) do testovacích kadičiek obsahujúcich obohatený sediment, prípadne sa testovaná chemikália aplikuje do vody po pridaní lariev. Vyhodnocuje sa vykuklenie pakomárov, čas do vykuklenia a pomer pohlaví úplne vykuklených a živých pakomárov. Vykuklené dospelé jedince sa prenesú do chovných klietok na uľahčenie rojenia, párenia a kladenia vajíčok. Vyhodnotí sa počet vyprodukovaných šnúr vajíčok a ich fertilita. Z týchto šnúr vajíčok sa získajú larvy 2. generácie v prvom instare. Tieto larvy sa umiestnia do čerstvo pripravených testovacích kadičiek (postup obohacovania ako pre 1. generáciu) na účely určenia životaschopnosti 2. generácie prostredníctvom vyhodnotenia vykuklenia, času do vykuklenia a pomeru pohlaví úplne vykuklených a živých pakomárov (schematické znázornenie testu životného cyklu je uvedené v dodatku 5). Všetky údaje sa analyzujú buď prostredníctvom regresného modelu na odhadnutie koncentrácie, ktorá by spôsobila X % pokles príslušného sledovaného parametra alebo prostredníctvom testovania hypotézy na stanovenie koncentrácie bez pozorovaného účinku (NOEC). Pri druhom spôsobe je potrebné pomocou štatistických testov porovnať reakcie na chemikáliu s príslušnými kontrolnými reakciami. Treba poznamenať, že v scenári s obohatenou vodou môžu byť v prípade rýchlo degradujúcich chemikálií neskoršie životné štádiá každej generácie (napr. štádium kukly) vystavené podstatne nižšej úrovni koncentrácie v nadložnej vode ako larvy v 1. instare. Ak to predstavuje problém a je potrebná porovnateľná úroveň expozície každého životného štádia, treba zvážiť tieto úpravy testovacej metódy:
|
—
|
paralelné pokusy s obohatením v rôznych životných štádiách alebo
|
|
—
|
opakované obohatenie (alebo obnovenie nadložnej vody) testovacieho systému počas obidvoch fáz testovania (1. a 2. generácia), pričom intervaly obohacovania (obnovenia) by sa mali prispôsobiť charakteru osudu testovanej chemikálie.
|
Tieto zmeny sú možné iba v scenári s obohatenou vodou, ale nie v scenári s obohateným sedimentom.
|
INFORMÁCIE O TESTOVANEJ CHEMIKÁLII
|
8.
|
Je potrebné poznať rozpustnosť testovanej chemikálie vo vode, jej tlak pary, hodnotu log K
ow, namerané alebo vypočítané delenie do sedimentu a stabilitu vo vode a v sedimente. Mala by byť k dispozícii spoľahlivá analytická metóda so známou a zdokumentovanou presnosťou a detekčným limitom na kvantifikáciu testovanej chemikálie v nadložnej vode, vode nachádzajúcej sa v póroch sedimentu a sedimente. Medzi užitočné informácie patrí štruktúrny vzorec a čistota testovanej chemikálie. Užitočnou informáciou je tiež chemický osud testovanej chemikálie (napr. rozptýlenie abiotická a biotická degradácia atď.). Ďalšie usmernenia pre testované chemikálie s fyzikálno-chemickými vlastnosťami, ktoré sťažujú ich testovanie, sú uvedené v literatúre (16).
|
REFERENČNÉ CHEMIKÁLIE
|
9.
|
Referenčné chemikálie sa môžu testovať pravidelne ako prostriedok na zabezpečenie, že sa nezmenila citlivosť laboratórnej populácie. Tak ako v prípade dafnií stačí vykonať 48-hodinový test akútnej toxicity (podľa bodu 17). Kým však nebude k dispozícii validované usmernenie pre akútnu toxicitu, možno zvážiť použitie testu chronickej toxicity podľa kapitoly C.28 tejto prílohy. Príkladmi referenčných toxických látok, ktoré sa úspešne používajú v kruhových testoch a validačných štúdiách, sú: lindán, trifluralín, pentachlórfenol, chlorid kademnatý a chlorid draselný (1) (3) (6) (7) (18).
|
VALIDITA TESTU
|
10.
|
Na to, aby bol test platný, musí spĺňať tieto podmienky:
|
—
|
priemerné vykuklenie v kontrolnej skupine musí byť na konci obdobia expozície na úrovni aspoň 70 % v obidvoch generáciách (1) (7),
|
|
—
|
v prípade C. riparius a C. yoshimatsui by sa 85 % z celkového počtu vykuklených dospelých pakomárov z kontrolnej skupiny v obidvoch generáciách malo objaviť do 12 – 23 dní po vložení lariev v prvom instare do nádob, v prípade C. dilutus je prijateľné obdobie 20 – 65 dní,
|
|
—
|
priemerný pomer pohlaví úplne vykuklených a živých dospelých jedincov (ako podiel samčekov alebo samičiek) v kontrolnej skupine v obidvoch generáciách by mal byť aspoň 0,4, ale nie vyšší ako 0,6,
|
|
—
|
v každej chovnej klietke by počet šnúr vajíčok v kontrolných skupinách 1. generácie mal byť aspoň 0,6 na samičku pridanú do chovnej klietky,
|
|
—
|
podiel fertilných šnúr vajíčok v každej chovnej klietke s kontrolnou skupinou 1. generácie by mal byť aspoň 0,6,
|
|
—
|
na konci obdobia expozície pre obidve generácie je potrebné odmerať v každej nádobe pH a koncentráciu rozpusteného kyslíka. Koncentrácia kyslíka by mala predstavovať aspoň 60 % hodnoty rozpustnosti vzdušného kyslíka (ASV (24)) a hodnota pH nadložnej vody by mala byť v rozmedzí 6 – 9 vo všetkých testovacích nádobách,
|
|
—
|
teplota vody by sa nemala líšiť o viac ako ± 1,0 °C.
|
|
OPIS METÓDY
Testovacie nádoby a chovné klietky
|
11.
|
Larvy sa vystavia vplyvu v 600 ml sklenených kadičkách s priemerom približne 8,5 cm (pozri dodatok 5). Sú vhodné aj iné nádoby, ale musia zaručiť vhodnú hĺbku nadložnej vody a sedimentu. Povrch sedimentu by mal byť dostatočne veľký, aby poskytoval 2 – 3 cm2 na larvu. Pomer hĺbky vrstvy sedimentu k hĺbke nadložnej vody by mal byť približne 1: 4. Mali by sa použiť chovné klietky (minimálne 30 cm vo všetkých troch rozmeroch) s gázou (veľkosť ôk približne 1 mm) aspoň na vrchu a jednej strane klietky (pozri dodatok 5). Do každej klietky sa umiestni 2 l kryštalizačná miska obsahujúca vodu použitú na testovanie a sediment na účely kladenia vajíčok. Pomer hĺbky vrstvy sedimentu k hĺbke nadložnej vody by aj v kryštalizačnej miske mal byť približne 1: 4. Po pozbieraní šnúr vajíčok z kryštalizačnej misky sa šnúry umiestnia na 12-jamkové mikrotitračné platne (jedna šnúra na jamku obsahujúcu aspoň 2,5 ml vody z obohatenej kryštalizačnej misky). Platne sa zakryjú vekom, aby sa zabránilo výraznému vyparovaniu. Možno použiť aj iné nádoby vhodné na uchovávanie šnúr vajíčok. S výnimkou mikrotitračných platní by všetky testovacie nádoby a iné prístroje, ktoré prichádzajú do styku s testovacím systémom, mali byť vyrobené výlučne zo skla alebo iného chemicky inertného materiálu (napr. polytetrafluóretylénu).
|
Výber druhov
|
12.
|
Uprednostňovaným druhom na použitie v teste je Chironomus riparius. Možno použiť aj C. yoshimatsui. C. dilutus je takisto vhodný, ale je náročnejší na manipuláciu a vyžaduje si dlhšie trvanie testu. Podrobné údaje o kultivačných metódach pre C. riparius sú uvedené v dodatku 2. Informácie o kultivačných podmienkach sú k dispozícii aj pre C. dilutus (5) a C. yoshimatsui (14). Pred testovaním by sa mala potvrdiť identifikácia druhov, ale nevyžaduje sa pred každým testom ak organizmy pochádzajú z internej kultúry.
|
Sediment
|
13.
|
Uprednostňuje sa použitie umelo pripraveného sedimentu (známeho aj pod názvom rekonštituovaný, umelý alebo syntetický sediment). Ak sa však použije prírodný sediment, je potrebné ho charakterizovať (aspoň pH, obsah organického uhlíka, odporúča sa aj stanovenie ďalších parametrov ako pomer C/N a granulometria) a nemal by obsahovať žiadnu kontamináciu ani iné organizmy, ktoré by mohli s larvami pakomárov súperiť alebo ich požierať. Takisto sa odporúča, aby sa pred testovaním sedimenty sedem dní uvádzali do testovacích podmienok. Odporúča sa (1) (20) (21) použiť tento umelo pripravený sediment opísaný v literatúre (1):
|
a)
|
4 – 5 % (suchá hmotnosť) rašeliny: čo najbližšie k pH 5,5 – 6,0. Je dôležité použiť rašelinu v práškovej forme, jemne rozomletú (veľkosť častíc ≤1 mm) a sušenú iba vzduchom;
|
|
b)
|
20 % (suchá hmotnosť) kaolínu (obsah kaolinitu podľa možnosti nad 30 %);
|
|
c)
|
75 – 76 % (suchá hmotnosť) kremenného piesku (mal by prevládať jemný piesok s viac ako 50 % častíc s veľkosťou od 50 do 200 μm);
|
|
d)
|
pridá sa deionizovaná voda, aby sa dosiahla vlhkosť konečnej zmesi v rozsahu 30 – 50 %;
|
|
e)
|
pridá sa uhličitan vápenatý chemicky čistej kvality (CaCO3), aby sa pH konečnej zmesi sedimentu upravilo na 7,0 ± 0,5;
|
|
f)
|
obsah organického uhlíka v konečnej zmesi by mal byť 2 % (± 0,5 %) a je potrebné ho upraviť pomocou primeraného množstva rašeliny a piesku podľa písmen a) a c).
|
|
|
14.
|
Zdroj rašeliny, kaolínu a piesku by mal byť známy. Je potrebné skontrolovať, či zložky sedimentu neobsahujú chemickú kontamináciu (napr. ťažké kovy, organochlórové zlúčeniny, organofosforové zlúčeniny). Príklad prípravy umelo pripraveného sedimentu je uvedený v dodatku 3. Miešanie suchých zložiek je takisto prípustné ak sa preukáže, že po pridaní nadložnej vody nedochádza k separácii zložiek sedimentu (napr. k vyplaveniu častíc rašeliny) a že rašelina alebo sediment sú v dostatočne uvedené do podmienok.
|
Voda
|
15.
|
Každá voda, ktorá vyhovuje chemickým charakteristikám prijateľnej riediacej vody podľa zoznamu uvedeného v dodatkoch 2 a 4, je vhodná ako voda použitá na testovanie. Každá vhodná voda, prírodná voda (povrchová alebo podzemná voda), rekonštituovaná voda (pozri dodatok 2) alebo odchlórovaná voda z vodovodu sú prijateľné ako kultivačná voda a voda použitá na testovanie ak v nej pakomáre prežijú počas celej kultivácie a testovania bez známok stresu. Na začiatku testu by pH vody použitej na testovanie malo mať hodnotu 6 až 9 a celková tvrdosť by nemala byť vyššia ako 400 mg/l pre CaCO3. Ak však existuje podozrenie na interakciu medzi iónmi tvrdosti a testovanou chemikáliou, mala by sa použiť voda s nižšou tvrdosťou (a v takom prípade sa teda nesmie použiť Elendtovo médium M4). Počas celej štúdie by sa mal používať rovnaký druh vody. Charakteristiky kvality vody uvedené v dodatku 4 by sa mali merať najmenej dvakrát za rok alebo ak existuje podozrenie, že sa tieto charakteristiky mohli významne zmeniť.
|
Zásobné roztoky – obohatená voda
|
16. a.
|
Testované koncentrácie sa vypočítajú na základe koncentrácií vo vodnom stĺpci, t. j. vody nad sedimentom. Testovacie roztoky vybratých koncentrácií sa zvyčajne pripravujú zriedením zásobného roztoku. Zásobné roztoky sa podľa možnosti pripravujú rozpustením testovanej chemikálie vo vode použitej na testovanie. V niektorých prípadoch môže byť na vytvorenie vhodne koncentrovaného zásobného roztoku potrebné použiť rozpúšťadlá alebo disperganty. Príkladmi vhodných rozpúšťadiel sú acetón, etylénglykolmonoetyléter, etylénglykoldimetyléter, dimetylformamid a trietylénglykol. Ako disperganty možno použiť Cremophor RH40, Tween 80, 0,01 % metylcelulózu a HCO-40. Koncentrácia solubilizačného prostriedku v konečnom testovacom médiu by mala byť minimálna (t. j. ≤ 0,1 ml/l) a mala by byť pre všetky testované koncentrácie chemikálie rovnaká. Ak sa použije solubilizačný prostriedok, nesmie mať žiadne významné účinky na prežívanie na základe porovnania kontrolnej skupiny s rozpúšťadlom s negatívnou (vodnou) kontrolnou skupinou. Je však potrebné vynaložiť maximálne úsilie, aby sa predišlo použitiu takýchto materiálov.
|
Zásobné roztoky – obohatené sedimenty
|
16. b.
|
Obohatené sedimenty vybratej koncentrácie sa zvyčajne pripravujú pridaním roztoku testovanej chemikálie priamo do sedimentu. Zásobný roztok testovanej chemikálie rozpustenej v deionizovanej vode sa zmieša s umelo pripraveným sedimentom pomocou valcovne, stroja na miešanie krmív alebo ručným miešaním. Ak je testovaná chemikália slabo rozpustná vo vode, možno ju rozpustiť v čo najmenšom objeme vhodného organického rozpúšťadla (napr. hexánu acetónu alebo chloroformu). Tento roztok sa následne zmieša s 10 g jemného kremenného piesku na každú testovaciu nádobu. Počká sa, kým sa rozpúšťadlo odparí, pričom sa musí z piesku celkom odstrániť. Piesok sa potom zmieša s vhodným množstvom sedimentu. Na rozpustenie, dispergovanie alebo emulgovanie testovanej chemikálie možno použiť iba látky, ktoré sú ľahko prchavé. Treba mať na zreteli, že pri príprave sedimentu je nutné zohľadniť piesok, ktorý pochádza z testovanej chemikálie a pieskovej zmesi (sediment by sa teda mal pripraviť s menším množstvom piesku). Je nutné zabezpečiť, aby sa testovaná chemikália pridávaná do sedimentu v sedimente dôkladne a rovnomerne distribuovala. V prípade potreby možno na účely stanovenia stupňa homogenity analyzovať podvzorky.
|
KONCEPCIA TESTU
|
17.
|
Koncepcia testu sa vzťahuje na výber počtu a odstup testovaných koncentrácií, počet nádob pre každú koncentráciu, počet lariev v každej nádobe, počet kryštalizačných misiek a chovných klietok. Ďalej sú opísané koncepcie na stanovenie hodnôt ECx a NOEC a na vykonanie limitného testu.
|
Koncepcia regresnej analýzy
|
18.
|
Účinná koncentrácia (ECx) a koncentračný rozsah, v ktorom sa skúmajú účinky testovanej chemikálie, sa majú odmerať takým testom, aby sa sledovaný parameter neextrapoloval za hranice vytvorených údajov. Je potrebné vyhýbať sa extrapolácii pod najnižšou alebo nad najvyššou koncentráciou. Pri výbere vhodného rozsahu testovaných koncentrácií môže byť užitočný predbežný test na určenie koncentračného rozsahu testovanej látky podľa testovacej metódy C.27 alebo C.28.
|
|
19.
|
Ak sa používa hodnota ECx, je potrebných aspoň päť koncentrácií a osem replikátov pre každú koncentráciu. Pre každú koncentráciu je potrebné použiť dve chovné klietky (A a B). Osem replikátov sa rozdelí na dve skupiny po štyroch replikátoch pre každú chovnú klietku. Toto zlúčenie replikátov je nutné vzhľadom na počet pakomárov potrebný v klietke na presné vyhodnotenie rozmnožovania. Druhá generácia však už má zase osem replikátov, ktoré pochádzajú z populácií vystavených vplyvu v chovných klietkach. Faktor medzi koncentráciami by nemal byť väčší ako dva (v prípadoch, keď má krivka závislosti reakcie od dávky plytký sklon, možno urobiť výnimku). Počet replikátov pri každej testovanej koncentrácii chemikálie sa môže znížiť na šesť (tri na každú chovnú klietku) ak sa zvýši počet testovaných koncentrácií s rozdielnymi reakciami. Zvýšenie počtu replikátov alebo skrátenie dĺžky intervalov testovaných koncentrácií zvyčajne vedie k užším intervalom spoľahlivosti pre hodnotu ECx.
|
Koncepcia odhadu NOEC
|
20.
|
V prípade prístupu NOEC by sa malo použiť päť testovaných koncentrácií s minimálne ôsmimi replikátmi (štyri na každú chovnú klietku a a B) a faktor medzi koncentráciami by nemal byť väčší ako dva. Počet replikátov by mal byť dostatočný na zabezpečenie primeranej štatistickej spoľahlivosti na zistenie rozdielu 20 % oproti kontrolnej skupine na hladine významnosti 5 % (α = 0,05). V prípade miery vývinu, plodnosti a fertility je zvyčajne vhodná analýza rozptylu (ANOVA) s následným Dunnettovým testom alebo Williamsovým testom (22 – 25). V prípade pomeru vykuklenia a pomeru pohlaví môže byť vhodný Cochranov-Armitageho test, Fisherov exaktný test (s Bonferroniho korekciou) alebo Mantelov-Haentzalov test.
|
Limitný test
|
21.
|
Môže sa vykonať limitný test (jedna testovaná koncentrácia a kontrolná/kontrolné skupina/skupiny) ak sa vo voliteľnom predbežnom teste na určenie koncentračného rozsahu testovanej látky nepozorovali žiadne účinky až po maximálnu koncentráciu. Účelom limitného testu je preukázať, že prípadné toxické účinky testovanej chemikálie sa vyskytujú pri vyššej koncentrácii ako testovaná limitná koncentrácia. V prípade vody sa odporúča 100 mg/l a v prípade sedimentu 1 000 mg/kg (suchá hmotnosť). Zvyčajne je na testovanú koncentráciu chemikálie a kontrolnú skupinu potrebných najmenej osem replikátov. Je nutné preukázať primeranú štatistickú spoľahlivosť na zistenie rozdielu 20 % od kontrolnej skupiny na hladine významnosti 5 % (α = 0,05). V prípade metrických reakcií (napr. miery vývinu) je vhodnou štatistickou metódou t-test, pokiaľ údaje spĺňajú požiadavky tohto testu (normalita, homogénne rozptyly). Ak tieto požiadavky nie sú splnené, môže sa použiť t-test s nerovnomerným rozptylom alebo neparametrický test, napríklad Wilcoxonov-Mannov-Whitheyho test. V prípade pomeru vykuklenia je vhodný Fisherov exaktný test.
|
POSTUP
Podmienky expozície
Príprava systému voda – sediment (obohatenie vody)
|
22. a.
|
Do každej testovacej nádoby a kryštalizačnej misky sa pridá umelo pripravený sediment (pozri body 13 až 14 a dodatok 3), aby sa vytvorila vrstva hrubá aspoň 1,5 cm (v prípade kryštalizačnej misky môže byť o niečo nižšia), ale maximálne 3 cm. Voda (pozri bod 15) sa pridá tak, aby pomer hĺbky vrstvy sedimentu a hĺbky vody nepresiahol 1: 4. Po príprave testovacích nádob by sa mal systém sediment – voda nechať jemne prevzdušňovať počas približne siedmich dní pred pridaním lariev v prvom instare 1. alebo 2. generácie (pozri bod 14 a dodatok 3). Systém sediment – voda v kryštalizačných miskách sa počas testu neprevzdušňuje, lebo nie je potrebné podporovať prežívanie lariev (šnúry vajíčok sa už pred vyliahnutím pozbierali). S cieľom zabrániť separácii zložiek sedimentu a resuspendovaniu jemného materiálu počas pridávania vody použitej na testovanie do vodného stĺpca môže byť sediment v čase, keď sa naň nalieva voda, prikrytý plastovým kotúčom, ktorý sa ihneď potom odstráni. Iné zariadenia môžu byť tiež vhodné.
|
Príprava systému voda – sediment (obohatený sediment)
|
22. b.
|
Obohatené sedimenty pripravené podľa bodu 16. b. sa umiestnia do nádob a kryštalizačnej misky, do ktorých sa pridá nadložná voda, aby sa vytvoril objemový pomer sediment – voda 1: 4. Hĺbka vrstvy sedimentu by mala byt v rozsahu 1,5 – 3 cm (v prípade kryštalizačnej misky môže byť o niečo nižšia). S cieľom zabrániť separácii zložiek sedimentu a resuspendovaniu jemného materiálu počas pridávania testovacej vody do vodného stĺpca môže byť sediment v čase, keď sa naň nalieva voda, prikrytý plastovým kotúčom, ktorý sa ihneď potom odstráni. Iné zariadenia môžu byť tiež vhodné. Keď je obohatený sediment s nadložnou vodou pripravený, je potrebné umožniť delenie testovanej chemikálie zo sedimentu do vodnej fázy (4) (5) (7) (18). To by sa podľa možnosti malo vykonať za rovnakých teplotných a prevzdušňovacích podmienok aké sa použijú v teste. Primeraný čas dosahovania rovnováhy závisí od konkrétneho sedimentu a chemikálie a môže trvať niekoľko hodín až dní a v zriedkavých prípadoch až päť týždňov. Keďže tým by sa poskytol čas na degradáciu mnohých chemikálií, na dosiahnutie rovnováhy sa nečaká, ale odporúča sa, aby obdobie dosahovania rovnováhy trvalo 48 hodín. Ak je však známe, že polčas degradácie chemikálie v sedimente bude dlhý (pozri bod 8), čas dosahovania rovnováhy sa môže predĺžiť. Na konci tohto ďalšieho obdobia dosahovania rovnováhy sa odmeria koncentrácia testovanej chemikálie v nadložnej vode, vode nachádzajúcej sa v póroch sedimentu a sedimente aspoň pri najvyššej koncentrácii a pri jednej nižšej koncentrácii (pozri bod 38). Tieto analytické stanovenia testovanej chemikálie umožňujú výpočet hmotnostnej bilancie a vyjadrenie výsledkov na základe meraných koncentrácií.
|
|
23.
|
Testovacie nádoby sa zakryjú (napr. sklenenými platňami). V prípade potreby sa počas štúdie môže dopĺňať hladina vody na pôvodný objem s cieľom kompenzovať vyparovanie. Na tento účel sa použije destilovaná alebo deionizovaná voda, aby sa predišlo hromadeniu solí. Kryštalizačné misky v chovných klietkach nie sú zakryté a môže, ale nemusí byť potrebné upraviť ich s cieľom kompenzovať stratu vody počas testovacieho obdobia, lebo šnúry vajíčok sú v styku s vodou približne len jeden deň a misky sa používajú iba počas krátkej fázy testu.
|
Pridanie testovacích organizmov
|
24.
|
Štyri až päť dní pred pridaním lariev v prvom instare 1. generácie sa z kultúry odoberú vaječné hmoty a umiestnia sa do malých nádob s kultivačných médiom. Môže sa použiť staršie médium zo zásobnej kultúry alebo čerstvo pripravené médium. V každom prípade je potrebné do kultivačného média pridať malé množstvo potravy, napr. niekoľko kvapiek filtrátu z jemne rozomletej suspenzie vločkového krmiva pre ryby (pozri dodatok 2). Použijú sa iba čerstvo nakladené vaječné hmoty. Larvy sa zvyčajne začnú liahnuť niekoľko dní po nakladení vajíčok (dva až tri dni v prípade C. riparius pri teplote 20 C a jeden až štyri dni v prípade C. dilutus pri teplote 23 °C a C. yoshimatsui pri teplote 25 °C) a rast lariev prebieha v štyroch instaroch, z ktorých každý trvá štyri až osem dní. V teste sa použijú larvy v prvom instare (maximálne 48 hodín po vyliahnutí). Instarové štádium lariev je potenciálne možné skontrolovať podľa šírky hlavového segmentu (7).
|
|
25.
|
Dvadsať lariev v prvom instare 1. generácie sa pomocou tupej pipety náhodne rozdelí do jednotlivých testovacích nádob obsahujúcich systém sediment – voda. Prevzdušňovanie vody sa počas pridávania lariev do testovacích nádob preruší a zostane prerušené počas 24 hodín po pridaní lariev (pozri bod 32). Podľa použitej koncepcie testu (pozri body 19 a 20) je počet lariev použitých pri každej koncentrácii aspoň 120 (šesť replikátov na koncentráciu) v prípade použitia hodnoty ECx a 160 v prípade prístupu NOEC (osem replikátov na koncentráciu). V koncepcii s obohateným sedimentom sa expozícia začína pridaním lariev.
|
Obohatenie nadložnej vody
|
26.
|
Dvadsaťštyri hodín po pridaní lariev v prvom instare 1. generácie sa testovaná chemikália aplikuje do nadložného vodného stĺpca a znova sa začne s jemným prevzdušňovaním (pokiaľ ide o možné zmeny koncepcie testu, pozri bod 7). Pod povrch vody sa pomocou pipety aplikujú malé množstvá zásobných roztokov testovanej chemikálie. Nadložná voda sa potom opatrne premieša, aby sa nenarušil sediment. V koncepcii s obohatenou vodou sa expozícia začína obohatením vody (t. j. jeden deň po pridaní lariev).
|
Zber vykuklených dospelých jedincov
|
27.
|
Vykuklené pakomáre 1. generácie sa z testovacích nádob zbierajú aspoň raz, ale podľa možnosti dvakrát denne (pozri bod 36) s použitím odsávačky, exhaustora alebo podobného zariadenia (pozri dodatok 5). Treba dbať najmä na to, aby sa dospelé jedince nepoškodili. Pozbierané pakomáre zo štyroch testovacích nádob z jednej skupiny s aplikovanou chemikáliou sa vypustia do chovnej klietky, do ktorej boli vopred pridelené. V deň prvého vykuklenia (samčekov) sa do kryštalizačných misiek pipetou aplikuje malý objem zásobného roztoku testovanej chemikálie pod vodnú hladinu (koncepcia s obohatenou vodou). Nadložná voda sa potom opatrne premieša, aby sa nenarušil sediment. Koncentrácia testovanej chemikálie v kryštalizačnej miske je nominálne rovnaká ako v nádobách s aplikovanou chemikáliou, ktoré sú priradené k danej chovnej klietke. V prípade koncepcie s obohateným sedimentom sa kryštalizačné misky pripravia približne na 11. deň po začatí expozície (t. j. po pridaní lariev 1. generácie), aby mohlo dôjsť k dosihnutiu rovnováhy počas približne 48 hodín pred nakladením prvých šnúr vajíčok.
|
|
28.
|
Šnúry vajíčok sa pozbierajú z kryštalizačnej misky v chovnej klietke pomocou pinzety alebo tupej pipety. Každá šnúra vajíčok sa umiestni do nádoby obsahujúcej kultivačné médium z kryštalizačnej misky, z ktorej bola odobratá (napr. do jamky v 12-jamkovej mikrotitračnej platni aspoň s 2,5 ml média). Nádoby so šnúrami vajíčok sa zakryjú vekom, aby sa zabránilo výraznému vyparovaniu. Šnúry vajíčok sa uchovávajú na pozorovanie aspoň šesť dní po tom ako sa nakladú, aby sa mohli klasifikovať ako fertilné alebo nefertilné.
Na účely začiatku 2. generácie sa aspoň tri, ale radšej šesť fertilných šnúr vajíčok vyberie z každej chovnej klietky, pridá sa trocha potravy a nechá sa vyliahnuť. Tieto šnúry vajíčok by mali byť nakladené na vrchole obdobia kladenia vajíčok, ktorý sa v kontrolných skupinách za normálnych okolností vyskytuje okolo 19. dňa testu. V ideálnom prípade sa 2. generácia pre všetky skupiny s aplikovanou chemikáliou začína v ten istý deň, ale v dôsledku účinkov súvisiacich s chemikáliou na vývin lariev to nie je vždy možné. V takom prípade sa 2. generácie pre vyššie koncentrácie môžu začať neskôr ako pre nižšie koncentrácie a kontrolnú skupinu (s rozpúšťadlom).
|
|
29. a.
|
V prípade koncepcie s obohatenou vodou sa systém sediment – voda pre 2. generáciu pripraví aplikovaním testovanej chemikálie do nadložného vodného stĺpca približne 1 hodinu pred pridaním lariev v prvom instare do testovacích nádob. Pod povrch vody sa pomocou pipety aplikujú malé množstvá roztokov testovanej chemikálie. Nadložná voda sa potom opatrne premieša, aby sa nenarušil sediment. Po obohatení sa začne mierne prevzdušňovanie.
|
|
29. b.
|
V prípade koncepcie s obohateným sedimentom sa expozičné nádoby obsahujúce systém sediment – voda pre 2. generáciu pripravia rovnakým spôsobom ako v prípade 1. generácie.
|
|
30.
|
Dvadsať lariev v prvom instare (maximálne 48 hod. po vyliahnutí) 2. generácie sa pomocou tupej pipety náhodne rozdelí do jednotlivých testovacích nádob obsahujúcich systém obohatený sediment – voda. Prevzdušňovanie vody by sa počas pridávania lariev v prvom instare do testovacích nádob malo prerušiť a malo by zostať prerušené počas ďalších 24 hodín po pridaní lariev. Podľa použitej koncepcie testu (pozri body 19 a 20) je počet lariev použitých pri každej koncentrácii aspoň 120 (šesť replikátov na koncentráciu) v prípade použitia hodnoty ECx a 160 v prípade prístupu NOEC (osem replikátov na koncentráciu).
|
Potrava
|
31.
|
Je nevyhnutné, aby sa larvy v testovacích nádobách kŕmili podľa možnosti každý deň alebo najmenej trikrát do týždňa. V prvých desiatich dňoch vývinu je pre mladé larvy vhodné krmivo pre ryby (suspenzia vo vode alebo jemne rozomletá potrava, napr. Tetra-Min alebo Tetra-Phyll, bližšie informácie pozri v dodatku 2) v dennom množstve 0,25 – 0,5 mg (0,35 – 0,5 mg pre C. yoshimatsui) na jednu larvu. Pre staršie larvy môže byť potrebné o niečo väčšie množstvo potravy: denné množstvo 0,5 – 1,0 mg na jednu larvu by malo po zvyšok testu postačovať. Ak sa pozoruje rast plesní alebo ak sa v kontrolných nádobách pozoruje úmrtnosť, prídel potravy by sa mal vo všetkých testovacích a kontrolných nádobách znížiť. Ak nie je možné vznik plesní zastaviť, test je potrebné zopakovať.
Toxikologický význam expozície prostredníctvom požitia je vo všeobecnosti vyšší v prípade chemikálií s vysokou afinitou k organickému uhlíku alebo chemikálií, ktoré sa kovalentne viažu na sediment. Preto sa pri testovaní chemikálií s týmito vlastnosťami môže do umelo pripraveného sedimentu pred stabilizačným obdobím pridať množstvo potravy potrebné na zabezpečenie prežitia a prirodzeného rastu lariev v závislosti od regulačných požiadaviek. S cieľom predísť zhoršeniu kvality vody sa má namiesto krmiva pre ryby použiť rastlinný materiál, napr. sa môže pridať 0,5 % (suchá hmotnosť) jemne rozomletých listov pŕhľavy dvojdomej (Urtica dioica), moruše (Morus alba), ďateliny plazivej (Trifolium repens), špenátu (Spinacia oleracea) alebo iného rastlinného materiálu (Cerophyl alebo α-celulóza). Pridanie celej dávky zdroja organickej potravy do sedimentu pred obohatením nie je triválne, pokiaľ ide o kvalitu vody a biologické vlastnosti (21) ani nejde o štandardizovanú metódu, no z posledných štúdií vyplýva, že táto metóda funguje (19) (26). Dospelé pakomáre v chovnej klietke normálne nepotrebujú žiadne kŕmenie, ale plodnosť a fertilita sa zvýšia, keď sa ako zdroj potravy pre vykuklené dospelé jedince použije vatový tampón napustený nasýteným sacharózovým roztokom (34).
|
Podmienky inkubácie
|
32.
|
Po 24 hodinách od pridania lariev v prvom instare obidvoch generácií sa zabezpečí jemné prevzdušňovanie nadložnej vody v testovacích nádobách a pokračuje sa v ňom počas celého testu (treba dbať na to, aby koncentrácia rozpusteného kyslíka neklesla pod 60 % ASV). Prevzdušňovanie sa zabezpečí pomocou sklenenej Pasteurovej pipety, ktorej vývod sa upevní 2 – 3 cm nad vrstvou sedimentu tak, aby bol prietok niekoľko bublín za sekundu. Ak sa testujú prchavé chemikálie, je potrebné zvážiť možnosť, že systém sediment – voda sa nebude prevzdušňovať, zároveň sa však musí splniť kritérium validity minimálne 60 % ASV (bod 10). Ďalšie usmernenia sa nachádzajú v literatúre (16).
|
|
33.
|
Test s C. riparius sa vykonáva pri konštantnej teplote 20 °C (± 2 °C). V prípade C. dilutus a C. yoshimatsui sa odporúča teplota 23 °C, resp. 25 °C (± 2 °C). Použije sa 16-hodinová fotoperióda, pričom intenzita svetla by mala byť 500 – 1 000 luxov. V chovných klietkach možno navyše pridať jednohodinovú fázu úsvitu a súmraku.
|
Trvanie expozície
|
34.
|
Koncepcia s obohatenou vodou: obdobie expozície 1. generácie sa začína, keď sa testovaná chemikália aplikuje do nadložnej vody v testovacej nádobe (čo je jeden deň po vložení lariev – pokyny na možné zmeny koncepcie expozície sa nachádzajú v bode 7). Expozícia 2. generácie lariev sa začína ihneď, lebo sa vkladajú do systému sediment – voda, ktorý už bol obohatený. Maximálne trvanie expozície pre 1. generáciu je 27 dní a pre 2. generáciu 28 dní (larvy 1. generácie strávia jeden deň v nádobách bez expozície) v prípade C. riparius a C. yoshimatsui. Vzhľadom na prekrývanie je celkové trvanie testu približne 44 dní. V prípade C. dilutus je maximálne trvanie expozície 64 dní pre 1. generáciu a 65 dní pre 2. generáciu. Celkové trvanie je približne 100 dní.
Koncepcia s obohateným sedimentom: expozícia sa začína pridaním lariev a trvá maximálne 28 dní pre obe generácie v prípade C. riparius a C. yoshimatsui a maximálne 65 dní pre obe generácie v prípade C. dilutus.
|
Pozorovania
Vykuklenie
|
35.
|
Určí sa čas vývinu a celkový počet úplne vykuklených a živých samčích a samičích pakomárov pre obidve generácie. Samčekovia sa ľahko identifikujú podľa obrvených tykadiel a tenkého tela.
|
|
36.
|
Testovacie nádoby pre obidve generácie je potrebné pozorovať najmenej trikrát do týždňa s cieľom vizuálne vyhodnotiť každé abnormálne správanie lariev (napr. opustenie sedimentu, nezvyčajné plávanie) v porovnaní s kontrolnou skupinou. Počas obdobia vykuklovania, ktoré v prípade C. riparius a C. yoshimatsui začína približne 12 dní po vložení lariev (20 dní v prípade C. dilutus), sa vykuklené pakomáre aspoň raz, ale podľa možnosti dvakrát denne (skoro ráno a neskoro popoludní) spočítajú a určí sa ich pohlavie. Po identifikácii sa pakomáre 1. generácie opatrne vyberú z nádob a prenesú do chovnej klietky. Pakomáre 2. generácie sa po identifikácii vyberú a usmrtia. Všetky šnúry vajíčok 1. generácie nakladené v testovacích nádobách sa majú jednotlivo pozbierať a preniesť aspoň s 2,5 ml natívnej vody na 12-jamkové mikrotitračné platne (alebo iné vhodné nádoby) zakryté vekom, aby sa zabránilo výraznému vyparovaniu. Zaznamená sa tiež počet mŕtvych lariev a viditeľných kukiel, ktoré sa nevykuklili. Príklady chovnej klietky, testovacej nádoby a exhaustora sú uvedené v dodatku 5.
|
Rozmnožovanie
|
37.
|
Účinky na rozmnožovanie sa posudzujú na základe počtu šnúr vajíčok vyprodukovaných 1. generáciou pakomárov a fertility týchto šnúr vajíčok. Raz denne sa šnúry vajíčok pozbierajú z kryštalizačnej misky, ktorá je umiestnená v každej chovnej nádobe. Šnúry vajíčok sa majú pozbierať a preniesť aspoň s 2,5 ml natívnej vody na 12-jamkovú mikrotitračnú platňu (jedna šnúra vajíčok do každej jamky) alebo iných vhodných nádob zakrytých vekom, aby sa zabránilo výraznému vyparovaniu. Pre každú šnúru vajíčok sa zdokumentujú tieto vlastnosti: deň produkcie, veľkosť (normálna, t. j. 1,0 cm ± 0,3 cm alebo malá, zvyčajne ≤ 0,5 cm), štruktúra (normálna = tvar banánu so špirálovou šnúrou vajíčok alebo abnormálna, napr. šnúra vajíčok bez špirály) a fertilita (fertilná alebo nefertilná). V priebehu šiestich dní po nakladení sa vyhodnotí fertilita šnúry vajíčok. Šnúra vajíčok sa považuje za fertilnú, keď sa vyliahne aspoň jedna tretina vajíčok. Celkový počet samičiek pridaných do chovnej klietky sa použije na výpočet počtu šnúr vajíčok na samičku a počtu fertilných šnúr vajíčok na samičku. Ak to je potrebné, počet vajíčok na šnúru vajíčok možno odhadnúť nedeštruktívnym spôsobom pomocou kruhovej metódy počítania (opísanej v odkazoch 32 a 33).
|
Analytické merania
Koncentrácia testovanej chemikálie
|
38.
|
Vzorky nadložnej vody, vody nachádzajúcej sa v póroch sedimentu a sedimentu sa majú analyzovať minimálne na začiatku expozície (v prípade obohacovania vody najlepšie jednu hodinu po aplikácii) a na konci testu a to pri najvyššej koncentrácii a jednej nižšej koncentrácii. Vzťahuje sa to na nádoby s obidvoma generáciami. Z kryštalizačných misiek v chovnej klietke sa analyzuje len nadložná voda, lebo práve s ňou prichádzajú do styku šnúry vajíčok (v prípade koncepcie s obohateným sedimentom možno zvážiť analytické potvrdenie koncentrácie v sedimente). Podľa potreby možno počas testu vykonať aj ďalšie merania sedimentu, vody nachádzajúcej sa v póroch sedimentu a nadložnej vody. Tieto stanovenia koncentrácie testovanej chemikálie poskytujú informácie o správaní/delení testovanej chemikálie v systéme voda – sediment. Odoberanie vzoriek sedimentu a vody nachádzajúcej sa v póroch sedimentu na začiatku a počas testu (pozri bod 39) si vyžaduje ďalšie testovacie nádoby na vykonanie analytických stanovení. Merania v sedimente v prípade koncepcie s obohatenou vodou nemusia byť potrebné ak sa delenie testovanej chemikálie medzi vodu a sediment jednoznačne určilo v štúdii voda/sediment pri porovnateľných podmienkach (napr. pomer sedimentu k vode, druh aplikácie, obsah organického uhlíka v sedimente) alebo ak sa preukáže, že namerané koncentrácie v nadložnej vode zostávajú v rozsahu 80 – 120 % nominálnych alebo nameraných prvotných koncentrácií.
|
|
39.
|
Ak sa vykonajú prostredné merania (napr. v 7. a/alebo 14. deň) a ak sú na analýzu potrebné veľké vzorky, ktoré nemožno odobrať z testovacích nádob bez ovplyvnenia testovacieho systému analytické stanovenia je potrebné vykonať na vzorkách z ďalších testovacích nádob, s ktorými sa zaobchádzalo rovnakým spôsobom (vrátane prítomnosti testovacích organizmov), ale ktoré sa nepoužili na biologické pozorovania.
|
|
40.
|
Na izolovanie intersticiálnej (= pórovej) vody je odporúčaným postupom centrifugácia napr. pri 10 000 g a 4 °C počas 30 minút. Ak sa však preukáže, že testovaná chemikália sa na filtroch neadsorbuje, môže byť prijateľná aj filtrácia. V niektorých prípadoch nemusí byť možné analyzovať koncentrácie vo vode nachádzajúcej sa v póroch sedimentu, lebo objem vzorky môže byť príliš malý.
|
Fyzikálno-chemické parametre
|
41.
|
Je potrebné vhodným spôsobom odmerať pH, rozpustený kyslík v testovacej vode a teplotu vody v testovacích nádobách a kryštalizačných miskách (pozri bod 10). Tvrdosť a amoniak sa merajú v kontrolných nádobách a v jednej testovacej nádobe a kryštalizačnej miske pri najvyššej koncentrácii na začiatku a na konci testu.
|
ÚDAJE A PODÁVANIE SPRÁV
Spracovanie výsledkov
|
42.
|
Účelom tohto testu životného cyklu je stanoviť účinok testovanej chemikálie na rozmnožovanie a mieru vývinu a celkový počet úplne vykuklených a živých samčekov a samičiek pakomárov pre dve generácie. Na účely stanovenia pomeru vykuklenia sa údaje pre samčekov a samičky majú spojiť. Ak neexistujú žiadne štatisticky významné rozdiely medzi pohlaviami v citlivosti z hľadiska miery vývinu, výsledky pre samčekov a samičky možno na účely štatistickej analýzy spojiť.
|
|
43.
|
Účinné koncentrácie vyjadrené ako koncentrácie v nadložnej vode (v prípade obohatenej vody) alebo sedimente (v prípade obohateného sedimentu) sa zvyčajne vypočítajú na základe nameraných koncentrácií na začiatku expozície (pozri bod 38). Preto sa v prípade obohatenej vody vypočíta priemer koncentrácií, ktoré sa zvyčajne merajú na začiatku expozície v nadložnej vode nádob pre obidve generácie a v kryštalizačných miskách, pre každú testovanú koncentráciu. V prípade obohateného sedimentu sa vypočíta priemer koncentrácií, ktoré sa zvyčajne merajú na začiatku expozície v nádobách pre obidve generácie (a voliteľne aj v kryštalizačných miskách), pre každú testovanú koncentráciu.
|
|
44.
|
Na vypočítanie bodového odhadu, t. j. ECx, sa ako pravé replikáty môžu použiť štatistické údaje na jednu nádobu alebo na jednu chovnú klietku. Pri výpočte intervalu spoľahlivosti pre každú hodnotu ECx je potrebné zohľadniť variabilitu medzi nádobami alebo je nutné preukázať, že táto variabilita je taká malá, že ju možno ignorovať. Ak sa zodpovedajúci model vypočíta metódou najmenších štvorcov, v štatistike na jednu nádobu je potrebné aplikovať transformáciu, aby sa zlepšila homogenita rozptylu. Hodnoty ECx by sa však mali vypočítať po tom ako sa reakcia transformuje naspäť na pôvodnú hodnotu (31).
|
|
45.
|
Ak je cieľom štatistickej analýzy určenie NOEC prostredníctvom testovania hypotézy, je potrebné zohľadniť variabilitu medzi nádobami, čo zaručuje použitie metód analýzy ANOVA (napr. postupmi Williamsovho testu a Dunnettovho testu). Williamsov test je vhodný v prípadoch, keď sa teoreticky očakáva monotónny priebeh krivky závislosti dávka-odpoveď a Dunnettov test je vhodný v prípadoch, keď sa hypotéza o monotónnosti nepotvrdí. Alternatívne môžu byť v prípadoch, keď sa nedodržia zvyčajné predpoklady analýzy ANOVA (31), vhodné robustnejšie testy (27).
|
Pomer vykuklenia
|
46.
|
Pomery vykuklenia sú kvantové údaje a môžu sa analyzovať pomocou Cochranovho-Armitageho testu aplikovaného zostupne v prípadoch, keď sa očakáva monotónny priebeh krivky závislosti dávka-odpoveď a tieto údaje zodpovedajú tomuto očakávaniu. Ak to tak nie je, možno použiť Fisherov exaktný test alebo Mantzelov-Haentzalov test s Bonferroniho-Holmovou úpravou hodnôt p. Ak sa medzi replikátmi s rovnakou koncentráciou preukáže väčšia variabilita, než akej by nasvedčovala binomická distribúcia (často sa uvádza ako ‚extra-binomická‘ variácia), potom by sa mal použiť robustný Cochranov-Armitageho test alebo Fisherov exaktný test ako sa navrhuje v bode (27).
Určí sa súčet živých pakomárov (samčekov plus samičiek) vykuklených na nádobu ne
a vydelí sa počtom pridaných lariev na:

kde:
|
ER
|
=
|
pomer vykuklenia,
|
|
ne
|
=
|
počet živých pakomárov vykuklených na nádobu,
|
|
na
|
=
|
počet pridaných lariev na nádobu (zvyčajne 20).
|
Ak je hodnota ne
vyššia ako hodnota na
(t. j. keď sa neúmyselne pridalo viac lariev ako plánovaný počet), mala by sa použiť hodnota na
rovná ne
.
|
|
47.
|
Najvhodnejším alternatívnym prístupom pri veľkých vzorkách v prípadoch extra-binomickej variácie je brať pomer vykuklenia ako spojitú reakciu a použiť postupy zodpovedajúce týmto údajom o ER. Za veľkú vzorku sa tu pokladá vzorka, v ktorej je počet vykuklených aj počet nevykuklených jedincov v každom replikáte (nádobe) vyšší ako päť.
|
|
48.
|
Pri použití metód ANOVA je potrebné najskôr transformovať hodnoty ER pomocou arkussínusovej transformácie druhej odmocniny alebo Tukeyho-Freemanovej transformácie s cieľom získať približnú normálnu distribúciu a vyrovnať rozptyly. Cochranov-Armitageho test, Fisherov exaktný (Bonferroniho) test alebo Mantelov-Haentzalov test možno aplikovať ak sa použijú absolútne frekvencie. Arkussínusová transformácia druhej odmocniny sa aplikuje pomocou prevrátenej hodnoty sínusu (sine– 1) druhej odmocniny ER.
|
|
49.
|
Hodnoty ECx pre pomery vykuklenia sa vypočítajú pomocou regresnej analýzy [napr. pomocou modelov probit, logit alebo Weibull (28)]. Ak je regresná analýza neúspešná (napr. ak sú menej ako dve čiastkové reakcie), možno použiť iné neparametrické metódy, napríklad metódu pohyblivého priemeru alebo jednoduchú interpoláciu.
|
Miera vývinu
|
50.
|
Priemerný čas vývinu predstavuje priemerné časové rozpätie medzi pridaním lariev (0. deň testu) a vykuklením pokusnej kohorty pakomárov (pri výpočte reálneho času vývinu sa zohľadní vek lariev v čase pridania). Miera vývinu (jednotka: 1/deň) je prevrátená hodnota času vývinu a predstavuje časť vývinu lariev, ktorá prebehne za deň. Pri hodnotení týchto štúdií toxicity v sedimente sa uprednostňuje miera vývinu, lebo jej rozptyl je nižší a v porovnaní s časom vývinu je homogénnejší a bližší normálnej distribúcii. S mierou vývinu teda možno použiť výkonnejšie parametrické testovacie postupy ako s časom vývinu. Pre mieru vývinu ako spojitú reakciu možno hodnoty ECx odhadnúť pomocou regresnej analýzy [napr. (29), (30)]. NOEC pre priemernú mieru vývinu možno stanoviť metódami ANOVA, napr. Williamsovým testom alebo Dunnettovým testom. Keďže samčekovia sa vykuklia skôr ako samičky, t. j. majú vyššiu mieru vývinu, je vhodné okrem hodnoty pre všetky pakomáre vypočítať mieru vývinu pre každé pohlavie oddelene.
|
|
51.
|
Pri štatistických testoch sa predpokladá, že počet pakomárov pozorovaných v kontrolnom dni x sa vykuklil v priemernom časovom intervale medzi dňom x a dňom x – l (l = dĺžka kontrolného intervalu, zvyčajne jeden deň). Priemerná miera vývinu na nádobu (

) sa vypočíta podľa tejto rovnice:
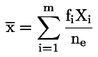
kde:
|

|
:
|
je priemerná miera vývinu na nádobu,
|
|
i
|
:
|
index kontrolného intervalu,
|
|
m
|
:
|
maximálny počet kontrolných intervalov,
|
|
fi
|
:
|
počet pakomárov vykuklených v kontrolnom intervale i,
|
|
ne
|
:
|
celkový počet pakomárov vykuklených na konci pokusu (= Σfi
)
|
|
xi
|
:
|
miera vývinu pakomárov vykuklených v intervale i,
|

kde:
|
deňi
|
:
|
kontrolný deň (počet dní od pridania lariev),
|
|
li
|
:
|
dĺžka kontrolného intervalu i (dni, zvyčajne jeden deň).
|
|
Pomer pohlaví
|
52.
|
Pomery pohlaví sú kvantové údaje a preto by sa mali hodnotiť prostredníctvom Fisherovho exaktného testu alebo iných vhodných metód. Prirodzený pomer pohlaví C. riparius je jeden, t. j. samčekovia a samičky sú rovnako zastúpené. Pre obidve generácie sa údaje o pomere pohlaví majú spracovať rovnako. Keďže maximálny počet pakomárov na nádobu (t. j. 20) je príliš nízky na zmysluplné štatistické analýzy, vypočíta sa súčet celkového počtu úplne vykuklených a živých pakomárov pre každé pohlavie vo všetkých nádobách pre jednu testovanú koncentráciu chemikálie. Tieto netransformované údaje sa otestujú proti kontrolnej skupine (s rozpúšťadlom) alebo spojeným údajom z kontrolných skupín v kontingenčnej tabuľke 2 × 2.
|
Rozmnožovanie
|
53.
|
Rozmnožovanie ako plodnosť sa vypočíta ako počet šnúr vajíčok na samičku. Konkrétnejšie, celkový počet šnúr vajíčok nakladených v chovnej klietke sa vydelí celkovým počtom živých a nepoškodených samičiek pridaných do tejto klietky. NOEC pre plodnosť možno stanoviť metódami ANOVA, napr. Williamsovým testom alebo Dunnettovým testom.
|
|
54.
|
Fertilita šnúr vajíčok sa použije na kvantifikáciu počtu fertilných šnúr vajíčok na samičku. Celkový počet fertilných šnúr vajíčok nakladených v chovnej klietke sa vydelí celkovým počtom živých a nepoškodených samičiek pridaných do tejto klietky. NOEC pre fertilitu možno stanoviť metódami ANOVA, napr. Williamsovým testom alebo Dunnettovým testom.
|
Protokol o skúške
|
55.
|
Protokol o skúške by mal obsahovať tieto informácie:
|
|
Testovaná chemikália:
|
—
|
fyzikálny charakter a fyzikálno-chemické vlastnosti [rozpustnosť vo vode, tlak pary, log K
ow, rozdeľovacia konštanta v pôde (alebo v sedimente ak je k dispozícii), stabilita vo vode a v sedimente atď.],
|
|
—
|
chemické identifikačné údaje (bežný názov, chemický názov, štrukturálny vzorec, číslo CAS atď.) vrátane čistoty a analytickej metódy kvantifikácie testovanej chemikálie.
|
|
|
|
Testovacie druhy:
|
—
|
použité testovacie organizmy: druh, vedecký názov, zdroj organizmov a podmienky chovu,
|
|
—
|
informácie o manipulácii s vaječnou hmotou a larvami,
|
|
—
|
informácie o manipulácii s vykuklenými dospelými jedincami 1. generácie s použitím exhaustora atď. (pozri dodatok 5),
|
|
—
|
vek testovacích organizmov 1. a 2. generácie v čase vloženia do testovacích nádob.
|
|
|
|
Podmienky testu:
|
—
|
použitý sediment, t. j. prírodný alebo umelo pripravený (umelý) sediment,
|
|
—
|
prírodný sediment: poloha a opis miesta odobratia vzoriek sedimentu vrátane histórie kontaminácie ak je to možné, charakteristiky sedimentu: pH, obsah organického uhlíka, pomer C/N a granulometria (podľa potreby),
|
|
—
|
umelo pripravený sediment: príprava, zložky a charakteristiky (obsah organického uhlíka, pH, vlhkosť atď. odmerané na začiatku testu),
|
|
—
|
príprava vody použitej na testovanie (ak sa použije rekonštituovaná voda) a charakteristiky (koncentrácia kyslíka, pH, tvrdosť atď. odmerané na začiatku testu),
|
|
—
|
hĺbka sedimentu a nadložnej vody v testovacích nádobách a kryštalizačných miskách,
|
|
—
|
objem nadložnej vody a vody nachádzajúcej sa v póroch sedimentu, hmotnosť mokrého sedimentu s vodou nachádzajúcou sa v póroch sedimentu a bez nej pre testovacie nádoby a kryštalizačné misky,
|
|
—
|
testovacie nádoby (materiál a veľkosť),
|
|
—
|
kryštalizačné misky (materiál a veľkosť),
|
|
—
|
chovné klietky (materiál a veľkosť),
|
|
—
|
metóda prípravy zásobných roztokov a testovacie koncentrácie pre testovacie nádoby a kryštalizačné misky,
|
|
—
|
aplikácia testovanej chemikálie do testovacích nádob a kryštalizačných misiek: testované koncentrácie, počet replikátov a prípadné rozpúšťadlá ak sú potrebné,
|
|
—
|
inkubačné podmienky v testovacích nádobách: teplota, cyklus a intenzita svetla, prevzdušňovanie (počet bubliniek za sekundu),
|
|
—
|
inkubačné podmienky v chovných klietkach a kryštalizačných miskách: teplota, cyklus a intenzita svetla,
|
|
—
|
inkubačné podmienky pre šnúry vajíčok na mikrotitračných platniach (alebo iných nádobách): teplota, cyklus a intenzita svetla,
|
|
—
|
podrobné informácie o kŕmení vrátane druhu potravy, prípravy, množstva a kŕmneho režimu.
|
|
|
|
Výsledky:
|
—
|
nominálne testované koncentrácie, namerané testované koncentrácie a výsledky všetkých analýz na stanovenie koncentrácie testovanej chemikálie v testovacích nádobách a kryštalizačných miskách,
|
|
—
|
kvalita vody v testovacích nádobách a kryštalizačných miskách, t. j. pH, teplota, rozpustený kyslík, tvrdosť a amoniak,
|
|
—
|
doplnenie prípadnej vyparenej vody použitej na testovanie v testovacích nádobách,
|
|
—
|
počet vykuklených samčích a samičích pakomárov na nádobu na deň pre 1. a 2. generáciu,
|
|
—
|
pomer pohlaví úplne vykuklených a živých pakomárov na testovanú koncentráciu pre 1. a 2. generáciu,
|
|
—
|
počet lariev na nádobu, ktoré sa nevykuklili ako pakomáre, pre 1. a 2. generáciu,
|
|
—
|
percento/podiel vykuklených jedincov na replikát a testovanú koncentráciu (samičky a samčekovia pakomárov spolu) pre 1. a 2. generáciu,
|
|
—
|
priemerná miera vývinu úplne vykuklených a živých pakomárov na replikát a testovanú koncentráciu (samičky a samčekovia pakomárov samostatne i spolu) pre 1. a 2. generáciu,
|
|
—
|
počet šnúr vajíčok uložených v kryštalizačných miskách na chovnú klietku a deň,
|
|
—
|
vlastnosti každej šnúry vajíčok (veľkosť, tvar a fertilita),
|
|
—
|
plodnosť – celkový počet šnúr vajíčok na celkový počet samičiek pridaných do chovnej klietky,
|
|
—
|
fertilita – celkový počet fertilných šnúr vajíčok na celkový počet samičiek pridaných do chovnej klietky,
|
|
—
|
odhady sledovaných parametrov toxicity, napr. ECx (a súvisiace intervaly spoľahlivosti), NOEC a štatistické metódy použité na jej stanovenie,
|
|
—
|
rozbor výsledkov vrátane každého vplyvu na výsledok testu vyplývajúceho z odchýlok od tejto testovacej metódy.
|
|
|
LITERATÚRA
|
1.
|
Kapitola C.28 tejto prílohy, Sediment-water chironomid toxicity test using spiked water.
|
|
2.
|
Shobanov, N.A., Kiknadze, I.I. a M.G. Butler (1999), Palearctic and Nearctic Chironomus (Camptochironomus) tentans Fabricius are different species (Diptera: Chironomidae). Entomologica Scandinavica, 30: 311 – 322.
|
|
3.
|
Fleming, R. et al. (1994), Sediment Toxicity Tests for Poorly Water-Soluble Substances, Final Report to the European Commission, Report No: EC 3738 august 1994. WRc, Spojené kráľovstvo.
|
|
4.
|
SETAC (1993), Guidance Document on Sediment toxicity Tests and Bioassays for Freshwater and Marine Environments, From the WOSTA Workshop held in the Netherlands.
|
|
5.
|
ASTM International (2009), E1706-05E01: Test Method for Measuring the Toxicity of Sediment-Associated Contaminants with Freshwater Invertebrates, In: Annual Book of ASTM Standards, Volume 11.06, Biological Effects and Environmental Fate; Biotechnology. ASTM International, West Conshohocken, PA.
|
|
6.
|
Environment Canada (1997), Test for Growth and Survival in Sediment using Larvae of Freshwater Midges (Chironomus tentans or Chironomus riparius), Biological Test Method, Report SPE 1/RM/32, december 1997.
|
|
7.
|
US-EPA (2000), Methods for Measuring the Toxicity and Bioaccumulation of Sediment-associated Contaminants with Freshwater Invertebrates, Second edition, EPA 600/R-99/064, March 2000, Revision to the first edition dated June 1994.
|
|
8.
|
US-EPA/OPPTS 850.1735 (1996), Whole Sediment Acute Toxicity Invertebrates.
|
|
9.
|
US-EPA/OPPTS 850.1790 (1996), Chironomid Sediment toxicity Test.
|
|
10.
|
Milani, D., Day, K.E., McLeay, D.J. a R.S. Kirby (1996), Recent intra- and inter-laboratory studies related to the development and standardisation of Environment Canada's biological test methods for measuring sediment toxicity using freshwater amphipods (Hyalella azteca) and midge larvae (Chironomus riparius), Technical Report, Environment Canada, National Water Research Institute, Burlington, Ontario, Canada.
|
|
11.
|
Norberg-King, T.J., Sibley, P.K., Burton, G.A., Ingersoll, C.G., Kemble, N.E., Ireland, S., Mount, D.R. a C.D. Rowland (2006), Interlaboratory evaluation of Hyalella azteca and Chironomus tentans short-term and long-term sediment toxicity tests, Environ. Toxicol. Chem., 25: 2662 – 2674.
|
|
12.
|
Taenzler, V., Bruns, E., Dorgerloh, M., Pfeifle, V. a L. Weltje (2007), Chironomids: suitable test organisms for risk assessment investigations on the potential endocrine-disrupting properties of pesticides, Ecotoxicology, 16: 221 – 230.
|
|
13.
|
Sugaya, Y. (1997), Intra-specific variations of the susceptibility of insecticides in Chironomus yoshimatsui, Jp. J. Sanit. Zool., 48: 345 – 350.
|
|
14.
|
Kawai, K. (1986), Fundamental studies on chironomid allergy, I. Culture methods of some Japanese chironomids (Chironomidae, Diptera), Jp. J. Sanit. Zool., 37: 47 – 57.
|
|
15.
|
Kapitola C.27 tejto prílohy, Sediment-water chironomid toxicity test using spiked sediment.
|
|
16.
|
OECD (2000), Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures, Environment, Health and Safety Publications, Series on Testing and Assessment No. 23, ENV/JM/MONO(2000)6, OECD, Paríž.
|
|
17.
|
Weltje, L., Rufli, H., Heimbach, F., Wheeler, J., Vervliet-Scheebaum, M. a M. Hamer (2010), The chironomid acute toxicity test: development of a new test system, Integr. Environ. Assess. Management.
|
|
18.
|
Environment Canada. (1995), Guidance Document on Measurement of Toxicity Test Precision Using Control Sediments Spiked with a Reference Toxicant, Report EPS 1/RM/30, september 1995.
|
|
19.
|
Oetken, M, Nentwig, G., Löffler, D, Ternes, T. a J. Oehlmann (2005), Effects of pharmaceuticals on aquatic invertebrates, Part I, The antiepileptic drug carbamazepine arch. Environ. Contam. Toxicol., 49: 353 – 361.
|
|
20.
|
Suedel, B.C. a J.H. Rodgers (1994), Development of formulated reference sediments for freshwater and estuarine sediment testing, Environ. Toxicol. Chem., 13: 1163 – 1175.
|
|
21.
|
Naylor, C. a C. Rodrigues (1995), Development of a test method for Chironomus riparius using a formulated sediment, Chemosphere, 31: 3291 – 3303.
|
|
22.
|
Dunnett, C.W. (1964) a multiple comparisons procedure for comparing several treatments with a control. J. Amer. Statis. Assoc., 50: 1096 – 1121.
|
|
23.
|
Dunnett, C.W. (1964), New tables for multiple comparisons with a control, Biometrics, 20: 482 – 491.
|
|
24.
|
Williams, D.A. (1971) a test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics, 27: 103 – 117.
|
|
25.
|
Williams, D.A. (1972), The comparison of several dose levels with a zero dose control. Biometrics, 28: 510 – 531.
|
|
26.
|
Jungmann, D., Bandow, C., Gildemeister, T., Nagel, R., Preuss, T.G., Ratte, H.T., Shinn, C., Weltje, L. a H.M. Maes (2009), Chronic toxicity of fenoxycarb to the midge Chironomus riparius after exposure in sediments of different composition. J Soils Sediments, 9: 94 – 102.
|
|
27.
|
Rao, J.N.K. a A.J. Scott (1992) a simple method for the analysis of clustered binary data. Biometrics, 48: 577 – 585.
|
|
28.
|
Christensen, E.R. (1984), Dose-response functions in aquatic toxicity testing and the Weibull model, Water Res., 18: 213 – 221.
|
|
29.
|
Bruce, R.D. a D.J. Versteeg (1992) a statistical procedure for modelling continuous toxicity data, Environ. Toxicol. Chem., 11: 1485 – 1494.
|
|
30.
|
Slob, W. (2002), Dose-response modelling of continuous endpoints. Toxicol. Sci., 66: 298 – 312.
|
|
31.
|
OECD (2006), Current Approaches in the Statistical Analysis of Ecotoxicity Data: a Guidance to Application, OECD Series on Testing and Assessment No. 54, s. 146, ENV/JM/MONO(2006)18, OECD, Paríž.
|
|
32.
|
Benoit, D.A., Sibley, P.K., Juenemann, J.L. a G.T. Ankley (1997), Chironomus tentans life-cycle test: design and evaluation for use in assessing toxicity of contaminated sediments, Environ. Toxicol. Chem., 16: 1165 – 1176.
|
|
33.
|
Vogt, C., Belz, D., Galluba, S., Nowak, C., Oetken, M. a J. Oehlmann (2007), Effects of cadmium and tributyltin on development and reproduction of the non-biting midge Chironomus riparius (Diptera) – baseline experiments for future multi-generation studies, J. Environ. Sci. Health Part A, 42: 1 – 9.
|
|
34.
|
OECD (2010), Validation report of the Chironomid full life-cycle toxicity test, Forthcoming publication in the Series on Testing and Assessment, OECD, Paríž.
|
Dodatok 1
Vymedzenie pojmov
Na účely tejto testovacej metódy sa používajú tieto vymedzenia pojmov:
|
|
Chemikália je látka alebo zmes.
|
|
|
Umelo pripravený sediment alebo rekonštituovaný, umelý alebo syntetický sediment je zmes materiálov použitých na napodobnenie fyzických zložiek prírodného sedimentu.
|
|
|
Nadložná voda je voda umiestnená v testovacej nádobe nad sedimentom.
|
|
|
Intersticiálna voda alebo voda nachádzajúca sa v póroch sedimentu je voda nachádzajúca sa v priestore medzi časticami sedimentu a pôdy.
|
|
|
Obohatená voda je voda použitá na testovanie, do ktorej bola pridaná testovaná chemikália.
|
|
|
Testovaná chemikália je akákoľvek látka alebo zmes, ktorá sa testuje pomocou tejto testovacej metódy.
|
Dodatok 2
Odporúčania na kultiváciu Chironomus riparius
|
1.
|
Larvy Chironomus sa môžu chovať v kryštalizačných miskách alebo vo väčších nádobách. Na dno nádoby sa nanesie tenká vrstva jemného kremenného piesku vo výške 5 – 10 mm. Je preukázané, že vhodným substrátom je aj diatomit (napr. Merck, položka 8117) (postačuje tenšia vrstva do výšky len niekoľkých milimetrov). Potom sa pridá vhodná voda do výšky niekoľkých centimetrov. Hladina vody by sa mala podľa potreby dolievať, aby sa doplnila strata vyparením a aby sa predišlo vysychaniu. Vodu je možné v prípade potreby vymeniť. Je potrebné zabezpečiť jemné prevzdušňovanie. Nádoby na chov lariev by mali byť umiestnené vo vhodnej klietke, ktorá zabráni úniku vykuklených dospelých jedincov. Klietka by mala byť dostatočne veľká, aby umožňovala rojenie vykuklených dospelých jedincov, v opačnom prípade by nemuselo dôjsť ku kopulácii (minimálna veľkosť je približne 30 × 30 × 30 cm).
|
|
2.
|
Klietky je potrebné udržiavať pri izbovej teplote alebo v miestnosti so stálym prostredím pri teplote 20 ± 2 °C s fotoperiódou 16 hodín svetla (intenzita približne 1 000 luxov) a 8 hodín tmy. Uvádza sa, že vlhkosť vzduchu nižšia ako 60 % RH môže brániť rozmnožovaniu.
|
Riediaca voda
|
3.
|
Možno použiť akúkoľvek vhodnú prírodnú alebo syntetickú vodu. Bežne sa používa studňová voda, odchlórovaná voda z vodovodu a umelé médiá (napr. Elendtovo médium ‚M4‘ alebo ‚M7‘, pozri ďalej). Pred použitím je potrebné vodu prevzdušniť. V prípade potreby možno kultivačnú vodu obnoviť opatrným odliatím alebo odčerpaním použitej vody z kultivačných nádob bez toho, aby sa poškodili trubice lariev.
|
Kŕmenie lariev
|
4.
|
Larvy rodu Chironomus sa kŕmia vločkovým krmivom pre ryby (TetraMin®, TetraPhyll® alebo inou podobnou chránenou značkou krmiva pre ryby) v približnom množstve 250 mg na nádobu na deň. Krmivo sa môže podávať ako suchý rozomletý prášok alebo ako suspenzia vo vode: 1,0 g vločkového krmiva sa pridá do 20 ml riediacej vody a premieša sa, aby sa získala homogénna zmes. Tento prípravok sa môže podávať v množstve približne 5 ml na nádobu na deň (pred použitím pretrepať). Staršie larvy môžu dostávať viac.
|
|
5.
|
Kŕmenie sa upraví podľa kvality vody. Ak sa kultivačné médium zakalí, kŕmenie je potrebné obmedziť. Prídavky do krmiva je potrebné starostlivo monitorovať. Nedostatok potravy spôsobí, že larvy sa budú presúvať k vodnému stĺpcu a prebytok potravy spôsobí zvýšenie činnosti mikróbov a zníženie koncentrácie kyslíka. V obidvoch prípadoch môže dôjsť k zníženiu rýchlosti rastu.
|
|
6.
|
Pri založení nových kultivačných nádob sa môžu pridať aj bunky niektorých zelených rias (napr. Scenedesmus subspicatus, Chlorella vulgaris).
|
Kŕmenie vykuklených dospelých jedincov
|
7.
|
Z niektorých pokusov vyplýva, že ako potrava pre vykuklené dospelé jedince môže slúžiť vatový tampón napustený nasýteným sacharózovým roztokom.
|
Vykuklenie
|
8.
|
Pri teplote 20 ± 2 °C sa dospelé jedince začnú vykuklovať z nádob na chov lariev po približne 13 – 15 dňoch. Samčekovia sa ľahko rozpoznajú podľa obrvených tykadiel a tenkého tela.
|
Vaječné hmoty
|
9.
|
Keď sú v chovnej klietke prítomné dospelé jedince, vo všetkých nádobách na chov lariev je potrebné trikrát do týždňa kontrolovať kladenie želatínových vaječných hmôt. Ak sú vaječné hmoty prítomné, opatrne sa odoberú. Mali by sa preniesť na malú misku so vzorkou kultivačnej vody. Vaječné hmoty sa použijú na založenie nových kultivačných nádob (napr. dve až štyri vaječné hmoty na nádobu) alebo sa použijú v testoch toxicity.
|
|
10.
|
Larvy prvého instaru by sa mali vyliahnuť po dvoch až troch dňoch.
|
Založenie nových kultivačných nádob
|
11.
|
Po vytvorení kultúr by malo byť možné založiť novú nádobu na kultiváciu lariev každý týždeň alebo menej často v závislosti od testovacích požiadaviek, pričom staršie nádoby sa po vykuklení dospelých pakomárov odstránia. Týmto spôsobom sa pri minimálnom riadení zabezpečí pravidelné dopĺňanie dospelých jedincov.
|
Príprava testovacích roztokov ‚M4‘ a ‚M7‘
|
12.
|
Elendt (1990) opísal médium ‚M4‘. Médium ‚M7‘ sa pripravuje ako médium ‚M4‘ s výnimkou látok uvedených v tabuľke 1, ktorých koncentrácie v médiu ‚M7‘ sú štyrikrát nižšie ako v médiu ‚M4‘. Testovací roztok by sa nemal pripraviť podľa Elendta a Biasa (1990), lebo uvedené koncentrácie NaSiO3, 5H2O, NaNO3, KH2PO4 a K2HPO4 na prípravu zásobných roztokov nie sú vhodné.
|
Príprava média ‚M7‘
|
13.
|
Každý zásobný roztok (I) sa pripraví jednotlivo a kombinovaný zásobný roztok (II) sa pripraví z týchto zásobných roztokov (I) (pozri tabuľku 1). Na prípravu média ‚M7‘ sa 50 ml z kombinovaného zásobného roztoku (II) a množstvá každého makronutričného zásobného roztoku uvedené v tabuľke 2 doplnia do 1 litra deionizovanej vody. Vitamínový zásobný roztok sa pripraví pridaním troch vitamínov do deionizovanej vody, ako je uvedené v tabuľke 3 a krátko pred použitím sa do konečného média ‚M7‘ pridá 0,1 ml kombinovaného vitamínového zásobného roztoku. Vitamínový zásobný roztok sa skladuje zmrazený v malých alikvotných častiach. Médium sa prevzdušňuje a stabilizuje.
|
Tabuľka 1
Zásobné roztoky stopových prvkov pre médiá M4 a M7
|
Zásobné roztoky (I)
|
Množstvo (mg) doplnené do 1 litra deionizovanej vody
|
Príprava kombinovaného zásobného roztoku (II): zmiešajte tieto množstvá (ml) zásobných roztokov (I) a doplňte do 1 litra deionizovanej vody
|
Konečné koncentrácie v testovacích roztokoch (mg/l)
|
|
M4
|
M7
|
M4
|
M7
|
|
H3BO3
(25)
|
57 190
|
1,0
|
0,25
|
2,86
|
0,715
|
|
MnCl2 · 4H2O (25)
|
7 210
|
1,0
|
0,25
|
0,361
|
0,090
|
|
LiCl (25)
|
6 120
|
1,0
|
0,25
|
0,306
|
0,077
|
|
RbCl (25)
|
1 420
|
1,0
|
0,25
|
0,071
|
0,018
|
|
SrCl2 · 6H2O (25)
|
3 040
|
1,0
|
0,25
|
0,152
|
0,038
|
|
NaBr (25)
|
320
|
1,0
|
0,25
|
0,016
|
0,004
|
|
Na2MoO4 · 2H2O (25)
|
1 260
|
1,0
|
0,25
|
0,063
|
0,016
|
|
CuCl2 · 2H2O (25)
|
335
|
1,0
|
0,25
|
0,017
|
0,004
|
|
ZnCl2
|
260
|
1,0
|
1,0
|
0,013
|
0,013
|
|
CaCl2 · 6H2O
|
200
|
1,0
|
1,0
|
0,010
|
0,010
|
|
KI
|
65
|
1,0
|
1,0
|
0,0033
|
0,0033
|
|
Na2SeO3
|
43,8
|
1,0
|
1,0
|
0,0022
|
0,0022
|
|
NH4VO3
|
11,5
|
1,0
|
1,0
|
0,00058
|
0,00058
|
|
Na2EDTA · 2H2O (25)
(26)
|
5 000
|
20,0
|
5,0
|
2,5
|
0,625
|
|
FeSO4 · 7H2O (25)
(26)
|
1 991
|
20,0
|
5,0
|
1,0
|
0,249
|
Tabuľka 2
Makronutričné zásobné roztoky pre médiá M4 a M7
|
|
Množstvo doplnené do 1 litra deionizovanej vody
(mg)
|
Množstvo pridaných makronutričných zásobných roztokov pri príprave médií M4 a M7
(ml/l)
|
Konečné koncentrácie v testovacích roztokoch M4 a M7
(mg/l)
|
|
CaCl2 · 2H2O
|
293 800
|
1,0
|
293,8
|
|
MgSO4 · 7H2O
|
246 600
|
0,5
|
123,3
|
|
KCl
|
58 000
|
0,1
|
5,8
|
|
NaHCO3
|
64 800
|
1,0
|
64,8
|
|
NaSiO3 · 9H2O
|
50 000
|
0,2
|
10,0
|
|
NaNO3
|
2 740
|
0,1
|
0,274
|
|
KH2PO4
|
1 430
|
0,1
|
0,143
|
|
K2HPO4
|
1 840
|
0,1
|
0,184
|
Tabuľka 3
Vitamínový zásobný roztok pre médiá M4 a M7
Všetky tri vitamínové roztoky sa skombinujú, aby sa vytvoril jeden vitamínový zásobný roztok.
|
|
Množstvo doplnené do 1 litra deionizovanej vody
(mg)
|
Množstvo pridaného vitamínového zásobného roztoku pri príprave médií M4 a M7
(ml/l)
|
Konečné koncentrácie v testovacích roztokoch M4 a M7
(mg/l)
|
|
Tiamín hydrochlorid
|
750
|
0,1
|
0,075
|
|
Kyanokobalamín (B12)
|
10
|
0,1
|
0,0010
|
|
Biotín
|
7,5
|
0,1
|
0,00075
|
LITERATÚRA
BBA (1995), Long-term toxicity test with Chironomus riparius: Development and validation of a new test system, Edited by M. Streloke a H. Köpp. Berlin.
Elendt, B.P. (1990), Selenium deficiency in Crustacea, Protoplasma, 154: 25 – 33.
Elendt, B.P. a W.-R. Bias (1990), Trace nutrient deficiency in Daphnia magna cultured in standard medium for toxicity testing, Effects on the optimisation of culture conditions on life history parameters of D. magna, Water Research, 24: 1157 – 1167.
Dodatok 3
Príprava umelo pripraveného sedimentu
ZLOŽENIE SEDIMENTU
Zloženie umelo pripraveného sedimentu by malo byť takéto:
|
Zložka
|
Charakteristika
|
% suchej hmotnosti sedimentu
|
|
Rašelina
|
Rašelinníková rašelina, pH čo najbližšie k 5,5 – 6,0, bez viditeľných zvyškov rastlín, jemne rozomletá (veľkosť častíc ≤ 1 mm) a vysušená vzduchom
|
4 – 5
|
|
Kremenný piesok
|
Veľkosť zrniek: > 50 % častíc by malo mať veľkosť v rozsahu 50 – 200 μm
|
75 – 76
|
|
Kaolín
|
Obsah kaolinitu ≥ 30 %
|
20
|
|
Organický uhlík
|
Upravený pridaním rašeliny a piesku
|
2 (± 0,5)
|
|
Uhličitan vápenatý
|
CaCO3, rozomletý na prach, chemicky čistý
|
0,05 – 0,1
|
|
Voda
|
Vodivosť ≤ 10 μS/cm
|
30 – 50
|
PRÍPRAVA
Rašelina sa usuší vzduchom a rozomelie na jemný prášok. V deionizovanej vode sa pomocou vysokovýkonného homogenizačného prístroja pripraví suspenzia požadovaného množstva rašelinového prášku. Hodnota pH tejto suspenzie sa upraví na 5,5 ± 0,5 pomocou CaCO3. Suspenzia sa aspoň na dva dni uvedie do podmienok jemným premiešavaním pri teplote 20 ± 2 °C, aby sa stabilizovala hodnota pH a vytvorila stabilná mikrobiálna zložka. Opäť sa zmeria pH, ktoré by malo byť na úrovni 6,0 ± 0,5. Rašelinová suspenzia sa následne zmieša s ostatnými zložkami (pieskom a kaolínom) a s deionizovanou vodou, aby sa získal homogénny sediment s obsahom vody v rozsahu 30 – 50 % suchej hmotnosti sedimentu. Znova sa zmeria pH konečnej zmesi a podľa potreby sa pomocou CaCO3 upraví na 6,5 – 7,5. Odoberú sa vzorky sedimentu, aby sa určila suchá hmotnosť a obsah organického uhlíka. Potom sa odporúča, aby sa pred použitím v teste toxicity pri pakomároch umelo pripravený sediment uviedol na sedem dní do rovnakých podmienok aké budú prevládať v nasledujúcom teste.
SKLADOVANIE
Suché zložky na prípravu umelého sedimentu sa môžu skladovať na suchom a chladnom mieste pri izbovej teplote. Umelo pripravený (mokrý) sediment by sa pred použitím v teste nemal skladovať. Mal by sa použiť ihneď po sedemdňovom období uvádzania do podmienok, ktorým sa končí jeho príprava.
LITERATÚRA
OECD (1984), Earthworm acute Toxicity Test, Test Guideline No. 207, Guidelines for the Testing of Chemicals, OECD, Paríž.
Meller, M., Egeler, P., Roembke, J., Schallnass, H., Nagel, R. a B. Streit (1998), Short-term toxicity of lindane, hexachlorobenzene and copper sulfate on tubificid sludgeworms (Oligochaeta) in artificial media, Ecotox. Environ. Safety, 39: 10 – 20.
Dodatok 4
Chemické charakteristiky prijateľnej riediacej vody
|
ZLOŽKA
|
KONCENTRÁCIE
|
|
Tuhé častice
|
< 20 mg/l
|
|
Celkový organický uhlík
|
< 2 mg/l
|
|
Neionizovaný amoniak
|
< 1 μg/l
|
|
Tvrdosť ako CaCO3
|
< 400 mg/l (27)
|
|
Zostatkový chlór
|
< 10 μg/l
|
|
Celkové organofosfátové pesticídy
|
< 50 ng/l
|
|
Celkové organochlórové pesticídy a polychlórované bifenyly
|
< 50 ng/l
|
|
Celkový organický chlór
|
< 25 ng/l
|
Dodatok 5
Usmernenia na vykonanie testu
Príklad chovnej klietky:

|
A
|
:
|
gáza na vrchu a aspoň na jednej strane klietky (veľkosť ôk približne 1 mm)
|
|
B
|
:
|
otvor na umiestnenie vykuklených dospelých jedincov do chovnej klietky a na odstránenie nakladených šnúr vajíčok z kryštalizačných misiek (nie sú zobrazené na tomto obrázku)
|
|
C
|
:
|
minimálna veľkosť chovnej klietky – dĺžka 30 cm, výška 30 cm, šírka 30 cm
|
Príklad testovacej nádoby:
|
A
|
:
|
Pasteurova pipeta na prívod vzduchu do nadložnej vody
|
|
B
|
:
|
sklenené veko na zabránenie úniku vykuklených pakomárov
|
|
C
|
:
|
úroveň hladiny vody
|
|
D
|
:
|
testovacia nádoba (sklenená kadička s objemom minimálne 600 ml)
|
|
E
|
:
|
vrstva sedimentu
|
Príklad exhaustora na zachytenie dospelých pakomárov (šípky označujú smer prúdenia vzduchu):
|
A
|
:
|
sklenená trubička (vnútorný priemer približne 5 mm) pripojená k samonasávaciemu čerpadlu
|
|
B
|
:
|
zátka z vulkanizovaného kaučuku perforovaná sklenenou trubičkou (A). Na vnútornej strane je otvor sklenenej trubičky (A) pokrytý bavlnou a gázou (veľkosť ôk približne 1 mm), aby sa pakomáre nasávané do exhaustora nepoškodili.
|
|
C
|
:
|
priehľadná nádoba (plastová alebo sklenená, dĺžka približne 15 cm) na chytené pakomáre
|
|
D
|
:
|
zátka z vulkanizovaného kaučuku perforovaná trubičkou (E). Na účely vypustenia pakomárov do chovnej klietky sa zátka D uvoľní z nádoby C.
|
|
E
|
:
|
trubička (plastová alebo sklenená, vnútorný priemer približne 8 mm) na zbieranie dospelých pakomárov z nádoby
|
Schematické zobrazenie testu životného cyklu:

|
A
|
:
|
1. generácia – testovacie nádoby obsahujúce systém sediment – voda, osem replikátov, 20 lariev v prvom instare na nádobu
|
|
B
|
:
|
štyri testovacie nádoby na každú chovnú klietku a a B
|
|
C
|
:
|
chovné klietky (A a B) na rojenie, párenie a kladenie vajíčok
|
|
D
|
:
|
kryštalizačné misky na kladenie šnúr vajíčok
|
|
E
|
:
|
mikrotitračné platne, jedna jamka pre každú šnúru vajíčok
|
|
F
|
:
|
2. generácia – testovacie nádoby obsahujúce systém sediment – voda, osem replikátov, 20 lariev v prvom instare na nádobu
|
C.41. TEST POHLAVNÉHO VÝVINU RÝB
ÚVOD
|
1.
|
Táto testovacia metóda je rovnocenná s usmernením OECD na vykonávanie testov (TG) 234 (2011). Je založená na rozhodnutí z roku 1998 vypracovať nové alebo aktualizovať existujúce testovacie metódy na skríning a testovanie potenciálnych endokrinných disruptorov. Test pohlavného vývinu rýb (FSDT) bol identifikovaný ako sľubná testovacia metóda zahŕňajúca citlivé vývinové štádium rýb reagujúce na chemikálie podobné estrogénu a androgénu. Testovacia metóda prešla medzilaboratórnou validáciou od roku 2006 do roku 2010, v ktorej medaka japonská (Oryzias latipes), dánio pruhované (Danio rerio) a pichľavka sivá (Gasterosteus aculeatus) boli validované a čerebľa potočná (Pimephales promelas) bola validovaná čiastočne (41) (42) (43). Tento protokol zahŕňa medaku japonskú, pichľavku sivú a dánio pruhované. Protokol je v zásade rozšírením usmernenia OECD TG 210 na test toxicity v ranom štádiu života rýb (1), v ktorom expozícia pokračuje, kým ryby nedosiahnu pohlavnú diferenciáciu, t. j. približne 60 dní po vyliahnutí (dph) pre medaku japonskú, pichľavku sivú a dánio pruhované (v prípade iných druhov, ktoré budú validované v budúcnosti, sa obdobie expozície môže skrátiť alebo predĺžiť) a boli pridané sledované parametre endokrinnej citlivosti. Testom FSDT sa vyhodnocujú účinky a potenciálne nepriaznivé dôsledky údajných endokrinných disruptorov (napr. estrogénov androgénov a inhibítorov steroidogenézy) na pohlavný vývin v skorých štádiách života. Kombinácia dvoch hlavných endokrinných sledovaných parametrov, teda koncentrácie vitellogenínu (VTG) a fenotypového pomeru pohlaví, umožňuje na základe testu stanoviť spôsob pôsobenia testovanej chemikálie. Vzhľadom na zmenu fenotypového pomeru pohlaví významného pre celú populáciu možno test FSDT použiť na posúdenie nebezpečenstva a rizika. Ak sa však test použije na posúdenie nebezpečenstva alebo rizika, pichľavka sivá by sa nemala používať, lebo z doteraz získaných validačných údajov vyplýva, že pri tomto druhu nie sú zmeny fenotypového pomeru pohlaví v dôsledku testovanej chemikálie časté.
|
|
2.
|
Protokol je založený na expozícii rýb chemikáliám vo vode počas obdobia citlivého na pohlavný vývin, v ktorom sa očakáva, že ryby budú najcitlivejšie na účinky endokrinných disruptorov, ktoré majú vplyv na pohlavný vývin. Ako ukazovatele vývinových odchýlok súvisiacich s endokrinnou činnosťou sa merajú dva hlavné sledované parametre: koncentrácie VTG a pomery pohlaví (podiely jednotlivých pohlaví), ktoré sa stanovujú histologickým vyšetrením gonád. Histopatologické vyšetrenie gonád (hodnotenie oocytov a spermatogénnych buniek a stanovenie ich štádia) je voliteľné. Ak to je možné, stanoví sa aj genetické pohlavie (napr. pri medake japonskej a pichľavke sivej). Prítomnosť genetického markera pohlavia je značnou výhodou, lebo zvyšuje spoľahlivosť štatistiky pomeru pohlaví a umožňuje zistiť jednotlivé prípady fenotypovej zmeny pohlavia. Medzi ďalšie vrcholové sledované parametre, ktoré by sa mali merať, patrí miera liahnutia, prežívanie, dĺžka a telesná hmotnosť. Testovaciu metódu možno prispôsobiť aj iným druhom ako tie, ktoré sú uvedené vyššie, za predpokladu, že tieto druhy prejdú validáciou rovnocennou validácii vykonanej pre medaku japonskú, pichľavku sivú a dánio pruhované, že kontrolné ryby sú na konci testu pohlavne diferencované, že hladiny VTG sú dostatočne vysoké na to, aby sa odhalili výrazné odchýlky súvisiace s chemikáliami a že citlivosť testovacieho systému sa stanoví pomocou referenčných chemikálií s endokrinným pôsobením [(anti)-estrogény, (anti)-androgény, inhibítory aromatázy atď.]. Všetky validačné správy obsahujúce údaje z testu FSDT s použitím iných druhov by navyše mala preskúmať organizácia OECD, pričom výsledok validácie by sa mal považovať za uspokojivý.
|
Úvodné úvahy a obmedzenia
|
3.
|
VTG sa normálne tvorí v pečeni samičiek oviparných stavovcov v reakcii na endogénny estrogén v krvnom obehu (2). Je prekurzorom proteínov vajcového žĺtka a po vytvorení v pečeni sa krvným obehom dostane do vaječníka, kde ho prijmú a upravia vyvíjajúce sa vajíčka. Pri nedospelých rybách a dospelých samčekoch rýb je syntéza VTG veľmi obmedzená, ale zistiteľná, lebo nemajú dostatok estrogénu v krvnom obehu. Pečeň je však schopná syntetizovať a vylučovať VTG v reakcii na exogénnu estrogénovú stimuláciu (3) (4) (5).
|
|
4.
|
Meranie VTG slúži na zistenie chemikálií s estrogénnym anti-estrogénnym a androgénnym spôsobom účinku a chemikálií, ktoré narúšajú steroidogenézu ako sú napríklad inhibítory aromatázy. Estrogénne chemikálie možno zistiť meraním indukcie tvorby VTG pri samčekoch rýb, čo je v partnersky preskúmanej vedeckej literatúre dostatočne zdokumentované. Indukcia tvorby VTG sa preukázala aj po expozícii aromatizovateľným androgénom (6) (7). Zníženie hladiny estrogénu v krvnom obehu pri samičkách, napríklad prostredníctvom inhibície aromatázy, ktorá konvertuje endogénny androgén na prirodzený estrogén 17β-estradiol, spôsobuje pokles koncentrácie VTG, čo sa používa na zisťovanie chemikálií s vlastnosťami inhibujúcimi aromatázu alebo inhibítorov steroidogenézy vo všeobecnosti (33). Biologický význam reakcie VTG po estrogénnej inhibícii aromatázy je známy a dobre zdokumentovaný (8) (9). Je však možné, že tvorbu VTG pri samičkách môže ovplyvniť aj všeobecná toxicita a neendokrinné spôsoby toxického pôsobenia.
|
|
5.
|
Viaceré metódy merania boli úspešne vyvinuté a štandardizované na bežné použitie na kvantifikáciu VTG vo vzorkách krvi, pečene, celého tela alebo homogenátu hlavy/chvosta odobratých z jednotlivých rýb. Týka sa to dánia pruhovaného, pichľavky sivej a medaky japonskej ako aj čiastočne validovaného druhu čerebľa potočná. Sú dostupné metódy enzýmového imunosorbentového stanovenia (ELISA) špecifické pre jednotlivé druhy využívajúce imunochémiu na kvantifikáciu VTG (5) (10) (11) (12) (13) (14) (15) (16). V prípade medaky japonskej a dánia pruhovaného existuje dobrá korelácia medzi nameranou hodnotou VTG vo vzorkách krvnej plazmy, pečene a homogenátu, hoci homogenáty mávajú mierne nižšie hodnoty ako plazma (17) (18) (19). Dodatok 5 obsahuje odporúčané postupy na odber vzoriek na analýzu VTG.
|
|
6.
|
Zmena vo fenotypovom pomere pohlaví (podiely pohlaví) je sledovaný parameter, ktorý odzrkadľuje zmenu pohlavia. Pomer pohlaví pri vyvíjajúcich sa rybách môžu v zásade ovplyvniť estrogény anti-estrogény androgény anti-androgény a chemikálie inhibujúce steroidogenézu (20). Preukázalo sa, že táto zmena pohlavia je čiastočne reverzibilné pri dániu pruhovanom (21) po expozícii chemikáliám podobným estrogénu, kým zmena pohlavia po expozícii chemikáliám podobným androgénu je trvalá (30). Pohlavie je definované ako samičie, samčie, intersexuálne (oocyty ako aj spermatogénne bunky v jednej gonáde) alebo nediferencované, pričom pri jednotlivých rybách sa stanovuje histologickým vyšetrením gonád. Usmernenie je uvedené v dodatku 7 a v usmerňovacom dokumente OECD na diagnózu endokrinnej histopatológie gonád rýb (22).
|
|
7.
|
Genetické pohlavie sa skúma prostredníctvom genetických markerov ak v danom druhu rýb existujú. V prípade medaky japonskej možno samičie gény XX alebo samčie gény XY zistiť polymerázovou reťazovou reakciou (PCR), prípadne možno analyzovať gén domény DM spojený s chromozómom Y (DMY, negatívny alebo pozitívny) podľa opisu v odkazoch (23) (24). V prípade pichľavky sivej existuje rovnocenná metóda PCR na stanovenie genetického pohlavia, ktorá je opísaná v dodatku 10. Spoľahlivosť tohto testu sa zlepší ak genetické pohlavie možno individuálne spojiť s fenotypovým pohlavím, takže pri druhoch so zdokumentovanými genetickými pohlavnými markermi by sa malo určiť genetické pohlavie.
|
|
8.
|
Dva hlavné endokrinné sledované parametre, teda VTG a pomer pohlaví, môžu v kombinácii preukázať endokrinný spôsob pôsobenia (MOA) chemikálie (tabuľka 1). Pomer pohlaví je biomarker významný pre celú populáciu (25) (26) a pri niektorých dobre vymedzených spôsoboch pôsobenia možno výsledky testu FSDT použiť na účely posúdenia nebezpečenstva a rizika ak to regulačná agentúra považuje za vhodné. Tieto spôsoby pôsobenia sú v súčasnosti estrogény androgény a inhibítory steroidogenézy.
Tabuľka 1
Reakcia endokrinných sledovaných parametrov na rôzne spôsoby pôsobenia chemikálií:
↑ = zvyšovanie, ↓ = znižovanie, — = neskúmalo sa
|
MOA
|
VTG ♂
|
VTG ♀
|
Pomer pohlaví
|
ODKAZY
|
|
Slabý agonista estrogénu
|
↑
|
↑
|
↑♀ alebo ↑ nedif.
|
(27) (40)
|
|
Silný agonista estrogénu
|
↑
|
↑
|
↑♀ alebo ↑ nedif., žiadne ♂
|
(28) (40)
|
|
Antagonista estrogénu
|
—
|
—
|
↓♀, ↑ nedif.
|
(29)
|
|
Agonista androgénu
|
↓ alebo —
|
↓ alebo –
|
↑ ♂, žiadne ♀
|
(28) (30)
|
|
Antagonista androgénu
|
—
|
—
|
↑♀
↑ intersex.
|
(31)
|
|
Inhibítor aromatázy
|
↓
|
↓
|
↓♀
|
(33)
|
|
|
9.
|
Test FSDT sa nevzťahuje na reprodukčné štádium života rýb, takže chemikálie, ktoré môžu ovplyvniť rozmnožovanie pri nižšej koncentrácii ako pohlavný vývin, by sa mali preskúmať v teste, ktorý sa týka rozmnožovania.
|
|
10.
|
Vymedzenie pojmov na účely tejto testovacej metódy je uvedené v dodatku 1.
|
|
11.
|
Test FSDT in vivo je určený na zistenie chemikálií s androgénnymi a estrogénnymi vlastnosťami ako aj s anti-androgénnymi anti-estrogénnymi vlastnosťami a vlastnosťami inhibujúcimi steroidogenézu. Fázy validácie testu FSDT (1 a 2) zahŕňali estrogénne a androgénne chemikálie a chemikálie inhibujúce steroidogenézu. Účinky antagonistov estrogénu a androgénu v teste FSDT sú uvedené v tabuľke 1, ale tieto endokrinné spôsoby pôsobenia (MOA) sú v súčasnosti menej zdokumentované.
|
PRINCÍP TESTU
|
12.
|
Pri teste sa štádiá rýb od čerstvo oplodnených vajíčok až po skončenie pohlavnej diferenciácie exponujú aspoň trom koncentráciám testovanej chemikálie rozpustenej vo vode. Podmienky testu by mali byť prietokové, pokiaľ to nie je nemožné vzhľadom na dostupnosť alebo povahu (napr. obmedzenú rozpustnosť) testovanej chemikálie. Test sa začína umiestnením čerstvo oplodnených vajíčok (pred ryhovaním blastodisku) do skúšobných komôr. Plnenie komôr je pre jednotlivé druhy opísané v bode 27. V prípade validovaných druhov rýb, teda medaky japonskej, pichľavky sivej a dánia pruhovaného, sa test ukončí pri 60 dph. Po ukončení testu sa všetky ryby humánnym spôsobom usmrtia. Z každej ryby sa odoberie biologická vzorka (krvná plazma, pečeň alebo homogenát hlavy/chvosta) na analýzu VTG a zvyšná časť sa zafixuje na účely histologického vyšetrenia gonád na určenie fenotypového pohlavia. Voliteľne možno vykonať histopatologické vyšetrenie (napr. stanovenie štádia gonád, závažnosti intersexuálnej formy). V prípade druhov s príslušnými markermi sa odoberie biologická vzorka (z análnej alebo chrbtovej plutvy) na stanovenie genetického pohlavia (dodatky 9 a 10).
|
|
13.
|
Prehľad príslušných podmienok testu špecifických pre validované druhy medaka japonská, pichľavka sivá a dánio pruhované je uvedený v dodatku 2.
|
INFORMÁCIE O TESTOVANEJ CHEMIKÁLII
|
14.
|
Mali by byť k dispozícii výsledky testu akútnej toxicity alebo inej skúšky krátkodobej toxicity [napr. testovacej metódy C.14 (34) a OECD TG 210 (1)], vykonanej podľa možnosti s druhmi zvolenými na tento test. To znamená, že má byť známa rozpustnosť vo vode a tlak pary testovanej chemikálie a že je dostupná spoľahlivá analytická metóda na kvantifikáciu chemikálie v skúšobných komorách so známou a zdokumentovanou presnosťou a detekčným limitom.
|
|
15.
|
Medzi ďalšie užitočné informácie patrí štruktúrny vzorec, čistota chemikálie, stabilita vo vode a na svetle, pKa, Pow a výsledky testu na ľahkú biodegradovateľnosť (testovacia metóda C.4) (35).
|
Kritériá prijateľnosti testu
|
16.
|
Na to, aby boli výsledky testu prijateľné, musia platiť tieto podmienky:
|
—
|
koncentrácia rozpusteného kyslíka musí byť počas testu aspoň 60 % z rozpustnosti vzdušného kyslíka (ASV),
|
|
—
|
teplota vody by sa v danom čase počas obdobia expozície nemala medzi skúšobnými komorami líšiť o viac ako ± 1,5 °C a musí sa udržiavať v teplotných rozsahoch vymedzených pre testovací druh (dodatok 2),
|
|
—
|
mala by byť k dispozícii validovaná metóda na analýzu expozície chemikálii s detekčným limitom podstatne nižším ako najnižšia nominálna koncentrácia a mali by sa zhromaždiť dôkazy preukazujúce, že koncentrácie testovanej chemikálie v roztoku sa uspokojivo udržiavali v rozsahu ± 20 % priemerných nameraných hodnôt,
|
|
—
|
počet všetkých oplodnených vajíčok, ktoré prežili v kontrolných skupinách, prípadne v kontrolných skupinách s rozpúšťadlom, musí byť väčší alebo rovnaký ako limity stanovené v dodatku 2,
|
|
—
|
kritériá prijateľnosti týkajúce sa rastu a podielov pohlaví na konci testu sú založené na údajoch z kontrolných skupín (zo spojenej kontrolnej skupiny s rozpúšťadlom a vodou, pokiaľ sa výrazne nelíšia, tak len zo skupiny s rozpúšťadlom):
|
|
Medaka japonská
|
Dánio pruhované
|
Pichľavka sivá
|
|
Rast
|
Mokrá hmotnosť ryby vytretej do sucha
|
> 150 mg
|
> 75 mg
|
> 120 mg
|
|
Dĺžka (štandardná dĺžka)
|
> 20 mm
|
> 14 mm
|
> 20 mm
|
|
Pomer pohlaví (% samčekov alebo samičiek)
|
30 – 70 %
|
30 – 70 %
|
30 – 70 %
|
|
|
—
|
ak sa použije rozpúšťadlo, nemalo by mať žiadny štatisticky významný účinok na prežívanie a nemalo by mať žiadne účinky narušujúce endokrinný systém ani iné nepriaznivé účinky na skoré štádiá života zistené analýzou kontrolnej skupiny pre rozpúšťadlo.
|
Ak sa zistí odchýlka od kritérií prijateľnosti testu, dôsledky by sa mali posudzovať s ohľadom na spoľahlivosť testovacích údajov a tieto úvahy by mali byť zahrnuté do správy.
|
OPIS TESTOVACEJ METÓDY
Skúšobné komory
|
17.
|
Možno použiť akékoľvek komory zo skla, nehrdzavejúcej ocele alebo iné chemicky inertné komory. Rozmery komôr by mali byť dostatočne veľké, aby zodpovedali kritériám pre stupeň zaťaženia uvedeným ďalej. Je potrebné umiestniť skúšobné komory náhodne na testovacej ploche. Náhodný blokový dizajn, v ktorom sa každá koncentrácia nachádza v každom bloku, sa uprednostňuje pred úplne náhodným dizajnom. Skúšobné komory by sa mali chrániť pred nežiaducimi narušeniami.
|
Výber druhov
|
18.
|
Odporúčané druhy rýb sú uvedené v dodatku 2. Postupy na zahrnutie nových druhov sú uvedené v bode 2.
|
Chov rodičovských rýb
|
19.
|
Podrobnosti o chove rodičovských rýb za uspokojujúcich podmienok nájdete v usmernení OECD TG 210 (1). Rodičovské ryby sa majú kŕmiť vhodnou potravou raz alebo dvakrát denne.
|
Manipulácia s embryami a larvami
|
20.
|
Embryá a larvy sa môžu najskôr exponovať v hlavnej komore umiestnené v menších komorách zo skla alebo nehrdzavejúcej ocele so sieťovanými bočnými alebo čelnými stenami, ktoré umožňujú tok testovanej chemikálie cez komoru. Neturbulentný tok cez tieto malé komory možno zabezpečiť ich zavesením na ramene upravenom na pohyb komory nadol a nahor tak, aby organizmy zostali vždy ponorené.
|
|
21.
|
Ak sa v hlavnej testovacej komore použili nádoby, mriežky alebo sieťky na zadržiavanie vajíčok, tieto obmedzenia by sa po vyliahnutí lariev mali odstrániť okrem sieťok, ktoré by sa mali zachovať, aby sa zabránilo úniku rýb. Ak je potrebné preniesť larvy, nemali by sa vystaviť vzduchu a nemali by sa používať siete na vylovenie rýb z nádob na vajíčka. Načasovanie tohto prenosu sa mení v závislosti od druhu, pričom prenos nemusí byť vždy potrebný.
|
Voda
|
22.
|
Ako voda použitá na testovanie je vhodná každá voda, v ktorej testovacie druhy vykazujú kontrolné prežívanie aspoň také dobré ako vo vode opísanej v dodatku 3. Počas celého trvania testu má mať konštantnú kvalitu. V pravidelných intervaloch sa majú odoberať vzorky na analýzu, aby sa overilo, že riediaca voda neprimeraným spôsobom neovplyvňuje výsledky testu (napríklad reakciou s testovanou chemikáliou) alebo že nemá nepriaznivý vplyv na násadu rýb. Mal by sa merať celkový organický uhlík, vodivosť, pH a suspendované pevné látky, napríklad každé tri mesiace ak je známe, že riediaca voda má pomerne konštantnú kvalitu. Ak je kvalita vody pochybná, mal by sa merať obsah ťažkých kovov (napr. Cu, Pb, Zn, Hg, Cd, Ni), hlavných aniónov a katiónov (napr. Ca2+, Mg2+, Na+, K+, Cl–, SO4
2–) a pesticídov. Údaje o chemickej analýze a odbere vody možno nájsť v bode 34.
|
Testovacie roztoky
|
23.
|
Ak to je prakticky možné, mal by sa použiť prietokový systém. Na účely prietokových testov je potrebný systém, ktorý do skúšobných komôr nepretržite privádza a zrieďuje zásobný roztok testovanej chemikálie v sérii koncentrácií (napr. meracie čerpadlo, proporcionálny zmiešavač a saturačný systém). Prietoky zásobných roztokov a riediacej vody sa majú kontrolovať v určitých intervaloch počas testu, pričom sa v priebehu testu nesmú meniť o viac ako 10 %. Za vhodný sa považuje prietok zodpovedajúci aspoň piatim objemom skúšobnej komory za 24 hodín (1). Treba dbať na to, aby sa nepoužívali plastové trubice ani iné materiály, z ktorých niektoré môžu obsahovať biologicky aktívne chemikálie alebo môžu adsorbovať testovanú chemikáliu.
|
|
24.
|
Zásobný roztok by sa podľa možnosti mal pripraviť bez použitia rozpúšťadiel jednoduchým premiešaním alebo pretrepaním testovanej chemikálie v riediacej vode s použitím mechanických prostriedkov (napr. miešaním alebo ultrazvukom). Ak sa testovaná chemikália ťažko rozpúšťa vo vode, mali by sa použiť postupy uvedené v usmerňovacom dokumente OECD o testovaní vodnej toxicity ťažkých látok a zmesí (36). Používaniu rozpúšťadiel sa treba vyhnúť, ale v niektorých prípadoch môže byť potrebné na vytvorenie vhodne koncentrovaného zásobného roztoku. Príklady vhodných rozpúšťadiel sú uvedené v literatúre (36).
|
|
25.
|
Treba sa vyhnúť semistatickým testovacím podmienkam, pokiaľ to nie je odôvodnené závažnými dôvodmi spojenými s testovanou chemikáliou (napr. stabilitou, obmedzenou dostupnosťou, vysokými nákladmi alebo rizikom). V prípade semistatickej metódy možno použiť dva rôzne postupy obnovy. Buď sa nové testovacie roztoky pripravia v čistých komorách a prežívajúce vajíčka a larvy sa opatrne prenesú do nových komôr alebo sa testovacie organizmy nechajú v skúšobných komorách a časť (aspoň dve tretiny) testovacej vody sa mení každý deň.
|
POSTUP
Podmienky expozície
Zber vajíčok a trvanie
|
26.
|
S cieľom zabrániť genetickému skresleniu sa odoberú vajíčka od najmenej troch chovných párov alebo skupín, následne sa zmiešajú a náhodne vyberú na test. V prípade pichľavky sivej si pozrite opis umelého oplodnenia v dodatku 11. Test by sa mal začať čo najskôr po oplodnení vajíčok, pričom embryá by sa podľa možnosti mali ponoriť do testovacích roztokov pred začiatkom ryhovania blastodisku alebo čo najskôr po tejto fáze a nie neskôr ako 12 hodín po oplodnení. Test by mal trvať dovtedy, kým sa v kontrolnej skupine neukončí pohlavná diferenciácia (60 dph pre medaku japonskú, pichľavku sivú i dánio pruhované).
|
Násada
|
27.
|
Počet oplodnených vajíčok na začiatku testu musí byť aspoň 120 na každú koncentráciu. Toto množstvo sa rozdelí medzi minimálne štyri replikáty (prijateľné rozdelenie do kontrolnej skupiny je na základe funkcie druhej odmocniny). Vajíčka by mali byť náhodne distribuované medzi jednotlivými skupinami s rôznymi koncentráciami chemikálie (s použitím štatistických tabuliek na randomizáciu). Stupeň zaťaženia (vymedzenie pojmu nájdete v dodatku 1) by mal byť dostatočne nízky na to, aby bolo možné udržať koncentráciu rozpustného kyslíka aspoň 60 % ASV bez priameho prevzdušňovania komôr. Pri prietokových testoch sa odporúča, aby stupeň zaťaženia neprekročil 0,5 g/l počas 24 hodín, pričom nikdy nesmie prekročiť množstvo 5 g/l roztoku. Najneskôr do 28 dní po oplodnení by sa mal prerozdeliť počet rýb v replikátoch tak, aby každý replikát obsahoval pokiaľ možno množstvo rýb. Ak dôjde k úmrtnosti súvisiacej s expozíciou, počet replikátov by sa mal primerane znížiť tak, aby bola hustota rýb medzi skupinami s jednotlivými koncentráciami pokiaľ možno rovnaká.
|
Svetlo a teplota
|
28.
|
Fotoperióda a teplota vody by mali byť vhodné pre testovacie druhy (pokusné podmienky testu FSDT nájdete v dodatku 2).
|
Kŕmenie
|
29.
|
Potrava a kŕmenie sú rozhodujúce a je nevyhnutné, aby sa v každom štádiu poskytovala správna potrava vo vhodných časových intervaloch a v dostatočnom množstve na podporu normálneho rastu. Kŕmiť by sa malo ad libitum a zároveň by sa mal minimalizovať prebytok. Na dosiahnutie dostatočnej rýchlosti rastu sa ryby majú kŕmiť aspoň dvakrát denne (cez víkendy je prijateľné raz denne), pričom medzi každým kŕmením by mali byť aspoň tri hodiny. Nadbytočná potrava a výkaly sa majú podľa potreby odstrániť, aby sa nehromadil odpad. Na základe získaných skúsenosti sa potrava a kŕmne režimy neprestajne upravujú s cieľom zlepšiť prežívanie a optimalizovať rast. Preto je potrebné vyvinúť ie na to, aby navrhovaný režim potvrdili uznávaní odborníci. Kŕmenie sa neposkytne 24 hodín pred koncom testu. Príklady vhodnej potravy sú uvedené v dodatku 2 [pozri tiež rámec OECD pre testovanie rýb (39)].
|
Testované koncentrácie
|
30.
|
Odstup medzi testovanými chemikáliami by mal zodpovedať opisu v dodatku 4. Majú sa použiť minimálne tri testované koncentrácie v aspoň štyroch replikátoch. Pri výbere rozsahu testovaných koncentrácií je potrebné vziať do úvahy krivku vzťahujúcu hodnotu LC50 k obdobiu expozície z dostupných štúdií akútnej toxicity. Ak sa údaje majú použiť na posúdenie rizika, odporúča sa päť testovaných koncentrácií.
|
|
31.
|
Koncentrácie chemikálie vyššie ako 10 % hodnoty LC50 pre akútnu toxicitu pri dospelých jedincoch alebo 10 mg/l, podľa toho, ktorá hodnota je nižšia, sa nemusia testovať. Maximálna testovaná koncentrácia by mala byť 10 % LC50 v štádiu života larvy/mladého jedinca.
|
Kontrolné skupiny
|
32.
|
Okrem testovaných koncentrácií by sa mala analyzovať kontrolná skupina s riediacou vodou (≥ 4 replikáty) a podľa potreby aj kontrolná skupina s rozpúšťadlom (≥ 4 replikáty). V teste možno použiť iba rozpúšťadlá, o ktorých sa zistilo, že nemajú žiadny štatisticky významný vplyv na sledované parametre testu.
|
|
33.
|
Ak sa použije rozpúšťadlo, jeho konečná koncentrácia nesmie byť vyššia ako 0,1 ml/l (36) a mala by byť rovnaká vo všetkých skúšobných komorách s výnimkou kontrolnej skupiny s riediacou vodou. Je však potrebné vynaložiť maximálne úsilie, aby sa predišlo použitiu rozpúšťadla alebo, aby sa jeho koncentrácia udržala na minime.
|
Frekvencia analytických stanovení a meraní
|
34.
|
Pred začatím testu by sa mala vykonať chemická analýza koncentrácie testovanej chemikálie na kontrolu splnenia kritérií prijateľnosti. Všetky replikáty by sa mali analyzovať individuálne na začiatku a konci testu. Počas testu by sa aspoň raz za týždeň mal analyzovať jeden replikát na testovanú koncentráciu, pričom replikáty by sa mali systematicky obmieňať (1, 2, 3, 4, 1, 2…). Ak sa vzorky skladujú na neskoršiu analýzu, metódu skladovania vzoriek je potrebné vopred validovať. Vzorky sa majú filtrovať (napr. pomocou filtra s veľkosťou pórov 0,45 μm) alebo odstrediť, aby sa zabezpečilo, že stanovenia sa vykonajú na chemikálii v skutočnom roztoku.
|
|
35.
|
Počas testu sa má vo všetkých skúšobných komorách merať rozpustený kyslík, pH, celková tvrdosť, vodivosť, slanosť (ak je relevantná) a teplota. Každý týždeň sa má merať aspoň rozpustený kyslík, slanosť (ak je relevantná) a teplota. Hodnota pH, vodivosť a tvrdosť sa majú merať na začiatku a konci testu. Teplota sa má podľa možnosti nepretržite monitorovať aspoň v jednej skúšobnej komore.
|
|
36.
|
Výsledky by mali byť založené na nameraných koncentráciách. Ak sa však koncentrácia testovanej látky v roztoku počas celého testu uspokojivo udržiavala v rozmedzí ± 20 % nominálnej koncentrácie, potom výsledky môžu byť založené buď na nominálnych alebo na nameraných hodnotách.
|
Pozorovania a merania
Štádium embryonálneho vývinu
|
37.
|
Expozícia by sa mala začať čo najskôr po oplodnení a pred začiatkom ryhovania blastodisku a nie neskôr ako 12 hodín po oplodnení, aby sa zabezpečila expozícia počas skorého embryonálneho vývinu.
|
Liahnutie a prežívanie
|
38.
|
Pozorovania liahnutia a prežívania by sa mali vykonávať aspoň raz za deň a mali by sa zaznamenať príslušné počty. Mŕtve embryá, larvy a mladé ryby je potrebné odstrániť ihneď ako sa spozorujú, lebo sa môžu rýchlo rozkladať a môže ich narušiť činnosť iných rýb. Mimoriadnu pozornosť treba venovať tomu, aby sa pri odstraňovaní mŕtvych jedincov neudreli alebo fyzicky nepoškodili susedné vajíčka/larvy, ktoré sú mimoriadne krehké a citlivé. Kritériá úhynu sa menia podľa štádia života:
|
—
|
vajíčka: najmä v skorých štádiách výrazná strata priesvitnosti a zmena sfarbenia spôsobená koaguláciou a/alebo zrážaním proteínov vedúca k bielemu nepriehľadnému vzhľadu,
|
|
—
|
larvy a mladé ryby: nepohyblivosť a/alebo neprítomnosť respiračných pohybov a/alebo neprítomnosť tepu srdca a/alebo biele nepriehľadné sfarbenie centrálneho nervového systému a/alebo nereagovanie na mechanické podnety.
|
|
Abnormálny vzhľad
|
39.
|
Je potrebné zaznamenať počet lariev alebo rýb s abnormálnym tvarom tela a opísať vzhľad a charakter abnormality. Treba poznamenať, že abnormálne embryá a larvy sa vyskytujú prirodzene a pri niektorých druhoch môžu byť rádovo v rozmedzí niekoľkých percent v kontrolných skupinách. Abnormálne živočíchy sa majú zo skúšobnej komory odstrániť len v prípade úhynu. V súlade so smernicou Európskeho parlamentu a Rady 2010/63/EÚ z 22. septembra 2010 o ochrane zvierat používaných na vedecké účely však v prípade, že abnormality spôsobujú bolesť, utrpenie, strach alebo trvalé poškodenie a možno spoľahlivo predvídať smrť, je potrebné živočíchy umŕtviť a usmrtiť podľa opisu v bode 44 a na účely analýzy údajov považovať za uhynuté.
|
Abnormálne správanie
|
40.
|
Ak sa vyskytnú abnormality, napr. hyperventilácia, nekoordinované plávanie, netypická nehybnosť a netypické správanie pri kŕmení, je potrebné ich výskyt zaznamenať.
|
Hmotnosť
|
41.
|
Na konci testu sa všetky prežívajúce ryby musia usmrtiť (umŕtviť ak sa majú odobrať krvné vzorky) a odmeria sa individuálna mokrá hmotnosť (ryby vytreté do sucha).
|
Dĺžka
|
42.
|
Na konci testu sa odmeria dĺžka jednotlivých rýb (štandardná dĺžka).
|
|
43.
|
Na základe týchto pozorovaní sa získajú niektoré alebo všetky z nasledujúcich údajov, ktoré možno uviesť v správe:
|
—
|
počet zdravých rýb na konci testu,
|
|
—
|
čas do začiatku liahnutia a konca liahnutia,
|
|
—
|
dĺžka a hmotnosť prežívajúcich živočíchov,
|
|
—
|
počet deformovaných lariev,
|
|
—
|
počet rýb s abnormálnym správaním.
|
|
Odber vzoriek rýb
|
44.
|
Odber vzoriek rýb sa vykonáva na konci testu. Odobraté ryby sa majú usmrtiť napr. pomocou látky MS-222 (100 – 500 mg/l tlmenej 200 mg NaHCO3/l) alebo FA-100 (4-alyl-2-metoxyfenol: eugenol) a individuálne odmerať a odvážiť (mokrá hmotnosť, ryby vytreté do sucha) alebo umŕtviť ak sa majú odobrať krvné vzorky (pozri bod 49).
|
Odber vzoriek na analýzu VTG a určenie pohlavia prostredníctvom histologického hodnotenia
|
45.
|
Všetky ryby sa majú odobrať a pripraviť na analýzu pohlavia a VTG. Všetky ryby sa majú histologicky analyzovať na účely určenia pohlavia. Na účely merania VTG je prijateľné odobrať podvzorku aspoň 16 rýb z každého replikátu. Ak sú výsledky analýzy VTG podvzoriek nejasné, je potrebné analyzovať viac rýb.
|
|
46.
|
Postup odberu vzoriek na analýzu VTG a určenie pohlavia závisí od metódy analýzy VTG:
|
Metóda homogenátu hlavy/chvosta na účely analýzy VTG
|
47.
|
Ryby sa usmrtia. Hlava a chvost z každej ryby sa skalpelom oddelia od tela ryby rezmi bezprostredne za prsnými plutvami a hneď za chrbtovou plutvou (pozri obrázok 1). Hlavová a chvostová časť každej ryby sa na účely analýzy VTG spoja, odvážia a jednotlivo očíslujú, zmrazia v tekutom dusíku a skladujú pri teplote – 70 C alebo nižšej. Telová časť ryby sa očísluje a zafixuje vo vhodnom fixačnom prostriedku na účely histologického hodnotenia (22). Pomocou tejto metódy sa vyhodnotí VTG a histopatológia na každom jedincovi, takže prípadná zmena v hladine VTG sa môže dať do súvislosti s fenotypovým pohlavím ryby alebo genetickým pohlavím (medaka japonská a pichľavka sivá) ryby. Ďalšie informácie nájdete v usmernení pre homogenizáciu (dodatok 5) a usmernení pre kvantifikáciu VTG (dodatok 6).
|
Metóda homogenátu pečene na účely analýzy VTG
|
48.
|
Ryby sa usmrtia. Pečeň sa oddelí rezom a skladuje pri teplote – 70 C alebo nižšej. Odporúčané postupy na vyrezanie pečene a predbežné spracovanie nájdete v usmernení OECD TG 229 (37) alebo v kapitole C.37 tejto prílohy (38). Pečene sa potom individuálne homogenizujú podľa opisu v usmernení OECD TG 229 alebo v kapitole C.37 tejto prílohy. Odobratý supernatant sa použije na odmeranie VTG pomocou homologickej metódy ELISA [príklad kvantifikácie nájdete v dodatku 6 pre dánio pruhované alebo v usmernení OECD TG 229 (37) pre medaku japonskú]. S použitím tohto prístupu je tiež možné získať údaje o VTG a histológii gonád jednotlivých rýb.
|
Metóda krvnej plazmy na účely analýzy VTG
|
49.
|
Krv sa odoberie z umŕtvených rýb vpichom do srdca, rezom chvostovej žily alebo chvosta a odstredí sa pri teplote 4 °C na účely odberu plazmy. Plazma sa až do použitia skladuje pri teplote – 70 °C alebo nižšej. Celá ryba sa usmrtí a zafixuje na účely histologického vyšetrenia. Vzorky plazmy i samotné ryby sa individuálne očíslujú, aby bolo možné stanoviť súvislosť hladiny VTG s pohlavím ryby.
Obrázok 1
Ako rezať rybu na účely merania VTG pomocou homogenátu hlavy/chvosta a histologického hodnotenia strednej časti

|
Určenie genetického pohlavia
|
50.
|
V prípade druhov s vhodnými markermi sa na určenie genetického pohlavia odoberú biologické vzorky jednotlivých rýb. V prípade medaky japonskej sa odoberie análna alebo chrbtová plutva. Podrobný opis je uvedený v dodatku 9 vrátane odberu tkaniva a určenia pohlavia metódou PCR. Opis odberu tkaniva a určenia pohlavia metódou PCR pre pichľavku sivú je uvedený v dodatku 10.
|
Meranie VTG
|
51.
|
Meranie VTG by malo byť založené na kvantitatívnej a analyticky validovanej metóde. Mali by byť k dispozícii informácie o variabilite metódy, ktorá sa použila v danom laboratóriu, v rámci skúšky a medzi skúškami. Zdroj variability v rámci laboratória a medzi laboratóriami je (najpravdepodobnejšie) založený na rôznych vývinových štádiách populácie rýb. Vzhľadom na variabilitu merania VTG by sa k hodnotám NOEC založeným len na tomto sledovanom parametri malo pristupovať veľmi opatrne. Sú k dispozícii rôzne metódy na posúdenie tvorby VTG pri druhoch rýb použitých v tejto skúške. Pomerne citlivou a zároveň špecifickou meracou metódou je stanovenie koncentrácie bielkovín pomocou enzýmového imunosorbentového stanovenia (ELISA). Mali by sa použiť homologické protilátky (vytvorené proti VTG rovnakého druhu) a najdôležitejšie homologické štandardy.
|
Určenie pohlavia
|
52.
|
V závislosti od postupu odberu vzoriek na analýzu VTG sa celá ryba alebo zvyšná stredná časť každej ryby umiestni do označenej spracovacej kazety a zafixuje vo vhodnom fixačnom prostriedku na účely histologického určenia pohlavia (voliteľne aj na vyhodnotenie štádia gonád). Usmernenia na fixáciu a zaliatie sú uvedené v dodatku 7 ako aj v usmerňovacom dokumente OECD o diagnóze endokrinnej histopatológie gonád rýb (22). Po spracovaní sa ryby zalejú do parafínových blokov. Ryby sa do parafínového bloku umiestňujú pozdĺžne. Z každého jedinca sa odoberie aspoň šesť pozdĺžnych rezov (s hrúbkou 3 – 5 μm) v čelnej rovine, ktoré obsahujú tkanivo z obidvoch gonád. Rozstup medzi týmito rezmi by mal byť približne 50 μm pri samčekoch a 250 μm pri samičkách. Keďže však každý blok bude často obsahovať samčekov i samičky (ak je v každom bloku zaliatych viac jedincov), rozstup medzi rezmi z týchto blokov by mal byť približne 50 μm, kým sa nezíska aspoň šesť rezov gonád z každého samčeka. Potom možno rozstup medzi rezmi zvýšiť na približne 250 μm pre samičky. Rezy sa zafarbia hematoxylínom a eozínom a vyhodnotia pomocou svetelnej mikroskopie s dôrazom na pohlavie (samčie, samičie, intersexuálne alebo nediferencované). Intersexuál je vymedzený ako prítomnosť viac, ako jedného oocytu v semenníkoch na šesť analyzovaných rezov alebo prítomnosť spermatogénnych buniek (áno/nie) vo vaječníkoch. Histopatologické vyšetrenie a stanovenie štádia vaječníkov a semenníkov je voliteľné, ale ak sa vykonáva, výsledky sa majú štatisticky analyzovať a uviesť do správy. Treba poznamenať, že niektoré druhy rýb prirodzene nemajú plne vyvinutý pár gonád a môže byť prítomná len jedna gonáda (napr. medaka japonská a príležitostne dánio pruhované). Všetky tieto pozorovania sa musia zaznamenať.
|
|
53.
|
Určenie genetického pohlavia pri jednotlivých medakách japonských je založené na prítomnosti alebo neprítomnosti génu určujúceho samčie pohlavie pri medakáchch DMY, ktorý sa nachádza na chromozóme Y. Genotypové pohlavie medaky možno identifikovať sekvenovaním génu DMY z DNA vyextrahovanej napríklad z kúska análnej alebo chrbtovej plutvy. Prítomnosť génu DMY znamená samčieho jedinca (XY) bez ohľadu na fenotyp, zatiaľ čo chýbajúci gén DMY znamená samičieho jedinca (XX) bez ohľadu na fenotyp (23). Usmernenie na prípravu tkaniva a použitie metódy PCR sú uvedené v dodatku 9. Genetické pohlavie jednotlivých pichľaviek sivých sa takisto určuje metódou PCR, ktorá je opísaná v dodatku 10.
|
|
54.
|
Výskyt intersexuálov (vymedzenie pojmu je uvedené v dodatku 1) je potrebné uviesť do správy.
|
Sekundárne pohlavné znaky
|
55.
|
Pri druhoch ako medaka japonská sekundárne pohlavné znaky reguluje endokrinný systém. Pozorovania fyzického vzhľadu rýb by sa preto mali podľa možnosti uskutočniť na konci expozície. V prípade medaky japonskej je bradavkový útvar v zadnej časti análnej plutvy samičiek citlivý na androgén. Kapitola C.37 tejto prílohy (38) obsahuje príslušné fotografie samčích sekundárnych pohlavných znakov a androgenizovaných samičiek.
|
ÚDAJE A PODÁVANIE SPRÁV
Spracovanie výsledkov
|
56.
|
Je dôležité, aby sa sledovaný parameter vyhodnocoval pomocou najsilnejšieho platného štatistického testu. Pokusnou jednotkou je replikát, ale do štatistického testovania je potrebné zahrnúť aj variabilitu v rámci replikátu. V dodatku 8 je uvedená schéma rozhodovania ako pomôcka pri výbere najvhodnejšieho štatistického testu na základe povahy údajov získaných z testu. Hladina štatistickej významnosti pre všetky zahrnuté sledované parametre je 0,05.
|
Podiel pohlaví a genetických pohlaví
|
57.
|
Podiely pohlaví sa majú analyzovať z hľadiska významného účinku (prístup NOEC/LOEC) expozície pomocou Jonckheereho-Terpstrovho (trendového) testu ak existuje monotónny priebeh krivky závislosti dávka-odpoveď. Ak sa zistí nemonotónnosť, je potrebné použiť párový test. V prípade normality a homogénneho rozptylu použite Dunnettov test. V prípade heterogénneho rozptylu použite Tamhaneho-Dunnettov test. V ostatných prípadoch použite presný Mann-Whitneyho test s Bonferroniho-Holmovou úpravou. Dodatok 8 obsahuje schému opisujúcu štatistiku pre podiely pohlaví. Podiely pohlaví sa musia uvádzať v tabuľkách ako podiely koncentrácií ± SD pre samčekov, samičky, intersexuálov a nediferencované jedince. Je potrebné uviesť štatistickú významnosť. Príklady sú uvedené vo validačnej správe o teste FSDT, fáza 2 (42). Genetické pohlavie sa uvádza ako percento zmeny fenotypového pohlavia pre samčekov, samičky, intersexuálov a nediferencované jedince.
|
Koncentrácie VTG
|
58.
|
Koncentrácie VTG sa majú analyzovať z hľadiska významného účinku (prístup NOEC/LOEC) expozície. Uprednostňuje sa Dunnettov test pred t-testom s Bonferroniho korekciou. Ak sa použije Bonferroniho korekcia, uprednostňuje sa Bonferroniho-Holmova korekcia. Je možné urobiť logaritmickú transformáciu hodnôt VTG, aby sa dosiahla normalita a homogenita rozptylu. Ďalej ak je závislosť veličiny od koncentrácie v súlade s monotónnosťou, namiesto všetkých uvedených testov sa uprednostňuje Jonckheereho-Terpstrov test. Ak sa použijú t-testy alebo Dunnettov test, nie je potrebné dosiahnuť významnosť v F-teste analýzy ANOVA na to, aby bolo možné pokračovať. Podrobnosti nájdete v schéme v dodatku 8. Výsledky sa majú uvádzať v tabuľkách ako priemery koncentrácií ± SD samostatne pre samčekov, samičky, intersexuálov a nediferencované jedince. Je potrebné uviesť štatistickú významnosť pre fenotypové samičky a fenotypových samčekov. Príklady sú uvedené vo validačnej správe o teste FSDT, fáza 2 (42).
|
Skutočné koncentrácie testovanej chemikálie
|
59.
|
Skutočné koncentrácie testovanej chemikálie v komorách sa majú analyzovať vo frekvenciách uvedených v bode 34. Výsledky sa majú uvádzať v tabuľkách ako priemerná koncentrácia ± SD pre replikáty a pre jednotlivé koncentrácie, pričom treba uviesť informácie o počte vzoriek a extrémnych hodnotách odchyľujúcich sa od priemernej koncentrácie v jednotlivých skupinách o ± 20 %. Príklady sú uvedené vo validačnej správe o teste FSDT, fáza 2 (42).
|
Interpretácia výsledkov
|
60.
|
Výsledky by sa mali interpretovať s opatrnosťou ak namerané koncentrácie testovanej chemikálie v testovacích roztokoch dosahujú úrovne blízke detekčnému limitu analytickej metódy.
|
Protokol o skúške
|
61.
|
Protokol o skúške musí obsahovať tieto informácie:
|
|
Testovaná chemikália:
|
—
|
fyzikálno-chemické vlastnosti, chemické identifikačné údaje vrátane čistoty a analytickej metódy kvantifikácie testovanej chemikálie.
|
|
|
|
Podmienky testu
|
—
|
použitý postup testu (napr. prietokový, semistatický/obnovovací), koncepcia testu vrátane testovaných koncentrácií, metódy prípravy zásobných roztokov (v prílohe), frekvencie obnovovania (ak sa použije solubilizačný prostriedok, musí sa uviesť jeho názov a koncentrácia),
|
|
—
|
nominálne testované koncentrácie, priemery nameraných hodnôt a ich štandardné odchýlky v skúšobných komorách a metóda akou sa vypočítali (použitá analytická metóda by mala byť uvedená v prílohe), dôkaz o tom, že merania odkazujú na koncentrácie testovanej chemikálie v skutočnom roztoku,
|
|
—
|
kvalita vody v skúšobných komorách: pH, tvrdosť, teplota a koncentrácia rozpustného kyslíka,
|
|
—
|
podrobné informácie o kŕmení (napr. druh potravy, zdroj, podávané množstvo a frekvencia a analýzy kontaminujúcich látok (napr. PCB, PAH a organochlórové pesticídy) ak to je relevantné.
|
|
|
|
Výsledky
|
—
|
dôkaz, že kontrolné skupiny splnili kritériá validity: údaje o miere liahnutia by sa mali uviesť v tabuľkách ako percento na replikát a na koncentráciu. Je potrebné zdôrazniť odchýlky od kritérií prijateľnosti (v kontrolných skupinách). Údaje o prežití by sa mali uviesť ako percento na replikát a na koncentráciu. Je potrebné zdôrazniť odchýlky od kritérií validity (v kontrolných skupinách),
|
|
—
|
jasné uvedenie výsledkov získaných pre rôzne sledované parametre: prežívanie embryí a úspech liahnutia, externé abnormality, dĺžka a hmotnosť, merania VTG (ng/g homogenátu, ng/ml plazmy alebo ng/mg pečene), histológia gonád, výskyt akýchkoľvek nezvyčajných reakcií rýb a akékoľvek viditeľné účinky testovanej chemikálie.
|
|
|
|
62.
|
Výsledky sa majú uviesť ako priemerné hodnoty ± štandardná odchýlka (SD) alebo štandardná chyba (SE). Štatistické údaje sa majú uvádzať minimálne ako hodnoty NOEC a LOEC a intervaly spoľahlivosti. Je potrebné dodržiavať štatistickú schému (dodatok 8).
|
LITERATÚRA
|
1.
|
OECD (1992), Fish, Early Life Stage Toxicity Test, Test Guideline No. 210, Guidelines for the Testing of Chemicals, OECD, Paríž.
|
|
2.
|
Jobling, S., D. Sheahan, J.A. Sumpter, 1996, ‚Inhibition of testicular growth in rainbow trout (Oncorhynchus mykiss) exposed to estrogenic alkylphenolic chemicals‘, Environmental Toxicology and Chemistry 15, s. 194 – 202.
|
|
3.
|
Sumpter, J.P. a S. Jobling, 1995, ‚Vitellogenesis As A Biomarker for Estrogenic Contamination of the Aquatic Environment‘, Environmental Health Perspectives 103, s. 173 – 178.
|
|
4.
|
Tyler, C.R., R.van Aerle, T.H. Hutchinson, S. Maddix a H. Trip (1999), ‚An in vivo testing system for endocrine disruptors in fish early life stages using induction of vitellogenin‘, Environmental Toxicology and Chemistry 18, s. 337 – 347.
|
|
5.
|
Holbech, H., L. Andersen, G.I. Petersen, B. Korsgaard, K.L. Pedersen a P. Bjerregaard (2001a), ‚Development of an ELISA for vitellogenin in whole body homogenate of zebrafish (Danio rerio)‘, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 130, s. 119 – 131.
|
|
6.
|
Andersen, L., P. Bjerregaard a B. Korsgaard ( 2003), ‚Vitellogenin induction and brain aromatase activity in adult male and female zebrafish exposed to endocrine disrupters‘, Fish Physiology and Biochemistry 28, s. 319 – 321.
|
|
7.
|
Orn, S., H. Holbech, T.H. Madsen, L. Norrgren a G.I. Petersen (2003), ‚Gonad development and vitellogenin production in zebrafish (Danio rerio) exposed to ethinylestradiol and methyltestosterone‘ aquatic Toxicology 65, s. 397 – 411.
|
|
8.
|
Panter, G.H., T.H. Hutchinson, R. Lange, C.M. Sumpter, M. Zerulla a C.R. Tyler (2002), ‚Utility of a juvenile fathead minnow screening assay for detecting (anti-)estrogenic substances‘, Environmental Toxicology and Chemistry 21, s. 319 – 326.
|
|
9.
|
Sun, L.W., J.M. Zha, P.A. Spear a Z.J. Wang (2007), ‚Toxicity of the aromatase inhibitor letrozole to Japanese medaka (Oryzias latipes) eggs, larvae and breeding adults‘, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 145, s. 533 – 541.
|
|
10.
|
Parks, L.G. a.O. Cheek, N.D. Denslow, S.A. Heppell, J.A. McLachlan, G.A. LeBlanc a C.V.Sullivan (1999), ‚Fathead minnow (Pimephales promelas) vitellogenin: purification, characterization and quantitative immunoassay for the detection of estrogenic compounds‘, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 123, s. 113 – 125.
|
|
11.
|
Brion, F., B.M. Nilsen, J.K. Eidem a. Goksoyr a J.M. Porcher (2002), ‚Development and validation of an enzyme-linked immunosorbent assay to measure vitellogenin in the zebrafish (Danio rerio)‘, Environmental Toxicology and Chemistry 21, s. 1699 – 1708.
|
|
12.
|
Nishi, K., M. Chikae, Y. Hatano, H. Mizukami, M. Yamashita, R. Sakakibara a E. Tamiya (2002), ‚Development and application of a monoclonal antibody-based sandwich ELISA for quantification of Japanese medaka (Oryzias latipes) vitellogenin‘, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 132, s. 161 – 169.
|
|
13.
|
Hahlbeck, E., I. Katsiadaki, I. Mayer, M. Adolfsson-Erici, J. James a B.E. Bengtsson (2004), ‚The juvenile three-spined stickleback (Gasterosteus aculeatus L.) as a model organism for endocrine disruption – II – kidney hypertrophy, vitellogenin and spiggin induction‘ aquatic Toxicology 70, s. 311 – 326.
|
|
14.
|
Tatarazako, N., M. Koshio, H. Hori, M. Morita a T. Iguchi (2004), ‚Validation of an enzyme-linked immunosorbent assay method for vitellogenin in the medaka‘, Journal of Health Science 50, s. 301 – 308.
|
|
15.
|
Eidem, J.K., H. Kleivdal, K. Kroll, N. Denslow, R. van Aerle, C. Tyler, G. Panter, T. Hutchinson a A. Goksoyr (2006), ‚Development and validation of a direct homologous quantitative sandwich ELISA for fathead minnow (Pimephales promelas) vitellogenin. Aquatic Toxicology‘, 78, s. 202 – 206.
|
|
16.
|
Jensen, K.M. a G.T. Ankley (2006), ‚Evaluation of a commercial kit for measuring vitellogenin in the fathead minnow (Pimephales promelas)‘, Ecotoxicology and Environmental Safety 64, s. 101 – 105.
|
|
17.
|
Holbech, H., Petersen, G. I., Norman a., Örn, S, Norrgren, L. a Bjerregaard, P (2001b), ‚Suitability of zebrafish as test organism for detection of endocrine disrupting chemicals. Comparison of vitellogenin in plasma and whole body homogenate from zebrafish (Danio rerio) and rainbow trout (Oncorhynchus mykiss)‘, Nordic Council of Ministers, TemaNord 2001:597, s. 48 – 51.
|
|
18.
|
Nilsen, B.M., K. Berg, J.K. Eidem, S.I. Kristiansen, F. Brion, J.M. Porcher a A. Goksoyr (2004), ‚Development of quantitative vitellogenin-ELISAs for fish test species used in endocrine disruptor screening‘ analytical and Bioanalytical Chemistry 378, s. 621 – 633.
|
|
19.
|
Orn, S., S. Yamani a L. Norrgren (2006), ‚Comparison of vitellogenin induction, sex ratio and gonad morphology between zebrafish and Japanese medaka after exposure to 17 alpha-ethinylestradiol and 17 beta-trenbolone‘ archives of Environmental Contamination and Toxicology 51, s. 237 – 243.
|
|
20.
|
Scholz, S. a N. Kluver (2009), ‚Effects of Endocrine Disrupters on Sexual, Gonadal Development in Fish‘, Sexual Development 3, s. 136 – 151.
|
|
21.
|
Fenske, M., G. Maack, C. Schafers a H. Segner (2005), ‚An environmentally relevant concentration of estrogen induces arrest of male gonad development in zebrafish, Danio rerio‘, Environmental Toxicology and Chemistry 24, s. 1088 – 1098.
|
|
22.
|
OECD (2010), Guidance Document on the Diagnosis of Endocrine-related Histopathology in Fish Gonads, Series on Testing and Assessment No. 123, ENV/JM/MONO(2010)14, OECD, Paríž.
|
|
23.
|
Kobayashi, T., M. Matsuda, H. Kajiura-Kobayashi a. Suzuki, N. Saito, M. Nakamoto, N. Shibata a Y. Nagahama (2004), ‚Two DM domain genes, DMY and DMRT1, involved in testicular differentiation and development in the medaka, Oryzias latipes‘, Developmental Dynamics 231, s. 518 – 526.
|
|
24.
|
Shinomiya a., H. Otake, K. Togashi, S. Hamaguchi a M. Sakaizumi (2004), ‚Field survey of sex-reversals in the medaka, Oryzias latipes: genotypic sexing of wild populations‘, Zoological Science 21, s. 613 – 619.
|
|
25.
|
Kidd, K.A., P.J. Blanchfield, K.H. Mills, V.P. Palace, R.E. Evans, J.M. Lazorchak a R.W. Flick (2007), ‚Collapse of a fish population after exposure to a synthetic estrogen‘, Proceedings of the National Academy of Sciences of the United States of America 104, s. 8897 – 8901.
|
|
26.
|
Palace,V.P., R.E. Evans, K.G. Wautier, K.H. Mills, P.J. Blanchfield, B.J. Park, C.L. Baron a K.A. Kidd (2009) ‚Interspecies differences in biochemical, histopathological, and population responses in four wild fish species exposed to ethynylestradiol added to a whole lake‘, Canadian Journal of Fisheries and Aquatic Sciences 66, s. 1920 – 1935.
|
|
27.
|
Panter, G.H., T.H. Hutchinson, K.S. Hurd, J. Bamforth, R.D. Stanley, S. Duffell, A. Hargreaves, S. Gimeno a C.R. Tyler (2006), ‚Development of chronic tests for endocrine active chemicals – Part 1. An extended fish early-life stage test for oestrogenic active chemicals in the fathead minnow (Pimephales promelas)‘, Aquatic Toxicology 77, s. 279 – 290.
|
|
28.
|
Holbech, H., K. Kinnberg, G.I. Petersen, P. Jackson, K. Hylland, L. Norrgren a P. Bjerregaard (2006), ‚Detection of endocrine disrupters: Evaluation of a Fish Sexual Development Test (FSDT)‘, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 144, s. 57 – 66.
|
|
29.
|
Andersen, L., K. Kinnberg, H. Holbech, B. Korsgaard a P. Bjerregaard (2004), ‚Evaluation of a 40 day assay for testing endocrine disrupters: Effects of an anti-estrogen and an aromatase inhibitor on sex ratio and vitellogenin concentrations in juvenile zebrafish (Danio rerio)‘, Fish Physiology and Biochemistry 30, s. 257 – 266.
|
|
30.
|
Morthorst, J.E., H. Holbech a P. Bjerregaard (2010), ‚Trenbolone causes irreversible masculinization of zebrafish at environmentally relevant concentrations‘, Aquatic Toxicology 98, s. 336 – 343.
|
|
31.
|
Kiparissis,Y., T.L. Metcalfe, G.C. Balch a C.D. Metcalf (2003), ‚Effects of the antiandrogens, vinclozolin and cyproterone acetate on gonadal development in the Japanese medaka (Oryzias latipes)‘, Aquatic Toxicology 63, s. 391 – 403.
|
|
32.
|
Panter, G.H., T.H. Hutchinson, K.S. Hurd, A. Sherren, R.D. Stanley a C.R. Tyler (2004), ‚Successful detection of (anti-) androgenic and aromatase inhibitors in pre-spawning adult fathead minnows (Pimephales promelas) using easily measured endpoints of sexual development‘, Aquatic Toxicology 70, s. 11 – 21.
|
|
33.
|
Kinnberg, K., H. Holbech, G.I. Petersen a P. Bjerregaard (2007), ‚Effects of the fungicide prochloraz on the sexual development of zebrafish (Danio rerio)‘, Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 145, s. 165 – 170.
|
|
34.
|
Kapitola C.14 tejto prílohy, rastová skúška na mladých jedincoch.
|
|
35.
|
Kapitola C.4 tejto prílohy, ľahká biodegradovateľnosť.
|
|
36.
|
OECD (2000), Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures, Series on Testing and Assessment No. 23, OECD, Paríž.
|
|
37.
|
OECD (2009), Fish Short Term Reproduction Assay, Test Guideline No. 229, Guidelines for the Testing of Chemicals, OECD, Paríž.
|
|
38.
|
Kapitola C.37 tejto prílohy, 21-Day Fish Assay: A Short Term Screening for Oestrogenic and Androgenic Activity, and Aromatase Inhibition.
|
|
39.
|
OECD (2012), Fish Toxicity Testing Framework, Series on Testing and Assessment No. 171, OECD, Paríž
|
|
40.
|
Schäfers, C., Teigeler, M., Wenzel, A., Maack, G., Fenske, M., Segner, H (2007), ‚Concentration- and time-dependent effects of the synthetic estrogen, 17 alpha-ethinylestradiol, on reproductive capabilities of the zebrafish, Danio rerio‘ Journal of Toxicology and Environmental Health-Part A, 70, 9-10 s 768 – 779.
|
|
41.
|
OECD (2011), Validation Report (Phase 1) for the Fish Sexual Development Test, Series on Testing and Assessment No 141, ENV/JM/MONO(2011)22, OECD, Paríž.
|
|
42.
|
OECD (2011), Validation Report ( Phase 2) for the Fish Sexual Development Test, Series on Testing and Assessment No 142, ENV/JM/MONO(2011)23, OECD, Paríž.
|
|
43.
|
OECD (2011), Peer Review Report of the validation of the Fish Sexual Development Test, Series on Testing and Assessment No 143, ENV/JM/MONO(2011)24, OECD, Paríž.
|
Dodatok 1
Skratky a vymedzenie pojmov
Vrcholový sledovaný parameter
: účinok pôsobiaci na úrovni populácie.
ASV
: rozpustnosť vzdušného kyslíka.
Biomarker
: účinok pôsobiaci na úrovni jedinca.
Chemikália
: látka alebo zmes.
Dph
: dni po vyliahnutí.
DMY
: gén domény DM špecifický pre chromozómom Y potrebný na vývin samčekov rýb rodu medaka.
ELISA
: enzýmové imunosorbentové stanovenie
Hmotnosť ryby
: mokrá hmotnosť ryby (vytretej do sucha).
FSDT
: test pohlavného vývinu rýb.
Os HPG
: os hypotalamus – hypofýza – gonády.
Intersexuálna ryba
: ryba s viac ako jedným oocytom v semenníkoch na 6 analyzovaných rezov alebo so spermatogénnymi bunkami (áno/nie) vo vaječníkoch.
Stupeň zaťaženia
: mokrá hmotnosť rýb na objem vody.
MOA
: spôsob pôsobenia.
RT-PCR
: polymerázová reťazová reakcia s reverznou transkriptázou.
Testovaná chemikália
: akákoľvek látka alebo zmes, ktorá sa testuje pomocou tejto testovacej metódy.
Nediferencovaná ryba
: ryba s gonádami bez rozoznateľných zárodočných buniek.
VTG
: vitellogenín.
Dodatok 2
Experimentálne podmienky testu FSDT (sladkovodné druhy)
|
|
Medaka japonská (Oryzias latipes)
|
Dánio pruhované (Danio rerio)
|
Pichľavka sivá (Gasterostreus aculeatus)
|
|
|
Prietokový alebo semistatický
|
Prietokový alebo semistatický
|
Prietokový alebo semistatický
|
|
|
25 ± 2 °C
|
27 ± 2 °C
|
20 ± 2 °C
|
|
|
Žiarivky (široké spektrum)
|
Žiarivky (široké spektrum)
|
Žiarivky (široké spektrum)
|
|
|
10 – 20 μE/m2/s, 540 – 1 080 luxov alebo 50 – 100 ft-c (úrovne v laboratórnom prostredí)
|
10 – 20 μE/m2/s, 540 – 1 080 luxov alebo 50 – 100 ft-c (úrovne v laboratórnom prostredí)
|
10 – 20 μE/m2/s, 540 – 1 080 luxov alebo 50 – 100 ft-c (úrovne v laboratórnom prostredí)
|
|
|
12 – 16 hod. svetlo, 8 – 12 hod. tma
|
12 – 16 hod. svetlo, 8 – 12 hod. tma
|
16 hod. svetlo, 8 hod. tma
|
|
7.
|
Minimálna veľkosť komory
|
|
Jednotlivé komory by mali obsahovať minimálne 7 l vody
|
Jednotlivé komory by mali obsahovať minimálne 7 l vody
|
Jednotlivé komory by mali obsahovať minimálne 7 l vody
|
|
8.
|
Výmena objemu testovacích roztokov
|
|
Minimálne päťkrát denne
|
Minimálne päťkrát denne
|
Minimálne päťkrát denne
|
|
9.
|
Vek testovacích organizmov na začiatku expozície
|
|
Čerstvo oplodnené vajíčka (skoré štádium blastuly)
|
Čerstvo oplodnené vajíčka (skoré štádium blastuly)
|
Čerstvo oplodnené vajíčka
|
|
10.
|
Počet vajíčok na testovanú koncentráciu
|
|
Minimálne 120
|
Minimálne 120
|
Minimálne 120
|
|
11.
|
Počet testovaných koncentrácií
|
|
Minimálne tri (plus primerané kontrolné skupiny)
|
Minimálne tri (plus primerané kontrolné skupiny)
|
Minimálne tri (plus primerané kontrolné skupiny)
|
|
12.
|
Počet replikátov na testovanú koncentráciu
|
|
Minimálne štyri (okrem kontrolných skupín, kde sa počet určí podľa funkcie druhej odmocniny)
|
Minimálne štyri (okrem kontrolných skupín, kde sa počet určí podľa funkcie druhej odmocniny)
|
Minimálne štyri (okrem kontrolných skupín, kde sa počet určí podľa funkcie druhej odmocniny)
|
|
|
Živé žiabronôžky rodu Artemia, dospelé zmrazené žiabronôžky soľné, vločkové krmivo atď. Odporúča sa kŕmiť dvakrát denne.
|
Špeciálna potrava pre mladé ryby, živé žiabronôžky rodu Artemia, dospelé zmrazené žiabronôžky soľné, vločkové krmivo atď. Odporúča sa kŕmiť dvakrát denne.
|
Živé žiabronôžky rodu Artemia, dospelé zmrazené žiabronôžky soľné, vločkové krmivo atď. Odporúča sa kŕmiť dvakrát denne.
|
|
|
Žiadne, pokiaľ koncentrácia rozpusteného kyslíka neklesne pod 60 % saturáciu
|
Žiadne, pokiaľ koncentrácia rozpusteného kyslíka neklesne pod 60 % saturáciu
|
Žiadne, pokiaľ koncentrácia rozpusteného kyslíka neklesne pod 70 % saturáciu
|
|
|
Čistá povrchová, studňová alebo rekonštituovaná voda
|
Čistá povrchová, studňová alebo rekonštituovaná voda
|
Čistá povrchová, studňová alebo rekonštituovaná voda
|
|
16.
|
Trvanie expozície testovanej chemikálii
|
|
60 dph
|
60 dph
|
60 dph
|
|
17.
|
Biologické sledované parametre
|
|
Úspešné vyliahnutie, prežitie, výrazná morfológia, VTG, histológia gonád, genetické pohlavie, pomer pohlaví
|
Úspešné vyliahnutie, prežitie, výrazná morfológia, VTG, histológia gonád, pomer pohlaví
|
Úspešné vyliahnutie, prežitie, výrazná morfológia, VTG, histológia gonád, pomer pohlaví
|
|
18.
|
Kritériá prijateľnosti testu pre spojené replikáty kontrolných skupín
|
|
Úspešné vyliahnutie > 80 %
|
Úspešné vyliahnutie > 80 %
|
Úspešné vyliahnutie > 80 %
|
|
Prežitie po vyliahnutí ≥ 70 %
|
Prežitie po vyliahnutí ≥ 70 %
|
Prežitie po vyliahnutí ≥ 70 %
|
|
Rast (mokrá hmotnosť ryby vytretej do sucha) > 150 mg
|
Rast (mokrá hmotnosť ryby vytretej do sucha) > 75 mg
|
Rast (mokrá hmotnosť ryby vytretej do sucha) > 120 mg
|
|
Dĺžka (štandardná dĺžka) > 20 mm
|
Dĺžka (štandardná dĺžka) > 14 mm
|
Dĺžka (štandardná dĺžka) > 20 mm
|
|
Pomer pohlaví (% samčekov alebo samičiek)
30 – 70 %
|
Pomer pohlaví (% samčekov alebo samičiek) 30 – 70 %
|
Pomer pohlaví (% samčekov alebo samičiek) 30 – 70 %
|
Dodatok 3
Chemické charakteristiky prijateľnej riediacej vody
|
ZLOŽKA
|
KONCENTRÁCIA
|
|
Tuhé častice
|
< 20 mg/l
|
|
Celkový organický uhlík
|
< 2 mg/l
|
|
Neionizovaný amoniak
|
< 1 μg/l
|
|
Zostatkový chlór
|
< 10 μg/l
|
|
Celkové organofosfátové pesticídy
|
< 50 ng/l
|
|
Celkové organochlórové pesticídy a polychlórované bifenyly
|
< 50 ng/l
|
|
Celkový organický chlór
|
< 25 ng/l
|
Dodatok 4
Podľa testovacej metódy C.14/Usmernenie o testovaných koncentráciách
|
Stĺpec (počet koncentrácií medzi 100 a 10 alebo medzi 10 a 1) (28)
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
|
100
|
100
|
100
|
100
|
100
|
100
|
100
|
|
32
|
46
|
56
|
63
|
68
|
72
|
75
|
|
10
|
22
|
32
|
40
|
46
|
52
|
56
|
|
3,2
|
10
|
18
|
25
|
32
|
37
|
42
|
|
1,0
|
4,6
|
10
|
16
|
22
|
27
|
32
|
|
|
2,2
|
5,6
|
10
|
15
|
19
|
24
|
|
|
1,0
|
3,2
|
6,3
|
10
|
14
|
18
|
|
|
|
1,8
|
4,0
|
6,8
|
10
|
13
|
|
|
|
1,0
|
2,5
|
4,6
|
7,2
|
10
|
|
|
|
|
1,6
|
3,2
|
5,2
|
7,5
|
|
|
|
|
1,0
|
2,2
|
3,7
|
5,6
|
|
|
|
|
|
1,5
|
2,7
|
4,2
|
|
|
|
|
|
1,0
|
1,9
|
3,2
|
|
|
|
|
|
|
1,4
|
2,4
|
|
|
|
|
|
|
1,0
|
1,8
|
|
|
|
|
|
|
|
1,3
|
|
|
|
|
|
|
|
1,0
|
Dodatok 5
Usmernenie na homogenizáciu hlavy a chvosta z mladých jedincov dánia pruhovaného, čereble potočnej, pichľavky sivej a medaky japonskej
Účelom tohto oddielu je opísať postupy, ktoré sa vykonávajú pred kvantifikáciou koncentrácie VTG. Možno použiť aj iné postupy, ktoré vedú k porovnateľnej kvantifikácii VTG. Namiesto homogenátu hlavy/chvosta je možné určiť koncentráciu VTG aj v krvnej plazme alebo pečeni.
Postup
|
1.
|
Ryby sa umŕtvia a usmrtia v súlade s opisom testu.
|
|
2.
|
Oddelí sa hlava a chvost ryby v súlade s opisom testu. Dôležité: Všetky nástroje a doska na rezanie sa musia medzi manipuláciami s jednotlivými rybami riadne vyčistiť a opláchnuť (napr. 96 % etanolom), aby sa zabránilo ‚znečisteniu VTG‘ zo samičiek alebo indukovaných samčekov na neindukovaných samčekov.
|
|
3.
|
Hmotnosť hlavy a chvosta spolu z každej ryby sa odmeria s presnosťou na mg.
|
|
4.
|
Po odvážení sa časti tela umiestnia do vhodných skúmaviek (napr. do 1,5 ml Eppendorfovej skúmavky) a zmrazia pri teplote – 80 °C až do homogenizácie alebo sa priamo homogenizujú na ľade pomocou dvoch plastových piestikov. (Môžu sa použiť aj iné metódy, ak sa vykonávajú na ľade a výsledkom je homogénna hmota). Dôležité: Skúmavky musia byť náležite očíslované tak, aby bolo možné hlavu a chvost z ryby priradiť k príslušnému rezu tela použitému na histologické vyšetrenie gonád.
|
|
5.
|
Po vytvorení homogénnej hmoty sa pridá množstvo ľadovo studeného homogenizačného tlmivého roztoku
(29) zodpovedajúce štvor- až desaťnásobku hmotnosti tkaniva (poznamenajte si riedenie). Pokračujte v práci s piestikmi, kým zmes nebude homogénna. Dôležitá poznámka: Pre každú rybu sa používajú nové piestiky.
|
|
6.
|
Vzorky sa umiestnia na ľad až do odstredenia pri teplote 4 °C pri 50 000 g počas 30 minút.
|
|
7.
|
Pipetou preneste dávky 20 – 50 μl (poznamenajte si množstvo) supernatantu aspoň do dvoch skúmaviek tak, že namočíte hrot pipety pod vrstvu tuku na povrchu a starostlivo odsajete supernatant bez tukových alebo peletových frakcií.
|
|
8.
|
Skúmavky sa až do použitia skladujú pri teplote – 80 °C.
|
Poznámka: Homogenizačný tlmivý roztok by sa mal použiť v ten istý deň, ako bol vyrobený. Počas používania ho umiestnite na ľad.
Dodatok 6
Usmernenie na kvantifikáciu vitellogenínu z homogenátu hlavy a chvosta dánia pruhovaného (danio rerio) (upravené z holbecha a kol., 2001). možno použiť aj iné postupy využívajúce homológne protilátky a štandardy.
|
1.
|
Mikrotitračné platne (certifikované Maxisorp F96, Nunc, Roskilde, Dánsko) potiahnuté 5 μg/ml IgG proti lipovitellínu dánia pruhovaného sa rozmrazia a trikrát premyjú premývacím tlmivým roztokom (*).
|
|
2.
|
Purifikovaný štandardný roztok vitellogenínu dánia pruhovaného (30) sa sériovo zriedi na 0,2; 0,5; 1; 2; 5; 10 a 20 ng/ml v riediacom tlmivom roztoku (**). Vzorky sa v riediacom tlmivom roztoku riedia aspoň 200-krát (aby nedošlo k efektu matrice) a aplikujú sa na platne. Kontrola skúšky sa aplikuje ako duplikát. Do každej jamky sa aplikuje 150 μl. Štandardy sa aplikujú v duplikátoch a vzorky v triplikátoch. Inkubujte cez noc pri teplote 4 °C na trepačke.
|
|
3.
|
Platne sa päťkrát premyjú premývacím tlmivým roztokom. (*)
|
|
4.
|
HRP pripojená k dextranovému reťazcu (napr. AMDEX A/S, Dánsko) a konjugované protilátky sa zriedia v premývacom tlmivom roztoku. Skutočné riedenie sa líši podľa šarže a veku. Do každej jamky sa aplikuje 150 μl a platne sa 1 hodinu inkubujú pri izbovej teplote na trepačke.
|
|
5.
|
Platne sa päťkrát premyjú premývacím tlmivým roztokom (*) a spodok platní sa opatrne vyčistí etanolom.
|
|
6.
|
Do každej jamky sa aplikuje 150 μl roztoku TMB plus (***). Platňu chráňte pred svetlom staniolom a sledujte vývoj farby na trepačke.
|
|
7.
|
Keď sa plne vytvorí krivka štandardného roztoku, enzymatická aktivita sa zastaví pridaním 150 μl 0,2 M H2SO4 do každej jamky.
|
|
8.
|
Absorbancia sa meria pri 450 nm (napr. na zariadení na čítanie platní Thermomax od spoločnosti Molecular Devices). Údaje sa analyzujú na pripojenom softvéri (napr. Softmax).
|
|
(*)
|
Premývací tlmivý roztok:
|
PBS-stock (****)
|
500,0
|
ml
|
|
BSA
|
5,0
|
g
|
|
Tween 20
|
5,0
|
ml
|
|
Upravte pH na 7,3 a doplňte na 5 l milipórovej H2O. Skladujte pri teplote 4 °C.
|
|
|
(**)
|
Riediaci tlmivý roztok:
|
PBS-Stock****
|
100,0
|
ml
|
|
BSA
|
3,0
|
g
|
|
Tween 20
|
1,0
|
ml
|
|
Upravte pH na 7,3 a doplňte na 1 l milipórovej H2O. Skladujte pri teplote 4 °C.
|
|
|
(***)
|
TMB plus je ‚hotový‘ substrát vyrobený spoločnosťou KemEnTec (Dánsko). Je citlivý na svetlo. Skladujte pri teplote 4 °C.
|
|
(****)
|
PBS stock
|
NaCl
|
160,0
|
g
|
|
KH2PO4
|
4,0
|
g
|
|
Na2HPO4
.2H2O
|
26,6
|
g
|
|
KCl
|
4,0
|
g
|
|
Upravte pH na 6,8 a doplňte na 2 l milipórovou vodou. Skladujte pri izbovej teplote.
|
|
Dodatok 7
Usmernenie na prípravu rezov tkaniva na účely určenia pohlavia a štádia gonád
Účelom tohto oddielu je opísať postupy, ktoré sa vykonávajú pred hodnotením histologických rezov. Možno použiť aj iné postupy, ktoré vedú k podobnému určeniu pohlavia a štádia gonád.
Až na niekoľko výnimiek sú tieto postupy podobné pre medaku japonskú (JMD) a dánio pruhované (ZF).
Usmrtenie, pitva a fixácia tkaniva
Ciele:
|
1.
|
Umožniť humánne usmrtenie rýb.
|
|
2.
|
Získať potrebné telesné miery a hmotnosť.
|
|
3.
|
Vyhodnotiť sekundárne pohlavné znaky.
|
|
4.
|
Narezať tkanivá na analýzu VTG.
|
Postupy:
|
1.
|
Ryby by sa mali usmrtiť bezprostredne pred pitvou. Preto by sa naraz nemalo usmrcovať viacero rýb, pokiaľ nie je k dispozícií viacero prosektorov.
|
|
2.
|
Ryba sa pomocou malej ponornej siete vyberie z pokusnej komory a v prepravnej nádobe prenesie na miesto pitvy.
|
|
3.
|
Ryba sa umiestni do usmrcovacieho roztoku. Keď sa rybe zastaví dýchanie a prestane reagovať na vonkajšie podnety, vyberie sa z roztoku.
|
|
4.
|
Odváži sa mokrá hmotnosť ryby.
|
|
5.
|
Na prípravu tkanív na analýzu VTG sa ryba môže umiestniť na korkovú dosku na stolík disekčného mikroskopu.
|
a)
|
V prípade dánia pruhovaného sa hlava odreže bezprostredne za prsnou plutvou a chvost bezprostredne za chrbtovou plutvou.
|
|
b)
|
V prípade medaky japonskej sa brucho otvorí opatrne vedeným rezom po ventrálnej stredovej čiare od hrudného pletenca po bod tesne kraniálne od análneho otvoru. Pečeň sa opatrne vyberie pomocou malej pinzety a malých nožníc.
|
|
|
6.
|
Vzorky na analýzu VTG sa umiestnia do Eppendorfových skúmaviek a ihneď sa zmrazia v tekutom dusíku.
|
|
7.
|
Mŕtvy živočích vrátane gonád sa umiestni do označenej plastovej kazety na tkanivá, ktorá sa prenesie do Davidsonovho alebo Bouinovho fixačného prostriedku. Objem fixačného prostriedku by mal byť aspoň desaťnásobkom približného objemu tkanív. Fixačná nádoba sa jemne premiešava päť sekúnd, aby sa z kazety uvoľnili vzduchové bubliny.
|
|
8.
|
|
a.
|
Všetky tkanivá zostanú cez noc v Davidsonovom fixačnom prostriedku a nasledujúci deň sa prenesú do samostatných nádob s 10 % neutrálnym tlmeným formalínom. Nádoby s kazetami sa jemne premiešavajú 5 sekúnd, aby sa zabezpečil dostatočný prienik formalínu do kaziet.
|
|
b.
|
Tkanivá zostanú 24 hodín v Bouinovom fixačnom prostriedku a potom sa prenesú do 70 % etanolu.
|
|
Spracovanie tkanív
Ciele:
|
1.
|
Dehydratovať tkanivo tak, aby sa zabezpečil dostatočný prienik parafínu.
|
|
2.
|
Impregnovať tkanivo parafínom, aby sa zachovala celistvosť tkanív a vytvoril pevný povrch umožňujúci mikrotómiu.
|
Postupy:
|
3.
|
Označené kazety s tkanivami sa vyberú z formalínu/etanolu a umiestnia do spracovacieho koša (spracovacích košov). Spracovací kôš sa vloží do prístroja na spracovanie tkaniva.
|
|
4.
|
Zvolí sa harmonogram spracovania.
|
|
5.
|
Po tom, ako prístroj na spracovanie tkaniva dokončil spracovací cyklus, kôš/koše sa môže/môžu preniesť do zalievacieho zariadenia.
|
Zalievanie
Cieľ:
Správne umiestniť vzorku do stuhnutého parafínu na účely mikrotómie.
Postupy:
|
1.
|
Koše s kazetami sa vyberú z prístroja na spracovanie tkaniva a ponoria do prednej komory tepelnej konzoly zalievacieho zariadenia naplnenej parafínom alebo sa kazety prenesú do samostatného parafínového ohrievača.
|
|
2.
|
Prvá kazeta, ktorá sa má zaliať, sa vyberie z prednej komory tepelnej konzoly alebo parafínového ohrievača. Kryt kazety sa odstráni a zlikviduje a označenie kazety sa porovná so záznamami o živočíchovi, aby sa pred zaliatím vyriešili prípadné nezrovnalosti.
|
|
3.
|
Vyberie sa zalievacia forma vhodnej veľkosti.
|
|
4.
|
Forma sa podrží pod výpustom dávkovacej konzoly a naplní roztaveným parafínom.
|
|
5.
|
Vzorka sa vyberie z kazety a umiestni do roztaveného parafínu vo forme. To sa zopakuje so štyrmi až ôsmimi vzorkami pre každú parafínovú formu. Pozícia jednotlivých rýb sa označí tak, že ryba č. 1 sa natočí do 180 stupňov vzhľadom na ryby 2 – 4/8.
|
|
6.
|
Pridá sa ďalší parafín na prekrytie vzorky.
|
|
7.
|
Forma s kazetovou základňou sa umiestni na chladiacu platňu kryokonzoly.
|
|
8.
|
Po stuhnutí parafínu sa blok (t. j. stvrdnutý parafín obsahujúci tkanivá a kazetovú základňu) vyberie z formy.
|
Mikrotómia
Cieľ:
Narezať a upevniť histologické rezy na účely farbenia.
Postupy:
|
1.
|
Prvá fáza mikrotómie označovaná ako ‚približovanie‘ (facing) sa vykonáva takto:
|
a)
|
Parafínový blok sa umiestni do skľučovadla mikrotómu.
|
|
b)
|
Skľučovadlo sa posúva otáčaním kolieska mikrotómu, pričom sa z parafínového povrchu bloku odrezávajú hrubé rezy, kým nôž nedosiahne zaliate tkanivá.
|
|
c)
|
Hrúbka rezu na mikrotóme sa nastaví na 3 – 5 mikrónov. Skľučovadlo sa posúva a z bloku sa odrežú viaceré rezy, aby sa odstránili prípadné artefakty vytvorené na reznom povrchu tkaniva pri hrubom rezaní.
|
|
d)
|
Blok možno vybrať zo skľučovadla a položiť prednou stranou nadol na ľad, aby tkanivo nasiaklo.
|
|
|
2.
|
Ďalšou fázou mikrotómie je konečné rezanie a pripevnenie rezov tkaniva na podložné sklíčka. Tieto postupy sa vykonávajú takto:
|
a)
|
Ak bol blok uložený na ľade, sníme sa z ľadu a znova sa vloží do skľučovadla mikrotómu.
|
|
b)
|
Hrúbka rezu na mikrotóme sa nastaví na 3 – 5 mikrónov a skľučovadlo sa posúva otáčaním kolieska mikrotómu. Z bloku sa odrezávajú rezy, kým sa nevytvorí ‚prúžok‘ obsahujúci aspoň jeden prijateľný rez s gonádami. (Podľa potreby možno počas rezania blok vybrať zo skľučovadla, položiť na ľad, aby tkanivo nasiaklo, a znova vložiť do skľučovadla.)
|
|
c)
|
Rezy sa vodorovne uložia na povrch vody vo vodnom kúpeli. Ideálne je získať aspoň jeden rez bez záhybov a zachytených vzduchových bublín na spodku.
|
|
d)
|
Pod najlepší rez sa ponorí podložné mikroskopické sklíčko, pomocou ktorého sa rez vyberie z vody. Tento proces sa označuje ako ‚pripevňovanie‘ rezu na podložné sklíčko.
|
|
e)
|
Pre každý súbor rýb sa pripravia tri rezy. Druhý a tretí rez sa urobia v odstupoch 50 mikrónov od prvého rezu. Ak sú ryby zaliate tak, že ich gonády nie sú v rovnakej úrovni rezu, treba urobiť viac rezov, aby sa z každej ryby získalo aspoň šesť rezov s gonádami.
|
|
f)
|
Perom na označovanie podložných sklíčok sa na sklíčko napíše číslo bloku, z ktorého sa podložné sklíčko vyrobilo.
|
|
g)
|
Podložné sklíčko sa umiestni do farbiaceho stojana.
|
|
h)
|
Blok sa vyberie zo skľučovadla a položí prednou stranou nadol na účely skladovania.
|
|
Farbenie, zakrytie krycím sklíčkom a označenie podložného sklíčka
Ciele:
|
—
|
Zafarbiť rezy na histopatologické vyšetrenie.
|
|
—
|
Trvalo zakryť pripevnené a zafarbené tkanivá.
|
|
—
|
Trvalo identifikovať zafarbené rezy spôsobom, ktorý umožňuje úplnú vysledovateľnosť.
|
Postupy:
|
1.
|
Farbenie
|
a)
|
Pred farbením sa podložné sklíčka cez noc vysušia vzduchom.
|
|
b)
|
Rezy sa zafarbia hematoxylín-eozínom.
|
|
|
2.
|
Zakrytie krycím sklíčkom
|
a)
|
Krycie sklíčka možno uložiť ručne alebo automaticky.
|
|
b)
|
Podložné sklíčko sa ponorí do xylénu alebo prostriedku TissueClear. Nadbytočné množstvo xylénu/prostriedku TissueClear sa opatrne strasie z podložného sklíčka.
|
|
c)
|
Približne 0,1 ml upevňovacieho média sa aplikuje do blízkosti konca podložného sklíčka oproti matnému koncu alebo na krycie sklíčko.
|
|
d)
|
Pri ukladaní na podložné sklíčko sa krycie sklíčko nakloní pod ostrým uhlom.
|
|
|
3.
|
Označovanie
|
a)
|
Každé označenie podložného sklíčka by malo obsahovať tieto informácie.
|
iii)
|
Č. vzorky/č. sklíčka
|
|
iv)
|
Chemikália/skupina s danou koncentráciou
|
|
|
Dodatok 8
Štatistická schéma pre analýzu vitellogenínu

Štatistická schéma pre analýzu pomeru pohlaví

Dodatok 9
Usmernenie na odber vzoriek tkanív na účely určenia genetického pohlavia a na účely určenia genetického pohlavia metódou PCR
Odber vzoriek tkanív, ich príprava a skladovanie pred určením genetického pohlavia metódou PCR pri medake (pripravené Laboratóriom pre vodné organizmy spoločnosti Bayer CropScience AG)
|
1.
|
Jemnými nožnicami sa odstrihne análna alebo chrbtová plutva každej jednotlivej ryby a umiestni sa do skúmavky naplnenej 100 μl extrakčného tlmivého roztoku 1 (podrobnosti o príprave tlmivého roztoku nájdete ďalej). Nožnice sa po každej rybe vyčistia v kadičke naplnenej destilovanou vodou a usušia papierovou vreckovkou.
|
|
2.
|
Tkanivá z plutiev sa následne homogenizujú mikrotrubičkovým teflónovým piestikom, aby sa dosiahla lýza buniek. Pre každú skúmavku sa použije nový piestik, aby nedošlo ku kontaminácii. Piestiky sa cez noc umiestnia do 0,5 M NaOH, 5 minút sa oplachujú v destilovanej vode a až do ich použitia sa skladujú v etanole alebo sterilnom prostredí po sterilizácii v autokláve.
|
|
3.
|
Tkanivo z plutvy možno skladovať aj bez extrakčného tlmivého roztoku 1 na suchom ľade a potom v chladničke pri teplote – 80 °C, aby nedošlo k degenerácii DNA. Extrakcia však funguje lepšie, ak sa zároveň extrahuje DNA (pokyny na manipuláciu sú uvedené vyššie, vzorky sa po skladovaní pri teplote – 80 °C majú pred naplnením tlmivého roztoku do skúmaviek rozmraziť na ľade).
|
|
4.
|
Po homogenizácii sa všetky skúmavky umiestnia do vodného kúpeľa a varia 15 minút pri teplote 100 °C.
|
|
5.
|
Potom sa do každej skúmavky pipetou pridá 100 μl extrakčného tlmivého roztoku 2 (podrobnosti o príprave tlmivého roztoku nájdete ďalej). Vzorky sa 15 minút skladujú pri izbovej teplote a v priebehu skladovania sa občas jemne pretrepú rukou.
|
|
6.
|
Potom sa všetky skúmavky znova umiestnia do vodného kúpeľa a varia 15 minút pri teplote 100 °C.
|
|
7.
|
Až do ďalšej analýzy sa skúmavky zmrazia na teplotu – 20 °C.
|
Príprava tlmivého roztoku
Tlmivý roztok na PCR 1:
|
|
500 mg N-lauroylsarkozínu (napr. Merck KGaA, Darmstadt, Nemecko),
|
|
|
pridajte 100 ml dest. H2O
|
|
|
→ sterilizujte v autokláve.
|
Tlmivý roztok na PCR 2:
|
|
20 g Chelex (napr. Biorad, Mníchov, Nemecko),
|
|
|
nechajte nasiaknuť v 100 ml dest. H2O
|
|
|
→ sterilizujte v autokláve.
|
Určenie genetického pohlavia metódou PCR pri medake (pripravené Laboratóriom pre vodné organizmy spoločnosti Bayer CropScience AG a centrom Universität Würzburg Biozentrum)
Pripravené a zmrazené skúmavky (opísané v predchádzajúcom oddiele) sa rozmrazia na ľade. Potom sa odstredia s použitím Eppendorfovej odstredivky (30 s pri max. rýchlosti pri izbovej teplote). Na analýzu PCR sa použije čistý supernatant oddelený od zrazeniny. Je bezpodmienečne nevyhnutné zabrániť tomu, aby sa akékoľvek stopy látky Chelex (nachádzajúce sa na zrazenine) preniesli do reakcie PCR, lebo to naruší pôsobenie ‚Taq‘-polymerázy. Supernatant sa použije priamo alebo sa môže skladovať zmrazený (– 20 C) a na účely ďalších analýz sa môže znova rozmraziť vo viacerých cykloch bez toho, aby to malo negatívny vplyv na DNA.
1. Príprava ‚reakčnej zmesi‘ (25 μl na vzorku):
|
|
Objem
|
Konečná koncentrácia
|
|
Templátová DNA
|
0,5 μl – 2 μl
|
|
|
10 × tlmivý roztok na PCR s MgCl2
|
2,5 μl
|
1x
|
|
Nukleotidy (každý spomedzi dATP, dCTP, dGTP, dTTP)
|
4 μl (5 mM)
|
200 μM
|
|
Priamy primer (10 μM) (pozri ďalej 3 – 5)
|
0,5 μl
|
200 nM
|
|
Reverzný primer (10 μM) (pozri ďalej 3 – 5)
|
0,5 μl
|
200 nM
|
|
DMSO
|
1,25 μl
|
5 %
|
|
Voda (kvalita na PCR)
|
do 25 μl
|
|
|
Taq E-polymeráza
|
0,3 μl
|
1,5 U
|
|
10 × tlmivý roztok na PCR s MgCl2: 670 mM Tris/HCl (pH 8,8 pri 25 °C), 160 mM (NH4)2SO4, 25 mM MgCl2, 0,1 % Tween 20
|
Na každú analýzu PCR (pozri ďalej 3 – 5) je potrebný špeciálny primer ako nová kombinácia ‚reakčnej zmesi‘ a primeraného potrebného množstva templátovej DNA pre každú vzorku (pozri vyššie). Príslušné objemy sa pipetami prenesú do nových skúmaviek. Potom sa všetky skúmavky uzavrú, premiešajú (približne 10 s) a odstredia (10 s pri izbovej teplote). Teraz možno spustiť príslušné programy PCR. Okrem toho sa v každom programe PCR použije pozitívna kontrolná vzorka (exemplárna vzorka DNA so známym pôsobením a jasnými výsledkami) a negatívna kontrolná vzorka (1 μl dest. vody).
2. Príprava agarózového gélu (1 %) – počas vykonávania programov PCR:
|
—
|
Rozpustite 3 g agarózy v 300 ml tlmivého roztoku 1 × TAE (1 % agarózový gél).
|
|
—
|
Tento roztok sa musí povariť v mikrovlnnej rúre (približne 2 – 3 min.).
|
|
—
|
Preneste horúci roztok do špeciálnej odlievacej schránky, ktorá leží na ľade.
|
|
—
|
Po približne 20 min. je agarózový gél pripravený na použitie.
|
|
—
|
Agarózový gél skladujte v tlmivom roztoku 1 × TAE až do konca programov PCR.
|
3. Aktínový program PCR:
Účelom tejto reakcie PCR je preukázať, že DNA vo vzorke nie je poškodená.
|
—
|
Špeciálny primer:
|
—
|
‚Mact1(horný/priamy)‘ → TTC AAC AGC CCT GCC ATG TA
|
|
—
|
‚Mact2(spodný/reverzný)‘ → GCA GCT CAT AGC TCT TCT CCA GGG AG
|
|
|
—
|
Program:
|
—
|
Cyklus (35-krát):
|
Denaturácia
|
→ 45 s pri 95 °C
|
|
Teplotná hybridizácia
|
→ 45 s pri 56 °C
|
|
Elongácia
|
→ 1 min. pri 68 °C
|
|
|
4. Program PCR na detekciu génov na chromozómoch X a Y
V tomto programe PCR sa vzorky neporušenej DNA použijú na detekciu génov na chromozómoch X a Y. V samčej DNA by sa mal ukázať jeden dvojitý pás a v samičej DNA jeden jednotlivý pás (po zafarbení a gélovej elektroforéze). V tomto programe by sa mala analyzovať aj jedna pozitívna kontrolná vzorka pre samčekov (vzorka XY) a jedna pre samičky (vzorka XX).
|
—
|
Špeciálny primer:
|
—
|
‚PG 17.5‘ (horný/priamy) → CCG GGT GCC CAA GTG CTC CCG CTG
|
|
—
|
‚PG 17.6‘ (dolný/reverzný) → GAT CGT CCC TCC ACA GAG AAG AGA
|
|
|
—
|
Program:
|
—
|
Cyklus (40-krát):
|
Denaturácia
|
→ 45 s pri 95 °C
|
|
Teplotná hybridizácia
|
→ 45 s pri 55 °C
|
|
Elongácia
|
→ 1 min. 30 s pri 68 °C
|
|
|
5. Program PCR na detekciu génov na chromozóme Y ako ‚kontrola‘ pre program PCR na detekciu génov na chromozómoch X a Y
Pomocou tohto programu PCR sa overujú výsledky programu PCR na detekciu génov na chromozómoch X a Y. Na samčích vzorkách by sa mal ukázať jeden pás a na samičích vzorkách by sa nemal ukázať žiadny pás (po zafarbení a gélovej elektroforéze).
|
—
|
Špeciálny primer:
|
—
|
‚DMTYa (horný/priamy)‘ → GGC CGG GTC CCC GGG TG
|
|
—
|
‚DMTYd (dolný/reverzný)‘ → TTT GGG TGA ACT CAC ATG G
|
|
|
—
|
Program:
|
—
|
Cyklus (40-krát):
|
Denaturácia
|
→ 45 s pri 95 °C
|
|
Teplotná hybridizácia
|
→ 45 s pri 56 °C
|
|
Elongácia
|
→ 1 min. pri 68 °C
|
|
|
6. Farbenie vzoriek PCR:
Farbiaci roztok:
|
|
0,25 % brómfenolová modrá
|
Pipetou aplikujte 1 μl farbiaceho roztoku do každej skúmavky.
7. Spustenie gélovej elektroforézy:
|
—
|
Pripravený 1 % agarózový gél sa prenesie do komory na gélovú elektroforézu naplnenej tlmivým roztokom 1 × TAE.
|
|
—
|
10 – 15 μl z každej zafarbenej vzorky PCR sa pipetou nanesie na príslušné miesto na agarózovom géle.
|
|
—
|
Na samostatné miesto sa pipetou nanesie 5 – 15 μl roztoku 1kb-‚Ladder‘(Invitrogen).
|
|
—
|
Spustite elektroforézu pri 200 V.
|
|
—
|
Po 30 – 45 minútach ju zastavte.
|
8. Určenie pásov:
|
—
|
Vyčistite agarózový gél v destilovanej vode.
|
|
—
|
Následne preneste agarózový gél do ethídiumbromidu na 15 – 30 minút.
|
|
—
|
Potom sa má urobiť snímka agarózového gélu v UV svetelnej komore.
|
|
—
|
Vzorky sa napokon analyzujú porovnaním s pozitívnym kontrolným pásom (alebo pásmi) a rebríkom (‚ladder‘).
|
Dodatok 10
Usmernenie na odber vzoriek tkanív na účely určenia genetického pohlavia metódou pcr pri pichľavke sivej
Odber vzoriek tkanív a extrakcia DNA
DNA možno extrahovať pomocou rôznych komerčne dostupných reaktantov a manuálnych i automatizovaných extrakčných systémov. Ďalej je opísaný protokol používaný v laboratóriu Cefas Weymouth a podľa potreby sú uvedené aj alternatívne prístupy.
|
1.
|
Pomocou jemných nožníc sa z každej ryby oddelí malá časť tkaniva (10 – 20 mg) z dorzolaterálnej oblasti (po odstránení hlavy a chvosta na analýzu VTG). Tkanivo sa vloží do skúmavky a buď sa priamo umiestni do tekutého dusíka (na účely skladovania pri teplote – 80 °C), alebo sa skúmavka naplní 70 % etanolom (na účely prepravy a následného skladovania pri teplote – 4 °C). Nožnice sa po každej rybe vyčistia v 70 % etanole a potom v destilovanej vode a usušia papierovou vreckovkou.
|
|
2.
|
Etanol (ak je prítomný) sa odstráni odsatím a tkanivo sa nechá cez noc digerovať proteinázou K v 400 μl tlmivého roztoku ATL (Qiagen). Alikvotná časť (200 μl) digerovaného tkaniva sa prenesie na 96-jamkový S-blok (Qiagen) a DNA sa vyextrahuje v 96-jamkovom formáte pomocou systému Qiagen Universal BioRobot a súpravy QIamp Investigator BioRobot Kit. DNA sa eluuje v 50 μl vody bez DNázy a RNázy. Ak sa na extrakciu DNA používajú tvrdé tkanivá (napr. chrbtica alebo prsná plutva), môže byť potrebné homogenizovať vzorku v lyzačnom tlmivom roztoku pomocou nástroja na lýzu tkaniva FastPrep® alebo ekvivalentného systému na disrupciu tkaniva.
Alternatíva:
|
a)
|
Tkanivo sa nechá cez noc digerovať proteinázou K v 400 μl lyzačného tlmivého roztoku G2 (Qiagen). DNA sa vyextrahuje z 200 μl digerovaného tkaniva buď pomocou súpravy EZ-1 DNA Easy Tissue Kit a systému EZ-1 Biorobot, alebo pomocou súpravy DNA Easy Tissue Mini Kit. DNA sa eluuje v objeme 50 μl.
|
|
b)
|
Tkanivá sa spracujú pomocou reaktanta DNAzol. Vzorky tkaniva sa 10 minút lyzujú v 1 ml DNAzolu v 1,5 ml mikrocentrifugačnej skúmavke a potom sa odstreďujú pri 13 000 ot./min. počas 5 minút, aby sa odstránili všetky tuhé častice. Lyzovaná vzorka sa následne prenesie do novej 1,5 ml mikrocentrifugačnej skúmavky obsahujúcej 500 μl 100 % etanolu v kvalite vhodnej na molekulárne analýzy a potom sa odstreďuje pri 13 000 ot./min. počas 10 minút, aby sa vyzrážala DNA. Etanol sa odstráni a nahradí 400 μl 70 % etanolu v kvalite vhodnej na molekulárne analýzy, vzorka sa odstreďuje pri 13 000 ot./min. počas 5 minút a peleta DNA sa rozpustí v 50 μl vody bez DNázy a RNázy vhodnej na molekulárne analýzy. Znova platí, že ak sa používajú tvrdé tkanivá (prsná plutva), pred extrakciou DNA môže byť potrebné homogenizovať vzorku v lyzačnom tlmivom roztoku pomocou nástroja na lýzu tkaniva FastPrep® alebo ekvivalentného systému na disrupciu tkaniva.
|
|
|
3.
|
DNA sa až do použitia skladuje pri teplote – 20 °C.
|
Dôležitá poznámka: počas postupov sa musia používať rukavice.
Analýza pomocou polymerázovej reťazovej reakcie (PCR)
Vykonajú sa amplifikácie pomocou 2,5 μl extraktu DNA v reakčnom objeme 50 μl pomocou primerov pre lokus Idh (opis: Peichel a kol., 2004. Current Biology 1:1416 – 1424):
|
Priamy primer
|
5′ GGG ACG AGC AAG ATT TAT TGG 3′
|
|
Reverzný primer
|
5' TAT AGT TAG CCA GGA GAT GG 3'
|
Vhodné reaktanty na PCR dodávajú mnohí dodávatelia. Metóda uvedená ďalej sa v súčasnosti používa v laboratóriu Cefas Weymouth.
1. Príprava ‚reakčnej zmesi‘ (50 μl na vzorku):
Ďalej je opísaný spôsob prípravy hlavnej zmesi. Možno ju pripraviť vopred a skladovať zmrazenú pri teplote – 20 °C až do použitia. Pripravte dostatočné množstvo hlavnej zmesi na negatívnu kontrolnú vzorku (len s použitím vody v kvalite vhodnej na molekulárne biologické analýzy).
|
|
Objem (zásobný konc.)/vzorku
|
Konečná koncentrácia
|
|
Reakčný tlmivý roztok 5xGoTaq®
|
10 μl
|
1x
|
|
MgCl2
|
5 μl (25 mM)
|
2,5 mM
|
|
Nukleotidy (dATP, dCTP, dGTP, dTTP)
|
0,5 μl (každý 25 mM)
|
každý 250 μM
|
|
Priamy primer
|
0,5 μl (0,1 nmol/μl)
|
2,0 μM
|
|
Reverzný primer
|
0,5 μl (0,1 nmol/μl)
|
2,0 μM
|
|
Voda v kvalite vhodnej na molekulárne biologické analýzy
|
30,75 μl
|
|
|
GoTaq-polymeráza
|
0,25 μl
|
1,25 U
|
|
—
|
Pridajte 47,5 μl do označenej 0,5 ml tenkostennej skúmavky na PCR.
|
|
—
|
Pridajte 2,5 μl purifikovanej DNA do príslušne označenej skúmavky. Zopakujte pre všetky vzorky a negatívnu kontrolnú vzorku.
|
|
—
|
Prekryte dvoma kvapkami minerálneho oleja. Alternatívne možno použiť termocyklér s vyhrievaným krytom.
|
|
—
|
Vzorky sa denaturovali v termocykléri Peltier PTC-225 pri teplote 94 C ± 2 °C počas 5 minút, potom nasledovalo 39 cyklov pri teplote 94 °C ± 2 °C počas 1 minúty, 55 °C ± 2 °C počas 1 minúty, 72 °C ± 2 C počas 1 minúty a záverečné predĺženie pri teplote 72 °C ± 2 C počas 10 minút.
|
2. Príprava agarózového gélu (2 %):
Tradične sa produkty PCR interpretujú na 20 % agarózovom géle obsahujúcom ethídiumbromid.
Možno použiť aj kapilárne elektroforetické systémy.
|
—
|
Navážte 2 g agarózy do 100 ml tlmivého roztoku 1 × TAE.
|
|
—
|
Zahrejte v mikrovlnnej rúre (približne 2 – 3 min.), aby sa agaróza rozpustila.
|
|
—
|
Pridajte dve kvapky ethídiumbromidu s konečnou koncentráciou 0,5 μg/ml.
|
|
—
|
Preneste horúci roztok do zariadenia na odlievanie gélu.
|
3. Gélová elektroforéza:
|
—
|
Preneste agarózový gél do zariadenia na elektroforézu a ponorte do tlmivého roztoku 1 × TAE.
|
|
—
|
Pridajte 20 μl z každej vzorky do samostatnej jamky a do náhradnej jamky pridajte marker molekulovej hmotnosti (DNA rebrík 100bp, Promega).
|
|
—
|
Elektroforéza sa vykonáva pri 120 V počas 30 – 45 minút.
|
4. Vizualizácia produktov amplifikácie
Ak bol do agarózového gélu pridaný ehtídiumbromid podľa opisu uvedeného vyššie, produkty DNA sa vizualizujú pod zdrojom UV žiarenia. Alternatívne sa agarózový gél pred vizualizáciou zafarbí pokrytím gélu zriedeným roztokom ethídiumbromidu (0,5 μg/ml vo vode) na 30 minút.
Dodatok 11
Usmernenie pre postup umelého oplodnenia pichľavky sivej
Účelom tohto oddielu je opísať postupy na získanie oplodnených vajíčok pichľavky sivej na použitie v teste FSDT.
Postupy
Získanie spermií od samčekov
|
1.
|
Dobre sfarbený samček z požadovanej populácie sa usmrtí.
|
|
2.
|
Z každej strany ryby sa odoberú semenníky. Semenníky sú väčšinou výrazne pigmentované štruktúry tvaru tyče, ktoré sú dobre viditeľné v laterálnej stredovej línii tela. Použite jednu z týchto metód:
|
|
3.
|
Pomocou jemných nožníc urobte rez s dĺžkou 1 – 1,5 cm jedným strihnutím od kloaky v uhle približne 45 stupňov.
|
|
4.
|
Skalpelom urobte malý rez na bočnej strane ryby mierne za panvou a mierne ventrálne od bočných štítkov.
|
|
5.
|
Jemnou pinzetou vyberte semenníky a vložte ich do Petriho misky.
|
|
6.
|
Každý semenník sa pokryje 100 μl čerstvo vyrobeného Hankovho konečného roztoku
(31).
|
|
7.
|
Semenníky sa nakrájajú na malé kocky pomocou žiletky alebo skalpela. Tým sa uvoľnia spermie a Hankov roztok získa mliečny vzhľad.
|
|
8.
|
Tekutina obsahujúca spermie sa pridá do skúmavky, pričom treba dávať pozor, aby sa pri pipetovaní nedostali do skúmavky kúsky semenníkov.
|
|
9.
|
Do skúmavky sa pridá 800 μl Hankovho konečného roztoku a dobre sa premieša.
|
|
10.
|
Ak je to potrebné, samčeka možno zafixovať v 100 % etanole alebo inom požadovanom fixačnom prostriedku. To je dôležité najmä vtedy, keď sa v štúdii určuje rodičovský pôvod mláďat.
|
Dôležitá poznámka: Hoci väčšinu potrebných zásobných roztokov možno pripraviť vopred,
zásobný roztok 5
a následne aj
konečný roztok
by sa mali pripraviť čerstvé v deň použitia.
|
Zásobný roztok 1
|
|
NaCl
|
8,00 g
|
|
KCl
|
0,40 g
|
|
Destilovaná voda (DV)
|
100 ml
|
|
Zásobný roztok 2
|
|
Na2HPO4 (bezvodý)
|
0,358 g
|
|
KH2PO4
|
0,60 g
|
|
DV
|
100 ml
|
|
Zásobný roztok 3
|
|
CaCl2
|
0,72 g
|
|
DV
|
50 ml
|
|
Zásobný roztok 4
|
|
MgSO4
.7H2O
|
1,23 g
|
|
DV
|
50 ml
|
|
Zásobný roztok 5 (čerstvo pripravený)
|
|
NaHCO3
|
0,35 g
|
|
DV
|
10 ml
|
Poznámka: Ak už máte pripravené niektoré z uvedených solí, ale s iným obsahom vody (t. j. 2H2O namiesto bezvodých), môžete ich použiť, najskôr však upravte hmotnosť na základe molekulovej hmotnosti.
V prípade Hankovho konečného roztoku ich kombinujte v tomto poradí:
|
zásobný roztok 1
|
1,0 ml
|
|
zásobný roztok 2
|
0,1 ml
|
|
zásobný roztok 3
|
0,1 ml
|
|
DV
|
8,6 ml
|
|
zásobný roztok 4
|
0,1 ml
|
|
zásobný roztok 5
|
0,1 ml
|
Pred použitím dobre premiešajte.
Oplodnenie
|
1.
|
V požadovanej populácii sa identifikujú veľké gravidné samičky. Samičky sú pripravené na vytláčanie až vtedy, keď vidíte vajíčka vyčnievať z kloaky. Pripravené samičky majú typickú polohu ‚hlava hore‘.
|
|
2.
|
Jemne prejdite prstom alebo palcom po bočnej strane ryby smerom k chvostu, aby ste podporili vypudenie vačku s vajíčkami do novej Petriho misky. Zopakujte to aj na druhej strane a vráťte rybu do nádrže.
|
|
3.
|
Vajíčka možno rozptýliť (aby tvorili jednu vrstvu) pomocou jemného štetca. Je dôležité snažiť sa vystaviť spermiám čo najviac vajíčok, preto je užitočné maximalizovať povrchovú plochu vajíčok. Dôležitá poznámka: Uchovávajte vajíčka vlhké tak, že okolo nich uložíte vlhkú vreckovku (je dôležité, aby sa vajíčka priamo nedotýkali vody, lebo to môže viesť k predčasnému stvrdnutiu choriónu, čím by sa znemožnilo oplodnenie). Existujú veľké rozdiely v počte vajíčok, ktoré sú jednotlivé samičky schopné vytvoriť, ale v priemere možno z jednej gravidnej samičky ľahko získať približne 150 vajíčok.
|
|
4.
|
25 μl spermií v Hankovej zmesi sa štetcom rovnomerne rozotrie na celý povrch vajíčok. Vajíčka po začiatku oplodňovania rýchlo stvrdnú a zmenia farbu (do minúty). Ak je odhadovaný počet vajíčok vyšší ako 150, postup zopakujte. Podobne ak vajíčka nestvrdnú do jednej minúty, pridajte trochu viac spermií. Dôležitá poznámka: Pridaním väčšieho množstva spermií sa nemusí nevyhnutne zvýšiť miera oplodnenia.
|
|
5.
|
Vajíčka a roztok spermií by sa mali nechať ‚interagovať‘ aspoň 15 minút a oplodnené vajíčka by sa mali umiestniť do expozičných akvárií do 1,5 hodiny od oplodnenia.
|
|
6.
|
Postup sa opakuje s použitím ďalšej samičky, kým sa nezíska želaný počet vajíčok.
|
|
7.
|
Odložte si niekoľko vajíčok z poslednej dávky a zafixujte ich v 10 % kyseline octovej.
|
Počítanie a rozdelenie vajíčok do testovacích akvárií
|
1.
|
Vajíčka by sa mali rovnomerne rozdeliť medzi jednotlivé úrovne koncentrácie chemikálie, aby sa zabránilo genetickému skresleniu. Každá dávka oplodnených vajíčok by sa mala rozdeliť na skupiny rovnakej veľkosti (v rovnakom počte ako úrovne koncentrácie chemikálie) pomocou tupého nástroja (t. j. entomologickej pinzety s tupou čepeľou alebo inokulačnej kľučky). Ak chcete použiť štyri replikáty na testovanú koncentráciu po 20 vajíčkach, musíte do každého expozičného akvária umiestniť 80 vajíčok. Dôležitá poznámka: Odporúča sa pridať ďalších 20 % (t. j. celkovo 96 vajíčok na úroveň koncentrácie chemikálie), aby ste si boli istí, že dosiahnete 100 % mieru oplodnenia.
|
|
2.
|
Vajíčka pichľavky sú mimo hniezda stráženého otcom veľmi náchylné na plesňové infekcie. V tejto súvislosti má rozhodujúci význam ošetrovanie všetkých vajíčok metylénovou modrou počas prvých piatich dní testu. Zásobný roztok metylénovej modrej sa pripraví v koncentrácii 1 mg/ml a pridá sa do expozičných akvárií, aby sa dosiahla maximálna konečná koncentrácia 2,125 mg/l. Dôležitá poznámka: Pichľavky by sa po vyliahnutí nemali vystavovať metylénovej modrej, takže v 6. deň by ju systém už nemal obsahovať.
|
|
3.
|
Vajíčka sa každý deň kontrolujú a všetky mŕtve alebo neoplodnené vajíčka sa zaznamenajú. Dôležitá poznámka: Vajíčka sa až do vyliahnutia nikdy nesmú dostať mimo vodu, a to ani na veľmi krátke obdobie.
|
C.42 BIODEGRADOVATEĽNOSŤ V MORSKEJ VODE
VŠEOBECNÝ ÚVOD
|
1.
|
Táto testovacia metóda je rovnocenná s usmernením OECD na vykonávanie testov (TG) 306 (1992). Keď sa vyvíjali pôvodné testovacie metódy, nebolo známe, do akej miery možno výsledky skríningových testov ľahkej biodegradovateľnosti s použitím pitnej vody a výtoku splaškových vôd alebo aktivovaného kalu ako inokula uplatniť v morskom prostredí. V tejto súvislosti sa získali rôznorodé výsledky [napr. (1)].
|
|
2.
|
Mnohé priemyselné odpadové vody obsahujúce rôzne chemikálie sa dostávajú do mora buď priamym vypúšťaním, alebo prostredníctvom ústí riek, v ktorých je čas zotrvania nízky v porovnaní s časom potrebným na úplnú biodegradáciu mnohých chemických látok. Vzhľadom na rastúcu informovanosť o potrebe chrániť morské prostredie pred zvyšovaním chemickej záťaže a o potrebe odhadnúť pravdepodobnú koncentráciu chemikálií v mori sa vyvinuli testovacie metódy týkajúce sa biodegradovateľnosti v morskej vode.
|
|
3.
|
Opísané metódy využívajú prírodnú morskú vodu ako vodnú fázu aj ako zdroj mikroorganizmov. V snahe dosiahnuť súlad s metódami stanovenia ľahkej biodegradovateľnosti v sladkej vode sa skúmalo použitie ultrafiltrovanej a odstredenej morskej vody, ako aj použitie morských sedimentov ako inokula. Tieto skúmania boli neúspešné. Testovacím médiom je teda prírodná morská voda, ktorá sa predupravila odstránením hrubých častíc.
|
|
4.
|
Na posúdenie úplnej biodegradovateľnosti metódou trepačkovej banky je nutné použiť pomerne vysoké koncentrácie testovanej látky vzhľadom na nízku citlivosť analytickej metódy využívajúcej rozpustený organický uhlík (DOC). To si následne vyžaduje, aby sa do morskej pridali minerálne živiny (N a P), ktorých nízke koncentrácie by inak obmedzili elimináciu DOC. Živiny sa musia pridať aj v prípade metódy uzavretej fľaše z dôvodu koncentrácie pridanej testovanej látky.
|
|
5.
|
Z toho vyplýva, že metódy nie sú testy ľahkej biodegradovateľnosti, lebo okrem mikroorganizmov, ktoré sú už prítomné v morskej vode, sa nepridáva žiadne inokulum. Testy ani nesimulujú morské prostredie, lebo sa pridávajú živiny a koncentrácia testovanej látky je oveľa vyššia, ako by bola v mori. Z týchto dôvodov sa metódy uvádzajú v novom pododdiele s názvom ‚Biodegradovateľnosť v morskej vode‘.
|
UPLATŇOVANIE
|
6.
|
Prvé informácie o biodegradovateľnosti v morskej vode poskytujú výsledky testov, ktoré by sa použili v prípade, keď model používania a likvidácie predmetnej látky nasvedčuje dráhe do mora. Ak je výsledok kladný (> 70 % eliminácia DOC, > 60 % ThOD – teoretická spotreba kyslíka), možno dospieť k záveru, že existuje potenciál pre biodegradáciu v morskom prostredí. Záporný výsledok však nevylučuje tento potenciál, ale naznačuje, že je potrebná ďalšia štúdia, napríklad s použitím čo najnižšej koncentrácie testovanej látky.
|
|
7.
|
V každom prípade, ak sa vyžaduje presnejšia hodnota miery alebo stupňa biodegradácie v morskej vode na konkrétnom mieste, je nutné použiť ďalšie zložitejšie a dokonalejšie, a teda aj nákladnejšie metódy. Napríklad by bolo možné použiť simulačný test s použitím koncentrácie testovanej látky bližšej predpokladanej koncentrácii v životnom prostredí. Takisto je možné použiť neobohatenú a nepredupravenú morskú vodu z miesta záujmu a po primárnej biodegradácii sa môže vykonať špecifická chemická analýza. Na stanovenie úplnej biodegradovateľnosti by bolo potrebné použiť látky označené uhlíkom 14C, aby bolo možné odmerať mieru zániku rozpustného organického uhlíka 14C a produkciu 14CO2 v realistických koncentráciách v životnom prostredí.
|
VÝBER METÓD
|
8.
|
Výber použitej metódy závisí od viacerých faktorov. Ako pomôcku pri výbere možno použiť nasledujúcu tabuľku. Látky s rozpustnosťou vo vode nižšou ako ekvivalent približne 5 mg C/l síce nemožno testovať metódou trepačkovej banky, ale v zásade možno tieto slabo rozpustné látky testovať aspoň metódou uzavretej fľaše.
Tabuľka
Výhody a nevýhody testu trepačkovej banky a testu uzavretej fľaše
|
METÓDA
|
VÝHODY
|
NEVÝHODY
|
|
TREPAČKOVÁ BANKA
|
|
—
|
jednoduché prístroje okrem analyzátora C
|
|
—
|
dĺžka trvania 60 dní nie je problém
|
|
—
|
žiadny vplyv nitrifikácie
|
|
—
|
možno upraviť pre prchavé látky
|
|
|
—
|
využíva 5 – 40 mg DOC/1, môže mať inhibujúce účinky
|
|
—
|
stanovenie DOC je ťažké pri nízkych koncentráciách v morskej vode (chloridový efekt)
|
|
—
|
koncentrácia DOC v morskej vode je niekedy vysoká
|
|
|
UZAVRETÁ FĽAŠA
|
|
—
|
jednoduché konečné stanovenie
|
|
—
|
použitie nízkej koncentrácie testovanej látky (2 mg/l), takže menšie riziko inhibície
|
|
—
|
ľahko upraviteľné pre prchavé látky
|
|
|
—
|
môže byť ťažké zachovať vzduchotesnosť fliaš
|
|
—
|
rast baktérií na stenách môže viesť k nesprávnym hodnotám
|
|
—
|
hodnoty spotreby O2 v slepých vzorkách môžu byť vysoké najmä po 28 dňoch, čo možno prekonať zrením morskej vody
|
|
—
|
možný vplyv spotreby O2 nitrifikáciou
|
|
|
METÓDA TREPAČKOVEJ BANKY
ÚVOD
|
1.
|
Táto metóda je variantom modifikovaného skríningového testu OECD opísaného v kapitole C.4 B tejto prílohy (2), v ktorom sa používa morská voda. Vypracovala sa na základe kruhového testu, ktorý pre Európsku komisiu (EK) uskutočnil dánsky Ústav pre kvalitu vody (3).
|
|
2.
|
Tak ako v prípade sprievodnej metódy uzavretej fľaše pre morskú vodu, výsledky tohto testu sa nepovažujú za ukazovatele ľahkej biodegradovateľnosti, ale majú sa použiť najmä na získanie informácií o biodegradovateľnosti látok v morskom prostredí.
|
PRINCÍP METÓDY
|
3.
|
Vopred stanovené množstvo testovanej látky sa rozpustí v testovacom médiu, aby sa získala koncentrácia 5 – 40 mg rozpusteného organického uhlíka (DOC)/l. Ak sa limity citlivosti analýz organického uhlíka zlepšia, môže byť výhodné použiť nižšie koncentrácie testovanej látky, najmä v prípade inhibujúcich látok. Roztok testovanej látky v testovacom médiu sa inkubuje za pretrepávania v tme alebo pri difúznom osvetlení v aeróbnych podmienkach pri stabilnej teplote (regulovanej na ± 2 °C), ktorá zvyčajne bude v rozsahu 15 – 20 °C. V prípadoch, keď je cieľom štúdie simulovať situácie v životnom prostredí, sa testy môžu uskutočniť aj mimo tohto zvyčajného rozsahu teplôt. Odporúčaná maximálna dĺžka trvania testu je približne 60 dní. Po degradácii nasledujú merania DOC (úplná degradácia) a v niektorých prípadoch aj špecifická analýza (primárna degradácia).
|
INFORMÁCIE O TESTOVANEJ LÁTKE
|
4.
|
Na to, aby bolo možné určiť, či sa test môže použiť na konkrétnu látku, musia byť známe niektoré jej vlastnosti. Musí sa stanoviť obsah organického uhlíka látky, jej prchavosť musí byť taká, aby v priebehu testu nedochádzalo k významným stratám, a jej rozpustnosť vo vode musí byť vyššia ako ekvivalent 25 – 40 mg C/l. Testovaná látka by sa navyše nemala výrazne adsorbovať na sklenené povrchy. Potrebné sú informácie o čistote alebo pomernom zastúpení hlavných zložiek testovanej látky, aby bolo možné interpretovať získané výsledky, a to najmä v prípade, že výsledok je blízko ‚úspešnej‘ úrovne.
|
|
5.
|
Informácie o toxicite testovanej látky pre baktérie, napríklad údaje namerané v krátkodobých testoch rýchlosti spotreby kyslíka (4), môžu byť užitočné pri výbere vhodných testovaných koncentrácií a môžu byť rozhodujúce pre správnu interpretáciu nízkych hodnôt biodegradácie. Tieto informácie však nie sú vždy dostatočné na interpretáciu výsledkov získaných v teste na biologickú odbúrateľnosť a vhodnejší je postup opísaný v bode 18.
|
REFERENČNÉ LÁTKY
|
6.
|
Na kontrolu mikrobiálnej činnosti vo vzorke morskej vody sa musia použiť vhodné referenčné látky. Príkladmi látok, ktoré možno použiť na tieto účely, sú benzoan sodný, octan sodný a anilín. Referenčné látky sa musia degradovať v primerane krátkom čase, v opačnom prípade sa odporúča, aby sa test zopakoval s použitím inej vzorky morskej vody.
|
|
7.
|
V kruhovom teste EK, v ktorom sa vzorky morskej vody odobrali z rôznych miest a v rôznych obdobiach roka (3), trvala lag fáza (tL) jeden až štyri dni a čas na dosiahnutie 50 % degradácie (t50) okrem lag fázy bol jeden až sedem dní pre benzoan sodný. Pre anilín sa hodnota tL pohybovala od nula do desať dní, kým hodnota t50 bola v rozsahu jeden až desať dní.
|
OPAKOVATEĽNOSŤ A CITLIVOSŤ METÓDY
|
8.
|
Opakovateľnosť metódy sa stanovila v kruhovom teste (3). Najnižšiu koncentráciu testovanej látky, pre ktorú možno túto metódu použiť s analýzou DOC, vo veľkej miere určuje detekčný limit analýzy organického uhlíka (v súčasnosti približne 0,5 mg C/l) a koncentrácia rozpusteného organického uhlíka v použitej morskej vode (zvyčajne rádovo 3 – 5 mg/l pre vodu z otvoreného mora). Koncentrácia DOC v pozadí by nemala presiahnuť približne 20 % celkovej koncentrácie DOC po pridaní testovanej látky. Ak to nie je uskutočniteľné, koncentráciu DOC v pozadí možno niekedy znížiť tak, že morská voda sa pred testom nechá zrieť. Ak sa metóda používa len so špecifickou chemickou analýzou (ktorou sa meria primárna degradácia), výskumník musí uviesť dodatočné informácie o tom, či možno očakávať úplnú degradáciu. Tieto dodatočné informácie môžu zahŕňať výsledky iných testov ľahkej alebo inherentnej biodegradovateľnosti.
|
OPIS METÓDY
Prístroje
|
9.
|
Bežné laboratórne zariadenie a:
|
a)
|
trepačka prispôsobená na pollitrové až dvojlitrové Erlenmeyerove banky, buď s automatickou reguláciou teploty, alebo umiestnená v miestnosti so stabilnou teplotou 15 – 20 °C regulovanou v rozmedzí ± 2 °C;
|
|
b)
|
pollitrové až dvojlitrové Erlenmeyerove banky s úzkym hrdlom;
|
|
c)
|
zariadenie na membránovú filtráciu alebo odstredivka;
|
|
d)
|
membránové filtre 0,2 – 0,45 μm;
|
|
f)
|
zariadenie na špecifickú analýzu (voliteľné).
|
|
Morská voda
|
10.
|
Odoberte vzorku morskej vody do dôkladne vyčistenej nádoby a dopravte ju do laboratória najlepšie do jedného alebo dvoch dní od odberu. Počas prepravy nedovoľte, aby teplota vzorky výrazne presiahla teplotu, aká sa použije v teste. Presne identifikujte miesto odberu vzorky a opíšte jeho stav z hľadiska znečistenia a živín. Najmä v prípade pobrežných vôd zahrňte do tejto charakterizácie počet heterotrofných mikrobiálnych kolónií a stanovenie koncentrácie rozpustených dusičnanov, amónnych iónov a fosforečnanov.
|
|
11.
|
O samotnej vzorke morskej vody uveďte tieto informácie:
|
—
|
vzhľad vzorky – zakalená atď.,
|
|
—
|
čas medzi odberom a použitím v teste.
|
|
|
12.
|
Ak sa zistí vysoký obsah DOC vo vzorke morskej vody (bod 8), odporúča sa, aby sa morská voda nechala pred použitím zrieť približne jeden týždeň. Nechajte ju zrieť za aeróbnych podmienok pri testovacej teplote a v tme alebo pri difúznom osvetlení. Ak je to potrebné, udržiavajte aeróbne podmienky jemným prevzdušňovaním. Počas zretia sa zníži obsah ľahko degradovateľného organického materiálu. V kruhovom teste (3) sa nezistili žiadne rozdiely medzi degradačným potenciálom vyzretých a čerstvo odobratých vzoriek morskej vody. Pred použitím predupravte morskú vodu tak, aby sa odstránili hrubé častice, napr. filtráciou cez nylonový filter alebo hrubý papierový filter (nie membránový ani GF-C filter) alebo sedimentáciou a dekantáciou. Použitý postup sa musí uviesť do správy. Ak nechávate vzorku zrieť, túto predúpravu vykonajte až potom.
|
Zásobné roztoky minerálnych živín
|
13.
|
Pripravte tieto zásobné roztoky s použitím reaktantov analytickej čistoty:
|
a)
|
Dihydrogénfosforečnan draselný, KH2PO4
|
8,50 g
|
|
Hydrogénfosforečnan didraselný, K2HPO4
|
21,75 g
|
|
Dihydrát hydrogénfosforečnanu disodného, Na2HPO4 · 2H2O
|
33,30 g
|
|
Chlorid amónny, NH4Cl
|
0,50 g
|
|
Rozpustite a doplňte destilovanou vodou do objemu 1 liter.
|
|
|
b)
|
Chlorid vápenatý, CaCl2
|
27,50 g
|
|
Rozpustite a doplňte destilovanou vodou do objemu 1 liter.
|
|
|
c)
|
Heptahydrát síranu horečnatého, MgSO4 · 7H2O
|
22,50 g
|
|
Rozpustite a doplňte destilovanou vodou do objemu 1 liter.
|
|
|
d)
|
Hexahydrát chloridu železitého, FeCl3 · 6H2O
|
0,25 g
|
|
Rozpustite a doplňte destilovanou vodou do objemu 1 liter.
|
|
Zrazeninám v roztoku d) možno predísť pridaním jednej kvapky koncentrovanej HCl alebo 0,4 g kyseliny etyléndiamíntetraoctovej (EDTA, disodná soľ) na liter. Ak sa v zásobnom roztoku vytvorí zrazenina, nahraďte ho čerstvo pripraveným roztokom.
|
Príprava testovacieho média
|
14.
|
Pridajte 1 ml každého z uvedených zásobných roztokov na liter predupravenej morskej vody.
|
Inokulum
|
15.
|
Okrem mikroorganizmov, ktoré sú už prítomné v morskej vode, nepridávajte osobitné inokulum. Stanovte (voliteľne) počet heterotrofov tvoriacich kolónie v testovacom médiu morskej vody (a podľa možnosti aj v pôvodných vzorkách morskej vody), napr. spočítaním na miske s použitím morského agaru. To je potrebné najmä pre vzorky z pobrežných alebo znečistených oblastí. Skontrolujte heterotrofnú mikrobiálnu činnosť v morskej vode vykonaním testu s referenčnou látkou.
|
Príprava baniek
|
16.
|
Zabezpečte, aby bolo všetko sklo pred použitím dôkladne čisté, nie nevyhnutne sterilné (napr. s použitím alkoholovej kyseliny chlorovodíkovej), opláchnuté a vysušené, aby sa zabránilo kontaminácii zvyškami z predchádzajúcich testov. Banky sa takisto pred prvým použitím musia vyčistiť.
|
|
17.
|
Testované látky v duplicitných bankách vyhodnocujte spolu s jednou bankou pre referenčnú látku. Vykonajte slepý test v duplikáte bez testovanej či referenčnej látky s cieľom stanoviť analytické slepé vzorky. Rozpustite testované látky v testovacom médiu – možno ich pohodlne pridať prostredníctvom koncentrovaného zásobného roztoku – aby sa dosiahla požadovaná počiatočná koncentrácia zvyčajne 5 – 40 mg DOC/l. Referenčnú látku otestujte vo zvyčajnej počiatočnej koncentrácii zodpovedajúcej 20 mg DOC/l. Ak sa používajú zásobné roztoky testovanej a/alebo referenčnej látky, zabezpečte, aby sa výrazne nezmenila slanosť média morskej vody.
|
|
18.
|
Ak možno očakávať alebo nemožno vylúčiť toxické účinky, môže byť vhodné zahrnúť do koncepcie testu inhibičný pokus v duplikáte. Pridajte testovanú a referenčnú látku do rovnakej nádoby, pričom koncentrácia referenčnej látky je zvyčajne rovnaká ako v kontrolnom teste (t. j. 20 mg DOC/l), aby sa umožnilo porovnanie.
|
|
19.
|
Pridajte primerané množstvá testovaných roztokov do Erlenmeyerových baniek (vhodné množstvo je najviac polovica objemu banky) a na každú banku nasaďte voľný kryt (napr. hliníkovú fóliu), ktorý umožňuje výmenu plynov medzi bankou a okolitým vzduchom. (Ak sa používa analýza DOC, vatové uzávery sú nevhodné.) Vložte nádoby do trepačky a počas celého testu nepretržite pretrepávajte pri miernej rýchlosti (napr. 100 ot./min.). Regulujte teplotu (15 – 20 °C v rozmedzí ± 2 °C) a chráňte nádoby pred svetlom, aby sa zabránilo rastu rias. Zabezpečte, aby vzduch neobsahoval toxické materiály.
|
Fyzikálno-chemický kontrolný test (voliteľný)
|
20.
|
Ak existuje podozrenie na abiotickú degradáciu alebo mechanizmy straty, ako je hydrolýza (problém len v prípade špecifickej analýzy), prchanie alebo adsorpcia, odporúča sa vykonať fyzikálno-chemický kontrolný pokus. Možno ho vykonať pridaním chloridu ortutnatého (HgCl2) (32) (50 – 100 mg/l) do nádob s testovanou látkou, aby sa zastavila mikrobiálna činnosť. Významný pokles hodnoty DOC alebo koncentrácie konkrétnej látky vo fyzikálno-chemickom kontrolnom teste nasvedčuje existencii mechanizmov abiotickej eliminácie. (Ak sa použije chlorid ortutnatý, pozornosť v analýze DOC by sa mala venovať interferenciám alebo otrave katalyzátorom).
|
Počet baniek
|
21.
|
V typickom teste sa použijú tieto banky:
|
banky 1 a 2
|
–
|
obsahujúce testovanú látku (testovaciu suspenziu),
|
|
banky 3 a 4
|
–
|
obsahujúce len morskú vodu (slepé),
|
|
banka 5
|
–
|
obsahujúca referenčnú látku (kontrola postupu),
|
|
banka 6
|
–
|
obsahujúca testovanú a referenčnú látku (kontrola toxicity) – voliteľná,
|
|
banka 7
|
–
|
obsahujúca testovanú látku a sterilizačné činidlo (abiotická sterilná kontrola) – voliteľná.
|
|
Analýza DOC
|
22.
|
V priebehu testu odoberajte vo vhodných intervaloch vzorky na analýzu DOC (dodatok 1). Vždy odoberte vzorky na začiatku testu (0. deň) a v 60. deň. Na opis priebehu degradácie v čase je potrebných celkovo minimálne päť vzoriek. Nemožno uviesť žiadny pevný harmonogram odberu vzoriek, lebo miera biodegradácie sa líši. Na každej vzorke vykonajte stanovenie DOC v duplikáte.
|
Odber vzoriek
|
23.
|
Požadovaný objem vzoriek závisí od analytickej metódy (špecifická analýza), použitého analyzátora uhlíka a postupu (membránová filtrácia alebo odstredenie) zvolených na úpravu vzorky pred stanovením uhlíka (body 25 a 26). Pred odberom vzoriek zabezpečte, aby bolo testovacie médium dobre premiešané a aby sa prípadný materiál prilepený na stene banky rozpustil alebo suspendoval.
|
|
24.
|
Membránovú filtráciu alebo odstredenie vykonajte ihneď po odbere vzorky. Ak je to potrebné, filtrované alebo odstredené vzorky skladujte pri teplote 2 – 4 °C maximálne 48 hodín alebo pri teplote nižšej ako –18 °C v prípade dlhšieho skladovania (ak je známe, že to nebude mať vplyv na testovanú látku, pred uskladnením roztok okyslite na pH 2).
|
|
25.
|
Membránové filtre (0,2 – 0,45 μm) sú vhodné, ak sa zabezpečí, aby neuvoľňovali uhlík ani neadsorbovali látku vo fáze filtrácie, napr. polykarbonátové membránové filtre. Niektoré membránové filtre sú impregnované povrchovo aktívnymi látkami na hydrofilizáciu a môžu uvoľňovať značné množstvo rozpusteného uhlíka. Tieto filtre pripravte prevarením v deionizovanej vode v troch po sebe nasledujúcich hodinových intervaloch. Po prevarení skladujte filtre v deionizovanej vode. Prvých 20 ml filtrátu zlikvidujte.
|
|
26.
|
Ako alternatívu k membránovej filtrácii možno vykonať odstredenie vzoriek. Odstreďujte pri 40 000 m.s– 2 (~ 4 000 g) počas 15 minút, podľa možnosti v chladenej centrifúge.
Poznámka: Oddelenie celkového obsahu organického uhlíka (TOC) od DOC (TOC/DOC) odstreďovaním nefunguje pri veľmi nízkych koncentráciách, lebo buď sa neodstránia všetky baktérie, alebo sa uhlík ako súčasť bakteriálnej plazmy znovu rozpustí. Pri vyšších testovaných koncentráciách (> 10 mg C na liter) je chyba odstreďovania pomerne nižšia.
|
Frekvencia odberu vzoriek
|
27.
|
Ak sa analýzy vykonávajú ihneď po odbere vzoriek, čas ďalšieho odberu vzoriek určite s ohľadom na výsledok analytického stanovenia.
|
|
28.
|
Ak sa vzorky konzervujú (bod 24) na neskoršiu analýzu, odoberte viac vzoriek ako požadovaný minimálny počet päť. Najskôr analyzujte posledné vzorky, pričom postupným ‚spätným‘ výberom vhodných vzoriek na analýzu možno s pomerne malým počtom analytických stanovení získať dobrý opis biodegradačnej krivky. Ak do konca testu nedošlo k žiadnej degradácii, nie je potrebné analyzovať žiadne ďalšie vzorky, a v takej situácii môže ‚spätná‘ stratégia ušetriť značné náklady na analýzu.
|
|
29.
|
Ak sa plató degradačnej krivky pozoruje pred 60. dňom, test ukončite. Ak degradácia zjavne začala do 60. dňa, ale nedosiahla plató, predĺžte experiment o ďalšie obdobie.
|
ÚDAJE A PODÁVANIE SPRÁV
Spracovanie výsledkov
|
30.
|
Zaznamenajte analytické výsledky na priloženú kartu údajov (dodatok 2) a vypočítajte hodnoty biodegradácie pre testovanú a referenčnú látku podľa rovnice:

kde:
|
Dt
|
=
|
degradácia ako percentuálna eliminácia DOC alebo špecifickej látky v čase t,
|
|
Co
|
=
|
počiatočná koncentrácia DOC alebo špecifickej látky v testovacom médiu,
|
|
Ct
|
=
|
koncentrácia DOC alebo špecifickej látky v testovacom médiu v čase t,
|
|
Cbl(0)
|
=
|
počiatočná koncentrácia DOC alebo špecifickej látky v slepej vzorke,
|
|
Cbl(t)
|
=
|
koncentrácia DOC alebo špecifickej látky v slepej vzorke v čase t.
|
|
|
31.
|
Degradáciu uveďte ako percentuálnu elimináciu DOC (úplnú degradáciu) alebo elimináciu špecifickej látky (primárnu degradáciu) v čase t. Vypočítajte koncentrácie DOC s presnosťou na 0,1 mg na liter a priemery hodnôt Dt zaokrúhlite na najbližšie celé percento.
|
|
32.
|
Priebeh degradácie graficky znázornite v diagrame uvedenom na obrázku v oddiele ‚Validita a interpretácia výsledkov‘. Ak máte dostatok údajov, vypočítajte z krivky lag fázu (tL) a čas potrebný na dosiahnutie 50 % eliminácie od konca lag fázy (t50).
|
Protokol o skúške
|
33.
|
Protokol o skúške musí obsahovať tieto informácie:
|
|
Testovaná látka:
|
—
|
fyzikálny charakter a v prípade potreby fyzikálno-chemické vlastnosti,
|
|
|
|
Podmienky testu:
|
—
|
umiestnenie a opis miesta odberu vzoriek, stav znečistenia a živín (počet kolónií, dusičnany, amóniové ióny, fosforečnany, ak je to vhodné),
|
|
—
|
charakteristiky vzorky [dátum odberu vzorky, hĺbka, vzhľad, teplota, slanosť, DOC (voliteľné), čas medzi odberom a použitím v teste],
|
|
—
|
použitá metóda zretia morskej vody (ak sa použije),
|
|
—
|
metóda použitá na predúpravu (filtrácia/sedimentácia) morskej vody,
|
|
—
|
metóda použitá na stanovenie DOC,
|
|
—
|
metóda použitá na špecifickú analýzu (voliteľné),
|
|
—
|
metóda použitá na určenie počtu heterotrofov v morskej vode (metóda počítania na miske alebo alternatívny postup) (voliteľné),
|
|
—
|
iné metódy (voliteľné) použité na stanovenie vlastností morskej vody (merania ATP atď.).
|
|
|
|
Výsledky:
|
—
|
analytické údaje uvedené na karte údajov (dodatok 2),
|
|
—
|
priebeh testu degradácie sa graficky znázorňuje v diagrame zobrazujúcom lag fázu (tL), sklon a čas (od konca lag fázy) na dosiahnutie 50 % eliminácie (t50). Lag fázu možno graficky odhadnúť podľa obrázka v oddiele ‚Validita a interpretácia výsledkov‘ alebo jednoducho uviesť ako čas potrebný na 10 % degradáciu,
|
|
—
|
percentuálna degradácia odmeraná po 60 dňoch alebo na konci testu.
|
|
|
Validita a interpretácia výsledkov
|
34.
|
Výsledky získané použitím referenčných látok, napr. benzoanu sodného, octanu sodného alebo anilínu, by mali byť porovnateľné s výsledkami získanými v kruhovom teste (3) (pozri oddiel ‚Referenčné látky‘, bod 7). Ak sú výsledky získané s použitím referenčných látok atypické, test by sa mal zopakovať s použitím inej vzorky morskej vody. Hoci interpretácia výsledkov testov inhibície nemusí byť vždy jednoduchá vzhľadom na príspevok testovanej látky k DOC, výrazné zníženie celkovej miery eliminácie DOC v porovnaní s kontrolnou vzorkou je pozitívnou známkou toxických účinkov.
|
|
35.
|
Vzhľadom na pomerne vysoké použité testované koncentrácie v porovnaní s väčšinou prírodných systémov (a teda nepriaznivý pomer medzi koncentráciami testovaných látok a iných zdrojov uhlíka) sa metóda má považovať za predbežnú skúšku, ktorú možno použiť na stanovenie, či látka je alebo nie je ľahko biodegradovateľná. V súlade s tým ani nízky výsledok nemusí nutne znamenať, že testovaná látka nie je biodegradovateľná v morskom prostredí, ale poukazuje na to, že na stanovenie tejto skutočnosti je potrebné vykonať ďalší výskum.
Na nasledujúcom obrázku je uvedený príklad teoretického pokusu s degradáciou, ktorý znázorňuje uskutočniteľný spôsob odhadu hodnôt tL (dĺžka ‚lag fázy‘) a t50 (časový interval začínajúci pri tL potrebný na dosiahnutie 50 % eliminácie).

|
METÓDA UZAVRETEJ FĽAŠE
ÚVOD
|
1.
|
Táto metóda je variantom testu uzavretej fľaše (5) s morskou vodou. Vypracovala sa na základe kruhového testu, ktorý pre Európsku komisiu (EK) uskutočnil dánsky Ústav pre kvalitu vody (3).
|
|
2.
|
Tak ako v prípade sprievodnej metódy trepačkovej banky pre morskú vodu, výsledky tohto testu sa nepovažujú za ukazovatele ľahkej biodegradovateľnosti, ale majú sa použiť najmä na získanie informácií o biodegradovateľnosti látok v morskom prostredí.
|
PRINCÍP METÓDY
|
3.
|
Vopred stanovené množstvo testovanej látky sa rozpustí v testovacom médiu v koncentrácii zvyčajne 2 – 10 mg testovanej látky na liter (možno použiť jednu alebo viac koncentrácií). Tento roztok sa uchováva v naplnenej uzavretej fľaši v tme v kúpeli alebo v komore s konštantnou teplotou regulovanou na ± 1 °C v rozsahu 15 – 20 °C. V prípadoch, keď je cieľom štúdie simulovať situácie v životnom prostredí, sa testy môžu uskutočniť aj mimo tohto normálneho rozsahu teplôt za predpokladu, že sa vhodne upraví regulácia teploty. Po degradácii nasleduje analýza kyslíka počas 28-dňového obdobia.
|
|
4.
|
V kruhovom teste sa ukázalo, že ak test trval dlhšie ako 28 dní, vo väčšine prípadov sa nezískali žiadne užitočné informácie v dôsledku závažných interferencií. Hodnoty biochemickej spotreby kyslíka (BSK) v slepých vzorkách boli príliš vysoké pravdepodobne v dôsledku rastu na stenách spôsobeného nedostatkom miešania a v dôsledku nitrifikácie. Odporúčaná dĺžka je preto 28 dní, ale ak hodnota BSK v slepých vzorkách zostane v rámci hranice 30 % (body 15 a 40), test sa môže predĺžiť.
|
INFORMÁCIE O TESTOVANEJ LÁTKE
|
5.
|
Na to, aby bolo možné určiť, či sa test môže použiť na konkrétnu látku, musia byť známe niektoré jej vlastnosti. Vyžaduje sa empirický vzorec na výpočet teoretickej spotreby kyslíka (ThOD) (pozri dodatok 3). Ak nie je k dispozícii, musí sa stanoviť chemická spotreba kyslíka (ChSK) látky, ktorá bude slúžiť ako referenčná hodnota. Použitie ChSK je menej uspokojivé, lebo niektoré látky sa v teste ChSK úplne neoxidujú.
|
|
6.
|
Rozpustnosť látky by mala byť aspoň 2 mg/l, hoci v zásade možno testovať aj menej rozpustné látky (napr. pomocou ultrazvuku), ako aj prchavé látky. Potrebné sú informácie o čistote alebo pomernom zastúpení hlavných zložiek testovanej látky, aby bolo možné interpretovať získané výsledky, a to najmä v prípade, že výsledok je blízko ‚úspešnej‘ úrovne.
|
|
7.
|
Informácie o toxicite látky pre baktérie, napríklad údaje namerané v krátkodobých testoch spotreby kyslíka (4), môžu byť veľmi užitočné pri výbere vhodných testovaných koncentrácií a môžu byť rozhodujúce na správnu interpretáciu nízkych hodnôt biodegradácie. Tieto informácie však nie sú vždy dostatočné na interpretáciu výsledkov získaných v teste na biologickú odbúrateľnosť a vhodnejší je postup opísaný v bode 27.
|
REFERENČNÉ LÁTKY
|
8.
|
Na kontrolu mikrobiálnej činnosti vo vzorke morskej vody sa musia použiť vhodné referenčné látky. Na tieto účely možno použiť (napríklad) anilín, octan sodný či benzoan sodný. V rozumnom čase musí dôjsť k aspoň 60 % (z ich ThOD) degradácii týchto látok, inak sa odporúča, aby sa test zopakoval s použitím inej vzorky morskej vody.
|
|
9.
|
V kruhovom teste EK, v ktorom sa vzorky morskej vody odobrali z rôznych miest a v rôznych obdobiach roka, trvala lag fáza (tL) 0 – 2 dni a čas na dosiahnutie 50 % degradácie (t50) okrem lag fázy bol 1 – 4 dni pre benzoan sodný. Pre anilín bola hodnota tL 0 – 7 dní a hodnota t50 2 – 12 dní.
|
REPRODUKOVATEĽNOSŤ
|
10.
|
Opakovateľnosť metód sa stanovila v kruhovom teste EK (3).
|
OPIS METÓDY
Prístroje
|
11.
|
Bežné laboratórne vybavenie a:
|
a)
|
možno použiť 250 – 300 ml fľaše na meranie BSK so sklenenými uzávermi alebo 250 ml fľaše s úzkym hrdlom so sklenenými uzávermi;
|
|
b)
|
viaceré dvojlitrové, trojlitrové a štvorlitrové fľaše s litrovými značkami na prípravu pokusu a na naplnenie fliaš na meranie BSK;
|
|
c)
|
vodný kúpeľ alebo miestnosť s konštantnou teplotou na udržiavanie fliaš pri konštantnej teplote (± 1 °C) s vylúčením svetla;
|
|
d)
|
zariadenie na analýzu rozpusteného kyslíka;
|
|
e)
|
membránové filtre 0,2 – 0,45 μm (voliteľné);
|
|
f)
|
zariadenie na špecifickú analýzu (voliteľné).
|
|
Morská voda
|
12.
|
Odoberte vzorku morskej vody do dôkladne vyčistenej nádoby a prepravte ju do laboratória najlepšie do jedného alebo dvoch dní od odberu. Počas prepravy nedovoľte, aby teplota vzorky výrazne presiahla teplotu, aká sa použije v teste.
|
|
13.
|
Presne identifikujte miesto odberu vzorky a opíšte jeho stav z hľadiska znečistenia a živín. Najmä v prípade pobrežných alebo znečistených vôd zahrňte do tejto charakterizácie počet heterotrofných mikrobiálnych kolónií a stanovenie koncentrácie rozpustených dusičnanov, amónnych iónov a fosforečnanov.
|
|
14.
|
O samotnej vzorke morskej vody uveďte tieto informácie:
|
—
|
vzhľad vzorky – zakalená atď.,
|
|
—
|
rozpustený organický uhlík (DOC),
|
|
—
|
čas medzi odberom a použitím v teste.
|
|
|
15.
|
Ak sa zistí vysoký obsah DOC vo vzorke alebo ak sa usúdi, že hodnota BSK v slepej vzorke by po 28 dňoch bola vyššia ako 30 % hodnoty referenčných látok, odporúča sa, aby sa morská voda nechala pred použitím zrieť približne jeden týždeň.
|
|
16.
|
Nechajte vzorku zrieť za aeróbnych podmienok pri testovacej teplote a v tme alebo pri difúznom osvetlení. Ak je to potrebné, udržiavajte aeróbne podmienky jemným prevzdušňovaním. Počas zretia sa zníži obsah ľahko degradovateľného organického materiálu. V kruhovom teste (3) sa nezistili žiadne rozdiely medzi degradačným potenciálom vyzretých a čerstvo odobratých vzoriek morskej vody.
|
|
17.
|
Pred použitím predupravte morskú vodu tak, aby sa odstránili hrubé častice, napr. filtráciou cez nylonový filter alebo hrubý papierový filter (nie membránový ani GF-C filter) alebo sedimentáciou a dekantáciou. Použitý postup uveďte do správy. Ak nechávate vzorku zrieť, túto predúpravu vykonajte až potom.
|
Zásobné roztoky minerálnych živín
|
18.
|
Pripravte tieto zásobné roztoky s použitím reaktantov analytickej čistoty:
|
a)
|
Dihydrogénfosforečnan draselný, KH2PO4
|
8,50 g
|
|
Hydrogénfosforečnan didraselný, K2HPO4
|
21,75 g
|
|
Dihydrát hydrogénfosforečnanu disodného, Na2HPO4 · 2H2O
|
33,30 g
|
|
Chlorid amónny, NH4Cl
|
0,50 g
|
|
Rozpustite a doplňte destilovanou vodou do objemu 1 liter.
|
|
|
b)
|
Chlorid vápenatý, CaCl2
|
27,50 g
|
|
Rozpustite a doplňte destilovanou vodou do objemu 1 liter.
|
|
|
c)
|
Heptahydrát síranu horečnatého, MgSO4 · 7H2O
|
22,50 g
|
|
Rozpustite a doplňte destilovanou vodou do objemu 1 liter.
|
|
|
d)
|
Hexahydrát chloridu železitého, FeCl3 · 6H2O
|
0,25 g
|
|
Rozpustite a doplňte destilovanou vodou do objemu 1 liter.
|
|
Zrazeninám v roztoku d) možno predísť pridaním jednej kvapky koncentrovanej HCl alebo 0,4 g kyseliny etyléndiamíntetraoctovej (EDTA, disodná soľ) na liter. Ak sa v zásobnom roztoku vytvorí zrazenina, nahraďte ho čerstvo pripraveným roztokom.
|
Príprava testovacieho média
|
19.
|
Pridajte 1 ml každého z uvedených zásobných roztokov na liter predupravenej morskej vody. Nasýťte testovacie médium vzduchom pri testovacej teplote metódou prevzdušňovania čistým stlačeným vzduchom počas približne 20 minút. Stanovte koncentráciu rozpusteného kyslíka na účely kontroly. Nasýtenú koncentráciu rozpusteného kyslíka ako funkciu slanosti a teploty možno odčítať z nomogramu priloženého k tejto testovacej metóde (dodatok 4).
|
Inokulum
|
20.
|
Okrem mikroorganizmov, ktoré sú už prítomné v morskej vode, nepridávajte osobitné inokulum. Stanovte (voliteľne) počet heterotrofov tvoriacich kolónie v testovacom médiu morskej vody (a podľa možnosti aj v pôvodnej vzorke morskej vody), napr. spočítaním na miske s použitím morského agaru. To je potrebné najmä pre vzorky z pobrežných alebo znečistených oblastí. Skontrolujte heterotrofnú mikrobiálnu činnosť v morskej vode vykonaním testu s referenčnou látkou.
|
Príprava testovacích fliaš
|
21.
|
Vykonajte všetky potrebné úpravy vrátane zretia a predúpravy morskej vody pri zvolenej testovacej teplote 15 – 20 °C, pričom zabezpečte čistotu, ale nie sterilnosť, všetkého skla.
|
|
22.
|
Pripravte skupiny fliaš na stanovenie BSK testovanej a referenčnej látky v sérii súbežných pokusov. Všetky analýzy vykonajte v duplicitných fľašiach (slepé vzorky, referenčná a testovaná látka), t. j. pripravte dve fľaše pre každé stanovenie. Analýzy vykonajte minimálne v 0., 5., 15. a 28. deň (štyri stanovenia). Na účely analýz kyslíka si štyri stanovenia vyžadujú celkovo 3 × 2 × 4 = 24 fliaš (slepá vzorka, referenčná a testovaná látka), a teda približne 8 litrov testovacieho média (na jednu koncentráciu testovanej látky).
|
|
23.
|
Pripravte samostatné roztoky testovanej a referenčnej látky vo veľkých fľašiach s dostatočným objemom (bod 11) tak, že najskôr pridáte testovanú a referenčnú látku do čiastočne naplnených veľkých fliaš buď priamo, alebo prostredníctvom koncentrovaného zásobného roztoku. Pridajte ďalšie testovacie médium, aby sa dosiahli požadované konečné koncentrácie. Ak sa používajú zásobné roztoky testovanej a/alebo referenčnej látky, zabezpečte, aby sa výrazne nezmenila slanosť média morskej vody.
|
|
24.
|
Koncentrácie testovanej a referenčnej látky zvoľte s ohľadom na:
|
a)
|
rozpustnosť rozpusteného kyslíka v morskej vode pri použitej testovacej teplote a slanosti (pozri priložený nomogram – dodatok 4);
|
|
b)
|
hodnotu BSK morskej vody v slepej vzorke a
|
|
c)
|
očakávanú biodegradovateľnosť testovanej látky.
|
|
|
25.
|
Pri teplotách 15 °C a 20 °C a slanosti 32 promile (oceánska voda) je rozpustnosť rozpusteného kyslíka približne 8,1, resp. 7,4 mg/l. Ak sa morská voda nenechá zrieť, spotreba kyslíka samotnej morskej vody (spotreba kyslíka v slepej vzorke) môže byť 2 mg O2/l alebo vyššia. Preto s cieľom zabezpečiť značnú koncentráciu kyslíka, ktorý zostane po oxidácii testovanej látky, použite počiatočnú koncentráciu testovanej látky približne 2 – 3 mg/l (v závislosti od hodnoty ThOD) pre látky, pri ktorých sa očakáva, že sa úplne degradujú za podmienok testu (napr. referenčné látky). Menej degradovateľné látky testujte pri vyšších koncentráciách až do približne 10 mg/l za predpokladu, že sa neprejavia toxické účinky. Môže byť výhodné vykonať súbežné testy s nízkou (približne 2 mg/l) a vysokou (približne 10 mg/l) koncentráciou testovanej látky.
|
|
26.
|
Súbežne sa musí stanoviť kyslíková slepá vzorka vo fľašiach bez testovanej alebo referenčnej látky.
|
|
27.
|
Ak sa majú stanoviť inhibičné účinky, pripravte túto sériu roztokov v samostatných veľkých fľašiach (bod 13):
|
a)
|
2 mg na liter ľahko degradovateľnej látky, napr. ktorejkoľvek z uvedených referenčných látok;
|
|
b)
|
x mg na liter testovanej látky (x je zvyčajne 2);
|
|
c)
|
2 mg na liter ľahko degradovateľnej látky plus x mg na liter testovanej látky.
|
|
Fyzikálno-chemický kontrolný test (voliteľný)
|
28.
|
Ak sa využije možnosť špecifických analýz, možno vykonať fyzikálno-chemický pokus na kontrolu, či sa testovaná látka eliminuje abiotickými mechanizmami, napr. hydrolýzou alebo adsorpciou. Fyzikálno-chemický kontrolný test možno vykonať pridaním chloridu ortutnatého (HgCl2) (33) (50 – 100 mg/l) do duplicitných baniek s testovanou látkou, aby sa zastavila mikrobiálna činnosť. Významný pokles koncentrácie konkrétnej látky v priebehu testu nasvedčuje existencii mechanizmov abiotickej eliminácie.
|
Počet fliaš na meranie BSK v typickom teste
|
29.
|
V typickom teste sa použijú tieto fľaše:
|
—
|
aspoň osem fliaš obsahujúcich testovanú látku,
|
|
—
|
aspoň osem fliaš obsahujúcich len morskú vodu obohatenú živinami,
|
|
—
|
aspoň osem fliaš obsahujúcich referenčnú látku a podľa potreby
|
|
—
|
šesť fliaš obsahujúcich testovanú a referenčnú látku (kontrola toxicity).
|
|
POSTUP
|
30.
|
Po príprave ihneď odčerpajte každý roztok zo spodnej štvrtiny (nie z dna) príslušnej veľkej fľaše a naplňte príslušnú skupinu fliaš na meranie BSK. Ihneď analyzujte nulové kontrolné vzorky (v čase nula) z hľadiska rozpusteného kyslíka (bod 33) alebo ich uchovajte na neskoršiu chemickú analýzu vyzrážaním s MnCl2 (chlorid mangánatý) a NaOH (hydroxid sodný).
|
|
31.
|
Inkubujte zvyšné paralelné fľaše na meranie BSK pri testovacej teplote (15 – 20 °C) v tme. Vo vhodných časových intervaloch (napr. po 5., 15. a 28. dni ako minimum) vyberte fľaše z inkubácie a analyzujte rozpustený kyslík (bod 33).
|
|
32.
|
Špecifické analýzy vzoriek (voliteľné) vykonajte s použitím membránového filtra (0,2 – 0,45 μm) alebo odstredenia počas 15 minút. Ak sa vzorky neanalyzujú ihneď, skladujte maximálne 48 hodín pri teplote 2 – 4 °C alebo dlhšie pri teplote –18 °C (ak je známe, že to nebude mať vplyv na testovanú látku, pred uskladnením roztok okyslite na pH 2).
|
Stanovenie rozpusteného kyslíka
|
33.
|
Stanovte koncentráciu rozpusteného kyslíka chemickou alebo elektrochemickou metódou, ktorá je uznaná na vnútroštátnej alebo medzinárodnej úrovni.
|
ÚDAJE A PODÁVANIE SPRÁV
Spracovanie výsledkov
|
34.
|
Analytické výsledky zaznamenajte do priložených kariet údajov (dodatok 5).
|
|
35.
|
Vypočítajte BSK ako rozdiel v spotrebe kyslíka medzi slepou vzorkou a roztokom testovanej látky za podmienok testu. Vydeľte čistú spotrebu kyslíka koncentráciou (hmotnosť/objem) látky s cieľom vyjadriť hodnotu BSK ako mg BSK/mg testovanej látky. Degradácia je vymedzená ako pomer biochemickej spotreby kyslíka buď k teoretickej spotrebe kyslíka (ThOD), ak je to možné, alebo k chemickej spotrebe kyslíka (ChSK) a je vyjadrená ako percento (pozri bod 36).
|
|
36.
|
Vypočítajte hodnoty biodegradácie v každom čase odberu vzoriek pre testovanú i referenčnú látku pomocou jednej z týchto rovníc:


kde:
|
ThOD
|
=
|
teoretická spotreba kyslíka (výpočet v dodatku 3),
|
|
ChSK
|
=
|
chemická spotreba kyslíka, stanovená experimentálne.
|
Poznámka: Niekedy sa týmito dvoma spôsobmi výpočtu (percento ThOD alebo percento ChSK) nezískajú rovnaké výsledky. Odporúča sa použiť metódu ThOD, lebo niektoré látky sa v teste ChSK úplne neoxidujú.
|
|
37.
|
Priebeh testu degradácie graficky znázornite v diagrame (pozri príklad v oddiele ‚Validita a interpretácia výsledkov‘). Ak máte dostatok údajov, vypočítajte z biodegradačnej krivky lag fázu (tL) a čas potrebný na dosiahnutie 50 % eliminácie od konca lag fázy (t50).
|
|
38.
|
Ak sa použije špecifická analýza (voliteľná), uveďte percento primárnej degradácie ako percento eliminácie špecifickej látky v rámci testovacieho obdobia (s korekciou vzhľadom analytické slepé vzorky).
|
Protokol o skúške
|
39.
|
Protokol o skúške musí obsahovať tieto informácie:
|
|
Testovaná látka:
|
—
|
fyzikálny charakter a v prípade potreby fyzikálno-chemické vlastnosti,
|
|
|
|
Podmienky testu:
|
—
|
umiestnenie a opis miesta odberu vzoriek: stav znečistenia a živín (počet kolónií, dusičnany, amóniové ióny, fosforečnany, ak je to vhodné),
|
|
—
|
charakteristiky vzorky [dátum odberu vzorky, hĺbka, vzhľad, teplota, slanosť, DOC (voliteľné), čas medzi odberom a použitím v teste],
|
|
—
|
použitá metóda zretia morskej vody (ak sa použije),
|
|
—
|
metóda použitá na predúpravu (filtrácia/sedimentácia) morskej vody,
|
|
—
|
metóda použitá na stanovenie ChSK (ak sa vykonáva),
|
|
—
|
metóda použitá na merania kyslíka,
|
|
—
|
postup disperzie pre látky, ktoré sú slabo rozpustné za testovacích podmienok,
|
|
—
|
metóda použitá na určenie počtu heterotrofov v morskej vode (metóda počítania na miske alebo alternatívny postup),
|
|
—
|
metóda použitá na stanovenie DOC v morskej vode (voliteľné),
|
|
—
|
metóda použitá na špecifickú analýzu (voliteľné),
|
|
—
|
iné voliteľné metódy použité na stanovenie vlastností morskej vody (merania ATP atď.).
|
|
|
|
Výsledky:
|
—
|
analytické údaje uvedené na karte údajov (priloženej v dodatku 5),
|
|
—
|
priebeh testu degradácie graficky znázornený v diagrame zobrazujúcom lag fázu (tL), sklon a čas (od konca lag fázy) na dosiahnutie 50 % konečnej spotreby kyslíka spôsobenej oxidáciou testovanej látky (t50); lag fázu možno graficky odhadnúť podľa pripojeného obrázka alebo jednoducho uviesť ako čas potrebný na 10 % degradáciu,
|
|
—
|
percentuálna degradácia odmeraná po 28 dňoch.
|
|
|
Validita a interpretácia výsledkov
|
40.
|
Spotreba kyslíka v slepej vzorke by nemala presiahnuť 30 % kyslíka v testovacej fľaši. Ak nie je možné splniť toto kritérium s použitím čerstvo odobratej morskej vody, morská voda sa pred použitím musí nechať vyzrieť (stabilizovať).
|
|
41.
|
Treba zohľadniť možnosť, že výsledky môžu ovplyvniť látky obsahujúce dusík.
|
|
42.
|
Výsledky získané použitím referenčných látok benzoanu sodného a anilínu by mali byť porovnateľné s výsledkami získanými v kruhovom teste (3) (bod 9). Ak sú výsledky získané s použitím referenčných látok atypické, test by sa mal zopakovať s použitím inej vzorky morskej vody.
|
|
43.
|
Testovaná látka sa môže považovať za inhibujúcu pre baktérie (pri použitej koncentrácii), ak je hodnota BSK zmesi a referenčnej a testovanej látky nižšia než súčet hodnôt BSK pre samostatné roztoky týchto dvoch látok.
|
|
44.
|
Vzhľadom na pomerne vysoké použité testované koncentrácie v porovnaní s väčšinou prírodných systémov (a teda nepriaznivý pomer medzi koncentráciami testovaných látok a iných zdrojov uhlíka) sa metóda má považovať za predbežnú skúšku, ktorú možno použiť na stanovenie, či látka je alebo nie je ľahko biodegradovateľná. V súlade s tým ani nízky výsledok nemusí nutne znamenať, že testovaná látka nie je biodegradovateľná v morskom prostredí, ale poukazuje na to, že na stanovenie tejto skutočnosti je potrebné vykonať ďalší výskum.
Na nasledujúcom obrázku je uvedený príklad teoretického pokusu s degradáciou, ktorý znázorňuje uskutočniteľný spôsob odhadu hodnôt tL (dĺžka ‚lag fázy‘) a t50, teda časového intervalu (začínajúceho pri tL) potrebného na dosiahnutie 50 % konečnej spotreby kyslíka spôsobenej oxidáciou testovanej látky:

|
LITERATÚRA
|
1.
|
de Kreuk J.F. a Hanstveit A.O. (1981). Determination of the biodegradability of the organic fraction of chemical wastes. Chemosphere, 10 (6); 561 – 573.
|
|
2.
|
Kapitola C.4 B tejto prílohy: Stanovenie ‚ľahkej‘ biodegradovateľnosti, časť III modifikovaný skríningový test OECD.
|
|
3.
|
Nyholm N. a Kristensen P. (1987). Screening Test Methods for Assessment of Biodegradability of Chemical Substances in Seawater. Final Report of the ring test programme 1984-1985, marec 1987, Komisia Európskych spoločenstiev.
|
|
4.
|
Kapitola C.11 tejto prílohy: Biodegradácia – respiračno-inhibičný test aktivovaného kalu.
|
|
5.
|
Kapitola C.4 E tejto prílohy: Stanovenie ľahkej biodegradovateľnosti, časť VI test v uzavretej fľaši.
|
Dodatok 1
Stanovenie organického uhlíka v morskej vode
METÓDA TREPAČKOVEJ BANKY
Na stanovenie obsahu organického uhlíka vo vzorke vody sa organické zlúčeniny vo vzorke oxidujú na oxid uhličitý zvyčajne pomocou jednej z týchto troch metód:
|
—
|
oxidáciou za mokra pomocou persíranu/UV ožarovania,
|
|
—
|
oxidáciou za mokra pomocou persíranu/zvýšenej teploty (116 – 130 °C),
|
Uvoľnený CO2 sa kvantifikuje pomocou infračervenej spektrometrie alebo titrimetrie. Alternatívne sa CO2 redukuje na metán, ktorý sa kvantifikuje na plameňovo-ionizačnom detektore (FID).
Metóda využívajúca persíran/UV ožarovanie sa bežne používa na analýzu ‚čistej‘ vody s nízkym obsahom tuhých častíc. Posledné dve metódy možno uplatniť na väčšinu druhov vzoriek vody, pričom metóda oxidácie pomocou persíranu/zvýšenej teploty je najvhodnejšia pre vzorky s nízkou koncentráciou a metódu spaľovania možno použiť na vzorky s obsahom neprchavého organického uhlíka (NVOC) výrazne vyšším ako 1 mg C/l.
Interferencie
Všetky tri metódy sú závislé od eliminácie alebo kompenzácie anorganického uhlíka (IC) prítomného vo vzorke. Odstránenie CO2 z okyslenej vzorky je najčastejšie používanou metódou eliminácie IC, hoci to vedie aj k strate prchavých organických zlúčenín (1). V každej matrici vzorky sa musí zabezpečiť úplná eliminácia alebo kompenzácia IC a okrem hodnoty NVOC sa musí stanoviť aj obsah prchavého organického uhlíka (VOC) v závislosti od druhu vzorky.
Vysoké koncentrácie chloridu vedú k zníženiu oxidačnej účinnosti pomocou metódy persíranu/UV ožarovania (2). Túto interferenciu však možno odstrániť použitím oxidačného činidla upraveného pridaním dusičnanu ortutnatého. Odporúča sa, aby sa na vyhodnotenie každého druhu vzorky obsahujúcej chlorid použil maximálny prípustný objem vzorky. Vysoké koncentrácie solí vo vzorke analyzovanej metódou spaľovania môžu spôsobiť soľný povlak na katalyzátore a nadmernú koróziu spaľovacej trubice. Mali by sa prijať preventívne opatrenia podľa príručky výrobcu.
Veľmi zakalené vzorky, ako aj vzorky obsahujúce tuhé častice, sa pri použití metódy persíranu/UV ožarovania nemusia úplne oxidovať.
Príklad vhodnej metódy
Neprchavý organický uhlík sa stanoví metódou persíranu/UV ožarovania a následnou kvantifikáciou uvoľneného CO2 pomocou nedisperznej infračervenej spektrometrie.
Oxidačné činidlo sa upraví v súlade s odporúčaniami uvedenými v literatúre (2) podľa príručky výrobcu:
|
a)
|
8,2 g HgCl2 a 9,6 g Hg(NO3)2
.H2O sa rozpustí v niekoľkých stovkách mililitrov reagenčnej vody s nízkou koncentráciou uhlíka;
|
|
b)
|
20 g K2S2O8 sa rozpustí v soľnom roztoku ortuti;
|
|
c)
|
do zmesi sa pridá 5 ml HNO3 (konc.);
|
|
d)
|
reaktant sa zriedi na 1 000 ml.
|
Interferencia chloridu sa odstráni pomocou objemu vzorky 40 μl pre 10 % chloridu a objemu vzorky 200 μl pre 1,9 % chloridu. Vzorky s vysokou koncentráciou chloridu a/alebo väčším objemom možno touto metódou analyzovať za predpokladu, že sa zabráni hromadeniu chloridu v oxidačnej nádobe. Následne sa podľa možnosti môže pre daný druh vzorky vykonať stanovenie prchavého organického uhlíka.
LITERATÚRA
|
1.
|
ISO, Water quality – determination of total organic carbon. Draft International Standard ISO/DIS 8245, 16. január 1986.
|
|
2.
|
American Public Health Association, Standard Methods for the Estimation of Water and Wastewater. American Water Works Association & Water Pollution Control Federation, 16th edition, 1985.
Tiež relevantné (poskytuje opis systému autoanalýzy):
|
|
3.
|
Schreurs W. (1978). An automated colorimetric method for the determination of dissolved organic carbon in seawater by UV destruction. Hydrobiological Bulletin 12, 137 – 142.
|
Dodatok 2
Biodegradácia v morskej vode
METÓDA TREPAČKOVEJ BANKY
KARTA ÚDAJOV
|
3.
|
TESTOVANÁ LÁTKA:
Názov:
|
Koncentrácia zásobného roztoku:
|
mg/l ako látka
|
|
Počiatočná koncentrácia v médiu, to:
|
mg/l ako látka
|
|
:
|
mg DOC/l
|
|
|
4.
|
MORSKÁ VODA:
Zdroj:
Dátum odberu:
Hĺbka odberu:
Vzhľad v čase odberu (napr. zakalená atď.):
|
Slanosť pri odbere:
|
‰
|
|
Teplota pri odbere:
|
°C
|
|
DOC ‚x‘ hodín po odbere:
|
mg/l
|
Predúprava pred testovaním (napr. filtrácia, sedimentácia, zretie atď.):
|
Počet mikrobiálnych kolónií
|
|
kolónií/ml
|
|
|
|
kolónií/ml
|
|
Ďalšie vlastnosti:
|
|
|
|
|
5.
|
STANOVENIE UHLÍKA:
Analyzátor uhlíka:
|
|
Banka č.
|
|
DOC po n dňoch (mg/l)
|
|
0
|
n1
|
n2
|
n3
|
nx
|
|
Test: morská voda obohatená živinami s testovanou látkou
|
1
|
a1
|
|
|
|
|
|
|
a2
|
|
|
|
|
|
|
priemer, Ca(t)
|
|
|
|
|
|
|
2
|
b1
|
|
|
|
|
|
|
b2
|
|
|
|
|
|
|
priemer, Cb(t)
|
|
|
|
|
|
|
Slepá vzorka: morská voda obohatená živinami bez testovanej látky
|
1
|
c1
|
|
|
|
|
|
|
c2
|
|
|
|
|
|
|
priemer, Cc(t)
|
|
|
|
|
|
|
2
|
d1
|
|
|
|
|
|
|
d2
|
|
|
|
|
|
|
priemer, Cd(t)
|
|
|
|
|
|
| priemer,

|
|
|
|
|
|
|
|
|
|
|
|
|
|
6.
|
VYHODNOTENIE ZÁKLADNÝCH ÚDAJOV:
|
Banka č.
|
Výpočet výsledkov
|
Degradácia v % po n dňoch
|
|
0
|
n1
|
n2
|
n3
|
nx
|
|
1
|

|
0
|
|
|
|
|
|
2
|

|
0
|
|
|
|
|
|
Priemer (34)
|

|
0
|
|
|
|
|
|
Poznámka:
|
Podobné formáty možno použiť aj vtedy, keď po degradácii nasleduje špecifická analýza, a na kontrolu referenčnej látky a toxicity.
|
|
|
7.
|
ABIOTICKÁ DEGRADÁCIA (voliteľné)
|
|
Čas (dni)
|
|
0
|
t
|
|
DOC konc. (mg/l) v sterilnej kontrole
|
Cs(o)
|
Cs(t)
|

|
Dodatok 3
Výpočet teoretickej biochemickej spotreby kyslíka
METÓDA UZAVRETEJ FĽAŠE
Hodnota ThOD látky CcHhClclNnNanaOoPpSs s molekulovou hmotnosťou MW sa vypočíta podľa tohto vzorca:
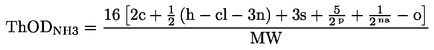
Tento výpočet znamená, že C sa mineralizuje na CO2, H na H2O, P na P2O5 a Na na Na2O. Halogén sa eliminuje ako halogénvodík a dusík ako amoniak.
Príklad:
Glukóza C6H12O6, MW = 180

Molekulové hmotnosti iných solí ako solí alkalických kovov sa vypočítajú na základe predpokladu, že soli boli hydrolyzované.
Predpokladá sa, že síra sa oxiduje do stavu + 6.
Príklad:
n-dodecylbenzénsulfonát sodný C18H29SO3Na, MW = 348

V prípade látok s obsahom dusíka sa dusík môže eliminovať ako amoniak, dusitan alebo nitrát podľa rôznych teoretických biochemických spotrieb kyslíka.


Predpokladajme, že v prípade sekundárneho amínu sa v analýze zistila úplná tvorba nitrátov:
(C12H25)2 NH, MW = 353

Dodatok 4

Dodatok 5
Biodegradácia v morskej vode
METÓDA UZAVRETEJ FĽAŠE
KARTA ÚDAJOV
|
3.
|
TESTOVANÁ LÁTKA:
Názov:
|
Koncentrácia zásobného roztoku:
|
mg/l
|
|
Počiatočná konc. v médiu morskej vody:
|
mg/l
|
|
ThOD alebo ChSK:
|
mg O2/mg testovanej látky
|
|
|
4.
|
MORSKÁ VODA:
Zdroj:
Dátum odberu:
Hĺbka odberu:
Vzhľad v čase odberu (napr. zakalená atď.):
|
Slanosť pri odbere:
|
‰
|
|
Teplota pri odbere:
|
°C
|
|
DOC ‚x‘ hodín po odbere:
|
mg/l
|
Predúprava pred testovaním (napr. filtrácia, sedimentácia, zretie atď.):
|
Počet mikrobiálnych kolónií
|
|
kolónií/ml
|
|
|
|
kolónií/ml
|
|
Ďalšie vlastnosti:
|
|
|
|
|
5.
|
TESTOVACIE MÉDIUM:
|
Teplota po prevzdušnení:
|
°C
|
|
Koncentrácia O2 po prevzdušnení a pred začiatkom testu:
|
mg O2/l
|
|
|
6.
|
STANOVENIE ROZPUSTENÉHO KYSLÍKA:
Metóda: Winklerova/elektródová
|
|
Banka č.
|
|
mg O2/l po n dňoch
|
|
0
|
5
|
15
|
28
|
|
Test: morská voda obohatená živinami s testovanou látkou
|
1
|
a1
|
|
|
|
|
|
2
|
a2
|
|
|
|
|
|
Priemer pre test
|

|
|
|
|
|
|
Slepá vzorka: živina – obohatená morská voda, ale bez testovanej látky
|
1
|
c1
|
|
|
|
|
|
2
|
c2
|
|
|
|
|
|
Priemer pre slepú vzorku
|

|
|
|
|
|
Poznámka: Podobný formát možno použiť na kontrolu referenčnej látky a toxicity.
|
|
7.
|
SPOTREBA ROZPUSTENÉHO KYSLÍKA: % DEGRADÁCIE ( % D):
|
|
Spotreba rozp. kyslíka po n dňoch
|
|
5
|
15
|
28
|
|
(mb
– mt
) (35)
|
|
|
|
|
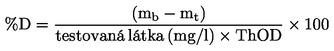
|
|
|
|
|
C.43. ANAERÓBNA BIODEGRADOVATEĽNOSŤ ORGANICKÝCH LÁTOK VO VYHNITOM KALE: MERANÍM TVORBY PLYNU
ÚVOD
|
1.
|
Táto testovacia metóda je rovnocenná s usmernením OECD na vykonávanie testov (TG) 311 (2006). Existuje množstvo skríningových testov na hodnotenie aeróbnej biodegradovateľnosti organických látok [testovacie metódy C.4, C.9, C.10 a C.11 (1) a usmernenie OECD TG 302C (2)] a výsledky ich uplatňovania sa úspešne používajú na predpovedanie osudu látok v aeróbnom prostredí, najmä v aeróbnych fázach čistenia odpadových vôd. Aeróbne sa spracúvajú aj rôzne podiely látok nerozpustných vo vode a látok, ktoré sa adsorbujú na splaškové tuhé látky, lebo sú prítomné v usadených splaškových vodách. Väčšie frakcie týchto látok sú viazané na primárny usadený kal, ktorý sa oddeľuje od nespracovanej splaškovej vody v usadzovacích nádržiach pred tým, ako sa usadené alebo supernatantné splaškové vody čistia aeróbne. Kal, ktorý obsahuje niektoré z rozpustných látok v intersticiálnej tekutine, potom prechádza do zahrievaných vyhnívacích nádrží, kde dochádza k anaeróbnemu čisteniu. Doteraz v tejto sérii neexistovali testy na vyhodnotenie anaeróbnej biodegradovateľnosti v anaeróbnych vyhnívacích nádržiach a tento test má túto medzeru vyplniť, nemusí však byť nevyhnutne použiteľný v iných zložkách životného prostredia bez kyslíka.
|
|
2.
|
Na vyhodnotenie anaeróbnej biodegradovateľnosti sa používajú respirometrické metódy merania množstva vytvoreného plynu, najmä metánu (CH4) a oxidu uhličitého (CO2) za anaeróbnych podmienok. Birch a kol. (3) preskúmali tieto postupy a dospeli k záveru, že najkomplexnejšia bola práca Sheltona a Tiedjeho (4) vychádzajúca z predchádzajúcich štúdií (5) (6) (7). Táto metóda (4), ktorú ďalej rozvinuli ďalší autori (8) a stala sa základom pre americké normy (9) (10), nevyriešila problémy týkajúce sa rozdielnych rozpustností CO2 a CH4 v testovacom médiu a výpočtu teoretickej tvorby plynu z testovanej látky. V správe ECETOC (3) sa odporúča ďalšie meranie obsahu rozpusteného anorganického uhlíka (DIC) v kvapalnom supernatante, čím sa táto metóda stala širšie použiteľnou. Metóda ECETOC prešla medzinárodnou kalibráciou (alebo kruhovým testom) a stala sa normou ISO 11734 (11).
|
|
3.
|
Táto testovacia metóda, ktorá je založená na norme ISO 11734 (11), opisuje skríningovú metódu na hodnotenie potenciálnej anaeróbnej biodegradovateľnosti organických látok za osobitných podmienok (t. j. v anaeróbnych vyhnívacích nádržiach v danom čase a rozsahu koncentrácie mikroorganizmov). Keďže zriedený kal sa používa v pomerne vysokej koncentrácii testovanej látky a trvanie testu je zvyčajne dlhšie ako retenčný čas v anaeróbnych vyhnívacích nádržiach, podmienky testu nemusia nevyhnutne zodpovedať podmienkam v anaeróbnych vyhnívacích nádržiach ani nie sú použiteľné na hodnotenie anaeróbnej degradácie organických látok v iných podmienkach životného prostredia. Kal sa vystaví testovanej látke najviac na 60 dní, čo je dlhšie ako bežný retenčný čas kalu (25 – 30 dní) v anaeróbnych vyhnívacích nádržiach, hoci v priemyselných čistiarňach môžu byť retenčné časy oveľa dlhšie. Predpovede podľa výsledkov tohto testu nie sú také presvedčivé ako v prípade aeróbnej biodegradácie. Získané dôkazy o správaní testovaných látok v ‚ľahkých‘ aeróbnych testoch a simulačných testoch a v aeróbnom prostredí sú totiž dostatočné na to, aby bolo možné presvedčivo tvrdiť, že medzi týmto správaním existuje spojenie. Len málo podobných dôkazov existuje v prípade anaeróbneho prostredia. Úplnú anaeróbnu degradáciu možno predpokladať vtedy, keď sa dosiahne 75 – 80 % teoretickej tvorby plynu. Vysoké podiely látky k biomase použité v týchto testoch znamenajú, že látka, ktorá prejde testom, sa s väčšou pravdepodobnosťou degraduje v anaeróbnej vyhnívacej nádrži. Ďalej platí, že látky, ktoré sa v teste nepremenia na plyn, sa nemusia nevyhnutne zachovať v realistickejšom životnom prostredí, pokiaľ ide o pomer látky a biomasy. Prebiehajú aj ďalšie anaeróbne reakcie, ktorými sa látky môžu aspoň čiastočne degradovať, napr. dechlorácia, ale v tomto teste sa tieto reakcie neodhalia. Uplatnením špecifických analytických metód na stanovenie testovanej látky však možno monitorovať jej elimináciu (pozri body 6, 30, 44 a 53).
|
PRINCÍP TESTU
|
4.
|
Premytý spracovaný kal (36) s nízkou (< 10 mg/l) koncentráciou anorganického uhlíka (IC) sa zriedi približne desaťnásobne tak, aby sa dosiahla celková koncentrácia tuhých látok 1 – 3 g/l, a inkubuje sa pri teplote 35 °C ± 2 °C v utesnených nádobách s testovanou látkou v koncentrácii 20 – 100 mg C/l maximálne 60 dní. Umožní sa meranie aktivity kalu, a to tak, že sa súbežne analyzujú slepé kontrolné vzorky s kalovým inokulom v médiu, ale bez testovanej látky.
|
|
5.
|
Odmeria sa zvýšenie tlaku v uzavretom priestore nad kvapalinou v nádobách v dôsledku tvorby oxidu uhličitého a metánu. Veľká časť vytvoreného CO2 sa za podmienok testu rozpustí v kvapalnej fáze alebo transformuje na uhličitan alebo hydrogénuhličitan. Tento anorganický uhlík sa odmeria na konci testu.
|
|
6.
|
Množstvo uhlíka (anorganického a metánu), ktoré vzniklo biodegradáciou testovanej látky, sa vypočíta z čistej tvorby plynu a čistej tvorby IC v kvapalnej fáze navyše oproti hodnotám v slepej kontrolnej vzorke. Rozsah biodegradácie sa vypočíta z celkového vytvoreného IC a uhlíka v metáne ako percento z nameraného alebo vypočítaného množstva uhlíka pridaného ako testovaná látka. V priebehu biodegradácie sa môžu vykonávať iba priebežné merania tvorby plynu. Špecifickými analýzami možno navyše stanoviť primárnu biodegradáciu na začiatku a na konci testu.
|
INFORMÁCIE O TESTOVANEJ LÁTKE
|
7.
|
Na správnu interpretáciu výsledkov je potrebné poznať čistotu, rozpustnosť vo vode, prchavosť a adsorpčné vlastnosti testovanej látky. Je potrebné poznať obsah organického uhlíka (hmotnostné percento) v testovanej látke buď podľa jej chemickej štruktúry, alebo na základe merania. V prípade prchavých testovaných látok je pri rozhodovaní o vhodnosti testu užitočná nameraná alebo vypočítaná Henryho konštanta. Pri výbere vhodnej testovanej koncentrácie a pri interpretácii výsledkov poukazujúcich na slabú biodegradovateľnosť sú užitočné informácie o toxicite testovanej látky pre anaeróbne baktérie. Pokiaľ nie je známe, že testovaná látka nemá na anaeróbnu mikrobiálnu činnosť inhibičné účinky, odporúča sa zahrnúť kontrolu inhibície [pozri bod 21 a normu ISO 13641-1 (12)].
|
UPLATNITEĽNOSŤ TESTOVACEJ METÓDY
|
8.
|
Testovaciu metódu možno použiť na látky rozpustné vo vode. Možno ju použiť aj na slabo rozpustné a nerozpustné látky za predpokladu, že sa použije metóda presného dávkovania [pozri napr. normu ISO 10634 (13)]. V prípade prchavých látok je vo všeobecnosti nutné rozhodovať sa v každom jednotlivom prípade osobitne. Môže byť potrebné prijať osobitné opatrenia, napríklad neuvoľňovať počas testu plyn.
|
REFERENČNÉ LÁTKY
|
9.
|
Na účely kontroly postupu sa súbežne so štandardným testovaním testuje aj referenčná látka s použitím vhodných nádob. Príkladmi sú fenol, benzoan sodný a polyetylénglykol 400, pri ktorých sa očakáva degradácia viac než 60 % teoretickej tvorby plynu (t. j. metánu a anorganického uhlíka) do 60 dní (3) (14).
|
REPRODUKOVATEĽNOSŤ VÝSLEDKOV TESTU
|
10.
|
V medzinárodnom kruhovom teste (14) sa dosiahla dobrá reprodukovateľnosť merania tlaku plynu medzi troma replikátmi nádob. Relatívna štandardná odchýlka (variačný koeficient, COV) bola väčšinou nižšia ako 20 %, hoci táto hodnota sa často zvýšila na > 20 % v prítomnosti toxických látok alebo ku koncu 60-dňového inkubačného obdobia. Väčšie odchýlky sa zistili aj v nádobách s objemom < 150 ml. Konečné hodnoty pH testovacieho média boli v rozmedzí 6,5 – 7,0.
|
|
11.
|
V kruhovom teste sa získali tieto výsledky:
|
Testovaná látka
|
Celkové údaje
n1
|
Priemerná degradácia
(z celkových údajov)
(%)
|
Relatívna štandardná odchýlka
(z celkových údajov)
(%)
|
Platné údaje
n2
|
Priemerná degradácia
(z platných údajov)
(%)
|
Relatívna štandardná odchýlka
(z platných údajov)
(%)
|
Údaje > 60 % degradácia v platných testoch
n3
|
|
Kyselina palmitová
|
36
|
68,7 ± 30,7
|
45
|
27
|
72,2 ± 18,8
|
26
|
19 = 70 % (37)
|
|
Polyetylén-glykol 400
|
38
|
79,8 ± 28,0
|
35
|
29
|
77,7 ± 17,8
|
23
|
24 = 83 % (37)
|
|
|
12.
|
Variačné koeficienty pre priemery všetkých hodnôt získaných s kyselinou palmitovou a polyetylénglykolom 400 boli až 45 % (n = 36), resp. 35 % (n = 38). Keď sa vylúčili hodnoty < 40 % a > 100 % (v prvom prípade sa predpokladá, že sú dôsledkom suboptimálnych podmienok, v druhom sú dôvody neznáme), hodnoty COV sa znížili na 26 %, resp. 23 %. Podiel ‚platných‘ hodnôt znamenajúcich aspoň 60 % degradáciu bol 70 % v prípade kyseliny palmitovej a 83 % v prípade polyetylénglykolu 400. Podiel percentuálnej biodegradácie odvodenej z meraní DIC bol pomerne nízky, ale variabilný. V prípade kyseliny palmitovej bol rozsah 0 – 35 %, priemer 12 % a hodnota COV 92 %, v prípade polyetylénglykolu 400 bol rozsah 0 – 40 %, priemer 24 % a hodnota COV 54 %.
|
OPIS TESTOVACEJ METÓDY
Prístroje
|
13.
|
Potrebné je bežné laboratórne vybavenie a toto:
|
a)
|
inkubátor – odolný proti elektrickému výboju a regulovaný na teplotu 35 °C ± 2 °C,
|
|
b)
|
sklenené testovacie nádoby odolné proti tlaku vhodnej nominálnej veľkosti (38), každá s plynotesnou priehradkou schopnou vydržať tlak približne 2 bary. Objem uzavretého priestoru nad kvapalinou by mal byť aspoň 10 – 30 % celkového objemu. Ak sa bioplyn uvoľňuje pravidelne, vhodný objem uzavretého priestoru nad kvapalinou je približne 10 %, ale ak sa plyn uvoľňuje len na konci testu, vhodný objem je 30 %. Keď sa tlak uvoľňuje v každom čase odberu vzoriek, odporúča sa použiť sklenené sérové fľaše s nominálnym objemom 125 ml, celkovým objemom približne 160 ml, utesnené sérovou priehradkou (39) a zahnutými hliníkovými krúžkami.
|
|
c)
|
zariadenie na meranie tlaku (40) prispôsobené tak, aby umožňovalo meranie a odvetrávanie vzniknutého plynu, napríklad ručný presný tlakomer pripojený k vhodnej injekčnej ihle. Trojcestný plynotesný ventil uľahčuje uvoľňovanie nadmerného tlaku (dodatok 1). Je nutné použiť hadičky a ventil snímača tlaku s čo najnižším vnútorným objemom, aby boli chyby vzniknuté zanedbaním objemu zariadenia zanedbateľné,
Poznámka – Hodnoty tlaku sa používajú priamo na výpočet množstva uhlíka vytvoreného v uzavretom priestore nad kvapalinou (body 42 až 44). Alternatívne možno hodnoty tlaku pomocou prevodového grafu previesť na objemy (pri teplote 35 °C a atmosférickom tlaku) vytvoreného plynu. Tento graf sa vytvorí z údajov získaných vstreknutím známych objemov plynného dusíka do série testovacích nádob (napr. sérových fliaš) pri teplote 35 ± 2 °, pričom sa zaznamenajú hodnoty vzniknutého stabilizovaného tlaku (pozri dodatok 2). Výpočet je uvedený v poznámke v bode 44.
Varovanie – dbajte na to, aby pri používaní mikrostriekačiek nedošlo k poraneniu ihlou.
|
|
d)
|
analyzátor uhlíka vhodný na priame stanovenie anorganického uhlíka v rozsahu od 1 mg/l do 200 mg/l,
|
|
e)
|
striekačky s vysokou presnosťou na plynné a kvapalné vzorky,
|
|
f)
|
magnetické miešadlá a miešadielka (voliteľné),
|
|
g)
|
rukavicový box (odporúčané).
|
|
Reaktanty
|
14.
|
Vždy sa používajú analyticky čisté reaktanty.
|
Voda
|
15.
|
Destilovaná alebo deionizovaná voda (odkysličená čerením plynným dusíkom obsahujúcim menej než 5 μl/l kyslíka), ktorá obsahuje menej než 2 mg/l rozpusteného organického uhlíka (DOC).
|
Testovacie médium
|
16.
|
Pripravte riediace médium tak, aby obsahovalo tieto zložky v uvedenom množstve:
|
Bezvodý dihydrogénfosforečnan draselný (KH2PO4)
|
0,27 g
|
|
Dodekahydrát hydrogénfosforečnanu disodného (Na2HPO4 · 12H2O))
|
1,12 g
|
|
Chlorid amónny (NH4Cl)
|
0,53 g
|
|
Dihydrát chloridu vápenatého (CaCl2· 2H2O)
|
0,075 g
|
|
Hexahydrát chloridu horečnatého (MgCl2 · 6H2O)
|
0,10 g
|
|
Tetrahydrát chloridu železnatého (FeCl2 · 4H2O)
|
0,02 g
|
|
Resazurín (indikátor kyslíka)
|
0,001 g
|
|
Nonahydrát sulfidu sodného (Na2S · 9H2O)
|
0,10 g
|
|
Zásobný roztok stopových prvkov (voliteľné, bod 18)
|
10 ml
|
|
Pridajte odkysličenú vodu (bod 15)
|
do 1 litra
|
Poznámka: Mal by sa použiť čerstvý sulfid sodný alebo by sa pred použitím mal premyť a vysušiť, aby mal dostatočnú redukčnú kapacitu. Test možno vykonať bez použitia rukavicového boxu (pozri bod 26). V takom prípade by sa konečná koncentrácia sulfidu sodného v médiu mala zvýšiť na 0,20 g Na2S · 9H2O na liter. Sulfid sodný sa môže pridať aj z vhodného anaeróbneho zásobného roztoku cez priehradku uzavretých testovacích nádob, lebo týmto postupom sa zníži riziko oxidácie. Sulfid sodný sa môže nahradiť citranom titanitým, ktorý sa pridáva cez priehradku uzavretých testovacích nádob v konečnej koncentrácii 0,8 – 1,0 mmol/l. Citran titanitý je vysoko účinné redukčné činidlo s nízkou toxicitou, ktoré sa pripravuje takto: Rozpustite 2,94 g dihydrátu citranu sodného v 50 ml odkysličenej vody (aby sa získal roztok 200 mmol/l) a pridajte 5 ml 15 % (hmotnosť/objem) roztoku chloridu titanitého. Neutralizujte anorganickými zásadami na pH 7 ± 0,2 a pridajte do vhodnej nádoby pod prúdom dusíka. Koncentrácia citranu titanitého v tomto zásobnom roztoku je 164 mmol/l.
|
|
17.
|
Zmiešajte zložky testovacieho média s výnimkou redukčného činidla (sulfid sodný alebo citran titanitý) a bezprostredne pred použitím čerte roztok plynným dusíkom asi 20 minút, aby sa odstránil kyslík. Potom bezprostredne pred použitím média pridajte vhodný objem čerstvo pripraveného roztoku redukčného činidla (pripraveného v odkysličenej vode). Podľa potreby upravte pH média zriedenou anorganickou kyselinou alebo zásadou na 7 ± 0,2.
|
Zásobný roztok stopových prvkov (voliteľné)
|
18.
|
Odporúča sa, aby testovacie médium obsahovalo tieto stopové prvky na zlepšenie procesov anaeróbnej degradácie, najmä ak sa používajú nízke koncentrácie (napr. 1 g/l) inokula (11).
|
Tetrahydrát chloridu manganatého (MnCl2 · 4H2O)
|
50 mg
|
|
Kyselina boritá (H3BO3)
|
5 mg
|
|
Chlorid zinočnatý (ZnCl2)
|
5 mg
|
|
Chlorid meďnatý (CuCl2)
|
3 mg
|
|
Dihydrát molybdénanu disodného (Na2MoO4 · 2H2O)
|
1 mg
|
|
Hexahydrát chloridu kobaltnatého (CoCl2 · 6H2O)
|
100 mg
|
|
Hexahydrát chloridu nikeltnatého (NiCl2 · 6H2O)
|
10 mg
|
|
Seleničitan disodný (Na2SeO3)
|
5 mg
|
|
Pridajte odkysličenú vodu (bod 15)
|
do 1 litra
|
|
Testovaná látka
|
19.
|
Pridajte testovanú látku ako zásobný roztok, suspenziu, emulziu alebo priamo ako tuhú alebo kvapalnú látku, alebo absorbovanú na filter zo sklených vlákien, aby sa dosiahla koncentrácia maximálne 100 mg/l organického uhlíka. Ak sa používajú zásobné roztoky, pripravte vhodný roztok vo vode (bod 15) (predtým odkysličenej čerením plynným dusíkom) takej sily, aby bol pridaný objem nižší ako 5 % celkového objemu reakčnej zmesi. Podľa potreby upravte pH zásobného roztoku na 7 ± 0,2. V prípade testovaných látok, ktoré sú nedostatočne rozpustné vo vode, si prečítajte normu ISO 10634 (13). Ak sa použije rozpúšťadlo, pripravte ďalšiu kontrolnú vzorku, v ktorej sa do inokulovaného média pridá len rozpúšťadlo. Nemali by sa používať organické rozpúšťadlá, o ktorých sa vie, že inhibujú tvorbu metánu, ako je chloroform a tetrachlórmetán.
Varovanie – s toxickými testovanými látkami a testovanými látkami, ktorých vlastnosti nie sú známe, zaobchádzajte opatrne.
|
Referenčné látky
|
20.
|
Na kontrolu postupu sa úspešne používajú referenčné látky ako benzoan sodný, fenol a polyetylénglykol 400, ktoré sa v priebehu 60 dní biodegradujú na viac ako 60 %. Pripravte zásobný roztok (v odkysličenej vode) zvolenej referenčnej látky rovnakým spôsobom ako v prípade testovanej látky a podľa potreby upravte pH na 7 ± 0,2.
|
Kontrola inhibície (podmienené)
|
21.
|
Na účely získania informácií o toxicite testovanej látky pre anaeróbne mikroorganizmy s cieľom nájsť najvhodnejšiu testovanú koncentráciu pridajte do nádoby obsahujúcej testovacie médium (pozri bod 16) testovanú látku a referenčnú látku v rovnakej koncentrácii, v akej sa pridáva v rámci samotného testu [pozri body 19 a 20 a normu ISO 13641-1 (12)].
|
Spracovaný kal
|
22.
|
Odoberte spracovaný kal z vyhnívacej nádrže v čistiarni odpadových vôd, ktorá spracúva prevažne odpadové vody z domácností. Kal by sa mal úplne charakterizovať a do správy by sa mali uviesť základné informácie o ňom (pozri bod 54). Ak sa zamýšľa použiť upravené inokulum, možno uvažovať o použití spracovaného kalu z čistiarne priemyselných splaškových vôd. Na odber spracovaného kalu použite fľaše so širokým hrdlom vyrobené z polyetylénu s vysokou hustotou alebo z podobného materiálu, ktorý sa môže rozširovať. Kal naplňte približne do 1 cm od horného okraja fliaš a hermeticky uzavrite, najlepšie bezpečnostným ventilom. Po preprave do laboratória možno odobratý kal priamo použiť alebo umiestniť do laboratórnej vyhnívacej nádrže. Nadmerné množstvo bioplynu uvoľnite opatrným otvorením fliaš s kalom. Prípadne možno ako zdroj inokula použiť anaeróbny kal vytvorený v laboratóriu, ale jeho spektrum aktivity môže byť narušené.
Varovanie – spracovaný kal vytvára horľavé plyny, ktoré predstavujú riziko vzniku požiaru a výbuchu. Obsahuje aj potenciálne patogénne organizmy, takže pri manipulácii s ním prijmite vhodné preventívne opatrenia. Z bezpečnostných dôvodov nepoužívajte na odber kalu sklenené nádoby.
|
|
23.
|
Možno uvažovať o predspracovaní kalu, aby sa znížila tvorba plynu v pozadí a obmedzil vplyv slepých kontrolných vzoriek. Ak sa vyžaduje predspracovanie, kal by sa mal nechať vyhnívať bez pridania živín alebo substrátov pri teplote 35 °C ± 2 °C maximálne sedem dní. Zistilo sa, že predspracovanie počas približne piatich dní zvyčajne vedie k optimálnemu poklesu tvorby plynu v slepej vzorke bez neprijateľného predĺženia lag fázy alebo inkubačného obdobia počas testovacej fázy alebo bez straty pôsobenia v prípade malého počtu testovaných látok.
|
|
24.
|
V prípade testovaných látok, ktoré sú alebo by mohli byť slabo biodegradovateľné, zvážte predexpozíciu kalu testovanej látke, aby sa získalo lepšie prispôsobené inokulum. V takom prípade pridajte testovanú látku s koncentráciou organického uhlíka 5 – 20 mg/l do spracovaného kalu a inkubujte až dva týždne. Pred použitím predexponovaný kal opatrne premyte (pozri bod 25) a do protokolu o skúške uveďte podmienky predexpozície.
|
Inokulum
|
25.
|
Bezprostredne pred použitím premyte kal (pozri body 22 až 24), aby sa koncentrácia IC v konečnej testovacej suspenzii znížila na menej ako 10 mg/l. Odstreďte kal v utesnených skúmavkách (napr. 3 000 g počas 5 minút) a odoberte supernatant. Suspendujte výslednú peletu v odkysličenom médiu (body 16 a 17), suspenziu znova odstreďte a odoberte supernatant. Ak sa hodnota IC dostatočne neznížila, postup premývania kalu možno zopakovať maximálne dvakrát. Zdá sa, že to nemá nepriaznivý vplyv na mikroorganizmy. Napokon peletu suspendujte v požadovanom objeme testovacieho média a stanovte celkovú koncentráciu tuhých látok [napr. ISO 11923 (15)]. Konečná celková koncentrácia tuhých látok v testovacích nádobách musí byť v rozsahu od 1 g/l do 3 g/l (alebo približne 10 % koncentrácie v nezriedenom spracovanom kale). Uvedené činnosti vykonajte tak, aby sa kal dostal do minimálneho kontaktu s kyslíkom (napr. s použitím dusíkatej atmosféry).
|
POSTUP TESTOVANIA
|
26.
|
Vykonajte nasledujúce úvodné postupy s využitím metód na udržanie čo najmenšieho možného kontaktu medzi spracovaným kalom a kyslíkom. Napríklad môže byť potrebné pracovať v rukavicovom boxe v dusíkatej atmosfére a/alebo prefúknuť fľaše dusíkom (4).
|
Príprava testovacích a kontrolných skúšok
|
27.
|
Pripravte aspoň tri replikáty testovacích nádob [pozri bod 13 písm. b)] pre komory s testovanou látkou, slepými kontrolnými vzorkami, referenčnou látkou, kontrolou inhibície (podmienené) a kontrolou tlaku (voliteľný postup) (pozri body 7, 19 až 21). Možno pripraviť aj ďalšie nádoby na účely hodnotenia primárnej biodegradácie pomocou špecifických analýz testovanej látky. Rovnaký súbor slepých kontrolných vzoriek možno použiť pre viaceré testované látky v tom istom teste, pokiaľ je objem uzavretého priestoru nad kvapalinou rovnaký.
|
|
28.
|
Pripravte zriedené inokulum a pridajte ho do nádob, napr. pomocou pipety so širokým otvorom. Alikvotné časti dobre premiešaného inokula (bod 25) pridávajte tak, aby koncentrácia tuhých látok bola vo všetkých nádobách rovnaká (medzi 1 g/l a 3 g/l). Pridajte zásobné roztoky testovanej a referenčnej látky, pričom podľa potreby najskôr upravte pH na 7 ± 0,2. Testovaná látka a referenčná látka by sa mali pridať s použitím najvhodnejšieho spôsobu pridania (bod 19).
|
|
29.
|
Testovaná koncentrácia organického uhlíka by zvyčajne mala byť medzi 20 a 100 mg/l (bod 4). Ak je testovaná látka toxická, testovaná koncentrácia by sa mala znížiť na 20 mg C/l alebo aj menej, ak sa má merať len primárna biodegradácia pomocou špecifických analýz. Treba poznamenať, že variabilita výsledkov testu sa zvyšuje pri nižších testovaných koncentráciách.
|
|
30.
|
V prípade slepých nádob pridajte namiesto zásobného roztoku, suspenzie alebo emulzie rovnocenné množstvo nosiča použitého na dávkovanie testovanej látky. Ak sa testovaná látka aplikovala pomocou filtrov zo sklených vlákien alebo organických rozpúšťadiel, pridajte do slepých nádob filter alebo rovnocenný objem odpareného rozpúšťadla. Pripravte navyše jeden replikát s testovanou látkou na odmeranie hodnoty pH. Podľa potreby upravte pH na 7 ± 0,2 pomocou malého množstva zriedenej anorganickej kyseliny alebo zásady. Do všetkých testovacích nádob sa má pridať rovnaké množstvo neutralizačného činidla. Nemalo by to však byť potrebné, lebo hodnota pH zásobných roztokov testovanej látky a referenčnej látky už bola upravená (pozri body 19 a 20). Ak sa má merať primárna biodegradácia, má sa odobrať vhodná vzorka z nádoby na kontrolu pH alebo z ďalšej testovacej nádoby a pomocou špecifických analýz sa má odmerať koncentrácia testovanej látky. Ak je potrebné reakčné zmesi premiešať, do všetkých nádob možno pridať zakryté magnety (voliteľné).
|
|
31.
|
Zabezpečte, aby boli celkový objem kvapaliny V1 a objem uzavretého priestoru nad kvapalinou Vh vo všetkých nádobách rovnaké. Hodnoty V1 a Vh si poznačte a uveďte do správy. Každá nádoba sa má utesniť plynotesnou priehradkou a preniesť z rukavicového boxu (pozri bod 26) do inkubátora [pozri bod 13 písm. a)].
|
Nerozpustné testované látky
|
32.
|
Priamo do pripravených nádob pridajte odvážené množstvá látok slabo rozpustných vo vode. Ak je potrebné použiť rozpúšťadlo (pozri bod 19), preneste roztok alebo suspenziu testovanej látky do prázdnych nádob. Ak je to možné, rozpúšťadlo nechajte odpariť zavedením plynného dusíka do nádob a potom pridajte ostatné zložky, teda zriedený kal (bod 25) a podľa potreby odkysličenú vodu. Je potrebné pripraviť aj doplnkovú kontrolnú vzorku s rozpúšťadlom (pozri bod 19). Ďalšie metódy pridávania nerozpustných látok nájdete v norme ISO 10634 (13). Kvapalné testované látky sa môžu pridávať striekačkou do úplne pripravených utesnených nádob, ak možno očakávať, že počiatočná hodnota pH nepresiahne 7 ± 1. V opačnom prípade použite postup opísaný vyššie (pozri bod 19).
|
Inkubácia a meranie tlaku plynu
|
33.
|
Inkubujte pripravené nádoby pri teplote 35 °C ± 2 °C počas približne 1 hodiny, aby sa dosiahol rovnovážny stav, a uvoľnite nadmerný plyn do atmosféry napríklad pretrepaním každej nádoby tak, že ihla tlakomera (bod 13) sa zavedie cez tesnenie a ventil sa otvorí, kým tlakomer neukáže nulu. Ak je v tejto fáze alebo pri uskutočňovaní priebežných meraní tlak v uzavretom priestore nad kvapalinou nižší ako atmosférický tlak, je potrebné zaviesť plynný dusík, aby sa atmosférický tlak obnovil. Zatvorte ventil [pozri bod 13 písm. c)] a pokračujte v inkubácii v tme, pričom zabezpečte, aby sa všetky časti nádob udržiavali pri teplote vyhnívania. Po inkubácii pozorujte nádoby počas 24 – 48 hodín. Nádoby vyraďte, ak má obsah nádob zreteľné ružové zafarbenie v supernatante, t. j., ak sa zmenila farba resazurínu (pozri bod 16), čo poukazuje na prítomnosť kyslíka (pozri bod 50). Hoci malé množstvo kyslíka je systém schopný tolerovať, vyššie koncentrácie môžu výrazne inhibovať priebeh anaeróbnej degradácie. Občasné vyradenie jednej nádoby zo súboru troch replikátov je prijateľné, ale v prípade výskytu viacerých takých prípadov je nutné preskúmať experimentálne postupy a zopakovať test.
|
|
34.
|
Opatrne premiešajte obsah každej nádoby miešaním alebo trasením počas niekoľkých minút aspoň dva- alebo trikrát za týždeň a krátko pred jednotlivými meraniami tlaku. Trasením sa inokulum resuspenduje a dosiahne sa rovnováha plynov. Všetky merania tlaku by sa mali vykonať rýchlo, lebo v testovacích nádobách môže dôjsť k zníženiu teploty, čo vedie k nesprávnym údajom. Počas merania tlaku sa má celá testovacia nádoba vrátane uzavretého priestoru nad kvapalinou udržiavať pri teplote vyhnívania. Tlak plynu odmerajte napríklad zavedením injekčnej ihly pripojenej k tlakomeru cez priehradku [bod 13 písm. c)]. Treba dávať pozor, aby sa do injekčnej ihly nedostala voda. Ak sa to stane, mokré časti sa musia vysušiť a musí sa nasadiť nová ihla. Tlak sa meria v milibaroch (pozri bod 42). Tlak plynu v nádobách sa môže merať pravidelne, napr. raz týždenne, a prebytok plynu sa môže uvoľniť do okolia. Alternatívne sa tlak meria len na konci testu na stanovenie množstva vytvoreného bioplynu.
|
|
35.
|
Odporúča sa vykonávať priebežné merania tlaku plynu, lebo zvýšenie tlaku poskytuje usmernenie o tom, kedy možno test ukončiť, a umožňuje sledovať kinetiku (pozri bod 6).
|
|
36.
|
Zvyčajne sa test ukončí po uplynutí inkubačného obdobia 60 dní, pokiaľ biodegradačná krivka získaná z meraní tlaku nedosiahla ešte predtým plató, teda stav, v ktorom sa dosiahla maximálna degradácia a biodegradačná krivka sa vyrovnala. Ak je hodnota plató nižšia ako 60 %, interpretácia je problematická, lebo to naznačuje, že sa mineralizovala iba časť molekuly alebo že došlo k chybe. Ak sa na konci zvyčajného inkubačného obdobia tvorí plyn, ale zjavne sa ešte nedosiahla fáza plató, treba zvážiť predĺženie testu na overenie, či sa dosiahne plató (> 60 %).
|
Meranie anorganického uhlíka
|
37.
|
Na konci testu po poslednom meraní tlaku plynu nechajte kal usadiť. Postupne otvorte všetky nádoby a ihneď odoberte vzorku na stanovenie koncentrácie (mg/l) anorganického uhlíka (IC) v supernatante. Supernatant sa nemá odstreďovať ani filtrovať, lebo by došlo k neprijateľnej strate rozpusteného oxidu uhličitého. Ak supernantant nemožno analyzovať ihneď po odbere, na maximálne dva dni ho uskladnite v utesnenej fľaštičke bez priestoru nad kvapalinou v chlade pri teplote 4 °C. Po odmeraní hodnoty IC odmerajte a zaznamenajte hodnotu pH.
|
|
38.
|
Alternatívne možno hodnotu IC v supernatante stanoviť nepriamo prostredníctvom uvoľnenia rozpusteného IC ako oxidu uhličitého, ktorý možno odmerať v uzavretom priestore nad kvapalinou. Po poslednom meraní tlaku plynu upravte tlak v každej testovacej nádobe na atmosférický tlak. Okyslite obsah každej nádoby približne na pH 1 pridaním koncentrovanej anorganickej kyseliny (napr. H2SO4) cez priehradku utesnených nádob. Za pretrepávania inkubujte nádoby pri teplote 35 °C ± 2 °C počas približne 24 hodín a tlakomerom odmerajte tlak plynu v dôsledku vzniknutého oxidu uhličitého.
|
|
39.
|
Podobné údaje získajte aj pre príslušné nádoby so slepou vzorkou, referenčnou látkou a kontrolou inhibície, ak sa použila (pozri bod 21).
|
|
40.
|
V niektorých prípadoch, najmä ak sa pre viaceré testované látky použijú rovnaké kontrolné nádoby, treba podľa potreby zvážiť merania priebežných koncentrácií IC v testovacích a kontrolných nádobách. V takom prípade sa má pripraviť dostatočný počet nádob na všetky priebežné merania. Tento postup sa uprednostňuje pred odobratím všetkých vzoriek iba z jednej nádoby. To možno urobiť len vtedy, keď sa požadovaný objem na analýzu DIC nepovažuje za príliš vysoký. Meranie DIC by sa malo uskutočniť po meraní tlaku plynu bez uvoľnenia prebytočného plynu podľa opisu ďalej:
|
—
|
striekačkou odoberte čo najmenší objem vzoriek supernatantu cez priehradku bez otvorenia nádob a stanovte hodnotu IC vzorky,
|
|
—
|
po odobratí vzorky sa prebytok plynu uvoľní alebo neuvoľní,
|
|
—
|
treba vziať do úvahy, že aj malé zníženie objemu supernatantu (napr. o 1 %) môže spôsobiť značné zvýšenie objemu plynu v uzavretom priestore nad kvapalinou (Vh),
|
|
—
|
rovnice (pozri bod 44) sa podľa potreby upravia zvýšením hodnoty Vh v rovnici 3.
|
|
Špecifické analýzy
|
41.
|
Ak sa má stanoviť primárna anaeróbna degradácia (pozri bod 30), na začiatku a na konci testu odoberte z nádob obsahujúcich testovanú látku vhodný objem vzorky na špecifické analýzy. V takom prípade majte na zreteli, že objem uzavretého priestoru nad kvapalinou (Vh) a objem kvapaliny (Vl) sa zmenia a zohľadnite to pri výpočte výslednej tvorby plynu. Alternatívne možno vzorky na špecifické analýzy odobrať z ďalších zmesí vopred pripravených na tento účel (bod 30).
|
ÚDAJE A PODÁVANIE SPRÁV
Spracovanie výsledkov
|
42.
|
Z praktických dôvodov sa tlak plynu meria v milibaroch (1 mbar = 1 h Pa = 102 Pa, 1 Pa = 1 N/m2), objem v litroch a teplota v stupňoch Celzia.
|
Uhlík v uzavretom priestore nad kvapalinou
|
43.
|
Keďže 1 mol metánu i 1 mol oxidu uhličitého obsahujú 12 g uhlíka, hmotnosť uhlíka v danom objeme uvoľneného plynu sa môže vyjadriť ako:
|
m= 12 × 103×n
|
Rovnica [1]
|
kde:
|
m
|
=
|
hmotnosť uhlíka (mg) v danom objeme uvoľneného plynu,
|
|
12
|
=
|
relatívna atómová hmotnosť uhlíka,
|
|
n
|
=
|
počet molov plynu v danom objeme.
|
Ak sa v značných množstvách tvorí iný plyn ako metán alebo oxid uhličitý (napr. N2O), vzorec [1] by sa mal upraviť tak, aby opisoval možnosť účinkov vytvorených plynov.
|
|
44.
|
Podľa zákonov o plynoch možno n vyjadriť ako:
|

|
Rovnica [2]
|
kde:
|
p
|
=
|
tlak plynu (pascaly),
|
|
V
|
=
|
objem plynu (m3),
|
|
R
|
=
|
molárna plynová konštanta [8,314 J/(mol K)],
|
|
T
|
=
|
inkubačná teplota (kelviny).
|
Kombináciou rovníc [1] a [2] a racionalizáciou s cieľom vyjadriť tvorbu plynu v slepej kontrolnej vzorke dostaneme:
|

|
Rovnica [3]
|
kde:
|
mh
|
=
|
hmotnosť čistého uhlíka vytvoreného ako plyn v uzavretom priestore nad kvapalinou (mg),
|
|
Δp
|
=
|
priemerný rozdiel medzi počiatočným a konečným tlakom v testovacích nádobách mínus príslušný priemer v slepých nádobách (milibary),
|
|
Vh
|
=
|
objem uzavretého priestoru nad kvapalinou v nádobe (l),
|
|
0,1
|
=
|
prevod pre newtony/m2 na milibary a pre m3 na litre.
|
Rovnica [4] by sa mala použiť pri normálnej inkubačnej teplote 35 °C (308 K):
|
mh
= 0,468(Δp·Vh
)
|
Rovnica [4]
|
Poznámka: Alternatívny výpočet objemu. Hodnoty na tlakomeri sa prevedú na ml vytvoreného plynu s použitím štandardnej krivky vytvorenej zakreslením vstreknutého objemu (ml) v závislosti od hodnoty na meracom prístroji (dodatok 2). Počet molov (n) plynu v uzavretom priestore nad kvapalinou v každej nádobe sa vypočíta vydelením kumulatívnej tvorby plynu (ml) číslom 25 286 ml/mol, čo je objem obsadený jedným molom plynu pri teplote 35 °C a štandardnom atmosférickom tlaku. Keďže 1 mol CH4 i 1 mol CO2 obsahujú 12 g uhlíka, množstvo uhlíka (mg) v uzavretom priestore nad kvapalinou (mh) je dané rovnicou [5]:
|
mh
= 12 × 103×n
|
Rovnica [5]
|
Racionalizácia s cieľom vyjadriť tvorbu plynu v slepej kontrolnej vzorke:
|

|
Rovnica [6]
|
kde:
|
mh
|
=
|
hmotnosť čistého uhlíka vytvoreného ako plyn v uzavretom priestore nad kvapalinou (mg),
|
|
ΔV
|
=
|
priemerný rozdiel medzi objemom plynu vytvoreným v uzavretom priestore nad kvapalinou v testovacích nádobách a slepých kontrolných nádobách,
|
|
25 286
|
=
|
objem obsadený 1 molom plynu pri teplote 35 °C a tlaku 1 atmosféra.
|
|
|
45.
|
Po biodegradácii možno podľa potreby vytvoriť graf kumulovaného zvýšenia tlaku Dp (milibary) v závislosti od času. Z tejto krivky identifikujte a zaznamenajte lag fázu (dni). Lag fáza je čas od začiatku testu do začiatku významnej degradácie (príklad nájdete v dodatku 3). Ak sa odoberali a analyzovali priebežné vzorky supernatantu (pozri body 40, 46 a 47), možno namiesto len kumulatívneho tlaku vytvoriť graf pre celkový vytvorený C (v plyne plus v kvapaline).
|
Uhlík v kvapaline
|
46.
|
Množstvo metánu v kvapaline sa neberie do úvahy, lebo je známe, že jeho rozpustnosť vo vode je veľmi nízka. Hmotnosť anorganického uhlíka v kvapaline v testovacích nádobách vypočítajte s použitím rovnice [7]:
kde:
|
ml
|
=
|
hmotnosť anorganického uhlíka v kvapaline (mg),
|
|
Cnet
|
=
|
koncentrácia anorganického uhlíka v testovacích nádobách mínus koncentrácia v kontrolných nádobách na konci testu (mg/l),
|
|
Vl
|
=
|
objem kvapaliny v nádobe (l).
|
|
Celkový splynovaný uhlík
|
47.
|
Celkovú hmotnosť splynovaného uhlíka v nádobe vypočítajte s použitím rovnice [8]:
kde:
|
|
mt
= celková hmotnosť splynovaného uhlíka (mg),
|
|
|
hodnoty mh
a ml
sú vymedzené vyššie.
|
|
Uhlík v testovanej látke
|
48.
|
Hmotnosť uhlíka v testovacích nádobách vytvoreného z pridanej testovanej látky vypočítajte s použitím rovnice [9]:
kde:
|
mv
|
=
|
hmotnosť uhlíka v testovanej látke (mg),
|
|
Cc
|
=
|
koncentrácia uhlíka v testovanej látke v testovacej nádobe (mg/l),
|
|
Vl
|
=
|
objem kvapaliny v testovacej nádobe (l).
|
|
Rozsah biodegradácie
|
49.
|
Vypočítajte percento biodegradácie z plynu v uzavretom priestore nad kvapalinou pomocou rovnice [10] a celkové percento biodegradácie pomocou rovnice [11]:
|
Dh
= (mh
/mv
) × 100
|
Rovnica [10]
|
|
Dt
= (mt
/mv
) × 100
|
Rovnica [11]
|
kde:
|
|
Dh
= biodegradácia z plynu v uzavretom priestore nad kvapalinou ( %),
|
|
|
Dt
= celková biodegradácia ( %),
|
|
|
hodnoty mh
, mv
a mt
sú vymedzené vyššie.
|
Množstvo primárnej biodegradácie sa vypočíta z (voliteľných) meraní koncentrácie testovanej látky na začiatku a konci inkubácie pomocou rovnice [12]:
|
Dp
= (1 –Se
/Si
) × 100
|
Rovnica [12]
|
kde:
|
Dp
|
=
|
primárna degradácia testovanej látky ( %),
|
|
Si
|
=
|
počiatočná koncentrácia testovanej látky (mg/l),
|
|
Se
|
=
|
koncentrácia testovanej látky na konci (mg/l).
|
Ak metóda analýzy naznačuje významné koncentrácie testovanej látky v neupravenom inokulu anaeróbneho kalu, použite rovnicu [13]:
|
Dp
1
= [1 – (Se
–Seb
)/(Si
–Sib
)] × 100
|
Rovnica [13]
|
kde:
|
Dp
1
|
=
|
upravená primárna degradácia testovanej látky ( %),
|
|
Sib
|
=
|
počiatočná ‚zjavná‘ koncentrácia testovanej látky v slepých kontrolných vzorkách (mg/l),
|
|
Seb
|
=
|
‚zjavná‘ koncentrácia testovanej látky v slepých kontrolných vzorkách na konci (mg/l).
|
|
Validita výsledkov
|
50.
|
Mali by sa použiť len hodnoty tlaku v nádobách, v ktorých sa neobjavilo ružové zafarbenie (pozri bod 33). Kontaminácia kyslíkom sa minimalizuje použitím vhodných metód manipulácie v anaeróbnom prostredí.
|
|
51.
|
Treba mať na zreteli, že test je platný, keď referenčná látka dosiahne plató predstavujúce viac ako 60 % biodegradáciu (41).
|
|
52.
|
Ak pH na konci testu prekročilo rozsah 7 ± 1 a došlo k nedostatočnej biodegradácii, zopakujte test so zvýšenou tlmivou kapacitou média.
|
Inhibícia degradácie
|
53.
|
Tvorba plynu v nádobách obsahujúcich testovanú látku i referenčnú látku by mala byť minimálne rovnaká ako v nádobách obsahujúcich iba referenčnú látku, inak to môže znamenať, že dochádza k inhibícii tvorby plynu. V niektorých prípadoch bude tvorba plynu v nádobách obsahujúcich testovanú látku bez referenčnej látky nižšia ako v slepých kontrolných nádobách, čo naznačuje, že testovaná látka má inhibujúci účinok.
|
Protokol o skúške
|
54.
|
Protokol o skúške musí obsahovať tieto informácie:
|
|
Testovaná látka:
|
—
|
bežný názov, chemický názov, číslo CAS, štruktúrny vzorec a relevantné fyzikálno-chemické vlastnosti,
|
|
—
|
čistota (nečistoty) testovanej látky.
|
|
|
|
Podmienky testu:
|
—
|
objem zriedenej kvapaliny vo vyhnívacej nádobe (Vl
) a objem uzavretého priestoru nad kvapalinou (Vh
) v nádobe,
|
|
—
|
opis testovacích nádob, hlavné charakteristiky merania bioplynu (napr. typ tlakomera) a analyzátora IC,
|
|
—
|
aplikácia testovanej látky a referenčnej látky do testovacieho systému: použitá testovaná koncentrácia a prípadné použitie rozpúšťadiel,
|
|
—
|
údaje o použitom inokule: názov čistiarne odpadových vôd, opis zdroja čistených odpadových vôd (napr. prevádzková teplota, retenčný čas kalu, prevažne odpadové vody z domácností atď.), koncentrácia, všetky informácie potrebné na odôvodnenie tohto postupu a informácie o prípadnej predúprave inokula (napr. predbežné vyhnívanie, predexpozícia),
|
|
|
|
Výsledky:
|
—
|
hodnoty pH a IC na konci testu,
|
|
—
|
koncentrácia testovanej látky na začiatku a konci testu, ak sa vykonalo špecifické meranie,
|
|
—
|
všetky namerané údaje získané v nádobách s testovanou látkou, slepou vzorkou, referenčnou látkou, prípadne kontrolou inhibície [napr. tlak v milibaroch, koncentrácia anorganického uhlíka (mg/l)] vo forme tabuľky (namerané údaje pre kvapalinu a uzavretý priestor nad kvapalinou sa majú uviesť samostatne),
|
|
—
|
štatistické spracovanie údajov, trvanie testu a graf biodegradácie testovanej látky, referenčnej látky a kontroly inhibície,
|
|
—
|
percento biodegradácie testovanej látky a referenčnej látky,
|
|
—
|
dôvody pre akékoľvek odmietnutie výsledkov testu,
|
|
|
LITERATÚRA
|
1.
|
Kapitoly tejto prílohy:
|
|
C.4, stanovenie ľahkej biodegradovateľnosti;
|
|
|
C.9, biodegradácia – Zahn-Wellensov test;
|
|
|
C.10, simulačný test – aeróbne čistenie odpadových vôd:
A: Jednotky s technológiou aktivovaného kalu, B: Biofilmy
|
|
|
C.11, biodegradácia – respiračno-inhibičný test aktivovaného kalu
|
|
|
2.
|
OECD (2009) Inherent Biodegradability: Modified MITI Test (II), OECD Guideline for Testing of Chemicals, No. 302C, OECD, Paríž
|
|
3.
|
Birch, R. R., Biver, C., Campagna, R., Gledhill, W.E., Pagga,U., Steber, J., Reust, H. a Bontinck, W.J. (1989) Screening of chemicals for anaerobic biodegradation. Chemosphere 19, 1527 – 1550. (publikované aj ako ECETOC Technical Report No. 28, jún 1988).
|
|
4.
|
Shelton D.R. a Tiedje, J.M. (1984) General method for determining anaerobic biodegradation potential. Appl. Environ. Mircobiology, 47, 850 – 857.
|
|
5.
|
Owen, W.F., Stuckey, DC., Healy J.B., Jr, Young L.Y. a McCarty, P.L. (1979) Bioassay for monitoring biochemical methane potential and anaerobic toxicity. Water Res. 13, 485 – 492.
|
|
6.
|
Healy, J.B.Jr. a Young, L.Y. (1979) Anaerobic biodegradation of eleven aromatic compounds to methane. Appl. Environ. Microbiol. 38, 84 – 89.
|
|
7.
|
Gledhill, W.E. (1979) Proposed standard practice for the determination of the anaerobic biodegradation of organic chemicals. Working document. Draft 2 no.35.24. American Society for Testing Materials, Philadelphia.
|
|
8.
|
Battersby, N.S. a Wilson, V. (1988) Evaluation of a serum bottle technique for assessing the anaerobic biodegradability of organic chemicals under methanogenic conditions. Chemosphere, 17, 2441 – 2460.
|
|
9.
|
E1192-92. Standard Test Method for Determining the Anaerobic Biodegradation Potential of Organic Chemicals. ASTM, Philadelphia.
|
|
10.
|
US-EPA (1998) Fate, Transport and Transformation Test Guidelines OPPTS 835.3400 Anaerobic Biodegradability of Organic Chemicals.
|
|
11.
|
International Organization for Standardization (1995) ISO 11 734 Water Quality – Evaluation of the ultimate anaerobic biodegradation of organic compounds in digested sludge – Method by measurement of the biogas production.
|
|
12.
|
International Organization for Standardization (2003) ISO 13 641-1 Water Quality – Determination of inhibition of gas production of anaerobic bacteria – Part 1 General Test.
|
|
13.
|
International Organization for Standardization (1995) ISO 10 634 Water Quality – Guidance for the preparation and treatment of poorly water-soluble organic compounds for the subsequent evaluation of their biodegradability in an aqueous medium.
|
|
14.
|
Pagga, U. a Beimborn, D.B., (1993) Anaerobic biodegradation test for organic compounds. Chemosphere, 27, 1499 – 1509.
|
|
15.
|
International Organization for Standardization (1997) ISO 11 923 Water Quality – Determination of suspended solids by filtration through glass-fibre filters.
|
Dodatok 1
Príklad prístroja na meranie tvorby bioplynu pomocou tlaku plynu

Legenda:
|
1
|
–
|
Tlakomer
|
|
2
|
–
|
Trojcestný plynotesný ventil
|
|
3
|
–
|
Injekčná ihla
|
|
4
|
–
|
Plynotesné tesnenie (zahnutý uzáver a priehradka)
|
|
5
|
–
|
Uzavretý priestor nad kvapalinou (Vh
)
|
|
6
|
–
|
Inokulum spracovaného kalu (Vl
)
|
Testovacie nádoby v prostredí s teplotou 35 °C ± 2 °C
Dodatok 2
Prevod hodnôt na tlakomeri
Hodnoty na tlakomeri možno dať do súvislosti s objemami plynu prostredníctvom štandardnej krivky vytvorenej vstreknutím známych objemov vzduchu pri teplote 35 °C ± 2 °C do sérových fliaš, ktoré obsahujú objem vody rovný objemu reakčnej zmesi V
R:
|
—
|
pridajte alikvotné časti vody V
R (ml) udržiavanej pri teplote 35 °C ± 2 °C do piatich sérových fliaš, utesnite fľaše a vložte ich na 1 hodinu do vodného kúpeľa pri teplote 35 °C, aby sa dosiahol rovnovážny stav,
|
|
—
|
zapnite tlakomer, nechajte ho stabilizovať a nastavte ho na nulu,
|
|
—
|
zaveďte injekčnú ihlu cez tesnenie jednej z fliaš, otvorte ventil a nechajte ho otvorený, kým na tlakomeri bude nula, a ventil zatvorte,
|
|
—
|
zopakujte postup so zvyšnými fľašami,
|
|
—
|
do každej fľaše vstreknite 1 ml vzduchu s teplotou 35 °C ± 2 °C. Zaveďte ihlu (na tlakomeri) cez tesnenie jednej z fliaš a nechajte hodnotu tlaku ustáliť. Zaznamenajte tlak, otvorte ventil a nechajte ho otvorený, kým na tlakomeri bude nula, a ventil zatvorte,
|
|
—
|
zopakujte postup so zvyšnými fľašami,
|
|
—
|
zopakujte uvedený postup s použitím objemov 2 ml, 3 ml, 4 ml, 5 ml, 6 ml, 8 ml, 10 ml, 12 ml, 16 ml, 20 ml a 50 ml vzduchu,
|
|
—
|
zostrojte prevodovú krivku tlaku (Pa) v závislosti od objemu vstreknutého plynu Vb (ml). Odpoveď prístroja je lineárna v rozsahu 0 – 70 000 Pa a 0 – 50 ml tvorby plynu.
|
Dodatok 3
Príklad degradačnej krivky (kumulatívne čisté zvýšenie tlaku)

Dodatok 4
Príklad kariet údajov pre test anaeróbnej degradácie – karta údajov pre testovanú látku
|
Laboratórium: …
|
Testovaná látka: …
|
Č. testu: …
|
|
Teplota testu (°C): …
|
Objem uzavretého priestoru nad kvapalinou (V
h): …(l)
|
Objem kvapaliny (V
l): …(l)
|
|
Uhlík v testovanej látke Cc,v: …(mg/l)
|
mv
(42): …(mg)
|
|
|
Deň
|
p
1 (test)
(mbar)
|
p
2 (test)
(mbar)
|
p
3 (test)
(mbar)
|
p (test)
priemer
(mbar)
|
p
4 (slepé)
(mbar)
|
p
5 (slepé)
(mbar)
|
p
6 (slepé)
(mbar)
|
p (slepé)
priemer
(mbar)
|
p (čisté)
test – slepé
priemer (mbar)
|
Δp (čisté)
kumulatívne
(mbar)
|
m
h
C v priest. nad kvap. (43)
(mg)
|
D
h
biodegradácia (44)
(%)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C
IC, 1
test
(mg)
|
C
IC, 2
test
(mg)
|
C
IC, 3
test
(mg)
|
C
IC
priemer testu
(mg)
|
C
IC, 4
slepé
(mg)
|
C
IC, 5
slepé
(mg)
|
C
IC, 6
slepé
(mg)
|
C
IC
priemer v slepej vzorke
(mg)
|
C
IC, net
test – slepé
priemer
(mg)
|
m
l
kvapalný C (45)
(mg)
|
m
t
celkový C (46)
(mg)
|
D
t
biodegradácia (47)
(%)
|
|
IC (koniec)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
pH (koniec)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Laboratórium: …
|
Referenčná látka: …
|
Č. testu: …
|
|
Teplota testu (°C): …
|
Objem uzavretého priestoru nad kvapalinou (V
h): …(l)
|
Objem kvapaliny (V
l) …(litre):
|
|
Uhlík v referenčnej látke C
c,v …(mg/l):
|
mv
(48)(mg):
|
|
|
Deň
|
p
1 (ref.)
(mbar)
|
p
2 (ref.)
(mbar)
|
p
3 (ref.)
(mbar)
|
p (ref.)
priemer
(mbar)
|
p
4 (inhib.)
(mbar)
|
p
5 (inhib.)
(mbar)
|
p
6 (inhib.)
(mbar)
|
p (inhib.)
priemer
(mbar)
|
p (ref.)
ref. – slepé
(mbar)
|
Δp (ref.)
kumulatívne
(mbar)
|
m
h
C v priest. nad kvap. (49)
(mg)
|
D
h
biodegradácia (50)
(%)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C
IC, 1
ref.
(mg)
|
C
IC, 2
ref.
(mg)
|
C
IC, 3
ref.
(mg)
|
C
IC
priemer ref.
(mg)
|
C
IC, 4
inhib.
(mg)
|
C
IC, 5
inhib.
(mg)
|
C
IC, 6
inhib.
(mg)
|
C
IC
priemer inhib.
(mg)
|
C
IC, net
ref. – inhib.
(mg)
|
m
l
kvapalný C (51)
(mg)
|
m
t
celkový C (52)
(mg)
|
D
t
biodegradácia (53)
(%)
|
|
IC (koniec)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
pH (koniec)
|
|
|
|
|
|
|
|
|
|
|
|
|
C.44. LÚHOVANIE V PÔDNYCH KOLÓNACH
ÚVOD
|
1.
|
Táto testovacia metóda je rovnocenná s usmernením OECD na vykonávanie testov (TG) 312 (2004). Syntetické chemikálie sa do pôdy môžu dostať priamo zámernou aplikáciou (napr. agrochemikálie) alebo nepriamymi cestami (napr. postupnosťou odpadové vody → splaškový kal → pôda alebo vzduch → mokré/suché skládkovanie). Z hľadiska posúdenia rizika týchto chemikálií je dôležité odhadnúť ich potenciál transformácie v pôde a pohybu (lúhovania) do hlbších vrstiev pôdy a napokon do podzemnej vody.
|
|
2.
|
K dispozícii je niekoľko metód na meranie potenciálu vylúhovania chemikálií v pôde pri riadených laboratórnych podmienkach, t. j. chromatografia na tenkej vrstve pôdy, chromatografia na hrubej vrstve pôdy, chromatografia v pôdnej kolóne a merania adsorpcie – desorpcie (1) (2). V prípade neionizovaných chemikálií možno použiť rozdeľovaciu konštantu n-oktanol – voda (Pow), ktorá umožňuje skorý odhad ich potenciálu adsorpcie a vylúhovania (3) (4) (5).
|
|
3.
|
Metóda opísaná v tejto testovacej metóde je založená na chromatografii v pôdnej kolóne s narušenou pôdou (vymedzenie pojmu pozri v dodatku 1). Uskutočnia sa dva druhy pokusov na stanovenie i) potenciálu vylúhovania testovanej chemikálie a ii) potenciálu vylúhovania produktov transformácie (štúdia s vyzretými rezíduami) v pôdach pri riadených laboratórnych podmienkach (54). Testovacia metóda je založená na existujúcich metódach (6) (7) (8) (9) (10) (11).
|
|
4.
|
Účastníci seminára OECD o výbere pôd/sedimentov, ktorý sa uskutočnil v roku 1995 v talianskom meste Belgirate (12), sa dohodli na počte a druhoch pôd, ktoré možno použiť v tejto testovacej metóde. Boli schválené aj odporúčania na odber vzoriek pôdy, manipuláciu s nimi a ich skladovanie pri pokusoch s lúhovaním.
|
PRINCÍP TESTOVACEJ METÓDY
|
5.
|
Kolóny vyrobené z vhodného inertného materiálu (napr. sklo, nehrdzavejúca oceľ, hliník, teflón, PVC atď.) sa naplnia pôdou, potom sa nasýtia a nechajú dosiahnuť rovnovážny stav s použitím roztoku ‚umelého dažďa‘ (vymedzenie pojmu pozri v dodatku 1). Následne sa nechajú odvodniť. Potom sa na povrch každej pôdnej kolóny aplikuje testovaná chemikália a/alebo vyzreté rezíduá testovanej chemikálie. Následne sa do pôdnych kolón aplikuje umelý dážď a odoberie sa výluh. Po procese lúhovania sa pôda vyberie z kolón a rozdelí na primeraný počet segmentov v závislosti od toho, aké informácie má štúdia priniesť. Každý segment pôdy a výluh sa potom analyzujú z hľadiska testovanej chemikálie a podľa potreby aj z hľadiska produktov transformácie alebo iných sledovaných chemikálií.
|
UPLATNITEĽNOSŤ TESTOVACEJ METÓDY
|
6.
|
Testovacia metóda sa uplatňuje na testované chemikálie (neoznačené alebo rádioaktívne označené, napr. uhlíkom14C), pre ktoré existuje analytická metóda s dostatočnou presnosťou a citlivosťou. Testovacia metóda by sa nemala uplatňovať na chemikálie, ktoré sú prchavé z pôdy a vody, teda nezostávajú v pôde a/ani vo výluhu pri experimentálnych podmienkach tejto testovacej metódy.
|
INFORMÁCIE O TESTOVANEJ CHEMIKÁLII
|
7.
|
Na meranie vyplavovania látky zo sedimentu v pôdnych kolónach možno použiť neoznačené alebo rádioaktívne označené testované chemikálie. Rádioaktívne označený materiál sa vyžaduje na skúmanie lúhovania produktov transformácie (vyzretých rezíduí testovanej chemikálie) a na stanovenie hmotnostnej bilancie. Odporúča sa značkovanie izotopom14C, ale užitočné môžu byť aj iné izotopy, napr.13C,15N,3H,32P. Značka by sa podľa možnosti mala umiestniť do najstabilnejšej časti (najstabilnejších častí) molekuly. Čistota testovanej chemikálie by mala byť aspoň 95 %.
|
|
8.
|
Väčšina chemikálií by sa mala aplikovať ako jedna látka. V prípade účinných látok v prípravkoch na ochranu rastlín však možno na skúmanie lúhovania východiskovej testovanej látky použiť aj zložené produkty. Ich testovanie je potrebné najmä v prípade, že sa predpokladá vplyv zmesi na rýchlosť uvoľňovania (napr. zrnité prípravky alebo prípravky s riadeným uvoľňovaním). Pokiaľ ide o osobitné požiadavky na koncepciu testu v prípade zmesí, môže byť užitočné poradiť sa pred vykonaním testu s regulačným orgánom. V prípade štúdií lúhovania vyzretých rezíduí by sa mala použiť čistá východisková testovaná látka.
|
|
9.
|
Pred vykonaním testov lúhovania v pôdnych kolónach by podľa možnosti mali byť k dispozícii tieto informácie o testovanej chemikálii:
|
1.
|
rozpustnosť vo vode [testovacia metóda A.6] (13);
|
|
2.
|
rozpustnosť v organických rozpúšťadlách;
|
|
3.
|
tlak pary [testovacia metóda A.4 ] (13) a Henryho konštanta;
|
|
4.
|
rozdeľovacia konštanta n-oktanol – voda [testovacie metódy A.8 a A.24] (13);
|
|
5.
|
adsorpčný koeficient (Kd, Kf alebo KOC) [testovacie metódy C.18 a/alebo C.19) (13);
|
|
6.
|
hydrolýza (testovacia metóda C.7) (13);
|
|
7.
|
disociačná konštanta (pKa) (usmernenie OECD TG 112) (25);
|
|
8.
|
aeróbna a anaeróbna transformácia v pôde (testovacia metóda C.23) (13).
|
Poznámka: Teplota, pri ktorej sa vykonali tieto merania, sa musí uviesť do príslušných protokoloch o skúške.
|
|
10.
|
Množstvo testovanej chemikálie aplikovanej do pôdnych kolón by malo byť dostatočné na zistenie aspoň 0,5 % aplikovanej dávky v jednotlivých segmentoch. V prípade účinných chemikálií v prípravkoch na ochranu rastlín môže množstvo aplikovanej testovanej chemikálie zodpovedať maximálnej odporúčanej dávke na použitie (jedna aplikácia).
|
|
11.
|
Musí byť k dispozícii vhodná analytická metóda na kvantifikáciu testovanej chemikálie a podľa potreby produktov jej transformácie v pôde a výluhu so známou správnosťou, presnosťou a citlivosťou. Mal by byť známy aj analytický detekčný limit testovanej chemikálie a významných produktov jej transformácie (zvyčajne aspoň všetkých produktov transformácie ≥10 % aplikovanej dávky pozorovanej v štúdiách spôsobov transformácie, ale podľa možnosti všetkých relevantných produktov transformácie) (pozri bod 17).
|
REFERENČNÉ CHEMIKÁLIE
|
12.
|
Na vyhodnotenie relatívnej mobility testovanej chemikálie v pôde by sa mali použiť referenčné chemikálie so známymi vlastnosťami lúhovania, ako sú atrazín alebo monurón, ktoré možno v teréne považovať za mierne lúhovacie látky (1) (8) (11). Na potvrdenie hydrodynamických vlastností pôdnej kolóny možno použiť aj nesorbčnú a nedegradovateľnú polárnu referenčnú chemikáliu (napr. trícium, bromid, fluoresceín, eozín), ktorou sa sleduje pohyb vody v kolóne.
|
|
13.
|
Užitočné môžu byť aj analytické štandardné chemikálie, ktoré možno použiť na charakterizáciu a/alebo identifikáciu produktov transformácie v pôdnych segmentoch a vo výluhoch chromatografickými, spektroskopickými alebo inými relevantnými metódami.
|
VYMEDZENIE POJMOV A JEDNOTKY
KRITÉRIÁ KVALITY
Výťažok
|
15.
|
Súčet percentuálnych podielov testovanej chemikálie v segmentoch pôdy a vo výluhu z kolóny po vylúhovaní predstavuje výťažok pokusu s lúhovaním. Výťažky by mali byť v rozpätí od 90 % do 110 % pre rádioaktívne označené chemikálie (11) a od 70 % do 110 % pre neoznačené chemikálie (8).
|
Opakovateľnosť a citlivosť analytickej metódy
|
16.
|
Opakovateľnosť analytickej metódy na kvantifikáciu testovanej chemikálie a produktov transformácie možno overiť duplikátnou analýzou rovnakého extraktu segmentu pôdy alebo výluhu (pozri bod 11).
|
|
17.
|
Detekčný limit (LOD) analytickej metódy pre testovanú chemikáliu a produkty transformácie by mal byť aspoň 0,01 mg · kg– 1 v každom segmente pôdy alebo výluhu (ako testovaná chemikália) alebo 0,5 % aplikovanej dávky v jednotlivých segmentoch podľa toho, ktorá hodnota je nižšia. Mal by sa stanoviť aj kvantifikačný limit (LOQ).
|
OPIS TESTOVACEJ METÓDY
Testovací systém
|
18.
|
V teste sa použijú lúhovacie kolóny (rozdeliteľné alebo nerozdeliteľné) vyrobené z vhodného inertného materiálu (napr. sklo, nehrdzavejúca oceľ, hliník, teflón, PVC atď.) s vnútorným priemerom najmenej 4 cm a minimálnou výškou 35 cm. Materiály kolóny by sa mali otestovať na možné vzájomné pôsobenie s testovanou chemikáliou a/alebo produktmi jej transformácie. Príklady vhodných rozdeliteľných a nerozdeliteľných kolón sú uvedené v dodatku 2.
|
|
19.
|
Na naplnenie a utlačenie pôdnych kolón sa používa lyžica, plunžer a vibračný prístroj.
|
|
20.
|
Na aplikovanie umelého dažďa do pôdnych kolón možno použiť piestové alebo peristaltické čerpadlá, sprchové hlavice, Mariottove fľaše alebo jednoduchý prikvapkávací lievik.
|
Laboratórne vybavenie a chemikálie
|
21.
|
Vyžaduje sa štandardné laboratórne vybavenie, najmä:
|
1.
|
analytické prístroje, napríklad zariadenia GLC, HPLC a TLC vrátane príslušných detekčných systémov na analyzovanie označených alebo neoznačených chemikálií alebo na inverznú metódu riedenia izotopov;
|
|
2.
|
prístroje na účely identifikácie (napr. MS, GC-MS, HPLC-MS, NMR atď.);
|
|
3.
|
kvapalinové scintilačné počítadlo na rádioaktívne označené chemikálie;
|
|
4.
|
oxidačné činidlo na spaľovanie označeného materiálu;
|
|
5.
|
extrakčný prístroj (napr. odstredivkové skúmavky na extrakciu za studena a Soxhletov prístroj na kontinuálnu extrakciu s refluxom);
|
|
6.
|
zariadenia na koncentrovanie roztokov a extraktov (napr. rotačná odparka).
|
|
|
22.
|
Medzi používané chemikálie patria: organické rozpúšťadlá analytickej čistoty, napr. acetón, metanol atď., scintilačná kvapalina, 0,01 M roztoku CaCl2 v destilovanej alebo deionizovanej vode (= umelý dážď).
|
Testovaná chemikália:
|
23.
|
Testovaná chemikália sa do pôdnej kolóny aplikuje rozpustená vo vode (deionizovanej alebo destilovanej). Ak je testovaná chemikália slabo rozpustná vo vode, možno ju aplikovať buď ako zložený produkt (podľa potreby po suspendovaní alebo emulgovaní vo vode), alebo v akomkoľvek organickom rozpúšťadle. Ak sa použije organické rozpúšťadlo, jeho množstvo by malo byť minimálne a malo by sa odpariť z povrchu pôdnej kolóny pred začiatkom lúhovania. Tuhé prípravky, napríklad granuly, by sa mali aplikovať v tuhej forme bez vody. Na dosiahnutie lepšej distribúcie na povrchu pôdnej kolóny možno zložený produkt pred aplikovaním zmiešať s malým množstvom kremenného piesku (napr. 1 g).
|
|
24.
|
Množstvo testovanej chemikálie aplikovanej do pôdnych kolón by malo byť dostatočné na zistenie aspoň 0,5 % aplikovanej dávky v jednotlivých segmentoch. V prípade účinných chemikálií v prípravkoch na ochranu rastlín to môže byť založené na maximálnej odporúčanej dávke na použitie (dávka pri jednej aplikácii), pričom v prípade lúhovania východiskovej chemikálie i vyzretého rezídua by sa malo vychádzať z plochy povrchu použitej pôdnej kolóny (55).
|
Referenčná chemikália
|
25.
|
V pokusoch s lúhovaním by sa mala použiť referenčná chemikália (pozri bod 12). Mala by sa aplikovať na povrch pôdnej kolóny podobným spôsobom ako testovaná chemikália a v primeranom množstve, ktoré umožní dostatočnú detekciu buď ako vnútorný štandard spolu s testovanou chemikáliou v tej istej pôdnej kolóne, alebo samostatne v osobitnej pôdnej kolóne. Vhodnejšie je, aby sa obidve chemikálie aplikovali do tej istej kolóny, okrem prípadov, keď sú obidve chemikálie podobne označené.
|
Pôdy
Výber pôdy
|
26.
|
V štúdiách s lúhovaním východiskovej testovanej chemikálie by sa mali použiť tri až štyri pôdy s rôznym pH, obsahom organického uhlíka a textúrou (12). Usmernenie na výber pôd na pokusy s lúhovaním je uvedené ďalej v tabuľke 1. V prípade ionizovateľných testovaných chemikálií by vybraté pôdy mali pokrývať široké rozpätie pH, aby bolo možné vyhodnotiť mobilitu chemikálie v ionizovanej i neionizovanej forme. Aspoň tri pôdy by mali mať pH, pri ktorom je testovaná chemikália v mobilnej forme.
Tabuľka 1
Usmernenie na výber pôd na štúdie s lúhovaním
|
Č. pôdy
|
Hodnota pH
|
Organický uhlík
%
|
Obsah ílu
%
|
Textúra (56)
|
|
1
|
> 7,5
|
3,5 – 5,0
|
20 – 40
|
ílovitá hlina
|
|
2
|
5,5 – 7,0
|
1,5 – 3,0
|
15 – 25
|
siltová hlina
|
|
3
|
4,0 – 5,5
|
3,0 – 4,0
|
15 – 30
|
hlina
|
|
4
|
< 4,0 – 6,0 (57)
|
< 0,5 – 1,5 (57)
(58)
|
< 10 – 15 (57)
|
hlinitý piesok
|
|
5
|
< 4,5
|
> 10 (59)
|
< 10
|
hlinitý piesok/piesok
|
|
|
27.
|
Iné druhy pôd môžu byť niekedy potrebné na zastúpenie chladnejších, miernych a tropických oblastí. Ak sa teda uprednostňujú iné druhy pôdy, musia sa charakterizovať rovnakými parametrami a mali by mať podobné odchýlky vo vlastnostiach ako pôdy opísané v usmernení na výber pôd na štúdie s lúhovaním (pozri tabuľku 1), aj keď presne nezodpovedajú kritériám.
|
|
28.
|
V štúdiách lúhovania s ‚vyzretými rezíduami‘ by sa mala použiť jedna pôda (12). Mala by mať obsah piesku > 70 % a obsah organického uhlíka 0,5 až 1,5 % (napr. pôda č. 4 v tabuľke 1). Použitie viacerých druhov pôd môže byť potrebné v prípade, keď dôležitú informáciu predstavujú údaje o produktoch transformácie.
|
|
29.
|
Všetky pôdy je potrebné charakterizovať aspoň z hľadiska textúry [ % piesku, % siltu, % ílu podľa klasifikačných systémov FAO a USDA (14)], pH, kapacity výmeny katiónov, obsahu organického uhlíka, sypnej hustoty (pre narušené pôdy) a kapacity retencie vody. Meranie mikrobiálnej biomasy sa vyžaduje len v prípade pôdy použitej v období zretia/v inkubačnom období pred pokusom s lúhovaním vyzretých rezíduí. Informácie o ďalších vlastnostiach pôdy (napr. klasifikácii pôdy, mineralógii ílu, špecifickej povrchovej ploche) môžu byť užitočné na interpretáciu výsledkov tejto štúdie. Na určenie vlastností pôdy možno použiť metódy odporúčané v literatúre (15) (16) (17) (18) (19).
|
Odber a skladovanie pôd
|
30.
|
Pôdy by sa mali odobrať z vrchnej vrstvy (horizontu A), ktorej hĺbka neprekračuje 20 cm. Je nutné odstrániť zvyšky vegetácie, makrofauny a kameňov. Pôdy (okrem tých, ktoré sa používajú na zretie testovanej chemikálie) sa vysušia vzduchom pri izbovej teplote (odporúča sa 20 – 25 °C). Disagregácia by sa mala vykonať s minimálnou silou, aby sa čo najmenej zmenila pôvodná textúra pôdy. Pôda sa preoseje cez sito s okami ≤ 2 mm. Odporúča sa opatrná homogenizácia, lebo sa tým zvyšuje reprodukovateľnosť výsledkov. Pred použitím možno pôdy skladovať pri teplote okolia a vysušené vzduchom (12). Neexistuje odporúčaný limit skladovania, ale pôdy, ktoré sa skladovali dlhšie než tri roky, by sa pred použitím mali znova analyzovať z hľadiska obsahu organického uhlíka a pH.
|
|
31.
|
Mali by byť dostupné podrobné informácie o histórii lokalít, z ktorých sa testované pôdy odobrali. Údaje zahŕňajú presnú polohu [presne vymedzenú súradnicami UTM (Universal Transversal Mercator-Projection/European Horizontal Datum) alebo zemepisnými súradnicami], vegetačnú pokrývku, aplikáciu chemikálií na ochranu plodín, aplikáciu organických a anorganických hnojív, pridanie biologických materiálov alebo náhodnú kontamináciu (12). Ak sa do pôdy v priebehu predchádzajúcich štyroch rokov aplikovala testovaná chemikália alebo jej štrukturálne analógy, nemala by sa používať na štúdie lúhovania.
|
Podmienky testu
|
32.
|
Počas trvania testu sa pôdne kolóny na lúhovanie majú držať v tme pri teplote okolia, pokiaľ sa táto teplota udržiava v rozmedzí ± 2 °C. Odporúča sa teplota 18 až 25 °C.
|
|
33.
|
Na povrch pôdnych kolón sa má nepretržite aplikovať umelý dážď (0,01 M CaCl2) s rýchlosťou 200 mm za obdobie 48 hodín (60). Táto rýchlosť zodpovedá aplikácii 251 ml do kolóny s vnútorným priemerom 4 cm. Ak to je potrebné na účely testu, možno navyše použiť aj iné rýchlosti aplikácie umelého dažďa a dlhšie trvanie.
|
Vykonanie testu
Lúhovanie s východiskovou testovanou chemikáliou
|
34.
|
Do lúhovacích stĺpcov aspoň v duplikátoch sa pridá nespracovaná, vzduchom vysušená a preosiata pôda (< 2 mm) do výšky približne 30 cm. Na to, aby bola pôda rovnomerne utlačená, sa pridáva do kolón v malých dávkach lyžicou a plunžerom sa stlačí za súčasného mierneho trasenia kolónou dovtedy, kým vrchná vrstva pôdy v kolóne neprestane klesať. Rovnomerné utlačenie je potrebné na získanie reprodukovateľných výsledkov v lúhovacích kolónach. Podrobnosti o metódach utláčania kolón nájdete v odkazoch (20), (21) a (22). Na kontrolu reprodukovateľnosti postupu utláčania sa stanoví celková hmotnosť pôdy utlačenej v kolónach (61). Hmotnosť duplikátov kolón by mala byť podobná.
|
|
35.
|
Po utlačení sa pôdne kolóny predzvlhčia umelým dažďom (0,01 M CaCl2) zdola nahor, aby sa vodou vytlačil vzduch z pórov pôdy. Potom sa pôdne kolóny nechajú dosiahnuť rovnovážny stav a nadbytočná voda odtečie pôsobením gravitácie. Metódy nasýtenia kolón sú zhrnuté v literatúre (23).
|
|
36.
|
Následne sa do pôdnych kolón aplikuje testovaná chemikália a/alebo referenčná chemikália (pozri aj body 23 – 25). Na získanie homogénnej distribúcie by sa roztoky, suspenzie alebo emulzie testovanej a/alebo referenčnej chemikálie mali rovnomerne aplikovať na povrch pôdnych kolón. Ak sa na účely aplikácie testovanej chemikálie odporúča zapracovanie do pôdy, chemikália sa má zmiešať s malým množstvom pôdy (napr. 20 g) a pridať na povrch pôdnej kolóny.
|
|
37.
|
Povrchy pôdnych kolón sa potom zakryjú kotúčom zo sintrového skla, sklenenými perlami, filtrami zo sklených vlákien alebo okrúhlym filtračným papierom, aby sa umelý dážď rovnomerne rozložil na celý povrch a aby sa predišlo narušeniu povrchu pôdy dažďovými kvapkami. Čím väčší je priemer kolóny, tým opatrnejšie sa do pôdnych kolón musí aplikovať umelý dážď, aby sa zabezpečilo rovnomerné rozdelenie umelého dažďa na povrchu pôdy. Potom sa umelý dážď pridáva po kvapkách do pôdnych kolón pomocou piestového alebo peristaltického čerpadla alebo prikvapkávacieho lievika. Výluhy sa podľa možnosti majú odoberať vo frakciách a majú sa zaznamenať ich príslušné objemy (62).
|
|
38.
|
Po vylúhovaní a odvodnení kolón sa pôda v kolónach rozdelí na vhodný počet segmentov v závislosti od informácií, ktoré sa majú v štúdii získať. Segmenty sa extrahujú príslušnými rozpúšťadlami alebo zmesami rozpúšťadiel a analyzujú z hľadiska testovanej chemikálie a podľa potreby produktov transformácie, celkovej rádioaktivity a referenčnej chemikálie. Výluhy alebo frakcie výluhov sa analyzujú z hľadiska rovnakých produktov priamo alebo po extrakcii. Ak sa používa rádioaktívne označená testovaná chemikália, mali by sa identifikovať všetky frakcie obsahujúce ≥ 10 % aplikovanej rádioaktivity.
|
Lúhovanie s vyzretými rezíduami
|
39.
|
Do čerstvej pôdy (vopred nevysušenej vzduchom) sa pridáva rádioaktívne označená testovaná chemikália v množstve zodpovedajúcom povrchovej ploche pôdnych kolón (pozri bod 24). Pôda sa inkubuje v aeróbnych podmienkach podľa testovacej metódy C.23 (13). Inkubačné obdobie (obdobie zretia) by malo byť dostatočne dlhé na to, aby sa vytvorilo významné množstvo produktov transformácie. Odporúča sa obdobie zretia zodpovedajúce jednému polčasu testovanej chemikálie (63), pričom toto obdobie by nemalo presiahnuť 120 dní. Pred vylúhovaním sa vyzretá pôda analyzuje z hľadiska testovanej chemikálie a produktov jej transformácie.
|
|
40.
|
Lúhovacie kolóny sa naplnia do výšky 28 cm rovnakou pôdou (ale vysušenou vzduchom), aká sa používa v pokuse s vyzretými rezíduami opísanom v bode 34. Stanoví sa aj celková hmotnosť naplnených pôdnych kolón. Pôdne kolóny sa potom predzvlhčia podľa opisu v bode 35.
|
|
41.
|
Testovaná chemikália a produkty jej transformácie sa následne aplikujú na povrchu pôdnych kolón vo forme vyzretých pôdnych rezíduí (pozri bod 39) ako 2 cm segment pôdy. Celková výška pôdnych kolón (neošetrená pôda + vyzretá pôda) by podľa možnosti nemala prekročiť 30 cm (pozri bod 34).
|
|
42.
|
Lúhovanie sa vykoná podľa opisu v bode 37.
|
|
43.
|
Po vylúhovaní sa segmenty pôdy a výluhy analyzujú z hľadiska testovanej chemikálie, produktov jej transformácie a neextrahovanej rádioaktivity podľa opisu v bode 38. Na stanovenie množstva vyzretého rezídua, ktoré po vylúhovaní zostalo vo vrchnej 2 cm vrstve, by sa tento segment mal analyzovať samostatne.
|
ÚDAJE A PODÁVANIE SPRÁV
Spracovanie výsledkov
|
44.
|
Množstvá testovanej chemikálie, produktov transformácie, neextrahovateľných zložiek a referenčnej chemikálie, ak sa použije, by sa mali uvádzať v % z pôvodne aplikovanej dávky pre každý segment pôdy a frakciu výluhu. Pre každú kolónu sa má uviesť grafické znázornenie na grafe so zistenými percentami ako funkciou hĺbky pôdy.
|
|
45.
|
Ak sa v týchto štúdiách lúhovania v kolónach použije referenčná chemikália, vylúhovanie chemikálie možno vyhodnotiť na relatívnej stupnici pomocou faktorov relatívnej mobility (RMF, vymedzenie pojmu nájdete v dodatku 3) (1) (11), ktoré umožňujú porovnať údaje o vylúhovaní rôznych chemikálií získané v rôznych druhoch pôd. Príklady hodnôt RMF pre rôzne chemikálie na ochranu plodín sú uvedené v dodatku 3.
|
|
46.
|
Zo štúdií lúhovania v kolónach možno získať aj odhady hodnôt Koc (normalizovaný adsorpčný koeficient pre organický uhlík) a Kom (normalizovaný distribučný koeficient pre organickú hmotu) s použitím priemernej vzdialenosti lúhovania alebo stanovenej korelácie medzi hodnotami RMF a Kom, resp. Koc (4) alebo aplikovaním jednoduchej chromatografickej teórie (24). Posledná metóda by sa však mala používať s opatrnosťou, najmä ak vezmeme do úvahy, že proces lúhovania nezahŕňa len podmienky nasýteného prietoku, ale skôr nenasýtené systémy.
|
Interpretácia výsledkov
|
47.
|
Štúdie lúhovania v kolónach opísané v tejto metóde umožňujú stanoviť potenciál lúhovania alebo mobility testovanej chemikálie (v štúdii lúhovania východiskovej chemikálie) a/alebo produktov jej transformácie (v štúdii lúhovania vyzretých rezíduí) v pôde. Tieto testy síce kvantitatívne nepredpovedajú vyplavovanie látky zo sedimentu v terénnych podmienkach, ale môžu sa použiť na porovnanie ‚vylúhovateľnosti‘ jednej chemikálie s inými, ktorých vlastnosti lúhovania sú známe (24). V testoch sa ani kvantitatívne nemeria percento aplikovanej chemikálie, ktorá sa môže dostať do podzemnej vody (11). Výsledky štúdií lúhovania v kolónach však môžu pomôcť pri rozhodovaní o tom, či sa má vykonať ďalšie poloterénne alebo terénne testovanie chemikálií, ktoré majú v laboratórnych testoch vysoký potenciál mobility.
|
Protokol o skúške
|
48.
|
Protokol musí obsahovať:
|
|
Testovaná chemikália a referenčná chemikália (ak sa použije):
|
—
|
bežný názov, chemický názov (názvoslovie IUPAC a CAS), číslo CAS, chemická štruktúra (s vyznačením polohy značky, ak sa používa rádioaktívne označený materiál) a relevantné fyzikálno-chemické vlastnosti,
|
|
—
|
čistota (nečistoty) testovanej chemikálie,
|
|
—
|
rádiochemická čistota označenej chemikálie a špecifická aktivita (v prípade potreby).
|
|
|
|
Testované pôdy:
|
—
|
vlastnosti pôdy, ako je pH, obsah organického uhlíka a ílu, textúra a sypná hustota (pre narušené pôdy),
|
|
—
|
mikrobiálna činnosť v pôde (iba pre pôdy použité na zretie testovanej chemikálie),
|
|
—
|
dĺžka skladovania pôdy a podmienky skladovania.
|
|
|
|
Podmienky testu:
|
—
|
dátumy vykonávania štúdií,
|
|
—
|
dĺžka a priemer lúhovacích kolón,
|
|
—
|
celková hmotnosť pôdy v pôdnych kolónach,
|
|
—
|
množstvo testovanej chemikálie a podľa potreby referenčnej chemikálie,
|
|
—
|
množstvo aplikovaného umelého dažďa a frekvencia a trvanie aplikácie,
|
|
—
|
teplota pokusnej zostavy,
|
|
—
|
počet replikácií (aspoň dve),
|
|
—
|
metódy na analýzu testovanej chemikálie, produktov transformácie a podľa potreby referenčnej chemikálie v rôznych segmentoch pôdy a výluhoch,
|
|
—
|
metódy na charakterizovanie a identifikáciu produktov transformácie v segmentoch pôdy a výluhoch.
|
|
|
|
Výsledky testu:
|
—
|
tabuľky výsledkov vyjadrených ako koncentrácie a ako % aplikovanej dávky pre segmenty pôdy a výluhy,
|
|
—
|
hmotnostná bilancia, ak to je vhodné,
|
|
—
|
vzdialenosti lúhovania a podľa potreby faktory relatívnej mobility,
|
|
—
|
grafické znázornenie % zisteného v segmentoch pôdy v závislosti od hĺbky segmentu pôdy,
|
|
—
|
rozbor a interpretácia výsledkov.
|
|
|
LITERATÚRA
|
1.
|
Guth, J.A., Burkhard, N. a Eberle, D.O. (1976). Experimental Models for Studying the Persistence of Pesticides in Soil. Proc. BCPC Symposium: Persistence of Insecticides and Herbicides.
|
|
2.
|
Russel, M.H. (1995). Recommended approaches to assess pesticide mobility in soil. In progress in Pesticide Biochemistry and Toxicology, Vol. 9 (Environmental Behaviour of Agrochemicals – T.R. Roberts and P.C. Kearney, Eds.). J. Wiley & Sons.
|
|
3.
|
Briggs, G.G. (1981). Theoretical and experimental relationships between soil adsorption, octanol-water partition coefficient, water solubilities, bioconcentration factors, and the parachor. J.Agric. Food Chem. 29, 1050 – 1059.
|
|
4.
|
Chiou, C.T., Porter, P.E. a Schmedding, D.W. (1983). Partition equilibria of non-ionic organic compounds between soil organic matter and water. Environ. Sci. Technol. 17, 227 – 231.
|
|
5.
|
Guth, J.A. (1983). Untersuchungen zum Verhalten von Pflanzenschutzmitteln im Boden. Bull. Bodenkundliche Gesellschaft Schweiz 7, 26 – 33.
|
|
6.
|
US-Environmental Protection Agency (1982). Pesticide Assessment Guidelines, Subdivision N. Chemistry: Environmental Fate.
|
|
7.
|
Agriculture Canada (1987). Environmental Chemistry and Fate Guidelines for registration of pesticides in Canada.
|
|
8.
|
Príloha I k smernici Komisie 95/36/ES zo 14. júla 1995, ktorou sa mení a dopĺňa smernica Rady 91/414/EHS o umiestnení prípravkov na ochranu rastlín na trh, Ú. v. ES L 172, 22.7.1995, s. 8.
|
|
9.
|
Dutch Commission for Registration of Pesticides (1991). Application for registration of a pesticide. Section G: Behaviour of the product and its metabolites in soil, water and air.
|
|
10.
|
BBA (1986). Richtlinie für die amtliche Prüfung von Pflanzenschutzmitteln, Teil IV, 4 – 2. Versickerungsverhalten von Pflanzenschutzmitteln.
|
|
11.
|
SETAC (1995). Procedures for Assessing the Environmental Fate and Ecotoxicity of Pesticides. Mark R. Lynch, Ed.
|
|
12.
|
OECD (1995). Final Report of the OECD Workshop on Selection of Soils/Sediments. Belgirate, Italy, 18. – 20. januára 1995.
|
|
13.
|
Kapitoly tejto prílohy:
|
|
Kapitola A.6, rozpustnosť vo vode
|
|
|
Kapitola A.8, rozdeľovacia konštanta, metóda trepačkovej banky
|
|
|
Kapitola A.24, rozdeľovacia konštanta, metóda HPLC
|
|
|
Kapitola C.7, degradácia — abiotická degradácia: hadrolýza ako funkcia pH
|
|
|
Kapitola C.18, adsorpcia/desorpcia s použitím rovnovážnej metódy dávkovania
|
|
|
Kapitola C.23, aeróbna a anaeróbna transformácia v pôde
|
|
|
14.
|
Soil Texture Classification (US and FAO systems). Weed Science, 33, Suppl. 1 (1985) and Soil Sci. Soc. Amer. Proc. 26, 305 (1962).
|
|
15.
|
Methods of Soil Analysis (1986). Part 1, Physical and Mineralogical Methods (A. Klute, Ed.). Agronomy Series No. 9, 2nd Edition.
|
|
16.
|
Methods of Soil Analysis (1982). Part 2, Chemical and Microbiological Properties (A.L. Page, R.H. Miller a D.R. Kelney, Eds.). Agronomy Series No. 9, 2nd Edition.
|
|
17.
|
ISO Standard Compendium Environment (1994). Soil Quality – General aspects; chemical and physical methods of analysis; biological methods of analysis. First Edition.
|
|
18.
|
Mückenhausen, E. (1975). Die Bodenkunde und ihre geologischen, geomorphologischen, mineralogischen und petrologischen Grundlagen. DLG-Verlag, Frankfurt/Main.
|
|
19.
|
Scheffer, F. a Schachtschabel, P. (1998). Lehrbuch der Bodenkunde. F. Enke Verlag, Stuttgart.
|
|
20.
|
Weber, J.B. a Peeper, T.F. (1977). In Research Methods in Weed Science, 2nd Edition (B. Truelove, Ed.). Soc. Weed Sci., Auburn, Alabama, 73 – 78.
|
|
21.
|
Weber, J.B., Swain, L.R., Strek, H.J. a Sartori, J.L. (1986). In Research Methods in Weed Science, 3rd Edition (N.D. Camper, Ed.). Soc. Weed Sci., Champaign, IL, 190 – 200.
|
|
22.
|
Oliveira, et al. (1996). Packing of sands for the production of homogeneous porous media. Soil Sci. Soc. Amer. J. 60(1): 49 – 53.
|
|
23.
|
Shackelford, C. D. (1991). Laboratory diffusion testing for waste disposal. – A review. J. Contam. Hydrol. 7, 177 – 217.
|
|
24.
|
(Hamaker, J.W. (1975). Interpretation of soil leaching experiments. In Environmental Dynamics of Pesticides (R. Haque, V.H. Freed, Eds), 115 – 133. Plenum Press, New York.
|
|
25.
|
OECD (1981). Dissociation constants in water. OECD Guideline for Testing of Chemicals, No. 4112, OECD, Paríž
|
Dodatok 1
Vymedzenie pojmov a jednotky
Vyzreté rezíduum pôdy
: testovaná chemikália a produkty transformácie prítomné v pôde po aplikácii a dostatočne dlhom období na to, aby došlo k procesom presunu, adsorpcie, metabolizmu a rozptylu, ktoré zmenia distribúciu a chemickú povahu niektorých aplikovaných chemikálií (1).
Umelý dážď
: 0,01 M roztoku CaCl2 v destilovanej alebo deionizovanej vode.
Priemerná vzdialenosť lúhovania
: spodná časť pôdy, kde sa kumulatívne množstvo získanej chemikálie = 50 % z celkového množstva získanej chemikálie (pokus s bežným vylúhovaním), alebo hodnote vypočítanej podľa vzorca (spodná časť pôdy, kde sa kumulatívne množstvo získanej chemikálie = 50 % z celkového množstva získanej chemikálie) – [(hrúbka vrstvy vyzretého rezídua)/2] (štúdia lúhovania vyzretého rezídua).
Chemikália
: látka alebo zmes.
Výluh
: vodná fáza vylúhovaná cez pôdny profil alebo pôdnu kolónu (1).
Lúhovanie
: proces, prostredníctvom ktorého sa chemikália pohybuje smerom nadol cez pôdny profil alebo pôdnu kolónu (1).
Vzdialenosť lúhovania
: najhlbší segment pôdy, v ktorom sa po procese lúhovania našlo ≥ 0,5 % aplikovanej testovanej chemikálie alebo vyzretého rezídua (ekvivalent hĺbky prieniku).
Detekčný limit (LOD) a kvantifikačný limit (LOQ)
: detekčný limit (LOD) je koncentrácia chemikálie, pod ktorou nemožno chemikáliu odlíšiť od analytických artefaktov. Kvantifikačný limit (LOQ) je koncentrácia chemikálie, pod ktorou nemožno stanoviť koncentráciu s prípustnou presnosťou.
RMF – faktor relatívnej mobility
: [vzdialenosť lúhovania testovanej chemikálie (cm)]/[vzdialenosť lúhovania referenčnej chemikálie (cm)].
Testovaná chemikália
: akákoľvek látka alebo zmes, ktorá sa testuje pomocou tejto testovacej metódy.
Produkt transformácie
: všetky chemikálie, ktoré sú výsledkom biotických alebo abiotických transformačných reakcií testovanej chemikálie vrátane CO2 a produktov viazaných v rezíduách.
Pôda
: zmes anorganických a organických chemických zložiek. Medzi organické zložky patria zlúčeniny s vysokým obsahom uhlíka a dusíka a vysokou molekulovou hmotnosťou. V pôde žijú malé (väčšinou mikroskopické) organizmy. S pôdou možno manipulovať v dvoch stavoch:
|
—
|
nenarušenom, teda v stave, ktorý vznikol pôsobením času vytvorením charakteristických vrstiev rôznych druhov pôdy,
|
|
—
|
narušenom, aký sa väčšinou nachádza v ornej pôde alebo aký vzniká, keď sa vzorky odobrali výkopom a použili v tejto testovacej metóde (2).
|
|
1.
|
Holland, P.T. (1996). Glossary of Terms Relating to Pesticides. IUPAC Reports on Pesticide (36). Pure & Appl. Chem. 68, 1167 – 1193.
|
|
2.
|
OECD Test Guideline 304 A: Inherent Biodegradability in Soil (prijaté 12. mája 1981).
|
Dodatok 2
Obrázok 1
Príklad nerozdeliteľných lúhovacích kolón vyrobených zo skla
s dĺžkou 35 cm a vnútorným priemerom 5 cm (1)

|
1.
|
Drescher, N. (1985). Moderner Acker- und Pflanzenbau aus Sicht der Pflanzenschutzmittelindustrie. In Unser Boden – 70 Jahre Agrarforschung der BASF AG, 225 – 236. Verlag Wissenschaft und Politik, Köln.
|
Obrázok 2
Príklad rozdeliteľnej kovovej kolóny s vnútorným priemerom 4 cm (1)

|
1.
|
Burkhard, N., Eberle D.O. a Guth, J.A. (1975). Model systems for studying the environmental behaviour of pesticides. Environmental Quality and Safety, Suppl. Vol. III, 203 – 213.
|
Dodatok 3
Príklady faktorov relatívnej mobility
(64)
(RMF) pre rôzne chemikálie na ochranu plodín (1) (2) a zodpovedajúce triedy mobility
(66)
|
Rozsah RMF
|
Chemikália (RMF)
|
Trieda mobility
|
|
≤ 0,15
|
Paratión (< 0,15), fluórdifén (0,15)
|
I
nemobilné
|
|
0,15 – 0,8
|
Profenofos (0,18), propikonazol (0,23), diazinón (0,28), diurón (0,38), terbutylazín (0,52), metidatión (0,56), prometrín (0,59), propazín (0,64), alachlór (0,66), metolachlór (0,68)
|
II
mierne mobilné
|
|
0,8 – 1,3
|
Monurón (65) (1,00), atrazín (1,03), simazín (1,04), fluometurón (1,18)
|
ΙΙΙ
stredne mobilné
|
|
1,3 – 2,5
|
Prometón (1,67), kyánazín (1,85), brómacil (1,91), karbutilát (1,98)
|
IV
dosť mobilné
|
|
2,5 – 5,0
|
Karbofurán (3,00), dioxakarb (4,33)
|
V
mobilné
|
|
> 5,0
|
Monokrotofos (> 5,0), dikrotofos (> 5,0)
|
VI
veľmi mobilné
|
|
1.
|
Guth, J.A. (1985). Adsorption/desorption. In Joint International Symposium ‚Physicochemical Properties and their Role in Environmental Hazard Assessment.‘ Canterbury, UK, 1. – 3. júla 1985.
|
|
2.
|
Guth, J.A. a Hörmann, W.D. (1987). Problematik und Relevanz von Pflanzenschutzmittel-Spuren im Grund (Trink-) Wasser. Schr.Reihe Verein WaBoLu, 68, 91 – 106.
|
|
3.
|
Harris, C.I. (1967). Movement of herbicides in soil. Weeds 15, 214 – 216.
|
|
4.
|
Helling, C.S. (1971). Pesticide mobility in soils. Soil Sci. Soc. Am. Proc. 35, 743 – 748.
|
|
5.
|
McCall, P.J., Laskowski, D.A., Swann, R.L. a Dishburger, H.J. (1981). Measurements of sorption coefficients of organic chemicals and their use in environmental fate analysis. In Test Protocols for Environmental Fate and Movement of Toxicants. Proceedings of AOAC Symposium, AOAC, Washington D.C.
|
|
6.
|
Hollis, J.M. (1991). Mapping the vulnerability of aquifers and surface waters to pesticide contamination at the national/regional scale. BCPC Monograph No. 47 Pesticides in Soil and Water, 165 – 174.
|
C.45. ODHAD EMISIÍ Z DREVA OŠETRENÉHO OCHRANNÝM PROSTRIEDKOM DO ŽIVOTNÉHO PROSTREDIA: LABORATÓRNA METÓDA PRE DREVENÉ KOMODITY BEZ POVRCHOVEJ ÚPRAVY, KTORÉ SÚ V KONTAKTE SO SLADKOU VODOU ALEBO MORSKOU VODOU
ÚVOD
|
1.
|
Táto testovacia metóda je rovnocenná s usmernením OECD na vykonávanie testov (TG) 313 (2007). Emisie z dreva ošetreného ochranným prostriedkom do životného prostredia je potrebné kvantifikovať, aby bolo možné posúdiť riziko ošetreného dreva pre životné prostredie. Táto testovacia metóda opisuje laboratórnu metódu na stanovenie emisií z dreva ošetreného ochranným prostriedkom v dvoch situáciách, v ktorých sa emisie môžu dostať do životného prostredia:
|
—
|
Emisie z ošetreného dreva v kontakte so sladkou vodou. Emisie z povrchu ošetreného dreva sa môžu dostať do vody.
|
|
—
|
Emisie z ošetreného dreva v kontakte s morskou vodou. Emisie z povrchu ošetreného dreva sa môžu dostať do morskej vody.
|
|
|
2.
|
Táto testovacia metóda je určená na testovanie emisií z dreva a drevených komodít bez povrchovej úpravy, ktoré sú v kontakte so sladkou vodou alebo morskou vodou. Triedy použitia sa používajú na medzinárodnej úrovni na kategorizáciu biologického nebezpečenstva, ktoré spôsobuje ošetrená komodita. Triedy použitia slúžia aj na vymedzenie situácie, v ktorej sa používa ošetrená komodita, a na stanovenie zložiek životného prostredia (ovzdušie, voda, pôda), ktoré sú potenciálne ohrozené drevom ošetreným ochranným prostriedkom.
|
|
3.
|
Testovacia metóda je laboratórny postup získavania vzoriek (emisátu) z vody použitej na ponorenie ošetreného dreva vo zvyšujúcich sa časových intervaloch po expozícii. Množstvo emisií v emisáte sa dá do súvislosti s plochou povrchu dreva a dĺžkou expozície, pomocou ktorých sa odhadne tok v mg/m2/deň. Možno tak odhadnúť tok (rýchlosť lúhovania) po predĺžení intervalov expozície.
|
|
4.
|
Množstvo emisií sa môže použiť na posúdenie rizika ošetreného dreva pre životné prostredie.
|
ÚVODNÉ ÚVAHY
|
5.
|
Mechanizmus lúhovania sladkou vodou na povrchu dreva sa nepovažuje za identický s lúhovaním z povrchu dreva morskou vodou, pokiaľ ide o jeho povahu a závažnosť. V prípade produktov alebo zmesí na ochranu dreva slúžiacich na ošetrenie dreva používaného v morskom prostredí je preto nutné vykonať štúdiu lúhovania z dreva pre morskú vodu.
|
|
6.
|
Drevo ošetrené ochranným prostriedkom na drevo by malo predstavovať komerčne používané drevo. Malo by sa s ním zaobchádzať v súlade s pokynmi výrobcu ochranného prostriedku a s príslušnými normami a špecifikáciami. Je nutné uviesť parametre úpravy dreva po ošetrení pred začatím testu.
|
|
7.
|
Použité vzorky dreva by mali predstavovať používané komodity (napr. pokiaľ ide o druh, hustotu a iné vlastnosti).
|
|
8.
|
Test možno použiť na drevo s využitím procesu prieniku alebo povrchovej aplikácie alebo na ošetrené drevo, ktoré obsahuje doplnkovú povinnú povrchovú úpravu (napr. aplikovanú farbu ako požiadavku na komerčné použitie).
|
|
9.
|
Na stanovenie množstva, obsahu a povahy emisií z dreva je nutné poznať zloženie, množstvo, pH a fyzikálnu formu vody.
|
PRINCÍP TESTOVACEJ METÓDY
|
10.
|
Skúšobné vzorky dreva ošetrené ochranným prostriedkom sa ponoria do vody. Voda (emisát) sa odoberie a chemicky analyzuje počas expozičného obdobia toľkokrát, aby to stačilo na štatistické výpočty. Z analytických výsledkov sa vypočítajú rýchlosti emisie v mg/m2/deň. Je potrebné zaznamenať časy odberu vzoriek. Testy s neošetrenými vzorkami možno zastaviť, ak sa nezistí žiadne pozadie v prvých troch bodoch zberu údajov.
|
|
11.
|
Zahrnutie vzoriek neošetreného dreva umožňuje stanoviť úrovne emisátov z dreva v pozadí iných, ako je použitý ochranný prostriedok.
|
KRITÉRIÁ KVALITY
Správnosť
|
12.
|
Správnosť testovacej metódy, pokiaľ ide o odhad emisií, závisí od toho, či testované vzorky predstavujú komerčne ošetrené drevo, do akej miery voda zodpovedá skutočnej vode a do akej miery režim expozície zodpovedá prírodným podmienkam.
|
|
13.
|
Správnosť, presnosť a opakovateľnosť analytickej metódy by sa mali stanoviť pred vykonaním testu.
|
Reprodukovateľnosť
|
14.
|
Odoberú a analyzujú sa tri vzorky vody, pričom ako hodnota emisií sa použije priemerná hodnota. Reprodukovateľnosť výsledkov v rámci jedného laboratória a medzi rôznymi laboratóriami závisí od režimu ponárania a dreva použitého ako skúšobná vzorka.
|
Prijateľný rozsah výsledkov
|
15.
|
Prijateľný rozsah výsledkov tohto testu je taký, kde sa horné a spodné hodnoty líšia o menej ako jednu rádovú hodnotu.
|
PODMIENKY TESTU
Voda
|
16.
|
Scenáre lúhovania sladkou vodou: Keď sa má v teste lúhovania vyhodnotiť drevo vystavené sladkej vode, odporúča sa použiť deionizovanú vodu (napr. ASTM D 1193 typ II). Teplota vody má byť 20 °C ± 2 °C. Do protokolu o skúške je potrebné uviesť nameranú hodnotu pH a teplotu vody. Analýza vzoriek použitej vody odobratých pred ponorením ošetrených vzoriek umožňuje odhadnúť analyzované chemikálie vo vode. Používa sa ako kontrola na určenie úrovní chemikálií, ktoré sa potom chemicky analyzujú, v pozadí.
|
|
17.
|
Scenáre lúhovania morskou vodou: Keď sa má v teste lúhovania vyhodnotiť drevo vystavené morskej vode, odporúča sa použiť umelú morskú vodu (napr. ASTM D 1141, náhradná oceánska voda bez ťažkých kovov). Teplota vody má byť 20 °C ± 2 °C. Do protokolu o skúške je potrebné uviesť nameranú hodnotu pH a teplotu vody. Analýza vzoriek použitej vody odobratých pred ponorením ošetrených vzoriek umožňuje odhadnúť analyzované chemikálie vo vode. Používa sa ako kontrola na analýzu úrovní dôležitých chemikálií v pozadí.
|
Skúšobné vzorky dreva
|
18.
|
Druh dreva by mal byť typickým druhom dreva používaným na testovanie účinnosti ochranných prostriedkov na drevo. Odporúčané druhy sú Pinus sylvestris L. (borovica lesná), Pinus resinosa Ait. (borovica smolná) alebo Pinus spp. (rod borovica). Môžu sa urobiť aj doplnkové testy s použitím iných druhov.
|
|
19.
|
Malo by sa použiť rovné vláknité drevo bez uzlov. Materiál živicového vzhľadu by sa nemal používať. Drevo musí byť typickým komerčne dostupným drevom. Treba zaznamenať zdroj, hustotu a počet letokruhov na 10 mm.
|
|
20.
|
Odporúča sa, aby skúšobné vzorky dreva boli súbory piatich blokov s veľkosťou podľa normy EN 113 (rozmery 25 mm × 50 mm × 15 mm) s pozdĺžnymi plochami rovnobežnými s vláknom dreva. Možno však použiť aj iné rozmery, napríklad 50 mm x 150 mm x10 mm. Skúšobná vzorka sa má úplne ponoriť do vody. Skúšobné vzorky sa musia 100 % skladať z beľového dreva. Každá vzorka sa jedinečne označí, aby ju počas testu bolo možné identifikovať.
|
|
21.
|
Všetky skúšobné vzorky by mali mať rovný povrch alebo by sa mali narezať tak, aby mali rovný povrch, a povrchy by sa nemali šmirgľovať.
|
|
22.
|
Počet súborov testovaných vzoriek dreva použitých na analýzu je aspoň päť: tri súbory vzoriek sa ošetria ochranným prostriedkom, jeden súbor vzoriek sa neošetrí a jeden súbor vzoriek sa použije na odhadnutie obsahu vlhkosti skúšobných vzoriek vysušených v peci pred ošetrením. Pripraví sa dostatočné množstvo skúšobných vzoriek, aby bolo možné vybrať tri súbory vzoriek, ktoré sú v rozmedzí 5 % priemernej hodnoty retencie ochranného prostriedku v skupine skúšobných vzoriek.
|
|
23.
|
Všetky skúšobné vzorky sa na konci utesnia chemikáliou, ktorá zabraňuje prieniku ochranného prostriedku do koncového vlákna vzoriek alebo lúhovaniu zo vzorky cez koncové vlákno. Pri aplikovaní koncovej tesniacej látky je potrebné rozlišovať medzi vzorkami použitými na povrchovú aplikáciu a na procesy prieniku. Koncová tesniaca látka sa musí aplikovať pred ošetrením iba v prípade povrchovej aplikácie.
|
|
24.
|
V prípade procesov prieniku musí byť koncové vlákno otvorené, aby bolo možné drevo ošetriť. Vzorky sa teda musia na konci utesniť až na konci obdobia úpravy. Emisie sa odhadujú len pre pozdĺžne povrchové plochy. Tesniace látky sa pred začiatkom lúhovania musia skontrolovať a podľa potreby aplikovať znova. Po začiatku lúhovania by sa už nemali aplikovať.
|
Ponorná nádoba
|
25.
|
Nádoba je vyrobená z inertného materiálu a je dostatočne veľká na to, aby sa do nej zmestilo päť vzoriek dreva podľa normy EN 113 v 500 ml vody, teda s pomerom povrchovej plochy k objemu vody 0,4 cm2/ml.
|
Zostava na testovanie vzoriek
|
26.
|
Skúšobné vzorky sú pripevnené na zostave, ktorá umožňuje kontakt všetkých vystavených povrchov vzorky s vodou.
|
POSTUP OŠETRENIA OCHRANNÝM PROSTRIEDKOM
Príprava ošetrených skúšobných vzoriek
|
27.
|
Skúšobná vzorka dreva, ktorá sa má v teste ošetriť ochranným prostriedkom, sa ošetrí metódou uvedenou pre daný ochranný prostriedok. Môže to byť proces ošetrenia prienikom alebo proces povrchovej aplikácie, a to ponorením, postriekaním alebo nanesením kefou.
|
Ochranné prostriedky, ktoré sa majú aplikovať procesom ošetrenia prienikom
|
28.
|
Pripraví sa taký roztok ochranného prostriedku, pomocou ktorého sa dosiahne špecifikovaná absorpcia alebo retencia pri použití procesu ošetrenia prienikom. Skúšobná vzorka dreva sa odváži a odmerajú sa jej rozmery. Proces ošetrenia prienikom by mal byť v súlade so špecifikáciou pre aplikovanie ochrannej látky na drevo používanou v rámci triedy použitia 4 alebo 5. Vzorka sa po ošetrení znova odváži a vypočíta sa retencia ochranného prostriedku (kg/m3) z rovnice:

|
|
29.
|
V tomto teste možno použiť aj drevo ošetrené v zariadení na priemyselné ošetrenie (napr. vákuovo-tlakovou impregnáciou). Použité postupy by sa mali zaznamenať a musí sa analyzovať a zaznamenať retencia materiálu ošetreného týmto spôsobom.
|
Ochranné prostriedky, ktoré sa majú aplikovať procesmi povrchovej aplikácie
|
30.
|
Proces povrchovej aplikácie zahŕňa ponáranie alebo postrekovanie skúšobných vzoriek dreva alebo nanášanie ochranného prostriedku kefou. Proces a miera aplikácie (napr. litre/m2) by mali byť v súlade so špecifikáciou pre povrchovú aplikáciu ochranného prostriedku.
|
|
31.
|
Aj v tomto prípade možno v tomto teste použiť drevo ošetrené v zariadení na priemyselné ošetrenie. Použité postupy by sa mali zaznamenať a musí sa analyzovať a zaznamenať retencia materiálu ošetreného týmto spôsobom.
|
Úprava skúšobných vzoriek po ošetrení
|
32.
|
Po ošetrení sa ošetrené skúšobné vzorky majú upraviť v súlade s odporúčaniami dodávateľa testovaného ochranného prostriedku podľa požiadaviek na označení prostriedku alebo v súlade s postupmi komerčného ošetrenia alebo normou EN 252.
|
Príprava a výber skúšobných vzoriek
|
33.
|
Po úprave po ošetrení sa vypočíta priemerná retencia skupiny testovaných vzoriek a na meranie lúhovania sa náhodne vyberú tri reprezentatívne súbory vzoriek s retenciou v rozmedzí 5 % priemeru pre skupinu.
|
POSTUP MERANÍ EMISIÍ OCHRANNÉHO PROSTRIEDKU
Metóda ponorenia
|
34.
|
Skúšobné vzorky sa odvážia a následne úplne ponoria do vody, pričom sa zaznamená dátum a čas. Nádoba sa zakryje, aby sa znížilo odparovanie.
|
|
35.
|
Voda sa vymieňa v týchto časových bodoch: 6 hodín, 1 deň, 2 dni, 4 dni, 8 dní, 15 dní, 22 dní, 29 dní (poznámka: sú to celkové časy, nie intervaly). Je potrebné zaznamenať čas a dátum výmeny vody a hmotnosť vody odobratej z nádoby.
|
|
36.
|
Po každej výmene vody sa odloží vzorka vody, do ktorej bol ponorený súbor skúšobných vzoriek, na následnú chemickú analýzu.
|
|
37.
|
Postup odberu vzoriek umožňuje výpočet profilu množstva emisií v čase. Vzorky by sa mali skladovať za podmienok, ktoré chránia analyt, napr. v chladničke a v tme, aby sa znížil rast mikróbov vo vzorke pred analýzou.
|
MERANIA EMISIÍ
Ošetrené vzorky
|
38.
|
Odobratá voda sa podľa potreby chemicky analyzuje z hľadiska účinnej látky a/alebo relevantných produktov degradácie/transformácie.
|
Neošetrené vzorky
|
39.
|
Odber vody (emisátu) v tomto systéme a následná analýza chemikálií, ktoré sa vylúhovali zo vzoriek neošetreného dreva, umožňujú odhadnúť možnú rýchlosť emisie ochranného prostriedku z neošetreného dreva. Odber a analýza emisátu po predĺžení časových intervalov expozície umožňujú odhadnúť mieru zmeny rýchlosti emisie v čase. Táto analýza je kontrolným postupom na určenie úrovne testovanej chemikálie v pozadí v neošetrenom dreve, ktorého účelom je potvrdiť, že drevo použité ako zdroj vzoriek nebolo predtým ošetrené ochranným prostriedkom.
|
ÚDAJE A PODÁVANIE SPRÁV
Chemické analýzy
|
40.
|
Odobratá voda sa chemicky analyzuje a výsledok analýzy vody sa vyjadrí vo vhodných jednotkách, napr. μg/l.
|
Hlásenie údajov
|
41.
|
Všetky výsledky sa zaznamenajú. Dodatok obsahuje príklad navrhovaného formulára na záznam údajov o jednom súbore ošetrených skúšobných vzoriek, ako aj súhrnnú tabuľku na výpočet priemerných hodnôt emisií v každom intervale odberu vzoriek.
|
|
42.
|
Denný tok emisií v mg/m2/deň sa vypočíta ako priemer troch meraní z troch replikátov vydelený počtom dní ponorenia.
|
Protokol o skúške
|
43.
|
Protokol o skúške má obsahovať aspoň tieto informácie:
|
—
|
názov dodávateľa testovaného ochranného prostriedku,
|
|
—
|
osobitný a jedinečný názov alebo kód testovaného ochranného prostriedku,
|
|
—
|
obchodný alebo bežný názov účinnej zložky (účinných zložiek) so všeobecným opisom ďalších zložiek (napr. pomocného rozpúšťadla, živice) a zloženie v hmotnostných % zložiek,
|
|
—
|
príslušná retencia alebo zaťaženie (v kg/m3, resp. l/m2) špecifikované pre použité drevo pri kontakte s vodou,
|
|
—
|
druh použitého dreva a jeho hustota a rýchlosť rastu v letokruhoch na 10 mm,
|
|
—
|
zaťaženie alebo retencia testovaného ochranného prostriedku a vzorec použitý na výpočet retencie, vyjadrené v l/m2 alebo kg/m3,
|
|
—
|
metóda aplikácie ochranného prostriedku s uvedením harmonogramu ošetrovania použitého v procese prieniku a metóda aplikácie v prípade povrchového ošetrenia,
|
|
—
|
dátum aplikácie ochranného prostriedku a odhad obsahu vlhkosti skúšobných vzoriek vyjadrený ako percento,
|
|
—
|
použité postupy úpravy s uvedením typu, podmienok a trvania,
|
|
—
|
špecifikácia koncovej tesniacej látky a počet aplikovaní,
|
|
—
|
špecifikácia prípadného následného ošetrenia dreva, napr. špecifikácia dodávateľa, typu, vlastností a množstva náteru,
|
|
—
|
čas a dátum každého ponorenia, množstvo vody použitej na ponorenie skúšobných vzoriek pri každom ponorení a množstvo vody absorbovanej drevom pri ponorení,
|
|
—
|
akákoľvek odchýlka od opísanej metódy a všetky faktory, ktoré mohli mať vplyv na výsledky.
|
|
LITERATÚRA
|
1.
|
Európska norma, EN 84 – 1997. Ochranné prostriedky na drevo. Urýchlené starnutie ošetreného dreva na biologické skúšky. Postup vyplavovaním.
|
|
2.
|
Európska norma, EN 113/A1 – 2004. Ochranné prostriedky na drevo. Skúšobná metóda zisťovania ochrannej účinnosti proti drevokazným hubám Basidiomycetes. Zisťovanie hraníc účinnosti.
|
|
3.
|
Európska norma, EN 252 – 1989. Postup skúšok na zisťovanie relatívnej účinnosti ochranného prostriedku na drevo v kontakte so zemou v prírodných podmienkach.
|
|
4.
|
Európska norma, EN 335 – Part 1: 2006. Trvanlivosť dreva a výrobkov na báze dreva. Triedy používania: definície, časť 1: Všeobecné.
|
|
5.
|
American Society for Testing and Materials Standards, ASTM D 1141 – 1998. Standard Practice for the Preparation of Substitute Ocean Water, Without Heavy Metals. Annual Book of ASTM Standards, Volume 11.02.
|
|
6.
|
American Society for Testing and Materials Standards, ASTM D 1193-77 Type II – 1983. Specifications for Reagent Water. Annual Book of ASTM Standards, Volume 11.01.
|
Dodatok 1
Formulár na záznam údajov z testovacej metódy
Odhad emisií z dreva ošetreného ochranným prostriedkom do životného prostredia: laboratórna metóda pre drevené komodity bez povrchovej úpravy, ktorésú v kontakte so sladkou vodou alebo morskou vodou
|
Testujúca inštitúcia
|
|
|
Prostriedok na ochranu dreva
|
|
Dodávateľ ochranného prostriedku
|
|
|
Osobitný a jedinečný názov alebo kód ochranného prostriedku
|
|
|
Obchodný alebo bežný názov ochranného prostriedku
|
|
|
Ďalšie zložky
|
|
|
Príslušná retencia použitého dreva pri kontakte s vodou
|
|
|
Aplikácia
|
|
Metóda aplikácie
|
|
|
Dátum aplikácie
|
|
|
Vzorec použitý na výpočet retencie:
|
|
|
Postup úpravy
|
|
|
Trvanie úpravy
|
|
|
Koncová tesniaca látka/počet aplikovaní
|
|
|
Následné ošetrenie
|
ak sa použije
|
|
Skúšobné vzorky
|
|
Druh dreva
|
|
|
Hustota dreva
|
(minimum … priemerná hodnota … maximum)
|
|
Rýchlosť rastu (letokruhy na 10 mm)
|
(minimum … priemerná hodnota … maximum)
|
|
Obsah vlhkosti
|
|
|
Testovacie zostavy
(67)
|
Retencia (napr. kg/m3)
|
|
Ošetrené ‚x‘
|
Priemerná hodnota a štandardná odchýlka alebo rozsah pre päť vzoriek
|
|
Ošetrené ‚y‘
|
Priemerná hodnota a štandardná odchýlka alebo rozsah pre päť vzoriek
|
|
Ošetrené ‚z‘
|
Priemerná hodnota a štandardná odchýlka alebo rozsah pre päť vzoriek
|
|
Neošetrené
|
|
|
Odchýlka od parametrov testovacej metódy
|
napr. kvalita vody, rozmery testovaných vzoriek atď.
|
|
Čas
|
Výmena vody
|
Hmotnosť vzorky
|
Absorpcia vody
|
Vzorka vody
|
|
Ošetrené (priemer)
|
Neošetrené
|
Ošetrené (priemer)
|
Neošetrené
|
|
Voda použitá na testovanie
|
x
|
y
|
z
|
|
|
Dátum
|
g
|
g
|
g
|
g
|
č.
|
pH
|
pH
|
pH
|
pH
|
|
začiatok
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6 hod.
|
|
|
|
|
|
1
|
|
|
|
|
|
24 hod.
|
|
|
|
|
|
2
|
|
|
|
|
|
2 dni
|
|
|
|
|
|
3
|
|
|
|
|
|
4 dni
|
|
|
|
|
|
4
|
|
|
|
|
|
8 dní
|
|
|
|
|
|
5
|
|
|
|
|
|
15 dní
|
|
|
|
|
|
6
|
|
|
|
|
|
22 dní
|
|
|
|
|
|
7
|
|
|
|
|
|
29 dní
|
|
|
|
|
|
8
|
|
|
|
|
|
|
|
Pre každú účinnú zložku vytvorte samostatnú tabuľku.
|
Čas
|
Výmena vody
|
Výsledky analýzy
|
|
Neošetrené vzorky
|
Ošetrené vzorky
|
|
Koncentrácia úč. látky vo vode
mg/l
|
Množstvo emisií
mg/m2
|
Rýchlosť emisie
mg/m2/d
|
Koncentrácia úč. látky vo vode
|
Množstvo emisií
|
Rýchlosť emisie
|
|
x
|
y
|
z
|
Priemer
|
x
|
y
|
z
|
Priemer
|
x
|
y
|
z
|
Priemer
|
|
|
Dátum
|
mg/l
|
mg/l
|
mg/l
|
mg/l
|
mg/m2
|
mg/m2
|
mg/m2
|
mg/m2
|
mg/m2/d
|
mg/m2/d
|
mg/m2/d
|
mg/m2/d
|
|
6 hod.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
24 hod.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 dni
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 dni
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8 dní
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
15 dní
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
22 dní
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
29 dní
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Poznámka: Keďže na korekciu rýchlostí emisie z ošetrených vzoriek môže byť nutné použiť výsledky pre neošetrené vzorky, výsledky pre neošetrené vzorky by mali byť k dispozícii ako prvé a všetky hodnoty pre ošetrené vzorky budú ‚opravené hodnoty‘. Môže sa vykonať aj korekcia počiatočnej analýzy vody.
Dodatok 2
Vymedzenie pojmov
Chemikália
: látka alebo zmes.
Testovaná chemikália
: akákoľvek látka alebo zmes, ktorá sa testuje pomocou tejto testovacej metódy.
C.46. BIOAKUMULÁCIA PRI BENTICKÝCH MÁLOŠTETINAVCOCH ŽIJÚCICH V SEDIMENTE
ÚVOD
|
1.
|
Táto testovacia metóda je rovnocenná s usmernením OECD na vykonávanie testov (TG) 2008. Endobentické živočíchy živiace sa sedimentom môžu byť vystavené látkam viazaným na sediment (1). Medzi týmito živočíchmi živiacimi sa sedimentom zohrávajú vodné máloštetinavce významnú úlohu na dnách vodných systémov. Žijú v sedimente a často sú najrozšírenejšími druhmi najmä na biotopoch s podmienkami životného prostredia, ktoré sú pre iné živočíchy nepriaznivé. Tieto živočíchy vzhľadom na bioturbáciu sedimentu a skutočnosť, že bývajú častou korisťou, môžu významne ovplyvňovať biodostupnosť týchto látok pre iné organizmy, napr. bentivorné ryby. Na rozdiel od epibentických organizmov sa endobentické vodné máloštetinavce zahrabávajú do sedimentu a živia sa časticami sedimentu pod jeho povrchom. Z tohto dôvodu sú tieto organizmy vystavené látkam prostredníctvom mnohých spôsobov absorpcie vrátane priameho kontaktu, požierania kontaminovaných častíc sedimentu, vody nachádzajúcej sa v póroch sedimentu a nadložnej vody. Niektoré druhy bentických máloštetinavcov, ktoré sa v súčasnosti využívajú v ekotoxikologickom testovaní, sú opísané v dodatku 6.
|
|
2.
|
Medzi parametre, ktoré charakterizujú bioakumuláciu látky, patrí predovšetkým bioakumulačný faktor (BAF), konštanta vyjadrujúca rýchlosť sorpcie látok sedimentu (ks) a konštanta rýchlosti eliminácie (ke). Podrobné vymedzenie týchto parametrov je uvedené v dodatku 1.
|
|
3.
|
Na vyhodnotenie bioakumulačného potenciálu látok vo všeobecnosti a na skúmanie bioakumulácie látok, ktoré majú tendenciu rozdeľovať sa do sedimentov a na ne, je potrebná testovacia metóda špecifická pre daný kompartment (1) (2) (3) (4).
|
|
4.
|
Táto testovacia metóda je určená na hodnotenie bioakumulácie látok viazaných na sediment pri endobentických červoch máloštetinavcoch. Testovaná látka sa aplikuje do sedimentu. Použitím obohateného sedimentu sa simuluje kontaminovaný sediment.
|
|
5.
|
Táto metóda je založená na existujúcich testovacích metódach stanovenia toxicity a bioakumulácie v sedimente (1) (4) (5) (6) (7) (8) (9). Ďalšie užitočné dokumenty: diskusie a výsledky z medzinárodného seminára (11) a výsledok medzinárodného kruhového testu (12).
|
|
6.
|
Táto skúška sa týka stabilných neutrálnych organických látok, ktoré majú tendenciu viazať sa na sediment. Pomocou tejto metódy možno merať aj bioakumuláciu stabilných organokovových zlúčenín, ktoré sa viažu na sediment (12). Nemožno ju použiť na kovy a iné stopové prvky (11) bez úpravy koncepcie testu s ohľadom na substrát a objemy vody a prípadne na veľkosť vzorky tkaniva.
|
PREDPOKLADY A INFORMÁCIE O TESTOVANEJ LÁTKE
|
7.
|
V súčasnosti existuje iba niekoľko dobre stanovených kvantitatívnych vzťahov štruktúry a aktivity (QSAR) v súvislosti s procesmi bioakumulácie (14). Najpoužívanejším vzťahom je korelácia medzi bioakumuláciou a biokoncentráciou stabilných organických látok a ich lipofilitou [vyjadrená ako logaritmus rozdeľovacej konštanty oktanol – voda (log Kow), vymedzenie pojmu nájdete v dodatku 1], ktorá sa používa na opis rozdeľovania látky medzi vodu a ryby. Pomocou tohto vzťahu sa stanovili aj korelácie pre kompartment sedimentu (15) (16) (17) (18). Korelácia medzi hodnotami log Kow a log BCF (logaritmus faktora biokoncentrácie) ako hlavný ukazovateľ QSAR môže byť užitočná na prvý predbežný odhad bioakumulačného potenciálu látok viazaných na sediment. Hodnota BAF však môže byť ovplyvnená obsahom lipidov v testovacom organizme a obsahom organického uhlíka v sedimente. Preto možno ako hlavný faktor bioakumulácie organických látok viazaných na sediment použiť aj rozdeľovaciu konštantu organický uhlík – voda (Koc).
|
|
8.
|
Tento test sa uplatňuje na:
|
—
|
stabilné organické látky s hodnotami log Kow medzi 3,0 a 6,0 (5) (19) a superlipofilné látky s hodnotou log Kow vyššou ako 6,0 (5),
|
|
—
|
látky patriace do triedy organických látok známych svojím bioakumulačným potenciálom v živých organizmoch, napr. povrchovo aktívne látky alebo vysoko adsorpčné látky (napr. vysoká hodnota Koc).
|
|
|
9.
|
Pred začiatkom štúdie je potrebné získať informácie o testovanej látke, napríklad o bezpečnostných preventívnych opatreniach, vhodných podmienkach skladovania a stabilite, ako aj o analytických metódach. Usmernenia na testovanie látok s fyzikálno-chemickými vlastnosťami, ktoré sťažujú ich testovanie, sú uvedené v odkazoch (20) a (21). Pred vykonaním testu bioakumulácie s vodnými máloštetinavcami musia byť známe tieto informácie o testovanej látke:
|
—
|
bežný názov, chemický názov (podľa možnosti názov IUPAC), štruktúrny vzorec, registračné číslo CAS, čistota,
|
|
—
|
rozpustnosť vo vode [testovacia metóda A.6 (22) ],
|
|
—
|
rozdeľovacia konštanta oktanol – voda, Kow [testovacie metódy A.8, A.24 (22)],
|
|
—
|
rozdeľovacia konštanta sediment – voda vyjadrený ako Kd alebo Koc [testovacia metóda C.19 (22)],
|
|
—
|
hydrolýza [testovacia metóda C.7 (22)],
|
|
—
|
fototransformácia vo vode (23),
|
|
—
|
tlak pary [testovacia metóda A.4 (22)],
|
|
—
|
ľahká biodegradovateľnosť [testovacie metódy C.4 a C.29 (22)],
|
|
—
|
povrchové napätie [testovacia metóda A.5 (22)],
|
|
—
|
kritická koncentrácia micel (24).
|
Okrem toho sú dôležité aj tieto informácie – ak sú dostupné:
|
—
|
biodegradácia vo vodnom prostredí [testovacie metódy C.24 a C.25 (22)],
|
|
|
10.
|
Rádioaktívne označené testované látky môžu uľahčiť analýzu vzoriek vody, sedimentu a biologických vzoriek a môžu sa použiť na stanovenie toho, či sa má vykonať identifikácia a kvantifikácia produktov degradácie. Metóda, ktorá je tu opísaná, bola validovaná v medzinárodnom kruhovom teste (12) pre látky označené uhlíkom 14C. Ak sa merajú celkové rádioaktívne rezíduá, bioakumulačný faktor (BAF) je založený na východiskovej látke vrátane všetkých zachovaných produktov degradácie. Takisto je možné skombinovať štúdiu metabolizmu so štúdiou bioakumulácie prostredníctvom analýzy a kvantifikácie percenta východiskovej látky a produktov jej degradácie vo vzorkách odobratých na konci vychytávacej fázy alebo na vrcholovej úrovni bioakumulácie. V každom prípade sa odporúča, aby výpočet hodnoty BAF vychádzal z koncentrácie východiskovej látky v organizmoch, nielen z celkových rádioaktívnych rezíduí.
|
|
11.
|
Okrem vlastností testovanej látky medzi ďalšie požadované informácie patrí toxicita pre druhy máloštetinavcov použité v teste, napríklad stredná letálna koncentrácia (LC50) v čase potrebnom na vychytávaciu fázu, aby sa zabezpečilo, že zvolené koncentrácie expozície sú oveľa nižšie ako toxické úrovne. Prednostne by sa mali použiť hodnoty toxicity získané z dlhodobých štúdií o subletálnych sledovaných parametroch (EC50), ak sú k dispozícii. Ak také údaje nie sú dostupné, užitočné informácie môže poskytnúť test akútnej toxicity za podmienok, ktoré sú identické s podmienkami testovania bioakumulácie, alebo údaje o toxicite pre iné náhradné druhy.
|
|
12.
|
Musí byť k dispozícii vhodná analytická metóda známej správnosti, presnosti a citlivosti na kvantifikáciu látky v testovacích roztokoch, sedimente a biologickom materiáli, ako aj údaje o príprave a skladovaní vzoriek a karty bezpečnostných údajov o materiáli. Treba poznať aj analytické detekčné limity testovanej látky vo vode, v sedimente a v tkanivách červov. Ak sa použije rádioaktívne označená testovaná látka, je nutné poznať aj špecifickú rádioaktivitu (t. j. Bq mol– 1), polohu rádioaktívne označeného atómu a percento rádioaktivity spojenej s nečistotami. Špecifická rádioaktivita testovanej látky by mala byť čo najvyššia, aby bolo možné zistiť čo najnižšie testované koncentrácie (11).
|
|
13.
|
Mali by byť k dispozícii informácie o charakteristikách použitého sedimentu [napr. pôvod sedimentu alebo jeho zložiek, pH a koncentrácia amoniaku vo vode nachádzajúcej sa v póroch sedimentu (terénne sedimenty), obsah organického uhlíka (TOC), rozdelenie veľkosti častíc (percento piesku, siltu a ílu) a percento suchej hmotnosti] (6).
|
PRINCÍP TESTU
|
14.
|
Test sa skladá z dvoch fáz: vychytávacej fázy (expozícia) a fázy eliminácie (po expozícii). Počas vychytávacej fázy sa červy vystavia pôsobeniu sedimentu obohateného testovanou látkou s rekonštituovanou vodou navrchu, podľa potreby po dosiahnutí rovnovážneho stavu (11). Skupiny kontrolných červov sa chovajú v tých istých podmienkach bez testovanej látky.
|
|
15.
|
Vo fáze eliminácie sa červy prenesú do systému sediment – voda, ktorý neobsahuje testovanú látku. Fáza eliminácie je nutná na získanie informácií o rýchlosti, ktorou testovacie organizmy vylučujú testovanú látku (19) (25). Fáza eliminácie je nutná vždy okrem prípadu, keď je absorpcia testovanej látky počas fázy expozície bezvýznamná (napr. neexistuje štatistický rozdiel medzi koncentráciou testovanej látky v teste a v kontrolných červoch). Ak sa v priebehu vychytávacej fázy nedosiahol ustálený stav, stanovenie kinetických parametrov – hodnoty BAFk, rýchlostných konštánt vychytávania a eliminácie – možno vykonať pomocou výsledkov pre fázu eliminácie. Zmena koncentrácie testovanej látky v/na červoch sa monitoruje v priebehu oboch fáz testu.
|
|
16.
|
Počas vychytávacej fázy sa vykonávajú merania, až kým hodnota BAF nedosiahne plató alebo ustálený stav. Vychytávacia fáza by štandardne mala trvať 28 dní. Z praktických skúseností vyplynulo, že pre viaceré stabilné neutrálne organické látky stačí na dosiahnutie ustáleného stavu 12-dňová až 14-dňová vychytávacia fáza (6) (8) (9).
|
|
17.
|
Ak sa však ustálený stav nedosiahne do 28 dní, začne sa fáza eliminácie prenesením vystavených máloštetinavcov do nádob obsahujúcich rovnaké médium bez testovanej látky. Fáza eliminácie sa ukončí vtedy, keď sa dosiahne 10 % úroveň koncentrácie nameranej v červoch v 28. deň vychytávacej fázy, alebo po uplynutí maximálneho trvania desať dní. Úroveň rezíduí v červoch na konci fázy eliminácie sa do správy uvedie ako dodatočný sledovaný parameter, napr. ako neeliminované rezíduá (NER). Bioakumulačný faktor (BAFss) sa podľa možnosti vypočíta ako pomer koncentrácie v červoch (Ca) a v sedimente (Cs) v zrejmom ustálenom stave aj ako kinetický bioakumulačný faktor BAFK ako pomer rýchlostnej konštanty vychytávania zo sedimentu (ks) a rýchlostnej konštanty eliminácie (ke) pri predpoklade kinetiky prvého rádu. Ak sa ustálený stav nedosiahne do 28 dní, hodnotu BAFK vypočítajte z rýchlostných konštánt vychytávania a eliminácie. Výpočet nájdete v dodatku 2. Ak nie je možné použiť kinetiku prvého rádu, mali by sa použiť zložitejšie modely [dodatok 2 a odkaz (25)].
|
|
18.
|
Ak sa ustálený stav nedosiahne do 28 dní, vychytávacia fáza sa prípadne môže predĺžiť, pričom skupiny vystavených červov – ak sú k dispozícii – sa podrobia ďalším meraniam, až kým sa nedosiahne ustálený stav. Súbežne sa však v 28. deň vychytávacej fázy musí začať aj fáza eliminácie.
|
|
19.
|
Rýchlostná konštanta vychytávania, rýchlostná konštanta eliminácie (alebo konštanty, ak sa použili zložitejšie modely), kinetický bioakumulačný faktor (BAFK) a podľa možnosti hranice spoľahlivosti každého z týchto parametrov sa vypočítajú pomocou počítačových modelových rovníc (modely nájdete v dodatku 2). Správnosť odhadu každého modelu možno stanoviť na základe korelačného koeficientu alebo koeficientu určenia (koeficienty blízke hodnote 1 znamenajú vysokú mieru správnosti odhadu).
|
|
20.
|
Na zníženie variability výsledkov testu v prípade organických látok s vysokou lipofilitou by sa bioakumulačné faktory mali vyjadriť aj vo vzťahu k obsahu lipidov v testovacích organizmoch a k obsahu organického uhlíka (TOC) v sedimente (akumulačný faktor bioty k sedimentu alebo BSAF ako hodnota TOC sedimentu v kg vydelená obsahom lipidov v červoch v kg). Tento prístup je založený na skúsenostiach a teoretických koreláciách pre vodný kompartment, kde v prípade niektorých tried chemikálií existuje zrejmý vzťah medzi bioakumulačným potenciálom látky a jej lipofilitou, ktorý bol jasne stanovený pri rybách ako modelových organizmoch (14) (25) (27). Existuje tiež vzťah medzi obsahom lipidov v testovacích rybách a pozorovanou bioakumuláciou týchto látok. V prípade bentických organizmov sa zistili podobné korelácie (15) (16) (17) (18). Ak je k dispozícii dostatok tkaniva z červov, obsah lipidov v testovacích živočíchoch možno určiť na rovnakom biologickom materiáli, aký sa použil na určenie koncentrácie testovanej látky. Je však praktické aspoň na začiatku alebo – podľa možnosti – na konci vychytávacej fázy použiť aklimatizované kontrolné živočíchy na odmeranie obsahu lipidov, ktorý sa následne môže použiť na normalizáciu hodnôt BAF.
|
VALIDITA TESTU
|
21.
|
Ak má byť test platný, musia platiť tieto podmienky:
|
—
|
kumulatívna úmrtnosť červov (v kontrolných skupinách a skupinách s aplikovanou látkou) do konca testu by nemala prekročiť 20 % pôvodného počtu,
|
|
—
|
okrem toho je potrebné preukázať, že červy sa zahrabávajú do sedimentu, aby sa dosiahla maximálna expozícia. Podrobnosti nájdete v bode 28.
|
|
OPIS METÓDY
Testovacie druhy
|
22.
|
V teste možno použiť viaceré druhy vodných máloštetinavcov. Najčastejšie používané druhy sú uvedené v dodatku 6.
|
|
23.
|
Testy toxicity (96 hod., len vo vode) by sa mali vykonávať v pravidelných intervaloch (napr. každý mesiac) s referenčnou toxickou látkou, ako je chlorid draselný (KCl) alebo síran meďnatý (CuSO4), (1) na preukázanie zdravotného stavu testovacích živočíchov (1) (6). Ak sa referenčné testy toxicity nevykonávajú v pravidelných intervaloch, dávka organizmov, ktoré sa majú použiť v teste bioakumulácie zo sedimentu, by sa mala skontrolovať pomocou referenčnej toxickej látky. Užitočné informácie o stave živočíchov môže poskytnúť aj meranie obsahu lipidov.
|
Kultivácia testovacích organizmov
|
24.
|
S cieľom získať dostatočný počet červov na vykonanie testov bioakumulácie sa červy môžu chovať v stálej jednodruhovej laboratórnej kultúre. Metódy laboratórnej kultivácie pre zvolené testovacie druhy sú zhrnuté v dodatku 6. Podrobnosti nájdete v odkazoch (8) (9) (10) (18) (28) (29) (30) (31) (32).
|
Prístroje
|
25.
|
V prípade všetkých častí zariadenia treba dbať na to, aby sa predišlo používaniu materiálov, ktoré sa môžu rozpustiť, absorbovať testované látky alebo vylúhovať iné látky a ktoré majú škodlivé účinky na testovacie živočíchy. Možno použiť štandardné komory pravouhlého alebo valcovitého tvaru vyrobené z chemicky inertného materiálu a s primeranou kapacitou, ktoré zodpovedajú veľkosti násady, t. j. počtu testovacích červov. Treba sa vyhnúť použitiu rúrok z mäkkých plastov na aplikovanie vody alebo vzduchu. Všetky zariadenia, ktoré prichádzajú do kontaktu s testovacími médiami, by mali byť vyrobené z polytetrafluóretylénu, nehrdzavejúcej ocele alebo skla. V prípade látok s vysokým adsorpčným koeficientom, ako sú syntetické pyretroidy, môže byť potrebné silanizované sklo. V týchto prípadoch je potrebné zariadenia po použití zlikvidovať (5). V prípade rádioaktívne označených testovaných látok a prchavých látok sa treba vyhnúť stripovaniu a úniku stripovanej testovanej látky. Na zachytenie všetkých rezíduí odparených zo skúšobných komôr by sa mali použiť zachytávače (napr. sklenené fľaše na premývanie plynu) obsahujúce vhodné absorbenty.
|
Voda
|
26.
|
Nadložná voda musí mať takú kvalitu, aby umožnila prežitie testovaného druhu počas celého obdobia aklimatizácie a testovania bez toho, aby sa prejavil nezvyčajný vzhľad alebo správanie. V testoch i laboratórnych kultúrach červov sa ako nadložnú vodu odporúča použiť rekonštituovanú vodu podľa testovacej metódy C.1 (25). Preukázalo sa, že v tejto vode môžu prežiť, rásť a rozmnožovať sa viaceré testovacie druhy (8), pričom je zabezpečená maximálna štandardizácia podmienok testu a kultivácie. Vodu je potrebné charakterizovať aspoň z hľadiska pH, vodivosti a tvrdosti. Užitočné informácie môže pred použitím poskytnúť analýza vody z hľadiska znečisťujúcich mikrolátok (dodatok 4).
|
|
27.
|
Voda musí mať počas celého trvania testu stálu kvalitu. Hodnota pH nadložnej vody by mala byť medzi 6 a 9. Celková tvrdosť by na začiatku testu mala byť medzi 90 a 400 mg CaCO3 na liter (7). Rozsahy pH a tvrdosti uvedenej rekonštituovanej vody sú uvedené v testovacej metóde C.1 (25). Ak existuje podozrenie na interakciu medzi iónmi tvrdosti a testovanou látkou, mala by sa použiť voda s nižšou tvrdosťou. V dodatku 4 sú zhrnuté ďalšie kritériá prijateľnej riediacej vody podľa usmernenia OECD TG 210 (34).
|
Sediment
|
28.
|
Sediment musí mať takú kvalitu, aby umožnila prežitie a podľa možnosti rozmnožovanie testovacích organizmov počas celého obdobia aklimatizácie a testovania bez toho, aby sa prejavil nezvyčajný vzhľad alebo správanie organizmov. Červy by sa mali zahrabávať do sedimentu. Zahrabávanie môže mať vplyv na expozíciu a následne aj na hodnotu BAF. Preto ak to zakalenie nadložnej vody umožňuje, malo by sa zaznamenať vyhýbanie sedimentu alebo zahrabávanie testovacích organizmov. Červy (v kontrolných skupinách i v skupinách s aplikovanou látkou) by sa mali zahrabať do sedimentu do 24 hodín od pridania do testovacích nádob. Ak sa pozoruje trvalé nezahrabávanie sa alebo vyhýbanie sa sedimentu (napr. viac ako 20 % v priebehu vyše polovicevychytávacej fázy), znamená to, že buď podmienky testovania nie sú vhodné, že testovacie organizmy nie sú zdravé alebo že toto správanie spôsobuje koncentrácia testovanej látky. V takom prípade je potrebné test zastaviť a zopakovať ho za upravených podmienok. Ďalšie informácie o požieraní sedimentu možno získať použitím metód opísaných v odkazoch (35) (36), ktorými sa stanovuje požieranie sedimentu alebo výber častíc pri testovacích organizmoch. Ak to je možné, je potrebné zaznamenať aspoň prítomnosť alebo neprítomnosť fekálnych peliet na povrchu sedimentu, ktoré poukazujú na požieranie sedimentu červami. Tieto informácie je nutné zohľadniť pri interpretácii výsledkov testu, pokiaľ ide o spôsoby expozície.
|
|
29.
|
V teste aj laboratórnych kultúrach červov (dodatok 5) sa odporúča použiť umelý sediment založený na umelo pripravenej pôde opísanej v testovacej metóde C.8 (40), lebo prírodné sedimenty dostatočnej kvality nemusia byť k dispozícii po celý rok. Test okrem toho môžu ovplyvniť aj pôvodné organizmy, ako aj možná prítomnosť znečisťujúcich mikrolátok v prírodných sedimentoch. V umelom sedimente môžu prežiť, rásť a rozmnožovať sa viaceré testovacie druhy (8).
|
|
30.
|
Umelý sediment je nutné charakterizovať aspoň z hľadiska pôvodu zložiek, rozdelenia veľkosti častíc (percento piesku, siltu a ílu), obsahu organického uhlíka (TOC), obsahu vody a pH. Meranie oxidačno-redukčného potenciálu je voliteľné. Ako testovací a/alebo kultivačný sediment sa však môže použiť prírodný sediment z neznečistených miest (1). Prírodné sedimenty je nutné charakterizovať aspoň z hľadiska pôvodu (miesta odberu), pH a obsahu amoniaku vo vode nachádzajúcej sa v póroch sedimentu, obsahu organického uhlíka (TOC), rozdelenia veľkosti častíc (percento piesku, siltu a ílu) a percentuálneho obsahu vody (6). Ak sa očakáva tvorba amoniaku, odporúča sa, aby sa prírodný sediment pred aplikovaním testovanej látky uviedol na sedem dní do podmienok, ktoré sa použijú v nasledujúcom teste. Na konci obdobia uvádzania do podmienok je nutné odstrániť a zlikvidovať nadložnú vodu. Analýzou sedimentu alebo jeho zložiek pred použitím možno získať užitočné informácie o znečisťujúcich mikrolátkach.
|
Príprava
|
31.
|
Manipulácia s prírodnými sedimentmi pred použitím v laboratóriu je opísaná v (1) (6) (44). Príprava umelého sedimentu je opísaná v dodatku 5.
|
Skladovanie
|
32.
|
Skladovanie prírodných sedimentov v laboratóriu by malo byť čo najkratšie. U.S. EPA (6) odporúča maximálnu dĺžku skladovania osem týždňov pri teplote 4 °C ± 2 °C v tme. V skladovacích nádobách by nad sedimentom nemal byť žiadny uzavretý priestor. Odporúčania na skladovanie umelého sedimentu sú uvedené v dodatku 5.
|
Aplikácia testovanej látky
|
33.
|
Sediment sa obohatí testovanou látkou. Postup obohacovania zahŕňa nanesenie testovanej chemikálie na jednu alebo viacero zložiek sedimentu. Napríklad kremenný piesok alebo jeho časť (napr. 10 g kremenného piesku na testovaciu nádobu) možno napustiť roztokom testovanej látky vo vhodnom rozpúšťadle, ktoré sa následne pomaly odparí do sucha. Časť s nánosom možno potom zamiešať do mokrého sedimentu. Pri príprave sedimentu je nutné zohľadniť množstvo piesku, ktorý pochádza zo zmesi testovanej látky a piesku, čiže sediment by sa mal pripraviť s menším množstvom piesku (6).
|
|
34.
|
Ak sa použije prírodný sediment, testovanú látku možno pridať obohatením vysušenej časti sedimentu podľa opisu pre umelý sediment alebo primiešaním testovanej látky do mokrého sedimentu s následným odparením prípadne použitého solubilizačného prostriedku. Medzi vhodné rozpúšťadlá, ktoré možno použiť na obohatenie mokrého sedimentu, patrí etanol, metanol, etylénglykolmonometyléter, etylénglykoldimetyléter, dimetylformamid a trietylénglykol (5) (34). Hlavnými kritériami pri výbere vhodného solubilizačného prostriedku by mali byť toxicita a prchavosť rozpúšťadla a rozpustnosť testovanej látky vo vybratom rozpúšťadle. Ďalšie usmernenia o postupoch obohacovania obsahuje Environment Canada (1995) (41). Je nutné zabezpečiť, aby sa testovaná látka pridávaná do sedimentu v sedimente dôkladne a rovnomerne distribuovala. Mali by sa analyzovať replikované podvzorky obohateného sedimentu, aby sa skontrolovali koncentrácie testovanej látky v sedimente a aby sa stanovila úroveň homogenity distribúcie testovanej látky.
|
|
35.
|
Keď je obohatený sediment s nadložnou vodou pripravený, je vhodné umožniť rozdelenie testovanej chemikálie medzi sediment a vodnú fázu. To by sa podľa možnosti malo vykonať za rovnakých teplotných a prevzdušňovacích podmienok aké sa použijú v teste. Primeraný čas dosahovania rovnováhy závisí od konkrétneho sedimentu a látky a môže trvať niekoľko hodín až dní a v zriedkavých prípadoch až niekoľko týždňov (štyri až päť týždňov) (28) (42). V tomto teste sa neočakáva dosiahnutie rovnovážneho stavu, ale odporúča sa obdobie dosahovania rovnováhy v trvaní 48 hodín až sedem dní. V závislosti od účelu štúdie, napr. ak sa napodobňujú podmienky životného prostredia, sa obohatený sediment môže nechať dosahovať rovnováhu alebo zrieť dlhšie (11).
|
VYKONANIE TESTU
Predbežná skúška
|
36.
|
V záujme optimalizácie podmienok hlavného testovania môže byť užitočné vykonať predbežný experiment zameraný napríklad na voľbu koncentrácie/koncentrácií testovanej látky a trvanie vychytávacej fázy a fázy eliminácie. Počas predbežnej skúšky sa pozoruje a zaznamenáva správanie červov, napríklad vyhýbanie sa sedimentu, teda únik červov zo sedimentu, ktoré môže byť spôsobené testovanou látkou a/alebo samotným sedimentom. Vyhýbanie sa sedimentu sa v predbežnej skúške môže použiť aj ako subletálny parameter na odhad koncentrácií testovanej látky, ktoré sa majú použiť v teste bioakumulácie.
|
Podmienky expozície
Trvanie vychytávacej fázy
|
37.
|
Testovacie organizmy sa počas vychytávacej fázy vystavia pôsobeniu testovanej látky. Prvá vzorka sa odoberie po 4 až 24 hodinách od začiatku vychytávacej fázy. Okrem prípadov, v ktorých sa dosiahne rovnováha preukázateľne skôr, by vychytávacia fáza mala trvať maximálne 28 dní (1) (6) (11). Ustálený stav nastáva vtedy, keď: i) je krivka závislosti bioakumulačných faktorov v jednotlivých časoch odberu vzoriek od času rovnobežná s časovou osou, ii) tri po sebe nasledujúce analýzy hodnôt BAF vzoriek odobratých v intervaloch najmenej dvoch dní sa navzájom nelíšia o viac ako ± 20 % a iii) neexistujú významné rozdiely medzi tromi časmi odberu vzoriek (na základe štatistických porovnaní, napr. analýzy rozptylu a regresnej analýzy). Ak sa rovnovážny stav nedosiahne do 28 dní, vychytávaciu fázu možno ukončiť začatím fázy eliminácie a hodnotu BAFK možno vypočítať z rýchlostných konštánt vychytávania a eliminácie (pozri tiež body 16 až 18).
|
Trvanie fázy eliminácie
|
38.
|
Prvá vzorka sa odoberie po 4 až 24 hodinách od začiatku fázy eliminácie, lebo v úvodnom období môže dôjsť k náhlym zmenám v rezíduu tkaniva. Fázu eliminácie sa odporúča ukončiť buď vtedy, keď je koncentrácia testovanej látky nižšia ako 10 % koncentrácie v ustálenom stave, alebo maximálne po desiatich dňoch. Úroveň rezíduí v červoch na konci fázy eliminácie sa do správy uvedie ako sekundárny sledovaný parameter. Toto obdobie však možno stanoviť ako obdobie, počas ktorého je koncentrácia testovanej látky v červoch vyššia ako analytický detekčný limit.
|
Testovacie organizmy
Počet testovacích červov
|
39.
|
Počet červov na vzorku musí predstavovať takú hmotnosť tkaniva červov, aby bola hmotnosť testovanej látky na vzorku na začiatku vychytávacej fázy, resp. na konci fázy eliminácie výrazne vyššia ako detekčný limit testovanej látky v biologickom materiáli. V uvedených štádiách vychytávacej fázy a fázy eliminácie je koncentrácia v testovacích živočíchoch zvyčajne pomerne nízka (6) (8) (18). Keďže individuálna hmotnosť mnohých druhov vodných máloštetinavcov je veľmi nízka (5 – 10 mg mokrej hmotnosti na jedinca v prípade Lumbriculus variegatus a Tubifex tubifex), červy z daného replikátu skúšobnej komory sa môžu na účely váženia a analýzy testovanej chemikálie spojiť. V prípade testovacích druhov s vyššou individuálnou hmotnosťou (napr. Branchiura sowerbyi) možno použiť replikáty obsahujúce jedného jedinca, ale v týchto prípadoch by sa počet replikátov mal zvýšiť na päť na bod odberu vzoriek (11). Treba však poznamenať, že druh B. sowerbyi nebol zahrnutý do kruhového testu (12), a preto sa neodporúča ako vhodný druh pre túto metódu.
|
|
40.
|
Mali by sa použiť červy podobnej veľkosti (informácie o druhu L. variegatus nájdete v dodatku 6). Mali by pochádzať z toho istého zdroja a malo by ísť o dospelých jedincov alebo veľké živočíchy tej istej vekovej triedy (pozri dodatok 6). Hmotnosť a vek živočícha môžu mať významný vplyv na hodnoty BAF (napr. v dôsledku rôzneho obsahu lipidov a/alebo prítomnosti vajíčok). Tieto parametre je potrebné presne zaznamenať. Na účely merania priemernej mokrej a suchej hmotnosti sa pred začatím testu odváži podvzorka červov.
|
|
41.
|
Očakáva sa, že červy druhov Tubifex tubifex a Lumbriculus variegatus sa počas trvania testu budú rozmnožovať. Neprítomnosť rozmnožovania v teste bioakumulácie by sa mala zaznamenať a vziať do úvahy pri interpretácii výsledkov testu.
|
Násada
|
42.
|
Mali by sa použiť vysoké pomery sedimentu k červom a vody k červom, aby sa minimalizovalo znižovanie koncentrácie testovanej látky v sedimente počas vychytávacej fázy a aby sa predišlo poklesu koncentrácie rozpusteného kyslíka. Zvolený stupeň zaťaženia by takisto mal zodpovedať prirodzene sa vyskytujúcim hustotám populácie vybratého druhu (43). Napríklad v prípade druhu Tubifex tubifex sa odporúča stupeň zaťaženia 1 – 4 mg tkaniva červov (mokrá hmotnosť) na gram mokrého sedimentu (8) (11). V odkazoch (1) a (6) sa pre druh L. variegatus odporúča stupeň zaťaženia ≤ 1 g suchej hmotnosti tkaniva červov na 50 g organického uhlíka v sedimente.
|
|
43.
|
Červy, ktoré sa použijú v teste, sa odoberú z kultúry preosiatím kultivačného sedimentu. Živočíchy (dospelé alebo veľké červy bez známok nedávnej fragmentácie) sa prenesú do sklenených misiek (napr. Petriho misiek) obsahujúcich čistú vodu. Ak sa podmienky testovania líšia od podmienok kultivácie, mala by stačiť fáza aklimatizácie v trvaní 24 hodín. Pred vážením sa má z červov odstrániť nadbytočná voda. Na tieto účely možno červy opatrne uložiť na navlhčenú papierovú servítku. Neodporúča sa na sušenie červov používať absorpčný papier, lebo im to môže spôsobiť stres alebo poškodenie. Brunson et al. (1998) odporučili použiť nevytreté červy s hmotnosťou približne 1,33-násobku cieľovej biomasy. Týchto dodatočných 33 % zodpovedá rozdielu medzi vytretými a nevytretými červami (28).
|
|
44.
|
Na začiatku vychytávacej fázy (0. deň testu) sa testovacie organizmy vyberú z aklimatizačnej komory a náhodne rozdelia do nádob (napr. Petriho misiek) obsahujúcich rekonštituovanú vodu, a to tak, že skupiny dvoch červov sa pridávajú do jednotlivých nádob, kým každá nádoba neobsahuje desať červov. Každá z týchto skupín červov sa potom náhodne prenesie do samostatných testovacích nádob, napr. pomocou jemnej oceľovej pinzety. Testovacie nádoby sa potom inkubujú za testovacích podmienok.
|
Kŕmenie
|
45.
|
Vzhľadom na nízky obsah živín v umelom sedimente by sa do sedimentu mal pridať zdroj potravy. S cieľom vyhnúť sa podhodnoteniu expozície testovacích organizmov, napr. selektívnym kŕmením nekontaminovanou potravou, by sa potrava potrebná na rozmnožovanie a rast testovacích organizmov mala do sedimentu pridať len raz pred aplikáciou testovanej látky alebo počas nej (pozri dodatok 5).
|
Pomer sediment – voda
|
46.
|
Odporúčaný pomer sediment – voda je 1: 4 (45). Tento pomer sa považuje za vhodný na udržanie koncentrácie kyslíka na vhodnej úrovni a na zabránenie hromadeniu amoniaku v nadložnej vode. Obsah kyslíka v nadložnej vode by sa mal udržiavať na ≥ 40 % saturácie. Nadložná voda v testovacích nádobách by sa mala jemne prevzdušňovať (napr. dve až štyri bubliny za sekundu) pomocou Pasteurovej pipety umiestnenej približne 2 cm nad povrchom sedimentu, aby sa minimalizovalo narušenie sedimentu.
|
Svetlo a teplota
|
47.
|
Fotoperióda v kultúre a v teste je 16 hodín (1) (6). Intenzita svetla v testovacom priestore by sa mala udržiavať približne na 500 – 1 000 lx. Teplota by počas celého testu mala byť 20 ± 2 °C.
|
Testované koncentrácie
|
48.
|
Na stanovenie kinetiky vychytávania sa používa jedna testovaná koncentrácia (čo najnižšia), ale možno použiť aj druhú (vyššiu) koncentráciu [napr. (46)]. V takom prípade sa vzorky odoberajú a analyzujú v ustálenom stave alebo po 28 dňoch s cieľom potvrdiť nameranú hodnotu BAF pri nižšej koncentrácii (11). Vyššia koncentrácia by sa mala zvoliť tak, aby sa vylúčili nepriaznivé účinky (napr. výberom približne 1 % koncentrácie spôsobujúcej najnižší známy chronický účinok ECx získanej z príslušných štúdií chronickej toxicity). Nižšia testovaná koncentrácia by mala byť výrazne vyššia ako detekčný limit v sedimente a biologických vzorkách pre použitú analytickú metódu. Ak je účinná koncentrácia testovanej látky blízko analytickému detekčnému limitu, odporúča sa použiť rádioaktívne označenú testovanú látku s vysokou špecifickou rádioaktivitou.
|
Replikáty s aplikovanou chemikáliou a kontrolné replikáty
|
49.
|
Minimálny počet replikátov s aplikovanou chemikáliou na meranie kinetických vlastností by mal byť tri na bod odberu vzorky (11) počas vychytávacej fázy a fázy eliminácie. Ďalšie replikáty sa majú použiť napr. pre voliteľné dodatočné dni odberu vzoriek. Vo fáze eliminácie sa pripraví zodpovedajúci počet replikátov s neobohateným sedimentom a nadložnou vodou tak, aby bolo možné na konci vychytávacej fázy preniesť červy s aplikovanou chemikáliou z určených nádob s aplikovanou látkou do nádob bez aplikovanej látky. Celkový počet replikátov s aplikovanou látkou by mal byť dostatočný na vychytávaciu fázu i fázu eliminácie.
|
|
50.
|
Alternatívne sa červy určené na odber vzoriek počas fázy eliminácie môžu exponovať v jednej veľkej nádobe obsahujúcej obohatený sediment z tej istej dávky, aká sa použila na stanovenie kinetiky vychytávania. Je potrebné preukázať, že testovacie podmienky (napr. hĺbka sedimentu, pomer sediment – voda, násada, teplota, kvalita vody) sú porovnateľné s replikátmi určenými na vychytávaciu fázu. Na konci vychytávacej fázy sa z tejto nádoby majú odobrať vzorky vody, sedimentu a červov na analýzu a dostatočný počet veľkých červov, ktoré nejavia žiadne známky nedávnej fragmentácie, opatrne sa vyberú a premiestnia do replikátov pripravených na fázu eliminácie (napr. desať organizmov na replikačnú nádobu).
|
|
51.
|
Ak sa nepoužije iné rozpúšťadlo ako voda, malo by sa použiť aspoň deväť replikátov negatívnej kontrolnej skupiny (aspoň tri vzorky na začiatku, tri na konci vychytávania a tri na konci eliminácie) na biologickú analýzu a analýzu pozadia. Ak sa na aplikáciu testovanej látky použije solubilizačný prostriedok, je potrebné vykonať analýzu kontrolnej skupiny s rozpúšťadlom (vzorky aspoň z troch replikátov na začiatku, troch na konci fázy vychytávania a troch na konci fázy eliminácie). V tomto prípade je na odber vzoriek na konci vychytávacej fázy potrebné použiť aspoň štyri replikáty negatívnej kontrolnej skupiny (bez rozpúšťadla). Tieto replikáty možno biologicky porovnať s kontrolnou vzorkou s rozpúšťadlom s cieľom získať informácie o možnom vplyve rozpúšťadla na testovacie organizmy. Podrobnosti sú uvedené v dodatku 3.
|
Frekvencia meraní kvality vody
|
52.
|
Počas vychytávacej fázy a fázy eliminácie by sa v nadložnej vode mali merať minimálne tieto parametre kvality vody:
|
Teplota
|
v jednej nádobe pre každú koncentráciu aplikovanej látky na deň odberu vzoriek a v jednej kontrolnej nádobe raz týždenne a na začiatku a na konci vychytávacej fázy a fázy eliminácie; možno zaznamenávať aj teplotu v okolitom médiu (okolitý vzduch alebo vodný kúpeľ) alebo v jednej reprezentatívnej testovacej nádobe, napr. nepretržite alebo v hodinových intervaloch,
|
|
Obsah rozpusteného kyslíka
|
v jednej nádobe pre každú koncentráciu aplikovanej látky a v jednej kontrolnej nádobe na deň odberu vzoriek, vyjadrený ako mg/l a % ASV (rozpustnosť vzdušného kyslíka),
|
|
Prívod vzduchu
|
kontrolovaný aspoň raz za deň (pracovné dni) a upravený podľa potreby,
|
|
pH
|
v jednej nádobe pre každú koncentráciu aplikovanej látky na deň odberu vzoriek a v jednej kontrolnej nádobe raz týždenne a na začiatku a na konci vychytávacej fázy a fázy eliminácie,
|
|
Celková tvrdosť vody
|
aspoň v jednej nádobe s aplikovanou látkou a v jednej kontrolnej testovacej nádobe na začiatku a na konci vychytávacej fázy a fázy eliminácie, vyjadrená ako mg/l CaCO3,
|
|
Celkový obsah amoniaku
|
aspoň v jednej nádobe s aplikovanou látkou a v jednej kontrolnej testovacej nádobe na začiatku a na konci vychytávacej fázy a fázy eliminácie, vyjadrený ako mg/l NH4
+ alebo NH3, alebo celkový amoniak –N.
|
|
Odber vzoriek a analýza červov, sedimentu a vody
Časový harmonogram odberov vzoriek
|
53.
|
Príklady harmonogramu odberov vzoriek v prípade 28-dňovej vychytávacej fázy a 10-dňovej fázy eliminácie sú uvedené v dodatku 3.
|
|
54.
|
Odoberte vzorky vody a sedimentu zo skúšobných komôr na účely stanovenia koncentrácie testovanej látky pred pridaním červov a počas vychytávacej fázy i fázy eliminácie. V priebehu testu sa stanovia koncentrácie testovanej látky v červoch, sedimente a vode s cieľom monitorovať distribúciu testovanej látky do kompartmentov testovacieho systému.
|
|
55.
|
Vzorky červov, sedimentu a vody odoberte aspoň šesťkrát v priebehu vychytávacej fázy i fázy eliminácie.
|
|
56.
|
Pokračujte v odbere vzoriek, kým sa nedosiahne plató (ustálený stav) (pozri dodatok 1), alebo počas 28 dní. Ak sa plató nedosiahne do 28 dní, začnite fázu eliminácie. Na začiatku fázy eliminácie preneste určené červy do replikačných komôr obsahujúcich neobohatený sediment a vodu (pozri aj body 17 a 18).
|
Odber a príprava vzoriek
|
57.
|
Získajte vzorky dekantáciou, odsaním alebo pipetovaním objemu dostatočného na odmeranie množstva testovanej látky vo vzorke.
|
|
58.
|
Zvyšná nadložná voda sa opatrne dekantuje alebo odsaje z testovacej komory (testovacích komôr). Vzorky sedimentu by sa mali odoberať opatrne, aby sa červy čo najmenej rušili.
|
|
59.
|
V čase odberu vzoriek vyberte všetky červy z testovaného replikátu, napr. tak, že suspendujete sediment s nadložnou vodou a rozotriete obsah každého replikátu na plytkú misku. Červy z nej potom vyberte jemnou oceľovou pinzetou. Rýchlo ich prepláchnite vodou v plytkom pohári alebo na oceľovej miske. Odstráňte prebytočnú vodu. Červy opatrne preneste do vopred odváženej nádoby a odvážte ich. Usmrťte červy zmrazením (napr. ≤ –18 °C). Zaznamenajte prítomnosť a množstvo zámotkov a/alebo mladých jedincov.
|
|
60.
|
Vo všeobecnosti sa červy majú odvážiť a usmrtiť ihneď po odbere vzorky bez fázy vyprázdnenia čriev, aby sa získala konzervatívna hodnota BAF, ktorá zahŕňa kontaminovaný obsah čriev, a aby sa zabránilo strate telesných rezíduí počas obdobia vyprázdňovania čriev len vo vode (8). Očakáva sa, že látky s hodnotami log Kow vyššími ako 5 sa nebudú výrazne eliminovať v prípadnom období vyprázdňovania čriev len vo vode, kým látky s hodnotou log Kow nižšou ako 4 sa môžu eliminovať v značnom množstve (47).
|
|
61.
|
Vo fáze eliminácie červy vyprázdňujú črevá do čistého sedimentu. To znamená, že merania bezprostredne pred fázou eliminácie zahŕňajú sediment s kontaminovaným obsahom čriev, zatiaľ čo pri meraniach po prvých 4 – 24 hodinách fázy eliminácie sa predpokladá, že väčšina kontaminovaného obsahu čriev sa nahradí čistým sedimentom (11) (47). Koncentrácia v červoch z tejto vzorky sa potom môže považovať za koncentráciu v tkanive po vyprázdnení čriev. Na zohľadnenie zriedenia koncentrácie testovanej látky nekontaminovaným sedimentom počas fázy eliminácie možno hmotnosť obsahu čriev odhadnúť na základe pomeru mokrej hmotnosti a hmotnosti popola alebo pomeru suchej hmotnosti a hmotnosti popola červov.
|
|
62.
|
Ak je účelom osobitnej štúdie merať biodostupnosť a skutočné tkanivové rezíduá v testovacích organizmoch, potom sa aspoň podvzorka živočíchov s aplikovanou látkou (napr. z ďalších troch replikačných nádob), ktorá sa podľa možnosti odobrala v ustálenom stave, má odvážiť, nechať vyprázdňovať v čistej vode počas 6 hodín (47) a pred analýzou znova odvážiť. Údaje o hmotnosti červov a telesnej koncentrácii v tejto podvzorke možno potom porovnať s hodnotami získanými z nevyprázdnených červov. Červy určené na meranie eliminácie by sa pred prenosom do čistého sedimentu nemali vyprázdniť, aby sa minimalizoval ďalší stres živočíchov.
|
|
63.
|
Vzorky vody, sedimentu a červov by sa podľa možnosti mali analyzovať ihneď (t. j. do jedného až dvoch dní) po odobratí, aby sa predišlo degradácii alebo iným stratám a aby bolo možné vypočítať približnú rýchlosť vychytávania a eliminácie v priebehu testu. Okamžitou analýzou sa tiež predíde oddialeniu stanovenia dosiahnutia plató.
|
|
64.
|
Ak sa analýza nevykoná ihneď, vzorky by sa mali skladovať za primeraných podmienok. Pred začiatkom štúdie získajte informácie o stabilite a vhodných podmienkach skladovania danej testovanej látky (napr. o trvaní a teplote skladovania, postupoch extrakcie atď.). Ak tieto informácie nie sú k dispozícii a považujú sa za potrebné, na stanovenie stability počas skladovania možno súbežne analyzovať obohatené kontrolné tkanivá.
|
Kvalita analytickej metódy
|
65.
|
Celý postup v zásade závisí od správnosti, presnosti a citlivosti metódy použitej na analýzu testovanej látky. Treba preto experimentálne overiť, či sú presnosť a reprodukovateľnosť chemickej analýzy, ako aj výťažok testovanej látky zo vzoriek vody, sedimentu a červov pre danú metódu uspokojivé. Takisto je potrebné overiť, či testovaná látka nie je zistiteľná v kontrolných komorách vo vyšších koncentráciách ako v pozadí. Ak je to potrebné, opravte hodnoty Cw, Cs a Ca podľa hodnôt výťažku a hodnôt v pozadí pre kontrolné vzorky. So všetkými vzorkami počas celého testu zaobchádzajte tak, aby sa minimalizovala kontaminácia a strata (napr. v dôsledku adsorpcie testovanej látky na zariadenie na odber vzoriek).
|
|
66.
|
Je potrebné zaznamenať a uviesť do správy celkový výťažok a výťažok testovanej látky v červoch, sedimente a vo vode, ako aj v zachytávačoch obsahujúcich absorbenty na zadržanie odparenej testovanej látky, ak sa použijú.
|
|
67.
|
Keďže sa odporúča použiť rádioaktívne označené látky, je možné analyzovať celkovú rádioaktivitu (t. j. východiskovej látky a produktov degradácie). Ak to je však analyticky uskutočniteľné, dôležité informácie možno získať kvantifikáciou východiskovej testovanej látky a produktov degradácie v ustálenom stave alebo na konci vychytávacej fázy. Ak sa majú vykonať tieto merania, vzorky sa podrobia vhodným extrakčným postupom, aby bolo možné samostatne kvantifikovať východiskovú látku. Ak zistený produkt degradácie predstavuje významné percento (napr. > 10 %) rádioaktivity nameranej v testovacích organizmoch v ustálenom stave alebo na konci vychytávacej fázy, odporúča sa identifikovať tieto produkty degradácie (5).
|
|
68.
|
V dôsledku nízkej individuálnej biomasy často nie je možné stanoviť koncentráciu testovanej látky v jednotlivých červoch okrem prípadu, keď sa ako testovací druh použije Branchiura sowerbyi (40 – 50 mg mokrej hmotnosti na červa) (11). Spájanie jedincov odobratých z danej testovacej nádoby je preto prípustné, ale obmedzujú sa tým štatistické postupy, ktoré možno použiť pri spracúvaní výsledkov. Ak sa má použiť konkrétny štatistický postup a spoľahlivosť, v teste sa musí použiť vhodný počet testovacích živočíchov a/alebo replikačných testovacích komôr, ktorý umožňuje želané spájanie vzoriek, postup a spoľahlivosť.
|
|
69.
|
Odporúča sa vyjadriť hodnotu BAF ako funkciu celkovej mokrej hmotnosti i celkovej suchej hmotnosti a v prípade potreby (napr. v prípade vysoko lipofilných látok) aj ako funkciu obsahu lipidov a hodnoty TOC sedimentu. Na stanovenie obsahu lipidov sa majú použiť vhodné metódy (48) (49). Ako štandardnú metódu (48) možno odporúčať extrakciu chloroformom/metanolom (50). S cieľom vyhnúť sa použitiu chlórovaných rozpúšťadiel by sa mala použiť upravená metóda podľa Bligha a Dyera (50) opísaná v literatúre (51), ktorá sa otestovala v kruhovom teste. Keďže rôznymi metódami sa nedospeje k rovnakým hodnotám (48), je dôležité uviesť podrobné informácie o použitej metóde. Ak je to možné, t. j. ak je k dispozícii dostatočné množstvo tkaniva z červov, obsah lipidov sa odmeria na rovnakej vzorke alebo extrakte, aké sa použili na analýzu testovanej látky, lebo pred chromatografickou analýzou je často nutné lipidy z extraktu odstrániť (5). Je však praktické aspoň na začiatku alebo – podľa možnosti – na konci vychytávacej fázy použiť na meranie obsahu lipidov aklimatizované kontrolné živočíchy, napr. v troch vzorkách.
|
ÚDAJE A PODÁVANIE SPRÁV
Spracovanie výsledkov
|
70.
|
Krivka vychytávania testovanej látky sa získa tak, že sa na aritmetickej osi zakreslí jej koncentrácia v/na červoch počas vychytávacej fázy v závislosti od času. Ak krivka dosiahne plató, vypočítajte hodnotu BAFss v ustálenom stave:

|
|
71.
|
Stanovte kinetický bioakumulačný faktor (BAFK) ako pomer ks/ke. Konštanta eliminácie (ke) sa zvyčajne stanoví podľa krivky eliminácie (t. j. znázornenia koncentrácie testovanej látky v červoch počas fázy eliminácie). Rýchlostná konštanta vychytávania ks sa potom vypočíta z kinetiky krivky vychytávania. Uprednostňovanou metódou stanovenia hodnoty BAFK a rýchlostných konštánt ks a ke sú nelineárne metódy odhadovania parametrov pomocou počítača (pozri dodatok 2). Ak je zrejmé, že eliminácia nie je prvého rádu, je potrebné použiť komplexnejšie modely (25) (27) (52).
|
|
72.
|
Akumulačný faktor bioty k sedimentu (BSAF) sa stanoví normalizáciou hodnoty BAFK podľa obsahu lipidov v červoch a celkového obsahu organického uhlíka v sedimente.
|
Interpretácia výsledkov
|
73.
|
Ak sa namerané koncentrácie testovanej látky pohybujú na úrovni blízkej detekčnému limitu použitej analytickej metódy, výsledky treba interpretovať s opatrnosťou.
|
|
74.
|
Jasne vymedzené krivky vychytávania a eliminácie sú známkou dobrej kvality údajov o bioakumulácii. Vo všeobecnosti by hranice spoľahlivosti pre hodnoty BAF v dobre navrhnutých štúdiách nemali presiahnuť 25 % (5).
|
Protokol o skúške
|
75.
|
Protokol o skúške musí obsahovať tieto informácie:
|
|
Testovaná látka
|
—
|
fyzikálny charakter a fyzikálno-chemické vlastnosti, napr. log Kow, rozpustnosť vo vode,
|
|
—
|
chemické identifikačné údaje, zdroj testovanej látky, identita a koncentrácia akéhokoľvek použitého rozpúšťadla,
|
|
—
|
ak sa použije rádioaktívne označená látka, presná poloha označených atómov, špecifická rádioaktivita a percento rádioaktivity spojenej s nečistotami.
|
|
|
|
Testovacie druhy
|
—
|
vedecký názov, kmeň, pôvod, všetky predúpravy, aklimatizácia, vek, rozsah hmotností atď.
|
|
|
|
Podmienky testu
|
—
|
použitý postup testu (napr. statický, semistatický alebo prietokový),
|
|
—
|
typ a charakteristiky použitého osvetlenia a dĺžka fotoperiódy/fotoperiód,
|
|
—
|
koncepcia testu [napr. počet, materiál a veľkosť skúšobných komôr, objem vody, hmotnosť a objem sedimentu, rýchlosť výmeny celého objemu vody (pri prietokových alebo semistatických postupoch), akékoľvek prevzdušňovanie pred testom a počas neho, počet replikátov, počet červov na replikát, počet testovaných koncentrácií, dĺžka vychytávacej fázy a fázy eliminácie, frekvencia odberov vzoriek],
|
|
—
|
metóda prípravy a aplikácie testovanej látky, ako aj dôvody pre výber konkrétnej metódy,
|
|
—
|
nominálne testované koncentrácie,
|
|
—
|
zdroj zložiek umelej vody a sedimentu alebo – ak sa použije prírodné médium – pôvod vody a sedimentu, opis všetkých predúprav, výsledky preukazujúce schopnosť testovacích živočíchov žiť a/alebo rozmnožovať sa v použitom médiu, charakteristiky sedimentu [pH a obsah amoniaku vo vode nachádzajúcej sa v póroch sedimentu (prírodné usadeniny), obsah organického uhlíka (TOC), rozdelenie veľkosti častíc (percento piesku, siltu a ílu), percentuálny obsah vody a všetky ostatné vykonané merania] a vlastnosti vody [pH, tvrdosť, vodivosť, teplota, koncentrácia rozpusteného kyslíka, úroveň zostatkového chlóru (ak sa merala) a všetky ostatné vykonané merania],
|
|
—
|
menovitá a nameraná suchá hmotnosť v % mokrej hmotnosti (alebo pomer suchej hmotnosti k mokrej hmotnosti) umelého sedimentu, nameraná suchá hmotnosť v % mokrej hmotnosti (alebo pomer suchej hmotnosti k mokrej hmotnosti) sedimentov z terénu,
|
|
—
|
kvalita vody v skúšobných komorách charakterizovaná teplotou, pH, obsahom amoniaku, celkovou tvrdosťou a koncentráciou rozpusteného kyslíka,
|
|
—
|
podrobné informácie o manipulácii so vzorkami vody, sedimentu a červov vrátane údajov o príprave, skladovaní, postupoch obohacovania, extrakcii a analytických postupoch (a presnosti) merania obsahu testovanej látky a lipidov a výťažku testovanej látky.
|
|
|
|
Výsledky
|
—
|
úmrtnosť kontrolných červov a červov v jednotlivých skúšobných komorách a všetky pozorované subletálne účinky vrátane nezvyčajného správania (napr. vyhýbanie sa sedimentu, prítomnosť alebo neprítomnosť fekálnych peliet, neprítomnosť rozmnožovania),
|
|
—
|
nameraná suchá hmotnosť v % mokrej hmotnosti (alebo pomer suchej hmotnosti k mokrej hmotnosti) sedimentu a testovacích organizmov (užitočné na účely normalizácie),
|
|
—
|
obsah lipidov v červoch,
|
|
—
|
krivky znázorňujúce vychytávaciu a eliminačnú kinetiku testovanej látky v červoch a čas do dosiahnutia ustáleného stavu,
|
|
—
|
hodnoty Ca, Cs a Cw (so štandardnou odchýlkou a rozsahom, ak je to vhodné) pre všetky časy odberu vzoriek (Ca vyjadrené v g kg– 1 mokrej a suchej hmotnosti celého tela, Cs vyjadrené v g kg– 1 mokrej a suchej hmotnosti sedimentu a Cw v mg l– 1). Ak sa požaduje akumulačný faktor bioty k sedimentu (BSAF, pozri vymedzenie pojmu v dodatku 1) (napr. na porovnanie výsledkov z dvoch alebo viacerých testov vykonaných so živočíchmi s odlišným obsahom lipidov), hodnota Ca by sa navyše mala vyjadriť ako g kg– 1 obsahu lipidov v organizme a hodnota Cs ako g kg– 1 organického uhlíka (OC) v sedimente,
|
|
—
|
hodnota BAF (vyjadrená v kg mokrého sedimentu kg– 1 mokrých červov), konštanta vyjadrujúca rýchlosť sorpcie látok sedimentu ks (vyjadrená v g mokrého sedimentu kg– 1 mokrých červov na deň d– 1) a rýchlostná konštanta eliminácie ke (vyjadrená v dňoch d– 1). Okrem toho možno uviesť aj hodnotu BSAF (vyjadrenú v kg OC sedimentu kg– 1 obsahu lipidov v červoch),
|
|
—
|
neeliminované rezíduá (NER) na konci fázy eliminácie,
|
|
—
|
ak sa merajú: percentá východiskovej látky, produktov degradácie a viazaných rezíduí (t. j. percento testovanej látky, ktorú nemožno extrahovať bežnými metódami extrakcie) zistené v testovacích živočíchoch,
|
|
—
|
metódy použité na štatistické analýzy údajov.
|
|
|
|
Vyhodnotenie výsledkov
|
—
|
súlad výsledkov s kritériami validity uvedenými v bode 21,
|
|
—
|
neočakávané alebo nezvyčajné výsledky, napr. neúplná eliminácia testovanej látky z testovacích živočíchov. V takých prípadoch môžu užitočné informácie poskytnúť výsledky z prípadnej predbežnej štúdie.
|
|
|
Dodatok 1
Vymedzenie pojmov a jednotky
|
|
Umelý sediment alebo umelo pripravený, rekonštituovaný alebo syntetický sediment je zmes materiálov použitých na napodobnenie fyzických zložiek prírodného sedimentu.
|
|
|
Bioakumulácia je zvyšovanie koncentrácie testovanej látky v alebo na organizme vzhľadom na koncentráciu testovanej látky v okolitom médiu. Bioakumulácia je výsledkom procesov biokoncentrácie a biomagnifikácie (pozri ďalej).
|
|
|
Bioakumulačný faktor (BAF) v akomkoľvek čase počas vychytávacej fázy tohto testu bioakumulácie je koncentrácia testovanej látky v/na testovacom organizme (Ca v g kg– 1 mokrej alebo suchej hmotnosti) vydelená koncentráciou látky v okolitom médiu (Cs ako g kg– 1 mokrej alebo suchej hmotnosti sedimentu). V záujme súladu s jednotkami parametrov Ca a Cs sa hodnota BAF uvádza v jednotkách kg sedimentu kg– 1 červov (15).
|
|
|
Bioakumulačné faktory vypočítané priamo na základe pomeru konštanty vyjadrujúcej rýchlosť sorpcie látok sedimentu a rýchlostnej konštanty eliminácie (ks, resp. ke, pozri ďalej) sa označujú ako kinetický bioakumulačný faktor (BAFK).
|
|
|
Biokoncentrácia je zvyšovanie koncentrácie testovanej látky v alebo na organizme, ktoré je výsledkom výlučne absorpcie povrchu telom, vzhľadom na koncentráciu testovanej látky v okolitom médiu.
|
|
|
Biomagnifikácia je zvyšovanie koncentrácie testovanej látky v alebo na organizme, ktoré je dôsledkom najmä vychytávania z kontaminovanej potravy alebo koristi, vzhľadom na koncentráciu testovanej látky v potrave alebo koristi. Biomagnifikácia môže viesť k prenosu alebo akumulácii testovanej látky v rámci potravinového reťazca.
|
|
|
Akumulačný faktor bioty k sedimentu (BSAF) je koncentrácia testovanej látky v ustálenom stave v/na testovacom organizme normalizovaná z hľadiska obsahu lipidov vydelená koncentráciou testovanej látky v ustálenom stave v sedimente normalizovanou z hľadiska obsahu organického uhlíka. Hodnota Ca je potom vyjadrená ako g·kg– 1 obsahu lipidov v organizme a Cs ako g·kg– 1 obsahu organických látok v sedimente.
|
|
|
Obdobie uvádzania do podmienok sa používa na stabilizáciu mikrobiálnej zložky sedimentu a na odstránenie napr. amoniaku pochádzajúceho zo zložiek sedimentu pred obohatením sedimentu testovanou látkou. Po uvedení do podmienok sa zvyčajne odstráni nadložná voda.
|
|
|
Eliminácia testovanej látky je strata tejto látky z tkaniva testovacieho organizmu aktívnymi alebo pasívnymi procesmi, ku ktorým dochádza bez ohľadu na prítomnosť alebo neprítomnosť testovanej látky v okolitom médiu.
|
|
|
Fáza eliminácie je čas nasledujúci po prenose testovacích organizmov z kontaminovaného média do média bez obsahu testovanej látky, počas ktorého sa skúma eliminácia (alebo čistá strata) látky z testovacích organizmov.
|
|
|
Rýchlostná konštanta eliminácie (ke) je číselná hodnota vyjadrujúca rýchlosť znižovania koncentrácie testovanej látky v/na testovacom organizme po prenose testovacích organizmov z média obsahujúceho testovanú látku do média bez chemikálie. Hodnota ke je vyjadrená v dňoch d– 1.
|
|
|
Obdobie dosahovania rovnováhy sa používa na umožnenie rozdelenia testovanej látky medzi pevnú fázu, vodu nachádzajúcu sa v póroch sedimentu a nadložnú vodu pred obohatením sedimentu testovanou látkou a pred pridaním testovacích organizmov.
|
|
|
Rozdeľovacia konštanta oktanol – voda (Kow) je pomer rozpustnosti látky v n-oktanole a vo vode v rovnovážnom stave, niekedy vyjadrený aj ako Pow. Logaritmus Kow (log Kow) sa používa na vyjadrenie potenciálu látky na bioakumuláciu vo vodných organizmoch.
|
|
|
Rozdeľovacia konštanta organický uhlík – voda (Koc) je pomer koncentrácie látky v/na frakcii sedimentu tvorenej organickým uhlíkom a koncentrácie látky vo vode v rovnovážnom stave.
|
|
|
Nadložná voda je voda nachádzajúca sa v testovacej nádobe nad sedimentom.
|
|
|
Plató alebo ustálený stav sa vymedzuje ako rovnováha medzi procesmi vychytávania a eliminácie, ku ktorým dochádza súčasne počas expozičnej fázy. Pri grafickom znázornení závislosti hodnoty BAF v jednotlivých časoch odberu vzoriek od času nastáva ustálený stav vtedy, keď sa priebeh krivky stane rovnobežným s časovou osou a tri po sebe idúce analýzy BAF uskutočnené na vzorkách odobratých minimálne v dvojdňových intervaloch sa od seba neodlišujú o viac ako 20 % a medzi týmito tromi časmi odberu vzoriek neexistujú štatisticky významné rozdiely. V prípade testovaných látok, ktoré sa vychytávajú pomalšie, je vhodnejšie použiť intervaly v trvaní sedem dní (5).
|
|
|
Voda nachádzajúca sa v póroch sedimentu alebo intersticiálna voda je voda nachádzajúca sa v priestore medzi časticami sedimentu alebo pôdy.
|
|
|
Konštanta vyjadrujúca rýchlosť sorpcie látok sedimentu (ks) je číselná hodnota vyjadrujúca rýchlosť zvyšovania koncentrácie testovanej látky v/na testovacom organizme v dôsledku vychytávania zo sedimentovej fázy. Hodnota ks je vyjadrená v g sedimentu kg– 1 červov na deň d– 1.
|
|
|
Obohatený sediment je sediment, do ktorého bola pridaná testovaná látka.
|
|
|
Rovnovážny bioakumulačný faktor (BAFss) je BAF v ustálenom stave, ktorý sa v priebehu dlhšieho obdobia výrazne nemení, pričom koncentrácia testovanej látky v okolitom médiu (Cs ako g kg– 1 mokrej alebo suchej hmotnosti sedimentu) je počas tohto obdobia konštantná.
|
|
|
Vychytávacia fáza alebo expozičná fáza je čas, počas ktorého sú testovacie organizmy vystavené pôsobeniu testovanej látky.
|
Dodatok 2
Výpočet parametrov vychytávania a eliminácie
Hlavným sledovaným parametrom testu bioakumulácie je bioakumulačný faktor BAF. Nameranú hodnotu BAF možno vypočítať tak, že koncentrácia testovanej látky v testovacom organizme Ca sa vydelí koncentráciou testovanej látky v sedimente Cs v ustálenom stave. Ak sa počas vychytávacej fázy nedosiahne ustálený stav, hodnota BAF sa vypočíta rovnakým spôsobom pre 28. deň. Treba však uviesť, či je hodnota BAF založená na koncentráciách v ustálenom stave alebo nie.
Uprednostňovaným spôsobom stanovenia kinetického bioakumulačného faktora (BAFK), konštanty vyjadrujúcej rýchlosť sorpcie látok sedimentu (ks) a rýchlostnej konštanty eliminácie (ke) sú nelineárne metódy odhadovania parametrov pomocou počítača. S použitím časových radov priemerných akumulačných faktorov (Ca, priemerné hodnoty pre každý deň odberu vzoriek/Cs, priemerné hodnoty pre každý deň odberu vzoriek = AF) vychytávacej fázy na základe mokrej hmotnosti červov a sedimentu a na základe modelovej rovnice:
|
AF(t) = BAF × (1 – eke × t)
|
[rovnica 1]
|
kde AF(t) je pomer koncentrácie testovanej látky v červoch a jej koncentrácie v sedimente v ktoromkoľvek časovom bode (t) vychytávacej fázy, tieto počítačové programy vypočítajú hodnoty BAFK, ks a ke.
Ak sa počas vychytávacej fázy dosiahne ustálený stav (t. j. t = ∞), rovnicu 1 možno skrátiť na:
|

|
[rovnica 2]
|
kde
|
ks
|
=
|
rýchlostná konštanta vychytávania v tkanive [g sedimentu kg– 1 červov na deň d– 1],
|
|
ke
|
=
|
rýchlostná konštanta eliminácie [d– 1]
|
Potom ks/ke × Cs je prístup k výpočtu koncentrácie testovanej látky v tkanive červov v ustálenom stave (Ca,ss).
Akumulačný faktor bioty k sedimentu (BSAF) sa má vypočítať takto:

kde foc je frakcia organického uhlíka v sedimente a flip je frakcia lipidov v červoch, pričom obidve hodnoty sú založené na suchej alebo mokrej hmotnosti.
Vzhľadom na časový rad hodnôt koncentrácie možno kinetiku eliminácie modelovať s využitím týchto modelových rovníc a metódy odhadu nelineárnych parametrov založenej na počítačovom výpočte.
Ako základný východiskový bod sa odporúča použiť priemerné namerané telesné rezíduá na konci vychytávacej fázy. Hodnoty modelované/odhadnuté podľa vychytávacej fázy by sa mali použiť len vtedy, keď sa napr. nameraná hodnota významne odchyľuje od modelovaného telesného rezídua. Informácie o alternatívnej predexpozícii červov určených na stanovenie eliminácie nájdete aj v bode 50. Podľa tohto prístupu sa predpokladá, že vzorky týchto predexponovaných červov poskytujú v 0. deň fázy eliminácie realistickú hodnotu telesného rezídua, z ktorej možno vychádzať pri stanovovaní kinetiky eliminácie.
Ak dátové body zakreslené v závislosti od času poukazujú na konštantný exponenciálny pokles koncentrácie testovanej látky v živočíchoch, na opísanie časového priebehu eliminácie možno použiť jednokompartmentový model (rovnica 4).
|

|
[rovnica 3]
|
Procesy eliminácie sa niekedy javia ako dvojfázové, pričom počas počiatočnej fázy vykazujú rýchly pokles hodnoty Ca, ktorý sa mení na pomalšiu stratu testovaných látok v neskoršej fáze eliminácie (8) (19) (25). Dve fázy možno interpretovať na základe predpokladu, že v organizme existujú dva rôzne kompartmenty, z ktorých sa testovaná látka stráca rôznymi rýchlosťami. V týchto prípadoch je potrebné si preštudovať konkrétnu literatúru (15) (16) (17) (25).
Dvojkompartmentová eliminácia je opísaná napr. touto rovnicou (25):
|

|
[rovnica 4]
|
A a B predstavujú veľkosť kompartmentov (v percente celkového tkanivového rezídua), kde A je kompartment s rýchlou stratou látky a B kompartment s pomalou stratou testovanej látky. Súčet A a B sa rovná 100 % celého objemu kompartmentov živočícha v ustálenom stave. Hodnoty ka a kb predstavujú príslušné konštanty eliminácie [d– 1]. Ak sa dvojkompartmentový model použije na údaje o depurácii, rýchlostná konštanta vychytávania ks sa môže stanoviť takto (53) (54):
|

|
[rovnica 5]
|
Tieto modelové rovnice by sa však mali používať opatrne, najmä ak počas testu dôjde k zmenám v biodostupnosti testovanej látky (42).
Alternatívne možno pomocou uvedených modelových rovníc vypočítať aj kinetické parametre (ks a ke) v jednom teste s použitím modelu kinetiky prvého rádu na všetky údaje z vychytávacej fázy a fázy eliminácie dohromady. Opis metódy, ktorá umožňuje tento kombinovaný výpočet rýchlostných konštánt vychytávania a eliminácie, možno nájsť v odkazoch (55), (56) a (57).
Neeliminované rezíduá (NER) sa majú vypočítať ako sekundárny sledovaný parameter vynásobením pomeru priemernej koncentrácie v červoch (Ca) v 10. deň fázy eliminácie a priemernej koncentrácie v červoch (Ca) v ustálenom stave (28. deň vychytávacej fázy) číslom 100:

Dodatok 3
Príklad harmonogramu odberov vzoriek počas 28-dňového testu bioakumulácie
a) Vychytávacia fáza (vrátane štvordňovej fázy dosahovania rovnováhy)
|
Deň
|
Činnosti
|
|
– 6.
|
Príprava rašelinovej suspenzie pre sediment, uvedenie suspenzie do podmienok na 48 hod.
|
|
– 4.
|
Obohatenie sedimentu alebo frakcie sedimentu, zmiešanie všetkých zložiek sedimentu, odobratie vzoriek sedimentu s aplikovanou látkou a kontrolného sedimentu s rozpúšťadlom na stanovenie koncentrácie testovanej látky, pridanie nadložnej vody, inkubácia v testovacích podmienkach (fáza dosahovania rovnováhy)
|
|
– 3./– 2.
|
Oddelenie testovacích organizmov z kultúry na účely aklimatizácie
|
|
0.
|
Meranie kvality vody (pozri bod 52), odobratie replikátov na účely odberu vzoriek vody a sedimentu na stanovenie koncentrácie testovanej látky, náhodné rozdelenie červov do skúšobných komôr, zachovanie dostatočného počtu podvzoriek červov na stanovenie analytických hodnôt v pozadí, kontrola prívodu vzduchu, ak sa použije uzavretý systém
|
|
1.
|
Odobratie replikátov na účely odberu vzoriek, kontrola prívodu vzduchu, správania červov, kvality vody (pozri bod 56), odobratie vzoriek vody, sedimentu a červov na stanovenie koncentrácie testovanej látky
|
|
2.
|
Kontrola prívodu vzduchu, správania červov a teploty
|
|
3.
|
Rovnaké ako v 1. deň
|
|
4. – 6.
|
Rovnaké ako v 2. deň
|
|
7.
|
Rovnaké ako v 1. deň, kompenzácia odparenej vody, ak je to potrebné
|
|
8. – 13.
|
Rovnaké ako v 2. deň
|
|
14.
|
Rovnaké ako v 1. deň, kompenzácia odparenej vody, ak je to potrebné
|
|
15. – 20.
|
Rovnaké ako v 2. deň
|
|
21.
|
Rovnaké ako v 1. deň, kompenzácia odparenej vody, ak je to potrebné
|
|
22. – 27.
|
Rovnaké ako v 2. deň
|
|
28.
|
Rovnaké ako v 1. deň, meranie kvality vody (pozri bod 52), koniec vychytávacej fázy, zachovanie dostatočného počtu podvzoriek červov na stanovenie analytických hodnôt v pozadí, mokrej a suchej hmotnosti a obsahu lipidov, prenos červov zo zvyšných exponovaných replikátov do nádob obsahujúcich čistý sediment na účely fázy eliminácie (bez vyprázdnenia čriev), odobratie vzoriek vody, sedimentu a červov z kontrolných skupín s rozpúšťadlom, odobratie vzoriek zachytávacích roztokov, ak sa používajú.
|
|
|
Činnosti pred expozíciou (fáza dosahovania rovnováhy) by sa mali naplánovať s ohľadom na vlastnosti testovanej látky. Ak je to potrebné, uvedenie pripraveného sedimentu pod nadložnou vodou do podmienok pri teplote 20 ± 2 °C počas siedmich dní – v takom prípade skoršia príprava sedimentu!
|
|
|
Činnosti opísané pre 2. deň by sa mali vykonávať denne (aspoň cez pracovné dni).
|
b) Fáza eliminácie
|
Deň
|
Činnosti
|
|
– 6.
|
Príprava rašelinovej suspenzie pre sediment, uvedenie suspenzie do podmienok na 48 hod.
|
|
– 4.
|
Zmiešanie všetkých zložiek sedimentu, odobratie vzoriek sedimentu s aplikovanou látkou a kontrolného sedimentu s rozpúšťadlom na stanovenie koncentrácie testovanej látky, pridanie nadložnej vody, inkubácia v testovacích podmienkach
|
|
0. (28. deň vychytávacej fázy)
|
Meranie kvality vody (pozri bod 52), prenos červov zo zvyšných exponovaných replikátov do nádob obsahujúcich čistý sediment, po 4 – 6 hod. odobratie replikátov na účely odberu vzoriek vody, sedimentu a červov na stanovenie koncentrácie testovanej látky, náhodné rozdelenie červov do skúšobných komôr,
|
|
1.
|
Odobratie replikátov na účely odberu vzoriek, kontrola prívodu vzduchu, správania červov, kvality vody (pozri bod 52), odobratie vzoriek vody, sedimentu a červov na stanovenie koncentrácie testovanej látky
|
|
2.
|
Kontrola prívodu vzduchu, správania červov a teploty
|
|
3.
|
Rovnaké ako v 1. deň
|
|
4.
|
Rovnaké ako v 2. deň
|
|
5.
|
Rovnaké ako v 1. deň
|
|
6.
|
Rovnaké ako v 2. deň
|
|
7.
|
Rovnaké ako v 1. deň, kompenzácia odparenej vody, ak je to potrebné
|
|
8. – 9.
|
Rovnaké ako v 2. deň
|
|
10.
|
Rovnaké ako v 1. deň, koniec fázy eliminácie, meranie kvality vody (pozri bod 52), odobratie vzoriek vody, sedimentu a červov z kontrolných skupín s rozpúšťadlom, odobratie vzoriek zachytávacích roztokov, ak sa používajú.
|
|
|
Príprava sedimentu pred začiatkom fázy eliminácie by mala byť rovnaká ako pred vychytávacou fázou.
|
|
|
Činnosti opísané pre 2. deň by sa mali vykonávať denne (aspoň cez pracovné dni).
|
Dodatok 4
Niektoré fyzikálno-chemické charakteristiky prijateľnej riediacej vody
|
ZLOŽKA
|
KONCENTRÁCIE
|
|
Tuhé častice
|
< 20 mg/l
|
|
Celkový organický uhlík
|
< 2 μg/l
|
|
Neionizovaný amoniak
|
< 1 μg/l
|
|
Zostatkový chlór
|
< 10 μg/l
|
|
Celkové organofosfátové pesticídy
|
< 50 ng/l
|
|
Celkové organochlórové pesticídy a polychlórované bifenyly
|
< 50 ng/l
|
|
Celkový organický chlór
|
< 25 ng/l
|
ZLOŽENIE ODPORÚČANEJ REKONŠTITUOVANEJ VODY
|
a)
|
Roztok chloridu vápenatého
Rozpustite 11,76 g CaCl2 · 2H2O v deionizovanej vode, doplňte deionizovanou vodou do 1 l.
|
|
b)
|
Roztok síranu horečnatého
Rozpustite 4,93 g MgSO4 · 7H2O v deionizovanej vode, doplňte deionizovanou vodou do 1 l.
|
|
c)
|
Roztok hydrogénuhličitanu sodného
Rozpustite 2,59 g NaHCO3 v deionizovanej vode, doplňte deionizovanou vodou do 1 l.
|
|
d)
|
Roztok chloridu draselného
Rozpustite 0,23 g KCl v deionizovanej vode, doplňte deionizovanou vodou do 1 l.
|
Všetky chemikálie musia byť analytickej čistoty.
Vodivosť destilovanej alebo deionizovanej vody by nemala presiahnuť 10 μScm– 1.
25 ml každého z roztokov a) až d) sa zmieša a celkový objem doplní deionizovanou vodou na 1 l. Súčet iónov vápnika a horčíka v tomto roztoku je 2,5 mmol/l
Pomer iónov Ca: Mg je 4: 1 a pomer iónov Na: K je 10: 1. Kyselinová kapacita KS4.3 tohto roztoku je 0,8 mmol/l.
Prevzdušňujte riediacu vodu, kým sa nenasýti kyslíkom, potom ju pred použitím približne na dva dni uskladnite bez ďalšieho prevzdušňovania.
Hodnota pH prijateľnej riediacej vody by mala byť v rozmedzí 6 – 9.
Dodatok 5
Umelý sediment – odporúčania na prípravu a skladovanie
Na rozdiel od požiadaviek v testovacej metóde C.8 (40) sa odporúča, aby obsah rašeliny v umelom sedimente bol 2 % namiesto 10 % suchej hmotnosti, aby to zodpovedalo nízkemu až stredne vysokému obsahu organických látok v prírodných sedimentoch (58).
Percento suchých zložiek umelého sedimentu:
|
Zložka
|
Charakteristika
|
% suchého sedimentu
|
|
Rašelina
|
Rašelinníková rašelina, stupeň rozkladu: ‚stredný‘, sušená na vzduchu, bez viditeľných rastlinných zvyškov, jemne mletá (veľkosť častíc ≤ 0,5 mm)
|
2 + 0,5
|
|
Kremenný piesok
|
Veľkosť zrniek: ≤ 2 mm, ale > 50 % častíc by malo mať veľkosť v rozsahu 50 – 200 μm
|
76
|
|
Kaolín
|
Obsah kaolinitu ≥ 30 %
|
22 + 1
|
|
Zdroj potravy
|
Folia urticae, listy Urtica spp. (pŕhľava) rozomleté na jemný prášok (veľkosť častíc ≤ 0,5 mm) alebo zmes rozomletých listov Urtica spp. s alfa-celulózou (1: 1); v súlade s farmaceutickými normami pre ľudskú spotrebu, pridané do suchého sedimentu
|
0,4 – 0,5 %
|
|
Uhličitan vápenatý
|
CaCO3, práškový, chemicky čistý, pridaný do suchého sedimentu
|
0,05 – 1
|
|
Deionizovaná voda
|
Vodivosť ≤ 10 μS/cm, pridaná do suchého sedimentu
|
30 – 50
|
Ak sa predpokladá zvýšená koncentrácia amoniaku, napr. ak je známe, že testovaná látka inhibuje nitrifikáciu, môže byť užitočné nahradiť 50 % prášku zo žihľavy bohatého na dusík celulózou (napr. α-celulóza v prášku, chemicky čistá, veľkosť častíc ≤ 0,5 mm).
Príprava
Rašelina sa usuší na vzduchu a rozomelie na jemný prášok (veľkosť zrna ≤ 0,5 mm, bez viditeľných rastlinných zvyškov). Pomocou vysokovýkonného homogenizačného zariadenia sa pripraví suspenzia požadovaného množstva rašelinového prášku s použitím časti deionizovanej vody, ktorá sa má pridať do suchého sedimentu [objem vody 11,5 × suchá hmotnosť rašeliny je vhodný na vytvorenie miešateľnej rašelinovej kaše (8)].
Hodnota pH tejto suspenzie sa upraví na 5,5 ± 0,5 pomocou CaCO3. Suspenzia sa aspoň na dva dni uvedie do podmienok jemným premiešavaním pri teplote 20 ± 2 °C, aby sa stabilizovalo pH a vytvorila stabilná mikrobiálna zložka. Znova sa odmeria pH a podľa potreby sa pomocou CaCO3 upraví na 6,0 ± 0,5. Potom sa celá suspenzia zmieša s ostatnými suchými zložkami, pričom sa zohľadní prípadná časť použitá na obohatenie. Pridá sa zvyšná deionizovaná voda, aby sa získal homogénny sediment. Znova sa odmeria pH a podľa potreby sa pomocou CaCO3 upraví na 6,5 až 7,5. Ak sa však očakáva tvorba amoniaku, môže byť užitočné udržiavať pH sedimentu nižšie ako 7,0 (napr. medzi 6,0 a 6,5). Odoberú sa vzorky sedimentu, aby sa určila suchá hmotnosť a obsah organického uhlíka. Ak sa očakáva tvorba amoniaku, umelý sediment sa môže predtým, ako sa obohatí o testovanú látku, sedem dní uvádzať do podmienok, aké sa použijú v nasledujúcom teste (napr. pomer sediment – voda 1: 4, výška vrstvy sedimentu ako v testovacích nádobách), t. j. mal by sa prekryť vodou, ktorá by sa mala prevzdušňovať. Na konci obdobia uvádzania do podmienok je nutné odstrániť a zlikvidovať nadložnú vodu. Odoberú sa vzorky sedimentu, aby sa určila suchá hmotnosť a celkový obsah organického uhlíka (napr. tri vzorky).
Potom sa obohatený kremenný piesok zmieša so sedimentom pre každú koncentráciu testovanej látky, sediment sa rozdelí do replikačných testovacích nádob a prekryje testovacou vodou (napr. pomer sediment – voda 1: 4, výška vrstvy sedimentu ako v testovacích nádobách). Nádoby sa potom inkubujú za rovnakých podmienok, aké sa použijú v nasledujúcom teste. V tomto bode sa začína obdobie dosahovania rovnováhy. Nadložnú vodu je potrebné prevzdušňovať.
Zvolený zdroj potravy by sa mal pridať pred obohatením sedimentu testovanou látkou alebo počas neho. Najskôr ho možno zmiešať s rašelinovou suspenziou (pozri vyššie). Nadmernej degradácii zdroja potravy pred pridaním testovacích organizmov – napr. v prípade dlhého obdobia dosahovania rovnováhy – však možno predísť tým, že obdobie medzi pridaním potravy a začiatkom expozície bude čo najkratšie. S cieľom zabezpečiť, aby potrava bola v dostatočnom kontakte s testovanou látkou, by sa zdroj potravy mal zmiešať so sedimentom najneskôr v deň, keď sa testovaná látka pridá do sedimentu. Výnimkou môže byť prípad, keď dĺžka obdobia dosahovania rovnováhy vedie k nadmernej mikrobiálnej degradácii potravy pred pridaním testovacích organizmov. Odoberú sa vzorky sedimentu na stanovenie suchej hmotnosti a celkového obsahu organického uhlíka (napr. tri vzorky obohateného alebo kontrolného sedimentu).
Suchá hmotnosť zložiek (rašelina, piesok, kaolín) by sa mala uvádzať v g a percentách celkovej suchej hmotnosti.
Objem vody, ktorá sa pri príprave sedimentu pridáva do suchých zložiek, by sa mal uviesť aj v percente celkovej suchej hmotnosti (napr. 100 % suchej hmotnosti + 46 % vody znamená, že na 1 000 g suchej hmotnosti sa pridá celkovo 460 ml vody a vznikne 1 460 g mokrého sedimentu).
Skladovanie
Suché zložky umelého sedimentu sa môžu skladovať na suchom a chladnom mieste pri izbovej teplote. Pripravený mokrý sediment možno skladovať (len na ďalšie použitie v kultúre) pri teplote 4 ± 2 °C v tme počas dvoch až štyroch týždňov odo dňa prípravy (8).
Sediment obohatený o testovanú látku by sa mal ihneď použiť, pokiaľ nie sú k dispozícii informácie, že konkrétny sediment možno skladovať bez toho, aby to malo vplyv na toxicitu a biodostupnosť testovanej látky. Vzorky obohateného sedimentu sa môžu až do analýzy skladovať v podmienkach odporúčaných pre konkrétnu testovanú látku.
Dodatok 6
Odporúčané druhy máloštetinavcov na testovanie bioakumulácie
Tubifex tubifex (MÜLLER), Tubificidae, Oligochaeta
Máloštetinavec Tubifex tubifex (Müller) z čeľade Tubificidae (Oligochaeta) žije v sedimentoch sladkých vôd v trubiciach vystlaných hlienom. Červy žijú v týchto trubiciach hlavou nadol a požierajú častice sedimentu, pričom sa živia v ňom žijúcimi mikroorganizmami a organickým odpadom. Zadná časť sa zvyčajne vlní v nadložnej vode, čo umožňuje červovi dýchať. Hoci druh Tubifex tubifex žije v širokej škále rôznych druhov sedimentov na celej severnej pologuli, uprednostňuje pomerne jemné častice (59). Vhodnosť tohto druhu na ekotoxikologické testovanie je opísaná napríklad v odkazoch (8) (29) (31) (39) (60) (62) (63).
Metódy kultivácie
Na to, aby sa získal dostatočný počet červov Tubifex tubifex na vykonanie testov bioakumulácie, sa červy musia chovať v stálej laboratórnej kultúre. Na kultiváciu červov T. tubifex sa odporúča použiť systém zložený z umelého sedimentu založeného na umelo pripravenej pôde podľa testovacej metódy C.8 (40) a z rekonštituovanej vody podľa testovacej metódy C.1 (8).
Ako kultivačné nádoby možno použiť nádoby zo skla alebo z nehrdzavejúcej ocele s výškou 12 – 20 cm. Do každej kultivačnej nádoby sa pridá vrstva mokrého umelého sedimentu pripravená podľa opisu v dodatku 5. Hĺbka vrstvy sedimentu by mala umožniť prirodzené zahrabávanie červov (minimálna hĺbka 2 cm pre T. tubifex). Do systému sa pridá rekonštituovaná voda. Treba dbať na to, aby sa minimalizovalo narušenie sedimentu. Voda sa jemne prevzdušňuje (napr. dve bubliny za sekundu pomocou vzduchu filtrovaného 0,45 μm filtrom) s použitím Pasteurovej pipety umiestnenej 2 cm nad povrchom sedimentu. Odporúčaná teplota kultúry je 20 ± 2 °C.
Červy sa pridávajú do kultivačného systému s maximálnou násadou 20 000 jedincov/m2 povrchu sedimentu. Väčšia násada môže spôsobiť zníženie rýchlosti rastu a rozmnožovania (43).
V kultúrach s umelým sedimentom sa červy musia kŕmiť. Ako doplnkovú výživu možno použiť jemne mletú potravu pre ryby, napr. TetraMin® (8), Klerks 1994, osobná komunikácia. Množstvo potravy by malo umožňovať dostatočný rast a rozmnožovanie a malo by udržať hromadenie amoniaku a rast plesní v kultúre na minime. Potravu možno podávať dvakrát týždenne (napr. 0,6 – 0,8 mg/cm2 povrchu sedimentu). Z praktických skúseností vyplynulo, že aplikovanie potravy suspendovanej a homogenizovanej v deionizovanej vode môže uľahčiť homogénnu distribúciu potravy na povrchu sedimentu v kultivačných nádobách.
Nadložná voda by sa mala vymieňať pomocou prietokového systému alebo ručne aspoň raz za týždeň, aby sa zabránilo hromadeniu amoniaku. Sediment v zásobných kultúrach by sa mal meniť každé tri mesiace.
Ak sú potrebné len dospelé jedince, vzorky červov možno odobrať z kultúry preosiatím kultivačného sedimentu cez sito s veľkosťou oka 1 mm. Na zachytenie zámotkov je vhodné sito s veľkosťou oka 0,5 mm a na zachytenie mladých červov sito s veľkosťou oka 0,25 mm. Po preosiatí sedimentu možno sitá umiestniť do rekonštituovanej vody. Keď červy opustia sito, možno ich vybrať z vody mäkkou oceľovou pinzetou alebo pipetou s hranami leštenými plameňom.
V teste alebo na založenie nových kultúr možno použiť iba neporušené a jasne identifikované jedince Tubifex tubifex [napr. (64)]. Choré alebo poranené červy a zámotky zamorené hubovými vláknami sa musia odstrániť.
Synchronizovaná kultúra môže byť podľa potreby zdrojom červov určitého veku vo vhodných intervaloch. Nové kultivačné nádoby sa zakladajú vo zvolených intervaloch (napr. každé dva týždne) so živočíchmi určitého veku (napr. so zámotkami). V kultivačných podmienkach, ktoré sú tu opísané, dosiahnu červy dospelosť po ôsmich až desiatich týždňoch. Červy možno odobrať z kultúry, keď nakládli nové zámotky, napr. po desiatich týždňoch. Vzorky dospelých jedincov možno použiť v teste a so zámotkami možno založiť nové kultúry.
Lumbriculus variegatus (MÜLLER), Lumbriculidae, Oligochaeta
Lumbriculus variegatus (Lumbriculidae, Oligochaeta) takisto žije v sladkovodných sedimentoch na celom svete a často sa používa v ekotoxikologickom testovaní. Informácie o biológii, kultivačných podmienkach a citlivosti druhu možno nájsť v odkazoch (1) (6) (9) (36). Červa Lumbriculus variegatus možno s určitými obmedzeniami kultivovať aj v umelom sedimente odporúčanom pre druh T. tubifex podľa odkazu (8). Keďže druh L. variegatus v prírode uprednostňuje hrubšie sedimenty ako T. tubifex (59), laboratórne kultúry s umelým sedimentom používané pre T. tubifex môžu po štyroch až šiestich mesiacoch zaniknúť. Z praktických skúseností vyplýva, že druh L. variegatus možno niekoľko rokov chovať v pieskovom substráte (napr. kremenný piesok, jemný štrk) v prietokovom systéme s použitím potravy pre ryby ako zdroja výživy bez nutnosti obnovovať substrát. Hlavnou výhodou druhu L. variegatus oproti iným druhom vodných máloštetinavcov je jeho rýchle rozmnožovanie, ktoré vedie k rýchlo sa zväčšujúcej biomase v laboratórne kultivovaných populáciách (1) (6) (9) (10).
Metódy kultivácie
Kultivačné podmienky pre druh Lumbriculus variegatus sú podrobne opísané v publikáciách Phipps a kol., (1993) (10), Brunson a kol. (1998) (28), ASTM (2000) (1), U.S. EPA (6). Ďalej je uvedené stručné zhrnutie týchto podmienok.
Červy možno chovať vo veľkých akváriách (57 – 80 l) pri teplote 23 °C s fotoperiódou 16 hod. svetla: 8 hod. tmy (100 – 1 000 luxov) s použitím denne obnovovanej prírodnej vody (45 – 50 l na akvárium). Substrát sa pripraví tak, že nebielené hnedé papierové servítky sa narežú na pásy, ktoré potom možno na niekoľko sekúnd ponoriť do kultivačnej vody, čím vzniknú malé kúsky papierového substrátu. Týmto substrátom potom možno priamo pokryť dno kultivačných akvárií pre Lumbriculus alebo ho možno uskladniť zmrazený v deionizovanej vode na neskoršie použitie. Nový substrát vydrží v nádrži vo všeobecnosti približne dva mesiace.
Každá kultúra červov sa zakladá s 500 – 1 000 červami, ktoré sa kŕmia 10 ml suspenzie obsahujúcej 6 g štartovacej potravy pre pstruhy trikrát týždenne v podmienkach obnovovania alebo prietoku. V statických alebo semistatických kultúrach by sa červy mali kŕmiť menej, aby sa zabránilo rastu baktérií a plesní. Potrava a papierový substrát by sa mali analyzovať z hľadiska látok, ktoré sa majú použiť v testoch bioakumulácie.
Za týchto podmienok sa počet jedincov v kultúre väčšinou zdvojnásobí približne za 10 až 14 dní.
Červy Lumbriculus variegatus možno odobrať z kultúr napr. prenesením substrátu v sieti s jemnými okami alebo prenesením organizmov sklenenou pipetou so širokým otvorom (s priemerom približne 5 mm) leštenej plameňom do samostatnej kadičky. Ak sa do tejto kadičky prenáša aj substrát, kadička s červami a substrátom sa cez noc nechá v podmienkach prietoku. Tým sa z nej odstráni substrát, zatiaľ čo červy zostanú na dne nádoby. Potom ich možno znova vložiť do nových pripravených kultivačných nádrží alebo ďalej spracovať na účely testu podľa opisu v odkazoch (1) a (6). Je potrebné zabrániť zraneniam alebo autotómii červov, napr. tak, že pri manipulácii s nimi sa budú používať pipety s hranami leštenými plameňom alebo špendlíky z nehrdzavejúcej ocele.
Otázka, ktorou sa treba kriticky zaoberať v prípade použitia červov L. variegatus v testoch bioakumulácie zo sedimentu, je ich spôsob rozmnožovania (architómia nasledovaná morfalaxiou). Toto nepohlavné rozmnožovanie vedie k vzniku dvoch fragmentov, ktoré sa počas určitého obdobia nekŕmia, až kým sa neregeneruje hlavová alebo chvostová časť [napr. (36) (37)]. To znamená, že v prípade L. variegatus absorpcia sedimentu a kontaminujúcej látky požitím nemusí prebiehať nepretržite ako pri čeľadi Tubificidae, ktorej zástupcovia sa nerozmnožujú fragmentáciou.
Preto by sa mala vykonať synchronizácia, aby sa minimalizovalo nekontrolované rozmnožovanie a regenerácia, a tým aj veľké rozdiely vo výsledkoch testu. Tieto rozdiely môžu vzniknúť, keď sú niektoré jedince, ktoré sa fragmentovali, a teda sa určitý čas nekŕmia, menej vystavené testovanej látke ako ostatné jedince, ktoré sa počas testu nefragmentovali, napr. (38). Červy by sa mali 10 – 14 dní pred začiatkom expozície umelo fragmentovať (synchronizácia) (65). Mali by sa použiť veľké červy, ktoré podľa možnosti nevykazujú známky nedávnej fragmentácie. Tieto červy možno umiestniť na sklenené podložné sklíčko do kvapky kultivačnej vody a skalpelom rozrezať v strednej časti tela. Treba dbať na to, aby zadné konce boli podobnej veľkosti. Zadné konce by sa potom mali až do začiatku expozície nechať, aby si regenerovali nové hlavy, v kultivačnej nádobe obsahujúcej rovnaký substrát, aký sa používa v kultivačnej vode, a rekonštituovanú vodu. Regenerácia nových hláv prebehla vtedy, keď sa synchronizované červy zahrabávajú do substrátu (prítomnosť regenerovaných hláv možno potvrdiť preskúmaním reprezentatívnej podvzorky pod binokulárnym mikroskopom). Očakáva sa, že testovacie organizmy budú mať podobný fyziologický stav. To znamená, že ak počas testu dôjde pri synchronizovaných červoch k regenerácii morfalaxiou, prakticky všetky živočíchy by mali byť rovnako vystavené obohatenému sedimentu. Synchronizované červy by sa mali nakŕmiť ihneď, ako sa začnú zahrabávať do substrátu, alebo sedem dní po reze. Kŕmny režim by mal byť porovnateľný s bežnými kultúrami a odporúča sa kŕmiť synchronizované červy tým istým zdrojom potravy, aký sa použije v teste. Červy sa majú chovať pri testovacej teplote 20 ± 2 °C. Po regenerácii sa v teste majú použiť neporušené úplné červy podobnej veľkosti, ktoré po jemnom mechanickom podnete aktívne plávajú alebo lezú. Je potrebné zabrániť zraneniam alebo autotómii červov, napr. tak, že pri manipulácii s nimi sa budú používať pipety s hranami leštenými plameňom alebo špendlíky z nehrdzavejúcej ocele.
Pri použití červov Lumbriculus variegatus v teste by vzhľadom na osobitný spôsob rozmnožovania tohto druhu malo počas testu za vhodných podmienok dôjsť k zvýšeniu počtu červov (6). Neprítomnosť rozmnožovania v teste bioakumulácie s druhom L. variegatus by sa mala zaznamenať a vziať do úvahy pri interpretácii výsledkov testu.
Branchiura sowerbyi (BEDDARD), Tubificidae, Oligochaeta (nevalidované v kruhovom teste)
Druh Branchiura sowerbyi žije v rôznych druhoch sedimentu vo vodných nádržiach, jazerách, rybníkoch a riekach, pôvodne v tropických oblastiach. Možno ho nájsť aj v útvaroch s teplou vodou na severnej pologuli. Početnejší je však v bahnito-ílových sedimentoch s vysokým obsahom organickej hmoty. Červy okrem toho žijú vo vrstve sedimentu. Dokonca aj zadný koniec červov je zvyčajne zahrabaný. Tento druh sa ľahko identifikuje podľa žiabrových vlákien na zadnej časti. Dospelé jedince môžu dosiahnuť dĺžku 9 – 11 cm a mokrú hmotnosť 40 – 50 mg. Červy majú vysokú rýchlosť rozmnožovania: v podmienkach teploty a kŕmenia uvedených ďalej sa populácia zdvojnásobí za menej ako dva týždne [Aston a kol., 1982, (65)]. Druh B. sowerbyi sa použil v štúdiách toxicity i bioakumulácie [Marchese a Brinkhurst 1996, (31), resp. Roghair a kol. 1996, (67)].
Metódy kultivácie
Ďalej sa uvádza zhrnutie kultivačných podmienok pre druh Branchiura sowerbyi (poskytli Mercedes R. Marchese, INALI, Argentína a Carla J. Roghair, RIVM, Holandsko).
Nevyžaduje sa žiadna konkrétna metóda kultivácie testovacích organizmov. Organizmy možno kultivovať s použitím nekontaminovaného prírodného sedimentu (31). Z praktických skúseností vyplynulo, že médium zložené z prírodného sedimentu a piesku zlepšuje stav červov v porovnaní s čisto prírodným sedimentom (32) (67). Na kultiváciu možno použiť 3 l kadičky obsahujúce 1 500 ml média zo sedimentu/vody, ktoré sa skladá z 375 ml prírodného nekontaminovaného sedimentu (približne 10 % celkového organického uhlíka, približne 17 % častíc ≤ 63 μm), 375 ml čistého piesku (M32) a 750 ml rekonštituovanej alebo odchlórovanej vody z vodovodu (31) (32) (67). Ako substrát na kultiváciu sa môžu použiť aj papierové servítky, ale rast populácie bude nižší ako v prírodnom sedimente. V semistatických systémoch sa vrstva vody v kadičke pomaly prevzdušňuje a nadložná voda by sa mala obnovovať raz týždenne.
Každá kadička na začiatku obsahuje 25 mladých červov. Po dvoch mesiacoch sa veľké červy vyberú zo sedimentu pinzetou a vložia sa do novej kadičky s čerstvo vyrobeným médiom zo sedimentu/vody. Stará kadička obsahuje aj zámotky a mladé červy. Týmto spôsobom možno z jednej kadičky získať až 400 mladých červov. Dospelé červy možno používať na rozmnožovanie minimálne jeden rok.
Kultúry by sa mali udržiavať pri teplote 21 – 25 °C. Zmeny teploty by nemali prekročiť ± 2 °C. Čas potrebný na embryonálny vývin od nakladenia vajíčok až po okamih, keď mladý jedinec opustí zámotok, je pri teplote 25 °C približne tri týždne. Prežívajúci červ druhu B. sowerbyi vytvorí 6,36 (31) až 11,2 (30) vajíčok v bahne pri teplote 25 °C. Počet vajíčok na zámotok je v rozmedzí od 1,8 do 2,8 (66) (69) alebo maximálne 8 (68).
Každý týždeň by sa mal odmerať rozpustený kyslík, tvrdosť vody, teplota a pH. Dvakrát alebo trikrát týždenne možno pridať potravu pre ryby (napr. TetraMin®) ako suspenziu ad libitum. Červy možno kŕmiť aj rozmrazeným šalátom ad libitum.
Veľkou výhodou tohto druhu je vysoká individuálna biomasa (až 40 – 50 mg mokrej hmotnosti na jedinca). Tento druh preto možno použiť na testovanie bioakumulácie testovaných látok, ktoré nie sú rádioaktívne označené. Expozícia môže prebiehať v systémoch používaných pre druh T. tubifex alebo L. variegatus s jedným jedincom na replikát (11). V takom prípade by sa však mal zvýšiť počet replikátov, pokiaľ sa nepoužijú väčšie skúšobné komory (11). Pri tomto druhu je potrebné upraviť aj kritérium validity týkajúce sa zahrabávania.
LITERATÚRA
|
1.
|
ASTM International (2000). Standard guide for the determination of the bioaccumulation of sediment-associated contaminants by benthic invertebrates, E 1688-00a. V ASTM International 2004 Annual Book of Standards. Volume 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
|
|
2.
|
Európska komisia (EK) (2003). Technical Guidance Document on Risk Assessment in support of Commission Directive 93/67/EEC on Risk Assessment for new notified substances, Commission Regulation (EC) No 1488/94 on Risk Assessment for existing substances and Directive 98/8/EC of the European Parliament and of the Council concerning the placing of biocidal products on the market; Part I – IV. Úrad pre vydávanie úradných publikácií Európskych spoločenstiev, Luxemburg.
|
|
3.
|
OECD (1992a). Report of the OECD workshop on effects assessment of chemicals in sediment. OECD Monographs No. 60. Organizácia pre hospodársku spoluprácu a rozvoj (OECD), Paríž.
|
|
4.
|
Ingersoll, C.G., Ankley, G.T., Benoit D.A., Brunson, E.L., Burton, G.A., Dwyer, F.J., Hoke, R.A., Landrum, P. F., Norberg-King, T. J. a Winger, P.V. (1995). Toxicity and bioaccumulation of sediment-associated contaminants using freshwater invertebrates: A review of methods and applications. Environ. Toxicol. Chem. 14, 1885 – 1894.
|
|
5.
|
Kapitola C.13 tejto prílohy, biokoncentrácia: prietokový rybí test.
|
|
6.
|
U.S. EPA (2000). Methods for measuring the toxicity and bioaccumulation of sediment-associated contaminants with freshwater invertebrates. Second Edition. EPA 600/R-99/064, U.S. Environmental Protection Agency, Duluth, MN, marec 2000.
|
|
7.
|
Kapitola C.27 tejto prílohy, test toxicity Chironomidae v systéme sediment – voda za použitia obohateného sedimentu
|
|
8.
|
Egeler, Ph., Römbke, J., Meller, M., Knacker, Th., Franke, C., Studinger, G. a Nagel, R. (1997). Bioaccumulation of lindane and hexachlorobenzene by tubificid sludgeworms (Oligochaeta) under standardised laboratory conditions. Chemosphere 35, 835 – 852.
|
|
9.
|
Ingersoll, C.G., Brunson, E.L., Wang N., Dwyer, F.J., Ankley, G.T., Mount D.R., Huckins J., Petty. J. a Landrum, P. F. (2003). Uptake and depuration of nonionic organic contaminants from sediment by the oligochaete, Lumbriculus variegatus. Environmental Toxicology and Chemistry 22, 872 – 885.
|
|
10.
|
Phipps, G.L., Ankley, G.T., Benoit, D.A. a Mattson, V.R. (1993). Use of the aquatic Oligochaete Lumbriculus variegatus for assessing the toxicity and bioaccumulation of sediment-associated contaminants. Environ.Toxicol. Chem. 12, 269 – 279.
|
|
11.
|
Egeler, Ph., Römbke, J., Knacker, Th., Franke, C. a Studinger, G. (1999). Workshop on ‚Bioaccumulation: Sediment test using benthic oligochaetes‘, 26. – 27.4.1999, Hochheim/Main, Nemecko. Report on the R+D-project No. 298 67 419, Umweltbundesamt, Berlín.
|
|
12.
|
Egeler, Ph., Meller, M., Schallnaß, H.J. & Gilberg, D. (2006). Validation of a sediment bioaccumulation test with endobenthic aquatic oligochaetes by an international ring test. Report to the Federal Environmental Agency (Umweltbundesamt Dessau), R&D No.: 202 67 437.
|
|
13.
|
Kelly, J.R., Levine, S.N., Buttel, L.A., Kelly, A.C., Rudnick, D.T. a Morton, R.D. (1990). Effects of tributyltin within a Thalassia seagrass ecosystem. Estuaries 13, 301 – 310.
|
|
14.
|
Nendza, M. (1991). QSARs of bioaccumulation: Validity assessment of log Kow/log BCF correlations. V: R. Nagel a R. Loskill (eds.): Bioaccumulation in aquatic systems. Contributions to the assessment. Proceedings of an international workshop, Berlín 1990. VCH, Weinheim.
|
|
15.
|
Landrum, P.F., Lee II, H. a Lydy, M.J. (1992). Toxicokinetics in aquatic systems: Model comparisons and use in hazard assessment. Environ. Toxicol. Chem. 11, 1709 – 1725.
|
|
16.
|
Markwell, R.D., Connell, D.W. a Gabric, A.J. (1989). Bioaccumulation of lipophilic compounds from sediments by oligochaetes. Wat. Res. 23, 1443 – 1450.
|
|
17.
|
Gabric, A.J., Connell, D.W. a Bell, P.R.F. (1990). A kinetic model for bioconcentration of lipophilic compounds by oligochaetes. Wat. Res. 24, 1225 – 1231.
|
|
18.
|
Kukkonen, J. a Landrum, P.F. (1994). Toxicokinetics and toxicity of sediment-associated Pyrene to Lumbriculus variegatus (Oligochaeta). Environ. Toxicol. Chem. 13, 1457 – 1468.
|
|
19.
|
Franke, C., Studinger, G., Berger, G., Böhling, S., Bruckmann, U., Cohors-Fresenborg, D. a Jöhncke, U. (1994). The assessment of bioaccumulation. Chemosphere 29, 1501 – 1514.
|
|
20.
|
OECD (2000). Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. OECD Environment, Health and Safety Publications, Series on Testing and Assessment No. 23.
|
|
21.
|
U.S. EPA (1996). Special Considerations for Conducting Aquatic Laboratory Studies. Ecological Effects Test Guidelines. OPPTS 850.1000. Public Draft. EPA 712-C-96-113. U.S. Environmental Protection Agency.
|
|
22.
|
Kapitoly tejto prílohy:
|
|
Kapitola A.5, povrchové napätie
|
|
|
Kapitola A.6, rozpustnosť vo vode
|
|
|
Kapitola A.8, rozdeľovacia konštanta, metóda trepačkovej banky
|
|
|
Kapitola A.24, rozdeľovacia konštanta, metóda HPLC
|
|
|
Kapitola C.7, degradácia — abiotická degradácia: hadrolýza ako funkcia pH
|
|
|
Kapitola C.4 A – F Stanovenie ľahkej biodegradovateľnosti
|
|
|
Kapitola C.19, odhad adsorpčného koeficientu (KOC) na pôde a kale z odpadových vôd pomocou vysokoúčinnej kvapalinovej chromatografie (HPLC).
|
|
|
Kapitola C.29, ľahká biodegradovateľnosť CO2 v hermeticky uzavretých nádobách
|
|
|
23.
|
OECD (1996). Direct phototransformation of chemicals in water. Environmental Health and Safety Guidance Document Series on Testing and Assessment of Chemicals No. 3. OECD, Paríž.
|
|
24.
|
Antoine, M.D., Dewanathan, S. a Patonay, G. (1991). Determination of critical micelles concentration of surfactants using a near-infrared hydrophobicity probe. Microchem. J. 43, 165 – 172.
|
|
25.
|
Beek, B., S. Boehling, U. Bruckmann, C. Franke, U. Joehncke a G. Studinger (2000). The assessment of bioaccumulation. V Hutzinger, O. (editor), The Handbook of Environmental Chemistry, Vol. 2 Part J (Vol. editor: B. Beek): Bioaccumulation – New Aspects and Developments. Springer-Verlag Berlin Heidelberg: 235 – 276.
|
|
26.
|
Spacie, A. a Hamelink, J.L. (1982). Alternative models for describing the bioconcentration of organics in fish. Environ. Toxicol. Chem. 1, 309 – 320.
|
|
27.
|
Hawker, D.W. a Connell, D.W. (1988). Influence of partition coefficient of lipophilic compounds on bioconcentration kinetics with fish. Wat. Res. 22, 701 – 707.
|
|
28.
|
Brunson, E.L., Canfield, T.J., Ingersoll, C.J. a Kemble, N.E. (1998). Assessing the bioaccumulation of contaminants from sediments of the Upper Mississippi river using field-collected oligochaetes and laboratory-exposed Lumbriculus variegatus. Arch. Environ. Contam. Toxicol. 35, 191 – 201.
|
|
29.
|
Reynoldson, T.B., Thompson, S.P. a Bamsey, J.L. (1991). A sediment bioassay using the tubificid oligochaete worm Tubifex tubifex. Environ. Toxicol. Chem. 10, 1061 – 1072.
|
|
30.
|
Aston, R.J. a Milner, A.G.P. (1981). Conditions for the culture of Branchiura sowerbyi (Oligochaeta: Tubificidae) in activated sludge. Aquaculture 26, 155 – 160.
|
|
31.
|
Marchese, M.R. a Brinkhurst, R.O. (1996). A comparison of two tubificid species as candidates for sublethal bioassay tests relevant to subtropical and tropical regions. Hydrobiologia 334, 163 – 168.
|
|
32.
|
Roghair, C.J. a Buijze, A. (1994). Development of sediment toxicity tests. IV. A bioassay to determine the toxicity of field sediments to the oligochaete worm Branchiura sowerbyi. RIVM Report 719102027.
|
|
33.
|
Kapitola C.1 tejto prílohy, ryby, test akútnej toxicity.
|
|
34.
|
OECD (1992c). Guidelines for Testing of Chemicals No. 210. Fish, Early-life Stage Toxicity Test. OECD, Paríž.
|
|
35.
|
Kaster, J.L., Klump, J.V., Meyer, J., Krezoski, J. a Smith, M.E. (1984). Comparison of defecation rates of Limnodrilus hoffmeisteri using two different methods. Hydrobiologia 11, 181 – 184.
|
|
36.
|
Leppänen, M.T. a Kukkonen, J.V.K. 1998: Factors affecting feeding rate, reproduction and growth of an oligochaete Lumbriculus variegatus (Müller). Hydrobiologia 377: 183 – 194.
|
|
37.
|
Leppänen, M.T. a Kukkonen, J.V.K. 1998: Relationship between reproduction, sediment type and feeding activity of Lumbriculus variegatus (Müller): Implications for sediment toxicity testing. Environ. Toxicol. Chem. 17: 2196 – 2202.
|
|
38.
|
Leppänen M.T. a Kukkonen J.V.K. (1998). Relative importance of ingested sediment and porewater as bioaccumulation routes for pyrene to oligochaete (Lumbriculus variegatus, Müller). Environ. Sci. Toxicol. 32, 1503 – 1508.
|
|
39.
|
Martinez-Madrid, M., Rodriguez, P., Perez-Iglesias, J.I. a Navarro, E. (1999). Sediment toxicity bioassays for assessment of contaminated sites in the Nervion river (Northern Spain). 2. Tubifex tubifex (Müller) reproduction sediment bioassay. Ecotoxicology 8, 111 – 124.
|
|
40.
|
Kapitola C.8 tejto prílohy, Toxicita pre dážďovky.
|
|
41.
|
Environment Canada (1995). Guidance document on measurement of toxicity test precision using control sediments spiked with a reference toxicant. Environmental Protection Series Report EPS 1/RM/30.
|
|
42.
|
Landrum, P.F. (1989). Bioavailability and toxicokinetics of polycyclic aromatic hydrocarbons sorbed to sediments for the amphipod Pontoporeia hoyi. Environ. Sci. Toxicol. 23, 588 – 595.
|
|
43.
|
Poddubnaya, T.L. (1980). Life cycles of mass species of Tubificidae (Oligochaeta). V: R.O. Brinkhurst a D.G. Cook (eds.): Aquatic Oligochaeta Biology, 175 – 184. Plenum Press, New York.
|
|
44.
|
ASTM (1998). Standard guide for collection, storage, characterisation, and manipulation of sediment for toxicological testing. American Society for Testing and Materials, E 1391-94.
|
|
45.
|
Hooftman, R.N., van de Guchte, K. a Roghair, C.J. (1993). Development of ecotoxicological test systems to assess contaminated sediments. Joint report no. 1: Acute and (sub)chronic tests with the model compound chlorpyrifos. RIVM-719102022.
|
|
46.
|
Franke, C. (1996). How meaningful is the bioconcentration factor for risk assessment? Chemosphere 32, 1897 – 1905.
|
|
47.
|
Mount, D.R., Dawson, T.D. a Burkhard, L.P. (1999). Implications of gut purging for tissue residues determined in bioaccumulation testing of sediment with Lumbriculus variegatus. Environ. Toxicol. Chem. 18, 1244 – 1249.
|
|
48.
|
Randall, R.C., Lee II, H., Ozretich, R.J., Lake, J.L. a Pruell, R.J. (1991). Evaluation of selected lipid methods for normalising pollutant bioaccumulation. Environ.Toxicol. Chem. 10, 1431 – 1436.
|
|
49.
|
Gardner, W.S., Frez, W.A., Cichocki, E.A. a Parrish, C.C. (1985). Micromethods for lipids in aquatic invertebrates. Limnology and Oceanography, 30, 1099 – 1105.
|
|
50.
|
Bligh, E.G. a Dyer, W.J. (1959). A rapid method of total lipid extraction and purification. Can. J. Biochem. Physiol. 37, 911 – 917.
|
|
51.
|
De Boer, J., Smedes, F., Wells, D. a Allan, A. (1999). Report on the QUASH interlaboratory study on the determination of total-lipid in fish and shellfish. Round 1 SBT-2. Exercise 1000. EU, Standards, Measurement and Testing Programme.
|
|
52.
|
Kristensen, P. (1991). Bioconcentration in fish: comparison of bioconcentration factors derived from OECD and ASTM testing methods; influence of particulate matter to the bioavailability of chemicals. Water Quality Institute, Dánsko.
|
|
53.
|
Zok, S., Görge, G., Kalsch, W. a Nagel, R. (1991). Bioconcentration, metabolism and toxicity of substituted anilines in the zebrafish (Brachydanio rerio). Sci. Total Environment 109/110, 411 – 421.
|
|
54.
|
Nagel, R. (1988). Umweltchemikalien und Fische – Beiträge zu einer Bewertung. Habilitationsschrift, Johannes Gutenberg-Universität Mainz, Nemecko.
|
|
55.
|
Janssen, M.P.M., A Bruins, T.H. De Vries a Van Straalen, N.M. (1991). Comparison of cadmium kinetics in four soil arthropod species. Arch. Environ. Contam. Toxicol. 20: 305 – 312.
|
|
56.
|
Van Brummelen, T.C. a Van Straalen, N.M. (1996). Uptake and elimination of benzo(a)pyrene in the terrestrial isopod Porcellio scaber. Arch. Environ. Contam. Toxicol. 31: 277 – 285.
|
|
57.
|
Sterenborg, I., Vork, N.A., Verkade, S.K., Van Gestel, C.A.M. a Van Straalen, N.M. (2003). Dietary zinc reduces uptake but not metallothionein binding and elimination of cadmium in the springtail Orchesella cincta. Environ. Toxicol. Chemistry 22: 1167 – 1171.
|
|
58.
|
Suedel, B.C. a Rodgers, J.H. (1993). Development of formulated reference sediments for freshwater and estuarine sediment testing. Environ. Toxicol. Chem. 13, 1163 – 1175.
|
|
59.
|
Wachs, B. (1967). Die Oligochaeten-Fauna der Fließgewässer unter besonderer Berücksichtigung der Beziehung zwischen der Tubificiden-Besiedlung und dem Substrat. Arch. Hydr. 63, 310 – 386.
|
|
60.
|
Oliver, B. G. (1987). Biouptake of chlorinated hydrocarbons from laboratory-spiked and field sediments by oligochaete worms. Environ. Sci. Technol. 21, 785 – 790.
|
|
61.
|
Chapman, P.M., Farrell, M.A. a Brinkhurst, R.O. (1982a). Relative tolerances of selected aquatic oligochaetes to individual pollutants and environmental factors. Aquatic Toxicology 2, 47 – 67.
|
|
62.
|
Chapman, P.M., Farrell, M.A. a Brinkhurst, R.O. (1982b). Relative tolerances of selected aquatic oligochaetes to combinations of pollutants and environmental factors. Aquatic Toxicology 2, 69 – 78.
|
|
63.
|
Rodriguez, P. a Reynoldson, T.B. (1999). Laboratory methods and criteria for sediment bioassessment. V: A. Mudroch, J.M. Azcue a P. Mudroch (eds.): Manual of Bioassessment of aquatic sediment quality. Lewis Publishers, Boca Raton, CRC Press LLC.
|
|
64.
|
Brinkhurst, R.O. (1971). A guide for the identification of British aquatic oligochaeta. Freshw. Biol. Assoc., Sci. Publ. No. 22.
|
|
65.
|
Egeler, Ph., Meller, M., Schallnaß, H.J. & Gilberg, D. (2005). Validation of a sediment toxicity test with the endobenthic aquatic oligochaete Lumbriculus variegatus by an international ring test. In co-operation with R. Nagel and B. Karaoglan. Report to the Federal Environmental Agency (Umweltbundesamt Berlin), R&D No.: 202 67 429.
|
|
66.
|
Aston, R.J., Sadler, K. a Milner, A.G.P. (1982). The effect of temperature on the culture of Branchiura sowerbyi (Oligochaeta: Tubificidae) on activated sludge. Aquaculture 29, 137 – 145.
|
|
67.
|
Roghair, C.J., Buijze, A., Huys, M.P.A., Wolters-Balk, M.A.H., Yedema, E.S.E. a Hermens, J.L.M. (1996). Toxicity and toxicokinetics for benthic organisms; II: QSAR for base-line toxicity to the midge Chironomus riparius and the tubificid oligochaete worm Branchiura sowerbyi. RIVM Report 719101026.
|
|
68.
|
Aston, R.J. (1984). The culture of Branchiura sowerbyi (Tubificidae, Oligochaeta) using cellulose substrate. Aquaculture 40, 89 – 94.
|
|
69.
|
Bonacina, C., Pasteris, A., Bonomi, G. a Marzuoli, D. (1994). Quantitative observations on the population ecology of Branchiura sowerbyi (Oligochaeta, Tubificidae). Hydrobiologia, 278, 267 – 274
|
“. |

 In force
In force