ISSN 1830-3625
doi:10.3000/18303625.L_2009.220.rum
Jurnalul Oficial
al Uniunii Europene
L 220

Ediţia în limba română
Legislaţie
Anul 52
24 august 2009
|
ISSN 1830-3625 doi:10.3000/18303625.L_2009.220.rum |
||
|
Jurnalul Oficial al Uniunii Europene |
L 220 |
|

|
||
|
Ediţia în limba română |
Legislaţie |
Anul 52 |
|
Cuprins |
|
I Acte adoptate în temeiul Tratatelor CE/Euratom a căror publicare este obligatorie |
Pagina |
|
|
|
REGULAMENTE |
|
|
|
* |
Regulamentul (CE) nr. 761/2009 al Comisiei din 23 iulie 2009 de modificare, în scopul adaptării la progresele tehnice, a Regulamentului (CE) nr. 440/2008 de stabilire a metodelor de testare în temeiul Regulamentului (CE) nr. 1907/2006 al Parlamentului European și al Consiliului privind înregistrarea, evaluarea, autorizarea și restricționarea substanțelor chimice (REACH) ( 1 ) |
|
|
|
|
|
(1) Text cu relevanță pentru SEE |
|
RO |
Actele ale căror titluri sunt tipărite cu caractere drepte sunt acte de gestionare curentă adoptate în cadrul politicii agricole şi care au, în general, o perioadă de valabilitate limitată. Titlurile celorlalte acte sunt tipărite cu caractere aldine şi sunt precedate de un asterisc. |
I Acte adoptate în temeiul Tratatelor CE/Euratom a căror publicare este obligatorie
REGULAMENTE
|
24.8.2009 |
RO |
Jurnalul Oficial al Uniunii Europene |
L 220/1 |
REGULAMENTUL (CE) NR. 761/2009 AL COMISIEI
din 23 iulie 2009
de modificare, în scopul adaptării la progresele tehnice, a Regulamentului (CE) nr. 440/2008 de stabilire a metodelor de testare în temeiul Regulamentului (CE) nr. 1907/2006 al Parlamentului European și al Consiliului privind înregistrarea, evaluarea, autorizarea și restricționarea substanțelor chimice (REACH)
(Text cu relevanță pentru SEE)
COMISIA COMUNITĂȚILOR EUROPENE,
având în vedere Tratatul de instituire a Comunității Europene,
având în vedere Regulamentul (CE) nr. 1907/2006 al Parlamentului European și al Consiliului din 18 decembrie 2006 privind înregistrarea, evaluarea, autorizarea și restricționarea substanțelor chimice (REACH), de înființare a Agenției Europene pentru Produse Chimice, de modificare a Directivei 1999/45/CE și de abrogare a Regulamentului (CEE) nr. 793/93 al Consiliului și a Regulamentului (CE) nr. 1488/94 al Comisiei, precum și a Directivei 76/769/CEE a Consiliului și a Directivelor 91/155/CEE, 93/67/CEE, 93/105/CE și 2000/21/CE ale Comisiei (1), în special articolul 13 alineatul (3),
întrucât:
|
(1) |
Regulamentul (CE) nr. 440/2008 al Comisiei (2) conține metodele de testare care se aplică în temeiul Regulamentului (CE) nr. 1907/2006, în scopul determinării proprietăților fizico-chimice, a toxicității și a ecotoxicității substanțelor. |
|
(2) |
Este necesară actualizarea Regulamentului (CE) nr. 440/2008 pentru a include modificările anumitor metode de testare și câteva noi metode de testare adoptate de OECD. Părțile interesate au fost consultate cu privire la această propunere. Respectivele modificări adaptează metodele în cauză la progresele tehnice și științifice. |
|
(3) |
Ar trebui revizuite prevederile privind presiunea vaporilor, pentru a include noua metodă a efuziunii. |
|
(4) |
Este necesară adăugarea unei noi metode de măsurare a diametrului mediu geometric ponderat pe lungime al fibrelor. |
|
(5) |
Este necesară actualizarea Regulamentului (CE) nr. 440/2008 pentru a include cu prioritate o nouă metodă de testare in vitro pentru iritația cutanată, în vederea reducerii numărului de animale utilizate în scopuri experimentale, în conformitate cu Directiva 86/609/CEE a Consiliului din 24 noiembrie 1986 privind apropierea actelor cu putere de lege și a actelor administrative ale statelor membre în ceea ce privește protecția animalelor utilizate în scopuri experimentale și în alte scopuri științifice (3). Deși un proiect de metodă de testare in vitro pentru iritația cutanată se află încă în discuție în cadrul OECD, este necesar ca, în acest caz excepțional, metoda B 46 să fie inclusă în prezentul regulament. Metoda B 46 ar trebui actualizată în cel mai scurt timp posibil după ce s-a ajuns la un acord în cadrul OECD sau în cazul în care devin disponibile informații suplimentare care justifică o astfel de revizuire. |
|
(6) |
Prevederile privind testul de inhibare a creșterii la alge trebuie revizuite pentru a include specii suplimentare și pentru a răspunde cerințelor privind evaluarea riscurilor și clasificarea substanțelor chimice. |
|
(7) |
Este necesară adăugarea unei noi metode de măsurare a mineralizării aerobe în apa de suprafață, prin intermediul unui test de simulare a biodegradării, precum și adăugarea unei noi metode de evaluare a toxicității la genul Lemna, prin intermediul unui test de inhibare a creșterii. |
|
(8) |
Prin urmare, Regulamentul (CE) nr. 440/2008 ar trebui modificat în consecință. |
|
(9) |
Măsurile prevăzute de prezentul regulament sunt conforme cu avizul comitetului instituit prin articolul 133 din Regulamentul (CE) nr. 1907/2006, |
ADOPTĂ PREZENTUL REGULAMENT:
Articolul 1
Anexa la Regulamentul (CE) nr. 440/2008 se modifică după cum urmează:
|
1. |
Partea A se modifică după cum urmează:
|
|
2. |
Partea B se modifică după cum urmează: Se adaugă capitolul B.46, așa cum figurează în anexa III la prezentul regulament. |
|
3. |
Partea C se modifică după cum urmează:
|
Articolul 2
Prezentul regulament intră în vigoare în a treia zi de la data publicării în Jurnalul Oficial al Uniunii Europene.
Prezentul regulament este obligatoriu în toate elementele sale și se aplică direct în toate statele membre.
Adoptat la Bruxelles, 23 iulie 2009.
Pentru Comisie
Stavros DIMAS
Membru al Comisiei
(1) JO L 396, 30.12.2006, p. 1.
(2) JO L 142, 31.5.2008, p. 1.
(3) JO L 358, 18.12.1986, p. 1.
ANEXA I
|
A.4. |
PRESIUNEA DE VAPORI |
1. METODĂ
Prezenta metodă este echivalentă cu orientările OECD privind testele nr. 104 (2004).
1.1. INTRODUCERE
Versiunea revizuită a metodei A.4(1) include o metodă suplimentară, metoda prin efuziune: termogravimetrie izotermă, proiectată pentru substanțe cu presiuni de evaporare foarte scăzute (până la 10–10 Pa). Având în vedere necesitatea stabilirii de proceduri, în special în cazul obținerii presiunii de vapori pentru substanțele cu presiune de vapori scăzută, sunt reevaluate alte proceduri ale acestei metode în ceea ce privește intervalele diferite de aplicabilitate.
La echilibru termodinamic, presiunea de vapori a unei substanțe în stare pură este exclusiv o funcție de temperatură. Principiile fundamentale sunt descrise în literatura de specialitate (2)(3).
Nu există o singură metodă de măsurare aplicabilă întregului interval de presiuni de vapori de la < 10–10 la 105 Pa. În această metodă sunt incluse opt metode de măsurare a presiunii de vapori, care pot fi aplicate în intervale diferite de presiuni de vapori. Diferitele metode sunt comparate din punctul de vedere al aplicației și intervalului de măsurare în tabelul 1. Metodele pot fi aplicate doar în cazul compușilor care nu se descompun în condițiile testului. În cazurile în care metodele experimentale nu pot fi aplicate din motive de ordin tehnic, presiunea de vapori poate fi estimată, o metodă de estimare recomandată fiind indicată în apendice.
1.2. DEFINIȚII ȘI UNITĂȚI
Presiunea de vapori a unei substanțe este definită ca presiunea de saturație la suprafața de contact cu aerul a unei substanțe solide sau lichide.
Unitatea din Sistemul Internațional (SI) pentru presiune care trebuie folosită este pascalul (Pa). Alte unități alternative folosite de-a lungul timpului, împreună cu factorii lor de conversie, sunt:
|
1 Torr |
= |
1 mm Hg |
= |
1,333 × 102 Pa |
|
1 atmosferă |
= |
1,013 × 105 Pa |
|
|
|
1 bar |
= |
105 Pa |
|
|
Unitatea de măsură din SI pentru temperatură este kelvinul (K). Transformarea gradelor Celsius în kelvini are loc după formula:
T = t + 273,15
unde T reprezintă temperatura exprimată în kelvin sau temperatura termodinamică, iar t reprezintă temperatura exprimată în grade Celsius.
Tabelul 1
|
Metodă de măsurare |
Substanța |
Repetabilitate estimată |
Reproductibilitate estimată |
Interval recomandat |
|
|
solid |
lichid |
||||
|
Metoda dinamică |
Topire joasă |
Da |
Până la 25 % 1-5 % |
Până la 25 % 1-5 % |
103 Pa- 2 × 103 Pa 2 × 103 Pa- 105 Pa |
|
Metoda statică |
Da |
Da |
5-10 % |
5-10 % |
10 Pa- 105 Pa 10–2 Pa- 105 Pa (1) |
|
Metoda izoteniscopului |
Da |
Da |
5-10 % |
5-10 % |
102 Pa- 105 Pa |
|
Metoda prin efuziune: balanța pentru presiunea de vapori |
Da |
Da |
5-20 % |
Până la 50 % |
10–3-1 Pa |
|
Metoda prin efuziune: celulă Knudsen |
Da |
Da |
10-30 % |
— |
10–10-1 Pa |
|
Metoda prin efuziune: termogravimetrie izotermă |
Da |
Da |
5-30 % |
Până la 50 % |
10–10-1 Pa |
|
Metoda gazului saturat |
Da |
Da |
10-30 % |
Până la 50 % |
10–10-103 Pa |
|
Metoda rotorului |
Da |
Da |
10-20 % |
— |
10–4-0,5 Pa |
1.3. PRINCIPIUL DE TESTARE
În general, presiunea de vapori este determinată la diferite temperaturi. Într-un interval limitat de temperaturi, logaritmul presiunii de vapori a unei substanțe pure este o funcție lineară a inversului temperaturii termodinamice, conform ecuației Clapeyron-Clausius simplificate:

unde:
|
p |
= |
presiunea de vapori a substanței, exprimată în pascali |
|
ΔHv |
= |
căldura de vaporizare, exprimată în J mol–1 |
|
R |
= |
constanta universală a gazelor, 8,314 J mol–1 K–1 |
|
T |
= |
temperatura în K |
1.4. SUBSTANȚE DE REFERINȚĂ
Nu este necesar să se folosească substanțe de referință. Acestea servesc în special la etalonarea periodică a metodei și la comparația cu rezultatele obținute prin alte metode.
1.5. DESCRIEREA METODEI
1.5.1. Metoda dinamică (Metoda lui Cottrell)
1.5.1.1. Principiu
Presiunea de vapori este determinată prin măsurarea temperaturii de fierbere a substanței la diferite presiuni între aproximativ 103 și 105 Pa. Această metodă este recomandată, de asemenea, pentru determinarea temperaturii de fierbere. Este utilă în acest sens pentru temperaturi până la 600 K. Temperaturile de fierbere ale lichidelor sunt cu aproximativ 0,1 °C mai mari la o adâncime de 3-4 cm decât la suprafață, datorită presiunii hidrostatice a coloanei de lichid. În metoda lui Cottrell (4), termometrul este plasat în vaporii de la suprafața lichidului, iar lichidul în stare de fierbere este pompat constant pe rezervorul termometrului. Rezervorul este acoperit de un strat subțire de lichid aflat în echilibru cu vaporii la presiune atmosferică. Astfel, termometrul indică punctul de fierbere real, fără erori apărute ca urmare a supraîncălzirii sau a presiunii hidrostatice. Pompa utilizată inițial de Cottrell este ilustrată în figura 1. Tubul A conține lichidul de fierbere. Un fir de platină B fixat la baza tubului facilitează fierberea uniformă. Tubul lateral C face legătura cu un condensator, iar mantaua D previne atingerea termometrului E de către condensatul rece. Când lichidul A este la punctul de fierbere, bulele și lichidul prinse în pâlnie se scurg pe rezervorul termometrului prin cele două brațe ale pompei F.
|
Figura 1
|
Figura 2
|
Pompă Cottrell (4)
|
A: |
Termocuplu |
|
B: |
Volum tampon |
|
C: |
Manometru |
|
D: |
Vid |
|
E: |
Punct de măsurare |
|
F: |
Element de încălzire (circa 150 W) |
1.5.1.2. Aparatură
Un aparat foarte precis, care funcționează conform principiului lui Cottrell, este ilustrat în figura 2. Este format dintr-un tub cu o zonă de fierbere în partea inferioară, un vas de răcire în zona mediană și o ieșire și o flanșă în partea superioară. Pompa Cottrell este plasată în zona de fierbere, încălzită cu ajutorul unui cartuș caloric. Temperatura se măsoară cu ajutorul unui termocuplu izolat sau a unui termometru cu rezistență introduse prin flanșa din vârf. Ieșirea se conectează la sistemul de reglare a presiunii. Acesta din urmă este format dintr-o pompă de vid, un volum tampon, un manostat pentru introducerea de azot necesar reglării presiunii și un manometru.
1.5.1.3. Procedură
Substanța se pune în zona de fierbere. Pot să apară probleme în cazul solidelor care nu sunt sub formă de pulbere, dar în unele cazuri acestea se pot rezolva încălzind agentul de răcire din mantaua de răcire. Aparatul se închide la flanșă și substanța se degazează. Această metodă nu poate fi folosită în cazul substanțelor care spumează.
Se stabilește cea mai joasă dintre presiunile dorite și se începe încălzirea. În același timp, senzorul de temperatură se conectează la contor.
Echilibrul este atins atunci când se înregistrează o temperatură de fierbere constantă la presiune constantă. Trebuie evitat fenomenul de vaporizare locală cu fierbere violentă. În plus, în vasul de răcire condensarea trebuie să fie completă. Când se determină presiunea de vapori a solidelor cu punct de topire scăzut, trebuie evitată blocarea condensatorului.
După înregistrarea acestui punct de echilibru se stabilește o presiune mai ridicată. Procesul se continuă în același fel până când se atinge o presiune de 105 Pa (aproximativ 5-10 măsurători în total). Pentru verificare, aceleași puncte de echilibru trebuie să se regăsească la descreșterea presiunii.
1.5.2. Metoda statică
1.5.2.1. Principiu
În metoda statică (5), presiunea vaporilor la echilibru termodinamic se determină la o temperatură specificată. Metoda este adecvată substanțelor și solidelor și lichidelor care conțin mai multe componente în intervalul 10–1-105 Pa, și în intervalul 1-10 Pa, cu condiția să fie aplicată atent.
1.5.2.2. Aparatură
Echipamentul este format dintr-o baie termostatată (precizie de ±0,2 K), un recipient pentru eșantion conectat la o linie de vid, un manometru și un sistem de reglare a presiunii. Vasul eșantion (figura 3a) este conectat la linia de vid prin intermediul unui ventil și al unui manometru diferențial (un tub în formă de U cu un fluid manometric adecvat) utilizat ca indicator de zero. În manometrul diferențial se pot folosi mercur, uleiuri de silicon și ftalați, în funcție de intervalul de presiune și comportamentul chimic al substanței de testat. Totuși, din rațiuni de protecție a mediului, utilizarea mercurului trebuie să fie evitată dacă este posibil. Substanța de testat nu trebuie să se dizolve perceptibil sau să reacționeze cu fluidul din tubul în formă de U. În locul tubului în formă de U se poate folosi un manometru (figura 3b). Pentru manometru, mercurul poate fi utilizat în intervalul de presiune de la normală scăzând până la 102 Pa, în timp ce uleiurile de silicon și ftalații se folosesc în intervalul de la mai puțin de 102 Pa până la 10 Pa. Există și alte tipuri de aparate de măsurare a presiunii utilizabile sub 102 Pa, precum și manometre cu membrană rezistente la temperatură care pot fi folosite chiar sub 10–1 Pa. Măsurarea temperaturii se face pe peretele exterior al vasului care conține eșantionul sau chiar în vas.
1.5.2.3. Procedură
Utilizând aparatul conform descrierii din figura 3a, se umple vasul în formă de U cu lichidul ales, care trebuie să fie degazat la o temperatură ridicată înainte de a se face citirile. Substanța de testat se introduce în aparat și se degazează la temperatură redusă. În cazul unui eșantion cu mai mulți componenți, temperatura trebuie să fie suficient de scăzută pentru a preveni alterarea compoziției materialului. Echilibrul poate fi stabilit mult mai rapid prin agitare. Eșantionul poate fi răcit cu azot lichid sau gheață carbonică, dar sunt necesare precauții pentru evitarea condensării aerului sau lichidului din pompă. Cu ventilul de deasupra vasului deschis, se evacuează aerul prin aspirație, timp de câteva minute. Dacă este necesar, operația de degazare se repetă de câteva ori.
|
Figura 3a
|
Figura 3b
|
Când eșantionul se încălzește cu ventilul închis, presiunea de vapori crește și modifică echilibrul fluidului din manometrul auxiliar. Pentru compensare se introduce azot sau aer în aparat până când indicatorul de presiune diferențială revine la zero. Presiunea cerută pentru echilibrare trebuie să fie citită la un manometru sau la un instrument de mai mare precizie. Această presiune corespunde presiunii de vapori a substanței la temperatura dată a eșantionului. Dacă se folosește aparatul descris în figura 3b, presiunea de vapori este citită direct.
Valorile presiunii de vapori se determină la intervale de timp mici (aproximativ 5-10 măsurători în total) până la temperatura maximă cerută.
Citirile la temperaturi scăzute trebuie să fie repetate pentru verificare. Dacă valorile obținute la citirile repetate nu coincid cu curba obținută pentru creșterea temperaturii, aceasta se poate datora următoarelor cauze:
|
(i) |
proba conține încă aer (de exemplu, în cazul materialelor cu vâscozitate mare) sau impurități cu temperaturi de fierbere scăzute, care se evaporă în timpul încălzirii; |
|
(ii) |
substanța suferă o reacție chimică în intervalul de temperatură analizat (de exemplu descompunere, polimerizare). |
1.5.3. Metoda izoteniscopului
1.5.3.1. Principiu
Metoda izoteniscopului (6) se bazează pe principiul metodei statice. Metoda presupune introducerea unui eșantion într-un rezervor menținut la temperatură constantă și conectat la un manometru și o pompă de vid. Impuritățile mai volatile decât substanța sunt îndepărtate prin degazare la presiune scăzută. Presiunea de vapori a eșantionului la temperaturi prestabilite este echilibrată cu ajutorul unei presiuni cunoscute a unui gaz inert. Izoteniscopul a fost creat pentru a măsura presiunea de vapori a anumitor hidrocarburi lichide, dar poate fi folosit și pentru studierea materialelor solide. De obicei, această metodă nu este adecvată sistemelor multicomponent. Pentru eșantioane care conțin impurități nevolatile, rezultatele sunt supuse unor marje de eroare destul de scăzute. Intervalul recomandat este 102-105 Pa.
1.5.3.2. Aparatură
Un exemplu de dispozitiv de măsurare este ilustrat în figura 4. O descriere completă poate fi consultată în ASTM D 2879-86 (6).
1.5.3.3. Procedură
În cazul lichidelor, substanța însăși servește ca fluid în manometrul auxiliar. O cantitate de lichid, suficientă pentru a umple rezervorul și brațul scurt al manometrului, se introduce în izoteniscop. Izoteniscopul este atașat la sistemul de vid și golit, după care se umple cu azot. Evacuarea și purjarea sistemului se repetă de două ori pentru îndepărtarea oxigenului rezidual. Izoteniscopul plin este plasat în poziție orizontală, astfel încât proba să se împrăștie într-un strat subțire în rezervorul bulbiform și în manometru. Presiunea sistemului se reduce la 133 Pa și proba se încălzește ușor numai până la fierbere (îndepărtarea gazelor dizolvate). Apoi izoteniscopul este plasat astfel încât proba să se întoarcă în rezervor și în manometru, astfel încât ambele să fie pline cu lichid. Presiunea se menține la 133 Pa. Vârful rezervorului bulbiform se încălzește la flacără mică până când vaporii degajați împing o parte din lichidul de la partea superioară și din brațul manometrului în secțiunea manometrică a izoteniscopului, creând un spațiu umplut cu vapori și fără azot. Izoteniscopul este introdus într-o baie termostatată, iar presiunea azotului este corectată până la presiunea eșantionului. La echilibru, presiunea de vapori a azotului este egală cu presiunea de vapori a substanței.
Figura 4
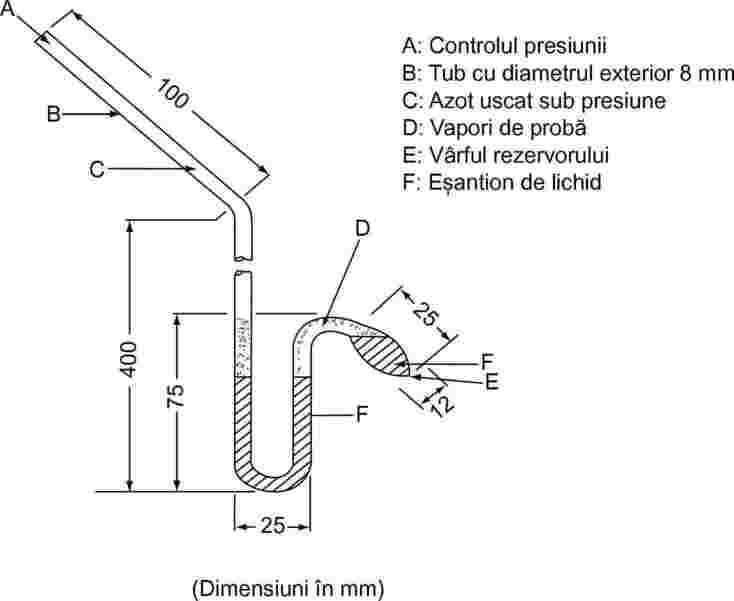
În cazul substanțelor solide, în funcție de intervalul de presiune și temperatură, se utilizează lichide manometrice, precum uleiuri de silicon sau ftalați. Lichidul manometric degazat este turnat în curbura brațului lung al izoteniscopului. Apoi, substanțele solide ce urmează să fie analizate sunt puse în rezervorul bulbiform și sunt degazate la temperatură ridicată. În continuare, izoteniscopul este înclinat astfel încât lichidul manometric să curgă în tubul în formă de U.
1.5.4. Metoda prin efuziune: balanța pentru presiunea de vapori (7)
1.5.4.1. Principiu
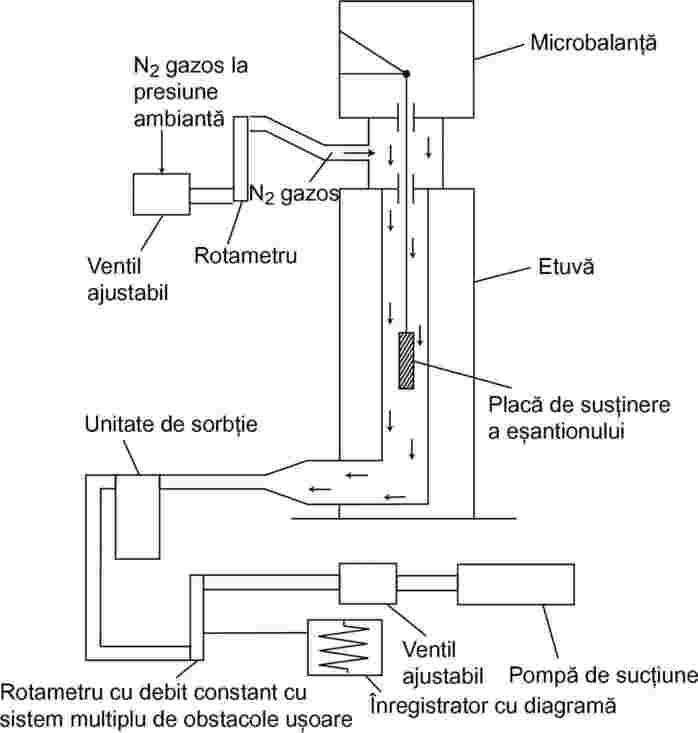
Un eșantion din substanța de testat se încălzește într-un cuptor mic și se introduce într-un clopot de sticlă vidat. Cuptorul este acoperit cu un capac având găuri de mici dimensiuni de diametru cunoscut. Vaporii substanței evacuați prin una dintre găuri sunt direcționați către un taler al unei balanțe foarte sensibile aflate, de asemenea, în clopotul de sticlă vidat. În unele soluții, talerul balanței este înconjurat de o cutie de răcire, care asigură disiparea căldurii către exterior prin conducție termică, și este răcită prin iradiere, astfel încât vaporii evacuați se condensează pe acesta. Forța jetului de vapori acționează asupra balanței. Presiunea de vapori poate fi calculată în două moduri: direct din forța exercitată asupra talerului balanței, precum și din rata de evaporare, utilizând ecuația Hertz-Knudsen (2):
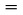
unde:
|
G |
= |
viteza de evaporare (kg s–1 m–2) |
|
M |
= |
masa moleculară (g mol–1) |
|
T |
= |
temperatura (K) |
|
R |
= |
constanta universală a gazelor (J mol–1 K–1) |
|
P |
= |
presiunea de vapori (Pa) |
Intervalul recomandat este 10–3-1 Pa.
1.5.4.2. Aparatură
Principiul general al aparatului este ilustrat în figura 5.
Figura 5

|
A: |
Placă de bază |
F: |
Cutie de refrigerare și bară de răcire |
|
B: |
Instrument cu serpentină mobilă |
G: |
Cuptor evaporator |
|
C: |
Clopot de sticlă |
H: |
Vas Dewar cu azot lichid |
|
D: |
Balanță cu talere |
I: |
Punct de măsurare a temperaturii eșantionului |
|
E: |
Dispozitiv de măsurare a vidului |
J: |
Substanță de testare |
1.5.5. Metoda prin efuziune: celula Knudsen
1.5.5.1. Principiu
Metoda se bazează pe estimarea cantității de substanță analizată care se elimină în unitatea de timp dintr-o celulă Knudsen (8) sub formă de vapori, printr-un orificiu foarte mic, în condiții de vid avansat. Cantitatea de vapori degajați se poate calcula fie prin determinarea pierderii de masă a celulei, fie prin condensarea vaporilor la temperatură joasă și determinarea cantității de substanță volatilizată prin analiză cromatografică. Presiunea de vapori se calculează prin aplicarea relației Hertz-Knudsen (a se vedea punctul 1.5.4.1) cu factori de corecție care depind de parametrii aparatului (9). Intervalul recomandat este 10–10-1 Pa (10)(11)(12)(13)(14).
1.5.5.2. Aparatură
Principiul general al aparatului este ilustrat în figura 6.
Figura 6

|
1: |
Conectare la vid |
7: |
Capac filetat |
|
2: |
Tuburi pentru termometru cu rezistență de platină sau pentru controlul și măsurarea temperaturii |
8: |
Piuliță tip fluture |
|
3: |
Capac pentru cuva de vid |
9: |
Bolțuri |
|
4: |
Garnitură de etanșare |
10: |
Celule de efuziune din oțel inoxidabil |
|
5: |
Cuvă de aluminiu pentru vid |
11: |
Cartuș caloric |
|
6: |
Dispozitiv pentru introducerea și scoaterea celulelor de efuziune |
|
|
1.5.6. Metoda prin efuziune: termogravimetrie izotermă
1.5.6.1. Principiu
Metoda se bazează pe determinarea vitezelor de evaporare accelerată pentru substanța de test la temperaturi ridicate și presiune ambiantă prin folosirea termogravimetriei (10)(15)(16)(17)(18)(19)(20). Vitezele de evaporare vT rezultă din expunerea compusului selectat la o atmosferă de gaz inert cu curgere lentă și monitorizarea pierderilor de masă la temperaturi definite T izoterme în kelvin la intervale de timp corespunzătoare. Presiunile de vapori pT sunt calculate din valorile vT prin folosirea relației liniare între logaritmul presiunii de vapori și logaritmul ratei de evaporare. Dacă este necesar, se poate face o extrapolare la temperaturi de 20 și 25 °C prin analiza regresivă a log pT vs. 1/T. Această metodă este adecvată pentru substanțe cu presiune de vapori de până la 10–10 Pa (10–12 mbar) și cu o puritate cât mai apropiată de 100 % pentru a evita interpretarea eronată a pierderilor de masă măsurate.
1.5.6.2. Aparatură
Principiul general al configurației experimentale este ilustrat în figura 7.
Figura 7
Placa de susținere a eșantionului, suspendată de o microbalanță aflată într-un spațiu cu temperatură constantă, se află în calea unui curent de azot uscat care evacuează moleculele vaporizate ale substanței testate. După părăsirea spațiului, curentul de gaze este purificat de către o unitate de sorbție.
1.5.6.3. Procedură
Substanța testată se aplică pe suprafața unei plăci de sticlă rugoasă într-un strat omogen. În cazul substanțelor solide, placa se udă uniform cu o soluție a substanței într-un solvent adecvat și se usucă într-o atmosferă inertă. Pentru măsurare, placa astfel acoperită se suspendă într-un analizor termogravimetric și, ulterior, pierderea sa de masă se măsoară continuu în funcție de timp.
Viteza de evaporare vT la o temperatură dată se calculează din pierderea de masă Δm a plăcii de eșantion prin

unde F este suprafața acoperită cu substanțele de test, în mod normal suprafața plăcii de eșantion, iar t este timpul pentru pierderea de masă Δm.
Presiunea de vapori pT se calculează pe baza funcției vitezei de evaporare vT:
Log pT = C + D · log vT
unde C și D sunt constante specifice pentru sistemul experimental, în funcție de diametrul spațiului de măsurare și de viteza de scurgere a gazelor. Aceste constante trebuie să fie determinate o singură dată prin măsurarea unui set de compuși cu presiuni de vapori cunoscute și log pT vs. log vT regresiv (11)(21)(22).
Relația între presiunea de vapori pT și temperatura T în kelvini se calculează cu ajutorul formulei
Log pT = A + B · 1/T
unde A și B sunt constante obținute prin regresiunea log pT vs. 1/T. Prin această ecuație, presiunea de vapori poate fi calculată prin extrapolare pentru orice altă temperatură.
1.5.7. Metoda gazului saturat (23)
1.5.7.1. Principiu
Gazul inert este trecut, la temperatura camerei și la o viteză de curgere cunoscută, prin sau peste un eșantion al substanței testate, suficient de lent pentru a fi asigurată saturarea. Atingerea saturării în faza gazoasă este deosebit de importantă. Substanța transportată se colectează, de obicei, cu ajutorul unui absorbant, cantitatea sa fiind apoi calculată. Ca alternativă la colectarea vaporilor și analizarea lor ulterioară, pentru determinarea cantității de material transportat pot fi utilizate tehnici analitice în flux, precum cromatografia în stare gazoasă. Presiunea de vapori se calculează pornind de la ipoteza că legea gazului ideal este respectată, presiunea totală a unui amestec de gaze fiind egală cu suma presiunilor gazelor componente. Presiunea parțială a substanței de test, reprezentând presiunea de vapori, se calculează din volumul total de gaz cunoscut și greutatea materialului transportat.
Metoda gazului saturat se aplică substanțelor chimice solide sau lichide. Poate fi folosită pentru presiuni de vapori de până la 10–10 Pa (10)(11)(12)(13)(14). Metoda are eficiență maximă pentru presiuni de vapori mai mici de 103 Pa. Peste 103 Pa, presiunile de vapori sunt în general supraestimate, probabil ca urmare a formării de aerosoli. Deoarece măsurarea presiunii de vapori se face la temperatura camerei, nu este necesară extrapolarea datelor de la temperaturi mari, erorile grave provocate ca urmare a acestei extrapolări fiind astfel evitate.
1.5.7.2. Aparatură
Procedura necesită folosirea unui recipient izolat termic. Schița din figura 8 ilustrează un recipient conținând câte trei vase de testare pentru eșantioane de substanțe solide și substanțe lichide, ceea ce permite o analiză triplă atât a eșantionului solid, cât și a celui lichid. Temperatura este menținută constantă cu o precizie de ±0,5 °C sau mai mare.
Figura 8

În general, azotul este folosit ca gaz purtător inert, dar, ocazional, poate fi necesar un alt gaz (24). Gazul purtător trebuie să fie uscat. Curentul de gaz este divizat în 6 curente, controlate prin ventile tip ac (cu orificiu de aproximativ 0,79 mm), și curge în recipient printr-un tub de cupru cu un diametru de 3,8 mm. După echilibrarea temperaturii, gazul curge prin eșantion și separatorul absorbant și iese din recipient.
Eșantioanele solide se încarcă în tuburi de sticlă cu diametru de 5 mm, fiind amplasate între dopuri din vată de sticlă (a se vedea figura 9). Figura 10 ilustrează un suport pentru eșantion lichid și un sistem absorbant. Cea mai ușor de reprodus metodă de măsurare a presiunii de vapori a lichidelor constă în acoperirea cu lichid a unor mărgele de sticlă sau a unui absorbant inert, cum ar fi silice, iar suportul se umple cu aceste mărgele. Ca alternativă, în gazul purtător se pot introduce frită de dimensiuni mari și bule care să treacă printr-o coloană a substanței lichide de testare.
|
Figura 9
|
Figura 10
|
Sistemul absorbant este format dintr-o secțiune frontală și o secțiune de rezervă absorbante. La presiuni de vapori foarte scăzute, absorbantul reține doar cantități mici, iar adsorbția la vata de sticlă și la tubul de sticlă dintre eșantion și absorbant poate fi serios afectată.
Separatoarele răcite cu CO2 solid constituie o altă metodă eficientă de colectare a materialului vaporizat. Acestea nu determină o contrapresiune pe coloana de saturare, iar îndepărtarea cantitativă a materialului separat este facilă.
1.5.7.3. Procedură
Viteza de curgere a gazului purtător efluent se măsoară la temperatura camerei. Viteza de curgere se verifică frecvent pe parcursul experimentului pentru a fi cunoscută valoarea exactă a volumului total de gaz purtător. Se preferă monitorizarea continuă cu un debitmetru de masă. Saturația fazei gazoase poate necesita o perioadă de contact considerabil de lungă care determină, prin urmare, viteze de curgere a gazului destul de scăzute (25).
La sfârșitul experimentului, ambele secțiuni absorbante frontală și de rezervă se analizează separat. Compusul din fiecare secțiune este desorbit prin adăugarea unui solvent. Soluțiile rezultate se analizează în mod cantitativ pentru a se determina masa desorbită din fiecare secțiune. Opțiunea asupra metodei analitice (precum și opțiunea asupra absorbantului și a solventului de desorbire) este dictată de natura materialului de testat. Eficiența desorbției se determină prin injectarea unei cantități cunoscute de eșantion în absorbant, provocând desorbirea acestuia, după care se analizează cantitatea recuperată. Este important să se verifice eficiența desorbției la sau în jurul concentrației eșantionului în condițiile de testare.
În scopul asigurării saturației gazului purtător cu substanța de testat, se folosesc trei viteze de curgere diferite. Dacă presiunea de vapori calculată nu arată că este dependentă de viteza de curgere, se presupune că gazul este saturat.
Presiunea de vapori se calculează prin ecuația:
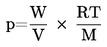
unde:
|
p |
= |
presiunea de vapori (Pa) |
|
W |
= |
masa de substanță de testat evaporată (g) |
|
V |
= |
volumul de gaz saturat (m3) |
|
R |
= |
constanta universală a gazelor 8,314 (J mol–1 K–1) |
|
T |
= |
temperatura (K) |
|
M |
= |
masa molară a substanței de testat (g mol–1) |
Volumele măsurate trebuie să fie corectate cu privire la diferențele de presiune și temperatură între debitmetru și coloana de saturație.
1.5.8. Metoda rotorului
1.5.8.1. Principiu
Această metodă folosește un indicator de viscozitate cu rotor, în care elementul de măsurare este o bilă mică de oțel, suspendată într-un câmp magnetic, care se rotește ca urmare a rotirii câmpurilor magnetice (26)(27)(28). Bobinele de control permit măsurarea vitezei de rotire. Când bila a atins o viteză de rotație dată, de regulă aproximativ 400 de rotații pe secundă, se oprește alimentarea bobinelor și are loc o decelerare datorată frecării cu moleculele de gaz. Scăderea vitezei de rotație este măsurată în funcție de timp. Presiunea gazului este calculată din încetinirea mișcării bilei de oțel, care este dependentă de presiune. Intervalul recomandat este 10–4-0,5 Pa.
1.5.8.2. Aparatură
O schiță a configurației experimentale este ilustrată în figura 11. Capul de măsurare este introdus într-o incintă cu temperatură constantă, reglată cu o abatere de 0,1 °C. Recipientul conținând eșantionul este plasat într-o incintă separată, de asemenea reglată cu o abatere de 0,1 °C. Toate celelalte părți ale configurației sunt menținute la o temperatură mai înaltă, pentru a preveni condensarea. Întregul aparat este conectat la un sistem de vid avansat.
Figura 11

2. DATE ȘI RAPORTARE
2.1. DATE
În oricare metodă, presiunea de vapori se determină la cel puțin două temperaturi diferite. Este de preferat să se folosească trei sau mai multe temperaturi, în intervalul 0-50 °C, pentru a verifica linearitatea curbei presiunii de vapori. În cazul metodei prin efuziune (celula Knudsen și termogravimetria izotermală) și a metodei gazului saturat, pentru intervalul de temperatură se recomandă 120-150 °C, în loc de 0-50 °C.
2.2. RAPORT DE TESTARE
Raportul de testare include următoarele date:
|
— |
metoda folosită; |
|
— |
specificațiile precise ale substanțelor (identitate și impurități) și etapa de purificare preliminară, după caz; |
|
— |
cel puțin două valori ale presiunii de vapori la temperaturi diferite – de preferință trei sau mai multe – pentru intervalul 0-50 °C (sau 120-150 °C); |
|
— |
cel puțin una dintre temperaturi trebuie să fie egală cu mai mică de 25 °C, dacă este posibil din punct de vedere tehnic, în funcție de metoda aleasă; |
|
— |
toate datele originale; |
|
— |
o curbă log p în funcție de 1/T; |
|
— |
o estimare a presiunii de vapori la 20 sau 25 °C. |
Dacă se observă o transformare (schimbarea de stare, descompunere), se consemnează următoarele date:
|
— |
natura modificării; |
|
— |
temperatura la care are loc transformarea corectată la presiune atmosferică; |
|
— |
presiunea de vapori la 10 și 20 °C sub temperatura de tranziție și la 10 și 20 °C peste această temperatură (în afara cazului în care tranziția este de la solid la gaz). |
Se consemnează toate informațiile și observațiile relevante pentru interpretarea rezultatelor, în special cele privitoare la impurități și starea fizică a substanței.
3. REFERINȚE BIBLIOGRAFICE
|
1. |
Jurnalul Oficial al Comunităților Europene L 383 A, 26-47 (1992). |
|
2. |
Ambrose, D. (1975). Experimental Thermodynamics, Vol. II, Le Neindre, B., și Vodar, B., Eds., Butterworths, Londra. |
|
3. |
Weissberger R., ed. (1959). Technique of Organic Chemistry, Physical Methods of Organic Chemistry, 3rd ed., Vol. I, Part I. Chapter IX, Interscience Publ., New York. |
|
4. |
Glasstone, S. (1946). Textbook of Physical Chemistry, ediția a doua, Van Nostrand Company, New York. |
|
5. |
NF T 20-048 AFNOR (septembrie 1985). Chemical products for industrial use – Determination of vapour pressure of solids and liquids within a range from 10–1 to 105 Pa – Static method. |
|
6. |
ASTM D 2879-86, Standard test method for vapour pressure – temperature relationship and initial decomposition temperature of liquids by isoteniscope. |
|
7. |
NF T 20-047 AFNOR (septembrie 1985). Chemical products for industrial use – Determination of vapour pressure of solids and liquids within range from 10–3 to 1 Pa – Vapour pressure balance method. |
|
8. |
Knudsen, M. (1909). Ann. Phys. Lpz., 29, 1979; (1911), 34, 593. |
|
9. |
Ambrose, D., Lawrenson, I.J., Sprake, C.H.S. (1975). J. Chem. Thermodynamics 7, 1173. |
|
10. |
Schmuckler, M.E., Barefoot, A.C., Kleier, D.A., Cobranchi, D.P. (2000), Vapor pressures of sulfonylurea herbicides; Pest Management Science 56, 521-532. |
|
11. |
Tomlin, C.D.S. (ed.), The Pesticide Manual, ediția a douăsprezecea (2000). |
|
12. |
Friedrich, K., Stammbach, K., Gas chromatographic determination of small vapour pressures determination of the vapour pressures of some triazine herbicides. J. Chromatog. 16 (1964), 22-28. |
|
13. |
Grayson, B.T., Fosbraey, L.A., Pesticide Science 16 (1982), 269-278. |
|
14. |
Rordorf, B.F., Prediction of vapor pressures, boiling points and enthalpies of fusion for twenty-nine halogenated dibenzo-p-dioxins, Thermochimia Acta 112 nr. 1 (1987), 117-122. |
|
15. |
Gückel, W., Synnatschke, G., Ritttig, R., A Method for Determining the Volatility of Active Ingredients Used in Plant Protection; Pesticide Science 4 (1973) 137-147. |
|
16. |
Gückel, W., Synnatschke, G., Ritttig, R., A Method for Determining the Volatility of Active Ingredients Used in Plant Protection II. Application to Formulated Products; Pesticide Science 5 (1974) 393-400. |
|
17. |
Gückel, W., Kaestel, R., Lewerenz, J., Synnatschke, G., A Method for Determining the Volatility of Active Ingredients Used in Plant Protection. Part III: The Temperature Relationship between Vapour Pressure and Evaporation Rate; Pesticide Science 13 (1982) 161-168. |
|
18. |
Gückel, W., Kaestel, R., Kroehl, T., Parg, A., Methods for Determining the Vapour Pressure of Active Ingredients Used in Crop Protection. Partea IV: An Improved Thermogravimetric Determination Based on Evaporation Rate; Pesticide Science 45 (1995) 27-31. |
|
19. |
Kroehl, T., Kaestel, R., Koenig, W., Ziegler, H., Koehle, H., Parg, A., Methods for Determining the Vapour Pressure of Active Ingredients Used in Crop Protection. Partea V: Thermogravimetry Combined with Solid Phase MicroExtraction (SPME); Pesticide Science, 53 (1998) 300-310. |
|
20. |
Tesconi, M., Yalkowsky, S.H., A Novel Thermogravimetric Method for Estimating the Saturated Vapor Pressure of Low-Volatility Compounds; Journal of Pharmaceutical Science 87(12) (1998) 1512-20. |
|
21. |
Lide, D.R. (ed.), CRC Handbook of Chemistry and Physics, a optzeci și una ediție (2000), Vapour Pressure in the Range – 25 °C to 150 °C. |
|
22. |
Meister, R.T. (ed.), Farm Chemicals Handbook, Vol. 88 (2002). |
|
23. |
40 CFR, 796. (1993). pp 148-153, Office of the Federal Register, Washington DC. |
|
24. |
Rordorf B.F. (1985). Thermochimica Acta 85, 435. |
|
25. |
Westcott et al. (1981). Environ. Sci. Technol. 15, 1375. |
|
26. |
Messer G., Röhl, P., Grosse G., Jitschin W. (1987). J. Vac. Sci. Technol. (A), 5(4), 2440. |
|
27. |
Comsa G., Fremerey J.K., and Lindenau, B. (1980). J. Vac. Sci. Technol. 17(2), 642. |
|
28. |
Fremerey, J.K. (1985). J. Vac. Sci. Technol. (A), 3(3), 1715. |
(1) Când se utilizează un manometru cu capacitanță.
Apendice
Metoda estimării
INTRODUCERE
Valorile estimate ale presiunii de vapori pot fi folosite:
|
— |
pentru a stabili care metodă experimentală este cea optimă; |
|
— |
pentru a furniza o estimare sau o valoare limită în cazul în care metoda experimentală nu poate să fie aplicată din cauza unor probleme tehnice. |
METODA ESTIMĂRII
Presiunea de vapori a solidelor și lichidelor poate fi estimată folosind corelația Watson modificată (a). Singura dată experimentală necesară este punctul de fierbere în condiții normale. Metoda este aplicabilă pentru intervalul de presiune de la 105 Pa la 10–5 Pa.
Informații detailate asupra metodei se găsesc în „Handbook of Chemical Property Estimation Methods” (Manual de metode de estimare a proprietăților substanțelor) (b). A se vedea și OECD Environmental Monograph nr. 67 (c).
METODA DE CALCUL
Presiunea de vapori este calculată după relația:
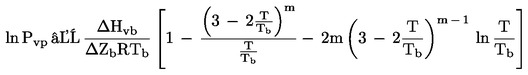
unde:
|
T |
= |
temperatura care interesează |
|
Tb |
= |
punct de fierbere în condiții normale |
|
PVP |
= |
presiunea de vapori la temperatura T |
|
ΔHVb |
= |
căldura de vaporizare |
|
ΔZb |
= |
factor de compresibilitate (este estimat la 0,97) |
|
m |
= |
factor empiric depinzând de starea fizică la temperatura T |
în continuare,

unde KF este un factor empiric dependent de polaritatea substanței. Pentru unele tipuri de compuși, factorii KF sunt enumerați în referința bibliografică (b).
Adesea, există date disponibile pentru punctul de fierbere la presiune redusă. În asemenea situații, presiunea de vapori se calculează conform relației:

unde T1 este punctul de fierbere la presiunea redusă P1.
RAPORT
În cazul în care se folosește metoda estimării, raportul de testare cuprinde o documentație cuprinzătoare a calculului utilizat.
REFERINȚE BIBLIOGRAFICE
|
(a) |
Watson, K.M. (1943). Ind. Eng. Chem, 35, 398. |
|
(b) |
Lyman, W.J., Reehl, W.F., Rosenblatt, D.H. (1982). Handbook of Chemical Property Estimation Methods, McGraw-Hill. |
|
(c) |
OECD Environmental Monograph No.67. Application of Structure-Activity Relationships to the Estimation of Properties Important in Exposure Assessment (1993). |
ANEXA II
|
A.22. |
DIAMETRU MEDIU GEOMETRIC PONDERAT PE LUNGIME AL FIBRELOR |
1. METODĂ
1.1. INTRODUCERE
Această metodă descrie procedura de măsurare a diametrului mediu geometric ponderat pe lungime (LWGMD) al Fibrelor Minerale Artificiale (FMA) în vrac. În măsura în care LWGMD al populației are o probabilitate de 95 % de a fi cuprins între limitele de încredere la 95 % (LWGMD ± două erori standard) din eșantion, valoarea raportată (rezultatul testării) va fi limita de încredere inferioară procentului de 95 % din eșantion (adică LWGMD – 2 erori standard). Această metodă se bazează pe actualizarea (iunie 1994) unui proiect de procedură industrială a HSE asupra căruia s-a convenit cu ocazia unei reuniuni între ECFIA și HSE, care a avut loc la Chester la 26 septembrie 1993, și care a fost elaborat pentru și pe baza unui al doilea test interlaboratoare (1, 2). Această metodă de măsurare poate fi utilizată pentru a caracteriza diametrul fibrelor care intră în alcătuirea substanțelor sau a produselor în vrac ce conțin FMA-uri, inclusiv fibre ceramice refractare (FCR), fibre vitroase artificiale (FVA), fibre cristaline și policristaline.
Ponderarea pe lungime reprezintă o metodă de compensare a efectelor asupra distribuției diametrului cauzate de spargerea fibrelor lungi în timpul eșantionării sau manipulării materialului. Statistica geometrică (media geometrică) este utilizată pentru a măsura distribuția diametrelor FMA-urilor, având în vedere că distribuțiile acestor diametre sunt în general apropiate de distribuția log-normală.
Măsurarea lungimii și a diametrului este o operațiune fastidioasă și de durată, însă, dacă se măsoară doar acele fibre care intră în contact cu o linie infinit de subțire a câmpului vizual al unui MEB (microscop electronic cu baleiaj), atunci probabilitatea de a selecționa o fibră dată este proporțională cu lungimea sa. Având în vedere că această metodă ia în considerare lungimea la efectuarea calculelor de ponderare pe lungime, singura măsurătoare necesară este diametrul și LWGMD-2SE poate fi calculat conform descrierii.
1.2. DEFINIȚII
Particulă: Un obiect al cărui raport lungime/lățime este mai mic de 3:1.
Fibră: Un obiect al cărui raport lungime/lățime (raport de aspect) este de cel puțin 3:1.
1.3. DOMENIUL ȘI LIMITELE DE APLICARE
Metoda este concepută pentru a analiza distribuția diametrelor având un diametru mediu cuprins între 0,5 μm și 6 μm. Diametrele mai mari pot fi măsurate cu ajutorul unor grosismente inferioare ale MEB, însă această metodă va fi din ce în ce mai limitată, pe măsură ce distribuțiile fibrelor devin mai fine. În această situație, se recomandă efectuarea de măsurători cu ajutorul unui microscop electronic cu transmisie (MET), dacă diametrul mediu este mai mic de 0,5 μm.
1.4. PRINCIPIUL METODEI DE TESTARE
Un număr de eșantioane reprezentative sunt prelevate din fibre de țesătură sau din fibre destrămate în vrac. Lungimea fibrelor în vrac este redusă printr-o procedură de zdrobire, apoi se dispersează în apă un subeșantion reprezentativ. Un număr de alicote sunt extrase și filtrate cu ajutorul unui filtru din policarbonat cu un diametru al porilor de 0,2 μm, înainte de a fi pregătite spre examinare cu ajutorul tehnicilor de microscopie electronică cu baleiaj (MEB). Diametrele fibrelor sunt măsurate utilizându-se un grosisment al ecranului de cel puțin × 10 000 (1) cu ajutorul unei eșantionări liniare, astfel încât să se obțină o estimare imparțială a diametrului mediu. Intervalul de încredere mai mic de 95 % (bazat pe un test unilateral) se calculează pentru a obține o estimare a valorii minime a diametrului mediu geometric al fibrelor materialului.
1.5. DESCRIEREA METODEI DE TESTARE
1.5.1. Siguranță/precauții
Este necesar să se reducă la minimum expunerea personalului la fibre în suspensie în atmosferă, precum și să se utilizeze o hotă sau o cutie cu mănuși în timpul manipulării fibrelor. Trebuie efectuate controale periodice privind expunerea personalului, pentru a determina eficacitatea metodelor de control. În timpul manipulării FMA-urilor, personalul trebuie să poarte mănuși de unică folosință pentru a reduce iritația pielii și pentru a preveni contaminarea încrucișată.
1.5.2. Aparatură/echipamente
|
— |
Prese și matrițe (capabile să producă 10 MPa). |
|
— |
Filtre din policarbonat cu pori capilari de 0,2 μm (diametru de 25 mm). |
|
— |
Filtru din membrană de ester de celuloză cu pori de 5 μm destinat utilizării ca filtru secundar. |
|
— |
Aparat de filtrare din sticlă (sau sisteme de filtrare de unică folosință) concepute pentru filtre cu diametrul de 25 mm (de exemplu trusă de microanaliză din sticlă Millipore, tip nr. XX10 025 00). |
|
— |
Apă proaspăt distilată și filtrată cu ajutorul unui filtru cu pori de 0,2 μm pentru îndepărtarea microorganismelor. |
|
— |
Pulverizator catodic cu anticatod din aur sau din aur/paladiu. |
|
— |
Microscop electronic cu baleiaj cu o rezoluție capabilă să coboare până la 10 nm și să funcționeze la un grosisment de x 10 000. |
|
— |
Diverse: spatule, lamă de scalpel de tip 24, pensete, tuburi MEB, adeziv sau bandă adezivă cu carbon, argint coloidal. |
|
— |
Sondă cu ultrasunete sau baie de ultrasunete de laborator. |
|
— |
Prelevator sau sondă, pentru prelevarea de eșantioane din țesătura de FMA. |
1.5.3. Procedura de testare
1.5.3.1. Eșantionare
Pentru țesături și plăci, se utilizează un prelevator sau o sondă de 25 mm pentru prelevarea de eșantioane din secțiunea transversală. Prelevările trebuie să fie efectuate la intervale identice pe toată lățimea unei mici lungimi din țesătură sau să fie colectate din zone aleatorii, dacă sunt disponibile lungimi mari ale țesăturii. Același echipament poate fi utilizat pentru a preleva eșantioane aleatorii din fibre destrămate. Dacă este posibil, trebuie prelevate șase eșantioane, pentru a reflecta variațiile spațiale din materialul în vrac.
Cele șase eșantioane trebuie zdrobite într-o matriță cu un diametru de 50 mm la 10 MPa. Materialul trebuie amestecat cu spatula și presat din nou la 10 MPa. Materialul este apoi îndepărtat din matriță și depozitat într-o sticlă închisă ermetic.
1.5.3.2. Pregătirea eșantionului
Dacă este necesar, lianții organici pot fi eliminați prin introducerea fibrei într-un cuptor la 450 °C timp de aproximativ o oră.
Se recomandă utilizarea conurilor pentru delimitare și împărțirea în sferturi pentru a subdivide eșantionul (această operațiune trebuie efectuată în interiorul unei incinte cu pulberi).
Cu ajutorul unei spatule, adăugați o cantitate mică (< 0,5 g) din eșantion în 100 ml de apă proaspăt distilată care a fost filtrată printr-un filtru cu membrană de 0,2 μm (pot fi utilizate și alte surse de apă ultra pură, cu condiția ca acestea să fie de o calitate satisfăcătoare). Dispersați atent cu ajutorul unei sonde cu ultrasunete care funcționează la 100 W și care este reglată pentru a produce cavitație. (Dacă nu dispuneți de o sondă, utilizați următoarea metodă: agitați și răsturnați de mai multe ori, timp de 30 de secunde; lansați ultrasunete într-o baie cu ultrasunete de laborator timp de cinci minute; apoi agitați și răsturnați de mai multe ori, timp de alte 30 de secunde.)
Imediat după dispersia fibrei, îndepărtați un anumit număr de alicote (de exemplu trei alicote de 3, 6 și 10 ml) utilizând o pipetă cu gură largă (cu o capacitate de 2-5 ml).
Filtrați sub vid fiecare alicotă cu ajutorul unui filtru din policarbonat de 0,2 μm susținut de un filtru secundar MEC cu pori de 5 µm, utilizând o pâlnie de filtrare din sticlă de 25 mm cu un rezervor clindric. O cantitate de aproximativ 5 ml de apă distilată filtrată trebuie introdusă în pâlnie, urmând ca alicota să fie pipetată încet în apă, menținând totodată vârful pipetei sub menisc. Pipeta și rezervorul trebuie clătite bine după pipetare, deoarece fibrele fine au tendința de a se localiza mai ales la suprafață.
Îndepărtați atent filtrul și separați-l de filtrul secundar înainte de a-l depune într-un recipient pentru a se usca.
Decupați un sfert sau o jumătate din secțiunea de depozit filtrat cu o lamă de scalpel de tip 24 printr-o mișcare oscilatorie. Fixați atent secțiunea decupată pe placa unui MEB cu ajutorul unui bande adezive sau al unui adeziv cu carbon. Argintul coloidal trebuie aplicat în cel puțin trei poziții diferite pentru a îmbunătăți contactul electric la marginile filtrului și ale plăcii. După uscarea lipiciului/argintului coloidal, pulverizați catodic aproximativ 50 nm de aur sau de aur/paladiu pe suprafața depozitului.
1.5.3.3. Calibrarea și funcționarea MEB
1.5.3.3.1. Calibrarea
Calibrarea MEB trebuie verificată cel puțin o dată pe săptămână (la modul ideal o dată pe zi) cu ajutorul unei grile de calibrare omologată. Valorile de calibrare trebuie comparate cu o normă omologată și, în cazul în care valoarea măsurată (MEB) se situează în afara plajei de ±2 % din valoarea omologată, calibrarea MEB trebuie ajustată și verificată din nou.
MEB trebuie să ofere cel puțin o rezoluție cu un diametru minim vizibil de 0,2 µm, utilizând o matrice de prelevare reală și un grosisment de × 2 000.
1.5.3.3.2. Funcționarea
MEB trebuie utilizat la un grosisment de 10 000 (2) în condiții care oferă o bună rezoluție și o imagine acceptabilă la viteze de baleiaj reduse de, spre exemplu, 5 secunde per cadru. Deși cerințele de funcționare ale diferitelor MEB-uri pot fi diferite, este necesar ca, în general, pentru a obține cea mai bună vizibilitate și rezoluție posibile cu materiale prezentând o masă atomică relativ scăzută, să se utilizeze tensiuni de accelerare între 5-10 keV cu o dimensiune redusă a spotului și o distanță mică de lucru. Având în vedere că se realizează o traversare liniară, este necesar să se utilizeze o inclinare de 0o pentru a reduce la minimum refocalizarea sau, dacă MEB-ul prezintă o fază eucentrică, trebuie să se utilizeze distanța de lucru eucentrică. Un grosisment inferior poate fi utilizat dacă materialul nu conține fibre mici și dacă diametrele fibrelor sunt mari (> 5 µm).
1.5.3.4. Dimensionare
1.5.3.4.1. Examinare la un grosisment redus pentru a analiza eșantionul
Inițial, eșantionul trebuie examinat la un grosisment redus pentru a identifica existența unei aglutinări de fibre mari și pentru a determina densitatea fibrei. În cazul formării unei aglutinări excesive, se recomandă pregătirea unui nou eșantion.
Pentru a garanta acuratețea datelor statistice, este necesar să se măsoare un număr minim de fibre. O densitate mare a fibrelor poate părea de dorit, deoarece examinarea câmpurilor goale necesită timp și nu aduce nicio contribuție în ceea ce privește analiza. Cu toate acestea, dacă filtrul este supraîncărcat, măsurarea tuturor fibrelor măsurabile devine dificilă și, având în vedere că fibrele mici pot fi ascunse de altele mai mari, ele sunt susceptibile de a nu fi observate.
O densitate superioară a fibrelor, de 150 de fibre per milimetru de traversare liniară, poate antrena o supraestimare a LWGMD. Pe de altă parte, concentrațiile reduse de fibre vor duce la creșterea timpului necesar efectuării analizei. Este adesea mai eficient din punctul de vedere al costurilor să se pregătească un eșantion cu o densitate a fibrei apropiată de valoarea optimală, decât să se insiste în ceea ce privește numărarea filtrelor cu concentrații reduse. Densitatea optimă de fibre trebuie să ofere o medie de aproximativ una sau două fibre numărabile per câmpuri vizuale la un grosisment de 5 000. Cu toate acestea, densitatea optimă va depinde de dimensiunea (diametrul) fibrelor, fiind așadar necesar ca operatorul să se bazeze pe experiența acumulată atunci când decide dacă densitatea fibrei este sau nu aproape de valoarea optimă.
1.5.3.4.2. Ponderarea pe lungime a diametrelor fibrelor
Numai fibrele care ating (sau intersectează) o linie (infinit) subțire trasată pe ecranul MEB sunt numărate. Din acest motiv, trebuie să se traseze o linie orizontală (sau verticală) de-a lungul centrului ecranului.
De asemenea, este posibil să se fixeze un punct unic în centrul ecranului și să se procedeze la un baleiaj continuu într-o singură direcție de-a lungul filtrului. Diametrul fiecărei fibre, al cărei raport de aspect depășește 3:1 și care atinge sau intersectează acest punct, trebuie măsurat și înregistrat.
1.5.3.4.3. Dimensionarea fibrei
Se recomandă măsurarea a minimum 300 de fibre. Fiecare fibră este măsurată o singură dată la punctul de intersectare cu linia sau punctul trasat pe imagine (sau în apropierea punctului de intersectare, dacă marginile fibrei sunt ascunse). Dacă este vorba de fibre care prezintă secțiuni transversale neuniforme, trebuie să se recurgă la o măsurătoare reprezentând diametrul mediu al fibrei. Trebuie să se acorde o atenție deosebită definirii marginii și măsurării distanței celei mai scurte dintre marginile fibrei. Dimensionarea se poate realiza on-line sau off-line, utilizându-se imagini sau fotografii stocate. Se recomandă utilizarea sistemelor semiautomate de măsurare a imaginii, care descarcă datele direct pe o foaie de calcul, deoarece acestea permit să se câștige timp, duc la eliminarea erorilor de transcriere și la automatizarea calculelor.
Extremitățile fibrelor lungi trebuie verificate la un grosisment redus, pentru a garanta că acestea nu revin în câmpul vizual în care se efectuează măsurătoarea și că sunt măsurate o singură dată.
2. DATE
2.1. PRELUCRAREA REZULTATELOR
În general, diametrele fibrelor nu au o distribuție normală. Cu toate acestea, prin efectuarea unei transformări log, este posibilă obținerea unei distribuții apropiate de cea normală.
Calculați media aritmetică (lnD mediu) și deviația standard (DSlnD) a logaritmului în raport cu valorile de bază (lnD) ale diametrelor celor n fibre (D).
|
|
(1) |
|
|
(2) |
Deviația standard se împarte la rădăcina pătrată a numărului de măsurători (n) pentru a obține eroarea standard (ESlnD).
|
|
(3) |
Scădeți de două ori eroarea standard din medie și calculați exponențiala acestei valori (media minus două erori standard) pentru a obține media geometrică minus două erori standard geometrice.
|
|
(4) |
3. RAPORTAREA
RAPORT DE TESTARE
Raportul de testare trebuie să includă cel puțin următoarele informații:
|
— |
Valoarea LWGMD-2ES. |
|
— |
Toate deviațiile și, în special, cele care riscă să afecteze precizia sau acuratețea rezultatelor, precum și justificările pertinente. |
4. REFERINȚE BIBLIOGRAFICE
|
1. |
B. Tylee SOP MF 240. Health and Safety Executive, February 1999. |
|
2. |
G. Burdett and G. Revell. Development of a standard method to measure the length-weigthed geometric mean fibre diameter: Results of the Second inter-laboratory exchange. IR/L/MF/94/07. Project R42.75 HPD. Health and Safety Executive, Research and Laboratory Services Division, 1994. |
(1) Această valoare de grosisment este indicată pentru fibrele de 3 µm. Pentru fibrele de 6 µm, un grosisment de × 5 000 poate fi mai potrivit.
(2) Pentru fibrele de 3 μm, a se vedea nota precedentă.
ANEXA III
|
B.46. |
IRITAȚIA CUTANATĂ IN VITRO: TEST PE MODEL DE EPIDERMĂ UMANĂ RECONSTRUITĂ |
1. METODĂ
1.1. INTRODUCERE
Iritația cutanată se referă la producerea unor leziuni reversibile ale pielii în urma aplicării unei substanțe testate timp de până la 4 ore [conform definiției din Sistemul global armonizat de clasificare și etichetare a substanțelor chimice (GHS) al Națiunilor Unite](1). Această metodă de testare asigură o procedură in vitro care, în funcție de necesarul de informații, poate permite determinarea riscului substanțelor de a produce iritații cutanate ca test substitutiv de sine stătător în cadrul unei strategii de testare, printr-o abordare având la bază forța probantă a datelor (2).
Evaluarea iritației cutanate implică în mod obișnuit utilizarea animalelor de laborator (a se vedea metoda B.4)(3). În ceea ce privește preocupările legate de bunăstarea animalelor, metoda B.4 permite determinarea coroziunii/iritației cutanate prin aplicarea unei strategii de testare secvențială, folosind metode in vitro și ex vivo validate, evitându-se astfel durerea și suferința animalelor. Pentru partea privind corozivitatea din cadrul strategiei de testare secvențială B.4, sunt utile trei metode de testare sau indicații orientative de testare in vitro validate, B.40, B.40bis și TG 435 (4,5,6).
Această metodă de testare se bazează pe modele de epidermă umană reconstruită, al căror design global (utilizarea de keratinocite de proveniență umană ca celule-sursă, țesut reprezentativ și citoarhitectură) copiază îndeaproape proprietățile biochimice și fiziologice ale părții superficiale a pielii umane, și anume epiderma. Procedura descrisă în cadrul prezentei metode de testare permite identificarea riscurilor pe care le prezintă substanțele iritante în conformitate cu categoria 2 din GHS al Națiunilor Unite. Prezenta metodă de testare include, de asemenea, un set de standarde de performanță pentru evaluarea metodelor similare și modificate de testare bazate pe epidermă umană reconstruită (7).
Au fost efectuate studii de prevalidare, optimizare și validare pentru două metode de testare in vitro (8, 9, 10, 11, 12, 13, 14, 15, 16, 17), disponibile sub denumirea comercială de EpiSkin™ și EpiDerm™, care folosesc modele de epidermă umană reconstruită. Aceste referințe au la bază R 38. Anumite aspecte legate de recalculare în scopul GHS sunt abordate în cadrul referinței bibliografice 25. Metodele cu performanțe echivalente cu EpiSkin™ (metoda de referință validată 1) se recomandă ca metodă de testare de sine stătătoare de substituire a testului in vivo pe iepuri pentru clasificarea substanțelor iritante din categoria 2 a GHS. Metodele cu performanțe echivalente cu EpiDermTM (metoda de referință validată 2) se recomandă numai ca metodă screening de testare sau ca parte a unei strategii de testare secvențială cu o abordare având la bază forța probantă a datelor, pentru clasificarea substanțelor iritante din categoria 2 GHS. Înainte ca un test in vitro propus pentru iritația cutanată pe baza unui model de epidermă umană reconstruită să poată fi utilizat în scopul reglementării, trebuie stabilite fiabilitatea, relevanța (precizia) și limitele sale de utilizare în scopul propus, în vederea asigurării comparabilității acestuia cu metoda de referință validată 1, în conformitate cu standardele de performanță stabilite în cadrul prezentei metode de testare (apendice).
În conformitate cu cerințele prezentei metode de testare, au fost validate alte două metode de testare in vitro cu epidermă umană reconstruită, iar acestea duc la obținerea unor rezultate similare cu cele ale metodei de referință validate 1 (18). Acestea sunt metoda de testare EpiDermTM modificată (metoda de referință 2 modificată) și metoda de testare SkinEthic RHETM (metoda similară sau „me-too” 1).
1.2. DEFINIȚII
În cadrul prezentei metode de testare se aplică următoarele definiții:
Precizie: Gradul de apropiere dintre rezultatele metodei de testare și valorile de referință acceptate. Aceasta constituie una dintre caracteristicile de performanță ale metodei de testare și unul dintre aspectele relevanței acesteia. Termenul este adesea utilizat în paralel cu termenul sinonim „concordanță”, pentru a desemna proporția de rezultate corecte ale unei metode de testare.
Substanță de control al lotului: Substanță etalon care produce un răspuns de viabilitate celulară medie al țesutului.
Viabilitate celulară: Parametru care măsoară activitatea totală a unei populații celulare, de exemplu capacitatea dehidrogenazelor mitocondriale celulare de a reduce colorantul vital MTT [bromură de 3-(4,5-Dimetiltiazol-2-il)-2,5-difeniltetrazoliu, albastru de tiazolil], care, în funcție de efectul măsurat și de tipul testului utilizat, se corelează cu numărul total și/sau vitalitatea celulelor vii.
ET50 : Perioada de expunere necesară pentru a reduce viabilitatea celulară cu 50 % la aplicarea substanței marker cu o concentrație specifică fixă; a se vedea, de asemenea, IC50.
Rată de rezultate fals negative: Proporția tuturor substanțelor pozitive identificate în mod fals de o metodă de testare ca fiind negative. Acesta este unul dintre indicatorii de performanță ai metodei de testare.
Rată de rezultate fals pozitive: Proporția tuturor substanțelor negative (inactive) care sunt identificate în mod fals ca fiind pozitive. Acesta este unul dintre indicatorii de performanță ai metodei de testare.
Doză infinită: Cantitate de substanță testată aplicată pe piele care depășește cantitatea necesară pentru acoperirea completă și uniformă a suprafeței pielii.
GHS (Sistemul global armonizat de clasificare și etichetare a substanțelor chimice): Un sistem care propune clasificarea substanțelor și amestecurilor în funcție de tipuri și niveluri standardizate de riscuri fizice, riscuri pentru sănătate și riscuri pentru mediu, care elaborează elemente de comunicare corespunzătoare, de exemplu pictograme, cuvinte de avertizare, fraze de pericol, fraze de securitate și fișe tehnice de siguranță, pentru a transmite informații privind efectele adverse ale acestora, în scopul protejării populației (inclusiv a angajatorilor, a lucrătorilor, a transportatorilor, a consumatorilor și a serviciilor de urgență) și a mediului (1) și care a fost implementat în cadrul UE în Regulamentul (CE) nr. 1272/2008.
IC50 : Concentrația la care o substanță marker reduce viabilitatea țesutului cu 50 % (IC50) după o perioadă fixă de expunere; a se vedea, de asemenea, ET50.
Standarde de performanță: Standarde bazate pe o metodă de referință validată, care permit evaluarea comparabilității unei metode de testare propuse similare din punct de vedere al mecanismului și din punct de vedere funcțional. Sunt incluse: I. componentele esențiale ale metodei de testare; II. o listă minimală de substanțe de referință selectate dintre substanțele utilizate pentru a demonstra performanțele acceptabile ale metodei de referință validate; și III. nivelurile comparabile de precizie și fiabilitate, pe baza rezultatelor obținute în cazul metodei de referință validate, care trebuie obținute de metoda de testare propusă în momentul evaluării sale pe baza listei minimale de substanțe de referință.
Fiabilitate: Măsura în care o metodă de testare poate fi reprodusă în timp, în același laborator sau în laboratoare diferite, folosind același protocol. Aceasta se evaluează prin calcularea reproductibilității în același laborator sau între laboratoare.
Sensibilitate: Proporția tuturor substanțelor pozitive/active clasificate corect în urma testului. Acesta permite măsurarea preciziei unei metode de testare care conduce la rezultate clasificabile în categorii și constituie un aspect important în evaluarea fiabilității unei metode de testare.
Specificitate: Proporția tuturor substanțelor negative/inactive clasificate corect în urma testului. Acesta permite măsurarea preciziei unei metode de testare care conduce la rezultate clasificabile în categorii și constituie un aspect important în evaluarea fiabilității unei metode de testare.
Iritație cutanată: Producerea de leziuni reversibile ale pielii în urma aplicării unei substanțe testate timp de până la 4 ore. Iritația cutanată este o reacție locală, neimunogenă, care apare la scurt timp după stimulare (24). Principala sa caracteristică este procesul reversibil care implică reacții inflamatorii și majoritatea semnelor clinice caracteristice iritației (eritem, edem, prurit și durere) asociate unui proces inflamator.
1.3. DOMENIUL ȘI LIMITELE DE APLICARE
Una dintre limitele testelor pe model de epidermă umană reconstruită cuprinse în această metodă de testare este aceea că ele permit clasificarea substanțelor chimice ca substanțe iritante pentru piele numai conform categoriei 2 din GHS al Națiunilor Unite. Deoarece acestea nu permit clasificarea substanțelor în categoria 3 opțională, după cum este definită în GHS al Națiunilor Unite, toate celelalte substanțe nu vor fi clasificate (nicio categorie). În funcție de nevoile de reglementare și de posibilitatea includerii ulterioare a unor noi criterii de evaluare, a ameliorării sau dezvoltării unor noi metode similare (me-too), poate fi necesară revizuirea prezentei metode de testare.
Prezenta metodă de testare permite identificarea riscurilor reprezentate de substanțele iritante monocomponente (19), dar nu furnizează informații adecvate privind coroziunea cutanată. Gazele și aerosolii nu se pot testa, iar amestecurile nu au fost încă evaluate în cadrul unui studiu de validare.
1.4. PRINCIPIUL METODEI
Substanța testată se aplică local pe un model tridimensional de epidermă umană reconstruită, compus din keratinocite normale derivate din epidermă umană și cultivate pentru a forma un model multistratificat extrem de diferențiat de epidermă umană. Modelul constă într-un strat bazal, într-un strat spinos și într-un strat granular organizate, precum și într-un strat cornos (stratum corneum) multistratificat care conține straturi lipidice lamelare intercelulare a căror dispunere este similară celei observate in vivo.
Principiul testului pe model de epidermă umană reconstruită se bazează pe ipoteza că substanțele iritante sunt capabile să penetreze stratul cornos prin difuziune și sunt citotoxice pentru celulele din straturile inferioare. Viabilitatea celulară se măsoară prin conversia de către dehidrogenaze a colorantului vital MTT [bromură de 3-(4,5-dimetiltiazol-2-il)-2,5-difeniltetrazoliu, albastru de tiazolil; număr EINECS 206-069-5, număr CAS 298-93-1)] într-o sare de formazan de culoare albastră care poate fi măsurată cantitativ după ce a fost extrasă din țesut (20). Substanțele iritante sunt identificate pe baza capacității acestora de a reduce viabilitatea celulară sub pragurile stabilite (și anume ≤ 50 % pentru substanțele iritante din categoria 2 din GHS al Națiunilor Unite). Substanțele pentru care viabilitatea celulară rezultată este superioară pragului stabilit nu vor fi clasificate (și anume > 50 %, nicio categorie).
Sistemele de modele de epidermă umană reconstruită pot fi utilizate pentru testarea substanțelor solide, lichide, semisolide și a cerurilor. Lichidele pot fi apoase sau neapoase; solidele pot fi solubile sau insolubile în apă. În măsura în care este posibil, solidele trebuie testate sub formă de pulbere fină. Deoarece validarea sistemelor de teste pe model de epidermă umană reconstruită a inclus 58 de substanțe atent selecționate, reprezentând o gamă largă de clase de substanțe chimice, se estimează că metodele sunt general aplicabile pentru toate clasele de substanțe chimice (16). Validarea include 13 substanțe iritante din categoria 2 a GHS. Trebuie menționat faptul că acizii necorosivi, bazele, sărurile și alte substanțe anorganice nu au fost incluse în studiul de validare, iar unele categorii cunoscute de substanțe organice iritante, precum hidroperoxizii, fenolii și surfactanții, nu au fost incluse sau au fost incluse numai în măsură limitată.
1.5. DEMONSTRAREA PERFORMANȚELOR
Înainte de utilizarea sistematică a unei metode validate conforme cu prezenta metodă de testare, este posibil ca laboratoarele să dorească să demonstreze performanțele sale tehnice, utilizând cele zece substanțe recomandate în tabelul 1. În cadrul prezentei metode de testare, categoria 3 opțională din GHS al Națiunilor Unite nu corespunde niciunei categorii. În cazul noilor metode de testare similare (me-too) elaborate conform prezentei metode de testare, care sunt similare din punct de vedere structural și funcțional cu metodele de referință validate, sau în cazul modificărilor aduse metodelor validate, trebuie utilizate standardele de performanță descrise în apendicele la prezenta metodă de testare pentru a demonstra că noua metodă are o fiabilitate și o precizie comparabile cu cele ale metodei validate, înainte de a fi utilizată pentru testare în scopul reglementării.
Tabelul 1
Substanțe de verificare care constituie un subansamblu al substanțelor de referință enumerate în apendice
|
Substanța |
Numărul CAS |
Scorul in vivo |
Starea fizică |
Categoria GHS |
|
Acid naftilacetic |
86-87-3 |
0 |
S |
Nicio cat. |
|
Izopropanol |
67-63-0 |
0,3 |
L |
Nicio cat. |
|
Stearat de metil |
112-61-8 |
1 |
S |
Nicio cat. |
|
Butirat de heptil |
5870-93-9 |
1,7 |
L |
Cat. 3 opțională |
|
Salicilat de hexil |
6259-76-3 |
2 |
L |
Cat. 3 opțională |
|
Ciclamenaldehidă |
103-95-7 |
2,3 |
L |
Cat. 2 |
|
1-bromhexan |
111-25-1 |
2,7 |
L |
Cat. 2 |
|
Metacrilat de butil |
97-88-1 |
3 |
L |
Cat. 2 |
|
1-metil-3-fenil-1-piperazină |
5271-27-2 |
3,3 |
S |
Cat. 2 |
|
Heptanal |
111-71-7 |
4 |
L |
Cat. 2 |
1.6. DESCRIEREA METODEI
Descriem în continuare componentele și procedurile testului pe model de epidermă umană reconstruită pentru evaluarea iritației cutanate. Modelul de epidermă umană reconstruită poate fi construit, preparat sau obținut pe cale comercială (de exemplu EpiSkin™, EpiDerm™ și SkinEthic RHE™). Protocoalele standard ale metodei de testare pentru EpiSkin™, EpiDerm™ și SkinEthic RHE™ pot fi obținute de la [http://ecvam.jrc.ec.europa.eu] (21, 22, 23). Testarea trebuie efectuată în conformitate cu următoarele aspecte:
1.6.1. Componentele modelului de epidermă umană reconstruită
1.6.1.1. Condiții generale ale modelului
Pentru construcția epiteliului trebuie utilizate keratinocite umane normale. Sub stratul cornos funcțional trebuie să existe straturi multiple de celule epiteliale viabile (stratul bazal, stratul spinos, stratul granulos). Stratul cornos trebuie să fie multistratificat și să prezinte profilul lipidic esențial pentru a forma o barieră funcțională robustă care să reziste la penetrarea rapidă a substanțelor marker citotoxice, de exemplu dodecilsulfat de sodiu (SDS) sau Triton X-100. Bariera funcțională trebuie evaluată fie prin stabilirea concentrației la care substanța marker reduce viabilitatea celulară cu 50 % (IC50) după o perioadă fixă de expunere, fie prin stabilirea perioadei de expunere necesare pentru a reduce viabilitatea celulară cu 50 % (ET50) la aplicarea substanței marker cu o concentrație specifică fixă. Etanșeitatea modelului trebuie să prevină trecerea substanței dincolo de stratul cornos către țesutul viabil, ceea ce ar duce la o slabă modelizare a expunerii pielii. Modelul de epidermă nu trebuie să fie contaminat cu bacterii, virusuri, micoplasmă sau ciuperci.
1.6.1.2. Condiții funcționale ale modelului
1.6.1.2.1. Viabilitatea
Testul recomandat pentru stabilirea viabilității este MTT (20). Densitatea optică (DO) a colorantului (solubilizat) extras din țesutul tratat cu substanță negativă de control (NC) trebuie să fie de cel puțin 20 de ori mai mare decât DO a solventului de extracție. Trebuie documentat faptul că țesutul tratat cu substanță negativă de control este stabil în cultură (prezintă măsurători similare ale viabilității) pe durata perioadei de expunere la testare.
1.6.1.2.2. Funcția de barieră
Stratul cornos și compoziția lipidică a acestuia trebuie să fie suficiente pentru a rezista la penetrarea rapidă a substanțelor marker citotoxice, de exemplu SDS sau Triton X-100, estimată prin IC50 sau ET50.
1.6.1.2.3. Morfologia
Examinarea histologică a pielii/epidermei reconstruite trebuie să fie efectuată de personal calificat adecvat care va demonstra că modelul prezintă o structură similară celei a pielii/epidermei umane (inclusiv stratul cornos multistratificat).
1.6.1.2.4. Reproductibilitatea
Trebuie demonstrată reproductibilitatea în timp a rezultatelor metodei de testare cu un model specific, de preferat cu ajutorul unei substanțe (etalon) adecvate de control al lotului (a se vedea apendicele).
1.6.1.2.5. Controalele de calitate (CC) ale modelului
Fiecare lot de modele de epidermă utilizat trebuie să îndeplinească anumite criterii bine definite de producție, printre care cele mai importante sunt criteriile privind viabilitatea (punctul 1.6.1.2.1) și funcția de barieră (punctul 1.6.1.2.2). Furnizorul de modele de epidermă (sau investigatorul, atunci când se utilizează un model produs intern) trebuie să stabilească o plajă de valori acceptabile (limita superioară și cea inferioară) pentru IC50 sau ET50. Proprietățile de barieră ale țesuturilor trebuie verificate de laborator după primirea acestora. Numai rezultatele obținute pe baza unor țesuturi corespunzătoare pot fi acceptate în vederea estimării fiabile a efectelor iritante. În continuare sunt prezentate cu titlu de exemplu plajele de valori acceptabile pentru metodele de referință validate.
Tabelul 2
Exemple de criterii pentru controlul calității lotului
|
|
Limita inferioară de acceptabilitate |
Media plajei de valori acceptabile |
Limita superioară de acceptabilitate |
|
Metoda de referință validată 1 (18 ore de tratament cu SDS) |
IC50 = 1,0 mg/ml |
IC50 = 2,32 mg/ml |
IC50 = 3,0 mg/ml |
|
Metoda de referință validată 2 (1 % Triton X100) |
ET50 = 4,8 h |
ET50 = 6,7 h |
ET50 = 8,7 h |
1.6.1.3. Aplicarea substanțelor testate și a substanțelor de control
Trebuie utilizat un număr suficient de țesuturi-replică pentru fiecare tratament și pentru controale (cel puțin trei replici pe serie). Atât în cazul substanțelor lichide, cât și în cazul celor solide, trebuie aplicată o cantitate suficientă de substanță testată pentru a acoperi uniform suprafața pielii, evitându-se totuși o doză infinită (a se vedea 1.2 Definiții), și anume trebuie utilizat minimum 25 μL/cm2 sau 25 mg/cm2. În cazul substanțelor solide, suprafața epidermei trebuie umezită cu apă deionizată sau distilată înainte de aplicare, pentru a asigura un bun contact cu pielea. În măsura în care este posibil, solidele trebuie testate sub formă de pulbere fină. La sfârșitul perioadei de expunere, substanța testată trebuie spălată cu atenție de pe suprafața pielii, utilizând o soluție-tampon apoasă sau NaCl de 0,9 %. În funcție de modelul de epidermă umană reconstruită utilizat, perioada de expunere poate varia între 15 și 60 de minute, iar temperatura de incubare poate varia între 20 și 37 °C. Pentru detalii, a se consulta Procedurile standard de operare pentru cele trei metode (21, 22, 23).
Pentru fiecare test trebuie utilizate simultan substanțe de control negative (NC) și pozitive (PC) pentru a demonstra că viabilitatea (NC), funcția de barieră și sensibilitatea rezultată (PC) a țesuturilor se încadrează în plaja istorică definită de valori acceptabile. Substanța PC recomandată este soluția apoasă de SDS de 5 %. Substanțele NC recomandate sunt apa sau soluție salină tamponată cu fosfat (PBS).
1.6.1.4. Măsurători ale viabilității celulare
Cel mai important element al procedurii de testare este constituit de faptul că măsurătorile de viabilitate celulară nu se efectuează imediat după expunerea la substanțele testate, ci după o perioadă de incubare posttratament suficient de lungă a țesuturilor spălate în mediu proaspăt. Această perioadă permite atât recuperarea în urma unor efecte slab iritante, cât și manifestarea efectelor citotoxice clare. În timpul fazei de optimizare a testului (9, 10, 11, 12, 13), o perioadă de incubare posttratament de 42 de ore s-a dovedit optimă și, prin urmare, a fost utilizată pentru validarea metodelor de testare de referință.
Testul de conversie a MTT este o metodă cantitativă validată care trebuie utilizată pentru măsurarea viabilității celulare. Acesta este compatibil cu o arhitectură tridimensională a țesutului. Mostra de piele este introdusă într-o soluție de MTT de concentrație adecvată (de exemplu 0,3-1 mg/ml) timp de 3 ore. Precipitatul de formazan albastru este apoi extras din țesut utilizând un solvent (de exemplu izopropanol sau izopropanol acid) și concentrația de formazan se măsoară determinând densitatea optică la 570 nm folosind o bandă de trecere de maximum ±30 nm.
Proprietățile optice ale substanței testate sau acțiunea sa chimică asupra MTT pot interfera cu testul, conducând la o falsă estimare a viabilității (deoarece substanța testată poate împiedica, poate inversa sau poate chiar produce generarea culorii). Acest lucru se poate întâmpla atunci când o anumită substanță testată nu este complet eliminată de pe piele prin spălare sau atunci când penetrează epiderma. Dacă substanța testată acționează direct asupra MTT, dacă este colorată în mod natural sau dacă se colorează în timpul tratamentului țesutului, trebuie utilizate controale suplimentare pentru a detecta și corecta interferența substanței testate cu tehnica de măsurare a viabilității. Pentru descrierea detaliată a modului în care poate fi testată direct reducerea MTT, vă rugăm consultați protocolul metodei de testare pentru metodele de referință validate (21, 22, 23). Culoarea nespecifică (NSC) datorată acestor interferențe nu trebuie să depășească 30 % din NC (pentru corecturi). Dacă NSC > 30 %, se consideră că substanța testată este incompatibilă cu testul.
1.6.1.5. Criterii de acceptabilitate ale testului
Pentru fiecare test care utilizează loturi valabile (a se vedea punctul 1.6.1.2.5), țesuturile tratate cu NC trebuie să prezinte o densitate optică care să reflecte calitatea țesuturilor supuse tuturor etapelor de transport și de recepționare, precum și întregului protocol privind iritația. Valorile densității optice a substanțelor de control nu trebuie să fie inferioare limitelor minime istorice stabilite. În mod analog, țesuturile tratate cu PC, și anume soluție apoasă de SDS de 5 %, trebuie să reflecte sensibilitatea intrinsecă a țesuturilor și capacitatea acestora de răspuns la substanța iritantă, în condițiile fiecărui test individual (de exemplu viabilitate ≤ 40 % pentru metoda de referință validată 1 și ≤ 20 % pentru metoda de referință validată 2). Trebuie definite valorile asociate și adecvate ale variabilității între replicile de țesut (de exemplu, dacă deviațiile standard sunt utilizate, acestea trebuie să fie ≤ 18 %).
2. REZULTATE
2.1. REZULTATE
Pentru fiecare tratament trebuie raportate sub forma unui tabel rezultatele obținute pentru fiecare mostră de țesut (de exemplu valorile densității optice și datele procentuale privind viabilitatea celulară calculate pentru fiecare substanță testată, inclusiv clasificarea corespunzătoare), inclusiv rezultatele obținute în urma repetării experimentelor, dacă este cazul. În plus, trebuie raportate pentru fiecare test valorile medii ± deviația standard. Interacțiunile observate cu reactivul MTT și cu substanțele testate colorate trebuie raportate pentru fiecare substanță testată.
2.2. INTERPRETAREA REZULTATELOR
Valorile densității optice obținute pentru fiecare mostră a testului pot fi utilizate pentru a calcula procentul de viabilitate relativ la substanța negativă de control, care este stabilit la 100 %. Valoarea limită a procentului de viabilitate celulară pe baza căreia se face distincția între substanțele testate iritante și cele neclasificate, precum și procedura (procedurile) statistică (statistice) utilizate pentru evaluarea rezultatelor și identificarea substanțelor iritante trebuie clar definite și documentate; de asemenea, trebuie demonstrat faptul că acestea sunt adecvate. În continuare sunt prezentate valorile limită pentru estimarea efectelor iritante asociate metodelor de referință validate:
Substanța testată este considerată iritantă pentru piele în conformitate cu categoria 2 din GHS al Națiunilor Unite:
|
(i) |
dacă viabilitatea țesutului după expunere și perioada de incubare posttratament este mai mică sau egală (≤) cu 50 %. |
Substanța testată este considerată neclasificată:
|
(ii) |
dacă viabilitatea țesutului după expunere și perioada de incubare posttratament este mai mare (>) de 50 %. |
3. RAPORTAREA
3.1. RAPORTUL DE TESTARE
Raportul de testare trebuie să conțină următoarele date:
Substanțe testate și de control:
|
— |
denumire (denumiri) chimică (chimice), precum denumirea IUPAC sau CAS și numărul CAS, dacă se cunosc; |
|
— |
puritatea și compoziția substanței [în procent(e) de greutate]; |
|
— |
proprietățile fizico-chimice relevante pentru desfășurarea studiului (de exemplu starea fizică, stabilitatea și volatilitatea, pH-ul, solubilitatea în apă, dacă se cunosc); |
|
— |
tratamentul substanțelor testate/de control înainte de efectuarea testului, după caz (de exemplu încălzire, măcinare); |
|
— |
condiții de depozitare. |
Justificare privind modelul de epidermă și protocolul utilizat.
Condiții de testare:
|
— |
sistemul celular utilizat; |
|
— |
informații de calibrare pentru instrumentul de măsurare și banda de trecere utilizată pentru măsurarea viabilității celulare (de exemplu spectrofotometru); |
|
— |
informații complete privind modelul de epidermă utilizat, inclusiv performanța acestuia. Aceasta trebuie să includă, fără a se limita la:
|
|
— |
detalii cu privire la procedura de testare utilizată; |
|
— |
dozele de testare utilizate, durata expunerii și perioada de incubare posttratament; |
|
— |
descrierea oricăror modificări ale procedurii de testare; |
|
— |
trimiteri la datele istorice ale modelului. Aceasta trebuie să includă, fără a se limita la:
|
|
— |
descrierea criteriilor de evaluare folosite, inclusiv justificarea privind alegerea punctului (punctelor) limită pentru modelul de estimare. |
Rezultate:
|
— |
prezentarea sub formă de tabel a rezultatelor obținute cu fiecare mostră de testare; |
|
— |
descrierea altor efecte observate. |
Discutarea rezultatelor.
Concluzii
4. REFERINȚE BIBLIOGRAFICE
|
1. |
United Nations (UN) (2007). Globally Harmonized System of Classification and Labelling of Chemicals (GHS), Second revised edition, UN New York and Geneva, 2007. Disponibilă la adresa: http://www.unece.org/trans/danger/publi/ghs/ghs_rev02/02files_e.html |
|
2. |
REACH: Guidance on Information Requirements and Chemical Safety Assessment. Disponibilă la adresa: http://guidance.echa.europa.eu/docs/guidance_document/information_requirements_en.htm?time=1232447649 |
|
3. |
Metoda de testare B.4. TOXICITATE ACUTĂ; IRITAȚIE/COROZIUNE CUTANATĂ. |
|
4. |
Metoda de testare B.40. COROZIUNE CUTANATĂ IN VITRO: TEST DE REZISTENȚĂ ELECTRICĂ TRANSCUTANATĂ TER. |
|
5. |
Metoda de testare B.40 BIS. COROZIUNE CUTANATĂ IN VITRO: TEST PE MODEL DE EPIDERMĂ UMANĂ. |
|
6. |
OECD (2006). Test Guideline 435. OECD Guideline for the Testing of Chemicals. In Vitro Membrane Barrier Test Method. Adoptată la 19 iulie 2006. Disponibilă la adresa: http://www.oecd.org/document/22/0,2340,en_2649_34377_1916054_1_1_1_1,00.html |
|
7. |
ECVAM (2009) Performance Standards for applying human skin models to in vitro skin irritation. Disponibil la rubrica „Download Study Documents”, la adresa: http://ecvam.jrc.ec.europa.eu |
|
8. |
Fentem, J.H., Briggs, D., Chesné, C., Elliot, G.R., Harbell, J.W., Heylings, J.R., Portes, P., Roguet, R., van de Sandt, J.J.M. & Botham, P. (2001). A prevalidation study on in vitro tests for acute skin irritation. Results and evaluation by the Management Team. Toxicology in Vitro 15, 57-93. |
|
9. |
Portes, P., Grandidier, M.H., Cohen, C. & Roguet, R.(2002). Refinement of the EPISKIN protocol for the assessment of acute skin irritation of chemicals: follow-up to the ECVAM prevalidation study. Toxicology in Vitro 16, 765-770. |
|
10. |
Kandárová, H., Liebsch, M., Genschow, E., Gerner, I., Traue, D., Slawik, B. & Spielmann, H. (2004). Optimisation of the EpiDerm test protocol for the upcoming ECVAM validation study on in vitro skin irritation tests. ALTEX 21, 107-114. |
|
11. |
Kandárová, H., Liebsch, M., Gerner, I., Schmidt, E., Genschow, E., Traue, D. & Spielmann H. (2005) The EpiDerm Test Protocol fort the Upcoming ECVAM Validation Study on In Vitro Skin Irritation Tests – An Assessment of the Performance of the Optimised Test. ATLA 33, 351-367. |
|
12. |
Cotovio, J., Grandidier, M.-H., Portes, P., Roguet, R. & G. Rubinsteen (2005). The In Vitro Acute Skin Irritation of Chemicals: Optimisation of the EPISKIN Prediction Model within the Framework of the ECVAM Validation Process. ATLA 33, 329-249. |
|
13. |
Zuang, V., Balls, M., Botham, P.A., Coquette, A., Corsini, E., Curren, R.D., Elliot, G.R., Fentem, J.H., Heylings, J.R., Liebsch, M., Medina, J., Roguet, R., van De Sandt, J.J.M., Wiemann, C. & Worth, A.(2002). Follow-up to the ECVAM prevalidation study on in vitro tests for acute skin irritation. ECVAM Skin Irritation Task Force Report 2. ATLA 30, 109-129. |
|
14. |
Spielmann, H., Hoffmann, S., Liebsch, M., Botham, P., Fentem, J., Eskes, C., Roguet, R., Cotovió, J., Cole, T., Worth, A., Heylings, J., Jones, P., Robles, C., Kandárová, H., Gamer, A., Remmele, M., Curren, R., Raabe, H., Cockshott, A., Gerner, I. and Zuang, V. (2007) The ECVAM International Validation Study on In Vitro Tests for Acute Skin Irritation: Report on the Validity of the EPISKIN and EpiDerm Assays and on the Skin Integrity Function Test. ATLA 35, 559-601. |
|
15. |
Hoffmann, S. (2006). ECVAM Skin Irritation Validation Study Phase II: Analysis of the Primary Endpoint MTT and the Secondary Endpoint IL1-α. 135 p. + annexes. Disponibil la rubrica „Download Study Documents”, la adresa: http://ecvam.jrc.ec.europa.eu |
|
16. |
Eskes, C., Cole, T., Hoffmann, S., Worth, A., Cockshott, A., Gerner, I. & Zuang. V (2007) ECVAM International Validation Study on In Vitro Tests for Acute Skin Irritation: Selection of Test Chemicals. ATLA 35, 603-619. |
|
17. |
J. Cotovio, M.-H. Grandidier, D. Lelièvre, R. Roguet, E. Tinois-Tessonneaud, J. Leclaire (2007). In vitro acute skin irritancy of chemicals using the validated EPISKIN model in a tiered strategy – Results and performances with 184 cosmetic ingredients, AATEX, Special Issue-proceedings from WC6. Vol.14, 351-358. |
|
18. |
ESAC statement on updated EpiDerm and similar SkinEthic assays. 5 November 2008. |
|
19. |
CE (2006). Regulamentul (CE) nr. 1907/2006 al Parlamentului European și al Consiliului din 18 decembrie 2006 privind înregistrarea, evaluarea, autorizarea și restricționarea substanțelor chimice (REACH), de înființare a Agenției Europene pentru Produse Chimice, de modificare a Directivei 1999/45/CE și de abrogare a Regulamentului (CEE) nr. 793/93 al Consiliului și a Regulamentului (CE) nr. 1488/94 al Comisiei, precum și a Directivei 76/769/CEE a Consiliului și a Directivelor 91/155/CEE, 93/67/CEE, 93/105/CE și 2000/21/CE ale Comisiei. Jurnalul Oficial al Uniunii Europene L 396/1 din 30.12.2006. OPOCE, Luxemburg. |
|
20. |
Mosman, T. (1983) Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. Journal of Immunological Methods 65, 55-63. |
|
21. |
EpiSkin™ SOP, Version 1.6 (January 2005). Validation of the EpiSkin Skin Irritation Test – 42 Hours Assay For The Prediction of Acute Skin Irritation of Chemicals. Disponibil la rubrica „Download Study Documents”, la adresa: http://ecvam.jrc.ec.europa.eu |
|
22. |
EpiDerm™ SOP, Version 5.0 (October 2004). Draft Standard Operating Procedure. In Vitro Skin Irritation Test: Human Skin Model. Model: EpiDerm™- 200. Disponibil la rubrica „Download Study Documents”, la adresa: http://ecvam.jrc.ec.europa.eu |
|
23. |
SkinEthic RHE™ SOP. Va fi disponibil la rubrica „Download Study Documents”, la adresa: http://ecvam.jrc.ec.europa.eu |
|
24. |
Harvell, J.D., Lammintausta, K., Maibach H.I. (1995) Irritant contact dermatitis IN: Guin J.D. Practical Contact Dermatitis Mc Graw-Hill New York, p. 7-18 |
|
25. |
Griesinger C, Barroso J & Zuang V: ECVAM background document on the recent adaptations of the ECVAM performance standards for in vitro skin irritation testing in the context of the drafting process of an EU test method and an OECD draft test guideline. Ispra, November 13, 2008. |
Apendice
Evaluarea caracteristicilor de performanță ale modelelor de epidermă umană reconstruită propuse pentru determinarea apariției iritației cutanate in vitro
INTRODUCERE
Procedurile propuse pentru utilizare în cadrul prezentei metode de testare trebuie evaluate folosind substanțe reprezentând întreaga gamă de scoruri Draize de evaluare a efectelor iritante, pentru a determina fiabilitatea și precizia acestora. Când este evaluată folosind cele 20 de substanțe de referință (tabelul 2), procedura propusă trebuie să prezinte valori ale fiabilității și preciziei comparabile cu cele ale metodei de referință validate 1 (tabelul 3) (1). Standardele de fiabilitate și precizie care trebuie atinse sunt prezentate în continuare, la punctele II și III. Sunt incluse substanțele neclasificate și cele clasificate (categoria 2 din GHS al Națiunilor Unite), reprezentând clasele de substanțe chimice relevante, astfel încât fiabilitatea și performanța (sensibilitatea, specificitatea, ratele de rezultate fals negative, ratele de rezultate fals pozitive și precizia) metodei de testare propuse să poată fi comparate cu cele ale metodei de referință validate 1. Fiabilitatea metodei de testare, precum și capacitatea acesteia de a identifica în mod corect substanțele iritante din categoria 2 din GHS al Națiunilor Unite trebuie determinate înainte ca aceasta să fie utilizată pentru testarea unor substanțe noi.
STANDARDE DE PERFORMANȚĂ
Standardele de performanță cuprind următoarele trei elemente: I. Componentele esențiale ale metodei de testare, II. Substanțele de referință și III. Valorile definite de precizie și fiabilitate (2). Aceste standarde de performanță se bazează pe standardele de performanță definite după încheierea studiului de validare privind iritația cutanată efectuat de ECVAM (3).
I. Componentele esențiale ale metodei de testare
Condiții generale ale modelului
Pentru construcția epiteliului trebuie utilizate keratinocite umane normale. Sub stratul cornos funcțional trebuie să existe straturi multiple de celule epiteliale viabile (stratul bazal, stratul spinos, stratul granulos). Stratul cornos trebuie să fie multistratificat și să prezinte profilul lipidic esențial pentru a forma o barieră funcțională robustă care să reziste la penetrarea rapidă a substanțelor marker citotoxice, de exemplu SDS sau Triton X-100. Bariera funcțională trebuie evaluată fie prin stabilirea concentrației la care substanța marker reduce viabilitatea celulară cu 50 % (IC50) după o perioadă fixă de expunere, fie prin stabilirea perioadei de expunere necesare pentru a reduce viabilitatea celulară cu 50 % (ET50) la aplicarea substanței marker cu o concentrație specifică fixă. Etanșeitatea modelului trebuie să prevină trecerea substanței dincolo de stratul cornos către țesutul viabil, ceea ce ar duce la o slabă modelizare a expunerii pielii. Modelul de epidermă nu trebuie să fie contaminat cu bacterii, virusuri, micoplasmă sau ciuperci.
Condiții funcționale ale modelului
Viabilitatea
Testul recomandat pentru stabilirea viabilității este MTT (4). Densitatea optică a colorantului (solubilizat) extras din țesutul tratat cu substanță negativă de control trebuie să fie de cel puțin 20 de ori mai mare decât densitatea optică a solventului de extracție. Trebuie documentat faptul că țesutul tratat cu substanță negativă de control este stabil în cultură (prezintă măsurători similare ale viabilității) pe durata perioadei de expunere la testare.
Funcția de barieră
Stratul cornos și compoziția lipidică a acestuia trebuie să fie suficiente pentru a rezista la penetrarea rapidă a substanțelor marker citotoxice, de exemplu SDS sau Triton X-100, estimată prin IC50 sau ET50.
Morfologia
Examinarea histologică a pielii/epidermei reconstruite trebuie să fie efectuată de personal calificat adecvat care va demonstra că modelul prezintă o structură similară celei a pielii/epidermei umane (inclusiv stratul cornos multistratificat).
Reproductibilitatea
Trebuie demonstrată reproductibilitatea în timp a rezultatelor metodei de testare cu un model specific, de preferat cu ajutorul unei substanțe (etalon) adecvate de control al lotului (a se vedea definițiile din punctul 1.2).
Controalele de calitate (CC) ale modelului
Fiecare lot de modele de epidermă utilizat trebuie să îndeplinească anumite criterii bine definite de producție, printre care cele mai importante sunt criteriile privind viabilitatea și funcția de barieră. Furnizorul de modele de epidermă (sau investigatorul, atunci când se utilizează un model produs intern) trebuie să stabilească o plajă de valori acceptabile (limita superioară și cea inferioară) pentru IC50 sau ET50. Proprietățile de barieră ale țesuturilor trebuie verificate de laborator după primirea acestora. Numai rezultatele obținute pe baza unor țesuturi corespunzătoare pot fi acceptate în vederea estimării fiabile a efectelor iritante. În continuare sunt prezentate cu titlu de exemplu plajele de valori acceptabile pentru metodele de referință validate.
Tabelul 1
Exemple de criterii pentru controlul calității lotului
|
|
Limita inferioară de acceptabilitate |
Media plajei de valori acceptabile |
Limita superioară de acceptabilitate |
|
Metoda de referință validată 1 (18 ore de tratament cu SDS) |
IC50 = 1,0 mg/ml |
IC50 = 2,32 mg/ml |
IC50 = 3,0 mg/ml |
|
Metoda de referință validată 2 (1 % Triton X100) |
ET50 = 4,8 h |
ET50 = 6,7 h |
ET50 = 8,7 h |
II. Substanțe de referință
Substanțele de referință sunt folosite pentru a stabili dacă fiabilitatea și precizia unei noi metode propuse de testare in vitro pe model de epidermă umană reconstruită, care s-a demonstrat că prezintă suficiente similitudini de natură structurală și funcțională cu metodele de referință validate sau care reprezintă o modificare minoră a metodei de referință validate, sunt comparabile cu cele ale metodei de referință validate 1 (1). Cele 20 de substanțe de referință enumerate în tabelul 2 includ substanțe reprezentând diferite clase de substanțe chimice de interes, precum și substanțele din categoria 2 din GHS al Națiunilor Unite. Substanțele incluse în această listă cuprind 10 substanțe din categoria 2 din GHS al Națiunilor Unite, 3 substanțe din categoria 3 opțională a GHS al Națiunilor Unite și 7 substanțe neclasificate. În cadrul prezentei metode de testare, categoria 3 opțională nu corespunde niciunei categorii. Aceste substanțe de referință reprezintă numărul minim de substanțe care trebuie utilizat pentru a evalua precizia și fiabilitatea metodei propuse de testare pe model de epidermă umană reconstruită pentru determinarea apariției iritației cutanate. În situațiile în care una dintre substanțele enumerate nu este disponibilă, pot fi utilizate alte substanțe pentru care sunt disponibile informații de referință in vivo adecvate. Dacă este necesar, pe lista minimă de substanțe de referință pot fi adăugate substanțe suplimentare reprezentând alte clase de substanțe, pentru care sunt disponibile informații de referință in vivo adecvate, în vederea evaluării suplimentare a preciziei metodei de testare propuse.
Tabelul 2
Substanțe de referință pentru stabilirea valorilor de precizie și fiabilitate ale modelelor de epidermă umană reconstruită pentru evaluarea iritației cutanate
|
Substanța (1) |
Nr. CAS |
Nr. EINECS |
Starea fizică |
Scorul in vivo |
Cat. GHS in vitro |
Cat. GHS in vivo |
|
1-bromo-4-clorobutan |
6940-78-9 |
230-089-3 |
L |
0 |
Cat. 2 |
Nicio cat. |
|
Ftalat de dietil |
84-66-2 |
201-550-6 |
L |
0 |
Nicio cat. |
Nicio cat. |
|
Acid naftilacetic |
86-87-3 |
201-705-8 |
S |
0 |
Nicio cat. |
Nicio cat. |
|
Fenoxiacetat de alil |
7493-74-5 |
231-335-2 |
L |
0,3 |
Nicio cat. |
Nicio cat. |
|
Izopropanol |
67-63-0 |
200-661-7 |
L |
0,3 |
Nicio cat. |
Nicio cat. |
|
4-(metiltio)-benzaldehidă |
3446-89-7 |
222-365-7 |
L |
1 |
Cat. 2 |
Nicio cat. |
|
Stearat de metil |
112-61-8 |
203-990-4 |
S |
1 |
Nicio cat. |
Nicio cat. |
|
Butirat de heptil |
5870-93-9 |
227-526-5 |
L |
1,7 |
Nicio cat. |
Cat. 3 opțională |
|
Salicilat de hexil |
6259-76-3 |
228-408-6 |
L |
2 |
Nicio cat. |
Cat. 3 opțională |
|
Fosfat de triizobutil |
126-71-6 |
204-798-3 |
L |
2 |
Cat. 2 |
Cat. 3 opțională |
|
1-decanol |
112-30-1 |
203-956-9 |
L |
2,3 |
Cat. 2 |
Cat. 2 |
|
Ciclamenaldehidă |
103-95-7 |
203-161-7 |
L |
2,3 |
Cat. 2 |
Cat. 2 |
|
1-bromhexan |
111-25-1 |
203-850-2 |
L |
2,7 |
Cat. 2 |
Cat. 2 |
|
Hidroclorură de 2-clorometil-3,5-dimetil-4-metoxipiridină |
86604-75-3 |
434-680-9 |
S |
2,7 |
Cat. 2 |
Cat. 2 |
|
Alfa-terpineol |
98-55-5 |
202-680-6 |
L |
2,7 |
Cat. 2 |
Cat. 2 |
|
Disulfură de di-n-propil |
629-19-6 |
211-079-8 |
L |
3 |
Nicio cat. |
Cat. 2 |
|
Metacrilat de butil |
97-88-1 |
202-615-1 |
L |
3 |
Cat. 2 |
Cat. 2 |
|
Benzentiol, 5-(1,1-dimetiletil)-2-metil |
7340-90-1 |
438-520-9 |
L |
3,3 |
Cat. 2 |
Cat. 2 |
|
1-metil-3-fenil-1-piperazină |
5271-27-2 |
431-180-2 |
S |
3,3 |
Cat. 2 |
Cat. 2 |
|
Heptanal |
111-71-7 |
203-898-4 |
L |
4 |
Cat. 2 |
Cat. 2 |
Substanțele enumerate în tabelul 2 asigură o distribuție reprezentativă a celor 58 de substanțe utilizate în studiul internațional de validare pentru evaluarea iritației cutanate al ECVAM (1). Selectarea lor se bazează pe următoarele criterii:
|
— |
substanțele sunt disponibile pe piață; |
|
— |
acestea sunt reprezentative pentru întreaga gamă de scoruri Draize de evaluare a efectelor iritante (de la substanțe neiritante până la substanțe puternic iritante); |
|
— |
au o structură chimică bine definită; |
|
— |
sunt reprezentative pentru reproductibilitatea și pentru capacitatea de estimare ale metodei validate, determinate în cadrul studiului de validare al ECVAM; |
|
— |
sunt reprezentative pentru funcționalitatea chimică utilizată în procesul de validare; |
|
— |
nu sunt asociate unui profil extrem de toxic (de exemplu cancerigen sau toxic pentru sistemul de reproducere) și unor costuri de eliminare prohibitive. |
III. Valorile definite de precizie și fiabilitate
Performanțele (sensibilitatea, specificitatea, ratele de rezultate fals negative, ratele de rezultate fals pozitive și precizia) metodei de testare propuse trebuie să fie comparabile cu cele ale metodei de referință validate 1 (tabelul 3), și anume sensibilitatea trebuie sau fie mai mare sau egală cu (≥) 80 %, specificitatea trebuie să fie mai mare sau egală cu (≥) 70 %, iar precizia trebuie să fie mai mare sau egală cu (≥) 75 %. Performanțele trebuie calculate folosind toate clasificările obținute pentru cele 20 de substanțe în diferite laboratoare participante. Clasificarea fiecărei substanțe în fiecare laborator trebuie obținută folosind valoarea medie de viabilitate corespunzătoare diferitelor serii de teste efectuate (minimum trei serii valabile).
Tabelul 3
Performanțele metodei de referință validate 1 (2)
|
Metoda de testare |
Nr. de substanțe |
Sensibilitatea |
Specificitatea |
Rata de rezultate fals negative |
Rata de rezultate fals pozitive |
Precizia |
|
Metoda de referință validată 1 (3) |
58 |
87,2 % (4) |
71,1 % (5) |
12,8 % |
29,9 % |
74,7 % |
|
Metoda de referință validată (3) |
20 |
90 % |
73,3 % |
10 % |
26,7 % |
81,7 % |
Fiabilitatea metodei de testare propuse trebuie să fie comparabilă cu cea a metodelor de referință validate.
Reproductibilitatea intralaborator
Evaluarea variabilității intralaborator trebuie să indice o concordanță mai mare sau egală cu (≥) 90 % a clasificărilor (categoria 2/nicio categorie) obținută în serii de teste diferite și independente cu cele 20 de substanțe de referință în cadrul aceluiași laborator.
Reproductibilitatea între laboratoare
Evaluarea reproductibilității între laboratoare nu este esențială dacă metoda de testare propusă se utilizează numai într-un singur laborator. Pentru ca metodele să poată fi transferate între laboratoare, concordanța clasificărilor (categoria 2/nicio categorie) obținute în serii de teste diferite și independente cu cele 20 de substanțe de referință, preferabil în cadrul a minimum trei laboratoare, trebuie să fie mai mare sau egală cu (≥) 80 %.
REFERINȚE BIBLIOGRAFICE
|
1. |
Spielmann, H., Hoffmann, S., Liebsch, M., Botham, P., Fentem, J., Eskes, C., Roguet, R., Cotovió, J., Cole, T., Worth, A., Heylings, J., Jones, P., Robles, C., Kandárová, H., Gamer, A., Remmele, M., Curren, R., Raabe, H., Cockshott, A., Gerner, I. and Zuang, V. (2007) The ECVAM International Validation Study on In Vitro Tests for Acute Skin Irritation: Report on the Validity of the EPISKIN and EpiDerm Assays and on the Skin Integrity Function Test. ATLA 35, 559-601. |
|
2. |
OECD (2005) Guidance Document No. 34 on the validation and international acceptance of new or updated test methods for hazard assessment. OECD, Paris. |
|
3. |
ECVAM (2007) Performance Standards for applying human skin models to in vitro skin irritation. Disponibil la rubrica „Download Study Documents”, la adresa http://ecvam.jrc.ec.europa.eu. Accesat la 27.10.2008. |
|
4. |
Mosman, T. (1983) Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays. Journal of Immunological Methods 65, 55-63. |
|
5. |
Eskes, C., Cole, T., Hoffmann, S., Worth, A., Cockshott, A., Gerner, I. & Zuang. V (2007) ECVAM International Validation Study on In Vitro Tests for Acute Skin Irritation: Selection of Test Chemicals. ATLA 35, 603-619. |
(1) Cele 20 de substanțe de referință constituie o selecție reprezentativă din cele 58 de substanțe utilizate inițial pentru validarea metodei de referință 1 (EpiSkin™). Lista completă a substanțelor testate și a criteriilor de selecție a acestora este disponibilă (5).
(2) Tabelul 3 conține performanțele metodei de referință validate 1, în ceea ce privește capacitatea acesteia de a identifica corect substanțele iritante (categoria 2 din GHS al Națiunilor Unite) și substanțele neclasificate (nicio categorie, inclusiv categoria 3 opțională) pentru cele 58 și, respectiv, cele 20 de substanțe de referință (tabelul 2).
(3) EpiSkin™
(4) Pe baza a 13 substanțe iritante din categoria 2 a GHS.
(5) Pe baza a 45 de substanțe iritante din categoria 3 a GHS sau din nicio categorie a GHS.
ANEXA IV
|
C.3. |
ALGE DE APĂ DULCE ȘI CIANOBACTERII, TEST DE INHIBARE A CREȘTERII |
1. METODĂ
Această metodă este echivalentă cu orientările OECD privind testele nr. 201 (2006)(1).
1.1. INTRODUCERE
Metodele de testare se revizuiesc și se actualizează conform progreselor științifice. Revizuirea metodei de testare C.3 era necesară pentru a include specii noi și pentru a îndeplini cerințele de evaluare a riscurilor și clasificare a substanțelor chimice. Revizuirea a fost efectuată pe baza unei experiențe practice largi, a progresului științific în domeniul studierii toxicității algelor și a utilizării largi în domeniul reglementării care s-au înregistrat după prima adoptare.
1.2. DEFINIȚII
Următoarele definiții și prescurtări se folosesc în sensul prezentei metode de testare:
Biomasă: greutatea uscată a materiei vii prezente într-o populație, exprimată în termenii unui volum dat; de exemplu mg alge/litru soluție de testat. De obicei, „biomasa” se definește ca masă, dar, în prezentul test, acest cuvânt desemnează masa per volum. Tot în prezentul test, se măsoară de obicei înlocuitorii pentru biomasă, cum ar fi numărul de celule, fluorescența etc., iar folosirea termenului „biomasă” se referă așadar și la măsurarea acestor înlocuitori.
Coeficient de variație: este o măsură adimensională a variabilității unui parametru, definită ca raportul dintre deviația standard și medie. Aceasta se poate exprima, de asemenea, ca valoare în procente. Coeficientul mediu de variație al vitezei medii specifice de creștere în culturi de control duplicate se calculează după cum urmează:
|
1. |
Se calculează % CV ale vitezei medii specifice de creștere din vitezele de creștere zilnice/pe secțiuni la culturile de control duplicate pentru duplicatul respectiv. |
|
2. |
Se calculează valoarea medie a tuturor valorilor calculate la subpunctul 1 pentru a se obține coeficientul mediu de variație a vitezei specifice de creștere pe zi/pe secțiuni la culturile de control duplicate. |
ECx : este concentrația substanței de testat dizolvate în mediul de testare din care rezultă o reducere de x % (de exemplu 50 %) a creșterii organismului de testat într-o anumită perioadă de expunere (care se menționează explicit în cazul în care durata completă sau normală a testului se modifică). Pentru a se reprezenta în mod clar valoarea EC derivată din viteza de creștere sau randament, se folosesc simbolurile „ErC”, respectiv „EyC”.
Mediu de cultură: este mediul de cultură complet sintetic în care algele de test cresc când sunt expuse substanței de testat. În mod normal, substanța de testat se dizolvă în mediul de test.
Viteza de creștere (viteza medie specifică de creștere): este creșterea logaritmică a biomasei în timpul perioadei de expunere.
Concentrația minimă cu efect observabil (CMEO): este cea mai scăzută concentrație testată la care se observă că substanța are un efect semnificativ din punct de vedere statistic asupra creșterii (la p < 0,05) prin comparație cu lotul martor, la un timp de expunere dat. Toate concentrațiile testate mai mari decât CMEO trebuie să aibă efect nociv egal sau mai mare decât cel observat la CMEO. Dacă aceste două condiții nu pot fi satisfăcute, se va furniza o explicație completă privind modul în care a fost selectat CMEO (și, prin urmare, CFEO).
Concentrația fără efecte observabile (CFEO): este concentrația testată imediat sub valoarea CMEO.
Variabilă de răspuns: este o variabilă pentru estimarea toxicității derivate din orice parametri măsurați care descriu biomasa prin diferite metode de calcul. În cazul acestei metode, vitezele de creștere și randamentul sunt variabile de răspuns derivate din măsurarea directă a biomasei sau a oricăruia dintre înlocuitorii menționați.
Viteza specifică de creștere: este o variabilă de răspuns definită ca raportul dintre diferența dintre logaritmii naturali ai unui parametru de observație (biomasa, în prezenta metodă de test) și perioada respectivă de timp.
Randament: este valoarea unei variabile de măsurare la sfârșitul perioadei de expunere minus valoarea variabilei de măsurare la începutul perioadei de expunere, pentru exprimarea creșterii biomasei în timpul testului.
1.3. APLICABILITATEA TESTULUI
Prezenta metodă de testare se aplică cel mai ușor în cazul substanțelor solubile în apă care, în condițiile testului, sunt susceptibile să rămână în apă. În cazul testării de substanțe volatile, puternic adsorbante, colorate, cu o solubilitate scăzută în apă, sau substanțe care pot afecta disponibilitatea nutrienților sau a mineralelor în mediul de test, pot fi necesare anumite modificări ale procedurii de testare descrise (de exemplu sistem închis, condiționarea vaselor de testare). Îndrumări privind unele modificări corespunzătoare se află la notele (2), (3) și (4).
1.4. PRINCIPIUL TESTULUI
Scopul acestui test constă în determinarea efectelor unei substanțe asupra creșterii microalgelor de apă dulce și/sau cianobacteriilor. Organismele de test cu o creștere exponențială se expun substanței de testat sub formă de loturi de cultură în general pentru o perioadă de 72 de ore. În pofida duratei relativ scurte a testului, se pot evalua efectele asupra câtorva generații.
Sistemul răspunde prin reducerea creșterii la o serie de culturi de alge (unități de test) expuse la diferite concentrații ale substanței de testat. Răspunsul se evaluează ca o funcție a concentrației de expunere în comparație cu creșterea medie a culturilor de control duplicate și neexpuse. Pentru exprimarea completă a răspunsului sistemului la efecte toxice (sensibilitate optimă), culturilor le este permisă o creștere exponențială nerestricționată în condiții de hrănire suficientă și lumină continuă, pentru o perioadă de timp suficientă pentru măsurarea reducerii vitezei specifice de creștere.
Creșterea și inhibarea creșterii sunt cuantificate prin măsurarea biomasei de alge în funcție de timp. Biomasa de alge se definește ca greutatea uscată per volum de soluție de testat, de exemplu mg alge/litru. Greutatea uscată este dificil de măsurat și, prin urmare, se folosesc parametri înlocuitori. Dintre acești parametri, numărul celulelor este cel mai des folosit. Alți parametri înlocuitori sunt volumul celulelor, fluorescența, densitatea optică etc. Este necesară cunoașterea unui factor de conversie între parametrul înlocuitorului măsurat și biomasă.
Punctul final al testului este inhibarea creșterii, exprimată ca creștere logaritmică a biomasei (viteza medie specifică de creștere) în timpul perioadei de expunere. Concentrația care provoacă o inhibare a vitezei de creștere specificată de x % (de exemplu 50 %) și exprimată ca ErCx (de exemplu ErC50) se determină din vitezele specifice medii de creștere înregistrate la o serie de soluții de testat.
Pentru aplicarea acestei metode în cadrul de reglementare al UE, calculul rezultatelor trebuie să se bazeze pe viteza specifică medie de creștere, din rațiunile expuse în continuare la punctul 2.2. O variabilă de răspuns suplimentară folosită în prezenta metodă de testare este randamentul, care poate fi necesar pentru îndeplinirea unor cerințe de reglementare specifice din unele țări. Acesta se definește ca biomasa la sfârșitul perioadei de expunere minus biomasa la începutul perioadei de expunere. Pe baza randamentului înregistrat pentru o serie de soluții de testat, concentrația care provoacă o inhibare a randamentului specificat de x % (de exemplu 50 %) se calculează și se exprimă ca EyCx (de exemplu EyC50).
În plus, concentrația minimă cu efect observabil (CMEO) și concentrația fără efecte observabile (CFEO) se pot determina statistic.
1.5. INFORMAȚII REFERITOARE LA SUBSTANȚA DE TESTARE
Informațiile referitoare la substanța de testare, care pot fi utile pentru stabilirea condițiilor de testare, includ formula structurală, puritatea, stabilitatea la lumină, stabilitatea în condițiile de testare, proprietățile de absorbție a luminii, pKa și rezultatele studiilor de transformare, inclusiv biodegrabilitatea în apă.
Este necesar să se cunoască solubilitatea în apă, coeficientul de partiție octanol/apă (Pow) și presiunea de vapori a substanței testate și să existe o metodă validată de determinare cantitativă a substanței în soluțiile de testat, cu eficiența recuperării și limita de detecție specificate.
1.6. SUBSTANȚĂ DE REFERINȚĂ
Substanța (substanțele) de referință, cum ar fi 3,5-diclorofenol, folosite în testul internațional interlaboratoare (4), pot fi testate ca mijloc de validare a procedurii de testare. Dicromatul de potasiu poate fi folosit, de asemenea, ca substanță de referință pentru algele verzi. Este de preferat ca o substanță de referință să fie testată de cel puțin două ori pe an.
1.7. VALIDITATEA TESTULUI
Pentru ca un test să fie valabil, trebuie să îndeplinească următoarele criterii de performanță:
|
— |
Biomasa din culturile de control trebuie să fi crescut exponențial cu un factor de cel puțin 16 pe durata de 72 ore a perioadei de testare. Acest lucru corespunde unei viteze specifice de creștere de 0,92 zi–1. În cazul speciilor utilizate cel mai frecvent, viteza de creștere este de obicei considerabil mai mare (a se vedea apendicele 1). Este posibil ca acest criteriu să nu fie respectat atunci când sunt folosite specii care cresc mai lent decât cele prezentate în apendicele 1. În acest caz, perioada de testare se extinde pentru a fi obținută o creștere de cel puțin 16 ori în culturile de control, creșterea trebuind să fie exponențială pe durata perioadei de testare. Atât timp cât factorul minim de multiplicare 16 este atins, perioada de testare poate fi redusă la cel puțin 48 de ore în scopul menținerii creșterii exponențiale nelimitate în timpul testului. |
|
— |
Coeficientul mediu de variație pentru vitezele specifice de creștere pe secțiuni (zilele 0-1, 1-2 și 2-3 pentru testele de 72 ore) în culturile de control (a se vedea „coeficient de variație”, punctul 1.2) nu trebuie să depășească 35 %. A se vedea punctul 2.2.1 al doilea paragraf, pentru calcularea vitezei specifice de creștere pe secțiuni. Acest criteriu se aplică valorii medii a coeficienților de variație calculați pentru culturile de control duplicate. |
|
— |
Coeficientul de variație al vitezelor medii specifice de creștere a culturilor de control duplicate nu trebuie să depășească 7 % la testele cu Pseudokirchneriella subcapitata și Desmodesmus subspicatus în timpul întregii perioade de testare. În cazul altor specii mai puțin testate, valoarea nu trebuie să depășească 10 %. |
1.8. DESCRIEREA METODEI
1.8.1. Aparatură
Vasele de testare și alte aparate care intră în contact cu soluțiile de testat trebuie să fie confecționate în întregime din sticlă sau alt material chimic inert. Vasele trebuie să fie spălate cu atenție pentru prevenirea efectelor contaminanților organici sau anorganici asupra creșterii algelor sau compoziției soluțiilor de testat.
Vasele de testare vor fi recipiente normale din sticlă de dimensiuni cuprinzând un volum suficient de cultură pentru măsurătorile din cursul testului și permițând un transfer suficient de masă de CO2 din atmosferă (a se vedea punctul 1.8.9 al doilea paragraf). Trebuie reținut că volumul de lichid trebuie să fie suficient pentru efectuarea determinărilor analitice (a se vedea punctul 1.8.11 al cincilea paragraf).
În afară de acestea, mai sunt necesare următoarele aparate:
|
— |
Aparat pentru cultură: se recomandă un laborator sau o cameră în care se poate menține o temperatură controlată de incubație de ±2 °C. |
|
— |
Instrumente de măsurare a luminii: este important de remarcat că metoda de măsurare a intensității luminii și, în special, tipul de receptor (colector) vor influența valoarea măsurată. Măsurătorile se fac preferabil prin folosirea unui receptor sferic (4 π), care răspunde la lumina directă și reflectată provenită din toate unghiurile de deasupra și dedesubtul planului de măsurare, sau a unui receptor (2 π), care răspunde la lumina provenită din toate unghiurile de deasupra planului de măsurare. |
|
— |
Aparat pentru determinarea biomasei de alge. Numărul celulelor, care este cel mai frecvent utilizat parametru înlocuitor pentru biomasa de alge, poate fi obținut prin folosirea unui contor electronic de particule, a unui microscop cu cameră de numărare sau a unui citometru de flux. Alți înlocuitori de biomasă se pot măsura folosind un citometru de flux, fluorimetru, spectrofotometru sau colorimetru. Este utilă calcularea unui factor de conversie care să stabilească relația dintre numărul de celule și greutatea uscată. Pentru a se obține rezultate utile ale măsurătorilor la concentrații scăzute de biomasă poate fi necesară folosirea de cuve cu un traseu al razelor luminoase de cel puțin 4 cm. |
1.8.2. Organismele testate
Se pot folosi câteva specii de microalge și cianobacterii neatașate. S-a demonstrat că sușele descrise în apendicele 1 sunt adecvate prin folosirea procedurii de testare specificate în prezenta metodă de testare.
Dacă se folosesc alte specii, sușa și/sau originea se raportează. Trebuie să se confirme că creșterea exponențială a algelor de testat selectate poate fi menținută pe întreaga durată a perioadei de testare, în condițiile predominante.
1.8.3. Mediu de cultură
Se recomandă două medii alternative de cultură, OECD și AAP. Compozițiile acestor medii sunt prezentate în apendicele 2. Trebuie reținut că valoarea inițială a pH-ului și capacitatea de tamponare (care reglează creșterea pH-ului) pentru cele două medii sunt diferite. Prin urmare, rezultatele testelor pot fi diferite, în funcție de mediul folosit, în special în cazul testării de substanțe ionizante.
Modificarea mediilor de cultură poate fi necesară pentru anumite scopuri, cum ar fi situațiile în care se testează metale și agenți de chelare sau la valori diferite ale pH-ului. Folosirea unui mediu modificat se descrie și se justifică în detaliu (3)(4).
1.8.4. Concentrația inițială a biomasei
Biomasa inițială din culturile testate trebuie să fie egală în toate aceste culturi și suficient de scăzută pentru a permite creșterea exponențială pe parcursul întregii perioade de incubare fără riscul de epuizare a nutrienților. Biomasa inițială nu trebuie să depășească 0,5 mg/l ca greutate uscată. Se recomandă următoarele concentrații celulare inițiale:
|
Pseudokirchneriella subcapitata |
5 × 103-104 |
celule/ml |
|
Desmodesmus subspicatus |
2-5 × 103 |
celule/ml |
|
Navicula pelliculosa |
104 |
celule/ml |
|
Anabaena flos-aquae |
104 |
celule/ml |
|
Synechococcus leopoliensis |
5 × 104-105 |
celule/ml |
1.8.5. Concentrațiile substanței de testat
Intervalul concentrațiilor în care pot apărea efectele se determină pe baza rezultatelor testelor de stabilire a intervalului. Pentru testul final se aleg cel puțin cinci concentrații în serie geometrică cu o rație care nu depășește 3,2. O rație mai mare este justificată în cazul substanțelor de testat care au o curbă de răspuns a concentrației cu pantă lină. Se preferă ca seriile de concentrație să acopere intervalul care provoacă 5-75 % inhibare a vitezei de creștere a algelor.
1.8.6. Duplicate și probe martor
Concepția experimentală a testului trebuie să includă trei duplicate la fiecare concentrație de testare. Dacă determinarea CFEO nu este necesară, testul poate fi modificat în sensul creșterii numărului de concentrații și reducerea numărului de duplicate per concentrație. Numărul de duplicate de control trebuie să fie de cel puțin trei, recomandându-se să depășească de două ori numărul duplicatelor folosite pentru fiecare concentrație de testare.
Pentru determinările analitice ale concentrațiilor substanței de testare se poate pregăti un set separat de soluții de testat (a se vedea punctul 1.8.11 al patrulea și al șaselea paragraf).
Dacă se utilizează un solvent pentru solubilizarea substanței testate, în test se vor include probe martor suplimentare conținând solventul în aceeași concentrație cu cea folosită în cazul culturilor testate.
1.8.7. Pregătirea culturii de inocul
În scopul adaptării algei de testat la condițiile de testare și al asigurării că algele se află în fază de creștere exponențială când sunt folosite pentru inocularea soluțiilor de testat, se pregătește o cultură de inocul în mediul de testare cu 2-4 zile înainte de începerea testului. Biomasa de alge se ajustează pentru a favoriza o creștere exponențială în cultura de inocul până la începerea testului. Cultura de inocul se incubează în aceleași condiții ca și culturile testate. Se măsoară creșterea biomasei în cultura de inocul pentru a se verifica dacă creșterea se încadrează în intervalul normal pentru sușa experimentală în condițiile de cultură. Un exemplu al procedurii pentru cultura algelor este descris în apendicele 3. Pentru a se evita diviziunile sincronizate ale celulelor în timpul testului, poate fi necesară o a doua etapă de propagare a culturii de inocul.
1.8.8. Pregătirea soluțiilor de testat
Toate soluțiile de testat trebuie să conțină aceleași concentrații de mediu de cultură și de biomasă inițială a algelor testate. Soluțiile de testat ale concentrațiilor alese se pregătesc de obicei prin amestecarea unei soluții mamă a substanței de testat cu mediu de cultură și cultură de inocul. De obicei, soluțiile mamă se pregătesc prin dizolvarea substanței în mediul de testare.
Solvenții, cum ar fi acetona, t-butil alcool și dimetil-formamida, pot fi folosiți ca purtători pentru adăugarea în mediul de testare de substanțe cu solubilitate scăzută în apă (2)(3). Concentrația solventului nu trebuie să depășească 100 µl/l, aceeași concentrație de solvent adăugându-se în toate culturile (inclusiv în probele martori) din seria de testare.
1.8.9. Incubarea
Se acoperă vasele de testare cu capace care permit trecerea aerului. Vasele se agită, după care se introduc în aparatul de cultură. Este necesar ca, în timpul testului, algele să fie menținute în suspensie și să se faciliteze transferul de CO2. În acest scop, se vor folosi mișcări de agitare și amestecare constante. Culturile se mențin la temperaturi între 21-24 °C, cu o marjă de ±2 °C. În cazul altor specii decât cele prezentate în apendicele 1, cum ar fi specii tropicale, pot fi utile temperaturi mai înalte, cu condiția îndeplinirii criteriilor de validitate. Se recomandă ca recipientele să fie așezate aleatoriu și repoziționate în fiecare zi în incubator.
pH-ul mediului de control nu trebuie să crească cu mai mult de 1,5 unități în timpul testului. În cazul metalelor și compușilor care se ionizează parțial la un pH aproximativ egal cu pH-ul de test, poate fi necesară limitarea devierii pH-ului în scopul obținerii de rezultate reproductibile și bine definite. O deviere de < 0,5 unități pH este posibilă din punct de vedere tehnic și poate fi obținută prin asigurarea unei viteze adecvate de transfer de masă CO2 din aerul înconjurător către soluția de testat, de exemplu prin creșterea vitezei de agitare. O altă metodă constă în reducerea necesarului de CO2 prin reducerea biomasei inițiale sau a duratei testului.
Suprafața unde sunt incubate culturile trebuie să primească iluminare fluorescentă continuă și uniformă, de tipul celei „alb-rece” sau „lumina zilei”. Sușele de alge și cianobacterii sunt diferite din punctul de vedere al necesarului de lumină. Intensitatea luminii se selectează la un nivel adecvat pentru organismul folosit. În cazul speciilor recomandate de alge verzi, intensitatea luminii la nivelul soluțiilor de testat se selectează în domeniul 60-120 µE·m–2·s–1 când se măsoară în domeniul de lungimi de undă eficient din punct de vedere fotosintetic de 400-700 nm, folosindu-se un receptor corespunzător. Unele specii, în special Anabaena flos-aquae, cresc bine la intensități scăzute ale luminii și pot fi afectate la intensități ridicate. În cazul unor astfel de specii se selectează o intensitate luminoasă medie în intervalul 40-60 µE·m–2·s–1. (În cazul instrumentelor de măsurare a luminii calibrate în lux, un interval echivalent de 4 440-8 880 lucși pentru lumină albă rece corespunde aproximativ intensității luminoase recomandate 60-120 µE·m–2·s–1). Intensitatea luminii nu trebuie să varieze cu mai mult de ±15 % din intensitatea medie a luminii din zona de incubare.
1.8.10. Durata testului
Durata normală a testului este de 72 de ore. Cu toate acestea, pot fi folosite durate de test mai lungi sau mai scurte, cu condiția respectării tuturor criteriilor de validitate de la punctul 1.7.
1.8.11. Măsurători și determinări analitice
Biomasa de alge din fiecare recipient se determină cel puțin o dată pe zi în timpul perioadei de testare. Dacă măsurătorile se fac pe volume mici, extrase din soluția de testat cu o pipetă, acestea nu se înlocuiesc.
Măsurarea biomasei are loc prin numărarea manuală a celulelor cu ajutorul unui microscop sau al unui contor electronic de particule (prin estimarea numărului celulelor și/sau a biovolumului). Tehnici alternative, cum ar fi citometria de flux, fluorescența clorofilei in vitro sau in vivo (6)(7) sau densitatea optică, pot fi folosite dacă se demonstrează o corelație satisfăcătoare cu biomasa pentru intervalul de cantități de biomasă utilizate în test.
pH-ul soluțiilor se măsoară la începutul și la sfârșitul testului.
Dacă este disponibilă o procedură analitică de determinare a substanței de testat în intervalul de concentrații utilizat, soluțiile de testat se analizează pentru a fi verificate concentrațiile inițiale și menținerea concentrațiilor de expunere în timpul testului.
Analizarea concentrației substanței de testat la începutul și la sfârșitul testului unei concentrații de testare scăzute și înalte, precum și o concentrație în jurul valorii anticipate EC50, pot fi suficiente în cazurile în care este probabil ca variația concentrațiilor expunerilor să fie de mai puțin de 20 % din valorile nominale din timpul testului. Analizarea tuturor concentrațiilor de testare la începutul și sfârșitul testului este recomandată în cazul concentrațiilor care nu rămân în intervalul de 80-120 % din valoarea nominală. În cazul substanțelor de testat volatile, instabile sau puternic absorbante, se recomandă recoltarea suplimentară la intervale de 24 de ore în timpul perioadei de expunere în scopul definirii cu mai mare precizie a pierderii de substanță de testat. Pentru aceste substanțe sunt necesare duplicate suplimentare. În toate cazurile, concentrațiile substanței testate se determină doar la un vas dintre cele identice pentru fiecare concentrație de testat (sau la conținutul vaselor grupate în funcție de duplicat).
Mediile de testare pregătite pentru analizarea concentrațiilor de expunere în timpul testului se tratează identic cu cele folosite pentru testare, adică se inoculează cu alge și sunt incubate în condiții identice. Dacă este necesară analizarea concentrației substanței de test dizolvate, se poate impune separarea algelor de mediu. Este de preferat ca separarea să aibă loc prin centrifugare la o forță gravitațională scăzută, suficientă pentru depunerea algelor.
Dacă se poate dovedi menținerea satisfăcătoare, pe toată durata testului, a concentrației substanței testate în limitele de ±20 % din cea nominală sau măsurată inițial, atunci analizarea rezultatelor poate avea loc pe baza valorilor nominale sau măsurate inițial. Dacă abaterea de la concentrația nominală sau cea măsurată inițial este mai mare de ±20 %, este necesar ca rezultatele să se exprime în funcție de media geometrică a concentrației în timpul expunerii sau de modelele care descriu scăderea concentrației substanței testate (3)(8).
Testul de inhibare a creșterii algelor este un sistem de testare mai dinamic decât majoritatea testelor de toxicitate acvatică pe termen scurt. Prin urmare, concentrațiile de expunere reale se pot dovedi dificil de definit, în special în cazul substanțelor adsorbante testate la concentrații scăzute. În astfel de cazuri, dispariția substanței din soluție prin adsorbție în biomasa de alge în creștere nu înseamnă că aceasta s-a pierdut din sistemul de testare. În cursul analizării rezultatului testului se va verifica dacă o descreștere a concentrației substanței testate în cursul testului este însoțită de o reducere a inhibării creșterii. Dacă acesta este cazul, poate fi luată în considerare aplicarea unui model adecvat de descriere a scăderii concentrației substanței testate (8). Dacă nu este cazul, analizarea rezultatelor se poate întemeia pe valorile concentrațiilor inițiale (nominale sau măsurate).
1.8.12. Alte observații
Observația microscopică se efectuează în scopul verificării stării normale și sănătoase a culturii de inocul și pentru observarea oricărei stări anormale a algelor (care poate fi provocată de expunerea la substanța de testat) la sfârșitul testului.
1.8.13. Testul la valori limită
În unele condiții, de exemplu atunci când un test preliminar arată că substanța de testat nu are efecte toxice la concentrații de până la 100 mg·l–1 sau până la limita solubilității în mediul de testare (oricare dintre ele este mai scăzută), poate avea loc un test la valori limită, care presupune compararea răspunsurilor unui grup de control și ale unei grupe supuse tratamentului (100 mg·l–1 sau o concentrație egală cu limita solubilității). Se recomandă ca acest test să fie confirmat prin analizarea concentrației de expunere. Unui test la valori limită i se aplică toate condițiile de testare și criteriile de validitate descrise anterior, cu excepția celei privind numărul de duplicate supuse tratării, care trebuie să fie de cel puțin șase. Variabilele de răspuns din grupul de control și din cel supus tratării pot fi analizate folosind un test statistic de comparare a mediilor, cum ar fi un test t (Student). Dacă varianțele acestor două grupuri sunt inegale, se va efectua un test t ajustat pentru varianțe inegale.
1.8.14. Modificări în cazul substanțelor puternic colorate
Iradierea (intensitatea luminii) trebuie să se afle la marginea superioară a intervalului descris în această metodă de testare: 120 µE m–2s–1 sau mai ridicat.
Traseul luminii trebuie scurtat prin reducerea volumului soluției de testat (în intervalul de 5-25 ml).
Trebuie asigurată agitarea suficientă pentru a se obține o frecvență a expunerii algelor la iradiere înaltă la suprafața culturii.
2. DATE
2.1. TRASAREA CURBELOR DE CREȘTERE
Biomasa în vasele de testare poate fi exprimată în unități ale parametrului înlocuitor folosit pentru măsurare (de exemplu numărul de celule, fluorescență).
Concentrația estimată a biomasei în culturile de testare și probele martor se prezintă sub forma unui tabel, împreună cu concentrațiile materialului de testare și perioadele de măsurare, înregistrate cu o rezoluție de cel puțin ore întregi, pentru a rezulta grafice ale curbelor de creștere. Ambele scale, logaritmică și lineară, pot fi utile în prima etapă, dar scalele logaritmice sunt obligatorii și, în general, prezintă mai bine variațiile modelului de creștere în timpul perioadei de testare. Trebuie reținut că creșterea exponențială este reprezentată ca o linie dreaptă când se face trasarea pe o scală logaritmică, iar înclinația liniei (panta) indică viteza specifică de creștere.
Folosind graficele, se examinează dacă, pe parcursul testului, culturile de control cresc exponențial la viteza prevăzută. Se examinează critic toate punctele experimentale și aspectul graficelor și se verifică datele brute și procedurile de detectare pentru identificarea posibilelor erori. Se verifică, în special, orice punct experimental care pare să devieze printr-o eroare sistematică. Dacă este evident că pot fi identificate erori de procedură și/sau acestea sunt considerate foarte probabile, punctul experimental se marchează ca valoare excepțională și nu se include în analiza statistică ulterioară. (O concentrație a algelor egală cu zero în unul din două sau trei vase duplicate poate arăta că vasul nu a fost inoculat corect sau nu a fost curățat corespunzător.) Motivele respingerii unui punct experimental ca fiind excepțional se indică în mod clar în raportul de testare. Motivele acceptate sunt numai erorile (rare) de procedură, nu simpla imprecizie. Procedurile statistice de identificare a valorilor excepționale au aplicabilitate limitată pentru acest tip de problemă și nu pot înlocui opinia specialiștilor. Se preferă ca valorile excepționale (marcate ca atare) să fie reținute între punctele experimentale ilustrate în orice prezentare grafică sau tabelară ulterioară a datelor.
2.2. VARIABILELE DE RĂSPUNS
Scopul testului este de a determina efectele substanței de testat asupra creșterii algelor. Prezenta metodă de testare descrie două variabile de răspuns, deoarece statele membre au diferite preferințe și necesități de reglementare. Pentru ca rezultatele de testare să fie acceptabile în toate statele membre, efectele se evaluează folosind ambele variabile de răspuns (a) și (b) descrise mai jos.
|
(a) |
Viteza medie specifică de creștere: această variabilă de răspuns se calculează pe baza creșterii logaritmice a biomasei în timpul perioadei de testare, exprimată pe zi. |
|
(b) |
Randament: această variabilă de răspuns reprezintă biomasa de la sfârșitul testului minus biomasa de la începutul testului. |
Pentru aplicarea acestei metode în cadrul de reglementare al UE, calculul rezultatelor trebuie să se bazeze pe viteza medie specifică de creștere din rațiunile descrise în continuare. Trebuie remarcat că valorile toxicității calculate prin folosirea acestor două variabile de răspuns nu sunt comparabile, iar această diferență trebuie să fie menționată atunci când se folosesc rezultatele testului. Valorile ECx bazate pe viteza medie specifică de creștere (ErCx) vor fi în general mai înalte decât rezultatele bazate pe randament (EyCx) dacă se respectă condițiile de testare din prezenta metodă de testare, ca urmare a bazei matematice a abordărilor respective. Aceasta nu se va interpreta ca o diferență de sensibilitate între cele două variabile de răspuns, valorile fiind diferite din punct de vedere matematic. Conceptul vitezei medii specifice de creștere se bazează pe modelul general al creșterii exponențiale a algelor în culturi nelimitate, în care toxicitatea se estimează pe baza efectelor asupra vitezei de creștere, fără a fi dependentă de valoarea absolută a vitezei specifice de creștere a probei martor, de panta curbei concentrație-răspuns sau de durata testului. Prin contrast, rezultatele bazate pe variabila de răspuns-randament depind de toate aceste variabile. EyCx depinde de viteza specifică de creștere a speciilor de alge folosite pentru fiecare test și de viteza maximă specifică de creștere, care poate varia între specii și chiar între sușe diferite de alge. Această variabilă de răspuns nu se folosește pentru compararea sensibilității la substanțe toxice între specii de alge sau chiar sușe diferite. În timp ce folosirea vitezei medii specifice de creștere în scopul estimării toxicității este preferată din punct de vedere științific, estimările de toxicitate bazate pe randament sunt incluse în prezenta metodă de testare pentru a satisface cerințele de reglementare din unele țări.
2.2.1. Viteza medie de creștere
Viteza medie specifică de creștere pentru o anumită perioadă se calculează ca fiind creșterea logaritmică a biomasei, pe baza ecuației pentru fiecare vas de probe martor și de probe supuse tratamentului:
 (zi–1)
(zi–1)
unde:
|
µ i-j : |
este viteza medie specifică de creștere de la momentul i la momentul j |
|
X i : |
este biomasa la momentul i |
|
X j : |
este biomasa la momentul j. |
Pentru fiecare grup etalon și grup supus tratării, se calculează o valoare medie a vitezei de creștere în paralel cu estimările varianței.
Se calculează viteza medie specifică de creștere pentru întreaga durată a testului (în mod normal, zilele 0-3), folosind biomasa inoculată nominal ca valoare inițială în locul unei valori inițiale măsurate, în acest mod fiind obținută o precizie sporită. Dacă dispozitivul folosit pentru măsurarea biomasei permite o determinare suficient de precisă a biomasei scăzute de inocul (de exemplu citometru de flux), se poate folosi concentrația biomasei măsurate inițial. De asemenea, se evaluează viteza de creștere pe secțiuni, calculată ca viteze specifice de creștere pentru fiecare zi din perioada testului (zilele 0-1, 1-2 și 2-3) și se examinează dacă viteza de creștere a probei martor rămâne constantă (a se vedea criteriile de validitate, punctul 1.7). O viteză de creștere specifică semnificativ mai scăzută poate indica o fază de latență. În timp ce o fază de latență poate fi minimizată și, practic, eliminată din culturile de control prin propagarea adecvată a preculturii, o fază de latență la culturile expuse poate indica recuperarea după un stres toxic inițial sau o expunere redusă ca urmare a pierderii de substanță de testat (inclusiv sorbție în biomasa de alge) după expunerea inițială. Prin urmare, viteza de creștere pe secțiuni poate fi estimată în scopul evaluării efectelor substanței de testat care se manifestă în timpul perioadei de expunere. Existența unor diferențe substanțiale între viteza de creștere pe secțiuni și viteza medie de creștere indică o deviere de la creșterea exponențială constantă și justifică examinarea atentă a curbelor de creștere.
Inhibarea procentuală a vitezei de creștere pentru fiecare duplicat supus tratării se calculează pe baza ecuației:

unde:
|
% Ir: |
inhibarea vitezei medii specifice de creștere, în procente |
|
µC: |
valoarea medie a vitezei medii specifice de creștere (µ) în grupul martor |
|
µT: |
viteza medie specifică de creștere pentru duplicatul supus tratării. |
Când se folosesc solvenți pentru pregătirea soluțiilor de testat, pentru calcularea inhibării se folosesc probele martor ale solvenților în locul probelor martor fără solvenți.
2.2.2. Randament
Randamentul se calculează ca biomasa la sfârșitul testului minus biomasa de la începutul testului în cazul fiecărui vas de probe martor și probe supuse tratamentului. Pentru fiecare concentrație de testare și probă martor, se calculează o valoare medie a randamentului împreună cu estimările varianței. Procentul de inhibare a randamentului (% Iy) se poate calcula pentru fiecare duplicat supus tratării, după cum urmează:

unde:
|
% Iy: |
inhibarea randamentului, în procente |
|
YC: |
valoarea medie a randamentului la grupul martor |
|
YT: |
valoarea randamentului pentru duplicatul supus tratării. |
2.3. TRASAREA CURBELOR DE RĂSPUNS A CONCENTRAȚIEI
Se reprezintă procentul de inhibare în funcție de logaritmul concentrației substanței de testat și se examinează graficul cu atenție, ignorându-se toate punctele experimentale care au fost indicate ca valori excepționale în prima fază. Punctele experimentale se unesc printr-o linie netedă, cu ochiul liber sau prin interpolare computerizată, pentru a se obține o primă impresie asupra relației concentrație-răspuns, apoi se continuă cu o metodă mai detaliată, preferabil o metodă de statistică informatizată. În funcție de viitoarea utilizare a datelor, calitatea (precizia) și cantitatea de date, precum și de disponibilitatea instrumentelor de analiză a datelor, se poate decide (uneori, bine justificat) oprirea analizării datelor în această etapă și se citesc doar cifrele cheie EC50 și EC10 (și/sau EC20) de pe curba trasată cu ochiul liber (a se vedea și punctul de mai jos despre efectele stimulatorii). Motivele valide de a nu folosi o metodă statistică pot include:
|
— |
Datele nu sunt adecvate pentru ca metodele computerizate să producă rezultate mai precise decât pot fi obținute prin concluziile experților – în astfel de situații, unele programe de computer pot chiar să nu producă o soluție precisă (iterațiile pot să nu conveargă etc.). |
|
— |
Răspunsurile de creștere stimulatorie nu pot fi prelucrate adecvat prin folosirea programelor de computer disponibile (a se vedea mai jos). |
2.4. PROCEDURI STATISTICE
Obiectivul este de a se obține o relație cantitativă concentrație-răspuns prin metoda analizei regresiei. Este posibilă folosirea unei regresii lineare ponderate după ce s-a efectuat o transformare de linearizare a datelor de răspuns – de exemplu în funcția probit, logit sau unități Weibull (9), dar procedurile de regresie nelineară sunt tehnici preferate, care tratează mai bine inexactitățile inevitabile ale datelor și abaterile de la distribuțiile netede. Când se apropie de zero sau inhibiție totală, aceste inexactități se pot amplifica prin transformare, interferând cu analiza (9). Trebuie remarcat că metodele standard de analiză folosind transformatele probit, logit sau Weibull se folosesc în cazul datelor cantitative (de exemplu date despre mortalitate sau supraviețuire) și trebuie să fie modificate pentru a reflecta datele despre creștere sau biomasă. Proceduri specifice de determinare a valorilor ECx pe baza datelor continue pot fi consultate la notele (10), (11) și (12). Folosirea analizei regresiei nelineare este detaliată în apendicele 4.
Pentru fiecare variabilă de răspuns de analizat, se utilizează relația concentrație-răspuns pentru calcularea estimărilor punctului valorilor ECx. Dacă este posibil, se vor determina limitele de încredere de 95 % pentru fiecare estimare. Calitatea de ajustare a datelor de răspuns la modelul de regresie se evaluează în mod grafic sau statistic. Analiza regresiei se efectuează folosind răspunsuri individuale ale duplicatului, nu medii ale grupului supus tratării. Dacă totuși interpolarea nelineară este dificilă sau eșuează ca urmare a datelor prea împrăștiate, problema poate fi ocolită prin efectuarea regresiei pe medii de grup, aceasta fiind o metodă practică de reducere a influenței valorilor excepționale suspectate. Folosirea acestei opțiuni se consemnează în raportul de testare ca abatere de la procedura normală, deoarece intersectarea curbei cu duplicatele individuale nu a produs un rezultat corect.
Estimările și limitele de încredere ale EC50 pot fi obținute folosind interpolarea lineară cu „bootstrap” (13), dacă modelele/metodele disponibile de regresie sunt inadecvate pentru date.
Pentru estimarea CMEO și, prin urmare, a CFEO și a efectelor substanței de testat asupra vitezei de creștere, este necesară compararea mediilor de tratare folosind tehnici de analizare a varianței (ANOVA). Media pentru fiecare concentrație se compară apoi cu media probei martor folosind o metodă de comparare multiplă adecvată sau de testare a tendinței. Testul lui Dunnett sau cel al lui Williams pot fi utile în acest sens (14)(15)(16)(17)(18). Este necesar să se evalueze dacă ipoteza ANOVA de omogenitate a varianței se verifică. Această evaluare se poate efectua grafic sau printr-un test formal (18). Teste adecvate în acest sens sunt cele ale lui Levene sau Bartlett. Neîndeplinirea ipotezei de omogenitate a varianțelor poate fi corectată uneori prin transformarea logaritmică a datelor. Dacă heterogenitatea varianței este extremă și nu poate fi corectată prin transformare, se va lua în considerare analizarea prin metode precum testele Jonkheere regresive de stabilire a tendinței. Îndrumări suplimentare privind determinarea CFEO sunt prezentate la nota (12).
Progresele științifice recente au condus la recomandarea de abandonare a conceptului de CFEO și înlocuirea sa cu estimările punctului ECx bazate pe regresie. Nu a fost stabilită o valoare adecvată a x pentru acest test cu alge. Un interval cuprins între 10-20 % pare a fi adecvat (în funcție de variabilele de răspuns alese) și se recomandă raportarea atât a EC10, cât și a EC20.
2.5. STIMULAREA CREȘTERII
Se observă uneori o stimulare a creșterii (inhibare negativă) la concentrații scăzute. Aceasta poate rezulta fie din hormesis („stimulare toxică”), fie în urma adăugării de factori de stimulare a creșterii odată cu materialul de testat la mediul minimal folosit. Rețineți că adăugarea de nutrienți anorganici nu ar trebui să aibă niciun efect direct, deoarece mediul de testare ar trebui să își mențină un surplus de nutrienți pe întreaga durată a testului. Stimularea cu doze scăzute poate fi ignorată de obicei în calculele EC50, cu excepția cazurilor când este extremă. Dacă este extremă sau se calculează o valoare ECx pentru x scăzut, pot fi necesare proceduri speciale. Ștergerea răspunsurilor stimulatorii din rezultatele analizării datelor trebuie să fie evitată dacă este posibil, iar dacă programele software de interpolare disponibile nu pot accepta stimulare minoră, se poate utiliza interpolarea lineară cu „boostrap”. Dacă stimularea este extremă, poate fi luată în considerare folosirea unui model hormetic (19).
2.6. INHIBARE NETOXICĂ A CREȘTERII
Materialele de testare fotoabsorbante pot determina o reducere a vitezei de creștere, deoarece umbra reduce cantitatea de lumină disponibilă. Astfel de tipuri de efecte fizice trebuie să fie separate de efectele toxice prin modificarea condițiilor de testare, iar primele se raportează separat. Îndrumări în acest sens sunt prezentate la notele (2) și (3).
3. RAPORT
3.1. RAPORTUL DE TESTARE
Raportul de testare trebuie să includă următoarele informații:
Substanța de testat:
|
— |
starea fizică și proprietățile fizico-chimice relevante, inclusiv limita solubilității în apă; |
|
— |
date de identificare de natură chimică, inclusiv puritatea. |
Speciile folosite pentru testare:
|
— |
sușa, furnizorul sau sursa și condițiile de cultură folosite. |
Condițiile de testare:
|
— |
data de începere a testului și durata acestuia; |
|
— |
descrierea protocolului testului: vasele de testare, volumele de cultură, densitatea biomasei la începutul testului; |
|
— |
compoziția mediului; |
|
— |
concentrații de testare și duplicate (de exemplu numărul duplicatelor, numărul concentrațiilor de testare și progresia geometrică utilizată); |
|
— |
descrierea modului de preparare a soluțiilor testate, inclusiv folosirea de solvenți etc.; |
|
— |
aparatul pentru cultură; |
|
— |
intensitatea și calitatea luminii (sursa, omogenitatea); |
|
— |
temperatura; |
|
— |
concentrațiile testate: concentrațiile nominale de testare și rezultatele tuturor analizelor pentru determinarea concentrației substanței testate în vasele de testare. De asemenea, se prezintă eficiența de recuperare a metodei și limita de cuantificare în matricea de testare; |
|
— |
orice deviere de la prezenta metodă de testare; |
|
— |
metoda de determinare a biomasei și dovada corelației dintre parametrul măsurat și greutatea uscată. |
Rezultate:
|
— |
valorile pH-ului la începutul și sfârșitul testului, pentru toate tipurile de tratare; |
|
— |
biomasa pentru fiecare recipient la fiecare punct de măsurare și pentru fiecare metodă de măsurare a biomasei; |
|
— |
curbele de creștere (graficul biomasei în funcție de timp); |
|
— |
variabilele de răspuns calculate pentru fiecare duplicat supus tratării, cu valori medii și coeficient de variație pentru duplicate; |
|
— |
prezentare grafică a relației concentrație/efect; |
|
— |
estimări ale toxicității pentru variabile de răspuns, cum ar fi EC50, EC10, EC20 și limitele de încredere aferente. Dacă au fost calculate, CMEO și CFEO, precum și metodele statistice folosite pentru determinarea acestora; |
|
— |
dacă s-a folosit ANOVA, dimensiunea efectului care poate fi detectat (de exemplu diferența cea mai puțin importantă); |
|
— |
orice stimulare a creșterii constatată în cazul oricărei tratări; |
|
— |
orice alte efecte observate, cum ar fi modificările morfologice ale algelor; |
|
— |
discutarea rezultatelor, inclusiv orice influență asupra rezultatului testului manifestată în urma abaterilor de la prezenta metodă de testare. |
4. REFERINȚE BIBLIOGRAFICE
|
1. |
OECD TG 201 (2006) Freshwater Alga and Cyanobacteria, Growth Inhibition Test. |
|
2. |
ISO 1998: Water quality – Guidance for algal growth inhibition tests with poorly soluble materials, volatile compounds, metals and waster water. ISO/DIS 14442. |
|
3. |
OECD 2000: Guidance Document on Aquatic Toxicity Testing of Difficult Substances and mixtures. Environmental Health and Safety Publications. Series on Testing and Assessment, no. 23. |
|
4. |
ISO 1998: Water quality – Sampling – Part 16: General Guidance for Biotesting. ISO 5667-16. |
|
5. |
ISO 1993: Water quality – Algal growth inhibition test. ISO 8692. |
|
6. |
Mayer, P., Cuhel, R. and Nyholm, N. (1997). A simple in vitro fluorescence method for biomass measurements in algal growth inhibition tests. Water Research 31: 2525-2531. |
|
7. |
Slovacey, R.E. and Hanna, P.J. In vivo fluorescence determinations of phytoplancton chlorophyll, Limnology & Oceanography 22,5 (1977), p. 919-925. |
|
8. |
Simpson, S.L., Roland, M.G.E., Stauber, J.L. and Batley, G.E. (2003) Effect of declining toxicant concentrations on algal bioassay endpoints. Environ. Toxicol. Chem 22, 2073-2079. |
|
9. |
Christensen, E.R., Nyholm, N. (1984): Ecotoxicological Assays with Algae: Weibull Dose-Response Curves. Env. Sci. Technol. 19, 713-718. |
|
10. |
Nyholm, N. Sørensen, P.S., Kusk, K.O. and Christensen, E.R. (1992): Statistical treatment of data from microbial toxicity tests. Environ. Toxicol. Chem. 11, 157-167. |
|
11. |
Bruce, R.D., and Versteeg, D.J. (1992). A statistical procedure for modelling continuous toxicity data. Env. Toxicol. Chem. 11:1485-1494. |
|
12. |
OECD. (2004). Guidance Document on Statistical Analysis of Ecotoxicity Data. |
|
13. |
Norberg-King T.J. (1988) An interpolation estimate for chronic toxicity: The ICp approach. National Effluent Toxicity Assessment Center Technical Report 05-88. USEPA, Duluth, MN. |
|
14. |
Dunnett, C.W. (1955) A multiple comparisons procedure for comparing several treatments with a control. J. Amer. Statist. Assoc. 50: 1096-1121. |
|
15. |
Dunnett, C.W. (1964) New tables for multiple comparisons with a control. Biometrics 20: 482-491. |
|
16. |
Williams, D.A. (1971) A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27: 103-117. |
|
17. |
Williams, D.A. (1972) The comparison of several dose levels with a zero dose control. Biometrics 28: 510-531. |
|
18. |
Draper, N.R. and Smith, H. (1981). Applied Regression Analysis, second edition. Wiley, New York. |
|
19. |
Brain P. and Cousens R. (1989). An equation to describe dose-responses where there is stimulation of growth at low doses. Weed Research, 29, 93-96. |
Apendicele 1
Sușe demonstrate ca fiind adecvate pentru testare
Alge verzi
|
— |
Pseudokirchneriella subcapitata (cunoscută anterior ca Selenastrum capricornutum), ATCC 22662, CCAP 278/4, 61.81 SAG |
|
— |
Desmodesmus subspicatus (cunoscută anterior ca Scenedesmus subspicatus) 86.81 SAG |
Diatomee
|
— |
Navicula pelliculosa, UTEX 664 |
Cianobacterii
|
— |
Anabaena flos-aquae, UTEX 1444, ATCC 29413, CCAP 1403/13A |
|
— |
Synechococcus leopoliensis, UTEX 625, CCAP 1405/1 |
Surse ale sușelor
Sușele recomandate sunt disponibile în culturi cu un singur tip de alge din următoarele colecții (în ordine alfabetică):
|
|
|
|
|
|
|
|
|
|
|
|
Aspectul și caracteristicile speciilor recomandate
|
|
P. subcapitata |
D. subspicatus |
N. pelliculosa |
A. flos-aquae |
S. leopoliensis |
|
Aspect |
Curbat, celule unice răsucite |
Oval, predominant celule unice |
Bastonașe |
Lanț de celule ovale |
Bastonașe |
|
Dimensiune (L × l) µm |
8-14 × 2-3 |
7-15 × 3-12 |
7,1 × 3,7 |
4,5 × 3 |
6 × 1 |
|
Volumul celulei (µm3/celulă) |
40-60 (1) |
60-80 (1) |
40-50 (1) |
30-40 (1) |
2,5 (2) |
|
Greutatea uscată a celulei (mg/celulă) |
2-3 × 10–8 |
3-4 × 10–8 |
3-4 × 10–8 |
1-2 × 10–8 |
2-3 × 10–9 |
|
Viteză de creștere (3) (zi–1) |
1,5-1,7 |
1,2-1,5 |
1,4 |
1,1-1,4 |
2,0-2,4 |
Recomandări specifice privind cultura și manipularea speciilor de testare recomandate
Pseudokirchneriella subcapitata și Desmodesmus subspicatus
Aceste alge verzi sunt, în general, ușor de întreținut în diferite medii de cultură. Informații privind mediile adecvate sunt disponibile în colecțiile de culturi. În mod normal, celulele sunt solitare, iar măsurătorile densității celulelor pot fi efectuate cu ușurință folosind un contor electronic de particule sau un microscop.
Anabaena flos-aquae
Pentru păstrarea unei culturi mamă pot fi folosite diferite medii de cultură. Cultura cultivată în serie nu trebuie să depășească faza de dezvoltare logaritmică în etapa de reînnoire, recuperarea fiind dificilă în acest punct.
Anabaena flos-aquae dezvoltă agregate de lanțuri de celule în serie. Dimensiunea acestor agregate poate varia în funcție de condițiile de cultură. Separarea acestor agregate poate fi necesară în timpul numărării la microscop sau când se folosește un contor electronic de particule pentru determinarea biomasei.
Desfacerea lanțurilor, în scopul reducerii variabilității numărului, se poate obține prin dezintegrarea cu ultrasunete a subeșantioanelor. O dezintegrare cu ultrasunete pentru o perioadă mai lungă decât cea necesară pentru desfacerea lanțurilor în lungimi mai mici poate avea ca efect distrugerea celulelor. Intensitatea și durata dezintegrării cu ultrasunete trebuie să fie identice în cazul fiecărei tratări.
Se vor număra suficiente câmpuri pe hemocitometru (cel puțin 400 de celule) pentru a se compensa variabilitatea. Aceasta va ameliora precizia determinărilor microscopice ale densității.
După desfacerea lanțului de celule prin dezintegrare prudentă cu ultrasunete, volumul total de celule de Anabaena se va putea determina folosind un contor electronic de particule. Energia dezintegrării se va ajusta pentru a se preveni distrugerea celulelor.
Folosiți un agitator Vortex sau o metodă adecvată similară pentru a vă asigura că suspensia de alge utilizată pentru inocularea vaselor de testare este bine amestecată și omogenă.
Vasele de testare se așază pe o masă de agitare orbitală sau oscilantă la aproximativ 150 de rotații pe minut. În mod alternativ, tendința Anabaena de a se agrega poate fi prevenită prin agitare intermitentă. Dacă se produce agregarea, eșantioanele reprezentative pentru măsurătorile de biomasă vor fi selectate cu atenție. Agitarea cu putere înainte de recoltare poate dezintegra agregatele de alge.
Synechococcus leopoliensis
Pentru păstrarea unei culturi mamă pot fi folosite diferite medii de cultură. Informații privind mediile adecvate sunt disponibile în colecțiile de culturi.
Synechococcus leopoliensis crește sub formă de celule solitare în formă de bastonașe. Celulele sunt foarte mici, ceea ce îngreunează numărarea acestora la microscop în scopul măsurării biomasei. Sunt utile contoarele electronice de particule calibrate pentru numărarea particulelor cu o dimensiune de până la 1 µm. Se pot folosi, de asemenea, măsurători fluorometrice in vitro.
Navicula pelliculosa
Pentru păstrarea unei culturi mamă pot fi folosite diferite medii de cultură. Informații privind mediile adecvate sunt disponibile la colecțiile de culturi. Rețineți că în mediu este necesară prezența silicatului.
Navicula pelliculosa poate forma agregate în anumite condiții de creștere. Ca urmare a producției de lipide, celulele algice tind uneori să se acumuleze în pelicula de suprafață. În această situație, se vor adopta măsuri speciale pentru obținerea de eșantioane reprezentative când se recoltează subeșantioane pentru determinarea biomasei. Poate fi necesară agitarea cu putere, cu ajutorul, de exemplu, al unui agitator Vortex.
(1) Măsurată cu contor electronic de particule.
(2) Calculat pe baza dimensiunii.
(3) Viteza de creștere observată cel mai frecvent în mediu OECD, la o intensitate a luminii de aprox. 70 µE·m–2·s–1 și o temperatură de 21 °C.
Apendicele 2
Medii de cultură
Se poate folosi unul dintre următoarele două medii de cultură:
Mediul OECD: Mediu original, conform cu orientările OECD privind testele nr. 201 și ISO 8692
Statele Unite, mediu EPA AAP, conform și cu ASTM.
Pentru pregătirea acestor medii se folosesc reactivi sau substanțe chimice de puritate analitică și apă deionizată.
Compoziția mediului AAP (Statele Unite, EPA) și a mediului conform cu orientările OECD privind testele nr. 201
|
Componentă |
EPA |
OECD |
||
|
|
mg/l |
mM |
mg/l |
mM |
|
NaHCO3 |
15,0 |
0,179 |
50,0 |
0,595 |
|
NaNO3 |
25,5 |
0,300 |
|
|
|
NH4Cl |
|
|
15,0 |
0,280 |
|
MgCl2·6(H2O) |
12,16 |
0,0598 |
12,0 |
0,0590 |
|
CaCl2·2(H2O) |
4,41 |
0,0300 |
18,0 |
0,122 |
|
MgSO4·7(H2O) |
14,6 |
0,0592 |
15,0 |
0,0609 |
|
K2HPO4 |
1,044 |
0,00599 |
|
|
|
KH2PO4 |
|
|
1,60 |
0,00919 |
|
FeCl3·6(H2O) |
0,160 |
0,000591 |
0,0640 |
0,000237 |
|
Na2EDTA·2(H2O) |
0,300 |
0,000806 |
0,100 |
0,000269 (1) |
|
H3BO3 |
0,186 |
0,00300 |
0,185 |
0,00299 |
|
MnCl2·4(H2O) |
0,415 |
0,00201 |
0,415 |
0,00210 |
|
ZnCl2 |
0,00327 |
0,000024 |
0,00300 |
0,0000220 |
|
CoCl2·6(H2O) |
0,00143 |
0,000006 |
0,00150 |
0,00000630 |
|
Na2MoO4·2(H2O) |
0,00726 |
0,000030 |
0,00700 |
0,0000289 |
|
CuCl2.2(H2O) |
0,000012 |
0,00000007 |
0,00001 |
0,00000006 |
|
pH |
7,5 |
8,1 |
||
În testul cu diatomeea Navicula pelliculosa, ambele medii trebuie să fie suplimentate cu Na2SiO3·9H2O pentru a se obține o concentrație de 1,4 mg Si/l.
pH-ul mediului se obține la echilibrul între sistemul carbonat al mediului și presiunea parțială a CO2 în aerul atmosferic. O relație aproximativă între pH la 25 °C și concentrația molară a bicarbonatului este:
PHeq = 11,30 + log [HCO3]
cu 15 mg NaHCO3, pHeq = 7,5 (mediu conform EPA, Statele Unite) și cu 50 mg NaHCO3/l, pHeq = 8,1 (mediu OECD).
Compoziția elementală a mediului de testare
|
Element |
EPA |
OECD |
|
|
mg/l |
mg/l |
|
C |
2,144 |
7,148 |
|
N |
4,202 |
3,927 |
|
P |
0,186 |
0,285 |
|
K |
0,469 |
0,459 |
|
Na |
11,044 |
13,704 |
|
Ca |
1,202 |
4,905 |
|
Mg |
2,909 |
2,913 |
|
Fe |
0,033 |
0,017 |
|
Mn |
0,115 |
0,115 |
Pregătirea mediului OECD
|
Nutrient |
Concentrație în soluție mamă |
|
Soluție mamă nr. 1: macronutrienți |
|
|
NH4Cl MgCl2·6H2O CaCl2·2H2O MgSO4·7H2O KH2PO4 |
1,5 g·l–1 1,2 g·l–1 1,8 g·l–1 1,5 g·l–1 0,16 g·l–1 |
|
Soluție mamă nr. 2: fier |
|
|
FeCl3·6H2O Na2EDTA·2H2O |
64 mg·l–1 100 mg·l–1 |
|
Soluție mamă nr. 3: elemente de urmărire |
|
|
H3BO3 MnCl2·4H2O ZnCl2 CoCl2·6H2O CuCl2·2H2O Na2MoO4·2H2O |
185 mg·l–1 415 mg·l–1 3 mg·l–1 1,5 mg·l–1 0,01 mg·l–1 7 mg·l–1 |
|
Soluție mamă nr. 4: bicarbonat |
|
|
NaHCO3 |
50 g·l–1 |
|
Na2SiO3·9H2O |
|
Soluțiile mamă se sterilizează prin filtrare prin membrană (diametrul mediu al porilor 0,2 µm) sau termic (120 °C, 15 min). Soluțiile se depozitează la întuneric la 4 °C.
Soluțiile mamă nr. 2 și 4 nu se sterilizează termic, ci doar prin filtrare prin membrană.
Se pregătește un mediu de creștere prin adăugarea unui volum adecvat al soluțiilor mamă 1-4 în apă:
Se adaugă 500 ml de apă sterilizată:
|
— |
10 ml de soluție mamă nr. 1 |
|
— |
1 ml de soluție mamă nr. 2 |
|
— |
1 ml de soluție mamă nr. 3 |
|
— |
1 ml de soluție mamă nr. 4 |
Se completează până la 1 000 ml cu apă sterilizată.
Se lasă suficient timp pentru echilibrarea mediului cu CO2 atmosferic, prin barbotare timp de câteva ore cu aer steril filtrat, dacă este necesar.
Pregătirea mediului AAP
|
A1.1. |
Se adaugă 1 ml din fiecare soluție mamă în A1.2.1-A1.2.7 la aproximativ 900 ml de apă deionizată sau distilată, apoi se diluează la 1 l. |
|
A1.2. |
Soluțiile mamă de macronutrienți se alcătuiesc prin dizolvarea următoarelor substanțe în 500 ml de apă deionizată sau distilată. Reactivii A1.2.1, A1.2.2, A1.2.3 și A1.2.4 pot fi combinați într-o singură soluție mamă. |
|
A1.2.1. |
NaNO3 —12,750 g. |
|
A1.2.2. |
MgCl2 ·6H2O—6,082 g. |
|
A1.2.3. |
CaCl2 ·2H2O—2,205 g. |
|
A1.2.4. |
Soluție mamă de micronutrienți—(a se vedea A1.3). |
|
A1.2.5. |
MgSO4·7H2O—7,350 g. |
|
A1.2.6. |
K2HPO4 —0,522 g. |
|
A1.2.7. |
NaHCO3 —7,500 g. |
|
A1.2.8. |
Na2SiO3·9H2O—A se vedea nota A1.1. Nota A1.1 – Se folosește exclusiv pentru specii de diatomee-test. Se poate adăuga direct (202,4 mg) sau prin soluția mamă, pentru a rezulta 20 mg/l Si concentrație finală în mediu. |
|
A1.3. |
Soluția mamă de micronutrienți se obține prin dizolvarea următoarelor substanțe în 500 ml de apă deionizată sau distilată: |
|
A1.3.1. |
H3BO3 —92,760 mg. |
|
A1.3.2. |
MnCl2·4H2O—207,690 mg. |
|
A1.3.3. |
ZnCl2 —1,635 mg. |
|
A1.3.4. |
FeCl3·6H2O—79,880 mg. |
|
A1.3.5. |
CoCl2·6H2O—0,714 mg. |
|
A1.3.6. |
Na2MoO4·2H2O—3,630 mg. |
|
A1.3.7. |
CuCl2·2H2O—0,006 mg. |
|
A1.3.8. |
Na2EDTA·2H2O—150,000 mg. [(Etilendiamino)tetraacetat disodic]. |
|
A1.3.9. |
Na2SeO4·5H2O—0,005 mg. A se vedea nota A1.2. Nota A1.2 – Se folosește exclusiv în mediul pentru culturile mamă ale speciilor de diatomee. |
|
A1.4. |
Se ajustează pH la 7,5 ± 0,1 cu soluție 0,1 N sau 1,0 N de NaOH sau HCl. |
|
A1.5. |
Se filtrează mediul într-un recipient steril printr-un filtru cu membrană de 0,22 μm, dacă se folosește un contor de particule, sau printr-un filtru de 0,45 μm, dacă nu se folosește un contor de particule. |
|
A1.6. |
Mediul se depozitează la întuneric la 4 °C până la utilizare. |
(1) Raportul molar al EDTA-fier depășește ușor unitatea. Aceasta previne precipitarea fierului și, în același timp, este minimizată chelatizarea ionilor de metale grele.
Apendicele 3
Exemplu de procedură pentru cultura de alge
Observații generale
Scopul cultivării pe baza metodei de mai jos este acela de a obține culturi de alge pentru testele de toxicitate.
Se folosesc metode adecvate pentru a garanta lipsa infectării cu bacterii a culturilor de alge. Se recomandă culturile necontaminate, dar se stabilesc și se folosesc culturile cu un singur tip de alge.
Toate operațiile se efectuează în condiții sterile pentru a evita contaminarea cu bacterii sau alte alge.
Echipament și materiale
A se vedea secțiunea Aparatură din Metoda de testare.
Proceduri pentru obținerea culturilor de alge
Prepararea soluțiilor de elemente nutritive (medii):
Toate sărurile nutritive ale mediului se prepară ca soluții mamă concentrate și se păstrează la rece și întuneric. Aceste soluții se sterilizează prin filtrare sau autoclavare.
Mediul se prepară prin adăugarea cantității corecte de soluție mamă la apa distilată sterilă, acordându-se atenție prevenirii infecțiilor. Pentru mediul solid se adaugă 0,8 % agar-agar.
Cultura mamă:
Culturile mamă sunt culturi mici de alge care se transferă cu regularitate într-un mediu proaspăt pentru a acționa ca material inițial de testare. Dacă nu sunt folosite cu regularitate, se scurg pe tuburile înclinate acoperite cu agar-agar. Culturile se transferă într-un mediu proaspăt cel puțin o dată la două luni.
Culturile mamă se cresc în vase conice care conțin mediul corespunzător (volum cca 100 ml). Când algele sunt incubate la 20 °C cu iluminare continuă, este necesar un transfer săptămânal.
În timpul transferului, o cantitate din cultura „veche” se transferă cu pipete sterile într-un vas cu mediu proaspăt, astfel încât, în cazul speciilor cu creștere rapidă, concentrația inițială să fie de cca 100 de ori mai mică decât în cultura veche.
Viteza de creștere a speciei se poate determina din curba de creștere. Dacă aceasta se cunoaște, este posibil să se estimeze densitatea la care cultura trebuie transferată într-un mediu nou. Acest lucru trebuie să se facă înainte ca algele din cultură să atingă faza morții.
Precultura:
Precultura are ca scop obținerea unei cantități de alge adecvată pentru inocularea culturilor de testare. Precultura se incubează în condițiile testării și se folosește în timpul creșterii exponențiale, în mod normal după o perioadă de incubare între 2-4 zile. Când culturile de alge conțin celule deformate sau anormale, acestea sunt înlăturate.
Apendicele 4
Analiza datelor prin metoda regresiei nelineare
Considerații generale
Răspunsul la testele pe alge și alte teste de creștere microbiană – în mod natural, creșterea biomasei este o variabilă continuă sau metrică – o viteză de proces, dacă se folosește viteza de creștere, și integrala sa în funcție de timp, dacă se selectează biomasa. Ambele fac trimitere la răspunsul mediu corespunzător al probelor martor duplicate neexpuse care manifestă un răspuns maxim pentru condițiile impuse – lumina și temperatura fiind principalii factori determinanți în testul pe alge. Sistemul este distribuit sau omogen, iar biomasa poate fi considerată ca fiind un continuum fără a se ține cont de celulele individuale. Distribuția varianței tipului de răspuns pentru un astfel de sistem are legătură exclusiv cu factorii experimentali (descriși în mod obișnuit de distribuțiile log-normale sau normale ale erorilor). Aceasta este în contrast cu răspunsurile tipice din cadrul biotestului cu date cantitative, pentru care toleranța (distribuită de obicei binomial) a organismelor individuale este adesea presupusă a fi componenta dominantă a varianței. Răspunsurile de control sunt, în acest caz, zero sau nivel de fond.
În situația necomplicată, răspunsul normalizat sau relativ r descrește uniform de la 1 (inhibare zero) la 0 (100 % inhibare). Rețineți că toate răspunsurile au o marjă de eroare aferentă și că inhibările aparent negative pot fi calculate doar ca rezultat al unei erori aleatorii.
Analiza regresiei
Modele
Obiectivul unei analize a regresiei este de a descrie cantitativ curba concentrație-răspuns sub forma unei funcții matematice de regresie Y = f (C) sau, mai frecvent, F (Z), unde Z = log C. Folosită invers, C = f–1 (Y) permite calcularea valorilor ECx, inclusiv EC50, EC10 și EC20 și limitele lor de încredere de 95 %. Câteva formule funcționale matematice simple au demonstrat că pot descrie cu succes relațiile concentrație-răspuns obținute în testele de inhibare a creșterii algelor. Funcțiile includ, de exemplu, ecuația logistică, ecuația Weibull nesimetrică și funcția de distribuție log-normală, toate acestea fiind curbe sigmoide care se apropie asimptotic de 1 pentru C → 0 și de 0 pentru C → infinit.
Folosirea modelelor funcției limită continue (de exemplu modelul Koyman „de inhibare a creșterii populațiilor”, Kooijman et al. 1996) este o alternativă propusă recent la modelele asimptotice. Acest model nu presupune efecte la concentrații sub o anumită limită EC0+, care se estimează prin extrapolarea relației concentrație-răspuns pentru a intersecta axa concentrației prin folosirea unei funcții continue simple care nu este diferențiabilă în punctul de pornire.
Trebuie reținut că analiza poate consta într-o simplă minimizare a sumelor pătratelor reziduale (presupunând că varianța este constantă) sau a pătratelor ponderate, dacă heterogenitatea varianței este compensată.
Procedură
Procedura poate fi descrisă după cum urmează: se selectează o ecuație funcțională adecvată Y = f (C) și se ajustează la date prin regresie nelineară. Se preferă folosirea măsurătorilor pentru fiecare recipient individual, și nu valorile medii ale duplicatelor, pentru a se obține din date cât mai multe informații posibil. Dacă, pe de altă parte, varianța este mare, experiența practică arată că valorile medii ale duplicatelor pot asigura o estimare matematică mai precisă, mai puțin influențată de erorile sistematice ale datelor decât în cazul fiecărui punct experimental reținut.
Se reprezintă curba adaptată și datele măsurate și se examinează dacă ajustarea curbei este adecvată. Analiza valorilor reziduale poate fi un instrument deosebit de util în acest scop. Dacă relația funcțională aleasă pentru ajustarea răspunsului concentrației nu descrie în mod corect întreaga curbă sau o parte esențială a acesteia, cum ar fi răspunsul la concentrații scăzute, se alege altă opțiune de ajustare a curbei – de exemplu o curbă asimetrică, cum ar fi funcția Weibull, în locul uneia simetrice. Inhibările negative pot fi o problemă pentru funcția de distribuție log-normală, de exemplu, fiind necesară și în acest caz o funcție de regresie alternativă. Nu se recomandă atribuirea valorii zero sau a unei valori pozitive mici unor astfel de valori negative, deoarece aceasta distorsionează distribuția erorilor. În scopul estimării valorilor ECscăzut x, se poate dovedi utilă trasarea de ajustări separate ale curbei pe părți ale acesteia, cum ar fi partea de inhibare scăzută. Se calculează pe baza ecuației ajustate [prin „estimare inversă”, C = f–1 (Y)] estimările punctului caracteristic al ECx și se raportează EC50 ca minim și una sau două estimări ECscăzut x. Experiența dobândită în urma testării practice a arătat că precizia testului pe alge permite, în mod normal, o estimare suficient de precisă la un nivel de inhibare de 10 %, dacă punctele experimentale sunt suficiente – cu excepția situațiilor când stimularea are loc la concentrații scăzute, ca factor de confuzie. Precizia unei estimări a EC20 este adesea considerabil mai bună decât cea a unui EC10, deoarece EC20 este poziționat de obicei pe partea aproximativ lineară a curbei concentrație-răspuns centrale. Uneori, EC10 poate fi dificil de interpretat ca urmare a stimulării creșterii. Astfel, chiar dacă EC10 poate fi obținut, în mod normal, cu o suficientă precizie, se recomandă ca și EC20 să fie întotdeauna raportat.
Factori de ponderare
Varianța experimentală nu este în general constantă și include de obicei o componentă proporțională, aplicarea unei regresii ponderate permanente fiind, prin urmare, avantajoasă. Factorii de ponderare pentru o astfel de analiză sunt dați de obicei invers proporțional cu varianța:
Wi = 1/Var(ri)
Mai multe programe de regresie includ opțiunea de analiză de regresie ponderată, factorii de ponderare fiind enumerați într-un tabel. Pentru simplificare, factorii de ponderare se normalizează prin multiplicarea lor cu n/Σ wi (n este numărul punctelor experimentale), astfel încât suma lor să fie egală cu 1.
Răspunsuri de normalizare
Normalizarea prin răspunsul mediu de control ridică unele probleme de principiu și determină apariția unei structuri a varianței destul de complicate. Împărțirea răspunsurilor la răspunsul mediu de control, în scopul obținerii procentajului de inhibare 1, introduce o eroare suplimentară, cauzată de eroarea pe media de control. Cu excepția cazului în care această eroare este neglijabilă, factorii de ponderare din regresie și limitele de încredere se corectează pentru covarianța cu proba martor (17). Rețineți că precizia înaltă pe răspunsul mediu de control estimat este importantă pentru minimizarea varianței generale pentru răspunsul relativ. Această varianță este descrisă mai jos:
indicele i se referă la nivelul concentrației i, iar indicele 0 se referă la probele martor.
Yi = Răspuns relativ = ri/r0 = 1 – I = f (Ci)
cu o varianță:
Var (Yi) = Var (ri/r0) ≅ (∂Yi / ∂ ri)2·Var(ri) + (∂ Yi/ ∂ r0)2·Var (r0)
și deoarece
(∂ Yi/ ∂ ri) = 1/r0 și (∂ Yi / ∂ r0) = ri/r0 2
cu date distribuite normal și duplicate mi și m0:
Var(ri) = σ2/mi
varianța totală a răspunsului relativ Yi devine astfel:
Var(Yi) = σ2/(r0 2 mi) + ri 2·σ2/r0 4 m0
Eroarea pe media de control este invers proporțională cu rădăcina pătrată a numărului de duplicate de probe martor exprimat ca medie, uneori fiind justificată introducerea de date anterioare în scopul reducerii considerabile în acest fel a erorii. O procedură alternativă este de a nu normaliza datele și adăuga răspunsurile absolute, inclusiv datele despre răspunsul de control, ci de a introduce valoarea răspunsului de control ca parametru adițional de adăugat prin regresie nelineară. Cu o ecuație obișnuită de regresie cu doi parametri, această metodă impune ajustarea a trei parametri, necesitând prin urmare mai multe puncte experimentale decât regresia nelineară pe date care sunt normalizate prin folosirea unui răspuns de control presetat.
Intervale de încredere inverse
Calcularea intervalelor de încredere ale regresiei nelineare prin estimare inversă este destul de complexă, nefiind inclusă ca dotare standard în programele uzuale de statistică informatizată. Limitele de încredere aproximative pot fi obținute cu ajutorul programelor standard de regresie nelineară cu opțiunea de reparametrizare (Bruce and Versteeg, 1992), care presupune rescrierea ecuației matematice cu estimările punctului dorit, de exemplu EC10 și EC50 ca parametri de estimat. [Fie funcția I = f (α, β, concentrație) și se folosesc relațiile de definiție f (α, β, EC10) = 0,1 și f (α, β, EC50) = 0,5 pentru a substitui f (α, β, concentrație) cu o funcție echivalentă g (EC10, EC50, concentrație)].
Un calcul mai direct (Andersen et al., 1998) se efectuează prin reținerea ecuației originale și folosirea unei expansiuni Taylor în jurul mediilor ri și r0.
În ultimul timp au devenit populare „metodele bootstrap”. Aceste metode folosesc datele măsurate și reeșantionarea frecventă cu ajutorul unui generator de numere aleatorii pentru a estima o distribuție empirică a varianței.
Referințe bibliografice
Kooijman, S.A.L.M.; Hanstveit, A.O.; Nyholm, N. (1996): No-effect concentrations in algal growth inhibition tests. Water Research, 30, 1625-1632.
Bruce, R.D. and Versteeg, D.J.(1992) A Statistical Procedure for Modelling Continuous Ecotoxicity Data. Env. Toxicol. Chem.11, 1485-1494.
Andersen, J.S., Holst, H., Spliid, H., Andersen, H., Baun, A. & Nyholm, N. (1998): Continuous ecotoxicological data evaluated relative to a control response. Journal of Agricultural, Biological and Environmental Statistics, 3, 405-420.
ANEXA V
|
C.25. |
MINERALIZAREA AEROBĂ ÎN APA DE SUPRAFAȚĂ – TEST DE SIMULARE A BIODEGRADĂRII |
1. METODĂ
Această metodă este echivalentă cu orientările OECD privind testele nr. 309 (2004)(1)
1.1. INTRODUCERE
Obiectivul acestui test vizează măsurarea în timp a biodegradării unei substanțe de testat la concentrație scăzută în apă aerobă în mod natural și cuantificarea observațiilor sub formă de expresii cinetice. Acest test de simulare este un test de laborator în serie prin metoda agitării flaconului pentru determinarea vitezelor de biodegradare aerobă a substanțelor organice în eșantioane de apă naturală de suprafață (dulce, salmastră sau marină). Se bazează pe ISO/DIS 14592-1 (2) și include, de asemenea, elemente ale metodelor de testare C.23 și C.24 (3)(4). Opțional, dacă perioada de testare este lungă, testarea în loturi se înlocuiește cu testarea semicontinuă, în scopul prevenirii deteriorării mediului de testare. Principalul obiectiv al testului de simulare constă în determinarea mineralizării substanței testate în apă de suprafață, iar mineralizarea constituie baza de exprimare a cineticii degradării. Un obiectiv opțional secundar al testului vizează obținerea de informații privind degradarea primară și formarea produșilor principali de transformare. Identificarea produșilor de transformare și, dacă este posibil, cuantificarea concentrațiilor acestora sunt importante în special pentru substanțe care se mineralizează foarte lent (de exemplu, cu perioade de înjumătățire pentru 14C rezidual total care depășesc 60 de zile). Ca urmare a limitărilor analitice, pentru identificarea și cuantificarea produșilor principali de transformare se folosesc, în mod normal, concentrații mai mari de substanță de testat (> 100 μg/l).
O concentrație scăzută în acest test se referă la o concentrație (de exemplu mai mică de 1 μg/l la 100 μg/l) suficient de scăzută pentru ca cinetica biodegradării rezultate în urma testului să o reflecte pe cea prevăzută pentru mediul ambiant. Comparativ cu masa totală a substraturilor de carbon biodegradabil disponibile în apa naturală folosită pentru testare, substanța testată prezentă în concentrație scăzută va avea rolul de substrat secundar. Aceasta presupune că cinetica anticipată a biodegradării este de prim ordin (cinetică de „non-creștere”), iar substanța testată poate fi degradată prin „cometabolism”. Cinetica de prim ordin presupune că viteza de degradare (mg/l/zi) este proporțională cu concentrația substratului care descrește în timp. În cazul cineticii de prim ordin reale, constanta vitezei specifice de degradare k este independentă de timp și concentrație. Prin urmare, k nu variază apreciabil în cursul experimentului și nu se modifică în funcție de concentrația adăugată între experimente. Prin definiție, constanta vitezei specifice de degradare este egală cu modificarea relativă a concentrației în funcție de timp k = (1/C) · (dC/dt). Deși, în condițiile descrise, se prevede obținerea unei cinetici de prim ordin, se pot manifesta circumstanțe în care este adecvată o cinetică de un tip diferit. Dacă viteza de biotransformare este limitată ca urmare a unor fenomene de transfer de masă, cum ar fi viteza de difuzie, în locul vitezei reacției biologice, pot fi observate abateri de la cinetica de prim ordin. Cu toate acestea, datele pot fi aproape întotdeauna descrise prin cinetică de pseudo-prim ordin, care acceptă o constantă a vitezei dependentă de concentrație.
În scopul facilitării stabilirii planului experimental și interpretării rezultatelor, informațiile despre biodegrabilitatea la concentrații mari a substanței testate (obținute în urma testelor standard de triere), precum și cele privind abiotică, produşii de transformare şi proprietățile fizico-chimice relevante trebuie să se cunoască înainte de test. Biodegradabilitatea finală poate fi stabilită ca urmare a folosirii substanțelor de testat marcate cu izotop 14C și determinarea distribuției fazice a 14C la sfârșitul testului. Dacă se folosește substanță de testat nemarcată, biodegradarea finală poate fi estimată doar dacă se testează o concentrație mai mare și se cunosc toți produșii principali de transformare.
1.2. DEFINIȚII
Biodegradare primară: Modificarea (transformarea) structurii unei substanțe chimice sub acțiunea unor microorganisme, având ca rezultat pierderea proprietăților chimice.
Biodegradare funcțională: Modificarea (transformarea) structurii unei substanțe chimice ca urmare a acțiunii unor microorganisme, având ca rezultat pierderea unei anumite proprietăți chimice.
Biodegradare aerobă finală: Descompunerea unei substanțe chimice în dioxid de carbon, apă și săruri minerale ale oricărui alt element prezent sub acțiunea unor microorganisme în prezența oxigenului (mineralizare) și obținerea de biomasă și produși noi de biosinteză microbiană organică.
Mineralizare: Descompunerea unei substanțe chimice sau materii organice în dioxid de carbon, apă și săruri minerale ale oricărui alt element prezent ca urmare a acțiunii unor microorganisme în prezența oxigenului.
Fază de latență: Perioada cuprinsă între începutul unui test și momentul în care se realizează adaptarea microorganismelor care produc degradarea, iar gradul de biodegradare al unei substanțe chimice sau materii organice a crescut la un nivel detectabil (de exemplu 10 % din biodegradarea teoretică maximă sau mai puțin, în funcție de precizia metodei de măsurare).
Nivel maxim de biodegradare: Gradul de biodegradare a unei substanțe chimice sau materii organice într-un test, înregistrat în procente, dincolo de care nu are loc biodegradare în timpul testului.
Substrat primar: Colecție de surse naturale de energie și carbon care asigură creșterea și menținerea biomasei microbiene.
Substrat secundar: Componenta unui substrat prezentă într-o concentrație atât de scăzută, încât, în urma degradării sale, microorganismele competente primesc doar cantități minime de carbon și energie comparativ cu carbonul și energia furnizate prin degradarea componentelor substratului principal (substraturi primare).
Constanta vitezei degradării: Constantă cinetică de prim ordin sau pseudo-prim ordin k (zi–1), indicând viteza procesului de degradare. Pentru un experiment în serie, k se estimează din partea inițială a curbei degradării obținute după încheierea fazei de latență.
Timp de înjumătățire, t1/2 (zi): Termen folosit pentru caracterizarea vitezei unei reacții de prim ordin. Este intervalul de timp care corespunde unei scăderi a concentrației de 2 ori. Timpul de înjumătățire și constanta vitezei de degradare sunt corelate de ecuația t1/2 = ln2/k.
Timp de înjumătățire a degradării, DT50 (zi): Termen utilizat pentru cuantificarea rezultatului testelor de biodegradare. Este intervalul de timp (inclusiv faza de latență) necesar pentru atingerea unei valori de 50 % a biodegradării.
Limita de detecție (LOD) și limita de cuantificare (LOQ): Limita de detecție (LOD) este concentrația unei substanțe sub nivelul căreia identitatea unei substanțe nu mai poate fi deosebită de artefactele analitice. Limita de cuantificare (LOQ) este concentrația unei substanțe sub nivelul căreia concentrația nu poate fi determinată cu o precizie acceptabilă.
Carbon organic dizolvat (COD): Acea parte a carbonului organic dintr-un eșantion de apă care nu poate fi eliminată prin separarea fazelor specificate, cum ar fi centrifugarea la 40 000 ms–2 timp de 15 minute sau filtrarea prin membrană cu pori de diametru 0,2 μm-0,45 μm.
Activitatea organică totală a 14C (TOA): Activitatea totală a 14C asociată cu carbonul organic.
Activitatea 14C organic dizolvat (DOA): Activitatea totală a 14C asociată cu carbonul organic dizolvat.
Activitatea 14C organic sub formă de particule (POA): Activitatea totală a 14C asociată cu carbonul organic sub formă de particule.
1.3. APLICABILITATEA TESTULUI
Acest test de simulare este aplicabil substanțelor organice nevolatile sau ușor volatile testate la concentrații scăzute. Folosind recipiente în care intră aerul (de exemplu acoperite cu vată hidrofilă), substanțele cu o constantă a legii lui Henry mai mică de aproximativ 1 Pa·m3/mol (aprox. 10–5 atm·m3/mol) pot fi considerate practic nevolatile. Testarea substanțelor puțin volatile (cu constante ale legii lui Henry < 100 Pa·m3/mol sau < 10–3 atm·m3/mol) poate avea loc fără pierderi din sistemul de testare dacă se folosesc recipiente închise cu volum tampon. CO2 se va îndepărta cu respectarea măsurilor de siguranță adecvate, în caz contrar putând avea loc pierderi de substanță marcată cu 14C. În astfel de situații, poate fi necesară capturarea CO2 într-o coloană de absorbție conținând compuși alcalini sau folosirea unui sistem absorbant extern de CO2 (determinare directă a 14CO2; a se vedea apendicele 3). Pentru determinarea cineticii biodegradării, concentrațiile de substanță de testat trebuie să fie inferioare solubilității acesteia în apă. Trebuie remarcat totuși că valorile solubilității în apă din lucrările științifice pot fi considerabil mai mari decât solubilitatea substanței testate în ape naturale. Opțional, solubilitatea substanțelor de testat cu grad scăzut de solubilitate în apă poate fi stabilită prin folosirea apelor naturale testate.
Metoda poate fi folosită pentru simularea biodegradării în apă de suprafață care nu conține particule mari (test pelagic) sau în apă de suprafață cu turbiditate, de exemplu care poate exista în apropierea unei interfețe apă/sedimente (test pe sedimente în suspensie).
1.4. PRINCIPIUL TESTULUI
Testul se efectuează în serii, prin incubarea substanței de testat exclusiv cu apă de suprafață (test pelagic) sau apă de suprafață combinată cu solide/sedimente în suspensie între 0,01-1 g/l greutate uscată (test pe sedimente suspendate) pentru simularea unui curs de apă cu solide în suspensie sau sedimente resuspendate. Concentrația solidelor/sedimentelor suspendate în intervalul inferior al acestui domeniu este reprezentativă pentru majoritatea apelor de suprafață. Recipientele de testare sunt incubate la întuneric, la temperatura mediului ambiant, în condiții aerobe, și sunt agitate. Pentru determinarea cineticii degradării se vor folosi cel puțin două concentrații diferite ale substanței testate. Concentrațiile trebuie să difere între ele cu un factor cuprins între 5-10, care trebuie să reprezinte intervalul așteptat de concentrații în mediul ambiant. Concentrația maximă a substanței testate nu trebuie să depășească 100 µg/l, dar sunt preferate concentrațiile de testare maxime inferioare 10 µg/l pentru ca biodegradarea să fie conformă cineticii de prim ordin. Concentrația minimă nu trebuie să depășească 10 µg/l, dar sunt preferate concentrațiile minime de 1-2 μg/l sau inferioare 1 μg/l. În mod normal, o analiză adecvată a unor concentrații atât de scăzute se poate realiza cu ajutorul substanțelor marcate 14C disponibile în comerț. Ca urmare a limitărilor analitice, măsurarea concentrației substanței testate cu precizia necesară este de cele mai multe ori imposibilă dacă substanța testată se aplică la o concentrație ≤ 100 µg/l (a se vedea punctul 1.7.2 al doilea paragraf). Concentrațiile mai mari ale substanței testate (> 100 µg/l și, uneori, > 1 mg/l) pot fi folosite pentru identificarea și cuantificarea produșilor principali de transformare sau dacă nu există o metodă specifică de analiză cu o limită scăzută a detectării. Dacă se testează concentrații mari ale substanței testate, este posibil ca rezultatele să nu poată fi folosite pentru estimarea constantei degradării de prim ordin și a timpului de înjumătățire, deoarece degradarea ar putea să nu respecte cinetica de prim ordin.
Degradarea se urmărește la intervale de timp regulate prin măsurarea 14C rezidual sau, dacă se folosește o analiză chimică specifică, prin măsurarea concentrației substanței testate. Marcarea cu 14C a celei mai stabile părți a moleculei permite determinarea mineralizării totale, în timp ce marcarea cu 14C a părții mai puțin stabile a moleculei, precum și folosirea analizei specifice permit doar evaluarea biodegradării primare. Cu toate acestea, porțiunea cea mai stabilă nu include în mod obligatoriu fracțiunea funcțională relevantă a moleculei (care poate fi corelată cu o proprietate specifică, cum ar fi toxicitatea, bioacumularea etc.). În acest caz, se recomandă folosirea în porțiunea funcțională a unei substanțe de testat marcate cu 14C în scopul urmăririi eliminării acelei proprietăți.
1.5. INFORMAȚII REFERITOARE LA SUBSTANȚA DE TESTAT
În acest test pot fi folosite deopotrivă substanțe de testat marcate sau nemarcate radioactiv. Se recomandă tehnica de marcare cu 14C, iar marcarea trebuie să aibă loc în porțiunea (porțiunile) cea (cele) mai stabilă (stabile) a (ale) moleculei (a se vedea și punctul 1.4). În cazul substanțelor care conțin mai mult de un inel aromatic, se preferă ca unul sau mai mulți atomi de carbon din fiecare inel să se marcheze cu 14C. În plus, se preferă ca unul sau mai mulți atomi de carbon de pe ambele părți ale legăturilor ușor de scindat să se marcheze cu 14C. Puritatea chimică și/sau radiochimică a substanței testate trebuie să fie > 95 %. În cazul substanțelor marcate radioactiv este preferată o activitate specifică de aproximativ 50 μCi/mg (1,85 MBq) sau mai mare, în scopul facilitării măsurării 14C în testele realizate la concentrații inițiale scăzute. Vor fi disponibile următoarele informații despre substanța testată:
|
— |
solubilitatea în apă [metoda de testare A.6]; |
|
— |
solubilitatea în solvent (solvenți) organic (organici) (substanțe folosite împreună cu solvent sau cu solubilitate scăzută în apă); |
|
— |
constanta de disociere (pKa) dacă este posibil ca substanța să fie supusă unei protonări sau deprotonări [orientarea nr. 112 a OECD] (5); |
|
— |
presiunea de vapori (metoda A.4) și constanta legii lui Henry; |
|
— |
stabilitate chimică în apă și la întuneric (hidroliză) [metoda C.7]. |
Când substanțele cu solubilitate scăzută în apă se testează în apă de mare, este utilă cunoașterea constantei de desalifiere (sau „constanta Setschenow”) Ks, definită prin expresia log (S/S’) = Ks Cm, unde S și S’ sunt solubilitatea substanței în apă dulce și, respectiv, în apă de mare, iar Cm este concentrația molară de sare.
Dacă testul se desfășoară ca „test pe sedimente în suspensie”, următoarele informații vor fi disponibile:
|
— |
coeficientul de partiție n-octanol/apă [metoda A.8]; |
|
— |
coeficientul de adsorbție [metoda C.18]. |
Alte informații utile pot include:
|
— |
concentrația în mediu, dacă se cunoaște sau estimată; |
|
— |
toxicitatea substanței testate asupra microorganismelor [metoda C.11]; |
|
— |
biodegradabilitatea imediată și/sau intrinsecă [metodele C.4 A-F, C.12, C.9, orientarea nr. 302 a OECD (5)]; |
|
— |
biodegradabilitatea aerobă sau anaerobă în sol și studii de transformare în sedimente/apă [metodele C.23, C.24]. |
1.6. SUBSTANȚĂ DE REFERINȚĂ
Se folosește ca substanță de referință o substanță în mod normal ușor degradabilă în condiții aerobe (de exemplu anilină sau benzoat de sodiu). Intervalul de timp preconizat pentru degradarea anilinei și benzoatului de sodiu este de obicei mai mic de două săptămâni. Scopul substanțelor de referință este de a asigura menținerea activității microbiene a apei de testare în anumite limite; de exemplu, se verifică dacă apa conține o populație microbiană activă.
1.7. CRITERII DE CALITATE
1.7.1. Recuperare
Imediat după adăugarea substanței de testat, fiecare concentrație inițială de testare se verifică prin măsurarea activității 14C sau prin analize chimice în cazul substanțelor nemarcate, în cel puțin eșantioane duble. Aceasta oferă informații privind aplicabilitatea și repetabilitatea metodei analitice, precum și omogenitatea distribuției substanței testate. În mod normal, activitatea 14C sau concentrația substanței testate măsurate inițial se folosesc în analizele ulterioare ale datelor, nu în concentrația nominală, deoarece pierderile provocate de sorbție și erorile de dozare sunt astfel compensate. În cazul substanței testate marcate cu 14C, nivelul de recuperare de la sfârșitul experimentului este dat de bilanțul maselor (a se vedea punctul 1.8.9.4 ultimul paragraf). În mod ideal, bilanțul maselor marcate radioactiv trebuie să fie cuprins între 90 % și 110 %, în timp ce precizia analitică trebuie să conducă la o recuperare inițială cuprinsă între 70 % și 110 % pentru substanțe de testat nemarcate. Aceste intervale se interpretează ca ținte și nu se folosesc sub formă de criterii pentru acceptabilitatea testului. Opțional, precizia analitică se poate determina pentru substanța testată la o concentrație mai mică decât cea inițială și pentru produșii de transformare.
1.7.2. Repetabilitatea și sensibilitatea metodei analitice
Repetabilitatea metodei analitice (cu excepția randamentului extracției inițiale) în ceea ce privește cuantificarea substanței de testat și a produșilor de transformare se poate controla prin efectuarea de cinci analize duplicate ale extraselor individuale de apă de suprafață.
Limita de detecție (LOD) a metodei analitice pentru substanța de testat și produșii de transformare trebuie să fie, dacă este posibil, de cel puțin 1 % din cantitatea inițială folosită în sistemul de testare. Limita de cuantificare (LOQ) trebuie să fie egală sau mai mică de 10 % din concentrația aplicată. Analizele chimice ale multor substanțe organice și produșii lor de transformare impun frecvent ca substanța de testat să fie folosită la o concentrație relativ mare, de exemplu > 100 μg/l.
1.8. DESCRIEREA METODEI DE TESTARE
1.8.1. Aparatură
Testul poate fi efectuat în recipiente conice sau cilindrice de capacitate corespunzătoare (de exemplu de 0,5 sau 1,0 l) acoperite cu dopuri de silicon sau cauciuc, sau în recipiente serologice închise ermetic (de exemplu cu membrană de cauciuc butilic). O altă opțiune de efectuare a testului constă în folosirea de recipiente multiple și recoltarea în întregime a conținutului acestora, cel puțin în duplicat, la fiecare interval de prelevare (a se vedea punctul 1.8.9.1 ultimul paragraf). În cazul substanțelor de testat nevolatile care nu sunt marcate radioactiv, dopurile sau capacele etanșe nu sunt necesare; sunt suficiente dopurile de vată care previn contaminarea din aer (a se vedea punctul 1.8.9.1 al doilea paragraf). Substanțele puțin volatile se testează într-un sistem de tip biometru, cu agitarea ușoară a suprafeței apei. În scopul prevenirii contaminării bacteriene, vasele pot fi sterilizate opțional prin încălzire sau autoclavare înainte de folosire. În plus, se folosesc următoarele echipamente standard de laborator:
|
— |
masă de agitare sau agitatoare magnetice pentru agitare continuă a recipientelor de testare; |
|
— |
centrifugă; |
|
— |
pH-metru; |
|
— |
turbidimetru pentru măsurarea turbidității nefelometrice; |
|
— |
etuvă sau cuptor cu microunde pentru determinarea greutății uscate; |
|
— |
dispozitiv de filtrare cu membrană; |
|
— |
autoclavă sau etuvă pentru sterilizarea la căldură a vaselor din sticlă; |
|
— |
instrumente de manipulare a substanțelor marcate cu 14C; |
|
— |
echipamente pentru cuantificarea activității 14C în eșantioane de soluții de captare a CO2 și, dacă este necesar, din eșantioane de sedimente; |
|
— |
echipamente analitice pentru determinarea substanței testate (și de referință) dacă se folosește analiză chimică specifică (de exemplu cromatograf cu gaz, cromatograf cu lichid la înaltă presiune). |
1.8.2. Soluțiile mamă ale substanței testate
Pentru pregătirea soluțiilor mamă ale substanțelor de testat și de referință se folosește apă deionizată (a se vedea punctul 1.8.7 primul paragraf). Apa deionizată nu trebuie să conțină substanțe toxice pentru microorganisme, iar carbonul organic dizolvat (COD) nu trebuie să depășească 1 mg/l (6).
1.8.3. Colectarea și transportul apei de suprafață
Locurile de prelevare pentru colectarea apei naturale se selectează în funcție de finalitatea testului în fiecare caz în parte. Pentru alegerea locurilor de prelevare trebuie avut în vedere istoricul eventualelor aporturi de natură agricolă, industrială sau menajeră. Dacă se cunoaște că un mediu acvatic a fost contaminat cu substanță de testat sau cu produși de natură analogă pe parcursul ultimilor 4 ani, acesta nu va fi folosit pentru prelevarea de apă, cu excepția cazului în care obiectivul expres al experimentatorului este cercetarea ratelor de degradare ale locurilor expuse anterior. pH-ul și temperatura apei se măsoară la locul de prelevare. În plus, adâncimea de prelevare și aspectul eșantionului de apă (de exemplu culoare și turbiditate) se înregistrează (a se vedea punctul 3). Concentrația de oxigen și/sau potențialul redox în apă și în stratul sedimentelor de suprafață se măsoară în scopul demonstrării condițiilor aerobe, cu excepția situației în care acestea sunt cunoscute ca urmare a observării aspectului și condițiilor anterioare de la locul de prelevare. Apa de suprafață se transportă într-un container care a fost curățat cu atenție. În timpul transportului, temperatura eșantionului nu trebuie să depășească semnificativ temperatura testului. Dacă durata transportului depășește 2-3 ore, se recomandă răcirea la 4 °C. Eșantionul de apă nu se congelează.
1.8.4. Stocarea și prepararea apei de suprafață
Se preferă ca textul să înceapă în termen de o zi de la colectarea eșantionului. Perioada de stocare a apei, dacă este necesară, se reduce la minimum și nu trebuie să depășească în niciun caz mai mult de 4 săptămâni. Eșantionul de apă se păstrează la 4 °C, în condiții de ventilație, până la folosire. Înainte de folosire, particulele mari se elimină, de exemplu prin filtrare cu ajutorul unui filtru de nailon cu o dimensiune a porilor de aproximativ 100 μm sau cu un filtru de hârtie cu porozitate mare sau prin sedimentare.
1.8.5. Prepararea apei tratate cu sedimente (opțional)
Pentru testul cu sedimente în suspensie, se adaugă sedimente de suprafață în recipiente conținând apă naturală (filtrată pentru eliminarea particulelor mari, conform descrierii de la punctul 1.8.4) pentru obținerea unei suspensii; concentrația solidelor în suspensie trebuie să fie între 0,01 și 1 g/l. Sedimentele de suprafață trebuie să provină din același loc de unde a fost prelevat eșantionul de apă. În funcție de mediul acvatic, sedimentele de suprafață pot fi caracterizate printr-un conținut ridicat de carbon organic (2,5-7,5 %) și o textură fină sau printr-un conținut scăzut de carbon organic (0,5-2,5 %) și o textură rugoasă (3). Sedimentele de suprafață se prepară după cum urmează: se extrag câteva carote de sediment intact folosind un tub de plastic transparent, se elimină straturile aerobe superioare (de la suprafață la o adâncime de max. 5 mm) imediat după prelevare și se combină. Eșantionul de sediment rezultat se transportă într-un recipient cu un volum mare al tamponului de aer pentru a menține sedimentul în condiții aerobe (răcit la 4 °C dacă durata transportului depășește 2-3 ore). Eșantionul de sediment se suspendă în apa de testare la un raport de 1:10 și se păstrează la 4 °C, în condiții de ventilare, până la folosire. Perioada de stocare a apei, dacă este necesară, se reduce la minimum și nu trebuie să depășească în niciun caz 4 săptămâni.
1.8.6. Procedura semicontinuă (opțional)
Dacă înainte ca substanța de testat să poată fi măsurată se manifestă o perioadă de latență lungă, poate fi necesară o incubare prelungită (câteva luni). Dacă acest aspect este cunoscut ca urmare a testării anterioare a unei substanțe, testul poate fi inițiat prin folosirea unei proceduri semicontinue, care permite reînnoirea periodică a unei porțiuni din apa sau suspensia de testare (a se vedea apendicele 2). Alternativ, dacă nu a avut loc o degradare a substanței de testat pe o perioadă de aproximativ 60 de zile de testare prin procedura în serii, testul normal în serii poate fi modificat într-un test semicontinuu (a se vedea punctul 1.8.8.3 al doilea paragraf).
1.8.7. Adăugarea substanței de testat (sau de referință)
Pentru substanțele cu solubilitate mare în apă (> 1 mg/l) și volatilitate scăzută (constante ale legii lui Henry < 1 Pa·m3/mol sau < 10–5 atm·m3/mol) se poate prepara o soluție mamă în apă deionizată (a se vedea punctul 1.8.2); în vasele de testare se adaugă volumul corespunzător de soluție mamă pentru obținerea concentrației dorite. Volumul oricărei soluții mamă adăugate se menține la minimul practic (< 10 % din volumul lichid final, dacă este posibil). O altă procedură constă în dizolvarea substanței de testat într-un volum mai mare de apă de testat, aceasta putând fi considerată o alternativă la folosirea de solvenți organici.
Dacă nu se poate evita, soluțiile mamă ale substanțelor nevolatile cu solubilitate scăzută în apă se prepară prin folosirea unui solvent organic volatil, dar cantitatea de solvent adăugată în sistemul de testare nu trebuie să depășească 1 % v/v și nu trebuie să aibă efecte adverse asupra activității microbiene. Solventul nu trebuie să afecteze stabilitatea substanței testate în apă. Solventul se elimină până ajunge la o cantitate extrem de mică, astfel încât să nu contribuie la creșterea semnificativă a concentrației COD a apei sau a suspensiei de testat. Aceasta se verifică prin intermediul unei analize specifice substanței sau, dacă este posibil, prin analiză COD (6). Se vor lua măsuri pentru limitarea la strictul necesar a cantității de solvent transferate și pentru asigurarea dizolvării substanței testate în volumul final de apă de testat. Alte tehnici de introducere a substanței testate în vasele de testare sunt descrise la notele (7) și (8). Atunci când la aplicarea substanței de testat se folosește un solvent organic, probele martor ale solventului conținând apa de testat (fără adăugări) și apa de testat cu substanța de referință adăugată sunt tratate similar cu vasele de testare activă în care s-a adăugat substanță de testat în solvent purtător. Rolul probelor martor ale solventului este de a examina posibilele efecte adverse ale solventului asupra populației microbiene, acestea fiind indicate de degradarea substanței de referință.
1.8.8. Condiții de testare
1.8.8.1. Temperatura de testare
Incubarea are loc la întuneric (preferabil) sau în condiții de lumină difuză, la temperatură controlată (± 2 °C), care poate fi temperatura ambientală sau o temperatură standard cuprinsă între 20-25 °C. Temperatura ambientală poate fi temperatura reală a eșantionului în momentul prelevării sau o temperatură ambientală medie la locul de prelevare.
1.8.8.2. Agitare
Agitarea (scuturare sau agitare continuă) are rolul de a menține particulele și microorganismele în suspensie. Agitarea facilitează, de asemenea, transferul de oxigen din volumul tampon către lichid, în scopul menținerii condițiilor aerobe adecvate. Recipientele se așază pe o masă de agitare (cu o frecvență de aprox. 100 rpm) sau se folosește agitare magnetică. Agitarea trebuie să fie continuă. Cu toate acestea, scuturarea sau agitarea vor fi cât mai ușoare posibil, menținându-se în același timp o suspensie omogenă.
1.8.8.3. Durata testului
În mod normal, durata testului nu trebuie să depășească 60 de zile, cu excepția cazului în care se aplică procedura semicontinuă cu reînnoire periodică a suspensiei de testat (a se vedea punctul 1.8.6 și apendicele 2). Cu toate acestea, dacă substanța testată a început să se degradeze în primele 60 de zile, perioada de testare a seriei poate fi extinsă la cel mult 90 de zile. Degradarea se monitorizează prin determinarea activității 14C rezidual sau a 14CO2 degajat (a se vedea punctul 1.8.9.4) și/sau prin analiză chimică (punctul 1.8.9.5) la intervale de timp adecvate. Perioada de incubare trebuie să fie suficient de lungă pentru a permite evaluarea procesului de degradare. Preferabil, nivelul degradării trebuie să depășească 50 %; în cazul substanțelor lent degradabile, nivelul degradării trebuie să fie suficient (în mod normal, mai mare de 20 %) pentru a permite estimarea constantei vitezei cineticii de degradare.
Se vor efectua măsurători periodice ale pH-ului și concentrației oxigenului în sistemul de testare, cu excepția cazurilor în care astfel de teste sunt inutile ca urmare a existenței unor date anterioare din teste similare cu eșantioane de apă și sedimente colectate din același loc. În unele condiții, metabolismul substraturilor primare la concentrații mult mai mari în apă sau sedimente poate provoca o degajare de CO2 și o epuizare a oxigenului suficient de mari pentru a modifica în mod semnificativ condițiile experimentale din timpul testului.
1.8.9. Procedură
1.8.9.1. Pregătirea recipientelor pentru testul pelagic
Se transferă un volum corespunzător de apă de testat în recipientele de testare, până la aproximativ o treime din volumul recipientului, nu mai puțin de 100 ml. Dacă se folosesc recipiente multiple (care permit recoltarea conținutului din întregul recipient la fiecare punct de prelevare), volumul corespunzător al apei de testat va fi tot de 100 ml, deoarece volumele mici ale eșantioanelor pot influența lungimea fazei de latență. Substanța de testat se adaugă dintr-o soluție mamă conform descrierii de la punctele 1.8.2 și 1.8.7. Pentru determinarea cineticii degradării și calcularea constantei vitezei cineticii de degradare se vor folosi cel puțin două concentrații de substanță de testat, diferența dintre acestea fiind un factor cuprins între 5 și 10. Ambele concentrații selectate trebuie să fie mai mici de 100 µg/l și, preferabil, să se situeze în intervalul < 1-10 µg/l.
Recipientele se astupă cu dopuri sau capace impermeabile la aer și CO2. În cazul substanțelor chimice de testat nevolatile care nu sunt marcate cu 14C, sunt suficiente dopurile de vată care previn contaminarea din aer (a se vedea punctul 1.8.1), dacă produșii majori de degradare sunt cunoscuți ca nevolatili și se folosește determinarea indirect a CO2 (a se vedea apendicele 3).
Recipientele se incubează la temperatura selectată (a se vedea punctul 1.8.8.1). Eșantioanele se retrag pentru analiză chimică sau măsurarea 14C la începutul testului (înainte de începerea biodegradării; a se vedea punctul 1.7.1), apoi la intervale adecvate în cursul testului. Recoltarea se efectuează prin retragerea subeșantioanelor (de exemplu alicote de 5 ml) din fiecare duplicat sau prin recoltarea întregului conținut al recipientelor la fiecare moment de prelevare. Mineralizarea substanței de testat poate fi determinată în mod direct sau indirect (a se vedea apendicele 3). În mod obișnuit, în timpul fazei de degradare (după terminarea fazei de latență) sunt necesare minimum cinci puncte de prelevare pentru estimarea unei constante precise a vitezei, cu excepția cazurilor când se poate demonstra că trei puncte de prelevare sunt suficiente pentru substanțele cu degradare rapidă. Pentru substanțele care nu se degradează rapid se pot face mai multe măsurători în timpul fazei de degradare și, prin urmare, se vor folosi mai multe puncte experimentale pentru estimarea k. Deoarece viteza de biodegradare variază, nu poate fi indicat un program fix de recoltare; cu toate acestea, dacă degradarea este lentă, se recomandă ca recoltarea să aibă loc o dată pe săptămână. Dacă substanța testată este rapid degradabilă, recoltarea trebuie să se efectueze o dată pe zi în primele trei zile, apoi la fiecare două sau trei zile. În anumite situații, cum ar fi cele în care se lucrează cu substanțe rapid hidrolizabile, recoltarea poate fi necesară la intervale de o oră. Se recomandă efectuarea unui studiu preliminar înainte de test, în scopul stabilirii intervalelor de recoltare adecvate. Dacă eșantioanele trebuie să fie disponibile și pentru alte analize specifice, se recomandă recoltarea mai multor eșantioane și selectarea celor care urmează să fie analizate la sfârșitul experimentului prin intermediul unei strategii inverse, prin care ultimele eșantioane se analizează prima dată (a se vedea punctul 1.8.9.5 al doilea paragraf, pentru recomandări privind stabilitatea eșantioanelor în timpul stocării).
1.8.9.2. Numărul recipientelor și eșantioanelor
Va fi disponibil un număr suficient de recipiente de testare pentru a avea:
|
— |
recipiente de testare: cel puțin două recipiente pentru fiecare concentrație a substanței de testat (preferabil, minimum 3) sau recipiente de testare multiple pentru fiecare concentrație, dacă se recoltează întregul conținut al recipientelor la fiecare moment de prelevare (reprezentate FT); |
|
— |
recipiente de testare pentru calculul bilanțului masic; cel puțin două recipiente pentru fiecare concentrație de testare (reprezentate FM); |
|
— |
probă martor, fără substanță de testat; cel puțin un recipient martor de testat conținând doar apa de testare (reprezentată FB); |
|
— |
etalon de referință; două recipiente cu substanță de referință (de exemplu anilină sau benzoat de sodiu, la 10 µg/l) (reprezentat FC). Scopul etalonului de referință este de a confirma un minim de activitate microbiană. Dacă este util, se poate folosi o substanță de referință marcată radioactiv, folosită și în cazurile când degradarea substanței de testat este monitorizată prin analize chimice; |
|
— |
etalon steril; unul sau două recipiente conținând apă de testare sterilizată necesară pentru examinarea posibilei degradări abiotice sau pentru altă procedură de eliminare prin mijloace nebiologice a substanței de testat (reprezentat FS). Activitatea biologică poate fi oprită prin autoclavarea (121 °C; 20 min.) apei de testare sau prin adăugarea unei substanțe toxice [de exemplu azidă de sodiu (NaN3), clorură de mercur (HgCl2) la 100 mg/l sau formol la 100 mg/l] sau prin radiații gama. Dacă se folosește HgCl2, acesta se va elimina conform procedurii pentru deșeuri toxice. Condițiile de sterilitate nu sunt ușor de obținut în cazul în care se adaugă apă cu sedimente în cantitate mare; în acest caz se recomandă autoclavarea repetată (de exemplu de trei ori). Trebuie avut în vedere că, prin autoclavare, caracteristicile de sorbție ale sedimentelor pot fi modificate; |
|
— |
etaloane de solvent, conținând apă de testat și apă de testat cu substanță de referință; recipiente duble tratate cu aceeași cantitate de solvent și prin folosirea unei proceduri similare cu cea pentru aplicarea substanței de testat. Obiectivul este de a examina efectele adverse posibile ale solventului prin determinarea degradării substanței de referință. |
În conceperea testului, experimentatorul trebuie să ia în considerare importanța relativă a creșterii duplicării experimentale comparativ cu creșterea numărului momentelor de recoltare. Numărul exact al recipientelor necesare va depinde de metoda folosită pentru măsurarea degradării (a se vedea punctul 1.8.9.1 al treilea paragraf, punctul 1.8.9.4 și apendicele 3).
În fiecare moment de prelevare, din fiecare recipient de testare se retrag două subeșantioane (de exemplu alicote de 5 ml). Dacă se folosesc mai multe recipiente pentru a fi posibilă recoltarea întregului conținut al recipientelor, în fiecare moment de prelevare se sacrifică cel puțin două recipiente (a se vedea punctul 1.8.9.1 primul paragraf).
1.8.9.3. Prepararea recipientelor pentru testul pe sedimente în suspensie [opțional]
Se adaugă volumele necesare de apă și sedimente de testare în vasele de testare, dacă este necesar (a se vedea punctul 1.8.5). Procedura de pregătire a recipientelor pentru testul pe sedimente în suspensie este similară cu cea pentru testul pelagic (a se vedea punctele 1.8.9.1 și 1.8.9.2). Se folosesc, preferabil, flacoane serologice sau recipiente de o formă asemănătoare. Sticlele (închise) se așază orizontal pe un agitator. Recipientele deschise pentru substanțe nevolatile care nu sunt marcate cu 14C se așază, evident, în poziție verticală; în astfel de situații se recomandă folosirea unui agitator magnetic și a unor tije magnetice căptușite cu sticlă. Dacă este necesar, sticlele se aerisesc pentru menținerea condițiilor aerobe adecvate.
1.8.9.4. Determinări radiochimice
14CO2 degajat se măsoară indirect sau direct (a se vedea apendicele 3). 14CO2 se determină indirect prin diferența între activitatea inițială a 14C în apa sau în suspensia de testat și activitatea reziduală totală în momentul prelevării, măsurată după acidifierea eșantionului la pH 2-3 și eliminarea CO2. Astfel, carbonul anorganic este îndepărtat, iar activitatea reziduală măsurată provine din materialul organic. Determinarea indirectă a 14CO2 nu se folosește dacă în timpul transformării substanței testate se formează produși majori volatili de transformare (a se vedea apendicele 3). Dacă este posibil, degajarea 14CO2 se măsoară direct (a se vedea apendicele 3) în fiecare moment de prelevare în cel puțin un recipient de testare; această procedură permite verificarea deopotrivă a bilanțului masic și a procesului de biodegradare, dar este limitată la teste efectuate cu recipiente închise.
Dacă 14CO2 degajat se măsoară direct în timpul testului, la începutul acestuia vor fi pregătite mai multe recipiente în acest scop. Dacă în timpul transformării substanței de testat se formează produși majori volatili de transformare, se recomandă determinarea directă a 14CO2. În fiecare punct de măsurare, recipientele de testare suplimentare se acidifiază la pH 2-3, iar 14CO2 se colectează într-un absorbant intern sau extern (a se vedea apendicele 3).
Opțional, concentrațiile substanței de testat marcate cu 14C și ale produșilor majori de transformare se pot determina prin folosirea radiocromatografiei (cromatografie în strat subțire, RAD-TLC) sau HPLC cu detectare radiochimică.
Opțional, se poate determina distribuția fazică a radioactivității rămase (a se vedea apendicele 1), a substanței de testat reziduale și a produșilor de transformare.
La sfârșitul testului, bilanțul masic se determină prin măsurare directă a 14CO2 folosind recipiente de testare separate, din care nu se recoltează eșantioane în cursul testului (a se vedea apendicele 3).
1.8.9.5. Analiză chimică specifică
Dacă există o metodă analitică specifică sensibilă, biodegradarea primară se poate evalua prin măsurarea concentrației reziduale totale a substanței testate, și nu prin folosirea tehnicilor de marcare radioactivă. Dacă se folosește o substanță de testat marcată radioactiv (pentru măsurarea mineralizării totale), se pot realiza în paralel analize chimice specifice care să ofere informații suplimentare utile și să contribuie la verificarea procedurii. Analizele chimice specifice mai pot fi folosite pentru măsurarea produșilor de transformare formați în timpul degradării substanței de testare, acestea fiind recomandate pentru substanțe care se mineralizează cu timpi de înjumătățire care depășesc 60 de zile. La fiecare prelevare se măsoară și se înregistrează concentrația substanței de testat și produșii de transformare (ca procent și concentrație de substanță aplicată). Ca regulă generală, se identifică toți produșii de transformare pentru care se detectează ≥ 10 % din concentrația aplicată, indiferent de momentul prelevării, cu excepția cazurilor în care există justificări rezonabile. Se identifică, de asemenea, produșii de transformare a căror concentrație crește constant pe durata studiului, chiar și în cazurile în care concentrațiile acestora nu depășesc limitele menționate mai sus, deoarece este posibil ca acesta să fie un indiciu asupra persistenței. Vor fi avute în vedere analize ale produșilor de transformare din etaloanele sterile dacă se consideră că sunt posibile transformări abiotice rapide ale substanței de testat (hidroliză). Nevoia de cuantificare și identificare a produșilor de transformare va fi examinată de la caz la caz, justificările fiind indicate în raport. Tehnicile de extracție cu solvent organic se aplică în conformitate cu îndrumările prezentate în procedura analitică respectivă.
Dacă analiza se desfășoară în 24 de ore (preferabil), toate eșantioanele se păstrează închise ermetic, la temperaturi între 2-4 °C. Pentru perioade mai lungi de stocare, eșantioanele se congelează sub –18 °C sau se conservă prin metode chimice. Nu se recomandă metoda de păstrare prin acidifiere, deoarece eșantioanele acidifiate pot fi instabile. Dacă eșantioanele nu sunt analizate în termen de 24 de ore și se păstrează pentru o perioadă mai lungă, se va efectua un studiu privind stabilitatea la stocare, pentru a se determina dacă substanțele chimice de interes sunt stabile la temperaturi mai mici de –18 °C sau în stare de conservare. Dacă metoda analitică presupune extracția cu solvent sau în fază solidă (SPE), extracția se efectuează imediat după recoltare sau după stocarea eșantionului la rece timp de maximum 24 de ore.
În funcție de sensibilitatea metodei analitice, pot fi necesare volume mai mari ale eșantionului decât cele indicate la punctul 1.8.1. Testul poate fi desfășurat cu ușurință cu volume de testare de un litru în recipiente cu un volum de 2-3 litri, ceea ce face posibilă recoltarea de eșantioane de aprox. 100 ml.
2. DATE ȘI RAPORT
2.1. PRELUCRAREA REZULTATELOR
2.1.1. Reprezentarea grafică a datelor
Timpii de recoltare se rotunjesc la un număr întreg de ore (cu excepția cazului în care substanța se degradează substanțial într-o perioadă de minute sau ore), dar nu la un număr întreg de zile. Se reprezintă estimările activității reziduale ale substanței de testat (pentru substanțe marcate cu 14C) sau concentrația reziduală (pentru substanțele nemarcate) în funcție de timp atât într-un grafic linear, cât și în unul semilogaritmic (a se vedea figurile 1a, 1b). Dacă degradarea a avut loc, se compară rezultatele recipientelor FT cu cele ale recipientelor FS. Dacă mediile rezultatelor pentru recipientele cu substanță de testat (FT) și pentru recipientele sterile (FS) deviază cu mai puțin de 10 %, se presupune că degradarea observată este predominant abiotică. Dacă degradarea din recipientele (FS) este mai scăzută, cifrele pot fi folosite pentru a le corecta pe cele obținute cu recipientele FT (prin scădere) în scopul estimării nivelului biodegradării. Când se efectuează analize opționale pentru produșii principali de transformare, formarea și declinul lor se reprezintă alături de graficul declinului substanței testate.
Durata tL a fazei de latență se estimează din curba degradării (grafic semilogaritmic) prin extrapolarea porțiunii sale lineare la degradare zero sau, alternativ, prin determinarea timpului pentru o degradare de aproximativ 10 % (figurile 1a și 1b). Constanta vitezei de prim ordin k se estimează pe baza graficului semilogaritmic, iar eroarea sa standard se stabilește prin regresia lineară a ln (activitatea reziduală a 14C sau concentrația substanței testate) în funcție de timp. În ceea ce privește măsurătorile 14C, în special, se folosesc doar date care aparțin porțiunii lineare inițiale a curbei după terminarea fazei de latență și se preferă selectarea de date mai puține, dar mai reprezentative, în locul selectării unui număr mare de date incerte. În acest caz, incertitudinea se referă la erori intrinseci legate de folosirea directă recomandată a activităților 14C rezidual măsurat (a se vedea mai jos). Dacă degradarea urmează un model bifazic, uneori poate fi utilă calcularea a două constante diferite ale vitezei. În acest scop, sunt definite două faze diferite ale curbei degradării. Calcularea constantei vitezei de degradare k și a timpului de înjumătățire t½ = ln2/k se realizează pentru fiecare dintre recipientele duplicate, dacă se extrag subeșantioane din același recipient, sau prin folosirea valorilor medii, când se recoltează întregul conținut al recipientelor la fiecare moment de prelevare (a se vedea punctul 1.8.9.2 ultimul paragraf). Când se folosește prima dintre procedurile menționate, constanta vitezei și timpul de înjumătățire se raportează pentru fiecare dintre recipientele duplicate ca valoare medie cu o eroare standard. Dacă au fost folosite concentrații mari ale substanțelor de testat, curba degradării poate devia considerabil de la o linie dreaptă (grafic semilogaritmic), iar cinetica de prim ordin poate să nu fie validă. Prin urmare, definirea timpului de înjumătățire nu are sens. Cu toate acestea, timpul de înjumătățire a degradării DT50 (perioada necesară pentru atingerea unei degradări de 50 %) poate fi estimat ca urmare a aplicării cineticii de pseudo-prim ordin pentru un interval limitat de date. Trebuie reținut totuși că perioada degradării dincolo de intervalul selectat de date nu poate fi previzionată folosind DT50, acesta fiind doar un indicator al unui set de date oferite. Oferta de instrumente analitice pentru facilitarea calculelor statistice și a interpolării este bogată, folosirea acestui tip de software fiind recomandată.
Dacă se realizează analize chimice specifice, constantele vitezei și timpii de înjumătățire pentru degradarea primară se estimează conform metodei de mai sus pentru mineralizarea totală. Dacă degradarea primară este procesul limitant, uneori pot fi folosite puncte experimentale din întregul proces de degradare. Aceasta se întâmplă deoarece, spre deosebire de măsurătorile activității 14C, măsurătorile sunt directe.
Dacă se folosesc substanțe marcate cu 14C, cel puțin la sfârșitul testului se va exprima un bilanț masic în procente din concentrația aplicată inițial.
2.1.2. Activitate reziduală
Când porțiunea marcată cu 14C a unei substanțe organice se biodegradează, porțiunea principală a 14C se transformă în 14CO2, în timp ce o altă porțiune este folosită pentru creșterea biomasei și/sau sinteza metaboliților extracelulari. Prin urmare, biodegradabilitatea „finală” completă a unei substanțe nu are ca rezultat transformarea în proporție de 100 % a carbonului său în 14CO2. 14C inclus în produse formate prin biosinteză este degajat lent ulterior ca 14CO2 ca urmare a „mineralizării secundare”. Din aceste cauze, graficele activității 14C organic rezidual (măsurat după îndepărtarea CO2) sau a 14CO2 produs în funcție de timp arată o „coadă” după ce degradarea s-a finalizat. Acest lucru complică interpretarea cinetică a datelor și, în acest scop, doar partea inițială a curbei (după terminarea fazei de latență și înainte de atingerea nivelului de 50 % degradare) se folosește în mod normal pentru estimarea unei constante a vitezei de degradare. Dacă substanța testată este degradată, activitatea 14C organic rezidual este întotdeauna mai mare decât activitatea 14C asociată cu substanța testată rămasă intactă. Dacă substanța testată se degradează ca urmare a unei reacții de prim ordin, iar o fracțiune constantă α se mineralizează în CO2, panta inițială a curbei de dispariție a 14C (14C total organic în funcție de timp) va fi α înmulțit cu panta curbei corespunzătoare concentrației substanței testate (sau, pentru precizie, partea substanței testate marcate cu 14C). Dacă se folosesc măsurătorile activității 14C organice totale necorectate, constanta calculată a vitezei degradării va fi conservativă. Proceduri de estimare a concentrațiilor substanței testate din activitățile radiochimice măsurate bazate pe diferite ipoteze de simplificare au fost descrise în literatura de specialitate (2)(9)(10)(11). Astfel de proceduri sunt cel mai ușor de aplicat pentru substanțele cu degradare rapidă.
2.2. INTERPRETAREA REZULTATELOR
Dacă se constată că valoarea k este independentă de concentrația adăugată (în cazul în care k obținut în urma calculelor este aproximativ egal la concentrații diferite ale substanței de testat), se presupune reprezentativitatea constantei vitezei de prim ordin pentru condițiile de testare folosite, cum ar fi substanța de testat, eșantionul de apă și temperatura de testare. Măsura în care rezultatele pot fi generalizate sau extrapolate către alte sisteme se evaluează de către experți. Dacă se folosește o concentrație mare a substanței de testat și, prin urmare, degradarea nu urmează cinetica de prim ordin, datele nu pot fi folosite pentru estimarea directă a unei constante a vitezei de prim ordin sau a timpului de înjumătățire corespunzător. Cu toate acestea, datele obținute în urma unui test folosind o concentrație mare a substanței de testat pot fi în continuare utile pentru estimarea gradului de mineralizare totală și/sau detectarea sau cuantificarea produșilor de transformare.
Dacă se cunosc vitezele unor procese de pierdere altele decât biodegradarea (de exemplu hidroliză sau volatilizare), acestea pot fi scăzute din viteza netă de pierdere observată în timpul testului, pentru a se obține o estimare aproximativă a vitezei de biodegradare. Datele pentru hidroliză pot fi obținute, printre altele, din etalonul steril sau în urma testării paralele cu o concentrație mai mare a substanței testate.
Determinarea directă și indirectă a 14CO2 (punctul 1.8.9.4 și apendicele 3) pot fi folosite doar pentru măsurarea gradului de mineralizare a substanței testate în CO2. Analiza concentrației substanței de testat marcate cu 14C și a formării produșilor majori de transformare se poate realiza cu ajutorul metodelor radiocromatografiei (RAD-TLC) sau HPLC (punctul 1.8.9.4 al treilea paragraf). Pentru a se permite estimarea directă a timpului de înjumătățire, nu trebuie să fie prezenți produși majori de transformare (definiți ca ≥ 10 % din cantitatea aplicată de substanță de testat). Dacă sunt prezenți produși majori de transformare care corespund definiției de mai sus, este necesară o evaluare detaliată a datelor. Aceasta poate include testarea și/sau identificarea repetată a produșilor de transformare (a se vedea punctul 1.8.9.5 primul paragraf), cu excepția situației în care evoluția produșilor de transformare poate fi evaluată cu un grad rezonabil de precizie pe baza experienței (de exemplu informații despre calea de degradare). Deoarece proporția carbonului din substanța de testat convertit în CO2 variază (depinzând în mare proporție de concentrația substanței de testat și a altor substraturi disponibile, condițiile de testare și populația microbiană), acest test nu permite o estimare clară a biodegradării finale, asemeni celei din testul de epuizare COD; totuși, rezultatele sunt similare cu cele obținute ca urmare a folosirii unui test respirometric. Astfel, gradul de mineralizare va fi mai mic sau egal cu nivelul minim al biodegradării finale. Pentru a se obține o imagine completă a biodegradării finale (mineralizarea și încorporarea în biomasă), la sfârșitul testului se efectuează analiza distribuției fazice a 14C (a se vedea apendicele 1).14C din amestecul de particule va consta în 14C încorporat în biomasa bacteriană și 14C absorbit în particule organice.
2.3. VALIDITATEA TESTULUI
Dacă substanța de referință nu se degradează în intervalul de timp prevăzut (pentru anilină și benzoat de sodiu, în mod normal, mai puțin de două săptămâni), validitatea testului poate fi pusă sub semnul întrebării și trebuie verificată sau, alternativ, testul se repetă cu un nou eșantion de apă. Într-un test interlaboratoare ISO al metodei, la care au participat șapte laboratoare din Europa, constantele adaptate ale vitezei de degradare pentru anilină s-au situat în intervalul 0,3-1,7 zi–1, cu o medie de 0,8 zi–1 la 20 oC și o eroare standard de ±0,4 zi–1 (t½ = 0,9 zile). Timpii de latență tipici s-au situat între 1 și 7 zile. Pentru apele examinate a fost raportată o biomasă bacteriană corespunzând la 103-104 unități formatoare de colonii (UFC) per ml. Vitezele de degradare în apele central-europene bogate în nutrienți au fost mai mari decât în apele oligotrofe nordice, ceea ce se poate datora stării trofice diferite sau expunerii anterioare la substanțe chimice.
Recuperarea totală (bilanțul masic) la sfârșitul experimentului trebuie să fie cuprinsă între 90 % și 110 % pentru substanțele marcate radioactiv, în timp ce recuperarea inițială la începutul experimentului trebuie să fie cuprinsă între 70 % și 110 % pentru substanțele nemarcate. Cu toate acestea, intervalele indicate se interpretează doar ca ținte și nu se folosesc drept criterii de acceptare a testului.
3. RAPORT DE TESTARE
Tipul studiului (test pelagic sau pe sedimente în suspensie) se indică clar în raportul de testare, care va mai conține cel puțin următoarele informații:
Substanță(e) de testat și de referință:
|
— |
denumirile uzuale, numele substanțelor chimice (se recomandă numele IUPAC și/sau CAS), numerele CAS, formulele structurale (indicând poziția 14C dacă se folosește substanță marcată radioactiv) și proprietățile fizico-chimice relevante ale substanței de testat și de referință (a se vedea punctele 1.5 și 1.6); |
|
— |
numele substanțelor chimice, numerele CAS, formulele structurale (indicând poziția 14C dacă se folosește substanță marcată radioactiv) și proprietățile fizico-chimice relevante ale substanțelor folosite ca standarde de identificare sau cuantificare a produșilor de transformare; |
|
— |
puritatea (impuritățile) substanțelor de testat și de referință; |
|
— |
puritatea radiochimică a substanței chimice marcate și activitatea specifică (dacă este cazul). |
Apa de suprafață:
Se furnizează cel puțin următoarele informații despre eșantionul de apă:
|
— |
locația și descrierea locului de recoltare, inclusiv, dacă este posibil, istoricul contaminărilor; |
|
— |
data și locul colectării eșantionului; |
|
— |
nutrienți (N total, amoniu, azotit, azotat, P total, ortofosfat dizolvat); |
|
— |
adâncimea de colectare; |
|
— |
aspectul eșantionului (de exemplu culoare și turbiditate); |
|
— |
DOC și COT; |
|
— |
CBO; |
|
— |
temperatura și pH-ul la momentul colectării; |
|
— |
prezența oxigenului sau potențialul redox (obligatoriu doar dacă nu sunt evidente condiții aerobe); |
|
— |
salinitatea sau conductivitatea (în cazul apei de mare sau al apei salmastre); |
|
— |
solide în suspensie (în cazul unui eșantion tulbure); |
|
— |
posibil, alte informații relevante despre locația de recoltare în momentul colectării (de exemplu informații actuale sau istorice despre viteza de curgere a râurilor sau a curentelor marine, deversările importante apropiate și tipul de deversare, condițiile meteorologice anterioare momentului recoltării); |
și opțional:
|
— |
biomasa microbiană (de exemplu aprecierea directă a oranjului de acridină sau a unităților formatoare de colonii); |
|
— |
carbonul anorganic; |
|
— |
concentrația de clorofilă-a ca indicator specific al biomasei algelor. |
În plus, dacă se efectuează testul pe sedimente suspendate, se furnizează următoarele informații despre sedimente:
|
— |
adâncimea de colectare a sedimentelor; |
|
— |
aspectul sedimentului (colorat, noroios, nămolos sau nisipos); |
|
— |
textura (de exemplu procentul de nisip grunjos, nisip fin, nămol și argilă); |
|
— |
greutatea uscată în g/l a solidelor în suspensie, concentrația COT sau pierderea de greutate la calcinare ca metodă de măsurare a conținutului materiei organice; |
|
— |
pH; |
|
— |
prezența oxigenului sau potențialul redox (obligatoriu doar dacă nu sunt evidente condiții aerobe). |
Condițiile de testare:
|
— |
intervalul între colectare și folosire în testul de laborator, păstrarea eșantionului și pretratarea eșantionului, datele efectuării studiilor; |
|
— |
cantitatea de substanță de testat aplicată, concentrația de testare și substanța de referință; |
|
— |
metoda de aplicare a substanței de testat, inclusiv folosirea de solvenți; |
|
— |
volumul de apă de suprafață și de sedimente folosite (dacă sunt folosite) și volumul recoltat pentru analiză la fiecare moment; |
|
— |
descrierea sistemului de testare folosit. |
Dacă nu se păstrează întunericul, informații despre condițiile de „iluminare difuză”;
|
— |
informații despre metoda (metodele) folosite pentru stabilirea etaloanelor sterile (de exemplu temperatură, perioadă și număr de autoclavări); |
|
— |
temperatura de incubare; |
|
— |
informații despre tehnicile analitice și metoda (metodele) folosite pentru măsurătorile radiochimice, precum și pentru verificarea bilanțului masic și măsurarea distribuției fazice (dacă este cazul); |
|
— |
numărul de duplicate. |
Rezultate:
|
— |
procentele de recuperare (a se vedea punctul 1.7.1); |
|
— |
repetabilitatea și sensibilitatea metodelor analitice folosite, inclusiv limita de detecție (LOD) și limita de cuantificare (LOQ) (a se vedea punctul 1.7.2); |
|
— |
toate datele măsurate (inclusiv punctele de recoltare) și valorile calculate în formă tabelară, precum și curbele de degradare; pentru fiecare concentrație de testare și pentru fiecare recipient duplicat se raportează coeficientul de corelație lineară pentru panta logaritmică, faza de latență estimată și o constantă a vitezei de prim ordin sau pseudo-prim ordin (dacă este posibil) și timpul de înjumătățire corespunzător al degradării (sau perioada de înjumătățire, t50); |
|
— |
valorile relevante se raportează ca medii ale rezultatelor observate la duplicatele individuale, cum ar fi durata fazei de latență, constanta vitezei degradării și timpul de înjumătățire a degradării (sau t50); |
|
— |
sistemul este clasificat ca neadaptat sau adaptat pe baza aspectului curbei de degradare și a posibilei influențe a concentrației de testare; |
|
— |
rezultatele verificării bilanțului masic final și rezultatele măsurării distribuției fazice (dacă există); |
|
— |
fracțiunea 14C mineralizat și, dacă se folosesc analize specifice, nivelul final de degradare primară; |
|
— |
identificarea, concentrația molară și procentajul de produși aplicați și produși majori de transformare (a se vedea punctul 1.8.9.5 primul paragraf), dacă este cazul; |
|
— |
propunerea unei căi de transformare, dacă este cazul; |
|
— |
discutarea rezultatelor. |
4. REFERINȚE BIBLIOGRAFICE
|
1. |
OECD TG 309 (2004) Aerobic Mineralisation in surface water – Simulation Biodegradation Test. |
|
2. |
ISO/DIS 14592-1 (1999) Water quality – Evaluation of the aerobic biodegradability of organic compounds at low concentrations – Part 1: Shake flask batch test with surface water or surface water/sediment suspensions. |
|
3. |
Metoda de testare C.23. Transformarea aerobă și anaerobă în sol. |
|
4. |
Metoda de testare C.24. Transformarea aerobă și anaerobă în sedimente acvatice. |
|
5. |
OECD (1993). Guidelines for the Testing of Chemicals. OECD, Paris. |
|
6. |
ISO 8245 (1999). Water quality – Guidelines on the determination of total organic carbon (TOC) and dissolved organic carbon (DOC). |
|
7. |
ISO 10634 (1995). Water quality – Guidance for the preparation and treatment of poorly water-soluble organic compounds for the subsequent evaluation of their biodegradability in an aqueous medium. |
|
8. |
OECD draft (2000). Guidance Document on aquatic toxicity testing of difficult substances and mixtures. Environmental Health and Safety Publications. Series on Testing and Assessment. No 22. |
|
9. |
Simkins, S. and Alexander, M. (1984). Models for mineralization kinetics with the variables of substrate concentration and population density. Appl. Environ. Microbiol.47, 394-401. |
|
10. |
Ingerslev, F. and N. Nyholm. (2000). Shake-flask test for determination of biodegradation rates of 14C-labeled chemicals at low concentrations in surface water systems. Ecotoxicol. Environ. Saf. 45, 274-283. |
|
11. |
ISO/CD 14592-1 (1999). Ring test report: Water Quality – Evaluation of the aerobic biodegradability of organic compounds at low concentrations part 1 – report of 1998/1999 ring-test. Shake flask batch test with surface water or surface water/sediment suspensions. |
Apendicele 1
Distribuția fazică a 14C
În scopul verificării procedurii, măsurătorile de rutină ale activității 14C organice totale (TOA) reziduale se completează cu măsurările bilanțului masic care presupun o determinare directă a 14CO2 degajat după captarea într-un absorbant (a se vedea apendicele 3). Formarea de 14CO2 este, în sine, o probă directă a biodegradării în contrast cu degradarea abiotică sau alte mecanisme de pierdere, cum ar fi volatilizarea sau absorbția. Informații utile suplimentare ce caracterizează biodegradabilitatea pot fi obținute în urma măsurării distribuției TOA între starea dizolvată (activitatea 14C organic dizolvat, DOA) și starea sub formă de particule (activitatea 14C sub formă de particule, POA) după separarea particulelor prin filtrarea prin membrană sau centrifugare. POA constă în substanță de testat absorbită în biomasa microbiană și în alte particule pe lângă carbonul substanței de testat care a fost folosit pentru sinteza noului material celular și, prin urmare, încorporat în fracțiunea biomasei sub formă de particule. Formarea de material organic 14C dizolvat poate fi estimată ca DOA la sfârșitul biodegradării (platou al curbei degradării în funcție de timp).
Distribuția fazică a 14C rezidual din eșantioanele selectate se estimează prin filtrarea acestora printr-o membrană filtrantă de 0,22 μm sau 0,45 μm dintr-un material care nu adsoarbe cantități semnificative ale substanței de testat (de exemplu filtrele din policarbonat). Dacă cantitatea de substanță de testat absorbită în filtru este prea mare pentru a fi neglijată (a se verifica înainte de experiment), în locul filtrării poate fi folosită metoda centrifugării la viteză mare (2 000 g; 10 min).
Filtratul sau centrifugatul se tratează conform metodei pentru eșantioane nefiltrate din apendicele 3. Membranele filtrante se dizolvă în fluid de scintilație corespunzător și se face numărarea în mod obișnuit, atenuarea fiind corectată de obicei doar prin folosirea metodei raportului față de standardul extern sau prin oxidarea eșantionului. Dacă s-a folosit metoda centrifugării, granulele formate din fracțiunea sub formă de particule se suspendă din nou în 1-2 ml de apă distilată și se transferă într-un flacon de scintilație. Se spală ulterior de două ori cu câte 1 ml apă distilată, care se transferă apoi în flacon. Dacă este necesar, suspensia poate fi introdusă într-un gel pentru numărarea scintilației lichide.
Apendicele 2
Procedura semicontinuă
Pentru degradarea substanțelor rezistente poate fi necesară o incubație prelungită, de până la câteva luni. În mod normal, durata testului nu trebuie să depășească 60 de zile, cu excepția cazului când caracteristicile eșantionului original de apă se mențin prin reînnoirea suspensiei de testat. Cu toate acestea, dacă substanța testată a început să se degradeze în primele 60 de zile, perioada de testare poate fi extinsă la cel mult 90 de zile fără reînnoirea suspensiei de testat.
În timpul incubației pentru perioade lungi, diversitatea populației microbiene poate să fie redusă ca urmare a diverse mecanisme de pierdere și a posibilei epuizări a nutrienților necesari și a substraturilor primare de carbon din eșantionul de apă. Se recomandă, prin urmare, efectuarea unui test semicontinuu în scopul determinării corecte a vitezei de degradare a substanțelor lent degradabile. Testul se inițiază prin folosirea procedurii semicontinue dacă, pe baza experienței anterioare, se crede că va fi necesară o perioadă de incubație de trei luni pentru obținerea unui procent de degradare a substanței de 20 %. Alternativ, dacă nu a avut loc degradarea substanței testate în aproximativ 60 de zile de testare prin metoda în serii, acesta poate fi modificat într-un test semicontinuu. Dacă a fost înregistrată o degradare substanțială (de exemplu > 20 %), procedura semicontinuă poate fi întreruptă, iar testul continuat ca experiment în serii.
În testul semicontinuu, la fiecare două săptămâni, aproximativ 1/3 din volumul suspensiei de testat se înlocuiește cu apă proaspăt colectată, substanța testată adăugându-se la concentrația inițială. În mod similar, dacă s-a efectuat testul opțional pe sedimente în suspensie, sedimentul se adaugă la apa de înlocuire până la atingerea concentrației inițiale (între 0,01 și 1 g/l). În ceea ce privește desfășurarea testului cu solide de sediment în suspensie, este important ca sistemul să fie menținut în suspensie completă și în timpul reînnoirii apei, iar timpul de reținere să fie identic pentru solide și apă, în caz contrar putându-se pierde similaritatea dorită cu un sistem omogen apos fără faze fixe. Din aceste motive, când se folosește procedura semicontinuă, se preferă o concentrație inițială a sedimentelor în suspensie aflată în intervalul inferior al domeniului specificat.
Adăugarea recomandată de substanță de testat presupune că concentrația inițială a substanței de testat nu este depășită de reînnoirea parțială a suspensiei de testat și, prin urmare, se evită adaptarea (care are loc frecvent la o concentrație mare a substanței de testat). Deoarece procedura include atât reinocularea, cât și compensarea nutrienților și substraturilor primare epuizate, diversitatea microbiană originală este refăcută, iar durata testului poate fi extinsă, în principiu, la infinit. Este important de observat că, atunci când se folosește procedura semicontinuă, concentrația reziduală a substanței de testat trebuie să fie corectată în funcție de cantitățile substanței de testat adăugate și îndepărtate la fiecare procedură de reînnoire. Concentrația de substanță de testat totală și dizolvată poate fi folosită alternativ pentru compușii slab absorbanți. Absorbția este nesemnificativă (< 5 %) în condițiile specificate (0,1-1 g solide/l) pentru substanțe cu log Kow < 3 (valabil pentru compuși neutri și lipofilici). Acest aspect este ilustrat prin următorul exemplu de calcul. 0,1 g/l de solide corespund aproximativ la 10 mg de carbon per litru (fracțiunea de carbon, fC = 0,01). Presupunând că:
Log Kow (din substanța de testat) = 3
Koc = 0,42 × Kow
Coeficient de partiție, Kd = fC × Koc
atunci fracțiunea dizolvată din concentrația totală C-apă (Cw)/C-total (Ct) este:
Cw/Ct = 1/(1 + Kd × SS) = 1(1 + Koc × fC × SS) = 1/(1 + 0,42 × 103 × 0,01 × 0,1 × 10–3) = 0,999
Apendicele 3
Determinarea 14CO2
Determinarea indirectă a 14CO2
În mod normal, pentru măsurătorile de rutină, metoda indirectă este cea mai rapidă și precisă metodă dacă substanța de testat este nevolatilă și nu se transformă în produși de transformare volatili. Se transferă eșantioane nefiltrate (de 5 ml) în flacoane de scintilație. Un nivel inițial adecvat al activității în eșantioane este de 5 000 dpm-10 000 dpm (80-170 Bq), iar activitatea inițială minimă este de aproximativ 1 000 dpm. CO2 se elimină după acidifiere la pH 2-3 cu 1-2 picături de H3PO4 sau HCl concentrat. Eliminarea CO2 poate fi efectuată prin barbotare cu aer timp de aproximativ ½-1 oră. Alternativ, flacoanele pot fi agitate cu putere timp de 1-2 ore (de exemplu pe un agitator pentru microplăci) sau lent, peste noapte. Eficiența procedurii de eliminare a CO2 se verifică (prin prelungirea perioadei de aerisire sau agitare). Se adaugă apoi un lichid de scintilație adecvat pentru numărarea eșantioanelor apoase, eșantionul se omogenizează pe un mixer turbionar, iar radioactivitatea se determină prin cuantificarea scintilației lichidului, scăzând activitatea de fond determinată în probele martor de testat (FB). Cu excepția cazului când apa de testat este foarte colorată sau conține o concentrație mare de particule, eșantioanele vor manifesta o atenuare uniformă, aceasta fiind suficientă pentru efectuarea corecțiilor atenuării folosind un standard extern. Dacă apa de testat este foarte colorată, corectarea atenuării se poate efectua cu ajutorul adăugării unui standard intern. Dacă concentrația particulelor este mare, nu este posibilă obținerea unei soluții sau gel omogen, variația atenuării între eșantioane fiind mare în caz contrar. În acest caz, poate fi folosită metoda de numărare pentru mâlurile de testare, descrisă mai jos. Dacă testul se desfășoară ca test pe sedimente în suspensie, măsurarea 14CO2 poate avea loc indirect, prin extragerea unui eșantion omogen de 10 ml apă/suspensie de testare și separarea fazelor prin centrifugare la o viteză corespunzătoare (de exemplu la 40 000 m/s2 timp de 15 minute). Faza apoasă se tratează apoi conform procedurii descrise mai sus. Activitatea 14C în faza de particule (POA) se determină prin resuspendarea sedimentului într-un volum mic de apă distilată, transferarea în flacoane de scintilație și adăugarea de lichid de scintilație pentru formarea unui gel (în acest scop, sunt disponibile lichide speciale de scintilație). În funcție de natura particulelor (de exemplu conținutul lor de material organic), eșantionul poate fi digerat în timpul nopții cu ajutorul unui dizolvant de țesuturi și apoi omogenizat pe un mixer turbionar înainte de adăugarea lichidului de scintilație. Alternativ, POA poate fi determinat prin combustie în exces de oxigen, folosind un oxidant al eșantionului. Pentru cuantificare, se includ întotdeauna standarde interne, corectarea atenuării putând fi efectuată, dacă este necesar, prin adăugarea unui standard intern pentru fiecare eșantion individual.
Determinarea directă a 14CO2
Dacă 14CO2 degajat este măsurat direct, aceasta se realizează prin folosirea unui număr mai mare de recipiente la începutul testului, recoltarea conținutului recipientelor de testare la fiecare punct de măsurare prin acidifierea recipientelor de testare la pH de 2-3 și captarea 14CO2 într-un absorbant intern (introdus în fiecare recipient de testare la începutul testului) sau extern. Ca mediu absorbant se pot folosi hidroxizi alcalini (de exemplu soluție 1 N de NaOH sau o granulă de NaOH), etanolamină sau absorbanți pe bază de etanolamină disponibili în comerț. Pentru măsurarea directă a 14CO2, recipientele se astupă (de exemplu cu o membrană din cauciuc butilic).
Figura 1a
Exemplu de reprezentare aritmetică a datelor (activitatea reziduală în funcție de timp)

Figura 1b
Exemplu de reprezentare semilogaritmică a datelor (ln al activității reziduale în funcție de timp)
ANEXA VI
|
C.26. |
TEST DE INHIBARE A CREȘTERII SPECIEI LEMNA |
1. METODĂ
Prezenta metodă este echivalentă cu orientările OECD privind testele nr. 221 (2006)(1). La nivelul autorităților din statele membre ale UE există consens cu privire la faptul că testele pe Lemna constituie o soluție acceptabilă de substituție pentru testele pe alge pentru substanțele puternic colorate (2)(3).
1.1. INTRODUCERE
Prezenta metodă de testare este concepută pentru a evalua toxicitatea substanțelor față de plantele acvatice de apă dulce din genul Lemna (lintiță). Se bazează pe orientările (4)(5)(6)(7)(8)(9) existente, dar include modificări ale acestor metode pentru a reflecta cercetările și consultările recente într-un număr de aspecte cheie. Metoda propusă a fost validată printr-un test interlaboratoare internațional (10).
Prezenta metodă de testare descrie testarea toxicității prin folosirea Lemna gibba și Lemna minor, care au fost ambele studiate pe larg și fac obiectul standardelor menționate mai sus. Taxonomia speciilor de Lemna este dificilă, fiind complicată de existența unei game largi de fenotipuri. Deși în cazul Lemna se poate manifesta variabilitate genetică în ceea ce privește răspunsul față de substanțele toxice, în prezent nu există date suficiente despre această sursă de variabilitate pentru a se recomanda folosirea unei anumite clone pentru această metodă de testare. Trebuie reținut că testul nu se desfășoară în condiții axenice, dar sunt luate măsuri de reducere la minimum a contaminării cu alte organisme în timpul procedurii de testare.
Sunt descrise detaliile privind testarea cu reînnoire (semistatică și în regim dinamic) și fără reînnoire (statică) a soluției de testat. În funcție de obiectivele testului și de cerințele de reglementare, se recomandă aplicarea metodei semistatice și a metodei dinamice, de exemplu pentru substanțe care se pierd cu rapiditate din soluție ca urmare a volatilizării, fotodegradării, precipitării sau biodegradării. Alte îndrumări sunt disponibile la nota (11).
1.2. DEFINIȚII
Următoarele definiții și prescurtări se folosesc în cadrul prezentei metode de testare:
Biomasă: este greutatea uscată a materiei vii prezente într-o populație. În prezentul test, înlocuitorii pentru biomasă, cum ar fi numărul de fronde sau suprafața frondelor, se măsoară de obicei, iar folosirea termenului „biomasă” se referă așadar și la măsurarea acestor înlocuitori.
Cloroză: este îngălbenirea țesutului frondei.
Clon: este un organism sau celulă provenind de la un singur individ prin reproducere asexuată. Indivizii din același clon sunt, prin urmare, identici din punct de vedere genetic.
Colonie: înseamnă un agregat de fronde mamă și fiică (de obicei, între 2-4) atașate unele de altele. Uneori, este denumită plantă.
ECx : este concentrația substanței de testat dizolvate în mediul de testare care rezultă în x % (de exemplu 50 %) reducere în creșterea Lemna într-o anumită perioadă de expunere (care se menționează explicit în cazul în care deviază de la durata de testare completă sau normală). Pentru a se reprezenta în mod clar o valoare EC derivată din viteza de creștere sau randament, se folosesc simbolurile „ErC” pentru viteza de creștere, respectiv „EyC” pentru randament, urmate de variabila de măsurare folosită, de exemplu ErC (numărul de fronde).
Test în regim dinamic: este un test în care soluțiile de testat sunt înlocuite continuu.
Frondă: desemnează aparatul vegetativ al lintiței redus la o lamelă individuală, având forma unei frunze. Este cea mai mică unitate (individ) capabilă de reproducere.
Gibozitate: înseamnă fronde care prezintă o proeminență sau umflătură.
Creștere: este o sporire a variabilei de măsurare, cum ar fi numărul frondelor, greutatea uscată, greutatea umedă sau suprafața frondelor, în perioada de testare.
Viteza de creștere (viteza medie specifică de creștere): este creșterea logaritmică a biomasei în timpul perioadei de expunere.
Concentrația minimă cu efect observabil (CMEO): este cea mai scăzută concentrație testată la care se observă că substanța are un efect semnificativ din punct de vedere statistic asupra creșterii (la p < 0,05) în comparație cu lotul martor, la un anumit timp de expunere. Toate concentrațiile testate mai mari decât CMEO trebuie să aibă efect nociv egal sau mai mare decât cel observat la CMEO. Dacă aceste două condiții nu pot fi satisfăcute, se va furniza o explicație completă privind modul în care a fost selectat CMEO (și, prin urmare, CFEO).
Variabile de măsurare: sunt orice tipuri de variabile care se măsoară pentru a exprima punctul stoechiometric prin folosirea uneia sau a mai multor variabile de răspuns diferite. În prezenta metodă, numărul de fronde, suprafața frondelor, greutatea în stare proaspătă și greutatea uscată sunt variabile de măsurare.
Monocultură: este o cultură cu o singură specie de plante.
Necroză: este un țesut al frondei mort (alb sau îmbibat în apă).
Concentrația fără efecte observabile (CFEO): este concentrația testată imediat sub valoarea CMEO.
Fenotip: este caracteristica observabilă a unui organism determinată de interacțiunea genelor sale cu mediul său înconjurător.
Variabile de răspuns: sunt variabile pentru estimarea toxicității derivate din orice variabile măsurate care descriu biomasa prin diferite metode de calcul. În cazul acestei metode, vitezele de creștere și randamentul sunt variabile de răspuns derivate din variabile de măsurare precum numărul frondelor, suprafața frondelor, greutatea în stare proaspătă sau greutatea uscată.
Test semistatic (cu reînnoire): este un test în care soluția de testat se înlocuiește periodic, la intervale specifice în timpul testului.
Test static: este o metodă de testare care nu presupune reînnoirea soluției de testat în timpul testului.
Punct stoechiometric: descrie factorul general care va fi modificat de către substanța chimică testată, în funcție de proba martor, acesta fiind obiectivul testului. În prezenta metodă, punctul stoechiometric este inhibarea creșterii, care poate fi exprimată prin diferite variabile de răspuns bazate pe una sau mai multe variabile de măsurare.
Mediu de testare: este mediul de cultură complet sintetic în care plantele testate cresc când sunt expuse la substanța de testat. În mod normal, substanța de testat se dizolvă în mediul de testare.
Randament: este valoarea unei variabile de măsurare pentru exprimarea biomasei la sfârșitul perioadei de expunere minus variabila de măsurare la începutul perioadei de expunere.
1.3. PRINCIPIUL TESTULUI
Culturile de plante cu creștere exponențială din genul Lemna se lasă să crească în monoculturi, cu diferite concentrații ale substanței testate, timp de șapte zile. Obiectivul testului este de a cuantifica efectele substanței asupra creșterii vegetative în această perioadă, pe baza evaluărilor variabilelor de măsurare selectate. Numărul frondelor este variabila de măsurare principală. Se mai măsoară cel puțin încă o variabilă de măsurare (suprafața totală a frondelor, greutatea uscată sau greutatea în stare proaspătă), deoarece unele substanțe pot afecta alte variabile de măsurare considerabil mai mult decât numărul frondelor. Pentru cuantificarea efectelor substanței, creșterea în soluțiile de testat se compară cu cea a probelor martor, fiind determinată concentrația care provoacă o inhibare specificată de x % a creșterii (de exemplu 50 %) și exprimată ca ECx (de exemplu EC50).
Punctul stoechiometric este inhibarea creșterii, exprimată ca creștere logaritmică a variabilei de măsurare (viteza medie specifică de creștere) în timpul perioadei de expunere. Concentrația care provoacă o inhibare a vitezei de creștere specificată de x % (de exemplu 50 %) și exprimată ca ErCx (de exemplu ErC50) se determină din vitezele specifice medii de creștere înregistrate pentru o serie de soluții de testat.
O variabilă de răspuns suplimentară folosită în prezenta metodă de testare este randamentul, care poate fi necesar pentru îndeplinirea unor cerințe de reglementare specifice din unele țări. Acesta se definește ca variabilele de măsurare la sfârșitul perioadei de expunere minus variabilele de măsurare la începutul perioadei de expunere. Concentrația care provoacă o inhibare specificată de x % (de exemplu 50 %) a randamentului se calculează și se exprimă ca EyCx (de exemplu EyC50) pe baza randamentului înregistrat pentru o serie de soluții de testat.
În plus, concentrația minimă cu efect observabil (CMEO) și concentrația fără efecte observabile (CFEO) se pot determina statistic.
1.4. INFORMAȚII REFERITOARE LA SUBSTANȚA DE TESTARE
Este necesară o metodă analitică cu sensibilitate specifică pentru cuantificarea substanței în mediul de testare.
Informațiile referitoare la substanța de testare, care pot fi utile pentru stabilirea condițiilor de testare, includ formula structurală, puritatea, solubilitatea în apă, stabilitatea în apă și la lumină, pKa, Kow, presiunea de vapori și biodegradabilitatea. Solubilitatea în apă și presiunea de vapori pot fi folosite pentru a calcula constanta legii lui Henry, care va arăta dacă sunt probabile pierderi semnificative ale substanței de testat în perioada de testare. Aceasta va indica dacă este necesară adoptarea anumitor măsuri pentru limitarea unor astfel de pierderi. Dacă informațiile privind solubilitatea și stabilitatea substanței de testat sunt incerte, se recomandă ca acestea să fie evaluate în condițiile testului, cum ar fi mediul de creștere, temperatura sau condițiile de iluminare din test.
Când este importantă controlarea pH-ului mediului de testare, de exemplu în cursul testării unor metale sau substanțe instabile din punct de vedere hidrolitic, se recomandă adăugarea unei substanțe tampon în mediul de creștere (a se vedea punctul 1.7.4 primul paragraf). Îndrumări suplimentare privind substanțele de testare cu proprietăți fizico-chimice care le fac dificil de testat sunt prezentate la nota (11).
1.5. SUBSTANȚA DE REFERINȚĂ
Substanța (substanțele) de referință folosită (folosite) în testul internațional interlaboratoare (10), cum ar fi 3-5 diclorofenol, poate (pot) fi testată (testate) ca mijloc de validare a procedurii de testare. Este recomandabil ca o substanță de referință să fie testată de cel puțin două ori pe an sau, dacă testarea se desfășoară la o frecvență mai joasă, în paralel cu determinarea toxicității unei substanțe de testat.
1.6. VALIDITATEA TESTULUI
Pentru ca un test să fie valid, perioada de dublare a numărului de fronde în proba de control trebuie să fie mai mică de 2,5 zile (60 de ore), corespunzând unei creșteri de aproximativ șapte ori într-o perioadă de șapte zile și unei viteze medii specifice de creștere de 0,275 zi–1. Folosind mediul și condițiile de testare descrise în prezenta metodă de testare, acest criteriu poate fi îndeplinit prin folosirea unui test static (8). Se consideră că acest criteriu poate fi îndeplinit în condiții de testare semistatică și dinamică. Calculul perioadei de dublare este prezentat la punctul 2.1.
1.7. DESCRIEREA METODEI
1.7.1. Aparatură
Toate echipamentele care intră în contact cu mediile de testare trebuie să fie confecționate din sticlă sau alt material chimic inert. Recipientele de sticlă folosite pentru cultură și testare trebuie să fie sterile și curățate de contaminanții chimici care se pot infiltra în mediul de testare. Vasele de testare trebuie să fie suficient de largi pentru ca frondele din diferitele colonii aflate în vasele de control să crească fără a se suprapune la sfârșitul testului. Nu este important dacă rădăcinile ating baza vaselor de testare, dar se recomandă o adâncime minimă de 20 mm și un volum minim de 100 ml în fiecare vas. Tipul de vase de testare nu influențează desfășurarea testului atât timp cât se respectă aceste cerințe. Pot fi folosite pahare de laborator, vase de cristalizare sau plăci Petri din sticlă de dimensiuni corespunzătoare. Vasele de testare trebuie să fie acoperite pentru a se reduce la minimum evaporarea și contaminarea accidentală, permițând în același timp trecerea aerului. Vasele de testare corespunzătoare, în special capacele, trebuie să prevină formarea umbrei sau modificarea caracteristicilor spectrale ale luminii.
Culturile și vasele de testare nu se păstrează în același loc. Această condiție poate fi îndeplinită prin folosirea unor spații, incubatoare sau camere de creștere care reproduc condițiile de mediu. Iluminarea și temperatura trebuie să fie controlabile și menținute la un nivel constant (a se vedea punctul 1.7.8).
1.7.2. Organismul de testare
Organismul folosit pentru acest test este Lemna gibba sau Lemna minor. Scurte descrieri ale speciilor de lintiță care au fost folosite pentru testarea toxicității sunt prezentate în apendicele 1. Plantele pot fi obținute dintr-o colecție de culturi, de la un alt laborator sau de pe teren. Dacă sunt colectate de pe teren, plantele se mențin în cultură într-un mediu similar cu cel folosit pentru testare timp de cel puțin opt săptămâni înainte de utilizare. Terenurile de pe care s-au colectat culturile inițiale trebuie să fie lipsite de surse vizibile de contaminare. Dacă au fost obținute de la un alt laborator sau dintr-o colecție de culturi, se vor menține în condiții similare timp de cel puțin trei săptămâni. Sursa plantelor, a speciilor și a clonului (dacă se cunoaște) folosite pentru testare se raportează întotdeauna.
Se vor folosi monoculturi care sunt vizibil necontaminate cu alte organisme, cum ar fi alge sau protozoare. Plantele sănătoase de L. minor vor consta în colonii cuprinzând între două și cinci fronde, în timp ce coloniile sănătoase de L. gibba pot conține până la șapte fronde.
Calitatea și uniformitatea plantelor folosite pentru testare vor avea o influență semnificativă asupra rezultatului testului și, prin urmare, se vor selecta cu atenție. Se vor folosi plante tinere, cu creștere rapidă, fără leziuni sau decolorări vizibile (cloroză). Culturile de bună calitate sunt indicate de numărul mare de colonii cuprinzând cel puțin două fronde. Un număr mare de fronde unice indică stres ambiental, cum ar fi o cantitate redusă de nutrienți, iar plantele din astfel de culturi nu se folosesc pentru testare.
1.7.3. Cultură
În scopul reducerii frecvenței de întreținere a culturii (de exemplu în situațiile în care nu sunt prevăzute teste cu Lemna pentru o anumită perioadă), culturile pot fi menținute în condiții de iluminare și temperatură scăzută (4-10 °C). Detalii privind culturile sunt prezentate în apendicele 2. Semnele vizibile de contaminare cu alge sau alte organisme necesită sterilizarea la suprafață a unui subeșantion de fronde de Lemna, urmată de transferul către un mediu proaspăt (a se vedea apendicele 2). În această situație, restul culturii contaminate se elimină.
Cu cel puțin șapte zile înainte de testare, se transferă un număr suficient de colonii în condiții aseptice într-un mediu steril proaspăt și se cultivă timp de 7-10 zile în condiții similare cu cele ale testului.
1.7.4. Mediul de testare
Pentru Lemna minor și Lemna gibba se recomandă medii diferite, conform descrierii de mai jos. Se va examina cu atenție includerea unei soluții tampon de pH în mediul de testare [MOPS (acid 4-morfolinpropansulfonic, CAS No: 1132-61-2; EINECS No: 214-478-5) în mediul L. minor și de NaHCO3 în mediul L. gibba] când se suspectează că va reacționa cu substanța de testat și va influența toxicitatea acesteia. Mediul Steinberg (12) este acceptabil dacă se îndeplinesc criteriile de validitate.
Pentru cultura și testarea cu L. minor se recomandă o modificare a mediului de creștere a Lemna prevăzut de standardul suedez (SIS). Compoziția acestui mediu este prezentată în apendicele 3.
Mediul de creștere 20X-AAP, descris în apendicele 3, este recomandat pentru cultura și testarea cu L. gibba.
Mediul Steinberg descris în apendicele 3 este, de asemenea, adecvat pentru L. minor, dar poate fi folosit și pentru L. gibba dacă se îndeplinesc criteriile de validitate.
1.7.5. Soluții de testat
Soluțiile de testat se prepară de obicei prin diluarea unei soluții mamă. Soluțiile mamă ale substanțelor de testat se prepară de preferință prin dizolvarea substanței în mediul de cultură.
Concentrația maximă testată a substanței de testat nu trebuie să depășească de preferință limita de solubilitate în apă a substanței în condițiile de testare. Cu toate acestea, trebuie remarcat că speciile de Lemna plutesc la suprafață și pot fi expuse la substanțe care se acumulează la interfața apă-aer (de exemplu substanțe cu solubilitate scăzută în apă, hidrofobe sau tensioactive). În astfel de circumstanțe, expunerea va rezulta de la alte materiale decât cele din soluție, iar concentrațiile de testare pot depăși nivelul de solubilitate în apă, în funcție de caracteristicile substanței de testat. În cazul substanțelor de testat cu solubilitate scăzută în apă, poate fi necesară prepararea unei soluții mamă concentrate sau dispersia substanței folosind un solvent sau agent de dispersie organic, pentru a facilita adăugarea de cantități exacte de substanță de testat în mediul de testare și a favoriza dispersia și dizolvarea sa. Se vor depune toate eforturile pentru evitarea folosirii unor astfel de materiale. Nu se vor folosi solvenți sau agenți de dispersie suplimentari în urma cărora să rezulte fitotoxicitate. De exemplu, solvenții obișnuiți care nu provoacă fitotoxicitate la concentrații de până la 100 μl·l–1 includ acetona și dimetilformamida. Dacă se folosește un solvent sau agent de dispersie, concentrația sa finală se raportează și se menține la minimum (≤ 100 μl·l–1), iar toate tratamentele și loturile martor trebuie să conțină aceeași concentrație de solvent sau agent de dispersie. Îndrumări suplimentare privind folosirea agenților de dispersie sunt prezentate la nota (11).
1.7.6. Grupele experimentale și cele martor
Cunoașterea prealabilă a toxicității substanței de testat față de Lemna, de exemplu ca urmare a unui test pentru stabilirea intervalului, va permite alegerea concentrațiilor potrivite de testare. În testul principal de stabilire a toxicității trebuie să existe cel puțin cinci concentrații de testare dispuse în serie geometrică. Se preferă ca factorul de separare între concentrațiile de testare să nu depășească 3,2, dar se poate folosi o valoare mai mare în cazul în care curba concentrație-răspuns este plană. În cazul în care se utilizează mai puțin de cinci concentrații, se vor aduce argumente pentru aceasta. Pentru fiecare concentrație de testare se folosesc cel puțin trei duplicate.
La stabilirea intervalului de concentrații de testare (pentru testul de stabilire a intervalului și/sau testul principal de stabilire a toxicității), trebuie să se rețină următoarele:
|
— |
pentru determinarea unui ECx, concentrațiile de testare trebuie să încadreze valoarea ECx în scopul asigurării unui nivel de încredere adecvat. De exemplu, dacă se estimează EC50, concentrația maximă testată trebuie să fie mai mare decât valoarea EC50. Dacă valoarea EC50 se află în afara intervalului concentrațiilor de testare, intervalele de încredere aferente vor fi mari și există riscul ca evaluarea corectă a adecvării statistice a modelului să nu fie posibilă; |
|
— |
dacă se urmărește estimarea CMEO/CFEO, concentrația cea mai mică de testare trebuie să fie suficient de mică, astfel încât creșterea să nu fie cu mult mai mică decât cea a probei martor. În plus, concentrația maximă testată trebuie să fie suficient de mare pentru ca creșterea să fie cu mult mai mică decât cea a probei martor. Dacă nu este așa, testul se va repeta folosind un interval diferit de concentrații (cu excepția cazului în care cea mai mare concentrație se află la limita solubilității sau la concentrația limită maximă cerută, de exemplu 100 mg·l–1). |
Fiecare test trebuie să includă probe martor constând în mediu nutritiv, număr de fronde și colonii, condiții ambientale și proceduri similare celor din vasele de testare, dar fără substanța de testat. Dacă se folosește un solvent sau agent de dispersie suplimentar, se va include o tratare suplimentară a probei martor cu acest solvent/agent de dispersie, prezent în aceeași concentrație cu cea din vasele cu substanța de testat. Numărul vaselor de control cu probe duplicat (și vasele cu solvenți, dacă este cazul) trebuie să fie cel puțin egal cu numărul de vase folosite pentru fiecare concentrație de testare; în mod ideal acest număr va fi de două ori mai mare.
Dacă determinarea CFEO nu este necesară, testul poate fi modificat în sensul creșterii numărului de concentrații și reducerii numărului de duplicate per concentrație. Cu toate acestea, numărul de duplicate martor trebuie să fie de cel puțin trei.
1.7.7. Expunere
Coloniile constând în 2-4 fronde vizibile se transferă din cultura de inocul și se distribuie aleatoriu în vasele de testare în condiții aseptice. Fiecare vas de testare va conține un total de 9-12 fronde. Numărul de fronde și colonii va fi același în fiecare vas de testare. Experiența dobândită în urma aplicării acestei metode și a testului interlaboatoare a indicat că folosirea a trei duplicate per tratament, fiecare duplicat conținând inițial 9-12 fronde, este suficientă pentru a detecta diferențe de creștere de aproximativ 4-7 % inhibare calculată în funcție de viteza de creștere (10-15 % calculată în funcție de randament) între tratamente (10).
Vasele de testare vor fi poziționate aleatoriu în incubator pentru a se minimiza influența diferențelor spațiale în intensitatea luminii sau în temperatură. Este nevoie, de asemenea, de o dispunere fixă sau aleatoare a vaselor (sau o repoziționare mai frecventă) atunci când se fac observații.
Dacă un test preliminar de stabilitate arată că nu poate fi menținută concentrația substanței de testat (concentrația măsurată scade sub 80 % din concentrația măsurată inițial) pe durata perioadei de testare (7 zile), se recomandă un test semistatic. În acest caz, coloniile se expun unor soluții proaspăt preparate de testare și soluții martor în cel puțin două ocazii în timpul testului (de exemplu ziua 3 și ziua 5). Frecvența expunerii la un mediu proaspăt va depinde de stabilitatea substanței de testat; pentru menținerea concentrațiilor cât mai aproape de nivelul constant în cazul substanțelor foarte instabile sau volatile, poate fi necesară o frecvență mai mare. În unele situații poate fi necesară o procedură dinamică (11)(13).
Scenariul de expunere prin pulverizare foliară (spray) nu este inclus în prezenta metodă de testare. Pentru aceasta, a se vedea nota (14).
1.7.8. Condiții de incubare
Se va asigura o lumină caldă sau fluorescentă alb-rece, cu o intensitate cuprinsă în intervalul 85-135 μE·m–2·s–1 măsurat în radiație activă fotosintetică (400-700 nm) în puncte aflate la distanțe egale de sursa de lumină cu distanțele la care se află frondele de Lemna (echivalent cu 6 500-10 000 lucși). Diferențele față de intensitatea selectată a luminii în zona de testare nu trebuie să depășească ± 15 %. Metoda de detectare și măsurare a luminii, în special tipul de senzor, va influența valoarea măsurată. Senzorii sferici (care răspund la lumina din toate unghiurile de deasupra și dedesubtul planului de măsurare) și senzorii „cosinus” (care răspund la lumina din toate unghiurile de deasupra planului de măsurare) sunt preferabili senzorilor unidirecționali și vor da valori mai mari pentru o sursă de lumină multipunct de tipul celei descrise aici.
Temperatura din vasele de testare trebuie să fie 24 ± 2 °C. pH-ul mediului de control nu trebuie să aibă o creștere mai mare de 1,5 unități în timpul testului. O deviație de peste 1,5 unități nu va invalida testul dacă se poate demonstra întrunirea criteriilor de validitate. Se va acorda o atenție sporită devierii pH-ului în cazuri speciale, cum ar fi în timpul testării de substanțe sau metale instabile. Pentru îndrumări suplimentare, consultați nota (11).
1.7.9. Durată
Testul se încheie după 7 zile de la transferul plantelor în vasele de testare.
1.7.10. Măsurători și determinări analitice
Numărul frondelor din vasele de testare se determină și se raportează la începutul testului, acordându-se atenție înregistrării frondelor proeminente și distincte. Numărul frondelor cu aspect normal sau anormal se stabilește la începutul testului, cel puțin o dată la fiecare trei zile în timpul perioadei de expunere (de exemplu în cel puțin două ocazii în timpul perioadei de 7 zile), precum și la încheierea testului. Se înregistrează modificările în dezvoltarea plantei, cum ar fi dimensiunea frondei, aspectul, indicațiile de necroză, cloroză sau gibozitate, separarea coloniilor sau pierderea de flotabilitate, precum și cele privind lungimea și aspectul rădăcinii. Se înregistrează, de asemenea, caracteristici semnificative ale mediului de testare (de exemplu prezența de material nedizolvat, creșterea de alge în vasul de testare).
Pe lângă determinările numărului de fronde în timpul testului, se evaluează și efectele substanței de testat asupra uneia (sau mai multor) dintre următoarele variabile de măsurare:
|
(i) |
suprafața totală a frondelor; |
|
(ii) |
greutatea uscată; |
|
(iii) |
greutatea în stare proaspătă. |
Suprafața totală a frondelor are avantajul de a putea fi determinată pentru fiecare vas de testare și de control la începutul, în timpul și la sfârșitul testului. Greutatea uscată sau în stare proaspătă se determină la începutul testului, pe baza unui eșantion al culturii de inocul reprezentativ pentru substanța folosită la începutul testului și la sfârșitul testului, pe baza materialului din fiecare vas de testare și control. Dacă suprafața frondelor nu se măsoară, greutatea uscată este preferată în detrimentul greutății în stare proaspătă.
Suprafața totală a frondelor, greutatea uscată și greutatea în stare proaspătă se determină după cum urmează:
|
(i) |
Suprafața totală a frondelor: suprafața totală a frondelor din toate coloniile poate fi determinată prin analiza imaginilor. Se capturează o imagine a vasului de testare și a plantelor cu ajutorul unei camere de fotografiat digitale (de exemplu, prin așezarea vasului pe o cutie iluminată), iar imaginile rezultate se prelucrează digital. Suprafața totală a frondelor dintr-un vas de testare se poate determina prin calibrare cu forme plane de suprafețe cunoscute. Se vor exclude interferențele provocate de marginea vasului de testare. O metodă alternativă mai complicată constă în fotocopierea vasului de testare și a plantelor, decuparea siluetei rezultate a coloniilor și determinarea suprafeței folosind un analizor al suprafeței frunzelor sau hârtie milimetrică. Alte tehnici (de exemplu raportul între greutatea hârtiei corespunzătoare suprafeței siluetei coloniilor și greutatea hârtiei corespunzătoare suprafeței unei unități) pot fi, de asemenea, utile. |
|
(ii) |
Greutatea uscată: se colectează toate coloniile din vasele de testare și se clătesc cu apă distilată sau deionizată. Se înlătură excesul de apă și se usucă la 60 °C, până se atinge o greutate constantă. Sunt incluse orice fragmente de rădăcină. Greutatea uscată se exprimă cu o precizie de cel puțin 0,1 mg. |
|
(iii) |
Greutatea în stare proaspătă: se transferă toate coloniile în tuburi de poliestiren precântărit (sau alt material inert), cu mici orificii (1 mm) în bazele rotunjite. Tuburile se centrifughează apoi la 3 000 rpm la temperatura camerei, timp de 10 minute. Tuburile, care conțin acum coloniile uscate, se recântăresc, iar greutatea în stare proaspătă se calculează prin scăderea greutății tubului gol. |
1.7.10.1. Frecvența măsurătorilor și determinărilor analitice
Dacă se folosește un test static, pH-ul fiecărui tratament se măsoară la începutul și sfârșitul testului. Dacă se folosește un test semistatic, pH-ul se măsoară în fiecare lot de soluție de testat „proaspătă” înainte de fiecare reînnoire, precum și în soluțiile corespunzătoare „uzate”.
Intensitatea luminii se măsoară în încăperea, incubatorul sau camera de creștere în puncte aflate la distanțe de sursa de lumină similare cu cele ale frondelor de Lemna. Măsurătorile se fac cel puțin o dată în timpul testului. Se înregistrează cel puțin o dată pe zi temperatura mediului într-un vas înlocuitor menținut în condiții similare în încăperea, incubatorul sau camera de creștere.
Concentrațiile substanței de testat se determină la intervale corespunzătoare în timpul testului. În testele statice, cerința minimă este de a determina concentrațiile la începutul și sfârșitul testului.
Pentru testele semistatice în care nu se estimează menținerea concentrației substanței testate în limitele de ± 20 % din cea nominală, este necesară analizarea tuturor soluțiilor de testat proaspăt preparate la fiecare reînnoire (a se vedea punctul 1.7.7 al treilea paragraf). Cu toate acestea, pentru acele teste în care concentrația inițială măsurată a substanței testate nu se situează în limitele de ± 20 % din valoarea nominală, dar se pot aduce dovezi care să indice repetabilitatea și stabilitatea concentrațiilor inițiale (adică în intervalul de 80-120 % din concentrațiile inițiale), determinarea chimică se va efectua doar la concentrațiile de testare cele mai mari și cele mai mici. În toate cazurile, este necesar să se determine concentrațiile substanței testate înaintea reînnoirii doar la un vas din cele duplicat, pentru fiecare concentrație de testare (sau la conținutul vaselor combinate în funcție de duplicat).
Dacă se folosește un test în regim dinamic, se recomandă un regim de recoltare a probelor similar cu cel descris pentru testele semistatice, inclusiv analiza la începutul, mijlocul și sfârșitul testului, dar măsurarea soluțiilor „uzate” nu convine în acest caz. La aceste tipuri de testări, trebuie verificat zilnic fluxul diluantului și al substanței testate sau al soluției mamă a substanței de testare.
Dacă se poate dovedi menținerea satisfăcătoare, pe toată durata testului, a concentrației substanței testate în limitele de ± 20 % din cea nominală sau măsurată inițial, atunci rezultatele se pot obține din valoarea nominală sau din cea măsurată inițial. Dacă abaterea de la concentrația nominală sau cea măsurată inițial este mai mare de ± 20 %, este necesar ca rezultatele să se exprime în funcție de media geometrică a concentrației în timpul expunerii sau de modelele care descriu declinul concentrației substanței de testat (11).
1.7.11. Testul la valori limită
În unele condiții, de exemplu atunci când un test preliminar arată că substanța de testat nu are efecte toxice la concentrații de până la 100 mg·l–1 sau până la limita solubilității în mediul de testare (oricare dintre ele este mai scăzută), se poate efectua un test la valori limită care presupune o comparare a răspunsurilor unui grup de control și ale unui grup supus tratamentului (100 mg·l–1 sau o concentrație egală cu limita solubilității). Se recomandă ca acest test să fie confirmat prin analizarea concentrației de expunere. Unui test la valori limită i se aplică toate condițiile de testare și criteriile de validitate descrise anterior, cu excepția celei privind numărul de duplicate supuse tratamentului, care trebuie să fie dublu. Creșterea în grupul de control și în cel supus tratamentului pot fi analizate folosind un test statistic de comparare a mediilor, cum ar fi un test-t (Student).
2. DATE ȘI RAPORT
2.1. TIMP DE DUPLICARE
Pentru determinarea timpului de duplicare (Td) a numărului de fronde și asigurarea respectării de către studiu a acestui criteriu de validitate (punctul 1.6), pentru datele obținute de la vasele de control se folosește următoarea formulă:
Td = ln 2/μ
unde μ este viteza medie specifică de creștere, astfel cum a fost descrisă în primul și al doilea paragraf de la punctul 2.2.1.
2.2. VARIABILE DE RĂSPUNS
Scopul testului este de a determina efectele substanței de testat asupra creșterii vegetative a Lemna. Prezenta metodă de testare descrie două variabile de răspuns, deoarece statele membre au preferințe și cerințe de reglementare diferite. Pentru ca rezultatele de testare să fie acceptabile în toate statele membre, efectele se evaluează folosind ambele variabile de răspuns (a) și (b) descrise mai jos.
|
(a) |
Viteza medie specifică de creștere: această variabilă de răspuns se calculează pe baza modificărilor logaritmilor numerelor frondelor și, în plus, pe baza modificărilor logaritmilor altui parametru de măsurare (suprafața totală a frondelor, greutatea uscată sau greutatea în stare proaspătă) în funcție de timp (exprimat în zile) în probele martor și fiecare grup supus tratamentului. Este numită uneori viteză relativă de creștere (15). |
|
(b) |
Randament: această variabilă de răspuns se calculează pe baza modificărilor numărului de fronde și, în plus, pe baza modificărilor unui alt parametru de măsurare (suprafața totală a frondelor, greutatea uscată sau greutatea în stare proaspătă) în probele martor și în fiecare grup supus tratamentului, până la încheierea testului. |
Trebuie remarcat că valorile de toxicitate calculate prin folosirea acestor două variabile de răspuns nu sunt comparabile, iar această diferență trebuie să fie recunoscută când se folosesc rezultatele testului. Valorile ECx bazate pe viteza medie specifică de creștere (ErCx) vor fi în general mai mari decât rezultatele bazate pe randament (EyCx) în cazul în care condițiile de testare din prezenta metodă de testare sunt respectate, ca urmare a bazei matematice a abordărilor respective. Aceasta nu se va interpreta ca o diferență de sensibilitate între cele două variabile de răspuns, valorile fiind diferite din punct de vedere matematic. Conceptul de viteză medie specifică de creștere se bazează pe modelul general al creșterii exponențiale a lintiței în culturi nelimitate, în care toxicitatea se estimează pe baza efectelor asupra vitezei de creștere, fără a fi dependentă de nivelul absolut al vitezei specifice de creștere a probei martor, de panta curbei concentrație-răspuns sau de durata testului. Prin contrast, rezultatele bazate pe variabila de răspuns-randament depind de toate aceste variabile. EyCx depinde de viteza specifică de creștere a speciilor de lintiță folosite pentru fiecare test și de viteza maximă specifică de creștere, care poate varia între specii și chiar între clone diferite. Această variabilă de răspuns nu se folosește pentru compararea sensibilității la substanțe toxice între specii de lintiță și chiar clone diferite. În timp ce folosirea vitezei medii specifice de creștere în scopul estimării toxicității este preferată din punct de vedere științific, estimările de toxicitate bazate pe randament sunt incluse în prezenta metodă de testare pentru a satisface cerințele de reglementare din unele țări.
Estimările toxicității trebuie să se bazeze pe numărul de fronde și pe o variabilă de măsurare suplimentară (suprafața totală a frondelor, greutatea uscată sau greutatea în stare proaspătă), deoarece unele substanțe pot afecta alte variabile de măsurare în proporție considerabil mai mare decât o poate face numărul de fronde. Acest efect nu va putea fi detectat exclusiv în urma calculării numărului de fronde.
Numărul de fronde, precum și orice altă variabilă de măsurare înregistrată, cum ar fi suprafața totală a frondelor, greutatea uscată sau greutatea în stare proaspătă, sunt introduse într-un tabel împreună cu concentrațiile substanței de testat cu ocazia fiecărei măsurări. Analiza ulterioară a datelor, inclusiv pentru estimarea CMEO, CFEO sau ECx, trebuie să se bazeze pe valorile duplicatelor individuale, și nu pe mediile calculate pentru fiecare grup supus tratamentului.
2.2.1. Viteza medie specifică de creștere
Viteza medie specifică de creștere pentru o anumită perioadă se calculează ca fiind creșterea logaritmică a variabilelor de creștere – numărul frondelor și încă o variabilă de măsurare (suprafața totală a frondelor, greutatea uscată sau greutatea în stare proaspătă) – pe baza formulei de mai jos pentru fiecare duplicat al probelor martor și probelor supuse tratamentului:

unde:
|
— |
μi-j: |
viteza medie specifică de creștere de la momentul i la momentul j |
|
— |
Ni: |
variabila de măsurare în vasul de testare sau control la momentul i |
|
— |
Nj: |
variabila de măsurare în vasul de testare sau control la momentul j |
|
— |
t: |
intervalul de timp între momentele i-j. |
Pentru fiecare grup de control și grup supus tratamentului, se calculează o valoare medie a vitezei de creștere în paralel cu estimarea varianței.
Viteza medie specifică de creștere se calculează pentru întreaga durată a testului (momentul „i” în formula de mai sus este începutul testului, iar momentul „j” este sfârșitul testului). Pentru fiecare concentrație de testare și probă martor se calculează o valoare medie pentru viteza medie specifică de creștere în paralel cu estimarea varianței. În plus, viteza de creștere pe secțiuni se evaluează în scopul evaluării efectelor substanței de testat care se produc în timpul perioadei de expunere (de exemplu prin verificarea curbelor de creștere transformate logaritmic). Diferențe substanțiale între viteza de creștere pe secțiuni și viteza medie de creștere indică o deviere de la creșterea exponențială constantă și impun verificarea atentă a curbelor de creștere. În acest caz, o metodă conservativă constă în compararea vitezelor specifice de creștere ale culturilor tratate în timpul perioadei de timp de inhibare maximă cu cele ale probelor martor, în aceeași perioadă.
Astfel, inhibarea procentuală a vitezei de creștere (Ir) se poate calcula pentru fiecare concentrație de testare (grup supus tratamentului) conform ecuației:
unde:
|
— |
% Ir: |
inhibarea vitezei medii specifice de creștere, în procente |
|
— |
μC: |
valoarea medie a µ în grupul de control |
|
— |
μT: |
valoarea medie a μ în grupul supus tratamentului. |
2.2.2. Randament
Efectele asupra randamentului se determină pe baza a două variabile de măsurare, numărul frondelor și încă o variabilă de măsurare (suprafața totală a frondelor, greutatea uscată sau greutatea în stare proaspătă) prezentă în fiecare vas de testare la începutul și sfârșitul testului. În cazul greutății uscate sau al greutății în stare proaspătă, biomasa inițială se determină pe baza unui eșantion de fronde recoltate din același lot folosit pentru inocularea vaselor de testare (a se vedea punctul 1.7.3 al doilea paragraf). Pentru fiecare concentrație de testare și probă martor, se calculează o valoare medie a randamentului în paralel cu estimările varianței. Procentul de inhibare medie a randamentului (% Iy) se poate calcula pentru fiecare grup supus tratamentului, după cum urmează:

unde:
|
— |
% Iy: |
inhibarea randamentului, în procente |
|
— |
bC: |
biomasa finală minus biomasa inițială pentru grupul de control |
|
— |
bT: |
biomasa finală minus biomasa inițială în grupul supus tratamentului. |
2.2.3. Trasarea curbelor concentrație-răspuns
Se trasează curbe concentrație-răspuns care fac legătura între media inhibării procentuale a variabilei de răspuns (Ir, sau Iy calculate conform metodei de la punctul 2.2.1 ultimul paragraf sau de la punctul 2.2.2) și concentrația logaritmică a substanței de testat.
2.2.4. Estimarea ECx
Estimările ECx (de exemplu EC50) trebuie să se bazeze atât pe viteza medie specifică de creștere (ErCx), cât și pe randament (EyCx), fiecare dintre acestea trebuind să se bazeze pe numărul frondelor și o variabilă de măsurare suplimentară (suprafața totală a frondelor, greutatea uscată sau greutatea în stare proaspătă). Aceasta se justifică deoarece există substanțe testate care au efecte diferite asupra numărului de fronde și a altor variabile de măsurare. Parametrii de toxicitate doriți sunt, prin urmare, patru valori ECx pentru fiecare nivel de inhibare x calculat: ErCx (numărul frondelor), ErCx (suprafața totală a frondelor, greutatea uscată sau greutatea în stare proaspătă), EyCx (numărul frondelor) și EyCx (suprafața totală a frondelor, greutatea uscată sau greutatea în stare proaspătă).
2.3. PROCEDURI STATISTICE
Obiectivul este de a se obține o relație cantitativă concentrație-răspuns prin metoda analizei regresiei. Este posibilă folosirea unei regresii lineare ponderate după ce s-a efectuat o transformare de linearizare a datelor de răspuns – de exemplu în funcția probit, logit sau unități Weibull (16), dar procedurile de regresie nelineară sunt tehnici preferate, care tratează mai bine inexactitățile inevitabile ale datelor și abaterile de la distribuțiile netede. Când se apropie de zero sau inhibiție totală, aceste inexactități se pot amplifica prin transformare, interferând cu analiza (16). Trebuie remarcat că metodele standard de analiză folosind transformatele probit, logit sau Weibull se folosesc în cazul datelor cantitative (de exemplu date privind mortalitate sau supraviețuire) și trebuie să fie modificate pentru a reflecta datele privind viteza de creștere și randament. Proceduri specifice de determinare a valorilor ECx pe baza datelor continue pot fi consultate la notele (17), (18) și (19).
Pentru fiecare variabilă de răspuns de analizat se utilizează relația concentrație-răspuns pentru calcularea estimărilor punctului valorilor ECx. Dacă este posibil, se vor determina limitele de încredere de 95 % pentru fiecare estimare. Calitatea de ajustare a datelor de răspuns la modelul de regresie se evaluează în mod grafic sau statistic. Analiza regresiei se efectuează folosind răspunsuri individuale ale duplicatului, nu medii ale grupului supus tratamentului.
Estimările și limitele de încredere ale EC50 pot fi obținute folosind interpolarea lineară cu „bootstrap” (20), dacă modelele/metodele disponibile de regresie sunt inadecvate pentru date.
Pentru estimarea CMEO și, prin urmare, a CFEO, este necesară compararea mediilor de tratare folosind tehnici de analiză a varianței (ANOVA). Media pentru fiecare concentrație se compară apoi cu media probei martor folosind o metodă de comparare multiplă adecvată sau de testare a tendinței. Testul lui Dunnett sau cel al lui Williams pot fi utile în acest sens (21)(22)(23)(24). Este necesar să se evalueze dacă ipoteza ANOVA de omogenitate a varianței se verifică. Această evaluare se poate efectua grafic sau printr-un test formal (25). Teste adecvate în acest sens sunt cele ale lui Levene sau Bartlett. Neîndeplinirea ipotezei de omogenitate a varianțelor poate fi corectată uneori prin transformarea logaritmică a datelor. Dacă eterogenitatea varianței este extremă și nu poate fi corectată prin transformare, se va lua în considerare analizarea prin metode precum testele Jonkheere regresive de stabilire a tendinței. Îndrumări suplimentare privind determinarea CFEO sunt prezentate la nota (19).
Progresele științifice recente au condus la recomandarea de abandonare a conceptului de CFEO și înlocuirea sa cu estimările punctului ECx bazate pe regresie. Nu a fost stabilită o valoare adecvată a x pentru acest test cu Lemna. Un interval cuprins între 10-20 % pare a fi adecvat (în funcție de variabilele de răspuns alese) și se recomandă raportarea atât a EC10, cât și a EC20.
3. RAPORT
3.1. RAPORTUL DE TESTARE
Raportul de testare trebuie să includă următoarele informații:
Substanța de testat:
|
— |
starea fizică și proprietățile fizico-chimice, inclusiv limita solubilității în apă; |
|
— |
date de identificare a substanțelor chimice (de exemplu numărul CAS), inclusiv puritatea. |
Speciile folosite pentru testare:
|
— |
denumirea științifică, clonul (dacă se cunoaște) și sursa. |
Condițiile de testare:
|
— |
procedura de testare folosită (statică, semistatică sau în regim dinamic); |
|
— |
data de începere a testului și durata sa; |
|
— |
mediul de testare; |
|
— |
descrierea protocolului testului: vasele de testare și capacele, volumele soluțiilor, numărul de colonii și fronde per vas de testare la începutul testului; |
|
— |
concentrațiile de testare (nominale și măsurate corespunzător) și numărul de duplicate per concentrație; |
|
— |
metodele de preparare a soluțiilor mamă și a soluțiilor de testat, inclusiv folosirea oricăror solvenți sau agenți de dispersie; |
|
— |
temperatura în timpul testului; |
|
— |
sursa de lumină, intensitatea luminii și omogenitatea; |
|
— |
valorile pH-ului mediilor de testare și control; |
|
— |
concentrațiile substanțelor de testat și metoda de analiză cu date adecvate de evaluare a calității (studii de validare, deviații standard sau limite de încredere ale analizelor); |
|
— |
metodele de determinare a numărului de fronde și a altor variabile de măsurare, cum ar fi greutatea uscată, greutatea în stare proaspătă sau suprafața frondelor; |
|
— |
orice deviere de la prezenta metodă de testare. |
Rezultate:
|
— |
date brute: numărul de fronde și alte variabile de măsurare în fiecare vas de testare și de control, cu ocazia fiecărei observări sau analize; |
|
— |
deviația medie și deviația standard pentru fiecare variabilă de măsurare; |
|
— |
curbele de creștere pentru fiecare concentrație (recomandate cu variabila de măsurare transformată logaritmic, a se vedea punctul 2.2.1 al doilea paragraf); |
|
— |
timpul de duplicare/viteza de creștere în grupul de control, pe baza numărului frondelor; |
|
— |
variabilele de răspuns calculate pentru fiecare duplicat supus tratării, cu valori medii și coeficient de variație pentru duplicate; |
|
— |
reprezentarea grafică a relației concentrație/efect; |
|
— |
estimări ale punctelor stoechiometrice toxice pentru variabile de răspuns, cum ar fi EC50, EC10, EC20 și intervalele de încredere aferente. Dacă au fost calculate, CMEO și/sau CFEO și metodele statistice folosite pentru determinarea acestora; |
|
— |
dacă s-a folosit ANOVA, dimensiunea efectului care poate fi detectat (de exemplu, diferența cea mai puțin semnificativă); |
|
— |
orice stimulare a creșterii constatată în cazul oricărui tratament; |
|
— |
orice indicii vizuale de fitotoxicitate, precum și observările soluțiilor de testat; |
|
— |
discutarea rezultatelor, inclusiv orice influență asupra rezultatului testului manifestată ca urmare a abaterilor de la prezenta metodă de testare. |
4. REFERINȚE BIBLIOGRAFICE
|
1. |
OECD TG 221 (2006) Lemna Sp. Growth Inhibition Test |
|
2. |
The use of Lemna studies for coloured substances is detailed in Section 13.5.3 of the EU Manual of Decisions dated July 2006, at http://ecb.jrc.ec.europa.eu/new-chemicals |
|
3. |
Guidance on information requirements and chemical safety assessment – Chapter R.7b: Endpoint specific guidance; Table 7.8.3 Summary of difficult substance testing issues, available at http://guidance.echa.europa.eu/docs/guidance_document/information_requirements_en.htm?time=1234958685#A |
|
4. |
ASTM International. (2003). Standard Guide for Conducting Static Toxicity Test With Lemna gibba G3. E 1415-91 (Reapproved 1998). p. 733-742. In, Annual Book of ASTM Standards, Vol. 11.05 Biological Effects and Environmental Fate; Biotechnology; Pesticides, ASTM, West Conshohocken, PA. |
|
5. |
USEPA – United States Environmental Protection Agency. (1996). OPPTS 850.4400 Aquatic Plant Toxicity Test Using Lemna spp., „Public draft”. EPA 712-C-96-156. 8 p. |
|
6. |
AFNOR – Association Française de Normalisation. (1996). XP T 90-337: Détermination de l’inhibition de la croissance de Lemna minor. 10 p. |
|
7. |
SSI – Swedish Standards Institute. (1995). Water quality – Determination of growth inhibition (7-d) Lemna minor, duckweed. SS 02 82 13. 15 p. (în limba suedeză). |
|
8. |
Environment Canada. (1999). Biological Test Method: Test for Measuring the Inhibition of Growth Using the Freshwater Macrophyte, Lemna minor. EPS 1/RM/37-120 p. |
|
9. |
Environment Canada. (1993) Proposed Guidelines for Registration of Chemical Pesticides: Non-Target Plant Testing and Evaluation. Canadian Wildlife Service, Technical Report Series No. 145. |
|
10. |
Sims I., Whitehouse P., and Lacey R. (1999) The OECD Lemna Growth Inhibition Test. Development and Ring-testing of draft OECD Test Guideline. R&D Technical Report EMA 003. WRc plc – Environment Agency. |
|
11. |
OECD (2000). Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. OECD Environmental Health and Safety Publications, Series on Testing and Assessment No.23. |
|
12. |
ISO DIS 20079. Water Quality – Determination of the Toxic Effect of Water Constituents and Waste Water to Duckweed (Lemna minor) – Duckweed Growth Inhibition Test. |
|
13. |
Walbridge C. T. (1977). A flow-through testing procedure with duckweed (Lemna minor). Environmental Research Laboratory – Duluth, Minnesota 55804. US EPA Report No. EPA-600/3-77 108. September 1977. |
|
14. |
Lockhart W. L., Billeck B. N. and Baron C. L. (1989). Bioassays with a floating plant (Lemna minor) for effects of sprayed and dissolved glyphosate. Hydrobiologia, 118/119, 353-359. |
|
15. |
Huebert, D.B. and Shay J.M. (1993) Considerations in the assessment of toxicity using duckweeds. Environmental Toxicology and Chemistry, 12, 481-483. |
|
16. |
Christensen, E.R., Nyholm, N. (1984): Ecotoxicological Assays with Algae: Weibull Dose-Response Curves. Env. Sci. Technol. 19, 713-718. |
|
17. |
Nyholm, N. Sørensen, P.S., Kusk, K.O. and Christensen, E.R. (1992): Statistical treatment of data from microbial toxicity tests. Environ. Toxicol. Chem. 11, 157-167. |
|
18. |
Bruce R.D. and Versteeg D.J. (1992) A statistical procedure for modelling continuous toxicity data. Environmental Toxicology and Chemistry, 11, 1485-1494. |
|
19. |
OECD. (2004). Guidance Document on Statistical Analysis of Ecotoxicity Data. |
|
20. |
Norberg-King T.J. (1988) An interpolation estimate for chronic toxicity: The ICp approach. National Effluent Toxicity Assessment Center Technical Report 05-88. USEPA, Duluth, MN. |
|
21. |
Dunnett, C.W. (1955) A multiple comparisons procedure for comparing several treatments with a control. J. Amer. Statist. Assoc., 50, 1096-1121. |
|
22. |
Dunnett, C.W. (1964) New tables for multiple comparisons with a control. Biometrics, 20, 482-491. |
|
23. |
Williams, D.A. (1971) A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics, 27: 103-117. |
|
24. |
Williams, D.A. (1972) The comparison of several dose levels with a zero dose control. Biometrics, 28: 510-531. |
|
25. |
Brain P. and Cousens R. (1989). An equation to describe dose-responses where there is stimulation of growth at low doses. Weed Research, 29, 93-96. |
Apendicele 1
Descrierea speciilor de Lemna
Planta acvatică denumită uzual lintiță, specia Lemna, aparține familiei Lemnaceae, care conține un număr de specii grupate în patru genuri, răspândite în întreaga lume. Aspectul și taxonomia lor variate au fost descrise pe larg (1)(2). Lemna gibba și L. minor sunt specii reprezentative pentru zonele temperate, fiind folosite în mod obișnuit pentru teste de toxicitate. Ambele specii au o tulpină discoidală plutitoare sau submersă (frondă) și o rădăcină foarte subțire provenind din centrul suprafeței inferioare a fiecărei fronde. Speciile de Lemna înfloresc rareori, iar plantele se reproduc prin înmulțire vegetativă, producând fronde noi (3). În comparație cu plantele mai în vârstă, cele tinere tind să fie mai deschise la culoare, au rădăcini mai scurte și 2-3 fronde de dimensiuni diferite. Ca urmare a dimensiunii reduse a Lemna, structurii sale simple, reproducerii asexuate și duratei scurte a unei generații, plantele acestui gen sunt adecvate în mare măsură testelor de laborator (4)(5).
Ca urmare a variației probabile între specii în ceea ce privește sensibilitatea, sunt valide doar comparațiile de sensibilitate realizate în cadrul aceleiași specii.
Exemple ale speciilor de Lemna folosite pentru testare: referințe bibliografice privind speciile
Lemna aequinoctialis: Eklund, B. (1996). The use of the red alga Ceramium strictum and the duckweed Lemna aequinoctialis in aquatic ecotoxicological bioassays. Licentiate in Philosophy Thesis 1996:2. Dep. of Systems Ecology, Stockholm University.
Lemna major: Clark, N. A. (1925). The rate of reproduction of Lemna major as a function of intensity and duration of light. J. phys. Chem., 29: 935-941.
Lemna minor: United States Environmental Protection Agency (USEPA). (1996). OPPTS 850.4400 Aquatic Plant Toxicity Test Using Lemna spp., „Public draft”. EPA 712-C-96-156. 8 p.
Association Française de Normalisation (AFNOR). (1996). XP T 90-337: Détermination de l’inhibition de la croissance de Lemna minor. 10 p.
Swedish Standards Institute (SIS). (1995). Water quality – Determination of growth inhibition (7-d) Lemna minor, duckweed. SS 02 82 13. 15 p. (în limba suedeză).
Lemna gibba: ASTM International. (2003). Standard Guide for Conducting Static Toxicity Test With Lemna gibba G3. E 1415-91 (Reapproved 1998). p. 733-742.
United States Environmental Protection Agency (USEPA). (1996). OPPTS 850.4400 Aquatic Plant Toxicity Test Using Lemna spp., „Public draft”. EPA 712-C-96-156. 8 p.
Lemna paucicostata: Nasu, Y., Kugimoto, M. (1981). Lemna (duckweed) as an indicator of water pollution. I. The sensitivity of Lemna paucicostata to heavy metals. Arch. Environ. Contam. Toxicol., 10:1959-1969.
Lemna perpusilla: Clark, J. R. et al. (1981). Accumulation and depuration of metals by duckweed (Lemna perpusilla). Ecotoxicol. Environ. Saf., 5:87-96.
Lemna trisulca: Huebert, D. B., Shay, J. M. (1993). Considerations in the assessment of toxicity using duckweeds. Environ. Toxicol. and Chem., 12:481-483.
Lemna valdiviana: Hutchinson, T.C., Czyrska, H. (1975). Heavy metal toxicity and synergism to floating aquatic weeds. Verh.-Int. Ver. Limnol., 19:2102-2111.
Surse ale speciilor de Lemna
|
Colecția de culturi de alge și cianobacterii a Universității din Toronto |
|
Departamentul de botanică, Universitatea din Toronto |
|
Toronto, Ontario, Canada, M5S 3 B2 |
|
Tel: +1-416-978-3641 |
|
Fax: +1-416-978-5878 |
|
e-mail: jacreman@botany.utoronto.ca |
|
http://www.botany.utoronto.ca/utcc |
|
Universitatea de stat din Carolina de Nord |
|
Departamentul forestier |
|
Colecția de culturi de lintiță |
|
Campus Box 8002 |
|
Raleigh, NC 27695-8002 |
|
Statele Unite ale Americii |
|
Telefon: 001 (919) 515-7572 |
|
astomp@unity.ncsu.edu |
|
Institutul de cercetare aplicată a mediului (ITM), Universitatea din Stockholm |
|
SE-106 91 STOCKHOLM |
|
SUEDIA |
|
Tel: +46 8 674 7240 |
|
Fax +46 8 674 7636 |
|
Agenția Federală de Mediu (UBA) |
|
FG III 3.4 |
|
Schichauweg 58 |
|
12307 Berlin |
|
Germania |
|
e-mail: lemna@uba.de |
|
http://www.umweltbundesamt.de/contact.htm |
REFERINȚE BIBLIOGRAFICE
|
1. |
Hillman, W.S. (1961). The Lemnaceae or duckweeds: A review of the descriptive and experimental literature. The Botanical Review, 27:221-287. |
|
2. |
Landolt, E. (1986). Biosystematic investigations in the family of duckweed (Lemnaceae). Vol. 2. Geobotanischen Inst. ETH, Stiftung Rubel, Zürich, Switzerland. |
|
3. |
Björndahl, G. (1982). Growth performance, nutrient uptake and human utilization of duckweeds (Lemnaceae family). ISBN 82-991150-0-0. Consiliul Norvegian pentru Cercetări în Agricultură, Universitatea din Oslo. |
|
4. |
Wang, W. (1986). Toxicity tests of aquatic pollutants by using common duckweed. Environmental Pollution, Ser B, 11:1-14. |
|
5. |
Wang, W. (1990). Literature review on duckweed toxicity testing. Environmental Research, 52:7-22. |
Apendicele 2
Întreținerea culturii mamă
Culturile mamă pot fi păstrate la temperaturi scăzute (4-10 °C) pentru perioade îndelungate de timp, fără a fi necesară refacerea. Mediul de cultură al Lemna poate fi similar celui folosit pentru testare, dar pentru culturile mamă pot fi folosite alte medii bogate în substanțe nutritive.
Un număr de plante tinere, de culoare verde-deschis, se transferă periodic, folosind o tehnică aseptică, în vase noi de cultură care conțin un mediu proaspăt. În condițiile de temperatură scăzută descrise anterior, subcultivarea poate avea loc la intervale de până la trei luni.
Se folosesc vase de cultură din sticlă, curate din punct de vedere chimic (curățate cu acid) și sterile, precum și tehnici de manipulare aseptică. În cazul contaminării culturii mamă, de exemplu cu alge sau ciuperci, organismele contaminante se elimină. În cazul algelor și al majorității celorlalte organisme contaminante, eliminarea are loc prin sterilizare de suprafață. Se recoltează un eșantion de material vegetal contaminat și se taie rădăcinile. Materialul se agită apoi energic în apă curată și se introduce într-o soluție de hipoclorit de sodiu 0,5 % (v/v) pentru o perioadă cuprinsă între 30 de secunde și 5 minute. Materialul vegetal se clătește apoi cu apă sterilă și se transferă, sub formă de loturi, în vase de cultură conținând mediu de cultură proaspăt. Un număr mare de fronde vor muri ca urmare a acestui tratament, în special dacă se folosesc perioade de expunere mai lungi, dar unele dintre cele care supraviețuiesc vor fi de obicei necontaminate. Acestea pot fi folosite ulterior pentru reinocularea noilor culturi.
Apendicele 3
Medii
Pentru L. minor și L. gibba se recomandă medii de cultură diferite. În cazul L. Minor se recomandă un mediu modificat conform standardului suedez (SIS), în timp ce pentru L. gibba se recomandă mediul 20X AAP. Compozițiile ambelor medii sunt prezentate mai jos. Pentru pregătirea acestor medii se folosesc reactivi sau substanțe chimice de puritate analitică și apă deionizată.
Mediul de cultură pentru Lemna conform standardului suedez (SIS)
|
— |
Soluțiile mamă nr. I-V se sterilizează prin autoclavare (120 °C, 15 minute) sau prin filtrare prin membrană (diametrul porilor de aproximativ 0,2 μm). |
|
— |
Soluția mamă nr. VI (și, opțional, nr. VII) se sterilizează exclusiv prin filtrare prin membrană; aceste soluții nu se autoclavează. |
|
— |
Soluțiile mamă sterile se păstrează la întuneric și temperaturi scăzute. Soluțiile mamă nr. I-V se elimină după șase luni, în timp ce soluțiile mamă nr. VI (și, opțional, nr. VII) au o perioadă de valabilitate de o lună.
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
— |
Pentru pregătirea unui litru de mediu SIS se adaugă următoarele soluții la 900 ml apă deionizată:
Notă: O soluție mamă suplimentară nr. VII (soluție tampon MOPS) poate fi necesară pentru anumite substanțe testate (a se vedea punctul 1.4 ultimul paragraf). |
|
— |
pH-ul se ajustează la valoarea de 6,5 ± 0,2 cu soluție de HCl sau NaOH 0,1 sau 1 mol, iar volumul se completează până la 1 litru cu apă deionizată. |
Mediul de cultură 20X AAP
Soluțiile mamă se prepară în apă distilată sau deionizată sterilă.
Soluțiile mamă sterile se păstrează la întuneric și temperatură scăzută. În aceste condiții, soluțiile mamă au un termen de valabilitate de cel puțin 6-8 săptămâni.
Pentru mediul 20X-AAP se pregătesc cinci soluții mamă nutritive (A1, A2, A3, B și C), folosindu-se substanțe chimice de puritate analitică. Pentru obținerea mediului de cultură se adaugă 20 ml din fiecare soluție mamă nutritivă la aproximativ 850 ml apă deionizată. pH-ul este ajustat la 7,5 ± 0,1 cu soluție de HCl sau NaOH 0,1 sau 1 mol, iar volumul se completează până la 1 litru cu apă deionizată. Mediul se filtrează apoi într-un recipient steril printr-un filtru cu membrană de (aproximativ) 0,2 μm.
Pentru a permite stabilizarea pH-ului, mediul de cultură pentru testare se prepară cu 1-2 zile înainte de utilizare. pH-ul mediului de cultură se verifică înainte de utilizare și se reajustează, dacă este necesar, prin adăugarea de soluție de HCl sau NaOH 0,1 sau 1 mol, conform descrierii de mai sus.
|
Soluția mamă nr. |
Substanța |
Concentrația în soluția mamă (g·l–1) (1) |
Concentrația în mediul preparat (mg·l–1) (1) |
Mediu preparat |
|
|
Element |
Concentrație (mg·l–1) (1) |
||||
|
A1 |
NaNO3 MgCl2·6H2O CaCl2·2H2O |
26 12 4,4 |
510 240 90 |
Na; N Mg Ca |
190; 84 58,08 24,04 |
|
A2 |
MgSO4·7H2O |
15 |
290 |
S |
38,22 |
|
A3 |
K2HPO4·3H2O |
1,4 |
30 |
K; P |
9,4;3,7 |
|
B |
H3BO3 MnCl2·4H2O FeCl3·6H2O Na2EDTA·2H2O ZnCl2 CoCl2·6H2O Na2MoO4·2H2O CuCl2·2H2O |
0,19 0,42 0,16 0,30 3,3 mg·l–1 1,4 mg·l–1 7,3 mg·l–1 0,012 mg·l–1 |
3,7 8,3 3,2 6,0 66 μg·l–1 29 μg·l–1 145 μg·l–1 0,24 μg·l–1 |
B Mn Fe — Zn Co Mo Cu |
0,65 2,3 0,66 — 31 μg·l–1 7,1 μg·l–1 58 μg·l–1 0,080 μg·l–1 |
|
C |
NaHCO3 |
15 |
300 |
Na; C |
220; 43 |
Notă: Concentrația finală de bicarbonat adecvată din punct de vedere teoretic (care va evita ajustarea semnificativă a pH-ului) este de 15 mg/l, nu de 300 mg/l. Cu toate acestea, utilizarea anterioară a mediului 20X-AAP, inclusiv testul interlaboratoare pentru această metodă, a luat în calcul concentrația de 300 mg/l. [I. Sims, P. Whitehouse și R. Lacey. (1999) The OECD Lemna Growth Inhibition Test. Development and Ring-testing of draft OECD Test Guideline. R&D Technical Report EMA 003. WRc plc – Environment Agency].
Mediul STEINBERG (conform ISO 20079)
Concentrații și soluții mamă
|
— |
Mediul Steinberg modificat este prevăzut în ISO 20079 exclusiv pentru Lemna minor (deoarece doar Lemna minor este permisă în acest caz), dar testele au arătat că pot fi obținute bune rezultate și în cazul Lemna gibba. |
|
— |
Pentru pregătirea acestui mediu se folosesc reactivi sau substanțe chimice de puritate analitică și apă deionizată. |
|
— |
Se prepară mediul nutritiv din soluțiile mamă sau din mediul cu o concentrație de 10 ori mai mare care permite concentrarea maximă a mediului fără precipitare. |
Tabelul 1
Mediu Steinberg cu pH stabilizat (modificat potrivit lui Altenburger)
|
Substanță |
Mediu nutritiv |
||
|
Macroelemente |
Masă molară |
mg/l |
mmol/l |
|
KNO3 |
101,12 |
350,00 |
3,46 |
|
Ca(NO3)2 · 4H2O |
236,15 |
295,00 |
1,25 |
|
KH2PO4 |
136,09 |
90,00 |
0,66 |
|
K2HPO4 |
174,18 |
12,60 |
0,072 |
|
MgSO4 · 7H2O |
246,37 |
100,00 |
0,41 |
|
Microelemente |
Masă molară |
µg/l |
µmol/l |
|
H3BO3 |
61,83 |
120,00 |
1,94 |
|
ZnSO4 · 7H2O |
287,43 |
180,00 |
0,63 |
|
Na2MoO4 · 2H2O |
241,92 |
44,00 |
0,18 |
|
MnCl2 · 4H2O |
197,84 |
180,00 |
0,91 |
|
FeCl3 · 6H2O |
270,21 |
760,00 |
2,81 |
|
EDTA disodic-dihidrat |
372,24 |
1 500,00 |
4,03 |
Tabelul 2
Soluții mamă (Macroelemente)
|
g/l |
||
|
Soluție mamă nr. 1: |
|||
|
KNO3 |
17,50 |
||
|
KH2PO4 |
4,5 |
||
|
K2HPO4 |
0,63 |
||
|
Soluție mamă nr. 2: |
|||
|
MgSO4 · 7H2O |
5,00 |
||
|
Soluție mamă nr. 3: |
|||
|
Ca(NO3)2 · 4H2O |
14,75 |
||
Tabelul 3
Soluții mamă (Microelemente)
|
mg/l |
||
|
Soluție mamă nr. 4: |
|||
|
H3BO3 |
120,0 |
||
|
Soluție mamă nr. 5: |
|||
|
ZnSO4 · 7H2O |
180,0 |
||
|
Soluție mamă nr. 6: |
|||
|
Na2MoO4 · 2H2O |
44,0 |
||
|
Soluție mamă nr. 7: |
|||
|
MnCl2 · 4H2O |
180,0 |
||
|
Soluție mamă nr. 8: |
|||
|
FeCl3 · 6H2O |
760,00 |
||
|
EDTA Disodic-dihidrat |
1 500,00 |
||
|
— |
Soluțiile mamă nr. 2 și 3, pe de o parte, și 4-7, pe de altă parte, pot fi combinate (respectând concentrațiile prevăzute). |
|
— |
Pentru obținerea unei perioade de valabilitate mai lungi, soluțiile mamă se autoclavează la 121 °C timp de 20 de minute sau, alternativ, se filtrează steril (0,2 µm). Filtrarea sterilă (0,2 µm) este ferm recomandată în cazul soluției mamă nr. 8. |
Prepararea concentrației finale a mediului STEINBERG (modificat)
|
— |
Se adaugă 20 ml de soluții mamă nr. 1, 2 și 3 (a se vedea tabelul 2) la aproximativ 900 ml apă deionizată, pentru a se evita precipitarea. |
|
— |
Se adaugă 1,0 ml de soluții mamă nr. 4, 5, 6, 7 și 8 (a se vedea tabelul 3). |
|
— |
pH-ul trebuie să aibă valoarea de 5,5 ± 0,2 (se ajustează prin adăugarea unui volum minim de soluție de NaOH sau HCl). |
|
— |
Se completează cu apă până la 1 000 ml. |
|
— |
Dacă soluțiile mamă sunt sterilizate și se folosește cantitatea de apă adecvată, nu este necesară sterilizarea suplimentară. Dacă mediul final este sterilizat, soluția mamă nr. 8 se adaugă după autoclavare (121 °C, timp de 20 min.). |
Prepararea mediului STEINBERG (modificat) de 10 ori mai concentrat pentru depozitare intermediară
|
— |
Se adaugă 20 ml de soluții mamă nr. 1, 2 și 3 (a se vedea tabelul 2) la aproximativ 30 ml apă deionizată pentru a se evita precipitarea. |
|
— |
Se adaugă 1,0 ml de soluții mamă nr. 4, 5, 6, 7 și 8 (a se vedea tabelul 3). Se completează cu apă până la 100 ml. |
|
— |
Dacă soluțiile mamă sunt sterilizate și se folosește cantitatea de apă adecvată, nu este necesară sterilizarea suplimentară. Dacă mediul final este sterilizat, soluția mamă nr. 8 se adaugă după autoclavare (la 121 °C, timp de 20 min). |
|
— |
pH-ul mediului (concentrația finală) trebuie să aibă valoarea de 5,5 ± 0,2. |
(1) În lipsa altor mențiuni.