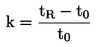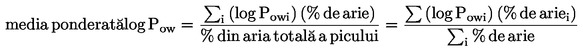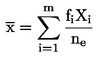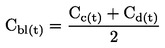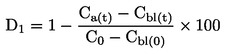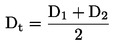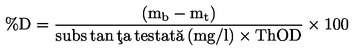|
(6)
|
Se adaugă următoarele capitole de la C.31 până la C.46: „C.31. TEST PE PLANTĂ TERESTRĂ: TEST DE APARIȚIE A PLANTULELOR ȘI DE CREȘTERE A PLANTULELOR
INTRODUCERE
|
1.
|
Prezenta metodă de testare este echivalentă cu Orientarea OCDE privind testarea (TG) nr. 208 (2006). Metodele de testare se revizuiesc periodic în lumina progreselor științifice și a aplicabilității în practica de reglementare. Prezenta metodă de testare actualizată are ca obiect evaluarea potențialelor efecte ale substanțelor chimice asupra apariției și creșterii plantulelor. Ea nu acoperă totuși efectele cronice sau efectele asupra reproducerii (adică formarea semințelor, formarea florilor, maturarea fructelor). Trebuie să se țină cont de condițiile de expunere și de proprietățile substanței chimice de testare pentru a asigura utilizarea unor metode de testare adecvate (de exemplu, atunci când se testează metale/compuși metalici, trebuie avute în vedere efectele de pH și ale contraionilor asociați) (1). Prezenta metodă de testare nu se aplică plantelor expuse la vapori de substanțe chimice. Ea se aplică testării substanțelor chimice generale, biocidelor și produselor de protecție a plantelor (cunoscute și sub denumirea de produse de uz fitosanitar sau de pesticide). Metoda a fost elaborată pe baza metodelor existente (2) (3) (4) (5) (6) (7). Au fost luate în considerare și alte referințe pertinente în materie de testare pe plante (8) (9) (10). Definițiile utilizate sunt prezentate în apendicele 1.
|
PRINCIPIUL TESTULUI
|
2.
|
Testul evaluează efectele expunerii la substanța chimică de testare aflată în sol (sau altă matrice de sol adecvată) asupra apariției plantulelor și a începutului creșterii unor plante mai înalte. Semințele se pun în contact cu solul tratat cu substanța chimică de testare, iar efectele se evaluează în general după 14-21 de zile de la apariția a 50 % dintre plantulele din grupul de control. Punctele finale măsurate sunt evaluarea vizuală a apariției plantulelor, greutatea uscată a lăstarilor (sau greutatea în stare proaspătă a lăstarilor) și, în unele cazuri, înălțimea lăstarilor, precum și o evaluare a efectelor nocive vizibile pe diferite părți ale plantei. Aceste măsurători și observații se compară cu cele efectuate pe plante de control netratate.
|
|
3.
|
În funcție de calea de expunere așteptată, substanța chimică de testare fie se încorporează în sol (sau eventual în matricea de sol artificial), fie se aplică pe suprafața solului, ceea ce reprezintă exact potențiala cale de expunere la substanța chimică. Încorporarea în sol se realizează prin tratarea solului brut. După aplicare, solul se transferă în vase, după care se plantează în sol semințele speciei de plantă date. Aplicarea pe suprafață se realizează pe solul din vase în care au fost plantate deja semințele. Unitățile de testare (probele de control și solurile tratate plus semințele) se plasează în condiții adecvate care să favorizeze germinarea/creșterea plantelor.
|
|
4.
|
În funcție de obiectivul studiului, testul poate fi efectuat pentru a determina curba doză-răspuns sau poate fi efectuat la o concentrație/rată unică sub forma unui test la valori-limită. Dacă valorile rezultate în urma unui test la concentrație/rată unică depășesc un anumit nivel de toxicitate (de exemplu, atunci când se observă efecte mai mari decât x %), se realizează un test de stabilire a intervalului pentru a determina limitele superioare și inferioare ale toxicității, urmat de un test la mai multe concentrații/rate pentru a genera curba doză-răspuns. O analiză statistică adecvată permite calcularea unei concentrații efective ECx sau a unei rate efective de aplicare ERx (de exemplu EC25, ER25, EC50, ER50) pentru parametrul sau parametrii de interes cei mai sensibili. De asemenea, prezentul test permite calcularea valorilor pentru concentrația la care nu se observă niciun efect (NOEC) și pentru concentrația cea mai scăzută pentru care este observat un efect (LOEC).
|
INFORMAȚII PRIVIND SUBSTANȚA CHIMICĂ DE TESTARE
|
5.
|
Următoarele informații sunt utile pentru identificarea căii de expunere așteptate la substanța chimică și pentru proiectul testului: formula structurală, puritatea, solubilitatea în apă, solubilitatea în solvenți organici, coeficientul de partiție 1-octanol/apă, comportamentul de absorbție în sol, presiunea de vapori, stabilitatea chimică în apă și la lumină și biodegradabilitatea.
|
VALIDITATEA TESTULUI
|
6.
|
Pentru ca testul să fie valid, probele de control trebuie să îndeplinească următoarele criterii de performanță:
|
—
|
apariția plantulelor este de cel puțin 70 %;
|
|
—
|
plantulele nu prezintă efecte fitotoxice vizibile (de exemplu cloroză, necroză, ofilire, deformări ale frunzelor și tulpinilor), iar plantele prezintă doar o variație normală a creșterii și morfologiei pentru respectiva specie;
|
|
—
|
media de supraviețuire a plantulelor de control apărute este de cel puțin 90 % pe durata studiului;
|
|
—
|
condițiile de mediu pentru o anumită specie sunt identice, iar mediile de cultură conțin aceeași cantitate de matrice de sol, mediu de susținere sau substrat din aceeași sursă.
|
|
SUBSTANȚA CHIMICĂ DE REFERINȚĂ
|
7.
|
O substanță chimică de referință poate fi testată la intervale regulate pentru a verifica dacă performanța testului și răspunsul plantelor de testare în cauză, precum și condițiile de testare nu s-au modificat semnificativ în timp. O altă opțiune ar fi utilizarea măsurătorilor anterioare ale biomasei și creșterii pentru a evalua performanța sistemului de testare, în special laboratoare, și poate servi ca măsură de control al calității intralaboratoare.
|
DESCRIEREA METODEI
Sol natural – Substrat artificial
|
8.
|
Plantele pot fi cultivate în vase conținând lut nisipos, nisip lutos sau lut argilos-nisipos care conține până la 1,5 % carbon organic (aprox. 3 % materie organică). Se poate utiliza și pământ de ghiveci din comerț sau un amestec de sol sintetic care să conțină până la 1,5 % carbon organic. Solurile argiloase nu trebuie utilizate dacă se știe că substanța chimică de testat are o afinitate mare pentru argile. Solul natural trebuie cernut în particule de 2 mm pentru a-l omogeniza și a îndepărta particulele mari. Trebuie raportate tipul și textura, % de carbon organic, pH-ul și conținutul de sare drept conductivitate electronică a solului final preparat. Solul trebuie clasificat în conformitate cu o schemă de clasificare standard (11). Solul poate fi pasteurizat sau tratat termic pentru a reduce efectul patogenilor din sol.
|
|
9.
|
Solul natural poate complica interpretarea rezultatelor și poate crește variabilitatea din cauza proprietăților fizice/chimice variate și a populațiilor microbiene. În schimb, aceste variabile modifică capacitatea de reținere a umidității, capacitatea de a crea legături chimice, aerarea și conținutul de nutrienți și oligoelemente. Pe lângă variația acestor factori fizici, va exista și o variație a proprietăților chimice cum ar fi pH-ul și potențialul redox, care poate afecta biodisponibilitatea substanței chimice de testare (12) (13) (14).
|
|
10.
|
În general, substraturile artificiale nu se utilizează pentru testarea produselor de protecție a plantelor, dar pot fi utile pentru testarea de substanțe chimice generale sau atunci când se dorește să se reducă la minimum variabilitatea solurilor naturale și să se amelioreze comparabilitatea rezultatelor testului. Substraturile utilizate trebuie să fie compuse din materiale inerte care să reducă la minimum interacțiunea cu substanța chimică de testare, cu solventul purtător sau cu ambele. S-a demonstrat că nisipul cuarțos spălat cu acid, lâna minerală și bilele de sticlă (de exemplu, cu diametru cuprins între 0,35 și 0,85 mm) reprezintă materiale inerte adecvate care absorb foarte puțin substanța chimică de testare (15), asigurând disponibilitatea maximală a substanței chimice pentru plantule prin absorbție radiculară. Printre substraturile necorespunzătoare se numără vermiculitul, perlitul sau alte materiale puternic absorbante. Aportul de nutrienți favorabili creșterii plantelor va asigura faptul că plantele nu sunt stresate din cauza carențelor nutritive și, dacă este posibil, acest lucru trebuie evaluat prin analize chimice sau prin inspecții vizuale ale plantelor de control.
|
Criterii pentru selectarea speciei de testare
|
11.
|
Specia selectată trebuie să aibă o răspândire rezonabilă, de exemplu, având în vedere diversitatea taxonomică în regnul vegetal, distribuția, abundența, caracteristicile ciclului de viață specifice speciei și regiunea de ocurență naturală, pentru a dezvolta o serie de răspunsuri (8) (10) (16) (17) (18) (19) (20). Pentru selectare, trebuie avute în vedere următoarele caracteristici ale posibilelor specii de testare:
|
—
|
speciile au semințe uniforme care sunt ușor disponibile la surse de semințe standard fiabile și care produc o germinare regulată, fiabilă și uniformă, precum și o creștere uniformă a plantulelor;
|
|
—
|
planta este adaptată la testele de laborator și poate genera rezultate fiabile și reproductibile în cadrul centrelor de testare și între centrele de testare;
|
|
—
|
sensibilitatea speciei testate trebuie să corespundă răspunsurilor plantelor care se găsesc în mediul expus la substanța chimică;
|
|
—
|
au fost utilizate într-o anumită măsură în teste anterioare de stabilire a toxicității, iar utilizarea lor, de exemplu, în teste biologice ale erbicidelor, depistarea metalelor grele, teste de stres salin sau mineral sau studii de alelopatie indică sensibilitatea la o gamă largă de agenți stresanți;
|
|
—
|
sunt compatibile cu condițiile de creștere ale metodei de testare;
|
|
—
|
îndeplinesc criteriile de validitate ale testului.
|
Unele dintre speciile de testare cele mai utilizate în trecut sunt enumerate în apendicele 2, iar eventualele specii necultivate sunt enumerate în apendicele 3.
|
|
12.
|
Numărul de specii care trebuie testat depinde de cerințele de reglementare relevante și, prin urmare, nu este specificat în prezenta metodă de testare.
|
Aplicarea substanței chimice de testare
|
13.
|
Substanța chimică trebuie aplicată într-un purtător adecvat (de exemplu, apă, acetonă, etanol, polietilenglicol, gumă arabică, nisip). Pot fi testate și amestecurile (produse formulate sau formule) care conțin ingrediente active și diverși adjuvanți.
|
Încorporarea în sol/substratul artificial
|
14.
|
Substanțele chimice care sunt solubile în apă sau în suspensie în apă pot fi adăugate în apă, iar soluția se amestecă apoi cu sol, utilizând un dispozitiv de amestecare adecvat. Acest tip de test poate fi potrivit în cazul în care expunerea la substanța chimică se face prin sol sau apă interstițială din sol și dacă există riscuri de absorbție radiculară. Capacitatea solului de reținere a apei nu trebuie depășită prin adăugarea substanței chimice de testare. Volumul de apă adăugat trebuie să fie identic pentru fiecare concentrație de testare, însă trebuie să fie limitat pentru a împiedica aglomerarea solului.
|
|
15.
|
Substanțele chimice cu solubilitate scăzută în apă trebuie dizolvate într-un solvent volatil adecvat (de exemplu acetonă, etanol) și amestecate cu nisip. Apoi solventul poate fi eliminat din nisip utilizând un curent de aer și amestecând continuu nisipul. Nisipul tratat se amestecă cu solul experimental. Se pregătește o a doua probă de control care trebuie să conțină numai nisip și solvent. La toate nivelurile de tratament și în a doua probă de control se adaugă cantități egale de nisip, cu solvent amestecat și eliminat. Pentru substanțele chimice de testare solide insolubile, se amestecă sol uscat cu substanța chimică utilizând un dispozitiv de amestecare adecvat. Ulterior, solul se adaugă în vase, iar semințele se plantează imediat.
|
|
16.
|
Atunci când în loc de sol se utilizează substrat artificial, substanțele chimice care sunt solubile în apă pot fi dizolvate în soluția nutritivă chiar înainte de începerea testului. Substanțele chimice care nu sunt solubile în apă, dar care pot fi puse în suspensie în apă cu ajutorul unui solvent purtător trebuie adăugate împreună cu purtătorul în soluția nutritivă. Substanțele chimice insolubile în apă, pentru care nu există niciun purtător netoxic solubil în apă, trebuie dizolvate într-un solvent volatil adecvat. Soluția se amestecă cu nisip sau bile de sticlă, se introduce într-un aparat rotativ cu vacuum și se evaporă, lăsând un strat uniform de substanță chimică pe nisip sau pe bile. O parte cântărită de bile se extrage cu ajutorul aceluiași solvent organic, iar substanța chimică se analizează înainte de umplerea vaselor.
|
Aplicarea la suprafață
|
17.
|
În cazul produselor de protecție a plantelor, aplicarea substanței chimice de testare se efectuează adesea prin pulverizarea suprafeței solului cu soluția de testare. Modelul și capacitatea tuturor echipamentelor utilizate pentru derularea testului, inclusiv ale echipamentelor utilizate pentru prepararea și administrarea substanței chimice de testare, trebuie să permită efectuarea cu precizie a testului și obținerea unei acoperiri reproductibile. Acoperirea trebuie să fie uniformă pe suprafețele de sol. Trebuie acordată atenție pentru a evita eventualele interacțiuni prin absorbție sau reacție dintre substanțele chimice și echipamente (de exemplu, tuburi de plastic și substanțe chimice lipofile sau piese și elemente din oțel). Substanța chimică de testare se pulverizează pe suprafața solului simulând aplicările obișnuite cu cisternă de pulverizare. În general volumele pulverizate trebuie să se încadreze în intervalul utilizat în practica agricolă obișnuită, iar aceste volume (cantitatea de apă etc.) trebuie raportate. Pentru a asigura o acoperire uniformă a suprafeței solului trebuie ales tipul de duză. Dacă se aplică solvenți și purtători, trebuie stabilit un al doilea grup de plante de control care să primească doar solventul/purtătorul. Acest lucru nu este necesar pentru produsele de protecție a plantelor care sunt testate sub formă de formule.
|
Verificarea concentrației/ratei de substanță chimică de testare
|
18.
|
Concentrațiile/ratele de aplicare trebuie confirmate de o verificare analitică adecvată. Pentru substanțele chimice solubile, verificarea tuturor concentrațiilor/ratelor de testare poate fi confirmată prin analiza soluției de testare având cea mai mare concentrație utilizată în cadrul testului cu documentația privind diluarea ulterioară și utilizarea de echipamente de aplicare calibrate (de exemplu, vase analitice calibrate din sticlă, calibrarea echipamentelor de aplicare prin pulverizare). Pentru substanțele chimice insolubile, verificarea materialului compus trebuie făcută cu greutățile de substanță chimică adăugată în sol. Dacă este necesară demonstrarea omogenității, poate fi necesară analiza solului.
|
PROCEDURA
Proiectul testului
|
19.
|
Se plantează în vase semințe din aceeași specie. Numărul de semințe plantate în fiecare vas depinde de specie, de dimensiunea vasului și de durata testului. Numărul de plante din fiecare vas trebuie să asigure condiții de creștere adecvate și să evite aglomerarea pe durata testului. Densitatea maximă a plantelor ar fi de aproximativ 3-10 semințe la 100 cm2 în funcție de mărimea semințelor. De exemplu, se recomandă una sau două plante de porumb, soia, pătlăgea roșie, castravete sau sfeclă de zahăr la fiecare recipient de 15 cm, trei plante de rapiță sau mazăre la fiecare recipient de 15 cm și 5-10 plante de ceapă, grâu sau alte plante cu semințe mici la fiecare recipient de 15 cm. Numărul de semințe și de vase duplicat (duplicatul corespunde unui vas, prin urmare plantele din același vas nu constituie duplicate) ar trebui să fie adecvat pentru analiza statistică optimă (21). Trebuie remarcat faptul că variabilitatea va fi mai mare la speciile de testare care utilizează mai puține semințe mai mari în fiecare vas (duplicat) decât la speciile de testare unde este posibilă utilizarea unui număr mai mare de semințe mici în fiecare vas. Prin plantarea unui număr egal de semințe în fiecare vas această variabilitate poate fi redusă la minimum.
|
|
20.
|
Grupurile de control se utilizează pentru a asigura faptul că efectele observate sunt asociate sau se atribuie numai expunerii la substanța chimică de testare. Grupul de control adecvat trebuie să fie identic din toate privințele cu grupul de testare, cu excepția expunerii la substanța chimică de testare. În cadrul unui test dat, toate plantele de testare, inclusiv probele de control, trebuie să provină din aceeași sursă. Pentru a preveni deviațiile, este necesară repartiția aleatorie a vaselor de testare și a vaselor de control.
|
|
21.
|
Trebuie evitate semințele acoperite de insecticid sau fungicid (adică semințe «îmbrăcate»). Cu toate acestea, utilizarea anumitor fungicide cu contact nesistemic (de exemplu captan, thiram) este permisă de unele autorități de reglementare (22). Dacă patogenii proveniți din semințe reprezintă o problemă, semințele trebuie înmuiate pentru scurt timp într-o soluție de hipoclorit slabă cu concentrație de 5 %, apoi clătite bine sub jet de apă și uscate. Nu se permite niciun alt tratament curativ cu alte produse de protecție a plantelor.
|
Condițiile de testare
|
22.
|
Condițiile de testare trebuie să fie apropiate de condițiile necesare pentru creșterea normală a speciilor și soiurilor testate (în apendicele 4 sunt prezentate exemple de condiții de testare). Plantele emergente trebuie întreținute prin bune practici horticole în camere, fitotroane sau sere cu mediu controlat. Când se utilizează instalații de cultivare, printre aceste practici se numără verificarea și consemnarea cu o frecvență adecvată (de exemplu zilnică) a temperaturii, umidității, concentrației de dioxid de carbon, luminii (intensitatea, lungimea undei, radiația activă fotosintetică) și a perioadei de lumină, mijloace de irigare etc. pentru a asigura o bună creștere a plantelor estimată prin observarea plantelor de control din specia selectată. Temperaturile din sere trebuie controlate prin sisteme de ventilare, încălzire și/sau răcire. Pentru testarea în sere se recomandă în general următoarele condiții:
|
—
|
temperatură: 22 °C ± 10 °C;
|
|
—
|
umiditate: 70 % ± 25 %;
|
|
—
|
fotoperioadă: minimum 16 ore de lumină;
|
|
—
|
intensitate luminoasă: 350 ± 50 μE/m2/s. Ar putea fi necesară o iluminare suplimentară în cazul în care intensitatea scade sub 200 μE/m2/s, lungime de undă de 400-700 nm, cu excepția anumitor specii pentru care cerințele de lumină sunt mai scăzute.
|
Condițiile de mediu trebuie monitorizate și raportate pe parcursul studiului. Plantele trebuie cultivate în vase din plastic neporos sau în vase emailate, cu o tavă sau farfurie dedesubt. Vasele pot fi repoziționate periodic pentru a reduce la minimum variabilitatea creșterii în rândul plantelor (din cauza diferenței condițiilor de testare din instalațiile de cultivare). Vasele trebuie să fie suficient de mari pentru a permite creșterea normală.
|
|
23.
|
Pentru a menține o bună vigoare a plantelor, nutrienții solului pot fi suplimentați. Nevoia și momentul adăugării nutrienților suplimentari pot fi determinate prin observarea plantelor de control. Se recomandă alimentarea cu apă prin partea inferioară a recipientelor de testare (de exemplu utilizând meșe din fibră de sticlă). Cu toate acestea, se poate efectua o irigare inițială prin partea superioară pentru a stimula germinarea semințelor și, pentru aplicarea la suprafața solului, aceasta facilitează pătrunderea substanței chimice în sol.
|
|
24.
|
Condițiile de cultivare specifice trebuie să fie adecvate pentru speciile testate și pentru substanța chimică de testare supusă studiului. Plantele de control și plantele tratate trebuie ținute în condiții de mediu identice. Cu toate acestea, trebuie luate măsuri adecvate pentru a împiedica expunerea încrucișată (de exemplu a substanțelor chimice volatile) între diferite tratamente și a probelor de control la substanța chimică de testare.
|
Testarea la concentrație/rată unică
|
25.
|
Pentru a determina concentrația/rata adecvată de substanță chimică de testare pentru efectuarea unui test la concentrație/rată unică (de simulare/la valori-limită), trebuie avută în vedere o serie de factori. Pentru substanțele chimice generale, printre acești factori se numără proprietățile fizice/chimice ale substanței chimice. Pentru produsele de protecție a plantelor, trebuie avute în vedere proprietățile fizice/chimice și modelul de utilizare ale substanței chimice de testare, concentrația sau rata de aplicare maximă, numărul de aplicări pe sezon și/sau persistența substanței chimice de testat. Pentru a stabili dacă o substanță chimică generală prezintă proprietăți fitotoxice, ar putea fi adecvată testarea unui nivel maxim de 1 000 mg/kg de sol uscat.
|
Testul de stabilire a intervalului
|
26.
|
Atunci când este necesar, se poate realiza un test de stabilire a intervalului pentru a furniza orientări privind concentrațiile/ratele care vor fi testate în cadrul studiului doză-răspuns final. Pentru testul de stabilire a intervalului, intervalele dintre concentrațiile/ratele de testare trebuie să fie mari (de exemplu 0,1, 1,0, 10, 100 și 1 000 mg/kg sol uscat). Pentru produsele de protecție a plantelor, concentrațiile/ratele ar putea fi bazate pe concentrația sau rata de aplicare recomandată sau maximă, de exemplu 1/100, 1/10, 1/1 din concentrația sau rata de aplicare recomandată/maximă.
|
Testarea la mai multe concentrații/rate
|
27.
|
Scopul testului la mai multe concentrații/rate este de a stabili o relație doză-răspuns și de a determina o valoare ECx sau ERx legată de apariție, biomasă și/sau efectele vizuale în comparație cu probele de control neexpuse, conform cerințelor autorităților de reglementare.
|
|
28.
|
Numărul de concentrații sau rate și intervalul dintre ele trebuie să fie suficiente pentru a genera o relație doză-răspuns și o ecuație de regresie fiabile și pentru a estima ECx. sau ERx.. Concentrațiile/ratele selectate trebuie să încadreze valorile ECx sau ERx care trebuie determinate. De exemplu, dacă este necesară o valoare EC50, ar fi de preferat realizarea testului la rate care produc un efect cuprins între 20 și 80 %. Numărul recomandat de concentrații/rate de testare pentru a obține acest rezultat este de cel puțin cinci în serie geometrică plus proba de control netratată și distanțate de un factor de cel mult trei. Pentru fiecare grup suspus tratamentului și fiecare grup de control, numărul de probe duplicat trebuie să fie de cel puțin patru, iar numărul total de semințe trebuie să fie de cel puțin 20. În cazul anumitor plante având o viteză scăzută de germinare sau caracteristici de creștere variabile, ar putea fi necesare mai multe probe duplicat pentru a crește puterea statistică a testului. Dacă se utilizează un număr mai mare de concentrații/rate de testare, numărul de probe duplicat poate fi redus. Dacă trebuie estimată NOEC, ar putea fi necesare mai multe probe duplicat pentru a obține puterea statistică dorită (23).
|
Observații
|
29.
|
Pe parcursul perioadei de observație, adică 14-21 de zile de la apariția a 50 % dintre plantele de control (și a plantelor de control cu solvent, dacă este cazul), plantele se examinează frecvent (cel puțin săptămânal și, dacă este posibil, zilnic) pentru a observa apariția, fitotoxicitatea vizuală și mortalitatea. La finalul testului, se măsoară și se consemnează procentajul de apariție și biomasa plantelor supraviețuitoare, precum și efectele nocive vizibile asupra diferitor părți ale plantei. Printre efectele nocive se numără anomaliile legate de aspectul plantulelor apărute, oprirea din creștere, cloroza, decolorarea, mortalitatea și efectele asupra dezvoltării plantelor. Biomasa finală poate fi măsurată utilizând greutatea uscată medie finală a lăstarilor plantelor supraviețuitoare, prin recoltarea lăstarilor de la suprafața solului și uscarea lor până la obținerea unei greutăți constante la 60 °C. Alternativ, biomasa finală se poate măsura utilizând greutatea în stare proaspătă a lăstarilor. Înălțimea lăstarilor poate reprezenta un alt punct final, dacă acest lucru este solicitat de autoritățile de reglementare. Pentru a evalua răspunsurile toxice observabile, ar trebui utilizat un sistem de notare uniformă a leziunilor vizibile. Exemple de efectuare a evaluărilor vizuale calitative și cantitative sunt furnizate în referințele (23) (24).
|
DATE ȘI RAPORT
Analiza statistică
Testul la concentrație/rată unică
|
30.
|
Datele pentru fiecare specie de plante trebuie analizate cu ajutorul unei metode statistice adecvate (21). Trebuie să se raporteze nivelul efectului la concentrația/rata de testare sau incapacitatea de a obține un efect dat la concentrația/rata de testare (de exemplu <x % efect observat la concentrația sau rata y).
|
Testul la mai multe concentrații/rate
|
31.
|
O relație doză-răspuns se stabilește pe baza unei ecuații de regresie. Pot fi utilizate diferite modele: de exemplu, pentru estimarea ECx sau ERx (de exemplu EC25, ER25, EC50, ER50) și a limitelor lor de încredere pentru apariție sub formă de date binare, pot fi adecvate metodele logit, probit, Weibull, Spearman-Karber, Spearman-Karber simplificată. Creșterea plantulelor (greutate sau înălțime) ca puncte finale continue ECx sau ERx și limitele sale de încredere pot fi estimate utilizând o analiză de regresie adecvată [de exemplu analiza de regresie neliniară Bruce-Versteeg (25)]. În măsura posibilului, R2 trebuie să fie 0,7 sau mai mare pentru speciile cele mai sensibile, iar concentrațiile/ratele de testare cuprind efectele de la 20 % la 80 %. Dacă trebuie estimată NOEC, este de preferat aplicarea unor teste statistice puternice, care trebuie selectate pe baza distribuției datelor (21) (26).
|
Raportul de testare
|
32.
|
Raportul de testare trebuie să prezinte rezultatele studiilor, precum și o descriere detaliată a condițiilor de testare, o discuție amplă a rezultatelor, analiza datelor și concluziile trase din analiză. Trebuie furnizate un rezumat sub formă de tabel și o sinteză a rezultatelor. Raportul trebuie să includă următoarele:
|
|
Substanța chimică de testare:
|
—
|
datele de identificare a substanței chimice, proprietățile relevante ale substanței chimice testate (de exemplu log Pow, solubilitatea în apă, presiunea de vapori și informații privind evoluția și comportamentul în mediu, dacă sunt disponibile);
|
|
—
|
detalii privind prepararea soluției de testare și verificarea concentrațiilor de testare, astfel cum se specifică la punctul 18.
|
|
|
|
Speciile de testare:
|
—
|
detalii privind organismul de testare: specia/soiul, familia de plante, denumirile științifice și comune, istoricul seminței cât mai detaliat posibil (adică numele furnizorului, procentajul de germinare, clasa de mărime a seminței, numărul seriei sau lotului, anul seminței sau sezonul de creștere în care a fost colectată, data evaluării germinării), fiabilitatea etc.;
|
|
—
|
numărul de specii monocotiledonate și dicotiledonate testate;
|
|
—
|
argumentarea alegerii speciei;
|
|
—
|
descrierea depozitării, tratării și întreținerii semințelor.
|
|
|
|
Condițiile de testare:
|
—
|
instalația de testare (de exemplu, cameră de cultivare, fitotron și seră);
|
|
—
|
descrierea sistemului de testare (de exemplu, dimensiunile vaselor, materialul vaselor și cantitățile de sol);
|
|
—
|
caracteristicile solului (textura sau tipul solului, distribuția și clasificarea particulelor de sol, proprietățile fizice și chimice, inclusiv % de materie organică, % de carbon organic și pH-ul)
|
|
—
|
prepararea solului/substratului (de exemplu, sol, sol artificial, nisip și altele) înainte de test;
|
|
—
|
descrierea mediului nutritiv, dacă a fost utilizat;
|
|
—
|
aplicarea substanței chimice de testare: descrierea metodei de aplicare, descrierea echipamentelor, procentajele de expunere și volumele, inclusiv verificarea substanței chimice, descrierea metodei de calibrare și descrierea condițiilor de mediu în timpul aplicării;
|
|
—
|
condițiile de creștere: intensitatea luminoasă (de exemplu RAF, radiația activă fotosintetică), fotoperioada, temperaturile max./min., programul și metoda de irigare, fertilizarea;
|
|
—
|
numărul de semințe din fiecare vas, numărul de plante per doză, numărul de duplicate (vase) per rată de expunere;
|
|
—
|
tipul și numărul de probe de control (probe de control negative și/sau pozitive, probe de control cu solvent, dacă au fost utilizate);
|
|
|
|
Rezultate:
|
—
|
tabel cu toate punctele finale pentru fiecare duplicat, concentrația/rata de testare și specia;
|
|
—
|
numărul și procentajul de apariție în comparație cu probele de control;
|
|
—
|
măsurătorile biomasei (greutatea uscată și greutatea în stare proaspătă a lăstarilor) plantelor sub formă de procentaj din probele de control;
|
|
—
|
înălțimea lăstarilor plantei sub formă de procentaj din probele de control, dacă a fost măsurată;
|
|
—
|
procentajul de leziuni vizuale și descrierea calitativă și cantitativă a leziunilor vizuale (cloroză, necroză, ofilire, deformarea frunzelor și tulpinilor, precum și orice lipsă a efectelor) provocate de substanța chimică de testare în comparație cu plantele de control;
|
|
—
|
descrierea scalei de evaluare utilizate pentru aprecierea leziunilor vizuale, dacă se furnizează o evaluare vizuală;
|
|
—
|
pentru studiile la rată unică, procentajul de leziuni trebuie raportat;
|
|
—
|
valorile ECx sau ERx (de exemplu EC50, ER50, EC25, ER25) și limitele de încredere aferente. Dacă se efectuează o analiză a regresiei, trebuie furnizate eroarea standard pentru ecuația de regresie și eroarea standard pentru estimarea parametrilor individuali (de exemplu pantă, intercepție);
|
|
—
|
valorile NOEC (și LOEC), dacă au fost calculate;
|
|
—
|
descrierea procedurilor statistice și a ipotezelor utilizate;
|
|
—
|
reprezentarea grafică a acestor date și a relației doză-răspuns pentru specia testată.
|
|
Abaterile de la procedurile descrise în cadrul prezentei metode de testare și toate evenimentele neobișnuite din timpul testului.
|
BIBLIOGRAFIE
|
(1)
|
Schrader G., Metge K., și Bahadir M. (1998). Importance of salt ions in ecotoxicological tests with soil arthropods. Applied Soil Ecology, 7, 189-193.
|
|
(2)
|
International Organisation of Standards. (1993). ISO 11269-1. Soil Quality -- Determination of the Effects of Pollutants on Soil Flora – Part 1: Method for the Measurement of Inhibition of Root Growth.
|
|
(3)
|
International Organisation of Standards. (1995). ISO 11269-2. Soil Quality -- Determination of the Effects of Pollutants on Soil Flora – Part 2: Effects of Chemicals on the Emergence and Growth of Higher Plants.
|
|
(4)
|
American Standard for Testing Material (ASTM). (2002). E 1963-98. Standard Guide for Conducting Terrestrial Plant Toxicity Tests.
|
|
(5)
|
U.S. EPA. (1982). FIFRA, 40CFR, Part 158.540. Subdivision J, Parts 122-1 and 123-1.
|
|
(6)
|
US EPA. (1996). OPPTS Harmonized Test Guidelines, Series 850. Ecological Effects Test Guidelines:
|
—
|
850.4000: Background – Non-target Plant Testing;
|
|
—
|
850.4025: Target Area Phytotoxicity;
|
|
—
|
850.4100: Terrestrial Plant Toxicity, Tier I (Seedling Emergence);
|
|
—
|
850.4200: Seed Germination/Root Elongation Toxicity Test;
|
|
—
|
850.4225: Seedling Emergence, Tier II;
|
|
—
|
850.4230: Early Seedling Growth Toxicity Test.
|
|
|
(7)
|
AFNOR, X31-201. (1982). Essai d'inhibition de la germination de semences par une substance. AFNOR X31-203/ISO 11269-1. (1993) Determination des effets des polluants sur la flore du sol: Méthode de mesurage de l'inhibition de la croissance des racines.
|
|
(8)
|
Boutin, C., Freemark, K.E. și Keddy, C.J. (1993). Proposed guidelines for registration of chemical pesticides: Non-target plant testing and evaluation. Technical Report Series No.145. Canadian Wildlife Service (Headquarters), Environment Canada, Hull, Québec, Canada.
|
|
(9)
|
Forster, R., Heimbach, U., Kula, C., și Zwerger, P. (1997). Effects of Plant Protection Products on Non-Target Organisms – A contribution to the Discussion of Risk Assessment and Risk Mitigation for Terrestrial Non-Target Organisms (Flora and Fauna). Nachrichtenbl. Deut. Pflanzenschutzd. No 48.
|
|
(10)
|
Hale, B., Hall, J.C., Solomon, K., și Stephenson, G. (1994). A Critical Review of the Proposed Guidelines for Registration of Chemical Pesticides; Non-Target Plant Testing and Evaluation, Centre for Toxicology, University of Guelph, Ontario Canada.
|
|
(11)
|
Soil Texture Classification (US and FAO systems): Weed Science, 33, Suppl. 1 (1985) and Soil Sc. Soc. Amer. Proc. 26:305 (1962).
|
|
(12)
|
Audus, L.J. (1964). Herbicide behaviour in the soil. In: Audus, L.J. ed. The Physiology and biochemistry of Herbicides, London, New York, Academic Press, NY, Chapter 5, pp. 163-206.
|
|
(13)
|
Beall, M.L., Jr. și Nash, R.G. (1969). Crop seedling uptake of DDT, dieldrin, endrin, and heptachlor from soil, J. Agro. 61:571-575.
|
|
(14)
|
Beetsman, G.D., Kenney, D.R. și Chesters, G. (1969). Dieldrin uptake by corn as affected by soil properties, J. Agro. 61:247-250.
|
|
(15)
|
U.S. Food and Drug Administration (FDA). (1987). Environmental Assessment Technical Handbook. Environmental Assessment Technical Assistance Document 4.07, Seedling Growth, 14 pp., FDA, Washington, DC.
|
|
(16)
|
McKelvey, R.A., Wright, J.P., Honegger, J.L. and Warren, L.W. (2002). A Comparison of Crop and Non-crop Plants as Sensitive Indicator Species for Regulatory Testing. Pest Management Science vol. 58:1161-1174
|
|
(17)
|
Boutin, C.; Elmegaard, N. and Kjær, C. (2004). Toxicity testing of fifteen non-crop plant species with six herbicides in a greenhouse experiment: Implications for risk assessment. Ecotoxicology vol. 13(4): 349-369.
|
|
(18)
|
Boutin, C. și Rogers, C.A. (2000). Patterns of sensitivity of plant species to various herbicides – An analysis with two databases. Ecotoxicology vol.9(4):255-271.
|
|
(19)
|
Boutin, C. și Harper, J.L. (1991). A comparative study of the population dynamics of five species of Veronica in natural habitats. J. Ecol. 9:155-271.
|
|
(20)
|
Boutin, C., Lee, H.-B., Peart, T.E., Batchelor, S.P. și Maguire, R.J.. (2000). Effects of the sulfonylurea herbicide metsulfuron methyl on growth and reproduction of five wetland and terrestrial plant species. Envir. Toxicol. Chem. 19 (10): 2532-2541.
|
|
(21)
|
OCDE (2006). Draft Guidance Document, Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. Series on Testing and Assessment No 54, Organisation for Economic Co-operation and Development, Paris.
|
|
(22)
|
Hatzios, K.K. și Penner, D. (1985). Interactions of herbicides with other agrochemicals in higher plants. Rev. Weed Sci. 1:1-63.
|
|
(23)
|
Hamill, P.B., Marriage, P.B. și G. Friesen. (1977). A method for assessing herbicide performance in small plot experiments. Weed Science 25:386-389.
|
|
(24)
|
Frans, R.E. și Talbert, R.E. (1992). Design of field experiments and the measurement and analysis of plant response. In: B. Truelove (Ed.) Research Methods in Weed Science, 2nd ed. Southern weed Science Society, Auburn, 15-23.
|
|
(25)
|
Bruce, R.D. și Versteeg, D. J.(1992). A Statistical Procedure for Modelling Continuous Toxicity Data. Environmental Toxicology and Chemistry 11, 1485-1492.
|
|
(26)
|
Capitolul C.33 al prezentei anexe: Test de reproducere a râmelor (Eisenia fetida/Eisenia andrei).
|
Apendicele 1
Definiții
|
|
«Ingredient activ (i.a.) [sau substanță activă (s.a.)]» înseamnă un material destinat să exercite un anumit efect biologic (de exemplu, controlul insectelor, controlul bolilor plantelor, controlul buruienilor în zona tratată), cunoscut și ca ingredient activ sau substanță activă de puritate tehnică.
|
|
|
«Substanță chimică» înseamnă o substanță sau un amestec.
|
|
|
«Produse de protecție a plantelor ori produse de uz fitosanitar sau pesticide» înseamnă materiale cu o anumită activitate biologică utilizate intenționat pentru protejarea culturilor împotriva dăunătorilor (de exemplu, boli criptogamice, insecte și plante competitive).
|
|
|
«ECx. concentrația efectivă x % sau ERx. rata efectivă x %» înseamnă concentrația sau rata care are ca rezultat o schimbare sau o modificare nedorită de x % din punctul final de testare măsurat în raport cu proba de control (de exemplu reducerea cu 25 % sau 50 % a apariției plantulelor, a greutății lăstarilor, a numărului final de plante prezente sau creșterea leziunilor vizuale constituie o EC25/ER25 sau, respectiv, o EC50/ER50).
|
|
|
«Apariție» înseamnă apariția coleoptilului sau a cotiledonului deasupra suprafeței solului.
|
|
|
«Formulă» înseamnă produsul formulat comercial care conține substanța activă (ingredientul activ), cunoscut și sub denumirea de preparat final (8) sau produs final tipic.
|
|
|
«LOEC (concentrația cea mai scăzută pentru care este observat un efect)» înseamnă concentrația cea mai scăzută a substanței chimice de testare pentru care este observat un efect. În prezentul test, concentrația corespunzătoare LOEC are un efect semnificativ din punct de vedere statistic (p < 0,05) pe parcursul unei perioade de expunere date comparativ cu proba de control și este mai mare decât valoarea NOEC.
|
|
|
«Plante nevizate» înseamnă plantele care se află în afara zonei unde se află plantele vizate. Pentru produsele de protecție a plantelor, acest termen se referă în general la plantele care se află în afara zonei supuse tratamentului.
|
|
|
«NOEC (concentrație la care nu se observă niciun efect)» înseamnă cea mai mare concentrație a substanței chimice de testare la care nu se observă niciun efect. În prezentul test, concentrația corespunzătoare NOEC nu prezintă niciun efect semnificativ din punct de vedere statistic (p < 0,05) pe parcursul unei perioade de expunere date comparativ cu proba de control.
|
|
|
«Fitotoxicitate» înseamnă devieri nocive (conform evaluărilor măsurate și vizuale) de la aspectul și creșterea normale ale plantelor ca răspuns la o substanță chimică dată.
|
|
|
«Duplicat» înseamnă unitatea experimentală care reprezintă grupul de control și/sau grupul supus tratamentului. În prezentele studii, duplicatul este reprezentat de un vas.
|
|
|
«Evaluare vizuală» înseamnă evaluarea defectelor vizuale pe baza observațiilor privind postura, vigoarea, malformațiile, cloroza, necroza și aspectul general al plantei în comparație cu o plantă de control.
|
|
|
«Substanță chimică de testare» orice substanță sau amestec testat cu ajutorul prezentei metode de testare.
|
Apendicele 2
Listă de specii utilizate în trecut în testele pe plante
|
Familia
|
Specia
|
Denumirea comună
|
|
DICOTYLEDONAE
|
|
Apiaceae (Umbelliferae)
|
Daucus carota
|
Morcov
|
|
Asteraceae (Compositae)
|
Helianthus annuus
|
Floarea-soarelui
|
|
Asteraceae (Compositae)
|
Lactuca sativa
|
Salată verde
|
|
Brassicaceae (Cruciferae)
|
Sinapis alba
|
Muștar alb
|
|
Brassicaceae (Cruciferae)
|
Brassica campestris var. chinensis
|
Varză chinezească
|
|
Brassicaceae (Cruciferae)
|
Brassica napus
|
Rapiță
|
|
Brassicaceae (Cruciferae)
|
Brassica oleracea var. capitata
|
Varză
|
|
Brassicaceae (Cruciferae)
|
Brassica rapa
|
Nap
|
|
Brassicaceae (Cruciferae)
|
Lepidium sativum
|
Creson de grădină
|
|
Brassicaceae (Cruciferae)
|
Raphanus sativus
|
Ridiche
|
|
Chenopodiaceae
|
Beta vulgaris
|
Sfeclă de zahăr
|
|
Cucurbitaceae
|
Cucumis sativus
|
Castravete
|
|
Fabaceae (Leguminosae)
|
Glycine max (G. soja)
|
Soia
|
|
Fabaceae (Leguminosae)
|
Phaseolus aureus
|
Fasole mung
|
|
Fabaceae (Leguminosae)
|
Phaseolus vulgaris
|
Fasole pitică, fasole franțuzească, fasole de grădină
|
|
Fabaceae (Leguminosae)
|
Pisum sativum
|
Mazăre
|
|
Fabaceae (Leguminosae)
|
Trigonella foenum-graecum
|
Schinduf
|
|
Fabaceae (Leguminosae)
|
Lotus corniculatus
|
Ghizdei
|
|
Fabaceae (Leguminosae)
|
Trifolium pratense
|
Trifoi roșu
|
|
Fabaceae (Leguminosae)
|
Vicia sativa
|
Măzăriche
|
|
Linaceae
|
Linum usitatissimum
|
In
|
|
Polygonaceae
|
Fagopyrum esculentum
|
Hrișcă
|
|
Solanaceae
|
Solanum lycopersicon
|
Pătlăgea roșie
|
|
MONOCOTYLEDONAE
|
|
Liliaceae (Amarylladaceae)
|
Allium cepa
|
Ceapă
|
|
Poaceae (Gramineae)
|
Avena sativa
|
Ovăz
|
|
Poaceae (Gramineae)
|
Hordeum vulgare
|
Orz
|
|
Poaceae (Gramineae)
|
Lolium perenne
|
Zizanie
|
|
Poaceae (Gramineae)
|
Oryza sativa
|
Orez
|
|
Poaceae (Gramineae)
|
Secale cereale
|
Secară
|
|
Poaceae (Gramineae)
|
Sorghum bicolor
|
Sorg
|
|
Poaceae (Gramineae)
|
Triticum aestivum
|
Grâu
|
|
Poaceae (Gramineae)
|
Zea mays
|
Porumb
|
Apendicele 3
Listă de specii necultivate potențiale
Specii potențiale potrivit OCDE pentru testarea toxicității la plante
Notă: Tabelul următor pune la dispoziție informații pentru 52 de specii necultivate (referințele sunt prezentate între paranteze pentru fiecare intrare). Ratele de apariție furnizate sunt extrase din literatura de specialitate publicată și sunt puse la dispoziție doar cu titlu de orientare generală. Experiența individuală poate varia în funcție de sursa semințelor și de alți factori.
|
FAMILIA Denumirea botanică a speciei
(denumirea comună în română)
|
Durata de viață (9) și habitatul
|
Greutatea seminței
(mg)
|
Fotoperioada pentru germinare sau creștere (10)
|
Adâncimea de plantare
(mm) (11)
|
Timpul de germinare
(zile) (12)
|
Tratamente speciale (13)
|
Test de toxicitate (14)
|
Furnizori de semințe (15)
|
Alte referințe (16)
|
|
APIACEAE
Torilis japónica
(Hațmațuchiul măgarului)
|
А, В zone perturbate, marginea tufișurilor, pășuni (16, 19)
|
1,7-1,9 (14, 19)
|
L = D (14)
|
0
(1, 19)
|
5 (50 %) (19)
|
stratificare rece (7, 14, 18, 19) maturarea poate fi necesară (19) germinare inhibată de întuneric (1, 19) niciun tratament special (5)
|
POST (5)
|
|
|
|
ASTERACEAE
Bellis perennis
(Părăluță)
|
Ρ
pășuni și fânețe, terenuri arabile, peluze (16, 19)
|
0,09-0,17 (4, 19)
|
L = D (14)
|
0
(4)
|
3 (50 %) (19)
11 (100 %) (18)
|
germinare neafectată de iradiație (18, 19) fără tratamente speciale (4, 14)
|
POST (4)
|
A, D, F
|
7
|
|
Centaurea cyanus
(Albăstrea)
|
A
câmpuri, marginea drumurilor, habitate deschise (16)
|
4,1-4,9 (4, 14)
|
L = D (14)
|
0-3 (2, 4, 14)
|
14-21 (100 %) (14)
|
fără tratamente speciale (2, 4)
|
POST (2,4)
|
A, D, E, F
|
7
|
|
Centaurea nigra
(Țintaură)
|
Ρ
câmpuri, marginea drumurilor, habitate deschise (16, 19)
|
2,4-2,6 (14, 19)
|
L = D (14)
|
0 (19)
|
3 (50 %) (19)
4 (97 %) (18)
|
maturarea poate fi necesară (18, 19) germinare inhibată de întuneric (19) fără tratamente speciale (5, 14, 26)
|
POST (5, 22, 26)
|
A
|
|
|
Inula helenium
(Iarbă mare)
|
Ρ
locuri umede, perturbate
(16)
|
1-1.3 (4, 14, 29)
|
|
0
(4, 29)
|
|
fără tratamente speciale (4)
|
POST (4)
|
A, F
|
|
|
Leontodon hispidus
(Potcapul-călugărului)
|
Ρ
câmpuri, marginea drumurilor, zone perturbate (16, 19)
|
0,85 -1,2 (14, 19)
|
L = D (14)
|
0 (19)
|
4 (50 %) (19)
7 (80 %) (18)
|
germinare inhibată de întuneric (17, 18, 19) fără tratamente speciale (5, 23)
|
POST (5, 22, 23)
|
|
|
|
Rudbeckia hirta
(Pălăria soarelui)
|
Β, Ρ perturbat
(16)
|
0,3 (4, 14)
|
L = D (14)
|
0
(4, 33)
|
< 10 (100 %) (33)
|
fără tratamente speciale
(4, 14, 33)
|
POST (4, 33)
|
C, D, E, F
|
|
|
Solidago canadensis
(Sânziană)
|
Ρ
pășuni, zone deschise (16)
|
0,06-0,08 (4, 14)
|
L = D (11)
|
0
(4)
|
14-21
(11)
|
se amestecă cu o parte egală de nisip și se înmoaie în 500ppm de GA timp de 24 de ore (11) fără tratamente speciale (4)
|
POST (4)
|
E, F
|
|
|
Xanthium pensylvanicum
(Scaiete comun)
|
A
câmpuri, habitate deschise (16)
|
25-61 (14, 29)
|
|
0(1)
5(29)
|
|
germinarea poate fi inhibată de întuneric (1) se înmoaie în apă caldă timp de 12 ore (29)
|
PRE și POST (31)
|
A
|
|
|
Xanthium spinosum
(Ghimpe)
|
A
habitate deschise (16)
|
200 (14)
|
L = D (14)
L > D (6)
|
10
(6)
|
|
scarificare (14) fără tratamente speciale (6)
|
PRE și POST (6)
|
A
|
|
|
Xanthium strumarium
(Scaietele popii)
|
A
câmpuri, habitate deschise (16)
|
67,4 (14)
|
L = D (14)
|
10-20 (6, 21)
|
|
fără tratamente speciale
(6, 14, 21)
|
PRE și POST (6, 21, 28, 31)
|
A
|
|
|
BRASSICACEAE
Cardamine pratensis
(Stupitul-cucului)
|
Ρ
câmpuri, marginea drumurilor, peluze (16, 19)
|
0,6 (14, 19)
|
L = D (14)
|
0 (19)
|
5 (50 %) (19)
15 (98 %) (18)
|
germinare inhibată de întuneric (18, 19) fără tratamente speciale (5, 14, 22)
|
POST (5, 22)
|
F
|
|
|
CARYOPHYLLACEAE
Lychnis flos-cuculi
(Floarea-cucului)
|
Ρ
(16)
|
0,21 (14)
|
L = D (14)
|
|
< 14 (100 %) (14, 25)
|
maturarea poate fi necesară (18) fără tratamente speciale (5, 14, 15, 22-26)
|
POST (5, 15, 22-26)
|
F
|
|
|
CHENOPODIACEAE
Chenopodium album
(Spanac sălbatic)
|
A
marginea câmpurilor, zone perturbate (16, 19)
|
0,7-1,5 (14, 19, 34)
|
L = D (14)
|
0
(1, 19)
|
2 (50 %) (19)
|
tratamentul diferă în funcție de culoarea semințelor (19) stagnarea creșterii în depozitare uscată (19) germinare inhibată de întuneric (1, 18, 19) stratificare rece (18) fără tratamente speciale (14, 34)
|
PRE și POST (28, 31, 34)
|
A
|
32
|
|
CLUSIACEAE
Hypericum perforatum
(Sunătoare)
|
Ρ
câmpuri, terenuri arabile, habitate deschise (16, 19)
|
0,1-0,23
(14, 19)
|
L= D
(14)
|
0
(1, 19)
|
3 (19)
11 (90 %) (18)
|
germinare inhibată de întuneric (1, 18, 19)
fără tratamente speciale (5, 14, 15, 25, 27)
|
POST
(5, 15, 25, 27)
|
A, E, F
|
|
|
CONVOLVULACEAE
Ipomoea hederacea
(Rochița-rândunicii)
|
A
marginea drumurilor, habitate deschise, lanuri de porumb (16)
|
28,2
(14)
|
L > D
(6, 10)
|
10-20
(6, 10, 21)
|
4 (100 %)
(10)
|
germinare neafectată de iradiație (1)
fără tratamente speciale (6, 21)
|
PRE și POST
(6, 12, 21, 28)
|
A
|
|
|
CYPERACEAE
Cyperus rotundus
(Căprișor)
|
Ρ
terenuri arabile, pășuni, marginea drumurilor (16, 30)
|
0,2
(14)
|
L= D
(14)
|
0 (1)
10-20 (6, 10)
|
12 (91 %)
(10)
|
germinare inhibată de întuneric (1)
fără tratamente speciale (6, 10, 14)
|
PRE și POST
(6, 28, 31)
|
B
|
7
|
|
FABACEAE
Lotus corniculatus
(Ghizdei)
|
Ρ
zone ierboase, marginea drumurilor, habitate deschise (16, 19)
|
1-1,67
(14, 19)
|
L = D (14)
|
|
1 (50 %)
(19)
|
scarificare (14, 19)
germinare neafectată de iradiație (18, 19) fără tratamente speciale (23, 25)
|
POST
(5, 23, 25)
|
A, D, E, F
|
|
|
Senna obtusifolia
(Senna chinezească)
|
A
păduri umede (16)
|
23-28
(9)
|
L = D (14)
L > D (9)
|
10-20
(6,9)
|
|
semințele se înmoaie în apă timp de 24 de ore (9)
scarificare (14) viabilitatea semințelor diferă în funcție de culoare (1) fără tratamente speciale (6)
|
POST
(6,9)
|
A
|
|
|
Sesbania exaltata
(Cânepă)
|
A
sol aluvial (16)
|
11-13
(9, 14)
|
L > D (9)
|
10-20
(9, 21)
|
|
semințele se înmoaie în apă timp de 24 de ore (9)
germinare neafectată de iradiație (1) fără tratamente speciale (21)
|
PRE și POST
(9, 21, 28, 31)
|
A
|
|
|
Trifolium pratense
(Trifoi roșu)
|
Ρ
câmpuri, marginea drumurilor, terenuri arabile (16, 19)
|
1,4-1,7
(14, 19)
|
L= D (14)
|
|
1 (50 %)
(19)
|
scarificare (14, 18)
poate necesita maturare (19) germinare neafectată de iradiație (1, 19) fără tratamente speciale (5)
|
POST
(5)
|
A, E, F
|
|
|
LAMIACEAE
Leonurus cardiaca
(Talpa-gâștei)
|
Ρ
zone deschise (16)
|
0,75-1,0
(4, 14)
|
L= D (14)
|
0
(4)
|
|
fără tratamente speciale
(4, 14)
|
POST
(4)
|
F
|
|
|
Mentha spicata
(Mentă comună)
|
Ρ
zone umede (16)
|
2,21
(4)
|
|
0
(4)
|
|
fără tratamente speciale
(4)
|
POST
(4)
|
F
|
|
|
Nepeta cataria
(Cătușnică)
|
Ρ
zone perturbate (16)
|
0,54
(4, 14)
|
L= D (14)
|
0
(4)
|
|
fără tratamente speciale
(2, 4, 14)
|
POST
(2,4)
|
F
|
|
|
Prunella vulgaris
(Busuioc-sălbatic)
|
Ρ
terenuri arabile, zone ierboase, locuri perturbate (16, 19)
|
0,58-1,2
(4, 14, 19)
|
L= D (14)
|
0
(4, 19)
|
5 (50 %) (19)
7 (91 %) (18)
|
germinare inhibată de întuneric (18, 19)
germinare mai bună cu semințe mai mari (1 ) fără tratamente speciale (4, 14, 22)
|
POST
(4, 22)
|
A, F
|
|
|
Stachys officinalis
(Vindecea)
|
Ρ
pășuni și fânețe, marginea câmpurilor (19)
|
14-18
(14, 19)
|
L= D (14)
|
|
7 (50 %)
(19)
|
fără tratamente speciale
(5, 14, 22)
|
POST
(5, 22)
|
F
|
|
|
MALVACEAE
Abutilón theophrasti
(Pristolnic)
|
A
câmpuri, habitate deschise (16)
|
8,8
(14)
|
L= D (14)
|
10-20
(6, 10, 21)
|
4 (84 %)
(10)
|
scarificare (14)
fără tratamente speciale (5, 10, 21)
|
PRE și POST
(6, 22, 28, 31)
|
A, F
|
|
|
Sida spinosa
(Sida spinoasă)
|
A
câmpuri, marginea drumurilor (16)
|
3,8
(14)
|
L= D (14)
|
10-20
(6, 21)
|
|
scarificare (14)
germinare neafectată de iradiație (1) fără tratamente speciale (6, 21 )
|
PRE și POST
(6, 21, 28, 31)
|
A, F
|
|
|
PAPAVERACEAE
Papaver rhoeas
(Mac)
|
A
câmpuri, terenuri arabile, locuri perturbate (16, 19)
|
0,1-0,3
(4, 14, 19, 29)
|
L= D (14)
|
0
(4, 29)
|
4 (50 %)
(19)
|
stratificare rece și scarificare (1, 19, 32)
fără tratamente speciale (4, 14, 29)
|
POST
(4)
|
A, D, E, F, G
|
|
|
POACEAE
Agrostis tenuis
(Păiuș)
|
peluze, pășuni (16)
|
0,07 (14)
|
L > D (Ю)
|
20 (10)
|
10 (62 %) (10)
|
germinare inhibată de întuneric (1, 17-19) fără tratamente speciale (10)
|
POST (10)
|
A, E
|
|
|
Alopecurus myosuroides
(Coada-vulpii)
|
A
câmpuri, habitate deschise (16)
|
0,9-1,6
(29, 34)
|
L = D (14)
|
2
(29)
|
< 24 (30 %) (34)
|
scarificare (14) se tratează cu 101 mg/l KNO3 (14) stratificare caldă (1) germinare inhibată de întuneric (1) fără tratamente speciale (34)
|
PRE și POST
(28, 34)
|
A
|
32
|
|
Avena fatua
(Ovăz sălbatic)
|
A
zone cultivate, habitate deschise (16)
|
7-37,5 (14, 30)
|
L = D (14)
L > D (6)
|
10-20 (6, 10)
|
3 (70 %) (18)
|
scarificare (7, 32) întunericul inhibă germinarea (1)
stratificare rece (1, 18) fără tratamente speciale (6, 10, 14)
|
PRE și POST (6, 10, 28, 31)
|
A
|
|
|
Bromus tectorum
(Obsigă)
|
A
câmpuri, marginea drumurilor, terenuri arabile (16)
|
0,45-2,28 (14, 29)
|
L = D (14)
|
3 (29)
|
|
perioadă de maturare (1, 7, 32) germinare inhibată de lumină (1) fără tratamente speciale (14)
|
PRE și POST (28, 31)
|
A
|
|
|
Cynosurus cristatus
(Pieptănariță)
|
P
câmpuri, marginea drumurilor, habitate deschise (16, 19)
|
0,5-0,7 (14, 19, 29)
|
L = D (14)
|
0 (29)
|
3 (50 %) (19)
|
germinare neafectată de iradiație (19) fără tratamente speciale (14, 29)
|
POST (5)
|
A
|
|
|
Digitaria sanguinalis
(Rouriță sanguinee)
|
A
câmpuri, peluze, habitate deschise (16)
|
0,52-0,6 (14, 30)
|
L = D (14)
|
10-20 (21)
|
7 (75 %)
14 (94 %) (7)
|
scarificare, stratificare rece și maturare (1, 7, 14, 32) se tratează cu 101 mg/l KNO3 (14) germinare inhibată de întuneric (1) fără tratamente speciale (21)
|
PRE și POST (18, 25, 31)
|
A
|
|
|
Echinochloa crusgalli
(Costrei)
|
A
(16)
|
1,5 (14)
|
L = D (14)
L > D (3)
|
10-20 (7, 21)
|
|
scarificare (7, 32) germinare neafectată de iradiație (1) fără tratamente speciale (3, 14, 21)
|
PRE și POST (3, 21, 28, 31)
|
A
|
|
|
Elymus canadensis
(Orzișor canadian)
|
P
riveran, locuri perturbate (16)
|
4-5 (14, 30)
|
L = D (11)
|
1
(11)
|
14-28
(11)
|
fără tratamente speciale
(2, 11)
|
POST (2)
|
C, D, E
|
|
|
Festuca pratensis
(Păiuș)
|
P
câmpuri, zone umede (16, 19)
|
1,53-2,2 (16, 19)
|
L = D (14)
L > D (10)
|
20 (10)
|
9 (74 %) (10)
2 (50 %) (19)
|
fără tratamente speciale
(10, 19)
|
POST (10)
|
A
|
7
|
|
Hordeum pusillum
(Orz pitic)
|
A
pășuni, marginea drumurilor, habitate deschise (16)
|
3,28 (14)
|
|
|
|
stratificare caldă (1) germinare neafectată de iradiație (1)
|
PRE (31)
|
|
7
|
|
Phieum pratense
(Timoftică)
|
P
pășuni, terenuri arabile, locuri perturbate (16, 19)
|
0,45 (14, 19)
|
L > D (10, 14)
|
0-10 (10, 19)
|
2 (74 %) (10)
8 (50 %) (19)
|
germinare inhibată de întuneric (19) germinare neafectată de iradiație (17) fără tratamente speciale (10, 14, 17, 19)
|
POST (10)
|
A, E
|
|
|
POLYGONACEAE
Polygonum convolvulus
(Hrișcă urcătoare)
|
A
habitate deschise, marginea drumurilor (16)
|
5-8 (4, 14, 29)
|
L = D (20)
|
0-2 (4, 29)
|
|
stratificare rece timp de 4-8 săptămâni (1, 2, 4, 20, 29) germinare neafectată de iradiație (1)
|
PRE și POST 1, 2, 20, 28, 31
|
A
|
32
|
|
Polygonum lapathifolium
(Iarbă roșie)
|
A
sol umed (16)
|
1,8-2,5 (14)
|
L > D (6)
|
|
5 (94 %) (18)
|
germinare neafectată de iradiație (1) germinare inhibată de întuneric (18) stratificare rece (1) fără tratamente speciale (5)
|
PRE și POST (6)
|
A, E
|
|
|
Polygonum pennsylvanicum
(Troscot de Pennsylvania)
|
A
câmpuri, habitate deschise (16)
|
3,6-7 (14, 29)
|
|
2 (29)
|
|
stratificare rece timp de 4 săpt. la 0-5 °C (1, 29) germinare inhibată de întuneric (1)
|
PRE (31)
|
A, E
|
|
|
Polygonum periscaria
(Troscot)
|
A
zone perturbate, terenuri arabile (16, 19)
|
2,1-2,3 (14, 19)
|
L > D (13)
|
0 (19)
|
< 14 (13)
2 (50 %) (19)
|
scarificare, stratificare rece, tratament cu GA (14) stratificare rece, maturare (17-19) germinare inhibată de întuneric (19) fără tratamente speciale (13)
|
POST (13)
|
A
|
32
|
|
Rumex crispus
(Dragavei)
|
P
terenuri arabile, marginea drumurilor, zone deschise (16, 19)
|
1,3-1,5 (4, 14, 19)
|
L = D (14, 33)
|
0
(4, 19, 33)
|
3 (50 %) (19)
6 (100 %) (33)
|
germinare inhibată de întuneric (18, 19) maturarea poate fi necesară (18) fără tratamente speciale (4, 14, 33)
|
POST (4, 33)
|
A, E
|
32
|
|
PRIMULACEAE
Anagallis arvensis
(Scânteiuță)
|
A
terenuri arabile, zone deschise, locuri perturbate (16, 19)
|
0,4-0,5 (4, 14, 19)
|
L = D (14)
|
|
1 (50 %) (19)
|
stratificare rece, tratament cu GA (1,14, 18, 19, 32) germinarea necesită lumină (1) fără tratamente speciale (2, 4)
|
POST (2, 4)
|
A, F
|
|
|
RANUNCULACEAE
Ranunculus acris
(Piciorul-cocoșului)
|
Ρ
terenuri arabile, marginea drumurilor, zone deschise (16, 19)
|
1,5-2 (14, 19, 29)
|
L = D (14)
|
1
(29)
|
41-56 (19, 29)
|
fără tratamente speciale
(5, 14, 22, 24-26)
|
POST (5, 22, 24-26)
|
|
32
|
|
ROSACEAE
Geum urbanum
(Cerențel)
|
Ρ
marginea tufișurilor, zone umede
(16, 19)
|
0,8-1,5 (14, 19)
|
L = D (14)
|
0 (19)
|
5 (50 %) (19)
16 (79 %) (18)
|
germinare inhibată de întuneric (18, 19) stratificare caldă (1) fără tratamente speciale (5, 14, 22, 25, 26)
|
POST (5, 22, 25, 26)
|
A
|
|
|
RUBIACEAE
Galium aparine
(Turiță)
|
A
terenuri arabile, zone umede, locuri perturbate (16, 19)
|
7-9 (14, 19)
|
L = D (14)
|
|
5 (50 %) (19)
6 (100 %) (18)
|
stratificare rece (1, 18, 19) germinare neafectată de iradiație (18, 19) germinare inhibată de lumină (1) fără tratamente speciale (6, 14)
|
PRE și POST (6, 28)
|
A
|
32
|
|
Galium mollugo
(Sânziană albă)
|
Ρ
maluri cu tufișuri, zone deschise (8)
|
7
(29)
|
L = D (14)
|
2
(29)
|
|
fără tratamente speciale
(5, 14, 22, 24, 26, 29)
|
POST (5, 22, 24, 26)
|
A
|
|
|
SCROPHULARIACEAE
Digitalis purpurea
(Degețel roșu)
|
Β, Ρ marginea tufișurilor, zone deschise (16, 19)
|
0,1-0,6 (4, 14, 19)
|
L = D (14)
|
0
(4, 19)
|
6 (50 %) (19)
8 (99 %) (18)
|
germinare inhibată de întuneric (1, 17-19) fără tratamente speciale (4, 22-26)
|
POST (4, 22 – 26)
|
D, G, F
|
|
|
Veronica persica
(Ventrilică)
|
A
terenuri arabile, zone deschise, locuri perturbate (16, 19)
|
0,5-0,6 (14, 19)
|
L = D (14)
|
0 (19)
|
3 (19)
5 (96 %) (18)
|
germinare inhibată de întuneric (18, 19) stratificare rece (18) fără tratamente speciale (14)
|
PRE și POST (28)
|
A
|
32
|
Furnizori de semințe citați
|
Identificarea furnizorului
|
Informații despre furnizor
|
|
A
|
|
Herbiseed
|
|
New Farm, Mire Lane, West End, Twyford RG10 0NJ ANGLIA +44 (0) 1189 349 464
|
|
www.herbiseed.com
|
|
|
B
|
|
Tropilab Inc.
|
|
8240 Ulmerton Road, Largo, FL 33771-3948 SUA
|
|
(727) 344 – 4050
|
|
www.tropilab.com
|
|
|
C
|
|
Pterophylla – Native Plants & Seeds
|
|
#316 Regional Road 60, RR#1, Walsingham, ON N0E 1X0 CANADA (519) 586 – 3985
|
|
|
D
|
|
Applewood Seed Co.
|
|
5380 Vivian St., Arvada, CO 80002 SUA (303) 431 – 7333
|
|
www.applewoodseed.com
|
|
|
E
|
|
Ernst Conservation Seeds
|
|
9006 Mercer Pike, Meadville, PA 16335 SUA
|
|
(800) 873 – 3321
|
|
www.ernstseed.com
|
|
|
F
|
|
Chiltern Seeds
|
|
Bortree Stile, Ulverston, Cumbria LA12 7PB ANGLIA
|
|
+44 1229 581137
|
|
www.chiltemseeds.co.uk
|
|
|
G
|
|
Thompson & Morgan
|
|
P.O. Box 1051, Fort Erie, ON L2A 6C7 CANADA (800) 274 – 7333
|
|
www.thompson-morgan.com
|
|
BIBLIOGRAFIE
|
(1)
|
Baskin, C.C. & Baskin, J.M. 1998. Seeds. Academic Press, Toronto
|
|
(2)
|
Blackburn, L.G. & Boutin, C. 2003. Subtle effects of herbicide use in the context of genetically modified crops: a case study with glyphosate (Round-Up®). Ecotoxicology, 12:271-285.
|
|
(3)
|
Boutin, C., Lee, H-B., Peart, T., Batchelor, P.S., & Maguire, R.J. 2000. Effects of the sulfonylurea herbicide metsulfuron methyl on growth and reproduction of five wetland and terrestrial plant species. Environmental Toxicology & Chemistry, 19(10):2532-2541.
|
|
(4)
|
Boutin, C., Elmegaard, N., & Kjaer, C. 2004. Toxicity testing of fifteen non-crop plant species with six herbicides in a greenhouse experiment: implications for risk assessment. Ecotoxicology, 13:349-369.
|
|
(5)
|
Breeze, V., Thomas, G., & Butler, R. 1992. Use of a model and toxicity data to predict the risks to some wild plant species from drift of four herbicides. Annals of Applied Biology, 121:669-677.
|
|
(6)
|
Brown, R.A., & Farmer, D. 1991. Track-sprayer and glasshouse techniques for terrestrial plant bioassays with pesticides. In: Plants for toxicity assessment: 2nd volume. ASTM STP 1115, J.W. Gorsuch, W.R. Lower, W.Wang, & M.A. Lewis, eds. American Society for Testing & Materials, Philadelphia. pp 197 – 208.
|
|
(7)
|
Buhler, D.D. & Hoffman, M.L. 1999. Anderson's guide to practical methods of propagating weeds and other plants. Weed Science Society of America, Lawrence, K.
|
|
(8)
|
Clapham, A.R., Tutin, T.G., & Warburg, E.F. 1981. Excursion flora of the British Isles, 3rd ed. Cambridge University Press, Cambridge
|
|
(9)
|
Clay, P.A. & Griffin, J.L. 2000. Weed seed production and seedling emergence response to late-season glyphosate applications. Weed Science, 48:481-486.
|
|
(10)
|
Cole, J.F.H. & Canning, L. 1993. Rationale for the choice of species in the regulatory testing of the effects of pesticides on terrestrial non-target plants. BCPC – Weeds. pp. 151 – 156.
|
|
(11)
|
Fiely, M. (Ernst Conservation Seeds). 2004. Personal communication. (www.ernstseed.com)
|
|
(12)
|
Fletcher, J.S., Johnson, F.L., & McFarlane, J.C. 1990. Influence of greenhouse versus field testing and taxonomic differences on plant sensitivity to chemical treatment. Environmental Toxicology & Chemistry, 9:769-776.
|
|
(13)
|
Fletcher, J.S., Pfleeger, T.G., Ratsch, H.C., & Hayes, R. 1996. Potential impact of low levels of chlorsulfuron and other herbicides on growth and yield of nontarget plants. Environmental Toxicology & Chemistry, 15(7):1189-1196.
|
|
(14)
|
Flynn, S., Turner, R.M., and Dickie, J.B. 2004. Seed Information Database (release 6.0, Oct 2004) Royal Botanic Gardens, Kew (www.rbgkew.org.uk/data/sid)
|
|
(15)
|
Franzaring, J., Kempenaar, C., & van der Eerden, L.J.M. 2001. Effects of vapours of chlorpropham and ethofumesate on wild plant species. Environmental Pollution, 114:21-28.
|
|
(16)
|
Gleason, H.A. & Cronquist, A. 1991. Manual of vascular plants of northeastern United States and adjacent Canada, 2nd ed. New York Botanical Garden, Bronx, NY
|
|
(17)
|
Grime, J.P. 1981. The role of seed dormancy in vegetation dynamics. Annals of Applied Biology, 98:555-558.
|
|
(18)
|
Grime, J.P., Mason, G., Curtis, A.V., Rodman, J., Band, S.R., Mowforth, M.A.G., Neal, A.M., & Shaw, S. 1981. A comparative study of germination characteristics in a local flora. Journal of Ecology, 69:1017-1059.
|
|
(19)
|
Grime, J.P., Hodgson, J.G., & Hunt, R. 1988. Comparative plant ecology: a functional approach to common British species. Unwin Hyman Ltd., London
|
|
(20)
|
Kjaer, C. 1994. Sublethal effects of chlorsulfuron on black bindweed (Polygonum convolvulus L.). Weed Research, 34:453-459.
|
|
(21)
|
Klingaman, T.E., King, C.A., & Oliver, L.R. 1992. Effect of application rate, weed species, and weed stage of growth on imazethapyr activity. Weed Science, 40:227-232.
|
|
(22)
|
Marrs, R.H., Williams, C.T., Frost, A.J., & Plant, R.A. 1989. Assessment of the effects of herbicide spray drift on a range of plant species of conservation interest. Environmental Pollution, 59:71-86.
|
|
(23)
|
Marrs, R.H., Frost, A.J., & Plant, R.A. 1991. Effects of herbicide spray drift on selected species of nature conservation interest: the effects of plant age and surrounding vegetation structure. Environmental Pollution, 69:223-235.
|
|
(24)
|
Marrs, R.H., Frost, A.J., & Plant, R.A. 1991. Effects of mecoprop drift on some plant species of conservation interest when grown in standardized mixtures in microcosms. Environmental Pollution, 73:25-42.
|
|
(25)
|
Marrs, R.H., Frost, A.J., Plant, R.A., & Lunnis, P. 1993. Determination of buffer zones to protect seedlings of non-target plants from the effects of glyphosate spray drift. Agriculture, Ecosystems, & Environment, 45:283-293.
|
|
(26)
|
Marrs, R.H. & Frost, A.J. 1997. A microcosm approach to detection of the effects of herbicide spray drift in plant communities. Journal of Environmental Management, 50:369-388.
|
|
(27)
|
Marshall, E.J.P. & Bernie, J.E. 1985. Herbicide effects on field margin flora. BCPC – Weeds. pp. 1021-1028.
|
|
(28)
|
McKelvey, R.A., Wright, J.P., & Honegger, J.L. 2002. A comparison of crop and non-crop plants as sensitive species for regulatory testing. Pest Management Science, 58:1161-1174.
|
|
(29)
|
Morton, S. (Herbiseed). 2004. Personal communication. (http://www.herbiseed.com)
|
|
(30)
|
USDA, NRCS. 2004. The Plants Database, version 3.5. (http://plants.usda.gov). National Plant Data Centre, Baton Rouge, LA 70874-4490 USA
|
|
(31)
|
USEPA. 1999. One-Liner Database. [U.S. E.P.A./Office of Pesticide Programs/Environmental Fate and Effects Division/Environmental Epidemiology Branch].
|
|
(32)
|
Webster, R.H. 1979. Technical Report No. 56: Growing weeds from seeds and other propagules for experimental purposes. Agricultural Research Council Weed Research Organization, Oxford.
|
|
(33)
|
White, A. L. & Boutin, C. (National Wildlife Research Centre, Environment Canada). 2004. Personal communication.
|
|
(34)
|
Zwerger, P. & Pestemer, W. 2000. Testing the phytotoxic effects of herbicides on higher terrestrial non-target plants using a plant life-cycle test. Z. PflKrankh. PflSchutz, Sonderh., 17:711-718.
|
Apendicele 4
Exemple de condiții de creștere pentru anumite specii cultivate
Următoarele condiții s-au dovedit a fi adecvate pentru 10 specii cultivate și pot fi utilizate ca orientare pentru teste în camere de cultivare și în cazul altor specii:
|
|
concentrația de dioxid de carbon: 350 ± 50 ppm;
|
|
|
umiditatea relativă: 70 ± 5 % pe perioadele de lumină și 90 ± 5 % pe perioadele de întuneric;
|
|
|
temperatura: 25 ± 3 °C în timpul zilei, 20 ± 3 °C în timpul nopții;
|
|
|
fotoperioada: 16 ore de lumină/8 ore de întuneric, presupunând o lungime de undă medie de 400-700 nm;
|
|
|
lumina: luminanță de 350 ± 50 μE/m2/s, măsurată deasupra frunzișului.
|
Speciile cultivate sunt:
|
—
|
pătlăgeaua roșie (Solanum lycopersicon);
|
|
—
|
castravetele (Cucumis sativus);
|
|
—
|
salata verde (Lactuca sativa);
|
|
—
|
varza (Brassica oleracea var. capitata);
|
|
—
|
morcovul (Daucus carota);
|
|
—
|
zizania (Lolium perenne);
|
C.32. TEST DE REPRODUCERE A ENCHITREIDELOR
INTRODUCERE
|
1.
|
Prezenta metodă de testare este echivalentă cu Orientarea OCDE privind testarea (TG) nr. 220 (2004). Aceasta este destinată utilizării în scopul evaluării efectelor substanțelor chimice asupra ratei de reproducere a viermelui enchitreid, Enchytraeus albidus, Henle 1873, în sol. Are ca bază principală o metodă elaborată de Umweltbundesamt, Germania (1) care a fost supusă unui ring test (2). Au fost luate în considerare și alte metode de testare a toxicității substanțelor chimice asupra enchitreidelor și râmelor (3)(4)(5)(6)(7)(8).
|
CONSIDERAȚII INIȚIALE
|
2.
|
Anelidele din genul Enchytraeus care trăiesc în sol sunt specii relevante din punct de vedere ecologic pentru testarea ecotoxicității. Deși enchitreidele se găsesc adesea în soluri care conțin râme, este adevărat și faptul că de multe ori acestea sunt prezente în abundență în multe soluri din care râmele lipsesc. Enchitreidele pot fi utilizate în testele de laborator, precum și în studiile derulate pe teren sau parțial pe teren. Din punct de vedere practic, multe specii de Enchytraeus sunt ușor de manipulat și de înmulțit, iar durata generației lor este semnificativ mai scurtă decât în cazul râmelor. Durata unui test de reproducere cu enchitreide este, prin urmare, de doar 4-6 săptămâni, în timp ce în cazul râmelor (Eisenia fetida) acesta durează 8 săptămâni.
|
|
3.
|
Informații de bază despre ecologia și ecotoxicologia enchitreidelor în mediul terestru pot fi găsite în referințele (9)(10)(11)(12).
|
PRINCIPIUL TESTULUI
|
4.
|
Enchitreidele adulte sunt expuse la o serie de concentrații ale substanței chimice de testare amestecate într-un sol artificial. Scenariul de testare poate fi împărțit în două etape: (a) un test de stabilire a intervalului, în cazul în care nu sunt disponibile suficiente informații, în care mortalitatea reprezintă principalul punct final evaluat după două săptămâni de expunere și (b) un test de reproducere final în care se evaluează numărul total de viermi tineri produs de animalul părinte și rata de supraviețuire a animalelor părinți. Durata testului final este de șase săptămâni. După primele trei săptămâni, viermii adulți se scot și se înregistrează schimbările morfologice. După încă trei săptămâni, se calculează numărul de descendenți eclozați din coconii produși de adulți. Rata de reproducere a animalelor expuse la substanța chimică de testare este comparată cu cea din proba (probele) de control în vederea determinării (i) concentrației la care nu se observă niciun efect (NOEC) și/sau (ii) ECx (de exemplu EC10, EC50) utilizând un model de regresie pentru a estima concentrația care ar putea cauza o reducere cu x % a ratei de reproducere. Concentrațiile de testare trebuie să încadreze ECx (de exemplu EC10, EC50) astfel încât ECx să fie mai degrabă interpolată decât extrapolată.
|
INFORMAȚII PRIVIND SUBSTANȚA CHIMICĂ DE TESTARE
|
5.
|
Ar fi de preferat să se cunoască solubilitatea în apă, log Kow, coeficientul de partiție sol/apă (de exemplu capitolele C.18 și C.19 din prezenta anexă) și presiunea de vapori a substanței chimice de testare. Sunt de dorit informații suplimentare privind evoluția substanței chimice de testare în sol, precum viteza de fotoliză și de hidroliză.
|
|
6.
|
Această metodă de testare poate fi utilizată în cazul substanțelor chimice solubile sau insolubile în apă. Cu toate acestea, modul de aplicare a substanței chimice de testare va varia în consecință. Metoda de testare nu se aplică substanțelor chimice volatile, și anume substanțelor în cazul cărora constanta Henry sau coeficientul de partiție aer/apă este mai mare de unu sau substanțelor chimice în cazul cărora presiunea de vapori depășește 0,0133 Pa la o temperatură de 25 °C.
|
VALIDITATEA TESTULUI
|
7.
|
Pentru ca testul să fie valid, probele de control trebuie să îndeplinească următoarele criterii de performanță:
|
—
|
mortalitatea adulților nu trebuie să depășească 20 % la finalul testului de stabilire a intervalului și în primele trei săptămâni ale testului de reproducere;
|
|
—
|
presupunând că s-au folosit 10 adulți pentru fiecare vas pentru pregătirea testului, la finalul testului trebuie să fi fost produsă o medie de cel puțin 25 de viermi tineri în fiecare vas;
|
|
—
|
coeficientul de variație calculat pentru numărul mediu de viermi tineri nu trebuie să fie mai mare de 50 % la finalul testului de reproducere.
|
În cazul în care un test nu îndeplinește criteriile de validitate de mai sus, testul trebuie încheiat, cu excepția cazului în care poate fi oferită o justificare pentru continuarea testului. Justificarea trebuie inclusă în raportul de testare.
|
SUBSTANȚA CHIMICĂ DE REFERINȚĂ
|
8.
|
Pentru a verifica dacă răspunsul organismelor de testare nu s-a modificat în timp, o substanță chimică de referință trebuie să fie testată la intervale regulate sau, eventual, să fie inclusă în fiecare test. O substanță chimică de referință adecvată este carbendazimul, care s-a demonstrat că afectează supraviețuirea și reproducerea enchitreidelor (13)(14), sau pot fi utilizate alte substanțe chimice ale căror date despre toxicitate sunt bine cunoscute. În cadrul unui ring test (2), s-a utilizat o formulă de carbendazim cunoscută sub denumirea comercială Derosal ™ furnizată de societatea AgrEvo (Frankfurt, Germania) și conținând 360 g/l (32,18 %) ingredient activ. EC50 pentru reproducere determinată în cadrul ring testului s-a încadrat în limita a 1,2 ± 0,8 mg ingredient activ (i.a.)/kg masă uscată (2). În cazul în care este inclus în seria de testare un standard toxic pozitiv, se utilizează o concentrație, iar numărul de probe duplicat trebuie să fie același cu cel de probe de control. Pentru carbendazim, se recomandă testarea a 1,2 mg i.a./kg greutate uscată (testat ca formulă lichidă).
|
DESCRIEREA TESTULUI
Echipamente
|
9.
|
Vasele de testare trebuie să fie confecționate din sticlă sau alt material inert din punct de vedere chimic. Borcanele de sticlă (de exemplu, volum: 0,20-0,25 litri; diametru: ≈ 6 cm) sunt adecvate. Vasele trebuie să aibă capace transparente (de exemplu din sticlă sau din polietilenă) care să fie concepute pentru a reduce evaporarea apei, permițând în același timp schimbul de gaze între sol și atmosferă. Capacele trebuie să fie transparente pentru a permite trecerea luminii.
|
|
10.
|
Sunt necesare echipamente de laborator obișnuite, care să includă în special următoarele:
|
—
|
cântare de precizie adecvate;
|
|
—
|
echipamente adecvate pentru controlul temperaturii;
|
|
—
|
echipamente adecvate pentru controlul umidității (neesențiale în cazul în care vasele de expunere sunt prevăzute cu capace);
|
|
—
|
incubator sau o cameră mică prevăzută cu sistem de climatizare;
|
|
—
|
pensete, cârlige sau anse;
|
|
Pregătirea solului artificial
|
11.
|
În cadrul prezentului test se utilizează un sol artificial (5)(7) având următoarea compoziție (pe baza greutăților uscate, uscat la o temperatură de 105 °C până la obținerea unei greutăți constante):
|
—
|
10 % turbă cu mușchi, uscată cu aer și măcinată fin (este acceptabilă o dimensiune de 2 ± 1 mm a particulelor); se recomandă să se verifice dacă un sol preparat cu un lot proaspăt de turbă este adecvat pentru cultura viermilor înainte de a fi utilizat pentru un test;
|
|
—
|
20 % argilă caolinică (de preferință, conținut caolinit de peste 30 %);
|
|
—
|
aproximativ 0,3-1,0 % carbonat de calciu (CaCO3, pulverizat, puritate analitică) pentru a obține un pH de 6,0 ± 0,5; cantitatea de carbonat de calciu care trebuie adăugată poate depinde în principal de calitatea/natura turbei;
|
|
—
|
aproximativ 70 % nisip cuarțos uscat cu aer (în funcție de cantitatea de CaCO3 necesară), nisip predominant fin cu peste 50 % dintre particule măsurând între 50 și 200 de microni.
|
Se recomandă demonstrarea caracterului adecvat al unui sol artificial pentru cultura viermilor și pentru îndeplinirea criteriilor de validitate înainte de a-l utiliza în cadrul unui test final. Efectuarea unei astfel de verificări se recomandă în special pentru a asigura faptul că performanța testului nu este compromisă în cazul în care conținutul de carbon organic al solului artificial este redus, de exemplu, prin reducerea conținutului de turbă la 4-5 % și creșterea conținutului de nisip în consecință. Printr-o astfel de reducere a conținutului de carbon organic, este posibil să scadă posibilitățile de adsorbție a substanței chimice de testare în sol (carbon organic) și să crească disponibilitatea substanței chimice de testare pentru viermi. S-a demonstrat că Enchytraeus albidus poate satisface criteriile de validitate privind reproducerea când este testat pe soluri naturale cu conținut mai scăzut de carbon organic decât cel menționat mai sus (de exemplu 2,7 %) (15) și s-a constatat experimental, deși într-un număr limitat de studii, că acest rezultat poate fi obținut și cu un sol artificial cu 5 % turbă.
Notă: Când se utilizează sol natural în cadrul unui test suplimentar (de exemplu, la un nivel superior), trebuie să se demonstreze, de asemenea, caracterul adecvat al solului și îndeplinirea criteriilor de validitate ale testului.
|
|
12.
|
Se amestecă bine constituenții uscați ai solului (de exemplu, într-un mixer de laborator mare). Această operațiune trebuie realizată cu cel puțin o săptămână înainte de începerea testului. Solul amestecat trebuie depozitat timp de două zile pentru a i se echilibra/stabiliza aciditatea. Pentru determinarea pH-ului, se utilizează un amestec de sol și 1 M de soluție de clorură de potasiu (KCl) sau 0,01 M de clorură de calciu (CaCl2) într-un raport de 1:5 [a se vedea referința (16) și apendicele 3]. Dacă aciditatea solului este mai mare decât limita impusă (a se vedea punctul 11), aceasta poate fi ajustată prin adăugarea unei cantități corespunzătoare de CaCO3. Dacă solul este prea alcalin, acest lucru poate fi ajustat prin adăugarea unei cantități suplimentare din amestecul menționat la punctul 11, dar fără CaCO3.
|
|
13.
|
Capacitatea maximă de retenție a apei (WHC) a solului artificial se determină conform procedurilor descrise în apendicele 2. Cu una-două zile înainte de începerea testului, solul artificial uscat este preumezit prin adăugarea unei cantități suficiente de apă deionizată pentru a obține aproximativ jumătate din conținutul final de apă, adică 40-60 % din capacitatea maximă de retenție a apei. La începutul testului, solul preumezit este împărțit în porții corespunzătoare numărului de concentrații de testare (și substanța chimică de referință, dacă este cazul) și de probe de control folosite pentru test. Conținutul de umiditate se ajustează la 40-60 % din WHC maximă prin adăugarea soluției de substanță chimică de testare și/sau prin adăugarea de apă distilată sau deionizată (a se vedea punctele 19-21). Conținutul de umiditate se determină la începutul și la sfârșitul testului (prin uscarea la 105 °C până la obținerea unei greutăți constante) și ar trebui să se încadreze în intervalul optim pentru supraviețuirea viermilor. Se poate efectua o verificare aproximativă a conținutului de umiditate din sol strângând ușor solul în mână; în cazul în care conținutul de umiditate este cel corect, trebuie să apară între degete picături mici de apă.
|
Selectarea și pregătirea animalelor pentru testare
|
14.
|
Specia de testare recomandată este Enchytraeus albidus Henle 1837 (viermele alb), membru al familiei Enchytraeidae (ordinul Oligochaeta, încrengătura Annelida). E. albidus este una dintre cele mai mari specii de enchitreide, fiind înregistrate specimene de până la 35 mm lungime (17)(18). E. albidus are o răspândire mondială și poate fi întâlnit în habitate marine, de apă dulce și terestre, în special în materia organică aflată în descompunere (alge, compost) și rareori în pajiști (9). Toleranța sa ecologică largă și unele variații morfologice ar putea indica existența diferitor rase.
|
|
15.
|
E. albidus este disponibil în comerț ca hrană pentru pești. Ar trebui verificat dacă cultura este contaminată cu alte specii, în general mai mici (1) (19). În cazul în care apare contaminarea, toți viermii ar trebui spălați cu apă într-o cutie Petri. Apoi ar trebui selectate specimene adulte mari de E. albidus (utilizând un stereomicroscop) pentru a începe o nouă cultură, iar toți ceilalți viermi se elimină. E. albidus poate fi crescut cu ușurință pe o gamă largă de materii organice (a se vedea apendicele 4). Ciclul de viață al E. albidus este scurt deoarece maturitatea survine între 33 de zile (la 18 °C) și 74 de zile (la 12 °C) (1). Pentru test se vor utiliza numai culturile care au fost păstrate fără probleme în laborator timp de cel puțin 5 săptămâni (o generație).
|
|
16.
|
Pot fi utilizate și alte specii din genul Enchytraeus, de exemplu E. buchholzi Vejdovsky 1879, sau E. crypticus Westheide & Graefe 1992 (a se vedea apendicele 5). Dacă se folosesc alte specii de Enchytraeus, acestea trebuie să fie clar identificate și ar trebui raportată o justificare pentru selectarea speciei.
|
|
17.
|
Animalele care se utilizează în cadrul testelor sunt viermii adulți. Aceștia trebuie să aibă ouă (puncte albe) în zona clitelumului și ar trebui să aibă aproximativ aceeași dimensiune (în jur de 1 cm lungime). Sincronizarea culturii de înmulțire nu este necesară.
|
|
18.
|
Dacă enchitreidele nu sunt crescute în același tip de sol și în aceleași condiții (inclusiv de hrănire) utilizate pentru test, acestea trebuie aclimatizate timp de cel puțin 24 de ore și până la trei zile. Pentru a permite respingerea specimenelor rănite sau inadecvate pentru orice alt motiv, trebuie aclimatizat la început un număr mai mare de adulți decât cel necesar pentru desfășurarea testului. La finalul perioadei de aclimatizare, se vor selecta pentru test numai viermii care au ouă și care nu prezintă anomalii de comportament (de exemplu să încerce să iasă din sol). Viermii se scot cu atenție utilizând o pensetă de bijutier, cârlige sau anse și se pun într-o cutie Petri conținând o cantitate mică de apă proaspătă. Pentru acest scop se preferă apa proaspătă reconstituită, conform propunerii din capitolul C.20 al prezentei anexe (Test de reproducere pentru Daphnia magna), deoarece apa deionizată, demineralizată sau de la robinet ar putea fi dăunătoare viermilor. Viermii se inspectează cu ajutorul unui stereomicroscop și toți cei care nu au ouă se elimină. Trebuie avut grijă să se scoată și să se elimine acarienii sau colembolele care ar fi putut infecta culturile. Viermii sănătoși neutilizați pentru test se pun înapoi în cultura stoc.
|
Pregătirea concentrațiilor de testare
Substanță chimică de testare solubilă în apă
|
19.
|
În apă deionizată, se pregătește o soluție a substanței chimice de testare, într-o cantitate suficientă pentru toate probele duplicat necesare pentru o concentrație de testare. Se recomandă utilizarea unei cantități corespunzătoare de apă pentru a obține conținutul de umiditate necesar, și anume 40-60 % din WHC maximă (a se vedea punctul 13). Fiecare soluție de substanță chimică de testare se amestecă bine cu un lot de sol preumezit în prealabil înainte de a fi introdusă în vasul de testare.
|
Substanță chimică de testare insolubilă în apă
|
20.
|
În cazul substanțelor chimice insolubile în apă, dar solubile în solvenți organici, substanța chimică de testare poate fi dizolvată în cel mai mic volum posibil al unui dizolvant adecvat (de exemplu, acetonă). Trebuie utilizați numai solvenți volatili. Dizolvantul se pulverizează sau se amestecă cu o cantitate redusă, de exemplu 2,5 g, de nisip cuarțos. Dizolvantul se elimină prin evaporare sub o hotă timp de cel puțin o oră. Acest amestec de nisip cuarțos și de substanță chimică de testare se adaugă la solul preumezit și se amestecă bine după adăugarea unei cantități corespunzătoare de apă deionizată pentru a se obține umiditatea dorită. Amestecul final se introduce în vasele de testare.
|
|
21.
|
În cazul substanțelor chimice puțin solubile în apă și solvenți organici, echivalentul de 2,5 g de nisip cuarțos fin măcinat pentru fiecare vas de testare este amestecat cu cantitatea de substanță chimică pentru a obține concentrația de testare dorită. Acest amestec de nisip cuarțos și de substanță chimică de testare se adaugă la solul preumezit și se amestecă bine după ce a fost adăugată o cantitate corespunzătoare de apă deionizată pentru a se obține conținutul de umiditate dorit. Amestecul final se distribuie în vasele de testare. Se repetă procedura pentru fiecare concentrație de testare și se pregătește, de asemenea, o probă de control corespunzătoare.
|
|
22.
|
În general, substanțele chimice nu ar trebui testate la concentrații mai mari de 1 000 mg/kg masă uscată de sol. Testarea la concentrații mai mari poate fi totuși necesară pentru obiectivele unui anumit test.
|
DESFĂȘURAREA TESTELOR
Grupuri de testare și de control
|
23.
|
Pentru fiecare concentrație de testare, o cantitate de sol de testare corespunzătoare unei cantități de 20 g de greutate uscată se pune în vasul de testare (a se vedea punctele 19-21). Se pregătesc, de asemenea, probe de control, fără substanța chimică de testat. În fiecare vas se adaugă hrană în conformitate cu procedurile descrise la punctul 29. În fiecare vas de testare se distribuie aleatoriu 10 viermi. Viermii se transferă cu atenție în fiecare vas de testare și se așează pe suprafața solului utilizând, de exemplu, o pensetă de bijutier, cârlige sau anse. Numărul de probe duplicat pentru concentrațiile de testare și pentru probele de control depinde de protocolul de testare utilizat (a se vedea punctul 34). Vasele de testare sunt poziționate în mod aleatoriu în incubatorul de testare, respectivele poziții fiind modificate săptămânal.
|
|
24.
|
În cazul utilizării unui dizolvant pentru aplicarea substanței chimice de testare, pe lângă seriile de testare, trebuie testată o serie de control conținând nisip cuarțos pulverizat sau amestecat cu solvent. Concentrația solventului sau a agentului de dispersie trebuie să fie egală cu cea utilizată în vasele de testare ce conțin substanța chimică de testare. Pentru substanțele chimice care necesită o administrare conformă cu procedurile descrise la punctul 21, trebuie testată o serie de control care să conțină nisip cuarțos suplimentar (2,5 g per vas).
|
Condițiile de testare
|
25.
|
Temperatura medie de testare este de 20 ± 2 °C. Pentru a împiedica viermii să iasă din sol, testul se efectuează în cicluri de lumină și de întuneric controlate (de preferință, 16 ore de lumină și 8 ore de întuneric) cu o intensitate a luminii cuprinsă între 400 și 800 lux în zona vaselor de testare.
|
|
26.
|
Pentru a verifica umiditatea solului, vasele se cântăresc la începutul testului, iar apoi o dată pe săptămână. Pierderea în greutate se compensează prin adăugarea unei cantități adecvate de apă deionizată. Trebuie remarcat faptul că pierderea de apă poate fi redusă prin menținerea unei umidități ridicate a aerului (> 80 %) în incubatorul de testare.
|
|
27.
|
Conținutul de umiditate și pH-ul trebuie măsurate la începutul și la sfârșitul testului atât în cazul testului de stabilire a intervalului, cât și în cazul testului final. Trebuie efectuate măsurători în eșantioanele de sol de control și tratate (la toate concentrațiile), preparate și menținute în aceleași condiții ca și culturile de testare, dar fără să conțină viermi. La aceste eșantioane se adaugă hrană numai la începutul testului pentru a facilita activitatea microbiană. Cantitatea de hrană adăugată trebuie să fie identică cu cea adăugată în culturile de testare. Nu este necesar să se mai adauge hrană în aceste vase pe parcursul testului.
|
Hrănirea
|
28.
|
Poate fi utilizată o hrană care poate întreține populația de enchitreide. S-a constatat că fulgii de ovăz, de preferat autoclavați înainte de utilizare pentru a evita contaminarea microbiană (încălzirea este, de asemenea, adecvată), reprezintă o hrană corespunzătoare.
|
|
29.
|
La început, hrana se administrează amestecând 50 mg de fulgi de ovăz măcinați cu solul din fiecare vas înainte de a introduce viermii. Apoi, hrana se administrează zilnic până în ziua 21. În ziua 28 nu se mai administrează hrană, deoarece în această etapă adulții vor fi fost scoși iar viermii tineri au nevoie de hrană suplimentară relativ puțină după acest moment. Hrana din timpul testului constă în 25 mg de fulgi de ovăz măcinați pentru fiecare vas, așezați cu atenție pe suprafața solului pentru a evita rănirea viermilor. Pentru a evita creșterea ciupercilor, fulgii de ovăz trebuie îngropați în sol prin acoperirea lor cu mici cantități de sol. Dacă hrana rămâne neconsumată, rația trebuie redusă.
|
Proiectul testului de stabilire a intervalului
|
30.
|
Atunci când este necesar, se realizează un test de stabilire a intervalului cu, de exemplu, cinci concentrații ale substanțelor chimice de testare de 0,1, 1,0, 10, 100 și 1 000 mg/kg (greutate uscată a solului). O probă duplicat pentru fiecare tratament și fiecare probă de control este suficientă.
|
|
31.
|
Durata testului de stabilire a intervalului este de două săptămâni. La sfârșitul testului, se evaluează mortalitatea viermilor. Un vierme este înregistrat ca fiind mort dacă nu are nicio reacție la un stimul mecanic la capătul anterior. Pentru a decide intervalul de concentrații pentru testul final, pot fi utile și alte informații pe lângă mortalitate. Modificările comportamentului adulților (de exemplu, incapacitatea de a săpa în sol, poziția nemișcată pe peretele de sticlă al vasului de testare) și ale morfologiei lor (de exemplu, prezența unor răni deschise) ar trebui, prin urmare, să fie consemnate împreună cu eventuala prezență a viermilor tineri. Aceasta din urmă poate fi determinată prin utilizarea metodei colorării descrise în apendicele 6.
|
|
32.
|
LC50 se poate determina cu aproximație prin calcularea mediei geometrice a datelor legate de mortalitate. La stabilirea intervalului de concentrații pentru testul final, efectele asupra reproducerii se presupun a fi mai mici decât LC50 cu un factor de maximum 10. Cu toate acestea, este vorba despre o relație empirică și, în orice caz specific, aceasta ar putea fi diferită. Observațiile suplimentare din timpul testului de stabilire a intervalului precum prezența viermilor tineri poate ajuta la rafinarea intervalului de concentrații ale substanței chimice de testare care vor fi utilizate pentru testul final.
|
|
33.
|
Pentru o determinare precisă a LC50, se recomandă efectuarea testului utilizând cel puțin patru probe duplicat pentru fiecare dintre concentrațiile substanței chimice de testare și un număr adecvat de concentrații pentru a cauza cel puțin patru răspunsuri medii semnificativ diferite din punct de vedere statistic la aceste concentrații. Dacă este cazul, se utilizează un număr similar de concentrații și de probe duplicat pentru probele de control.
|
Proiectul testului de reproducere final
|
34.
|
Sunt propuse trei proiecte de test, pe baza recomandărilor formulate în cadrul unui ring test (2).
|
—
|
Pentru stabilirea NOEC, trebuie testate cel puțin cinci concentrații într-o serie geometrică. Se recomandă utilizarea a patru probe duplicat pentru fiecare concentrație de testare și opt probe de control. Concentrațiile trebuie să fie distanțate cu un factor care să nu depășească valoarea de 1,8.
|
|
—
|
Pentru determinarea ECx (de exemplu EC10, EC50), trebuie testate cel puțin cinci concentrații, iar concentrațiile trebuie să încadreze ECx pentru a permite interpolarea și nu extrapolarea ECx. Se recomandă cel puțin patru probe duplicat pentru fiecare concentrație de testare și patru probe duplicat de control. Factorul de diluție poate varia, putând fi mai mic sau egal cu 1,8 în seria de efecte prevăzută și mai mare de 1,8 la concentrațiile cele mai mari și cele mai scăzute.
|
|
—
|
O abordare combinată permite determinarea valorilor NOEC și ECx. Trebuie utilizate opt concentrații de tratament în serie geometrică. Se recomandă utilizarea a patru probe duplicat pentru fiecare tratament și opt probe de control. Concentrațiile trebuie să fie distanțate cu un factor care să nu depășească valoarea de 1,8.
|
|
|
35.
|
Trebuie utilizați câte 10 viermi adulți pentru fiecare vas de testare (a se vedea punctul 23). Hrana se adaugă în vasele de testate la începutul testului, iar apoi o dată pe săptămână (a se vedea punctul 29) până inclusiv în ziua 21. În ziua 21, probele de sol se verifică ușor cu mâna pentru a observa și a număra viermii adulți vii, iar modificările comportamentului (de exemplu, incapacitatea de a săpa în sol, poziția nemișcată pe peretele de sticlă al vasului de testare) și ale morfologiei (de exemplu, prezența unor răni deschise) se consemnează. Ulterior, toți viermii adulți se scot din vasele de testare și din solul de testare. Solul de testare conținând eventual coconii produși se incubează timp de trei săptămâni suplimentare în aceleași condiții de testare, cu excepția faptului că hrănirea are loc abia în ziua 35 (adică, 25 mg de fulgi de ovăz măcinați pentru fiecare vas).
|
|
36.
|
După șase săptămâni, se numără viermii nou eclozați. Se recomandă metoda bazată pe colorarea cu roșu Bengal (a se vedea apendicele 6), deși s-au dovedit a fi adecvate și alte tehnici de extracție umedă (dar fără căldură) și de flotație (a se vedea apendicele 6) (4)(10)(11)(20). Se recomandă colorarea cu roșu Bengal deoarece extracția umedă dintr-un substrat de sol poate fi împiedicată de turbiditatea cauzată de particulele de argilă în suspensie.
|
Test la valori-limită
|
37.
|
În cazul în care nu se observă niciun efect la cea mai mare concentrație în cadrul testului de stabilire a intervalului (și anume 1 000 mg/kg), testul de reproducere poate fi realizat sub forma unui test la valori-limită, utilizând o concentrație de testare de 1 000 mg/kg pentru a demonstra că NOEC pentru reproducere este mai mare decât această valoare.
|
Rezumatul și calendarul testului
|
38.
|
Etapele testului pot fi rezumate după cum urmează:
|
Momentul
|
Testul de stabilire a intervalului
|
Testul final
|
|
Ziua –7 sau mai devreme
|
|
—
|
Pregătirea solului artificial (amestecarea constituenților uscați)
|
|
|
—
|
Pregătirea solului artificial (amestecarea constituenților uscați)
|
|
|
Ziua –5
|
|
—
|
Verificarea pH-ului solului artificial
|
|
—
|
Măsurarea WHC max. a solului
|
|
|
—
|
Verificarea pH-ului solului artificial
|
|
—
|
Măsurarea WHC max. a solului
|
|
|
Ziua –5 până la –3
|
|
—
|
Sortarea viermilor pentru aclimatizare
|
|
|
—
|
Sortarea viermilor pentru aclimatizare
|
|
|
Ziua – 3 până la 0
|
|
—
|
Aclimatizarea viermilor timp de cel puțin 24 de ore
|
|
|
—
|
Aclimatizarea viermilor timp de cel puțin 24 de ore
|
|
|
Ziua –1
|
|
—
|
Preumezirea solului artificial și distribuirea în loturi
|
|
|
—
|
Preumezirea solului artificial și distribuirea în loturi
|
|
|
Ziua 0
|
|
—
|
Prepararea soluțiilor stoc
|
|
—
|
Aplicarea substanței chimice de testare
|
|
—
|
Cântărirea substratului de testare în vasele de testare
|
|
—
|
Amestecarea hranei în sol
|
|
—
|
Măsurarea pH-ului și a conținutului de umiditate din sol
|
|
|
—
|
Prepararea soluțiilor stoc
|
|
—
|
Aplicarea substanței chimice de testare
|
|
—
|
Cântărirea substratului de testare în vasele de testare
|
|
—
|
Amestecarea hranei în sol
|
|
—
|
Măsurarea pH-ului și a conținutului de umiditate din sol
|
|
|
Ziua 7
|
|
—
|
Verificarea conținutului de umiditate din sol
|
|
|
—
|
Verificarea conținutului de umiditate din sol
|
|
|
Ziua 14
|
|
—
|
Determinarea mortalității adulților
|
|
—
|
Estimarea numărului de viermi tineri
|
|
—
|
Măsurarea pH-ului și a conținutului de umiditate din sol
|
|
|
—
|
Verificarea conținutului de umiditate din sol
|
|
|
Ziua 21
|
|
|
—
|
Observarea comportamentului adulților
|
|
—
|
Determinarea mortalității adulților
|
|
—
|
Verificarea conținutului de umiditate din sol
|
|
|
Ziua 28
|
|
|
—
|
Verificarea conținutului de umiditate din sol
|
|
|
Ziua 35
|
|
|
—
|
Verificarea conținutului de umiditate din sol
|
|
|
Ziua 42
|
|
|
—
|
Numărarea viermilor tineri
|
|
—
|
Măsurarea pH-ului și a conținutului de umiditate din sol
|
|
|
DATE ȘI RAPORT
Prelucrarea rezultatelor
|
39.
|
Cu toate că în apendicele 7 este furnizată o prezentare generală, în cadrul prezentei metode de testare nu este oferită nicio orientare statistică definitivă pentru analiza rezultatelor testului.
|
|
40.
|
În cadrul testului de stabilire a intervalului, punctul final principal este mortalitatea. Cu toate acestea, modificările comportamentului (de exemplu, incapacitatea de a săpa în sol; poziția nemișcată pe peretele de sticlă al vasului de testare) și ale morfologiei (de exemplu, prezența unor răni deschise) viermilor adulți trebuie, de asemenea, înregistrate împreună cu prezența eventualilor viermi tineri. De obicei, trebuie aplicată analiza probit (21) sau regresia logistică pentru determinarea LC50. Cu toate acestea, în cazurile în care această metodă de analiză nu este adecvată (de exemplu, dacă sunt disponibile mai puțin de trei concentrații având ca efect mortalitatea parțială), pot fi utilizate metode alternative. Aceste metode ar putea include mediile mobile (22), metoda simplificată Spearman-Karber (23) sau simpla interpolare (de exemplu, media geometrică a LC0 și LC100, calculată prin înmulțirea rădăcinii pătrate a LC0 cu LC100).
|
|
41.
|
În cadrul testului final, punctul final principal este fecunditatea (adică numărul de viermi tineri produși). Cu toate acestea, ca și în cazul testului de stabilire a intervalului, toate celelalte semne de nocivitate trebuie înregistrate în raportul final. Pentru a calcula rezultatele reproducerii, analiza statistică necesită cunoașterea mediei aritmetice și a abaterii standard per tratament și per probă de control.
|
|
42.
|
Dacă s-a efectuat o analiză a varianței, abaterea standard, s, și gradele de libertate, df, pot fi înlocuite de estimarea varianței combinate obținute din ANOVA și, respectiv, de gradele sale de libertate, cu condiția ca varianța să nu depindă de concentrație. În acest caz, se utilizează varianțele unice ale probelor de control și ale probelor supuse tratamentului. Respectivele valori se calculează de obicei cu ajutorul unui software statistic comercial utilizând ca duplicat rezultatele pentru fiecare vas. În cazul în care combinarea datelor pentru probele de control negative și pentru probele de control cu solvent pare rezonabilă în locul testării în raport cu una dintre ele, acestea trebuie testate pentru a vedea dacă nu diferă în mod semnificativ (pentru teste adecvate, a se vedea punctul 45 și apendicele 7).
|
|
43.
|
Testarea statistică și inferența suplimentare depind de distribuția normală și omogenitatea valorilor duplicate în ceea ce privește varianța.
|
Estimarea NOEC
|
44.
|
Ar fi de preferat aplicarea unor teste puternice. Trebuie utilizate informații, de exemplu, din experiența anterioară din cadrul ring testelor sau alte date istorice, cu privire la distribuția aproximativ normală a datelor. Omogenitatea varianței (omoscedasticitatea) este mai importantă. Experiența arată că varianța crește adesea odată cu creșterea mediei. În aceste cazuri, o transformare a datelor ar putea duce la omoscedasticitate. Cu toate acestea, o astfel de transformare ar trebui să se bazeze mai degrabă pe experiența cu datele istorice decât pe datele studiate. Cu date omogene, ar trebui efectuate teste t multiple cum ar fi testul lui Williams (α = 0,05, unilateral) (24)(25) sau, în anumite cazuri, testul lui Dunnett (26)(27). Trebuie remarcat faptul că, în cazul unei duplicări inegale, valorile t din tabel trebuie corectate astfel cum au sugerat Dunnett și Williams. Uneori, din cauza variației mari, răspunsurile nu cresc/descresc în mod regulat. În acest caz de abatere puternică de la monotonicitate, testul lui Dunnett este mai adecvat. Dacă există abateri de la omoscedasticitate, ar putea fi rezonabilă examinarea mai îndeaproape a posibilelor efecte asupra varianțelor pentru a decide dacă testele t pot fi aplicate fără a pierde mult din putere (28). În mod alternativ, se poate aplica un test U multiplu, de exemplu testul U al lui Bonferroni după Holm (29), sau, când aceste date prezintă heteroscedasticitate, dar din alte puncte de vedere corespund unei relații doză-răspuns subiacente monotone, un alt test neparametric [de exemplu, Jonckheere-Terpstra (30) (31) sau Shirley (32) (33)] și ar fi în general de preferat testelor t cu varianță inegală. (A se vedea, de asemenea, schema din apendicele 7.)
|
|
45.
|
Dacă s-a efectuat un test la valori-limită, iar premisele procedurilor de testare parametrice (normalitate, omogenitate) sunt îndeplinite, poate fi utilizat testul t (Student) pe perechi sau procedura de testare U al lui Mann-Whitney (29).
|
Estimarea ECx
|
46.
|
Pentru a calcula orice valoare a ECx, se utilizează mediile pentru fiecare tratament pentru analiza regresiei (liniară sau neliniară), după obținerea unei funcții doză-răspuns adecvate. Pentru creșterea viermilor considerată răspuns continuu, valorile ECx- pot fi estimate utilizând o analiză de regresie adecvată (35). Printre funcțiile potrivite pentru datele binare (mortalitate/supraviețuire și număr de descendenți produși) se numără funcția sigmoidă normală, funcția logistică sau funcția Weibull, cu doi sau patru parametri, dintre care unii pot modela și răspunsuri hormetice. Dacă s-a stabilit o funcție doză-răspuns prin analiză de regresie liniară, trebuie obținut un r2 (coeficient de determinare) și/sau o pantă semnificative în analiza de regresie înainte de a estima ECx prin introducerea unei valori corespunzătoare x % din media probelor de control în ecuația obținută prin analiza de regresie. Limitele de încredere de 95 % se calculează după metoda lui Fieller [citată de Finney (21)] sau după alte metode moderne adecvate.
|
|
47.
|
Alternativ, răspunsul se modelează ca procentaj sau proporție din parametrul modelului, care se interpretează ca răspuns mediu al probelor de control. În aceste cazuri, curba sigmoidă normală (logistică, Weibull) poate fi adesea ajustată la rezultate utilizând procedura de regresie probit (21). În aceste cazuri, funcția de ponderare trebuie ajustată pentru răspunsurile metrice potrivit lui Christensen (36). Cu toate acestea, dacă se observă o hormeză, analiza probit ar trebui înlocuită cu o funcție logistică sau Weibull cu patru parametri, stabilită printr-o procedură de regresie neliniară (36). Dacă este imposibilă ajustarea unei funcții doză-răspuns adecvate la date, se pot utiliza metode alternative de estimare a ECx și a limitelor sale de încredere, cum ar fi mediile mobile după Thompson (22) și procedura Spearman-Karber simplificată (23).
|
RAPORTUL DE TESTARE
|
48.
|
Raportul de testare trebuie să includă următoarele informații:
|
|
Substanța chimică de testare:
|
—
|
natura fizică și, după caz, proprietățile fizico-chimice (de exemplu solubilitatea în apă, presiunea de vapori);
|
|
—
|
identificarea chimică a substanței chimice de testare în conformitate cu nomenclatorul IUPAC, numărul CAS, lotul de fabricație, lotul de ambalare, formula structurală și puritatea;
|
|
—
|
data de expirare a eșantionului.
|
|
|
|
Specia de testare:
|
—
|
animalele de testare utilizate: specia, denumirea științifică, sursa organismelor și condițiile de înmulțire.
|
|
|
|
Condițiile de testare:
|
—
|
ingredientele și pregătirea solului artificial;
|
|
—
|
metoda de aplicare a substanței chimice de testare;
|
|
—
|
descrierea condițiilor de testare, inclusiv temperatura, conținutul de umiditate, pH-ul etc.;
|
|
—
|
descrierea completă a protocolului și a procedurilor de testare.
|
|
|
|
Rezultatele testului:
|
—
|
mortalitatea viermilor adulți după două săptămâni și numărul de viermi tineri la finalul testului de stabilire a intervalului;
|
|
—
|
mortalitatea viermilor adulți după trei săptămâni de expunere și numărul total de viermi tineri la finalul testului final;
|
|
—
|
orice simptom fizic sau patologic și orice modificare a comportamentului observate la organismele de testare;
|
|
—
|
valorile LC50, NOEC și/sau ECx (de exemplu, EC50, EC10) pentru reproducere, în cazul în care unele dintre acestea sunt aplicabile cu intervale de încredere și un grafic al modelului ajustat utilizat pentru calcularea acestora, toate informațiile și observațiile utile pentru interpretarea rezultatelor.
|
|
Abaterile de la procedurile descrise în prezenta metodă de testare și orice eveniment neobișnuit survenit pe parcursul testului.
|
BIBLIOGRAFIE
|
(1)
|
Römbke, J. (1989). Entwicklung eines Reproduktionstests an Bodenorganismen – Enchytraeen. Abschlußbericht des Battelle-Instituts e.V. Frankfurt für das Umweltbundesamt (Berlin), FE-Vorhaben 106 03 051/01.
|
|
(2)
|
Römbke, J. și Moser, T. (1999). Organisation and Performance of an International Ringtest for the Validation of the Enchytraeid Reproduction Test. UBA-Texte 4/99, 150 + 223 pp.
|
|
(3)
|
Westheide, W. și Bethge-Beilfuss, D. (1991). The sublethal enchytraeid test system: guidelines and some results, In: Modern Ecology: Basic and Applied Aspects. Ed. by Esser, G. and Overdieck, D. pp 497-508. Elsevier, Amsterdam,
|
|
(4)
|
Dirven-Van Breemen, E., Baerselmann, R. și Notenboom, J. (1994). Onderzoek naar de Geschiktheid van de Potwormsoorten Enchytraeus albidus en Enchytraeus crypticus (Oligochaeta, Annelida) in Bodemecotoxicologisch Onderzoek. RIVM Rapport Nr. 719102025. 46 pp.
|
|
(5)
|
Capitolul C.8 al prezentei anexe, Toxicitatea la râme.
|
|
(6)
|
ISO (International Organization for Standardization) (1993). Soil Quality – Effects of pollutants on earthworms (Eisenia fetida). Part 1: Determination of acute toxicity using Artificial Soil substrate, No. 11268-1. ISO, Geneve.
|
|
(7)
|
ISO (International Organization for Standardization) (1996). Soil Quality – Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction, No. 11268-2. ISO, Geneve.
|
|
(8)
|
Rundgren, S. și A.K. Augustsson (1998). Test on the enchytraeid Cognettia sphagnetorum (Vejdovsky 1877). In: Løkke, H. and C.A.M. Van Gestel, Handbook of soil invertebrate toxicity tests. John Wiley and Sons, Chichester, 73-94.
|
|
(9)
|
Kasprzak, K. (1982). Review of enchytraeid community structure and function in agricultural ecosystems. Pedobiologia 23, 217-232.
|
|
(10)
|
Römbke, J. (1995). Enchytraeen (Oligochaeta) als Bioindikator, UWSF – Z. Umweltchem. Ökotox. 7, 246-249.
|
|
(11)
|
Dunger, W. și Fiedler, H.J. (1997). Methoden der Bodenbiologie. G. Fischer Verlag, Stuttgart, New York.
|
|
(12)
|
Didden, W.A.M. (1993). Ecology of terrestrial Enchytraeidae. Pedobiologia 37, 2-29.
|
|
(13)
|
Becker, H. (1991). Bodenorganismen – Prüfungskategorien der Forschung. UWSF – Z. Umweltchem. Ökotox. 3, 19-24.
|
|
(14)
|
Römbke, J. și Federschmidt, A. (1995). Effects of the fungicide Carbendazim on Enchytraeidae in laboratory and field tests, Newsletter on Enchytraeidae 4, 79-96.
|
|
(15)
|
Römbke, J., Riepert, F. & Achazi R. (2000): Enchytraeen als Testorganismen. In: Toxikologische Beurteilung von Böden. Heiden, S., Erb, R., Dott, W. & Eisentraeger, A. (eds.). Spektrum Verl., Heidelberg. 59-81.
|
|
(16)
|
ISO (International Organization for Standardization) (1994). Soil Quality – Determination of pH, No. 10390. ISO, Geneve.
|
|
(17)
|
Bell, A.W. (1958). The anatomy of Enchytraeus albidus, with a key to the species of the genus Enchytraeus. Ann. Mus. Novitat. 1902, 1-13.
|
|
(18)
|
Nielsen, C.O. și Christensen, B. (1959). The Enchytraeidae, critical revision and taxonomy of European species. Natura Jutlandica 8-9, 1-160.
|
|
(19)
|
Bouguenec, V. și Giani, N. (1987). Deux nouvelles especes d'Enchytraeus (Oligochaeta, Enchytraeidae) et rediscription d'E. bigeminus. Remarques sur le genre Enchytraeus. Ann. Limnol. 23, 9-22.
|
|
(20)
|
Korinkova, J. și Sigmund, J. (1968). The colouring of bottom-fauna samples before sorting, Vestnik Ceskoslovensko Spolecnosti Zoologicke 32, 300-305.
|
|
(21)
|
Finney, D.J. (1971). Probit Analysis (3rd ed.), pp. 19-76. Cambridge Univ. Press.
|
|
(22)
|
Finney, D.J. (1978). Statistical Method in Biological Assay. – Charles Griffin & Company Ltd, London.
|
|
(23)
|
Hamilton, M.A., R.C. Russo și R.V. Thurston. (1977). Trimmed Spearman-Karber Method for estimating median lethal concentrations in toxicity bioassays. Environ. Sci. Technol. 11(7), 714-719; Correction Environ. Sci. Technol. 12(1998), 417.
|
|
(24)
|
Williams, D.A., (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27, 103-117.
|
|
(25)
|
Williams, D.A., (1972). The comparison of several dose levels with a zero dose control. Biometrics 28, 519-531.
|
|
(26)
|
Dunnett, C.W., (1955). A multiple comparison procedure for comparing several treatments with a control. Amer. Statist. Ass. J. 50, 1096-1121.
|
|
(27)
|
Dunnett, C.W., (1964) New tables for multiple comparisons with a control. Biometrics 20, 482-491.
|
|
(28)
|
Hoeven, N. van der, (1998). Power analysis for the NOEC: What is the probability of detecting small toxic effects on three different species using the appropriate standardized test protocols? Ecotoxicology 7: 355-361
|
|
(29)
|
Holm, S., (1979): A simple sequentially rejective multiple test procedure. Scand. J. Statist. 6, 65-70.
|
|
(30)
|
Jonckheere, A. R. (1954); A Distribution-free k-Sample Test Against Ordered Alternatives, Biometrika 41, 133-145.
|
|
(31)
|
Terpstra, T. J. (1952); The Asymptotic Normality and Consistency of Kendall's Test Against Trend, When Ties are Present in One Ranking, Indagationes Math. 14, 327-333.
|
|
(32)
|
Shirley, E. A. (1979); The comparison of treatment to control group means in toxicology studies, Applied Statistics 28, 144-151.
|
|
(33)
|
Williams, D.A. (1986); A Note on Shirley's Nonparametric Test for Comparing Several Dose Levels with a Zero-Dose Control, Biometrics 42, 183-186.
|
|
(34)
|
Sokal, R.R. și F.J. Rohlf. (1981). Biometry. The Principle and practice of statistics in biological research. 2nd edition. W.H. Freeman and Company. New York.
|
|
(35)
|
Christensen, E.R., (1984). Dose-response functions in aquatic toxicity testing and the Weibull model. Water Research 18, 213-221.
|
|
(36)
|
Van Ewijk, P.H. și J.A. Hoekstra. (1993). Calculation of the EC50 and its confidence interval when sub-toxic stimulus is present. Ecotox, Environ. Safety. 25, 25-32.
|
Apendicele 1
Definiții
În scopul prezentei metode de testare se utilizează următoarele definiții:
|
|
«Substanță chimică» înseamnă o substanță sau un amestec.
|
|
|
«ECx» (concentrația efectivă pentru un efect de x %) înseamnă concentrația care determină un efect de x % asupra organismelor de testare pe parcursul unei perioade de expunere date comparativ cu o probă de control. În cadrul prezentului test, concentrațiile efective sunt exprimate ca masă a substanței chimice de testare per masă uscată de sol de testare.
|
|
|
«LC0» (concentrație neletală) înseamnă concentrația unei substanțe chimice de testare care nu ucide niciunul dintre organismele de testare expuse pe parcursul unei perioade date. În cadrul prezentului test, LC0 este exprimată ca masă a substanței chimice de testare per masă uscată de sol de testare.
|
|
|
«LC50» (concentrație letală medie) înseamnă concentrația unei substanțe chimice de testare care ucide 50 % dintre organismele de testare expuse pe parcursul unei perioade date. În cadrul prezentului test, LC50 este exprimată ca masă a substanței chimice de testare per masă uscată de sol de testare.
|
|
|
«LC100» (concentrație în întregime letală) este concentrația unei substanțe chimice de testare care ucide 100 % dintre organismele de testare expuse pe parcursul unei perioade date. În cadrul prezentului test, LC100 este exprimată ca masă a substanței chimice de testare per masă uscată de sol de testare.
|
|
|
«LOEC» (concentrația cea mai scăzută pentru care este observat un efect) înseamnă cea mai scăzută concentrație a substanței chimice de testat care are un efect semnificativ din punct de vedere statistic (p < 0,05). În cadrul prezentului test, LOEC este exprimată ca masă a substanței chimice de testare per masă uscată de sol de testare. Toate concentrațiile de testare mai mari decât LOEC trebuie să indice în mod normal un efect diferit din punct de vedere statistic de cel observat în cazul probei de control. Orice abatere de la cele sus-menționate pentru identificarea LOEC trebuie justificată în raportul de testare.
|
|
|
«NOEC» (concentrația la care nu se observă niciun efect) înseamnă cea mai mare concentrație a substanței chimice de testare aflată imediat sub LOEC la care nu se observă niciun efect. În cadrul acestui test, concentrația corespunzătoare NOEC nu prezintă niciun efect semnificativ din punct de vedere statistic (p < 0,05) pe parcursul unei perioade de expunere date comparativ cu proba de control.
|
|
|
«Rată de reproducere» înseamnă numărul mediu de viermi tineri produși raportat la numărul de adulți pe parcursul perioadei de testare.
|
|
|
«Substanță chimică de testare» înseamnă orice substanță sau amestec care se testează utilizându-se prezenta metodă de testare.
|
Apendicele 2
Determinarea capacității maxime de retenție a apei
Determinarea capacității de retenție a apei a solului artificial
Următoarea metodă s-a dovedit a fi adecvată. Ea este descrisă în anexa C la ISO DIS 11268-2.
Se prelevează o cantitate definită (de exemplu 5 g) din substratul de sol de testare cu ajutorul unui dispozitiv adecvat (tub cu sfredel etc.). Se acoperă fundul tubului cu o bucată de hârtie de filtru și, după umplerea sa cu apă, se așează pe un suport într-o baie de apă. Tubul trebuie scufundat treptat până ce nivelul apei depășește nivelul solului. Acesta trebuie apoi ținut în apă timp de aproximativ trei ore. Întrucât apa absorbită de capilarele solului nu poate fi reținută în totalitate, aceasta trebuie lăsată să se evapore din proba de sol timp de două ore prin amplasarea tubului pe un pat de nisip cuarțos fin măcinat și foarte umed într-un vas închis (pentru a preveni uscarea acestuia). Proba trebuie apoi cântărită, uscată la o temperatură de 105 °C până ce atinge o masă constantă. Capacitatea de retenție a apei (WHC) poate fi apoi calculată după cum urmează:

unde:
|
S
|
=
|
masa substratului saturat cu apă + masa tubului + masa hârtiei de filtru
|
|
T
|
=
|
tara (masa tubului + masa hârtiei de filtru)
|
|
D
|
=
|
masa uscată a substratului
|
BIBLIOGRAFIE:
ISO (International Organization for Standardization) (1996). Soil Quality -Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction, No. 11268-2. ISO, Geneve.
Apendicele 3
Determinarea pH-ului solului
Următoarea metodă de determinare a pH-ului probei de sol se bazează pe descrierea din ISO 10390 (Calitatea solului – Determinarea pH-ului).
O cantitate definită de sol este uscată la temperatura camerei timp de cel puțin 12 ore. Se prepară apoi o suspensie a solului (conținând cel puțin 5 grame de sol) într-o cantitate echivalentă cu de cinci ori volumul său formată din 1 M de clorură de potasiu (KCl) de puritate analitică sau 0,01 M de clorură de calciu (CaCl2) de puritate analitică. Ulterior, suspensia se agită bine timp de cinci minute. După agitare, suspensia se lasă la limpezit timp de cel puțin 2 ore, dar nu mai mult de 24 de ore. pH-ul fazei lichide este apoi măsurat cu ajutorul unui pH-metru care a fost calibrat înaintea fiecărei măsurători utilizând o serie corespunzătoare de soluții-tampon (de exemplu, pH 4,0 și 7,0).
BIBLIOGRAFIE:
ISO (International Organization for Standardization) (1994). Soil Quality – Determination of pH, No. 10390. ISO, Geneve.
Apendicele 4
Condiții de cultură a speciilor de Enchytraeus
Enchitreidele din specia Enchytraeus albidus (precum și alte specii de Enchytraeus) pot fi crescute în cutii mari de plastic (de exemplu 30 × 60 × 10 cm) umplute cu un amestec 1:1 de sol artificial și sol de grădină natural necontaminat. Trebuie evitată utilizarea compostului deoarece acesta poate conține substanțe chimice toxice, cum ar fi metale grele. Fauna trebuie eliminată din sol înainte de utilizare (de exemplu, prin congelare). Se poate utiliza și un substrat format doar din sol artificial, însă rata de reproducere poate fi mai mică decât cea obținută cu un substrat de sol amestecat. Substratul utilizat pentru cultură trebuie să aibă un pH de 6,0 ± 0,5.
Cultura se păstrează la întuneric, la o temperatură de 15-20 °C ± 2 °C. Trebuie evitate temperaturile mai mari de 23 °C. Solul trebuie menținut umed, dar nu ud. Conținutul de umiditate corect este indicat de apariția unor mici picături de apă între degete atunci când solul este strâns ușor în mână. Crearea de condiții anoxice trebuie evitată prin asigurarea faptului că recipientele de cultură permit un schimb de gaze adecvat cu atmosfera. Solul trebuie întors cu grijă săptămânal pentru a facilita aerarea.
Viermii pot fi hrăniți cu fulgi de ovăz. Fulgii de ovăz trebuie păstrați în vase închise ermetic și autoclavați sau încălziți înainte de utilizare pentru a evita infecțiile cu acarieni de făină (de exemplu, Glyzyphagus sp., Astigmata, Acarina) sau cu acarieni prădători [de exemplu, Hypoaspis (Cosmolaelaps) miles, Gamasida, Acarina]. După tratamentul termic, hrana trebuie măcinată pentru a putea fi ușor împrăștiată pe suprafața solului. Din când în când, fulgii de ovăz pot fi suplimentați cu vitamine, lapte și ulei de ficat de cod. Alte surse adecvate de hrană sunt drojdia de panificație și hrana pentru pești «Tetramin».
Administrarea hranei se face aproximativ de două ori pe săptămână. O cantitate adecvată de fulgi de ovăz se împrăștie pe suprafața solului sau se amestecă cu grijă în substrat atunci când se întoarce solul pentru a facilita aerarea. Cantitatea absolută de hrană furnizată depinde de numărul de viermi prezenți în substrat. Cu titlu orientativ, cantitatea de hrană trebuie crescută dacă este consumată în decurs de o zi de la administrare. Invers, dacă pe suprafața solului încă mai există hrană la momentul celei de a doua administrări de hrană (o săptămână mai târziu), cantitatea trebuie redusă. Hrana contaminată cu ciuperci trebuie eliminată și înlocuită. După trei luni, viermii trebuie transferați într-un substrat proaspăt.
Condițiile de cultură sunt considerate satisfăcătoare dacă viermii: (a) nu încearcă să părăsească substratul, (b) se mișcă repede prin sol, (c) prezintă o suprafață exterioară lucioasă, fără particule de sol lipite, (d) au o culoare mai mult sau mai puțin albicioasă (e) prezintă o varietate de intervale de vârstă în culturi și (f) se reproduc continuu.
Apendicele 5
Desfășurarea testului cu alte specii de Enchytraeus
Alegerea speciei
Pot fi utilizate și alte specii decât E. albidus, însă procedura de testare și criteriile de validitate trebuie adaptate în consecință. Întrucât multe specii de Enchytraeus sunt ușor disponibile și pot fi întreținute în mod satisfăcător în laborator, cel mai important criteriu pentru selectarea unei alte specii decât E. albidus este relevanța ecologică și, în plus, sensibilitatea comparabilă. Schimbarea speciei poate avea și motive oficiale. De exemplu, în țările în care nu există și nu se poate importa E. albidus (de exemplu, din cauza unor restricții de carantină), va fi necesară utilizarea unei alte specii de Enchytraeus.
Exemple de specii alternative adecvate
|
—
|
Enchytraeus crypticus (Westheide & Graefe 1992): în ultimii ani, această specie a fost deseori folosită în studii ecotoxicologice datorită ușurinței înmulțirii și testării. Cu toate acestea, este vorba despre un vierme mic, ceea ce face manipularea mai dificilă în comparație cu E. albidus (în special în etapele anterioare utilizării metodei de colorare). Nu s-a dovedit cu certitudine existența E. crypticus în natură, specia fiind descrisă numai în culturi de râme. Prin urmare, nu se cunosc cerințele sale ecologice.
|
|
—
|
Enchytraeus buchholzi (Vejdovsky 1879): Această denumire acoperă probabil un grup de specii foarte apropiate care sunt dificil de distins din punct de vedere morfologic. Utilizarea sa pentru testare nu se recomandă decât după ce se poate identifica specia indivizilor utilizați într-un test. E. buchholzi trăiește de obicei în pajiști sau în locuri perturbate cum ar fi marginea drumurilor.
|
|
—
|
Enchytraeus luxuriosus: această specie a fost cunoscută inițial ca E.«minutus», însă a fost descrisă recent (1). A fost descoperită pentru prima dată de U. Graefe (Hamburg) pe o pajiște din apropiere de St. Peter-Ording (Schleswig-Holstein, Germania). E. luxuriosus are aproximativ jumătate din dimensiunea E. albidus, însă este mai mare decât alte specii discutate în prezentul apendice; această caracteristică o poate transforma într-o bună specie pentru înlocuirea E. albidus.
|
|
—
|
Enchytraeus bulbosus (Nielsen & Christensen 1963): această specie a fost raportată până acum pentru solurile minerale din Germania și Spania, unde este o specie obișnuită, însă de obicei nu foarte abundentă. Spre deosebire de alte specii mici din acest gen, este relativ ușor de identificat. Nu există informații despre comportamentul său în testele de laborator sau despre sensibilitatea sa la substanțele chimice. Cu toate acestea, s-a constatat că este o specie ușor de crescut (E. Belotti, comunicare personală).
|
Condiții de înmulțire
Toate speciile de Enchytraeus menționate mai sus pot fi crescute în aceleași substraturi utilizate pentru E. albidus. Având în vedere dimensiunea lor mai mică, vasele de cultură pot fi mai mici și, deși se poate utiliza aceeași hrană, rația trebuie să fie ajustată. Ciclul de viață al acestor specii este mai scurt decât în cazul E. albidus, iar administrarea hranei trebuie efectuată mai frecvent.
Condiții de testare
Condițiile de testare sunt în general ca cele aplicabile pentru E. albidus, cu următoarele excepții:
|
—
|
dimensiunea vasului de testare poate (dar nu trebuie) să fie mai mică;
|
|
—
|
durata testului de reproducere poate (dar nu trebuie) să fie mai mică, adică patru în loc de șase săptămâni; cu toate acestea, durata testului de stabilire a intervalului nu trebuie modificată;
|
|
—
|
având în vedere dimensiunea mică a viermilor tineri, utilizarea metodei de colorare este foarte recomandată pentru numărare;
|
|
—
|
criteriul de validitate legat de «numărul de viermi tineri din fiecare vas de testare din proba de control» trebuie schimbat cu «50».
|
BIBLIOGRAFIE
|
(1)
|
Schmelz, R.M. and Collado, R. (1999). Enchytraeus luxuriosus sp.nov., a new terrestrial oligochaete species (Enchytraeidae, Clitellata, Annelida). Carolinea 57, 93-100.
|
Apendicele 6
Descriere detaliată a tehnicilor de extracție
Colorarea cu roșu Bengal
Această metodă, dezvoltată inițial în ecologia limnică (1) a fost propusă pentru prima dată în scopul numărării enchitreidelor tinere din testul de reproducere a enchitreidelor de W. de Coen (Universitatea din Ghent, Belgia). O versiune modificată (roșu Bengal amestecat cu formaldehidă în loc de etanol) a fost dezvoltată independent de RIVM Bilthoven (2)(3).
La sfârșitul testului final (adică după șase săptămâni), solul din vasele de testare se transferă într-un recipient cu adâncime mică. În acest scop este util un vas Bellaplast sau un bazin fotografic cu fund canelat, cel din urmă, datorită canelurilor, împiedică deplasarea viermilor în câmpul de observație. Viermii tineri sunt fixați cu etanol (aproximativ 5 ml per probă duplicat). Vasele se umplu apoi cu apă până la un strat de 1-2 cm. Se adaugă câteva picături (200-300 μl) de roșu Bengal (soluție de 1 % în etanol) (0,5 % eozină este o altă opțiune) după care cele două componente se amestecă cu grijă. După 12 ore, viermii ar trebui să aibă pete de culoare roșiatică și ar trebui să fie ușor de numărat deoarece se vor afla pe suprafața substratului. Alternativ, amestecul substrat/alcool poate fi spălat printr-o sită (dimensiunea ochiurilor: 0,250 mm) înainte de numărarea viermilor. Utilizând această procedură, caolinitul, turba și o parte din nisip vor fi îndepărtate prin spălare, iar viermii de culoare roșiatică vor fi mai ușor de văzut și de numărat. Utilizarea unor lupe iluminate (dimensiune a lupei de 100 × 75 mm cu un factor de mărire de 2-3) va facilita, de asemenea, numărătoarea.
Tehnica colorării reduce timpul de numărare la câteva minute pentru fiecare vas și, orientativ, ar trebui să fie posibil ca o singură persoană să evalueze toate vasele din cadrul unui test în maximum două zile.
Extracția umedă
Extracția umedă trebuie începută imediat după încheierea testului. Solul din fiecare vas de testare se pune în site de plastic cu o dimensiune a ochiurilor de aproximativ 1 mm. Sitele se suspendă apoi în boluri de plastic, fără a atinge fundul. Bolurile se umplu atent cu apă până când probele din site se află în întregime sub suprafața apei. Pentru a asigura o rată de recuperare de peste 90 % dintre viermii prezenți, trebuie utilizată o perioadă de extracție de 3 zile la 20 ± 2 °C. La finalul perioadei de extracție, sitele se scot, iar apa (cu excepția unei cantități mici) se decantează ușor, având grijă să nu se agite sedimentul de pe fundul bolurilor. Ulterior, bolurile de plastic se agită ușor pentru a pune sedimentul în suspensie în apa de deasupra. Apa se transferă într-o cutie Petri și, după ce particulele de sol se depun, enchitreidele pot fi identificate, scoase și numărate utilizând un stereomicroscop și o pensetă fină din oțel.
Flotația
O metodă bazată pe flotație a fost descrisă într-o notă de R. Kuperman (4). După fixarea conținutului unui vas de testare cu etanol, solul se inundă cu Ludox (silice coloidală AM-30, suspensie apoasă de 30 % în greutate) până la 10-15 mm deasupra suprafeței solului. După o amestecare completă a solului cu agentul de flotație timp de 2-3 minute, viermii tineri care plutesc la suprafață pot fi numărați cu ușurință.
BIBLIOGRAFIE
|
(1)
|
Korinkova, J. și Sigmund, J. (1968). The colouring of bottom-fauna samples before sorting, Vestnik Ceskoslovensko Spolecnosti Zoologicke 32, 300-305.
|
|
(2)
|
Dirven-Van Breemen, E., Baerselmann, R. și Notenboom, J. (1994). Onderzoek naar de Geschiktheid van de Potwormsoorten Enchytraeus albidus en Enchytraeus crypticus (Oligochaeta, Annelida) in Bodemecotoxicologisch Onderzoek. RIVM Rapport Nr. 719102025. 46 pp.
|
|
(3)
|
Posthuma, L., Baerselmann, R., Van Veen, R.P.M. și Dirven-Van Breemen, E.M. (1997). Single and joint toxic effects of copper and zinc on reproduction of Enchytraeus crypticus in relation to sorption of metals in soils. Ecotox. Envir. Safety 38, 108-121.
|
|
(4)
|
Phillips, C.T., Checkai, R.T. și Kuperman, R.G. (1998). An alternative to the O'Connor Method for Extracting Enchytraeids from Soil. SETAC 19th Annual Meeting, Charlotte, USA. Abstract Book No. PMP069, p. 157.
|
Apendicele 7
Prezentare generală a evaluării statistice a datelor (determinarea NOEC)

C.33. TEST DE REPRODUCERE A RÂMELOR (EISENIA FETIDA/EISENIA ANDREI)
INTRODUCERE
|
1.
|
Prezenta metodă de testare este echivalentă cu Orientarea OCDE privind testarea (TG) nr. 222 (2004). Aceasta este concepută pentru evaluarea efectelor substanțelor chimice din sol asupra ratei de reproducere (și a altor puncte finale subletale) a speciei de râme Eisenia fetida (Savigny 1826) sau Eisenia andrei (Andre 1963) (1)(2). Testul a făcut obiectul unui ring test (3). Există o metodă de testare a toxicității acute asupra râmelor (4). S-au publicat numeroase alte orientări internaționale și naționale pentru testele de toxicitate acută și cronică asupra râmelor (5)(6)(7)(8).
|
|
2.
|
Eisenia fetida /Eisenia andrei este considerat unul dintre reprezentanții faunei din sol și, în special, al râmelor. Sunt disponibile informații de referință privind ecologia râmelor și utilizarea acestora în cadrul testelor ecotoxicologice (7)(9)(10)(11)(12).
|
PRINCIPIUL TESTULUI
|
3.
|
Râmele adulte sunt expuse la o serie de concentrații ale substanței chimice de testare, fie amestecată în sol, fie, în cazul pesticidelor, aplicată în sau pe sol utilizând proceduri conforme cu modelul de utilizare a substanței chimice respective. Metoda de aplicare depinde de scopul testului. Seria de concentrații de testare este selectată pentru a include concentrațiile susceptibile de a cauza efecte subletale și letale pe parcursul unei perioade de opt săptămâni. Mortalitatea și efectele asupra creșterii la râmele adulte sunt determinate după 4 săptămâni de expunere. Adulții sunt apoi extrași din sol, iar efectele asupra reproducerii sunt evaluate după alte 4 săptămâni prin calcularea numărului de descendenți prezenți în sol. Rata de reproducere a râmelor expuse la substanța chimică de testare este comparată cu cea din proba (probele) de control în vederea determinării (i) concentrației la care nu se observă niciun efect (NOEC) și/sau a (ii) valorii ECx (de exemplu, EC10, EC50) utilizând un model de regresie pentru a estima concentrația care ar putea cauza o reducere cu x % a ratei de reproducere. Concentrațiile de testare trebuie să acopere valoarea ECx (de exemplu, EC10, EC50) astfel încât valoarea ECx să fie mai degrabă interpolată decât extrapolată (pentru definiții, a se vedea apendicele 1).
|
INFORMAȚII PRIVIND SUBSTANȚA CHIMICĂ DE TESTARE
|
4.
|
Trebuie să fie disponibile următoarele informații privind substanța chimică de testare pentru a putea defini procedurile de testare corespunzătoare:
|
—
|
și informații privind evoluția și comportamentul în mediu, dacă este posibil (de exemplu, viteza de fotoliză și viteza de hidroliză în cazul în care acestea sunt relevante pentru modelele de aplicare).
|
|
|
5.
|
Această metodă de testare se aplică tuturor substanțelor chimice de testare, indiferent de solubilitatea lor în apă. Metoda de testare nu se aplică substanțelor chimice volatile, definite ca fiind substanțe chimice în cazul cărora constanta lui Henry sau coeficientul de partiție sol/apă este mai mare de unu sau substanțelor chimice în cazul cărora presiunea de vapori depășește 0,0133 Pa la o temperatură de 25 °C.
|
|
6.
|
Prezenta metodă de testare nu ia în considerare posibila degradare a substanței chimice de testare pe parcursul testului. În consecință, nu se poate garanta menținerea concentrațiilor de expunere la valorile inițiale pe tot parcursul testului. În acest caz, se recomandă efectuarea unei analize chimice a substanței chimice de testare la începutul și la finalul testului.
|
SUBSTANȚA CHIMICĂ DE REFERINȚĂ
|
7.
|
Trebuie determinată valoarea NOEC și/sau ECx a unei substanțe chimice de referință pentru a garanta caracterul adecvat al condițiilor de testare din laborator și pentru a verifica regularitatea în timp din punct de vedere statistic a răspunsului organismelor de testare. Este recomandabil ca o substanță chimică de referință să fie testată cel puțin o dată pe an sau, dacă testarea se desfășoară la o frecvență mai redusă, în paralel cu determinarea toxicității unei substanțe chimice de testare. Carbendazimul și benomilul reprezintă substanțe chimice de referință corespunzătoare care au demonstrat că afectează reproducerea (3). Trebuie observate efecte semnificative între (a) 1 și 5 mg de ingredient activ/kg de masă uscată sau (b) 250-500 g/ha sau 25-50 mg/m2. În cazul în care un standard toxic pozitiv este inclus în seria de testare, se utilizează o singură concentrație, iar numărul de probe duplicat trebuie să fie același cu cel al probelor de control.
|
VALIDITATEA TESTULUI
|
8.
|
Pentru ca rezultatul unui test să fie considerat valid, probele de control trebuie să îndeplinească următoarele criterii:
|
—
|
fiecare probă duplicat (conținând 10 adulți) trebuie să fi produs ≥ 30 de exemplare tinere la finalul testului;
|
|
—
|
coeficientul de variație al reproducerii trebuie să fie ≤ 30 %;
|
|
—
|
rata mortalității în rândul adulților pe parcursul celor 4 săptămâni inițiale ale testului trebuie să fie ≤10 %.
|
În cazul în care un test nu îndeplinește criteriile de validitate de mai sus, testul trebuie încheiat, cu excepția cazului în care poate fi oferită o justificare pentru continuarea acestuia. Justificarea trebuie inclusă în raport.
|
DESCRIEREA TESTULUI
Echipamente
|
9.
|
Trebuie utilizate recipiente de testare din sticlă sau dintr-un alt material chimic inert cu o capacitate de aproximativ unu până la doi litri. Recipientele trebuie să aibă o secțiune orizontală de aproximativ 200 cm2 astfel încât să se obțină o adâncime a substratului umed de aproximativ 5-6 cm atunci când se adaugă 500-600 g de masă uscată de substrat. Modelul capacului recipientului trebuie să permită schimbul de gaze între substrat și atmosferă și accesul luminii (de exemplu, prin intermediul unui capac transparent perforat) fără să permită ieșirea râmelor din recipient. În cazul în care cantitatea de substrat de testare utilizată este mult mai mare de 500-600 g per recipient de testare, numărul de râme trebuie crescut proporțional.
|
|
10.
|
Sunt necesare echipamente de laborator obișnuite, care să includă, în special, următoarele:
|
—
|
cântare de precizie adecvate;
|
|
—
|
echipamente adecvate pentru controlul temperaturii;
|
|
—
|
echipamente adecvate pentru controlul umidității (neesențiale în cazul în care vasele de expunere sunt prevăzute cu capace);
|
|
—
|
incubator sau o cameră mică prevăzută cu sistem de climatizare;
|
|
—
|
pensete, cârlige sau anse;
|
|
Pregătirea solului artificial
|
11.
|
În cadrul acestui test se utilizează un sol artificial (5)(7) având următoarea compoziție (pe baza greutății uscate, uscat la o temperatură de 105 C până la obținerea unei greutăți constante):
|
—
|
10 % mușchi de turbă (cu pH-ul cât mai apropiat posibil de valoarea de 5,5-6,0, fără reziduuri vizibile de plante, fin măcinat, uscat până la atingerea unui grad de umiditate măsurat);
|
|
—
|
20 % argilă caolinică (cu un conținut de caolinit de preferat mai mare de 30 %);
|
|
—
|
0,3-1,0 % carbonat de calciu (CaCO3, pulverizat, de puritate analitică) pentru a obține un pH inițial de 6,0 ± 0,5.
|
|
—
|
70 % nisip cuarțos uscat cu aer (în funcție de cantitatea de CaCO3 necesară), nisip predominant fin cu peste 50 % din particule măsurând între 50 și 200 de microni.
|
Nota 1: cantitatea de CaCO3 necesară va depinde de componentele substratului de sol, inclusiv hrana, și trebuie determinată prin măsurarea subeșantioanelor de sol chiar înainte de test. pH-ul este măsurat într-o probă amestecată într-o soluție 1 M de clorură de potasiu (KCl) sau într-o soluție de 0,01 M de clorură de calciu (CaCl2) (13).
Nota 2: conținutul de carbon organic al solului artificial poate fi redus, de exemplu, prin scăderea conținutului de turbă la 4-5 % și prin creșterea în consecință a conținutului de nisip. Printr-o astfel de reducere a conținutului de carbon organic, este posibil să scadă posibilitățile de absorbție a substanței chimice de testare în sol (carbon organic) și să crească disponibilitatea substanței chimice de testare pentru râme. S-a demonstrat că Eisenia fetida poate satisface criteriile de validitate privind reproducerea când este testată pe soluri naturale cu conținut mai scăzut de carbon organic (de exemplu 2,7 %) (14) și s-a constatat experimental că aceasta se poate obține și în soluri artificiale cu 5 % turbă. Prin urmare, nu este necesar ca înainte de utilizarea unui astfel de sol în cadrul unui test final să se demonstreze caracterul adecvat al solului artificial pentru a permite conformitatea testului cu criteriile de validitate, cu excepția cazului în care conținutul de turbă este mai mic decât valorile specificate mai sus.
Nota 3: când se utilizează sol natural în cadrul unui test suplimentar (de exemplu, la un nivel superior), trebuie, de asemenea, să se demonstreze caracterul adecvat al solului și îndeplinirea criteriilor de validitate.
|
|
12.
|
Se amestecă bine constituenții uscați ai solului (de exemplu, într-un amestecător de laborator mare) într-un spațiu bine ventilat. Înainte de începerea testului, solul artificial uscat este umezit prin adăugarea de apă deionizată pentru a obține aproximativ jumătate din conținutul final de apă, reprezentând între 40 % și 60 % din capacitatea maximă de retenție a apei (corespunzând cu 50 ± 10 % din masa uscată umezită). Astfel, se obține un substrat din care nu se scurge apă stătătoare sau liberă atunci când este strâns în mână. Capacitatea de retenție a apei (WHC) maximă a solului artificial este determinată conform procedurilor descrise în apendicele 2, ISO 11274 (15) sau un standard UE echivalent.
|
|
13.
|
În cazul în care substanța chimică de testare se aplică pe suprafața solului sau este amestecată în sol fără apă, cantitatea finală de apă poate fi amestecată în solul artificial în timpul pregătirii solului. În cazul în care substanța chimică de testare este amestecată în sol împreună cu o anumită cantitate de apă, se poate adăuga o cantitate de apă suplimentară în același timp cu substanța chimică de testare (a se vedea punctul 19).
|
|
14.
|
Gradul de umiditate din sol este determinat la începutul și la finalul testului în conformitate cu ISO 11465 (16) sau cu un standard UE echivalent, iar pH-ul solului, în conformitate cu apendicele 3 sau cu ISO 10390 (13) sau cu un standard UE echivalent. Aceste determinări trebuie efectuate pe o probă de sol de control și pe o probă de sol cu fiecare concentrație de testare. pH-ul solului nu trebuie ajustat atunci când sunt testați acizi sau baze. Gradul de umiditate trebuie să fie monitorizat pe întreaga perioadă a testului prin cântărirea periodică a recipientelor (a se vedea punctele 26 și 30).
|
Selectarea și pregătirea animalelor pentru testare
|
15.
|
Specia utilizată în cadrul testului este Eisenia fetida sau Eisenia andrei (1)(2). Pentru a începe testul sunt necesare râmele adulte cu vârsta între două luni și un an și cu un clitellum. Râmele trebuie să fie selectate dintr-o cultură sincronizată cu o structură de vârstă relativ omogenă (apendicele 4). Exemplarele dintr-un grup de testare nu trebuie să difere din punctul de vedere al vârstei cu mai mult de 4 săptămâni.
|
|
16.
|
Râmele selectate trebuie să se aclimatizeze timp de cel puțin o zi cu tipul de substrat de sol artificial pentru a fi utilizate în cadrul testului. În această perioadă râmele trebuie să fie hrănite cu același tip de hrană care va fi utilizat în cadrul testului (a se vedea punctele 31-33).
|
|
17.
|
Grupuri de câte 10 râme trebuie cântărite individual, repartizându-le aleatoriu în recipientele de testare în momentul începerii testului. Râmele sunt spălate înainte de cântărire (cu apă deionizată), iar excesul de apă se îndepărtează prin așezarea pentru scurt timp a râmelor pe hârtie de filtru. Masa umedă a fiecărei râme trebuie să fie cuprinsă între 250 și 600 mg.
|
Pregătirea concentrațiilor de testare
|
18.
|
Pot fi utilizate două metode de aplicare a substanței chimice de testare: amestecarea substanței chimice de testare în sol (a se vedea punctele 19-21) sau aplicarea pe suprafața solului (a se vedea punctele 22-24). Selectarea metodei adecvate depinde de scopul testului. În general, se recomandă amestecarea substanței chimice de testare în sol. Cu toate acestea, se pot impune proceduri de aplicare conforme cu practica agricolă obișnuită (de exemplu, pulverizarea preparatelor lichide sau utilizarea de preparate speciale de pesticide precum granule sau produse de tratare a semințelor). Solvenții utilizați pentru facilitarea tratamentului solului cu substanța chimică de testare trebuie selectați pe baza toxicității lor scăzute pentru râme și trebuie inclus în proiectul de testare un vas de control cu solvent (a se vedea punctul 27).
|
Amestecarea substanței chimice de testare în sol
Substanța chimică de testare solubilă în apă
|
19.
|
O soluție a substanței chimice de testare este pregătită în apă deionizată, chiar înainte de începerea testului, într-o cantitate suficientă pentru toate probele duplicat cu aceeași concentrație. Poate fi necesar un cosolvent pentru a facilita prepararea soluției de testare. Este de preferat să se pregătească o cantitate de soluție necesară pentru a atinge gradul final de umiditate (între 40 și 60 % din capacitatea maximă de retenție a apei). Soluția este amestecată bine cu substratul de sol înainte de a fi introdusă într-un recipient de testare.
|
Substanța chimică de testare insolubilă în apă
|
20.
|
Substanța chimică de testare se dizolvă într-un volum mic de solvent organic adecvat (de exemplu acetonă) și apoi este pulverizată pe o cantitate mică de nisip cuarțos fin sau este amestecată în acesta. Solventul este apoi eliminat prin evaporare sub o hotă timp de cel puțin câteva minute. Nisipul tratat este apoi amestecat bine cu solul artificial umezit în prealabil. Se adaugă apoi apă deionizată (o cantitate necesară) pentru a atinge un grad final de umiditate cuprins între 40 și 60 % din capacitatea maximă de retenție a apei și se amestecă în sol. Solul este gata pentru a fi introdus în recipientele de testare. Trebuie să se aibă în vedere faptul că anumiți solvenți pot fi toxici pentru râme.
|
Substanța chimică de testare insolubilă în apă și solvenți organici
|
21.
|
Se prepară un amestec format din 10 g de nisip cuarțos industrial fin măcinat și o cantitate de substanță chimică de testare necesară pentru a atinge concentrația de testare în sol. Amestecul este apoi mixat bine cu solul artificial umezit în prealabil. Se adaugă apoi apă deionizată într-o cantitate necesară pentru a atinge un grad final de umiditate cuprins între 40 și 60 % din capacitatea maximă de retenție a apei și se amestecă în sol. Solul este gata pentru a fi introdus în recipientele de testare.
|
Aplicarea substanței chimice de testare pe suprafața solului
|
22.
|
Solul este tratat după introducerea râmelor. Recipientele de testare sunt primele care trebuie umplute cu substratul de sol umezit, iar râmele cântărite sunt așezate pe suprafața acestuia. Râmele sănătoase pătrund în mod normal imediat în substrat și, prin urmare, orice râmă rămasă la suprafață după 15 minute este considerată bolnavă și trebuie înlocuită. Dacă râmele sunt înlocuite, cele noi și cele înlocuite trebuie cântărite astfel încât să se cunoască de la început greutatea totală în viu a grupului de râme destinate expunerii și greutatea totală a recipientului cu râme.
|
|
23.
|
Se aplică substanța chimică de testare. Aceasta nu trebuie să fie adăugată la sol în prima jumătate de oră de la introducerea râmelor (sau dacă râmele sunt prezente pe suprafața solului), pentru a se evita orice expunere directă la substanța chimică de testare prin contact cutanat. Atunci când substanța chimică de testare este un pesticid, poate fi adecvată aplicarea acesteia pe suprafața solului prin pulverizare. Substanța chimică de testare trebuie aplicată pe suprafața solului, în mod cât mai uniform posibil, cu ajutorul unui dispozitiv de pulverizare de laborator pentru a simula pulverizarea pe teren. Înainte de aplicare capacul recipientului de testare trebuie să fie îndepărtat și înlocuit cu un înveliș care protejează pereții laterali ai recipientului în timpul pulverizării. Învelișul poate fi realizat dintr-un recipient de testare de la care a fost îndepărtată baza. Aplicarea trebuie să aibă loc la o temperatură de 20 ± 2 °C și pentru soluțiile apoase, emulsii sau dispersii la o rată de aplicare a apei cuprinsă între 600 și 800 μl/m2. Rata trebuie să fie verificată cu ajutorul unei tehnici de calibrare adecvate. Preparatele speciale precum granulele sau produsele de tratare a semințelor trebuie aplicate într-un mod similar cu modul de aplicare în agricultură.
|
|
24.
|
Recipientele de testare trebuie să fie lăsate neacoperite timp de o oră pentru a permite oricărui solvent volatil asociat cu aplicarea substanței chimice de testare să se evapore. Trebuie avut grijă ca nicio râmă să nu scape din vasele de testare în perioada respectivă.
|
PROCEDURA
Grupuri de testare și vase de control
|
25.
|
Se recomandă introducerea a 10 râme în 500-600 g de masă uscată de sol artificial (de exemplu, 50-60 g de sol per râmă). Dacă se utilizează cantități mari de sol, ca în cazul testării pesticidelor cu moduri speciale de aplicare, cum ar fi produsele de tratare a semințelor, cantitatea de 50-60 g de sol per râmă trebuie menținută prin creșterea numărului de râme. Se pregătesc zece râme pentru fiecare recipient de control și de tratament. Râmele sunt spălate cu apă și șterse și sunt așezate apoi pe hârtie absorbantă pentru o perioadă scurtă pentru a permite scurgerea excesului de apă.
|
|
26.
|
Pentru a evita erorile sistematice în distribuirea râmelor în recipientele de testare, omogenitatea populației de testare trebuie să fie determinată prin cântărirea individuală a 20 de râme prelevate aleatoriu din populația din care vor fi selectate râmele pentru testare. După asigurarea omogenității, loturile de râme sunt apoi selectate, cântărite și distribuite în recipientele de testare utilizând o procedură de randomizare. După adăugarea râmelor de testare, fiecare recipient de testare trebuie să fie cântărit pentru a se asigura că există o greutate inițială care poate fi utilizată ca bază pentru monitorizarea gradului de umiditate a solului pe toată durata testului, conform descrierii de la punctul 30. Recipientele de testare sunt apoi acoperite conform descrierii de la punctul 9 și așezate în camera de testare.
|
|
27.
|
Sunt pregătite vase de control corespunzătoare pentru fiecare dintre metodele de aplicare a substanței chimice de testare descrise la punctele 18-24. Pentru pregătirea probelor de control sunt urmate procedurile relevante descrise, fără a se adăuga substanța chimică de testare. Astfel, dacă este cazul, se adaugă în probele de control solvenți organici, nisip cuarțos sau alți dizolvanți în concentrații/cantități echivalente cu cele utilizate în vasele de tratament. Atunci când se utilizează un solvent sau un alt dizolvant pentru a adăuga substanța chimică de testare, trebuie pregătită și testată, de asemenea, o probă de control suplimentară fără dizolvant sau substanța chimică de testare pentru a se asigura că dizolvantul nu influențează rezultatele testului.
|
Condiții de testare
|
28.
|
Temperatura de testare este de 20 ± 2 °C. Testul este efectuat în cicluri de lumină și de întuneric controlate (de preferință, 16 ore de lumină și 8 ore de întuneric) cu o intensitate a luminii cuprinsă între 400 și 800 lux în zona recipientelor de testare.
|
|
29.
|
Recipientele de testare nu sunt aerate în timpul testului, dar modelul capacelor vaselor de testare trebuie să ofere posibilitatea schimbului de gaze, limitând totodată evaporarea umezelii (a se vedea punctul 9).
|
|
30.
|
Conținutul de apă al substratului de sol în recipientele de testare este menținut pe toată durata testului prin recântărirea periodică a recipientelor de testare (fără capacele acestora). Dacă este necesar, pierderile sunt compensate cu apă deionizată. Conținutul de apă nu trebuie să varieze cu mai mult de 10 % față de cel de la începutul testului.
|
Hrănirea
|
31.
|
Este considerat acceptabil orice tip de hrană de o calitate considerată adecvată cel puțin pentru menținerea greutății râmelor în timpul testului. Experiența a demonstrat că fulgii de ovăz și gunoiul de grajd provenit de la bovine sau cabaline constituie o hrană adecvată. Trebuie efectuate verificări pentru a se asigura că bovinele sau cabalinele de la care este obținut gunoiul de grajd nu sunt supuse unui tratament cu medicamente sau cu substanțe chimice, cum ar fi hormoni de creștere, nematocide sau produse de uz veterinar similare care ar putea afecta negativ râmele în timpul testului. Se recomandă colectarea individuală de gunoi de grajd de la bovine, deoarece experiența a arătat că gunoiul de grajd disponibil pe piață, utilizat ca îngrășământ de grădină, poate avea efecte adverse asupra râmelor. Gunoiul de grajd trebuie uscat cu aer, măcinat fin și pasteurizat înainte de utilizare.
|
|
32.
|
Înainte de a fi utilizat în cadrul unui test, fiecare lot proaspăt de hrană trebuie administrat unei culturi de râme netestate pentru a se asigura că acesta este de o calitate corespunzătoare. Creșterea și producția de coconi nu trebuie reduse în comparație cu cele ale râmelor crescute într-un substrat care nu conține lotul nou de hrană [condițiile descrise în metoda de testare C.8(4)].
|
|
33.
|
Hrana se administrează prima dată la o zi după introducerea râmelor și aplicarea substanței chimice de testare în sol. Aproximativ 5 g de hrană sunt distribuite pe suprafața solului din fiecare recipient și sunt umezite cu apă deionizată (aproximativ între 5 ml și 6 ml per recipient). Ulterior, hrana se administrează o dată pe săptămână pe parcursul perioadei de testare de 4 săptămâni. În cazul în care există resturi de hrană neconsumată, rația trebuie redusă astfel încât să se evite dezvoltarea de ciuperci sau apariția de infecții fungice. Adulții sunt extrași din sol în cea de a 28-a zi a testului. Alte 5 g de hrană sunt apoi administrate în fiecare recipient de testare. Nu se mai administrează hrană pe parcursul celor 4 săptămâni rămase ale testului.
|
Selectarea concentrațiilor de testare
|
34.
|
Informațiile anterioare cu privire la toxicitatea substanței chimice de testare, provenite, de exemplu, dintr-un test de toxicitate acută (4) și/sau dintr-o serie de studii de stabilire a intervalului, ar trebui să faciliteze selectarea concentrațiilor de testare adecvate. Dacă este necesar, se realizează un test de stabilire a intervalului, de exemplu, cu cinci concentrații de 0,1, 1,0, 10, 100 și 1 000 mg/kg (masă uscată a solului). Este suficientă o probă duplicat pentru fiecare tratament și pentru fiecare probă de control. Durata testului de stabilire a intervalului este de două săptămâni, iar rata mortalității este evaluată la finalul testului.
|
Proiectul experimentului
|
35.
|
Întrucât nu poate fi prescris pentru test niciun rezumat statistic, prezenta metodă de testare oferă instrucțiuni pentru determinarea valorilor NOEC și ECx. Un calcul al NOEC ar putea fi solicitat de autoritățile de reglementare în viitorul apropiat. O utilizare pe scară mai largă a ECx, determinată de rațiuni de natură statistică și ecologică, ar putea fi adoptată în viitorul apropiat. În consecință, sunt propuse trei modele, bazate pe recomandările formulate în urma unui ring test privind o metodă de testare a reproducerii enchitreidelor (17).
|
|
36.
|
Pentru stabilirea intervalului de concentrații, trebuie să se rețină următoarele:
|
—
|
Pentru determinarea valorii NOEC, trebuie testate cel puțin cinci/douăsprezece concentrații într-o serie geometrică. Se recomandă utilizarea a patru probe duplicat pentru fiecare concentrație de testare și opt probe de control. Concentrațiile trebuie să fie separate de un factor care să nu depășească valoarea de 2,0.
|
|
—
|
Pentru determinarea valorii ECx (de exemplu, EC10, EC50), se recomandă utilizarea unui număr adecvat de concentrații pentru a obține cel puțin patru răspunsuri medii semnificativ diferite din punct de vedere statistic la aceste concentrații. Se recomandă cel puțin două probe duplicat pentru fiecare concentrație de testare și șase probe duplicat de control. Factorul de separare poate varia, putând fi mai mic sau egal cu 1,8 în seria de efecte prevăzută și mai mare de 1,8 la concentrațiile cele mai mari și cele mai scăzute.
|
|
—
|
O abordare combinată permite determinarea valorilor NOEC și ECx. Trebuie utilizate opt concentrații de tratament în serie geometrică. Se recomandă utilizarea a patru probe duplicat pentru fiecare tratament și opt probe de control. Concentrațiile trebuie să fie separate de un factor care să nu depășească valoarea de 1,8.
|
|
Durata testului și măsurători
|
37.
|
În cea de a 28-a zi, râmele adulte vii sunt observate și numărate. Se înregistrează, de asemenea, orice comportament neobișnuit (de exemplu, incapacitatea de a săpa în sol; poziția nemișcată) și orice modificare a morfologiei (de exemplu, prezența unor răni deschise). Toate râmele adulte se scot apoi din vasele de testare și sunt numărate și cântărite. Transferul, înainte de evaluare, al solului care conține râmele într-o tavă curată poate facilita căutarea adulților. Râmele extrase din sol trebuie spălate înainte de cântărire (cu apă deionizată), iar excesul de apă se îndepărtează prin așezarea pentru scurt timp a râmelor pe hârtie de filtru. Toate râmele care nu sunt găsite în această perioadă sunt înregistrate ca moarte, întrucât se presupune că respectivele râme au murit și s-au descompus înainte de evaluare.
|
|
38.
|
În cazul în care a fost scos din recipiente, solul trebuie apoi reintrodus în acestea (fără râmele adulte, însă cu toți coconii produși). Solul este apoi incubat timp de patru săptămâni suplimentare în aceleași condiții de testare, cu excepția faptului că hrana este administrată doar la începutul acestei faze a testului (a se vedea punctul 33).
|
|
39.
|
La finalul celei de a doua perioade de 4 săptămâni, se determină numărul de exemplare tinere eclozate din coconii din solul de testare și numărul de coconi utilizându-se procedurile descrise în apendicele 5. Toate semnele de rănire sau de vătămare a râmelor trebuie, de asemenea, înregistrate pe tot parcursul perioadei de testare.
|
Test la valori-limită
|
40.
|
În cazul în care nu este observat niciun efect la cea mai înaltă concentrație în cadrul testului de stabilire a intervalului (și anume 1 000 mg/kg), testul de reproducere va fi efectuat sub forma unui test la valori-limită, utilizând o concentrație de testare de 1 000 mg/kg. Un test la valori-limită va oferi posibilitatea de a demonstra că NOEC pentru reproducere este mai mare decât concentrația-limită, diminuând în același timp numărul râmelor utilizate în cadrul testului. Trebuie utilizate opt probe duplicat atât pentru solul tratat, cât și pentru proba de control.
|
DATE ȘI RAPORT
Prelucrarea rezultatelor
|
41.
|
Cu toate că în apendicele 6 este furnizată o prezentare generală, în cadrul prezentei metode de testare nu este oferită nicio orientare statistică definitivă pentru analiza rezultatelor testului.
|
|
42.
|
Unul dintre punctele finale este mortalitatea. Cu toate acestea, modificările comportamentului (de exemplu, incapacitatea de a săpa în sol; poziția nemișcată pe peretele de sticlă al vasului de testare) și ale morfologiei (de exemplu, prezența unor răni deschise) râmelor adulte trebuie, de asemenea, înregistrate împreună cu prezența oricărui exemplar tânăr. De obicei, trebuie aplicată analiza probit (18) sau regresia logistică pentru determinarea LC50. Cu toate acestea, în cazurile în care această metodă de analiză nu este adecvată (de exemplu, dacă sunt disponibile mai puțin de trei concentrații având ca efect mortalitatea parțială), pot fi utilizate metode alternative. Aceste metode ar putea include mediile mobile (19), metoda simplificată Spearman-Karber (20) sau simpla interpolare (de exemplu, media geometrică a LC0 și LC100, calculată prin înmulțirea rădăcinii pătrate a LC0 cu LC100).
|
|
43.
|
Celălalt punct final este fecunditatea (de exemplu, numărul de exemplare tinere produse). Cu toate acestea, ca și în cazul testului de stabilire a intervalului, toate celelalte semne de nocivitate trebuie înregistrate în raportul final. Pentru a calcula rezultatele reproducerii, analiza statistică necesită cunoașterea mediei aritmetice

și a abaterii standard per tratament și per probă de control. |
|
44.
|
Dacă s-a efectuat o analiză a varianței, abaterea standard, s, și gradele de libertate (df) pot fi înlocuite de estimarea varianței combinate obținute din ANOVA și, respectiv, de gradele sale de libertate, cu condiția ca varianța să nu depindă de concentrație. În acest caz, se utilizează varianțele unice ale probelor de control și ale probelor supuse tratamentului. Respectivele valori se calculează de obicei cu ajutorul unui software statistic comercial utilizând ca duplicat rezultatele pentru fiecare vas. În cazul în care combinarea datelor pentru probele de control negative și pentru probele de control cu solvent pare rezonabilă în locul testării în funcție de una dintre ele, acestea trebuie testate pentru a vedea dacă nu diferă în mod semnificativ (pentru testul adecvat, a se vedea punctul 47 și apendicele 6).
|
|
45.
|
Testarea statistică și inferența suplimentare depind de distribuția normală și omogenitatea în ceea ce privește varianța ale valorilor duplicate.
|
Estimarea NOEC
|
46.
|
Ar fi de preferat aplicarea unor teste puternice. Trebuie utilizate informații, de exemplu, din experiența anterioară din cadrul ring testelor sau alte date istorice cu privire la distribuția aproximativ normală a datelor. Omogenitatea varianței (omoscedasticitatea) este mai critică. Experiența arată că varianța crește adesea odată cu creșterea mediei. În aceste cazuri, o transformare a datelor ar putea duce la omoscedasticitate. Cu toate acestea, o astfel de transformare trebuie să se bazeze pe experiența legată de datele istorice mai degrabă decât pe datele supuse analizei. Cu date omogene, ar trebui efectuate teste t multiple cum ar fi testul Williams (α = 0,05, unilateral) (21)(22) sau, în anumite cazuri, testul lui Dunnett (23)(24). Trebuie remarcat faptul că, în cazul unei duplicări inegale, valorile t din tabel trebuie corectate astfel cum sugerează Dunnett și Williams. Uneori, din cauza variației mari, răspunsurile nu cresc/descresc în mod regulat. În acest caz de abatere puternică de la monotonicitate, testul lui Dunnett este mai adecvat. În cazul în care există abateri de la omoscedasticitate, ar putea fi rezonabilă analizarea mai aprofundată a posibilelor efecte asupra varianțelor pentru a decide dacă testele t pot fi aplicate fără a pierde multă putere (25). În mod alternativ, un test U multiplu, de exemplu testul U al lui Bonferroni potrivit Holm (26), sau, când aceste date prezintă heteroscedasticitate, dar din alte puncte de vedere corespund unei relații doză-răspuns monotonă subiacentă, poate fi aplicat un alt test neparametric [de exemplu, Jonckheere-Terpstra (27) (28) sau Shirley (29) (30)] și ar fi în general de preferat testelor t cu varianță inegală. (a se vedea, de asemenea, schema din apendicele 6).
|
|
47.
|
Dacă s-a efectuat un test la valori-limită, iar premisele procedurilor de testare parametrică (normalitate, omogenitate) sunt îndeplinite, poate fi utilizat testul t (Student) pe perechi sau testul U Mann-Whitney (31).
|
Estimarea ECx
|
48.
|
Pentru a calcula orice valoare a ECx, se utilizează mediile pentru fiecare tratament pentru analiza regresiei (liniară sau neliniară), după obținerea unei funcții doză-răspuns. Pentru creșterea râmelor ca răspuns continuu, valorile ECx- pot fi estimate utilizând o analiză de regresie adecvată (32). Printre funcțiile potrivite pentru datele binare (mortalitate/supraviețuire) și număr de descendenți produs se numără funcția sigmoidă normală, funcția logistică și funcția Weibull, conținând doi sau patru parametri, dintre care unii pot modela și răspunsurile hormetice. Dacă s-a stabilit o funcție doză-răspuns prin analiză de regresie liniară, trebuie identificat un r2 (coeficient de determinare) și/sau o pantă semnificativă în analiza de regresie înainte de a estima ECx prin introducerea unei valori corespunzătoare x % din media probelor de control în ecuația obținută prin analiza de regresie. Limitele de încredere de 95 % se calculează după metoda lui Fieller [citată de Finney (18)] sau după alte metode moderne adecvate.
|
|
49.
|
Alternativ, răspunsul se modelează ca procentaj sau proporție din parametrul modelului, care se interpretează ca răspuns mediu al probelor de control. În aceste cazuri, curba sigmoidă normală (logistică, Weibull) poate fi adesea ajustată la rezultate utilizând procedura de regresie probit (18). În aceste cazuri, funcția de ponderare trebuie ajustată pentru răspunsurile metrice potrivit lui Christensen (33). Cu toate acestea, dacă se observă o ormeză, analiza probit ar trebui înlocuită cu o funcție logistică sau Weibull cu patru parametri, stabilită printr-o procedură de regresie neliniară (34). Dacă este imposibilă ajustarea unei funcții doză-răspuns adecvate la date, se pot utiliza metode alternative de estimare a ECx și a limitelor sale de încredere, cum ar fi mediile mobile după Thompson (19) și procedura Spearman-Karber simplificată (20).
|
RAPORTUL DE TESTARE
|
50.
|
Raportul de testare trebuie să includă următoarele informații:
|
|
Substanța chimică testată:
|
—
|
o descriere definitivă a substanței chimice de testare, lotul de fabricație, lotul de ambalare și numărul CAS, puritatea;
|
|
—
|
proprietățile substanței chimice de testare [de exemplu, log Kow, solubilitatea în apă, presiunea de vapori, constanta Henry (H) și informații privind evoluția și comportamentul].
|
|
|
|
Organismele de testare:
|
—
|
animalele de testare utilizate: specii, denumirea științifică, sursa organismelor și condițiile de creștere;
|
|
—
|
vârsta, intervalul de dimensiune (masa) al organismelor de testare.
|
|
|
|
Condițiile de testare
|
—
|
detalii privind pregătirea solului de testare;
|
|
—
|
capacitatea maximă a solului de retenție a apei;
|
|
—
|
o descriere a tehnicii utilizate pentru aplicarea substanței chimice de testare în sol;
|
|
—
|
detalii privind substanțele chimice auxiliare utilizate pentru administrarea substanței chimice de testare;
|
|
—
|
detalii privind calibrarea echipamentului de pulverizare, dacă este cazul;
|
|
—
|
descrierea protocolului și a procedurii de testare;
|
|
—
|
dimensiunea recipientelor de testare și volumul solului de testare;
|
|
—
|
condițiile de testare: intensitatea luminii, durata ciclurilor lumină-întuneric, temperatura;
|
|
—
|
o descriere a regimului de hrănire, tipul și cantitatea hranei utilizate în cadrul testului, datele hrănirii;
|
|
—
|
pH-ul și conținutul de apă din sol la începutul și la sfârșitul testului.
|
|
|
|
Rezultatele testului:
|
—
|
mortalitatea în rândul adulților (%) în fiecare recipient de testare la finalul primelor 4 săptămâni ale testului;
|
|
—
|
masa totală a adulților la începutul testului în fiecare recipient de testare;
|
|
—
|
modificările de greutate corporală ale adulților vii (% din greutatea inițială) din fiecare recipient de testare după primele patru săptămâni ale testului;
|
|
—
|
numărul de exemplare tinere produse în fiecare recipient de testare la sfârșitul testului;
|
|
—
|
o descriere a simptomelor evidente sau patologice sau a schimbărilor clare de comportament;
|
|
—
|
rezultatele obținute cu substanța chimică de testare de referință;
|
|
—
|
valorile LC50, NOEC și/sau ECx (de exemplu, EC50, EC10) pentru reproducere, în cazul în care unele dintre acestea sunt aplicabile cu intervale de încredere și un grafic al modelului ajustat utilizat pentru calcularea acestora, toate informațiile și observațiile utile pentru interpretarea rezultatelor;
|
|
—
|
un grafic al raportului doză/răspuns;
|
|
—
|
rezultatele aplicabile fiecărui recipient de testare;
|
|
Abaterile de la procedurile descrise în prezenta metodă de testare și orice eveniment neobișnuit survenit pe parcursul testului.
|
BIBLIOGRAFIE
|
(1)
|
Jaenicke, J. (1982). «Eisenia foetida» is two biological species. Megadrilogica 4, 6-8.
|
|
(2)
|
Oien, N. și J. Stenerson (1984). Esterases of earthworm – III. Electrophoresis reveals that Eisenia foetida (Savigny) is two species. Oblig. Biochem. Physiol. 78c (2), 277 – 282.
|
|
(3)
|
Kula, C. (1996). Development of a test method on sublethal effects of pesticides on the earthworm species Eisenia fetida/Eisenia andrei – comparison of two ringtests. În: Riepert, F., Kula, C. (1996): Development of laboratory methods for testing effects of chemicals and pesticides on collembola and earthworms. Mitt. Biol. Bundesamst. f. Land- Forstwirtsch. Berlin-Dahlem, 320, p. 50-82.
|
|
(4)
|
Capitolul C.8 din prezenta anexă, Test de toxicitate acută pe râme.
|
|
(5)
|
ISO (International Organization for Standardization) (1996). Soil Quality – Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction, No.11268-2. ISO, Geneve.
|
|
(6)
|
ISO (International Organization for Standardization) (1993). Soil Quality – Effects of pollutants on earthworms (Eisenia fetida). Part 1: Determination of acute toxicity using artificial soil substrate, No.11268-1. ISO, Geneve.
|
|
(7)
|
SETAC (1998). Advances in Earthworm Ecotoxicology. Sheppard, S.C., Bembridge, J.D., Holmstrup, M., and L. Posthuma, (eds). SETAC Press, 456 pp.
|
|
(8)
|
EPA (1996). Ecological effects test guidelines. Earthworm Subchronic Toxicity Test (850.62.00). United States Environmental Protection Agency. Office of Prevention, Pesticides and Toxic Substances. EPA712-C-96-167, April 1996.
|
|
(9)
|
Bouché, M.B. (1972). Lombriciens de France, Ecologie et systématique. Publication de l'Institut National de la Recherche Agronomique.
|
|
(10)
|
Edwards, C.A. (1983). Development of a standardized laboratory method for assessing the toxicity of chemical substances to earthworms. Report EUR 8714 EN, Commission of European Communities.
|
|
(11)
|
Greig-Smith, P.W., H. Becker, P.J. Edwards and F. Heimbach (eds.) (1992). Ecotoxicology of Earthworms. Intercept.
|
|
(12)
|
Edwards, C.A. și J. P. Bohlen, (1996). Biology and ecology of Earthworms, 3rd Edition. Chapman and Hall, London.
|
|
(13)
|
ISO (International Organization for Standardization) (1994). Soil Quality – Determination of pH, No. 10390. ISO, Geneve.
|
|
(14)
|
Hund-Rinke, K, Römbke, J., Riepert, F. & Achazi R. (2000): Beurteilung der Lebensraumfunktion von Böden mit Hilfe von Regenwurmtests. În: Toxikologische Beurteilung von Böden. Heiden, S., Erb, R., Dott, W. & Eisentraeger, A. (eds.). Spektrum Verl., Heidelberg. 59-81.
|
|
(15)
|
ISO (International Organization for Standardization) (1992). Soil Quality –Determination of water retention characteristics –Laboratory methods, No. 11274. ISO, Geneve.
|
|
(16)
|
ISO (International Organization for Standardization) (1993). Soil Quality –Determination of dry matter and water content on a mass basis – Gravimetric method, No. 11465. ISO, Geneve.
|
|
(17)
|
Römbke, J. and Th. Moser (1999). Organisation and Performance of an International Ringtest for the validation of the Enchytraeid Reproduction Test. UBA-Texte 4/99, 150+ 223 pp.
|
|
(18)
|
Finney, D.J. (1971). Probit Analysis (3rd ed.), pp. 19-76. Cambridge Univ. Press.
|
|
(19)
|
Finney, D.J. (1978). Statistical Method in Biological Assay. – Charles Griffin & Company Ltd, London.
|
|
(20)
|
Hamilton, M.A., R.C. Russo și R.V. Thurston. (1977). Trimmed Spearman-Karber Method for estimating median lethal concentrations in toxicity bioassays. Toxicol. Sci. Technol. 11(7), 714-719; Correction Environ. Sci. Technol. 12(1998), 417.
|
|
(21)
|
Williams, D.A., (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27, 103-117.
|
|
(22)
|
Williams, D.A., (1972). The comparison of several dose levels with a zero dose control. Biometrics 28, 519-531.
|
|
(23)
|
Dunnett, C.W., (1955). A multiple comparison procedure for comparing several treatments with a control. Amer. Statist. Ass. J. 50, 1096-1121.
|
|
(24)
|
Dunnett, C.W., (1964) New tables for multiple comparisons with a control. Biometrics 20, 482-491.
|
|
(25)
|
Hoeven, N. van der, (1998). Power analysis for the NOEC: What is the probability of detecting small toxic effects on three different species using the appropriate standardized test protocols? Ecotoxicology 7: 355-361
|
|
(26)
|
Holm, S., (1979): A simple sequentially rejective multiple test procedure. Scand. J. Statist. 6, 65-70.
|
|
(27)
|
Jonckheere, A. R. (1954); A Distribution-free k-Sample Test Against Ordered Alternatives, Biometrika 41, 133-145.
|
|
(28)
|
Terpstra, T. J. (1952); The Asymptotic Normality and Consistency of Kendall's Test Against Trend, When Ties are Present in One Ranking, Indagationes Math. 14, 327-333.
|
|
(29)
|
Shirley, E. A. (1979); The comparison of treatment to control group means in toxicology studies, Applied Statistics 28, 144-151.
|
|
(30)
|
Williams, D.A. (1986); A Note on Shirley's Nonparametric Test for Comparing Several Dose Levels with a Zero-Dose Control, Biometrics 42, 183-186.
|
|
(31)
|
Sokal, R.R. și F.J. Rohlf. (1981). Biometry. The Principle and practice of statistics in biological research. 2nd edition. W.H. Freeman and Company. New York.
|
|
(32)
|
Bruce R.D. și Versteeg D.J. (1992) A statistical procedure for modelling continuous toxicity data. Environmental Toxicology and Chemistry 11:1485-1494
|
|
(33)
|
Christensen, E.R., (1984). Dose-response functions in aquatic toxicity testing and the Weibull model. Water Research 18, 213-221.
|
|
(34)
|
Van Ewijk, P.H. și J.A. Hoekstra. (1993). Calculation of the EC50 and its confidence interval when sub-toxic stimulus is present. Ecotox, Environ. Safety. 25, 25-32.
|
Apendicele 1
Definiții
În cadrul prezentei metode de testare se aplică următoarele definiți:
|
|
«Substanță chimică» înseamnă o substanță sau un amestec.
|
|
|
«ECx» (concentrația efectivă pentru un efect de x %) reprezintă concentrația care determină un efect de x % asupra organismelor de testare pe parcursul unei perioade de expunere date comparativ cu o probă de control. De exemplu, o EC50 reprezintă o concentrație estimată care determină un efect asupra unui punct final de testare în cazul a 50 % dintr-o populație expusă pe parcursul unei perioade de expunere definite. În cadrul prezentului test concentrațiile efective sunt exprimate ca masă a substanței chimice de testare raportată la masa uscată a solului de testare sau ca masă a substanței chimice de testare per unitate de suprafață a solului.
|
|
|
«LC0» (concentrație neletală) este concentrația unei substanțe chimice de testare care nu ucide niciunul dintre organismele de testare expuse pe parcursul unei perioade date. În cadrul prezentului test, LC0 este exprimată ca masă a substanței chimice de testare per masă uscată de sol de testare.
|
|
|
«LC50» (concentrație medie letală) este concentrația unei substanțe chimice de testare care ucide 50 % dintre organismele de testare expuse pe parcursul unei perioade date. În cadrul prezentului test LC50 este exprimată ca masă a substanței chimice de testare raportată la masa uscată a solului de testare sau ca masă a substanței chimice de testare per unitate de suprafață a solului.
|
|
|
«LC100» (concentrație în întregime letală) este concentrația unei substanțe chimice de testare care ucide 100 % dintre organismele de testare expuse pe parcursul unei perioade date. În cadrul prezentului test, LC100 este exprimată ca masă a substanței chimice de testare per masă uscată de sol de testare.
|
|
|
«LOEC» (concentrația cea mai scăzută pentru care este observat un efect) reprezintă concentrația cea mai scăzută a substanței chimice de testare care prezintă un efect semnificativ din punct de vedere statistic (p < 0,05). În cadrul prezentului test LOEC este exprimată ca masă a substanței chimice de testare raportată la masa uscată a solului de testare sau ca masă a substanței chimice de testare per unitate de suprafață a solului. Toate concentrațiile de testare mai mari de LOEC trebuie să indice în mod normal un efect diferit din punct de vedere statistic de cel observat în cazul probei de control. Orice abatere de la cele sus-menționate trebuie justificată în raportul de testare.
|
|
|
«NOEC» (concentrația la care nu se observă niciun efect) reprezintă cea mai mare concentrație a substanței chimice de testare aflată imediat sub LOEC în cazul căreia nu se observă niciun efect. În cadrul acestui test, concentrația corespunzătoare NOEC nu prezintă niciun efect semnificativ din punct de vedere statistic (p < 0,05) pe parcursul unei perioade de expunere date comparativ cu proba de control.
|
|
|
Rată de reproducere: numărul mediu de exemplare tinere de râme produs raportat la numărul de adulți pe parcursul perioadei de testare.
|
|
|
«Substanță chimică de testare» înseamnă orice substanță sau amestec testat cu ajutorul prezentei metode de testare.
|
Apendicele 2
Determinarea capacității maxime a solului de retenție a apei
Următoarea metodă pentru determinarea capacității maxime a solului de retenție a apei (WHC) este considerată a fi una adecvată. Aceasta este descrisă în anexa C la ISO DIS 11268-2 (1).
Se prelevează o cantitate definită (de exemplu, 5 g) din substratul de sol de testare cu ajutorul unui dispozitiv de prelevare adecvat (tub cu sfredel etc.). Se acoperă fundul tubului cu o bucată de hârtie de filtru, se umple cu apă și apoi se așează pe un suport într-o baie de apă. Tubul trebuie scufundat treptat până ce nivelul apei depășește nivelul solului. Acesta trebuie apoi ținut în apă timp de aproximativ trei ore. Întrucât apa absorbită de capilarele solului nu poate fi reținută în totalitate, aceasta trebuie lăsată să se evapore din proba de sol timp de două ore prin amplasarea tubului pe un pat de nisip cuarțos fin măcinat și foarte umed într-un vas acoperit (pentru a preveni uscarea acestuia). Proba trebuie apoi cântărită și uscată la o temperatură de 105 °C până ce se atinge o masă constantă. Capacitatea de retenție a apei (WHC) poate fi apoi calculată după cum urmează:

unde:
|
S
|
=
|
masa substratului saturat în apă + masa tubului + masa hârtiei de filtru
|
|
T
|
=
|
tara (masa tubului + masa hârtiei de filtru)
|
|
D
|
=
|
masa uscată a substratului
|
BIBLIOGRAFIE:
|
(1)
|
ISO (International Organization for Standardisation ) (1996). Soil Quality – Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction, No.11268-2. ISO, Geneve.
|
Apendicele 3
Determinarea pH-ului solului
Următoarea metodă pentru determinarea pH-ului solului se bazează pe descrierea din ISO DIS 10390: Soil Quality – Determination of pH (1).
O cantitate definită de sol este uscată la temperatura camerei timp de cel puțin 12 ore. Se prepară apoi o suspensie a solului (conținând cel puțin 5 grame de sol) într-o cantitate echivalentă cu de cinci ori volumul său de soluție de clorură de potasiu (KCl) 1 M de puritate analitică sau de soluție de clorură de calciu (CaCl2) 0,01 M de puritate analitică. Ulterior, suspensia se agită bine timp de cinci minute și este lăsată să se sedimenteze timp de cel puțin 2 ore, însă nu mai mult de 24 de ore. pH-ul fazei lichide este apoi măsurat cu ajutorul unui pH-metru care a fost calibrat înaintea fiecărei măsurători utilizând o serie corespunzătoare de soluții-tampon (de exemplu, pH 4,0 și 7,0).
BIBLIOGRAFIE:
|
(1)
|
ISO (International Organization for Standardization) (1994). Soil Quality – Determination of pH, No. 10390. ISO, Geneve.
|
Apendicele 4
Creșterea Eisenia fetida/Eisenia andrei
Creșterea este preferabil să fie efectuată într-o cameră climatică la o temperatură 20 °C ± 2 °C. La această temperatură și cu o cantitate de hrană suficientă, râmele devin mature după aproximativ 2-3 luni.
Ambele specii pot fi înmulțite într-o gamă largă de deșeuri animale. Mediul de înmulțire recomandat este un amestec 50:50 gunoi de grajd provenit de la cai sau de la bovine și turbă. Trebuie realizate verificări pentru a se asigura că bovinele sau caii de la care este obținut gunoiul de grajd nu sunt supuse unui tratament cu medicamente sau cu substanțe chimice, cum ar fi hormoni de creștere, nematocide sau produse de uz veterinar similare care ar putea afecta negativ râmele în timpul testului. Se recomandă colectarea individuală de gunoi de grajd dintr-o sursă «ecologică», deoarece experiența a arătat că gunoiul de grajd disponibil pe piață utilizat ca îngrășământ de grădină poate avea efecte adverse asupra râmelor. Mediul trebuie să aibă o valoare a pH-ului de aproximativ 6-7 (ajustată cu carbonat de calciu), o conductivitate ionică scăzută (mai puțin de 6 mS/cm sau o concentrație de sare de 0,5 %) și nu trebuie să fie contaminat excesiv cu amoniac sau urină de origine animală. Substratul trebuie să fie umed, dar nu prea ud. Sunt recomandate cutii pentru înmulțire cu o capacitate de 10-50 litri.
Pentru a se obține râme cu o vârstă și o dimensiune (masă) standard, cel mai bine este să se înceapă cu creșterea de coconi. Odată ce cultura a fost creată, aceasta este menținută prin plasarea de râme adulte într-o cutie de înmulțire cu substrat proaspăt între 14 zile și 28 de zile pentru a permite producerea altor coconi. Adulții sunt apoi îndepărtați și exemplarele tinere produse din coconi sunt utilizate ca bază pentru cultura următoare. Râmele sunt hrănite continuu cu deșeuri animale și transferate la anumite intervale de timp în substrat proaspăt. Experiența a demonstrat gunoiul de grajd provenit de la bovine sau cai, uscat cu aer și fin mărunțit sau fulgii de ovăz constituie o hrană adecvată. Trebuie să se asigure că bovinele sau caii de la care este obținut gunoiul de grajd nu sunt supuși unui tratament cu medicamente sau cu substanțe chimice, cum ar fi hormoni de creștere, care ar putea afecta negativ râmele dintr-o cultură pe termen lung. Râmele eclozate din coconi sunt utilizate pentru teste atunci când au vârsta între 2 și 12 luni și sunt considerate adulte.
Râmele pot fi considerate sănătoase dacă se deplasează prin substrat, nu încearcă să părăsească substratul și se reproduc continuu. Epuizarea substratului este indicată de râmele care se deplasează foarte încet și care au o extremitate posterioară galbenă. În acest caz, se recomandă furnizarea de substrat proaspăt și/sau o reducere a densității populației de râme.
Apendicele 5
Tehnici de numărare a exemplarelor tinere de râme eclozate din coconi
Sortarea manuală a râmelor din substratul sol necesită foarte mult timp. Prin urmare, sunt recomandate două metode alternative:
|
(a)
|
Recipientele de testare sunt plasate într-o baie de apă inițial la o temperatură de 40 °C, dar care ajunge până la 60 °C. După o perioadă de aproximativ 20 de minute, exemplarele tinere de râme ar trebui să apară la suprafața solului de unde pot fi ușor extrase și numărate.
|
|
(b)
|
Solul de testare poate fi strecurat printr-o sită utilizând metoda dezvoltată de van Gestel et al. (1), cu condiția ca turba și gunoiul de grajd sau fulgii de ovăz adăugați în sol să fi fost măcinați într-o pulbere fină. Două site cu ochiuri de 0,5 mm (diametru de 30 cm) sunt așezate una peste cealaltă. Conținutul unui recipient de testare este strecurat prin site sub un jet puternic de apă de la robinet, astfel încât exemplarele tinere de râme și coconii să rămână în principal în sita superioară. Este important de remarcat faptul că întreaga suprafață a sitei superioare trebuie menținută umedă în timpul acestei operațiuni, astfel încât exemplarele tinere de râme vor pluti pe o peliculă de apă, împiedicându-le astfel să strecoare prin ochiurile sitelor. Cele mai bune rezultate se obțin atunci când se utilizează un duș.
|
După ce întregul substrat de sol a fost strecurat prin sită, exemplarele tinere și coconii pot fi transferați prin clătire din sita superioară într-un bol. Conținutul bolului este apoi lăsat deoparte pentru a permite coconilor goi să plutească pe suprafața apei și coconilor plini și exemplarelor tinere de râme să cadă pe fundul bolului. Apa din bol poate a fi apoi scursă, iar exemplarele tinere de râme și coconii pot fi transferați într-un vas Petri conținând puțină apă. Râmele pot fi extrase pentru a fi numărate cu ajutorul unui ac sau al unei pensete.
Experiența a demonstrat că metoda (a) este mai potrivită pentru extragerea exemplarelor tinere de râme care ar putea fi strecurate cu ajutorul unei site cu ochiuri de 0,5 mm.
Eficiența metodei utilizate pentru a extrage râmele (și coconii, după caz) din substratul de sol trebuie să fie întotdeauna determinată. În cazul în care exemplarele tinere sunt colectate cu ajutorul tehnicii de sortare manuală este recomandabil ca operațiunea să se efectueze de două ori pe toate probele.
BIBLIOGRAFIE:
|
(1)
|
Van Gestel, C.A.M., W.A. van Dis, E.M. van Breemen, P.M. Sparenburg (1988). Comparison of two methods determining the viability of cocoons produced in earthworm toxicity experiments. Pedobiologia 32:367-371.
|
Apendicele 6
Prezentare generală a evaluării statistice a datelor (determinarea NOEC)

C.34. DETERMINAREA INHIBĂRII ACTIVITĂȚII BACTERIILOR ANAEROBE – REDUCEREA PRODUCȚIEI DE GAZE PROVENITE DIN NĂMOL (DE EPURARE) SUPUS PROCESULUI DE DIGESTIE ANAEROBĂ
INTRODUCERE
|
1.
|
Prezenta metodă de testare este echivalentă cu Orientarea OCDE privind testarea (TG) nr. 224 (2007). Substanțele chimice eliminate în mediul acvatic traversează zonele aerobe și cele anaerobe, unde pot fi degradate și/sau pot inhiba activitatea bacteriană; în anumite cazuri acestea pot rămâne în zone anaerobe timp de decenii sau pentru o perioadă mai lungă fără să sufere modificări. În tratarea apelor uzate, prima etapă, decantarea primară, este aerobă în lichidul supernatant și anaerobă în nămolul subnatant. Aceasta este urmată în cea de a doua etapă de o zonă aerobă într-un bazin de aerare a nămolului activat și de o zonă anaerobă în nămolul subnatant în bazinul de decantare secundar. Nămolul rezultat din aceste două etape este supus de obicei unui tratament anaerob, producând metan și dioxid de carbon care se utilizează în mod obișnuit pentru producerea de energie electrică. Într-un mediu mai larg, substanțele chimice care ajung în sedimentele din golfuri, estuare și mare sunt susceptibile de a rămâne în aceste zone anaerobe pentru o perioadă nedeterminată dacă nu sunt biodegradabile. Proporții mai mari din anumite substanțe chimice vor ajunge în special în aceste zone din cauza proprietăților lor fizice precum solubilitatea scăzută în apă, adsorbția ridicată în solidele în suspensie, precum și imposibilitatea de a fi biodegradate aerobic.
|
|
2.
|
Cu toate că este de preferat ca substanțele chimice eliminate în mediu să fie biodegradabile atât în condiții aerobice, cât și în condiții anaerobice, este esențial ca respectivele substanțe să nu inhibe activitatea microorganismelor în niciuna dintre zone. În Regatul Unit, au existat câteva cazuri de inhibiție completă a producției de metan cauzată, de exemplu, de pentaclorfenolul prezent în emisiile industriale, determinând costuri foarte mari de transport al nămolului inhibat de la fierbător către locurile «sigure» și de import de nămol de digestie necontaminat provenit de la instalații învecinate. Însă există numeroase cazuri de întreruperi mai puțin drastice a digestiei de multe alte substanțe chimice, inclusiv de hidrocarburi alifatice halogene (curățare chimică) și detergenți, conducând la o afectare a eficienței fierbătoarelor.
|
|
3.
|
Doar o singură metodă, C.11 (1), abordează inhibarea activității bacteriene (Respirația de nămol activ) și evaluează efectul substanțelor chimice de testare asupra vitezei de absorbție a oxigenului în prezența unui substrat. Metoda a fost utilizată pe scară largă în vederea avertizării timpurie cu privire la posibilele efecte nocive ale substanțelor chimice asupra tratamentului aerob al apelor uzate, precum și pentru indicarea concentrațiilor neinhibitoare ale substanțelor chimice de testare care urmează să fie utilizate în diferite teste de biodegrabilitate. Metoda de testare C.43 (2) oferă o posibilitate limitată pentru determinarea toxicității unei substanțe chimice de testare asupra producției de gaz prin nămol anaerob, diluat de zece ori față de concentrația sa normală de solide pentru a obține precizia necesară în evaluarea procentajului de biodegradare. Întrucât nămolul diluat ar putea fi mai sensibil la substanțe chimice inhibitoare, grupul ISO a decis să elaboreze o metodă bazată pe utilizarea de nămol nediluat. Au fost examinate cel puțin trei texte (din Danemarca, Germania și Regatul Unit) și, în cele din urmă, au fost elaborate două standarde ISO, unul bazat pe utilizarea de nămol nediluat, ISO 13 641-1 (3), și celălalt bazat pe utilizarea de nămol diluat de o sută de ori, ISO 13 641-2 (4), în scopul reprezentării mâlului și a sedimentelor cu populații de bacterii reduse. Ambele metode a fost supuse unui ring test (5); partea 1 a fost recunoscută ca un standard acceptabil, însă în cazul părții 2 nu s-a ajuns la un acord. Regatul Unit a considerat că, din cauză că o proporție semnificativă dintre participanți au raportat o producție de gaz foarte mică sau nulă, parțial deoarece proporția de spațiu gazos era prea mare (de 75 %) pentru o sensibilitate optimă, metoda trebuie să fie reexaminată.
|
|
4.
|
Lucrările anterioare din Regatul Unit (6)(7) descriau o metodă manometrică bazată pe nămol de digestie nediluat la care se adaugă nămol de epurare ca substrat, în recipiente de 500 ml; aparatura era ancombrantă, iar mirosul nămolului brut era insuportabil. Ulterior, aparatura mi compactă și mai practică a Shelton și Tiedje (8), dezvoltată de Battersby și Wilson (9) a fost aplicată cu succes de Wilson et al. (10). Kawahara et al. (11) a reușit să prepare în laborator nămol standard mai omogen pentru a fi utilizat în cadrul unor teste de biodegrabilitate anaerobă și de inhibare pe mai multe substanțe chimice. De asemenea, nămolul brut ca substrat a fost înlocuit pentru efectuarea unui test fie cu nămol anaerob diluat de o sută de ori, fie cu mâl, sedimente etc. cu activitate bacteriană redusă.
|
|
5.
|
Această metodă poate furniza informații utile pentru a prevedea eventualul efect a unei substanțe chimice de testare asupra producției de gaz în fierbătoare anaerobe. Cu toate acestea, numai testele mai lungi care simulează funcționarea mai detaliată a fierbătoarelor pot indica dacă adaptarea microorganismelor la substanța chimică de testare se poate realiza sau dacă substanțele chimice susceptibile de a fi absorbite și adsorbite în nămol se pot acumula până la atingerea unei concentrații toxice pentru o perioadă mai lungă decât cea permisă în cadrul acestui test.
|
PRINCIPIUL TESTULUI
|
6.
|
Alicotele cu un amestec de nămol supus unui proces de digestie anaerobă (20 g/l-40 g/l de solide totale) și o soluție de substrat degradabil sunt incubate individual și simultan cu o serie de concentrații ale substanței chimice de testare în vase ermetice pentru o perioadă de până la trei zile. Cantitatea de gaz (metan plus dioxid de carbon) produsă este măsurată prin creșterea presiunii (Pa) în flacoane. Procentajul de inhibare a producției de gaze atribuit diferitelor concentrații ale substanței chimice de testare este calculat pe baza cantităților produse în flacoanele de testare și de probă corespunzătoare. EC50 și alte concentrații sunt calculate pornind de la curbele procentajului de inhibare în funcție de concentrația substanțelor chimice de testare sau, cel mai adesea, de la logaritmul său.
|
INFORMAȚII PRIVIND SUBSTANȚA CHIMICĂ DE TESTARE
|
7.
|
Substanțele chimice de testare trebuie utilizate în mod normal în forma cea mai pură ușor accesibilă, deoarece impuritățile din anumite substanțe chimice, de exemplu clorfenolii, pot fi mult mai toxice decât substanța chimică în sine. Cu toate acestea, trebuie luată în considerare necesitatea testării substanțelor chimice în forma în care sunt produse/comercializate. Utilizarea de produse chimice preparate nu este recomandată în mod obișnuit, însă utilizarea de materiale preparate ar putea fi adecvată în cazul substanțelor chimice de testare cu solubilitate redusă. Proprietățile substanței chimice de testare care trebuie cunoscute includ solubilitatea în apă și anumiți solvenți organici, presiunea de vapori, coeficientul de absorbție, hidroliza și biodegradabilitatea în condiții anaerobe.
|
APLICABILITATEA METODEI
|
8.
|
Testul se aplică substanțelor chimice solubile sau insolubile în apă, inclusiv substanțelor chimice volatile. Însă, trebuie acordată o atenție sporită materialelor cu solubilitate scăzută în apă [a se vedea referința (12)] și cu volatilitate ridicată. De asemenea, pot fi utilizați inoculi proveniți din alte locuri anaerobe, de exemplu mâl, soluri saturate, sedimente. Sistemele bacteriene anaerobe care au fost anterior expuse la substanțe chimice toxice pot fi adaptate astfel încât activitatea lor să fie menținută în prezența unor substanțe chimice xenobiotice. Inoculii din sistemele bacteriene adaptate pot indica o toleranță mai mare la substanțele chimice de testare comparativ cu inoculii obținuți din sisteme neadaptate.
|
SUBSTANȚE CHIMICE DE REFERINȚĂ
|
9.
|
Pentru a verifica procedura, se testează în paralel o substanță chimică de referință prin pregătirea de vase corespunzătoare ca parte a ciclurilor testului normal; 3,5 diclorfenolul s-a dovedit a fi un inhibitor consecvent al producției de gaz anaerob, precum și al consumului de oxigen de către nămolul activ și de către alte reacții biochimice. Două alte substanțe chimice s-au dovedit a fi mai inhibitoare pentru producția de metan decât 3,5 diclorfenolul, și anume bistiocianatul de metilen și pentaclorfenolul, însă rezultatele cu acestea nu a fost validate. Pentaclorfenolul nu este recomandat deoarece este dificil de obținut în formă pură.
|
REPRODUCTIBILITATEA REZULTATELOR
|
10.
|
În cadrul unui ring test internațional (5), s-a realizat doar o reproductibilitate medie a valorilor EC50 obținute de cele 10 laboratoare pentru 3,5 diclorfenol și acid 2-brometan sulfonic. (Intervalul pentru primul a fost cuprins între 32mg/l și 502 mg/l, iar pentru cel de al doilea între 220 și 2 190 mg/l.)
|
Număr de laboratoare
|
În mg/l
|
În mg/g de nămol
|
|
medie
|
abatere standard
|
cv (%)
|
medie
|
abatere standard
|
cv (%)
|
|
|
3,5-Diclorfenol
|
|
10
|
153
|
158
|
103
|
5
|
4,6
|
92
|
|
|
Acid 2-brometan sulfonic
|
|
10
|
1 058
|
896
|
85
|
34
|
26
|
76
|
|
Date privind EC50 provenite din ring test – nămol nediluat
|
11.
|
Coeficienții mari de variație dintre laboratoare reflectă în mare măsură diferențele de sensibilitate a microorganismelor din nămol care au fost sau nu au fost expuse în prealabil la substanța chimică de testare sau la alte substanțe înrudite din punct de vedere chimic. Precizia determinării valorii EC50 pe baza concentrației nămolului a fost cu puțin mai bună decât cea a valorii «volumetrice» (mg/l). Cele trei laboratoare care au raportat precizia valorilor lor EC50 pentru 3,5-diclorfenol au indicat coeficienți de variație mult mai mici (22, 9 și, respectiv, 18 % pentru EC50 mg/g) decât cei obținuți din mediile tuturor celor zece laboratoare. Mediile individuale ale celor trei laboratoare au fost de 3,1, 3,2 și, respectiv, 2,8 mg/g. Coeficienții de variație mai mici acceptabili din cadrul laboratoarelor în comparație cu coeficienții mult mai mari dintre valorile laboratoarelor, și anume 9-22 % față de 92 %, indică faptul că există diferențe semnificative între proprietățile nămolurilor individuale.
|
DESCRIEREA METODEI
Aparatură
|
12.
|
Este necesară utilizarea echipamentelor obișnuite de laborator și a următoarelor:
|
a)
|
Incubator – ignifug și cu temperatură controlată de 35 °C ± 2 °C;
|
|
b)
|
Vase de testare din sticlă rezistentă la presiune de o dimensiune nominală corespunzătoare (17), fiecare prevăzut cu un sept impermeabil la gaze, capabil să suporte o presiune de aproximativ 2 bari sau de 2 × 105 Pa (învelișul utilizat va fi, de exemplu, din PTFE = politetrafluoretilenă). Se recomandă utilizarea de flacoane de ser de sticlă cu un volum nominal de 125 ml și un volum real de aproximativ 160 ml, etanșate cu septuri adaptate pentru flacoanele de ser (18) și cu inele ondulate din aluminiu; însă pot fi utilizate cu succes flacoane cu un volum cuprins între 0,1 și 1 litru;
|
|
c)
|
Manometru de precizie
(19)
și ace fixate
Producția totală de gaze (metan și dioxid de carbon) măsurată cu ajutorul unui manometru adaptat pentru a permite măsurarea și evacuarea gazelor produse. Un exemplu de instrument adecvat este un manometru de precizie manual conectat la un ac de seringă; o supapă etanșă la gaze cu trei căi permite eliberarea presiunii în exces (anexa 1). Este necesară menținerea volumului intern în tubulatura și supapa transductorului de presiune la un nivel cât mai scăzut posibil, astfel încât erorile introduse prin neluarea în considerare a volumului echipamentului să fie nesemnificativă;
|
|
d)
|
Recipiente etanșe pentru transportul nămolului de digestie;
|
|
e)
|
Supape de presiune cu trei căi;
|
|
f)
|
Sită, cu ochiuri de 1 mm pătrat;
|
|
g)
|
Rezervor pentru nămolul de digestie, un flacon din sticlă sau din polietilenă de înaltă densitate, cu o capacitate de 5 litri, prevăzut cu un agitator și un dispozitiv care permite trecerea unui curent de azot gazos (a se vedea punctul 13) prin spațiul superior:
|
|
h)
|
filtre membranare (0,2 μm) pentru sterilizarea substratului;
|
|
i)
|
microseringi, pentru conexiunea etanșă la gaze a transductorului de presiune [a se vedea punctul 12 litera (c)] cu spațiul superior din flacoane [a se vedea punctul 12 litera (b)]; de asemenea, pentru adăugarea de materiale de testare lichide insolubile în flacoane;
|
|
j)
|
boxă cu mănuși, opțională, dar recomandată, cu o presiune de azot ușor pozitivă.
|
|
Reactivi
|
13.
|
Se utilizează întotdeauna reactivi cu puritate analitică. Trebuie utilizat întotdeauna azot gazos de înaltă puritate cu un conținut de oxigen mai mic de 5μl/l.
|
Apă
|
14.
|
În cazul în care diluarea este necesară în orice etapă, se utilizează apă deionizată dezaerată în prealabil. Nu sunt necesare controale analitice ale acestei ape, însă trebuie asigurată întreținerea regulată a aparaturii de deionizare. Trebuie utilizată apă deionizată și pentru pregătirea soluțiilor stoc. Înainte de adăugarea inoculului la orice soluție sau soluție de diluare a materialului de testare, trebuie să se verifice ca soluția respectivă să nu conțină oxigen. Acest lucru se realizează prin suflarea de azot gazos în apa de diluție (sau în diluanți) timp de 1 oră înainte de adăugarea inoculului sau, alternativ, prin încălzirea apei de diluție până la punctul de fierbere și răcirea acesteia la temperatura camerei într-o atmosferă fără oxigen.
|
Nămolul digerat
|
15.
|
Nămolul de digestie activ este prelevat într-un fierbător al unei stații de tratare a apelor uzate sau, alternativ, într-un fierbător de laborator, care tratează nămol provenit în cea mai mare parte din apele uzate menajere. Informații practice privind nămolul dintr-un fierbător de laborator sunt disponibile în alte referințe (11). În cazul în care este prevăzută utilizarea unui inocul adaptat, poate fi luată în considerare prelevarea de nămol de digestie provenit de la o stație de tratare a efluenților industriali. Pentru colectarea nămolului, a se utiliza flacoane cu gura largă din polietilenă de înaltă densitate sau dintr-un material similar, care se pot dilata. Se introduce nămol în flacoanele de probe până la aproximativ 1 cm distanță de gura acestora, se închid ermetic, de preferat cu o supapă de siguranță [punctul 12 litera (e)] și se așează în recipiente etanșe [punctul 12 litera (d)] pentru a reduce la minimum șocul termic, până la transferul acestora într-un incubator menținut la o temperatură de 35 °C ± 2 °C. La deschiderea flacoanelor, se eliberează presiunea de gaze în exces prin desfacerea cu atenție a capacului sau cu ajutorul unei supape de presiune cu trei căi [punctul 12 litera (e)]. Se recomandă utilizarea nămolului într-un interval de câteva ore de la prelevare sau depozitarea acestuia la o temperatură de 35 °C ± 2 °C sub un spațiu superior umplut cu azot timp de maximum 3 zile, când survine în mod obișnuit o oarecare pierdere de activitate.
Avertisment – Nămolul de digestie produce gaze inflamabile care prezintă risc de incendiu și de explozie: acesta conține și organisme potențial patogene, de aceea, trebuie luate măsuri de precauție corespunzătoare în momentul manipulării acestuia. Din motive de siguranță, a se evita utilizarea de vase din sticlă pentru colectarea nămolului.
|
Inocul
|
16.
|
Imediat înainte de utilizare, se amestecă nămolul prin agitare ușoară și se strecoară cu o strecurătoare cu ochiuri de 1 mm2 [a se vedea punctul 12 litera (f)] înainte de a se introduce într-un flacon corespunzător [punctul 12 litera (g)] al cărui spațiu superior este traversat de un curent de azot. Se prelevează o probă pentru măsurarea concentrației materiilor solide uscate totale [a se vedea, de exemplu, ISO 11 923 (13) sau un standard UE echivalent]. A se utiliza în general nămol fără diluție. Concentrația solidelor este de obicei cuprinsă între 2 % și 4 % (g/v). Trebuie verificată valoarea pH-ului nămolului și, dacă este necesar, ajustată la 7 ± 0,5.
|
Substratul de testare
|
17.
|
Se dizolvă 10 g de bulion nutritiv (de exemplu oxid), 10 g de extract de drojdie și 10 g de D-glucoză în apa deionizată și se diluează la 100 ml. Se sterilizează prin filtrare cu un filtru membranar de 0,2 μm [punctul 12 litera (h)] și se utilizează imediat sau se depozitează la o temperatură de 4 °C maximum 1 zi.
|
Substanța chimică de testare
|
18.
|
Se pregătește o soluție stoc separată pentru fiecare substanță chimică de testare solubilă în apă astfel încât să conțină, de exemplu, 10 g/l din substanța chimică în apa de diluție fără oxigen (punctul 14). Se utilizează volume corespunzătoare din aceste soluții stoc pentru a pregăti amestecurile de reacție cu concentrații crescătoare. Alternativ, se pregătește o serie de soluții de diluare din fiecare soluție stoc astfel încât volumul adăugat la flacoanele de testare să fie identic cu cel pentru fiecare concentrație finală necesară. Dacă este necesar, pH-ul soluțiilor stoc trebuie ajustat la 7 ± 0,2.
|
|
19.
|
Pentru substanțele chimice care nu sunt suficient de solubile în apă, a se consulta standardul ISO 10 634 (12) sau un standard UE echivalent. În cazul în care trebuie utilizat un solvent organic, a se evita solvenți precum cloroformul și tetraclorura de carbon cunoscute ca fiind inhibitoare puternice ale producției de metan. Se prepară o soluție cu o concentrație corespunzătoare de substanță chimică insolubilă în apă într-un solvent volatil adecvat, de exemplu, acetonă, eter dietilic. Se adaugă volumele necesare de soluție de solvent în flacoanele de testare goale [punctul 12 litera (b)] și se evaporă solventul înainte de adăugarea nămolului. Pentru alte tratamente, ase consulta standardul ISO 10 634 (12) sau un standard UE echivalent, însă a se avea în vedere faptul că orice agent tensioactiv utilizat pentru producere de emulsii poate fi inhibitor pentru producția anaerobă de gaze. Dacă se estimează că prezența unor solvenți organici și a unor emulsionanți cauzează artefacte, substanța chimică de testare ar putea fi adăugată direct la amestecul de testare sub formă de pudră sau sub formă lichidă. Substanțele chimice volatile și substanțele chimice de testare lichide insolubile în apă pot fi injectate în flacoane de ser inoculat cu ajutorul unor microseringi [punctul 12 litera (i)].
|
|
20.
|
Se adaugă substanțele chimice de testare în flacoane pentru a obține o serie geometrică de concentrații, de exemplu, 500 mg/l, 250 mg/l, 125 mg/l, 62,5 mg/l, 31,2 mg/l și 15,6 mg/l. În cazul în care nu se cunoaște intervalul de toxicitate din soluții chimice similare, se efectuează mai întâi un test preliminar de stabilire a intervalului la concentrațiile de 1 000 mg/l, 100 mg/l și 10 mg/l pentru determinarea intervalului corespunzător.
|
Substanța chimică de referință
|
21.
|
Se prepară o soluție apoasă de 3,5-diclorfenol (10 g/l) adăugând treptat cantitatea minimă de 5 mol/l de soluție de hidroxid de sodiu la materia solidă, agitând în același timp până la dizolvare. Se adaugă apoi apă de diluție deoxigenată (punctul 14) la volumul necesar; sonicarea poate favoriza diluarea. Pot fi utilizate și alte substanțe chimice de referință atunci când intervalul mediu al EC50 a fost obținut în cadrul a cel puțin trei teste cu inoculi diferiți (surse diferite sau momente diferite de colectare).
|
INTERFERENȚĂ/ERORI
|
22.
|
Se pare că anumiți constituenți ai nămolului ar putea reacționa cu potențiali inhibitori anulându-le efectele asupra microorganismelor determinând o inhibare mai redusă sau nulă. De asemenea, dacă nămolul conține deja o substanță chimică inhibitoare, ar putea fi obținute rezultate eronate atunci când substanța chimică respectivă este supusă testării. În afară de aceste posibilități, există o serie de factori identificați care pot conduce la rezultate false. Aceștia sunt enumerați în apendicele 3 împreună cu metodele pentru eliminarea sau cel puțin pentru reducerea erorilor.
|
PROCEDURA DE TESTARE
|
23.
|
Numărul probelor duplicat necesare depinde de gradul de precizie necesar pentru indicii de inhibare. În cazul în care capacele flacoanelor sunt suficient de etanșe la gaze pe întreaga durată a testului, se pregătește un singur lot (cel puțin trei probe duplicat) de flacoane de testare la fiecare concentrație necesară. Similar, se pregătește un lot de flacoane cu substanța chimică de referință și un set de probe de control. Cu toate acestea, în cazul în care fiabilitatea capacelor flacoanelor este asigurată doar pentru o străpungere sau pentru câteva străpungeri, se pregătește un lot (de exemplu, trei probe duplicat) de flacoane de testare pentru fiecare interval (t) pentru care sunt necesare rezultate la toate concentrațiile unei substanțe chimice de testare care trebuie testate. Similar, se pregătesc loturi «t» de flacoane pentru substanța chimică de referință și pentru probele de control.
|
|
24.
|
Se recomandă utilizarea unei boxe cu mănuși [punctul 12 litera (j)]. Cu cel puțin 30 de minute înainte de începerea testului, se lasă să treacă un flux de azot gazos prin boxa cu mănuși care conține toate echipamentele necesare. Temperatura nămolului trebuie să fie de 35 °C ± 2 °C pe parcursul manipulării și ermetizării flacoanelor.
|
Test preliminar
|
25.
|
În cazul în care nu se cunoaște activitatea nămolului, se recomandă efectuarea unui test preliminar. Se pregătesc probe de control pentru a obține, de exemplu, concentrații ale materiilor solide de 10 g/l, 20 g/l și 40 g/l la care se adaugă substratul, însă nu se utilizează nicio substanță chimică de testare. De asemenea, se utilizează volume diferite de amestec de reacție pentru a obține trei sau patru raporturi între volumul de spațiu superior și volumul de lichid. Dintre rezultatele de volume de gaze produse la diferite intervale de timp, se aleg condițiile cele mai adecvate care permit două măsurători zilnice caracterizate de volume semnificative de gaze și care eliberează o presiune zilnică cu o sensibilitate (20) optimă fără risc de explozii.
|
Adăugarea substanțelor chimice de testare
|
26.
|
În flacoanele de testare goale se adaugă substanțe chimice de testare solubile în apă [punctul 12 litera (b)] sub formă de soluții apoase (punctul 18). Se utilizează seturi de flacoane care conțin cel puțin trei probe duplicat pentru fiecare concentrație dintr-un interval (punctul 20). În cazul unor substanțe chimice de testare insolubile sau puțin solubile, se injectează soluții din acestea în solvenți organici cu ajutorul unei microseringi în flacoanele goale pentru a obține seturi de probe duplicat cu cinci concentrații de substanță chimică de testare. Se evaporă solventul prin purjare cu un jet de azot gazos pe suprafața soluțiilor din flacoanele de testare. Alternativ, se adaugă direct în flacoanele de testare cantități cântărite de substanțe chimice solide insolubile.
|
|
27.
|
Dacă substanțele chimice de testare lichide insolubile sau puțin solubile în apă nu se adaugă utilizând un solvent, acestea se adaugă direct cu ajutorul unei microseringi în flacoanele de testare după adăugarea inoculului și a substratului de testare (a se vedea punctul 30). Substanțele chimice de testare volatile pot fi adăugate în același mod.
|
Adăugarea inoculului și a substratului
|
28.
|
Se agită un volum corespunzător de nămol de digestie strecurat (a se vedea punctul 16) într-un flacon de 5 litri [punctul 12 litera (g)], lăsând în același timp să treacă prin spațiul superior un curent de azot gazos. Flacoanele de testare, care conțin soluțiile apoase sau soluțiile dintr-un solvent evaporat de substanțe chimice de testare, sunt purjate cu un curent de azot gazos timp de aproximativ două minute pentru a elimina aerul. Se repartizează în flacoanele de testare alicote, de exemplu 100 ml, de nămol amestecat bine utilizând o pipetă cu vârf larg sau o eprubetă gradată. Este esențial ca pipeta să fie umplută dintr-o singură încercare cu volumul exact de nămol deoarece materiile solide din nămol se sedimentează cu ușurință. În cazul în care se prelevează prea mult, pipeta se golește și se repetă operațiunea.
|
|
29.
|
Se adaugă apoi o cantitate suficientă de soluție de substrat (punctul 17) pentru a obține în amestec o concentrație de 2 g/l din fiecare dintre componentele bulionului nutritiv, și anume extractul de drojdie și D-glucoza, continuând în aceleași timp purjarea cu azot. În continuare este prezentat un exemplu de loturi de testare.
|
Concentrația masică finală a substanței chimice de testare din flacoanele de testare
(mg/l)
|
Volumul substanței chimice de testare
(ml)
|
Reactivi și medii
(ml)
|
|
Soluție stoc a)10 g/lpunctul 18
|
Soluție stoc b)1 g/lpunctul 18
|
Apa de diluție
punctul 14
|
Inocul
punctul 16
|
Substrat
punctul 17
|
|
0
|
—
|
0
|
1,0
|
100
|
2
|
|
1
|
—
|
0,1
|
0,9
|
100
|
2
|
|
3,3
|
—
|
0,33
|
0,67
|
100
|
2
|
|
10
|
0,1
|
—
|
0,9
|
100
|
2
|
|
33
|
0,33
|
—
|
0,67
|
100
|
2
|
|
100
|
1,0
|
—
|
0
|
100
|
2
|
|
Volumul total al flaconului = 160 ml. Volumul de lichid = 103 ml
Volumul de gaz = 57 ml sau 35,6 % din volumul total.
|
|
|
30.
|
În mod similar, se purjează cu azot gazos un număr suficient de flacoane de testare goale pentru a elimina orice substanță chimică de testare volatilă și lichidă insolubilă (a se vedea punctul 27).
|
Probele de control și substanța chimică de referință
|
31.
|
Se prepară seturi de flacoane conținând cel puțin trei probe duplicat, incluzând doar nămolul și substratul, pentru a fi utilizate ca probe de control. Se prepară apoi flacoane duplicat care conțin nămolul și substratul, precum și o cantitate suficientă de soluție stoc a substanței chimice de referință, 3,5-diclorfenol (punctul 21) pentru a obține o concentrație finală de 150 mg/l. Această concentrație trebuie să inhibe producția de gaze cu aproximativ 50 %. Alternativ, se prepară un interval de concentrații pentru substanța chimică de referință. În plus, se pregătesc patru flacoane suplimentare pentru măsurarea pH-ului care conțin nămol, apă deoxigenată și substrat. Se adaugă substanța de testare în două flacoane cu cea mai mare concentrație de testare, iar apa deoxigenată se adaugă în cele două flacoane rămase.
|
|
32.
|
Toate flacoanele – substanțele chimice de testare și de referință și probele de control – trebuie să conțină același volum (VR) de lichid; dacă este necesar, se adaugă apă deionizată deoxigenată (punctul 14) pentru a ajusta volumul. Spațiul superior trebuie să fie între 10 % și 40 % din volumul flacoanelor, valoarea efectivă fiind selectată din datele obținute în urma testului preliminar. După adăugarea tuturor constituenților în flacoane, se îndepărtează acul de alimentare cu gaz și se etanșeizează fiecare flacon cu un dop din cauciuc și cu o capsulă din aluminiu [punctul 12 litera (b)] umezind dopul cu o picătură de apă deionizată pentru a facilita introducerea sa. Se amestecă conținutul fiecărui flacon prin agitare.
|
Incubarea flacoanelor
|
33.
|
Flacoanele sunt transferate în incubatorul controlat termostatic, de preferință echipat cu un dispozitiv de agitare, și ținute la o temperatură de 35 °C ± 2 °C. Flacoanele sunt incubate la întuneric. După aproximativ 1 oră, se echilibrează presiunea în flacoane la presiunea atmosferică prin introducerea acului seringii, atașat la manometru [punctul 12 litera (c)], în capacul fiecărui flacon, se deschide supapa până ce manometrul afișează valoarea zero și, în final, se închide supapa. Acul trebuie introdus la un unghi de 45° pentru a împiedica scurgerile de gaze din flacoane. Dacă flacoanele sunt incubate fără un dispozitiv de agitare, acestea trebuie agitate manual de două ori pe zi pe parcursul întregii perioade de incubare pentru a echilibra sistemul. Flacoanele trebuie incubate în poziție răsturnată pentru a împiedica orice pierdere de gaze prin sept. Cu toate acestea, răsturnarea nu este recomandată în cazurile în care substanțele chimice de testare insolubile se pot lipi de fundul flaconului.
|
Măsurarea presiunii
|
34.
|
Atunci când flacoanele au atins temperatura de 35 °C ± 2 °C, se măsoară și se înregistrează pH-ul conținutului a patru flacoane pregătite în acest scop și se elimină conținutul; se continuă incubarea la întuneric a restului de flacoane. Se măsoară și se înregistrează presiunea din flacoane de două ori pe zi timp de 48-72 de ore prin introducerea acului manometrului, pe rând, în capacul fiecărui flacon, uscând acul după fiecare măsurătoare. Toate părțile flaconului trebuie menținute la temperatura de incubare pe parcursul măsurătorii care trebuie efectuată cât mai repede posibil. Presiunea se înregistrează după stabilizarea afișajului acesteia. Apoi se deschide supapa pentru ventilație și se închide atunci când presiunea atinge valoarea zero. Testul durează de obicei 48 de ore din momentul primei echilibrări a presiunii, indicate prin «timpul 0». Numărul măsurătorilor și a ventilărilor trebuie limitat în cazul substanțelor chimice volatile la unu (la încheierea perioadei de incubare) sau la doi pentru a reduce la minimum pierderile de substanță chimică de testare (10).
|
|
35.
|
Dacă rezultatul măsurătorii presiunii este negativ, nu deschideți supapa. Uneori se acumulează umezeală în acul și tubul seringii, fenomen indicat printr-o valoare ușor negativă a presiunii. În acest caz, se îndepărtează acul, se agită tubul, se șterge cu un șervețel și se introduce un ac nou.
|
Măsurarea pH-ului
|
36.
|
pH-ul conținutului fiecărui flacon se măsoară și se înregistrează după măsurarea presiunii finale.
|
DATE ȘI RAPORT
Exprimarea rezultatelor
|
37.
|
Se calculează suma și media presiunilor înregistrate la fiecare interval de timp pentru fiecare set de flacoane duplicat și se calculează media presiunilor brute cumulate de gaze la fiecare interval de timp pentru fiecare set de flacoane duplicat. Se trasează curbele producției medii cumulate de gaze (Pa) în funcție de timp pentru flacoanele de control, de testare și de referință. Se selectează un timp pe partea liniară a curbei, în general 48 de ore, și se calculează procentajul de inhibare (I) pentru fiecare concentrație cu ecuația [1]:
|
I = (1 – Pt/PC) × 100
|
[1],
|
unde
|
I
|
=
|
procentajul de inhibiție, în %;
|
|
Pt
|
=
|
presiunea gazului produsă cu materialul de testare la timpul selectat, în Pascal (Pa);
|
|
Pc
|
=
|
presiunea gazului produsă în proba de control la același timp, în Pascal (Pa).
|
Se recomandă trasarea a două curbe, și anume curba I în funcție de concentrație și, de asemenea, în funcție de logaritmul concentrației astfel încât să poată fi selectată curba care este cea mai apropiată de liniaritate. Se evaluează vizual sau prin analiză de regresie valoarea EC50 (mg/l) pornind de la curba cea mai apropiată de liniaritate. În scopul comparării, ar putea fi mai utilă exprimarea concentrației substanței chimice în mg de substanță chimică/g din totalul materiilor solide uscate. Pentru a obține această concentrație, se împarte concentrația volumetrică (mg/l) la concentrația volumetrică a materiilor solide din nămolul uscat (g/l) (punctul 16).
|
|
38.
|
Se calculează procentajul de inhibare obținut prin unica concentrație a substanței chimice de referință utilizată sau valoarea EC50 în cazul în care a fost examinat un număr suficient de concentrații.
|
|
39.
|
Se realizează conversia presiunii medii a gazelor produse în flaconul de control Pc(Pa) în volum pe baza curbei de calibrare a manometrului (apendicele 2) și se calculează astfel randamentul de gaze, exprimat în volumul produs în 48 de ore din 100 ml de nămol nediluat la o concentrație a materiilor solide cuprinsă între 2 % (20 g/l) și 4 % (40 g/l).
|
Criterii de validitate
|
40.
|
Rezultatele obținute în urma testului interlaboratoare ISO (5) au indicat că substanța chimică de referință (3,5-diclorfenol) a cauzat o inhibare de 50 % a producției de gaze într-un interval al concentrațiilor cuprins între 32 mg/l și 510 mg/l, cu o medie de 153 mg/l (punctul 10). Acest interval este atât de larg încât nu pot fi stabilite cu încredere limite exacte pentru inhibiție utilizabile drept criterii de validitate; acest lucru ar trebui să fie posibil atunci când tehnicile vor indica un mod de producere de inocul mai consistent. Volumele de gaze produse în flacoanele de control în 48 de ore s-au încadrat între 21 ml/g de materie uscată de nămol și 149 ml/g (cu o medie de 72 ml/g). Nu a existat un raport clar între volumul de gaze produs și valoarea EC50 corespunzătoare. pH-ul final a variat între 6,1 și 7,5.
|
|
41.
|
Testul este considerat valid atunci când este obținută o inhibare mai mare de 20 % în proba de control de referință care conține 150 mg/l de 3,5-diclorfenol, atunci când se produce mai mult de 50 ml de gaz per g de materie uscată în proba-martor și valoarea pH-ului se încadrează în intervalul 6,2-7,5 la finalul testului.
|
Raportul de testare
|
42.
|
Raportul de testare trebuie să includă următoarele informații:
|
|
Substanța chimică testată
|
—
|
denumirea comună, denumirea chimică, numărul CAS, formula structurală și proprietățile fizico-chimice relevante;
|
|
—
|
puritatea (impuritățile) substanței chimice testate.
|
|
|
|
Condițiile de testare
|
—
|
volumul conținutului de lichid și volumul spațiului superior din vasele de testare;
|
|
—
|
descrierea vaselor de testare și a aparatului de măsurare a gazelor (de exemplu, tipul de manometru);
|
|
—
|
aplicarea substanței chimice de testare și a substanței chimice de referință la sistemul de testare, concentrațiile de testare utilizate și utilizarea de solvenți;
|
|
—
|
detalii privind inoculul utilizat: numele stației de tratare a apelor uzate, descrierea sursei apelor uzate tratate (de exemplu, temperatura de funcționare, timpul de retenție al nămolului, provenit în cea mai mare parte din apele uzate menajere sau deșeuri industriale etc.), concentrația materiilor solide, activitatea de producere de gaze a fierbătorului anaerob, expunerea prealabilă sau posibila preadaptare la substanțele chimice toxice sau locul prelevării mâlului, sedimentului etc.;
|
|
—
|
temperatura și intervalul de incubare;
|
|
—
|
numărul de flacoane duplicat.
|
|
|
|
Rezultate
|
—
|
valoarea pH-ului la finalul testului;
|
|
—
|
toate datele măsurate colectate din vasele de testare, probele-martor și vasele de control cu substanțele chimice de referință, după caz (de exemplu, presiunea în Pa sau milibari) sub formă de tabel;
|
|
—
|
procentul de inhibare din flacoanele de testare și de referință și curbele de inhibare în funcție de concentrație;
|
|
—
|
calcularea valorilor EC50, exprimate în mg/l și mg/g;
|
|
—
|
producția de gaze per g de nămol în 48 de ore;
|
|
—
|
motivele unei eventuale respingeri a rezultatelor testului;
|
|
—
|
discutarea rezultatelor, inclusiv orice abatere de la procedurile din cadrul prezentei metode de testare și discutarea tuturor abaterilor observate în rezultatele testului cauzate de interferențe și de erori în raport cu rezultatele estimate;
|
|
—
|
abordarea, de asemenea, a aspectelor legate de definirea scopului testului, și anume măsurarea toxicității pentru microorganisme expuse sau nu în prealabil.
|
|
|
BIBLIOGRAFIE
|
(1)
|
Capitolul C.11 din prezenta anexă: Nămol activ, test de inhibare a respirației.
|
|
(2)
|
Capitolul C.43 din prezenta anexă: Biodegradabilitatea anaerobă a substanțelor organice din nămolul digerat: metoda prin măsurarea producerii de gaze.
|
|
(3)
|
International Organisation for Standardisation (2003) ISO 13 641-1 Water Quality – Determination of inhibition of gas production of anaerobic bacteria – Part 1: General Test.
|
|
(4)
|
International Organisation for Standardisation (2003) ISO 13 641-2 Water Quality – Determination of inhibition of gas production of anaerobic bacteria – Part 2: Test for low biomass concentrations.
|
|
(5)
|
ISO (2000) Ring test of ISO 13 641-1 and ISO 13 641-2. Determination of inhibition of activity of anaerobic bacteria. BL 6958/A. Evans MR, Painter HA. Brixham Environmental Laboratory, AstraZeneca UK Ltd., Brixham, TQ5 8BA UK.
|
|
(6)
|
Swanwick JD, Foulkes M (1971). Inhibition of anaerobic digestion of sewage sludge by chlorinated hydrocarbons. Res. Control Fed. Control, 70, 58-70.
|
|
(7)
|
HMSO (1986) Determination of the inhibitory effects of chemicals and waste waters on the anaerobic digestion of sewage sludge. ISBN 0 117519 43 X, In: Methods for the Examination of Waters and Associated Materials UK.
|
|
(8)
|
Shelton DR, Tiedje JM (1984). General method for determining anaerobic biodegradation potential., Appl. Env. Microbiol. 47 850-857.
|
|
(9)
|
Battersby NS și Wilson V (1988). Evaluation of a serum bottle technique for assessing the anaerobic biodegradability of organic compounds under methanogenic conditions. Chemosphere 17, 2441-2460.
|
|
(10)
|
Wilson V, Painter HA și Battersby NS (1992). A screening method for assessing the inhibition of the anaerobic gas production from sewage sludge. Ind. Int. Symp. on Ecotoxicology. Ecotoxicological Relevance of Test Methods, GSF Forschungzentrum, Neuherberg, Germany (1990). Eds. Steinberg C and Kettrup A, pp117-132 (1992).
|
|
(11)
|
Kawahara K, Yakabe Y, Chida T și Kida K (1999). Evaluation of laboratory-made sludge for an anaerobic biodegradability test and its use for assessment of 13 chemicals. Chemosphere, 39 (12), 2007-2018.
|
|
(12)
|
International Organization for Standardization (1995) ISO 10 634 Water Quality – Guidance for the preparation and treatment of poorly water-soluble organic compounds for the subsequent evaluation of their biodegradability in an aqueous medium.
|
|
(13)
|
International Organization for Standardization (1997) ISO 11 923 Water Quality – Determination of suspended solids by filtration through glass-fibre filters.
|
Apendicele 1
Exemplu de aparat pentru măsurarea producției de biogaz prin presiunea gazului
Legendă:
|
1
|
–
|
Manometru
|
|
2
|
–
|
Supapă etanșă la gaze cu trei căi
|
|
3
|
–
|
Ac de seringă
|
|
4
|
–
|
Capac etanș la gaze (capsulă și sept ondulate)
|
|
5
|
–
|
Spațiu superior
|
|
6
|
–
|
Inocul de nămol digerat
|
Vase de testare dintr-un mediu cu o temperatură de 35 °C ± 2 °C
Apendicele 2
Conversia măsurătorilor manometrice
Valorile indicate de manometru pot fi raportate la volumele de gaze cu ajutorul unei curbe standard de referință și pornind de la aceasta se poate calcula volumul de gaz produs per g de nămol uscat per 48 de ore. Acest index de activitate este utilizat ca unul dintre criteriile de evaluare a validității rezultatelor testului. Curba de calibrare se obține prin injectarea volumelor de gaz cunoscute la o temperatură de 35 °C ± 2 °C în flacoanele de ser care conțin un volum de apă egal cu cel al amestecului de reacție, VR;
|
—
|
Se introduc alicote de VR ml de apă, menținute la o temperatură de 35 °C ± 2 °C în cinci flacoane de ser. Se etanșează flacoanele și se așează într-o baie de apă la o temperatură de 35 °C ± 2 °C timp de 1 oră pentru echilibrare;
|
|
—
|
Se pornește manometrul, se lasă să se stabilizeze și se reglează la zero;
|
|
—
|
Se introduce acul seringii prin capacul unuia dintre flacoane, se deschide supapa până ce manometrul afișează valoarea zero și se închide supapa;
|
|
—
|
Se repetă procedura cu restul flacoanelor;
|
|
—
|
Se injectează 1 ml de aer la temperatura de 35 °C ± 2 °C în fiecare flacon. Se introduce acul (pe manometru) prin capacul unuia dintre flacoane și se așteaptă stabilizarea presiunii. Se înregistrează presiunea, se deschide supapa până ce presiunea atinge valoarea zero și apoi se închide supapa;
|
|
—
|
Se repetă procedura cu restul flacoanelor;
|
|
—
|
Se repetă întreaga procedură utilizând 2 ml, 3 ml, 4 ml, 5 ml, 6 ml, 8 ml, 10 ml, 12 ml, 16 ml, 20 ml și 50 ml de aer;
|
|
—
|
Se trasează o curbă de conversie a presiunii (Pa) în funcție de volumul de gaz injectat (ml). Răspunsul instrumentului este linear în intervalul 0 Pa-70 000 Pa și 0 ml-50 ml de producție de gaze.
|
Apendicele 3
Factori identificați care pot conduce la rezultate false
(a) Calitatea dopurilor flacoanelor
Sunt disponibile pe piață diferite tipuri de septuri pentru flacoanele de ser; multe dintre acestea, inclusiv butil-cauciucul, pierd din etanșeitate atunci când sunt străpunse cu un ac în condițiile acestui test. Uneori presiunea scade foarte ușor după străpungerea septului cu acul seringii. Se recomandă utilizarea unor septuri etanșe la gaze pentru a preveni scurgerile [punctul 12 litera (b)].
(b) Umiditatea din acul seringii
Uneori se acumulează umezeală în acul și tubul seringii, fenomen indicat printr-o valoare ușor negativă a presiunii. Pentru a corecta acest fenomen, se îndepărtează acul, se agită tubul, se șterge cu un șervețel și se introduce un ac nou [punctele 12 litera (c) și 35].
(c) Contaminarea cu oxigen
Metodele anaerobe sunt sensibile la erori determinate de contaminarea cu oxigen care poate cauza reducerea producției de gaze. În cadrul prezentei metode, această posibilitate ar trebui redusă la minimum prin utilizarea de tehnici strict anaerobe, inclusiv utilizarea unei boxe cu mănuși.
(d) Substraturile brute din nămol
Producția anaerobă de gaze și sensibilitatea nămolului sunt influențate de substraturile care sunt transferate cu inoculul în flacoanele de testare. Nămolul digerat din fierbătoare anaerobe menajere conține adesea materii identificabile ca păr și reziduuri vegetale de celuloză, care tind să îngreuneze prelevarea de probe reprezentative. Prin strecurare, materiile insolubile grosiere de nămol pot fi eliminate pentru a spori reprezentativitatea prelevării de probe (punctul 16).
(e) Substanțele chimice de testare volatile
Substanțele de testare volatile vor fi eliberate în spațiul superior al flacoanelor de testare. Acest lucru poate avea ca rezultat pierderea din sistem a unei părți din materialele de testare pe parcursul ventilării după efectuarea măsurătorilor presiunii, ceea ce se traduce prin valori ale EC50 fals ridicate. Acest tip de erori poate fi redus prin alegerea corectă a unui raport între volumul de spațiu superior și volumul de lichid și prin eliminarea ventilării după efectuarea măsurătorilor presiunii (10).
(f) Neliniaritatea producției de gaze
În cazul în care curba de producție medie cumulată de gaze în raport cu timpul de incubare nu este aproape liniară pentru o perioadă de 48 de ore, exactitatea testului poate fi diminuată. Pentru soluționarea acestei probleme, se recomandă utilizarea de nămol de digerare dintr-o sursă diferită și/sau adăugarea unei concentrații crescute de substrat de testare și bulion nutritiv, extract de drojdie și glucoză (punctul 29).
Apendicele 4
Aplicare pe probe prelevate din mediu cu concentrație de biomasă redusă – mâl, sedimente etc.
INTRODUCERE
A.1 În general, activitatea microbiană specifică (volumul de gaze produs per g de materii solide uscate) a mâlurilor, sedimentelor, solurilor etc. anaerobe naturale este mult mai redusă decât cea a nămolului anaerob derivat din apele uzate. În consecință, atunci când urmează să fie măsurate efectele inhibitorii ale substanțelor chimice asupra acestor probe mai puțin active, trebuie modificate unele dintre condițiile experimentale. Pentru aceste probe mai puțin active, există două căi generale de acțiune posibile:
|
(a)
|
Efectuarea unui test preliminar modificat (punctul 25) cu proba de nămol, de sol etc. nediluat la o temperatură de 35 °C ± 2 °C sau la temperatura din locul de prelevare a probei, pentru optimizarea simulării (conform părții 1 din ISO 13 641);
|
|
(b)
|
Sau efectuarea testului cu un nămol diluat provenit de la un fierbător (1 în 100) pentru a simula activitatea redusă prevăzută a probei prelevate din mediu, însă menținând temperatura la 35 °C ± 2 °C (conform părții 2 din ISO 13 641).
|
A.2 Opțiunea (a) se poate realiza urmând metoda descrisă în prezenta anexă (echivalentă cu partea 1 din ISO 13 641), însă este esențială efectuarea unui test preliminar (punctul 25) pentru determinarea condițiilor optime, cu excepția cazului în care acestea sunt deja cunoscute din teste anterioare. Proba de mâl sau de sediment trebuie să fie bine amestecată, de exemplu, într-un blender și, dacă este necesar, diluată cu o proporție mică de apă de diluție dezaerată (punctul 14) astfel încât să fie suficient de mobilă pentru a fi transferată cu o pipetă cu vârful larg sau cu o eprubetă gradată. Dacă se consideră că lipsesc nutrienți, proba de mâl poate fi centrifugată (în condiții anaerobe) și repusă în suspensie în mediul mineral care conține extract de drojdie (A.11).
A.3 Opțiunea (b). Aceasta reproduce în mod rezonabil activitatea redusă a probelor prelevate din mediu, cu excepția concentrației ridicate de materii solide în suspensie prezentă în aceste probe. Nu se cunoaște rolul acestor materii solide în inhibare, însă este posibil ca reacția dintre substanțele chimice de testare și constituenții mâlului, precum și adsorbția substanțelor chimice de testare în materiile solide să aibă ca rezultat o scădere a toxicității substanței chimice de testare.
A.4 Temperatura este un alt factor important: pentru o simulare riguroasă, testele trebuie efectuate la temperatura din locul prelevării probelor, întrucât se știe că diferite grupuri metanogene de bacterii sunt funcționale în intervale de temperatură diferite, și anume termofilele (~ 30-35 °C), mezofilele (20-25 °C) și psihrofilele (< 20 °C), care pot prezenta modele de inhibare diferite.
A.5 Durata. În cadrul testului general, partea 1, în care s-a utilizat nămol nediluat, producția de gaze în cele 2-4 zile a fost întotdeauna suficientă, în timp ce în partea 2, cu nămol diluat de 100 de ori, producția de gaze, în cazul în care a existat, a fost insuficientă pe parcursul acestei perioade în cadrul ring testului. Madsen et al (1996), în descrierea lor a acestui din urmă test, propun o perioadă de 7 zile.
Testare cu o concentrație redusă de biomasă (opțiunea b)
Trebuie efectuate următoarele modificări și completări, prin adăugarea sau înlocuirea anumitor puncte și subpuncte din textul principal.
A.6 La punctul 6 se adaugă textul următor: Principiul testului;
«Prezenta tehnică poate fi utilizată cu nămol anaerob diluat 1 la 100, parțial pentru a simula activitatea redusă a mâlului și a sedimentelor. Temperatura de incubare poate fi de 35 °C sau egală cu cea din locul în care a fost prelevată proba. Întrucât activitatea bacteriană este mult mai redusă decât în nămolul nediluat, perioada de incubare trebuie prelungită la cel puțin 7 zile».
A.7 La punctul 12 litera (a) se adaugă textul următor:
«incubatorul trebuie să aibă capacitatea de a funcționa la temperaturi mai mici de 15 °C.»
A.8 Se adaugă un reactiv suplimentar după punctul 13:
«Acid fosforic (H3PO4), 85 % procente masice în apă.»
A.9 La finalul punctului 16 se adaugă următorul text:
«Se utilizează în cadrul testului o concentrație finală de 0,20 ± 0,05 g/l din materiile solide uscate.»
A.10 Punctul 17. Substratul de testare
Acest substrat nu este utilizat, însă este înlocuit cu extract de drojdie (a se vedea punctul 17; punctele A.11, A.12, A.13).
A.11 Este necesar un mediu mineral, incluzând oligoelemente, pentru diluarea nămolului anaerob și se recomandă adăugarea la acest mediu a substratului organic, extractul de drojdie.
După alineatul (17), se adaugă
|
«(a)
|
Mediu mineral de testare, cu extract de drojdie.
|
Acesta se prepară dintr-un mediu de testare concentrat de 10 ori [punctul 17 litera (b), A.12] cu o soluție cu oligoelemente [punctul 17 litera (c), A.13]. Se utilizează sulfură de sodiu nonahidrat proaspătă [punctul 17 litera (b)]; A.12] sau se spală și se usucă înainte de utilizare pentru a se asigura că are o capacitate reducătoare suficientă. În cazul în care testul este efectuat fără a se utiliza o boxă cu mănuși [punctul 12 litera (j)], concentrația sulfurii de sodiu în soluția stoc trebuie să fie crescută la 2 g/l (de la 1 g/l). Sulfura de sodiu poate fi adăugată și dintr-o soluție stoc corespunzătoare prin septul flacoanelor de testare închise, întrucât această procedură va reduce riscul de oxidare, până la obținerea unei concentrații finale de 0,2 g/l. Alternativ, poate fi utilizat citrat de titan (III) [punctul 17 litera (b)]. Acesta se adaugă prin septul flacoanelor de testare închise pentru a obține o concentrație cuprinsă între 0,8 mmol/l și 1,0 mmol/l. Citratul de titan (III) este un agent reducător foarte eficient și cu toxicitate redusă, care se prepară după cum urmează: se dizolvă 2,94 g de citrat trisodic dihidrat în 50 ml de apă de diluție fără oxigen (punctul 14) (rezultând o soluție de 200 mmol/l] și se adaugă 5 ml de soluție de clorură de titan (III) (15g/100 ml de apă de diluție). Se neutralizează la un pH de 7± 0,5 cu carbonat de sodiu și se distribuie într-un flacon de ser corespunzător sub un curent de azot gazos. Concentrația de citrat de titan (III) din această soluție stoc este de 164 mmol/l. Utilizați mediul de testare imediat sau depozitați-l la 4 °C timp de maximum 1 zi.
|
A.12
|
(b)
|
Mediul de testare concentrat de zece ori, pregătit cu următoarele componente:
|
dihidrogenofosfat de potasiu anhidru (KH2PO4)
|
2,7 g
|
|
hidrogenofosfat disodic (Na2HPO4)
|
4,4 g
|
|
(sau 11,2 g dodecahidrat)
clorură de amoniu (NH4Cl)
|
5,3 g
|
|
clorură de calciu dihidrat (CaCl2 · 2H2O)
|
0,75 g
|
|
clorură de magneziu hexahidrat (MgCl2 · 6H2O)
|
1,0 g
|
|
clorură de fier (II) tetrahidrat (FeCl2 · 4H2O)
|
0,2 g
|
|
resazurin (indicator redox)
|
0,01 g
|
|
sulfură de sodiu nonahidratat (Na2S · 9H2O)
|
1,0 g
|
|
[sau citrat de titan (III)] concentrație finală
|
0,8 mmol/l -1,0 mmol/l
|
|
soluție de oligoelemente [punctul 17 litera (c); A.13]
|
10,0 ml
|
|
extract de drojdie
|
100 g
|
|
se dizolvă în apă de diluție (punctul 14) și se ajustează la:
|
1 000 ml
|
|
|
A.13
|
(c)
|
Soluția de oligoelemente, preparată cu următoarele componente:
|
clorură de mangan (II) tetrahidrat (MnCl2 · 4H2O)
|
0,5 g
|
|
acid ortoboric (H3BO3)
|
0,05 g
|
|
clorură de zinc (ZnCl2)
|
0,05 g
|
|
clorură de cupru (II) (CuCl2)
|
0,03 g
|
|
molibdat de sodiu dihidrat (Na2MoO4 · 2H2O)
|
0,01 g
|
|
clorură de cobalt (II) hexahidrat (CoCl2 · 6H2O)
|
1,0 g
|
|
clorură de nichel (II) hexahidrat (NiCl2 · 6H2O)
|
0,1 g
|
|
selenit de disodiu (Na2SeO3)
|
0,05 g
|
|
se dizolvă în apă de diluție (punctul 14) și se ajustează la:
|
1 000 ml»
|
|
A.14 Punctul 25: Testul preliminar
Este esențial să se efectueze un test preliminar conform descrierii de la punctul 24, exceptând nivelul concentrației de materii solide din nămol care trebuie să fie echivalent cu o sutime din concentrațiile indicate, și anume 0,1g/l, 0,2g/l și 0,4g/l. Durata incubației trebuie să fie de cel puțin 7 zile.
Notă: În cadrul ring testului (5), volumul de spațiu superior a fost prea mare reprezentând 75 % din volumul total; acesta trebuie să se încadreze în intervalul recomandat de 10 %-40 %. Criteriul relevant este ca volumul de gaze produs pentru o inhibare de aproximativ 80 % să fie măsurabil cu o precizie acceptabilă (de exemplu, între ± 5 % și ± 10 %).
A.15 Punctele 26-30: Adăugarea substanței chimice de testare, a inoculului și a substratului.
Adăugările se realizează în același mod ca cel descris la prezentele puncte, însă soluția de substraturi (punctul 17) se înlocuiește cu mediul de testare la care se adaugă substratul de extract de drojdie (A.11).
De asemenea, concentrația finală a materiilor solide din nămol este redusă de la 2 g/l – 4 g/l la 0,2 ± 0,05 g/l (A.9). În tabelul A.1, care înlocuiește tabelul de la punctul 29, sunt furnizate două exemple de adăugare de componente la amestecul de testare.
A.16 Punctul 33: Incubarea flacoanelor
Ca urmare a vitezei scăzute estimate a producției de gaze, incubarea durează cel puțin 7 zile.
A.17 Punctul 34: Măsurători ale presiunii
Se utilizează aceeași procedură pentru măsurarea presiunii în spațiul superior al flacoanelor, astfel cum se descrie la punctul 34, în cazul în care este necesară analiza cantităților în faza gazoasă. Dacă trebuie măsurate cantitățile totale de CO2 și CH4, pH-ul în faza lichidă este redus la aproximativ pH 2 prin injectarea de H3PO4 în fiecare flacon relevant și prin măsurarea presiunii după 30 de minute de agitare la temperatura testului. Cu toate acestea, informații suplimentare cu privire la calitatea inoculului pot fi obținute prin măsurarea presiunii în fiecare flacon înainte și după acidificare. De exemplu, dacă viteza de producere de CO2 este mult mai mare decât cea de producere a metanului, sensibilitatea bacteriilor fermentative poate fi modificată și/sau bacteriile metanogene sunt preferențial afectate de substanța chimică de testare.
A.18 Punctul 36: măsurarea pH-ului
Dacă trebuie utilizat H3PO4, trebuie pregătite anumite flacoane suplimentare, în care nu se adaugă H3PO4, în special pentru măsurarea pH-ului.
BIBLIOGRAFIE:
Madsen, T, Rasmussen, HB și Nilsson, L (1996), Methods for screening anaerobic biodegradability and toxicity of organic chemicals. Project No.336, Water Quality Institute, Danish Environment Protection Agency, Copenhaga.
Tabelul A.1
Exemple de organizare a testului pentru loturile de testare
|
Constituenții amestecului de reacție
|
Exemplul 1
|
Exemplul 2
|
Ordinea normală a adăugării
|
|
Concentrația inoculului preparat (g/l)
|
0,42
|
2,1
|
—
|
|
Volumul inoculului adăugat (ml)
|
45
|
9
|
4
|
|
Concentrația inoculului din flacoanele de testare (g/l)
|
0,20
|
0,20
|
—
|
|
Volumul mediului de testare adăugat (ml)
|
9
|
9
|
2
|
|
Volumul apei de diluție adăugată (ml)
|
36
|
72
|
3
|
|
Concentrația extractului de drojdie din flacoanele de testare (g/l)
|
9,7
|
9,7
|
—
|
|
Volumul soluției stoc de substanță chimică de testare (ml)
|
3
|
3
|
1
|
|
Volumul total de lichid (ml)
|
93
|
93
|
—
|
Apendicele 5
Definiții
În scopul prezentei metode de testare se utilizează următoarele definiții:
|
|
«Substanță chimică» înseamnă o substanță sau un amestec.
|
|
|
«Substanță chimică de testare» înseamnă orice substanță sau amestec care se testează utilizându-se prezenta metodă de testare.
|
C.35 TEST DE TOXICITATE PE LUMBRICULUS ÎNTR-UN SISTEM APĂ-SEDIMENT ÎMBOGĂȚIT
INTRODUCERE
|
1.
|
Prezenta metodă de testare este echivalentă cu Orientarea OCDE privind testarea (TG) nr. 225 (2007). Animalele endobentice care ingerează sedimente sunt supuse unui risc potențial ridicat de expunere la substanțele chimice legate de sedimente și, în consecință, trebuie să li se acorde o atenție deosebită, de exemplu, referințele (1), (2), (3). Printre aceste organisme care ingerează sedimente, oligochetele acvatice joacă un rol important în sedimentele sistemelor acvatice. Prin implicarea lor în bioturbația sedimentului și prin funcția lor de pradă, aceste animale pot avea o puternică influență asupra biodisponibilității respectivelor substanțe chimice pentru alte organisme, de exemplu peștii care se hrănesc cu organisme bentice. Spre deosebire de organismele epibentice, oligochetele acvatice endobentice (de exemplu, Lumbriculus variegatus) se ascund în sediment și ingerează particule sedimentare de sub suprafața sedimentară. Acest lucru asigură expunerea organismelor de testare la substanța chimică de testare prin toate căile posibile de absorbție (de exemplu, contactul cu particule sedimentare contaminate și ingerarea acestora, dar și prin intermediul apei interstițiale și al apei acoperitoare).
|
|
2.
|
Această metodă de testare este concepută pentru a evalua efectele unei expuneri prelungite a oligochetelor endobentice Lumbriculus variegatus (Müller) la substanțele chimice asociate sedimentelor. Aceasta se bazează pe protocoalele existente de testare a toxicității și a bioacumulării din sedimente, de exemplu, referințele (3), (4), (5), (6), (7), (8), (9), (10). Metoda este descrisă pentru condiții statice de testare. Scenariul de expunere utilizat în cadrul acestei metode de testare este îmbogățirea sedimentului cu substanța chimică de testare. Utilizarea sedimentului îmbogățit este prevăzută pentru simularea unui sediment contaminat cu substanța chimică de testare.
|
|
3.
|
De obicei, substanțele chimice care trebuie testate din punctul de vedere al efectului asupra organismelor care trăiesc în sedimente persistă timp îndelungat în acest compartiment. Organismele care trăiesc în sedimente pot fi expuse prin mai multe căi. Importanța relativă a fiecărei căi de expunere, precum și timpul necesar pentru ca fiecare să contribuie la efectele toxice generale depind de proprietățile fizico-chimice ale substanței chimice respective și de destinația sa finală în animal. Pentru substanțele chimice puternic absorbante (de exemplu, cu log Kow > 5) sau pentru substanțele chimice cu legături covalente cu sedimentul, ingerarea de hrană contaminată poate fi o cale de expunere semnificativă. Pentru a nu subestima toxicitatea respectivelor substanțe chimice, hrana necesară pentru reproducerea și creșterea organismelor de testare se adaugă la sediment înainte de aplicarea substanței chimice de testare (11). Metoda de testare descrisă este suficient de detaliată astfel încât testul să poată fi efectuat permițând în același timp adaptări ale modelului experimental în funcție de condițiile din anumite laboratoare și de caracteristicile variate ale substanțelor chimice de testare.
|
|
4.
|
Metoda de testare are ca scop determinarea efectelor unei substanțe chimice de testare asupra reproducerii și a biomasei organismelor de testare. Parametrii biologici măsurați sunt numărul total de viermi supraviețuitori și biomasa (greutatea uscată) la finalul expunerii. Aceste date sunt analizate cu ajutorul unui model de regresie pentru a estima concentrația care ar putea cauza un efect de x % (de exemplu, EC50, EC25 și EC10) sau cu ajutorul verificării unei ipoteze statistice pentru a determina concentrația la care nu se observă niciun efect (NOEC) și concentrația cea mai scăzută pentru care este observat un efect (LOEC).
|
|
5.
|
Capitolul C. 27 din prezenta anexă «Test de toxicitate pe chironomide cu utilizarea de sediment îmbogățit» (6), furnizează numeroase detalii esențiale și utile pentru aplicarea metodei de testare a toxicității asupra sedimentului. În consecință, acest document servește drept bază pentru efectuarea modificărilor necesare efectuării de teste de toxicitate asupra sedimentelor cu Lumbriculus variegatus. Alte documente la care se face referire sunt de exemplu «ASTM Standard Guide for Determination of the Bioaccumulation of Sediment-Associated Contaminants by Benthic Invertebrates» (3), «U.S. EPA Methods for Measuring the Toxicity and Bioaccumulation of Sediment-Associated Contaminants with Freshwater Invertebrates» (7) și «ASTM Standard Guide for Collection, Storage, Characterization, and Manipulation of Sediments for Toxicological Testing and for selection of samplers used to collect benthic invertebrates» (12). În plus, experiența practică dobândită pe parcursul ring testului metodei de testare [(13), raportul privind ring testul] și detalii din literatura de specialitate reprezintă surse importante de informații pentru redactarea prezentului document.
|
CONDIȚII PREALABILE ȘI RECOMANDĂRI
|
6.
|
Înainte de începerea studiului, trebuie obținute informații cu privire la substanța chimică de testare, cum ar fi măsurile de precauție pentru asigurarea siguranței, condițiile adecvate de depozitare și metodele analitice. Orientări cu privire la substanțele chimice de testare cu proprietăți fizico-chimice care le fac dificil de testat sunt prezentate în referința (14).
|
|
7.
|
Înainte de efectuarea unui test, sunt necesare următoarele informații privind substanța chimică de testare:
|
—
|
denumirea comună, denumirea chimică (de preferat, denumirea IUPAC), formula structurală, numărul de înregistrare CAS, puritatea;
|
|
|
8.
|
Următoarele informații suplimentare sunt considerate utile înainte de începerea testului:
|
—
|
coeficientul de partiție octanol/apă, Kow;
|
|
—
|
coeficientul de partiție carbon organic/apă, exprimat sub forma Koc;
|
|
—
|
fototransformarea în apă;
|
|
—
|
tensiunea superficială.
|
|
|
9.
|
Înainte de începerea testului, trebuie obținute informații cu privire la anumite caracteristici ale sedimentului care urmează să fie utilizat (7). Pentru detalii a se vedea punctele (22)-(25).
|
PRINCIPIUL TESTULUI
|
10.
|
Viermii aflați într-o stare fiziologică similară (sincronizați conform descrierii din apendicele 5) sunt expuși la o serie de concentrații toxice aplicate fazei de sediment a unui sistem sediment-apă. Ca mediu trebuie utilizate un sediment artificial și apă reconstituită. Vasele de testare fără adăugarea substanței chimice de testare servesc drept vase de control. Substanța chimică de testare este introdusă în sediment în cantitate mare pentru fiecare nivel de concentrație în vederea reducerii la minimum a variabilității între duplicatele pentru fiecare nivel de concentrație, iar organismele de testare sunt introduse ulterior în vasele de testare în care au fost echilibrate concentrațiile de sediment și de apă [a se vedea punctul (29)]. Animalele de testare sunt expuse la sistemele sediment-apă pentru o perioadă de 28 de zile. Având în vedere conținutul scăzut de nutrienți din sedimentul artificial, sedimentul trebuie îmbogățit cu o sursă de hrană (a se vedea punctele 22-23 și apendicele 4) pentru a garanta creșterea și reproducerea viermilor în condiții controlate. Se asigură astfel expunerea animalelor prin intermediul apei și a sedimentului, precum și prin intermediul hranei lor.
|
|
11.
|
Punctul final preferat al acestui tip de studiu este ECx (de exemplu,. EC50, EC25 și EC10; concentrația efectivă, care afectează x % din organismele de testare) pentru reproducere și, respectiv, biomasă comparativ cu vasul de control. Cu toate acestea, având în vedere gradul mare de incertitudine privind valorile scăzute ale ECx (de exemplu, EC10, EC25) cu limite de încredere de 95 % extrem de ridicate [de exemplu, (15)] și puterea statistică calculată pe parcursul verificării ipotezei, trebuie observat faptul că EC50 este considerată ca fiind punctul final cel mai fiabil. În plus, concentrația la care nu se observă niciun efect (NOEC) și concentrația cea mai scăzută pentru care este observat un efect (LOEC) pot fi calculate pentru biomasă și reproducere, în cazul în care proiectul testului și datele susțin aceste calcule (a se vedea punctele 34-38). Scopul studiului, calculul ECx sau NOEC, va determina proiectul testului.
|
TEST DE REFERINȚĂ
|
12.
|
Se preconizează ca performanțele organismelor de control să demonstreze într-o măsură suficientă capacitatea unui laborator de a efectua testul și, în cazul în care sunt disponibile date istorice, repetabilitatea testului. În plus, pot fi efectuate, la intervale regulate, teste de toxicitate de referință utilizând o substanță toxică de referință pentru evaluarea sensibilității organismelor de testare. Numai testele de toxicitate de referință cu durata de 96 de ore pot demonstra într-un mod satisfăcător sensibilitatea și starea animalelor de testare (4)(7). Informații privind toxicitatea pentaclorfenolului (PCP) în teste efectuate (28 de zile de expunere la un sediment îmbogățit) sunt incluse în apendicele 6 și în raportul privind ring testul metodei de testare (13). Toxicitatea acută a PCP doar în prezența apei este descrisă, de exemplu, în referința (16). Aceste informații pot fi utilizate pentru compararea sensibilității organismelor de testare în testele de referință cu PCP ca substanță toxică de referință. Clorura de potasiu (KCl) sau sulfatul de cupru (CuSO4) au fost recomandate ca substanțe toxice de referință pentru L. variegatus (4)(7). În prezent, este dificilă stabilirea unor criterii de calitate pe baza datelor privind toxicitatea pentru KCI din cauza lipsei de date din literatura de specialitate în ceea ce privește L. variegatus. Informații privind toxicitatea cuprului pentru L. variegatus sunt pot fi găsite în referințele (17)-(21).
|
VALIDITATEA TESTULUI
|
13.
|
Pentru ca testul să fie valabil, trebuie să se îndeplinească următoarele cerințe:
|
—
|
Un ring test (13) a demonstrat că în cazul Lumbriculus variegatus, numărul mediu de viermi vii per probă duplicat în vasele de control trebuie să fi crescut cu un factor de cel puțin 1,8 la finalul expunerii comparativ cu numărul de viermi per probă duplicat de la începutul expunerii.
|
|
—
|
pH-ul apei acoperitoare trebuie să fie cuprins între 6 și 9 pe întreaga durată a testului.
|
|
—
|
Concentrația de oxigen din apa acoperitoare nu trebuie să fie mai mică de 30 % din valoarea de saturație din aer (VSA) la temperatura de testare aplicată pe parcursul testului.
|
|
DESCRIEREA METODEI DE TESTARE
Sistemul de testare
|
14.
|
Se recomandă utilizarea sistemelor statice fără reînnoirea apei acoperitoare. În cazul în care raportul sediment/apă (a se vedea punctul 15) este corespunzător, o aerare ușoară va fi în mod normal suficientă pentru menținerea calității apei la niveluri acceptabile pentru organismele de testare (de exemplu, creșterea la maximum a nivelurilor de oxigen dizolvat, reducerea la minimum a acumulării de produse excretoare). Sistemele semistatice sau dinamice, cu reînnoire continuă sau intermitentă a apei acoperitoare pot fi utilizate numai în cazuri excepționale, întrucât se așteaptă ca reînnoirea periodică a apei acoperitoare să afecteze echilibrul chimic (de exemplu, pierderi de substanță chimică de testare din sistemul de testare).
|
Vasele și aparatura de testare
|
15.
|
Expunerea trebuie realizată în pahare de laborator din sticlă, de exemplu, de 250 ml și cu un diametru 6 cm. Se pot utiliza și alte vase din sticlă corespunzătoare, dar acestea trebuie să asigure o adâncime corespunzătoare pentru apa acoperitoare și sediment. În fiecare vas trebuie introdus un strat de aproximativ 1,5-3 cm de sediment preparat. Raportul dintre adâncimea stratului de sediment și adâncimea apei acoperitoare trebuie să fie 1:4. Vasele trebuie să aibă o capacitate corespunzătoare conformă cu rata de încărcare, și anume numărul de viermi de testare adăugați pe unitatea ponderală de sediment (a se vedea, de asemenea, punctul 39).
|
|
16.
|
Vasele de testare și alte aparate care vor intra în contact cu substanța chimică de testare trebuie să fie în întregime din sticlă sau dintr-un alt material chimic inert. A se evita, pentru toate componentele echipamentelor, utilizarea de materiale care pot dizolva și absorbi substanța chimică de testare sau care pot elibera alte substanțe chimice și care pot avea un efect advers asupra animalelor de testare. Politetrafluoretilena (PTFE), oțelul inoxidabil și/sau sticla trebuie utilizate pentru orice echipament care intră în contact cu mediul de testare. Pentru substanțele chimice organice care se absorb în sticlă, ar putea fi necesară sticlă silanizată. În aceste situații, echipamentul va trebui eliminat după utilizare.
|
Specia de testare
|
17.
|
Specia de testare utilizată în cadrul acestui tip de studiu este oligochetul de apă dulce Lumbriculus variegatus (Müller). Această specie tolerează o gamă largă tipuri de sedimente și este utilizată pe scară largă pentru testarea toxicității și a bioacumulării din sedimente [de exemplu, (3), (5), (7), (9), (13), (15), (16), (22), (23), (24), (25), (26), (27), (28), (29), (30), (31), (32), (33), (34), (35)]. Trebuie raportate originea animalelor de testare, confirmarea identității speciilor [de exemplu, (36)], precum și condițiile de cultură. Identificarea speciei nu este necesară înainte de fiecare test în cazul în care organismele provin dintr-o cultură internă.
|
Creșterea organismelor de testare
|
18.
|
Pentru a avea un număr suficient de viermi pentru realizarea testelor de toxicitate asupra sedimentului, este utilă menținerea viermilor în cultura de laborator permanentă. Orientări privind metodele de creștere în laborator pentru Lumbriculus variegatus și sursele culturilor de pornire sunt furnizate în apendicele 5. Pentru detalii privind creșterea acestei specii, a se vedea referințele (3), (7), (27).
|
|
19.
|
Pentru a garanta că testele sunt efectuate cu animale din aceeași specie, se recomandă stabilirea de specii individuale. Asigurați-vă că culturile și, în special, viermii utilizați în cadrul testelor nu prezintă boli și anomalii vizibile.
|
Apa
|
20.
|
Se recomandă utilizarea, în cadrul testelor, de apă reconstituită conform capitolului C.1 din prezenta anexă (37) ca apă acoperitoare; aceasta poate fi utilizată și pentru culturile de viermi de laborator (pentru pregătire, a se vedea apendicele 2). Dacă este necesar, se poate utiliza apă naturală. Calitatea apei alese trebuie să permită creșterea și reproducerea speciilor de testare pe parcursul perioadelor de aclimatizare și de testare fără manifestarea vreunui aspect sau comportament anormal. S-a demonstrat că Lumbriculus variegatus supraviețuiește, crește și se reproduce în acest tip de apă (30) și este asigurată o standardizare maximă a condițiilor de testare și de creștere. În cazul în care se utilizează apă reconstituită, compoziția acesteia trebuie raportată, iar apa trebuie să fie caracterizată înainte de utilizare cel puțin în ceea ce privește pH-ul, conținutul de oxigen și duritate (exprimată în mg de CaCO3/l). Analiza micropoluanților din apă înainte de utilizarea acesteia ar trebui să furnizeze informații utile (a se vedea, de exemplu, apendicele 3).
|
|
21.
|
pH-ul apei acoperitoare trebuie să se încadreze între 6,0 și 9,0 (a se vedea punctul 13). În cazul în care se preconizează degajarea unei cantități mari de amoniac, se consideră utilă menținerea pH-ului în limitele de 6,0 și 8,0. Pentru testarea de exemplu a unor acizi organici slabi, se recomandă ajustarea pH-ului prin tamponarea apei care urmează să fie utilizată în cadrul testului, conform descrierii, de exemplu, din referința (16). Duritatea totală a apei care urmează să fie utilizată în cadrul testului trebuie să se încadreze între 90 și 300 mg de CaCO3/litru de apă naturală. Apendicele 3 sintetizează alte criterii pentru o apă de diluție acceptabilă conform Orientării nr. 210 a OCDE (38).
|
Sedimentul
|
22.
|
Având în vedere că sedimentele naturale necontaminate provenite dintr-o anumită sursă ar putea să nu fie disponibile pe tot parcursul anului, iar organismele indigene, precum și prezența micropoluanților pot influența testul, trebuie utilizat de preferință un sediment preparat (denumit, de asemenea, sediment reconstituit, artificial sau sintetic). Utilizarea unui sediment preparat limitează variabilitatea condițiilor de testare, precum și introducerea unei faune indigene. Următorul sediment preparat se bazează pe sedimentul artificial descris în referințele (6), (39) și (40). Este recomandat a fi utilizat în cadrul acestui tip de test [(6), (10), (30), (41), (42), (43)]:
|
(a)
|
4-5 % mușchi de turbă (greutate uscată); este important să se utilizeze turbă sub formă de pudră, grad de descompunere: «mediu», fin mărunțită (dimensiunea particulelor ≤ 0,5 mm) și uscată numai cu aer.
|
|
(b)
|
20 ± 1 % (greutate uscată) argilă caolinică (de preferință, cu conținut de caolinit de peste 30 %).
|
|
(c)
|
75-76 % (greutate uscată) nisip cuarțos (nisip fin, granulație: ≤ 2 mm, însă > 50 % din particule trebuie să se încadreze în intervalul 50-200 μm).
|
|
(d)
|
Apă deionizată, 30–50 % din greutatea uscată a sedimentului, în plus față de componentele sedimentului uscat.
|
|
(e)
|
Se adaugă carbonat de calciu de calitate chimică pură (CaCO3) pentru a ajusta pH-ul amestecului final al sedimentului.
|
|
(f)
|
Conținutul total de carbon organic (TOC) din amestecul final trebuie să fie de 2 % (± 0,5 %) din greutatea uscată a sedimentului și trebuie să fie ajustat prin utilizarea unor cantități corespunzătoare de turbă și nisip, conform (a) și (c).
|
|
(g)
|
Hrana, de exemplu frunze de urzică mică (Urtica sp., în conformitate cu standardele farmaceutice, pentru consumul uman) sub formă de pulbere sau un amestec de frunze Urtica sp. sub formă de pulbere și celuloză alfa (1:1), la 0,4 – 0,5 % din greutatea uscată a sedimentului, în plus față de componentele sedimentului uscat; pentru detalii a se vedea apendicele 4.
|
|
|
23.
|
Trebuie să se cunoască sursa de turbă, de argilă caolinică, de hrană și de nisip. În plus față de cele enunțate la litera (g), în capitolul C.27 din prezenta anexă (6) sunt enumerate alte substanțe vegetale care trebuie utilizate ca sursă de hrană: frunze deshidratate de dud (Morus alba), trifoi alb (Trifolium repens), spanac (Spinacia oleracea) sau cereale.
|
|
24.
|
Sursa de hrană aleasă trebuie adăugată înainte sau pe parcursul introducerii în sediment a substanței chimice de testare. Sursa de hrană aleasă trebuie să permită cel puțin o reproducere acceptabilă în vasele de control. Analiza micropoluanților din sedimentul artificial sau din constituenți înainte de utilizare ar putea furniza informații utile. În apendicele 4 este descris un exemplu de preparare a sedimentului. Se acceptă și amestecul de constituenți uscați, dacă se demonstrează că după adăugarea apei acoperitoare nu apare o separare a constituenților sedimentului (de exemplu, plutirea unor particule de turbă) și că turba sau sedimentul este suficient condiționat (a se vedea, de asemenea, punctul 25 și apendicele 4). Sedimentul artificial trebuie să fie caracterizat cel puțin prin originea constituenților, prin distribuția dimensiunii granulelor (procentul de nisip, de silt și de argilă), prin conținutul total de carbon organic (TOC), prin conținutul de apă și prin pH-ul său. Măsurarea potențialului redox este opțională.
|
|
25.
|
Dacă este necesar, de exemplu în scopul unei testări specifice, sedimentele naturale provenite din locuri nepoluate pot servi, de asemenea, drept sediment de testare și/sau de cultură (3). Cu toate acestea, în cazul utilizării unui sediment natural, acesta trebuie caracterizat cel puțin prin originea (locul prelevării), pH-ul și conținutul de amoniac din apa interstițială, prin conținutul total de carbon organic (TOC) și prin conținutul de azot, prin distribuția dimensiunii particulelor (procentul de nisip, de silt și de argilă) și prin procentul de apă (7) și nu trebuie să prezinte niciun fel de contaminare și alte organisme care ar putea concura cu organismele de testare sau care le-ar putea consuma. Măsurarea potențialului redox și a capacității de schimb de cationi este opțională. De asemenea, se recomandă ca, înainte de introducerea substanței chimice de testare, sedimentul natural să fie condiționat timp de șapte zile în aceleași condiții care predomină în testul ulterior. La finalul acestei perioade de condiționare, apa acoperitoare trebuie extrasă și eliminată.
|
|
26.
|
Calitatea sedimentului care urmează să fie utilizat trebuie să permită supraviețuirea și reproducerea organismelor de control pe parcursul perioadei de expunere fără manifestarea vreunui aspect sau comportament anormal. Viermii de control trebuie introduși în sediment, iar aceștia trebuie să ingereze sedimentul. Reproducerea în vasele de control trebuie să fie cel puțin conformă cu criteriile de validitate descrise la punctul 13. Prezența sau absența granulelor de fecale pe suprafața sedimentului, care indică ingestia sedimentului de către viermi, trebuie înregistrată și poate fi utilă pentru interpretarea rezultatelor testului în ceea ce privește căile de expunere. Informații suplimentare privind ingestia sedimentului pot fi obținute cu ajutorul metodelor descrise în referințele (24), (25), (44) și (45), în care se specifică ingestia sedimentului sau selectarea particulelor în organismele de testare.
|
|
27.
|
Procedurile de manipulare a sedimentelor naturale înainte de utilizarea acestora în laborator sunt descrise în referințele (3), (7) și (12). Pregătirea și depozitarea sedimentului artificial recomandat a fi utilizat în cadrul testului pe Lumbriculus sunt descrise în apendicele 4.
|
Aplicarea substanței chimice de testare
|
28.
|
Substanța chimică de testare trebuie introdusă în sediment. Întrucât se estimează că cele mai multe substanțe chimice au o solubilitate scăzută în apă, acestea trebuie să fie dizolvate într-un solvent organic corespunzător (de exemplu, acetonă, n-hexan, ciclohexan), într-un volum cât mai mic posibil pentru a pregăti soluția stoc. Soluția stoc trebuie diluată cu același solvent pentru a pregăti soluțiile de testare. Toxicitatea și volatilitatea solventului și solubilitatea substanței chimice de testare în solventul ales ar trebui să reprezinte principalele criterii pentru selectarea unui agent de solubilizare adecvat. Pentru fiecare nivel de concentrație, trebuie utilizat același volum de soluție corespunzătoare. Sedimentul trebuie îmbogățit în cantitate mare pentru fiecare nivel de concentrație în vederea reducerii la minimum a variabilității între duplicate a concentrației substanței chimice de testare. Fiecare dintre soluțiile de testare este apoi amestecată cu nisip cuarțos conform descrierii de la punctul 22 (de exemplu, 10 g de nisip cuarțos pentru fiecare vas de testare). Pentru imersiunea completă a nisipului cuarțos, un volum cuprins între 0,20 și 0,25 ml/g este considerat suficient. Apoi, solventul trebuie evaporat complet. Pentru a reduce la minimum pierderile de substanță chimică de testare prin coevaporare (de exemplu, în funcție de presiunea de vapori a substanței chimice), nisipul acoperit trebuie utilizat imediat după uscare. Nisipul uscat este amestecat cu cantitatea adecvată de sediment preparat la nivelul de concentrație corespunzător. Cantitatea de nisip provenit din amestecul de substanță de testare și de nisip trebuie să fie luată în considerare în momentul preparării sedimentului (astfel, sedimentul trebuie să fie preparat cu mai puțin nisip). Principalul avantaj al acestei proceduri este acela că, în principiu, nu este introdus în sediment niciun fel de solvent (7). Alternativ, de exemplu în cazul sedimentului natural, substanța chimică de testare poate fi adăugată prin încorporarea unei părți de sediment uscat și fin măcinat conform descrierii de mai sus pentru nisipul cuarțos sau prin amestecarea substanței chimice de testare în sedimentul umed, evaporând apoi orice agent de solubilizarea utilizat. Trebuie să se asigure distribuirea completă și uniformă în sediment a substanței chimice de testare adăugate la sediment. Dacă este necesar, subeșantioanele pot fi analizate pentru a confirma concentrațiile vizate din sediment și pentru a determina gradul de omogenitate. De asemenea, ar putea fi utilă analiza subeșantioanelor soluțiilor de testare pentru a confirma concentrațiile vizate din sediment. Întrucât se utilizează un solvent pentru depunerea substanței chimice de testare peste nisipul cuarțos, trebuie utilizat un vas de control cu solvent pregătit cu aceeași cantitate de solvent ca și sedimentele de testare. Trebuie raportate metoda utilizată pentru îmbogățire și motivele alegerii unei anumite proceduri de îmbogățire diferită de cea descrisă mai sus. Metoda de îmbogățire poate fi adaptată la proprietățile fizico-chimice ale substanței chimice de testare, de exemplu, pentru a se evita pierderile cauzate de volatilizare pe parcursul procesului de îmbogățire sau de echilibrare. Orientări suplimentare privind procedurile de îmbogățire sunt furnizate în Environment Canada (1995) (46).
|
|
29.
|
După pregătirea sedimentului îmbogățit, distribuirea acestuia în vasele de testare duplicat și adăugarea de apă de testare, este de preferat să se permită distribuția substanței chimice de testare din sediment în faza apoasă [de exemplu, (3)(7)(9)]. De preferință, această operațiune trebuie să se facă în aceleași condiții de temperatură și aerare ca și cele utilizate în test. Perioada de echilibrare corespunzătoare depinde de sediment și de substanțele chimice și poate fi de ordinul orelor sau de ordinul zilelor, iar în cazuri rare poate ajunge la câteva săptămâni (4-5 săptămâni) [de exemplu, (27)(47)]. În cadrul acestui test nu este necesar un echilibru complet, însă se recomandă o perioadă de echilibrare cuprinsă între 48 de ore și 7 zile. Astfel, timpul de degradare a substanței chimice de testare va fi redus la minimum. În funcție de scopul studiului, de exemplu, atunci când sunt reproduse condițiile de mediu, sedimentul îmbogățit poate fi echilibrat sau maturat pentru o perioadă mai mare.
|
|
30.
|
La finalul acestei perioade de echilibrare, trebuie prelevate probe cel puțin din apa acoperitoare și din masa de sediment, cel puțin la cea mai mare și la cea mai mică concentrație pentru analiza concentrației substanței chimice de testare. Aceste determinări analitice ale substanței chimice de testare permit calculul bilanțului masic și exprimarea rezultatelor pe baza concentrațiilor inițiale măsurate. În general, prelevarea de probe împiedică sau distruge sistemul sediment-apă. În consecință, nu este posibil de obicei să se utilizeze aceleași duplicate pentru prelevarea de probe de sediment și viermi. Trebuie pregătite vase«analitice» suplimentare de dimensiuni corespunzătoare, tratate în același mod (inclusiv prin prezența organismelor de testare), însă nu trebuie utilizate pentru observații biologice. Dimensiunile vaselor de testare trebuie selectate pentru a preleva cantitățile de probe impuse de metoda analitică. Detalii privind prelevarea de probe sunt prezentate la punctul 53.
|
DESFĂȘURAREA TESTULUI
Testul preliminar
|
31.
|
În cazul în care nu este disponibilă nicio informație privind toxicitatea substanței chimice de testare pentru Lumbriculus variegatus, ar putea fi utilă realizarea unui test preliminar pentru a determina intervalul de concentrații care trebuie testate în cadrul testului final și pentru a optimiza condițiile de testare ale testului final. În acest scop, se utilizează o serie de concentrații ale substanței chimice de testare, distribuite la intervale mari. Viermii sunt expuși la fiecare nivel de concentrație a substanței chimice de testare pentru o perioadă (de exemplu, 28 de zile ca în cazul testului final) care permite estimarea concentrațiilor de testare corespunzătoare; nu sunt necesare duplicate. Comportamentul viermilor, de exemplu evitarea sedimentului, care poate fi cauzată de substanța chimică de testare și/sau de sediment, trebuie observat și înregistrat pe parcursul unui test preliminar. Concentrațiile mai mari de 1 000 mg/kg de greutate uscată de sediment nu trebuie testate în cadrul testului preliminar.
|
Testul final
|
32.
|
În cadrul testului final, trebuie utilizate și selectate cel puțin cinci concentrații, de exemplu pe baza rezultatului testului preliminar de stabilire a intervalului (punctul 31) și conform descrierii de la punctele 35, 36, 37 și 38.
|
|
33.
|
Un vas de control (pentru duplicare, a se vedea punctele 36, 37 și 38) care conține toți constituenții, cu excepția substanței chimice de testare, este tratat în paralel cu seria de testare. În cazul în care nu se utilizează niciun agent de solubilizare pentru aplicarea substanței chimice de testare, acest lucru nu ar trebui să aibă niciun efect semnificativ asupra organismelor de testare, astfel cum se demonstrează cu ajutorul unui vas de control suplimentar care conține doar solvent.
|
Proiectul testului
|
34.
|
Proiectul testului se referă la selectarea numărului și a intervalelor de concentrații de testare, la numărul de vase pentru fiecare nivel de concentrație și la numărul de viermi adăugați pentru fiecare vas. Modelele pentru estimarea ECx, pentru estimarea NOEC și pentru efectuarea unui test la valori-limită sunt descrise la punctele 35, 36, 37 și 38.
|
|
35.
|
Concentrațiile efective (de exemplu, EC50 EC25, EC10) și intervalul de concentrații în care efectul substanței de testare prezintă interes trebuie să fie cuprinse în seria concentrațiilor incluse în test. Trebuie evitată extrapolarea la valori mult sub cel mai mic nivel de concentrație care afectează organismele de testare sau la valori mai mari decât cel mai mare nivel de concentrație testată. Dacă – în cazuri excepționale – se realizează o astfel de extrapolare, trebuie furnizată o explicație completă în raport.
|
|
36.
|
Dacă trebuie estimată valoarea ECx, trebuie testate cel puțin cinci niveluri de concentrație și minimum trei probe duplicat pentru fiecare nivel de concentrație; se recomandă utilizarea a șase probe duplicat pentru vasul de control sau – în cazul în care este utilizat – pentru vasul de control cu solvent pentru a îmbunătăți estimarea variabilității între vasele de control. În orice caz, este recomandat să se utilizeze concentrații de testare suficiente, pentru a permite o bună estimare a modelului. Factorul dintre concentrații nu trebuie să fie mai mare de doi (cu o posibilă excepție în cazurile în care curba de răspuns a concentrației are o înclinare mică). Numărul de probe duplicat pentru fiecare tratament poate fi redus în cazul în care se crește numărul de concentrații de testare cu răspunsuri cuprinse în intervalul 5 – 95 %. La creșterea numărului de probe duplicat sau la reducerea mărimii intervalelor concentrațiilor de testare, intervalele de încredere pentru test au tendința de a se îngusta.
|
|
37.
|
În cazul în care trebuie estimate valorile LOEC/NOEC, trebuie utilizate cel puțin cinci concentrații de testare cu cel puțin patru probe duplicat (se recomandă șase probe duplicat pentru vasul de control sau – în cazul în care este utilizat – pentru vasul de control cu solvent pentru a îmbunătăți estimarea variabilității între vasele de control), iar factorul dintre concentrații nu trebuie să fie mai mare de doi. Anumite informații privind puterea statistică determinată pe parcursul testării ipotezei în cadrul ring testului metodei de testare sunt furnizate în apendicele 6.
|
|
38.
|
Se poate efectua un test la valori-limită (utilizând o concentrație de testare și vase de control), în cazul în care nu se preconizează niciun efect până la 1 000 mg/kg de greutate uscată de sediment (de exemplu, în urma unui test preliminar de stabilire a intervalului) sau în cazul în care testarea la un singur nivel de concentrație va fi adecvată pentru confirmarea unei valori NOEC de interes. În acest din urmă caz, trebuie inclus în raportul de testare o argumentație detaliată a selectării concentrației-limită. Scopul testului la valori-limită este de a efectua un test la o concentrație suficient de mare pentru a permite factorilor de decizie să excludă efectele posibil toxice ale substanței chimice, iar limita este stabilită la o concentrație care nu este probabil să apară în nicio situație. Se recomandă 1 000 mg/kg (greutate uscată). De obicei, sunt necesare cel puțin șase probe duplicat atât pentru tratament, cât și pentru probele de control. Anumite informații privind puterea statistică determinată pe parcursul testării ipotezei în cadrul ring testului metodei de testare sunt furnizate în apendicele 6.
|
Condiții de expunere
Organismele de testare
|
39.
|
Testul se efectuează cu cel puțin 10 viermi pentru fiecare probă duplicat utilizată pentru determinarea parametrilor biologici. Acest număr de viermi corespunde cu aproximativ 50 – 100 mg de biomasă umedă. La un conținut de materie uscată estimat la 17,1 % (48), se obține aproximativ 9 – 17 mg de biomasă uscată per vas. U.S. EPA [2000 (7)] recomandă utilizarea unei rate de încărcare care să nu depășească 1: 50 (biomasă uscată: TOC). Pentru sedimentul preparat descris la punctul 22, această rată corespunde cu aproximativ 43 g de sediment (greutate uscată) pentru 10 viermi la un conținut TOC de 2,0 % de sediment uscat. În cazul utilizării unui număr mai mare de 10 viermi per recipient, cantitatea de sediment și de apă acoperitoare trebuie ajustată în consecință.
|
|
40.
|
Viermii utilizați în cadrul unui test trebuie să provină toți din aceeași sursă și trebuie să se afle într-o stare fiziologică similară (a se vedea apendicele 5). Trebuie selectați viermi de dimensiuni similare (a se vedea punctul 39). Se recomandă ca un subeșantion din lotul sau stocul de viermi să fie cântărit înainte de test pentru estimarea greutății medii.
|
|
41.
|
Viermii care urmează să fie utilizați în cadrul unui test sunt extrași din cultură (pentru detalii a se vedea apendicele 5). Animalele (adulte) de mari dimensiuni care nu prezintă semne de fragmentare recentă sunt transferate în recipiente din sticlă (de exemplu, vase Petri) care conțin apă curată. Acestea sunt apoi sincronizate conform descrierii din apendicele 5. După o perioadă de regenerare de 10-14 zile, trebuie utilizați pentru test viermii intacți și întregi de dimensiuni similare, care înoată sau se târăsc activ după aplicarea unui ușor stimul mecanic. În cazul în care condițiile de testare diferă de condițiile de cultură (de exemplu, în ceea ce privește temperatura, lumina și apa acoperitoare), o etapă de aclimatizare, de exemplu, de 24 de ore cu parametri de temperatură, de lumină și de apă acoperitoare identici cu cei ai testului ar trebui să fie suficientă pentru adaptarea viermilor la condițiile de testare. Oligochetele adaptate trebuie distribuite aleatoriu în vasele de testare.
|
Hrănirea
|
42.
|
Întrucât hrana este adăugată la sediment înaintea (sau pe parcursul) aplicării substanței chimice de testare, viermii nu sunt hrăniți suplimentar pe parcursul testului.
|
Lumina și temperatura
|
43.
|
Perioada de expunere la lumină aplicată culturii și în cadrul testului este de obicei de 16 ore (3), (7). Intensitatea luminii trebuie menținută la un nivel scăzut (de exemplu, 100-500 lx) pentru a imita condițiile naturale la suprafața sedimentului și trebuie măsurată cel puțin o dată pe parcursul perioadei de expunere. Temperatura trebuie să fie de 20 °C ± 2 °C pe tot parcursul testului. La o anumită dată de măsurare, diferența de temperatură dintre vasele de testare nu trebuie să fie mai mare de ± 1 °C. Vasele de testare trebuie așezate în incubatorul de testare sau în zona de testare într-un mod aleatoriu, de exemplu, pentru a reduse la minimum eroarea de reproducere determinată de locul vasului.
|
Aerarea
|
44.
|
Apa acoperitoare din vasele de testare trebuie să fie supusă unui ușor proces de aerare (de exemplu, 2-4 bule pe secundă) cu ajutorul unei pipete Pasteur așezată la aproximativ 2 cm deasupra suprafeței sedimentului astfel încât să limiteze perturbațiile. Concentrația de oxigen dizolvat nu trebuie să scadă sub 30 % din valoarea de saturație din aer (VSA). Aportul de aer trebuie controlat și – dacă este necesar – ajustat cel puțin o dată pe zi în zilele lucrătoare.
|
Măsurători ale calității apei
|
45.
|
Următorii parametri de calitate a apei trebuie măsurați în apa acoperitoare:
|
Temperatura:
|
cel puțin într-un vas de testare cu fiecare nivel de concentrație și într-un vas de testare dintre vasele de control, o dată pe săptămână și la începutul și la încheierea perioadei de expunere; dacă este posibil, temperatura din mediul înconjurător (aerul înconjurător sau baia de apă) trebuie, de asemenea, înregistrată, de exemplu la intervale de o oră;
|
|
Conținutul de oxigen dizolvat:
|
cel puțin într-un vas de testare cu fiecare nivel de concentrație și într-un vas de testare dintre vasele de control, o dată pe săptămână și la începutul și la încheierea perioadei de expunere; exprimat în mg/l și % din VSA (valoarea de saturație din aer);
|
|
Aportul de aer:
|
trebuie controlat cel puțin o dată pe zi în zilele lucrătoare și – dacă este necesar – trebuie ajustat;
|
|
pH-ul:
|
cel puțin într-un vas de testare cu fiecare nivel de concentrație și într-un vas de testare dintre vasele de control, o dată pe săptămână și la începutul și la încheierea perioadei de expunere;
|
|
Duritatea totală a apei:
|
cel puțin într-o probă duplicat din vasele de control și într-un vas de testare cu cea mai mare concentrație la începutul și la încheierea perioadei de expunere; exprimată în mg/l CaCO3;
|
|
Conținutul total de amoniac:
|
cel puțin într-o probă duplicat din vasele de control și într-un vas de testare cu fiecare nivel de concentrație la începutul și la încheierea perioadei de expunere și, ulterior, de 3 ori pe săptămână; exprimată în mg/l NH4
+ sau NH3 sau azot amoniacal total.
|
În cazul în care parametrii de calitate a apei necesită prelevarea unor probe semnificative de apă din vase, se recomandă pregătirea unor vase separate pentru efectuarea măsurătorilor calității apei astfel încât să nu se modifice raportul volumic apă-sediment.
|
Observații biologice
|
46.
|
Pe parcursul expunerii, vasele de testare trebuie observate în vederea evaluării vizuale a oricărei diferențe de comportament manifestată de viermi (de exemplu, evitarea sedimentului, granule de fecale vizibile pe suprafața sedimentului) comparativ cu vasele de control. Observațiile trebuie înregistrate.
|
|
47.
|
La finalul testului, fiecare probă duplicat este examinată (pot fi excluse de la examinare vasele suplimentare destinate analizelor chimice). Trebuie utilizată o metodă corespunzătoare pentru a recupera toți viermii din vasul de testare. Trebuie avut grijă ca toți viermii să fie recuperați nevătămați. O metodă posibilă este strecurarea viermilor din sediment. Poate fi utilizată o plasă din oțel inoxidabil cu o dimensiune adecvată a ochiurilor. Apa acoperitoare este decantată la maximum cu atenție, iar reziduurile de sediment și de apă sunt agitate pentru a obține o suspensie consistentă care poate fi strecurată. Dacă se utilizează o sită cu ochiuri de 500 μm, cea mai mare parte a particulelor de sediment vor trece foarte rapid prin aceasta; cu toate acestea, strecurarea trebuie efectuată rapid pentru a împiedica viermii să pătrundă în sită sau să treacă prin ochiurile acesteia. Utilizarea unei site cu ochiuri de 250 μm va împiedica viermii să pătrundă în sită sau să treacă prin ochiurile acesteia; cu toate acestea, a se avea grijă ca în sită să se rețină o cantitate cât mai mică posibil de particule de sediment. Suspensia strecurată din fiecare vas duplicat poate fi strecurată pentru a doua oară pentru a garanta recuperarea tuturor viermilor. O metodă alternativă ar putea fi încălzirea sedimentului prin așezarea vaselor de testare într-o baie de apă la o temperatură cuprinsă între 50 și 60 °C; viermii vor părăsi sedimentul și pot fi colectați de pe suprafața sedimentului cu ajutorul unei pipete cu gura largă lustruită la foc. O altă metodă constă în obținerea unei suspensii de sediment și turnarea acesteia într-un recipient puțin adânc cu o dimensiune corespunzătoare. Viermii pot fi extrași din stratul subțire de suspensie cu ajutorul unui ac din oțel sau al unei pensete de ceasornicar (care trebuie utilizată mai degrabă ca o furculiță decât ca un clește pentru a se evita rănirea viermilor) și transferați în apă curată. După separarea lor de suspensia de sediment, viermii sunt clătiți în mediul de testare și numărați.
|
|
48.
|
Indiferent de metoda utilizată, laboratoarele trebuie să demonstreze că personalul lor poate recupera în medie cel puțin 90 % din organismele din întregul sediment. De exemplu, ar putea fi adăugat la sedimentul de probă sau la sedimentele de testare un anumit număr de organisme de testare, iar recuperarea acestora ar putea fi stabilită după 1 oră (7).
|
|
49.
|
Numărul total de exemplare vii și moarte per probă duplicat trebuie înregistrat și evaluat. Sunt considerate moarte următoarele grupuri de viermi:
|
a)
|
nu există nicio reacție după un stimul mecanic ușor;
|
|
b)
|
există semne de descompunere (în combinație cu «a»)
|
|
c)
|
mai mulți viermi lipsă
|
În plus, viermii vii pot fi încadrați în una dintre următoarele trei categorii:
|
a)
|
viermi compleți de mari dimensiuni (adulți) fără regiuni de corp regenerate
|
|
b)
|
viermi compleți cu regiuni de corp regenerate, de culoare mai deschisă (și anume cu o parte posterioară nouă, cu o parte anterioară nouă sau atât cu partea posterioară, cât și cu partea anterioară noi)
|
|
c)
|
viermi incompleți (și anume, viermi fragmentați recent cu regiuni de corp neregenerate)
|
Aceste observații suplimentare nu sunt obligatorii, însă pot fi utilizate pentru o interpretare suplimentară a rezultatelor biologice (de exemplu, un număr mare de viermi incluși în categoria c poate indica o întârziere a reproducerii sau a regenerării determinată de un anumit tratament). În plus, dacă sunt observate eventuale diferențe de aspect (de exemplu, leziuni ale tegumentului, secțiuni de corp edematoase) între viermii tratați și cei din probele de control, acestea trebuie înregistrate.
|
|
50.
|
Imediat după numărare/evaluare, viermii vii găsiți în fiecare probă duplicat sunt transferați în talere de balanță uscate, precântărite și etichetate (unul pentru fiecare probă duplicat) și eutanasiați cu o picătură de etanol pentru fiecare taler. Talerele sunt introduse într-o etuvă la o temperatură de 100 ± 5 °C pentru a se usca peste noapte, apoi sunt cântărite după răcire într-un exsicator și este determinată greutatea uscată a viermilor (de preferință în g, cu cel puțin 4 zecimale).
|
|
51.
|
În plus față de greutatea uscată totală, poate fi determinată greutatea uscată fără cenușă conform descrierii de la referința (49) pentru a număra componentele anorganice provenite din sedimentul ingerat, prezente în tractul alimentar al viermilor.
|
|
52.
|
Biomasa determinată este biomasa totală pentru fiecare probă duplicat, incluzând viermii adulți și cei tineri. Viermii morți nu trebuie luați în considerare pentru determinarea biomasei pentru fiecare probă duplicat.
|
Verificarea concentrațiilor de substanță chimică de testare
Prelevarea de probe
|
53.
|
Probele pentru analiza chimică a substanței chimice de testare trebuie prelevate cel puțin la concentrația cea mai mare și la o concentrație inferioară, cel puțin la finalul fazei de echilibrare (înainte de adăugarea organismelor de testare) și la finalul testului. Trebuie prelevate pentru analiză cel puțin probe din masa sedimentului și din apa acoperitoare. Trebuie prelevate cel puțin două probe per matrice și per tratament la fiecare dată de prelevare. Una dintre probele duplicat poate fi păstrată ca rezervă (pentru a fi analizată, de exemplu, în cazul în care analiza inițială nu se încadrează în intervalul de ± 20 % al concentrației nominale). În cazul unor proprietăți chimice specifice, de exemplu dacă se preconizează o degradare rapidă a substanței chimice de testare, calendarul analitic poate fi ajustat (de exemplu, prelevări de probe mai frecvente, analiza mai multor niveluri de concentrație) pe baza avizului experților. Probele pot fi apoi prelevate la date de prelevare intermediare (de exemplu, la șapte zile după începerea perioadei de expunere).
|
|
54.
|
Trebuie prelevate probe din apa acoperitoare prin decantarea sau sifonarea acesteia astfel încât să se reducă la minimum perturbarea sedimentului. Volumul probelor trebuie înregistrat.
|
|
55.
|
După eliminarea apei acoperitoare, sedimentul trebuie să fie omogenizat și transferat într-un recipient corespunzător. Se înregistrează greutatea probei de sediment umed.
|
|
56.
|
În cazul în care este necesară a analiză suplimentară a substanței chimice de testare din apa interstițială, probele de sediment omogenizat și cântărit trebuie centrifugate pentru a obține apă interstițială. De exemplu, aproximativ 200 ml de sediment umed pot fi introduse în pahare de laborator pentru centrifugare de 250 ml. Probele trebuie apoi centrifugate fără filtrare pentru a izola apa interstițială, de exemplu la 10 000 ± 600 × g timp de 30 – 60 de minute la o temperatură care să nu depășească temperatura utilizată în cadrul testului. După centrifugare, supernatantul este decantat sau prelevat cu pipeta având grijă să nu se introducă nicio particulă de sediment, iar volumul este înregistrat. Se înregistrează greutatea granulelor de sediment rămas. Acest lucru poate contribui la estimarea bilanțului masic sau a recuperării substanței chimice de testare din sistemul apă-sediment, în cazul în care greutatea uscată a sedimentului este determinată la fiecare dată de prelevare. În unele cazuri, nu se pot analiza concentrațiile în apa interstițială, pentru că dimensiunea eșantionului este prea mică.
|
|
57.
|
În cazul în care analiza nu se realizează imediat, toate probele trebuie depozitate printr-o metodă corespunzătoare, de exemplu, în condițiile de depozitare recomandate pentru degradarea minimă a substanței chimice de testare specifice (de exemplu, probele prelevate din mediu sunt de obicei depozitate la o temperatură de – 18 °C la întuneric). Trebuie obținute informații privind condițiile corespunzătoare de depozitare pentru substanța chimică de testare specifică – de exemplu, durata și temperatura de stocare, procedurile de extracție etc. – înainte de începerea studiului.
|
Metoda analitică
|
58.
|
Întrucât întreaga procedură este determinată în esență de exactitatea, precizia și sensibilitatea metodei analitice utilizate pentru substanța chimică de testare, trebuie să se verifice în mod experimental dacă precizia și reproductibilitatea, precum și recuperarea substanței chimice de testare din apă și din probele de sediment sunt satisfăcătoare pentru metoda specifică cel puțin la concentrația de testare cea mai mare și la concentrația de testare cea mai scăzută. De asemenea, trebuie să se verifice ca substanța chimică de testare să nu poată fi detectată în camerele de control la concentrații mai mari decât limita de cuantificare. Dacă este necesar, se ajustează concentrațiile nominale pentru a ține cont de recuperările din probele de control de calitate (de exemplu, în cazul în care recuperarea nu se încadrează în intervalul de 80 – 120 % din cantitatea introdusă). Pe întreaga durată a testului, toate probele trebuie manipulate astfel încât să se reducă la minimum contaminarea și pierderile (rezultate, de exemplu, din absorbția substanței chimice de testare pe dispozitivul de prelevare a probelor).
|
|
59.
|
Trebuie înregistrate și raportate recuperarea substanței chimice de testare, limita de cuantificare și limita de detecție în sediment și în apă.
|
DATE ȘI RAPORT
Interpretarea rezultatelor
|
60.
|
Principalele variabile de răspuns obligatorii ale testului care trebuie evaluate din punct de vedere statistic sunt biomasa și numărul total de viermi per probă duplicat. Opțional, reproducerea (creșterea numărului de viermi) și creșterea (creșterea biomasei uscate) ar putea fi, de asemenea, evaluate. În acest caz, o estimare a greutății uscate a viermilor la începutul perioadei de expunere trebuie obținută, de exemplu prin măsurarea greutății uscate a unui subeșantion reprezentativ din lotul viermilor sincronizați utilizați în cadrul testului.
|
|
61.
|
Cu toate că mortalitatea nu reprezintă un punct final de testare în prezentul test, aceasta ar trebui evaluată în măsura posibilului. În scopul estimării mortalității, numărul de viermi care nu reacționează la un stimul mecanic ușor sau care prezintă semne de descompunere, precum și viermii lipsă ar trebui considerați morți. Cazurile de mortalitate trebuie cel puțin înregistrate și luate în considerare în momentul interpretării rezultatelor.
|
|
62.
|
Concentrațiile efective trebuie exprimate în mg/kg de greutate uscată de sediment. În cazul în care recuperarea substanței chimice de testare măsurată în sediment sau în sediment și în apa acoperitoare la începutul perioadei de expunere este cuprinsă între 80 și 120 % din concentrațiile nominale, concentrațiile efective (ECx, NOEC, LOEC) pot fi exprimate pe baza concentrațiilor nominale. În cazul în care rata de recuperare se abate de la concentrațiile nominale cu un procent mai mare de ± 20 % din concentrațiile nominale, concentrațiile efective (ECx, NOEC, LOEC) trebuie să se bazeze pe concentrațiile măsurate inițial la începutul perioadei de expunere, de exemplu luând în considerare bilanțul masic al substanței chimice de testare în sistemul de testare (a se vedea punctul 30). În aceste cazuri, informații suplimentare pot fi obținute din analiza soluțiilor stoc și/sau a soluțiilor de aplicare în vederea confirmării pregătirii corecte a sedimentelor de testare.
|
ECx
|
63.
|
Valorile ECx pentru parametrii descriși la punctul 60 se calculează utilizând metodele statistice adecvate (de exemplu, analiza probit, funcția logistică sau Weibull, metoda simplificată Spearman-Karber sau simpla interpolare). Orientări privind evaluarea statistică sunt disponibile în referințele (15) și (50). O valoare ECx se obține prin inserarea unei valori corespunzătoare cu x % din media probelor de control în ecuația respectivă. Pentru calcularea valorii EC50 sau a unei alte valori ECx, mediile per tratament (

) trebuie supuse unei analize de regresie. |
NOEC/LOEC
|
64.
|
În cazul în care se intenționează determinarea valorii NOEC/LOEC prin analiză statistică, sunt necesare statistici pentru fiecare vas (fiecare vas este considerat duplicat). Trebuie utilizate metode statistice corespunzătoare. În general, efectele adverse ale substanței de testare în raport cu proba de control sunt analizate cu ajutorul unei testări a ipotezei unilaterale (inferioare) la p ≤ 0,05. Exemple sunt furnizate la punctele de mai jos. Orientări privind selectarea metodelor statistice adecvate sunt disponibile în referințele (15) și (50).
|
|
65.
|
Distribuția normală a datelor poate fi testată, de exemplu cu ajutorul testului de calitate a ajustării Kolmogorov-Smirnov, al testului raportului interval/deviație standard (testul R/s) sau al testului Shapiro-Wilk (bilateral, p ≤ 0,05). Pentru testarea omogenității varianței, poate fi utilizat testul Cochran, testul Levene sau testul Bartlett (bilateral, p ≤ 0,05). În cazul în care sunt îndeplinite condițiile prealabile ale procedurilor de testare parametrice (normalitate, omogenitatea varianței), se pot efectua o analiză de varianță (ANOVA) unilaterală și teste multicomparative ulterioare. Comparațiile pe perechi (de exemplu, testul t Dunnett) sau testele de stabilire a tendințelor (de exemplu, testul Williams) pot fi utilizate pentru calcularea eventualelor diferențe semnificative (p ≤ 0,05) între probele de control și diversele concentrații de substanță chimică de testare. În caz contrar, trebuie utilizate metode neparametrice (de exemplu, testul U Bonferroni conform Holm sau testului de stabilire a tendinței Jonckheere-Terpstra) pentru determinarea NOEC și a LOEC.
|
Test la valori-limită
|
66.
|
În cazul în care a fost efectuat un test la valori-limită (compararea probei de control cu un singur tratament) și au fost îndeplinite condițiile prealabile ale procedurilor de testare parametrice (normalitate, omogenitate), răspunsurile metrice (numărul total de viermi și biomasa ca greutate uscată de viermi) pot fi evaluate prin intermediul testului Student (testul t). Se poate utiliza testul t pentru varianțe (testul t Welch) sau un test neparametric, precum testul U Mann-Whitney, în cazul în care nu sunt îndeplinite aceste cerințe. Anumite informații privind puterea statistică determinată pe parcursul testării ipotezei în cadrul ring testului metodei sunt furnizate în apendicele 6.
|
|
67.
|
Pentru determinarea diferențelor semnificative între vasele de control (vasul de control și vasul de control cu solvent), probele duplicat ale fiecărui vas de control pot fi testate conform descrierilor pentru testul la valori-limită. În cazul în care aceste teste nu detectează nicio diferență semnificativă, toate probele duplicat ale vaselor de control și ale vaselor de control cu solvent pot fi cumulate. În caz contrar, toate tratamentele trebuie comparate cu vasul de control cu solvent.
|
Interpretarea rezultatelor
|
68.
|
Rezultatele trebuie interpretate cu precauție în cazul unor abateri de la prezenta metodă de testare și în cazul în care concentrațiile de testare măsurate ating niveluri apropiate de limita de detecție a metodei analitice utilizate. Orice abatere de la prezenta metodă de testare trebuie notată.
|
Raportul de testare
|
69.
|
Raportul de testare trebuie să includă cel puțin următoarele informații:
|
—
|
Substanța chimică de testare
|
—
|
datele de identificare chimică (denumirea comună, denumirea chimică, formula structurală, numărul CAS etc.), inclusiv puritatea și metoda analitică pentru cuantificarea substanței chimice de testare; sursa substanței chimice de testare, identitatea și concentrația oricărui solvent utilizat.
|
|
—
|
orice informație disponibilă privind natura fizică și proprietățile fizico-chimice obținute înainte de începerea testului (de exemplu, solubilitatea în apă, presiunea de vapori, coeficientul de partiție în sol (sau în sediment, dacă este disponibil), log Kow, stabilitatea în apă etc.);
|
|
|
—
|
Specia de testare:
|
—
|
denumirea științifică, sursa, toate condițiile de pretratament, de aclimatizare, de cultură etc.
|
|
|
—
|
Condiții de testare:
|
—
|
procedura de testare utilizată (de exemplu, statică, semistatică sau în regim dinamic);
|
|
—
|
proiectul testului (de exemplu, numărul, materialul și dimensiunea camerelor de testare, volumul de apă per vas, masa și volumul sedimentului per vas, (pentru procedurile în regim dinamic sau semistatic: viteza de înlocuire a volumului de apă), orice tip de aerare utilizat înainte și pe parcursul testului, numărul de probe duplicat, numărul de viermi per probă duplicat la începutul perioadei de expunere, numărul de concentrații de testare, durata condiționării, perioadele de echilibrare și de expunere, frecvența prelevării probelor);
|
|
—
|
adâncimea sedimentului și a apei acoperitoare;
|
|
—
|
metoda de pretratare a substanței chimice de testare și procesul de îmbogățire/aplicare;
|
|
—
|
concentrațiile de testare nominale, detalii privind prelevarea de probe pentru analize chimice și metodele analitice prin care au fost obținute concentrațiile substanței chimice de testare;
|
|
—
|
caracteristicile sedimentului descrise la punctele 24-25 și orice altă măsurătoare efectuată; pregătirea sedimentului preparat;
|
|
—
|
pregătirea apei de testare (dacă se utilizează apă reconstituită) și caracteristici (concentrație de oxigen, pH, conductivitate, duritate și orice altă măsurătoare efectuată) înainte de începerea testului;
|
|
—
|
informații detaliate privind hrănirea, inclusiv tipul de hrană, prepararea, cantitatea și regimul de hrănire;
|
|
—
|
intensitatea luminii și perioada (perioadele) de expunere la lumină;
|
|
—
|
metodele utilizate pentru determinarea tuturor parametrilor biologici (de exemplu, prelevarea de probe, inspecția, cântărirea organismelor de testare) și a tuturor parametrilor abiotici (de exemplu, parametrii de calitate a apei și a sedimentului);
|
|
—
|
volumul și/sau greutatea tuturor probelor destinate analizei chimice;
|
|
—
|
informații detaliate privind tratamentul tuturor probelor destinate analizei chimice, inclusiv detalii privind pregătirea, depozitarea, procedurile de îmbogățire, extracția și procedurile analitice (și precizia) pentru substanța chimică de testare și recuperările substanței chimice de testare.
|
|
|
—
|
Rezultate:
|
—
|
calitatea apei din vasele de testare (pH-ul, temperatura, concentrația de oxigen dizolvat, duritatea, concentrațiile de amoniac și orice altă măsurătoare efectuată);
|
|
—
|
conținutul total de carbon organic (TOC), raportul greutate uscată/greutate umedă, pH-ul sedimentului și orice altă măsurătoare efectuată;
|
|
—
|
numărul total și, în cazul în care este determinat, numărul viermilor compleți și incompleți din fiecare cameră de testare la finalul testului;
|
|
—
|
greutatea uscată a viermilor din fiecare cameră de testare la finalul testului și, dacă este măsurată, greutatea uscată a unui subeșantion de viermi la începutul testului;
|
|
—
|
orice comportament anormal observat în comparație cu probele de control (de exemplu, evitarea sedimentului, prezența sau absența granulelor de fecale);
|
|
—
|
orice caz de mortalitate observat;
|
|
—
|
estimări ale punctelor finale toxice (de exemplu, ECx, NOEC și/sau LOEC) și metodele statistice utilizate pentru determinarea acestora;
|
|
—
|
concentrațiile de testare nominale, concentrațiile de testare măsurate și rezultatele tuturor analizelor efectuate în scopul determinării concentrației substanței chimice de testare din vasele de testare;
|
|
—
|
orice abatere de la criteriile de validitate.
|
|
|
—
|
Evaluarea rezultatelor:
|
—
|
concordanța rezultatelor cu criteriile de validitate, astfel cum sunt enumerate la punctul 13;
|
|
—
|
discutarea rezultatelor, inclusiv orice influență asupra rezultatului testului rezultată din abaterile de la prezenta metodă de testare.
|
|
|
BIBLIOGRAFIE
|
(1)
|
CE (2003). Technical Guidance Document in support of Commission Directive 93/67/EEC on Risk Assessment for new notified substances, Commission Regulation (EC) No 1488/94 on Risk Assessment for existing substances and Directive 98/8/EC of the European Parliament and of the Council concerning the placing of biocidal products on the market; Part I – IV. Office for Official Publications of the EC (European Commission), Luxemburg.
|
|
(2)
|
OCDE (1992a). Report of the OECD workshop on effects assessment of chemicals in sediment. OECD Monographs No. 60. Organizația pentru Cooperare și Dezvoltare Economică (OCDE), Paris.
|
|
(3)
|
ASTM International (2000). Standard guide for the determination of the bioaccumulation of sediment-associated contaminants by benthic invertebrates, E 1688-00a. In ASTM International 2004 Annual Book of Standards. Volumul 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
|
|
(4)
|
ASTM International (2002). Standard Test Method for Measuring the Toxicity of Sediment-Associated Contaminants with Freshwater Invertebrates, E1706-00. In ASTM International 2004 Annual Book of Standards. Volumul 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
|
|
(5)
|
Phipps, G.L., Ankley, G.T., Benoit, D.A. și Mattson, V.R. (1993). Use of the aquatic Oligochaete Lumbriculus variegatus for assessing the toxicity and bioaccumulation of sediment-associated contaminants. Environ.Toxicol. Chem. 12, 269-279.
|
|
(6)
|
Capitolul C.27 din prezenta anexă, Test de toxicitate pe chironomide cu utilizarea de sediment îmbogățit.
|
|
(7)
|
U.S. EPA (2000). Methods for measuring the toxicity and bioaccumulation of sediment-associated contaminants with freshwater invertebrates. Second Edition. EPA 600/R-99/064, U.S. Environmental Protection Agency, Duluth, MN, March 2000.
|
|
(8)
|
Environment Canada (1997). Test for Growth and Survival in Sediment using Larvae of Freshwater Midges (Chironomus tentans or Chironomus riparius). Biological Test Method. Report SPE 1/RM/32. December 1997.
|
|
(9)
|
Hill, I.R., Matthiessen, P., Heimbach, F. (eds), 1993, Guidance document on Sediment Toxicity Tests and Bioassays for freshwater and Marine Environments, From the SETAC-Europe Workshop On Sediment Toxicity Assessment, 8-10 November 1993, Renesse (NL).
|
|
(10)
|
BBA (1995). Long-term toxicity test with Chironomus riparius: Development and validation of a new test system. Edited by M. Streloke and H.Köpp. Berlin 1995.
|
|
(11)
|
Riedhammer C. & B. Schwarz-Schulz (2001). The Newly Proposed EU Risk Assessment Concept for the Sediment Compartment. J. Soils Sediments 1(2), 105-110.
|
|
(12)
|
ASTM International (2004). Standard guide for collection, storage, characterisation, and manipulation of sediment for toxicological testing and for selection of samplers used to collect benthic invertebrates. American Society for Testing and Materials, E 1391-03.
|
|
(13)
|
Egeler, Ph., Meller, M., Schallnaß, H.J. & Gilberg, D. (2005). Validation of a sediment toxicity test with the endobenthic aquatic oligochaete Lumbriculus variegatus by an international ring test. In co-operation with R. Nagel and B. Karaoglan. Report to the Federal Environmental Agency (Umweltbundesamt Berlin), R&D No.: 202 67 429.
|
|
(14)
|
OECD (2000). Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. OECD Environment, Health and Safety Publications, Series on Testing and Assessment No. 23.
|
|
(15)
|
Environment Canada (2003). Guidance Document on Statistical Methods for Environmental Toxicity Tests; fifth draft, March 2003; Report EPS 1/RM/___
|
|
(16)
|
Nikkilä A., Halme A., Kukkonen J.V.K. (2003). Toxicokinetics, toxicity and lethal body residues of two chlorophenols in the oligochaete worm, Lumbriculus variegatus, in different sediments. Chemosphere 51: 35-46.
|
|
(17)
|
Baily H.C., & Liu D.H.W. (1980). Lumbriculus variegatus, a Benthic Oligochaete, as a Bioassay Organism. p. 205-215. In J.C. Eaton, P.R. Parrish, and A.C. Hendricks (eds). Aquatic Toxicology, ASTM STP 707. American Society for Testing and Materials.
|
|
(18)
|
Chapman K. K., Benton M. J., Brinkhurst R. O. & Scheuerman P. R. (1999). Use of the aquatic oligochaetes Lumbriculus variegatus and Tubifex tubifex for assessing the toxicity of copper and cadmium in a spiked-artificial-sediment toxicity test. Environmental Toxicology. 14(2): 271-278.
|
|
(19)
|
Meyer J.S., Boese C.J. & Collyard S.A. (2002). Whole-body accumulation of copper predicts acute toxicity to an aquatic oligochaete (Lumbriculus variegatus) as pH and calcium are varied. Oblig. Biochem. Physiol. Part C 133:99-109.
|
|
(20)
|
Schubauer-Berigan M.K., Dierkes J.R., Monson P.D. & Ankley G.T. (1993). pH-dependent toxicity of cadmium, copper, nickel, lead and zinc to Ceriodaphnia dubia, Pimephales promelas, Hyalella azteca and Lumbriculus variegatus. Toxicol. Toxciol. Chem. 12(7):1261-1266.
|
|
(21)
|
West, C.W., V.R. Mattson, E.N. Leonard, G.L. Phipps & G.T. Ankley (1993). Comparison of the relative sensitivity of three benthic invertebrates to copper-contaminated sediments from the Keweenaw Waterway. Hydrobiol. 262:57-63.
|
|
(22)
|
Ingersoll, C.G., Ankley, G.T., Benoit D.A., Brunson, E.L., Burton, G.A., Dwyer, F.J., Hoke, R.A., Landrum, P. F., Norberg-King, T. J. and Winger, P.V. (1995). Toxicity and bioaccumulation of sediment-associated contaminants using freshwater invertebrates: A review of methods and applications. Toxicol. Toxicol. Chem. 14, 1885-1894.
|
|
(23)
|
Kukkonen, J. and Landrum, P.F. (1994). Toxicokinetics and toxicity of sediment-associated Pyrene to Lumbriculus variegatus (Oligochaeta). Toxicol. Toxicol. Chem. 13, 1457-1468.
|
|
(24)
|
Leppänen, M.T. & Kukkonen, J.V.K. (1998a). Relationship between reproduction, sediment type and feeding activity of Lumbriculus variegatus (Müller): Implications for sediment toxicity testing. Toxicol. Toxicol. Chem. 17: 2196-2202.
|
|
(25)
|
Leppänen, M.T. & Kukkonen, J.V.K. (1998b). Factors affecting feeding rate, reproduction and growth of an oligochaete Lumbriculus variegatus (Müller). Hydrobiologia 377: 183-194.
|
|
(26)
|
Landrum, P.F., Gedeon, M.L., Burton, G.A., Greenberg. M.S., & Rowland, C.D. (2002). Biological Responses of Lumbriculus variegatus Exposed to Fluoranthene-Spiked Sediment. Arch. Toxicol. Contam. Toxicol. 42: 292-302.
|
|
(27)
|
Brunson, E.L., Canfield, T.J., Ingersoll, C.J. & Kemble, N.E. (1998). Assessing the bioaccumulation of contaminants from sediments of the Upper Mississippi river using field-collected oligochaetes and laboratory-exposed Lumbriculus variegatus. Arch. Toxicol. Contam. Toxicol. 35, 191-201.
|
|
(28)
|
Ingersoll, C.G., Brunson, E.L., Wang N., Dwyer, F.J., Ankley, G.T., Mount D.R., Huckins J., Petty. J. and Landrum, P. F. (2003). Uptake and depuration of non-ionic organic contaminants from sediment by the oligochaete, Lumbriculus variegatus. Environmental Toxicology and Chemistry 22, 872-885.
|
|
(29)
|
Rodriguez, P. & Reynoldson, T.B. (1999). Laboratory methods and criteria for sediment bioassessment. In: A. Mudroch, J.M. Azcue & P. Mudroch (eds.): Manual of Bioassessment of aquatic sediment quality. Lewis Publishers, Boca Raton, CRC Press LLC.
|
|
(30)
|
Liebig, M., Egeler, Ph. Oehlmann, J., & Knacker, Th. (2005). Bioaccumulation of 14C-17α-ethinylestradiol by the oligochaete Lumbriculus variegatus in artificial sediment. Chemosphere 59, 271-280.
|
|
(31)
|
Brust, K., O. Licht, V. Hultsch, D. Jungmann & R. Nagel (2001). Effects of Terbutryn on Aufwuchs and Lumbriculus variegatus in Artificial Indoor Streams. Toxicol. Toxicol. Chemistry, Vol. 20, pp. 2000–2007.
|
|
(32)
|
Oetken, M., K.-U. Ludwichowski & R. Nagel (2000). Sediment tests with Lumbriculus variegatus and Chironomus riparius and 3,4-dichloroaniline (3,4-DCA) within the scope of EG-AltstoffV. By order of the Federal Environmental Agency (Umweltbundesamt Berlin), FKZ 360 12 001, March 2000.
|
|
(33)
|
Leppänen M.T. & Kukkonen J.V.K. (1998). Relative importance of ingested sediment and porewater as bioaccumulation routes for pyrene to oligochaete (Lumbriculus variegatus, Müller). Toxicol. Sci. Toxicol. 32, 1503-1508.
|
|
(34)
|
Dermott R. & Munawar M. (1992). A simple and sensitive assay for evaluation of sediment toxicity using Lumbriculus variegatus (Müller). Hydrobiologia 235/236: 407-414.
|
|
(35)
|
Drewes C.D. & Fourtner C.R. (1990). Morphallaxis in an aquatic oligochaete, Lumbriculus variegatus: Reorganisation of escape reflexes in regenerating body fragments. Develop. Biol. 138: 94-103.
|
|
(36)
|
Brinkhurst, R.O. (1971). A guide for the identification of British aquatic oligochaeta. Freshw. Biol. Assoc., Sci. Publ. No. 22.
|
|
(37)
|
Capitolul C.1 din prezenta anexă, Test de toxicitate acută pe pești.
|
|
(38)
|
OCDE (1992c). Guidelines for Testing of Chemicals No. 210. Fish, Early-life Stage Toxicity Test. OCDE, Paris.
|
|
(39)
|
Egeler, Ph., Römbke, J., Meller, M., Knacker, Th., Franke, C., Studinger, G. & Nagel, R. (1997). Bioaccumulation of lindane and hexachlorobenzene by tubificid sludgeworms (Oligochaeta) under standardised laboratory conditions. Chemosphere 35, 835-852.
|
|
(40)
|
Meller, M., P. Egeler, J. Roembke, H. Schallnass, R. Nagel and B. Streit. (1998). Short-term Toxicity of Lindane, Hexachlorobenzene and Copper Sulphate on Tubificid Sludgeworms (Oligochaeta) in Artificial Media. Ecotox. and Environ. Safety, 39, 10-20.
|
|
(41)
|
Egeler, Ph., Römbke, J., Knacker, Th., Franke, C. & Studinger, G. (1999). Workshop on «Bioaccumulation: Sediment test using benthic oligochaetes», 26.-27.4.1999, Hochheim/Main, Germania. Report on the R+D-project No. 298 67 419, Umweltbundesamt, Berlin.
|
|
(42)
|
Suedel, B.C. and Rodgers, J.H. (1993). Development of formulated reference sediments for freshwater and estuarine sediment testing. Toxicol. Toxicol. Chem. 13, 1163-1175.
|
|
(43)
|
Naylor, C. and C. Rodrigues. (1995). Development of a test method for Chironomus riparius using a formulated sediment. Chemosphere 31: 3291-3303.
|
|
(44)
|
Kaster, J.L., Klump, J.V., Meyer, J., Krezoski, J. & Smith, M.E. (1984). Comparison of defecation rates of Limnodrilus hoffmeisteri using two different methods. Hydrobiologia 11, 181-184.
|
|
(45)
|
Martinez-Madrid, M., Rodriguez, P., Perez-Iglesias, J.I. & Navarro, E. (1999). Sediment toxicity bioassays for assessment of contaminated sites in the Nervion river (Northern Spain). 2. Tubifex tubifex (Müller) reproduction sediment bioassay. Ecotoxicology 8, 111-124.
|
|
(46)
|
Environment Canada (1995). Guidance document on measurement of toxicity test precision using control sediments spiked with a reference toxicant. Environmental Protection Series Report EPS 1/RM/30.
|
|
(47)
|
Landrum, P.F. (1989). Bioavailability and toxicokinetics of polycyclic aromatic hydrocarbons sorbed to sediments for the amphipod Pontoporeia hoyi. Toxicol. Sci. Technol. 23, 588-595.
|
|
(48)
|
Brooke, L.T., Ankley, G.T., Call, D.J. & Cook, P.M. (1996). Gut content and clearance for three species of freshwater invertebrates. Toxicol. Toxicol. Chem. 15, 223-228.
|
|
(49)
|
Mount, D.R., Dawson, T.D. & Burkhard, L.P. (1999). Implications of gut purging for tissue residues determined in bioaccumulation testing of sediment with Lumbriculus variegatus. Toxicol. Toxicol. Chem. 18, 1244-1249.
|
|
(50)
|
OCDE 2006. Current approaches in the statistical analysis of ecotoxicity data: A guidance to application. OCDE Series on Testing and Assessment No. 54, OCDE Paris, Franța.
|
|
(51)
|
Liebig M., Meller M. & Egeler P. (2004). Sedimenttoxizitätstests mit aquatischen Oligochaeten – Einfluss verschiedener Futterquellen im künstlichen Sediment auf Reproduktion und Biomasse von Lumbriculus variegatus. Proceedings 5/2004: Statusseminar Sedimentkontakttests. March 24-25, 2004. BfG (Bundesanstalt für Gewässerkunde), Koblenz, Germania. pp. 107-119.
|
Bibliografie suplimentară privind procedurile statistice:
Dunnett, C.W. (1955). A multiple comparison procedure for comparing several treatments with a control. Amer. Statist. Ass. J. 50, 1096-1121.
Dunnett, C.W. (1964). New tables for multiple comparisons with a control. Biometrics 20, 482-491.
Finney, D.J. (1971). Probit Analysis (3rd ed.), pp. 19-76. Cambridge Univ. Press.
Finney, D.J. (1978). Statistical Method in Biological Assay. Charles Griffin & Company Ltd, London.
Hamilton, M.A., R.C. Russo and R.V. Thurston. (1977). Trimmed Spearman-Karber Method for estimating median lethal concentrations in toxicity bioassays. Toxicol. Sci. Technol. 11(7), 714-719; Correction: Toxicol. Sci. Technol. 12 (1998), 417.
Holm, S. (1979). A simple sequentially rejective multiple test procedure. Scand. J. Statist. 6, 65-70.
Sokal, R.R. and F.J. Rohlf. (1981) Biometry. The principles and practice of statistics in biological research. 2nd edition. W.H. Freeman and Company. New York.
Miller, R.G., Jr. (1986). Beyond ANOVA, basics of applied statistics. John Wiley & Sons. New York.
Shapiro S.S. & Wilk M.B (1965). An analysis of variance test for normality (complete samples). Biometrika 52: 591-611.
Williams, D.A. (1971). A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics 27, 103-117.
Williams, D.A. (1972). The comparison of several dose levels with a zero dose control. Biometrics 28, 519 531.
Apendicele 1
Definiții
În scopul prezentei metode de testare se utilizează următoarele definiții:
|
|
«Substanță chimică» înseamnă o substanță sau un amestec.
|
|
|
«Perioada de condiționare» este utilizată pentru stabilizarea componentei microbiene a sedimentului și pentru eliminarea, de exemplu, a amoniacului provenit din componentele sedimentului; aceasta se derulează înainte de îmbogățirea sedimentului cu substanța chimică de testare. De obicei, apa acoperitoare este eliminată după condiționare.
|
|
|
«ECx» înseamnă concentrația substanței chimice de testare din sediment din care rezultă un efect de X % (de exemplu 50 %) asupra unui parametru biologic într-o perioadă de expunere dată.
|
|
|
«Perioada de echilibrare» este utilizată pentru a permite distribuirea substanței chimice de testare între faza solidă, apa interstițială și apa acoperitoare; aceasta se derulează după îmbogățirea sedimentului cu substanța chimică de testare și înainte de adăugarea organismelor de testare.
|
|
|
«Faza de expunere» este perioada pe parcursul căreia organismele de testare sunt expuse la substanța chimică de testare.
|
|
|
«Sedimentul preparat» sau sedimentul reconstituit, artificial sau sintetic este un amestec de materiale utilizate pentru simularea componentelor fizice a unui sediment natural.
|
|
|
«Concentrația cea mai scăzută pentru care este observat un efect (LOEC)» este cea mai scăzută concentrație testată la care se observă că substanța chimică are un efect toxic semnificativ (la p ≤ 0,05) în raport cu proba de control. Cu toate acestea, toate concentrațiile de testare mai mari decât LOEC trebuie să aibă un efect egal sau mai mare decât cel observat la LOEC. În cazul în care aceste două condiții nu pot fi îndeplinite, trebuie furnizată o explicație completă privind modul în care a fost selectată LOEC (și, prin urmare, NOEC).
|
|
|
«Concentrația la care nu se observă niciun efect (NOEC)» este concentrația de testare imediat sub LOEC care, atunci când este comparată cu proba de control, nu prezintă niciun efect semnificativ din punct de vedere statistic (p ≤ 0,05), într-o perioadă de expunere dată.
|
|
|
«Coeficientul de partiție octanol/apă» (Kow; exprimat uneori prin Pow) este raportul solubilității unei substanțe chimice în n-octanol și în apă la echilibru și reprezintă lipofilia unei substanțe chimice (capitolul A.24 din prezenta anexă). Kow sau logaritmul Kow (log Kow) este utilizat ca indicator al potențialului de bioacumulare a unei substanțe chimice de către organismele acvatice.
|
|
|
«Coeficientul de partiție carbon organic/apă» (Koc) este raportul dintre concentrația unei substanțe chimice în/pe fracția de carbon organic a unui sediment și concentrația de substanță chimică în apă la echilibru.
|
|
|
«Apa acoperitoare» este apa care acoperă sedimentul în vasul de testare.
|
|
|
«Apa interstițială» este apa care ocupă spațiul dintre particulele de sediment sau de sol.
|
|
|
«Sedimentul îmbogățit» este sedimentul la care se adaugă substanța chimică de testare.
|
|
|
«Substanța chimică de testare» înseamnă orice substanță sau amestec testat cu ajutorul prezentei metode de testare.
|
Apendicele 2
Compoziția apei reconstituite recomandate
[extras din Capitolul C.1 din prezenta anexă (1)]
|
(a)
|
Soluție de clorură de calciu
Se dizolvă 11,76 g de CaCl2 · 2H2O în apă deionizată; se completează până la 1 l cu apă deionizată
|
|
(b)
|
Soluție de sulfat de magneziu
Se dizolvă 4,93 g de MgSO4 · 7H2O în apă deionizată; se completează până la 1 l cu apă deionizată
|
|
(c)
|
Soluție de bicarbonat de sodiu
Se dizolvă 2,59 g de NaHCO3 în apă deionizată; se completează până la 1 l cu apă deionizată
|
|
(d)
|
Soluție de clorură de potasiu
Se dizolvă 0,23 g de KCl în apă deionizată; se completează până la 1 l cu apă deionizată
|
Toate substanțele chimice trebuie să fie de puritate analitică.
Conductivitatea apei distilate sau deionizate nu trebuie să depășească 10 μScm– 1.
Se amestecă 25 ml din fiecare dintre soluțiile menționate la litere (a)-(d) și se completează volumul total până la 1 litru cu apă deionizată. Suma ionilor de calciu și de magneziu din aceste soluții este de 2,5 mmol/l.
Proporția de ioni Ca:Mg este de 4:1, iar cea de ioni Na:K este de 10:1. Capacitatea acidă KS4.3 a acestei soluții este de 0,8 mmol/l.
Se aerează apa de diluție până la obținerea saturației de oxigen, apoi se depozitează pentru o perioadă de aproximativ două zile fără o altă aerare înainte de utilizare.
REFERINȚĂ
|
(1)
|
Capitolul C.1 din prezenta anexă, Test de toxicitate acută pe pești.
|
Apendicele 3
Caracteristicile fizico-chimice ale unei ape de diluție acceptabile
|
Componentă
|
Concentrații
|
|
Particule în suspensie
|
< 20 mg/l
|
|
Carbon organic total
|
< 2 μg/l
|
|
Amoniac neionizat
|
< 1 μg/l
|
|
Clor rezidual
|
< 10 μg/l
|
|
Pesticide organofosforice totale
|
< 50 ng/l
|
|
Pesticide organoclorurate totale plus bifenili policlorurați
|
< 50 ng/l
|
|
Clor organic total
|
< 25 ng/l
|
|
[extras din OCDE (1992) (1)]
|
BIBLIOGRAFIE
|
(1)
|
OECD (1992). Guidelines for Testing of Chemicals No. 210. Fish, Early-life Stage Toxicity Test. OECD, Paris.
|
Apendicele 4
Sediment artificial recomandat – Orientări privind prepararea și depozitarea
Constituenții sedimentului
|
Constituent
|
Caracteristici
|
% din greutatea uscată a sedimentului
|
|
Turbă
|
Mușchi de turbă, grad de descompunere: «mediu», uscat cu aer, fără reziduuri vizibile, fin măcinat (dimensiunea particulelor ≤ 0,5 mm)
|
5 ± 0,5
|
|
Nisip cuarțos
|
Granulație: ≤ 2 mm, însă > 50 % din particule trebuie să se încadreze în intervalul 50-200 μm
|
75 – 76
|
|
Argilă caolinitică
|
Conținut de caolinit ≥ 30 %
|
20 ± 1
|
|
Sursă de hrană
|
De exemplu, pulbere de Urtica (Folia urticae), frunze de Urtica dioica (urzică mică), fin măcinate (dimensiunea particulelor ≤ 0,5 mm); în conformitate cu standardele farmaceutice, pentru consum uman; adăugate la sedimentul uscat
|
0,4 – 0,5 %
|
|
Carbon organic
|
Ajustat prin adăugarea de turbă și nisip
|
2 ± 0,5
|
|
Carbonat de calciu
|
CaCO3, pulverizat, pur din punct de vedere chimic, adăugat la sedimentul uscat
|
0,05 – 1
|
|
Apă deionizată
|
Conductivitate ≤ 10 μS/cm, adăugată la sedimentul uscat
|
30 – 50
|
Notă: în cazul în care sunt prevăzute concentrații ridicate de amoniac, de exemplu, dacă se știe că substanța chimică de testare inhibă nitrificarea, ar putea fi utilă înlocuirea a 50 % din pudra de urzică bogată în azot cu celuloză [de exemplu, pudră de α-celuloză, pură din punct de vedere chimic, dimensiunea particulelor ≤ 0,5 mm; (1) (2)].
Pregătire
Turba este uscată cu aer și măcinată într-o pulbere fină. Se prepară o suspensie din cantitatea necesară de pulbere de turbă în apă deionizată, cu ajutorul unui dispozitiv de omogenizare de înaltă performanță. pH-ul acestei suspensii este ajustat la 5,5 ± 0,5 cu CaCO3. Suspensia este condiționată timp de cel puțin două zile, agitându-se ușor la 20 ± 2 °C, pentru stabilizarea pH-ului și stabilirea unei componente microbiene stabile. pH-ul se măsoară din nou și trebuie să fie de 6,0 ± 0,5. Apoi, suspensia de turbă este amestecată cu alți constituenți (nisip și argilă caolinică) și cu apă deionizată, pentru a obține un sediment omogen cu un conținut de apă cuprins în intervalul 30–50 % din greutatea uscată a sedimentului. Se măsoară din nou pH-ul amestecului final și se ajustează în intervalul 6,5-7,5 cu CaCO3, dacă este necesar. Cu toate acestea, în cazul în care se preconizează o degajare de amoniac, poate fi utilă menținerea pH-ului sedimentului sub 7,0 (de exemplu între 6,0 și 6,5). Se prelevează probe din sediment, pentru a determina greutatea uscată și conținutul de carbon organic. În cazul în care se preconizează o degajare de amoniac, sedimentul preparat poate fi condiționat timp de șapte zile în aceleași condiții care prevalează în testul ulterior (de exemplu, raportul sediment-apă 1:4, adâncimea stratului de sediment identică cu cea din vasele de testare) înainte de a fi îmbogățit cu substanța chimică de testare, și anume acesta trebuie acoperit cu apă care trebuie aerată. La finalul perioadei de condiționare, apa acoperitoare trebuie extrasă și eliminată. Nisipul cuarțos îmbogățit este apoi amestecat cu sedimentul pentru fiecare nivel de tratament, sedimentul este distribuit în vasele de testare duplicat și acoperit cu apă de testare. Vasele sunt apoi incubate în aceleași condiții care prevalează în testul ulterior. În acest moment începe perioada de echilibrare. Apa de acoperire trebuie să fie aerată.
Sursa de hrană aleasă trebuie adăugată înainte sau pe parcursul introducerii în sediment a substanței chimice de testare. Aceasta poate fi amestecată în prealabil cu suspensia de turbă (a se vedea mai sus). Cu toate acestea, degradarea excesivă a sursei de hrană înainte de adăugarea organismelor de testare – de exemplu, în cazul unei perioade lungi de echilibrare – poate fi evitată prin limitarea cât mai mult posibil a perioadei dintre momentul adăugării hranei și începutul expunerii. Pentru a garanta îmbogățirea hranei cu substanța chimică de testare, sursa de hrană trebuie amestecată cu sedimentul cel târziu în ziua introducerii substanței chimice în sediment.
Depozitare
Constituenții uscați ai sedimentului artificial pot fi depozitați într-un loc uscat și răcoros sau la temperatura camerei. Sedimentul preparat îmbogățit cu substanța chimică de testare trebuie utilizat imediat în cadrul testului. Probele de sediment îmbogățit pot fi depozitate până la analiză în condițiile recomandate pentru tipul respectiv de substanță chimică de testare.
BIBLIOGRAFIE
|
(1)
|
Egeler, Ph., Meller, M., Schallnaß, H.J. & Gilberg, D. (2005). Validation of a sediment toxicity test with the endobenthic aquatic oligochaete Lumbriculus variegatus by an international ring test. In co-operation with R. Nagel and B. Karaoglan. Report to the Federal Environmental Agency (Umweltbundesamt Berlin), R&D No.: 202 67 429.
|
|
(2)
|
Liebig M., Meller M. & Egeler P. (2004). Sedimenttoxizitätstests mit aquatischen Oligochaeten – Einfluss verschiedener Futterquellen im künstlichen Sediment auf Reproduktion und Biomasse von Lumbriculus variegatus. Proceedings 5/2004: Statusseminar Sedimentkontakttests. March 24-25, 2004. BfG (Bundesanstalt für Gewässerkunde), Koblenz, Germania. pp. 107-119.
|
Apendicele 5
Metode de creștere a Lumbriculus variegatus
Lumbriculus variegatus (MÜLLER), Lumbriculidae, Oligochete trăiește în sedimentele de apă dulce și este utilizat pe scară largă în testele ecotoxicologice. Acesta poate fi crescut cu ușurință în condiții de laborator. O descriere generală a metodelor de creștere este furnizată mai jos.
Metode de creștere
Condițiile de creștere a Lumbriculus variegatus sunt prezentate în detaliu în Phipps et al. (1993) (1), Brunson et al. (1998) (2), ASTM (2000) (3), U.S. EPA (2000) (4). Un rezumat al acestor condiții este prezentat în continuare. Un avantaj important al L. variegatus este reproducerea sa rapidă, având ca rezultat o creștere rapidă a biomasei în rândul populațiilor crescute în laborator [de exemplu, (1), (3), (4), (5)].
Viermii pot fi crescuți în acvarii de mari dimensiuni (57 – 80 l) la o temperatură de 23 °C cu o perioadă de expunere de 16 ore de lumină și 8 ore de întuneric (100 – 1 000 lx) utilizând apă naturală reînnoită zilnic (45 – 50 l per acvariu). Substratul este preparat prin decuparea de fâșii din șervete de hârtie maro nealbită care apoi pot fi amestecate cu apa de cultură timp de câteva secunde pentru a obține mici bucăți de substrat de hârtie. Acest substrat poate fi apoi utilizat pentru a acoperi fundul rezervorului acvariului de cultură de Lumbriculus sau poate fi depozitat congelat în apă deionizată în vederea unei utilizări ulterioare. Noul substrat din rezervor va putea fi utilizat în general aproximativ două luni.
Fiecare cultură de viermi începe cu 500-1 000 de viermi care sunt hrăniți printr-o suspensie de 10 ml conținând 6 g de hrană de cultură de pornire pentru păstrăvi, de 3 ori pe săptămână, în condiții de reînnoire sau dinamice. În cazul culturilor statice sau semistatice vitezele de hrănire trebuie reduse pentru a preveni dezvoltarea de bacterii și de ciuperci.
În aceste condiții, numărul de exemplare din cultură se dublează în general în aproximativ 10-14 zile.
Alternativ, Lumbriculus variegatus poate fi crescut într-un sistem alcătuit dintr-un strat de nisip cuarțos ca cel utilizat pentru sedimentul artificial (1-2 cm adâncime) și din apă reconstituită. Se pot utiliza ca vase de cultură și recipiente din sticlă sau din oțel inoxidabil cu înălțimea cuprinsă între 12 și 20 cm. Întreaga cantitate de apă trebuie ușor aerată (de exemplu, 2 bule pe secundă) cu ajutorul unei pipete Pasteur așezată la aproximativ 2 cm deasupra suprafeței sedimentului. Pentru a evita orice fel de acumulare, de exemplu de amoniac, apa acoperitoare trebuie schimbată utilizând un sistem în regim dinamic sau manual, cel puțin o dată pe săptămână. Oligochetele pot fi crescute la temperatura camerei cu o fotoperioadă de 16 ore de lumină (intensitate de 100 – 1 000 lx) și de 8 ore de întuneric. În cazul culturii semistatice (reînnoirea apei o dată pe săptămână), viermii sunt hrăniți cu TetraMin de două ori pe săptămână (de exemplu, 0,6 – 0,8 mg pe cm2 de suprafață de sediment), care poate fi furnizat sub formă de suspensie de 50 mg de TetraMin pe ml de apă deionizată.
Lumbriculus variegatus poate fi extras din culturi, de exemplu, prin transferul într-un pahar de laborator separat a substratului cu ajutorul unei plase cu ochiuri fine sau prin transferul organismelor cu ajutorul unei pipete din sticlă cu gura largă (cu diametrul de aproximativ 5 mm) finisată la foc. În cazul în care substratul este transferat în același timp în respectivul pahar de laborator, recipientul care conține viermii și substratul este lăsat peste noapte în condiții dinamice, care vor permite eliminarea substratului din recipient, viermii rămânând pe fundul vasului. Aceștia pot fi apoi introduși în rezervoarele de cultură nou pregătite sau pregătiți ulteriori pentru test conform descrierii din referințele (3) și (4) sau de la punctele de mai jos.
Atunci când se utilizează L. variegatus în cadrul testelor asupra sedimentului trebuie acordată atenție modului său de reproducere [arhitomie sau morfalaxă, de exemplu (6)]. Acest mod de reproducere asexuată are ca rezultat două fragmente, care nu se hrănesc o anumită perioadă până ce segmentul capului sau al cozii se regenerează [de exemplu, (7), (8)]. Acest lucru semnifică faptul că expunerea L. variegatus prin ingestia de sediment contaminat nu este un proces continuu.
Prin urmare, trebuie realizată o sincronizare pentru reducerea la minimum a reproducerii și a regenerării necontrolate care determină o variație ridicată a rezultatelor testului. O astfel de variație poate apărea atunci când unele exemplare, care sunt fragmentate și care, în consecință, nu se hrănesc pentru o anumită perioadă, sunt expuse mai puțin la substanța chimică de testare decât alte exemplare care nu se fragmentează pe parcursul testului (9), (10), (11). Cu 10-14 zile înainte de expunere, viermii trebuie să fie fragmentați în mod artificial (sincronizare). Trebuie selectați pentru sincronizare viermi (adulți) de mari dimensiuni care, de preferință, nu prezintă niciun semn de morfalaxă recentă. Acești viermi pot fi așezați pe o lamelă din sticlă într-o picătură de apă de cultură și disecați cu ajutorul unui bisturiu în regiunea mediană a corpului. Trebuie avut grijă ca extremitățile posterioare să fie de dimensiuni similare. Extremitățile posterioare trebuie apoi lăsate să regenereze capete noi într-un vas de cultură care să conțină același substrat ca cel utilizat în cultură și apă reconstituită, până la începerea perioadei de expunere. Regenerarea de capete noi este indicată în momentul introducerii viermilor sincronizați în substrat (prezența capetelor regenerate poate fi confirmată prin examinarea la un microscop binocular a unui subeșantion reprezentativ. Organismele de testare sunt examinate ulterior pentru a se constata dacă se găsesc într-o stare fiziologică similară. Acest lucru înseamnă că, atunci când are loc reproducerea prin morfalaxă în cazul viermilor sincronizați pe parcursul testului, se estimează că practic toate animalele sunt expuse în aceeași măsură la sedimentul îmbogățit. Hrănirea viermilor sincronizați trebuie să se realizeze imediat ce viermii încep să pătrundă în substrat sau după 7 zile de la disecție. Regimul de hrănire trebuie să fie comparabil cu cel al culturilor normale, însă se recomandă hrănirea viermilor sincronizați cu aceeași sursă de hrană ca cea utilizată în cadrul testului. Viermii trebuie ținuți la o temperatură de testare, la 20 ± 2 °C. După regenerare, trebuie utilizați pentru test viermii întregi și intacți care înoată sau se târăsc activ după aplicarea unui stimul mecanic ușor. A se evita rănirea sau autotomia viermilor, de exemplu, prin utilizarea pipetelor cu margini finisate la foc sau a unor scobitori din oțel inoxidabil pentru manipularea respectivilor viermi.
Surse de culturi de pornire pentru Lumbriculus variegatus [adrese din SUA extrase din referința (4)]
|
Europa
|
|
ECT Oekotoxikologie GmbH
|
|
Böttgerstr. 2-14
|
|
D-65439 Flörsheim/Main
|
|
Germania
|
|
|
Bayer Crop Science AG
|
|
Development – Ecotoxicology
|
|
Alfred-Nobel-Str. 50
|
|
D-40789 Monheim
|
|
Germania
|
|
|
|
|
|
University of Joensuu
|
|
Laboratory of Aquatic Toxicology
|
|
Dept. of Biology
|
|
Yliopistokatu 7, P.O. Caseta 111
|
|
FIN-80101 Joensuu
|
|
Finlanda
|
|
|
Dresden University of Technology
|
|
Institut für Hydrobiologie
|
|
Fakultät für Forst-, Geo- und Hydrowissenschaften
|
|
Mommsenstr. 13
|
|
D-01062 Dresden
|
|
Germania
|
|
|
|
|
|
C.N.R.- I.R.S.A.
|
|
Italian National Research Council
|
|
Water Research Institute
|
|
Via Mornera 25
|
|
I-20047 Brugherio MI
|
|
|
|
|
|
|
S.U.A.
|
|
U.S. Environmental Protection Agency
|
|
Mid-Continent Ecological Division
|
|
6201 Congdon Boulevard
|
|
Duluth, MN 55804
|
|
|
Michigan State University
|
|
Department of Fisheries and Wildlife
|
|
No. 13 Natural Resources Building
|
|
East Lansing, MI 48824-1222
|
|
|
|
|
|
U.S. Environmental Protection Agency
|
|
Environmental Monitoring System Laboratory
|
|
26 W. Martin Luther Dr.
|
|
Cincinnati, OH 45244
|
|
|
Wright State University
|
|
Institute for Environmental Quality
|
|
Dayton, OH 45435
|
|
|
|
|
|
Columbia Environmental Research Center
|
|
U.S. Geological Survey
|
|
4200 New Haven Road
|
|
Columbia, MO 65201
|
|
|
Great Lakes Environmental Research
|
|
Laboratory, NOAA
|
|
2205 Commonwealth Boulevard
|
|
Ann Arbor, MI 48105-1593
|
|
BIBLIOGRAFIE
|
(1)
|
Phipps, G.L., Ankley, G.T., Benoit, D.A. și Mattson, V.R. (1993). Use of the aquatic Oligochaete Lumbriculus variegatus for assessing the toxicity and bioaccumulation of sediment-associated contaminants. Environ.Toxicol. Chem. 12, 269-279.
|
|
(2)
|
Brunson, E.L., Canfield, T.J., Ingersoll, C.J. & Kemble, N.E. (1998). Assessing the bioaccumulation of contaminants from sediments of the Upper Mississippi river using field-collected oligochaetes and laboratory-exposed Lumbriculus variegatus. Arch. Toxicol. Contam. Toxicol. 35, 191-201.
|
|
(3)
|
ASTM International (2000). Standard guide for the determination of the bioaccumulation of sediment-associated contaminants by benthic invertebrates, E 1688-00a. În ASTM International 2004 Annual Book of Standards. Volumul 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
|
|
(4)
|
U.S. EPA (2000). Methods for measuring the toxicity and bioaccumulation of sediment-associated contaminants with freshwater invertebrates. A doua ediție. EPA 600/R-99/064, U.S. Environmental Protection Agency, Duluth, MN, March 2000.
|
|
(5)
|
Kukkonen, J. și Landrum, P.F. (1994). Toxicokinetics and toxicity of sediment-associated Pyrene to Lumbriculus variegatus (Oligochaeta). Toxicol. Toxicol. Chem. 13, 1457-1468.
|
|
(6)
|
Drewes C.D. & Fourtner C.R. (1990). Morphallaxis in an aquatic oligochaete, Lumbriculus variegatus: Reorganisation of escape reflexes in regenerating body fragments. Develop. Biol. 138: 94-103.
|
|
(7)
|
Leppänen, M.T. & Kukkonen, J.V.K. (1998a). Relationship between reproduction, sediment type and feeding activity of Lumbriculus variegatus (Müller): Implications for sediment toxicity testing. Toxicol. Toxicol. Chem. 17: 2196-2202.
|
|
(8)
|
Leppänen, M.T. & Kukkonen, J.V.K. (1998b). Factors affecting feeding rate, reproduction and growth of an oligochaete Lumbriculus variegatus (Müller). Hydrobiologia 377: 183-194.
|
|
(9)
|
Brust, K., O. Licht, V. Hultsch, D. Jungmann & R. Nagel (2001). Effects of Terbutryn on Aufwuchs and Lumbriculus variegatus in Artificial Indoor Streams. Toxicol. Toxicol. Chemistry, Vol. 20, pp. 2000–2007.
|
|
(10)
|
Oetken, M., K.-U. Ludwichowski & R. Nagel (2000). Sediment tests with Lumbriculus variegatus and Chironomus riparius and 3,4-dichloroaniline (3,4-DCA) within the scope of EG-AltstoffV. By order of the Federal Environmental Agency (Umweltbundesamt Berlin), FKZ 360 12 001, March 2000.
|
|
(11)
|
Leppänen M.T. & Kukkonen J.V.K. (1998). Relative importance of ingested sediment and porewater as bioaccumulation routes for pyrene to oligochaete (Lumbriculus variegatus, Müller). Toxicol. Sci. Toxicol. 32, 1503-1508.
|
Apendicele 6
Rezumatul rezultatelor ring testului
«Test de toxicitate asupra sedimentului cu Lumbriculus variegatus»
Tabelul 1
Rezultatele ciclurilor individuale ale ring testului: numărul mediu de viermi din vasele de control și din vasele de control cu solvent la finalul testului; SD = abatere standard; CV = coeficient de variație.
|
|
numărul mediu de viermi din vasele de control
|
SD
|
CV (%)
|
n
|
numărul mediu de viermi din vasele de control cu solvent
|
SD
|
CV (%)
|
n
|
|
|
32,3
|
7,37
|
22,80
|
3
|
39,0
|
3,61
|
9,25
|
3
|
|
|
40,8
|
6,55
|
16,05
|
6
|
36,0
|
5,29
|
14,70
|
3
|
|
|
41,5
|
3,54
|
8,52
|
2
|
38,5
|
7,05
|
18,31
|
4
|
|
|
16,3
|
5,99
|
36,67
|
6
|
30,8
|
6,70
|
21,80
|
4
|
|
|
24,3
|
10,69
|
43,94
|
3
|
26,3
|
3,06
|
11,60
|
3
|
|
|
28,5
|
8,29
|
29,08
|
4
|
30,7
|
1,15
|
3,77
|
3
|
|
|
28,3
|
3,72
|
13,14
|
6
|
28,8
|
2,56
|
8,89
|
6
|
|
|
25,3
|
5,51
|
21,74
|
3
|
27,7
|
1,53
|
5,52
|
3
|
|
|
23,8
|
2,99
|
12,57
|
4
|
21,3
|
1,71
|
8,04
|
4
|
|
|
36,8
|
8,80
|
23,88
|
6
|
35,0
|
4,20
|
11,99
|
6
|
|
|
33,0
|
3,58
|
10,84
|
6
|
33,5
|
1,73
|
5,17
|
4
|
|
|
20,7
|
2,73
|
13,22
|
6
|
15,0
|
6,68
|
44,56
|
4
|
|
|
42,0
|
7,07
|
16,84
|
6
|
43,7
|
0,58
|
1,32
|
3
|
|
|
18,2
|
3,60
|
19,82
|
6
|
21,7
|
4,04
|
18,65
|
3
|
|
|
32,0
|
3,95
|
12,34
|
6
|
31,3
|
4,79
|
15,32
|
4
|
|
media interlaboratoare
|
29,59
|
|
20,10
|
|
30,61
|
|
13,26
|
|
|
SD
|
8,32
|
|
10,03
|
|
7,57
|
|
10,48
|
|
|
n
|
15
|
|
|
|
15
|
|
|
|
|
min
|
16,3
|
|
|
|
15,0
|
|
|
|
|
max
|
42,0
|
|
|
|
43,7
|
|
|
|
|
CV (%)
|
28,1
|
|
|
|
24,7
|
|
|
|
Tabelul 2
Rezultatele ciclurilor individuale ale ring testului: greutatea uscată medie totală a viermilor per probă duplicat în vasele de control și în vasele de control cu solvent la finalul testului; SD = abatere standard; CV = coeficient de variație.
|
|
greutatea uscată totală a viermilor per probă duplicat (vase de control)
|
SD
|
CV (%)
|
n
|
greutatea uscată totală a viermilor per probă duplicat (vase de control cu solvent)
|
SD
|
CV (%)
|
n
|
|
|
24,72
|
6,31
|
25,51
|
3
|
27,35
|
4,08
|
14,93
|
3
|
|
|
30,17
|
2,04
|
6,75
|
6
|
33,83
|
10,40
|
30,73
|
3
|
|
|
23,65
|
3,61
|
15,25
|
2
|
28,78
|
4,68
|
16,28
|
4
|
|
|
12,92
|
6,83
|
52,91
|
6
|
24,90
|
6,84
|
27,47
|
4
|
|
|
21,31
|
4,17
|
19,57
|
3
|
25,87
|
5,30
|
20,49
|
3
|
|
|
22,99
|
4,86
|
21,16
|
4
|
24,64
|
5,09
|
20,67
|
3
|
|
|
18,91
|
1,91
|
10,09
|
6
|
19,89
|
1,77
|
8,89
|
6
|
|
|
24,13
|
1,63
|
6,75
|
3
|
25,83
|
2,17
|
8,41
|
3
|
|
|
22,15
|
3,18
|
14,34
|
4
|
22,80
|
2,60
|
11,40
|
4
|
|
|
35,20
|
8,12
|
23,07
|
6
|
31,42
|
8,45
|
26,90
|
6
|
|
|
41,28
|
5,79
|
14,02
|
6
|
41,42
|
4,37
|
10,55
|
4
|
|
|
15,17
|
5,78
|
38,09
|
6
|
10,50
|
3,42
|
32,53
|
4
|
|
|
35,69
|
8,55
|
23,94
|
6
|
38,22
|
1,23
|
3,21
|
3
|
|
|
19,57
|
5,21
|
26,65
|
6
|
28,58
|
6,23
|
21,81
|
3
|
|
|
29,40
|
2,16
|
7,34
|
6
|
31,15
|
2,70
|
8,67
|
4
|
|
media interlaboratoare
|
25,15
|
|
20,36
|
|
27,68
|
|
17,53
|
|
|
SD
|
7,87
|
|
12,56
|
|
7,41
|
|
9,10
|
|
|
n
|
15
|
|
|
|
15
|
|
|
|
|
min
|
12,9
|
|
|
|
10,5
|
|
|
|
|
max
|
41,3
|
|
|
|
41,4
|
|
|
|
|
CV (%)
|
31,3
|
|
|
|
26,8
|
|
|
|
Tabelul 3
Toxicitatea PCP: Rezumatul punctelor finale în cadrul ring testului; mediile interlaboratoare pentru EC50, NOEC și LOEC; SD = abatere standard; CV = coeficient de variație.
|
parametru biologic
|
|
media interlaboratoare (mg/kg)
|
min.
|
max.
|
factor interlaboratoare
|
SD
|
CV (%)
|
media geometrică (mg/kg)
|
|
numărul total de viermi
|
EC50
|
23,0
|
4,0
|
37,9
|
9,4
|
10,7
|
46,3
|
19,9
|
|
NOEC
|
9,9
|
2,1
|
22,7
|
10,7
|
7,2
|
72,3
|
7,6
|
|
LOEC
|
27,9
|
4,7
|
66,7
|
14,2
|
19,4
|
69,4
|
20,9
|
|
MDD (%)
|
22,5
|
7,1
|
39,1
|
|
|
|
|
|
greutatea uscată totală a viermilor
|
EC50
|
20,4
|
7,3
|
39,9
|
5,5
|
9,1
|
44,5
|
18,2
|
|
NOEC
|
9,3
|
2,1
|
20,0
|
9,4
|
6,6
|
70,4
|
7,4
|
|
LOEC
|
25,7
|
2,1
|
50,0
|
23,5
|
16,8
|
65,5
|
19,4
|
|
MDD (%)
|
24,8
|
10,9
|
44,7
|
|
|
|
|
|
mortalitate/supraviețuire
|
LC50
|
25,3
|
6,5
|
37,2
|
5,7
|
9,4
|
37,4
|
23,1
|
|
NOEC
|
16,5
|
2,1
|
40,0
|
18,8
|
10,3
|
62,4
|
12,8
|
|
LOEC
|
39,1
|
4,7
|
66,7
|
14,2
|
18,1
|
46,2
|
32,6
|
|
reproducere (creșterea numărului de viermi per probă duplicat)
|
EC50
|
20,0
|
6,7
|
28,9
|
4,3
|
7,6
|
37,9
|
18,3
|
|
NOEC
|
7,9
|
2,1
|
20,0
|
9,4
|
5,2
|
66,0
|
6,4
|
|
LOEC
|
22,5
|
2,1
|
50,0
|
23,5
|
15,4
|
68,6
|
16,0
|
|
MDD (%)
|
29,7
|
13,9
|
47,9
|
|
|
|
|
|
creștere (creșterea biomasei per probă duplicat)
|
EC50
|
15,3
|
5,7
|
29,9
|
5,2
|
7,1
|
46,5
|
13,7
|
|
NOEC
|
8,7
|
2,1
|
20,0
|
9,4
|
6,0
|
68,1
|
6,9
|
|
LOEC
|
24,0
|
2,1
|
50,0
|
23,5
|
15,7
|
65,5
|
17,3
|
|
MDD (%)
|
32,2
|
13,6
|
65,2
|
|
|
|
|
|
MDD: diferența detectabilă minimă în raport cu valorile probelor de control pe parcursul testării ipotezei; utilizată ca o măsură a puterii statistice
|
BIBLIOGRAFIE
Egeler, Ph., Meller, M., Schallnaß, H.J. & Gilberg, D. (2005). Validation of a sediment toxicity test with the endobenthic aquatic oligochaete Lumbriculus variegatus by an international ring test. In co-operation with R. Nagel and B. Karaoglan. Report to the Federal Environmental Agency (Umweltbundesamt Berlin), R&D No.: 202 67 429.
C.36 TEST DE REPRODUCERE A UNUI ACARIAN PRĂDĂTOR [HYPOASPIS (GEOLAELAPS) ACULEIFER] DIN SOL
INTRODUCERE
|
1.
|
Prezenta metodă de testare este echivalentă cu Orientarea OCDE privind testarea (TG) 226 (2008). Prezenta metodă de testare este concepută pentru a evalua efectele substanțelor chimice din sol asupra ratei de reproducere a unei specii de acarian din sol, Hypoaspis (Geolaelaps) aculeifer Canestrini (Acari: Laelapidae), permițând astfel estimarea inhibiției ritmului de creștere specific al unei populații (1,2). În acest caz, capacitatea de reproducere semnifică numărul de exemplare tinere la finalul perioadei de testare. H. aculeifer reprezintă un nivel trofic suplimentar față de speciile pentru care sunt deja disponibile metode de testare. În scopul prezentei metode de testare, un test de reproducere fără discriminare și cuantificare a diferitelor stadii ale ciclului de reproducere este considerat adecvat. Pentru substanțele chimice al căror mod de expunere nu implică solul, ar putea fi adecvate alte abordări (3).
|
|
2.
|
Hypoaspis (Geolaelaps) aculeifer este considerat un reprezentant relevant al faunei din sol și, în special, al acarienilor prădători. Acesta este răspândit în toată lumea (5) și poate fi colectat și înmulțit cu ușurință în laborator. Un rezumat al biologiei speciei de H. aculeifer este prezentat în apendicele 7. Informații de referință privind ecologia speciilor de acarieni și utilizarea acestora în cadrul testelor ecotoxicologice sunt disponibile în referințele (4), (5), (6), (7), (8), (9), (10), (11), (12).
|
PRINCIPIUL TESTULUI
|
3.
|
Femelele adulte sunt expuse la o serie de concentrații ale substanței chimice de testare amestecate în sol. La începutul testului, în fiecare vas duplicat sunt introduse câte 10 femele adulte. Masculii nu sunt incluși în test deoarece experiența a demonstrat că femelele se împerechează imediat sau la scurt timp după ecloziune în stadiul de deutonimfă, în cazul în care masculii sunt prezenți. În plus, includerea masculilor ar prelungi durata testului întrucât ar fi necesară o diferențiere laborioasă a stadiilor de dezvoltare. În consecință, împerecherea în sine nu constituie parte a testului. Femelele sunt incluse în test după 28-35 de zile de la începerea perioadei de pontă în cadrul procesului de sincronizare (a se vedea apendicele 4), deoarece se poate considera în acest caz că femelele deja s-au împerecheat și au trecut în etapa anterioară pontei ovulare. La o temperatură de 20 °C, testul se încheie în cea de a 14-a zi după includerea femelelor (ziua 0), ceea ce permite primilor descendenți din grupurile de control să atingă stadiul de deutonimfă (a se vedea apendicele 4). Pentru calcularea principalei variabile măsurate, se stabilește numărul de exemplare tinere pentru fiecare vas de testare, precum și numărul de femele supraviețuitoare. Rata de reproducere a acarienilor expuși la substanța chimică de testare este comparată cu cea a acarienilor din grupurile de control pentru a determina ECx (de exemplu, EC10, EC50) sau concentrația la care nu se observă niciun efect (NOEC) (pentru definiții, a se vedea apendicele 1), în funcție de proiectul experimentului (a se vedea punctul 29). O prezentare generală a calendarului testelor este inclusă în apendicele 8.
|
INFORMAȚII PRIVIND SUBSTANȚA CHIMICĂ DE TESTARE
|
4.
|
Ar fi de preferat să se cunoască solubilitatea în apă, log Kow, coeficientul de partiție sol/apă și presiunea de vapori a substanței de testare. Sunt de dorit informații suplimentare privind evoluția substanței chimice de testare în sol, precum viteza de degradare biotică și abiotică.
|
|
5.
|
Această metodă de testare poate fi utilizată în cazul substanțelor chimice solubile sau insolubile în apă. Cu toate acestea, modul de aplicare a substanței de testare va varia în consecință. Metoda de testare nu se aplică substanțelor chimice volatile, și anume substanțelor în cazul cărora constanta Henry sau coeficientul de partiție sol/apă este mai mare de unu sau substanțelor chimice în cazul cărora presiunea de vapori depășește 0,0133 Pa la o temperatură de 25 °C.
|
VALIDITATEA TESTULUI
|
6.
|
Pentru ca un rezultat să fie considerat valabil, grupurile de control netratate trebuie să îndeplinească următoarele criterii:
|
—
|
Rata medie a mortalității în rândul femelelor adulte nu trebuie să depășească 20 % la finalul testului;
|
|
—
|
Numărul mediu de exemplare tinere per vas duplicat (cu 10 femele adulte incluse) trebuie să fie de cel puțin 50 la finalul testului;
|
|
—
|
Coeficientul de variație calculat pentru numărul de exemplare tinere de acarieni per vas duplicat nu trebuie să fie mai mare de 30 % la încheierea testului final.
|
|
SUBSTANȚA CHIMICĂ DE REFERINȚĂ
|
7.
|
Trebuie determinată valoarea ECx și/sau NOEC a unei substanțe chimice de referință pentru a garanta caracterul adecvat al condițiilor de testare din laborator și pentru a verifica regularitatea răspunsului organismelor de testare în timp. Dimetoatul (CAS 60-51-5) este o substanță chimică de referință corespunzătoare care și-a demonstrat efectul asupra dimensiunii populației (4). Acidul boric (CAS 10043-35-3) poate fi utilizat ca o substanță chimică de referință alternativă. Experiența dobândită în cazul acestei substanțe chimice este limitată. Sunt posibile două opțiuni conceptuale:
|
—
|
Substanța chimică de referință poate fi testată în paralel cu determinarea toxicității fiecărei substanțe de testare la o concentrație demonstrată în prealabil în cadrul unui studiu doză-răspuns pentru a provoca o reducere > 50 % a numărului descendenților. În acest caz, numărul probelor duplicat trebuie să fie același cu cel din vasele de control (a se vedea punctul 29).
|
|
—
|
Alternativ, substanța chimică de referință este testată de 1-2 ori pe an în cadrul unui test doză-răspuns. În funcție de modelul ales, numărul de concentrații și de probe duplicat și factorul de separare variază (a se vedea punctul 29), însă trebuie obținut un răspuns echivalent cu 10-90 % din efect (factor de separare de 1,8). Valoarea EC50 a dimetoatului calculată pe baza numărului de exemplare tinere trebuie să se încadreze în intervalul cuprins între 3,0 și 7,0 mg a.s./kg de sol (greutate uscată). Pe baza rezultatelor obținute până în prezent cu acidul boric, valoarea EC50 bazată pe numărul de exemplare tinere trebuie să se încadreze în intervalul cuprins între 100 și 500 mg/kg greutate uscată a solului.
|
|
DESCRIEREA TESTULUI
Vasele și echipamentele de testare
|
8.
|
Trebuie utilizate vase de testare cu diametrul de 3-5 cm (înălțimea solului ≥1,5 cm), din sticlă sau dintr-un alt material chimic inert și prevăzute cu un capac corespunzător. A se utiliza de preferință capace cu filet și, în acest caz, vasele ar putea fi aerate de două ori pe săptămână. Alternativ, pot fi utilizate capace care permit un schimb direct de gaze între substrat și atmosferă (de exemplu, tifon). Întrucât gradul de umiditate trebuie să rămână suficient de mare pe parcursul testului, este esențial să se verifice greutatea fiecărui vas de control pe parcursul testului și să se adauge apă dacă este necesar. Acest lucru este important în special în cazul în care nu sunt disponibile capace cu filet. În cazul în care este utilizat un vas de testare opac, capacul trebuie să fie dintr-un material care să permită accesul luminii (de exemplu, printr-un capac transparent perforat) împiedicându-i în același timp pe acarieni să scape. Dimensiunea și tipul vasului de testare depinde de metoda de extracție (pentru detalii, a se vedea apendicele 5). În cazul aplicării unei extracții la căldură direct pe vasul de testare, ar putea fi adăugată pe fundul vasului o plasă cu ochiuri de dimensiuni corespunzătoare (sigilată până în momentul extracției), iar adâncimea solului trebuie să fie suficientă pentru a permite stabilirea unui gradient de temperatură și de umiditate.
|
|
9.
|
Sunt necesare echipamente de laborator standard, care să includă, în special, următoarele:
|
—
|
vase, de preferință din sticlă cu capace cu filet;
|
|
—
|
pensule pentru transferul acarienilor
|
|
—
|
cântare de precizie adecvate;
|
|
—
|
echipamente adecvate pentru controlul temperaturii;
|
|
—
|
echipamente adecvate pentru controlul umidității aerului (neesențiale în cazul în care vasele de expunere sunt acoperite cu capace);
|
|
—
|
incubator sau o cameră mică cu temperatură controlată;
|
|
—
|
echipamente de extracție (a se vedea apendicele 5) (13)
|
|
—
|
panou luminos suspendat cu sistem de control al luminii
|
|
—
|
borcane de colectare pentru acarienii extrași.
|
|
Pregătirea solului artificial
|
10.
|
Pentru prezentul test, se utilizează un sol artificial. Solul artificial include următoarele componente (toate valorile se bazează pe masa uscată):
|
—
|
5 % mușchi de turbă, uscat cu aer și fin măcinat (se acceptă o dimensiune a particulelor de 2 ±1 mm);
|
|
—
|
20 % argilă caolinică (de preferință, conținut caolinit de peste 30 %);
|
|
—
|
aproximativ 74 % de nisip industrial uscat cu aer (în funcție de cantitatea de CaCO3 necesară), nisip predominant fin cu peste 50 % din particule măsurând între 50 și 200 de microni. Cantitatea exactă de nisip depinde de cantitatea de CaCO3 (a se vedea mai jos), proporția combinată a celor două componente trebuie să atingă 75 %.
|
|
—
|
< 1,0 % carbonat de calciu (CaCO3, pulverizat, puritate analitică) pentru a obține un pH de 6,0 ± 0,5; cantitatea de carbonat de calciu care trebuie adăugată poate depinde în principal de calitatea/natura turbei (a se vedea Nota 1).
|
Nota 1: Cantitatea de CaCO3 necesară va depinde de componentele substratului de sol și trebuie determinată prin măsurarea pH-ului subeșantioanelor de sol chiar înainte de test (14).
Nota 2: Conținutul de turbă din solul artificial diferă de cea recomandată în cadrul altor metode de testare a organismelor din sol pentru care se utilizează în cele mai multe cazuri un procent de 10 % turbă [de exemplu (15)]. Cu toate acestea, conform OEPP (16), un sol agricol tipic nu conține mai mult de 5 % materie organică, iar diminuarea conținutului de turbă reflectă astfel posibilitățile reduse ale unui sol natural de sorbție a substanței chimice de testare în raport cu carbonul organic.
Nota 3: Dacă este necesar, de exemplu în scopul unei testări specifice, solurile naturale provenite din locuri nepoluate pot servi, de asemenea, ca substrat de testare și/sau de cultură. Cu toate acestea, în cazul în care se utilizează sol natural, acesta trebuie să fie caracterizat cel puțin prin originea (locul colectării), pH-ul și textura sa (distribuția dimensiunii particulelor) și conținutul său de materie organică. Dacă sunt disponibile, trebuie incluse tipul și denumirea solului conform clasificării solurilor, iar solul nu trebuie să fie contaminat. În cazul în care substanța chimică de testare este un metal sau un compus organometalic, trebuie determinată, de asemenea, capacitatea de schimb cationic (CEC) a solului natural. Trebuie acordată o atenție specială respectării criteriilor de validitate întrucât informațiile de referință privind solurile naturale sunt în general rare.
|
|
11.
|
Se amestecă bine constituenții uscați ai solului (de exemplu, într-un amestecător de laborator mare). Pentru determinarea pH-ului, se utilizează un amestec de sol și de soluție de clorură de potasiu 1 M (KCl) sau de clorură de calciu 0,01 M (CaCl2) într-un raport de 1:5 [a se vedea referința (14) și apendicele 3]. Dacă aciditatea solului este mai mare decât limita impusă (a se vedea punctul 10), aceasta poate fi ajustată prin adăugarea unei cantități corespunzătoare de CaCO3. Dacă solul este prea alcalin, acest lucru poate fi ajustat prin adăugarea unei cantități suplimentare din amestecul care conține primele trei componente descrise la punctul 10, cu excepția CaCO3.
|
|
12.
|
Capacitatea maximă de retenție a apei (WHC) a solului artificial este determinată conform procedurilor descrise în apendicele 2. Cu două-șapte zile înainte de începerea testului, solul artificial uscat este umezit în prealabil prin adăugarea unei cantități suficiente de apă distilată sau deionizată pentru a obține aproximativ jumătate din conținutul final de apă, adică 40-60 % din WHC maximă. Gradul de umiditate este ajustat la 40-60 % din WHC maximă prin adăugarea soluției de substanță de testare și/sau prin adăugarea de apă distilată sau deionizată (a se vedea punctele 16-18). Se poate realiza o verificare suplimentară aproximativă a gradului de umiditate din sol strângând ușor solul în mână; în cazul în care gradul de umiditate este cel corect, trebuie să apară între degete picături mici de apă.
|
|
13.
|
Gradul de umiditate din sol este determinat, la începutul și la finalul testului, prin uscare la o temperatură de 105 °C până la obținerea unei greutăți constante în conformitate cu standardul ISO 11465 (17) și a unui pH al solului în conformitate cu anexa 3 sau cu standardul ISO 10390 (14). Aceste măsurători trebuie efectuate pe probe suplimentare fără acarieni, atât pentru solul de control, cât și pentru solul cu fiecare concentrație de testare. pH-ul solului nu trebuie ajustat atunci când sunt testați acizi sau baze. Gradul de umiditate trebuie să fie monitorizat pe întreaga perioadă a testului prin cântărirea periodică a vaselor (a se vedea punctele 20 și 24).
|
Selectarea și pregătirea animalelor pentru testare
|
14.
|
Specia utilizată în cadrul testului este Hypoaspis (Geolaelaps) aculeifer (Canestrini, 1883). Pentru începerea testului, sunt necesare femele adulte de acarieni, prelevate dintr-un grup sincronizat. Acarienii trebuie incluși după aproximativ 7-14 zile de la trecerea la stadiul de adult, după 28-35 de zile de la începerea perioadei de pontă în cadrul procesului de sincronizare (a se vedea punctul 3 și apendicele 4). Trebuie să se înregistreze sursa acarienilor sau furnizorul acestora și întreținerea culturii de laborator. În cazul în care este menținută o cultură de laborator, se recomandă ca identitatea speciilor să fie confirmată cel puțin o dată pe an. O fișă de identificare este inclusă în anexa 6.
|
Pregătirea concentrațiilor de testare
|
15.
|
Substanța de testare este amestecată în sol. Solvenții organici utilizați pentru facilitarea tratamentului solului cu substanța chimică de testare trebuie selectați pe baza toxicității lor scăzute pentru acarieni și trebuie inclus în proiectul de testare un vas de control cu solvent (a se vedea punctul 29).
|
Substanța chimică de testare solubilă în apă
|
16.
|
O soluție a substanței de testare este pregătită în apă deionizată într-o cantitate suficientă pentru toate duplicatele cu o concentrație de testare. Se recomandă utilizarea unei cantități corespunzătoare de apă pentru a obține gradul de umiditate necesar, și anume 40-60 % din WHC maximă (a se vedea punctul 12). Fiecare soluție a substanței de testare se amestecă bine cu o probă de sol umezit în prealabil înainte de a fi introdusă în vasul de testare.
|
Substanța chimică de testare insolubilă în apă
|
17.
|
În cazul substanțelor chimice insolubile în apă, dar solubile în solvenți organici, substanța chimică de testare poate fi dizolvată în cel mai mic volum posibil al unui dizolvant adecvat (de exemplu, acetonă). Trebuie utilizați numai solvenți volatili. În cazul în care sunt utilizați astfel de dizolvanți, toate concentrațiile de testare și vasul de control trebuie să conțină aceeași cantitate minimă de dizolvant. Dizolvantul este pulverizat sau amestecat cu o cantitate redusă, de exemplu 10 g, de nisip cuarțos. Conținutul total de nisip din substrat trebuie corectat în funcție de această cantitate. Dizolvantul este eliminat prin evaporare sub o hotă timp de cel puțin o oră. Acest amestec de nisip cuarțos și de substanță chimică de testare se adaugă la solul umezit în prealabil și se amestecă bine adăugând o cantitate corespunzătoare de apă deionizată pentru a se obține umiditatea dorită. Amestecul final este introdus în vasele de testare. A se avea în vedere faptul că anumiți solvenți pot fi toxici pentru acarieni. Prin urmare, se recomandă utilizarea unui vas de control suplimentar cu apă fără dizolvant, în cazul în care nu se cunoaște toxicitatea solventului pentru acarieni. În cazul în care se demonstrează în mod corespunzător că solventul (în concentrațiile care trebuie aplicate) nu are niciun efect, vasul de control cu apă poate fi exclus.
|
Substanță chimică puțin solubilă în apă și solvenți organici
|
18.
|
În cazul substanțelor chimice puțin solubile în apă și solvenți organici, echivalentul de 2,5 g de nisip cuarțos fin măcinat pentru fiecare vas de testare (de exemplu, 10 g de nisip cuarțos fin pentru patru duplicate) este amestecat cu cantitatea de substanță chimică pentru a obține concentrația de testare dorită. Conținutul total de nisip din substrat trebuie corectat în funcție de această cantitate. Acest amestec de nisip cuarțos și de substanță chimică de testare se adaugă la solul umezit în prealabil și se amestecă bine după ce a fost adăugată o cantitate corespunzătoare de apă deionizată pentru a se obține gradul de umiditate dorit. Amestecul final este distribuit în vasele de testare. Se repetă procedura pentru fiecare concentrație de testare și se pregătește, de asemenea, un vas de control corespunzător.
|
PROCEDURA
Grupuri de testare și vase de control
|
19.
|
Pentru fiecare vas de control și de tratament, se recomandă utilizarea a zece femele adulte în 20 g de masă de sol artificial. Organismele de testare trebuie adăugate într-un interval de două ore după pregătirea substratului de testare final (și anume, după aplicarea substanței de testare). În anumite cazuri (de exemplu, atunci când îmbătrânirea este considerată un factor determinant), intervalul de timp între pregătirea substratului de testare final și adăugarea acarienilor trebuie prelungit [pentru detalii privind îmbătrânirea, a se vedea referința (18)]. Cu toate acestea, în astfel de cazuri, trebuie furnizată o justificare științifică.
|
|
20.
|
După adăugarea acarienilor în sol, aceștia sunt hrăniți, iar greutatea inițială a fiecărui vas de testare trebuie măsurată pentru a fi utilizată ca referință pentru monitorizarea gradului de umiditate a solului pe tot parcursul testului, conform descrierii de la punctul 24. Vasele de testare sunt apoi acoperite conform descrierii de la punctul (8) și așezate în camera de testare.
|
|
21.
|
Sunt pregătite vase de control corespunzătoare pentru fiecare dintre metodele de aplicare a substanței chimice de testare descrise la punctele 15-18. Sunt urmate procedurile relevante descrise pentru pregătirea vaselor de control, fără a se adăuga substanța chimică de testare. Astfel, dacă este cazul, se adaugă în vasele de control solvenți organici, nisip cuarțos sau alți dizolvanți în concentrații/cantități echivalente cu cele din vasele de tratament. Atunci când se utilizează un solvent sau un alt dizolvant pentru a adăuga substanța chimică de testare, trebuie pregătit și testat, de asemenea, un vas de control fără dizolvant sau substanța chimică de testare în cazul în care nu se cunoaște toxicitatea solventului (a se vedea punctul 17).
|
Condiții de testare
|
22.
|
Temperatura de testare trebuie să fie de 20 ± 2 °C. Temperatura trebuie înregistrată cel puțin zilnic și ajustată, dacă este necesar. Testul este efectuat în cicluri de lumină și de întuneric controlate (de preferință, 16 ore de lumină și 8 ore de întuneric) cu o intensitate a luminii cuprinsă între 400 și 800 lux în apropiere de vasele de testare. Din motive de compatibilitate, aceste condiții sunt identice ca și în cazul celorlalte teste ecotoxicologice ale solului [de exemplu, referința (15)].
|
|
23.
|
Schimbul de gaze trebuie garantat prin aerarea vaselor de testare de două ori pe săptămână în cazul în care sunt utilizate capace cu filet. În cazul utilizării unor capace din tifon, trebuie acordată o atenție specială menținerii gradului de umiditate a solului (a se vedea punctele 8 și 24).
|
|
24.
|
Gradul de umiditate a substratului de sol din vasele de testare este menținut pe tot parcursul testului prin cântărire și, dacă este necesar, prin adăugarea periodică de apă în vasele de testare (de exemplu, o dată pe săptămână). Dacă este necesar, pierderile sunt compensate cu apă deionizată. Gradul de umiditate a solului pe parcursul testului nu trebuie să difere cu mai mult de 10 % din valoarea inițială.
|
Hrănirea
|
25.
|
S-a demonstrat că acarienii de brânză [Tyrophagus putrescentiae (Schrank, 1781)] reprezintă o sursă de hrană adecvată. Pot fi, de asemenea, adecvate colembolele de mici dimensiuni [de exemplu, exemplare tinere de Folsomia candida Willem, 1902 sau Onychiurus fimatus (19), (20), enchitreide (de exemplu, Enchytraeus crypticus Westheide & Graefe, 1992) sau nematode (de exemplu, Turbatrix silusiae de Man, 1913)] (21). Se recomandă verificarea hranei înainte de utilizarea sa în cadrul testului. Tipul și cantitatea de hrană trebuie să asigure obținerea unui număr adecvat de exemplare tinere pentru a îndeplini criteriile de validitate (punctul 6). Pentru selectarea prăzii, trebuie luat în considerare modul de acțiune al substanței de testare (de exemplu, un acaricid poate fi toxic și pentru acarienii utilizați ca hrană; a se vedea punctul 26).
|
|
26.
|
Hrana trebuie furnizată ad libitum [și anume, de fiecare dată într-o cantitate mică (vârful unei spatule)]. În acest scop, poate fi utilizat și un aspirator cu aspirație ușoară astfel cum este propus în testul asupra colembolelor sau o pensulă de vopsit fină. De obicei, va fi suficientă furnizarea de hrană la începutul testului și de două-trei ori pe săptămână. Atunci când substanța de testare pare a fi toxică pentru pradă, trebuie luată în considerare o creștere a frecvenței hrănirii și/sau o sursă de hrană alternativă.
|
Selectarea concentrațiilor de testare
|
27.
|
Informațiile anterioare cu privire la toxicitatea substanței chimice de testare, provenite, de exemplu, dintr-o serie de studii de stabilire a intervalului, ar trebui să faciliteze selectarea concentrațiilor de testare adecvate. Dacă este necesar, se realizează un test de stabilire a intervalului cu cinci concentrații ale substanței chimice de testare cuprinse între 0,1 și 1 000 mg/kg de sol uscat, cu cel puțin o probă duplicat pentru tratamente și pentru vasul de control. Durata testului de stabilire a intervalului este de 14 zile, după care se stabilesc rata mortalității în rândul acarienilor adulți și numărul de exemplare tinere. Intervalul concentrațiilor în cadrul testului final trebuie să fie ales de preferință astfel încât să includă concentrații care să influențeze numărul de exemplare tinere, însă nu și supraviețuirea generației materne. Cu toate acestea, acest lucru nu poate fi posibil în cazul substanțelor chimice care provoacă efecte letale și subletale în concentrații aproximativ similare. Concentrațiile efective (de exemplu, EC50 EC25, EC10) și intervalul de concentrații în care efectul substanței de testare prezintă interes trebuie să fie cuprinse în seria concentrațiilor incluse în test. Extrapolarea la valori cu mult sub cea mai scăzută concentrație care afectează organismele de testare sau cu mult peste cea mai mare concentrație testată trebuie realizată numai în cazuri excepționale și trebuie furnizată o explicație completă în raport.
|
Proiectul experimentului
Teste doză-răspuns
|
28.
|
Sunt propuse trei modele de teste, pe baza recomandărilor formulate în cadrul unui alt ring test [Testul de reproducere a enchitreidelor (22)]. Caracterul adecvat general al tuturor acestor modele a fost confirmat de rezultatele validării privind H. aculeifer.
|
|
29.
|
La stabilirea intervalului de concentrații, trebuie să se rețină următoarele:
|
—
|
Pentru stabilirea valorii ECx (de exemplu, EC10, EC50), trebuie testate douăsprezece concentrații. Se recomandă cel puțin două probe duplicat pentru fiecare concentrație de testare și șase probe duplicat de control. Factorul de separare poate varia, putând fi mai mic sau egal cu 1,8 în gama de efecte prevăzută și mai mare de 1,8 la concentrații mai ridicate sau mai scăzute.
|
|
—
|
Pentru stabilirea valorii NOEC, trebuie testate cel puțin cinci concentrații într-o serie geometrică. Se recomandă utilizarea a patru probe duplicat pentru fiecare concentrație de testare și opt vase de control. Concentrațiile trebuie să fie separate de un factor care să nu depășească valoarea de 2,0.
|
|
—
|
O abordare combinată permite determinarea valorilor NOEC și ECx. Trebuie utilizate opt concentrații de tratament într-o serie geometrică. Se recomandă utilizarea a patru probe duplicat pentru fiecare tratament și opt vase de control. Concentrațiile trebuie să fie separate de un factor care să nu depășească valoarea de 1,8.
|
|
Test la valori-limită
|
30.
|
În cazul în care nu este observat niciun efect la cea mai înaltă concentrație în cadrul testului de stabilire a intervalului (și anume 1 000 mg/kg greutate uscată a solului), testul de reproducere final poate fi realizat sub forma unui test la valori-limită utilizând o concentrație de testare de 1 000 mg/kg greutate uscată a solului. Un test la valori-limită va oferi posibilitatea de a demonstra că NOEC sau EC10 pentru reproducere este mai mare decât concentrația-limită, diminuând în același timp numărul acarienilor utilizați în cadrul testului. Trebuie utilizate opt probe duplicat atât pentru solul tratat, cât și pentru vasul de control.
|
Durata testului și măsurători
|
31.
|
Trebuie înregistrată orice diferență observată între comportamentul și morfologia acarienilor din vasele de control și cele tratate.
|
|
32.
|
În cea de a 14-a zi, acarienii supraviețuitori sunt extrași din sol prin extracție la căldură/lumină sau printr-o altă metodă corespunzătoare (a se vedea apendicele 5). Exemplarele tinere (și anume, larve, protonimfe și deutonimfe) și adulții sunt numărați separat. Toți acarienii adulți care nu sunt găsiți în acest stadiu sunt înregistrați ca morți, presupunându-se că respectivii acarieni au murit și s-au descompus înainte de evaluare. Eficiența extracției trebuie validată o dată sau de două ori pe an în vasele de control cu numere cunoscute de adulți și de exemplare tinere. Eficiența trebuie să fie mai mare de 90 % în medie combinată pentru toate stadiile de dezvoltare (a se vedea apendicele 5). Numărul de adulți și de exemplare tinere nu este ajustat în funcție de eficiență.
|
DATE ȘI RAPORT
Interpretarea rezultatelor
|
33.
|
Informațiile privind metodele statistice care pot fi utilizate pentru analiza rezultatelor testelor sunt furnizate la punctele 36-41. În plus, trebuie consultat Documentul 54 al OCDE intitulat «Current Approaches in the Statistical Analysis of Ecotoxicity Data: a Guidance to Application» (31).
|
|
34.
|
Principalul punct final de testare este rata de reproducere, în acest caz, numărul de exemplare tinere produse per vas de testare duplicat (cu 10 femele adulte incluse). Analiza statistică necesită calcularea mediei aritmetice (X) și a varianței (s2) pentru rata de reproducere pentru fiecare tratament și pentru fiecare vas de control. X și s2 sunt utilizate pentru procedurile ANOVA precum testul t Student, testul Dunnett sau testul Williams, precum și pentru calcularea intervalelor de încredere la 95 %.
Notă: acest punct final principal este echivalent cu rata de reproducere măsurată ca numărul de exemplare tinere supraviețuitoare produse pe parcursul testului împărțit la numărul de femele părinți incluse la începutul testului.
|
|
35.
|
Numărul de femele supraviețuitoare din vasele de control netratate reprezintă un criteriu de validitate important și trebuie documentat. Ca și în cazul testului de stabilire a intervalului, toate celelalte semne nocive trebuie înregistrate și în raportul final.
|
ECx:
|
36.
|
Valorile ECx, inclusiv limitele de încredere de 95 % inferioare și superioare corespunzătoare parametrului descris la punctul 34 se calculează utilizând metodele statistice adecvate (de exemplu, analiza probit, funcția logistică sau Weibull, metoda simplificată Spearman-Karber sau simpla interpolare). O valoare ECx se obține prin inserarea unei valori corespunzătoare cu x % din media etaloanelor în ecuația respectivă. Pentru calcularea valorii EC50 sau a unei alte valori ECx, mediile per tratament (X) trebuie supuse unei analize de regresie.
|
NOEC/LOEC
|
37.
|
În cazul în care se intenționează determinarea valorii NOEC/LOEC prin analiză statistică, sunt necesare statistici pentru fiecare vas (fiecare vas este considerat duplicat). Trebuie utilizate metode statistice adecvate (conform Documentului 54 al OCDE intitulat «Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application»). În general, efectele adverse ale substanței de testare în raport cu proba de control sunt analizate cu ajutorul unei testări a ipotezei unilaterale (inferioare) la p ≤ 0,05. Exemple sunt furnizate la punctele de mai jos.
|
|
38.
|
Distribuția normală a datelor poate fi testată, de exemplu cu ajutorul testului de calitate a ajustării Kolmogorov-Smirnov, al testului raportului interval/deviație standard (testul R/s) sau al testului Shapiro-Wilk (bilateral, p ≤ 0,05). Pentru testarea omogenității varianței, poate fi utilizat testul Cochran, testul Levene sau testul Bartlett (bilateral, p ≤ 0,05). În cazul în care sunt îndeplinite condițiile prealabile ale procedurilor de testare parametrice (normalitate, omogenitatea varianței), se pot efectua o analiză de varianță (ANOVA) unilaterală și teste multicomparative ulterioare. Pot fi utilizate comparații multiple (de exemplu, testul Dunnett) sau teste regresive de stabilire a tendinței (testul Williams în cazul unui raport doză-răspuns monoton) pentru calcularea eventualelor diferențe semnificative (p ≤ 0,05) între vasele de control și diversele concentrații ale substanței de testare (selectarea testului recomandat conform Documentului 54 al OCDE intitulat «Current Approaches in the Statistical Analysis of Ecotoxicity Data: a Guidance to Application»). În caz contrar, trebuie utilizate metode neparametrice (de exemplu, testul U Bonferroni conform testului de Holm sau testului de stabilire a tendinței Jonckheere-Terpstra) pentru determinarea NOEC și a LOEC.
|
Test la valori-limită
|
39.
|
În cazul în care a fost efectuat un test la valori-limită (compararea probei de control cu un singur tratament) și au fost îndeplinite condițiile prealabile ale procedurilor de testare parametrice (normalitate, omogenitate), pot fi evaluate răspunsurile metrice prin intermediul testului Student (testul t). Se poate utiliza testul t pentru varianțe (testul t Welch) sau un test neparametric, precum testul U Mann-Whitney, în cazul în care nu sunt îndeplinite aceste cerințe.
|
|
40.
|
Pentru determinarea diferențelor semnificative între vasele de control (vasul de control și vasul de control cu solvent), probele duplicat ale fiecărui vas de control pot fi testate conform descrierilor pentru testul la valori-limită. În cazul în care aceste teste nu detectează nicio diferență semnificativă, toate probele duplicat ale vaselor de control și ale vaselor de control cu solvent pot fi cumulate. În caz contrar, toate tratamentele trebuie comparate cu vasul de control cu solvent.
|
Raportul de testare
|
41.
|
Raportul de testare trebuie să includă cel puțin următoarele informații:
|
—
|
Substanța chimică testată
|
—
|
identitatea substanței chimice de testare, denumirea, lotul și numărul CAS, puritatea;
|
|
—
|
proprietățile fizico-chimice ale substanței chimice de testare [de exemplu, log Kow, solubilitatea în apă, presiunea de vapori, constanta Henry (H) și, de preferință, informații privind evoluția substanței chimice de testare în sol).
|
|
|
—
|
Organismele de testare
|
—
|
identificarea și furnizorul organismelor de testare, descrierea condițiilor de creștere;
|
|
—
|
intervalul de vârstă al organismelor de testare.
|
|
|
—
|
Condițiile de testare
|
—
|
descrierea modelului experimental și a procedurii;
|
|
—
|
detalii privind pregătirea solului de testare; specificații detaliate în cazul în care se utilizează sol natural (origine, istoric, distribuția dimensiunii particulelor, pH-ul, conținutul de materie organică și, dacă este disponibilă, clasificarea solului)
|
|
—
|
capacitatea maximă a solului de retenție a apei;
|
|
—
|
o descriere a tehnicii utilizate pentru aplicarea substanței chimice de testare în sol;
|
|
—
|
detalii privind substanțele chimice auxiliare utilizate pentru administrarea substanței chimice de testare;
|
|
—
|
dimensiunea vaselor de testare și masa uscată de sol de testare pentru fiecare vas;
|
|
—
|
condițiile de testare: intensitatea luminii, durata ciclurilor lumină-întuneric, temperatura;
|
|
—
|
o descriere a regimului de hrănire, tipul și cantitatea hranei utilizate în cadrul testului, datele hrănirii;
|
|
—
|
pH-ul și conținutul de apă din sol la începutul și pe parcursul testului (probă de control și fiecare tratament)
|
|
—
|
o descriere detaliată a metodei de extracție și eficiența extracției.
|
|
|
—
|
Rezultatele testului
|
—
|
numărul de exemplare tinere determinat în fiecare vas de testare la finalul testului;
|
|
—
|
numărul de femele adulte și rata mortalității în rândul exemplarelor adulte ( %) din fiecare vas de testare la finalul testului
|
|
—
|
o descriere a simptomelor evidente sau schimbările clare de comportament;
|
|
—
|
rezultatele obținute cu substanța chimică de testare de referință;
|
|
—
|
rezumatul statisticilor (ECx și/sau NOEC), inclusiv limitele de încredere de 95 % și o descriere a metodei de calcul;
|
|
—
|
un grafic al relației concentrație/răspuns;
|
|
—
|
abaterile de la procedurile descrise în prezenta metodă de testare și orice eveniment neobișnuit survenit pe parcursul testului.
|
|
|
BIBLIOGRAFIE
|
(1)
|
Casanueva, M.E. (1993). Phylogenetic studies of the free-living and arthropod associated Laelapidae (Acari: Mesostigmata). Gayana Zool. 57, 21-46.
|
|
(2)
|
Tenorio, J. M. (1982). Hypoaspidinae (Acari: Gamasida: Laelapidae) of the Hawaiian Islands. Pacific Insects 24, 259-274.
|
|
(3)
|
Bakker, F.M., Feije, R., Grove, A. J., Hoogendorn, G., Jacobs, G., Loose, E.D. and van Stratum, P. (2003). A laboratory test protocol to evaluate effects of plant protection products on mortality and reproduction of the predatory mite Hypoaspis aculeifer Canestrini (Acari: Laelapidae) in standard soil. JSS – Journal of Soils and Sediments 3, 73-77.
|
|
(4)
|
Karg, W. (1993). Die freilebenden Gamasina (Gamasides), Raubmilben. A 2-a ediție În: Dahl, F. (Hrsg.): Die Tierwelt Deutschlands 59. Teil, G. Fischer, Jena, 523 pp.
|
|
(5)
|
Ruf, A. (1991). Do females eat males?: Laboratory studies on the popualation development of Hypoaspis aculeifer (Acari: Parasitiformes). În: F. Dusbabek & V. Bukva (eds.): Modern Acarology. Academia Prague & SPD Academic Publishing bv, Haga, Vol. 2, 487-492
|
|
(6)
|
Ruf, A. (1995). Sex ratio and clutch size control in the soil inhabiting predatory mite Hypoaspis aculeifer (Canestrini 1883) (Mesostigmata, Dermanyssidae). Ind. 2nd Symp. EURAAC: p 241-249.
|
|
(7)
|
Ruf, A. (1996). Life-history patterns in soil-inhabiting mesostigmatid mites. Ind. IXth Internat. Congr. Acarol. 1994, Columbus, Ohio: p 621-628.
|
|
(8)
|
Krogh, P.H. și Axelsen, J.A. (1998). Test on the predatory mite Hypoaspis aculeifer preying on the collembolan Folsomia fimetaria. În: Lokke, H. and van Gestel, C.A.M.: Handbook of soil invertebrate toxicity tests. John Wiley Sons, Chichester, p 239-251.
|
|
(9)
|
Løkke, H., Janssen, C.R., Lanno, R.P., Römbke, J., Rundgren, S. și Van Straalen, N.M. (2002). Soil Toxicity Tests – Invertebrates. În: Test Methods to Determine Hazards of Sparingly Soluble Metal Compounds in Soils. Fairbrother, A., Glazebrook, P.W., Van Straalen, N.M. and Tarazona, J.V. (eds.). SETAC Press, Pensacola, USA. 128 pp.
|
|
(10)
|
Schlosser, H.-J. și Riepert, F. (1991/92). Entwicklung eines Prüfverfahrens für Chemikalien an Bodenraubmilben (Gamasina). Teil 1: Biologie der Bodenraubmilbe Hypoaspis aculeifer Canestrini, 1883 (Gamasina) unter Laborbedingungen. Zool. Beiträge, 34, 395-433.
|
|
(11)
|
Schlosser, H.-J. și Riepert, F. (1992). Entwicklung eines Prüfverfahrens für Chemikalien an Boden-raubmilben (Gamasina). Teil 2: Erste Ergebnisse mit Lindan und Kaliumdichromat in subletaler Dosierung. Zool. Beitr. N.F. 34, 413-433.
|
|
(12)
|
Heckmann, L.-H., Maraldo, K. și Krogh, P. H. (2005). Life stage specific impact of dimethoate on the predatory mite Hypoaspis aculeifer Canestrini (Gamasida: Laelapidae). Environmental Science & Technology 39, 7154-7157.
|
|
(13)
|
Petersen, H. (1978). Some properties of two high-gradient extractors for soil microarthropods, and an attempt to evaluate their extraction efficiency. Natura Jutlandica 20, 95-122.
|
|
(14)
|
ISO (Organizația Internațională de Standardizare) (1994). Calitatea solului – Determinarea pH-ului, nr. 10390. ISO, Geneva.
|
|
(15)
|
Capitolul C.8 din prezenta anexă – Toxicitatea la râme.
|
|
(16)
|
EPPO (2003): EPPO Standards. Environmental risk assessment scheme for plant protection products. Chapter 8. Soil Organisms and Functions. Bull. OEPP/EPPO Bull. 33, 195-209.
|
|
(17)
|
ISO (International Organization for Standardization) (1993). Soil Quality –Determination of dry matter and water content on a mass basis – Gravimetric method, No. 11465. ISO, Geneve.
|
|
(18)
|
Fairbrother, A., Glazebrock, P.W., Van Straalen, N.M. și Tarazona, J.V. 2002. Test methods to determine hazards of sparingly soluble metal compounds in soils. SETAC Press, Pensacola, FL, USA.
|
|
(19)
|
Chi, H. 1981. Die Vermehrungsrate von Hypoaspis aculeifer Canestrini (Acarina, Laelapidae) bei Ernährung mit Onychiurus fimatus Gisin (Collenbola). Ges.allg..angew. Ent. 3:122-125.
|
|
(20)
|
Schlosser, H.J., und Riepert, F. 1992. Entwicklung eines Prüfverfahrens für Chemikalien an Bodenraubmilden (Gamasina). Zool.Beitr. N.F. 34(3):395-433.
|
|
(21)
|
Heckmann, L.-H., Ruf, A., Nienstedt, K. M. and Krogh, P. H. 2007. Reproductive performance of the generalist predator Hypoaspis aculeifer (Acari: Gamasida) when foraging on different invertebrate prey. Applied Soil Ecology 36, 130-135.
|
|
(22)
|
Capitolul C.32 din prezenta anexă – Testul de reproducere a enchitreidelor.
|
|
(23)
|
ISO (International Organization for Standardization) (1994). Soil Quality – Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction, No. 11268-2. ISO, Geneve.
|
|
(24)
|
Southwood, T.R.E. (1991). Ecological methods. With particular reference to the study of insect populations. (2nd ed.). Chapman & Hall, London, 524 pp.
|
|
(25)
|
Dunger, W. și Fiedler, H.J. (1997). Methoden der Bodenbiologie (2nd ed.). G. Fischer, Jena, 539 pp.
|
|
(26)
|
Lesna, I. și Sabelis, M.W. (1999). Diet-dependent female choice for males with «good genes» in a soil predatory mite. Nature 401, 581-583.
|
|
(27)
|
Ruf, A. (1989). Die Bedeutung von Arrhenotokie und Kannibalismus für die Populationsentwicklung von Hypoaspis aculeifer (Canestrini 1883) (Acari, Gamasina). Mitt. Deut. Ges. Allg. Angew. Ent. 7, 103-107.
|
|
(28)
|
Ruf, A. (1993). Die morphologische Variabilität und Fortpflanzungsbiologie der Raubmilbe Hypoaspis aculeifer (Canestrini 1883) (Mesostigmata, Dermanyssidae). Dissertation, Universität Bremen.
|
|
(29)
|
Ignatowicz, S. (1974). Observations on the biology and development of Hypoaspis aculeifer Canestrini, 1885 (Acarina, Gamasides). Zoologica Poloniae 24, 11-59.
|
|
(30)
|
Kevan, D.K. McE. și Sharma, G.D. (1964). Observations on the biology of Hypoaspis aculeifer (Canestrini, 1884), apparently new to North America (Acarina: Mesostigmata: Laelaptidae). Acarologia 6, 647-658.
|
|
(31)
|
OECD (2006c). Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. OECD environmental Health and Safety Publications Series on Testing and Assessment No.54. ENV/JM/MONO(2006)18
|
Apendicele 1
Definiții
Următoarele definiții se aplică prezentei metode de testare (în cadrul prezentului test toate concentrațiile cu efecte observate sunt exprimate ca masă a substanței chimice testate raportată la masa uscată a solului de testare):
|
|
«Substanța chimică» este o substanță sau un amestec.
|
|
|
«NOEC» (concentrația la care nu se observă niciun efect) reprezintă concentrația substanței chimice de testare în cazul căreia nu se observă niciun efect. În cadrul prezentului test, concentrația corespunzătoare NOEC nu prezintă niciun efect semnificativ din punct de vedere statistic (p < 0,05) pe parcursul unei perioade de expunere date comparativ cu proba de control.
|
|
|
«LOEC» (concentrația cea mai scăzută pentru care este observat un efect) reprezintă concentrația cea mai scăzută a substanței chimice de testare care prezintă un efect semnificativ (p < 0,05) pe parcursul unei perioade de expunere date comparativ cu proba de control.
|
|
|
«ECx» (concentrația efectivă pentru un efect de x %) reprezintă concentrația care determină un efect de x % asupra organismelor de testare pe parcursul unei perioade de expunere date comparativ cu o probă de control. De exemplu, o EC50 reprezintă o concentrație estimată care determină un efect asupra unui punct final de testare în cazul a 50 % dintr-o populație expusă pe parcursul unei perioade de expunere.
|
|
|
«Substanța chimică de testare» reprezintă orice substanță sau amestec testat utilizând prezenta metodă de testare.
|
Apendicele 2
Determinarea capacității maxime a solului de retenție a apei
Următoarea metodă pentru determinarea capacității maxime a solului de retenție a apei este considerată a fi una adecvată. Aceasta este descrisă în anexa C din ISO DIS 11268-2 [Soil Quality – Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction (23)].
Se prelevează o cantitate definită (de exemplu, 5 g) din substratul de sol de testare cu ajutorul unui dispozitiv de prelevare adecvat (tub cu sfredel etc.). Se acoperă fundul tubului cu o bucată de hârtie de filtru îmbibată cu apă și apoi se așează pe un suport într-o baie de apă. Tubul trebuie scufundat treptat până ce nivelul apei depășește nivelul solului. Acesta trebuie apoi ținut în apă timp de aproximativ trei ore. Întrucât apa absorbită de capilarele solului nu poate fi reținută în totalitate, aceasta trebuie lăsată să se evapore din proba de sol timp de două ore prin amplasarea tubului pe un pat de nisip cuarțos fin măcinat și foarte umed într-un vas acoperit (pentru a preveni uscarea acestuia). Proba trebuie apoi cântărită, uscată la o temperatură de 105 °C până ce atinge o masă constantă. Capacitatea de retenție a apei (WHC) poate fi apoi calculată după cum urmează:

unde:
S= masa substratului saturat în apă + masa tubului + masa hârtiei de filtru
T= tara (masa tubului + masa hârtiei de filtru)
D= masa uscată a substratului
Apendicele 3
Determinarea pH-ului solului
Următoarea metodă pentru determinarea pH-ului solului se bazează pe descrierea din ISO DIS 10390: Soil Quality – Determination of pH (16).
O cantitate definită de sol este uscată la temperatura camerei timp de cel puțin 12 ore. Se prepară apoi o suspensie a solului (conținând cel puțin 5 grame de sol) într-o cantitate echivalentă cu de cinci ori volumul său de soluție de clorură de potasiu (KCl) 1 M de puritate analitică sau de soluție de clorură de calciu (CaCl2) 0,01 M de puritate analitică. Ulterior, suspensia este agitată bine timp de cinci minute și lăsată să se sedimenteze timp de cel puțin 2 ore, însă nu mai mult de 24 de ore. pH-ul fazei lichide este apoi măsurat cu ajutorul unui pH-metru care a fost calibrat înaintea fiecărei măsurători utilizând o serie corespunzătoare de soluții-tampon (de exemplu, pH 4,0 și 7,0).
Apendicele 4
Creșterea acarianului Hypoaspis (Geolaelaps ) aculeifer, a acarienilor utilizați ca hrană și sincronizarea culturilor
Creșterea acarianului Hypoaspis (Geolaelaps) aculeifer:
Culturile pot fi menținute în vase din plastic sau în borcane din sticlă umplute cu un amestec din ipsos de Paris și de pulbere de cărbune (9:1). Ipsosul poate fi menținut umed prin adăugarea a câtorva picături de apă distilată sau deionizată, dacă este necesar. Temperaturile de creștere optime sunt cuprinse între 20 ± 2 °C, regimul lumină/întuneric nu este relevant pentru această specie. Prada poate fi constituită din acarieni Typrophagus putrescentiae sau Caloglyphus sp. (acarienii utilizați ca hrană trebuie manipulați cu atenție întrucât ar putea provoca alergii la om), însă și nematodele, enchitreidele și colembolele sunt adecvate ca pradă. Sursa lor trebuie înregistrată. Dezvoltarea populației poate începe cu o singură femelă, deoarece masculii se dezvoltă în ouă nefecundate. Generațiile se suprapun într-o mare măsură. O femelă poate trăi cel puțin 100 de zile și poate depune aproximativ 100 de ouă pe parcursul întregii sale durate de viață. Nivelul maxim de pontă ovulară este atins între 10 și 40 de zile (după atingerea stadiului de adult) și se ridică la un număr de 2,2 ouă femelă– 1 zi– 1. Perioada de dezvoltare de la stadiul de ou la cel de femelă adultă este de aproximativ 20 de zile la o temperatură de 20 °C. Trebuie menținute și tratate mai multe culturi în prealabil.
Creșterea acarianului Typrophagus putrescentiae:
Acarienii sunt ținuți într-un vas de sticlă umplut cu drojdie fină de bere uscată, care este introdus într-o găleată din plastic umplută cu soluție de KNO3 pentru a împiedica acarienii să scape. Acarienii utilizați pentru hrană sunt așezați deasupra acestui strat de drojdie urcată. Ulterior, cu ajutorul unei spatule, aceștia sunt amestecați atent cu drojdia (care trebuie înlocuită de două ori pe săptămână).
Sincronizarea culturilor:
Exemplarele utilizate în cadrul testului trebuie să aibă aceeași vârstă (aproximativ 7 zile după atingerea stadiului de adult). La o temperatură de creștere de 20 °C, sincronizarea se realizează astfel:
Se transferă femelele într-un vas de creștere curat și se adaugă suficientă hrană
|
—
|
Se lasă femelele să depună ouă timp de două-trei zile și apoi se scot din vas
|
|
—
|
Se prelevează femelele adulte pentru testare între cea de a 28-a și a 35-a zi după introducerea femelelor adulte în vase de creștere curate.
|
Femelele adulte pot fi ușor diferențiate de masculi și de cele aflate în alte stadii de dezvoltare prin dimensiunea lor mai mare, prin forma umflată și prin scutul dorsal de culoare maro (masculii sunt mai subțiri și plați), iar acarienii imaturi au o culoare alb-crem. Dezvoltarea acarienilor urmează aproximativ același tipar descris mai jos la o temperatură de 20 °C (figura): ou 5 zile, larvă 2 zile, protonimfă 5 zile, deutonimfă 7 zile, perioada anterioară pontei ovulare a femelei 2 zile. Apoi, acarienii devin adulți.
Figură
Dezvoltarea acarianului Hypoaspis (Geolaelaps) aculeifer la o temperatură de 20 °C. (extracție = femele utilizate pentru test)

Animalele adulte pentru testare sunt extrase din cultura sincronizată și introduse în vasele de testare între cea de a 28-a zi și cea de a 35-a zi după începerea perioadei de pontă a femelelor părinți (și anume, 7-14 zile după trecerea la stadiul de adult). Aceasta garantează faptul că animalele pentru testare au trecut deja de perioada anterioară pontei ovulare și s-au împerecheat cu masculii prezenți, de asemenea, în vasul de cultură. Observațiile efectuate pe culturile de laborator sugerează că, dacă masculii sunt prezenți, femelele se împerechează imediat sau la scurt timp după trecerea în stadiul de adult (Ruf, Vaninnen, obs. pers.). Perioada de șapte zile este aleasă pentru a facilita integrarea în rutina de laborator și pentru a atenua variabilitatea de dezvoltare individuală în rândul acarienilor. Ponta ovulară trebuie inițiată cu un număr de femele cel puțin egal cu cel care va fi în final necesar pentru test (Dacă, de exemplu, sunt necesare 400 de femele în cadrul testului, cel puțin 400 de femele trebuie lăsate să depună ouă timp de două-trei zile. Cel puțin 1 200 de ouă trebuie să reprezinte punctul de pornire pentru populația sincronizată (proporția relativă a sexelor fiind de aproximativ 0,5, rata mortalității, de aproximativ 0,2). Pentru a se evita canibalismul, este de preferat să nu se introducă într-un vas mai mult de 20-30 de femele aflate în perioada de pontă ovulară.
Apendicele 5
Metode de extracție
În cazul microartropodelor, o extracție la căldură reprezintă o metodă adecvată pentru separarea exemplarelor de sol/substrat (a se vedea figura de mai jos). Metoda se bazează pe activitatea organismelor, astfel că doar exemplarele mobile vor avea șansa de a fi înregistrate. Principiul extracției la căldură constă în degradarea progresivă a condițiilor pentru organismele din eșantion, astfel încât acestea vor părăsi substratul și vor cădea într-un lichid de fixare (de exemplu, etanol). Punctele esențiale sunt durata extracției și variația condițiilor pentru organisme de la bune la moderate și precare. Durata extracției pentru testele ecotoxicologice trebuie să fie cât mai scurtă posibil, deoarece orice creștere a populației pe parcursul perioadei de extracție ar vicia rezultatele. Pe de altă parte, condițiile de temperatură și de umiditate din eșantion trebuie să se încadreze întotdeauna într-un interval care să permită deplasarea acarienilor. Încălzirea unui eșantion de sol conduce la o deshidratare a substratului. Dacă deshidratarea este prea rapidă, anumiți acarieni ar putea să se deshidrateze la rândul lor înainte de a reuși să scape.
Prin urmare, este propusă următoarea procedură (24) (25):
|
|
Aparatură: pâlnie Tullgren sau metode comparabile precum, de exemplu, metoda McFadyen (încălzire pe deasupra, eșantionul este așezat pe o pâlnie)
|
|
|
Regimul de încălzire: 25 °C timp de 12 ore, 35 °C timp de 12 ore, 45 °C timp de 24 de ore (în total 48 de ore). Temperatura trebuie măsurată în substrat.
|
|
|
Lichidul de fixare: etanol la 70 %
|
|
|
Detalii: Luați flaconul din sticlă care a fost utilizat pentru test. Scoateți capacul și înfășurați gura flaconului cu o bucată de plasă sau de țesătură. Țesătura trebuie să aibă o dimensiune a ochiurilor cuprinsă între 1,0 și 1,5 mm. Fixați țesătura cu o bandă elastică. Răsturnați cu atenție flaconul și așezați-l în aparatul de extracție. Țesătura împiedică substratul să se scurgă în lichidul de fixare, însă permite acarienilor să iasă din eșantion. Începeți procesul de încălzire după introducerea tuturor flacoanelor. Încheiați extracția după 48 de ore. Îndepărtați flacoanele de fixare și numărați acarienii cu ajutorul unui microscop de disecție.
|
Eficiența de extracție a metodei alese trebuie să fi fost demonstrată o dată sau de două ori pe an cu ajutorul unor vase care conțin un număr cunoscut de exemplare tinere și de acarieni adulți crescuți într-un substrat de testare netratat. Eficiența trebuie să fie ≥ 90 % în medie combinată pentru toate stadiile de dezvoltare.
Dispozitivul de extracție de tip Tullgren

Modul de pregătire a flaconului de testare după finalizarea testului, înainte de extracție

Apendicele 6
Identificarea acarianului Hypoaspis (Geolaelaps ) aculeifer
|
Subclasă/ordin/subordin:
|
|
Familia:
|
|
Genul/subgenul/specia:
|
|
Acarieni/Parazitiforme/Gamasida
|
|
Laelapidae
|
|
Hypoaspis (Geolaelaps) aculeifer
|
|
Autorul și data:
|
F. Faraji, Ph.D. (MITOX), 23 ianuarie 2007
|
|
Bibliografie
|
Karg, W. (1993). Die freilebenden Gamasina (Gamasides), Raubmilben. Tierwelt Deutschlands 59, a 2-a ediție revizuită: 1-523.
Hughes, A.M. (1976). The mites of stored food and houses. Ministry of Agriculture, Fisheries and Food, Technical Bulletin 9: 400pp.
Krantz, G.W. (1978). A manual of Acarology. Oregon State University Book Stores, Inc., 509 pp.
|
|
Caracteristici de determinare:
|
Înveliș cu marginea denticulată rotunjită; caneluri hipostomatice cu mai mult de 6 denticule; peri dorsali caudali Z4 nu foarte lungi; peri dorsali setiformi; scut genital normal, nu foarte dezvoltat și care nu atinge scutul anal; partea posterioară a scutului dorsal fără peri nepereche; picioarele II și IV cu câțiva peri mari și groși; păr dorsal Z5 de aproape două ori mai lung decât J5; deget fix de chelicer cu 12-14 dinți și deget mobil cu 2 dinți; Idiosoma 520-685 μm lungime.
Hypoaspis miles este utilizat și în controlul biologic și poate fi confundat cu H. aculeifer. Principala diferență este:
H. miles aparține subgenului Cosmolaelaps și are peri dorsali sub formă de lamă în timp ce H. aculeifer aparține subgenului Geolaelaps ași are peri dorsali setiformi.
|

Apendicele 7
Informații de bază privind biologia acarianului Hypoaspis (Geolaelaps) aculeifer
Hypoaspis aculeifer aparține familiei Lealapidae, ordinul Acari (acarieni), clasa Arahnide, încrengătura Arthropoda. Aceștia trăiesc în toate tipurile de sol și se hrănesc cu alți acarieni, nematode, enchitreide și colembole (26). În lipsă de hrană, aceștia devin canibali (27). Acarienii prădători sunt segmentați în Idiosoma și Gnathosoma. Nu există o diferențiere clară între Idiosoma din Prosoma (cap) și Opisthosoma (abdomen). Gnathosoma (scutul de pe cap) conține instrumentele de hrănire precum pedipalpi și chelicere. Chelicerele sunt trifurcate și prevăzute cu dinți de diferite forme. În afară de ingestie, masculii își folosesc chelicerele în principal pentru transferul spermatoforelor la femele. Idiosoma este acoperită aproape în totalitate de un scut dorsal. O mare parte din idiosoma femelei este ocupată de organele de reproducere care se pot distinge în special cu puțin timp înainte de pontă. Pe partea ventrală, se găsesc două scuturi, scutul sternal și scutul genital. Toate picioarele sunt prevăzute cu țepi și gheare. Țepii sunt folosiți pentru ancorare în timpul deplasării în sol și pe sol. Prima pereche de picioare este utilizată în principal ca antenă. A doua pereche de picioare este utilizată nu numai pentru deplasare, ci și pentru imobilizarea prăzii. Ghearele de la cea de a patra pereche de picioare pot servi ca protecție, precum și ca «motor de deplasare» (28). Masculii au o lungime cuprinsă între 0,55 și 0,65 mm și o greutate cuprinsă între 10 și 15 μg. Femelele au o lungime cuprinsă între 0,8 și 0,9 mm și o greutate cuprinsă între 50 și 60 μg (8) (28) (Fig. 1).
Figura 1
Femelă, mascul, protonimfă și larvă de H. aculeifer.

La o temperatură de 23 °C, acarienii devin maturi din punct de vedere sexual după 16 zile (femelele) și, respectiv, după 18 zile (masculii) (6). Femelele transportă spermatozoizii prin solenostom de unde vor fi transferați în ovar. În ovar, spermatozoizii trec printr-un proces de maturizare și vor fi stocați. Fertilizarea are loc numai după maturizarea spermatozoizilor în ovar. Ovulele fecundate sau nefecundate vor fi depuse de femele în grămadă sau separat, de preferință în crăpături sau orificii. Femelele care s-au împerecheat pot purta exemplare de ambele sexe, în timp ce ouăle de la femelele care nu s-au împerecheat pot produce doar masculi. Pe parcursul dezvoltării până la stadiul de adult, acarienii traversează patru stadii de dezvoltare (ou – larvă, larvă – protonimfă, protonimfă – deutonimfă, deutonimfă – adult).
Oul este alb lăptos, hialin și eliptic, are o lungime de aproximativ 0,37 mm și o coajă tare. Conform celor menționate în referința (8), larvele au o dimensiune cuprinsă între 0,42 și 0,45 mm. Acestea au doar trei perechi de picioare. În regiunea capului, se dezvoltă pedipalpi și chelicere. Chelicerele, prevăzute cu câțiva dinți mici, sunt folosite pentru eclozare. La ieșirea din cocon, după 1-2 zile de la eclozare, se dezvoltă protonimfele. Acestea sunt, de asemenea, albe, au o dimensiune cuprinsă între 0,45 și 0,62 mm (8) și patru perechi de picioare. Chelicerele sunt în întregime acoperite cu dinți. Din acest stadiu, acarienii încep să își caute hrana. Din acest motiv, cuticula prăzii este străpunsă cu chelicerele și este eliberată în pradă o secreție care permite digestia extraintestinală. Amestecul de hrană poate fi apoi absorbit de către acarian. Chelicerele pot fi utilizate și la sfâșierea bucăților de hrană pentru a extrage din acestea particulele mai mari (28). Deutonimfele se dezvoltă după îndepărtarea unui alt strat al oului. Acestea au o dimensiune cuprinsă între 0,60 și 0,80 mm (8) și au o culoare galbenă spre maro deschis. Din acest stadiu, acestea pot fi separate în femele și masculi. În următoarea fază de eclozare, timp în care animalele sunt inactive și se dezvoltă scutul de culoare maro (după aproximativ 14 zile), acarienii ating stadiul de adulți (28) (29) (30). Ciclul lor de viață este cuprins între 48 și 100 de zile la o temperatură de 25 °C (27).
Apendicele 8
Rezumatul și calendarul principalelor măsuri care trebuie luate pentru efectuarea testului pe hypoaspis
|
Timp (zile)
începutul testului = ziua 0
|
Activitate/sarcină
|
|
Ziua – 35
până la – 28
|
Transferul femelelor din cultura stoc în vase curate pentru inițierea sincronizării
2 zile mai târziu: extracția femelelor
de două-trei ori pe săptămână: furnizarea unei cantități suficiente de hrană
|
|
Ziua – 5 (+/– 2)
|
Pregătirea solului artificial
|
|
Ziua – 4 (+/– 2)
|
Determinarea capacității solului artificial de retenție a apei
Uscare peste noapte
Ziua următoare: cântărirea probelor și calcularea capacității de retenție a apei
|
|
Ziua – 4 (+/– 2)
|
Umezirea în prealabil a solului artificial pentru a atinge 20 – 30 % din capacitatea de retenție a apei
|
|
Ziua 0
|
Începerea testului: adăugarea substanței chimice de testare în solul artificial
Introducerea a 10 femele în fiecare vas duplicat
Cântărirea fiecărei probe duplicat
Pregătirea de probe de control abiotice pentru măsurarea gradului de umezeală și a pH-ului, 2 probe duplicat pentru fiecare tratament
Uscarea peste noapte a probelor de control
Ziua următoare: cântărirea probelor de control pentru determinarea umidității
Ziua următoare: măsurarea pH-ului din probele de control abiotice uscate
|
|
Ziua 3, 6, 9, 12 (aproximativ)
|
Adăugarea în fiecare duplicat a unei cantități suficiente de pradă
Cântărirea fiecărei probe duplicat și,eventual, adăugarea unei cantități de apă echivalente cu cea evaporată
|
|
Ziua 14
|
Încheierea testului, efectuarea extracției din toate probele duplicat și din probele de control pentru verificarea eficienței extracției
Uscarea peste noapte a probelor de control care conțin apă
Ziua următoare: cântărirea probelor de control care conțin apă
Ziua următoare: măsurarea pH-ului din probele de control uscate
|
|
Ziua 16
|
Finalizarea extracției
|
|
Ziua 16 +
|
Înregistrarea numărului de adulți și de exemplare tinere din materialul extras
Raportarea rezultatelor în tabele-tip
Raportarea procedurii de testare în fișele pentru protocoalele de testare
|
C.37. TEST DE 21 DE ZILE PE PEȘTI: SCREENING CU DURATĂ SCURTĂ PENTRU DETECTAREA ACTIVITĂȚII ESTROGENICE ȘI ANDROGENICE ȘI A INHIBĂRII AROMATAZEI
INTRODUCERE
|
1.
|
Această metodă de testare este echivalentă cu Orientarea de testare (test guideline – TG) nr. 230 a OCDE (2009). Necesitatea dezvoltării și validării unui test pe pești capabil să detecteze anumite substanțe chimice active endocrin își are originea în îngrijorările cu privire la faptul că anumite niveluri de substanțe chimice din mediu pot cauza efecte adverse atât oamenilor, cât și faunei sălbatice, din cauza interacțiunii respectivelor substanțe chimice cu sistemul endocrin. În 1998, OCDE a inițiat o activitate prioritară de revizuire a orientărilor existente și de elaborare a unor noi orientări pentru screeningul și testarea unor potențiali perturbatori endocrini. Un element al activității a constat în elaborarea unei orientări de testare pentru screeningul substanțelor chimice active asupra sistemului endocrin al unor specii de pești. Testul de screening endocrin de 21 de zile la pești a făcut obiectul unui amplu program de validare constând în studii interlaboratoare cu substanțe chimice selectate pentru a demonstra relevanța și fiabilitatea testului de detectare a substanțelor chimice estrogenice și inhibitoare ale aromatazei (1, 2, 3, 4, 5) la cele trei specii de pești investigate (Pimephales promelas, Oryzias latipes și peștele-zebră); detectarea activității androgenice este posibilă la Pimephales promelas și Oryzias latipes, dar nu la peștele-zebră. Această metodă de testare nu permite detectarea substanțelor chimice cu efecte antiandrogenice. Activitatea de validare a fost revizuită inter pares de către un grup de experți desemnați de coordonatorii naționali ai programului privind orientarea de testare (6). Testul nu este conceput pentru a identifica mecanismele specifice ale perturbărilor hormonale deoarece animalele testate au axul hipotalamo-hipofizo-gonadal (hypothalamic-pituitary-gonadal – HPG) intact, care poate reacționa la substanțele chimice care au efecte asupra axului HPG la diferite niveluri. Testul de reproducere cu durată scurtă pe pești (TG 229 a OCDE) include fertilitatea și, dacă este cazul, histopatologia gonadală a Pimephales promelas, precum și toți parametri studiați incluși în această metodă de testare. TG 229 a OCDE descrie screeningul substanțelor chimice care afectează reproducerea prin diferite mecanisme, inclusiv endocrine. Acesta fapt ar trebui luat în considerare înainte de selectarea celei mai adecvate metode de testare.
|
|
2.
|
Această metodă de testare descrie un test de screening in vivo în cadrul căruia pești masculi maturi din punct de vedere sexual și pești femele ovulante sunt ținuți împreună și expuși la o substanță chimică pe parcursul unei durate limitate a ciclului lor de viață (21 de zile). La finalul perioadei de expunere de 21 de zile, în funcție de specia testată, se măsoară unul sau doi biomarkeri cu rol de parametru, la masculi și la femele, ca indicatori ai efectelor estrogenice, de inhibare a aromatazei sau androgenice ale substanței chimice testate; acești parametri sunt vitelogenina și caracteristicile sexuale secundare. Vitelogenina se măsoară la Pimephales promelas, la Oryzias latipes și la peștele-zebră, în timp ce caracteristicile sexuale secundare se măsoară doar la Pimephales promelas și la Oryzias latipes.
|
|
3.
|
Acest test biologic servește drept test de screening in vivo pentru anumite moduri endocrine de acțiune, iar aplicarea sa ar trebui considerată în contextul «Cadrului conceptual al OCDE pentru testarea și evaluarea perturbatorilor endocrini» (28).
|
CONSIDERAȚII INIȚIALE ȘI LIMITĂRI
|
4.
|
Vitelogenina este produsă în mod normal de ficatul femelelor vertebrate ovipare ca răspuns la circulația estrogenului endogen. Ea este un precursor al proteinelor din vitellus și, după ce este produsă în ficat, circulă prin sânge la ovar, unde este absorbită și modificată de ouăle în dezvoltare. Vitelogenina este aproape nedetectabilă în plasma peștilor imaturi, femele și masculi, deoarece nu au suficient estrogen circulant; cu toate acestea, ficatul are capacitatea de a sintetiza și de a secreta vitelogenină ca răspuns la o stimulare estrogenică exogenă.
|
|
5.
|
Măsurarea vitelogeninei servește la detectarea substanțelor chimice cu diferite moduri estrogenice de acțiune. Detectarea substanțelor chimice estrogenice este posibilă prin măsurarea inducției vitelogeninei la peștii masculi și a fost amplu documentată în literatura științifică de specialitate revizuită inter pares [ex. (7)]. Inducția vitelogeninei a fost demonstrată și în urma expunerii la androgeni aromatizabili (8, 9). O reducere a nivelului de estrogen circulant la femele, de exemplu prin inhibarea aromatazei care transformă androgenul endogen în estrogenul natural 17β-estradiol, determină o reducere a nivelului de vitelogenină, care se utilizează pentru detectarea substanțelor chimice cu proprietăți de inhibare a aromatazei (10, 11). Relevanța biologică a răspunsului vitelogeninei ca urmare a inhibării estrogenice/a aromatazei este bine stabilită și a fost amplu documentată. Cu toate acestea, este posibil ca producția de vitelogenină la femele să fie afectată și de toxicitatea generală și de modurile de acțiune toxice neendocrine, de exemplu de hepatotoxicitate.
|
|
6.
|
Mai multe metode de măsurare au fost dezvoltate cu succes și standardizate pentru utilizarea de rutină. Acesta este cazul metodelor cu specificitate de specie utilizând testul de imunoabsorbție cu anticorpi marcați enzimatic (ELISA), în care se utilizează imunochimia pentru a cuantifica vitelogenina produsă în probe mici de sânge sau hepatice prelevate de la pești individuali (12, 13, 14, 15, 16, 17, 18). Pentru măsurarea vitelogeninei, de la Pimephales promelasse prelevează probe de sânge, de la peștele-zebră se prelevează probe de sânge sau omogenat din cap/coadă, iar de la Oryzias latipes se prelevează probe hepatice. În cazul Oryzias latipes, există o bună corelație între vitelogenina măsurată în sânge și cea măsurată în ficat (19). În apendicele 6 sunt descrise procedurile recomandate pentru prelevările efectuate în scopul măsurării vitelogeninei. Seturile pentru măsurarea vitelogeninei sunt disponibile pe scară largă; respectivele seturi trebuie să fie bazate pe o metodă ELISA validată, cu specificitate de specie.
|
|
7.
|
Caracteristicile sexuale secundare ale peștilor masculi de anumite specii sunt vizibile la exterior, cuantificabile și sensibile la nivelurile de androgeni endogeni circulanți; acesta este cazul pentru Pimephales promelas și Oryzias latipes – însă nu și pentru peștele-zebră, care nu are caracteristici sexuale secundare cuantificabile. Femelele își păstrează capacitatea de a dezvolta caracteristici sexuale secundare masculine atunci când sunt expuse la substanțe chimice androgenice din apă. În literatura de specialitate există mai multe studii pentru a documenta acest tip de răspuns în cazul Pimephales promelas(20) și al Oryzias latipes (21). O atenuare a caracteristicilor sexuale secundare ale masculilor ar trebui interpretată cu prudență din cauza puterii statistice mici și ar trebui să fie bazată pe opiniile experților și pe greutatea dovezilor. Există limitări în ceea ce privește utilizarea peștelui-zebră în acest test din cauza absenței caracteristicilor sexuale secundare cuantificabile sensibile la substanțe chimice cu efecte androgenice.
|
|
8.
|
În cazul Pimephales promelas, principalul indicator al expunerii la androgeni exogeni este numărul de tuberculi nupțiali situați pe botul femelei. În cazul femelelor de Oryzias latipes, numărul de procese papilare constituie principalul indicator al expunerii exogene la substanțe chimice cu efecte androgenice. Procedurile recomandate pentru evaluarea caracteristicilor sexuale ale Pimephales promelas și, respectiv, ale Oryzias latipes sunt indicate în apendicele 5A și în apendicele 5B.
|
|
9.
|
Definițiile utilizate în cadrul acestei metode de testare sunt prezentate în apendicele 1.
|
PRINCIPIUL TESTULUI
|
10.
|
În cadrul testului, masculii și femelele aflați în stadiu de reproducere sunt expuși împreună în vase de testare. Stadiul de adult și cel reproducător al acestora permite o diferențiere clară a fiecărui sex și, în consecință, o analiză a fiecărui parametru în funcție de sex, și asigură sensibilitatea lor la substanțe chimice exogene. La finalul testului, sexul este confirmat printr-o examinare macroscopică a gonadelor după incizia ventrală a abdomenului cu ajutorul unei foarfeci. O prezentare generală a condițiilor de biotestare relevante este redată în apendicele 2. Testul se efectuează în mod normal pe pești selectați dintr-o populație capabilă să elibereze gameți; nu trebuie utilizate animale senescente. Orientarea privind vârsta peștilor și stadiul de reproducere al acestora este inclusă în secțiunea privind selectarea speciei de pește. Testul este realizat utilizând trei concentrații de expunere la substanțe chimice, precum și un vas de control cu apă și un vas de control cu solvent, dacă este necesar. Pentru fiecare tratament se utilizează două vase sau vase duplicat (fiecare vas conținând 5 masculi și 5 femele) în cazul Oryzias latipes și al peștelui-zebră și patru vase sau vase duplicat (fiecare vas conținând 2 masculi și 4 femele) în cazul Pimephales promelas. Acest principiu permite acomodarea comportamentului teritorial al masculului de Pimephales promelas menținând în aceleași timp o putere suficientă a testului. Expunerea se realizează timp de 21 de zile, iar prelevarea de probe de la pești se efectuează în cea de a 21 zi de expunere.
|
|
11.
|
După prelevarea de probe în cea de a 21-a zi, toate animalele sunt eutanasiate. Caracteristicile sexuale secundare se măsoară în cazul Pimephales promelas și al Oryzias latipes (a se vedea apendicele 5A și apendicele 5B); se prelevează probe de sânge pentru determinarea vitelogeninei de la peștele-zebră și de la Pimephales promelas, ca alternativă putându-se preleva probe de la cap/coadă pentru determinarea vitelogeninei la peștele-zebră (apendicele 6); pentru măsurarea VTG în cazul Oryzias latipes se prelevează probe din ficat (apendicele 6).
|
CRITERII DE ACCEPTARE A TESTULUI
|
12.
|
Pentru ca rezultatele testului să fie acceptabile, trebuie să îndeplinească următoarele condiții:
|
—
|
mortalitatea din vasele de control cu apă (sau cu solvent) nu trebuie să depășească 10 % la încheierea perioadei de expunere;
|
|
—
|
concentrația oxigenului dizolvat trebuie să fie pe parcursul întregii perioade de expunere de cel puțin 60 % din valoarea de saturație din aer (VSA);
|
|
—
|
temperatura apei nu trebuie să difere cu mai mult de ± 1,5 °C între vasele de testare în niciun moment pe parcursul perioadei de expunere și trebuie să fie menținută într-un interval de 2 °C în limitele de temperatură specificate pentru speciile testate (apendicele 2);
|
|
—
|
trebuie să existe dovezi care să demonstreze menținerea satisfăcătoare în soluție a concentrațiilor substanței chimice utilizate în test în intervalul de ± 20 % din valorile medii măsurate.
|
|
DESCRIEREA METODEI
Aparatură
|
13.
|
Echipamentul obișnuit de laborator și în special următoarele:
|
(a)
|
pH-metru și aparat de măsurare a oxigenului;
|
|
(b)
|
echipament pentru determinarea durității și alcalinității apei;
|
|
(c)
|
aparatură adecvată pentru controlul temperaturii, de preferat cu monitorizare continuă;
|
|
(d)
|
bazine din material chimic inert și de capacitate adaptată la încărcarea și densitatea populației recomandate (a se vedea apendicele 2);
|
|
(e)
|
substrat de reproducere pentru Pimephales promelas și peștele-zebră, apendicele 4 conține detaliile necesare;
|
|
(f)
|
balanță cu precizie adecvată (adică precizie de ± 0,5 mg).
|
|
Apă
|
14.
|
În cadrul testului poate fi utilizat orice tip de apă în care specia testată supraviețuiește și crește o perioadă îndelungată corespunzătoare. Apa trebuie să fie de calitate constantă pe durata testului. Trebuie să aibă un pH cuprins în intervalul 6,5 – 8,5, dar pe durata unui test pH-ul trebuie să se încadreze într-un interval de ± 0,5 unități. Pentru a garanta faptul că apa de diluție nu influențează în mod negativ rezultatul testului (de exemplu prin formarea de complexe ale substanței chimice utilizate în testare) trebuie prelevate periodic probe pentru analiză. De exemplu, la fiecare trei luni trebuie măsurate metale grele (ex., Cu, Pb, Zn, Hg, Cd, și Ni), anioni și cationi majori (ex., Ca2+, Mg2+, Na+, K+, Cl– și SO4
2–), pesticide (ex., organofosforice totale și organoclorurate totale), carbon organic total și solide în suspensie în cazul în care apa de diluție este cunoscută ca având calitate constantă. Dacă s-a demonstrat că apa are calitate constantă pe parcursul unei perioade de cel puțin un an, analizele se pot efectua la intervale mai mari (de exemplu, la fiecare șase luni). Anumite caracteristici chimice ale unei ape de diluție acceptabile sunt prezentate în apendicele 3.
|
Soluții de testare
|
15.
|
Soluțiile de testare în concentrațiile alese se prepară prin diluarea unei soluții stoc. Soluția stoc se prepară de preferință prin simpla amestecare sau agitare a substanței chimice de testare în apa de diluție utilizând mijloace mecanice (de exemplu, un agitator sau cu ajutorul ultrasunetelor). Pentru obținerea unei soluții stoc cu o concentrație corespunzătoare se pot utiliza coloane de saturare (coloane de solubilitate). Nu se recomandă utilizarea unui solvent purtător. Cu toate acestea, în cazul în care este necesară utilizarea unui solvent, trebuie testat în paralel un vas de control cu solvent la aceeași concentrație ca cea a substanțelor chimice utilizate în tratamente. În cazul substanțelor chimice care sunt dificil de testat, un solvent poate constitui cea mai bună soluție din punct de vedere tehnic; trebuie consultat documentul de orientare al OCDE privind testarea toxicității acvatice a substanțelor și amestecurilor dificile (22). Alegerea solventului va fi determinată de proprietățile chimice ale substanței chimice. Documentul de orientare al OCDE recomandă să nu se depășească o concentrație maximă de 100μl/l. Cu toate acestea, o analiză recentă (23) a evidențiat îngrijorări suplimentare generate de utilizarea solvenților pentru testarea activității endocrine. Prin urmare, se recomandă reducerea la minimum concentrației solventului, dacă este necesar și dacă este posibil din punct de vedere tehnic (în funcție de proprietățile fizico-chimice ale substanței chimice utilizate în testare).
|
|
16.
|
Va fi utilizat un sistem de testare cu flux continuu. Un astfel de sistem alimentează și diluează continuu o soluție stoc conținând substanța chimică utilizată în testare (de exemplu, pompă dozatoare, diluator proporțional, sistem de saturare) pentru a furniza o serie de concentrații în incintele de testare. Debitele soluțiilor stoc și ale apei de diluție trebuie verificate periodic, de preferință zilnic, pe durata testului și nu trebuie să varieze cu mai mult de 10 % pe parcursul întregului test. Trebuie evitată utilizarea unor tuburi din plastic de calitate inferioară sau a altor materiale care pot conține substanțe biologic active. În momentul selectării materialului pentru sistemul de testare cu flux continuu trebuie luată în considerare posibila absorbție a substanței de testare de către respectivul material.
|
Alegerea peștilor
|
17.
|
Peștii de testare trebuie selectați dintr-o populație de laborator, de preferință dintr-un singur stoc, care a fost aclimatizată timp de cel puțin două săptămâni înainte de test în condiții de calitate a apei și de expunere la lumină similare celor utilizate în test. Este important ca rata de încărcare și densitatea populației (pentru definiții, a se vedea apendicele 1) să fie adecvate pentru speciile utilizate în cadrul testului (a se vedea apendicele 2).
|
|
18.
|
După o perioadă de aclimatizare de 48 de ore, se înregistrează mortalitățile și se aplică următoarele criterii:
|
—
|
mortalități mai mari de 10 % din populație în șapte zile: se respinge întregul lot;
|
|
—
|
mortalități între 5 % și 10 % din populație: aclimatizare timp de alte șapte zile; dacă mortalitatea este mai mare de 5 % în timpul celei de a doua perioade de șapte zile, întregul lot se respinge;
|
|
—
|
mortalități mai mici de 5 % din populație în șapte zile: se acceptă întregul lot
|
|
|
19.
|
Peștii nu trebuie tratați de boli pe parcursul perioadei de aclimatizare, în perioada de preexpunere sau pe parcursul perioadei de expunere.
|
Preexpunerea și selectarea peștilor
|
20.
|
Se recomandă o perioadă de preexpunere de o săptămână pe parcursul căreia animalele sunt introduse în vase similare cu cele utilizate în cadrul testului propriu-zis. Peștii trebuie hrăniți ad libitum pe parcursul întregii perioade de reținere și în faza de expunere. Faza de expunere începe cu pești adulți dimorfici din punct de vedere sexual selectați dintr-o populație de animale de laborator mature din punct de vedere reproductiv (de exemplu, prezentând caracteristici sexuale secundare clare, vizibile în cazul Pimephales promelas și al Oryzias latipes) și care eliberează activ gameți. Exclusiv pentru o orientare generală (și fără ca acest fapt să fie luat în considerare independent de observarea stadiului efectiv de reproducere al unui anumit lot de pești), Pimephales promelas trebuie să aibă aproximativ 20 (± 2) de săptămâni, presupunând că au fost crescuți la o temperatură de 25 ± 2 °C pe parcursul întregii lor vieți. Oryzias latipes trebuie să aibă aproximativ 16 (± 2) săptămâni, presupunând că au fost crescuți la o temperatură de 25 ± 2 C pe parcursul întregii lor vieți. Peștii-zebră trebuie să aibă aproximativ 16 (± 2) săptămâni, presupunând că au fost crescuți la o temperatură de 26 ± 2 °C pe parcursul întregii lor vieți.
|
PROTOCOLUL TESTULUI
|
21.
|
Se utilizează trei concentrații ale substanței chimice de testare, un vas de control (apă) și, dacă este necesar, un vas de control cu solvent. Datele pot fi analizate pentru a determina diferențele semnificative din punct de vedere statistic dintre răspunsurile corespunzătoare tratamentului și vaselor de control. Aceste analize vor oferi informații cu privire la necesitatea efectuării unor teste suplimentare pe termen mai lung pentru a se detecta posibile efecte adverse (și anume, asupra supraviețuirii, dezvoltării, creșterii și reproducerii) ale substanței chimice, în loc de a fi utilizate în cadrul evaluării riscurilor (24).
|
|
22.
|
În cazul peștelui-zebră și al Oryzias latipes, în cea de a 21-a zi a experimentului, sunt prelevate probe de la masculi și femele pentru fiecare nivel de tratament (5 masculi și 5 femele din fiecare dintre cele două vase duplicat) și din vasul sau vasele de control pentru a măsura vitelogenina și a evalua caracteristicile sexuale secundare, după caz. În cazul Pimephales promelas, în cea de a 21-a zi de expunere, sunt prelevate probe de la masculi și femele (2 masculi și 4 femele din fiecare dintre cele patru vase duplicat) și din vasul sau vasele de control pentru a măsura vitelogenina și a evalua caracteristicile sexuale secundare.
|
Selectarea concentrațiilor de testare
|
23.
|
În scopurile acestui test, cea mai mare concentrație de testare trebuie stabilită fie la concentrația maximă tolerată (CMT) obținută cu ajutorul unei metode de determinare a intervalului sau din alte date privind toxicitatea, fie la valoarea de 10 mg/l, fie la valoarea corespunzătoare solubilității maxime în apă, oricare este cea mai mică. CMT este definită ca fiind cea mai mare concentrație de testare a substanței chimice având ca rezultat o rată a mortalității mai mică de 10 %. Utilizarea acestei metode presupune existența unor date empirice privind toxicitatea acută sau a altor date privind toxicitatea pe baza cărora poate fi estimată CMT. Estimarea CMT poate fi inexactă și, în general, necesită o anumită analiză profesională.
|
|
24.
|
Sunt necesare trei concentrații de testare, diferențiate printr-un factor constant care nu depășește valoarea 10, și un control cu apă de diluție (și un control cu solvent, dacă este necesar). Se recomandă ca factorii de diferențiere să se încadreze în intervalul 3,2 și 10.
|
PROCEDURA
Selectarea și cântărirea peștilor pentru testare
|
25.
|
Este important ca diferențele de greutate a peștilor să fie reduse la minimum la începutul testului. În apendicele 2 sunt prezentate intervalele recomandate de mărime corespunzătoare diferitelor specii pentru acest test. Pentru întregul lot de pești utilizați în cadrul testului, intervalul greutăților individuale ale masculilor și femelelor la începutul testului trebuie menținut, dacă este posibil, în limite de ± 20 % din media aritmetică a greutății fiecărui sex. Se recomandă cântărirea unui subeșantion din stocul de pești înainte de testare pentru a estima greutatea medie.
|
Condiții de expunere
Durată
|
26.
|
Durata testului este de 21 de zile după o perioadă de preexpunere. Perioada de preexpunere recomandată este de o săptămână.
|
Hrănirea
|
27.
|
Peștii trebuie hrăniți ad libitum cu hrană corespunzătoare (apendicele 2) într-o cantitate suficientă pentru menținerea condiției fizice. Trebuie evitată proliferarea microbilor și apariția turbidității apei. Ca orientare generală, rația zilnică poate fi împărțită în două sau trei porții egale administrate de mai multe ori pe zi, la intervale de cel puțin trei ore. Se acceptă o singură rație mai mare în special în weekenduri. Peștii nu trebuie hrăniți timp de 12 ore înainte de prelevarea probelor/necropsie.
|
|
28.
|
Hrana peștilor trebuie evaluată pentru a detecta contaminanți precum pesticide organoclorurate, hidrocarburi aromatice policiclice (HAP), bifenili policlorurați (BPC). Trebuie evitate alimente cu un nivel înalt de fitoestrogeni care ar compromite răspunsul în cadrul testului la un agonist de estrogen cunoscut (de exemplu, 17-beta estradiol).
|
|
29.
|
Hrana neconsumată și materiile fecale trebuie înlăturate din vasele de testare cel puțin de două ori pe săptămână, de exemplu prin curățarea cu grijă a fundului fiecărui bazin cu ajutorul unui sifon.
|
Lumina și temperatura
|
30.
|
Perioada de expunere la lumină și temperatura apei trebuie să fie adecvate pentru specia testată (apendicele 2).
|
Frecvența determinărilor și măsurătorilor analitice
|
31.
|
Înainte de începerea perioadei de expunere, trebuie asigurată funcționarea corespunzătoare a sistemului de alimentare cu substanța chimică. Trebuie stabilite toate metodele analitice necesare, incluzând cunoștințe suficiente privind stabilitatea substanței chimice în sistemul de testare. Pe parcursul testului, concentrațiile substanței chimice de testare sunt determinate la intervale regulate, astfel: debitul diluantului și cel al soluției stoc toxice trebuie verificate, de preferat zilnic, însă de cel puțin două ori pe săptămână, iar aceste fluxuri nu trebuie să varieze cu mai mult de 10 % pe întreaga durată a testului. Se recomandă măsurarea concentrațiilor efective ale substanței chimice de testare în toate vasele la începutul testului și, ulterior, săptămânal.
|
|
32.
|
Se recomandă ca rezultatele să fie fundamentate pe concentrațiile măsurate. Cu toate acestea, în cazul în care concentrația substanței chimice de testare în soluție a fost menținută în mod satisfăcător pe tot parcursul testului într-un interval de ±20 % din concentrația nominală, rezultatele pot fi fundamentate fie pe valorile nominale, fie pe cele măsurate.
|
|
33.
|
Poate fi necesară filtrarea probelor (de exemplu, cu ajutorul unui filtru cu pori de 0,45μμm) sau centrifugarea lor. Dacă este necesară, procedura recomandată este centrifugarea. Cu toate acestea, dacă materialul de testare nu se absoarbe în filtre, filtrarea este de asemenea acceptabilă.
|
|
34.
|
Pe parcursul testului, oxigenul dizolvat, temperatura și pH-ul trebuie măsurate în toate vasele de testare cel puțin o dată pe săptămână. Duritatea și alcalinitatea totale trebuie măsurate cel puțin o dată pe săptămână în vasele de control și în vasul cu cea mai înaltă concentrație. Este de preferat ca temperatura să fie monitorizată continuu cel puțin într-unul dintre vasele de testare.
|
Observații
|
35.
|
O serie de răspunsuri biologice generale (de exemplu, supraviețuirea) și esențiale (de exemplu, nivelurile de vitelogenină) sunt evaluate pe parcursul testului sau la încheierea acestuia. Măsurarea și evaluarea acestor parametri și utilitatea lor sunt descrise în continuare.
|
Supraviețuire
|
36.
|
Peștii trebuie examinați zilnic pe parcursul perioadei de testare și orice caz de deces trebuie înregistrat, iar peștii morți trebuie îndepărtați cât mai rapid posibil. Peștii morți nu trebuie înlocuiți în vasele de control sau în vasele de tratament. Sexul peștilor morți în timpul testului trebuie stabilit printr-o evaluare macroscopică a gonadelor.
|
Comportament și aspect
|
37.
|
Trebuie notat orice comportament anormal (în raport cu grupul de control); acesta ar putea include semne ale toxicității generale, inclusiv hiperventilația, înotul necoordonat, pierderea echilibrului, imobilitate sau hrănire atipice. În plus, trebuie observate anomaliile externe (precum hemoragia, modificările de culoare). Astfel de semne de toxicitate trebuie luate în considerare cu atenție în timpul interpretării datelor, deoarece ele pot indica concentrații la care biomarkerii activității endocrine nu sunt fiabili. Aceste observații referitoare la comportament pot furniza, de asemenea, informații calitative utile pentru potențialele viitoare cerințe în materie de testare a peștilor. De exemplu, a fost observată o agresivitate teritorială la masculii normali sau la femele masculinizate de Pimephales promelas prin expunere la androgenice; în cazul peștelui-zebră, comportamentul caracteristic de împerechere și de eliberare de gameți după răsăritul soarelui este redus sau stânjenit de expunerea la estrogenice sau la antiandrogenice.
|
|
38.
|
Deoarece anumite elemente legate de aspect (în primul rând culoarea) se pot modifica rapid în timpul manipulării, este important să se realizeze observații calitative înainte de eliminarea animalelor din sistemul de testare. Experiența de până în prezent în ceea ce privește Pimephales promelas sugerează că anumite substanțe chimice care acționează la nivel endocrin pot induce inițial modificări ale următoarelor caracteristici exterioare: culoarea corpului (deschisă sau închisă), modele de colorație (prezența unor dungi verticale) și forma corpului (regiunea capului și regiunea pectorală). Prin urmare, trebuie realizate observații privind aspectul fizic al peștilor pe parcursul testului și la încheierea studiului.
|
Eutanasierea peștilor
|
39.
|
În ziua 21, adică la încheierea perioadei de expunere, peștii trebuie eutanasiați cu ajutorul unor cantități corespunzătoare de tricaină [metan sulfonat de tricaină, metacaină, MS-222 (CAS 886-86-2), 100-500 mg/l, tamponată cu 300 mg/l NaHCO3 (bicarbonat de sodiu, CAS 144-55-8) pentru a reduce iritația mucoaselor; apoi sunt prelevate probe de sânge sau de țesut pentru determinarea vitelogeninei, conform explicațiilor din secțiunea privind vitelogenina.
|
Observarea caracteristicilor sexuale secundare
|
40.
|
Anumite substanțe chimice care acționează la nivel endocrin pot induce modificări ale caracteristicilor sexuale secundare specializate (numărul de tuberculi nupțiali la masculul de Pimephales promelas, procesele papilare la masculul de Oryzias latipes). În special, substanțele chimice cu anumite moduri de acțiune pot cauza apariția anormală a unor caracteristici sexuale secundare la animalele de sex opus; de exemplu, agoniști ai receptorilor androgenici, cum ar fi trenbolonul, metiltestosteronul și dihidrotestosteronul pot cauza dezvoltarea de tuberculi nupțiali proeminenți la femelele de Pimephales promelas sau dezvoltarea de procese papilare la femelele de Oryzias latipes (11, 20, 21). De asemenea, s-a raportat faptul că agoniștii receptorilor estrogenici pot reduce numărul de tuberculi nupțiali și dimensiunea depozitelor subcutanate dorsale ale masculilor adulți (25, 26). Aceste observații morfologice macroscopice pot furniza informații calitative și cantitative utile pentru potențialele viitoare cerințe privind testarea peștilor. Numărul și dimensiunea tuberculilor nupțiali ai Pimephales promelas și ale procesele papilare ale Oryzias latipes pot fi cuantificate direct sau, mai practic, în eșantioanele conservate. Procedurile recomandate pentru evaluarea caracteristicilor sexuale secundare la Pimephales promelas și la Oryzias latipes sunt disponibile în apendicele 5A și, respectiv, apendicele 5B.
|
Vitelogenina (VTG)
|
41.
|
Se prelevează sânge din artera/vena caudală cu un tub capilar microhematocrit heparinizat sau, alternativ, printr-o puncție cardiacă cu ajutorul unei seringi. În funcție de mărimea peștelui, volumul de sânge prelevat se încadrează în general între 5 și 60 μl pe individ în cazul Pimephales promelas și între 5 și 15 μl pe individ în cazul peștelui-zebră. Plasma este separată de sânge prin centrifugare și este depozitată cu inhibitori de protează la o temperatură de – 80 °C până ce este analizată pentru a măsura vitelogenina. Alternativ, în cazul Oryzias latipes se va utiliza ficatul, iar în cazul peștelui-zebră, omogenatul de cap/coadă poate fi utilizat ca țesut-sursă pentru determinarea vitelogeninei (apendicele 6). Măsurarea VTG trebuie să se bazeze pe o metodă ELISA omoloagă validată, utilizând un standard omolog de VTG și anticorpi omologi. Se recomandă utilizarea unei metode capabile să detecteze nivelurile de VTG de ordinul a câteva ng/ml de plasmă (sau ng/mg de țesut), care reprezintă nivelul de fond la masculii neexpuși.
|
|
42.
|
Controlul calității măsurării vitelogeninei se va realiza prin utilizarea de soluții standard, de probe-martor și, cel puțin, de teste duplicat. Pentru fiecare metodă ELISA, trebuie realizat un test al efectului matricial (efectul de diluție a probei) pentru a determina factorul de diluție minimă a probei. Fiecare placă ELISA utilizată pentru testele VTG trebuie să includă următoarele probe de control al calității: cel puțin 6 soluții standard de calibrare care acoperă intervalul de concentrații de vitelogenină preconizate și cel puțin o probă-martor de testare de legare nespecifică (analizată în duplicat). Absorbanța acestor probe-martor trebuie să fie mai mică de 5 % din absorbanța maximă a soluțiilor standard de calibrare. Vor fi analizate cel puțin două alicote (duplicate godeu) din fiecare diluție a probei. Duplicatele godeu care diferă cu un procent mai mare de 20 % trebuie reanalizate.
|
|
43.
|
Coeficientul de corelație (R2) al curbelor de calibrare trebuie să fie mai mare de 0,99. Cu toate acestea, o corelație mare nu este suficientă pentru a garanta o predicție adecvată a concentrației pentru toate intervalele. În plus față de o corelație suficient de mare pentru curba de calibrare, concentrația fiecărei soluții standard, calculată pornind de la curba de calibrare, trebuie să se încadreze între 70 și 120 % din concentrația sa nominală. În cazul în care concentrațiile nominale tind să se îndepărteze de linia de regresie a calibrării (de exemplu, spre concentrații mai mici), poate fi necesară împărțirea curbei de calibrare în intervale de concentrații mici și mari sau utilizarea unui model neliniar pentru a ajusta în mod adecvat datele privind absorbanța. În cazul împărțirii curbei, ambele segmente de linie trebuie să aibă valoarea R2 > 0,99.
|
|
44.
|
Limita de detecție (LOD) este definită ca fiind cea mai mică concentrație a soluției standard analitice, iar limita de cuantificare (LOQ) este definită ca fiind cea mai mică concentrație a soluției standard analitice înmulțită cu cel mai mic factor de diluție.
|
|
45.
|
În fiecare zi în care sunt efectuate măsurări ale vitelogeninei va fi analizată o probă fortificată utilizând un standard de referință interteste (apendicele 7). Raportul dintre concentrația preconizată și concentrația măsurată va fi raportat împreună cu rezultatele fiecărui set de teste efectuate în ziua respectivă.
|
DATE ȘI RAPORTARE
Evaluarea răspunsurilor biomarkerilor prin analiza varianței (ANOVA)
|
46.
|
Pentru a identifica potențiala activitate endocrină a unei substanțe chimice, răspunsurile grupurilor tratate sunt comparate cu cele ale grupurilor de control utilizând analiza varianței (ANOVA). În cazul în care se utilizează un solvent de control, trebuie efectuat un test statistic corespunzător între apa de diluție și solventul de control pentru fiecare parametru studiat. Orientări cu privire la interpretarea datelor referitoare la apa de diluție și solventul de control în cadrul analizei statistice ulterioare sunt disponibile în OCDE, 2006c (27). Toate datele privind răspunsurile biologice trebuie analizate și raportate separat per sex. Dacă nu sunt îndeplinite ipotezele necesare pentru metodele parametrice – distribuție anormală (de exemplu, testul Shapiro-Wilk) sau varianță eterogenă (testul Barlett sau testul Levene) – trebuie luată în considerare transformarea datelor în scopul omogenizării varianțelor înainte de efectuarea analizei varianței sau efectuarea unei analize ponderate a varianței. Testul Dunnett (parametric) care permite comparații multiple pe perechi sau testul Mann-Whitney cu ajustare Bonferroni (neparametrică) poate fi utilizat pentru un raport doză-răspuns nemonoton. Pot fi utilizate alte teste statistice (de exemplu, testul Jonckheere-Terpstra sau testul Williams), în cazul în care raportul doză-răspuns este aproximativ monoton. În apendicele 8 este furnizată o diagramă statistică care ajută la luarea unei decizii cu privire la alegerea testului statistic cel mai adecvat pentru a fi utilizat. Informații suplimentare pot fi obținute și din Documentul OCDE privind metodele actuale de analiză statistică a datelor de ecotoxicitate (27).
|
Raportarea rezultatelor testului
|
47.
|
Datele studiului trebuie să includă:
|
|
Facilitatea de testare:
|
—
|
Personalul responsabil și responsabilitățile sale în cadrul studiului
|
|
—
|
Fiecare laborator trebuie să își fi demonstrat competența prin utilizarea unei game de substanțe chimice reprezentative
|
|
|
|
Substanța chimică de testare:
|
—
|
Caracterizarea substanței chimice de testare
|
|
—
|
Natura fizică și proprietățile fizico-chimice relevante
|
|
—
|
Metoda și frecvența preparării concentrațiilor de testare
|
|
—
|
Informații privind stabilitatea și biodegradabilitatea
|
|
|
|
Solventul:
|
—
|
Caracterizarea solventului (natura, concentrația utilizată)
|
|
—
|
Justificarea alegerii solventului (în cazul în care acesta nu este apa)
|
|
|
|
Animalele pentru testare:
|
—
|
Furnizorul și unitatea specifică a furnizorului
|
|
—
|
Vârsta peștilor la începutul testului și stadiul de reproducere/de eliberare a gameților
|
|
—
|
Detalii cu privire la procedura de aclimatizare a animalelor
|
|
—
|
Greutatea corporală a peștilor la începutul expunerii (dintr-un subeșantion din stocul de pești)
|
|
|
|
Condiții de testare:
|
—
|
Procedura de testare utilizată (tipul testului, rata de încărcare, densitatea populației, etc.);
|
|
—
|
Metoda de preparare a soluțiilor stoc și debitul;
|
|
—
|
Concentrațiile nominale de testare, concentrațiile măsurate săptămânal ale soluțiilor de testare și metoda analitică utilizată, mediile valorilor măsurate și deviațiile standard în vasele de testare și dovada faptului că măsurătorile se referă la concentrațiile substanței chimice de testare în soluție veritabilă;
|
|
—
|
Caracteristicile apei de diluție (incluzând pH, duritate, alcalinitate, temperatură, concentrația oxigenului dizolvat, nivelurile de clor rezidual, carbonul organic total, solidele în suspensie și orice altă măsurătoare efectuată)
|
|
—
|
Calitatea apei din vasele de testare: pH, duritate, temperatură și concentrația oxigenului dizolvat;
|
|
—
|
Informații detaliate privind hrănirea [de exemplu, tipul de aliment (alimente), sursa, cantitatea furnizată, frecvența și analizele privind contaminanți relevanți, dacă sunt disponibile (de exemplu, BPC, HAP și pesticide organoclorurate)].
|
|
|
|
Rezultate
|
—
|
Dovada că soluțiile de control îndeplinesc criteriile de acceptare a testului;
|
|
—
|
Datele privind mortalitățile pentru fiecare nivel de concentrație de testare și pentru fiecare control;
|
|
—
|
Tehnicile de analiză statistică utilizate, prelucrarea datelor și justificarea tehnicilor utilizate;
|
|
—
|
Datele privind observațiile biologice de morfologie macroscopică, inclusiv caracteristicile sexuale secundare și vitelogenina;
|
|
—
|
Rezultatele analizelor datelor, de preferință sub formă de tabele și de grafice;
|
|
—
|
Incidența oricărei reacții neobișnuite a peștilor și a oricărui efect vizibil provocat de substanța chimică de testare
|
|
|
ORIENTĂRI PENTRU INTERPRETAREA ȘI ACCEPTAREA REZULTATELOR TESTULUI
|
48.
|
Această secțiune include câteva observații care trebuie luate în considerare pentru interpretarea rezultatelor testului în ceea ce privește diferiții parametri măsurați. Rezultatele trebuie interpretate cu precauție în cazul în care substanța chimică de testare pare a cauza semne evidente de toxicitate sau a afecta starea generală a animalului testat.
|
|
49.
|
La stabilirea intervalului de concentrații de testare, nu trebuie să se depășească concentrația maximă tolerată pentru a permite o interpretare corespunzătoare a datelor. Este important să se aplice cel puțin un tratament care să nu determine semne ale unor efecte toxice. Semnele de boală și semnele unor efecte toxice trebuie evaluate și raportate în detaliu. De exemplu, producția de VTG la femele poate fi, de asemenea, afectată de toxicitatea generală și de modurile de acțiune toxice neendocrine, de exemplu de hepatotoxicitate. Cu toate acestea, interpretarea efectelor poate fi consolidată prin alte niveluri de tratament, ele nefiind mascate de toxicitatea sistemică.
|
|
50.
|
Există câteva aspecte care trebuie luate în considerare pentru acceptarea rezultatelor testului. Cu titlu orientativ, nivelurile de VTG la grupele de control de masculi și de femele trebuie să fie distincte și separate de aproximativ trei ordine de mărime în cazul Pimephales promelas și al peștelui-zebră și de aproximativ un ordin de mărime în cazul Oryzias latipes. Exemple ale intervalului de valori întâlnite la grupele de control și la grupele tratate sunt disponibile în rapoartele de validare (1, 2, 3, 4). Valori mari ale VTG la masculii din grupele de control ar putea compromite performanța testului și capacitatea acestuia de a detecta agoniștii estrogenici slabi. Valori mici ale VTG la femelele din grupele de control ar putea compromite performanța testului și capacitatea acestuia de a detecta inhibitorii aromatazei și antagoniștii estrogenici. Studiile de validare au fost utilizate pentru a elabora această orientare.
|
|
51.
|
În cazul în care un laborator nu a realizat anterior testul sau au fost efectuate modificări substanțiale (de exemplu, schimbarea subspeciei sau a furnizorului de pești), se recomandă efectuarea unui studiu de competență tehnică. Se recomandă utilizarea unor substanțe chimice care posedă o serie de moduri de acțiune sau de impacturi asupra unor parametri studiați. Practic, fiecare laborator este încurajat să își elaboreze propriile date istorice de control pentru masculi și femele și să efectueze teste cu o substanță chimică de control pozitivă pentru activitatea estrogenică (de exemplu, 17β-estradiol la 100 ng/l sau un agonist slab cunoscut) având ca rezultat creșterea VTG la masculi, cu o substanță chimică de control pozitivă pentru inhibarea aromatazei (de exemplu, fadrozol sau procloraz la 300 μg/l) având ca rezultat scăderea VTG la femele și cu o substanță chimică de control pozitivă pentru activitatea androgenică (de exemplu, 17β-trenbolon la 5 μg/l) având ca rezultat inducerea caracteristicilor sexuale secundare la femelele de Pimephales promelas și de Oryzias latipes. Toate aceste date pot fi comparate cu datele disponibile din studiile de validare (1, 2, 3) pentru a garanta competența laboratorului.
|
|
52.
|
În general, măsurătorile vitelogeninei trebuie considerate pozitive în cazul unei creșteri semnificative statistic a VTG la masculi (p < 0,05) sau în cazul unei scăderi semnificative statistic la femele (p < 0,05) cel puțin la doza maximă testată în comparație cu grupul de control și în absența semnelor de toxicitate generală. Un rezultat pozitiv este confirmat și prin demonstrarea unei relație plauzibilă din punct de vedere biologic între doză și curba răspunsurilor. Astfel cum s-a menționat anterior, scăderea vitelogeninei poate să nu fie în totalitate de origine endocrină; cu toate acestea, un rezultat pozitiv trebuie să fie, în general, interpretat ca o dovadă a activității endocrine in vivo și trebuie să genereze în mod normal acțiuni pentru clarificări suplimentare.
|
BIBLIOGRAFIE
|
(1)
|
OECD (2006a). Report of the Initial Work Towards the Validation of the 21-Day Fish Screening Assay for the Detection of Endocrine active Substances (Phase 1 A). OECD Environmental Health and Safety Publications Series on Testing and Assessment No.60, ENV/JM/MONO(2006)27.
|
|
(2)
|
OECD (2006b). Report of the Initial Work Towards the Validation of the 21-Day Fish Screening Assay for the Detection of Endocrine active Substances (Phase 1 B). OECD Environmental Health and Safety Publications Series on Testing and Assessment No.61, ENV/JM/MONO(2006)29.
|
|
(3)
|
OECD (2007). Final report of the Validation of the 21-day Fish Screening Assay for the Detection of Endocrine Active Substances. Phase 2: Testing Negative Substances. OECD Environmental Health and Safety Publications Series on Testing and Assessment No.78, ENV/JM/MONO(2007)25.
|
|
(4)
|
Owens JW (2007). Phase 3 report of the validation of the OECD Fish Screening Assay. CEFIC LRI Project, Endocrine. http://www.cefic-lri.org/index.php?page=projects (accessed 18/09/08).
|
|
(5)
|
US EPA 2007. Validation of the Fish Short-Term Reproduction Assay: Integrated Summary Report. Unpublished report dated 15 December 2007. US Environmental Protection Agency, Washington, DC. 104 pp.
|
|
(6)
|
OECD, 2008. Report of the Validation Peer Review for the 21-Day Fish Endocrine Screening Assay and Agreement of the Working Group of the National Coordinators of the Test Guidelines Programme on the Follow-up of this Report. OECD Environmental Health and Safety Publications Series on Testing and Assessment No.94, ENV/JM/MONO(2008)21.
|
|
(7)
|
Sumpter and Jobling (1995). Vitellogenesis as a biomarker for estrogenic contamination of the aquatic environment. Environmental Health Perspectives;103 Suppl 7:173-8 Review.
|
|
(8)
|
Pawlowski S, Sauer A, Shears JA, Tyler CR, Braunbeck T (2004). Androgenic and estrogenic effects of the synthetic androgen 17alpha-methyltestosterone on sexual development and reproductive performance in the fathead minnow (Pimephales promelas) determined using the gonadal recrudescence assay. Aquatic Toxicology; 68(3):277-91.
|
|
(9)
|
Andersen L, Goto-Kazato R, Trant JM, Nash JP, Korsgaard B, Bjerregaard P (2006). Short-term exposure to low concentrations of the synthetic androgen methyltestosterone affects vitellogenin and steroid levels in adult male zebrafish (Danio rerio). Aquatic Toxicology; 76(3-4):343-52.
|
|
(10)
|
Ankley GT, Kahl MD, Jensen KM, Hornung MW, Korte JJ, Makynen EA, Leino RL (2002). Evaluation of the aromatase inhibitor fadrozole in a short-term reproduction assay with the fathead minnow (Pimephales promelas). Toxicological Sciences;67(1):121-30.
|
|
(11)
|
Panter GH, Hutchinson TH, Hurd KS, Sherren A, Stanley RD, Tyler CR (2004). Successful detection of (anti-)androgenic and aromatase inhibitors in pre-spawning adult fathead minnows (Pimephales promelas) using easily measured endpoints of sexual development. Aquatic Toxicology; 70(1):11-21.
|
|
(12)
|
Parks LG, Cheek AO, Denslow ND, Heppell SA, McLachlan JA, LeBlanc GA, Sullivan CV (1999). Fathead minnow (Pimephales promelas) vitellogenin: purification, characterization and quantitative immunoassay for the detection of estrogenic compounds. Comparative Biochemistry and Physiology. Part C Pharmacology, toxicology and endocrinology; 123(2):113-25.
|
|
(13)
|
Panter GH, Tyler CR, Maddix S, Campbell PM, Hutchinson TH, Länge R, Lye C, Sumpter JP, 1999. Application of an ELISA to quantify vitellogenin concentrations in fathead minnows (Pimephales promelas) exposed to endocrine disrupting chemicals. CEFIC-EMSG research report reference AQ001. CEFIC, Brussels, Belgium.
|
|
(14)
|
Fenske M., van Aerle, R.B., Brack, S.C., Tyler, C.R., Segner, H., (2001). Development and validation of a homologous zebrafish (Danio rerio Hamilton- Buchanan) vitellogenin enzyme-linked immunosorbent assay (ELISA) and its application for studies on estrogenic chemicals. Comp. Biochem. Phys. C 129 (3): 217-232.
|
|
(15)
|
Holbech H, Andersen L, Petersen GI, Korsgaard B, Pedersen KL, Bjerregaard P. (2001). Development of an ELISA for vitellogenin in whole body homogenate of zebrafish (Danio rerio). Comparative Biochemistry and Physiology. Part C Pharmacology, toxicology and endocrinology; 130: 119-131
|
|
(16)
|
Rose J, Holbech H, Lindholst C, Noerum U, Povlsen A, Korsgaard B, Bjerregaard P. 2002. Vitellogenin induction by 17ß-estradiol and 17ß-ethinylestradiol in male zebrafish (Danio rerio). Comp. Biochem. Physiol. C. 131: 531-539.
|
|
(17)
|
Brion F, Nilsen BM, Eidem JK, Goksoyr A, Porcher JM, Development and validation of an enzyme-linked immunosorbent assay to measure vitellogenin in the zebrafish (Danio rerio). Environmental Toxicology and Chemistry; vol 21: 1699-1708.
|
|
(18)
|
Yokota H, Morita H, Nakano N, Kang IJ, Tadokoro H, Oshima Y, Honjo T, Kobayashi K. 2001. Development of an ELISA for determination of the hepatic vitellogenin in Medaka (Oryzias latipes). Jpn J Environ Toxicol 4:87–98.
|
|
(19)
|
Tatarazako N, Koshio M, Hori H, Morita M and Iguchi T., 2004. Validation of an enzyme-linked immunosorbent assay method for vitellogenin in the Medaka. Journal of Health Science 50:301-308.
|
|
(20)
|
Ankley GT, Jensen KM, Makynen EA, Kahl MD, Korte JJ, Homung MW, Henry TR, Denny JS, Leino RL, Wilson VS, Cardon MC, Hartig PC, Gray LE (2003). Effects of the androgenic growth promoter 17-beta-trenbolone on fecundity and reproductive endocrinology of the fathead minnow. Environmental Toxicology and Chemistry; 22(6): 1350-60.
|
|
(21)
|
Seki M, Yokota H, Matsubara H, Maeda M, Tadokoro H, Kobayashi K (2004). Fish full life-cycle testing for androgen methyltestosterone on medaka (Oryzias latipes). Environmental Toxicology and Chemistry; 23(3):774-81.
|
|
(22)
|
OECD (2000) Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. Environmental Health and Safety Publications. Series on Testing and Assessment. No. 23. Paris
|
|
(23)
|
Hutchinson TH, Shillabeer N, Winter MJ, Pickford DB, 2006a. Acute and chronic effects of carrier solvents in aquatic organisms: A critical review. Review. Aquatic Toxicology, 76; pp.69–92.
|
|
(24)
|
Hutchinson TH, Ankley GT, Segner H, Tyler CR, 2006b. Screening and testing for endocrine disruption in fish-biomarkers as «signposts,» not «traffic lights,» in risk assessment. Environmental Health Perspectives;114 Suppl 1:106-14.
|
|
(25)
|
Miles-Richardson, SR, Kramer VJ, Fitzgerald SD, Render JA, Yamini B, Barbee SJ, Giesy JP. 1999. Effects of waterborne exposure to 17B-estradiol on secondary sex characteristics and gonads of the fathead minnow (Pimephales promelas). Aquat. Toxicol. 47, 129-145.
|
|
(26)
|
Martinovic, D., L.S. Blake, E.J. Durhan, K.J. Greene, M.D. Kahl, K.M., Jensen, E.A. Makynen, D.L. Villeneuve and G.T. Ankley. 2008. Characterization of reproductive toxicity of vinclozolin in the fathead minnow and co-treatment with an androgen to confirm an anti-androgenic mode of action. Environ. Toxicol. Chem. 27, 478-488.
|
|
(27)
|
OECD (2006c). Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. OECD environmental Health and Safety Publications Series on Testing and Assessment No.54. ENV/JM/MONO(2006)18
|
|
(28)
|
OECD (2012) OECD Conceptual Framework for Testing and Assessment of Endocrine Disrupters (revised). Annex I to Draft Guidance Document on Standardised Test Guidelines for Evaluating Chemicals for Endocrine Disruption. Series on Testing and Assessment No 150. ENV/JM/MONO(2012)22
|
Apendicele 1
Abrevieri și definiții
Substanță chimică
: o substanță sau un amestec
CV
: coeficient de variație.
ELISA
: test de imunoabsorbție cu anticorpi marcați enzimatic.
Rata de încărcare
: greutatea umedă a peștilor per volum de apă.
Densitatea populației
: numărul de pești per volum de apă.
VTG (vitelogenină)
: fosfolipoglicoproteină precursoare a proteinelor din vitellus care în mod normal apare la femelele active din punct de vedere sexual din toate speciile ovipare.
Axul HPG
: axul hipotalamo-hipofizo-gonadal.
CMT
: concentrația maximă tolerată, reprezentând aproximativ 10 % din CL50 (concentrația letală).
Substanța chimică de testare
: orice substanță sau amestec testat în cadrul acestei metode de testare.
Apendicele 2
Condiții experimentale pentru testul de screening endocrin la pești
|
|
Pimephales promelas
|
Oryzias latipes
|
Peștele-zebră
(Danio rerio)
|
|
|
În regim dinamic
|
În regim dinamic
|
În regim dinamic
|
|
|
25 ± 2 °C
|
25 ± 2 °C
|
26 ± 2 °C
|
|
4.
|
Calitatea iluminatului
|
|
Becuri fluorescente (spectru larg)
|
Becuri fluorescente (spectru larg)
|
Becuri fluorescente (spectru larg)
|
|
|
10-20 μE/m2/s, 540-1 000 lux, sau 50-100 ft-c (niveluri ambientale de laborator)
|
10-20 μE/m2/s, 540-1 000 lux, sau 50-100 ft-c (niveluri ambientale de laborator)
|
10-20 μE/m2/s, 540-1 000 lux, sau 50-100 ft-c (niveluri ambientale de laborator)
|
|
6.
|
Perioada de expunere la lumină (tranzițiile răsărit-apus sunt opționale, cu toate acestea nu sunt considerate necesare)
|
|
16 h de lumină, 8 h de întuneric
|
12-16 h de lumină, 12-8 h de întuneric
|
12-16 h de lumină, 12-8 h de întuneric
|
|
|
< 5 g/l
|
< 5 g/l
|
< 5 g/l
|
|
8.
|
Dimensiunea camerelor de testare
|
|
10 l (minimum)
|
2 l (minimum)
|
5 l (minimum)
|
|
9.
|
Volumul soluției de testare
|
|
8 l (minimum)
|
1,5 l (minimum)
|
4 l (minimum)
|
|
10.
|
Volumele soluțiilor de testare schimbate
|
|
Minimum 6/zi
|
Minimum 5/zi
|
Minimum 5/zi
|
|
11.
|
Vârsta organismelor testate
|
|
A se vedea punctul 20.
|
A se vedea punctul 20.
|
A se vedea punctul 20.
|
|
12.
|
Greutatea umedă aproximativă a peștilor adulți (g)
|
|
Femele: 1,5 ± 20 %
Masculi: 2,5 ± 20 %
|
Femele: 0,35 ± 20 %
Masculi: 0,35 ± 20 %
|
Femele: 0,65 ± 20 %
Masculi: 0,4 ± 20 %
|
|
13.
|
Nr. de pești per vas de testare
|
|
6 (2 masculi și 4 femele)
|
10 (5 masculi și 5 femele)
|
10 (5 masculi și 5 femele)
|
|
|
= 3 (plus controalele corespunzătoare)
|
= 3 (plus controalele corespunzătoare)
|
= 3 (plus controalele corespunzătoare)
|
|
15.
|
Nr. de vase per tratament
|
|
4 minimum
|
2 minimum
|
2 minimum
|
|
16.
|
Nr. de pești per concentrație testată
|
|
16 femele adulte și 8 masculi adulți (4 femele și 2 masculi în fiecare vas duplicat)
|
10 femele adulte și 10 masculi adulți (5 femele și 5 masculi în fiecare vas duplicat)
|
10 femele adulte și 10 masculi adulți (5 femele și 5 masculi în fiecare vas duplicat)
|
|
|
Adulți sau nauplius de Artemia, vii sau congelați, de două sau de trei ori pe zi (ad libitum), hrană disponibilă în comerț sau o combinație a celor menționate
|
Nauplius de Artemia de două sau de trei ori pe zi (ad libitum), hrană disponibilă în comerț sau o combinație a celor menționate
|
Nauplius de Artemia de două sau trei ori pe zi (ad libitum), hrană disponibilă în comerț sau o combinație a celor menționate
|
|
|
Fără aerare, cu excepția cazului în care concentrația de oxigen dizolvat este sub 60 % din valoarea de saturație din aer
|
Fără aerare, cu excepția cazului în care concentrația de oxigen dizolvat este sub 60 % din valoarea de saturație din aer
|
Fără aerare, cu excepția cazului în care concentrația de oxigen dizolvat este sub 60 % din valoarea de saturație din aer
|
|
|
Apă curată de suprafață, din puțuri sau reconstituită sau apă de la robinet declorizată
|
Apă curată de suprafață, din puțuri sau reconstituită sau apă de la robinet declorizată
|
Apă curată de suprafață, din puțuri sau reconstituită sau apă de la robinet declorizată
|
|
20.
|
Perioada de preexpunere
|
|
Perioadă recomandată de 7 zile
|
Perioadă recomandată de 7 zile
|
Perioadă recomandată de 7 zile
|
|
21.
|
Durata expunerii la substanța chimică
|
|
21 de zile
|
21 de zile
|
21 de zile
|
|
22.
|
Parametri biologici studiați
|
|
supraviețuire
comportament
caracteristici sexuale secundare
VTG
|
supraviețuire
comportament
caracteristici sexuale secundare
VTG
|
supraviețuire
comportament
VTG
|
|
23.
|
Criterii de acceptare a testului
|
|
Oxigen dizolvat > 60 % din saturație; temperatura medie de 25 ± 2 °C; supraviețuire de 90 % la peștii de control; concentrațiile de testare măsurate menținute în limita a 20 % din valorile medii măsurate pentru fiecare nivel de tratament.
|
Oxigen dizolvat > 60 % din saturație; temperatura medie de 24 ± 2 °C; supraviețuire de 90 % la peștii de control; concentrațiile de testare măsurate menținute în limita a 20 % din valorile medii măsurate pentru fiecare nivel de tratament.
|
Oxigen dizolvat > 60 % din saturație; temperatura medie de 26 ± 2 °C; supraviețuire de 90 % la peștii de control; concentrațiile de testare măsurate menținute în limita a 20 % din valorile medii măsurate pentru fiecare nivel de tratament.
|
Apendicele 3
Câteva caracteristici chimice ale unei ape de diluție acceptabile
|
Componentă
|
Concentrații
|
|
Particule în suspensie
|
< 20 mg/l
|
|
Carbon organic total
|
< 2 mg/l
|
|
Amoniac neionizat
|
< 1 μg/l
|
|
Clor rezidual
|
< 10 μg/l
|
|
Total pesticide organofosforice
|
< 50 ng/l
|
|
Total pesticide organoclorurate plus bifenili policlorurați
|
< 50 ng/l
|
|
Total clor organic
|
< 25 ng/l
|
Apendicele 4 A
Substratul de reproducere pentru peștele-zebră
Tavă de reproducere
: tavă instrumentară în întregime din sticlă, cu dimensiuni de exemplu de 22 × 15 × 5,5 cm (L × l × î), acoperită cu o sită mobilă din oțel inoxidabil (orificii de 2 mm). Sita trebuie să acopere deschiderea tăvii instrumentare la un nivel situat mai jos decât marginea ei.

Substratul de reproducere se fixează pe sită. Se formează o structură în care pot pătrunde peștii. De exemplu, sunt adecvate plante de acvariu artificiale realizate din plastic de culoare verde (NB: trebuie luată în considerare posibila absorbție a substanței chimice de testare în materialul din plastic). Plasticul trebuie să fie curățat cu o cantitate suficientă de apă caldă pentru o perioadă suficientă pentru a se asigura că nicio substanță chimică nu poate pătrunde în apa de testare. Dacă se utilizează materiale din sticlă, trebuie avut grijă ca peștii să nu se rănească sau să se înghesuie în timpul deplasărilor.
Distanța dintre tavă și pereții din sticlă trebuie să fie de cel puțin 3 cm pentru a se asigura că eliberarea gameților nu se realizează în afara tăvii. Ouăle depuse pe tavă cad printre ochiurile sitei și pot fi prelevate la 45-60 de minute după pornirea iluminării. Ouăle transparente nu se lipesc și pot fi ușor numărate în condiții de iluminare transversală. Atunci când se utilizează cinci femele pentru fiecare vas, numărul de ouă este considerat mic dacă este de maximum 20 pe zi, mediu dacă este de maximum 100 și mare dacă este peste 100. Tava de reproducere trebuie îndepărtată, ouăle colectate, iar tava reintrodusă în vasul de testare, fie seara la o oră cât mai târzie, fie dimineața foarte devreme. Perioada până la reintroducere nu trebuie să depășească o oră, întrucât, în caz contrar, semnalul substratului de reproducere poate induce împerecherea individuală și eliberarea gameților într-un moment neobișnuit. Dacă situația impune introducerea mai târziu a tăvii de reproducere, aceasta trebuie să se efectueze cu cel puțin 9 ore după pornirea iluminării. La această oră târzie din zi, eliberarea gameților nu mai este indusă.
Apendicele 4 B
Substratul de reproducere pentru Pimephales promelas
Două sau trei plăci și tăvi de reproducere din plastic/ceramică/sticlă sau oțel inoxidabil combinate sunt așezate în fiecare cameră de testare (de exemplu, un jgheab semicircular de culoare gri cu o lungime de 80 mm, așezat pe o tavă cu margini ridicate cu o lungime de 130 mm) (a se vedea imaginea). S-a demonstrat că plăcile din PVC sau din ceramică tratate în mod corespunzător sunt adecvate pentru un substrat de reproducere (Thorpe et al, 2007).
Se recomandă ca plăcile să fie șlefuite pentru a îmbunătăți aderența. Tava trebuie să fie, de asemenea, prevăzută cu un ecran de protecție pentru a împiedica accesul peștilor la ouăle căzute, cu excepția cazului în care eficiența aderenței ouălor a fost demonstrată pentru substratul de reproducere utilizat.

Baza este concepută pentru a reține toate ouăle care nu aderă la suprafața plăcilor și care, în consecință, ar cădea pe fundul bazinului (sau acele ouă să fie depuse direct pe baza plană din plastic). Toate substraturile de reproducere trebuie curățate înainte de utilizare timp de cel puțin 12 ore în apă de diluție.
REFERINȚE BIBLIOGRAFICE
Thorpe KL, Benstead R, Hutchinson TH, Tyler CR, 2007. An optimised experimental test procedure for measuring chemical effects on reproduction in the fathead minnow, Pimephales promelas. Aquatic Toxicology, 81, 90–98.
Apendicele 5 A
Evaluarea caracteristicilor sexuale secundare la Pimephales promelas pentru detectarea anumitor substanțe chimice care acționează la nivel endocrin
Prezentare generală
În cazul adulților de Pimephales promelas, caracteristicile aspectului fizic potențial importante în cadrul testării perturbatorilor endocrini includ culoarea corpului (deschisă/închisă), modelele de colorație (prezența sau absența unor dungi verticale), forma corpului (forma capului și a regiunii pectorale, distensia abdomenului), precum și caracteristicile sexuale secundare specializate (numărul și dimensiunea tuberculilor nupțiali, dimensiunea depozitului subcutanat dorsal și ovipozitorul).
Tuberculii nupțiali sunt situați pe cap (depozit subcutanat dorsal) la masculii de Pimephales promelas activi din punct de vedere reproductiv și sunt de obicei dispuși bilateral simetric (Jensen et al. 2001). Femelele de control și masculii și femelele tinere nu dezvoltă tuberculi (Jensen et al. 2001). La masculi, numărul de tuberculi individuali situați în jurul ochilor și între nări este de maximum opt. Cei mai mulți și mai mari tuberculi sunt așezați sub forma a două șiruri paralele imediat sub nări și deasupra gurii. Numeroși pești au grupuri de tuberculi sub mandibulă; cei situați cel mai aproape de gură apar în general într-o singură pereche, în timp ce setul situat mai ventral se poate compune din până la patru tuberculi. Numărul efectiv de tuberculi este rareori mai mare de 30 (interval 18-28; Jensen et al. 2001). Tuberculii predominanți (din punctul de vedere al numărului) sunt prezenți sub forma unei structuri singulare, relativ rotunde, cu înălțimea aproximativ echivalentă cu raza. Cei mai mulți masculi activi din punct de vedere reproductiv au, de asemenea, cel puțin câțiva tuberculi măriți și pronunțați astfel încât nu pot fi distinși ca structuri individuale.
Unele tipuri de substanțele chimice cu efecte la nivel endocrin pot cauza apariția anormală a unor caracteristici sexuale secundare la sexul opus; de exemplu, agoniști ai receptorilor androgenici, cum ar fi 17β-metiltestosteronul sau 17β-trenbolonul, pot cauza apariția de tuberculi nupțiali la femelele de Pimephales promelas (Smith 1974; Ankley et al. 2001; 2003), în timp ce agoniști ai receptorilor estrogenici pot reduce numărul sau dimensiunea tuberculilor nupțiali la masculi (Miles-Richardson et al. 1999; Harries et al. 2000).
În continuare este prezentată o descriere a caracterizării tuberculilor nupțiali la Pimephales promelas pe baza procedurilor utilizate în cadrul laboratorului Agenției de Protecție a Mediului din SUA din Duluth, Minnesota. Produsele și/sau echipamentele specifice pot fi înlocuite cu materiale comparabile aflate la dispoziție.
Vizualizarea se realizează cel mai bine cu ajutorul unei lupe iluminate sau al unui microscop de disecție 3X iluminat. Peștele este observat din partea dorsală și cu partea anterioară înainte (capul spre observator).
|
a)
|
Se așează peștele într-o placă Petri mică (de exemplu, cu diametrul de 100 mm), cu partea anterioară înainte și cu partea ventrală în jos. Se reglează vizorul pentru a putea identifica tuberculii. Se rulează peștele ușor și încet de pe o parte pe alta pentru a identifica zonele cu tuberculi. Se numără și se clasifică tuberculii.
|
|
b)
|
Se repetă observația pe partea ventrală a capului după ce s-a așezat peștele în placa Petri cu partea dorsală anterioară înainte.
|
|
c)
|
Observațiile nu ar trebui să dureze mai mult de 2 minute pentru fiecare pește.
|
Numărarea și clasificarea tuberculilor
Au fost identificate șase zone specifice pentru evaluarea prezenței și dezvoltării de tuberculi la adulții de Pimephales promelas. A fost creat un model pentru a cartografia localizarea și cantitatea tuberculilor prezenți (a se vedea partea de încheiere a prezentului apendice). Numărul tuberculilor este înregistrat, iar dimensiunea lor poate fi clasificată cantitativ astfel: 0- absent, 1-prezent, 2-mărit și 3-pronunțat pentru fiecare organism (Fig. 1).
Categoria 0 – absența oricărui tubercul. Categoria 1 – tubercul prezent, identificat ca orice tubercul care are un singur punct a cărui înălțime este aproape echivalentă cu raza sa (diametru). Categoria 2 – tubercul mărit, identificat prin țesutul sub formă de asterisc, prezentând de obicei o bază radială mare cu șanțuri sau caneluri care pornesc din centru. Cupola tuberculului este adesea mai neregulată, însă uneori poate fi întrucâtva rotunjită. Categoria 3 – tubercul pronunțat, de obicei foarte mare și rotunjit cu o structură mai puțin definită. Uneori, acești tuberculi se grupează formând o singură masă de-a lungul unei zone sau a mai multor zone (B, C și D, descrise mai jos). Colorația și forma sunt similare celor din categoria 2, însă, uneori, sunt destul de greu de distins. Utilizând acest sistem de clasificare va conduce în general la un scor < 50 la un mascul normal din grupul de control care posedă un număr de tuberculi cuprins între 18 și 20 (Jensen et al. 2001).
Figura 1

Numărul efectiv de tuberculi la unii pești poate fi mai mare decât cel indicat în casetele model (apendicele A) pentru o anumită zonă de clasificare. În acest caz, cifrele suplimentare pot fi marcate în interior, la dreapta sau la stânga casetei. Prin urmare, modelul nu trebuie să afișeze o simetrie. O altă tehnică pentru cartografierea tuberculilor perechi sau grupați vertical de-a lungul planului orizontal al gurii ar putea consta în dubla marcare a două puncte de clasificare a tuberculilor într-o singură casetă.
Zonele cartografiate:
A– Tuberculii situați în jurul ochilor. Localizați dorsal spre ventral în jurul marginii anterioare a ochilor. De obicei multiplii la masculii maturi din grupul de control, absenți la femelele din grupul de control, dispuși în general în perechi (câte unul lângă fiecare ochi) sau singuri la femelele expuse la androgeni.
B– Tuberculii situați între nări (porii canalelor senzoriale). De obicei dispuși în perechi la masculii din grupul de control la niveluri de dezvoltare mai mari (2- mărit sau 3- pronunțat). Absenți la femelele din grupul de control, însă uneori prezenți și dezvoltați la femelele expuse la androgeni.
C– Tuberculii situați imediat anterior nărilor, paralel cu gura. În general măriți sau pronunțați la masculii maturi din grupul de control. Prezenți sau măriți la masculii mai puțin dezvoltați sau la femelele tratate cu androgeni.
D– Tuberculi situați paralel cu linia gurii. În general clasificați ca dezvoltați la masculii din grupul de control. Absenți la femelele din grupul de control, însă prezenți la femelele expuse la androgeni.
E– Tuberculii situați pe mandibulă, aproape de gură, de obicei de mici dimensiuni și în general dispuși în perechi. Variabili la masculii din grupul de control sau tratați și la femelele tratate.
F– Tuberculii situați ventral față de E. De obicei de mici dimensiuni și dispuși în perechi. Prezenți la masculii din grupul de control și la femelele expuse la androgeni.
BIBLIOGRAFIE
|
(1)
|
Ankley GT, Jensen KM, Kahl MD, Korte JJ, Makynen ME. 2001. Description and evaluation of a short-term reproduction test with the fathead minnow (Pimephales promelas). Environ Toxicol Chem 20:1276-1290.
|
|
(2)
|
Ankley GT, Jensen KM, Makynen EA, Kahl MD, Korte JJ, Hornung MW, Henry TR, Denny JS, Leino RL, Wilson VS, Cardon MC, Hartig PC, Gray EL. 2003. Effects of the androgenic growth promoter 17-β trenbolone on fecundity and reproductive endocrinology of the fathead minnow. Environ Toxicol Chem 22:1350-1360.
|
|
(3)
|
Harries JE, Runnalls T, Hill E, Harris CA,Maddix S, Sumpter JP, Tyler CR. 2000. Development of a reproductive performance test for endocrine disrupting chemicals using pair-breeding fathead minnows (Pimephales promelas). Environ Sci Technol 34:3003-3011.
|
|
(4)
|
Jensen KM, Korte JJ, Kahl MD, Pasha MS, Ankley GT. 2001. Aspects of basic reproductive biology and endocrinology in the fathead minnow (Pimephales promelas). Comp Biochem Physiol C 128:127-141.
|
|
(5)
|
Kahl MD, Jensen KM, Korte JJ, Ankley GT. 2001. Effects of handling on endocrinology and reproductive performance of the fathead minnow. J Fish Biol 59:515-523.
|
|
(6)
|
Miles-Richardson SR, Kramer VJ, Fitzgerald SD, Render JA, Yamini B, Barbee SJ, Giesy JP. 1999. Effects of waterborne exposure of 17-estradiol on secondary sex characteristics and gonads of fathead minnows (Pimephales promelas). Aquat Toxicol 47:129-145.
|
|
(7)
|
Smith RJF. 1974. Effects of 17-methyltestosterone on the dorsal pad and tubercles of fathead minnows (Pimephales promelas). Can J Zool 52:1031-1038.
|
|
Model de tuberculi
|
Clasificare numerică
|
|
ID
|
1-prezent
|
|
Data
|
2-mărit
|
|
Scor total
|
3-pronunțat
|
|
|
C
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
|
|
D
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
X1
|
Apendicele 5 B
Evaluarea caracteristicilor sexuale secundare la Oryzias latipes pentru detectarea anumitor substanțe chimice care acționează la nivel endocrin
Mai jos este prezentată o descriere a măsurării proceselor papilare (21), care sunt caracteristici sexuale secundare ale Oryzias latipes.
|
(1)
|
După excizia ficatului (apendicele 6), carcasa este așezată într-un tub conic care conține aproximativ 10 ml de formol neutru 10 % tamponat (cu capul în sus și cu coada în jos). În cazul în care gonada este fixată într-o altă soluție decât formol neutru 10 % tamponat, se realizează cu ajutorul unei lame tăietoare o incizie transversală în carcasă între regiunea anterioară a înotătoarei anale și anus, având grijă să nu se lezeze gonoporul și gonada însăși (Fig. 3). Se introduce capul peștelui în soluția fixativă pentru a conserva gonadele, iar coada peștelui în formol neutru tamponat 10 % conform descrierii de mai sus.
|
|
(2)
|
După ce se introduce corpul peștelui în formol neutru tamponat 10 %, se prinde regiunea anterioară a înotătoarei anale cu ajutorul unei pensete și se pliază timp de 30 de secunde pentru a menține deschisă înotătoarea anală. Prinzând înotătoarea anală cu ajutorul unei pensete, se prind câteva nervuri ale înotătoarei din regiunea anterioară având grijă să nu se zgârie procesele papilare.
|
|
(3)
|
După menținerea deschisă a înotătoarei anale timp de aproximativ 30 de secunde, se introduce corpul peștelui în formol neutru 10 % tamponat la temperatura camerei și se lasă astfel până la măsurarea proceselor papilare (măsurarea trebuie efectuată după fixare timp de cel puțin 24 de ore).
|
Măsurare
|
(1)
|
După fixarea corpului peștelui în formol neutru 10 % tamponat timp de cel puțin 24 de ore, se scoate carcasa peștelui din tubul conic și se șterge formolul cu hârtie de filtru (sau un șervet de hârtie).
|
|
(2)
|
Se așează peștele cu abdomenul în sus. Se taie apoi cu grijă înotătoarea anală cu ajutorul unei foarfeci mici de disecție (este de preferat să se taie înotătoarea anală cu puțin pterigiofor).
|
|
(3)
|
Se prinde cu ajutorul unei pensete zona anterioară a înotătoarei anale excizate și se așează pe o lamelă din sticlă cu câteva picături de apă. Se acoperă apoi înotătoarea anală cu o altă lamelă din sticlă. Se procedează cu grijă pentru a nu se zgâria procesele papilare în momentul prinderii înotătoarei anale cu penseta.
|
|
(4)
|
Se determină numărul de plăci comune care prezintă procese papilare cu ajutorul unui contor sub un microscop biologic (microscop drept sau microscop inversat). Procesele papilare sunt recunoscute atunci când o mică formațiune de procese este vizibilă pe marginea posterioară a plăcii comune. Se notează pe foaia de lucru numărul de plăci comune care prezintă procese papilare pentru fiecare nervură a înotătoarei (de exemplu, prima nervură: 0, a doua nervură: 10, a treia nervură: 12, etc.) și se notează suma acestor numere în fișa Excel pentru fiecare pește în parte. Dacă este necesar, se fotografiază înotătoarea anală și se determină pe fotografie numărul de plăci comune care prezintă procese papilare.
|
|
(5)
|
După măsurare, se introduce înotătoarea anală în tubul conic descris la punctul (1) și se depozitează.
|
Fig. 1.
Diagramă care ilustrează diferența de formă și de dimensiune a înotătoarei anale între sexe. A, mascul; B, femelă. Oka, T. B., 1931. On the processes on the fin rays of the male of Oryzias latipes and other sex characters of this fish. J. Fac. Sci., Tokyo Univ., IV, 2: 209-218.

Fig. 2.
A, Procese papilare pe plăcile comune ale înotătoarei anale. J.P., placă comună; A.S., spațiu axial; P., proces. B, Extremitatea distală a înotătoarei anale. Actinotrichiile (Act.) sunt situate la vârf. Oka, T. B., 1931. On the processes on the fin rays of the male of Oryzias latipes and other sex characters of this fish. J. Fac. Sci., Tokyo Univ., IV, 2: 209-218.

Fig. 3.
Fotografia unui corp de pește care ilustrează locul inciziei atunci când gonada este fixată într-o altă soluție de fixare decât formol neutru 10 % tamponat. În acest caz, corpul restant va fi tăiat între zona anterioară a înotătoarei anale și anus cu ajutorul unei lame tăietoare (linia roșie), iar capul peștelui va fi introdus în soluția de fixare pentru gonade și partea corpului dinspre coadă va fi introdusă în formol neutru 10 % tamponat.
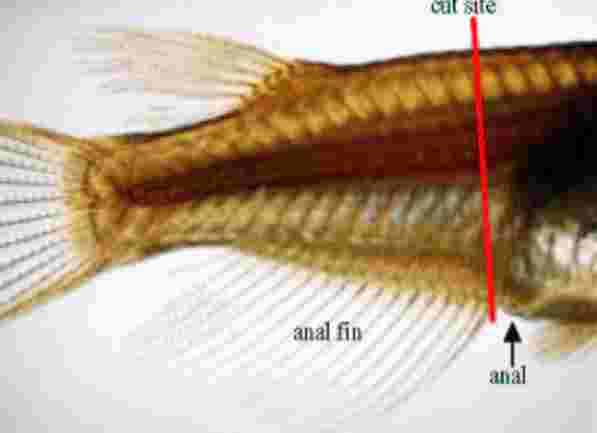
Apendicele 6
Proceduri recomandate de prelevare a probelor pentru analiza vitelogeninei
Se procedează cu grijă pentru a evita contaminarea încrucișată între probele VTG ale masculilor și femelelor.
Procedura 1 A: Pimephales promelas, prelevare de sânge din vena/artera caudală
După anesteziere, pedunculul caudal este parțial secționat cu o lamă de bisturiu și se recoltează sânge din vena/artera caudală cu un tub capilar heparinizat microhematocrit. După prelevarea sângelui, plasma este separată rapid prin centrifugare timp de 3 minute la 15 000g (sau, alternativ, timp de 10 minute la 15 000 g la o temperatură de 4 °C). Dacă se dorește, procentul de hematocrit poate fi determinat în urma centrifugării. Plasma este apoi extrasă din tubul microhematocrit și depozitată într-un tub de centrifugare cu 0,13 unități de aprotinină (un inhibitor de protează) la o temperatură de – 80 °C până când poate fi determinată vitelogenina. În funcție de dimensiunea Pimephales promelas (care depinde de sex), volumele de plasmă care pot fi prelevate sunt cuprinse între 5 și 60 de microlitri per pește (Jensen et al. 2001).
Procedura 1B: Pimephales promelas, prelevare de sânge din inimă
Alternativ, sângele poate fi prelevat și printr-o puncție cardiacă realizată cu ajutorul unei seringi heparinizate (1 000 de unități de heparină/ml). Sângele este transferat în tuburi Eppendorf (ținute în gheață) și apoi centrifugat (5 minute, 7 000 g, la temperatura camerei). Plasma trebuie transferată în tuburi Eppendorf curate (în alicote, dacă volumul de plasmă permite acest lucru) și congelată rapid la – 80 °C până ce este analizată (Panter et al., 1998).
Procedura 2A: Oryzias latipes, excizie a ficatului
Extragerea peștilor pentru testare din camera de testare
|
(1)
|
Peștii pentru testare trebuie scoși din camera de testare cu ajutorul unui minciog de mici dimensiuni. Se procedează cu grijă pentru a nu scăpa peștii pentru testare în alte camere de testare.
|
|
(2)
|
În principiu, peștii pentru testare trebuie să fie scoși în următoarea ordine: din vasul de control, vasul de control cu solvent (dacă este cazul), vasul cu cea mai mică concentrație, vasul cu concentrația medie, vasul cu cea mai mare concentrație și vasul de control pozitiv. În plus, trebuie extrași toți masculii dintr-o cameră de testare înainte de extragerea femelelor rămase.
|
|
(3)
|
Sexul fiecărui pește pentru testare este identificat pe baza caracteristicilor sexuale secundare externe (de exemplu, forma înotătoarei anale).
|
|
(4)
|
Se așează peștii pentru testare într-un container de transport și se transportă la stația de lucru pentru excizia ficatului. Se verifică etichetele camerei de testare și containerul de transport pentru precizie și pentru a confirma faptul că numărul peștilor scoși din camera de testare și numărul peștilor rămași în camera de testare sunt conforme celor preconizate.
|
|
(5)
|
În cazul în care sexul nu poate fi stabilit pe baza aspectului exterior al peștelui, se îndepărtează toți peștii din camera de testare. În acest caz, sexul este identificat prin observarea gonadei sau a caracteristicilor sexuale secundare cu ajutorul unui microscop stereoscopic.
|
Excizia ficatului
|
(1)
|
S transferă peștii pentru testare din containerul de transport în soluția anestezică cu ajutorul unui minciog de mici dimensiuni.
|
|
(2)
|
După anestezierea peștilor pentru testare, ei sunt transferați pe o hârtie de filtru (sau pe un șervet de hârtie) cu ajutorul unei pensete (obișnuite). Când se prind peștii pentru testare, se aplică brațele pensetei de o parte și de alta a capului pentru a evita ruperea cozii.
|
|
(3)
|
Se șterge apa de pe suprafața peștilor pentru testare cu o hârtie de filtru (sau cu un șervet de hârtie).
|
|
(4)
|
Se așează peștele cu abdomenul în sus. Se efectuează apoi o mică incizie transversală între zona ventrală a gâtului și zona de mijloc a abdomenului cu ajutorul unei foarfeci de disecție.
|
|
(5)
|
Se introduce foarfeca de disecție în incizia mică și se efectuează o incizie de-a lungul liniei mediane a abdomenului, de la un punct caudal la mantaua branhială până la partea craniană a anusului. Se procedează cu grijă pentru a nu se introduce foarfeca de disecție prea adânc evitându-se astfel distrugerea ficatului și a gonadei.
|
|
(6)
|
Se efectuează următoarele operațiuni la un microscop stereoscopic.
|
|
(7)
|
Se așează peștele pentru testare cu abdomenul în sus pe un șervet de hârtie (se află la dispoziție și o placă Petri din sticlă sau o lamelă din sticlă).
|
|
(8)
|
Se îndepărtează pereții cavității abdominale cu ajutorul unei pensete de precizie și se exteriorizează organele interne. Dacă este necesar, organele interne pot fi exteriorizate și prin înlăturarea unei părți a peretelui cavității abdominale.
|
|
(9)
|
Se expune porțiunea care leagă ficatul de vezica biliară cu ajutorul unei alte pensete de precizie. Se prinde apoi canalul biliar și se excizează vezicula biliară. Se procedează cu grijă pentru a nu leza vezicula biliară.
|
|
(10)
|
Se prinde esofagul și se separă prin excizare tractul gastrointestinal de ficat în același mod. Se procedează cu grijă pentru a nu vărsa conținutul tractului gastrointestinal. Se separă prin excizare tractul gastrointestinal caudal de anus și se îndepărtează tractul din cavitatea abdominală.
|
|
(11)
|
Se taie masa de grăsime și alte țesuturi de la periferia ficatului. Se procedează cu grijă pentru a nu zgâria ficatul.
|
|
(12)
|
Se prinde zona portală hepatică cu ajutorul pensetei de precizie și se extrage ficatul din cavitatea abdominală.
|
|
(13)
|
Se așează ficatul pe o lamelă din sticlă. Cu ajutorul pensetei de precizie, se îndepărtează grăsimea și alte țesuturi (de exemplu, mucoasă abdominală), dacă este necesar, de pe suprafața ficatului.
|
|
(14)
|
Se cântărește ficatul cu ajutorul unei balanțe analitice electronice, utilizând ca tară un microtub de 1,5 ml. Se înregistrează valoarea pe fișa de lucru (citire: 0,1 mg). Se confirmă informațiile de identificare pe eticheta microtubului.
|
|
(15)
|
Se închide capacul microtubului care conține ficatul. Se depozitează într-un stativ pentru răcire (sau stativ cu gheață).
|
|
(16)
|
După excizia unui ficat, se curăță instrumentele de disecție sau se înlocuiesc cu unele curate.
|
|
(17)
|
Se excizează ficații de la toți peștii din containerul de transport conform descrierii de mai sus.
|
|
(18)
|
După excizarea ficaților de la toți peștii din containerul de transport (adică, toți masculii sau toate femelele dintr-o cameră de testare), se așează toate eșantioanele de ficat pe un stativ pentru tuburi prevăzute cu o etichetă de identificare și se depozitează într-un congelator. Atunci când ficații sunt donați pentru pretratament la scurt timp după excizie, eșantioanele sunt transportate la stația de lucru următoare într-un stativ pentru răcire (sau stativ cu gheață).
|
După excizia ficatului, carcasa peștelui este disponibilă pentru măsurarea caracteristicilor sexuale secundare.
Eșantion
Se depozitează eșantioanele de ficat prelevate de la pești la temperatura de ≤ – 70 °C în cazul în care nu sunt utilizate pentru pretratament la scurt timp după excizie.
Fig-1
Se efectuează o incizie în partea anterioară a înotătoarelor pectorale cu ajutorul unei foarfeci.

Fig-2
Se efectuează o incizie pe linia mediană a abdomenului cu ajutorul unei foarfeci spre un punct situat la aproximativ 2 mm cranial față de anus.
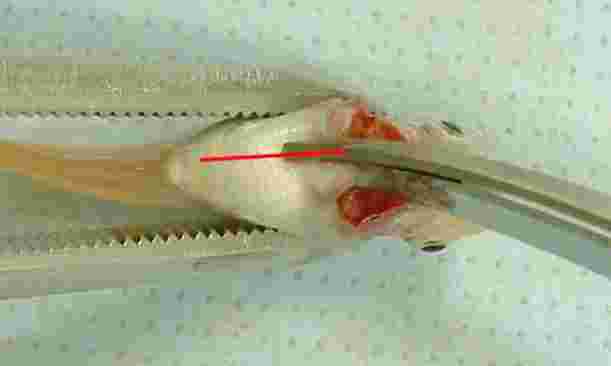
Fig-3
Pereții abdominali sunt îndepărtați cu ajutorul unui forceps pentru a expune ficatul și celelalte organe interne. (Alternativ, pereții abdominali pot fi fixați cu ace lateral).

Fig-4
Ficatul este disecat și excizat cu ajutorul unui forceps.

Fig-5
Intestinele sunt retrase ușor cu ajutorul unui forceps.

Fig-6
Ambele capetele ale intestinelor și toate elementele mezenterice atașate sunt secționate cu ajutorul unei foarfeci.

Fig-7 (femelă)
Procedura este identică în cazul femelei.

Fig-8
Procedura încheiată.
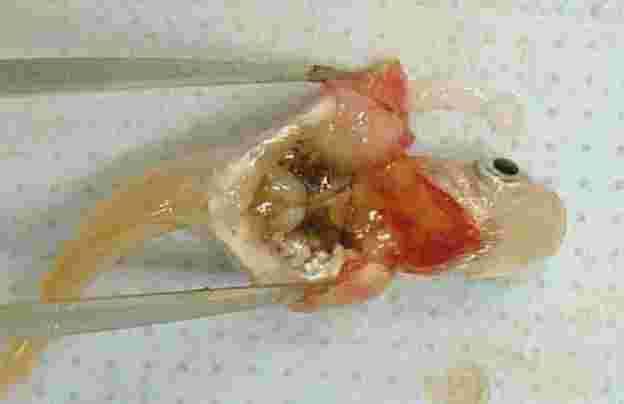
Procedura 2 B: Oryzias latipes, pretratament a ficatului pentru măsurarea vitelogeninei
Se ia flaconul cu tamponul de omogenat din trusa ELISA și se răcește în bucăți de gheață (temperatura soluției: ≤ 4 °C). În cazul în care se utilizează un tampon de omogenat din sistemul EnBio ELISA, se decongelează soluția până ajunge la temperatura camerei și apoi se răcește flaconul în bucăți de gheață.
Se calculează volumul tamponului de omogenat pentru ficat pe baza greutății sale (se adaugă 50 μl de tampon de omogenat per mg de ficat pentru omogenat). De exemplu, în cazul în care greutatea ficatului este de 4,5 mg, volumul tamponului de omogenat pentru ficat este de 225 μl. Se întocmește o listă a volumelor de tampon de omogenat pentru toți ficații.
Se pregătește ficatul pentru pretratament.
|
(1)
|
Se scoate de la congelator microtubul de 1,5 ml care conține ficatul chiar înainte de pretratament.
|
|
(2)
|
Pretratamentul ficatului de la masculi trebuie realizat înaintea celui al femelelor pentru a evita contaminarea cu vitelogenină. În plus, pretratamentul pentru grupele de testare trebuie realizat în următoarea ordine: control, control cu solvent (dacă este cazul), cea mai mică concentrație, concentrație medie, cea mai mare concentrație și control pozitiv.
|
|
(3)
|
Numărul microtuburilor de 1,5 ml care conțin probe de ficat scoase din congelator la un moment dat nu trebuie să depășească numărul care poate fi centrifugat în acel moment.
|
|
(4)
|
Se aranjează microtuburile de 1,5 ml care conțin probe de ficat pe stativul cu gheață în ordinea numerotării eșantioanelor (nu este necesară decongelarea ficatului).
|
Efectuarea pretratamentului
1. Adăugarea tamponului de omogenizare
|
(1)
|
Se verifică lista pentru a se identifica volumul de tampon de omogenat care trebuie utilizat pentru o anumită probă de ficat și se ajustează micropipeta (intervalul de volume: 100-1 000 μl) până la volumul adecvat. Se montează un vârf curat la micropipetă.
|
|
(2)
|
Se extrage tamponul de omogenat din flaconul cu reactiv și se adaugă tamponul în microtubul de 1,5 ml care conține ficatul.
|
|
(3)
|
Se adaugă tamponul de omogenat în toate microtuburile de 1,5 ml care conțin ficat conform procedurii descrise mai sus. Nu este necesară schimbarea vârfului micropipetei cu unul nou. Cu toate acestea, în cazul în care vârful este contaminat sau este suspectat a fi contaminat, acesta trebuie schimbat.
|
2. Omogenizarea ficatului
|
(1)
|
Se atașează un nou pistil pentru omogenizare la omogenizatorul microtubului.
|
|
(2)
|
Se introduce pistilul în microtubul de 1,5 ml. Se utilizează omogenizatorul microtubului pentru a presa ficatul între suprafața pistilului și peretele intern al microtubului de 1,5 ml.
|
|
(3)
|
Se lasă omogenizatorul microtubului să funcționeze 10-20 de secunde. Se răcește microtubul de 1,5 ml cu ajutorul unor bucăți de gheață pe parcursul operațiunii.
|
|
(4)
|
Se scoate pistilul din microtubul de 1,5 ml și se lasă deoparte aproximativ 10 secunde. Se efectuează apoi un control vizual al stării suspensiei.
|
|
(5)
|
Dacă bucățile de ficat sunt observate în suspensie, se repetă operațiunile (3) și (4) pentru a pregăti în mod satisfăcător omogenatul de ficat.
|
|
(6)
|
Se răcește omogenatul de ficat în suspensie pe stativul cu gheață până în momentul centrifugării.
|
|
(7)
|
Se schimbă pistilul cu unul nou pentru fiecare omogenat.
|
|
(8)
|
Se omogenizează toți ficații cu tampon de omogenat conform procedurii descrise mai sus.
|
3. Centrifugarea omogenatului de ficat în suspensie
|
(1)
|
Se fixează temperatura camerei centrifugii frigorifice la ≤ 5 °C.
|
|
(2)
|
Se introduc microtuburile de 1,5 ml care conțin omogenatul de ficat în suspensie în centrifuga frigorifică (se ajustează dacă este necesar).
|
|
(3)
|
Se centrifughează omogenatul de ficat în suspensie la 13 000g timp de 10 min la ≤ 5 °C. Totuși, dacă supernatantele sunt separate în mod adecvat, forța și timpul de centrifugare pot fi ajustate după necesități.
|
|
(4)
|
După centrifugare, se verifică dacă supernatantele sunt separate în mod adecvat (suprafață: lipide, intermediar: supernatant, strat inferior: țesut hepatic). Dacă separarea nu este adecvată, se centrifughează suspensia din nou în aceleași condiții.
|
|
(5)
|
Se elimină toate probele din centrifuga frigorifică și se aranjează în ordinea numerotării eșantioanelor pe stativul cu gheață. Se procedează cu atenție pentru a nu resuspenda fiecare strat separat după centrifugare.
|
4. Colectarea supernatantului
|
(1)
|
Se așează patru microtuburi de 0,5 ml pentru depozitarea supernatantului în stativul pentru tuburi.
|
|
(2)
|
Se colectează 30 μl din fiecare supernatant (separat ca strat intermediar) cu micropipeta și se introduce într-un microtub de 0,5 ml. Se procedează cu atenție pentru a nu colecta lipide de pe suprafață sau țesutul hepatic din stratul inferior.
|
|
(3)
|
Se colectează supernatantul și se introduce în celelalte două microtuburi de 0,5 ml în același mod ca cel descris mai sus.
|
|
(4)
|
Se colectează restul supernatantului cu micropipeta (dacă este fezabil: ≥ 100 μl). Se introduce apoi supernatantul în microtubul de 0,5 ml rămas. Se procedează cu atenție pentru a nu colecta lipide de pe suprafață sau țesutul hepatic din stratul inferior.
|
|
(5)
|
Se închide dopul microtubului de 0,5 ml și se notează volumul supernatantului pe etichetă. Apoi se răcesc imediat microtuburile pe stativul cu gheață.
|
|
(6)
|
Se schimbă vârful micropipetei cu unul nou pentru fiecare supernatant. În cazul în care o cantitate mare de lipide se lipește de vârf, se schimbă imediat cu unul nou pentru a evita contaminarea extractului de ficat cu grăsime.
|
|
(7)
|
Se repartizează întregul supernatant centrifugat în patru microtuburi de 0,5 ml în conformitate cu procedura descrisă mai sus.
|
|
(8)
|
După aceasta, toate se așează pe stativul pentru tuburi cu eticheta de identificare și apoi se introduc imediat în congelator. În cazul în care concentrațiile de VTG sunt măsurate imediat după pretratament, un microtub de 0,5 ml (conținând 30 μl de supernatant) se păstrează la rece în stativul pentru tuburi și se transferă în stația de lucru unde se realizează testul ELISA. În acest caz, se așează microtuburile rămase în stativele pentru tuburi și se introduc în congelator.
|
|
(9)
|
După colectarea supernatantului, se elimină reziduurile în mod corespunzător.
|
Depozitarea eșantioanelor
Microtuburile de 0,5 ml conținând supernatantul omogenatului de ficat se depozitează la temperatura ≤ – 70 °C până în momentul utilizării acestora în cadrul testului ELISA..
Procedura 3 A: Peștele-zebră, prelevare de sânge din vena/artera caudală
Imediat după anestezie, se secționează transversal pedunculul caudal și se prelevează probe de sânge din artera/vena caudală cu ajutorul unui tub capilar microhematocrit heparinizat. Volumele de sânge variază de la 5 la 15 μl în funcție de dimensiunile peștilor. În tubul microcapilar se adaugă un volum egal de tampon de aprotinină (6 μgml în PBS), iar plasma este separată de sânge prin centrifugare (5 minute la 600 g). Plasma este colectată în tuburi de testare și depozitată la o temperatură de – 20 °C până în momentul măsurării vitelogeninei sau a altor proteine care prezintă interes.
Procedura 3 B: Peștele-zebră, prelevare de sânge prin puncție cardiacă
Pentru a se evita coagularea sângelui și degradarea proteinelor, probele sunt colectate într-o soluție salină tamponată cu fosfat (PBS) conținând heparină (1 000 unități/ml) și aprotinină – inhibitoare de protează (2 TIU/ml). Ca ingrediente pentru tampon se recomandă, sare de amoniu a heparinei și aprotinină liofilizată. Pentru prelevarea de probe de sânge se recomandă utilizarea unei seringi (1 ml) cu un ac subțire fix (de exemplu, Braun Omnikan-F). Seringa trebuie preumplută cu tampon (aproximativ 100 μl) pentru a realiza o eluare completă a volumelor sanguine mici de la fiecare pește. Probele de sânge sunt prelevate prin puncție cardiacă. Peștele trebuie anesteziat în prealabil cu MS-222 (100 mg/l). Un plan de anestezie corespunzător este acela care permite utilizatorului să distingă bătăile inimii peștelui-zebră. În timpul efectuării puncției cardiace, aplicați o tensiune ușoară continuă pe pistonul seringii. Volumele sanguine care pot fi colectate se încadrează în intervalul 20-40 de microlitri. După efectuarea puncției cardiace, amestecul de sânge și soluție tamponată trebuie introdus într-un tub de testare. Plasma este separată de sânge prin centrifugare (20 de minute; 5 000 g) și trebuie depozitată la o temperatură de – 80 °C până în momentul efectuării analizei.
Procedura 3C: POS: Peștele-zebră, omogenizarea capului și a cozii
|
(1)
|
Peștii sunt anesteziați și eutanasiați conform descrierii testului.
|
|
(2)
|
Capul și coada peștelui sunt tăiate conform Figurii 1.
|
Important: Toate instrumentele de disecție și planșa pentru efectuarea inciziilor trebuie clătite și curățate în mod corespunzător (de exemplu, cu etanol 96 %) între fiecare operațiune de manipulare a peștilor pentru a preveni «poluarea cu vitelogenină» de la femele sau de la masculii induși la masculii neinduși.
Figura 1

|
(3)
|
Greutatea materialului conținând cap și coadă de la fiecare pește este măsurată, rotunjindu-se greutatea la cea mai apropiată cifră întreagă în mg.
|
|
(4)
|
După cântărire, părțile sunt introduse în tuburi corespunzătoare (de exemplu, 1,5 ml Eppendorf) și congelate la o temperatură de – 80 °C până la omogenizare sau sunt direct omogenizate pe gheață cu ajutorul a două pistiluri din plastic. (Pot fi utilizate alte metode dacă sunt realizate pe gheață, iar rezultatul este o masă omogenă). Important: Tuburile trebuie numerotate în mod corect astfel încât capul și coada peștelui să poată fi corelate cu secțiunea de trup corespunzătoare utilizată pentru histologia gonadelor.
|
|
(5)
|
Atunci când se obține o masă omogenă, se adaugă tampon de omogenizare (22) la temperatura gheții în greutate 4 × greutatea țesutului. Se continuă operațiunea cu ajutorul pistilurilor până ce amestecul devin omogen. Notă importantă: se utilizează pistiluri noi pentru fiecare pește.
|
|
(6)
|
Probele se plasează pe gheață până la centrifugare, care se realizează la 4 °C la 50 000 × g timp de 30 min.
|
|
(7)
|
Se utilizează o pipetă pentru a repartiza câte 20 μl de supernatant în cel puțin două tuburi introducând vârful pipetei sub stratul de grăsime de la suprafață și aspirând cu grijă supernatantul fără nicio fracțiune de grăsime sau de granule.
|
|
(8)
|
Tuburile se depozitează la – 80 °C până la utilizare.
|
Apendicele 7
Probe fortificate de vitelogenină și standard de referință interteste
De fiecare dată când sunt efectuate teste de măsurare a vitelogeninei, va fi analizată o probă fortificată obținută cu ajutorul unui standard de referință interteste. Vitelogenina utilizată pentru prepararea standardului de referință interteste va proveni de la un lot diferit de cel utilizat pentru prepararea standardelor de calibrare pentru testul care urmează să fie realizat.
Proba fortificată va fi preparată prin adăugarea unei cantități cunoscute de standard interteste la o probă de plasmă de mascul de control. Proba va fi fortificată pentru a obține o concentrație de vitelogenină între de 10 și de 100 de ori mai mare față de concentrația de vitelogenină preconizată pentru peștii masculi de control. Proba de plasmă de masculi de control care este fortificată poate proveni de la un singur pește sau poate fi un amestec de la mai mulți pești.
Un subeșantion de plasmă nefortificată de mascul de control va fi analizat în cel puțin două godeuri duplicat. Proba fortificată va fi, de asemenea, analizată în cel puțin două godeuri duplicat. Cantitatea medie de vitelogenină din cele două probe de plasmă nefortificate de mascul de control va fi adăugată la cantitatea calculată de vitelogenină adăugată la probele fortificate în vederea determinării concentrației preconizate. Raportul dintre respectiva concentrație preconizată și concentrația măsurată va fi raportat împreună cu rezultatele fiecărui set de teste efectuate în ziua respectivă.
Apendicele 8

C.38. TEST DE METAMORFOZĂ LA AMFIBIENI
INTRODUCERE
|
1.
|
Prezenta metodă de testare este echivalentă cu Orientarea OCDE privind testarea (test guideline – TG) nr. 231 (2009). Necesitatea creării și validării unui test care să aibă capacitatea de a detecta substanțele chimice active asupra sistemul tiroidian al speciilor vertebrate reprezintă o consecință a temerilor conform cărora concentrațiile din mediu ale substanțelor chimice pot cauza efecte adverse atât oamenilor, cât și faunei. În 1998, OCDE a inițiat o activitate, cu prioritate mare, de revizuire a orientărilor existente și de elaborare a unor noi orientări vizând screeningul și testarea unor factori perturbatori potențiali ai sistemului endocrin. Un element al activității a constat în dezvoltarea unei orientări vizând screeningul substanțelor active asupra sistemului tiroidian al speciilor vertebrate. Au fost propuse atât o variantă perfecționată a studiului toxicității orale, cu doze repetate, cu durată de 28 de zile, la rozătoare (capitolul B.7 din prezenta anexă) și testul de metamorfoză la amfibieni (Amphibian Metamorphosis Assay – AMA). Metoda de testare B.7 în varianta ei perfecționată a fost supusă validării și a fost emisă o metodă de testare revizuită. Testul de metamorfoză la amfibieni (AMA) a făcut obiectul unui amplu program de validare care a inclus studii intra- și interlaboratoare demonstrând relevanța și fiabilitatea testului (1, 2). Ulterior, validarea testului a făcut obiectul unei evaluări inter pares efectuate de un grup de experți independenți (3). Această metodă de testare reprezintă rezultatul experienței dobândite pe parcursul studiilor de validare pentru detectarea substanțelor chimice active asupra sistemului tiroidian și al activității desfășurate în alte părți, în țările membre ale OCDE.
|
PRINCIPIUL TESTULUI
|
2.
|
Testul de metamorfoză la amfibieni (AMA) este un test de screening care are ca obiectiv identificarea pe bază empirică a substanțelor chimice care pot interfera cu funcționarea normală a axului hipotalamo-hipofizo-tiroidian (HHT). AMA reprezintă un model generalizat pentru vertebrate în măsura în care se bazează pe structurile și funcțiile conservate ale axului HHT. Acesta este un test important deoarece metamorfoza la amfibieni oferă un proces bine studiat, dependent de tiroidă, care răspunde la substanțele chimice active din axul HHT, fiind singurul test în măsură să detecteze activitatea tiroidiană la animalele care sunt în cursul unei dezvoltări morfologice.
|
|
3.
|
Protocolul experimental general implică expunerea mormolocilor de Xenopus laevis aflați în stadiul 51 la minimum trei concentrații diferite ale unei substanței chimice testate și la un control reprezentat de apa diluată, timp de 21 de zile. Există patru replici ale fiecărui tratament de testare. Densitatea larvară la inițierea testului este de 20 de mormoloci per bazin de testare pentru toate grupele tratate. Parametrii studiați observați sunt lungimea membrelor posterioare, lungimea bot-cloacă (snout to vent length – SVL), stadiul de dezvoltare, greutatea umedă, histologia tiroidiană și observațiile zilnice ale mortalității.
|
DESCRIEREA METODEI
Speciile folosite pentru testare
|
4.
|
Xenopus laevis este crescut în mod uzual în condiții de laborator în întreaga lume, fiind ușor de obținut prin intermediul furnizorilor comerciali. Reproducerea poate fi indusă cu ușurință în cazul acestei specii pe parcursul întregului an utilizând injecții cu gonadotropină corionică umană (human chorionic gonadotropin – HCG), larvele rezultate putând fi crescute ușor până la stadii de dezvoltare selectate, în număr mare, pentru a permite utilizarea de protocoale de testare specifice stadiilor. Este de preferat ca larvele utilizate în test să derive din adulți crescuți în propriul laborator. Ca alternativă, deși nu este procedura preferată, ouăle sau embrionii pot fi expediați la laboratorul care efectuează testul, unde li se permite aclimatizarea; expedierea organismelor în stadiu de larvă în scopuri de testare nu este acceptabilă.
|
Echipament și materiale
|
5.
|
Următoarele echipamente și materiale sunt necesare pentru realizarea acestui test:
|
a)
|
Sistem de expunere (a se vedea descrierea de mai jos);
|
|
b)
|
Acvarii din sticlă sau din oțel inoxidabil (a se vedea descrierea de mai jos);
|
|
c)
|
Bazine de reproducere;
|
|
d)
|
Aparat de controlare a temperaturii [de exemplu aparate de încălzire sau aparate de răcire (ajustabile la 22° ± 1 °C)];
|
|
f)
|
Microscop de disecție binocular;
|
|
g)
|
Cameră digitală cu o rezoluție de cel puțin 4 megapixeli și cu funcție micro;
|
|
h)
|
Software pentru digitalizarea de imagini;
|
|
i)
|
Placă Petri (ex. 100 × 15 mm) sau o cameră transparentă din plastic de dimensiuni comparabile;
|
|
j)
|
Balanță analitică capabilă să măsoare greutatea cu 3 zecimale (mg);
|
|
k)
|
Aparat pentru măsurarea oxigenului dizolvat;
|
|
m)
|
Aparat pentru măsurat intensitatea luminii în unități lux;
|
|
n)
|
Diverse vase din sticlă și instrumente de laborator;
|
|
o)
|
Pipete ajustabile (10 – 5 000 μl) sau pipete asortate de dimensiuni echivalente;
|
|
p)
|
Substanță chimică utilizată în testare, în cantități suficiente pentru realizarea studiului, de preferat dintr-un singur lot;
|
|
q)
|
Instrumente analitice corespunzătoare pentru substanța chimică utilizată în testare sau servicii analitice contractate.
|
|
Posibilitatea ca substanța chimică să fie utilizată în test
|
6.
|
AMA se bazează pe un protocol de expunere în mediu acvatic, în cadrul căruia substanța chimică este introdusă în incintele de testare prin intermediul unui sistem de testare cu flux continuu. Cu toate acestea, metodele testare cu flux continuu sunt supuse unor constrângeri legate de tipul substanțelor chimice care pot fi testate, în funcție de proprietățile lor fizico-chimice. Prin urmare, înainte de utilizarea acestui protocol, este necesară obținerea de informații de referință privind substanța chimică în cauză pentru a determina posibilitatea ca substanța chimică să fie utilizată în test, precum și consultarea publicației «OECD Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures» (Document de orientare al OCDE privind testarea toxicității acvatice a substanțelor și amestecurilor dificile ) (4). Caracteristicile care indică faptul că substanța chimică poate fi dificil de testat în sisteme acvatice includ: coeficienții de partiționare apă/octanol (log Kow) mari, volatilitate mare, susceptibilitatea la hidroliză și la fotoliză în condiții de iluminat de laborator. De asemenea, alți factori pot fi relevanți pentru determinarea posibilității ca substanța chimică să fie utilizată în test, iar aceștia trebuie determinați pentru fiecare caz în parte. Dacă utilizarea unui sistem de testare cu flux continuu nu permite succesul în testarea substanței chimice, este posibil să se recurgă la un sistem static cu reînnoire. În cazul în care niciunul dintre sisteme nu este adaptat pentru substanța chimică testată, atunci aceasta nu se testează prin acest protocol.
|
Sistemul de expunere
|
7.
|
Un sistem de diluție cu flux continuu este preferabil, dacă este posibil, unui sistem static cu reînnoire. Dacă proprietățile fizice și/sau chimice ale oricăreia dintre substanțele chimice nu permit utilizarea unui sistem de diluție cu flux continuu, se poate utiliza un sistem de expunere alternativ (de exemplu, static cu reînnoire). Componentele sistemului trebuie să fie fabricate dintr-un material adaptat pentru contactul cu apa, precum sticla, oțelul inoxidabil și/sau politetrafluoretilena. Cu toate acestea, pot fi utilizate materiale plastice corespunzătoare dacă acestea nu compromit studiul. Bazinele de expunere trebuie să fie acvarii din sticlă sau oțel inoxidabil, prevăzute cu conducte verticale care să mențină volumul aproximativ al bazinului între 4 și 10 l și o adâncime minimă a apei de 10 – 15 cm. Sistemul trebuie să aibă capacitatea de a susține toate concentrațiile de expunere și un control, cu patru replici per tratament. Debitul fiecărui bazin trebuie să fie constant, luând în considerare menținerea condițiilor biologice și expunerea la substanța chimică (ex. 25 ml/min). Bazinele de tratament trebuie să fie dispuse aleator într-o anumită poziție în cadrul sistemului de expunere, pentru a reduce eventualele efecte legate de poziție, inclusiv variațiile ușoare ale temperaturii, intensității luminii etc. Iluminarea fluorescentă trebuie să fie utilizată pentru a asigura o perioadă de expunere la lumină de 12 h de lumină: 12 h de întuneric la o intensitate cuprinsă între 600 și 2 000 lux (lumen/m2) la suprafața apei. În fiecare bazin de testare, temperatura apei trebuie menținută la 22° ± 1 °C, pH-ul trebuie menținut la valori cuprinse între 6,5 și 8,5, iar concentrația oxigenului dizolvat (OD) la > 3,5 mg/l (> 40 % din saturația în aer). Ca o condiție minimă, temperatura apei, pH-ul și oxigenul dizolvat trebuie măsurate săptămânal; temperatura trebuie să fie măsurată, de preferință, în mod continuu în cel puțin unul dintre vasele de testare. Apendicele 1 schițează condițiile experimentale necesare executării protocolului. Pentru informații suplimentare privind instalare sistemelor de expunere cu flux continuu și/sau a celor statice cu reînnoire, a se consulta ghidul ASTM «Standard Guide for Conducting Acute Toxicity Tests on Test Materials with Fishes, Macroinvertebrates, and Amphibians» (Orientare-standard privind efectuarea testelor de toxicitate acută cu materiale de testare pe pești, macronevertebrate și amfibieni) (5) și testele de toxicologie acvatică generale.
|
Calitatea apei
|
8.
|
Poate fi utilizată orice apă disponibilă local (apa de izvor sau apa de la robinet filtrată cu filtru de carbon) și care permite creșterea și dezvoltarea normale ale mormolocilor de X. laevis. Întrucât calitatea apei locale poate varia în mod semnificativ de la o zonă la alta, trebuie efectuată o analiză a calității apei, în special dacă nu sunt disponibile date istorice privind utilitatea respectivei ape pentru creșterea de Xenopus. O atenție specială trebuie acordată confirmării absenței din apă a cuprului, a clorului și a cloraminelor, toate acestea fiind toxice pentru broaște și mormoloci. În plus, se recomandă să se analizeze apa în ceea ce privește concentrațiile de fond de fluoruri, perclorați și clorați (subproduse rezultate din dezinfectarea apei potabile), întrucât toți acești anioni sunt substraturi ale transportatorului iodului la glanda tiroidă, iar nivelurile ridicate ale acestora pot perturba rezultatele studiului. Analiza trebuie să fie efectuată înainte de începerea testării, iar apa de testare trebuie în mod normal să nu conțină acești anioni.
|
Concentrația de ioduri din apa de testare
|
9.
|
Sinteza hormonilor tiroidieni în glanda tiroidă se bazează pe cantități suficiente de ioduri aflate la dispoziția larvelor, din surse acvatice și alimentare. În prezent, nu există recomandări empirice privind concentrațiile de ioduri minime. Cu toate acestea, cantitățile de ioduri disponibile pot afecta reactivitatea sistemului tiroidian la agenții activi asupra tiroidei, un factor de altfel cunoscut ca influențând activitatea bazală a acestei glande, un aspect care trebuie luat în considerare în momentul interpretării rezultatelor histopatologiei tiroidei. Prin urmare, trebuie raportate concentrațiile de ioduri măsurate în apa utilizată pentru testare. Pe baza datelor disponibile provenind din studiile de validare, s-a demonstrat că protocolul funcționează bine atunci când concentrațiile de ioduri (I–) din apa de testare au fost situate între 0,5 și 10 μg/l. În mod ideal, concentrația minimă de ioduri din apa de testare trebuie să fie de 0,5μg/l. Dacă testul este efectuat cu apă deionizată, pentru a atinge această concentrație minimă de 0,5μg/l este necesară suplimentare cu iod. Orice altă suplimentare a apei de testare cu iod sau cu alte săruri trebuie notată în raport.
|
Îngrijirea animalelor
Îngrijirea și reproducerea animalelor adulte
|
10.
|
Îngrijirea și reproducerea animalelor adulte este realizată în conformitate cu orientările standard, iar pentru informații mai detaliate, cititorul este invitat să consulte orientările standard privind efectuarea testului intitulat «Frog Embryo Teratogenesis Assay (FETAX)» (Testul de teratogeneză la embrionii de broască) (6). Aceste orientări standard oferă un exemplu de metode de îngrijire și de reproducere adecvate, însă fără să fie necesară respectarea loc cu strictețe. Pentru a induce reproducerea, mai multe cupluri (3 – 5) de adulți, femele și masculi, sunt injectate cu gonadotropină corionică umană (HCG). Dozele injectate femelelor și masculilor sunt de aproximativ 800 IU – 1 000 IU și, respectiv, la 600 IU – 800 IU de HCG dizolvată într-o soluție salină de 0,6 – 0,9 %. Cuplurile reproducătoare sunt ținute în bazine de mari dimensiuni, ferite de perturbări și în condiții statice, în vederea promovării amplexusului. Fundul fiecărui bazin de reproducere este prevăzut cu un grilaj din plastic sau din oțel inoxidabil, care să permită maselor de ouă să cadă pe fundul bazinului. Broaștele injectate după-amiaza târziu vor depune, de obicei, cea mai mare parte a ouălor pe la jumătatea dimineții zilei următoare. După ce o cantitate suficientă de ouă sunt eliberate și fertilizate, adulții trebuie să fie îndepărtați din bazinele de reproducere.
|
Îngrijirea și selectarea larvelor
|
11.
|
După ce adulții sunt îndepărtați din bazinele de reproducere, ouăle sunt colectate și evaluate din punctul de vedere al viabilității lor, utilizându-se un subset de embrioni prelevați din toate bazinele de reproducere. Cele mai bune progenituri (2 – 3 sunt recomandate pentru evaluarea calității lor) trebuie reținute pe baza viabilității embrionilor și a prezenței unui număr adecvat (minimum 1 500) de embrioni. Toate organismele utilizate în cadrul unui studiu trebuie să provină dintr-un singur eveniment de reproducere (progeniturile nu trebuie amestecate). Embrionii sunt transferați într-un recipient sau vas mare și plat și toate ouăle vizibil moarte sau anormale [a se vedea definiția de la (5)] sunt îndepărtate cu ajutorul unei pipete sau al unei pipete oculare. Embrionii sănătoși rezultați din fiecare set de progenituri sunt transferați în trei bazine de eclozare separate. La patru zile după transferare în bazinele de eclozare se selectează, pe baza viabilității și a succesului eclozării, cele mai bune progenituri, iar larvele sunt transferate într-un număr corespunzător de bazine de creștere la 22° ±1 °C. În plus, alte larve sunt mutate în bazine suplimentare pentru a servi ca înlocuitori în caz de mortalitate în bazinele de creștere pe parcursul primei săptămâni. Această procedură menține o densitate constantă de organisme, ceea ce reduce divergența dezvoltării în cohorta provenită dintr-un singur eveniment de reproducere. Toate bazinele de creștere trebuie să fie curățate zilnic. Ca măsură de precauție, mănușile de vinil sau de nitril sunt preferabile mănușilor din latex. Organismele moarte trebuie să fie îndepărtate zilnic și înlocuite cu larve pentru a menține astfel densitatea organismelor la un nivel constant pe parcursul primei săptămâni. Larvele trebuie hrănite cel puțin de două ori pe zi.
|
|
12.
|
Pe parcursul etapei de preexpunere, mormolocii sunt aclimatizați la condițiile corespunzătoare etapei de expunere, inclusiv la tipul de hrană, la temperatură, la ciclul lumină-întuneric și la mediul de cultură. Prin urmare, se recomandă ca aceeași apă de cultură/diluție să fie utilizată pe parcursul etapei de preexpunere și al celei de expunere. Dacă un sistem de cultură static este utilizat pentru menținerea mormolocilor pe durata etapei de preexpunere, mediul de cultură trebuie să fie înlocuit complet cel puțin de două ori pe săptămână. Suprapopularea, cauzată de densitățile mari de larve din cursul etapei de preexpunere, trebuie evitată deoarece un astfel de fenomen ar putea afecta în mod semnificativ dezvoltarea mormolocilor în cursul fazei de testare care urmează. Prin urmare, densitatea din bazinul de creștere nu trebuie să depășească aproximativ patru mormoloci/l de mediu de cultură (sistem de expunere statică) sau 10 mormoloci/l de mediu de cultură (de exemplu, cu un debit de 50 ml/min în sistemul de cultură sau de preexpunere). În aceste condiții, mormolocii trebuie să se dezvolte de la stadiul 45/46 la stadiul 51 în doisprezece zile. Mormolocii reprezentativi ai acestei populații trebuie inspectați zilnic pentru a observa stadiul de dezvoltare în vederea estimării timpului corespunzător pentru începerea expunerii. Trebuie procedat cu atenție pentru a minimaliza stresul și traumele pentru mormoloci, în special în timpul mobilizării, al curățării acvariilor și al manipulării larvelor. Condițiile/activitățile stresante trebuie evitate, în special zgomotele puternice și/sau constante, vibrațiile și lovirea acvariilor, activitatea excesivă în laborator și modificări rapide ale mediului (lumina, temperatura, pH-ul, OD, debitul apei, etc.). Dacă mormolocii nu ajung în stadiul 51 în decurs de 17 zile de la fertilizare, stresul excesiv trebuie considerat ca fiind una dintre cauze.
|
Cultura și hrănirea larvelor
|
13.
|
Mormolocii sunt hrăniți de exemplu cu hrană comercială pentru mormoloci utilizată în studiile de validare (a se vedea, de asemenea, apendicele 1) pe parcursul etapei de preexpunere [conform stadiului Nieuwkoop și Faber (NF) 45/46 (8)] și pe parcursul întregii perioade de testare de 21 de zile sau cu alt tip de hrană care a demonstrat aceeași performanță în cadrul testului de metamorfoză la amfibieni. Regimul de hrănire pe parcursul perioadei de preexpunere trebuie să fie ajutat cu atenție pentru a îndeplini necesitățile mormolocilor în dezvoltare. În practică, de mai multe ori pe zi (de cel puțin două ori), porții mici de hrană trebuie administrate larvelor recent eclozate. Hrănirea în exces trebuie evitată în vederea i) menținerea calității apei și ii) a prevenirii depunerii pe filtrelor branhiilor de particule și resturi de hrană. În ceea ce privește hrana administrată mormolocilor în studiile de validare, porțiile zilnice trebuie crescute pe măsura creșterii mormolocilor până la atingerea unei cantități de aproximativ 30 mg/animal/zi cu puțin timp înainte de începerea testului. În studiile de validare s-a demonstrat că hrana disponibilă comercial susține creșterea și dezvoltarea corespunzătoare a mormolocilor de X. laevis și că este o masă de particule fine care rămân suspendate în coloana de apă timp îndelungat și sunt îndepărtate odată cu fluxul apei. Prin urmare, volumul zilnic total de hrană trebuie împărțit în porții mai mici și administrate zilnic de cel puțin două ori. Pentru acest tip de hrană, regimul de hrănire este prezentat în tabelul 1. Ritmul de hrănire trebuie înregistrat. Acest tip de hrană poate fi administrat sub formă uscată sau sub formă de soluție stoc pregătită în apă de diluție. O astfel de soluție stoc trebuie pregătită proaspăt la un interval de două zile și depozitată la 4 °C atunci când nu este utilizată.
Tabelul 1
Regimul de hrănire cu hrană comercială pentru mormoloci utilizată în studiile de validare pentru mormolocii de X. laevis în etapa în care animalele sunt în viață în cursul AMA în condiții de flux continuu
|
Ziua studiului
|
Porția de hrană (mg de hrană/animal/zi)
|
|
0 – 4
|
30
|
|
5 – 7
|
40
|
|
8 – 10
|
50
|
|
11 – 14
|
70
|
|
15 – 21
|
80
|
|
Chimie analitică
|
14.
|
Înainte de efectuarea unui studiu, stabilitatea substanței chimice testate ar trebui evaluată utilizând informațiile existente referitoare la solubilitatea, degradabilitatea și volatilitatea sa. Soluțiile de testat din fiecare bazin replică la fiecare concentrație ar trebui eșantionate pentru analize de chimie analitică la începerea testării (ziua 0) și săptămânal pe durata testării, cu un minimum de patru eșantioane. De asemenea, se recomandă ca fiecare concentrație de testare să fie analizată pe durata pregătirii sistemului, înainte de începerea testării, în vederea verificării performanței sistemului. În plus, se recomandă ca soluțiile stoc să fie analizate atunci când sunt modificate, în special dacă volumul soluției stoc nu furnizează cantități corespunzătoare de substanțe chimice pentru a acoperi durata perioadelor de eșantionare de rutină. În cazul substanțelor chimice care nu pot fi detectate la anumite concentrații sau la toate concentrațiile utilizate într-o testare trebuie măsurate soluțiile stoc și trebuie înregistrate debitele sistemului pentru a calcula concentrațiile nominale.
|
Livrarea substanței chimice
|
15.
|
Metoda utilizată pentru a introduce substanța chimică testată în sistem poate varia în funcție de proprietățile sale fizico-chimice. Substanțele chimice solubile în apă pot fi dizolvate în alicote de apă de testare la o concentrație care permite livrarea la concentrația de testare vizată în cadrul unui sistem cu flux continuu. Substanțele chimice care sunt lichide la temperatura camerei și greu solubile în apă pot fi introduse cu ajutorul metodelor care implică o saturare lichid:lichid. Substanțele chimice care sunt solide la temperatura camerei și greu solubile în apă pot fi introduse cu ajutorul unor coloane de saturare cu vată de sticlă (7). Se preferă utilizarea unui sistem de testare fără cărăuși, totuși, diferitele substanțe chimice testate vor avea proprietăți fizico-chimice diferite care probabil vor necesita diferite abordări pentru pregătirea apei de expunere la substanțe chimice. Este de preferat să se depună eforturi pentru a evita solvenții sau cărăușii deoarece: i) anumiți solvenți pot fi ei înșiși toxici și/sau pot induce răspunsuri endocrinologice nedorite sau neașteptate, ii) testarea substanțelor chimice în concentrații care depășesc solubilitatea lor în apă (astfel cum se poate întâmpla frecvent în cazul solvenților) pot conduce la determinări inexacte ale concentrațiilor efective și iii) utilizarea solvenților în teste cu o durată mai lungă poate conduce la un grad semnificativ de formare de «biofilme» asociat cu activitatea microbiană. În ceea ce privește substanțele chimice care sunt dificil de testat, trebuie utilizat, în ultimă instanță, un solvent și trebuie consultat documentul de orientare al OCDE privind testarea toxicității acvatice a substanțelor și amestecurilor dificile (4) pentru a determina cea mai bună metodă. Alegerea solventului va fi determinată de proprietățile chimice ale substanței chimice. Solvenții care s-au dovedit eficienți pentru testarea toxicității acvatice includ acetona, etanolul, metanolul, dimetilformamida și trietilenglicolul. În cazul în care este utilizat un solvent-cărăuș, concentrațiile solventului trebuie să fie sub concentrația fără efecte observabile (No Observed Effect Concentration – NOEC) cronică; documentul de orientare al OCDE recomandă un maximum de 100μl/l; o examinare recentă recomandă utilizarea de concentrații ale solvenților de maximum 20μl/l în apa de diluție (12). În cazul în care sunt utilizați solvenți-cărăuși, trebuie evaluate controalele cu solvent adecvate în plus față de controalele fără solvent (apă curată). În cazul în care nu este posibilă administrarea unei substanțe chimice cu ajutorul apei, fie din cauza caracteristicilor fizico-chimice (solubilitate mică) sau disponibilitate limitată a substanței chimice, poate fi luată în considerare introducerea acesteia prin alimentație. Au fost efectuate activități preliminare privind expunerile prin hrană; totuși, această rută de expunere nu este utilizată frecvent. Alegerea metodei trebuie documentată și verificată în mod analitic.
|
Selectarea concentrațiilor de testare
Stabilirea concentrației de testare mari
|
16.
|
În scopul acestei testări, concentrația de testare mare trebuie stabilită de limita de solubilitate a substanței chimice testate; concentrația maximă tolerată (maximum tolerated concentration – MTC) pentru substanțele chimice cu toxicitate acută; sau 100 mg/l, oricare este concentrația cea mai mică.
|
|
17.
|
MTC este definită drept cea mai mare concentrație de testare a substanței chimice care determină o mortalitate acută de sub 10 %. Utilizarea acestei metode presupune faptul că există date empirice privind mortalitatea acută pe baza cărora poate fi estimată MTC. Estimarea MTC poate fi inexactă și, în general, necesită o anumită judecată profesională. Cu toate că utilizarea de modele de regresie poate fi cea mai bună abordare din punct de vedere tehnic pentru a estima MTC, o aproximare utilă a MTC poate fi obținută din datele existente privind toxicitatea acută utilizând 1/3 din valoarea LC50 acute. Totuși, datele privind toxicitatea acută pot lipsi în cazul speciilor testate. În cazul în care nu sunt disponibile date specifice privind toxicitatea acută pentru specii, poate fi efectuat un test LC50 de 96 de ore cu mormoloci reprezentativi (adică, în același stadiu) pentru cei testați în cadrul AMA. În mod opțional, în cazul în care sunt disponibile date privind alte specii acvatice (ex., studii LC50 la pești și alte specii de amfibieni), judecata profesională poate fi utilizată pentru a estima o MTC probabilă pe baza extrapolării inter-specii.
|
|
18.
|
În mod alternativ, în cazul în care substanța chimică nu este toxică în mod acut și este solubilă la peste 100 mg/l, atunci valoarea de 100 mg/l ar trebui considerată concentrația de testare cea mai mare (highest test concentration – HTC), deoarece această concentrație este considerată în mod tipic ca fiind «practic netoxică».
|
|
19.
|
Deși nu este procedura recomandată, metode statice cu reînnoire pot fi utilizate în cazurile în care metodele cu flux continuu nu sunt adecvate pentru a obține MTC. În cazul în care sunt utilizate metode statice cu reînnoire, stabilitatea concentrației substanței chimice testate trebuie documentată și trebuie să rămână în limitele criteriilor privind performanța. Sunt recomandate perioade de reînnoire de douăzeci și patru de ore. Perioadele de reînnoire care depășesc 72 de ore nu sunt acceptabile. În plus, parametrii privind calitatea apei (OD, temperatură, pH, etc.) trebuie măsurați la sfârșitul fiecărei perioade de reînnoire, imediat înainte de reînnoire.
|
Intervalul de concentrații de testare
|
20.
|
Este necesar un număr minim de trei concentrații de testare și un control cu apă curată (și un control cu vehicul, dacă este necesar). Diferența minimă a concentrației de testare între cea mai mare și cea mai mică trebuie să fie de aproximativ un ordin de mărime. Separarea maximă a dozei este de 0,1 și cea minimă este de 0,33.
|
PROCEDURA
Începerea și realizarea testului
Ziua 0
|
21.
|
Expunerea trebuie începută în momentul în care un număr suficient de mormoloci din populația stocului de preexpunere a atins stadiul de dezvoltare de 51, conform Nieuwkoop și Faber (8), și care au vârsta mai mică sau egală cu 17 zile după fertilizare. Pentru selectarea animalelor de testare, mormoloci sănătoși și cu aspect normal din cadrul populației stoc trebuie comasați într-un singur vas care să conțină un volum corespunzător de apă de diluție. Pentru determinarea stadiului de dezvoltare, mormolocii trebuie să fie îndepărtați în mod individual din bazinul de în care au fost comasați, cu ajutorul unei mici plase sau strecurători și trebuie transferați într-un spațiu de măsurare transparent (de exemplu, placă Petri de 100 mm) care conține apă de diluție. Pentru determinarea stadiului, este preferabil să nu se recurgă la anestezie, însă mormolocii pot fi anesteziați individual utilizând 100 mg/l de metansulfonat de tricaină (de exemplu, MS-222), tamponată în mod corespunzător cu bicarbonat de sodiu (pH 7) înainte de manipulare. Dacă este utilizată, metodologia de utilizare corespunzătoare, de exemplu a MS-222, pentru anestezie trebuie obținută de la laboratoare experimentate și raportată împreună cu rezultatele testului. Animalele trebuie să fie manipulate cu grijă pe durata acestui transfer pentru a minimaliza stresul cauzat de manipulare și pentru a evita orice leziune.
|
|
22.
|
Stadiul de dezvoltare al animalelor este determinat cu ajutorul un microscop de disecție binocular. Pentru a reduce variabilitatea ultimă în stadiul de dezvoltare, este important ca determinarea stadiului să fie realizată cât mai exact posibil. Conform Nieuwkoop și Faber (8), reperul principal care indică stadiul de dezvoltare utilizat pentru selectarea organismelor din stadiul 51 este morfologia membrelor posterioare. Caracteristicile morfologice ale membrelor posterioare trebuie să fie examinate la microscop. Dacă pentru informații complete privind determinarea stadiului mormolocilor trebuie să se consultate ghidul Nieuwkoop și Faber (8), stadiul poate fi determinat în mod fiabil utilizând reperele morfologice majore. Tabelul de mai jos poate fi utilizat pentru a simplifica și pentru a standardiza procesul de determinare a stadiului pe întreaga durată a studiului prin identificarea acelor repere morfologice majore care sunt asociate unor diferite stadii, presupunând că dezvoltarea este normală.
Tabelul 2
Repere morfologice majore de stadializare conform ghidului Neuwkoop și Faber.
|
Repere morfologice majore
|
Stadiu de dezvoltare
|
|
51
|
52
|
53
|
54
|
55
|
56
|
57
|
58
|
59
|
60
|
61
|
62
|
63
|
64
|
65
|
66
|
|
Membre posterioare
|
X
|
X
|
X
|
X
|
X
|
X
|
X
|
|
|
|
|
|
|
|
|
|
|
Membre anterioare
|
|
|
|
|
|
X
|
X
|
X
|
X
|
X
|
|
|
|
|
|
|
|
Structura craniofacială
|
|
|
|
|
|
|
|
|
|
X
|
X
|
X
|
X
|
|
|
|
|
Morfologia nervului olfactiv
|
|
|
|
|
|
|
|
|
|
|
X
|
X
|
X
|
|
|
|
|
Lungimea cozii
|
|
|
|
|
|
|
|
|
|
|
|
|
X
|
X
|
X
|
X
|
|
|
23.
|
Pentru începerea testului, toți mormolocii trebuie să fie în stadiul 51. Cel mai important reper morfologic major de stadializare pentru stadiul respectiv este morfologia membrelor posterioare, care este demonstrată în Figura 1.
Figura 1
Morfologia membrelor posterioare a unui mormoloc X. laevis în stadiul 51.

|
|
24.
|
În plus față de selectarea stadiului de dezvoltare, poate fi folosită selectarea opțională a dimensiunii animalelor utilizate în scopuri experimentale. În acest scop, lungimea corpului întreg (nu SVL) trebuie măsurată în ziua 0 pentru un subeșantion de aproximativ 20 de mormoloci aflați în stadiul 51 conform NF. După calcularea mediei lungimii corpului întreg pentru acest grup de animale, limitele minimă și maximă pentru lungimea corpului întreg a animalelor utilizate în scopuri experimentale pot fi stabilite permițând un interval al valorii medii de ± 3 mm (valorile medii ale lungimii corpului întreg sunt cuprinse între 24 și 28,1 mm pentru mormolocii în stadiul 51). Cu toate acestea, determinarea stadiului de dezvoltare constituie parametrul principal în a determina dacă fiecare animal este gata de testare. Mormolocii care prezintă malformații sau leziuni vizibile macroscopic trebuie excluși de la testare.
|
|
25.
|
Mormolocii care îndeplinesc criteriile de stadializare descrise mai sus sunt ținuți într-un bazin cu apă curată de cultură până la finalizarea procesului de determinare a stadiului. După finalizarea procesului de determinare a stadiului, larvele sunt distribuite în mod aleatoriu în bazinele de tratament de expunere până când fiecare bazin conține 20 de larve. Fiecare bazin de tratament este ulterior inspectat pentru a detecta animale cu aspect anormal (de exemplu, leziuni, comportament de înot anormal, etc.). Mormolocii cu un aspect evident nesănătos trebuie îndepărtați din bazinele de tratament și înlocuiți cu larve nou selectate din bazinul de comasare.
|
Observații
|
26.
|
Pentru informații mai aprofundate privind procedurile de terminare a testării și prelucrarea mormolocilor, a se consulta «OECD Guidance Document on Amphibian Thyroid Histology» (Document de orientare al OCDE privind histologia tiroidei amfibienilor) (9).
|
Ziua 7 Măsurători
|
27.
|
În ziua 7, cinci mormoloci aleși în mod aleatoriu per replică sunt îndepărtați din fiecare bazin de testare. Procedura de selectare aleatorie utilizată trebuie să confere fiecărui organism testat o probabilitate egală de a fi selectat. Aceasta se poate realiza prin utilizarea oricărei metode de randomizare, însă necesită ca fiecare mormoloc să fie prins. Mormolocii neselectați sunt transferați înapoi în bazinul de origine, iar mormolocii selectați sunt eutanasiați fără cruzime excesivă în 150 – 200 mg/l MS-222 tamponată în mod corespunzător cu bicarbonat de sodiu pentru a se obține pH 7. Mormolocii eutanasiați sunt clătiți cu apă și uscați prin tamponare, proces urmat de determinarea greutății corporale cu rotunjire la cel mai apropiat miligram. Lungimea membrelor posterioare, lungimea bot-cloacă și stadiul de dezvoltare sunt determinate pentru fiecare mormoloc (cu ajutorul unui microscop de disecție binoculară).
|
Ziua 21 Măsurători (încheierea testului)
|
28.
|
În momentul încheierii testului (ziua 21), mormolocii rămași sunt îndepărtați din bazinele de testare și eutanasiați fără cruzime excesivă în 150 – 200 mg/l MS-222 tamponată în mod corespunzător cu bicarbonat de sodiu, astfel cum se descrie mai sus. Mormolocii sunt clătiți cu apă și uscați prin tamponare, proces urmat de determinarea greutății corporale cu rotunjire la cel mai apropiat miligram. Stadiul de dezvoltare, SVL și lungimile membrelor posterioare sunt măsurate pentru fiecare mormoloc.
|
|
29.
|
Toate larvele sunt plasate în soluție de fixare Davidson timp de 48 – 72 de ore, fie ca eșantioane de corp întreg, fie ca eșantioane fără cap conținând maxilarul inferior pentru evaluări histologice. Pentru histopatologie, trebuie prelevați din fiecare bazin replică un număr total de cinci mormoloci. Având în vedere faptul că înălțimea unei celule foliculare depinde de stadiu (10), cea mai adecvată metodă în ceea ce privește eșantionarea pentru analize histologice este, ori de câte ori este posibil, utilizarea unor indivizi aflați în stadii de dezvoltare compatibile. În vederea selectării indivizilor aflați în stadii de dezvoltare compatibile, trebuie determinat stadiul de dezvoltare a tuturor larvelor înainte de selectare și prelucrarea subsecventă în vederea colectării și conservării de date. Acest lucru este necesar deoarece divergența normală în dezvoltare va avea ca rezultat distribuții stadiale distincte în cadrul fiecărui bazin replică.
|
|
30.
|
Animalele selectate pentru histopatologie (n = 5 din fiecare bazin replică) trebuie corelate medianei stadiului controalelor (replici comasate), ori de câte ori este posibil. În cazul în care există bazine replică în care se află mai mult de cinci larve în stadiul corespunzător, atunci cinci larve sunt selectate în mod aleatoriu.
|
|
31.
|
În cazul în care există bazine replică cu mai puțin de cinci larve în stadiul corespunzător, atunci indivizii selectați în mod aleatoriul din stadiul vecin de dezvoltare, inferior sau superior, trebuie să fie eșantionați pentru a constitui o dimensiune totală a eșantionului de cinci larve per replică. De preferință, decizia de a eșantiona larve suplimentare din stadiul vecin de dezvoltare, inferior sau superior, trebuie luată pe baza unei evaluări generale a distribuției stadiilor în bazinele de control și în cele cu tratament chimic. Adică, în cazul în care tratamentul chimic este asociat cu o întârziere a dezvoltării, trebuie eșantionate larve suplimentare din stadiul imediat inferior. În schimb, în cazul în care tratamentul chimic este asociat cu o accelerare a dezvoltării, trebuie eșantionate larve suplimentare din stadiul imediat superior.
|
|
32.
|
În caz de modificări severe ale dezvoltării mormolocilor ca urmare a tratamentului cu o substanță chimică testată, ar putea să nu existe o suprapunere a distribuirii stadiilor în bazinele cu tratament chimic cu stadiul de dezvoltare median calculat în bazinele de control. Doar în aceste cazuri, procesul de selecție trebuie să fie modificat utilizând un stadiu diferit de stadiul median de control pentru a se obține o eșantionare compatibilă cu stadiul a larvelor pentru histopatologie tiroidiană. În plus, dacă stadiile sunt nedeterminate (asincronie), 5 mormoloci din fiecare replică trebuie aleși în mod aleatoriu pentru analiza histologică. Raționamentul care stă la baza eșantionării oricărei larve care nu se află într-un stadiu echivalent cu stadiul de dezvoltare median de control trebuie raportată.
|
Determinarea parametrilor biologici studiați
|
33.
|
Pe durata fazei de expunere de 21 de zile, măsurarea principalilor parametri studiați este realizată în zilele 7 și 21, fiind necesară, totuși, observarea zilnică a animalelor testate. Tabelul 3 conține o prezentare generală a parametrilor studiați care vor fi măsurați și a momentelor de observare corespunzătoare. Informații mai detaliate privind procedurile tehnice de măsurare a parametrilor studiați apicali și evaluările histologice sunt disponibile în documentele de orientare ale OCDE (9).
Tabelul 3
Momentele de observare a principalilor parametri studiați în AMA.
|
Parametrii apicali
|
Zilnic
|
Ziua 7
|
Ziua 21
|
|
|
ߦ
|
|
|
|
|
|
ߦ
|
ߦ
|
|
—
|
Lungimea membrelor posterioare
|
|
|
ߦ
|
ߦ
|
|
|
|
ߦ
|
ߦ
|
|
—
|
Greutatea corporală umedă
|
|
|
ߦ
|
ߦ
|
|
—
|
Histologia glandei tiroide
|
|
|
|
ߦ
|
|
Parametrii apicali
|
34.
|
Stadiul de dezvoltare, lungimea membrelor posterioare, SVL și greutatea umedă sunt parametrii apicali ai AMA, fiecare fiind descris în mod succint mai jos. În documentele de orientare din referințe sunt disponibile mai multe informații tehnice referitoare la colectarea acestor date, inclusiv proceduri de analiză asistate de calculator, care sunt recomandate pentru a fi utilizate.
|
Stadiu de dezvoltare
|
35.
|
Stadiul de dezvoltare al mormolocilor de X. laevis este determinat cu ajutorul criteriilor de determinare a stadiului de dezvoltare conform Nieuwkoop și Faber (8). Datele privind stadiul de dezvoltare sunt utilizate pentru a determina dacă dezvoltarea este accelerată, asincronă, întârziată sau neafectată. Accelerarea sau întârzierea dezvoltării este determinată prin compararea medianei stadiilor atinse de grupele de control și de grupele tratate. Dezvoltarea asincronă este raportată atunci când țesuturile examinate nu prezintă nicio anomalie sau malformație, însă ritmul morfogenezei sau al dezvoltării diferitelor țesuturi este perturbat la un singur mormoloc.
|
Lungimea membrelor posterioare
|
36.
|
Diferențierea și creșterea membrelor posterioare se află sub controlul hormonilor tiroidieni și reprezintă repere majore de dezvoltare deja utilizate în determinarea stadiului de dezvoltare. Dezvoltarea membrelor posterioare este utilizată calitativ în determinarea stadiul de dezvoltare, însă aici este luată în considerare ca parametru cantitativ. Prin urmare, lungimea membrelor posterioare este măsurată ca parametru studiat în vederea detectării efectelor asupra axului tiroidian (figura 2). Din motive de coerență, lungimea membrelor posterioare este măsurată la nivelul membrului posterior stâng. Lungimea membrelor posterioare este evaluată în ziua 7 și în ziua 21 a testului. În ziua 7, măsurarea lungimii membrelor posterior este simplă, astfel cum se ilustrează în figura 2. Cu toate acestea, măsurarea lungimii membrelor posterioare în ziua 21 este mai complicată ca urmare a flectării membrelor. Prin urmare, măsurarea lungimii membrelor posterioare în ziua 21 trebuie să înceapă de la peretele cavității abdominale și să urmeze linia mediană a membrului prin orice devieri unghiulare. Modificările lungimii membrelor posterioare în ziua 7, chiar dacă nu sunt evidente în ziua 21, sunt considerate în continuare semnificative pentru potențialul activității tiroidiene. Măsurătorile lungimilor sunt obținute fotografii digitale utilizând programe informatice de analiză, astfel cum este descris în documentul OCDE de orientare privind histologia tiroidei amfibienilor (9).
|
Lungimea corpului și greutatea umedă
|
37.
|
Determinarea lungimii bot-cloacă (SVL) (figura 2) și a greutății umede este inclusă în protocolul de testare în vederea evaluării efectelor posibile ale substanțelor chimice testate asupra ritmului de creștere a mormolocilor în raport cu grupal de control și sunt utile în detectarea toxicității generale determinate de substanța chimică testată. Întrucât eliminarea apei aderente pentru determinarea greutății poate provoca condiții de stres pentru mormoloci și poate cauza leziuni ale pielii, aceste măsurători sunt efectuate în ziua 7 pe mormolocii subeșantionați și pe toți mormolocii rămași la încheierea testului (ziua 21). Din motive de coerență, ca limită caudală de măsurare trebuie utilizat partea cranială a cloacei.
|
|
38.
|
Lungimea bot-cloacă (SVL) este utilizată pentru a evalua creșterea mormolocilor astfel cum se ilustrează în figura 2.
Figura 2
(A) Tipuri de măsurători ale lungimii corpului și (B) măsurători ale lungimii membrelor posterioare pentru mormoloci de X. laevis (1).

|
Histologia glandei tiroide
|
39.
|
În timp ce stadiul de dezvoltare și lungimea membrelor posterioare reprezintă parametrii studiați importanți pentru evaluarea schimbărilor legate de expunere în dezvoltarea metamorfică, întârzierea în dezvoltare nu poate considerată, prin ea însăși, un indicator cu valoare diagnostică pentru activitatea antitiroidiană. Unele modificări pot fi observate doar prin analiza histopatologică de rutină. Criteriile de diagnostic includ hipertrofia/atrofia glandei tiroide, hipertrofia celulelor foliculare, hiperplazia celulelor foliculare și următoarele criterii calitative suplimentare: zona luminală foliculară, calitate coloidului și înălțimea/forma celulelor foliculare. Gradele de gravitate (4 grade) trebuie raportate. Informații privind obținerea și prelucrarea eșantioanelor pentru analize histologice și pentru efectuarea analizelor histologice pe eșantioane de țesuturi sunt disponibile în «Amphibian Metamorphosis Assay: Part 1 – Technical guidance for morphologic sampling and histological preparation» (Testul metamorfozei la amfibieni: Partea 1 – Orientare tehnică pentru eșantionare morfologică și pregătire histologică ) și în «Amphibian Metamorphosis Assay: Part 2 – Approach to reading studies, diagnostic criteria, severity grading and atlas» (Testul metamorfozei la amfibieni: Partea 2 – Metodă de interpretare a studiilor, criterii de diagnostic, aprecierea severității și atlas) (9). Laboratoarele care efectuează testul pentru prima dată (primele dăți) trebuie să solicite consiliere din partea unor patologi cu experiență în scopuri de formare înainte de efectuarea analizei histologice și a evaluării glandei tiroide. Schimbările evidente și semnificative în ceea ce privește parametrii apicali indicând accelerarea sau asincronia dezvoltării pot exclude necesitatea efectuării analizei histopatologice a glandelor tiroide. Cu toate acestea, absența unor modificări morfologice evidente sau a dovezilor privind întârzierea dezvoltării impun efectuarea analizelor histologice.
|
Mortalitate
|
40.
|
Toate bazinele de testare trebuie verificate zilnic pentru a verifica dacă nu există mormoloci morți, iar numărul acestora se înregistrează pentru fiecare bazin. Data, concentrația și numărul bazinelor trebuie înregistrate pentru orice activitate de observare a mortalității. Animalele moarte trebuie îndepărtate din bazinul de testare imediat după ce au fost observate. O rată a mortalității de peste 10 % poate indica condiții de testare necorespunzătoare sau efecte toxice ale substanței chimice testate.
|
Observații suplimentare
|
41.
|
Cazurile de comportament anormal și de malformații și leziuni vizibile macroscopic trebuie înregistrate. Data, concentrația și numărul bazinului trebuie înregistrate în caz că se observă comportament anormal, malformații sau leziuni vizibile macroscopic. Comportamentul normal este caracterizat prin rămânerea mormolocilor suspendați în coloana de apă cu coada ridicată deasupra capului, bătaia ritmică și regulată a înotătoarei caudale, ridicarea periodică la suprafață, opercularea și receptivitatea la stimuli. Un comportament anormal ar include, de exemplu, plutirea la suprafață, rămânerea pe fundul bazinului, înotare inversată sau neregulată, lipsa de activitate la suprafață și lipsa de reacție la stimuli. În plus, diferențele mari în consumul de hrană între tratamente trebuie înregistrate. Malformațiile și leziuni majore ar putea include anomalii morfologice (de exemplu, deformări ale membrelor), leziuni hemoragice, infecții bacteriene sau fungice, pentru a menționa doar câteva. Aceste determinări sunt calitative și trebuie considerate analoage semnelor clinice de boală/stres și trebuie raportate la animalele de control. În cazul în care apariția sau rata apariției este mai mare în bazinele expuse decât în cele de control, atunci acestea ar trebui considerate drept dovadă de toxicitate evidentă.
|
DATE ȘI RAPORTARE
Colectarea de date
|
42.
|
Toate datele trebuie colectate cu ajutorul sistemelor electronice sau manuale care sunt în conformitate cu bunele practici de laborator (BPL). Datele studiului trebuie să includă:
|
|
Substanța chimică testată:
|
—
|
Caracterizarea substanței chimice testate: proprietățile fizico-chimice; informații referitoare la stabilitate și biodegradabilitate;
|
|
—
|
Informații și date privind substanța chimică: metoda și frecvența de pregătire a diluțiilor. Informațiile referitoare la substanța chimică testată includ concentrațiile reale și nominale ale substanței chimice testate, iar în unele cazuri, substanțe chimice neparentale, după caz. Măsurătorile privind substanța chimică testată pot fi necesare pentru soluțiile stoc, precum și pentru soluțiile de testare;
|
|
—
|
Solvent (dacă este altul decât apa): justificarea alegerii unui solvent și caracterizarea solventului (natură, concentrație utilizată);
|
|
|
|
Condiții de testare:
|
—
|
Înregistrări operaționale: acestea constau în observații referitoare la funcționarea sistemului de testare și la mediul și infrastructura de sprijin. Înregistrările tipice includ: temperatura ambiantă, temperatura de testare, perioada de expunere la lumină, starea componentelor critice ale sistemului de expunere (de exemplu pompe, contoare de cicluri, presiuni), debite, niveluri de apă, schimbări ale recipientelor de rezervă, precum și înregistrări privind hrănirea. Parametrii generali de calitate a apei includ: pH, OD, conductivitate, iod total, alcalinitate și duritate;
|
|
—
|
Abateri de la metoda de testare: aceste informații trebuie să includă orice informație sau descrieri ale abaterilor de la metoda de testare;
|
|
|
|
Rezultate:
|
—
|
Observații și date biologice: acestea includ observații zilnice legate de mortalitate, consumul de alimente, comportamentul de înot anormal, letargie, pierderea echilibrului, malformații, leziuni, etc. Observațiile și datele colectate la intervale prestabilite includ: stadiul de dezvoltare, lungimea membrelor posterioare, lungimea bot-cloacă și greutatea umedă;
|
|
—
|
Tehnicile de analiză statistică și justificarea tehnicilor utilizate; rezultatele analizei statistice, de preferat, sub formă de tabel;
|
|
—
|
Date histologice: acestea includ descrieri, precum și severitatea gradată și scoruri privind incidența unor observații specifice, astfel cum se detaliază în documentul de orientare privind histopatologia;
|
|
—
|
Observații ad hoc: aceste observații trebuie să includă descrieri ale studiului care nu se încadrează în categoriile descrise anterior.
|
|
|
Raportarea datelor
|
43.
|
Apendicele 2 conține foi de calcul privind colectarea zilnică a datelor care pot fi utilizate ca orientări pentru introducerea datelor brute și pentru calcularea statisticilor sumare. În plus, tabelele de raportare sunt astfel elaborate încât să fie convenabile pentru comunicarea rezumatelor datelor privind parametrii studiați. Tabelele de raportare pentru evaluările histologice pot fi consultate în apendicele 2.
|
Criterii de performanță și de acceptabilitate/validitate a testelor
|
44.
|
În general, abaterile majore de la metoda de testare vor conduce la date inacceptabile pentru interpretare sau raportare. Prin urmare, următoarele criterii din tabelul 4 au fost dezvoltate ca orientare pentru determinarea calității testului efectuat, performanța generală a organismelor de control.
Tabelul 4
Criterii de performanță pentru testul AMA.
|
Criteriu
|
Limite acceptabile
|
|
Concentrațiile testate
|
Menținute la ≤ 20 % CV (coeficient de variație) (variabilitatea concentrațiilor de testare măsurate) pe parcursul testului cu durata de 21 de zile
|
|
Mortalitatea în grupurilor de control;
|
≤ 10 % – mortalitatea în orice replică în grupurile de control trebuie să nu depășească 2 mormoloci
|
|
Stadiul de dezvoltare median minim al grupurilor de control la sfârșitul testului
|
57
|
|
Intervalul stadiilor de dezvoltare în grupul de control
|
A 10-a și a 90-a procentilă a distribuției stadiilor de dezvoltare nu trebuie să difere cu mai mult de 4 stadii.
|
|
Oxigen dizolvat
|
≥ 40 % față de saturația în aer (23)
|
|
pH
|
pH-ul trebuie menținut între 6,5 și 8,5. Diferențele între replici/tratament nu trebuie să depășească 0,5.
|
|
Temperatura apei
|
22° ± 1 °C – diferențele între replici/tratament nu trebuie să depășească 0,5 °C.
|
|
Concentrațiile de testare fără toxicitate evidentă
|
≥ 2
|
|
Performanța replicii
|
≤ 2 replici per test pot fi compromise
|
|
Condiții speciale de utilizare a unui solvent
|
Dacă se utilizează un solvent cărăuș, trebuie să se utilizeze un vas de control cu solvent și un vas de control cu apă curată, iar rezultatele trebuie raportate.
|
|
Diferențele semnificative din punct de vedere statistic dintre vasul de control cu solvent și vasul de control cu apă curată sunt tratate în mod specific. Pentru informații suplimentare, a se vedea mai jos.
|
|
Condiții speciale pentru sistemul static cu reînnoire
|
Analizele substanțelor chimice reprezentative înainte și după reînnoire trebuie raportate.
|
|
Nivelurile de amoniac trebuie măsurate imediat înainte de reînnoire.
|
|
Toți parametrii legați de calitatea apei enumerați în tabelul 1 din apendicele 1 trebuie măsurați imediat înainte de reînnoire.
|
|
Perioada de reînnoire nu trebuie să depășească 72 de ore.
|
|
Program corespunzător de hrănire (50 % din porția zilnică de hrană din hrana comercială pentru mormoloci)
|
|
Validitatea testului
|
45.
|
Pentru ca un test să fie considerat acceptabil/valid, trebuie să fie îndeplinite următoarele cerințe:
|
|
Experiment valid în cadrul unui test determinat a fi negativ pentru activitatea tiroidei:
|
(1)
|
Pentru orice tratament dat (inclusiv în grupurile de control), mortalitatea nu poate depăși 10 %. Pentru orice replică dată, mortalitatea nu poate depăși trei mormoloci, în caz contrar replica este considerată compromisă
|
|
(2)
|
Cel puțin două niveluri de tratament, cu toate cele patru replici necompromise, trebuie să fie disponibile pentru analiză
|
|
(3)
|
Cel puțin două niveluri de tratament fără toxicitate evidentă ar trebui să fie disponibile pentru analiză
|
|
|
|
Experiment valid în cadrul unui test determinat a fi pozitiv pentru activitatea tiroidei:
|
(1)
|
Poate exista mortalitate de maximum doi mormoloci/replică în grupul de control
|
|
|
Arbore decizional pentru efectuarea testului AMA
|
46.
|
Arborele decizional a fost dezvoltat astfel încât testul AMA să ofere asistență logică în efectuarea și interpretarea rezultatelor biotestului (a se vedea diagrama din figura 3). Arborele decizional, în esență, ponderează parametrii prin faptul că dezvoltarea avansată, dezvoltarea asincronă și histopatologia tiroidiană au o importanță mare, în timp ce dezvoltarea întârziată, lungimea bot-cloacă și greutatea corporală umedă, parametri care pot fi potențial afectați de toxicitatea generală, au o importanță mai mică.
Figura 3
Arbore decizional pentru efectuarea testului AMA.
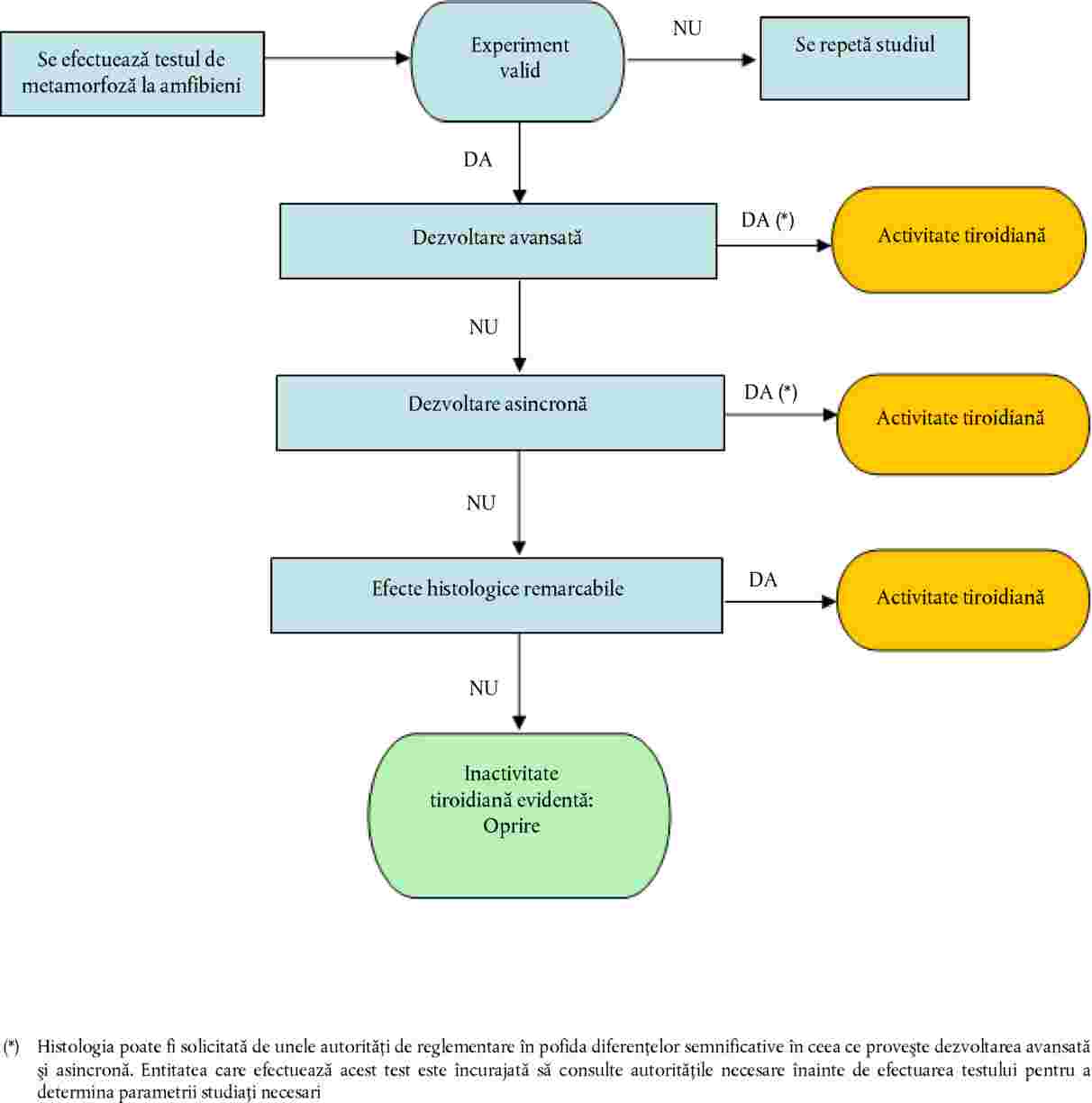
|
Dezvoltarea avansată (determinată utilizând stadiul de dezvoltare, SVL și HLL)
|
47.
|
Dezvoltarea avansată este cunoscută ca survenind numai prin efecte datorate hormonilor tiroidieni. Acestea pot fi efecte la nivelul țesuturilor periferice, precum interacțiunea directă cu receptorul hormonilor tiroidieni (cum ar fi T4) sau efecte care modifică nivelurile circulante ale hormonilor tiroidieni. În oricare dintre cazuri, acestea sunt considerate dovezi suficiente pentru a indica faptul că substanța chimică are activitate tiroidiană. Dezvoltarea avansată este evaluată în unul din două moduri. În primul mod, stadiul de dezvoltare generală poate fi evaluat pe baza metodei standardizate detaliate în Nieuwkoop și Faber (8). În al doilea mod, caracteristici morfologice specifice pot fi cuantificate, precum lungimea membrelor posterioare, în zilele 7 și 21, ele fiind asociate în mod pozitiv cu efecte agoniste asupra receptorilor hormonilor tiroidieni. În cazul în care apar progrese semnificative statistic în ceea ce privește dezvoltarea sau lungimea membrelor posterioare, testul indică faptul că substanța chimică este are activitate tiroidiană.
|
|
48.
|
Evaluarea animalelor testate privind prezența unei dezvoltări accelerate în raport cu populația de control se va baza pe rezultatele analizelor statistice efectuate pentru următorii patru parametri:
|
—
|
lungimea membrelor posterioare (normalizată prin lungimea bot-cloacă) în ziua de studiu 7
|
|
—
|
lungimea membrelor posterioare (normalizată prin lungimea bot-cloacă) în ziua de studiu 21
|
|
—
|
stadiul de dezvoltare în ziua de studiu 7
|
|
—
|
stadiul de dezvoltare în ziua de studiu 21.
|
|
|
49.
|
Analizele statistice ale lungimii membrelor posterioare trebuie efectuate pe baza măsurătorilor lungimii membrului posterior stâng. Lungimea membrelor posterioare este normalizată prin stabilirea raportului dintre lungimea membrelor posterioare și lungimea bot-cloacă pentru un individ. Media valorilor normalizate pentru fiecare nivel de tratament sunt ulterior comparate. Accelerarea dezvoltării este apoi indicată printr-o creștere semnificativă a mediei lungimii membrelor posterioare (normalizate) într-un grup de tratament chimic în raport cu grupul de control în ziua de studiu 7 și/sau în ziua de studiu 21 (a se vedea apendicele 3).
|
|
50.
|
Analizele statistice ale stadiului de dezvoltare trebuie efectuate pe baza determinării stadiilor de dezvoltare în conformitate cu criteriile morfologice descrise de Nieuwkoop și Faber (8). Accelerarea dezvoltării este indicată atunci când analiza multicuantică detectează o creștere semnificativă a valorilor stadiilor de dezvoltare într-un grup de tratament chimic în raport cu grupul de control în ziua de studiu 7 și/sau în ziua de studiu 21.
|
|
51.
|
În ceea ce privește metoda de testare AMA, un efect semnificativ asupra oricăruia din cei patru parametri sus-menționați este considerat suficient pentru o detectare pozitivă a dezvoltării accelerate. Aceasta înseamnă că efectele semnificative asupra lungimii membrelor posterioare într-un moment specific nu necesită coroborare nici cu efectele semnificative asupra lungimii membrelor posterioare la momentul alternativ și nici cu efectele semnificative asupra stadiului de dezvoltare în acest moment specific. În schimb, efectele semnificative asupra stadiului de dezvoltare la un moment specific nu necesită coroborare nici cu efectele semnificative asupra stadiului de dezvoltare în momentul alternativ și nici cu efectele semnificative asupra lungimii membrelor posterioare în acest moment specific. Cu toate acestea, greutatea dovezilor privind dezvoltarea accelerată va crește dacă sunt detectate efecte semnificative la mai mult de un parametru.
|
Dezvoltarea asincronă (determinată utilizând criteriile de determinare a stadiului de dezvoltare)
|
52.
|
Dezvoltarea asincronă este caracterizată prin perturbarea evoluției temporale a morfogenezei sau a dezvoltării diferitelor țesuturi într-un singur mormoloc. Incapacitatea de a stabili cu claritate stadiul de dezvoltare a unui organism utilizând setul de parametri morfologici considerați tipici pentru orice stadiu dat indică faptul că țesuturile se dezvoltă asincron prin metamorfoză. Dezvoltarea asincronă este un indicator al activității tiroidiene. Singurele modalități de acțiune cunoscute care conduc la dezvoltare asincronă sunt prin efecte ale substanțelor chimice asupra acțiunilor hormonilor tiroidieni la nivel periferic și/sau asupra metabolismului hormonilor tiroidieni în țesuturile în curs de dezvoltare astfel cum se observă în cazul inhibitorilor deiodinazei.
|
|
53.
|
Evaluarea animalelor testate privind prezența dezvoltării asincrone în raport cu populația de control se va baza pe evaluarea morfologică macroscopică a animalelor testate în ziua de studiu 7 și în ziua de studiu 21.
|
|
54.
|
Descrierea dezvoltării normale a Xenopus laevis de către Nieuwkoop și Faber (8) furnizează cadrul necesar identificării unei ordini secvențiale de remodelare a țesuturilor normale. Termenul «dezvoltare asincronă» se referă în mod specific la abaterile de la dezvoltarea morfologică macroscopică a mormolocilor care nu permit stabilirea definitivă a unui stadiu de dezvoltare în conformitate cu criteriile stabilite de Nieuwkoop și Faber (8), deoarece reperele morfologice esențiale prezintă caracteristici ale unor stadii diferite.
|
|
55.
|
Astfel cum implică termenul «dezvoltare asincronă», trebuie luate în considerare numai cazurile care prezintă abateri de la progresul remodelării țesuturilor specifice în raport cu progresul remodelării altor țesuturi. Unele fenotipuri clasice includ întârzierea sau absența apariției membrelor anteriore în pofida dezvoltării normale sau avansate a membrelor posterioare și a țesuturilor cozii, sau resorbția precoce a branhiilor în raport cu stadiul morfogenezei membrelor posterioare și resorbția cozii. Un animal va fi înregistrat ca prezentând o dezvoltare asincronă dacă acesta nu poate fi atribuit unui stadiu deoarece nu îndeplinește majoritatea criteriilor-reper de dezvoltare pentru un anumit stadiu conform Niewkoop și Faber (8) sau dacă există întârziere sau accelerare extremă a uneia sau a mai multor caracteristici esențiale (de exemplu, coadă complet resorbită, dar fără apariția membrelor anterioare). Această evaluare se efectuează calitativ și trebuie să examineze setul complet de caracteristici-reper enumerate de Nieuwkoop și Faber (8). Cu toate acestea, nu este necesară înregistrarea stadiului de dezvoltare a diferitelor caracteristici-reper ale animalelor observate. Animalelor înregistrate ca prezentând o dezvoltare asincronă nu li se atribuie un stadiu de dezvoltare Nieuwkoop și Faber (8).
|
|
56.
|
Prin urmare, un criteriu central pentru desemnarea cazurilor de dezvoltare morfologică anormală ca «dezvoltare asincronă» este acela că momentul relativ al remodelării tisulare și al morfogenezei țesuturilor este perturbat în timp ce morfologia țesuturilor afectate nu este evident anormală. Un exemplu pentru ilustrarea acestei interpretări a anomaliilor morfologice macroscopice este faptul că o întârziere a morfogenezei membrelor posterioare în raport cu dezvoltarea altor țesuturi va îndeplini criteriul de «dezvoltare asincronă» în timp ce cazurile care prezintă lipsa membrelor posterioare, degete anormale (de exemplu ectrodactilie, polidactilie), sau alte malformații evidente ale membrelor nu trebuie considerate drept «dezvoltare asincronă».
|
|
57.
|
În acest context, principalele repere morfologice care trebuie evaluate din punctual de vedere al progresului lor metamorfic coordonat trebuie să includă morfogeneza membrelor posterioare, morfogeneza membrelor anterioare, apariția membrelor anterioare, stadiul de resorbție a cozii (în special resorbția înotătoarei caudale) și morfologia capului (de exemplu, dimensiunea branhiilor și stadiul resorbției branhiilor, morfologia maxilarului inferior, proeminența cartilajului Meckel).
|
|
58.
|
În funcție de modul de acțiune al substanței chimice, pot apărea diferite fenotipuri morfologice macroscopice. Unele fenotipuri clasice includ întârzieri sau absențe ale apariției membrelor anterioare în pofida dezvoltării normale sau avansate a membrelor posterioare și a țesuturi cozii, resorbția precoce a branhiilor în raport cu membrele posterioare și remodelarea cozii.
|
Histopatologie
|
59.
|
În cazul în care substanța chimică nu cauzează toxicitate evidentă și nu accelerează dezvoltarea sau nu conduce la dezvoltare asincronă, atunci histopatologia glandelor tiroide este evaluată pe baza documentului de orientare adecvat (9). Întârzierea dezvoltării, în absența toxicității, reprezintă un indicator puternic al activității antitiroidiene, însă analiza stadiului de dezvoltare este mai puțin sensibilă și cu valoare diagnostică mai mică decât analiza histopatologică a glandei tiroide. Prin urmare, efectuarea de analize histopatologice ale glandelor tiroide este necesară în acest caz. Efectele asupra histologiei glandei tiroide au fost demonstrate în absența unor efecte asupra dezvoltării. În cazul în care apar modificări în histopatologia tiroidiană, substanța chimică este considerată a avea activitate tiroidiană. În cazul în care nu sunt observate întârzieri în dezvoltare sau leziuni histologice în glandele tiroide, substanța chimică este considerată a nu avea activitate tiroidiană. Raționamentul acestei decizii este faptul că glanda tiroidă este sub influența TSH și orice substanță chimică care modifică hormonii tiroidieni circulanți suficient pentru a modifica secreția de TSH va conduce la modificări histopatologice ale glandelor tiroide. Diverse moduri și mecanisme de acțiune pot modifica hormonii tiroidieni circulanți. Așadar, în timp ce nivelul hormonilor tiroidieni indică un efect tiroidian, el este insuficient pentru a determina modul sau mecanismul de acțiune care determină răspunsul.
|
|
60.
|
Deoarece acest parametru nu poate fi analizat prin metode statistice de bază, determinarea unui efect asociat cu expunerea la o substanță chimică trebuie efectuată pe baza opiniei experte a unui patolog.
|
Dezvoltarea întârziată (determinată utilizând stadiul de dezvoltare, HLL, BW, SVL)
|
61.
|
Dezvoltarea întârziată poate avea loc prin intermediul unor mecanisme antitiroidiene și prin toxicitate indirectă. Ușoarele întârzieri de dezvoltare cuplate cu semne evidente de toxicitate indică un posibil efect toxic nespecific. Evaluarea toxicității netiroidiene reprezintă un element esențial al testului pentru a reduce probabilitatea unor rezultate fals pozitive. Mortalitatea excesivă reprezintă un indiciu evident că operează alte mecanisme toxice. În mod similar, ușoare reduceri în creștere, astfel cum sunt stabilite prin greutatea umedă și/sau SVL sugerează, de asemenea, toxicitate netiroidiană. Creșteri aparente ale creșterii sunt de obicei observate în cazul substanțelor chimice care afectează negativ dezvoltarea normală. În consecință, prezența unor animale mai mari nu indică neapărat o toxicitate netiroidiană. Totuși, toxicitatea tiroidiană nu trebuie stabilită niciodată doar pe baza creșterii. Mai degrabă, creșterea, în coroborare cu stadiul de dezvoltare și cu histopatologia tiroidiană, trebuie utilizată pentru a determina activitatea tiroidei. De asemenea, pentru determinarea toxicității evidente, trebuie să fie luați în considerare alți parametri incluzând edemul, leziunile hemoragice, letargia, consumul de produse alimentare redus, comportamentul anormal/modificare a înotului, etc. Dacă toate concentrațiile de testare determină semne de toxicitate evidentă, substanța chimică testată trebuie reevaluată la concentrații de testare mai mici înainte de a determina dacă substanța chimică este potențial activă la nivel tiroidian sau nu are activitate tiroidiană.
|
|
62.
|
Întârzierile de dezvoltare semnificative din punct de vedere statistic, în absența altor semne de toxicitate evidentă, indică faptul că substanța chimică are activitate tiroidiană (antagonistă). În absența unor răspunsuri statistice solide, acest rezultat poate fi sporit cu rezultate obținute în urma histopatologiei tiroidiene.
|
Analize statistice
|
63.
|
Analizele statistice ale datelor ar trebui să urmeze, de preferat, proceduri descrise în documentul «Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application» (Metode actuale de analiză statistică a datelor privind exotoxicitatea: orientări de aplicare) (11). Pentru toți parametri studiați cantitativi continui (HLL SVL, greutate umedă) care prezintă o relația doză-răspuns monotonă trebuie aplicat testul Jonckheere-Terpstra în manieră descrescătoare pentru a stabili existența unui efect semnificativ al tratamentului.
|
|
64.
|
Pentru parametrii continui care nu sunt compatibili cu o relație doză-răspuns monotonă, datele trebuie să fie evaluate din punctul de vedere al normalității (de preferat cu ajutorul testului Shapiro-Wilk sau Anderson-Darling) și al omogenității varianței (de preferat cu ajutorul testului Levene). Ambele teste sunt efectuate pe reziduurile de la o ANOVA. Se poate recurge la opinia experților în locul acestor teste formale privind normalitatea și omogenitatea varianței, deși sunt preferate testele formale. În cazul în care se constată o anormalitate sau o eterogenitate a varianței, trebuie căutată o normalizare, o transformare de stabilizare a varianței. În cazul în care datele (probabil după o transformare) sunt distribuite în mod normal cu o varianță omogenă, un efect semnificativ al tratamentului este determinat prin testul Dunnett. În cazul în care datele (probabil după o transformare) sunt distribuite în mod normal cu o varianță eterogenă, un efect semnificativ al tratamentului este determinat prin testul Tamhane-Dunnett sau prin testul T3 sau prin testul Mann-Whitney-Wilcoxon U. În cazul în care nu se poate constata vreo transformare de normalizare, un efect semnificativ al tratamentului este determinat prin testul Mann-Whitney-Wilcoxon U utilizând o ajustare Bonferroni-Holm la valorile p. Testul Dunnett se aplică independent de orice test ANOVA F, iar testul Mann-Whitney se aplică independent de orice test de ansamblu Kruskall-Wallis.
|
|
65.
|
Nu se preconizează o mortalitate semnificativă, însă aceasta trebuie evaluată prin testul Cochran-Armitage regresiv dacă datele sunt compatibile o relație doză-răspuns monotonă, iar altfel, prin testul Exact al lui Fisher cu o ajustare Bonferroni-Holm.
|
|
66.
|
Un efect semnificativ al tratamentului asupra stadiului de dezvoltare este determinat prin aplicarea regresivă a testului Jonckheere-Terpstra aplicat medianelor replicilor. În mod alternativ, și de preferat, testul Jonckheere multicuantic de la a 20-a la a 80-a procentilă trebuie să fie utilizat pentru determinarea efectului, deoarece ia în considerare modificările profilului distribuției.
|
|
67.
|
Unitatea de analiză corespunzătoare este replica, astfel încât datele constau în mediane ale replicilor dacă este utilizat testul Jonckheere-Terpstra sau testul Mann-Whitney U, sau mediile replicilor dacă este utilizat testul Dunnett. Relația monotonă doză-răspuns poate fi evaluată vizual cu ajutorul mediilor sau al medianelor replicilor și tratamentului sau cu ajutorul testelor formale, precum cele descrise anterior (11). În condițiile în care se utilizează sub cinci replici per tratament sau control, versiunile de permutare exacte ale testelor Jonckheere-Terpstra și Mann-Whitney trebuie utilizate dacă sunt disponibile. Semnificația statistică a tuturor testelor indicate este considerată la nivelul de 0,05.
|
|
68.
|
Figura 4 reprezintă o organigramă pentru efectuarea de teste statistice asupra datelor continue.
Figura 4
Diagramă a metodelor statistice pentru datele privind răspunsuri continue.

|
Considerații speciale privind analiza datelor
Utilizarea nivelurilor de tratament compromise
|
69.
|
O serie de factori trebuie luați în considerare pentru a determina dacă o replică sau întregul tratament demonstrează toxicitate evidentă și trebuie excluși din analiză. Toxicitatea evidentă se caracterizează printr-o mortalitate > 2 indivizi în orice replică care nu poate fi explicată decât prin toxicitate și nu printr-o eroare tehnică. Alte semne ale toxicității evidente includ hemoragia, comportamentele anormale, modalitățile anormale de înot, anorexia și orice alt semn clinic de boală. În ceea ce privește semnele subletale de toxicitate, pot fi necesare evaluări calitative care trebuie întotdeauna realizate în raport cu un grup de control dintr-un vas cu apă curată.
|
Vase de control cu solvent
|
70.
|
Utilizarea unui solvent trebuie avută în vedere ca ultimă soluție, după epuizarea tuturor celorlalte opțiuni de livrare a substanței chimice. În cazul utilizării unui solvent, este imperativă utilizarea unui grup de control într-un vas cu apă curată. La încheierea testului, trebuie efectuată o evaluare a potențialelor efecte ale solventului. Aceasta se realizează printr-o comparație statistică a grupului de control din vasul cu solvent și a grupului de control din vasul cu apă curată. Cei mai relevanți parametri pentru această analiză sunt stadiul de dezvoltare, SVL și greutatea umedă, deoarece acestea pot fi afectate prin toxicități netiroidiene. În cazul în care sunt constatate diferențe semnificative din punct de vedere statistic ale acestor parametri între grupul de control din vasul cu apă curată și grupul de control din vasul cu solvent, trebuie determinați parametrii studiului pentru măsurătorile răspunsului folosind grupul de control din vasul cu apă curată. Dacă nu se constată diferențe semnificative din punct de vedere statistic între grupul de control din vasul cu apă curată și grupul de control din vasul cu solvent pentru toate variabilele măsurătorilor răspunsului, trebuie determinați parametrii studiului pentru măsurătorile răspunsului utilizând un grupurile de control comasate din vasul cu apă de diluție și din cel cu solvent.
|
Grupurile de tratament care ating un stadiu de dezvoltare superior sau egal cu 60
|
71.
|
După stadiul 60, mormolocii scad ca dimensiune și greutate ca urmare a resorbției țesuturilor și a reducerii conținutului de apă în valoare absolută. Astfel, măsurarea greutății umede și a lungimii bot-cloacă nu poate fi utilizată în analizele statistice ale diferențelor vitezelor de creștere. Prin urmare, datele referitoare la greutatea umedă și la lungime ale organismelor aflate într-un stadiu NF mai mare de 60 trebuie cenzurate și eliminate din analizele mediilor sau medianelor replicilor. Două metode diferite ar putea fi utilizate pentru a analiza acești parametri de creștere.
|
|
72.
|
Una dintre metode constă în luarea în considerare exclusiv a mormolocilor cu stadii de dezvoltare mai mici sau egale cu 60 pentru analizele statistice ale greutății umede și/sau ale lungimii bot-cloacă. Această metodă este considerată a furniza informații suficient de solide cu privire la severitatea posibilelor efecte asupra creșterii, cu condiția ca proporția animalelor de testare excluse din analize să fie mică (≤ 20 %). Dacă un număr crescut de mormoloci se caracterizează printr-un stadiu de dezvoltare mai mare decât 60 (≥ 20 %) pentru una sau mai multe concentrații nominale, atunci trebuie realizată o structură ANOVA bifactorială cu o varianță ierarhică pentru toți mormolocii pentru a evalua efectele asupra creșterii ale tratamentelor chimice, luând în considerare în același timp efectul stadiului târziu de dezvoltare asupra creșterii. Apendicele 3 furnizează orientări privind analiza ANOVA bifactorială pentru greutate și lungime..
|
BIBLIOGRAFIE
|
(1)
|
OECD (2004) Report of the Validation of the Amphibian Metamorphosis Assay for the detection of thyroid active substances: Phase 1 – Optimisation of the Test Protocol. Environmental Health and Safety Publications. Series on Testing and Assessment. No. 77, Paris.
|
|
(2)
|
OECD (2007) Final Report of the Validation of the Amphibian Metamorphosis Assay: Phase 2 – Multi-chemical Interlaboratory Study. Environmental Health and Safety Publications. Series on Testing and Assessment. No. 76. Paris
|
|
(3)
|
OECD (2008) Report of the Validation Peer Review for the Amphibian Metamorphosis Assay and Agreement of the Working Group of the National Coordinators of the Test Guidelines Programme on the Follow-up of this Report. Environmental Health and Safety Publications. Series on Testing and Assessment. No. 92. Paris
|
|
(4)
|
OECD (2000) Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. Environmental Health and Safety Publications. Series on Testing and Assessment. No. 23. Paris
|
|
(5)
|
ASTM (2002) Standard Guide for Conducting Acute Toxicity Tests on Test Materials with Fishes, Macroinvertebrates, and Amphibians. American Society for Testing and Materials, ASTM E729-96(2002), Philadelpia, PA
|
|
(6)
|
ASTM (2004) Standard Guide for Conducting the Frog Embryo Teratogenesis Assay – Xenopus (FETAX). E 1439-98
|
|
(7)
|
Kahl, M.D., Russom, C.L., DeFoe, D.L. & Hammermeister, D.E. (1999) Saturation units for use in aquatic bioassays. Chemosphere 39, pp. 539-551
|
|
(8)
|
Nieuwkoop, P.D. & Faber, J. (1994) Normal Table of Xenopus laevis. Garland Publishing, New York
|
|
(9)
|
OECD (2007) Guidance Document on Amphibian Thyroid Histology. Environmental Health and Safety Publications. Series on Testing and Assessment. No. 82. Paris
|
|
(10)
|
Dodd, M.H.I. & Dodd, J.M. (1976) Physiology of Amphibia. Lofts, B. (ed.), Academic Press, New York, pp. 467-599
|
|
(11)
|
OECD (2006) Current Approaches in the Statistical Analysis of Ecotoxicity Data: A Guidance to Application. Environmental Health and Safety Publications. Series on Testing and Assessment, No. 54. Paris
|
|
(12)
|
Hutchinson TH, Shillabeer N, Winter MJ, Pickford DB, 2006. Acute and chronic effects of carrier solvents in aquatic organisms: A critical review. Review. Aquatic Toxicology, 76; pp. 69–92.
|
Apendicele 1
Tabelul 1
Condiții experimentale pentru testul de metamorfoză la amfibieni de 21 de zile
|
Animale utilizate în test
|
Larve de Xenopus laevis
|
|
Stadiul larvar inițial
|
Stadiul 51 conform Nieuwkoop și Faber
|
|
Perioada de expunere
|
21 de zile
|
|
Criteriile de selecție a larvelor
|
Stadiul de dezvoltare și lungimea totală (opțional)
|
|
Concentrațiile de testare
|
Minimum 3 concentrații care acoperă aproximativ un ordin de magnitudine
|
|
Regimul de expunere
|
Cu flux continuu (preferat) și/sau static cu reînnoire
|
|
Debitul sistemului de testare
|
25 ml/min (înlocuirea completă a volumului la aproximativ fiecare 2,7 h)
|
|
Parametri studiați principali /zile de determinare
|
Mortalitate
|
Zilnic
|
|
Stadiu de dezvoltare
|
Z 7 și 21
|
|
Lungimea membrelor posterioare
|
Z 7 și 21
|
|
Lungimea bot-cloacă
|
Z 7 și 21
|
|
Greutatea corporală umedă
|
Z 7 și 21
|
|
Histologia glandei tiroide
|
Z 21
|
|
Apa de diluție/control de laborator
|
Apă de robinet declorurată (cu filtru de carbon) sau sursă echivalentă de laborator
|
|
Densitatea larvelor
|
20 larve/vas de testare (5/l)
|
|
Soluție de testare/vas de testare
|
4– 10 l (10– 15 cm de apă minimum)/vas de testare din sticlă sau din oțel inoxidabil (de exemplu, 22,5 cm × 14 cm × 16,5 cm)
|
|
Replică
|
4 vase-replică de testare/concentrație de testare și control
|
|
Rată de mortalitate admisă în grupurile de control
|
≤ 10 % per vas-replică de testare
|
|
Fixare tiroidiană
|
Număr fixat
|
Toți mormolocii (5/replică sunt evaluați inițial)
|
|
Regiune
|
Cap sau întregul corp
|
|
Lichide de fixare
|
Fixatorul Davidson
|
|
Hrănire
|
Hrană
|
Sera Micron® sau echivalent
|
|
Cantitate/frecvență
|
A se vedea tabelul 1 pentru regimul de hrănire cu Sera Micron®
|
|
Iluminat
|
Perioadă de expunere la lumină
|
12 h lumină: 12 h întuneric
|
|
Intensitate
|
600 – 2 000 lux (măsurată la suprafața apei)
|
|
Temperatura apei
|
22° ± 1 °C
|
|
pH
|
6,5 – 8,5
|
|
Concentrația oxigenului dizolvat (OD)
|
> 3,5 mg/l (> 40 % saturația în aer)
|
|
Program de eșantionare pentru analize chimice
|
O dată/săptămână (4 eșantionări/test)
|
Apendicele 2
Tabele pentru raportarea datelor brute și de sinteză
Tabelul 1
Informații generale privind substanțele chimice testate
|
Informații privind substanțele chimice
|
|
|
A se introduce substanța chimică testată, unitățile concentrațiilor și tratamentele
|
|
|
Substanța chimică testată:
|
|
|
|
|
Unități ale concentrațiilor:
|
|
|
|
|
Tratament 1
|
|
|
|
|
Tratament 2
|
|
|
|
|
Tratament 3
|
|
|
|
|
Tratament 4
|
|
|
|
|
|
|
|
|
|
Data (ziua 0):
|
|
A se introduce data (ll/zz/aa)
|
|
|
Data (ziua 7):
|
|
A se introduce data (ll/zz/aa)
|
|
|
Data (ziua 21):
|
|
A se introduce data (ll/zz/aa)
|
Tabelul 2
Fișe de colectare a datelor primare pentru zilele 7 și 21
|
ZIUA X
DATA 00/00/00
|
|
|
Concentrație
|
Număr tratament
|
Număr replică
|
Număr individual
|
Identificator individual
|
Stadiu de dezvoltare
|
Lungimea SVL (mm)
|
Lungimea membrelor posterioare (mm)
|
Greutatea umedă a întregului organism (mg)
|
|
RÂND
|
TRT
|
TRT#
|
REP
|
IND
|
ID#
|
STADIU
|
BL
|
HLL
|
GREUTATE
|
|
1
|
0,00
|
1
|
|
|
|
|
|
|
|
|
2
|
0,00
|
1
|
|
|
|
|
|
|
|
|
3
|
0,00
|
1
|
|
|
|
|
|
|
|
|
4
|
0,00
|
1
|
|
|
|
|
|
|
|
|
5
|
0,00
|
1
|
|
|
|
|
|
|
|
|
6
|
0,00
|
1
|
|
|
|
|
|
|
|
|
7
|
0,00
|
1
|
|
|
|
|
|
|
|
|
8
|
0,00
|
1
|
|
|
|
|
|
|
|
|
9
|
0,00
|
1
|
|
|
|
|
|
|
|
|
10
|
0,00
|
1
|
|
|
|
|
|
|
|
|
11
|
0,00
|
1
|
|
|
|
|
|
|
|
|
12
|
0,00
|
1
|
|
|
|
|
|
|
|
|
13
|
0,00
|
1
|
|
|
|
|
|
|
|
|
14
|
0,00
|
1
|
|
|
|
|
|
|
|
|
15
|
0,00
|
1
|
|
|
|
|
|
|
|
|
16
|
0,00
|
1
|
|
|
|
|
|
|
|
|
17
|
0,00
|
1
|
|
|
|
|
|
|
|
|
18
|
0,00
|
1
|
|
|
|
|
|
|
|
|
19
|
0,00
|
1
|
|
|
|
|
|
|
|
|
20
|
0,00
|
1
|
|
|
|
|
|
|
|
|
21
|
0,00
|
2
|
|
|
|
|
|
|
|
|
22
|
0,00
|
2
|
|
|
|
|
|
|
|
|
23
|
0,00
|
2
|
|
|
|
|
|
|
|
|
24
|
0,00
|
2
|
|
|
|
|
|
|
|
|
25
|
0,00
|
2
|
|
|
|
|
|
|
|
|
26
|
0,00
|
2
|
|
|
|
|
|
|
|
|
27
|
0,00
|
2
|
|
|
|
|
|
|
|
|
28
|
0,00
|
2
|
|
|
|
|
|
|
|
|
29
|
0,00
|
2
|
|
|
|
|
|
|
|
|
30
|
0,00
|
2
|
|
|
|
|
|
|
|
|
31
|
0,00
|
2
|
|
|
|
|
|
|
|
|
32
|
0,00
|
2
|
|
|
|
|
|
|
|
|
33
|
0,00
|
2
|
|
|
|
|
|
|
|
|
34
|
0,00
|
2
|
|
|
|
|
|
|
|
|
35
|
0,00
|
2
|
|
|
|
|
|
|
|
|
36
|
0,00
|
2
|
|
|
|
|
|
|
|
|
37
|
0,00
|
2
|
|
|
|
|
|
|
|
|
38
|
0,00
|
2
|
|
|
|
|
|
|
|
|
39
|
0,00
|
2
|
|
|
|
|
|
|
|
|
40
|
0,00
|
2
|
|
|
|
|
|
|
|
|
41
|
0,00
|
3
|
|
|
|
|
|
|
|
|
42
|
0,00
|
3
|
|
|
|
|
|
|
|
|
43
|
0,00
|
3
|
|
|
|
|
|
|
|
|
44
|
0,00
|
3
|
|
|
|
|
|
|
|
|
45
|
0,00
|
3
|
|
|
|
|
|
|
|
|
46
|
0,00
|
3
|
|
|
|
|
|
|
|
|
47
|
0,00
|
3
|
|
|
|
|
|
|
|
|
48
|
0,00
|
3
|
|
|
|
|
|
|
|
|
49
|
0,00
|
3
|
|
|
|
|
|
|
|
|
50
|
0,00
|
3
|
|
|
|
|
|
|
|
|
51
|
0,00
|
3
|
|
|
|
|
|
|
|
|
52
|
0,00
|
3
|
|
|
|
|
|
|
|
|
53
|
0,00
|
3
|
|
|
|
|
|
|
|
|
54
|
0,00
|
3
|
|
|
|
|
|
|
|
|
55
|
0,00
|
3
|
|
|
|
|
|
|
|
|
56
|
0,00
|
3
|
|
|
|
|
|
|
|
|
57
|
0,00
|
3
|
|
|
|
|
|
|
|
|
58
|
0,00
|
3
|
|
|
|
|
|
|
|
|
59
|
0,00
|
3
|
|
|
|
|
|
|
|
|
60
|
0,00
|
3
|
|
|
|
|
|
|
|
|
61
|
0,00
|
4
|
|
|
|
|
|
|
|
|
62
|
0,00
|
4
|
|
|
|
|
|
|
|
|
63
|
0,00
|
4
|
|
|
|
|
|
|
|
|
64
|
0,00
|
4
|
|
|
|
|
|
|
|
|
65
|
0,00
|
4
|
|
|
|
|
|
|
|
|
66
|
0,00
|
4
|
|
|
|
|
|
|
|
|
67
|
0,00
|
4
|
|
|
|
|
|
|
|
|
68
|
0,00
|
4
|
|
|
|
|
|
|
|
|
69
|
0,00
|
4
|
|
|
|
|
|
|
|
|
70
|
0,00
|
4
|
|
|
|
|
|
|
|
|
71
|
0,00
|
4
|
|
|
|
|
|
|
|
|
72
|
0,00
|
4
|
|
|
|
|
|
|
|
|
73
|
0,00
|
4
|
|
|
|
|
|
|
|
|
74
|
0,00
|
4
|
|
|
|
|
|
|
|
|
75
|
0,00
|
4
|
|
|
|
|
|
|
|
|
76
|
0,00
|
4
|
|
|
|
|
|
|
|
|
77
|
0,00
|
4
|
|
|
|
|
|
|
|
|
78
|
0,00
|
4
|
|
|
|
|
|
|
|
|
79
|
0,00
|
4
|
|
|
|
|
|
|
|
|
80
|
0,00
|
4
|
|
|
|
|
|
|
|
Tabelul 3
Sinteze calculate pentru datele parametrilor din zilele 7 și 21
|
|
|
Stadiu de dezvoltare
|
SVL (mm)
|
Lungimea membrelor posterioare (mm)
|
Greutate (mg)
|
|
TRT
|
REP
|
MIN
|
MEDIANĂ
|
MAX
|
MEDIE
|
STADIU DE DEZVOLTARE
|
MEDIE
|
STADIU DE DEZVOLTARE
|
MEDIE
|
STADIU DE DEZVOLTARE
|
|
1
|
1
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
1
|
2
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
1
|
3
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
1
|
4
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
2
|
1
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
2
|
2
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
2
|
3
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
2
|
4
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
3
|
1
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
3
|
2
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
3
|
3
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
3
|
4
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
4
|
1
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
4
|
2
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
4
|
3
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
4
|
4
|
0
|
#NUM!
|
0
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
#DIV/0!
|
|
Notă: Calculele din celule sunt asociate cu datele introduse în tabelul 2.
|
Tabelul 4
Date privind mortalitatea zilnică
|
Ziua de testare
|
Data
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
|
0
|
00/00/00
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1
|
#Valoare!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
#Valoare!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
#Valoare!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
#Valoare!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5
|
#Valoare!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6
|
#Valoare!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7
|
#Valoare!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8
|
#Valoare!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9
|
#Valoare!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10
|
#Valoare!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
11
|
#Valoare!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
12
|
#Valoare!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
13
|
#Valoare!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
14
|
#Valoare!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
15
|
#Valoare!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
16
|
#Valoare!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
17
|
#Valoare!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
18
|
#Valoare!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
19
|
#Valoare!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
20
|
#Valoare!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
21
|
#Valoare!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Număr per replică
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
0
|
|
Număr per tratament
|
0
|
|
|
|
0
|
|
|
|
0
|
|
|
|
0
|
|
|
|
|
Notă: Calculele din celule sunt asociate cu datele introduse în tabelul 1.
|
Tabelul 5
Criterii privind calitatea apei
Sistemul de expunere (cu flux continuu/static cu reînnoire):
Temperatura:
Intensitatea luminii:
Ciclul lumină-întuneric:
Hrană:
Frecvența hrănirii:
pH-ul apei:
Concentrația de iod în apa utilizată pentru testare
Tabelul 6
Data de sinteză privind substanțele chimice:
|
Denumirea substanței chimice:
|
|
Cas #:
|
|
Ziua de testare
|
Data
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
1
|
2
|
3
|
4
|
|
0
|
00/00/00
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1
|
#Valoare!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
#Valoare!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
#Valoare!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
#Valoare!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
5
|
#Valoare!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6
|
#Valoare!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7
|
#Valoare!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8
|
#Valoare!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
9
|
#Valoare!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10
|
#Valoare!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
11
|
#Valoare!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
12
|
#Valoare!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
13
|
#Valoare!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
14
|
#Valoare!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
15
|
#Valoare!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
16
|
#Valoare!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
17
|
#Valoare!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
18
|
#Valoare!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
19
|
#Valoare!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
20
|
#Valoare!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
21
|
#Valoare!
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Notă: Calculele din celule sunt asociate cu datele introduse în tabelul 1.
|
Tabelul 7:
Tabele de raportare a histopatologiei pentru criteriile de bază
|
Data:
|
Substanța chimică:
|
|
|
Patolog:
|
|
|
Hipertrofia glandei tiroide
|
Atrofia glandei tiroide
|
Hipertrofia celulelor foliculare
|
Hiperplazia celulelor foliculare
|
|
Hipertrofia glandei tiroide
|
Atrofia glandei tiroide
|
Hipertrofia celulelor foliculare
|
Hiperplazia celulelor foliculare
|
|
Control Animal ID – replică 1
|
|
|
|
|
|
Doză Animal ID – replică 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Control Animal ID – replică 2
|
|
|
|
|
|
Doză Animal ID – replică 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Total:
|
|
|
|
|
Total:
|
|
|
|
|
|
|
Hipertrofia glandei tiroide
|
Atrofia glandei tiroide
|
Hipertrofia celulelor foliculare
|
Hiperplazia celulelor foliculare
|
|
|
Hipertrofia glandei tiroide
|
Atrofia glandei tiroide
|
Hipertrofia celulelor foliculare
|
Hiperplazia celulelor foliculare
|
|
Doză Animal ID – replică 1
|
|
|
|
|
|
Doză Animal ID – replică 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Doză Animal ID – replică 2
|
|
|
|
|
|
Doză Animal ID – replică 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Total:
|
|
|
|
|
Total:
|
|
|
|
|
Tabelul 8:
Criterii histopatologie suplimentare
|
Data:
|
Substanța chimică:
|
|
|
Patolog:
|
|
|
|
|
|
|
|
|
Creșterea ariei lumenului folicular
|
Scăderea ariei lumenului folicular
|
Creșterea ariei lumenului folicular
|
Scăderea ariei lumenului folicular
|
|
Control Animal ID – replică 1
|
|
|
|
Doză Animal ID – replică 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Control Animal ID – replică 2
|
|
|
|
Doză Animal ID – replică 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Total:
|
|
|
Total:
|
|
|
|
|
Creșterea ariei lumenului folicular
|
Scăderea ariei lumenului folicular
|
|
|
Creșterea ariei lumenului folicular
|
Scăderea ariei lumenului folicular
|
|
Doză Animal ID – replică 1
|
|
|
|
Doză Animal ID – replică 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Doză Animal ID – replică 2
|
|
|
|
Doză Animal ID – replică 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Total:
|
|
|
Total:
|
|
|
Tabelul 9
Descrieri ale concluziilor histopatologice
|
Data:
|
|
Substanța chimică:
|
|
Patolog:
|
|
|
Descriere
|
|
Control Animal ID – replică 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Control Animal ID – replică 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Doză Animal ID – replică 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Doză Animal ID – replică 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Doză Animal ID – replică 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Doză Animal ID – replică 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Doză Animal ID – replică 1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Doză Animal ID – replică 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Tabelul 10
Tabel sintetic de raportare pentru ziua x (7 sau 21) a AMA
|
|
|
Control
|
Doza 1
|
Doza 2
|
Doza 3
|
|
Parametru studiat
|
Replică
|
Medie
|
SD
|
CV
|
N
|
Medie
|
SD
|
CV
|
N
|
valoare p
|
Medie
|
SD
|
CV
|
N
|
valoare p
|
Medie
|
SD
|
CV
|
N
|
valoare p
|
|
Lungimea membrelor posterioare
(mm)
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Medie:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
SVL
(mm)
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Medie:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Greutate umedă
(mg)
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Medie:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Tabelul 11
Model de tabel sintetic de raportare pentru ziua x (7 sau 21) a datelor privind stadiile de dezvoltare pentru testul AMA
|
|
|
Control
|
Doza 1
|
Doza 2
|
Doza 3
|
|
|
Replică
|
Mediană
|
Minim
|
Maxim
|
N
|
Mediană
|
Minim
|
Maxim
|
N
|
valoare p
|
Mediană
|
Minim
|
Maxim
|
N
|
valoare p
|
Mediană
|
Minim
|
Maxim
|
Mediană
|
valoare p
|
|
Stadiu de dezvoltare
|
1
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Medie:
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Apendicele 3
Analiză alternativă a greutății și a lungimii în caz de stadiu târziu de dezvoltare care afectează peste 20 % dintre mormoloci pentru una sau mai multe concentrații
Dacă un număr crescut de mormoloci se caracterizează printr-un stadiu de dezvoltare mai mare decât 60 (≥ 20 %) pentru una sau mai multe concentrații nominale, atunci trebuie realizată o structură ANOVA bifactorială cu o varianță ierarhică pentru toți mormolocii pentru a evalua efectele asupra creșterii ale tratamentelor chimice, luând în considerare în același timp efectul stadiului târziu de dezvoltare asupra creșterii.
Propunerea este de a utiliza toate datele, dar ținând cont de efectul stadiului târziu de dezvoltare. Aceasta se poate realiza cu o ANOVA bifactorială cu o varianță ierarhică. Se definește LateStage =«Da» pentru un animal dacă stadiul său de dezvoltare este 61 sau mai mare. Altfel, se definește LateStage = «Nu». Ulterior, poate fi realizată o ANOVA bifactorială concentrație și LateStage și interacțiunea acestora, cu Rep(Conc) un factor aleatoriu și Tadpole(Rep) alt efect aleatoriu. Aceasta tratează încă rep ca unitate de analiză și furnizează, în esență, aceleași rezultate ca o analiză ponderată a mediilor rep*latestage, ponderată cu numărul de animale per medie. Dacă datele încalcă normalitatea sau varianța cerințelor de omogenitate ale ANOVA, atunci poate fi realizată o transformare ierarhizată normalizată pentru îndepărta obiecția.
În plus față de testele standard ANOVA F pentru efectele Conc, LateStage și interacțiunile lor, testul F pentru interacțiuni poate fi «divizat» în două teste ANOVA F, unul vizând răspunsurile medii pentru concentrații pentru LateStage = «Nu» și altul vizând răspunsurile medii pentru concentrații pentru LateStage = «Da». Comparații suplimentare ale mediilor tratamentelor în raport cu controlul se efectuează în cadrul fiecărui nivel de LateStage. O analiză a tipului de tendințe poate fi efectuată utilizând contraste corespunzătoare sau prin comparații simple pe perechi dacă există dovezi ale unei relații doză-răspuns nemonotone în cadrul unui nivel al variabilei LateStage. O ajustare Bonferroni-Holm a valorilor p se efectuează numai dacă diviziunea F corespunzătoare nu este semnificativă. Aceasta se poate realiza în SAS și, probabil, cu ajutorul altor pachete de software statistic. Pot apărea complicații atunci când nu există animale în stadiu târziu pentru anumite concentrații, însă aceste situații pot fi gestionare în mod direct.
Apendicele 4
Definiții
Substanța chimică
: o substanță sau un amestec
Substanța chimică testată
: orice substanță sau amestec testate prin această metodă de testare
C.39. TEST DE REPRODUCERE A COLEMBOLELOR ÎN SOL
INTRODUCERE
|
1.
|
Prezenta metodă de testare este echivalentă cu Orientarea OCDE privind testarea (test guideline – TG) nr. 232 (2009). Această metodă de testare este concepută pentru a evalua efectele substanțelor chimice asupra producției reproductive a colembolelor în sol. Ea se bazează pe procedurile existente (1) (2). Specia Folsomia candida, care se reproduce partenogenetic, și specia Folsomia fimetaria, care se reproduce sexual, sunt două dintre cele mai accesibile specii de colembole care pot fi cultivate și care sunt disponibile comercial. Atunci când habitate specifice care nu sunt acoperite de aceste două specii trebuie să fie evaluate, procedura poate fi extinsă și la alte specii de colembole, dacă acestea pot îndeplini criteriile de validitate a testului.
|
|
2.
|
Colembolele care trăiesc în sol sunt specii relevante din punct de vedere ecologic pentru testarea ecotoxicității. Colembolele sunt hexapode cu un exoschelet subțire foarte permeabil la aer și la apă și reprezintă specii de artropode cu diferite rute și cu diferite rate de expunere în raport cu râmele și cu enchitreidele.
|
|
3.
|
Densitățile populațiilor de colembole ating frecvent 105 m– 2 în sol și în straturile de frunze în multe ecosisteme terestre (3) (4). Adulții măsoară în mod obișnuit între 0,5 și 5 mm, iar contribuția acestora la biomasa totală a animalelor din sol este mică, fiind estimată a fi cuprinsă între 1 % și 5 % (5). Prin urmare, rolul lor cel mai important poate fi acela de organism cu potențial de reglare a proceselor prin acționând ca prădător de microorganisme și microfaună. Colembolele sunt animale de pradă pentru o mare varietate de nevertebrate endogeice și epigeice precum acarieni, miriapode, păianjeni, carabide și stafilinide. Colembolele contribuie la procesele de descompunere în solurile acide unde e posibil ca ele să fie cele mai importante nevertebrate din sol pe lângă enchitreide, întrucât râmele și diplopodele sunt în general absente.
|
|
4.
|
F. fimetaria este răspândită în toată lumea și este frecvent întâlnită în mai multe tipuri de sol, de la solul nisipos la solul argilos și de la soluri cu humus neacid (mull) la soluri cu humus acid (mor). Este o specie de colembolă anoftalmică și nepigmentată. A fost observată în solurile agricole din întreaga Europă (6). Are un obicei de hrănire omnivor, incluzând hife fungice, bacterii, protozoare și resturi. Interacționează în pășuni cu ciuperci patogene pentru plante (7) și pot influența micoriza, după cum se știe că este cazul pentru F. candida. La fel ca cea mai mare parte dintre speciile de colembole, ea se reproduce sexual, fiind necesară prezența permanentă a masculilor pentru fertilizarea ouălor.
|
|
5.
|
F. candida este, de asemenea, răspândită în toată lumea. Deși aceasta nu este frecvent întâlnită în cea mai mare parte a solurilor naturale, ea se întâlnește deseori în număr foarte mare în solurile bogate în humus. Este o specie de colembolă anoftalmică și nepigmentată. Este prevăzută cu o furcă (aparat de sărit) bine dezvoltată, se deplasează repede și sare cu ușurință dacă este perturbată. Rolul ecologic al F. candida este similar celui al F. fimetaria, însă habitatele sunt constituite din soluri mai bogate în materii organice. Se reproduce prin partenogeneză. Proporția masculilor poate fi mai mică decât 1 la o mie.
|
PRINCIPIUL TESTULUI
|
6.
|
Colembolele sincrone, adulte (F. fimetaria) sau tinere (F. candida) sunt expuse unui interval de concentrații ale substanțelor chimice testate amestecate într-un sol modificat artificial (8) utilizând conținut organic în proporție de 5 % (sau un sol alternativ). Scenariul de testare poate fi împărțit în două etape:
|
—
|
Un test de stabilire a intervalului, în cazul în care nu există suficiente informații disponibile privind toxicitatea, în care mortalitatea și reproducerea reprezintă principalii parametri studiați, fiind evaluați după 2 săptămâni pentru F. fimetaria și după 3 săptămâni pentru F. candida.
|
|
—
|
Un test de reproducere definitiv în care sunt evaluate numărul total al colembolelor tinere produse de animalele-părinți și rata de supraviețuire a animalelor-părinți. Durata testului definitiv este de 3 săptămâni pentru F. fimetaria sau de 4 săptămâni pentru F. candida.
|
Efectul toxic al substanței chimice testate asupra mortalității și a producției reproductive este exprimat în LCx și ECx, datele fiind ajustate conform unui model adecvat prin intermediul unei regresii neliniare pentru a estima concentrația care ar cauza o mortalitate de x % sau, respectiv, scăderea producției reproductive, sau, alternativ, ca valoare NOEC/LOEC (9).
|
INFORMAȚII PRIVIND SUBSTANȚA CHIMICĂ TESTATĂ
|
7.
|
Ar fi de preferat să se cunoască proprietățile fizice, solubilitatea în apă, log Kow, coeficientul de partiție sol-apă și presiunea vaporilor substanței chimice testate. Este de dorit să fie disponibile informații suplimentare privind soarta substanței chimice testate în sol, precum viteza de fotoliză, de hidroliză și de degradare biotică. Identificarea chimică a substanței chimice testate prin denumirea IUPAC, numărul CAS, seria, lotul, formula structurală și puritatea trebuie să fie documentată atunci când este posibil.
|
|
8.
|
Această metodă de testare poate fi utilizată în cazul substanțelor chimice solubile sau insolubile în apă. Cu toate acestea, modul de aplicare a substanței chimice testate va varia în consecință. Metoda de testare nu se aplică substanțelor chimice volatile, și anume substanțelor chimice în cazul cărora constanta Henry sau coeficientul de partiție între aer-apă este mai mare de unu sau substanțelor chimice în cazul cărora presiunea vaporilor depășește 0,0133 Pa la o temperatură de 25 °C.
|
VALIDITATEA TESTULUI
|
9.
|
Pentru ca un rezultat al testului să fie considerat valid, grupurile de control netratate trebuie să îndeplinească următoarele criterii:
|
—
|
Mortalitatea medie a adulților nu trebuie să depășească 20 % la finalul testului;
|
|
—
|
Numărul mediu de exemplare tinere per vas trebuie să fie de cel puțin 100 la finalul testului;
|
|
—
|
Coeficientul de variație calculat pentru numărul de exemplare tinere nu trebuie să fie mai mic de 30 % la încheierea testului definitiv.
|
|
SUBSTANȚA CHIMICĂ DE REFERINȚĂ
|
10.
|
O substanță chimică de referință trebuie testată la concentrația ei EC50 pentru tipul de sol ales pentru test, fie la intervale regulate, fie, posibil, inclusă în fiecare efectuare de teste pentru a verifica faptul că răspunsurile organismelor testate în sistemul de testare sunt în limite normale. O substanță chimică de referință adecvată este acidul boric, care ar trebui să reducă reproducerea cu 50 % (10) (11) la o concentrație de aproximativ 100 mg/kg de sol uscat pentru ambele specii.
|
DESCRIEREA TESTULUI
Vasele și echipamentele de testare
|
11.
|
Recipientele adecvate ca vase de testare sunt cele care pot conține 30 g de sol umed. Ele trebuie să fie fabricate din sticlă sau din plastic inert (netoxic). Cu toate acestea, utilizarea de recipiente din plastic trebuie evitată dacă expunerea substanței chimice testate este redusă din cauza absorbției. Vasele de testare trebuie să aibă o secțiunea transversală care să permită o adâncime a solului din vasele de testare de 2 – 4 cm. Vasele trebuie să fie prevăzute cu capace (din sticlă sau polietilenă) concepute astfel încât să reducă evaporarea apei și să permită, în același timp, schimbul gazos între sol și atmosferă. Recipientul trebuie să fie cel puțin parțial transparent pentru a permite trecerea luminii.
|
|
12.
|
Sunt necesare echipamente de laborator obișnuite, care să includă, în mod specific, următoarele:
|
—
|
microscop stereoscopic;
|
|
—
|
cântare de precizie adecvate;
|
|
—
|
echipamente adecvate pentru controlul temperaturii;
|
|
—
|
echipamente adecvate pentru controlul umidității aerului (neesențiale în cazul în care vasele de expunere sunt acoperite cu capace);
|
|
—
|
incubator sau o cameră mică cu temperatură controlată;
|
|
—
|
forceps sau dispozitiv de aspirare a aerului cu putere mică.
|
|
Pregătirea solului de testare
|
13.
|
Pentru testare este utilizat un sol artificial modificat (8) cu un conținut organic de 5 %. În mod alternativ, ar putea fi utilizat un sol natural, întrucât solul artificial nu este asemănător cu solul natural. Compoziția recomandată a solului artificial este următoarea (pe bază de greutăți uscate, uscare la 105 °C până la obținerea unei greutăți constanțe):
|
—
|
5 % mușchi de turbă, uscat la aer și măcinat fin (dimensiuni ale particulelor de 2 ± 1 mm) sunt acceptabile);
|
|
—
|
20 % argilă caolinică (conținutul de caolinit este preferabil să fie de peste 30 %);
|
|
—
|
aproximativ 74 % nisip industrial uscat la aer (în funcție de cantitatea de CaCO3 necesară), nisip predominant fin cu peste 50 % din particule măsurând între 50 și 200 de microni. Cantitatea exactă de nisip depinde de cantitatea de CaCO3 (a se vedea mai jos), împreună trebuie să reprezinte 75 %.
|
|
—
|
1 % carbonat de calciu (CaCO3, pulverizat, de calitate analitică) pentru a obține un pH de 6 ± 0,5; cantitatea de carbonat de calciu care trebuie adăugată poate depinde în principal de calitatea/natura turbei (a se vedea Nota 1).
|
Nota 1: Cantitatea de CaCO3 necesară va depinde de componentele substratului de sol și trebuie determinată prin măsurarea pH-ului subeșantioanelor de sol umed preincubat imediat înainte de test.
Nota 2: Se recomandă măsurarea pH-ului și, opțional, a raportului C/N, a capacității de schimb de cationi (CEC) și a conținutului de materie organică al solului pentru a permite normalizarea într-o etapă ulterioară și o mai bună interpretare a rezultatelor.
Nota 3: Dacă este necesar, de exemplu în scopul unor testări specifice, solurile naturale provenite din locuri nepoluate pot servi, de asemenea, ca substrat de testare și/sau de cultură. Cu toate acestea, în cazul în care se utilizează sol natural, acesta trebuie să fie caracterizat cel puțin prin originea sa (locul colectării), pH, textură (distribuția dimensiunii particulelor), CEC și conținutul de materie organică și trebuie să fie necontaminat. În cazul în care se utilizează sol natural, înainte ca acesta să fie utilizat într-un test definitiv, se recomandă demonstrarea faptului că este adecvat pentru a fi utilizat în test și pentru a îndeplini criteriile de validitate a testului.
|
|
14.
|
Se amestecă bine constituenții uscați ai solului (de exemplu, într-un mixer de laborator de mari dimensiuni). Capacitatea maximă de retenție a apei (water holding capacity – WHC) a solului artificial este determinată conform procedurilor descrise în apendicele 5. Gradul de umezeală a solului de testare trebuie să fie optimizat pentru a se asigura o structură poroasă a solului care să permită colembolelor să pătrundă în pori. Acesta înseamnă în general între 40 și 60 % din capacitatea maximă de retenție a apei.
|
|
15.
|
Solul artificial uscat este preumezit prin adăugarea unei cantități suficiente de apă deionizată pentru a obține aproximativ jumătate din conținutul final de apă cu 2-7 zile înainte de începerea testului, pentru a echilibra/stabiliza aciditatea. Pentru determinarea pH-ului, se utilizează un amestec de sol și de soluție de clorură de potasiu 1 M (KCl) sau de clorură de calciu 0,01 M (CaCl2) într-un raport de 1:5 (în conformitate cu apendicele 6). Dacă aciditatea solului este mai mare decât intervalul necesar, ea poate fi ajustată prin adăugarea unei cantități adecvate de CaCO3. Dacă solul este prea alcalin, el poate fi ajutat prin adăugarea unui acid anorganic nedăunător pentru colembole.
|
|
16.
|
Solul preumezit este împărțit în porții corespunzătoare numărului de concentrații de testare (și substanței chimice de referință, dacă este cazul) și controalelor folosite în test. Se adaugă substanțele chimice testate și se ajustează conținutul de apă conform punctului 24.
|
Selectarea și pregătirea animalelor pentru testare
|
17.
|
Specia recomandată este F. candida, care se reproduce partenogenetic, întrucât în testarea interlaboratoare a metodei de testare (11), această specie îndeplinește criteriile de validitate în materie de supraviețuire mai des decât specia F. fimetaria. În cazul utilizării unei specii alternative, ea trebuie să îndeplinească criteriile de validitate menționate la punctul 9. La începutul testului, animalele trebuie să fie bine hrănite și trebuie să aibă o vârstă cuprinsă între 23 și 26 de zile în cazul speciei F. fimetaria și între 9 și 12 zile în cazul speciei F. candida. Pentru fiecare replică, numărul exemplarelor din specia F. fimetaria trebuie să fie de 10 masculi și 10 femele, iar numărul exemplarelor din special F. candida trebuie să fie de 10 femele (a se vedea apendicele 2 și apendicele 3). Pentru fiecare lot adăugat la o replică, animalele cu dezvoltare sincronă sunt selectate în mod aleatoriu din vase, iar starea lor fizică și de sănătate este verificată. Fiecare grup de 10/20 de indivizi este adăugat într-un recipient de testare selectat în mod aleatoriu, iar femelele mari din specia F. fimetaria sunt selectate pentru a le putea deosebi mai ușor de masculii din aceeași specie.
|
Pregătirea concentrațiilor de testare
|
18.
|
Pot fi utilizate patru metode de aplicare a substanțelor chimice testate: 1) amestecarea substanței chimice testate în sol utilizând apa drept cărăuș; 2) amestecarea substanței chimice testate în sol utilizând un solvent organic drept cărăuș; 3) amestecarea substanței chimice testate în sol utilizând nisipul drept cărăuș; sau 4) aplicarea substanței chimice testate pe suprafața solului. Alegerea metodei adecvate depinde de caracteristica substanței chimice și de scopul testului. În general, se recomandă amestecarea substanței chimice testate în sol. Cu toate acestea, pot fi necesare proceduri de aplicare conforme cu utilizarea practică a substanței chimice testate (pulverizarea formulărilor lichide sau utilizarea unor formulări speciale de pesticide, precum granulele sau produsele de tratare a semințelor). Solul este tratat înainte de introducerea colembolelor, cu excepția cazului în care substanța chimică testată este adăugată la suprafața solului, colembolele trebuind să intre în sol.
|
Substanța chimică testată solubilă în apă
|
19.
|
O soluție a substanței chimice testate este pregătită în apă deionizată într-o cantitate suficientă pentru toate replicile cu o concentrație de testare. Fiecare soluție de substanță testată se amestecă bine cu un lot de sol preumezit înainte de a fi introdusă în vasul de testare.
|
Substanța chimică testată insolubilă în apă
|
20.
|
În ceea ce privește substanțele chimice insolubile în apă, dar solubile în solvenți organici, substanța chimică testată poate fi dizolvată în cel mai mic volum posibil de solvent adecvat (de exemplu, acetonă) asigurând în continuare amestecarea corespunzătoare a substanței chimice în sol, precum și amestecarea ei cu o porție necesară de nisip de cuarț. Trebuie utilizați numai solvenți volatili. În cazul în care este utilizat un solvent organic, toate concentrațiile de testare și un control negativ cu solvent suplimentar trebuie să conțină aceeași cantitate minimă de solvent. Recipientele pentru aplicare trebuie să fie lăsate descoperite o anumită perioadă de timp pentru a permite solventului asociat cu aplicarea substanței chimice testate să se evapore, asigurându-se că, în acest timp, nu are loc disiparea substanței chimice toxice.
|
Substanță chimică testată puțin solubilă în apă și în solvenți organici
|
21.
|
În ceea ce privește substanțele chimice puțin solubile în apă și în solvenții organici, nisipul de cuarț, care trebuie să fie o parte din nisipul total adăugat în sol, se amestecă cu cantitatea de substanță chimică testată pentru a obține concentrația de testare dorită. Acest amestec de nisip de cuarț și de substanță chimică testată se adaugă la solul preumezit și se amestecă bine după ce a fost adăugată o cantitate corespunzătoare de apă deionizată pentru a se obține conținutul de umiditate dorit. Amestecul final este distribuit în vasele de testare. Se repetă procedura pentru fiecare concentrație de testare și se pregătește, de asemenea, un control corespunzător.
|
Aplicarea substanței chimice testate pe suprafața solului
|
22.
|
Atunci când substanța chimică testată este un pesticid, poate fi adecvat ca aceasta să fie aplicată pe suprafața solului prin pulverizare. Solul este tratat după adăugarea colembolelor. Recipientele de testare sunt în primul rând umplute cu substratul de sol umezit, apoi se introduc animalele, iar ulterior se cântăresc recipientele de testare. Pentru a evita orice expunere prin contact direct a animalelor la substanța chimică testată, aceasta se aplică la cel puțin jumătate de oră după introducerea colembolelor. Substanța chimică testată trebuie aplicată pe suprafața solului în mod cât mai uniform posibil, cu ajutorul unui dispozitiv de pulverizare de laborator pentru a simula pulverizarea pe teren. Aplicarea trebuie să aibă loc la o temperatură de ± 2 °C, iar pentru soluțiile apoase, emulsii sau dispersii, cu o rată de aplicare a apei în conformitate cu recomandările de evaluare a riscurilor. Rata trebuie să fie verificată cu ajutorul unei tehnici de calibrare adecvate. Formulările speciale, precum granulele sau produsele de tratare a semințelor, ar putea fi aplicate într-un mod similar cu modul de aplicare în agricultură. Hrana este adăugată după pulverizare
|
PROCEDURA
Condițiile de testare
|
23.
|
Temperatura medie de testare trebuie să fie de 20 ± 1 °C, cu un interval de temperatură de 20 ± 2 °C. Testul este efectuat în cicluri de lumină și de întuneric controlate (de preferință 12 ore de lumină și 12 ore de întuneric) cu o intensitate a luminii cuprinsă între 400 și 800 lux în aria în care se află vasele de testare.
|
|
24.
|
Pentru a verifica umiditatea solului, vasele sunt cântărite la începutul, la jumătatea și la sfârșitul testului. Orice pierdere de greutate de > 2 % este compensată prin adăugarea de apă deionizată. Trebuie remarcat că pierderea de apă poate fi redusă prin menținerea unei umidități mari a aerului (> 80 %) în incubatorul de testare.
|
|
25.
|
pH-ul trebuie măsurat la începutul și la sfârșitul testului de stabilire a intervalului și ale testului definitiv. Măsurătorile trebuie să fie realizate într-un eșantion de control suplimentar și într-un eșantion suplimentar al eșantioanelor de sol tratate (toate concentrațiile) pregătite și menținute în același mod ca în culturile de testare, dar fără adăugarea de colembole.
|
Procedură de testare și măsurători
|
26.
|
Pentru fiecare concentrație de testare, o cantitate de sol de testare corespunzătoare unei cantități de 30 g de greutate umedă este plasată în vasul de testare. Sunt pregătite, de asemenea, controale de apă, fără substanța chimică testată. În cazul utilizării unui vehicul pentru aplicarea substanței chimice testate, o serie de control care conține doar vehiculul trebuie să fie realizată în plus față de seria de testare. Concentrația solventului sau a agentului de dispersie trebuie să fie egală cu cea utilizată în vasele de testare care conțin substanța chimică testată.
|
|
27.
|
Colembolele individuale sunt transferate cu atenție în fiecare vas de testare (alocate în mod aleatoriu vaselor de testare) și sunt plasate pe suprafața solului. Pentru un transfer eficient al animalelor, poate fi utilizat un dispozitiv de aspirare a aerului cu putere mică. Numărul de replici pentru concentrațiile de testare și pentru controale depinde protocolul testului utilizat. Vasele de testare sunt poziționate în mod aleatoriu în incubatorul de testare, respectivele poziții fiind modificate aleator săptămânal.
|
|
28.
|
Pentru testul cu F. fimetaria trebuie să se utilizeze douăzeci de adulți per vas de testare, 10 masculi și 10 femele, cu vârste cuprinse între 23 și 26 de zile. În ziua 21, colembolele sunt extrase din sol și numărate. Pentru F. fimetaria genul este determinat în funcție de dimensiuni în lotul de animale cu dezvoltare sincronă utilizate pentru testare. Femelele sunt evident mai mari decât masculii (a se vedea apendicele 3).
|
|
29.
|
Pentru testul cu F. candida trebuie utilizate zece exemplare tinere, cu vârsta de 9– 12 zile, per vas de testare. În ziua 28, colembolele sunt extrase din sol și numărate.
|
|
30.
|
Ca sursă adecvată de hrană, o cantitate suficientă, și anume 2 – 10 mg de drojdie uscată granulată, disponibilă în comerț pentru uz casnic, se adaugă în fiecare recipient la începutul testului și după aproximativ 2 săptămâni.
|
|
31.
|
La sfârșitul testului, sunt evaluate mortalitatea și reproducerea. După 3 săptămâni (F. fimetaria) sau după 4 săptămâni (F. candida), colembolele sunt extrase din solul de testare (a se vedea apendicele 4) și numărate (12). O colembolă este înregistrată ca fiind moartă dacă nu este prezentă în extracție. Metoda de extragere și numărare trebuie să fie validate. Validitatea include eficiența extracției exemplarelor tinere mai mare de 95 %, de exemplu prin adăugarea unui număr cunoscut de exemplare în sol.
|
|
32.
|
Rezumatul practic și calendarul procedurii de testare sunt descrise în apendicele 2.
|
Protocolul testului
Testul de stabilire a intervalului
|
33.
|
Atunci când este necesar, se realizează un test de stabilire a intervalului cu, de exemplu, cinci concentrații ale substanțelor chimice testate de 0,1, 1, 10, 100 și 1 000 mg/kg greutate uscată a solului și două replici pentru fiecare tratament și control. Informații suplimentare, provenite din teste cu substanțe chimice similare sau din literatura de specialitate, privind mortalitatea sau reproducerea colembolelor pot fi de asemenea utile în alegerea intervalului concentrațiilor care urmează să fie utilizate în testul de stabilire a intervalului.
|
|
34.
|
Durata testului de stabilire a intervalului este de două săptămâni pentru F. fimetaria și de 3 săptămâni pentru F. candida pentru a asigura producerea unei serii de exemplare tinere. La sfârșitul testului, sunt evaluate mortalitatea și reproducerea colembolelor. Numărul adulților și apariția exemplarelor tinere trebuie înregistrate.
|
Testul definitiv
|
35.
|
Pentru stabilirea valorii ECx (de exemplu, EC10, EC50), trebuie testate douăsprezece concentrații. Se recomandă cel puțin două replici pentru fiecare concentrație de testare și șase replici de control. Factorul de spațiere poate varia în funcție de tipul de relație doză-răspuns.
|
|
36.
|
Pentru stabilirea NOEC/LOEC, trebuie testate cel puțin cinci concentrații într-o serie geometrică. Se recomandă utilizarea a patru replici pentru fiecare concentrație de testare și opt controale. Concentrațiile trebuie să fie spațiate printr-un factor care să nu depășească valoarea de 1,8.
|
|
37.
|
O metodă combinată permite determinarea valorilor NOEC/LOEC și ECx. Pentru această metodă combinată, trebuie utilizate opt concentrații de tratament într-o serie geometrică. Se recomandă utilizarea a patru replici pentru fiecare tratament și opt controale. Concentrațiile trebuie să fie spațiate printr-un factor care să nu depășească valoarea de 1,8.
|
|
38.
|
În cazul în care nu este observat niciun efect la cea mai înaltă concentrație în cadrul testului de stabilire a intervalului (și anume 1 000 mg/kg), testul de reproducere poate fi realizat ca test limită utilizând o concentrație de testare de 1 000 mg/kg și controlul. Un test limită va oferi posibilitatea de a demonstra că nu există un efect semnificativ din punct de vedere statistic la concentrația limită. Trebuie utilizate opt replici atât pentru solul tratat, cât și pentru control.
|
DATE ȘI RAPORTARE
Tratamentul rezultatelor
|
39.
|
Producția reproductivă reprezintă principalul parametru studiat (de exemplu numărul de exemplare tinere produse per vas de testare). Analiza statistică, de exemplu procedurile ANOVA, compară tratamentele prin intermediul testelor Student t, Dunnett sau Williams. Intervalul de încredere de 95 % se calculează pentru mediile tratamentelor individuale.
|
|
40.
|
Numărul de adulți supraviețuitori din vasele de control netratate reprezintă un criteriu de validitate important și trebuie documentat. Ca și în cazul testului de stabilire a intervalului, toate celelalte semne nocive trebuie înregistrate și în raportul final.
|
LCx și ECx
|
41.
|
Valorile ECx, inclusiv limitele lor de încredere de 95 % inferioară și superioară corespunzătoare parametrului se calculează utilizând metode statistice adecvate (de exemplu, funcția logistică sau Weibull, metoda Spearman-Karber simplificată sau simpla interpolare). O valoare ECx se obține prin inserarea unei valori corespunzătoare la x % din media controalelor în ecuația respectivă. Pentru calcularea valorii EC50 sau a oricărei alte valori ECx, seturile de date complete trebuie supuse unei analize de regresie. LC50 este de obicei estimată prin analiza probit sau o analiză similară care ține cont de datele privind mortalitatea distribuite binominal.
|
NOEC/LOEC
|
42.
|
În cazul în care se intenționează determinarea valorii NOEC/LOEC prin analiză statistică, sunt necesare statistici pentru fiecare vas (fiecare vas este considerat o replică). Trebuie utilizate metode statistice adecvate conform Documentului 54 al OCDE intitulat «Current Approaches in the Statistical Analysis of Ecotoxicity Data: a Guidance to Application» (Metode actuale de analiză statistică a datelor privind exotoxicitatea: orientări de aplicare) (9). În general, efectele adverse ale substanței chimice testate în raport cu controlul sunt analizate utilizând testarea unilaterală a ipotezei la p ≤ 0,05.
|
|
43.
|
Distribuția normală și omogenitatea varianței pot fi testate cu ajutorul unui test statistic adecvat, de exemplu testul Shapiro-Wilk și, respectiv, testul Levene (p ≤ 0,05). Se pot efectua o analiză a varianței unidirecțională (ANOVA) și teste multicomparative ulterioare. Comparațiile multiple (de exemplu, testul Dunnett) sau testele tendinței regresive (de exemplu, testul Williams) pot fi utilizate pentru calcularea eventualelor diferențe semnificative (p ≤ 0,05) între controale și diversele concentrații de substanță chimică testată [selectarea testului recomandat conform Documentului 54 al OCDE (9)]. În caz contrar, ar putea fi utilizate metode neparametrice (de exemplu, testul Bonferroni U conform testului tendinței regresive Holm sau Jonckheere-Terpstra) pentru determinarea NOEC și a LOEC.
|
Test limită
|
44.
|
În cazul în care a fost efectuat un test imită (compararea controlului cu un singur tratament) și au fost îndeplinite condițiile prealabile ale procedurilor de testare parametrice (normalitate, omogenitate), pot fi evaluate răspunsurile metrice prin intermediul testului Student (testul t). Se poate utiliza testul t pentru varianțe inegale (testul Welch t) sau un test neparametric, precum testul Mann-Whitney u, în cazul în care nu sunt îndeplinite aceste cerințe.
|
|
45.
|
Pentru determinarea diferențelor semnificative între controale (control și control cu solvent), replicile fiecărui control pot fi testate conform descrierilor pentru testul limită. În cazul în care aceste teste nu detectează nicio diferență semnificativă, toate replicile cu control și control cu solvent pot fi comasate. În caz contrar, toate tratamentele trebuie comparate cu controlul cu solvent.
|
Raportul privind testul
|
46.
|
Raportul privind testul trebuie să includă cel puțin următoarele informații:
|
|
Substanța chimică testată
|
—
|
identitatea substanței chimice testate, lotul de fabricație, lotul de ambalare și numărul CAS, puritatea;
|
|
—
|
proprietățile fizico-chimice ale substanței chimice testate [de exemplu, log Kow, solubilitatea în apă, presiunea vaporilor, constanta Henry (H) și, de preferință, informații privind soarta substanței chimice testate în sol), dacă sunt disponibile;
|
|
—
|
formularea substanței chimice testate și a aditivilor trebuie specificate dacă nu este testată substanța chimică pură;
|
|
|
|
Organismele testate
|
—
|
identificarea speciilor și a furnizorului organismelor testate, descrierea condițiilor de reproducere și intervalul de vârstă al organismelor testate;
|
|
|
|
Condițiile de testare
|
—
|
descrierea protocolului și a procedurii experimentale;
|
|
—
|
detalii privind pregătirea solului de testare; specificații detaliate în cazul în care se utilizează sol natural (origine, istoric, distribuția dimensiunii particulelor, pH, conținut de materie organică);
|
|
—
|
capacitatea solului de retenție a apei;
|
|
—
|
descrierea tehnicii utilizate pentru aplicarea substanței chimice testate în sol;
|
|
—
|
condiții de testare: intensitatea luminii, durata ciclurilor lumină-întuneric, temperatura;
|
|
—
|
o descriere a regimului de hrănire, tipul și cantitatea hranei utilizate în cadrul testului, datele hrănirii;
|
|
—
|
pH-ul și conținutul de apă din sol la începutul și la sfârșitul testului (control și fiecare tratament);
|
|
—
|
o descriere detaliată a metodei de extracție și eficiența extracției;
|
|
|
|
Rezultatele testului
|
—
|
numărul de exemplare tinere determinat în fiecare vas de testare la sfârșitul testului;
|
|
—
|
numărul de exemplare adulte și rata mortalității în rândul acestora ( %) în fiecare vas de testare la sfârșitul testului;
|
|
—
|
o descriere a simptomelor fiziologice sau patologice evidente sau schimbările evidente de comportament;
|
|
—
|
rezultatele obținute cu substanța chimică testată de referință;
|
|
—
|
valorile NOEC/LOEC, LCx pentru mortalitate și ECx pentru reproducere (în principal LC50, LC10, EC50 și EC10) împreună cu intervalele de încredere de 95 %. Un grafic al modelului ajustat folosit în calcule, ecuația funcției sale și parametrii acestuia [a se vedea alineatul (9)];
|
|
—
|
toate informațiile și observațiile utile pentru interpretarea rezultatelor;
|
|
—
|
puterea testului efectiv dacă se realizează testarea ipotezei (9);
|
|
—
|
abaterile de la procedurile descrise în prezenta metodă de testare și orice eveniment neobișnuit survenit pe parcursul testului;
|
|
—
|
pentru NOEC, dacă este estimată, diferența minimală detectabilă.
|
|
|
BIBLIOGRAFIE
|
(1)
|
Wiles JA and Krogh PH (1998) Testing with the collembolans I. viridis, F. candida and F. fimetaria. In Handbook of soil invertebrate toxicity tests (ed. H Løkke and CAM Van Gestel), pp. 131-156. John Wiley & Sons, Ltd., Chichester
|
|
(2)
|
ISO (1999) Soil Quality – Effects of soil pollutants on Collembola (Folsomia candida): Method for determination of effects on reproduction. No. 11267. International Organisation for Standardisation, Geneve
|
|
(3)
|
Burges A and Raw F (Eds) (1967) Soil Biology. Academic Press. London
|
|
(4)
|
Petersen H and Luxton M (1982) A comparative analysis of soil fauna populations and their role in decomposition processes. Oikos 39: 287-388
|
|
(5)
|
Petersen H (1994) A review of collembolan ecology in ecosystem context. Acta Zoologica Fennica 195: 111-118
|
|
(6)
|
Hopkin SP (1997). Biology of the Springtails (Insecta: Collembola). Oxford University Press. 330 pp (ISBN 0-19-854084-1)
|
|
(7)
|
Ulber B (1983) Einfluss von Onychirurus fimatus Gisin (Collembola, Onychiuridae) und Folsomia fimetaria L. (Collembola, Isotomidae) auf Pythium ultimum Trow. einen Erreger des Wurzelbrandes der Zuckerrübe. In New trends in soil Biology (Lebrun Ph, André HM, De Medts A, Grégoire-Wibo, Wauthy G (Eds), Proceedings of the VI. international colloquium on soil zoology, Louvain-la-neuve (Belgium), 30 August-2 September 1982, I Dieu-Brichart, Ottignies-Louvain-la-Neuve, pp. 261-268
|
|
(8)
|
Chapter C.36 of this Annex, Predatory mite (Hypoaspis (Geolaelaps) aculeifer) reproduction test in soil.
|
|
(9)
|
OECD (2006), Current approaches in the statistical analysis of ecotoxicity data: a guidance to application. OECD series on testing and assessment Number 54, ENV/JM/MONO(2006)18, OECD Paris
|
|
(10)
|
Scott-Fordsmand JJ and Krogh PH (2005) Background report on prevalidation of an OECD springtail test guideline. Environmental Project Nr. 986. Miljøstyrelsen 61 pp. Danish Ministry for the Environment.
|
|
(11)
|
Krogh, P.H., 2009. Toxicity testing with the collembolans Folsomia fimetaria and Folsomia candida and the results of a ringtest. Danish Environmental Protection Agency, Environmental Project No. 1256, pp. 66.
|
|
(12)
|
Krogh PH, Johansen K and Holmstrup M (1998) Automatic counting of collembolans for laboratory experiments. Appl. Soil Ecol. 7, 201-205
|
|
(13)
|
Fjellberg A (1980) Identification keys to Norwegian collembolans. Norsk Entomologisk Forening.
|
|
(14)
|
Edwards C.A. (1955) Simple techniques for rearing Collembola, Symphyla and other small soil inhabiting arthropods. In Soil Zoology (Kevan D.K. McE., Ed). Butterworths, London, pp. 412-416
|
|
(15)
|
Goto HE (1960) Simple techniques for the rearing of Collembola and a not on the use of a fungistatic substance in the cultures. Entomologists' Monthly Magazine 96:138-140.
|
Apendicele 1
Definiții
Următoarele definiții se aplică acestei metode de testare (în cadrul acestui test, toate concentrațiile pentru care se observă efecte sunt exprimate ca masă a substanței chimice testate raportată la masa uscată a solului de testare):
|
|
Substanța chimică este o substanță sau un amestec.
|
|
|
NOEC (concentrație la care nu se observă niciun efect) înseamnă concentrația substanței chimice testate în cazul căreia nu se observă niciun efect. În cadrul acestui test, concentrația corespunzătoare NOEC nu prezintă niciun efect semnificativ din punct de vedere statistic (p < 0,05) pe parcursul unei perioade de expunere date comparativ cu controlul.
|
|
|
LOEC (concentrația cea mai mică la care este observat un efect) reprezintă concentrația cea mai mică a substanței chimice testate care are un efect semnificativ din punct de vedere statistic (p < 0,05) pe parcursul unei perioade de expunere date comparativ cu controlul.
|
|
|
ECx (concentrație la care se observă x % efect) înseamnă concentrația care determină un efect de x % asupra organismelor testate pe parcursul unei perioade de expunere date comparativ cu un control. De exemplu, o EC50 reprezintă o concentrație pentru care se estimează că determină un efect asupra unui parametru studiat în test la 50 % dintr-o populație expusă pe parcursul unei perioade de expunere definite.
|
|
|
Substanța chimică testată este orice substanță sau amestec testat utilizând această metodă de testare.
|
Apendicele 2
Principalele acțiuni și calendarul pentru realizarea unui test asupra colembolelor
Etapele testului pot fi rezumate după cum urmează:
|
Timp (zile)
|
Acțiune
|
|
– 23 – – 26
|
Pregătirea culturii de F. fimetaria cu dezvoltare sincronă
|
|
– 14
|
Pregătirea solului artificial (amestecul de constituenți uscați)
Se verifică pH-ul solului artificial și se ajustează în consecință
Se măsoară WHC maximă a solului
|
|
– 9 – – 12
|
Pregătirea culturii de F. candida cu dezvoltare sincronă
|
|
– 2 – – 7
|
Se preumezește solul
|
|
– 1
|
Se distribuie exemplarele tinere în loturi
Se prepară soluțiile stoc și se aplică substanța chimică testată dacă solventul este necesar
|
|
0
|
Se prepară soluții stoc și se aplică substanța chimică testată dacă este necesară aplicarea de substanțe chimice solide, solubile în apă sau pe suprafață.
Se măsoară pH-ul solului și se cântăresc recipientele.
Se adaugă hrană. Se introduc colembolele.
|
|
14
|
Test de determinare a intervalului F. fimetaria: Se încheie testul, se extrag animalele, se măsoară pH-ul solului și pierderea de apă (greutate)
Testele definitive: Se măsoară conținutul de umiditate și se realimentează cu apă și se adaugă 2 – 10 mg de drojdie
|
|
21
|
Test definitiv pentru F. fimetaria: Se încheie testul, se extrag animalele, se măsoară pH-ul solului și pierderea de apă (greutate)
Test de determinare a intervalului F. candida: Se încheie testul, se extrag animalele, se măsoară pH-ul solului și pierderea de apă (greutate)
|
|
28
|
Test definitiv pentru F. candida: Se încheie testul, se extrag animalele, se măsoară pH-ul solului și pierderea de apă (greutate)
|
Apendicele 3
Orientări pentru creșterea și sincronizarea F. fimetaria și a F. candida
Timpii și duratele indicate în aceste orientări trebuie verificate pentru fiecare tulpină specifică de colembole pentru a se asigura exemplare tinere suficient de sincronizate. În principiu, incidența depunerii ouălor după ce adulții sunt transferați în substrat proaspăt și eclozarea ouălor determină ziua adecvată pentru colectarea ouălor și a exemplarelor tinere sincrone.
Se recomandă dispunerea în permanență de o cultură stoc care să conțină de exemplu 50 de recipiente/placă Petri. Cultura stoc trebuie să fie menținută în bune condiții de hrănire prin hrănire săptămânală, alimentare cu apă și îndepărtarea hranei vechi și a cadavrelor. Prea puține colembole pe substrat pot conduce la inhibare printr-o creștere mai accentuată a fungilor. Dacă cultura stoc este utilizată prea des pentru producerea de ouă, ea riscă se să devină mai ineficientă. Semnele de ineficiență sunt adulți morți și prezența fungilor pe substrat. Ouăle rămase în urma producerii de animale sincrone pot fi folosite pentru a reîntineri cultura.
Într-o cultură sincronizată de F. fimetaria, masculii se disting de femele mai ales prin dimensiune. Masculii sunt în mod clar mai mici decât femelele, iar viteza de deplasare a masculilor este mai mare decât cea a femelelor. Selectarea corectă a genului necesită puțină practică și poate fi confirmată prin inspecția microscopică a zonei genitale (13).
1. Creșterea
1.a. Pregătirea substratului de cultură
Substratul de cultură este constituit din ipsos de Paris (sulfat de calciu) și cărbune activ. Se obține astfel un substrat umed, funcția cărbunelui fiind cea de a absorbi gazele și excrementele (14) (15). Pentru a facilita observația colembolelor pot fi utilizat diferite forme de cărbune. De exemplu, pulberea de cărbune este utilizată pentru F. candida și F. fimetaria (producând un ipsos de Paris negru/gri).
Constituenții substratului:
|
—
|
200 ml de apă distilată
|
|
—
|
200 ml de ipsos de Paris
|
sau
|
—
|
50 g de cărbune activ pulverizat
|
|
—
|
260 – 300 ml de apă distilată
|
|
—
|
400 g de ipsos de Paris
|
Amestecul de substrat se lasă să se așeze înainte de utilizare.
1.b. Reproducerea
Colembolele sunt ținute în recipiente precum placa Petri (90 mm × 13 mm) cu fundul acoperit cu un strat de ipsos/substrat de cărbune de 0,5 cm. Ele sunt cultivate la 20 ± 1 °C la un ciclu lumină-întuneric de 12 – 12 ore (400 – 800 lux). Recipientele sunt menținute în permanență umede, asigurându-se că umiditatea relativă a aerului din recipiente este de 100 %. Aceasta poate fi garantată prin prezența apei libere în ipsosul poros, dar cu evitarea generării unui film de apă pe suprafața ipsosului. Pierderea de apă poate fi prevenită prin asigurarea unui aer ambiant umed. Toți indivizii morți trebuie să fie îndepărtați din recipiente, la fel ca și hrana mucegăită. Pentru a stimula producția de ouă este necesar ca exemplarele adulte să fie transferate în plăci Petri prevăzute cu ipsos de Paris/substrat de cărbune proaspăt pregătit.
1.c. Sursa de hrană
Drojdia uscată granulată este folosită ca unică sursă de hrană pentru ambele specii, F. candida și F fimetaria. Hrana proaspătă este administrată o dată sau de două ori pe săptămână, pentru a evita mucegăirea acesteia. Ea este plasată direct pe ipsosul de Paris sub forma unei mici grămezi. Masa de drojdie adăugată trebuie să fie ajustată în funcție de dimensiunea populației de colembole, însă, în general, o cantitate de 2 – 15 mg este suficientă.
2. Sincronizarea
Testul trebuie efectuat cu exemplare sincronizate pentru a obține animale de testare omogene în stadiu și cu dimensiuni identice. În plus, sincronizarea permite deosebirea masculilor și a femelelor de F. fimetaria începând cu vârsta de 3 săptămâni și ulterior pe baza dimorfismului sexual, adică a diferențelor de dimensiune. Procedura de mai jos reprezintă o sugestie privind modul în care se pot obține animale sincronizate (etapele practice sunt opționale).
2.a. Sincronizarea.
|
—
|
Se pregătesc recipiente cu un strat de ipsos de Paris/substrat de cărbune de 0,5 cm.
|
|
—
|
Pentru depunerea de ouă, se transferă 150 – 200 de adulți de F. fimetaria și 50 – 100 de adulți de F. candida din cele mai bune 15 – 20 de recipiente cu cultură stoc cu substrat vechi de 4 – 8 săptămâni și se hrănesc cu 15 mg de drojdie. Trebuie evitată comasarea exemplarelor tinere și a adulților, deoarece exemplarele tinere pot inhiba producerea de ouă.
|
|
—
|
Mediul de cultură se menține la 20 ± 1 °C (media trebuie să fie de 20 °C) și la un ciclu de lumină-întuneric de 12 – 12 ore (400 – 800 lux). Se asigură că este disponibilă hrană proaspătă și că aerul este saturat cu apă. Lipsa de hrană poate determina animalele să elimine materialele fecale pe ouă, acest lucru având ca rezultat dezvoltarea de fungi pe ouă sau F. candida își poate canibaliza propriile ouă. După 10 zile, ouăle sunt colectate cu grijă cu ajutorul unui ac și al unei spatule și sunt mutate în «cofraje de ouă» (bucăți mici de hârtie de filtru imersate în ipsos de Paris/suspensie de cărbune) care sunt plasate într-un recipient cu un substrat proaspăt de ipsos/cărbune. Câteva granule de drojdie sunt adăugate substratului pentru a atrage exemplarele tinere și pentru a le determina să părăsească cofrajele de ouă. Este important ca atât cofrajele de ouă cât și substratul să fie umede, altfel ouăle se vor deshidrata. Ca alternativă, animalele adulte pot fi îndepărtate din cutiile de cultură de sincronizare după ce produc ouă timp de 2 sau 3 zile.
|
|
—
|
După trei zile, cea mai mare parte a ouălor din cofraje vor fi eclozate și sub cofraj pot fi găsite exemplare tinere.
|
|
—
|
Pentru a avea exemplare tinere de aceeași vârstă, cofrajele cu ouă neeclozate se îndepărtează din placa Petri cu forcepsul. Exemplarele tinere, de 0 – 3 zile, rămân în placă și sunt hrănite cu drojdie. Ouăle neeclozate sunt eliminate.
|
|
—
|
Ouăle și exemplarele tinere eclozate se cultivă în același mod ca exemplarele adulte. În special pentru F. fimetaria trebuie luate următoarele măsuri: se asigură hrană proaspătă suficientă, îndepărtarea hranei vechi mucegăite, după 1 săptămână exemplarele tinere sunt împărțite în noi plăci Petri cu condiția ca densitatea să fie de peste 200.
|
2.b. Manipularea colembolelor la începerea testului
|
—
|
Se colectează exemplare de F. candida cu vârste cuprinse între 9 și 12 zile și de F. fimetaria cu vârste cuprinse între 23 și 26 de zile, de exemplu prin aspirare, și sunt eliberate într-un recipient de mici dimensiuni cu un substrat de ipsos/cărbune umed, starea lor fizică fiind verificată cu ajutorul unui microscop binocular (animalele lezate sau deteriorate sunt eliminate). Toate etapele trebuie realizate în condiții de menținere a colembolelor într-o atmosferă umedă, pentru a evita stresul cauzat de uscare, de exemplu, prin utilizarea de suprafețe umezite, etc.
|
|
—
|
Recipientul se răstoarnă și se lovește ușor pentru a transfera colembolele pe sol. Electricitatea statică trebuie neutralizată, în caz contrar animalele pot zbura în aer sau pot rămâne pe partea laterală a containerului de testare și se pot usca. Pentru neutralizare poate fi folosit un ionizator sau o pânză umedă sub recipient.
|
|
—
|
Hrana trebuie răspândită pe toată suprafața solului și nu plasată ca o singură grămadă.
|
|
—
|
În timpul transportului și în timpul perioadei de testare trebuie să se evite lovirea sau perturbarea în alt mod fizic a recipientelor de testare, deoarece se poate crește compactarea solului și se poate împiedica interacțiunea dintre colembole.
|
3. Specii de colembole alternative
Conform acestei metode de testare, pot fi selectate alte specii de colembole pentru testare, precum Proisotoma minuta, Isotoma viridis, Isotoma anglicana, Orchesella cincta, Sinella curviseta, Paronychiurus kimi, Orthonychiurus folsomi, Mesaphorura macrochaeta. Înainte de utilizarea speciilor alternative, trebuie îndeplinite o serie de condiții prealabile:
|
—
|
Ele trebuie să fie identificate fără echivoc;
|
|
—
|
Trebuie furnizată argumentația care stă la baza selectării respectivelor specii;
|
|
—
|
Trebuie să se asigure că biologia de reproducere este inclusă în faza de testare și că astfel va fi o țintă potențială în timpul expunerii;
|
|
—
|
Trebuie cunoscut ciclul biologic de viață: vârsta la maturitate, durata dezvoltării ouălor și stadiile care fac obiectul expunerii;
|
|
—
|
Condițiile optime de creștere și de reproducere trebuie asigurate de substratul de testare și de aprovizionarea cu hrană;
|
|
—
|
Variabilitatea trebuie să fie suficient de mică pentru o estimare precisă și exactă a toxicității.
|
Apendicele 4
Extragerea și numărarea animalelor
1. Pot fi aplicate două metode de extragere.
|
1.a.
|
Prima metodă: Poate fi utilizat un extractor cu gradient de temperatură controlat, pe baza principiilor MacFadyen (1). Căldura care provine de la un element de încălzire situat în partea superioară a cutiei de extragere (reglată printr-un termistor plasat pe suprafața eșantionului de sol). Temperatura din lichidul răcit care înconjoară vasul de colectare este reglată printr-un termistor plasat la suprafața cutiei de colectare (sub miezul solului). Termistoarele sunt conectate la o unitate de controlare programabilă care crește temperatura în funcție un calendar preprogramat. Animalele sunt colectate în cutia de colectare răcită (2 °C) care este prevăzută pe fund cu un strat din ipsos de Paris/cărbune. Extragerea este începută la 25 °C, temperatura fiind crescută automat la fiecare 12 ore cu 5 °C, ea durând în total 48 de ore. După 12 ore la 40 °C extragerea este finalizată.
|
|
1.b.
|
A doua metodă: După perioada de incubare experimentală se evaluează prin flotație numărul de colembolelor tinere prezente. În acest scop, testul se efectuează în vase cu un volum de aproximativ 250 ml. La sfârșitul testului, se adaugă aproximativ 200 ml de apă distilată. Solul este agitat ușor cu o pensulă fină pentru a permite colembolelor să plutească la suprafața apei. O cantitate mică, de aproximativ 0,5 ml de vopsea Kentmere neagră fotografică poate fi adăugată în apă pentru a ajuta la numărare prin creșterea contrastului dintre apă și colembolele albe. Vopseaua nu este toxică pentru colembole.
|
2. Numărarea:
Numărarea se poate face cu ochiul liber sau sub un microscop optic cu ajutorul unei grile plasate deasupra vasului de plutire sau prin fotografierea suprafeței fiecărui vas și numărarea ulterioară a colembolelor pe imagini tipărite mărite sau imagini proiectate. Numărarea poate fi realizată și cu ajutorul tehnicilor digitale de prelucrare a imaginilor (12). Toate tehnicile trebuie să fie validate.
Apendicele 5
Determinarea WHC maxime a solului
Următoarea metodă pentru determinarea capacității maxime a solului de retenție a apei (WHC) este considerată a fi una adecvată. Ea este descrisă în anexa C din ISO DIS 11268-2 (Soil Quality – Effects of pollutants on earthworms (Eisenia fetida). Part 2: Determination of effects on reproduction). [Calitatea solului – Efectele poluanților asupra râmelor (Eisenia fetida). Partea 2: Determinarea efectelor asupra reproducerii].
Se colectează o cantitate definită (de exemplu, 5 g) din substratul de sol de testare cu ajutorul unui dispozitiv de prelevare adecvat (tub cu sfredel etc.). Se acoperă fundul tubului cu o bucată de hârtie de filtru umedă și apoi se așează pe un suport într-o baie de apă. Tubul trebuie scufundat treptat până când nivelul apei depășește nivelul solului. El trebuie apoi lăsat în apă timp de aproximativ trei ore. Întrucât nu toată apa absorbită de capilarele solului poate fi reținută, eșantionul de sol trebuie lăsat să dreneze timp de două ore prin plasarea tubului pe un pat de nisip de cuarț fin măcinat și foarte umed într-un vas acoperit (pentru a preveni uscarea). Eșantionul trebuie apoi să fie cântărit, uscat până la masa constantă la 105 °C. Capacitatea de retenție a apei (water holding capacity – WHC) se calculează după cum urmează:

unde:
|
S
|
=
|
masa substratului saturat cu apă + masa tubului + masa hârtiei de filtru
|
|
T
|
=
|
tara (masa tubului + masa hârtiei de filtru)
|
|
D
|
=
|
masa uscată a substratului
|
Apendicele 6
Determinarea pH-ului solului
Următoarea metodă pentru determinarea pH-ului solului se bazează pe descrierea din ISO DIS 10390: Calitatea solului – Determinarea pH-ului.
O cantitate definită de sol este uscată la temperatura camerei timp de cel puțin 12 ore. Se prepară apoi o suspensie de sol (conținând cel puțin 5 grame de sol) într-o cantitate echivalentă cu de cinci ori volumul său de soluție de clorură de potasiu (KCl) 1 M de puritate analitică sau de soluție de clorură de calciu (CaCl2) 0,01 M de puritate analitică. Suspensia este apoi agitată puternic timp de cinci minute, apoi se lasă să se decanteze timp de cel puțin 2 de ore, dar nu mai mult de 24 de ore. pH-ul fazei lichide este apoi măsurat cu ajutorul unui pH-metru care a fost etalonat înainte de fiecare măsurătoare folosind o serie de soluții tampon adecvate (de exemplu, pH 4 și 7).
C.40. TEST DE TOXICITATE PE CHIRONOMIDE CARE CUPRINDE CICLUL DE VIAȚĂ DESFĂȘURAT ÎNTR-UN SISTEM APĂ-SEDIMENT UTILIZÂND APĂ ADIȚIONATĂ SAU SEDIMENT ADIȚIONAT
INTRODUCERE
|
1.
|
Această metodă de testare este echivalentă cu Orientarea OCDE privind testarea (TG) nr. 233 (2010). Este concepută pentru a evalua efectele expunerii pe tot parcursul vieții a substanțelor chimice asupra Chironomus sp., un dipter de apă dulce, acoperind complet prima generație (generația P) și prima parte a celei de a 2-a generații (generația F1). Metoda este o extindere a metodelor de testare C.28 (1) sau C.27 (15) existente în cadrul unui scenariu de expunere la apă adiționată sau, respectiv, la sediment adiționat. Ia în considerare actualele protocoale de testare a toxicității pentru Chironomus riparius și Chironomus dilutus [denumit anterior C. tentans (2)], care au fost dezvoltate în Europa și în America de Nord (3) (4) (5) (6) (7) (8 ) (9) și ulterior supuse unor testări interlaboratoare (1) (7) (10) (11) (12). Se pot utiliza și alte specii de chironomide bine documentate, de exemplu Chironomus yoshimatsui (13) (14). Durata completă de expunere este de circa 44 de zile pentru C. riparius și C. yoshimatsui și de circa 100 de zile pentru C. dilutus.
|
|
2.
|
Ambele scenarii de expunere, la apă și la sediment, sunt descrise în această metodă de testare. Selectarea unui scenariu de expunere adecvat depinde de aplicarea preconizată a testului. Scenariul de expunere la apă, care implică adiționarea coloanei de apă, este menit să simuleze o pulverizare cu pesticide și acoperă concentrația maximă inițială în apele de suprafață. Apa adiționată este utilă și pentru alte tipuri de expunere (inclusiv deversări de substanțe chimice), dar nu și pentru procesele de acumulare în sediment cu o durată mai mare decât durata testării. În acest caz, dar și în cazul în care deversarea reprezintă principala cale de intrare a pesticidelor în acumulările de apă, poate fi mai adecvat un test cu sediment adiționat. Dacă sunt avute în vedere alte scenarii de expunere, protocolul de testare poate fi adaptat cu ușurință. De exemplu, dacă distribuția substanței chimice testate între faza apoasă și stratul de sediment nu este de interes și dacă absorbția în sediment trebuie să fie redusă la minimum, poate fi luată în considerare utilizarea unui sediment artificial surogat (de exemplu, nisip de cuarț).
|
|
3.
|
Substanțele chimice care necesită testarea organismelor care trăiesc în sedimente pot persista în sediment un timp îndelungat. Organismele care trăiesc în sedimente pot fi expuse prin mai multe căi. Importanța relativă a fiecărei căi de expunere, precum și timpul necesar pentru ca fiecare să contribuie la efectul toxic general, depind de proprietățile fizico-chimice ale substanței chimice respective. Pentru substanțele chimice puternic absorbante sau pentru substanțele chimice care se leagă covalent de sediment, ingerarea de hrană contaminată poate fi o cale de expunere semnificativă. Pentru a nu subestima toxicitatea substanțelor chimice puternic lipofile, se poate lua în considerare adăugarea de hrană la sediment înainte de aplicarea substanței chimice testate (a se vedea punctul 31). Prin urmare, este posibil să se includă toate căile de expunere și toate etapele de viață.
|
|
4.
|
Parametri studiați măsurați sunt numărul total de adulți eclozați (pentru prima și a doua generație), rata de dezvoltare (pentru prima și a doua generație), raportul sexelor adulților eclozați și vii (pentru prima și a doua generație), numărul de șiraguri de ouă per femelă (doar prima generație) și fertilitatea șiragurilor de ouă (doar prima generație).
|
|
5.
|
Sedimentul formulat este foarte recomandat. Sedimentul formulat are o serie de avantaje față de sedimentele naturale:
|
—
|
variabilitatea experimentală este redusă, pentru că formează o «matrice standardizată» cu caracter reproductibil și se elimină necesitatea găsirii de surse de sedimente necontaminate și curate;
|
|
—
|
testele pot fi inițiate în orice moment, fără a întâmpina problema variabilității sezoniere în sedimentul de testare și nu este necesară pretratarea sedimentului pentru a elimina fauna indigenă;
|
|
—
|
reducerea costului în raport cu costul necesar pentru colectarea pe teren de cantități suficiente necesare pentru testarea de rutină;
|
|
—
|
sedimentul formulat permite comparații ale toxicității între studii și clasificarea substanțelor chimice în consecință (3).
|
|
|
6.
|
Definițiile utilizate sunt furnizate în apendicele 1.
|
PRINCIPIUL TESTULUI
|
7.
|
Chironomidele în primul stadiu larvar sunt expuse la o gamă de concentrații de substanță chimică testată într-un sistem apă-sediment. Testul începe prin introducerea chironomidelor în primul stadiu larvar (prima generație) în pahare de laborator pentru testare care conțin sediment adiționat sau, alternativ, substanța chimică testată este adiționată în apă după introducerea larvelor. Sunt evaluate eclozarea chironomidelor, timpul până la eclozare și raportul sexelor chironomidelor complet eclozate și vii. Adulții eclozați sunt transferați în cuști de reproducere, pentru a facilita formarea roiurilor, împerecherea și depunerea ouălor. Sunt evaluate numărul de șiraguri de ouă produse și fertilitatea lor. Din aceste șiraguri de ouă, se obțin larve în primul stadiu din a 2-a generație. Aceste larve sunt introduse în pahare de laborator proaspăt pregătite (procedură de adiționare la fel ca în cazul primei generații) pentru a determina viabilitatea celei de a 2-a generații prin evaluarea eclozării lor, a timpului până la eclozare și a raportului sexelor chironomidelor complet eclozate și vii (o prezentarea schematică a testului care cuprinde ciclul de viață este furnizată în apendicele 5). Toate datele sunt analizate fie printr-un model de regresie pentru a estima concentrația care ar conduce la reducerea cu X % a parametrului studiat relevant, fie prin testarea ipotezei pentru a determina o concentrație fără efecte observate (NOEC). Cea din urmă implică compararea răspunsurilor la tratament cu răspunsurile controlului adecvat cu ajutorul unor teste statistice. Trebuie remarcat faptul că în scenariul bazat pe apa adiționată, în cazul substanțelor chimice cu degradare rapidă, ultimele stadii ale ciclului viață al fiecărei generații (de exemplu, faza pupală) ar putea fi expuse la un nivel al concentrației considerabil mai redus în apa acoperitoare în raport cu chironomidele în primul stadiu larvar. Dacă aceasta reprezintă o preocupare și dacă este necesar un nivel de expunere comparabil pentru fiecare stadiu de viață, ar putea fi luate în considerare următoarele modificări ale metodei de testare:
|
—
|
testări paralele cu adiționare în diferite stadii de viață sau
|
|
—
|
adiționare repetată (sau înnoirea apei acoperitoare) a sistemului de testare pe durata ambelor etape de testare (prima și a 2-a generație), prin care intervalele de adiționare (de înnoire) trebuie să fie ajustate la caracteristicile sorții substanței chimice testate.
|
Astfel de modificări sunt fezabile doar în scenariul bazat pe apă adiționată, dar nu și în cel bazat pe sediment adiționat.
|
INFORMAȚII PRIVIND SUBSTANȚA TESTATĂ
|
8.
|
Trebuie să fie cunoscute solubilitatea în apă a substanței chimice testate, presiunea vaporilor ei și log K
ow măsurat sau calculat în sediment, precum și stabilitatea ei în apă și în sediment. Ar trebui să fie disponibilă o metodă analitică fiabilă de cuantificare a substanței chimice testate în apa acoperitoare, în apa interstițială și în sediment, a cărei precizie și ale cărei limite de detecție să fie cunoscute și raportate. Informații utile includ formula structurală și puritatea substanței chimice testate. De asemenea, este util să se cunoască soarta chimică a substanței chimice testate (de exemplu, disiparea, degradarea abiotică și biotică etc.). Orientări suplimentare privind testarea substanțelor chimice cu proprietăți fizico-chimice care le fac dificil de testat sunt prezentate în referința (16).
|
SUBSTANȚE CHIMICE DE REFERINȚĂ
|
9.
|
Substanțele chimice de referință pot fi testate periodic pentru a se asigura că sensibilitatea populației de laborator nu s-a schimbat. La fel ca în cazul dafniilor, ar fi suficientă efectuarea unui test al toxicității acute de 48 de ore (conform 17). Cu toate acestea, în așteptarea unei orientări valabile privind toxicitatea acută, conform capitolului C.28 din prezenta anexă poate fi luat în considerare un test al toxicității cronice. Exemple de substanțe toxice de referință utilizate cu succes în teste interlaboratoare și studii de validare sunt: lindan, trifluralin, pentaclorfenol, clorura de cadmiu și clorură de potasiu. (1) (3) (6) (7) (18).
|
VALIDITATEA TESTULUI
|
10.
|
Pentru ca testul să fie valid, trebuie să îndeplinească următoarele condiții:
|
—
|
eclozarea medie în tratamentul de control trebuie să fie de cel puțin 70 % la sfârșitul perioadei de expunere pentru ambele generații (1) (7);
|
|
—
|
pentru C. riparius și pentru C. yoshimatsui 85 % din totalul chironomidelor adulte eclozate din vasul de tratament de control pentru ambele generații trebuie să aibă loc într-un interval de 12 – 23 de zile de la introducerea în vase a larvelor din primul stadiu larvar; pentru C. dilutus,, este acceptabilă o perioadă cuprinsă între 20 și 65 zile;
|
|
—
|
Raportul mediu al sexelor exemplarelor adulte complet eclozate și vii (ca fracție de femelă sau mascul) în tratamentul de control pentru ambele generații trebuie să fie de cel puțin 0,4, dar nu mai mare de 0,6;
|
|
—
|
pentru fiecare cușcă de reproducere numărul de șiraguri de ouă din vasele de control ale primei generații trebuie să fie de cel puțin 0,6 per femelă adăugată în cușca de reproducere;
|
|
—
|
proporția de șiraguri de ouă fertile din fiecare cușcă de reproducere ale controalelor primei generații trebuie să fie de cel puțin 0,6;
|
|
—
|
la sfârșitul perioadei de expunere pentru ambele generații, pH-ul și concentrația oxigenului dizolvat se măsoară în fiecare vas. Concentrația oxigenului trebuie să fie de cel puțin 60 % din valoarea de saturație în aer (air saturation value – ASV (24)), iar pH-ul apei acoperitoare trebuie să fie cuprins între 6 și 9 în toate vasele de testare;
|
|
—
|
temperatura apei nu trebuie să difere cu mai mult de ± 1 °C.
|
|
DESCRIEREA METODEI
Vasele de testare și cuștile de reproducere
|
11.
|
Larvele sunt expus în pahare de laborator de sticlă de 600 ml măsurând circa 8,5 cm în diametru (a se vedea apendicele 5). Se pot folosi și alte vase, dar ele trebuie să asigure o adâncime corespunzătoare pentru sediment și apa acoperitoare. Suprafața sedimentului trebuie să fie suficient de mare pentru a permite un spațiu de 2 până la 3 cm2 pentru fiecare larvă. Raportul dintre adâncimea stratului de sediment și adâncimea apei acoperitoare trebuie să fie de circa 1:4. Trebuie utilizate cuști de reproducere (minimum 30 cm în toate cele trei dimensiuni) prevăzute o plasă (dimensiunea ochiului de circa 1 mm) minimum la partea superioară și pe o parte a cuștii (a se vedea apendicele 5). În fiecare cușcă, se introduce un vas de cristalizare de 2 l, care conține apă și sediment de testare, pentru depunerea ouălor. De asemenea, pentru vasul de cristalizare, raportul dintre adâncimea stratului de sediment și adâncimea apei acoperitoare trebuie să fie de aproximativ 1:4. După ce șiragurile de ouă sunt colectate din vasul de cristalizare, ele sunt plasate într-o placă de microtitrare cu 12 godeuri (un șirag per godeu conținând cel puțin 2,5 ml apă din vasul de cristalizare adiționat), ulterior plăcile fiind acoperite cu un capac pentru a preveni evaporarea semnificativă. Pot fi utilizate și alte vase adecvate pentru păstrarea șiragurilor de ouă. Cu excepția plăcilor de microtitrare, se recomandă ca toate vasele de testare și alte aparate care vor intra în contact cu sistemul de testare să fie complet din sticlă sau dintr-un alt material inert din punct de vedere chimic (de exemplu, politetrafluoretilenă).
|
Alegerea speciei
|
12.
|
De preferință, specia care se utilizează în test este Chironomus riparius. Se mai poate utiliza și C. yoshimatsui. Este potrivită și specia C. dilutus, dar este mai greu de manipulat și necesită o durată mai mare de testare. Detalii privind metodele de cultură a C. riparius sunt prezentate în apendicele 2. De asemenea, sunt disponibile informații privind condițiile de cultură pentru C. dilutus (5) și pentru C. yoshimatsui (14). Identificarea speciei trebuie să fie confirmată înainte de testare, dar nu este necesară înainte de fiecare test în parte atunci când organismele provin dintr-o cultură proprie.
|
Sediment
|
13.
|
De preferință, trebuie să se utilizeze sediment formulat (numit și sediment reconstituit, artificial sau sintetic). Totuși, în cazul în care se folosește sediment natural, caracteristicile acestuia trebuie să fie cunoscute (cel puțin pH-ul, conținutul de carbon organic, dar se recomandă și determinarea altor parametri ca raportul C/N și granulometria) și trebuie să nu existe niciun fel de contaminare și nici alte organisme care ar putea concura cu larvele de chironomide sau pe care le-ar putea consuma. De asemenea, înaintea testării se recomandă ca sedimentele să fie condiționate timp de șapte zile în condiții de testare. Se recomandă (1) (20) (21) următorul sediment formulat, astfel cum este descris în (1):
|
a.
|
4 – 5 % (greutate uscată) turbă: cu pH cât mai apropiat de valoarea 5,5 – 6; este important să se utilizeze turbă sub formă de pudră (dimensiunea particulelor ≤ 1 mm) și doar aer uscat;
|
|
b.
|
20 % (greutate uscată) argilă caolinică (de preferință, cu conținut de caolinit de peste 30 %);
|
|
c.
|
75 – 76 % (greutate uscată) nisip de cuarț (trebuie să predomine nisipul fin, cu peste 50 % dintre particule între 50 și 200 μm);
|
|
d.
|
Se adaugă apă deionizată pentru a obține un conținut de umiditate al amestecului final în intervalul 30 – 50 %;
|
|
e.
|
Se adaugă carbonat de calciu de calitate chimică pură (CaCO3), pentru a ajusta pH-ul amestecului final al sedimentului la 7 ± 0,5;
|
|
f.
|
Conținutul de carbon organic din amestecul final trebuie să fie 2 % (± 0,5 %) și se ajustează prin utilizarea unor cantități corespunzătoare de turbă și nisip, conform (a) și (c).
|
|
|
14.
|
Trebuie să se cunoască sursa de turbă, argilă caolinică și nisip. Componentele sedimentului trebuie să fie verificate, pentru a confirma absența contaminării chimice (de exemplu, metale grele, compuși organoclorurați, compuși organofosforici). În apendicele 3 este descris un exemplu de preparare a sedimentului formulat. Se acceptă și amestecul de constituenți uscați dacă se demonstrează că după adăugarea apei acoperitoare nu apare o separare a constituenților sedimentului (de exemplu, plutirea unor particule de turbă) și că turba sau sedimentul sunt suficient condiționate.
|
Apă
|
15.
|
Orice apă care corespunde caracteristicilor chimice ale unei ape de diluție acceptabile, astfel cum este prezentată în apendicele 2 și 4, este potrivită ca apă pentru testare. Orice apă adecvată, apă naturală (apă de suprafață sau apă subterană), apă reconstituită (a se vedea apendicele 2) sau apă de la robinet declorurată sunt acceptabile ca apă de cultură și apă de testare dacă chironomidele vor supraviețui în ea pe durata culturii și testării fără să prezinte semne de stres. La începutul testului, pH-ul apei de testare trebuie să fie între 6 și 9, iar duritatea totală să nu fie mai mare de 400 mg/l CaCO3. Totuși, în cazul în care se bănuiește că există o interacțiune între ionii care determină duritatea apei și substanța chimică testată, trebuie să se utilizeze o apă cu duritate mai mică (astfel, în această situație nu trebuie să se folosească mediul Elendt M4). Același tip de apă trebuie să se utilizeze pe toată durata studiului. Caracteristicile calității apei prezentate în apendicele 4 trebuie să fie măsurate cel puțin de două ori pe an sau ori de câte ori se presupune că este posibil ca aceste caracteristici să se fi schimbat semnificativ.
|
Soluții stoc – Apă adiționată
|
16. a.
|
Concentrațiile de testare se calculează pe baza concentrațiilor din coloana de apă, adică apa care acoperă sedimentul. Soluțiile de testare în concentrațiile alese se prepară de obicei prin diluarea unei soluții stoc. Soluțiile stoc se prepară de preferință prin dizolvarea substanței chimice testate în apa de testare. În unele cazuri poate fi necesară folosirea solvenților sau a agenților de dispersie pentru a realiza o soluție stoc cu concentrație corespunzătoare. Exemple de solvenți adecvați sunt acetona, eterul monoetilic al etilen glicolului, eterul dimetilic al etilen glicolului, dimetilformamida și trietilen glicolul. Agenții de dispersie care pot fi utilizați sunt Cremophor RH40, Tween 80, metilceluloză 0,01 % și HCO-40. Concentrația agentului de solubilizare în mediul de testare final trebuie să fie minimă (i.e. ≤ 0,1 ml/l) și trebuie să fie aceeași pentru toate tratamentele. În cazul utilizării unui agent de solubilizare, acesta nu trebuie să aibă niciun efect semnificativ asupra supraviețuirii, astfel cum a fost demonstrat cu ajutorul unui control cu solvent în comparație cu un control negativ (apă). Totuși, se vor luat toate măsurile necesare pentru evitarea utilizării unor astfel de materiale.
|
Soluții stoc – Sediment adiționat
|
16. b.
|
De obicei, sedimentele adiționate la o concentrație aleasă sunt preparate prin adăugarea unei soluții de substanță chimică testată direct în sediment. O soluție stoc de substanță testată dizolvată în apa deionizată este amestecată cu sedimentul formulat cu ajutorul unui tambur, al unui malaxor sau prin amestecare manuală. Dacă este puțin solubilă în apă, substanța chimică testată se poate dizolva într-un volum cât se poate de mic de solvent organic adecvat (de exemplu, hexan, acetonă sau cloroform). Această soluție este apoi amestecată cu 10 g de nisip de cuarț fin pentru fiecare vas de testare. Se așteaptă evaporarea solventului și trebuie eliminat în totalitate din nisip; apoi nisipul este amestecat cu o cantitate adecvată de sediment. Pentru solubilizarea, dispersia sau emulsionarea substanței chimice testate se pot folosi numai agenți cu volatilizare rapidă. Este necesar să se țină cont de faptul că nisipul provenit din amestecul de substanță chimică testată și nisip trebuie să fie luat în considerare atunci când se prepară sedimentul (adică sedimentul trebuie să fie astfel preparat cu mai puțin nisip). Trebuie să se asigure că substanța chimică testată adăugată la sediment este distribuită completă și uniform în sediment. Dacă este necesar, se pot analiza subeșantioane pentru determinarea gradului de omogenitate.
|
PROTOCOLUL TESTULUI
|
17.
|
Protocolul testului se referă la alegerea numărului și la spațierea concentrațiilor de testare, la numărul de vase pentru fiecare concentrație și la numărul de larve per vas, la numărul de vase de cristalizare și de cuști de creștere. Protocolul pentru ECx, NOEC și pentru un test limită sunt descrise mai jos.
|
Protocolul pentru analiza prin regresie
|
18.
|
Concentrația pentru care se observă efecte (ECx,) și intervalul de concentrații la care efectul substanței chimice testate este de interes trebuie să fie cuprinse în test, astfel încât parametrul studiat să nu fie extrapolat în afara limitelor datelor generate. Extrapolarea mult sub cea mai mică sau peste cea mai mare concentrație trebuie evitată. Pentru selectarea unui interval adecvat de concentrații de testare poate fi utilă realizarea unui test preliminar de determinare a intervalelor în conformitate cu metodele de testare C.27 sau C.28.
|
|
19.
|
Pentru o metodă implicând ECx, sunt necesare cel puțin cinci concentrații și opt replici pentru fiecare concentrație. Pentru fiecare concentrație trebuie utilizate două cuști de reproducere (A și B). Cele opt replici sunt împărțite în două grupe a câte patru replici pentru a deservi fiecare cușcă de reproducere. Această reunire a replicilor este necesară datorită numărului de chironomide necesare în cușcă în vederea unor evaluări corecte ale reproducerii. Cu toate acestea, cea de a 2-a generație numără din nou opt replici, inițiate din populațiile expuse în cuștile de reproducere. Factorul dintre concentrații nu trebuie să fie mai mare de doi (cu o posibilă excepție în cazurile în care curba de doză-răspuns are o pantă ușoară). Numărul de replici pentru fiecare tratament poate fi redus la șase (trei pentru fiecare cușcă de reproducere) în cazul în care se crește numărul de concentrații de testare cu răspunsuri diferite. Creșterea numărului de replici sau reducerea mărimii intervalelor concentrațiilor de testare tinde să micșoreze intervalele de încredere în jurul ECX.
|
Protocolul pentru estimarea NOEC
|
20.
|
Pentru o metodă privind NOEC, trebuie utilizate cel puțin cinci concentrații de testare și cel puțin opt replici (4 pentru fiecare cușcă de reproducere, A și B), iar factorul dintre concentrații nu trebuie să fie mai mare de doi. Numărul de replici trebuie să fie suficient pentru a asigura o putere statistică adecvată pentru detectarea unei diferențe de 20 % față de control la un nivel de semnificație statistică de 5 % (α = 0,05). Pentru rata de dezvoltare, fecunditate și fertilitate, este în general utilă o analiză a varianței (ANOVA), urmată de testul Dunnett sau testul Williams (22 – 25). În ceea ce privește raportul de eclozare și raportul sexelor, pot fi utile testul Cochran-Armitage, testul exact al lui Fisher (cu corecție Bonferroni) sau testul Mantel-Haentzal.
|
Test limită
|
21.
|
Un test limită [o concentrație de testare și control (controale)] poate fi efectuat în cazul în care nu există efecte observate în testul preliminar opțional de determinare a intervalelor până la concentrația maximă. Scopul testului limită este de a indica faptul că orice efecte toxice ale substanței chimice testate se constată la niveluri superioare concentrației-limită testate. Pentru apă, sunt recomandate concentrații de 100 mg/l, iar pentru sediment de 1 000 mg/kg (greutate uscată). De obicei, sunt necesare cel puțin opt replici, atât pentru tratament, cât și pentru control. Trebuie să se demonstreze o putere statistică adecvată pentru detectarea unei diferențe de 20 % față de control la un nivel de semnificație statistică de 5 % (α = 0,05). Cu răspunsuri metrice (rată de dezvoltare), testul t este o metodă statistică adecvată atunci când datele îndeplinesc cerințele acestui test (normalitate, varianțe omogene). În cazul în care aceste cerințe nu sunt îndeplinite, se poate utiliza testul t pentru varianțe inegale sau un test neparametric, precum testul Wilcoxon-Mann-Whithey. Pentru raportul de eclozare este adecvat testul exact al lui Fisher.
|
PROCEDURA
Condiții de expunere
Pregătirea sistemului apă-sediment (adiționarea apei)
|
22. a.
|
Sediment formulat (a se vedea punctele 13 – 14 și apendicele 3) este introdus în fiecare vas de testare și de cristalizare pentru a forma un strat de minimum 1,5 cm (pentru vasul de cristalizare acesta poate fi relativ mai subțire), dar de maximum 3 cm. Apa (a se vedea punctul 15) este introdusă astfel încât raportul dintre adâncimea stratului de sediment și adâncimea apei să nu depășească 1:4. După pregătirea vaselor de testare, sistemul sediment-apă trebuie lăsat la aerare ușoară timp de aproximativ șapte zile înainte de introducerea larvelor în primul stadiu din prima și din cea de a 2-a generație (a se vedea punctul 14 și apendicele 3). Sistemul sediment-apă al vaselor de cristalizare nu este aerat pe durata testării, deoarece nu este necesară asigurarea supraviețuirii larvelor (înainte de eclozare șiragurile de ouă sunt deja colectate). Pentru a evita separarea ingredientelor sedimentului și resuspendarea materiilor fine în timpul adăugării apei de testare în coloana de apă, sedimentul poate fi acoperit cu un disc din plastic în timp ce se toarnă apa. Discul este înlăturat imediat după aceea. Se pot utiliza și alte dispozitive.
|
Pregătirea sistemului apă-sediment (sediment adiționat)
|
22. b.
|
Sedimentele adiționate pregătite conform punctului 16b sunt introduse în vase și în vasul de cristalizare, iar apa acoperitoare este adăugată pentru a se obține un raport volumic sediment-apă de 1:4. Adâncimea stratului de sediment trebuie să fie cuprinsă între 1,5 și 3 cm (aceasta poate fi relativ mai mică pentru vasul de cristalizare). Pentru a evita separarea ingredientelor sedimentului și resuspendarea materiilor fine în timpul adăugării apei de testare în coloana de apă, sedimentul poate fi acoperit cu un disc din plastic în timp ce se toarnă apa, apoi discul este înlăturat imediat. Se pot utiliza și alte dispozitive. După adăugarea de apă acoperitoare peste sedimentul adiționat, este de dorit să se lase timp pentru migrarea substanței chimice testate din sediment în faza apoasă (4) (5) (7) (18). De preferință, aceasta trebuie să se realizeze în condițiile de temperatură și aerare utilizate în test. Perioada de timp corespunzătoare pentru echilibrare depinde de sediment și de substanța chimică și poate fi de ordinul orelor sau de ordinul zilelor, iar în cazuri rare poate ajunge până la cinci săptămâni. Întrucât în această perioadă s-ar putea produce degradarea multor substanțe chimice, nu se așteaptă atingerea echilibrului, dar se recomandă o perioadă de echilibrare de 48 de ore. Cu toate acestea, atunci când timpul de înjumătățire a degradării substanței chimice în sediment este cunoscut ca fiind lung (a se vedea punctul 8), perioada de echilibrare poate fi prelungită. La sfârșitul acestei perioade de echilibrare suplimentare, concentrația substanței chimice testate trebuie să fie măsurată în apa acoperitoare, în apa interstițială și în sediment, cel puțin la concentrația cea mai mare și la una mai mică (a se vedea punctul 38). Aceste determinări analitice ale substanței chimice testate permit calculul bilanțului masic și exprimarea rezultatelor pe baza concentrațiilor măsurate.
|
|
23.
|
Vasele de testare trebuie să fie acoperite (de exemplu, cu plăci din sticlă). Dacă este necesar, în timpul studiului nivelul apei se completează până la volumul original, pentru a compensa evaporarea. Această operațiune trebuie să se efectueze cu apă distilată sau apă deionizată, pentru a preveni acumularea de săruri. Vasele de cristalizare din cuștile de reproducere nu sunt acoperite și este posibil, însă nu indispensabil, să fie ajustate pentru a compensa pierderea de apă pe durata perioadei de testare, întrucât șiragurile de ouă sunt în contact cu apa numai timp de aproximativ o zi, iar vasele sunt utilizate numai într-o scurtă fază a testului.
|
Adăugarea de organisme de testare
|
24.
|
Cu patru sau cinci zile înainte de a introduce larve în primul stadiu pentru prima generație, masele de ouă trebuie prelevate din cultură și plasate în vase mici conținând mediul de cultură. Se poate utiliza un mediu de cultură învechit provenit din cultura stoc sau un mediu proaspăt preparat. În orice caz, în mediul de cultură se va adăuga o mică cantitate de hrană, de exemplu câteva picături dintr-o suspensie de hrană fin măcinată pentru pești sub formă de fulgi (a se vedea apendicele 2). Trebuie să se utilizeze doar mase de ouă proaspăt depuse. În mod normal, larvele încep să eclozeze după aproximativ 2 zile de la depunerea ouălor (2 – 3 zile pentru C. riparius la 20 °C și 1 – 4 zile pentru C. dilutus la 23 °C și C. yoshimatsui la 25 °C), iar creșterea larvelor se realizează în patru stadii, fiecare cu o durată de 4 – 8 zile. În test trebuie utilizate larve în primul stadiu (maximum 48 de ore după eclozare). Este posibilă verificarea stadiului de dezvoltare a larvelor în funcție de lățimea capsulei cefalice (7).
|
|
25.
|
Douăzeci de larve din primul stadiu de dezvoltare pentru prima generație sunt alocate în mod aleatoriu fiecărui vas de testare care conține sistemul de sediment-apă, cu ajutorul unei pipete neefilate. Aerarea apei este oprită în timpul introducerii larvelor în vasele de testare și trebuie să rămână astfel timp de 24 de ore după introducerea acestora (a se vedea punctul 32). În funcție de protocolul de testare utilizat (a se vedea punctele 19 și 20), numărul de larve folosite pentru fiecare concentrație este de cel puțin 120 (6 replici per concentrație) pentru metoda ECX și de cel puțin 160 pentru metoda NOEC (8 replici per concentrație). În cazul protocolului cu sediment adiționat, expunerea începe o dată cu introducerea larvelor.
|
Adiționarea apei acoperitoare
|
26.
|
La douăzeci și patru de ore după adăugarea de larve în primul stadiul larvar pentru prima generație, substanța chimică testată este adiționată în coloana de apă acoperitoare, fiind asigurată din nou o ușoară aerare (pentru posibile modificări ale protocolului de testare, a se vedea punctul 7). Cu ajutorul unei pipete se aplică mici volume de soluții stoc de substanță chimică testată sub suprafața apei. Apoi, apa acoperitoare trebuie să fie amestecată cu grijă, pentru a nu perturba sedimentul. În cadrul protocolului cu apă adiționată, expunerea începe cu adiționarea apei (la o zi de la introducerea larvelor).
|
Colectarea adulților eclozați
|
27.
|
Chironomidele eclozate din prima generație sunt colectate cel puțin o dată, însă, de preferință, de două ori pe zi (a se vedea punctul 36) din vasele de testare cu ajutorul unui aspirator, exhaustor sau al unui dispozitiv similar (a se vedea apendicele 5). Trebuie să fie acordată o atenție deosebită pentru a nu provoca leziuni adulților. Chironomidele colectate din patru vase de testare aferente unui tratament sunt eliberate într-o cușcă de reproducere la care au fost repartizate în prealabil. În ziua primei eclozări (masculi), vasele de cristalizare sunt adiționate prin introducerea cu ajutorul unei pipete a unui volum mic de soluție stoc de substanță chimică testată sub suprafața apei (protocol cu apă adiționată). Apoi, apa acoperitoare trebuie să fie amestecată cu grijă, pentru a nu perturba sedimentul. Concentrația substanței chimice testate din vasul de cristalizare este în mod nominal aceeași ca în vasele de tratament care sunt alocate respectivei cuști de reproducere specifice. În cadrul protocolului cu sediment adiționat, vasele de cristalizare sunt preparate în aproximativ, ziua a 11-a de la începerea expunerii (introducerea de larve de primă generație), astfel încât să se poată realiza echilibrarea acestora timp de aproximativ 48 de ore înainte de producerea primelor șiraguri de ouă.
|
|
28.
|
Șiragurile de ouă sunt colectate din vasul de cristalizare în cușca de reproducere cu ajutorul unor pensete sau al unei pipete neefilate. Fiecare șirag de ouă se introduce într-un vas care conține mediu de cultură din vasul de cristalizare din care a fost colectat (de exemplu, o microplacă cu 12 godeuri împreună cu cel puțin 2,5 ml de mediu). Vasele care conțin șiragurile de ouă sunt acoperite cu un capac pentru a preveni evaporarea semnificativă. Șiragurile de ouă sunt păstrate pentru observație timp de cel puțin șase zile după ce au fost produse, astfel încât să poată fi clasificate ca fertile sau infertile.
Pentru începerea celei de a 2-a generații, cel puțin trei, însă de preferință șase șiraguri de ouă fertile sunt selectate din fiecare cușcă de creștere și, cu puțină hrană, sunt lăsate să eclozeze. Aceste șiraguri de ouă trebuie să fi fost produse în momentul maxim al activității de depunere a ouălor, care în mod normal are loc în jurul celei de a 19-a zile de testare în controale. În mod ideal, a 2-a generație în toate grupurile de tratament apare în aceeași zi, însă din cauza efectelor substanței chimice asupra dezvoltării larvelor, se poate ca aceasta să nu fie posibilă întotdeauna. În acest caz, concentrațiile mai mari pot fi inițiate mai târziu decât tratamentele cu concentrații mai mici și controlul (solvent).
|
|
29. a.
|
În cadrul protocolului cu apă adiționată, sistemul apă-sediment pentru cea de a 2-a generație este pregătit prin adiționarea substanței chimice testate în coloana de apă acoperitoare cu circa 1 oră înainte de introducerea larvelor în primul stadiu de dezvoltare în vasele de testare. Cu ajutorul unei pipete, se aplică mici volume de soluții stoc ale substanțelor chimice testate sub suprafața apei. Apoi, apa acoperitoare trebuie să fie amestecată cu grijă, pentru a nu perturba sedimentul. După adiționare, se asigură o ușoară aerare.
|
|
29. b.
|
În protocolul cu sediment adiționat, vasele de expunere care conțin sistemul apă-sediment pentru cea de a 2-a generație sunt pregătite în același mod ca pentru prima generație.
|
|
30.
|
Douăzeci de larve în primul stadiu de dezvoltare (maximum 48 de ori după eclozare) din cea de a 2-a generație sunt alocate în mod aleatoriu fiecărui vas de testare care conține sistemul sediment adiționat-apă, cu ajutorul unei pipete neefilate. Aerarea apei trebuie să fie oprită după introducerea de larve din primul stadiu de dezvoltare în vasele de testare și trebuie să fie menținută astfel timp de încă 24 de ore după introducerea larvelor. În funcție de protocolul de testare utilizat (a se vedea punctele 19 și 20), numărul de larve folosite pentru fiecare concentrație este de cel puțin 120 (6 replici per concentrație) pentru metoda ECX și de cel puțin 160 pentru metoda NOEC (8 replici per concentrație).
|
Hrană
|
31.
|
Larvele din vasele de testare trebuie să fie hrănite de preferință zilnic sau de cel puțin trei ori pe săptămână. Hrană pentru pești (o suspensie în apă sau hrană fin măcinată, de exemplu Tetra-Min sau Tetra-Phyll; a se vedea detalii în apendicele 2) între 0,25 și 0,5 mg (0,35 – 0,5 mg pentru C. yoshimatsui) per larvă per zi reprezintă o cantitate adecvată de hrană pentru larvele tinere în primele 10 zile a dezvoltării lor. Este posibil să fie necesară mai multă hrană pentru larvele cu vârstă mai mare: 0,5 – 1 mg per larvă per zi ar trebui să fie suficient pentru restul testului. Porția de hrană trebuie să fie redusă pentru toate grupurile tratate sau de control dacă se constată dezvoltarea de ciuperci sau dacă sunt observate cazuri de deces la controale. În cazul în care dezvoltarea de ciuperci nu poate fi oprită, testul trebuie repetat.
Relevanța toxicologică a expunerii prin ingestie este în general mai mare în cazul substanțelor chimice cu o puternică afinitate pentru carbonul organic sau al substanțelor chimice cu legături covalente cu sedimentul. Prin urmare, în cazul testării substanțelor chimice care au astfel de proprietăți, cantitatea de hrană necesară pentru a asigura supraviețuirea și creșterea naturală a larvelor poate fi adăugată în sedimentul formulat înainte de perioada de stabilizare, în funcție de cerința de reglementare. Pentru a preveni deteriorarea calității apei, trebuie folosite plante în loc de hrană pentru pești, de exemplu adăugarea a 0,5 % (greutate uscată) de frunze fin măcinate de urzică (Urtica dioica), de dude (Morus alba), de trifoi alb (Trifolium repens), de spanac (Spinacia oleracea) sau de la alte plante (Cerophyl sau α-celuloză). Adăugarea în sediment a întregii porții de hrană de origine organică înainte de adiționare nu este lipsită de consecințe în ceea ce privește calitatea apei și performanțele biologice (21) și nici nu reprezintă o metodă standardizată, însă studii recente indică că această metodă dă rezultate (19) (26). Chironomidele adulte din cuștile de reproducere nu au în mod normal nevoie de hrană, însă fecunditatea și fertilitatea sunt îmbunătățite atunci când adulților eclozați li se pune la dispoziție ca sursă de hrană un tampon de vată îmbibat cu o soluție saturată de zaharoză (34).
|
Condiții de incubare
|
32.
|
Aerarea ușoară a apei acoperitoare în vasele de testare se efectuează cu 24 de ore după adăugarea larvelor din primul stadiul de dezvoltare din ambele generații și este continuată pe tot parcursul testului (trebuie să se acorde atenție concentrației de oxigen dizolvat, care nu trebuie să scadă sub nivelul de 60 % din ASV). Aerarea se face cu ajutorul unei pipete Pasteur din sticlă a cărei orificiu este fixat la 2 – 3 cm deasupra stratului de sediment eliberând câteva bule pe secundă. La testarea substanțelor chimice volatile, trebuie să se acorde atenție ca sistemul sediment-apă să nu fie aerat, asigurând în același timp respectarea criteriului de validitate de 60 % din ASV (punctul 10). Orientări suplimentare sunt disponibile la referința (16).
|
|
33.
|
Testul pentru C. riparius se efectuează la o temperatură constantă de 20 °C (± 2 °C). Pentru C. dilutus și C. yoshimatsui, temperaturile recomandate sunt 23 °C și, respectiv, 25 °C (± 2 °C). Se utilizează o perioadă de expunere la lumină de 16 ore, iar intensitatea luminii trebuie să fie de 500 – 1 000 lux. Pentru cuștile de reproducere, poate fi inclusă o oră suplimentară de fază de zori și de amurg.
|
Durata expunerii
|
34.
|
Protocolul cu apă adiționată: Perioada de expunere a primei generații începe atunci când substanța chimică testat este adiționată în apa acoperitoare a vaselor de testare (adică la o zi de la introducerea larvelor – pentru modificări posibile ale protocolului de expunere, a se vedea punctul 7). Expunerea larvelor din cea de a 2-a generație începe imediat, întrucât ele sunt introduse într-un sistem sediment-apă deja adiționat. Durata maximă de expunere pentru 1-a generație este de 27 de zile, iar pentru a 2-a generație este de 28 de zile (larvele din 1-a generație petrec o zi în vasele fără expunere) pentru C. riparius și C. yoshimatsui. Ținând cont de suprapunere, durata totală a testării este de aproximativ 44 de zile. Pentru C. dilutus, duratele maxime de expunere sunt de 64 și de 65 de zile pentru prima generație și, respectiv, pentru cea de a 2-a generație. Durata totală este de aproximativ 100 de zile.
Protocolul cu sediment adiționat: expunerea începe cu adăugarea de larve și este de maximum 28 de zile pentru ambele generații pentru C. riparius și C. yoshimatsui și de maximum 65 de zile pentru ambele generații pentru C. dilutus.
|
Observații
Eclozare
|
35.
|
Timpul de dezvoltare și numărul total de chironomide, femele și masculi, eclozate și vii sunt determinate pentru ambele generații. Masculii sunt ușor de identificat prin antenele plumoase și prin corpul lor fin.
|
|
36.
|
Vasele de testare pentru ambelor generații trebuie observate de cel puți trei ori pe săptămână pentru a vedea dacă larvele prezintă comportamente anormale (de exemplu, ieșirea din sediment, înot neobișnuit) în raport cu controlul. În perioada de eclozare, care începe după aproximativ 12 zile de la introducerea larvelor pentru C. riparius și C. yoshimatsui (după 20 de zile pentru C. dilutus), chironomidele eclozate sunt numărate și li se stabilește sexul cel puțin o dată, dar, de preferință, de două ori pe zi (dimineața devreme și după-amiaza târziu). După identificare, chironomidele din prima generație sunt îndepărtate cu grijă din vase și sunt transferate într-o cușcă de reproducere. Chironomidele din cea de a 2-a generație sunt îndepărtate și ucise după identificare. Orice șiraguri de ouă depozitate în vasele de testare ale primei generații trebuie să fie colectate individual și transferate cu cel puțin 2,5 ml de apă nativă în plăci de microtitrare cu 12 godeuri (sau în alte vase adecvate) care sunt acoperite cu un capac pentru a preveni evaporarea semnificativă. Numărul de larve moarte și pupe vizibile care nu au eclozat trebuie înregistrate. Exemple de cuști de reproducere, de vase de testare și de exhaustoare sunt furnizate în apendicele 5.
|
Reproducerea
|
37.
|
Efectele asupra reproducerii sunt evaluate prin determinarea numărului de șiraguri de ouă produse de prima generație de chironomide și prin fertilitatea acestor șiraguri de ouă. O dată pe zi șiragurile de ouă sunt colectate din vasele de cristalizare plasate în fiecare recipient de reproducere. Șiragurile de ouă trebuie colectate și transferate cu cel puțin 2,5 ml de apă nativă într-un placă de microtitrare cu 12 godeuri (un șirag de ouă în fiecare godeu) sau în alte vase adecvate care sunt acoperite cu un capac pentru a preveni evaporarea semnificativă. Următoarele caracteristici sunt documentate pentru fiecare șirag de ouă: ziua de producție, dimensiuni (normale, adică 1 ± 0,3 cm sau mici; tipic ≤ 0,5 cm) și structura (normală = formă de banană cu șirag de ouă dispuse în spirală sau anormală, de exemplu, șirag de ouă nespiralat) și fertilitatea (fertile sau infertile). Pe parcursul unei perioade de șase zile după producere fertilitatea unui șirag de ouă este evaluată. Un șirag de ouă este considerat fertil atunci când cel puțin un ou din trei eclozează. Numărul total de femele introduse în cușca de reproducere este utilizat pentru a calcula numărul de șiraguri de ouă per femelă și numărul de șiraguri de ouă fertile per femelă. Dacă este necesar, numărul de ouă dintr-un șirag de ouă poate fi estimat în mod nedistructiv cu ajutorul metodei numărării inelelor (detaliată în referințele 32 și 33).
|
Măsurători analitice
Concentrația substanței chimice testate
|
38.
|
Ca cerință minimă, eșantioanele din apa acoperitoare, din apa interstițială și din sediment trebuie analizate la începutul expunerii (în cazul adiționării apei, de preferință la o oră după aplicare) și la sfârșitul testului, la concentrația cea mai mare și la o concentrație mai mică. Aceasta se aplică vaselor din ambele generații. Din vasele de cristalizare în cuștile de reproducere numai apa acoperitoare este analizată, întrucât doar cu aceasta intră în contract șiragurile de ouă (în ceea ce privește protocolul cu sediment adiționat, poate fi avută în vedere o confirmare analitică a concentrației sedimentului). Dacă se consideră necesar, pe durata testului pot fi efectuate măsurători suplimentare ale sedimentului, ale apei interstițiale sau ale apei acoperitoare. Aceste determinări ale concentrației substanței chimice testate furnizează informații despre comportamentul/partiția substanței chimice testate în sistemul apă-sediment. Eșantionarea sedimentului și a apei interstițiale la începutul și pe durata testului (a se vedea punctul 39) necesită vase de testare suplimentare pentru realizarea de determinări analitice. Măsurătorile efectuate în sediment în cadrul protocolului cu apă adiționată pot să nu fie necesare dacă migrarea substanței chimice testate între apă și sediment a fost determinată în mod clar într-un studiu apă/sediment în condiții comparabile (de exemplu, raportul sediment/apă, tipul de aplicare, conținutul de carbon organic din sediment) sau dacă se arată că concentrațiile măsurate în apa acoperitoare au rămas la valori cuprinse între 80 și 120 % din valorile nominale sau măsurate inițial.
|
|
39.
|
Atunci când se efectuează măsurători intermediare (de exemplu, în ziua a 7-a și/sau a 14-a) și dacă pentru analiză este nevoie de eșantioane mari care nu pot fi prelevate din vasele de testare fără a influența sistemul de testare, trebuie să se efectueze determinări analitice pe eșantioane din vase de testare suplimentare tratate în același mod (inclusiv prezența organismelor de testare), dar neutilizate pentru observații biologice.
|
|
40.
|
Procedura recomandată pentru izolarea apei interstițiale este centrifugarea, de exemplu la 10 000 g și 4 °C timp de 30 de minute. Totuși, în cazul în care se demonstrează că substanța chimică testată nu se adsoarbe pe filtre, se poate accepta și filtrarea. În unele cazuri, nu se pot analiza concentrațiile în apa interstițială, pentru că dimensiunea eșantionului este prea mică.
|
Parametri fizico-chimici
|
41.
|
pH-ul. oxigenul dizolvat în apa de testare și temperatura apei din vasele de testare și din vasele de cristalizare trebuie măsurate în mod corespunzător (a se vedea punctul 10). Duritatea apei și amoniacul trebuie măsurate în vasele de control, precum și în unul dintre vasele de testare și de cristalizare la cea mai mare concentrație, la începutul și la sfârșitul testului.
|
DATE ȘI RAPORTARE
Tratamentul rezultatelor
|
42.
|
Scopul acestui test care cuprinde ciclul de viață este determinarea efectului substanței chimice testate asupra reproducerii și, pentru două generații, a ratei de dezvoltare și a numărul total al chironomidelor complet eclozate și vii, femele și masculi. Pentru a determinat rata de eclozare, trebuie agregate datele privind femelele și masculii. În cazul în care nu există diferențe semnificative din punct de vedere statistic între sensibilitățile ratelor de dezvoltare ale sexelor separate, rezultatele privind femelele și masculii pot fi agregate pentru analizare statistică.
|
|
43.
|
Concentrațiile la care se observă efecte exprimate sub formă de concentrații în apa acoperitoare (pentru apa adiționată) sau în sediment (pentru sedimentul adiționat) sunt calculate de obicei pe baza concentrațiilor măsurate la începutul expunerii (a se vedea punctul 38). Prin urmare, pentru apa adiționată, concentrațiile măsurate în mod tipic la începutul expunerii în apa acoperitoare a vaselor pentru ambele generații și cele măsurate în vasele de cristalizare sunt transformate în medii pentru fiecare tratament. Pentru sedimentul adiționat, concentrațiile măsurate în mod tipic la începutul expunerii în vasele pentru ambele generații (și opțional cele măsurate în vasele de cristalizare) sunt transformate în medii pentru fiecare tratament.
|
|
44.
|
Pentru a calcula o estimare punctuală, adică o ECx, datele statistice per vas și per cușcă de reproducere pot fi utilizate ca replici veritabile. La calcularea intervalului de încredere pentru orice ECx, trebuie să se țină seama de variabilitatea între vase sau trebuie să se demonstreze că această variabilitate este atât de mică încât poate fi ignorată. Atunci când modelul este ajustat cu metoda celor mai mici pătrate, trebuie să se aplice o transformare la datele statistice pentru fiecare vas, în vederea îmbunătățirii omogenității varianței. Totuși, valorile ECx trebuie să fie calculate după ce răspunsul este transformat înapoi la valoarea originală (31).
|
|
45.
|
Atunci când analiza statistică vizează determinarea NOEC prin testarea ipotezei, variabilitatea între vase trebuie să fie luată în considerare, ceea ce garantează utilizarea metodelor ANOVA (de exemplu, procedurile de testare Williams și Dunnett). Testul Williams este adecvat atunci când o relație doză-răspuns monotonă este preconizată în teorie, iar testul Dunnett este adecvat atunci când ipoteza monotonicității nu este preconizată. Alternativ, teste mai robuste (27) pot fi adecvate în situații în care există violări ale ipotezelor ANOVA obișnuite (31).
|
Rata de eclozare
|
46.
|
Ratele de eclozare sunt date cantitative și pot fi analizate cu ajutorul testului Cochran-Armitage aplicat în mod descrescător atunci când se preconizează o relație doză-răspuns monotonă și când aceste date corespund preconizării. În caz contrar, se poate utiliza testul exact al lui Fisher sau testul Mantel-Haentzal, cu valori p ajustate Bonferroni-Holm. În cazul în care există dovezi că variabilitatea între replici este mai mare la aceeași concentrație decât ar indica o distribuție binomială (adesea numită variație «extra-binomială»), atunci trebuie să se utilizeze un test robust Cochran-Armitage sau testul exact al lui Fisher, așa cum se propune în referința (27).
Suma chironomidelor vii (masculi plus femele) eclozate per vas, ne
, este determinată și împărțită la numărul de larve introduse, na
:

unde:
|
ER
|
=
|
rata de eclozare
|
|
ne
|
=
|
numărul de chironomide vii eclozate per vas
|
|
na
|
=
|
numărul de larve introduse per vas (în mod normal 20)
|
Atunci când ne
este mai mare decât na
(adică atunci când a fost introdus în mod neintenționat un număr de larve mai mare decât numărul prevăzut) na
trebuie să fie adus la egalitate cu ne
.
|
|
47.
|
O abordare alternativă mai adecvată pentru eșantioane de dimensiuni mari, atunci când există o varianță extra-binominală, este tratarea ratei de eclozare ca răspuns continuu și utilizarea de proceduri coerente cu aceste date ER. O dimensiune mare a eșantionului este definită, în acest caz, ca fiind numărul de eclozări și numărul de neeclozări, ambele mai mari decât cinci, per replică (vas).
|
|
48.
|
Pentru aplicarea metodelor ANOVA, valorile ER trebuie să fie mai întâi transformate prin transformarea arcsin-sqrt sau prin transformarea Freeman-Tukey, pentru a obține o distribuție aproximativ normală și pentru a egaliza varianțele. Testul Cochran-Armitage, testul exact al lui Fisher (Bonferroni) sau testul Mantel-Haentzal pot fi aplicate atunci când se utilizează frecvențe absolute. Transformarea arcsin-sqrt este aplicată prin preluarea inversul sinusului (sinus– 1) al rădăcinii pătrate a ER.
|
|
49.
|
Pentru ratele de eclozare, valorile ECx sunt calculate cu ajutorul analizei de regresie [de exemplu, probit, logit sau modelele Weibull (28)]. În cazul în care analiza de regresie eșuează (de exemplu, atunci când există mai puțin de două răspunsuri parțiale), se utilizează alte metode neparametrice, precum media mobilă sau interpolarea simplă.
|
Rata de dezvoltare
|
50.
|
Durata medie de dezvoltare reprezintă intervalul de timp mediu dintre introducerea larvelor (ziua 0 a testului) și eclozarea cohortelor experimentale de chironomide (pentru calcularea duratei de dezvoltare reale, trebuie luată în considerare vârsta larvelor în momentul introducerii). Rata de dezvoltare (unitate: 1/zi) este inversul duratei de dezvoltare și reprezintă acea parte din dezvoltarea larvară care are loc în cursul unei zile. Rata de dezvoltare este preferată pentru evaluarea acestor studii de toxicitate cu sedimente, pentru că varianța sa este mai mică și este mai omogenă și mai apropiată de distribuția normală, comparativ cu durata de dezvoltare. Prin urmare, cu rata de dezvoltare se pot utiliza proceduri de testare parametrică mai puternice, spre deosebire de durata de dezvoltare. Pentru rata de dezvoltare ca răspuns continuu, valorile ECx pot fi estimate prin utilizarea analizei de regresie [de exemplu, (29), (30)]. O NOEC pentru rata de dezvoltare medie poate fi determinată prin metode ANOVA, de exemplu testul Williams sau testul Dunnett. Întrucât eclozarea masculilor are loc mai devreme decât cea a femelelor, adică au o rată de dezvoltare mai ridicată, are sens ca rata de dezvoltare să fie calculată separat pentru fiecare sex, în plus față de cea pentru toate chironomidele.
|
|
51.
|
Pentru testele statistice, se presupune că numărul de chironomide observate în ziua de inspecție x au eclozat la media intervalului de timp dintre ziua x – l (l = lungimea intervalului de inspecție, de obicei 1 zi). Rata medie de dezvoltare per vas (

) este calculată cu formula:
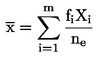
unde:
|

|
:
|
rata medie de dezvoltare per vas
|
|
i
|
:
|
indicele intervalului de inspecție
|
|
m
|
:
|
numărul maxim de intervale de inspecție
|
|
fi
|
:
|
numărul de chironomide eclozate în intervalul de inspecție i
|
|
ne
|
:
|
numărul total de chironomide eclozate la sfârșitul experimentului (Σfi
)
|
|
xi
|
:
|
rata de dezvoltare a chironomidelor eclozate în intervalul i
|

unde:
|
ziuai
|
:
|
ziua de inspecție (numărul de zile de la introducerea larvelor)
|
|
li
|
:
|
lungimea intervalului de inspecție i (zile, de obicei 1 zi)
|
|
Raportul sexelor
|
52.
|
Datele privind raportul sexelor sunt date cantitative și, prin urmare, trebuie evaluate cu ajutorul testului exact al lui Fisher sau al altor metode adecvate. Raportul natural al sexelor pentru C. riparius este unu, adică masculii și femelele sunt în număr egal. Pentru ambele generații, datele privind raportul sexelor trebuie tratate în mod identic. Întrucât numărul maxim de chironomide per vas (20) este prea mic pentru o analiză statistică semnificativă, se va aduna numărul total de chironomide complet eclozate și vii pentru fiecare sex din toate vasele corespunzătoare unui singur tratament. Aceste date brute sunt comparate cu controlul (solvent) sau cu datele agregate referitoare la control într-un tabel de contingență 2 × 2.
|
Reproducerea
|
53.
|
Reproducerea, la fel ca fecunditatea, se calculează ca numărul de șiraguri de ouă per femelă. Mai specific, numărul total de șiraguri de ouă produs într-o cușcă de reproducere este împărțit la numărul total de femele vii și fără leziuni introduse în cușca respectivă. NOEC pentru fecunditate poate fi determinată prin metode ANOVA, de exemplu testul Williams sau testul Dunnett.
|
|
54.
|
Fertilitatea șiragurilor de ouă este utilizată pentru cuantificarea numărului de șiraguri de ouă fertile per femelă. Numărul total de șiraguri de ouă fertile produs într-o cușcă de reproducere este împărțit la numărul total de femele vii și fără leziuni, introduse în cușca respectivă. NOEC pentru fertilitate poate fi determinată prin metode ANOVA, de exemplu testul Williams sau testul Dunnett.
|
Raportul privind testul
|
55.
|
Raportul privind testul trebuie să furnizeze următoarele informații:
|
|
Substanța chimică testată:
|
—
|
natura fizică și proprietățile fizico-chimice [solubilitatea în apă, presiunea vaporilor, coeficientul de partiție log K
ow în sol (sau în sediment, dacă este disponibil), stabilitatea în apă etc.];
|
|
—
|
datele de identificare chimică (denumirea comună, denumirea chimică, formula structurală, numărul CAS etc.), inclusiv puritatea și metoda analitică de cuantificare a substanței chimie testate.
|
|
|
|
Speciile folosite pentru testare:
|
—
|
organisme de testare utilizate: specie, denumirea științifică, sursa organismelor și condițiile de creștere;
|
|
—
|
informații privind modul în care au fost manipulate masele de ouă și larvele;
|
|
—
|
informații privind manipularea adulților eclozați din prima generație cu ajutorul unui exhaustor (a se vedea apendicele 5);
|
|
—
|
vârsta organismelor de testare în momentul introducerii lor în vasele de testare pentru prima și cea de a 2-a generație.
|
|
|
|
Condiții de testare:
|
—
|
sedimentul folosit, adică sediment natural sau formulat (artificial);
|
|
—
|
sediment natural: locația de prelevare și descrierea ei, incluzând, dacă este posibil, istoricul contaminării; caracteristicile sedimentului: pH, conținutul de carbon organic, raportul C/N și granulometria (dacă este cazul).
|
|
—
|
sediment formulat: pregătirea, ingredientele și caracteristicile (conținutul de carbon organic, pH-ul, umiditatea etc. măsurate la începutul testului);
|
|
—
|
pregătirea apei de testare (dacă se folosește apă reconstituită) și caracteristici (concentrație de oxigen, pH, duritate etc. măsurate la începutul testului);
|
|
—
|
adâncimea sedimentului și a apei acoperitoare pentru vasele de testare și pentru vasele de cristalizare;
|
|
—
|
volumul apei acoperitoare și al apei interstițiale; greutatea sedimentului umed cu și fără apă interstițială pentru vasele de testare și pentru vasele de cristalizare;
|
|
—
|
vasele de testare (material și dimensiune);
|
|
—
|
vasele de cristalizare (material și dimensiune);
|
|
—
|
cuști de reproducere (material și dimensiune);
|
|
—
|
metoda de preparare a soluțiilor stoc și a concentrațiilor de testare pentru vasele de testare și pentru vasele de cristalizare;
|
|
—
|
aplicarea substanței chimice testate în vasele de testare și în vasele de cristalizare: concentrațiile de testare, numărul de replici și solvenții, dacă este necesar;
|
|
—
|
condițiile de incubare pentru vasele de testare: temperatură, ciclul și intensitatea luminii, aerare (numărul de bule pe secundă);
|
|
—
|
condițiile de incubare pentru cuștile de reproducere și pentru vasele de cristalizare: temperatură, ciclul și intensitatea luminii;
|
|
—
|
condițiile de incubare pentru șiragurile de ouă din microplăci (sau din alte vase): temperatură, ciclul și intensitatea luminii:
|
|
—
|
informații detaliate privind hrănirea, inclusiv tipul de hrană, prepararea, cantitatea și regimul de hrănire.
|
|
|
|
Rezultate:
|
—
|
valorile nominale ale concentrațiilor de testare, valorile măsurate ale concentrațiilor de testare și rezultatele tuturor analizelor pentru determinarea concentrației substanței chimice testate în vasele de testare și în vasele de cristalizare;
|
|
—
|
calitatea apei din vasele de testare și din vasele de cristalizare, și anume, pH-ul, temperatura, oxigenul dizolvat, duritatea și amoniacul;
|
|
—
|
înlocuirea apei de testare evaporate pentru vasele de testare, dacă este cazul;
|
|
—
|
numărul de chironomide, masculi și femele, eclozate per vas și pe zi pentru prima și pentru cea de a 2-a generație;
|
|
—
|
raportul sexelor chironomidelor complet eclozate și vii per tratament pentru prima și pentru cea de a 2-a generație;
|
|
—
|
numărul larvelor neeclozate ca chironomide per vas pentru prima și pentru cea de a 2-a generație;
|
|
—
|
procentul/fracție de eclozare per replică și concentrația de testare (chironomide masculi și femele agregate) pentru prima și pentru cea de a 2-a generație;
|
|
—
|
rata de dezvoltare medie a chironomidelor complet eclozate și vii per replică și rata de tratament (chironomide masculi și femele separate și agregate) pentru prima și pentru cea de a 2-a generație;
|
|
—
|
numărul de șiraguri de ouă depozitate în vasele de cristalizare per cușcă de reproducere și per zi;
|
|
—
|
caracteristicile fiecărui șirag de ouă (dimensiune, formă și fertilitate);
|
|
—
|
fecunditatea – numărul total de șiraguri de ouă per număr total de femele introduse în cușca de reproducere;
|
|
—
|
fertilitatea – numărul total de șiraguri de ouă per număr total de femele introduse în cușca de reproducere;
|
|
—
|
estimate ale parametrilor studiați care semnifică toxicitate, de exemplu ECx (și intervalele de încredere asociate), NOEC și metodele statistice utilizate pentru determinarea lor;
|
|
—
|
discutarea rezultatelor, inclusiv orice influență asupra semnificației testului rezultată din abaterile de la această metodă de testare.
|
|
|
BIBLIOGRAFIE
|
(1)
|
Chapter C.28 of this Annex, Sediment-water chironomid toxicity test using spiked water.
|
|
(2)
|
Shobanov, N.A., Kiknadze, I.I. and M.G. Butler (1999), Palearctic and Nearctic Chironomus (Camptochironomus) tentans Fabricius are different species (Diptera: Chironomidae). Entomologica Scandinavica, 30: 311-322.
|
|
(3)
|
Fleming, R. et al. (1994), Sediment Toxicity Tests for Poorly Water-Soluble Substances, Final Report to the European Commission, Report No: EC 3738. August 1994. WRc, UK.
|
|
(4)
|
SETAC (1993), Guidance Document on Sediment toxicity Tests and Bioassays for Freshwater and Marine Environments, From the WOSTA Workshop held in the Netherlands.
|
|
(5)
|
ASTM International (2009), E1706-05E01: Test Method for Measuring the Toxicity of Sediment-Associated Contaminants with Freshwater Invertebrates, In: Annual Book of ASTM Standards, Volume 11.06, Biological Effects and Environmental Fate; Biotechnology. ASTM International, West Conshohocken, PA.
|
|
(6)
|
Environment Canada (1997), Test for Growth and Survival in Sediment using Larvae of Freshwater Midges (Chironomus tentans or Chironomus riparius), Biological Test Method, Report SPE 1/RM/32, December 1997.
|
|
(7)
|
US-EPA (2000), Methods for Measuring the Toxicity and Bioaccumulation of Sediment-associated Contaminants with Freshwater Invertebrates, Second edition, EPA 600/R-99/064, March 2000, Revision to the first edition dated June 1994.
|
|
(8)
|
US-EPA/OPPTS 850.1735 (1996), Whole Sediment Acute Toxicity Invertebrates.
|
|
(9)
|
US-EPA/OPPTS 850.1790 (1996), Chironomid Sediment toxicity Test.
|
|
(10)
|
Milani, D., Day, K.E., McLeay, D.J. and R.S. Kirby (1996), Recent intra- and inter-laboratory studies related to the development and standardisation of Environment Canada's biological test methods for measuring sediment toxicity using freshwater amphipods (Hyalella azteca) and midge larvae (Chironomus riparius), Technical Report, Environment Canada, National Water Research Institute, Burlington, Ontario, Canada.
|
|
(11)
|
Norberg-King, T.J., Sibley, P.K., Burton, G.A., Ingersoll, C.G., Kemble, N.E., Ireland, S., Mount, D.R. and C.D. Rowland (2006), Interlaboratory evaluation of Hyalella azteca and Chironomus tentans short-term and long-term sediment toxicity tests, Environ. Toxicol. Chem., 25: 2662-2674.
|
|
(12)
|
Taenzler, V., Bruns, E., Dorgerloh, M., Pfeifle, V. and L. Weltje (2007), Chironomids: suitable test organisms for risk assessment investigations on the potential endocrine-disrupting properties of pesticides, Ecotoxicology, 16: 221-230.
|
|
(13)
|
Sugaya, Y. (1997), Intra-specific variations of the susceptibility of insecticides in Chironomus yoshimatsui, Jp. J. Sanit. Zool., 48: 345-350.
|
|
(14)
|
Kawai, K. (1986), Fundamental studies on chironomid allergy, I. Culture methods of some Japanese chironomids (Chironomidae, Diptera), Jp. J. Sanit. Zool., 37: 47-57.
|
|
(15)
|
Chapter C.27 of this Annex, Sediment-water chironomid toxicity test using spiked sediment.
|
|
(16)
|
OECD (2000), Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures, Environment, Health and Safety Publications, Series on Testing and Assessment No. 23, ENV/JM/MONO(2000)6, OECD, Paris.
|
|
(17)
|
Weltje, L., Rufli, H., Heimbach, F., Wheeler, J., Vervliet-Scheebaum, M. and M. Hamer (2010), The chironomid acute toxicity test: development of a new test system, Integr. Environ. Assess. Management.
|
|
(18)
|
Environment Canada. (1995), Guidance Document on Measurement of Toxicity Test Precision Using Control Sediments Spiked with a Reference Toxicant, Report EPS 1/RM/30, September 1995.
|
|
(19)
|
Oetken, M, Nentwig, G., Löffler, D, Ternes, T. and J. Oehlmann (2005), Effects of pharmaceuticals on aquatic invertebrates, Part I, The antiepileptic drug carbamazepine, Arch. Environ. Contam. Toxicol., 49: 353-361.
|
|
(20)
|
Suedel, B.C. and J.H. Rodgers (1994), Development of formulated reference sediments for freshwater and estuarine sediment testing, Environ. Toxicol. Chem., 13: 1163-1175.
|
|
(21)
|
Naylor, C. and C. Rodrigues (1995), Development of a test method for Chironomus riparius using a formulated sediment, Chemosphere, 31: 3291-3303.
|
|
(22)
|
Dunnett, C.W. (1964), A multiple comparisons procedure for comparing several treatments with a control. J. Amer. Statis. Assoc., 50: 1096-1121.
|
|
(23)
|
Dunnett, C.W. (1964), New tables for multiple comparisons with a control, Biometrics, 20: 482-491.
|
|
(24)
|
Williams, D.A. (1971), A test for differences between treatment means when several dose levels are compared with a zero dose control. Biometrics, 27: 103-117.
|
|
(25)
|
Williams, D.A. (1972), The comparison of several dose levels with a zero dose control. Biometrics, 28: 510-531.
|
|
(26)
|
Jungmann, D., Bandow, C., Gildemeister, T., Nagel, R., Preuss, T.G., Ratte, H.T., Shinn, C., Weltje, L. and H.M. Maes (2009), Chronic toxicity of fenoxycarb to the midge Chironomus riparius after exposure in sediments of different composition. J Soils Sediments, 9: 94-102.
|
|
(27)
|
Rao, J.N.K. and A.J. Scott (1992), A simple method for the analysis of clustered binary data. Biometrics, 48: 577-585.
|
|
(28)
|
Christensen, E.R. (1984), Dose-response functions in aquatic toxicity testing and the Weibull model, Water Res., 18: 213-221.
|
|
(29)
|
Bruce, R.D. and D.J. Versteeg (1992), A statistical procedure for modelling continuous toxicity data, Environ. Toxicol. Chem., 11: 1485-1494.
|
|
(30)
|
Slob, W. (2002), Dose-response modelling of continuous endpoints. Toxicol. Sci., 66: 298-312.
|
|
(31)
|
OECD (2006), Current Approaches in the Statistical Analysis of Ecotoxicity Data: a Guidance to Application, OECD Series on Testing and Assessment No. 54, 146 pp., ENV/JM/MONO(2006)18, OECD, Paris.
|
|
(32)
|
Benoit, D.A., Sibley, P.K., Juenemann, J.L. and G.T. Ankley (1997), Chironomus tentans life-cycle test: design and evaluation for use in assessing toxicity of contaminated sediments, Environ. Toxicol. Chem., 16: 1165-1176.
|
|
(33)
|
Vogt, C., Belz, D., Galluba, S., Nowak, C., Oetken, M. and J. Oehlmann (2007), Effects of cadmium and tributyltin on development and reproduction of the non-biting midge Chironomus riparius (Diptera) – baseline experiments for future multi-generation studies, J. Environ. Sci. Health Part A, 42: 1-9.
|
|
(34)
|
OECD (2010), Validation report of the Chironomid full life-cycle toxicity test, Forthcoming publication in the Series on Testing and Assessment, OECD, Paris.
|
Apendicele 1
Definiții
În cadrul acestei metode de testare se folosesc următoarele definiții:
|
|
Substanța chimică este o substanță sau un amestec.
|
|
|
Sedimentul formulat sau reconstituit, artificial sau sintetic, este un amestec de materiale utilizat pentru a simula componentele fizice ale sedimentului natural.
|
|
|
Apa acoperitoare este apa plasată peste sediment în vasul de testare.
|
|
|
Apa interstițială este apa care ocupă spațiul dintre sediment și particulele de sol.
|
|
|
Apa adiționată este apa de testare la care s-a adăugat substanța chimică testată.
|
|
|
Substanța chimică testată este orice substanță sau amestec testat utilizând această metodă de testare.
|
Apendicele 2
Recomandări pentru cultivarea Chironomus riparius
|
1.
|
Larvele de Chironomus pot fi crescute în vase de cristalizare sau în recipiente mai mari. Pe fundul unui recipient se împrăștie nisip fin de cuarț într-un strat subțire, de circa 5 – 10 mm grosime. Un substrat adecvat (este suficient un strat mai subțire, de maximum câțiva mm) s-a dovedit a fi și Kieselgur (de exemplu Merck, articolul 8117). Apoi se adaugă apă adecvată până se atinge o înălțime de câțiva cm. Nivelurile apei trebuie să fie completate în funcție de necesități pentru a înlocui apa evaporată și a preveni uscarea. Apa poate fi înlocuită, dacă este necesar. Trebuie să se asigure o aerare ușoară. Vasele în care sunt crescute larvele trebuie să fie păstrate într-o cușcă adecvată, pentru a nu permite ca adulții eclozați să scape. Cușca trebuie să fie suficient de mare pentru a permite formarea roiurilor de adulți eclozați, altfel este posibil să nu apară copulația (dimensiunea minimă este de circa 30 × 30 × 30 cm).
|
|
2.
|
Cuștile trebuie să fie păstrate la temperatura camerei sau într-o încăpere cu mediu constant, la 20 ± 2 °C, cu o perioadă de expunere la lumină de 16 ore (intensitate de circa 1 000 lux), cu 8 ore de întuneric. S-a raportat că o umiditate a aerului mai mică de 60 % umiditate relativă poate împiedica reproducerea.
|
Apa de diluție
|
3.
|
Se poate utiliza orice apă naturală sau sintetică adecvată. În mod obișnuit se folosește apă de fântână, apă de la robinet declorurată și medii artificiale (de exemplu, mediu Elendt «M4» sau «M7», a se vedea mai jos). Apa trebuie să fie aerată înainte de utilizare. Dacă este nevoie, apa de cultură poate fi reînnoită prin turnarea sau sifonarea cu atenție a apei uzate din vasele de cultură, fără să se distrugă eprubetele cu larve.
|
Hrănirea larvelor
|
4.
|
Larvele de Chironomus trebuie să fie hrănite cu hrană pentru pești sub formă de fulgi (TetraMin®, TetraPhyll® sau altă marcă similară de hrană pentru pești), în cantitate de aproximativ 250 mg pe zi pentru fiecare vas. Hrana poate fi furnizată sub formă de pulbere măcinată uscată sau sub formă de suspensie în apă: se adaugă 1 g de hrană sub formă de fulgi în 20 ml de apă de diluție și se amestecă pentru a obține un amestec omogen. Acest preparat poate fi administrat cu o rată de aproximativ 5 ml pe zi per vas. (se agită înainte de utilizare). Larvele cu vârstă mai avansată pot primi mai mult.
|
|
5.
|
Hrănirea este ajustată în funcție de calitatea apei. Dacă mediul de cultură devine «tulbure», hrănirea trebuie redusă. Adăugarea de hrană trebuie să fie atent monitorizată. Prea puțină mâncare va conduce la emigrarea larvelor spre coloana de apă, iar o cantitate prea mare de hrană va avea ca rezultat creșterea activității microbiene și concentrații reduse de oxigen. Ambele condiții pot conduce la scăderea ratelor de creștere.
|
|
6.
|
Se pot adăuga și câteva celule de alge verzi (de exemplu, Scenedesmus subspicatus, Chlorella vulgaris) atunci când se pregătesc noile vase de cultură.
|
Hrănirea adulților eclozați
|
7.
|
Unii cercetători au sugerat că se poate folosi ca hrană pentru adulții eclozați un tampon de vată îmbibat într-o soluție saturată de zaharoză.
|
Eclozare
|
8.
|
La 20 ± 2 °C, adulții vor începe să eclozeze în vasele de creștere a larvelor după aproximativ 13 – 15 zile. Masculii sunt ușor de identificat după antenele plumoase și după corpul lor fin.
|
Masele de ouă
|
9.
|
După ce adulții sunt prezenți în cușca de reproducere, toate vasele de creștere a larvelor trebuie să fie verificate de trei ori pe săptămână, pentru a observa depunerea de mase de ouă gelatinoase. Dacă acestea apar, masele de ouă trebuie să fie înlăturate cu atenție. Ele trebuie să fie transferate într-un vas mic, care conține un eșantion din apa în care au crescut. Masele de ouă sunt utilizate pentru a începe un nou vas de cultură (de exemplu, 2 – 4 mase de ouă /vas) sau sunt folosite pentru teste de toxicitate.
|
|
10.
|
Larvele în primul stadiu trebuie să eclozeze după 2 – 3 zile.
|
Pregătirea de noi vase de cultură
|
11.
|
După constituirea culturilor, se poate pregăti un nou vas de cultură larvară o dată pe săptămână sau mai puțin frecvent, în funcție de cerințele de testare, prin înlăturarea vaselor mai vechi după ce chironomidele adulte au eclozat. Cu ajutorul acestui sistem, se va asigura o cantitate regulată de adulți, cu minimum de efort.
|
Pregătirea soluțiilor de testare «M4» și «M7»
|
12.
|
Elendt (1990) a descris mediul «M4». Mediul «M7» este pregătit în același mod ca mediul «M4», cu excepția substanțelor indicate în tabelul 1 pentru care concentrațiile sunt de patru ori mai mici în cazul «M7» în raport cu «M4». Soluția de testare nu trebuie pregătită conform indicațiilor Elendt și Bias (1990) deoarece concentrațiile de NaSiO3 · 5H2O, NaNO3, KH2PO4 și K2HPO4 indicate pentru pregătirea soluțiilor stoc nu sunt adecvate.
|
Pregătirea mediului «M7»
|
13.
|
Fiecare soluție stoc (I) este preparată individual, iar din aceste soluții stoc (I) se prepară o soluție stoc combinată (II) (a se vedea tabelul 1). 50 de ml din soluția stoc combinată (II) și cantitățile din fiecare soluție stoc de macronutrienți care sunt indicate în tabelul 2 sunt adăugate până la 1 litru cu apă deionizată pentru a pregăti mediul «M7». Se prepară o soluție stoc de vitamine, prin adăugarea a trei vitamine la apa deionizată, așa cum se indică în tabelul 3, iar 0,1 ml din soluția stoc de vitamine combinată se adaugă la mediul final «M7» cu puțin timp înainte de utilizare. Soluția stoc combinată de vitamine se păstrează în stare înghețată, în mici alicote. Mediul este aerat și stabilizat.
|
Tabelul 1
Soluții stoc de microelemente pentru mediile M4 și M7
|
Soluții stoc (I)
|
Cantitate (mg) adăugată la 1 litru de apă deionizată
|
Pentru a prepara soluția stoc combinată (II): se amestecă următoarele cantități (ml) de soluții stoc (I) și se adaugă până la 1 litru cu apă deionizată
|
Concentrații finale în soluțiile de testare (mg/l)
|
|
M4
|
M7
|
M4
|
M7
|
|
H3BO3
(25)
|
57 190
|
1
|
0,25
|
2,86
|
0,715
|
|
MnCl2 · 4H2O (25)
|
7 210
|
1
|
0,25
|
0,361
|
0,09
|
|
LiCl (25)
|
6 120
|
1
|
0,25
|
0,306
|
0,077
|
|
RbCl (25)
|
1 420
|
1
|
0,25
|
0,071
|
0,018
|
|
SrCl2 · 6H2O (25)
|
3 040
|
1
|
0,25
|
0,152
|
0,038
|
|
NaBr (25)
|
320
|
1
|
0,25
|
0,016
|
0,004
|
|
Na2MoO4 · 2H2O (25)
|
1 260
|
1
|
0,25
|
0,063
|
0,016
|
|
CuCl2 · 2H2O (25)
|
335
|
1
|
0,25
|
0,017
|
0,004
|
|
ZnCl2
|
260
|
1
|
1
|
0,013
|
0,013
|
|
CaCl2 · 6H2O
|
200
|
1
|
1
|
0,010
|
0,010
|
|
KI
|
65
|
1
|
1
|
0,0033
|
0,0033
|
|
Na2SeO3
|
43,8
|
1
|
1
|
0,0022
|
0,0022
|
|
NH4VO3
|
11,5
|
1
|
1
|
0,00058
|
0,00058
|
|
Na2EDTA · 2H2O (25)
(26)
|
5 000
|
20,0
|
5
|
2,5
|
0,625
|
|
FeSO4 · 7H2O (25)
(26)
|
1 991
|
20,0
|
5
|
1
|
0,249
|
Tabelul 2
Soluții stoc de macronutrienți pentru mediile M4 și M7
|
|
Cantitate adăugată până la 1 litru cu apă deionizată
(mg)
|
Cantitate de soluții stoc de macronutrienți adăugate pentru pregătirea mediilor M4 și M7
(ml/l)
|
Concentrații finale în soluțiile de testare M4 și M7
(mg/l)
|
|
CaCl2 · 2H2O
|
293 800
|
1
|
293,8
|
|
MgSO4 · 7H2O
|
246 600
|
0,5
|
123,3
|
|
KCl
|
58 000
|
0,1
|
5,8
|
|
NaHCO3
|
64 800
|
1
|
64,8
|
|
NaSiO3 · 9H2O
|
50 000
|
0,2
|
10
|
|
NaNO3
|
2 740
|
0,1
|
0,274
|
|
KH2PO4
|
1 430
|
0,1
|
0,143
|
|
K2HPO4
|
1 840
|
0,1
|
0,184
|
Tabelul 3
Soluție stoc de vitamine pentru mediile M4 și M7
Toate cele trei soluții de vitamine sunt combinate pentru a se obține o singură soluție stoc de vitamine.
|
|
Cantitate adăugată până la 1 litru cu apă deionizată
(mg)
|
Cantitate de soluție stoc de vitamine adăugată pentru prepararea mediilor M4 și M7
(ml/l)
|
Concentrații finale în soluțiile de testare M4 și M7
(mg/l)
|
|
Clorhidrat de tiamină
|
750
|
0,1
|
0,075
|
|
Cianocobalamină (B12)
|
10
|
0,1
|
0,001
|
|
Biotină
|
7,5
|
0,1
|
0,00075
|
REFERINȚE
BBA (1995), Long-term toxicity test with Chironomus riparius: Development and validation of a new test system, Edited by M. Streloke and H. Köpp. Berlin.
Elendt, B.P. (1990), Selenium deficiency in Crustacea, Protoplasma, 154: 25-33.
Elendt, B.P. and W.-R. Bias (1990), Trace nutrient deficiency in Daphnia magna cultured in standard medium for toxicity testing, Effects on the optimisation of culture conditions on life history parameters of D. magna, Water Research, 24: 1157-1167.
Apendicele 3
Prepararea sedimentului formulat
COMPOZIȚIA SEDIMENTULUI
Compoziția sedimentului formulat trebuie să fie următoarea:
|
Constituent
|
Caracteristici
|
% din sediment, greutate uscată
|
|
Turbă
|
Mușchi de turbă (Sphagnum), cu pH cât mai apropiat posibil de valoarea 5,5 – 6, fără resturi vizibile de plante, fin măcinat (dimensiunea particulelor ≤ 1 mm) și uscat cu aer
|
4 – 5
|
|
Nisip de cuarț
|
Dimensiunea granulelor: > 50 % dintre particule trebuie să se încadreze în intervalul 50 – 200 μm
|
75 – 76
|
|
Argilă de caolinit
|
Conținut de caolinit ≥ 30 %
|
20
|
|
Carbon organic
|
Ajustat prin adăugarea de turbă și nisip
|
2 (± 0,5)
|
|
Carbonat de calciu
|
CaCO3, pulverizat, chimic pur
|
0,05 – 0,1
|
|
Apă
|
Conductivitate ≤ 10 μS/cm
|
30 – 50
|
PREGĂTIRE
Turba este uscată cu aer și măcinată într-o pulbere fină. O suspensie din cantitatea necesară de pudră de turbă în apă deionizată este preparată utilizând un dispozitiv de omogenizare performant. pH-ul acestei suspensii este ajustat la 5,5 ± 0,5 cu CaCO3. Suspensia este condiționată timp de cel puțin două zile, agitându-se ușor la 20 ± 2 °C, pentru stabilizarea pH-ului și stabilirea unei componente microbiene stabile. Se măsoară din nou pH-ul, care trebuie să fie de 6 ± 0,5. Apoi, suspensia de turbă este amestecată cu alți constituenți (nisip și argilă caolinică) și cu apă deionizată, pentru a obține un sediment omogen cu un conținut de apă în intervalul de 30–50 % din greutatea uscată a sedimentului. Se măsoară încă o dată pH-ul amestecului final și se ajustează la 6,5 până la 7,5 cu CaCO3, dacă este necesar. Se prelevează eșantioane din sediment pentru a determina greutatea uscată și conținutul de carbon organic. Apoi, înainte de utilizarea sa într-un test de toxicitate pentru chironomide, se recomandă ca sedimentul formulat să fie condiționat timp de șapte zile în aceleași condiții care predomină în testul ulterior.
DEPOZITARE
Constituenții uscați destinați preparării sedimentului artificial pot fi depozitați într-un loc uscat și răcoros, la temperatura camerei. Sedimentul formulat (umed) nu trebuie să fie depozitat înainte de utilizarea sa în test. El trebuie să fie folosit imediat după perioada de condiționare de 7 zile, cu care se încheie prepararea sa.
REFERINȚE
OECD (1984), Earthworm, Acute Toxicity Test, Test Guideline No. 207, Guidelines for the Testing of Chemicals, OECD, Paris.
Meller, M., Egeler, P., Roembke, J., Schallnass, H., Nagel, R. and B. Streit (1998), Short-term toxicity of lindane, hexachlorobenzene and copper sulfate on tubificid sludgeworms (Oligochaeta) in artificial media, Ecotox. Environ. Safety, 39: 10-20.
Apendicele 4
Caracteristicile chimice ale unei ape de diluție acceptabile
|
CONSTITUENT
|
CONCENTRAȚII
|
|
Materie particulată
|
< 20 mg/l
|
|
Carbon organic total
|
< 2 mg/l
|
|
Amoniac neionizat
|
< 1 μg/l
|
|
Duritate ca CaCO3
|
< 400 mg/l (27)
|
|
Clor rezidual
|
< 10 μg/l
|
|
Total pesticide organofosforice
|
< 50 ng/l
|
|
Total pesticide organofosforice plus bifenili policlorurați
|
< 50 ng/l
|
|
Clor organic total
|
< 25 ng/l
|
Apendicele 5
Orientări privind efectuarea testului
Exemplu de cușcă de reproducere:

|
A
|
:
|
plasă în partea superioară și cel puțin pe una dintre părțile laterale ale cuștii (dimensiunea ochiurilor de aproximativ 1 mm)
|
|
B
|
:
|
deschidere pentru introducerea adulților eclozați în interiorul cuștii de reproducere și pentru îndepărtarea maselor de ouă depuse din vasele de cristalizare (nu se indică în acest grafic)
|
|
C
|
:
|
cuști de reproducere cu dimensiuni de minimum 30 cm lungime, 30 cm înălțime și 30 cm lățime
|
Exemplu de vas de testare:

|
A
|
:
|
pipetă Pasteur pentru alimentarea cu aer a apei acoperitoare
|
|
B
|
:
|
capac din sticlă pentru prevenirea evadării chironomidelor eclozate
|
|
C
|
:
|
suprafața stratului de apă
|
|
D
|
:
|
vas de testare (pahar de laborator din sticlă de minimum 600 ml)
|
|
E
|
:
|
strat de sediment
|
Exemplu de exhaustor pentru capturarea chironomidelor adulte (săgețile indica direcția fluxului de aer):

|
A
|
:
|
eprubetă din sticlă (diametru interior de aproximativ 5 mm) conectat la o pompă cu autoamorsare
|
|
B
|
:
|
dop din cauciuc vulcanizat, perforat cu tub din sticlă (A). În interior, deschiderea tubului de sticlă (A) este acoperită cu bumbac și o plasă (dimensiunea ochiurilor de aproximativ 1 mm) pentru a preveni deteriorarea chironomidelor atunci când acestea sunt aspirate în exhaustor
|
|
C
|
:
|
recipient transparent (din plastic sau din sticlă, cu o lungime de aproximativ 15 cm) pentru chironomidele capturate
|
|
D
|
:
|
dop din cauciuc vulcanizat, perforat cu tub (E). Pentru eliberarea chironomidelor în cușca de reproducere, sonda D se eliberează din recipientul C
|
|
E
|
:
|
tub (din plastic sau din sticlă, cu un diametru interior de aproximativ 8 mm) pentru colectarea chironomidelor adulte din vas
|
Prezentare schematică a unui test care cuprinde ciclul de viață:
|
A
|
:
|
prima generație – vasele de testare car conțin un sistem sediment-apă, opt replici, 20 de larve în primul stadiu larvar per vas
|
|
B
|
:
|
patru vase de testare pentru fiecare cușcă de reproducere, A și B
|
|
C
|
:
|
cuști de reproducere (A și B) pentru formare de roiuri, împerechere și depunere de ouă
|
|
D
|
:
|
vase de cristalizare pentru depunerea șiragurilor de ouă
|
|
E
|
:
|
microplăci, câte una pentru fiecare șirag de ouă
|
|
F
|
:
|
a doua generație – vase de testare care conțin un sistem sediment-apă, opt replici, 20 de larve în primul stadiu larvar per vas
|
C.41. TEST DE DEZVOLTARE SEXUALĂ A PEȘTILOR
INTRODUCERE
|
1.
|
Prezenta metodă de testare este echivalentă cu Orientarea OCDE privind testarea (test guideline – TG) nr. 234 (2011). Ea se bazează pe o decizie din 1998 de dezvoltare a unor noi metode de testare sau de actualizare a metodelor de testare existente pentru screeningul și testarea potențialelor perturbatori endocrini. Testul de dezvoltare sexuală a peștilor (Fish Sexual Development Test – FSDT) a fost identificat ca o metodă de testare promițătoare care acoperă un stadiu de viață la pești receptiv la substanțe chimice estrogenice și androgenice. Metoda de testare a făcut obiectul unei validări interlaboratoare în perioada 2006 – 2010, prin ea fiind validate Oryzias latipes, peștele-zebră (Danio rerio) și ghidrinul (Gasterosteus aculeatus), Pimephales promelas fiind parțial validată (41)(42)(43). Acest protocol include Oryzias latipes, ghidrinul și peștele-zebră. Protocolul reprezintă, în principiu, o îmbunătățire a Orientării TG nr. 210 a OCDE Fish, Early Life Stage Toxicity Test (Pește, Test de toxicitate în primele stadii de viață) (1), în cadrul căreia expunerea se continuă până când peștii se diferențiază sexual, adică aproximativ la 60 de zile de la eclozare (days post-hatch – dph) pentru Oryzias latipes, ghidrin și peștele-zebră (perioada de expunere poate fi mai scurtă sau mai lungă pentru alte specii, care vor fi validate în viitor) și la care se adaugă parametri studiați care reflectă starea endocrină. FSDT evaluează efectele în primele stadii de viață și potențialele efecte negative ale substanțelor chimice presupuse a avea un efect de perturbare endocrină (de exemplu estrogeni, androgeni și inhibitori de steroidogeneză) asupra dezvoltării sexuale. Combinația celor doi parametri endocrini studiați principali, concentrația de vitelogenină (VTG) și raportul fenotipic între sexe permite testului să indice modul de acțiune al substanței chimice testate. Ca urmare a schimbării populațional relevante în raportul fenotipică al sexelor, FSDT poate fi utilizat pentru evaluarea pericolelor și a riscurilor. Cu toate acestea, în cazul în care testul este utilizat pentru evaluarea pericolelor sau a riscurilor, nu trebuie să se folosească ghidrinul deoarece datele de validare disponibile până în prezent au arătat că pentru această specie modificările raportului fenotipic al sexelor de către substanțele chimice testate au fost rare.
|
|
2.
|
Protocolul se bazează pe pești expuși prin intermediul apei la substanțe chimice în timpul perioadei sexuale labile în care se așteaptă ca peștele să fie mai sensibil la efectele substanțelor chimice cu efect de perturbare endocrină care interferează cu dezvoltarea sexuală. Doi parametri studiați principali sunt măsurați ca indicatori ai anomaliilor de dezvoltare cauzate de efecte endocrine, concentrația de VTG și raportul între sexe (proporția sexelor) determinate prin intermediul histologiei gonadelor. Histopatologia gonadală (evaluarea și determinarea stadiilor ovocitelor și a celulelor spermatogenetice) este opțională. În plus, sexul genetic este determinat ori de câte ori este posibil (de exemplu, pentru Oryzias latipes și ghidrin). Prezența unui marker al sexului genetic constituie un avantaj considerabil deoarece crește puterea datelor statistice referitoare la raportul sexelor și permite detectarea inversării sexului fenotipic individual. Alți parametri studiați apicali care ar trebui măsurați includ rata de eclozare, supraviețuirea, lungimea și greutatea corporală. Metoda de testare ar putea fi adaptabilă la alte specii decât cele menționate mai sus, cu condiția ca celelalte specii să fie supuse unui proces de validare echivalent celui realizat pentru Oryzias latipes, ghidrin și peștele-zebră, ca peștii de control să fie diferențiați sexual la sfârșitul testului, ca nivelurile de VTG să fie suficient de mari pentru a detecta variații semnificative determinate de substanțe chimice și ca sensibilitatea sistemului de testare să fie stabilită utilizând substanțe chimice de referință cu activitate endocrină [(anti)estrogenice, (anti)androgenice, inhibitori de aromatază etc]. În plus, orice raport sau rapoarte de validare care se referă la datele FSDT utilizând alte specii trebuie să fie revizuit(e) de către OCDE, iar rezultatele validării trebuie să fie considerate ca satisfăcătoare.
|
Considerații inițiale și limitări
|
3.
|
Vitelogenina (VTG) este produsă în mod normal de ficatul femelelor vertebrate ovipare ca răspuns la estrogenul endogen circulant (2). Este un precursor al proteinelor din vitelus și, după ce este produsă în ficat, circulă în fluxul sanguin la ovar de unde este preluată și modificată de ovocitele în dezvoltare. Sinteza VTG este foarte limitată, deși detectabilă, la peștii imaturi și la peștii adulți masculi, deoarece acestora le lipsește estrogenul circulant suficient. Cu toate acestea, ficatul este capabil să sintetizeze și să secrete VTG ca răspuns la stimularea cu estrogen exogen (3)(4)(5).
|
|
4.
|
Măsurarea VTG servește la detectarea substanțelor chimice cu moduri de acțiune estrogenice, antiestrogenice, androgenice și a substanțelor chimice care interferează cu steroidogeneza, ca de exemplu inhibitorii de aromatază. Detectarea substanțelor chimice estrogenice este posibilă prin măsurarea inducției de VTG la peștii masculi și a fost amplu documentată în literatura științifică de specialitate revizuită inter pares. Inducția de VTG a fost demonstrată și în urma expunerii la androgeni aromatizabili (6)(7). O reducere a nivelului de estrogen circulant la femele, de exemplu prin inhibarea aromatazei care transformă androgenul endogen în estrogenul natural 17β-estradiol, determină o diminuare a concentrației de VTG, care este utilizată pentru detectarea substanțelor chimice cu proprietăți de inhibare a aromatazei sau, în sens mai larg, a inhibitorilor steroidogenezei (33). Relevanța biologică a răspunsului VTG ca urmare a inhibării estrogenice/a aromatazei este stabilită și a fost amplu documentată (8)(9). Cu toate acestea, este posibil ca producția de VTG la femele să fie, de asemenea, afectată de toxicitatea generală și de modurile de acțiune toxice neendocrine.
|
|
5.
|
Mai multe metode de măsurare au fost dezvoltate și standardizate cu succes pentru utilizarea de rutină în vederea cuantificării VTG în eșantioanele de sânge, ficat, organism întreg sau omogenat din cap/coadă colectate de la pești individuali. Acesta este cazul pentru peștele-zebră, ghidrini și Oryzias latipes, precum și pentru specia parțial validată Pimephales promelas; există disponibile metode testare prin imunoadsorbție cu anticorpi marcați enzimatic (ELISA) specifice de specie, care utilizează imunochimia pentru cuantificarea VTG (5)(10)(11)(12)(13)(14)(15)(16). Pentru Oryzias latipes și peștele-zebră există o corelație bună între VTG măsurată din eșantioane de plasmă sanguină, ficat și omogenat, deși acestea din urmă tinde să arate valori ușor mai mici decât plasma (17)(18)(19). Apendicele 5 conține procedurile recomandate pentru prelevările de eșantioane efectuate în scopul analizării VTG.
|
|
6.
|
Schimbarea raportului fenotipic al sexelor (proporția sexelor) constituie un parametru studiat care reflectă inversarea sexelor. În principiu, substanțele chimice cu efect estrogenic, antiestrogenic, androgenic, antiandrogenic și de inhibare a steroidogenezei pot afecta raportul sexelor la peștii în dezvoltare (20). S-a arătat că această inversare a sexelor este parțial reversibilă în cazul peștelui-zebră (21) în urma expunerii la o substanță chimică cu efect estrogenic, în timp ce inversarea sexelor în urma expunerii la substanțe chimice cu efect androgenic este permanentă (30). Sexul este definit ca femelă, mascul, hermafrodit (ovocite și celule spermatogenetice într-o singură gonadă) sau nediferențiat, determinat la pești individuali prin examinarea histologică a gonadelor. Orientări sunt furnizate în apendicele 7 și în documentul intitulat OECD Guidance Document on the Diagnosis of Endocrine-Related Histopathology of Fish Gonads (Document OCDE de orientare privind diagnosticul histopatologiei influențate endocrin a gonadelor de pește) (22).
|
|
7.
|
Sexul genetic este examinat prin markeri genetici atunci când aceștia există la o anumită specie de pești. În ceea ce privește Oryzias latipes, genele de femele XX sau de masculi YY pot fi detectate prin metoda reacției în lanț a polimerazei (PCR) sau poate fi analizată gena domeniului DM legată de Y (DMY) (DMY negativ sau pozitiv) astfel cum se descrie în (23)(24). În ceea ce privește ghidrinul, există o metodă echivalentă metodei PCR pentru determinarea sexului genetic, descrisă în apendicele 10. În cazul în care sexul genetic poate fi legat în mod individual de sexul fenotipic, puterea testului este îmbunătățită și, prin urmare, sexul genetic trebuie determinat la specii cu markeri ai sexului genetic documentați.
|
|
8.
|
Cei doi parametri studiați endocrini principali, VTG și raportul sexelor, pot demonstra, în combinație, modul de acțiune endocrin (MOA) al substanței chimice (tabelul 1). Raportul sexelor este un biomarker relevant pentru populație (25)(26) și pentru unele moduri de acțiune bine definite, rezultatele FSDT pot fi utilizate în scopul evaluării pericolelor și a riscurilor dacă se consideră necesar de către agenția de reglementare. Aceste moduri de acțiune sunt în prezent cele cu efect estrogenic, androgenic și de inhibare a steroidogenezei.
Table 1
Reacția parametrilor endocrini studiați la diferite moduri de acțiune ale substanțelor chimice:
↑ = creștere, ↓ = scădere, — = neinvestigată
|
MOA
|
VTG ♂
|
VTG ♀
|
Raportul sexelor
|
Referințe
|
|
Agonist estrogenic slab
|
↑
|
↑
|
↑♀ sau ↑Nedif
|
(27)(40)
|
|
Agonist estrogenic puternic
|
↑
|
↑
|
↑♀ sau ↑Nedif, Nr. ♂
|
(28)(40)
|
|
Antagonist estrogenic
|
—
|
—
|
↓♀, ↑Nedif
|
(29)
|
|
Agonist androgenic
|
↓ sau —
|
↓ sau —
|
↑ ♂, Nr. ♀
|
(28)(30)
|
|
Antagonist androgenic
|
—
|
—
|
↑♀
↑Hermafrodit
|
(31)
|
|
Inhibitor al aromatazei
|
↓
|
↓
|
↓♀
|
(33)
|
|
|
9.
|
FSDT nu cuprinde stadiul de viață reproductiv al peștilor și, prin urmare, substanțele chimice care se presupune că afectează reproducerea la concentrații mai mici decât dezvoltarea sexuală trebuie să fie examinate în cadrul unui test care să cuprindă reproducerea.
|
|
10.
|
Definițiile utilizate în scopul acestei metode de testare sunt prezentate în apendicele 1.
|
|
11.
|
Testul FSDT in vivo este destinat detectării substanțelor chimice cu proprietăți androgenice și estrogenice, precum și cu proprietăți antiandrogenice, antiestrogenice și de inhibare a steroidogenezei. Fazele de validare a FSDT (1 și 2) au cuprins substanțele chimice cu proprietăți estrogenice, androgenice și de inhibare a steroidogenezei. Efectele în cadrul FSDT ale antagoniști estrogenici și androgenici sunt ilustrate în tabelul 1, dar aceste MOA sunt mai puțin documentate în prezent.
|
PRINCIPIUL TESTULUI
|
12.
|
În cadrul testului, sunt expuși pești, din ouă recent fertilizate, până la finalizarea diferențierii sexuale, la cel puțin trei concentrații ale substanței chimice testate dizolvate în apă. Testul trebuie să se desfășoare în flux continuu, cu excepția cazului în care nu este posibil din cauza disponibilității sau naturii (de exemplu, solubilitate limitată) a substanței testate. Testul începe cu introducerea ouălor nou fertilizate (înainte de divizarea discului embrionar) în camerele de testare. Încărcarea camerelor este descrisă pentru fiecare specie la punctul 27. Pentru speciile de pești validate, Oryzias latipes, ghidrinul și peștele-zebră, testul se termină la 60 dph. La terminarea testului, toți peștii sunt eutanasiați. Un eșantion biologic (plasmă sanguină, ficat sau omogenat cap/coadă) este colectată pentru analiza VTG din fiecare pește, iar partea rămasă este fixată pentru evaluarea histologică a gonadelor în vederea determinării sexul fenotipic; opțional, se poate realiza histopatologia (de exemplu determinarea stadializarea gonadelor, severitatea hermafroditismului). Se prelevează un eșantion biologic (din înotătoarea anală sau dorsală) pentru determinarea sexului genetic la specii care posedă markeri adecvați (apendicele 9 și 10).
|
|
13.
|
O prezentare generală a condițiilor de testare relevante specifice pentru speciile validate: Oryzias latipes, ghidrinul și peștele-zebră, este furnizată în apendicele 2.
|
INFORMAȚII PRIVIND SUBSTANȚA CHIMICĂ TESTATĂ
|
14.
|
Rezultatele unui test de toxicitate acută sau ale unui alt test de toxicitate pe termen scurt [de exemplu, metoda de testare C.14 (34) și Orientarea TG nr. 210 a OCDE (1)] efectuate de preferință cu speciile alese pentru acest test, trebuie să fie disponibile. Aceasta înseamnă că se cunosc solubilitatea în apă și presiunea vaporilor substanței chimice testate, precum și că există disponibilă o metodă analitică fiabilă pentru cuantificarea substanței chimice în camerele de testare, a cărei acuratețe și ale cărei limite de detecție sunt cunoscute.
|
|
15.
|
Alte informații utile includ formula structurală, puritatea substanței chimice, stabilitatea în apă și la lumină, pKa, Pow și rezultatele unui test privind ușurința biodegradabilității (metoda de testare C.4) (35).
|
Criteriile de acceptare a testului
|
16.
|
Pentru ca rezultatele testului să fie acceptabile, trebuie să îndeplinească următoarele condiții:
|
—
|
Concentrația oxigenului dizolvat trebuie să fie de cel puțin 60 % din valoarea de saturație în aer (ASV) pe toată durata testului,
|
|
—
|
Temperatura apei nu trebuie să difere cu mai mult de ± 1,5 °C între camerele de testare în niciun moment pe parcursul perioadei de expunere și trebuie să fie menținută în intervalul de temperatură specificat pentru specia testată (apendicele 2);
|
|
—
|
O metodă validată pentru analiza substanței chimice de expunere cu o limită de detecție cu mult sub cea mai mică concentrație nominală trebuie să fie disponibilă și trebuie colectate dovezi pentru a demonstra că respectivele concentrații ale substanței chimice testate în soluție au fost menținute în mod satisfăcător în intervalul de ± 20 % din valorile medii măsurate;
|
|
—
|
Supraviețuirea generală a ouălor fertilizate în controale și, dacă este relevant, în controalele cu solvent, trebuie să fie mai mare sau egală cu limitele definite în apendicele 2;
|
|
—
|
Criteriile de acceptare legate de creștere și proporțiile sexelor la terminarea testului se bazează pe date obținute din grupurile de control (controale cu solvent și apă agregate, cu excepția cazului în care sunt semnificativ diferite, când sunt utilizate doar cele cu solvent):
|
|
Oryzias latipes
|
peștele zebră
|
ghidrin
|
|
Creștere
|
Greutatea umedă a peștilor, uscați prin tamponare
|
> 150 mg
|
> 75 mg
|
> 120 mg
|
|
Lungime (lungime standard)
|
> 20 mm
|
> 14 mm
|
> 20 mm
|
|
Raportul sexelor (% masculi sau femele)
|
30 – 70 %
|
30 – 70 %
|
30 – 70 %
|
|
|
—
|
Atunci când se utilizează un solvent, acesta nu trebuie să aibă niciun efect semnificativ statistic asupra supraviețuirii și nu trebuie să producă nicio perturbare endocrină sau să aibă alte efecte adverse asupra stadiilor timpurii de viață, astfel cum se indică prin controlul cu solvent.
|
Dacă se observă o abatere de la criteriile de acceptare a testului, consecințele trebuie să fie luate în considerare în relație cu fiabilitatea datelor testului, iar aceste considerente trebuie incluse în raport.
|
DESCRIEREA METODEI DE TESTARE
Camerele de testare
|
17.
|
Poate fi utilizată orice cameră de testare din sticlă, oțel inoxidabil sau dintr-un alt material chimic inert. Dimensiunile camerelor trebuie să fie suficient de mari pentru a permite respectarea vitezei de încărcare menționate mai jos. Se recomandă poziționarea aleatorie a camerelor de testare în zona de testare. Un protocol de dispunere aleatorie a blocurilor cu fiecare concentrație prezentă în fiecare bloc este de preferat unui protocol complet aleatoriu. Camerele de testare trebuie protejate împotriva oricărei perturbări nedorite.
|
Alegerea speciei
|
18.
|
În apendicele 2 se află o listă de specii de pești recomandate. Procedura necesară includerii de noi specii este furnizată la punctul 2.
|
Menținerea peștilor parentali
|
19.
|
Detalii privind menținerea peștilor parentali în condiții satisfăcătoare pot fi găsite în Orientarea TG nr. 210 a OCDE (1). Peștii parentali trebuie hrăniți o dată sau de două ori pe zi cu hrană adecvată.
|
Manipularea embrionilor și a larvelor
|
20.
|
Inițial, embrionii și larvele pot fi expuse în cadrul unei camere principale în camere mai mici din sticlă sau din oțel inoxidabil, prevăzute cu plase laterale sau la capete pentru a permite fluxul substanței chimice testate în cameră. Curgerea neturbulentă prin aceste camere de mici dimensiuni poate fi indusă prin suspendarea lor de un braț mobil, care le deplasează în sus și în jos, dar astfel încât să mențină organismele imersate.
|
|
21.
|
Când au fost folosite recipiente, grile sau plase pentru a păstra ouăle în camera principală de testare, acestea trebuie îndepărtate după eclozarea larvelor, cu excepția plaselor care sunt păstrate pentru a împiedica peștii să scape. Dacă este necesar să se transfere larvele, acestea nu trebuie expuse la aer, iar plasele nu trebuie utilizate pentru a elibera peștii din recipientele pentru ouă. Momentul transferului variază în funcție de specie, iar transferul nu este întotdeauna necesar.
|
Apă
|
22.
|
Orice apă în care specia de testare prezintă supraviețuirea controlului cel puțin la fel de bună ca în apa descrisă în apendicele 3 este adecvată ca apă de testare. Trebuie să fie de calitate constantă pe durata testului. Pentru ca apa de diluție să nu influențeze în mod nepermis rezultatele testelor (de exemplu prin reacție cu substanța chimică testată) sau să afecteze negativ comportamentul peștilor reproducători, trebuie prelevate periodic eșantioane pentru analiză. Carbonul organic total, conductivitatea, pH-ul și materiile solide în suspensie se măsoară, de exemplu, la fiecare trei luni dacă se știe că apa de diluție este relativ constantă în calitate. Trebuie efectuate măsurători ale metalelor grele (de exemplu Cu, Pb, Zn, Hg, Cd, Ni), ale anionilor și cationilor majori (de exemplu Ca2+, Mg2+, Na+, K+, Cl–, SO4
2–) și ale pesticidelor, dacă calitatea apei este îndoielnică. Detalii privind analiza substanței chimice și colectarea apei pot fi găsite la punctul 34.
|
Soluții de testare
|
23.
|
Sistemul cu flux continuu trebuie utilizat dacă este posibil din punct de vedere practic. Pentru testele în regim de flux continuu este necesar un sistem care să disperseze și să dilueze continuu o soluție stoc de substanță chimică testată (de exemplu pompă dozatoare, diluator proporțional, sistem de saturație) pentru a asigura o serie de concentrații în camerele de testare. Debitele soluțiilor stoc și ale apei de diluție trebuie verificate periodic pe durata testului și nu trebuie să varieze cu mai mult de 10 % pe parcursul întregului test. Un debit echivalent cu cel puțin de cinci ori volumul unei camere, în 24 de ore, este considerat adecvat (1). Trebuie avut grijă să se evite folosirea de țevi din plastic sau alte materiale, dintre care unele pot conține substanțe active din punct de vedere biologic sau care ar putea absorbi substanța chimică testată.
|
|
24.
|
Soluția stoc se prepară de preferință, fără folosirea de solvenți, prin simpla amestecare sau agitare a substanței chimice testate în apa de diluție utilizând mijloace mecanice (de exemplu, un agitator sau ultrasunete). În cazul substanțelor chimice care sunt dificil de dizolvat în apă, trebuie urmate procedurile descrise în documentul OECD Guidance Document on aquatic toxicity testing of difficult substances and mixtures should be followed (Document OCDE de orientare privind testarea toxicității acvatice a substanțelor și amestecurilor dificile) (36). În unele cazuri, folosirea solvenților trebuie evitată, însă aceasta poate fi necesară în unele cazuri pentru a realiza o soluție stoc cu concentrație corespunzătoare. Exemple de solvenți corespunzători sunt oferite în referința (36).
|
|
25.
|
Condițiile de testare semistatice trebuie evitate, cu excepția cazurilor când este furnizată o argumentație privind motivele imperioase asociate cu substanța chimică testată (de exemplu, stabilitatea, disponibilitatea limitată, costul ridicat sau pericolul). Pentru tehnicile semistatice, pot fi urmate două proceduri de reînnoire diferite. Fie sunt preparate noi soluții de testare în camere curate, iar ouăle și larvele care au supraviețuit sunt transferate cu grijă în noile camere, fie organismele de testare sunt reținute în camerele de testare în timp ce o proporție (cel puțin două treimi) din apa de testare este schimbată zilnic.
|
PROCEDURA
Condiții de expunere
Colectarea ouălor și durata
|
26.
|
Pentru evitarea rezultatelor incorecte din cauze genetice, ouăle sunt colectate de la un minimum trei cupluri sau grupuri reproducătoare, amestecate și selectate în mod aleatoriu pentru a începe testul. Pentru ghidrin, a se vedea descrierea fertilizării artificiale din apendicele 11. Testul ar trebui să înceapă cât mai curând posibil după ce ouăle au fost fertilizate, embrionii fiind de preferință scufundați în soluțiile de testare înainte de începerea divizării discului embrionar sau cât mai aproape posibil după această etapă și nu mai târziu de 12 ore de la fertilizare. Testul ar trebui să continue până la finalizarea diferențierii sexuale în grupul de control (60 dph pentru Oryzias latipes, ghidrin și peștele-zebră).
|
Încărcare
|
27.
|
Numărul de ouă fertilizate la începutul testului trebuie să fie de cel puțin 120 per concentrație împărțite între minimum 4 replici (este acceptată alocarea radicalică la control). Ouăle trebuie să fie distribuite în mod aleatoriu (prin utilizarea tabelelor statistice pentru procedura aleatorie) între tratamente. Viteza de încărcare (pentru definiție, a se vedea apendicele 1) trebuie să fie suficient de mică pentru ca o concentrație de oxigen dizolvat de cel puțin 60 % din ASV să poată fi menținută fără aerarea directă a camerelor. Pentru testele în flux continuu este recomandată o viteză de încărcare care să nu depășească 0,5 g/l în 24 de ore și 5 g/l de soluție în orice moment. Nu mai târziu de 28 zile de la fertilizare numărul de pești per replică trebuie redistribuit, astfel încât fiecare replică să conțină un număr egal de pești, în măsura în care este posibil. Dacă survine mortalitate asociată expunerii, numărul de replici trebuie redus în mod corespunzător, astfel încât densitatea peștilor între nivelurile de tratament să se mențină egală, în măsura în care este posibil.
|
Lumina și temperatura
|
28.
|
Perioada de expunere la lumină și temperatura apei trebuie să fie adecvate pentru specia testată (a se vedea apendicele 2 pentru condițiile experimentale pentru FSDT).
|
Hrănire
|
29.
|
Hrana și hrănirea sunt critice, și este esențial administrarea unei hrane corecte pentru fiecare etapă la intervale adecvate de timp și la un nivel suficient pentru a susține creșterea normală. Hrănirea ar trebui să se realizeze ad libitum minimalizând surplusul. Pentru a obține o viteză de creștere suficientă, peștii trebui hrăniți cel puțin de două ori pe zi (se acceptă o dată pe zi în weekend), cu o diferență de cel puțin trei ore între fiecare administrare de hrană. Surplusul de hrană și excrementele trebuie îndepărtate, după necesități, pentru a evita acumularea de deșeuri. Pe măsură ce se dobândește experiență, hrănirea și regimurile de hrănire sunt în permanență perfecționate pentru a îmbunătăți supraviețuire și pentru a optimiza creșterea. Prin urmare, regimul propus ar trebui confirmat de experți recunoscuți. Hrănirea trebuie oprită cu 24 de ore înainte de finalizarea testului. Exemple de hrană adecvată sunt prezentate în apendicele 2 [a se vedea de asemenea OECD Fish Testing Framework (39)]
|
Concentrațiile testate
|
30.
|
Substanțele chimice testate trebuie spațiate astfel cum se descrie în apendicele 4. Trebuie utilizate cel puțin trei concentrații de testare în cel puțin patru replici. La alegerea intervalului de concentrații de testare trebuie luată în considerare curba reprezentând LC50 în funcție de perioada de expunere rezultată din studiile de toxicitate acută. Dacă datele urmează să fie folosite pentru evaluarea riscurilor, se recomandă cinci concentrații de testare.
|
|
31.
|
Concentrațiile de substanță chimică mai mari de 10 % din concentrația acută la adulți LC50 sau 10 mg/l, oricare este mai mică, nu trebuie să fie testate. Concentrația de testare maximă trebuie să fie de 10 % din LC50 pentru larve/exemplare tinere.
|
Controale
|
32.
|
Un control cu apă de diluție (≥ 4 replici) și, dacă este relevant, un control cu solvent (≥ 4 replici) trebuie utilizate în plus față concentrațiile de testare. Numai solvenții care au fost analizați și s-a demonstrat că nu au nicio influență statistic semnificativă asupra parametrilor studiați trebuie să fie utilizați în testare.
|
|
33.
|
În cazul în care se folosește un solvent, concentrația sa finală nu trebuie să fie mai mare de 0,1 ml/l (36) și trebuie să aibă aceeași concentrație în toate camerele de testare, cu excepția controlului cu apă de diluție. Cu toate acestea, trebuie depuse eforturi pentru a evita utilizarea de astfel de solvenți sau pentru a menține concentrațiile solventului la o valoare minimă.
|
Frecvența determinărilor și măsurătorilor analitice
|
34.
|
Analiza chimică a substanței chimice testate trebuie efectuată înainte de începerea testului pentru a verifica respectarea criteriile de acceptanță. Toate replicile trebuie analizate individual la începutul și la terminarea testului. O replică per concentrație de testare trebuie analizată cel puțin o dată pe săptămână pe durata testului, făcând schimbări sistematice între replici (1,2,3,4,1,2…). În cazul în care eșantioanele sunt depozitate pentru a fi analizate ulterior, metoda de depozitare a eșantioanelor trebuie să fie validată în prealabil. Eșantioanele trebuie filtrate (de exemplu, utilizând un filtru cu pori de 0,45 μm) sau centrifugate pentru a se asigura că determinările sunt realizate pe substanța chimică din soluția veritabilă.
|
|
35.
|
Pe durata testării, oxigenul dizolvat, pH-ul, duritatea totală, conductivitate, salinitatea (dacă este relevantă) și temperatura trebuie să fie măsurate în toate camerele de testare. Ca o condiție minimă, oxigenul dizolvat, salinitatea (dacă este relevantă) și temperatura trebuie să fie măsurate săptămânal, iar pH-ul, conductivitatea și duritatea la începutul și la sfârșitul testului. De preferință, temperatura trebuie să fie monitorizată continuu cel puțin într-una dintre camerele de testare.
|
|
36.
|
Rezultatele trebuie să se bazeze pe concentrațiile măsurate. Cu toate acestea, în cazul în care concentrația substanței chimice testate în soluție a fost menținută în mod satisfăcător pe tot parcursul testului într-un interval de ± 20 % din concentrația nominală, rezultatele pot fi bazate fie pe valorile nominale, fie pe cele măsurate.
|
Observații și măsurători
Stadiul dezvoltării embrionare
|
37.
|
Expunerea trebuie să înceapă imediat ce este posibil după fertilizare și înainte de începerea divizării discului embrionar și nu mai târziu de 12 ore de la fertilizare pentru a asigura expunerea pe durata stadiului de dezvoltare embrionară timpurie.
|
Eclozarea și supraviețuirea
|
38.
|
Observațiile referitoare la eclozare și supraviețuire trebuie să fie făcute cel puțin o dată pe zi și numărul ouălor eclozate și al supraviețuitorilor trebuie înregistrat. Embrionii, larvele și exemplarele tinere de pești morți trebuie îndepărtate imediat după ce au fost observate întrucât se pot descompune rapid și pot fi dezintegrate prin acțiunile altor pești. La îndepărtarea exemplarelor moarte trebuie să se manifeste o grijă extremă pentru a nu lovi sau leza fizic ouăle/larvele din vecinătate, acestea fiind extrem de delicate și de sensibile. Simptomele care indică moartea variază în funcție de stadiul de viață:
|
—
|
pentru ouă: în special în stadiile timpurii, o pierdere accentuată a translucidității și schimbarea colorației, provocată de coagularea și/sau precipitarea proteinelor, conducând la un aspect alb-opac;
|
|
—
|
pentru larve și exemplarele tinere de pești: imobilitatea și/sau absența mișcărilor respiratorii și/sau absența bătăilor inimii și/sau colorația alb-opacă a sistemului nervos central și/sau absența reacției la stimuli mecanici.
|
|
Aspectul anormal
|
39.
|
Numărul de larve sau de pești care prezintă anomalii legate de forma corpului trebuie înregistrat, iar aspectul și natura anomaliei trebuie descrise. Trebuie remarcat că embrionii și larve anormale apar în mod natural și numărul lor poate reprezenta câteva procente în loturile de control ale unor specii. Animalele anormale nu trebuie îndepărtate din camerele de testare decât atunci când sunt moarte. Cu toate acestea, în conformitate cu Directiva 2010/63/UE a Parlamentului European și a Consiliului din 22 septembrie 2010 privind protecția animalelor utilizate în scopuri științifice, dacă anomaliile duc la durere, suferință și stres sau vătămări de durată, iar moartea poate fi prezisă în mod fiabil, animalele trebuie anesteziate și eutanasiate în conformitate cu descrierea de la punctul 44 și considerate a contribui la mortalitate în analiza datelor.
|
Comportamentul anormal
|
40.
|
Anomaliile, de exemplu hiperventilarea, înotul necoordonat, imobilitatea sau hrănirea atipice trebuie înregistrate la capitolul aspect.
|
Greutate
|
41.
|
La sfârșitul testului, toți peștii supraviețuitori trebuie eutanasiați (anesteziați dacă trebuie prelevate de eșantioane de sânge), iar greutatea umedă individuală (uscare prin tamponare) trebuie măsurată.
|
Lungime
|
42.
|
La sfârșitul testului, lungimile individuale (lungimea standard) trebuie măsurate.
|
|
43.
|
Aceste observații vor face ca o parte sau toate datele următoare să fie disponibile pentru raportare.
|
—
|
numărul de pești sănătoși la sfârșitul testului;
|
|
—
|
timpul până la începerea eclozării și până la sfârșitul eclozării;
|
|
—
|
lungimea și greutatea animalelor supraviețuitoare;
|
|
—
|
numărul larvelor deformate;
|
|
—
|
numărul peștilor care prezintă un comportament anormal.
|
|
Eșantionarea peștilor
|
44.
|
Eșantionarea peștilor se realizează la terminarea testului. Peștii eșantionați trebuie eutanasiați cu, de exemplu, MS-222 (100 – 500 mg per l tamponat cu 200 mg NaHCO3 per l) sau FA-100 (4-alil-2-metoxifenol: eugenol) și măsurați și cântăriți individual ca greutate umedă (uscare prin tamponare) sau anesteziați dacă un eșantion de sânge trebuie prelevat (a se vedea punctul 49).
|
Selectarea pentru analiza VTG și determinarea sexului prin evaluarea histologică
|
45.
|
Toți peștii trebuie eșantionați și pregătiți pentru analiza sexului și a VTG. Toți peștii trebuie analizați histologic în vederea determinării sexului. Pentru măsurarea VTG, se acceptă un subeșantion de cel puțin 16 pești din fiecare replică. Mai mulți pești trebuie analizați pentru a determina VTG dacă rezultatele obținute în urma subeșantionării sunt neclare.
|
|
46.
|
Procedura de eșantionare pentru VTG și determinarea sexului depinde de metoda de analiză a VTG:
|
Metoda cu omogenat cap/coadă pentru analiza VTG
|
47.
|
Peștele este eutanasiat. Capul și coada fiecărui pește se separă de corpul peștelui prin incizii imediat înapoia înotătoarelor pectorale și imediat înaintea înotătoarei dorsale, cu ajutorul unui bisturiu (a se vedea figura 1). Capul și coada fiecărui pește sunt comasate, cântărite și numerotate individual, congelate în azot lichid și depozitate la – 70° sau mai puțin, pentru analiza VTG. Corpul peștelui este numerotat și fixat într-un fixativ adecvat pentru evaluarea histologică (22). Prin utilizarea acestei metode sunt evaluate VTG și histopatologia pentru fiecare individ și o posibilă modificare a nivelului VTG poate fi astfel corelată cu sexul fenotipic al peștilor sau cu sexul genetic (Oryzias latipes și ghidrin) al peștilor. Pentru informații suplimentare a se vedea orientările privind omogenizarea (apendicele 5) și orientările privind cuantificarea VTG (apendicele 6).
|
Metoda cu omogenat din ficat pentru analiza VTG
|
48.
|
Peștele este eutanasiat. Ficatul este excizat și depozita la o temperatură de – 70 °C sau mai mică. Procedurile recomandate pentru excizia ficatului și pretratarea sunt disponibile în Orientarea TG nr. 229 a OCDE (37) sau în capitolul C.37 din prezenta anexă (38). Ficații sunt apoi omogenizați individual, astfel cum se descrie în Orientarea TG nr. 229 a OCDE sau în capitolul C.37 din prezenta anexă. Supernatantul colectat este folosit pentru măsurarea VTG cu o tehnică ELISA omoloagă [a se vedea apendicele 6 pentru un exemplu de cuantificare la peștele-zebră sau Orientarea TG nr. 229 a OCDE (37) pentru Oryzias latipes]. Pe baza acestei metode, este posibil, de asemenea, să se obțină date individuale privind peștii atât în ceea ce privește VTG, cât și în ceea ce privește histologia gonadelor.
|
Metoda cu plasmă sanguină pentru analiza VTG
|
49.
|
Sângele este colectat de la peștii anesteziați prin puncție cardiacă, din venă caudală sau prin tăierea cozii și este centrifugat la 4 °C pentru colectarea de plasmă. Plasma este depozitată la maximum – 70 °C, până la utilizare. Peștele întreg este eutanasiat și fixat pentru histologie. Atât eșantioanele de plasmă, cât și peștii, sunt numerotați individual pentru a corela nivelurile de VTG cu sexul peștelui.
Figura 1
Modul de incizare a unui pește pentru măsurarea VTG în omogenat din cap/coadă și evaluarea histologică a secțiunii mijlocii.

|
Determinarea sexului genetic
|
50.
|
Un eșantion biologic pentru determinarea sexului genetic este prelevat din pești aparținând speciilor care posedă markeri corespunzători. Pentru Oryzias latipes, se colectează înotătoarea anală sau înotătoarea dorsală. O descriere detaliată este furnizată în apendicele 9 incluzând prelevarea de eșantioane de țesut și determinarea sexului printr-o metodă PCR. De asemenea, pentru ghidrin, o descriere a prelevării de țesut și a determinării sexului prin metoda PCR este furnizată în apendicele 10.
|
Măsurarea VTG
|
51.
|
Măsurarea VTG trebuie să se bazeze pe o metodă cantitativă, validată din punct de vedere analitic. Informațiile trebuie să fie disponibile pe baza variabilității intra- și interteste a metodei utilizate într-un anumit laborator. Sursa variabilității intra- și interlaboratoare este (cel mai probabil) bazată pe diferitele stadii de dezvoltare a populației de pești. Luând în considerare variabilitatea măsurării VTG, NOEC bazate doar pe acest parametru studiat trebuie tratate cu multă atenție. Sunt disponibile diferite metode pentru evaluarea producerii de VTG în speciile de pești avute în vedere în acest test. O tehnică de măsurare care este relativ sensibilă și specifică este determinarea concentrațiilor de proteine prin intermediul unui test de imunoadsorbție cu anticorpi marcați enzimatic (ELISA). Anticorpi omologi (formați împotriva VTG de la aceeași specie) și cele mai importante standarde omoloage trebuie utilizate.
|
Determinarea sexului
|
52.
|
În funcție de procedura de eșantionare a VTG, întregul pește sau secțiunea mijlocie rămasă a fiecărui pește se plasează într-o casetă de procesare etichetată în prealabil și fixată într-un fixator corespunzător pentru determinarea histologică a sexului (opțional și pentru evaluare stadializării gonadale). Orientări privind fixarea și integrarea sunt furnizate în apendicele 7, precum și în documentul intitulat OECD Guidance Document on the Diagnosis of Endocrine-Related Histopathology of Fish Gonads (Document OCDE de orientare privind diagnosticul histopatologiei influențate endocrin a gonadelor de pește) (22). După procesare, peștele este integrat în blocuri de parafină. Indivizii trebuie plasați în blocurile de parafină în poziție longitudinală. Cel puțin șase secțiuni longitudinale (cu o grosime de 3 – 5 μm) într-un plan frontal incluzând țesut gonadal de la ambele gonade sunt realizate pentru fiecare individ. Intervalul dintre aceste secțiuni trebuie să fie de aproximativ 50 μm pentru masculi și de 250 μm pentru femele. Totuși, având în vedere că fiecare bloc va conține adesea masculi și femele (dacă în fiecare bloc sunt integrați mai mulți indivizi), intervalul dintre secțiunile acestor blocuri trebuie să fie de aproximativ 50 μm până la obținerea a cel puțin șase secțiuni ale gonadelor pentru fiecare mascul. Prin urmare, intervalul dintre secțiuni poate fi crescut până la aproximativ 250 μm pentru femele. Secțiunile sunt colorate cu hematoxilină și eozină și examinate la microscop optic cu o atenție deosebită acordată sexului (mascul, femelă, hermafrodit sau exemplar nediferențiat). Hermafrodit înseamnă prezența mai multor ovocite în testicul per șase secțiuni analizate sau celule spermatogenetice (da/nu) în ovare. Histopatologia și stadializarea ovarelor și a testiculelor este opțională, însă dacă sunt investigate, rezultatele trebuie analizate statistic și raportate. Trebuie remarcat faptul că unora dintre speciile de pești le lipsește în mod natural o pereche de gonade complet dezvoltate și poate fi prezentă doar o singură gonadă (de exemplu Oryzias latipesși, ocazional, peștele-zebră). Toate aceste observațiile trebuie înregistrate.
|
|
53.
|
Determinarea sexului genetic pentru exemplarele de Oryzias latipes se bazează pe prezența sau pe absența genei care determină sexul masculin la Oryzias latipes, DMY, care este situată pe cromozomul Y. Sexul genotipic al Oryzias latipes poate fi identificat prin secvențierea genei DMY din ADN-ul extras din, de exemplu, o bucată de înotătoare anală sau dorsală. Prezența DMY indică un exemplar XY (mascul) indiferent de fenotip, în timp ce absența DMY indică un exemplar XX (femelă), indiferent de fenotip (23). Orientări privind pregătirea țesutului și metoda PCR sunt furnizate în apendicele 9. Determinarea sexului genetic în exemplarele de ghidrin se realizează, de asemenea, printr-o metodă PCR, descrisă în apendicele 10.
|
|
54.
|
Apariția de exemplare hermafrodite (pentru definiție, a se vedea apendicele 1) trebuie înregistrată.
|
Caracteristici sexuale secundare
|
55.
|
Caracteristicile sexuale secundare se află sub controlul endocrin la specii precum Oryzias latipes; prin urmare, dacă este posibil, observațiile privind aspectul fizic al peștelui trebuie să fie efectuate la sfârșitul expunerii. În ceea ce privește Oryzias latipes, formarea papilară a părții posterioare a înotătoarei anale la femele este sensibilă la androgen. Capitolul C. 37 din prezenta anexă (38) furnizează fotografii relevante ale caracteristicilor sexuale secundare masculine și ale femelelor androgenizate.
|
DATE ȘI RAPORTARE
Tratamentul rezultatelor
|
56.
|
Este important ca cel mai puternic test statistic valid să determine parametrul studiat. Replica este unitatea experimentală, însă variabilitatea între replici trebuie inclusă în testarea statistică O organigramă a deciziilor este disponibilă în apendicele 8 pentru a ajuta cu testul statistic cel mai potrivit pentru a fi utilizat pe baza caracteristicilor datelor obținute în test. Nivelul de semnificație statistică este de 0,05 pentru toți parametri studiați incluși.
|
Proporțiile sexelor și sexul genetic
|
57.
|
Proporțiile sexelor ar trebui să fie analizate din punctul de vedere al efectului semnificativ (metoda NOEC/LOEC) al expunerii prin Jonckheere-Terpstra (testul Trend), în cazul în care există o relație doză-răspuns monotonă. Dacă se constată absența monotonicității, trebuie aplicat un teste pe perechi: Dacă se poate obține normalitate și varianță omogenă se utilizează testul Dunnett. Dacă este prezentă o varianță eterogenă, se utilizează testul Tamhane-Dunnett. Altfel, se utilizează testul exact Mann-Whitney cu ajustare Bonferroni-Holm. O organigramă care descrie statistica proporțiilor sexelor este furnizată în apendicele 8. Proporțiile sexelor trebuie prezentate în tabele ca proporții de concentrații ± SD pentru masculi, femele, hermafrodiți și exemplare nediferențiate. Semnificația statistică trebuie evidențiată. În raportul de validare a fazei 2 a FSDT sunt prezentate exemple (42). Sexul genetic trebuie raportat ca procent de inversări ale sexului fenotipic al masculilor, femelelor, hermafrodiților și exemplarelor nediferențiate.
|
Concentrațiile VTG
|
58.
|
Concentrațiile VTG trebuie analizate din punctul de vedere al efectului semnificativ (metoda NOEC/LOEC) al expunerii. Testul Dunnett este preferabil testului t cu corecție Bonferroni. În cazul aplicării unei corecții Bonferroni, se recomandă corecția Bonferroni-Holm. Trebuie realizată o ajustare pentru transformarea logaritmică a VTG pentru a obține normalitate și omogenitatea varianței. Apoi, dacă relația concentrație-răspuns este compatibilă cu monotonicitatea, se preferă testul Jonckheere Terpstra față de oricare dintre cele de mai sus. În cazul în care sunt utilizate teste t sau testul Dunnett, nu este necesară efectuarea unui test F de semnificație ANOVA pentru a continua. Pentru detalii, a se vedea organigrama din apendicele 8. Rezultatele trebuie raportate în tabele ca medii de concentrații ± SD separat pentru masculi, femele, hermafrodiți și exemplarele nediferențiate. Semnificativitatea statistică pentru femelele fenotipice și masculii fenotipici trebuie evidențiată. În raportul de validare a fazei 2 a FSDT sunt prezentate exemple (42).
|
Concentrațiile efective ale substanței chimice testate
|
59.
|
Concentrațiile efective din cameră ale substanței chimice testate trebuie analizate cu frecvențele descrise la punctul 34. Rezultatele trebuie raportate în tabele sub formă de concentrații medii ± SD per replică, precum și per concentrație, împreună cu informații privind numărul de eșantioane și cu valorile aberante pentru concentrația medie de tratament ± 20 % evidențiată. Exemple pot fi găsite în raportul de validare a fazei 2 a FSDT (42).
|
Interpretarea rezultatelor
|
60.
|
Rezultatele testului se interpretează cu precauție atunci când concentrațiile măsurate ale substanței chimice testate apar la niveluri apropiate de limitele de detecție ale metodei analitice.
|
Raportul privind testul
|
61.
|
Raportul privind testul trebuie să conțină următoarele informații:
|
|
Substanța chimică testată
|
—
|
Proprietățile fizico-chimice relevante; datele de identificare chimică, inclusiv puritatea și metoda analitică pentru cuantificare a substanței chimice testate.
|
|
|
|
Condițiile de testare
|
—
|
Procedura de testare utilizată (de exemplu cu flux continuu, semistatică/reînnoire); protocolul de testare inclusiv concentrațiile de testare, metoda de preparare a soluțiilor stoc (într-o anexă), frecvența de reînnoire (dacă se utilizează, trebuie indicat agentul de solubilizare și concentrația acestuia);
|
|
—
|
Concentrațiile de testare nominale, mediile valorilor măsurate și abaterile lor standard în camerele de testare și metoda prin care acestea au fost obținute (metoda de analiză utilizată trebuie prezentată într-o anexă); dovada că măsurătorile se referă la concentrațiile de substanței chimice testate în soluție veritabilă;
|
|
—
|
Calitatea apei în camerele de testare: pH-ul, duritatea, temperatura și concentrația de oxigen dizolvat;
|
|
—
|
Informații detaliate privind hrănirea [de exemplu, tipul (tipurile) de hrană, sursa, cantitatea furnizată, frecvența și analizele contaminanților (de exemplu, PCBs, PAHs și pesticide organoclorurate), dacă sunt relevante].
|
|
|
|
Rezultate
|
—
|
Dovada că controalele au îndeplinit criteriile de validitate: datele privind rata de eclozare trebuie prezentate în tabele ca procente per replică și per concentrație. Valorile aberante din criteriile de acceptanță (în controale) trebuie evidențiate. Supraviețuirea trebuie prezentată ca procent per replică și per concentrație. Valorile aberante din criteriile de valabilitate (în controale) trebuie evidențiate;
|
|
—
|
Indicarea clară a rezultatelor obținute privind diferiții parametri studiați observați: supraviețuire embrionilor și succesul eclozării; anomalii externe; lungime și greutate; măsurători ale VTG (ng/g omogenat, ng/ml plasmă sau ng/mg ficat); histologia gonadelor, raportul sexelor, datele privind sexul genetic; incidența reacțiilor neobișnuite per pește și orice efect vizibil produs de substanța chimică testată.
|
|
|
|
62.
|
Rezultatele trebuie prezentate ca valori medii ± deviație standard (standard deviation – SD) sau eroare standard (standard error – SE). Statisticile trebuie raportate minimum ca NOEC și LOEC și intervale de încredere. Organigrama statistică (apendicele 8) trebuie urmată.
|
BIBLIOGRAFIE
|
(1)
|
OECD (1992), Fish, Early Life Stage Toxicity Test, Test Guideline No. 210, Guidelines for the Testing of Chemicals, OECD, Paris.
|
|
(2)
|
Jobling, S., D. Sheahan, J.A. Osborne, P. Matthiessen, and J.P. Sumpter, 1996, «Inhibition of testicular growth in rainbow trout (Oncorhynchus mykiss) exposed to estrogenic alkylphenolic chemicals», Environmental Toxicology and Chemistry 15, pp. 194-202.
|
|
(3)
|
Sumpter, J.P. and S. Jobling, 1995, «Vitellogenesis As A Biomarker for Estrogenic Contamination of the Aquatic Environment», Environmental Health Perspectives 103, pp. 173-178.
|
|
(4)
|
Tyler, C.R., R.van Aerle, T.H. Hutchinson, S. Maddix, and H. Trip (1999), «An in vivo testing system for endocrine disruptors in fish early life stages using induction of vitellogenin», Environmental Toxicology and Chemistry 18, pp. 337-347.
|
|
(5)
|
Holbech, H., L. Andersen, G.I. Petersen, B. Korsgaard, K.L. Pedersen, and P. Bjerregaard (2001a), «Development of an ELISA for vitellogenin in whole body homogenate of zebrafish (Danio rerio)», Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 130, pp. 119-131.
|
|
(6)
|
Andersen, L., P. Bjerregaard, and B. Korsgaard ( 2003), «Vitellogenin induction and brain aromatase activity in adult male and female zebrafish exposed to endocrine disrupters», Fish Physiology and Biochemistry 28, pp. 319-321.
|
|
(7)
|
Orn, S., H. Holbech, T.H. Madsen, L. Norrgren, and G.I. Petersen (2003), «Gonad development and vitellogenin production in zebrafish (Danio rerio) exposed to ethinylestradiol and methyltestosterone», Aquatic Toxicology 65, pp. 397-411.
|
|
(8)
|
Panter, G.H., T.H. Hutchinson, R. Lange, C.M. Lye, J.P. Sumpter, M. Zerulla, and C.R. Tyler (2002), «Utility of a juvenile fathead minnow screening assay for detecting (anti-)estrogenic substances», Environmental Toxicology and Chemistry 21, pp. 319-326.
|
|
(9)
|
Sun, L.W., J.M. Zha, P.A. Spear, and Z.J. Wang (2007), «Toxicity of the aromatase inhibitor letrozole to Japanese medaka (Oryzias latipes) eggs, larvae and breeding adults», Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 145, pp. 533-541.
|
|
(10)
|
Parks, L.G., A.O. Cheek, N.D. Denslow, S.A. Heppell, J.A. McLachlan, G.A. LeBlanc, and C.V.Sullivan (1999), «Fathead minnow (Pimephales promelas) vitellogenin: purification, characterization and quantitative immunoassay for the detection of estrogenic compounds», Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 123, pp. 113-125.
|
|
(11)
|
Brion, F., B.M. Nilsen, J.K. Eidem, A. Goksoyr, and J.M. Porcher (2002), «Development and validation of an enzyme-linked immunosorbent assay to measure vitellogenin in the zebrafish (Danio rerio)», Environmental Toxicology and Chemistry 21, pp. 1699-1708.
|
|
(12)
|
Nishi, K., M. Chikae, Y. Hatano, H. Mizukami, M. Yamashita, R. Sakakibara, and E. Tamiya (2002), «Development and application of a monoclonal antibody-based sandwich ELISA for quantification of Japanese medaka (Oryzias latipes) vitellogenin», Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 132, pp. 161-169.
|
|
(13)
|
Hahlbeck, E., I. Katsiadaki, I. Mayer, M. Adolfsson-Erici, J. James, and B.E. Bengtsson (2004), «The juvenile three-spined stickleback (Gasterosteus aculeatus L.) as a model organism for endocrine disruption – II – kidney hypertrophy, vitellogenin and spiggin induction», Aquatic Toxicology 70, pp. 311-326.
|
|
(14)
|
Tatarazako, N., M. Koshio, H. Hori, M. Morita, and T. Iguchi (2004), «Validation of an enzyme-linked immunosorbent assay method for vitellogenin in the medaka», Journal of Health Science 50, pp. 301-308.
|
|
(15)
|
Eidem, J.K., H. Kleivdal, K. Kroll, N. Denslow, R. van Aerle, C. Tyler, G. Panter, T. Hutchinson, and A. Goksoyr (2006), «Development and validation of a direct homologous quantitative sandwich ELISA for fathead minnow (Pimephales promelas) vitellogenin. Aquatic Toxicology», 78, pp. 202-206.
|
|
(16)
|
Jensen, K.M. and G.T. Ankley (2006), «Evaluation of a commercial kit for measuring vitellogenin in the fathead minnow (Pimephales promelas)», Ecotoxicology and Environmental Safety 64, pp. 101-105.
|
|
(17)
|
Holbech, H., Petersen, G. I., Norman, A., Örn, S, Norrgren, L., and Bjerregaard, P (2001b), «Suitability of zebrafish as test organism for detection of endocrine disrupting chemicals. Comparison of vitellogenin in plasma and whole body homogenate from zebrafish (Danio rerio) and rainbow trout (Oncorhynchus mykiss)», Nordic Council of Ministers, TemaNord 2001:597, pp. 48-51.
|
|
(18)
|
Nilsen, B.M., K. Berg, J.K. Eidem, S.I. Kristiansen, F. Brion, J.M. Porcher, and A. Goksoyr (2004), «Development of quantitative vitellogenin-ELISAs for fish test species used in endocrine disruptor screening», Analytical and Bioanalytical Chemistry 378, pp. 621-633.
|
|
(19)
|
Orn, S., S. Yamani, and L. Norrgren (2006), «Comparison of vitellogenin induction, sex ratio, and gonad morphology between zebrafish and Japanese medaka after exposure to 17 alpha-ethinylestradiol and 17 beta-trenbolone», Archives of Environmental Contamination and Toxicology 51, pp. 237-243.
|
|
(20)
|
Scholz, S. and N. Kluver (2009), «Effects of Endocrine Disrupters on Sexual, Gonadal Development in Fish, Sexual Development 3», pp. 136-151.
|
|
(21)
|
Fenske, M., G. Maack, C. Schafers, and H. Segner (2005), «An environmentally relevant concentration of estrogen induces arrest of male gonad development in zebrafish, Danio rerio», Environmental Toxicology and Chemistry 24, pp. 1088-1098.
|
|
(22)
|
OECD (2010), Guidance Document on the Diagnosis of Endocrine-related Histopathology in Fish Gonads, Series on Testing and Assessment No. 123, ENV/JM/MONO(2010)14, OECD, Paris.
|
|
(23)
|
Kobayashi, T., M. Matsuda, H. Kajiura-Kobayashi, A. Suzuki, N. Saito, M. Nakamoto, N. Shibata, and Y. Nagahama (2004), «Two DM domain genes, DMY and DMRT1, involved in testicular differentiation and development in the medaka, Oryzias latipes», Developmental Dynamics 231, pp. 518-526.
|
|
(24)
|
Shinomiya, A., H. Otake, K. Togashi, S. Hamaguchi, and M. Sakaizumi (2004), «Field survey of sex-reversals in the medaka, Oryzias latipes: genotypic sexing of wild populations», Zoological Science 21, pp. 613-619.
|
|
(25)
|
Kidd, K.A., P.J. Blanchfield, K.H. Mills, V.P. Palace, R.E. Evans, J.M. Lazorchak, and R.W. Flick (2007), «Collapse of a fish population after exposure to a synthetic estrogen», Proceedings of the National Academy of Sciences of the United States of America 104, pp. 8897-8901.
|
|
(26)
|
Palace,V.P., R.E. Evans, K.G. Wautier, K.H. Mills, P.J. Blanchfield, B.J. Park, C.L. Baron, and K.A. Kidd (2009), «Interspecies differences in biochemical, histopathological, and population responses in four wild fish species exposed to ethynylestradiol added to a whole lake», Canadian Journal of Fisheries and Aquatic Sciences 66, pp. 1920-1935.
|
|
(27)
|
Panter, G.H., T.H. Hutchinson, K.S. Hurd, J. Bamforth, R.D. Stanley, S. Duffell, A. Hargreaves, S. Gimeno, and C.R. Tyler (2006), «Development of chronic tests for endocrine active chemicals – Part 1. An extended fish early-life stage test for oestrogenic active chemicals in the fathead minnow (Pimephales promelas)», Aquatic Toxicology 77, pp. 279-290.
|
|
(28)
|
Holbech, H., K. Kinnberg, G.I. Petersen, P. Jackson, K. Hylland, L. Norrgren, and P. Bjerregaard (2006), «Detection of endocrine disrupters: Evaluation of a Fish Sexual Development Test (FSDT)», Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 144, pp. 57-66.
|
|
(29)
|
Andersen, L., K. Kinnberg, H. Holbech, B. Korsgaard, and P. Bjerregaard (2004), «Evaluation of a 40 day assay for testing endocrine disrupters: Effects of an anti-estrogen and an aromatase inhibitor on sex ratio and vitellogenin concentrations in juvenile zebrafish (Danio rerio)», Fish Physiology and Biochemistry 30, pp. 257-266.
|
|
(30)
|
Morthorst, J.E., H. Holbech, and P. Bjerregaard (2010), «Trenbolone causes irreversible masculinization of zebrafish at environmentally relevant concentrations», Aquatic Toxicology 98, pp. 336-343.
|
|
(31)
|
Kiparissis,Y., T.L. Metcalfe, G.C. Balch, and C.D. Metcalf (2003), «Effects of the antiandrogens, vinclozolin and cyproterone acetate on gonadal development in the Japanese medaka (Oryzias latipes)», Aquatic Toxicology 63, pp. 391-403.
|
|
(32)
|
Panter, G.H., T.H. Hutchinson, K.S. Hurd, A. Sherren, R.D. Stanley, and C.R. Tyler (2004), «Successful detection of (anti-) androgenic and aromatase inhibitors in pre-spawning adult fathead minnows (Pimephales promelas) using easily measured endpoints of sexual development», Aquatic Toxicology 70, pp. 11-21.
|
|
(33)
|
Kinnberg, K., H. Holbech, G.I. Petersen, and P. Bjerregaard (2007), «Effects of the fungicide prochloraz on the sexual development of zebrafish (Danio rerio)», Comparative Biochemistry and Physiology C-Toxicology & Pharmacology 145, pp. 165-170.
|
|
(34)
|
Chapter C.14 of this Annex, Fish Juvenile Growth Test.
|
|
(35)
|
Chapter C.4 of this Annex, Ready Biodegradability.
|
|
(36)
|
OECD (2000), Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures, Series on Testing and Assessment No. 23, OECD, Paris.
|
|
(37)
|
OECD (2009), Fish Short Term Reproduction Assay, Test Guideline No. 229, Guidelines for the Testing of Chemicals, OECD, Paris.
|
|
(38)
|
Chapter C.37 of this Annex, 21-Day Fish Assay: A Short Term Screening for Oestrogenic and Androgenic Activity, and Aromatase Inhibition.
|
|
(39)
|
OECD (2012), Fish Toxicity Testing Framework, Series on Testing and Assessment No. 171, OECD, Paris
|
|
(40)
|
Schäfers, C., Teigeler, M., Wenzel, A., Maack, G., Fenske, M., Segner, H (2007), «Concentration- and time-dependent effects of the synthetic estrogen, 17 alpha-ethinylestradiol, on reproductive capabilities of the zebrafish, Danio rerio» Journal of Toxicology and Environmental Health-Part A, 70, 9-10 pp 768-779.
|
|
(41)
|
OECD (2011), Validation Report (Phase 1) for the Fish Sexual Development Test, Series on Testing and Assessment No 141, ENV/JM/MONO(2011)22, OECD, Paris.
|
|
(42)
|
OECD (2011), Validation Report ( Phase 2) for the Fish Sexual Development Test, Series on Testing and Assessment No 142, ENV/JM/MONO(2011)23, OECD, Paris.
|
|
(43)
|
OECD (2011), Peer Review Report of the validation of the Fish Sexual Development Test, Series on Testing and Assessment No 143, ENV/JM/MONO(2011)24, OECD, Paris.
|
|
(44)
|
Directive 2010/63/EU of the European Parliament and of the Council of 22 September 2010 on the protection of animals used for scientific purposes. OJ L 276, 20.10.2010, p. 33.
|
Apendicele 1
Abrevieri și definiții
Parametrii studiați apicali
: care cauzează efecte la nivelul populației
ASV
: Valoarea de saturație din aer (Air saturation value)
Biomarker
: Care cauzează efecte la nivel individual
Substanța chimică
: o substanță sau un amestec.
Dph
: Zile de la eclozare (Days post hatch)
DMY
: Gena domeniului DM Y-specifică necesară pentru dezvoltarea masculilor din specia Oryzias latipes
ELISA
: Test de imunoadsorbție cu anticorpi marcați enzimatic
Greutate pește
: Greutatea umedă peștilor (uscați prin tamponare)
FSDT
: Test de dezvoltare sexuală a peștilor (Fish Sexual Development Test)
Axul HPG
: Axul hipotalamo-hipofizo-gonadal.
Pești hermafrodiți
: Pești care prezintă mai multe ovocite în testicul pe 6 secțiuni analizate sau celule spermatogenetice în ovare (da/nu)
Rate de încărcare
: Greutatea umedă a unui pește per volum de apă
MOA
: Mod de acțiune
RT-PCR
: Reacție de polimerizare în lanț a revers transcriptazei
Substanța chimică testată
: orice substanță sau amestec testat cu ajutorul acestei metode de testare.
Pești nediferențiați
: Pești cu gonade care gonade care nu prezintă celulele germinale vizibile.
VTG
: Vitelogenină
Apendicele 2
Condiții experimentale pentru FSDT (specii de apă dulce)
|
|
Oryzias latipes
|
Peștele-zebră (Danio rerio)
|
Ghidrinul (Gasterostreus aculeatus)
|
|
|
Flux continuu sau semistatic
|
Flux continuu sau semistatic
|
Flux continuu sau semistatic
|
|
|
25 ± 2 °C
|
27 ± 2 °C
|
20 ± 2 °C
|
|
|
Becuri fluorescente (spectru larg)
|
Becuri fluorescente (spectru larg)
|
Becuri fluorescente (spectru larg)
|
|
|
10-20 μE/m2/s, 540-1 080 lux sau 50-100 ft-c (niveluri ambientale din laborator)
|
10-20 μE/m2/s, 540-1 080 lux sau 50-100 ft-c (niveluri ambientale din laborator)
|
10-20 μE/m2/s, 540-1 080 lux sau 50-100 ft-c (niveluri ambientale din laborator)
|
|
6.
|
Perioadă de expunere la lumină
|
|
12-16 h de lumină, 8-12 h de întuneric
|
12-16 h de lumină, 8-12 h de întuneric
|
16 h de lumină, 8 h de întuneric
|
|
7.
|
Dimensiunea minimă a camerelor de testare
|
|
Camerele individuale trebuie să conțină un volum de apă de minimum 7 l
|
Camerele individuale trebuie să conțină un volum de apă de minimum 7 l
|
Camerele individuale trebuie să conțină un volum de apă de minimum 7 l
|
|
8.
|
Schimburile volumice ale soluțiilor de testare
|
|
Minimum 5/zi
|
Minimum 5/zi
|
Minimum 5/zi
|
|
9.
|
Vârsta organismelor testate la începutul expunerii
|
|
Ouă recent fertilizate (stadiul de blastulă timpurie)
|
Ouă recent fertilizate (stadiul de blastulă timpurie)
|
Ouă recent fertilizate
|
|
10.
|
Numărul de ouă per tratament
|
|
Minimum 120
|
Minimum 120
|
Minimum 120
|
|
11.
|
Numărul de tratamente
|
|
Minimum 3 (plus controale corespunzătoare)
|
Minimum 3 (plus controale corespunzătoare)
|
Minimum 3 (plus controale corespunzătoare)
|
|
12.
|
Numărul de replici per tratament
|
|
Minimum 4 (cu excepția alocării prin rădăcină pătrată la control)
|
Minimum 4 (cu excepția alocării prin rădăcină pătrată la control)
|
Minimum 4 (cu excepția alocării prin rădăcină pătrată la control)
|
|
|
Artemia vii, creveți adulți congelați, hrană sub formă de fulgi etc. Se recomandă administrarea de hrană de două ori pe zi.
|
Hrană specială pentru pești tineri, Artemia, creveți adulți congelați, hrană sub formă de fulgi etc. Se recomandă administrarea de hrană de două ori pe zi.
|
Artemia vii, creveți adulți congelați, hrană sub formă de fulgi etc. Se recomandă administrarea de hrană de două ori pe zi.
|
|
|
Fără aerare, cu excepția cazului în care concentrația OD scade sub 60 % din saturație
|
Fără aerare, cu excepția cazului în care concentrația OD scade sub 60 % din saturație
|
Fără aerare, cu excepția cazului în care concentrația OD scade sub 70 % din saturație
|
|
|
Apă curată de suprafață, din puțuri sau reconstituită
|
Apă curată de suprafață, din puțuri sau reconstituită
|
Apă curată de suprafață, din puțuri sau reconstituită
|
|
16.
|
Durata expunerii la substanța chimică testată
|
|
60-dph
|
60-dph
|
60-dph
|
|
17.
|
Parametri biologici studiați
|
|
Succesul eclozării, supraviețuire, morfologie macroscopică, VTG histologia gonadală, sexul genetic, raportul sexelor
|
Succesul eclozării, supraviețuire Morfologie macroscopică, VTG histologie gonadală, raportul sexelor
|
Succesul eclozării, supraviețuire Morfologie macroscopică, VTG histologie gonadală, raportul sexelor
|
|
18.
|
Criteriile de acceptabilitate a testului pentru replicile comasate ale controalelor
|
|
Succesul eclozării > 80 %
|
Succesul eclozării > 80 %
|
Succesul eclozării > 80 %
|
|
Supraviețuirea ulterioară eclozării ≥ 70 %
|
Supraviețuirea ulterioară eclozării ≥ 70 %
|
Supraviețuirea ulterioară eclozării ≥ 70 %
|
|
creșterea (greutatea umedă peștilor uscați prin tamponare) > 150 mg
|
creșterea (greutatea umedă peștilor uscați prin tamponare) > 75 mg
|
creșterea (greutatea umedă peștilor uscați prin tamponare) > 120 mg
|
|
Lungime (lungime standard) > 20mm
|
Lungime (lungime standard) > 14 mm
|
Lungime (lungime standard) > 20 mm
|
|
Raportul sexelor (% masculi sau femele)
30 % – 70 %
|
Raportul sexelor (% masculi sau femele) 30 % – 70 %
|
Raportul sexelor (% masculi sau femele) 30 % – 70 %
|
Apendicele 3
Caracteristici chimice ale unei ape de diluție acceptabile
|
CONSTITUENT
|
CONCENTRAȚIE
|
|
Materie sub formă de particule
|
< 20 mg/l
|
|
Carbon organic total
|
< 2 mg/l
|
|
Amoniac neionizat
|
< 1 μg/l
|
|
Clor rezidual
|
< 10 μg/l
|
|
Total pesticide organofosforice
|
< 50 ng/l
|
|
Total pesticide organoclorurate plus bifenili policlorurați
|
< 50 ng/l
|
|
Clor organic total
|
< 25 ng/l
|
Apendicele 4
Din metoda de testare C.14/Orientări privind concentrațiile de testare
|
Coloană (numărul de concentrații între 100 și 10, sau între 10 și 1) (28)
|
|
1
|
2
|
3
|
4
|
5
|
6
|
7
|
|
100
|
100
|
100
|
100
|
100
|
100
|
100
|
|
32
|
46
|
56
|
63
|
68
|
72
|
75
|
|
10
|
22
|
32
|
40
|
46
|
52
|
56
|
|
3,2
|
10
|
18
|
25
|
32
|
37
|
42
|
|
1
|
4,6
|
10
|
16
|
22
|
27
|
32
|
|
|
2,2
|
5,6
|
10
|
15
|
19
|
24
|
|
|
1
|
3,2
|
6,3
|
10
|
14
|
18
|
|
|
|
1,8
|
4
|
6,8
|
10
|
13
|
|
|
|
1
|
2,5
|
4,6
|
7,2
|
10
|
|
|
|
|
1,6
|
3,2
|
5,2
|
7,5
|
|
|
|
|
1
|
2,2
|
3,7
|
5,6
|
|
|
|
|
|
1,5
|
2,7
|
4,2
|
|
|
|
|
|
1
|
1,9
|
3,2
|
|
|
|
|
|
|
1,4
|
2,4
|
|
|
|
|
|
|
1
|
1,8
|
|
|
|
|
|
|
|
1,3
|
|
|
|
|
|
|
|
1
|
Apendicele 5
Orientări privind omogenizarea capului și a cozii la exemplarele tinere din speciile pește-zebră, Pimephales promelas, ghidrin și Oryzias latipes
Scopul acestei secțiuni este de a descrie procedurile care au loc înainte de cuantificarea concentrației VTG. Pot fi utilizate alte proceduri care conduc la cuantificarea comparabilă a VTG. Determinarea concentrației de VTG în plasma sanguină sau ficat în loc de omogenatul din cap/coadă este o opțiune.
Procedură
|
1.
|
Peștii sunt anesteziați și eutanasiați conform descrierii testului.
|
|
2.
|
Capul și coada peștelui sunt tăiate conform descrierii testului. Important: Toate instrumentele de disecție și planșa pentru efectuarea inciziilor trebuie clătite și curățate în mod corespunzător (de exemplu, cu etanol 96 %) între fiecare operațiune de manipulare a peștilor pentru a preveni «poluarea cu VTG» de la femele sau de la masculii la care aceasta a fost indusă la masculii la care nu a fost indusă.
|
|
3.
|
Greutatea ansamblului cap-coadă al fiecărui pește este măsurată la cel mai apropiat mg.
|
|
4.
|
După cântărire, părțile sunt introduse în eprubete corespunzătoare (de exemplu, Eppendorf de 1,5 ml) și congelate la o temperatură de – 80 °C până la omogenizare sau sunt direct omogenizate pe gheață cu ajutorul a două pistiluri din plastic. (Pot fi utilizate alte metode dacă sunt realizate pe gheață și rezultatul este o masă omogenă). Important: Eprubetele trebuie numerotate în mod corect astfel încât capul și coada peștelui să poată fi corelate cu secțiunea de corp corespunzătoare utilizată pentru histologia gonadelor.
|
|
5.
|
Atunci când se obține o masă omogenă, se adaugă o cantitate de tampon de omogenizare
(29) înghețat reprezentând de 4 – 10 ori greutatea țesutului (a se nota diluția). Se continuă operațiunea cu pistilurile până ce amestecurile devin omogene. Notă importantă: Se utilizează pistiluri noi pentru fiecare pește.
|
|
6.
|
Eșantioanele sunt așezate pe gheață până în momentul centrifugării la o temperatură de 4 °C și la 50 000 g timp de 30 de minute.
|
|
7.
|
Se utilizează o pipetă pentru a repartiza părți de 20 – 50 μl (a se nota cantitatea) de supernatant în cel puțin două eprubete introducând vârful pipetei sub stratul de grăsime de la suprafață și aspirând cu grijă supernatantul fără fracțiuni de grăsime sau de granule.
|
|
8.
|
Eprubetele sunt depozitate la o temperatură de – 80 °C până în momentul utilizării.
|
Notă: Tamponul de omogenizare trebuie utilizat în ziua fabricării sale. Se așează pe gheață în timpul utilizării
Apendicele 6
Orientări privind cuantificarea vitelogeninei din omogenatul din cap și coadă la peștele-zebră (Danio rerio) (modificat după Holbech et al., 2001). pot fi utilizate alte proceduri care utilizează anticorpi și standarde omoloage
|
1.
|
Plăci de microtitrare (certificate Maxisorp F96, Nunc, Roskilde Danemarca) acoperite în prealabil cu 5 μ g/ml IgG antilipovitelină de pește-zebră sunt decongelate și spălate de 3 ori cu tampon de spălare (*).
|
|
2.
|
Standardul de vitelogenină de pește-zebră purificat (30) este diluat în serie la 0,2, 0,5, 1, 2, 5, 10 și 20 ng/ml în tampon de diluare (**), iar eșantioanele sunt diluate de cel puțin de 200 ori (pentru a preveni efectul de matrice) în tampon de diluare și sunt aplicate pe plăci. Un control al testului este aplicat în duplicat. 150 μl se aplică în fiecare godeu. Standardele sunt aplicate în duplicat, iar eșantioanele în triplicat. Se lasă la incubat pe timpul nopții la 4 °C pe un agitator.
|
|
3.
|
Plăcile sunt spălate de 5 ori cu tampon de spălare (*)
|
|
4.
|
HRP cuplat la un lanț dextran (de exemplu, AMDEX A/S, Danemarca) și anticorpi conjugați se diluează în tamponul de spălare; diluarea efectivă diferă în funcție de lot și de vârstă. 150 μl se aplică în fiecare godeu, iar plăcile sunt incubate timp de 1 oră la temperatura camerei pe un agitator.
|
|
5.
|
Plăcile sunt spălate de 5 ori cu tampon de spălare (*), iar partea de jos a plăcilor este curățată cu grijă cu etanol.
|
|
6.
|
150 μl TMB plus (***) se aplică în fiecare godeu. Se protejează placa împotriva luminii cu staniol și se urmărește apariția culorii pe un agitator.
|
|
7.
|
Atunci când curba standard este pe deplin dezvoltată, activitatea enzimei este oprită prin adăugarea a 150 μl 0,2 M H2SO4 în fiecare godeu.
|
|
8.
|
Absorbanța este măsurată la 450 nm (de exemplu, pe un cititor de plăci Molecular Devices Thermomax). Datele sunt analizate pe software-ul asociat (de exemplu, Softmax).
|
|
(*)
|
Tampon de spălare:
|
stoc PBS (****)
|
500
|
ml
|
|
BSA
|
5
|
g
|
|
Tween 20
|
5
|
ml
|
|
Se ajustează pH-ul la 7,3 și se umple până la 5 l cu H2O millipore. Se depozitează la 4 °C.
|
|
|
(**)
|
Tampon de diluție:
|
Stoc PBS (****)
|
100
|
ml
|
|
BSA
|
3
|
g
|
|
Tween 20
|
1
|
ml
|
|
Se ajustează pH-ul la 7,3 și se umple până la 1 l cu H2O millipore. Se depozitează la 4 °C.
|
|
|
(***)
|
TMB plus este un substrat «gata de utilizare» produs de KemEnTec (Danemarca). Este sensibil la lumină. Se depozitează la 4 °C.
|
|
(****)
|
Stoc PBS
|
NaCl
|
160
|
g
|
|
KH2PO4
|
4
|
g
|
|
Na2HPO4
.2H2O
|
26,6
|
g
|
|
KCl
|
4
|
g
|
|
Se ajustează pH-ul la 6,8 și se umple cu H2O millipore până la 2 l. Se depozitează la temperatura camerei.
|
|
Apendicele 7
Orientări privind pregătirea secțiunilor tisulare pentru determinarea sexului și stadializarea gonadelor
Scopul acestei secțiuni este de a descrie procedurile care au loc înainte de evaluarea secțiunilor histologice. Pot fi utilizate și alte proceduri care au ca rezultat o determinare a sexului și stadializarea gonadală similare.
Cu câteva excepții, aceste proceduri sunt similare pentru Oryzias latipes (Japanese medaka – JMD) și peștele-zebră (zebrafish – ZF).
Eutanasierea, necropsia și fixarea tisulară
Obiective:
|
1.
|
Peștele este eutanasiat.
|
|
2.
|
Se obține greutățile și se efectuează măsurătorile necesare.
|
|
3.
|
Se evaluează caracteristicile sexuale secundare.
|
|
4.
|
Țesuturile sunt disecate pentru analiza VTG.
|
Proceduri:
|
1.
|
Peștele trebuie sacrificat imediat înainte de necropsie. Prin urmare, cu excepția cazului în care sunt disponibile mai multe persoane pentru a efectua disecții, peștii nu trebuie să fie sacrificați simultan.
|
|
2.
|
Folosind plase de mici dimensiuni, peștele este îndepărtat din camera experimentală și transportat în zona de necropsie în recipientul de transport.
|
|
3.
|
Peștele este introdus în soluția de eutanasiere. Peștele este îndepărtat din soluție atunci când peștele încetează să respire și să răspundă la stimuli externi.
|
|
4.
|
Peștele este cântărit umed.
|
|
5.
|
Pentru pregătirea țesuturilor pentru analiza VTG, peștele poate fi plasat pe o placă de plută a unui microscop de disecție.
|
a.
|
Pentru peștele-zebră, capul este tăiat chiar în spatele înotătoarei pectorale, iar coada este tăiată chiar în spatele înotătoarei dorsale.
|
|
b.
|
Pentru Oryzias latipes, abdomenul este deschis printr-o incizie efectuată cu grijă, care se extinde de-a lungul liniei mediane ventrale de la centura pectorală la un punct situat imediat cranial față de anus. Cu ajutorul forcepsului fin și a unei foarfeci mici, ficatul este îndepărtat cu grijă.
|
|
|
6.
|
Eșantionul pentru analiza VTG este plasat în tuburi Eppendorf și congelat imediat în azot lichid.
|
|
7.
|
Carcasa care include gonadele este introdusă într-o casetă din plastic pentru țesut preetichetată, care este transferată într-un fixator Davidson sau Bouin. Volumul fixatorului trebuie să fie de cel puțin 10 de ori mai mare ca volumul aproximat al țesuturilor. Recipientul fixator este agitat ușor timp de cinci secunde pentru dislocarea bulelor de aer din casetă.
|
|
8.
|
|
a.
|
Toate țesuturile rămân în timpul nopții în fixatorul Davidson, a doua zi fiind transferate în recipiente individuale conținând formol 10 % tamponat neutru. Recipientele cu casete sunt agitate ușor timp de 5 secunde pentru a asigura penetrarea adecvată a formolului în casete.
|
|
b.
|
Țesuturile rămân în fixatorul Bouin timp de 24 de ore, fiind transferate în etanol 70 %.
|
|
Procesarea țesuturilor
Obiective:
|
1.
|
Se deshidratează țesutul pentru penetrarea adecvată a parafinei.
|
|
2.
|
Se impregnează țesutul cu parafină pentru a menține integritatea țesuturilor și pentru a crea o suprafață fermă pentru microtomie.
|
Proceduri:
|
3.
|
Casetele de țesut etichetate sunt îndepărtate din mediul de stocare cu formol/etanol și sunt introduse în coșul (coșurile) de procesare. Coșul de procesare este încărcat în procesatorul tisular.
|
|
4.
|
Se selectează calendarul de procesare.
|
|
5.
|
După ce procesatorul tisular a finalizat ciclul de procesare, coșul (coșurile) poate (pot) fi transferat(e) în stația integrată.
|
Integrare
Obiectiv:
Orientarea corectă a eșantionului în parafină solidificată pentru microtomie.
Proceduri:
|
1.
|
Coșul (coșurile) de casete este (sunt) îndepărtat(e) din procesator și este (sunt) scufundat(e) în camera frontală umplută cu parafină a consolei termică a stației de integrare sau casetele sunt mutate într-un încălzitor de parafină separat.
|
|
2.
|
Prima casetă care urmează să fie integrată este îndepărtată din camera frontală a consolei termice sau din încălzitorul de parafină. Capacul casetei este îndepărtat și eliminat, iar eticheta casetei este verificată în ceea ce privește înregistrările privind animalul pentru a soluționa potențialele discrepanțe înainte de integrare.
|
|
3.
|
Se alege o matriță de dimensiuni corespunzătoare pentru integrare.
|
|
4.
|
Matrița este ținută sub duza consolei de distribuire și umplută cu parafină topită.
|
|
5.
|
Eșantionul este îndepărtat din casetă și introdus în parafina topită din matriță. Aceasta operațiune se repetă cu 4 – 8 eșantioane pentru fiecare matriță cu parafină. Poziția fiecărui pește este marcată prin plasarea peștelui nr. 1 la 180 de grade față de peștii 2-4/8.
|
|
6.
|
Se adaugă parafină suplimentară pentru a acoperi eșantionul.
|
|
7.
|
Matrița și baza casetei se plasează pe placa de răcire a crioconsolei.
|
|
8.
|
După ce parafina s-a solidificat, blocul (adică, parafina întărită care conține țesuturile și baza casetei) este îndepărtată din matriță
|
Microtomie
Obiectiv:
Se taie și se montează secțiunile histologice pentru colorare.
Proceduri:
|
1.
|
Faza inițială a microtomiei, denumită «facing» se desfășoară astfel:
|
a.
|
Blocul de parafină este plasat în mandrina microtomului.
|
|
b.
|
Mandrina este avansată prin rotirea roții microtomului, iar secțiuni groase sunt tăiate de la suprafața blocului de parafină până când cuțitul ajunge la țesuturile integrate.
|
|
c.
|
Grosimea secțiunii pe microtom este stabilită la 3 – 5 microni. Mandrina este avansată și din bloc se taie secțiuni multiple pentru a se elimina orice artefacte create pe suprafața tăiată a țesutului în cursul tăierii grosiere.
|
|
d.
|
Blocul poate fi îndepărtat din mandrină și plasat cu fața în jos pe gheață pentru înmuierea țesutului.
|
|
|
2.
|
Următoarea fază a microtomiei este secționarea finală și montarea secțiunilor de țesut pe lame. Aceste proceduri sunt efectuate după cum urmează:
|
a.
|
Dacă blocul a fost plasat pe gheață, el este îndepărtat de pe gheață și înlocuit în mandrin microtomului.
|
|
b.
|
În condițiile în care grosimea secțiunilor de pe microtom este fixată la 3 – 5 microni, mandrina este avansată prin rotirea roții microtomului. Secțiunile sunt tăiate din bloc până când se obține o «panglică» care conțin cel puțin o secțiune acceptabilă care include gonade. (În măsura în care este necesar în timpul secționării, blocul poate fi îndepărtat din mandrină, plasat pe gheață pentru a înmuia țesutul și apoi înlocuit în mandrină.)
|
|
c.
|
Secțiunile plutesc la suprafața apei din baia de apă. Se încearcă să se obțină cel puțin o secțiune care nu conține nici încrețituri și nici bule de aer.
|
|
d.
|
O lamă de microscop este introdusă sub cea mai bună secțiune, care este ridicată din apă cu ajutorul lamei. Acest proces este denumit «montarea» secțiunii pe lamă.
|
|
e.
|
Pentru un set de pești sunt pregătite trei secțiuni. A doua și a treia secțiune sunt tăiate la intervale de 50 de microni de la prima secțiune. Dacă peștele nu este integrat cu gonadele sale în același nivel de secționare, se vor realiza mai multe secțiuni pentru a se asigura că de la fiecare pește sunt obținute cel puțin șase secțiuni care să includă gonadele.
|
|
f.
|
Cu un pix de marcare a lamei, numărul blocului din care a fost produsă lama este înregistrat pe lamă.
|
|
g.
|
Lama este plasată pe un suport de colorare.
|
|
h.
|
Blocul este îndepărtat din mandrină și plasat cu fața în jos pentru depozitare.
|
|
Colorarea, aplicarea lamelelor și marcarea lamelor
Obiective:
|
—
|
Se colorează secțiunile pentru examenul histopatologic.
|
|
—
|
Se sigilează permanent țesturile montate și colorate.
|
|
—
|
Se identifică permanent secțiunile colorate într-un mod care să permită o trasabilitate completă.
|
Proceduri:
|
1.
|
Colorare
|
a.
|
Lamele se lasă să se usuce la aer peste noapte înainte de colorare.
|
|
b.
|
Secțiunile sunt colorate cu hematoxilină-eozină.
|
|
|
2.
|
Aplicarea lamelelor
|
a.
|
Lamelele pot fi aplicate manual sau automat.
|
|
b.
|
O lamă se scufundă în xilen sau în TissueClear, iar excesul de xilen/TissueClear este îndepărtat ușor de pe lamă.
|
|
c.
|
Aproximativ 0,1 ml de mediu de montare se aplică aproape de capătul lamei, opus capătului congelat sau pe lamelă.
|
|
d.
|
Se aplică lamela pe lamă înclinând-o ușor.
|
|
|
3.
|
Etichetarea
|
a.
|
Eticheta de pe fiecare lamă trebuie să includă următoarele informații:
|
i.
|
Denumirea laboratorului
|
|
iii.
|
Eșantion nr. / Lama nr.
|
|
iv.
|
Substanța chimică/grupul de tratament
|
|
|
Apendicele 8
Organigramă statistică pentru analiza vitelogeninei

Organigramă statistică pentru analiza raportului sexelor

Apendicele 9
Orientări privind prelevarea de țesut pentru determinarea sexului genetic și pentru determinarea sexului genetic prin metoda PCR
Prelevarea de țesut, pregătirea și depozitarea înainte de determinarea sexului genetic prin metoda PCR la Oryzias latipes (pregătită de Laboratorul pentru organisme acvatice al Bayer CropScience AG)
|
1.
|
Cu ajutorul unor foarfeci fine se taie înotătoarea anală sau dorsală a fiecărui pește individual și se plasează într-o eprubetă umplută cu 100μl de tampon de extracție 1 (pentru detalii privind prepararea tamponului, a se vedea mai jos). Foarfecele vor fi curățate după fiecare pește individual într-un pahar de laborator umplut cu H2O distilată și uscate cu un șervet de hârtie.
|
|
2.
|
Țesuturile de la înotătoare vor fi omogenizate cu un pistil de teflon într-o microeprubetă pentru liza celulelor. Pentru fiecare eprubetă va fi utilizat un nou pistil pentru a preveni orice contaminare. Pistilurile vor fi plasate peste noapte în 0,5 M NaOH, clătite timp de 5 minute în H2O distilată și depozitate în etanol sau în apă sterilă după autoclavare, până la utilizare.
|
|
3.
|
De asemenea, este posibil ca țesutul de la înotătoare să fie depozitat fără ajutorul unui tampon de extracție 1 pe dioxid de carbon solid și apoi într-un congelator la o temperatură de – 80 °C pentru a preveni orice degenerare a ADN-ului. Dar extragerea se realizează mai bine dacă se extrage ADN-ul în același timp (pentru manipulare, a se vedea mai sus; eșantioanele trebuie decongelate pe gheață după depozitare – 80 °C înainte ca tamponul să fie vărsat eprubete).
|
|
4.
|
După omogenizare, toate eprubetele vor fi plasate într-o baie de apă și se fierb timp de 15 minute la 100 °C.
|
|
5.
|
Apoi, 100 μl din tampon de extracție 2 (pentru detalii privind prepararea tamponului, a se vedea mai jos) vor fi pipetați în fiecare eprubetă. Eșantioanele vor fi depozitate la temperatura camerei timp de 15 minute și, între timp, vor fi agitate ușor, din când în când, manual.
|
|
6.
|
Apoi, toate eprubetele vor fi plasate din nou în baia de apă și se fierb timp de încă 15 minute la 100 °C.
|
|
7.
|
Până la o analiză suplimentară eprubetele vor fi congelate la – 20 °C.
|
Prepararea tamponului
Tamponul 1 pentru PCR:
|
|
500 mg N--lauroilsarcozina (de exemplu, Merck KGaA, Darmstadt, GE)
|
|
|
se adaugă 100 ml apă distilată H2O
|
Tamponul 2 pentru PCR:
|
|
20 g Chelex (e.g. Biorad, Munich, GE)
|
|
|
Se umflă în 100 ml apă distilată H2O
|
Determinarea sexului genetic (prin metoda PCR) la Oryzias latipes (pregătită de Laboratorul pentru organisme acvatice al Bayer CropScience AG și de Universität Würzburg Biozentrum)
Eprubetele pregătite și congelate (descrise în secțiunea de mai sus) vor fi decongelată pe gheață. Apoi, ele vor fi centrifugate folosind o centrifugă Eppendorf (30 de secunde la viteză maximă, la temperatura camerei). Pentru PCR, se va folosi supernatantul clar separat de precipitat. Trebuie să se evite cu orice preț ca orice urmă de Chelex (localizată în precipitat) să fie transferată la reacția PCR, deoarece aceasta va interfera cu activitatea polimerazei «Taq». Supernatantul va fi utilizat direct sau poate fi depozitat congelat (la – 20 °C) și redecongelat în mai multe cicluri fără un impact negativ asupra ADN-ului, pentru analize ulterioare.
1. Pregătirea «amestecului de reacție» (25 μl per eșantion):
|
|
Volum
|
Concentrație finală
|
|
Model de ADN
|
0,5μl – 2μl
|
|
|
10 x tampon PCR cu MgCl2
|
2,5μl
|
1x
|
|
Nucleotide (fiecare dintre dATP, dCTP, dGTP, dTTP)
|
4μl (5mM)
|
200 μM
|
|
Primer sens (10 μM) (a se vedea mai jos 3 – 5)
|
0,5μl
|
200 nM
|
|
Primer antisens (10 μM) (a se vedea mai jos 3 – 5)
|
0,5μl
|
200 nM
|
|
DMSO
|
1,25 μl
|
5 %
|
|
Apă (calitate PCR)
|
până la 25 μl
|
|
|
Polimerază Taq E
|
0,3 μl
|
1,5 U
|
|
10 x tampon PCR cu MgCl2: 670 mM Tris/HCl (pH 8,8 la 25 °C), 160 mM (NH4)2SO4, 25 mM MgCl2, 0,1 % Tween 20
|
Pentru fiecare PCR (a se vedea mai jos 3 – 5) este necesar primerul special ca o nouă combinație de «amestec de reacție» și cantitatea adecvată necesară pentru modelul de ADN pentru fiecare eșantion (a se vedea mai sus). Volumele respective vor fi transferat în eprubete noi, folosind pipete. Ulterior, toate eprubetele vor fi închise și agitate (aproximativ 10 secunde) și centrifugate (10 secunde la temperatura camerei). Acum respectivele programe PCR pot fi pornite. În plus, un control pozitiv (eșantion de ADN exemplar cu activitate cunoscută și rezultate clare) și un control negativ (1 μl H2O distilată) vor fi utilizate în fiecare program PCR.
2. Prepararea gelului de agaroză (1 %) – Pe durata funcționării programelor PCR:
|
—
|
Se dizolvă 3 g agaroză în 300 ml 1 × tampon TAE (1 % gel de agaroză).
|
|
—
|
Această soluție trebuie fiartă într-un cuptor cu microunde (aproximativ 2 – 3 minute).
|
|
—
|
Se transferă soluția fierbinte într-o cutie specială de turnare, care este așezată pe gheață.
|
|
—
|
După aproximativ 20 de minute, gelul de agaroză este gata de utilizare.
|
|
—
|
Se depozitează gelul de agaroză în 1 × tampon TAE până la sfârșitul programelor PCR.
|
3. Programul PCR pentru actină:
Această reacție PCR are ca scop să demonstreze că ADN-ul din eșantion nu este deteriorat.
|
—
|
Primer special:
|
—
|
«Mact1(sus/sens)» → TTC AAC AGC CCT GCC ATG TA
|
|
—
|
«Mact2(jos/antisens)» → GCA GCT CAT AGC TCT TCT CCA GGG AG
|
|
|
—
|
Program:
|
—
|
Ciclu (35 de ori):
|
Denaturare
|
→ 45 sec la 95 °C
|
|
Atașarea primerului
|
→ 45 sec la 56 °C
|
|
Elongare
|
→ 1 min la 68 °C
|
|
|
4. Programul PCR pentru genele X și Y
Probele cu ADN intact vor fi utilizate în acest program PCR pentru a detecta genele X și Y. ADN-ul de la masculi trebuie să indice o bandă dublă, iar ADN-ul de la femele trebuie să indice o singură bandă (după colorare și electroforeză în gel). Pentru acest program trebuie inclus un control pozitiv pentru masculi (eșantion XY) și unul pentru femele (eșantion XX).
|
—
|
Primer special:
|
—
|
«PG 17.5» (sus/sens) → CCG GGT GCC CAA GTG CTC CCG CTG
|
|
—
|
«PG 17.6» (jos/antisens) → GAT CGT CCC TCC ACA GAG AAG AGA
|
|
|
—
|
Program:
|
—
|
Ciclu (40 de ori):
|
Denaturare
|
→ 45 sec la 95 °C
|
|
Atașarea primerului
|
→ 45 sec la 55 °C
|
|
Elongare
|
→ 1 min 30 sec la 68 °C
|
|
|
5. Program PCR pentru gena Y drept «control» pentru X și program PCR pentru genele X și Y:
Acest program PCR verifică rezultatele «programului PCR pentru genele X și Y». «Eșantioanele-mascul» trebuie să prezinte o bandă, iar «eșantioanele-femelă» nu trebuie să prezintă nicio bandă (după colorare și electroforeză în gel).
|
—
|
Primer special:
|
—
|
«DMTYa (sus/sens)» → GGC CGG GTC CCC GGG TG
|
|
—
|
«DMTYd (jos/antisesn)» → TTT GGG TGA ACT CAC ATG G
|
|
|
—
|
Program:
|
—
|
Ciclu (40 de ori):
|
Denaturare
|
→ 45 sec la 95 °C
|
|
Atașarea primerului
|
→ 45 sec la 56 °C
|
|
Elongare
|
→ 1 min la 68 °C
|
|
|
6. Colorarea eșantioanelor PCR:
Soluție pentru colorare:
|
|
0,25 % Albastru de bromfenol
|
Se pipetează 1 μl de soluție de colorare în fiecare eprubetă în parte
7. Începerea electroforezei în gel:
|
—
|
Gelul de agaroză 1 % preparat va fi transferat într-o cameră pentru electroforeză în gel umplută cu 1 × tampon TAE
|
|
—
|
10 – 15 μl din fiecare eșantion PCR colorat vor fi pipetați într-un godeu de gel de agaroză
|
|
—
|
De asemenea, 5 – 15 μl din 1kb-«Ladder»(Invitrogen) vor fi pipetați într-un godeu separat
|
|
—
|
Se începe electroforeza cu 200 V
|
|
—
|
Se oprește după 30 – 45 de minute
|
8. Determinarea benzilor:
|
—
|
Se curăță gelul de agaroză în H2O distilată
|
|
—
|
În continuare, se transferă gelul de agaroză în bromură de etidiu timp de 15 – 30 minute
|
|
—
|
Apoi se fotografiază gelul de agaroză într-o cutie cu UV
|
|
—
|
În final, eșantioanele se analizează în comparație cu banda (benzile) controlului pozitiv și scara
|
Apendicele 10
Orientări privind prelevarea de țesut pentru determinarea sexului genetic prin metoda PCR la ghidrin
Prelevarea de țesut și extracția ADN-ului
ADN-ul poate fi extras utilizând o varietate de reactivi disponibili comercial și sisteme manuale și automate de extracție. Protocolul utilizat în laboratorul Cefas Weymouth este indicat mai jos și au fost adăugate metode alternative acolo unde a fost cazul.
|
1.
|
Cu ajutorul unor foarfece fine, se prelevă o bucată mică de țesut (10 – 20 mg) din zona dorsolaterală (după înlăturarea capului și a cozii pentru analiza VTG) de la fiecare pește. Țesutul se adaugă într-o eprubetă și fie este plasat direct în azot lichid (pentru depozitare la – 80 °C), fie umplut cu etanol 70 % (pentru transport și depozitare ulterioară la 4 °C). Foarfecele sunt curățate după fiecare pește în parte în etanol 70 %, apoi în apă distilată și se usucă cu hârtie absorbantă.
|
|
2.
|
Etanolul (dacă este prezent) este îndepărtat prin aspirare, iar țesutul este digerat peste noapte cu proteinaza K în 400 μl de tampon ATL (Qiagen). O alicotă (200 μl) de soluție de digestie este transferată într-un bloc S cu 96 de godeuri (Qiagen), iar ADN-ul este extras într-o structură cu 96 de godeuri folosind Qiagen Universal BioRobot și kitul QIamp Investigator BioRobot. ADN-ul este eluat în 50 μl de apă fără DNază și RNază. Dacă se folosesc țesuturi dure pentru a extrage ADN-ul (precum coloana vertebrală sau o înotătoare pectorală), poate fi necesar să se omogenizeze eșantionul în tampon pentru liză cu ajutorul unui produs de liză tisulară FastPrep® sau al unui sistem echivalent de liză tisulară.
În mod alternativ,
|
(a)
|
țesutul este digerat peste noapte cu proteinază K în 400 μl de tampon de liză G2 (Qiagen) și se extrage ADN-ul din 200 μl de țesut digerat utilizând fie kit-ul tisular ușor ADN EZ-1 și biorobotul EZ-1, fie minikit-ul tisular ușor ADN. AND-ul este eluat într-un volum de 50 μl.
|
|
(b)
|
Țesuturile sunt procesate utilizând reactivul DNAzol. Rezumând, eșantioanele de țesut sunt lizate în 1 ml de DNAzol timp de 10 minute într-o eprubetă de microcentrifugă de 1,5 ml și apoi centrifugate la 13 000 rpm timp de 5 minute pentru a îndepărta orice materie sub formă de particule. Eșantionul lizat este apoi transferat într-o nouă eprubetă de microcentrifugă de 1,5 ml care conține 500 μl de etanol 100 % de grad molecular și apoi centrifugat la 13 000 rpm timp de 10 minute pentru a precipita ADN-ul. Etanolul este îndepărtat și înlocuit cu 400 μl de etanol 70 % de grad molecular, centrifugat la 13 000 rpm timp de 5 minute, iar granulele de ADN sunt dizolvate în 50 μl de apă fără DNază și RNază moleculară. Din nou, atunci când se utilizează țesuturi dure (înotătoare pectorală), poate fi necesar să se omogenizeze eșantionul în tamponul pentru liză cu ajutorul unui produs de liză tisulară FastPrep® sau al unui sistem echivalent de liză tisulară înainte de extragerea ADN-ului.
|
|
|
3.
|
ADN-ul se păstrează la temperatura de – 20 °C, până în momentul utilizării.
|
Notă importantă: în cursul procedurilor este obligatorie purtarea mănușilor.
Testarea prin reacția în lanț a polimerazei (PCR)
Amplificările au fost efectuate utilizând 2,5 μl de extract de ADN într-un volum de reacție de 50 μl utilizând primeri de locus Idh (astfel cum a fost descris de Peichel et al., 2004. Current Biology 1:1416-1424):
|
Primer sens
|
5' GGG ACG AGC AAG ATT TAT TGG 3'
|
|
Primer antisens
|
5' TAT AGT TAG CCA GGA GAT GG 3'
|
Există numeroși furnizori de reactivi PCR corespunzători. Metoda descrisă mai jos este cea utilizată în prezent în laboratorul Cefas Weymouth.
1. Pregătirea «amestecului de reacție» (50 μl per eșantion):
Se prepară un amestec principal după cum urmează: Acesta poate fi pregătit în prealabil și păstrat în stare congelată la – 20 °C până în momentul utilizării. Amestecul principal trebuie să fie pregătit într-o cantitate suficientă pentru un control negativ (numai apă de calitate pentru biologie moleculară).
|
|
Volum (conc. stoc)/ eșantion
|
Concentrație finală
|
|
Tampon de reacție 5xGoTaq®
|
10μl
|
1x
|
|
MgCl2
|
5 μl (25 mM)
|
2,5 mM
|
|
Nucleotide (dATP, dCTP, dGTP, dTTP)
|
0,5 μl (25 mM fiecare)
|
250 μM fiecare
|
|
Primer sens
|
0,5μl (0,1 nmol/μl)
|
2 μM
|
|
Primer antisens
|
0,5μl (0,1 nmol/μl)
|
2 μM
|
|
Apă de calitate pentru biologie moleculară
|
30,75 μl
|
|
|
Polimerază GoTaq
|
0,25 μl
|
1,25 U
|
|
—
|
Se introduce 47,5 μl într-o eprubetă cu pereți subțiri de 0,5 ml pentru PCR.
|
|
—
|
Se adaugă 2,5 μl de ADN purificat în eprubeta marcată corespunzător. Procedura se repetă pentru toate eșantioanele și pentru controlul negativ.
|
|
—
|
Se adaugă deasupra 2 picături de ulei mineral. În mod alternativ, se utilizează un aparat de ciclizare termică cu capac încălzit.
|
|
—
|
Eșantioanele au fost denaturate într-un aparat de ciclizare termică Peltier PTC-225 la 94 ± 2 °C timp de 5 minute, urmată de 39 de cicluri la 94 ± 2 °C timp de 1 minut, 55 ± 2 °C timp de 1 minut, 72 ± 2 °C timp de 1 minut și o extensie finală la 72 ± 2 °C timp de 10 minute.
|
2. Prepararea gelului de agaroză (2 %):
În mod tradițional, produsele PCR sunt introduse într-un gel de agaroză 20 % care conține bromură de etidiu.
Pot fi utilizate, de asemenea, sisteme de electroforeză capilare.
|
—
|
Se cântăresc 2 g de agaroză în 100 ml 1 × tampon TAE
|
|
—
|
Se încălzesc într-un cuptor cu microunde (aproximativ 2 – 3 min) pentru a dizolva agaroza.
|
|
—
|
Se adaugă 2 picături de bromură de etidiu cu o concentrație finală de 0,5μg/ml
|
|
—
|
Se transferă soluția fierbinte în echipamentul de formare a gelului.
|
|
—
|
Se lasă gelul să se întărească
|
3. Electroforeza în gel:
|
—
|
Gelul de agaroză este transferat în echipamentul de electroforeză și se scufundă în 1 × tampon TAE
|
|
—
|
Se încarcă 20 μl din fiecare eșantion într-un godeu separat, adăugând un marker de greutate moleculară (scară ADN 100 bp, Promega) într-un godeu liber.
|
|
—
|
Electroforeza se realizează la 120 V timp de 30 – 45 de minute.
|
4. Vizualizarea produșilor de amplificare
Dacă bromura de etidiu a fost încorporată în gelul de agaroză astfel cum se descrie mai sus, produșii ADN sunt vizualizați cu o sursă de raze UV. Ca alternativă, gelul de agaroză este colorat prin acoperirea gelului cu soluție diluată de bromură de etidiu (0,5 μg/ml în apă) timp de 30 de minute înainte de vizualizare.
Apendicele 11
Orientări pentru procedura de fertilizare artificială a de ghidrinilor
Scopul acestei secțiuni este de a descrie procedurile de obținere a ouălor fertilizate de ghidrin în vederea utilizării lor în FSDT.
Proceduri
Obținerea spermei de la masculi
|
1.
|
Un mascul bine colorat din populația dorită este eutanasiat.
|
|
2.
|
Testiculele sunt disecate de pe fiecare latură a peștelui. Testiculele sunt în general structuri intens pigmentate, sub formă bastoane, care sunt ușor vizibile lateral de linia mediană a corpului. Se utilizează una dintre următoarele metode:
|
|
3.
|
Utilizând o pereche de foarfeci fine, se începe de la cloacă și se realizează o incizie de 1 – 1,5 cm într-o singură mișcare sub un unghi de circa 45 de grade.
|
|
4.
|
Se folosește un bisturiu pentru realizarea unei incizii mici în părțile laterale ale peștelui ușor posterior față de pelvis și imediat ventral față de plăcile laterale.
|
|
5.
|
Testiculele sunt îndepărtate utilizând un forceps fin și sunt plasate într-o placă Petri.
|
|
6.
|
Fiecare testicul este acoperit cu 100 μl de soluție finală Hank
(31) proaspăt preparată.
|
|
7.
|
Testiculele sunt tăiate mărunt folosind o lamă de oțel sau un bisturiu. Aceasta va elibera sperma și va conferi soluției Hank un aspect lăptos.
|
|
8.
|
Fluidul conținând spermă se adaugă într-o pipetă, încercând, în același timp, să nu se includă bucăți de țesut de testicule atunci când se pipetează.
|
|
9.
|
800 μl de soluție finală Hank se adaugă într-o eprubetă și se amestecă bine.
|
|
10.
|
Dacă este necesar, masculii pot fi conservați prin fixare în etanol 100 % sau în alt fixator dorit. Aceasta este deosebit de important în cazul în care studiul atribuie originea parentală a descendenților.
|
Notă importantă: Cu toate că majoritatea soluțiilor stoc necesare pot fi efectuate în avans,
soluția stoc 5
și, ulterior, soluția finală, trebuie constituite în stare
proaspătă
în ziua utilizării.
|
Soluția stoc 1
|
|
NaCl
|
8,00 g
|
|
KCl
|
0,40 g
|
|
Apă distilată (Distilled water – DW)
|
100 ml
|
|
Soluția stoc 2
|
|
Na2HPO4 (anhidru)
|
0,358 g
|
|
KH2PO4
|
0,60 g
|
|
DW
|
100 ml
|
|
Soluția stoc 3
|
|
CaCl2
|
0,72 g
|
|
DW
|
50 ml
|
|
Soluția stoc 4
|
|
MgSO4 · 7H2O
|
1,23 g
|
|
DW
|
50 ml
|
|
Soluția stoc 5 (proaspăt preparată)
|
|
NaHCO3
|
0,35 g
|
|
DW
|
10 ml
|
Notă: Dacă există disponibile unele dintre sărurile de mai sus dar cu conținut de apă diferit (i.e. 2H2O în loc de anhidre) ele pot fi utilizate, dar mai întâi se ajustează greutatea pe baza greutății moleculare).
Pentru soluția finală Hank se combină în următoarea ordine:
|
soluția stoc 1
|
1 ml
|
|
soluția stoc 2
|
0,1 ml
|
|
soluția stoc 3
|
0,1 ml
|
|
DW
|
8,6 ml
|
|
soluția stoc 4
|
0,1 ml
|
|
soluția stoc 5
|
0,1 ml
|
Se amestecă bine înainte de utilizare.
Fertilizare
|
1.
|
Se identifică femele mari, gestante, din populația dorită; femelele sunt gata de presare numai atunci când se pot vedea ouăle ieșind din cloacă. Femelele pregătite au o postură caracteristică cu capul în sus.
|
|
2.
|
Se presează ușor cu un deget pe partea laterală a peștelui în direcția spre coadă pentru a stimula expulzarea ouălor într-un vas Petri proaspăt. Acțiunea se repetă pe cealaltă parte, apoi peștele este întors în bazin.
|
|
3.
|
Ouăle pot fi răspândite (formând un monostrat) cu ajutorul unei pensule fine. Este important să se încerce expunerea a cât mai multor ouă la spermă maximalizând astfel aria suprafeței ouălor. Notă importantă: Ouăle se mențin umede prin plasarea unui șervet umed în jurul lor (este important ca ouăle să nu intre în contact direct cu apa pentru că acest lucru poate întări prematur corionul, împiedicând fertilizarea). Există o mare variație a numărului de ouă produse de fiecare femelă, dar ca o medie, ar trebui să se obțină cu ușurință aproximativ 150 de ouă de la o singură femelă gestantă.
|
|
4.
|
25μl de spermă în amestecul Hank se aplică în mod uniform pe întreaga suprafață a ouălor cu ajutorul unei pensule. Ouăle se vor întări rapid și își vor schimba culoarea (într-un minut) odată cu începerea fertilizării. Dacă numărul estimat de ouă este mai mare de 150 procedura se repetă. În mod similar, dacă ouăle nu se întăresc într-un minut se mai adaugă spermă. Notă importantă: Adăugarea de spermă suplimentară nu îmbunătățește neapărat rata de fertilizare.
|
|
5.
|
Ouăle și soluția de spermă trebuie lăsate să «interacționeze» timp de minimum 15 minute, iar ouăle fertilizate trebuie introduse în acvariile de expunere după 1,5 ore de la fertilizare.
|
|
6.
|
Procedura se repetă utilizând o altă femelă până se colectează numărul dorit de ouă.
|
|
7.
|
Se păstrează câteva ouă din ultimul lot și se fixează în acid acetic 10 %.
|
Numărarea și distribuirea ouălor în acvariile de testare
|
1.
|
Ouăle trebuie să fie distribuite în mod uniform între fiecare nivel de tratament pentru evitarea rezultatelor incorecte din cauze genetice. Fiecare lot de ouă fertilizate trebuie separat în grupe de mărimi egale (număr egal cu nivelurile de tratament) folosind un instrument neascuțit (forceps entomologic cu lame late sau o ansă de inoculare). În cazul în care se vizează 4 replici per tratament, fiecare cu 20 de ouă, trebuie să se distribuie 80 ouă per acvariu de expunere. Notă importantă: Este recomandabil să se adauge un supliment de 20 % (adică 96 de ouă per nivel de tratament) până când este sigur că se obțin rate de fertilizare de 100 %.
|
|
2.
|
Ouăle de ghidrin sunt foarte predispuse la infecții micotice în afara cuibului păzit de tată. În această privință, tratarea tuturor ouălor cu albastru de metilen în primele 5 de zile ale testului are o importanță capitală. O soluție stoc de albastru de metilen este preparată la concentrația de 1 mg/ml și este adăugată în acvariile de expunere pentru a se obține o concentrație finală maximă de 2,125 mg/l. Notă importantă: Ghidrinii nu trebuie să fie expuși la albastru de metilen odată eclozați, astfel încât sistemul trebuie să fie lipsit de albastru de metilen până în ziua 6.
|
|
3.
|
Ouăle se inspectează în fiecare zi și orice ouă moarte sau nefertilizate sunt înregistrate ca atare. Notă importantă: Ouăle nu trebuie să ajungă niciodată în afara apei până când eclozează, chiar și pentru perioade foarte scurte.
|
C.42 BIODEGRADABILITATEA ÎN APĂ DE MARE
INTRODUCEREA GENERALĂ
|
1.
|
Prezenta metodă de testare este echivalentă cu Orientarea OCDE privind testarea (TG) nr. 306 (1992). Atunci când au fost elaborate metodele de testare originale, nu se știa în ce măsură rezultatele testelor de screening pentru ușurința biodegradabilității, utilizând apă dulce cu inocul de apă de canal sau nămol activat, ar putea fi aplicate mediului marin. Cu privire la acest subiect au fost raportate rezultate variabile [de exemplu (1)].
|
|
2.
|
Multe ape reziduale industriale, care conțin o varietate de substanțe chimice, ajung în mare fie prin descărcare directă, fie prin intermediul unor estuare și râuri în care timpii de staționare sunt mici în comparație cu perioada necesară pentru biodegradarea completă a multora dintre substanțele chimice prezente. Având în vedere conștientizarea crescândă a nevoii de a proteja mediul marin împotriva unor cantități din ce în ce mai mari de substanțe chimice și necesitatea de a estima concentrația probabilă a substanțelor chimice în mare, au fost elaborate metode de testare a biodegradabilității în apa de mare.
|
|
3.
|
Metodele descrise aici folosesc apă de mare naturală atât ca fază apoasă, cât și ca sursă de microorganisme. În încercarea de a respecta metodele privind ușurința biodegradabilității în apă dulce, a fost investigată utilizarea apei de mare ultrafiltrate și centrifugate și a sedimentelor marine ca inocul. Aceste investigații au fost lipsite de succes. Prin urmare, mediul de testare este apa de mare naturală pretratată pentru îndepărtarea particulelor grosiere.
|
|
4.
|
Pentru a evalua biodegradabilitatea completă prin metoda agitării flaconului, trebuie să fie utilizate concentrații relativ mari ale substanței testate din cauza sensibilității mici a metodei analitice de determinare a carbonului organic dizolvat (dissolved organic carbon – DOC). Acesta, necesită în schimb adăugarea la apa de mare a unor nutrienți minerali (N și P), ale căror concentrații mici ar limita înlăturarea DOC. În metoda cu flaconul închis este de asemenea necesar să se adauge nutrienți din cauza concentrației substanței testate adăugate.
|
|
5.
|
Prin urmare, metodele nu sunt teste pentru ușurința biodegradabilității deoarece nu se adaugă inocul în plus față de microorganismele deja prezente în apa de mare. Teste nici nu simulează mediului marin, întrucât se adaugă nutrienți, iar concentrația substanței testate este mult mai mare decât ar fi prezentă în mare. Din aceste motive, metodele sunt propuse în cadrul unei noi secțiuni, «Biodegradabilitatea în apă de mare».
|
APLICARE
|
6.
|
Rezultatele testelor, care ar fi aplicate deoarece modelul de utilizare și de eliminare a substanței în cauză indică o cale către mare, oferă o primă impresie asupra biodegradabilității în apa de mare. Dacă rezultatul este pozitiv (îndepărtare > 70 % DOC; > 60 % ThOD – theoretical oxygen demand), se poate concluziona că există un potențial pentru biodegradare în mediul marin. Cu toate acestea, un rezultat negativ nu exclude un astfel de potențial, însă indică faptul că este necesar un studiu suplimentar, de exemplu, utilizând o concentrației a substanței testate cât mai mică.
|
|
7.
|
În orice caz, dacă o valoare mai definitivă pentru rata sau gradul de biodegradare în apa de mare într-un anumit loc este necesară, trebuie aplicate alte metode mai complexe și mai sofisticate și, prin urmare, mai costisitoare. De exemplu, ar putea fi aplicat un teste de simulare folosind o concentrație a substanței testate mai apropiată de concentrația din mediu probabilă. De asemenea, apa de mare nefortificată și nepretratată prelevată din locația de interes ar putea fi utilizată, iar biodegradarea primară ar putea fi urmată de analiza chimică specifică. Pentru biodegradabilitatea completă, ar fi necesare substanțe marcate cu 14C pentru a se putea măsura la concentrații care reflectă realist concentrațiile din mediu ratele dispariției 14C organic solubil și producția de 14CO2.
|
ALEGEREA METODELOR
|
8.
|
Selectarea metodei de utilizat depinde de o serie de factori; tabelul următor ajută la procesul de selecție. În timp ce substanțele cu solubilitate în apă sub echivalentul de 5 mg C/l nu pot fi testate prin metoda agitării flaconului, cel puțin, în principiu, substanțele puțin solubile în apă pot fi testate prin metoda de testare cu flacon închis.
Tabel
Avantajele și dezavantajele testării prin metoda agitării flaconului și a flaconului închis
|
METODĂ
|
AVANTAJE
|
DEZAVANTAJE
|
|
AGITAREA FLACONULUI
|
|
—
|
aparatură simplă cu excepția analizorului C
|
|
—
|
o durată de 60 de zile nu constituie o problemă
|
|
—
|
fără interferență din partea nitrificării
|
|
—
|
poate fi adaptată pentru substanțe volatile
|
|
|
—
|
utilizează 5 – 40 mg DOC/1, poate avea efect inhibitor
|
|
—
|
determinarea DOC este dificilă la concentrații mici în apa de mare (efect al clorurilor)
|
|
—
|
uneori DOC este mai mare în apa de mare
|
|
|
FLACON ÎNCHIS
|
|
—
|
determinare finală simplă
|
|
—
|
utilizează concentrație mică de substanță testată (2 mg/l), prin urmare, șanse mai mici de inhibiție
|
|
—
|
poate fi adaptată cu ușurință pentru substanțe volatile
|
|
|
—
|
poate fi dificil de menținut etanșeitatea flacoanelor
|
|
—
|
creșterea de bacterii pe peretele flaconului poate conduce la valori false
|
|
—
|
valorile absorției de O2 în martor pot fi mari în special după 28 de zile; ar putea fi eliminate prin învechirea apei de mare
|
|
—
|
posibilă interferență cu absorția de O2 prin nitrificare
|
|
|
METODA AGITĂRII FLACONULUI
INTRODUCERE
|
1.
|
Această metodă este o variantă cu apă de mare a Testului de screening modificat al OCDE descris în capitolul C.4B din prezenta anexă (2). A fost finalizată în urma unui test interlaboratoare organizat pentru Comisia Europeană (CE) de Institutul danez pentru calitatea apei (3).
|
|
2.
|
La fel ca în cazul metodei de testare cu flacon închis utilizând apă de mare, rezultatele acestui test nu trebuie să fie considerate drept indicatori ai ușurinței biodegradabilității, însă trebuie să fie utilizate pentru a obține informații privind biodegradabilitatea substanțelor în mediile marine.
|
PRINCIPIUL METODEI
|
3.
|
O cantitate predeterminată de substanță testată este dizolvată în mediul de testare pentru a se obține o concentrație de 5 – 40 mg de carbon organic dizolvat (DOC)/l. Dacă limitele sensibilității analizelor carbonului organic sunt îmbunătățite, poate fi avantajoasă utilizarea de concentrații mai mici ale substanței testate, în special pentru substanțele inhibitoare. Soluția substanței testate în mediul de testare este incubată în condiții aerobe cu agitare la întuneric sau la lumină difuză și la o temperatură fixă controlată (controlată la ± 2 °C) care în mod normal variază între 15 și 20 °C. În cazurile în care obiectivul studiului este acela de a simula condițiile de mediu, testele pot fi efectuate în afara acestui interval normal de temperatură. Durata testului maximă recomandată este de aproximativ 60 de zile. Degradarea este urmată de măsurători ale DOC (degradare completă) și, în unele cazuri, prin analize specifice (degradare primară).
|
INFORMAȚII PRIVIND SUBSTANȚA TESTATĂ
|
4.
|
Pentru a ști dacă testul poate fi aplicat unei anumite substanțe, trebuie să fie cunoscute anumite proprietăți ale acesteia. Trebuie stabilit conținutul de carbon organic din substanță, volatilitatea acesteia trebuie să fie astfel încât nu existe pierderi semnificative pe durata testului, iar solubilitatea ei în apă trebuie să fie mai mare decât echivalentul a 25 – 40 mg C/l. În plus, substanța testată nu trebuie să se absoarbă în mod semnificativ pe suprafața sticlei. Sunt necesare informații privind puritatea sau proporțiile relative ale componentelor majore ale substanței testate pentru ca rezultatele obținute să poată fi interpretate, în special atunci când rezultatul se situează aproape de nivelul de «trecere».
|
|
5.
|
Informațiile privind toxicitatea substanței testate pentru bacterii, de exemplu astfel cum este măsurată în testele ratei respirației pe termen scurt (4), pot fi utile atunci când sunt selectate concentrațiile de testare corespunzătoare și pot fi esențiale pentru interpretarea corectă a valorilor mici ale biodegradării. Cu toate acestea, astfel de informații nu sunt întotdeauna suficiente pentru interpretarea rezultatelor obținute în testarea biodegradării, iar procedura descrisă la punctul 18 este mai adecvată.
|
SUBSTANȚE DE REFERINȚĂ
|
6.
|
Trebuie utilizate substanțe de referință adecvate pentru a verifica activitatea microbiană a eșantionului de apă de mare. Benzoatul de sodiu, acetatul de sodiu și anilina sunt exemple de substanțe care pot fi utilizate în acest scop. Substanțele de referință trebuie să se degradeze într-un interval de timp rezonabil de scurt, altfel se recomandă repetarea testului folosind un alt eșantion de apă de mare.
|
|
7.
|
În testul interlaboratoare organizat de CE, în care eșantioanele de apă de mare au fost prelevate din diferite locații și în diferite momente din cursul unui an (3), faza de latență (tL) și timpul necesar obținerii unei degradări de 50 % (t50), cu excepția fazei de latență, au fost de 1 – 4 zile și, respectiv, de 1 – 7 zile pentru benzoatul de sodiu. În ceea ce privește anilina, tL a variat între 0 și 10 zile, în timp ce t50 a variat între 1 și 10 zile.
|
REPRODUCTIBILITATEA ȘI SENSIBILITATEA METODEI
|
8.
|
Reproductibilitatea metodei a fost stabilită în urma testului interlaboratoare (3). Cea mai mică concentrație a substanței testate, pentru care această metodă poate fi utilizată cu analiza DOC, este determinată în mare măsură prin limita de detectare a analizei carbonului organic (aproximativ 0,5 mg C/l, în prezent) și prin concentrația de carbon organic dizolvat în apa de mare utilizată (în general de ordinul a 3 – 5 mg/l pentru apa de mare din larg). Concentrația de fond a DOC nu trebuie să depășească în jur de 20 % din concentrația DOC total după adăugarea substanței testate. Dacă nu este fezabil, concentrația de fond a DOC poate fi redusă uneori prin învechirea apei de mare înainte de testare. Dacă metoda este folosită numai cu analiza chimică specifică (prin care se măsoară degradarea primară), investigatorul trebuie să documenteze, prin furnizarea de informații suplimentare, dacă se poate preconiza o degradare completă. Informațiile suplimentare pot consta în rezultatele obținute în urma altor teste privind biodegradabilitatea cu ușurință sau inerentă.
|
DESCRIEREA METODEI
Aparatură
|
9.
|
Aparatură obișnuită de laborator și:
|
a.
|
Dispozitiv de agitare care să poată conține flacoane Erlenmeyer de 0,5 – 2 litri, fie cu control automat al temperaturii, fie utilizat într-o cameră cu o temperatură constantă de 15 – 20 °C controlată la ± 2 °C;
|
|
b.
|
Flacoane Erlenmeyer de 0,5 – 2 litri cu gâtul îngust;
|
|
c.
|
Dispozitive de filtrare cu membrană, sau centrifuge;
|
|
d.
|
Filtre cu membrană, 0,2 – 0,45 μm;
|
|
f.
|
Echipamente pentru analize specifice (opțional).
|
|
Apa de mare
|
10.
|
Se prelevează un eșantion de apă de mare într-un recipient curățat cu atenție și se transportă la laborator, de preferință în termen de o zi sau două de la prelevare. Pe durata transportului, temperatura eșantionului nu trebuie lăsată să depășească semnificativ temperatura care urmează să fie utilizată în test. Se identifică cu precizie locația de unde a fost prelevat eșantionul și se descrie situația poluării și nutrienților. În special pentru apele de coastă, această caracterizare trebuie să includă numărul coloniilor microbiene heterotrofe și determinarea concentrațiilor azotatului, amoniacului și fosfatului dizolvați.
|
|
11.
|
Se furnizează următoarele informații pentru eșantionul de apă de mare:
|
—
|
adâncimea de prelevare;
|
|
—
|
aspectul eșantionului – tulbure etc.;
|
|
—
|
temperatura la momentul prelevării;
|
|
—
|
intervalul de timp dintre prelevare și utilizarea în test.
|
|
|
12.
|
În cazul în care conținutul de DOC din eșantionul cu apă de mare este mare (punctul 8), se recomandă ca apa de mare să fie învechită timp de aproximativ o săptămână înainte de utilizare. Învechirea se realizează prin depozitare în condiții aerobe la temperatura de testare la întuneric sau la lumină difuză. Dacă este necesar, condițiile aerobe sunt menținute prin aerare ușoară. Pe durata învechirii, conținutul materialului organic ușor degradabil este redus. În testul interlaboratoare (3), nu au fost observate diferențe între potențialele de degradare ale eșantioanelor de apă de mare învechită sau recent prelevate. Înainte de utilizare, apa de mare se tratează în prealabil pentru a îndepărta particulele mari, de exemplu prin filtrarea cu ajutorul unui filtru din nailon sau al unui filtru de hârtie cu porozitate mare (fără membrană sau filtre GF-C) sau prin sedimentare și decantare. Procedura utilizată trebuie raportată. Pretratamentul se efectuează după învechire, dacă se utilizează.
|
Soluții stoc pentru nutrienți minerali
|
13.
|
Se prepară următoarele soluții stoc folosind reactivi de puritate analitică:
|
(a)
|
Ortofosfat diacid monopotasic, KH2PO4
|
8,5 g
|
|
Ortofosfat acid dipotasic, K2HPO4
|
21,75 g
|
|
Ortofosfat acid disodic dihidrat, Na2HPO4
.2H2O
|
33,3 g
|
|
Clorură de amoniu, NH4Cl
|
0,5 g
|
|
Se dizolvă și se completează cu apă distilată până la 1 l.
|
|
|
(b)
|
Clorură de calciu, CaCl2
|
27,5 g
|
|
Se dizolvă și se completează cu apă distilată până la 1 l.
|
|
|
(c)
|
Sulfat de magneziu heptahidrat, MgSO4
.7H2O
|
22,5 g
|
|
Se dizolvă și se completează cu apă distilată până la 1 l.
|
|
|
(d)
|
Clorură de fier (III) hexahidrat, FeCl3
.6H2O
|
0,25 g
|
|
Se dizolvă și se completează cu apă distilată până la 1 l.
|
|
Precipitarea în soluție (d) poate fi prevenită prin adăugarea unei picături de HCl concentrat sau a 0,4 g de acid etilendiaminotetraacetic (EDTA, sare disodică) per litru. Dacă se formează un precipitat într-o soluție stoc, aceasta trebuie înlocuită cu o soluție nou preparată.
|
Pregătirea mediului de testare
|
14.
|
Se adaugă 1 ml din fiecare soluție stoc menționată mai sus per litru de apă de mare pretatată.
|
Inoculul
|
15.
|
Nu se adaugă un inocul specific în plus față de microorganismele care sunt deja prezente în apa de mare. Se determină (opțional) numărul de heterotrofe care formează colonii în mediul de testare cu apă de mare (și, de preferință, și în eșantioanele de apă de mare originale), de exemplu, prin numărarea pe placă, utilizând agar marin. Acest lucru este de dorit în special pentru eșantioanele prelevate din locații costiere sau poluate. Se verifică activitatea microbiană heterotrofă în apa de mare prin realizarea unui test cu o substanță de referință.
|
Pregătirea flacoanelor
|
16.
|
Se asigură că toate vasele din sticlă sunt curățate foarte atent, nu trebuie să fie neapărat sterile (de exemplu, folosind acid clorhidric alcoolic), se clătesc și se usucă înainte de utilizare pentru a evita contaminarea cu reziduuri rezultate din teste anterioare. Flacoanele trebuie, de asemenea, să fie curățate înainte de prima utilizare.
|
|
17.
|
Se evaluează substanțele testate în flacoane duplicat simultan, împreună cu un singur flacon pentru substanța de referință. Se realizează un test martor, în duplicat, fără substanța testată sau de referință, pentru determinarea valorilor analitice ale martorului. Se dizolvă substanțele testate în mediul de testare – ele pot să fie adăugate în mod convenabil prin intermediul unei soluții stoc concentrate – pentru a asigura concentrațiile inițiale dorite, în mod normal de 5 – 40 mg DOC/l. Se testează substanța de referință, în mod normal la o concentrație inițială corespunzătoare de 20 mg DOC/l. În cazul în care sunt utilizate soluții stoc ale substanței testate și/sau de referință, se asigură faptul că salinitatea mediului de apă de mare nu este modificat în mod semnificativ.
|
|
18.
|
În cazul în care sunt estimate efecte toxice sau dacă acestea nu pot fi excluse, se recomandă includerea unui experiment privind inhibarea, în duplicat, în protocolul de testare. Se adaugă substanțele testată și de referință în același vas, concentrația substanței de referință fiind, în mod normal, aceeași cu cea din testul de control (și anume 20 mg DOC/l) pentru a permite de comparațiile.
|
|
19.
|
Se varsă cantități adecvate de soluții de testare în flacoanele Erlenmeyer (până la aproximativ jumătatea volumului, ceea ce reprezintă o cantitate convenabilă) și apoi se acoperă fiecare flacon în mod neermetic (folie de aluminiu) pentru a permite schimbul gazos dintre flacon și aerul ambiental. (În cazul în care se utilizează analiza DOC, dopurile de vată nu sunt adecvate). Vasele se plasează pe agitator și se agită în mod continuu cu viteză redusă (de exemplu, 100 rpm) pe durata testului. Se controlează temperatură (15 – 20 °C și în intervalul ± 2 °C) și se protejează vasele de lumină pentru a evita creșterea de alge. Se asigură că aerul nu conține materiale toxice.
|
Test fizico-chimic de control (opțional)
|
20.
|
Dacă se suspectează degradarea abiotică sau mecanisme de pierdere, precum hidroliza (problemă care apare numai în cazul unei analize specifice), volatilizarea sau absorbția, se recomandă efectuarea unui test de control fizico-chimic. Acesta poate fi realizat prin adăugarea de clorură de mercur (II) (HgCl2) (32) (50 – 100 mg/l) în vase cu substanțe testată pentru a opri activitatea microbiană. O scădere semnificativă a DOC sau a concentrației substanței specifice în testul de control fizico-chimic indică prezența unor mecanisme de îndepărtare abiotice. (Dacă se utilizează clorură de mercur, trebuie să se acorde atenție interferențelor sau dezactivării catalizatorului în analiza DOC).
|
Numărul de flacoane
|
21.
|
Într-un test tipic sunt folosite următoarele flacoane:
|
Flacoanele 1 & 2
|
–
|
care conțin substanța testată (suspensia de testare);
|
|
Flacoanele 3 & 4
|
–
|
care conțin numai apă de mare (martor);
|
|
Flaconul 5
|
–
|
care conține substanța de referință (control procedură);
|
|
Flaconul 6
|
–
|
care conține substanța testată și de referință (control toxicitate) – opțional;
|
|
Flaconul 7
|
–
|
care conține substanța testată și agentul de sterilizare (control steril abiotic) – opțional.
|
|
Analiza DOC
|
22.
|
Pe parcursul testului, eșantioanele se extrag la intervale adecvate pentru analiza DOC (apendicele 1). Eșantioanele se prelevează întotdeauna la începutul testului (ziua 0) și în ziua 60. Cel puțin cinci eșantioane în total sunt necesare pentru a descrie evoluția în timp a degradării. Nu se poate indica un calendar fix pentru eșantionare întrucât viteza de biodegradare variază. Se determină DOC în duplicat pentru fiecare eșantion.
|
Eșantionarea
|
23.
|
Volumul necesar de eșantioane depinde de metoda de analiză (analiză specifică), de analizorul de carbon utilizat și de procedura (filtrarea cu membrană sau centrifugarea) selectată pentru tratamentul eșantionului înainte de determinarea carbonului (punctele 25 și 26). Înainte de eșantionare, trebuie să se asigure că mediul de testare este bine amestecat și că orice material aderent pe peretele flaconului este dizolvat sau suspendat.
|
|
24.
|
Se filtrează cu membrană sau se centrifughează imediat după eșantionare. Dacă este necesar, eșantioanele filtrate sau centrifugate se depozitează la 2 – 4 °C timp de 48 de ore sau sub – 18 °C pentru perioade de timp mai lungi (dacă se cunoaște faptul că substanța va rămâne neafectată, se acidifiază la pH 2 înainte de depozitare).
|
|
25.
|
Filtrele cu membrană (0,2 – 0,45 μm) sunt adecvate dacă se asigură că acestea nu eliberează carbon și nu absorb substanța în etapa de filtrare, de exemplu, filtre cu membrană din policarbonat. Anumite filtre cu membrană sunt impregnate cu agenți tensioactivi pentru hidrofilizare și pot elibera cantități considerabile de carbon dizolvat. Aceste filtre se pregătesc prin fierberea în apă deionizată pe parcursul a trei perioade consecutive, fiecare cu durata de o oră. După fierbere, filtrele se depozitează în apă deionizată. Primii 20 ml de filtrat se elimină.
|
|
26.
|
Centrifugarea eșantioanelor poate fi aleasă ca alternativă la filtrarea cu membrană. Se realizează centrifugarea la 40 000 m.s– 2 (~ 4 000 g) timp de 15 minute, de preferință într-o centrifugă frigorifică.
Notă: Diferențierea dintre carbonul organic total (Total Organic Carbon – TOC) și DOC (TOC/DOC) prin centrifugare la concentrații foarte mici nu pare să funcționeze, deoarece fie nu au fost îndepărtate toate bacteriile, fie carbonul, ca parte a plasmei bacteriene, este redizolvat. La concentrații mai mari (> 10 mg C per litru), eroarea în urma centrifugării pare a fi comparativ mică.
|
Frecvența eșantionării
|
27.
|
Dacă analizele sunt efectuate imediat după eșantionare, se evaluează următorul moment de eșantionare, luând în considerare rezultatul determinării analitice.
|
|
28.
|
Dacă eșantioanele sunt conservate (punctul 24) pentru o analiză ulterioară, trebuie prelevate mai multe eșantioane decât numărul minim de cinci. Se analizează mai întâi ultimele eșantioane prelevate și, printr-o selecție pas cu pas «inversă» a eșantioanelor adecvate pentru analiză, este posibilă obținerea unei bune descrieri a curbei de biodegradare cu un număr relativ mic de determinări analitice. În cazul în care până la sfârșitul testului nu există degradare, nu mai este necesară analiza de eșantioane suplimentare, și în această situație, strategia «inversă» poate asigura economisirea unei părți considerabile a costurilor analitice.
|
|
29.
|
Dacă se observă un platou al curbei de degradare înainte de ziua 60, se încheie testul. Dacă degradarea a început în mod evident înainte de ziua 60, dar nu a atins un platou, experimentul se prelungește pentru o perioadă suplimentară.
|
DATE ȘI RAPORTARE
Tratamentul rezultatelor
|
30.
|
Se înregistrează rezultatele analitice pe fișa de date anexată (apendicele 2) și se calculează valorile biodegradării pentru substanțele testată și de referință pe baza ecuației:

unde:
|
Dt
|
=
|
degradarea în procent de îndepărtare a DOC sau a substanței specifice în momentul t;
|
|
Co
|
=
|
concentrația inițială a DOC sau a substanței specifice în mediul de testare;
|
|
Ct
|
=
|
concentrația DOC sau a substanței specifice în mediul de testare la momentul t,
|
|
Cbl(0)
|
=
|
concentrația inițială a DOC sau a substanței specifice în martor,
|
|
Cbl(t)
|
=
|
concentrația DOC sau a substanței specifice în martor la momentul t;
|
|
|
31.
|
Se indică degradarea sub formă de procent al îndepărtării DOC (degradare completă) sau a substanței specifice (degradare primară) la momentul t. Concentrațiile DOC se calculează cu rotunjire la cea mai apropiată zecime de mg/l și se rotunjesc valorile medii ale Dt la cel mai apropiat procent întreg.
|
|
32.
|
Se ilustrează în mod grafic curba de degradare într-o diagramă astfel cum se indică în figura «Validitatea și interpretarea rezultatelor». Dacă există suficiente date, pornind de la această curbă, se calculează faza de latență tL) și timpul necesar pentru a obține îndepărtarea în proporție de 50 % după încheierea fazei de latență (t50).
|
Raportul privind testul
|
33.
|
Raportul privind testul trebuie să conțină următoarele informații:
|
|
Substanța testată:
|
—
|
natura fizică și, dacă este relevant, proprietățile fizico-chimice;
|
|
|
|
Condiții de testare:
|
—
|
locul prelevării de eșantioane și descrierea sa; situația poluării și a nutrienților (numărul coloniilor, azotat, amoniu, fosfat, dacă este cazul);
|
|
—
|
caracteristicile eșantionului [data eșantionării, adâncimea, aspectul, temperatura, salinitatea, DOC (opțional), intervalul de timp dintre prelevare și utilizarea în test];
|
|
—
|
metoda utilizată (dacă este cazul) pentru învechirea apei de mare;
|
|
—
|
metoda utilizată pentru pretratarea (filtrare/sedimentare) apei de mare;
|
|
—
|
metoda utilizată pentru determinarea DOC;
|
|
—
|
metoda utilizată pentru analize specifice (opțional);
|
|
—
|
metoda utilizată pentru determinarea numărului de heterotrofe în apa de mare (metoda de numărare pe placă sau o procedură alternativă) (opțional);
|
|
—
|
alte metode (opțional) utilizate pentru caracterizarea apei de mare (măsurători ale ATP etc.).
|
|
|
|
Rezultate:
|
—
|
datele analitice raportate într-o fișă de date (apendicele 2);
|
|
—
|
evoluția testului de degradare este reprezentată grafic într-o diagramă indicând faza de latență (tL), panta și timpul (începând cu sfârșitul fazei de latență) de obținere a îndepărtării în proporție de 50 % (t50). Faza de latență poate fi estimată grafic astfel cum se indică în figura din secțiunea «Validitatea și interpretarea rezultatelor» sau considerată în mod convenabil ca timpul necesar pentru o degradare de 10 %;
|
|
—
|
procentul de degradare măsurat după 60 de zile sau la sfârșitul testului.
|
|
|
Validitatea și interpretarea rezultatelor
|
34.
|
Rezultatele obținute cu substanțele de referință, de exemplu benzoatul de sodiu, acetatul de sodiu sau anilina, trebuie să fie comparabile cu rezultatele obținute în testul interlaboratoare (3) (a se consulta secțiunea «Substanțe de referință», punctul 7). Dacă rezultatele obținute cu substanțele de referință sunt atipice, testul trebuie repetat folosind alt eșantion de apă de mare. Deși rezultatele testelor de inhibiție nu pot fi întotdeauna ușor de interpretat din cauza aportului de DOC al substanței testate, o reducere semnificativă a ratei de îndepărtare a DOC total, în raport cu cea controlului, este un semn pozitiv că există efecte toxice.
|
|
35.
|
Ca urmare a concentrațiilor de testare relativ mari utilizate în raport cu cea mai mare parte a sistemelor naturale (și în consecință, a unui raport nefavorabil între concentrațiile substanțelor testate și a altor surse de carbon), metoda trebuie considerată ca test preliminar care poate fi utilizat pentru a indica dacă o substanță este sau nu ușor degradabilă. Prin urmare, un rezultat slab nu înseamnă în mod necesar că substanța testată nu este biodegradabilă în medii marine, ci indică faptul că pentru a stabili aceasta vor fi necesare studii suplimentare.
Un exemplu de experiment teoretic privind degradarea ilustrând un mod fezabil de estimare a valorilor tL (durata «fazei de latență») și t50 (intervalul de timp, începând de la tL), necesare pentru a obține o îndepărtare în proporție de 50 %, este oferit în figura de mai jos.

|
METODA FLACONULUI ÎNCHIS
INTRODUCERE
|
1.
|
Această metodă este o variantă de testare cu apă de mare prin testul cu flaconul închis (5) și a fost finalizată în urma unui test interlaboratoare organizat pentru Comisia Europeană (CE) de Institutul danez pentru calitatea apei (3).
|
|
2.
|
La fel ca în cazul metodei însoțitoare de testare cu apă de mare prin agitarea flaconului, rezultatele acestui test nu trebuie să fie considerate drept indicații ale ușurinței biodegradabilității, însă trebuie să fie utilizate în mod specific pentru a obține informații privind biodegradabilitatea substanțelor din mediile marine.
|
PRINCIPIUL METODEI
|
3.
|
O cantitate predeterminată de substanță testată este dizolvată în mediul de testare într-o concentrație, de obicei, de 2 – 10 mg de substanță testată per litru (pot fi utilizate una sau mai multe concentrații). Soluție este păstrată într-un flacon plin, închis, la întuneric, într-o baie cu temperatură constantă sau într-o incintă controlată la ± 1 °C în intervalul 15 – 20 °C. În cazurile în care obiectivul studiului este acela de a simula condițiile de mediu, testele pot fi efectuate în afara acestui interval normal de temperatură, cu condiția efectuării ajutărilor adecvate pentru a controla temperatura. Degradarea este urmată de analizele oxigenului pe parcursul unei perioade de 28 de zile.
|
|
4.
|
Testul interlaboratoare a indicat că dacă testul se prelungește peste perioada de 28 de zile, nu pot fi colectate informații utile, în cele mai multe dintre cazuri, din cauza interferențelor severe. Valorile consumului biologic de oxigen (biological oxygen demand – BOD) pentru martor au fost excesiv de mari, probabil din cauza creșterii parietale, ca urmare a neagitării și a nitrificării. Așadar, durata recomandată este de 28 de zile, însă dacă valoarea BOD pentru martor se menține în limita a 30 % (punctele 15 și 40), perioada de testare poate fi prelungită.
|
INFORMAȚII PRIVIND SUBSTANȚA TESTATĂ
|
5.
|
Pentru a ști dacă testul poate fi aplicat unei anumite substanțe, trebuie să fie cunoscute anumite proprietăți ale acesteia. Este necesară formula empirică pentru a putea calcula consumul teoretic de oxigen (theoretical oxygen demand – ThOD) (a se vedea apendicele 3); altfel, consumul chimic de oxigen (chemical oxygen demand – COD) al substanței trebuie să fie determinat pentru a servi ca valoare de referință. Utilizarea COD este mai puțin satisfăcătoare, deoarece unele substanțe nu sunt complet oxidate în testul COD.
|
|
6.
|
Solubilitatea substanței trebuie să fie de minimum 2 mg/l, deși, în principiu, ar putea fi testate substanțe mai puțin solubile (de exemplu, folosind ultrasonicarea), la fel cum ar putea fi testate și substanțele volatile. Sunt necesare informații privind puritatea sau proporțiile relative ale componentelor majore ale substanței testate pentru ca rezultatele obținute să poată fi interpretate, în special atunci când rezultatul se situează aproape de nivelul de «trecere».
|
|
7.
|
Informațiile privind toxicitatea substanței pentru bacterii, de exemplu astfel cum este măsurată în testele de respirație pe termen scurt (4), pot fi foarte utile atunci când sunt selectate concentrațiile de testare corespunzătoare și pot fi esențiale pentru interpretarea corectă a valorilor mici ale biodegradabilității. Cu toate acestea, astfel de informații nu sunt întotdeauna suficiente pentru interpretarea rezultatelor obținute în testarea biodegradării, iar procedura descrisă la punctul 27 este mai adecvată.
|
SUBSTANȚE DE REFERINȚĂ
|
8.
|
Trebuie utilizate substanțe de referință adecvate pentru a verifica activitatea microbiană a eșantionului de apă de mare. Anilina, acetatul de sodiu sau benzoatul de sodiu (de exemplu) pot fi utilizate în acest scop. O degradare a acestor substanțe în proporție de cel puțin 60 % (din ThOD-ul lor) trebuie să intervină într-un interval de timp rezonabil de scurt, altfel se recomandă ca testul să fie repetat folosind alt eșantion de apă de mare.
|
|
9.
|
În testul interlaboratoare organizat de CE în urma căruia au fost prelevate eșantioane de apă de mare din diferite locații și în momente diferite pe parcursul anului, faza de latență (tL) și timpul necesar obținerii unei degradări de 50 % (t50), neincluzând faza de latență, au fost de 0 – 2 zile și, respectiv, de 1 ± 4 zile pentru benzoatul de sodiu. Pentru anilină, valorile tLși t50 au fost de 0 – 7 zile și, respectiv, de 2 – 12 zile.
|
REPRODUCTIBILITATE
|
10.
|
Reproductibilitatea metodelor a fost stabilită prin testul interlaboratoare organizat de CE (3).
|
DESCRIEREA METODEI
Aparatură
|
11.
|
Echipament de laborator obișnuit și:
|
(a)
|
Pot fi utilizate flacoane BOD de 250 – 300 ml cu dop de sticlă sau flacoane cu gât îngust de 250 ml cu dop de sticlă;
|
|
(b)
|
Mai multe flacoane de 2-, 3- și 4- litri cu gradație pentru litri pentru pregătirea experimentului și pentru umplerea flacoanelor BOD;
|
|
(c)
|
Baie de apă sau o cameră cu temperatură constantă pentru păstrarea flacoanelor la temperatură constantă (± 1 °C) ferite de lumină.
|
|
(d)
|
Echipament pentru analiza oxigenului dizolvat;
|
|
(e)
|
Filtre cu membrană, 0,2 – 0,45 μm (opțional);
|
|
(f)
|
Echipamente pentru analize specifice (opțional).
|
|
Apa de mare
|
12.
|
Se prelevează un eșantion de apă de mare într-un recipient curățat cu atenție și se transportă la laborator, de preferință în termen de o zi sau două după prelevare. Pe durata transportului, temperatura eșantionului nu trebuie lăsată să depășească semnificativ temperatura care urmează să fie utilizată în test.
|
|
13.
|
Locația de unde a fost prelevat eșantionul se identifică cu precizie și se descrie situația poluării și a nutrienților. În special pentru apele de coastă sau poluate, această descriere trebuie să includă numărul coloniilor microbiene heterotrofe și determinarea concentrațiilor azotatului, amoniului și fosfatului dizolvați.
|
|
14.
|
Se furnizează următoarele informații pentru eșantionul de apă de mare:
|
—
|
adâncimea de prelevare;
|
|
—
|
aspectul eșantionului – tulbure etc.;
|
|
—
|
temperatura la momentul prelevării;
|
|
—
|
carbonul organic dizolvat (DOC);
|
|
—
|
intervalul de timp dintre prelevare și utilizarea în test.
|
|
|
15.
|
În cazul în care conținutul de DOC dintr-un eșantion se dovedește a fi mare sau în care se consideră că BOD pentru martor după 28 de zile va fi mai mare de 30 % din cel al substanțelor de referință, se recomandă ca apa de mare să fie învechită timp de aproximativ o săptămână înainte de utilizare.
|
|
16.
|
Eșantionul se învechește prin depozitare în condiții aerobe la temperatura de testare, la întuneric sau la lumină difuză. Dacă este necesar, condițiile aerobe sunt menținute prin aerare ușoară. Pe durata învechirii, conținutul materialului organic ușor degradabil este redus. În testul interlaboratoare (3), nu au fost observate diferențe între potențialele de degradare ale eșantioanelor de apă de mare învechite sau recent prelevate.
|
|
17.
|
Înainte de utilizare, apa de mare este tratată în prealabil pentru a îndepărta particulele mari, de exemplu prin filtrare cu ajutorul unui filtru din nailon sau al unui filtru de hârtie cu porozitate mare (fără membrană sau filtre GF-C) sau prin sedimentare și decantare. Procedura utilizată se raportează. După învechire se pretratează, dacă se utilizează.
|
Soluții stoc pentru nutrienți minerali
|
18.
|
Se prepară următoarele soluții stoc folosind reactivi de puritate analitică:
|
(a)
|
Ortofosfat diacid monopotasic, KH2PO4
|
8,5 g
|
|
Ortofosfat acid dipotasic, K2HPO4
|
21,75 g
|
|
Ortofosfat acid disodic dihidrat, Na2HPO4
.2H2O
|
33,3 g
|
|
Clorură de amoniu, NH4Cl
|
0,5 g
|
|
Se dizolvă și se completează cu apă distilată până la 1 l.
|
|
|
(b)
|
Clorură de calciu, CaCl2
|
27,5 g
|
|
Se dizolvă și se completează cu apă distilată până la 1 l.
|
|
|
(c)
|
Sulfat de magneziu heptahidrat, MgSO4
.7H2O
|
22,5 g
|
|
Se dizolvă și se completează cu apă distilată până la 1 l.
|
|
|
(d)
|
Clorură de fier (III) hexahidrat, FeCl3
.6H2O
|
0,25 g
|
|
Se dizolvă și se completează cu apă distilată până la 1 l.
|
|
Precipitarea în soluție (d) poate fi prevenită prin adăugarea unei picături de HCl concentrat sau a 0,4 g de acid etilendiaminotetraacetic (EDTA, sare disodică) per litru. Dacă se formează un precipitat într-o soluție stoc, aceasta trebuie înlocuită cu o soluție nou preparată.
|
Pregătirea mediului de testare
|
19.
|
Se adaugă pentru fiecare litru de apă de mare pretratată 1 l din fiecare dintre soluțiile stoc sus-menționate. Se saturează mediul de testare cu aer la temperatura de testare prin aerarea cu aer comprimat curat timp de aproximativ 20 de minute. Se determină concentrația oxigenului dizolvat pentru control. Concentrația saturată a oxigenului dizolvat ca funcție a salinității și temperatura pot fi citite în nomograma anexată la această metodă de testare (apendicele 4).
|
Inoculul
|
20.
|
Nu se adaugă un inocul specific în plus față de microorganismele care sunt deja prezente în apa de mare. Se determină (opțional) numărul de heterotrofe care formează colonii în mediul de testare cu apă de mare (și, de preferință, și în eșantionul de apă de mare original), de exemplu, prin numărarea pe placă utilizând agar marin. Acest lucru este de dorit în special pentru eșantioanele prelevate din locații costiere sau poluate. Se verifică activitatea microbiană heterotrofă în apa de mare prin realizarea unui test cu o substanță de referință.
|
Pregătirea flacoanelor de testare
|
21.
|
Se efectuează toate manipulările necesare, inclusiv învechirea și pretratarea apei de mare la temperatura de testare aleasă între 15 și 20 °C, asigurând curățenia, dar nu sterilitatea, tuturor vaselor din sticlă.
|
|
22.
|
Se pregătesc grupuri de flacoane BOD pentru determinarea BOD cu substanțele testată și de referință în serii experimentale simultane. Se efectuează toate analizele pe flacoanele duplicat (martor, substanțe de referință și testată), adică se pregătesc două flacoane pentru fiecare determinare. Se efectuează analize cel puțin în zilele 0, 5, 15 și 28 (patru determinări). Pentru analizele oxigenului, patru determinări necesită un total de 3 × 2 × 4 = 24 de flacoane (martor, substanță de referință și substanță testată) și, prin urmare, aproximativ 8 litri de mediu de testare (pentru o concentrație de substanță testată).
|
|
23.
|
Se prepară soluții separate pentru substanțele de referință și testată în flacoane mari cu un volum suficient (punctul 11) prin adăugarea mai întâi a substanțelor testată și de referință, fie direct, fie prin utilizarea unei soluții stoc concentrate în flacoanele mari parțial umplute. Se adaugă mediu de testare suplimentar pentru a se asigura concentrațiile dorite finale. În cazul în care sunt utilizate soluții stoc de substanță testată și/sau de referință, se asigură faptul că salinitatea mediului cu apă de mare nu este modificată în mod semnificativ.
|
|
24.
|
Se selectează concentrațiile substanțelor testată și de referință ținând cont de:
|
(a)
|
solubilitatea oxigenului dizolvat în apa de mare la temperatura de testare predominantă și salinitatea (a se vedea nomograma anexată – apendicele 4);
|
|
(b)
|
valoarea BOD a apei de mare din martor; și
|
|
(c)
|
biodegradabilitatea preconizată a substanței testate.
|
|
|
25.
|
La 15 °C și 20 °C și la o salinitate de 32 de părți la mie (apă de ocean), solubilitatea oxigenului dizolvat este de aproximativ 8,1 și 7,4 mg/l, respectiv. Consumul de oxigen al apei de mare înseși (respirație martor) poate fi de 2 mg O2/l sau mai mult, în cazul în care apa de mare nu este învechită. Prin urmare, în vederea asigurării unei concentrații semnificative de oxigen care să rămână după oxidarea substanței testate, se utilizează o concentrație inițială a substanței testate de aproximativ 2 – 3 mg/l (în funcție de ThOD) pentru substanțele pentru care se preconizează că se vor degrada complet în condițiile testului (precum substanțele de referință). Substanțele mai puțin degradabile se testează la concentrații mai mari, de până la aproximativ 10 mg/l, cu condiția să nu apară efecte toxice. Efectuarea de teste paralele cu o concentrație mică (aproximativ 2 mg/l) și mare (aproximativ 10 mg/l) a substanței testate poate fi avantajoasă.
|
|
26.
|
Un martor pentru oxigen trebuie să fie determinat în paralel în flacoanele care nu conțin nici substanță testată, nici substanță de referință.
|
|
27.
|
Dacă trebuie determinate efecte inhibitorii, se pregătește următoarea serie de soluții în flacoane mari separate (punctul 13):
|
(a)
|
2 mg/l de substanță ușor degradabilă, de exemplu orice substanță de referință menționată;
|
|
(b)
|
x mg/l de substanță testată (x este în general 2);
|
|
(c)
|
2 mg/l de substanță ușor degradabilă plus x mg/l de substanță testată.
|
|
Test fizico-chimic de control (opțional)
|
28.
|
Dacă se recurge la opțiunea utilizării de analize specifice, poate fi realizat un experiment fizico-chimic pentru a verifica dacă substanța testată este îndepărtată prin mecanisme abiotice, precum hidroliza sau adsorbția. Un test fizico-chimic de control poate fi efectuat prin adăugarea de clorură de mercur (II) (HgCl2) (33) (50 – 100 mg/l) în flacoanele duplicat cu substanță testată pentru a opri activitatea microbiană. O scădere semnificativă a concentrației substanței specifice în cursul testului indică prezența unor mecanisme de îndepărtare abiotice.
|
Numărul de flacoane BOD într-o testare tipică
|
29.
|
Într-o testare tipică sunt folosite următoarele flacoane:
|
—
|
cel puțin 8 care conțin substanța testată;
|
|
—
|
cel puțin 8 care conțin numai apă de mare fortificată cu nutrienți;
|
|
—
|
cel puțin 8 care conțin substanța de referință și dacă este necesar
|
|
—
|
6 flacoane care conțin substanță testată și de referință (control pentru toxicitate).
|
|
PROCEDURA
|
30.
|
După preparare, se sifonează imediat fiecare soluție, din sfertul inferior (nu din partea de jos) într-un flacon suficient de mare, pentru a umple respectivul grup de flacoane BOD. Imediat se analizează controalele zero (timp zero) pentru oxigenul dizolvat (punctul 33) sau se conservă pentru analiză chimică ulterioară prin precipitare cu MnCl2 [clorură de mangan (II)] și NaOH (hidroxid de sodiu).
|
|
31.
|
Se incubează flacoanele BOD paralele rămase la temperatura de testare (15 – 20 °C), se mențin în întuneric și se scot din zona de incubare la intervale de timp adecvate (de exemplu, după minimum 5, 15 și 28 zile) și se analizează oxigenul dizolvat (punctul 33).
|
|
32.
|
Se filtrează cu filtru cu membrană (0,2 – 0,45 μm) sau se centrifughează, timp de 15 minute, eșantioanele pentru analize specifice (opțional). Se depozitează timp de până la 48 de ore la 2 – 4 °C sau perioade mai lungi la – 18 °C, dacă nu sunt analizate imediat (dacă se știe că substanța testată nu va fi afectată, se acidifică la pH 2 înainte de depozitare).
|
Determinarea oxigenului dizolvat
|
33.
|
Se determină concentrația oxigenului dizolvat folosind o metodă chimică sau electrochimică recunoscută la nivel național sau internațional.
|
DATE ȘI RAPORTARE
Prelucrarea rezultatelor
|
34.
|
Se înregistrează rezultatele analitice pe fișele de date anexate (apendicele 5).
|
|
35.
|
Se calculează BOD ca diferența de depleție de oxigen între un martor și o soluție a substanței testate în condițiile de testare. Se împarte depleție netă de oxigen la concentrația (G/V) substanței pentru a exprima BOD ca mg BOD/mg substanță testată. Degradarea este definită ca raportul dintre consumul biochimic de oxigen și, de preferință, consumul teoretic de oxigen (ThOD) sau consumul chimic de oxigen (COD) și se exprimă ca procent (a se vedea punctul 36).
|
|
36.
|
Se calculează valorile biodegradării pentru fiecare moment de eșantionare pentru substanța chimică testată și pentru substanța de referință, utilizând una dintre ecuațiile:


unde:
|
ThOD
|
=
|
consumul teoretic de oxigen (calculare, apendicele 3)
|
|
COD
|
=
|
consumul chimic de oxigen, determinat experimental.
|
Notă: Uneori, cele două modalități de calculare (procent din ThOD sau procent din COD) nu furnizează aceleași rezultate; se preferă să utilizeze ThOD, deoarece unele substanțe nu sunt complet oxidate în testul COD.
|
|
37.
|
Se ilustrează în mod grafic curba de degradare într-o diagramă (a se vedea un exemplu în secțiunea «Validitatea și interpretarea rezultatelor»). Dacă există suficiente date, din această curbă se calculează faza de latență tL) și timpul necesar pentru a obține îndepărtarea în proporție de 50 % de la încheierea fazei de latență (t50).
|
|
38.
|
Dacă se folosește analiza specifică (opțional), se precizează degradarea primară ca procent al îndepărtării substanței specifice în perioada de testare (corectată pentru martorii analitici).
|
Raportul privind testul
|
39.
|
Raportul privind testul trebuie să conțină următoarele informații:
|
|
Substanța testată:
|
—
|
natura fizică și, dacă este relevant, proprietățile fizico-chimice;
|
|
|
|
Condiții de testare:
|
—
|
locul prelevării de eșantioane și descrierea sa: situația poluării și a nutrienților (numărul coloniilor, azotat, amoniu, fosfat, dacă este cazul);
|
|
—
|
caracteristicile eșantionului [data eșantionării, adâncimea, aspectul, temperatura, salinitatea, DOC (opțional), intervalul de timp dintre prelevare și utilizarea în test];
|
|
—
|
metoda utilizată (dacă este cazul) pentru învechirea apei de mare;
|
|
—
|
metoda utilizată pentru pretratarea (filtrare/sedimentare) apei de mare;
|
|
—
|
metoda utilizată pentru determinarea COD (dacă este efectuată);
|
|
—
|
metoda utilizată pentru măsurarea oxigenului;
|
|
—
|
procedura de dispersie pentru substanțele care sunt puțin solubile în condițiile de testare;
|
|
—
|
metoda utilizată pentru determinarea numărului de heterotrofe în apa de mare (metoda de numărare pe placă sau o procedură alternativă);
|
|
—
|
metoda utilizată pentru determinarea DOC în apa de mare (opțional);
|
|
—
|
metoda utilizată pentru analize specifice (opțional);
|
|
—
|
alte metode opționale utilizate pentru caracterizarea apei de mare (măsurători ale ATP etc.).
|
|
|
|
Rezultate:
|
—
|
datele analitice raportate în fișa de date (astfel cum este anexată, apendicele 5);
|
|
—
|
evoluția testului de degradare reprezentată grafic într-o diagramă indicând faza de latență (tL), panta și timpul (începând cu sfârșitul fazei de latență) necesar atingerii absorbție finale a oxigenului proporție de 50 % (t50) cauzate de oxidarea substanței testate. Faza de latență poate fi estimată grafic astfel cum se indică în figura atașată sau considerată, în mod convențional, ca fiind timpul necesar pentru o degradare de 10 %;
|
|
—
|
procentul de degradare măsurat după 28 de zile.
|
|
|
Validitatea și interpretarea rezultatelor
|
40.
|
Respirația martor nu trebuie să depășească 30 % din oxigenul din flaconul de testare. Dacă nu este posibil să se respecte acest criteriu folosind apă de mare proaspăt prelevată, apa de mare trebuie să fie învechită (stabilizată) înainte de utilizare.
|
|
41.
|
Trebuie luată în considerare posibilitatea ca substanțele care conțin azot să afecteze rezultatele.
|
|
42.
|
Rezultatele obținute cu substanțele de referință benzoat de sodiu și anilină trebuie să fie comparabile cu rezultatele obținute în testul interlaboratoare (3) (punctul 9). Dacă rezultatele obținute cu substanțele de referință sunt atipice, testul trebuie repetat folosind alt eșantion de apă de mare.
|
|
43.
|
Substanța testată poate fi considerată inhibitoare pentru bacterii (la concentrația utilizată) dacă BOD a amestecului dintre substanța de referință și cea testată este mai mic decât suma BOD pentru soluțiile separate ale celor două substanțe.
|
|
44.
|
Ca urmare a concentrațiilor relativ mari utilizate în test față de cea mai mare parte a sistemelor naturale și, în consecință, a unui raport nefavorabil între concentrațiile substanțelor testate și a altor surse de carbon, metoda trebuie considerată ca test preliminar care poate fi utilizat pentru a indica dacă o substanță este sau nu ușor biodegradabilă. Prin urmare, un rezultat slab nu înseamnă în mod necesar că substanța testată nu este biodegradabilă în medii marine, ci indică faptul că pentru a stabili acest aspect vor fi necesare studii suplimentare.
Mai jos este prezentat un exemplu de experiment de degradare teoretică ilustrând un mod fezabil de estimare a valorilor tL (durata «fazei de latență») și t50, intervalul de timp (începând de la tL) necesare pentru a atinge 50 % din absorbția finală de oxigen cauzată de oxidarea substanței testate:
|
BIBLIOGRAFIE
|
(1)
|
de Kreuk J.F. and Hanstveit A.O. (1981). Determination of the biodegradability of the organic fraction of chemical wastes. Chemosphere, 10 (6); 561-573.
|
|
(2)
|
Chapter C.4-B of this Annex: Determination of «Ready» Biodegradability Part III Modified OECD Screening Test
|
|
(3)
|
Nyholm N. and Kristensen P. (1987). Screening Test Methods for Assessment of Biodegradability of Chemical Substances in Seawater. Final Report of the ring test programme 1984-1985, March 1987, Commission of the European Communities.
|
|
(4)
|
Chapter C.11 of this Annex: Biodegradation — Activated Sludge, Respiration Inhibition Test.
|
|
(5)
|
Chapter C.4-E of this Annex: Determination of «Ready» Biodegradability, Part VI. Closed Bottle Test.
|
Apendicele 1
Determinarea carbonului organic din apa de mare
METODA AGITĂRII FLACONULUI
Pentru determinarea carbonului organic dintr-un eșantion de apă, compușii organici din eșantion sunt oxidați la bioxid de carbon folosind în general una din următoarele trei tehnici:
|
—
|
oxidare umedă prin persulfat/iradiere UV;
|
|
—
|
oxidare umedă prin persulfat/temperatură crescută (116-130 °C);
|
CO2 degajat este cuantificat folosind spectrometrie cu infraroșu sau titrimetrie. Alternativ, CO2 este redus la metan, care este cuantificat cu un detector cu ionizare în flacără (flame ionization detector – FID).
Metoda cu persulfat/UV este frecvent utilizată pentru analiza apei «curate», cu conținut mic de particule în suspensie. Ultimele două metode pot fi aplicate la cele mai multe tipuri de eșantioane de apă, metode cu persulfat/temperatură crescută-oxidare fiind cea mai potrivită pentru eșantioanele cu nivel mic, iar tehnica cu combustie fiind aplicabilă pentru eșantioane cu conținut de carbon organic nevolatil (non-volatile organic carbon – NVOC) mult peste 1 mg C/l.
Interferențe
Toate cele trei metode sunt dependente de eliminarea sau de compensarea carbonului anorganic (inorganic carbon – IC) prezent în eșantion. Epurarea CO2 eșantionul acidifiat este cea mai frecvent utilizată metodă de eliminare a IC, cu toate că aceasta determină și o pierdere de compuși organici volatili (1). Eliminarea completă sau compensarea IC trebuie să se asigure pentru fiecare matrice de eșantion, iar carbonul organic volatil (volatile organic carbon – VOC) trebuie să fie determinat în plus față de NVOC, în funcție de tipul de eșantion.
Concentrațiile mari de clorură au ca rezultat scăderea eficienței oxidării folosind metoda cu persulfat/UV (2). Aplicarea unui reactiv de oxidare modificat prin adăugarea de azotat de mercur (II) poate, totuși, să elimine această interferență. Se recomandă ca volumul maxim tolerabil al eșantionului să fie utilizat pentru a evalua fiecare tip de eșantion care conține clorură. Concentrațiile mari de sare din eșantionul analizat folosind metoda prin combustie poate provoca acoperirea cu sare a catalizatorului și coroziunea excesivă a tubului de ardere. Trebuie luate măsuri de precauție în conformitate cu manualul producătorului.
Eșantioanele de apă foarte tulburi, precum și eșantioanele care conțin particule poate fi oxidate incomplet atunci când se utilizează metoda persulfat/UV.
Un exemplu de metodă adecvată
Carbonul organic nevolatil este determinat prin oxidarea cu persulfat/iradiere UV și cuantificarea ulterioară a emisiilor de CO2 degajate folosind spectrometrie nedispersivă cu infraroșu.
Reactivul de oxidare se modifică în conformitate cu sugestiile prezentate în referința (2), astfel cum se descrie în manualul producătorului:
|
a)
|
8,2 g HgCl2 și 9,6 g Hg(NO3)2 · H2O se dizolvă în câteva sute de mililitri de apă de reacție cu o concentrație mică de carbon.
|
|
b)
|
20 g K2S2O8 se dizolvă în soluție de sare mercurică.
|
|
c)
|
5 ml HNO3 (conc.) se adaugă la amestec.
|
|
d)
|
reactivul este diluat până la 1 000 ml.
|
Interferența clorurii este îndepărtată cu ajutorul unui volum de eșantion de 40 μl pentru clorură 10 % și al unui volum de eșantion de 200 μl pentru clorură 1,9 %. Eșantioanele cu concentrații mari de clorură și/sau volumele mai mari de eșantioane pot fi analizate în baza acestei metode, cu condiția ca acumularea de clorură în vasul de oxidare să fie împiedicată. Determinarea carbonului organic volatil poate fi realizată ulterior, dacă este cazul, pentru tipul de eșantion în cauză.
BIBLIOGRAFIE
|
(1)
|
ISO, Water quality – determination of total organic carbon. Draft International Standard ISO/DIS 8245, January 16, 1986.
|
|
(2)
|
American Public Health Association, Standard Methods for the Estimation of Water and Wastewater. American Water Works Association & Water Pollution Control Federation, 16th edition, 1985.
Also of interest (gives a description of an autoanalysis system):
|
|
(3)
|
Schreurs W. (1978). An automated colorimetric method for the determination of dissolved organic carbon in seawater by UV destruction. Hydrobiological Bulletin 12, 137-142.
|
Apendicele 2
Biodegradarea în apa de mare
METODA AGITĂRII FLACONULUI
FIȘA DE DATE
|
2.
|
DATE ÎNCEPERII TESTULUI:
|
|
3.
|
SUBSTANȚA TESTATĂ:
Denumire:
|
Concentrația soluției stoc:
|
mg/l de substanță
|
|
Concentrația inițială în mediu, to:
|
mg/l de substanță
|
|
:
|
mg DOC/l
|
|
|
4.
|
APA DE MARE:
Sursa:
Data prelevării:
Adâncimea de prelevare:
Aspectul la momentul prelevării (de exemplu, tulbure etc.):
|
Salinitatea la prelevare:
|
‰
|
|
Temperatura la prelevare:
|
°C
|
|
DOC «x» ore după prelevare:
|
mg/l
|
Pretratare înainte de testare (de exemplu, filtrare, sedimentare, învechire, etc.):
|
Numărul coloniilor microbiene
|
|
colonii/ml
|
|
|
|
colonii/ml
|
|
Alte caracteristici:
|
|
|
|
|
5.
|
DETERMINĂRILE CARBONULUI:
Analizorul de carbon:
|
|
Flacon nr.
|
|
DOC după n zile (mg/l)
|
|
0
|
n1
|
n2
|
n3
|
nx
|
|
Test: apă de mare fortificată cu nutrienți cu substanță testată
|
1
|
a1
|
|
|
|
|
|
|
a2
|
|
|
|
|
|
|
medie, Ca(t)
|
|
|
|
|
|
|
2
|
b1
|
|
|
|
|
|
|
b2
|
|
|
|
|
|
|
medie, Cb(t)
|
|
|
|
|
|
|
Martor: apă de mare fortificată cu nutrienți fără substanță testată
|
1
|
c1
|
|
|
|
|
|
|
c2
|
|
|
|
|
|
|
medie, Cc(t)
|
|
|
|
|
|
|
2
|
d1
|
|
|
|
|
|
|
d2
|
|
|
|
|
|
|
medie, Cd(t)
|
|
|
|
|
|
| medie,
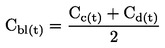
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6.
|
EVALUAREA DATELOR BRUTE:
|
Flacon nr.
|
Calcularea rezultatelor
|
% Degradare după n zile
|
|
0
|
n1
|
n2
|
n3
|
nx
|
|
1
|
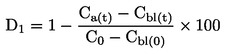
|
0
|
|
|
|
|
|
2
|

|
0
|
|
|
|
|
|
Medie (34)
|
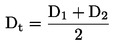
|
0
|
|
|
|
|
|
Notă:
|
Formate similare pot fi folosite atunci când degradarea este urmată de o analiză specifică și pentru substanța de referință și controalele de toxicitate.
|
|
|
7.
|
DEGRADARE ABIOTICĂ (opțional)
|
|
Timp (zile)
|
|
0
|
t
|
|
Concentrație DOC (mg/l) în controlul steril
|
Cs(o)
|
Cs(t)
|

|
Apendicele 3
Calcularea consumului biochimic teoretic de oxigen
METODA FLACONULUI ÎNCHIS
ThOD al substanței CcHhClclNnNanaOoPpSs cu masa moleculară (molecular weight – MW) se calculează în conformitate cu:

Acest calcul implică faptul că C este mineralizat la CO2, H la H2O, P la P2O5 și Na la Na2O. Halogenul este eliminat sub formă de halogenură de hidrogen, iar azotul sub formă de amoniac
Exemplu:
Glucoză C6H12O6, MW = 180
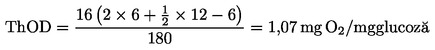
Greutățile moleculare ale altor săruri decât cele ale metalelor alcaline sunt calculate pe baza ipotezei că respectivele săruri au fost hidrolizate.
Se presupune că sulful este oxidat la starea + 6.
Exemplu:
n-Dodecilbenzensulfonat de sodiu C18H29SO3Na, MW = 348

În cazul substanțelor care conțin azot, acesta poate fi eliminat sub formă de amoniac, nitrit sau nitrat corespunzând diferitelor consumuri biochimice teoretice de oxigen.

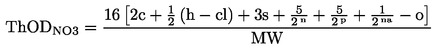
Se presupune că în cazul unei amine secundare a fost observată prin analiză formarea completă de nitrat:
(C12H25)2 NH, MW = 353

Apendicele 4

Apendicele 5
Biodegradarea în apa de mare
METODA FLACONULUI ÎNCHIS
FIȘA DE DATE
|
2.
|
DATE ÎNCEPERII TESTULUI:
|
|
3.
|
SUBSTANȚA TESTATĂ:
Denumire:
|
Concentrația soluției stoc:
|
mg/l
|
|
Inclusiv concentrația în mediul de apă de mare:
|
mg/l
|
|
ThOD sau COD:
|
mg O2/mg substanță testată
|
|
|
4.
|
APA DE MARE:
Sursa:
Data prelevării:
Adâncimea de prelevare:
Aspectul la momentul prelevării (de exemplu, tulbure etc.):
|
Salinitatea la prelevare:
|
‰
|
|
Temperatura la prelevare:
|
°C
|
|
DOC «x» ore după prelevare:
|
mg/l
|
Pretratare înainte de testare (de exemplu, filtrare, sedimentare, învechire etc.):
|
Numărul coloniilor microbiene
|
|
colonii/ml
|
|
|
|
colonii/ml
|
|
Alte caracteristici:
|
|
|
|
|
5.
|
MEDIU DE TESTARE:
|
Temperatura după aerare:
|
°C
|
|
Concentrația de O2 după aerare și înainte de începerea testului:
|
mg O2/l
|
|
|
6.
|
DETERMINAREA OD:
Metoda: Winkler/electrod
|
|
Flacon nr.
|
|
mg O2/l după n zile
|
|
0
|
5
|
15
|
28
|
|
Test: apă de mare fortificată cu nutrienți cu substanță testată
|
1
|
a1
|
|
|
|
|
|
2
|
a2
|
|
|
|
|
|
Media testului
|

|
|
|
|
|
|
Martor: apă de mare fortificată cu nutrienți, dar fără substanță testată
|
1
|
c1
|
|
|
|
|
|
2
|
c2
|
|
|
|
|
|
Medie martor
|

|
|
|
|
|
Notă: Un format similar poate fi folosit pentru substanța de referință și controalele de toxicitate.
|
|
7.
|
CONSUM DE OD: % DEGRADARE ( %D):
|
|
Consum de OD după n zile
|
|
5
|
15
|
28
|
|
(mb
– mt
) (35)
|
|
|
|
|
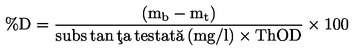
|
|
|
|
|
C.43. BIODEGRADABILITATEA ANAEROBĂ A SUBSTANȚELOR ORGANICE DIN NĂMOLUL FERMENTAT: PRIN MĂSURAREA PRODUCERII DE GAZE
INTRODUCERE
|
1.
|
Prezenta metodă de testare este echivalentă cu Orientarea OCDE privind testarea (TG) nr. 311 (2006). Există o serie de teste de screening pentru evaluarea biodegradabilității aerobe a substanțelor organice [metodele de testare C.4, C.9, C.10, C.11 și (1) și Orientarea OCDE privind testarea (TG) nr. 302 C (2)], iar rezultatele aplicării acestora au fost utilizate cu succes pentru a prevedea soarta substanțelor în mediul aerob, în special în etapele aerobe de tratare a apelor uzate. Diferite proporții de substanțe insolubile în apă, precum și ale celor care se adsorb pe solidele din apa uzată, sunt de asemenea tratate aerobic, întrucât ele sunt prezente în apă uzată decantată. Cu toate acestea, fracțiunile mai mari ale acestor substanțe sunt legate de nămol decantat primar, care este separat de nămolul brut în bazine de decantare înainte ca nămolul decantat sau supernatant să fie tratat aerobic. Nămolul, care conține o parte dintre substanțele solubile în lichidul interstițial, este apoi transmis către bazinele de fermentare încălzite pentru tratament anaerob. Deocamdată nu există teste în această serie pentru evaluarea biodegradabilității anaerobe în bazine de fermentare anaerobă, iar acest test vizează remedierea acestei lacune; nu este în mod necesar aplicabil la alte compartimentele de mediu anoxice.
|
|
2.
|
Tehnici respirometrice care măsoară cantitățile de gaze produse, în special metanul (CH4) și dioxidul de carbon (CO2), în condiții anaerobe au fost utilizate cu succes pentru evaluarea biodegradabilității anaerobe. Birch et al. (3) a revizuit aceste proceduri și a concluzionat că activitatea realizată de Shelton și Tiedje (4), pe baza studiilor anterioare (5) (6) (7), a fost cea mai cuprinzătoare. Metoda (4), care a fost dezvoltat în continuare prin altele (8) și a fost inclusă în standardele americane (9) (10), nu a rezolvat problemele legate de solubilitățile diferite ale CO2 și CH4 în mediul de testare și de calculare a producției teoretice de gaz a unei substanțe testate. Raportul ECETOC (3) a recomandat măsurarea suplimentară a conținutului de carbon anorganic dizolvat (dissolved inorganic carbon – DIC) în lichidul supernatant, care a făcut ca tehnica să fie aplicabilă la scară mai largă. Metoda ECETOC a fost supusă unui exercițiu internațional de calibrare (sau test interlaboratoare) și a devenit standardul ISO 11734 (11).
|
|
3.
|
Această metodă de testare, care se bazează pe ISO 11734 (11), descrie o metodă de screening pentru evaluarea potențialului de biodegradabilitate anaerobă a substanțelor organice în condiții specifice (de exemplu, într-un bazin de fermentare anaerobă la un moment dat și pentru un interval de concentrații ale microorganismelor). Întrucât un nămol diluat este utilizat la o concentrație relativ mare a substanței testate, iar durata testului este în general mai mare decât timpul de retenție în bazinele de fermentare anaerobă, condițiile de testare nu corespund în mod necesar condițiilor din bazinele de fermentare anaerobă și nici nu este aplicabil pentru evaluarea biodegradabilității anaerobe a substanțelor organice în condiții de mediu diferite. Nămolul este expus la substanța testată până la 60 de zile, ceea ce este mai mult decât timpul normal de retenție a nămolului (25 – 30 de zile) în bazinele de fermentare anaerobă, deși în locațiile industriale timpul de retenție poate fi mult mai mare. Predicțiile din rezultatele acestui test nu pot fi făcute la fel de convingător ca în cazul biodegradării aerobe, întrucât dovezile acumulate cu privire la comportamentul substanțelor testate în testele aerobe «imediate» și în testele de simulare și în mediul aerobic sunt suficiente pentru a considera că există o legătură; există puține dovezi similare pentru mediul anaerob. Se poate presupune că biodegradarea anaerobă completă apare dacă 75 % – 80 % din producția de gaze teoretică este atinsă. Rapoartele mari de substanță în raport cu biomasa utilizate în aceste teste înseamnă că o substanță care trece este mai probabil să fie degradată într-un bazin de fermentare anaerobă. În plus, substanțele care nu pot fi transformate în gaze în test nu persistă în mod necesar în condițiile unor rapoarte substanță-biomasă în mediu mai realiste. În plus, apar alte reacții anaerobe prin care substanțele pot fi cel puțin parțial degradate, de exemplu prin declorurare, dar acest test nu detectează astfel de reacții. Totuși, prin aplicarea unor metode analitice specifice pentru determinarea substanței testate, dispariția acesteia poate fi monitorizată (a se vedea punctele 6, 30, 44 și 53).
|
PRINCIPIUL TESTULUI
|
4.
|
Nămolul fermentat spălat (36), care conține concentrații mici (< 10 mg/l) de carbon anorganic (inorganic carbon – IC), este diluat de aproximativ zece ori până la o concentrație totală a solidelor de 1 g/l – 3 g/l și se incubează la 35 °C ± 2 °C în vase închise ermetic, cu substanță testată la 20 – 100 mg C/l timp de maximum 60 de zile. Se realizează o ajustare pentru măsurarea activității nămolului prin utilizarea în paralel a unor martori de control cu inocul de nămol în mediu, dar fără substanța testată.
|
|
5.
|
Se măsoară creșterea presiunii în spațiul neumplut al vaselor care rezultă din producerea de dioxid de carbon și metan. O mare parte a CO2 produs va fi dizolvat în faza lichidă sau transformat în carbonat sau hidrogen carbonat în condițiile testului. Acest carbon anorganic este măsurat la sfârșitul testului.
|
|
6.
|
Cantitatea de carbon (anorganic plus metan) care rezultă din biodegradarea substanței testate este calculată pe baza producției nete de gaze și a formării nete de IC în faza lichidă în exces față de valorile martorului de control. Amploarea biodegradării se calculează din IC total și C-metanic produse ca procent al cantității măsurate sau calculate a carbonului adăugat ca substanță testată. Evoluția biodegradării poate fi urmărită prin măsurări intermediare doar a producerii de gaze. In plus, biodegradarea primară poate fi determinată prin analize specifice la începutul și sfârșitul testului.
|
INFORMAȚII PRIVIND SUBSTANȚA TESTATĂ
|
7.
|
Pentru o interpretare corectă a rezultatelor trebuie să se cunoască puritatea, solubilitatea în apă, volatilitatea și caracteristicile de absorbție ale substanței testate. Conținutul de carbon organic (% G/G) al substanței testate trebuie să fie cunoscut, fie din structura sa chimică, fie prin măsurare. Pentru substanțele testate volatile, o constantă a legii lui Henry măsurată sau calculată ajută la stabilirea aplicabilității testului. Informațiile privind toxicitatea substanței testate pentru bacteriile anaerobe ajută la selectarea unei concentrații de testare corespunzătoare, precum și la interpretarea rezultatelor care indică o biodegradabilitate slabă. Se recomandă includerea unui control pentru inhibiție, cu excepția cazului în care se știe că substanța testată nu inhibă activitățile microbiene anaerobe [a se vedea punctul 21 și ISO 13641-1 (12)].
|
APLICABILITATEA METODEI DE TESTARE
|
8.
|
Metoda de testare poate fi aplicată pentru substanțele solubile în apă; de asemenea, poate fi aplicată substanțelor greu solubile și insolubile, cu condiția să fie folosită o metodă de dozare exactă, de exemplu a se vedea ISO 10634 (13). În general pentru substanțele volatile este necesar ca deciziile să fie luate de la caz la caz. Trebuie luate măsuri speciale, de exemplu, neeliberarea de gaze pe durata testului.
|
SUBSTANȚE DE REFERINȚĂ
|
9.
|
Pentru a verifica procedura, se testează în paralel o substanță chimică de referință prin pregătirea unor vase corespunzătoare ca parte a testărilor normale. Fenolul, benzoatul de sodiu și polietilenglicol 400 sunt exemple și se preconizează că se vor degrada în proporție mai mare de 60 % din producția de gaz teoretică (adică metan și carbon anorganic) în 60 de zile (3) (14).
|
REPRODUCTIBILITATEA REZULTATELOR TESTĂRII
|
10.
|
În cadrul unui test interlaboratoare (14) s-a constat o bună reproductibilitate a măsurătorilor presiunii gazelor în vasele triplicat. Devierea standard relativă (coeficientul de variație, coefficient of variation – COV) a fost în principal sub 20 %, deși această valoare a crescut de multe ori la > 20 % în prezența substanțelor toxice sau spre finalul perioadei incubație de 60 de zile. Deviațiile mai mari au fost constatate și în vasele cu volum < 150 ml. Valorile finale ale pH-ului mediului de testare au fost situate în intervalul 6,5 – 7.
|
|
11.
|
Următoarele rezultate au fost obținute în testul interlaboratoare.
|
Substanța testată
|
Date totale
n1
|
Degradarea medie
(din datele totale)
(%)
|
Deviația standard relativă
(din datele totale)
(%)
|
Date valide
n2
|
Degradare medie
(din datele valabile)
(%)
|
Deviația standard relativă
(din datele valabile)
(%)
|
Date > 60 % degradarea în testele valide
n3
|
|
Acid palmitic
|
36
|
68,7 ± 30,7
|
45
|
27
|
72,2 ± 18,8
|
26
|
19 = 70 % (37)
|
|
Polietilenglicol 400
|
38
|
79,8 ± 28,0
|
35
|
29
|
77,7 ± 17,8
|
23
|
24 = 83 % (37)
|
|
|
12.
|
Coeficienții de variație a mediei pentru toate valorile obținute cu acid palmitic și cu polietilenglicol 400 au fost de până la 45 % (n = 36) și, respectiv, de 35 % (n = 38). Atunci când valorile < 40 % și > 100 % au fost omise (prima fiind presupusă a fi cauzată de condițiile suboptime, cea din urmă din motive necunoscute), cei doi COV au fost reduși la 26 % și, respectiv, la 23 %. Proporțiile valorilor «valide» care au atins o degradare de cel puțin 60 % au fost de 70 % pentru acidul palmitic și de 83 % pentru polietilenglicol 400. Proporțiile procentului de biodegradare obținute din măsurarea DIC au fost relativ mici, dar variabile. Pentru acidul palmitic, intervalul a fost de 0 – 35 %, media de 12 %, cu un COV de 92 %, iar pentru polietilenglicol 400 intervalul a fost de 0 – 40 %, media de 24 %, cu un COV de 54 %.
|
DESCRIEREA METODEI DE TESTARE
Aparatură
|
13.
|
Este necesară utilizarea echipamentelor obișnuite de laborator și a următoarelor:
|
a.
|
Incubator – fără risc de scântei și cu temperatură controlată de 35 °C ± 2 °C;
|
|
b.
|
Vase de testare – rezistente la presiune cu o dimensiunea nominală corespunzătoare (38), fiecare prevăzut cu un sept impermeabil la gaze, capabil să suporte o presiune de aproximativ 2 bari. Volumul de spațiu neumplut trebuie să fie de aproximativ 10 % – 30 % din volumul total. Dacă biogazele sunt eliberate regulat, este adecvat un volum de spațiu neumplut de aproximativ 10 %, însă în cazul în care gazele sunt eliberate numai la sfârșitul testului, volumul de spațiu neumplut trebuie să fie de 30 %. Se recomandă utilizarea de flacoane de sticlă pentru ser cu un volum nominal de 125 ml și un volum total de aproximativ 160 ml, sigilate cu septuri pentru ser (39) și inele din aluminiu atunci când se eliberează presiunea în fiecare moment de prelevare;
|
|
c.
|
Un dispozitiv de măsurare a presiunii (40) adaptat pentru a permite măsurarea și ventilarea gazelor produse, de exemplu, manometru de precizie manual conectat la un ac de seringă adecvat; o supapă etanșă la gaze cu trei căi facilitează eliberarea presiunii în exces (apendicele 1). Este necesară menținerea volumului intern în tubulatura și supapa transductorului de presiune la un nivel cât mai mic posibil, astfel încât erorile introduse prin neluarea în considerare a volumului echipamentului să fie nesemnificative;
Notă – Citirile presiunii sunt utilizate direct pentru a calcula cantitatea de carbon produsă în spațiul neumplut (punctele 42 – 44). Ca alternativă, citirile presiunii pot fi convertite la volume (la 35 °C, presiune atmosferică) de gaze produse cu ajutorul unui grafic de conversie. Acest grafic este construit cu datele obținute prin injectarea unor volume cunoscute de azot gazos într-o serie de vase de testare (de exemplu, flacoane pentru ser) la at 35 °C +/– 2 °C și înregistrarea citirilor presiunii stabilizate rezultate (a se vedea apendicele 2). Modul de calculare este indicat în nota de la punctul 44.
Avertisment – Trebuie avut grijă să se evite leziunile cauzate de ace atunci când se utilizează microseringi.
|
|
d.
|
Analizor de carbon, adecvat pentru determinarea directă a carbonului anorganic în intervalul 1 mg/l – 200 mg/l;
|
|
e.
|
Seringi de precizie mare pentru eșantioanele gazoase sau lichide;
|
|
f.
|
Agitatoare magnetici și piese auxiliare (opțional);
|
|
g.
|
Cutie cu mănuși (recomandată).
|
|
Reactivi
|
14.
|
Se utilizează întotdeauna reactivi cu puritate analitică.
|
Apă
|
15.
|
Apă distilată sau deionizată (dezoxigenată prin barbotare cu azot gazos conținând sub 5 μl/l oxigen), care conține carbon organic dizolvat (DOC) într-o concentrație mai mică de 2 mg/l.
|
Mediul de testare
|
16.
|
Mediul de diluție se prepară astfel încât să conțină următorii constituenți în cantitățile specificate:
|
Fosfat diacid de potasiu anhidru (KH2PO4)
|
0,27 g
|
|
Fosfat acid disodic dodecahidrat [Na2HPO4 · 12H2O)]
|
1,12 g
|
|
Clorură de amoniu (NH4Cl)
|
0,53 g
|
|
Clorură de calciu dihidrat (CaCl2 · 2H2O)
|
0,075 g
|
|
Clorură de magneziu hexahidrat (MgCl2 · 6H2O)
|
0,10 g
|
|
Clorură de fier(II) tetrahidrat (FeCl2 · 4H2O)
|
0,02 g
|
|
Resazurin (indicator oxigen)
|
0,001 g
|
|
Sulfură de sodiu nonahidrat (Na2S · 9H2O)
|
0,10 g
|
|
Soluții stoc de microelemente (opțional, punctul 18)
|
10 ml
|
|
Se adaugă apa dezoxigenată (punctul 15)
|
până la 1 litru
|
Notă: Se utilizează sulfură de sodiu proaspăt obținută sau se spală și se usucă înainte de utilizare, pentru a se asigura că este suficient de reductoare. Testul poate fi efectuat fără a se utiliza o cutie cu mănuși (a se vedea punctul 26). În acest caz, concentrația finală a sulfurii de sodiu în mediu trebuie să fie crescută la 0,2 g de Na2S · 9H2O per litru. Sulfura de sodiu poate fi adăugată și dintr-o soluție stoc anaerobă corespunzătoare prin septul flacoanelor de testare închise, întrucât această procedură va reduce riscul de oxidare. Sulfura de sodiu poate fi înlocuită cu citrat de titan (III), care se adaugă prin septul flacoanelor de testare închise la o concentrație finală de 0,8 – 1 mmol/l. Citratul de titan (III) este un agent reductor foarte eficient și cu toxicitate mică, care este preparat după cum urmează: Se dizolvă 2,94 g de citrat trisodic dihidrat în 50 ml de apă dezoxigenată (rezultând o soluție de 200 mmol/l) și se adaugă 5 ml de soluție de clorură de titan (III) de 15 % (G/V). Se neutralizează la pH de 7 ± 0,2 cu alcalin mineral și se distribuie într-un flacon corespunzător sub un curent de azot. Concentrația de citrat de titan (III) din această soluție stoc este de 164 mmol/l.
|
|
17.
|
Se amestecă componentele mediului de testare cu excepția agentului reductor (sulfură de sodiu citrat de titan) și se barbotează soluția cu azot gazos timp de aproximativ 20 de minute imediat înainte de utilizare pentru a elimina oxigenul. Apoi se adaugă volumul adecvat de soluție proaspăt preparată de agent reductor (preparat în apă dezoxigenată) chiar înainte de utilizarea mediului. Se ajustează pH-ul mediului, dacă este necesar, cu acid sau alcalin mineral diluat la 7 ± 0,2.
|
Soluțiile stoc de microelemente (opțional)
|
18.
|
Se recomandă ca mediul de testare să conțină următoarele microelemente pentru a îmbunătăți procesele de degradare anaerobă, în special dacă sunt utilizate concentrații mici (de exemplu 1 g/l) de inocul (11).
|
Clorură de mangan tetrahidrat (MnCl2 · 4H2O)
|
50 mg
|
|
Acid boric acid (H3BO3)
|
5 mg
|
|
Clorură de zinc (ZnCl2)
|
5 mg
|
|
Clorură de cupru (II) (CuCl2)
|
3 mg
|
|
Molibdat disodic dihidrat (Na2MoO4 · 2H2O)
|
1 mg
|
|
Clorură de cobalt hexahidrat (CoCl2 · 6H2O)
|
100 mg
|
|
Clorură de nichel hexahidrat (NiCl2 · 6H2O)
|
10 mg
|
|
Selenit disodic (Na2SeO3)
|
5 mg
|
|
Se adaugă apa dezoxigenată (punctul 15)
|
până la 1 litru
|
|
Substanța testată
|
19.
|
Se adaugă substanța testată ca soluție, suspensie sau emulsie stoc sau direct în formă solidă sau lichidă sau ca substanță absorbită pe filtru cu fibre din sticlă pentru a obține o concentrație de carbon organic de maximum 100 mg/l. Dacă se utilizează soluții stoc, se prepară o soluție adecvată cu apă (punctul 15) (dezoxigenată în prealabil prin barbotare cu azot gazos) cu o astfel de concentrație încât volumul adăugat să fie mai mic de 5 % din volumul total al amestecului de reacție. Se ajustează pH-ul soluției stoc la pH 7 ± 0,2, dacă este necesar. Pentru substanțele testate care nu sunt suficient de solubile în apă, a se consulta standardul ISO 10634 (13). Dacă se utilizează solvent, se prepară un control suplimentar, în mediul inoculat fiind adăugat numai solventul. A se evita solvenții organici precum cloroformul și tetraclorura de carbon, cunoscute ca fiind inhibitoare ale producției de metan.
Avertisment – A se manipula cu grijă substanțele testate toxice și cele ale căror proprietăți sunt necunoscute.
|
Substanțe de referință
|
20.
|
Substanțe de referință, precum benzoatul de sodiu, fenolul și polietilenglicol 400, au fost utilizate cu succes pentru a verifica procedura, fiind biodegradate în proporție de peste 60 % în 60 de zile. Se prepară o soluție stoc (în apă dezoxigenată) a substanței de referință alese în același mod ca pentru substanța testată și se ajustează la pH 7 ± 0,2, dacă este necesar.
|
Controlul pentru inhibiție (condițional)
|
21.
|
Pentru a obține informații privind toxicitatea substanței testate pentru microorganisme anaerobe pentru a găsi cea mai adecvată concentrație de testare, se adaugă substanța testată și substanța de referință într-un vas care conține mediul de testare (a se vedea punctul 16), fiecare la aceleași concentrații ca cele adăugate, respectiv [a se vedea punctele 19 și 20 și, de asemenea, ISO 13641-1 (12)].
|
Nămolul fermentat
|
22.
|
Se colectează nămol fermentat dintr-un bazin de fermentare al unei stații de tratare a apelor uzate care tratează în special apele uzate menajere. Nămolul trebuie să fie caracterizat complet, iar informațiile de bază aferente trebuie raportate (a se vedea punctul 54). În cazul în care se intenționează utilizarea unui inocul adaptat, poate fi luată în considerare utilizarea de nămol fermentat provenit de la o stație de tratare a apelor uzate industriale. Pentru colectarea nămolului fermentat se utilizează flacoane cu gât larg fabricate din polietilenă cu densitate mare sau dintr-un material similar, care se pot dilata. Se introduce nămol în flacoane până la aproximativ 1 cm distanță de partea lor superioară și se închid ermetic, de preferință cu o supapă de siguranță. După transportul la laborator, nămolul colectat poate fi utilizat direct sau poate fi introdus într-un bazin de fermentare de laborator. Biogazele în exces se eliberează prin deschiderea cu atenție a flacoanelor cu nămol. În mod alternativ, nămolul anaerob cultivat în laborator poate fi utilizat ca sursă de inocul, însă spectrul de activitate al acestuia poate să fi fost redus.
Avertisment – Nămolul fermentat produce gaze inflamabile care prezintă risc de incendiu și de explozie: el conține și organisme potențial patogene, de aceea, trebuie luate măsuri de precauție corespunzătoare în momentul manipulării acestuia. Din motive de siguranță, a se evita utilizarea de vase din sticlă pentru colectarea nămolului.
|
|
23.
|
Pentru a reduce producția de gaze de fond și pentru a reduce influența martorilor de control, poate fi luată în considerare fermentarea prealabilă a nămolului. În cazul în care fermentarea prealabilă este necesară, nămolul trebuie să poată fermenta fără adăugarea oricăror nutrienți sau substraturi la 35 °C ± 2 °C timp de maximum 7 de zile. S-a constatat că fermentarea prealabilă timp de aproximativ 5 zile oferă, în mod uzual, o scădere optimă a producției de gaze a martorului fără creșteri inacceptabile ale perioadelor de latență sau de incubare în cursul fazei de testare sau pierdere de activitate în sensul unui număr mai mic de substanțe testate.
|
|
24.
|
Pentru substanțele testate care sunt sau care se preconizează că sunt puțin biodegradabile, se ia în considerare preexpunerea nămolului la substanța testată pentru a obține un inocul care este mai bine adaptat. Într-un astfel de caz, substanța testată se adaugă la o concentrație de carbon organic de 5 – 20 mg/l la nămolul digerat și se incubează timp de până la 2 săptămâni. Înainte de utilizare, nămolul preexpus se spală cu grijă (a se vedea punctul 25), iar în raportul privind testul se indică condițiile preexpunerii.
|
Inoculul
|
25.
|
Se spală nămolul (a se vedea punctele 22 – 24) chiar înainte de utilizare, pentru a reduce concentrația IC la mai puțin de 10 mg/l în suspensia finală de testat. Se centrifughează nămolul în eprubete închise ermetic (de exemplu, 3 000 g timp de 5 minute) și se elimină supernatantul. Se suspendă granulele rezultate în mediu dezoxigenat (punctele 16, 17), se centrifughează din nou suspensia și se elimină lichidul supernatant. În cazul în care IC nu a fost redusă suficient, procedura de spălare a nămolului se poate repeta de maximum două ori. Aceasta nu pare a avea un efect advers pentru microorganisme. În final, se suspendă granulele din volumul necesar de mediu de testare și se determină concentrația totală a solidelor [de exemplu, ISO 11923 (15)]. Concentrația finală a solidelor totale din vasele de testare trebuie să fie situată în intervalul 1 g/l – 3 g/l (sau aproximativ 10 % din cea a nămolului fermentat nediluat). Operațiunile descrise mai sus se execută astfel încât să se asigure nămolului un contact minim cu oxigenul (de exemplu, se utilizează o atmosferă de azot).
|
PROCEDURA DE TESTARE
|
26.
|
Se efectuează următoarele proceduri inițiale folosind tehnici pentru a menține contactul dintre nămol fermentat și oxigen la un nivel cât mai mic posibil, de exemplu, poate fi necesar să se utilizeze o cutie cu mănuși într-o atmosferă de azot și/sau să se purjeze flacoanele cu azot (4).
|
Pregătirea testării substanței de testat și a controalelor
|
27.
|
Se pregătesc câte cel puțin trei vase de testare (a se vedea punctul 13-b) pentru substanța testată, martorii de control, substanța de referință, controalele pentru inhibiție (condițional) și camerele de control al presiunii (procedură opțională) (a se vedea punctele 7, 19 – 21). Pot fi pregătite, de asemenea, vase suplimentare pentru evaluarea biodegradării primare folosind analize specifice substanței testate. Același set de martori de control poate fi folosit pentru mai multe substanțe testate în cadrul aceluiași test dacă volumele spațiului neumplut sunt concordante.
|
|
28.
|
Se prepară inoculul diluat înainte de adăugarea acestuia în vase, de exemplu cu ajutorul unei pipete cu orificiu larg. Se adaugă alicote de inocul bine amestecat (punctul 25) astfel încât concentrația solidelor totale să fie aceeași în toate vasele (între 1 g/l și 3 g/l). Se adaugă soluții stoc ale substanțelor testate și de referință după ajustarea pH-ului la 7 ± 0,2, dacă este necesar. Substanța testată și substanța de referință trebuie să fie adăugate folosind cea mai adecvată cale de administrare (punctul 19).
|
|
29.
|
Concentrația de testare a carbonului organic trebuie în mod normal să se situeze în intervalul 20 – 100 mg/l (punctul 4). Dacă substanța testată este toxică, concentrația de testare trebuie să fie redusă la 20 mg C/l sau chiar sub această valoare dacă se măsoară doar biodegradarea primară cu analize specifice. Trebuie remarcat faptul că variabilitatea rezultatelor testului crește la concentrații de testare mai mici
|
|
30.
|
Pentru vasele martor, se adaugă o cantitate echivalentă din cărăușul utilizat pentru a doza substanța testată în locul unei soluții, suspensii sau emulsii stoc. Dacă substanța testată a fost administrată folosind filtre cu fibre din sticlă sau solvenți organici, martorilor li se adaugă un filtru sau un volum de solvent echivalent cu cel evaporat. Se pregătește o replică suplimentară cu substanță testată pentru măsurarea valorii pH-ului. Se ajustează pH-ul la 7 ± 0,2, dacă este necesar, cu mici cantități de acid sau alcalin mineral diluat. Aceleași cantități de agenți de neutralizare trebuie adăugate în toate vasele de testare. Aceste adăugiri nu trebuie să fie necesar a fi efectuate deoarece valoarea pH-ului soluțiilor stoc ale substanței testate și ale substanței de referință au fost deja ajustate (a se vedea punctele 19 și 20). Dacă se măsoară biodegradarea primară, trebuie prelevat un eșantion adecvat din vasul de control al pH-ului sau dintr-un vas de testare suplimentar, iar concentrația substanței testate trebuie măsurată folosind analize specifice. În toate vasele pot fi adăugați magneți acoperiți dacă amestecurile de reacție trebuie agitate (opțional).
|
|
31.
|
Se asigură că volumul total de lichid V1 și volumul spațiului neumplut Vh au aceleași valori în toate vasele; se notează și se înregistrează V1 și Vh. Fiecare vas trebuie să fie închis ermetic cu un sept impermeabil la gaze și transferat din cutia cu mănuși (a se vedea punctul 26) în incubator (a se vedea punctul 13-a).
|
Substanțele testate insolubile
|
32.
|
Se adaugă cantități cântărite de substanțe greu solubile în apă direct în vasele pregătite. Dacă este necesară utilizarea unui solvent (a se vedea punctul 19), soluția sau suspensia substanței testate se transferă în vasele goale. Dacă este posibil, solventul se lasă să se evapore trecând azotul gazos prin vase și apoi se adaugă alte ingrediente, și anume, nămol fermentat (punctul 25) și apă dezoxigenată, după necesități. Trebuie să se pregătească, de asemenea, un vas suplimentar de control cu solvent (a se vedea punctul 19). Pentru alte metode de adăugare de substanțe insolubile, se poate consulta ISO 10634 (13). Substanțele testate lichide pot fi dozate cu ajutorul unei seringi în vasele complet pregătite închise ermetic, dacă se preconizează că pH-ul inițial nu va depăși 7 ± 1, în caz contrar se dozează astfel cum este descris mai sus (a se vedea punctul 19).
|
Incubarea și măsurarea presiunii gazelor
|
33.
|
Vasele pregătite se lasă la incubat la 35 °C ± 2 °C timp de aproximativ 1 oră pentru a permite echilibrarea și eliberarea gazelor în exces în atmosferă, de exemplu, prin agitarea fiecărui vas pe rând, inserând acul manometrului (punctul 13-c) prin dopul sigilant și deschizând supapa până când manometrul indică valoarea zero. Dacă în această etapă sau în momentul efectuării de măsurători intermediare, presiunea din spațiu neumplut este mai mică decât cea atmosferică, azotul gazos trebuie introdus pentru a restabili presiunea atmosferică. Se închide supapa (a se vedea punctul 13-c) și se continuă incubarea la întuneric, asigurându-se că toate părțile vaselor sunt menținute la temperatura de fermentare. Se observă vasele după incubare timp de 24 – 48 de ore. Vasele se resping în cazul în care conținutul lor prezintă o colorație roz distinctă în lichidul supernatant, de exemplu, dacă resazurinul (a se vedea punctul 16) și-a schimbat culoarea indicând prezența oxigenului (a se vedea punctul 50). În timp ce mici cantități de oxigen pot fi tolerată de către sistem, concentrațiile mai mari pot inhiba semnificativ evoluția biodegradării anaerobe. Respingerea ocazională a unui singur vas dintr-un set de trei vase poate fi acceptată, însă apariția mai multor eșecuri trebuie să conducă la o investigație a procedurilor experimentale, precum și la repetarea testului.
|
|
34.
|
Conținutul fiecărui vas se amestecă cu atenție prin agitare timp de câteva minute de cel puțin 2 – 3 ori pe săptămână și imediat înainte de fiecare măsurare a presiunii. Agitarea resuspendă inoculul și asigura echilibrul gazos. Toate măsurătorile trebuie să fie efectuate cu rapiditate, deoarece vasele de testare pot face obiectul unei scăderi a temperaturii, conducând la valori false. În timpul măsurării presiunii, întregul vas de testare inclusiv spațiul neumplut trebuie să fie menținut la temperatura de fermentare. Se măsoară presiunea gazelor, de exemplu, prin inserarea prin sept a acului unei seringi (punctul 13-c) conectat la un aparat de monitorizare a presiunii. Trebuie avută grijă pentru a nu lăsa apa să pătrundă în acul de seringă; dacă acest lucru se întâmplă, părțile umede trebuie uscate și trebuie utilizat un ac nou. Presiunea trebuie să fie măsurată în milibari (a se vedea punctul 42). Presiunea gazelor din vase poate fi măsurată periodic, de exemplu în fiecare săptămână, și, în mod opțional, excesul de gaze este eliminat în atmosferă. Ca alternativă, presiunea este măsurată numai la sfârșitul testului pentru a determina cantitatea de biogaze produsă.
|
|
35.
|
Se recomandă citiri intermediare ale presiunii gazelor, întrucât creșterea presiunii oferă orientări privind momentul în care testul poate fi încheiat și permite urmărirea cineticii (a se vedea punctul 6).
|
|
36.
|
În mod normal, testul trebuie terminat după o perioadă de incubație de 60 de zile cu excepția cazului în care curba biodegradării obținută din măsurarea presiunii a atins faza de platou înainte; aceasta este faza în care a fost atins cel mai înalt grad de biodegradare și în care curba biodegradării s-a stabilizat. Dacă valoarea platoului este sub 60 % interpretarea este problematică deoarece ea indică faptul că numai o parte a moleculei a fost mineralizată sau că s-a comis o eroare. Dacă la sfârșitul perioadei de incubare, se produc gaze, dar faza de platou nu a fost în mod evident atinsă, trebuie luată în considerare prelungirea testului pentru a verifica dacă platoul (> 60 %) va fi atins.
|
Măsurarea carbonului anorganic
|
37.
|
La sfârșitul testului după ultima măsurare a presiunii gazelor, nămolul trebuie lăsat să se decanteze. Se deschide fiecare vas pe rând și se prelevează imediat eșantioane pentru determinarea concentrației (mg/l) carbonului anorganic (IC) din lichidul supernatant. Nu trebuie să se recurgă nici la centrifugarea, nici la filtrarea lichidului supernatant, întrucât în acest caz ar exista o pierdere inacceptabilă de dioxid de carbon dizolvat. Dacă lichidul nu poate fi analizat în momentul prelevării de eșantioane, el se depozitează într-un flacon închis ermetic, fără spațiu neumplut și răcit la aproximativ 4 °C timp de 2 zile. După măsurarea IC, se măsoară și se înregistrează valoarea pH-ului.
|
|
38.
|
Ca alternativă, IC în supernatant poate fi determinată indirect prin eliberarea IC dizolvat ca dioxid de carbon care poate fi măsurat în spațiul neumplut. După ultima măsurare a presiunii gazelor, se ajustează presiunea în fiecare dintre vasele de testare la presiunea atmosferică. Conținutul fiecărui vas se acidifiază la un pH de aproximativ 1 prin adăugarea de acid mineral concentrat (de exemplu, H2SO4) prin septul vaselor închise ermetic. Vasele agitate se incubează la 35 °C ± 2 °C timp de aproximativ 24 de ore și se măsoară presiunea gazelor rezultate din dioxidul de carbon degajat folosind un manometru.
|
|
39.
|
Se realizează citiri similare pentru vasele de control corespunzătoare cu martor, cu substanță de referință și, dacă sunt incluse, vasele de control pentru inhibiție (a se vedea punctul 21).
|
|
40.
|
În unele cazuri, în special dacă aceleași vase de control sunt utilizate pentru mai multe substanțe testate, măsurătorile concentrațiilor IC intermediare în vasele de testare și în vasele de control trebuie luate în considerare, după caz. În acest caz, trebuie să se pregătească un număr suficient de vase pentru toate măsurătorile intermediare. Această procedură este preferată celei care implică prelevarea tuturor eșantioanelor dintr-un singur vas. Aceasta din urmă se poate realiza numai dacă volumul necesar pentru analiza DIC nu este considerat prea mare. Măsurarea DIC trebuie efectuată după măsurarea presiunii gazelor fără eliberarea gazelor în exces, astfel cum se descrie mai jos:
|
—
|
se prelevează un volum cât mai mic de eșantioane de supernatant cu o seringă introdusă în sept fără a deschide vasele și se determină IC din eșantion;
|
|
—
|
după prelevarea eșantionului, gazele în exces sunt eliberate sau nu;
|
|
—
|
trebuie să se țină cont de faptul că chiar și o scădere mică a volumului supernatantului (de exemplu, de aproximativ 1 %) poate conduce la o creștere semnificativă a volumului de gaze în spațiul neumplut (Vh);
|
|
—
|
ecuațiile (a se vedea punctul 44) sunt corectate prin creșterea Vh în ecuația 3, după necesități.
|
|
Analize specifice
|
41.
|
Dacă trebuie determinată degradarea anaerobă primară (a se vedea punctul 30), se prelevează un volum corespunzător de eșantion pentru analize specifice la începutul și la sfârșitul testului din vasele care conțin substanța testată. Dacă aceasta este realizată, este de remarcat faptul că volumele spațiului neumplut (Vh) și de lichid (Vl) vor fi modificate, acest fenomen trebuind a fi luat în considerate la calcularea rezultatelor producerii de gaze. Ca alternativă, se pot preleva eșantioane pentru analize specifice din amestecuri suplimentare pregătite anterior în acest scop (punctul 30).
|
DATE ȘI RAPORTARE
Tratamentul rezultatelor
|
42.
|
Din considerente practice, presiunea gazelor se măsoară în milibari (1 mbar = 1h Pa = 105 Pa; 1 Pa = 1 N/m2), volumul în litri și temperatura în grade Celsius.
|
Carbonul din spațiul neumplut
|
43.
|
Întrucât 1 mol de metan și 1 mol de dioxid de carbon conțin fiecare 12 g de carbon, masa carbonului dintr-un volum dat de gaze degajate poate fi exprimată ca:
|
m= 12 × 103×n
|
Ecuația [1]
|
unde:
|
m
|
=
|
masa carbonului (mg) într-un volum dat de gaze degajate;
|
|
12
|
=
|
masa atomică relativă a carbonului;
|
|
n
|
=
|
numărul de moli de gaz dintr-un volum dat.
|
Dacă un gaz, altul decât metanul sau dioxidul de carbon (de exemplu, N2O) este generat în cantități considerabile, formula [1] trebuie modificată pentru a descrie posibilitatea efectelor gazelor generate.
|
|
44.
|
Conform legilor gazelor, n poate fi exprimat ca:
|

|
Ecuația [2]
|
unde:
|
p
|
=
|
presiunea gazelor (Pascali);
|
|
V
|
=
|
volumul gazului (m3);
|
|
R
|
=
|
constanta molară a gazelor [8,314J/(mol K)];
|
|
T
|
=
|
temperatura de incubare (Kelvin).
|
Prin combinarea ecuațiilor [1] și [2] și raționalizare pentru a ajusta în raport cu producția de gaze în martorul de control:
|

|
Ecuația [3]
|
unde:
|
mh
|
=
|
masa de carbon net produs ca gaz în spațiul neumplut (mg);
|
|
Δp
|
=
|
media diferențelor dintre presiunea inițială și cea finală în vasele de testare minus media corespunzătoare în vasele martor (milibari);
|
|
Vh
|
=
|
volumul de spațiu neumplut din vas (l);
|
|
0,1
|
=
|
conversia pentru newtoni/m2 în milibari și m3 în litri.
|
Ecuația [4] trebuie utilizată pentru temperatura normală de incubare de 35 °C (308 K):
|
mh
= 0,468(Δp·Vh
)
|
Ecuația [4]
|
Notă: Calcularea alternativă a volumului. Citirile manometrului sunt convertite în ml de gaze produse folosind curba standard generată prin trasarea volumului (ml) injectat versus valoarea măsurată (apendicele 2). Numărul de moli (n) de gaz în spațiul neumplut din fiecare vas este calculat prin împărțirea producției cumulate de gaze (ml) la 25 286 ml/mol, care reprezintă volumul ocupat de un mol de gaz la 35 °C și presiunea atmosferică standard. Întrucât 1 mol de CH4 și 1 mol de CO2 conține fiecare 12 g de carbon, cantitatea de carbon (mg) din spațiul neumplut (mh
) este dată de ecuația [5]:
|
mh
= 12 × 103×n
|
Ecuația [5]
|
Raționalizare pentru a ajusta în raport cu producția de gaze în martorul de control:
|

|
Ecuația [6]
|
unde:
|
mh
|
=
|
masa de carbon net produs ca gaz în spațiul neumplut (mg);
|
|
ΔV
|
=
|
media diferenței dintre volumul de gaze produse în spațiul neumplut din vasele de testare și din vasele de control martor;
|
|
25 286
|
=
|
volumul ocupat de 1 mol de gaz la 35 °C, 1 atmosferă.
|
|
|
45.
|
Evoluția biodegradării poate fi urmărită prin trasarea unei curbe a creșterii presiunii cumulate Δp (milibari) în funcție de timp, dacă este cazul. Din această curbă, se identifică și se înregistrează faza de latență (zile). Faza de latență este intervalul de timp de la începutul testului până la începerea degradării semnificative (de exemplu, a se vedea apendicele 3). Dacă au fost prelevate și analizate eșantioane intermediare de supernatant (a se vedea punctele 40, 46 și 47), atunci C total produs (în gaze plus în lichid) poate fi trasat grafic în loc de a trasa doar presiunea cumulată.
|
Carbonul din lichid
|
46.
|
Cantitatea de metan din lichid este ignorată întrucât solubilitatea sa în apă este cunoscută ca fiind foarte mică. Masa carbonului anorganic din lichidul din vasele de testare se calculează folosind ecuația [7]:
unde:
|
ml
|
=
|
masa de carbon anorganic din lichid (mg);
|
|
Cnet
|
=
|
concentrația de carbon anorganic din vasele de testare minus cea din vasele de control la sfârșitul testului (mg/l);
|
|
Vl
|
=
|
volumul de lichid din vas (l).
|
|
Carbon gazificat total
|
47.
|
Masa totală a carbonului gazificat din vas se calculează folosind ecuația [8]:
unde:
|
|
mt
= masa totală a carbonului gazificat (mg);
|
|
|
mh
și ml
sunt definite mai sus.
|
|
Carbonul din substanța testată
|
48.
|
Masa de carbon din vasul de testare derivat din substanța testată adăugată se calculează folosind ecuația [9]:
unde:
|
mv
|
=
|
masa carbonului din substanța testată (mg);
|
|
Cc
|
=
|
concentrația carbonului din substanța testată din vasul de testare (mg/l)
|
|
Vl
|
=
|
volumul de lichid din vasul de testare (l).
|
|
Amploarea biodegradării
|
49.
|
Procentul de biodegradare a gazelor din spațiul neumplut se calculează folosind ecuația [10], iar procentul total al biodegradării se calculează folosind ecuația [11]:
|
Dh
= (mh
/mv
) × 100
|
Ecuația [10]
|
|
Dt
= (mt
/mv
) × 100
|
Ecuația [11]
|
unde:
|
|
Dh
= biodegradarea gazelor din spațiul neumplut ( %);
|
|
|
Dt
= biodegradarea totală ( %);
|
|
|
mh
, mv
și mt
sunt definite mai sus.
|
Amploarea biodegradării primare este calculată din (opțional) măsurătorile concentrației substanței testate la începutul și sfârșitul incubării, utilizând ecuația [12]:
|
Dp
= (1 –Se
/Si
) × 100
|
Ecuația [12]
|
unde:
|
Dp
|
=
|
degradarea primară a substanței testate ( %);
|
|
Si
|
=
|
concentrația inițială a substanței testate (mg/l);
|
|
Se
|
=
|
concentrația substanței testate la sfârșit (mg/l).
|
Dacă metoda de analiză indică concentrații semnificative ale substanței testate în inoculul de nămol anaerob nemodificat, se folosește ecuația [13]:
|
Dp
1
= [1 – (Se
–Seb
)/(Si
–Sib
)] × 100
|
Ecuația [13]
|
unde:
|
Dp
1
|
=
|
degradarea primară corectată a substanței testate ( %);
|
|
Sib
|
=
|
concentrația inițială «aparentă» a substanței testate în martorii de control (mg/l);
|
|
Seb
|
=
|
concentrația «aparentă» a substanței testate în controalele martor la final (mg/l).
|
|
Validitatea rezultatelor
|
50.
|
Citirile presiunii trebuie utilizate numai din vasele care nu prezintă o colorație roz (a se vedea punctul 33). Contaminarea cu oxigen este redusă la minimum prin utilizarea unor tehnici de manipulare anaerobe corespunzătoare.
|
|
51.
|
Trebuie să se aibă în vedere faptul că testul este valid dacă substanțele de referință ating un platou ce reprezintă biodegradare peste 60 % (41).
|
|
52.
|
Dacă la sfârșitul testului pH-ul a depășit intervalul de 7 ± 1 și dacă a avut loc o biodegradare insuficientă, testul se repetă cu o capacitate de tamponare crescută a mediului.
|
Inhibarea degradării
|
53.
|
Producerea de gaze în vasele care conțin atât substanțe testată, cât și substanțe de referință, trebuie să fie cel puțin egală cu cea din vasele care conțin numai substanțe de referință; în caz contrar, se indică inhibarea producerii de gaze. În unele cazuri, producția de gaze în vasele care conțin substanța testată fără substanță de referință va fi mai mică decât cea din martorii de control, indicând faptul că substanța testată este inhibitoare.
|
Raportul privind testul
|
54.
|
Raportul privind testul trebuie să includă următoarele informații:
|
|
Substanța testată:
|
—
|
denumire comună, denumire chimică, număr CAS, formulă structurală și proprietăți fizico-chimice relevante;
|
|
—
|
puritatea (impurități) substanței testate.
|
|
|
|
Condiții de testare:
|
—
|
volumele lichidului fermentat diluat (Vl
) și al spațiului neumplut (Vh
) din vas;
|
|
—
|
descrierea vaselor de testare, a principalelor caracteristici ale măsurării biogazelor (de exemplu, tipul de manometru) și a analizorului IC;
|
|
—
|
aplicarea substanței testate și a substanței de referință la sistemul de testare: concentrațiile de testare utilizate și utilizarea oricăror solvenți;
|
|
—
|
detalii privind inoculul utilizat: denumirea stației de tratare a apelor uzate, descrierea sursei apelor uzate tratate (de exemplu, temperatura de operare, timpul de retenție a nămolului, în cea mai mare parte din apele uzate menajere), concentrația, orice informație necesară pentru a confirma acestea și informații privind orice pretratament al inoculului (de exemplu, prefermentare, preexpunere);
|
|
—
|
temperatura de incubare;
|
|
|
|
Rezultate:
|
—
|
valorile pH și IC la sfârșitul testului;
|
|
—
|
concentrația substanței testate la începutul și la sfârșitul testului, dacă a fost efectuată o măsurare specifică;
|
|
—
|
toate datele măsurate colectate pentru vasele cu substanță testată, martor, substanță de referință și de control pentru inhibiție, după caz [de exemplu, presiunea în milibari, concentrația de carbon anorganic (mg/l) sub formă de tabel (datele măsurate pentru spațiul neumplut și lichid trebuie raportate separat;]
|
|
—
|
tratarea statistică a datelor, durata testului și o diagramă a biodegradării substanței testate, a substanței de referință și a controlului inhibiției;
|
|
—
|
procentul biodegradării substanței testate și a substanței de referință;
|
|
—
|
motivele oricărei respingeri a rezultatelor testului;
|
|
—
|
discutarea rezultatelor.
|
|
|
BIBLIOGRAFIE
|
(1)
|
The following chapters of this Annex:
|
|
C.4, Determination of Ready Biodegradability;
|
|
|
C.9, Biodegradation – Zahn-Wellens Test;
|
|
|
C.10, Simulation Test – Aerobic Sewage Treatment:
A: Activated Sludge Units, B: Biofilms
|
|
|
C.11, Biodegradation – Activated sludge respiration inhibition
|
|
|
(2)
|
OECD (2009) Inherent Biodegradability: Modified MITI Test (II), OECD Guideline for Testing of Chemicals, No. 302C, OECD, Paris
|
|
(3)
|
Birch, R. R., Biver, C., Campagna, R., Gledhill, W.E., Pagga,U., Steber, J., Reust, H. and Bontinck, W.J. (1989) Screening of chemicals for anaerobic biodegradation. Chemosphere 19, 1527-1550. (Also published as ECETOC Technical Report No. 28, June 1988).
|
|
(4)
|
Shelton D.R. and Tiedje, J.M. (1984) General method for determining anaerobic biodegradation potential. Appl. Environ. Mircobiology, 47, 850-857.
|
|
(5)
|
Owen, W.F., Stuckey, DC., Healy J.B., Jr, Young L.Y. and McCarty, P.L. (1979) Bioassay for monitoring biochemical methane potential and anaerobic toxicity. Water Res. 13, 485-492.
|
|
(6)
|
Healy, J.B.Jr. and Young, L.Y. (1979) Anaerobic biodegradation of eleven aromatic compounds to methane. Appl. Environ. Microbiol. 38, 84-89.
|
|
(7)
|
Gledhill, W.E. (1979) Proposed standard practice for the determination of the anaerobic biodegradation of organic chemicals. Working document. Draft 2 no.35.24. American Society for Testing Materials, Philadelphia.
|
|
(8)
|
Battersby, N.S. and Wilson, V. (1988) Evaluation of a serum bottle technique for assessing the anaerobic biodegradability of organic chemicals under methanogenic conditions. Chemosphere, 17, 2441-2460.
|
|
(9)
|
E1192-92. Standard Test Method for Determining the Anaerobic Biodegradation Potential of Organic Chemicals. ASTM, Philadelphia.
|
|
(10)
|
US-EPA (1998) Fate, Transport and Transformation Test Guidelines OPPTS 835.3400 Anaerobic Biodegradability of Organic Chemicals.
|
|
(11)
|
International Organization for Standardization (1995) ISO 11 734 Water Quality – Evaluation of the ultimate anaerobic biodegradation of organic compounds in digested sludge – Method by measurement of the biogas production.
|
|
(12)
|
International Organization for Standardization (2003) ISO 13 641-1 Water Quality – Determination of inhibition of gas production of anaerobic bacteria – Part 1 General Test.
|
|
(13)
|
International Organization for Standardization (1995) ISO 10 634 Water Quality – Guidance for the preparation and treatment of poorly water-soluble organic compounds for the subsequent evaluation of their biodegradability in an aqueous medium.
|
|
(14)
|
Pagga, U. and Beimborn, D.B., (1993) Anaerobic biodegradation test for organic compounds. Chemosphere, 27, 1499-1509.
|
|
(15)
|
International Organization for Standardization (1997) ISO 11 923 Water Quality – Determination of suspended solids by filtration through glass-fibre filters.
|
Apendicele 1
Exemplu de aparatură de măsurare a producerii de gaze prin presiunea gazelor

Legendă:
|
1
|
–
|
Manometru
|
|
2
|
–
|
Supapă etanșă pentru gaze cu trei căi
|
|
3
|
–
|
Ac de seringă
|
|
4
|
–
|
Capac etanș pentru gaze (dop ambutisat și sept)
|
|
5
|
–
|
Spațiu neumplut (Vh
)
|
|
6
|
–
|
Inocul de nămol fermentat (Vl
)
|
Vase de testare într-un mediu cu o temperatură de 35 °C ± 2 °C
Apendicele 2
Conversia manometrului
Citirile manometrului pot fi raportate la volumele de gaze cu ajutorul unei curbe standard realizate prin injectarea de volume de aer cunoscute la 35 °C ± 2 °C în flacoane pentru ser care conțin un volum de apă egal cu cel al amestecului de reacție, V
R:
|
—
|
Se repartizează alicote V
R ml de apă, ținute la temperatura de 35 °C ± 2 °C în cinci flacoane pentru ser. Se sigilează flacoanele și se așează într-o baie de apă la temperatura de 35 °C timp de 1 oră pentru echilibrare;
|
|
—
|
Se pornește manometrul, se lasă să se stabilizeze și se ajustează la zero;
|
|
—
|
Se introduce acul seringii prin septul unuia dintre flacoane, se deschide supapa până ce manometrul afișează valoarea zero și se închide supapa;
|
|
—
|
Se repetă procedura cu restul flacoanelor;
|
|
—
|
Se injectează 1 ml de aer la temperatura de 35 °C ± 2 °C în fiecare flacon. Se introduce acul (pe manometru) prin septul unuia dintre flacoane și se așteaptă stabilizarea presiunii. Se înregistrează presiunea, se deschide supapa până ce presiunea este zero și apoi se închide supapa;
|
|
—
|
Se repetă procedura cu restul flacoanelor;
|
|
—
|
Se repetă întreaga procedură de mai sus utilizând 2 ml, 3 ml, 4 ml, 5 ml, 6 ml, 8 ml, 10 ml, 12 ml, 16 ml, 20 ml și 50 ml de aer;
|
|
—
|
Se trasează o curbă de conversie a presiunii (Pa) în funcție de volumul de gaz injectat Vb (ml). Răspunsul instrumentului este linear în intervalul 0 Pa – 70 000 Pa și 0 ml – 50 ml de producție de gaze.
|
Apendicele 3
Exemplu de curbă de degradare (creștere cumulativă a presiunii nete )
Apendicele 4
Exemplu de fișe de date pentru testul de biodegradare anaerobă – fișă de date pentru substanța testată
|
Laborator: …
|
Substanța testată: …
|
Test nr.: …
|
|
Temperatură de testare (°C): …
|
Volumul spațiului neumplut (V
h): …(l)
|
Volumul de lichid (V
l ): …(l)
|
|
Carbon în substanța testată C
c,v: …(mg/l)
|
mv
(42): …(mg)
|
|
|
Ziua
|
p
1 (test)
(mbar)
|
p
2 (test)
(mbar)
|
p
3 (test)
(mbar)
|
p (test)
medie
(mbar)
|
p
4 (martor)
(mbar)
|
p
5 (martor)
(mbar)
|
p
6 (martor)
(mbar)
|
p (martor)
medie
(mbar)
|
p (net)
test – martor
medie (mbar)
|
Δ
p (net)
Cumulat
(mbar)
|
m
h
spațiu neumplut C
(43)
(mg)
|
D
h
Biodegradare (44)
(%)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C
IC, 1
test
(mg)
|
C
IC, 2
test
(mg)
|
C
IC, 3
test
(mg)
|
C
IC
media pentru test
(mg)
|
C
IC, 4
martor
(mg)
|
C
IC, 5
martor
(mg)
|
C
IC, 6
martor
(mg)
|
C
IC
media pentru martor
(mg)
|
C
IC, net
test – martor
medie
(mg)
|
m
l
lichid C (45)
(mg)
|
m
t
C total (46)
(mg)
|
D
t
Biodegradare (47)
(%)
|
|
IC (sfârșit)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
pH (sfârșit)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Laborator: …
|
Substanță de referință: …
|
Test nr.: …
|
|
Temperatură de testare (°C): …
|
Volumul spațiului neumplut (V
h): …(l)
|
Volumul de lichid (V
l) (litri): …
|
|
Carbon în substanța de referință Cc,v (mg/l): …
|
mv
(48) (mg):
|
|
|
Ziua
|
p
1 (ref.)
(mbar)
|
p
2 (ref.)
(mbar)
|
p
3 (ref.)
(mbar)
|
p (ref.)
medie
(mbar)
|
p
4 (inhib.)
(mbar)
|
p
5 (inhib.)
(mbar)
|
p
6 (inhib.)
(mbar)
|
p (inhib.)
medie
(mbar)
|
p (ref.)
ref. – martor
(mbar)
|
Δ
p (ref.)
cumulativ
(mbar)
|
m
h
spațiu neumplut C
(49)
(mg)
|
D
h
Biodegradare (50)
(%)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C
IC, 1
ref.
(mg)
|
C
IC, 2
ref.
(mg)
|
C
IC, 3
ref.
(mg)
|
C
IC
medie ref.
(mg)
|
C
IC, 4
inhib.
(mg)
|
C
IC, 5
inhib.
(mg)
|
C
IC, 6
inhib.
(mg)
|
C
IC
medie inhib.
(mg)
|
C
IC, net
ref. – inhib.
(mg)
|
m
l
lichid C (51)
(mg)
|
m
t
C total (52)
(mg)
|
D
t
Biodegradare (53)
(%)
|
|
IC (sfârșit)
|
|
|
|
|
|
|
|
|
|
|
|
|
|
pH (sfârșit)
|
|
|
|
|
|
|
|
|
|
|
|
|
C.44. PERCOLARE ÎN COLOANE DE SOL
INTRODUCERE
|
1.
|
Prezenta metodă de testare este echivalentă cu Orientarea OCDE privind testarea (TG) nr. 312 (2004). Substanțele chimice sintetice pot ajunge în sol direct prin aplicare deliberată (de exemplu, substanțe agrochimice) sau prin căi indirecte (de exemplu, prin ape reziduale nămol de epurare sol sau aer depuneri umede/uscate). Pentru evaluarea riscului acestor substanțe chimice, este important să se estimeze potențialul lor de transformare în sol și de migrare (percolare) în straturile mai profunde ale solului și, în cele di urmă, în apele subterane.
|
|
2.
|
Mai multe metode sunt disponibile pentru a măsura potențialul de percolare al substanțelor chimice în sol în condiții de laborator controlate și anume cromatografie în strat subțire de sol, cromatografie în strat gros de sol, cromatografie în coloană de sol și măsurători ale adsorbției – desorbției (1) (2). Pentru substanțele chimice neionizate, coeficientul de partiție n-octanol-apă (Pow) permite o estimare timpurie a potențialului lor de absorbție și de percolare (3)(4)(5).
|
|
3.
|
Metoda descrisă în această metodă de testare se bazează pe cromatografie în coloană de sol cu sol perturbat (a se vedea apendicele 1 pentru definiție). Se efectuează două tipuri de experimente pentru a determina (i) potențialul de percolare al substanței testate și (ii) potențialul de percolare al produșilor de transformare (studiu cu reziduuri învechite) în soluri în condiții de laborator controlate (54). Metoda de testare se bazează pe metodele existente (6)(7)(8)(9)(10)(11).
|
|
4.
|
Numărul și tipul solurilor utilizate în cadrul acestei metode de testare au fost convenite cu ocazia unui atelier de lucru al OCDE privind selectarea solului/sedimentelor, care a avut loc la Belgirate, Italia, în 1995 (12). De asemenea, el a formulat o serie de recomandări cu privire la colectarea, manipularea și depozitarea eșantioanelor de sol pentru experimente de percolare.
|
PRINCIPIUL METODEI DE TESTARE
|
5.
|
Coloane fabricate din material inert adecvat (de exemplu, sticlă, oțel inoxidabil, aluminiu, teflon, PVC etc.) sunt umplute cu sol și apoi saturate și echilibrate cu o soluție de «ploaie artificială» (pentru definiție a se vedea apendicele 1) și se lasă să se dreneze. Ulterior, suprafața fiecărei coloane de sol este tratată cu substanța chimică testată și/sau cu reziduuri învechite ale substanței chimice testate. Apoi ploaia artificială este aplicată în coloanele de sol și se colectează percolatul. După procesul de percolare, solul este eliminat din coloane și este secționat într-un număr corespunzător de segmente în funcție de informațiile urmărite prin studiu. Fiecare segment de sol și percolatul sunt apoi analizate în ceea ce privește substanța chimică testată și, dacă este cazul, produșii de transformare sau alte substanțe chimice de interes.
|
APLICABILITATEA METODEI DE TESTARE
|
6.
|
Metoda de testare este aplicabilă pentru testarea substanțelor chimice (nemarcate sau marcate radioactiv: de exemplu cu 14C) pentru care există o metodă analitică cu acuratețe și sensibilitate suficiente. Metoda de testare nu trebuie să se aplice substanțelor chimice care sunt volatile din sol și apă și, prin urmare, care nu rămân în sol și/sau în percolat în condițiile experimentale ale acestei metode de testare.
|
INFORMAȚII PRIVIND SUBSTANȚA CHIMICĂ TESTATĂ
|
7.
|
Substanțele chimice testate nemarcate sau marcate radioactiv pot fi folosite pentru a măsura comportamentul de percolare în coloanele de sol. Materialele marcate radioactiv sunt necesare pentru a studia percolarea produșilor de transformare (reziduuri învechite ale substanței chimice testate) și pentru a determina bilanțul masic. Este recomandată marcarea cu 14C, dar pot fi utili și alți izotopi precum 13C, 15N, 3H, 32P. Pe cât posibil, marcarea ar trebui făcută în porțiunea sau porțiunile cele mai stabile ale moleculei. Puritatea substanței chimice testate trebuie să fie de cel puțin 95 %.
|
|
8.
|
Cele mai multe substanțe chimice trebuie să fie aplicate ca substanță unică. Cu toate acestea, în cazul substanțelor active din produsele fitosanitare, pot fi utilizate produse formulate pentru a studia percolarea substanței testate parentale, însă testarea lor este necesară în special atunci când amestecul poate afecta viteza de eliberare (de exemplu, formulările granulare sau cu eliberare controlată). În ceea ce privește cerințele specifice amestecurilor pentru protocolul de testare, ar putea fi utilă consultarea autorității de reglementare înainte de efectuarea testului. Pentru studiile percolării reziduurilor învechite, trebuie utilizată substanța testată parentală pură.
|
|
9.
|
Înainte de efectuarea unor teste de percolare în coloanele de sol, este de preferat să fie disponibile următoarele informații privind substanța chimică testată:
|
(1)
|
solubilitatea în apă [metoda de testare A.6] (13);
|
|
(2)
|
solubilitatea în solvenți organici;
|
|
(3)
|
presiunea de vapori [metoda de testare A.4] (13) și constanta legii lui Henry;
|
|
(4)
|
coeficientul de partiție n-octanol/apă [metodele de testare A.8 și A.24 ] (13);
|
|
(5)
|
coeficientul de absorbție (Kd, Kf sau KOC) [metodele de testare C.18 și/sau C.19] (13);
|
|
(6)
|
hidroliza [metoda de testare C.7] (13);
|
|
(7)
|
constanta de disociere (pKa) [OCDE TG 112] (25);
|
|
(8)
|
transformarea aerobă și anaerobă în sol [metoda de testare C.23] (13)
|
Notă: Temperatura la care au fost efectuate aceste măsurători trebuie raportată în rapoartele respective privind testele.
|
|
10.
|
Cantitatea de substanță chimică testată aplicată coloanelor de sol trebuie să fie suficientă pentru a permite detectarea a cel puțin 0,5 % din doza aplicată într-un singur segment. Pentru substanțele chimice active din produsele fitosanitare, cantitatea de substanță chimică testată aplicată poate corespunde ratei de utilizare recomandate maxime (o singură aplicare).
|
|
11.
|
Trebuie să fie disponibilă o metodă analitică adecvată cu acuratețe, precizie și sensibilitate cunoscute, pentru a cuantifica substanța chimică testată și, dacă este relevant, produșii ei de transformare în sol și în percolat. De asemenea, ar trebui să fie cunoscută limita de detecție analitică pentru substanța chimică testată și pentru produșii ei de transformare semnificativi (în mod normal, cel puțin toți produșii de transformare ≥10 % din doza aplicată observați în studiile privind căile de transformare, dar de preferință, orice produs de transformare relevant de interes) (a se vedea punctul 17).
|
SUBSTANȚELE CHIMICE DE REFERINȚĂ
|
12.
|
Substanțele chimice de referință cu un comportament de percolare cunoscut, precum atrazina sau monuronul, care pot fi considerați percolatori moderați în teren trebuie folosite pentru a evalua mobilitatea relativă în sol a substanței chimice testate (1)(8)(11). O substanță chimică de referință polară neabsorbantă și nedegradabilă (de exemplu, tritiu, bromură, fluoresceină, eozină) pentru a trasa mișcarea apei în coloană poate, de asemenea, să fie utilă pentru confirmarea proprietăților hidrodinamice ale coloanei de sol.
|
|
13.
|
Substanțele chimice standard analitice pot fi, de asemenea, utile pentru caracterizarea și/sau identificarea produșilor de transformare găsiți în segmentele de sol și în segmentele de percolat prin metode cromatografice, spectroscopice sau prin alte metode relevante.
|
DEFINIȚII ȘI UNITĂȚI
|
14.
|
A se vedea apendicele 1.
|
CRITERII DE CALITATE
Recuperarea
|
15.
|
Suma procentelor de substanță chimică testată găsite în segmentele de sol și în percolatul din coloană după percolare redă recuperarea pentru un experiment de percolare. Recuperările trebuie să varieze între 90 % și 110 % pentru substanțele chimice marcate radioactiv (11) și între 70 % și 110 % pentru substanțele chimice nemarcate (8).
|
Repetabilitatea și sensibilitatea metodei analitice
|
16.
|
Repetabilitatea metodei analitice pentru a cuantifica substanța chimică testată și produșii de transformare pot fi verificate prin analize duplicat a aceluiași extract dintr-un segment de sol sau din percolat (a se vedea punctul 11).
|
|
17.
|
Limita de detecție (limit of detection – LOD) a metodei de analiză pentru substanța chimică testată și pentru produșii de transformare trebuie să fie de cel puțin 0,01 mg · kg– 1 în fiecare segment de sol sau în percolat (ca substanță chimică testată) sau 0,5 % din doza aplicată într-un singur segment, oricare dintre acestea este mai mică. Se specifică și limita de cuantificare (limit of quantification – LOQ).
|
DESCRIEREA METODEI DE TESTARE
Sistemul de testare
|
18.
|
Coloanele de percolare (secționabile sau nesecționabile) fabricate din material inert adecvat (de exemplu, sticlă, oțel inoxidabil, aluminiu, teflon, PVC etc.), cu un diametru interior de cel puțin 4 cm și o înălțime minimă de 35 cm sunt utilizate pentru test. Materiale coloanei trebuie să fie testate din punctul de vedere al potențialelor interacțiuni cu substanța chimică testată și/sau cu produșii ei de transformare. Exemple de coloane secționabile sau nesecționabile adecvate sunt prezentate în apendicele 2.
|
|
19.
|
Pentru umplerea coloanelor de sol se folosesc cupe, plonjoare și vibratoare.
|
|
20.
|
Pentru aplicarea ploii artificiale în coloanele de sol, pot fi utilizate pompe cu piston sau peristaltice, capete de duș, flacoane Mariotte sau simple pâlnii de picurare.
|
Echipamente de laborator și substanțe chimice
|
21.
|
Este necesar echipament de laborator standard, care să cuprindă, în particular, următoarele:
|
(1)
|
instrumente de analiză cum sunt: echipamente pentru GLC, HPLC și TLC, inclusiv sisteme adecvate de detecție pentru analiza substanțelor marcate radioactiv și a celor nemarcate sau metoda diluției izotopice inverse;
|
|
(2)
|
instrumente de identificare (de exemplu MS, GC-MS, HPLC-MS, NMR etc.);
|
|
(3)
|
contor cu lichid de scintilație pentru substanțele chimice marcate radioactiv;
|
|
(4)
|
oxidant pentru combustia materialelor marcate;
|
|
(5)
|
aparat de extracție (de exemplu eprubete de centrifugare pentru extracția la rece și aparat Soxhlet pentru extracția continuă sub reflux);
|
|
(6)
|
instrumente pentru concentrarea soluțiilor și a extractelor (de exemplu, evaporator rotativ);
|
|
|
22.
|
Substanțele chimice utilizate includ: solvenți organici, reactivi de puritate analitică, precum acetona, metanolul etc.; lichid de scintilație; soluție 0,01 M CaCl2 în apă distilată sau deionizată (= ploaie artificială).
|
Substanța chimică testată
|
23.
|
Pentru a aplica substanța chimică testată în coloana de sol, aceasta trebuie dizolvată în apă (deionizată sau distilată). Dacă substanța chimică testată este puțin solubilă în apă, acesta poate fi aplicată fie ca produs formulat (dacă este necesar, după suspendare sau emulsifiere în apă), fie în orice solvent organic. În cazul în care se utilizează un solvent organic, acesta trebuie să fie utilizat la minimum și trebuie evaporat de pe suprafața coloanei de sol înainte de a începe procedura de percolare. Formulările solide, precum granulele, trebuie să fie aplicate sub formă solidă fără apă; pentru a permite o mai bună distribuție pe suprafața coloanei de sol, produsul formulat poate fi amestecat cu o cantitate mică de nisip de cuarț (de exemplu 1 g) înainte de aplicare.
|
|
24.
|
Cantitatea de substanță chimică testată aplicată coloanelor de sol trebuie să fie suficientă pentru a permite detectarea a cel puțin 0,5 % din doza aplicată într-un singur segment. Pentru substanțele chimice active din produsele de protecție a plantelor, aceasta poate fi bazată pe rata de utilizare maximă recomandată (o singură rată de aplicare) și, atât pentru percolarea substanței parentale, cât și a celei învechite, trebuie să fie raportată la aria suprafeței coloanei de sol utilizate (55).
|
Substanța chimică de referință
|
25.
|
O substanță chimică de referință trebuie să fie utilizată în experimente de percolare (a se vedea punctul 12). Ea trebuie să fie aplicată pe suprafața coloanei de sol într-un mod similar cu cel al substanței chimice testate și la o rată corespunzătoare care să permită detectarea adecvată fie ca standard intern împreună cu substanța chimică testată pe aceeași coloană de sol, fie singură pe o coloană de sol separată. De preferință, ambele substanțe chimice trebuie să fie aplicate în aceeași coloană, cu excepția cazului când ambele substanțe chimice sunt marcate în mod similar.
|
Soluri
Selectarea solurilor
|
26.
|
Pentru studiile de percolare cu substanța chimică testată parentală trebuie utilizate 3 – 4 soluri cu pH-uri, conținut de carbon organic și textură diferite (12). Orientări privind selectarea solurilor pentru experimentele de percolare sunt furnizate în tabelul 1 de mai jos. Pentru substanțele chimice testate ionizabile, solurile selectate trebuie să aibă o gamă largă de pH-uri, pentru a evalua mobilitatea substanței chimice în formele sale ionizate și neionizate; cel puțin 3 soluri trebuie să aibă un pH la care substanța chimică testată este în forma sa mobilă.
Tabelul 1
Orientări privind selectarea solurilor pentru studiile percolării
|
Solul nr.
|
Valoarea pH-ului
|
Carbon organic
%
|
Conținut de argilă
%
|
Textură (56)
|
|
1
|
> 7,5
|
3,5 – 5
|
20 – 40
|
lut argilos
|
|
2
|
5,5 – 7
|
1,5 – 3
|
15 – 25
|
lut mâlos
|
|
3
|
4 – 5,5
|
3 – 4
|
15 – 30
|
lut
|
|
4
|
< 4 – 6 (57)
|
< 0,5 – 1,5 (57)
(58)
|
< 10 – 15 (57)
|
nisip lutos
|
|
5
|
< 4,5
|
> 10 (59)
|
< 10
|
nisip lutos/nisip
|
|
|
27.
|
Alte tipuri de sol pot fi uneori necesare pentru a reprezenta regiunile mai reci, temperate și tropicale. Prin urmare, în cazul în care sunt preferate alte tipuri de sol, ele trebuie să se caracterizeze prin aceeași parametri și trebuie să aibă variații similare ale proprietăților ca cele descrise în orientările privind selectarea solurilor pentru studiile de percolare (a se vedea tabelul 1 de mai sus), chiar dacă ele nu îndeplinesc perfect criteriile respective.
|
|
28.
|
Pentru studii de percolare cu «reziduuri învechite» trebuie utilizat un singur tip de sol (12). Acesta trebuie să aibă un conținut de nisip > 70 % și un conținut de carbon organic între 0,5 – 1,5 % (de exemplu, solul nr. 4 din tabelul 1). Poate fi necesară utilizarea mai multor tipuri de soluri dacă datele privind produșii de transformare sunt semnificative.
|
|
29.
|
Toate solurile trebuie să fie caracterizate cel puțin din punctul de vedere al texturii [ % nisip, % mâl, % argilă în conformitate cu sistemele de clasificare FAO și USDA (14)], al pH-ului, al capacității de schimb de cationi, al conținutului de carbon organic, al densității în vrac (pentru sol perturbat) și al capacității de reținere a apei. Măsurarea biomasei microbiene este necesară numai pentru solul care este utilizat în perioada de învechire/incubare efectuată înainte de experimentul de percolare a substanței învechite. Informații privind proprietățile suplimentare ale solului (de exemplu, clasificarea solului, mineralogia argilei, aria suprafeței specifice) for fi utile pentru interpretarea rezultatelor acestui studiu. Pentru determinarea caracteristicilor solului se pot utiliza metodele recomandate în referințele (15)(16)(17)(18)(19).
|
Colectarea și depozitarea solurilor
|
30.
|
Solurile trebuie prelevate din stratul superior (orizont A) de la o adâncime maximă de 20 cm. Resturile de vegetație, macrofauna și pietrele trebuie eliminate. Solurile (cu excepția celor utilizate pentru a învechirea substanței chimice testate) sunt uscate cu aer la temperatura camerei (de preferință între 20 – 25 °C). Dezagregarea se realizează cu o forță minimă, astfel încât structura originală a solului să se modifice cât se poate de puțin. Solurile se cern printr-o sită de ≤ 2 mm. Se recomandă omogenizarea atentă, deoarece aceasta crește reproductibilitatea rezultatelor. Înainte de utilizare, solurile pot fi depozitate la temperatura ambiantă și se mențin uscate cu aer (12). Nu există recomandate limite temporale de depozitare, dar solurile depozitate mai mult de 3 ani trebuie analizate din nou înaintea utilizării pentru determinarea conținutului de carbon organic și a pH-ului.
|
|
31.
|
Trebuie furnizate informații detaliate privind istoricul locurilor din care se prelevează solul testat. Aceste detalii includ localizarea exactă [exact stabilită cu ajutorul UTM (Universal Transversal Mercator-Projection/European Horizontal Datum) sau a coordonatelor geografice], acoperirea vegetală, tratamentele cu produsele fitosanitare, cu îngrășăminte organice și anorganice, adaosurile de material biologic sau contaminările accidentale (12). Dacă solul a fost tratat cu substanța testată sau cu substanțe cu structură analogă pe parcursul precedenților patru ani, aceste soluri nu trebuie să fie utilizate în studii de percolare.
|
Condițiile de testare
|
32.
|
În cursul perioadei de testare, coloanele de sol percolante trebuie ținute la întuneric la temperatură ambientală atâta timp cât această temperatură este menținută într-un interval de ± 2 °C. Temperaturile recomandate sunt între 18 și 25 °C.
|
|
33.
|
Ploaia artificială (0,01 M CaCl2) trebuie aplicată în mod continuu pe suprafața coloanelor de sol cu o rată de 200 mm în 48 de ore (60); această rată este echivalentă cu aplicare a 251 ml într-o coloană cu un diametru interior de 4 cm. Dacă testul impune, pot fi utilizate și alte rate de ploaie artificială și durate mai lungi.
|
Efectuarea testului
Percolare cu substanță chimică testată parentală
|
34.
|
Coloane de percolare cel puțin în duplicat sunt umplute cu sol netratate, uscat cu aer și cernut (< 2 mm) până la o înălțime de aproximativ 30 cm. Pentru a obține o umplere uniformă, solul se adaugă la coloanele în porții mici cu ajutorul unei cupe și este presat cu ajutorul unui plonjon cu vibrare simultană ușoară a coloanei până când partea superioară a coloanei de sol nu mai coboară. Umplerea uniformă este necesară pentru a obține rezultate reproductibile din coloana de percolare. Pentru detalii privind tehnicile de umplere a coloanei, a se vedea referințele (20)(21) și (22). Pentru a controla reproductibilitatea procedurii de umplere, se determină greutatea totală a solului umplut în coloane (61); greutățile coloanelor duplicat trebuie să fie similare.
|
|
35.
|
După umplere, coloanele de sol sunt preumezite cu ploaie artificială (0,01 M CaCl2) de jos în sus, pentru a înlocui aerul din porii solului cu apă. Apoi coloanele de sol sunt lăsate să se echilibreze, iar excesul de apă este eliminat prin efectul gravității. Metodele de saturație a coloanei sunt revizuite în referința (23).
|
|
36.
|
Apoi substanța chimică testată și/sau de referință este aplicată pe coloana de sol (a se vedea, de asemenea, punctele 23 – 25). Pentru a obține o distribuție omogenă, soluțiile, suspensiile sau emulsiile substanței chimice testate și/sau de referință trebuie aplicate uniform pe suprafața coloanei de sol. În cazul în care pentru aplicarea unei substanțe chimice testate se recomandă încorporarea în sol, aceasta trebuie să fie amestecată cu o cantitate mică (de exemplu 20 g) de sol și adăugată la suprafața coloanei de sol.
|
|
37.
|
Suprafețele coloanelor de sol sunt acoperite cu un disc sinterizat de sticlă, perle de sticlă, filtre din fibră de sticlă sau hârtie de filtru rotundă pentru a distribui ploaia artificială în mod uniform pe toată suprafața și pentru a evita perturbarea suprafeței solului de către picăturile de ploaie. Cu cât este mai mare diametrul coloanei, cu atât este nevoie de mai multă atenție pentru aplicarea ploii artificiale pe coloanele de sol pentru a asigura o distribuție uniformă a ploii artificiale pe suprafața solului. Apoi, ploaia artificială este adăugată la coloana de sol picătură cu picătura cu ajutorul unui piston sau al unei pompe peristaltice sau a unei pâlnii de picurare. De preferință, percolatul trebuie să fie colectat în fracțiuni, iar volumele lor respective sunt înregistrate (62).
|
|
38.
|
După percolare și lăsarea coloanelor să dreneze, coloanele de sol sunt secționate într-un număr corespunzător de segmente în funcție de informațiile necesar a fi obținute din studiu, segmentele sunt extrase cu solvenți adecvați sau cu amestecuri de solvenți adecvate și analizate din punctul de vedere al substanței chimice testate și, dacă este cazul, al produșilor de transformare, al radioactivității totale si al substanței chimice de referință. Percolatul sau fracțiunile de percolat sunt analizate direct sau după extracție din punctul de vedere al acelorași produși. Atunci când se utilizează substanțe chimice testate marcate radioactiv, trebuie identificate toate fracțiunile care conțin ≥ 10 % din radioactivitatea aplicată.
|
Percolare cu reziduuri învechite
|
39.
|
Solul proaspăt (care nu a fost uscat anterior cu aer) este tratat la o rată corespunzătoare ariei suprafeței coloanelor de sol (a se vedea punctul 24) cu substanța chimică testată marcată radioactiv și incubat în condiții aerobe în conformitate cu metoda de testare C.23 (13). Perioada de incubare (învechire) trebuie să fie suficient de lungă pentru a produce cantități semnificative de produși de transformare; este recomandată o perioadă de învechire de un timp de înjumătățire a substanței chimice testate (63), dar nu trebuie să depășească 120 zile. Înainte de percolare, solul învechit este analizat în ceea ce privește substanța chimică testată și produșii ei de transformare.
|
|
40.
|
Coloanele de percolare sunt umplute până la o înălțime de 28 cm cu același sol (dar uscat cu aer) ca cel utilizat în experimentul de învechire astfel cum este descris la punctului 34, determinându-se și greutatea totală a coloanelor de sol umplute. Ulterior coloanele de sol sunt preumezite astfel cum se descrie la punctul 35.
|
|
41.
|
Apoi substanța chimică testată și produșii ei de transformare se aplică pe suprafața coloanelor de sol sub formă de reziduuri de sol învechite (a se vedea punctul 39) ca segment de sol de 2 cm. Este de preferat ca înălțimea totală a coloanelor de sol (sol netratat + sol învechit) să nu depășească 30 cm (a se vedea punctul 34).
|
|
42.
|
Percolarea se realizează astfel cum se descrie la punctul 37.
|
|
43.
|
După percolare, segmentele de sol și percolatele sunt analizate astfel cum se indică la punctul 38 din punctul de vedere al substanței chimice testate, al produșilor ei de transformare și al radioactivității neextrase. Pentru a se determina cantitatea de reziduuri învechite reținută în stratul superior de 2 cm după percolare, acest segment trebuie analizat separat.
|
DATE ȘI RAPORTARE
Tratamentul rezultatelor
|
44.
|
Cantitățile de substanță chimică testată, de produși de transformare, neextractabili și, dacă este inclusă, de substanță chimică de referință trebui să fie exprimate în % din doza inițială aplicată pentru fiecare segment de sol și fracțiune de percolat. Trebui realizată o prezentare grafică pentru fiecare coloană, raportând procentele constatate la adâncimea solului.
|
|
45.
|
Atunci când o substanță chimică de referință este inclusă în aceste studii de percolare pe coloană, percolarea unei substanțe chimice să poată fi evaluată pe o scară relativă utilizând factorii de mobilitate relativă (relative mobility factors – RMF; pentru definiție, a se vedea apendicele 3) (1)(11) care permite compararea datelor referitoare la percolare a unor diverse substanțe chimice obținute cu diferite tipuri de sol. Exemple de valori RMF pentru o varietate de substanțe chimice fitosanitare sunt oferite în apendicele 3.
|
|
46.
|
Estimările Koc (coeficientul de adsorție normalizată a carbonului organic) și Kom (coeficientul de distribuție normalizată a materiei organice) pot fi obținute și din rezultatele percolării în coloane prin utilizarea distanței de percolare medie sau corelații consacrate între RMF și Kom respectiv Koc (4) sau prin aplicarea teoriei cromatografiei simple (24). Totuși, metoda din urmă trebuie utilizată cu precauție, mai ales dacă se ia în considerare faptul că procesul de percolare nu implică exclusiv condiții de fluxuri saturate, ci mai degrabă sisteme nesaturate.
|
Interpretarea rezultatelor
|
47.
|
Studiile de percolare în coloană descrise în această metodă permit determinarea potențialului de percolare sau de mobilitate în sol al substanței chimice testate (în studiul de percolare a substanței parentale) și/sau al produșilor de transformare (în studiul de percolare a reziduurilor învechite). Aceste teste nu estimează din punct de vedere cantitativ comportamentul de percolare în condiții de teren, însă ele pot fi utilizate pentru a compara «percolabilitatea» a unei substanțe chimice cu a altor substanțe chimice al căror comportament de percolare poate fi cunoscut (24). De asemenea, ele nu măsoară cantitativ procentul de substanțe chimice aplicate care ar putea ajunge în apele freatice (11). Cu toate acestea, rezultatele studiilor de percolare pe coloană pot contribui la a decide dacă sunt necesare testări suplimentar în mediul natural sau seminatural pentru substanțele chimice care prezintă un potențial mare de mobilitate în testele de laborator.
|
Raportul privind testul
|
48.
|
Raportul trebuie să conțină:
|
|
Substanța chimică testată și substanța chimică de referință (atunci când este utilizată):
|
—
|
denumirea comună, denumirea chimică (nomenclatura IUPAC și CAS), numărul CAS, structura chimică (indicând poziția marcatorului dacă se folosește substanță marcată radioactiv) și proprietățile fizico-chimice relevante;
|
|
—
|
puritățile (impuritățile) substanței chimice testate;
|
|
—
|
puritatea radiochimică a substanței chimice marcate și activitatea specifică (dacă este cazul).
|
|
|
|
Solurile de testare:
|
—
|
detalii privind locul de colectare;
|
|
—
|
proprietățile solurilor, precum pH-ul, conținutul de carbon organic și de argilă, textura și densitatea brută (pentru solul perturbat);
|
|
—
|
activitatea microbiană a solului (numai pentru solul folosit pentru învechirea substanței chimice testate);
|
|
—
|
durata depozitării solului și condițiile de depozitare.
|
|
|
|
Condiții de testare:
|
—
|
datele la care au fost realizate studiile;
|
|
—
|
lungimea și diametrul coloanelor de percolare;
|
|
—
|
greutatea totală a solului din coloanele de sol;
|
|
—
|
cantitatea de substanță chimică testată și, dacă este cazul, a substanței chimice de referință;
|
|
—
|
cantitatea, frecvența și durata aplicării ploii artificiale;
|
|
—
|
temperatura de desfășurare a experimentului;
|
|
—
|
numărul replici (cel puțin două);
|
|
—
|
metodele de analiză a substanței chimice testate, a produșilor de transformare și, dacă este cazul, a substanței chimice de referință din diferite segmente de sol și din percolat;
|
|
—
|
metodele de caracterizare și identificare a produșilor de transformare în segmentele de sol și în percolat.
|
|
|
|
Rezultatele testului:
|
—
|
tabele cu rezultatele exprimate în concentrații și ca % din doza aplicată pentru segmentele de sol și percolat;
|
|
—
|
bilanțul masic, dacă este cazul;
|
|
—
|
distanțele de percolare și, dacă este cazul, factorii de mobilitate relativă;
|
|
—
|
trasarea grafică a % găsit în segmentele de sol în raport cu adâncimea segmentului de sol;
|
|
—
|
discutarea și interpretarea rezultatelor.
|
|
|
BIBLIOGRAFIE
|
(1)
|
Guth, J.A., Burkhard, N. and Eberle, D.O. (1976). Experimental Models for Studying the Persistence of Pesticides in Soil. Proc. BCPC Symposium: Persistence of Insecticides and Herbicides.
|
|
(2)
|
Russel, M.H. (1995). Recommended approaches to assess pesticide mobility in soil. In progress in Pesticide Biochemistry and Toxicology, Vol. 9 (Environmental Behaviour of Agrochemicals – T.R. Roberts and P.C. Kearney, Eds.). J. Wiley & Sons.
|
|
(3)
|
Briggs, G.G. (1981). Theoretical and experimental relationships between soil adsorption, octanol-water partition coefficient, water solubilities, bioconcentration factors, and the parachor. J.Agric. Food Chem. 29, 1050-1059.
|
|
(4)
|
Chiou, C.T., Porter, P.E. and Schmedding, D.W. (1983). Partition equilibria of non-ionic organic compounds between soil organic matter and water. Environ. Sci. Technol. 17, 227-231.
|
|
(5)
|
Guth, J.A. (1983). Untersuchungen zum Verhalten von Pflanzenschutzmitteln im Boden. Bull. Bodenkundliche Gesellschaft Schweiz 7, 26-33.
|
|
(6)
|
US-Environmental Protection Agency (1982). Pesticide Assessment Guidelines, Subdivision N. Chemistry: Environmental Fate.
|
|
(7)
|
Agriculture Canada (1987). Environmental Chemistry and Fate Guidelines for registration of pesticides in Canada.
|
|
(8)
|
Annex I to Commission Directive 95/36/EC of 14 July 1995 amending Council Directive 91/414/EEC concerning the placing of plant protection products on the market, OJ L 172, 22.7.1995, p. 8.
|
|
(9)
|
Dutch Commission for Registration of Pesticides (1991). Application for registration of a pesticide. Section G: Behaviour of the product and its metabolites in soil, water and air.
|
|
(10)
|
BBA (1986). Richtlinie für die amtliche Prüfung von Pflanzenschutzmitteln, Teil IV, 4-2. Versickerungsverhalten von Pflanzenschutzmitteln.
|
|
(11)
|
SETAC (1995). Procedures for Assessing the Environmental Fate and Ecotoxicity of Pesticides. Mark R. Lynch, Ed.
|
|
(12)
|
OECD (1995). Final Report of the OECD Workshop on Selection of Soils/Sediments. Belgirate, Italy, 18-20 January 1995.
|
|
(13)
|
The following chapters of this Annex:
|
|
Chapter A.4, vapour pressure
|
|
|
Chapter A.6, Water solubility
|
|
|
Chapter A.8, Partition coefficient, shake flask method
|
|
|
Chapter A.24, Partition coefficient, HPLC method
|
|
|
Chapter C.7, degradation — abiotic degradation: hydrolysis as a function of pH
|
|
|
Chapter C.18, Adsorption/desorption using a batch equilibrium method
|
|
|
Chapter C.23, Aerobic and anaerobic transformation in soil
|
|
|
(14)
|
Soil Texture Classification (US and FAO systems). Weed Science, 33, Suppl. 1 (1985) and Soil Sci. Soc. Amer. Proc. 26, 305 (1962).
|
|
(15)
|
Methods of Soil Analysis (1986). Part 1, Physical and Mineralogical Methods (A. Klute, Ed.). Agronomy Series No. 9, 2nd Edition.
|
|
(16)
|
Methods of Soil Analysis (1982). Part 2, Chemical and Microbiological Properties (A.L. Page, R.H. Miller and D.R. Kelney, Eds.). Agronomy Series No. 9, 2nd Edition.
|
|
(17)
|
ISO Standard Compendium Environment (1994). Soil Quality – General aspects; chemical and physical methods of analysis; biological methods of analysis. First Edition.
|
|
(18)
|
Mückenhausen, E. (1975). Die Bodenkunde und ihre geologischen, geomorphologischen, mineralogischen und petrologischen Grundlagen. DLG-Verlag, Frankfurt/Main.
|
|
(19)
|
Scheffer, F. and Schachtschabel, P. (1998). Lehrbuch der Bodenkunde. F. Enke Verlag, Stuttgart.
|
|
(20)
|
Weber, J.B. and Peeper, T.F. (1977). In Research Methods in Weed Science, 2nd Edition (B. Truelove, Ed.). Soc. Weed Sci., Auburn, Alabama, 73-78.
|
|
(21)
|
Weber, J.B., Swain, L.R., Strek, H.J. and Sartori, J.L. (1986). In Research Methods in Weed Science, 3rd Edition (N.D. Camper, Ed.). Soc. Weed Sci., Champaign, IL, 190-200.
|
|
(22)
|
Oliveira, et al. (1996). Packing of sands for the production of homogeneous porous media. Soil Sci. Soc. Amer. J. 60(1): 49-53.
|
|
(23)
|
Shackelford, C. D. (1991). Laboratory diffusion testing for waste disposal. – A review. J. Contam. Hydrol. 7, 177-217.
|
|
(24)
|
(Hamaker, J.W. (1975). Interpretation of soil leaching experiments. In Environmental Dynamics of Pesticides (R. Haque, V.H. Freed, Eds), 115-133. Plenum Press, New York.
|
|
(25)
|
OECD (1981). Dissociation constants in water. OECD Guideline for Testing of Chemicals, No. 4112, OECD, Paris
|
Apendicele 1
Definiții și unități
Reziduu de sol învechit: Substanța chimică testată și produșii de transformare prezenți în sol după aplicare și după o perioadă suficient de lungă pentru a permite transportul, adsorbția, metabolismul și procesele de disipare pentru a modifica distribuirea și natura chimică unei părți din substanța chimică aplicată (1).
Ploaia artificială
: 0,01 M soluție de CaCl2 în apă distilată sau deionizată.
Distanța medie de percolare
: Partea de jos a secțiunii de sol unde substanța chimică recuperată cumulată = 50 % din totalul substanței chimice recuperate [experiment de percolare normal] sau; (partea de jos a secțiunii de sol unde substanța chimică recuperată cumulată = 50 % din totalul substanței chimice recuperate) – [(grosimea stratului de sol învechit/2] [studiu de percolare a reziduului învechit]
Substanța chimică
: o substanță sau un amestec
Percolat
: Faza apoasă percolată printr-un profil de sol sau o coloană de sol (1).
Percolare
: Proces prin care o substanță chimică se deplasează descendent prin profilul de sol sau o coloană sol (1).
Distanța de percolare
: Cel mai adânc segment de sol în care s-a constatat ≥ 0,5 % din substanța chimică testată aplicată sau reziduul învechit aplicat după procesul de percolare (echivalentă cu adâncimea de penetrare).
Limita de detecție (LOD) și limita de cuantificare (LOQ)
: Limita de detecție (LOD) este concentrația unei substanțe chimice sub care identitatea unei substanțe chimice nu mai poate fi deosebită de artefactele analitice. Limita de cuantificare (LOQ) este concentrația unei substanțe chimice sub care concentrația nu poate fi determinată cu o precizie acceptabilă.
Factorul de mobilitate relativă (Relative Mobility Factor) RMF
: [distanța de percolare a substanței chimice testate (cm)] / [distanța de percolare a substanței chimice de referință (cm)]
Substanța chimică testată
: orice substanță sau amestec testat cu ajutorul acestei metode de testare.
Produs de transformare
: toate substanțele chimice rezultate din reacțiile de transformare biotice sau abiotice ale substanței chimice testate, incluzând CO2 și produșii legați în reziduuri.
Sol
: un amestec de constituenți chimici minerali și organici, aceștia din urmă conținând compuși cu un conținut ridicat de carbon și azot și cu mase moleculare mari, populat cu organisme mici (în cea mai mare parte microorganisme). Solul poate fi manipulat în două forme:
|
—
|
neperturbat, așa cum s-a format în timp, în straturile caracteristice ale unei varietăți de tipuri de sol;
|
|
—
|
perturbat, așa cum se găsește de obicei în terenurile arabile când eșantioanele se prelevează prin săpare și sunt utilizate în cadrul acestei metode de testare (2).
|
|
(1)
|
Holland, P.T. (1996). Glossary of Terms Relating to Pesticides. IUPAC Reports on Pesticide (36). Pure & Appl. Chem. 68, 1167-1193.
|
|
(2)
|
OECD Test Guideline 304 A: Inherent Biodegradability in Soil (adopted 12 May 1981).
|
Apendicele 2
Figura 1
Exemplu de coloane nesecționabile de percolare din sticlă
Cu o lungime de 35 cm și un diametru interior de 5 cm (1)

|
(1)
|
Drescher, N. (1985). Moderner Acker- und Pflanzenbau aus Sicht der Pflanzenschutzmittelindustrie. In Unser Boden – 70 Jahre Agrarforschung der BASF AG, 225-236. Verlag Wissenschaft und Politik, Köln.
|
Figura 2
Exemplu de coloană secționabilă din metal cu un diametru interior de 4 cm (1)

|
(1)
|
Burkhard, N., Eberle D.O. and Guth, J.A. (1975). Model systems for studying the environmental behaviour of pesticides. Environmental Quality and Safety, Suppl. Vol. III, 203-213.
|
Apendicele 3
Exemple de factori de mobilitate relativă
(64)
(RMF) pentru o varietate de substanțe chimice fitosanitare (1) (2) și clasele de mobilitate corespunzătoare
(66)
|
Interval RMF
|
Substanța chimică (RMF)
|
Clasa de mobilitate
|
|
≤ 0,15
|
Paration (< 0,15), Flurodifen (0,15)
|
I
imobilă
|
|
0,15 – 0,8
|
Profenofos (0,18), Propiconazol (0,23), Diazinon (0,28), Diuron (0,38), Terbutilazină (0,52), Metidation (0,56), Prometrin (0,59), Propazină (0,64), Alaclor (0,66), Metolaclor (0,68)
|
II
ușor mobilă
|
|
0,8 – 1,3
|
Monuron (65) (1), Atrazină (1,03), Simazină (1,04), Fluometuron (1,18)
|
III.
moderat mobilă
|
|
1,3 – 2,5
|
Prometon (1,67), Cianazină (1,85), Bromacil (1,91), Carbutilat (1,98)
|
IV
relativ mobilă
|
|
2,5 – 5
|
Carbofuran (3), Dioxacarb (4,33)
|
V
mobilă
|
|
> 5,0
|
Monocrotofos (> 5), Dicrotofos (> 5)
|
VI
foarte mobilă
|
|
(1)
|
Guth, J.A. (1985). Adsorption/desorption. In Joint International Symposium «Physicochemical Properties and their Role in Environmental Hazard Assessment.» Canterbury, UK, 1-3 July 1985.
|
|
(2)
|
Guth, J.A. and Hörmann, W.D. (1987). Problematik und Relevanz von Pflanzenschutzmittel-Spuren im Grund (Trink-) Wasser. Schr.Reihe Verein WaBoLu, 68, 91-106.
|
|
(3)
|
Harris, C.I. (1967). Movement of herbicides in soil. Weeds 15, 214-216.
|
|
(4)
|
Helling, C.S. (1971). Pesticide mobility in soils. Soil Sci. Soc. Am. Proc. 35, 743-748.
|
|
(5)
|
McCall, P.J., Laskowski, D.A., Swann, R.L. and Dishburger, H.J. (1981). Measurements of sorption coefficients of organic chemicals and their use in environmental fate analysis. In Test Protocols for Environmental Fate and Movement of Toxicants. Proceedings of AOAC Symposium, AOAC, Washington D.C.
|
|
(6)
|
Hollis, J.M. (1991). Mapping the vulnerability of aquifers and surface waters to pesticide contamination at the national/regional scale. BCPC Monograph No. 47 Pesticides in Soil and Water, 165-174.
|
C.45. ESTIMAREA EMISIILOR ÎN MEDIU PROVENITE DE LA LEMNUL TRATAT CU PRODUSE DE CONSERVARE: METODĂ DE LABORATOR PENTRU PRODUSELE DIN LEMN CARE NU SUNT ACOPERITE ȘI CARE SUNT ÎN CONTACT CU APĂ DULCE SAU CU APĂ DE MARE
INTRODUCERE
|
1.
|
Prezenta metodă de testare este echivalentă cu Orientarea OCDE privind testarea (test guideline – TG) nr. 313 (2007). Emisiile provenite de la lemnul tratat cu produse de conservare în mediu trebuie cuantificate pentru a permite o evaluare a riscurilor pe care lemnul tratat îl prezintă pentru mediu. Această metodă de testare descrie o metodă de laborator pentru estimarea emisiilor provenite lemnul tratat cu produse de conservare în două situații în care emisiile ar putea pătrunde în mediu
|
—
|
Emisiile provenite de la lemnul tratat în contact cu apa dulce. Emisiile de la suprafața lemnului tratat ar putea pătrunde în apă.
|
|
—
|
Emisiile provenite de la lemnul tratat în contact cu apa de mare. Emisiile de la suprafața lemnului tratat ar putea pătrunde în apa de mare.
|
|
|
2.
|
Această metodă de testare vizează testarea emisiilor provenite de la lemn și produsele din lemn care nu sunt acoperite și care se află în contact cu apa dulce sau cu apa de mare. Clasele de utilizare sunt folosite pe plan internațional și clasifică pericolul biologic la care va fi supus produsul tratat. Clasele de utilizare definesc, de asemenea, situația în care se utilizează produsul tratat și determină compartimentele de mediu (aer, apă, sol) care sunt supuse unui risc potențial de către lemnul tratat cu produse de conservare.
|
|
3.
|
Metoda de testare este o procedură de laborator destinată obținerii de eșantioane de (emisii) din apa folosită pentru a scufunda lemnul tratat, la intervale de timp tot mai mari după expunere. Cantitatea de emisii din receptorul emisiilor este legată de aria suprafeței lemnului și de durata expunerii, pentru a estima un flux în mg/m2/zi. Astfel se poate estima fluxul (rata de percolare) după perioade de expunere crescătoare.
|
|
4.
|
Cantitatea de emisii poate fi utilizată într-o evaluare a riscurilor ecologice prezentate de lemnul tratat.
|
CONSIDERAȚII INIȚIALE
|
5.
|
Mecanismul de percolare de la suprafața lemnului de către apa dulce nu se presupune a fi identic din punctul de vedere al naturii și severității cu percolarea de la suprafața lemnului de către apa de mare. Astfel, pentru produsele sau amestecurile de conservare a lemnului utilizate pentru tratarea lemnului, utilizate în mediu cu apă de mare, este necesar un studiu de percolare a lemnului pentru apa de mare.
|
|
6.
|
Lemnul, în cazul lemnului tratat cu un produs de conservare, trebuie să fie reprezentativ pentru lemnul utilizat în scopuri comerciale. El trebuie să fie tratat în conformitate cu instrucțiunile producătorului produselor de conservare și în conformitate cu standardele și specificațiile corespunzătoare. Parametrii pentru condiționarea lemnului după tratare trebuie indicați înainte de începerea testului.
|
|
7.
|
Eșantioanele de lemn utilizate trebuie să fie reprezentative pentru produsele utilizate (de exemplu, în ceea ce privește specia, densitatea si alte caracteristici).
|
|
8.
|
Testul poate fi aplicat lemnului cu ajutorul unui proces penetrant sau al unei aplicări superficiale sau lemnului tratat suspus unui tratament de suprafață suplimentar obligatoriu (de exemplu, vopseaua aplicată ca cerință pentru uzul comercial).
|
|
9.
|
Compoziția, volumul, pH-ul și forma fizică a apei sunt importante în determinarea cantității, a conținutului și a naturii emisiilor provenite de la lemn.
|
PRINCIPIUL METODEI DE TESTARE
|
10.
|
Eșantioanele de lemn de testare tratat cu produse de conservare sunt scufundate în apă. Apa (receptorul emisiilor) este colectată și analizată chimic de mai multe ori pe parcursul perioadei de expunere, suficientă pentru a efectua calcule statistice. Ratele de emisie în mg/m2/zi sunt calculate pe baza rezultatelor analitice. Perioadele de eșantionare trebuie înregistrate. Testele cu eșantioane netratate pot fi oprite dacă nu există nicio valoare de fond detectată în primele trei puncte de date.
|
|
11.
|
Includerea de eșantioane de lemn netratat permite determinarea nivelurilor de fond pentru receptorul emisiilor provenite de la lemn de tip diferit decât cel pentru care au fost folosite produse de conservare.
|
CRITERII DE CALITATE
Acuratețea
|
12.
|
Precizia metodei de testare pentru a estima emisiile depinde de cât de reprezentative sunt eșantioanele de testare pentru lemnul tratat comercial, de cât de reprezentativă este apa în raport cu apa reală și de cât de reprezentativ este regimul de expunere pentru condiții naturale.
|
|
13.
|
Acuratețea, precizia și repetabilitatea metodei analitice trebuie stabilite înainte de efectuarea testului.
|
Reproductibilitatea
|
14.
|
Trei eșantioane de apă sunt colectate și analizate, iar valoarea medie este considerată ca fiind valoarea emisiilor. Reproductibilitatea rezultatelor în cadrul unui laborator și între diferite laboratoare depinde de regimul de imersiune și de lemnul utilizat ca eșantion de testare.
|
Interval acceptabil al rezultatelor
|
15.
|
Este acceptabil un interval de rezultate obținute în urma acestui test, în cazul căruia valorile superioară și inferioară variază cu mai puțin de un ordin de magnitudine.
|
CONDIȚII DE TESTARE
Apă
|
16.
|
Scenarii de percolare în apă dulce: Pentru evaluarea lemnului expus la apa dulce, pentru testul de percolare se recomandă utilizarea de apă deionizată (de exemplu, ASTM D 1193 de tip II). Temperatura apei trebuie să fie de 20 °C +/– 2 °C, iar pH-ul și temperatura apei măsurate trebuie să fie incluse în raportul privind testul. Analiza eșantioanelor de apă utilizate, prelevate înainte de imersia eșantioanelor tratate, permite estimarea substanțelor chimice analizate în apă. Acesta are rol de control menit să determine nivelurile de fond ale substanțelor chimice care sunt apoi analizate chimic.
|
|
17.
|
Scenarii de percolare în apă de mare: Pentru evaluarea lemnului expus la apa de mare, pentru testul de percolare se recomandă utilizarea apei de mare sintetice (de exemplu, ASTM D 1141 susbtituent de apă de ocean, fără metale grele). Temperatura apei trebuie să fie de 20 °C +/– 2 °C, iar pH-ul și temperatura apei măsurate trebuie să fie incluse în raportul privind testul. Analiza eșantioanelor de apă utilizate, prelevate înainte de imersia eșantioanelor tratate, permite estimarea substanțelor chimice analizate în apă. Acesta are rol de control pentru analiza nivelurilor de fond pentru substanțele chimice importante.
|
Eșantioane de lemn pentru testare
|
18.
|
Speciile de lemn trebuie să fie dintre cele utilizate pentru testarea eficacității produselor de conservare a lemnului. Speciile recomandate sunt Pinus sylvestris L. (pinul scoțian), Pinus resinosa Ait. (pinul roșu) sau Pinus spp (pinul sudic). Pot fi efectuate teste suplimentare folosind alte specii.
|
|
19.
|
Trebuie să se utilizeze lemn neted, fără noduri. Trebuie evitate exemplarele cu aspect rășinos. Lemnul trebuie sa fie reprezentativ pentru lemnul disponibil în comerț. Sursă, densitatea și numărul de inele anuale per 10 mm trebuie înregistrate.
|
|
20.
|
Se recomandă ca eșantioanele de lemn de testare să fie constituite din seturi de cinci conforme standardului EN 113 privind dimensiunea blocurilor (dimensiuni de 25 mm × 50 mm × 15 mm), cu fețele longitudinale paralele cu fibra lemnului, deși pot fi utilizate și alte dimensiuni precum 50 mm × 150 mm × 10 mm. Eșantionul de testare trebuie să fie complet scufundat în apă. Eșantioanele de testare se compun 100 % din lemn curățat. Fiecare eșantion este marcat unic astfel încât să poată fi identificat pe toată durata testului.
|
|
21.
|
Toate eșantioanele de testare trebuie să fie rindeluite sau tăiate neted, dar suprafețele nu trebuie să fie șmirgheluite.
|
|
22.
|
Numărul de seturi de eșantioane de lemn utilizate pentru analizare este de cel puțin cinci: trei seturi de eșantioane sunt tratate cu produs de conservare, un set de eșantioane este netratat, iar un set de eșantioane este utilizat pentru estimarea conținutului de umiditate prin metoda uscării în cuptor a eșantioanelor testate înainte de tratament. Se prepară suficiente eșantioane de testare pentru a permite alegerea a trei seturi de eșantioane care se situează în limita a 5 % din valoarea medie a reținerilor de produs de conservare pentru grupul de eșantioane de testare.
|
|
23.
|
Toate eșantioanele sunt izolate la capete cu o substanță chimică care împiedică pătrunderea produsului de conservare în capătul lor sau împiedică percolarea din eșantioane prin intermediul capătului. Este necesar să se facă o distincție între eșantioanele folosite pentru aplicare superficială și procesele de penetrare pentru aplicarea izolantului la capete. Aplicarea izolantului la capete trebuie realizată înainte de tratament numai în cazul aplicării superficiale.
|
|
24.
|
Capătul trebuie să fie deschis pentru tratamente prin procese de penetrare. Prin urmare, eșantioanele trebuie să fie izolate la capete la sfârșitul perioadei de condiționare. Emisia trebuie să fie estimată numai pentru suprafața longitudinală. Materialele de izolare trebuie inspectate și reaplicate dacă este necesar înainte de a începe percolarea și nu trebuie reaplicate după ce percolarea a fost inițiată.
|
Recipientul de imersie
|
25.
|
Recipientul este confecționat dintr-un material inert și este destul de mare pentru a conține 5 eșantioane de lemn EN113 în 500 ml de apă rezultând un raport arie per volum de apă de 0,4 cm2/ml.
|
Ansamblul de testare a eșantioanelor
|
26.
|
Eșantioanele de testare sunt susținute pe un ansamblu care permite ca toate suprafețele expuse ale eșantioanelor să fie în contact cu apa.
|
PROCEDURA DE TRATARE CU PRODUS DE CONSERVARE
Pregătirea eșantioanelor de testare tratate
|
27.
|
Eșantionul de lemn de testare care urmează să fie tratat cu produsul de conservare supus testării este tratat prin metoda specificată pentru respectivul produs de conservare, care poate fi de un proces de tratare prin penetrare sau un proces de aplicare superficială, de exemplu prin imersie, pulverizare sau pensulare.
|
Produsele de conservare aplicate prin procese de tratament prin penetrare
|
28.
|
Trebuie preparată o soluție a produsului de conservare care să permită absorbția sau retenția specificată atunci când este aplicată prin intermediul procesului de tratare prin penetrare. Eșantionul de lemn de testare este cântărit, iar dimensiunile sale sunt măsurate. Procesul de tratare prin penetrare trebuie să fie cel specificat pentru aplicarea produsului de conservare a lemnului utilizat în clasa 4 sau 5 de utilizare. Eșantionul este din nou cântărit după tratament și retenția produsului de conservare (kg/m3) este calculată pe baza ecuației:

|
|
29.
|
Trebuie remarcat faptul că în acest test poate fi utilizat lemn tratat într-o fabrică de tratare industrială (de exemplu, prin impregnare la presiune mică). Procedurile utilizate trebuie înregistrate și retenția materialului tratat astfel trebuie analizată și înregistrată.
|
Produsele de conservare care urmează să fie aplicate prin procese de aplicare superficială
|
30.
|
Procesul de aplicare superficială include imersia, pulverizarea sau pensularea eșantioanelor de lemn de testare. Procesul și rata de aplicare (de exemplu, litri/m2) trebuie să fie astfel cum se specifică pentru aplicarea superficială a produsului de conservare.
|
|
31.
|
De asemenea, trebuie remarcat faptul că, în acest caz, lemnul tratat într-o fabrică de tratare industrială pot fi utilizat în acest test. Procedurile utilizate trebuie înregistrate și retenția materialului tratat astfel trebuie analizată și înregistrată.
|
Condiționarea eșantioanelor de testare după tratare
|
32.
|
După tratare, specimenele de testare tratate trebuie să fie condiționate în conformitate cu recomandările furnizorului de produse de conservare potrivit cerințelor privind etichetele produselor de conservare sau în conformitate cu practicile de tratare comerciale sau în conformitate cu standardul EN 252.
|
Pregătirea și selectarea eșantioanelor de testare
|
33.
|
După condiționarea în urma tratării, retenția medie a grupului de eșantioane de testare este calculată, iar trei seturi de eșantioane cu o retenție care se situează în intervalul +/- 5 % din media grupului sunt selectate în mod aleatoriu pentru măsurători ale percolării.
|
PROCEDURA PENTRU MĂSURAREA EMISIILOR DE PRODUSE DE CONSERVARE
Metoda prin imersie
|
34.
|
Eșantioanele de testare sunt cântărite și apoi scufundate total în apă, înregistrându-se data și ora aferente. Recipientul este acoperit pentru a reduce evaporarea.
|
|
35.
|
Apa este înlocuită la următoarele intervale: 6 ore, 1 zi, 2 zile, 4 zile, 8 zile, 15 zile, 22 de zile, 29 de zile (notă: acestea sunt durate totale, nu intervalele de timp). Ora și data schimbării apei și masa de apă recuperată din recipient trebuie înregistrate.
|
|
36.
|
După fiecare schimbare a apei, este reținut pentru analize chimice ulterioare un eșantion de apă în care a fost scufundat setul de eșantioane de testare.
|
|
37.
|
Procedura de eșantionare permite calcularea profilului cantității de emisii în funcție de timp. Eșantioanele trebuie depozitate în condiții care să asigure conservarea substanței analizate, de exemplu într-un frigider la întuneric pentru a reduce proliferarea microbilor în eșantion înainte de analiză.
|
MĂSURAREA EMISIILOR
Eșantioane tratate
|
38.
|
Apa colectată este analizată chimic pentru a se verifica substanța activă și/sau produsele de degradare/transformare relevante, dacă este cazul.
|
Eșantioane netratate
|
39.
|
Colectarea apei (receptorul emisiilor) în acest sistem și analiza ulterioară a substanțelor chimice care au percolat din eșantioanele de lemn netratat permit estimarea posibilei rate de emisii a produsului de conservare din lemnul netratat. Colectarea și analizarea de receptor de emisii după perioade de expunere crescătoare permit estimarea ratei schimbării ratei de emisii în funcție de timp. Această analiză este o procedură de control care vizează determinarea nivelurilor de fond ale substanței chimice testate în lemnul netratat pentru a confirma faptul că lemnul utilizat ca sursă de eșantioane nu a fost tratat anterior cu produse de conservare.
|
DATE ȘI RAPORTARE
Analizele chimice
|
40.
|
Apa colectată este analizată chimic, iar rezultatul analizei apei este exprimat în unități corespunzătoare, de exemplu μg/l.
|
Înregistrarea datelor
|
41.
|
Toate rezultatele sunt înregistrate. Apendicele prezintă un exemplu al formei de înregistrare recomandate pentru un set de eșantioane de testare tratate și tabelul de sinteză pentru calcularea valorilor medii ale emisiilor pentru fiecare interval de eșantionare.
|
|
42.
|
Fluxul zilnic al emisiilor exprimat în mg/m2/zi se calculează împărțirea mediei celor trei măsurători ale celor trei replici la numărul de zile de imersie.
|
Raportul privind testul
|
43.
|
Cel puțin următoarele informații trebuie furnizate în raportul privind testul.
|
—
|
Numele furnizorului produsului de conservare supus testării;
|
|
—
|
Denumirea sau codul unic sau specific al produsului de conservare supus testării;
|
|
—
|
Denumirea comercială sau comună a ingredientului sau a ingredienților activi cu o descriere generică a excipienților (de exemplu, cosolvenți, rășină) și compoziția în % de m/m a ingredienților;
|
|
—
|
Retenția sau încărcarea relevantă (în kg/m3 sau, respectiv, l/m2) specificată pentru lemnul utilizat în contactul cu apa;
|
|
—
|
Speciile de lemn utilizate cu densitatea lor și rata de creștere în inele per 10 mm;
|
|
—
|
Încărcarea sau retenția produsului de conservare testat și formula utilizată pentru calcularea retenției exprimată ca l/m2 sau ca kg/m3;
|
|
—
|
Metoda de aplicare a produsului de conservare, specificând calendarul de tratament utilizat pentru procesul prin penetrare și metoda de aplicare în cazul folosirii unui tratament superficial;
|
|
—
|
Data aplicării produsului de conservare și o estimare a conținutului de umiditate a eșantioanelor de testare, exprimate în procente;
|
|
—
|
Procedurile de condiționare utilizate, specificând tipul, condițiile și durata;
|
|
—
|
Specificațiile materialului de izolare a capetelor și numărul de aplicări;
|
|
—
|
Specificarea oricărui tratament ulterior al lemnului, de exemplu specificarea furnizorului, tipul, caracteristicile și încărcarea unei vopsele;
|
|
—
|
Ora și data fiecărui eveniment de imersie, cantitatea de apă utilizată pentru imersia eșantioanelor de testare în cadrul fiecărui eveniment și cantitatea de apă absorbită de lemn pe durata imersiei;
|
|
—
|
Orice abatere de la metoda descrisă și orice factori care ar fi putut influența rezultatele.
|
|
BIBLIOGRAFIE
|
(1)
|
European Standard, EN 84 – 1997. Wood preservatives. Accelerated ageing of treated wood prior to biological testing. Leaching procedure.
|
|
(2)
|
European Standard, EN 113/A1 – 2004. Wood preservatives. Test method for determining the protective effectiveness against wood destroying basidiomycetes. Determination of the toxic values.
|
|
(3)
|
European Standard, EN 252 – 1989. Field test method for testing the relative protective effectiveness of a wood preservative in ground contact.
|
|
(4)
|
European Standard, EN 335 – Part 1: 2006. Durability of wood and wood-based products – Definition of use classes – Part1: General.
|
|
(5)
|
American Society for Testing and Materials Standards, ASTM D 1141 – 1998. Standard Practice for the Preparation of Substitute Ocean Water, Without Heavy Metals. Annual Book of ASTM Standards, Volume 11.02.
|
|
(6)
|
American Society for Testing and Materials Standards, ASTM D 1193-77 Type II – 1983. Specifications for Reagent Water. Annual Book of ASTM Standards, Volume 11.01.
|
Apendicele 1
Formular de înregistrare pentru metoda de testare
Estimarea emisiilor din lemnul tratat cu conservant în mediu: Metodă de laborator pentru produsele din lemn care nu sunt acoperite și care sunt în contact cu apă dulce sau cu apă de mare
|
Locul testării
|
|
|
Conservant pentru lemn
|
|
Furnizorul conservantului
|
|
|
Denumirea sau codul specific și unic al conservantului
|
|
|
Denumirea comercială sau comună a conservantului
|
|
|
Excipienți
|
|
|
Retenția relevantă pentru lemnul folosit în contact cu apă
|
|
|
Aplicarea
|
|
Metoda de aplicare
|
|
|
Data aplicării
|
|
|
Formula utilizată pentru calcularea retenției:
|
|
|
Procedura de condiționare
|
|
|
Durata condiționării
|
|
|
Materialul de izolare a capetelor/numărul de aplicări
|
|
|
Tratamentul ulterior
|
dacă este cazul
|
|
Specimene de testare
|
|
Specii de lemn
|
|
|
Densitatea lemnului
|
(minimum … valoare medie … maximum)
|
|
Rata de creștere (inele per 10 mm)
|
(minimum … valoare medie … maximum)
|
|
Conținutul de apă
|
|
|
Ansamblul de testare
(67)
|
Retenție (kg/m3)
|
|
Tratat «x»
|
Valoarea medie și deviația standard sau intervalul pentru 5 specimene
|
|
Tratat «y»
|
Valoarea medie și deviația standard sau intervalul pentru 5 specimene
|
|
Tratat «z»
|
Valoarea medie și deviația standard sau intervalul pentru 5 specimene
|
|
Netratat
|
|
|
Variația parametrilor metodei de testare
|
de exemplu, calitatea apei, dimensiunea specimenelor de testare etc.
|
|
Timp
|
Schimbarea apei
|
Masa specimenului
|
Consumul de apă
|
Eșantionul de apă
|
|
Tratat (medie)
|
Netratat
|
Tratat (medie)
|
Netratat
|
|
Apa de testare
|
x
|
y
|
z
|
|
|
Data
|
g
|
g
|
g
|
g
|
nr.
|
pH
|
pH
|
pH
|
pH
|
|
start
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
6 h
|
|
|
|
|
|
1
|
|
|
|
|
|
24 h
|
|
|
|
|
|
2
|
|
|
|
|
|
2 zile
|
|
|
|
|
|
3
|
|
|
|
|
|
4 zile
|
|
|
|
|
|
4
|
|
|
|
|
|
8 zile
|
|
|
|
|
|
5
|
|
|
|
|
|
15 zile
|
|
|
|
|
|
6
|
|
|
|
|
|
22 zile
|
|
|
|
|
|
7
|
|
|
|
|
|
29 zile
|
|
|
|
|
|
8
|
|
|
|
|
|
|
|
A se realiza tabele separate pentru fiecare ingredient activ
|
Timp
|
Schimbarea apei
|
Rezultate analitice
|
|
Specimene netratate
|
Specimene tratate
|
|
Concentrația i.a. în apă
mg/l
|
Cantitate emisă
mg/m2
|
Rata emisiilor
mg/m2/zi
|
Concentrația i.a. în apă
|
Cantitate emisă
|
Rata emisiilor
|
|
x
|
y
|
z
|
Medie
|
x
|
y
|
z
|
Medie
|
x
|
y
|
z
|
Medie
|
|
|
Data
|
mg/l
|
mg/l
|
mg/l
|
mg/l
|
mg/m2
|
mg/m2
|
mg/m2
|
mg/m2
|
mg/m2/zi
|
mg/m2/zi
|
mg/m2/zi
|
mg/m2/zi
|
|
6 h
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
24 h
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 zile
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 zile
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
8 zile
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
15 zile
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
22 zile
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
29 zile
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Notă: Deoarece rezultatele lemnului netratat pot fi utilizate pentru a corecta ratele emisiilor eșantioanelor tratate, ele trebuie să apară primele și toate valorile pentru eșantioanele tratate ar fi «valori corecte». Poate exista, de asemenea, o corecție pentru analiza inițială a apei.
Apendicele 2
Definiții
Substanța chimică
: o substanță sau un amestec.
Substanța chimică testată
: orice substanță sau amestec testat cu ajutorul acestei metode de testare.
C.46. BIOACUMULAREA ÎN OLIGOCHETELE BENTICE CARE TRĂIESC ÎN SEDIMENTE
INTRODUCERE
|
1.
|
Această metodă de testare este echivalentă cu Orientarea OCDE privind testarea (TG) nr. 315 (2008). Animalele endobentice care ingeră sedimente pot fi expuse la substanțe legate de sedimente (1). Printre aceste organisme care ingeră sedimente, oligochetele acvatice joacă un rol important la baza sistemelor acvatice. Acestea trăiesc în sedimente și deseori reprezintă cele mai abundente specii, mai ales în habitate cu condiții de mediu adverse pentru alte animale. Prin forarea sedimentului și prin funcția lor de pradă, aceste animale pot avea o puternică influență asupra biodisponibilității respectivelor substanțe pentru alte organisme, de exemplu peștii care se hrănesc cu organisme bentice. Spre deosebire de organismele epibentice, oligochetele acvatice endobentice sapă galerii în sediment și ingeră particule de sediment de sub suprafața sedimentului. Din acest motiv, aceste organisme sunt expuse la substanțe prin multe căi de absorție incluzând contactul direct, ingestia de particule de sediment contaminate, apa interstițială sau apa acoperitoare. Unele specii de oligochete bentice care sunt folosite în prezent în cadrul testelor ecotoxicologice sunt descrise în apendicele 6.
|
|
2.
|
Parametrii care caracterizează bioacumularea unei substanțe includ, în primul rând, factorul de bioacumulare (bioaccumulation factor – BAF), constanta vitezei de absorție din sediment (ks) și constanta vitezei de eliminare (ke). Definițiile detaliate ale acestor parametri sunt prezentate în apendicele 1.
|
|
3.
|
Pentru a evalua potențialul de bioacumulare al substanțelor în general și pentru a investiga bioacumularea substanțelor care tind să pătrundă în sau pe sedimente este necesară o metodă specifică pentru fiecare compartiment (1) (2) (3) (4).
|
|
4.
|
Această metodă de testare este concepută pentru a evalua bioacumularea substanțelor asociate sedimentelor la viermii de oligochete endobentice. Substanța testată este adiționată în sediment. Utilizarea sedimentului adiționat are menirea să simuleze un sediment contaminat.
|
|
5.
|
Această metodă se bazează pe metodele existente de testare a toxicității și a bioacumulării în sedimente (1) (4) (5) (6) (7) (8) (9). Alte documente utile sunt: discuțiile și rezultatele unui atelier de lucru internațional (11) și rezultatul unui test interlaboratoare internațional (12).
|
|
6.
|
Acest test se aplică substanțelor organice stabile și neutre care tind să se asocieze cu sedimentele. Bioacumularea compușilor metalo-organici stabili asociați cu sedimentele poate fi, de asemenea, măsurată cu ajutorul acestei metode (12). Acesta nu este aplicabilă în cazul metalelor sau al altor microelemente (11) fără modificarea protocolului de testare în ceea ce privește volumul substratului și al apei și eventual a dimensiunii eșantionului de țesut.
|
CONDIȚII PREALABILE ȘI INFORMAȚII PRIVIND SUBSTANȚA TESTATĂ
|
7.
|
Există disponibile în prezent doar câteva relații structură-activitate cantitative (Quantitative Structure-Activity Relationships – QSAR) bine stabilite privind procesele de bioacumulare (14). Cea mai mult folosită relație este corelația între bioacumulare și bioconcentrarea substanțelor organice stabile și lipofilia lor [exprimată ca logaritmul coeficientului de partiție octanol-apă (log Kow); a se vedea apendicele 1 pentru definiție], respectiv, care a fost elaborată pentru descrierea migrării unei substanțe între apă și de pești. Corelații pentru compartimentul de sedimente au fost, de asemenea, stabilite cu ajutorul acestei relații (15), (16), (17), (18). Corelația log Kow-log BCF ca QSAR majoră poate fi utilă pentru o primă estimare preliminară a potențialului de bioacumulare a substanțelor asociate sedimentului. Cu toate acestea, BAF poate fi influențat de conținutul de lipide al organismului testat și de conținutul de carbon organic din sediment. Prin urmare, coeficientul de partiție carbon organic-apă (Koc) poate fi, de asemenea, utilizat ca un determinant major al bioacumulării substanțelor organice asociate sedimentului.
|
|
8.
|
Acest test se aplică pentru:
|
—
|
substanțele organice stabile cu valori ale log Kow cuprinse între 3 și 6 (5)(19) și substanțele superlipofile care au un log Kow mai mare de 6 (5);
|
|
—
|
substanțele care aparțin unei clase de substanțe organice cunoscute pentru potențialul lor de bioacumulare în organismele vii, de exemplu agenții tensioactivi sau substanțele ușor absorbabile (de exemplu, cu Koc mare).
|
|
|
9.
|
Înainte de începerea studiului trebuie obținute informații cu privire la substanța testată, precum precauțiile de siguranță, condițiile adecvate de depozitare și stabilitatea, precum și metodele analitice. Orientări privind substanțele testate cu proprietăți fizico-chimice care le fac dificil de testat sunt prezentate în (20) și (21). Înainte de efectuarea unui test privind bioacumularea cu oligochete acvatice, sunt necesare următoarele informații privind substanța testată:
|
—
|
denumirea comună, denumirea chimică (de preferință denumirea IUPAC), formula structurală, numărul de înregistrare CAS, puritatea;
|
|
—
|
solubilitatea în apă [metoda de testare A.6 (22) ];
|
|
—
|
coeficientul de partiție octanol-apă, Kow [metodele de testare A.8, A.24 (22)];
|
|
—
|
coeficientul de partiție sediment-apă, exprimat ca Kd sau Koc [metoda de testare C.19 (22)];
|
|
—
|
hidroliza [metoda de testare C.7 (22)];
|
|
—
|
fototransformarea în apă (23);
|
|
—
|
presiunea vaporilor [metoda de testare A.4 (22)];
|
|
—
|
biodegradabilitatea rapidă [metodele de testare C.4 și C.29 (22)];
|
|
—
|
tensiunea suprafeței [metoda de testare A.5 (22)];
|
|
—
|
concentrația critică a micelelor (24).
|
În plus, următoarele informații – dacă sunt disponibile – ar fi relevante:
|
—
|
biodegradarea în mediul acvatic [metodele de testare C.24 și C.25 (22)];
|
|
—
|
constanta legii lui Henry.
|
|
|
10.
|
Substanțele testate marcate radioactiv pot facilita analiza eșantioanelor de apă, sediment și biologice și pot fi utilizate pentru a determina dacă sunt necesare identificarea și cuantificarea produșilor de degradare. Metoda descrisă aici fost validată printr-un testul interlaboratoare internațional (12) pentru substanțe marcate cu 14C. Dacă reziduurile radioactive totale sunt măsurate, factorul de bioacumulare (BAF) se bazează pe substanța parentală inclusiv orice produs de degradare reținut. De asemenea, este posibilă combinarea unui studiu de metabolism cu un studiu de bioacumulare prin analiza și cuantificarea procentului de substanță parentală și a produșilor ei de degradare în eșantioanele prelevate la sfârșitul fazei de absorbție sau la vârful bioacumulării. În orice caz, se recomandă calcularea BAF pe baza concentrației substanței parentale din organism și nu numai pe baza totalului de reziduuri radioactive.
|
|
11.
|
În plus față de proprietățile substanței testate, alte informații necesare sunt toxicitatea pentru speciile de oligochete care urmează să fie utilizate în test, precum concentrația letală mediană (LC50) pentru timpul necesar fazei de absorbție, pentru a asigura că respectivele concentrații de expunere selectate sunt mult mai mici decât nivelurile toxice. Dacă sunt disponibile, trebuie utilizate în mod preferențial valorile de toxicitate determinate din studiile de lungă durată folosind parametri de studiu subletali (EC50). Dacă astfel de date nu sunt disponibile, un test al toxicității acute în condiții identice cu cele ale testului de bioacumulare sau date privind toxicitatea pentru alte specii surogat pot furniza informații utile.
|
|
12.
|
Trebuie să fie disponibilă o metodă analitică adecvată pentru care se cunosc acuratețea, precizia și sensibilitatea în vederea cuantificării substanței din soluțiile de testare, din sediment și din materialul biologic, împreună cu detalii privind prepararea și depozitarea eșantioanelor, precum și cu fișe tehnice de siguranță. Limitele de detectare analitică ale substanței testate în apă, în sediment și în țesutul viermilor trebuie, de asemenea, să fie cunoscute. În cazul utilizării unei substanțe testate marcate radioactiv, radioactivitatea specifică (Bq mol– 1), poziția atomului marcat radioactiv și procentul radioactivității asociate cu impurități trebuie, de asemenea, să fie cunoscute. Radioactivitatea specifică a substanței testate trebuie să fie cât mai mare posibil pentru a detecta concentrațiile de testare cât mai mici posibil (11).
|
|
13.
|
Trebuie să fie puse la dispoziție informații privind caracteristicile sedimentului care urmează să fie utilizat [originea sedimentului sau a constituenților săi, pH-ul și concentrația de amoniac a apei interstițiale (sedimente naturale), conținutul de carbon organic (TOC), distribuția dimensiunii particulelor (procent de nisip, de mâl și de argilă) și procentul greutății uscate] (6).
|
PRINCIPIUL TESTULUI
|
14.
|
Testul constă în două faze; faza de absorbție (expunere) și faza de eliminare (postexpunere). Pe durata fazei de absorbție, viermii sunt expuși la sediment adiționat cu substanța testată, acoperiți cu apă reconstituită și echilibrați în mod corespunzător (11). Grupele de viermi de control sunt ținute în condiții identice fără substanța testată.
|
|
15.
|
Pentru faza de eliminare, viermii sunt transferați într-un sistem sediment-apă fără substanța testată. O fază de eliminare este necesară pentru a obține informații privind viteza cu care substanța testată este excretată de organismele de testare (19) (25). O fază de eliminare este necesară întotdeauna, exceptând cazul în care absorbția substanței testate în timpul fazei de expunere a fost nesemnificativă (de exemplu, nu există diferențe statistice între concentrația substanței testate în viermi testați și în cei de control). În cazul în care o stare de echilibru nu a fost atinsă în timpul fazei de absorbție, determinarea cineticii – BAFK, a constantei sau a constantelor vitezei de absorbție și de eliminare – pot fi efectuate utilizând rezultatele fazei de eliminare. Modificarea concentrației substanței testate din/de pe viermi se monitorizează pe parcursul ambelor faze ale testului.
|
|
16.
|
Pe durata fazei de absorbție, se efectuează măsurători până când BAF ajunge la un platou sau la o stare de echilibru. Implicit, durata fazei de absorbție trebuie să fie de 28 de zile. Experiența practică a demonstrat că o fază de absorbție de 12 – 14 zile este suficientă pentru ca mai multe substanțe organice stabile și neutre să atingă o stare de echilibru (6) (8) (9).
|
|
17.
|
Cu toate acestea, dacă starea de echilibru nu este atinsă în termen de 28 de zile, faza de eliminare este începută prin transferarea oligochetelor în vase conținând același mediu fără substanța testată. Faza de eliminare este încheiată fie atunci când este atins nivelul de 10 % al concentrației măsurate în viermi în ziua 28 a fazei de absorbție, fie după o perioadă maximă de 10 zile. Nivelul rezidual din viermi la sfârșitul fazei de eliminare este raportat ca parametru de studiat suplimentar, adică ca reziduuri neeliminate (non-eliminated residues – NER). Factorul de bioacumulare (BAFss) se calculează de preferință ca raportul dintre concentrația din viermi (Ca) și din sediment (Cs) la starea de echilibru aparentă și ca factor de bioacumulare cinetic, BAFK ca raportul între constanta vitezei de absorbție din sediment (ks) și constanta vitezei de eliminare (ke) pe baza unei cinetici de ordinul întâi. Dacă în termen de 28 de zile nu este obținută o stare de echilibru, BAFK se calculează pe baza constantei (constantelor) vitezei de absorbție și de eliminare. Pentru modul de calculare, a se vedea apendicele 2. În cazul în care cinetica de ordinul întâi nu este aplicabilă, trebuie utilizate modele mai complexe [apendicele 2 și referința (25)].
|
|
18.
|
În cazul în care în termen de 28 de zile nu este obținută o stare de echilibru, faza de absorbție poate, în mod opțional, să fie prelungită pentru grupurile de viermi expuși – dacă sunt disponibili – pentru măsurători suplimentare până la atingerea unei stări de echilibru; în paralel, faza de eliminare trebuie totuși să fie începută în ziua 28 a fazei de absorbție.
|
|
19.
|
Constanta vitezei de absorbție, constanta vitezei de eliminare (sau constantele, în cazul în care sunt implicate modele mai complexe), factorul de bioacumulare cinetică (BAFK) și, dacă este posibil, limitele de încredere pentru fiecare dintre acești parametri, se calculează plecând de la ecuații model computerizate (a se vedea apendicele 2 pentru modele). Cât de adecvată este utilizarea unui model poate fi determinată din coeficientul de corelație sau coeficientul de determinare (coeficienții apropiați de 1 indică o bună adecvare).
|
|
20.
|
Pentru a reduce variabilitatea în rezultatele testelor pentru substanțele organice cu lipofilie mare, factorii de bioacumulare trebuie să fie exprimați în plus în legătură cu conținutul de lipide al organismelor de testare și cu conținutul de carbon organic (TOC) din sediment (factorul de acumulare biotă-sediment sau BSAF în kg sediment TOC kg– 1 de conținut de lipide în viermi). Această metodă se bazează pe experiențe și pe corelațiile teoretice pentru compartimentul acvatic, în cazul în care – pentru unele clase de substanțe chimice – există o relație clară între potențialul unei substanțe de a se bioacumula și lipofilia acesteia, care a fost bine stabilită pentru pești ca model de organisme (14) (25) (27). De asemenea, există o relație între conținutul de lipide al peștilor de testare și bioacumularea observată a acestor substanțe. Pentru organismele bentice au fost identificate corelații similare (15) (16) (17) (18). Dacă este disponibil suficient țesut de vierme, conținutul de lipide al animalelor de testare poate fi determinat pe același material biologic ca cel utilizat pentru determinarea concentrației de substanță chimică testată. Totuși, este practic să se utilizeze animalele de control aclimatizate cel puțin la începutul sau – de preferință – la finalul fazei de absorbție în vederea măsurării conținutului de lipide, care pot fi apoi utilizate pentru a normaliza valorile BAF.
|
VALIDITATEA TESTULUI
|
21.
|
Pentru ca un test să fie valid, trebuie să se aplice următoarele condiții:
|
—
|
Mortalitatea cumulată a viermilor (control și tratament) până la sfârșitul testului nu trebuie să depășească 20 % din numărul inițial.
|
|
—
|
În plus, trebuie să se demonstreze că viermii sapă galerii în sediment pentru a permite o expunere maximă. Pentru detalii, a se vedea punctul 28.
|
|
DESCRIEREA METODEI
Speciile folosite pentru testare
|
22.
|
Mai multe specii de oligochete acvatice pot fi folosite pentru testare. Speciile cel mai frecvent folosite sunt enumerate în apendicele 6.
|
|
23.
|
Testele de toxicitate (96 h, în numai apă) trebuie efectuate la intervale regulate (de exemplu, în fiecare lună), cu o substanță toxică de referință precum clorura de potasiu (KCl) sau sulfatul de cupru (CuSO4) (1) pentru a demonstra starea de sănătate a animalelor de testare (1) (6). În cazul în care testele de toxicitate de referință nu sunt efectuate la intervale regulate, lotul organismelor care urmează să fie utilizate într-un test de bioacumulare în sediment trebuie verificat cu ajutorul unei substanțe toxice de referință. Măsurarea conținutului de lipide poate furniza, de asemenea, informații utile privind starea animalelor.
|
Cultura organismelor de testare
|
24.
|
Pentru a avea un număr suficient de viermi pentru efectuarea testelor de bioacumulare, este utilă menținerea viermilor în cultură de laborator permanentă monospecie. Metodele de cultură în laborator pentru speciile de testare selectate sunt sintetizate în apendicele 6. Pentru detalii, a se vedea referințele (8) (9) (10) (18) (28) (29) (30) (31) (32).
|
Aparatură
|
25.
|
A se evita, pentru toate componentele echipamentelor, utilizarea de materiale care pot dizolva și absorbi substanțele testate sau care pot percola alte substanțe și care pot avea un efect advers asupra animalelor de testare. Pot fi folosite camere standard rectangulare sau cilindrice, realizate din material inert chimic și cu o capacitate adecvată, în concordanță cu rata de încărcare, adică cu numărul de viermi testați. Trebuie evitată utilizarea de tuburi din plastic moale pentru administrarea apei sau a aerului. Politetrafluoretilena, oțelul inoxidabil și/sau sticla trebuie utilizate pentru orice echipament care intră în contact cu mediul de testare. Pentru substanțele cu coeficienți mari de adsorbție, cum ar fi piretroidele de sinteză, poate fi necesară sticla silanizată. În aceste cazuri, echipamentul se va elimina după utilizare (5). A se evita, pentru substanțele de testare marcate radioactiv și pentru substanțele volatile, detașarea sau scăparea substanțelor testate detașate. Trebuie utilizate captatoare (de exemplu, flacoane din sticlă de spălare a gazelor) care conțin absorbanți adecvați pentru a reține orice reziduuri care se evaporă din camerele de testare (11).
|
Apă
|
26.
|
Calitatea apei acoperitoare trebuie să permită supraviețuirea speciei de testare, în perioada de aclimatizare și pe parcursul testării, fără apariția unui comportament sau aspect anormal. Apă reconstituită în conformitate cu metoda de testare C.1 (25) este recomandată pentru utilizarea ca apă acoperitoare în teste, precum și în culturile de laborator ale viermilor. S-a demonstrat că mai multe specii de testare pot supraviețui, crește și se pot reproduce în acest tip de apă (8) fiind asigurată o standardizare maximă a condițiilor de testare și de cultură. Apa trebuie să fie caracterizată cel puțin prin pH, conductivitate și duritate. Analiza micropoluanților din apă înainte de utilizarea acesteia ar putea să furnizeze informații utile (apendicele 4).
|
|
27.
|
Pe toată perioada testării, apa trebuie să fie de calitate constantă. pH-ul apei acoperitoare trebuie să fie cuprins între 6 și 9. Duritatea totală trebuie să fie între 90 și 400 mg CaCO3 per litru la începutul testului (7). Intervalele pentru pH și duritate în apa reconstituită menționată este indicat în metoda de testare C.1 (25). Dacă se estimează o interacțiune între ionii de duritate și substanța testată, atunci trebuie să se utilizeze apă cu o duritate mai mică. Apendicele 4 sintetizează criteriile suplimentare pentru o apă de diluție acceptabilă conform Orientării TG nr. 210 a OCDE (34).
|
Sediment
|
28.
|
Calitatea sedimentului trebuie să permită supraviețuirea și, de preferință, reproducerea organismelor de testare în perioada de aclimatizare și pe parcursul testării, fără apariția unui comportament sau aspect anormal. Viermii trebuie să sape galerii în sediment. Comportamentul de săpare de galerii poate influența expunerea și, în consecință, BAF. Prin urmare, tendința de evitare a sedimentului sau comportamentul de săpare de galerii al organismelor de testare trebuie înregistrat, dacă turbiditatea apei acoperitoare permite astfel de observații. Viermii (control și tratamente) trebuie să sape galerii în sediment în 24 de ore de la introducerea în vasele de testare. În cazul în care se observă că în mod permanent nu sapă galerii sau evită sedimentul (de exemplu, peste 20 % timp de peste jumătate din faza de absorbție), aceasta indică faptul că fie condițiile de testare nu sunt adecvate, fie organismele de testare nu sunt sănătoase, fie concentrația substanței testate provoacă acest comportament. În acest caz, testul trebuie oprit și repetat în condiții îmbunătățite. Informații suplimentare privind ingestia de sediment pot fi obținute cu ajutorul metodelor descrise în referințele (35) și (36), în care se specifică ingestia sedimentului sau selectarea particulelor în organismele de testare. Dacă este observabilă, cel puțin prezența sau absența granulelor de fecale pe suprafața sedimentului, care indică ingestie de sediment de către viermi, trebuie înregistrate și luate în considerare pentru interpretarea rezultatelor testului în ceea ce privește căile de expunere.
|
|
29.
|
Un sediment artificial bazat pe solul artificial descris în metoda de testare C.8 (40) este recomandat pentru a fi utilizat atât în teste, cât și culturile de laborator ale viermilor (apendicele 5), întrucât sedimentele naturale de calitate adecvată pot să nu fie disponibile pe parcursul întregului an. In plus, organismele indigene precum și posibila prezență a micropoluanților în sedimentele naturale ar putea influența testul. Mai multe specii de testare pot supraviețui, crește și se pot reproduce în sedimentul artificial (8).
|
|
30.
|
Sedimentul artificial trebuie să fie caracterizat cel puțin prin originea constituenților, prin distribuția dimensiunii particulelor (procentul de nisip, de mâl și de argilă), prin conținutul de carbon organic (TOC), prin conținutul de apă și prin pH-ul său. Măsurarea potențialului redox este opțională. Cu toate acestea, sedimentele naturale provenite din locuri nepoluate pot servi drept sediment de testare și/sau de cultură (1). Sedimentele naturale trebuie caracterizate cel puțin prin origine (locul prelevării), pH-ul și conținutul de amoniac din apa interstițială, prin conținutul de carbon organic (TOC), prin distribuția dimensiunii particulelor (procentul de nisip, de mâl și de argilă) și prin procentul de apă (6). Se recomandă ca, înainte de adiționarea cu substanță testată, sedimentul natural să fie condiționat timp de șapte zile în aceleași condiții care predomină în testul ulterior, dacă se estimează formarea de amoniac. La finalul acestei perioade de condiționare, apa acoperitoare trebuie extrasă și eliminată. Analiza micropoluanților din sediment sau din constituenții săi înainte de utilizare ar putea furniza informații utile.
|
Pregătire
|
31.
|
Procedurile de manipulare a sedimentelor naturale înainte de utilizarea acestora în laborator sunt descrise în referințele (1), (6) și (44). În apendicele 5 este descrisă prepararea sedimentului artificial.
|
Depozitare
|
32.
|
Depozitarea sedimentelor naturale în laborator trebuie să fie cât mai scurtă posibil. U.S. EPA (6) recomandă o perioadă de depozitare de maximum 8 săptămâni la 4 ± 2 °C la întuneric. Nu trebuie să existe un spațiul neumplut deasupra sedimentului în recipientele de depozitare. Recomandări pentru depozitarea sedimentului artificial sunt prezentate în apendicele 5.
|
Aplicarea substanței testate
|
33.
|
Sedimentul este adiționat cu substanță testată. Procedura de adiționare implică acoperirea unuia sau mai multor constituenți ai sedimentului cu substanța testată. De exemplu, nisipul de cuarț sau o parte a acestuia (de exemplu, 10 g de nisip de cuarț per vas de testare) poate fi irigat cu o soluție a substanței testate într-un solvent adecvat, care este ulterior evaporat lent până la uscare. Fracțiunea acoperită poate fi apoi amestecată cu solul umed. Cantitatea de nisip din amestecul de substanță testată și de nisip trebuie să fie luată în considerare în momentul preparării sedimentului, adică sedimentul trebuie să fie preparat cu mai puțin nisip (6).
|
|
34.
|
În cazul sedimentului natural, substanța chimică testată poate fi adăugată prin adiționarea unei porții uscate de sediment conform descrierii de mai sus pentru sedimentul artificial sau prin amestecarea substanței testate în sedimentul umed, cu evaporare ulterioară a oricărui agent de solubilizarea utilizat. Solvenții adecvați pentru adiționarea sedimentului umed sunt etanolul, metanolul, eterul monometilic de etilen glicol, eterul dimetilic de etilen glicol, dimetilformamida și trietilen glicolul (5) (34). Toxicitatea și volatilitatea solventului și solubilitatea substanței testate în solventul ales trebuie să reprezinte principalele criterii pentru selectarea unui agent de solubilizare adecvat. Orientări suplimentare privind procedurile de adiționare sunt furnizate în Environment Canada (1995) (41). Trebuie să se procedeze cu grijă astfel încât substanța testată adăugată la sediment să fie distribuită minuțios și uniform în sediment. Subeșantioanele replici ale sedimentului adiționat trebuie analizate pentru a verifica concentrația substanței testate în sediment și pentru a determina gradul de omogenitate al distribuției substanței testate.
|
|
35.
|
După pregătirea sedimentului adiționat cu apă acoperitoare, este de dorit să se lase timp pentru migrarea substanței de testate din sediment în faza apoasă. De preferință, aceasta trebuie să se realizeze în condițiile de temperatură și aerare utilizate în test. Perioada de echilibrare corespunzătoare depinde de sediment și de substanță și poate fi de ordinul orelor sau de ordinul zilelor, iar în cazuri rare poate ajunge la câteva săptămâni (4 – 5 săptămâni) (28)(42). În acest test nu este necesar să se aștepte un echilibru complet, însă se recomandă o perioadă de echilibrare cuprinsă între 48 de ore și 7 zile. În funcție de scopul studiului, de exemplu, atunci când trebuie reproduse condițiile de mediu, sedimentul adiționat poate fi echilibrat sau învechit într-o perioadă mai lungă (11).
|
EFECTUAREA TESTULUI
Testul preliminar
|
36.
|
Se poate dovedi utilă realizarea unui experiment preliminar pentru optimizarea condițiilor de testare ale testului definitiv, de exemplu selecția concentrației (concentrațiilor) substanței testate și durata fazelor de absorbție și de eliminare. Comportamentul viermilor, de exemplu evitarea sedimentului, adică viermii ies din sediment, care poate fi cauzat de substanța de testare și/sau de însuși sedimentul, trebuie observat și înregistrat pe parcursul unui test preliminar. Evitarea sedimentului poate fi, de asemenea, utilizată ca parametru subletal într-un test preliminar pentru estimarea concentrației (concentrațiilor) substanțe testate în vederea utilizării într-un test de bioacumulare.
|
Condiții de expunere
Durata fazei de absorbție
|
37.
|
Organismele testate sunt expuse la substanța testată în timpul fazei de absorbție. Primul eșantion trebuie prelevat la 4 – 24 de ore după începerea fazei de absorbție. Faza de absorbție trebuie să dureze 28 de zile (1) (6) (11), exceptând cazul în care se poate demonstra că echilibrul a fost atins mai devreme. Starea de echilibru apare atunci când: (i) curba factorilor de bioacumulare la fiecare perioadă de eșantionare în raport cu timpul este paralelă cu axa timpului; (ii) trei analize succesive ale BAF realizate pe eșantioane prelevate la intervale de cel puțin două zile nu variază mai mult de ± 20 % între ele; și (iii) nu există diferențe semnificative între cele trei perioade de eșantionare (pe baza comparațiilor statistice, de exemplu analiza varianței și analiza regresiei). În cazul în care starea de echilibru nu a fost obținută până în ziua 28, faza de absorbție poate fi încheiată prin începerea fazei de eliminare, iar BAFK poate fi calculat pe baza constantelor vitezelor de absorbție și de eliminare (a se vedea, de asemenea, punctele 16 și 18).
|
Durata fazei de eliminare
|
38.
|
Primul eșantion trebuie prelevat la 4 – 24 de ore după începerea fazei de eliminare, deoarece în timpul perioadei inițiale pot să apară schimbări rapide ale reziduul tisular. Terminarea fazei de eliminare se recomandă să fie realizată fie atunci când concentrația substanței testate este mai mică de 10 % din concentrația stării de echilibru, fie după o durată maximă de 10 zile. Nivelul de reziduuri din viermi la sfârșitul fazei de eliminare este raportat ca parametru studiat secundar. Totuși, perioada poate fi determinată de perioada în care concentrația substanței testate din viermi rămâne deasupra limitei de detecție analitice.
|
Organismele testate
Numărul viermilor testați
|
39.
|
Numărul de viermi per eșantion trebuie să asigure o masă de țesut de vierme astfel încât masa de substanță de testare per eșantion la începutul fazei de absorbție și, respectiv, la sfârșitul fazei de eliminare, să fie semnificativ mai mare decât limita de detecție pentru substanța testată din materialul biologic. În fazele de absorbție și de eliminare menționate, concentrația din animalele testate este, de obicei, relativ mică (6) (8) (18). Întrucât greutatea individuală pentru multe dintre speciile de oligochete acvatice este foarte mică (5 – 10 mg greutate umedă per individ pentru Lumbriculus variegatus și Tubifex tubifex), viermii dintr-o cameră de testare replică dată pot fi comasați pentru cântărire și analiza substanței chimice testate. Pentru speciile testate cu o greutate individuală mai mare parte (de exemplu, Branchiura sowerbyi) pot fi utilizate camerele de testare replică care conțin un individ, însă în astfel de cazuri trebuie să se crească numărul de replici la cinci pentru fiecare punct de prelevare (11). Totuși, trebuie remarcat faptul că B. sowerbyi nu a fost inclusă în testul interlaboratoare (12) și, prin urmare, nu este recomandată ca specie preferabilă pentru această metodă.
|
|
40.
|
Trebuie folosiți viermi de dimensiuni similare (pentru L. variegatus a se vedea apendicele 6). Ei trebuie să provină din aceeași sursă și trebuie să fie animale adulte sau animale mari aparținând aceleași categorii de vârstă (a se vedea apendicele 6). Greutatea și vârsta unui animal pot avea un efect semnificativ asupra valorilor BAF (de exemplu, datorită conținutului lipidic diferit și/sau a prezenței ouălor); acești parametri trebuie să fie înregistrați cu precizie. Pentru a măsura greutatea umedă și uscată medie, înainte de începerea testului trebuie cântărit un subeșantion de viermi.
|
|
41.
|
În ceea ce privește Tubifex tubifex și Lumbriculus variegatus, se estimează că pe parcursul testului va exista reproducere. Lipsa reproducerii în cadrul unui test de bioacumulare trebuie înregistrată și trebuie luată considerare la interpretarea rezultatelor testelor.
|
Încărcare
|
42.
|
Trebuie să se utilizeze raporturi sediment-vierme și apă-vierme mari pentru a minimiza reducerea concentrației substanței chimice testate în sediment pe durata fazei de absorbție și pentru a evita scăderea concentrației oxigenului dizolvat. Rata de încărcare aleasă trebuie să corespundă, de asemenea, densităților naturale ale populației pentru specia selectată (43). De exemplu, pentru Tubifex tubifex, se recomandă o rată de încărcare de 1 – 4 mg de țesut de vierme (greutate umedă) per gram de sediment umed (8) (11). Referințele (1) și (6) recomandă o rată de încărcare ≤1 g greutate uscată de țesut de vierme per 50 g de carbon organic în sediment pentru L. variegatus.
|
|
43.
|
Viermii care urmează să fie utilizați în cadrul unui test sunt extrași din cultură prin cernerea sedimentului de cultură. Animalele (adulte sau de mari dimensiuni care nu prezintă semne de fragmentare recentă) sunt transferate în vase din sticlă (de exemplu, plăci Petri) care conțin apă curată. Dacă condițiile de testare diferă de condițiile de cultură, o fază de aclimatizare de 24 de ore trebuie să fie suficientă. Înainte de cântărire, trebuie să fie eliminat excesul de apă de pe viermi. Aceasta se poate realiza prin plasarea cu atenție a viermilor pe șervețele de hârtie preumezite. Nu este recomandat utilizarea de hârtie absorbantă pentru a usca viermii întrucât aceasta poate provoca stres sau deteriorare a viermilor. Brunson et al. (1998) a recomandat utilizarea de viermi neuscați de aproximativ 1,33 ori mai mari decât biomasa vizată. Acestea procent suplimentar de 33 % corespunde diferenței dintre viermii uscați și viermii neuscați (28).
|
|
44.
|
La începutul fazei de absorbție (ziua 0 a testului), organismele de testare sunt îndepărtate din camera de aclimatizare și distribuite în mod aleatoriu în vase (de exemplu, plăci Petri) care conțin apă reconstituită prin adăugarea de grupuri de doi viermi în fiecare vas, până când fiecare vas conține zece viermi. Fiecare dintre aceste grupuri de viermi sunt apoi transferate în mod aleatoriu în vase de testare separate, de exemplu folosind un forceps fin din oțel. Vasele de testare sunt ulterior incubate în condițiile de testare.
|
Hrănire
|
45.
|
Având în vedere conținutul mic de nutrienți din sedimentul artificial, sedimentul trebuie modificat cu o sursă de hrană. Pentru a nu subestima expunerea organismelor de testare, de exemplu prin alimentarea selectivă cu hrană necontaminată, hrana necesară pentru reproducerea și creșterea organismelor de testare trebuie adăugată în sediment înainte sau pe parcursul aplicării substanței testate (a se vedea apendicele 5).
|
Raportul sediment-apă
|
46.
|
Raportul sediment-apă recomandat este de 1:4 (45). Acest raport este considerat adecvat pentru a menține concentrațiilor de oxigen la niveluri adecvate și pentru a evita acumularea de amoniac în apa acoperitoare. Conținutul de oxigen în apa acoperitoare trebuie menținut la o saturație ≥ 40 %. Apa acoperitoare din vasele de testare trebuie aerată ușor (de exemplu 2 – 4 bule pe secundă) cu ajutorul unei pipete Pasteur așezată la aproximativ 2 cm deasupra suprafeței sedimentului astfel încât să se limiteze la minimum perturbarea acestuia.
|
Lumina și temperatura
|
47.
|
Perioada de expunere la lumină a culturii și în cadrul testului este e 16 ore (1) (6). Intensitatea luminii în zona de testare trebuie menținută la aproximativ 500 – 1 000 lux. Temperatura trebuie să fie 20 ± 2 °C pe parcursul întregului test.
|
Concentrațiile testate
|
48.
|
O concentrație de testare (cât mai mică posibil) este utilizată pentru determinarea cineticii absorbției, dar poate fi utilizată o a doua concentrație (mai mare) [de exemplu, (46)]. În acest caz, eșantioanele sunt prelevate și analizate la starea de echilibru sau după 28 de zile pentru a confirma BAF măsurat la concentrația mai mică (11). Concentrația mai mare trebuie selectată astfel încât efectele adverse să poată fi excluse (de exemplu, prin alegerea a aproximativ 1 % din cea mai mică concentrație ECx cunoscută fără efecte cronice, astfel cum rezultă din studiile de toxicitate cronică relevante). Concentrația de testare mai mică trebuie să fie semnificativ mai mare decât limita de detecție din eșantioanele de sedimente și biologice prin metoda analitică utilizată. În cazul în care concentrația substanței testate la care se observă efecte este aproape de limita de detecție analitică, se recomandă utilizarea unei substanței testate marcate radioactiv cu o radioactivitate specifică mare.
|
Replicile tratate și de control
|
49.
|
Numărul minim de replici tratate pentru măsurătorile cinetice trebuie să fie de trei pe punct de prelevare (11) pe durata fazelor de absorbție și de eliminare. Trebuie utilizate replici suplimentare, de exemplu pentru date de eșantionare suplimentare opționale. Pentru faza de eliminare, un număr corespunzător de replici este pregătit cu sedimente neadiționate și apă acoperitoare, astfel încât viermii tratați să poată fi transferați din vasele tratate desemnate în vase netratate la sfârșitul fazei de absorbție. Numărul total de replici tratate trebuie să fie suficient atât pentru faza de absorbție, cât și pentru faza de eliminare.
|
|
50.
|
Ca alternativă, viermii desemnați pentru eșantionare pe durata fazei de eliminare pot fi expuși într-un recipient mare conținând sediment adiționat din același lot ca cel utilizat pentru cinetica absorbției. Trebuie să se demonstreze că condițiile de testare (de exemplu, adâncimea sedimentului, raportul sediment-apă, încărcarea, temperatura, calitatea apei) sunt comparabile cu cele ale replicilor desemnate pentru faza de absorbție. La sfârșitul fazei de absorbție, eșantioanele de apă, de sediment și de viermi trebuie prelevate din acest recipient pentru analiză și un număr suficient de viermi mari care nu prezintă semne de fragmentare recentă trebuie îndepărtați cu grijă și transferați în replicile pregătite pentru faza de eliminare (de exemplu, 10 organisme per vas replică).
|
|
51.
|
În cazul în care nu este utilizat niciun alt solvent în afară de apă, trebuie asigurate cel puțin 9 replici cu control negativ (cel puțin 3 eșantionate la început, 3 la sfârșitul absorbției și 3 la sfârșitul eliminării) pentru o analiză biologică și de fond. În cazul în care se utilizează vreun agent de solubilizare pentru aplicarea substanței testate, un solvent de control ar trebui să fie utilizat (trebuie eșantionate cel puțin 3 replici la început, 3 la sfârșitul fazei de absorbție și 3 la sfârșitul fazei de eliminare). În acest caz, trebuie asigurate cel puțin 4 replici cu control negativ (fără solvent) pentru eșantionare la sfârșitul fazei de absorbție. Aceste replici pot fi comparate din punct de vedere biologic cu solventul de control pentru a se obține informații privind posibila influență a solventului asupra organismelor de testare. Detalii sunt incluse în apendicele 3.
|
Frecvența de măsurare a calității apei
|
52.
|
Ca o condiție minimă, următorii parametri privind calitatea apei trebuie măsurați în apa acoperitoare pe parcursul fazei de absorbție și al fazei de eliminare:
|
Temperatura
|
în unul dintre vasele aferente fiecărui nivel de tratament pentru fiecare dată de eșantionare și în unul dintre vasele de control o dată pe săptămână și la începutul și la sfârșitul perioadei de absorbție și de eliminare; temperatura în mediul înconjurător (aerul ambiental sau baia de apă) sau în unul dintre vasele de testare reprezentative poate fi, de asemenea, înregistrată, de exemplu în intervale continue sau orare;
|
|
Conținutul de oxigen dizolvat
|
în unul dintre vasele aferente fiecărui nivel de tratament și în unul dintre vasele de control pentru fiecare dată de eșantionare; exprimat în mg/L și % ASV (valoarea de saturație din aer);
|
|
Alimentarea cu aer
|
controlată cel puțin o dată pe zi (zile lucrătoare) și ajustată, dacă este necesar;
|
|
pH
|
în unul dintre vasele aferente fiecărui nivel de tratament pentru fiecare data de eșantionare și în unul dintre vasele de control o dată pe săptămână și la începutul și la sfârșitul perioadei de absorbție și de eliminare;
|
|
Duritatea totală a apei
|
cel puțin în unul dintre vasele de tratament și în unul dintre vasele de testare de control la începutul și la sfârșitul fazei de absorbție și eliminare, exprimată ca mg/l CaCO3;
|
|
Conținutul total de amoniac
|
cel puțin în unul dintre vasele de tratament și în unul dintre vasele de testare de control la începutul și la sfârșitul perioadei de absorbție și de eliminare; exprimat ca mg/l NH4
+ sau NH3 sau total amoniac-N.
|
|
Eșantionarea și analiza viermilor, a sedimentului și a apei
Calendarul eșantionării
|
53.
|
Exemple de programe de eșantionare pentru o fază de absorbție de 28 de zile și o fază de eliminare de 10 zile sunt prezentate în apendicele 3.
|
|
54.
|
Se prelevează eșantioane de apă și de sediment din camerele de testare pentru determinarea concentrației substanței testate înainte de introducerea viermilor și pe parcursul fazelor de absorbție și de eliminare. Pe durata testării, se determină concentrațiile substanței testate din viermi, sediment și apă cu scopul de a monitoriza distribuirea substanței testate în compartimentele sistemului de testare.
|
|
55.
|
Se prelevează eșantioane de viermi, de sediment și de apă de cel puțin șase ori pe durata fazei de absorbție și a fazei de eliminare.
|
|
56.
|
Se continuă eșantionarea până la stabilirea unui platou (starea de echilibru) (a se vedea apendicele 1) sau timp de 28 de zile. În cazul în care platoul nu a fost atins până în ziua 28, se începe faza de eliminare. La începerea fazei de eliminare, se transferă viermii desemnați în camere replică care conțin sediment și apă netratate (a se vedea, de asemenea, punctele 17 și 18).
|
Eșantionarea și pregătirea eșantioanelor
|
57.
|
Se obțin eșantioane de apă prin decantare, sifonare sau pipetarea unui volum suficient pentru măsurarea cantității substanței testate din eșantion.
|
|
58.
|
Apa acoperitoare rămasă este decantată sau sifonată cu atenție din camera (camerele de testare). Eșantioanele de sediment trebuie prelevate cu atenție, astfel încât viermii să fie perturbați la minimum.
|
|
59.
|
Se îndepărtează toți viermii din vasele de testare replică în momentul eșantionării, de exemplu prin suspendarea sedimentului și a apei acoperitoare și răspândirea conținutului fiecărei replici pe o tavă de mică adâncime, culegând viermii cu ajutorul unui forceps fin din oțel. Viermii se clătesc rapid cu apă pe o tavă de mică adâncime din sticlă sau din oțel. Se îndepărtează excesul de apă. Se transferă cu atenție viermii într-un vas precântărit și se cântăresc. Se sacrifică viermii prin înghețare (de exemplu la ≤ – 18 °C). Prezența și numărul de coconi și/sau de exemplare tinere trebuie înregistrate.
|
|
60.
|
În general, viermii trebuie cântăriți și sacrificați imediat după prelevare în absența unei faze de purjare intestinală pentru a obține un BAF conservator care să includă conținut intestinal contaminat, precum și pentru a evita pierderile de reziduuri ale corpului în timpul unei perioade de purjare a intestinelor numai în apă (8). Este de așteptat că substanțele cu log Kow mai mare de 5 nu se elimină în mod semnificativ în cursul unei perioade de purjare intestinală numai în apă, în timp ce substanțele cu log Kow mai mic de 4 pot fi pierdute în cantități importante (47).
|
|
61.
|
În timpul fazei de eliminare, viermii își curăță intestinele în sedimentul curat. Aceasta înseamnă că măsurătorile efectuate imediat înainte de faza de eliminare includ sediment contaminat cu excreții, în timp ce după perioada inițială de 4 – 24 de ore a fazei de eliminare, cea mai mare parte a conținutului contaminat cu excreții se presupune că este înlocuit cu sediment curat (11) (47). Concentrația din viermii din acest eșantion poate fi apoi considerată drept concentrația tisulară după purjare intestinală. Pentru a ține cont de diluția concentrației substanței testate de sedimentul necontaminat în timpul fazei de eliminare, greutatea conținutului intestinal poate fi estimată din raportul greutate umedă vierme/greutate cenușă vierme sau din raportul greutate uscată vierme/greutate cenușă vierme.
|
|
62.
|
În cazul în care scopul unui studiu specific este de a măsura biodisponibilitatea și reziduurile tisulare reale din organismele de testare, atunci cel puțin un subeșantion de animale tratate (de exemplu, din trei vase replică suplimentare), de preferință eșantionate pe parcursul stării de echilibru, trebuie cântărite, purjate în apă curată pentru o perioadă de 6 ore (de 47 de) și cântărite din nou înainte de analiză. Datele privind greutatea viermilor și concentrația din corp pentru acest subeșantion pot fi ulterior comparate cu valorile obținute pentru viermi nepurjați. Viermii desemnați pentru măsurarea eliminării nu trebuie purjați înainte de transferul în sedimentul curat pentru a minimiza stresul suplimentar pentru animale.
|
|
63.
|
De preferință, eșantioanele de apă, de sediment și de viermi se analizează imediat (adică în termen de 1 – 2 zile) după îndepărtare pentru a preveni degradarea sau alte pierderi și pentru a calcula vitezele aproximative de absorbție și de eliminare pe măsură ce testul avansează. O analiză imediată determină și evitarea întârzierilor în stabilirea momentului în care a fost atins un platou.
|
|
64.
|
În cazul în care nu este efectuată o analiză imediată, eșantioanele trebuie depozitate în condiții adecvate. Se obțin informații privind stabilitatea și condițiile de depozitare adecvate pentru substanța testată în cauză înainte de începerea studiului (de exemplu, durata și temperatura de depozitare, procedurile de extragere etc.). Dacă astfel de informații nu sunt disponibile, dar sunt considerate necesare, pot fi utilizate simultan țesuturi de control adiționate pentru a determina stabilitatea la depozitare.
|
Calitatea metodei analitice
|
65.
|
Întrucât întreaga procedură este determinată, în principal, de acuratețea, precizia și sensibilitatea metodei analitice utilizate pentru substanța testată, trebuie verificat în mod experimental că precizia și reproductivitatea analizei chimice, precum și recuperarea substanței testate din eșantioanele de apă, de sediment și de viermi sunt pe deplin satisfăcătoare în cazul particular al respectivei metode. De asemenea, trebuie să se verifice că substanța testată nu poate fi detectată în camerele de control la concentrații mai mari decât cele de fond. Dacă este necesar, se corectează valorile Cw, Cs și Ca pentru valorile de control pentru recuperări și de fond. Pe întreaga durată a testului, toate eșantioanele trebuie manipulate astfel încât să se minimizeze contaminarea și pierderile (rezultate, de exemplu, din absorbția substanței testate pe dispozitivul de eșantionare).
|
|
66.
|
Recuperarea totală și recuperarea substanței testate din viermi, din sediment și din apă și, dacă se utilizează, din captatoarele care conțin absorbanți pentru a reține substanța testată evaporată, trebuie înregistrate și raportate.
|
|
67.
|
Întrucât se recomandă utilizarea de substanțe marcate radioactiv, este posibil să se analizeze radioactivitatea totală (produși parentali și de degradare). Totuși, dacă este fezabilă din punct de vedere analitic, cuantificarea substanței parentale și a produșilor de degradare în starea de echilibru sau la sfârșitul fazei de absorbție poate furniza informații importante. Dacă se intenționează efectuarea unor astfel de măsurători, eșantioanele trebuie apoi supuse unor proceduri adecvate de extragere, astfel încât substanța parentală să poate fi cuantificată separat. Atunci când un produs de degradare detectat reprezintă un procent semnificativ (de exemplu, > 10 %) din radioactivitatea măsurată în organismele de testare în starea de echilibru sau la sfârșitul fazei de absorbție, se recomandă identificarea respectivilor produși de degradare (5).
|
|
68.
|
Ca urmare a unei biomase individuale mici, de multe ori nu este posibil să se determine concentrația substanței testate din fiecare vierme individual, cu excepția cazului în care ca specie de testare este folosită specia Branchiura sowerbyi (40 – 50 mg greutate umedă per vierme) (11). Prin urmare, comasarea indivizilor eșantionați dintr-un anumit vas de testare este acceptabilă, însă aceasta restrânge procedurile statistice care pot fi aplicate datelor. În cazul în care o procedură statistică specifică și puterea reprezintă considerente importante, atunci trebuie incluse în test un număr adecvat de animale de testare și/sau de camere de testare replică pentru a putea obține agregarea, procedura și puterea dorite.
|
|
69.
|
Se recomandă ca BAF să fie exprimat atât în funcție de greutatea umedă totală, de greutatea uscată totală și, dacă este necesar (de exemplu, pentru substanțele foarte lipofile) în funcție de conținutul de lipide și de TOC din sediment. Pentru determinarea conținutului de lipide trebuie utilizate metode adecvate (48) (49). Se poate recomanda tehnica de extragere cu cloroform/metanol (50), ca metodă standard (48). Totuși, pentru a evita utilizarea solvenților clorurați, poate fi utilizată o modificare testată interlaboratoare a metodei Bligh și Dyer (50) astfel cum este descrisă în (51). Întrucât metodele diferite nu oferă rezultate identice (48), este important să se precizeze detaliile metodei utilizate. Ori de câte ori este posibil, adică atunci când este disponibil suficient țesut de vierme, măsurarea conținutului de lipide se realizează pe aceleași eșantioane sau extracte ca cele produse pentru analiza substanței chimice testate, întrucât, adesea, lipidele trebuie îndepărtate din extras înaintea analizării prin cromatografie (5). Totuși, este practic să se utilizeze animale de control aclimatizate cel puțin la începutul sau – de preferință – la sfârșitul fazei de absorbție în vederea măsurării conținutului de lipide, de exemplu în trei eșantioane.
|
DATE ȘI RAPORTARE
Tratamentul rezultatelor
|
70.
|
Curba de absorbție a substanței testate este obținută prin trasarea la scală aritmetică a concentrației substanței testate în/pe viermi pe parcursul fazei de absorbție în funcție de timp. În cazul în care curba a ajuns la un platou, se calculează BAFss pentru starea de echilibru:

|
|
71.
|
Se determină factorul de bioacumulare cinetică (BAFK) ca raport între ks/ke. Constanta de eliminare (ke) se determină de obicei din curba de eliminare (adică o curbă a concentrației substanței testate din viermi pe parcursul fazei de eliminare). Constanta vitezei de absorbție ks este apoi calculată din cinetica curbei de absorbție. Metoda preferată pentru obținerea BAFK și a constantelor vitezelor ks și ke este utilizarea metodelor computerizate de estimare a parametrilor neliniari (a se vedea apendicele 2). Dacă este evident că eliminarea nu este de ordinul întâi, atunci trebuie utilizate modele mai complexe (25) (27) (52).
|
|
72.
|
Factorul de acumulare biotă-sediment (BSAF) este determinat prin normalizarea BAFK pentru conținutul de lipide din viermi și pentru conținutul total de carbon organic din sediment.
|
Interpretarea rezultatelor
|
73.
|
Rezultatele trebuie interpretate cu precauție, atunci când concentrațiile măsurate ale concentrațiilor de testare se află la niveluri apropiate de limita de detecție a metodei de analiză utilizate.
|
|
74.
|
Curbele de absorbție și de eliminare clar definite constituie o indicație a bunei calități a datelor referitoare la bioacumulare. În general, limitele de încredere pentru valorile BAF din studii bine concepute nu trebuie să depășească 25 % (5).
|
Raportul privind testul
|
75.
|
Raportul privind testul trebuie să includă următoarele informații:
|
|
Substanța testată
|
—
|
natura fizică și proprietățile fizico-chimice, de exemplu log Kow, solubilitatea în apă;
|
|
—
|
date de identificare a substanței chimice; sursa substanței chimice testate, identitatea și concentrația oricărui solvent utilizat;
|
|
—
|
în cazul marcării radioactive, poziția precisă a atomilor marcați, radioactivitatea specifică și procentul de radioactivitate asociată cu impuritățile.
|
|
|
|
Speciile folosite pentru testare
|
—
|
denumire științifică, tulpină, sursă, orice pretratament, aclimatizare, vârstă, gama de dimensiuni etc.
|
|
|
|
Condițiile de testare
|
—
|
procedura de testare utilizată (de exemplu, statică, semistatică sau cu flux continuu);
|
|
—
|
tipul și caracteristicile iluminării utilizate și perioada (perioadele) de expunere la lumină;
|
|
—
|
protocolul de testare (de exemplu, numărul, materialul și dimensiunea camerelor de testare, volumul de apă, masa și volumul sedimentului, rata de înlocuire a volumului de apă (pentru procedurile cu flux continuu sau semistatice), orice aerare utilizată înainte și pe parcursul testului, numărul de replici, numărul de viermi per replică, numărul de concentrații de testare, durata fazelor de absorbție și de eliminare, frecvența eșantionării);
|
|
—
|
metoda de preparare și aplicare a substanței testate, precum și motivele alegerii unei metode specifice;
|
|
—
|
concentrațiile de testare nominale;
|
|
—
|
sursa constituenților apei și sedimentului artificial sau – în cazul în care se utilizează medii naturale – originea apei și a sedimentului, descrierea oricărui tratament prealabil, rezultatele oricărei demonstrații a capacității animalelor de testare de a trăi și/sau de a se reproduce în mediile utilizate, caracteristicile sedimentului [pH-ul și amoniacul din apa interstițială (sediment natural), conținutul de carbon organic (TOC), distribuția dimensiunii particulelor (procentul de nisip, de mâl și de argilă), procentul conținutului de apă, precum și orice alte măsurători efectuate] și caracteristicile apei [pH, duritate, conductivitate, temperatură, concentrația oxigenului dizolvat, nivelurile de clor rezidual (dacă se măsoară), precum și orice alte măsurători efectuate];
|
|
—
|
greutatea uscată nominală și măsurată în % din greutatea umedă (sau raportul greutate uscată-greutate umedă) a sedimentului artificial; greutatea uscată măsurată în % din greutatea umedă (sau raportul greutate uscată-greutate umedă) pentru sediment natural;
|
|
—
|
calitatea apei din camerele de testare caracterizată prin temperatură, pH, amoniac, duritatea totală și concentrația oxigenului dizolvat;
|
|
—
|
informații detaliate privind tratamentul eșantioanelor de apă, de sediment și de viermi, inclusiv detalii privind pregătirea, depozitarea, procedurile de adiționare, extragerea și procedurile analitice (și precizia) pentru substanța testată și conținutul de lipide, precum și recuperările substanței testate.
|
|
|
|
Rezultate
|
—
|
mortalitatea în rândul viermilor de control și al viermilor din fiecare cameră de testare și orice efecte subletale observate inclusiv orice comportament anormal (de exemplu, evitarea sedimentului, prezența sau absența granulelor de fecale, lipsa reproducerii);
|
|
—
|
greutatea uscată măsurată în % din greutatea umedă (sau raportul greutate uscată-greutate umedă) a sedimentului și a organismelor de testare (utilă pentru normalizare);
|
|
—
|
conținutul de lipide din viermi;
|
|
—
|
curbe care indică cinetica de absorbție și de eliminare ale substanței testate în viermi și timpul până la starea de echilibru;
|
|
—
|
Ca, Cs și Cw (împreună cu deviația standard și intervalul, dacă este cazul) pentru toate momentele de eșantionare (Ca exprimată în g kg– 1 greutate umedă și uscată a întregului organism, Cs exprimată în g kg– 1 greutate umedă și uscată a sedimentului și Cw exprimată în mg l– 1). În cazul în care este necesar un factor de acumulare biotă-sediment (BSAF; a se vedea apendicele 1 pentru definiție) (de exemplu pentru compararea rezultatelor obținute din două sau mai multe teste efectuate cu animale cu conținut diferit de lipide), Ca trebuie exprimată suplimentar ca g kg– 1 conținut de lipide din organism, iar Cs trebuie exprimată ca g kg– 1 carbon organic (CO) din sediment;
|
|
—
|
BAF (exprimat în kg de sediment umed kg– 1 viermii umezi), constanta vitezei de absorbție din sediment ks (exprimată în g sediment umed kg– 1 viermii umezi d– 1), precum și constanta vitezei de eliminare ke (exprimată în d– 1); BSAF (exprimat în kg sediment CO kg– 1 conținut de lipide din viermi) poate fi raportat suplimentar;
|
|
—
|
Reziduuri neeliminate (NER) la sfârșitul fazei de eliminare;
|
|
—
|
dacă sunt măsurate: procentele de substanță parentală, de produși de degradare și de reziduuri legate (adică, procentul de substanță testată care nu poate fi extrasă cu metodele de extragere comune) detectate la animalele de testare;
|
|
—
|
metodele utilizate pentru analizele statistice ale datelor.
|
|
|
|
Evaluarea rezultatelor
|
—
|
conformitatea rezultatelor cu criteriile de validitate enumerate la punctul 21;
|
|
—
|
rezultate neprevăzute sau neobișnuite, de exemplu eliminarea incompletă a substanței testate din animalele de testare; în astfel de cazuri rezultatele obținute din orice studii preliminare pot furniza informații utile.
|
|
|
Apendicele 1
Definiții și unități
|
|
Sedimentul artificial, sau sedimentul formulat, reconstituit sau sintetic, este un amestec de materiale utilizate pentru simularea componentelor fizice ale unui sediment natural.
|
|
|
Bioacumularea este creșterea concentrației substanței testate în sau pe un organism în raport cu concentrația acestei substanțe testate în mediul înconjurător. Bioacumularea rezultă atât din procesul de bioconcentrare, cât și din cel de bioamplificare (a se vedea mai jos).
|
|
|
Factorul de bioacumulare (bioaccumulation factor – BAF) în orice moment pe parcursul fazei de absorbție a acestui test de bioacumulare este concentrația substanței testate în/pe organismul testat (Ca în g kg– 1 greutate umedă sau uscată) împărțită la concentrația substanței în mediul înconjurător (Cs ca g kg– 1 greutate umedă sau uscată a sedimentului). Pentru referirea la unitățile Ca și Cs, BAF este exprimat în unități de kg sediment kg– 1 vierme (15).
|
|
|
Factorii de bioacumulare calculați direct din raportul dintre constanta vitezei de absorbție din sediment împărțită la constantele vitezei de eliminare (ks și, respectiv, ke – a se vedea mai jos) sunt denumite factor de bioacumulare cinetică (kinetic bioaccumulation factor – BAFK).
|
|
|
Bioconcentrarea este creșterea concentrației substanței testate în sau pe un organism, care rezultă exclusiv din absorbția prin intermediul suprafeței organismului, în raport cu concentrația acestei substanțe testate din mediul înconjurător.
|
|
|
Bioamplificarea este creșterea concentrației substanței testate în sau pe un organism, care rezultă în principal din absorbția din alimente sau pradă contaminate, în raport cu concentrația substanței testate în hrană sau în pradă. Bioamplificarea poate duce la un transfer sau la o acumulare a substanței testate în rețelele trofice.
|
|
|
Factorul de acumulare biotă-sediment (biota-sediment accumulation factor – BSAF) este concentrația stabilizată normalizată pentru lipide a substanței testate în/pe organismul testat împărțită la concentrația normalizată pentru carbon organic a substanței în sediment la starea de echilibru. Ca este apoi exprimată ca g kg– 1 conținut de lipide al organismului, iar Cs ca kg– 1 conținut organic al sedimentului.
|
|
|
Perioada de condiționare este utilizată pentru stabilizarea componentei microbiene a sedimentului și pentru eliminarea, de exemplu, a amoniacului provenit din componentele sedimentului; ea se derulează înainte de adiționarea sedimentului cu substanța testată. De obicei, apa acoperitoare este eliminată după condiționare.
|
|
|
Eliminarea unei substanțe testate înseamnă pierderea de substanță din țesutul organismului de testare prin procese active sau pasive care se produc independent de prezența substanței testate în mediul înconjurător.
|
|
|
Faza de eliminare este timpul, după transferul organismelor de testare dintr-un mediu contaminat într-un mediu în care nu se află substanța testată, pe parcursul căruia se studiază eliminarea (sau pierdere netă) substanței din organismele de testare.
|
|
|
Constanta vitezei de eliminare (ke) este valoarea numerică care definește viteza de scădere a concentrației substanței testate în/pe organismul de testare, după transferul organismelor de testare dintr-un mediu care conține substanța testată într-un mediu fără substanțe chimice; ke este exprimată ca d– 1.
|
|
|
Perioada de echilibrare este utilizată pentru a permite distribuirea substanței testate între faza solidă, apa interstițială și apa acoperitoare; ea se derulează după adiționarea sedimentului cu substanța testată și înainte de adăugarea organismelor de testare.
|
|
|
Coeficientul de partiție octanol-apă (Kow) este raportul dintre solubilitatea unei substanțe în n-octanol și în apă la echilibru, exprimată uneori și ca Pow. Logaritmul lui Kow (log Kow) este utilizat ca indicator al potențialului de bioacumulare al unei substanțe în organismele acvatice.
|
|
|
Coeficientul de partiție carbon organic-apă (Koc) este raportul dintre concentrația unei substanțe în/pe fracția de carbon organic a unui sediment și concentrația substanței în apă la echilibru.
|
|
|
Apa acoperitoare este apa care acoperă sedimentul în vasul de testare.
|
|
|
Platoul sau starea de echilibru înseamnă echilibrul între procesele de absorbție și de eliminare care apare simultan în timpul fazei de expunere. Starea de echilibru este atinsă în graficul BAF pentru fiecare perioadă de eșantionare în funcție de timp atunci când curba devine paralelă cu axa timpului, iar trei analize succesive ale BAF realizate asupra unor eșantioane prelevate la intervale de cel puțin două zile se mențin într-un interval de 20 % una față de alta și nu există diferențe statistic semnificative între cele trei perioade de eșantionare. Pentru substanțele testate care se absorb lent, intervalele cele mai adecvate ar fi de șapte zile (5).
|
|
|
Apa interstițială este apa care ocupă spațiul dintre particulele de sediment sau de sol.
|
|
|
Constanta vitezei de absorbție din sediment (ks) reprezintă valoarea numerică care definește viteza de creștere a concentrației substanței testate în/pe organismul testat care rezultă din absorbția din sediment. ks se exprimă în g sediment kg– 1 de vierme d– 1.
|
|
|
Sedimentul adiționat este sedimentul în care se adaugă substanța testată.
|
|
|
Factorul de bioacumulare la starea de echilibru (BAFss) este BAF la starea de echilibru și nu se modifică în mod semnificativ în cursul unui interval lung de timp, concentrația substanței testate în mediul înconjurător (Cs exprimată ca g kg– 1 greutate uscată sau umedă de sediment) fiind constantă în acest interval de timp.
|
|
|
Faza de absorbție sau de eliminare înseamnă timpul în care organismele testate sunt expuse la substanța testată.
|
Apendicele 2
Calculul parametrilor de absorbție și de eliminare
Principalul parametru studiat al unui test de bioacumulare este factorul de bioacumulare, BAF. BAF măsurat poate fi calculat prin împărțirea concentrației substanței testate în organismul de testare, Ca, la concentrația substanței testate din sediment, Cs, la starea de echilibru. În cazul în care starea de echilibru nu se atinge în timpul fazei de absorbție, BAF se calculează în același mod pentru ziua 28. Cu toate acestea, ar trebui să se indice dacă BAF se bazează sau nu pe concentrațiile la starea de echilibru.
Mijlocul preferat de obținere a factorului de bioacumulare cinetică (BAFK), a constantei vitezei de absorbție din sediment (ks) și a constantei vitezei de eliminare (ke) este recurgerea la metode computerizate de estimare a parametrilor neliniari. Dată fiind seria de timp a factorilor de acumulare medii (Ca, valorile medii ale fiecărei date de eșantionare/Cs, valorile medii ale fiecărei date de eșantionare = AF) a fazei de absorbție în funcție de greutatea umedă a viermelui și a sedimentului, și ecuația model
|
AF(t) = BAF × (1 – eke × t)
|
[ecuația 1]
|
unde AF(t) este raportul dintre concentrația substanței testate în viermi și concentrația acesteia în sediment în orice moment (t) pe parcursul fazei de absorbție, aceste programe informatice calculează valorile BAFK, ks și ke.
Atunci când se atinge starea de echilibru pe parcursul fazei de absorbție (i.e. t = ∞), ecuația 1 poate fi redusă la:
|

|
[ecuația 2]
|
unde
|
ks
|
=
|
constanta vitezei de absorbție în țesut [g sediment kg– 1 din vierme d– 1]
|
|
ke
|
=
|
constanta vitezei de eliminare [d– 1]
|
Atunci ks/ke × Cs reprezintă o metodă de obținere a concentrației substanței testate în țesutul de vierme la starea de echilibru (Ca,ss).
Factorul de acumulare biotă-sediment (BSAF) trebuie calculat astfel:

unde foc este fracțiunea de carbon organic din sediment, iar flip este fracțiunea de conținut de lipide din vierme, ambele bazate pe greutatea uscată sau pe greutatea umedă.
Data fiind o serie de timp a valorilor concentrațiilor, cinetica eliminării poate fi modelată folosind următoarele ecuații model și o metodă computerizată de estimare a parametrilor neliniari.
Media măsurată a reziduului corporal la sfârșitul fazei de absorbție este recomandată ca punct de pornire implicit. Valoarea modelată/estimată din faza de absorbție trebuie folosită numai dacă, de exemplu, valoarea măsurată se abate semnificativ de la valoarea reziduului corporal modelat. A se vedea, de asemenea, punctul 50 pentru preexpunerea alternativă a viermilor desemnați pentru eliminare; cu această metodă, eșantioanele din acești viermi preexpuși în ziua 0 a fazei de eliminare se consideră că oferă o valoare realistă a reziduului corporal cu care se începe eliminarea cinetică.
Dacă punctele aferente datelor reprezentate grafic în funcție de timp indică o scădere exponențială constantă a concentrației substanței testate în animale, poate fi utilizat un model cu un compartiment (ecuația 4) pentru a descrie evoluția temporală a eliminării.
|

|
[ecuația 3]
|
Uneori, procesele de eliminare par a se derula în două etape, indicând o scădere rapidă a Ca în timpul etapelor timpurii, care se modifică în sensul unei pierderi mai lente de substanțe testate în fazele mai târzii ale eliminării (8) (19) (25). Cele două etape pot fi interpretate plecând de la ipoteza că în organism există două compartimente diferite din care substanța testată se elimină cu viteză diferită. În aceste cazuri, trebuie studiată literatura relevantă (15) (16) (17) (25).
O eliminare din două compartimente este descrisă, de exemplu, prin următoare ecuație (25):
|
|
[ecuația 4]
|
A și B reprezintă dimensiunea compartimentelor (în procente de reziduu tisular general), unde A este compartimentul cu pierdere rapidă de substanță, iar B compartimentul cu pierdere lentă a substanței testate. Suma A și B este egală cu 100 % din volumul întregului compartiment de animal la starea de echilibru. ka și kb reprezintă constantele de eliminare corespunzătoare [d– 1]. Dacă modelul cu două compartimente este aplicat datelor privind depurarea, constanta vitezei de absorbție ks poate fi determinată după cum urmează (53) (54):
|

|
[ecuația 5]
|
Cu toate acestea, aceste ecuații model trebuie folosite cu prudență, în special atunci când în timpul testului au loc modificări ale biodisponibilității substanței testate (42).
Ca alternativă la ecuațiile model descrise mai sus, parametrii cinetici (ks și ke) pot fi calculați și într-o singură etapă, aplicând modelul cineticii de ordinul întâi tuturor datelor obținute din faza de absorbție și din cea de eliminare împreună. Pentru o descriere a unei metode care ar putea permite un astfel de calcul combinat al constantelor vitezei de absorbție și de eliminare, pot fi consultate referințele (55), (56) și (57).
Reziduurile neeliminate (NER) trebuie calculate ca parametru studiat secundar prin înmulțirea raportului dintre concentrația medie din viermi (Ca) în ziua 10 a fazei de eliminare și concentrația medie din viermi (Ca) la starea de echilibru (ziua 28 a fazei de absorbție) cu 100:

Apendicele 3
Exemplu de program de eșantionare pentru un test de bioacumulare de 28 de zile
a) Faza de absorbție (inclusiv o fază de echilibrare de 4 zile)
|
Ziua
|
Activități
|
|
– 6
|
Pregătirea suspensiei de turbă pentru sediment; condiționarea suspensiei timp de 48 de ore;
|
|
– 4
|
Adiționarea sedimentului sau a unei părți din sediment; amestecarea tuturor constituenților sedimentului; îndepărtarea eșantioanelor de sediment din sedimentul tratat și din cel de control cu solvent pentru determinarea concentrației substanței de testare; adăugarea de apă acoperitoare; incubarea în condiții de testare (faza de echilibrare);
|
|
– 3/– 2
|
Separarea organismelor de testare din cultură pentru aclimatizare;
|
|
0
|
Măsurarea calității apei (a se vedea punctul 52); îndepărtarea replicilor pentru prelevarea de eșantioane de apă și de sediment pentru determinarea concentrației substanței testate; distribuirea în mod aleatoriu a viermilor în camerele de testare; reținerea unor subeșantioane suficiente de viermi pentru determinarea valorilor analitice de fond; controlarea alimentării cu aer, dacă se utilizează un sistem de testare închis;
|
|
1
|
Îndepărtarea replicilor pentru eșantionare; controlarea alimentării cu aer, a comportamentului viermilor, a calității apei (a se vedea punctul 56); prelevarea de eșantioane de apă, de sediment și de viermi pentru determinarea concentrației substanței testate;
|
|
2
|
Controlarea alimentării cu aer, a comportamentului viermilor și a temperaturii;
|
|
3
|
La fel ca în ziua 1;
|
|
4 – 6
|
La fel ca în ziua 2;
|
|
7
|
La fel ca în ziua 1; se compensează apa evaporată, dacă este necesar;
|
|
8 – 13
|
La fel ca în ziua 2;
|
|
14
|
La fel ca în ziua 1; se compensează apa evaporată, dacă este necesar;
|
|
15 – 20
|
La fel ca în ziua 2;
|
|
21
|
La fel ca în ziua 1; se compensează apa evaporată, dacă este necesar;
|
|
22 – 27
|
La fel ca în ziua 2;
|
|
28
|
La fel ca în ziua 1; măsurarea calității apei (a se vedea punctul 52); sfârșitul fazei de absorbție; reținerea unor subeșantioane suficiente de viermi pentru determinarea valorilor analitice de fond, a greutății umede și uscate și a conținutului de lipide; transferarea viermilor din replicile expuse rămase în vase care conțin sediment curat pentru faza de eliminare (fără purjare intestinală); prelevarea de eșantioane de apă, de sediment și de viermi din vasele de control cu solvent; eșantionarea soluțiilor de captare, dacă sunt instalate.
|
|
|
Activitățile de preexpunere (faza de echilibrare) trebuie programate ținând cont de proprietățile substanței testate. Dacă este necesar, se condiționează sedimentul preparat sub apa acoperitoare la 20 ± 2 °C timp de 7 zile; în acest caz, este necesară prepararea mai timpurie a sedimentului!
|
|
|
Activitățile descrise pentru ziua 2 trebuie realizate zilnic (cel puțin în zilele lucrătoare).
|
b) Faza de eliminare
|
Ziua
|
Activități
|
|
– 6
|
Pregătirea suspensiei de turbă pentru sediment; condiționarea suspensiei timp de 48 de ore;
|
|
– 4
|
Amestecarea tuturor constituenților sedimentelor; îndepărtarea eșantioanelor de sediment din sedimentul tratat și din cel de control cu solvent pentru determinarea concentrației substanței de testare; adăugarea de apă acoperitoare; incubarea în condiții de testare;
|
|
0 (ziua 28 a fazei de absorbție)
|
Măsurarea calității apei (a se vedea punctul 52); transferarea viermilor din replicile expuse rămase în vase care conțin sediment curat; îndepărtarea după 4 – 6 ore a replicilor pentru prelevarea de eșantioane de apă, de sediment și de viermi pentru determinarea concentrației substanței testate; distribuirea în mod aleatoriu a viermilor în camerele de testare;
|
|
1
|
Îndepărtarea replicilor pentru eșantionare; controlarea alimentării cu aer, a comportamentului viermilor, a calității apei (a se vedea punctul 52); prelevarea de eșantioane de apă, de sediment și de viermi pentru determinarea concentrației substanței testate;
|
|
2
|
Controlarea alimentării cu aer, a comportamentului viermilor și a temperaturii;
|
|
3
|
La fel ca în ziua 1;
|
|
4
|
La fel ca în ziua 2;
|
|
5
|
La fel ca în ziua 1;
|
|
6
|
La fel ca în ziua 2;
|
|
7
|
La fel ca în ziua 1; se compensează apa evaporată, dacă este necesar;
|
|
8 – 9
|
La fel ca în ziua 2;
|
|
10
|
La fel ca în ziua 1; sfârșitul fazei de eliminare; măsurarea calității apei (a se vedea punctul 52); prelevarea de eșantioane de apă, de sediment și de viermi din vasele de control cu solvent; eșantionarea soluțiilor de captare, dacă sunt instalate.
|
|
|
Prepararea sedimentului înainte de începerea fazei de eliminare trebuie realizată în același mod ca înainte de faza de absorbție.
|
|
|
Activitățile descrise pentru ziua 2 trebuie realizate zilnic (cel puțin în zilele lucrătoare).
|
Apendicele 4
Câteva caracteristici fizico-chimice ale unei apei de diluție acceptabile
|
CONSTITUENT
|
CONCENTRAȚII
|
|
Materie sub formă de particule
|
< 20 mg/l
|
|
Carbon organic total
|
< 2 μg/l
|
|
Amoniac neionizat
|
< 1 μg/l
|
|
Clor rezidual
|
< 10 μg/l
|
|
Pesticide organofosforice totale
|
< 50 ng/l
|
|
Total pesticide organofosforice plus bifenili policlorurați
|
< 50 ng/l
|
|
Clor organic total
|
< 25 ng/l
|
COMPOZIȚIA APEI RECONSTITUITE RECOMANDATE
|
(a)
|
Soluție de clorură de calciu
Se dizolvă 11,76 g CaCl2 · 2H2O în apă deionizată; se completează până la 1 l cu apă deionizată
|
|
(b)
|
Soluție de sulfat de magneziu
Se dizolvă 4,93 g MgSO4 · 7H2O în apă deionizată; se completează până la 1 l cu apă deionizată
|
|
(c)
|
Soluție de bicarbonat de sodiu
Se dizolvă 2,59 g de NaHCO3 în apă deionizată; se completează până la 1 l cu apă deionizată
|
|
(d)
|
Soluție de clorură de potasiu
Se dizolvă 0,23 g de KCl în apă deionizată; se completează până la 1 l cu apă deionizată
|
Toate substanțele chimice trebuie să fie de puritate analitică.
Conductivitatea apei distilate sau deionizate nu trebuie să depășească 10 μScm– 1.
Se amestecă 25 ml din fiecare dintre soluțiile menționate la litere (a) – (d) și se completează volumul total până la 1 litru cu apă deionizată. Suma ionilor de calciu și de magneziu din aceste soluții este de 2,5 mmol/l.
Proporția de ioni Ca:Mg este de 4:1, iar cea de ioni Na:K este de 10:1. Capacitatea acidă KS4.3 a acestei soluții este de 0,8 mmol/l.
Se aerează apa de diluție până la obținerea saturației în oxigen, apoi se depozitează pentru o perioadă de aproximativ două zile fără o altă aerare înainte de utilizare.
pH-ul unei apei de diluție acceptabile trebuie să se încadreze între 6 și 9.
Apendicele 5
Sedimentul artificial – recomandări privind prepararea și depozitarea
Spre deosebire de cerințele metodei de testare C.8 (40), se recomandă ca respectivul conținut de turbă din sedimentul artificial să fie de 2 % în loc de 10 % din greutatea uscată, pentru a corespunde unui conținut de carbon organic mic spre mediu în sedimentele naturale (58).
Procentul de constituenți uscați ai sedimentului artificial:
|
Constituent
|
Caracteristici
|
% din sedimentul uscat
|
|
Turbă
|
Mușchi de turbă Sphagnum, grad de descompunere: «mediu», uscat cu aer, fără reziduuri vizibile de plante, fin măcinat (dimensiunea particulelor ≤ 0,5 mm)
|
2 ± 0,5
|
|
Nisip de cuarț
|
Dimensiunea granulelor: ≤ 2 mm, însă > 50 % din particule trebuie să se încadreze în intervalul 50 – 200 μm
|
76
|
|
Argilă de caolinit
|
Conținut de caolinit ≥ 30 %
|
22 ± 1
|
|
Sursa de hrană
|
Folia urticae, frunze granulate de Urtica sp. (urzică iritantă), fin măcinată (dimensiunea particulelor ≤ 0,5 mm) sau un amestec de frunze granulate de Urtica sp. cu alfa-celuloză (1: 1); în conformitate cu standardele farmaceutice, pentru consum uman; în plus față de sedimentul uscat
|
0,4 – 0,5 %
|
|
Carbonat de calciu
|
CaCO3, pulverizat, pur din punct de vedere chimic, adăugat la sedimentul uscat
|
0,05 – 1
|
|
Apă deionizată
|
Conductivitate ≤ 10 μS/cm, adăugată la sedimentul uscat
|
30 – 50
|
În cazul în care se preconizează concentrații mari de amoniac, de exemplu, dacă se știe că substanța testate inhibă nitrificarea, ar putea fi utilă înlocuirea a 50 % din pudra de urzică bogată în azot cu celuloză (de exemplu, pudră de α-celuloză, pură din punct de vedere chimic, dimensiunea particulelor ≤ 0,5 mm).
Pregătire
Turba este uscată cu aer și măcinată ca pudră fină (dimensiunea particulelor ≤ 0,5 mm, fără reziduuri vizibile de plante). Se prepară o suspensie din cantitatea necesară de pudră de turbă cu ajutorul unei părți de apă deionizată care trebuie adăugată la sedimentul uscat [un volum de apă de 11,5 × greutate umedă a turbei s-a considerat a fi util pentru a realiza o suspensie de turbă agitabilă (8)] utilizând un dispozitiv de omogenizare de înaltă performanță.
pH-ul acestei suspensii este ajustat la 5,5 ± 0,5 cu CaCO3. Suspensia este condiționată timp de cel puțin două zile, agitându-se ușor la 20 ± 2 °C, pentru stabilizarea pH-ului și stabilirea unei componente microbiene stabile. Se măsoară din nou pH-ul și se ajustează în intervalul 6 ± 0,5 cu CaCO3, dacă este necesar. Apoi întreaga suspensie se amestecă cu ceilalți constituenți uscați, ținând cont de orice porție utilizată pentru adiționare. Se adaugă apa deionizată rămasă pentru a obține un sediment omogen. Se măsoară din nou pH-ul și se ajustează în intervalul 6,5 – 7,5 cu CaCO3, dacă este necesar. Totuși, în cazul în care se preconizează o degajare de amoniac, poate fi utilă menținerea pH-ului sedimentului sub 7 (de exemplu între 6 și 6,5). Se prelevează eșantioane din sediment pentru a determina greutatea uscată și conținutul de carbon organic. În cazul în care se preconizează degajare de amoniac, sedimentul artificial poate să fie condiționat timp de șapte zile în aceleași condiții care predomină în testul ulterior (de exemplu, raport sediment-apă 1: 4, înălțimea stratului de sediment în vasele de testare) înainte de a fi adiționat cu substanța testată, adică necesită completare cu apă, care trebuie să fie aerată. La finalul perioadei de condiționare, apa acoperitoare trebuie extrasă și eliminată. Se prelevează eșantioane din sediment pentru a determina greutatea uscată și conținutul total de carbon organic (de exemplu, 3 eșantioane).
Ulterior, nisipul de cuarț adiționat este amestecat cu sediment pentru fiecare nivel de tratament, sedimentul este distribuit în vasele replică de testare și acoperit cu apă de testare (de exemplu, raport sediment-apă 1: 4, înălțimea stratului de sediment în vasele de testare). Vasele sunt apoi incubate în aceleași condiții care prevalează în testul ulterior. În acest moment începe perioada de echilibrare. Apa de acoperire trebuie să fie aerată.
Sursa de hrană aleasă trebuie adăugată înainte sau pe parcursul adiționării sedimentului cu substanța testată. Ea poate fi amestecată în prealabil cu suspensia de turbă (a se vedea mai sus). Cu toate acestea, degradarea excesivă a sursei de hrană înainte de adăugarea organismelor de testare – de exemplu, în cazul unei perioade lungi de echilibrare – poate fi evitată prin scurtarea cât mai mult posibil a perioadei dintre momentul adăugării hranei și începutul expunerii. Pentru a asigura un contact suficient al hranei cu substanța testată, sursa de hrană trebuie amestecată cu sedimentul cel târziu în ziua adiționării substanței testate în sediment. Se pot face excepții în cazul în care durata perioadei de echilibrare conduce la degradarea microbiană excesivă a hranei înainte de adăugarea organismele de testare. Se prelevează eșantioane din sediment pentru a determina greutatea uscată și carbonul organic total (de exemplu, 3 eșantioane de sediment adiționat sau de control).
Greutatea uscată a constituenților (turbă, nisip, caolin) trebuie să fie raportată în g și în procente din substanța uscată totală.
Volumul de apă care trebuie adăugat la componentele uscate în timpul preparării sedimentului trebuie, de asemenea, raportat în procente din greutatea uscată totală (de exemplu, 100 % greutate uscată + 46 % apă înseamnă 1 000 g greutate uscată primesc un total de 460 ml de apă, care rezultată în 1 460 g de sediment umed).
Depozitare
Constituenții uscați ai sedimentului artificial pot fi depozitați într-un loc uscat și răcoros, la temperatura camerei. Sedimentul preparat umed poate fi depozitat (pentru utilizarea ulterioară numai în cultură) la 4 ± 2 °C, la întuneric, timp de 2 – 4 săptămâni de la ziua preparării (8).
Sedimentul adiționat cu substanța testată trebuie utilizat imediat, exceptând cazul în care există informații care indică faptul că acel sediment poate fi depozitat fără a fi afectate toxicitatea și biodisponibilitatea substanței testate. Eșantioanele de sediment adiționat pot fi depozitate până la analiză în condițiile recomandate pentru tipul respectiv de substanță testată.
Apendicele 6
Speciile de oligochete recomandate pentru testarea bioacumulării
Tubifex tubifex (MÜLLER), Tubificidae, Oligochaeta
Oligochetele tubificide (Tubificidae, Oligochaeta) Tubifex tubifex (Müller) trăiesc în sedimente de apă dulce în conducte căptușite cu mucus. În aceste conducte, viermii stau cu capul în jos, ingerând particule de sedimente folosind microorganisme asociate și resturi organice. Partea posterioară de obicei se ondulează în apa acoperitoare în scopuri de respirare. Deși habitatul acestei specii este reprezentat de o mare varietate de tipuri de sedimente întâlnite în întreaga emisferă nordică, Tubifex tubifex preferă particulele de dimensiuni relativ mici (59). Caracterul adecvat al acestei specii pentru testarea ecotoxicologică este descrisă, de exemplu, în referințele (8) (29) (31) (39) (60 )(62) (63).
Metode de cultură
Pentru a avea un număr suficient de exemplare de Tubifex tubifex pentru efectuarea testelor de bioacumulare, viermii trebuie păstrați în cultură de laborator permanentă. Pentru cultura T. tubifex se recomandă un sistem alcătuit din sediment artificial bazat pe sol artificial conform metodei de testare C.8 (40) și apă reconstituită conform metodei de testare C.1 (8).
Se pot utiliza ca vase de cultură și recipiente din sticlă sau din oțel inoxidabil cu înălțimea cuprinsă între 12 și 20 cm. Fiecare recipient de cultură este încărcat cu un strat de sediment artificial umed preparat astfel cum se descrie în apendicele 5. Adâncimea stratului de sediment trebuie să permită comportament natural de săpare de galerii al viermilor (adâncime minimă de 2 cm pentru T. tubifex). Apa reconstituită este adăugat la sistem. Trebuie procedat cu grijă pentru a minimiza perturbarea sedimentului. Întreaga cantitate de apă trebuie ușor aerată (de exemplu, 2 bule pe secundă cu aer filtrat prin sită de 0,45 μm ) cu ajutorul unei pipete Pasteur așezată la aproximativ 2 cm deasupra suprafeței sedimentului. Temperatura recomandă pentru cultură este de 20 ± 2 °C.
Viermii se adăugă la sistemul de cultură în condițiile unei încărcături maxime de 20 000 de indivizi/m2 de suprafață a sedimentului. O încărcare mai mare poate duce la o reducere a vitezei de creștere și de reproducere (43).
In culturile de sediment artificial, viermii trebuie să fie hrăniți. Un regim de hrănire constând din hrană de pești măcinată fin, de exemplu TetraMin® poate servi ca nutriție suplimentară (8); Klerks 1994, comunicare personală. Intervalele de hrănire trebuie să permită creștere și reproducere suficiente și trebuie să mențină la un nivel minim acumularea de amoniac și dezvoltarea de ciuperci în cultură. Hrana trebuie administrată de două ori pe zi (de exemplu, 0,6 – 0,8 mg per cm2 de suprafață a sedimentului). Experiența practică a demonstrat că aplicarea de hrană suspendată și omogenizată în apă deionizată poate facilita distribuirea omogenă hranei pe suprafața sedimentului în recipientele de cultură
Pentru a evita orice fel de acumulare de amoniac, apa acoperitoare trebuie schimbată utilizând un sistem cu flux continuu sau, cel puțin o dată pe săptămână, manual. Sedimentul trebuie schimbat la fiecare trei luni în culturile stoc.
Prelevarea de viermi din cultură se poate face prin cernerea sedimentului de cultură printr-o sită de 1 mm în cazul în care sunt necesari doar adulții. Pentru reținerea coconilor e necesară o sită de 0,5 mm, iar pentru viermii tineri, una de 0,25 mm. Sitele pot fi introduse în apă reconstituită după ce sedimentul a fost cernut. Viermii părăsesc sita și pot fi apoi preluați din apă folosind un forceps fin din oțel sau o pipetă cu margini finisate la foc.
Numai exemplarele intacte și clar identificate de Tubifex tubifex [de exemplu (64)] sunt utilizate pentru a începe un test sau noi culturi. Viermii bolnavi sau lezați, precum și coconii infestați cu hife fungice trebuie eliminați.
O cultură sincronizată poate furniza viermi de o anumită vârstă la intervale adecvate, atunci când se dorește. Noi vase de cultură sunt pregătite la intervalele alese (de exemplu, la fiecare două săptămâni), începând cu animale de o anumită vârstă (de exemplu, coconi). La condițiile de cultură descrise aici, viermii devin adulți după 8 – 10 săptămâni. Culturile pot fi recoltate, în cazul în care viermii au depus noi coconi, de exemplu, după zece săptămâni. Adulții prelevați pot fi utilizați în teste, iar cu coconii se pot iniția noi culturi.
Lumbriculus variegatus (MÜLLER), Lumbriculidae, Oligochaeta
Lumbriculus variegatus (Lumbriculidae, Oligochaeta) este, de asemenea, un locuitor al sedimentelor de apă dulce în întreaga lume și este utilizat pe scară largă în testarea ecotoxicologică. Informații cu privire la biologia, condițiile de cultură și la sensibilitatea speciei pot fi obținute din (1) (6) (9) (36). Lumbriculus variegatus poate fi, de asemenea, cultivat în sedimentul artificial recomandate pentru T. tubifex în conformitate cu (8), în anumite limite. Întrucât, în natură, L. variegatus preferă sedimente mai aspre decât T. tubifex (59), culturile în laborator cu sediment artificial folosit pentru T. tubifex pot înceta după 4 – 6 luni. Experiența practică a demonstrat că L. variegatus poate fi ținut într-un substrat nisipos (de exemplu, nisip de cuarț, pietriș fin) într-un sistem cu flux continuu utilizând peștele ca sursă de hrană de-a lungul mai multor ani fără a reînnoi substratul. Un avantaj major al L. variegatus față de alte specii de oligochete acvatice este reproducerea rapidă, rezultând o biomasă rapid crescătoare în populații cultivate în laborator (1)(6)(9)(10).
Metode de cultură
Condițiile cultivării Lumbriculus variegatus sunt schițate în detaliu în Phipps et al. (1993) (10), Brunson et al. (1998) (28), ASTM (2000) (1), U.S. EPA (2000) (6). Un rezumat al acestor condiții este prezentat în continuare.
Viermii pot fi cultivați în acvarii de mari dimensiuni (57 – 80 l) la o temperatură de 23 °C cu o perioadă de expunere de 16 ore de lumină și 8 ore de întuneric (100 – 1 000 lux) utilizând apă naturală reînnoită zilnic (45 – 50 l per acvariu). Substratul este preparat prin decuparea de fâșii din șervete de hârtie maro nealbită care apoi pot fi amestecate cu apa de cultură timp de câteva secunde pentru a obține mici bucăți de substrat de hârtie. Acest substrat poate fi apoi utilizat direct în acvariul de cultură a Lumbriculus prin acoperirea fundului bazinului sau poate fi depozitat congelat în apă deionizată în vederea unei utilizări ulterioare. Noul substrat din bazin va dura în general aproximativ două luni.
Fiecare cultură de viermi începe cu 500 – 1 000 de viermi care sunt hrăniți cu o suspensie de 10 ml conținând 6 g de hrană de pornire pentru păstrăvi de 3 ori pe săptămână, în condiții de reînnoire sau cu flux continuu. În cazul culturilor statice sau semistatice, vitezele de hrănire trebuie reduse pentru a preveni dezvoltarea de bacterii și de ciuperci. Hrana și substratul de hârtie trebuie analizat din punctul de vedere al substanțelor care trebuie folosite în testele de bioacumulare.
În aceste condiții, numărul de exemplare din cultură se dublează în general în aproximativ 10 – 14 zile.
Lumbriculus variegatus poate fi extras din culturi, de exemplu, prin transferul substratului într-un pahar de laborator separat cu ajutorul unei plase fine sau al organismelor cu ajutorul unei pipete din sticlă cu gura largă (cu diametrul de aproximativ 5 mm) finisată la foc. În cazul în care substratul este cotransferat în respectivul pahar de laborator, paharul conținând viermi și substrat este lăsat peste noapte în condiții de flux continuu, care vor elimina substratul din pahar, viermii rămânând pe fundul vasului. Aceștia pot fi apoi introduși în bazine de cultură nou pregătite sau prelucrați ulterior pentru test conform descrierii din referințele (1) și (6). A se evita rănirea sau autotomia viermilor, de exemplu, prin utilizarea pipetelor cu margini finisate la foc sau a unor pensete din oțel inoxidabil pentru manipularea respectivilor viermi.
Atunci când se utilizează L. variegatus în testele de bioacumulare în sediment trebuie acordată atenție modului său de reproducere (fragmentare urmată de regenerare). Acest mod de reproducere asexuată are ca rezultat două fragmente, care nu se hrănesc o anumită perioadă până ce segmentul capului sau al cozii se regenerează [de exemplu, (36), (37)]. Aceasta înseamnă că este posibil ca în cazul L. variegatus absorbția de sediment și de contaminanți să nu se realizeze continuu ca în cazul tubificidelor, care nu se reproduc prin fragmentare.
Prin urmare, trebuie realizată o sincronizare pentru reducerea la minimum a reproducerii și a regenerării necontrolate care determină o variație mare a rezultatelor testului. O astfel de variație poate apărea atunci când unele exemplare, care sunt fragmentate și care, în consecință, nu se hrănesc într-o anumită perioadă, sunt expuse mai puțin la substanța testată decât alte exemplare care nu se fragmentează pe parcursul testului, de exemplu (38). Cu 10 – 14 zile înainte de expunere, viermii trebuie să fie fragmentați în mod artificial (sincronizare) (65). Trebuie utilizați viermi mari, care, de preferință, nu prezintă semne de fragmentare recentă. Acești viermi pot fi așezați pe o lamă din sticlă într-o picătură de apă de cultură și disecați cu ajutorul unui bisturiu în regiunea mediană a corpului. Trebuie avut grijă ca extremitățile posterioare să fie de dimensiuni similare. Extremitățile posterioare trebuie apoi lăsate să regenereze capete noi într-un vas de cultură care să conțină același substrat ca cel utilizat în cultură și apă reconstituită, până la începerea perioadei de expunere. Regenerarea de capete noi este indicată în momentul în care viermii sincronizați sapă galerii în substrat (prezența capetelor regenerate poate fi confirmată prin examinarea la un microscop binocular a unui subeșantion reprezentativ). Se preconizează că, ulterior, organismele de testare se află într-o stare fiziologică similară. Aceasta înseamnă că, atunci când are loc regenerarea în cazul viermilor sincronizați pe parcursul testului, se estimează că practic toate animalele sunt expuse în aceeași măsură la sedimentul adiționat. Hrănirea viermilor sincronizați trebuie să se realizeze imediat ce viermii încep să sape galerii în substrat sau după 7 zile de la disecție. Regimul de hrănire trebuie să fie comparabil cu cel al culturilor normale, însă se recomandă hrănirea viermilor sincronizați cu aceeași sursă de hrană ca cea utilizată în cadrul testului. Viermii trebuie ținuți la o temperatură de testare, la 20 ± 2 °C. După regenerare, trebuie utilizați pentru test viermii de dimensiune similară, întregi și intacți care înoată sau se târăsc activ după aplicarea unui stimul mecanic ușor. A se evita rănirea sau autotomia viermilor, de exemplu, prin utilizarea pipetelor cu margini finisate la foc sau a unor pensete din oțel inoxidabil pentru manipularea respectivilor viermi.
Când se utilizează Lumbriculus variegatus pentru testare, din cauza modului specific de reproducere a acestei specii, o creștere a numărului de viermi trebuie să apară în timpul testului, dacă condițiile sunt corespunzătoare (6). Lipsa reproducerii în cadrul unui test de bioacumulare cu L. variegatus trebuie înregistrată și trebuie luată în considerare la interpretarea rezultatelor testelor.
Branchiura sowerbyi (BEDDARD), Tubificide, Oligochete (nevalidate în teste interlaboratoare)
Branchiura sowerbyi locuiește într-o varietate de tipuri de sedimente din bazine, lacuri, iazuri și râuri, fiind originară din zonele tropicale. De asemenea, ea poate fi întâlnită și în acumulările de apă caldă din emisfera nordică. Cu toate acestea, ea este mai abundentă în sedimentele cu mâl argilos, cu un conținut mare de materie organică. În plus, viermii trăiesc în stratul de sedimente. Chiar și partea posterioară a viermilor este de obicei pătrunsă în galerie. Această specie este ușor de identificat prin filamentele branhiale din partea lor posterioară. Adulții pot ajunge la o lungime de 9 – 11 cm și la o greutate umedă de 40 – 50 mg. Adulții au o rată mare de reproducere, populația dublându-se în mai puțin de 2 săptămâni, în condițiile de temperatură și de hrănire descrise mai jos [Aston et al., 1982, (65)]. B. sowerbyi a fost folosită în studiile de toxicitate și de bioacumulare [Marchese & Brinkhurst 1996, (31) Roghair et al. 1996, respectiv (67)].
Metode de cultură
Un rezumat al condițiilor de cultură pentru Branchiura sowerbyi este oferit mai jos (pus la dispoziție de Mercedes R. Marchese, INALI, Argentina și Carla J. Roghair, RIVM, Țările de Jos).
Nu este necesară o singură tehnică pentru cultivarea organismelor de testare. Organismele pot fi cultivate folosind sediment natural necontaminat (31). Experiența practică a demonstrat că un mediu alcătuit din sediment natural si nisip îmbunătățește starea viermilor în raport cu sedimentul pur natural (32) (67). pahare de laborator de 3 l care conține 1 500 ml de sediment/apă, constând în 375 ml de sediment natural necontaminat (aproximativ 10 % carbon organic total; aproximativ 17 % dintre particule ≤ 63 μm), 375 ml nisip curat (M32) și 750 ml de apă de la robinet reconstituită sau declorurată pot fi utilizate pentru cultură (31) (32) (67). De asemenea, pot fi utilizate prosoape de hârtie ca substrat pentru cultură, însă creșterea populației este mai mică decât în sedimentele naturale. În sistemele semistatice, stratul de apă în paharul de laborator este aerat ușor, iar apa acoperitoare trebuie reînnoită săptămânal.
Fiecare pahar conține la început 25 de viermi tineri. După două luni, viermii mari sunt colectați din sediment cu ajutorul unei pensete și sunt introduși într-un nou pahar cu mediu sediment/apă proaspăt preparat. Paharul vechi conține, de asemenea, coconi și viermi tineri. Până la 400 de viermi tineri per pahar pot fi recoltați în acest mod. Viermii adulți pot fi folosiți pentru reproducere timp de cel puțin un an.
Culturile trebuie menținute la o temperatură de 21 până la 25 °C. Variația temperaturii trebuie menținută sub ± 2 °C. Perioada necesară pentru dezvoltarea embrionară din ouăle care sunt depuse până când exemplarele tinere părăsesc coconul este de aproximativ trei săptămâni la 25 °C. Producția de ouă obținută per vierme supraviețuitor în cazul B. sowerbyi s-a constatat că este între 6,36 (31) și 11,2 (30) în nămol la 25 °C. Numărul de ouă per cocon variază de la 1,8 la 2,8 (66) (69) sau până la 8 (68).
Oxigenul dizolvat, duritatea apei, temperatura și pH-ul trebuie măsurate săptămânal. Hrana pentru pești (de exemplu, TetraMin®) poate fi adăugată sub formă de suspensie de două sau de trei ori pe săptămână ad libitum. Viermii pot fi hrăniți și cu salată verde decongelată ad libitum.
Un avantaj major al acestei specii este biomasa individuală mare (până la 40 – 50 mg greutate umedă per individ). Prin urmare, această specie poate fi utilizată pentru testarea bioacumulării substanțelor testate nemarcate radioactiv. Poate fi expusă în sistemele utilizate pentru T. tubifex sau L. variegatus cu un singur individ per replică (11). Totuși, numărul de replici trebuie mărit, cu excepția situației în care sunt folosite camere de testare mai mari (11). De asemenea, criteriul de validitate pentru comportamentul de săpare de galerii trebuie ajustat pentru această specie.
BIBLIOGRAFIE
|
(1)
|
ASTM International (2000). Standard guide for the determination of the bioaccumulation of sediment-associated contaminants by benthic invertebrates, E 1688-00a. In ASTM International 2004 Annual Book of Standards. Volume 11.05. Biological Effects and Environmental Fate; Biotechnology; Pesticides. ASTM International, West Conshohocken, PA.
|
|
(2)
|
European Commission (EC) (2003). Technical Guidance Document on Risk Assessment in support of Commission Directive 93/67/EEC on Risk Assessment for new notified substances, Commission Regulation (EC) No 1488/94 on Risk Assessment for existing substances and Directive 98/8/EC of the European Parliament and of the Council concerning the placing of biocidal products on the market; Part I – IV. Office for Official Publications of the European Communities, Luxembourg.
|
|
(3)
|
OECD (1992a). Report of the OECD workshop on effects assessment of chemicals in sediment. OECD Monographs No. 60. Organisation for Economic Co-operation and Development (OECD), Paris.
|
|
(4)
|
Ingersoll, C.G., Ankley, G.T., Benoit D.A., Brunson, E.L., Burton, G.A., Dwyer, F.J., Hoke, R.A., Landrum, P. F., Norberg-King, T. J. and Winger, P.V. (1995). Toxicity and bioaccumulation of sediment-associated contaminants using freshwater invertebrates: A review of methods and applications. Environ. Toxicol. Chem. 14, 1885-1894.
|
|
(5)
|
Chapter C.13 of this Annex, Bioconcentration Flow Thorough Fish test.
|
|
(6)
|
U.S. EPA (2000). Methods for measuring the toxicity and bioaccumulation of sediment-associated contaminants with freshwater invertebrates. Second Edition. EPA 600/R-99/064, U.S. Environmental Protection Agency, Duluth, MN, March 2000.
|
|
(7)
|
Chapter C.27 of this Annex, Sediment water Chironomid toxicity test using spliked sediment
|
|
(8)
|
Egeler, Ph., Römbke, J., Meller, M., Knacker, Th., Franke, C., Studinger, G. & Nagel, R. (1997). Bioaccumulation of lindane and hexachlorobenzene by tubificid sludgeworms (Oligochaeta) under standardised laboratory conditions. Chemosphere 35, 835-852.
|
|
(9)
|
Ingersoll, C.G., Brunson, E.L., Wang N., Dwyer, F.J., Ankley, G.T., Mount D.R., Huckins J., Petty. J. and Landrum, P. F. (2003). Uptake and depuration of nonionic organic contaminants from sediment by the oligochaete, Lumbriculus variegatus. Environmental Toxicology and Chemistry 22, 872-885.
|
|
(10)
|
Phipps, G.L., Ankley, G.T., Benoit, D.A. and Mattson, V.R. (1993). Use of the aquatic Oligochaete Lumbriculus variegatus for assessing the toxicity and bioaccumulation of sediment-associated contaminants. Environ.Toxicol. Chem. 12, 269-279.
|
|
(11)
|
Egeler, Ph., Römbke, J., Knacker, Th., Franke, C. & Studinger, G. (1999). Workshop on «Bioaccumulation: Sediment test using benthic oligochaetes», 26.-27.04.1999, Hochheim/Main, Germany. Report on the R+D-project No. 298 67 419, Umweltbundesamt, Berlin.
|
|
(12)
|
Egeler, Ph., Meller, M., Schallnaß, H.J. & Gilberg, D. (2006). Validation of a sediment bioaccumulation test with endobenthic aquatic oligochaetes by an international ring test. Report to the Federal Environmental Agency (Umweltbundesamt Dessau), R&D No.: 202 67 437.
|
|
(13)
|
Kelly, J.R., Levine, S.N., Buttel, L.A., Kelly, A.C., Rudnick, D.T. & Morton, R.D. (1990). Effects of tributyltin within a Thalassia seagrass ecosystem. Estuaries 13, 301-310.
|
|
(14)
|
Nendza, M. (1991). QSARs of bioaccumulation: Validity assessment of log Kow/log BCF correlations. In: R. Nagel and R. Loskill (eds.): Bioaccumulation in aquatic systems. Contributions to the assessment. Proceedings of an international workshop, Berlin 1990. VCH, Weinheim
|
|
(15)
|
Landrum, P.F., Lee II, H., & Lydy, M.J. (1992). Toxicokinetics in aquatic systems: Model comparisons and use in hazard assessment. Environ. Toxicol. Chem. 11, 1709-1725.
|
|
(16)
|
Markwell, R.D., Connell, D.W. & Gabric, A.J. (1989). Bioaccumulation of lipophilic compounds from sediments by oligochaetes. Wat. Res. 23, 1443-1450.
|
|
(17)
|
Gabric, A.J., Connell, D.W. & Bell, P.R.F. (1990). A kinetic model for bioconcentration of lipophilic compounds by oligochaetes. Wat. Res. 24, 1225-1231.
|
|
(18)
|
Kukkonen, J. and Landrum, P.F. (1994). Toxicokinetics and toxicity of sediment-associated Pyrene to Lumbriculus variegatus (Oligochaeta). Environ. Toxicol. Chem. 13, 1457-1468.
|
|
(19)
|
Franke, C., Studinger, G., Berger, G., Böhling, S., Bruckmann, U., Cohors-Fresenborg, D. and Jöhncke, U. (1994). The assessment of bioaccumulation. Chemosphere 29, 1501-1514.
|
|
(20)
|
OECD (2000). Guidance Document on Aquatic Toxicity Testing of Difficult Substances and Mixtures. OECD Environment, Health and Safety Publications, Series on Testing and Assessment No. 23.
|
|
(21)
|
U.S. EPA (1996). Special Considerations for Conducting Aquatic Laboratory Studies. Ecological Effects Test Guidelines. OPPTS 850.1000. Public Draft. EPA 712-C-96-113. U.S. Environmental Protection Agency.
|
|
(22)
|
The following chapters of this Annex:
|
|
Chapter A.4, vapour pressure
|
|
|
Chapter A.5, Surface tension
|
|
|
Chapter A.6, Water solubility
|
|
|
Chapter A.8, Partition coefficient, shake flask method
|
|
|
Chapter A.24, Partition coefficient, HPLC method
|
|
|
Chapter C.7, degradation — abiotic degradation: hydrolysis as a function of pH
|
|
|
Chapter C.4 A-F Determination of ready biodegradability
|
|
|
Chapter C.19, Estimation of the adsorption coefficient (Koc ) on soil and on sewage sludge using high performance liquid chromatography (HPLC)
|
|
|
Chapter C.29, Ready biodegradability CO2 in sealed vessels
|
|
|
(23)
|
OECD (1996). Direct phototransformation of chemicals in water. Environmental Health and Safety Guidance Document Series on Testing and Assessment of Chemicals No. 3. OECD, Paris.
|
|
(24)
|
Antoine, M.D., Dewanathan, S. & Patonay, G. (1991). Determination of critical micelles concentration of surfactants using a near-infrared hydrophobicity probe. Microchem. J. 43, 165-172.
|
|
(25)
|
Beek, B., S. Boehling, U. Bruckmann, C. Franke, U. Joehncke & G. Studinger (2000). The assessment of bioaccumulation. In Hutzinger, O. (editor), The Handbook of Environmental Chemistry, Vol. 2 Part J (Vol. editor: B. Beek): Bioaccumulation – New Aspects and Developments. Springer-Verlag Berlin Heidelberg: 235-276.
|
|
(26)
|
Spacie, A. & Hamelink, J.L. (1982). Alternative models for describing the bioconcentration of organics in fish. Environ. Toxicol. Chem. 1, 309-320.
|
|
(27)
|
Hawker, D.W. & Connell, D.W. (1988). Influence of partition coefficient of lipophilic compounds on bioconcentration kinetics with fish. Wat. Res. 22, 701-707.
|
|
(28)
|
Brunson, E.L., Canfield, T.J., Ingersoll, C.J. & Kemble, N.E. (1998). Assessing the bioaccumulation of contaminants from sediments of the Upper Mississippi river using field-collected oligochaetes and laboratory-exposed Lumbriculus variegatus. Arch. Environ. Contam. Toxicol. 35, 191-201.
|
|
(29)
|
Reynoldson, T.B., Thompson, S.P. and Bamsey, J.L. (1991). A sediment bioassay using the tubificid oligochaete worm Tubifex tubifex. Environ. Toxicol. Chem. 10, 1061-1072.
|
|
(30)
|
Aston, R.J. & Milner, A.G.P. (1981). Conditions for the culture of Branchiura sowerbyi (Oligochaeta: Tubificidae) in activated sludge. Aquaculture 26, 155-160.
|
|
(31)
|
Marchese, M.R. & Brinkhurst, R.O. (1996). A comparison of two tubificid species as candidates for sublethal bioassay tests relevant to subtropical and tropical regions. Hydrobiologia 334, 163-168.
|
|
(32)
|
Roghair, C.J. & Buijze, A. (1994). Development of sediment toxicity tests. IV. A bioassay to determine the toxicity of field sediments to the oligochaete worm Branchiura sowerbyi. RIVM Report 719102027.
|
|
(33)
|
Chapter C.1 of this Annex, Fish, Acute Toxicity Test.
|
|
(34)
|
OECD (1992c). Guidelines for Testing of Chemicals No. 210. Fish, Early-life Stage Toxicity Test. OECD, Paris.
|
|
(35)
|
Kaster, J.L., Klump, J.V., Meyer, J., Krezoski, J. & Smith, M.E. (1984). Comparison of defecation rates of Limnodrilus hoffmeisteri using two different methods. Hydrobiologia 11, 181-184.
|
|
(36)
|
Leppänen, M.T. & Kukkonen, J.V.K. 1998: Factors affecting feeding rate, reproduction and growth of an oligochaete Lumbriculus variegatus (Müller). Hydrobiologia 377: 183-194.
|
|
(37)
|
Leppänen, M.T. & Kukkonen, J.V.K. 1998: Relationship between reproduction, sediment type and feeding activity of Lumbriculus variegatus (Müller): Implications for sediment toxicity testing. Environ. Toxicol. Chem. 17: 2196-2202.
|
|
(38)
|
Leppänen M.T. & Kukkonen J.V.K. (1998). Relative importance of ingested sediment and porewater as bioaccumulation routes for pyrene to oligochaete (Lumbriculus variegatus, Müller). Environ. Sci. Toxicol. 32, 1503-1508.
|
|
(39)
|
Martinez-Madrid, M., Rodriguez, P., Perez-Iglesias, J.I. & Navarro, E. (1999). Sediment toxicity bioassays for assessment of contaminated sites in the Nervion river (Northern Spain). 2. Tubifex tubifex (Müller) reproduction sediment bioassay. Ecotoxicology 8, 111-124.
|
|
(40)
|
Chapter C.8 of this Annex, Toxicity for Earthworms.
|
|
(41)
|
Environment Canada (1995). Guidance document on measurement of toxicity test precision using control sediments spiked with a reference toxicant. Environmental Protection Series Report EPS 1/RM/30.
|
|
(42)
|
Landrum, P.F. (1989). Bioavailability and toxicokinetics of polycyclic aromatic hydrocarbons sorbed to sediments for the amphipod Pontoporeia hoyi. Environ. Sci. Toxicol. 23, 588-595.
|
|
(43)
|
Poddubnaya, T.L. (1980). Life cycles of mass species of Tubificidae (Oligochaeta). In: R.O. Brinkhurst and D.G. Cook (eds.): Aquatic Oligochaeta Biology, 175-184. Plenum Press, New York.
|
|
(44)
|
ASTM (1998). Standard guide for collection, storage, characterisation, and manipulation of sediment for toxicological testing. American Society for Testing and Materials, E 1391-94.
|
|
(45)
|
Hooftman, R.N., van de Guchte, K. & Roghair, C.J. (1993). Development of ecotoxicological test systems to assess contaminated sediments. Joint report no. 1: Acute and (sub)chronic tests with the model compound chlorpyrifos. RIVM-719102022.
|
|
(46)
|
Franke, C. (1996). How meaningful is the bioconcentration factor for risk assessment?. Chemosphere 32, 1897-1905.
|
|
(47)
|
Mount, D.R., Dawson, T.D. & Burkhard, L.P. (1999). Implications of gut purging for tissue residues determined in bioaccumulation testing of sediment with Lumbriculus variegatus. Environ. Toxicol. Chem. 18, 1244-1249.
|
|
(48)
|
Randall, R.C., Lee II, H., Ozretich, R.J., Lake, J.L. & Pruell, R.J. (1991). Evaluation of selected lipid methods for normalising pollutant bioaccumulation. Environ.Toxicol. Chem. 10, 1431-1436.
|
|
(49)
|
Gardner, W.S., Frez, W.A., Cichocki, E.A. & Parrish, C.C. (1985). Micromethods for lipids in aquatic invertebrates. Limnology and Oceanography, 30, 1099-1105.
|
|
(50)
|
Bligh, E.G. & Dyer, W.J. (1959). A rapid method of total lipid extraction and purification. Can. J. Biochem. Physiol. 37, 911-917.
|
|
(51)
|
De Boer, J., Smedes, F., Wells, D. & Allan, A. (1999). Report on the QUASH interlaboratory study on the determination of total-lipid in fish and shellfish. Round 1 SBT-2. Exercise 1000. EU, Standards, Measurement and Testing Programme.
|
|
(52)
|
Kristensen, P. (1991). Bioconcentration in fish: comparison of bioconcentration factors derived from OECD and ASTM testing methods; influence of particulate matter to the bioavailability of chemicals. Water Quality Institute, Denmark.
|
|
(53)
|
Zok, S., Görge, G., Kalsch, W. & Nagel, R. (1991). Bioconcentration, metabolism and toxicity of substituted anilines in the zebrafish (Brachydanio rerio). Sci. Total Environment 109/110, 411-421
|
|
(54)
|
Nagel, R. (1988). Umweltchemikalien und Fische – Beiträge zu einer Bewertung. Habilitationsschrift, Johannes Gutenberg-Universität Mainz, Germany.
|
|
(55)
|
Janssen, M.P.M., A Bruins, T.H. De Vries & Van Straalen, N.M. (1991). Comparison of cadmium kinetics in four soil arthropod species. Arch. Environ. Contam. Toxicol. 20: 305-312.
|
|
(56)
|
Van Brummelen, T.C. & Van Straalen, N.M. (1996). Uptake and elimination of benzo(a)pyrene in the terrestrial isopod Porcellio scaber. Arch. Environ. Contam. Toxicol. 31: 277-285.
|
|
(57)
|
Sterenborg, I., Vork, N.A., Verkade, S.K., Van Gestel, C.A.M. & Van Straalen, N.M. (2003). Dietary zinc reduces uptake but not metallothionein binding and elimination of cadmium in the springtail Orchesella cincta. Environ. Toxicol. Chemistry 22: 1167-1171.
|
|
(58)
|
Suedel, B.C. and Rodgers, J.H. (1993). Development of formulated reference sediments for freshwater and estuarine sediment testing. Environ. Toxicol. Chem. 13, 1163-1175.
|
|
(59)
|
Wachs, B. (1967). Die Oligochaeten-Fauna der Fließgewässer unter besonderer Berücksichtigung der Beziehung zwischen der Tubificiden-Besiedlung und dem Substrat. Arch. Hydr. 63, 310-386.
|
|
(60)
|
Oliver, B. G. (1987). Biouptake of chlorinated hydrocarbons from laboratory-spiked and field sediments by oligochaete worms. Environ. Sci. Technol. 21, 785-790.
|
|
(61)
|
Chapman, P.M., Farrell, M.A. & Brinkhurst, R.O. (1982a). Relative tolerances of selected aquatic oligochaetes to individual pollutants and environmental factors. Aquatic Toxicology 2, 47-67.
|
|
(62)
|
Chapman, P.M., Farrell, M.A. & Brinkhurst, R.O. (1982b). Relative tolerances of selected aquatic oligochaetes to combinations of pollutants and environmental factors. Aquatic Toxicology 2, 69-78.
|
|
(63)
|
Rodriguez, P. & Reynoldson, T.B. (1999). Laboratory methods and criteria for sediment bioassessment. In: A. Mudroch, J.M. Azcue & P. Mudroch (eds.): Manual of Bioassessment of aquatic sediment quality. Lewis Publishers, Boca Raton, CRC Press LLC.
|
|
(64)
|
Brinkhurst, R.O. (1971). A guide for the identification of British aquatic oligochaeta. Freshw. Biol. Assoc., Sci. Publ. No. 22.
|
|
(65)
|
Egeler, Ph., Meller, M., Schallnaß, H.J. & Gilberg, D. (2005). Validation of a sediment toxicity test with the endobenthic aquatic oligochaete Lumbriculus variegatus by an international ring test. In co-operation with R. Nagel and B. Karaoglan. Report to the Federal Environmental Agency (Umweltbundesamt Berlin), R&D No.: 202 67 429.
|
|
(66)
|
Aston, R.J., Sadler, K. & Milner, A.G.P. (1982). The effect of temperature on the culture of Branchiura sowerbyi (Oligochaeta: Tubificidae) on activated sludge. Aquaculture 29, 137-145.
|
|
(67)
|
Roghair, C.J., Buijze, A., Huys, M.P.A., Wolters-Balk, M.A.H., Yedema, E.S.E. & Hermens, J.L.M. (1996). Toxicity and toxicokinetics for benthic organisms; II: QSAR for base-line toxicity to the midge Chironomus riparius and the tubificid oligochaete worm Branchiura sowerbyi. RIVM Report 719101026.
|
|
(68)
|
Aston, R.J. (1984). The culture of Branchiura sowerbyi (Tubificidae, Oligochaeta) using cellulose substrate. Aquaculture 40, 89-94.
|
|
(69)
|
Bonacina, C., Pasteris, A., Bonomi, G. & Marzuoli, D. (1994). Quantitative observations on the population ecology of Branchiura sowerbyi (Oligochaeta, Tubificidae). Hydrobiologia, 278, 267-274
|
” |