
|
15/Volumul 17 |
RO |
Jurnalul Ofícial al Uniunii Europene |
150 |
32006L0086
|
L 294/32 |
JURNALUL OFÍCIAL AL UNIUNII EUROPENE |
DIRECTIVA 2006/86/CE A COMISIEI
din 24 octombrie 2006
de punere în aplicare a Directivei 2004/23/CE a Parlamentului European și a Consiliului cu privire la cerințele de trasabilitate, notificarea reacțiilor și a incidentelor adverse grave, precum și la anumite cerințe tehnice pentru codificarea, prelucrarea, conservarea, stocarea și distribuirea țesuturilor și a celulelor umane
(Text cu relevanță pentru SEE)
COMISIA COMUNITĂȚILOR EUROPENE,
având în vedere Tratatul de instituire a Comunității Europene,
având în vedere Directiva 2004/23/CE a Parlamentului European și a Consiliului din 31 martie 2004 privind stabilirea standardelor de calitate și securitate pentru donarea, obținerea, controlul, prelucrarea, conservarea, stocarea și distribuirea țesuturilor și a celulelor umane (1), în special articolul 8, articolul 11 alineatul (4) și articolul 28 literele (a), (c), (g) și (h),
întrucât:
|
(1) |
Directiva 2004/23/CE stabilește standardele de calitate și securitate pentru donarea, obținerea, controlul, prelucrarea, conservarea, stocarea și distribuirea țesuturilor și a celulelor umane destinate aplicațiilor umane, precum și a produselor preparate, derivate din țesuturi și celule umane destinate utilizării la om, astfel încât să se asigure un nivel înalt de protecție a sănătății umane. |
|
(2) |
Pentru a preveni transmiterea bolilor prin țesuturi și celule umane destinate utilizării la om și pentru a asigura un nivel echivalent de calitate și siguranță, Directiva 2004/23/CE preconizează stabilirea de cerințe tehnice specifice pentru fiecare dintre etapele procedeului de preparare a țesuturilor și celulelor umane, inclusiv de standarde și specificații cu privire la un sistem de calitate pentru centrele de țesuturi. |
|
(3) |
Pentru a asigura un nivel înalt de protecție a sănătății umane, în statele membre ar trebui să se instituie un sistem de acreditare, desemnare, autorizare sau acordare a licenței pentru centrele de țesuturi și pentru procedeele de preparare la centrele de țesuturi, în conformitate cu Directiva 2004/23/CE. Este necesar să se stabilească cerințele tehnice pentru sistemul respectiv. |
|
(4) |
Cerințele pentru acreditarea, desemnarea, autorizarea sau acordarea licențelor pentru centrele de țesuturi ar trebui să se refere la organizare și gestionare, personal, echipamente și materiale, instalații/localuri, documentație și înregistrarea datelor, precum și analiza calității. Centrele de țesuturi acreditate, desemnate, autorizate sau cu licență ar trebui să respecte cerințe suplimentare pentru activitățile specifice pe care le efectuează. |
|
(5) |
Standardul de calitate a aerului în timpul prelucrării țesuturilor și celulelor reprezintă un factor determinant care poate influența riscul de contaminare a țesuturilor sau celulelor. În general, este necesară o calitate a aerului cu un număr de particule și un număr de colonii microbiene echivalente cu cele din clasa A, definită de anexa 1 la Ghidul european pentru bunele practici de fabricație și de Directiva 2003/94/CE a Comisiei (2). Cu toate acestea, în anumite situații, nu este indicată o calitate a aerului în care numărul de particule și numărul de colonii microbiene sunt echivalente cu cele din clasa A. În aceste cazuri, ar trebui să se demonstreze și să se dovedească cu documente că mediul ales asigură nivelul de calitate și siguranță necesar pentru tipul de țesut și celule, pentru respectivul proces și utilizarea la oameni. |
|
(6) |
Domeniul de aplicare a prezentei directive ar trebui să cuprindă calitatea și siguranța țesuturilor și celulelor umane în cursul codificării, prelucrării, conservării, stocării și distribuirii la centrele de asistență medicală unde vor fi aplicate pe corpul uman. Cu toate acestea, nu ar trebui extins la utilizarea la oameni a acestor țesuturi și celule (ca în cazul chirurgiei de implanturi, perfuziei, inseminării sau transferului de embrioni). Dispozițiile prezentei directive referitoare la trasabilitate și la notificarea reacțiilor și incidentelor adverse grave se aplică, de asemenea, donării, obținerii și controlului țesuturilor și celulelor umane reglementate prin Directiva 2006/17/CE a Comisiei (3). |
|
(7) |
Utilizarea țesuturilor și celulelor în utilizarea la om prezintă un risc de transmitere a bolilor și de alte efecte adverse la receptori. Pentru a supraveghea și reduce aceste efecte, ar trebui să se definească cerințe specifice de trasabilitate și o procedură comunitară pentru notificarea reacțiilor și incidentelor adverse grave. |
|
(8) |
Suspiciunile de reacții adverse grave la donator sau receptor și de incidente adverse grave de la donarea până la distribuirea țesuturilor și celulelor, care pot influența calitatea și siguranța țesuturilor și celulelor și care se pot atribui obținerii (inclusiv evaluarea și selectarea donatorului), controlului, prelucrării, conservării, stocării și distribuției țesuturilor și celulelor umane ar trebui să fie notificate de îndată autorității competente. |
|
(9) |
Reacțiile adverse grave pot fi detectate în cursul sau în urma obținerii la donatorii în viață sau în cursul sau în urma utilizării la om. Acestea ar trebui semnalate centrului de țesuturi în cauză pentru investigații ulterioare și notificarea autorității competente. Aceasta nu ar trebui să împiedice o organizație de obținere sau o organizație responsabilă de utilizare la om să notifice, de asemenea, în mod direct autorității competente, în cazul în care dorește acest lucru. Prezenta directivă ar trebui să definească datele minime necesare pentru a fi comunicate autorității competente, fără a aduce atingere capacității statelor membre de a menține sau a introduce pe teritoriul lor măsuri de protecție mai stricte, care să respecte dispozițiile tratatului. |
|
(10) |
Pentru a reduce la minimum costurile de transmitere, a evita suprapunerile și a spori eficiența administrativă, ar trebui să se utilizeze tehnologii moderne și soluții de administrare electronică pentru îndeplinirea sarcinilor legate de transmiterea și tratarea informațiilor. Tehnologiile respective ar trebui să se bazeze pe un format standard de schimb care să utilizeze un sistem corespunzător pentru gestionarea datelor de referință. |
|
(11) |
Pentru a facilita trasabilitatea și informarea cu privire la principalele caracteristici și proprietăți ale țesuturilor și celulelor, este necesar să se stabilească datele de bază care trebuie să fie incluse în codul european unic. |
|
(12) |
Prezenta directivă respectă drepturile fundamentale și principiile recunoscute, în special de Carta Drepturilor Fundamentale a Uniunii Europene. |
|
(13) |
Măsurile prevăzute de prezenta directivă sunt în conformitate cu avizul comitetului instituit prin articolul 29 din Directiva 2004/23/CE, |
ADOPTĂ PREZENTA DIRECTIVĂ:
Articolul 1
Domeniul de aplicare
(1) Prezenta directivă se aplică codificării, prelucrării, conservării, stocării și distribuției de:
|
(a) |
țesuturi și celule umane destinate utilizării la oameni și |
|
(b) |
produse preparate, derivate din țesuturi și celule umane destinate utilizării la oameni, în cazurile în care produsele respective nu constituie obiectul altor directive. |
(2) Dispozițiile articolelor 5-9 din prezenta directivă, referitoare la trasabilitate și la raportarea reacțiilor și incidentelor adverse grave se aplică, de asemenea, donării, obținerii și controlului de țesuturi și celule umane.
Articolul 2
Definiții
În sensul prezentei directive, se aplică următoarele definiții:
|
(a) |
„celule de reproducere” înseamnă toate țesuturile și celulele destinate utilizării în scopul reproducerii asistate; |
|
(b) |
„donare între parteneri” înseamnă donarea de celule de reproducere între un bărbat și o femeie care declară că au o relație fizică intimă; |
|
(c) |
„sistem de calitate” înseamnă structura organizatorică, responsabilitățile, procedurile, procesele și resursele definite pentru punerea în aplicare a managementului calității și include totalitatea activităților care contribuie la calitate în mod direct sau indirect; |
|
(d) |
„managementul calității” înseamnă activitățile coordonate pentru conducerea și controlul unei organizații cu privire la calitate; |
|
(e) |
„proceduri standard de operare” înseamnă instrucțiunile scrise care descriu etapele dintr-un proces specific, inclusiv materialele și metodele ce trebuie utilizate și produsul final preconizat; |
|
(f) |
„validare” (sau „calificare”, în cazul echipamentelor sau al mediului) înseamnă stabilirea unor mijloace de probă documentate care să asigure, cu un grad înalt de certitudine, că un proces, un element de echipament sau mediu specific vor permite obținerea invariabilă a unui produs care să satisfacă specificațiile și atributele sale de calitate determinate în prealabil; un proces este validat pentru a evalua performanța unui sistem cu privire la eficacitatea sa în raport cu utilizarea prevăzută; |
|
(g) |
„trasabilitate” înseamnă capacitatea de a localiza și identifica țesutul/celula în oricare dintre etape, de la achiziție, trecând prin prelucrare, control și stocare, până la distribuție la receptor sau eliminare, ceea ce implică, de asemenea, capacitatea de a identifica donatorul și centrul de țesuturi sau instalația de fabricație care primește, prelucrează sau stochează țesutul/celulele, precum și capacitatea de a identifica receptorul(receptorii) la serviciul/serviciile medical(e) care aplică țesutul/celulele receptorului(receptorilor); trasabilitatea include, de asemenea, capacitatea de a localiza și identifica totalitatea datelor relevante referitoare la produse și materiale care vin în contact cu țesuturile/celulele respective; |
|
(h) |
„critic” înseamnă posibilitatea de a avea un efect asupra calității și/sau a siguranței celulelor și țesuturilor sau de a fi în contact cu acestea; |
|
(i) |
„organizație de achiziție” înseamnă un centru de sănătate sau o unitate a unui spital sau un alt organism care se angajează să obțină țesuturi și celule umane și care nu poate fi acreditat, desemnat, autorizat sau titularul unei licențe în calitate de centru de țesuturi, |
|
(j) |
„organizații responsabile pentru utilizarea la oameni” înseamnă un centru de sănătate sau o unitate a unui spital sau alt organism care utilizează țesuturi și celule umane la oameni. |
Articolul 3
Cerințe pentru acreditarea, desemnarea, autorizarea sau acordarea licenței centrelor de țesuturi
Un centru de țesuturi trebuie să respecte cerințele prevăzute la anexa I.
Articolul 4
Cerințe pentru acreditarea, desemnarea, autorizarea sau acordarea licenței proceselor de preparare a țesuturilor și celulelor
Procesele de preparare realizate la centrele de țesuturi trebuie să respecte cerințele prevăzute la anexa II.
Articolul 5
Notificarea reacțiilor adverse grave
(1) Statele membre se asigură că:
|
(a) |
organizațiile de achiziție dispun de procedurile necesare pentru a ține evidența țesuturilor și celulelor obținute și pentru a notifica de îndată centrelor de țesuturi orice reacții adverse grave la donatorul în viață, care pot influența calitatea și siguranța țesuturilor și a celulelor; |
|
(b) |
organizațiile responsabile pentru utilizarea la oameni a țesuturilor și celulelor dispun de proceduri pentru a ține evidența țesuturilor și celulelor utilizate și să notifice de îndată centrelor de țesuturi orice reacții adverse grave constatate în cursul sau ulterior utilizării clinice care pot fi legate de calitatea și siguranța țesuturilor și a celulelor; |
|
(c) |
centrele de țesuturi care distribuie țesuturi și celule pentru utilizare la om furnizează organizației responsabile pentru utilizarea la om a țesuturilor și celulelor informații despre modul în care organizația respectivă ar trebui să raporteze reacțiile adverse grave menționate la litera (b). |
(2) Statele membre se asigură că centrele de țesuturi:
|
(a) |
dispun de procedurile necesare pentru a comunica de îndată autorității competente toate informațiile disponibile relevante despre reacțiile adverse grave menționate la alineatul (1) literele (a) și (b); |
|
(b) |
dispun de procedurile necesare pentru a comunica de îndată autorității competente concluzia investigației privind analiza cauzei și a consecințelor. |
(3) Statele membre se asigură că:
|
(a) |
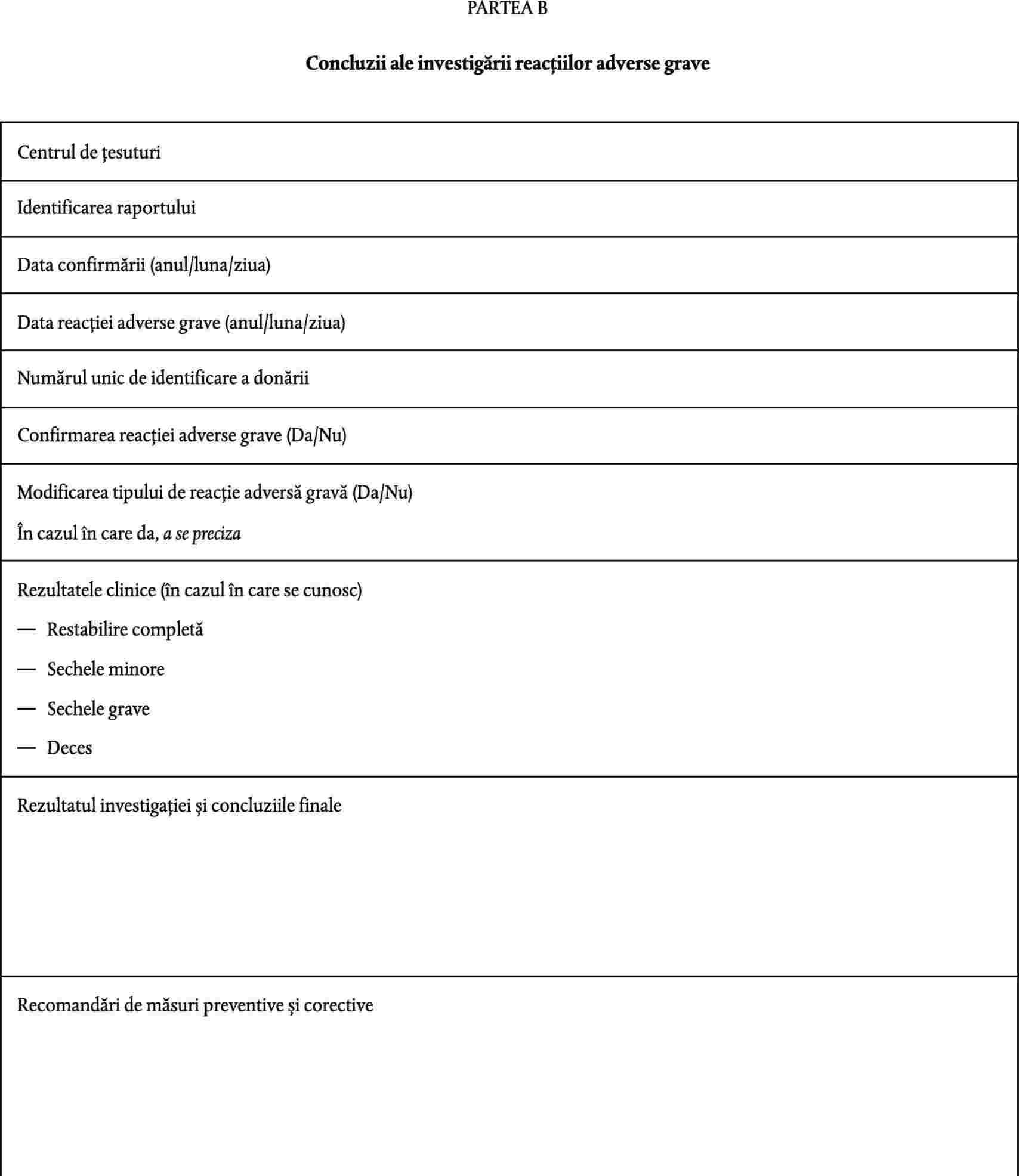
persoana responsabilă, menționată la articolul 17 din Directiva 2004/23/CE, comunică autorității competente informațiile incluse în notificarea prevăzută de partea A din anexa III; |
|
(b) |
centrele de țesuturi comunică autorității competente măsurile adoptate cu privire la alte țesuturi și celule implicate care au fost distribuite pentru a fi utilizate la oameni; |
|
(c) |
centrele de țesuturi comunică autorității competente concluziile investigației, furnizând cel puțin informațiile prevăzute de partea B din anexa III. |
Articolul 6
Comunicarea incidentelor adverse grave
(1) Statele membre se asigură că:
|
(a) |
organizațiile de achiziție și centrele de țesuturi dispun de procedurile necesare pentru ținerea evidenței și comunicarea de îndată către centrele de țesuturi a oricăror incidente adverse grave care apar în timpul obținerii și care pot influența calitatea și/sau siguranța țesuturilor și a celulelor umane; |
|
(b) |
organizațiile responsabile pentru utilizarea la oameni a țesuturilor și celulelor dispun de procedurile necesare pentru a comunica de îndată centrelor de țesuturi orice incidente adverse grave care pot influența calitatea și siguranța țesuturilor și a celulelor; |
|
(c) |
centrele de țesuturi furnizează organizației responsabile pentru utilizarea la oameni informații despre modul în care organizația ar trebui să le raporteze incidentele adverse grave care pot influența calitatea și siguranța țesuturilor și a celulelor. |
(2) În cazul reproducerii asistate, orice tip de identificare greșită sau confuzie referitoare la un gamet sau embrion se consideră a fi un incident advers grav. Toate persoanele sau organizațiile de achiziție sau organizațiile responsabile pentru utilizarea la oameni care realizează reproducere asistată raportează aceste incidente centrelor furnizoare de țesuturi în vederea investigării și comunicării către autoritatea competentă.
(3) Statele membre se asigură că centrele de țesuturi:
|
(a) |
dispun de procedurile necesare pentru a comunica de îndată autorității competente toate informațiile disponibile relevante despre incidentele adverse grave suspectate, menționate la alineatul (1) literele (a) și (b); |
|
(b) |
dispun de procedurile necesare pentru a comunica de îndată autorității competente concluzia investigației pentru analiza cauzei și a consecințelor. |
(4) Statele membre se asigură că:
|
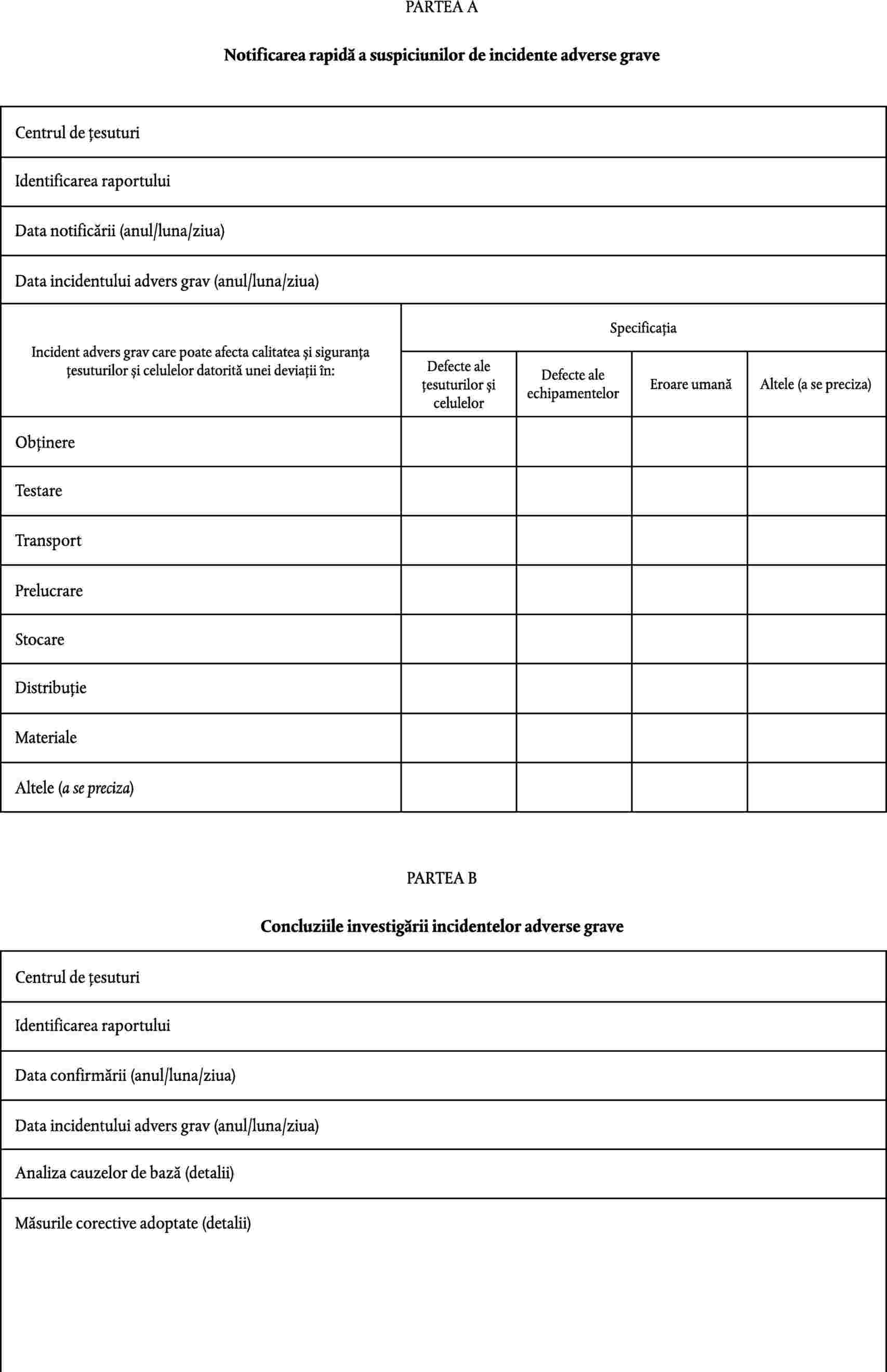
(a) |
persoana responsabilă menționată la articolul 17 din Directiva 2004/23/CE comunică autorității competente informațiile incluse în notificarea prevăzută de partea A din anexa IV; |
|
(b) |
centrele de țesuturi evaluează incidentele adverse grave pentru a identifica cauzele care pot fi evitate în cursul procesului; |
|
(c) |
centrele de țesuturi comunică autorității competente concluzia investigației, furnizând cel puțin informațiile prevăzute de partea B din anexa IV. |
Articolul 7
Rapoarte anuale
(1) Statele membre prezintă Comisiei, până la data de 30 iunie a anului următor, un raport anual cu privire la notificările reacțiilor și a incidentelor adverse grave transmise autorității competente. Comisia prezintă autorităților competente ale statelor membre o sinteză a rapoartelor primite. Autoritatea competentă pune acest raport la dispoziția centrelor de țesuturi.
(2) Transmiterea datelor se efectuează în conformitate cu specificațiile formularului pentru schimbul de date prezentate de anexa V părțile A și B și furnizează toate informațiile necesare pentru identificarea expeditorului și păstrarea datelor de referință cu privire la acesta.
Articolul 8
Comunicarea informațiilor între autoritățile competente și către Comisie
Statele membre se asigură că autoritățile lor competente își comunică reciproc și comunică și Comisiei toate informațiile necesare cu privire la reacțiile și incidentele adverse grave pentru a garanta adoptarea unor măsuri corespunzătoare.
Articolul 9
Trasabilitate
(1) Centrele de țesuturi dispun de sisteme eficace și precise de identificare și etichetare în mod unic a celulelor/țesuturilor primite și distribuite.
(2) Centrele de țesuturi și organizațiile responsabile pentru utilizarea la oameni păstrează datele menționate de anexa VI cel puțin 30 de ani, într-un mediu de stocare corespunzător și lizibil.
Articolul 10
Sistemul european de codificare
(1) Se alocă un cod european unic de identificare tuturor produselor donate la centrul de țesuturi pentru a asigura identificarea corespunzătoare a donatorului și trasabilitatea tuturor produselor donate, precum și pentru a furniza informații privind principalele caracteristici și proprietăți ale țesuturilor și celulelor. Codul conține cel puțin informațiile prevăzute la anexa VII.
(2) Alineatul (1) nu se aplică donării între parteneri de celule de reproducere.
Articolul 11
Transpunere
(1) Statele membre pun în aplicare actele cu putere de lege și actele administrative necesare pentru a se conforma prezentei directive până la 1 septembrie 2007. Comisiei îi sunt comunicate de îndată de către statele membre textele acestor dispoziții și un tabel de corespondență între aceste dispoziții și prezenta directivă.
Statele membre pun în aplicare actele cu putere de lege și actele administrative necesare pentru a se conforma articolului 10 din prezenta directivă până la 1 septembrie 2008.
Atunci când statele membre adoptă aceste acte, ele cuprind o trimitere la prezenta directivă sau sunt însoțite de o asemenea trimitere la data publicării lor oficiale. Statele membre stabilesc modalitatea de efectuare a acestei trimiteri.
(2) Comisiei îi sunt comunicate de către statele membre textele principalelor dispoziții de drept intern pe care le adoptă în domeniul reglementat de prezenta directivă.
Articolul 12
Intrarea în vigoare
Prezenta directivă intră în vigoare în a douăzecea zi de la data publicării în Jurnalul Oficial al Uniunii Europene.
Articolul 13
Destinatari
Prezenta directivă se adresează statelor membre.
Adoptată la Bruxelles, 24 octombrie 2006.
Pentru Comisie
Markos KYPRIANOU
Membru al Comisiei
(1) JO L 102, 7.4.2004, p. 48.
(2) http://pharmacos.eudra.org./F2/eudralex/col-4/home.htm și JO L 262, 14.10.2003, p. 22.
ANEXA I
Cerințe pentru acreditarea, desemnarea, autorizarea sau acordarea licenței centrelor de țesuturi, menționate la articolul 3
A. ORGANIZARE ȘI GESTIONARE
|
(1) |
Trebuie să fie numită o persoană responsabilă având calificările și responsabilitățile prevăzute la articolul 17 din Directiva 2004/23/CE. |
|
(2) |
Un centru de țesuturi trebuie să aibă o structură organizatorică și proceduri de operare corespunzătoare activităților pentru care se solicită acreditarea/desemnarea/autorizarea/acordarea licenței; trebuie să existe o organigramă care să definească în mod clar răspunderea și raporturile ierarhice. |
|
(3) |
Fiecare centru de țesuturi trebuie să aibă acces la un medic autorizat, desemnat să ofere consiliere și să supervizeze activitățile medicale ale centrului, precum selecția donatorilor, examinarea rezultatelor clinice ale utilizării țesuturilor și celulelor sau interacțiunea cu utilizatorii clinici, după caz. |
|
(4) |
Trebuie să existe un sistem documentat de management al calității, aplicat activităților pentru care se solicită acreditarea/desemnarea/autorizarea sau acordarea licenței, în conformitate cu standardele stabilite de prezenta directivă. |
|
(5) |
Trebuie să se asigure identificarea și reducerea la minimum a riscurilor inerente utilizării și manipulării materialului biologic, menținând în același timp calitatea și siguranța corespunzătoare pentru utilizarea preconizată a țesuturilor și celulelor. Riscurile le includ pe cele referitoare, în special, la proceduri, mediu, starea de sănătate a personalului specific centrului de țesuturi. |
|
(6) |
Acordurile încheiate între centrele de țesuturi și terți trebuie să respecte articolul 24 din Directiva 2004/23/CE. Acordurile cu terți trebuie să specifice condițiile acordului și responsabilitățile, precum și protocoalele ce trebuie urmate pentru a respecta specificația de performanță cerută. |
|
(7) |
Trebuie să existe un sistem documentat, controlat de persoana responsabilă, care să confirme că țesuturile și/sau celulele respectă specificațiile corespunzătoare privind siguranța și calitatea pentru eliberarea și distribuirea lor. |
|
(8) |
În cazul încetării activităților, acordurile încheiate și procedurile adoptate în conformitate cu articolul 21 alineatul (5) din Directiva 2004/23/CE includ datele privind trasabilitatea și informațiile referitoare la calitatea și siguranța celulelor și țesuturilor. |
|
(9) |
Trebuie să existe un sistem documentat care să asigure identificarea fiecărei unități de țesut sau celule în toate etapele activităților pentru care s-a solicitat acreditarea/desemnarea/autorizarea/acordarea licenței. |
B. PERSONAL
|
(1) |
Personalul centrului de țesuturi trebuie să fie disponibil în număr suficient și să fie calificat pentru sarcinile pe care le îndeplinește. Competența personalului trebuie evaluată la intervale corespunzătoare, specificate de sistemul de calitate. |
|
(2) |
Ar trebui să existe fișe ale postului clare, documentate și actualizate pentru întreg personalul. Sarcinile, responsabilitățile și funcțiile trebuie să fie documentate în mod clar și bine înțelese. |
|
(3) |
Personalul trebuie să beneficieze de formare inițială/de bază și de formare actualizată, după caz, atunci când procedurile se modifică și cunoștințele științifice evoluează, precum și de oportunități adecvate de perfecționare profesională în domeniul respectiv. Programul de formare trebuie să asigure și să dovedească prin documente că fiecare persoană:
|
C. ECHIPAMENTE ȘI MATERIALE
|
(1) |
Toate echipamentele și materialele trebuie să fie concepute și întreținute astfel încât să corespundă scopului pentru care au fost destinate și trebuie să reducă la minimum orice risc pentru receptori și/sau personal. |
|
(2) |
Toate echipamentele și dispozitivele critice trebuie să fie identificate și validate, inspectate cu regularitate și întreținute preventiv, în conformitate cu instrucțiunile producătorului. În cazul în care echipamentele sau materialele afectează parametrii critici de prelucrare sau stocare (de ex. temperatură, presiune, numărătoarea de particule, nivele de contaminare microbiană), acestea trebuie identificate și trebuie să facă obiectul supravegherii, alertelor, alarmelor și a unor măsuri corective, după caz, pentru a detecta disfuncțiile și defectele și pentru a asigura menținerea parametrilor critici în limite acceptabile în orice moment. Toate echipamentele cu o funcție de măsurare critică trebuie să fie calibrate în raport cu un standard identificabil, în cazul în care există. |
|
(3) |
Echipamentele noi și cele reparate trebuie să fie testate atunci când sunt instalate și trebuie validate înainte de utilizare. Rezultatele testelor trebuie documentate. |
|
(4) |
Întreținerea, repararea, curățirea, dezinfecția și igienizarea tuturor echipamentelor critice trebuie să se efectueze în mod regulat și să se înregistreze în consecință. |
|
(5) |
Trebuie să existe proceduri pentru funcționarea fiecărei componente a unui echipament critic, cu descrierea detaliată a măsurilor ce trebuie luate în caz de disfuncție sau de întrerupere a funcționării. |
|
(6) |
Procedurile pentru activitățile pentru care s-a solicitat acreditare/desemnarea/autorizarea/acordarea licenței trebuie să descrie în mod detaliat specificațiile pentru toate materialele critice și reactivii critici utilizați. În special, trebuie să fie definite specificațiile pentru aditivi (de ex. soluții) și materialele ambalajelor. Reactivii critici și materialele critice trebuie să îndeplinească cerințele și specificațiile documentate și, după caz, cerințele din Directiva 93/42/CEE a Consiliului din 14 iunie 1993 privind dispozitivele medicale (1) și din Directiva 98/79/CE a Parlamentului European și a Consiliului din 27 octombrie 1998 privind dispozitivele medicale pentru diagnostic in vitro (2). |
D. INSTALAȚII/LOCALURI
|
(1) |
Un centru de țesuturi trebuie să dispună de instalații corespunzătoare pentru executarea activităților pentru care s-a solicitat acreditarea/desemnarea/autorizarea sau acordarea licenței, în conformitate cu standardele prevăzute de prezenta directivă. |
|
(2) |
În cazul în care activitățile menționate includ prelucrarea țesuturilor și celulelor în timpul expunerii în mediu, aceasta trebuie să aibă loc într-un mediu cu o calitate și o puritate a aerului determinate, pentru a reduce la minimum riscul contaminării, inclusiv contaminarea încrucișată între donații. Eficacitatea acestor măsuri trebuie să fie validată și controlată. |
|
(3) |
Cu excepția unor dispoziții contrare ale punctului 4, în cazul în care țesuturile sau celulele sunt expuse la mediu în timpul prelucrării, fără un proces de inactivare microbiană ulterioară, este necesară o calitate a aerului caracterizată printr-un număr de particule și un număr de colonii microbiene echivalente cu cele din clasa A, definită de anexa 1 la Ghidul european pentru buna practică de fabricație (BPF) și de Directiva 2003/94/CE, cu un mediu ambiant corespunzător pentru prelucrarea țesutului/celulei în cauză, dar cel puțin echivalent cu clasa D din Ghidul BPF, în privința numărului de particule și a numărului de microbi. |
|
(4) |
Se poate accepta un mediu mai puțin strict decât cel specificat la punctul 3, în cazul în care:
|
|
(5) |
La punctul 4 literele (a), (b), (c) și (d), trebuie să se specifice un mediu. Trebuie să se demonstreze și să se dovedească cu documente că mediul ales garantează calitatea și siguranța necesare, cel puțin ținând seama de scopul prevăzut, modul de aplicare și starea imunitară a receptorului. Trebuie să se furnizeze îmbrăcăminte și echipamente de protecție individuală, precum și igienă corespunzătoare în fiecare serviciu relevant din centrul de țesuturi, împreună cu instrucțiuni scrise privind igiena și îmbrăcămintea. |
|
(6) |
În cazul în care activitățile pentru care s-a solicitat acreditarea/desemnarea/autorizarea sau acordarea licenței includ stocarea țesuturilor și celulelor, trebuie să se definească condițiile de stocare necesare pentru a menține proprietățile necesare ale țesuturilor și celulelor, inclusiv parametrii relevanți precum temperatura, umiditatea sau calitatea aerului. |
|
(7) |
Parametrii critici (de ex. temperatura, umiditatea, calitatea aerului) trebuie controlați, supravegheați și înregistrați pentru a demonstra conformitatea cu condițiile de stocare specificate. |
|
(8) |
Trebuie să se prevadă instalații de stocare care să asigure o separare și o distincție clară a țesuturilor și celulelor aflate înaintea eliberării/în carantină de cele care sunt eliberate și cele care sunt respinse, pentru a preveni confuzia și contaminarea încrucișată a acestora. Trebuie să se prevadă zone sau dispozitive de stocare separate fizic sau separare securizată în interiorul dispozitivului, atât în locurile de carantină, cât și în cele de eliberare pentru a deține anumite țesuturi și celule colectate în conformitate cu criterii speciale. |
|
(9) |
Centrul de țesuturi trebuie să dispună de reguli și proceduri scrise pentru controlul accesului, curățare și întreținere, pentru eliminarea deșeurilor și reorganizarea serviciilor în caz de urgență. |
E. DOCUMENTAȚIE ȘI ÎNREGISTRĂRI
|
(1) |
Trebuie să existe un sistem care să asigure o documentație clar definită și eficace, date înregistrate și registre corecte, precum și proceduri de lucru standardizate (PLS), pentru activitățile pentru care s-a solicitat acreditarea/desemnarea/autorizarea/acordarea licenței. Documentele trebuie revăzute în mod regulat și trebuie să fie conforme cu normele stabilite de prezenta directivă. Sistemul trebuie să garanteze standardizarea lucrărilor efectuate și trasabilitatea tuturor etapelor, de exemplu codificarea, eligibilitatea donatorilor, achiziția, prelucrarea, conservarea, stocarea, transportul, distribuția sau eliminarea, inclusiv aspecte legate de controlul calității și asigurarea calității. |
|
(2) |
Pentru fiecare activitate critică, trebuie să se identifice și să se justifice cu documente materialele, echipamentele și personalul implicat. |
|
(3) |
În centrele de țesuturi, toate modificările documentelor trebuie să fie controlate, datate, aprobate, justificate cu documente și să fie puse în aplicare de îndată de către personalul autorizat. |
|
(4) |
Trebuie să se stabilească o procedură de control al documentelor pentru a asigura istoricul revizuirilor și modificărilor documentelor și pentru a garanta că se utilizează doar versiunile actuale ale documentelor. |
|
(5) |
Trebuie să se demonstreze că datele înregistrate sunt fiabile și sunt o reprezentare fidelă a rezultatelor. |
|
(6) |
Datele înregistrate trebuie să fie lizibile și indelebile și pot fi scrise de mână sau transferate în alt sistem validat, de exemplu un calculator sau microfilm. |
|
(7) |
Fără a aduce atingere articolului 9 alineatul (2), toate datele înregistrate, inclusiv datele de bază, care sunt critice pentru siguranța și calitatea țesuturilor și celulelor, se păstrează într-un mod care să permită accesul la datele respective timp de cel puțin 10 ani după data de expirare, utilizarea clinică sau eliminarea. |
|
(8) |
Datele înregistrate trebuie să îndeplinească cerințele de confidențialitate prevăzute la articolul 14 din Directiva 2004/23/CE. Accesul la registre și la date trebuie să fie limitat la persoanele autorizate de persoana responsabilă, precum și la autoritatea competentă, în scopul aplicării măsurilor de inspecție și control. |
F. CONTROLUL CALITĂȚII
|
(1) |
Trebuie să existe un sistem de audit pentru activitățile pentru care s-a solicitat acreditarea/desemnarea/autorizarea/acordarea licenței. Persoane formate și competente trebuie să conducă auditul în mod independent, la intervale de cel puțin doi ani, pentru a verifica conformitatea cu protocoalele aprobate și cu cerințele de reglementare. Rezultatele și măsurile corective trebuie documentate. |
|
(2) |
Abaterile de la standardele de calitate și siguranță prevăzute trebuie să conducă la investigații documentate care să includă o decizie privind eventuale măsuri corective și preventive. Soarta țesuturilor și celulelor neconforme trebuie să se decidă în conformitate cu procedurile scrise, sub controlul persoanei responsabile și să fie înregistrate. Toate țesuturile și celulele în cauză trebuie să fie identificate și contabilizate. |
|
(3) |
Măsurile corective trebuie să fie justificate cu documente, să fie inițiate și definitivate la termen și în mod eficace. După punerea în aplicare a măsurilor preventive și corective, ar trebui să se evalueze eficacitatea acestora. |
|
(4) |
Centrul de țesuturi ar trebui să dispună de procedee pentru evaluarea performanței sistemului de management al calității pentru a asigura îmbunătățirea continuă și sistematică a acestuia. |
(1) JO L 169, 12.7.1993, p. 1. Directivă astfel cum a fost modificată ultima dată prin Regulamentul (CE) nr. 1882/2003 al Parlamentului European și al Consiliului (JO L 284, 31.10.2003, p. 1).
(2) JO L 331, 7.12.1998, p. 1. Directivă astfel cum a fost modificată prin Regulamentul (CE) nr. 1882/2003.
ANEXA II
Cerințe privind autorizarea proceselor de preparare a țesuturilor și celulelor la centrele de țesuturi, menționate la articolul 4
Autoritatea competentă autorizează fiecare procedeu de preparare a țesuturilor și celulelor după evaluarea criteriilor de selecție a donatorilor și a procedurilor de achiziție, precum și a protocoalelor pentru fiecare etapă a procedeului, a criteriilor de management al calității și a criteriilor cantitative și calitative finale pentru celule și țesuturi. Această evaluare trebuie să respecte cel puțin cerințele specificate de prezenta anexă.
A. RECEPȚIA LA CENTRUL DE ȚESUTURI
La recepția, la centrul de țesuturi, a țesuturilor și celulelor obținute, țesuturile și celulele trebuie să respecte cerințele definite de Directiva 2006/17/CE.
B. PRELUCRAREA
În cazul în care activitățile pentru care s-a solicitat acreditarea/desemnarea/autorizarea/acordarea licenței includ prelucrarea țesuturilor și a celulelor, procedurile centrului de țesuturi trebuie să respecte următoarele criterii:
|
1. |
Procedurile critice de prelucrare trebuie validate și nu trebuie să facă țesuturile și celulele ineficace din punct de vedere clinic sau nocive pentru receptor. Această validare se poate realiza pe baza studiilor efectuate chiar de centrul respectiv sau pe baza datelor din studii publicate sau, în cazul procedurilor de prelucrare bine stabilite, prin evaluarea retrospectivă a rezultatelor clinice pentru țesuturile furnizate de centrul de țesuturi. |
|
2. |
Trebuie să se demonstreze că procedeul validat se poate aplica în mod sistematic și eficace de către personal în mediul oferit de centrul de țesuturi. |
|
3. |
Procedurile trebuie documentate în proceduri de lucru standardizate (PLS) care trebuie să fie conforme cu metoda validată și cu standardele prevăzute de prezenta directivă, în conformitate cu anexa I litera (E) punctele 1-4. |
|
4. |
Trebuie să se asigure executarea tuturor proceselor în conformitate cu procedurile de lucru standardizate (PLS) aprobate. |
|
5. |
În cazul în care se aplică țesutului sau celulelor o procedură de inactivare microbiană, aceasta trebuie specificată, documentată și validată. |
|
6. |
Înaintea aplicării unei modificări importante în prelucrare, procesul modificat trebuie validat și documentat. |
|
7. |
Trebuie să se procedeze la evaluări critice regulate ale procedurilor de prelucrare pentru a asigura obținerea în continuare a rezultatelor preconizate. |
|
8. |
Procedurile de eliminare a țesuturilor și celulelor trebuie să prevină contaminarea altor donații și produse, a mediului de prelucrare sau a personalului. Aceste proceduri trebuie să respecte dispozițiile naționale. |
C. STOCAREA ȘI ELIBERAREA PRODUSELOR
În cazul în care activitățile pentru care s-a solicitat acreditarea/desemnarea/autorizarea/acordarea licenței includ stocarea și eliberarea țesuturilor și a celulelor, procedurile autorizate ale centrului de țesuturi trebuie să respecte următoarele criterii:
|
1. |
Timpul maxim de stocare trebuie specificat pentru fiecare tip de condiție de stocare. Perioada selectată trebuie să reflecte, printre altele, posibila deteriorare a proprietăților necesare ale țesuturilor și celulelor. |
|
2. |
Trebuie să existe un sistem de inventariere a țesuturilor și/sau a celulelor pentru a garanta că acestea nu se pot elibera înainte ca toate cerințele stabilite de prezenta directivă să fie îndeplinite. Trebuie să existe o procedură de lucru standardizată care să descrie detaliat condițiile, responsabilitățile și procedurile pentru eliberarea țesuturilor și celulelor în vederea distribuției. |
|
3. |
Un sistem de identificare a țesuturilor și celulelor în toate fazele de prelucrare din centrul de țesuturi trebuie să facă o distincție clară între produsele eliberate și cele neeliberate (în carantină) și respinse. |
|
4. |
Înregistrarea datelor trebuie să demonstreze îndeplinirea tuturor cerințelor înaintea eliberării țesuturilor și celulelor, în special că toate formularele de declarație în vigoare, înregistrările datelor medicale, înregistrările datelor privind prelucrarea și rezultatele testelor au fost verificate în conformitate cu o procedură scrisă, de o persoană autorizată pentru această activitate de către persoana responsabilă specificată la articolul 17 din Directiva 2004/23/CE. În cazul în care se utilizează un calculator pentru furnizarea rezultatelor de laborator, o pistă de control ar trebui să indice persona responsabilă de furnizarea lor. |
|
5. |
Trebuie să se procedeze la o evaluare documentată a riscurilor, aprobată de persoana responsabilă definită la articolul 17 din Directiva 2004/23/CE, pentru a determina soarta tuturor țesuturilor și celulelor stocate după introducerea oricăror criterii noi de selecție a donatorilor sau de testare sau a oricărei etape de prelucrare modificate semnificativ care conduce la o siguranță sau calitate sporită. |
D. DISTRIBUȚIA ȘI RETRAGEREA
În cazul în care activitățile pentru care s-a solicitat acreditarea/desemnarea/autorizarea/acordarea licenței includ distribuția țesuturilor și a celulelor, procedurile centrului de țesuturi trebuie să respecte următoarele criterii:
|
1. |
Condițiile critice de transport, ca temperatura și termenul, trebuie definite pentru a păstra proprietățile necesare ale țesuturilor și celulelor. |
|
2. |
Recipientul/ambalajul trebuie să fie securizat și să asigure păstrarea țesuturilor și celulelor în condițiile specificate. Toate recipientele și ambalajele trebuie validate pentru utilizarea pentru care sunt destinate. |
|
3. |
În cazul în care distribuția se realizează prin contract de către un terț, trebuie să existe un contract documentat care să garanteze menținerea condițiilor necesare. |
|
4. |
În cadrul centrului de țesuturi trebuie să existe personal autorizat să evalueze necesitatea retragerii, precum și să inițieze și să coordoneze măsurile necesare. |
|
5. |
Trebuie să existe o procedură de retragere eficace care să includă o descriere a responsabilităților și măsurilor ce trebuie adoptate. Aceasta trebuie să includă notificarea făcută autorității competente. |
|
6. |
Măsurile trebuie adoptate în intervale de timp prestabilite și trebuie să includă urmărirea circuitului tuturor țesuturilor și celulelor și, după caz, trebuie să includă cercetarea retrospectivă a acestora. Scopul acestei cercetări este de a identifica orice donator care ar fi putut contribui la provocarea reacției la receptor și de a regăsi țesuturile și celulele provenind de la donatorul respectiv, precum și de a informa destinatarii și receptorii țesuturilor și celulelor obținute de la același donator, în cazul în care acestea ar fi putut prezenta un risc. |
|
7. |
Trebuie să existe proceduri pentru rezolvarea cererilor de țesuturi și celule. Regulile de alocare a țesuturilor și celulelor anumitor pacienți sau instituții de sănătate trebuie documentate și puse la dispoziția acestor părți, la cerere. |
|
8. |
Trebuie să existe un sistem documentat pentru manipularea produselor returnate, care să includă criteriile de acceptare a acestora în inventar, după caz. |
E. ETICHETAREA FINALĂ ÎN VEDEREA DISTRIBUIRII
|
(1) |
Recipientul primar pentru țesut/celule trebuie să poarte următoarele mențiuni:
În cazul în care informațiile prevăzute la literele (d) și (e) anterioare nu se pot include pe eticheta ambalajului primar, acestea trebuie indicate pe o foaie separată care însoțește recipientul primar. Această foaie se ambalează împreună cu recipientul primar într-un mod care să garanteze că rămân împreună. |
|
(2) |
Informațiile prezentate în continuare trebuie să fie specificate fie pe etichetă, fie în documentele însoțitoare:
|
F. ETICHETAREA EXTERIOARĂ A RECIPIENTULUI DE TRANSPORT
Pentru transport, recipientul primar trebuie plasat într-un recipient de transport care trebuie să poarte o etichetă conținând cel puțin următoarele informații:
|
(a) |
identificarea centrului de țesuturi expeditor, inclusiv o adresă și un număr de telefon; |
|
(b) |
identificarea organizației responsabile pentru utilizarea la oameni destinatară, inclusiv o adresă și un număr de telefon; |
|
(c) |
precizarea că ambalajul conține țesuturi/celule umane și mențiunea „FRAGIL” |
|
(d) |
în cazul în care sunt necesare celule vii pentru funcția de grefare, ca celule stem, gameți și embrioni, se adaugă următoarea mențiune: „A NU SE IRADIA”; |
|
(e) |
condițiile de transport recomandate (de ex. a se păstra la rece, în poziție verticală etc.); |
|
(f) |
instrucțiuni de siguranță/metoda de răcire (după caz). |
ANEXA III
NOTIFICAREA REACȚIILOR ADVERSE GRAVE

ANEXA IV
NOTIFICAREA INCIDENTELOR ADVERSE GRAVE
ANEXA V
FORMULARUL DE NOTIFICARE ANUALĂ


ANEXA VI
Informații privind datele minimale referitoare la donator/receptor prevăzute a fi păstrate în conformitate cu articolul 9
A. DE CENTRUL DE ȚESUTURI
Identificarea donatorului
Identificarea donării, care va include cel puțin:
|
— |
Identificarea organizației de achiziție sau a centrului de țesuturi |
|
— |
Numărul unic de identificare al donării |
|
— |
Data obținerii |
|
— |
Locul obținerii |
|
— |
Tipul donării (de ex. țesut unic/țesut multiplu, autologă/alogenă, donator în viață/decedat) |
Identificarea produsului, care va include cel puțin:
|
— |
Identificarea centrului de țesuturi |
|
— |
Tipul țesutului și al celulei/produsului (nomenclatura de bază) |
|
— |
Numărul grupei de loturi (după caz) |
|
— |
Numărul de subloturi (după caz) |
|
— |
Data expirării |
|
— |
Statutul țesutului/celulelor (de ex. în carantină, corespunzător pentru utilizare) |
|
— |
Descrierea și originea produselor, a etapelor de prelucrare aplicate, a materialelor și aditivilor care vin în contact cu țesuturile și celulele și care au un efect asupra calității și/sau siguranței lor |
|
— |
Identificarea unității de emitere a etichetei finale |
Identificarea utilizării la oameni, care va include cel puțin:
|
— |
Data distribuției/eliminării |
|
— |
Identificarea medicului sau a utilizatorului/unității final(e) |
B. DE ORGANIZAȚIA RESPONSABILĂ PENTRU UTILIZAREA LA OAMENI
|
(a) |
Identificarea centrului de țesuturi furnizor |
|
(b) |
Identificarea medicului sau a utilizatorului/unității final(e) |
|
(c) |
Tipul de țesuturi și celule |
|
(d) |
Identificarea produsului |
|
(e) |
Identificarea receptorului |
|
(f) |
Data utilizării |
ANEXA VII
Informațiile cuprinse în sistemul european de codificare
|
(a) |
Identificarea donării:
|
|
(b) |
Identificarea produsului:
|