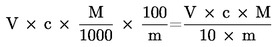 ,
,|
03/Volumul 10 |
RO |
Jurnalul Ofícial al Uniunii Europene |
66 |
31991R2568
|
L 248/1 |
JURNALUL OFÍCIAL AL UNIUNII EUROPENE |
REGULAMENTUL (CEE) NR. 2568/91 AL COMISIEI
din 11 iulie 1991
privind caracteristicile uleiurilor de măsline și ale uleiurilor din resturi de măsline, precum și metodele de analiză a acestora
COMISIA COMUNITĂȚILOR EUROPENE,
având în vedere Tratatul de instituire a Comunității Economice Europene,
având în vedere Regulamentul nr. 136/66/CEE al Consiliului din 22 septembrie 1966 privind stabilirea unei organizări comune a piețelor în sectorul uleiurilor și grăsimilor (1), astfel cum a fost modificat ultima dată de Regulamentul (CEE) nr. 3577/90 (2), în special articolul 35a,
întrucât anexa la Regulamentul nr. 136/66/CEE prevede denumirile și definițiile uleiurilor de măsline și ale uleiurilor din resturi de măsline comercializate în fiecare stat membru, în comerțul intracomunitar și în comerțul cu țările terțe;
întrucât, pentru a face deosebirea între diversele tipuri de ulei, ar trebui definite proprietățile fizico-chimice ale fiecăruia dintre ele, precum și caracteristicile organoleptice ale uleiurilor virgine, astfel încât să se asigure puritatea și calitatea produselor respective, fără a se aduce atingere altor dispoziții existente;
întrucât ar trebui determinată în mod unitar la nivelul Comunității prezența caracteristicilor diferitelor tipuri de ulei; întrucât, în acest scop, ar trebui stabilite metodele comunitare de analiză chimică și de evaluare organoleptică; întrucât ar trebui permisă, pentru o perioadă tranzitorie, utilizarea altor metode de analiză aplicate în statele membre, cu condiția ca, în cazul în care există diferențe între rezultate, să prevaleze cele obținute prin aplicarea metodei comune;
întrucât definirea proprietăților fizico-chimice ale uleiurilor de măsline și ale metodelor de analiză implică modificarea notelor adiționale de la capitolul 15 din Nomenclatura combinată;
întrucât metoda de evaluare a caracteristicilor organoleptice ale uleiurilor virgine presupune înființarea unor comisii de degustători selectați și instruiți; întrucât, prin urmare, ar trebui stabilită perioada necesară pentru înființarea unei asemenea structuri; întrucât, având în vedere dificultățile pe care le vor întâmpina unele state membre la înființarea comisiilor de degustători, ar trebui autorizată utilizarea de comisii ale degustătorilor din alte state membre;
întrucât, pentru a asigura funcționarea corectă a sistemului de prelevări aplicabile importului de resturi de măsline, ar trebui să se stabilească o metodă unică de determinare a conținutului de ulei din aceste produse;
întrucât, pentru a nu aduce atingere comerțului, ar trebui să se prevadă ca uleiul ambalat înainte de intrarea în vigoare a prezentului regulament să fie vândut pe o durată limitată;
întrucât este necesar să se abroge Regulamentul (CEE) nr. 1058/77 (3) al Comisiei, astfel cum a fost modificat ultima dată de Regulamentul (CEE) nr. 1858/88 (4);
întrucât Comitetul de gestionare pentru uleiuri și grăsimi nu a emis un aviz în termenul stabilit de președinte,
ADOPTĂ PREZENTUL REGULAMENT:
Articolul 1
(1) Sunt considerate uleiuri de măsline virgine, în înțelesul punctului 1 literele (a), (b) și (c) din anexa la Regulamentul nr. 136/66/CEE, uleiurile ale căror caracteristici sunt conforme cu cele indicate în anexa I punctele 1, 2 și 3 la prezentul regulament.
(2) Este considerat ulei de măsline virgin lampant, în sensul punctului 1 litera (d) din anexa la Regulamentul nr. 136/66/CEE, uleiul ale cărui caracteristici sunt conforme cu cele indicate în anexa I punctul 4 la prezentul regulament.
(3) Este considerat ulei de măsline rafinat, în înțelesul punctului 2 din anexa la Regulamentul nr. 136/66/CEE, uleiul ale cărui caracteristici sunt conforme cu cele indicate în anexa I punctul 5 la prezentul regulament.
(4) Este considerat ulei de măsline, în înțelesul punctului 3 din anexa la Regulamentul nr. 136/66/CEE, uleiul ale cărui caracteristici sunt conforme cu cele indicate în anexa I punctul 6 la prezentul regulament.
(5) Este considerat ulei brut din resturi de măsline, în înțelesul punctului 4 din anexa la Regulamentul nr. 136/66/CEE, uleiul ale cărui caracteristici sunt conforme cu cele indicate în anexa I punctul 7 la prezentul regulament.
(6) Este considerat ulei rafinat din resturi de măsline, în înțelesul punctului 5 din anexa la Regulamentul nr. 136/66/CEE, uleiul ale cărui caracteristici sunt conforme cu cele indicate în anexa I punctul 8 la prezentul regulament.
(7) Este considerat ulei din resturi de măsline, în înțelesul punctului 6 din anexa la Regulamentul nr. 136/66/CEE, uleiul ale cărui caracteristici sunt conforme cu cele indicate în anexa I punctul 9 la prezentul regulament.
Articolul 2
(1) Caracteristicile uleiurilor prevăzute la anexa I se efectuează în conformitate cu metodele de analiză următoare:
|
— |
pentru determinarea acizilor grași liberi, exprimați în procente de acid oleic, metoda descrisă în anexa II; |
|
— |
pentru determinarea indicelui de peroxid, metoda descrisă în anexa III; |
|
— |
pentru determinarea alcoolilor alifatici, metoda descrisă în anexa IV; |
|
— |
pentru determinarea conținutului de steroli, metoda descrisă în anexa V; |
|
— |
pentru determinarea eritrodiolului și a uvaolului, metoda descrisă în anexa VI; |
|
— |
pentru determinarea acizilor grași saturați în poziția 2 a trigliceridei, metoda descrisă în anexa VII; |
|
— |
pentru determinarea conținutului de trilinoleină, metoda descrisă în anexa VIII; |
|
— |
pentru analiza spectrofotometrică, metoda descrisă în anexa IX; |
|
— |
pentru determinarea compoziției de acizi grași, metoda descrisă în anexele X „A” și X „B”; |
|
— |
pentru determinarea solvenților halogenați volatili, metoda descrisă în anexa XI; |
|
— |
pentru evaluarea caracteristicilor organoleptice ale uleiurilor de măsline virgine, metoda descrisă în anexa XII, aplicată în conformitate cu alineatul (2); |
|
— |
pentru a se dovedi că a fost efectuată rafinarea, metoda descrisă în anexa XIII. |
(2) Evaluarea caracteristicilor organoleptice se efectuează de către un analist și, dacă este cazul, cu sprijinul unui specialist, în conformitate cu procedura descrisă în fișa de degustare menționată în anexa XII. În cazul în care analiza evidențiază caracteristici organoleptice diferite de cele care rezultă din descrierea produsului, mostra este examinată de o comisie de degustători, în conformitate cu dispozițiile din anexa XII.
O a doua analiză se efectuează de către comisia de degustători în conformitate cu dispozițiile menționate.
Pentru a evalua caracteristicile organoleptice legate de operațiunile privind sistemul de intervenție, comisia de degustători va efectua această evaluare în conformitate cu anexa XII.
Articolul 3
Până la 31 octombrie 1992, introducerea metodelor de analiză prevăzute la articolul 2 nu împiedică folosirea de către statele membre a altor metode verificate și valabile din punct de vedere științific, cu condiția ca produsele recunoscute a fi conforme cu normele în vigoare care reglementează metodele comunitare să fie lăsate să circule liber. Înainte de utilizarea altor metode, statele membre interesate le notifică Comisiei.
În cazul în care una dintre celelalte metode dă un rezultat diferit față de cel obținut prin metoda comună, va prevala rezultatul obținut prin aplicarea acesteia din urmă.
Articolul 4
(1) În vederea evaluării caracteristicilor organoleptice, statele membre înființează comisii de degustători formați și selectați în conformitate cu normele stabilite de metoda prevăzută de anexa XII.
(2) În cazul în care un stat membru întâmpină dificultăți la înființarea unei comisii de degustători pe teritoriul său, el poate face apel la serviciile unei comisii de degustători care funcționează într-un alt stat membru.
Articolul 5
Notele adiționale 2, 3 și 4 la capitolul 15 din Nomenclatura combinată se înlocuiesc cu notele adiționale 2, 3 și 4 menționate în anexa XIV la prezentul regulament.
Articolul 6
(1) Conținutul de ulei din resturile și alte reziduuri rezultate din extragerea uleiului cu codurile NC 2306 90 11 și 2306 90 19 se determină în conformitate cu metoda prezentată în anexa XV.
(2) Conținutul de ulei la care se face referire în alineatul (1) se exprimă ca procent din greutatea de ulei raportată la greutatea materiei uscate.
Articolul 7
Se aplică dispozițiile comunitare privind prezența substanțelor nedorite, altele decât cele prevăzute de anexa XI.
Articolul 8
(1) Statele membre comunică Comisiei măsurile luate pentru punerea în aplicare a prezentului regulament.
(2) Statele membre transmit Comisiei, la începutul fiecărui semestru, un raport cu datele analitice obținute pe baza testelor efectuate în cursul semestrului precedent.
Comitetul de gestionare pentru uleiuri și grăsimi analizează aceste date în conformitate cu procedura stabilită la articolul 39 din Regulamentul nr. 136/66/CEE.
Articolul 9
Regulamentul (CEE) nr. 1058/77 se abrogă.
Articolul 10
(1) Prezentul regulament intră în vigoare în a treia zi de la data publicării în Jurnalul Oficial al Comunităților Europene.
Cu toate acestea, metoda prezentată în anexa XII se aplică de la 1 ianuarie 1992, cu excepția operațiunilor privind sistemul de intervenție.
(2) Prezentul regulament nu se aplică uleiurilor de măsline și uleiurilor din resturi de măsline ambalate înainte de intrarea în vigoare a prezentului regulament și comercializate până la 31 octombrie 1992.
Prezentul regulament este obligatoriu în toate elementele sale și se aplică direct în toate statele membre.
Adoptat la Bruxelles, 11 iulie 1991.
Pentru Comisie
RAY MAC SHARRY
Membru al Comisiei
(1) JO 172 30.9.1966, p. 3025/66.
(2) JO L 353, 17.12.1990, p. 23.
(3) JO L 128, 24.5.1977, p. 6.
(4) JO L 166, 1.7.1988, p. 10.
ANEXE
Cuprins
|
Anexa I: |
Caracteristicile uleiurilor de măsline |
|
Anexa II: |
Determinarea acizilor grași liberi |
|
Anexa III: |
Determinarea indicelui de peroxid |
|
Anexa IV: |
Determinarea conținutului de alcooli alifatici prin cromatografia în fază gazoasă cu coloană capilară |
|
Anexa V: |
Determinarea compoziției și a conținutului de steroli prin cromatografia în fază gazoasă cu coloană capilară |
|
Anexa VI: |
Determinarea conținutului de eritrodiol și de uvaol |
|
Anexa VII: |
Determinarea acizilor grași saturați în poziția 2 a trigliceridelor |
|
Anexa VIII: |
Determinarea conținutului de trilinoleină |
|
Anexa IX: |
Analiza spectrofotometrică |
|
Anexa XA: |
Analiza prin cromatografie în fază gazoasă a esterilor metilici de acizi grași |
|
Anexa XB: |
Prepararea esterilor metilici de acizi grași |
|
Anexa XI: |
Determinarea conținutului de solvenți halogenați volatili din uleiul de măsline |
|
Anexa XII: |
Evaluarea organoleptică a uleiului de măsline virgin |
|
Anexa XIII: |
Dovada rafinării |
|
Anexa XIV: |
Notele adiționale 2, 3 și 4 la capitolul 15 din nomenclatura combinată |
|
Anexa XV: |
Conținutul de ulei al resturilor de măsline |
|
Anexa XVI: |
Determinarea indicelui de iod |
ANEXA I
CARACTERISTICILE ULEIURILOR DE MĂSLINE
|
Categorie |
Aciditate (%) |
Indice de peroxid (mEq/O2/kg) |
Solvanți halogenați (mg/kg) (1) |
Alcooli alifatici (mg/kg) |
Acizi saturați în poziția 2 a trigliceridei (%) |
Eritro-diol și uvaol (%) |
Trilinoleină (%) |
Colesterol (%) |
Brasicasterol (%) |
Campesterol (%) |
Stigomasterol (%) |
Beta-sitosterol (%) (2) |
Delta-7-Stigmasterol (%) |
Total steroli (mg/kg) |
|
1. Ulei de măsline virgin extra |
M 1,0 |
M 20 |
M 0,20 |
M 300 |
M 1,3 |
M 4,5 |
M 0,5 |
M 0,5 |
M 0,2 |
M 4,0 |
< Camp. |
m 93,0 |
M 0,5 |
m 1 000 |
|
2. Ulei de măsline virgin |
M 2,0 |
M 20 |
M 0,20 |
M 300 |
M 1,3 |
M 4,5 |
M 0,5 |
M 0,5 |
M 0,2 |
M 4,0 |
< Camp. |
m 93,0 |
M 0,5 |
m 1 000 |
|
3. Ulei de măsline virgin obișnuit |
M 3,3 |
M 20 |
M 0,20 |
M 300 |
M 1,3 |
M 4,5 |
M 0,5 |
M 0,5 |
M 0,2 |
M 4,0 |
< Camp. |
m 93,0 |
M 0,5 |
m 1 000 |
|
4. Ulei de măsline virgin lampant |
> 3,3 |
> 20 |
> 0,20 |
M 400 |
M 1,3 |
M 4,5 |
M 0,5 |
M 0,5 |
M 0,2 |
M 4,0 |
— |
m 93,0 |
M 0,5 |
m 1 000 |
|
5. Ulei de măsline rafinat |
M 0,5 |
M 10 |
M 0,20 |
M 350 |
M 1,5 |
M 4,5 |
M 0,5 |
M 0,5 |
M 0,2 |
M 4,0 |
< Camp. |
m 93,0 |
M 0,5 |
m 1 000 |
|
6. Ulei de măsline |
M 1,5 |
M 15 |
M 0,20 |
M 350 |
M 1,5 |
M 4,5 |
M 0,5 |
M 0,5 |
M 0,2 |
M 4,0 |
< Camp. |
m 93,0 |
M 0,5 |
m 1 000 |
|
7. Ulei brut din resturi de măsline |
m 2,0 |
— |
— |
— |
M 1,8 |
m 12 |
M 0,5 |
M 0,5 |
M 0,2 |
M 4,0 |
— |
m 93,0 |
M 0,5 |
m 2 500 |
|
8. Ulei rafinat din resturi de măsline |
M 0,5 |
M 10 |
M 0,20 |
— |
M 2,0 |
m 12 |
M 0,5 |
M 0,5 |
M 0,2 |
M 4,0 |
< Camp. |
m 93,0 |
M 0,5 |
m 1 800 |
|
9. Ulei din resturi de măsline |
M 1,5 |
M 15 |
M 0,20 |
— |
M 2,0 |
> 4,5 |
M 0,5 |
M 0,5 |
M 0,2 |
M 4,0 |
< Camp. |
m 93,0 |
M 0,5 |
m 1 800 |
|
M = maxim, m = minim. Este suficient ca o singură caracteristică să nu fie conformă cu valorile indicate pentru ca uleiul să fie încadrat în altă clasă ori să fie declarat neconform în ceea ce privește puritatea. |
||||||||||||||
|
Clasificare |
Conținutul de acizi |
K232 |
K270 |
K270 după testul cu alumină (3) |
Delta K |
Test de grup |
|||||
|
Miristic (%) |
Linolenic (%) |
Arahidic (%) |
Eicosanoic (%) |
Behenic (%) |
Lignoceric (%) |
||||||
|
1. Ulei de măsline virgin extra |
M 0,1 |
M 0,9 |
M 0,7 |
M 0,5 |
M 0,3 |
M 0,5 |
M 2,40 |
M 0,20 |
M 0,10 |
M 0,01 |
≥6,5 |
|
2. Ulei de măsline virgin |
M 0,1 |
M 0,9 |
M 0,7 |
M 0,5 |
M 0,3 |
M 0,5 |
M 2,50 |
M 0,25 |
M 0,10 |
M 0,01 |
≥5,5 |
|
3. Ulei de măsline virgin obișnuit |
M 0,1 |
M 0,9 |
M 0,7 |
M 0,5 |
M 0,3 |
M 0,5 |
M 2,50 |
M 0,25 |
M 0,10 |
M 0,01 |
≥3,5 |
|
4. Ulei de măsline virgin lampant |
M 0,1 |
M 0,9 |
M 0,7 |
M 0,5 |
M 0,3 |
M 0,5 |
M 3,70 |
> 0,25 |
M 0,11 |
— |
<3,5 |
|
5. Ulei rafinat de măsline |
M 0,1 |
M 0,9 |
M 0,7 |
M 0,5 |
M 0,3 |
M 0,5 |
M 3,40 |
M 1,20 |
— |
M 0,16 |
— |
|
6. Ulei de măsline |
M 0,1 |
M 0,9 |
M 0,7 |
M 0,5 |
M 0,3 |
M 0,5 |
M 3,30 |
M 1,00 |
— |
M 0,13 |
— |
|
7. Ulei brut din resturi de măsline |
M 0,1 |
M 0,9 |
M 0,7 |
M 0,5 |
M 0,3 |
M 0,5 |
— |
— |
— |
— |
— |
|
8. Ulei rafinat din resturi de măsline |
M 0,1 |
M 0,9 |
M 0,7 |
M 0,5 |
M 0,3 |
M 0,5 |
M 5,50 |
M 2,50 |
— |
M 0,25 |
— |
|
9. Ulei din resturi de măsline |
M 0,1 |
M 0,9 |
M 0,7 |
M 0,5 |
M 0,3 |
M 0,5 |
M 5,30 |
M 2,00 |
— |
M 0,20 |
— |
(1) Limita maximă totală pentru compușii depistați cu detectorul pentru captarea electronilor. Pentru componentele detectate individual, limita maximă este de 0,10mg/kg.
(2) Delta –5-23-Stigmastadienol + Clerosterol + Betasitosterol + Sitostanol + Delta-5-Avenasterol + Delta-5-24-Stigmastadienol.
Notă:
Este suficient ca o singură caracteristică să nu fie conformă cu valorile indicate pentru ca uleiul să fie încadrat în altă clasă ori să fie declarat neconform în ceea ce privește puritatea.
(3) În cazul uleiurilor cu aciditate mai mare de 3,3 %, dacă prin testul cu alumină se obține K270 mai mare de 0,11, trebuie să se efectueze dovada rafinării menționată în anexa XIII. În vederea stabilirii purității, în cazul în care K270 depășește limita categoriei în cauză, trebuie să se determine K270 în urma testului cu alumină.
ANEXA II
DETERMINAREA ACIZILOR GRAȘI LIBERI
1. OBIECT
Determinarea acizilor grași liberi din uleiurile de măsline. Conținutul de acizi grași liberi se exprimă prin aciditatea calculată în mod convențional.
1.1. Principiu
Se dizolvă o mostră într-un amestec de solvenți, apoi se titrează acizii grași liberi prezenți cu ajutorul unei soluții etanolice de hidroxid de potasiu.
1.2. Reactivi
Toți reactivii trebuie să aibă o calitate analitică recunoscută, iar apa utilizată trebuie să fie distilată sau cu un grad de puritate echivalent.
1.2.1. Oxid dietilic etanol în concentrație de 95 % (V/V), amestec în volum de1 la 1.
Notă: Oxidul dietilic este foarte inflamabil și poate forma peroxizi explozivi. A se utiliza cu precauții speciale.
Se neutralizează exact în momentul folosirii cu soluția de hidroxid de potasiu (1.2.2) în prezența a 0,3 ml din soluția de fenolftaleină (1.2.3) pentru 100 ml de amestec.
Notă: În cazul în care nu se poate utiliza oxidul dietilic, se poate folosi un amestec de solvenți format din etanol și toluen. Dacă este necesar, se poate înlocui etanolul cu propanol 2.
1.2.2. Hidroxid de potasiu, soluție etanolică titrată c(KOH)- aproximativ 0,1 moli la litru sau, dacă este necesar, c(KOH)- aproximativ 0,5 moli la litru.
Concentrația exactă a soluției etanolice de hidroxid de potasiu trebuie să fie cunoscută și verificată imediat înainte de folosire. Se utilizează o soluție preparată cu cel puțin cinci zile înainte de folosire și decantată într-un flacon de sticlă maro închis cu un dop de cauciuc. Soluția trebuie să fie incoloră sau de nuanța galben pai.
Notă: O soluție incoloră stabilă de hidroxid de potasiu se poate prepara în modul următor. Se pun la fiert și se mențin timp de o oră la temperaturi din ce în ce mai scăzute 8 000 ml de etanol cu 8 g de hidroxid de potasiu și 0,5 g de pilitură de aluminiu. Se distilează imediat. Se dizolvă în distilat cantitatea de hidroxid de potasiu necesară. Se lasă în repaus timp de mai multe zile și se decantează lichidul limpede supernatant de precipitatul de carbonat de potasiu.
Soluția poate fi preparată și fără distilare, astfel: la 1 000 ml de etanol se adaugă 4 ml de butilită de aluminiu și se lasă amestecul în repaus timp de câteva zile. Se decantează lichidul supernatant și se dizolvă cantitatea de hidroxid de potasiu necesară. Soluția se poate utiliza ca atare.
1.2.3. Fenolftaleină, soluție de 10 g/l în etanol în concentrație de 95–96 % (V/V) sau albastru alcalin (în cazul substanțelor grase foarte colorate), soluție de 20 g/l în etanol în concentrație de 95–96 % (V/V).
1.3. Aparatură
Materiale obișnuite de laborator, în special:
1.3.1. Balanță analitică.
1.3.2. Balon conic cu capacitatea de 250 ml.
1.3.3. Biuretă cu capacitatea de 10 ml, gradată la 0,05 ml.
1.4. Mod de lucru
1.4.1. Prepararea mostrei
Determinarea se efectuează asupra mostrei filtrate. În cazul în care conținutul global de umiditate și de impurități este mai mic de 1 %, determinarea se efectuează asupra mostrei ca atare.
1.4.2. Prelevarea mostrei
Se prelevează o mostră, în funcție de indicele presupus al acidului, după indicațiile din tabelul următor:
|
Indicele presupus al acidului |
Masa mostrei (în g) |
Precizia de cântărire a mostrei (în g) |
|
< 1 |
20 |
0,05 |
|
1–4 |
10 |
0,02 |
|
4–15 |
2,5 |
0,01 |
|
15–75 |
0,5 |
0,001 |
|
> 75 |
0,1 |
0,0002 |
Se cântărește mostra în balonul conic (1.3.2).
1.4.3. Determinare
Se dizolvă mostra (4.5.2) într-o cantitate de 50-150 ml de amestec de oxid dietilic/etanol (1.2.1), neutralizat în prealabil.
Se titrează în timp ce se agită, cu soluția de hidroxid de potasiu de 0,1 mol la litru (1.2.2) (a se vedea nota 2) până când se modifică indicatorul (colorarea în roz a fenolftaleinei persistă cel puțin zece secunde).
Nota 1: Soluția etanolică titrată de hidroxid de potasiu (1.2.2) poate fi înlocuită cu o soluție apoasă de hidroxid de potasiu sau de sodiu, cu condiția ca volumul de apă introdus să nu producă separarea fazelor.
Nota 2: În cazul în care cantitatea necesară de soluție de hidroxid de potasiu de 0,1 moli la litru depășește 10 ml, se utilizează o soluție de 0,5 moli la litru.
Nota 3: În cazul în care soluția devine tulbure în timpul titrării, se adaugă o cantitate suficientă de amestec de solvenți (1.2.1) pentru a obține o soluție limpede.
1.5. Exprimarea acidității în procente de acid oleic
Aciditatea, exprimată în procente de masă este egală cu:
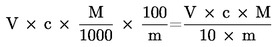 ,
,
în care:
|
V |
= |
volumul soluției titrate de hidroxid de potasiu utilizate, în mililitri; |
|
c |
= |
concentrația exactă, în moli la litru, a soluției titrate de hidroxid de potasiu utilizate; |
|
M |
= |
masa molară, în grame la mol, a acidului folosit pentru exprimarea rezultatului (= 282); |
|
m |
= |
masa în grame a mostrei. |
Se consideră drept rezultat media aritmetică a celor două determinări.
ANEXA III
DETERMINAREA INDICELUI DE PEROXID
1. OBIECT
Prezenta normă descrie o metodă de determinare a indicelui de peroxid în uleiuri și materii grase.
2. DOMENIUL DE APLICARE
Prezenta normă se aplică uleiurilor și materiilor grase animale și vegetale.
3. DEFINIȚIE
Indicele de peroxid reprezintă cantitatea de substanțe din mostră (exprimată în miliechivalenți de oxigen activ la kilogram) care oxidează iodura de potasiu în condițiile de lucru descrise.
4. PRINCIPIU
Mostra sub formă de soluție într-un amestec de acid acetic și cloroform se tratează cu o soluție de iodură de potasiu. Iodul eliberat se titrează cu o soluție de tiosulfat de sodiu.
5. APARATURĂ
Echipamentele utilizate trebuie să fie lipsite de orice urmă de substanțe oxidante sau dezoxidante.
Nota bene: nu se gresează suprafețele din sticlă rodată.
5.1. Lingură de sticlă de 3 ml.
5.2. Baloane de aproximativ 250 ml, cu gâtul și dopul din sticlă rodată, uscate în prealabil și umplute cu un gaz inert, uscat și pur (azot sau, de preferință, bioxid de carbon).
5.3. Biuretă de 25 sau 50 ml cu gradare la 0,1 ml.
6. REACTIVI
6.1. Cloroform de calitate analitică, fără oxigen (acesta din urmă fiind eliminat prin barbotarea unui curent de gaz inert, uscat și pur).
6.2. Acid acetic glacial de calitate analitică, fără oxigen (acesta din urmă fiind eliminat prin barbotarea unui curent de gaz uscat și pur).
6.3. Iodură de potasiu în soluție apoasă saturată în urma unei preparări recente, fără de iod și iodați.
6.4. Soluție apoasă de tiosulfat de sodiu 0,01 sau 0,002 N, standardizată cu atenție chiar înainte de folosire.
6.5. Soluție de amidon (dispersare apoasă de 10 g/l) preparată recent din amidon natural solubil.
7. MOSTRA
Mostra trebuie să fie prelevată și păstrată la adăpost de lumină, conservată la rece și închisă în recipiente de sticlă umplute în întregime și închise ermetic cu dopuri de plută sau de sticlă rodată.
8. MOD DE LUCRU
Testul trebuie să fie realizat la o lumină difuză (lumina zilei) sau artificială. Într-o lingură de sticlă (5.1) sau, la nevoie, într-un balon (5.2), se cântărește, cu o aproximare de 0,001 grame, una dintre masele de mostră menționate în tabelul următor, în funcție de indicele de peroxid prevăzut.
|
Indicele prevăzut de peroxid (în meq O2/kg) |
Masa mostrei (în g) |
|
0–12 |
5,0–2,0 |
|
12–20 |
2,0–1,2 |
|
20–30 |
1,2–0,8 |
|
30–50 |
0,8–0,5 |
|
50–90 |
0,5–0,3 |
Se scoate dopul unui balon (5.2) și se introduce lingura de sticlă cu mostra. Se adaugă 10 ml de cloroform (6.1). Se dizolvă rapid mostra prin agitare. Se adaugă 15 ml de acid acetic (6.2), apoi 1 ml de soluție de iodură de potasiu (6.3). Se pune rapid dopul la loc, se agită timp de un minut și se lasă în repaus exact 5 minute, la adăpost de lumină și la o temperatură de la 15–25 °C.
Se adaugă aproximativ 75 ml de apă distilată. Se titrează iodul eliberat cu soluție de tiosulfat de sodiu (6.4) (soluție de 0,002 N, în cazul în care indicii prevăzuți sunt mai mici de 12, și de 0,001 N, în cazul în care sunt mai mari de 12) prin agitare puternică și prin folosirea soluției de amidon (6,5) ca indicator.
Se efectuează două analize pe aceeași mostră.
Simultan, se efectuează un test etalon. În cazul în care rezultatul acestuia din urmă este mai mare de 0,05 ml de soluție de tiosulfat de sodiu (6,4) 0,001 N, se înlocuiesc reactivii impuri.
9. EXPRIMAREA REZULTATELOR
Indicele de peroxid (IP), exprimat în miliechivalenți de oxigen activ la kilogram, este dat de formula:
 ,
,
în care:
|
V |
= |
numărul ml de soluție de tiosulfat de sodiu standardizată (6.4) utilizat pentru test, modificat în funcție de rezultatele mostrei etalon; |
|
T |
= |
factorul exact de standardizare al soluției de tiosulfat de sodiu (6,4) utilizate; |
|
m |
= |
masa (în grame) a mostrei. |
Se ia drept rezultat media aritmetică a celor două determinări.
ANEXA IV
DETERMINAREA CONȚINUTULUI DE ALCOOLI ALIFATICI CU AJUTORUL CROMATOGRAFIEI ÎN FAZĂ GAZOASĂ CU COLOANĂ CAPILARĂ
1. OBIECT
Metoda descrie un procedeu de determinarea conținutului de alcooli alifatici, simpli și totali, din materiile grase.
2. PRINCIPIUL METODEI
Materia grasă, la care s-a adăugat 1-eicosanol ca etalon intern, este saponificată cu soluție de hidroxid de potasiu în etanol, apoi nesaponificabilul pur se extrage cu eter etilic.
Fracțiunea de alcooli se separă de extractul nesaponificabil prin cromatografiere pe placă de silicagel bazic; alcoolii recuperați din silicagel sunt transformați în trimetilsilileteri și analizați prin cromatografie în fază gazoasă în coloană capilară.
3. APARATURĂ
3.1. Balon de 250 ml echipat cu un condensator cu reflux cu racorduri din sticlă rodată.
3.2. Pâlnie de decantare de 500 ml.
3.3. Baloane de 250 ml.
3.4. Echipament complet pentru cromatografie în fază solidă cu plăci de sticlă de 20×20 cm.
3.5. Lampă cu lumină ultravioletă cu lungime de undă de 366 sau 254 nm.
3.6. Microseringi de 100 și 500 μl.
3.7. Pâlnie cilindrică de filtrare, cu filtru poros G 3 (porozitate 15–40 μm) cu un diametru de aproximativ 2 cm și înălțime de 5 cm, cu racord adaptat pentru filtrarea în vid și un racord tată din sticlă rodată 12/21.
3.8. Balon cu vid de 50 ml cu un racord mamă din sticlă rodată 12/21 adaptabil la pâlnia de filtrare (3.7).
3.9. Eprubetă cu fund conic de 10 ml, cu dop ermetic.
3.10. Cromatograf în fază gazoasă adaptat la funcționarea cu coloană capilară, echipat cu un sistem de fracționare, alcătuit din:
3.10.1. Incintă termostatată pentru coloană, permițând menținerea temperaturii dorite cu o precizie de aproximativ 1 °C.
3.10.2. Ansamblu de vaporizare termoreglabil cu element vaporizator din sticlă tratată cu persilan.
3.10.3. Detector cu ionizare în flacără și convertizor-amplificator.
3.10.4. Aparat de înregistrare-integrator adaptat la funcționarea cu un convertizor-amplificator cu un timp de răspuns sub 1 secundă și cu o viteză a hârtiei variabilă.
3.11. Coloană capilară de sticlă sau siliciu topit cu o lungime de 20–30 metri și un diametru interior de la 0,25–0,32 mm, acoperită în interior cu lichid SE-52 sau SE-54 sau echivalent, cu o grosime cuprinsă între 0,10 și 0,30 μm.
3.12. Microseringă pentru cromatografie în fază gazoasă de 10 μl cu ac cementat.
4. REACTIVI
4.1. Hidroxid de potasiu, soluție etanolică până la aproximativ 2 N: se dizolvă, răcind în același timp, 130 g de hidroxid de potasiu (titru minim 85 %) în 200 ml de apă distilată, apoi se completează până la un litru cu etanol. Soluția se păstrează în vase de sticlă opacă bine închise.
4.2. Eter etilic de calitate analitică.
4.3. Sulfat de sodiu anhidru pur, de calitate analitică.
4.4. Plăci de sticlă acoperite cu silicagel fără indicator de fluorescență, cu o grosime de 0,25 mm (acestea sunt disponibile în comerț, gata pentru utilizare).
4.5. Hidroxid de potasiu, soluție etanolică până la aproximativ 2 N: se dizolvă 13 g de hidroxid de potasiu în 20 ml de apă distilată, apoi se completează până la un litru cu etanol.
4.6. Benzen, pentru cromatografie (5.2.2).
4.7. Acetonă, pentru cromatografie (5.2.2).
4.8. Hexan pentru cromatografie (5.2.2).
4.9. Eter etilic, pentru cromatografie (5.2.2).
4.10. Cloroform pur, de calitate analitică.
4.11. Soluție de răcire pentru cromatografie pe placă: colesterol sau fitosterol, soluție de 0,5 % în cloroform.
4.12. Dicloro 2′-7′ fluoresceină, soluție etanolică de 0,2 %. Aceasta este făcută ușor bazică prin adăugarea de câteva picături dintr-o soluție alcoolică 2 N de hidroxid de potasiu.
4.13. Piridină anhidră, pentru cromatografie.
4.14. Hexametildisilazan.
4.15. Trimetilclorosilan.
4.16. Soluție etalon de trimetilsilileteri de alcooli alifatici de la C20 la C28. Se prepară în momentul folosirii amestecului de alcooli puri.
4.17. Eicosanol, soluție de 0,2 % (m/V) în cloroform (etalon intern).
4.18. Gaz vector: hidrogen sau heliu pur, pentru cromatografie în fază gazoasă.
4.19. Gaz auxiliar:
|
— |
hidrogen sau heliu pur, |
|
— |
pentru cromatografie în fază gazoasă. |
5. MOD DE LUCRU
Prepararea nesaponificabilelor
5.1.1. Se introduce într-un balon de 250 ml, cu ajutorul microseringii de 500 μl, un volum de soluție de eicosanol de 0,1 % în cloroform (4.17) care conține o cantitate de eicosanol ce corespunde la aproximativ 10 % din conținutul de alcooli alifatici din partea alicotă de mostră de prelevat pentru determinare. De exemplu, pentru 5 g de mostră, trebuie să se adauge 250 μl de soluție de eicosanol de 0,1 % în cazul unei mostre de ulei de măsline sau ulei de semințe și 1 500 μl în cazul uleiului din resturi de măsline.
Se evaporă într-un curent de azot până la uscare, după aceea se cântăresc exact 5 g de mostră uscată și filtrată în același balon.
5.1.2. Se adaugă 50 ml de soluție etanolică de hidroxid de potasiu la 0,2 N, se pune în funcțiune condensatorului cu reflux, se încălzește în baie de aburi până la o ușoară fierbere, menținând o agitare energică până când se produce saponificarea (soluția devine limpede). Se continuă să se încălzească timp de 20 minute, apoi se adaugă 50 ml de apă distilată care provine de partea de sus a condensatorului, se deconectează condensatorul și se răcește balonul la aproximativ 30 °C.
5.1.3. Se transvazează cantitativ conținutul balonului într-o pâlnie de decantare de 500 ml, adăugând apă distilată de mai multe ori, folosind în total aproximativ 50 ml. Se adaugă aproximativ 80 ml de eter etilic, se agită energic timp de aproximativ 30 de secunde și se lasă să se facă separarea (nota 1).
Se separă faza apoasă inferioară preluând-o în altă pâlnie de decantare. Se fac încă două extracții pe fază apoasă, procedând identic, utilizând de fiecare dată 60–70 ml de eter etilic.
Nota 1: Eventualele emulsii pot fi eliminate adăugând cu o pisetă o cantitate mică de alcool etilic sau metilic.
5.1.4. Se colectează extractele eterice într-o singură pâlnie de decantare și se spală cu apă distilată (50 ml de fiecare dată) până la reacția neutră a apei de spălare.
Se elimină apa de spălare, se usucă cu sulfat de sodiu anhidru și se filtrează, pe sulfat de sodiu anhidru, într-un balon de 250 ml cântărit în prealabil, spălând balonul și filtrul cu mici cantități de eter etilic.
5.1.5. Se distilează eterul până când rămâne numai o cantitate mică, apoi se usucă sub un vid ușor sau într-un curent de azot, se completează uscarea în etuvă la 100 °C timp de un sfert de oră aproximativ și se cântărește după răcirea într-un exsicator.
Separarea fracțiunii alcoolilor
5.2.1. Prepararea plăcilor bazice: se cufundă complet plăcile în silicagel (4.4), în soluție etanolică 0,2 N de hidroxid de potasiu (4.5) timp de 10 secunde, se lasă să acționeze, bine închis, timp de două ore și se pune în etuvă la 100 °C timp de o oră.
Se scoate din etuvă și se păstrează într-un exsicator cu clorură de calciu până în momentul folosirii (plăcile astfel tratate trebuie folosite în termen de cincisprezece zile).
Nota 2: Folosirea plăcilor de silicagel bazice pentru separarea fracțiunii alcoolilor elimină necesitatea tratamentului nesaponificabilului cu alumină. În acest mod, toți compușii de natură acidă (acizi grași și alții) sunt reținuți pe linia de depunere. Se obține astfel banda de alcooli alifatici și terpenici, separați net de banda de steroli.
5.2.2. Se introduce în cuva de developare un amestec de benzen-acetonă 95/5 (V/V) până la o înălțime de aproximativ 1 cm. Se poate utiliza în loc un amestec hexan-eter etilic 65/35 (V/V). Se închide cuva folosind un capac corespunzător și se lasă astfel timp de cel puțin o jumătate de oră, în așa fel încât echilibrul lichid/vapori să se stabilizeze. Pe suprafețele interioare ale cuvei se pot fixa benzi de hârtie de filtru care se scufundă în eluant: această precauție permite reducerea cu aproximativ o treime a timpului de migrare a frontului de lichid și obținerea unei eluări mai uniforme a componentelor.
Nota 3: Pentru a avea condiții de eluare perfect reproductibile, amestecul trebuie să fie schimbat la fiecare test.
5.2.3. Se prepară o soluție de aproximativ 5 % de nesaponificabile (5.1.5.) în cloroform și, cu microseringa de 100 μl, se pune pe placa cromatografică (5.2.1) la aproximativ 2 cm de o margine, 0,3 ml din soluția menționată anterior într-o linie continuă, cât mai fină și mai uniformă posibil. În paralel cu linia de depunere, se depun, la una dintre extremitățile plăcii, 2–3 μl de soluție de referință de alcooli alifatici (4.11), în scopul identificării benzii de alcooli alifatici în timpul ultimei developări.
5.2.4. Se pune placa în cuva de developare, preparată conform descrierii de la punctul 5.2.2. Temperatura ambiantă trebuie să fie menținută între 15 și 20 °C. Se închide imediat camera cu capacul și se lasă să elueze până când frontul de solvent ajunge la aproximativ 1 cm de marginea superioară a plăcii. Se scoate apoi placa din cuva de developare și se trece la evaporarea solventului într-un curent de aer cald sau lăsând placa închisă pentru puțin timp.
5.2.5. Se vaporizează placa ușor și uniform cu soluție de dicloro-2′-7′ fluoresceină. Se identifică banda de alcooli alifatici prin alinierea cu pata obținută cu ajutorul soluției de referință; se delimitează cu un creion negru ansamblul benzii de alcooli alifatici și al benzii imediat superioare care corespunde alcoolilor terpenici.
Nota 4: Precizarea făcută de a colecta ansamblul benzii de alcooli alifatici și al benzii de alcooli terpenici este datorată faptului că în aceasta, în condițiile metodei, sunt înglobate cantități semnificative de alcooli alifatici.
5.2.6. Se răzuiește cu o spatulă metalică silicagelul din zona delimitată. Materialul extras, sfărâmat fin, se introduce în pâlnia de filtrare (3.7); se adaugă 10 ml de cloroform cald, se amestecă cu grijă cu o spatulă metalică și se filtrează cu ajutorul vidului, apoi se colectează filtratul în balonul (3.8) conectat la pâlnia de filtrare.
Se spală reziduul din balon de trei ori cu eter etilic (aproximativ 10 ml de fiecare dată) și se colectează filtratul în același fel în balonul conectat la pâlnia de filtrare. Se evaporă filtratul până ajunge la un volum de aproximativ 4–5 ml, se transvazează soluția reziduală în eprubeta de 10 ml (3.9) cântărită în prealabil, se usucă prin încălzire ușoară într-un ușor curent de azot, se continuă cu câteva picături de acetonă, se usucă din nou, se pune timp de aproximativ 10 minute în etuvă la 105 °C, apoi se lasă să se răcească în exsicator și se cântărește.
Reziduul din eprubetă este alcătuit din fracțiunea alcoolilor.
Prepararea trimetilsilileterilor
5.3.1. Se adaugă, în eprubeta ce conține fracțiunea alcoolilor, reactivul de sililare, constituit dintr-un amestec de piridină-hexametildisilazan-trimetilclorosilan 9/3/1 (V/V/V) (nota 5) într-o proporție de 50 μl pe miligram de alcooli alifatici, evitând toate absorbțiile de umiditate (nota 6).
Nota 5: În comerț există soluții gata preparate: în plus, alți reactivi silanizanți, precum, de exemplu, bi-trimetilsililtrifluorescentamida + 1 % trimetilclorosilan care trebuie să se dilueze cu un volum egal de piridină anhidră.
5.3.2. Se închide eprubeta, se agită cu grijă (fără a o răsturna) până la solubilizarea completă a alcoolilor alifatici. Se lasă în repaus minimum 15 minute la temperatura camerei, apoi se centrifughează timp de câteva minute: soluția limpede este gata pentru analiza prin cromatografie în faza gazoasă.
Nota 6: Eventuala formare a unei opalescențe ușoare este normală și nu provoacă nici o interferență. Formarea unei floculații albe sau apariția unei colorații roz indică prezența umidității sau alterarea reactivului. În acest caz, testul trebuie să fie repetat.
Analiza prin cromatografie în faza gazoasă.
Operațiuni preliminare, condiționarea coloanei
5.4.1.1. Se instalează coloana în cromatograful în fază gazoasă, legând extremitatea de intrare la evaporatorul conectat la sistemul de fracționare și extremitatea de ieșire la detector.
Se efectuează controalele generale ale complexului de cromatografie în faza gazoasă (etanșeitatea circuitului de gaz, eficacitatea detectorului, eficacitatea sistemului de fracționare și a sistemului de înregistrare etc.)
5.4.1.2. În cazul în care se utilizează coloana pentru prima dată, se recomandă să se efectueze condiționarea sa. Se trece un ușor flux de gaz de-a lungul acestei coloane, apoi se conectează complexul de cromatografie în fază gazoasă și se începe o încălzire treptată până când se atinge o temperatură cu cel puțin 20 °C mai mare decât cea de funcționare (nota 7). Se menține această temperatură timp de minimum 2 ore, apoi se pune complexul în condiții de funcționare (reglarea fluxului gazos și a separării, aprinderea flăcării, joncțiunea cu aparatul de înregistrare electronic, reglarea temperaturii camerei pentru coloană, a detectorului și a inițiatorului etc.) și se înregistrează semnalul la o sensibilitate de cel puțin două ori mai mare decât cea prevăzută pentru executarea analizei. Traseul liniei de bază obținute trebuie să fie liniar, fără valori de vârf, de orice natură, și nu trebuie să prezinte abateri.
O abatere rectilinie negativă indică o etanșeitate imperfectă a conexiunilor coloanei, o abatere pozitivă indică o condiționare insuficientă a coloanei.
Nota 7: Temperatura de condiționare trebuie să fie întotdeauna mai mică cu cel puțin 20 °C decât temperatura maximă prevăzută pentru lichidul de repartizare folosit.
Alegerea condițiilor de lucru
5.4.2.1. Condițiile de lucru maxime sunt următoarele:
|
— |
temperatura coloanei: început izoterm 8 minute la 180 °C, apoi program de 5 °C pe minut până la 260 °C, apoi încă 15 minute la 260 °C; |
|
— |
temperatura evaporatorului: 280 °C; |
|
— |
temperatura detectorului: 290 °C; |
|
— |
viteza liniară a gazului de transport: heliu, 20–35 cm pe secundă; hidrogen, 30–50 cm pe secundă; |
|
— |
raportul de separare: de la 1/50 la 1/100; |
|
— |
sensibilitatea instrumentală: de 4–16 ori atenuarea minimă; |
|
— |
sensibilitatea de înregistrare: 1–2 milivolți din limita scării; |
|
— |
viteza hârtiei: 30–60 cm pe oră; |
|
— |
cantitatea de substanță injectată: 0,5–1 μl de soluție de TMSE |
Aceste condiții pot fi modificate în funcție de caracteristicile coloanei și ale cromatografului în fază gazoasă, astfel încât să se obțină cromatograme care îndeplinesc condițiile următoare:
|
— |
timpul de retenție a alcoolului în C26 trebuie să fie de 18 ± 5 minute; |
|
— |
punctul maxim al alcoolului în C22 trebuie să fie 80 ± 20 % din valoarea maximă admisibilă de citire, iar pentru uleiul de semințe 40 ± 20 % din valoarea maximă admisibilă de citire. |
5.4.2.2. Pentru a verifica condițiile impuse anterior, se efectuează injecții repetate cu mostre de amestecuri de TMSE de alcooli și se corectează condițiile de operare până la obținerea celor mai bune rezultate.
5.4.2.3. Parametri de integrare ai valorilor de vârf trebuie să fie astfel impuși încât să se obțină valori corecte pentru valorile de vârf care sunt luate în considerare.
Efectuarea analizei
5.4.3.1. Se prelevează, cu microseringa de 10 μl, 1 μl de hexan, se aspiră 0,5 μl de aer și succesiv 0,5 și 1 μl din soluția de mostră; se trage pistonul seringii în așa fel încât acul să fie gol.
Se introduce acul prin membrana complexului de injecție și după 1–2 secunde se injectează rapid și apoi se extrage acul lent, după aproximativ 5 secunde.
5.4.3.2. Se efectuează înregistrarea până la eluarea completă a TMSE a alcoolilor alifatici prezenți. Linia de bază trebuie să corespundă întotdeauna condițiilor impuse (5.4.1.2).
5.4.4. Identificarea valorilor de vârf
Identificarea valorilor de vârf unice se efectuează pe baza timpilor de retenție și prin comparație cu amestecul de TMSE de alcooli alifatici, analizați în aceleași condiții.
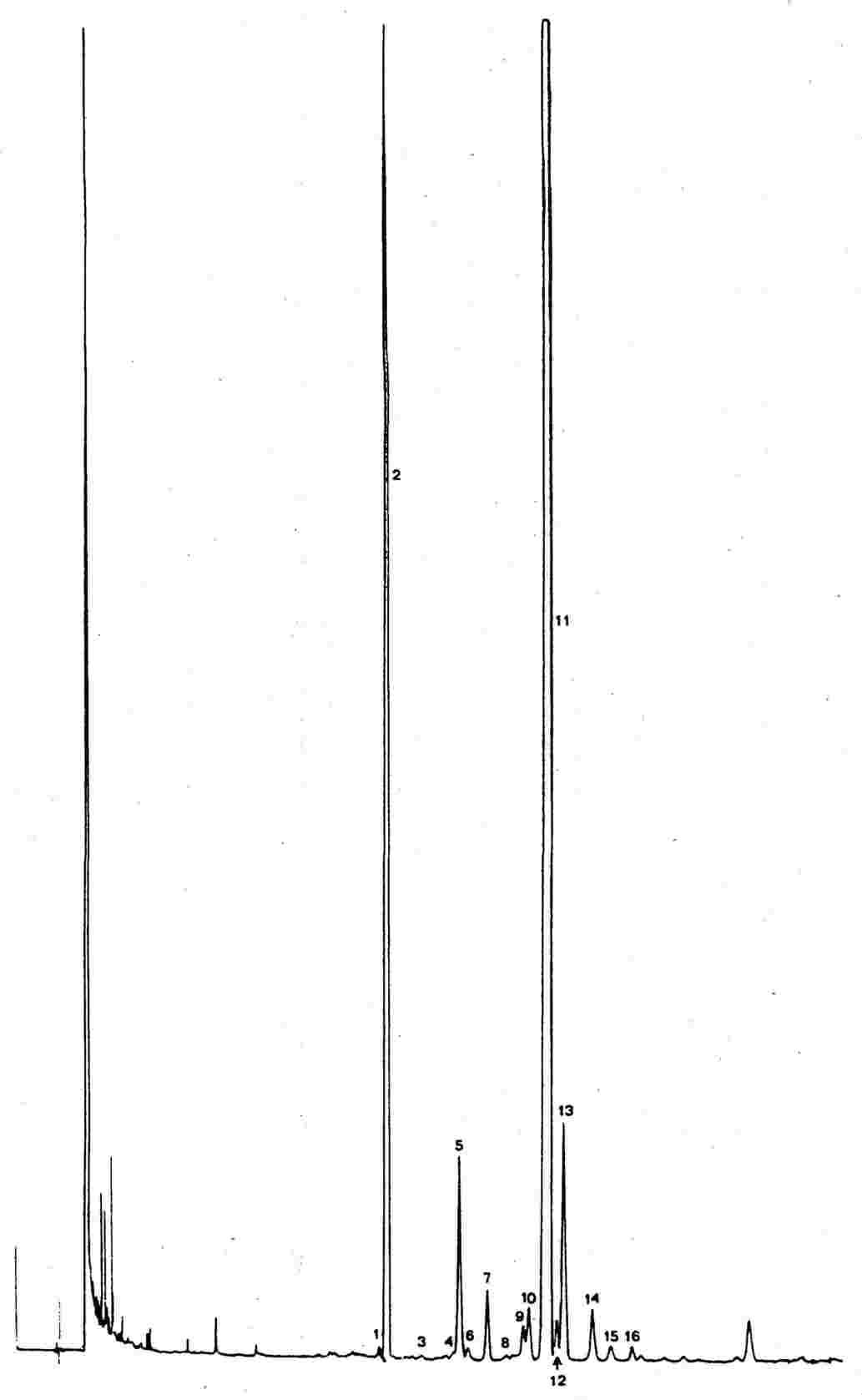
Figura 1 prezintă o cromatogramă de fracțiune alcoolică a unui ulei de măsline virgin.
Evaluarea cantitativă
5.4.5.1. Se trece, cu ajutorul integratorului, la calcularea ariei valorilor de vârf ale 1-eicosanolului și ale alcoolilor alifatici de la C22 la C28.
5.4.5.2. Se calculează conținutul în fiecare alcool alifatic simplu, în miligrame la 100 g de materie grasă, după cum urmează:
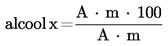 ,
,
în care:
|
Ax |
= |
aria valorii de vârf a alcoolilor x, în milimetri pătrați; |
|
As |
= |
aria valorii de vârf a 1-eicosanolului, în milimetri pătrați; |
|
ms |
= |
masa 1-eicosanolului adăugat, în miligrame; |
|
m |
= |
masa mostrei prelevate pentru determinare, în grame. |
6. EXPRIMAREA REZULTATELOR
Se raportează conținutul de alcooli alifatici în miligrame la 100 g de substanță grasă și suma lor ca „alcooli alifatici totali”.
APENDICE
Determinarea vitezei liniare a gazului
În cromatograful în fază gazoasă, reglat la condiții de operare normale, se injectează 1–3 μl de metan (sau propan) și se cronometrează timpul folosit de gaz pentru a parcurge coloana, între momentul de injecție și cel de ieșire din valoarea de vârf (tM).
Viteza liniară în cm pe secundă este dată de L/tM, unde L este lungimea coloanei în cm și tM timpul cronometrat în secunde.

|
1 |
= |
Eicosanol |
|
2 |
= |
Docosanol |
|
3 |
= |
Tricosanol |
|
4 |
= |
Tetracosanol |
|
5 |
= |
Pentacosanol |
|
6 |
= |
Hexacosanol |
|
7 |
= |
Heptacosanol |
|
8 |
= |
Octacosanol |
ANEXA V
DETERMINAREA COMPOZIȚIEI ȘI A CONȚINUTULUI DE STEROLI CU AJUTORUL CROMATOGRAFIEI ÎN FAZĂ GAZOASĂ CU COLOANĂ CAPILARĂ
1. OBIECT
Metoda descrie procedeul de determinare a conținutului de steroli, simpli și totali, al materiilor grase.
2. PRINCIPIUL METODEI
Materia grasă, la care s-a adăugat α-colestanol ca etalon intern, este saponificată cu hidroxid de potasiu soluție în etanol, apoi se extrage nesaponificabilul cu eter etilic.
Fracțiunea sterolică se separă de extractul nesaponificabil prin cromatografie pe placă de silicagel bazic; sterolii recuperați din silicagel sunt transformați în trimetilsilileteri și analizați prin cromatografie în fază gazoasă în coloană capilară.
3. APARATURĂ
3.1. Balon de 250 ml echipat cu un condensator cu reflux cu racordurile din sticlă rodată.
3.2. Pâlnie de decantare de 500 ml.
3.3. Baloane de 250 ml.
3.4. Echipament complet pentru cromatografie în fază solidă cu plăci de sticlă de 20×20 cm.
3.5. Lampă cu lumină ultravioletă cu lungime de undă de 366 sau 254 nm.
3.6. Microseringi de 100 și 500 μl.
3.7. Pâlnie cilindrică de filtrare cu filtru poros G 3 (porozitate 15–40 μm) cu un diametru de aproximativ 2 cm și înălțime de 5 cm, cu racord adaptat pentru filtrarea în vid și un racord tată din sticlă rodată 12/21.
3.8. Balon cu vid de 50 ml cu un racord mamă din sticlă rodată 12/21 adaptabil la pâlnia de filtrare (3.7).
3.9. Eprubetă cu fund conic de 10 ml, prevăzută cu dop ermetic.
3.10. Cromatograf în fază gazoasă adaptat la funcționarea cu coloană capilară, dotat cu un sistem de separare, alcătuit din:
3.10.1. Incintă termostatată pentru coloană, care permite menținerea temperaturii dorite cu o precizie de circa 1 °C.
3.10.2. Ansamblu de vaporizare termoreglabil cu element vaporizator din sticlă tratată cu persilan.
3.10.3. Detector cu ionizare în flacără și convertizor-amplificator.
3.10.4. Aparat de înregistrare-integrator adaptat la funcționarea cu un convertizor-amplificator.
3.11. Coloană capilară de sticlă sau siliciu topit cu o lungime de 20–30 m și un diametru interior de 0,25–0,32 mm, acoperită în interior cu lichid SE-52 sau SE-54 sau echivalent, cu o grosime cuprinsă între 0,10 și 0,30 μm.
3.12. Microseringă pentru cromatografie în fază gazoasă de 10 μl cu ac cementat.
4. REACTIVI
4.1. Hidroxid de potasiu, soluție etanolică până la aproximativ 2 N: se dizolvă, prin răcire, 130 g de hidroxid de potasiu (titru minim 85 %) în 200 ml de apă distilată, apoi se completează până la un litru cu etanol. Soluția se păstrează în vase de sticlă opacă bine astupate (etanol 95 % V%V).
4.2. Eter etilic pur pentru analize.
4.3. Sulfat de sodiu anhidru pur, pentru analize.
4.4. Plăci de sticlă acoperite cu silicagel fără indicator de fluorescență, cu o grosime de 0,25 mm (acestea sunt disponibile în comerț gata pentru utilizare).
4.5. Hidroxid de potasiu, soluție etanolică până la aproximativ 2 N: se dizolvă 13 g de hidroxid de potasiu în 20 ml de apă distilată, apoi se completează până la un litru cu etanol.
4.6. Benzen, pentru cromatografie (5.2.2).
4.7. Acetonă, pentru cromatografie (5.2.2).
4.8. Hexan pentru cromatografie (5.2.2).
4.9. Eter etilic, pentru cromatografie (5.2.2).
4.10. Cloroform pur, de calitate analitică.
4.11. Soluție de răcire pentru cromatografie pe placă: colesterol sau fitosterol, soluție de 0,5 % în cloroform.
4.12. Dicloro 2′-7′ fluoresceină, soluție etanolică de 0,2 %. Aceasta este făcută ușor bazică prin adăugarea de câteva picături dintr-o soluție alcoolică 2 N de hidroxid de potasiu.
4.13. Piridină anhidră, pentru cromatografie.
4.14. Hexametildisilazan.
4.15. Trimetilclorosilan.
4.16. Soluție etalon de trimetilsilileter de steroli: se prepară în momentul folosirii din sterolii extrași din uleiurile care le conțin.
4.17. α-colestanol soluție de 0,2 % (m/V) în cloroform (etalon intern).
4.18. Gaz vector: hidrogen sau heliu pur, pentru cromatografie în fază gazoasă.
4.19. Gaz auxiliar:
|
— |
hidrogen sau heliu pur, |
|
— |
pentru cromatografie în fază gazoasă. |
5. MOD DE LUCRU
Prepararea nesaponificabilului
5.1.1. În balonul de 250 ml se introduce, cu ajutorul microseringii de 500 μl, un volum de soluție de α-colestanol de 0,2 % în cloroform (4.17) care conține o cantitate de α-colestanol ce corespunde la aproximativ 10 % steroli conținuți în partea alicotă din mostra de prelevat pentru determinare. De exemplu, pentru 5 g de mostră trebuie să se adauge 500 μg de soluție de α-colestan de 0,2 %, în cazul unei mostre de ulei de măsline și 1 500 μl, în cazul uleiului de semințe sau uleiului din resturi de măsline.
Se evaporă într-un curent de azot până la uscare, apoi se cântăresc exact 5 g de mostră uscată și filtrată în același balon.
În cazul uleiurilor și grăsimilor animale sau vegetale care conțin cantități considerabile de colesterol, poate fi prezentă o valoare de vârf cu un timp de retenție identic cu cel al colestanolului. În astfel de cazuri, trebuie să se analizeze fracțiunea sterolică în dupticat, cu și fără etalon intern.
5.1.2. Se adaugă 50 ml de soluție etanolică de hidroxid de potasiu la 0,2 N, se pune în funcțiune condensatorul cu reflux, se încălzește în baie de aburi până la o ușoară fierbere menținând o agitare energică până la producerea saponificării (soluția devine limpede). Se continuă să se încălzească timp de 20 minute, apoi se adaugă 50 ml de apă distilată provenită din partea de sus a condensatorului, se deconectează condensatorul și se răcește balonul la aproximativ 30 °C.
5.1.3. Se transvazează cantitativ conținutul balonului, într-o pâlnie de decantare de 500 ml, adăugând apă distilată de mai multe ori, folosind în total aproximativ 50 ml. Se adaugă aproximativ 80 ml de eter etilic, se agită energic timp de aproximativ 30 de secunde și se lasă să se facă separarea (nota 1).
Se separă faza apoasă inferioară colectând-o în altă pâlnie de decantare. Se fac încă două extracții pe fază apoasă, după aceleași modalități, utilizând de fiecare dată 60–70 ml de eter etilic.
Nota 1: Eventualele emulsii pot fi eliminate adăugând cu o pisetă o cantitate mică de alcool etilic sau metilic.
5.1.4. Se colectează extractele eterice într-o singură pâlnie de decantare și se spală cu apă distilată (50 ml de fiecare dată) până la reacția neutră a apei de spălare.
Se elimină apa de spălare, se usucă cu sulfat de sodiu anhidru și se filtrează, pe sulfat de sodiu anhidru, într-un balon de 250 ml cântărit în prealabil, spălând pâlnia și filtrul cu mici cantități de eter etilic.
5.1.5. Se distilează eterul până când rămân numai cantități mici, apoi se usucă sub un ușor vid sau într-un curent de azot, se continuă uscarea în etuvă la 100 °C timp de aproximativ un sfert de oră și se cântărește după răcirea într-un exsicator.
Separarea fracțiunii sterolice.
5.2.1. Prepararea plăcilor bazice: se scufundă complet plăcile de silicagel (4.4) în soluție etanolică 0,2 N de hidroxid de potasiu (4.5) timp de 10 secunde, se lasă apoi să acționeze închise, sub hotă, timp de două ore și se pun, în final, în etuvă la 100 °C timp de o oră.
Se scoate din etuvă și se păstrează într-un exsicator cu clorură de calciu până în momentul folosirii (plăcile astfel tratate trebuie să fie folosite în termen de cincisprezece zile).
Nota 2:
Folosirea plăcilor bazice de silicagel pentru separarea fracțiunii sterolice elimină necesitatea tratamentului nesaponificabilului cu alumină. În acest mod, toți compușii de natură acidă (acizi grași și alții) sunt reținuți pe linia de depunere. Se obține astfel banda de steroli separată net de banda de alcooli alifatici și terpenici.
5.2.2. Se introduce în cuva de developare un amestec benzen-acetonă 95/5 (V/V) până la o înălțime de aproximativ 1 cm. Se poate utiliza în loc un amestec hexan-eter etilic 55/35 (V/V). Se închide cuva folosind un capac corespunzător și se lasă astfel timp de cel puțin o jumătate de oră, în așa fel încât echilibrul lichid/vapori să se stabilizeze. Pe suprafețele interioare ale cuvei se pot fixa benzi de hârtie de filtru care se cufundă în eluant: această precauție permite reducerea cu aproximativ o treime a timpului de migrare a frontului de lichid și obținerea unei eluări mai uniforme a componentelor.
Nota 3: Pentru a avea condiții de eluare perfect reproductibile, amestecul trebuie să fie schimbat la fiecare test.
5.2.3. Se prepară o soluție de nesaponificabil (5.1.5) de aproximativ 5 % în cloroform și, cu microseringa de 100 μl, se depune pe placa cromatografică (5.2.1), la aproximativ 2 cm de o margine, 0,3 ml din soluția menționată anterior într-o linie continuă, cât mai fină și mai uniformă posibil. În paralel cu linia de depozit, se depun, la una dintre extremitățile plăcii, 2–3 μl de soluție de referință de steroli (4.11), în scopul identificării benzii de steroli în timpul ultimei developări.
5.2.4. Se pune placa în cuva de developare, preparată conform descrierii de la punctul 5.2.2. Temperatura ambiantă trebuie să fie menținută între 15 și 20 °C. Se închide imediat camera cu capacul și se lasă să elueze până când frontul de solvent ajunge la aproximativ 1 cm de marginea superioară a plăcii. Se scoate apoi placa din cuva de developare și se trece la evaporarea solventului într-un curent de aer cald sau prin menținerea plăcii scurt timp sub hotă.
5.2.5. Se vaporizează placa ușor și uniform cu soluție de dicloro-22-72 fluoresceină. Se identifică banda de steroli prin alinierea cu pata obținută cu soluția de referință; se delimitează banda cu un creion negru de-a lungul marginilor de fluorescență.
5.2.6. Se răzuiește silicagelul cu o spatulă metalică în zona delimitată. Materialul extras, sfărâmat fin, se introduce în pâlnia de filtrare (3.7); se adaugă 10 ml de cloroform cald, se amestecă cu grijă cu o spatulă metalică și se filtrează cu ajutorul vidului, apoi se colectează filtratul în balonul (3.8) conectat la pâlnia de filtrare.
Se spală reziduul în balon de trei ori cu eter etilic (aproximativ 10 ml de fiecare dată) și se colectează filtratul în balonul conectat la pâlnia de filtrare. Se evaporă filtratul până când ajunge la un volum de aproximativ 4–5 ml, se transvazează soluția reziduală în eprubeta de 10 ml (3.9) cântărită în prealabil, se usucă încălzind-o ușor într-un ușor curent de azot, se continuă cu câteva picături de acetonă, uscând-o din nou, se pune timp de aproximativ 10 minute în etuvă la 105 °C, apoi se lasă să se răcească în exsicator.
Reziduul din eprubetă este alcătuit din fracțiunea sterolică.
Prepararea trimetilsilileterilor
5.3.1. Se adaugă, în tubul care conține fracțiunea sterolică, reactivul de sililare, constituit dintr-un amestec de piridină-hexametildisilazan-trimetilclorosilan 9/3/1 (V/V/V) (nota 4) într-o proporție de 50 μl pe miligram de steroli, evitând toate absorbțiile de umiditate (nota 5).
Nota 4: În comerț există soluții gata pentru folosire: în plus, alți reactivi silanizanți, precum, de exemplu, bi-trimetilsililtrifluoracentamida + 1 % trimetilclorosilan care se diluează cu un volum egal de piridină anhidră.
5.3.2. Se închide eprubeta, se agită cu grijă (fără a o răsturna) până la solubilizarea completă a sterolilor. Se lasă în repaus minimum 15 minute la temperatura ambiantă, apoi se centrifughează timp de câteva minute: soluția limpede este gata pentru analiza prin cromatografie în faza gazoasă.
Nota 5: Eventuala formare a unei opalescențe ușoare este normală și nu provoacă nici un deranjament. Formarea unei floculații albe sau apariția unei colorații roz sunt indici de prezență a umidității sau de alterare a reactivului. În acest caz, testul trebuie repetat.
Analiza prin cromatografie în faza gazoasă
Operațiuni preliminare, condiționarea coloanei
5.4.1.1. Se instalează coloana în cromatograful în fază gazoasă, legând extremitatea de intrare la evaporatorul conectat la sistemul de separare și extremitatea de ieșire la detector.
Se efectuează controalele generale ale complexului de cromatografie în faza gazoasă (etanșeitatea circuitului de gaz, eficacitatea detectorului, eficacitatea sistemului de separare și a sistemului de înregistrare etc.).
5.4.1.2. În cazul în care se utilizează coloana pentru prima dată, se recomandă să se efectueze condiționarea sa. Se trece un ușor flux de gaz de-a lungul acestei coloane, apoi se conectează complexul de cromatografie în fază gazoasă și se începe o încălzire treptată până când se atinge o temperatură cu cel puțin 20 °C mai mare decât cea de funcționare (nota 6). Se menține această temperatură timp de minimum 2 ore, apoi se asigură condițiile de funcționare pentru complex (reglarea fluxului gazos și a fracționării, aprinderea flăcării, joncțiunea cu aparatul de înregistrare electronic, reglarea temperaturii camerei pentru coloană, a detectorului și inițiatorului etc.) și se înregistrează semnalul la o sensibilitate de cel puțin două ori mai mare decât cea prevăzută pentru executarea analizelor. Traseul liniei de bază obținute trebuie să fie liniar, fără valori de vârf de orice natură și nu trebuie să prezinte abateri.
O abatere rectilinie negativă indică o etanșeitate imperfectă a conexiunilor coloanei, o abatere pozitivă indică o condiționare insuficientă a coloanei.
Nota 6: Temperatura de condiționare trebuie să fie totdeauna cu cel puțin cu 20 °C mai mică decât temperatura maximă prevăzută pentru lichidul de repartizare folosit.
Alegerea condițiilor de lucru
5.4.2.1. Condițiile de lucru maxime sunt următoarele:
|
— |
temperatura coloanei: 260 °C ± 5 °C; |
|
— |
temperatura evaporatorului: 280 °C; |
|
— |
temperatura detectorului: 290 °C; |
|
— |
viteza liniară a gazului de transport: heliu, 20–35 cm/s; hidrogen, 30–50 cm/s; |
|
— |
raportul de separare: de la 1/50 la 1/100; |
|
— |
sensibilitatea instrumentală: de la 4 la 16 ori atenuarea minimă; |
|
— |
sensibilitatea de înregistrare: 1–2 mV din limita scării; |
|
— |
viteza hârtiei: 30–60 cm/h; |
|
— |
cantitatea de substanță injectată: 0,5–1 μl de soluție de TMSE. |
Aceste condiții pot fi modificate în funcție de caracteristicile coloanei și ale cromatografului în fază gazoasă pentru a se obține cromatograme care îndeplinesc condițiile următoare:
|
— |
timpul de retenție a β-sitosterolului trebuie să fie de 20 ± 5 minute; |
|
— |
valoarea de vârf pentru campesterol trebuie să fie: pentru uleiul de măsline (conținut mediu 3 %) 15 ± 5 % din limita scării, iar pentru uleiul de soia (conținut mediu 20 %) 80 ± 10 % din limita scării; |
|
— |
trebuie să se efectueze separarea tuturor sterolilor prezenți; celelalte valori de vârf separate să fie, de asemenea, complet rezolvate, ceea ce înseamnă că traseul valorii de vârf trebuie să se unească cu linia de bază înaintea de ieșirea din valoarea de vârf următoare. Cu toate acestea, o rezolvare incompletă este tolerată cu condiția ca aceasta să fie cuantificabilă după perpendiculara la valoarea de vârf la TRR 1,02. |
Efectuarea analizei
5.4.3.1. Se prelevează cu microseringa de 10 μl, 1 μl de hexan, se aspiră 0,5 μl de aer și succesiv 0,5 și 1 μl de soluție din mostră; se trage pistonul seringii în așa fel încât acul să fie gol. Se introduce acul prin membrana complexului de injecție și după 1–2 secunde se injectează rapid și apoi se extrage lent acul, după aproximativ 5 secunde.
5.4.3.2. Se procedează la înregistrare până la eluarea completă a TMSE a sterolilor prezenți.
Linia de bază trebuie să corespundă întotdeauna cu calitățile impuse (5.4.1.2).
5.4.4. Identificarea valorilor de vârf
Identificarea valorilor de vârf unice se efectuează pe baza timpilor de retenție și prin comparație cu amestecul de TMSE de steroli analizați în aceleași condiții.
Sterolii sunt eluați în ordinea următoare: colesterol, brassicasterol, 24-metilen-colesterol, campesterol, campestanol, stigmasterol, Δ 7-campesterol, Δ 5,23 stigmastadienol, clerosterol, β-sitosterol, sitostanol, Δ 5-avenasterol, 5,24 stigmastadienol, Δ 7-stigmastenol, Δ 7-avenasterol.
În tabelul 1 sunt prezentați timpii de retenție pentru sitosterol, pentru coloanele SE 52 și SE 54.
Figurile 1și 2 ilustrează cromatogramele tipice ale unor uleiuri.
Evaluarea cantitativă
5.4.5.1. Se trece, cu ajutorul integratorului, la calculul ariei valorilor de vârf ale α-colestanol și ale sterolilor. Nu se iau în considerare valorile de vârf eventuale de componentelor care nu sunt cuprinse în cele enumerate în tabelul 1. Coeficientul de răspuns GLC al α-colestanolului se consideră a fi egal cu 1.
5.4.5.2. Se calculează conținutul în fiecare sterol simplu, în mg/100 g de materie grasă, după cum urmează:
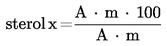 ,
,
în care:
|
Ax |
= |
aria valorii de vârf a sterolului x, în milimetri pătrați; |
|
As |
= |
aria valorii de vârf a α-colestanolului, în milimetri pătrați; |
|
ms |
= |
masa α-colestanolului adăugat, în miligrame; |
|
m |
= |
masa mostrei prelevate pentru determinare, în grame. |
6. EXPRIMAREA REZULTATELOR
6.1. Se raportează conținutul fiecărui sterol în miligrame la 100 g de substanță grasă și suma lor ca „steroli totali”.
6.2. Se calculează procentul fiecărui sterol pornind de la raportul dintre aria valorii de vârf corespondente și suma ariilor valorilor de vârf ale sterolilor.
 ,
,
în care:
Ax= aria valorii de vârf x,
ΣΑ= suma ariilor tuturor valorilor de vârf.
APENDICE
Determinarea vitezei liniare a gazului
În cromatograful în fază gazoasă, reglat în condiții de operare normale, se injectează 1–3 μl de metan (sau propan) și se cronometrează timpul folosit de gaz pentru a parcurge coloana, între momentul de injecție și cel de ieșire din valoarea de vârf (tM).
Viteza liniară în cm pe secundă este dată de L/tM, unde L este lungimea coloanei în cm și tM timpul cronometrat în secunde.
Tabelul 1
Timpii de retenție relativi ai sterolilor
|
Valoare de vârf |
Identificare |
Timpi de retenție relativi |
||
|
Coloana SE 54 |
Coloana SE 52 |
|||
|
1 |
Colesterol |
Δ-5-colesten-3β |
0,67 |
0,63 |
|
2 |
colestanol |
5α-colestan |
0,68 |
0,64 |
|
3 |
brasicasterol |
[24S]-24-metil-Δ-5,22-colestadienă-3β |
0,73 |
0,71 |
|
4 |
24-metilen-colesterol |
24-metilen-Δ-5,24-colestadienă-3β |
0,82 |
0,80 |
|
5 |
campesterol |
[24R]-24-metil-Δ-5-colesten-3β |
0,83 |
0,81 |
|
6 |
campestanol |
[24R]-24-metil-colestan-3β |
0,85 |
0,82 |
|
7 |
stigmasterol |
[24S]-24-etil-Δ-5,22-colestadienă-3β |
0,88 |
0,87 |
|
8 |
Δ-7-campesterol |
[24R]-24-metil-Δ-7-colesten-3β |
0,93 |
0,92 |
|
9 |
Δ-5,23-stigmastadienol |
[24S,R]-24-etil-Δ-5,23-colestadienă-3β |
0,95 |
0,95 |
|
10 |
clerosterol |
[24S]-24-etil-Δ-5,25-colestenă-3β |
0,96 |
0,96 |
|
11 |
β-sitosterol |
[24R]-24-etil-Δ-5-colestenă-3β |
1,00 |
1,00 |
|
12 |
sitostanol |
24-etil-colestan-3β |
1,02 |
1,02 |
|
13 |
Δ-5-avenasterol |
[24Z]-24-etiliden-5-colesten-3β |
1,03 |
1,03 |
|
14 |
Δ-5,24-stigmastadienol |
[24S,R]-24-etil-Δ-5,24-colestadienă-3β |
1,08 |
1,08 |
|
15 |
Δ-7-stigmastenol |
[24S,R]-24-etil-Δ-7,24-colesten-3β |
1,12 |
1,12 |
|
16 |
Δ-7-avenesterol |
[24Z]-24-etiliden-Δ-7-colesten-3β |
1,16 |
1,16 |
Figura 1
Cromatografie în fază gazoasă a fracțiunii sterolice a unui ulei de măsline brut

Figura 2
Cromatografie în fază gazoasă a fracțiunii sterolice a unui ulei de măsline rafinat
ANEXA VI
DETERMINAREA CONȚINUTULUI DE ERITRODIOL ȘI DE UVAOL
INTRODUCERE
Eritrodiolul (termen generic care desemnează în mod convențional ansamblul de dioli eritrodiol și uvaol) este un element constitutiv al nesaponificabilului care se găsește în anumite tipuri de materii grase. Dozarea sa poate să servească la verificarea prezenței uleiului de măsline de extracție, concentrația sa fiind net mai ridicată decât în celelalte uleiuri (uleiuri de măsline obținute prin presare, uleiuri de sâmburi de struguri).
1. OBIECT
Metoda descrie procedeul de determinare a conținutului de eritrodiol din materiile grase.
2. PRINCIPIUL METODEI
Substanța grasă este saponificată cu soluție de hidroxid de potasiu în etanol. Se extrage apoi nesaponificabilul cu eter etilic, purificat prin trecerea pe o coloană de alumină și fracționat prin cromatografie în strat subțire pe plăcile de silicagel. În acest mod, benzile de fracțiuni sterolică și eritrodiolică sunt izolate.
Sterolii și eritrodiolul recuperați pe placă sunt transformați în trimetilsilileteri și analizați prin cromatografie în fază gazoasă.
Rezultatul se exprimă în procente de eritrodiol în raport cu ansamblul eritrodioli + steroli.
3. APARATURĂ
3.1. Aparatura descrisă în anexa V (determinarea conținutului de steroli).
4. REACTIVI
4.1. Reactivi enumerați în anexa V (determinarea conținutului de steroli).
4.2. Soluție de referință de eritrodiol de 0,5 % în cloroform.
5. MODUL DE LUCRU
5.1. Prepararea nesaponificabilului
Se procedează conform indicațiilor de la punctul 5.1.2 din anexa V.
5.2. Separarea eritrodiolului și sterolilor
5.2.1. A se vedea punctul 5.2.1 din metoda descrisă în anexa V.
5.2.2. A se vedea punctul 5.2.2 de la aceeași metodă.
5.2.3. Se prepară o soluție de nesaponificabil (de 5 %) în cloroform.
Cu microseringa de 0,1 ml, se depune pe o placă cromatografică, la aproximativ 1,5 cm de marginea inferioară, 0,3 ml din soluția menționată anterior, într-o linie foarte fină cât mai uniform posibil.
La o extremitate a plăcii se depun, pentru referință, câțiva microlitri de soluție de colesterol și eritrodiol.
5.2.4. Se pune placa în cuva de developare pregătită conform indicațiilor de la punctul 5.2.1. Temperatura ambiantă trebuie să fie aproximativ 20 °C. Se închide imediat cu capacul și se eluează până când nivelul solventului ajunge la aproximativ 1 cm de marginea superioară a plăcii. Se ia apoi placa din cuva de developare și se evaporă solventul într-un curent de aer cald.
5.2.5. Se vaporizează uniform soluția de dicloro-2′ 7′ fluoresceină pe placă. Se examinează aceasta din urmă la lumină ultravioletă, se identifică benzile de steroli și eritrodiol prin aliniere cu elementele de referință, apoi se delimitează cu un vârf ascuțit ușor în afara marginilor de fluorescență.
5.2.6. Cu o spatulă metalică, se curăță silicagelul cuprins în zonele delimitate. Se introduce materialul scos de pe placă într-un balon de 50 ml. Se adaugă 15 ml de cloroform cald, se agită bine și se filtrează într-un balon cu filtru poros transferând silicagelul pe filtru. Se spală de trei ori cu cloroform cald (aproximativ 10 ml de fiecare dată) și se colectează filtratul într-un balon de 100 ml. Se evaporă până la obținerea unui volum de 4–5 ml, se transvazează într-o eprubetă de centrifugare cu fund conic de 10 ml cântărit în prealabil, se usucă încălzind ușor într-un curent de azot, apoi se cântărește.
5.3. Prepararea trimetilsilileterilor
Se procedează conform indicațiilor de la punctul 5.3 din metoda descrisă în anexa V.
5.4. Analiza prin cromatografie în fază gazoasă
Se procedează conform indicațiilor de la punctul 5.4 de la aceeași metodă. Analiza prin cromatografie în fază gazoasă trebuie să fie realizată în condiții care să permită respectarea cerințelor de analiză a sterolilor și de separare a TMSE, a eritrodiolului și a uvaolului.
După injectarea mostrei, se lasă hârtia să se deruleze până la eluarea completă a sterolilor prezenți, a eritrodiolului și a uvaolului. Se identifică apoi valorile de vârf (timpii de reținere relativi ai eritrodiolului și uvaolului, în raport cu β-sitosterolul, sunt de aproximativ 1,4, respectiv 1,55). Se calculează apoi ariile conform indicațiilor pentru steroli.
6. EXPRIMAREA REZULTATELOR
 ,
,
în care:
|
A1 |
= |
aria valorii de vârf a eritrodiolului, în milimetri pătrați; |
|
A2 |
= |
aria valorii de vârf a uvaolului, în milimetri pătrați; |
|
ΣΑsteroli |
= |
suma ariilor sterolilor prezenți, în milimetri pătrați. |
Rezultatul se exprimă cu o zecimală.
ANEXA VII
DETERMINAREA ACIZILOR GRAȘI SATURAȚI ÎN POZIȚIA 2 A TRIGLICERIDEI
1. OBIECT
Prezenta normă descrie o metodă de determinare a compoziției fracțiunii acizilor grași ai unui ulei sau ai unei materii grase esterificate în poziția 2 (sau poziția internă) a glicerolului.
2. DOMENIUL DE APLICARE
Prezenta normă se aplică uleiurilor și materiilor grase care au un punct de topire sub 45 °C datorită caracteristicilor acțiunii lipazei pancreatice.
Aceasta nu se aplică fără rezerve la uleiurile și materiile grase care conțin cantități importante de acizi grași cu un număr de atomi de carbon egal sau mai mic de doisprezece (ulei de cocos și de palmier, substanță grasă butilică), de acizi grași foarte nesaturați (cu mai mult de patru legături duble) ce conțin un număr de atomi de carbon egal sau mai mare de douăzeci (uleiuri de pește și de animale marine) sau de acizi grași ce cuprind grupuri oxigenate, altele decât grupul acid.
3. PRINCIPIU
Neutralizarea eventuală a uleiurilor și materiilor grase într-un solvent. Purificarea prin trecerea pe o coloană de alumină. Hidroliza parțială a trigliceridelor prin lipază pancreatică în cursul unui interval de timp determinat. Separarea monogliceridelor formate prin cromatografie în strat subțire și metanoliza acestora. Analiza esterilor metilici prin cromatografie în fază gazoasă/lichidă.
4. APARATURĂ
4.1. Balon de 100 ml.
4.2. Balon de 25 ml cu racord din sticlă rodată.
4.3. Condensator cu aer cu o lungime de un metru, adaptabil la balonul vizat la punctul 4.2.
4.4. Balon conic de 250 ml.
4.5. Pahar de laborator de 50 ml.
4.6. Pâlnie de decantare de 500 ml.
4.7. Coloană de sticlă pentru cromatografie (diametru interior: 13 mm; lungime: 400 mm) echipată cu un disc din sticlă sinterizată și un robinet.
4.8. Eprubetă de centrifugare de 10 ml cu dop din sticlă rodată.
4.9. Biuretă de 5 ml cu gradații de 0,05 ml.
4.10. Seringă hipodermică de 1 ml echipată cu un ac fin.
4.11. Microseringă pentru picături de 3–4 μl.
4.12. Distribuitor pentru cromatografie în strat subțire.
4.13. Plăci de sticlă pentru cromatografie în strat subțire (20 × 20 cm).
4.14. Cuvă de developare din sticlă pentru cromatografie în strat subțire, cu capac din sticlă rodată, potrivit pentru plăci de 20 × 20 cm.
4.15. Vaporizator cromatografic pentru cromatografie în strat subțire.
4.16. Etuvă reglată la 103 ± 2 °C.
4.17. Termostat reglabil între 30 și 45 °C, la aproximativ 0,5 °C.
4.18. Evaporator rotativ.
4.19. Agitator electric vibrant, care permite agitarea energică a eprubetei de centrifugare.
4.20. Lampă cu ultraviolete pentru examinarea plăcilor pentru cromatografie în strat subțire.
Pentru controlul activității lipazei:
4.21. pH-metru
4.22. Agitator cu spirală
4.23. Biuretă de 5 mililitri
4.24. Cronometru.
Pentru prepararea eventuală a lipazei:
4.25. Agitator de laborator potrivit pentru dispersia și amestecul substanțelor eterogene.
5. REACTIVI
5.1. n-hexan sau, în lipsa acestuia, eter de petrol (punct de fierbere 30-50 °C), de calitate cromatografică.
5.2. 2-propanol (sau etanol), 95 °C (V/V), de calitate analitică.
5.3. 2-propanol (sau etanol) în soluție apoasă 1/1.
5.4. Eter dietilic fără peroxizi.
5.5. Acetonă.
5.6. Acid formic de minimum 98 % (m/m).
5.7. Solvent de developare: amestec de n-hexan (5.1), de eter dietilic (5.4) și de acid formic (5.6), conform proporțiilor 70/30/1 (V/V/V).
5.8. Alumină activată pentru cromatografie, neutră, cu grad de activitate Brockmann 1.
5.9. Pudră de siliciu, cu liant, de calitate adecvată pentru cromatografie în strat subțire.
5.10. Lipază pancreatică de calitate adecvată (notele 1 și 2).
5.11. Hidroxid de sodiu în soluție apoasă (120 g/l).
5.12. Acid clorhidric în soluție apoasă (6 N).
5.13. Clorură de calciu (CaCl2) în soluție apoasă (220 g/l).
5.14. Colat de sodiu (calitate enzimatică) în soluție apoasă (1 gram la litru).
5.15. Soluție tampon: soluție apoasă 1 M de tri-hidroximetilaminometan la un pH de 8 prin adăugarea de acid clorhidric (5.12) (control cu potențiometrul).
5.16. Fenolftaleină în soluție (10 g/l) în etanol la 95 % (V/V).
5.17. Dicloro-2′-7′-fluoresceină în soluție (2 g/l) în etanol la 95 % (V/V), ușor alcalinizat prin adăugarea unei picături de soluție de hidroxid de sodiu 1 N la 100 ml.
Pentru controlul activității lipazei:
5.18. Ulei neutralizat
5.19. Hidroxid de sodiu în soluție apoasă 0,1 N
5.20. Colat de sodiu (calitate enzimatică) în soluție apoasă (200 g/l)
5.21. Gumă arabică în soluție apoasă (100 g/l).
6. PREPARAREA MOSTREI
În cazul în care aciditatea mostrei, determinată conform anexei II, este mai mică de 3 %, se purifică direct pe alumină, în conformitate cu indicațiile de la punctul 6.2.
În cazul în care aciditatea mostrei, determinată conform anexei II, este mai mare de 3 %, se neutralizează cu alcalin în prezența unui solvent, în conformitate cu indicațiile de la punctul 6.1, apoi se trece pe alumină, în conformitate cu indicațiile de la punctul 6.2.
6.1. Neutralizarea cu alcalin în prezența unui solvent
Într-o pâlnie de decantare (4.6) se introduc aproximativ 10 g de ulei brut și se adaugă 100 ml de hexan (5.1), 50 ml de 2-propanol (5.2), câteva picături de soluție de fenolftaleină (5.16) și o cantitate de soluție de hidroxid de sodiu (5.11) corespunzătoare conținutului de acizi liberi ai uleiului, majorată cu 0,3 %. Se agită energic timp de un minut, se adaugă 50 ml, se agită din nou și se lasă în repaus.
După separare, se elimină stratul inferior de săpun. Se elimină, de asemenea, toate straturile intermediare (mucilagii, materii insolubile). Se spală soluția de hexan și de ulei neutralizat cu mai multe doze de 25–30 ml de soluție de 2-propanol (5.3) până când dispare culoarea roz a fenolftaleinei.
Se elimină cea mai mare parte de hexan prin distilarea sub vid în evaporatorul rotativ (4.18) și se usucă uleiul la 30–40 °C (tot sub vid) cu ajutorul unui curent de azot pur până la eliminarea hexanului.
6.2. Purificarea prin trecere pe alumină
Se prepară o suspensie de 15 g de alumină activată (5.8) în 50 ml de hexan (5.1) și se toarnă, agitând încontinuu, pe coloana cromatografică (4.7). Se procedează la tasarea aluminei și se lasă să scadă nivelul solventului până la 1 sau 2 mm deasupra absorbantului. Se toarnă cu grijă pe coloană o soluție de 5 g de ulei în 25 ml de hexan (5.1). Se colectează în totalitate efluentul coloanei într-un balon (4.1).
7. PREGĂTIREA PLĂCILOR CROMATOGRAFICE
Se curăță temeinic plăcile de sticlă (4.13) cu etanol, eter, petrol și acetonă pentru a elimina toate urmele de materii grase.
Într-un balon conic (4.4) se introduc 30 g de pudră de siliciu (5.9). Se adaugă 60 ml de apă distilată. Se astupă și se agită energic timp de un minut. Se transferă imediat suspensia în distribuitor (4.12) și se ung plăcile curate cu un strat de 0,25 mm grosime.
Se usucă plăcile timp de 15 minute, la aer, apoi timp de o oră în etuvă (4.16) la 103 ± 2 °C. Se aduc plăcile la temperatura ambiantă într-un exsicator, înainte de folosire.
Plăci astfel preparate se găsesc în comerț.
8. MODUL DE LUCRU
8.1. Hidroliza cu lipază pancreatică
Se cântăresc aproximativ 0,1 g de mostră preparată în eprubeta de centrifugare (4.8). În cazul unei substanțe grase solide, se dizolvă în 0,2 ml de hexan încălzind ușor, dacă este necesar.
Se adaugă 20 ml de lipază (5.10) și 2 ml de soluție tampon (5.15). Se agită convenabil, dar prudent, apoi se adaugă 0,5 ml de soluție de colat de sodiu (5.14) și 0,2 ml de soluție de clorură de calciu (5.13). Se închide eprubeta cu dopul din sticlă rodată, se agită cu prudență (se va evita umezirea dopului) și se pune eprubeta imediat în termostat (4.17), menținut la 40 ± 0,5 °C.Se agită cu mâna timp de exact 1 minut.
Se scoate eprubeta din termostat și se agită energic cu ajutorul unui agitator electric (4.19) timp de exact 2 minute.
Se răcește imediat cu apă curentă, se adaugă 1 ml de acid clorhidric (5.12) și 1 ml de eter dietilic (5.4). Se închide și se agită energic cu ajutorul unui agitator electric. Se lasă să se liniștească și se elimină stratul organic cu ajutorul unei seringi (4.10), dacă este necesar după centrifugare.
8.2. Separarea monogliceridelor prin cromatografie în strat subțire
Se aplică extractul pe placa cromatografică într-un strat subțire și uniform, cât mai drept posibil, cu ajutorul microseringii (4.11), la aproximativ 1,5 cm de extremitatea inferioară. Se introduce placa în cuva de developare bine saturată (4.14) și se developează cu ajutorul solventului (5.7) la aproximativ 20 °C, până la aproximativ 1 cm de extremitatea superioară a plăcii.
Placa se usucă cu aer la temperatura cuvei și se pulverizează soluția de 2′-7′ fluoresceină (5.17). Se delimitează banda de monogliceride (R1 de aproximativ 0,035) sub lumină ultravioletă (4.20).
8.3. Analiza monogliceridelor prin cromatografie gaz-lichid
Se recuperează banda obținută la punctul 8.2 cu ajutorul unei spatule (evitând scoaterea componentelor rămase pe linia de bază) și se colectează într-un recipient de metilare (4.2).
Se tratează direct siliciul colectat conform indicațiilor de la punctul 4.1 din anexa X „B” în astfel încât monogliceridele să fie convertite în esteri metilici, apoi se examinează esterii prin cromatografie în fază gazoasă conform indicațiilor din anexa X „A”.
9. EXPRIMAREA REZULTATELOR
Se determină compoziția fracțiunii de acizi grași în poziția 2, exprimând rezultatul cu o zecimală (nota 3).
10. NOTE
Nota 1: Controlul activității lipazei
Se prepară o emulsie de ulei agitând într-un agitator adecvat un amestec compus din 165 ml de soluție de gumă arabică (5.21), din 15 g de gheață pisată și 20 ml dintr-un ulei neutralizat (5.18).
Într-un pahar de laborator (4.5) se toarnă 10 ml din această emulsie, apoi 0,3 ml de soluție de colat de sodiu (5.20) și 20 ml de apă distilată.
Se plasează paharul de laborator într-un termostat menținut la 37 ± 0,5 °C (nota 4). Se introduc electrozii unui pH-metru (4.21) și un agitator cu spirală (4.22).
Cu ajutorul unei biurete (4.23), se adaugă soluția de hidroxid de sodiu (5.19) picătură cu picătură, până când pH-ul atinge valoarea de 8,5.
Se adaugă o cantitate suficientă de suspensie apoasă de lipază (a se vedea în continuare). Din momentul în care pH-metrul indică un pH de 8,3, se declanșează cronometrul (4.24) și se începe adăugarea soluției de hidroxid de sodiu (5.19) picătură cu picătură cu viteza necesară pentru a menține constant pH-ul de 8,3. Se notează la fiecare minut volumul de soluție alcalină consumat.
Se raportează observațiile pe o diagramă ce indică pe abscisă timpii și pe ordonată mililitrii de soluție alcalină necesari pentru menținerea pH-ului constant. Rezultatul obținut este o linie dreaptă.
Suspensia de lipază menționată anterior este o suspensie de 1 la 1 000 (m/m) în apă. Pentru fiecare test trebuie să se utilizeze o cantitate suficientă pentru ca aproximativ 1 ml de soluție alcalină să fie consumat în 4–5 minute. În mod normal, este necesară o cantitate de pudră de 1–5 mg.
Unitatea lipazică este definită ca o cantitate de enzime care eliberează 10 microeechivalenți de acid pe minut. Activitatea A a pudrei utilizate, exprimată în unități lipazice pe miligram, este calculată cu ajutorul formulei următoare:

V: volumul de soluție de hidroxid de sodiu (5.19) consumat pe minut (calculat pornind de la grafic) m: masa mostrei, în miligrame.
Nota 2: Prepararea lipazei
Lipazele cu un nivel de activitate satisfăcător sunt disponibile în comerț, dar pot fi, de asemenea, preparate după cum urmează:
Se răcesc 5 kg de pancreas de porc proaspăt la 0 °C; se elimină grăsimea solidă și țesutul conjunctiv prezente, apoi se triturează într-un malaxor până la obținerea unei paste fluide. Se agită această masă într-un agitator (4.25) cu 2,5 litri de acetonă anhidră timp de 4–6 ore, apoi se centrifughează. Se efectuează alte trei extracții pe reziduu cu același volum de acetonă, apoi două extracții cu un amestec 1/1 (V/V) de acetonă și de eter dietilic, și două extracții cu eter dietilic.
Se usucă reziduul sub vid timp de 48 ore pentru a obține o pudră stabilă, care se păstrează în frigider.
Nota 3: În toate cazurile, se recomandă determinarea compoziției acizilor grași totali din aceeași mostră deoarece comparația cu cea a acizilor în poziția 2 permite interpretarea cifrelor obținute.
Nota 4: Temperatura de hidroliză se stabilește la 37 °C, deoarece se utilizează un ulei lichid. Cu toate acestea, temperatura mostrei se stabilește la 40 °C pentru a putea examina materiile grase cu un punct de topire ce poate atinge 45 °C.
ANEXA VIII
DETERMINAREA CONȚINUTULUI DE TRINOLEINĂ
1. OBIECT
Determinarea compoziției trigliceridelor din uleiurile vegetale lichide, sub formă de carbon echivalent, prin cromatografie în fază lichidă de înaltă performanță.
Prezenta normă descrie o metodă de separare și de determinare a cantității trigliceridelor din uleiurile vegetale sub formă de masă moleculară și de grad de nesaturare, luate ca funcții ale carbonului echivalent (a se vedea nota 1).
2. DOMENIUL DE APLICARE
Prezenta normă se aplică tuturor uleiurilor vegetale ce conțin trigliceride de acizi grași cu lanț lung și este utilă în special pentru detectarea prezenței cantităților mici de uleiuri semisicative (bogate în acid linoleic) în uleiurile vegetale la care principalul acid gras nesaturat este acidul oleic (ulei de măsline).
3. PRINCIPIU
Separarea trigliceridelor după numărul lor de carbon echivalent, prin cromatografie în fază lichidă de înaltă performanță (faza inversă) și interpretarea cromatogramelor.
4. APARATURĂ
4.1. Aparat de cromatografie în fază lichidă de înaltă performanță care permite un control termostatic al temperaturii coloanei.
4.2. Seringă pentru injecții de 10 μl.
4.3. Detector: refractometru diferențial capabil să determine indicele de refracție cu aproximație de 10-4.
4.4. Coloană: tub din oțel inoxidabil cu o lungime de 250 mm și un diametru interior de 4,5 mm, prevăzut cu particule de siliciu cu diametru de 5 μm și conținând 22–23 % carbon sub formă de octadecilsilan (nota 2).
4.5. Aparat de înregistrare și/sau integrator.
5. REACTIVI
Reactivii trebuie să fie de puritate analitică, iar solvenții de eluare trebuie să fie degazați (ei pot fi reciclați de mai multe ori, fără ca acest lucru să aibă repercusiuni asupra separărilor).
5.1. Cloroform.
5.2. Acetonă.
5.3. Acetonitril.
5.4. Solvent de eluare: acetonitril + acetonă. (Proporțiile trebuie să fie ajustate în funcție de separarea dorită; se începe cu un amestec 50/50).
5.5. Solvent de solubilizare: acetonă sau amestec (1:1) de acetonă și cloroform.
5.6. Trigliceride de referință: trigliceride comerciale, precum tripalmitina, trioleina etc. (timpii de retenție trebuie să fie reluați în grafic după numărul de carboni echivalent), sau cromatograma de referință obținută datorită uleiului de soia (a se vedea notele 3 și 4 și schemele 1 și 2).
6. PREPARAREA MOSTRELOR
Se prepară o soluție la 5 % din mostrele de analizat prin cântărirea a 0,5 ± 0,0001 g de mostră într-un balon gradat de 10 ml și se completează până la 10 ml cu solventul de solubilizare (5.5).
7. MODUL DE LUCRU
7.1. Se montează sistemul cromatografic. Se pompează solventul de eluare (5.4) în proporție de 1,5 ml pe milimetru pentru a purja întregul sistem. Se așteaptă până la obținerea unei linii de bază stabile.
Se injectează 10 μl de mostră preparată conform indicațiilor de la punctul 6.
8. CALCULAREAȘI EXPRIMAREA REZULTATELOR
Se utilizează metoda de standardizare internă, altfel spus se presupune că suma procentelor ariilor valorilor de vârf corespunzând diverselor trigliceride este egal cu 100 %. Se calculează procentajul fiecărei trigliceride utilizând formula:

Procentajul se calculează cu o zecimală
Nota 1: Este posibil să se determine ordinea de eluare prin calcularea echivalentului carbon, definit deseori prin raportul NCE = NC - 2n, unde NC este numărul atomilor de carbon și n numărul de legături duble. Se poate îmbunătăți calculul ținând seama de originea legăturilor duble. Dacă no, n1 și n1n reprezintă numărul de legături duble ce pot fi atribuite acizilor oleic, linoleic și linolenic, carbonul echivalent poate fi calculat după formula:
NCE = NC - dono - d1n1 - d1nn1n
unde coeficienții do, d1 și d1n pot fi calculați cu ajutorul trigliceridelor de referință. În condițiile specificate în prezenta metodă, rezultatul obținut este comparabil cu formula:
NCE = NC - (2,60no) - (2,35n1) - (2,17n1n).
Nota 2: Exemple: Licrosorb (Merck) RP 18 articolul 50333,
Licrosferă (Merck) 100 CH 18 articolul 50377 sau similare.
Nota 3: Cu mai multe trigliceride de referință, este posibil, de asemenea, să se calculeze rezoluția pentru trioleină.
α = TR′/TR′oleină
utilizând timpii de retenție corectați TR′ = TR - TRsolvent
Schema log α în funcție de f (număr de legături duble) permite determinarea indicilor de retenție pentru toate trigliceridele acizilor grași ai trigliceridelor de referință (a se vedea schema 2).
Nota 4: Eficacitatea coloanei trebuie să permită separarea netă a valorii de vârf a LLL (trilinoleici) de cea a trigliceridelor care au un timp de retenție apropiat.
Schema 1
Cromatograma unei mostre de ulei de soia

|
P |
= |
acid palmitic; |
|
St |
= |
acid stearic; |
|
O |
= |
acid oleic; |
|
I |
= |
acid linoleic; |
|
Ln |
= |
acid linolenic. |
Schema 2
Evoluția logaritmului α în funcție de f (numărul legăturilor duble)

La= acid lauric;
My= acid miristic;
P= acid palmitic;
St= acid stearic;
O= acid oleic;
L= acid linoleic;
Ln= acid linolenic.
ANEXA IX
ANALIZĂ SPECTROFOTOMETRICĂ
INTRODUCERE
Examinarea spectrofotometrică în ultraviolet poate furniza indicații privind calitatea unei materii grase, starea de conservare a acesteia și modificările datorate proceselor tehnologice.
Absorbțiile cu lungimi de undă prevăzute în metodă sunt datorate prezenței sistemelor de diene și triene conjugate. Valorile acestor absorbții sunt exprimate ca extincția specifică E1 % 1 cm (extincția unei soluții de substanță grasă de 1 % în solventul prescris, pentru o grosime de 1 % cm) notată în mod condițional cu K (denumit, de asemenea, coeficient de extincție).
1. OBIECT
Metoda descrie procedeul executării examinării spectrofotometrice în ultraviolet a materiilor grase.
2. PRINCIPIUL METODEI
Substanța grasă studiată se dizolvă în solventul necesar, apoi se determină extincția soluției la lungimea de undă prescrisă, în raport cu solventul pur. Se calculează extincțiile specifice pornind de la citirile spectrofotometrice.
3. APARATURĂ
3.1. Spectofotometru pentru măsurarea extincțiilor în ultraviolete între 220 și 360 nm, cu posibilitatea de citire pentru fiecare unitate nanometrică.
3.2. Cuve de cuarț prismatic, cu capac, cu parcurs optic de 1 cm. Cuvele, umplute cu apă sau cu alt solvent adecvat, nu trebuie să prezinte diferențe mai mari de 0,01 unități de extincție.
3.3. Baloane calibrate cu o capacitate de 25 ml.
3.4. Coloană de cromatografie cu o lungime de 540 mm și diametru de 35,0 mm, dotată cu un tub cu reflux, având un diametru de aproximativ 10 mm.
4. REACTIVI
4.1. Izooctan (2,2,4-trimetilpentan) pur din punct de vedere spectrofotometric: trebuie să prezinte, în raport cu apa distilată, o transmitanță cel puțin egală cu 60 % la 220 nm și nu mai mică de 95 % la 250 nm sau
|
— |
ciclohexan pur din punct de vedere spectrofotometric: trebuie să prezinte, în raport cu apa distilată, o transmitanță cel puțin egală cu 40 % la 220 nm și nu mai mică de 95 % la 250 nm; |
|
— |
un alt solvent adecvat capabil să dizolve perfect substanța grasă (alcoolul etilic pentru uleiul de ricin). |
4.2. Alumină bazică pentru cromatografia pe coloană, preparată și controlată conform descrierii de la apendicele 1.
4.3. n-Hexan pentru cromatografie.
5. MOD DE LUCRU
5.1. Mostra examinată trebuie să fie perfect omogenă și lipsită de impurități în suspensie. Uleiurile lichide cu temperatură ambiantă sunt filtrate pe hârtie la o temperatură de aproximativ 30 °C, grăsimile solide sunt omogenizate și filtrate la o temperatură cu cel mult 10 °C mai mică decât temperatura lor de topire.
5.2. Se cântăresc aproximativ 0,25 g din mostra astfel preparată într-un balon calibrat de 25 ml, se completează cu solventul prescris și se omogenizează. Soluția obținută trebuie să fie perfect limpede. În cazul în care soluția ar prezenta o opalescență sau o tulburare, se filtrează rapid printr-un filtru de hârtie.
5.3. Se umple o cuvă cu soluția obținută și se măsoară extincțiile, folosind ca referință solventul utilizat, la lungimi de undă cuprinse între 232 și 276 nm.
Valorile de extincție citite trebuie să fie cuprinse în intervalul 0,1-0,8: în caz contrar, este necesară repetarea măsurătorilor folosind soluții adecvate mai concentrate sau mai diluate.
5.4. În cazul în care ar fi necesară determinarea extincțiilor specifice după trecerea pe alumină, se procedează în felul următor: se introduc în coloana cromatografică 30 g de alumină bazică în suspensie în hexan; se elimină excesul de hexan după tasarea absorbantului sau cel puțin până la aproximativ 1 cm peste nivelul superior al aluminei.
Se dizolvă 10 g de materie grasă, omogenizată și filtrată conform descrierii de la punctul 5.1 în 100 ml de hexan și se toarnă această soluție în coloană. Se colectează eluantul și se evaporă solventul în vid și la o temperatură mai mică de 25 °C.
Se acționează imediat asupra materiei grase obținute conform descrierii de la punctul 5.2.
6. EXPRIMAREA REZULTATELOR
6.1. Se raportează extincțiile specifice (coeficienții de extincție) la diferitele lungimi de undă, calculate după cum urmează:
 ,
,
în care:
|
Kλ |
= |
extincție specifică la lungimea de undă λ; |
|
Eλ |
= |
extincție măsurată la lungimea de undă λ: |
|
c |
= |
concentrația soluției în grame la 100 mililitri; |
|
s |
= |
grosimea cuvetei în centimetri. |
Rezultatele sunt exprimate cu două zecimale.
6.2. Examinarea spectrofotometrică a uleiului de măsline conform metodei oficiale din regulamentele oficiale ale Comunității Economice Europene prevede determinarea extincției specifice, în soluție în izooctan, la lungimi de undă de 232 și 270 nm și determinarea Δ K exprimată după cum urmează:
 ,
,
în care Km reprezintă extincția specifică la lungimea de undă m, lungime de undă de absorbție maximă de aproximativ 270 nm.
ANEXA X A
ANALIZĂ PRIN CROMATOGRAFIE ÎN FAZĂ GAZOASĂ A ESTERILOR METILICI AI ACIZILOR GRAȘI
1. DOMENIUL DE APLICARE
Prezenta metodă furnizează directive generale pentru determinarea prin cromatografie în fază gazoasă a compoziției calitative și cantitative a unui amestec de esteri metilici ai acizilor grași obținut conform metodei vizate la anexa X B.
Metoda nu se aplică acizilor grași polimerizați.
2. REACTIVI
2.1. Gaz vector
Gaz inert (azot, heliu, argon, hidrogen etc.) uscat cu grijă și conținând mai puțin de 10 mg pe kilogram de oxigen.
Nota 1: Hidrogenul care se utilizează ca gaz vector numai cu coloanele capilare permite dublarea vitezei de analiză, dar prezintă pericole. Cu toate acestea, există dispozitive de securitate.
2.2. Gaze auxiliare
2.2.1. Hidrogen (cu puritate ≥ 99,9 %), care nu conține impurități organice.
2.2.2. Aer sau oxigen care nu conține impurități organice.
2.3. Produse de etalonare
Amestec de esteri metilici de acizi grași puri sau esteri metilici ai unei substanțe grase, cu compoziție cunoscută, dacă este posibil apropiată de cea a substanței grase de analizat.
Se iau toate prevederile pentru a se evita oxidarea acizilor grași polinesaturați.
3. APARATURA
Indicațiile se referă la aparatele obișnuite de cromatografie în fază gazoasă care utilizează coloane pline și/sau capilare și un detector cu ionizare cu flacără. Orice aparatură cu aceeași eficacitate și aceeași rezoluție ca cea definită la punctul 5.1.2 este adecvată.
3.1. Aparat de cromatografie în fază gazoasă
Aparatul de cromatografie în fază gazoasă trebuie să cuprindă elementele următoare.
3.1.1. Dispozitiv de injecție
Se utilizează un dispozitiv de injecție:
|
(a) |
fie cu coloane pline, dispozitivul având cel mai slab volum mort posibil (în acest caz, trebuie să poată fi folosit la o temperatură mai mare, cu 20 °C – 50 °C, decât cea a coloanei); |
|
(b) |
fie cu coloane capilare, caz în care dispozitivul trebuie să fie special conceput pentru utilizarea unor astfel de coloane. Poate fi de tip divizator sau de tip pe injecție totală în capul coloanei răcite (injector „non column”). |
Nota 2: În absența substanței grase care conține acizi grași cu mai puțin de 16 atomi de carbon, se poate folosi un injector cu ac mobil.
3.1.2. Cuptor
Cuptorul trebuie să fie în măsură să aducă coloana la o temperatură de minimum 260 °C și să mențină temperatura aleasă în limita a 1 °C, cu o coloană plină, și în limita a 0,1 °C, cu o coloană capilară. Această ultimă caracteristică este importantă îndeosebi atunci când se utilizează un tub de siliciu topit.
Utilizarea unui aparat echipat cu un programator de temperatură este recomandată în toate cazurile, în special în prezența acizilor grași cu mai puțin de 16 atomi de carbon.
3.1.3. Coloană plină
3.1.3.1. Coloană, din material inert față de subtsanțele de analizat: sticlă sau oțel inoxidabil, cu următoarele dimensiuni:
|
(a) |
lungime: 1–3 m. O coloană relativ scurtă va fi utilizată în cazul în care sunt prezenți acizi grași cu lanț lung (>C20). În cazul determinării acizilor cu C4 și C6, se recomandă utilizarea unei coloane de 2 m; |
|
(b) |
diametru interior: 2–4 mm. |
Nota 3: Dacă în amestec există compuși polinesaturați cu mai mult de trei legături duble, o coloană de oțel inoxidabil poate cauza descompunerea acestora.
Nota 4: Se poate utiliza un sistem cu coloană plină dublă.
3.1.3.2. Umplere, care conține elementele următoare:
|
(a) |
suport: pământ cu diatomit spălat în acizi și silanizat, sau orice alt suport inert care poate fi adecvat, cu un scurt interval de granulometrie (25 μm între 125 și 200 μm), dimensiunea medie fiind legată de diametrul interior și de lungimea coloanei; |
|
(b) |
faza staționară: fază polară de tip poliester (de exemplu polisuccinat de dietileneglicol, polisuccinat de butanediol, polidipat de etileneglicol etc.), cianosilicoane sau orice altă fază care permite separarea cromatografică (a se vedea punctul 5). Rata de impregnare va fi cuprinsă între 5 % (m/m) și 20 % (m/m). Pentru anumite separări se pot utiliza fazele apolare. |
3.1.3.3. Condiționarea coloanei
După deconectarea coloanei din partea detectorului, se ridică progresiv temperatura cuptorului la 185 °C și se menține coloana care tocmai a fost preparată la un curent de gaz inert de 20–60 mm pe minut timp de cel puțin 16 ore la această temperatură, apoi 2 ore la 195 °C.
3.1.4. Coloana capilară
3.1.4.1. Tub din material inert față de substanțele de analizat, în general de sticlă sau de siliciu topit. Diametrul intern trebuie să fie cuprins între 0,2 și 0,8 mm. În interior, trebuie să suporte tratamente adecvate (prepararea stării de suprafață, inactivarea) înainte de a primi filmul fazei staționare. O lungime de 25 m este suficientă în majoritatea cazurilor.
3.1.4.2. Fază staționară, în principal de tip poliglicoli [poli(etilen glicol) 20 000], poliesteri (polisuccinat de butanediol) sau polisiloxani polari (cianosilicoane). Coloanele grefate sau reticulate sunt adecvate.
Nota 5: Cu toate acestea, polisiloxanii polari riscă să creeze dificultăți în identificarea și separarea acidului linolenic și a acizilor C20.
Grosimile filmului trebuie să fie reduse: 0,1–0,2 μm.
3.1.4.3. Montajul și condiționarea coloanei
Se respectă precauțiile obișnuite de montare a coloanelor capilare, adică dispunerea coloanei în cuptor (suport), alegerea și montarea îmbinărilor (etanșeitate), poziționarea extremităților coloanei în injector și detectorul (reducerea volumelor moarte). Se pune coloana sub gaz vector [de exemplu, 0,3 bar (30kl′a) pentru o coloană de 25 metri în lungime și cu un diametru interior de 0,3 mm].
Se condiționează coloana prin programarea temperaturii cuptorului la 3 °C pe minut de la temperatura ambiantă până la o temperatură mai mică de 10 °C la limita de descompunere a fazei staționare. Se menține la această temperatură 1 oră, până la stabilizarea liniei de bază. Se revine la 180 °C pentru a lucra în condiții izoterme.
Nota 6: Coloanele precondiționate adecvate sunt disponibile în comerț.
3.1.5. Detector, de preferință capabil să ajungă la o temperatură mai mare decât cea a coloanei.
3.2. Seringa
Seringa trebuie să aibă o capacitate de maximum 10 ml și să fie gradată la 0,1 ml.
3.3. Aparatul de înregistrare
Când curba înregistrată este utilizată pentru a calcula compoziția amestecului analizat, aparatul de înregistrare trebuie să fie un aparat electronic de mare precizie, compatibil cu aparatura utilizată, și cu următoarele caracteristici:
|
(a) |
viteză de răspuns mai mică de 1,5 secunde, de preferință 1 secundă (viteza de răspuns este timpul necesar pentru ca acul aparatului de înregistrare să ajungă de la 0 la 90 % la introducerea bruscă a unui semnal de 100 %); |
|
(b) |
suprafața hârtiei, cel puțin 20 cm; |
|
(c) |
viteza derulării hârtiei, reglabilă la valori cuprinse între 0,4 și 2,5 cm pe minut. |
3.4. Integrator sau calculator (facultativ)
Folosirea unui integrator electronic sau a unui calculator permite un calcul rapid și precis. Acesta trebuie să furnizeze un răspuns liniar, să prezinte o sensibilitate suficientă, iar corecția deviației liniei de bază trebuie să fie satisfăcătoare.
4. MODUL DE LUCRU
Detaliile privind modul de lucru de la punctele 4.1–4.3. se referă la folosirea unui detector cu ionizarea cu flacără.
Ca variantă, se poate utiliza un aparat de cromatografie în fază gazoasă cu un detector cu conductibilitate termică (catarometru). Condițiile de operare trebuie modificate conform descrierii de la punctul 6.
4.1. Condițiile de testare
Alegerea condițiilor optime de lucru
4.1.1.1. Pe coloană plină
La alegerea condițiilor de lucru, trebuie să se țină seama de următoarele variabile:
|
(a) |
lungimea și diametrul coloanei; |
|
(b) |
natura și cantitatea fazei staționare; |
|
(c) |
temperatura coloanei; |
|
(d) |
debitul gazului vector; |
|
(e) |
rezoluția dorită; |
|
(f) |
importanța mostrei, aleasă astfel încât ansamblul detector-electrometru să furnizeze un răspuns liniar; |
|
(g) |
durata analizei. |
În general, valorile date în tabelul 1 și în tabelul 2 vor fi cele care dau rezultatele dorite, adică un număr de platouri teoretice, cel puțin egal cu 2 000 pe metru de coloană pentru stearatul de metil, și eluarea acestuia în aproximativ 15 minute.
Atunci când aparatul o permite, injectorul trebuie să înregistreze o temperatură apropiată de 200 °C, iar detectorul la o temperatură egală sau mai mare decât cea a coloanei.
În general, raportul dintre debitul de hidrogen al detectorului cu ionizarea cu flacără și cel al gazului vector variază între 1:2 și 1:1, în funcție de diametrul coloanei. Debitul de oxigen este de aproximativ 5–10 ori mai mare decât cel al hidrogenului.
Tabelul 1
|
Diametrul interior al coloanei (în mm) |
Viteza gazului vector (în ml/min) |
|
2 |
15–25 |
|
3 |
20–40 |
|
4 |
40–60 |
Tabelul 2
|
Concentrația fazei staționare [în % (m/m)] |
Temperatura coloanei (în °C) |
|
5 |
175 |
|
10 |
180 |
|
15 |
185 |
|
20 |
185 |
4.1.1.2. Pe coloană capilară
Caracteristicile de eficacitate și de permeabilitate ale coloanelor capilare fac ca separarea între constituenți și durata analizei să fie foarte dependente de debitul gazului vector în coloană. Va fi nevoie, folosind acest parametru (sau, mai simplu, pierderea încărcăturii din capătul coloanei), să se optimizeze condițiile de operare în funcție de ceea ce se dorește, adică îmbunătățirea separărilor sau realizarea rapidă a analizei.
4.1.2. Determinarea numărului de platouri teoretice (eficacitatea) și a rezoluției (A se vedea figura 1)
Se efectuează analiza unui amestec de stearat și de oleat de metil în proporții sensibil echivalente (de exemplu, esteri metilici de unt de cacao).
Se aleg importanța mostrei, temperatura coloanei și debitul gazului vector, astfel încât valoarea de vârf maximă a stearatului de metil să se înregistreze la aproximativ 15 minute de la înregistrarea valorii de vârf a solventului, și această valoare de vârf să corespundă la aproximativ trei sferturi din scara totală.
Se calculează numărul de platouri teoretice n cu ajutorul formulei
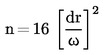
și rezoluția R, cu formula
 ,
,
în care:
|
dr1 |
distanța de retenție, în mm, măsurată pornind de la începutul cromatogramei până la valoarea de vârf maximă a stearatului de metil; |
|
ω1 și ω2 |
lățimile, în mm, ale valorilor de vârf ale stearatului și ale oleatului de metil, măsurate între punctele de intersecție cu linia de bază a tangentelor cu punctele de inflexiune ale curbei; |
|
Δ |
distanța, în milimetri, între maximele relative ale valorilor de vârf ale stearatului și oleatului de metil. |
Figura 1
Cromatogramă pentru determinarea numărului de platouri teoretice (eficacitate) și a rezoluției

Condițiile de operare sunt cele care furnizează un număr de platouri teoretice pentru stearatul de metil, cel puțin egal cu 2 000 pe metru de coloană, și o rezoluție de minimum 1,25.
4.2. Mostră pentru testare
Cu ajutorul seringii (4.2), se prelevează 0,1–2 μl din soluția de esteri metilici obținută conform metodei descrise în anexa X „B” și se injectează în coloană.
În cazul esterilor fără solvenți, se prepară o soluție cu aproximativ 100 mg pe mililitru în heptanul pentru cromatografie în fază gazoasă și se injectează 0,1–1 μl din această soluție.
Pentru cercetarea constituenților prezenți în starea de urme, această mostră pentru test va putea fi mărită (până la zece ori).
4.3. Analiza
În cazurile obișnuite, se operează în condițiile descrise la 5.1.1.
Totuși, este posibil să se opereze cu o temperatură de coloană mai scăzută, în cazul în care este necesară dozarea acizilor grași al căror număr de atomi de carbon este mai mic de 12, sau mai mare, în cazul în care este necesară dozarea acizilor grași al căror număr de atomi de carbon este mai mare de 20. Eventual, este posibilă operarea cu o temperatură programată în cele două cazuri. De exemplu, dacă mostra conține esteri metilici de acizi grași cu mai puțin de 12 atomi de carbon, se injectează mostra la 100 °C (sau la 50-60 °C dacă acidul butiric este prezent) și se programează imediat la un debit de la 4–8 °C pe minut până la temperatura optimă. În anumite cazuri, cele două procedee pot fi combinate.
După perioada de programare a temperaturii, se continuă eluarea la temperatură izotermă până la eluarea tuturor constituanților. În cazul în care aparatul nu poate funcționa la temperatura programată, se operează la cele două temperaturi stabilite între 100 și 195 °C.
Dacă este necesar, se recomandă o analiză a celor două faze fixe de polarități diferite pentru a se verifica absența valorilor de vârf mascate, de exemplu în cazul prezenței simultane a C18:3 și C20:0 sau a C18:3 și C18:2 conjugate.
4.4. Pregătirea cromatogramei de referință și a curbelor de referință
Se analizează amestecul etalon (a se vedea punctul 2.3), în condiții de operare identice cu cele ale testului, și se determină timpii de retenție sau distanțele de retenție pentru acizii grași constitutivi. Se trasează pe hârtie semilogaritmică, pentru fiecare rată de nesaturare, curbele care dau logaritmul timpului de retenție sau al distanței de retenție în funcție de numărul atomilor de carbon; în condiții izoterme și pentru esteri cu lanț drept și o rată de nesaturare fixă, aceste curbe trebuie să fie drepte. Aceste drepte trebuie să fie practic paralele.
Se evită condițiile de operare care favorizează existența „valorilor de vârf mascate”, adică doi constituenți nu pot fi separați în urma unei rezoluții insuficiente.
5. EXPRIMAREA REZULTATELOR
5.1. Analiza cantitativă
Pentru test, se identifică valorile de vârf ale metil esterului prin raportarea la curbele preparate la punctul 4.4 prin interpolare.
5.2. Analiza cantitativă
5.2.1. Determinarea compoziției
Se utilizează metoda de standardizare internă (în afara excepțiilor), adică se admite că totalitatea constituenților prezenți în mostră este reprezentată pe cromatogramă, prin urmare că suma ariilor valorilor de vârf reprezintă 100 % din constituenți (eluare totală).
În cazul în care aparatura include un integrator, se utilizează cifrele furnizate de acesta. În caz contrar, se determină aria fiecărei valori de vârf prin multiplicarea înălțimii vârfului cu lățimea acestuia la jumătate din înălțime, ținând seama de diversele atenuări utilizate eventual în cursul înregistrării.
5.2.2. Mod de calcul
5.2.2.1. Caz general
Se calculează conținutul într-un constituent dat, exprimat în procentaj în masă, al esterilor metilici, determinând procentajul reprezentat de raportul ariei valorii de vârf care corespunde sumei ariilor totalității vârfurilor, cu ajutorul formulei:
 ,
,
în care:
|
Ai: |
aria valorii de vârf corespunzătoare compusului i; |
|
ΣΑ: |
suma ariilor totalității valorilor de vârf. |
Rezultatul se exprimă cu o zecimală.
Notă: În acest caz general, rezultatul calculului bazat pe ariile relative este considerat ca reprezentând un procentaj în masă. În cazul în care această ipoteză nu este permisă, a se vedea punctul 5.2.2.2.
5.2.2.2. Cazul folosirii factorilor de corecție
În anumite cazuri, de exemplu în prezența acizilor grași al căror număr de atomi de carbon este mai mic de 8 sau a acizilor cu funcții secundare, la folosirea detectorilor cu conductivitate termică, sau dacă cel mai înalt grad de precizie este solicitat în mod special, trebuie să se intervină cu factori de corecție pentru a converti procentajele ariilor valorilor de vârf în procentaje în masă ale constituenților.
Se determină factorii de corecție cu ajutorul unei cromatograme obținute pornind de la un amestec etalon de esteri metilici cu o compoziție cunoscută exact în condiții identice cu cele ale testului.
Pentru acest amestec etalon, procentajul în masă al compusului i este dat de formula:
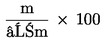 ,
,
în care:
|
mi: |
masa compusului i în amestecul etalon; |
|
Σm: |
suma maselor diverșilor constituenți ai amestecului etalon. |
Pornind de la cromatograma amestecului etalon (4.4), se calculează procentajul (arie/arie) al compusului i astfel:
 ,
,
în care:
|
Ai: |
aria valorii de vârf corespunzătoare compusului i; |
|
ΣΑ: |
suma ariilor totalității valorilor de vârf. |
De unde, factorul de corecție:
![]()
În mod obișnuit, factorii de corecție sunt exprimați în raport cu KC16 și factorii relativi devin:

Pentru mostră, conținutul din fiecare compus i, exprimat în procentaj în masă de esteri metilici, este:

Rezultatul se exprimă cu o zecimală.
5.2.2.3. Cazul folosirii unui etalon intern
În anumite analize (de exemplu, când toți acizii grași nu sunt cuantificați și când acizii în C4 și în C6 sunt prezenți alături de acizii în C16 și C18, sau când este necesară determinarea cantității absolute a acizilor grași într-o mostră), este necesară utilizarea unui etalon intern. Acizii grași în C5, C15 sau C17 sunt utilizați în mod frecvent. Se determină factorul de corecție al etalonului intern (dacă este necesar).
Procentajul în masă al compusului i, exprimat în esteri metilici, este dat în continuare de formula:
![]() ,
,
în care:
|
A1: |
suprafața valorii de vârf corespunzătoare constituentului i; |
|
As: |
suprafața valorii de vârf corespunzătoare etalonului intern; |
|
K′: |
factor de corecție al compusului i (referitor la KC16); |
|
K′s: |
factor de corecție al etalonului intern (referitor la KC16); |
|
m: |
masa mostrei, în miligrame; |
|
ms: |
masa etalonului intern, în miligrame. |
Rezultatul se exprimă cu o zecimală.
6. CAZUL SPECIAL AL UTILIZĂRII UNUI DETECTOR CU CONDUCTIBILITATE TERMICĂ (CATAROMETRU)
Pentru determinarea compoziției calitative și cantitative a unui amestec de esteri metilici de acizi grași se poate utiliza un aparat de cromatografie în fază gazoasă cu un detector cu conductibilitate termică (catarometru). În acest caz, condițiile specificate la punctele 3 și 4 trebuie să fie modificate conform indicațiilor din tabelul 3.
Pentru analiza cantitativă, se utilizează factorii de corecție definiți la 5.2.2.2.
Tabelul 3
|
Variabilă |
Valoare/condiție |
|
Coloană |
Lungime: 2–4 m diametru interior: 4 mm |
|
Suport |
Granulometrie între 160 și 200 μm |
|
Rata de impregnare a fazei staționare |
15–25 % (m/m) |
|
Gaz vector |
Heliu sau, în lipsă, hidrogen cu un conținut de oxigen cât mai scăzut posibil |
|
Gaze auxiliare |
Nici unul |
|
Temperatura injectorului |
Cu 40–60 °C mai mare decât cea a coloanei |
|
Temperatura coloanei |
180–200 °C |
|
Debitul gazului vector |
În general cuprins între 60 și 80 ml/min |
|
Cantități injectate |
În general cuprinse între 0,5 și 2 μl |
7. PROCESUL-VERBAL DE TESTARE
Procesul-verbal de testare trebuie să indice metodele utilizate pentru prepararea esterilor metilici și pentru analiza prin cromatografie în fază gazoasă, precum și rezultatele obținute. În plus, trebuie să se menționeze toate detaliile de operare necuprinse în prezenta normă internațională sau facultative, precum și incidentele eventuale care au putut influența rezultatele.
Procesul-verbal de testare trebuie să ofere toate informațiile necesare identificării complete a mostrei.
ANEXA X B
PREGĂTIREA ESTERILOR METILICI AI ACIZILOR GRAȘI, CONFORM ANEXEI VI PUNCTELE I ȘI II LA REGULAMENTUL (CEE) NR. 72/77 SAU CONFORM METODEI ALTERNATIVE DESCRISE ÎN CONTINUARE
PREAMBUL
Alegerea metodei care urmează să fie folosite trebuie să se facă în funcție de compoziția în acizi și de aciditatea materiei grase de analizat și de analiza prin cromatografie în fază gazoasă care se va efectua.
De remarcat, în special, că:
|
— |
în ceea ce privește materiile grase care conțin acizi grași mai mici decât C12, se utilizează numai metodele de analiză în balon închis sau cu sulfat dimetilic; |
|
— |
în ceea ce privește materiile grase cu o aciditate mai mare de 3 %, se utilizează numai metodele cu metanol și cu acid clorhidric sau sulfat dimetilic; |
|
— |
pentru determinările prin cromatografie în fază gazoasă a izomerilor trans, se utilizează numai metodele cu metilat de sodiu sau sulfat dimetilic; |
|
— |
metoda cu metanol, hexan și acid sulfuric trebuie să se utilizeze pentru prepararea esterilor metilici ai micilor cantități de materii grase ce provin din separarea prin cromatografie în strat subțire. |
Prezența nesaponificabilelor poate fi neglijată dacă nu depășește 3 %, în caz contrar esterii metilici se prepară folosind acizi grași.
1. OBIECT
În continuare este prezentată descrierea a cinci metode de preparare a esterilor metilici din materii grase:
|
(a) |
cu metilat de sodiu; |
|
(b) |
cu metilat de sodiu în balon închis; |
|
(c) |
cu metanol și acid clorhidric în balon închis; |
|
(d) |
cu sulfat dimetilic; |
|
(e) |
cu metanol, hexan și acid sulfuric. |
Metoda A
2. PRINCIPIU
Substanța grasă de analizat este încălzită cu reflux cu ajutorul alcoolului metilic și al metilatului de sodiu. Esterii metilici obținuți sunt extrași cu eter etilic.
3. INSTRUMENTE
3.1. Balon de 100 ml cu condensator cu reflux, prevăzut la extremitatea superioară cu un tub de var sudat, cu îmbinări din sticlă rodată.
3.2. Eprubete gradate de 50 ml.
3.3. Pipetă gradată de 5 ml, cu subdiviziuni de 0,1 ml.
3.4. Pâlnii de decantare de 250 ml.
3.5. Balon de 200 ml.
4. REACTIVI
4.1. Metanol anhidru.
4.2. Metilat de sodiu, soluție metanolică de aproximativ 1 %: această soluție se prepară prin dizolvarea a 0,34 g de sodiu metalic în 100 ml de metanol anhidru.
4.3. Eter etilic.
4.4. Clorură de sodiu, soluție de 10 %.
4.5. Eter de petrol la 40–60 °C.
5. MOD DE LUCRU
5.1. În balonul de 100 ml, se introduc 2 g de substanță grasă deshidratată în prealabil în sulfat de sodiu și filtrată. Se adaugă 35 ml de metanol, se adaptează condensatorul și se fierbe până la reflux timp de câteva minute.
5.2. Se întrerupe reîncălzirea, se detașează condensatorul și se adaugă rapid 3,5 ml de soluție de metilat de sodiu; se reconectează condensatorul și se fierbe la reflux timp de cel puțin 3 ore. Metilarea este considerată completă atunci când toată substanța grasă este trecută în soluție și amestecul de reacție este perfect limpede la temperatura ambiantă.
5.3. Se răcește și se toarnă amestecul de reacție într-o pâlnie de decantare de 250 ml, se adaugă 35–40 ml de eter etilic, 100 ml de apă și 5–6 ml de soluție de clorură de sodiu de 10 %. Se agită și se așteaptă separarea straturilor: faza apoasă este transferată într-o a doua pâlnie de decantare și se extrage din nou cu 25 ml de eter etilic.
Se adaugă ansamblului de extrase eterate 50 ml de eter de petrol la 40–60 °C; acest lucru va determina separarea apei care trebuie eliminată.
Se spală de trei ori faza eterată cu doze de 10–15 ml de apă, se usucă pe sulfatul de sodiu și se filtrează pe hârtie, colectând filtratul într-un balon de 200 ml.
Se distilează solventul prin completarea prelungirii la baie de aburi într-un curent de azot pur.
Metoda B
2. PRINCIPIU
Substanța grasă de analizat trebuie să fie tratată cu metilat de sodiu în soluție metanolică, într-un balon închis, la 85–90 °C.
3. INSTRUMENTE
3.1. Balon de sticlă cu pereți robuști, de aproximativ 5 mm (înălțimea 40–50 mm; diametrul 14–16 mm).
3.2. Pipetă gradată de 1 ml cu subdiviziuni de 0,1 ml.
4. REACTIVI
4.1. Metilat de sodiu, soluție metanolică de aproximativ 1,5. Această soluție se prepară prin dizolvarea a 0,50 g de sodiu metalic în 100 ml de metanol anhidru.
5. MOD DE LUCRU
5.1. În balonul de sticlă se introduc 2 g de substanță grasă deshidratată în prealabil cu sulfat de sodiu și filtrată. Se adaugă 0,3 g (aproximativ 0,4 mililitri) de soluție de metilat de sodiu și se închide balonul la flacără.
5.2. Se menține balonul timp de două ore într-o baie la 85–92 °C și se agită din când în când; limpezimea conținutului balonului este cea care, după sedimentarea glicerinei și a reziduului de reactivi, indică esterificarea.
5.3. Se aduce la temperatura ambiantă. Se deschide balonul în momentul folosirii esterilor metilici. Aceștia nu necesită altă manipulare înainte de introducerea în cromatograful în fază gazoasă.
Metoda C
2. PRINCIPIU
Substanța grasă de analizat trebuie să fie tratată cu metanol și acid clorhidric, într-un balon închis, la 100 °C.
3. INSTRUMENTE
3.1. Balon de sticlă, cu pereți robuști, de aproximativ 5 mm (înălțimea 40–50 mm; diametrul 14–16 mm).
3.2. Pipete gradate de 1 și de 2 mm.
4. REACTIVI
4.1. Soluție metanolică de acid clorhidric de 2 %. Se prepară cu acid clorhidric gazos și cu metanol anhidru (nota 1).
4.2. Hexan pentru cromatografie în stare gazoasă.
5. MOD DE LUCRU
5.1. Se introduc în balonul de sticlă 0,2 g de substanță grasă deshidratată în prealabil în sulfat de sodiu și filtrată, precum și 2 ml de soluție metanolică de acid clorhidric. Se închide balonul la flacără.
5.2. Se menține balonul într-o baie la 100 °C timp de patruzeci de minute.
5.3. Se răcește balonul în apă curentă, se deschide, se adaugă 2 ml de apă distilată și 1 ml de hexan. Se centrifughează și se prelevează faza hexanică, care este gata de folosire.
Metoda D
2. PRINCIPIU
Substanța grasă de analizat este saponificată cu o soluție metilalcoolică de hidroxid de potasiu, apoi tratată cu sulfat dimetilic. După adăugarea acidului clorhidric, separarea esterilor metilici care s-au format se efectuează în mod spontan. După tratarea cu alumină, se obțin esteri metilici de o mare puritate.
3. INSTRUMENTE
3.1. Eprubetă de sticlă, cu pereți robuști, cu o capacitate de aproximativ 20 ml, cu un dop din sticlă rodată 10/19 și cârlige de siguranță.
3.2. Condensatori cu reflux cu cinci bule, cu îmbinare din sticlă rodată 10/19.
3.3. Filtre de sticlă cu sept poros, gradație G 2, diametru 20 mm.
3.4. Eprubete de sticlă, cu o capacitate de aproximativ 10 ml, cu fund conic.
3.5. Seringi de 1 și de 5 ml.
4. REACTIVI
4.1. Hidroxid de potasiu, soluție de 10 % în alcool metilic pentru cromatografie în stare gazoasă.
4.2. Indicator verde de bromocresol: soluție de 0,05 % în alcool metilic.
4.3. Sulfat dimetilic (d = 1,335 la 15 °C).
4.4. Acid clorhidric concentrat (d = 1,19) diluat 1 + 1 în alcool metilic pentru cromatografie în fază gazoasă.
4.5. Oxid de aluminiu standardizat conform metodei Brockmann pentru cromatografia de absorbție.
5. MOD DE LUCRU
5.1. Se introduc într-o eprubetă de 20 ml aproximativ 2,2 ml de substanță grasă deshidratată în prealabil în sulfat de sodiu și filtrată, se adaugă 5 ml din soluția de hidroxid de potasiu și câteva granule de cuarț pentru regularizarea fierberii. Se adaptează condensatorul cu reflux și se încălzește la flacără slabă timp de 5 minute agitându-se: saponificarea este completă atunci când soluția este limpede. Se răcește cu apă curentă și se detașează condensatorul.
5.2. Se adaugă două picături de indicator și, cu ajutorul unei seringi, 1 ml de sulfat dimetilic, lent. Se închide ermetic eprubeta și se agită 2 sau 3 minute, punând frecvent fundul eprubetei într-o baie de aburi în fierbere: reacția este completă atunci când indicatorul își schimbă culoarea din albastru în galben. Se răcește eprubeta în curent de apă, apoi se deschide și se adaugă 5 ml din soluție metanolică de acid clorhidric.
5.3. După ce se agită timp de câteva secunde, se pune eprubeta într-o poziție înclinată, imprimându-i oscilații ușoare pentru a facilita nivelarea esterului metilic sub forma unei mase uleioase (nota A).
Se prelevează esterii metilici cu o seringă, se introduc într-o eprubetă cu fund conic, se adaugă un volum de alumină egal cu aproximativ un sfert din volumul esterilor metilici, se agită și se filtrează pe hârtie.
Nota A: În cazul în care separarea esterilor metilici nu se produce în mod spontan, se adaugă 5 ml de apă în eprubetă și se agită.
Metoda E
2. PRINCIPIU
Substanța grasă de analizat este încălzită cu ajutorul unui sistem cu reflux, cu metanol, hexan și acid sulfuric. Esterii metilici obținuți sunt extrași cu eter de petrol.
3. INSTRUMENTE
3.1. Eprubetă de aproximativ 20 ml, prevăzută cu un condensator cu reflux de aer, cu o lungime de 1 metru, cu îmbinări din sticlă rodată.
3.2. Pipetă gradată de 5 ml.
3.3. Pâlnie de decantare de 50 ml.
3.4. Eprubete gradate de 10 și de 25 ml.
3.5. Eprubetă de 15 ml, cu fund conic.
4. REACTIVI
4.1. Reactivi de metilare: metanol anhidru, hexan, acid sulfuric concentrat (d = 1,84), într-un raport de 75:25:1 (V/V/V).
4.2. Eter de petrol la 40–60 °C.
4.3. Sulfat de sodiu anhidru.
5. MOD DE LUCRU
5.1. În eprubeta de 20 ml, se introduc produsele care provin din placă și se adaugă 5 ml de reactiv de metilare.
5.2. Se adaptează condensatorul cu reflux și se încălzește timp de 30 minute într-o baie de aburi la temperatura de fierbere (nota 2).
5.3. Se transferă amestecul într-o pâlnie de decantare de 50 ml, cu ajutorul a 10 ml de apă distilată și 10 ml de eter de petrol. Se agită energic, se așteaptă separarea fazelor, se îndepărtează stratul apos și se spală stratul eterat de două ori cu 20 ml de apă distilată. Se adaugă în pâlnia de decantare o cantitate mică de sulfat de sodiu anhidru, se agită, se lasă câteva minute și se filtrează, se colectează apoi filtratul într-o eprubetă de 15 ml cu fund conic.
Se evaporă solventul în baie de aburi, într-un curent de azot.
Nota 1: Se pot prepara cu ușurință cantități mici de acid clorhidric gazos în laborator modificând soluția disponibilă în comerț (ρ = 1,18) prin adăugarea de câteva picături de acid sulfuric concentrat (ρ = 1,84). Gazul eliberat poate fi ușor uscat dacă se barbotează în acid sulfuric concentrat. Întrucât acidul clorhidric este rapid absorbit de metanol, se recomandă luarea de măsuri de precauție obișnuite la dizolvare, de exemplu prin introducerea gazului printr-o fiolă mică inversată a cărei margine să atingă suprafața lichidului. Soluția metanolică de acid clorhidric poate fi preparată în cantități mari în prealabil, pentru că se poate conserva perfect în sticle cu dop de sticlă păstrate la întuneric.
Nota 2: Pentru a controla fierberea, se introduce o baghetă de sticlă în eprubetă și se limitează temperatura băii de aburi la 90 °C.
ANEXA XI
DETERMINAREA CONȚINUTULUI DE SOLVENȚI HALOGENAȚI VOLATILI ÎN ULEIUL DE MĂSLINE
1. PRINCIPIU
Analiză prin cromatografie în fază gazoasă cu tehnica spațiului de cap (tehnica head space).
2. APARATURĂ
2.1. Aparat de cromatografie în fază gazoasă, dotat cu un detector cu captură de electroni (ECD).
2.2. Aparatură pentru spațiul de cap (tehnica head space).
2.3. Coloană de cromatografie în fază gazoasă din sticlă cu o lungime de 2 metri și un diametru de 2 mm, fază staționară. OV 101 la 10 % sau echivalent, impregnând un pământ cu diatomit calcinat, spălat cu acizi și silanizat, cu granulometrie de 80–100 Mesh.
2.4. Gaz vector și gaz auxiliar: azot pentru cromatografie în fază gazoasă, adaptată la detectarea prin captură de electroni.
2.5. Flacoane de sticlă de 10–15 mm dotate cu o garnitură de teflon și cu un dop de aluminiu și un orificiu care permite prelevarea cu seringa.
2.6. Pensă cu închidere ermetică.
2.7. Seringă pentru gaz de 0,5–2 ml.
3. REACTIVI
Standard: solvenți halogenați volatili cu un grad de puritate adecvat utilizării cromatografiei în fază gazoasă.
4. PROCEDURA DE ANALIZĂ
4.1. Se cântăresc cu grijă aproximativ 3 g de ulei într-un flacon de sticlă (a nu se reutiliza), se astupă flaconul până la închiderea ermetică. Se introduce flaconul într-un termostat la 70 °C timp de 1 oră. Se prelevează cu precizie cu ajutorul seringii un volum de 0,2–0,5 ml din tehnica head space. Se injectează în coloana aparatului de cromatografie în fază gazoasă reglat după cum urmează:
|
— |
temperatura injectorului: 150 °C; |
|
— |
temperatura coloanei: 70–80 °C; |
|
— |
temperatura detectorului: 200–250 °C. |
Pot fi utilizate și alte temperaturi, cu condiția ca rezultațele să fie echivalente.
4.2. Soluții etalon. Se prepară soluții etalon, utilizând ulei rafinat fără urmă de solvenți, cu concentrații variabile între 0,05 și 1 miligram pe kilogram și în raport cu conținutul presupus al mostrei. Diluarea eventuală trebuie să se efectueze cu pentan.
4.3. Evaluarea cantitativă. Se face raportul între suprafețele sau înălțimile valorilor de vârf ale mostrei și ale soluției etalon cu concentrația presupusă cea mai apropiată. În cazul în care abaterea relativă este mai mare de 10 %, trebuie să se refacă analiza prin compararea cu o nouă soluție etalon până când concentrația va respecta abaterea relativă menționată anterior. Conținutul este stabilit pe baza unei medii de injecții elementare.
4.4. Exprimarea rezultatelor. Rezultatele sunt exprimate în miligrame pe kilogram (ppm). Limita de detectare a metodei este de 0,01 mg pe kilogram.
ANEXA XII
EVALUAREA ORGANOLEPTICĂ A ULEIULUI DE MĂSLINE VIRGIN
1. OBIECT
Prezenta metodă are ca scop stabilirea criteriilor necesare pentru evaluarea caracteristicilor aromei uleiului de măsline virgin și elaborarea metodologiei necesare.
2. DOMENIU DE APLICARE
Metoda descrisă se aplică numai pentru evaluarea și clasificarea organoleptică a uleiului de măsline virgin pentru consumul direct. Metoda se limitează la clasificarea uleiului de măsline virgin pe o scară numerică stabilită în raport cu percepția stimulilor aromei acestuia, conform evaluării efectuate de către un grup de degustători selectați, care lucrează în comisie.
3. VOCABULARUL GENERAL DE BAZĂ AL ANALIZEI SENZORIALE
A se vedea capitolul „Analiza senzorială: vocabular general de bază”.
4. VOCABULARUL SPECIFIC PENTRU ULEIUL DE MĂSLINE
Amar: gust caracteristic uleiului obținut din măsline verzi sau în stadiul de pârguială. Poate fi mai mult sau mai puțin plăcut, în funcție de intensitate.
Aspru: senzație caracteristică anumitor uleiuri a căror degustare provoacă o reacție chinestezică buco-tactilă de astringență.
Castravete: aroma uleiului care se produce în urma unei condiționări ermetice prelungite în mod excesiv, în special în recipiente de tinichea, și care este atribuită formării a 2-6 nonadienal.
Copt sau ars: aromă caracteristică a uleiurilor, care provine din încălzirea excesivă și/sau prelungită în cursul obținerii acestora și în special în timpul malaxării termice a pastei, dacă se realizează în condiții necorespunzătoare.
Cu savoare de fruct copt: aromă a uleiului de măsline extras din fructe coapte, în general cu miros șters și cu savoare dulceagă.
De săpun: aromă care provoacă o senzație gustativ-olfactivă care se aseamănă cu cea a săpunului verde.
Drojdii: aromă caracteristică uleiului recuperat din sedimente decantate în teancurile și rezervoarele subterane.
Dulce: savoare plăcută a uleiului la care nu s-a adăugat zahăr în mod expres, în care nu predomină atributele amar, astringent și picant.
Fad sau stins: aromă de ulei de măsline ale cărui caracteristici organoleptice sunt foarte slabe în urma pierderii constituenților aromatici.
Fân: aromă caracteristică anumitor uleiuri care se aseamănă cu cea a ierbii mai mult sau mai puțin uscate.
Fructat: aromă care se aseamănă, în același timp, cu mirosul și gustul fructului sănătos și proaspăt, recoltat în stadiul optim de maturitate.
Frunze verzi (amar): aroma uleiului obținut din măsline prea verzi sau care au fost zdrobite împreună cu frunze și crenguțe.
Grosier: percepție caracteristică anumitor uleiuri a căror degustare provoacă o senzație buco-tactilă densă și păstoasă.
Iarbă: aromă caracteristică anumitor uleiuri care se aseamănă cu cea a ierbii proaspăt cosite.
Margini: aromă caracteristică dobândită de ulei în urma unei decantări insuficiente și a unui contact prelungit cu apele de vegetație.
Măr: aromă de ulei de măsline care se aseamănă cu cea a acestui fruct.
Metalic: aromă care se aseamănă cu cea a metalelor. Este caracteristică uleiului care a rămas mult timp în contact cu alimente sau cu suprafețe metalice, în condiții improprii, în cursul procesului de măcinare, de malaxare, de presare sau de stocare.
Migdală: această aromă poate să îmbrace două forme diferite: una tipică migdalei proaspete, alta specifică migdalei uscate și sănătoase care se poate confunda cu un început de rânced. Gustul extrem de special care rămâne este perceput atunci când uleiul rămâne în contact cu limba și cu palatul. Aroma este asociată uleiurilor dulci și cu miros stins.
Mucegai umed: aromă caracteristică uleiului de măsline obținut din măsline atacate de mucegaiuri și de drojdii în urma unei fermentări anaerobe a fructelor timp de mai multe zile în umiditate.
Pământ: aromă caracteristică uleiului obținut din măsline adunate cu pământ sau măsline noroioase și nespălate. În anumite cazuri, această aromă poate fi însoțită de cea de mucegai.
Putregai: aromă caracteristică uleiului din măsline care au fost supuse unui atac puternic al larvelor provenite de la musca de măsline (Dacus oleae).
Rânced: aromă caracteristică și comună tuturor uleiurilor și grăsimilor care au fost supuse unui proces de autooxidare, în urma unui contact prelungit cu aerul. Această aromă este neplăcută și ireversibilă.
Rogoz: aromă caracteristică uleiului obținut din măsline presate între rogojini împletite din rogoz nou. Aroma poate fi diferită în funcție de materialul folosit la fabricarea rogojinilor, adică rogoz verde sau rogoz uscat.
Saramură: aroma uleiului obținut din măsline conservate în soluții saline.
Săculeț: aromă caracteristică uleiului obținut din măsline presate în săculeții împletiți din fibre vegetale, impregnați cu reziduuri fermentate.
Stătut: aromă caracteristică uleiului extras din măsline adunate grămadă, într-o stare avansată de fermentație.
Resturi de măsline: aromă caracteristică ce se aseamănă cu cea a resturilor de măsline.
Ulei de mașină: miros de ulei de măsline obținut într-o fabrică de ulei al cărei echipament de extracție nu a fost supus acțiunii de eliminare corespunzătoare a reziduurilor de petrol, de grăsime sau de ulei mineral.
Vechi sau închis: aromă caracteristică uleiului atunci când rămâne prea mult timp în recipientele de stocare. Poate fi întâlnit și la uleiurile condiționate pe parcursul unei perioade de timp prelungite în exces.
Vin oțetit: aromă caracteristică anumitor uleiuri care se aseamănă cu cea de vin sau de oțet. Această aromă este datorată în principal formării acidului acetic, acetatului de etil și etanolului, în cantități mai mari decât cele normale în aroma uleiului de măsline.
5. PAHAR PENTRU DEGUSTAREA ULEIURILOR
A se vedea capitolul „Pahar pentru degustarea uleiurilor”.
6. SALA DE DEGUSTARE
Vezi capitolul „Ghid pentru instalarea unei săli de degustare”.
7. USTENSILE
Fiecare cabină trebuie să fie dotată cu ustensilele necesare care să se afle la îndemâna degustătorului pentru a-i permite să-și îndeplinească sarcina în mod corespunzător, de exemplu:
|
— |
pahare (standardizate) care conțin mostre marcate codificat cu două cifre luate la întâmplare sau cu cifre și litere. Inscripțiile se fac cu creion care nu se poate șterge și inodor; |
|
— |
capace de sticlă, având aceleași inscripții, pentru a acoperi paharele; |
|
— |
fișă de notare (a se vedea figura 2), completată cu instrucțiuni de folosire; |
|
— |
creion sau pix; |
|
— |
platouri cu felii de măr; |
|
— |
un pahar cu apă la temperatura ambiantă. |
8. METODOLOGIE
Această secțiune stabilește cunoștințele prealabile necesare pentru realizarea analizei senzoriale a uleiurilor de măsline virgine și încearcă să standardizeze conduita și modul în care procedează degustătorii care participă la teste, ținând seama atât de recomandările cu caracter general, cât și de recomandările specifice pentru degustarea uleiurilor de măsline.
8.1. Atribuțiile organizatorului comisiei sau responsabilului comisiei (sau ale comisiei de degustători)
Organizatorul comisiei trebuie să aibă o pregătire corespunzătoare, să fie un expert în toate tipurile de uleiuri de măsline pe care le va degusta în timpul testării. El este personalitatea de bază din comisie și are responsabilitatea organizării și funcționării acestuia. El îi convoacă din timp pe degustători și clarifică orice nelămuriri pe care le au degustătorii cu privire la desfășurarea testelor, dar nu le va sugera păreri cu privire la mostră.
El răspunde de inventarierea aparatului, se asigură că acesta este în stare corespunzătoare de curățenie, pregătește și alocă un cod mostrelor și le prezintă degustătorului în conformitate cu protocolul de degustare și, de asemenea, răspunde de colectarea și prelucrarea statistică a datelor obținute, astfel încât să se obțină rezultate optime cu un efort minim.
Activitatea responsabilului comisiei necesită capacitate senzorială, meticulozitate în pregătirea și aranjarea lor în ordine strictă, precum și aptitudini și răbdare pentru planificarea și efectuarea testelor. Responsabilul comisiei are datoria de a stimula moralul membrilor comisiei de degustători prin promovarea interesului, curiozității și spiritului competitiv. El nu trebuie să-și facă publică opinia și va preveni situația în care eventualii lideri își impun propriile criterii celorlalți degustători. De asemenea, el răspunde de pregătirea, selectarea și monitorizarea degustătorilor pentru a asigura că au capacitatea corespunzătoare.
8.2. Condițiile de testare
8.2.1. Volumul mostrei
Fiecare pahar trebuie să conțină 15 ml de ulei.
8.2.2. Temperatura de testare
Mostrele de ulei pentru degustat trebuie să fie menținute în pahare la o temperatură de 28 °C ± 2 °C. Această temperatură a fost reținută pentru că permite cel mai ușor evidențierea diferențelor organoleptice, la temperatură normală, atunci când uleiurile sunt utilizate drept condiment. Un alt motiv care justifică alegerea acestei valori constă în faptul că temperaturi mai scăzute sau mai ridicate produc o ușoară volatilizare a componentelor aromatice sau, dimpotrivă, volatile, caracteristice uleiurilor încălzite.
8.2.3. Orarul testelor
Pentru degustarea uleiurilor, orele optime de lucru sunt cele de dimineață: s-a dovedit că există perioade optime de percepție a gustului și mirosului în timpul zilei.
Înainte de mese sensibilitatea gustativ-olfactivă crește, în timp ce după mese percepția gustativ-olfactivă scade.
Cu toate acestea, criteriul menționat nu trebuie absolutizat în cazul în care foamea poate să distragă atenția degustătorilor, ceea ce diminuează capacitatea lor de departajare și îndeosebi criteriile de preferință și de acceptare.
9. DEGUSTĂTORII
Persoanele care au calitatea de degustători în testarea organoleptică a uleiurilor de măsline alimentare trebuie să fie pregătite și selectate în conformitate cu aptitudinile lor de a face deosebirea între mostre similare; trebuie să se țină seama de faptul că precizia se îmbunătățește datorită antrenamentului (a se vedea secțiunea la care se referă).
Pentru fiecare test trebuie să existe de la opt la doisprezece degustători. Cu toate acestea, trebuie să se prevadă câțiva degustători suplimentari care să poate fi folosiți în cazul unei eventuale absențe.
9.1. Recomandări generale pentru candidați și degustători
Aceste recomandări se referă la comportamentul candidaților și degustătorilor în timpul degustării.
Atunci când este chemat de către responsabilul comisiei să participe la testul organoleptic, degustătorul trebuie să fie în măsură să participe la ora stabilită și trebuie să respecte următoarele reguli:
9.1.1. Să se abțină de la fumat timp de cel puțin 30 minute înainte de ora stabilită pentru test.
9.1.2. Să nu folosească parfumuri, produse cosmetice sau un săpunuri al căror miros ar putea să persiste în momentul testului. Mâinile trebuie să fie spălate cu un săpun fără miros sau foarte puțin parfumat, apoi clătite și uscate ori de câte ori este necesar pentru a elimina orice miros.
9.1.3. Să nu mănânce nimic cu cel puțin o oră înaintea degustării.
9.1.4. În cazul unui disconfort fizic, în special dacă este afectat simțul mirosului sau al gustului sau dacă se află sub efectul unui impact psihologic care îl poate împiedica să se concentreze, degustătorul respectiv îl informează pe responsabilul comisiei pentru ca acesta să îl retragă din testare ori să ia deciziile corespunzătoare, luând în considerare eventuala deviere din punct de vedere al valorilor medii a celorlalți membri ai comisiei.
9.1.5. După îndeplinirea celor menționate, degustătorul își ocupă locul în cabina care i-a fost atribuită, într-un mod cât mai ordonat și silențios.
9.1.6. După ce s-a așezat, trebuie să verifice dacă dispune de materialul necesar și dacă acesta este pregătit și verifică dacă inscripționarea de pe pahar corespunde cu cea de pe paharul martor.
9.1.7. Trebuie să citească atent instrucțiunile care figurează pe fișa de notare și să înceapă examinarea mostrei numai după ce îi este foarte clar ce are de făcut. În cazul unor nelămuriri, trebuie să se adreseze responsabilului comisiei pentru a discuta dificultățile întâlnite.
9.1.8. Degustătorul trebuie să ia paharul, ținându-l acoperit cu capacul de sticlă, apoi să îl încline încet, și în această poziție să răsucească paharul pentru a umezi interiorul acestuia pe o suprafață cât mai mare. După această operațiune, trebuie să scoată capacul de sticlă și să miroasă mostra cu inspirări suave, lente și intense, pentru a-și putea face un criteriu privind mostra pe care trebuie să o evalueze. Perioada olfactivă nu trebuie să depășească 30 de secunde. Dacă în acest timp degustătorul nu a ajuns la nici o concluzie, trebuie să facă o pauză înainte de a trece la o nouă încercare. După încheierea testului olfactiv se trece la evaluarea aromei (ansamblul de senzații gustativ-olfactiv-tactile). În acest scop, se ia o mică înghițitură de ulei, de aproximativ 3 ml. Este foarte importantă distribuirea uleiului în toată cavitatea bucală, de la partea anterioară a gurii și limbii, trecând prin părțile laterale și partea posterioară până la vălul palatului; după cum se știe, cele patru gusturi fundamentale (dulce, sărat, acid și amar), sunt practic percepute cu o intensitate variabilă în funcție de diferitele zone ale limbii și ale palatului.
Trebuie să se insiste asupra necesității de a răspândi uleiul în cantități suficiente și foarte lent în partea posterioară a limbii până la vălul palatului și spre gât, concentrând atenția asupra ordinii apariției stimulilor amar și picant; dacă nu se procedează astfel, la anumite uleiuri cei doi stimuli pot trece neobservați sau stimulul amar poate fi mascat de stimulul picant.
Aspirații scurte și succesive, lăsând aerul să pătrundă prin gură, permit nu numai răspândirea mostrei în toată cavitatea bucală, dar și perceperea pe cale retro-nazală a componenților volatili aromatici.
Senzația tactilă trebuie, de asemenea, luată în considerare. Astfel, fluiditatea gradul de umflare și mâncărimea sau înțepătura trebuie notate în momentul detectării și, dacă testul impune acest lucru, trebuie să se cuantifice intensitatea acestora.
9.1.9. Evaluarea organoleptică a uleiului de măsline virgin trebuie să se facă pe o singură mostră pe ședință, pentru a se evita efectele de contrast pe care le-ar putea determina degustarea imediată a altor mostre.
Având în vedere că degustările succesive sunt afectate de oboseală sau de pierderea acuității, cauzate de degustările precedente, trebuie să se utilizeze un produs capabil să elimine din gură resturile de ulei de la degustarea tocmai efectuată.
Se recomandă utilizarea unei bucățele de măr de aproximativ 15 g care, după mestecare, poate fi aruncat în scuipătoare. În continuare, se clătește gura cu puțină apă la temperatura ambiantă. Se lasă să treacă cel puțin 15 minute înainte de a începe o nouă degustare.
9.2. Preselecția candidaților
Această etapă este derulată de organizatorul comisiei care îi intervievează personal pe candidați pentru a se familiariza cu personalitatea acestora și cu mediul de lucru. Condițiile fiziologice și psihologice care trebuie îndeplinite nu sunt foarte riguroase întrucât, teoretic vorbind, orice persoană normală poate desfășura această activitate. Factori precum vârsta, sexul, obiceiurile specifice (fumatul) etc. se află în prezent pe plan secund față de alte aspecte precum: sănătatea, interesul personal și timpul disponibil pentru acest gen de activitate.
În timpul interviului, organizatorul comisiei trebuie să explice candidatului caracteristicile funcției pe care o va asigura și să îi spună, aproximativ, cât timp îl va ține ocupat. În continuare, organizatorul comisiei trebuie să obțină din partea candidatului datele care să îi permită să evalueze atât interesul, cât și motivația acestuia, cerându-i să indice cât timp va putea să dedice efectiv acestei activități. Chestionarul următor poate servi drept referință.

Organizatorul comisiei efectuează preselecția pe baza datelor astfel culese. Candidații care dovedesc un interes redus pentru o astfel de activitate, care au timp puțin la dispoziție sau sunt incapabili să își precizeze ideile sunt eliminați.
9.3. Determinarea „pragului mediu” al grupului pentru „atributele caracteristice”
Se aleg cu grijă patru uleiuri, astfel încât fiecare dintre acestea să fie considerat reprezentativ pentru atributele: fermentat, oțetit, rânced și amar, cu o intensitate cât mai marcată și netă posibil.
Se prelevează o parte alicotă din fiecare dintre uleiurile menționate și se prepară mostre cu diferite concentrații (motivul 2) prin diluări succesive folosind suportul adecvat până când, la ultimele două sau trei diluări, nu mai este posibilă detectarea diferenței față de paharul care conține numai suportul. Un ultim cuplu trebuie să fie format din două pahare care conțin suportul.
Seria trebuie să fie completă cu pahare cu concentrații mai mari, până la opt în total.
Se prepară o cantitate suficientă de mostre cu diferite concentrații pentru a putea prezenta fiecărui candidat serii complete ale fiecărui atribut.
Pentru a putea stabili „pragul mediu” al candidaților față de fiecare atribut, trebuie să li se prezinte un pahar ce conține 15 ml din una dintre concentrațiile preparate, precum și un pahar ce conține numai 15 ml de „suport”. După realizarea testului, candidatul trebuie să indice dacă în pahare este un conținut identic sau diferit.
Se repetă același test în ceea ce privește concentrațiile rămase ale atributului studiat.
Se notează numărul de răspunsuri corecte obținute pentru fiecare concentrație, din numărul total al candidaților, și se exprimă în procente din numărul testelor efectuate.
Se reprezintă în ordine crescătoare, pe abscise, concentrațiile testate și, pe ordonate, procentajul identificărilor corecte efectuate pentru fiecare concentrație.
Figura 1 prezintă un exemplu practic al acțiunile anterioare. Pragul de detectare este definit pe abscise prin extrapolarea de la curbă la punctul ordonatei care corespunde procentului de 75 % de răspunsuri exacte.
Această concentrație „prag” care poate fi diferită pentru fiecare ulei de plecare, deoarece este o funcție a intensității atributului prezent, trebuie să fie similară pentru diferitele grupe de candidați din diferite comisii; nu este tributară nici unei cutume, obișnuințe sau preferințe tendențioase. În consecință, există un punct de reper comun oricărui grup uman normal care poate servi la omogenizarea diferitelor comisii numai pe baza acuității gustativ-olfactive.
Pornind de la concentrația „prag” a grupului astfel obținută, se procedează după cum urmează.
Se prepară o serie de concentrații crescătoare și descrescătoare astfel încât această „concentrație prag” să se situeze pe treapta 10 a acestei scări. Prin urmare, concentrațiile 11 și 12 vor fi mai diluate și, în consecință, va fi foarte dificilă detectarea prezenței uleiului cu atributul ales în cazul acestor concentrații.
Pornind de la concentrația C10, mostrele rămase pot fi preparate prin aplicarea următoarei formule:
C10 × an, în care: „a” este o constantă care corespunde factorului de diluare egal cu 1,5 și „n” exponentul care variază de la 9 la –2.
De exemplu: în cazul în care pragul obținut pentru uleiul rânced este de 0,32, atunci când C10 este de 0,32 și având în vedere că „a” este 1,5, seria mostrelor va avea următoarele concentrații:
|
Mostră |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
|
Concentrație |
12,30 |
8,20 |
5,47 |
3,65 |
2,43 |
1,62 |
1,08 |
0,72 |
0,48 |
0,32 |
0,21 |
0,14 |
Dacă se procedează în același fel pentru celelalte trei atribute, pornind de la pragurile respective calculate conform celor indicate anterior, vom obține scări care vor prezenta, pentru toate laboratoarele, intensități aromatice similare pentru fiecare stimul, chiar dacă uleiurile de plecare au defecte perceptibile la intensități diferite.
9.4. Selectarea degustătorilor prin metoda „clasificării intensității”
Selecția trebuie să se facă pornind de la un număr de candidați de două sau de trei ori mai mare decât cel considerat necesar pentru constituirea echipei de degustători, pentru a facilita alegerea celor mai sensibili candidați sau a celor care fac dovada unei capacități de diferențiere mai accentuate. Se recomandă, în orice caz, realizarea testelor cu același produs care va fi analizat ulterior (în acest caz, trebuie să se utilizeze întotdeauna ulei de măsline).

La alegerea metodei, trebuie să se țină seama, independent de eficacitatea acesteia, de faptul că procedura care se va aplica trebuie să fie cea mai economicoasă din punctul de vedere al cantității de ulei, al numărului de mostre de utilizat și al timpului rezervat selecției. Eficacitatea unei proceduri de selecție se caracterizează prin alegerea unor nivele optime ale celor trei variabile dependente menționate în continuare: (a) „costul” determinat de numărul testelor; (b) „proporția” candidaților potențial apți, dar care, din întâmplare, au fost eliminați din nefericire cu ocazia selecției și (c) „proporția” candidaților inapți, dar care, printr-o întâmplare favorabilă, au fost acceptați, deși n-ar fi trebuit să fie.
Procedura de selecție reținută este cea descrisă la titlul „The intensity rating test” (test de clasificare a intensității) din normele A.S.T.M. (American Society for Testing and Materials Publication), S.T.P. (Special Technical Publication) nr. 440, p. 53, modificată în patru puncte:
|
1. |
reducerea numărului de mostre din serie; |
|
2. |
extinderea stimulilor, având ca efect creșterea numărului de notări gustativ-olfactive pe care se bazează selecția, din dorința de a le adapta defectelor celor mai des întâlnite în uleiul de măsline; |
|
3. |
variația relației de concentrație din serie; |
|
4. |
prelucrarea statistică a rezultatelor. Materialul necesar
|
9.4.1. Mod de lucru
După prepararea diluărilor, se trece la selecție începând cu douăzeci și cinci de candidați, conform metodologiei care va fi explicată în continuare pentru fiecare stimul:
|
1. |
Se prepară serii de douăsprezece pahare pentru degustare, marcate cu cod (o serie pe candidat). Se toarnă în fiecare pahar 15 ml din fiecare dintre diferitele concentrații, preparate după formula C10 × an. |
|
2. |
După ce au fost umplute și acoperite cu capacul de sticlă, paharele trebuie să rămână în sala de degustare la o temperatură de 20–22 °C timp de cel puțin o oră înaintea începerii testelor pentru omogenizarea temperaturii lor cu temperatura ambiantă. |
|
3. |
Responsabilul cu testele va alinia apoi cele douăsprezece pahare din fiecare serie, în ordine descrescătoare a concentrației. Apoi, fiecare candidat este invitat să realizeze testul separat, respectând instrucțiunile menționate în continuare. |
9.4.2. Instrucțiuni pentru candidat
Cele douăsprezece pahare aranjate în linie în fața candidatului conțin diluări din fiecare dintre stimulii fermentat, oțetit, rânced sau amar, după caz. Paharele se disting unele de altele prin intensitatea mirosului, cu precizarea că cel cu mirosul cel mai intens este plasat în partea stângă, intensitatea mirosului paharelor rămase scăzând treptat spre dreapta. Ultimul pahar din dreapta poate prezenta un miros atât de atenuat, încât ar putea fi imposibil de detectat.
Procedați după cum urmează: familiarizați-vă cu mirosurile degajate de paharele din serie. În acest sens, începeți cu cel din dreapta (nr. 12) și încercați să rețineți intensitatea mirosurilor, fără a vă obosi.
Din momentul în care considerați că v-ați obișnuit cu scara de concentrație a mirosurilor degajate de paharele din serie, ieșiți din încăpere.
În acest timp, responsabilul cu testele alege un pahar din serie și îl plasează la același nivel cu ultimul din dreapta (nr. 12) apropiind paharele rămase pentru a umple golul lăsat de cel ales. Întoarceți-vă în încăpere pentru a continua testul.
Proba care vi se cere este următoarea:
Paharul care a fost ales de responsabilul cu testele trebuie să fie reașezat la locul său exact din serie. În acest scop, puteți să mirosiți și să comparați cu paharele rămase de câte ori este nevoie, având în vedere că în cazul în care doriți să reașezați paharul la locul său exact din serie, nu trebuie să uitați că mirosul pe care îl degajă trebuie să fie mai intens decât cel din paharul plasat imediat la dreapta și mai puțin intens decât cel din paharul plasat imediat la stânga. Testul se repetă cu încă trei pahare diferite.
Pentru a facilita operațiunea și colectarea răspunsurilor, fiecare candidat trebuie să primească, pe lângă instrucțiunile menționate anterior, următoarea listă.

9.4.3. Obținerea rezultatelor
Pentru a facilita punerea în ordine a datelor fiecărui candidat, organizatorul comisiei trebuie să-i noteze în felul următor:

9.4.4. Procedura statistică de notare
În cazul special al selecției efectuate, paharele care trebuie să fie repuse în locul lor exact trebuie să fie aceleași pentru candidați. În conformitate cu calculele statistice realizate în acest sens, aceste pahare corespund, în ordinea seriei, locurilor menționate în continuare pentru fiecare stimul:
|
Stătut (Ch) |
Oțetit (Vi) |
Rânced (Ra) |
Amar (Am) |
|
Nr. pahar |
Nr. pahar |
Nr. pahar |
Nr. pahar |
|
(10, 5, 7, 2) |
(11, 3, 8, 6) |
(7, 4, 10, 2) |
(6, 3, 11, 9) |
Numărul corespunzător locului ocupat de pahare în ordinea seriei nu poate fi modificat, dat fiind faptul că calculele statistice pentru acest test au fost realizate ținând seama de probabilitatea că paharele indicate sunt înlocuite la locul lor exact în mod aleator.
Cu toate acestea, pentru a evita filtrarea informațiilor de la un candidat la altul, organizatorul comisiei trebuie să se asigure că:
|
1. |
împiedică orice comunicare între candidați. Se modifică codul pentru fiecare candidat; |
|
2. |
locul ocupat de paharele care au fost retrase nu este cunoscut de către candidați; |
|
3. |
modifică ordinea paharelor, la fiecare candidat, chiar dacă acestea sunt aceleași pentru toți. |
Fiecare candidat va primi apoi o notare în funcție de rezultatele pe care le va obține. În acest scop, se procedează astfel:
Se notează cu ei 1, ei 2, … ei 12 cele douăsprezece pahare care conțin concentrații corespunzătoare unui stimul „i” (i = oricare dintre cei patru stimuli: fermentat, oțetit, rânced și amar), aliniate în ordine descrescătoare intensității stimulului luat în considerare.
Se notează cu ei k unul dintre paharele alese și cu K′ poziția pe care candidatul o va atribui paharului în momentul repunerii în serie. Valorile K și K′ sunt, prin urmare, numere întregi cuprinse între 1 și 12 inclusiv, care corespund pozițiilor reale și respectiv atribuite de candidat.
Se notează cu T (abaterea maximă admisă) o valoare, stabilită în prealabil, în cazul nostru egală cu 3, astfel încât, dacă (K′ – K) > T, candidatul este automat eliminat (2).
Dimpotrivă, în cazul în care (K′ – K) ≤ T, candidatul, în principiu, nu este eliminat și poate, în consecință, să continue testul, deoarece s-a dovedit a fi capabil să repună stimulul luat în considerare la locul său exact sau cel puțin în locurile din imediata apropiere.
În acest caz, notarea atribuită unui candidat la evaluarea unui stimul (concentrație) determinat, de exemplu seria „stătut” (Ch), este egală cu valoarea pătrată a diferenței dintre numărul de ordine care corespunde locului exact ocupat de pahar în serie și celui în care a fost repus de candidat, adică:
Ph (Ch) = (K′ – K)2
Dat fiind faptul că această operațiune trebuie să fie realizată de fiecare candidat pe patru concentrații din seria fiecărui stimul, notarea parțială pentru fiecare stimul menționat (Ch, de exemplu) ar fi următoarea:
ZCh = PCh h + PCh j + PCh 1 + PCh m
Pentru o mai bună înțelegere, iată următoarele exemple:
|
|
Exemplul nr. 1: Să presupunem că răspunsurile candidatului A, în ceea ce privește cele patru concentrații ale stimulului (i) care au fost retrase din serie, sunt următoarele:
|
|
|
Exemplul nr. 2: Să presupunem că un alt candidat repune cele patru concentrații ale stimulului luat în considerare după cum urmează:
Acest candidat nu este eliminat, notarea lui privind acest stimul fiind: Zi = O2 + O2 +32 + (–1)2 = 10 Notarea finală a candidatului în sensul selecției sale sau nu ca degustător în funcție de răspunsurile sale cu privire la cei patru stimuli luați în considerare se prezintă după cum urmează:
în care:
|
Se determină în continuare valoarea maximă a lui Z până la care se poate considera existența unui nivel de percepție, de memorie olfactivă și de organizare mentală corespunzător pentru ca acest candidat să dea răspunsul adecvat cu privire la cei patru stimuli luați în considerare. În orice caz, Z nu este niciodată o valoare negativă și Z = 0 arată că respectivul candidat a recunoscut și cuantificat corect ansamblul de șaisprezece intensități care i-au fost prezentate (patru pentru fiecare stimul). Valorile lui Z diferite de 0 indică faptul că candidatul a recunoscut zonele scării pe care se situează intensitățile alese, dar că, in interiorul acestor zone, nu a fost în măsură să repună stimulii la locul lor exact deoarece nu are o bună capacitate de discriminare, asociate gamei de intensități care i-a fost prezentată pentru unul sau mai mulți dintre stimulii luați în considerare.
Astfel, trebuie să se determine valoarea critică Z, astfel încât, în ipoteza în care candidatul repune toate paharele la întâmplare în interiorul zonelor pe care le-a recunoscut în prealabil, probabilitatea notării definitive Z, mai mică decât Z0, să fie o cantitate suficient de mică (α) care poate fi stabilită în prealabil. Altfel spus, trebuie să se asigure că probabilitatea, prin acest procedeu, de a selecționa un degustător pentru comisie nu îndeplinește condițiile de discriminare suficiente pentru intensitățile stimulilor utilizați în sensul selecției, este mai mică decât α.
O dată fixată valoarea α (în cazul nostru 0,05), obținerea lui Z0 depinde de distribuirea probabilității variabilei Z, care depinde la rândul ei de distribuțiile probabilității variabilelor p (K′).
După efectuarea calculelor statistice corespunzătoare, valoarea obținută pentru Z0 este egală cu 34.
După obținerea notării Z pentru toți candidații, cei care au o notare mai mare de 34 trebuie să fie eliminați.
A se vedea, drept exemplu, notările candidaților A și B:
|
Stimul |
Candidat A |
Candidat B |
|
Stătut (Ch) |
ZCh = 10 |
ZCh = 12 |
|
Oțetit (Vi) |
ZVi = 10 |
ZVi = 11 |
|
Rânced (Ra) |
ZRa = 10 |
ZRa = 15 |
|
Amar (Am) |
ZAm = 4 |
ZAm = 0 |
|
|
Σ = 34 |
Σ = 38 |
Deoarece valorile lui Z pentru cei doi candidați luați în considerare sunt de 34, respectiv 38, candidatul A va fi reținut, în timp ce candidatul B va fi eliminat. După eliminarea tuturor candidaților care au obținut o notare mai mare de 34, cei rămași sunt clasificați în funcție de valorile Z până la completarea echipei de doisprezece candidați pe care dorim să îi avem.
9.5. Antrenamentul
Antrenamentul are ca obiectiv fundamental:
|
(a) |
familiarizarea degustătorilor cu multiplele variante gustativo-olfactiv-tactile pe care le oferă uleiurile de măsline; |
|
(b) |
familiarizarea degustătorilor cu metodologia senzorială specifică; |
|
(c) |
creșterea abilității individuale de a recunoaște, identifica și cuantifica stimulii senzoriali și |
|
(d) |
îmbunătățirea acuității și memoriei în privința diferiților stimuli luați în considerare, pentru a ajunge la evaluări consecvente. |
Perioada de antrenament constă de obicei într-o serie de ședințe, în funcție de posibilitățile echipei și ale studiului, în cursul cărora, după analiza individuală a uleiurilor, degustătorii discută împreună cu organizatorul comisiei dificultățile întâlnite și comentează calificativele în vederea unificării criteriilor și a opiniilor.
Nivelul de antrenament atins după un număr dat de ședințe este evaluat prin evidențierea creșterii procentului de răspunsuri exacte, în cazul în care se utilizează teste de discriminare, sau prin analiza variațiilor calificărilor individuale medii ale grupului, în cazul testelor efectuate cu ajutorul unei scări.
Utilitatea practică a acestei perioade de antrenament a fost amplu discutată, dar în prezent este considerată foarte eficace și chiar indispensabilă în cazul în care dorim să dispunem de datele senzoriale exacte și precise.
9.6. Controlul
Echipele de degustători veterani realizează de obicei degustări regulate și urmate de teste senzoriale care necesită mari eforturi din partea lor. Discuțiile prezintă o mare importanță tehnologică și comercială care depinde deseori de evaluările lor și astfel, după ce au fost selectați și bine antrenați, degustătorii trebuie să fie supuși unor controale care trebuie să garanteze fiabilitatea rezultatelor.
În orice caz, după constituirea comisiilor și supunerea acestora la teste de rutină, trebuie să se controleze în mod regulat „performanța” acestora la intervale adecvate.
10. PROCEDURA CARE TREBUIE RESPECTATĂ LA EVALUAREA ORGANOLEPTICĂ A ULEIULUI DE MĂSLINE VIRGIN
De la îndeplinirea condițiilor indicate în normele menționate anterior, disponibilitatea mijloacelor necesare și selecția grupului de degustători, fiecare dintre ei trebuie să miroasă, apoi să deguste (4) uleiul supus examinării, aflat în paharul de degustat, pentru a putea analiza percepțiile olfactive, gustative, tactile și chinestezice cu ajutorul fișei din figura 2, pe care trebuie să noteze prezența și valoarea pe care o atribuie intensității acestor percepții. În continuare, trebuie să treacă la faza de notare a calității uleiului.
10.1. Utilizarea fișei de la figura 2 (descrierea aromei și notarea calității)
În partea stângă a fișei se află unele dintre percepțiile senzoriale cele mai caracteristice pe care le regăsim cel mai adesea la uleiurile de măsline și care descriu aroma. În cazul în care se percep alți stimuli care nu corespund calificativelor enumerate, degustătorul trebuie să le noteze la rubrica „altele” folosind calificativul sau calificativele care le descriu cel mai precis.
Stimulii perceptibili trebuie să fie evaluați proporțional cu intensitatea prin indicarea unui semn (+) în rubrica corespunzătoare, conform următorului criteriu:
|
1 |
: |
abia perceptibil |
|
2 |
: |
slab |
|
3 |
: |
mediu |
|
4 |
: |
mare |
|
5 |
: |
extrem |
În partea dreaptă a fișei se află o scară de la 1 la 9 (9 pentru calitate excepțională și 1 pentru cea mai proastă calitate), care trebuie utilizată de degustător pentru a da o notare unică, de ansamblu, caracteristicilor uleiului. Această notare trebuie să fie în conformitate cu calitățile și defectele identificate în ulei și evidențiate deja în partea stângă a fișei.
Prima coloană (defecte) a tabelului de notări cuprinde cinci rubrici, în consecință, clasificarea uleiurilor trebuie să se bazeze în principal pe absența totală sau prezența aromelor defectuoase, precum și pe gravitate sau intensitate mai mare sau mai puțin mare a defectelor. Cu toate acestea, deoarece scara de evaluare are 9 puncte, trebuie să se țină seama de anumite nuanțe sau aspecte, descrise în a doua coloană „caracteristici”, care contribuie definitiv la luarea unei decizii privind notarea totală a calității.
10.2. Notarea finală
Organizatorul comisiei trebuie să adune fișele completate ale fiecărui degustător pentru a verifica dacă atributele senzoriale și intensitățile cu care le-a perceput și notat în „fișa de profil” corespund cu evaluarea atribuită uleiului în „tabelul de notare”. În cazul unei diferențe mari, organizatorul trebuie să ceară degustătorului să revizuiască fișa de notare.
Dacă este necesar, degustătorul trebuie să repete testul.
În final, organizatorul comisiei trebuie să treacă la introducerea în tabel a notărilor întregului grup și la calcularea mediei aritmetice și erorii-tip (a mediei) ce rezultă.
În cazul în care eroarea-tip este mai mare decât eroarea metodei, trebuie să repete testul pentru întregul grup. Grupul trebuie să repete testul până la obținerea a trei evaluări pe mostră numai în cazul unei analize de revizuire. Notarea finală este rezultanta mediei celor trei notări date, cu o zecimală.
În cazul în care valoarea intensității medii a amarului și/sau picantului este mai mare decât 2,5, uleiul trebuie să primească notarea corespunzătoare, adăugând că acesta este extrem de amar și/sau picant.
Exprimarea rezultatelor: organizatorul comisiei, pe baza notării medii, determină categoria în care intră mostra, conform limitelor prevăzute în anexa I. Raportul de analiză indică numai această categorie.
Notă: Mostrele trebuie să fie păstrate în recipiente închise și la frigider până în momentul analizei și trebuie să fie repuse la loc până la completarea celor trei evaluări.
Figura 2
Ulei de măsline virgin
|
|
|
ANALIZA SENZORIALĂ: VOCABULAR GENERAL DE BAZĂ
1. OBIECT
Prezenta normă are ca obiect colectarea termenilor generali utilizați pentru analiza senzorială și furnizarea definiției acestora.
2. Vocabular
2.1. Terminologia generală
Analiza senzorială (subst.):
examen al proprietăților organoleptice ale unui produs cu ajutorul organelor de simț.
Percepție (subst.):
luarea la cunoștință senzorială a obiectelor sau evenimentelor exterioare.
Organoleptic (adj.) (caracter sau proprietate):
califică orice proprietate a unui produs perceptibil cu ajutorul organelor de simț.
Expert (subst.):
(în ceea ce privește examenul caracteristicilor organoleptice)
degustător specializat în analiza senzorială a unui produs determinat care deține cunoștințe fundamentale în materie de elaborare a produsului menționat și a preferințelor pieței.
Degustător (subst.):
persoană perspicace, sensibilă, selecționată și antrenată care evaluează caracteristicile organoleptice ale unui produs alimentar cu organele sale de simț.
Comisie (subst.):
grup de degustători care au fost supuși unei selecții și unui antrenament speciale, care se reunește pentru a efectua, în condiții controlate, analiza senzorială a produsului.
Senzație (subst.):
fenomen subiectiv rezultat al stimulului unui sistem senzorial. Acest fenomen este subiectiv discriminatoriu sau obiectiv definitoriu cu ajutorul organului senzorial luat în considerare, în funcție de natura sau calitatea stimulului, precum și de intensitatea sa.
Acuitate (subst.):
aptitudinea organelor senzoriale de a percepe calitativ și cantitativ un stimul de slabă intensitate sau diferențe ușoare între stimuli. În franceză, acest termen este diferit de termenul „sensibilitate”, care nu se referă la nivelul aptitudinii.
Degustare (subst.):
operațiune care constă în a percepe, analiza și judeca caracteristicile organoleptice și, în special, caracteristicile gustativ-olfactive, tactile și chinestezice ale unui produs alimentar.
Acceptare (subst.):
act ce constă, pentru un individ sau o populație, în primirea favorabilă a unui produs.
Armonie (subst.):
calitatea unui produs care provoacă o senzație generală plăcută. Această senzație este datorată percepției constituenților unui produs sub formă de stimuli gustativo-olfactivi, tactili și chinestezici, având în vedere raporturile lor de concentrație adecvate.
Acceptabilitate (subst.):
starea unui produs primit în mod favorabil de un individ sau o populație, în funcție de proprietățile sale organoleptice.
Discriminare (subst.):
diferențiere calitativă și/sau cantitativă între doi sau mai mulți stimuli.
Compensare (subst.):
rezultat al interacțiunii consecutive la un ansamblu de stimuli, astfel încât fiecare dintre ei să fie perceput mai puțin intens decât la perceperea izolată.
Aspect (subst.):
ansamblu de caracteristici organoleptice percepute de organul vederii: dimensiune, formă, culoare, conformație, turbiditate, limpiditate, fluiditate, spumă și efervescență. Acest termen se utilizează de preferință la „formă exterioară”.
Atribut (subst.):
proprietate caracteristică perceptibilă.
2.2. Terminologie referitoare la fiziologie
Stimul (subst.):
agent fizic sau chimic care produce în mod specific răspunsul receptorilor senzoriali externi sau interni (pl.:stimuli).
Gust (subst.):
(simțul gustului)
simțul ai cărui receptori se află în gură, în special pe limbă, și sunt activați de diferiți compuși în soluție.
Gustativ (adj.):
califică proprietatea unui produs capabil să stimuleze aparatul gustativ prin trezirea simțurilor corespunzătoare uneia sau mai multor dintre cele patru gusturi fundamentale: dulce, sărat, acid și amar.
Receptor (subst.):
structură specializată a unui organ senzorial excitabil, capabil să primească un stimul și să îl transforme în influx nervos.
Notă: Receptorii sunt clasificați în funcție de tipul de energie asociată stimulului (lumină, căldură, sunet etc.).
Olfacție (subst.):
funcție a organului olfactiv, în vederea percepției și discriminării moleculelor care pătrund, în fază gazoasă, din exterior, pe cale nazală directă sau indirectă.
Intensitate (subst.):
grad de energie al unei calități măsurabile cu ajutorul unei scări cantitative de valori superioare valorii-prag.
Adaptare senzorială (subst.):
modificarea temporară a acuității pentru perceperea stimulilor senzoriali, în urma unei expuneri continue și repetate la același stimul sau la un stimul asemănător.
Inhibare (subst.):
lipsa răspunsului unui organ senzorial sau a unei părți a acestui organ, în ciuda faptului că este supus acțiunii unui stimul adecvat cu o intensitate superioară intensității-prag.
Răspuns (subst.):
acțiune prin care celulele senzoriale răspund la cea a unuia sau mai multor stimuli care se referă la o modalitate senzorială definită.
Corp (subst.):
senzație tactilă percepută în gură care conferă un grad de densitate, de viscozitate, de consistență sau de compactitate a unui produs alimentar.
Mireasmă (subst.):
miros proaspăt, suav și delicios.
A mirosi (verb):
(simț activ aplicat simțului mirosului).
Desemnează acțiunea de a percepe un miros. Sinonimul este „odorer” (a simți un miros) (în franceză, acest verb, deși rar folosit, poate fi considerat ca fiind sinonim).
Obiectiv (adj.):
|
(a) |
califică senzația provocată de reprezentarea reală și verificabilă a obiectului, reducând la minimum factorii umani (de exemplu preferința, obișnuința, afectivitatea); |
|
(b) |
califică tehnica ce permite, prin intermediul metodelor senzoriale sau instrumentale, reducerea la minimum a erorilor personale. |
Notă: Folosirea, ca sinonim, a termenului „instrumental” nu este recomandată.
Subiectiv (adj.):
califică senzația provocată de o percepție, condiționată de gândirea sau de sentimentele fiecăruia, nu numai de stimuli.
Chinestezie:
ansamblu de senzații care rezultă dintr-o presiune aplicată mostrei printr-o mișcare în cavitatea bucală sau cu degetele (de exemplu, presiunea degetelor în cazul brânzei).
Prag (subst.):
Prag absolut:
valoare minimă a unui stimul senzorial necesar:
|
— |
la suscitarea unei senzații (prag de apariție sau de detectare) sau |
|
— |
la recunoașterea senzației percepute (prag de identificare). |
Prag diferențial:
valoare minimă a unui stimul senzorial care determină o diferență perceptibilă în intensitatea senzației.
Prag final:
valoarea maximă a unui stimul deasupra căreia nu mai există diferență perceptibilă în intensitatea senzației.
Prag preferențial:
valoare cantitativă minimă a unui stimul sau valoare critică supra-liminară a acestui stimul ce corespunde apariției unui răspuns de atracție sau de respingere față de un stimul neutru, de exemplu, în alegerea dintre o soluție zaharată și apă.
Notă: Trebuie să se facă distincția între pragul absolut de preferință și pragul diferențial de preferință.
Intraliminar (adj.):
califică un stimul care se situează sub pragul absolut.
Supraliminar (adj.):
califică un stimul care se situează deasupra pragului absolut.
Oboseală senzorială:
formă de adaptare senzorială ce corespunde unei diminuări a acuității.
Compensare (subst.):
rezultat al interacțiunii consecutive la un ansamblu de stimuli, astfel încât fiecare dintre ei să fie perceput mai puțin intens decât la perceperea izolată.
Sinergic (adj.):
efect sau acțiune conjugată a substanțelor determinate, astfel încât intensitatea caracteristicilor organoleptice ce rezultă din asocierea lor să fie mai mare decât cea care este așteptată prin simpla adăugare a intensităților fiecăreia, luate separat.
Efect de contrast:
mărirea răspunsului la diferențele dintre doi stimuli simultani sau consecutivi.
Inversul efectului de convergență.
Efect de convergență:
diminuarea răspunsului la diferențele dintre doi stimuli simultani sau consecutivi. Inversul efectului de contrast.
2.3. Terminologie referitoare la proprietățile organoleptice
Acid (adj.):
|
(a) |
califică savoarea elementară provocată de soluții apoase diluate a marii majorități a acizilor (de exemplu, acid citric, lactic și tartric); |
|
(b) |
califică proprietatea substanțelor pure sau a amestecurilor a căror degustare provoacă această savoare. |
Substantivul corespunzător este aciditate.
Acru (adj.):
califică senzația gustativă-olfactivă, predominând în general acizii de origine fermentativă, precum și produsele alimentare care produc această senzație.
Anumiți factori ce contribuie la această senzație sunt legați de procesul de fermentare, de exemplu fermentare acetică sau lactică, a unui produs alimentar.
Amară (savoare) (adj.):
|
(a) |
califică savoarea elementară provocată de soluții apoase diluate de diverse substanțe, precum chinina, cafeina și a substanțelor heterozide determinate; |
|
(b) |
califică proprietatea substanțelor pure și a amestecurilor a căror degustare provoacă această savoare. |
Substantivul corespunzător este amăreală.
Sărată (savoare) (adj.):
|
(a) |
senzație caracteristică percepută prin simțul gustului; cea provocată de o soluție de clorură de sodiu este exemplul cel mai tipic; |
|
(b) |
califică proprietatea substanțelor sau a amestecurilor a căror degustare provoacă această savoare. |
Substantivul corespunzător este salinitate.
Zaharată (savoare) (adj.):
|
(a) |
califică savoarea elementară provocată de soluțiile apoase ale diverselor substanțe, precum zaharoza; |
|
(b) |
califică proprietatea substanțelor pure sau a amestecurilor a căror degustare provoacă această savoare. |
Substantivul corespunzător este zaharificare.
Astringentă (savoare) (adj.):
|
(a) |
califică senzația complexă produsă în gură de o soluție apoasă diluată de produse precum anumite taninuri (de exemplu, taninurile kaki și taninuri ale porumbei); |
|
(b) |
califică proprietatea substanțelor pure sau a amestecurilor care produc această senzație. |
Substantivul corespunzător este astringență.
Aromă (subst.):
prin aromă se înțelege ansamblul percepțiilor stimulilor gustativo-olfactivi, tactili, chinestezici care permit unui subiect să identifice un produs alimentar și să stabilească un criteriu, la diferite nivele, favorabil sau defavorabil privind produsul în cauză.
Savoare (subst.):
|
(a) |
senzații percepute de papilele gustative atunci când sunt stimulate de anumite substanțe solubile; |
|
(b) |
calitate a senzației speciale produse de aceste substanțe. |
Savoare elementară (subst.):
fiecare dintre cele patru savori recunoscute: dulce, sărată, acidă, amară.
Miros (subst.):
|
(a) |
ansamblul senzațiilor percepute de organul olfactiv prin inspirarea anumitor substanțe volatile; |
|
(b) |
calitate a senzației speciale produse de fiecare dintre substanțele menționate anterior. |
Parfum (subst.):
|
(a) |
senzații plăcute percepute de organul olfactiv pe cale indirectă în timpul degustării unui produs alimentar; |
|
(b) |
în industria parfumului și în limbajul obișnuit, acest termen este folosit, de asemenea, în cazul acelorași senzații percepute pe cale nazală directă. |
Gustul rămas (subst.):
ansamblul senzațiilor percepute după dispariția stimulului din gură și care este diferit față de celelalte percepute în prealabil.
Aromatic (adj.):
|
(a) |
califică proprietatea substanțelor pure sau a amestecurilor a căror degustare produce senzațiile calificate drept „aromate”; |
|
(b) |
califică produsele alimentare a căror examinare pe cale nazală directă produce senzațiile de miros plăcut și prospețime. |
Textură (subst.):
ansamblul caracteristicilor stării solide sau reologice a unui produs alimentar capabil să stimuleze receptorii mecanici, în timpul degustării, și în special a celor situați în regiunea bucală.
Notă: Acest termen se aplică numai proprietăților obiective, nu în cazul senzațiilor produse, care sunt desemnate prin termeni generali, precum consistență, fibrozitate, onctuozitate etc.
„A plimba în gură” (a savura sau a degusta în gură) (verb):
acțiune ce tinde ca un produs alimentar situat în gură să intre în contact cu toate zonele sale sensibile în scopul de percepe senzațiile bucale pe care le provoacă.
Notă: Acest vocabular poate fi îmbogățit consultând Normele ISO 5492, părțile I–V, și alte lucrări, precum cea elaborată de J.L. Magnen, Caietele tehnice ale Centrului Național de Coordonare a Studiilor și Cercetărilor privind Nutriția și Alimentația etc.
PAHAR PENTRU DEGUSTAREA ULEIURILOR
1. OBIECT
Prezenta normă are ca scop descrierea caracteristicilor paharului destinat analizei organoleptice a uleiurilor comestibile (miros, savoare, aromă).
În plus, ea descrie dispozitivul de încălzire adaptat, necesar pentru obținerea și menținerea temperaturii adecvate pentru această analiză.
2. DESCRIEREA PAHARULUI
Schița din figura 1 a fost desenată în scopul de a optimiza caracteristicile pe care trebuie să le prezinte un astfel de instrument și ale cărui aspecte fundamentale sunt precizate în continuare:
|
(a) |
stabilitate maximă, prin evitarea balansării paharului și a răsturnării uleiului conținut; |
|
(b) |
formă ușor adaptabilă cavităților unui bloc de încălzire ce permite o încălzire uniformă a bazei paharului; |
|
(c) |
îngustarea gurii ce favorizează concentrarea mirosurilor și facilitează identificarea acestora; |
|
(d) |
sticlă închisă la culoare, astfel încât degustătorul să nu poată evalua culoarea uleiului, ceea ce elimină orice prejudecată și posibilitatea de a fi obiectiv, ceea ce ar putea dăuna obiectivității determinării. |
2.1. Dimensiuni
Schița paharului este cea prezentată în figura 1, cu următoarele dimensiuni:
|
130 ml ± 10 ml, |
||
|
60 mm ± 1 mm, |
||
|
50 mm ± 1 mm, |
||
|
70 mm ± 1 mm, |
||
|
35 mm ± 1 mm, |
||
|
1,5 mm ± 0,2 mm, |
||
|
5 mm ± 1 mm. |
Fiecare pahar trebuie să fie însoțit de un capac de sticlă cu un diametru mai mare cu aproximativ 10 mm decât cel al gurii. Acest capac va servi drept dispozitiv de acoperire pentru a evita pierderea mirosului și pătrunderea prafului.
2.2. Caracteristici de fabricație
Paharul trebuie să fie fabricat din sticlă rezistentă, de culoare închisă pentru a împiedica evaluarea culorii conținutului și să nu prezinte zgârieturi și bule.
Marginea paharului trebuie să fie regulată, netedă și rotunjită.
Paharul trebuie să fie din sticlă arsă, pentru a-i permite să reziste la variațiile de temperatură pe care trebuie să le suporte pe parcursul testelor.
2.3. Reguli de utilizare
Curățarea paharelor trebuie să se facă folosindu-se săpun sau detergent fără miros și să fie urmată de mai multe clătiri până la eliminarea totală a produsului folosit. În cele din urmă, paharele se clătesc cu apă distilată, iar după scurgere, se usucă într-o etuvă de uscare.
Nu trebuie să se folosească acizi concentrați sau amestecuri cu acid cromic.
Paharele trebuie să fie păstrate într-o etuvă până la utilizare sau să fie menținute într-un dulap, protejate de orice contaminare cu mirosuri anormale.
Înaintea fiecărei utilizări trebuie să se asigure prin mirosire că paharele nu conțin nici un miros anormal. La prepararea testului, se are în vedere notarea codului fiecărui pahar și al uleiului corespunzător. Această corespondență a codului și a uleiului va fi cunoscută numai de către organizatorul experimentului.
3. DISPOZITIV DE ÎNCĂLZIRE A MOSTRELOR
Examenul organoleptic al mostrelor trebuie să se facă la o temperatură dată care se situează, pentru uleiurile alimentare, la 28 ± 2 °C. Pentru a ajunge la această temperatură, trebuie să se instaleze în interiorul fiecărei cabine, la îndemâna degustătorului, un dispozitiv de încălzire (a se vedea figura 2). Acest dispozitiv constă într-un bloc de aluminiu scufundat într-un bazin cu apă reglată de termostat, cu scopul de a obține o temperatură uniformă. Acest bloc prezintă o serie de cavități pentru a adapta acestora fundul paharelor. Diferența de temperatură dintre dispozitivul de încălzire și uleiul din paharele așezate în cavitățile diferitelor blocuri nu trebuie să fie mai mare de ± 2 °C.
Figura 1 - Pahar pentru degustare

Figura 2 - Dispozitiv de încălzire a mostrelor

GHID PENTRU INSTALAREA UNEI SĂLI PENTRU DEGUSTARE
1. INTRODUCERE
Sala pentru degustare trebuie să ofere grupului de degustători care efectuează testele senzoriale un mediu adecvat, confortabil și standardizat de natură să faciliteze munca lor și să contribuie la îmbunătățirea repetabilității și reproductibilității rezultatelor.
2. OBIECT
Prezenta normă are ca scop precizarea condițiilor esențiale de care trebuie să se țină seama la amenajarea unei săli pentru degustare.
3. SPECIFICAȚII GENERALE PENTRU INSTALARE
Orice încăpere, indiferent de suprafața acesteia (vezi punctul 3.1) trebuie să îndeplinească următoarele specificații:
Încăperea trebuie să fie agreabilă și bine luminată (a se vedea punctul 3.2), păstrând totodată un aspect neutru. În acest scop, este recomandat să se utilizeze pentru pereți o nuanță uni, relaxantă și luminoasă, astfel încât să creeze o atmosferă relaxată (5).
Încăperea trebuie să poată fi curățată cu ușurință. În plus, ea trebuie să fie departe de orice sursă de zgomot;este, de preferință, izolată fonic. De asemenea, ea trebuie să fie departe de orice miros anormal, motiv pentru care trebuie, dacă este posibil, să fie dotată cu un dispozitiv de ventilație eficient. În cazul fluctuațiilor sensibile ale temperaturii ambiante, sala pentru degustare trebuie să fie dotată cu o instalație de aer condiționat, astfel încât temperatura să poată fi menținută la o valoare de 20–22 °C.
3.1. Dimensiuni
Dimensiunile încăperii depind cel mai adesea de posibilitățile laboratoarelor sau ale întreprinderilor. În general, încăperea trebuie să fie suficient de spațioasă pentru a permite instalarea a aproximativ zece cabine, precum și a unei zone pentru prepararea mostrelor.
În orice caz, se recomandă ca spațiul rezervat instalațiilor să fie mai mare, pentru a putea prevedea, de asemenea, dependințe anexe pentru, de exemplu, curățarea materialului, aranjatul felurilor de mâncare, precum și pentru reuniunile în „comisie deschisă”.
3.2. Iluminatul
Iluminatul general, fie că este asigurat de lumina solară sau de lămpi (de exemplu, tuburi tip „lumina zilei”), trebuie să fie uniform, reglabil și cu lumină difuză.
3.3. Temperatura și starea higrometrică
Incinta trebuie să fie menținută constant în condiții termice și higrometrice agreabile. Cu excepția circumstanțelor speciale, se recomandă menținerea unei temperaturi de 20–22 °C și o stare higrometrică de 60–70 % umiditate relativă.
4. DESCRIEREA CABINELOR
4.1. Caracteristici generale
Cabinele pentru analiza senzorială trebuie să fie montate una lângă alta în încăpere.
Ele trebuie să fie identice și separate între ele prin pereți suficienți de înalți și groși pentru a izola degustători odată așezați.
Cabinele pot fi fabricate din orice material adecvat care se întreține ușor (de exemplu lemn, placaj melaminat, panouri laminate etc.). În cazul în care se utilizează vopsea, aceasta trebuie să fie complet inodoră după uscare.
Scaunele prevăzute în fiecare cabină trebuie să fie confortabile și cu înălțime reglabilă.
Fiecare cabină trebuie să aibă, de asemenea, iluminat individual reglabil în ceea ce privește atât direcția, cât și intensitatea.
Se recomandă ca aceste cabine să fie dotate cu un buton pentru un semnalizator luminos care să îi permită degustătorului să comunice persoanei care se ocupă de el, aflate în exterior, fără ca acest lucru să îi distragă pe ceilalți, că a încheiat testul, că dorește să i se trimită alte mostre, că îi lipsește un anumit instrument, că a observat o neregularitate sau că dorește informații etc.
4.2. Dimensiuni
Cabinele trebuie să fie suficient de mari și de confortabile.
În general, trebuie să se respecte următoarele dimensiuni:
|
— |
lățime: 0,75 metri (fără chiuvetă); 0,85 metri (cu chiuvetă); |
|
— |
lungime: 0,50 metri (masă); 0,20 metri (în plus, pentru peretele despărțitor); |
|
— |
înălțimea pereților despărțitori: minim 0,60 metri, măsurați pornind de la masă; |
|
— |
înălțimea mesei: 0,75 metri. |
4.3. Așezare
Suprafața mesei trebuie să poată fi curățată cu ușurință.
O parte a acestei suprafețe trebuie să fie rezervată montării unei chiuvete cu apă curentă potabilă. În cazul în care nu se poate realiza acest lucru, spațiul în cauză trebuie rezervat pentru a amplasa o cuvă, o scuipătoare sau alte dispozitive similare.
În cazul în care, în timpul realizării testului, mostrele trebuie menținute la o temperatură constantă mai mare sau mai mică decât temperatura ambiantă, trebuie să existe un echipament adecvat în acest scop (baie de aburi, placă de încălzire etc.).
De asemenea, se poate instala o etajeră, la aproximativ 1,10 metri de sol, pentru a aranja diferite accesorii (pahare, materiale de dimensiuni mici etc.).
În cazul în care așezarea cabinelor în sala de degustare o permite, se recomandă instalarea unui dispozitiv pentru facilitarea prezentării mostrelor. Acest dispozitiv poate fi în formă de glisieră (figura 1), de giruetă rotativă pe verticală (figura 2), recomandată în special pentru paharele sau cupele înalte, sau de dispozitiv cu deschizătură orizontală, în cazul în care recipientele în care se servesc mostrele nu sunt foarte înalte (figura 3). Practic, cabina trebuie să aibă o deschizătură suficient de mare pentru a permite trecerea tăvilor de serviciu și a paharelor ce conțin mostrele care urmează să fie examinate.
Figura 4 prezintă un exemplu schematic de sală de degustare și anexe.
5. ANEXE
Dacă spațiul o permite, se recomandă să se prevadă încăperi separate pentru prepararea mostrelor (în scopuri culinare sau în alte scopuri), aranjarea paharelor sau ustensilelor, precum și pentru discuții prealabile sau ulterioare testelor. În cazul în care există astfel de camere, ele trebuie să fie întotdeauna curate și să nu deranjeze, prin mirosul lor, zgomote sau discuții ale persoanelor reunite, munca comisiei din sala de degustare.
Notă: Condițiile descrise anterior sunt condiții ideale. Cu toate acestea, în cazul în care nu este posibil să se dispună de o sală rezervată numai analizelor senzoriale, testele ar putea fi realizate într-o încăpere care îndeplinește condițiile minime descrise (lumină, temperatură, zgomote, mirosuri), instalându-se cabine mobile făcute din elemente demontabile și pliabile, astfel încât să asigure, cel puțin, separarea intenționată a fiecărui degustător.
DISPUNEREA CABINEI
Figura 1

DISPOZITIV ROTATIV DE PREZENTARE A MOSTRELOR
Figura 2

DISPOZITIV CU FEREASTRĂ PENTRU PREZENTAREA MOSTRELOR
Figura 3

LABORATOR DE ANALIZĂ SENZORIALĂ (exemplu)
Figura 4 - Exemplu de sală de degustare

(1) Vă rugăm să precizați care este, după părerea dumneavoastră, interesul pe care îl poate prezenta evaluarea oricărui aliment sau a uleiului de măsline, din punctulde vedere al caracteristicilor sale organoleptice.
(2) Responsabilul juriului trebuie să instruiască candidatul pentru ca testul să fie realizat în mod rezonabil, adică fără ca acesta să își piardă acuitatea din cauza oboselii olfactive.
(3) Acest candidat este eliminat, deoarece valoarea T este mai mare de 3.
(4) Acesta se poate abține dacă observă un anumit atribut extrem de neplăcut, și va nota pe fișa de notare această circumstanță excepțională.
(5) Culoarea încăperii și iluminarea acesteia pot influența rezultatele analizei senzoriale.
ANEXA XIII
DOVADA RAFINĂRII
1. NEUTRALIZAREA ȘI DECOLORAREA ULEIULUI DE MĂSLINE ÎN LABORATOR
1.1. Neutralizarea uleiului
1.1.1. Aparatură
|
— |
pahar de laborator de 300 ml de formă înaltă; |
|
— |
centrifugă de laborator cu tuburi de 100 mm; |
|
— |
pahar de laborator de 250 ml; |
|
— |
baloane de 100 ml; |
|
— |
pâlnie de decantare de 1 litru. |
1.1.2. Reactivi
|
— |
soluție apoasă de hidroxid de sodiu de 12 %; |
|
— |
soluție etanolică de 1 % de fenolftaleină; |
|
— |
hexan pur pentru analiză; |
|
— |
alcool izopropilic pur pentru analiză. |
1.1.3. Mod de lucru
(a) Uleiuri cu o aciditate exprimată în acid oleic mai mică de 30 %
Se introduc, într-un pahar de laborator de 300 mm de formă înaltă, 50 g de ulei brut și se încălzesc până la 65 °C la baie de aburi. Agitându-se lent, se adaugă o cantitate de soluție de hidroxid de sodiu de 12 % ce corespunde acidității libere a uleiului, cu un exces de 5 %. Se continuă să se agite timp de cinci minute, menținând temperatura la 65 °C.
Se transferă totul în eprubete de centrifugare de 100 ml, se separă pasta de săpun prin centrifugare. Se toarnă uleiul decantat într-un pahar de laborator de 250 ml și se spală cu 50–60 ml apă distilată fiartă, eliminând în același timp stratul apos cu ajutorul unui sifon. Se repetă spălările până la eliminarea completă a urmelor de săpun rezidual (dispariția colorației roz a fenolftanelinei).
Se centrifughează uleiul pentru a elimina micile cantități de apă reziduală.
(b) Uleiuri cu o aciditate exprimată în acid oleic mai mare de 30 %
Într-o pâlnie de decantare de un litru, se introduc 50 g de ulei brut, 200 ml de hexan, 100 ml de alcool izopropilic și o cantitate de soluție de hidroxid de sodiu de 12 % ce corespunde acidității libere a uleiului, cu un supliment de 0,3 %.
Se agită energic timp de 1 minut. Se adaugă 100 ml de apă distilată, se agită din nou și se lasă în repaus.
După separarea straturilor, se lasă să se scurgă stratul inferior ce conține săpun. Între cele două straturi (uleios deasupra și apos dedesubt) se formează deseori un strat intermediar format din mucilagii și din substanțe insolubile care trebuie să fie, de asemenea, eliminat. În continuare, se trece la spălarea soluției hexanice de ulei neutru cu 50–60 ml dintr-o soluție de alcool izopropilic/apă distilată 1/1 (v/v) până la dispariția colorației roz a fenolftaleinei. Se trece apoi la eliminarea completă a hexanului prin distilare în vid (de exemplu, în evaporatorul rotativ).
1.2. Decolorarea uleiului neutralizat
1.2.1. Aparatură
|
— |
balon de 250 ml cu 3 gâturi din sticlă rodată ce permit inserarea:
|
|
— |
pompă de vid, echipată cu un manometru, capabil să dea presiuni reziduale de 15–30 milibari. |
1.2.2. Mod de lucru
Se cântăresc în balonul cu 3 gâturi aproximativ 100 g de ulei neutralizat. Se inserează termometrul și agitatorul, se conectează la pompa de vid și se încălzește până la 90 °C, agitând. Se menține această temperatură, agitând mereu, până când uleiul analizat elimină complet umiditatea sa (aproximativ treizeci de minute). Se întrerupe vidul și se adaugă 2–3 g de pământ activat.
Se restabilește vidul până la obținerea unei presiuni reziduale de 15–30 milibari și, la aceeași temperatură de 90 °C, se agită timp de treizeci de minute la aproximativ 250 turații pe minut.
Se filtrează apoi la cald într-o etuvă termostatică (50–60 °C).
ANEXA XIV
NOTELE ADIȚIONALE 2, 3 ȘI 4 LA CAPITOLUL 15 DIN NOMENCLATURA COMBINATĂ
„Nota 2 A: Se consideră «ulei de măsline» în sensul numerelor de cod NC 1509 și 1510 numai uleiul ce provine exclusiv din tratarea măslinelor, cu excepția uleiului de măsline reesterificat și a oricărui amestec de ulei de măsline cu uleiuri de altă natură.
Prezența uleiului de măsline reesterificat sau a uleiurilor de altă natură se stabilește cu ajutorul metodelor indicate în anexele VII, IX și XII. Caracteristicile analitice referitoare la conținutul de steroli și de acizi al tuturor uleiurilor de măsline de la numerele de cod NC 1509 și 1510 figurează în tabelul menționat în continuare.
|
Tabelul 1 - Conținutul de acizi în procente |
Tabelul II - Conținutul de steroli în procente |
||||||||
|
Acid miristic |
M 0,1 |
Colesterol |
M 0,5 |
||||||
|
Acid linolenic |
M 0,9 |
Brassicasterol |
M 0,2 |
||||||
|
Acid arahidic |
M 0,7 |
Campesterol |
M 4,0 |
||||||
|
Acid eicosenic |
M 0,5 |
Stigmasterol |
< Campesterol |
||||||
|
Acid behenic |
M 0,3 |
Betasitosterol (1) |
m 93,0 |
||||||
|
Acid lignoceric |
M 0,5 |
Δ 7-Stigmasterol |
M 0,5 |
||||||
|
|||||||||
Nota 2 B: Sunt considerate «uleiuri de măsline virgine» uleiurile obținute din măsline numai prin procedee mecanice sau prin alte procedee fizice, în condiții, în special termice, care nu alterează uleiul, care nu au fost supuse altui tratament decât spălarea, decantarea, centrifugarea și filtrarea, cu excepția uleiurilor obținute din măsline cu ajutorul solvenților (1510) și definite la punctele I și II de mai jos.
|
I. |
Se consideră «ulei de măsline virgin lampant», în sensul subpoziției 1509 10 10, uleiul care prezintă, indiferent de aciditatea lui:
|
|
II. |
Se consideră «ulei de măsline virgin», în sensul codului NC 1509 10 90, uleiul de măsline care prezintă următoarele caracteristici:
|
Nota 2 C: Se consideră ca încadrat la codul NC 1509 90 00 uleiul de măsline obținut prin tratarea uleiurilor încadrate la codurile NC 1509 10 10 și/sau 1509 10 90, chiar îndoit cu ulei de măsline virgin, care prezintă caracteristicile următoare:
|
(a) |
o aciditate, exprimată în acid oleic, mai mică sau egală cu 3,3 g pe 100 de grame; |
|
(b) |
un conținut de alcooli alifatici mai mic sau egal cu 350 mg pe kilogram; |
|
(c) |
un coeficient de extincție K270 mai mare de 0,25 și mai mic sau egal cu 1,20 și, după trecerea mostrei pe alumină activată, mai mare de 0,10; |
|
(d) |
o variație a coeficientului de extincție (ΔΚ) de aproximativ 270 nm mai mare de 0, 01și mai mică sau egală cu 0,16; |
|
(e) |
un conținut de eritrodiol și uvaol mai mic sau egal cu 4,5 %; |
|
(f) |
un conținut de acizi grași saturați în poziția 2 mai mic sau egal cu 1,5 %. |
Nota 2 D: Se consideră „uleiuri brute” încadrate la codul NC 1510 00 10 uleiurile, în special uleiurile din resturi de măsline, care prezintă caracteristicile următoare:
|
(a) |
o aciditate, exprimată în acid oleic, mai mare de 2 g pe 100 de grame; |
|
(b) |
un conținut de eritrodiol și uvaol mai mare de 12 %; |
|
(c) |
un conținut de acizi grași saturați în poziția 2 a trigliceridelor mai mic sau egal cu 1,8 %. |
Nota 2 E: Se consideră uleiuri încadrate la codul NC 1510 00 90 uleiurile obținute prin tratarea uleiurilor încadrate la codul NC 1510 00 10, chiar îndoite cu ulei de măsline virgin, care nu prezintă caracteristicile menționate în punctele I și II, cu condiția ca ele să prezinte un conținut de acizi grași saturați în poziția 2 a trigliceridelor mai mic sau egal cu 2 %.
„Nota 3: Sunt excluse de la codurile NC 1522 00 31 și 1522 00 39:
|
(a) |
reziduurile provenite din tratarea substanțelor grase ce conțin ulei cu un indice de iod, determinat conform metodei indicate în anexa XVI, mai mic de 70 sau mai mare de 100; |
|
(b) |
reziduurile provenite din tratarea substanțelor grase ce conțin ulei cu un indice de iod între 70 și 100, dar a cărui suprafață a valorii de vârf cu un volum de retenție a beta-sitosterolului, determinată conform dispozițiilor din anexa V la regulamentul în cauză la nota complementară 4 menționată în continuare, reprezintă mai puțin de 93 % din suprafața totală a valorilor de vârf ale sterolilor.” |
„Nota 4: Metodele de analiză care trebuie folosite pentru determinarea caracteristicilor produselor în cauză menționate anterior sunt cele prevăzute în anexele la Regulamentul (CEE) nr. 2568/91.”
(1) Delta-5-23 Stigmasterol + Colesterol + Betasitosterol + Sitostanol + Delta-5-Avenasterol + Delta-5-24- Stigmastadienol
|
m |
= |
minimum |
|
M |
= |
maximum |
(2) adică:
ΔΚ = Km – 0,5 (Km - 4 + Km + 4)
Km desemnează coeficientul de extincție la lungimea de undă din punctul maxim al curbei de absorbție în apropiere de 270 nm,
Km – 4 și Km + 4 desemnează coeficienți de extincție la lungimi de undă mai mici și mai mari de 4 nm decât aceea în Km;
(3) În cazul în care K270 este mai mare de 0,25, trebuie să se realizeze o altă determinare după trecerea pe alumină; K270 nu trebuie să fie mai mare de 0,10.”
ANEXA XV
1. CONȚINUTUL DE ULEI AL RESTURILOR DE MĂSLINE
1.1. Material
|
— |
aparat de extracție adecvat, echipat cu un balon de 200–250 ml; |
|
— |
baie cu încălzire electrică (baie de nisip, baie de apă etc.) sau placă de încălzire; |
|
— |
balanță analitică; |
|
— |
etuvă reglată la maxim 80 °C; |
|
— |
etuvă cu încălzire electrică echipată cu un dispozitiv de termoreglare reglat la 103 °C ± 2 °C care permite realizarea unei insuflări de aer sau a unei presiuni reduse; |
|
— |
concasor mecanic ușor de curățat care permite concasarea fără încălzire și fără diminuarea sensibilă a conținutului lor de apă și de ulei; |
|
— |
cartuș de extracție și vată hidrofilă sau hârtie de filtru, fără produse care se extrag cu hexan; |
|
— |
exsicator; |
|
— |
sită cu găuri cu diametru de 1 mm; |
|
— |
piatră ponce cu granule mici, uscată în prealabil. |
1.2. Reactiv
n-hexan tehnic al cărui reziduu în urma evaporării complete trebuie să fie mai mic de 0,002 g pentru 100 de ml.
2. MOD DE LUCRU
2.1. Prepararea mostrei
Se sfărâmă mostra pentru laborator, dacă este necesar, în concasorul mecanic bine curățat în prealabil cu scopul de a-l mărunți în particule ce pot trece prin sită.
Se folosește aproximativ a douăzecea parte din mostră pentru a finaliza curățarea concasorului, se aruncă mostra măcinată, se macină restul, se colectează, se amestecă cu grijă și se analizează imediat.
2.2. Mostra
Se cântăresc, cu o precizie de 0,01 grame, după încheierea concasării, aproximativ 10 g de mostră pentru test.
2.3. Prepararea cartușului de extracție
Se plasează mostra în cartuș și se astupă cu tamponul de vată hidrofilă. În cazul în care se folosește hârtie de filtru, se ambalează mostra măcinată în această hârtie.
2.4. Uscarea prealabilă
În cazul în care resturile sunt foarte umede (conținutul de apă și de materii volatile este mai mare de 10 %), se efectuează o uscare prealabilă prin introducerea, pentru o perioadă de timp suficientă, a cartușului umplut (sau a hârtiei de filtru) în etuva încălzită la maximum 80 °C, pentru a reduce conținutul de apă și de materii volatile la mai puțin de 10 %.
2.5. Prepararea balonului
Se cântărește, cu o precizie de 1 miligram, balonul ce conține 1 sau 2 granule de piatră ponce, uscat în prealabil în etuvă la 103 °C ± 2 °C, apoi se răcește timp de cel puțin o oră într-un exsicator.
2.6. Prima extracție
Se pune în aparatul de extracție cartușul (sau hârtia de filtru) ce conține mostra. Se toarnă în balon cantitatea necesară de hexan. Se adaptează balonul la aparatul de extracție și se plasează totul pe baia cu încălzire electrică. Încălzirea se efectuează în așa fel încât debitul refluxului să fie de cel puțin trei picături pe secundă (fierbere moderată, fără clocote). După 4 ore de extracție, se lasă să se răcească. Se scoate cartușul aparatului de extracție și se plasează într-un curent de aer astfel încât să se elimine cea mai mare parte a solventului impregnat.
2.7. A doua extracție
Se golește cartușul în microconcasor și se concasează cât mai fin posibil. Se plasează din nou, cantitativ, amestecul în cartuș, și acesta se pune în aparatul de extracție.
Se începe din nou extracția timp de încă două ore folosindu-se același balon ce conține prima extracție.
Soluția obținută în balonul de extracție trebuie să fie limpede. În caz contrar, aceasta se filtrează printr-o hârtie de filtru, spălându-se de mai multe ori primul balon și hârtia de filtru cu hexan. Se colectează filtratul și solventul de spălare într-un al doilea balon, uscat în prealabil și tarat cu o precizie de 1 miligram.
2.8. Eliminarea solventului și cântărirea extractului
Se înlătură, prin distilare pe baia cu încălzire electrică, cea mai mare parte a solventului. Se elimină ultimele urme de solvent prin încălzirea balonului în etuvă la 103 °C ± 2 °C timp de 20 de minute. Se facilitează această eliminare fie prin insuflarea de aer, din când în când, sau, de preferință, a unui gaz inert, fie operând sub presiune redusă.
Se lasă să se răcească balonul într-un exsicator timp de cel puțin o oră, și se cântărește cu o precizie de 1 mg.
Se încălzește din nou 10 minute în aceleași condiții, se răcește în exsicator și se cântărește.
Diferența dintre rezultatele celor două cântăriri trebuie să fie mai mică sau egală cu 10 mg. În caz contrar, se încălzește din nou timp de câte 10 minute, perioade urmate de răciri și de cântăriri, până când diferența de masă este cel mult egală cu 10 mg. Se reține ultima cântărire a balonului.
Se efectuează două determinări pe aceeași mostră pentru testare.
3. EXPRIMAREA REZULTATELOR
3.1. Mod de calcul și formula
|
(a) |
Extractul exprimat în procente de masă a produsului ca atare, este egal cu:
Se ia ca rezultat media aritmetică a celor două determinări, în cazul în care sunt îndeplinite condițiile lor de repetabilitate. Rezultatul se exprimă cu o singură zecimală. |
|
(b) |
Extractul este raportat la materia uscată folosind-se următoarea formulă:
în care: S= este procentul de masă al extractului produsului ca atare [a se vedea litera (a)], U= conținutul acestuia de apă și de materii volatile. |
3.2. Repetabilitatea
Diferența dintre rezultatele celor două determinări, efectuate simultan sau rapid una după alta de către același analist, nu trebuie să fie mai mare de 0,2 g de extract cu hexan pentru 100 g de mostră.
În caz contrar, se repetă analiza pe alte două mostre pentru test. În cazul în care și de această dată diferența depășește 0,2 grame, se ia ca rezultat media aritmetică a celor patru determinări efectuate.
ANEXA XVI
DETERMINAREA INDICELUI DE IOD
1. OBIECT
Prezenta normă internațională descrie o metodă destinată determinării indicele de iod în substanțele grase de origine animală și vegetală.
2. DEFINIȚIE
În sensul prezentei norme internaționale, se aplică următoarele definiții.
2.1. Indice de iod: masa de iod absorbită de mostră în condiții de operare specificate de prezenta normă internațională.
Indicele de iod se exprimă în număr de grame de iod pe 100 g de mostră.
3. PRINCIPIU
Punerea în soluție a mostrei într-un solvent și adăugarea reactivului Wijs. După un interval de timp determinat, adăugarea unei soluții de iodură de potasiu și de apă; titrarea iodului eliberat cu ajutorul unei soluții de tiosulfat de sodiu.
4. REACTIVI
Toți reactivii sunt de calitate analitică recunoscută.
4.1. Apa, care să conformă cu cerințele ISO 3696, categoria a 3-a.
4.2. Iodură de potasiu, soluție de 100 g/l, fără iod sau iodat.
4.3. Soluție de amidon. Se amestecă 5 g de amidon solubil în 30 ml de apă, se adaugă acestui amestec 1 000 ml de apă fiartă, se fierbe 3 minute și se lasă să se răcească.
4.4. Soluție volumetrică etalon de tiosulfat de sodiu.
c(Na2S3O3.5H2O) = 0,1 mol pe litru, standardizat timp de cel mult șapte zile înainte de folosire.
4.5. Solvent preparat prin amestecul de volume egale de ciclohexan și de acid acetic.
4.6. Reactiv Wijs care conține monoclorură de iod în acid acetic. Se utilizează reactivul de Wijs care se găsește în comerț.
5. APARATURĂ
Materialul de laborator obișnuit, în special:
5.1. Nacele de sticlă pentru cântărit, adecvate mostrei și care pot fi introduse în baloane (5.2.).
5.2. Baloane conice, cu o capacitate de 500 ml, prevăzute cu capace de sticlă și complet uscate.
6. PREPARAREA MOSTREI DE ANALIZAT
Mostra omogenizată este uscată pe sulfat de sodiu și filtrată.
7. MOD DE LUCRU
7.1. Mostra
Masa mostrei variază conform indicelui de iod presupus, așa cum indică tabelul 1.
Tabelul 1
|
|
Indice de iod presupus Masa mostrei (în g) |
|
mai mic de 5 |
3,00 |
|
5–20 |
1,00 |
|
21–50 |
0,40 |
|
51–100 |
0,20 |
|
101–150 |
0,13 |
|
150–200 |
0,10 |
Se cântărește mostra cu o precizie de 0,1 mg într-o nacelă de sticlă pentru cântărit (5.1).
7.2. Determinare
Se introduce mostra într-un balon de 500 ml (5.2). Se adaugă 20 ml de solvent (4.4) pentru a dizolva substanțele grase. Se adaugă exact 25 ml de reactiv Wijs (4.5), se astupă, se agită conținutul și se pune balonul într-un loc întunecos. Pentru reactivul de Wijs nu se utilizează pipeta.
Se prepară o mostră etalon cu solventul și cu reactivul, dar fără mostra pentru testare.
Pentru mostrele care au un indice de iod mai mic de 150, se lasă baloanele într-un spațiu întunecos timp de o oră; pentru cele care au un indice de iod mai mare de 150 și pentru produsele polimerizate sau produse oxidate într-o măsură considerabilă, se lasă timp de două ore.
După ce a trecut acest interval de timp, se adaugă 20 ml din soluția de iodură de potasiu (4.1) și 150 ml de apă în fiecare balon.
Se titrează cu soluția de tiosulfat de sodiu volumetrică etalon (4.3) până când dispare culoarea galbenă datorată iodului. Se adaugă câteva picături din soluția de amidon (4.2) și se continuă titrarea până în momentul în care dispare culoarea albastră, după ce s-a agitat energic conținutul.
Notă: Determinarea potențiometrică a punctului final este tolerată.
7.3. Numărul de determinări
Se efectuează două determinări pe aceeași mostră.
8. EXPRIMAREA REZULTATELOR
Indicele de iod este egal cu:
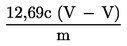 ,
,
în care:
c= valoarea numerică a concentrației exacte, în moli pe litru, a soluției etalon de tiosulfat de sodiu volumetric (4.3) utilizate;
V1= valoarea numerică a volumului, în ml, a soluției etalon de tiosulfat de sodiu volumetric (4.3) utilizate pentru mostra etalon;
V2= valoarea numerică a volumului, în ml, a soluției etalon de tiosulfat de sodiu volumetric (4.3) utilizate pentru determinare;
m= valoarea numerică a masei, în grame, a mostrei (7.1).
Se ia ca rezultat media aritmetică a celor două determinări, cu condiția să fie îndeplinit criteriul repetabilității.